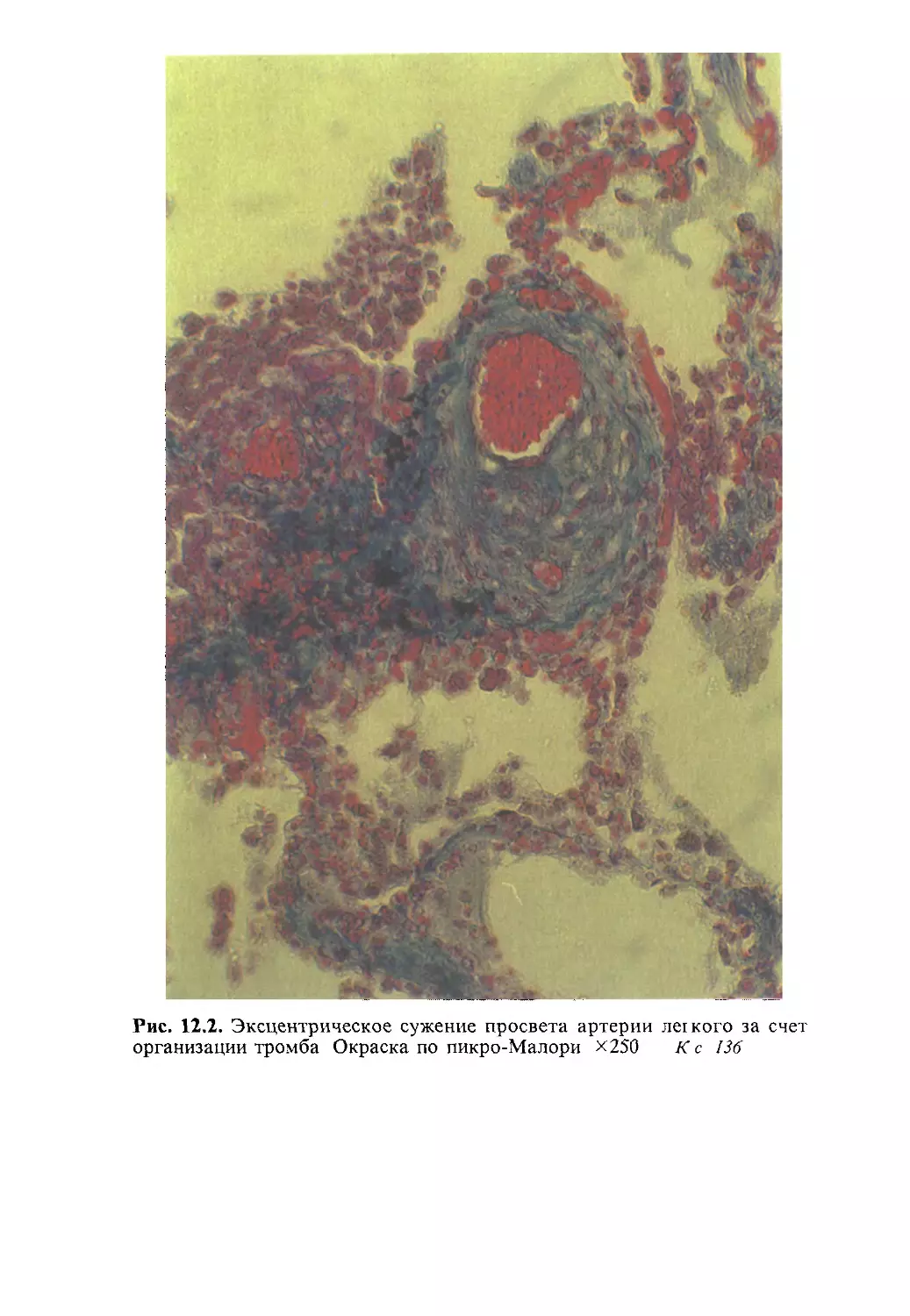
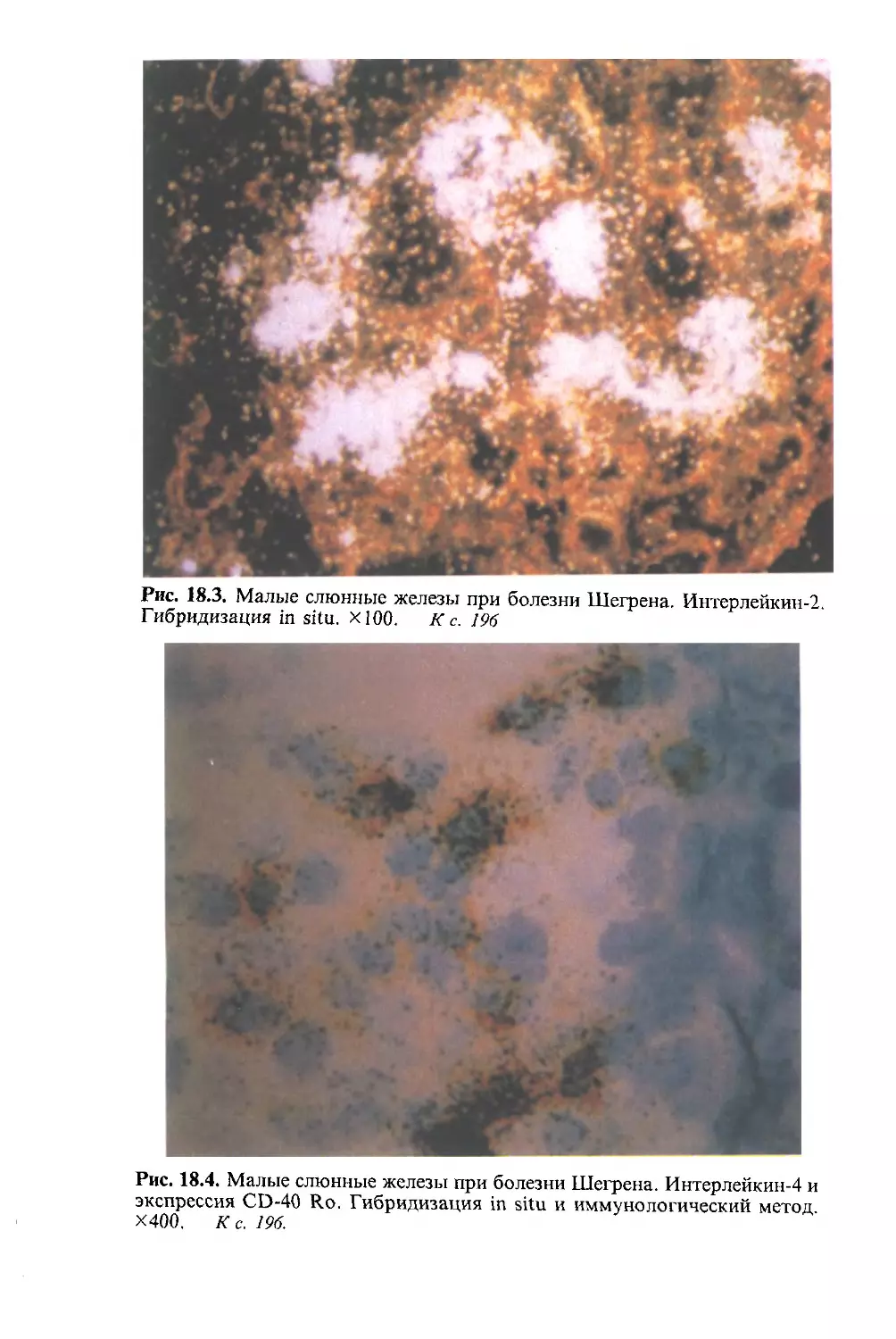
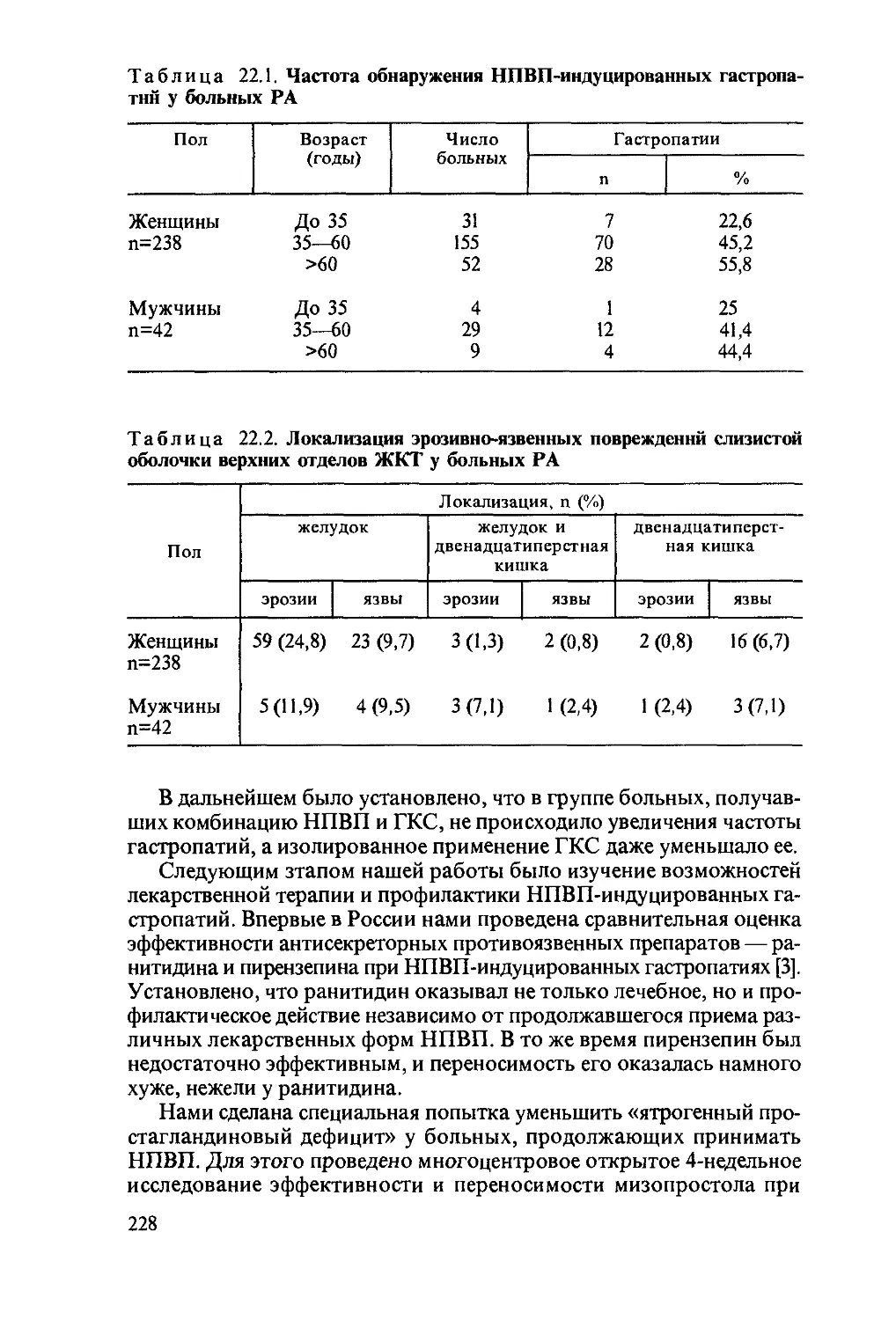
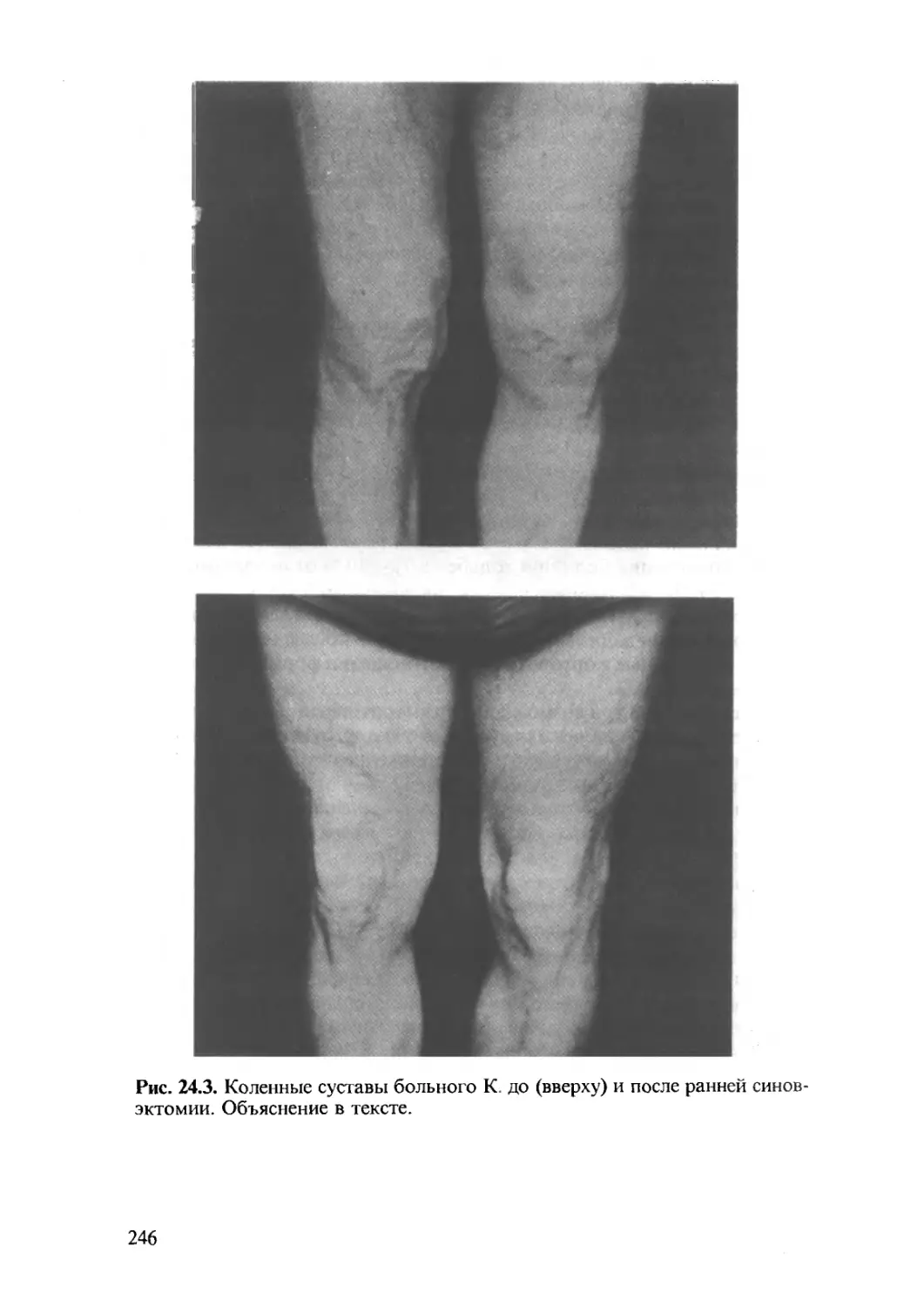
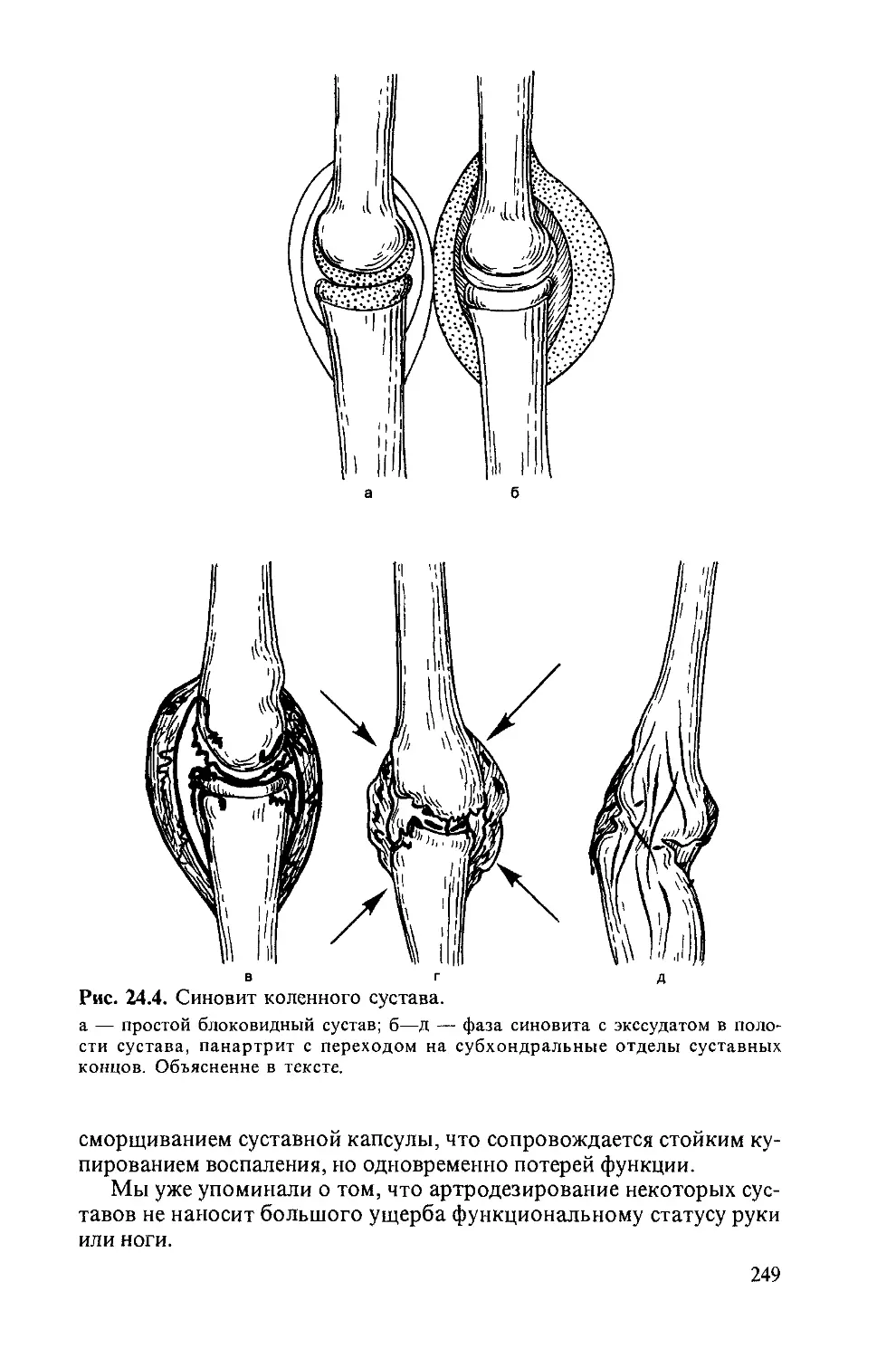
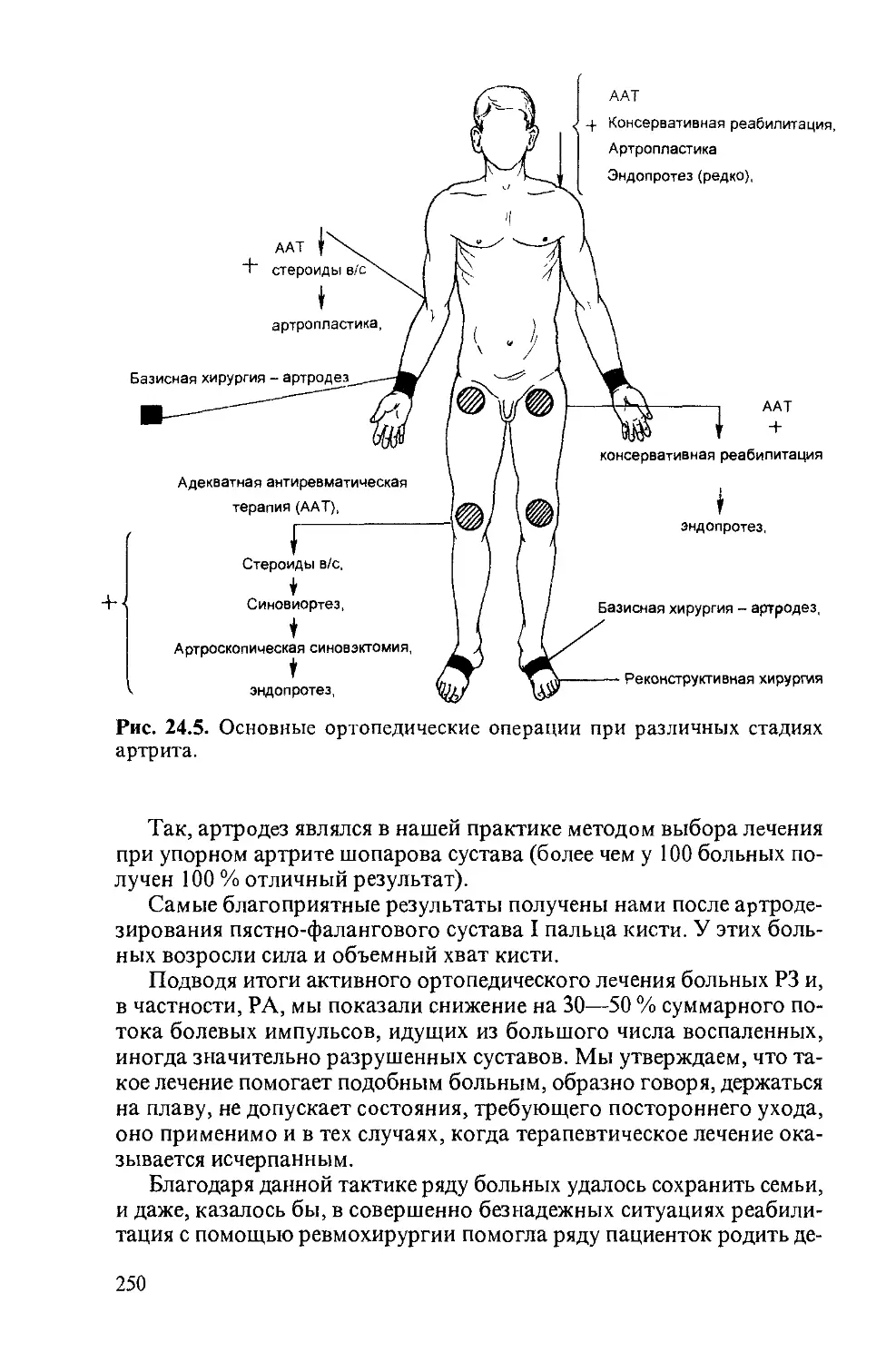
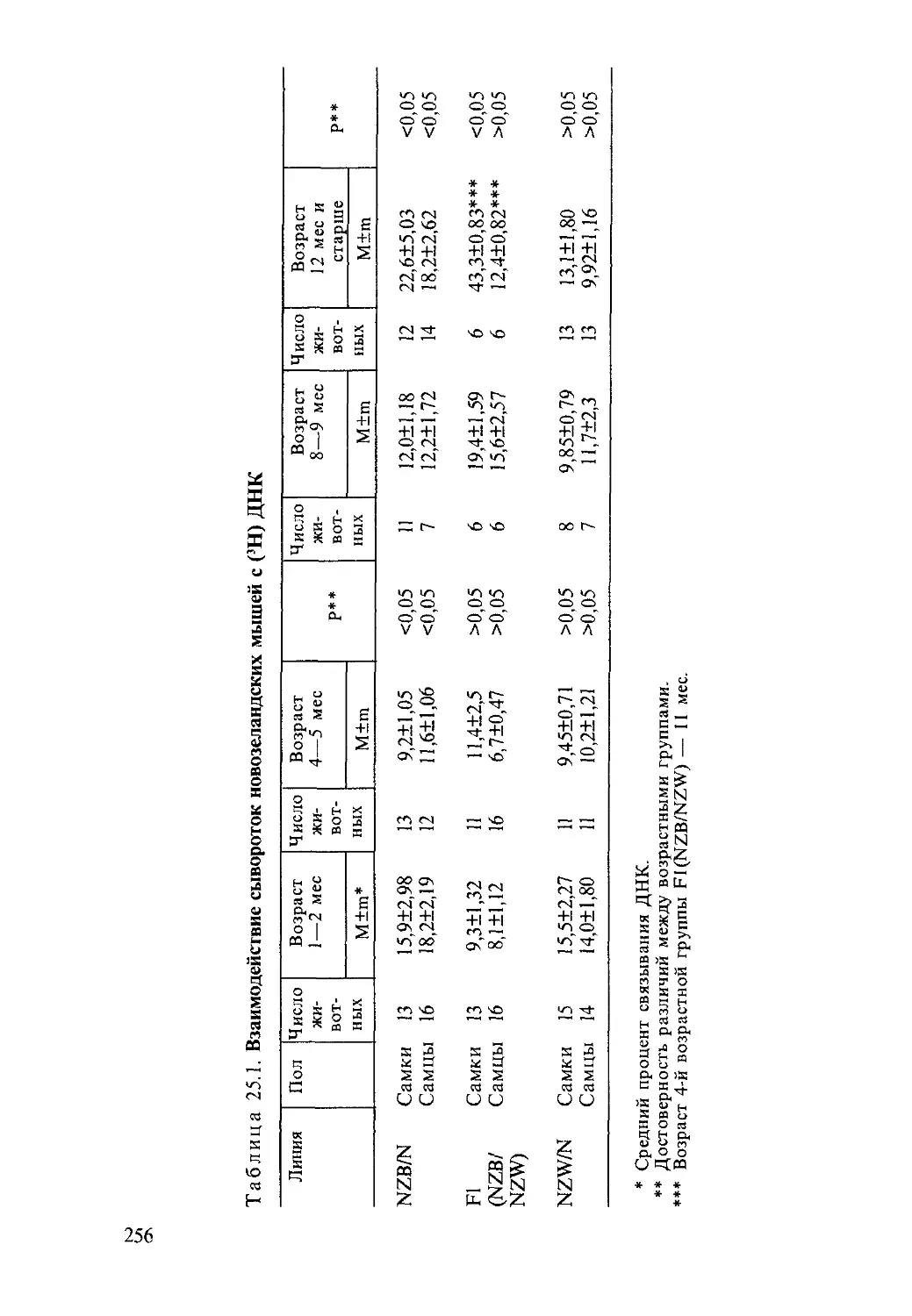
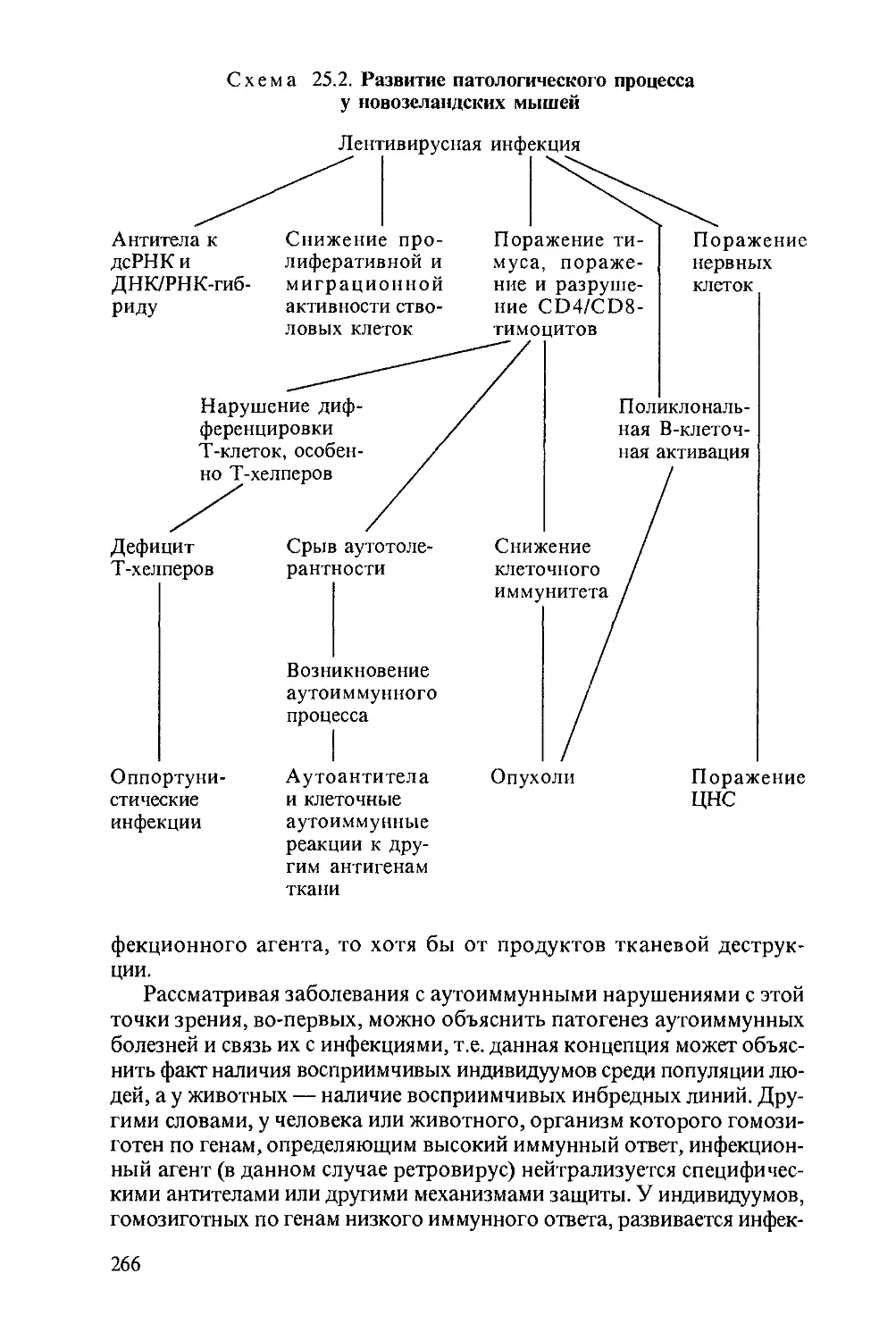
Автор: Насонова В.А. Бунчук Н.В.
Теги: воспаление раздражение застойная гиперемия слизистая гиперемия внутренние болезни медицина ревматология теоретическая медицина
ISBN: 5-225-04469-7
Год: 2001
Учебная литература для слушателей
институтов и факультетов
последипломного образования
ИЗБРАННЫЕ ЛЕКЦИИ
ПО КЛИНИЧЕСКОЙ
РЕВМАТОЛОГИИ
Под редакцией
академика РАМН В. А.Насоновой,
доктора мед. наук Н.В.Бунчука
Рекомендовано Департаментом
научно-исследовательских
и образовательных медицинских учреждений
Министерства здравоохранения Российской Федерации
в качестве учебного пособия для слушателей институтов
и факультетов последипломного образования
Москва
"Медицина"
2001
УДК 616-002.77(0.75.8)
ББК 54.191
И32
Рецензент В. П. Крикунов — профессор, зав курсом рсвмагочо-
гии Российской медицинской академии последиплом-
ного образования
Избранные лекции по клинической ревматологии: Учебное
И32 пособие для слушателей институтов и факультетов последиплом-
ного образования / Под ред. В.А.Насоновой, Н.В.Бунчука. -
М.: Медицина, 2001. — 272 с.: ил.
ISBN 5-225-04469-7
В книге представлены лекции по клинической ревматологии, под-
готовленные научными сотрудниками Института ревматологии
РАМН и других медицинских центров Москвы. В лекциях скон-
центрирована информация о последних достижениях в ревматоло-
гии, освещены вопросы этиологии и патогенеза ревматических за-
болеваний (аутоиммунитет, воспаление, генетика), их диагностики,
общие и частные вопросы лечения. Сведения, изложенные в лекци-
ях, в преобладающем большинстве содержат факты, ранее не пуб-
ликовавшиеся в отечественной литературе, касающиеся таких забо-
леваний, как ревматоидный артрит, остеоартроз, спондилоартризы,
болезнь Лайма, антифосфолипидный синдром, ревматизм, диффуз-
ные болезни соединительной ткани и др.
Для ревматологов, терапевтов, педиатров, а также студентов
старших курсов медицинских вузов.
ББК 54.191
ISBN 5-225-04469-7
© Коллектив авторов, 2001
Все права авторов защищены. Ни одна часть этого издания не может быть
занесена в память компьютера либо воспроизведена любым спосооом без предва-
рительного письменного разрешения издателя.
КОЛЛЕКТИВ АВТОРОВ
АГАБАБОВА
Эльза Романовна — д-р мед, наук, профессор, руководитель
лаборатории серонегативных артритов
и артроза Института ревматологии
РАМН
АЛЕКБЕРОВА
Земфира Садуллаевна — д-р мед. наук, профессор, руководитель
лаборатории системных ревматических
заболеваний Института ревматологии
РАМН
АЛЕКСЕЕВА
Людмила Ивановна — д-р мед. наук, ведущий научный со-
трудник отдела эпидемиологии и гене-
тики Института ревматологии РАМН
АНАНЬЕВА
Лидия Петровна
— д-р мед. наук, ведущий научный со-
трудник лаборатории системных рев-
матических заболеваний Института
ревматологии РАМН
АРИНИНА
Евгения Евгеньевна —
аспирант кафедры факультетской тера-
пии Российского государственного ме-
дицинского университета
Б АДОКИН
Владимир Васильевич
— канд. мед. наук, доцент курса ревмато-
логии Российской медицинской акаде-
мии последипломного образования
БАЛАБАНОВА
Римма Михайловна — д-р мед. наук, профессор, руководитель
отдела по изучению механизмов и кор-
рекции аутоиммунитета Института рев-
матологии РАМН
3
БЕЛОВ
Борис Сергеевич
канд. мед. наук, старшим научный со-
трудник отдела по изучению механиз-
мов и коррекции аутоиммунитета Ин-
ститута ревматологии РАМН
БЕНЕВОЛЕНСКАЯ
Лидия Ивановна
д-р мед. наук, профессор, руководитель
отдела эпидемиологии и генетики Ин-
ститута ревматологии РАМН
БОЧКОВА
Анна Георгиевна — канд. мед. наук, научный сотрудник ла-
боратории серонегативных артритов и
артроза Института ревматологии
РАМН
БУНЧУК
Николай Васильевич —
д-р мед. наук, ведущий научный со-
трудник лаборатории серонегативных
артритов и артроза Института ревма-
тологии РАМН
ВАСИЛЬЕВ
Владимир Иванович
— канд. мед. наук, старший научный со-
трудник лаборатории микроциркуля-
ции и воспаления Института ревмато-
логии РАМН
ГУСЕВА
Наталья Гавриловна
д-р мед. наук, профессор, руководитель
лаборатории микроциркуляции и вос-
паления Института ревматологии РАМН
ИВАНОВА
Маргарита Михайловна
— д-р мед. наук, профессор, руководитель
лаборатории прогнозирования исходов
и течения ревматических заболеваний
Института ревматологии РАМН
КАРАТЕЕВ
Дмитрий Евгеньевич
— канд. мед. наук, старший научный со
трудник лаборатории прогнозирования
исходов и течения ревматических забо-
леваний Института ревматологии РАМН
КОТЕЛЬНИКОВА
Галина Петровна
— канд. мед. наук, старший научный со-
трудник лаборатории инструменталь-
ной и ультразвуковой диагностики Ин-
ститута ревматологии РАМН
4
КУЗЬМИНА
Нина Николаевна — д-р мед. наук, профессор, руководитель
лаборатории ревматических заболева-
ний детского возраста Института рев-
матологии РАМН
МАЧ
Эвелина Семеновна — д-р мед. наук, профессор, руководитель
лаборатории инструментальной и ульт-
развуковой диагностики Института рев-
матологии РАМН
МУРАВЬЕВ
Юрий Владимирович —
д-р мед. наук, профессор, руководитель
группы по изучению безопасности ан-
тиревматических препаратов Институ-
та ревматологии РАМН
МЯКОТКИН
Валерий Андреевич —
д-р мед. наук, руководитель лаборато-
рии генетики Института ревматологии
РАМН
НАСОНОВ
Евгений Львович —
д-р мед. наук, профессор, член-коррес-
пондент РАМН, заведующий кафедрой
ревматологии факультета последиплом-
ного образования Московской меди-
цинской академии им. И.М.Сеченова
НАСОНОВА
Валентина Александровна
д-р мед. наук, профессор, академик РАМН,
директор Института ревматологии
РАМН
ПАВЛОВ
Вадим Петрович —
д-р мед. наук, профессор, руководи-
тель лаборатории ревмоортопедии и
реабилитации Института ревматологии
РАМН
ПЛЕСКОВСКАЯ
Галина Николаевна —
д-р биол. наук, руководитель лабора-
тории биологических моделей Институ-
та ревматологии РАМН
ПУШКОВА
Ольга Владимировна —
канд. мед. наук, зав. кабинетом ультра-
звуковой диагностики Института рев-
матологии РАМН
5
РАДЕНСКА-ЛОПОВОК
Стефка Господиновна
канд. мед. наук, руководитель лабо-
ратории морфогенеза ревматических
заболеваний Института ревматологии
РАМН
РЕШЕТНИК
Татьяна Магомедалиевна— д-р мед. наук, ведущий научный со-
трудник лаборатории системных рев-
матических заболеваний Института
ревматологии РАМН
САМСОНОВ
Михаил Юрьевич — канд. мед. наук, ассистент кафедры
ревматологии факультета последип-
ломного образования Московской ме-
дицинской академии им. И.М.Сеченова
САФОНОВА
Татьяна Николаевна — канд. мед. наук, Институт глазных бо-
лезней РАМН
СИГИДИН
Яков Александрович ~~ д-р мед. наук, профессор, руководи-
тель лаборатории клинической фар-
макологии Института ревматологии
РАМН
СИМОНОВА
Марина Владимировна — канд. мед. наук, Институт ревматоло-
гии РАМН
СМИРНОВ
Александр Викторович — канд. мед. наук, руководитель группы
по денситометрической диагностике
Института ревматологии РАМН
СОЛОВЬЕВ
Сергей Константинович — д-р мед. наук, зав. лабораторией ин-
тенсивной терапии отдела по изуче-
нию механизмов и коррекции аутоим-
мунитета Института ревматологии
РАМН
ФОЛОМЕЕВА
Ольга Михайловна — канд. мед. наук, руководитель лабора-
тории научно-организационных проб-
лем ревматологии Института ревмато-
логии РАМН
6
ЦВЕТКОВА
Елена Сергеевна — канд. мед. наук, ведущий научный со-
трудник лаборатории серонегативных
артритов и артроза Института ревма-
тологии РАМН
ШЕМЕТОВ
Дмитрий Алексеевич — ассистент кафедры факультетской тера-
пии Российского государственного ме-
дицинского университета
ШОСТАК
Надежда Александровна —
д-р мед. наук, профессор, зав. кафедрой
факультетской терапии Российского
государственного медицинского уни-
верситета
ПРЕДИСЛОВИЕ
Значение вышедших в 1989 и 1997 гг. руководств по ревматичес-
ким болезням трудно переоценить, поскольку они позволили широко-
му кругу врачей познакомиться с наиболее значимыми болезнями опор-
но-двигательного аппарата и соединительной ткани, которые относят
к ревматическим. О широком распространении знаний в области рев-
матологии свидетельствуют статистические данные за 1998 г., соглас-
но которым распознавание болезней костно-мышечной системы прак-
тическими врачами поликлиник было почти на таком же уровне, как
и сердечно-сосудистых заболеваний. Соответственно прогрессивно
повышалась общая заболеваемость по обращаемости не только с вос-
палительными болезнями, но и так называемыми дегенеративными.
Так, с 1988 по 1999 г. общее число больных с болезнями, включенны-
ми в XIII класс МКБ-Х (болезни костно-мышечной системы и соеди-
нительной ткани), увеличилось с 7,5 млн до более чем 12 млн, при этом
в 1999 г. было выявлено 2 млн больных детей и подростков. К концу
XX в. увеличилась «прослойка» больных старших возрастных групп,
как и в целом популяция людей пожилого возраста, составляющая
более 21 % от общего числа россиян. В связи с увеличением доли
«маргинальных» групп населения — детей и стариков — в общем
числе больных необходимо пересмотреть приоритетность направлений
развития ревматологии в сторону более активной разработки фунда-
ментальных и практических проблем педиатрической и гериатричес-
кой ревматологии.
В области педиатрической ревматологии необходимо более тща-
тельное изучение генетически детерминированного гипермобильного
синдрома, являющегося причиной развития нередко тяжелого пораже-
ния опорно-двигательного аппарата в виде плоскостопия и сколиозов,
а также нагрузочных суставов и сердечно-сосудистой системы в виде
пролапса митрального клапана сердца. При этом также следует об-
ратить внимание на то, что при гипермобильном синдроме возможны
образование грыж, разрывы связок и сухожилий, возникновение пнев-
мотораксов в связи с повреждением легочной ткани и развитие дру-
гой патологии. Важно и другое: накапливается все больше данных о
роли гипермобильности суставов как фактора риска развития остео-
артрозов и поражения позвоночника, особенно шейного отдела, в
молодом возрасте.
Для гериатрической ревматологии характерны полиморбидность
и полипрагмазия, нередко обусловливающие несовместимость лекар-
8
ственных препаратов или, наоборот, их синергическую активность,
дающую токсический эффект. Старшим возрастным группам свой-
ственны собственные болезни, среди которых ревматическая полими-
алгия, подробно описанная в обоих руководствах, нередко сочетаю-
щаяся с темпоральным артериитом (болезнь Хортона). К болезням
пожилого возраста относятся также идиопатический диффузный гипе-
ростоз скелета и детально рассмотренное в настоящих лекциях свое-
образное поражение суставов с мягким отеком кистей и др.
Естественно, вызывает интерес вопрос о месте ревматологии сре-
ди других медицинских специальностей и о тех фундаментальных про-
блемах, познание которых в рамках ревматологии стало поводом для
их изучения в других отраслях медицины. Из таких проблем в пер-
вую очередь необходимо отметить обоснование роли молекулярной
мимикрии как основополагающего звена в механизмах перехода
стрептококковой (группы А) инфекции в ревматическую лихорадку.
Молекулярная мимикрия — антимикробный ответ организма на дей-
ствие патогенных агентов, способный в свою очередь перекрестно
реагировать с аутоантигенами, приводя к индукции аутоиммунного
ответа и иммуноопосредованного воспаления. Применительно к рев-
матической лихорадке установлена антигенная общность типоспеци-
фических эпитопов М-протеина стрептококка группы А и перекрест-
но реагирующих эпитопов миозина, тканей суставов и мозга, распо-
ложенных в тесной близости с типоспецифическими.
При анкилозирующем спондилоартрите также обнаружена пере-
крестно реагирующая реактивность 6 аминокислотных последователь-
ностей в сегменте HLA-B27.05 и нейрогеназах Klebsielle pneumonia,
а при реактивных энтероартритах — 5 аминокислотных последова-
тельностей в том же сегменте HLA-B27.05 и плазмиде pHS-2 Shigella
flexneri и 3 во внешней мембране белка YOP1 Yersinia enterocolitica.
Однако феномен молекулярной мимикрии имеет значение и при дру-
гих заболеваниях, например в реализации инфекции, вызванной ви-
русом Коксаки В, в развитии миокардита.
Все большее общемедицинское значение приобретает Лайм-борре-
лиоз, при котором проникающая в кровяное русло спирохета (борре-
лия) обладает тропизмом к тканям не только суставов, но также сер-
дца и мозга и вызывает развитие синовита, разнообразных пораже-
ний нервной системы — от серозного менингита до полирадикулонев-
ритов и периферических невритов черепных нервов. Следовательно,
знание клиники и методов раннего лечения Лайм-боррелиоза важно
не только для ревматологов, но и для дерматологов, кардиологов и
невропатологов.
Столь же важно распространение среди широкого круга медицин-
ских работников знаний об антифосфолипидном синдроме. Распозна-
вание природы описанных в 50-е годы рецидивирующих венозных и
артериальных тромбозов в сочетании с тромбоцитопенией и ложно-
положительной реакцией Вассермана при системной красной волчан-
ке стало одним из важнейших достижений середины XX в. В сущнос-
9
ти трудно найти какой-либо орган или систему органов, которые не
вовлекались бы в патологический процесс при антифосфолипидном
синдроме (вторичном или первичном). Установлено, что ряд клини-
ческих синдромов связан с циркуляцией антифосфолипидных антител:
синдром Бадда—Киари, легочная гипертензия, синдромы верхней и
нижней полых вен, хронические язвы голени и сетчатое ливедо, синд-
ром Снеддона, поперечный миелит, почечная тромботическая микро-
ангиопатия и др. Особенно большое внимание привлекли к себе аку-
шерские проблемы —рецидивирующие спонтанные аборты и внутри-
утробная гибель плода. Поражает воображение, как быстро были
установлены основные механизмы развития антифосфолипидного син-
дрома, связанные с образованием антител к различным фосфолипидам,
и роль при этом кофактора, каковым является Р2-гликопротеин 1, а
возможно, и другие белки. Огромное значение этой проблемы в со-
временной клинической практике состоит в правильном определении
иммуноопосредованных причин тромбозов и проведение антикоагу-
лянтной терапии, однако необходимо дальнейшее изучение вопросов
лечения и профилактики антифосфолипидного синдрома.
Одна из важных проблем XXI в. — взаимоотношения системных
ревматических заболеваний и атеросклероза. В связи с этим небезын-
тересно отметить, что еще в середине XX в. была общепризнанной
точка зрения, согласно которой ревмокардит, ревматические пороки
сердца и другие воспалительные ревматические заболевания находятся
как бы в конкурентных взаимоотношениях с атеросклерозом и, в ча-
стности, с коронаросклерозом. Однако в последней четверти XX в.
было отмечено достаточно частое развитие инфаркта миокарда как
при системной красной волчанке, так и при ревматоидном артрите.
При этом не всегда, а, скорее, крайне редко обнаруживались класси-
ческие факторы риска развития сердечно-сосудистой патологии, ус-
тановленные в популяционных исследованиях. Поэтому основное вни-
мание было уделено изучению влияния длительной глюкокортикосте-
роидной терапии, способствовавшей увеличению продолжительнос-
ти жизни больных с системной красной волчанкой и, таким образом,
реализации возрастных аспектов развития атеросклероза. Однако на-
капливается все больше данных, свидетельствующих о том, что при
таких иммуновоспалительных заболеваниях, как системная красная
волчанка и ревматоидный артрит, имеют значение и другие факторы
риска, а не только лечение кортикостероидами. В последние годы
показано, что развитие атеросклеротического процесса, нередко про-
грессирующего, обусловлено многообразными факторами. В частно-
сти, обсуждается вопрос о связи атеросклеротического процесса, осо-
бенно при системной красной волчанке, не только с длительным при-
емом кортикостероидов, но и с нередко выявляемым поражением по-
чек и развитием почечной гипертензии, а также наличием антифосфо-
липидных антител.
Согласно одной из последних гипотез атерогенеза, определенное
значение придают повышению уровня сывороточного гомоцистеина,
10
обладающего способностью оказывать прямое и непрямое поврежда-
ющее воздействие на эндотелий. Причина возникновения гипергомо-
цистеинемии при системной красной волчанке все еще недостаточно
ясна, хотя нельзя исключить роль пищевого фактора и систематичес-
кого приема глюкокортикостероидов. В известной мере неожиданно-
стью были данные о развитии гипергомоцистеинемии у больных рев-
матоидным артритом, леченных метотрексатом, которое обусловле-
но его антифолатным эффектом. Неудивительно, что в конце XX в. и
системную красную волчанку, и ревматоидный артрит стали рассмат-
ривать как факторы риска возникновения сосудистых катастроф, кон-
кретные причины которых предстоит уточнить. В связи с этим огром-
ное практическое значение имеют накопление клинического и науч-
ного материала, тщательное обследование больных и длительное на-
блюдение за ними с целью выявления нарушений липидного обмена и
факторов, способствующих поражению сосудистой системы, в том
числе при гипергомоцистеинемии.
Тот факт, что кортикостероидная терапия получила широкое рас-
пространение в ревматологии, хорошо известен. Однако история это-
го открытия любопытна с точки зрения подтверждения огромной роли
клинического наблюдения. В апреле 1929 г. американский ревмато-
лог Ph.S.Hench наблюдал больную, у которой ремиссия ревматоид-
ного артрита развилась во время желтухи, а в 1930 г. он отметил
аналогичный эффект у женщин, больных артритом, во время беремен-
ности. Оба клинических наблюдения позволили Ph.S.Hench предпо-
ложить, что во время беременности и при желтухе вырабатывается
один и тот же противовоспалительный компонент, получивший назва-
ние «субстанция X», которая, скорее всего, является гормоном, об-
щим для мужчин и женщин. Небезынтересно, что в мае 1948 г. биохи-
миком E.C.Kendall и доктором L.Z.Sarett из желчи было выделено
несколько граммов 17-гидрокси-11-дегидрокортикостерона, названно-
го субстанцией Е. В сентябре 1948 г. это вещество было введено боль-
ной ревматоидным артритом, у которой был отмечен такой же эффект,
как и у больных во время беременности и при желтухе.
За прошедшие более чем 50 лет кортикостероидная терапия полу-
чила широчайшее распространение и по-прежнему занимает важное
место в лечении больных с ревматическими болезнями как мощней-
шее противовоспалительное средство, дающее местный (при внутри-
суставном введении) или системный эффект Однако, как и 50 лет
назад, не решена проблема безопасности лечения, что касается дози-
ровок, назначения препарата с учетом циркадианных ритмов, комби-
нации с лекарствами иммуносупрессивного действия и др., а это оз-
начает, что в XXI в. проблема эффективности и безопасности лече-
ния кортикостероидами будет столь же актуальной, как и в первые
годы их клинического применения.
Огромным достижением последнего десятилетия XX в. стало от-
крытие механизмов противовоспалительной и токсической активнос-
ти аспирина и нестероидных противовоспалительных препаратов.
И
Показана роль ключевого фермента циклооксигеназы в превращении
арахидоновой кислоты в противовоспалительные и цитопротективные
простагландины. Установлено, что оба эффекта обусловлены двумя
изоферментами: провоспалительным — ЦОГ-2 и физиологическим —
ЦОГ-1. Однако результаты клинических наблюдений свидетельству-
ют, что ЦОГ-2 вовлечена не только в воспалительный, но и в опухо-
левый процесс; в частности, показано, что бессмертие клеток некото-
рых видов эпителиального рака (толстой кишки, желудка, молочных
желез и др.) обусловлено гиперэкспрессией ЦОГ-2 на поверхности этих
клеток. На этой основе создано новое направление применения несте-
роидных противовоспалительных препаратов — химиопрофилакти-
ческое. Небезынтересно отметить, что понимание механизмов действия
нестероидных противовоспалительных препаратов способствовало
созданию новых лекарственных средств, селективно (преимуществен-
но) подавляющих ЦОГ-2, как это свойственно мелоксикаму, или спе-
цифически (исключительно) воздействующих на ЦОГ-2, что харак-
терно для целекоксиба и рофекоксиба.
Нами не рассмотрены достижения новых инструментальных и им-
мунодиагностических исследований, значение которых трудно пере-
оценить. Однако, учитывая, что лекции предназначены для клиници-
стов широкого профиля, а не только ревматологов, мы сочли инте-
ресным и важным показать роль клинициста, его наблюдательности и
постоянного анализа в выявлении новых интересных клинических фак-
тов.
Мы глубоко убеждены, что для клинициста не должно и не может
быть неинтересных больных, ему необходимо развивать постоянное
желание находить особенности клинических проявлений и стараться
их понять. Подтверждение этого — история открытия кортикостерои-
дов, Лайм-боррелиоза, антифосфолипидного синдрома, иммуноопос-
редованных механизмов развития атеросклероза и решение многих
других важных проблем второй половины XX в. Ревматология все-
гда была полна загадок и остается постоянно изменяющейся научно-
практической дисциплиной, поскольку изучает в клинике подвижный
субстрат, каковым является соединительная ткань.
В.А.Насонова,
Н.В.Бунчук,
Е.Л.Насонов
СПИСОК СОКРАЩЕНИЙ
АНФ — антинуклеарный фактор
АФС — антифосфолипидный синдром
БЛ — болезнь Лайма
ВИЧ — вирус иммунодефицита человека
ГКС — глюкокортикостероиды
ДБСТ — диффузные болезни соединительной ткани
ДНК — дезоксирибонуклеиновая кислота
ЖКТ — желудочно-кишечный тракт
ИЛ — интерлейкины
ПФ — интерфероны
ИФу — интерферон-гамма
IgG — иммуноглобулин G
IgM — иммуноглобулин М
мпк — минеральная плотность кости
нпвп — нестероидные противовоспалительные препараты
ОА -- остеоартроз
оп — остеопороз
пг — простагландины
РА — ревматоидный артрит
РЗ — ревматические заболевания
РНК — рибонуклеиновая кислота
РФ — ревматоидный фактор
СКВ — системная красная волчанка
спид синдром приобретенного иммунодефицита
СРБ -- С-рсактивный белок
ССД — системная склеродермия
ТФР — трансформирующий фактор роста
ФИО — фактор некроза опухоли
ЦИК — циркулирующие иммунные комплексы
цог — циклооксигеназа
эк — эндотелиальные клетки
ЭКГ - -- электрокардиограмма
ЮРА — ювенильный ревматоидный артрит
ЮУП ювенильный узелковый полиартериит
ЮХА — ювенильный хронический артрит
HLA - (human lymphocyte antigens) главный комплекс гистосовмес- тимости у человека
Лекция 1
ЭПИДЕМИОЛОГИЯ РЕВМАТИЧЕСКИХ
ЗАБОЛЕВАНИЙ — ВЧЕРА И СЕГОДНЯ
Профессор Л.И. Беневоленская (Институт ревматологии
РАМН)
Изучение распространенности, заболеваемости, смертности и про-
филактики ревматических заболеваний становится, по рекомендации
ВОЗ, важной составной частью национальных программ сохранения
здоровья населения и основой планирования медицинской помощи.
Эпидемиология неинфекционных заболеваний — наука о законо-
мерностях возникновения и распространения болезней, факторах рис-
ка и мерах массовой профилактики; в отличие от клиники она изуча-
ет болезнь как массовое явление, что определяет особенности ее ме-
тодологии.
Эпидемиология неинфекционных болезней, к которым принадле-
жат и ревматические заболевания, сформировалась в России как са-
мостоятельное направление в науке к концу 60-х годов. К этому
времени изменилась структура болезней: исчезли особо опасные ин-
фекции (чума, холера), стали преобладать неинфекционные: сердеч-
но-сосудистые, онкологические, психические, ревматические и дру-
гие заболевания. Появилась необходимость их изучения как массо-
вого явления. Большая и длительная дискуссия о правомерности
выделения эпидемиологии неинфекционных заболеваний в самосто-
ятельное направление завершилась признанием правомерности ее
существования.
Эпидемиология отличается мультидисциплинарностью, что обус-
ловлено многопрофильностью рассматриваемых на популяционном
уровне задач. Она использует не только опыт клиницистов, но и дос-
тижения и методы микробиологии, иммунологии, биохимии, генетики,
социальной гигиены и организации здравоохранения, социологии,
демографии, статистики и др.
Основные направления исследований в эпидемиологии ревматичес-
ких заболеваний:
— совершенствование методов с внедрением компьютерных сис-
тем;
— разработка и совершенствование критериев диагностики, но-
менклатуры и классификации болезней;
— изучение распространенности ревматических заболеваний сре-
ди городского и сельского населения в различных климатоге-
ографических зонах, на промышленных предприятиях, среди
разных этнических групп населения;
14
— проспективные лонгитудинальные исследования заболеваемо-
сти, создание системы регистра;
— изучение наследственных и средовых (инфекционных, соци-
альных, семейных и др.) факторов с целью определения их зна-
чимости в этиологии и патогенезе ревматических болезней,
выделения факторов риска;
— прогнозирование заболеваемости;
— изучение инвалидности и временной нетрудоспособности боль-
ных хроническими ревматическими заболеваниями;
— разработка и внедрение профилактических и реабилитационных
программ;
— многоцентровые исследования, национальные программы, меж-
дународная кооперация.
За прошедший период был разработан и осуществлен ряд комп-
лексных национальных программ, которые дали возможность на боль-
ших выборках населения, в более короткие сроки и на высоком уров-
не решать сложные научные задачи в области эпидемиологии, оказы-
вать непосредственно квалифицированную помощь населению.
Впервые при разработке дизайна исследования определялся круг
основных методических вопросов: стандартизация всех методов сбо-
ра информации — от создания вопросников (карт), являющихся пер-
вичными носителями информации, до использования единых диагнос-
тических критериев, унификации инструментальных и лабораторных
методов, включая стандартизацию расшифровки рентгенограмм, элек-
тро- и фонограмм, методов забора материала и т.д.; создание систе-
мы единого статистического анализа данных и др.
Одной из важнейших задач эпидемиологии является унификация
диагностики, которая достигается использованием единых диагности-
ческих критериев. Чрезвычайно трудно было убедить клиницистов в
необходимости использования критериев диагностики для исключения
врачебного субъективизма. Нами были разработаны критерии диаг-
ностики ревматизма (ревматическая лихорадка, ревматические поро-
ки сердца), остеоартроза, подагры, с внедрением в эпидемиологичес-
кие исследования международных критериев, что позволило, особен-
но при многоцентровых исследованиях, получать сравнимые адекват-
ные результаты.
В круг основных задач эпидемиологии входит изучение распрост-
раненности важнейших ревматических заболеваний среди различных
контингентов населения. Так, в 8 городах (Ярославль, Иркутск,
Новосибирск, Владивосток, Красноводск, Вильнюс, Одесса, Душан-
бе) было проведено по единому дизайну одномоментное обследование
взрослого населения (по 7000 человек в каждом центре) на распрост-
раненность ревматизма, РА, анкилозирующего спондилоартрита, ОА,
подагры, псориатического артрита.
Частота ревматизма (использовались критерии Американской рев-
матологической ассоциации, АРА; 1966 г.) равна в среднем 1,5 % (оп-
15
ределенный — 1 %, вероятный — 0,5 %), ревматоидного артрита —
0,42 % (от 0,12 до 0,7 % в разных центрах). Распространенность АС
(по тем же критериям) колеблется в пределах от 0,01 до 0,09 % в раз-
ных центрах (в среднем 0,05 %), причем среди мужчин в 6,5 раза выше
(0 09 %), чем среди женщин (0,015 %); частота подагры равна в сред-
нем 0,1 % (0,02 — 0,26 %) [1].
Первые исследования эпидемиологии РА с использованием единых
критериев диагностики РА, предложенные АРА (1961), проведены под
руководством проф. М.Г.Астапенко в Институте ревматологии РАМН
за период с 1962 по 1973 г.
В последующие годы получены данные о распространенности
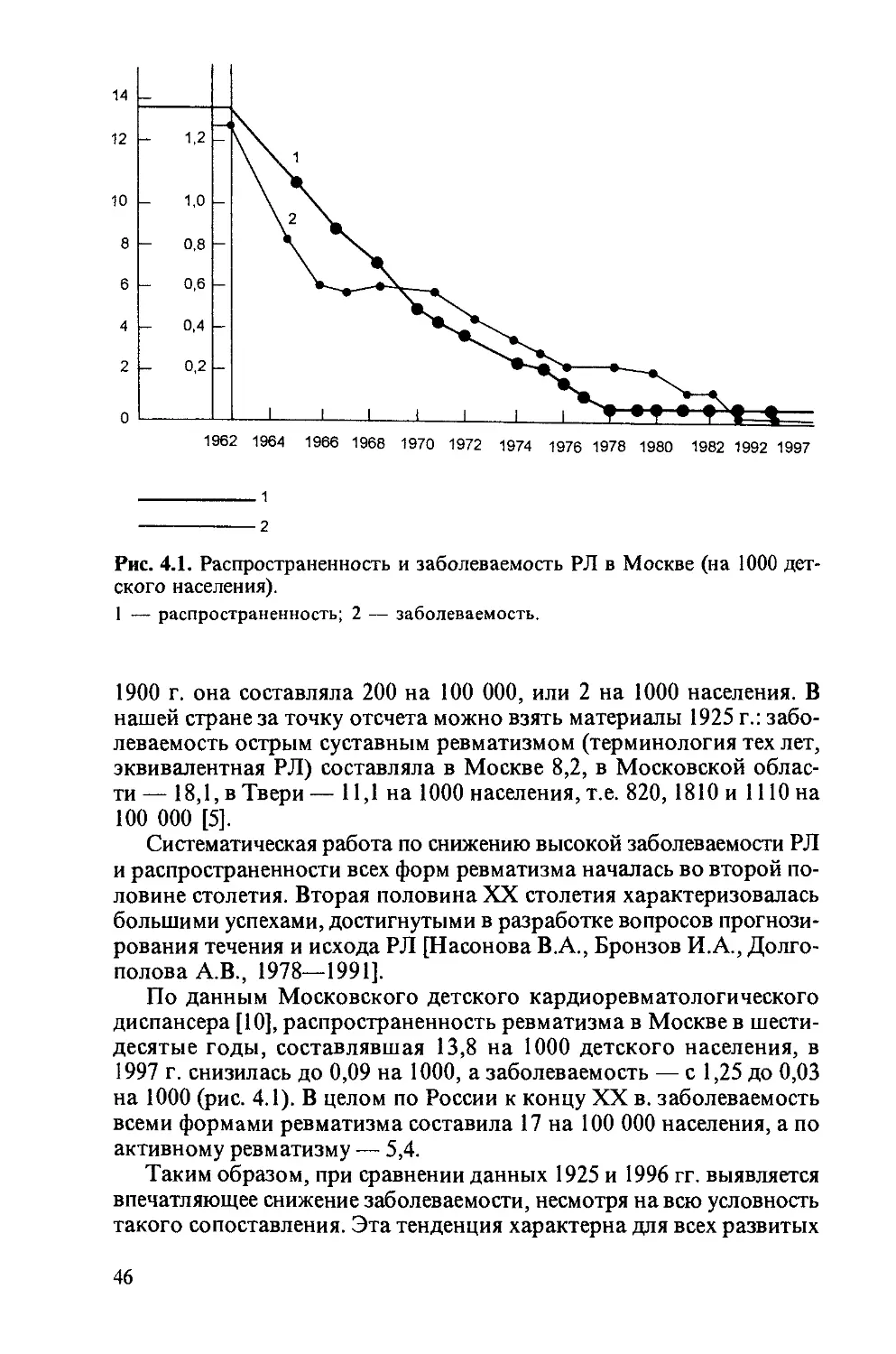
СКВ [3] и БЛ [2], ЮРА [5]. Так, распространенность СКВ (основание —
обращаемость больных за медицинской помощью среди взрослого на-
селения Свердловской области) составила 7,5 случаев на 100 000 на-
селения, среди женщин и мужчин соответственно 13,0 и 1,9 [3].
Впервые изучены клинико-эпидемиологические закономерности БЛ
на Среднем Урале. Частота БЛ по данным регистрации составила по
Екатеринбургу 18,5, а по области — 9,8 на 100 000 населения. Пора-
жения опорно-двигательного аппарата (в основном в виде миалгий,
артралгий и реже — артрита, миозита, синдрома фибромиалгии) име-
ли место у 33 % больных. В структуре БЛ преобладали поражения
нервной системы (20 %), частота артрита не превышала 4 %, у 66 %
больных БЛ ограничивалась мигрирующей эритемой [2].
До сих пор мы располагаем лишь единичными данными о распро-
страненности ювенильного ревматоидного артрита (ЮРА). Поэтому
представляет большой интерес эпидемиологическое исследование
ЮРА, основанное на данных обращаемости больных за медицинской
помощью, согласно которым распространенность достоверного ЮРА
в соответствии с восточноевропейскими (1979) критериями и крите-
риями АРА (1973) составила 0,31 на 1000 детского населения, веро-
ятного — 0,12/1000, а показатель суммарной частоты заболевания
достигал 0,40/1000 [5].
Эпидемиологические исследования показали, что в структуре рев-
матических заболеваний первое место занимает остеоартроз (ОА).
Следует подчеркнуть, что изучение ОА в популяции стало возможным
лишь после разработки в нашем отделе критериев диагностики с оп-
ределением их чувствительности, специфичности и информативности.
Сравнительная оценка чувствительности и специфичности наших кри-
териев и критериев ОА коленных суставов АРА (1987) показала оди-
наковую чувствительность наших (93,4 %) и клинических критериев
АРА (93,4 %) при более низкой специфичности (62,1 %) американских
критериев по сравнению с нашими (79,3 %), хотя последние были
разработаны для эпидемиологических исследований и диагностики О А
любой локализации.
При многоцентровом исследовании ОА (обследованы 41 348 че-
ловек городского населения) частота ОА составила в среднем 6,45 %
(4,4—7,3 %), определенного 5,1 %, вероятного 1,3 %.
16
Значительно более высокая распространенность ОА обнаружена
при обследовании рабочих и служащих различных промышленных
предприятий. Многоцентровое исследование проведено также по еди-
ному дизайну с использованием унифицированных критериев и пред-
варительным обучением персонала. Частота ОА (сочетание — пери-
ферические суставы и позвоночник) среди рабочих одного из маши-
ностроительных предприятий Москвы достигала 24,6 % — у женщин
38,5 %.
Эпидемиологическое исследование среди рабочих динасового за-
вода, занятых тяжелым физическим трудом, позволило выявить раз-
личные ревматические болезни (23 вида) у 47,9 %, ОА периферичес-
ких суставов — у 57 %, позвоночника — у Г8,2 % [7].
Заболеваемость с временной утратой трудоспособности, обуслов-
ленная ревматическими болезнями, занимает в общей структуре вто-
рое (на большинстве предприятий) или третье место после острых
инфекций респираторного тракта и сердечно-сосудистых заболеваний.
Вместе с тем профилактика, систематическое лечение и реабилитация
пациентов, особенно в условиях санатория-профилактория, позволи-
ла снизить нетрудоспособность в 2—3 раза и улучшить качество жиз-
ни больных.
Серьезная проблема, особенно на промышленных предприятиях —
установление правильного диагноза при жалобах на боли в нижнем
отделе спины (БНС). Учитывая большие трудности, а часто просто
невозможность нозологической диагностики, во всем мире принято
выделять этот синдром как БНС, что нашло отражение в современ-
ной номенклатуре и классификации болезней (IX—X пересмотры). Как
показали наши исследования, у 48 % работников одного из промыш-
ленных предприятий в течение длительного периода имели место БНС,
причем в последний год — у 31,5 %. При рентгенологическом обсле-
довании пациентов с БНС у 13,6 % не выявлено патологии, что сви-
детельствует об определенной доле неспецифической боли в структу-
ре синдрома БНС.
Выявлены факторы, способствующие БНС: частый подъем тяжес-
тей, работа в вынужденном положении, интенсивное курение, отсут-
ствие спортивной активности, избыточная масса тела и др. [6].
В течение последних 10 лет изучалась эпидемиология спондилоар-
тропатий среди этнических групп населения России с высокой часто-
той HLA-B27 (чукчи, эскимосы — Чукотка; мордва, мари — финно-
угорская группа народов Поволжья). Всего при экспедициях обсле-
дованы 832 жителя Чукотки и 1312 лиц старше 15 лет финно-угорс-
кой группы. Цель исследования — изучить распространенность, ди-
агностический спектр спондилоартропатий (СА) среди населения с
высокой предполагаемой частотой HLA-B27. Была выявлена высо-
кая частота HLA-B27 на Чукотке — 32,3 %, в том числе среди эски-
мосов — 39,7 %, чукчей — 28,6 %. Обнаружена высокая корреляция
между частотой В27 и распространенностью С А (г=0,99). Распрост-
раненность СА составила 2,3 %, в том числе среди эскимосов — 3,1 %,
17
чукчей — 1,9 %. В угро-финнской популяции Поволжья эта связь ока-
залась несколько меньше (г—0,65), что связано как с меньшей часто-
той HLA-B27 (мордва — 14 %, мари — 26 %), так и более низкой
распространенностью СА: мордва — 0,59 %, мари — 0,43 %. Резуль-
таты олиготипирования гена HLA-B27 как среди В27-позитивных
здоровых лиц, так и среди больных выявили только один «европеоид-
ный» субтип HLA-B2705, что дает основание думать о том, что ассо-
циация между СА и В27 связана, по-видимому, не со структурными
вариантами В27 гена, а с общей детерминантой В27 гена. Более низ-
кая распространенность СА в угро-финнских популяциях по сравне-
нию с Чукоткой, по-видимому, в большей степени ассоциирована с
генотипическими особенностями этносов (ген HLA-B27), хотя нельзя
исключать и сильного влияния среды — проживание населения в луч-
ших климатических и социальных условиях (опосредованное влияние
на устойчивость генотипа) [8].
Одна из актуальных проблем медицины, разработкой которой за-
няты практически все страны мира, — остеопороз — заболевание, для
которого характерна низкая минеральная плотность кости (МПК),
приводящая к повышенному риску переломов. Последствия остеопо-
роза в виде переломов трубчатых костей и позвоночника обусловли-
вают значительный подъем заболеваемости, смертности и инвалидно-
сти среди лиц пожилого возраста. Трагедией для человека пожилого
возраста является перелом шейки бедра: 20 % из них умирают в тече-
ние 6 мес после перелома, у половины больных снижается качество
жизни, а */3 утрачивают независимость и нуждаются в длительном
постоянном уходе. По нашим эпидемиологическим данным, низкая
МПК в поясничном отделе позвоночника и шейке бедра имеет место
в среднем у 20—50 % женщин 50 лет и старше. Частота переломов
шейки бедра, которая в большой степени подлежит медицинскому
учету в ретроспективном исследовании, проведенном в 2 городах
России, составила в Электростали 77,1 случая на 100 000 среди жен-
щин и 39,2 — среди мужчин, в Ярославле соответственно 69,9 среди
женщин и 45 — среди мужчин, значительно нарастая с возрастом [4].
В разработке проблемы остеопороза, а также в обучении врачей раз-
личных специальностей в этой области Институт ревматологии зани-
мает одно из лидирующих мест.
Важным разделом аналитической эпидемиологии является изуче-
ние факторов риска. Принятый в эпидемиологии неинфекционных
заболеваний термин «факторы риска» предполагает выделение при
массовых эпидемиологических обследованиях населения причин, яв-
лений, условий, повышающих вероятность возникновения, распрост-
ранения и развития заболевания, его неблагоприятного течения и ис-
хода. Введение этого понятия было продиктовано необходимостью
выделить среди множества причин, сопутствующих развитию болез-
ни, ограниченную группу факторов, имеющих с ней связь.
В настоящее время практически при всех основных ревматических
заболеваниях выделены факторы риска: пол, возраст, этнические осо-
18
бенности, генетические факторы, профессиональные условия труда,
избыточная масса тела, курение, алкоголь и др. Важно подчеркнуть,
что факторы риска важны для диагностики и определения тактики
лечения и профилактики: при сочетанном воздействии риск заболева-
ния значительно возрастает, а подверженность заболеванию прямо
пропорциональна количеству, величине и длительности воздействия
факторов, хотя существующие внутренние связи между факторами
риска и болезнью часто трудно объяснить. Вклад отечественных рев-
матологов в разработку этой проблемы несомненен.
За последние 10—15 лет активно развивается эпидемиологическая
фармакотерапия, призванная разрабатывать и активно внедрять но-
вые принципы и методы лечения и профилактики заболеваний, осо-
бенно широко распространенных, таких как ОА, остеопороз, синдром
БНС и т.д.
В заключение хотелось бы подчеркнуть, что за прошедшие годы
по сути созданы новая дисциплина в медицине — эпидемиология не-
инфекционных болезней, новое направление исследований в ревмато-
логии — эпидемиология. Перспективы развития в области эпидемио-
логии могут быть представлены следующим образом.
1. Разработка и внедрение профилактических программ, особенно
при широко распространенных заболеваниях, на регионарном и в
целом государственном уровнях.
2. Изучение распространенности ревматических заболеваний.
3. Проверка теоретических гипотез о факторах риска, выявление
новых факторов риска.
4. Дальнейшее развитие эпидемиологической фармакотерапии в
целях первичной и вторичной профилактики заболеваний.
5. Разработка и осуществление крупных национальных программ
(многоцентровые исследования).
6. Международная кооперация.
СПИСОК ЛИТЕРАТУРЫ
1. Беневоленская Л.И., Бржезовский М.М. Эпидемиология ревматических
болезней. — М.: Медицина, 1988. — 240 с.
2. Лесняк О.М. Клинико-эпидемиологические закономерности Лайм-бор-
релиоза на Среднем Урале: Автореф. дис. ... д-ра мед. наук. — М., 1995. —
26 с.
3. Лесняк О.М. Изучение наследственности, антигенов гистосовместимос-
ти и некоторых иммунологических параметров в семьях больных СКВ:
Автореф. дис. ... канд. мед. наук. — М., 1987. — 20 с.
4. Михайлов Е.Е., Беневоленская Л.И., Мылов Н. М. Распространенность пе-
реломов позвоночника в популяционной выборке лиц 50 лет и стар-
ше // Вестн. травматол. и ортопед. — 1997. - - - № 3. — С. 20—27.
5. Румба И.В. Клинико-генетическое исследование ЮРА: Автореф. дис. ...
канд. мед. наук. — М., 1990. — 20 с.
6. Торопцова Н.В., Беневоленская Л.И., Карякин А.Н., Сергеев И.П. Распро-
19
страненность болей в нижнем отделе спины среди рабочих промыш-
ленных предприятий России // Клин, ревматол. -- 1994. — № 2. —
С. 26—29.
7. Ходырев В.Н. Эпидемиологическое исследование остеоартроза среди ра-
бочих, занятых тяжелым физическим трудом: Автореф. ди с. ... канд. мед.
наук. — М., 1989. — 20 с.
8. Эрдес Ш.Ф. Эпидемиология спондилоартропатий и HLA-B27 средн
этнических групп населения Российской Федерации: Автореф дис. ...
д-ра мед. наук. — М., 1998. — 27 с.
Лекция 2
ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ
В ИДЕНТИФИКАЦИИ ГЕНОВ
ПРЕДРАСПОЛОЖЕННОСТИ
К РЕВМАТИЧЕСКИМ ЗАБОЛЕВАНИЯМ
Ц-р мед. наук В.А.Мякоткин (Институт ревматологии
РАМН)
Этиология большинства ревматических заболеваний (РЗ), широ-
ко распространенных среди населения, и в настоящее время остается
не вполне ясной, что обусловливает широкий поиск как средовых, так
и генетических факторов, ответственных за их этиологию.
В Институте ревматологии систематические исследования струк-
туры наследственной предрасположенности РЗ проводятся в течение
последних 25 лет с использованием генеалогического, близнецового,
популяционно-генетического, иммуногенетического и молекулярно-
генетического методов исследования.
Проведенные нами исследования, также как и работы зарубеж-
ных авторов [1], показали, что вклад генетических факторов в де-
терминацию РЗ превалирует над вкладом средовых факторов. Это
открывает перспективы поиска генов предрасположенности к рев-
матическим заболеваниям с использованием методологии «обрат-
ной генетики». Стратегия «обратной генетики» применительно к
поиску генов предрасположенности на первом этапе подразумевает
их локализацию на конкретном участке конкретной хромосомы (т.е.
картирование) с помощью анализа сцепления с генетическими мар-
керами, хромосомная локализация которых уже известна. Анализ
сцепления представляет собой проверку совместного или независи-
мого наследования заболевания и генетических маркеров в семьях.
Чем ближе на хромосоме расположены ген предрасположенности к
заболеванию и гены генетических маркеров, тем чаще они наследу-
ются совместно в родословных, что позволяет с помощью показате-
20
лей частоты рекомбинации между ними определить хромосомную ло-
кализацию гена чувствительности. Количественным показателем
сцепления является логарифм соотношения шансов за и против его
наличия в обследованной семье — лод-балл. Суммарная величи-
на лод-баллов для выборки семей, равная +3,0 и более (что соот-
ветствует вероятности р=0,001 и менее), свидетельствует о нали-
чии сцепления, тогда как величина -2,0 и менее — о его отсутст-
вии.
Для выявления гена предрасположенности с помощью анализа
сцепления используются в основном два подхода: а) отбираются
гены-кандидаты на роль главного гена и исследуется их полимор-
физм в информативных семьях с последующим подсчетом лод-бал-
лов, причем отрицательное значение этого показателя (-2,0 и менее)
позволяет однозначно исключить ген-кандидат из претендентов на
роль главного гена; б) подбираются полиморфные, достаточно ин-
формативные (с высоким уровнем гетерозиготности) ДНК-маркеры
(от 15 и более на хромосому), проводится тестирование семей с пос-
ледующим анализом сцепления между заболеванием и всеми исполь-
зованными маркерами. Полученные в результате такого анализа
значения лод-баллов помогают определить сегмент хромосомы, в
котором может быть локализован ген предрасположенности к забо-
леванию.
Таким образом, методология «обратной генетики» открывает
возможности для поиска генов предрасположенности, не имея пред-
варительной информации о их количестве, функции и значимости в
этиопатогенезе заболевания.
В рамках вышеизложенной методологии в последние годы был
проведен широкий поиск генов чувствительности к ряду РЗ. Так,
Shiozawa и соавт. (1997) на семьях с повторными случаями РА
проскринировали все хромосомы, использовав для этой цели 358 по-
лиморфных ДНК-маркера. В результате проведенной работы мето-
дом анализа сцепления были выделены два перспективных для по-
иска генов чувствительности к РА участка на Х-хромосоме, в кото-
рых локализованы ген рецептора фактора некроза опухолей и ген
лиганда CD40, являющихся, по мнению авторов, генами-кандидата-
ми предрасположенности к РА. F.Cornells и соавт. (1997), использо-
вав сходную методологию, выявили два критических хромосомных
участка, маркеры которых сцеплены с РА и могут содержать гены
чувствительности к заболеванию. Один из этих участков распола-
гается на Х-хромосоме (локализация соответствует данным японс-
ких авторов), тогда как другой расположен в том же самом сегмен-
те 3-й хромосомы, где и ген IDDM9, являющийся одним из генов,
детерминирующих чувствительность к инсулинзависимому диабету.
По данным авторов, вклад этого гена в детерминацию заболевания
составляет около 27 %.
Нами проведен анализ сцепления в двух, трех и четырех поколе-
ниях сорока семей с повторными и множественными случаями РА с
21
Таблица 2.1. Результаты тестирования генов-кандидатов предрасполо-
женности к РА
Гены-кандидаты Хромосомная локализация Маркеры генов-каидида гов Л оч-баллы
HLA 6р21 Антигены HLA 2,11
COLIA2 7q21 - q22 Rsal ПДРФ 2,32
COLIIA1 12ql4 VNTR -2,40
TCRB 7q35 VNTR 3,81
TCRA 14qll VNTR +0,94
1CRD 14ql 1 VN1R + 1,68
BamHl ПДРФ +0,60
Короткое плечо 18pter-pl 1 D18S63 -3,12
18-хромосомы 18ql1 ? D18S452 -0,72
VNTR — вариабельный тандемный нуклеотидным повтор.
ПДРФ — полиморфизм длины рестриктных фрагментов
Rsal, BamHl — рестриктазы.
рядом генов-кандидатов, в число которых входили HLA локусы (6-я
хромосома), гены a-цепей коллагена I и II типов (COLIA2 и COLIIA1,
7-я и 12-я хромосомы соответственно), гены 0 (TCRB — 7-я хромосо-
ма), а- и 8-цепей (TCRA и TCRD — 14-я хромосома) Т-клеточного
рецептора, а также с маркерами D18S63 и D18S452, которые были
выбраны в связи с имеющимися в литературе данными о повышенной
частоте РА среди носителей делеции в коротком плече 18-й хромосо-
мы, где и локализованы эти маркеры. Для всех исследованных мар-
керов (табл. 2.1), кроме маркеров TCRD, были получены отрицатель-
ные значения лод-баллов, что позволяет отвергнуть по крайней мере
тесное сцепление с вышеперечисленными генами и исключить их из
числа генов чувствительности к РА. Для анализа сцепления РА с
TCRD в качестве маркера был использован 6-аллельный динуклео-
тид ный GT повтор с высоким уровнем гетерозиготности (0,74), лока-
лизованный в 3-м интроне этого гена. Для анализа сцепления с дан-
ным маркером оказались пригодными 14 семей (149 человек, из них
35 больных РА). Максимальный лод-балл был равен + 1,68 при RF=0,0
у обоих полов. Подобное значение лод-балла не может рассматривать-
ся в качестве строгого доказательства наличия сцепления, однако
является достаточно серьезным указанием на его вероятность, особен-
но при анализе сцепления гена с неполной пенетрантностью. Для под-
тверждения полученных оценок возможной сцепленности TCRD гена
с главным геном РА был использован другой ДНК-маркер -ПДРФ,
связанный с точковой изменчивостью TCRD гена в положении NT 256
и выявляемый рестриктазой RamH I. Однако этот маркер менее ин-
формативен для анализа сцепления (гетерозиготность, по данным ли-
тературы, равна 0,32), что существенно повышает требования к точ-
ности оценок частот его аллелей, в связи с чем были обследованы 36
22
здоровых лиц из московской популяции. Полученные опенки аллель-
ных частот практически не отличались от таковых в среднеевропейс-
ких популяциях. Анализ сцепления был проведен на 15 информатив-
ных поданному маркеру семьях (167 человек, 37 больных РА). Мак-
симальный лод-балл составил +0,6 при частоте рекомбинации, рав-
ной 0,08 для обоих полов. Результаты изучения аллельных ассоциа-
ций маркерного GT повтора и РА выявили статистически значимое
увеличение частоты носительства редкого аллеля Е1 среди больных
РА с системными проявлениями по сравнению со здоровыми лицами.
Показатель относительного риска (ОР) составил 3,9. Мы также изу-
чили распределение аллельных вариантов динуклеотидного GT по-
втора среди больных системной склеродермией, анкилозирующим
спондилоартритом и в контрольной группе здоровых индивидуумов.
Среди больных ССД отмечались повышенная частота аллеля Е2
(ОР=3,22) и сниженная частота аллеля Е1 (ОР=0,3). Распределение
аллельных вариантов GT повтора у больных анкилозирующим спон-
дилоартритом статистически значимо не отличалось от такового в
контрольной группе.
Сопоставимые с нашими данные были представлены Hall и со-
авт. [4]. Ими было получено также положительное значение лод-
баллов (+0,65) для одного из маркеров TCRA локуса, расположен-
ного в том же самом сегменте (ql 1) 14-й хромосомы, что и изучен-
ный нами локус TCRD. Помимо этого, Cornells и соавт. (1996) изу-
чили ДНК полиморфизм V6, V7, V8 и V10 TCRA генов, кодирую-
щих синтез вариабельного участка а-полипептидной цепи Т-клеточ-
ного рецептора. Было выявлено увеличение частоты аллеля 2(+) V8
гена у больных РА. Значимость этой ассоциации была подтвержде-
на на 2 других независимых европеоидных выборках. В совокупно-
сти эти результаты позволяют рассматривать хромосомный сегмент
ql 1 14-й хромосомы как перспективный для дальнейшего поиска
гена предрасположенности к РА. Интересно отметить, что в этом же
хромосомном сегменте локализованы ген серин-эстеразы 1, ассоци-
ированный с цитотоксичностью Т-лимфоцитов (GZMB), ген матрич-
ной металлопротеиназы 14 (ММН14), ген транскрипционного фак-
тора ингибитора каппа легких цепей В-лимфоцитов (NFkBI), лока-
лизованный в 14q 12 хромосомном сегменте, определенная значимость
которых в этиопатогенезе РА подтверждена последними исследова-
ниями зарубежных авторов.
Другой возможный вариант трактовки полученных результатов:
сами гены 8-полипептидной цепи Т-клеточного рецептора (TCRD)
являются одними из генов предрасположенности к РА. В связи с этим
представляют интерес некоторые особенности у/8 Т-клеточного им-
мунитета, приведенные ниже [3].
1. у/8 Т-лимфоциты в отличие от <x/(J Т-лимфоцитов негативны по
CD4 и CD8, но так же, как и В-лимфоциты, позитивны по CD3. Одна-
ко CD3 сегмент 8-цепи более вариабельный, чем у иммуноглобулино-
вых цепей В-клеток.
23
2. Повышенное содержание у/8 Т-клеток отмечено: а) при мико-
бактериальных инфекциях (лепра, туберкулез), листериозе, стрепто-
кокковой и стафилококковой инфекциях и др.; б) при инфицировании
вирусом Эпштейна—Барр, ВИЧ; в) при паразитарных инфекциях (лей-
шманиозе, шистосомозе).
3. Пул у/8 Т-клеток подразделяется на две субпопуляции — V81
(негативные по CD45 RO) и V82 (позитивные по CD45 RO). Количе-
ство V81 Т-клеток уменьшается с возрастом, тогда как количество
V82 Т-клеток увеличивается с возрастом. Блокада CD45 RO антиген-
ной детерминанты моноклональным антителом предотвращает разви-
тие аллергического энцефаломиелита в эксперименте.
4. V81 Т-клетки распознают эндогенные антигены и белки тепло-
вого шока (Hsp). Показано, что микобактериальные Hsp являются
суперантигеном для V81 клеток. Отмечена положительная динамика
у больных ЮРА при использовании в лечении белков теплового шока.
5. Показано, что в синовиальной жидкости больных РА во много
раз повышено содержание V81 Т-клеток. Отмечена аккумуляция V81
Т-клеток при неспецифическом язвенном колите, аутоиммунном поли-
гландулярном синдроме I типа. Повышенное содержание V82 Т-кле-
ток отмечено при рассеянном склерозе, атопическом дерматите. Уве-
личение концентрации у/8 Т-клеток было выявлено у больных синд-
ромом Дауна, у которых значительно чаще встречаются аутоиммун-
ные заболевания, лейкемия и отмечается повышенная чувствитель-
ность к бактериальным и вирусным инфекциям.
6. Иммунный ответ к эндогенным антигенам у/8 Т-клеток не инги-
бируется (в отличие от сх/fJ Т-клеток) антителами против специфично-
стей I и II классов главного комплекса гистосовместимости. Эндоген-
ные лиганды, индуцирующие аутореактивность V81 клеток, остают-
ся до конца не выясненными. Предполагают, что ими в первую оче-
редь являются белки теплового шока. Аутореактивность реализуется
только в присутствии лигандов к витронектиновому рецептору (VNR),
относящемуся к группе мембранных рецепторов, включающих в себя
рецептор фибронектина (FNR), ПЬ/П1а рецептор тромбоцитов и др.
7. у/8 Т-клетки-киллеры экспрессируют FcyRIIIa рецепторы. По-
казано, что полиморфизм FcyRIIIa гена по двум отличающимся друг
от друга сайтам ассоциирован с чувствительностью к СКВ.
8. у/8 Т-клетки обладают функцией надзора над опухолевыми клет-
ками, они распознают клетки лимфомы Burkitt, трансформированные
вирусом Эпштейна—Барр В-клетки, клетки лимфатической лейкемии
и др. как в острой стадии, так и в стадии ремиссии.
Несколько отличный подход, базирующийся на данных об опре-
деленной гомологии структурных генов человека и мыши, был исполь-
зован F.Tan и соавт. (1997) для выявления генов чувствительности к
ССД. Ранее на инбредной линии мышей был выявлен на 15-й хромосо-
ме участок, на котором идентифицирован ген фибриллина-1 (FBN-1),
ответственный за детерминацию синдрома плотной кожи (tsk), моде-
лирующего отдельные клинические проявления ССД у человека. За-
24
тем с помощью ряда ДНК-маркеров был изучен аналогичный мыши-
ному сегмент 15-й хромосомы человека на популяции американских
индейцев Чоктау с высокой распространенностью ССД. Было пока-
зано, что ген чувствительности к ССД локализован на участке разме-
ром в 2 сантиморганиды 15-й хромосомы, содержащем порядка 40
генов, и что носительство определенных маркерных гаплотипов (39 %
у больных против 7,8 % у здоровых) увеличивает риск развития ССД
в 7,5 раз.
Аналогичная методология была использована для идентификации
генов чувствительности к СКВ. Критический хромосомный участок,
несущий ген или гены чувствительности к модельной СКВ, сначала
был выявлен и локализован на l-й хромосоме у инбредных линий
мышей. Затем вся 1-я хромосома была прицельно протестирована у
человека. Так, Tsao и соавт., использовав ДНК-маркеры и метод
анализа сцепления, показали, что один из генов предрасположеннос-
ти к СКВ локализован на участке протяженностью в 5 сантиморга-
нид в сегменте q41—42 1-й хромосомы. Следует подчеркнуть, что
результаты получены на семьях, относящихся к различным расам, —
европеоидам, азиатам, афроамериканцам, что подчеркивает универ-
сальность действия этого гена предрасположенности в детерминации
СКВ. Вклад этого гена в формирование подверженности к СКВ по
предварительной оценке составляет около 20 %. В исследованиях
G.Kearns и соавт. (1997) и K.Moser и соавт. (1997), проведенных на
независимых выборках пораженных пар сибсов с использованием
аналогичной методологии, была подтверждена локализация гена пред-
расположенности к СКВ в сегменте q41—42 1-й хромосомы, а также
выявлены два других сегмента этой же хромосомы — q21 и q31—32,
в которых могут быть локализованы гены чувствительности к СКВ.
Интересно отметить, что в сегменте q21—q23 1-й хромосомы локали-
зованы гены экспрессирующихся на В-лимфоцитах Fc-рецепторов,
полиморфизм которых ассоциирован с чувствительностью к СКВ. Так,
Y.W.Song и соавт. (1997), J.T.Salmon и соавт. (1997) было показано,
что Н/Н гомозиготы по 131-му аллелю FcyRIIa рецептора имеют в
3 раза меньшую вероятность заболевания СКВ. J.Wu и соавт. (1997)
был изучен полиморфизм другого гена семейства Fc-рецепторов —
FcyRIIIa. Было показано, что V/V гомозиготные носители аллеля 176
этого гена имеют в 2 раза меньший риск заболеть СКВ без нефрита.
Вероятность заболеть СКВ с развитием нефрита, для V/V гомозигот в
6 раз меньше, чем для носителей других генотипов этого гена.
R.Mehrian и соавт. (1997) при изучении у больных СКВ ДНК поли-
морфизма гена интерлейкина-10 (IL-10), локализованного в q31—32
сегменте 1-й хромосомы и bcl-2 гена, локализованного в q21 сегменте
18-й хромосомы и ингибирующего апоптоз (запрограммированную
смерть клетки), показали, что носительство аллеля 193 bcl 2-го гена и
аллеля 127 IL-10 гена в раздельности умеренно повышает риск воз-
никновения СКВ, тогда как их совместное наследование в 40 раз
повышает риск развития этого заболевания.
25
Следует отметить, что на 1-й хромосоме также картирован ген Fas
протеина (CD95), который в норме экспрессируется на мембране лим-
фоцитов и индуцирует апоптоз. Показано [5], что гены апоптоза об-
ладают критическим регуляторным эффектом на иммунную систему.
Инактивация или снижение регуляторной функции одного или более
из этих генов может в части случаев вызывать аутоиммунное заболе-
вание. Эти критические иммунорегуляторные гены получили назва-
ние «аутогенов» по аналогии с онкогенами, классом нормальных кле-
точных генов, которые при утрате их функций обусловливают возник-
новение рака. В настоящее время в ревматологии активно изучается
полиморфизм некоторых генов апоптоза, таких как Fas, bcl-2, р53,
c-fos, c-myc. Дефект апоптоза, связанный с аутоиммунитетом и обус-
ловленный bcl-2 геном, был выявлен у мышей линии NOD, у которых
развивается не только диабет I типа, но и поражение слюнных желез,
сходное с таковым при болезни Шегрена. В ряде исследований было
показано, что ген р53 суперэкспрессирован в синовии больных РА; в
синовии и фибробластах больных РА выявлены соматические мута-
ции р53 гена, которые обусловливают его аномальную функцию и как
следствие— образование паннуса и костной деструкции. Мутации
Fas-гена и как следствие этого аномальный синтез Fas-протеина вы-
явлены в ряде исследований при СКВ и РА.
Интересный пример взаимодействия средовых и генетических фак-
торов, связанный с нарушением функции аутогена, был найден у мы-
шей инбредной линии 1рг, для которых характерно развитие системных
аутоиммунных и лимфопролиферативных нарушений. Эти мыши явля-
ются носителями мутантного 1рг аллеля Fas-гена, кодирующего синтез
Fas-протеина. У гомозиготных по мутантному аллелю мышей отсут-
ствует экспрессия Fas-протеина, что приводит к дефекту апоптоза, к
массивной аккумуляции лимфоцитов и развитию аутоиммунного забо-
левания. Молекулярный анализ дефектного Fas-гена показал, что ген
разорван вследствие встраивания в его кодирующую последователь-
ность ретровирусного мобильного генетического элемента, известного
как ЕТп. Таким образом, эта находка является первым примером бо-
лее общего механизма, посредством которого ретровирусы и связанные
с ними эндогенные последовательности могут нарушать иммунную
функцию за счет изменения экспрессии аутогенов, одним из потенци-
альных результатов которой может быть аутоиммунное заболевание.
Другой генетический механизм нарушения иммунной функции,
присущий ретровирусам, заключается в трансактивации иммунорегу-
ляторных генов [2]. Геномы всех ретровирусов человека обладают
способностью кодировать синтез протеинов, которые воздействуют на
LTR-промотеры вируса и стимулируют транскрипцию. Эти регулято-
ры носят название «трансактивирущие транскрипционные активато-
ры tat и tax» (tat у ВИЧ-1 и tax у HTLV-1 — вируса 1 Т-клеточной
лейкемии человека). Хотя главная функция этих трансактиваторов —
усиление транскрипции вирусного генома, выявлено, что эти протеи-
ны могут также усиливать транскрипцию определенных генов инфи-
26
цированнои клетки хозяина, одновременно репрессируя экспрессию
других клеточных генов. Так, было показано, что трансактивация с
помощью ВИЧ" 1-tat или HTLV-1-tax протеинов индуцирует актив-
ность части генов, таких как ИЛ-2, ИЛ-2 рецептор, гранулоцитомак-
рофагальный колониестимулирующий фактор, ИЛ-3, ИЛ-6, трансфор-
мирующий фактор роста Р-1, продукты синтеза которых принимают
участие в воспалительных реакциях. Недавние исследования на
трансгенных мышах подзвердили правомочность модели ретровирус-
ной индукции воспалительных заболеваний с помощью механизмов
трансактивации. Группой исследователей на трансгенных по HTLV-
I гену была смоделирована болезнь, тождественная синдрому Шегре-
на. Другой группой исследователей были получены две линии, транс-
генные по большому участку генома HTLV-1, содержащего env
(envelope protein) и tax-гены. У этих мышей с высокой частотой отме-
чалось поражение суставов с образованием паннуса и эрозий, гисто-
логически сходное с РА.
Помимо методологии сцепления, для выявления генов предраспо-
ложенности к РЗ широко используется и традиционный метод ассоци-
аций. Классический пример плодотворности этого подхода — иден-
тификация антигенов и гаплотипов риска системы HLA для всех рев-
матических заболеваний, причем методами молекулярной генетики
проводится изучение как самих генов (преимущественно II класса),
так и их антигенов, что позволило сформулировать гипотезу «общего
эпитопа». В то же время тот факт, что большинство носителей анти-
генов и гаплотипов риска не заболевают ревматическими болезнями,
свидетельствует о наличии других генов чувствительности, не связан-
ных с системой HLA. Поэтому в последние годы в качестве генов-
кандидатов предрасположенности к РЗ изучается полиморфизм дру-
гих генов, продукты которых играют значимую роль в этиопатогене-
зе заболеваний, — генов интерлейкинов, факторов некроза опухолей
и их рецепторов, металлопротеиназ, коллагенов, факторов роста и
многих других. Так, T.Hohler и соавт. (1997) при изучении полимор-
физма промоторной части гена фактора некроза опухолей (ФНОос)
показали, что мутация в положении 238 у больных псориатической
артропатией встречается в 32 % случаев по сравнению с 7 % в конт-
роле (показатель риска OR=6,2). В то же время исследования поли-
морфизма ФНОос у больных РА подобной ассоциации не выявили.
S.John и соавт. (1997) с помощью ДНК-маркеров на пораженных па-
рах сибсов изучили связь РА с генами интерферонов (ИФос, ИФР,
ИФу), интерлейкинов (ИЛ- 1а, ИЛ-ip, ИЛ-2, ИЛ-6) и рецепторов ин-
терлейкинов (ИЛ-IR, ИЛ-SR, ИЛ-SR). Более частое по сравнению со
случайным совместное наследование общих аллелей среди поражен-
ных пар отмечалось для ИФу, ИЛ-SR и ИЛ-2, что свидетельствует о
значимости аллельного полиморфизма этих генов в этиопатогепезе РА,
особенно гена ИЛ-2.
Другим, активно развиваемым в последнее время направлением
исследований в ревматологии является изучение полиморфизма регу-
27
ля горных факторов, оказывающих влияние на экспрессию структур-
ных генов К ним относятся системы гомеобоксов — повторяющихся
последовательностей ДНК, кодирующих синтез тканеспецифических
белков, которые способны связывать определенные участки ДНК,
выполняя таким образом регуляторные и координирующие функции,
а также транскрипционные факторы (вспомогательные белки, облег-
чающие РНК-полимеразам прохождение основных этапов транскрип-
ции, а также обеспечивающие тканеспецифическую экспрессию струк-
турных генов путем взаимодействия с их промотерами).
К числу транскрипционных факторов, изучаемых при ревматичес-
ких заболеваниях, относятся АР-1 (взаимодействующий с промотера-
ми генов коллагена IV типа и стромелизина), сКРОХ (взаимодейству-
ющий с геном коллагена Al), IRF-1 (интерферон и NO-синтетазу ре-
гулирующий фактор), NF-kB и др. Семейство транскрипционных фак-
торов NF-kB вовлечено в регуляцию выработки многих молекул им-
мунной системы, включая молекулы адгезии, ИЛ, ПГ, ФНО и др. На
основании проведенных исследований было показано, что экспрессия
NF-kB повышена в клетках синовии больных РА и псориатического
артрита, что обусловливает повышенную выработку цитокинов и
клеточную пролиферацию, т е NF-kB, являются одной из ключевых
молекул в регуляции иммунного ответа. Интересно отметить, что ин-
гибиторы этих транскрипционных факторов (например, IkBa и др.)
уменьшают воспаление и клеточную пролиферацию, поэтому NF-kB
рассматривается как мишень для генотерапии аутоиммунных, в том
числе и ревматических заболеваний. Значимость полученных в пос-
ледние годы результатов по идентификации генов чувствительности
к РЗ можно проиллюстрировать следующим примером: за рубежом в
клиническую практику активно внедряются методы лечения, исполь-
зующие принципы генотерапии, например лечение РА растворимым
рецептором ФНО, рекомбинантным рецептором ИЛ-1, пептидами
Т-клеточных рецепторов и др. [6].
В заключение следует отметить, что в результате реализации меж-
дународного проекта «Геном человека» к 2002 г. планируется карти-
ровать (т.е. локализовать на хромосомах) все 80 000 структурных
генов человека, что существенно упростит поиск генов чувствитель-
ности болезней с наследственным предрасположением, в том числе и
ревматических, так как не будет требовать проведения трудоемких
семейных исследований. Прорыва в идентификации генов предраспо-
ложенности к ревматическим заболеваниям следует ожидать в ближай-
шие годы, хотя и в настоящий момент полученные в этом направле-
нии результаты достаточно впечатляющие.
СПИСОК ЛИТЕРАТУРЫ
1 Беневоленская Л И Ревматические болезни — В кн Наследственная па-
тология человека / Под ред Ю Е Вельтищева, Н П Бочкова — М ,
1992 — С 60—66
28
2 Behar S M , Porcelh S A Mechanisms of autoimmune disease induction The
role of the immune response to microbial pathogens И Arthr Rheum —
1995 — Vol 38, N 4 — P 458-476
3 Haas W, Pereira P, Eonegawa S Gamma/Delta cells // Ann Rev Immu-
nol - 1993 — Vol И --P 637—685
4 Hall FC, Blown M A , Weeks DE et al //A Linkage study across the T
cell receptor A and T cell receptor В loci m families with rheumatoid
arthritis//Arthr Rheum — 1997 —Vol 40, N 10 —P 1798—1802
5 Mountz J D , Wu J, Cheng J, Zhou T Autoimmune disease A Problem of
defective apoptosis//Arthr Rheum — 1994 — Vol 37, N 10 —P 1415 -
1420
6 Novel Therapeutic Agents for the Treatment of Autoimmune Diseases // Eds
V Strand, D L Scott L S Simon // — New Vork Marcel Dekker, Inc , 1997 —
309 p
Лекция 3
НОВЫЕ НАПРАВЛЕНИЯ
В ИССЛЕДОВАНИИ ВОСПАЛЕНИЯ
ПРИ РЕВМАТИЧЕСКИХ
ЗАБОЛЕВАНИЯХ
Член-корр. РАМН профессор Е.Л.Насонов, канд мед. наук
М.Ю.Самсонов (кафедра ревматологии ФППО Московской
медицинской академии им. И.М. Сеченова)
Воспаление — фундаментальный физиологический процесс, направ-
ленный на защиту организма от патогенных возбудителей и репара-
цию тканей после физического, химическою или микробного повреж-
дения Воспаление может быть острым или хроническим Острое вос-
паление характеризуется сосудистой реакцией, активацией нейтрофи-
лов и тучных клеток, а хроническое — активацией мононуклеарных
клеток (макрофаги, лимфоциты, плазматические клетки), а также фиб-
робластов, присутствие которых отражает пролиферацию соединитель-
ной ткани Хроническое воспаление обычно следует за острым, но
нередко воспалительный процесс с самого начала имеет черты хро-
нического Последнее особенно характерно для ревматических забо-
леваний, особенностью которых является нарушение иммунных меха-
низмов, обеспечивающих элиминацию потенциально патогенных аген-
тов (которые в большинстве случаев не известны) и ограничивающих
выраженность воспалительных реакций [2]
Основу воспаления составляет каскад биохимических и иммуно-
логических процессов, регуляция которых осуществляется очень боль-
шим числом гуморальных медиаторов Среди них особое место зани-
29
мают цитокины — низкомолекулярные белковые молекулы, обеспе-
чивающие процесс межклеточных коммуникаций, к которым относят-
ся колониестимулирующие факторы (КСФ), факторы роста, интерлей-
кины (ИЛ), хемокины, фактор некроза опухоли (ФНО) и интерферо-
ны (ИФ) [16]. Все цитокины обладают следующими общими свойст-
вами:
— низкой молекулярной массой (менее 80 kD);
— аутокринным и паракринным способом клеточной регуляции;
— связыванием с высокоафинными рецепторами, специфичными
для каждого цитокина или групп цитокинов;
— участием в регуляции синтеза ДНК, РНК и белка в клетках;
— плеотропной биологической активностью;
— взаимодействием друг с другом и другими медиаторами.
Каждый цитокин обладает перекрещивающейся, синергической
или ингибирующей активностью по отношению к другим цитокинам.
Это свойство цитокинов обеспечивает оптимальное развитие иммун-
ного ответа, в рамках так называемой «цитокиновой сети» (cytokine
network). Последняя рассматривается как саморегулирующаяся сис-
тема, в функционировании которой наряду с самими цитокинами при-
нимают участие другие молекулы, в том числе антагонисты цитоки-
новых рецепторов, растворимые рецепторы цитокинов, антитела к
цитокинам, ингибиторные белки и др.
По функциональной активности цитокины можно условно подраз-
делить на 5 основных групп:
1) «провоспалительные»: ИЛ-1, ФНО, ИФу, хемокины;
2) участвующие в клеточной деструкции: ФНО, ИЛ-2, ИЛ-15,
ИФу;
3) способствующие синтезу антител: ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-
10, ИЛ-13;
4) участвующие в аллергических реакциях: ИЛ-3, ИЛ-4, ИЛ-5,
ИЛ-9, ИЛ-13;
5) «антивоспалительные»: ИЛ-4, ИЛ-10, трансформирующий фак-
тор роста (ТФР)-Р.
По современным представлениям, характер иммунного ответа, во
многом определяющий особенности развития воспаления при различ-
ных заболеваниях человека, зависит от «селекции» или преимуще-
ственной активации определенных субпопуляций Т-лимфоцитов (глав-
ным образом CD4+), которые обладают способностью синтезировать
цитокины различных типов [15,17]. Условно выделяют 3 субпопуля-
ции Т-лимфоцитов, которые обозначаются как ТЫ-, Th2- и ThO-клет-
ки. К цитокинам ТЫ-типа относят ИЛ-2, ИЛ-12, ИФ-у и фактор не-
кроза опухоли, к цитокинам ТЬ2-типа — ИЛ-4, ИЛ-5, ИЛ-13 и
ИЛ-10. Профиль синтеза цитокинов, соответствующий представлен-
ным характеристикам ТЫ - или ТЬ2-клеток, но не обязательно опос-
редуемый именно CD4+ Т-лимфоцитами, определяется соответствен-
30
но как ТЫ - и Th 2-типы иммунного ответа. Предполагают, что Th2-
клегки обеспечивают в первую очередь хелперный сигнал в отноше-
нии синтеза антител и принимают участие в развитии аллергических
реакций, в то время как Th 1-клетки вовлечены в реакции клеточного
иммунитета, а именно гиперчувствительность замедленного типа, вос-
паление, клеточную цитотоксичность. Кроме того, в процессе разви-
тия CD4+ Т-лимфоциты часто проходят через ThO-стадию, в которой
синтезируют ИЛ-2, ИЛ-4, ИЛ-5 и, вероятно, другие типы цитокинов
Выделена клеточная популяция, активно синтезирующая ТФР-Р, ко-
торая получила название ТйЗ-клетки. Как уже отмечалось, характер-
ной особенностью цитокинов, синтезирующихся Th 1~ и Тй2-клетками.
является ингибирование дифференцировки и эффекторных функций
реципрокных фенотипов Th-клегок в рамках «цитокиновой» сети.
Например, ИФ-у (цитокин Th 1-типа) подавляет пролиферацию Th2-
к леток, а ИЛ-К) (цитокин Th 2-типа) — синтез цитокинов Th 1-клет-
ками.
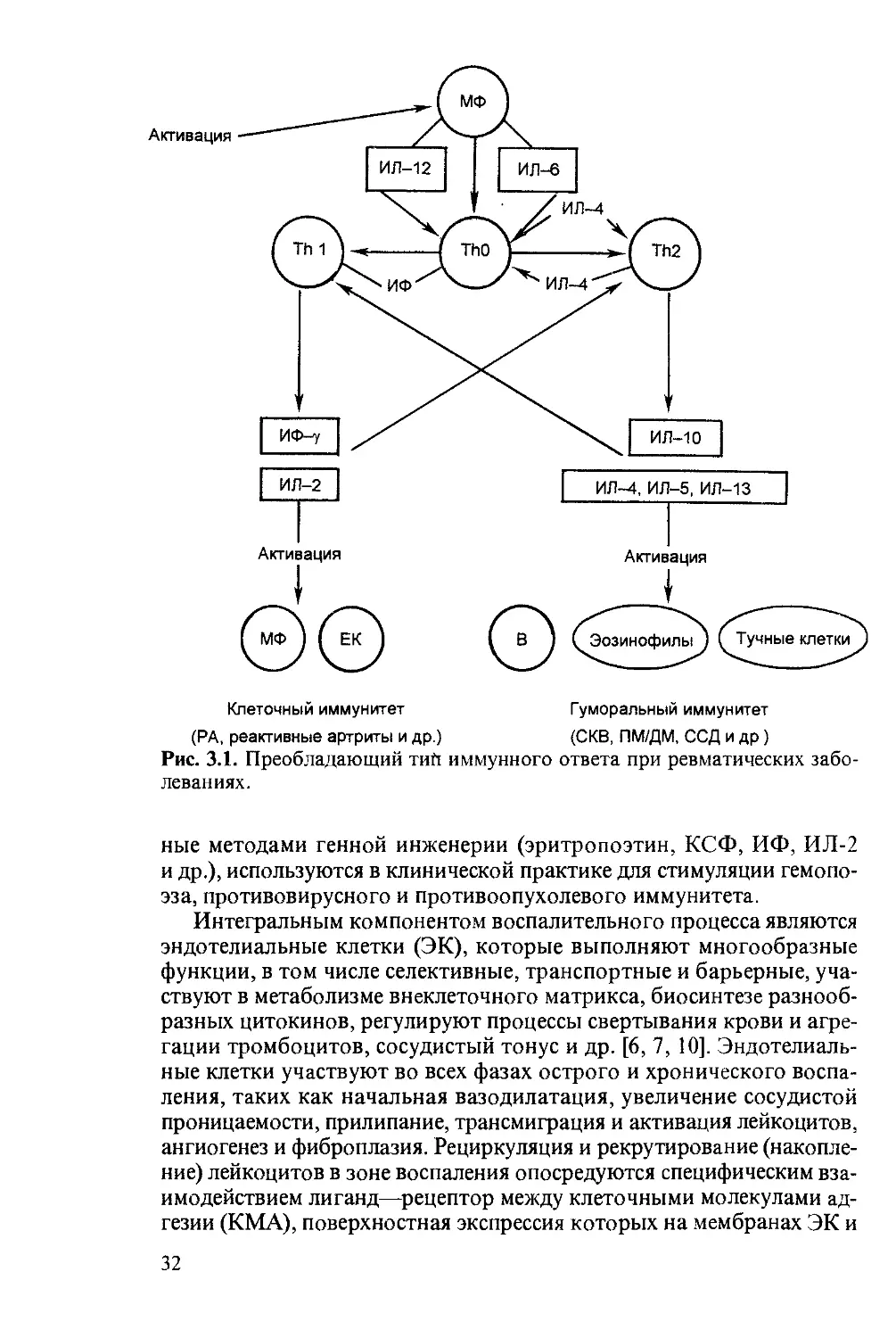
Имеющиеся в настоящее время данные позволяют условно клас-
сифицировать некоторые заболевания и патологические состояния с
учетом преобладающего профиля синтеза цитокинов (рис. 3.1). Сле-
дует также иметь в виду, что профиль синтеза цитокинов может суще-
ственно меняться в различных фазах заболевания. Например, при РА
в дебюте заболевания отмечается увеличение числа клеток, синтези-
рующих ИЛ-2 и ИФ-у, а в хронической стадии — клеток, синтезиру-
ющих ИЛ-6, ИЛ-10 и ФНО-а. При СКВ у больных с лимфаденопати-
ей и нефротическим синдромом отмечается увеличение синтеза ИЛ-6
и ИФ-у, а уровень ФНО-а в пределах нормы, при развитии тромбо-
цитопении, напротив, наблюдается увеличение уровня ФНО-а. Про-
филь ситеза цитокинов при воспалительных заболеваниях находит-
ся под строгим генетическим и гормональным контролем. Например,
у больных СКВ обнаружен полиморфизм гена ИЛ-10, наличие кото-
рого коррелирует с увеличением синтеза ИЛ-10. При РА снижение
уровня андрогенов ассоциируется с увеличением синтеза ИЛ-12, ко-
торый индуцирует секрецию ИФ-у и способствует пролиферации Th 1 -
клеток.
Во время беременности отмечается увеличение синтеза цитокинов
Тй2-типа и снижение синтеза цитокинов Th 1-типа. Это позволяет
объяснить причины нередко наблюдаемого обострения заболевания у
беременных женщин, страдающих СКВ.
Поскольку именно нарушение синтеза цитокинов лежит в основе
патогенеза воспалительных заболеваний человека, для их лечения
применяют фармакологические препараты и биотехнологические аген-
ты (например, моноклональные антитела), соответственно ингибиру-
ющие синтез или блокирующие активность «провоспалительных» ци-
токинов. В последние годы изучается возможность использования
методов так называемой генной терапии, позволяющей восполнить
недостаток синтеза иммунорегуляторных (главным образом антивос-
палительных) цитокинов. Кроме того, некоторые цитокины, получен-
31
Активация
Гуморальный иммунитет
(СКВ, ПМ/ДМ, ССД и др)
Клеточный иммунитет
(РА, реактивные артриты и др.)
Рис. 3.1. Преобладающий тий иммунного ответа при ревматических забо-
леваниях.
ные методами генной инженерии (эритропоэтин, КСФ, ИФ, ИЛ-2
и др.), используются в клинической практике для стимуляции гемопо-
эза, противовирусного и противоопухолевого иммунитета.
Интегральным компонентом воспалительного процесса являются
эндотелиальные клетки (ЭК), которые выполняют многообразные
функции, в том числе селективные, транспортные и барьерные, уча-
ствуют в метаболизме внеклеточного матрикса, биосинтезе разнооб-
разных цитокинов, регулируют процессы свертывания крови и агре-
гации тромбоцитов, сосудистый тонус и др. [6, 7, 10]. Эндотелиаль-
ные клетки участвуют во всех фазах острого и хронического воспа-
ления, таких как начальная вазодилатация, увеличение сосудистой
проницаемости, прилипание, трансмиграция и активация лейкоцитов,
ангиогенез и фиброплазия. Рециркуляция и рекрутирование (накопле-
ние) лейкоцитов в зоне воспаления опосредуются специфическим вза-
имодействием лиганд—рецептор между клеточными молекулами ад-
гезии (КМА), поверхностная экспрессия которых на мембранах ЭК и
32
лейкоцитов усиливается (или индуцируется) цитокинами и другими
воспалительными медиаторами. В настоящее время охарактеризова-
но более 30 КМА, которые составляют 3 основных семейства, — се-
лектины (L-селектин, Р-селектин, Е-селектин), интегрины и суперсе-
мейство иммуноглобулинов (ICAM-1, ICAM-2, ICAM-3 и др.). КМА
обеспечивают костимуляторный сигнал для активации лейкоцитов и
пролиферации лимфоцитов, регулируют миграцию лейкоцитов из кро-
вяного русла и их накопление в зоне тканевого воспаления.
Развитие и прогрессирование воспаления при ревматических забо-
леваниях тесно связано с аутоиммунными механизмами. Такие воспа-
лительные ревматические заболевания, как СКВ, РА, системная скле-
родермия, синдром Шегрена, полимиозит (дерматомиозит), грануле-
матоз Вегенера, являются наиболее яркими прототипами аутоиммун-
ных болезней человека, в основе которых лежит нарушение толеран-
тности к собственным антигенам, приводящее к развитию иммунного
ответа против нормальных тканей, как если бы они были чужеродны-
ми антигенами. Этот процесс в свою очередь опосредуется сложным
взаимодействием генетических, иммунологических факторов, различ-
ных инфекционных (вирусы, бактерии, паразиты) и других внешнесре-
довых воздействий (облучение, токсины, стресс, лекарства, вакцина-
ция и др.), дефектов гормональной и нейроэндокринной регуляции.
Предрасположенность к аутоиммунным ревматическим заболеваниям
носит мультифакториальный и полигенный характер.
Важное место в процессах иммунопатогенеза воспалительных рев-
матических заболеваний занимают нарушения механизмов апоптоза
(или программированной гибели клеток). Апоптоз — фундаменталь-
ный процесс жизнедеятельности многоклеточных организмов, физио-
логическое значение которого заключается в элиминации поврежден-
ных и патологически измененных клеток, поддержании нормальной
архитектоники и размера тканей, предотвращении воспалительного
повреждения нормальных клеток. Особенно важную роль апоп-
тоз играет в функционировании иммунной системы, а именно делеции
Т-лимфоцитов в тимусе, механизмах цитотоксичности, опосредован-
ной цитокинами (ФНО-а и ИЛ-6 и др.) и глюкокортикостероидами
(ГКС) в «созревании» антительного ответа (элиминация лимфоцитов,
экспрессирующих низкоаффинные рецепторы для антигенов) и др.
Предполагается, что дефекты апоптоза могут вносить существенный
вклад в развитие воспалительных ревматических заболеваний за счет
следующих основных механизмов [23]: 1) нарушение делеции ауторе-
активных клеток; 2) экспрессия «скрытых» внутриклеточных аутоан-
тигенов на клеточной мембране в виде макромолекулярных частиц;
3) нарушение свертывания крови (сосудистый эндотелий); 4) индук-
ция синтеза провоспалительных цитокинов; 5) нарушение нормальной
регенерации тканей.
Среди разнообразных патогенетических механизмов воспалитель-
ных ревматических заболеваний важное место принадлежит наруше-
нию неоваскуляризации или ангиогенеза [13]. Напомним, что ангио-
2—3592
33
генез включает в себя несколько последовательно развивающихся
этапов — цитокинининдуцированную активацию ЭК сосудистой стен-
ки, разрушение эндотелиального матрикса протеолитическими фермен-
тами, хемотаксис ЭК, развитие новых капилляров. В норме ангиоге-
нез является регулируемым самоограничивающимся процессом (физи-
ологический ангиогенез), который строго контролируется широким
спектром медиаторов (цитокины, факторы роста и др.), условно под-
разделяющихся на 2 основные группы: стимуляторы, или «проангио-
генные» факторы (тромбоцитарный фактор роста, ИЛ-2, КСФ, фак-
тор роста эндотелия, ТФР-(3 и др.), и ингибиторы, или «анти-ангио-
генные» факторы (ИФ-у, ИЛ-12, тканевый ингибитор металлопроте-
иназ и др.). Синтез указанных медиаторов находится в сбалансиро-
ванном состоянии. Однако при ряде патологических состояний, к ко-
торым наряду с воспалительными ревматическими заболеваниями (РА
и ССД), относят злокачественные новообразования, диабетическую
ретинопатию, псориаз, баланс нарушается в сторону преобладания
синтеза проангиогенных медиаторов, что приводит к «патологичес-
кому» ангиогенезу, ассоциирующемуся с хронизацией воспаления,
развитию тканевой деструкции и фиброзу.
Благодаря открытию двух изоформ циклооксигеназы (ЦОГ), регу-
лирующих образование простагландинов (ПГ), получены новые фак-
ты, уточняющие значение ПГ в развитии воспаления, иммунного от-
вета, апоптоза и др. [5,11]. ЦОГ-1 проявляет функциональную актив-
ность структурного («housekeeping») фермента, регулирующего про-
дукцию ПГ, участвующих в обеспечении нормальной (физиологичес-
кой) функциональной активности клеток. Напротив, ЦОГ-2 в норме
обнаруживается в большинстве тканей (за исключением мозга и кор-
кового слоя почек) лишь в следовых количествах, однако ее экспрес-
сия существенно увеличивается на фоне развития воспаления, зави-
сит от активации фактора транскрипции (NF-kB) и подавляется глю-
кокортикостероидами. Полагают, что индукция ЦОГ-2 является ком-
понентом координированного ответа организма на инфекцию и тка-
невое повреждение. К другим составляющим этого процесса относят-
ся фосфолипаза А2 (ФЛА2), которая обеспечивает высвобождение ара-
хидоновой кислоты (субстрат для ЦОГ), липокортин-1, подавляющий
активность ФЛА2, и оксид азота (NO), обладающий способностью как
стимулировать, так и ингибировать ЦОГ. Особенно существенное
значение гиперэкспрессия ЦОГ-2 играет в патогенезе воспалительных
заболеваний суставов. Установлено, что у крыс с адъювантным арт-
ритом выявляется увеличение экспрессии иРНК ЦОГ-2, но не ЦОГ-1,
коррелирующее с выраженностью отека сустава. Отмечено увеличение
экспрессии ЦОГ-2 в микрососудах синовиальной оболочки при стиму-
ляции ИЛ-1 и синовиальных клетках при РА. Индукторами ЦОГ-2
в синовиоцитах (а также хондроцитах и остеобластах) являются сле-
дующие медиаторы: форболовый эфир, липополисахарид, ИЛ-1(3,
ФНО-а, ТФР-Р, суперантиген ИФ-у стимулированных клеток, в то
время как ГКС, ИЛ-4 и ИЛ-13 ингибируют экспрессию ЦОГ-2. При-
34
мечательно, что недостаток синтеза ИЛ-4 рассматривается в качестве
важного патогенетического механизма хронизации воспаления при РА.
Получены данные о том, что ЦОГ-2-зависимая гиперэкспрессия про-
стагландина Е2 в макрофагах приводит к увеличению синтеза ИЛ-6.
Последний относится к числу наиболее важных медиаторов острофа-
зового ответа при воспалительных заболеваниях человека и прини-
мает участие в патогенезе РА, остеопороза и плазмоклеточных опу-
холей. Кроме того, ПГ вызывают увеличение экспрессии матриксных
металлопротеиназ в синовиоцитах, стимулируют продукцию фактора
роста сосудистого эндотелия синовиоцитами и, таким образом, могут
вносить вклад в «патологический» ангиогенез. Матриксные протеина-
зы играют важную роль в развитии краевых костных эрозий, причем
увеличение экспрессии ЦОГ-2 коррелирует с увеличением уровня кол-
лагеназы. Полагают, что стабильная гиперэкспрессия ЦОГ-2 повыша-
ет резистентность синовиоцитов к апоптозу и, таким образом, может
иметь значение в поддержании «злокачественного» фенотипа синови-
альных клеток, участвующих в образовании ревматоидного паннуса
при РА. Расшифровка структуры ЦОГ-1 и ЦОГ-2 создала теоретичес-
кие предпосылки для создания нового класса нестероидных противо-
воспалительных препаратов (НПВП), обладающих способностью се-
лективно ингибировать ЦОГ-2, применение которых позволит повысить
эффективность и безопасность лечения заболеваний человека [22].
Многие современные тенденции в изучении механизмов иммунопа-
тогенеза воспалительных ревматических заболеваний можно просле-
дить на примере РА, характерной особенностью которого являются
постоянные боли, прогрессирующее нарушение функции суставов,
приводящие к снижению качества жизни и ранней инвалидизации боль-
ных, увеличение риска сопутствующих заболеваний, таких как ате-
росклеротическое поражение сосудов, интеркуррентные инфекции,
остеопоротические переломы костей скелета и др. Согласно современ-
ным представлениям, патогенез РА является динамическим процессом,
который, как с точки зрения патогенетических механизмов, так и кли-
нико-лабораторных проявлений, можно условно подразделить на не-
сколько последовательно развивающихся стадий. Распознавание ста-
дийности имеет не только очень важное теоретическое (для расшифров-
ки фундаментальных механизмов хронизации воспаления при заболе-
ваниях человека), но и практическое значение с точки зрения разработки
стратегических направлений фармакотерапии РА (табл. 3.1) [24].
Очевидно, что наиболее сложный и дискуссионный вопрос — воз-
можность выделения нулевой стадии (предболезнь). О ее существова-
нии косвенно свидетельствуют результаты немногочисленных морфо-
логических исследований, указывающих на наличие воспалительных
изменений в синовиальной ткани, полученной у больных РА из клини-
чески не пораженных суставов, и обнаружение РФ в сыворотке «здо-
ровых» людей за много лет до клинической манифестации РА. Одна-
ко достоверные маркеры, позволяющие прогнозировать возможность
развития РА, пока не разработаны. Пути воздействия на патологичес-
2*
35
кии процесс с помощью индукции толерантности к коллагену или
вакцинации с использованием пептидных фрагментов, имитирующих
«патогенные» эпитопы Т-клеточных рецепторов, хотя и являются пред-
метом интенсивных экспериментальных исследований, но пока обсуж-
даются только гипотетически.
Таблица 3.1. Клинико-рентгенологические проявления и терапевтические
подходы к лечению РА в зависимости от патогенетической стадии заболе-
вания
Ста- дия (па- тоге- нети- чес- кая) Предполагаемые патогенетичес- кие механизмы Клинические проявления, лабораторные показатели Признаки, выявленные при инстру- ментальном исследовании Лечение
0 Факторы окру- Клинические Нет Вакцинация (?)',
жающей среды, генетическая предрасполо- женность, ауто- иммунитет, де- фект системы гипофиз—гипо- таламус—над- почечники проявления отсутствуют, иногда может обнаруживать- ся РФ индукция толе- рантности, им- муномодуляция (?)
1(a) Активация Т- и В-лимфоцитов, нейтрофилов, эндотелия, си- новиоцитов, остеокластов Недомогание, Отек мягких артралгия, арт- тканей, ©коло- рит, скованность, суставная остео- РФ, увеличение пения (костная СОЭ и СРВ денситометрия) Моноклональ- ные антитела (к Т-клеткам, цитокинам, к мо- молекулам адге- зии и др., ГКС внутрисуставно), циклоспорин А(?)
Кб) То же, что 1(a) + пролиферация синовиоцитов, неоваскуляри- зация (ангиоге- нез), синтез ме- таллопротеиназ То же, что 1(a) Паннус (маг- + нарушения нитно-резонанс- функции суета- ная томогра- вов фия), генерали- зованный остео- пороз (костная денситометрия) Базисные про- тиворевматичес- кие препараты, ингибиторы ме- таллопротеиназ (миноциклин) ?, антиостеопоре- тическая тера- пия (?)
2 Активация хондроцитов, инвазия панну- са, дефект апоп- тоза синовио- цитов То же, что 1(6), Эрозии но более тяже- лые То же, что 1(6), комбинирован- ная терапия ба- зисными проти- вовоспалитель- ными препара-
36
Продолжение
Ста- дия (па- тоге- иети- чес- кая) Предполагаемые патогенетичес- кие механизмы Клинические проявления, лабораторные показатели Признаки, выявленные при инстру- ментальном исследовании Лечение
тами, ГКС (сис-
темно), индукто-
ры апоптоза (?)
3 Автономная Деформации Деформация и То же, что 2
пролиферация деструкция сус-
и соматические тавов
мутации, дефект
апоптоза сино-
виоцитов
4 То же, что 3 Необратимое Анкилоз Хирургическое
нарушение
функции суста-
вов
1 Знак вопроса (?) обозначает лечение в стадии разработки.
Значительно лучше изучена «ранняя» стадия РА (или дебют болез-
ни), характеризующаяся развитием синовита и системных (главным
образом острофазовых) проявлений. В этот период основное патоге-
нетическое значение имеют два тесно взаимосвязанных процесса. Во-
первых, активация (антигенспецифическая ?) CD4+ Т-лимфоцитов по
ТЫ-типу, характеризующаяся избыточным синтезом ИЛ-2, ИФ-у и
ИЛ-17. Во-вторых, дисбаланс между гиперпродукцией «провоспали-
тельных» цитокинов преимущественно макрофагальной природы
(ФНОа, ИЛ-1, ИЛ-6, ИЛ-8 и др.) и антивоспалительных цитокинов
(ИЛ-10, растворимый антагонист ИЛ-1, растворимые ФНО-а-рецеп-
торы, ИЛ-4) с преобладанием продукции первых над вторыми рассмат-
ривается в качестве ведущего фактора, определяющего характерный
для РА очень быстрый переход острого воспаления в хроническое [12].
Полагают, что одним из важных последствий хронического воспали-
тельного процесса, определяющего формирование ревматоидного
паннуса, является стимуляция «патологического» ангиогенеза. Дей-
ствительнр, в синовиальной ткани, полученной от больных РА, выяв-
лен широкий спектр проангиогенных медиаторов. Среди них особое
значение придают фактору роста эндотелия, обладающего способно-
стью индуцировать хемотаксис и митогенез ЭК и моноцитов и другие
проангиогенные эффекты. В недавних исследованиях было показано,
что снижение активности экспериментального коллагенового артри-
37
та на фоне введения ингибиторов ангиогенеза коррелирует с умень-
шением концентрации фактора роста эндотелия. Полагают, что один
из механизмов гиперэкспрессии фактора роста эндотелия связан с
процессом гипоксии—реперфузии, наблюдаемой в суставах у больных
РА. Действительно, в области 5'-фланкированного участка гена фак-
тора роста эндотелия идентифицировано несколько факторов транс-
крипции, активирующихся на фоне гипоксии—реперфузии. Дру-
гой медиатор, присутствующий в синовиальной жидкости при РА,
ТФР-Р, проявляет бифункциональную активность, в низких концен-
трациях стимулируя, а в высоких — ингибируя ангиогенез. Примеча-
тельно, что ангиогенная активность фактора роста эндотелия и ТФР-£
опосредуется сходными механизмами, а именно КМА (особенно семей-
ства интегринов), гиперэкспрессия которых обнаружена на клетках
синовиальной ткани при РА. Важное значение придают ИЛ-8 — пред-
ставителю С-Х-С семейства хемокинов, который рассматривается как
важный макрофагальный медиатор ангиогенеза. ИЛ-8 присутствует
в избыточном количестве в суставных тканях и синовиальной жидко-
сти при РА. Вероятными медиаторами ангиогенеза при РА являются
растворимые молекулы адгезии, такие как Е-селектин и сосудистая
молекула адгезии-1, уровень которых существенно увеличен в сыво-
ротке и синовиальной жидкости.
Лечение РА в этой стадии предполагает использование моно- или
комбинированной терапии базисными противовоспалительными пре-
паратами (метотрексат, сульфасалазин, соли золота, циклоспорин А
и др.), ГКС; интенсивно разрабатываются экспериментальные мето-
ды лечения, связанные с селективным ингибированием синтеза про-
воспалительных цитокинов, экспрессии молекул адгезии и др. Несом-
ненный интерес представляет изучение возможности терапевтическо-
го применения естественных ингибиторов ангиогенеза, присутствую-
щих в хрящевой ткани. Установлено, что уникальными особенностя-
ми хряща являются отсутствие кровеносных сосудов и резистентность
к развитию злокачественных новообразований, что позволило пред-
положить наличие в нем ингибиторных субстанций. Ингибиторы ан-
гиогенеза были выделены в чистом виде из различных типов хряще-
вой ткани. Наиболее популярным природным ингибитором ангиоге-
неза является вещество, изолированное из хряща акулы (жидкий эк-
стракт— CarTCell), которое в настоящее время начали использовать
в качестве вспомогательной терапии при воспалительных и дегенера-
тивных заболеваниях суставов (РА и остеоартроз), а также при зло-
качественных новообразованиях. На модели экспериментального
коллагенового артрита у крыс было установлено, что ингибиторы
ангиогенеза обладают способностью предотвращать или существен-
но замедлять прогрессирование воспалительного поражения суставов
и образование паннуса. Следует также подчеркнуть, что ингибирова-
ние ангиогенеза — один из механизмов, определяющих терапевтичес-
кую эффективность некоторых противовоспалительных препаратов,
использующихся для лечения РА, таких как миноциклин, антималя-
38
рийные препараты, сульфасалазин, метотрексат, D-пеницилламин,
талидомид, соли золота, ГКС.
Важный механизм хронизации воспаления при РА может быть свя-
зан с дефектами на уровне оси гипоталамус—гипофиз—надпочечник.
Установлено, что при РА отмечается нарушение эндогенного синтеза
кортизола, играющего важную роль в предотвращении избыточной
активации иммунной системы и хронизации воспаления.
На поздних (2-я и 3-я) стадиях в патогенезе РА начинают преобла-
дать индуцированные хроническим воспалением автономные (опухо-
леподобные) процессы, обусловленные соматической мутацией сино-
виальных клеток и дефектами апоптоза (гиперэкспрессия гена опухо-
левой супрессии р53, мутация H-ras гена и др.).
Все эти данные хорошо объясняют те трудности, которые возни-
кают в процессе лечения РА. Создается впечатление, что фармакоте-
рапия РА может быть в большей или меньшей степени эффективной
только в рамках достаточно узкого по времени «окна», до того пери-
ода (2—3-я стадии), когда клетки-мишени приобретают аномальные
(опухолеподобные) свойства, теряют способность отвечать на физио-
логические регулирующие антивоспалительные стимулы и становят-
ся устойчивыми к фармакологическим воздействиям. Следует также
подчеркнуть, что наиболее высокая скорость нарастания рентгеноло-
гических изменений в суставах, достигающая 50 % от максимально
возможной, наблюдается именно на ранних стадиях РА (в течение 2—
6 лет от начала болезни), а выраженность деструкции суставов (по
данным рентгенологического исследования) коррелирует с неблаго-
приятным прогнозом. Можно полагать, что активное лечение с исполь-
зованием всего арсенала противовоспалительных препаратов имен-
но на ранних стадиях заболевания является единственной реальной
возможностью улучшить непосредственный и отдаленный прогноз у
больных РА.
Одной из важных проблем современной ревматологии продолжа-
ет оставаться разработка доступных для широкой клинической прак-
тики серологических методов, позволяющих оценить активность и
характер прогрессирования иммуновоспалительного процесса. Мно-
гие цитокины присутствуют в биологических жидкостях в достаточ-
но высоких концентрациях; изменение их уровня ассоциируется с ак-
тивностью и прогрессированием различных патологических процес-
сов при ревматических заболеваниях (воспаление, фиброз, аутоимму-
нитет и др.), однако их определение ограничено трудностями методи-
ческого порядка. На результаты определения цитокинов существен-
ное влияние оказывает целый ряд факторов, а именно специфичность
используемых моноклональных антител к цитокинам в отношении их
способности связываться со свободными или связанными с белками
молекулами (или теми и другими), интерференция с растворимыми
рецепторами, наличие в циркуляции фрагментов или предшественни-
ков цитокинов, отсутствие корреляции между уровнем цитокинов,
выявляемых иммунохимическими методами, и их биологической ак-
39
тивностью, циркадные вариации синтеза цитокинов, наличие сопут-
ствующих заболеваний и лекарственная терапия. Кроме того, боль-
шинство цитокинов обладают низкой устойчивостью и, связываясь с
клетками-мишенями, очень быстро исчезают из циркуляции после
высвобождения из секретирующих клеток [16].
В последние годы проведена серия исследований, посвященных
изучению клинического значения более стабильных лабораторных
маркеров, уровень которых также отражает активность воспаления и
активацию клеточного иммунитета. К ним относятся С-реактивный
белок (СРВ), растворимые рецепторы (р) цитокинов (рИЛ-2Р, рФНО-
55/75Р, рИЛ-1РА), растворимые формы молекул адгезии (ICAM-1,
ICAM-3, Р-селектин, Е-селектин и др.) и неоптерин, биохимический
показатель, отражающий цитокинзависимую активацию иммуноком-
петентных клеток [8].
Таблица 3.2. Связь между уровнем СРВ и характером рентгенологичес-
кого прогрессирования суставной деструкции
Характер динамики деструкции суставов Число больных Исходный уровень СРБ (мг/л)
Без прогрессирования Умеренное прогрессы- 16 18,1±21,4
рование (< 4 новых эрозий) 21 29,9+27,3
Выраженное прогресси- рование (>4 новых эрозий) 18 95,8+88,6
Примечание. У больных с выраженным и умеренным рентгенологическим
прогрессированием исходный средний уровень СРВ существенно выше, чем у
больных без рентгенологического прогрессирования (р=0,001 и р<0,05 соот-
ветственно).
В настоящее время благодаря разработке высокочувствительного
иммуноферментного метода вновь возрос интерес к определению
СРВ — острофазового белка, синтез которого регулируется провос-
палительными цитокинами, а уровень в сыворотке хорошо отражает
активность воспаления. В ряде исследований показано наличие кор-
реляции между уровнем СРВ и провоспалительных цитокинов в сино-
виальной жидкости и плазме при РА и других воспалительных ревма-
тических заболеваниях [3]. Изучается значение СРВ для оценки про-
грессирования деструктивных изменений в суставах при РА. По на-
шим данным, у больных с исходно повышенным уровнем СРВ наблю-
дается более выраженное прогрессирование эрозивного процесса в ки-
стях й стопах в течение 6—12 мес наблюдения (табл. 3.2). Кроме того,
при РА увеличение уровня СРВ коррелирует с прогрессированием ге-
нерализованного (позвоночник, шейка бедренной кости) остеопоро-
40
за, по данным костной денситометрии [4], и концентрацией биохими-
ческих маркеров, отражающими деструкцию (циркулирующий олиго-
мерный белок хряща) и регенерацию (эпитоп 846 хондроитинсульфа-
та) хряща. Примечательно, что увеличение концентрации циркулиру-
ющего олигомерного белка хряща и снижение уровня хондроитинсуль-
фата (эпитоп 846) ассоциируется с быстрой деструкцией хряща и не-
благоприятным в отношении инвалидизации прогнозом. Таким обра-
зом, СРВ является чувствительным лабораторным индикатором вос-
палительной активности синовита, деструкции хряща, потери костной
массы и в целом показателем индуцированного воспалением систем-
ного катаболического процесса.
Наши результаты и данные других авторов свидетельствуют о
важном клиническом значении определения неоптерина (6-Э-эритро-
Г,2*,3*-тригидроксипропилптерин). Неоптерин — низкомолекулярное
вещество (молекулярная масса— 253 Да), промежуточный продукт
метаболизма гуанозинтрифосфата (ГТФ), который регулируется ГТФ-
циклогидролазой 1. Его синтез происходите макрофагах под действи-
ем ИФ-у, вырабатываемого Т-лимфоцитами в процессе их активации
и, в меньшей степени, В-лимфоцитами и ЭК. Определенной костиму-
ляторной активностью обладает и ФНО-сс. Хотя функции, выполняе-
мые неоптерином в организме, до конца не ясны, существование спе-
цифической регуляции его продукции свидетельствует о важной роли
этого вещества в организме человека. Например, добавление неопте-
рина в культуру моноцитов, стимулированных липополисахаридом in
vitro, приводит к усилению высвобождения ФНО-сс. Неоптерин спо-
собен усиливать клеточную цитотоксичность, опосредованную свобод-
ными кислородными радикалами, играющими важную роль в повреж-
дении ЭК, посредством индукции их апоптоза, принимает активное
участие в образовании оксида азота. Увеличение синтеза неоптерина
продемонстрировано при различных заболеваниях, характеризующих-
ся активацией клеточного иммунитета, таких как инфекционные бо-
лезни (туберкулез, малярия, СПИД и др.), злокачественные новооб-
разования, неспецифический язвенный колит, болезнь Крона, а также
при пересадке органов и аутоиммунных заболеваниях. Наши данные
свидетельствуют о тесной корреляции между уровнем неоптерина и
клинико-лабораторными показателями активности иммуновоспали-
тельного процесса при РА, СКВ, гранулематозе Вегенера, болезни
Бехчета, полимиозите (дерматомиозите), системной склеродермии,
острой ревматической лихорадке, хроническом миокардите и дилата-
ционной кардиомиопатии [1,9, 14, 18—21] (табл. 3.3). Нами установ-
лено, что развитие иммунопатологического процесса при РА сопро-
вождается увеличением сывороточной концентрации СРБ, неоптери-
на, растворимых рецепторов цитокинов (рИЛ-2Р, рФНО-а), раство-
римых молекул адгезии (р1САМ-1, pICAM-З и рР-селектина), причем
уровень неоптерина и Р-селектина лучше всего коррелирует с клини-
ческими и лабораторными показателями активности РА (табл. 3.4).
Связь между уровнем рР-селектина и активностью РА представляет
41
Таблица 3.3. Клиническое значение неоптерина при ревматических забо-
леваниях и поражении миокарда
Заболевание Число больных Клиническое значение
СКВ 52 Корреляция с активностью по ECLAM* (г=0,77, р<0,001)
РА 67 Корреляция с индексами активности (г=0,374, р<0,001) и тяжести (г-0,441, р<0,0001), уровнями рФНО-55Р (г=0,32, р=0,05), рИЛ-2Р (г=0,36, р=0,02), СОЭ (г=0,60, р<0,0001), р1САМ-3(г=0,41,р=0,01)
Гранулематоз Вегенера 26 Корреляция с активностью по BVAS** (г=0,59, р<0,01), уровнем рФНО-55Р (r=0,08, р<0,001), рИЛ-2Р (r=0,58, р<0,01) и СРБ (г=0,44, р<0,05); средний уровень неоптерина выше при гене- рализованной, чем при лимитированной фор- ме заболевания
Полиомиозит (дерматомиозит) 59 Корреляция с внемышечными проявлениями, рФНО-55Р (r=0,46, р<0,001), рИЛ-2Р (г=0,70, р<0,0001)
Острая ревмати- ческая лихорадка 32 Корреляция с рФНОР (r=0,06, р<0,001), рИЛ-2Р (г=0,35, р<0,05); уровень неоптерина выше у больных с поражением митрального и аортального клапанов (р<0,05)
Болезнь Бехчета 38 Корреляция с уровнем СРБ (г=0,42, р<0,02), положительным тестом патергии (р<0,05) и развитием узловатой эритемы, артрита и эпи- дидимита ф<0,05)
Геморрагический васкулит 12 Корреляция с активностью по BVAS** (г=0,60, р<0,05), уровнем СОЭ (г=0,86, р<0,001), концентрацией IgA (г=0,78, р<0,01)
Дилатационная кардиомиопатия 53 Корреляция с функциональным классом сер- дечной недостаточности по NYHA*** (0,001), уровнем ангиотензинпревращающего фер- мента (г=0,35, р<0,01), альдостерона (г=0,36, р<0,01) ИФНО-55Р (г=0,41, р<0,01)
ECLAM (European consensus lupus activity measure) — Европейские крите-
рии активности СКВ.
** BVAS (Birmingham vascular activity score) — Бирмингемский индекс активно-
сти васкулита. \
*** NYHA (New York Heart Association) — Нью-Йоркская кардиологическая ас-
социация.
42
Таблица 3.4. Корреляция между уровнем СРБ, неоптерина, растворимых
рИЛ-2Р, рФНО-а, клеточных молекул адгезии и клинико-лабораторными
показателями активности РА
Показа- тель р1САМ-1 (п=36) р1САМ-3 (п=36) рР-селек- тин (п=36) рИЛ-2Р (п=36) рФНО-55Р (п=36) Неоптерин (п=67)
Длитель- ность забо- -0,402** -0,097 0,134 0,103 -0,252 -0,123
левания Суставной индекс 0,270 0,120 0,368* 0,246 0,194 0,282*
(Ричи) Индекс при- 0,140 0,402* 0,444** 0,231 0,291 0 409****
пухлости (Ричи) Индекс ак- 0,299 0,400* 0,421** 0,337* 0,252 0,37***
тивности Индекс тя- 0,281 0,409* 0,528*** 0,350* 0,222 0,441***
жести Гемогло- бин, г/л 0,075 0,288 -0,303* -0,059 0,392** -0,05
СОЭ, мм/ч 0,139 0,47** 0,189 0,430** 0,410* 0,458***
СРБ, мг/л 0,08 0,14 0,7 0,14 0,01 0,335**
* р<0,05.
** р<0,01.
*** р<0,001.
**** р<0,0001.
особый интерес. Напомним, что рР-селектин (гранулярный мембран-
ный белок 140) хранится в а-гранулах тромбоцитов и секреторных
гранулах (тельца Weibel-Palade) ЭК. Он обеспечивает взаимодействие
между тромбоцитами и лейкоцитами и между лейкоцитами и ЭК, а его
экспрессия индуцируется воспалительными медиаторами (гистамином,
тромбином, липополисахаридом, компонентами комплемента, ФНО,
супероксидными радикалами и др.), принимающими участие в пато-
генезе РА. По данным иммуногистохимических исследований, при РА
отмечается увеличение экспрессии Р-селектина на ЭК и макрофагах.
Кроме того, увеличение уровня рР-селектина может отражать акти-
вацию тромбоцитов, которым придают важное значение в патогене-
зе РА.
Таким образом, развитие хронического воспаления при ревмати-
ческих заболеваниях опосредуется сложным сочетанием разнообраз-
ных нарушений в системе иммунитета, а активность воспаления кор-
релирует с изменением синтеза широкого спектра иммунных медиа-
торов. Расшифровка механизмов развития иммунопатологического
процесса и воспаления имеет очень важное значение для разработки
новых методов диагностики, профилактики и лечения ревматичес-
ких заболеваний.
43
СПИСОК ЛИТЕРАТУРЫ
1. Баранов А.А., Самсонов М.Ю., Насонов ЕЛ. и др. Неоптерин сыворот-
ки крови при геморрагическом васкулите // Клин. мед. — 1997. —
№ 6. — С. 34—35.
2. Насонов ЕЛ. Противовоспалительная терапия ревматических болез-
ней. — М.: М-Сити, 1996. — 345 с.
3. Насонов ЕЛ., Баранов А.А., Чичасова Н.В. и др. Клиническое значение
С-реактивного белка при ревматоидном артрите (Обзор литературы
и собственные данные) // Клин. мед. — 1997. — №7. — С. 29—32.
4. Насонов ЕЛ., Скрипникова И.А., Насонова В.А. Проблема остеопороза
в ревматологии. — М.: Стин, 1997.
5. Насонов ЕЛ., Цветкова Е.С., Toe НЛ. Селективные ингибиторы цик-
лооксигеназы-2: новые перспективы лечения, заболеваний человека //
Тер. арх. — 1998. — № 5. — С. 8—14.
6. Пальцев М.А., Иванов А.А. Межклеточные взаимодействия. — М.: Ме-
дицина, 1995. — 222 с.
7. Соломин К.В., Насонов ЕЛ., Беленков Ю.Н. Роль эндотелиальной клет-
ки в иммунопатологии // Тер. арх. — 1992. — №3. — С. 150—157.
8. ФуксД., Самсонов М.Ю., Насонов ЕЛ. и др. Клиническое значение нео-
птерина при заболеваниях человека // Тер. арх. — 1993. — № 5. —
С. 80—87.
9. Самсонов М.Ю., Прокаева Т.Б., Маданат В. и др. Сывороточный нео-
птерин при болезни Бехчета // Клин. мед. — 1995. — №5. — С. 53—55.
10. Cines D.B., Pollak E.S., Buck С.А. Endothelial cells in physiology and in
the pathophysiology of vascular disorders // Blood. — 1998. — Vol. 91. —
P. 3527—3561.
11. DuBois R.N, Abramson S.B., Crofford L. et al. Cyclooxygenase in biology
and medicine // FASEB J. — 1998. — Vol. 12. — P. 1063—1073.
12. Feldman M., Brennan F., Maini R.N. Role of cytokines in rheumatoid
arthritis // Ann. Rev. Immunol. — 1996. — Vol. 14. — P. 397—440.
13. Koch A.E. Angiogenesis. Implications for rheumatoid arthritis // Arthr.
Rheum. — 1998. — Vol. 41. — P. 951—962.
14. Nassonov E., Samsonov M., THz G.P. et al. Serum concentrations of neopterin,
soluble interleukin 2 receptor, and soluble tumor necrosis factor receptor
in Wegener’s granulomatosis // J. Rheumatol. — 1997. — Vol. 24. —
P. 666—700.
15. O’Garra A. Cytokines induce the development of functionally heterogenous
T helper cell subsets // Immunity. — 1998. — Vol. 8. — P. 275—283.
16. Oppenheim J., Rossio J., Gearing A.J.H. Clinical applications of cytokines:
Role in diagnosis, pathogenesis, and therapy // Oxford University Press. —
1993.
17. Romagnani S. Lymphokine production by human T cells in disease state //
Ann. Rev. Immunol. — 1994. — Vol. 12. — P. 227—257.
18. Samsonov M., Nassonov E., Kostin S. et al. Serum neopterin — possible
immunological marker of myocardial inflammation in patients with
dilated heart muscle disease. // Europ. Heart J. — 1991. — Vol. 12 (Suppl.
D). — P. 151—153.
19. Samsonov M.Y., Tllz G.P., Egorova O. et al. Serum soluble markers of
immune activation and disease activity in systemic lupus erythematosus //
Lupus. — 1994. — Vol. 4. — P. 29—32.
44
20. Samsonov M„ Tilz G.P., Pisklakov V. et al. Serum soluble receptors for
tumor necrosis factor alpha and interleukin-2t and neopterin in acute
rheumatic fever // Clin. Immunol. Inmunopath. — 1995. — Vol. 74. —
P. 31—34.
21. Samsonov M.Y., Nassonov E.L., Tilz G.P. et al. Elevated serum levels of
neopterin in adult patients with polymyositis/dermatomyositis II Brit. J.
Rheumatol. — 1997. — Vol. 36. — P. 656—660.
22. Samsonov Lopatin L.t Nassonov E.L. et al. The activated immune system
and the renin-angiotensin-aldosteron system in congestive heart failure /
/ J. Intern. Med. — 1998. — Vol. 243. — P. 93—98.
23. Vane J. Towards a better aspirin И Nature. — 1994. — Vol. 367. — P. 215—
216.
24. Utz P.J., Anderson P. Posttranslational protein modifications, apoptosis,
and the bypass of tolerance to autoantigens II Arthr. Rheum. — 1998. —
Vol.41.-P. 1152—1160.
25. Urbina-Joiro H., Cardiel M.H., Alcocer-Virela J. Reclassifying the
pathogenesis of rheumatoid arthritis: from the susceptibility to the
degenerative stages И Clin. Exp. Rheumatol. — 1998. — Vol. 16. — P. 87—
91.
Лекция 4
РЕВМАТИЧЕСКАЯ ЛИХОРАДКА
(РЕВМАТИЗМ) В XX в.
Академик РАМН профессор В.А.Насонова, профессор
Н.Н.Кузьмина (Институт ревматологии РАМН)
Как показывает накопленный мировой наукой опыт, ревматизм
(ревматическая лихорадка — РЛ) на протяжении всего XX в. оста-
вался актуальной проблемой для многих стран. Ведущие отечествен-
ные и зарубежные исследователи рассматривают РЛ как уникальное
сердечно-сосудистое заболевание, которое до настоящего времени
будоражит умы ученых.
Ревматизм (РЛ) — системное воспалительное заболевание соеди-
нительной ткани с преимущественной локализацией процесса в сер-
дечно-сосудистой системе, развивающееся в связи с инфекцией 0-ге-
молитическим стрептококком группы А у лиц, главным образом мо-
лодого возраста (7—15 лет), предрасположенных к нему [15].
Эпидемиология. Трудно назвать какое-либо другое заболевание,
в статистические материалы по которому были бы внесены столь
ошеломляющие результаты.
Анализируя заболеваемость РЛ, обычно ссылаются на данные
министерства здравоохранения Дании, в соответствии с которыми в
45
------------------1
------------------2
Рис. 4.1. Распространенность и заболеваемость РЛ в Москве (на 1000 дет-
ского населения).
I — распространенность; 2 — заболеваемость.
1900 г. она составляла 200 на 100 000, или 2 на 1000 населения. В
нашей стране за точку отсчета можно взять материалы 1925 г.: забо-
леваемость острым суставным ревматизмом (терминология тех лет,
эквивалентная РЛ) составляла в Москве 8,2, в Московской облас-
ти — 18,1, в Твери — 11,1 на 1000 населения, т.е. 820, 1810 и 1110 на
100 000 [5].
Систематическая работа по снижению высокой заболеваемости РЛ
и распространенности всех форм ревматизма началась во второй по-
ловине столетия. Вторая половина XX столетия характеризовалась
большими успехами, достигнутыми в разработке вопросов прогнози-
рования течения и исхода РЛ [Насонова В.А., Бронзов И.А., Долго-
полова А.В., 1978—1991].
По данным Московского детского кардиоревматологического
диспансера [10], распространенность ревматизма в Москве в шести-
десятые годы, составлявшая 13,8 на 1000 детского населения, в
1997 г. снизилась до 0,09 на 1000, а заболеваемость — с 1,25 до 0,03
на 1000 (рис. 4.1). В целом по России к концу XX в. заболеваемость
всеми формами ревматизма составила 17 на 100 000 населения, а по
активному ревматизму — 5,4.
Таким образом, при сравнении данных 1925 и 1996 гг. выявляется
впечатляющее снижение заболеваемости, несмотря на всю условность
такого сопоставления. Эта тенденция характерна для всех развитых
46
стран мира, что позволяет связывать существенное снижение заболе-
ваемости и распространенности ревматизма со значительным улучше-
нием качества жизни, питания и медицинской помощи. Несомненно,
большую роль сыграла введенная с начала 50-х годов бициллино-
профилактика. Вместе с тем необходимо подчеркнуть, что снижение
заболеваемости РЛ началось еще с середины 30-х годов до повсемес-
тного введения антибиотикотерапии и антибиотикопрофилактики, со-
впав с тенденциями в совершенствовании социальных условий жиз-
ни. В сущности, прав был С.П.Боткин, предположивший еще в 60-х
годах прошлого столетия связь РЛ (острого суставного ревматизма,
по терминологии того времени) с плохим питанием, скученностью и
перенесенной скарлатиной [3].
Однако разразившиеся в середине XX в. вспышки РЛ в США сре-
ди новобранцев в Сан-Диего и позже — среди детей (штаты Юта,
Огайо, Питтсбург) показали, что заболевали дети обеспеченных ро-
дителей с доходами выше средних, живущие в отдельных домах, пол-
ноценно питающиеся и постоянно наблюдающиеся семейными врача-
ми. Парадокс состоял в том, что диагноз РЛ был у большинства боль-
ных поставлен с опозданием. Это можно объяснить тем, что «вспыш-
ки» РЛ явились полной неожиданностью не только для врачей широ-
кого профиля, но и авторитетов в области ревматологии, в связи с чем
в конце 80-х годов РЛ снова названа «загадочным», «интригующим»
заболеванием, а диагноз РЛ — одним из самых трудных. Таким обра-
зом, в последние десятилетия XX в. РЛ в очередной раз поразила
общественное мнение и заставила оживить теоретические и научные
исследования в этой области.
Согласно наблюдениям зарубежных исследователей, «вспышки
РЛ» связаны со многими факторами, в том числе с драматическим
ростом стрептококковой инфекции; ослаблением настороженнос-
ти врачей к последствиям циркуляции вирулентных штаммов стреп-
тококка группы А, отсутствием теоретических подходов к прог-
нозированию постстрептококковых заболеваний, в частности РЛ,
а также недостаточным знанием врачами клинической симптома-
тики заболевания, встречающегося редко в последние десятилетия
[31].
Аналогичная ситуация имела место в России в 1989 и 1994 гг., ко-
гда было отмечено повышение заболеваемости до 0,185 %о и 0,196 %о
(соответственно по годам) впервые выявленного активного ревматиз-
ма, а через 2—4 года впервые зарегистрированных хронических рев-
матических болезней сердца. В эти годы заболеваемость на Северном
Кавказе, в основном в Ингушетии, была в 2—3 раза выше, чем в
целом по России [23].
Указанный ростРЛ, отмеченный во многих странах, подтвержда-
ет постулат J.Rotta о том, что ревматизм не исчезнет, пока циркули-
рует в природе стрептококк группы А, а детское население нашей
планеты не может быть избавлено от стрептококка этой группы в те-
чение последующих десятилетий [19].
47
Этиопатогенез. После возникших «всплесков» РЛ в США начались
серьезные исследования по идентификации «ревматогенных» штаммов
стрептококка. Собственно связь РЛ с особо вирулентными штаммами
^-гемолитического стрептококка группы А обсуждалась всегда, ког-
да возникали вспышки РЛ в воинских частях, училищах, других зак-
рытых и полузакрытых коллективах. Несмотря на то что все еще не
выяснено, существуют ли специфические серотипы, обладающие «рев-
матогенным потенциалом», выполненные приоритетные исследования
за последнее десятилетие позволяют обсуждать этот вопрос.
Еще в 1940 г. во время вспышки РЛ в одной из военно-воздушных
баз США, где заболели 3 % рекрутов, была показана связь заболева-
ния с существованием вирулентных штаммов, содержащих М-проте-
ин и принадлежавших к нескольким серотипам А-стрептококка [30].
Наиболее часто при эпидемических вспышках определяли М5, 18, 19,
24 и др. [31].
Толчком к интенсификации исследований стрептококковых инфек-
ций вообще послужила разразившаяся необычно тяжелая инвазивная
стрептококковая инфекция в США и ряде европейских стран, прояв-
лявшаяся сепсисом и синдромом токсического шока. Эта угрожавшая
жизни стрептококковая инфекция чаще проникала чрескожно, а не из
носоглоточного кольца, однако А-стрептококковые штаммы и в этих
случаях принадлежали к Ml и М3 серотипам.
Анализ инвазивных стрептококковых инфекций в США в 1985—
1992 гг. показал, что кривые РЛ и синдрома токсического шока
стрептококкового генеза совпадали по времени и были близкими по
выраженности. Если наибольшая выраженность РЛ отмечалась в
1985—1987 гг., то синдром токсического шока — в 1987—1990 гг.
[29].
Достаточно поучителен анализ заболеваемости скарлатиной в Рос-
сии на протяжении XX в., проведенный В.Д.Беляковым (1996). Выяв-
лено, что в столетнем интервале выделяются 3 больших цикла подъе-
ма заболеваемости скарлатиной: I цикл относился к 1891—1915 гг.,
II цикл — с 1918 по 1942 г. с максимумом в 1930 г., а III цикл начал-
ся сразу же после окончания второй мировой войны и достиг макси-
мума в 1955 г., после чего заболеваемость стала неуклонно снижать-
ся (рис. 4.2). Небезынтересно, что аналогичная динамика отмечена в
отношении ревматизма и в 30—60-х годах.
Вышеприведенные данные позволили обсуждать вопрос о суще-
ствовании ревматогенного стрептококка. Совершенно очевидно, что
такие свойства присущи только некоторым носоглоточным культурам.
Согласно данным J.Stollerman (1997), ревматогенные штаммы имеют
большую гиалуроновую капсулу, которая продуцирует мукоидные
колонии на поверхности кровяного агара и образует очень короткие
цепи в бульонных культурах. Одной из очень важных характеристик
ревматогенных штаммов является высокая контагиозность с быстрой
передачей инфекционного фактора от больного к здоровому. Возмож-
но, наиболее важным признаком ревматогенности стрептококка сле-
48
Годы
Рис. 4.2. Заболеваемость скарлатиной в России за период с 1890 по 1990 г.
(В .Д .Беляков).
1 — динамика заболеваемости скарлатиной (1:10 000); 2 — летальность (%);
3— смертность (1:10 000); 4 — доля тяжелых случаев (%); 5 — доля нагное-
ний (%); 6 — ревматизм (%).
дует считать наличие очень больших молекул М-протеина на поверх-
ности штаммов, имеющих отношение к патогенезу РЛ.
К достижениям ученых XX в. можно отнести установленный ими
факт, что экстрагируемый из вирулентных штаммов ревматогенного
А-стрептококка М-ассоциированный поверхностный белок имеет эпи-
топ, который обозначен как класс I в отличие от эпитопа класса II,
который свойствен неревматогенным стрептококкам [26]. Позже у
больных РЛ были обнаружены в высоком титре IgG-антитела к спе-
цифическому эпитопу класса I. Таким образом, исследования показа-
ли, что ассоциированный с РЛ микроорганизм имеет все признаки
инвазивного, вирулентного микроба, но не строго специфичного для
этой болезни. Особенно важно то, что в молекулах М-протеина име-
ются также эпитопы, перекрестно реагирующие с сердечной и други-
ми тканями хозяина.
Большая лепта внесена учеными и в изучение патогенеза РЛ. Осо-
бенно значимо открытие на М5-молекуле эпитопов, перекрестно реа-
гирующих с миозином, синовией, мозгом, сарколеммальной мембра-
ной. Обращает на себя внимание и тот факт, что эти эпитопы распо-
ложены в молекуле М-протеина проксимальнее типоспецифического
49
эпитопа NH2. Эти данные укрепили концепцию молекулярной мимик-
рии как ведущего патогенетического фактора в реализации стрепто-
кокковой инфекции в РЛ за счет того, что образующиеся на антигены
стрептококка антитела реагируют с аутоантигенами хозяина. С дру-
гой стороны, патогенетическое значение имеет и то обстоятельство,
что М-протеин обладает свойствами суперантигена, индуцирующего
эффект аутоиммунитета [32].
Немаловажное значение в индукции РЛ имеют иммунные (клеточные
и гуморальные) реакции. Хорошо известен гуморальный ответ на раз-
личные антигены стрептококка (антистрептолизин-О, антистрептокина-
за, антистрептогиалуронидаза и др.). Антистрептолизин-0 может прини-
мать участие в формировании ЦИК, циркуляция которых коррелирует
с изменением на ЭКГ в виде атриовентрикулярной диссоциации и блока-
ды. Показано также наличие и других гуморальных иммунных реакций
при РЛ — антител к кардиолипину IgG-класса (у 54 % больных).
А высокий и стойкий уровень этих антител и неоптерина у больных с по-
роками сердца позволил обсуждать гипотезу об этих маркерах как фак-
торах риска по возникновению клапанных поражений [13].
Российские ученые внесли большой вклад в разработку нового
направления, касающегося оценок характера развития при РЛ им-
мунопатологических реакций в виде повышения уровней ИЛ-1а,
рФНО-а и неоптерина, отражающих активацию моноцитов/макрофа-
гов и Т-лимфоцитов в связи с повышением уровня рИЛ-2Р. Эти дан-
ные позволили обсуждать важную роль клеточных иммунных реакций
в целом и растворимых медиаторов иммунной системы (цитокинов) в
частности в патогенезе РЛ.
Значительный интерес представляют ассоциация высоких уровней
неоптерина и ИЛ-1а с развитием поражения клапанов сердца во вре-
мя первой атаки РЛ [13].
Следовательно, патогенез РЛ обусловлен развитием сложных им-
мунопатологических процессов под влиянием, видимо, ревматогенных
стрептококков, компоненты которых способны активировать клеточ-
но-опосредованный и гуморальный иммунный ответ, развитие ауто-
иммунных реакций, в том числе за счет перекрестно реагирующих
аутоантител, циркулирующих и фиксированных иммунных комп-
лексов.
Важно отметить, что именно ревматогенные стрептококки группы
А типа М3, М5 и М18 содержат необходимые эпитопы, обусловлива-
ющие иммунизирующий эффект и развитие иммуноопосредованного
патологического процесса.
Полученные данные позволили J.Stollerman в 1997 г. сформули-
ровать определение РЛ следующим образом: заболевание является
постинфекционным осложнением стрептококкового фарингита, выз-
ванного стрептококком группы А (ангины) у предрасположенных к
нему лиц в связи с развитием аутоиммунного ответа на эпитопы стреп-
тококка и перекрестной реактивностью со схожими эпитопами тканей
человека (в суставах, сердце, мозге, коже).
50
Развитие РЛ в 0,3 % случаев после спорадической носоглоточной
А-стрептококковой инфекции и в 3 % после эпидемической предпола-
гает наличие особой чувствительности больного к этой инфекции,
своего рода предрасположенности к РЛ и формированию ревматичес-
ких пороков сердца.
Еще в начале XX в. А.А.Кисель указывал на роль семейной пред-
расположенности, а в восьмидесятых годах была сформулирована
мультифакториальная модель ревматизма, основанная на сочетанном
участии генетических и средовых факторов [2]. По данным этих
авторов, частота семейного ревматизма в 6 раз выше, чем в попу-
ляции.
Одним из крупных достижений в понимании конкретных путей
предрасположенности к РЛ стало открытие аллоантигена В-лимфоци-
тов с помощью моноклональных антител Д8/17. На большом клини-
ческом материале Н.А.Шостак [24] показано высокое носительство
Д8/17 у больных кардитом и полиартритом (соответственно 95,7 % и
93,9 %) и несколько более редкое (75 %) — при хорее. Семейные ис-
следования также констатировали накопление этого маркера у мате-
рей пробандов (63,6 %), у детей (50 %) и сибсов (54 %). Таким обра-
зом, в реализации инфекции, вызываемой стрептококком группы А, в
РЛ имеют значение комплекс семейных, мультифакториальных пред-
посылок и В-клеточный аллоантиген, конкретные механизмы реали-
зации которых еще предстоит раскрыть.
Клиника. Институт ревматологии РАМН располагает 25-летними
наблюдениями более чем за тысячью пациентов с РЛ. Сравнительный
анализ основных проявлений этого заболевания за прошедшие годы
показал, что структура клинической симптоматики в целом не претер-
пела существенных изменений. Так, по данным ученых России (табл.
4.1) и США (табл. 4.2) процентное соотношение кардита, полиартри-
та, хореи или их сочетаний остается достаточно постоянным.
В то же время необходимо подчеркнуть, что выраженность клини-
ческих проявлений заболевания в связи с патоморфозом значительно
Таблица 4.1. Клинические проявления РЛ
в Москве в 1980—1990 гг. [25|
Клинические проявления
Число
наблю-
дений
Кардит
Артрит
Хорея
Кардит + полиартрит
Кардит + артралгии
Кардит + хорея
Всего . .
20
15
7
42
13
6
103
51
Таблица 4.2, Клинические проявления
вспышки ревматической лихорадки в США
в 1985—1986 гг. (штат Utah)
Клинические проявления Число наблю- дений
Кардит 14
Полиартрит 14
Хорея 4
Кардит + полиартрит 43
Кардит + хорея 14
Кардит + полиартрит + хорея 6
Полиартрит + хорея 4
Всего . . . 99
уменьшилась. Особенностью современного течения РЛ следует счи-
тать снижение тяжести кардита, протекающего без отчетливых при-
знаков недостаточности кровообращения; значительное уменьшение
частоты вовлечения в патологический процесс серозных оболочек,
преобладание умеренной и минимальной степени активности воспа-
лительного процесса, сведение до минимума диагностической ценно-
сти аннулярной эритемы и ревматических узелков; более низкая ин-
формативность лабораторных тестов, особенно при моносиндромном
варианте РЛ, значительное улучшение прогноза заболевания [7,9, 33
и др.]. Эта эволюция связана с тем, что патологический процесс при
РЛ в последние годы в значительной мере утратил присущий ему ра-
нее выраженный экссудативный характер. Однако, по данным ряда
исследователей, в 80—90-е годы вновь наметилась тенденция к утя-
желению кардиальной патологии [Кузьмина Н.Н., 1997; Stoller-
mann J.H., 1997].
Кардит. Ведущим в клинической картине заболевания, опреде-
ляющим тяжесть течения и его исход, был и остается ревмокардит, по-
прежнему встречающийся в настоящее время у преобладающего боль-
шинства детей (80—85 %), при этом у V5 из них он протекает как бы
изолированно, а у остальных сочетается чаще с полиартритом и
реже — с хореей [25].
Симптоматика ревмокардита во многом определяется преимуще-
ственным поражением той или иной оболочки сердца — миокарда,
эндокарда или перикарда. Однако в связи с трудностями разграниче-
ния поражения отдельных оболочек сердца в клинической практике
широкое распространение получил термин «ревмокардит».
Приоритетом отечественных педиатров явилось выделение в об-
щей клинической картине первичного ревмокардита компонента кла-
панного поражения, имеющего принципиально важное значение, так
52
как у пациентов с вальвулитами очень высок риск формирования
порока сердца.
Как показывают клинические наблюдения, особое значение в рас-
познавании клапанного поражения принадлежит качественной ха-
рактеристике впервые появившегося шума: систолический шум при
митральном вальвулите имеет «дующий» оттенок, хорошо прослу-
шивается в зоне проекции митрального клапана, диастолический
шум аортального вальвулита носит черты «льющегося» протодиас-
толического с максимумом звучания вдоль левого края грудины.
Именно эта аускультативная оценка звуковой симптоматики уже
клинически способствует правильной трактовке и интерпретации
шума, возникающего при поражении эндокарда. Распознавание рев-
мокардита наряду с объективными данными базируется на резуль-
татах функционального (ЭКГ, фонокардиограмма) и рентгенологи-
ческого обследования.
Экспертами ВОЗ постулируется важная роль эхокардиографии в
диагностике ревматического кардита. Объективизировать признаки
клапанного поражения сердца позволяет ультразвуковое обследова-
ние. При вальвулите митрального клапана с помощью М-сканирова-
ния у 75 % детей выявляются утолщение и «лохматость» эхосигнала
от створок и хорд клапанного аппарата. Примерно у '/3 пациентов
определяются ограничение подвижности задней створки митрального
клапана, уменьшение систолической экскурсии сомкнутых митраль-
ных створок. Нередко обнаруживается небольшое пролабирование
створок в конце систолы, свидетельствующее о поражении подклапан-
ного аппарата [4, 6, 12, 20, 22].
Использование аппаратуры нового поколения, а именно допплер-
эхокардиографии (ДЭХОГ), позволило Е.И.Полубенцевой (1993—
1995) выделить ДЭХОГ-критерии ревматического эндокардита, кото-
рые с успехом могут быть применены в любой возрастной группе.
Согласно ее наблюдениям, ревматический эндокардит митрального
клапана включает следующие признаки: краевое булавовидное утол-
щение передней митральной створки, гипокинезию задней митральной
створки, митральную регургитацию, преходящий куполообразный
изгиб передней митральной створки. Ультразвуковое обследование в
М-режиме при аортальном вальвулите позволяет выявить у 50 % де-
тей мелкоамплитудное диастолическое трепетание митральных ство-
рок. У части больных обнаруживается утолщение ЭХО-сигнала от
створок аортального клапана. При ДЭХОГ отмечаются ограничен-
ное краевое утолщение аортальных клапанов, преходящий пролапс
створок, аортальная регургитация. Одним из важнейших критериев,
подтверждающих наличие у пациента первичного ревматического
поражения сердца, является положительная динамика клинических и
параклинических проявлений под влиянием антиревматической тера-
пии.
Установлено, что исход РЛ определяется частотой формирования
порока сердца. При этом сохраняется прямая зависимость между тя-
53
жестью перенесенного ревмокардита и частотой формирования поро-
ка сердца. Так, после первой атаки, протекающей с легким кардитом,
ревматический порок сердца формируется у 5—7 % больных. Исход
первичного ревмокардита в порок сердца при среднетяжелой форме
кардиальной патологии составляет уже 25—30 %, а при эндомиокар-
дите с поражением клапанного аппарата возрастает до 55—65 %.
В отличие от прошлых десятилетий пороки сердца после первичного
ревмокардита наблюдаются в 2,5 раза реже — в 20—25 % случа-
ев [91.
В структуре ревматических пороков сердца преобладает митраль-
ная недостаточность, реже формируются недостаточность аорталь-
ного клапана, митральный и аортальный пороки и митральный
стеноз.
С помощью ультразвукового исследования уже в исходе первич-
ного ревмокардита удается выявить комиссуральный митральный сте-
ноз [12, 17], который, как правило, не находит клинического звуча-
ния, а определяется только при эхосканировании.
Примерно у 7—10 % детей (а по данным некоторых авторов, до
25—27 %) после перенесенного первичного ревмокардита происходит
формирование пролапса митрального клапана [4, 6, 12, Uysal S. et al.,
1992].
Пороки сердца в настоящее время отличают более медленный по
сравнению с предыдущими десятилетиями темп возникновения, нерез-
кая степень выраженности и стойкая компенсация на протяжении ряда
лет.
Многолетнее катамнестическое наблюдение за детьми, перенесши-
ми РЛ, позволяет сформулировать концепцию основных путей форми-
рования порока сердца: 1) порок сердца является следствием перене-
сенного вальвулита и развивается в течение ближайших 1—2 лет
после ревматической атаки; 2) формирование порока сердца начина-
ется спустя несколько лет после атаки, что позволяет предположить в
этом случае вторично латентное течение ревматического процесса; об
этом свидетельствуют наличие светлого промежутка после первой
атаки и отсутствие указаний на рецидивы за истекший период време-
ни [11].
Изучение катамнеза показывает, что у 5 % пациентов происходит
нивелирование симптоматики недостаточности митрального клапана,
что можно объяснить адаптационной перестройкой внутрижелудочко-
вой гемодинамики в период физического роста ребенка. Рецидивы
ревмокардита, безусловно, усугубляют степень выраженности поро-
ка сердца.
Диагноз, диагностические критерии, классификация. Установле-
но, что РЛ характеризуется многообразием клинических проявлений
и вариабельностью течения. Вот почему со времени выдающихся ис-
следований Сокольского и Буйо не прекращается совершенствование
диагностических критериев этого заболевания, блестящее описа-
ние которых было представлено выдающимся ученым-педиатром
54
А.А.Киселем в 1940 г. и названо им абсолютным симптомокомплек-
сом болезни. К последнему относились полиартрит, поражение серд-
ца, хорея, анулярная эритема и ревматические узелки [8]. Несколько
позднее критерии распознавания ревматической лихорадки были сфор-
мулированы американским исследователем T.D. Jones в 1944 г. [28].
Существенные дополнения диагностических критериев сделаны
А.И.Нестеровым в 1963—1973 гг. [16]. Описанные А.А.Киселем,
А.И.Нестеровым, T.D.Jones диагностические критерии ревматизма с
успехом использовались педиатрами и терапевтами на протяжении
ряда лет.
Для распознавания РЛ за рубежом используются критерии, реко-
мендованные ВОЗ (1989).
Сложности диагностики ревмокардита в современных условиях
связаны со следующими обстоятельствами:
— стрептококковый генез предшествующей носоглоточной инфек-
ции не всегда очевиден;
— противострептококковые антитела могут быть в низком титре;
— высеять стрептококк из зева чаще не удается;
— кардит как начальное проявление РЛ маломанифестный;
— признаки системного воспаления недостаточно показательны.
Значительной информативностью обладает эхокардиография,
чаще, чем при аускультации, выявляющая митральную или аорталь-
ную регургитацию и способствующая распознаванию кардита.
Существуют трудности при дифференциальной диагностике РЛ и
реактивного постстрептококкового артрита. Например, А.И.Сперан-
ский (1996) обнаружил артралгии, артрит соответственно у 18,1 и
8,4 % из 83 обследованных подростков после перенесенной ангины.
Суставной синдром у них сопровождался высеваем остью [J-гемолити-
ческого стрептококка группы А (73,5 %), высокими титрами анти-
стрептолизина О (67 %) и положительным бацитрациновым тестом
(68,7 %). Длительное наблюдение за этими больными не выявило фор-
мирования пороков сердца и дало право обсуждать диагноз реактив-
ного постстрептококкового артрита.
Безусловно, задачей будущего должно стать решение вопросов
дифференциальной диагностики, а главное — понимание того, по-
чему у ряда больных развивается полный симптомокомплекс РЛ, а
у других — только артрит или другое изолированное проявление бо-
лезни.
Самым загадочным проявлением РЛ остается хорея, наблюдаемая
у 12—17 % больных, преимущественно девочек в возрасте от 6 до
15 лет. Хорея чаще встречается как изолированное проявление РЛ
(83—90 %), реже в сочетании с кардитом и/или артритом. В круг диф-
ференцируемых состояний при распознавании хореи включаются фун-
кциональные тики, гиперкинезы, возникающие при СКВ, тиреотокси-
козе, опухолях мозга, антифосфолипидном синдроме.
На протяжении XX в. существенные изменения претерпела клас-
55
сификация ревматизма. В основу последнего варианта положены кли-
нические синдромы, основанные на главных и дополнительных кри-
териях РЛ, сохранены степень активности патологического процесса
и исход заболевания, модифицирован перечень вариантов течения.
В данной классификации оставлены три варианта течения РЛ: острое,
затяжное и латентное. Возможны следующие разновидности затяжно-
Рабочая классификация ревматизма (ревматической лихорадки]
Клинические синдромы Степень активно- сти Течение Исход (неактив- ная фаза) Стадия недоста- точности кровооб- ращения
основные дополнительные
• Ревмокардит
первичный
• Ревмокардит
возвратный
— без порока
сердца
— на фоне
порока
сердца
• Артрит
— без вовле-
чения серд-
ца
— с вовлече-
нием серд-
ца
• Хорея
— без вовле-
чения серд-
ца
— с вовлече-
нием серд-
ца
• Впервые вы-
явленный рев-
матический
порок сердца
• Кольцевид-
ная эритема
• Ревматичес-
кие узелки
• Артралгия
• Абдоминаль-
ный синдром
и другие се-
роз иты
• Предшеству-
ющая стреп-
тококковая
инфекция
3 Острое
2 Затяжное
1 Латент-
ное
Без по- 0
рока т
сердца X
Порок Па
сердца Пб
III
Примечание. При формулировке диагноза по возможности следует указать:
а) число достоверных атак ревматической лихорадки; б) степень тяжести
первичного и возвратного кардита без порока сердца; в) тип ревматического
порока сердца; г) доказательство предшествующей стрептококковой инфек-
ции [ангина, скарлатина, фарингит и др., а также повышение титров антител к
стрептококку — антистрептолизина-О, антистрептогиалуронидазы, антистреп-
токиназы].
56
го течения: а) затяжное течение, возникшее после острого начала;
б) затяжное волнообразное течение во время данной атаки; в) затяж-
ное течение после нерезко выраженного дебюта РЛ.
Латентное течение может быть первичным (впервые выявленный
ревматический порок сердца) и вторичным (появление поражения сер-
дца или нарастание уже имеющихся сердечных изменений в отдален-
ные сроки после перенесенной атаки ревматизма без клинически вы-
являемой активности патологического процесса). Обсуждаются раз-
личные объяснения латентного течения. Первое из них предусматри-
вает возможность «тлеющей» ревматической активности. В последнее
десятилетие V.Roisada и соавт., P.Amoils и соавт. показали, что фиб-
робласты иссеченных участков митрального клапана через много лет
после первой атаки острой РЛ проявляют необычайную реакцию,
экспрессируя DR4, а также поверхностные белки, что способствует
развитию хронического вальвулита даже без воздействия А-стрепто-
кокковой инфекции. Таким образом, нельзя исключить роль латент-
ного вальвулита в генезе формирования и прогрессирования ревма-
тического порока сердца.
Лечение. В 1999 г. исполнилось полвека со времени первого при-
менения кортизола (Е-ацетата) при РЛ [Hench P.S., 1950]. Использо-
вание ГКС — большое достижение науки второй половины XX сто-
летия. Установлено, что они обладают мощным противовоспалитель-
ным потенциалом и иммуномодулирующим эффектом. Однако после
первоначального энтузиазма наступила эра более сдержанного отно-
шения к ГКС при РЛ. Последующие длительные наблюдения за боль-
ными, перенесшими РЛ, выявили значительное количество побочных
реакций при применении ГКС, особенно со стороны миокарда. Так,
рандомизированное назначение больным РЛ (солдатам-новобранцам)
преднизолона, индометацина и вольтарена показало, что число побоч-
ных явлений у тех, кто получал преднизолон (20 %), было больше, чем
у лечившихся индометацином (13 %); у принимавших вольтарен по-
бочные реакции отсутствовали. В то же время частота развития по-
роков сердца во всех 3 группах больных была одинаковой (20 %). Эти
данные показывают, что терапией выбора при РЛ могут быть несте-
роидные противовоспалительные препараты, в первую очередь дик-
лофенак [6]. Принимая во внимание отчетливый противовоспалитель-
ный и десенсибилизирующий эффект ГКС, педиатры единодушно при-
ходят к заключению о том, что эти препараты и в современных усло-
виях показаны детям с отчетливо выраженными компонентами воспа-
ления, т.е. при ярко и умеренно выраженном кардите, при максималь-
ной или умеренной степени активности ревматического процесса, при
остром течении заболевания.
Профилактика. К большим достижениям науки XX в. надо отнес-
ти разработку вопросов профилактики ревматизма и его рецидивов.
Была разработана программа предупреждения РЛ и борьбы с рециди-
вами заболевания, включающая первичную и вторичную профилак-
тику.
57
Отмеченный с середины 80-х годов драматический накал стрепто-
кокковой инфекции в развитых странах вызывает большую озабочен-
ность ввиду возможного роста заболеваемости РЛ и вызванных ею
ревматических пороков сердца во всем мире. Поэтому остаются в силе
активные меры, включающие ряд стратегических аспектов профилак-
тики ревматизма.
Препаратом выбора для первичной профилактики, как и раньше,
остается пенициллин. Согласно рекомендациям ВОЗ (1989), эффектив-
ным средством в лечении носоглоточной инфекции является перораль-
ный кислотоустойчивый пенициллин — феноксиметилпенициллин. Для
пациентов с аллергией к пенициллинам приемлемой альтернативой
следует считать эритромицин. Сообщается, что полусинтетический
макролидный антибиотик азитромицин обладает некоторым преиму-
ществом перед эритромицином. Сходное с азитромицином действие
присуще рокситромицину. Антибиотики широкого спектра действия
(например, цефалоспорины) также могут эффективно элиминировать
стрептококк группы А из носоглотки.
В последние годы оцениваются различные антибактериальные
препараты для вторичной профилактики. Перспективными антибио-
тиками пролонгированного действия считаются бензилпенициллины
(ретарпен и экстенциллин). Круглогодичная, 5-летняя вторичная про-
филактика пролонгированными препаратами бензилпенициллина по-
зволила резко снизить рецидивы заболевания и первичную РЛ*.
На протяжении второй половины XX в. не прекращались попытки
получить стрептококковую вакцину. Последние достижения в облас-
ти молекулярной биологии, позволившие иметь ценную дополнитель-
ную информацию о стрептококке группы А, дают основание надеять-
ся на создание в будущем эффективной вакцины против РЛ.
Заключение. Обобщая вышеизложенное, необходимо отметить, что
РЛ в конце XX в. классифицируется как системное заболевание со-
единительной ткани с преимущественной локализацией процесса в
сердечно-сосудистой системе, развивающееся в связи с острой инфек-
цией 0-гемолитическим стрептококком группы А у лиц, предрасполо-
женных к заболеванию, главным образом у детей и подростков. На-
капливается все больше данных о роли особых ревматогенных А-
стрептококков, в молекулах М-протеина которого наряду с типоспе-
цифическими эпитопами находятся эпитопы, способные перекрестно
реагировать с тканями сердца, синовии и мозга. Реализация стрепто-
кокковой инфекции происходит с участием феномена молекулярной
мимикрии и нарушений клеточно-опосредованного и гуморального
иммунитета и обусловлена индивидуальной реактивностью, связанной
с семейно-генетической предрасположенностью и носительством В-
лимфоцитарного аллоантигена Д8/17.
* Подробнее о применении антибактериальных препаратов при РЛ
говорится в лекции Б.С.Белова.
58
Известно, что свойства ревматогенного А-стрептококка, как и
других штаммов этого микроорганизма, подчиняются цикловым ко-
лебаниям с усилением или ослаблением вирулентности микроба, про-
гнозирование которых имеет большое практическое значение. Это в
первую очередь относится к «сюрпризам» стрептококковой инфекции,
которая, по мнению В.Д.Белякова (1996), должна проявить большую
мощь в первой половине XXI в. и, возможно, будет сопровождаться
высоким уровнем РЛ [1]. Можно надеяться, что современная ревма-
тология, вышедшая на новые рубежи и располагающая знанием ме-
ханизмов развития стрептококковой инфекции, высокоразрешающей
диагностической аппаратурой, адекватными лечебными препаратами,
встретит эти «сюрпризы» А-стрептококковой инфекции на рубеже
веков во всеоружии.
СПИСОК ЛИТЕРАТУРЫ
1. Беляков В.Д. «Сюрпризы» стрептококковой инфекции И Вести. РАМН. —
1996. — № 11. —С. 24—28.
2. Беневоленская Л.И. и др. Клинико-генетические аспекты ревматических
болезней. — М.: Медицина, 1989. — 289 с.
3. Боткин С.П. Клинические лекции, т.1. — 1951. — 2 с.
4. Воронина Н.М. Клинико-эхокардиографическая характеристика первич-
ного ревмокардита и его исходов у детей: Автореф. дис. ... канд. мед.
наук. — М., 1983. — 20 с.
5. Данишевский Г.И. Острый и хронический ревматизм в СССР // Acta
Rheumatologica. — 1930. — Вып. 2. — С. 5—23.
6. Джузенова Б.С. Острая ревматическая лихорадка и ее исходы у моло-
дых мужчин (новобранцев): Автореф. дис. ... д-ра мед. наук. — М.,
1992.—26 с.
7. Долгополова А.В., Кузьмина Н.Н. Первичный ревмокардит у детей. —
М.: Медицина, 1978.
8. Кисель А.А. Ревматизм у детей. — М.: Медгиз, 1940.
9. Кузьмина Н.Н., Шох Б.П. Эволюция ревматизма у детей за 30 лет (1960—
1986) // Ревматология. — 1991. — № 4. — С. 3—6.
10. Кузьмина Н.Н., Амирджанова В.Н., Добровольская З.А. Распространен-
ность ревматических заболеваний у детей и состояние детской кардио-
ревматологической службы в Российской Федерации // Детская ревма-
тология. — 1996. — № 1. — С. 3—8.
11. Лепская Е.С. Клинико-рентгенологическая диагностика ревмокардита
у детей. — М.: Медицина, 1980.
12. Медынцева Л.Г. Физическая работоспособность больных ревматизмом
детей на этапе диспансеризации: Автореф. дис. ... канд. мед. наук. —
М., 1990.— 20 с.
13. Насонов Е.Л., Самсонов М.Ю., Тилз Г.П. (THz Q.P.) и др. Активация
клеточного иммунитета при острой ревматической лихорадке: клини-
ческое и патогенетическое значение // Вести. РАМН. — 1996. — № 11. —
С. 41—44.
14. Насонова В.А., Бронзов И.А. Ревматизм. — М.: Медицина, 1978.
59
15. Насонова В.А. Ревматизм И Клиническая ревматология. — М.: Медици-
на, 1989. — 108 с.
16. Нестеров А.И. Ревматизм. — М.: Медицина, 1973.
17. Полубенцева Е.И. Ревматические клапанные поражения сердца, механиз-
мы формирования, ранняя эволюция, дифференциальный диагноз:
Автореф. дис. ... д-ра мед. наук. — М., 1995. — 26 с.
18. Ревматизм и ревматическая болезнь сердца (доклад исследовательской
группы ВОЗ) И ВОЗ. — Женева, 1989.
19. Ротта Дж. Перспективы новых подходов к диагностике инфекции,
вызванной стрептококком группы А, и контроль за ревматической
лихорадкой И Ревматология. — 1986. — № 3. — С.37—39.
20. Сафронов В.В., Абрамова Г.А. Эхокардиография в диагностике степени
сердечного поражения у детей с первичным ревматизмом И Тез. докл.
XI съезда педиатров ЭССР. — Таллин, 1980. — 128 с.
21. Сперанский А.И., Красильникова О.А., Рязанцева Т.А. и др. Иммунологи-
ческие исследования при острой ревматической лихорадке и ревмати-
ческих пороках сердца И Вестн. РАМН. — 1996. — № 11. — С. 44—
50.
22. Сторожаков Г.И., Кузьмина Н.Н., Воронина Н.М. Возможности эхо-
кардиографической диагностики ревматического вальвулита и пролапса
митрального клапана И Вопр. ревмат. — 1980. — № 1. — С. 18—21.
23. Фоломеева О.М., Беневоленская Л.И. Ревматизм в Российской Федера-
ции: статистика и действительность И Вестн. РАМН. — 1996. — № 11. —
С. 21—24.
24. Шостак Н.А. Новые возможности диагностики и первичной профи-
лактики ревматической лихорадки И Вестник РАМН. — 1996. — №11. —
С. 38—41.
25. Шох Б.П., Медынцева Л.Г. Клинические проявления и исход первой
атаки ревматизма у детей в 1980-е годы И Клин, ревмат. — 1993. —
№ 1. —С. 12—15.
26. Carapetis J.R., Wolff D.R., Currie В. J. И Med. J. Aust. — 1996. — Vol. 164. —
P. 146—164.
27. Hench P.S., Kendall E.C., Slocumb C.H. et al. H Arch. Intern. Med. — 1950. —
N 85. — 545 p.
28. Jones T.D. The diagnosis of rheumatic fever // J.A.M.A. — 1944. —
Vol. 126. —P. 481—484.
29. Kaplan E.L. H Circulation. — 1993. — Vol. 88. — P. 1964—1972.
30. Rammelkump C.H., Denny F.W., Wannamaku L.W. Rheumatic Fever. Ed.
L. Thomas. — Minneapolis, 1952. — P. 72—89.
31. Stollerman J.H. Rheumatic fiver // Lancet. — 1997. — N 349. — P. 935—
942.
32. Watanabe-Ohnishi R., Aelion J. // J. Immunol. — 1994. — Vol. 152. —
P. 2066—2071.
33. Williams R.C., Klippel J.H., Dieppe P.A. Acute rheumatic fiver 11
Rheumatology. — Mosby St Louis Baltimore, Boston, Chicago, London,
Phyladelphia, Sydnay, Toronto. — 1994. — N 4. — P. 8—10.
Лекция 5
РЕВМАТОИДНЫЙ АРТРИТ
НА РУБЕЖЕ ВЕКОВ
Профессор Р.М. Балабанова, профессор М.М. Иванова, канд.
мед. наук Д.Е.Каратпеев (Институт ревматологии РАМН)
Термин «ревматоидный артрит», под которым понималось систем-
ное воспалительное заболевание соединительной ткани с прогресси-
рующим поражением преимущественно периферических (синовиаль-
ных) суставов, появился в отечественной классификации ревматичес-
ких заболеваний сравнительно недавно. В первой классификации рев-
матических заболеваний (1932) были выделены две рубрики заболе-
ваний суставов, соответствующие современному пониманию РА:
а) хронические полиартриты неопределенной этиологии доброкаче-
ственного течения, и б) прогрессирующий деформирующий полиарт-
рит разного происхождения [4].
Следует сказать, что российские клиницисты не сразу приняли
европейское название болезни — ревматоидный артрит. До 70-х го-
дов это заболевание именовалось «инфекционно-неспецифическим
полиартритом» [1]. С 80-х годов отечественные ревматологи исполь-
зуют рабочую классификацию РА, в которой впервые представлены
клиническая характеристика болезни, выделены ее иммунологические
варианты (РФ+ и РФ-), характер течения, активность, рентгенологи-
ческие стадии.
Последняя модификация классификации РА сохраняет основные
положения предыдущей, но приближается к международной статисти-
ческой классификации болезней (10-й пересмотр).
Говоря о РА на рубеже веков, нельзя не отметить важную роль
генетических исследований. В нашей стране изучение генетики РЗ
начато и успешно продолжается школой Л.И.Беневоленской. Пока-
зано, что в семьях больных РА среди родственников первой степени
родства происходит 10-кратное увеличение популяционной частоты
этого заболевания. В 1970-х годах была установлена ассоциация меж-
ду HLA-DR4 и РА [2]. Дальнейшие исследования расширили ассоци-
ативную связь РА с Dw4, Dwl4, Dwl5 субтипами DR4 [8]. Использо-
вание методов молекулярной биологии позволило выявить, что все эти
ассоциации могут быть объяснены определенной аминокислотной пос-
ледовательностью в 3-м гипервариабельном регионе DR01 гена. Ус-
тановлено, что гомозиготность по некоторым аллелям DR01 ассоции-
руется с более тяжелыми проявлениями РА: васкулитом, синдромом
Фелти, поражением легких, а также различным ответом на базисную
терапию. На сегодняшний день генетическим исследованиям прида-
61
ется большое значение не только в понимании патогенеза РА, но и в
плане разработки новых подходов к его лечению.
Однако не у всех носителей известных генетических факторов
риска развивается РА, поэтому нельзя исключить участие внешнесре-
довых факторов, в первую очередь инфекции.
Рабочая классификация РА
Клиническая характеристика Иммуно- логичес- кая ха- ракте- ристика (по РФ) Течение Актив- ность, степень Стадия рент- генологичес- кая (по Штейи- брокеру) Функцио- нальная способ- ность
Полиартрит Серопо- Быстро-
(М.06.4) зитивиый прогрес- (М.05) сирую-
Системные Сероне- щее
проявления: гатив иый Медлен-
васкулит (М.06.0) н0 Пр0Г.
(М.05.2), полн- рессиру-
иейропатия (М.05.3), рев- матоидные уз- лы (М.06.3), миопатия гене- рализованная, ющее
0 — ре- миссия 1 — околосус- Сохране- суставной ос- на теопороз
1 — низ- Ограни-
кая л 2 — остеопо- чеиа роз + сужение
Z суставной щели, Утрачена
средняя могут быть еди-
3 — вы- сокая ничные узуры 3 — то же + + множествен- ные узуры
полисерозит
(перикардит,
плеврит и др.)
(М.05.3), альвео-
лит, ревмато-
идное легкое
(М.05.1), мио-,
эндокардит
(М.05.3), ами-
лоидоз почек,
гломерулонеф-
рит
Особые синд-
ромы: синдром
Фелти (М.05.0),
синдром Стилла
взрослых
(М.06.1), синд-
ром Шегрена,
синдром Капла-
на
4 — то же +
+ костные анки-
лозы
62
В связи с тем что до настоящего времени не удается выделить из
крови и тканей больных РА специфический возбудитель болезни, ин-
фекционная теория этиологии остается дискуссионной. В ранних ра-
ботах РА связывали со стрептококковой инфекцией, что обосновыва-
лось выявлением очаговой, чаще всего тонзиллярной инфекции, по-
вышением уровня противострептококковых антител, а также наблю-
дениями рецидивов болезни после перенесенной носоглоточной инфек-
ции. Большое число работ посвящено роли микоплазмы в этиологии
РА в связи с длительным сохранением антигенных компонентов этого
микроорганизма в экстрацеллюлярных пространствах и мононуклеа-
рах синовии.
В 70-е годы лидирующее место заняла вирусная теория РА. Осо-
бое значение придавали «медленным вирусам», которые, внедряясь в
клетки хозяина, могут длительно в них персистировать, изменять био-
синтез клеточных белков путем встраивания своего генома в ДНК
клеток хозяина. Использование антибиотиков резко снизило число
заболеваний, вызываемых бактериями и простейшими, но при этом
стал резко возрастать удельный вес вирусных инфекций в патологии
человека. Это обусловлено и снижением иммунной защиты в резуль-
тате изменения генофонда, экологических катастроф, использовани-
ем препаратов, подавляющих иммунитет, и т.д. [8].
Современные микробиологические методы позволяют обнаружить
вирус в синовиальной жидкости больных хроническим артритом. При
инфицировании неизмененной синовиальной ткани различными вирус-
ными агентами оказалось, что вирусы имеют индивидуальные особен-
ности размножения: вирус краснухи и эпидемического паротита реп-
родуцируется и проникает глубоко в синовиальную мембрану; вирус
herpes zoster находится только в поверхностных синовиальных клет-
ках, как и лимфотропный вирус человека 1-го типа, который спосо-
бен индуцировать продукцию гранулоцитарно-макрофагального ко-
лониестимулирующего фактора, и усиливать пролиферацию синови-
альных клеток.
Механизм участия вирусов в развитии РА может быть различным.
Во-первых, возможно прямое воздействие вируса на синовиоциты с
развитием острой вирусной артропатии и антигенемии, как это имеет
место при инфицировании вирусом краснухи, парвовирусом В19, ви-
русом простого герпеса 1-го типа, вирусом паротита. Во-вторых,
может происходить инфицирование вирусами лейкоцитов, проникно-
вение их в полость сустава с током крови, где лейкоциты разруша-
ются, а вирусы фагоцитируются клетками синовиальной оболочки и
персистируют в них. При этом циркулирующие антитела не могут ней-
трализовать вирус, в результате чего он служит «адъювантом», под-
держивает воспаление с изменением иммунного ответа, индукцией ан-
тителообразования, иммунных комплексов. Этот механизм присущ
вирусам Коксаки А13, аденовирусам, вирусу Эпштейна—Барр, ци-
томегаловирусу, человеческому лимфотропному вирусу 1-го типа,
вирусам гепатита В и С.
63
По нашим наблюдениям, у 70 % больных РА выявляются антите-
ла к цитомегаловирусу и вирусу Эпштейна—Барр. Подтверждается
роль вирусной инфекции в патогенезе РА и положительными резуль-
татами при использовании полимеразной цепной реакции. Дальнейшие
исследования в этом направлении помогут уточнить этиологию РА,
отдельные звенья патогенеза, лучше понять причины клинической
гетерогенности и усовершенствовать терапию.
Большие успехи достигнуты в изучении патогенеза РА. Ранние
исследования были в основном сфокусированы на В-клеточной гипер-
реактивности и выработке антител, в частности, к Fc-фрагменту IgG
(РФ).
К настоящему времени предложены 3 основные гипотезы патоге-
неза.
Первая Т-клеточная, основанная на том, что РА вызывается спе-
цифическим антигеном, скорее всего, артритогенным, с последующим
Т-клеточным ответом. В пользу этой гипотезы свидетельствуют эк-
стенсивная инфильтрация синовиальной оболочки CD4+ (хелпер-ин-
дуктор) Т-клетками и наличие ассоциации РА со специфическим HLA-
DR гаплотипом, который участвует в распознавании антигена, пред-
ставлении (презентации) его клеткам иммунной системы и последую-
щем включении всего репертуара Т-клеток [3]. При активации
ревматоидного процесса возрастает число ТЫ-клеток, а накопление
ТЬ2-клеток связано с ремиссией.
Вторая гипотеза предполагает участие макрофагов и фиброблас-
тов, концентрирующихся в синовиальной оболочке при РА. Такие
цитокины, как ИЛ-1, ФНО-а, гранулоцитарно-макрофагальный ко-
лониестимулирующий фактор, ИЛ-6, хемокины, стимулируют выра-
ботку ПГ, металлопротеиназ, активируют систему комплемента, кле-
точное взаимодействие. При недостатке противовоспалительных ци-
токинов эта сеть медиаторов становится самоподцерживающей и при-
водит к хронизации воспаления.
Третья гипотеза патогенеза РА основана на способности фибро-
бластоподобных синовиоцитов трансформироваться, инвазировать
матрикс хряща и индуцировать провоспалительные медиаторы. В си-
новиальных мононуклеарах выявлен белок р53, а также другие бел-
ки, являющиеся продуктами протоонкогенов. Предполагается, что
изменение экспрессии протоонкогенов в синовиальной оболочке при
РА может способствовать неконтролируемой пролиферации клеток,
придающей сходство с неопластическим процессом. В связи с тем что
эти белки находят на поздних стадиях РА, не исключено, что накоп-
ление провоспалительных цитокинов вызывает образование геноток-
сических стимулов, таких как окись азота, перекисные формы кисло-
рода, повреждающие ДНК [7].
Понимание патогенеза РА позволяет по-новому подойти к терапии
этого клинически гетерогенного заболевания.
Приводим перечень антиревматических препаратов, применяемых
в настоящее время.
64
Антиревматические препараты
Противовоспалительные, модифицирующие симптомы (1-я линия):
— нпвп,
— глюкокортикостероиды.
Медленно действующие, болезньмодифицирующие (базисные)
(2-я линия):
— аминохинолиновые,
— сульфасалазин,
— соли золота,
— D-пеницилламин.
Цитотоксические иммунодепрессанты (3-я линия):
— метотрексат,
— циклофосфамид,
— циклоспоринА,
— азатиоприн и др.
Модификаторы биологического ответа:
— модулирующие иммунный ответ,
— интерфероны, цитокины,
— тимические гормоны,
— иммунные эффекторы в виде клеток, антител,
— генная терапия,
— пересадка костного мозга или отдельных линий клеток.
В лечении РА за 70 лет произошли большие изменения — от ис-
пользования аспирина, которому исполнилось 100 лет, до генной те-
рапии [6, 7].
Нестероидные противовоспалительные препараты по-прежнему
являются лечебными средствами 1-й линии. Открытие 2 изоформ цик-
лооксигеназы (ЦОГ) — ключевого фермента, участвующего в пре-
вращении арахидоновой кислоты и образовании простагландинов,
привело к разработке новых лекарственных средств, угнетающих
преимущественно ЦОГ-2 — индуцируемую при воспалении форму
ЦОГ. К так называемым селективным ингибиторам ЦОГ-2 относят-
ся мелоксикам, набуметон, нимесулид. Созданы уже и специфичес-
кие ингибиторы ЦОГ-2— целекоксиб. Фармацевтические фирмы
работают над созданием новых лекарственных форм — кишечно-
растворимых, ретардированных, комплексных, препаратов для ло-
кальной терапии, что позволяет снизить частоту побочных эффектов,
вызываемых НПВП.
Так называемые медленно действующие или «базисные» препара-
ты, относящиеся к средствам 2-й линии, позволяют изменять течение
РА. Они по-прежнему играют первостепенную роль в комплексной
терапии РА, но сейчас наметился новый подход к их назначению. В
отличие от хорошо известной тактики постепенного наращивания
3—3592
65
терапии РА («принцип пирамиды») теперь пропагандируется раннее
агрессивное лечение.
Назначение «базисных» препаратов рекомендуется в сочетании с
ГКС в малых дозах, что позволяет снизить активность РА до начала
действия первых. Обсуждается нецелесообразность дальнейшей тера-
пии одним избранным «базисным» препаратом, если нет эффекта че-
рез 6—12 нед.
Новым подходом является использование высоких доз ГКС (пульс-
терапия) в комбинации с «медленно действующими» средствами, что
позволяет повысить эффективность последних; комбинаций «базис-
ных» препаратов, особенно метотрексата, с аминохинолиновыми про-
изводными, солями золота, сульфасалазином, а также относительно
новым для ревматологии селективным иммунодепрессантом — цикло-
спорином А.
В последние годы наметился возврат к использованию антибиоти-
ков при лечении РА, в основном тетрациклинового ряда, что обосно-
вывается не антимикробным действием, а способностью ингибировать
коллагеназу, металлопротеиназы, влиянием на хемотаксис и фагоци-
тоз и др.
Большое число работ посвящено исследованию роли модификато-
ров биологического ответа: цитокинов, интерферонов и их индукто-
ров, тимических гормонов, а также генной терапии с использованием
вирусных векторов для доставки генов противовоспалительных ци-
токинов и пересадки костного мозга или отдельных линий клеток.
Наш собственный опыт показал, что активная и рано начатая
базисная терапия способна затормозить прогрессирование РА, что
наиболее отчетливо прослеживается при использовании солей золота
и метотрексата.
При выборе терапии необходимо учитывать прогностические мар-
керы РА, которые подразделяют на социодемографические (начало
болезни в пожилом возрасте, женский пол, низкий уровень образова-
ния, тяжелый физический труд); клинические (длительный период бо-
лезни до первого обращения к врачу, большое число пораженных
суставов, наличие внесуставных проявлений болезни, высокая степень
функциональной недостаточности); лабораторные (высокие титры РФ
и уровень СРБ, значительно увеличенная СОЭ, наличие HLA-DR4* ),
а также рентгенологические — быстрое прогрессирование деструктив-
ных изменений суставов.
Неясным остается вопрос о том, как оценить эффект проводимой
терапии, поскольку стечением времени клиническая и лабораторная
активность снижается, а деструктивные изменения в суставах нарас-
тают, при этом не всегда коррелируя с функциональной способнос-
тью пациента. Полагаем, что для этого можно использовать динами-
ку разработанного в Институте ревматологии «индекса тяжести»,
включающего рентгенологическую стадию, степень функциональной
недостаточности, число внесуставных проявлений, а также комплек-
сный показатель активности.
66
В заключение следует сказать, что несмотря на то, что ревматоло-
ги добились существенных успехов в изучении РА, остается много
проблем, которые нужно будет решать в XXI веке.
СПИСОК ЛИТЕРАТУРЫ
1. Астапенко М.Г. Инфекционный неспецифический полиартрит. — М.:
Медгиз, 1951.
2. Беневоленская Л.И., Бржезовский М.М. Эпидемиология ревматических
болезней. — М.: Медицина, 1988. — С. 98—116.
3. Клиническая иммунология. — М.: Медицина, 1998.
4. О единой классификации ревматических и суставных заболеваний // Вопр.
ревмат. — 1932. — №3. — С. 3—4.
5. Руководство по иммунофармакологии / Под ред. М.М.Дейла, Дж.К.Фор-
мена. — М.: Медицина, 1998.
6. Novel therapeutic agents for the treatment of autoimmune diseases. / Eds
V.Strand, D.Seott, L.Simon. —N.Y., 1997.
7. Rheumatology highlights, 1997 / Ed. P.Emery. — Oxford, 1997.
8. Silman A.J., Hochberg M.C. Epidemiology of the Rheumatic Diseases. —
Oxford University press, 1993.
Лекция 6
ЛЕЧЕНИЕ РЕВМАТОИДНОГО
АРТРИТА ЦИКЛОСПОРИНОМ А
Профессор Я. А. Сигидин (Институт ревматологии
РАМН)
Циклоспорин А (ЦА) представляет собой циклический полипептид,
выделенный из грибков Tolypocladium inflatum и Cylindrocarpon
lucidum. Среди 9 различных циклоспоринов только 3 обнаружили
иммунотропные эффекты (А, С и G), из которых лишь ЦА нашел ре-
альное применение в медицине. Важной особенностью ЦА является
сочетание иммунодепрессивного действия (ярко проявившегося преж-
де всего при подавлении трансплантационного иммунитета) с отсут-
ствием общего цитотоксического эффекта. Таким образом, ЦА при-
суще определенное селективное влияние на иммунную систему, что вы-
годно отличает его от классических иммунодепрессантов, используе-
мых в ревматологии, — как антиметаболитов (метотрексат, азатиоп-
рин), так и алкилирующих (циклофосфамид, хлорбутин). Механизм
действия ЦА не может считаться полностью выясненным, несмотря на
большое количество соответствующих исследований. Большинство
3*
67
авторов считают, что основное значение в лечебном действии этого
препарата принадлежит торможению синтеза и секреции ИЛ-2 Т-лим-
фоцитами. Проникнув в клетку путем простой диффузии, ЦА специ-
фически связывается с внутриклеточными белками — циклофиллина-
ми, участвующими в регуляции белкового синтеза, и некоторыми дру-
гими, менее изученными регулирующими белками (в частности, с каль-
цийсвязывающим белком кальмодулином и кальциневрином). Есть
также данные о связывании ЦА с некоторыми ядерными белками,
имеющими отношение к транскрипции генов. В результате отмечен-
ного взаимодействия ЦА с белками нарушается функционирование
генов, кодирующих синтез цитокинов, вследствие чего продукция
последних (особенно ИЛ-2, но также ИЛ-3, ИЛ-4, ИЛ-6 и ИФ-у) сни-
жается, в связи с чем происходит угнетение преимущественно Т-кле-
точных иммунных реакций, которым в развитии РА придается особен-
но большое значение. Торможение активности В-клеток при назначе-
нии ЦА происходит, по-видимому, преимущественно вторично, за счет
ингибирования Т-клеточного звена, хотя имеются отдельные наблю-
дения относительно первичного влияния препарата на В-клетки. По-
лагают, что в больших дозах ЦА оказывает тормозящее влияние на
функцию В-клеток, макрофагов, тучных клеток и базофилов, клеток
кости и хряща. В связи с этим становятся более понятными данные об
угнетении ЦА синтеза и секреции ИЛ-1 и ФИО макрофагами. В им-
мунодепрессивном эффекте ЦА определенное значение придается его
способности уменьшать экспрессию антигенов гистосовместимости
2-го класса (прежде всего DR) на поверхности макрофагов, что, воз-
можно, происходит опосредованно — благодаря торможению продук-
ции интерферона у. Как известно, молекулы DR играют решающую
роль в представлении антигенов макрофагами Т-лимфоцитам. Неко-
торые авторы считают, что независимо от тормозящего влияния на
систему цитокинов ЦА противодействует резорбтивному влиянию на
кость простагландина Е2, ИЛ-1 и гормона паращитовидной желе-
зы. Селективность действия ЦА проявляется, в частности, в том, что
он тормозит синтез только части цитокинов, вырабатываемых Т-лим-
фоцитами и макрофагами. Так, продукция гранулоцитарно-макро-
фагального колониестимулирующего фактора не снижается, что,
возможно, объясняет редкость гематологических осложнений при
лечении ЦА.
Привлекают большое внимание данные о тормозящем влиянии ЦА
и некоторых его аналогов на клеточный мембранный комплекс, от-
ветственный за множественную лекарственную резистентность, осо-
бенно по отношению к противоопухолевым препаратам. В связи с этим
возникает естественный вопрос о потенциальной возможности преодо-
левать резистентность к антиревмагическим лекарственным препара-
там с помощью ЦА.
ЦА существует в виде раствора или капсул — для приема внутрь
и в виде раствора — для внутривенного введения. При лечении РА
препарат вводится только внутрь. Суточная доза обычно делится на
68
2 приема — утром и вечером. Основанием для такого назначения слу-
жит относительно длительный период полувыведения — 6 ч. Препа-
рат метаболизируется в печени, поэтому при печеночной патологии
период полувыведения может значительно удлиняться — до 20 ч. Вса-
сывание из пищеварительного тракта происходит сравнительно мед-
ленно, иногда со значительными индивидуальными различиями, при-
чем прием пищи еще более замедляет его; в крови ЦА активно связы-
вается с белками, особенно с липопротеидами. Необходимо иметь в
виду, что ЦА для внутривенного введения не может использоваться
для приема внутрь: эта лекарственная форма не всасывается в пище-
варительном тракте.
За последние годы выпущена особая микроэмульсионная форма
ЦА, получившая название неорал, который также применяется внутрь
(в тех же дозах), но всасывается полнее и быстрее. Он обладает боль-
шей биодоступностью, после его назначения пик концентрации пре-
парата в крови достигается раньше и бывает более высоким.
Первые годы применения ЦА в медицине были связаны с его ши-
роким использованием в трансплантологии. В последующем селек-
тивные иммунодепрессивные свойства препарата побудили исследо-
вать его возможный лечебный эффект при ряде заболеваний, связы-
ваемых с иммунной и аутоиммунной патологией. Естественно, что
среди них большое внимание привлекали ревматические болезни,
прежде всего РА.
Обобщая предшествующий опыт, B.Amor указывает, что среди
болезней соединительной ткани только при РА эффективность и пере-
носимость ЦА являются предсказуемыми и контролируемыми. Хотя до
настоящего времени продолжаются отдельные попытки использовать
ЦА у больных другими болезнями соединительной ткани, применение
этого препарата в ревматологии показано в основном при РА (лече-
ние проведено уже тысячам больных). Важной предпосылкой для дли-
тельного успешного лечения ЦА больных РА оказалась возможность
получения терапевтического эффекта при использовании относитель-
но малых (по сравнению с трансплантологией) доз. Так, в 1986 г. было
отмечено явное клиническое улучшение при лечении больных с тяже-
лыми формами РА в суточной дозе 10 мг/кг (A. van Rijthoven et al.).
Однако токсичность препарата оказалась слишком высокой. В 1991 г.
те же авторы обнаружили, что для достижения терапевтического
эффекта оказалась достаточной суточная доза 5 мг/кг. Наиболее
существенным этапом явилось установление эффективности дозы
2,5 мг/кг/сут [Сигидин Я.А., Усова С.Б., 1995; Tugwell Р., 1995]. Эту
дозу мы считаем оптимальной, поскольку она обеспечивает сочета-
ние отчетливого лечебного действия и вполне удовлетворительной пе-
реносимости. Применение меньших доз (в частности, 1 мг/кг/сут) дает
явно недостаточный эффект, хотя у единичных больных некоторое
улучшение отмечалось и при такой суточной дозе.
Существует ряд двойных слепых плацебо-контролируемых иссле-
дований, в которых были доказаны достоверная терапевтическая
69
эффективность и удовлетворительная переносимость ЦА при РА [van
Rijthoven А., 1986; Tugwell Р., 1995; Dougados ML, 1996]. Происхо-
дило существенное улучшение таких показателей активности РА, как
количество болезненных и воспаленных суставов, сила кисти, утрен-
няя скованность, функциональный индекс и С-реактивный белок. В то
же время достоверной положительной динамики СОЭ некоторые ав-
торы не отмечали.
Большинство современных авторов единодушны в том, что лече-
ние ЦА следует начинать с суточных доз 2,5—3,5 мг/кг массы паци-
ента, т.е. обычно со 150—200 мг в день. Отчетливые положительные
результаты его назначения в большинстве случаев можно ожидать
только через 3 мес непрерывной терапии (хотя некоторые клиничес-
кие симптомы улучшения иногда появляются и несколько ранее —
через 1,5—2 мес). Поэтому популярную рекомендацию увеличивать
суточную дозу при ее неэффективности уже через 4—6 нед на 0,5—
1 мг/кг и продолжать аналогичное увеличение через такие же интер-
валы до максимальной суточной дозы 5 мг/кг нельзя считать обосно-
ванной. Нарастание дозы в подобных случаях происходит неоправ-
данно быстро, тем более что отдельные исследователи отмечали наи-
лучший результат только через 6 мес. Кроме того, увеличение суточ-
ной дозы до 5 мг/кг значительно повышает вероятность побочных
эффектов. Поэтому на основании практического опыта нам представ-
ляется наиболее рациональным использовать у больных РА в качестве
начальной суточной дозы ЦА 2,5 мг/кг и при хорошей переносимости
сохранять ее неизменной в течение 3,5—4 мес. Если в этот период
времени положительный эффект полностью отсутствует, то дальней-
шее применение препарата нецелесообразно. Если же улучшение до-
стигнуто, но выражено недостаточно, возможно увеличение дозы до
3 или 3,5 мг/кг в сутки в последующие 2—2,5 мес, т.е. всего до 6 мес.
При отсутствии удовлетворительного результата к концу этого сро-
ка продолжать терапию ЦА бесполезно.
Очень важно, что в ряде наблюдений установлено тормозящее
влияние ЦА на прогрессирование деструктивных суставных измене-
ний у больных РА [Сигидин Я.А., Усова С.В., 1995; Thompson R.,
1984; Russel R., 1993; Forte О., 1994], что вполне обосновывает вклю-
чение данного препарата в категорию базисных антиревматоидных
средств. О том же свидетельствует возможность уменьшения доз пред-
низолона и НПВП на фоне успешного лечения ЦА.
Работы по сопоставлению ЦА с другими базисными препаратами
немногочисленны. Van den Borne и соавт. нашли, что после двухлет-
него назначения ЦА и хлорохин оказали тождественный положитель-
ный эффект у больных РА. Аналогичным образом было показано, что
результаты лечения ЦА сопоставимы с результатами, полученными
при лечении D-пеницилламином (A. van Rijthoven) и азатиоприном
[Forre О., 1994].
В течение длительного времени наиболее бесспорным показанием
для назначения ЦА больным РА является неэффективность или непе-
70
реносимость (либо наличие соответствующих противопоказаний) клас-
сических базисных средств. Нас прежде всего интересовали терапев-
тические возможности ЦА при лечении заведомо тяжелых суставных
форм РА и наиболее серьезных вариантов болезни с выраженными
системными проявлениями. При этом особенно важным представлял-
ся вопрос о сравнительной эффективности ЦА и таких наиболее по-
пулярных классических иммунодепрессантов-антиметаболитов, как
метотрексат и азатиоприн, у больных РА с внесуставными проявле-
ниями болезни. Как известно, такие больные представляют наиболь-
шую сложность для терапии. С этой целью мы провели клиническое
изучение ЦА в сопоставлении с метотрексатом и азатиоприном у
75 пациентов, страдающих тяжелым РА с системными проявлениями
(у всех больных отмечались длительное течение заболевания и неэф-
фективность нескольких базисных препаратов). Длительность терапии
во всех группах составляла один год. На основании проведенных ис-
следований оказалось возможным сделать вывод об отчетливом ба-
зисном эффекте ЦА при РА: препарат оказывал лечебное действие у
большинства больных к концу 3-го месяца назначения, вызывал дос-
товерное уменьшение не только клинических, но и иммунологических
проявлений болезни (в частности, снижение уровня ревматоидного
фактора и циркулирующих иммунных комплексов), в некоторой сте-
пени тормозил прогрессирование суставной деструкции. В ходе ран-
домизированного сопоставления ЦА, метотрексата и азатиоприна все
три препарата обнаружили отчетливый и в принципе одинаковый по-
ложительный лечебный эффект. Особенно важно, что у части больных
РА, резистентных к другим иммунодепрессантам, ЦА также вызвал
заметное улучшение. Таким образом, препарат оказался эффективным
у наиболее серьезных больных РА и подтвердил, что он может пре-
тендовать на самостоятельное место в антиревматоидной терапии в
качестве средства, назначаемого при неэффективности всех других
иммунодепрессантов. Интересно, что в отличие от результатов, при-
веденных во многих публикациях, лечение ЦА в наших наблюдениях
привело к достоверному снижению СОЭ.
Некоторые варианты РА, его осложнения и часто сочетающиеся с
ним синдромы могут влиять на возможность назначения ЦА. В част-
ности, при синдроме Фелти применение препарата вполне возможно.
Наличие признаков вторичного амилоидоза, тем более почечного,
является противопоказанием для терапии ЦА в связи с потенциальной
нефротоксичностью этого препарата. Его использование у больных
РА с синдромом Шегрена способно улучшить проявления артрита, но
не обнаруживало положительного влияния на симптомы сухого синд-
рома как такового.
В течение последних лет отчетливо наметилась тенденция к назна-
чению ЦА в ранней стадии РА. Для этого имеются определенные тео-
ретические предпосылки, к которым относится прежде всего факт
особенно высокой активности Т-лимфоцитов именно на начальных
этапах РА. Таким образом, назначение в этот период ЦА, целенап-
71
равленно тормозящего функцию указанных клеток, вполне оправда-
но. Значительный интерес в этом смысле представляет большое иссле-
дование Pasero, в котором были сопоставлены результаты лечения 340
больных в относительно раннем периоде РА (средняя длительность
заболевания — 1,4 года), из которых 167 пациентов получали ЦА в
начальной суточной дозе 3 мг/кг и 173 — обычные базисные препара-
ты. Через 12 мес лечения клиническое улучшение в обеих группах
было одинаковым. Однако прогрессирование суставной деструкции
оказалось достоверно меньшим среди лечившихся ЦА. Особенно впе-
чатляющими были различия у больных без признаков костной дест-
рукции в начале исследования. Среди них через год лечения ЦА эро-
зии появились у 11 %, а на фоне лечения остальными базисными пре-
паратами — у 52 %. Такое торможение анатомического прогрессиро-
вания суставных поражений у больных РА согласуется с отмеченным
в эксперименте на модели адъювантного артрита торможением дест-
рукции кости и хряща воспаленных суставов в результате назначе-
ния ЦА. В то же время на небольшой группе больных (44 человека) с
ранней стадией РА после 2 лет лечения не было обнаружено различий
в количестве костных эрозий между группами, получавшими анало-
гичные суточные дозы ЦА (в среднем 2,7 мг/кг) и малые дозы хлоро-
хина (в среднем 100 мг в день) [van den Borne В., 1995].
За последние годы в связи с частой неудовлетворенностью резуль-
татами базисной монотерапии РА наблюдается тенденция к комбини-
рованию базисных средств, в том числе с использованием ЦА. Име-
ются сообщения о развитии клинического улучшения после добавле-
ния ЦА к ранее недостаточно эффективному метотрексату [Tugwell Р.,
1990], хлорохину [Dijkmans В., 1986; Landewe М., 1990], препаратам
золота [Bensen W., 1996]. Нарастание терапевтического эффекта в
подобных случаях может быть вызвано разными причинами: истинным
синергизмом, простым суммированием эффекта, уменьшенным выде-
лением ранее назначенного препарата почками и тем самым увеличе-
нием в крови его концентрации, торможением гена лекарственной ре-
зистентности. В настоящее время проводится крупное международное
многоцентровое двойное слепое исследование комбинированного ле-
чения метотрексатом и ЦА.
Как уже указывалось, переносимость ЦА стала удовлетворитель-
ной только после отказа от ранее применявшихся больших доз препа-
рата. Тем не менее даже принятое теперь использование меньших су-
точных доз (2,5—3,5 мг/кг) нередко сопровождается развитием побоч-
ных эффектов. Среди них наиболее часты желудочно-кишечные рас-
стройства (боли в эпигастрии, тошнота, рвота, понос), артериальная
гипертония, снижение функции почек с повышением уровня креати-
нина в сыворотке крови, гипертрихоз, гиперплазия десен с их повы-
шенной кровоточивостью, неврологические расстройства (головная
боль, гиперестезии или парестезии), повышение уровня печеночных
ферментов, билирубина, калия. Самыми серьезными из них являются
нарушения почечной функции и гипертония. Во многих случаях ги-
72
пертония хорошо контролируется назначением умеренных доз бета-
блокаторов, нифедипина или других гипотензивных средств. Отрица-
тельное влияние на функцию почек связано с тем, что ЦА нередко
вызывает функциональные и гистологические изменения канальцев и
клубочков почек. В большинстве случаев после отмены препарата эти
изменения бывают полностью обратимыми, но у единичных больных
наблюдались стойкие морфологические изменения почек: непроходи-
мость артериол клубочков, атрофия канальцев, интерстициальный
фиброз.
В процессе лечения ЦА следует регулярно следить за уровнем кре-
атининемии — сначала через каждые 15 дней, а затем ежемесячно.
Если уровень креатинина повышается более чем на 30 % исходной
величины, доза препарата уменьшается, и через месяц содержание
креатинина определяет дальнейшую тактику. В случае сохранения
повышенного уровня креатинина (т.е. более чем на 30 % от исход-
ного) препарат отменяется. Если же уровень креатинина снизился
ниже этой пороговой величины, то лечение может быть продолжено
в уменьшенной дозе, но по-прежнему с регулярным контролем креа-
тининемии.
Высокая, плохо контролируемая гипертония, нарушение функции
почек или печени являются противопоказаниями к назначению ЦА.
В соответствии с общими представлениями об эффекте иммунодепрес-
сантов препарат не назначается также больным со злокачественными
заболеваниями (в том числе в прошлом), при иммунодефицитах,
сопутствующих инфекционным болезням, беременности и лактации.
В то же время необходимо иметь в виду, что риск гематологических и
инфекционных осложнений при использовании ЦА гораздо меньше,
чем при терапии классическими иммунодепрессантами. При хирурги-
ческих вмешательствах у больных РА рационально временно отменить
В наших наблюдениях отмена циклоспорина из-за побочных эффек-
тов потребовалась только у 2 из 35 больных РА (в обоих случаях в
связи с появлением крапивницы). Среди других побочных явлений
чаще наблюдалось повышение артериального давления, иногда в
сочетании с вегетативными сосудистыми реакциями (покраснение
лица, чувство жара, потливость, сердцебиение). Лишь в единичных
случаях регистрировались боли в мышцах, гиперплазия десен и ги-
пертрихоз. Неожиданным оказалось полное отсутствие нефротоксич-
ности у наших пациентов, что мы склонны связать с небольшими су-
точными дозами препарата. Тем самым опровергается мнение авто-
ров, считающих нарушение функции почек при развитии лечебного
эффекта ЦА практически неизбежным. Существенно также, что на фоне
лечения ЦА нами ни у одного пациента не было отмечено лейкопении
или интеркуррентных инфекций.
Некоторые авторы считают, что потенциальный риск развития
побочных эффектов ЦА увеличивается при его одновременном на-
значении с такими препаратами, как антиэпилептические средства,
73
эритромицин, верапамил, триметоприм, кетоконазол, флуконазол,
дилтиазем.
В первые годы после внедрения ЦА в медицинскую практику счи-
талось обязательным регулярно контролировать концентрацию пре-
парата в крови в процессе лечения. В настоящее время от этого тре-
бования отказались. На собственном материале мы убедились в от-
сутствии закономерного параллелизма между лечебным эффектом и
переносимостью ЦА, с одной стороны, и его содержанием в крови, с
другой.
Таким образом, ЦА пополнил арсенал базисных антиревматоид-
ных средств и заметно расширил возможности врача при лечении РА
По сравнению с классическими базисными препаратами ЦА облада-
ет принципиально иным механизмом действия и может привести к за-
метному улучшению течения заболевания у больных, резистентных к
традиционному лечению. Спектр побочных эффектов ЦА и других
иммунодепрессантов не совпадает, и поэтому непереносимость мето-
трексата и азатиоприна в большинстве случаев не служит противо-
показанием для его применения. Можно полагать, что дальнейшее фар-
макологическое и клиническое изучение ЦА приведет к его более
широкому использованию в терапии РА.
Лекция 7
СПОНДИЛОАРТРИТЫ КАК ОБЪЕКТ
ПЕРСПЕКТИВНЫХ НАУЧНЫХ
ИССЛЕДОВАНИЙ В РЕВМАТОЛОГИИ
Профессор Э.Р.Агабабова (Институт ревматологии
РАМН)
В последнее десятилетие наметился серьезный интерес клиницис-
тов, микробиологов, иммунологов, иммуногенетиков к изучению
проблемы спондилоартритов/спондилоартропатий, к числу которых
относится большой круг всем хорошо известных ревматических за-
болеваний: анкилозирующий спондилоартрит — болезнь Бехтерева,
болезнь Рейтера, артриты реактивные; энтеропатические (при неспе-
цифических воспалительных заболеваниях кишечника); ювенильный
хронический и псориатический артрит.
Важнейшими объединяющими признаками всех этих хронических
суставных воспалительных процессов являются преимущественно
моно-, олигоартикулярное поражение нижних конечностей, частое
вовлечение илеосакральных сочленений и позвоночника, отрицатель-
ные реакции на ревматоидный фактор, семейная предрасположен-
74
ность, ассоциация с антигеном HLA-B27, а также целый ряд внесус-
тавных проявлений со стороны глаз, кожи, урогенитального тракта и
кишечника, связанных, как правило, с различными инфекционными
факторами.
На примере спондилоартропатий теоретики и клиницисты пытают-
ся разрешить в наши дни не только множество практически важных
для ревматологии задач, но и понять некоторые важнейшие процессы,
лежащие в основе заболеваний, и наметить новые подходы к их
терапии и профилактике. В частности, это касается взаимоотношения
хронических инфекций и организма хозяина, характера и значимости
иммунологических нарушений при этих состояниях, роли генетичес-
ких факторов — различных антигенов гистосовместимости, и прежде
всего HLA-B27, в патогенезе болезней.
Если говорить о перспективах клинических исследований спон-
дилоартритов, то следует иметь в виду следующие обстоятельства.
Спектр этих гетерогенных по своей природе заболеваний в последнее
время неуклонно расширяется, чему в значительной мере способство-
вало упрочение концепции о спондилоартритах, которая стала хорошо
известна практическим врачам. Многие спондилоартриты имеют до-
статочно четко разработанные диагностические критерии, которые,
однако, как показывает жизнь, не всегда приемлемы для распо-
знавания и дифференциальной диагностики на самых ранних этапах
болезней, при осуществлении эпидемиологических исследований и в
случаях так характерной для спондилоартритов перекрестной клини-
ческой симптоматики.
Новейший опыт ревматологов-клиницистов различных стран по-
казывает, что такие признаки спондилоартритов, как острый передний
увеит, энтезиты, дактилит, онихолизис, поражение слизистых оболо-
чек, в течение длительного времени могут быть единственными кли-
ническими знаками даже при отсутствии болей в крестцовой области,
спине или периферического артрита. Это послужило основанием для
введения в последние годы термина «недифференцированная спон-
дилоартропатия». Этот термин часто упоминается в современной
ревматологической литературе, отражая несомненный прогресс в кли-
нических взглядах на суставную патологию.
При длительном наблюдении за эволюцией недифференцированных
спондилоартропатий у большинства больных удается установить
конкретный нозологический диагноз одного из заболеваний, входящих
в обсуждаемую группу, в частности реактивных артритов, что может
быть подтверждено данными серологических и бактериологических
исследований [3].
Следует также помнить, что отдельные признаки спондилоарт-
ропатий и даже развитие классической картины анкилозирующего
спондилоартрита могут появиться и при ряде других заболеваний,
особенно заболеваниях кишечника (некоторые случаи болезней
Крона, Уиппла, при так называемом синдроме слепой петли кишеч-
ника — jejunoileal bypass, амебиазе, жирардиазе), и при этом не
75
ассоциироваться с антигеном В27 [15]. Так, установлено, что у боль-
ных спондилоартритами, включая недифференцированные
спондилоартропатии и даже анкилозирующий спондилоартрит, в 65 %
случаев (против 3 % случаев у здоровых) при илеоколоноскопии вы-
являются воспалительные изменения в кишечнике, независимо от на-
личия или отсутствия клинических проявлений кишечного заболева-
ния. Именно у 15—25 % этих больных при многолетнем динамичес-
ком наблюдении развивается болезнь Крона, т.е. можно полагать, что
эти больные изначально имели субклиническую форму воспалитель-
ного заболевания кишечника, при котором патология локомоторного
аппарата являлась единственным клиническим проявлением. При этом
тяжелое течение и прогрессирование суставной патологии, вплоть до
классического анкилозирующего спондилоартрита, наблюдались
преимущественно лишь у лиц с HLA-B27, в то время как в целом
хроническое воспаление кишечника и болезнь Крона ассоциируются
с антигеном HLA-Bw62. Авторы полагают, что антиген Bw62, возмож-
но, играет протективную роль в эволюции заболевания локомоторного
аппарата [14, 20, 26,].
Таким образом, уже эти находки подтверждают гетерогенность
спондилоартропатий и возможность существования В27-независимой
патогенетической связи между ними и другими заболеваниями, в час-
тности хроническим воспалительным поражением кишечника,
играющим, как признано сейчас, важную роль в патогенезе многих
спондилоартропатий [23].
С целью унификации подходов к диагностике спондилоартропатий
Европейской группой по изучению этих заболеваний — European
Spondyloarthropathy Study Group — в начале 90-х годов были
предложены высокочувствительные и специфичные критерии, полу-
чившие название ESSG-критерии [9], которые, однако, не всегда по-
зволяли идентифицировать больных недифференцированными
спондилоартропатиями. Это в большей степени возможно при исполь-
зовании критериев B.Amor и соавт. (1995), оценивающихся в баллах
и имеющих приемлемую специфичность и чувствительность. Применяя
их, можно заподозрить спондилоартропатию даже при отсутствии
периферического артрита или воспалительных болей в спине и
илеосакральных областях, а также четких рентгеновских признаков
сакроилеита, что может встречаться, например, на самых ранних эта-
пах заболевания.
Полагают, что в целом спондилоартриты встречаются среди насе-
ления не реже, чем ревматоидный артрит, но очень плохо распознают-
ся — труднее, чем ревматоидный артрит или даже остеоартроз [Hal-
verson Р.В., 1997]. Ошибочные первичные диагнозы при спондило-
артропатиях ставятся 72 % больных и особенно часты у женщин —
94 % [7], что подтверждает необходимость критериальной диагности-
ки этих заболеваний как в клинической практике, так и при эпидеми-
ологических исследованиях.
В литературе последних лет появились первые сообщения о резуль-
76
татах эпидемиологических исследований с применением критериев
ESSR и критериев B.Amor, показавшие, что эти заболевания в
различных регионах мира и среди разных этнических групп
встречаются с неодинаковой частотой. Так, впервые в нашей стране
сотрудниками Института ревматологии РАМН [2] осуществлено эпи-
демиологическое исследование частоты спондилоартропатий среди
чукотской популяции, в которой распространенность HLA-B27 намно-
го превышает аналогичный показатель в русской популяции (29,3 %
против 7—10 %). Общая частота спондилоартропатий у чукчей соста-
вила 1,7 %: анкилозирующего спондилоартрита — 0,8 % (против
0,05 % в русской популяции), реактивных артритов — 0,6 %,
недифференцированных спондилоартритов — 0,4 %. По данным ли-
ванских авторов [5], частота спондилоартропатий в их стране дости-
гает 8,56 %, из них анкилозирующий спондилоартрит и
недифференцированные спондилоартропатии составляют по 40,3 %,
псориатический артрит — 13,8 %, реактивный и энтеропатический
артрит — по 2,8 % случаев.
К сожалению, подобных работ в литературе пока явно недоста-
точно. Проведение в нашей стране дальнейших эпидемиологических
и клинических исследований по выявлению спондилоартропатий по-
зволит уточнить структуру воспалительных ревматических заболева-
ний суставов и позвоночника в отдельных регионах и, возможно, вне-
сет корректировку в существующую рабочую классификацию и
номенклатуру болезней. Эти работы, особенно если к ним подключатся
микробиологи, иммунологи, иммуногенетики, позволят оценить зна-
чение различных факторов внешней среды (инфекций, социальных,
бытовых условий), генетических особенностей и пр. в формировании
тех или клинических вариантов спондилоартропатий.
Следует иметь в виду, что основной контингент впервые заболев-
ших — это молодые люди (возраст до 45 лет), которые на длительный
срок теряют трудоспособность или даже становятся стойкими инва-
лидами, поэтому проблема приобретает и социальное значение. Но не
следует забывать и о пожилых больных. Имеются единичные работы
[8, 22], описывающие особенности позднего начала спондилоартро-
патий у пожилых людей (средний возраст 52—62 года), характери-
зующихся широким спектром проявлений, иногда с системными симп-
томами и тяжелым течением (см. лекцию Н.В.Бунчука и А.Г.Бочко-
вой).
Большого внимания заслуживают совершенствование диагности-
ки, изучение клиники и эволюции спондилоартропатий у женщин в
связи с поздним распознаванием и высоким процентом ошибочных
диагнозов именно у этой категории больных.
Необходимость иметь собственный опыт не только относительно
частоты недифференцированных спондилоартропатий, но и их клини-
ческих вариантов, связи с инфекционными факторами, которые в наши
дни рассматривают или только подозревают в качестве триггерных
агентов различных спондилоартропатий. При проведении таких ис-
77
следований, безусловно, необходим тесный контакт с микробиологами
и иммунологами, владеющими современными методическими приема-
ми в своей области. Именно эти специалисты должны окончательно
внести ясность в значимость серологической (сравнительно с бакте-
риологической) диагностики инфекций при спондилоартритах, как,
например, это пытаются сделать в отношении хламидийной инфекции
[1, 11], или, наконец, определиться по поводу этиопатогенетической
общности (либо различий) центральной и периферической форм
анкилозирующего спондилоартрита [19].
Особого внимания заслуживает изучение состояния слизистой обо-
лочки кишечника с гистологическим и иммунологическим ее конт-
ролем у больных спондилоартритами, независимо от выраженности
клинических проявлений кишечной патологии. Это может способство-
вать своевременной дифференциальной диагностике, позволит наблю-
дать за эволюцией изменений в илеосакральных сочленениях и
периферических суставах в связи с состоянием кишечника. Такой
подход тем более важен, что в последние годы серьезно раз-
рабатывается гипотеза «оси кишечник—синовия», согласно которой
в основе энтеропатических артритов лежат те же иммунопатологичес-
кие механизмы, которые развиваются в самой кишечной стенке под
воздействием внутриклеточных микробов, откуда активированные
лейкоциты и микробные антигены могут переноситься под влиянием
пока еще неизвестных факторов (homing-рецепторов) в полость сус-
тавов, вызывая местное воспаление [10].
Наконец, имеет смысл проводить контроль за состоянием слизис-
той оболочки кишечника при назначении больным многомесячного
лечения сульфасалазином, относительно эффективности которого при
спондилоартритах, особенно при центральной форме анкилозирующего
спондилоартрита, окончательного мнения все еще нет. Безусловно,
подобные работы должны проводиться с обязательным привлечением
гастроэнтерологов.
Вообще же многие вопросы ревматологии невозможно решать без
содружества с научными коллективами других специальностей,
которые, к сожалению, в нашей стране в настоящее время в отличие
от иностранных ученых мало интересуются ревматологическими
проблемами. Например, весьма серьезной в практическом и теоре-
тическом плане является проблема ревматических синдромов при
ВИЧ-инфекции, учитывая наблюдавшийся во всем мире, как и в на-
шей стране, рост этой инфекции, приобретающей характер пандемии.
Описываются, в частности, такие спондилоартриты, как псориа-
тический артрит и синдром Рейтера у ВИЧ-инфицированных. После-
дний встречается у них намного чаще, чем в популяции, и харак-
теризуется более тяжелым течением. Подчеркивается необходимость
соблюдения у таких больных осторожности при использовании с це-
лью подавления агрессивного артрита иммуносупрессивных пре-
паратов или внутрисуставных инъекций кортикостероидов, чтобы не
ускорять развитие СПИДа или гнойного артрита [13, 27].
78
С другой стороны, показано, что у В27-положительных больных
ВИЧ-инфекция развивается гораздо медленнее, чем у лиц без этого
антигена, что пока еще не нашло окончательного объяснения с пози-
ций патогенеза.
Важнейшим признаком спондилоартропатий является воспаление
илеосакральных сочленений. Основным методом диагностики
сакроилеита является обычная рентгенография. Внедрение в последние
годы в клиническую практику новых методических приемов — рент-
геновской компьютерной и магнитно-резонансной томографии — зна-
чительно расширило возможности распознавания поражения
илеосакральных суставов на самых ранних стадиях или в трудных для
диагностики случаях. Собственный опыт при этом имеет большое зна-
чение.
Компьютерную рентгеновскую томографию рассматривают также
как весьма полезный и доступный метод, позволяющий контролиро-
вать введение ГКС непосредственно в крестцово-подвздошные сус-
тавы, что значительно облегчает достижение положительного эффек-
та при спондилоартритах, резистентных к традиционной терапии [24].
Лечение спондилоартритов — весьма сложная задача. Принимая
во внимание явную или предполагаемую связь этих заболеваний с
инфекционными факторами, клиницисты стали прибегать к антибио-
тикам для устранения триггерных агентов. При этом они столкнулись
с биологическим парадоксом: артриты практически не поддавались
антибиотикотерапии, хотя казалось, что инфекция должна быть пол-
ностью устранена. Совместными работами теоретиков и клиницистов
в области реактивных артритов •— наиболее ярких форм артритов,
связанных с инфекционными агентами, — в последние годы была вне-
сена некоторая ясность в эту проблему. Так, удалось показать, что
при урогенном реактивном артрите, индуцированном хламидией,
микробный агент длительно сохраняется в суставе в живой, хотя и
измененной, персистирующей форме, резистентной к антибиотикам, но
способной на месте вызывать иммунопатологические реакции,
поддерживающие воспаление сустава. При постэнтероколитических
артритах не столько интактный микроб, вступающий в слизистой обо-
лочке кишечника в контакт с клетками иммунной системы, сколько
его антигены могут рециркулирующими иммуноцитами переноситься
и задерживаться в суставе, вызывая артрит. Дальнейшие исследова-
ния, в том числе и с применением новых, высокоактивных антибиоти-
ков в отношении триггерных агентов, позволят окончательно опре-
делить место этих препаратов в терапии спондилоартритов, профилак-
тике их обострений, установить наиболее рациональные схемы и дли-
тельность антибактериального лечения.
Безусловно, наиболее важными остаются теоретические исследо-
вания в области изучения самого антигена В27, его субтипов, их
структуры, функции и роли в патогенезе спондилоартритов, для чего
привлекаются новые методы молекулярной генетики, молекулярной
биохимии, иммунологии.
79
Известно, что антигены гистосовместимости участвуют в презен-
тации различных антигенных пептидов иммунокомпетентным Т-клет-
кам. Так, антиген В27 задействован в презентации микробных пепти-
дов CD8+ Т-клеткам (цитотоксические клетки/супрессоры), ответствен-
ным за элиминацию микробов. Однако CD8+ Т-клеточный ответ при
спондилоартритах снижен или извращен. Причина этого феномена пока
не установлена. Высказывается также гипотеза [17], согласно которой
молекула В27 вследствие антигенной мимикрии способна участвовать
в аутоиммунном процессе, направленном против собственных тканей
организма, богатых коллагеном II, IX и XI типа или протеогликанами.
Вот почему при спондилоартритах поражаются именно эти ткани и
активируются CD4+ Т-клетки, участвующие в аутоиммунных реакциях,
характеризующихся тенденцией к хронизации.
Возможно, развитие спондилоартритов объясняется особенностя-
ми субтипов антигена В27, выявляемых у больных и в отдельных по-
пуляциях [21, 25].
Число субтипов В27 постоянно растет, к настоящему времени их
известно уже 12 [16]. Показано, что субтипы 06,09 не ассоциируются
с анкилозирующим спондилоартритом, и ученые пытаются охаракте-
ризовать их отличия от других субтипов.
Значительным достижением последних лет явилась кристаллизация
трехмерной структуры пептидосвязывающего участка молекулы ан-
тигена В27, в частности наиболее распространенного на планете суб-
типа 05, который, как и ряд других субтипов, ассоциируется со
спондилоартритами. Показано, что отдельные субтипы отличаются
друг от друга по числу замещений и виду аминокислотных остатков,
расположенных на участке молекулы HLA-B27, обладающем пепти-
досвязывающими свойствами [6,12,16,17]. Это чрезвычайно сложный
объект исследований, включающий и методы молекулярной биохимии.
Разработка его может иметь в перспективе большое значение для
иммунотерапии спондилоартритов.
Исследователи полагают, что не менее важным является выясне-
ние характера пептидов, в частности микробных, участвующих в этом
сложном взаимодействии, а также механизмов и условий, способству-
ющих переносу инфекционного начала или отдельных артритогенных
антигенов в суставную полость.
Развитие перечисленных направлений исследований может быть
полезным как для выяснения вопросов этиологии и патогенеза
спондилоартритов, так и для разработки принципиально новых мето-
дов терапии и профилактики обсуждаемой группы заболеваний.
СПИСОК ЛИТЕРАТУРЫ
1. Панкратова В.Н., Хартманн М., Гро А. и др. Определение серологичес-
кого ответа к Chlamydia trachomatis у больных ревматическими забо-
леваниями // Труды 2-го Всероссийского съезда ревматологов. — Тула,
1997.—С. 143.
80
2. Эрдес I1L, Гусева И.А., Крылов М.Ю., Беневоленская Л.И. Спондило-
артропатии и субтипы HLA-B27 в некоторых популяциях Северной
России // Тер. арх. — 1997. — № 69, 5. — С. 41—43.
3. Aggarwal A,, Misra R., Chandrasekhar S. et al. Is undifferentiated sero-
negative spondyloarthropathy a forme fruste of reactive arthritis? // Brit.
J. Rheumatol. — 1997. — Vol. 31. — P. 1001—1004.
4. A mor B., Dougados M., Listrat V. Les criteres de spondyloarthropathies.
Criteres de classification et/ou d aide au diagnostic? // Rev. Rheum. —
1995.—Vol. 62. —P. 11—16.
5. Baddoura F.f Awada H.t Okais T. et al. Validation of European Spondy-
loarthropathy Study Group and Amor B. criteria for spondyloarthropa-
thies in Lebanon // Rev. Rhum. (Engl.ed). — 1997. — Vol. 64(7). — P. 459—
464.
6, Bollow M., Loreck D., Braun J., Hanme D. Die Sakroiliitis. Das
Schlusselsymptom der Spondylarthropathien. Teil 2. Morphologische
Aspekte // Rofo-Fortschr-Geb-Rontgenst-Neuen-Bildgeb-Verfahr. —
1997. — Vol. 166(4). — P. 275—289.
7. Boyer G.S., Templin D.W., Bowler A. et al. A comparison of patients with
spondyloarthropathy seen in specialy clinics with those identified in
community wide epidemiologic study. Has the classic case misled us? //
Arch, intern. Med. — 1997. — N 13, 157(18). — P. 2111—2117.
8. Caplanne D., Tubach F., Le Parc J.M. Late onset spondyloarthropathy:
clinical and biological comparison with early onset patients // Ann.
Rheum. Dis. — 1997. — Vol. 56. — P. 176—179.
9. Dougados M.t Van der Linden S., Juhlin R. et al. ESSR Criteria for
spondyloarthropathy // Arthr. Rheum. — 1991. — Vol. 34(10). — P. 1218—
1222.
10. Elewaut D., Granfors K, De Keyser F. et al. Extra-intestinal manifestations
of enteropathies: why are the joints involved? // Rheumatol, in Europe. —
1997. — Vol. 26(1). — P. 18—23.
11. Erlacher L., Wintersberger W.t Menschik M. et al. Reactive arthritis:
urogenital swab, culture is the only useful dignostic method for the ar-
thritogenic infection in extra-articularly asymptomatic patients with
undifferentiated oligoarthritis // Brit. J. Rheumatol. — 1995. —Vol. 34. —
P. 838—842.
12. Felkamp T.E.W., Verjans G.M. The pathogenesis of HLA-B27 associated
diseases // Rheumatol, in Europe. — 1995. —Vol. 24, suppl. 2. — P. 45—47.
13. Garcia F, Galocha B., Villadangos J.A. et al. HLA-B27 (B 2701) specificity
for peptides lackiny Arg2 is determined by polymorphism outside the В
pocket // Tissue Antigens. — 1997, Jun. — Vol. 49(6). — P. 580—587.
14. Gyselbrecht G., Mielans FL, Veys E.M. et al. Disease progression in
spondylarthropathy patients in relation to theis gut histology and HLA
class antigens // Rheumatol, in Europe. — 1995. — Vol. 24, suppl 2. —
P. 92.
15. Khan M.A. Spondyloarthropathies // Current Opinion in Rheumatol. —
1997. — Vol. 9. — P. 281—283.
16. Khan M.A. Spondyloarthropathies // Current Opinion in Rheumatol. —
1998, —Vol. 10. —P. 279—281.
17. Khare S.D., Luthra H.S., David C.S. HLA-B27 and other predisposing factors
in spondyloarthropathies // Current Opinion in Rheumatol. — 1998. —
Vol 10. —P. 282—291.
81
18. Kaplan G. Rheumatological manifestations of HIV infection // Rheumatol,
in Europe. — 1996. — Vol. 25(4). — P. 134—136.
19. Maki-Ikola O., Nissila M., Lehtinen K. et al. Antibodies to Klebsiella
pneumoniae, Escherichia coli and proteus mirabilis in sera of patients
with axial and peripheral form of ankylosing spondylitis // Brit.
J. Rheumatol. — 1995. — Vol. 34. — P. 413—417.
20. Mielants H., Veys E.M., Cuverier C. et al. Risk factor for a patient with
spondyloarthropathy to develop ankylosing spondylitis or inflammatory
bowel disease // Rheumatol, in Europe. — 1997. — Vol. 24, suppl 2. —
P. 92, B62.
21. Nasution A.R., Mardjuadi A., Kunmartini S. et al. HLA B27 subtypes
positively and negatively associated with spondyloarthropathy // J.
Rheumatol. — 1997. — Vol. 24(6). — P. 1111—1114.
22. Oliveri I., Padula A., Pierro A. et al. Late onset undifferentiated seronega-
tive spondyloarthropathy // Rheumatol, in Europe. — 1995. — Vol. 24,
suppl 2. — P. 91, B56.
23. Porzio V., Biasi G., Cfrrado A. et al. Intestinal histological and
ultrastructural inflammatory changes in spondyloarthropathy and rheu-
matoid arthritis // Scand. J. Rheumatol. — 1997. — Vol. 26(2). — P. 92—
98.
24. Remy M., Berlin Ph., Bonnet C. et al. Sort term estimation of CT-guided
corticosteroid injection of the sacro-iliac joint in spondylarthropathies //
Rheumatol, in Europe. — 1995. — Vol. 24, suppl 2. — P. 89, B49.
25. Taurog J. HLA-B27 subtypes, disease susceptibility and peptide binding
specificity. — In: Spondylarthritides / Eds A.Calin, J.Taurog. — Oxford:
Oxford University Press, 1998. — P. 267—273.
26. Veys E.M., Mielants H. Symposium: Rheumatological manifestation of the
enteropathies // Rheumatol, in Europe. — 1997. — Vol. 26, 1. — P. 4—5.
27. Winchester R. AIDS and rheumatic diseases // Rheum. Dis. Clin. N. Amer. —
1991.—Vol. 17. —P. 1—189.
Лекция 8
ПСОРИАТИЧЕСКИЙ АРТРИТ
И ПСОРИАЗ: ПРОБЛЕМА
ВЗАИМОСВЯЗИ
И ВЗАИМООБУСЛОВЛЕННОСТИ
Канд. мед. наук В.В.Бадокин (Курс ревматологии Российс-
кой медицинской академии последипломного образования)
Начиная с первой четверти XIX века, когда Alibert, основатель
французской дерматологической школы, в то время наиболее извест-
ной и прогрессивной, впервые отметил ассоциацию псориаза и артри-
та, дискутируется вопрос о взаимоотношении псориаза и псориати-
ческого артрита (ПА). Этот вопрос является кардинальным во всей
проблеме ПА. ПА и псориаз — это два самостоятельных заболевания
82
или ПА представляет собой одну из форм псориаза и является его
составной частью?
Для того чтобы ответить на этот вопрос, следует проанализиро-
вать общность и различие этих патологических состояний, включая
этиопатогенетические и клинические аспекты.
Прежде всего следует остановиться на дефиниции ПА. ПА пред-
ставляет собой хроническое воспалительное прогрессирующее систем-
ное заболевание, ассоциированное с псориазом, характеризующееся
преимущественной локализацией патологического процесса в тканях
опорно-двигательного аппарата и приводящее к развитию эрозивно-
го артрита, внутрисуставного остеолиза и спондилоартрита. Кстати,
внутрисуставной остеолиз не всегда является результатом синовита,
как это наблюдается при РА, а связан с особенностями метаболизма
костной ткани при этом заболевании.
Псориаз встречается повсеместно, его распространенность в по-
пуляции составляет 1—3 % [8,9]. Эпидемиологических исследований
по изучению распространенности ПА не проводилось. Однако извес-
тно, что распространенность артрита среди больных псориазом, по
данным разных авторов, колеблется от 7 до 47 % [16]. Столь широ-
кий разброс этого показателя связан со многими факторами, но ре-
шающее значение имеют выбор диагностических критериев и контин-
гент больных. Например, у дерматологов относительно часто наблю-
даются больные с тяжелыми формами чешуйчатого лишая, включая
генерализованный экссудативный, эритродермический или пустулез-
ный псориаз, т. е. те клинические варианты, при которых воспалитель-
ный процесс в суставах и/или позвоночнике наблюдается наиболее
часто.
В комплексном исследовании C.Salvarini и соавт. (1995), где в
качестве экспертов были привлечены ревматологи и дерматологи,
распространенность ПА у больных псориазом составила 36 %, при
этом использовались критерии как Европейской группы по изучению
спондилоартропатий, так и критерии B.Amor. В то же время следует
подчеркнуть, что, рассматривая распространенность артрита у боль-
ных псориазом, следует делать поправку на возможность развития ПА
без сопутствующего псориаза (arthritis sine psoriasis).
Нами при изучении 370 больных ПА выявлено, что у 106 (28,6 %)
из них поражение суставов предшествовало появлению первых эф-
флоресценций псориаза за много месяцев и лет, а у 8 % больных этот
период варьировал от 6 до 15 лет. На показатель распространенно-
сти артрита у больных псориазом оказывает влияние и регистрация
не только основных клинико-морфологических вариантов ПА, но и
особых его вариантов, а именно синдрома передней грудной клет-
ки, изолированного энтезита, синдрома SAPHO, онихопахидермопе-
риостита.
Длительные наблюдения убеждают в существовании тесной взаи-
мосвязи основных синдромов ПА — кожного и суставного. Паралле-
лизм развития этих синдромов нами отмечен у 39,8 % больных и рас-
83
сматривается в качестве одного из диагностических критериев ПА [1].
Параллелизм течения находит свое выражение в синхронности раз-
вития кожного и суставного синдромов в дебюте ПА и в синхроннос-
ти их обострений в развернутой стадии заболевания, при этом обо-
стрению артрита или спондилита обычно предшествует прогрессиро-
вание кожных проявлений, хотя возможна и обратная ситуация. На-
конец, развитие артрита или спондилита нередко наступает при транс-
формации характера течения псориаза, что проявляется в его распро-
странении на ранее не пораженные области и появлении генерализо-
ванных форм, трансформации вульгарного псориаза в экссудативный,
эритродермический или, тем более, в пустулезный, в стирании имев-
шей место ранее четкой сезонности обострений и развитии устойчи-
вых к терапии вариантов.
При ПА характер дерматоза оказывает влияние на основные па-
раметры патологического процесса. Для доказательства этого поло-
жения нами проведено сопоставление двух полярных вариантов кож-
ного псориаза — ограниченного вульгарного и атипичного — с ос-
новными клиническими формами ПА. Ограниченный вульгарный псо-
риаз является наиболее благоприятным из всех известных вариантов
этого дерматоза и, как правило, не требует активного лечения. На-
против, атипичный псориаз, включающий парциальную или универ-
сальную эритродермию, а также пустулезный псориаз, характеризу-
ется торпидным течением и имеет серьезный прогноз, вплоть до леталь-
ного исхода [15]. Что же касается клинической формы ПА, то она
представляет собой интегральное понятие и включает распространен-
ность эрозивного артрита и выраженность внутрисуставного остео-
лиза, наличие анкилозирующего спондилоартрита, темпы прогресси-
рования костно-хрящевой деструкции, наличие и выраженность сис-
темных проявлений, функциональное состояние опорно-двигательно-
го аппарата.
Сопоставление вышеприведенных вариантов дерматоза с клини-
ческой формой ПА показало, что при атипичном псориазе в 95 % слу-
чаев наблюдалась тяжелая форма и лишь в 5 % — относительно лег-
кая и средней тяжести, которую мы называем обычной. Что касается
ограниченного вульгарного псориаза, то здесь наблюдалась обратная
зависимость, а именно преобладающее число больных имели обычную
форму и только 18,5 % — тяжелую.
Характер псориаза четко коррелирует с клинико-анатомическими
вариантами суставного синдрома. Для ограниченного дерматоза ха-
рактерен дистальный и моноолигоартритический варианты, а для
распространенного вульгарного, экссудативного или атипичного псо-
риаза— как правило, ревматоидоподобный и спондилоартритичес-
кий варианты.
При сопоставлении рентгенологической стадии ПА с характером
псориаза оказалось, что IV стадия при атипичном псориазе встреча-
ется в 2,3 раза чаще, чем при ограниченном вульгарном. Но особен-
но четкая ассоциация отмечается в тех случаях, когда поражается
84
осевой скелет. Так, при атипичном псориазе сакроилеит III—IV ста-
дии наблюдается в 6,5 раз чаще, чем при ограниченном вульгарном
псориазе, а анкилозирующий спондилоартрит, сопровождающийся
синдесмофитами, параспинальными оссификатами или анкилозирова-
нием межпозвонковых суставов, — в 8 раз чаще.
Можно проследить взаимообусловленность кожного синдрома и с
другими проявлениями ПА. Это касается четко выраженной взаимо-
связи артрита дистальных межфаланговых суставов с дистрофией
ногтевых пластинок. Без псориатической ониходистрофии — эквива-
лента кожных изменений — артрит терминальных суставов обычно не
развивается. Имеет место и топографическая идентичность локализа-
ции артрита или спондилита с локализацией кожных высыпаний.
Например, при псориазе на коже шеи или затылка развивается спон-
дилоартрит с преимущественным поражением шейного отдела позво-
ночника. Особенности дерматоза откладывают отпечаток и на дру-
гие проявления заболевания, в частности на активность воспалитель-
ного процесса в целом, распространенность и выраженность систем-
ных проявлений.
Псориаз и ПА характеризуются общностью системных проявлений,
хотя их частота и выраженность при этих заболеваниях различны. Так,
при псориазе возможны длительная лихорадка, существенное и быст-
рое снижение массы тела, увеличение лимфатических узлов, особен-
но паховых, при наличии обильных эффлоресценций на коже нижних
конечностей. Так же как и при ПА, возможно поражение клапанного
эндокарда, включая симптоматику порока сердца, различные стадии
патологического процесса в печени, вплоть до фиброза и цирроза.
Нередко при псориазе находят диффузный гломерулонефрит, проте-
кающий по типу болезни Берже, и амилоидоз почек, особенно у боль-
ных с пустулезным псориазом. Возможно вовлечение слизистых обо-
лочек полости рта и уретры, что может привести к дополнительным
трудностям при проведении дифференциальной диагностики ПА и
болезни Рейтера.
Нарушения обмена веществ также могут быть ассоциированы с
псориазом. Возможны нарушения углеводного обмена, проявляющи-
еся симптоматической гипергликемией или сахарным диабетом, что
чаще наблюдается у лиц с интертригинозным псориазом. Хорошо из-
вестна вторичная гиперурикемия у больных псориазом и псориатичес-
ким артритом, уровень которой коррелирует с распространенностью
высыпаний на коже [2]. Гиперурикемия может быть не только симпто-
матической, но и привести к манифестной подагре с типичными ата-
ками артрита и уратной нефропатией. Нарушение жирового обмена
находит свое выражение в гиперлипидемии, коронарной болезни и хро-
нической ишемической болезни мозга. Все эти метаболические нару-
шения требуют адекватной медикаментозной терапии, включая назна-
чения соответствующей диеты, гипогликемических препаратов, ури-
косупрессоров и статинов.
Характер поражения кожи также оказывает влияние на системные
85
проявления ПА. Так, при атипичном псориазе лихорадка наблюдает-
ся в 11 раз чаще, чем при ограниченном вульгарном псориазе, трофи-
ческие нарушения — в 5 раз, полиадения — в 4,3 раза, кардиальный
синдром — в 2 раза, гепатопатия — в 1,5 раза, поражение глаз — в
1,6 раза, анемия — в 3,2 раза, а злокачественная, наиболее тяжелая
форма заболевания встречается исключительно у больных с атипич-
ным псориазом.
Псориаз и ПА объединяют и многие этиопатогенетические аспек-
ты, в частности участие генетических, иммунологических и внешних
факторов. Доминирующее значение придается генетической предрас-
положенности. Полагают, что псориаз передается по аутосомно-до-
минантному типу и является мультифакториальным заболеванием с
долей генетической компоненты, равной 60—70 %, и средовой — 30—
40 % [3]. ПА характеризуется также полигенным, мультифакториаль-
ным типом наследования. Одним из доказательств генетической де-
терминированности является семейная агрегация псориаза и, в мень-
шей степени, ПА. Причем подобная тенденция характерна лишь для
псориаза 1-го типа, при котором наблюдается раннее начало заболе-
вания — до 40 лет [5]. Значение генетического фактора доказывает
высокая конкордантность по псориазу у монозиготных близнецов,
которая составляет 60—70 %, что во много раз превышает аналогич-
ный показатель у дизиготных близнецов, а также более высокая рас-
пространенность псориаза и ПА среди кровных родственников, чем у
супругов.
Еще одним доказательством генетической концепции рассматри-
ваемых заболеваний является ассоциация с определенными HLA-ан-
тигенами. Псориаз ассоциируется прежде всего с Cw6, при этом отно-
сительный риск составляет 9,1 %. Другие гены (Cw2, В13, В17, В52,
DR7), предрасполагающие к развитию псориаза, встречаются реже
[12]. Расхождения в частоте выявления этих антигенов во многом
определяются этнической спецификой изучаемых групп и особеннос-
тями подбора пациентов. Во всяком случае имеются существенные
различия вышеприведенной ассоциации у больных псориазом с ран-
ней и поздней манифестациями [4,12]. В 90-х годах был открыт ген,
расположенный на дистальном плече 17-й хромосомы, который, как
предполагается, имеет прямое отношение к наследованию псориаза
(хотя и он выявляется не у всех кровных родственников больных псо-
риазом) [18].
При ПА также повышена частота HLA-A, -В, -С и DR-антигенов
[6,11,13]. Ассоциация с HLA-B27, В38, DR4 и DR7 является хорошо
установленным фактом. Гены главного комплекса гистосовместимо-
сти коррелируют с различными проявлениями столь гетерогенного за-
болевания, каковым является ПА [7,10]. Так, В27 четко коррелирует
со спондилоартритом и (в меньшей степени) с сакроилеитом. При на-
личии псориатического спондилоартрита частота обнаружения этого
антигена приближается к 80 % и более. В то же время периферичес-
кий артрит ассоциируется с другими HLA-антигенами: В38, В39, DR7.
86
Некоторые антигены коррелируют с темпами прогрессирования забо-
левания. Так, при наличии В39 наблюдается быстрое прогрессирова-
ние костно-хрящевой деструкции на раннем этапе развития ПА, а при
наличии таких гаплотипов, как В27+ и DR7+, DQw3+ и DR7+, а
также В39+ и DQw3-, — быстрое прогрессирование на всех этапах.
В то же время при наличии HLA-B17 наблюдается, как правило, доб-
рокачественное течение заболевания. Антигены гистосовместимости
откладывают свой отпечаток и на распространенность артрита, а
именно: В17 и Cw6 коррелируют с ограниченным числом пораженных
суставов, а В57 — с множественным, что соответствует полиартри-
тическому варианту суставного синдрома. Так же как и при РА, DR4
чаще встречается при генерализованном деструктивном ПА, как и
DR3, а В13 и DR7 соответствуют началу заболевания в молодом воз-
расте.
Таким образом, в генезе как псориаза, так и ПА большая роль
принадлежит генетической предрасположенности, которая контроли-
рует не только развитие этих заболеваний в целом, но и отдельные их
параметры. Это относится к возрастным аспектам псориаза, течению
ПА и клиническому оформлению суставного синдрома, а также тем-
пам прогрессирования костно-хрящевой деструкции. Однако генети-
ческий код при псориазе и ПА различен. Данное положение просле-
живается не только при анализе результатов изучения HLA-антигенов.
При ПА в 60,7 % выявлен специфический полиморфизм области «пе-
реключателя» генов, кодирующих синтез иммуноглобулинов тяжелых
цепей, а при неосложненном псориазе — только в 12,2 % [17].
Значительные успехи достигнуты и в иммунопатологии псориаза
и ПА, что позволяет по-новому'взглянуть на проблему взаимосвязи и
взаимоотношений этих заболеваний. Много общих черт имеется в
иммунологических нарушениях, основу которых составляет актива-
ция клеточного иммунного ответа с ведущей ролью Т-лимфоцитов
[6,13]. Так, иммуногистохимический анализ псориатических папул
показал, что инфильтрация Т-клетками предшествует появлению ма-
нифестного псориаза и что Т-клеточные инфильтраты кожи и синови-
альной оболочки в основном состоят из CD4+ Т-лимфоцитов, проду-
цирующих цитокины Thl-типа, например ИЛ-2 или ИФН-у, облада-
ющих провоспалительной активностью. Было также показано, что
Т-клетки, локализующиеся в эпидермисе и в синовии, способны сти-
мулировать пролиферацию кератиноцитов, ответственных за наплас-
тования чешуек в очагах поражения кожи, т.е. наиболее значимого
стигмата чешуйчатого лишая. Подтверждением ведущей роли Т-лим-
фоцитов в патогенезе псориаза служит также моделирование клини-
ческой и морфологической картины этого дерматоза у мышей с тяже-
лым иммунодефицитом при введении им CD4+-клеток, выделенных из
очагов поражения кожи.
Имеются и другие многочисленные доказательства участия Т-лим-
фоцитов в патогенезе псориаза и ПА. Так, при ПА выявлен высокий
уровень провоспалительных цитокинов в синовиальной жидкости и в
87
биоптатах поврежденной синовии. Косвенным подтверждением учас-
тия клеточного звена иммунитета в развитии псориаза и ПА являются
довольно частые случаи развития этих заболеваний и их тяжелое те-
чение у ВИЧ-инфицированных больных, у которых значение CD4+T-
лимфоцитов представляется несомненным. Об этом же свидетельству-
ет высокая терапевтическая эффективность при псориазе и ПА селек-
тивных иммуносупрессантов, в частности препарата FK 506, цикло-
спорина А, анти-СГ)4+ моноклональных антител.
Однако наряду с иммунологическими особенностями, идентичны-
ми для псориаза и ПА, имеются и существенные различия, во всяком
случае на уровне Т-лимфоцитов [13]. Оказалось, что фенотипически
Т-лимфоциты кожи отличаются от Т-лимфоцитов синовиальной обо-
лочки и что Т-клеточный рецептор кожных и синовиальных лимфоци-
тов имеет неодинаковую структуру, а следовательно, в его распозна-
вании участвуют различные антигены. Имеются и количественные
различия в секретируемых лимфоцитами ИЛ, в частности синовиаль-
ные лимфоциты продуцируют меньше ИЛ-2 и ИФН-у по сравнению с
лимфоцитами, находящимися в коже. И, наконец, у эксперименталь-
ных животных, которым вводились Т-лимфоциты, содержащиеся в
коже больных псориазом, развился дерматит, близкий по своим про-
явлениям к псориазу, но ни у одного из них не развился артрит.
В реализации иммуногенетических нарушений принимают участие
триггерные факторы, которые идентичны для псориаза и ПА. В этом
плане первостепенное значение придается инфекции и прежде всего
^-гемолитическому стрептококку группы А [20]. Клинические наблю-
дения свидетельствуют о том, что обострение псориаза или его появ-
ление нередко происходит на фоне стрептококковой инфекции или
спустя 2—3 нед после нее, при этом чаще всего развивается psoriasis
guttata. При прогрессирующей стадии псориаза значительно повыша-
ются титры антистрептококковых антител наряду с активацией СЗ-,
снижением С4-компонентов комплемента и изменениями в соотноше-
нии CD4/CD8. Однако не только стрептококк имеет значение в этио-
патогенезе рассматриваемых заболеваний. Полагают, что латентная
инфекция, локализующаяся в небных миндалинах, кишечнике или псо-
риатических папулах, приводит к хронической стимуляции макрофа-
гов и моноцитов [19]. Эти клетки активно мигрируют в организме и
депонируются в коже и суставах. Взаимодействуя с генетически ги-
перреактивными синовиоцитами и кератиноцитами, они способству-
ют секреции и освобождению биологически активных субстанций,
которые и ответственны за развитие морфологических изменений на
ранней стадии псориаза и/или ПА.
В качестве триггерного фактора выступают и лекарства. Хиноли-
новые производные, по данным многочисленных публикаций в анг-
лийской печати, в 18 % случаев приводят к прогрессированию псори-
аза вследствие изменения активности энзимов, принимающих участие
в пролиферации эпидермиса [21]. В противоположность антималярий-
ным препаратам, литий и бета-адреноблокаторы вызывают псориаз
88
de novo. Длительное системное применение ГКС дестабилизирует псо-
риаз и формирует резистентные к проводимой терапии формы. С дру-
гой стороны, нередко при отмене ГКС развивается симптом «рикоше-
та» с обострением кожных проявлений. При длительном применении
ГКС следует учитывать и возможность трансформации относительно
доброкачественного псориаза в генерализованный экссудативный или
пустулезный [8], как и появление ПА. Соли золота способны вызвать
псориатическую эритродермию, что обычно наблюдается после раз-
вития «золотого» дерматита, одного из побочных проявлений хризо-
терапии, причем это осложнение встречается существенно чаще при
ПА, чем при РА. Обострение псориаза могут вызвать антибиотики, а
также НПВП вследствие гиперпродукции лейкотриенов [8]. В некото-
рых ситуациях целесообразно наряду с НПВП назначение средств с
антилейкотриеновой активностью, например аколата или сингулара.
В качестве пускового механизма придается значение физической
травме и даже выделяется посттравматический ПА [14]. Полагают,
что в генезе посттравматического ПА имеют значение гиперваскуля-
ризация синовиальной оболочки и выброс нейропептидов, например
субстанции Р, способной повреждать синовиоциты. При всем много-
образии триггерных факторов, в их реализации, по-видимому, перво-
степенное значение имеет неспецифическая стимуляция CD4+ Т-лим-
фоцитов, которая приводит к гиперсекреции цитокинов, а это в свою
очередь способствует стимуляции эпидермальных кератиноцитов и
синовиоцитов.
Таким образом, представленные данные свидетельствуют о нали-
чии существенных этиопатогенетических различий, присущих псори-
азу и ПА, что позволяет считать их двумя самостоятельными заболе-
ваниями, а не рассматривать ПА лишь как одну из форм псориаза.
В то же время между ПА и псориазом существуют тесная взаимосвязь
и взаимообусловленность, которые прежде всего находят выражение
в параллелизме кожного и суставного синдромов при ПА. Из этого
следует, что при выборе терапевтической тактики у конкретных боль-
ных следует обращать внимание на клиническую разновидность псо-
риаза и стадию его развития и включать в лечебный комплекс меро-
приятия, направленные на уменьшение воспаления кожи и купирова-
ние прогрессирующей стадии дерматоза. Это требует назначения иных
препаратов, чем для подавления обострения суставного синдрома,
например ароматических ретиноидов или оральных псораленов.
СПИСОК ЛИТЕРАТУРЫ
1. Агабабова Э.Р., Бадокин В.В., Эрдес Ш.Ф. и др. Разработка и апробация
диагностических критериев псориатического артрита //Тер. арх. —
1988. — №12.— С. 117—121.
2. Голов К.Г., Иванов О.Л., Балкаров И.М., Новоселов В.С. Клиническое
значение гиперурикемии при псориазе//Клин. мед. — 1994. — Т. 72,
№3. —С. 34—36.
89
3. Мордовцев В.Н. Псориаз //Кожные и венерические болезни: Руковод-
ство для врачей / Под ред. Ю.К.Скрипкина: в 4 томах. — Т. 2. — М.:
Медицина, 1995. —С. 179—230.
4. Мошкалов А.В., Имянитов Е.Н. Генетика псориаза//Журн. дерматове-
нерол. и косметол. — 1995. — № I. — С. 17—19.
5. Elder J.T., Nair R.P., Guo S.-W. et al. The genetics of psoriasis//Arch.
Dermatol. — 1994. — Vol. 130. — P. 216—224.
6. Espinosa L.R. Psoriatic arthritis: pathogenesis: genetic and immunologic
factors. //XIX ILAR Congress of Rheumatology.Proceeding. —Singapore,
1997. — P. 262—263.
7. Glandman D.D., Farewell V.T. The role of HLA antigens as indicators of
disease progression in psoriatic arthritis/ZArthr. Rheum. — 1995. —
Vol. 38. — P. 845—850.
8. Griffits C.E.M. Therapy for psoriatic arthritis: sometimes a conflict for
psoriasis/ZBrit. J. Rheumatol. — 1997. — Vol. 36. — P. 409—412.
9. Krueger C.G., Duvic M. Epidemiology of psoriasis: clinical issue ll J. Invest
Derm. — 1994. — I4S—I8S.
10. Me Hugh N.J., Laurent M.R., Treadwell B.L.J. et al. Psoriatic arthritis:
clinical subgroups and histocompability antigens//Ann. Rheum. Dis. —
1987. ___ Vol. 46. — P. 184—188.
11. Michet C.J. Psoriatic arthritis/Textbook of Rheumatology. — 4th ed. / Eds
W.N.Kelly, E.D.Harris, S.Ruddy, C.B.Sledge. — 1993. — Vol. 1. — P. 974—
984.
12. Mrowietz U. Cutaneous manifestation associated with spondyloarthro-
pathies — clinical and therapeutic aspects// Rheumatol, in Europe. —
1998.— Vol. 27. —P. 90—94.
13. Pitzalis C, Skin and joint disease in psoriatic arthritis: what is the line? //
Brit. J. Rheumatol. — 1998. — Vol. 37. — P. 480—483.
14. Punzi L., Pianon M., Bertazollo N. et al. Clinical, laboratory and
immunogenetic aspects of post-traumatic psoriatic arthritis // Clin. exp.
Rheumatol. — 1998. — Vol. 16. — P. 277—281.
15. Roth P.E., Grosshans E.t Bergoend H. Psoriatic arthritis: evolution et
compIications//Acta Dermatol. Venerol. — 1991. — Vol. 118. — P. 97—
105.
16. Salvarani C., Machioni L., Oliveri I. et al. Epidemiologia et immunogenetica
dell* artrite psoriatica/ZReumatismo. — 1997. — Vol. 49 (suppl. 3). —
P. 17—20.
17. Sakkas L.I., Demaine A.G., Panayi G.S., Welsh K.I. Arthritis in patients
with psoriasis is associated with an immunoglobulin gene polymorphism
//Arthr. Rheum. — 1988. — Vol. 31. — P. 276—278.
18. Tomfohrole J., Silverman A., Barnes R. Gene for familian psoriasis
susceptobility mapped to the distal end of human chromosome I7q ll
Science. — 1994. — Vol. 264. — P. 1141—1145.
19. Troughton P.R., Morgan A.W. Laboratory findings and pathology of
psoriatic artritisZ/Bailliere’s Clin. Rheumatol. — 1994. — Vol. 8. — P.
439—463.
20. Weigl B.A. Evidence for immunodeficiency syndrome related to
betahaemolytic streptococci with psoriasis/ZEuropean Acad. Dermatol.
Venerol.— 1992. —Vol. 1.—P. 123—133.
21. Wolf R., Ruocco V. Triggered psoriasis//RheumaDerm*97. — Abstracts. —
Malta, 1997. —L. 21.
90
Лекция 9
ЭВОЛЮЦИЯ МЕТОДОВ ЛЕЧЕНИЯ
СИСТЕМНОЙ КРАСНОЙ ВОЛЧАНКИ
Профессор Mt М, Иванова (Институт ревматологии
РАМН)
Несмотря на то, что прогноз системной красной волчанки (СКВ) в
последние годы значительно улучшился, лечение этого заболевания
остается весьма трудной задачей. Это обусловлено большой вариа-
бельностью течения болезни, необходимостью подбирать адекватное
активности болезни лечение в соответствии с органной патологией,
разрабатывать так называемую поддерживающую терапию, чтобы из-
бежать обострений и прогрессирования болезни. Представляет труд-
ности и оценка отдаленных результатов. До сих пор обсуждается по-
нятие «ремиссия» СКВ и тем более определение понятия такого состо-
яния больных, когда на протяжении многих лет не возвращаются сим-
птомы болезни даже без поддерживающей терапии. Больные ведут
нормальный образ жизни, благополучно рожают и растят детей, ра-
ботают, сохраняя профессиональную ориентацию, т.е. практически
здоровы.
Выживаемость больных СКВ значительно изменилась в течение
последних 4 десятилетий: в 1959 г. 5-летняя выживаемость составля-
ла менее 50 %, а к 90-м годам она достигла более 90 %. К 1998 г.
20-летняя выживаемость больных СКВ составляет 70 %. Основные
причины улучшения прогноза больных СКВ — ранняя диагностика и
разработка методов лечения с умелым применением ГКС, иммунодеп-
рессантов, а также совершенствование терапевтических программ,
включающих экстракорпоральные методы лечения, современные пре-
параты, подавляющие отдельные симптомы болезни (гипотензивные,
антитромботические, антибиотики и др.). Оптимальные методы тера-
пии разрабатывались на протяжении многих лет. Уже в первые годы
работы Института ревматологии под руководством В.А.Насоновой
были разработаны адекватные методы лечения СКВ глюкокортико-
стероидами (ГКС), когда удалось значительно увеличить продолжи-
тельность жизни больных, ранее обреченных [Насонова В.А. и др.,
1968]. В последующие годы программа лечения ГКС неуклонно со-
вершенствовалась, однако глюкокортикостероиды по сей день состав-
ляют основу лечения СКВ.
Лекарственные формы ГКС совершенствовались на протяжении
многих лет. Наиболее удобным при СКВ остается преднизолон, осо-
бенно 6-метилпреднизолон (урбазон, медрол, солю-медрол), минималь-
но влияющий на водно-минеральный обмен. Введение фтора в моле-
91
кулу преднизолона позволило создать новые ГКС (триамсинолон,
дексаметазон, бетаметазон), которые используют при плохой перено-
симости преднизолона или его неэффективности в острой фазе СКВ.
Однако для длительного применения они оказались малопригодными
из-за быстрого развития ожирения, артериальной гипертонии (декса-
метазон), миопатии (триамцинолон). Дозировки ГКС на протяжении
многих лет подбирались эмпирически. В большинстве случаев при
высокой активности СКВ адекватной оказывается суточная доза пред-
низолона, составляющая 1 мг/кг массы тела. При гломерулонефрите
и острых церебральных нарушениях, гематологическом кризе суточ-
ная доза может быть и выше (до 80—100 мг). Практически всем боль-
ным ГКС назначаются внутрь, так как они быстро и почти полностью
всасываются в желудочно-кишечном тракте. Пероральный прием яв-
ляется наиболее эффективным путем введения ГКС. Укрепилось мне-
ние о том, что ГКС следует давать больным СКВ в течение многих
лет, в основном пожизненно, переходя с высоких доз в фазе активно-
сти к поддерживающим (7,5—5 мг) и сохраняя эту дозу даже в период
клинической ремиссии. Лишь в редких случаях ГКС приходится вво-
дить внутримышечно, увеличивая при этом дозу в 3—4 раза по срав-
нению с пероральной.
Новую эру в лечении СКВ открыла пульс-терапия — внутривен-
ное введение метилпреднизолона по 1000 мг в день в течение 3 дней.
Метод оказался весьма эффективным у некурабельных ранее больных
СКВ и успешно применяется в Институте ревматологии РАМН на
протяжении последних 15 лет. Пульс-терапию проводят при активном
люпус-нефрите, гематологическом кризе, острых нейропсихических
расстройствах. Если в таких случаях диагноз СКВ не вызывает со-
мнений, не следует ждать, пока другая терапия окажется неэффектив-
ной. Поначалу показания к пульс-терапии были очень строгими. Так,
например, считалось, что у больных с активным люпус-нефритом мож-
но применять метилпреднизолон в сверхвысоких дозах лишь при на-
личии клеточной пролиферации в биоптате почки, подобной таковой
при кризе отторжения.
По мере накопления опыта изменилась и методика проведения
пульс-терапии. Классическая пульс-терапия (по 1 г внутривенно в
течение 3 дней) не всегда бывает достаточной. При активном лю-
пус-нефрите мы проводили повторные курсы пульс-терапии метил-
преднизолоном по 1000 мг (иногда 2000 мг) ежемесячно в течение
6—12 мес. Тактика ведения больных с активным люпус-нефритом
очень сложна. Возможность быстрого снижения пероральной дозы
преднизолона после пульс-терапии не подтвердилась в связи с ухуд-
шением состояния у некоторых больных, прогрессированием почеч-
ного синдрома (в том числе быстрым снижением скорости клубочко-
вой фильтрации).
Вскоре после освоения метода пульс-терапии и оценки ее первых
результатов мы изменили тактику лечения после завершения внут-
ривенного введения метилпреднизолона. В последующие 4 нед про-
92
должается лечение ГКС в достаточно высокой дозе внутрь (40—
50 мг преднизолона в сутки). У части больных-при недостаточной
эффективности трехдневной пульс-терапии мы вводили метилпред-
низолон внутривенно по 250 мг/сут еще 2—3 нед, что значительно
повышало эффективность применения сверхвысоких доз ГКС при лю-
пус-нефрите.
Фармакокинетические исследования показали, что концентрация
метилпреднизолона в плазме уже через 1 ч достигает максимума, а
затем быстро снижается в течение 6—7 ч. Через 4 дня в периферичес-
кой крови обнаруживают только следовые количества метилпредни-
золона, чего явно недостаточно для достижения стойкого эффекта. О
пересмотре механизма действия сверхвысоких доз метилпреднизоло-
на сообщают Е.Л.Насонов и соавт.
Пульс-терапия не только значительно снижает содержание акти-
ваторов воспаления, высвобождение вазоактивных веществ и их по-
вреждающее действие на ткань почки, но и улучшает функцию почек
за счет влияния на физиологические факторы (улучшение почечного
кровотока, снижение общего периферического сосудистого сопротив-
ления). Стимулируя почечный кровоток, метилпреднизолон в ударных
дозах предотвращает сладж-феномен в капиллярах клубочков, харак-
терный для активного люпус-нефрита. Наши наблюдения подтверди-
ли, что внутривенное введение метилпреднизолона может несколько
улучшить функциональную способность почек и при хронической
почечной недостаточности, если имеются признаки активности нефри-
та, что можно объяснить уменьшением воспалительного процесса и ак-
тивацией компенсаторных вазодилатационных механизмов.
Пульс-терапию метилпреднизолоном следует индивидуализиро-
вать, учитывая возраст, особенности висцеральной патологии: у
больных старшего возраста при давней болезни, артериальной ги-
пертонии, поражении миокарда целесообразно изменить дозировку
препарата (250—500 мг/сут в течение 8—10 дней). Многолетнее на-
блюдение показало, что в день проведения пульс-терапии следует
в вечерние часы сохранять прием 74 суточной дозы преднизолона
per os.
Таким образом, тактика применения ГКС при СКВ за прошедшие
десятилетия претерпела значительные изменения. Наиболее оправдан-
ным является применение препаратов метилпреднизолона, которые
даже при длительном лечении реже вызывают побочные реакции.
Цитотоксические иммунодепрессанты по-прежнему являются со-
ставной частью лечения больных СКВ. Чаще всего применяют аза-
тиоприн и циклофосфамид, реже хлорамбуцил (хлорбутин, лейкеран).
В последние годы довольно успешно испцльзуют циклоспорин А, а при
некоторых формах СКВ (чаще при поражении ЦНС или стойких из-
менениях суставов) — метотрексат. После продолжительной дискус-
сии о вреде и пользе цитотоксических иммунодепрессантов при рев-
матических заболеваниях утвердились следующие показания к их
применению при СКВ:
93
• активный нефрит,
• генерализованный васкулит (поражение легких, ЦНС),
• резистентность к ГКС или их плохая переносимость.
Цитотоксические иммунодепрессанты при СКВ всегда применяют
в сочетании с ГКС. Показана целесообразность комбинации цитоста-
тических иммунодепрессантов с разным механизмом действия (анти-
метаболитов и алкилирующих агентов). Так, эффективным при лю-
пус-нефрите оказалось сочетание азатиоприна (100 мг внутрь ежед-
невно) и циклофосфамида (1000 мг внутривенно 1 раз в 3 мес). При
активном нефрите, генерализованном васкулите высокоэффективна
сочетанная пульс-терапия: одновременное внутривенное введение
1000 мг циклофосфамида и 1000 мг метилпреднизолона с последую-
щим введением последнего в течение еще 2 дней. Циклофосфамид
затем применяют по 200 мг в неделю внутривенно в течение 3—6 мес
в сочетании с преднизолоном по 20—25 мг/сут.
Анализ данных литературы и наш собственный опыт показали, что
ведущая роль в лечении тяжелых форм СКВ, особенно с поражением
почек и нервной системы, принадлежит циклофосфамиду. Внутривен-
ное введение сверхвысоких доз этого препарата позволяет спасти
жизнь, казалось бы, некурабельным больным. Особенно эффективным
при поражении нервной системы оказалось длительное парентераль-
ное лечение циклофосфамидом, когда после пульс-терапии этим пре-
паратом больной продолжает получать его внутривенно в поддержи-
вающих дозах в течение нескольких лет. Мы с успехом (хороший и
отличный эффект у 62—90 % больных) применяем циклофосфамид для
лечения пациентов с разнообразной острой и хронической психонев-
рологической симптоматикой, считая его препаратом выбора у дан-
ной категории больных. По современным представлениям, в патоге-
незе поражения ЦНС при СКВ играет роль поражение сосудов и нер-
вной ткани перекрестно реагирующими с ней антителами, которые,
вероятнее всего, синтезируются интратекально. Циклофосфамид по-
давляет выработку антител в любой фазе клеточного цикла и воздей-
ствует на неспецифический компонент воспаления. Следует подчерк-
нуть высокую зависимость этой категории больных от циклофосфа-
мида; даже снижение частоты инъекций ведет к возобновлению и уси-
лению нейропсихических расстройств. Возможно, это отчасти связа-
но с наличием у большого числа наших больных (46 %) антител к
кардиолипину или полного антифосфолипидного синдрома, когда
ГКС даже в высоких дозах неэффективны. Мы имеем данные о воз-
можности продолжения терапии циклофосфамидом в течение 5—7 лет
практически без побочных эффектов. В литературе публикаций о дли-
тельном парентеральном применении циклофосфамида при волчаноч-
ном поражении ЦНС не имеется.
Среди других цитотоксических иммунодепрессантов следует отме-
тить азатиоприн, который эффективен при длительном применении у
больных с нейролюпусом, сочетающимся с антифосфолипидным син-
94
дромом. Что касается метотрексата, то впечатляющим является сооб-
щение G.Valezini и соавт. об эффективности интратекального введе-
ния этого препарата в дозе 10 мг в комбинации с дексаметазоном
(20 мг) 1 раз в неделю в течение 2—7 нед у двух больных (в возрасте
20 и 26 лет) с тяжелой неврологической симптоматикой, не поддавав-
шейся предшествующей терапии, включая парентеральное введение
циклофосфамида.
Плазмаферез и гемосорбция, применяющиеся в последние 2 деся-
тилетия, являются эффективными вспомогательными методами для по-
давления активности СКВ. Обобщение 15-летнего опыта использова-
ния плазмафереза и гемосорбции показало целесообразность включе-
ния этих методов в комплексное лечение больных с торпидным тече-
нием СКВ, резистентностью к предшествующей терапии [Соловь-
ев С.К., Насонова В.А., 1998]. Плазмаферез и гемосорбция позволя-
ют снизить активность болезни за счет интенсивного воздействия на
иммунопатологический процесс и удаления из крови биологически ак-
тивных веществ — медиаторов воспаления, циркулирующих иммун-
ных комплексов, криопреципитинов, различных антител и др. Пола-
гают, что механическое очищение крови помогает на некоторое вре-
мя разгрузить систему мононуклеаров, стимулируя, таким образом, эн-
догенный фагоцитоз новых иммунных комплексов, что в итоге умень-
шает степень органных повреждений. Не исключено, что при гемо-
сорбции происходит не просто связывание сывороточных иммуногло-
булинов, но и изменение их состава, ведущее к уменьшению массы
иммунных комплексов и облегчающее процесс их удаления из кровя-
ного русла. Возможно, что при прохождении крови через сорбент
иммунные комплексы меняют свой заряд, чем объясняется выражен-
ное улучшение, наблюдающееся у больных с поражением почек даже
при неизменном уровне иммунных комплексов в крови. Известно, что
лишь положительно заряженные иммунные комплексы способны осаж-
даться на базальной мембране клубочков почки. В Институте ревма-
тологии наблюдался поразительный эффект у крайне тяжелой катего-
рии больных СКВ (быстро прогрессирующий нефрит, генерализован-
ный васкулит) при чередовании плазмафереза или гемосорбции с
пульс-терапией метилпреднизолоном и циклофосфамидом. Процедуры
проводили дважды в неделю на протяжении 3 нед. Положительные
результаты были достигнуты в 87 % случаев [Соловьев С.К., Насо-
нова В.А., 1998].
Известны другие методы лечения, необходимые для успешного
лечения СКВ.
Так, не утратили своего значения в качестве вспомогательного, а
иногда и основного метода лечения при доброкачественном течении
хронической СКВ аминохинолиновые производные.Впос-
ледние годы был более детально изучен механизм действия этих пре-
паратов; показаны их противовоспалительный эффект, связанный с
торможением выработки ИЛ-1 и ИЛ-6, иммуносупрессивное, антиаг-
регантное, гиполипидемическое действие. Последнее особенно важ-
95
но для больных, длительно принимающих ГКС. На III Международ-
ной конференции, посвященной СКВ (Лондон, 1992), было подтверж-
дено положение об отсутствии офтальмологических осложнений, даже
при многолетнем применении, гидроксихлорина (плаквенила), но при
условии, что суточная доза не превышает оптимальной (600 мг). Весь-
ма эффективно применение этих препаратов при длительном лечении
СКВ.
Современные подходы к лечению СКВ подчеркивают необходи-
мость применения антимутагенных препаратов, к которым
относятся антиоксиданты и бемитил. Они не только препятствуют
гипоксии, но и обладают иммуностимулирующими свойствами, повы-
шают неспецифическую резистентность организма к действию небла-
гоприятных факторов окружающей среды. В Институте ревматоло-
гии РАМН изучалась возможность предупреждения цитотоксичес-
кого действия циклофосфамида в больших дозах у больных СКВ с
поражением почек и ЦНС с помощью бемитила [Лисицина Т.А.,
1997].
В настоящее время мы располагаем результатами наблюдения 775
больных СКВ, обратившихся в Институт ревматологии в период
1958—1998 гг. У 620 из них в патологический процесс были вовлече-
ны жизненно важные органы и системы, в том числе у 510 человек
наряду с другими проявлениями СКВ (6—8 критериев Американской
коллегии ревматологов) выявлен активный нефрит, у 110 — отмеча-
лось поражение ЦНС с тяжелыми нейропсихическими расстройствами.
У 155 больных наблюдались преимущественно кожно-суставно-
мышечные изменения, преходящая лейкопения, незначительно выра-
женные признаки вовлечения центральной и периферической нервной
системы.
Следует обратить внимание на то, что большинство из наблюдав-
шихся нами пациентов (65 %) заболели в период возрастного пика,
характерного для начала СКВ, — 14 лет —24 года (60 % больных
наблюдались более 10 лет, из них в возрасте от 21 года до 40 лет —
31,5 %).
Терапевтический комплекс включал различные программы пато-
генетической терапии. Основными препаратами были ГКС и цито-
токсические иммунодепрессанты. Было показано, что эф-
фективность лечения значительно повысилась с введением пульс-те-
рапии метилпреднизолоном, применявшейся либо изолированно, либо
в сочетании с циклофосфамидом. Еще более обнадеживающий эффект
получен от так называемой синхронной терапии — чередования плаз-
мафереза и пульс-терапии метилпреднизолоном в сочетании с цикло-
фосфамидом на протяжении 3 нед либо ежемесячно в течение года. Так,
по данным С.К.Соловьева, из 50 наблюдавшихся 19 лет (1979—
1998) крайне тяжелых больных СКВ с нефритом и генерализованным
васкулитом, несмотря на проведение пульс-терапии метилпреднизоло-
ном, умерли 26 больных, тогда как при использовании «синхронной»
программы лечения (плазмаферез, пульс-терапия метилпреднизолоном
96
ежемесячно в течение года) из 56 больных за 15 лет наблюдения умер-
ли только 12.
Внутривенное введение иммуноглобулина (сандоглобулин,
отечественный иммуноглобулин) в дозе 400—500 мг/сут в течение 3—
5 последующих дней оказалось весьма эффективным у больных со
стойкой тромбоцитопенией, рефрактерной даже к повторным курсам
пульс-терапии.
Указанные методы интенсивного лечения применялись в группе
больных СКВ с вовлечением в патологический процесс почек и ЦНС
Так, из 620 больных с тяжелой органной патологией изолированно
ГКС внутрь в дозе 1 мг/кг/сут и больше принимали лишь 33 %, при-
чем суточная доза преднизолона доходила иногда до 120 мг. Осталь-
ные больные получали комбинированную терапию ГКС и цитотокси-
ческими иммунодепрессантами (в основном циклофосфамид и азатио-
прин, в единичных случаях метотрексат или сандиммун). Из-за тяже-
сти нефрита, поражения ЦНС или гематологических осложнений бо-
лее трети больных получали интенсивную терапию либо в виде пульс-
терапии метилпреднизолоном и циклофосфамидом, либо в виде соче-
тания плазмафереза и пульс-терапии указанными препаратами по «син-
хронной» программе, как указано выше [Соловьев С.К., 1999]. Од-
новременное применение экстракорпоральных методов лечения (плаз-
маферез, гемосорбция) с пульс-терапией метилпреднизолоном и цик-
лофосфамидом не только спасало жизнь некурабельных ранее боль-
ных, но в ряде случаев приводило к практическому выздоровлению.
У части больных без тяжелых висцеральных изменений (155 боль-
ных) методы терапии не были столь интенсивными, однако почти у всех
применялись ГКС (0,5—1 мг/кг/сут) из-за артрита, существенного
поражения периартикулярных тканей, вплоть до разрыва сухожилий,
рецидивирующих плеврита и перикардита. В этой группе больных
также применялся азатиоприн (100—150 мг/сут) в течение 6—12 мес
из-за рефрактерного к ГКС поражения кожи. Кроме того, при сосуди-
стой патологии с изъязвлением кожи использовались плазмаферез и
гемосорбция с последующим введением циклофосфамида. Лечение
ГКС в поддерживающих дозах проводилось в течение многих лет (5—
10 лет непрерывно).
Длительное наблюдение подтвердило важность адекватной тера-
пии. Так, даже в самом начале нефрита важно назначить подавляю-
щую активность терапию. Многолетний опыт показал, что лечение
активного нефрита следует начинать с сочетанной пульс-терапии ме-
тилпреднизолоном и циклофосфамидом, в последующем длительно
продолжая применение ГКС и циклофосфамида. Лечение проводится
на фоне гипотензивных, антиагрегантных препаратов, периодичес-
ки — антикоагулянтов.
Своевременная интенсивная терапия особенно необходима при
СКВ у подростков. По данным О.М.Фоломеевой, из 137 больных
СКВ, заболевших в возрасте 13—18 лет, умерли за период с 1967 по
1997 г. 75 человек, средняя продолжительность жизни составила все-
4—3592
97
го 5,8 лет. Только 6 человек в этой группе получали пульс-терапию
метилпреднизолоном. Столь же важным является проведение адекват-
ной терапии и при вовлечении ЦНС. Даже при хроническом пораже-
нии ЦНС появление таких симптомов, как упорная головная боль,
чаще мигрень, судорожные припадки, психические расстройства, при-
знаки поражения черепных и периферических нервов, требует длитель-
ного лечения циклофосфамидом на фоне сравнительно небольших доз
ГКС. Мы получали хороший эффект при внутривенном введении
500 мг циклофосфамида 1 раз в неделю или 1 раз в 2 нед в течение
4—8 нед, а затем по 200 мг в неделю в течение 12—24 мес [Иванова
М.М., Близнюк О.И., 1995]. Своевременность назначения и адекват-
ность терапии особенно показательны на примере лечения активного
люпус-нефрита. Так, больные, получавшие низкие дозы преднизоло-
на, в основном погибали через 1—3 года от начала болезни; 5-летняя
выживаемость составляла лишь 26 %. После включения в программу
лечения цитотоксических иммунодепрессантов, в особенности цикло-
фосфамида, 10-летняя выживаемость больных с активным люпус-не-
фритом увеличилась до 84 %.
Наши наблюдения показали, что из 620 больных СКВ с пораже-
нием жизненно важных органов к 1998 г. у 46 человек (все женского
пола) признаков СКВ не наблюдается. Они уже в течение 10—23 лет
не получают ГКС (активный нефрит наблюдался в прошлом у 40 и
острое поражение ЦНС — у 6 из них). Все больные заболели в возра-
сте от 14 лет до 21 года. Лечение, адекватное активности болезни,
было начато в срок от 6 до 18 мес от ее начала. Только ГКС внутрь
получали всего 6 человек, ГКС в комбинации с цитотоксическими
иммунодепрессантами — 32, плазмаферез с последующей пульс-те-
рапией метилпреднизолоном и циклофосфамидом — 8 человек. Боль-
ные ведут нормальный образ жизни, работают по специальности, боль-
шинство вышли замуж, имеют здоровых детей [Иванова М.М., Со-
ловьев С.К., Фоломеева О.М., 1998].
У 261 больного произошла стабилизация процесса, однако и в этой
группе 2/3 больных ведут нормальный образ жизни, домашнее хозяй-
ство, имеют детей и работают. */3 больных имеют инвалидность II или
I группы (последняя — из-за асептических некрозов головок бедрен-
ных или других костей). У 40 больных продолжала нарастать почеч-
ная недостаточность; 273 умерли — большинство из них в период
1958—1968 гг., когда не были разработаны методы адекватной тера-
пии. Продолжительность жизни в этой группе составляла от 1 года
до 35 лет, в среднем 14,7 лет.
По наблюдению Е.Л.Лучихиной (1998), детально изучившей при-
чины смерти у 237 больных СКВ, структура летальности с течением
времени менялась. В 60—70-е годы на первом месте среди причин
смерти были активный люпус-нефрит, поражение ЦНС, бактериаль-
ная или вирусная инфекция, сердечно-легочная недостаточность, тром-
бозы магистральных сосудов. В 90-е годы главными причинами смер-
ти стали инфекционные осложнения, тромбозы магистральных сосу-
98
дов, хроническая почечная недостаточность, а активный нефрит и
сердечно-легочная недостаточность составили лишь 10 и 3 % соответ-
ственно. Продолжительность жизни составила от 6 мес до 35 лет, в
среднем 11 лет.
В группе (155 больных) без тяжелых висцеральных изменений к
1998 г. отсутствие симптомов СКВ наблюдалось у 51 человека, ста-
билизация процесса — у 42. Следует подчеркнуть, что 37 % этих боль-
ных имели инвалидность из-за ревматоидноподобного артрита, асеп-
тических некрозов головок бедренных костей (5 человек), сердечно-
легочной недостаточности в связи с перенесенным выпотным плеври-
том, перикардитом либо сопутствующих заболеваний (возраст боль-
шинства этих больных к 1998 г. достиг 55—65 лет). Умерли 24 боль-
ных, но только у двух причина смерти была связана с СКВ — острая
сердечно-легочная недостаточность. У других летальный исход был
обусловлен вирусной или бактериальной инфекцией, инфарктом мио-
карда, артериальной гипертонией и др. Продолжительность наблю-
дения в этой группе составила от 10 до 35 лет, а 20-летняя выживае-
мость — более чем 70 %.
Таким образом, тактика лечения больных СКВ в 70—90-е годы
претерпела значительные изменения: от монотерапии преднизолоном
внутрь до комплексных программ, включающих внутривенное введе-
ние метилпреднизолона и циклофосфамида в сочетании с экстракор-
поральными методами. Сегодня имеется возможность достаточно эф-
фективно воздействовать на патологический процесс при СКВ. При
умелом применении современных ГКС, цитотоксических иммунодеп-
рессантов, биологических и синтетических средств иммунотерапии
можно не только значительно улучшить прогноз при СКВ, но и до-
биться социальной реабилитации больных и даже практического выз-
доровления.
СПИСОК ЛИТЕРАТУРЫ
1. Иванова М.М., Соловьев С.К., Сперанский А.И., Насонов Е.Л. Внутривен-
ное введение ударных доз метилпреднизолона (пульс-терапия) при
люпус-нефритеУУТер.арх. — 1983. — №7. — С. 114—117.
2. Иванова М.М. Лечение системной красной волчанкиУУКлин. мед. —
1985. _ № 1,~С. 16—23.
3. Иванова М.М., Близнюк О.И. Лечение больных системной красной вол-
чанкой с поражением центральной нервной системыУУВестн. дерматол. —
1994. — № 2. — С. 64—67.
4. Иванова М.М. Системная красная волчанка (клиника, диагностика, ле-
чениеУУРос. мед. журн. — 1998. — № 4. — С. 54—60.
5. Лучихина Е.Л., Каратеев Д.Е., Иванова М.М., Соловьев С. К. Структура
летальных исходов при системной красной волчанкеУУРоссийская рев-
матология. — 1998. — № 3. — С. 2—9.
6. Насонова В.А. Системная красная волчанка. — М.: Медицина, 1972. —
246 с.
7. Насонов Е.Л., Иванова М.М., Панин Д. И. Глюкокортикостероиды врев-
4*
99
матологии: опыт использования Солю-Медрола // Клин. фарм. тера-
пия. — 1994. — № 1.— С. 46—48.
8. Соловьев С.К., Насонова В.Л. Синхронная интенсивная терапия у боль-
ных СКВ с неблагоприятным исходом//Вестн. РАМН. — 1998. --
№ 12.— С. 32—36.
9. Фоломеева О.М. Системная красная волчанка у подростков //Дег.
ревм. — 1997. — № 1. — С. 45—53.
Лекция 10
СКЛЕРОДЕРМИЯ — МОДЕЛЬ
ЛОКАЛЬНОГО
И ГЕНЕРАЛИЗОВАННОГО ФИБРОЗА
Профессор Н. Г, Гусева (Институт ревматологии РАМН)
За последние 40 лет произошла огромная эволюция в представле-
ниях о системной склеродермии (ССД), которая лишь в середине на-
стоящего столетия вошла в круг ревматологических проблем, а в
настоящее время может быть охарактеризована как хорошо изучен-
ная с клинических позиций яркая нозологическая форма и уникаль-
ная модель фиброза. Изучение ССД и склеродермической группы за-
болеваний в целом открывает все новые грани интимных механизмов
фиброзообразования, мембранной патологии, взаимосвязи соедини-
тельнотканных, иммунных и микроциркуляторных нарушений, роли
иммуногенетических и внешнесредовых факторов в развитии фибро-
за [1].
В качестве небольшой исторической преамбулы можно условно
выделить следующие основные этапы развития учения о склеродер-
мии:
I — длительный (более 300 лет) «дерматологический» этап с
введением в начале XX в. представлений об ограниченной
(очаговой) и генерализованной склеродермии.
П — «терапевтический» этап (со II половины XX в.), когда пос-
ле появления концепции Клемперера о коллагенозах начал-
ся своеобразный бум в развитии учения о системных забо-
леваниях соединительной ткани, введены термины «систем-
ная склеродермия», «системный прогрессирующий скле-
роз» и началось интенсивное изучение ССД с общеинтер-
нистских позиций.
III — «патогенетический» этап. В этот период времени изучают-
ся механизмы развития болезни, особенности фиброзообра-
зования, нарушения микроциркуляции, иммунитета; разра-
батывается патогенетическая терапия ССД.
100
IV — «экологический» этап. Стали рассматриваться проблемы
взаимоотношений экологии и склеродермической группы
болезней.
Подводя итоги 40-летней деятельности Института ревматологии
РАМН, необходимо подчеркнуть, что большой вклад в изучение про-
блемы системной склеродермии внесла отечественная медицина, в
первую очередь многолетние исследования, проводившиеся в Инсти-
туте ревматологии (возглавляемом академиками АМН А.И.Нестеро-
вым и В.А.Насоновой с 1970 г. по настоящее время).
Начало нашей работы по проблеме ССД относится к концу 50-х
годов, когда больные с колоссальным трудом набирались для обще-
терапевтического обследования по всей Москве из дерматологичес-
ких, неврологических и других стационаров, где после многократных
ошибочных диагнозов ставился или предполагался диагноз склеро-
дермии. При этом наблюдались в основном тяжелые формы заболева-
ния (V больных имели инвалидность I и II группы, большинство из
них погибли уже в ближайшие годы). Целенаправленное изучение
общих, периферических и висцеральных проявлений ССД выявило
большой полиморфизм клинической картины и изменило в целом пред-
ставления о болезни, что нашло отражение в ряде публикаций [2, 3].
Многие исследования, проводившиеся в Институте ревматологии,
носили приоритетный характер, сохранили значение до настоящего
времени, получили подтверждение и развитие при использовании со-
временных технологий и накопленного опыта [4].
Следует подчеркнуть, что из всей группы так называемых колла-
генозов именно ССД сохранила признаки коллагеновой болезни, ибо
изменения в сфере метаболизма коллагена и других компонентов со-
единительной ткани оказались ведущими в развитии генерализован-
ного фиброза, который определяет своеобразный клинический и мор-
фологический облик заболевания.
Хорошо известно характерное поражение кожи, откуда возникло
название «склеродерма» и появились литературные аналоги: «шагре-
невая кожа», человек-мумия (1’homme momie) французских авторов и
«Живые мощи» И.С.Тургенева, где дано замечательно точное и ху-
дожественное описание болезни. «...Передо мною лежало живое че-
ловеческое существо, но что это было такое?
Голова совершенно высохшая, одноцветная, бронзовая — ни дать
ни взять икона старинного письма; нос узкий, как лезвие ножа; губ
почти не видать — только зубы белеют и глаза, да из-под платка
выбиваются на лоб жидкие пряди желтых волос. У подбородка, на
складке одеяла, движутся, медленно перебирая пальцами, как палоч-
ками, две крошечные руки тоже бронзового цвета. Я вглядываюсь по-
пристальнее: лицо не только не безобразное, даже красивое, — но
страшное, необычайное. И тем страшнее кажется это лицо, что по
нему, по металлическим его щекам, я вижу — силится ...силится и не
может расплыться улыбка».
101
В основе индурации кожи (склеродактилия, маскообразность, ге-
нерализованные изменения), столь поразившей воображение писате-
ля, лежит фиброз.
Именно в зависимости от распространенности поражения кожи в
международной классификации выделяют диффузную и лимитирован-
ную клинические формы ССД, что в значительной мере обусловлено
тем, что заболевание за рубежом изучается как в ревматологических,
так и в дерматологических центрах.
Проведенные нами исследования показали, что поражение кожи
является частым (93 % больных) и характерным, но не всегда ранним
и строго обязательным проявлением ССД. Так, среди наблюдавших-
ся больных лишь у V изменения со стороны кожи были начальными
признаками заболевания. В последующем выделена преимуществен-
но висцеральная форма заболевания, диагностика которой все еще до-
статочно сложна.
Наиболее частым первым признаком ССД оказался синдром Рей-
но (95 % больных). Проведенные в Институте ревматологии клини-
ко-морфологические исследования выявили характерное для ССД
генерализованное поражение мелких артерий и артериол, наруше-
ния микроциркуляции, обусловливающие синдром Рейно; ишемичес-
кие и некротические изменения, как периферические, так и висцераль-
ные. Высказано предположение о наличии эквивалента синдрома
Рейно в легких, сердце, почках, что позже стало активно обсуждать-
ся в зарубежной литературе и доказано современными методами ис-
следования.
Последующее введение широкопольной капилляроскопии ногте-
вого ложа позволило использовать наличие характерных для ССД
изменений капилляров в ранней и дифференциальной диагностике
ССД с другими заболеваниями соединительной ткани и болезнью
Рейно.
Уже на первом этапе изучения заболевания обращено внимание
на большую частоту поражения опорно-двигательного аппарата при
ССД, нередко приводящего к инвалидизации больных. Это склеро-
дермический полиартрит, остеолиз, кальциноз, что вместе с пораже-
нием кожи и синдромом Рейно создает картину характерного для
ССД «периферического» симптомокомплекса. Впервые наряду с
характерным индуративным полиартритом и периартритом с разви-
тием фиброзных контрактур выделен ревматоидноподобный полиар-
трит у больных ССД, отмечена также возможность развития у них
полимиозита. Совместно с французскими коллегами (проф. F.Delbarre
и др.) изучался перекрестный (overlap) с другими заболеваниями со-
единительной ткани (РА, дерматомиозит, полимиозит, СКВ) синдром
ССД, который мы выделяем теперь как особую клиническую фор-
му. Следует отметить, что число больных с overlap-синдромом в пос-
ледние годы увеличилось.
К 60-м годам относятся первые работы по клинико-рентгенологи-
ческой, функциональной и морфологической характеристике пораже-
102
ния легких при ССД: выделены основные формы патологии, функци-
ональные нарушения — снижение диффузионной емкости, рестриктив-
ный тип поражения, уменьшение сосудистого объема легких по дан-
ным гамма-радиографии (Э.С.Мач), динамичность процесса, корреля-
ция выраженности пневмофиброза с активностью заболевания; целе-
сообразность использования кортикостероидов при активном и про-
грессирующем поражении (фиброзирующем альвеолите, по современ-
ной терминологии). Все эти положения были подтверждены и допол-
нены в последующем при появлении специальных методов исследова-
ния: бронхоальвеолярного лаважа с изучением клеточного и медиа-
торного компонентов воспаления и компьютерной рентгеновской то-
мографии, способствовавших уточнению биологической сущности
процесса и диагностике двух патологических состояний — фибрози-
рующего альвеолита и базального пневмофиброза.
Уже на начальном этапе исследований также выявлен сосудистый
компонент поражения легких при ССД с развитием легочной гипер-
тензии. Эти данные нашли подтверждение при использовании совре-
менных методов исследования и учитываются при проведении диффе-
ренцированной терапии больных ССД.
Следует подчеркнуть приоритетные исследования, проводившие-
ся в Институте ревматологии в области кардиальной патологии: на
основании клинических и морфологических исследований выявлены
большая частота и прогностическая значимость поражения сердца при
ССД с превалирующими изменениями миокарда по типу склеродер-
мического кардиосклероза (Н.Г.Гусева, Н.Н.Грицман). Показана воз-
можность развития панкардита — комбинированного поражения мио-
карда, перикарда и эндокарда с характерным преобладанием процес-
сов фиброза. Впервые обращено внимание на нередкое поражение
париетального и клапанного эндокарда с формированием склеродер-
мических пороков сердца. Детально изучены нарушения ритма и про-
водимости (Г.П.Котельникова); рентгенологические особенности
склеродермического сердца (В.Шанина). Выявленные закономернос-
ти подтверждены и детализированы в дальнейшем при использовании
современных неинвазивных методов (холтеровский мониторинг, эхо-
кардиография, сцинтиграфия миокарда, вентрикулография и др.) и
анализе большого морфологического материала, позволяющих диф-
ференцировать процессы фиброза и очагового некроза миокарда, обус-
ловленного поражением микрососудов. Это направление исследова-
ний оказалось чрезвычайно важным в настоящее время, когда карди-
альная патология нередко выходит на первый план, особенно в слу-
чаях внезапной смерти больных ССД.
Поражение пищеварительного тракта уже в 60—70-е годы выде-
лено нами как одна из характерных локализаций склеродермическо-
го процесса, имеющая диагностическое и прогностическое значение
Помимо нередко превалирующих изменений со стороны пищевода,
описаны склеродермический дуоденит, поражение кишечника, синд-
ром нарушения всасывания и частичной непроходимости. Разработа-
103
ны рентгенологические методы оценки выраженности и стадии скле-
родермического эзофагита (А.И.Саваровский). Следует отметить и
первые детальные работы по клинико-морфологической характерис-
тике поражения печени при ССД, сохраняющие значение до настоя-
щего времени (З.Г.Апросина, Н.Г.Гусева).
Серия работ посвящена клинико-морфологической и функциональ-
ной характеристике нефропатии при ССД, особенно ранее фатальной
«истинной склеродермической почке» — основной причине смер-
ти больных с быстро прогрессирующей ССД. Выделены основные ва-
рианты склеродермической нефропатии, изучен генез патологии
(Н.В.Аникина). Выявлена корреляция нарушений микроциркуляции,
ренальных функций и морфологических изменений (биопсия), включая
состояние ультраструктурных признаков поражения почек, что послу-
жило основанием для разработки эффективной терапии. В настоящее
время, согласно нашим наблюдениям и данным зарубежных авторов,
поражение почек (особенно острая склеродермическая нефропатия)
встречается реже, что позволяет предполагать превентивный эффект
современной фармакотерапии.
При анализе полиморфной клинической картины и особенностей
семиотики заболевания разработаны диагностические критерии ССД,
которые в отличие от предложенных за рубежом, преимущественно
дерматологических критериев, ориентированы на заболевание в це-
лом. С учетом частоты и специфичности выделены основные («боль-
шие») и дополнительные («малые») диагностические признаки забо-
левания. К основным отнесены синдром Рейно, склеродермическое
поражение кожи, суставно-мышечный синдром, синдром Тибьержа—
Вейссенбаха (кальциноз), остеолиз, базальный пневмосклероз, круп-
ное чатовый первичный кардиосклероз, склеродермическое поражение
пищеварительного тракта и истинная склеродермическая почка.
В настоящее время для диагностики используются лабораторные тес-
ты на специфические для ССД антицентро мерные и антитопоизомераз-
ные (анти-8с1-70) антитела, а также признаки ССД, выявляемые при
капилляроскопии.
Изучение проблемы ССД оказалось важным как в клиническом,
так и в теоретическом плане, поскольку сложный патогенез заболе-
вания затрагивает ряд общебиологических проблем, в первую оче-
редь — процессы коллагено- и фиброзообразования, которые широ-
ко представлены в физиологии (начиная с эмбриогенеза) и особенно
патологии человека.
Болезнь привлекала внимание теоретиков (биологов, биохимиков)
как уникальная природная модель локального и генерализованного
фиброза.
В мире, особенно в США и Финляндии, создаются научные цент-
ры по изучению молекулярных механизмов фиброзообразования на
модели склеродермии, в коже, культуре фибробластов больных, на
отдельных экспериментальных моделях. Это направление успешно
развивается и в Институте ревматологии (лаборатория биохимии со-
104
мкг/106
А Фосфолипиды
мкг/106
Б Ганглиозиды
Рис. 10.1. Содержание фосфолипидов и ганглиозидов фибробластов в мо-
нослойных культурах кожи больных ССД и здоровых доноров.
SM — сфингомиелин, PCh — фосфатидилхолин, PS — фосфатидилсерин, PJ —
фосфатидилинозит, РЕ — фосфатидилэтаноламии, ТР суммарные фосфоли-
пиды, TG — суммарные ганглиозиды
единительной ткани, руководитель — д-р биол. наук. А.Ф.Панасюк),
где в 80—90-е годы выполнен ряд интересных научных исследований
по механизмам фиброза при ССД. Выявлено, что в основе фиброза при
ССД лежат повышение биосинтеза коллагена и неофибриллогенез,
фенотипически устойчивая гиперфункция фибробластов, дефектность
мембранной рецепции, увеличение концентрации фибронектина («фиб-
ронектиновая шуба») и других компонентов межклеточного матрик-
са [5]. Обнаружены структурные изменения мембран с увеличением
содержания фосфолипидов, снижением уровня и изменением состава
ганглиозидов (рис. 10.1), что подтверждает функциональную и струк-
турную дефектность мембран, рецепции и обусловливает относитель-
ную автономность фибробластов при ССД.
Часть этих работ, как и наши клинико-биологические исследова-
ния маркеров метаболизма коллагена при ССД, проводилась в комп-
лексе с учеными лаборатории Университета Оулу (Финляндия), воз-
главляемой профессором K.Kivirikko. Выявлено повышение содержа-
ния аминотерминального пропептида проколлагена III типа (РШ NP),
фрагмента Р1 ламинина и галактозилглюкозилтрансферазы (GGN),
коррелировавших в известной степени с активностью ССД [7].
Принципиально важное значение имеют новые данные о клеточ-
ной и молекулярной биологии фиброза при ССД. Обнаружены тесная
взаимосвязь и участие по крайней мере 6 основных видов клеток в
развитии склеродермического процесса. Помимо фибробластов, ак-
тивное участие при ССД принимают такие полипотентные клетки, как
эндотелий и гладкомышечные с их функциональной способностью к
105
вазоконстрикции и фибробластной активностью, иммунокомпетентные
клетки (Т-лимфоциты и моноциты), тучные клетки, играющие важную
роль в активации эндотелия и фибробластов, и тромбоциты как ис-
точник факторов роста и других цитокинов, высвобождающихся при
дегрануляции. Межклеточная кооперация осуществляется рядом ме-
диаторных систем, включая молекулы адгезии (селектины, ELAM-1,
VCAM-1 и ICAM-1); факторы роста — трансформирующие, тромбо-
цитарные и фибробластные (TGF£, PDGF, £FGF); фактор некроза
опухоли (ФНО-а), эндотелии-1 и другие вазоактивные пептиды; ин-
терфероны и интерлейкины 1, 2, 4, 6 и 8, часть из которых обладает
потенциальным фиброгенным эффектом. Изучение этих факторов пер-
спективно с позиций выявления новых направлений фармакотерапии
заболевания.
Следует подчеркнуть и значительный прогресс иммунологических
исследований, иллюстрирующих важную роль клеточных и гумораль-
ных факторов иммунитета в развитии ССД, уже в 80-х годах разру-
шивших миф об иммунологической инертности заболевания. Несом-
ненно, важна роль иммунокомпетентных клеток в формировании фиб-
роза. Иммунное воспаление — клеточная инфильтрация с активным
участием иммунокомпетентных клеток — предшествует развитию
быстро прогрессирующего фиброза в дерме при ССД [Fleishmayer Р.,
1983; Kottinen, 1992, и др.]. Аналогичные клинико-морфологические
изменения мы видим в суставах, мышцах, фасциях и, наконец, в лег-
ких — при фиброзирующем альвеолите, что обосновывает более ак-
тивное применение кортикостероидов и иммунодепрессантов у этой
категории больных наряду с антифиброзной терапией.
Отмечается «прорыв» и в отношении изучения изменений гумораль-
ного иммунитета. Выявлены большая частота и разнообразие ауто-
антител при ССД, главным образом антинуклеарных и антинуклео-
лярных. Наряду с высоким процентом антиядерных антител (до 96 %)
идентифицированы специфические для ССД аутоантитела: антицент-
ромерные (АЦА), антитопоизомеразные (АТА) или анти-8с!-70 и анти-
нуклеолярные анти-РНП, антитела к PM-Scl-полимеразе I, анти-
Th-антитела и др. Обращено внимание на наличие антинейтрофиль-
ных цитоплазматических антител (АНЦА) к миелопероксидазе у час-
ти больных с активной ССД, при быстро прогрессирующем гломеру-
лонефрите с почечной недостаточностью, при лечении D-пеницилл-
амином.
АЦА обнаруживаются у 25—50 % больных ССД, преимуществен-
но при лимитированном поражении кожи и хроническом течении, а
АТА (Scl-70) — при диффузном поражении кожи и быстро прогресси-
рующем течении ССД. Антитела к рибонуклеопротеину чаще встре-
чаются при подостром течении и перекрестных формах: так, для соче-
тания ССД с полимиозитом более характерны анти-PM-Scl, анти-Ul
RNP, U3 RNP-антитела.
Еще больший интерес и практическую значимость представляют
ориентировочные корреляции, установленные между специфическими
106
для ССД аутоантителами, генетическими маркерами и определенны-
ми клиническими формами ССД (табл. 10.1), требующие дальнейше-
го изучения и уточнения [8].
Таблица 10.1. Аутоантитела, генетические маркеры и клинические осо-
бенности ССД
Аутоантитела к антигенам HLA Клинические особенности
Антитопоизомеразные DR5 (DR11) 1. Диффузная ССД
к Scl-70 (топоизомера- DR3/DR52 2. Быстропрогрессиру-
за I) DQ7 ющее течение 3. Фиброз легких
Антицентромерные DR1.DR11, 1. Лимитированная
(центромеры) DQB1,DR4 ссд 2. Медленно прогресси- рующее течение 3. Легочная гипертензия
Анти PM-Scl DR3/DR52 1. Overlap ССД ~~ поли- миозит (дерматомио- зит) 2. Подострое течение 3. Поражение мышц
Благодаря современным исследованиям расшифрованы и некото-
рые генетические механизмы предрасположенности к заболеванию,
что ранее аргументировалось наличием семейных случаев ССД и близ-
ких заболеваний, увеличением иммунных и других сдвигов у здоро-
вых родственников пробандов. Подтверждено наличие хромосомной
нестабильности у больных ССД. Выявлено сочетание определен-
ных антигенов и аллелей системы гистосовместимости (HLA) с ССД:
HLA-A9, В8, В35, DR1, DR3, DR5, DR11, DR52, С4А и др., варьиру-
ющее в разных популяциях.
При исследовании русской популяции на материале наблюдавших-
ся нами 60 больных ССД выявлены достоверное повышение встреча-
емости HLA-A10, В8 и DR5 и снижение В27-антигенов. Ассоциация с
антигеном А10 была выше при хроническом течении и при пораже-
нии легких, а с DR5 — при остром и подостром течении (по сравне-
нию с хроническим); ассоциация с В8 отмечена у больных с более
ранним началом заболевания.
Выявленные клинико-иммуногенетические ассоциации позволяют
предполагать, что носительство определенных HLA-антигенов пред-
располагает к продукции различных свойственных ССД аутоантител
и формированию соответствующих клинических синдромов и субти-
пов заболевания.
107
Возвращаясь к проблемам фиброза, подчеркнем, что наличие
HLA DR5, DR3 аллелей и антитопоизомеразных антител (Scl-70) кор-
релирует с быстро прогрессирующим фиброзом, который является
прерогативой острого («злокачественного») течения ССД: диффуз-
ный фиброз кожи и внутренних органов развивается в первые 2 года
болезни.
Другие варианты течения ССД — подострое и хроническое —
имеют свои характерные клинические, иммунологические и генетичес-
кие особенности.
Основные варианты течения были выделены нами ранее на осно-
вании клинико-морфологических исследований и изучения эволюции
ССД. В настоящее время в связи с выявлением клинико-иммуногене-
тических корреляций считаем возможным предложить концепцию ге-
нетически обусловленных альтернативных вариантов течения: с пре-
обладанием фиброза — при остром быстропрогрессирующем течении,
иммунного воспаления — при подостром и сосудистой патологии —
при хроническом течении ССД. Выделенные варианты течения уже
сейчас являются основой дифференцированной патогенетической те-
рапии заболевания [1]. В будущем специфические иммунологические
тесты и HLA-типирование, по-видимому, явятся основой доклиничес-
кой диагностики и прогнозирования. Это принципиально важно для
больных ССД, особенно при быстропрогрессирующем течении и ге-
нерализованном фиброзе, где максимально ранняя диагностика и ак-
тивная («агрессивная») терапия с использованием «болезньмодифици-
рующих» средств может предотвратить неблагоприятный исход забо-
левания.
Сегодня мы отмечаем значительный прогресс в диагностике и ле-
чении заболевания: современная и своевременная патогенетическая
терапия позволяет корригировать, а иногда и предотвратить разви-
тие тяжелых висцеральных поражений, что наиболее очевидно на
примере истинной склеродермической почки.
В настоящей лекции я не буду останавливаться на комплексном
лечении ССД, результаты которого неоднократно публиковались и
широко используются во врачебной практике. Подчеркну лишь не-
которые особенности современной терапии. Так, наряду с D-пеницилл-
амином и другой антифиброзной терапией при активной ССД (быст-
рое прогрессирование, наличие клинических и лабораторных призна-
ков активности) целесообразно использование циклофосфамида и
других иммунодепрессантов. Среди сосудистых препаратов, кроме
уже зарекомендовавших себя Са-блокаторов и ингибиторов ангиотен-
зинпревращающего фермента, следует отметить как наиболее эффек-
тивный при тяжелых ишемических нарушениях вазапростан, который
обладает многогранным активным действием на разные звенья пато-
логического процесса, на периферическую и, очевидно, висцеральную
циркуляцию. В перспективе, несомненно, будут использованы новые
биологические агенты и средства лечения, апробируемые пока в экс-
перименте.
108
Несмотря на значительные успехи, достигнутые при лечении ССД,
нельзя обойти молчанием тенденцию роста заболеваний склеродерми-
ческой группы. Тревожные экологические проблемы века оказались
в тесном соприкосновении с патологией соединительной ткани чело-
века и проблемой фиброза, что позволяет выделить «экологический»
этап в развитии учения о склеродермии. Обращено внимание на появ-
ление различных вариантов индуцированной склеродермии и близких
состояний, обусловленных воздействием следующих продуктов: хлор-
винила, органических растворителей, блеомицина, силиконовых ма-
териалов, «токсического масла» и др. Реальность этих форм, их рас-
пространение в различных странах мира и необходимость разработ-
ки превентивных мер обусловили включение индуцированной скле-
родермии в современные международные и отечественную классифи-
кации, куда входят также выделенные ранее диффузный эозинофиль-
ный фасциит, склеродерма Бушке, мультифокальный фиброз, паранео-
пластическая склеродермия.
Общей доминантой заболеваний склеродермической группы яв-
ляется развитие локального или генерализованного фиброза, не-
редко с вовлечением в патологический процесс жизненно важных ор-
ганов.
К сожалению, приходится констатировать, что диагностика забо-
леваний склеродермической группы явно недостаточна. Необходимы
дальнейшее изучение заболеваний этого круга с клинических позиций,
их ранней и дифференциальной диагностики, разработка диагности-
ческих критериев, методов лечения и профилактики.
Вместе с тем следует подчеркнуть, что эта группа заболеваний
открывает новую страницу в изучении фиброза, соединительноткан-
ной и общей патологии.
Представляет, например, интерес, что не только распространен-
ность, но и локализация фиброза, его аффинитет в отношении раз-
ных органов и тканей при этих заболеваниях различен и в значитель-
ной степени определяет клинические особенности и своеобразие но-
зологий. Так, при диффузном эозинофильном фасциите (ДЭФ) инфиль-
тративно-фиброзные изменения локализуются преимущественно в
фасциях и подлежащих тканях, что клинически проявляется глубо-
кой индурацией в области предплечий и голеней, а для склеродермы
Бушке характерно индуративное поражение тканей шеи и лица, вер-
хнего отдела грудной клетки, плечевого пояса с преобладанием па-
тологических изменений в подкожной клетчатке. При мультифокаль-
ном фиброзе в патологический процесс вовлекаются серозные обо-
лочки, ткани средостения, ретроперитонеальной области и др.; при
склеродермическом паранеопластическом синдроме нередко наблю-
дается развитие фиброза периартикулярных тканей; при химичес-
ки индуцированной склеродермии преобладает поражение кистей и
легких.
Заслуживает внимания и тот факт, что развитию ДЭФ нередко
предшествует необычная или чрезмерная физическая нагрузка, скле-
109
родерме Бушке — инфекция верхних дыхательных путей, а зонами
первого контакта с «химией» при индуцированной склеродермии яв-
ляются кожа кистей и органы дыхания.
Можно думать о своеобразном микротравматизме и неспецифичес-
кой локальной стимуляции воспалительно-фиброзных изменений через
взаимодействие активированных лимфоцитов, эндотелия, фибробла-
стов, тучных клеток и продуцируемых ими медиаторов. В этом слу-
чае клиническая гетерогенность и преимущественная топология фиб-
роза могут быть связаны (в большей или меньшей степени) с триггер-
ными механизмами развития отдельных клинических форм склеродер-
мической группы болезней.
Другие «экологические» факторы фиброза — алиментарные и ме-
дикаментозные — иллюстрируют эпидемия «испанского токсическо-
го масляного синдрома», сравнительно недавно описанная «эозино-
фильная миалгия», частично — мультифокальный фиброз, где дока-
зана роль L-триптофансодержащих продуктов и добавок.
Следует также иметь в виду, что индуцированная склеродермия
представляет собой яркую модель взаимосвязи экзогенных и генети-
ческих факторов в формировании патологического процесса с избы-
точным фиброзообразованием, как это доказано, в частности, при
«хлорвиниловой» склеродермии [9], которая в свою очередь иллюст-
рирует вклад экогенетических патологических реакций в генез рев-
матических заболеваний.
Таким образом, склеродермическая группа болезней дает исклю-
чительные возможности исследования различной топологии фиброза,
роли триггерных агентов, взаимодействия внешнесредовых и эндоген-
ных факторов, вклада генетической предрасположенности в развитие
патологии, что может быть основой профилактики и разработки этио-
тропных подходов к лечению в будущем.
В заключение разрешите кратко остановиться на основных итогах
и перспективах развития учения о склеродермии: с чем мы идем в XXI
век?
К концу XX века можно констатировать:
1. Прогресс в изучении патогенеза системной склеродермии.
2. Успехи в диагностике и лечении ССД.
3. Рост заболеваний склеродермической группы (проблема эколо-
гии и фиброза).
В качестве перспектив выделим по крайней мере 5 важнейших
направлений.
1. Клиническое изучение заболеваний склеродермической группы:
ранняя и дифференциальная диагностика (собственно нозологий и
субтипов), разработка диагностических критериев и адекватных те-
рапевтических программ.
2. Изучение триггерных факторов и возможностей их элиминации
как основы этиотропных подходов к терапии заболеваний склеродер-
мической группы.
НО
3. Генетические исследования; выделение диагностических и про-
гностических HLA-маркеров, групп риска (основы профилактики,
доклинической диагностики, прогнозирования).
4. Дальнейшее изучение молекулярных основ фиброза, клегочно-
лигандных систем с выявлением новых точек приложения фармакоте-
рапии при ССД и близких состояниях.
5. Разработка новых биологических методов лечения («инноваци-
онная терапия»): моноклональные антитела, трансплантация аутоло-
гичных стволовых клеток и др.
Склеродермическая группа болезней в целом представляет собой
уникальную модель изучения механизмов фиброзообразования и дру-
гих вопросов фундаментальной и клинической ревматологии, которые
могут быть использованы в общей биологии и медицине.
СПИСОК ЛИТЕРАТУРЫ
1. Гусева Н.Г. Системная склеродермия и псевдосклеродермические синд-
ромы. — М.: Медицина, 1993. — 265 с.
2. Гусева Н.Г Клиника системной склеродермии: Автореф. дис.... канд. мед.
наук. — М., 1961. — 20 с.
3. Гареев Е.М. Коллагенозы. — М.: Медицина, 1965.
4. Гусева Н.Г 40 лет изучения системной склеродермии (по данным ин-
ститута Ревматологии РАМН)//Вестн. РАМН. — 1998. — № 12. — С. 27—
31.
5. Панасюк А.Ф. Патогенетическое значение нарушений метаболизма со-
единительной ткани при системной склеродермии: Автореф. дис. . .
д-ра биол. наук. — М., 1990.
6. Габриэлян Н.Д., Проказова НВ., Комлева А.В. и др. Фосфолипиды и гли-
кофосфолипиды культивируемых фибробластов кожи здоровых доно-
ров и больных системной склеродермией //Биохимия. — 1990. — Т. 55,
вып. 8. — С. 1402—1407.
7. Guseva N.G., Anikina N. К, Муllyla R. et al. Markers of collagen and basement
membrane metabolism in sera of patients with progressive systemic
sclerosis//!.Royal Coll. Physic. — London, 1995. — Vol. 29. — P. 119—130.
8. Black C.M. The aetiopathogenesis of systemic sclerosis//!.Royal Coll.
Physic. — London, 1995. — Vol. 29. — P. 119--130.
9. Black C.M., Pereira Me Whirler el al.HGvaeXic susceptibility to
scleroderma — like syndrome in symptomatic and asymptomatic workers
exposed to vinil chlorid//!.Rheum. - 1986. — Vol. 13. — P. 1059—1062.
Ill
Лекция 11
КРИТЕРИИ ДИАГНОЗА БОЛЕЗНИ
И СИНДРОМА ШЕГРЕНА
Канд. мед. наук В.И.Васильев, канд. мед. наук М. В. Симоно-
ва (Институт ревматологии РАМН), канд. мед. наук
Т.Н.Сафонова (Институт глазных болезней РАМН)
Болезнь Шегрена (БШ) — системное заболевание неизвестной эти-
ологии, характерной чертой которого является хронический аутоим-
мунный процесс в секретирующих эпителиальных железах с обязатель-
ным поражением слюнных и слезных желез.
Наряду с БШ (первичный синдром Шегрена в зарубежной литера-
туре) выделяют синдром Шегрена (вторичный СШ — в зарубежной
литературе), сопутствующий ревматоидному артриту (РА), диффузным
болезням соединительной ткани (ДБСТ), гепатобилиарным (хроничес-
кий активный гепатит, билиарный цирроз печени) и другим аутоим-
мунным заболеваниям.
Лимфоплазмоцитарная инфильтрация секретирующих эпителиаль-
ных желез является основным морфологическим признаком БШ. Рас-
пространение лимфоидной инфильтрации на другие органы и тка-
ни (мышцы, легкие, почки и т.д.) приводит к развитию системных
проявлений заболевания различной степени тяжести и нередкой
трансформации в злокачественные лимфопролиферативные заболе-
вания.
Проведенные в последние годы эпидемиологические исследования
позволили установить, что распространенность заболевания в общей
популяции составляет 0,1—0,77 % в целом и 2,7—4,8 % у людей стар-
ше 50 лет (табл. 11.1).
Частота развития СШ при различных аутоиммунных заболевани-
ях (рис. 11.1) колеблется в пределах 5—40 % при ДБСТ; 15—30 % —
ТаблицаП.1. РаспространенностьБШ(эпидемиологическиеисследования)
Государства Популяция Распространенность заболевания, %
Англия, Греция, Шве- ция, Шотландия > 50 лет 2,7-48
Китай Общая популяция 0,77
США, Канада » » —А 0,1
112
Рис. 11.1. Частота синдрома Шегрена при различных аутоиммунных за-
болеваниях (%).
ССД — системная склеродермия; СКВ — системная красная волчанка; ПМ —
полимиозит.
при хронических аутоиммунных артритах и тиреоидитах; 50—
100 % — при аутоиммунных гепатобилиарных заболеваниях. Среди
ревматологических больных с клиническими признаками поражения
секретирующих эпителиальных желез чаще всего встречаются РА в
сочетании с СШ и БШ (рис. 11.2).
Существенные различия в частоте встречаемости БШ и СШ у
больных, наблюдаемых в клиниках, а также при эпидемиологичес-
ких исследованиях связаны с тем, что при выявлении этих заболева-
ний используются различные диагностические критерии. Поэтому це-
лесообразно более подробно остановиться на критериях диагноза БШ
и СШ, применяемых в различных странах, и сравнить их с критери-
ями, используемыми в диагностике и дифференциальной диагности-
ке БШ и СШ в Институте ревматологии РАМН. Последние разра-
ботаны на основании обследования более чем 10 000 больных, на-
правленных в клинику с различными диагнозами поражений слюн-
ных и слезных желез; СШ и БШ диагностированы у 3000 больных в
течение 25 лет.
Когда этиология заболевания остается неизвестной, предваритель-
ные диагностические критерии представляют собой «согласие мнений»
и должны рассматриваться скорее как «легенда», чем научный факт.
При этом сторонники любых диагностических критериев будут нахо-
диться под влиянием работающих совместно с ними специалистов:
113
Рис. 11.2. Частота болезни Шегрена (БШ) и синдрома Шегрена (СШ) у
больных с клиническими признаками поражения слюнных и слезных же-
лез (по материалам ревматологических клиник, %).
РА — ревматоидный артрит; СЗСТ — смешанное заболевание соединительной
ткани; СКВ — системная красная волчанка; ССД — системная склеродермия;
ПМ — полимиозит; ХАГ — хронический активный гепатит; ПБЦ — первичный
билиарный цирроз печени.
ревматолога, стоматолога, офтальмолога, морфолога и иммунолога
[27]. Тем не менее диагностические критерии необходимы как прак-
тическим врачам, чтобы, выявляя рациональный комплекс симптомов
заболевания, оценивать прогноз и назначать адекватную терапию, так
и исследователям, чтобы правильно определять группу больных, у
которых проводится изучение этиологии и патогенеза данного забо-
левания.
В связи с этим ключевым вопросом является применение терминов
БШ и СШ: они должны либо применяться к ограниченной группе боль-
ных с аутоиммунной основой данной экзокринопатии, либо — к бо-
лее значительной группе больных, у которых имеется сходный симп-
томокомплекс (сухость рта и глаз) различного генеза.
История вопроса. J.Mikulicz [33] в 1888 г. описал больного со значитель-
ным увеличением слезных и всех групп слюнных (околоушных, подчелю-
стных, небных) желез без четких признаков снижения их функции. Не-
смотря на то что Микулич в 1892 г. подробно остановился на клиничес-
ких и патологических аспектах своего наблюдения, показав доброкаче-
ственность лимфоидной инфильтрации желез и четкие отличия от увели-
чения слюнных и слезных желез, возникающих при туберкулезе, лейкемии
114
или злокачественных лимфомах, более половины столетия термин «синд-
ром Микулича» использовали, чтобы описать различные патогенетичес-
кие состояния, включая туберкулез, саркоидоз, лимфомы и т.д.
В 1933 г. Н.Sjogren [37] описал офтальмологические проявления у 19
больных, связанные с отсутствием слезовыделения, у 13 из них имелся
хронический полиартрит. Он ввел термин «сухой кератоконъюнктивит»,
для того чтобы отделить это состояние от ксерофтальмии (недостаточность
витамина А).
История описания отдельных клинических признаков БШ и СШ и их
взаимосвязей приведена ниже.
1. 1882, Leber ввел термин «нитчатый кератит».
2. 1888, J.Mikulicz описал увеличение слюнных и слезных желез вслед-
ствие доброкачественной лимфоплазмоцитарной инфильтрации.
3. 1888, W.В.Hadden ввел термин «ксеростомия».
4. 1889, Е.Fischer отметил связь кератита с артритом.
5. 1919, A.Fuchs указал на связь сухости рта (ксеростомия) с увеличе-
нием околоушных слюнных желез.
6. 1924, L.Schbninger установил связь нитчатого кератита с гипофун-
кцией слезных желез вследствие их лимфоидной инфильтрации.
7. 1925, Н.Gougerot указал на тесную взаимосвязь между сухостью рта
и глаз и сухостью носа, глотки, гортани, влагалища, часто с гипофункци-
ей щитовидной железы и яичников.
8. 1927, M.Houwer установил четкую взаимосвязь нитчатого кератита
с хроническим артритом.
9. 1930, W.S.Duke-Elder ввел термин «сухой кератит».
10. 1933, Н.Sjogren ввел термин «сухой кератоконъюнктивит».
Термин «синдром Шегрена», однако, не использовался широко до 1953 г.
В это время W.S.Morgan и В.Castleman [34] установили, что гистологичес-
кие различия между синдромом Шегрена и описанным ранее синдромом
Микулича отсутствуют. Анализируя результаты обследования более чем
10 000 больных, направленных в Институт ревматологии с различными по-
ражениями слюнных и слезных желез, можно согласиться с авторами этой
статьи о нецелесообразности использования термина «синдром Микули-
ча». Однако, по нашему мнению, болезнь Микулича остается самостоятель-
ной нозологической единицей со своеобразными клиническими и гисто-
логическими проявлениями без признаков аутоиммунного поражения сек-
ретирующих эпителиальных желез [17]. В отличие от БШ болезнь Мику-
лича является редкостью (всего 8 больных в нашей клинике за 25 лет), не
имеет четких признаков аутоиммунного заболевания (отсутствуют какие-
либо аутоантитела в крови). Сиалографическое исследование при болезни
Микулича выявляет интерстициальный сиалоаденит в отличие от парен-
химатозного сиаладенита при БШ, поэтому более обосновано рассмат-
ривать болезнь Микулича как самостоятельное заболевание неизвестной
этиологии [11].
В 1965 г. К.J.Bloch и соавт. [22] предложили диагностировать СШ по
наличию по крайней мере 2 из 3 признаков: сухой кератоконъюнктивит,
ксеростомия и РА (или ДБСТ). Эти авторы впервые обратили внимание
на группу больных, имевших признаки поражения секретирующих эпи-
телиальных желез и различные аутоиммунные нарушения без четких кри-
териев какого-либо известного в тот период аутоиммунного заболевания.
В течение последующих лет стало очевидным, что необходимо отделить
БШ (первичный СШ) от синдрома Шегрена (вторичный СШ). БШ харак-
теризуется своеобразными системными проявлениями, генетической пред-
расположенностью и спектром различных аутоантител (1, 2, 4, 29, 40), а
также значительной частотой развития злокачественной лимфопролифе-
рации. Ниже мы приводим историю изменений в терминологии, связан-
ную с БШ и СШ.
1. 1914, H.Thursfield. Болезнь Микулича.
2. 1926, H.Gougerot. Синдром офтальмориностоматоксероза.
3. 1927, A.J.Schaffer, A.W.Jacobsen. Синдром и болезнь Микулича.
4. 1933—1936, Mikulicz—Sjogren-синдром.
5. 1933—1936, Gougerot—Houwez—Sjogren-синдром.
6. 1936, S. von Grosz. Синдром Шегрена.
7. 1940, H.Sjogren. Атрофическая дакриосиалоаденопатия.
8. 1965, K.J.Bloch и соавт. Сухой синдром. Синдром Шегрена.
9. 1979, V.Strand, N.Talal. Аутоиммунная экзокринопатия. Синдрсм
Шегрена.
10. 1979, H.M.Moutsopoulos и соавт. Первичный сухой синдром. Вто-
ричный сухой синдром.
11. 1980, В.И.Васильев; V.Nasonova, V.Vasiljev. Болезнь Шегрена. Синд-
ром Шегрена.
12. 1981, R.Monthorpe и соавт. Первичный синдром Шегрена. Вторич-
ный синдром Шегрена.
Диагностика офтальмологических проявлений синдрома и болез-
ни Шегрена. Постоянным клиническим признаком поражения слезных
желез при БШ является сухой кератоконъюнктивит (СКК), обуслов-
ленный снижением выработки слезной жидкости. Степень выраженно-
сти СКК находится в прямой зависимости от интенсивности пораже-
ния слезных желез и нарушения их функций.
В 1900 г. G.Koster предложил полоски фильтровальной бумажки
для изучения секреции слезных желез. В 1903 г. О.Schirmer стандар-
тизировал метод измерения секреции слезных желез с помощью поло-
сок плотной фильтровальной бумаги (ширина 5 мм и длина 35 мм),
закладывающихся с двух сторон в область конъюнктивального меш-
ка. Он считал нормальным увлажнение полосок, достигающее > 15 мм
в течение 5 мин (тест Ширмера-I), а также модифицировал метод,
используя для стимуляции базальной секреции слезных желез вдыха-
ние нашатырного спирта (стимулированный тест Ширмера-П). Шир-
мер считал обязательным использование стимулированного теста у па-
циентов с увлажнением полосок, не достигающим 15 мм при исполь-
зовании первого варианта теста [38].
В дальнейшем многие исследователи делали попытки модифици-
ровать тест Ширмера; наиболее удачная модификация предложена
Ю.В.Юдиной (1975); взвешивание полосок до смачивания, через
5 мин после смачивания и через 5 мин после стимуляции нашатыр-
ным спиртом, что позволяет более точно определить количество ос-
новной, базальной и общей секреции слезных желез. Эта методика,
однако, трудоемка, поэтому в диагностических целях она не полу-
чила широкого применения, но может быть использована в научных
целях.
116
В настоящее время тест Ширмера (I или II) используется во всех
предлагаемых критериях (стандартизированные коммерческие полос-
ки шириной 4 мм, длиной 50 мм).
В 1930 г. Н.Sjogren, экспериментируя с различными окрашиваю-
щими материалами, пришел к выводу о том, что бенгальский розо-
вый и флюоресцеин являются лучшими красящими веществами для ди-
агностики сухого кератоконъюнктивита. Использование 1 % раство-
ра бенгальского розового и флюоресцеина с последующей био микрос-
копией позволяет оценить степень дистрофии эпителия конъюнктивы
и роговицы.
В дальнейшем, в 1949 г. S.Holm [38] и в 1969 г. О.Р. van Bijsterveld
[21], разработали полуколичественные методы оценки окрашивания
эпителия конъюнктивы и роговицы, использующиеся для диагности-
ки СКК практически во всех критериях. Как правило, существует
четкая корреляция между степенью снижения лакримации и тяжестью
дистрофических изменений, обнаруживаемых при окраске бенгальс-
ким розовым и флюоресцеином.
В копенгагенских критериях для диагностики СКК также исполь-
зуется хорошо зарекомендовавший себя метод определения стабиль-
ности прекорнеального слоя (по скорости образования «сухих пятен»
на поверхности роговицы) [40].
Дополнительные тесты для диагностики СКК, разработанные в два
последних десятилетия, включают анализ состава слезной жидкости
(мукосахариды, концентрация лактоферрина, лизоцима, преальбуми-
на, альбумина, иммуноглобулинов, цитокинов) и морфологические
исследования (импрессионно-цитологические отпечатки конъюнктивы,
хирургическая биопсия конъюнктивы, слезных желез и добавочных
слезных желез), широко используемые в диагностике и дифференци-
альной диагностике СКК при БШ и СШ, но пока не включенные в
какие-либо диагностические критерии [13, 31,40].
Таким образом, наличие СКК является обязательным критерием
при постановке диагноза БШ. Клиническими проявлениями СКК мо-
гут быть сухой хронический конъюнктивит, блефароконъюнктивит,
эпителиальная дистрофия роговицы 3 (разделяемая на 3 степени вы-
раженности), нитчатый или буллезно-нитчатый кератит, ксероз рого-
вой оболочки [19].
Клинико-морфологические исследования глаза включают функци-
ональное исследование слезной железы (тест Ширмера I или II), опре-
деление стабильности прекорнеального слоя (по скорости образова-
ния «сухих пятен» на поверхности роговицы), прижизненное окраши-
вание эпителия роговицы и конъюнктивы бенгальским розовым и
флюоресцеином.
Проведение этих методик обследования возможно в поликлиничес-
ких условиях и позволяет с большой долей вероятности поставить
диагноз СКК при БШ и СШ [7, 9]. Дополнительными диагностичес-
кими методами являются проведение импрессионно-цитологического
исследования и исследование состава слезной жидкости. При помо-
117
щи этих методик удается провести дифференциальную диагностику
между СКК при БШ и СШ и СКК при других состояниях [13, 31].
Диагностика стоматологических проявлений синдрома и болезни
Шегрена. Поражение слюнных желез является постоянным признаком
БШ. Не останавливаясь на общих методах обследования при заболе-
ваниях слюнных желез, которые хорошо освещены в литературе [11,
12, 18], обсудим специальные методы исследования, результаты ко-
торых используются в критериях диагностики БШ и СШ.
В настоящее время наиболее простым, общепринятым исследова-
нием секреторной функции слюнных желез является сиалометрия. Боль-
шинство авторов используют метод раздельного получения секрета
больших слюнных желез, применяя капсулы Лешли, Лешли—Ющен-
ко—Красногорского, Лешли—Красногорского—Сазама или специ-
альные канюли [11, 15, 18, 22]. Применяется как стимулированная
(5 % аскорбиновая кислота, 1 % раствор пилокарпина гидрохлорида,
лимонный сок, спирт 40 % этиловый), так и нестимулированная сиа-
лометрия. Сбор слюны с помощью ватных тампонов или жевательной
резинки в настоящее время практически не используется. В Институ-
те ревматологии РАМН сиалометрия проводится с помощью капсулы
Лешли—Красногорского в модификации Сазама. Слюна собирается
в градуированные пробирки в течение 5 мин при периодическом сти-
мулировании раствором аскорбиновой кислоты: нормой считается
более 2,5 мл секрета, первая степень снижения секреции устанавли-
вается в случае получения 2,5—2 мл, вторая степень — 2—0,6 мл,
третья степень — 0,5—0 мл (учитывается воспалительный осадок в
слюне). Визуально определяется, имеется ли (в виде «озерца») или нет
(в том числе после стимуляции) секреция из поднижнечелюстных слюн-
ных желез, а также подсчитывается количество функционирующих
малых слюнных желез слизистой оболочки нижней губы на площади
2 см2 (норма 20). Хорошо освещены в отечественной [11, 13, 18] и
зарубежной литературе [32, 38, 40] и другие, более сложные методы
диагностики функционального состояния слюнных желез: радиосиа-
лография, сцинтиграфия и радиометрическое исследование выделения
слюны. Некоторые исследователи наряду с сиалометрией включают
в диагностические критерии поражения слюнных желез при БШ и СШ
данные сцинтиграфии [32].
В 1925 г. T.Barsony [20] предложил метод рентгеноконтрастиро-
вания слюнных желез, который после множества модификаций [36,38]
стал широко использоваться для изучения функциональных и морфо-
логических изменений больших слюнных желез [11]. Сиалография с
масляными контрастными веществами (йодлипол, липйодол, йодипин
и др.), как показано многочисленными зарубежными [22, 35, 38] и
отечественными [11, 14, 15, 16, 39] исследователями, является наибо-
лее ценным методом диагностики поражения слюнных желез при БШ
и СШ. Выявленные с помощью сиалограмм нарушения равномернос-
ти заполнения паренхимы железы в виде точечных, круглых и кавер-
нозных ателектазов, разрушение протоковой системы и изменения
118
Рис. 11.3. Схематическое изображение сиалограмм околоушной железы,
а — хронический паренхиматозный паротит; б — хронический интерстициаль-
ный паротит; в — хронический сиалодохит.
Стадии: 1 — начальная; 2 — клинически выраженная; 3 — поздняя.
главного протока в больших слюнных железах имеют большое зна-
чение в диагностике заболевания, хотя и не являются абсолютно спе-
цифичными [11]. Схематическое изображение сиалограмм околоуш-
ной слюнной железы при основных различных патологических состо-
яниях приведено на рис. 11.3 [11]. Особое внимание обращается на
нечеткость заполнения протоков железы и контуры полостей — при-
знак проницаемости ткани железы для йодлипола. Этот признак счи-
тается наиболее патогномоничным для сиалоаденита при БШ, в мень-
шей степени — СШ в отличие от сиалоаденита, протекающего как
самостоятельное заболевание [15]. Паренхиматозный сиалоаденит с
полостями диаметром > 1 мл является диагностическим признаком
поражения слюнных желез при БШ и СШ. Сиалограмма позволяет
определить стадии процесса, проводить динамическое наблюдение и
контролировать эффективность терапии. Сиалография в Институте
ревматологии РАМН проводится всем больным с поражением слюн-
ных желез, так как данный метод показал себя наиболее информатив-
ным. Учитывая системность поражения слюнных желез при БШ и СШ,
чаще в околоушную, реже подчелюстную слюнную железу вводится
1 мл подогретого до температуры тела йодолипола (лишь при значи-
тельном расширении протоков — сиалодохите — возможно введение
большего количества контрастного вещества). Сиалограммы оцени-
ваются по состоянию паренхимы — наличию в ней полостей различ-
ного размера, состоянию протоков железы малого калибра, внутри-
железистой части околоушного протока, а также по состоянию вне-
железистой части протока (при этом необходимо учитывать наличие
дополнительных долек железы) [15].
119
В 1966 г. H.I.Caiman, S.Reifman [23], P.S.Cifarelli и соавт. [24] для
подтверждения диагноза СШ впервые использовали биопсию малых
слюнных желез нижней губы. В 1968 г. D.M.Chisholm и соавт. [25]
обратили внимание на очаговые сиалоадениты в биоптатах малых
слюнных желез у больных БШ и СШ и ввели полуколичественную
оценку фокусов инфильтрации (фокус лимфоидной инфильтрации —
не менее 50 лимфоретикулярных клеток в 4 мм2), так как лимфоидная
инфильтрация меньшей интенсивности встречается и при отсутствии
БШ и СШ. Многими исследователями было показано, что отдельные
фокусы лимфоидной инфильтрации (1+ или 2+) в биоптатах слюнных
желез у больных различными аутоиммунными заболеваниями могут
встречаться при отсутствии клинических признаков СШ, а также
выявляться у лиц без четких признаков аутоиммунного заболевания
[31,40]. Это привело к разработке полуколичественных методов оцен-
ки фокусов лимфоидной инфильтрации, предложенных различными
исследователями: в 1974 г. T.M.Tarpley и соавт., J.S.Greenspan и
соавт., T.E.Daniels и соавт. [26] настаивали на обязательном исполь-
зовании биопсии малых слюнных желез для подтверждения ксеросто-
мии при БШ и СШ. Использование биопсии малых слюнных желез как
основного критерия для диагностики их поражения привело в конце
70-х годов к гипердиагностике СШ при РА, ДБСТ и других аутоим-
мунных заболеваниях, что послужило поводом к пересмотру тех кри-
териев, в которых за основу был взят морфологический признак [30,
32].
В начале 70-х годов мы, приступив к изучению различных аспек-
тов СШ, взяли за основу критерии, предложенные в 1965 г. R.J.Bloch
и соавт.: 1) сухой кератоконъюнктивит; 2) ксеростомия; 3) РА или
другие ДБСТ. Такой критерий, как ксеростомия, предложенный дан-
ными авторами, требовал более четкой расшифровки, так как сухость
рта наблюдается при различных состояниях и у здоровых лиц отмеча-
ются значительные вариации в функции слюнных желез [26, 40].
В отечественные критерии БШ и СШ было введено понятие парен-
химатозного сиалоаденита, который диагностировался с помощью си-
алографии наряду с функциональным исследованием секреции около-
ушных слюнных желез методом стимулированной сиалометрии [13,
15].
Изучение большого количества больных с поражением слюнных и
слезных желез показало, что для диагностики БШ и СШ целесообраз-
но учитывать следующий симптомокомплекс клинико-лабораторных
проявлений:
— артралгии или значительно реже — артриты мелких суставов
кистей;
— рецидивирующий сиалоаденит или постепенное увеличение
слюнных желез;
— сухость слизистой оболочки полости рта (носоглотки) и быст-
рое развитие множественного, преимущественно пришеечного
кариеса;
120
— рецидивирующий хронический кератоконъюнктивит;
— синдром Рейно, стойкое увеличение СОЭ (> 30 мм/ч);
— гипергаммаглобулинемия (> 20 относительных %);
— ревматоидный фактор (латекс-тест, титры > 1/80.
Хотя ни один из этих признаков не является строго специфичным
для БШ и СШ, наличие четырех и более из указанных выше призна-
ков позволяет в 80—90 % случаев заподозрить и в дальнейшем под-
твердить с помсщью специальных методов диагноз БШ и СШ [3,7,9,
10].
Сопоставление сиалографических изменений и биоптатов слюнных
желез при обследовании большого количества больных БШ и СШ по-
казало, что имеется корреляция паренхиматозного сиалоаденита с
очагово-диффузными или диффузными инфильтратами [15]. Пер иду к-
тальный инфильтрат считается очаговым при наличии не менее 50
лимфоидных клеток; очагово-диффузным — если рядом с долькой,
частично замещенной лимфоидной тканью, располагается относитель-
но сохранная долька; диффузным — если рядом с долькой, почти пол-
ностью замещенной на инфильтрат, располагается долька, поражен-
ная поствоспалительным склерозом или жировой тканью, т.е. при
наличии более двух фокусов лимфоидной инфильтрации по шкале
1974 г. Ж.С.Гриншпана и др. [14, 15, 16].
При невозможности проведения сиалографии диагноз БШ и СШ
должен подтверждаться обнаружением перидуктальной очагово-диф-
фузной или диффузной инфильтрации в биоптатах малых слюнных
желез нижней губы.
Критерии диагноза БШ и СШ. В течение последних трех десяти-
летий было предложено несколько различных вариантов диагности-
ческих критериев (представлены ниже):
Бостон, Сан-Франциско (Medicine 44:187, 1965; Sjogren’s syndrome,
ed. L.H.Smith, 1971; Oral Surg 39: 875, 1975; Sjogren’s syndrome, ed.
S.S.Kassan, 1987).
Копенгаген (Allegry 36:139.1981; Scand. J. Rheumatol, Suppl. 61:29,
1986).
Япония, Токио (Sjogren’s disease Research Committee, Japan, 1977;
Scand. J. Rheumatol, Suppl. 61:26, 1986).
Греция (Scand. J. Rheumatol., 61:22,1986).
Сан-Диего (Scand. J. Rheumatol., Suppl. 61:28—30, 1986; Arthr.
Rheum., 29:577, 1986; Rheumatic disease clinic of North America,
20:2:391—407.1994).
Москва (ВДНХ СССР, 1988. Методические рекомендации М3
СССР, 1989; IV International Symposium on Sjogren’s syndrome, 86,
1993).
Европейские критерии (Arthr. Rheum., 36:340, 1993).
В основе всех предложенных диагностических критериев, за ис-
ключением критериев Европейской исследовательской группы, лежат
121
признаки, предложенные в 1965 г. K.Bloch и соавт., в 1968 г. —
T.E.Feltkamp и A.L.van Rossum, которые впервые ввели понятия «ве-
роятного» и «определенного» СШ. В первой монографии, посвящен-
ной различным аспектам СШ, в 1971 г. M.A.Shearn утверждал, что
«определенный» СШ может быть диагностирован при наличии: а)
объективных признаков СКК; б) характерных морфологических из-
менений в биоптатах слюнных и слезных желез, а «вероятный» СШ —
при наличии двух из следующих трех проявлений: 1) рецидивирую-
щее или хроническое, «идиопатическое» увеличение слюнных желез;
2) «необъяснимая» ксеростомия; 3) ДБСТ [38].
Проведенные после 70-х годов клинические, генетические, гисто-
логические и иммунологические исследования у больных с признака-
ми поражения секретирующих эпителиальных желез [2, 3, 4, 8, 29,40]
показали необходимость разработки самостоятельных критериев для
БШ (первичный СШ) и СШ (вторичный СШ). В табл. 11.2 даны наи-
более часто использующиеся в настоящее время в разных странах
критерии диагноза БШ и СШ.
Таблица 11.2. Наиболее часто используемые критерии болезни Шегрена
и синдрома Шегрена
Регион Сухой кератоконъюнктивит Поражение слюнных желез Лаборатор- ные приз- наки ауто- иммунного заболевания
Сан-Фран-
циско (1971
1979, 1987)
1. Тест Ширмера-1
< 5 мм/5 мин
2. Сниженное время
образования «сухих
пятен»
3. Характерное окра-
шивание эпителия
Очаговый сиалоаденит
в адекватной биопсии
слюнных желез
(> 1 фокуса/4 мм2)
конъюнктивы и рого-
вицы бенгальским ро-
зовым____________________________________
Вторичный СШ: РА или другие диффузные со-
единительнотканные заболевания и один из двух
или оба критерия диагноза первичного СШ
Вероятный СШ: один из компонентов первич-
ного СШ, описанных выше, и наличие любого
из следующих признаков: легочные лимфоци-
тарные интерстициальные инфильтраты, интер-
стициальный нефрит или канальцевый ацидоз,
гипергаммаглобулинемическая пурпура, васку-
лит, полимиопатия, нейропатия, хроническое
заболевания печени, гипергаммаглобулинемия
(поликлональная или моноклональная); крио-
глобулинемия, наличие аутоантител (РФ, А НФ,
Ro/La)
Не включа-
ются
122
Продолжение
Регион Сухой кератоконъюнктивит Поражение слюнных желез Лаборатор- ные приз- наки ауто- иммунного заболевания
Копенгаген Два из трех: Два из трех:
(1981, 1986) 1) тест Ширмера-1 < 10 мм/5 мин; 2) время образования «сухих пятен» < 10 с; 3) van Bijsterveld score (>4, шкала 0—9) 1) нестимулированная сиалометрия < 1,5/15 мин; 2) сцинтиграфия; 3) биопсия слюнных желез (> 1 фокуса лим- Не включа- фоплазмоцитарной ин- ются фильтрации)
Вторичный СШ: РА, ДБСТ и другие воспали-
тельные соединительнотканные заболевания и
один из первых двух критериев диагноза пер-
вичного СШ
Япония 1. Тест Ширмера-1
(1977,1986) < 10 мм/5 мин
2. Положительный тест
с бенгальским розовым
(++) или флюоресцеи-
новый тест (+)
1. Сиалография (полос-
ти > 1 мм)
2. Биопсия слюнных Невключа-
или слезных желез ются
(1 фокус или более мо-
нонуклеарно-клеточ-
ной инфильтрации)
Вероятный первичный СШ: СКК неизвестной
этиологии, сниженная саливация, рецидивирую-
щая или хроническая припухлость слюнных же-
лез. Исключения: РА, ДБСТ и другие аутоим-
мунные заболевания
Сан-Диего
(1986, 1994)
1. Снижение стимули-
рованной секреции
слюны
2. Биопсия малых
слюнных желез (оценка
4 долек; наличие в
среднем > 2 фокусов)
РФ > 1:320
АНФ > 1:320
Ro/La анти-
тела +
1. Тест Ширмера-1
< 9 мм/5 мин
2. Повышенное окра-
шивание конъюнктивы
и роговицы бенгаль-
ским розовым или
флюоресцеином_______
Вторичный СШ: характерные признаки или
симптомы СШ, описанные выше, а также РА,
ДБСТ или билиарный цирроз. Исключения: пред-
шествующая лимфома, СПИД или другие из-
вестные причины СКК или увеличения слюн-
ных желез
Далее представлены отечественные критерии, разработанные в
Институте ревматологии и Институте глазных болезней РАМН, а
также критерии Европейского эпидемиологического центра.
123
Критерии диагноза болезни Шегрена (Институт ревматологии РАМН)
I. Сухой конъюиктивит/кератоконъюнктивит:
1) снижение слезовыделения, стимулированный тест Ширмера:
< 10 мм/5 мин;
2) окрашивание эпителия конъюнктивы/роговицы бенгальским розо-
вым и флюоресцеином, +1 и более.
II. Паренхиматозный паротит:
1) обнаружение полостей > 1 мм при сиалографии или очагово-диф-
фузная, диффузная лимфоплазмоклеточная инфильтрация в биопта-
тах слюнных желез (4 оцениваемые железки);
2) снижение секреции слюны после стимуляции аскорбиновой кисло-
той < 2,5 мл/5 мин.
III. Лабораторные признаки системного аутоиммунного заболевания:
— обнаружение РФ (латекс-тест; титр > 1:80) или
— обнаружение АНФ (титр > 1:160) или
— обнаружение Ro/La антиядерных антител.
Диагноз определенной БШ может быть поставлен при наличии пер-
вых двух критериев (I, II) и не менее одного признака из III критерия при
исключении СКВ, ССД, полимиозита, РА, ЮРА и аутоиммунных гепато-
билиарных заболеваний.
Диагноз вероятной БШ может быть поставлен при наличии III крите-
рия и следующих признаков:
1) неравномерность заполнения паренхимы в виде облачков и отсут-
ствие контрастирования протоков IV, V порядка;
2) снижение слезовыделения при использовании стимулированного
теста Ширмера от 20 10 мм/5 мин;
3) окрашивание эпителия конъюнктивы и роговицы I степени бенгаль-
ским розовым или флюоресцеином;
4) незначительное увеличение слюнных желез или рецидивирующий
паротит.
Критерии диагноза болезни Шегрена
Европейского эпидемиологического центра
L Первичный СШ (если присутствуют по крайней мере 4 признака):
1) офтальмологические симптомы (при наличии по крайней мере од-
ного из следующих признаков):
а) ежедневное, устойчивое ощущение сухости глаз в течение 3 мес;
б) рецидивирующее ощущение «песка» или «соринки» в глазах;
в) использование заменителей слез более чем 3 раза в день.
2) стоматологические симптомы (при наличии по крайней мере одно-
го из следующих признаков):
а) ежедневное ощущение сухости рта в течение хотя бы 3 мес;
б) рецидивирующее ощущение припухлости слюнных желез у
взрослых;
в) употребление жидкостей для смачивания сухой пищи.
3) объективные признаки сухости глаз (при наличии по крайней мере
одного из следующих признаков):
а) положительный тест Ширмера-1;
б) положительный тест с окраской бенгальским розовым;
124
в) один или большее число фокусов лимфоидной инфильтрации при
биопсии слезной железы.
4) объективные признаки поражения слюнных желез (полученные в ре-
зультате применения по крайней мере одного из следующих мето-
дов):
а) сцинтиграфия слюнных желез;
б) сиалография околоушных желез;
в) нестимулированная общая сиалометрия < 1,5 мл за 5 мин).
5) лабораторные нарушения (при наличии по крайней мере одного из
следующих признаков):
а) обнаружение анти-SS-A- или анти-ЗБ-В-антител;
б) обнаружение АНФ;
в) обнаружение IgM-ревматоидного фактора.
Эти критерии демонстрируют спектр мнений авторов, отдающих
предпочтение либо преимущественно гистологической диагностике по-
ражений слюнных желез (Сан-Франциско, Сан-Диего, Греция) и обя-
зательному обнаружению серологических признаков аутоиммунного
заболевания (Сан-Диего, Москва), либо основывающихся главным
образом на результатах клинических, сцинтиграфических и сиалогра-
фических исследований (Копенгаген, Бостон, Япония, Москва, Евро-
пейские критерии) и не учитывающих признаки аутоиммунного пора-
жения (Копенгаген, Греция, Япония, Европейские критерии). На не-
скольких международных симпозиумах, посвященных синдрому Шег-
рена, согласия в отношении единого набора диагностических крите-
риев достигнуто не было (Дания, 1986 г.; США, 1988 г.; Япония,
1993 г.; Нидерланды, 1995 г.).
Рассмотрим основные различия отечественных и наиболее часто
используемых зарубежных диагностических критериев БШ и СШ.
Как видно из вышесказанного, признаки СКК диагностируются прак-
тически одинаково всеми исследователями. В основном используется
нестимулированный тест Ширмера-I с колебаниями увлажнения по-
лосок фильтровальной бумаги от 5—10 мм за 5 мин. Следует отме-
тить, что в 1903 г. Ширмер считал обязательным использование сти-
муляции слезных желез в тех случаях, когда нестимулированная лак-
римация составляет менее 15 мл [34]. Поэтому в копенгагенских и аме-
риканских (Сан-Франциско) критериях дополнительно используется
тест, фиксирующий время образования «сухих пятен», что позволяет
уменьшить количество диагностических ошибок при использовании
нестимулированного теста Ширмера.
Исследования Ю.В.Юдиной [19] показали, что стимулированный
тест Ширмера с определением основной, рефлекторной и общей сек-
реции позволяет снизить частоту ошибок при диагностике СКК, так
как именно рефлекторная секреция наиболее четко характеризует по-
ражение слезных желез при БШ и СШ.
По нашим наблюдениям, у половины направленных на консуль-
тацию в Институт ревматологии РАМН больных с диагнозом СКК,
установленным на основании нестимулированного теста Ширмера,
125
после стимуляции подтвердить этот диагноз не удалось: рефлектор-
ная секреция слезных желез оказалась нормальной. Анализ значимос-
ти различных методов для диагностики БШ и СШ показал более вы-
сокую специфичность стимулированного теста Ширмера-П, особен-
но в комбинации его с окрашиванием эпителия конъюнктивы и рого-
вицы бенгальским розовым и флюоресцеином (табл. 11.3). В связи с
этим два последних теста признаны обязательными для диагностики
СКК в отечественных критериях. В европейских критериях диагнос-
тика СКК основана на субъективных жалобах больных и использо-
вании по крайней мере одного из объективных тестов. Чувствитель-
ность такого подхода к диагностике сухости глаз резко возрастает,
однако специфичность значительно ниже по сравнению с диагности-
кой СКК в других критериях (Сан-Франциско, Копенгаген, Япония,
Сан-Диего, Москва). Действительно, 90 % больных, направленных с
предположительным диагнозом СКК и осмотренных нами в Институ-
те ревматологии, удовлетворяли европейским критериям (тест Шир-
мера-1 < 15 мм за 5 мин, жалобы на ощущение «инородного тела» в
глазах в течение 3 мес), однако только у 50 % из них удалось под-
твердить наличие СКК, характерного для БШ и СШ.
Диагностика поражения слюнных желез при БШ и СШ в критери-
ях (Сан-Франциско, Сан-Диего, Греция, Япония) основана на биопсии
Таблица 11.3. Специфичность и чувствительность различных методов, ис-
пользуемых в диагностике БШ (%)
Методы Чувствительность Специфичность
Тест Ширмера < 10/5 мин не- стимулированный 86 62
Тест Ширмера < 10/5 мин сти- мулированный 80 76
Окрашивание конъюнктивы/ро- говицы 1+ 54 94
Сочетание 2 указанных выше тестов 91 95
Сиалометрия < 2,5 мл/5 мин стимулированная 72 50
Сиалография полости < 1 мм 96 60
Сиалография полости > 1 мм 92 96
Биопсия: 1 фокус/4 мм2 99 54
Биопсия: очагово-диффузная инфильтрация 87 95
РФ, титр > 1:80 97 56
АНФ, титр > 1:160 72 68
Ro/La-антитела + 60 86
126
малых слюнных желез нижней губы. В 1975 г. Daniels и соавт. счита-
ли, что очаговые с и ало адениты являются специфичными для диагно-
стики стоматологических поражений при БШ и СШ, однако подчер-
кивали: очаговые сиалоадениты необходимо отличать от хроничес-
ких неспецифических сиалоаденитов (рассеянные мононуклеарные
инфильтраты, нейтрофильное воспаление в ответ на просачивание
слизи в окружающие ткани у пожилых лиц, инфильтраты, содержа-
щие амилоид и жир). Только в критериях Сан-Диего использован та-
кой гистологический признак, как наличие более чем 2 фокусов оча-
говой инфильтрации в четырех оцениваемых дольках (в остальных
критериях считается достаточным обнаружения 1 фокуса в 4 мм2 тка-
ни слюнных желез, что заметно снижает специфичность этого призна-
ка в диагностике заболевания) [30]. Исследования М.В.Симоновой
[13] показали, что с сиалографическими изменениями (полости > 1 мм
на сиалограмме) коррелирует перидуктальная очагово-диффузная/
диффузная инфильтрация слюнных желез, т.е. обнаружение более чем
2 фокусов в четырех оцениваемых дольках. Если же для диагностики
поражения слюнных желез используется всего лишь обнаружение 1 фо-
куса/4 мм2, чувствительность таких критериев достигает 99 %, но
специфичность очень низка (54 %). При обнаружении очагово-диффуз-
ной или диффузной инфильтрации специфичность диагностики повы-
шается до 95 % (см. табл. 11.3). Только в японских критериях в каче-
стве обязательных методов диагностики поражения слюнных желез при
БШ и СШ используются сиалография и биопсия, что значительно по-
вышает специфичность обнаруживаемых изменений. Таким образом,
ценность биопсии, а следовательно, точность диагноза БШ и СШ за-
висит от адекватности образца получаемой ткани и его оценки мор-
фологом. Важно, чтобы биопсия была получена через клинически
нормальную слизистую оболочку, так как местное воспаление может
приводить к ложноположительным результатам исследования. Должны
быть получены по крайней мере четыре слюнные железы, в которых
подсчитывается среднее число фокусов инфильтрации. Частая ошиб-
ка — оценка одной дольки [30]. Воспалительный неспецифический ин-
фильтрат как результат закупорки протоков слюнных желез сгущенной
слизью должен быть исключен из оценки биоптатов. Даже если каж-
дый специалист, занимающийся СШ, будет согласен с тем, что биопсия
малых слюнных желез является лучшим методом диагностики, его ши-
рокое использование маловероятно: многие ревматологи, офтальмоло-
ги, стоматологи будут колебаться из-за дискомфорта процедуры и по-
тенциального риска осложнений (онемение губы или присоединение
инфекции в месте биопсии). К сожалению, многие хирурги и хирурги-
стоматологи не знакомы с правильной техникой проведения биопсии
малых слюнных желез. Морфологи, не учитывая критерии адекватно-
сти образцов и унифицированные методы их оценки, не всегда могут
дать правильное заключение. В итоге на практике оказывается, что у
73 больных с морфологически диагностированными БШ и СШ эти ди-
агнозы подтвердить другими методами исследования не удается.
127
Суммируя вышеизложенное, следует сказать, что биопсия малых
слюнных желез может использоваться в практической медицине для
диагностики БШиСШ в сочетании с сиалографическим исследова-
нием.
Снижение секреции слюнных желез оценивается с помощью нести-
мулированной (копенгагенские и европейские критерии) и стимулиро-
ванной (Сан-Диего, Москва) сиалометрии. Как показали наши иссле-
дования, даже результаты стимулированной сиалометрии обладают
малой чувствительностью и специфичностью в диагностике (см. табл.
11.3); этот метод не может быть использован в качестве единственно-
го критерия стоматологических проявлений БШ и СШ. Поэтому он
не включен в критерии Сан-Франциско и японские критерии.
Исследовательские группы 26 центров из 12 стран разработали
предварительные европейские критерии для диагностики БШ и СШ.
Для этого использовался краткий опросник (он содержал 6 вопросов,
3 — в отношении сухости глаз и 3 — в отношении сухости слизистой
оболочки рта). В результате проведения мультивариантного статис-
тического анализа были идентифицированы наиболее важные для
диагностики БШ и СШ клинические и лабораторные признаки. Ев-
ропейские исследователи подчеркивают, что предложенные класси-
фикационные критерии являются предварительными. Показано, что
только меньшая часть больных, у которых СШ был диагностирован
на основании европейских критериев, удовлетворяли критериям, раз-
работанным в Сан-Франциско и Сан-Диего [30]. В связи с этим мож-
но полагать, что европейские критерии более подходят для эпидеми-
ологических исследований, а критерии Сан-Диего являются малочув-
ствительными и соответствуют развернутой стадии СШ.
Несколько аспектов европейских критериев требует комментари-
ев. Так, в европейских критериях для диагностики стоматологичес-
ких проявлений СШ считается достаточным наличия 1 фокуса лим-
фоидной инфильтрации слюнных желез, тогда как в критериях Сан-
Франциско и Сан-Диего учитывается среднее число фокусов — 2 или
более. Наши исследования показали (см. табл. 11.3), что при высо-
кой чувствительности первого диагностического подхода его специ-
фичность составляет не более 54 %, что может приводить к значитель-
ной гипердиагностике СШ. Только 65 % больных, отобранных с по-
мощью европейских критериев, удовлетворяли стоматологическим
критериям Сан-Франциско и Сан-Диего. Среди больных СШ, отобран-
ных на основании европейских критериев, частота обнаружения
Ro/La-антител методом ELISA составляла только 23,5 %. У больных
СШ, отобранных на основании критериев Сан-Диего, эти антитела
обнаруживались в 90 % случаев даже при использовании менее чув-
ствительного метода контриммуноэлектрофореза. Независимые иссле-
дования (г. Иоаннина, Греция) методом контриммуноэлектрофореза
100 сывороток больных, у которых БШ был диагностирован с помо-
щью московских критериев, показали, что Ro/La антиядерные анти-
тела имелись в 99 % проб.
128
Использование европейских критериев для последующих эпидеми-
ологических исследований, скорее всего, приведет к включению в
разряд СШ гетерогенной группы заболеваний, сопровождающихся
сухостью рта и глаз (лимфома, рассеянный склероз, деменция и т.д.).
В результате может искусственно завышаться истинная распростра-
ненность СШ и занижаться частота трансформации в лимфомы и раз-
вития демиелинизирующих нарушений. Различия в частоте развития
БШ и СШ, демиелинизирующих нарушений и лимфом в литературе
связываются именно с отсутствием общепризнанных критериев диаг-
ностики. Таким образом, существует реальная опасность того, что
значительные различия используемых диагностических подходов при-
ведут к сравнению «яблок» в одном медицинском центре с «апельси-
нами» — в другом. Так, например, при использовании копенгагенс-
ких критериев частота выявления СШ в европейских странах коле-
балась от 2,7 до 4,8 %, в то время как при использовании критериев
Сан-Диего частота СШ в Северной Америке не превышала 0,1 %.
В наших исследованиях у 100 % больных имеются признаки ауто-
иммунных заболеваний, а ксеростомия сохраняется, несмотря на дли-
тельный прием ГКС и цитотоксических иммунодепрессантов; у '/
больных наблюдается прогрессирование заболевания [5, 6]. Мы счи-
таем, что при наличии только ксеростомии и изменений, выявляемых
при морфологическом исследовании, диагностировать БШ или СШ
не следует.
Итак, критерии диагноза БШ и СШ остаются противоречивыми.
С одной стороны, используется строгий набор критериев (Москва,
Сан-Диего), который обязательно требует выявления признаков ауто-
иммунного процесса, связанного с лимфоплазмоцитарной инфильтра-
цией слюнных и слезных желез; с другой стороны, несколько групп
исследователей (Копенгаген, европейские) предлагают критерии, ос-
нованные преимущественно на клинической диагностике сухости глаз
и рта; биопсия слюнных желез и обнаружение аутоантител не обяза-
тельны. Европейская исследовательская группа считает, что крите-
рии Сан-Диего, а следовательно, и московские критерии идентифици-
руют только развернутую стадию заболевания и пропускают больных
с ранними признаками БШ и СШ. Действительно, московские крите-
рии позволяют диагностировать на ранних стадиях только «вероят-
ную» БШ, так как в этот период отсутствуют сиалографические при-
знаки, соответствующие отчетливому поражению слюнных желез при
данном заболевании (полости на сиалограмме < 1 мм). Такие боль-
ные требуют динамического наблюдения или четкого морфологичес-
кого подтверждения диагноза (очагово-диффузная или диффузная ин-
фильтрация в биоптатах слюнных желез).
Мы считаем, что пока не будет установлен патогенез БШ, необ-
ходимо использовать московские критерии или критерии, разработан-
ные в Сан-Диего. Больных с отсутствием признаков аутоиммунного
процесса мы предлагаем классифицировать как группу с «сухим син-
дромом», если имеется сочетание сухости рта и сухости глаз, а при
5—3592
129
изолированном существовании этих симптомов — соответственно как
группу с «изолированной ксеростомией» и «изолированным сухим
кератоконъюнктивитом» Больные с отсутствием признаков аутоим-
мунного поражения не должны лечиться ГКС и цитотоксическими
иммунодепрессантами. Врачам в таких случаях следует использовать
все методы диагностики для обнаружения других причин развития
ксеростомии и ксерофтальмии
СПИСОК ЛИТЕРАТУРЫ
1 Васильев В И, Симонова М В, Финогенова И А , Пробатова Н А Лим
фопролиферативные заболевания и синдром Шегрена // Тер арх
1978 - №9 — С 103—108
2 Васильев В И, Панасюк А Ф, Ефимова И В, Бойцова О Б Взаимодей-
ствие in vitro лимфоцит-фибробласг при болезни Шегрена // Тер арх —
1979 — №7 — С 82—88
3 Васильев В И Клинико-иммунологические нарушения при болезни Шег-
рена Автореф дис канд мед наук -— М , 1980 — 20 с
4 Васильев В И, Кадагидзе 3 I, Симонова МВ и др Варианты течения
болезни Шегрена//Тер арх — 1982 — №6 - С 41—49
5 Васильев В И, Соловьев С К, Симонова М В и др Пульс-терапия в ком-
плексном лечении тяжелых форм синдрома и болезни Шегрена//Тер
арх - 1986 — №7 — С 117—122
6 Васильев В И, Симонова М В, Сафонова Т Н, Мач Э С Сравнительная
оценка лечения болезни Шегрена противоревматическими препарата-
ми//Тер арх — 1988 — №4 — С 67—72
7 Васильев ВИ, Симонова М В, Сафонова Т Н и др Клиника, диагнос-
тика и лечение болезни Шегрена Метод рекомендации — М, 1989
8 Васильев В И, Симонова М В, Сафонова Т Н Болезнь Шегрена Рук-во
по внутренним болезням «Ревматические болезни» /Под ред В А На-
соновой, Н В Бунчука — М Медицина, 1997 — С 196 210
9 Васильев В И Болезнь ШегренаУ/Русский медицинский ж>рн — 1998 —
№ 18 — С 1206-1210
10 Васильев В И, Симонова М В, Сафонова Т Н, Веникова М С Д иа] нос-
тика и лечение болезни Шегрена М ВДНХ СССР 1988
11 Ромачева И Ф , Юдин Л А , Афанасьев В В, Морозов А Н Заболевания
и повреждения слюнных желез — М Медицина, 1987
12 Ромачева И Ф Воспалительные заболевания слюнных желез Авт ореф
дис д-ра мед наук — М , 1973 — 26 с
13 Сафонова ТН, Овчинников А Н, Федоров А Л, Полу нин Г С Сухой ке-
ра гоконъюнктивит при синдроме Шегрена, диагностическое значение
относительного белкового состава слезы/УВестн офтальмоч - 1998
№2 -С 40- 42
14 Симонова М В Синдром Сьегрена в клинике коллагенозов //Тез отчет-
ной сессии и конференции молодых ученых НИИ ревматизма АМН
СССР — М, 1977 - С 83—87
15 Симонова М В Болезнь и синдром Шегрена клиника, диагностика, ле-
чение поражения слюнных желез и полости рта Автореф дис канд
мед наук — М , 1982 -- 30 с
16 Симонова М В, Грицман Н Н, Веникова М С, Мылов Н М Сгоматоло-
130
17
18
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
37
5*
гические проявления болезни и синдрома Шегренa/f Гер арх — 1988
№4 -С 32—35
Симонова М В, Васильев В И, Корнилова Н Н, Сафонова Т Н, Киртава
3 3 Дифференциальная диат ностика болезни Микулича и болезни LLIei -
рена//Стоматология —1988 —№3 —С 71—73
Юдин Л А , Ромачева И Ф, Сверчкова Т С, Юдина Ю В, Саидкаримова
У А Функциональное состояние слюнных желез при синдроме Сьег
рена//Клин мед — 1973 — №9 —С 127—133
Юдина Ю В Клиника, диагноз, лечение поражения органа зрения при
синдроме Шегрена Автореф дис канд мед наук — М , 1975 —
20 с
Barsany Т Idiopathishe Stenongand-dilatation//Khn Wschr — 1925 —
Vol 4 — Р 2500
Van Bijsterveld О P Diagnostic tests in the sicca syndrome/ZArch
Opthalmol — 1969 — Vol 82 — P 10
Bloch R J, Buchanan W W, Wohl MJ et al Sjogren’s syndrome a clinical
pathological and serological study, of sixty-two cases //Medicine
(Baltimore) — 1965 — Vol 44 — P 187
Caiman HI, Reifman S Sjogren’s syndrome report of a case // Oral
Surg — 1966 - N 21 — P 158
Cifarelh PS, Bennet MJ, Zaino EC Sjogren’s syndrome a case re
port with an additional diagnostic aid // Arch intern Med — 1966 -
Vol 117 -P 429
Chisholm D M, Mason D К Labial salivary gland biopsy in Sjogren s
disease//} elm Path — 1968 —Vol 21 — P 656
Daniels Г E, Silverman S et al The oral component of Sjogren’s syndrome//
Oral Surg — 1975 — Vol 39 — P 875
Edworthy S M Classification criteria-what value they serve9//J Rheu-
matol — 1992 —N 19 — P 192
Feltkamp T E V International Symposium on Sjogren’s syndrome//Chn
Rheumat — 1995 —N 14 — Suppl 1
Fox R I, Howell F V, Bone R C, Michelson P Primary Sjogren Syndrome
Clinical and Immunopathologic Features/ZSemmars in Arthritis and
Rheumatism — 1984 - N 2 — 77 p
Fox R I, Saito I Criteria for diagnosis of Sjogren’s syndromeZ/Rheumatic
disease clinic of North America — 1994 — Vol 2 — P 391
Homma M, Sugai S, Tojo T, Miyasaka N, Akizuki M State of the art
Fourth International Symposium — Tokyo Publications, Amsterdam
1993
Manthorpe R, Prause JU I International Seminar on Sjogren’s syndrome//
Scand J Rheum (Sweden) — 1986 — Suppl 61
Mikulicz J Discassion at Verem fur wissenschaftliche Heilkunde zu
Konigsberg, Januar 23, 1888//Berl Klin Wehschr — 1888 — Bd 25
759 S
Morgan WS, Castleman BA Clinical of «Mikulicz, s Disease Chnico-
pathologic study//Amer J Path — 1953 —Vol 29 —P 471
Nasonova V, Vasilyew V Sjogren-syndrome und Sjogren-Krankheit in der
Reumatologie/ZZ gess mn Ved — 1981 — N 36 — 6 S
Rubin P, Holt J F Secretory sialography in diseases of the major salivary
glands/ZAmer J Roentgen — 1957 — Vol 77 — P 575
Sjogren H Zur Kenntnis der Keratoconjunctivitis secca (Keratitis fihformis
131
bei hypofunktion der Tranendrisen)//Acta Ophthal. — 1933. — Suppl. 2,
N 11. — 1 p.
38. Shearn M.A. Sjogren’s syndrome. Major problems in internal medicine. —
Philadelphia, London, Toronto: W.B.Saunders company, 1971.
39. Simonova M.V., Vasilyev V.I. Sialography in differential diagnosis of
Raynard's disease and Sjogren’s syndrome//Clin. Rheumatol. - 1995. —
Suppl. 1. — P. 56.
40. Talal N., Moutsopoulos H.M., Kassan S.S. Sjogren’s syndrome. Clinical and
Immunological Aspects. — Berlin, Heidelberg: Springer-Verlag, 1987.
41. Vasilyew V.I., Simonova M.V., Safonova T.N., Manuilova L.S. Criteria for
the diagnosis of Sjogren’s disease. V International Symposium on
Sjogren’s syndrome, Program-Abstracts. - Tokjo, 1993. — P. 86.
42. Vitali C„ Bombardiery S., Moutsopoulos H.M. et al. Preliminary criteria for
the classification of Sjogren’s syndrome/TArthr. Rheum. — 1993. —
Vol. 36. — P. 340.
Лекция 12
АНТИФОСФОЛИПИДНЫЙ СИНДРОМ:
15 ЛЕТ ИЗУЧЕНИЯ
Профессор З.С.Алекберова (Институт ревматологии
РАМН), член-корр. РАМН профессор Е.Л.Насонов (кафед-
ра ревматологии ФППО Московской медицинской академии
имени И. М. Сеченова), д-р мед. наук Т.М.Решетняк, канд.
мед. наук С.Г.Раденска (Институт ревматологии РАМН)
Симптомокомплекс, проявляющийся своеобразным спектром кли-
нических проявлений и изменением лабораторных показателей, полу-
чил название антифосфолипидного синдрома(АФС) [12]. Основные
признаки — венозные и/или артериальные тромбозы; различные
формы акушерской патологии (в первую очередь привычное невына-
шивание беременности — более 2 случаев потери плода); тромбоци-
топения. Различные неврологические, кожные, сердечно-сосудистые
и гематологические нарушения относятся к дополнительным
признакам. Серологические маркеры этого синдрома — ан-
тифосфолипидные антитела (аФЛ).
Основные типы аФЛ — волчаночный антикоагулянт (ВА) и анти-
тела к кардиолипину (аКЛ) — гетерогенная популяция аутоантител,
реагирующих с широким спектром антигенных детерминант [27]. Хотя
изучение аФЛ фактически началось еще в начале века с разработки
Вассерманом серологического метода диагностики сифилиса (реакция
Вассермана), интерес к этим антителам особенно возрос в последнее
132
десятилетие в связи с описанием АФС. Первое клиническое описание
синдрома (еще не названного АФС) было представлено E.A.Johansson
и соавт. в 1977 г. как «периферический сосудистый синдром, пере-
крещивающийся с СКВ», который проявлялся рецидивирующими ве-
нозными тромбозами, геморрагической капилляропатией с циркули-
рующим антикоагулянтом и ложноположительной реакцией Вассер-
мана. И наконец, 1983 г. — год описания этого синдрома [22], вна-
чале G.R.V.Hughes, а затем E.N.Harris под названием антикардио-
липиновый синдром, или синдром антител к аФЛ [21]. Однако поз-
же эти же авторы предложили более широкое название — АФС [22].
В 1994 г. на VI Международном симпозиуме по аКЛ было предло-
жено называть АФС синдромом Hughes, по имени английского рев-
матолога, впервые описавшего этот синдром и внесшего наиболь-
ший вклад в разработку проблемы [23]. В связи с обнаружением
кофакторов аФЛ дискутируется и другое название этого синдрома —
антифосфолипид-кофакторный или антифосфолипид-белковый синд-
ром.
В России изучение АФС началось с 1986 г. и с тех пор интенсив-
но разрабатывается большой группой ученых в нескольких медицин-
ских центрах [1, 7].
Клинико-лабораторные признаки антифосфолипидного синдрома |12, 22]
Основные Дополнительные Серологические маркеры
Рецидивирующие тром- бозы (артериальные и/или венозные Рецидивирующие поте- ри плода1 Тромбоцитопения2 Сетчатое ливедо Неврологические нару- шения (хорея, эпилеп- сия, мигрень) Асептические некрозы костей Неспецифический эн- докардит Хронические язвы го- лени Антикардиолипиновые антитела класса IgG Волчаночный антикоа- гулянт Антикардиолипиновые антитела класса IgM + волчаночный антикоа- гулянт
1 Более 2 случаев потери плода при обязательном исключении акушерской па-
тологии.
2 Количество тромбоцитов < 100 000 в 1 мм3 (должно быть зарегистрировано не
менее 2 раз).
Примечание. Для диагноза АФС необходимы наличие одного основного или
двух дополнительных признаков и выявление одного из серологических мар-
керов (они должны быть обнаружены по крайней мере дважды не менее чем в
течение 3 мес).
Вначале АФС был описан как вариант СКВ или волчаночноподоб-
ного синдрома. Однако очень скоро было установлено, что связь меж-
ду гиперпродукцией аФЛ и тромботическими нарушениями наблюда-
133
ется в отсутствие достоверных клинических и серологических призна-
ков СКВ или какого-либо другого ведущего заболевания. Для опре-
деления этой новой нозологической формы был предложен термин
«первичный антифосфолипидный синдром» [19]. В 1987 г. Л.А.Калаш-
никова и соавт. впервые установили, что синдром Снеддона (сочета-
ние цереброваскулярной патологии, сетчатого ливедо и лабильной
артериальной гипертонии) фактически является вариантом первично-
го АФС [5].
В настоящее время известно, что клинические проявления АФС
разнообразны и зависят от системы органов, вовлекаемых в процесс
(табл. 12.1).
Таблица 12.1. Клинические проявления, ассоциирующиеся с синтезом аФЛ
Осложнения Частота аФЛ Примечание
Кардиологические: клапаны сердца, коронарные артерии, мелкие артерии, окклюзия шунта Кожные: сетчатое ливедо, инфаркты ногтевого ложа, язвы Г ематологические: тромбоцитопения, Кумбс-позитивная анемия Неврологические: инсульт, полинейромышечный комплекс, мигрень, деменция, судороги, синдром Гийена—Барре, хорея, поперечный миелит Глазные: атрофия зрительного нерва, тромбоз артерий и вен сетчатки ~ 90 % при пораже- Инфаркт миокарда нии створок клала- Кардиомиопатия нов сердца ~ 20 % при инфарк- те миокарда - 33 % после аорто- коронарного шунти- рования 50 % Дилатация поверхност- ных вен Ишемия, гангрена Тромбозы артериол, ве- нул дермы 50 % СКВ От 40 до 50 % Тромбозы крупных со- судов мозга Тромбозы мелких сосу- дов мозга 44 % Инфаркты сетчатки Мягкие экссудаты вслед- ствие окклюзии артери- ол сетчатки
134
Продолжение
Осложнения Частота аФЛ, % Примечание
Печеночные: синдром Бадда- - Киари, инфаркт печени Неизвестно Тромбоз артерий и вен печени
Почечные: тромбоз артерий почек, злокачественная артериальная гипертензия Неизвестно Почечная недостаточ- ность
Костные: асептический некроз костей Неизвестно ‘
Легочные: легочная гипертензия, тромбоэмболия сосудов легких Неизвестно
Надпочечники: надпочечниковая недоста- точность, болезнь Аддисона Неизвестно Тромбоз сосудов надпо- чечников
Акушерские: спонтанные аборты, внутриутробная гибель плода 30 % Инфаркт плаценты
Сосуды конечностей: тромбозы глубоких вен, артериальные тромбозы 19% Легочные эмболии
По современным представлениям, основу АФС составляет своеоб-
разная васкулопатия, обусловленная невоспалительным и/или тром-
ботическим поражением сосудов и заканчивающаяся их окклюзией.
Отсутствие в большинстве случаев воспалительных или дегенератив-
ных изменений сосудистой стенки подчеркивает нозологическую са-
мостоятельность и патогенетическое своеобразие поражения сосудов
при АФС [2, 8]. В биоптате кожно-мышечного лоскута в сосудах дер-
мы гистологически отмечаются оживление и/или десквамация эндо-
телия (рис. 12.1) и тромбы в капиллярах; признаки васкулопатии вы-
являются и в мышце.
Исследуя биоптаты кожи и мышцы у больных с первичным и вто-
ричным АФС, мы выявили ангиоматоз, который, вероятно, является
следствием хронической ишемии. Следует отметить, что у больных с
первичным АФС наряду с васкулопатией выявлялся и васкулит, ко-
135
торый имел в основном продуктивный характер. Клеточная инфильт-
рация при этом, скорее всего, была вторичной на фоне обтурации и
развития коллатералей. На рис. 12.2 представлено эксцентрическое
сужение просвета ветви легочной артерии на фоне организации тром-
ба (материал аутопсии больной с первичным АФС).
Для диагностики АФС разработаны диагностические и классифи-
кационные критерии [18, 22]. Проанализировав 667 больных СКВ,
D.Alarcon-Segovia и соавт. [18] предложили предварительные класси-
фикационные критерии АФС у больных СКВ. Авторы выделили 9 кли-
нических проявлений (привычное невынашивание беременности, ре-
цидивирующие венозные тромбозы, артериальные тромбозы, хрони-
ческие язвы голеней, сетчатое ливедо, гемолитическая анемия, тром-
боцитопения, легочная гипертензия, поперечный миелит), ассоцииру-
емых с аКЛ, и, исходя из комбинации этих симптомов с уровнями аКЛ,
предложили выделять определенный, вероятный и сомнительный АФС
у больных СКВ. Определенный АФС может быть диагностирован при
наличии как минимум 2 из 9 клинических признаков в сочетании с аКЛ
в крови, уровень которых должен превышать 5 стандартных откло-
нений (8) по сравнению со здоровыми лицами (в наших исследовани-
ях это составляло 26 ME); вероятный АФС — при наличии одного из
9 клинических признаков и выявлении уровня аКЛ выше 58 по срав-
нению с донорами или при наличии 2 клинических признаков и уров-
ня аКЛ меньше 58, но больше 38 (26<аКЛ>23). Заключение о сомни-
тельном АФС делается при отсутствии клинических признаков, но об-
наружении в сыворотке аКЛ в количестве, превышающем 58, или вы-
явлении одного клинического признака и уровня аКЛ, составляюще-
го менее 58, но более 38.
Как видно из табл. 12.2, рецидивирующие тромбозы встречались
у 39 % наблюдавшихся нами больных СКВ, привычное невынашива-
ние беременности — у 60 % женщин с беременностями в анамнезе,
тромбоцитопения — у 30 %; отмечалось значительное количество до-
полнительных признаков.
Таблица 12.2. Частота клинических признаков, связанных с антифосфо-
липидными антителами (у 260 больных СКВ)
Признаки Частота признаков
п О/ /0
Основные: рецидивирующие тромбозы (артериаль- 100 38,5
ные и/или венозные); рецидивирующие потери плода; 50/84 59,5
тромбоцитопения 79 30,4
Дополнительные: сетчатое ливедо; 102 39,2
136
Продолжение
Признаки Частота признаков
и %
неврологические нарушения (хорея, 150 57,7
эпилепсия, мигрень);
асептические некрозы костей; 13 5,0
хронические язвы голени; 41 15,8
неинфекционный эндокардит 102/180 56,5
IgG — аКЛ 78 30
IgM — аКЛ 75 28
IgG-—аКЛ + IgM—аКЛ 58 22,3
ВА 120 46,1
ВА + аКЛ 102 39,2
Наши данные [3], полученные на основании длительного проспек-
тивного наблюдения 260 больных СКВ, подтверждают целесообраз-
ность выделения «вероятного» и «сомнительного» АФС, поскольку это
может иметь важное значение для ранней диагностики синдрома. Как
следует из табл. 12.3, 26,2 % больных СКВ имели достоверный АФС,
24,4 % — вероятный и 15,4 % — сомнительный.
Таблица 12.3. Частота АФС (у 260 больных СКВ) по классификацион-
ным критериям D.Alarcon—Segovia и соавт.
Число больных
абс. %
Форма АФС
Признаки, ассоцииро-
ванные с аКЛ
Венозный тромбоз Артериальный тромбоз Привычное невынаши- вание беременности Определенный: 2 и более клинических признака + аКЛ > 56 68 26,2
Вероятный: 61 24,4
Язвы ног
Сетчатое ливедо а) 1 клинический приз-
Гемолитическая анемия нак + аКЛ > 58; 19 7,3
Тромбоцитопения Легочная гипертензия Поперечный миелит б) 2 клинических приз- нака + аКЛ > 28 < 58 42 16,1
Сомнительный: 40 15,4
а) 2 клинических приз- нака без аКЛ; 20 7,9
б) 1 клинический приз- нак аКЛ > 28 < 58; 12 4,6
в) без клинических признаков с аКЛ > 58 8 з,о
137
По нашему мнению, наличие одного классического признака АФС
(рецидивирующие тромбозы) в сочетании с высокими титрами аКЛ
IgG изотипа и ВА достаточно для диагноза «определенный» АФС,
особенно у мужчин [9].
Течение АФС, тяжесть и распространенность тромботических ослож-
нений непредсказуемы. У одних больных АФС проявляется преимуще-
ственно венозными тромбозами, у других — инсультом, у третьих —
акушерской патологией или тромбоцитопенией. Полагают, что пример-
но у половины больных АФС не имеется признаков какого-либо друго-
го заболевания (первичный АФС). Однако вопрос о нозологической са-
мостоятельности первичного АФС до конца не ясен. Имеются данные о
том, что первичный АФС иногда может быть вариантом начала СКВ.
Наоборот, у некоторых больных с классической СКВ в дальнейшем на
первый план могут выходить признаки АФС, которые и определяют
прогноз заболевания. Наши исследования и данные литературы свиде-
тельствуют об отсутствии существенных различий в спектре клиничес-
ких проявлений АФС у больных с первичной и вторичной формами за-
болевания.
В последние годы обсуждается возможность существования гак
называемого «аФЛ-негативного» варианта АФС, при котором имеют-
ся характерные клинические проявления патологии, но отсутствуют
классические серологические маркеры — ВА и аКЛ.
Прогресс в изучении АФС во многом связан с разработкой стан-
дартизованных чувствительных и специфичных методов определения
аКЛ [4, 20] и расшифровкой структуры антигенных детерминант (эпи-
топов), с которыми реагируют эти антитела [26, 27]. Было установле-
но, что взаимодействие аФЛ с фосфолипидами — сложный феномен,
в реализации которого важную роль играют кофакторы белковой
природы. В 1990 г. 3 группы исследователей независимо друг от дру-
га представили данные о том, что аКЛ, выявляемые в сыворотках
крови больных с АФС, связываются с кардиолипином только в присут-
ствии кофактора, который был идентифицирован как (3,-гликопротеин-
I (р2-ГП1). Он обладает антикоагулянтной активностью in vivo, присут-
ствует в нормальной плазме в концентрации примерно 200 мкг/мл
в ассоциации с липопротеинами (обозначается как аполипопротеин
Н). Полагают, что аФЛ, присутствующие в сыворотках больных с
АФС, на самом деле распознают антигенные детерминанты не фосфо-
липидов, а конформационные детерминанты («неоантиген»), форми-
рующиеся в молекуле {32-ГП1 в процессе ее взаимодействия с фосфо-
липидами, или линейные эпитопы самого |32-ГТ11 [27]. Об этом свиде-
тельствуют данные об обнаружении в сыворотках больных АФС ан-
тител, реагирующих с |32-ГП1 как в присутствии фосфолипидов, так и
без них.
Наши результаты, полученные при изучении ингибирующей актив-
ности пептидных фрагментов р2-ГП1, показали, что пептид
(FCKNKEKKCS), соответствующий последовательности 274—288
р2-ГШ в С-терминальном участке молекулы, обладает способностью
138
ингибировать связывание lgG-фракции, выделенной из сывороток
больных АФС, содержащих кардиолипин [15].
Расшифровка биологических свойств аФЛ имеет не только теоре-
тическое, но и большое практическое значение. Установлено, что в
сыворотках больных АФС присутствуют так называемые «аутоиммун-
ные» антитела, реагирующие с кардиолипином только в присутствии
Р2-ГШ, и их синтез ассоциируется с развитием тромботических нару-
шений и акушерской патологии, характерных для этого синдрома.
Напротив, в сыворотках больных инфекционными заболеваниями
присутствуют главным образом антитела, реагирующие с кардиоли-
пином в отсутствие |3Э-ГП1. Эти различия в свойствах антител позво-
ляют объяснить относительно низкую частоту тромботических нару-
шений у больных инфекционными заболеваниями. Наши результаты
свидетельствуют о том, что у больных СКВ гиперпродукция IgG-ан-
тител к |32“ГП1 коррелирует с развитием АФС в целом (табл. 12.4), его
основными клиническими проявлениями в отдельности (венозный и
артериальный тромбозы, акушерская патология и тромбоцитопения)
и некоторыми дополнительными признаками синдрома (трофические
язвы голени, гемолитическая анемия и поражение клапанов сердца)
[17]. Кроме того, увеличение концентрации IgM-антител к |32-ГП1
ассоциировалось с привычным невынашиванием беременности. Оба
изотипа антител к р2~ГШ существенно чаще обнаруживались в сыво-
ротках, позитивных по ВА и аКЛ.
Таким образом, антитела к |32-ГШ являются новым серологи-
ческим маркером АФС и их определение имеет важное клиническое
значение для совершенствования лабораторной диагностики АФС
[27].
Развитие признаков АФС у лабораторных животных с эксперимен-
тально-индуцированным или спонтанным синтезом аФЛ подтвержда-
ет роль этих антител в формировании симптомокомплекса [14]. При
этом уровень аФЛ коррелирует с частотой (или риском) развития тром-
бозов.
Наши результаты и данные других авторов свидетельствуют о том,
что аФЛ обладают способностью перекрестно реагировать с компо-
нентами сосудистого эндотелия, включая фосфатидилсерин и другие
отрицательно заряженные молекулы (сосудистый гепарансульфат про-
теогликана, хондроитинсульфатный компонент тромбомодулина) [24].
Ва&ную роль в процессе взаимодействия аФЛ с эндотелиальными
клетками (ЭК) играет (32-ГП1. При АФС отмечена достоверная корре-
ляция между обнаружением аФЛ, антиэндотелиальных антител и ан-
тител к |32-ГП1 [10]. Установлено, что |32-ГП1 может экспрессировать-
ся на мембране ЭК, a in vitro |32-ГП1 индуцирует связывание аФЛ с
ЭК [24]. При этом |32-ГП1-зависимое связывание аФЛ и ЭК приводит
к активации эндотелия: гиперэкспрессии молекул адгезии (Е-селектин,
VCAM-1, ICAM-1), увеличению прилипания моноцитов к поверхнос-
ти эндотелия. О роли |32-ГП1 свидетельствует тот факт, что поликло-
нальные и моноклональные антитела к 3.-ГП1 in vitro индуцируют экс-
139
Таблица 12.4. Связь клинико-серологических признаков АФС у больных
СКВ с антителами к р2-гликопротеиду I
Признаки IgG- анти-р, ГП1 + п=19 IgG анти-р, ГП1 - ’ п-50 Р IgM анти-р, ГП1+ ‘ п=16 IgM анти-р, ГП1 ‘ п=53 Р
АТ (п—6) 1 5 НЗ ] 5 НЗ
ВТ (п= 18) 6 12 НЗ 5 13 НЗ
АТ+ВТ (п=20) 10 10 0,01 3 17 НЗ
Всего Т (п-44) 17 27 0,005 9 35 НЗ
ПНБ (п= 15/38) 6/8 9/30 0,03 7/9 8/29 0,01
ТЦП (п=28) 12 16 0,02 9 19 НЗ
Ливедо сетчатое 12 26 НЗ 11 27 НЗ
(п=38) Язвы голеней (п-20) 9 11 0,04 6 14 Н4
Г емо литическая 12 6 0,0001 7 11 НЗ
анемия (п= 18) Поражение клала- 11 6 0,0002 5 12 НЗ
нов сердца (п=17) Легочная гипертен- 2 2 НЗ 1 3 НЗ
зия (п=4) Поперечный миелит — 3 НЗ 1 3 НЗ
(п=3) ВА (п=45) 18 27 0,0009 15 30 0,005
IgG-аКЛ (п=46) 18 28 0,002 15 31 0,007
IgM-аКЛ (п-49) 19 30 0,004 15 34 0,02
Условные сокращения: АТ — артериальные тромбозы; ВТ — венозные
тромбозы; Т — общее количество больных с тромбозами; ПНБ — привычное
невынашивание беременности (в Числителе — количество женщин с потерями
плода, в знаменателе — количество женщин с беременностями в анамнезе);
ТЦП — тромбоцитопения; НЗ — статистически не значимо (Р по методу Фише-
ра).
прессию Е-селектина (ELAM-1) на мембране ЭК и секрецию провос-
палительных цитокинов (ИЛ-1 и ИЛ-6) и простагландина Е2. Таким
образом, аФЛ in vitro имитируют активность провоспалительных ци-
токинов (ИЛ-1, ФНО-а), обладающих выраженной прокоагулянтной
активностью. Особенно большой интерес представляет связь между
синтезом аФЛ и апоптозом (программированной гибелью) ЭК. Напом-
ним, что основная черта клеточного апоптоза — асимметрия фосфо-
липидной мембраны с экспонированием отрицательно заряженного
фосфолипида фосфатидилсерина (ФС), который, как и кардиолипин,
является мишенью для аФЛ. Экспонирование ФС на внешней мемб-
ране клеток является самым ранним проявлением клеточного апопто-
за, предшествующим фрагментации ДНК и нарушению целостности
мембраны. Известно, что при активации тромбоцитов экспонирова-
ние ФС ассоциируется с активацией свертывания. Отрицательно за-
ряженные фосфолипиды принимают участие в фактор VIII- и фактор
140
IXa-зависимой активации фактора X на ЭК, а анексин V полностью
ингибирует эту реакцию. Подвергнутые апоптозу ЭК обладают спо-
собностью увеличивать скорость активации фактора X, что ассоции-
руется с повышенным экспонированием ФС. Сходным образом уве-
личение экспозиции анионных фосфолипидов на мембране моноцитов
сопровождается повышением активности протромбиназного комплек-
са. Имеются данные о том, что эндотоксинстимулированные ЭК и
тканевые факторы, экспрессируемые моноцитами в процессе развития
апоптоза, проявляют прокоагулянтную активность, а стимулы, подав-
ляющие активность тромбомодулина и гепарансульфата (провоспали-
тельные цитокины, эндотоксины, гипоксия, гомоцистеинемия), обла-
дают способностью индуцировать апоптоз ЭК. В недавних исследо-
ваниях было показано, что аФЛ обладают способностью связывать-
ся с поверхностью ЭК, подвергнутых апоптозу, и сами индуцируют
процесс апоптоза ЭК, причем связывание аФЛ с находящимися в апоп-
тозе клетками зависит от присутствия Р2-ГП1. Все эти данные свиде-
тельствуют о том, что аФЛ-индуцированное нарушение нормальных
механизмов апоптоза ЭК может иметь важное значение в развитии на-
рушений свертывания крови при АФС.
Наряду с Р2-ГП1 мишенью для аФЛ могут являться отдельные бел-
ки, регулирующие коагуляционный каскад, такие как белок С, бе-
лок S или тромбомодулин, экспрессирующиеся на мембране ЭК.
Имеются данные о том, что моноклональные аКЛ связываются с бел-
ком S только в присутствии Р2-ГП1 и кардиолипина. Эти данные по-
зволили высказать предположение о том, что индуцированный
Р2-ГП1-зависимыми аФЛ дефицит свободного белка S является од-
ним из важных патогенетических механизмов развития тромбозов при
АФС. Акушерская патология при АФС также связана с синтезом
Р2-ГП1-зависимых аФЛ. Полагают, что в основе внутриутробной ги-
бели плода лежит гипоксия, обусловленная недостаточным утеро-
плацентарным кровотоком вследствие тромбоза сосудов плаценты
и нарушением имплантации эмбриона. Инфаркты плаценты связы-
вают также с аФЛ-зависимым снижением экспрессии анексина V на
поверхности плацентарных ворсинок, способностью аФЛ перекрес-
тно реагировать с клетками трофобласта. IgG-фракция, выделенная
из сыворотки, содержащей ВА, увеличивает синтез плацентарного
тромбоксана без компенсаторного увеличения продукции простацик-
лина. Это может иметь значение при развитии акушерской патоло-
гии во втором триместре беременности. Кроме того, другие иссле-
дования показали, что поликлональные аКЛ ингибируют синтез пла-
центарного Р-хориогонадотропина.
Сосудистые катастрофы (инфаркт миокарда и инсульт) относятся
к числу частых причин преждевременной смерти больных СКВ. Сре-
ди причин сосудистой патологии при СКВ и других системных ревма-
тических заболеваниях обсуждается вопрос об атеросклеротическом
поражении сосудов [13]. Тромбоз мозговых и коронарных артерий —
характерные локализации тромбоза у больных с АФС. Наши резуль-
141
таты свидетельствуют о том, что эхокардиографические изменения,
отражающие ишемическое поражение миокарда (очаговая акинезия
или диффузная гипокинезия), чаще выявляются у тех больных СКВ, в
сыворотках которых присутствуют аФЛ [6], а тромбоз коронарных
артерий у мужчин с СКВ — наиболее частая форма артериального
тромбоза [9].
Хорошо известно, что увеличение уровня липопротеида(а)[ЛП(а)]
рассматривается как важный фактор риска атеросклеротического
поражения сосудов. Поскольку ЛП(а) принимает участие в отложе-
нии липидов в сосудистую стенку и имеет структурную гомологию с
плазминогеном, он может играть определенную роль в развитии ате-
ротромбоза. По нашим данным, при СКВ увеличение уровня ЛП(а)
более 30 мг% отмечено у 6 (25 %) из 24 больных. При этом тромботи-
ческие (в первую очередь артериальные) осложнения достоверно чаще
наблюдались в группе больных с повышенным, чем с нормальным
уровнем ЛП(а) (р-0,02), а титры аКЛ коррелировали с концентраци-
ей ЛП(а) [16]. Поражение коронарных артерий (ишемическая болезнь
сердца у 2 больных и инфаркт миокарда— у одного больного) на-
блюдалось только у больных с повышенным уровнем ЛП(а) (р-0,009).
Другой механизм атеротромбоза может быть связан с перекисным
окислением липопротеидов низкой плотности (ЛНП). Установлено, что
взаимодействие малонового альдегида (конечный продукт перекисно-
го окисления липидов) с лизиновыми остатками аполипопротеина В
приводит к формированию аутоантигенного эпитопа, стимулирующе-
го синтез антител к окисленному ЛНП (оЛНП). Увеличение уровня
антител к оЛНП ассоциируется с атеросклеротическим поражением
коронарных сосудов, прогрессированием атеросклероза каротидных
артерий и развитием инфаркта миокарда. Интересно, что поверхнос-
тная конфигурация оЛНП, включающая аполипопротеин В и моно-
слой, состоящий из фосфолипидов и холестерина, в определенной сте-
пени напоминает антигенный эпитоп, с которым взаимодействуют
аФЛ. Последний, как уже отмечалось, образуется в процессе взаимо-
действия анионных фосфолипидов и Р2-ГП1. Имеются данные о том,
что антитела к оЛНП часто присутствуют в сыворотках больных СКВ
с АФС [11], причем аФЛ обладают способностью перекрестно реаги-
ровать с оЛНП. Совсем недавно было обнаружено, что аФЛ и моно-
клональные антитела к оЛНП перекрестно реагируют с модифициро-
ванным окисленным кардиолипином. Хотя наши результаты и данные
других авторов свидетельствуют об отсутствии связи между увеличе-
нием уровня антител к оЛНП и развитием тромбозов у больных АФС,
установлено, что увеличение концентрации аФЛ и повышенный уро-
вень антител к оЛНП являются независимыми факторами риска ко-
ронарного тромбоза, и их одномоментное выявление у одних и тех же
больных резко увеличивает риск развития этого осложнения. О важ-
ной роли иммунного ответа против оЛНП свидетельствуют данные
экспериментальных исследований мышей линии (NZW/BXSB)F1, у
которых спонтанно развивается окклюзионное поражение коронарных
142
Рис. 12.3. Факторы, предрасполагающие к раннему развитию атеро-
тромбоза при системных ревматических заболеваниях.
артерий, а в сыворотках обнаруживаются как аФЛ, так и антитела к
оЛНП. При этом моноклональные антитела, полученные при гибри-
дизации селезеночных клеток мышей линии (NZW/BXSB)F1, реаги-
рующие с аФЛ в присутствии Р2-ГШ, обладают способностью пере-
крестно реагировать с оЛНП. Интересно, что хотя сам 2-ГП1 частич-
но ингибирует захват и протеолитическое расщепление оЛНП мак-
рофагами и, таким образом, обладает определенной антиатерогенной
активностью, особенно на фоне окислительного стресса, в присутствии
антител к р3-гш захват оЛНП макрофагами существенно усилива-
ется. Все эти данные свидетельствуют о тесной патогенетической вза-
имосвязи между гиперпродукцией аФЛ, окислительным стрессом и раз-
витием сосудистой патологии при ревматических заболеваниях (рис.
12.3).
Курация больных АФС представляет сложную проблему [25]. Это
обусловлено неоднородностью патогенетических механизмов, лежа-
щих в основе АФС, полиморфизмом клинических проявлений, отсут-
ствием достоверных клинических и лабораторных показателей, позво-
ляющих прогнозировать рецидивирование тромботических наруше-
ний. Полагают, что риск повторных тромбозов особенно высок у лиц
молодого возраста, с высоким уровнем аКЛ (Р2-ГП1-зависимая попу-
ляция антител), ВА или антител к Р3-ГШ, наличием рецидивирующих
тромбозов и/или акушерской патологии в анамнезе.
Лечение больных АФС основывается на назначении непрямых ан-
тикоагулянтов и антиагрегантов (низкие дозы аспирина). Терапия
АФС имеет свои особенности, что в первую очередь связано с более
высоким риском рецидивирования тромбозов, чем у больных тромбо-
143
филией, и необходимостью лечения ведущего заболевания (при вто-
ричном АФС) Представляем общие принципы лечения АФС
Основные препараты
Вспомогательные
препараты
Дру[ие препараты
Непрямые антикоагу-
лянты
Прямые антикоагулянты
Аспирин (низкие дозы)
Антималярийные сред-
ства
Глюкокортикостероиды
(только при СКВ)
Даназол (тромбоцито-
пения)
Внутривенный имму-
ноглобулин (акушер-
ская патология)
Плазмаферез + цнкло-
фосфамид («катастро-
фический» АФС)
Полиненасыщенные
жирные кислоты, инги-
биторы циклооксигена
зы 2, антиоксиданты
витамины (Bf2, Bs, фоли
евая кислота), тиклопи-
дин, пентоксифиллин
гируидин, антикоагу
лянтные пептиды моно-
клональные антитела к
тромбоцитам RGD-
пептиды, ингибиторы
апоптоза, цитокины
(ИЛ-3)
Полагают, что у больных с высоким уровнем аФЛ в сыворотке,
но без клинических признаков АФС (в том числе у беременных жен-
щин без акушерской патологии в анамнезе) следует ограничиться
назначением небольших доз аспирина (75—100 мг/сут) Однако эти
больные требуют тщательного динамического наблюдения, так как
риск тромботических осложнений у них весьма высок По нашему
мнению, в схему лечения таких больных целесообразно включение
антималярийного препарата плаквенила (200 мг/сут), который широ-
ко используется в лечении воспалительных ревматических заболева-
ний и отличается очень низкой токсичностью Установлено, что плак-
венил наряду с противовоспалительным действием, обладает анти-
тромботическим (подавляет агрегацию и адгезию тромбоцитов, умень-
шает размер тромба) и гиполипидемическим эффектами Все это дает
основание полагать, что лечение плаквенилом (в сочетании с низки-
ми дозами аспирина, а при необходимости и с другими препаратами)
показано почти всем больным с АФС Наличие АФС, и тем более толь-
ко аФЛ, не является показанием к назначению или увеличению доз
глюкокортикостероидов
Применение антикоагулянтов чревато осложнениями, поэтому их
назначение требует тщательного лабораторного контроля и динами-
ческого наблюдения за больными Различают 2 группы непрямых ан-
тикоагулянтов производные кумарина и индандиона В настоящее
время предпочтение отдается производным кумарина, которые реже
вызывают аллергические реакции и дают стабильный антикоагулян-
тный эффект В США и многих других странах препаратом выбора
является варфарин Основными непрямыми антикоагулянтами, исполь-
144
Рис. 12.1. Васкулопатия эндотелия дермы Десквамация и оживление эндо-
телия Окраска гематоксилином и эозином Х400 К с 135
Рис. 12,2. Эксцентрическое сужение просвета артерии легкого за счет
организации тромба Окраска по пикро-Малори Х250 К с 136
Рис. 18.1. Синовиальная оболочка Гистологические признаки апоптоза
Окраска гематоксилином и эозином Х400 К с 195
Рис. 18.2. Лимфатический узел при ревматоидном артрите EBV в макро
фагах Иммунопероксидазный метод Х250 Кс 195
аФЛ — антифосфолипидные антитела р ГП I — р2 гликопротеин I ЭК эндо
телиальные клетки Лп (а) — липопротеид (а) оЛНП — окисленный липопро
теид низкой плотности
Рис. 18.3. Малые слюнные железы при болезни Шегрена. Интерлейкин-2.
Гибридизация in situ. Х100. К с. 196
Рис. 18.4. Малые слюнные железы при болезни Шегрена. Интерлейкин-4 и
экспрессия CD-40 Ro. Гибридизация in situ и иммунологический метод.
Х400. К с. 196.
зуемыми в России, из производных кумарина являются инкумар, нео-
дикумарин и др., а также фенил ин — производное индандиона.
Контроль за лечением, как известно, осуществляется по протром-
биновому времени, что не может считаться теперь достаточно надеж-
ным. Для определения протромбинового времени используется тром-
бопластин, биологическая активность которого зависит от вида тка-
ни и технологии получения. Для стандартизации результатов опреде-
ления протромбинового времени с применением различных тромбо-
пластинов ВОЗ (1983) рекомендовала использовать международный
нормализационный индекс (МНИ).
Некоторым больным, резистентным к антикоагулянтной терапии,
требуется достаточно высокая доза варфарина (до 20 мг/сут) для под-
держания МНИ в терапевтических пределах — от 2 до 3, хотя наибо-
лее оптимальными при АФС являются значения МНИ, составляющие
3 и 4.
На сегодняшний день стандартом профилактики рецидивирующих
потерь плода являются малые дозы аспирина (50—100 мг/сут), кото-
рые рекомендуется принимать до, в течение беременности и после рож-
дения ребенка. Во время беременности малые дозы аспирина можно
комбинировать с подкожным введением гепарина. Необходимо под-
черкнуть, что риск развития гепаринового остеопороза у матери мо-
жет быть сведен к минимуму при назначении низкомолекулярных ге-
паринов (фраксипарин, клексан и др.). Прием непрямых антикоагу-
лянтов должен быть прерван при наступлении беременности из-за их
возможных тератогенных влияний на плод. В течение всей беремен-
ности необходим мониторинг с помощью ультразвуковых исследова-
ний для раннего выявления сосудистой плацентарной недостаточнос-
ти и дистресс-синдрома у плода.
В отдельных клинических наблюдениях или небольших открытых
испытаниях сообщается об эффективности плазмафереза, внутривен-
ного введения иммуноглобулина, простациклина, фибринолитичес-
ких препаратов, препаратов рыбьего жира у женщин с акушерской
патологией. Лечение плазмаферезом, высокими дозами ГКС (в том
числе пульс-терапия) и цитотоксическими иммунодепрессантами про-
должает оставаться основным методом лечения «катастрофическо-
го» АФС.
Определенные надежды возлагают на использование тиклопиди-
на и пентоксифиллина, а особенно на внедрение новых методов анти-
коагулянтной терапии, основанных на использовании аргиналов, ги-
руидинов, антикоагулянтных пептидов, антитромбоцитарных агентов
(моноклональные антитела к тромбоцитам, RGD-пептиды). Большой
интерес представляет оценка эффективности ингибиторов апоптоза
(в том числе антиоксидантов), поскольку развитие апоптоза эндоте-
лиальных клеток является одним из ключевых факторов, обеспечи-
вающих их прокоагулянтные свойства.
Таким образом, в настоящее время АФС следует рассматривать
как уникальную модель аутоиммунной тромботической васкулопатии,
6—3592
145
изучение которой имеет существенное значение для расшифровки вза-
имоотношений между патологическими процессами, составляющими
основу сосудистых изменений при заболеваниях человека, таких как
атеросклероз, васкулиты, нарушения свертывания крови и системы
иммунитета. Несмотря на достигнутый прогресс, изучение механизмов
развития, клинических особенностей и подходов к лечению сосудис-
тых нарушений продолжает оставаться одной из наиболее актуаль-
ных мультидисциплинарных проблем современной медицины, для ре-
шения которой необходимо объединение усилий специалистов различ-
ных областей медицины — ревматологов, кардиологов, невропатоло-
гов, акушеров-гинекологов, гематологов, иммунологов.
СПИСОК ЛИТЕРАТУРЫ
1. Алекберова З.С., Насонов ЕЛ., Прудникова Л.3. и др. Клиническое зна-
чение определения волчаночного антикоагулянта и антител к кардио-
липину//Тер. арх. — 1988. — № 7. — С. 84—86.
2. Алекберова З.С., Решетняк Т.М., РоденскаЛоповок С.Г. и др. Васкуло-
патия у больных системной красной волчанкой с антифосфолипидным
синдромом//Тер. арх. — 1995. — № 5. — С. 41—44.
3. Алекберова З.С., Решетняк Т.М., Кошелева Н.М. и др. Антифосфоли-
пидный синдром при системной красной волчанке: оценка диагности-
ческих и классификационных критериев//Клин. мед. — 1996. — №6,—
С. 39—42.
4. Александрова Е.Н., Насонов ЕЛ., Ковалев В.Ю. Количественный имму-
ноферментный метод определения антител к кардиолипину в сыворот-
ке крови//Клин. ревматол. — 1995. — № 4. — С. 35—39.
5. Калашникова Л.А., Насонов ЕЛ., Стоянович Л.З. и др. Синдром Снед-
дона и первичный антифосфолипидный синдром//Тер. арх. — 1993. —
№ 3. — 64 с.
6. Карпов Ю.А., Насонов ЕЛ., Вильчинская М.Ю. и др. Проявления ИБС и
состояние коронарных артерий у больных антифосфолипидным син-
дромом//Тер. арх. — 1995. — № 10. — С. 27—31.
7. Насонов Е.Л., Алекберова З.С., Александрова Л.З. и др. Антитела к кар-
диолипину: метод определения и клиническое значение//Клин. мед. —
1987. —№ И. —С. 100—104.
8. Насонов ЕЛ., Баранов А. А., Шилкина Н.П., Алекберова З.С. Патология
сосудов при антифосфолипидном синдроме. — М.—Ярославль, 1995. —
162 с.
9. Насонов ЕЛ., Алекберова З.С., Клюквина Н.Г. и др. Антифосфолипид-
ный синдром при системной красной волчанке у мужчин//Клин. мед. —
1996.—№4. — С. 18—22.
10. Насонов ЕЛ., Алекберова З.С., Саложин К.В. и др. Антиэндотелиаль-
ные антитела при системной красной волчанке у мужчин: связь с пора-
жением почек и антифосфолипидным синдромом//Тер. арх. — 1996. --
№6, —С. 46—49.
11. Насонов ЕЛ., Попкова Т.В., Ефремов Е.Е. и соавт. Антитела к окислен-
ному липопротеину низкой плотности при системной красной вол-
чанке//Клин. мед. — 1997. — № 9. — С. 49—52.
146
12. Насонов Е.Л., Алекберова З.С., Калашникова Л.А. и др. Антифосфоли-
пидный синдром (синдром Hughes): 10 лет изучения в России//Клин.
мед. — 1998. — №2. — С. 4—11.
13. Насонов ЕЛ. Атеротромбоз при ревматических заболеваниях: анализ
патогенеза //Тер. арх. — 1998. — №9. — С. 92—95.
14. Насонов Е.Л., Кобылянский А.Г., Кузнецова Т.В. и др. Современные пред-
ставления о патогенезе антифосфолипидного синдрома//Клин. мед. —
1998. — № 9. — 9 с.
15. Палькеева М.Е., Сидорова М.В., Кузнецова ТВ. и др. Синтез и исследо-
вание антигенных свойств пептидных фрагментов р2-гликопротенна-
1//Биоорганическая химия. — 1996. — № 9. — С. 678—685.
16. Попкова ТВ., Покровский СИ., Алекберова З.С. и др. Липопротеин(а)
при системной красной волчанке//Клин. мед. — 1998. — № 1. — С. 21—
24.
17. Решетняк Т.М., Дерксен Р.В., Алекберова З.С. и др. Антитела кр2 гли-
копротеину-1 при СКВ //Клин. мед. — 1998. — № 3. — С. 36—40.
18. Alarcon-Segovia D., Perez-Vazquez М.Е., Villa A.R. et al. Preliminary
classification criteria for the antiphospholipid syndrome in systemic
lupus erythematosus. A prospective analysis of 500 consecutive patients/
/Medicine. — 1989. — Vol. 21. — P. 275—286.
19. Asherson R.A., Cervera R., Piette J.C, Shoenfeld Y. The antiphospholipid
syndrome: history, definition, classification, and differential diagnosis. —
In: The antiphospholipid syndrome// R.A.Asherson, R.Cervera, J.C.Piette,
Y.Shoenfeld (eds). — CRC Press: Boca Raton, 1996. — P. 3—12.
20. Harris E.N., Charavi A.E., Boey M.L. et al. Anticardiolipin antibodies:
detection by radioimmunoassay and association with thrombosis in
systemic lupus erythematosus//Lancet. — 1983. — N 2. — P. 1211—1214.
21. Hughes G.R.V. Thrombosis, abortion, cerebral disease and lupus
anticoagulant //Brit. Med. J. — 1983. — Vol. 187. — P. 1088—1089.
22. Hughes G.R.V. The antiphospholipid syndrome: ten years on//Lancet. —
1993. _ Vol. 324. — P. 341—344.
23. Khamashta M.A., Asherson R.A. Hughes syndrome: antiphospholipid
antibodies move to thrombosis in 1994//Brit.J.Rheumatol. — 1995. — Vol.
34. — P. 493—494.
24. Le Tonqueze M., Salozhin K., Dueymes M. et al. Role of p2-glycoprotein I
in the antiphospholipid antibody binding to endothelian cells///Lupus. —
1995. — Vol. 4. — P. 179—186.
25. McCrae K.B. Antiphospholipid antibody associated thrombosis: a con-
sensus for treatment?//Lupus. — 1996. — Vol. 5. — P. 560—570.
6*
147
Лекция 13
БОЛЕЗНЬ ЛАИМА —
МУЛЬТИДИСЦИПЛИНАРНАЯ
ПРОБЛЕМА
Д-р мед. наук Л.П.Ананьева (Институт ревматологии
РАМН)
В 1975 г. в г. Лайм (США) была отмечена вспышка артритов у
детей. Авторы, описавшие лайм-артрит, предположили, что имеют
дело с новой болезнью [24]. Впоследствии был распознан более ши-
рокий спектр симптомов, который, как выяснилось, развивался пос-
ле присасывания клеща: кожная мигрирующая эритема, интоксика-
ция, артралгии или артрит и неврологические расстройства. Этот
расширенный симптомокомплекс получил название болезни Лайма
(Lyme disease), или лаймской болезни [25]. Обнаружение спирохето-
подобного микроорганизма в иксодовых клещах [10] и выделение
этих спирохет из крови [8], кожи и цереброспинальной жидкости
пациентов с болезнью Лайма [25] указало на спирохетозную этио-
логию болезни.
В 1984 г. спирохета была идентифицирована как новый вид бор-
релий [14].
В 1985 г. на II Международном симпозиуме по болезни Лайма (БЛ)
в Вене был принят термин «боррелиоз Лайма» (Lyme borreliosis) как
более точный для обозначения этого симптомокомплекса. Лаймский
боррелиоз — природно-очаговое мультисистемное воспалительное
заболевание, вызываемое спирохетами рода боррелий, переносчика-
ми которых являются иксодовые клещи.
БЛ имеет глобальное распространение в местах обитания иксо-
довых клещей, в основном в северном полушарии планеты; встре-
чается в Северной и Южной Америке, Европе и Азии. В России, яв-
ляющейся, по-видимому, самым большим ареалом болезни в мире,
эндемичные регионы протянулись от Балтики до Дальнего Восто-
ка и Сахалина. С момента введения государственной регистра-
ции БЛ в 1992 г. средняя заболеваемость по всей Российской Феде-
рации возросла в три раза и в 1996 г. достигала в ряде эндемичных
регионов 20—30 и даже 89 свежих случаев на 100 тыс. населения.
В 1997 г. заболеваемость по России составляла в среднем 4,7 на
100 000 населения (по данным Федерального Центра Госсанэпиднад-
зора РФ).
Первым клиническим симптомом инфекции является локальное
кожное воспаление (эритема) в месте присасывания клеща в ответ на
инвазию боррелии. Патогномоничным ранним симптомом болезни
является мигрирующая эритема, которая в своем классическом виде
148
считается диагностическим критерием ранней стадии болезни [5, 23].
Мигрирующая эритема появляется в месте присасывания клеща сна-
чала в виде макулы или папулы, которая постепенно увеличивается
в размерах от 5 см в диаметре (в среднем до 15—20 см). В дебюте за-
болевания часто возникает «гриппоподобный синдром»: головная
боль, слабость и разбитость, лихорадка, миалгии и артралгии, боли
или скованность в области шеи, иногда конъюнктивит, боли в горле.
В случае безэритематозного начала неспецифические проявления бо-
лезни приходится дифференцировать с другими острыми лихорадоч-
ными состояниями.
Проникнув в кожу, возбудитель может распространяться далее
гематогенно, лимфогенно или периневрально, попадая в различные
органы, что проявляется моно- или полиорганными симптомами.
В редких случаях наблюдается длительная персистенция боррелии в
тканях, болезнь приобретает хроническое течение.
Наряду со стадийностью клиника БЛ характеризуется системнос-
тью и включает кожные, неврологические, ревматологические, кар-
диологические, глазные и другие синдромы, которые развиваются в
разных сочетаниях и в разные сроки от начала болезни, что требует
дифференциальной диагностики с самым широким кругом заболева-
ний [26].
Наибольшим клиническим полиморфизмом характеризуется стадия
диссеминации. Клинический маркер диссеминации — вторичная эри-
тема — отмечается в отдаленных от места присасывания клеща уча-
стках кожи. Эти изменения напоминают первичный очаг как клини-
чески, так и морфологически. К характерным кожным проявлениям
периода диссеминации относят единичную лимфоцитому. Доброкаче-
ственная лимфоцитома, или лимфаденоз кожи (lymphadenosis benigna
cutis), представляет собой опухолеподобное уплотнение, локализую-
щееся на мочке уха, в области соска молочной железы; может появ-
ляться и на других участках кожи. Наряду с типичными кожными
проявлениями БЛ встречаются и неспецифические: уртикарный вас-
кулит, нодозная эритема, геморрагическая пурпура, панникулит, пе-
риорбитальный отек.
К синдромам, предположительно связанным с боррелиозной ин-
фекцией, относят очаговую склеродермию и некоторые другие скле-
ротические кожные состояния — склерозирующий лихен (lichen
sclerosis et atrophicus), эозинофильный фасциит и прогрессирующую
гемиатрофию лица [9]. Хронический атрофический акродерматит —
относительно редкое проявление позднего периода БЛ. Типич-
но вовлечение разгибательных поверхностей дистальных отделов ко-
нечностей: процесс начинается с инфильтративно-воспалительной
фазы, за которой через годы следует атрофическая фаза; иногда при-
соединяется склеротический процесс, напоминающий склеродер-
мию [6].
Неврологические проявления БЛ представлены симптоматикой,
свидетельствующей о поражении как центральной (менингит, энцефа-
149
лит, миелит, энцефалопатия), так и периферической нервной системы
(краниальные нейропатии, радикулопатии, периферическая нейропа-
тия, множественные мононевриты, плечевая плексопатия, пояснично-
крестцовая плексопатия, проявления, напоминающие синдром Гийе-
на—Барре, моторная нейропатия и др.).
Дифференциальная диагностика нейроборрелиоза крайне сложна
и должна проводиться со многими неврологическими заболевания-
ми — идиопатической или диабетической периферической нейропати-
ей, цервикальной или люмбальной радикулопатиями различной этио-
логии, опухолями мозга и мозжечка, рассеянным склерозом, боковым
амиотрофическим склерозом, поражением нервной системы при анти-
фосфолипидном синдроме, судорожными расстройствами, атипичной
мигренью, головными болями при гипертензии, синуситах и др.
Иногда приходится дифференцировать неврологические проявле-
ния БЛ с психическими расстройствами, синдромом хронической ус-
талости, депрессивными состояниями и даже с хронической шизофре-
нией [18].
Ревматологи проявляют неослабевающий интерес к БЛ, посколь-
ку существенной частью общей клинической картины этой инфекции
являются поражение опорно-двигательного аппарата и различные
висцериты и васкулиты. Полиорганность, склонность к рецидивиру-
ющему и хроническому течению иногда приводят к тому, что эта бо-
лезнь протекает под маской ревматических заболеваний. Описаны
случаи БЛ, которые симулируют РА, ЮРА, болезнь Рейтера и другие
артропатии, а также ревматизм, СКВ, ССД, полимиозит. Такие забо-
левания, как эозинофильный фасциит и фибромиалгия, могут быть
связаны с боррелиоз ной инфекцией.
К особенностям суставного синдрома при БЛ относят моноолиго-
артикулярный характер поражения, преимущественное вовлечение
крупных суставов (коленные, тазобедренные, плечевые), умеренный
или клинически слабо выраженный синовит, сочетающийся с воспа-
лением периартикулярных тканей, часто развивающийся поблизости
от места присасывания клеща, а также сочетание с экстраартикуляр-
ными проявлениями болезни, преимущественно с поражением нервной
системы. Поражение позвоночника, сакроилеит, уретрит не характер-
ны, и HLA-B27 выявляется с популяционной частотой [1].
Проявления суставного синдрома при БЛ и основной спектр рев-
матических заболеваний, с которыми проводится дифференциальная
диагностика, приведены ниже.
Существенная доля ревматологических синдромов в клинической
картине, их связь с генетической предрасположенностью, в частности
с повышением частоты HLA-DR2 и DR4 при хроническом лайм-арт-
рите, системные проявления, развитие аутоиммунных феноменов в
процессе развития инфекции — все это обосновывает включение про-
блемы БЛ в ряд актуальных задач ревматологии.
150
Ревматологические проявления
боррелиоза Лайма
РЗ, с которыми проводится
дифференциальная диагностика БЛ
Артралгии
Артрит
Тендинит
Остеоартроз
Региональные болевые синд-
ромы
Серонегативные
спондилоартропатии
Хондромаляция надколенника
Теносиновит
Бурсит
Энтезопатии
Миалгии
Миозит
Фиброзиты
Фибромиалгия
Ревматическая лихорадка
Ревматическая полимиалгия
Ревматоидный артрит
Подагра
Кристаллическая артропатия
Системная красная волчанка
Васкулиты
Септические артриты
Острая парвовирусная инфек-
ция В19
Поражение сердца при БЛ обычно начинается через 3—12 нед от
начала заболевания. Наиболее характерны нарушения проводимос-
ти — атриовентрикулярные блокады. Степень блокады может быстро
меняться от первой до полной. Электрофизиологические исследования
выявляют множественные очаговые изменения проводящих путей сер-
дца, поэтому на ЭКГ могут быть отмечены многообразные наруше-
ния проводимости. Описаны также нарушения ритма, среди которых
наиболее часто встречаются тахиаритмии (предсердная и вентрику-
лярная эктопия). Клинически лайм-кардит чаще проявляется умерен-
ными признаками мио- или перикардита, возможна слабо выраженная
сердечная недостаточность. Лайм-кардит может протекать благопри-
ятно или персистировать и, как полагают, приводить к формирова-
нию дилатационной кардиомиопатии [29].
Новой проблемой является офтальмоборрелиоз, к проявлениям
которого относят неспецифический фолликулярный конъюнктивит,
кератит, поражение стекловидного тела, передний увеит, а также не-
врит зрительного нерва, нейроретинит и нейротрофический кератит на
фоне паралича лицевого нерва [30]. К неспецифическим, но нередким
для БЛ относят такие проявления, как лимфаденопатия и лимфаденит,
гепатит и спленит. Более редко встречаются признаки поражения рес-
пираторной системы (гиперемия зева, кашель), почек (гематурия, про-
теинурия), половых органов (орхит) [26].
Заболевание встречается во всех возрастных группах и у лиц обо-
его пола. В США лайм-артрит чаще встречается у детей, тогда как у
взрослых преобладает субклиническая инфекция. Боррелиоз Лайма у
детей составляет 10—15 % от общей заболеваемости. Вообще же БЛ
чаще встречается у лиц зрелого и пожилого возраста и характеризу-
151
ется хронизацией, развитием постинфекционных и параинфекционных
проявлений, что ухудшает прогноз и значительно снижает качество
жизни.
Необходимо остановиться и на такой особенности лайм-боррели-
оза, как способность к трансплацентарной передаче возбудителя,
что может приводить к внутриутробной инфекции (как и при дру-
гих спирохетозах), возникновению пороков развития и даже гибели
плода.
Боррелиоз Лайма относится к зоонозам, при которых инфекцион-
ный агент циркулирует между клещами и большим кругом позвоноч-
ных животных, являющихся резервуаром боррелии в природе. Глав-
ными переносчиками инфекции являются иксодовые клещи. Значение
болезни постоянно возрастает в связи с выявлением ранее неизвест-
ных очагов, заносом птицами зараженных клещей на новые террито-
рии, расширением распространения и ростом численности переносчи-
ка в результате экологических изменений, а также процессами мас-
сивной миграции людей. Антропогенные воздействия (озеленение,
очистка лесов, увеличение пригородного строительства и т.д.) приве-
ли к мозаичному распространению лесов, что создало благоприятные
условия для клещей и их прокормителей [12]. Зараженные клещи по
парковым коридорам проникают из пригородных лесов в городские
парки, создавая угрозу городскому населению. Значительная часть
заражения людей в России происходит в пригородной зоне и на садо-
во-огородных участках.
Потенциальный риск заболеть БЛ для проживающих в эндемичном
районе определяется комплексом факторов. Большое значение для
оценки степени риска заражения имеют такие аспекты, как идентифи-
кация резервуара (хозяев) спирохет, характеристика переносчиков —
инфицированных клещей, плотность инфицирования векторных кле-
щей, векторные способности клещевых штаммов боррелий и геогра-
фическое распределение генотипов боррелий. Значение этих факторов
можно продемонстрировать на примере изучения резервуара спирохет
и взаимоотношения клещей с их прокормителями. В разных геогра-
фических зонах существует множество видов иксодовых клещей, ко-
торые избирательно питаются на разных видах прокормителей. На-
пример, морские птицы являются прокормителями клещей Ixodes urea,
инфицированных боррелиями, и, мигрируя между Северным и Южным
полушариями, могут через клещей обмениваться спирохетами и раз-
носить их в различные географические зоны. Предполагается суще-
ствование «немых» природных очагов боррелиоза, где боррелия цир-
кулирует, но болезнь у человека возникает нечасто, поскольку пере-
носчики в очаге редко нападают на человека. Несмотря на то что в
таких «немых» очагах боррелии не представляют существенной уг-
розы для здоровья людей, их циркуляция демонстрирует комплексность
экологии этого микроорганизма и разнообразие экологических ниш,
оккупируемых этими спирохетами [13].
Иксодовые клещи являются переносчиками возбудителей многих
152
заболеваний, включая вирус клещевого энцефалита и более 100 ар-
бовирусов. Клещи могут быть инфицированы паразитами Babesia
microti, возбудителем эрлихиоза (риккетсиями), пятнистой лихорадки
Скалистых гор и рядом других микроорганизмов, которые могут пе-
редаваться как изолированно, так и совместно с боррелиями. Приса-
сывание клеща оказалось общим фактором риска для бактериальных,
вирусных и протозойных инфекций, что ставит вопрос о необходимо-
сти изучения микст-инфекций.
Биология возбудителей иксодовых клещевых боррелиозов находит-
ся в процессе активных исследований. Изучение структуры боррелии
и ее генома привело к выявлению большого полиморфизма в строе-
нии поверхностных белков в циркулирующих штаммах. Было пока-
зано, что конкретные различия в поверхностных белках обусловли-
вают такие особенности биологических свойств, как скорость роста,
вирулентность, восприимчивость к бактерицидному действию нор-
мальной сыворотки, стимуляция моноцитов и лимфоцитов к выработ-
ке биологически активных субстанций, выраженность иммуногенных
свойств и многие другие, что в итоге приводит к разному проявлению
патологических реакций [19]. Это позволило приблизиться к расшиф-
ровке молекулярного базиса таких общих свойств микробов, как ин-
вазивность, органотропизм и персистенция.
В составе B.burgdorferi было выявлено более 100 различных бел-
ков [17]. Белки, наиболее постоянно вступающие в реакцию с сыво-
ротками больных БЛ, имеют значительно различающуюся молекуляр-
ную массу, но только некоторые из них охарактеризованы в отноше-
нии функции, иммунодиагностической значимости и иммунопротектив-
ных свойств. Так, были обнаружены общие антигенные детерминан-
ты у флагеллярного белка боррелий и миелиновых волокон перифе-
рических нервов, нервных клеток и аксонов ЦНС, миоцитов сердеч-
ной мышцы и некоторых клеток эпителия, включая синовию, т.е. имен-
но тех тканей, которые наиболее часто поражаются при БЛ [4]. Мо-
ноклональные антитела к одному из жгутиковых эпитопов (Н9724)
перекрестно реагируют с аксонами нервных клеток человека. Анти-
аксональная направленность антифлагеллярных антител создает ус-
ловия для реализации феномена молекулярной мимикрии, играющего
роль в патогенезе неврологических проявлений болезни [22]. Предпо-
лагается, что антитела, продуцируемые к белкам теплового шока
боррелии, перекрестно реагируют с человеческими аналогами, что
может вести к аутоиммунному воспалению, в частности, в суставе [21].
Большой интерес вызвало открытие различных патогенетических по-
тенциалов и органотропизма различных серотипов боррелии. Выска-
зывается гипотеза о том, что доминантное распознавание Т-клетками
артритогенного эпитопа OspA может быть одним из механизмов, вов-
леченных в патогенез артрита. Авторы этой гипотезы показали, что
Т-лимфоциты больных с резистентным хроническим лайм-артритом ре-
агировали преимущественно с OspA. Более того, обнаружен общий для
всех пациентов распознаваемый эпитоп — область между аминокис-
153
лотами от 84 до 113, который, как полагают, является артритоген-
ным эпитопом [16]. Можно предполагать общность эпитопа OspA с еще
не расшифрованным аутоантигеном, содержащимся в синовии. Обна-
ружение определенного оганотропизма у разных штаммов возбудите-
ля направило ученых на поиски молекулярного базиса этого феноме-
на в надежде на то, что это может привести к пониманию механизмов
патогенеза патологических процессов, инициируемых микробами.
Большое значение имело воспроизведение разнообразных моделей
боррелиоза у животных — от бессимптомной инфекции с интенсивным
иммунным ответом до различных изолированных органных (артрит,
кардит) и системных форм.
Определение антител к белкам боррелий широко применяется в
серодиагностике БЛ. Иммунный ответ к некоторым белкам является
протективным, поэтому среди них идет активный поиск кандидатов
для вакцины. Уже созданы рекомбинантные протеины, ставшие пер-
вым вариантом вакцины против БЛ. Некоторые вакцины уже исполь-
зуются в ветеринарии, а также прошли первые испытания на добро-
вольцах [28].
В процессе изучения выявилось существенное фенотипическое (ан-
тигенное) и генотипическое разнообразие возбудителей БЛ. Примене-
ние современных молекулярно-биологических методов позволило в
настоящее время четко различить 10 геновидов, которые объединены
в комплекс под названием Borrelia burgdorferi sensu lato. Основными
возбудителями БЛ, широко распространенными и патогенными для
человека, являются первые три вида, роль остальных точно не уста-
новлена. Современные данные по таксономии бактерий рода Borrelia
дали основание для эпидемиологической классификации боррелиоз-
ных заболеваний человека. Среди них выделены иксодовые клеще-
вые боррелиозы, к которым, помимо собственно БЛ, вызываемой
В. burgdorferi sensu stricto (s.s.), относят и ряд других этиологически
самостоятельных заболеваний [2].
Большой интерес вызывает географическая карта распределения
генотипов. Практически единственным в США является генотип
В.burgdorferi s.s., который значительно реже встречается в Европе и
пока не обнаружен в Азии. B.garinii и B.afzelii — наиболее распро-
страненные варианты в Евразии, но они никогда не встречаются в
США. Распространение непатогенной B.japonica ограничено исклю-
чительно Японией [20]. При этом в одном клеще уже обнаружены
боррелии, принадлежащие к различным генотипам, например B.garinii
и B.afzelii. Оказалось, что это совсем нередкая клиническая ситуа-
ция. Так, у 8 из 18 пациентов с нейроборрелиозом в биологических
жидкостях обнаружены два геновида боррелий, что позволило авто-
рам говорить о плюриинфекции [11].
Важность определения спектра циркулирующих генотипов объяс-
няется в первую очередь тем, что обнаружены значительные различия
в иммунологических свойствах региональных популяций. На экспе-
риментальных животных продемонстрировано, что антитела к штам-
154
му B.burgdorferi из одной географической зоны не предотвращали
развития инфекции при инокуляции боррелий, изолированных в дру-
гой географической зоне [15]. По-видимому, известный клинический
полиморфизм болезни, послужившей в свое время основанием назвать
ее «великим имитатором», отчасти может быть обусловлен тем, что
определенный геновид возбудителя вызывает определенный клиничес-
кий симптомокомплекс. Было показано, что хронический боррелиоз
кожи ассоциируется преимущественно с B.afzelii; B.burgdorferi s.s.
обладает более выраженным артритогенным потенциалом, a B.garinii
свойственна выраженная тропность к нервной ткани, что чаще ассо-
циируется с нейроборрелиозом [7, 27]. Обширные данные литературы
позволяют говорить о том, что генотипические и антигенные разли-
чия возбудителей определяют особенности патогенеза и клиники за-
болеваний, которые вызываются разными геновидами. Важный прак-
тический вывод из этого состоит в том, что для серодиагностики Б Л
в США можно использовать только один типовой штамм (геновид), а
в Европе — три патогенных геновида. В табл. 13.1 приведены соб-
ственные результаты тестирования сывороток пациентов с лаймовс-
ким боррелиозом в Институте ревматологии РАМН, демонстрирую-
щие различное реагирование с тремя генотипами боррелии, циркули-
рующими в разных регионах земного шара. Эти данные подтвержда-
ют, что для России нужны тест-системы на основе отечественных
штаммов и их стандартизация, а также собственные критерии серо-
позитивности.
Таблица 13.1. Частота (%) реагирования в иммуиоблоте IgG-антител с диа-
гностически значимыми антигенами боррелий разных генотипов в сыво-
ротках 86 пациентов с боррелиозом Лайма
Число (%) сывороток, реагирующих с белками
белки (kDA) B.burgdorferi (В31) B.afzelii (IP-3) B.garinii (IP-90)
18 9(10,5) 14(16,3) 14(16,3)
23 7(8,1) 8 (9,3) 15(17,4)
28 11 (12,8) 25(29,1) 9(10,5)
30 П (12,8) 8 (9,3) 14(16,3)
37 8(8,1)* 7(8,1)* 23 (26,7)*
39 18(20,9)** 42 (48,8)** 27 (31,4)**
41 43 (50,0) 41 (47,7) 35 (40,7)
45 33 (39,3) 19(22,1) 20 (23,3)
58 34 (39,5) 37 (43,0) 26 (30,2)
66 13(15,1) 21 (24,4) 14(16,3)
93 20 (23,3) 23 (26,7) 25 (29,1)
* Р,,_3 = 0,002.
** Р,_, = 0,002, Р2 3 = 0,03.
155
Доказана различная чувствительность к антибиотикам разных
штаммов боррелии, что ставит вопрос о разработке индивидуальных
схем терапии для конкретных регионов. Еще более важным предста-
ет вопрос о вакцине. По-видимому, в России нужна вакцина, приго-
товленная на основе тех штаммов, которые в ней циркулируют. В свя-
зи с этим для России ключевое значение имеет вопрос о том, какие
именно геновиды B.burgdorferi в ней распространены. Исследование
более чем 300 изолятов (из клещей) с территории России показало до-
минирующее распространение B.afzelii и B.garinii, при этом
B.burgdorferi s.s. не обнаружена совсем [3].
За 20 лет ученые прошли путь от описания отдельных проявлений
болезни до вакцинации против иксодовых клещевых боррелиозов. Ча-
стная ревматологическая проблема (лайм-артрит) трансформирова-
лась в мультидисциплинарную проблему, имеющую большое социаль-
ное значение для стран Северного полушария. При этом ревматоло-
гические проявления и экспериментальный лайм-артрит остаются в
центре внимания исследователей, так как являются уникальной моде-
лью изучения патологических реакций, инициируемых инфекционным
агентом.
СПИСОК ЛИТЕРАТУРЫ
1. АнаньеваЛ.П. Лаймская болезнь//Руководство по внутренним болезням.
Ревматические болезни./Под ред. В.А.Насоновой, Н.В. Бунчука. — М.:
Медицина, 1997. — С. 344—353.
2. Коренберг Э.И. Инфекции группы лайм-боррелиоза — иксодовые кле-
щевые боррелиозы в России // Мед. паразитол. — 1996. — № 3. — С.
14—18.
3. Коренберг Э.И. Резервуарные хозяева и переносчики боррелий — воз-
будителей иксодовых клещевых боррелиозов в России // Журн. микро-
биол. — 1997. — № 6. — С. 36—38.
4. Aberer Е.> Brunner С., Suchanek G. et al. Molecular mimicry and Lime
borreliosis*, a shared antigenic determinant between Borrelia burgdorferi
and human tissue // Ann.Neurol. — 1989. — Vol. 26(6). — P. 732-737.
5. Anonimous. Centers for Disease Control: case definitions for public health
surveillance// Morbidity Mortality Weekly Report. — 1990. - - Vol. 39. —
P. 19—21.
6. Asbrink E., Hovmark A. Early and late cutaneous manifestations of Ixodes-
borne borreliosis (etythema migrans borreliosis, Lyme borreliosis //Ann.
N.Y. Acad. Sci. — 1988. — N 3. — P. 30—33.
7. Assous M. И, Pos tic D., Paul G. et al. Western blot analysis of sera from
Lyme borreliosis patients according to the genomic species of the Borrelia
strains used as antigens // Europ. J. clin. Microbiol. Infect. Dis. — 1993. —
Vol. 12, N 4.— P. 261—268.
8. Benach J.L., В osier E.M., Hanrahan J.P. et al. Spirochetes isolated from the
blood of two patients with Lyme disease //New Engl. J. Med. — 1981. —
N 308. — P. 740—742.
9. Berger В. ИК Dermatologic aspects //Lyme disease / Ed. P.Coyle. — Mosby:
Year Book, 1993. — P. 69—72.
156
10. Burgdorfer W., Barbur A.G., Hayes S.F. et al, Lyme disease - a tick-borne
spirochetosis? //Science. — 1982. — Vol. 216. — P. 1317—1319.
11. Demaerschalck I., Ben Messaoud A„ De Kesel M, et al. Simultaneous presence
of different Borrelia burgdorferi genospecies in biological fluids of Ly-
me disease patients //J. clin. Microbiol. — 1995. — Vol. 33(3). — P. 602—
608.
12. Fish D., Des Vignes F, Schwartz I, et al. Epidemiology of Lyme disease
and human erlichiosis in the Northeastern USA // Intern. Sci. Conf. «Tick-
borne viral, ricketts and bact. infections». — Irkutsk: Abstract book, 1996.
— P. 65—67.
13. Gern L., Humair P.E The natural history of Lyme borreliosis //Symposium
on the Pathogenesis and Management of Tick-Borne Diseases //Ed.
G.Stanek, F. Strle. — 28—30 Sept. 1998, Vien, 1998. — P.8.
14. Johnson R.C., Schmid G.P., Hyde F.W. et al. Borrelia burgdorferi sp. nov.:
etiological agent of Lyme disease// Int. J. Sys. Bacteriol. — 1984. —
Vol. 34. — P. 496—497.
15. Johnson R.C., Kodner C., Russel M. et al. Experimental infection of the
hamster with Borrelia burgdorferi// Ann. N.Y. Acad. Sci. — 1988. —
Vol. 539. — P. 258—263.
16. Kamradt T.f Lengl-Janssen B., Strauss A.F. et al. Dominant recognition of
Borrelia burgdorferi outer surface protein A by T-helper cells in patients
with treatment resistent Lyme arthritis //Infect and. Immun. — 1996. —
N 64(4). — P. 1284-1289.
17. Luft B.J., Bosler E.M.> Dattwyler R.J. Diagnosis of Lyme borreliosis //
Current Communications in Cell and Molecular Biology. — N 6. Lyme
disease: Molecular and Immunologic Approaches/ Ed. S.E.Schutzer. —
Cold Spring Harbor Laboratory Press, 1992. — P. 317—325.
18. Reik L. Neurologic aspects of North American Lyme Disease// Lyme disease.
Ed. P.Coyle. — Mosby: Year Book, 1992. — P. 101—114.
19. Rosa P.A. Microbiology of Borrelia burgdorferi// Sem. Neurol. — 1997. —
Vol. 17. —P. 5—10.
20. Postic D., Korenberg E., Gorelova N. et al. Borrelia burgdorferi sensu lato
in Russia and neighbouring countries: high incidence of mixed isolates //
Res. Microbiol. — 1997. — Vol. 148. — P. 691—702.
21. Shanafelt V.C., Hindersson P.t Soderberg C. et al. T-cells and antibody
reactivity with Borrelia burgdorferi 60-kd heat schock protein in Lyme
arthritis //J. Immunol. — 1991. — Vol. 146. — P. 3985—3992.
22. Sigal L.#.//Immunologic mechanisms in Lyme neuroborreliosis: the
potential role of autoimmunity and molecular mimicry // Sem. Neurol. —
1997. —Vol. 17. —P. 63—68.
23. Stanek G., O'Connell S., Cimmino M. et al. European Union concerted action
on risk assessment in Lyme borreliosis: clinical definition for Lyme
borreliosis// Wien Klin. Wschr. — 1996. — Vol. 108. — P. 741—747.
24. Steere A.C.> Malawista S.E., Snydman D.R. et al. Lyme arthritis: an epidemic
of oligoarthicular arthritis in children and adults in three Connecticut
communities// Arthr. Rheum. — 1977. — Vol. 20. — P. 7—17.
25. Steere A.C., Grodsziski R.L., Kornblatt A.N. The early clinical manifestations
of Lyme disease //New Engl. J. Med. — 1983. — Vol. 309. — P. 733—740.
26. Steere A.C. Lyme disease // New Engl. J. Med. — 1989. — Vol. 321. —
P. 586—596.
27. Van Dam A.P., Kuiper H, Vos K. et al. Different genospecies of Borrelia
157
burgdorferi are associated with distinct clinical manifestations of Lyme
borreliosis// Clin. Infect. Dis. — 1993. — Vol. 17. — P. 708—717.
28. Van Hoecke C., Fu D., De Grave D. et al. Evaluation of a lipoprotein OspA
vaccine administered following a 0,1 month primary vaccination course with
a booster at month 12//Abstracts of VII International Congress on Ly-
me Borreliosis. — San Francisco, California, USA, June 16—21, 1996.—
Hl 425.
29. Vlay S.C. Cardiac manifestations //Lyme disease /Ed. P. Coyle. — Mosby:
Year Book, 1993. — P. 86—92.
30. Wittpenn J.R., Sibony R.A. Ophthalmic Manifestations //Lyme disease /Ed.
P. Coyle. — Mosby: Year Book, 1993. — P. 93—100.
Лекция 14
НЕКОТОРЫЕ АСПЕКТЫ
РЕВМАТОЛОГИИ ДЕТСКОГО
И ПОДРОСТКОВОГО ВОЗРАСТА
Канд. мед. наук О.М.Фоломеева (Институт ревматологии
РАМН)
Знаменитому французскому ученому и мыслителю Пьеру Ланже-
вену принадлежит образное выражение о том, что человека на раз-
ных возрастных этапах жизни нельзя уподоблять вложенным друг в
друга «русским матрешкам», различающимся только своим объемом.
Каждый возраст характеризуется свойственным только ему качествен-
ным своеобразием, проявляющимся как в здоровом организме, так и
во время болезни.
Важнейшим, буквально «судьбоносным» периодом являются пер-
вые два десятилетия человеческой жизни. За это время человек при-
спосабливается к совершенно новым условиям существования (пери-
од новорожденности), растет и развивается, увеличиваясь в массе в
10 раз и более (период детства) и, наконец, переживает сложнейшую
нейроэндокринную и иммунную перестройку препубертатного и пу-
бертатного периода (подростковый возраст). Последняя заканчивает
анатомическое и функциональное формирование организма. Человек
«готов» к жизни как биологический и социальный объект, как лич-
ность, как будущий продолжатель рода.
Для выполнения столь сложных задач природа располагает огром-
ным биофизиологическим потенциалом. Механизмы его насколько
сложны и совершенны, настолько хрупки и уязвимы для воздействия
множества факторов, как эндогенных, так и экзогенных.
Поэтому здоровье детей и подростков всегда находится в центре
внимания научной и практической медицины. Не случайно эта про-
158
блема названа в июле 1998 г. среди 14 основных направлений дея-
тельности Всемирной организации здравоохранения в XXI в. Прошед-
шая в те же сроки расширенная Коллегия Министерства здравоохра-
нения Российской Федерации была посвящена здоровью подростков
России. Отмечены явные негативные тенденции: рост общей заболе-
ваемости среди подростков за последние 5 лет почти на 30 %, смена
процесса акселерации децелерацией с замедлением физического раз-
вития, дефицитом массы тела (на примере 17-летних москвичей, у 18—
20 % которых выявлена гипотрофия), снижением функциональных
возможностей растущего организма. Те или иные хронические забо-
левания имеют 60 % юношей и до 80 % девушек, оканчивающих
школу в последние годы XX столетия.
Не явились исключением и ревматические заболевания (РЗ): за 5
последних лет официально зарегистрированная общая «ревматичес-
кая» заболеваемость среди российских детей увеличилась на 30 %, а
среди подростков — почти на 48 %.
РЗ подстерегает человека буквально со дня появления на свет.
В дальнейшем по мере роста и развития ребенка опасность развития
того или иного ревматического заболевания возрастает. Рамки насто-
ящей лекции не позволяют подробно остановиться на причинах и слож-
ных механизмах, ответственных за формирование «детской и подрос-
тковой ревматологии». Напомним лишь основные звенья нейроэндок-
ринных и иммунных взаимодействий препубертатного и пубертатно-
го возраста, на фоне которых разворачивается ревматическое забо-
левание.
При достижении определенной зрелости нейроэндокринной систе-
мы ребенка в ведущем для этих процессов органе — гипоталамусе —
начинают вырабатываться рилизинг-факторы, индуцирующие гормо-
нальную деятельность передней доли гипофиза [6]. Тропные гормоны
последнего действуют не только на половые железы, надпочечники и
щитовидную железу, но и на иммунокомпетентные органы (тимус и
через него — костный мозг), вырабатывающие иммунные клетки (Т-
и В-лимфоциты) [9]. В этот же период онтогенеза проявляется извест-
ная иммуномодулирующая роль половых гормонов: усиливающий
эффект эстрогенов и тормозящий — андрогенов. С последним меха-
низмом связывается феномен полового диморфизма, становящийся
очевидным при многих РЗ именно с периода препубертата и пубер-
тата.
Важнейшее значение в регулировании взаимодействия клеток им-
мунной, кроветворной, нервной и эндокринной систем имеют, кроме
гормонов, также различные цитокины. Установлено, что в организме
ребенка существует своеобразный физиологический защитный барь-
ер, обеспечивающий известную уравновешенность регуляторных осей.
В препубертатном и пубертатном возрасте действие защитных систем
снижается. Возникает реальная возможность разрегулирования взаи-
моотношений в структурах осей гипоталамус — гипофиз — надпочеч-
ники — гонады — тимус, связанных с их неустойчивостью, неодно-
159
временностью созревания, несвоевременностью активации или по-
давления различных клеточных и гуморальных механизмов. Так, в
период подростковой перестройки могут возникать состояния, бла-
гоприятствующие развитию или обострению аутоиммунных ревма-
тических заболеваний: подавление апоптоза, транзиторные иммуно-
дефицитные эпизоды, относительный дефицит кортизола и др. [7].
Поэтому становится понятным, почему при многих РЗ именно в под-
ростковом периоде наблюдаются наиболее тяжелые, быстропрогрес-
сирующие варианты заболеваний, тогда как в детском возрасте не-
редко отмечается относительно благоприятное течение процесса с
лучшим прогнозом.
Какие же РЗ угрожают человеку в первые два десятилетия его
жизни? Обратимся к Международной статистической классификации
болезней X пересмотра (МКБ X). РЗ, в соответствии с современны-
ми представлениями о сущности ревматологии, составляют основу
XIII класса болезней: «Болезни костно-мышечной системы и соедини-
тельной ткани (БКСМ)». В отечественной ревматологии к РЗ тради-
ционно относятся также острая ревматическая лихорадка и хроничес-
кие ревматические болезни сердца, входящие в IX класс МКБ: «Бо-
лезни системы кровообращения». И, наконец, в классе XVI («Отдель-
ные состояния, возникающие в перинатальном периоде») выделяется
редкая патология новорожденных, развивающаяся в связи с опреде-
ленными иммунологическими нарушениями у страдающей ревматичес-
ким заболеванием матери.
Итак, РЗ, представленные в МКБ X, можно условно представить
следующим образом.
А. РЗ, присущие только детям и подросткам («специфические» по
отношению к этому возрасту):
Класс XIII.
М08. Ювенильный артрит.
МЗО.З. Болезнь Кавасаки (слизисто-кожный лимфонодулярный
синдром).
М42.0 Ювенильные остеохондропатии позвоночника.
М91—92. Ювенильные остеохондропатии других костей.
Класс XVI.
Р008. Поражение плода и/или новорожденного, обусловлен-
ное состоянием матери (волчанка новорожденных и др.)
Б. РЗ, развивающиеся (встречающиеся) преимущественно в пер-
вые десятилетия жизни человека:
Класс IX.
100—102. Острая ревматическая лихорадка.
Класс XIII.
МО 1.4. Артрит при краснухе.
МО 1.5. Артрит при эпидемическом паротите.
М35.7. Гипермобильный синдром.
160
В. РЗ, встречающиеся в других возрастных группах, но у детей и под-
ростков отличающиеся особенностями, обусловленными спе-
цифическими анатомо-физиологическими и иммунными свойства-
ми растущего организма. Многие из этих нозологий имеют опре-
деление «ювенильный».
Класс XIII.
МО 1.2. Артрит при болезни Лайма.
М08.1. Ювенильный анкилозирующий спондилоартрит.
М09. Ювенильный артрит при псориазе, болезни Крона, яз-
венном колите.
М30.2. Ювенильный узелковый полиартериит.
М32. Системная красная волчанка (СКВ).
М33.0. Ювенильный дерматомиозит.
М34. Системная склеродермия (ССД).
У детей и подростков могут развиваться и многие другие воспали-
тельные и дегенеративные заболевания из класса БКМС (например,
другие системные васкулиты, реактивные артриты, различная приоб-
ретенная патология суставов, костей и мягких тканей и др.). Но есть
заболевания и патологические состояния, относящиеся к XIII классу
МКБ, практически не встречающиеся у лиц моложе 20 лет (например,
первичный остеоартроз, подагра, анкилозирующий гиперостоз, рев-
матическая полимиалгия и др.).
Кратко остановимся на характеристике возрастных особенностей
некоторых заболеваний, включенных в каждую из 3 вышеназванных
условных групп РЗ, основываясь на исследованиях последних лет.
Группу «А» открывает рубрика МО 8. — ювенильный артрит (кстати,
неправильно названный в русском переводе МКБ X «юношеским»).
Дефиниция этой рубрики — артрит у детей, начавшийся до 16-летне-
го возраста и длящийся более 3 мес, т.е. определяющим признаком
оказывается именно возраст начала заболевания. В рубрику включен
целый ряд воспалительных суставных заболеваний детей и подрост-
ков, имеющих в МКБ X собственный 4-значный шифр:
М08.0 — Ювенильный ревматоидный артрит (ЮРА) (с ревматоидным
фактором и без него); М08.1. — Ювенильный анкилозирующий спонди-
лоартрит; М08.2. — Ювенильный артрит с системным началом (болезнь
Стилла); М08.3. — Ювенильный серонегативный полиартрит (ювениль-
ный хронический артрит—ЮХА); М08.4. — Пауциартикулярный юве-
нильный артрит; М08.8. — Другие ювенильные артриты; М08.9. —
Ювенильные артриты неуточненные. На примере данной рубрики вид-
но, что у детей и подростков, с одной стороны, выделяются воспалитель-
ные ревматические заболевания, сходные с таковыми у взрослых, но име-
ющие определенные возрастные особенности. К ним можно отнести се-
ропозитивный и серонегативный ЮРА и ювенильный анкилозирующий
спондилоартрит. С другой стороны, имеется ряд особых, специфических
для юного возраста нозологически самостоятельных суставных заболе-
ваний: болезнь Стилла, ЮХА, пауциартикулярный ювенильный артрит.
161
И наконец, возможны ситуации, когда нозологическая сущность
заболевания еще не сформировалась и состояние может быть обозна-
чено как «другие» или «неуточненные» ювенильные артриты. Таким
образом, каждая форма ювенильного артрита получила свое имя и
свой статистический код.
Нам представляется, что данная Международная классификация
ювенильного артрита является определенным шагом вперед в реше-
нии спорного вопроса о номенклатуре и классификации ювенильных
артритов. Она закрепляет дебатируемое в течение ряда лет представ-
ление о нозологической, а возможно, и этиопатогенетической само-
стоятельности каждого из входящих в рубрику «ювенильные артри-
ты» заболеваний, не оставляя за ними статуса «вариантов течения
ЮРА, или ЮХА». И наконец, термин «ЮХА» (или как синоним —
«ювенильный серонегативный полиартрит») используется для обозна-
чения самостоятельной нозологической формы ювенильного артрита.
Последнее положение может быть подтверждено, в частности, недав-
ней работой Е.Ю.Логиновой и соавт. [3]. При изучении 83 больных
ювенильным артритом, достигших взрослого возраста, авторы пока-
зали их нозологическую неоднородность, выявившуюся при длитель-
ном проспективном наблюдении. При этом к концу наблюдения, по-
мимо больных, удовлетворявших критериям либо ЮРА, либо ювениль-
ного анкилозирующего спондилоартрита, сформировалась группа из
9 человек, имевших одновременно выраженный (III—IV стадии) пе-
риферический эрозивный полиартрит и определенный (III—IV стадии),
обычно двусторонний сакроилеит. Этих больных объединяли полиар-
тритический дебют в раннем детском возрасте, высокая воспалитель-
ная активность, нередкое наличие лихорадочного синдрома и систем-
ных проявлений, не исключалось развитие увеита. Все больные были
серонегативными по РФ и не являлись носителями HLA-B27. В отдель-
ных случаях непостоянно и в невысоких титрах выявлялся АНФ. Ав-
торы обоснованно считают, что изученная ими группа больных отно-
сится к особой нозологической форме — «ювенильный серонегатив-
ный полиартрит», или «ювенильный хронический артрит», представ-
ленной в МКБ X под шифром МО 8.3.
Второй представитель сугубо ювенильных РЗ — болезнь Каваса-
ки — не является актуальной для России проблемой, ибо встречается
преимущественно среди детского населения желтой расы. Она отно-
сится к статистической группе узелкового полиартериита и родствен-
ных состояний и определяется как артериит, поражающий крупные,
средние и мелкие артерии, сочетающийся с кожно-слизисто-лимфати-
ческим синдромом. Именно сосудистая патология, вплоть до разры-
вов коронарных аневризм и развития коронаротромбозов, является
причиной возможных летальных исходов у заболевших детей.
Весьма существенную проблему детского и подросткового возра-
ста представляют ювенильный остеохондроз позвоночника и много-
численные остеохондропатии костей и суставов, обозначаемые либо
по локализации патологического очага, либо по имени описавших их
162
врачей (например, остеохондроз головки бедренной кости — Легга—
Калве—Пертеса, подвздошного гребешка — Бьюкенена, головки пле-
чевой кости — Хааса, головок костей пястья — Моклера, проксималь-
ного конца большеберцовой кости — Бланта и др.). Ревматологу сле-
дует не забывать об этих своеобразных локальных дегенеративно-дис-
трофических процессах в костной ткани и при подозрении на их разви-
тие вовремя направлять детей и юношей к специалисту-ортопеду.
В группу состояний, встречающихся только у детей, мы отнесли,
как отмечено выше, своеобразную патологию новорожденных, рож-
денных от матерей, имеющих одно из системных поражений соедини-
тельной ткани (СКВ, болезнь Шегрена, смешанное заболевание со-
единительной ткани, реже РА). Эти новорожденные могут иметь сим-
птомы «пассивно приобретенного аутоиммунного заболевания». Уп-
рощенный механизм развития данной патологии — трансплацентар-
ный перенос аутоантител от матери к плоду. Наиболее изученной
является «волчанка новорожденных», связываемая с наличием у боль-
ной матери антител к растворимому рибонуклеопротеиду — Ro/SSA
и La/SSB. Наиболее опасное проявление синдрома — поперечная бло-
када сердца, могущая стать причиной гибели плода/новорожденного.
Поданным Европейской ассоциации педиатров, на 600 беременнос-
тей у матерей с одним из указанных выше системных ревматических
заболеваний приходится до 10 детей с поперечной блокадой сердца.
В последние годы появляются сообщения о том, что при трансплацен-
тарной передаче других патологических аутоантител — антикардио-
липиновых, связываемых с формированием первичного и вторичного
антифосфолипидного синдрома у матери, возможно развитие тяжелой
сосудистой патологии новорожденных, вплоть до инсультов.
Первое отечественное описание волчанки новорожденных относит-
ся к 1983 г. [1]. Нами с 1979 г. наблюдалась 20-летняя женщина, у
которой в течение 3 лет отмечались эпизоды лихорадки, артритов,
преходящей эритемы лица, протеинурия, увеличенная СОЭ. Система-
тического обращения к врачу больная избегала, патогенетической
терапии не получала. В 1979 г. женщина родила мальчика с попереч-
ной блокадой сердца II степени, которому в возрасте 12 лет был ус-
тановлен водитель ритма. Вскоре после родов, вызвавших выражен-
ное обострение, больной в Институте ревматологии был установлен
диагноз системной красной волчанки в сочетании с синдромом Шег-
рена («бабочка», неэрозивный полиартрит, нефрит, а также рециди-
вирующий паренхиматозный паротит, ксеростомия, геморрагическая
пурпура, гипергаммаглобулинемия, LE-клетки, АНФ+, РФ+) и нача-
та терапия преднизолоном в дозе до 40 мг/сут. Поддерживающая
доза — 10 мг/сут. Через 10 лет на фоне относительной клинической
ремиссии женщина родила 2-го ребенка — девочку, у которой в воз-
расте от 2 до 5 мес наблюдались кожные проявления в виде эритемы
на лице в форме «бабочки» и фотосенсибилизация. Указанные симп-
томы прошли без лечения к полугоду жизни, т.е. произошла обычная
инволюция, связываемая с исчезновением из кровотока ребенка пас-
163
сивно переданных аутоантител матери. Следует отметить, однако, что
целенаправленное исследование сыворотки больной во время 2-й бе-
ременности на наличие анти-Ro- и анти-Ьа-антител дало отрицатель-
ный результат, что свидетельствует об отсутствии однозначной пря-
мой связи между этими антителами и неонатальной волчанкой. Дан-
ный пример демонстрирует, как определенное аутоиммунное заболе-
вание матери может вызывать внутриутробное (1-й ребенок) или по-
стнатальное (2-й ребенок) развитие патологии, известной как волчан-
ка новорожденных.
Среди РЗ, свойственных преимущественно детскому и подростко-
вому возрасту (группа «Б»), находится, во-первых, хорошо известная
острая ревматическая лихорадка, или первичный ревматизм, соглас-
но традиционной отечественной номенклатуре. Не случайно возраст
начала заболевания 7—15 лет рассматривается как важнейший кри-
териальный диагностический признак.
К этой же условной группе можно отнести вторичный, по сути
реактивный артрит, развивающийся у некоторых больных с такими
«детскими болезнями», как краснуха и эпидемический паротит, и ис-
чезающий по мере выздоровления от данной вирусной инфекции.
В детском и подростковом возрасте может проявиться особая сис-
темная патология соединительной ткани, известная как гипермобиль-
ный синдром, или синдром излишней подвижности, разболтанности,
обозначаемый иногда как «семейная слабость связок». За, казалось
бы, безобидной гибкостью ребенка, его способностью без усилий вы-
полнять необычные движения в суставах, свидетельствующие об их
разболтанности и склонности к чрезмерному переразгибанию, может
лежать наследуемый дефект коллагена, приводящий к гиперэластич-
ности и сверхрастяжимости кожи, сухожилий и других соединитель-
нотканных структур. Отсюда — нередкая при указанном синдроме
вторичная патология в виде опущения внутренних органов, пролапса
клапанов сердца, выраженного сколиоза, плоскостопия, склонности
к повторным подвывихам и вывихам суставов и др. Гипермобильный
синдром с повторной микротравматизацией суставов выступает как
фактор риска развития раннего артроза. Поэтому детям и подросткам
с признаками гипермобильности должен быть рекомендован щадящий
двигательный режим. Не следует усугублять их врожденную гибкость
занятиями балетом, художественной гимнастикой, акробатикой. Це-
лесообразны упражнения, направленные на укрепление и развитие
мышечной массы, регулярный массаж, плавание.
В последнюю условно выделенную статистическую группу («В»)
мы отнесли РЗ, встречающиеся у лиц разного возраста, но имеющие у
детей и подростков некоторые особенности по сравнению со взрос-
лыми больными, которые следует учитывать и в диагностике, и в те-
рапии. Кратко остановимся на них, располагая нозологии в порядке
представления их в МКБ X.
Так, изучая боррелиоз Лайма у детей, В.Г.Барскова и соавт. [2]
показали, что по сравнению со взрослыми больными у первых в 3 раза
164
чаще встречается «гриппоподобный дебют» болезни, но достоверно
реже развиваются вторичная эритема, суставной синдром и опре-
деляется серопозитивность к антигенам B.burgdorferi. Тщательно об-
следовав и проследив в динамике 90 заболевших анкилозирующим
спондилоартритом в детском возрасте больных, И.П.Никишина и
Н.Н.Кузьмина установили [5], что ювенильный анкилозирующий
спондилоартрит, удовлетворяя в развернутой стадии известным кри-
териям анкилозирующего спондилоартрита взрослых, на ранних эта-
пах имеет ряд отличительных черт: преобладание симптомов перифе-
рического артрита при стертости признаков спондилоартрита, раннее
вовлечение сухожильно-связочных структур, манифестирующее боля-
ми в области ягодиц, паховых связок, дактилитами, теносиновитами.
Авторы отметили также факт раннего развития множественных энте-
зопатий, особенно при ювенильном анкилозирующем спондилоартри-
те, развивающихся у детей старше 10 лет. Характеризуя системные
васкулиты у детей, Г.А.Лыскина [4] выделила 2 варианта ювениль-
ного узелкового полиартериита, различающихся по топике васкули-
та, клинике, подходам к лечению и исходам. При преимуществен-
ном поражении периферических сосудов у большинства детей раз-
виваются тромбангиитические осложнения с формированием очагов
сухих некрозов кожи, слизистых оболочек, гангреной пальцев. Вис-
церальная патология при этом варианте ювенильного узелкового по-
лиартериита обычно выражена слабо и не влияет на его исход, но в
общем процесс склонен к длительному хроническому рецидивирую-
щему течению. В лечении этих больных используются ГКС в сочета-
нии с бутадионом, аминохинолиновыми и сосудистыми препара-
тами.
Второй вариант ювенильного узелкового полиартериита, харак-
теризующийся преимущественным развитием системных висцеритов,
близок к типичному узелковому полиартерииту взрослых. Он отлича-
ется тяжелым течением, обусловленным поражением почек с высокой
артериальной гипертензией, абдоминальной ишемией, сосудистыми
церебральными кризами, коронаритом, легочным васкулитом, множе-
ственными мононевритами и др., и имеет высокую летальность. Од-
нако у части таких пациентов существует вероятность развития ре-
миссии без последующих рецидивов. Такая вероятность повышается
в случаях раннего активного применения циклофосфамида в сочета-
нии с невысокими дозами ГКС.
Вторым серьезным представителем статистического класса систем-
ных поражений соединительной ткани является СКВ. Наши многолет-
ние наблюдения показали, что болезнь, развившаяся в период препу-
бертата и пубертата, отличается особой «злокачественностью». Бо-
лее чем у половины подростков она возникает остро, нередко напо-
миная инфекционное заболевание. Типичным для подростковой СКВ
является быстрое, в течение первых недель-месяцев болезни развитие
истинной системности поражения. Последняя характеризуется, поми-
мо «периферической симптоматики» (кожный, трофический, суставной
165
синдромы), также тяжелыми висцеритами (нефрит, поражение ЦНС,
экссудативный полисерозит, кардит и др.).
Ситуация осложняется фактом плохой переносимости подростка-
ми необходимых для подавления высокоактивного аутоиммунного
процесса высоких доз ГКС. Значительная частота и тяжесть развития
различных осложнений и побочных реакций от массивных доз ГКС
связаны во многом с анатомо-физиологическими особенностями орга-
низма подростка, находящегося в периоде сложной нейроэндокринной
и иммунной перестройки.
Не случайно именно подростковая СКВ явилась объектом отработ-
ки оптимальных методов интенсивной терапии: раннее подключение ци-
тотоксических препаратов, пульс-терапия ГКС, экстракорпоральные
методы лечения, программные режимы сочетанной терапии и др.
Показателем тяжести течения СКВ у подростков является высокая
летальность — 55 % (длительное наблюдение в течение 15—35 лет за
137 больными). Примечательно, что целый ряд исследователей, изу-
чая кривые выживаемости больных СКВ разного возраста, отмеча-
ли, что выживаемость детей, заболевших в возрасте до 10 лет, была
заметно выше, чем у заболевших в препубертатном и пубертатном
возрасте.
В этом можно усмотреть действие упоминавшегося выше «физио-
логического барьера», свойственного детскому организму. Известный
оптимизм и уверенность в перспективности дальнейшего изучения
закономерностей развития патологии и совершенствования терапев-
тических подходов при подростковой волчанке вселяют наши наблю-
дения над группой длительно живущих пациентов [62]. 20 из них
(14,5 % от всей группы и 32 % от живущих) в течение 8—23 лет не
нуждаются в лечении. Они ведут нормальную трудовую и семейную
жизнь, имеют детей и рассматриваются нами как выздоровевшие от
СКВ.
Картина ювенильного дерматомиозита состоит из известных для
этой нозологии кожного и мышечного синдромов. Особенностью дет-
ского дерматомиозита является частое присутствие в клинике также
кожных и висцеральных васкулитов, в том числе поражение сосудов
желудочно-кишечного тракта, отягощающее течение и прогноз болез-
ни при остром ее варианте. Основными препаратами для лечения та-
ких форм остаются ГКС в высоких дозах. Раннее адекватное лечение
ювенильного дерматомиозита может привести к практическому выз-
доровлению больного. Тяжелым инвалидизирующим вариантом юве-
нильного дерматомиозита является первично-хроническая болезнь с
множественными контрактурами и нередко обширными кальцината-
ми в мышцах, коже и подкожной клетчатке. Эффективная терапия
этого варианта практически отсутствует.
Системная склеродермия (ССД) редко начинается в ювенильном
возрасте и до последнего времени была малоизученной проблемой.
Однако недавняя работа М.Н.Старовойтовой и Н.Г.Гусевой [8], про-
анализировавших особенности ССД у 60 человек, заболевших в воз-
166
расте от 1 года до 16 лет, заполнила этот пробел. Авторы показали,
что при существенной схожести ССД взрослых и детей последняя от-
личается в целом более благоприятным течением, отсутствием тяже-
лых поражений внутренних органов, более редким развитием синдро-
ма Рейно. Кожный процесс у детей носит, как правило, характер оча-
говой склеродермии. Однако при выраженности последнего и лока-
лизации очагов индурации и склерозирования кожи в области суста-
вов возможно формирование стойких контрактур. Лечение этой фор-
мы ювенильной ССД может ограничиваться аминохинолиновыми,
сосудистыми препаратами, по показаниям — курсами антифиброзных
средств, обязательными физиотерапевтическими и реабилитационны-
ми мероприятиями.
Интересно, что и на примере ССД были выявлены четкие возрас-
тные различия между заболеванием, начавшимся в детском возрасте,
и ССД у подростков. Подростковая ССД, как и целый ряд вышеопи-
санных РЗ, протекает с яркой клинической картиной диффузной скле-
родермии, нередкой склонностью к быстрому прогрессированию, раз-
витием типичного висцерального системного склероза. У четверти
больных подростков выявляются клинико-иммунологические перекре-
сты ССД с другими РЗ: СКВ, дерматомиозитом, РА (overlap-синдром).
Лечение этой группы больных требует активного применения совре-
менных антифиброзных средств, противовоспалительных, иммуномо-
дулирующих и сосудистых препаратов.
Таким образом, круг ревматологических проблем, возникающих
в процессе онтогенетического развития человека, весьма сложен и
имеет многоплановый характер. В нем переплетаются серьезные тео-
ретические и актуальные практические вопросы. Задача ревматоло-
га — знать эту патологию, где возможно — предотвращать ее разви-
тие, уметь вовремя диагностировать и правильно лечить больного,
учитывая его особую возрастную реактивность.
Перед научной ревматологией стоит задача не только дальнейше-
го изучения клинических особенностей и вариантов течения различ-
ных РЗ у детей и подростков, но и раскрытие интимных причин и глу-
бинных механизмов имеющегося возрастного своеобразия. Важнейшей
задачей остается также совершенствование схем и методов лечения
этой категории больных по двум направлениям: достижение макси-
мального эффекта терапии без грубого нарушения физиологических
механизмов роста и развития ребенка и/или подростка.
СПИСОК ЛИТЕРАТУРЫ
1. Алекберова З.С., Фоломеева О.М., Эрдес Ш.Ф. Врожденная блокада сер-
дца и системная красная волчанка//Ревматол. — 1983. — № 3. — С. 56-
59.
2. Бар скова В. Г., Федоров Е.С., Шайков А,В,, Ананьева Л. П. Болезнь Лайма
у детей России //Детск. ревматол. — 1997. — №4. — С. 26—32.
3. Логинова Е.Ю., Мылов Н.М., Амирджанова В.Н., Фоломеева О.М. Сак-
167
роилеит у больных ювенильным артритом //Рос. ревматол. — 1998. —
№2.~С. 18—26.
4. Лыскина Г.А. Системные васкулиты у детей: клиника, диагностика, ле-
чение (узелковый полиартериит, гранулематоз Вегенера, болезнь Бех-
чета, неспецифический аортоартериит): Автореф. дис. ... д-ра мед.
наук. — М., 1994. — 71 с.
5. Никишина И.П., Кузьмина Н.Н. Вопросы диагностики ювенильного ан-
килозирующего спондилоартрита //Детск. ревматол. — 1996. — № 4. —
С. 39—46.
6. Сердюковская Г.II., Антонова Л.Т., Арнолъди И.А. Клиника заболеваний,
физиология и гигиена в подростковом возрасте. — М.: Медицина,
1979.—480 с.
7. Соколов Е.И. Клиническая иммунология. — М.: Медицина, 1998. —
270 с.
8. Старовойтова М.Н., Гусева Н.Г. Клинические особенности ювенильной
склеродермии //Тер.арх. — 1996. — № 3. — С. 24—27.
9. Golsteyn E.J., Fritzler MJ. Review: The role of the thymus-hypothalamus-
pituitary-gonadal axis in normal immune processes and autoimmunity //
J. Rheumatol. — 1987. — Vol. 14. — N 5. — P. 982—990.
Лекция 15
РЕВМАТИЧЕСКИЕ ЗАБОЛЕВАНИЯ
В ПОЖИЛОМ ВОЗРАСТЕ.
НОВЫЕ ФАКТЫ
Д-р мед. наук Н.В.Бунчук, канд. мед. наук А.Г.Бочкова
(Институт ревматологии РАМН)
Ремиттирующий серонегативный симметричный синовит, сопро-
вождающийся мягким отеком. За несколько последних лет список
ревматических заболеваний, присущих исключительно или почти ис-
ключительно людям пожилого возраста, пополнился еще одним —ре-
митгирующим серонегативным симметричным синовитом, сопровож-
дающимся мягким отеком (табл. 15.1).
В 1985 г. известным американским ревматологом D.McCarty и
коллегами, работающими в г.Милуоки (штат Висконсин), был опи-
сан (10 наблюдений) своеобразный артрит [5]. Особенности его были
следующими.
1. Заболевание развивалось остро (в течение нескольких
дней) почти исключительно у лиц пожилого возраста (48—86 лет,
в среднем 71 год); среди заболевших было в два раза больше муж-
чин.
2. Наблюдались поражение многих суставов и симметричный ха-
рактер синовита. У всех больных были воспалены лучезапястные,
168
Таблица 15.1. Ревматические заболевания, развивающиеся в пожилом воз-
расте
Заболевания Первое описание (год) Авторы первого описания
Ревматическая полимиалгия 1888 W.Bruce, Шотландия
Гигантоклеточный артериит (болезнь Хортона) 1890 J.Hutchinson, Англия
Идиопатический генерали- зованный гиперостоз скеле- та (болезнь Форестье) 1950 J.Forestier, J.Rotes- Querol, Франция
Болезнь отложения кристал- лов пирофосфата кальция дигидрата (пирофосфатная артропатия) 1958—1961 D.Zitnan, S.Sitaj, Словакия; D.McCarty, США
Синдром «плечо—колено» Милуоки (гидроксиапатит- ная деструктивная артро- патия) 1981 D.McCarty, США
Ремиттирующий серонега- тивный симметричный си- новит, сопровождающийся мягким отеком 1985 D.McCarty и соавт., США
запястные, пястно-фаланговые и проксимальные межфаланговые су-
ставы кистей, поражались также любые другие суставы верхних и
нижних конечностей: локтевые, плечевые, тазобедренные, коленные,
голеностопные и суставы стоп. Боль и нарушения функций суставов
были значительными, что приводило к необходимости госпитализа-
ции. У ряда больных отмечались болевые ощущения в области пле-
чевого пояса, напоминающие ревматическую полимиалгию. Сино-
вит, как правило, достаточно выражен, но характер изменений си-
новиальной жидкости варьировал от явно воспалительного до сла-
бо воспалительного и нормального. Клеточный состав синовиаль-
ной жидкости не был постоянным, отмечалось преобладание как
нейтрофилов, так и мононуклеаров. Морфологическая картина си-
новиальной оболочки чаще соответствовала острому неспецифичес-
кому синовиту.
3. У всех больных обращал на себя внимание двусторонний зна-
чительный мягкий отек кистей, скрывавший воспаление отдельных
мелких суставов и особенно выраженный на тыльной поверхности, где
после нажатия оставалась ямка (кисть в виде боксерской перчатки).
Определялись признаки поражения сухожилий—сгибателей и сухожи-
лий—разгибателей пальцев, чем в значительной мере и объяснялся их
значительный отек. У ряда больных подобные отеки отмечались в
области стоп и голеней.
169
4. При лабораторном обследовании отмечались высокая СОЭ,
снижение альбумина и чаще нормальный уровень гемоглобина.
5. Ревматоидный фактор в сыворотке крови отсутствовал.
6. Рентгенологические признаки деструкции суставов, в частности
эрозии, не выявлялись ни при первом обследовании, ни при дальней-
шем наблюдении.
7. Нестероидные противовоспалительные средства были малоэф-
фективны. Внутрисуставное введение кортикостероидов приводило
только к кратковременному улучшению.
8. Применение кортикостероидов внутрь в небольших дозах (пред-
низолон в дозе 10 мг в день) приводило к быстрому положительному
эффекту, нередко заметному уже в первые часы и дни: на глазах исче-
зали симптомы артрита и мягкий отек кистей. После постепенного
снижения дозы и отмены преднизолона у всех больных сохранялась
стойкая ремиссия; у большинства она была полной, у некоторых со-
хранялись небольшие сгибательные бессимптомные контрактуры паль-
цев кистей и утолщение сухожилий—сгибателей пальцев.
У больных не было отмечено симптомов иных заболеваний, при
которых могут наблюдаться мягкий отек кистей (синдром «плечо—
кисть», амилоидная артропатия, псориатический артрит, болезнь от-
ложения кристаллов пирофосфата кальция, реактивный артрит и сме-
шанное заболевание соединительной ткани), что позволило авторам
предположить, что они столкнулись с новым, ранее неизвестным за-
болеванием, и предложить название «ремиттирующий серонега-
тивный симметричный синовит, сопровождающийся мягким оте-
ком» (remitting seronegative symmetrical synovitis with pitting oedema»,
или сокращенно — «синдром RS3PE»). В этом названии нашли от-
ражение следующие наиболее примечательные особенности заболе-
вания: симметричный множественный синовит, серонегативность по
ревматоидному фактору, выраженный двусторонний мягкий отек
кистей и развитие ремиссии, сохраняющейся после прекращения ле-
чения.
Обсуждая возможные причины этого заболевания, авторы обрати-
ли внимание на определенную сезонность его начала (у преобладаю-
щего большинства артрит развивался в осенние месяцы), а также на
то, что все пациенты проживали в сельской местности. У 70 % боль-
ных выявлен HLA-B7, что примерно в 4 раза превышало популяци-
онную частоту этого антигена. Клинических признаков каких-либо
известных инфекций не отмечено, антитела к Borrelia burgdorferi не
выявлялись. Позже установлено отсутствие антител к ВИЧ и к чело-
веческому Т-клеточному лимфотропному вирусу-1, а также отсутствие
антигенов ретровирусов в синовиальной оболочке [8]. Через пять лет
(в 1990 г.) D.McCarty и его коллеги сообщили еще о 13 подобных
больных [9].
В последующем сообщения о синдроме RS3PE появились и в дру-
гих странах [2, 7, 11]. В этих наблюдениях наряду с подтверждением
существования заболевания, описанного в Милуоки, были установ-
ив
лены два новых важных обстоятельства, не соответствующих перво-
му описанию. Во Франции при ретроспективном анализе 24 больных,
начало заболевания у которых было неотличимым от синдрома RS3PE,
установлено, что с течением времени (в среднем через 5 лет) почти у
половины пациентов возникали обострения, характеризовавшиеся
умеренно выраженным олигоартритом [11], при этом мягкий отек ки-
стей рецидивировал только у одного пациента. Первое обострение
развивалось небыстро (через 18 мес — 12 лет после начала заболева-
ния) и хорошо контролировалось небольшими дозами кортикостеро-
идов или нестероидными противовоспалительными средствами.
Французские авторы выразили сомнение в нозологической самосто-
ятельности синдрома RS3PE, указав, что длительное наблюдение
многих больных вынуждает пересмотреть диагноз. В частности, у
двух пациентов через 3 года и 6 лет наблюдения был установлен
диагноз серонегативных спондилоартропатий, у одного больного —
типичного ревматоидного артрита, еще у трех пациентов — синдро-
ма Шегрена и «недифференцированных» системных заболеваний со-
единительной ткани. Не было подтверждено повышение частоты
HLA-B7. Следует, однако, указать, что данное исследование было
ретроспективным. Его авторы не наблюдали больных лично во вре-
мя начала заболевания (использовались архивные данные) и не во
всех случаях имели возможность опять же лично обследовать их в
дальнейшем. Все это несколько снижало точность и ценность выво-
дов этого исследования.
Заключение об отсутствии нозологической целостности синдрома
RS3PE сделано и в ретроспективном исследовании, проведенном в
Испании [7]. При анализе течения заболевания у 27 больных изменить
первоначальный диагноз (синдром RS3PE) пришлось со временем как
минимум у 4 пациентов. У двух больных развилась Т-клеточная лим-
фома, у одного — миелодиспластический синдром и еще у одного при
повторном рентгенологическом исследовании выявлен эрозивный
процесс в суставах.
A.C.Koeger, M.Karmochkine и P.Chaibi сообщили о развитии выра-
женного симметричного полиартрита, сопровождавшегося мягким оте-
ком кистей, запястий, а также тыла стоп у 63-летнего пациента, в тече-
ние многих лет страдавшего анкилозирующим спондилитом [4]. Лече-
ние преднизолоном (20 мг/день) привело к быстрому стиханию артрита
и устранению отеков. Через 10 мес преднизолон был отменен, на про-
тяжении последующего года сохранялась ремиссия заболевания. Было
высказано мнение о том, что у данного больного развился, скорее все-
го, синдром RS3PE, а не обострение анкилозирующего спондилита,
обычно не поддающегося терапии кортикостероидами.
Известно сообщение о синдроме RS3PE, возникшем у 80-летней
женщины через несколько дней после проведения гастроскопии, выя-
вившей рак желудка [12]. Вскоре после хирургического удаления
опухоли полиартрит и отеки кистей полностью прошли и не возобнов-
лялись в течение 3 лет наблюдения.
171
По данным B.Bhakta и C.Pease [1], мягкий отек кистей может воз-
никать в дебюте РА у лиц пожилого возраста, причем в этих случа-
ях наблюдается более благоприятное течение заболевания. При пер-
вом обследовании таких пациентов достоверно реже выявлялся рев-
матоидный фактор, а в последующем (в среднем через 2,4 года) у
них при сравнении с пациентами, у которых не было мягкого отека
кистей, чаще возникали ремиссии (соответственно у 90,9 % и 55,5 %)
и реже развивались эрозии суставов (у 17,4 % и у 48,2 % соответ-
ственно).
Острое развитие серонегативного симметричного полисиновита,
сопровождающегося мягким отеком тыла обеих кистей и стоп, было
описано у трех мужчин молодого и среднего возраста [10]. Во всех
случаях через 10—15 мес от начала заболевания отмечена полная ре-
миссия. Деформаций или эрозий суставов, а также рецидивов артри-
та в течение 1—2 лет последующего наблюдения выявлено не было.
Таким образом, к настоящему времени можно полагать, что синд-
ром, первоначально описанный D.McCarty и коллегами, не всегда яв-
ляется самостоятельным заболеванием и может быть одним из прояв-
лений других ревматических и неревматических болезней, развиваю-
щихся главным образом (хотя и не всегда) в пожилом возрасте. Уста-
новить диагноз «истинного» синдрома RS3PE позволяют лишь длитель-
ное наблюдение и повторные обследования, направленные на выяв-
ление серонегативных спондилоартропатий, диффузных болезней со-
единительной ткани, а также гематологических и иных злокачествен-
ных опухолей.
При обсуждении дифференциального диагноза синдрома RS3PE
нужно учитывать возможность развития отека кистей при ревматичес-
кой полимиалгии, РА и синдроме «полиартрит—ладонный апоневро-
зит». При ревматической полимиалгии в ряде случаев могут возни-
кать тендинит (тендовагинит) сгибателей кистей и ладонный апонев-
розит, что сопровождается болевыми ощущениями и сгибательными
контрактурами пальцев. Сухожилия разгибателей кистей почти никог-
да не поражаются, поэтому столь выраженного отека, как при синд-
роме RS3PE, не наблюдается. Кроме того, ревматической полимиал-
гии не свойствен полиартрит. При РА в редких случаях возникает вы-
раженный диффузный отек дистальных отделов конечностей (как од-
носторонний, так и двусторонний), который связывают с нарушения-
ми оттока лимфы. В отличие от синдрома RS3PE в этих случаях не
отмечается положительного эффекта от применения кортикостероидов,
отек сохраняется на протяжении длительного времени и не поддается
антиревматической терапии. Синдром «полиартрит—ладонный апо-
неврозит» может быть идиопатическим либо развиваться на фоне раз-
личных, как правило, скрыто протекающих болезней (злокачествен-
ных опухолей, тиреоидита и др.). Он нередко начинается остро и со-
провождается выраженными болевыми ощущениями и значительными
функциональными нарушениями. Но так же, как и при ревматичес-
кой полимиалгии, в этих случаях не наблюдается поражения сухожи-
172
лий—разгибателей пальцев, приводящего к диффузному мягкому оте-
ку тыла кистей.
«Поздние» периферические спондилоартропатии. Под таким назва-
нием в 1989 г. была опубликована статья французских ревматологов
[3]. В ней впервые в литературе подробно описывалась небольшая
группа больных (10 человек), у которых в возрасте 50—68 лет разви-
вались симптомы серонегативных спондилоартритов, но при этом
отсутствовали псориаз, инфекции (характерные для реактивных арт-
ритов) и хронические воспалительные заболевания кишечника.
Нужно отметить, что до этого описания развитие серонегативных
спондилоартритов во второй половине жизни считалось маловероят-
ным, хотя единичные сообщения о таких больных были известны.
Появившаяся в 1995 г. еще одна публикация [6], в которой приводи-
лись сведения о 23 аналогичных больных, позволила говорить о воз-
можности развития этой патологии в пожилом возрасте как о вполне
установленном факте.
Наиболее частое проявление заболевания — стойкий несим-
метричный олигоартрит нижних конечностей;почтивсе-
гда поражаются коленные суставы. Артрит же суставов верхних ко-
нечностей встречается лишь в единичных случаях, нет полиартику-
лярности, симметричности поражения суставов. У многих больных
отмечались мягкие отеки стоп или голеней, выходящие за границы
пораженных суставов, однако отеки кистей, характерные для синд-
рома RS3PE, не наблюдались. В ряде случаев отмечался дактилит.
Следующее по частоте проявление— периферические энте-
з о п а т и и, особенно в области пяток, причем иногда на протяжении
определенного отрезка времени они бывают единственным клиничес-
ким симптомом заболевания.
Характерно минимальное поражение позвоночного стол-
б а. Хотя у части больных отмечались эпизоды болей воспалительно-
го характера в позвоночнике, но ни в одном случае нарушений дви-
жений в каких-либо отделах позвоночника или ограничения дыхатель-
ной экскурсии грудной клетки не наблюдалось, так же как и типич-
ных для серонегативных спондилоартритов рентгенологических при-
знаков поражения позвоночного столба. Рентгенологические симпто-
мы сакроилеита во время первого обследования были найдены лишь
у 1/4—1/3 больных. В последующем, на протяжении нескольких лет на-
блюдения, частота обнаружения сакроилеита несколько повышалась,
но не превышала 50 %; в единичных случаях развивался увеит.
«Поздние» серонегативные спондилоартропатии встречаются оди-
наково часто у мужчин и женщин. У многих, по наблюдениям авто-
ров, отмечаются выраженные общие симптомы — лихорадка, сла-
бость, потеря массы тела, во всех случаях значительно увеличивает-
ся СОЭ. У большинства больных выявлялся HLA-B27, в отдельных
случаях установлено наличие серонегативных спондилоартритов у
членов семей.
Применение нестероидных противовоспалительных препаратов и
173
преднизолона было, как правило, неэффективным. Не отмечалось
склонности к спонтанной ремиссии, олигоартриту была свойственна
стойкость.
За время наблюдения ни разу не выявлено псориаза, признаков
инфекции, характерных для реактивных артритов, синдрома Рейтера,
хронических воспалительных заболеваний кишечника. У 4 больных
в последующем было отмечено прогрессирующее поражение позвоноч-
ного столба, что позволило авторам установить диагноз идиопатичес-
кого анкилозирующего спондилита.
Таким образом, наблюдения последних лет показали, что сероне-
гативные спондилоартропатии, развивающиеся у лиц пожилого воз-
раста, не относятся к числу раритетов. Термин «спондилоартропатии»
используется в данном случае потому, что эти заболевания не удает-
ся отнести ни к одной из известных форм спондилоартритов (идиопа-
тическому спондилиту, псориатическому спондилоартриту, реактив-
ным спондилоартритам или спондилоартритам при хронических забо-
леваниях кишечника). Но клинические проявления «поздних» спон-
дилоартропатий характерны для всех заболеваний из «группы HLA-
В27» и не отличаются по своему спектру от симптомов, наблюдаю-
щихся у детей и больных молодого возраста.
СПИСОК ЛИТЕРАТУРЫ
1. Bhakta В.В., Pease С.Т. Late-onset rheumatoid arthritis: is pitting oedema
of the hands at onset a good prognostic indicator? // Brit. J. Rheumatol. —
1997. —Vol. 36. —P. 214—219.
2. Chaouat D.t Le Parc J.~M. The syndrome of seronegative symmetrical
sinovitis with pitting edema (RS3PE syndrome): a unique form of arthritis
in the elderly? Report of 4 additional cases // J. Rheumatol. — 1989. —
Vol. 16.—P. 1211—1213.
3. Dubost J-J., Sauvezie B. Late onset peripheral spondyloarthropathy //
J. Rheumatol. — 1989. — Vol. 16. — P. 1214—1217.
4. Koeger A., Karmochkine M., Chaibi P. RS3PE syndrome associated with
advanced ankylosing spondylitis // J. Rheumatol. — 1995. — Vol. 22. — P.
375—376.
5. McCarty D.J., O’Duffy D., Pearson L. et al. Remitting seronegative
symmetrical synovitis with pitting edema. RS3PE syndrome // J.A.M.A. —
1985. — Vol. 254. — P. 2763—2767.
6. Olivieri A., Padula A., Pierro A. et al. Late onset undifferentiated seronegative
spondyloarthropathy // J. Rheumatol. — 1995. — Vol. 22. — P. 899—903.
7. Olive A., del Blanco J., Pons M., Vaquero M., Тепа X. The clinical spectrum
of remitting seronegative symmetrical synovitis with pitting edema. The
Catalon Group for the Study of RS,PE, Spain // J. Rheumatol. — 1997. -
Vol. 24. — P. 333—336.
8. Russell D., McCarty D.J., Schwab J. et al. RS, PE syndrome: no evidence for
retroviruses // J. Rheumatol. — 1994. — Vol. 21. — P. 1105—1106.
9. Russell B., Hunter J.B., Pearson L., McCarty D.J. Remitting seronegative
symmetrical synovitis with pitting odema — 13 additional cases // J.
Rheumatol. — 1990. — Vol. 17. — P. 633—639.
174
10. Sattar В. Remitting seronegative symmetrical synovitis with pitting oedema
in young adults: a subset of rheumatoid arthritis or a distinct syndrome?
// Brit. J. Rheumatol. — 1990. — Vol. 29. — P. 479—481.
11. Schaeverbeke T., Fatout E., Marce S., Vernhes J.-P. et al. Remitting spitting
seronegative symmetrical synovitis with oedema: disease or syndrome? //
Ann. Rheum. Dis. — 1995. — Vol. 54. — P. 681—684.
12. Tada Y., Sato H., Yoshizawa S., Kimura H. et al. Remitting seronegative
symmetrical synovitis with pitting oedema associated with gastric
carcinoma // J. Rheumatol. — 1997. — Vol. 24. — P. 974—975.
Лекция 16
СИНДРОМ БОЛИ В НИЖНЕЙ ЧАСТИ
СПИНЫ В ПРАКТИКЕ
ВРАЧА-РЕВМАТОЛОГА
Профессор Н.А.Шостак, Д.А.Шеметов, Е.Е.Аринина
(Российский государственный медицинский университет)
Под синдромом боли в нижней части спины (low back pain) пони-
мают боль, локализующуюся между XII парой ребер и ягодичными
складками [8].
В течение длительного времени люмбаго рассматривалось как
проявление пояснично-крестцового радикулита, в связи с чем заболе-
вание было прерогативой невропатологов. Однако исследованиями
последних лет доказано, что вторичная вертебральная радикулопа-
тия диагностируется лишь у 7—8 % больных с люмбаго [1]. Посте-
пенно сформировалось мнение, что боль в нижней части спины
(БНС) — это междисциплинарная проблема, в которой наряду с не-
врологическими, травматологическими и ортопедическими аспекта-
ми ведущее место стали отводить и ревматологическим. В МКБ X пе-
ресмотра БНС введена в рубрику «Болезни костно-мышечной систе-
мы» (XIII класс).
Распространенность БНС составляет от 40 до 80 %, а ежегодная
заболеваемость — 5 %. По данным английских авторов, в Велико-
британии из-за боли в спине за 4 года наблюдений потеряно 52 млн
рабочих дней (более высокие цифры отмечают только при заболева-
ниях органов дыхания и кровообращения) [5, 11]. В США потеря тру-
доспособности, вызванная БНС, обходится, например, штату Кали-
форния в 200 млн долларов ежегодно [11]. По данным Н.В.Тороп-
цевой и соавт. (1995), заболеваемость с временной утратой тру-
доспособности у лиц с БНС в 1992 и 1993 гг. составила 47,2 и
41,8 дня и 5,1 и 4,1 случая на 100 работающих. Чаще болеют муж-
чины в возрасте 35 лет — 44 года и женщины в возрасте 25 лет — 34
175
года. В недавно проведенном в Швеции популяционном исследова-
нии спинальной боли (возраст 35—45 лет) установлено, что частота
БНС за последний год составила 66,3 % с небольшой разницей у
мужчин и женщин. У 25 % обследованных имели место существен-
ные проблемы с трудоспособностью, нарушения функционального
статуса. Популяционные исследования выявили ассоциацию БНС с
такими факторами, как пол и возраст, осанка, мышечная сила, под-
вижность позвоночника, курение, занятия спортом и уровень обра-
зования [1, 8].
СиндромыБНС. Выделяют первичный и вторичный синдромы БНС
[8, 9]. Главными причинами первичного синдрома являются механи-
ческие факторы: 1) дисфункция мышечно-связочного аппарата,
2) спондилез, 3) грыжа межпозвонкового диска.
В настоящее время в клинической практике участилась гипер-
диагностика остеохондроза позвоночника как основной причины
болевого синдрома в спине [1, 11]. По мнению Т.Г.Вознесенской и
А.М. Вейна, гипердиагностика приводит к игнорированию функци-
ональных нарушений опорно-двигательного аппарата с формирова-
нием блоков в мелких и крупных суставах, появлением различных
болевых мышечно-скелетных синдромов [1]. Также недооценивает-
ся роль миофасциальных болевых симптомов, при которых первич-
но страдают мышцы. Известно, что скелетная мускулатура состав-
ляет около 40 % массы тела и включает около 700 отдельных мышц.
Тем не менее мышечная система исследуется недостаточно, а зна-
чимость ее патологии в происхождении боли явно недооценивается
[6, II].
В генезе БНС большое значение придается функциональным нару-
шениям в различных отделах позвоночника — ограничению его под-
вижности в двигательном сегменте или обратимому блокированию,
причинами которого могут быть статические или динамические на-
грузки, антифизиологические позы и травмы [1,4]. Однако у каждого
пациента чрезвычайно важно исключить вторичный характер синд-
рома БНС, причины которого приведены ниже.
Основные причины вторичного синдрома БНС [Kuriisky, 1997]
1. Врожденные аномалии:
— spina bifida,
— спондилолистез.
2. Травма:
— переломы позвонков,
— протрузия межпозвонковых дисков,
— повреждение межпозвонковых дисков.
3. Артриты, в том числе:
— анкилозирующий спондилоартрит.
4. Другие заболевания:
— опухоли,
— инфекции (туберкулез, остеомиелит, эпидуральный абсцесс),
176
— болезнь Педжета,
— боль «слабой осанки»,
— психические заболевания,
— метаболические (остеопороз, остеомаляция).
5. Проекционная боль при заболеваниях внутрен-
них органов:
— язва или опухоль задней стенки желудка,
— воспаление, кисты или опухоль поджелудочной железы,
— расслаивающаяся аневризма брюшного отдела аорты,
— опухоли, дивертикулиты, воспаление толстой кишки.
6. Заболевания мочеполовых органов:
— альгодисменорея,
— опухоль и нарушение расположения мочеточников,
— опухоль и воспаление простаты,
— мочекаменная болезнь.
Заподозрить вторичный синдром БНС позволяют дополнительные
клинические проявления, в том числе лихорадка (характерна для опу-
холевого поражения, ДБСТ, инфекций межпозвонковых дисков, ту-
беркулеза); снижение массы тела (злокачественные опухоли); неспо-
собность найти удобное положение (метастазы опухолей, аневризма
брюшного отдела аорты, мочекаменная болезнь); очень интенсивная
локальная боль (деструктивные процессы любого генеза) [8].
При клиническом обследовании больного с БНС N.Hadler [8] пред-
лагает использовать набор симптомов — «индикаторов» вторичного
синдрома БНС.
Симптомы — «индикаторы» вторичного
синдрома БНС [Hadler, 1997]
Клинические признаки Возможные причины
Снижение массы тела Метастазы, хронические инфекции
Лихорадка Септический дисцит, эпидураль- ный абсцесс
Ночные боли Неопластический процесс
Ночные боли, умень- шающиеся в положении сидя Опухоль «конского хвоста»
Боли по типу «из- вивающих» Сосудистая катастрофа, почечная колика
БНС чаще всего развивается в возрасте от 20 до 50 лет (пик забо-
леваемости 35—45 лет). Именно в этой возрастной группе обычно ди-
агностируют первичный (механический) синдром БНС, тогда как у
7—3592
177
больных моложе 20 и старше 50 лет преобладает вторичный синд-
ром. Заболевание может протекать остро {до 3 нед), подостро (3—
12 нед) и хронически (более 12 нед), а также рецидивировать. Кли-
нически выделяют 4 вида боли в спине: локальная, проекционная,
радикулярная (корешковая) и боль, возникающая при мышечном
спазме [6, 8, 10].
Локальная боль. Причиной локальной боли является патоло-
гический процесс, воздействующий на чувствительные нервные окон-
чания. Боль чаще бывает постоянной, но может быть интермиттирую-
щей, изменяется в зависимости от положения тела и двигательной ак-
тивности. Она, как правило, диффузная и всегда локализуется в об-
ласти поражения позвоночника. Часто наблюдается рефлекторное
«шинирование» позвоночника паравертебральными мышцами, что
может приводить к изменению осанки.
Проекционная боль бывает двух видов: 1) проецирующаяся
от позвоночника в поясничную и крестцовую области; 2) иррадииру-
ющая из органов малого таза и брюшной полости в область позво-
ночника. Проекционная боль по интенсивности и характеру прибли-
жается к локальным и также меняется при изменении положения тела,
но носит более диффузный характер и имеет тенденцию к поверхнос-
тному распространению.
Радикулярная, или «корешковая», боль характери-
зуется большей интенсивностью, чем локальная и проекционная. Она
может быть тупой и ноющей, однако движения, усиливающие раздра-
жение корешков, значительно интенсифицируют боль, которая стано-
вится острой, режущей и почти всегда иррадиирует от позвоночника
в какую-либо часть нижней конечности. Кашель, чиханье, натужива-
ние — характерные провоцирующие факторы; наклон вперед или
подъем прямых ног, сдавление яремных вен, приводящее к повыше-
нию внутрипозвоночного давления и смещению корешков, усилива-
ют радикулярную боль в результате растяжения.
Боль, возникающая при мышечном спазм е,клиничес-
ки близка к локальным, однако анатомические и физиологические от-
личия позволяют выделить ее. Хроническое мышечное напряжение
может вызывать тупую, а иногда и спастическую боль. Считается, что
в 50 % случаев боль в спине ассоциируется со спазмом мышц, который
вызывает довольно сильную боль, объясняющуюся накоплением мета-
болитов, выделенных сокращенной мышцей. В нормальных условиях
эти метаболиты вымываются кровью. Если мышечный спазм продол-
жается долго, кровоток нарушается и накопленные метаболиты акти-
вируют болевые рецепторы [4, 6]. Боль, вызванная локальным спазмом
мышц, сама по себе может являться стимулом, провоцирующим спазм.
Таким образом, возникает порочный круг, в котором изначальная мы-
шечно-скелетная патология активирует местные болевые рецепторы,
боль вызывает рефлекторный спазм, в свою очередь усиливающий боль,
являющуюся стимулом для пролонгирования или усиления спазма [8].
В настоящее время в генезе болевого синдрома при БНС большое
178
значение придается также миофасциальному болевому синдрому
(МБС), проявляющемуся спазмом мышц, наличием в напряженных
мышцах болезненных мышечных уплотнений или локальных мышеч-
ных гипертонусов и триггерных точек (myofascial trigger points). МБС
часто не связан с остеохондрозом позвоночника и может встречаться
вне зависимости от него [1]. Т.Г.Вознесенская и А.М.Вейн для диаг-
ностики МБС предлагают ориентироваться на следующие клиничес-
кие проявления: 1) боль, связанная с физической перегрузкой, длитель-
ным пребыванием в одном положении, после прямого охлаждения
мышцы; 2) боль, распространяющаяся в область, достаточно отдален-
ную от напряженной мышцы (болевой паттерн); 3) боль, возникающая
при наличии плотных, болезненных тяжей в мышцах (без гипо- или ат-
рофии); 4) резко усиливающаяся болезненность при пальпации участ-
ков уплотнения в пределах напряженных мышц — «симптом прыжка»;
5) боль воспроизводится в зоне отраженных болей при сдавлении триг-
герных точек; 6) устранимость симптомов при специфическом местном
воздействии на напряженную мышцу [1].
При клиническом обследовании врачу необходимо установить не
только тип, характер и локализацию боли, но и факторы, которые
провоцируют (кашель, движение и т.д.) и ослабляют ее в положении
лежа. Необходимо учитывать также анамнез (травма), начало боли
(в рабочее время), длительность, личностные особенности пациента
(истерия, канцерофобия). При осмотре можно выявить чрезмерный
поясничный лордоз, сгорбленность, предполагающую врожденные
аномалии или переломы позвоночника в прошлом, сколиоз, аномалии
тазового скелета, асимметричность паравертебральных и ягодичных
мышц. При тяжелой ишиалгии может наблюдаться частичное сгиба-
ние в тазобедренном и коленном суставах. Локальная болезненность
при пальпации может быть обусловлена спазмом мышц в области
поражения позвоночника или крестцово-подвздошных сочленений.
При пальпации остистого отростка обращают внимание на его под-
вижность в боковом (перелом) или переднезаднем направлении. Сту-
пенчатое расположение остистых отростков может быть ключом к
диагнозу спондилолистеза.
Лабораторно-инструментальное обследование обычно включает
общий анализ крови (величина СОЭ имеет значение для диагностики
инфекции или миеломы), определение уровней кальция и фосфора,
щелочной фосфатазы. При подозрении на метастазы рака предстатель-
ной железы необходимо исследование кислой фосфатазы и простат-
специфического антигена. Рентгенологическое исследование пояснич-
ного отдела в различных проекциях следует проводить всем пациен-
там с БНС. Сцинтиграфия позвоночника может оказать помощь в ди-
агностике воспаления и новообразований. Для грыжи диска, требую-
щей хирургического вмешательства, целесообразно провести контра-
стную миелографию. У лиц среднего и пожилого возраста при реци-
дивирующей боли в спине наряду с онкологической настороженнос-
тью необходимо исключать остеопороз, особенно у лиц женского пола
7*
179
после менопаузы (костная денситометрия). Магнитно-резонансная
томография (МРТ) позволяет визуализировать тела позвонков, дис-
ки, позвоночный канал, корешки и околопозвоночные мягкие ткани.
Компьютерная рентгеновская томография дополняет МРТ в плане
визуализации костной структуры позвонков. Вместе с тем МРТ и ком-
пьютерная рентгеновская томография не заменяют клинического об-
следования, а результаты их необходимо интерпретировать совмест-
но с клиницистом, курирующим пациента.
Лечение БНС проводится с учетом формы заболевания и варианта
его течения и заключается в следующем:
— устранение причины,
— отдых в течение нескольких дней,
— нестероидные противовоспалительные препараты (НПВП),
— миорелаксанты,
— мануальная терапия,
— тракция,
— ношение бандажа,
— физические упражнения,
— обучающие программы,
— нормализация массы тела.
При возникновении БНС рекомендуется: 1) отдых в течение не-
скольких дней; 2) ношение пояснично-крестцового бандажа для им-
мобилизации позвоночника до полного выздоровления; 3) миорелак-
санты (диазепам, сирдалуд); 4) НПВП. При предполагаемом воспа-
лительном компоненте БНС назначают индометацин (75 мг в сутки),
ибупрофен (до 2,4 г в сутки), диклофенак натрия, пироксикам и др.
При выраженном болевом синдроме можно использовать наркотичес-
кие анальгетики (кодеин, морфина гидрохлорид, пентазоцин). Одна-
ко надо отметить, что до настоящего времени применение НПВП не
решило проблемы борьбы с болью. Необходимость использования этих
препаратов в течение длительного времени, особенно при хроничес-
ком течении БНС, частое развитие гастропатий ставят вопрос о поис-
ке более эффективного и безопасного НПВП [7]. Использование се-
лективного ингибитора фермента циклооксигеназы-2 мелоксикама
представлено в литературе единичными работами. Наш опыт приме-
нения этого препарата в суточной дозе 15 мг (в течение 5 дней) с пос-
ледующим ее снижением до 7,5 мг при БНС позволяет сделать заклю-
чение о том, что он является эффективным и безопасным средством,
вызывающим значительное уменьшение болевого синдрома и повы-
шение двигательной активности у большинства пациентов.
При стихании острой боли в программу лечения включают физи-
ческие упражнения, уменьшающие мышечный спазм и улучшающие
состояния мышц спины и брюшного пресса. При неэффективности
терапии, сохраняющемся болевом синдроме ряд авторов рекоменду-
ют эпидуральное введение ГКС (после исключения инфекции, опухо-
ли и некоторых других заболеваний)[9].
180
Широко применяющаяся тракционная терапия — «сухое» или под-
водное вытяжение позволяют уменьшить функциональные нарушения
в позвоночнике, связанные с ограничением его подвижности в двига-
тельном сегменте или формированием его обратимого блокирования
.[4, 8]. Вместе с тем показано, что тракционная терапия эффективна
лишь у 45 % пациентов и имеет ряд противопоказаний, ограничиваю-
щих возможности ее использования: гипертоническая болезнь 2—3-й
стадии, церебральный атеросклероз, остеофитоз в области позвонков
и др. В связи с этим в настоящее время в Московском государствен-
ном техническом университете им. Н.Э.Баумана разработан новый тип
механотерапии, основанный на комбинации естественных последова-
тельных нагрузок на позвоночник под воздействием собственной мас-
сы тела и периодического массажа мышц — так называемая комплек-
сная механотерапия [2, 3]. Вопрос о хирургической помощи в каждом
конкретном случае определяется совместно специалистами разных
специальностей — терапевтами, невропатологами, ревматологами,
ортопедами и нейрохирургами.
СПИСОК ЛИТЕРАТУРЫ
1. Вознесенская Т.Г., Вейн А.М. // В кн.: А.М.Вейн, М.Я.Авруцкий. Боль и
обезболивание. — М.: Медицина, 1977. — С. 98—126.
2. Кён-Чул-Лю. Научные основы и принцип построения механотерапев-
тической аппаратуры для коррекции деформаций позвоночника: Ав-
тореф. дис. ... д-ра техн. наук. — М., 1996. — 26 с.
3. Семикин Г.И., Шостак Н.А., Шеметов Д.А. и др. Эффективность при-
менения дистракционной массажной установки у больных с заболе-
ваниями позвоночника // Мед. техника. — 1998. — № 11.
4. Сителъ А.Б. Мануальная терапия. — М.: Издатцентр, 1998.
5. Торопцева П.В., Беневоленская Л.И., Карякин А.Н., Сергеев И.Л. Распро-
страненность болей в нижнем отделе спины среди рабочих промыш-
ленных предприятий России //Клин, ревматол. — 1995. — № 5. —
С. 26—29.
6. Яхно Н.И., Богачева Л.А., Снеткова Е.П., Ушаков Г.Н. Болевые невис-
церальные синдромы в амбулаторной практике (структура заболева-
емости, клиника, диагностика, патогенез, организация лечения) // Все-
российский съезд неврологов, 7-й: Тезисы докладов. — Нижний Нов-
город, 1995.—№517.
7. Agrawal N.M. Antiinflammatories and gastroduodenal damage //
Therapeutic Options, Europ. J. Rheumatol. Inflammat. — 1993. — Vol. B,
№ 1. —P. 17—24.
8. Hadler N. Arthritis and Allied conditions. — 13th ed. — Baltimore, 1997. —
Vol. 2. —P. 1821—1833.
9. Kuritsky L. Comprehensive therapy, 1997, 23(5), 332.
10. Mankin H, Borges L. In Harrison’s principles of internal medicine. — 13th
ed. — McGraw-Hill, Inc., 1994.
11. Travell J.G., Simons D.G. Myofascial pain and dysfunction. — Baltimore-
London, 1984.
181
Лекция 17
ДОСТИЖЕНИЯ И ПЕРСПЕКТИВЫ
ИНСТРУМЕНТАЛЬНОЙ ДИАГНОСТИКИ
ПРОЯВЛЕНИЙ РЕВМАТИЧЕСКИХ
БОЛЕЗНЕЙ
Профессор Э.С.Мач, канд. мед. наук А.В.Смирнов, канд. мед.
наук Г.П. Котельникова, О.В.Пушкова (Институт ревма-
тологии РАМН)
Клиническая картина ревматических заболеваний (РЗ) определя-
ется характером, выраженностью и локализацией патологического
процесса в соединительной ткани различных органов и систем. Одна-
ко общность патогенетических механизмов является причиной того,
что многим РЗ присуще поражение суставов — от преходящих болей
до полного их разрушения, сердца — от поражения различных оболо-
чек до формирования тяжелых пороков с нарушением кровообраще-
ния, а также сосудов на всех уровнях во всех органах и тканях — от
спастических явлений до полной окклюзии с развитием тромбозов и
последующим нарушением функции, вплоть до летальных исходов.
Поражение суставов, сердца, сосудов, выраженность и распрост-
раненность патологического процесса определяют течение и прогноз
заболевания в целом. Следовательно, своевременная и ранняя диаг-
ностика симптомов и синдромов РЗ имеет важное значение для выбо-
ра адекватного лечения с целью предотвращения прогрессирования
заболевания и улучшения прогноза. Несомненно, правильная диагно-
стика основывается на выборе адекватных методов, зависящих от
уровня развития техники. Так, уже в 60—70-е годы использование
графических методов (ЭКГ, фонокардиография, механо- и поликар-
диография) и метода разведения радиоиндикатора в крови с исполь-
зованием наружных сцинтилляционных датчиков и самописца позво-
лило выявить сдвиги как в проводящей системе сердца в виде атрио-
вентрикулярной блокады и появления ритмов в атриовентрикулярном
соединении, так и в показателях центральной гемодинамики в виде
гипердинамического синдрома, проявляющегося увеличением минут-
ного и ударного объемов кровообращения, увеличения массы цирку-
лирующей крови за счет увеличения объема циркулирующей плазмы
[17,18]. Все указанные нарушения исчезали на фоне проводимого про-
тивовоспалительного лечения, особенно при первичном ревмокарди-
те. Определение скорости потенциала зубца Р в I грудном отведении
ЭКГ позволяло выявить ранние признаки перегрузки правых отделов
сердца у больных СКВ с признаками пневмонита и ССД с пневмофиб-
розом, а использование метода гамма-радиографии подтвердило сни-
жение емкости сосудистого ложа легких у этой категории больных [15,
16].
182
С развитием техники и внедрением в клиническую практику мето-
да эхокардиографии (эхоКГ) и в дальнейшем — допплер-эхоКГ по-
явилась возможность не только изучения и оценки состояния клапан-
ного аппарата сердца, но и контролирования основных показателей
внутрисердечной гемодинамики. Так, при первичном ревмокардите
выявлялось достоверное увеличение внутренних размеров левого же-
лудочка, сопровождающееся увеличением ударного объема и пока-
зателей сократимости, т.е. подтверждались прежние данные графичес-
ких и радиоизотопного методов [4].
Сравнительное изучение особенностей сердечной патологии при РЗ
с использованием метода допплер-эхоКГ показало наличие как общих,
так и отличительных признаков поражения структур сердца. С помо-
щью этого метода при СКВ и РА нередко выявляется клинически и
электрокардиографически не диагностируемое поражение перикарда,
что очень важно для подбора адекватного лечения.
Исследование с помощью допплер-эхоКГ особенностей состояния
клапанного аппарата сердца позволило обнаружить своеобразное
поражение аорты при анкилозирующем спондилоартрите, приводящее
к аортальной регургитации [5]. Изучение кардиальной патологии при
антифосфолипидном синдроме у больных СКВ позволило установить
частое наличие тромбогенного эндокардита различной локализации
(преимущественно митральной), приводящих к формированию поро-
ков сердца [6].
Весьма перспективны для дальнейшего изучения поражения серд-
ца метод стресс-эхоКГ и использование в аппаратах «второй энерге-
тики» с целью оценки как сократительной способности различных
областей миокарда, так и его васкуляризации.
Нарушения микроциркуляции (МЦ) являются важным звеном в
патогенезе РЗ, а морфофункциональные преобразования в терминаль-
ном русле кровообращения носят системный характер. Такие клини-
ческие проявления микроциркуляторных нарушений как синдром Рей-
но, васкулиты и васкулопатии различной локализации, геморрагии и
изъязвления, «истинная склеродермическая почка», нередко формиру-
ют «лицо» РЗ и ухудшают их прогноз.
Изучение тканевой МЦ методом клиренса 133Хе из внутриткане-
вого депо (клинически не пораженные кожа и скелетная мышца) по-
казало, что при РЗ имеются генерализованные нарушения в системе
МЦ, различающиеся лишь выраженностью. Так, для ССД, СКВ и РА
характерно уменьшение эффективного кожного кровотока (истинно
капиллярного), коррелирующее с распространенностью патологичес-
кого процесса (в частности, с поражением почек при СКВ и РА) и
некоторыми иммунологическими показателями. При анкилозирующем
спондилоартрите раньше поражается МЦ скелетных мышц нижних ко-
нечностей [8, 10].
Внедрение в ревматологию неинвазивного метода лазерной
допплер-флоуметрии позволило изучить кожную микроциркуляцию
практически над всеми интересующими участками кожи, решить
183
многие вопросы по оценке характера нарушений МЦ при РЗ и пра-
вильно подойти к их коррекции и оценке результатов лечения [1, 9,
21].
Результаты комплексного изучения кожной микроциркуляции (ме-
тод клиренса 1ИХе, лазерная допплер-флоуметрия, капилляроскопия
и гистоморфологическое исследование биоптатов тех же участков
клинически не пораженной кожи) позволили определить общие и от-
личительные признаки нарушений МЦ при РЗ. При РА с системными
проявлениями нарушения МЦ более выражены, чем у больных РА без
признаков системности. При СКВ на раннем этапе болезни имеет ме-
сто высокая чувствительность сосудов МЦ к симпатической стиму-
ляции (преобладает вазоконстрикция) генерализованного характера
над всеми участками кожи (включая область суставов, в частности
тазобедренных), выраженная вазодилатация и реактивная гиперемия,
что по существу говорит о распространенной васкулопатии при этом
заболевании. При ССД в связи с первичным поражением микроцир-
куляторного русла на уровне артериолярно-капиллярного звена и
снижением кровотока характерно раннее включение в кровообраще-
ние неполноценного шунтирующего кровотока (артериовенозные ана-
стомозы) уже при клинически минимальных признаках синдрома Рей-
но. Эти нарушения проявлялись снижением пальцевого кровотока,
повышенной вазоконстрикцией и снижением вазодилатационного по-
тенциала [11].
С момента описания антифосфолипидного синдрома (АФС) было
обращено внимание на ассоциацию антител к фосфолипидам с разви-
тием венозных и артериальных тромбозов различной локализации, а
также с акушерской патологией. Частота тромбозов при СКВ, сопро-
вождающейся АФС, колеблется от 20 до 60 %, чаще поражаются вены
нижних конечностей. Нередко флебиты опережают другие проявления
СКВ либо могут развиваться спустя несколько лет от начала заболе-
вания.
Наиболее серьезным осложнением АФС является тромбоэмболия
мелких ветвей легочной артерии, реже артерий головного мозга, ко-
ронарных артерий и артерий сетчатки глаза. Результаты многолетней
совместной работы с отделением проф. З.С.Алекберовой показали, что
сцинтиграфия легких является информативным методом в оценке на-
рушений легочного кровообращения у больных СКВ, сопровождаю-
щейся АФС, а также при первичном АФС: дефекты альвеолярного кро-
вообращения выявлялись у всех больных, имевших признаки легоч-
ной тромбоэмболии (на момент исследования или в анамнезе), а де-
фекты накопления радиофармпрепарата (признак инфаркта легкого)
— у половины пациентов.
Метод ультразвуковой допплерографии (УЗДГ) с цветным карти-
рованием в настоящее время практически заменил метод ангиографии
в диагностике сосудистых поражений, не уступая последнему по
чувствительности и информативности. Так, при СКВ, сопровождаю-
щейся АФС, выявлено снижение церебрального кровотока, которое
184
прямо пропорционально зависело от длительности АФС и признаков
поражения ЦНС. Снижение растяжимости общей бедренной вены и
монофазный кровоток на клинически не пораженной конечности у
больных с АФС позволяет заподозрить тромботические изменения
контралатеральной вены [3]. УЗДГ артерий верхних и нижних конеч-
ностей при ССД выявила разной выраженности их сужение с увели-
чением сосудистого сопротивления и уменьшением величины потока
крови. Перспективным является изучение с помощью этого метода
состояния стенки сосудов конечностей и кровообращения внутренних
органов.
Вторым направлением в области инструментальной диагностики
РЗ и их симптомов является исследование опорно-двигательного ап-
парата.
В течение многих лет рентгенография была единственным методом
оценки состояния суставов. Как известно, недостатки этого метода
состоят в облучении больного и невозможности оценить состояние
мягкотканных структур, расположенных как внутри, так и около су-
става.
Развитие метода тепловидения значительно продвинуло диагнос-
тику воспалительного процесса в суставах, но не позволило отдиф-
ференцировать вклад отдельных анатомических структур в этот про-
цесс. Внедрение гамма-камеры и новых, короткоживущих радиоизо-
топов, в частности генератора 99тТс, значительно уменьшило дозу
радиации и создало возможность ранней диагностики воспалительно-
го процесса в суставах, его распространенности и степени выражен-
ности. Установлено, что РА характеризуется диффузным распределе-
нием радиофармпрепарата в пораженных суставах, а остеоартроз —
очаговым. На ранних стадиях аваскулярного некроза головки бед-
ренной кости при сцинтиграфии отмечаются «холодная» зона в обла-
сти головки и повышенный захват радиофармпрепарата в области
шейки бедренной кости. При выраженном аваскулярном некрозе зах-
ват радиофармпрепарата носит диффузный характер. Сравнительный
анализ клинических и сцинтиграфических признаков поражения опор-
но-двигательного аппарата при РЗ показал более высокую информа-
тивность метода сцинтиграфии. Так, мы установили, что при РА по-
ражение суставов по данным клинического обследования имелось у
57,3 % больных, тогда как при сцинтиграфии оно выявлялось у 63,1 %,
причем более часто изменения обнаруживались на I—II стадиях забо-
левания. Поражение периферических суставов при анкилозирующем
спондилоартрите клинически выявлялось у 30,9 % больных, а при
сцинтиграфии — у 49,2 %. При сравнительном анализе результатов
обследования больных ревматизмом, у которых клинические призна-
ки поражения опорно-двигательного аппарата отсутствовали, с помо-
щью сцинтиграфии изменения периферических суставов были выявле-
ны у 21,1 %, а в крестцово-подвздошных — у 41 % пациентов. Ос-
новной недостаток данного метода — ионизирующая радиация, зат-
рудняющая динамическое наблюдение.
185
Проблема поиска новых неинвазивных и безопасных как дая боль-
ного, так и для исследователя методов диагностики всегда остается в
центре внимания, однако наряду с поиском нового не надо забывать
об уже существующих методах и о максимальном их использовании.
Это относится к применению ультразвукового двухмерного сканиро-
вания для оценки состояния структур опорно-двигательного аппа-
рата.
Современная ультразвуковая аппаратура позволяет оценить как
поверхностные периартикулярные, так и внутриартикулярные ткани,
составляющие сустав.
Впервые в нашей стране сотрудницей лаборатории В.Р.Шастиной
[20] была дана сравнительная ультразвуковая характеристика анато-
мических элементов коленного сустава при РА с учетом клиническо-
го варианта, длительности и стадии болезни, а также влияния лече-
ния. Это позволило определить структурные изменения в коленном
суставе даже при отсутствии четких клинических признаков его по-
ражения и предложить ультразвуковые критерии для оценки выражен-
ности локального воспаления [12].
Анализ данных ультразвукового сканирования 1400 суставов боль-
ных различными РЗ показал, что у подавляющего большинства име-
лись те или иные признаки поражения суставов даже при отсутствии
или минимальной выраженности клинических и рентгенологических
изменений. Исследовано 622 коленных, 610 тазобедренных и 150 пле-
чевых суставов. Изменения найдены соответственно в 90,6, 86 и
67,3 % суставов. Наиболее часто, по данным ультразвукового иссле-
дования, обнаруживались синовит (61,6 %), изменения контура кости
(50,6 %), подлежащих мышц и сухожилий (25,2 %); кисты Бейкера
были обнаружены в 30 % коленных суставов [11, 13].
Характерными ультразвуковыми находками при РА, ОА и псори-
атическом артрите были отек периартикулярных тканей, увеличение
размеров супрапателлярной сумки и жидкость в ней, утолщение сино-
виальной оболочки, пристеночный фибрин, изменение четкости и нео-
днородность контуров костей, составляющих сустав, жидкость в зад-
них отделах коленного сустава. Как правило, наиболее яркое воспа-
ление наблюдалось у больных РА. Очень существенно, что при ульт-
развуковом сканировании суставов имеется возможность обнаружить
признаки воспаления в клинически интактных суставах (выявлены у
58,3 % обследованных больных) — наличие жидкости и увеличение
размеров супрапателлярной сумки, утолщение синовиальной обо-
лочки.
Большое значение имеет ультразвуковая диагностика поражения
тазобедренного сустава, вовлечение которого в патологический про-
цесс нередко значительно снижает трудоспособность больных и при-
водит к их инвалидизации. Ультразвуковые признаки повреждения та-
зобедренных суставов часто опережают рентгенологические, что по-
могает своевременной диагностике и коррекции лечения [13] (табл.
17.1).
186
Таблица 17.1. Ультразвуковые и рентгенологические признаки повреж-
дения тазобедренного сустава
Рентгено- логические признаки аваскуляр- ного некроза головкн бедренной кости Ультразвуковые признаки повреждения
головка бедренной кости тазобедренный сустав
дефект нечет- кий контур протру- зия дефор- мация признаки воспаления
размер сустав- ной сумки отек подле- жащих мышц
около шейки бедрен- ной кости около головки бедрен- ной кости
Выражен- 89,2 % 64,2 % 25% 21,4% 7,29 мм 2,1 мм 60%
ные
Ранние 70% 70% Нет 30% 6,9 мм 2,77 мм 40%
Подозрение 20% 80 % Нет 20 % 5,8 мм 2 мм Нет
Остеоартроз (ОА), как известно, характеризуется прогрессирующи-
ми эрозивными изменениями гиалинового хряща, развитием краевых ос-
теофитов и деформацией суставов. Измерение с помощью ультразву-
кового сканирования размеров хряща коленных суставов у больных ОА
показало [14], что уменьшение толщины суставного хряща коррелиро-
вало с рентгенологической стадией гонартроза (табл. 17.2). Достовер-
ность ультразвуковой оценки состояния хряща коленных суставов у
больных РА и ОА подтверждена работой Ostergaard и соавт. [20], ко-
торые установили тесную корреляцию результатов, полученных этим
методом и с помощью магнитно-резонансной томографии.
Таблица 17.2. Ультразвуковая характеристика хряща при различных ста-
диях ОА
Состояние хряща Стадия ОА
1(п=126) 11(п=40) 111(п=120)
Толщина (мм): >0,1 67,9 % 53,6 % 45,8 %
<0,1 10,7% 8,9 % 8,4 %
Гомогенный 61,3% 39,8 % 33,4 %
Негомогенный 17,3% 23,2 % 20,8 %
Контур мыщелка бедренной кости: ровный 86,9 % 62,5 % 53,8 %
неровный 13,1% 37,5 % 41,7%
187
Ультразвуковое сканирование коленных суставов позволяет хоро-
шо визуализировать кисты в подколенной области и их разрывы Этот
метод, особенно в комбинации с допплерографией в цветном режиме,
дает возможность четко отличить подколенные кисты от патологии
вен
Таким образом, ультразвуковое исследование суставов является
идеальным скрининговым методом для установления изменений, ди-
намического наблюдения за развитием патологического процесса и
объективной оценки лечения
В последние годы большое внимание уделяется ранней диагности-
ке остеопороза Широкое распространение получили рентгеновские
и ультразвуковые методы остеоденситометрии Метод рентгеновской
денситометрии скелета обладает целым рядом преимуществ, в част-
ности высокой скоростью исследования (3—5 мин, а в последних мо-
делях 10—30 с), высокой разрешающей способностью, точностью и
воспроизводимостью результатов исследований, при этом дозы облу-
чения низкие (0,03—0,05 мЗв) Эти денситометры позволяют выявлять
даже незначительную потерю костной массы (2—3 %)
Активно развивается также ультразвуковая денситометрия (УЗД),
она, по мнению многих исследователей, в ближайшем будущем зай-
мет одно из ведущих мест в диагностике остеопороза В отличие от
рентгеновской денситометрии УЗД позволяет получить совершенно
иные характеристики костной ткани, а именно скорость прохождения
ультразвука через кость и так называемую единицу механической ре-
акции кости При этом воспроизводимость измерений достаточно
высока Однако степень корреляции этих показателей с показателя-
ми плотности костной ткани, полученными при рентгеновской денси-
тометрии, до сих пор не ясна и продолжает обсуждаться специалиста-
ми Несколькими исследователями продемонстрировано значительное
сходство результатов этих двух методов, а также показано, что УЗД
с высокой степенью достоверности позволяет прогнозировать риск
развития переломов при остеопорозе, особенно шейки бедренной ко-
сти Тем не менее в настоящее время УЗД считается скрининговым
методом, предназначенным для выявления групп риска
Проведенное нами в Институте ревматологии сравнение резуль-
татов оценки минеральной плотности кости (МПК) в области шейки
бедренной кости (на остеоденситометре фирмы «Голоджик») и в кор-
тикальном слое большеберцовой кости (с помощью УЗД фирмы «Ми-
риад») у 20 женщин с РА показало, что частота остеопении, выявля-
емой при УЗД, составляла 60 %, а в случае проведения рентгеновской
денситометрии — 75 % (различия недостоверны) Совпадение резуль-
татов, полученных рентгеновским и ультразвуковым методами, отме-
чено в 15 случаях (75 %), из них в 4 (20 %) выявлялись нормальные
показатели МПК, а в 11 случаях (55 %) — остеопения или остеопо-
роз (табл 17 3)
Наряду со специальными измерительными приборами, к которым
относятся рентгеновские и ультразвуковые установки, нашли приме-
188
нение и специальные программы для оценки остеопороза в телах по-
звонков при проведении количественной компьютерной рентгеновской
томографии Возможность с помощью этого метода проводить изме-
рения тела позвонка в поперечном сечении является уникальной по-
зволяет провести раздельную оценку МПК в трабекулярном и корти-
кальном слоях костной ткани и получить истинные значения минераль-
ной плотности кости, выраженные в граммах на кубический сантиметр
(г/см3)
Таблица 17 3 Сравнительная оценка МПК по данным ультразву ковои и
рентгеновской денситометрии
Результаты Ультразвуковая денситометрия Рентгеновская денситометрия
абс % абс %
Норма 8 40 5 25
Снижение МПК 12 60 15 75
СПИСОК ЛИТЕРАТУРЫ
1 Алекперов Р Т, Мач Э С, Гусева Н Г Лечение вазопростаном больных
с синдромом Рейно И Тер арх — 1997 — №8 — С 22—23
2 Цахи А , Цветкова Е С, Мач Э С и др УЗ-диагностика синовита при
гонартрозе И Клин ревматол — 1994 — № 1 — С 19—22
3 Елубаева В И Клинико-инструментальная оценка состояния периферичес-
ких сосудов у больных системной красной волчанкой с антифосфоли-
пидным синдромом Автореф дис канд мед наук — М , 1993 — 20 с
4 Котельникова Г П Функциональное состояние миокарда при остром
ревматизме, изученное методом эхокардиографии И Вопр ревмат —
1980 - №2 — С 23—26
5 Котельникова ГП, Камова НН, Полянская И П Характер сердечной
патологии при анкилозирующем спондилоартрите (болезни Бехтере-
ва)//Тер арх - 1993 — №5 —С 34—37
6 Клюквина Н Г, Котельникова ГП, Насонов ЕЛ, Алекберова 3 С Кар-
диальная патология у мужчин, больных СКВ и вторичным АФС //
Клин ревматол — 1996 —№3 —С 47—50
7 Луговец С Г, Мач Э С, Пушкова О В Значение артросонографии в ди-
агностике подколенных кист при ревматоидном артрите // Материа-
лы 2-го Всерос съезда ревматологов —Тула, 1997 —С 109—110
8 Мач Э С, Сперанский АПК вопросу о значимости определения кож-
ной микроциркуляции при системной красной волчанке И Тер арх —
1979 — №7 — С 167—170
9 Мач Э С, Щербаков А Б Лазер-допплер-флоуметрия в ревматологии /
/Ревматология — 1987 — №4 —С 48—51
10 Мач Э С Тканевая микроциркуляция при ревматических заботевани
ях клинико-функциональные особенности и лечение Автореф дис
д-ра мед наук — М , 1989 — 30 с
189
11. Мач Э.С., Пушкова О.В., Шастина В.Р. Возможности артросоно-
графии в ревматологии // Клин, ревматол. — 1993. — № 2. — С. 14—
19.
12. Мовсесян Г.Р., Мач Э.С., Шайков А.В. и др. Оценка эффективности про-
лонгированного внутрисуставного лечения глюкокортикоидами с по-
мощью артросонографии // Клин, фармакол. и терапия. — 1994. —
№ 1. —С. 36.
13. Мач Э.С., Пушкова О.В., Савин Н.А. Arthrosonography as the usefull
method for establishment of disturbanses in hip joints in rheumatic
diseases // News Letters (ARCO). — 1995. — N 72. — P. 113.
14. Мач Э.С., Пушкова О. В. Современные инструментальные методы ди-
агностики остеоартроза // Матер. 2-го Всерос. съезда ревматологов. —
Тула, 1997. —С. 121.
15. Насонова В.А., Сысоев В.Ф., Мач Э.С. К диагностике перегрузки пра-
вых отделов сердца при системной красной волчанке И Тер. арх. —
1965. — № 4. — С. 37—41.
16. Насонова В. А., Сысоев В.Ф., Грицман НН и др. Sclerodermic pneumo -
fibrosis. — In: La Sclerodermie // MASSON et CIE EDITEURS. — Paris,
1972. —P. 59—67; 311.
17. Сысоев В.Ф., Мач Э.С. Клиническое значение определения массы цир-
кулирующей крови и ее компонентов с помощью АСЧ-йод-131 у боль-
ных ревматизмом и инфекционным неспецифическим полиартритом //
Тер. арх. — 1966. — № 7. — С. 50—56.
18. Сысоев В.Ф., Евтеева Р.С, Мач Э.С. Состояние гемодинамики у боль-
ных в активной фазе ревматизма. — В кн.: Клинические варианты те-
чения ревматизма и других коллагеновых болезней и критерии актив-
ности патологического процесса. — М., 1966. — С. 29—30.
19. Цурко В.В., Сысоев В.Ф., Бадокина Г.И. и др. Клинико-рентгенологи-
ческие и сцинтиграфические параллели при асептическом некрозе го-
ловки бедренной кости при ревматоидном артрите // Тер. арх. —
1987. —№4.— С. 54—56.
20. Шастина В.Р. Значение УЗ-двухмерного сканирования в оценке состо-
яния различных структур коленного сустава у больных ревматоид-
ным артритом: Автореф. дис. ... канд. мед. наук. — М., 1988. — 20 с.
21. Щербаков А.Б., Гусева Н.Г, Мач Э.С. Антагонисты кальция при синд-
роме Рейно и системной склеродермии // Клин, фармакол. и терапия. —
1992. — №1. — С. 32—37.
22. Ostergaard М., Court-Payen M.t Gideon Р., Wieslander S. et al. Ultra-
sonography in arthritis of the knee // Ann. Radiol. — 1995. — Vol. 36. —
P. 19—26.
190
Лекция 18
МОРФОЛОГИЧЕСКИЙ СУБСТРАТ
РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ.
ЧТО НОВОГО В БИОПСИЙНОЙ
ДИАГНОСТИКЕ?
Канд. мед. наук С.Г.Раденска-Лоповок (Институт ревма-
тологии РАМН)
Морфологические исследования в ревматологии тесно связаны с
достижениями в других областях — биохимии, биологии, иммуноло-
гии.
Комплексный анализ данных, полученных исследователями смеж-
ных специальностей, способствует более полному пониманию меха-
низмов развития ревматических заболеваний (РЗ). Разработка но-
вых, современных методов изучения цитокинов, онкогенов, а также
маркеров апоптоза быстро находит применение в иммуногистохи-
мии.
Развитие морфологических знаний условно можно разделить на 3
этапа (табл. 18.1). Каждый период характеризуется приоритетными
целями, методами и использованным материалом исследования.
Таблица 18.1. Этапы развитияревмоморфологии
Этапы
Методы исследования
Материал
До начала 70-х годов
Г истологические
Г истохимические
Электронно-микроско-
пический
Аутопсийный
Операционный
С начала 70-х годов
До начала 90-х годов
Г истологические
Г истохимические
Электронно-микроско-
пический
Иммунофлюоресцент-
ный:
Биопсийный
Операционный
Аутопсийный
- прямой метод
Кунса
— непрямой метод
Кунса
90-е годы
Г истологические
Иммуноморфологичес-
кие:
— пероксидазный
— авидин-биотин-
Биопсийный
Операционный (ауто-
псийный)
стрепто ви дино вый
— иммунофлюорес-
центный
191
Продолжение
Этапы
Методы исследования
Mai ери ал
Г истохимические
Гибридизация in situ
Электронная иммуно-
гистохимия
На первом этапе морфология характеризовалась статикой. Это-
му способствовало применение описательных методов, констатирую-
щих факты повреждения и фиксирующих состояние органов и тканей
на данный момент. Основной вклад в фундаментальные разработки
внесли В.Т.Талалаев (1929), М.А.Скворцов (1938), Н.Н.Грицман
(1950), А.И.Струков (1958, 1961). В 50—60-х годах на аутопсийном
материале рутинными методами был определен субстрат ревматичес-
ких болезней. Мишенью иммунопатологического процесса был опре-
делен гистион, где развивается прогрессирующая дезорганизация со-
единительной ткани. Описание основных стадий морфогенеза РЗ (му-
коидное набухание, фибриноидное набухание, воспалительные клеточ-
ные реакции и склероз) является основным при диагностике ревмати-
ческих заболеваний и по сей день. Ведущими российскими ревмато-
логами были определены и основные этапы патогенеза РЗ — наруше-
ние иммунного гомеостаза, развитие системной дезорганизации соеди-
нительной ткани, системных васкулитов и склероза.
В конце 60-х годов морфологи взяли на вооружение новый для того
времени метод электронной микроскопии. Широкое внедрение в кли-
нической практике методов кардиопластики митрального клапана и
эндобиопсии дало возможность получения свежего материала различ-
ных органов и тканей. На операционном и биопсийном материале
начались работы по ультраструктурной патологии соединительной
ткани и микроциркуляторного русла при РА, ССД, ревматизме.
Н.Н.Грицман (1968) выявила морфологические особенности пораже-
ния сердца при различных РЗ. Наряду с этим она показала, что цве-
тущая ревматическая гранулема, описанная Л.Ашоффом и В.Т.Тала-
лаевым, характеризуется активным метаболизмом, отражает защит-
но-приспособительные механизмы и является высшей степенью специ-
фической мезенхимальной реакции организма. Ультраструктурное
изучение межклеточных взаимодействий и патологии коллагена по-
зволило Е.О.Дрейер (1970), Г.И.Яковлевой (1972), П.Я.Мульдияро-
ву (1981) и др. наметить подходы к пониманию тонких механизмов
повреждения коллагенового волокна, эндотелия и других элементов
синовии и кожи. Определение Е.О.Дрейер субклеточной характерис-
тики ревматической гранулемы и в настоящее время имеет особое
значение в связи с новыми знаниями о медиаторных нарушениях и
клеточных кооперациях при ревматизме и участии неоптерина в па-
тологическом процессе. При помощи иммунофлюоресценции было
192
показано, что в основе тканевых изменений при ревматических забо
леваниях лежит иммунокомплексный механизм повреждения сосудов
с развитием васкулитов.
В 70—80-е годы тонкие методы исследования биопсийного и опе-
рационного материала находят широкое применение и становятся ве-
дущими в морфологии. Это характеризует второй этап гистологичес-
ких исследований. Перед морфологами была поставлена задача ран-
ней диагностики РЗ и поиска дифференциально-диагностических кри-
териев. Морфогенезу раннего ревматоидного синовита, а также си-
новита при СКВ и ССД посвящены работы М.С.Вениковой, В.А.Ах-
назаровой (1985). Наряду с известными нозологическими формами про-
водились поиски диагностических морфологических признаков новых
нозологических форм и патологических состояний. В конце 80-х го-
дов Н.Н.Грицман, М.В.Симонова и Л.С.Мануйлова начали изучение
морфологических особенностей поражения желез внешней секреции и
сосудов микроциркуляторного русла при болезни и синдроме Шегре-
на. Системный характер поражения экзокринного аппарата и клеточ-
ный цитолиз эпителиальных клеток описаны в работах С.Г.Раденской
(1990). Было показано, что выраженность лимфоцитарной инфильтра-
ции и ее цитопатический эффект, снижение секреторной активности и
развитие склероза не только в малых слюнных железах, но и в слизи-
стой оболочке желудка и кишечника отражают иммунную природу
повреждения, а процесс имеет системный характер. Полученные ре-
зультаты легли в основу диагностических критериев этих заболева-
ний.
В настоящее время широко разрабатываются и внедряются в прак-
тику новые методы иммуногистохимии, а именно авидин-биотиновый
метод, гибридизация in situ и другие, позволяющие работать не толь-
ко на свежем, но и на архивном материале. Этот факт обусловливает
особенности современной морфологии (третий этап). Уникальный
архив ранних биопсий синовии, сохраненный в лаборатории, дает нам
возможность провести анализ эволюции синовитов при РА, ССД и
СКВ с учетом современного понимания механизмов иммунопатологи-
ческих процессов.
Накопление знаний о патогенезе РЗ, а также успешное лечение
больных привели к снижению смертности. В связи с этим изучение
аутопсийного материала уже не имеет столь большого научного зна-
чения, как раньше. Гистологическое исследование различных орга-
нов и тканей (почки, печень, лимфатические узлы, синовия, кожа,
мышцы, малые слюнные железы) позволяет не только вовремя поста-
вить правильный диагноз, но и выявить особенности течения заболе-
вания и провести контроль за проводимой терапией. В настоящее вре-
мя совместно с клиницистами в лаборатории морфогенеза ревматичес-
ких заболеваний Института ревматологии РАМН продолжаются ис-
следования по изучению болезни Шегрена, болезни Лайма, болезни
Бехчета, гетерогенности ССД. Особое внимание уделяется патологии
сосудов, микроциркуляции при различных РЗ.
193
В медицинской литературе широко обсуждается характер повреж-
дений артерий и вен при первичном и вторичном антифосфолипидном
синдроме (АФС). Применяется термин «васкулопатия», подчеркива-
ется при этом отсутствие воспалительной реакции сосудистой стенки,
однако четких признаков этого понятия не существует. Нами была
проведена работа по выявлению особенностей состояния сосудов в
кожно-мышечном лоскуте. Полученные данные показали, что, дей-
ствительно, обнаружение антикардиолипиновых антител коррелиру-
ет с выявлением некроза и десквамации эндотелия микроциркулятор-
ного русла, с пролиферацией эндотелиальных клеток и сосудов, а так-
же с образованием тромбов, приводящих к хронической ишемизации
тканей. Наряду с этим развивается склероз различной степени выра-
женности. Наличие одновременно альтеративных и продуктивных
процессов определяет понятие «васкулопатия». Выявление воспали-
тельно-клеточного инфильтрата в периваскулярных пространствах и
базальной мембране сосудов дает основание говорить о развитии вас-
кулита различного типа и степени активности. Следует отметить, что
при АФС можно наблюдать сочетание васкулопатии с васкулитами.
Поиск новых подходов к морфологической диагностике касается
не только хорошо изученных патологических процессов. Всем нам из-
вестны морфологические особенности активного ревматоидного си-
новита. Пролиферация клеток покровного слоя сочетается со стира-
нием границы с подлежащими тканями. Объяснение этого явления
заложено в эмбриогенезе суставов. Отсутствие в норме базальной мем-
браны между кроющими синовиоцитами и подлежащими тканями обес-
печивает единое суставное пространство. Патологически гиперпла-
зированные клетки легко погружаются в строму. Морфогенез этих
изменений также связан с клеточными рецепторами адгезии и с меди-
аторами воспаления. Это объясняется, во-первых, тем, что рецепторы
обеспечивают сцепление клеток как между собой, так и с подлежа-
щими структурами и с хрящом. Во-вторых, через них передается ин-
формация, регулирующая функцию клеток, в частности секрецию ме-
таллопротеиназ. В-третьих, что особенно интересно, клеточные рецеп-
торы адгезии могут способствовать прикреплению микроорганизмов
к синовии и вызывать развитие реактивного артрита или отягощать
течение ревматоидного синовита. И наконец, экспрессия интегринов
регулируется цитокинами, которые выявляются в сыворотке больных
РА. Иммунофлюоресцентным методом в синовии выявляется сниже-
ние интегринов классов а5 и повышение интегринов класса £6 в срав-
нении с нормой и ОА. Наряду с этим выявляется повышенное содер-
жание фибронектина и витронектина как между кроющими синовио-
цитами, так и в строме. Цитокины (ФНО-а, ИЛ-1[3, фактор роста |3 и
интерферон-у), регулирующие экспрессию интегринов, также выявля-
ются в синовии. Эти данные свидетельствуют о выраженных наруше-
ниях функционального состояния синовиоцитов. Следует отметить, что
интегрины в синовиальной оболочке при РА и ОА имеют похожие
характеристики. Это может быть объяснено стереотипным механизмом
194
воспаления. Кроме указанных лейкинов, в морфологической практи-
ке стало возможно выявление и таких молекул адгезии, как Е-селек-
тин, VCAM-1 (vascular cell adhesion molecule-1), ICAM-1 (intercellular
adhesion molecule-1) и др.
В 70-е годы появились первые сообщения об апоптозе как о физи-
ологически запрограммированной гибели клеток, регулирующей ба-
ланс клеточных элементов в тканях. Хотя механизм апоптоза еще не
полностью ясен, имеются специфические морфологические признаки,
отличающие его от альтерации клеток в виде некроза (рис. 18.1).
Вокруг ядра формируется ореол, хроматин конденсируется, цитоплаз-
ма становится эозинофильной. Можно увидеть фрагментацию части
ядра, при этом ткань остается сохранной. При ревматоидном синови-
те методом in situ neck end labelling (ISNEL) выявляются подавление
апоптоза и повышение экспрессии ядерного антигена пролиферирую-
щих клеток (PCNA) как в кроющем слое синовиоцитов, так и в под-
лежащих тканях [3]. Подавление процесса апоптоза, вероятно, связа-
но с повышенной экспрессией онкопротеина Вс1-2 в клетках воспали-
тельного инфильтрата глубоких слоев, в лимфоцитах и в псевдофол-
ликулах. При ревматоидном синовите индуцирующие апоптоз онко-
гены р53, р21 и с-тус выявляются в различных отделах синовии, что
дает основание предположить, что эти белки не вовлечены в патоло-
гический процесс.
Всем ревматологам хорошо известен риск развития лимфопроли-
феративных процессов у больных, долгое время принимающих цито-
токсические иммунодепрессанты. Фенотипирование клеток лимфати-
ческих узлов для дифференциации лимфаденопатии при РЗ и неходж-
кинской лимфомы стало возможно с применением иммунопероксидаз-
ного метода. Моноклональные антитела, меченные пероксидазой хре-
на, позволяют обнаружить также и антигены вирусов, в том числе ви-
руса Эпштейна—Барр (рис. 18.2). Гистологически отмечаются стира-
ние рисунка лимфатического узла и смесь большого количества мел-
ких и крупных клеток. В данном случае крупные клетки характери-
зуются фенотипом CD-20. Диффузная пролиферация В-лимфоцитов с
плеоморфными цитологическими характеристиками и наличие имму-
нобластов могут сочетаться с экспрессией латентного белка одной
мембраны вируса Эпштейна—Барр в макрофагах. Таким образом, по-
явилась возможность определить характер поражения лимфатических
узлов и понять, связаны ли они с развитием лимфопролиферативного
процесса, ассоциированного с вирусами Эпштейна—Барр, или это
лимфаденопатия, обусловленная основным процессом. Применение
моноклональных антител, меченных флюоросцеином или пероксида-
зой хрена, помогает при выявлении и изучении оппортунистических
инфекций в ревматологии.
Участие цитокинов в процессе развития ревматоидного синовита
уже обсуждалось. Эти белки, как медиаторы воспаления, причастны
не только к РА, но и к другим РЗ. Болезнь Шегрена как системная
экзокринопатия характеризуется массивной лимфомакрофагальной
195
инфильтрацией желез внешней секреции и цитотоксическим эффектом
[1]. Методом электронной микроскопии выявлены нарушения функ-
ции макрофагов в очаге иммунного воспаления. Имеют место сниже-
ние их фагоцитарной и повышение секреторной активности, при этом
отмечаются межклеточные взаимодействия активированных лимфоци-
тов с плазматическими клетками и моноцитами. Описанный клазма-
тоз лимфоцитов позволил высказать предположение о том, что выде-
ленные в межклеточном пространстве части цитоплазмы лимфоцитов
содержат цитокины. Однако в 80-е годы электронная микроскопия
была методом констатации, описывающим явления на момент иссле-
дования. Электронная гистохимия в то время имела ограниченное
применение, в связи с чем отсутствовала возможность определить со-
держание этих фрагментов. Метод гибридизации in situ позволяет
выявлять рецепторы клеток для интерлейкинов [2]. В очаге иммунно-
го воспаления присутствуют клетки, синтезирующие ФНО-а и £, ИЛ-
6, ИЛ-2 (рис. 18.3) и ИЛ-4 (рис. 18.4). Иммуногистохимически были
идентифицированы субпопуляции клеток, экспрессирующих мРНК
ИЛ-2 и ИЛ-4. Активированные клетки и клетки памяти коррелируют
с высоким содержанием ИЛ-2. Большое количество ИЛ-4 в активи-
рованных клетках и его отсутствие в клетках памяти выявляется лишь
при ранних и слабовыраженных поражениях малых слюнных желез.
Таким образом, было доказано, что местный синтез цитокинов моно-
нуклеарами и эпителиальными клетками малых слюнных желез при-
водит к иммунной деструкции экзокринных желез при болезни Шег-
рена.
В заключение следует отметить, что новые методологические под-
ходы в ревмоморфологии дают возможность более точно проводить
дифференциальную диагностику патологических процессов. Приме-
нение иммуногистохимических методов, метода гибридизации in situ
и др. способствует установлению корреляции между местными изме-
нениями и серологическими маркерами. На основании полученных
данных, с учетом клинических проявлений, характера течения и раз-
вития РЗ, создаются условия для фундаментальных исследований в
области патогенеза заболеваний соединительной ткани.
СПИСОК ЛИТЕРАТУРЫ
1. Раденска С.Г. Морфологическая характеристика изменений желудочно-
кишечного тракта при болезни и синдроме Шегрена // Арх. пат. —
1990.— №5. — С, 40—46,
2. Boumba D., Skopouli F.N., Moutsopoulos Н.М. Cytokine mRNA expression
in the labial salivary gland tissues from patients with primary Sjogren’s
syndrome // Brit. J. Rheum, — 1995. — Vol. 34. — P. 326—333,
3. Sugiyama M., Tzukazaki T., Yonekura A. et al. Localization of apoptosis
and expression of apoptotis related proteins in the synovium of patients
with rheumatoid arthritis // Ann. Rheum, Dis. — 1996, — Vol. 55. — P. 442
449.
196
Лекция 19
ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ
ФАРМАКОТЕРАПИИ ОСТЕОАРТРОЗА
Канд.мед.наук Е.С.Цветкова, канд.мед.наук Л.И.Алексеева
(Институт ревматологии РАМН)
Остеоартроз (ОА) занимает лидирующее место (60 %) среди рев-
матических заболеваний. Распространенность в популяции О А (6,43 %)
коррелирует с возрастом, достигая максимальных показателей (13,9 %)
в возрастной группе старше 45 лет. Женщины болеют ОА почти в
2 раза чаще мужчин. Частота ОА в семьях больных в 2 раза выше,
чем в популяции, причем риск развития ОА у лиц с врожденными де-
фектами опорно-двигательного аппарата повышен в 7,7 раза, у лиц с
избыточной массой тела — в 2 раза [8, 9, 15].
Первичный ОА (по Международной классификации — остеоарт-
рит) — одно из самых распространенных заболеваний, при котором в
патологический процесс вовлекаются гиалиновый хрящ, субхондраль-
ная кость, синовиальная оболочка и другие структуры сустава, та-
кие как внутрисуставные связки, суставная капсула и прилежащие к
суставу мышцы и сухожилия [1].
Воспаление является наиболее универсальным патологическим
процессом, лежащим в основе клинических проявлений ревматичес-
ких болезней, в том числе, как выявлено в последние годы, и при пер-
вичном ОА.
Лечение ОА в конечном итоге может рассматриваться как анти-
воспалительное, несмотря на то, что противовоспалительный эффект
различных лекарственных средств реализуется неодинаковыми меха-
низмами.
Современные подходы к фармакотерапии ОА базируются на зна-
ниях о патогенезе данного заболевания [14]. Сложность патогенеза ОА
определена особенностями строения гиалинового хряща и его взаи-
модействия с другими основными структурами сустава. Гиалиновый
хрящ состоит из клеток (хондроцитов), занимающих всего от 1 до 10 %
объема, и внеклеточного вещества (матрикса), представленного преж-
де всего коллагеном II типа, сульфатированными протеогликанами
(ПГ) и гиалуроновой кислотой (несульфатированный ПГ). Сульфати-
рованные ПГ содержат гликопротеиды («стержневые» белки) и гли-
козаминогликаны (ГАГ), в основном хондроитин-4,6-сульфат и кера-
тансульфат. Хондроциты окружены трехмерной сетью аркадообраз-
но расположенных коллагеновых волокон, переплетенных с сетью аг-
регатов ГАГ, что в норме обеспечивает биомеханические возможнос-
ти хряща — так называемую «обратную деформацию» — максималь-
ное сжатие при нагрузке и последующее полное преодоление дефор-
197
мации. Хондроциты являются высокодифференцированными клетка-
ми, которым отводится основная роль в поддержании хряща в нор-
мальном состоянии. Объясняется это тем обстоятельством, что в нор-
ме хондроцит продуцирует не только ПГ, коллаген II типа, но и энзи-
мы (коллагеназу и протеазы), обладающие способностью разрушать
матрикс, т.е. вызывать так называемый хондролизис. Другими сло-
вами, нормальное состояние хряща зависит от равновесия анаболи-
ческих и катаболических процессов.
При возникновении ОА данный баланс нарушается. На самых
ранних стадиях ОА хрящевые структуры еще способны к самоогра-
ничению деструкции, однако через определенный промежуток вре-
мени процесс разрушения хряща становится безудержным, резко сни-
жается синтез нормального коллагена и ПГ. Поврежденный хонд-
роцит вырабатывает ПГ, неспособные к агрегации, и вместо нор-
мального для хряща коллагена II типа продуцирует коллаген I, IX и
X типов, не образующий фибрилл. Интенсивность катаболического
процесса усугубляется избыточной продукцией хондроцитами, клет-
ками синовии и субхондральной кости провоспалительных цитоки-
нов — ИЛ-1 и ФИО. ИЛ-1 играет ключевую роль в патогенезе вос-
паления, прямо влияя на такие катаболические факторы, как уро-
вень оксида азота и металлопротеиназ.
Установлено, что в артрозном хряще концентрация металло-
протеиназ повышается на 150 % при минимальном увеличении тка-
невого ингибитора данной протеазы, что способствует прогресси-
рованию деструкции. Кроме того, подтверждением воспалитель-
ной природы происходящих при ОА процессов является тот факт, что
при возникновении ОА в хондроцитах происходит накопление цик-
лооксигеназы-2 (ЦОГ-2) — провоспалительного изофермента, в зна-
чительной степени определяющего интенсивность воспаления при
всех ревматических заболеваниях. Полноценной репарации хря-
ща не происходит, гиалиновый хрящ разволокняется, образуются
множественные эрозии и трещины различной глубины. Дальнейшее
прогрессирование ОА приводит к полной потере гиалинового хря-
ща [4].
Основная цель терапии ОА заключается в восстановлении нормаль-
ной структуры гиалинового хряща путем активации синтеза полно-
ценных ГАГ и коллагена II типа хондроцитами, подавлении катабо-
лических процессов и увеличении резистентности хондроцитов к воз-
действию протеаз и цитокинов.
Исходя из знаний о патогенезе ОА, общие задачи лечения данного
хронического прогрессирующего заболевания суставов могут быть
сведены к предотвращению деструкции хряща, уменьшению боли и к
улучшению функции суставов.
Очевидно, что решение основных задач терапии возможно лишь
при длительном комплексном использовании лекарственных пре-
паратов, воздействующих на основные патогенетические звенья
ОА.
198
Условно все препараты, применяемые при лечении ОА, подразде-
ляются на две группы:
1) препараты симптоматического действия (symptoms modifying
drugs);
2) препараты патогенетического или, иначе, структурно-модифи-
цирующего действия (structure modifying drugs).
Условность подобного деления заключается в том, что лекарствен-
ные препараты могут иметь смешанные свойства, отнесение их к оп-
ределенной группе вызвано в основном недостаточностью наших зна-
ний о механизмах действия лекарств, применяемых при ОА [3].
Традиционно к препаратам первой группы относят нестероидные
противовоспалительные средства (НПВП), наиболее часто использу-
емые при лечении ОА и имеющие преимущественное значение для ус-
транения основных проявлений этого заболевания, главным образом
боли и синовита. При длительном применении НПВП, воздействуя на
различные патологические звенья воспаления, прежде всего подавляя
активность фермента циклооксигеназы и биосинтез простагландинов,
приводят к ограничению воспаления и анальгетическому эффекту.
НПВП, применяемые при ОА, должны обладать бесспорной антивос-
палительной активностью при минимальном риске возникновения по-
бочных реакций и сочетаться с целым рядом других лекарственных
средств (гипотензивные, антидиабетические и др.). Эти требования
обусловлены прежде всего возрастом пациентов, страдающих ОА, и
нередким наличием у данных больных так называемых сопутствую-
щих болезней, прежде всего артериальной гипертонии, сахарного
диабета, язвенной болезни желудка, двенадцатиперстной кишки и др.
Следует учитывать, что с возрастом уменьшается масса печени, за-
медляется ток крови, снижается скорость фильтрации в клубочках
почек, повышается масса тела, что в целом увеличивает риск возник-
новения токсических реакций при применении НПВП [2].
Наибольшее внимание при назначении НПВП больным ОА долж-
ны привлекать лекарственные гастропатии, проявляющиеся развити-
ем глубоких эрозий и язв препилорического и антрального отделов
желудка, в ряде случаев приводящие к опасным для жизни кровоте-
чениям. Поскольку риск возникновения таких побочных реакций не
уточнен (часто они бывают бессимптомными), следует в динамике, осо-
бенно при длительном назначении НПВП, проводить ежегодно гаст-
роскопию для своевременной коррекции возникающих осложнений.
Другие известные побочные реакции НПВП не отличаются по спект-
ру и частоте от побочных реакций, описанных при назначении дан-
ной группы лекарств больным другими ревматическими заболева-
ниями.
Из всех известных применяемых с конца 60—70-х годов НПВП для
терапии ОА наиболее подходят ибупрофен (1200—1800 мг/сут), дик-
лофенак натрия (100—150 мг/сут) и флугалин (100—200 мг/сут). Опыт
Института ревматологии РАМН по длительному (12 и 36 мес) приме-
199
нению флугалина и диклофенака натрия при ОА крупных суставов
свидетельствует о возможной минимализации артралгий и проявлений
синовита у подавляющего большинства больных, причем риск возник-
новения побочных реакций (прежде всего лекарственной гастропатии)
наиболее высок в первые месяцы приема указанных НПВП. Ориен-
тиром в выборе конкретного НПВП и оптимальной дозы должны слу-
жить индивидуальная чувствительность к препарату, а также преоб-
ладание основных симптомов ОА — синовита или артралгий.
Что касается индометацина, то данный препарат наименее пока-
зан при ОА, а для длительного применения не показан вообще из-за
высокого риска развития побочных реакций. Кроме того, следует
принимать во внимание возможность прямого отрицательного воздей-
ствия индометацина на хрящ при ОА, поскольку препарат подавляет
синтез ПГ [10].
Наиболее перспективными для лечения ОА НПВП являются селек-
тивные ингибиторы ЦОГ-2, имеющие высокую антивоспалительную
активность и отличающиеся хорошей переносимостью, главным об-
разом за счет минимального раздражающего действия на желудочно-
кишечный тракт. Кроме того, следует учитывать определенную па-
тогенетическую направленность действия подобных средств (за счет
подавления ЦОГ-2 в хондроцитах при возникновении ОА). На рос-
сийском фармацевтическом рынке из активных ингибиторов ЦОГ-2
имеется мовалис (мелоксикам), применяемый в суточной дозе 7,5 или
15 мг. Мовалис сочетается с дигоксином, непрямыми антикоагулян-
тами, антидиабетическими препаратами, [J-блокаторами и может быть
применен у больных пожилого возраста, а также у пациентов с на-
чальными признаками почечной и печеночной недостаточности без
риска увеличения частоты побочных реакций [5].
В тех случаях, когда назначение НПВП затруднено или невозмож-
но, используется местное, т.е. внутрисуставное, введение ГКС, кото-
рые уменьшают уровень клеточного метаболизма, подавляют клеточ-
ную пролиферацию, продукцию металлопротеиназы и ИЛ-1, участву-
ющего в деструкции хряща. Следует учитывать, что ГКС подавляют
образование макромолекул ГАГ. Основным показанием для примене-
ния ГКС является наличие синовита, причем перед их введением не-
обходимо удалить синовиальную жидкость. Местное назначение ГКС
является паллиативным методом лечения, и на протяжении одного
года число внутрисуставных введений в один сустав не должно пре-
вышать четырех. Считается, что необходимость двукратного введе-
ния ГКС в один сустав на протяжении 12 мес свидетельствует о неэф-
фективности проводимого лечения ОА и требует пересмотра всего
плана ведения больного и коррекции медикаментозной терапии. Если
применяется триамцинолона ацетонид (кеналог), его доза в зависимо-
сти от объема сустава колеблется от 20 мг для коленного сустава до
4 мг для проксимальных и дистальных межфаланговых суставов кис-
ти. Эффективность ГКС зависит от техники внутрисуставного введе-
ния, выраженности синовита, размера сустава и типа применяемого
200
препарата. Наименее эффективным ГКС, обладающим при этом боль-
шим по сравнению с другими числом побочных реакций, является
гидрокортизон [2, 10].
К препаратам второй группы, т.е. к структурно-модифицирующим
средствам, могут быть отнесены те, основным компонентом которых
являются сульфатированные и (возможно) несульфатированные ГАГ.
Основа действия препаратов второй группы — подавление энзимов,
вызывающих деструкцию хряща, усиление метаболических процессов
в субхондральной кости и стимуляция выработки хондроцитами пол-
ноценных ГАГ. Отличительной особенностью этих препаратов явля-
ются время наступления эффекта (обычно спустя 2—8 нед от начала
лечения) и сохранение эффекта в течение 2-3 мес после прекращения
лечения.
Наиболее известными лекарственными средствами данной группы
являются гликозаминогликан поли сульфат (артепарон), полипептид-
ный комплекс ГАГ (румалон) и гиалуронат натрия (гиалган) [6, 13].
Указанные препараты применяются внутримышечно (артепарон, ру-
малон) и/или внутрисуставно (артепарон, гиалган), повторными кур-
сами и рассчитаны на длительное, часто многолетнее, применение.
Несмотря на доказанную эффективность данных лекарств, их значе-
ние в последние годы утрачивается. Этому способствуют как меди-
цинские (парентеральный путь введения), так и не медицинские (отсут-
ствие на фармацевтическом рынке, высокая цена и др.) причины.
В последние годы список препаратов с предполагаемым структур-
но-модифицирующим действием пополнился ГАГ, назначаемыми per
os, что, бесспорно, для длительного лечения предпочтительнее, чем
инъекционные формы. Гистохимические исследования биопсийного
материала показали, что при ОА хрящ теряет примерно 40—50 % ГАГ,
поэтому применение данных препаратов является весьма привлека-
тельным и патогенетически обоснованным. При фармакокинетических
исследованиях выявлено, что при приеме внутрь они хорошо абсор-
бируются и обнаруживаются в высоких концентрациях в синовиаль-
ной жидкости и поврежденном хряще. Они обладают противовоспа-
лительной активностью (воздействуя в основном на клеточный ком-
понент воспаления), стимулируют синтез ПГ и гиалуроновой кисло-
ты, ингибируют действие протеолитических ферментов (исследования
in vivo).
Глюкоз амина сульфат (препарат дона) и хондроитина сульфат (пре-
парат структум), являясь структурными компонентами нормального
гиалинового хряща, как свидетельствуют контролируемые междуна-
родные исследования и данные Института ревматологии РАМН, спо-
собны при систематическом применении уменьшить клинические про-
явления артроза любой локализации за счет подавления активности
хондролитических ферментов (при отсутствии воздействия на синтез
ПГ [11, 12].
Дона назначается по 1500 мг (содержимое 1 пакетика) в день кур-
сами по 6 нед с интервалом в 1—2 мес. Препарат сочетается с НПВП
201
и, по экспериментальным данным, препятствует отрицательному вли-
янию последних на синтез ГАГ.
Структум в течение первых 3 мес приема применяется при ОА в
дозе 1500 мг, в последующие недели и месяцы доза уменьшается до
1000 мг. Возможно сочетание с НПВП, а при наступлении клиничес-
кого улучшения целесообразно уменьшение дозы НПВП.
В клинических исследованиях, в том числе проведенных в Инсти-
туте ревматологии РАМН, продемонстрирована эффективность пре-
паратов дона и структум в отношении влияния на болевой синдром,
выраженность синовита, функциональное состояние суставов, возмож-
ность уменьшения дозы НПВП, а также улучшение качества жизни
больных ОА. В международных исследованиях последних лет уста-
новлено, что назначение препаратов дона и структум в течение не-
скольких лет позволяет замедлить прогрессирование ОА. Существен-
но, что клиническая эффективность этих препаратов подтверждена
лабораторным (содержание кератансульфата и остеокальцина в кро-
ви, пиридинолина в моче) и инструментальным (рентгенография и
магнитно-резонансная томография) мониторингом. Особым преимуще-
ством препаратов дона и структум является очень низкая частота
побочных реакций, в том числе и при их многолетнем приеме.
Углубление современных представлений о патогенезе и течении
ОА, создание препаратов, сочетающих в себе патогенетическую на-
правленность и хорошую переносимость, создают предпосылки для
изменения прогноза заболевания и улучшения качества жизни боль-
ных.
СПИСОК ЛИТЕРАТУРЫ
1. Creamer Р„ Hochberg М.С. Osteoarthritis // Lancet —1997. — Vol. 350. —
Р. 503—508.
2. Dieppe P.A.t Sathapatayavongs В., Jones H.E. et al. Intra-articular steroids
in osteoarthritis // Rheum. RehabiL — 1980. — Vol. 19. — P. 212—217.
3. Dieppe P., Cushnaghan J., Jasani M.K. et al. A two-year, placebo-control
trial of non-steroidal anti-inflammatory therapy in osteoarthritis of the
knee joint // Brit. J. Rheumatol. — 1993. — Vol. 32. —P. 595—600.
4. Dingle J. T. Cartilage maintenance in osteoarthritis: interactions of cytokines,
NSAID and prostaglandins in articular cartilage damage and repair // J.
Rheumatol. — 1991. — Vol. 28, Suppl. 18. — P. 30—37.
5. Distel A/., Mueleer C., Bluhmki E., Fries J. Safety of meloxicam: a global analy-
sis of clinical trials // Brit. J. Rheumatol. — 1996. — Vol. 35, SuppL 1. —
P. 68—77.
6. Dougados A/., Nguyen M., Listrat K, Amor B. High molecular weight sodium
hyaluronate in osteoarthritis of the knee: a 1 year placebo-control trial //
Osteoarthritis Cartilage. — 1993. — Vol. 1. — P. 97—103.
7. Edelson R., Burks R. T. Bloebaum R.D. Short-term effects of knee washout
for osteoarthritis // Amer. J. Sports Med. — 1995. — VoL 23. — P. 345—
349.
8. Felson D. T„ Anderson J. J., Naimark A. et al. Obesity and knee osteoarthritis
// Ann. intern. Med. — 1988. — Vol. 109. — P. 18—24.
202
9. Felson D. T, Zhang У. An update on the epidemiology of knee and hip
osteoarthritis with view to prevention // Arthr. Rheum. — 1998. — Vol. 41. —
P. 1343—1355.
10. Huskinsson E.G., Berry H., Gishen P. et al. On bahalf of the LINK study
group. Effects of anti-inflammatory drugs on the progression of
osteoarthritis of the knee //J. Rheumatol. — 1995. — Vol. 22. — P. 1941—
1946.
11. Mor reale P., Manopulo R., Galati M. et al. Comparison of the anti-
inflammatory efficacy of chondroitin sulphate and diclofenac sodium in
patients with knee osteoarthritis // J. Rheumatol. — 1996. — Vol. 23. —P.
1385—1391.
12. Noack W., Fischer M., Forster K.K. et al. Glucosamine sulfate in
osteoarthritis of the knee // Osteoarthritis Cartilage. — 1994. — Vol. 2. —
P. 51—59.
13. Pavelka KJr., Sedlackova M., Gatterova J. et al. GAGPS (Arteparon) in
osteoarthritis of the knee // Osteoarthritis Cartilage. — 1995. — Vol. 3. —
P. 15—23.
14. Pelletier J.P., Martel-Pelletier J., Howell D.S. Etiopathogenesis of osteo-
arthritis // Textbook of Rheumatology // Ed. W.J.Koopman. — Baltimore,
1997. —P. 1966-1984.
15. Schouten J.S., Vanden Ouweland EA.t Valkenburg H.A. A 12 year follow up
study in the general population on prognostis factor of cartilage loss in
OA of the knee // Ann. Rheum. Dis. — 1992. — Vol. 51. — P. 932—937.
Лекция 20
СОВРЕМЕННЫЕ ПРОБЛЕМЫ
ГЛЮКОКОРТИКОИДНОЙ ТЕРАПИИ
Член-корр. РАМН, профессор Е.Л. Насонов (кафедра рев-
матологии ФППО Московской медицинской академии им.
И. М. Сеченова)
История применения глюкокортикостероидов (ГКС) в медицине
неразрывно связана с развитием ревматологии. Изучение ГКС нача-
лось еще в начале 20-х годов XX в. с клинических наблюдений аме-
риканского клинициста-ревматолога Ф.Хенча, работавшего в знаме-
нитой клинике Мейо (США). Он обратил внимание на то, что во вре-
мя беременности у женщин, страдающих РА, наблюдается уменьше-
ние воспаления суставов. Было высказано предположение о том, что
развитие беременности стимулирует синтез адренокортикотропного ве-
щества, которое было обозначено как «субстанция X», вероятно, об-
ладающего противовоспалительной активностью. К середине 30-х го-
203
дов группа американских биохимиков под руководством Кендала
изолировала несколько адренокортикотропных веществ, среди кото-
рых наиболее высокой активностью обладала субстанция Е, в насто-
ящее время известная как кортизол. В сентябре 1948 г. 29-летней жен-
щине-инвалиду, длительно страдавшей тяжелым РА, было сделано
несколько внутримышечных инъекций кортизола, что привело к очень
быстрому и значительному уменьшению воспаления суставов [12]. В
1950 г. за открытие глюкокортикостероидных гормонов и создание
на этой основе противовоспалительных глюкокортикостероидных
препаратов группа исследователей во главе с Ф.Хенчем были удос-
тоены Нобелевской премии в области физиологии и медицины. В Рос-
сии в середине 50-х годов ГКС (преднизон) впервые с успехом исполь-
зованы для лечения ряда ревматических заболеваний А.И. Нестеровым
и Е.М.Тареевым [3, 4].
До сих пор, несмотря на большие достижения в области фармако-
терапии воспалительных заболеваний, ГКС остаются самыми мощны-
ми из существующих противовоспалительных препаратов. Сфера их
применения при заболеваниях человека чрезвычайно разнообразна:
трансплантология, лечение аллергических и гематологических болез-
ней, заболеваний почек, кишечника, печени, глаз, кожи и особенно
ревматических заболеваний, при которых (наряду с бронхиальной
астмой) показана длительная терапия ГКС. Известно, что в США ГКС
назначаются более чем 5 млн больных с различными заболеваниями
внутренних органов.
ГКС оказывают мощное действие на развитие и гомеостаз иммун-
ной системы [7]. В физиологических дозах эти препараты модулиру-
ют селекцию тимоцитов, регулируют иммунный опыт посредством
изменения секреции цитокинов. В фармакологических концентрациях
ГКС предотвращают или отменяют развитие воспаления и иммуноло-
гически опосредованные процессы путем подавления миграции лей-
коцитов в зону воспаления, модуляции функциональной активности
лейкоцитов, эндотелиальных клеток (ЭК) и фибробластов, ингибиро-
вании синтеза и цитотоксических эффектов гуморальных медиаторов
воспаления. Основной молекулярный механизм, лежащий в основе
биологической активности ГКС, — регуляция экспрессии ряда генов
на транскрипционном и посттранскрипционном уровнях. Препараты
проявляют свою биологическую активность за счет связывания с ци-
топлазматическими ГКС-рецепторами, расположенными внутри кле-
ток-мишеней, регулирующих транскрипцию широкого спектра генов
[6]. ГКС-рецепторы регулируют транскрипцию ГКС-зависимых генов
за счет двух основных механизмов: прямого и опосредованного. Во-
первых, внутри клетки они образуют димер, который связывается с
участками ДНК, получившими название глюкокортикоидотвечаю-
щих элементов (glucocorticoid response elements-GRE), расположенны-
ми в промоторном участке стероидотвечающего гена. Во-вторых,
ГКС-рецепторы взаимодействуют с различными факторами транс-
крипции или ядерными факторами (nuclear factor, NF). Ядерные фак-
204
торы, такие как активаторный белок фактора транскрипции (АР-1) и
NF-kB, являются естественными регуляторами нескольких генов, при-
нимающих участие в иммунном ответе и воспалении, включая гены
цитокинов, их рецепторов, молекул адгезии, протеиназ и др. Недав-
но открыт еще один важный механизм действия ГКС, связанный с
влиянием на транскрипционную активацию цитоплазматического ин-
гибитора NF-kB — IkBa [8].
Следует особо подчеркнуть многообразие форм глюкокортикосте-
роидной терапии, которая может проводиться путем системного (пе-
рорального или парентерального) введения препаратов или локаль-
ной терапии (внутрисуставная, ингаляционная, внутриректальная и
др.), а также в виде мазей, капель и др.
В ревматологии системное применение ГКС является основным (или
одним из основных) подходов к лечению большой группы тяжелых
инвалидизирующих или потенциально смертельных заболеваний:
СКВ, большинство форм системных васкулитов, идиопатические вос-
палительные миопатии, а также важным компонентом комплексной
терапии РА [1] (табл. 20.1).
Таблица 20.1. Основные показания к системному применению ГКС при
ревматических заболеваниях
Заболевания
Показания
Доза
РА
СКВ
Неэффективность
НПВП или противо-
показания для назна-
чения НПВП (+базис-
ная терапия)
Ревматоидный васкулит
Артрит, низкая актив-
ность болезни
Поражение почек и
ЦНС
Преднизолон <10 мг/сут
Преднизолон 1 мг/кг-сут
+ циклофосфамид 1—
2 мг/кг/сут
Полимиозит (дермато-
миозит)
Синдром Шегрена
Узелковый полиартери-
ит и синдром Черга—
Стросса
Гранулематоз Вегенера
и микроскопический
полиартериит
Эссенциальная смешан-
ная криоглобулинемия
Васкулит
Умеренная активность
Высокая активность
Преднизолон 15 мг/сут
Преднизолон 1 мг/кг-сут
+ циклофосфамид
(пульс-терапия)
1 мг/кг/сут
Преднизолон I мг/кг-сут
Преднизолон 1 мг/кг-сут
Преднизолон 1 мг/кг-сут
+ циклофосфамид 1—
2 мг/кг/сут
Преднизолон 1 мг/кг/сут
+ циклофосфамид 1—
2 мг/кг/сут
Преднизолон 1 мг/кг-сут
+ циклофосфамид 1—
2 мг/кг/сут
205
Продолжение
Заболевания
Показания
Доза
Системная склеродермия
Синдром эозинофилии-
миалгии
Рецидивирующий по-
лихондрит
Побочные эффекты ба-
зисной терапии
Миозит, плеврит, вас-
кулит, перикардит,
артрит
Преднизолон 15—
60 мг/сут
Преднизолон 1 мг/кг/сут
Преднизолон 0,5—
1 мг/кг-сут
Соли золота, D-пени-
цилламин, сульфасала-
зин и др. 15—60 мг/сут
Одним из наиболее часто применяемых и эффективных вариантов
лечения ГКС является инъекционное (локальное) введение препаратов
как в полость сустава, так и в пер партикулярные ткани (сухожильные
влагалища, суставные сумки). Впервые гидрокортизон введен в колен-
ный сустав больного РА известным американским ревматологом Хол-
ландером еще в 1951 г., что привело не только к уменьшению воспале-
ния, но и улучшению общего состояния больного. Уже через 10 лет
Холландер, проанализировав результаты более чем 100 тыс. внутри-
суставных (и околосуставных) введений ГКС, проведенных более чем
у 4000 больных, подтвердил противовоспалительный эффект этого вида
лечения, отметил безопасность повторных инъекций. В настоящее вре-
мя локальная терапия ГКС при разнообразных воспалительных пора-
жениях опорно-двигательного аппарата не вызывает сомнений, но ее
успех зависит от ряда факторов (правильная оценка показаний и про-
тивопоказаний, выбор препарата, его дозировка, техника проведения
манипуляции, соблюдение правил асептики и антисептики). Следует
подчеркнуть, что особенно широкое распространение получили мощ-
ные длительно действующие (пролонгированные) ГКС, к наиболее
эффективным из них, несомненно, относится дипроспа н. Он пред-
ставляет собой смесь натрий-фосфатной соли бетаметазона, которая
хорошо растворяется, и поэтому быстро всасывается, обеспечивая
быстрый эффект (в течение нескольких часов), и бетаметазона ацетата
(или бетаметазона пропионата), который слабо растворяется и медлен-
но всасывается. Комбинация этих веществ обеспечивает быстрое дей-
ствие препарата, продолжающееся длительное время (до 30—35 дней).
Важным этапом на пути повышения эффективности терапии ГКС
явилось внедрение в клиническую практику метода «пульс-терапия»,
под которым подразумевают быстрое (в течение 30—60 мин) внутри-
венное введение больших доз ГКС (1000 мг метилпреднизолона) 1 раз
в день на протяжении 3 сут. Наиболее часто при проведении пульс-
терапии используют метилпреднизолон, а в последнее время —декса-
метазон (дексавен).
206
Показания к пульс-терапии
при ревматических заболеваниях
Заболевание Комментарий
СКВ без нефрита Эффективный ме- тод купирования внепочечных про- явлений (лихорад- ка, артрит, серозит, миозит, гематоло- гические наруше- ния; поражение ЦНС (?)
Волчаночный неф- В сочетании с цик-
рит лофосфамидом
Системные васкули- В большинстве слу-
ты чаев (за исключени- ем гигантоклеточ- ного артериита) в сочетании с цито- токсическими им- мунодепрессантами
Полимиозит Эффективен при
(дерматомиозит) ювенильном дерма- томиозите, снижает частоту кальцино- за. При полимиози- те (дерматомиози- те) у взрослых при- меняется в случае развития опасных для жизни ослож- нений
РА Ревматоидный вас- кулит (+ цитотокси- ческие иммунодеп- рессанты); «bridge»- терапия (?)
Необходимо подчеркнуть, что у больных с наиболее тяжелыми
формами ревматических болезней, такими как волчаночный нефрит,
ЦНС-люпус, ревматоидный васкулит, системные некротизирующие
васкулиты, пульс-терапия, ГКС обычно сочетается с активной цито-
токсической терапией, в первую очередь циклофосфамидом, что по-
зволяет улучшить прогноз заболевания.
В процессе системного применения ГКС очень скоро стало очевид-
ным, что лечение этими препаратами ассоциируется с широким спек-
тром тяжелых побочных явлений, что существенно ограничивает их
207
использование в клинической практике (табл. 20.2). Среди них осо-
бое место занимает ГКС-индуцированный остеопороз, который рас-
сматривается как одно из наиболее характерных и потенциально тя-
желых последствий терапии этими препаратами.
Таблица 20.2. Побочные эффекты в зависимости от дозы ГКС
Побочные эффекты
вероятные при высокой дозе вероятные при высокой и низкой дозе определенные
Инфекции Ожирение
Остеонекроз Остеопороз Миопатия Синдром отмены
Панкреатит Разрыв кишечника Пептическая язва
Гипертензия Дислипопротеинемия
Задержка роста плода Психоз Катаракта, глаукома
Нарушение ре- парации Утри Гирсуитизм Пурпура Атрофия кожи
Патология оси типо- физ -“Гипоталамус— надпочечники Сахарный диабет
В последние годы были проведены дополнительные клиничес-
кие испытания, позволившие разработать более строгие показания
к применению ГКС в ревматологии, схемы лечения. Тем не менее,
несмотря на продолжающиеся с возрастающей интенсивностью ис-
следования до сих пор остается немало вопросов, касающихся ха-
рактера взаимосвязи между вводимой дозой препарата и выражен-
ностью противовоспалительного эффекта, соотношения эффективно-
сти и токсичности, оптимального времени назначения ГКС с учетом
циркадных колебаний синтеза кортизола и, наконец, механизмов,
лежащих в основе резистентности к глюкокортикостероидным пре-
паратам или предрасположенности к развитию побочных эффек-
тов.
208
Большой интерес представляют недавно полученные данные о том,
что в зависимости от дозы эффекты ГКС могут реализовываться на
разных уровнях [10]. В низких концентрациях (>1012 моль/л) ГКС реа-
лизуют свое действие за счет так называемых геномных эффектов, в
средних концентрациях (>10-9 моль/л) — за счет как геномных, так и
рецепторопосредованных. В высоких концентрациях (>104 моль/л)
наряду с перечисленными выше эффектами определенную роль играет
способность ГКС влиять на физико-химические свойства биомембран
клеток-мишеней. Эти данные в определенной степени позволяют объяс-
нить различия в противовоспалительной и иммуномодулирующей ак-
тивности ГКС при назначении их больным в низких (<10 мг/сут), сред-
них/высоких (~ 1 мг/кг/сут) дозах или пульс-терапии (1 г/сут).
Достижения и нерешенные проблемы терапии ГКС особенно ярко
видны на примере РА — широко распространенного системного ауто-
иммунного ревматического заболевания, рассматриваемого как про-
тотип хронических воспалительных заболеваний человека, фармако-
терапия которого продолжает оставаться одной из наиболее сложных
проблем современной медицины [13].
Оценка действия ГКС при ревматоидном
артрите [15]
За
Против
Подавляют симпто-
мы (боль, скован-
ность, суставной
индекс) и лаборатор-
ные (СОЭ, СРБ)
признаки воспаления
Улучшают «качество
жизни» больных;
замедляют рентге-
нологически выяв-
ляемое прогрессиро-
вание артрита
В низких дозах эф-
фективны не всегда; у
некоторых больных
быстро развиваются
побочные эффекты
Не улучшают отда-
ленный (через 20 лет)
прогноз болезни
Могут замедлять
снижение плотности
костной ткани, осо-
бенно в шейке бед-
ренной кости
Могут увеличивать
риск остеопоротичес-
ких переломов
Предполагают, что в основе развития РА (по крайней мере на ран-
ней стадии) лежит активация Т-лимфоцитов по ТЫ-типу, а хрониза-
ция ревматоидного воспаления определяется нарушением равновесия
между синтезом провоспалительных цитокинов, таких как ФНО-а,
ИЛ-1, ИЛ-6, ИЛ-8 и др. и антивоспалительных цитокинов (ИЛ-10,
8—3592
209
Ингибирование
Рис. 20.1. Взаимодействие между глюкокортикостероидами и цитокинами
Th-1 и Th-2 типов.
растворимый антагонист ИЛ-1, растворимые рецепторы ФНО-а,
ИЛ-4) с преобладанием синтеза первых над вторыми [11]. Учитывая
характер нарушений в системе иммунитета при РА и известных ме-
ханизмов противовоспалительной активности ГКС, можно выделить
следующие основные точки приложения этих препаратов, которые
объясняют эффективность локальной и системной ГКС-терапии при
этом заболевании: подавление Thl-типа (провоспалительного) иммун-
ного ответа (ИЛ-2, ИФ-у) и стимуляция ТЬ2-типа (антивоспалитель-
ного) иммунного ответа (ИЛ-4, ИЛ-10) (рис. 20.1), ингибирование
экспрессии генов, кодирующих синтез провоспалительных цитоки-
нов (ФНО-а, ИЛ-1, ИЛ-6, ИЛ-8), молекул адгезии, протеиназ (кол-
лагеназа, стромелизин) и других ферментов, подавление синтеза про-
стагландинов (ингибирование циклооксигеназы-2 и липокортинзави-
симые механизмы) [16]. Очевидно, что ГКС потенциально обладают
способностью влиять на большинство патогенетических механизмов,
лежащих в основе ревматоидного воспаления. Действительно, в се-
рии исследований было обнаружено, что назначение ГКС больным
РА ассоциируется с подавлением синтеза ФНО-а и ИЛ-ip синовио-
цитами, ФНО-индуцированной гиперэкспрессии межклеточной мо-
лекулы адгезии-1 (ICAM-1) синовиальными фибробластами, миграции
нейтрофилов в полость суставов, снижением экспрессии Р2-интегрина
(CD11b), а также снижением прилипания лимфоцитов больных РА к
культивируемым фибробластам, что связывают с подавлением эксп-
рессии сосудистой молекулы адгезии-1 (VCAM-1). На фоне пульс-те-
рапии ГКС отмечено снижение уровня растворимых ИЛ-2-рецепторов
(маркер активации Т-клеточного иммунитета) и провоспалительных
цитокинов (ИЛ-6 и ИЛ-8) в сыворотке крови. Примечательно, что в
210
целом пульс-терапия ГКС оказывает такое же воздействие на систе-
му иммунитета у больных РА, какое имеет место при введении боль-
ным моноклональных антител к ФНОа (табл. 20.3). Это позволяет
предположить, что одной из важных точек приложения ГКС при РА
является прежде всего ингибирование синтеза ФНО-а, гиперпродук-
ция которого рассматривается в качестве одного из ключевых элемен-
тов иммунопатогенеза РА. Наконец, ГКС в физиологических концен-
трациях ингибируют циклооксигеназу-2, которая играет основную
роль в синтезе простагландинов, обладающих воспалительной актив-
ностью [2].
Таблица 20.3. Сходство механизмов действия пульс-терапии ГКС и мо-
ноклональных анти-ФНОа при РА |17]
Механизм действия Анти-ФНОа Пульс-терапия
Кинетика ответа Быстрый Быстрый
Отсутствие эффекта Около 20 % Около 20 %
Обострение Последующий эффект при повторном введе- нии 6—12 нед 6—12 нед
Побочные эффекты Минимальные Минимальные
ФНОа ' *
ИЛ-8 ' * f
ИЛ-6 ' *
СРБ ' * f
Е-селектин ' * ' *
Движение лейкоцитов ' * ч f
Тахифилаксия Возможна Возможна
В последние годы активно изучается еще один аспект ГКС-тера-
пии РА, который может объяснить высокую эффективность этих пре-
паратов. Полагают, что один из важных патогенетических механиз-
мов РА (по крайней мере у некоторых больных) может быть связан с
дефектами на уровне оси гипоталамус—гипофиз—надпочечник, по-
скольку эндогенное увеличение синтеза кортизола имеет большое
значение для предотвращения избыточной активации иммунной сис-
темы и хронизации воспаления. Известны данные о том, что у боль-
ных РА отмечены отсутствие суточных колебаний концентрации
кортизола в сыворотке крови, неадекватный синтез кортизола в от-
вет на стрессорные стимулы и низкий базальный уровень этого гор-
мона, не соответствующий выраженности воспалительного процес-
са, ослабление базального и кортикотропинстимулированного син-
теза кортизола [18].
Однако несмотря на то, что возможность лечения ГКС больных РА
теоретически хорошо обоснована, результаты клинического примене-
ния этих препаратов весьма противоречивы. Еще в ранних исследова-
8*
211
ниях было показано, что преднизолон в суточной дозе 30—40 мг/сут
обладает более выраженной противовоспалительной активностью, чем
высокие дозы (более 6 г/сут) аспирина. Однако развитие большого
числа побочных эффектов на фоне лечения столь высокими дозами
ГКС приостановило дальнейшее изучение эффективности высоких доз
ГКС при РА.
В начале 1980 г. E.Harris [13] предложил использовать низкие
дозы ГКС при РА в качестве так называемой мост-терапии («bridge»)
до того момента, когда начнут действовать базисные противорев-
матические препараты. В целом есть основания полагать, что низ-
кие дозы ГКС (7—15 мг/сут) в ряде случаев позволяют адекватно
контролировать ревматоидное воспаление, не уступая в этом отно-
шении другим методам лечения, и обладают приемлемым профилем
токсичности.
В последние годы особый интерес вызывают «базисные» (или «мо-
дифицирующие болезнь») эффекты ГКС. По данным недавно прове-
денного двойного слепого контролируемого исследования, лечение
преднизолоном (7,5 мг/сут) в течение 2 лет в сочетании с базисной
терапией снижает скорость рентгенологического прогрессирования у
больных с ранним активным РА [14].
Серия специальных исследований посвящена оценке возможностей
пульс-терапии ГКС при РА. Имеются данные о том, что пульс-тера-
пия ГКС позволяет поддерживать клиническое улучшение в течение
определенного периода (по крайней мере 24 нед), до начала действия
базисных противоревматических препаратов, снизить частоту ранних
побочных эффектов.
Важные результаты получены недавно при изучении связи между
клинической эффективностью ГКС и временем назначения препара-
тов с учетом их фармакокинетики и циркадных колебаний уровня
кортизола и цитокинов. Появились данные о том, что назначение пред-
низолона (5—7,5 мг) больным РА в ночное время предпочтительнее с
точки зрения клинической эффективности и подавления секреции про-
воспалительных цитокинов, чем в утренние часы. Фактически пред-
низолон в дозе 5 мг, назначенный в 2 ч ночи, проявлял такую же ан-
тивоспалительную активность, как и доза преднизолона 15—17,5 мг,
принятого в утреннее или дневное время [5].
Данные, касающиеся роли ГКС в развитии остеопороза при РА,
противоречивы. Несмотря на то, что способность ГКС индуцировать
развитие остеопороза не вызывает сомнений, у больных РА имеет
место много других факторов, оказывающих негативное влияние на
массу костной ткани (хроническое воспаление, нарушение двигатель-
ной активности и др.).
Имеются сведения о том, что адекватная терапия низкими дозами
ГКС (5—7,5 мг/сут) ассоциируется с менее выраженным снижением
плотности кости, чем лечение высокими (>10 мг/сут) или очень низки-
ми (<5 мг/сут) дозами ГКС. Это позволяет предположить, что низкие
дозы ГКС у некоторых больных РА могут обладать определенным ан-
212
тиостеопоротическим действием в связи с улучшением подвижности
суставов и уменьшением выраженности воспаления [15].
В последние годы особое внимание исследователей привлечено к
проблеме резистентности к ГКС, наблюдаемой у больных ревматичес-
кими (РА, СКВ) и неревматическими (болезнь Крона, саркоидоз, хро-
ническая крапивница, бронхиальная астма) заболеваниями, злокаче-
ственными новообразованиями и при пересадке органов и тканей.
Полагают, что частота резистентности к ГКС в популяции довольно
высока и затрагивает не менее 25 % здоровых индивидуумов. В осно-
ве резистентности к ГКС лежат разнообразные, пока еще недостаточ-
но изученные механизмы, регистрирующиеся на клеточном (снижение
чувствительности лимфоцитов к ГКС-индуцированному апоптозу),
молекулярном (увеличение экспрессии иРНК ИЛ-2, ИЛ-4 и ИЛ-13 в
лимфоцитах) и рецепторном (увеличение экспрессии глюкокортико-
стероидных рецепторов а, снижение связывающей аффинности ГКС-
рецепторов) уровнях.
Таким образом, ГКС остаются одними из наиболее эффективных
препаратов для лечения ревматических заболеваний, позволяют су-
щественно улучшить прогноз и повысить качество жизни больным
такими тяжелыми ревматическими заболеваниями, как СКВ, полими-
озит/дерматомиозит, некоторые формы системных васкулитов (вклю-
чая ревматоидный васкулит). При РА применение низких доз ГКС
позволяет получить не только симптоматический эффект, но и в ком-
бинации с «базисными» противоревматическими препаратами, веро-
ятно, создает реальные предпосылки для модификации течения болез-
ни, снижения скорости прогрессирования деструктивного процесса в
суставах. Однако наиболее оптимальные схемы назначения ГКС, по-
казания и противопоказания для их применения, место пульс-терапии
в комплексном лечении РА и других ревматических заболеваний тре-
буют дальнейшего изучения.
СПИСОК ЛИТЕРАТУРЫ
1. Насонов Е.Л, Противовоспалительная терапия ревматических болез-
ней. — Москва: М-Сити, 1996. — 345 с.
2. Насонов Е.Л., Цветкова Е.С., Тов НВ. Селективные ингибиторы цикло-
оксигеназы 2: перспективы применения для лечения заболеваний чело-
века // Тер. арх. — 1998. — №5. — С. 8—14.
3. Тареев Е.М.> Насонова В. А. Место стероидных гормонов в комплексном
лечении так называемых больших коллагенозов // Сов. мед. — 1960. —
№ 12. — С. 3.
4. Тареев Е.М., Виноградова О.М., Насонова В.А., Гусева Н.Г. Коллагенозы
(системная красная волчанка, системная склеродермия, дерматомиозит,
узелковый периартериит). — М.: Медицина, 1965.
5. Arvidson N.G., Gudbjornsson В., Larson A., Hllgren R. The time of
glucocorticoid administration in rheumatoid arthritis // Ann. Rheum.
Dis. — 1997. — Vol. 56. — P. 27—31.
213
6. Barnes P.J., Adcock I. Anti-inflammatory actions of steroids: molecular
mechanisms // TIPS. — 1993. — Vol. 14. — P. 436—441.
7. Boumpas D.T., Chrousos G.P., Wilder R.L. et al. Glucocorticoid therapy
for immune-mediated diseases: basic and clinical correlates // Ann. Intern.
Med. — 1993. —Vol. 119. —P. 1198—1208.
8. Boumpas D.T. A novel action of glucocorticoids // Brit. J. Rheumatol. —
1996. — Vol. 35. — P. 709—710.
9. Buckingham J.C. Stress and the neuroendocrine-immune axis: the pivotal
role of glucocorticoids and lipocortin 1 // Brit. J. Pharmacol. — 1996. —
Vol. 118. —P. 1—19.
10. Buttgereit F., Wehling M., Burmester G.R. New hypothesis of modular
glucocorticoid actions. Steroid treatment of rheumatic diseases revisited //
Arthr. Rheum. — 1998. — Vol. 41. — P. 761—767.
11. Feldman M., Brennan F.M., Maini R.N. Role of cytokines in rheumatoid
arthritis // Ann. Rev. Immunol. — 1996. — Vol. 14. — P. 397—440.
12. Hench P.S., Kendall E.C., Slocumb C.H., Polley H.F. The effect of a hormone
of the adrenal cortex (17-hydroxy-l 1-dehydrocortisone: compound E) and
the pituitary adrenocorticotrophic hormone on rheumatoid arthritis:
preliminary report // Proc. Staff Meet Mayo Clin. — 1949. — Vol. 24. —
P. 181—197.
13. Harris E.D. Rheumatoid arthritis. Pathophysiology and implications for
therapy // New Engl. J. Med. — 1990. — Vol. 322. — P. 1277—1289.
14, Kirwan J.R. and the ARC council low-dose glucocorticoid study group.
The effects of glucocorticoids on joint destruction in rheumatoid arthritis
// New Engl. J. Med. — 1995. — Vol. 333. — P. 142—146.
15. Kirwan J.R., Russell A.S. Systemic glucocorticoid treatment in rheumatoid
arthritis — a debate // Scand. J. Rheumatol. — 1998. — Vol. 27. — P. 247—
251.
16. Norbito G., Belvilacqua M., Vago T.t Clerici M. Glucocorticoids and Th-1,
Th-2 type cytokines in rheumatoid arthritis, asthma, atopic dermatitis and
AIDS // Clin. exp. Rheumatol. — 1997. — Vol. 15. — P. 315—323.
17. Robert-Thompson P.J., Smith M.D., Ahern MJ. Similarities in the
mechanisms of action of pulse corticosteroids and anti-tumor necrosis
factor alpha therapy in rheumatoid arthritis // Arthr. Rheum, — 1998. —
Vol. 41. —P. 564—565.
18. Wilder R.L. Neuroendocrine-immune system interaction and autoimmunitv
// Ann. Rev. Immunol. — 1995. — Vol. 13. — P. 307—338.
214
Лекция 21
ИНТЕНСИВНАЯ ТЕРАПИЯ
РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЙ.
ОТ КАЗУИСТИКИ К ПОВСЕДНЕВНОСТИ
Д-р. мед, наук С,К, Соловьев (Институт ревматологии
РАМН)
На протяжении многих десятков лет к числу ревматических забо-
леваний (РЗ) относились прежде всего хронические, медленно прогрес-
сирующие заболевания опорно-двигательного аппарата. Обычной
врачебной практикой считалось назначение обезболивающих препа-
ратов, физиотерапии и санаторно-курортного лечения. Но уже с сере-
дины XX в. стремительное вхождение в круг РЗ диффузных болезней
соединительной ткани, имеющих в своей основе аутоиммунную агрес-
сию, заставило принципиально изменить наши взгляды на некоторые
аспекты терапии.
Установление диагноза СКВ, дерматомиозита, системной склеро-
дермии, некоторых системных васкулитов, развитие системных форм
ювенильного ревматоидного артрита или системных проявлений при
ревматоидном артрите фактически означало неизбежный летальный
исход еще в 50—60-е годы XX в. Появление ГКС и цитотоксических
иммунодепрессантов значительно расширило терапевтические возмож-
ности ревматологов и способствовало резкому увеличению выживае-
мости больных. Однако наблюдавшееся у 25—30 % пациентов дра-
матическое развитие клинических проявлений болезни в течение не-
скольких месяцев, недель, а иной раз и нескольких дней, вынуждало
ревматологов к поиску и внедрению в практику методов ургентной
интенсивной терапии (ИТ), которая позволяла бы получить выражен-
ный лечебный эффект за минимально короткое время.
За последние 15 лет в ревматологии утвердилось несколько спо-
собов ИТ.
Некоторые способы ИТ, применяемые в лечении ревматических
заболеваний
1. Внутривенное введение мегадоз метилпреднизолона или дексаметазона
(пульс-терапия)
2. Внутривенное введение мегадоз циклофосфамида и метотрексата (пульс-
терапия)
3. Внутривенное введение иммуноглобулина, антицитокиновых антител
и интерферонов
4. Различные типы афереза, гемосорбция, иммуносорбция, облучение крови
5. Пересадка костного мозга
215
Основным и наиболее распространенным способом ИТ можно счи-
тать внутривенное введение мегадоз ГКС, цитотоксических иммуно-
депрессантов, иммуноглобулина и (в некоторых случаях) антицито-
киновых антител и интерферонов. На втором месте по частоте приме-
нения находятся различные методы афереза: плазмаферез, цитоферез,
плазмо- и гемосорбция, биологическая и химическая иммуносорбция
(селективное удаление патологических белковых структур). Пока еще
на стадии изучения и разработки находится весьма перспективное
направление — пересадка костного мозга.
Востребованность и частота применения методов ИТ при различ-
ных РЗ зависят в первую очередь от вероятности развития критичес-
кой ситуации, непосредственно угрожающей жизни пациента. Анали-
зируя данные литературы по «Medline» за последние 20 лет и матери-
ал, накопленный в клинике Института ревматологии РАМН (более
5000 процедур экстракорпоральной терапии и не менее 1500 случаев
применения мегадоз ГКС и цитотоксических иммунодепрессантов), мы
получили следующие данные: около 2/3 всего объема интенсивной те-
рапии приходится на СКВ, далее следуют РА и системные васкули-
ты. Исторически сложилось так, что столь распространенные теперь
пульс-терапия 6-метилпреднизолоном, плазмаферез и гемосорбция
были впервые применены именно при СКВ. В последние годы при РА,
ЮРА и системных васкулитах все чаще стали использоваться более
совершенные в патогенетическом плане подходы к лечению: антици-
токиновые антитела и мегадозы иммуноглобулина.
Самые первые сообщения о применении экстракорпоральных ме-
тодов и пульс-терапии у больных РЗ касались использования этих ме-
тодов исключительно при критических состояниях. Благополучные
исходы после применения ИТ рассматривались поначалу как казуис-
тический и даже невероятный эффект, а в показаниях к ИТ явно пре-
валировали достаточно редкие критические ситуации, связанные с
прогрессирующим поражением жизненно важных органов и систем.
Некоторые из этих критических состояний у больных СКВ представ-
лены ниже:
— геморрагический пневмонит, альвеолит,
— поперечный миелит,
— цереброваскулит (судороги, психоз, кома),
— перитонит (поражение сосудов брюшной полости при волчан-
ке),
— глубокая тромбоцитопения с геморрагическим синдромом и раз-
витием синдрома диссеминированного внутрисосудистого свер-
тывания крови (синдром ДВС),
— «молниеносный васкулит» с распространенным поражением
кожи и слизистых оболочек.
Достаточно редкие, но почти безнадежные состояния с чрезвычай-
но высокой летальностью, достигающей при геморрагическом пнев-
моните, поперечном миелите и церебральной коме почти 100 %, бе-
216
зусловно, требовали решительных действий и нетрадиционных под-
ходов в лечении. И действительно, применение методов ИТ, а осо-
бенно их комбинирование резко повысили выживаемость этих паци-
ентов. С середины 80-х годов происходило лавинообразное накопле-
ние позитивных результатов применения ИТ у больных РЗ (главным
образом при СКВ и системных васкулитах), изучались механизмы
действия, совершенствовались технологии, аппаратура. Своеобраз-
ным стимулом для развития показаний к ИТ послужило выявление
факторов, определяющих неблагоприятный жизненный прогноз при
ряде РЗ. Хотя в целом при СКВ 10-летняя выживаемость превысила
80 %, в группах риска смертность в первые 5 лет оставалась высо-
кой — до 50 %, даже несмотря на очень тщательно разработанные про-
граммы консервативной терапии. При анализе причин смерти, леталь-
ности и выживаемости у больных СКВ отечественными (М.М.Ивано-
ва) и зарубежными (E.W.Karlson, J.V.Donedio, A.A.Bakir) исследова-
телями выявлены определенные факторы, с высокой степенью веро-
ятности определяющие неблагоприятный жизненный прогноз у боль-
ных СКВ.
Клинические и общие
исследования
Острое начало СКВ в подрост-
ковом возрасте
Прогрессирующий волчаноч-
ный нефрит
Синдром ДВС
Артериальная гипертензия
Цереброваскулит (судороги)
Европеоидная раса
Низкий уровень социальной
защиты
Лабораторные
исследования
Тромбоцитопения
Криоглобулинемия
Азотемия
Г ипокомплементемия
Высокий уровень антител к ДНК
Одна из самых распространенных и трудных задач — лечение СКВ
в подростковом возрасте в случае развития прогрессирующего нефри-
та, быстрого возникновения почечной недостаточности и артериаль-
ной гипертензии. Тромбоцитопения и синдром ДВС крайне редко ку-
пируются традиционной консервативной терапией, в том числе при
пероральном применении подавляющих доз цитотоксических иммуно-
депрессантов и ГКС. Волчаночная церебропатия с судорожным синд-
ромом (эпилептический или хорееподобный синдром, клонические
судороги и коматозное состояние) даже при купировании первых про-
явлений предопределяет крайне неблагоприятный прогноз. Из лабо-
раторных маркеров неблагоприятного прогноза следует особо выде-
217
лить криоглобулинемию, которая обычно сопровождается прогресси-
рующим поражением почек, язвенно-некротическим васкулитом либо
церебропатией.
Ниже приведены показания к ИТ у больных РА
Критические
состояния
Прогрессирующая
полинейропатия
«Ревматоидное лег-
кое»
Прогрессирующий
нефрит
Трофические язвы,
гангрена
Неблагоприятный
прогноз
Неэффективность
или непереноси-
мость базисных
средств
Кортикостероид-
ная зависимость
Ревматоидный вас-
кулит (лихорадка,
полиадения, диги-
тальный васкулит,
ревматоидные уз-
лы)
Персистирование
высокой воспали-
тельной активности
При РА критические состояния наблюдаются значительно реже,
чем при СКВ, хотя их развитие также драматично: по данным Skott и
Bacon, 5-летняя выживаемость у нелеченых больных с ревматоидным
васкулитом не превышает 50 %. В то же время прогрессирующее те-
чение РА, при котором отмечается неэффективность или непереноси-
мость основных базисных средств, встречает в своей практике прак-
тически каждый ревматолог. Кортикостероидная зависимость неко-
торых больных РА — также трудноразрешимая проблема.
Безусловно, такая задача, как улучшение жизненного прогноза, не
может и не должна решаться некими «разовыми акциями» — 3-днев-
ной пульс-терапией (ПТ), несколькими сеансами плазмафереза и т.п.
В основе лечения таких категорий больных должна быть, по нашему
мнению, заложена специально разработанная, индивидуальная про-
грамма ИТ. Такие программы существуют достаточно давно, и име-
ются данные, позволяющие оценить их достоинства и недостатки.
Некоторые программы ИТ, применяемые в ревматологии
— Ежемесячная пульс-терапия метилпреднизолоном [Liebling М.Р.,
1982].
— Многомесячная пульс-терапия циклофосфамидом [Sessoms S.L.,
1984; Boumpas D.T., 1992].
— Комбинированное применение пульс-терапии метилпреднизоло-
218
ном и циклофосфамидом [Соловьев С.К., Насонова В.А., Ива-
нова М.М., 1985; Gourly M.F., 1996].
— Синхронное применение плазмафереза и пульс-терапии [Соловь-
ев С.К., Насонова В.А., 1984, 1995; Shroeder F.O., Euler Н.Н.,
1987, 1994].
— Внутривенное применение иммуноглобулина в течение года
[Шайков А.В., Соловьев С.К., 1997—1998].
К становлению некоторых из этих программ имеет прямое отно-
шение и Институт ревматологии. Повторяющиеся, цикличные и пос-
ледовательные курсы ИТ, проводимые не только в периоды обостре-
ний и кризов, но и в спокойные, почти ремиссионные периоды (что осо-
бенно важно), позволяют принципиально по-новому оценивать перс-
пективы при самых тяжелых формах болезни.
Впервые ПТ метилпреднизолоном была с успехом применена у
больных с активным волчаночным нефритом Csthkart в 1976 г. В на-
шей стране первые сообщения о ПТ при СКВ относятся к 1979 г. Трех-
дневная ПТ метилпреднизолоном оказалась высокоэффективным спо-
собом лечения при многих внепочечных проявлениях СКВ — лихорад-
ке, полисерозите, полиартрите, в некоторых случаях волчаночной це-
ребропатии и цитопении. Лихорадочный синдром, полиартрит и по-
лисерозит обычно полностью купируются на 2—3-й день от начала ПТ
метилпреднизолоном. Эффективность ПТ метилпреднизолоном при це-
ребропатии подтверждается в случаях органического поражения моз-
га. При появлении первых симптомов (головные боли, зрительные
расстройства) по 1 г метилпреднизолона вводится в течение 3—
7 последующих дней. В случаях поперечного миелита эффективность
ПТ метилпреднизолоном невысока, около 50 %, и зависит от сроков
начала лечения. ПТ метилпреднизолоном высокоэффективна у боль-
ных СКВ с лейкопенией, в том числе и лекарственной, в некоторых
случаях аутоиммунной анемии и тромбоцитопении (синдром Верльго-
фа). При наиболее прогностически неблагоприятном и сложном для
курации волчаночном нефрите ПТ метилпреднизолоном, безусловно,
занимает одно из центральных мест. Эффективность лечения во мно-
гом зависит от длительности нефрита, его морфологической стадии и
выраженности почечной недостаточности. Наиболее эффективно на-
значение 3-дневной ПТ метилпреднизолоном на самых ранних стади-
ях нефрита, когда нет признаков серьезных изменений почечной тка-
ни и почечной недостаточности. В этих случаях длительность ремис-
сии нефрита может достигать многих месяцев и даже лет. У больных
с активным быстропрогрессирующим люпус-нефритом стандартная
ПТ метилпреднизолоном приводит к быстрому уменьшению протеи-
нурии, мочевого осадка и отеков, улучшению функции почек и ста-
билизации артериального давления.
Пульс-терапия метилпреднизолоном у больных РА имеет ограни-
ченное значение, поскольку лечебный эффект обычно непродолжите-
лен — от нескольких дней до нескольких недель. Однако в отдельных
219
исследованиях установлено, что ПТ метилпреднизолоном при высо-
кой активности РА и неэффективности базисных средств может при-
водить к значительному уменьшению суставного синдрома в течение
5—6 мес и существенно повышает «качество жизни». Этот период
необходимо использовать для новых попыток назначения базисных
препаратов по принципу «моста» (bridge). Вполне обоснованным яв-
ляется назначение ПТ метилпреднизолоном больным РА с системны-
ми проявлениями — лихорадкой, дигитальным васкулитом, нефритом,
нейропатией и прогрессирующим снижением массы тела; применение
этого метода терапии может быть решающим фактором в улучшении
жизненного прогноза.
Мощный противовоспалительный и иммуномодулирующий эф-
фект мегадоз метилпреднизолона с успехом используется в лечении
больных дерматомиозитом (полимиозитом), особенно при поражении
дыхательной и глотательной мускулатуры, системных васкулитов (в
том числе, болезни Хортона) и при болезни Шегрена. Пульс-тера-
пия метилпреднизолоном является одним из самых эффективных
средств купирования синдрома Лайелла, который может развивать-
ся у больных РЗ в ответ на лекарственную терапию. Препаратом
выбора для проведения ПТ традиционно считается метилпреднизо-
лон, прекрасно зарекомендовавший себя в клинической практике уже
в течение 15 лет. Он обладает минимальной минералкортикоидной
активностью, для него характерно выраженное противовоспалитель-
ное и иммуномодулирующее действие. В последние годы стали по-
являться сообщения о хороших результатах применения мегадоз дек-
саметазона (80—120 мг в день внутривенно). Дексаметазон превос-
ходит остальные ГКС по противовоспалительной активности, обла-
дает выраженным анти аллергическим и противоотечным действием.
Возможно, что дексаметазон будет эффективным у больных с тяже-
лой церебропатией, сопровождающейся отеком мозга, и «молниенос-
ным васкулитом».
Для повышения клинической эффективности ПТ при прогрессиру-
ющем волчаночном нефрите используется внутривенное введение 1 г
препарата один раз в месяц повторно в течение 6—12 мес. Программ-
ное проведение ПТ метилпреднизолона у больных люпус-нефритом
приводит к стойкому улучшению азотовыделительной функции почек,
уменьшению протеинурии и уровня антиядерных антител в сыворот-
ке крови. В определенных ситуациях, например при высокой иммуно-
логической активности, поперечном миелите и геморрагическом аль-
веолите, большего лечебного эффекта удается достичь при сочетании
мегадоз метилпреднизолона и циклофосфамида. Циклофосфамид в
этом случае применяется в дозе 15 мг на 1 кг массы тела больного
однократно, обычно на 2-й день стандартной пульс-терапии метил-
преднизолоном. Нестабильный клинический эффект ПТ метилпредни-
золоном наблюдается у больных с многолетним течением люпус-не-
фрита, преобладанием склероза клубочкового аппарата (V класс по
классификации ВОЗ), стойкой артериальной гипертензией и прогрес-
220
сирующей азотемией, но и здесь иногда назначение ударных доз ме-
тилпреднизолона приводило к быстрому и стойкому улучшению фун-
кции почек. Необходимо иметь в виду, что ПТ метилпреднизолоном
является лишь одним из методов лечения, ее яркий эффект нередко
бывает кратковременным и нестабильным.
Программное применение пульс-терапии циклофосфамидом у боль-
ных быстро прогрессирующим люпус-нефритом впервые предложено
S.L.Sessoms в 1984 г., а в начале 90-х годов — D.T.Boumpas и груп-
пой исследователей, руководимой проф. И.Е.Тареевой. Согласно этой
методике, циклофосфамид вводится внутривенно из расчета 1 г на
1 м2 поверхности тела больного 1—2 раза в месяц в течение года. По
сравнению с пероральной терапией циклофосфамидом и преднизоло-
ном эта программа позволяет добиться хороших и стабильных резуль-
татов у более чем 70 % больных с прогрессирующим волчаночным
нефритом. Особенно важным представляется и то, что внутривенное
введение мегадоз циклофосфамида оказывает значительно меньшее
токсическое воздействие на эпителий мочевого пузыря и костный мозг,
практически не вызывая геморрагических циститов и агранулоци-
тоза.
Одним из самых популярных и хорошо себя зарекомендовавших
методов программной ИТ можно считать синхронную ИТ, сочетаю-
щую в себе достоинства экстракорпоральной терапии — плазмафере-
за и пульс-терапии.
Методы эфферентной терапии — плазмаферез, гемосорбция и им-
муносорбция за счет удаления циркулирующих патологических ауто-
антител, ЦИК, криоглобулинов и цитокинов в значительной ме-
ре способствуют достижению быстрого клинического эффекта у
больных СКВ с рефрактерным нефритом или в ситуациях, непосред-
ственно угрожающих жизни, в случаях развития системных про-
явлений при РА, болезни Шегрена и некоторых системных васкули-
тах.
Приводим некоторые методы экстракорпоральной терапии, приме-
няемые в лечении ревматических заболеваний.
Гемоперфузионная терапия
Карбогемосорбция
Лимфосорбция
Иммуносорбция
Ультрафиолетовое или лазерное
облучение крови
Спленоперфузия
Плазмаферез
Центрифужный (гравитационный)
— дискретный
— непрерывный
Фильтрационный
— капиллярный
— мембранный
Каскадная плазмафильтрация
221
В силу различных причин в России наиболее распространены кар-
богемоперфузия (гемосорбция) и дискретный плазмаферез. Центри-
фужно-непрерывный и фильтрационный плазмаферез, вероятно, в наи-
большей степени отвечают современным технологиям лечения и
широко используются в клиниках стран Западной Европы, США и
Японии.
Появление в последние годы мембранных плазмафильтров отече-
ственного производства предоставляет возможность проводить плаз-
маферез на современном уровне.
Среди всех аутоиммунных РЗ наиболее часто плазмаферез и гемо-
сорбция применяются у больных СКВ в критических, угрожающих
жизни ситуациях. Результаты планового применения плазмафереза,
например, у больных с волчаночным нефритом весьма противоречи-
вы. Обычно после короткого периода улучшения наступает обостре-
ние, сопровождающееся резким повышением уровня антиядерных
антител и ЦИК.
Применение изолированной экстракорпоральной терапии у боль-
ных СКВ существенно ограничено из-за угрозы развития так называ-
емого «синдрома рикошета», характеризующегося бурной продукци-
ей аутоантител через 12—24 ч после окончания процедуры. Подавле-
ние активности лимфоцитов и предотвращение «рикошета» может
быть достигнуто путем синхронного программного применения плаз-
мафереза (или гемосорбции) и пульс-терапии метилпреднизолоном и
циклофосфамидом. Первые сообщения об успешном применении син-
хронной ИТ при СКВ появились в начале 80-х годов и касались в
основном лечения некурабельного нефрита, цереброваскулита и пнев-
монита.
Принципиально новый подход к плановому лечению тяжелых
форм СКВ был предложен H.H.Euler и F.O.Schreder, представивших
в 1994 г. результаты программы «синхронного» назначения плазма-
фереза и пульс-терапии циклофосфамидом. На первом этапе програм-
мы проводилось 3 последовательных плазмафереза с удалением
60 мл плазмы на 1 кг массы тела за сеанс, на 2-м этапе — внутри-
венное введение циклофосфамида по 500—750 мг в течение 3 дней.
Далее проводились внутривенно инфузии иммуноглобулина, назна-
чались циклофосфамид (от 50 до 100 мг в день) и преднизолон внутрь.
В результате длительная, многомесячная ремиссия отмечена у
16 из 25 больных. Исключительный интерес представляет то, что у
всех 16 больных сразу после окончания протокола терапии (через
6 мес) удалось отменить ГКС и цитотоксические иммунодепрес-
санты.
В нашем исследовании синхронная программная интенсивная те-
рапия использовалась для лечения 56 больных СКВ с неблагоприят-
ным жизненным прогнозом. Характерной особенностью каждого из
отобранных для лечения больных было сочетание нескольких прогно-
стически неблагоприятных признаков: начало заболевания в молодом
или подростковом возрасте, прогрессирующий нефрит, артериальная
222
гипертензия, церебропатия, генерализованный васкулит, криоглобу-
линемия, высокая иммунологическая активность и неэффективность
предшествующей терапии. Непосредственно после окончания I этапа
синхронной ИТ (3 сеанса плазмафереза, 3 г метилпреднизолона и 1 г
циклофосфамида внутривенно) у подавляющего большинства пациен-
тов отмечено значительное уменьшение активности заболевания. На
2-м этапе в течение года каждые 3 мес проводился 1 сеанс плазмафе-
реза и пульс-терапии с введением 1 г метилпреднизолона и 1 г цикло-
фосфамида. Последующее длительное, многомесячное наблюдение
продемонстрировало стойкое улучшение почти у 71 % больных. Наше
исследование еще раз подтверждает тот факт, что наибольший эффект
ИТ наблюдается у пациентов с высокой активностью и относительно
небольшой давностью заболевания. В лечении больных СКВ плазма-
ферез и пульс-терапия перестают быть «терапией отчаяния». Плано-
вое назначение программы ИТ, в особенности синхронной ИТ, заво-
евывает все больше сторонников, особенно при лечении больных не-
фритом и при поражении ЦНС. Весьма перспективным представляет-
ся комбинация плазмафереза и внутривенного введения иммуноглобу-
лина.
Осложнения и побочные реакции ИТ достаточно хорошо изучены,
легкоустранимы и редко представляют опасность для жизни. Высокая
эффективность, удовлетворительная переносимость и возможность
значительно уменьшить стоимость за счет назначения в амбулаторных
условиях обеспечивают синхронной ИТ устойчивые позиции в лече-
нии различных категорий больных СКВ.
В последнее время все больший интерес вызывают данные об эф-
фективности внутривенного введения иммуноглобулина G у больных
ревматическими заболеваниями, который стал применяться в лече-
нии аутоиммунных болезней около 10 лет назад. Сначала появились
отдельные сообщения, касающиеся его эффективности при тром-
боцитопенических кризах, затем при самых различных синдромах
СКВ — поражении ЦНС с развитием комы и судорожного синдро-
ма, АФС (тромбозы и выкидыши), рецидивирующих плевритах и
васкулите.
При полимиозите (дерматомиозите) внутривенно применяемый им-
муноглобулин особенно эффективен и имеет решающее значение при
лечении подростков и детей после безуспешной терапии кортикосте-
роидами; при болезни Кавасаки он является препаратом выбора. Все
большее значение имеет внутривенно применяемый иммуноглобулин
у детей с системной формой ЮРА, на ранней стадии развития систем-
ной формы ЮРА, до начала терапии ГКС, особенно в случаях остро-
го, манифестного развития заболевания.
Многомесячные программы внутривенно применяемого иммуно-
глобулина у детей с системной формой ЮРА позволяют практически
полностью отказаться от использования ГКС и существенно отдалить
назначение цитотоксических иммунодепрессантов.
Схемы лечения и дозы внутривенно применяемого иммуноглобули-
223
на при некоторых ревматических заболеваниях представлены в табл.
21.1.
Таблица 21.1. Применение иммуноглобулина при некоторых РЗ
Вид РЗ Доза внутривенно применяемого иммуноглобулина Продолжительность лечения
РА с системными про- явлениями 0,5 г/кг 1—2 раза в месяц в тече- ние 6 мес
Системная форма ЮРА 0,5 г/кг 5 дней подряд, 4 раза в год
СКВ (тромбоцитопения, церебропатия, плеврит); 0,5 г/кг 5 дней подряд
При АФС (выкидыши) 1 г/кг однократно
Дерматомиозит (поли- миозит) 2 г/кг 1—2 дня, ежемесячно до наступления эффекта
Внутривенно применяемый иммуноглобулин изготавливается из
донорской плазмы; по рекомендациям ВОЗ, для этого необходимо не
менее 5000 доноров. Наиболее эффективны и безопасны препараты
4-го поколения, содержащие не менее 97 % мономера IgG, с периодом
полужизни не менее 20 дней и с высокой степенью защиты от вирусов
гепатита и ВИЧ. Наиболее полно отвечает этим требованиям авст-
рийский препарат «Октагам»,
Таким образом, в последние годы значительно расширились пред-
ставления об интенсивной терапии в ревматологии, появились прин-
ципиально новые технологии, методы, препараты. Активно формиру-
ется представление о целесообразности планового, программного на-
значения ИТ уже на ранних стадиях заболеваний. Агрессивные мето-
ды лечения перестают быть «терапией отчаяния», уделом реанимаци-
онных отделений и применяются не только в ургентных ситуациях.
Плановое применение этих методов способно существенно улучшить
отдаленный прогноз у значительной части больных СКВ, системными
васкулитами и другими аутоиммунными ревматическими заболевани-
ями.
В ближайшей перспективе вполне вероятно появление новых схем
и программ ИТ, например «синхронизация» внутривенно применяемо-
го иммуноглобулина и плазмафереза, иммуносорбции и циклофосфа-
мида, программное назначение препаратов интерферона и антицито-
киновых антител.
224
Лекция 22
БЕЗОПАСНА ЛИ ТЕРАПИЯ
АНТИРЕВМАТИЧЕСКИМИ
ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ?
Профессор Ю. В. Муравьев (Институт ревматологии
РАМН)
Лекарственное средство (лекарство) — любое вещество или про-
дукт, который употребляется или предполагается к употреблению для
того, чтобы благоприятно повлиять на физиологическую систему или
исследовать патологическое состояние принимающего его лица [7].
Такое определение было впервые предложено в 1967 г. научной груп-
пой ВОЗ по принципам доклинических испытаний безопасности лекар-
ственных веществ.
В настоящее время можно определенно говорить о том, что не су-
ществует совершенно безопасных лекарств. Это связано прежде все-
го с тем, что они не обладают абсолютной избирательностью. По-
этому, попадая в «мишень», лекарственные средства одновременно
могут влиять и на другие органы и системы организма, вызывая при
этом побочные явления. Побочные действия лекарственного сред-
ства — вредные, нежелательные действия, наблюдающиеся при обыч-
но применяемых дозах [8]. Условно их подразделяют следующим об-
разом:
— побочные действия группы А: результат фармакологического
действия лекарства; возникают довольно часто и зависят от
дозы, поэтому их можно избежать путем подбора индивиду-
альной дозы (побочные действия этой группы известны еще до
поступления лекарственного средства в аптечную сеть, по-
скольку изучаются и воспроизводятся в условиях эксперимен-
та);
— побочные действия группы Б: являются иммунологически или
генетически обусловленной реакцией больного, у которо-
го могут быть предрасполагающие факторы к такой реакции
(о них, как правило, заранее ничего не известно). Побочные
действия этой группы возникают реже и не зависят (или почти
не зависят) от дозы препарата.
Судя по данным зарубежных авторов, побочные действия возни-
кают в среднем у 10—20 % госпитализированных больных, в разви-
вающихся странах этот показатель достигает 30—40 %.
В России не существует достоверных статистических данных о
частоте развития побочных действий лекарственных средств вообще
и антиревматических препаратов в частности, но ситуация вряд ли
225
коренным образом отличается от других стран. В настоящее время из-
вестно, что, нуждаясь в диагностике и лечении, не менее 10 млн жите-
лей России ежегодно посещают поликлиники, причем по обращаемо-
сти одно из первых мест среди хронических неинфекционных заболе-
ваний занимают ревматические заболевания.
НПВП — наиболее широко применяемые в ревматологии лекар-
ственные средства. Основной механизм их лечебного действия связы-
вают с подавлением синтеза простагландинов (ПГ), ключевую роль в
этом процессе играет фермент циклооксигеназа (ЦОГ), существующая
по крайней мере в двух изоформах — ЦОГ-1 (физиологический фер-
мент, регулирующий продукцию цитопротективных ПГ) и ЦОГ-2 (при-
нимает участие в продукции ПГ, вовлеченных в процессы воспале-
ния). Это позволило J.Vane сформулировать гипотезу о том, что
НПВП, ингибируя оба изофермента, вызывают как противовоспали-
тельный эффект, так и побочные действия.
В настоящее время в Институте ревматологии проводится работа
по регистрации и изучению причин побочных действий антиревмати-
ческой терапии у стационарных больных. Предварительные данные
показали, что у больных РА они встречаются в 32,5 %, причем 42 %
из них составляют эндоскопически обнаруживаемые эрозии и язвы в
верхних отделах ЖКТ. Данные литературы также свидетельствуют
о частом повреждении слизистой оболочки ЖКТ в результате приме-
нения НПВП. Установить последнее стало возможно благодаря при-
менению эндоскопа, позволяющего осмотреть пищевод, желудок и
двенадцатиперстную кишку.
Первое сообщение о том, что аспирин может повреждать желу-
док, появилось в 1938 г., когда A.H.Douthwaite и G.A.M.Lintott,
проведя эндоскопическое исследование у 16 больных, принимавших
ацетилсалициловую кислоту, у 13 из них обнаружили геморрагии и
участки гиперемии на слизистой оболочке желудка. H.W.Davenport
(1967), сообщив о повреждениях слизистой оболочки желудка, вы-
зываемых аспирином, впервые указал на связь между приемом
НПВП и пептическими язвами. E.N.Larkai и соавт. (1987) обнару-
жили, что систематическое применение НПВП даже в течение 6 нед
вызывает у 68 % больных эндоскопически видимое повреждение
слизистой оболочки желудка (геморрагии, эрозии), в том числе
язвы— у 15 %. При этом жалобы со стороны ЖКТ предъявляли
только 19 % больных. На большом клиническом материале F.F.Fries
и соавт. (1989) убедительно показали, что больные РА, принимаю-
щие НПВП, имеют в 6,5 раза больше шансов быть госпитализиро-
ванными в связи с осложнениями со стороны ЖКТ, нежели больные,
не получающие эти препараты. Причем смерть от этих осложнений
у больных РА в два раза превышает популяционную. Эти авторы
установили также, что в США ежегодно регистрируется не менее
76 000 госпитализаций, обусловленных осложнениями со стороны
ЖКТ, связанными с приемом НПВП; в 10 % случаев эти осложне-
ния приводят к летальному исходу. Полученные в разных странах
226
данные свидетельствуют о достоверной связи между приемом НПВП
и развитием повреждений ЖКТ, что послужило поводом называть
их гастропатиями, связанными с приемом НПВП (NSAID-induced
gastropathy). Этот термин был предложен S.H.Roth [10], поскольку
повреждения слизистой оболочки желудка, вызываемые этими пре-
паратами (геморрагии, эрозии, язвы), имели ряд отличий от клас-
сической пептической язвы. В частности, предполагалось, что соля-
ная кислота, основной фактор агрессии при пептических язвах, не
имеет значения при НПВП-гастропатиях, а повреждения связаны
главным образом с подавлением синтеза простагландинов, регули-
рующих секрецию слизи и бикарбонатов эпителиальными клетками
желудка, а также кровоснабжение слизистой оболочки ЖКТ и обес-
печивающих, таким образом, ее защитные и репарационные свой-
ства.
НПВП-индуцированные гастропатии часто протекают бессимптом-
но. Сопоставление многочисленных эндоскопических исследований с
клинической картиной показало, что у больных, систематически при-
нимающих НПВП, возникновение повреждений слизистой оболочки
ЖКТ (геморрагии, эрозии, язвы) не зависит от того, имеются ли у них
характерные симптомы или нет. Это подтверждается и результатами
большого исследования, проведенного в Институте ревматологии
(А.Е.Каратеев) и показавшего, что лишь 18,2 % больных с гастропа-
тиями, возникшими на фоне лекарственной терапии, активно предъяв-
ляли жалобы на гастралгии или диспепсические явления.
Считается, что факторами риска развития НПВП-индуцирован-
ных гастропатий являются возраст старше 65 лет, одновременный
прием глюкокортикостероидов (ГКС), высокие дозы НПВП, значи-
тельное ограничение подвижности (обусловленное основным забо-
леванием).
Обработав результаты эзофагогастродуоденоскопии (А.Е.Карате-
ев) у 280 больных РА, находившихся на лечении в Институте ревма-
тологии в связи с обострением основного заболевания в 1995 г., мы с
помощью специально разработанной программы (А.В.Гринько) уста-
новили, что эрозивно-язвенные изменения слизистой оболочки верх-
них отделов ЖКТ на фоне проводимой терапии возникают в средней
(35—60 лет) и старшей (старше 60 лет) возрастных группах почти в
два раза чаще, чем у больных в возрасте до 35 лет (с равной частотой
у женщин и мужчин) (табл. 22.1).
В целом у этой группы больных РА эрозивные изменения слизис-
той оболочки желудка встречались чаще, нежели двенадцатиперстной
кишки (более чем в 20 раз). При этом эрозии желудка преобладали у
женщин (в 1,8 раза), а эрозии двенадцатиперстной кишки у мужчин
(в 3 раза), в то время как частота обнаружения язв желудка и двенад-
цатиперстной кишки не зависела от пола больных и была практичес-
ки одинаковой (табл. 22.2). Установлена еще одна особенность
НПВП-индуцированных гастропатий — отсутствие сезонности их воз-
никновения.
227
Таблица 22.1, Частота обнаружения НПВП-индуцированных гастропа-
тнн у больных РА
Пол Возраст (годы) Число больных Гастропатии
п %
Женщины До 35 31 7 22,6
п=238 35—60 155 70 45,2
>60 52 28 55,8
Мужчины До 35 4 1 25
п=42 35—60 29 12 41,4
>60 9 4 44,4
Таблица 22.2. Локализация эрозивно-язвенных повреждений слизистой
оболочки верхних отделов ЖКТ у больных РА
Пол Локализация, п (%)
желудок желудок и двенадцатиперстная кишка двенадцатиперст- ная кишка
эрозии ЯЗВЫ эрозии ЯЗВЫ эрозии язвы
Женщины п=238 59 (24,8) 23 (9,7) 3(1.3) 2 (0,8) 2 (0,8) 16(6,7)
Мужчины п=42 5(11,9) 4 (9,5) 3(7,1) 1 (2,4) 1 (2,4) 3(7,1)
В дальнейшем было установлено, что в группе больных, получав-
ших комбинацию НПВП и ГКС, не происходило увеличения частоты
гастропатий, а изолированное применение ГКС даже уменьшало ее.
Следующим этапом нашей работы было изучение возможностей
лекарственной терапии и профилактики НПВП-индуцированных га-
стропатий. Впервые в России нами проведена сравнительная оценка
эффективности антисекреторных противоязвенных препаратов — ра-
нитидина и пирензепина при НПВП-индуцированных гастропатиях [3].
Установлено, что ранитидин оказывал не только лечебное, но и про-
филактическое действие независимо от продолжавшегося приема раз-
личных лекарственных форм НПВП. В то же время пирензепин был
недостаточно эффективным, и переносимость его оказалась намного
хуже, нежели у ранитидина.
Нами сделана специальная попытка уменьшить «ятрогенный про-
стагландиновый дефицит» у больных, продолжающих принимать
НПВП. Для этого проведено многоцентровое открытое 4-недельное
исследование эффективности и переносимости мизопростола при
228
НПВП-индуцированных гастропатиях. Примечательно, что 4-недель-
ный прием мизопростола был достаточным для заживления язв желуд-
ка у всех больных и язв двенадцатиперстной кишки — у 71 % боль-
ных. Из-за побочных действий (гастралгии и/или метеоризм, жидкий
стул) препарат был отменен у 9,5 % больных.
Весьма актуальным нам представляется изучение влияния НПВП
на желудочную секрецию, в частности у больных РА, вынужденных
принимать эти препараты длительно, поскольку уточнение значения
соляной кислоты в патогенезе НПВП-индуцированных гастропатий
является немаловажным для проведения адекватной терапии и профи-
лактики. Исследование желудочной секреции, проведенное с помощью
современного физиологического метода— 24-часовой внутрижелу-
дочной pH-метрии (А.В.Гринько), позволило установить, что у 68 %
больных РА без НПВП-гастропатий время закисления превышает 360
мин, что является фактором риска возникновения повреждений слизи-
стой оболочки верхних отделов ЖКТ. При НПВП-индуцированных
гастропатиях отмечено усиление кислотообразующей функции желуд-
ка с одновременным снижением нейтрализующей функции. Показано,
что влияние диклофенака натрия и индометацина на секрецию желуд-
ка при РА разнонаправлено и требует дальнейшего изучения.
Таким образом, тот факт, что НПВП могут повреждать слизистую
оболочку ЖКТ с возникновением угрожающих жизни осложнений
(кровотечений, перфораций), не вызывает никаких сомнений и заслу-
живает самого серьезного отношения в плане диагностики, лечения
и профилактики. Однако механизмы этих повреждений не совсем по-
нятны.
В частности, несмотря на простоту и логичность простагландино-
вой гипотезы возникновения НПВП-индуцированных гастропатий, в
последние годы стали накапливаться контраргументы.
1. В отличие от доказанного противовоспалительного действия этих
препаратов, четкой корреляции между степенью подавления активно-
сти ЦОГ и повреждением НПВП слизистой оболочки желудка не
имеется.
2. Ко времени возникновения язвы активность ЦОГ нормализуется.
3. Подавление активности ЦОГ более чем на 95 % не сопровож-
дается повреждением слизистой оболочки ЖКТ.
4. Малые дозы аспирина почти полностью инактивируют ЦОГ,
однако повышение его дозы ведет к прогрессирующему увеличению
повреждений слизистой желудка, не сопровождаясь при этом дальней-
шим подавлением ЦОГ.
5. Повреждения возникают в течение 5—10 мин после приема
НПВП, что представляется слишком быстрым для развития процес-
сов, обусловленных простагландинами.
6. После прекращения терапии НПВП риск возникновения гемор-
рагий и перфораций ЖКТ сохраняется в течение нескольких недель.
7. У гомозиготных мышей, лишенных простагландинсинтетазы-1
(ЦОГ-1) в результате разрушения соответствующего гена, язвы сли-
229
зистой оболочки желудка не развиваются, что ставит под сомнение
тезис о цитопротективной роли ЦОГ-1.
8. У гомозиготных мышей, лишенных простагландинсинтетазы-2
(ЦОГ-2), отмечаются выраженная почечная дисплазия и фиброз серд-
ца (а у самок также бесплодность), при этом полностью сохранен нор-
мальный воспалительный ответ. Следовательно, положение о том, что
фермент ЦОГ-2 отвечает за воспаление, также представляется не со-
всем убедительным.
Поскольку предполагалось, что, влияя на метаболизм биологичес-
ки активных веществ (ПГ, кинины, тромбоксан, АТФ), НПВП спо-
собны нарушать состояние ряда систем, в том числе и сердечно-сосу-
дистой, мы оценили их воздействие на функциональное состояние сер-
дца и тканевой микроциркуляции при РА. Были обследованы больные
в возрасте от 18 до 45 лет, с давностью заболевания до 2 лет, без за-
болеваний сердца в анамнезе и патологических изменений на ЭКГ и
при проведении эхокардиографии [6]. Установлено, что диклофенак
натрия и индометацин в средних терапевтических дозах оказывают
клинически не проявляющееся негативное влияние на функциональ-
ное состояние миокарда. Даже однократный прием диклофенака на-
трия и индометацина вызывал снижение скорости раннего диастоли-
ческого наполнения левого желудочка. Назначение этих препаратов
в течение месяца сопровождалось снижением амплитуды зубцов Г на
ЭКГ у 52 % больных, получавших диклофенак натрия, и у 66 % боль-
ных, получавших индометацин. При эхокардиографическом исследо-
вании отмечено снижение показателей раннего диастолического на-
полнения левого желудочка у 87 и 89 % больных соответственно.
Индометацин после 3-месячного применения оказывал более выражен-
ное неблагоприятное влияние на функциональное состояние миокар-
да, максимально снижая амплитуду зубца Т на ЭКГ, а также снижая
показатели не только диастолической, но и систолической функции
левого желудочка. После месячной терапии диклофенаком натрия и
индометацином происходило снижение кожного и мышечного крово-
тока у 50 % больных, а через 3 мес — у всех больных.
Обнаруженные изменения функции миокарда являются обратимы-
ми при небольших сроках лечения (до 6 мес): при снижении дозы до
50 мг или после отмены диклофенака натрия и индометацина; зубцы
Т и показатели функции левого желудочка, по данным эхокардиог-
рафии, имели тенденцию к нормализации.
НПВП могут влиять на регуляцию артериального давления через
широкий спектр простагландинзависимых механизмов. Специально
проведенный мета-анализ 54 исследований [Popo F.E. et al., 1993]
показал, что НПВП достоверно повышали среднее артериальное
давление у больных с артериальной гипертензией, мало влияя на него
у больных с исходно нормальными показателями. Популяционные ис-
следования, проведенные в США, позволили установить, что НПВП
и гипотензивные средства принимают по крайней мере 20 млн боль-
ных, в том числе 12 % в возрасте 60 лет и старше [Quilley et al., 1994].
230
Это сочетание препаратов весьма существенно, поскольку НПВП
могут снижать эффективность гипотензивных средств, лечебное дей-
ствие которых частично или полностью связано со стимуляцией син-
теза ПГ, а повышение диастолического артериального давления на
5—6 мм рт.ст. в течение нескольких лет увеличивает риск возникно-
вения инсульта на 67 % и инфаркта миокарда — на 15 %.
В настоящее время в Институте ревматологии начата работа по
изучению влияния антиревматической терапии на артериальное дав-
ление с использованием метода его суточного мониторирования
(Т.Н.Цапина). Установлено, что даже однократное внутрисуставное
введение пролонгированных ГКС (кеналог, дипроспан) вызывает за-
метное повышение как систолического, так и диастолического арте-
риального давления.
Нельзя забывать, что дополнительно к прямому действию на сосу-
ды НПВП могут изменять артериальное давление, влияя на различ-
ные почечные механизмы. У здоровых людей участие ПГ в регуляции
функции почек незначительно, однако при ряде состояний, в частно-
сти при реноваскулярной гипертензии, активирующей ренин-ангио-
тензиновую систему, клубочковая фильтрация и почечный кровоток
становятся в значительной мере зависимыми от синтеза ПГ. При ак-
тивации ренин-ангиотензиновой системы ангиотензин вызывает суже-
ние как прегломерулярных, так и постгломерулярных сосудов, но его
влиянию на последние противодействует локальный синтез ПГ, что
позволяет сохранить на должном уровне клубочковую фильтрацию.
Подавление синтеза ПГ вызывает несдерживаемую вазоконстрикцию,
ведущую к падению внутригломерулярного давления и к снижению
функции почек, нередко выраженному.
Впервые проведенное в России изучение влияния НПВП на филь-
трационную функцию почек у больных РА показало, что ибупрофен,
индометацин, диклофенак натрия и пироксикам в терапевтических до-
зах оказывают разнонаправленное влияние, зависящее от перенесенной
ранее почечной патологии. При длительности основного заболевания
более 10 лет риск снижения фильтрационной функции почек на фоне
терапии ибупрофеном и диклофенаком натрия нарастал [1].
Заслуживает внимания тот факт, что НПВП, подавляя синтез ПГ,
приводит к повышению продукции ИЛ-1 [9]. Так, после 3-недельной
терапии 10 больных диклофенаком натрия (100 мг/сут) отмечено значи-
тельное (р<0,05) повышение уровня ИЛ-1, ТНФ-а, лейкотриена-В4 и
ТкВ2 [5]. Повышенная продукция ИЛ-1 подавляет синтетическую ак-
тивность хондроцитов, стимулирует выброс металлопротеиназ синови-
альной оболочкой, что в последующем повышает катаболизм хря-
ща. Кроме того, ИЛ-1 является мощным индуктором активности гена
ЦОГ-2, а именно ЦОГ-2 принимает участие в продукции ПГ, вовлечен-
ных в процессы воспаления, клеточной пролиферации и деструкции [4].
Для ряда ревматических болезней, в частности для РА, характер-
но развитие вторичного остеопороза — заболевания, характеризую-
щегося снижением массы костной ткани и изменениями ее микрострук-
231
туры, что приводит к повышению ломкости кости и риска перело-
мов.
В результате впервые проведенного в России денситометрического
исследования плотности костной ткани при РА нами было установле-
но, что остеопения и остеопороз наблюдаются у 77 % больных, нарас-
тая до 86 % в период менопаузы и при назначении ГКС [2]. Длительное
(в течение 12 мес) исследование эффективности отечественного бифос-
фоната ксидифона показало, что этот препарат достоверно превосхо-
дил плацебо по влиянию на трабекулярный остеопороз и остеопению.
Таким образом, терапия антиревматическими препаратами неред-
ко вызывает побочные действия, возникновение которых в большин-
стве случаев можно прогнозировать, но только с помощью специаль-
ных методов обследования. Поэтому, назначая антиревматическую
терапию, нельзя забывать о необходимости ее мониторировании: ис-
следовании анализов крови, мочи, функциональных проб печени, по-
чек, ЭКГ, проведении эзофагогастродуоденоскопии, остеоденситомет-
рии, рентгенографии, измерение артериального давления и др., что по-
зволит избежать серьезных побочных действий.
СПИСОК ЛИТЕРАТУРЫ
1. Дворкин Е.Б. Влияние нестероидных противовоспалительных препара-
тов на состояние фильтрационной функции почек у больных ревма-
тоидным артритом: Автореф. дис.... канд. мед. наук. — М., 1993. — 22 с.
2. Дыдыкина И.С. Влияние бифосфоната ксидифона на денситометричес-
кие показатели минеральной плотности костной ткани у больных рев-
матоидным артритом: Автореф. дис. ... канд. мед. наук. — М., 1996. —
20 с.
3. Каратеев А.Е. Эффективность антисекреторных противоязвенных пре-
паратов при НПВП-индуцированных гастропатиях у больных ревма-
тическими заболеваниями: Автореф. дис. ... канд. мед. наук. — М.,
1998.— 23 с.
4. Насонов Е.Л., Цветкова Е.С., Балабанова Р.М. и др. Новые аспекты про-
тивовоспалительной терапии ревматических болезней: теоретические
предпосылки и клиническое применение мелоксикама // Клин. мед. —
1996. — № 4. — С. 1—4.
5. Пасечников В.Д., Бобрышев Д. В., Витковский Ю.В. Нестероидные гаст-
ропатии: опыт использования артротека // Medical market. — 1997. —
№ 25. — С. 46—47.
6. Санталова Е.Н. Функциональное состояние сердца у больных ревма-
тоидным артритом в процессе комплексной лекарственной терапии:
Автореф. дис. ... канд. мед. наук. — М., 1992. ----- 28 с.
7. Серия технических докладов ВОЗ. — 1967. — № 341.
8. Серия технических докладов ВОЗ. — 1973. — № 498.
9. Dingle J. Т. Cartilage maintenance in osteoarthritis: interaction of cytocines,
NSAID and prostaglandins in articular cartilage damage and repair // J.
Rheumatol. — 1991. — Vol. 18 (suppl. 28). — P. 30—37.
10. Roth S.H. Nonsteroidal anti-inflammatory drug gastropathy // Arch, intern.
Med. — 1986. — Vol. 146, N 10. — P. 1075—1076.
232
Лекция 23
АНТИБИОТИКИ В РЕВМАТОЛОГИИ:
НАСТОЯЩЕЕ И БУДУЩЕЕ
Канд. мед. наук Б. С.Белов (Институт ревматологии
РАМН)
В современной ревматологии проблема инфекционной патологии
стоит достаточно остро. Это обусловлено в первую очередь участием
различных инфекционных агентов в развитии РЗ, при которых мик-
роорганизмы играют триггерную роль, запуская иммунопатологичес-
кие механизмы воспаления. Не менее сложную задачу представляет
собой борьба с сопутствующей инфекцией, нередко осложняющей те-
чение многих РЗ из-за нарушения иммунного статуса, обусловленно-
го как основным заболеванием, так и применением иммуносупрессив-
ных препаратов.
Несмотря на обширный арсенал антимикробных средств, разрабо-
танных и внедренных в клиническую практику в течение последних
50 лет, вопросы рациональной терапии инфекционной патологии при
РЗ по-прежнему требуют к себе самого пристального внимания как в
научном, так и в практическом плане. Выявление новых возбудите-
лей, нарастающая роль условно-патогенной микрофлоры, увеличение
числа резистентных микроорганизмов, неполноценность иммунного
ответа, вопросы переносимости и взаимодействия с противоревмати-
ческими препаратами — это далеко не полный перечень проблем, сти-
мулирующих поиск и разработку новых схем и методов антибактери-
альной терапии в ревматологии.
В настоящее время накоплено большое количество данных, сви-
детельствующих о важнейшей роли ^-гемолитического стрептококка
группы А в возникновении и развитии острой ревматической лихорад-
ки (РЛ).
В исследованиях последних лет показана тесная ассоциация забо-
левания с высоковирулентными («ревматогенными») А-стрептококко-
выми штаммами, компоненты которых обусловливают иммунизиру-
ющий эффект и развитие иммуноопосредованного патологического
процесса [8]. Высокая чувствительность данного возбудителя к при-
родным и полусинтетическим пенициллинам позволяла успешно про-
водить антибактериальную терапию А-стрептококковых носоглоточ-
ных инфекций в течение нескольких десятилетий и таким образом осу-
ществлять один из важнейших принципов первичной и вторичной про-
филактики острой РЛ. Однако, несмотря на то что Р-гемолитический
А-стрептококк по-прежнему сохраняет полную чувствительность к
пенициллиновым антибиотикам, в последние годы появились опреде-
ленные проблемы в терапии фарингитов и тонзиллитов, вызванных
233
этим микроорганизмом. Частота неудач применения пенициллина при
данных формах инфекций достигает 38 %. В качестве одной из наибо-
лее вероятных причин этого явления рассматривается гидролиз пени-
циллина специфическими ферментами — р-лактамазами, которые про-
дуцируются микроорганизмами — копатогенами (S. aureus, Н. influ-
enzae, В. catarrhalis), присутствующими в глубоких тканях миндалин
при хроническом тонзиллите [3, 6].
В связи с изложенным препараты пенициллинового ряда сохраня-
ют свою роль в качестве терапии выбора только при лечении острого
стрептококкового тонзиллофарингита. Вопрос о назначении конкрет-
ного антибиотика и пути его введения должен быть решен лечащим
врачом в зависимости от клинической ситуации и исполнительности
больного. Так, в случае развития острой РЛ, несомненно, показано
назначение бензилпенициллина (пенициллин G) в суточной дозе 2—
4 млн ЕД у подростков и взрослых и 750 000—1 000 000 ЕД у детей
в течение 10 дней с последующим переходом на применение дюрант-
ной формы препарата (бензатин-бензилпенициллин). При острой А-
стрептококковой носоглоточной инфекции у лиц молодого возраста,
имеющих факторы риска развития острой РЛ (отягощенная наслед-
ственность, неблагоприятные социально-бытовые условия и т.д.), так-
же целесообразно применение бензилпенициллина по вышеуказанной
схеме с последующей однократной инъекцией бензатин-бензилпеницил-
лина. Во всех остальных случаях возможен 10-дневный курс лечения
оральными пенициллинами. В настоящее время оптимальным препа-
ратом из этой группы представляется амоксициллин, который по про-
тивострептококковой активности аналогичен ампициллину и фенок-
симетилпенициллину, но существенно превосходит их по своим фар-
макокинетическим характеристикам, отличаясь большей биодоступ-
ностью (95,40 и 50 % соответственно) и меньшей степенью связыва-
ния с сывороточными белками (17, 22 и 80 % соответственно). Реко-
мендуемая схема применения амоксициллина — 1,5 г (для взрослых и
детей старше 12 лет) и 750 мг (для детей от 5 до 12 лет) в сутки в
3 приема в течение 10 сут.
Наряду с пенициллинами заслуживает несомненного внимания
представитель оральных цефалоспоринов I поколения цефадроксил,
высокая эффективность которого в терапии А-стрептококковых тон-
зиллитов, а также хорошая переносимость подтверждены в многочис-
ленных клинических исследованиях. При непереносимости бета-лак-
тамных антибиотиков целесообразно назначение макролидов (спира-
мицин, азитромицин, рокситромицин, кларитромицин). Наряду с вы-
сокой противострептококковой активностью преимуществами этих
препаратов являются способность создавать высокую тканевую кон-
центрацию в очаге инфекции, более короткий (в частности, для азит-
ромицина) курс лечения, хорошая переносимость. Применение эрит-
ромицина — первого представителя антибиотиков данного класса в
настоящее время существенно снизилось, особенно в терапевтической
практике, поскольку он наиболее часто по сравнению с другими мак-
234
ролидами вызывает нежелательные эффекты со стороны желудочно-
кишечного тракта, обусловленные его стимулирующим действием на
моторику желудка и кишечника.
Антибиотики-линкозамины (линкомицин, клиндамицин) назначают
при А-стрептококковых тонзиллитах и фарингитах только при непе-
реносимости как бета-лактамов, так и макролидов. Широкое приме-
нение этих препаратов при данных нозологических формах не реко-
мендуется во избежание утраты их роли как средств выбора для лече-
ния инфекционной патологии костно-суставной системы. Известно,
что при частом применении оральных пенициллинов чувствительность
к ним со стороны зеленящих стрептококков, локализующихся в поло-
сти рта, существенно снижается. Поэтому у данной категории паци-
ентов, особенно у больных ревматическими пороками сердца, линко-
замины рассматриваются как препараты первого ряда для профилак-
тики инфекционного эндокардита при выполнении различных стома-
тологических манипуляций.
При наличии хронического рецидивирующего А-стрептококково-
го тонзиллита, фарингита высока вероятность колонизации очага ин-
фекции микроорганизмами, продуцирующими бета-лактамазы. В этих
случаях целесообразно проведение курса лечения ингибиторзащищен-
ными пенициллинами (амоксициллин/клавуланат) или оральными це-
фалоспоринами II поколения (цефуроксим), а при непереносимости
бета-лактамных антибиотиков — линкозаминами. Указанные антиби-
отики также рассматриваются как препараты второго ряда для слу-
чаев безуспешной пенициллинотерапии острых стрептококковых тон-
зиллитов и фарингитов (что чаще встречается при использовании фе-
ноксиметилпенициллина) (табл. 23.1). Универсальной же схемы, обес-
печивающей 100% элиминацию А-стрептококка из носоглотки, в ми-
ровой клинической практике не имеется.
Необходимо отметить, что применение тетрациклинов, сульфанил-
амидов, котримоксазола и хлорамфеникола при А-стрептококковой
инфекции глотки в настоящее время не оправдано по причине высо-
кой частоты резистентности и, следовательно, низких показателей эф-
фективности терапии.
Обсуждая проблемы применения антибиотиков в терапии и профи-
лактике острой РЛ, нельзя обойти стороной пенициллин пролонгиро-
ванного действия (бензатин-бензилпенициллин). Применение этого
препарата в различных формах, особенно бициллина-5, сыграло ог-
ромную роль в профилактике повторных ревматических атак, снизив
их число в 4—47 раз. Отмечая большое медицинское и социальное
значение бициллинопрофилактики, ряд авторов указывали на недо-
статочную ее эффективность у 13—37 % больных. В качестве возмож-
ных причин неэффективности назывались персистирование L-форм
стрептококка, аллергогенность препарата (обусловленная, по всей
видимости, входящей в его состав новокаиновой солью бензилпени-
циллина), влекущая за собой его отмену, низкие концентрации анти-
биотика в сыворотке крови пациентов в отдаленные сроки после внут-
235
римышечного введения общепринятых профилактических доз и др.
Учитывая изложенное выше и принимая во внимание появление на
российском рынке зарубежных бензатин-бензилпенициллинов, пред-
ставляло несомненный интерес исследование эффективности и пере-
носимости указанных препаратов с целью определения их пригоднос-
ти для профилактики рецидивов ревматизма.
Таблица 23.1. Лечение А-стрептококковой инфекции глотки
Форма Антибиотик Суточная доза Длитель- ность лечения (дни)
Острый тонзил- Бензилпенициллин См. текст См. текст лофарингит Амоксициллин » » » » Макролиды: спирамицин 6 млн ЕД в 10 2 приема азитромицин 0,5 г—1-й день, 5 затем 0,25 г в 1 прием рокситромицин 0,3 г в 2 приема 10 кларитромицин 0,5 г в 2 приема 10 Оральные цефалоспорины: цефадроксил 1 г в 2 приема 10 Хронический амоксициллин/клавула- 1,875 г в 3 приема 10 рецидивирующий нат тонзиллофарин- цефуроксим аксетил 0,5 г в 2 приема 10 гит Препараты Линкозамины: резерва линкомицин 1,5гвЗ приема 10 клиндамицин 600 мг в 4 прие- ма 10
В настоящее время в Институте ревматологии РАМН накоплен
опыт применения нового бензатин-пенициллина (препарат экстенцил-
лин). Препарат назначали в дозе 2,4 млн ЕД внутримышечно 1 раз в
3 нед с целью профилактики А-стрептококкового тонзиллофарингита
и последующего возникновения повторных атак РЛ у больных с дос-
товерным ревматическим анамнезом. Результаты 3-летнего наблюде-
ния свидетельствуют о высокой и продолжительной активности эк-
стенциллина в отношении А-стрептококковой инфекции и хорошей пе-
реносимости, что позволяет рекомендовать его в качестве препарата
для эффективной вторичной профилактики острой РЛ.
Наряду с этим сравнительное изучение фармакокинетики различ-
ных лекарственных форм бензатин-пенициллина показало, что после
введения экстенциллина в дозе 2,4 млн ЕД концентрация бензилпени-
236
циллина, достаточная для ингибирования р-гемолитического А-стреп-
тококка (>25 нг/мл), сохранялась в течение 3-недельного срока в
83,3 % случаев. При инъекции экстенциллина в дозе 1,2 млн ЕД или
бициллина-5 в дозе 1,5 млн ЕД указанная концентрация бензилпени-
циллина определялась на 21-й день в 30 и 0 % случаев соответствен-
но. Таким образом, лекарственные препараты бензатин-пенициллина
(экстенциллин в дозе 1,2 млн ЕД и бициллин-5 в дозе 1,5 мл ЕД) не
обеспечивают достаточной бактерицидной концентрации бензилпени-
циллина на протяжении рекомендуемого 4-недельного интервала вве-
дения.
Другую, не менее важную проблему представляют собой реактив-
ные артриты (РеА), особенно урогенные (включая болезнь Рейтера),
имеющие тесную взаимосвязь с возникновением или обострением ин-
фекционного урогенитального очага. При этом наиболее значимым
этиологическим агентом признается микроорганизм Chlamydia
trachomatis.
В многочисленных исследованиях обоснована целесообразность
раннего назначения антибиотиков при урогенитальной хламидийной
инфекции, что позволяет предупредить развитие РеА, а в случае его
возникновения — контролировать патологический процесс. Хотя мне-
ния о влиянии антибиотиков на суставной синдром противоречивы,
тем не менее при устранении урогенитальной инфекции реже возника-
ют рецидивы и хронизация болезни.
В табл. 23.2 представлены антибиотики, обладающие наиболее
высокой противохламидийной активностью и применяемые в комплек-
сном лечении РеА. Обычно лечение начинают одним из антибиотиков
группы макролидов или тетрациклинов, а фторхинолоновые производ-
ные используют в качестве препаратов второго ряда. Одновременно
назначают противогрибковые средства (нистатин или леворин в дозе
2 млн ЕД в сутки в 4 приема) и поливитамины. Курс лечения должен
составлять не менее 4 нед с последующим ежемесячным (как минимум
трехкратным) бактериологическим контролем. При наличии сопут-
ствующей патогенной или условно-патогенной микрофлоры мочепо-
лового тракта возможно одновременное или последовательное назна-
чение двух или даже трех антибиотиков. Использование р-лактамных
препаратов (пенициллины, цефалоспорины) не рекомендуется ввиду
возможности образования под их действием L-подобных форм хлами-
дий, резистентных практически ко всем известным антимикробным
средствам. Необходимо подчеркнуть, что 7—10-дневные курсы анти-
биотикотерапии, применяемые для лечения неосложненного урогени-
тального хламидиоза, совершенно неэффективны при развитии хла-
мидиозного РеА.
В плане перспектив исследований в области антибактериальной
терапии урогенитального хламидиоза при РеА представляет несомнен-
ный интерес применение прерывистых курсов антибиотиков, а также
сравнительные рандомизированные исследования фторхинолонов ново-
го поколения (грепафлоксацин, клинафлоксацин, гатифлокацин и др.).
237
Таблица 23.2. Антибактериальная терапия урогенитального хламидио-
за при реактивном артрите
Антибиотики Суточная доза Длительность курса (сут)
Макролиды: спирамицин 9 млн ЕД в 3 приема 28
азитромицин 1,0 г в 1-й день, затем 29
рокситромицин 0,5 г в 1 прием 0,3 г в 2 приема 30
кларитромицин 0,5 г в 2 приема 30
Тетрациклины: тетрациклин 2,0 в 4 приема 30
метациклин 0,9 г в 3 приема 30
доксициклин 0,3 г в 3 приема 30
миноциклин 0,2 г в 2 приема 30
Фторхинолоны: офлоксацин 0,6 г в 2 приема 28
ципрофлоксацин 1,5 г в 2 приема 28
пефлоксацин 0,8 г в 2 приема 28
ломефлоксацин 0.4—0,8 г в 1 или 28
2 приема
В последние годы все больший интерес медицинских специалистов,
в том числе ревматологов, привлекает болезнь Лайма (БЛ), которой
в настоящем издании посвящена отдельная лекция (Л.П.Ананьева).
Показано, что ранняя (т.е. назначенная по поводу клещевой мигри-
рующей эритемы) антибактериальная терапия снижает риск развития
вторичной эритемы, поражения суставов и сосудов и, таким образом,
является важным фактором дальнейшего благоприятного течения БЛ.
Выявлена высокая степень корреляции между лечением, начатым в
первый месяц болезни, и выздоровлением. Таким образом, при БЛ
прогноз четко коррелирует не только с оптимальной антибактериаль-
ной терапией, но и с ранними сроками ее начала [1]. Применительно
к ревматологии это означает, что своевременная адекватная терапия
локальной кожной инфекции по сути является первичной профилак-
тикой развития артрита и других системных проявлений БЛ.
В табл. 23.3 представлены наиболее распространенные в США
схемы начальной антибактериальной терапии БЛ в зависимости от
стадии процесса. При неэффективности данного лечения показано
(обычно не ранее чем через 3 мес) парентеральное введение пеницил-
лина (20 млн ЕД в сутки с 4—6-часовыми интервалами) в течение 10—
14 сут или цефтриаксона (2 г в сутки внутривенно однократно) в те-
чение 14 сут. При развитии диссеминации боррелий и поздних прояв-
лениях БЛ целесообразно парентеральное введение пенициллина или
цефалоспоринов третьей генерации в течение 14—30 сут.
238
Таблица 23.3. Антибактериальная терапия болезни Лайма
Стадия Антибиотик Суточная доза Длительность курса (сут)
Ранняя Доксициклин 0,2 г в 2 приема 10—21
Амоксициллин 2 г в 4 приема
плюс пробенецид 2 г в 4 приема 14—21
Эритромицин 2 г в 4 приема 14—21
Азитромицин 0,5 г в 1 прием 10—14
Лайм-артрит Доксициклин 0,2 г в 2 приема 30
Амоксициллин 2 г в 4 приема 30
Представляет особый интерес выполненное в России сравнительное
рандомизированное проспективное испытание 11 схем лечения у боль-
шой группы пациентов с клещевой мигрирующей эритемой. Достовер-
но лучшие результаты получены при применении доксициклина (0,2 г
в сутки per os в течение 14 сут) по сравнению с пенициллином (2 млн
ЕД в сутки внутримышечно в течение 10—14 сут) и тетрациклином
(1,2 г в сутки в течение 14 дней). Применение цефуроксима в дозе 1 г в
сутки в течение 10 сут дало результаты, аналогичные таковым при ле-
чении доксициклином. Оптимальный результат лечения отмечен при на-
значении антибиотиков в первые 5 дней болезни, при этом длительность
курса антибактериальной терапии составляла не менее 14 дней [2].
В рамках настоящей лекции хотелось бы акцентировать внимание
на уже упоминавшихся новых синтетических антимикробных сред-
ствах — фторхинолонах, которые в последнее время получили широ-
кое распространение. В Институте ревматологии РАМН накоплен
опыт применения трех представителей данного класса препаратов —
ципрофлоксацина, пефлоксацина и ломефлоксацина — при лечении
инфекций различной локализации (дыхательные пути, урогенитальный
тракт, кожа и мягкие ткани) у ревматологических больных. В целом
клиническое и бактериологическое излечение от инфекции достигну-
то в 78,3 % случаев. Побочные явления, частота которых составила
27,4 %, были типичными для всех представителей фторхинолонового
ряда и включали 3 основных симптомокомплекса: 1) со стороны цен-
тральной нервной системы — головокружение, рассеянность внима-
ния, головная боль; 2) со стороны желудочно-кишечного тракта —
сухость и «металлический» привкус во рту, чувство дискомфорта в
эпигастрии, тошнота; 3) явления фотосенсибилизации и кожная сыпь
с зудом. Вследствие выраженности побочных эффектов препараты
были отменены у 3,8 % больных. Во всех случаях побочные действия
расценены как имеющие определенную связь с приемом того или ино-
го фторхинолона. При этом прослежена достоверная зависимость ча-
стоты побочных реакций от суточной дозы ломефлоксацина.
В результате проведенного исследования нами были сделаны сле-
дующие выводы.
239
1. Подтверждена эффективность фторхинолонов в терапии уроге-
нитального хламидиоза, что представляется особенно важным для ком-
плексной терапии РеА и профилактики его развития у лиц, страдаю-
щих воспалительными заболеваниями мочеполовой системы.
2. Заслуживает внимания возможность адекватного лечения инфек-
ций бронхолегочной системы (особенно пневмоний) при пероральном
применении фторхинолонов. Данное обстоятельство не только созда-
ет несомненные удобства для больного, но и приобретает существен-
ное значение при необходимости проведения антибактериальной тера-
пии у пациентов, длительно страдающих РА, сопровождающимся вы-
раженной амиотрофией, в условиях которой внутримышечное введение
антибиотиков в требуемых дозах далеко не всегда приводит к созда-
нию терапевтической концентрации в крови и тканях организма.
3. Высказанное ранее предположение о существовании взаимосвязи
между отрицательными реакциями со стороны ЦНС и совместным вве-
дением фторхинолонов и НПВП на нашем материале подтверждения
не получило. Напротив, отсутствие каких-либо клинически манифес-
тных отрицательных взаимодействий с ГКС и НПВП нами трактует-
ся как одна из положительных характеристик фторхинолонов.
Вместе с тем следует предостеречь от широкомасштабного и бес-
контрольного применения фторхинолонов. В частности, присущая
этим препаратам потенциальная возможность развития реакций фото-
чувствительности и стимуляции ЦНС накладывает ограничения на их
применение при лечении инфекционной патологии у больных СКВ.
Доказанная резистентность большинства штаммов стрептококков к
данным препаратам делает нецелесообразным их назначение при ост-
рой РЛ. Учитывая экспериментальные данные, свидетельствующие об
альтеративном воздействии фторхинолонов на суставной хрящ непо-
ловозрелых животных, эти препараты не рекомендуются для приме-
нения в детской ревматологии, а также при лечении беременных и
кормящих грудью женщин.
Как видно из вышеизложенного, на современном этапе развития
ревматологии рациональная антимикробная терапия занимает одно из
важных мест в комплексном лечении РЗ и профилактике их развития.
Однако для ревматологов интерес к антибактериальным препаратам
отнюдь не ограничивается их непосредственным противомикробным
действием. Не меньшего внимания также заслуживают противовос-
палительные эффекты, которыми, как выяснилось в ходе многочислен-
ных экспериментальных и клинических исследований, обладает ряд
антимикробных и антипаразитарных средств. В качестве примера
можно напомнить о хлорохине (делагиле) и гидроксихлорохине (плак-
вениле), которые впервые были применены в медицине как противо-
малярийные средства, а позже был отмечен их лечебный эффект при
СКВ и РА, после чего началось активное внедрение данных средств
в ревматологию.
Другой пример — тетрациклины. Показано, что препараты дан-
ной группы обладают способностью инактивировать металлопротеи-
240
назы в синовиальной ткани, подавлять активность фосфолипазы А2,
снижать окислительную активацию латентной коллагеназы, ингиби-
ровать функциональную активность нейтрофилов (хемотаксис, фаго-
цитарная активность, образование реактивных форм кислорода). Сле-
довательно, имеется ряд достаточно веских экспериментальных дока-
зательств, свидетельствующих о целесообразности применения тетра-
циклинов при хроническом воспалении.
Эффективность тетрациклиновых препаратов при РА была изуче-
на в серии клинических исследований. Наиболее демонстративными
являются данные двух крупных, выполненных в двойном слепом ре-
жиме испытаний полусинтетического тетрациклинового антибиотика
миноциклина у 299 больных РА [4, 9]. Показано, что назначение ми-
ноциклина по 100 мг внутрь дважды в день на срок от 24 до 48 нед
приводило к статистически значимому улучшению ряда клинических
и лабораторных параметров активности болезни (индекс Ричи, число
воспаленных суставов, уровень гемоглобина, СОЭ, С-реактивный
белок, IgM-ревматоидный фактор) по сравнению с группой больных,
получавших индифферентные вещества. Данные результаты заслужи-
вают серьезного внимания и свидетельствуют о явной перспективно-
сти работ в этом направлении.
С другой стороны, доказанный факт ингибирования матриксных
металлопротеиназ и выраженное нарастание проникновения тетрацик-
линовых производных (в частности, доксициклина) в хрящевую ткань,
субхондральный костный слой и синовиальную оболочку в присут-
ствии флурбипрофена позволяют сделать вывод о целесообразности
проведения клинических испытаний доксициклина при остеоартрозе
с предполагаемыми сроками лечения от 12 до 18 мес [7].
Не меньший интерес с позиции ревматологии представляют и ан-
тибиотики-макролиды, которые в нашей стране довольно долго были
представлены только эритромицином и олеандомицином, а сейчас
являются одним из наиболее интенсивно развивающихся классов ан-
тибактериальных средств. В течение последнего десятилетия арсенал
макролидов пополнился новыми препаратами, а области их клиничес-
кого применения заметно расширились. Одним из побудительных мо-
ментов для научных исследований в области неантибактериального
потенциала макролидов явилась высокая эффективность этих антиби-
отиков (в частности, рокситромицина, кларитромицина и азитроми-
цина) при диффузном панбронхиолите — заболевании, широко рас-
пространенном в Японии и характеризующемся хроническим воспа-
лительным и прогрессирующим деструктивным процессом в бронхио-
лах, ведущим к нарастанию дыхательной недостаточности. Результа-
ты многочисленных экспериментальных и клинических работ показы-
вают, что макролиды обладают противовоспалительной активностью
[5]. Это выражается в ингибировании продукции нейтрофильных про-
теиназ и экспрессии клеточных молекул адгезии на нейтрофилах, по-
давлении синтеза провоспалительных цитокинов, угнетении актива-
ции энергетического метаболизма в фагоцитирующих клетках (так
9—3592
241
называемого окислительного взрыва) и, следовательно, уменьшении
образования кислородных свободных радикалов при сохранении бак-
терицидной активности нейтрофилов, а также росте эндогенной про-
дукции глюкокортикостероидов. Следовательно, имеются теоретичес-
кие предпосылки для клинических испытаний макролидов в терапии
хронических воспалительных процессов различной локализации, в том
числе и в ревматологии. Хорошая переносимость и низкая токсичность
этих препаратов позволяют применять их в течение достаточно дли-
тельного времени (до 12 мес и более).
Таким образом, антибиотики, история клинического применения
которых насчитывает более полувека, по-прежнему остаются одним
из наиболее интересных и перспективных классов лекарственных
средств. Работы последних лет выявили ранее неизвестные стороны
действия антибиотиков, открывающие новые возможности для их
практического использования. Дальнейшее их применение, несомнен-
но, позволит изжить представление об антибиотиках как о препара-
тах с относительно узкой сферой действия и расширить диапазон по-
казаний для их назначения как в ревматологии, так и в других обла-
стях клинической медицины.
СПИСОК ЛИТЕРАТУРЫ
1. Барскова В. Г. Ревматические синдромы при различных исходах болез-
ни Лайма: Автореф. дис. ... канд. мед. наук. - М., 1995. — 27 с.
2. Лайковская Е.Э. Изучение эффективности антибактериальной терапии
ранней стадии лайм-бореллиоза (болезни Лайма) при длительном про-
спективном наблюдении: Автореф. дис. ... канд. мед. наук. — М., 1997. —
23 с.
3. Brook I.f Gober А.Е. Role of bacterial interference and p-lactamase— pro-
ducing bacteria in the failure of penicillin to eradicate Group A strep-
tococcal pharyngotonsillitis // Arch. Otolaryngol. Head Neck Surg. —
1995.—N 121 (12). —P. 1405—1409.
4. Kloppenburg M., Breedveld F.C., Terwiel J.P., Mallee C., Dijkmans B.A.
Minocycline in active rheumatoid arthritis. A double-blind, placebo-
controlled trial // Arthr. and Rheum. — 1994. — Vol. 37. — P. 629—636.
5. Labro M.T. Anti-inflammatory activity of macrolides: a new therapeutic
potential? // J. Antimicrob. Chemother. — 1998. — N 41; Suppl. B. —
P. 37—46.
6. Pichichero M.E. The rising incidence of penicillin treatment failures in group
A streptococcal tonsillopharyngitis: an emerging role for the
cephalosporins? // Pediatr. Infect. Dis. J. — 1991. — N 10. — P. 50—55.
7. Ryan M.E., Greenwald R.A., Golub L.M. Potential of tetracyclines to modify
cartilage breakdown in osteoarthritis // Curr. Opin. Rheumatol. — 1996. —
N 8. — P. 238—247.
8. St oilerman G.H. Rheumatic fever // Lancet. — 1997. — N 349. — P. 935—
942.
9. Tilley B.C., Alarcon G.S., Heyse S.P., Trentham D.E., Neuner R., Kaplan D.A
Minocycline in rheumatoid arthritis. A 48-week double-blind, placebo-
controlled trial // Ann. intern. Med — 1995. — N 122. — P. 81—89.
242
Лекция 24
РЕВМООРТОПЕДИЯ: РЕТРОСПЕКТИВА,
ПРОБЛЕМЫ, ВЗГЛЯД В БУДУЩЕЕ
Профессор В. П. Павлов (Институт ревматологии РАМН)
Собственная деятельность в Институте ревматологии в течение
38 лет показала настоятельную необходимость тесного взаимодей-
ствия ортопедов и ревматологов для обеспечения оптимального про-
филактического, лечебного и реабилитационного эффекта.
Каковы возможности ревмоортопедии? Она позволяет эффектив-
но бороться с болевым симптомом, характерным для большинства РЗ
и являющихся одной из главных проблем ревматологии. Это купиро-
вание болей при острых воспалительных процессах в суставах, связ-
ках, местах прикрепления мышц к костям с помощью блокад с ново-
каином, в том числе и в коктейле со стероидами.
Наши исследования в области ортезирования показали, что ста-
тические и динамические ортезы в виде шин, лонгет, туторов, разгру-
зочных повязок, установленных в физиологической позиции, отчетли-
во снижают боли, так как устраняется мышечный спазм, а с ним и
внутрисуставное давление, либо часть
статической или динамической нагруз-
ки во время движения неполноценного и • •
в опорном отношении сустава перерас-
пределяется на ортез и тем уменьшает
болевой симптом.
Хорошо зарекомендовал себя раз- й ’ Е
работанный нами шейный ортез (рис.
24.1) — стабилизатор для купирования
болей в шейном отделе позвоночника
при остеохондрозе у больных РА и ОА,
а также ортез для поясничного отдела
позвоночника [4].
Другим чрезвычайно важным на-
правлением консервативной ревмоор-
топедии являются профилактика и ле- i
чебные мероприятия, направленные на
предупреждение или торможение де-
формаций опорно-двигательного ап-
парата, в том числе и в отношении тя-
Рис. 24.1. Стабилизатор для
купирования болей в шейном
отделе позвоночника при
остеохондрозе.
желых дискордантных деформаций
при воспалительных РЗ и прежде все-
го РА.
243
Рис. 24.2. Наколенник, применяемый при лечении поражения коленного
сустава. Объяснение в тексте.
244
Уже с самого раннего периода развития РА при минимальной или
средней общей активности заболевания мы настойчиво рекомендова-
ли занятия лечебной физкультурой с учетом возраста и сопутствую-
щих заболеваний не только в утренние часы, но и днем и вечером, ука-
зывая параллельно с этим на необходимость широко пользоваться ле-
чением положением, выработкой правильного стереотипа. Больные РА
по нашему настоянию избегали длительных фиксированных поз во
время работы и отдыха, влекущих к формированию суставных дефор-
маций.
Нами, особенно за последние 3 года, широко использовались ор-
тезы для купирования боли и возможной деформации лучезапястного
сустава и кисти.
Большой вклад в разработку консервативных мероприятий по
улучшению функции плечевого пояса при РА и ОА внесли исследова-
ния А.Е.Вершинина и Г.Ф.Назаренко. Они добивались 100 % реаби-
литации функции руки в плечевом поясе в ранних случаях РА и ОА и
повышали функциональный статус руки до 60 % от нормы в продви-
нутых стадиях заболеваний.
Для консервативного лечения поражения коленного сустава при
РА и ОА нами использовался наколенник оригинальной конструк-
ции, уменьшавший боли при ходьбе на 10—40 % от исходного уров-
ня (рис. 24.2).
Настойчивая пропаганда некоторых положений консервативной
ревмоортопедии дала свои результаты: мы за последнее время редко
видели запущенные в ортопедическом отношении формы заболеваний
у больных РА.
Укажем еще на три возможности ревмоортопедии: профилактичес-
кие операции на «ключевых» суставах, реконструктивные операции
в продвинутых стадиях заболевания, снижение глубокой инвалидно-
сти у некоторых больных РА.
Излагаем собственную концептуальную идеологию в отношении
хирургических методов с учетом технических возможностей нашего
института, да может быть, и здравоохранения страны. Ранее много
говорилось о профилактическом значении синовэктомии. Нужна ли
она сейчас?
Наши ранние исследования совместно с М.С.Русаковой [2] пока-
зали, что при ранних синовитах коленного сустава, когда хрящ мак-
роскопически не изменен, морфологически выявляется параллелизм
патологических изменений в синовиальной оболочке и хряще, в кото-
ром менялись тинкториальные свойства. Эти ранние изменения хря-
ща, по нашему предположению, обратимы. Поэтому патогенетичес-
ки синовэктомия обоснована только в раннем периоде, спустя 4—
6 мес после возникновения синовита.
Показание к операции — безуспешность интенсивного консерва-
тивного лечения в указанные сроки.
Мы имеем отличные сверхотдаленные результаты (20—25 лет)
после ранней синовэктомии в 80 % случаев: стойко купируется сино-
245
Рис. 24.3. Коленные суставы больного К. до (вверху) и после ранней синов-
эктомии. Объяснение в тексте.
246
Рис. 24.3. Продолжение.
вит и сохраняется полностью функция коленного сустава (рис. 24.3).
Несомненно, в данном случае можно говорить и о профилактическом
эффекте этой операции.
В более поздних стадиях артрита коленного сустава синовэктомия
не показана. Можно производить — и мы это делали — синовкапсул-
эктомию (debridement). Эффективность этой операции невелика: 60 %
в сроки от 3 до 5 лет, а в более запущенных случаях дальше неизбе-
жен рецидив, предпочтительнее поэтому вместо синовкапсулэктомии
производить эндопротезирование. Во время операции удаляются ос-
татки патологически измененного хряща и субхондральной кости, в
которых сосредоточены очаги и элементы иммунопатологической
реакции. Эндопротезирование дает излечение с сохранением функции
сустава на протяжении времени износоустойчивости эндопротеза в
среднем 10—15 лет, после чего следует замена или всего эндопроте-
за, или его истершихся частей.
Мы имеем опыт эндопротезирования коленного сустава салазоч-
ным эндопротезом В.Линка (эффективность примерно 60 %). В насто-
ящее время созданы более совершенные конструкции, например Страй-
кера или Байомета, которые нами предполагается использовать в
ближайшем будущем.
Несколько слов о теносиновэктомии. Мы производили операцию
больным с теносиновитами дорсальной области лучезапястного сус-
тава. Она была показана, так как длительное существование теноси-
новита приводило у ряда больных к подкожным разрывам сухожилий
разгибателей пальцев. Тенопластика разгибателей дала неплохие
результаты, хотя о полной нормализации функции кисти говорить не
247
приходится. Теносиновэктомия сухожилий сгибателей пальцев выпол-
няется нами реже (примерно 25 наблюдений). Результаты операции
очень хорошие: устраняется симптом защелкивания пальцев, восста-
навливается полное сгибание пальцев.
Как раннее, так и позднее хирургическое вмешательство показа-
но при синовите локтевого сустава. Рецидивы после синовэктомии или
даже синовкапсулэктомии (debridement) редки, а функциональные
результаты хорошие, о чем свидетельствуют отдаленные наблюдения
[3].
Тазобедренный сустав, суставы предплюсны также не подлежат
оперативному лечению типа синовэктомии. В случаях прогрессиро-
вания ревматоидного коксартрита мы протезировали этот сустав,
вначале эндопротезом Сиваша (он оказался малопригодным), а впос-
ледствии эндопротезами Байомет, Зиммер. То же относится и к луче-
запястному суставу: синовэктомия лишь тормозит течение артрита, на-
блюдаются развитие коллапса и подвывихи области лучезапястного
сустава. Артродез излечивает поражение данной области локомотор-
ного аппарата.
В среднем периоде эволюции РА мы выполняли реконструктивные
и артропластические операции. Укажем на наиболее перспективные,
с нашей точки зрения, вмешательства.
Резекция головок плюснефаланговых суставов с артропластикой
I плюснефалангового сустава является стандартизированной опера-
цией при подвывихах головок и hallux valgus ревматоидной стопы.
Хорошие результаты (200 наблюдений) отмечаются у 75 % больных:
восстанавливается опороспособность стопы и возвращается возмож-
ность ношения обычной обуви.
Нашли свое место такие виды реконструктивных операций, как
резекция и аутопластика надколенника (собственный метод, защищен-
ный авторским свидетельством) [1], резекционная артропластика го-
леностопного, коленного суставов в ряде случаев как альтернатива
эндопротезированию; высокая остеотомия голени при варусной или
вальгусной установках коленного сустава.
Примерно 20 % всех операций приходится на долю артродезов.
Идеология этой операции по сути давно скопирована, исходя из жиз-
ненных наблюдений. Позволю себе некоторое отступление. На рито-
рический вопрос, возможно ли самоизлечение при РА, следует отве-
тить: да, возможно, и при этом стойкое, на всю последующую жизнь.
На рис. 24.4 представлен простой блоковидный сустав, далее —
фаза синовита с экссудатом в полости сустава, панартрит с перехо-
дом патологического процесса на субхондральные отделы суставных
концов. При этом можно предположить, что организм стремится унич-
тожить хрящ, который приобретает, по-видимому, антигенные свой-
ства и сам становится стимулятором воспаления в суставе. Уничто-
жение идет с помощью ферментов, паннуса, субхондральных грану-
ляций, перфорирующих хрящ со стороны субхондрия. После исчезно-
вения хряща создаются условия для анкилозирования со склерозом и
248
в
Д
г
Рис. 24.4. Синовит коленного сустава.
а — простой блоковидный сустав; б—д — фаза синовита с экссудатом в поло-
сти сустава, панартрит с переходом на субхондральные отделы суставных
концов. Объяснение в тексте.
сморщиванием суставной капсулы, что сопровождается стойким ку-
пированием воспаления, но одновременно потерей функции.
Мы уже упоминали о том, что артродезирование некоторых сус-
тавов не наносит большого ущерба функциональному статусу руки
или ноги.
249
ААТ
артропластика,
Базисная хирургия - артродез
Стероиды в/с,
Синовиортез,
эндопротез,
Адекватная антиревматическая
терапия (ААТ),
консервативная реабилитация
эндопротез,
Базисная хирургия - артродез,
Реконструктивная хирургия
Консервативная реабилитация,
Артропластика
Эндопротез (редко),
Рис. 24.5. Основные ортопедические операции при различных стадиях
артрита.
ААТ
Н“ стероиды в/с
ААТ
Артроскопическая синовэктомия,
Так, артродез являлся в нашей практике методом выбора лечения
при упорном артрите шопарова сустава (более чем у 100 больных по-
лучен 100 % отличный результат).
Самые благоприятные результаты получены нами после артроде-
зирования пястно-фалангового сустава I пальца кисти. У этих боль-
ных возросли сила и объемный хват кисти.
Подводя итоги активного ортопедического лечения больных РЗ и,
в частности, РА, мы показали снижение на 30—50 % суммарного по-
тока болевых импульсов, идущих из большого числа воспаленных,
иногда значительно разрушенных суставов. Мы утверждаем, что та-
кое лечение помогает подобным больным, образно говоря, держаться
на плаву, не допускает состояния, требующего постороннего ухода,
оно применимо и в тех случаях, когда терапевтическое лечение ока-
зывается исчерпанным.
Благодаря данной тактике ряду больных удалось сохранить семьи,
и даже, казалось бы, в совершенно безнадежных ситуациях реабили-
тация с помощью ревмохирургии помогла ряду пациенток родить де-
250
подтверждением эффективности
тей, что является бесспорным
наших действий.
На рис. 24.5 представлен ос-
новной набор ортопедических
операций, применяемый в зависи-
мости от стадии артрита. Но как
этим арсеналом наиболее рацио-
нально пользоваться? Критичес-
ки оценивая работу ревмоортопе-
дов института, я бы сравнил ее с
деятельностью пожарной коман-
ды. Образно говоря, мы тушили
пожар в тех местах, которые дли-
тельно горели, и чинили разру-
шения, возникшие от пожара, —
словом, все-таки пассивный или,
лучше сказать, вынужденно пас-
сивный метод работы.
Мне бы хотелось заглянуть в
будущее и представить идеаль-
ную форму взаимодействия рев-
моортопедов и ревматологов в
виде сбалансированной системы,
в которой нашли бы свое место
наиболее целесообразные и свое- Рис. 24.6. Тотальный артродез,
временно произведенные опера-
тивные вмешательства без перекосов в сторону допротезной хирургии
или эндопротезирования. Нельзя же представить себе больного, у ко-
торого большинство суставов конечностей заменено на искусственные.
Предположим, что мы имеем дело с больными РА в относитель-
но ранней стадии, с упорным артритом лучезапястного, запястных
суставов и теносиновитом. Не нужно продолжать малоэффективное
консервативное лечение. Следует произвести тотальный артродез
(рис. 24.6). Он излечит и предотвратит осложнения и мало отразится
на функции руки (тот же подход мы рекомендуем при патологии в об-
ласти шопарова сустава). Я бы назвал такую хирургию базисной
хирургией РА первого у р ов н я. Она сравнительна дешева, а
главное, доступна в любом регионе страны.
На рис. 24.5 представлена базисная хирургия второго уровня (эн-
допротезирование «ключевых» — тазобедренных и коленных суста-
вов), очень дорогого лечения, доступного не каждому пациенту. Про-
блема эндопротезирования в нашей стране может быть решена толь-
ко в условиях стабильной и динамически развивающейся экономики.
Поэтому в данный момент я предусмотрел в этой схеме для коленных
суставов сохранение цепи последовательных консервативных и опе-
ративных вмешательств: внутрисуставное введение ГКС, синовиор-
251
тез, синовэктомию (в будущем, по-видимому, эндоскопическую или,
лучше сказать, артроскопическую), которые, возможно, сами по себе
способны купировать или резко тормозить ревматоидный гонартрит.
Базисная хирургия I и II уровня может сделать больных полнос-
тью независимыми от окружающих, резко снизить суммарный боле-
вой поток, сохранить трудовую и профессиональную активность.
Другие оперативные вмешательства типа артропластик, реконструк-
тивных операций на других суставах могут рассматриваться как эф-
фективные методы, улучшающие функцию суставов, а следовательно,
повышающие качество жизни больных. Заметим, что такое
программирование взаимодействия ревмохирургов и ревматологов наи-
более эффективно на фоне адекватной антиревматической терапии.
Несколько слов о ревмоортопедии остеоартроза с поражением колен-
ных и тазобедренных суставов. Взаимодействие ревмоортопеда и ревма-
толога здесь необходимо в любой стадии гонартроза и коксартроза.
При патологических, как правило варусных, установках колен-
ного сустава мы выполняем корригирующе-разгрузочные операции
типа высокой остеотомии большой берцовой кости. По собственным
исследованиям, эта операция дает удовлетворительный эффект, зак-
лючающийся в снижении болей на 50—70 % от исходного уровня и
улучшении осевой нагрузки (эффект длится 5—7 лет). Перспективным
может оказаться и эндопротезирование, производимое в Институте
ревматологии РАМН в последние годы.
Другой проблемой, еще не решенной окончательно, является эн-
допротезирование тазобедренного сустава при коксартрозе. Прихо-
дится констатировать, что отечественные эндопротезы уступают по
своим износоустойчивым параметрам импортной продукции (пациен-
ты приобретают их за довольно значительные суммы денег).
Главной проблемой ревмоортопедии конца нашего столетия и пос-
ледующего XXI в. остается создание совершенных отечественных
конструкций эндопротезов. Современные эндопротезы остаются со-
хранными в течение 15 лет. В настоящее время ведутся работы по
созданию высокопрочных полиэтиленовых вкладок со сроком износа
20—30 лет. Известно, что специалисты вновь возвращаются к конст-
рукциям типа металл—металл. Изобретен сплав метасул, износоустой-
чивость которого чрезвычайно мала, всего 0,5 микрона в год. Прак-
тически тазобедренный сустав из такого сплава служит если и не веч-
но, то очень продолжительное время.
Что касается лечения РА в XXI в., мы позволим себе прогнозиро-
вать 2 варианта. Если будет создан высокоэффективный препарат, по-
давляющий активность РА длительно и эффективно, то роль ревмоор-
топеда может быть сведена к минимуму. Однако в другом варианте,
наряду с совершенными эндопротезами получит свое развитие артрос-
копическая техника и такие суставы, как коленный, плечевой, локте-
вой, даже мелкие суставы кисти, можно будет оперировать практи-
чески амбулаторным методом.
В отношении лечения остеоартроза мы ожидаем дальнейшего прогрес-
252
са в создании эффективных хондропротекторов, что уменьшит необхо-
димость хирургических вмешательств на крупных суставах. Следует
помнить о том, что улучшение микропедиатрической помощи новорож-
денным и стопроцентная диагностика и лечение врожденных аномалий
тазобедренного сустава повлияют на частоту развития коксартроза, и
необходимость таких операций, как эндопротезирование, выполняемое
во всем мире в сотнях тысяч случаев, отпадет у многих людей.
СПИСОК ЛИТЕРАТУРЫ
1. Павлов В.П. Способ лечения надколенника. — А.с. № 814348 В.П.П., 1980.
2. Русакова М.С., Грицман Н.Н., Павлов В.П. Об изменении суставного хря-
ща при ревматоидном артрите и резорбирующей роли паннуса // Арх.
пат. — 1970. — № 7. — С. 20—21.
3. Павлов В.П., Хамалайнен М., Нурми М. Хирургическое лечение II, III и
IV классов артрита локтевого сустава при ревматоидном артрите //
Ревматология. — 1989. — № 4. — С. 28-32.
4. Павлов В.П., Насонова В.А., Казначеев Л.Н. Шейный стабилизатор. —
Патент № 2108074, 1998.
Лекция 25
ВЗАИМОСВЯЗЬ ВИРУСНОЙ
ИНФЕКЦИИ, ИММУНОДЕФИЦИТА
И АУТОИММУННОЙ ПАТОЛОГИИ
У НОВОЗЕЛАНДСКИХ МЫШЕЙ
Д-р биол. наук Г.Н.Плесковская (Институт ревматологии
РАМН, Москва)
В лаборатории биологических моделей Института ревматологии
РАМН с 1975 г. для изучения аутоиммунных заболеваний биологи-
ческим объектом исследования служили инбредные линии новозелан-
дских мышей и их гибриды первого поколения, у которых «спонтан-
но» (без вмешательства экспериментатора) развиваются аутоиммун-
ные нарушения.
Ретроспективный анализ литературных данных, а также собствен-
ный фактический материал, касающийся возникновения и развития за-
болевания у этих животных, выявил сходство с возникновением и
развитием синдрома иммунодефицита при лентивирусных инфекциях
у этих животных.
Вероятным этиологическим агентом заболевания является вирус,
относящийся к семейству ретровирусов (Retroviridae), подсемейству
лентивирусов (Lentiviridae), напоминающий вирус мышиной лейкемии
Гросса (Mu LV). Последний по морфологической характеристике был
253
отнесен к РНК-содержащим вирусам С-типа. Главное общее свойство,
определяющее принадлежность к семейству ретровирусов, — наличие
в их природной биологии процесса обратной транскрипции генома,
т.е. преобразования генома в жизненном цикле вирусов идут в после-
довательности «РНК—ДНК—РНК». Геном зрелого вириона пред-
ставлен РНК. Этот вирус у новозеландских мышей обнаруживается
в тканях тимуса, печени, почек, лимфомы [12, 13, 14, 15].
Нарушение иммунорегуляторных механизмов у новозеландских
мышей является результатом сложных комплексных процессов и про-
является на различных уровнях иммунной системы. Для детального
анализа особенностей иммунологической реактивности при аутоим-
мунной патологии у данных животных проведено основательное ис-
следование различных звеньев иммуногенеза.
I. Определение антител к ДНК—РНК-гибриду, двуспиральной
РНК (дсРНК), нативной ДНК (нДНК) в сыворотке крови у новозе-
ландских мышей разного возраста.
Установлено, что патогенез заболевания новозеландских мышей
линии NZB и гибридов F1(NZB/NZW) линии тесно связан с генетичес-
кими, иммунологическими факторами, вирусной инфекцией. Наличие
антител к ДНК-РНК-гибриду, дсРНК в сыворотке крови является кос-
венным показателем вирусной инфекции. Мы изучали гуморальный
иммунный ответ на вирусную инфекцию в динамике развития патоло-
гического процесса, провели сравнительный анализ результатов иссле-
дования уровня антител к ДНК—РНК-гибриду, дсРНК и нДНК ра-
диоиммунологи чески м методом [8]. Использованы мыши линии NZB,
NZW и Fl (NZB/NZW), самки и самцы в возрасте от 1 до 11 мес.
Результаты исследования свидетельствуют, что статистически до-
стоверных различий в содержании антител к ДНК—РНК-гибриду у
животных различного возраста не имеется (Р > 0,05).
Сыворотки самок мышей линии NZW, NZB и Fl (NZB/NZW) в
возрасте 5—6 мес связывали в среднем 11,5 + 1,50; 11,7 + 1,35;
9,8 + 0,46 % (3Н) ДНК—РНК-гибрида.
В возрасте 10—11 мес у мышей линии NZW, NZB, Fl NZB/NZW
средний уровень связывания (3Н) ДНК—РНК-гибрида составил
9,5 + 1,83; 9,9 + 1,16; 11,1 + 2,17 % соответственно.
Также не удалось выявить различий в содержании антител у жи-
вотных одного возраста разных линий Fl NZB/NZW и NZW, F1
NZB/NZW и NZB (Р > 0,05).
Аналогичные результаты получены при сопоставлении средних
показателей связывания (3Н) ДНК-РНК-гибрида сыворотками самцов
этих же линий (Р > 0,05). Следует, однако, отметить, что эти пока-
затели выше, чем у мышей линии СВА (контрольная группа), —
6,0+ 0,87 % (Р< 0,05).
Данные по определению антител к дсРНК в сыворотке крови у
мышей Fl NZB/NZW в динамике развития заболевания свидетель-
ствуют о персистенции вируса на протяжении всей жизни животных.
Однако следует отметить, что в возрасте 3—4 мес происходит увели-
254
чение аутоантител к дсРНК, что свидетельствует об активизации
вирусной инфекции в этом возрасте.
У новозеландских мышей NZW, NZB, F1(NZB/NZW) линий раз-
ного возраста и пола нами было изучено распространение антител к
нДНК (табл. 25.1).
Установлено, что у самок изученных возрастных групп линий NZB,
Fl NZB/NZW с возрастом достоверно увеличивается количество
антител, реагирующих с нДНК.
Таким образом, результаты проведенных исследований, направлен-
ных на изучение гуморального звена иммунитета в ходе развития па-
тологического процесса, позволили проследить динамику образова-
ния антител к ДНК—РНК-гибриду, дсРНК, нДНК по мере развития
заболевания у новозеландских мышей. Отмечено, что аутоантитела к
ДНК—РНК-гибриду присутствуют в организме обследованных жи-
вотных на протяжении всей их жизни и дают основание полагать, что
они отражают персистенцию вирусного антигена. Уровень антител к
дсРНК с 3-месячного возраста имел тенденцию к нарастанию. И если
допустить, что антитела к дсРНК обусловлены присутствием вируса,
содержащего дсРНК, то полученные результаты являются свидетель-
ством персистенции вируса в организме новозеландских мышей. Кроме
того, повышение уровня антител к дсРНК на определенном этапе
развития заболевания может служить показателем усиления реплика-
ции вируса.
Установлено, что уровень аутоантител к нДНК увеличивается у
самок NZB линии, особенно у самок F1(NZB/NZW) мышей, в терми-
нальной стадии заболевания, что свидетельствует о половом димор-
физме при развитии аутоиммунной патологии у данных животных, а
также о том, что повышение уровня антител к дсРНК на несколько
месяцев предшествует повышению уровня антител к нДНК.
II Уровень хромосомных аберраций, спонтанных и индуцирован-
ных митомицином С, у новозеландских мышей.
Как следует из вышеизложенного, в результате наших исследова-
ний установлено, что у новозеландских мышей с возрастом повыша-
ется уровень аутоантител к ядерным компонентам клеток. Известно,
что продуцирование антител к ДНК, развитие гломерулонефрита и
гемолитической анемии у мышей NZB и NZW линий находится под
контролем нескольких доминантных или кодоминантных генов. По-
этому в качестве биологической модели аутоиммунных заболеваний
наиболее часто используют гибриды F1(NZB/NZW), у которых при-
знаки заболевания выражены значительно сильнее и возникают в бо-
лее ранние сроки, чем у исходных родительских линий. Полагают, что
генетические факторы играют существенную роль в этиологии и па-
тогенезе этой группы заболеваний.
Нами изучен спонтанный и индуцированный митомицином С (МС)
уровень хромосомных аберраций у новозеландских мышей [9]. Резуль-
таты исследований хромосомных аберраций представлены в табл.
25.2.
255
to
о
Таблица 25.1. Взаимодействие сывороток новозеландских мышей с (3Н) ДНК
Линия Пол Число жи- вот- ных Возраст 1—2 мес Число жи- вот- ных Возраст 4—5 мес Р* * Число жи- вот- ных Возраст 8—9 мес Число жи- вот- ных Возраст 12 мес и старше Р* *
М±ш* М±ш М±т М±т
NZB/N Самки 13 15,9±2,98 13 9,2±1,05 <0,05 11 12,0±1,18 12 22,6±5,03 <0,05
Самцы 16 18,2±2,19 12 11,6+1,06 <0,05 7 12,2±1,72 14 18,2±2,62 <0,05
F1 Самки 13 9,3±1,32 11 11,4±2,5 >0,05 6 19,4±1,59 6 43,3±0,83*** <0,05
(NZBZ NZW) Самцы 16 8,1±1,12 16 6,7±0,47 >0,05 6 15,6±2,57 6 12,4±0,82*** >0,05
NZWZN Самки 15 15,5±2,27 11 9,45±0,71 >0,05 8 9,85±0,79 13 13,1±1,80 >0,05
Самцы 14 14,0±1,80 11 10,2±1,21 >0,05 7 11,7±2,3 13 9,92±1,16 >0,05
* Средний процент связывания ДНК.
** Достоверность различий между возрастными группами,
*** Возраст 4-й возрастной группы F1(NZB/NZW) — 11 мес.
Уровень как спонтанных, так и индуцированных митомицином С
хромосомных аберраций в клетках костного мозга 9—10-месячных
самок F1(NZB/NZW) достоверно выше, чем у 3—4-месячных самцов
того же генотипа и мышей линии C57BL/6J (Р < 0,005). В то же время
имеются различия в уровнях клеток с аберрациями хромосом между
гибридами Fl (NZB/NZW) и мышами линии C57BL/6J (Р < 0,005).
Таблица 25.2. Спонтанные и индуцированные митомицином С аберра-
ции хромосом в клетках костного мозга мышей Fl (NZB/NZW) и конт-
рольной линии C57BL/6J
Линия, пол Возраст, месяцы Число Доля клеток, %
живот- ных клеток с поврежде- ниями хро- мосом* со структур- ными аберра- циями хро- мосом с множест- венными аберрация- ми хро- мосом***
F1 (NZB/NZW) 3—4 10 1000 2,8 (2,0-40)** 0,6 (0-2,0) 0
F1 (NZB/NZW) 9—10 10 1000 3,2 (0-7,0) 1,5 (0-3,0) 0
C57BL/6J 3 12 1200 1,8 (0-3,0) 0,4 (0—1,0) 0
Митоми- цин С F1 (NZB/NZW) 3—4 9 450 38,4 (24,0—70,0) 32,7 (16,0—56,0) 7,6 (0—12,0)
Fl (NZB/NZW) 9—10 11 550 50,4 (38,0—60,0) 46,4 (32,0—56,0) 5,6 (2,0-12,0)
C57BL/6J 3 7 350 26,6 (12,0—36,0) 21,7 (8,0—26,0) 1,4 (0-6,0)
* Поврежденными считаются клетки со структурными аберрациями и(или)
ахроматиновыми пробелами.
** Минимальные и максимальные значения.
*** Клетки, имеющие более 10 разрывов хромосом.
Основная масса спонтанных повреждений хромосом представле-
на фрагментами (одиночными или парными). При воздействии МС
наблюдали в основном структурные аберрации хроматидного типа:
одиночные фрагменты, хроматидные дицентрики, обмены, кольца,
центромерные слияния акроцентрических хромосом, ахроматиновые
пробелы. Природа этих повреждений пока не ясна. Однако существует
предположение, что некоторые из них обусловлены повреждением
ДНК.
257
При воздействии МС на хромосомы модельных мышей зарегист-
рированы клетки с множественными аберрациями хромосом, имею-
щие более 10 разрывов хромосом, вплоть до сильной фрагментации.
Процент таких клеток приведен в табл. 25.2, из которой видно, что
доля клеток с множественными аберрациями хромосом у гибридов
Fl(NZB/NZW) в несколько раз выше, чем у контрольной линии
C57BL/6J.
Таким образом, 9—10-месячные самки F1(NZB/NZW), у которых
ранее найден наиболее высокий уровень антител к ДНК, отличаются
и большей нестабильностью хромосом. У мышей линии C57BL/6J
уровень клеток с хромосомными аберрациями наиболее низкий; а 3—
4-месячные самцы Fl(NZB/NZW) занимают промежуточное положе-
ние как по уровню аутоантител к ДНК, так и по мутабельности хро-
мосом.
III. Определение аутоантител к эпителиальной ткани тимуса у
мышей линии NZB и у гибридов Fl (NZB/NZW) линий.
В настоящее время установлено, что эпителий корковой зоны ти-
муса млекопитающих составляет микроокружение, в котором проис-
ходят созревание и дифференцировка Т-лимфоцитов. Показано так-
же, что в течение первых месяцев после рождения у мышей NZB сни-
жается в крови уровень тимусного гормона и происходит уменьше-
ние особой популяции эпителиальных клеток тимуса, продуцирующих
этот гормон.
В связи с этим испытаны сыворотки крови, полученные на 1—2-м
и 4—5-м месяце после рождения от мышей NZB и F1(NZB/NZW), а
также от мышей контрольной линии BALB/c. Исследования проведе-
ны непрямым методом иммунофлюоресценции на нефиксированных
криостатных срезах тканей тимуса.
На срезах тканей тимуса мышей всех использованных линий в ауто-
логичной и сингенной системах, на срезах тимуса мышей BALB/c, а
также на тканях тимуса человека положительные реакции с эпители-
ем обнаружены в медуллярной зоне вокруг телец Гассаля и в корко-
вой зоне тимуса. На срезах тимуса морских свинок сыворотки реаги-
руют с эпителием только в медуллярной зоне. В контрольных опытах,
проведенных с сыворотками мышей BALB/c, на срезах тимуса чело-
века, морских свинок и мышей разных линий получены отрицатель-
ные результаты [2].
Таким образом, у мышей линии NZB и у F1(NZB/NZW) в тече-
ние первых месяцев после рождения установлено наличие антител,
реагирующих с эпителием корковой и медуллярной зон тимуса, а
также с эпителием базального слоя кожи. Подобные антитела не
найдены у мышей BALB/c.
Антитела, обнаруженные у мышей NZB и у Fl(NZB/NZW), сле-
дует считать аутоантителами. Во-первых, положительные реакции
обнаружены в аутологичной и сингенной системах. Во-вторых, ан-
тиген, с которым реагируют эти антитела, содержится во всех испы-
танных образцах тканей тимуса и кожи человека, морской свинки и
258
мышей разных линий. Последнее свидетельствует о том, что этот
антиген относится к тканеспецифическим антигенам, общим для раз-
ных видов, по отношению к которым обычно возникают аутоанти-
тела. Следует отметить, что аутоантитела, реагирующие с эпители-
ем тимуса, отличаются от аутоантител, реагирующих с ядрами кле-
ток.
Необходимо подчеркнуть, что аутоантитела, реагирующие с эпи-
телием тимуса, обнаруживаются еще до начала аутоиммунного про-
цесса. Какова же роль этих аутоантител в повреждении эпителия ти-
муса и в возникновении иммунорегуляторных нарушений, характер-
ных для аутоиммунного процесса? Основываясь на том, что повреж-
дение эпителиальной ткани тимуса на 2—3 мес опережает другие про-
явления патологического процесса в организме этих животных, мож-
но предположить, что происходит первичное поражение тимуса ново-
рожденных мышей вирусом с преждевременной утратой функций дан-
ного органа, нарушением процессов созревания и дифференцировки
иммунокомпетентных клеток и развитием дефицита Т-системы имму-
нитета.
IV. Миграция и дифференцировка кроветворных стволовых кле-
ток.
С целью изучения миграции и дифференцировки кроветворных
стволовых клеток нами проведены опыты на мышах FI(NZB/NZW)
линий разного возраста, на модели летально облученных мышей с
экранировкой ’/2 голени с подсчетом на 7—8-й день числа кроветвор-
ных колоний в селезенке, образовавшихся в результате миграции ство-
ловых клеток из экранированного участка костного мозга.
Из представленных в табл. 25.3 результатов исследований видно,
что у мышей NZB/NZW 2-месячного возраста в селезенку мигрирует
в среднем 15,4 колониеобразующих единиц (КОЕ).
У мышей Fl(NZB/NZW) 4—5-месячного возраста (табл. 25.3), у
которых выявляются симптомы аутоиммунной патологии, миграци-
онная активность стволовых кроветворных клеток приобретает тен-
денцию к снижению. Выраженное угнетение миграционной активно-
сти стволовых клеток из костного мозга отмечается в терминальной
стадии аутоиммунного процесса у 10—11-месячных животных. Оп-
ределение относительного (в расчете на 105 клеток) и абсолютного
(в расчете на клеточность кости) числа стволовых клеток в костном
мозге экранированной конечности 2-месячных (соответственно
38,1 ±3,2 и 3560 КОЕ) и 10-месячных (21,6±2,7 и 2000 КОЕ) мышей
показало, что их число с возрастом снижается в 1,5—2 раза. Следо-
вательно, наряду с уменьшением числа мигрировавших из костного
мозга КОЕ имеет место истинное снижение миграции стволовых
клеток.
Гистологический анализ колоний в селезенке показывает, что раз-
витие аутоиммунного процесса приводит к торможению дифференци-
ровки стволовых клеток по гранулоцитарному пути, вплоть до пол-
ного отсутствия колоний гранулоцитов. Вместе с тем увеличивается
259
Таблица 25.3. Миграция стволовых клеток у мышей Fl(NZBTNZW)
Возраст мышей, мес Число животных Количество КОЕ на селезенку М+т, р < 0,05
2 (норма) 10 15,4±1,5
5 (начало аутоиммунного процесса) 9 13,0±2,1
10 (терминальная стадия аутоиммунного процесса) 8 2,8±1,0
относительное число эритроидных колоний, т.е. колониеобразование
происходит по эритроидному пути.
Изучение дифференцировки стволовых клеток свидетельствует о
том, что у мышей Fl(NZB/NZW) во всех возрастных группах наблю-
дается угнетение или полное отсутствие гранулоцитарной дифферен-
цировки стволовых клеток [10].
Таким образом, на основании полученных данных можно предпо-
ложить, что у мышей F1(NZB/NZW) с аутоиммунной патологией, не-
зависимо от возраста, наблюдается торможение дифференцировки
стволовых клеток по гранулоцитарному пути развития.
Уже высказывалась точка зрения, согласно которой дифференци-
ровка стволовых клеток по гранулоцитарному пути обеспечивается
в определенной степени влиянием Т-лимфоцитов. С другой стороны,
нельзя также исключить возможность того, что у мышей F1(NZB/
NZW) существует генетический дефект на уровне предшественников
гранулоцитарного ряда кроветворения.
V. Миграция и кооперативное взаимодействие Т- и В-лимфоцитов
у мышей Fl (NZB/NZW) линий.
Изучение процессов миграции Т-лимфоцитов проводились нами по
методу Р.М.Хаитова (1975).
Результаты исследований представлены в табл. 25.4, из кото-
рой видно, что у мышей Fl(NZB/NZW) с возрастом снижается
миграция Т-лимфоцитов, особенно сильно — у 10—11-месячных мы-
шей F1(NZB/NZW).
Таким образом, в стадии выраженного аутоиммунного процес-
са наблюдается значительное угнетение миграционной активности
Т-лимфоцитов.
В другой серии исследований изучена миграционная способность
В-лимфоцитов у мышей F1(NZV/NZW) различного возраста. Полу-
ченные данные свидетельствуют о том, что при аутоиммунном пора-
жении процессы миграции В-лимфоцитов из костного мозга практи-
чески не нарушаются.
260
Таблица 25.4. Миграционная активность Т-лимфоцитов у мышей F1(NZB/
NZW)
Возраст мышей, мес Число животных Количество антителообразующих клеток на селезенку, Milp (р < 0,01)
2 8 2111,0 (1799,2±2422,8)
5 7 1610,0 (1228,911991,1)
10—11 8 1147,5(902,711399,3)
Кооперативное взаимодействие Т~ и В-лимфоцитов
В настоящем разделе работы мы исследовали особенности взаимо-
действия Т-лимфоцитов с В-лимфоцитами у мышей F1(NZB/NZW)
разного возраста. Эффект взаимодействия Т- и В-лимфоцитов в им-
мунном ответе определяли по методу Miller, Mitchell (1968).
Из табл. 25.5 видно (вариант I), что перенос клеток только кост-
ного мозга или только лимфатических узлов летально облученным ре-
ципиентам сопровождается образованием сравнительно небольшого
числа антителообразующих клеток (АОК) в селезенке (группы I—IV).
Перенос смеси клеток костного мозга и лимфатических узлов приво-
дит к резкому повышению числа АОК, накапливающихся в селезенке
(группы V-VIII), что отражает процесс кооперации между Т- и В-лим-
фоцитами. Однако эффект кооперации клеток костного мозга и лим-
фатических узлов при их совместном переносе проявляется в различ-
ной степени в зависимости от возраста доноров.
Таблица 25.5. Эффект взаимодействия Т- и В-лимфоцитов 1—2-месячиых
и 4—5-месячиых доноров (вариант 1) и 1—2-месячиых и 10—11-месячных
доноров (вариант 2) мышей в культуре лимфоидных клеток
№ группы Возраст доноров, мес Число реципи- ентов Количество АОК на селезенку 1±1р (р < 0,05)
клетки костного мозга 10XI06 клетки лимфати- ческих узлов 1ХЮ6
Вариант 1
I 1—2 8 1365,5 (1125,411659,9)
II Д 5 — 8 507,1 (462,41555,7)
III — 1—2 8 868,3(670,611124,3)
IV * - Д 8 174,2(144,81209,4)
V 1—2 1—2 8 5675,0 (6376,716820,0)
VI Д Д 8 1514,5(1324,311729,8)
VII 1—2 Д 8 1582,0(1527,611636,4)
VIII Д 5 1—2 8 4414,0 (4045,714797,1)
261
Продолжение
№ группы Возраст доноров, мес Число реципи- ентов Количество АОК на селезенку 1±1р (р < 0,05)
клетки костного мозга 10ХЮ6 клетки лимфати- ческих узлов 1Х106
Вариант 2
I 1—2 — 8 390,0 (304,7±498,8)
II 10—11 — 8 104,7 (68,8± 159,5)
III 1 1—2 8 434,0 (357,2±509,3)
IV — 10—11 6 168,4 (120,7±234,4)
V 1—2 1—2 9 5005,0 (4405,5±5677,0)
VI 10—11 10—11 6 812,2 (663,7±950,6)
VII 1—2 10-11 8 891,2 (864,3±918,6)
VIII 10—11 1—2 8 4927,0 (4970,0±5296,6)
Из приведенных в табл. 25.5 (вариант 1) данных видно, что эф-
фект Т- и В-кооперации при использовании клеток 4—5-месячных
мышей доноров значительно ниже (группа VI), чем при переносе кле-
ток 1—2-месячных доноров (группа V). За снижение эффекта коопе-
рации у 4—5-месячных мышей ответственны клетки лимфатических
узлов. Действительно, клетки лимфатических узлов 1—2-месячных
мышей эффективно кооперируют с клетками костного мозга 4—5-ме-
сячных животных (группа VIII), но клетки лимфатических узлов 4—
5-месячных животных плохо кооперируют как с клетками костного
мозга 4—5-месячных доноров (группа VI), так и с клетками 1—2-ме-
сячных доноров (группа VII). Клетки лимфатических узлов и костно-
го мозга старых (10—11-месячных) мышей практически не вступают
в кооперацию (табл. 25.5, вариант 2, группа VI). Использование ре-
ципрокных сочетаний доноров костного мозга и доноров лимфатичес-
ких узлов разного возраста показало, что неспособность к коопера-
тивному Т- и В-взаимодействию у старых мышей Fl(NZB/NZW) опос-
редуется на уровне клеток лимфатических узлов (табл. 25.5, вари-
ант 2, группы VI, VII, VIII).
Полученные данные позволяют сделать вывод о том, что с разви-
тием аутоиммунной патологии у мышей Fl(NZB/NZW) нарушается
хелперная функция Т-лимфоцитов, однако В-клетки, предшественни-
ки АОК, при этом сохраняют свою активность. Данные литературы
подтверждают наличие Т-дефицита у аутоиммунных мышей. Однако
нельзя было исключить возможность того, что неспособность Т-кле-
ток старых мышей Fl(NZB/NZW) к кооперации с В-клетками связа-
на с появлением в лимфатических узлах при старении супрессорных
клеток. Показано, что в селезенке старых мышей Fl(NZB/NZW) по-
являются мононуклеарные радиорезистентные клетки, устойчивые к
262
действию антитимоцитарной сыворотки и комплемента, обладающие
способностью супрессировать иммунный ответ и продукцию АОК
клетками селезенки молодых мышей Fl(NZB/NZW) в культуре in vitro
[1].
В связи с этим возник вопрос, не является ли снижение хелперной
функции клеток лимфатических узлов старых мышей Fl (NZB/NZW)
следствием появления или повышения супрессорной активности. Для
ответа на этот вопрос в смесь эффективно взаимодействующих Т- и
В-клеток молодых мышей Fl(NZB/NZW) добавляли разные дозы
клеток лимфатических узлов старых мышей F1(NZB/NZW).
Из табл. 25.6 видно, что клетки лимфатических узлов старых мы-
шей, добавленные к клеткам лимфатических узлов молодых мышей в
соотношении 1:1 (группа III), не влияют на Т- и В-кооперацию у мо-
лодых доноров. Однако повышение дозы клеток лимфатических уз-
лов старых доноров (соотношение 5:1 и особенно 10:1 группы IV—V)
приводит к супрессии кооперации Т- и В-клеток молодых доноров [4].
Таблица 25.6. Анализ супрессионных свойств клеток лимфатических уз-
лов старых мышей
№ труп- пы Трансплантированные клетки (X Ю6) Число реци- пиен- тов Количество АОК на селезенку М±1р (р < 0,05)
костный мозг лимфатичес- кие узлы
возраст мышей, мес
1—2 10—11 1—2 10—11
I 10 — 1 — 8 1626 (130512025) II 10 — 10 — 8 1368 (1185± 1578) III 10 — 1 1 8 1233 (101311501) IV 10 — 1 5 8 533,4 (3701749,9) V 10 — 1 10 8 301,7(265,41344)
Следовательно, снижение кооперативной способности Т- и В-лим-
фоцитов у мышей Fl(NZB/NZW) с появлением аутоиммунного про-
цесса, по-видимому, объясняется не только количественным или фун-
кциональным дефицитом Т-хелперов, но и повышением супрессорной
активности клеток лимфатических узлов.
Изучение заболевания у мышей нашей колонии, начиная с 1975 г.,
позволило нам обнаружить патологические процессы, развивающие-
ся у новозеландских мышей в сердце, легких, печени, тимусе, почках,
крови, коже, молочной железе. У данных животных нами определя-
лись хромосомная нестабильность, нарушение функции ферментов,
антитела к ДНК—РНК-гибриду, нДНК, дсРНК, эпителию тимуса,
базальному слою кожи, коллагену I типа, ЦИК, изменение функции
регуляторных клеток иммунной системы.
Следствием вышеописанной тяжелой патологии, по-видимому,
263
являются низкий уровень воспроизводительной функции данных жи-
вотных и короткая продолжительность жизни. В терминальной стадии
наблюдается резко выраженная кахексия [3, 5, 6].
Итак, разностороннее изучение иммунного статуса у новозеланд-
ских мышей позволило установить и расшифровать отдельные меха-
низмы нарушения со стороны иммунной системы.
Следует отметить, что показатель, подтверждающий наличие ви-
русной инфекции в организме, — ДНК—РНК-гибрид определяется во
всех возрастных группах (при отсутствии достоверных различий в
зависимости от генотипа, возраста и пола новозеландских мышей), а
также у контрольных мышей линии СВА, хотя его уровень достовер-
но ниже (р < 0,05). Однако же те признаки, которые характеризуют
степень выраженности патологического процесса, — наличие аутоан-
тител к эпителию тимуса и кожи, хромосомных аберраций, аутоанти-
тел к нДНК с возрастом динамично нарастают. Показатели клеточ-
ного иммунитета: миграция, расселение и дифференцировка крове-
творных стволовых клеток, функциональное и количественное состо-
яние Т-хелперов, кооперация Т- и В-лимфоцитов — с возрастом сни-
жаются, состояние Т-супрессоров остается или без существенных из-
менений, или в конце заболевания активизируется. В результате у
новозеландских мышей наблюдается иммунодефицит Т-хелперов при
неизмененном или повышенном количестве Т-супрессоров в терми-
нальной стадии заболевания (схема 25.1).
Полученные результаты ставят нас перед тем фактом, что аутоим-
мунные болезни следует рассматривать не как результат повышенной
активности иммунной системы, а как проявление иммунодефицита.
В связи с этим интересны исследования Eudenberg [11] по изуче-
нию генетического контроля иммунного ответа у мышей разных ли-
ний к вирусу Гросса. Он обнаружил у новозеландских мышей нали-
чие гена низкого иммунного ответа к вирусу Гросса. Используя глав-
ное положение этой области иммуногенетики — наличие генов высо-
кого и низкого иммунного ответа на те или иные конкретные антиге-
ны, можно предположить следующее: если организм гомозиготен по
генам, определяющим низкую иммунологическую реактивность по от-
ношению к антигенам некоего микроорганизма, то он не может осу-
ществлять полноценную иммунную защиту от этого микроорганизма.
В отношении других антигенов организм способен развивать нормаль-
ный иммунный ответ. Иммунодефицит такого типа обеспечивает дос-
таточно длительное безнаказанное персистирование данного микро-
организма, например ретровируса, в тканях организма. Вызванная им
деструкция тканей приводит к высвобождению скрытых в обычных
условиях тканевых антигенов, которые в норме никогда в кровоток
не поступают. Поскольку генетический дефект иммунной системы
обусловливает ее неполноценность только в отношении ретровируса,
она полноценно реагирует на высвобожденные вследствие инфекци-
онной деструкции тканевые аутоантигены. Вырабатываются аутоан-
титела — организм пытается защититься сам, если не от самого ин-
264
Схема 25.1. Развитие иммунодефицита у новозеландских мышей
Возраст, мес Антитела к ДНК- РНК-гибриду Аититела к эпители- альной ткани тимуса и кожи Антитела к двуспи- ральной РНК Хромосом- ные аберра- ции, наруше- ние репара- ционных про- цессов ДНК Антитела к нативной ДНК Снижение кооператив- ного взаимо- действия Т- и В-лимфо- цитов Снижение функциональ- ной актив- ности и ко- личества Т-хелперов Повышение функции Т-супрес- соров
ю
Схема 25.2. Развитие патологического процесса
у новозеландских мышей
Антитела к
дсРНК и
ДНК/РНК-гиб-
риду
Дефицит
Т-хелперов
Лентивирусная инфекция
Поражение ти-
муса, пораже-
ние и разруше-
ние CD4/CD8-
тимоцитов
Поражение
нервных
клеток
Снижение про-
лиферативной и
миграционной
активности ство-
ловых клеток
Нарушение диф-
ференцировки
Т-клеток, особен-
но Т-хелперов
Срыв аутотоле-
рантности
Возникновение
аутоиммунного
процесса
Поликлональ-
ная В-клеточ-
ная активация
Снижение
клеточного
иммунитета
Оппортуни-
стические
инфекции
Аутоантитела
и клеточные
аутоиммунные
реакции к дру-
гим антигенам
ткани
Опухоли
Поражение
ЦНС
фекционного агента, то хотя бы от продуктов тканевой деструк-
ции.
Рассматривая заболевания с аутоиммунными нарушениями с этой
точки зрения, во-первых, можно объяснить патогенез аутоиммунных
болезней и связь их с инфекциями, т.е. данная концепция может объяс-
нить факт наличия восприимчивых индивидуумов среди популяции лю-
дей, а у животных — наличие восприимчивых инбредных линий. Дру-
гими словами, у человека или животного, организм которого гомози-
готен по генам, определяющим высокий иммунный ответ, инфекцион-
ный агент (в данном случае ретровирус) нейтрализуется специфичес-
кими антителами или другими механизмами защиты. У индивидуумов,
гомозиготных по генам низкого иммунного ответа, развивается инфек-
266
ционный процесс (схема 25.2). Эта гипотеза может служить обоснова-
нием теоретического предположения об иммунодефиците как след-
ствии оппортунистической инфекции. Вероятность развития продук-
тивной стадии иммунодефицита зависит от степени гомозиготности
индивидуума по генам, определяющим силу иммунного ответа на дан-
ный антиген. Во-вторых, при этом ставится под сомнение целесооб-
разность иммунодепрессивной терапии, широко применяемой при лече-
нии ряда аутоиммунных болезней. В-третьих, эта концепция подчерки-
вает важность проблемы поиска способов превращения генетически
низкореагирующих на данный антиген особей в высокореагирующих.
Иначе говоря, ставится вопрос о том, что для лечения аутоиммунных
расстройств необходимо целенаправленно стимулировать иммунную
систему, а не подавлять ее иммунодепрессивными средствами [7].
К тому же результаты проведенных исследований позволяют счи-
тать обоснованными возможность и целесообразность использования
новозеландских мышей в качестве природной биологической модели
иммунодефицита человека. Использование данных животных, имею-
щих характеристику патологического процесса по генотипу, полу,
возрасту, позволит продолжить изучение вопросов этиологии, пато-
генеза, поиск средств эффективного лечения и профилактики [7].
СПИСОК ЛИТЕРАТУРЫ
1. Лесков В.П., Чередеев А.Н., Соловьев В.В., Костюк Л.Е., Плесковская ГН.
Выделение супрессорных и стимулирующих факторов лимфоцитами
иммунных мышей разных линий при контакте с сингенными эритро-
цитами // Иммунология. — 1982. — № 2. — С. 27—29.
2. Лямперт И.М., Рыжикова Е.В.> Плесковская ГН, Насонова В.А. Ауто-
антитела к эпителиальной ткани тимуса и кожи у мышей и гибридов
Fl (NZB/NZW) // Бюл. эксп. биол. и мед. — 1986. -№9.~ С. 321—324.
3. Матулис А.А., Астарускас В.И., Пташекас Р.С., Плесковская ГН, Злат-
кувене В.Н., Жукене Г.И. Влияние противовирусных препаратов реман-
тадина и метисазона на развитие патологического процесса у мышей
NZB/NZW F1 //Тез. докл. конф. «Актуальные вопросы ревматологии и
реабилитации больных ревматическими заболеваниями». — Вильнюс,
1979.—С. 172—174.
4. Петров Р.В., Насонова В.А., Хаитов Р.М., Нажметдинов А.М., Плесков-
ская Г.Н., Пчелинцев С.Ю. Регуляторные клетки иммунной системы (по-
мощники и супрессоры) у мышей NZB/NZW с аутоиммунными рас-
стройствами // Доклады Академии наук СССР.— 1979. — Т. 245,
№5. —С. 1269—1271.
5. Плесковская Г.Н. Разработка условий воспроизводства новозеландских
мышей и определение наличия аутоиммунного процесса у выведенных
популяций: Автореф. дис. ... канд. биол. наук. — М., 1980. — 20 с.
6. Плесковская Г.Н. Природные биологические модели аутоиммунных за-
болеваний (обзор литературы) // Ревматология. — 1991. — № 4. —
С. 38—44.
7. Плесковская Г.Н. Новозеландские мыши как модель иммунодефицитов:
Автореф. дис. ... д-ра биол. наук. — М., 1994. — 26 с.
267
8. Поверенный А,М., Насонова В. А., Плесковская Г.Н, БрыксинаЛ.Е., Под-
городниченко В.К Белки сыворотки: реагирующие с ДНК и ДНК—РНК-
гибридами у новозеландских мышей разного возраста // Доклады Ака-
демии наук СССР. — 1980. — №5. — С. 251, 1278—1280.
9. Сказкина О.Я., Лилъп И.Т., Плесковская Г.Н., Туголукова С.С., Корого-
дина Ю.В. Хромосомные аберрации у мышей Fl(NZB/NZW) — экспе-
риментальной модели системной красной волчанки // Цитология и ге-
нетика. — 1984. — Т. 18, № 6. — С. 458—460.
10. Хаитов Р.М., Шаталова И.Н, Нажметдинов А.М., Дикая Т.В., Пчелин-
цев С.Ю., Плесковская ПН., Насонова В.А. Миграция и дифференциров-
ка кроветворных стволовых клеток у аутоиммунных мышей разного
возраста // Бюл. экспер. биологии и медицины. — М., 1980. — № 2. —
С. 224—226.
11. Fudenberg Н.Н. Are autoimmune disease immunologic deficiency states. —
In: Immunol. Immunobiol. — Stamford (USA), 1971. — P. 175—183.
12. Mellors R.C., Huang C.G. Immunopathology of NZB/B1 mice. Virus —
like (filterable) agent separable from lymphoma cells and identifiable by
electron-microscopy // J. exp. Med. — 1966. — Vol. 124. — P. 1031—1038.
13. Mellors R.C. Wild-type Grossa leukemia virus and heritable autoimmune
disease of New Zealand mice // Amer. J. clin. Pathol. — 1971. — Vol. 56.
— P. 270—279.
14. Simpson L.O. An NZB virus or NZB mice with viral infections? // J. Lab.
Animals. — 1976. — Vol. 10, N 3. — P. 249—260.
15. Talal N., Steinberg A.D. The pathogenesis of autoimmunity in New Zealand
Black mice // Curr. Topics Microbiol, and Immunol. — 1974. — Vol. 64. —
P. 79—103.
ОГЛАВЛЕНИЕ
Предисловие.................................................. 7
Лекция 1. Эпидемиология ревматических заболеваний — вчера и
сегодня. Профессор Л.И .Беневоленская (Институт ревматологии
РАМН)..................................................... 14
Лекция 2. Достижения и перспективы в идентификации генов
предрасположенности к ревматическим заболеваниям.
Д-р мед. наук В.А.Мякоткин (Институт ревматологии РАМН) ..... 20
Лекция 3. Новые направления в исследовании воспаления при
ревматических заболеваниях. Член-корр. РАМН, профессор
ЕДЕНасонов, канд. мед. наук М.Ю. Самсонов (кафедра ревматологии
ФППО Московской медицинской академии им. И. М. Сеченова) ............. 29
Лекция 4. Ревматическая лихорадка (ревматизм) в XX в. Академик
РАМН профессор В.А.Насонова, профессор Н.Н.Кузьмина (Инсти-
тут ревматологии РАМН)................................................ 45
Лекция 5. Ревматоидный артрит на рубеже веков. Профессор
Р.М.Балабанова, профессор М.М.Иванова, канд. мед. наук
Д.Е.Каратеев (Институт ревматологии РАМН) .............................. 61
Лекция 6. Лечение ревматоидного артрита циклоспорином А.
Профессор Я'А'Сигидин (Институт ревматологии РАМН)................. 67
Лекция 7. Спондилоартриты как объект перспективных научных
исследований в ревматологии. Профессор Э'Р.Агабабова (Инсти-
тут ревматологии РАМН) ............................................. 74
Лекция 8. Псориатический артрит и псориаз: проблема взаимо-
связи и взаимообусловленности. Канд. мед. наук В.В.Бадокин
(Курс ревматологии Российской медицинской академии последип-
ломного образования)............................................................................... 82
Лекция 9. Эволюция методов лечения системной красной волчан-
ки. Профессор М'М'Иванова (Институт ревматологии РАМН) 91
Лекция 10. Склеродермия — модель локального и генерализо-
ванного фиброза. Профессор II.Г.Гусева (Институт ревматологии
РАМН) ..................................................................................................... 100
Лекция 11. Критерии диагноза болезни и синдрома Шегрена.
Канд. мед. наук В.И.Васильев, канд. мед. наук М.В.Симонова
(Институтревматологии РАМН), канд. мед. наук Т.Н'Сафонова
(Институт глазных болезней РАМН)................................................................ 112
269
Лекция 12. Антифосфолипидный синдром: 15 лет изучения. Про-
фессор З.С.Алекберова (Институт ревматологии РАМН), член-корр.
РАМН, профессор Е.Л.Насонов (кафедра ревматологии ФППО
Московской медицинской академии им. И. М.Сеченова), д-р мед. наук
Т.М.Решетняк, канд. мед. наук С.Г.Раденска-Лоповок (Институт
ревматологии РАМН) ............................................................................. 132
Лекция 13. Болезнь Лайма — мультидисциплинарная проблема.
Д-р мед. наук Л.П.Ананьева (Институт ревматологии РАМН)........... 148
Лекция 14. Некоторые аспекты ревматологии детского и подрост-
кового возраста. Канд. мед. наук О.М.Фоломеева (Институт ревма-
тологии РАМН) .................................................................................. 158
Лекция 15. Ревматические заболевания в пожилом возрасте. Но-
вые факты. Д-р мед. наук Н.В.Бунчук, канд. мед. наук А.Г.Бочкова
(Институт ревматологии РА МН)................................................................... 168
Лекция 16. Синдром боли в нижней части спины в практике
врача-ревматолога. Профессор Н.А.Шостак, Д.А.Шеметов,
Е.Е.Аринина (Российский государственный медицинский универ-
ситет).......................................................................................... 175
Лекция 17. Достижения и перспективы инструментальной диаг-
ностики проявлений ревматических болезней. Профессор Э.С.Мач,
канд. мед. наук А.В.Смирнов, канд. мед. наук Г.П.Котельникова,
О.В.Пушкова (Институт ревматологии РАМН) ....................................................... 182
Лекция 18. Морфологический субстрат ревматических заболева-
ний. Что нового в биопсийной диагностике? Канд. мед. наук
С.Г.Раденска-Лоповок (Институт ревматологии РАМН) .............................................. 191
Лекция 19. Возможности и перспективы фармакотерапии остео-
артроза. Канд. мед. наук Е.С.Цветкова, канд. мед. наук
Л.И.Алексеева (Институт ревматологии РАМН)...................................................... 197
Лекция 20. Современные проблемы глюкокортикоидной терапии.
Член-корр. РАМН, профессор Е.Л.Насонов (кафедра ревматологии
ФППО Московской медицинской академии им. И. М. Сеченова)........................................ 203
Лекция 21. Интенсивная терапия ревматических заболеваний. От
казуистики к повседневности. Д-р мед. наук С.К.Соловьев (Ин-
ститут ревматологии РАМН)....................................................................... 215
Лекция 22. Безопасна ли терапия антиревматическими лекарст-
венными средствами? Профессор Ю.В.Муравьев (Институт ревма-
тологии РАМН)................................................................................... 225
Лекция 23. Антибиотики в ревматологии: настоящее и будущее.
Канд. мед. наук Б.С.Белов (Институт ревматологии РАМН)............ 233
Лекция 24. Ревмоортопедия: ретроспектива, проблемы, взгляд в
будущее. Профессор В.П.Павлов (Институт ревматологии РАМН) 243
Лекция 25. Взаимосвязь вирусной инфекции, иммунодефицита и
аутоиммунной патологии у новозеландских мышей. Д-р биол. на-
ук Г.Н.Плесковская (Институт ревматологии РАМН) ................................................ 253
270
Учебное пособие
ИЗБРАННЫЕ ЛЕКЦИИ
ПО КЛИНИЧЕСКОЙ РЕВМАТОЛОГИИ
Зав.редакцией Т. 77. Осокина
Научный редактор А. К. Владимирова
Художественный редактор С. М. Лъшина
Технический редактор Н В. Сорокина
Корректор Л. Г. Воронина
ЛР № 010215 от 29.04.97. Сдано в набор
13.11.2000. Подписано к печати 27.02.2001.
Формат бумаги 60X90'/|fi. Бумага офсетная
№ 1. Гарнитура Таймс. Печать офсетная.
Усл. печ. л. 17,25. Усл. кр.-отт. 18,25. Уч.-
изд. л. 19,71. Тираж 5000 экз. Заказ № 3592
Ордена Трудового Красного Знамени изда-
тельство «Медицина».
101000, Москва, Петроверигский пер., 6/8.
ОАО «Ярославский полиграфкомбинат»,
150049, Ярославль, ул. Свободы, 97.
ISBN 5-ЕЕ5-ОЧЧЬЧ-7
785225
044695