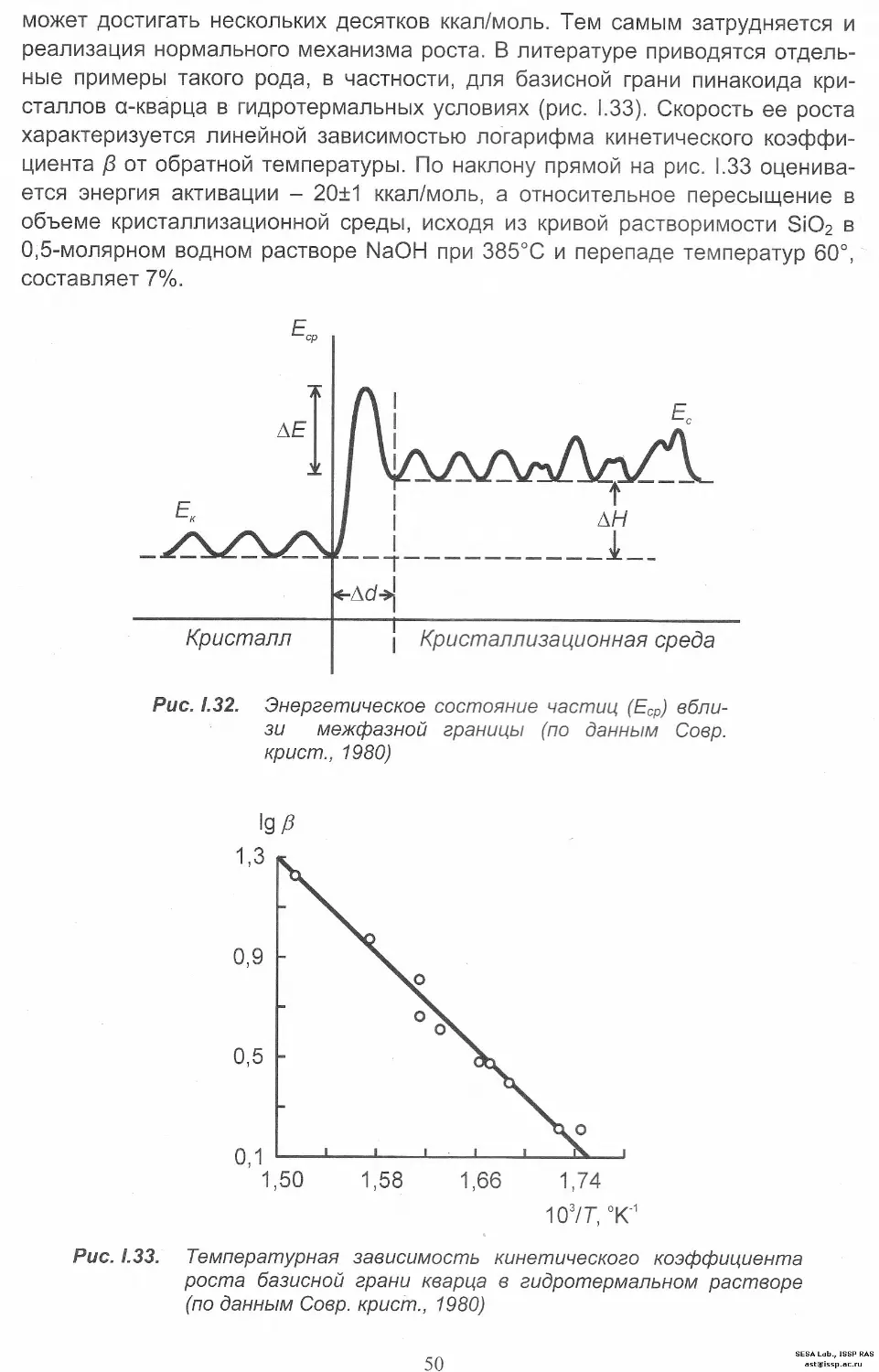
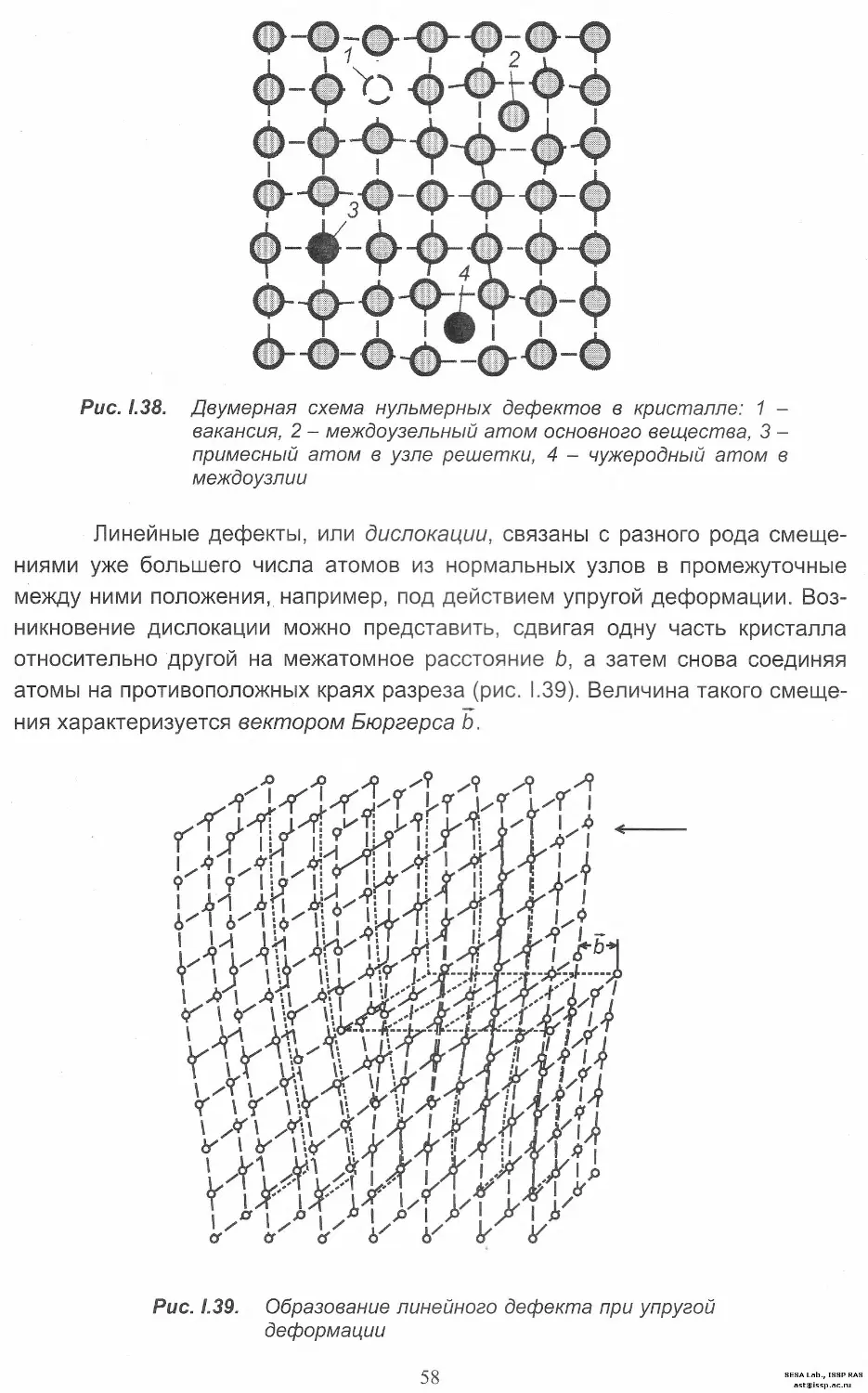
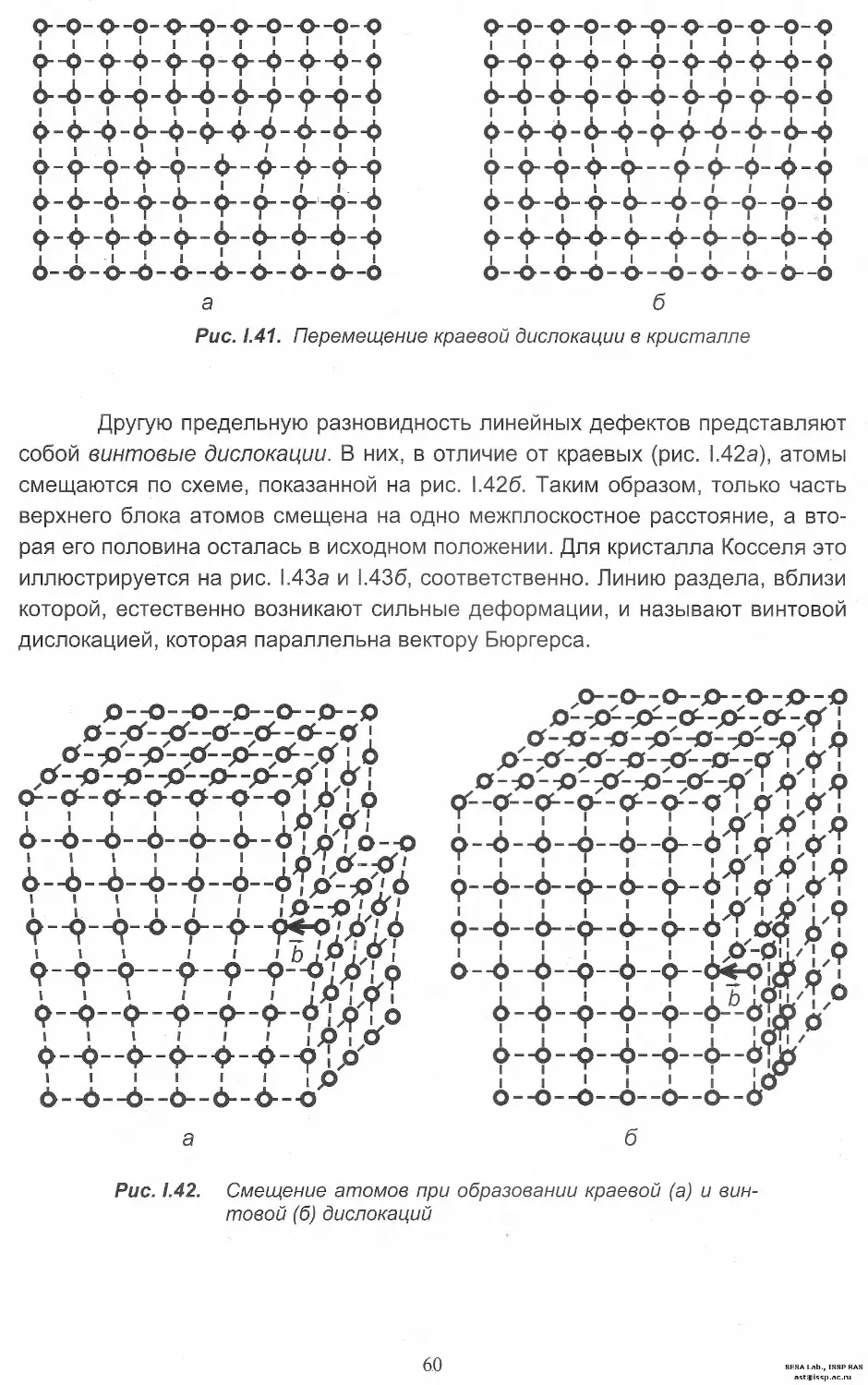
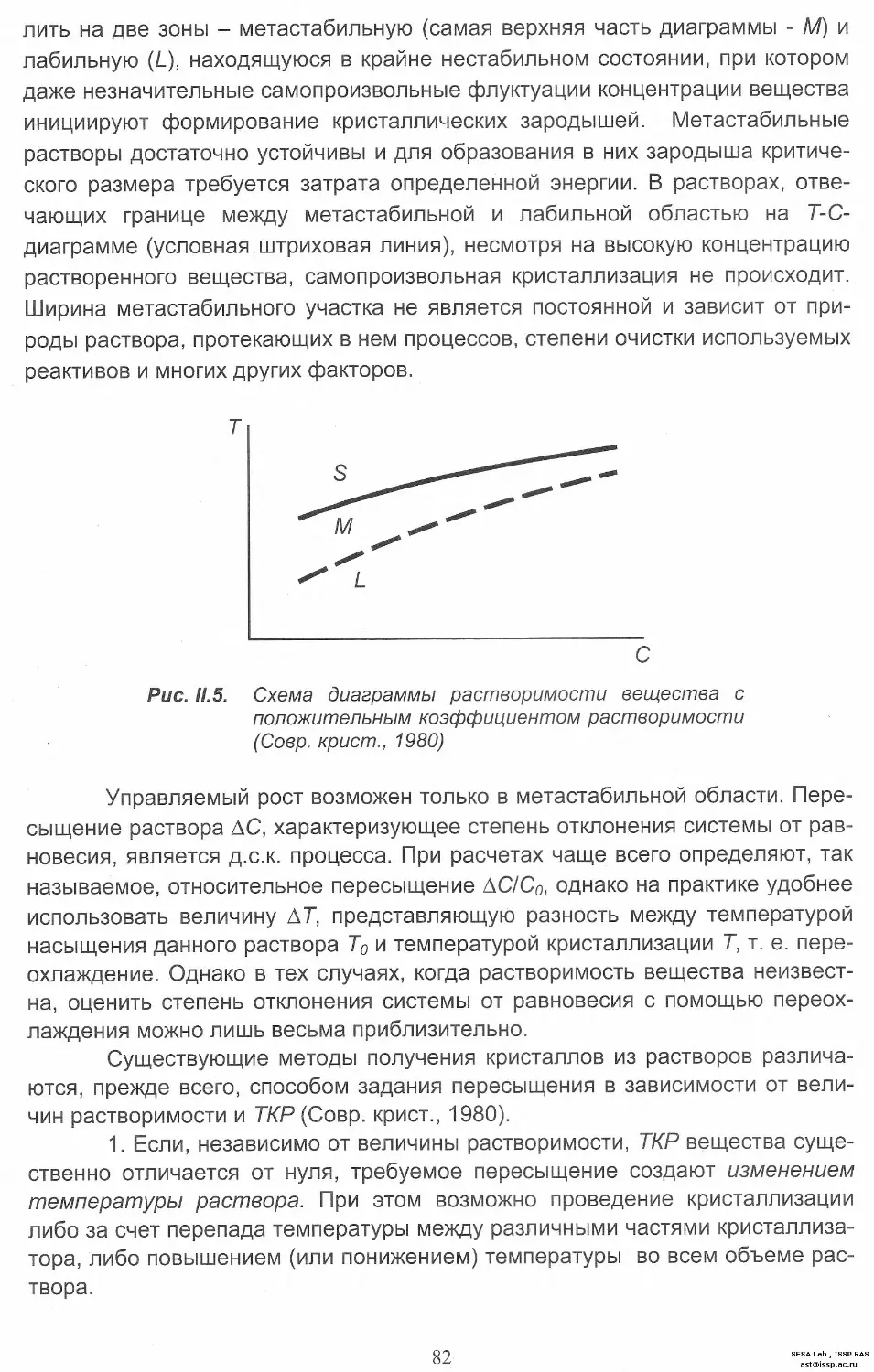
Автор: Леонюк Н.И. Копорулина Е.В. Волкова Е.А.
Теги: зарождение, рост и растворение кристаллов историческая геология кристаллография кристаллохимия кристаллы
ISBN: 978-5-89118-675-0
Год: 2014
Текст
Н.И. Леонюк
Е.В. Копорулина
Е.А. Волкова
В.В. Мальцев
РОСТ КРИСТАЛЛОВ
Лабораторный практикум
с основами теории
Н.И. Леонюк
Е.В. Копорулина
Е.А. Волкова
В.В. Мальцев
РОСТ КРИСТАЛЛОВ
Лабораторный практикум
с основами теории
Допущено УМО по классическому университетскому
образованию в качестве учебного пособия для студентов,
обучающихся по направлению 020700 «Геология»
Москва
ГЕОС
2014
SESA Lab., ISSP RAS
ast@issp.ac.ru
УДК 548.5(075.8)
ББК 26.323
Р 57
Рост кристаллов. Лабораторный практикум с основами теории.
Учебное пособие/ Н.И. Леонюк, Е.В. Копорулина, Е.А. Волкова,
В.В. Мальцев. - М.: ГЕОС , 2014. - 146 с.: ил.
ISBN 978-5-89118-675-0
Изложены основные представления о кристаллообразовании, включающие
зарождение, рост и морфологию кристаллов. Показаны особенности мето-
дов выращивания монокристаллов, наиболее широко применяемых в лабо-
раторной практике и промышленности. Главное внимание акцентируется на
приемах, необходимых для выполнения лабораторных работ, которые на
конкретных примерах наглядно демонстрируют процессы зарождения кри-
сталлов, влияние внешних факторов - пересыщения, переохлаждения и
состава кристаллизационной среды - на их формирование. Практическая
часть включает также получение кристаллов из расплавов, растворов в
расплавах, водных растворов и пара. Пособие рассчитано на студентов
геолого-минералогического, материаловедческого и химико-технологи-
ческого профилей, имеющих отношение к кристаллическому веществу.
УДК 548.5(075.8)
ББК 26.323
Рецензенты:
доктор геолого-минералогических наук А.В. Мохов
кандидат геолого-минералогических наук ПЛ. Шванский
ISBN 978-5-89118-675-0
© Н.И. Леонюк, Е.В. Копорулина,
Е.А. Волкова, В.В. Мальцев, 2014
SESA Lab., ISSP RAS
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ................................................ 5
I ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
Термодинамические предпосылки
Кристаллизация как фазовый переход........................ 8
Поверхностная энергия.................................... 14
Движущая сила кристаллизации............................. 18
Зарождение кристаллов в гомогенных условиях
Уравнение Томсона-Гиббса................................. 21
Работа и скорость зародышеобразования.................... 23
Геометрическая модель нуклеации.......................... 27
Пределы метастабильности кристаллизационной среды........ 31
Гетерогенные системы
Образование новых центров роста.......................... 34
Двумерные зародыши....................................... 37
Эпитаксиальные явления................................... 38
Механизм и кинетика кристаллизации
Анизотропия поверхностной энергии........................ 40
Типы граней кристаллов................................... 41
Нормальный и послойный рост.............................. 43
Структура межфазных границ и диффузионные процессы....... 44
Скорости нормального роста............................... 49
Особенности послойного роста в различных средах.......... 51
Рост реальных кристаллов
Дефекты кристаллической структуры........................ 57
Дислокационный механизм роста............................ 63
Вхождение примесей...................................... 65
II ТЕХНИЧЕСКИЕ ПРИЕМЫ
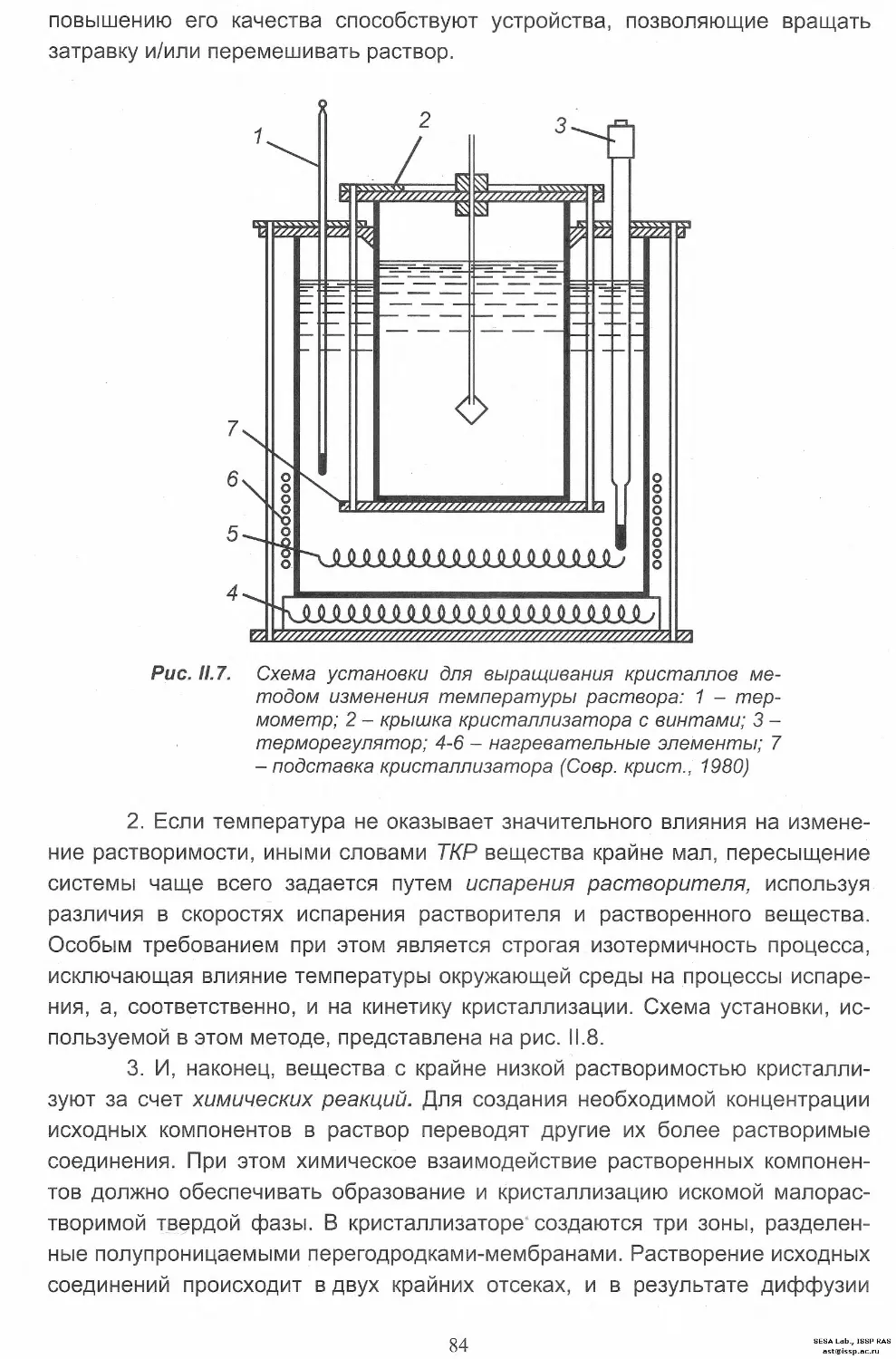
Критерии выбора способа выращивания кристаллов 70
Кристаллизация из расплава
Физико-химические основы................................. 74
Метод Чохральского....................................... 75
Метод Киропулоса......................................... 77
3
SESA Lab., ISSP RAS
Метод Бриджмена-Стокбаргера............................. 79
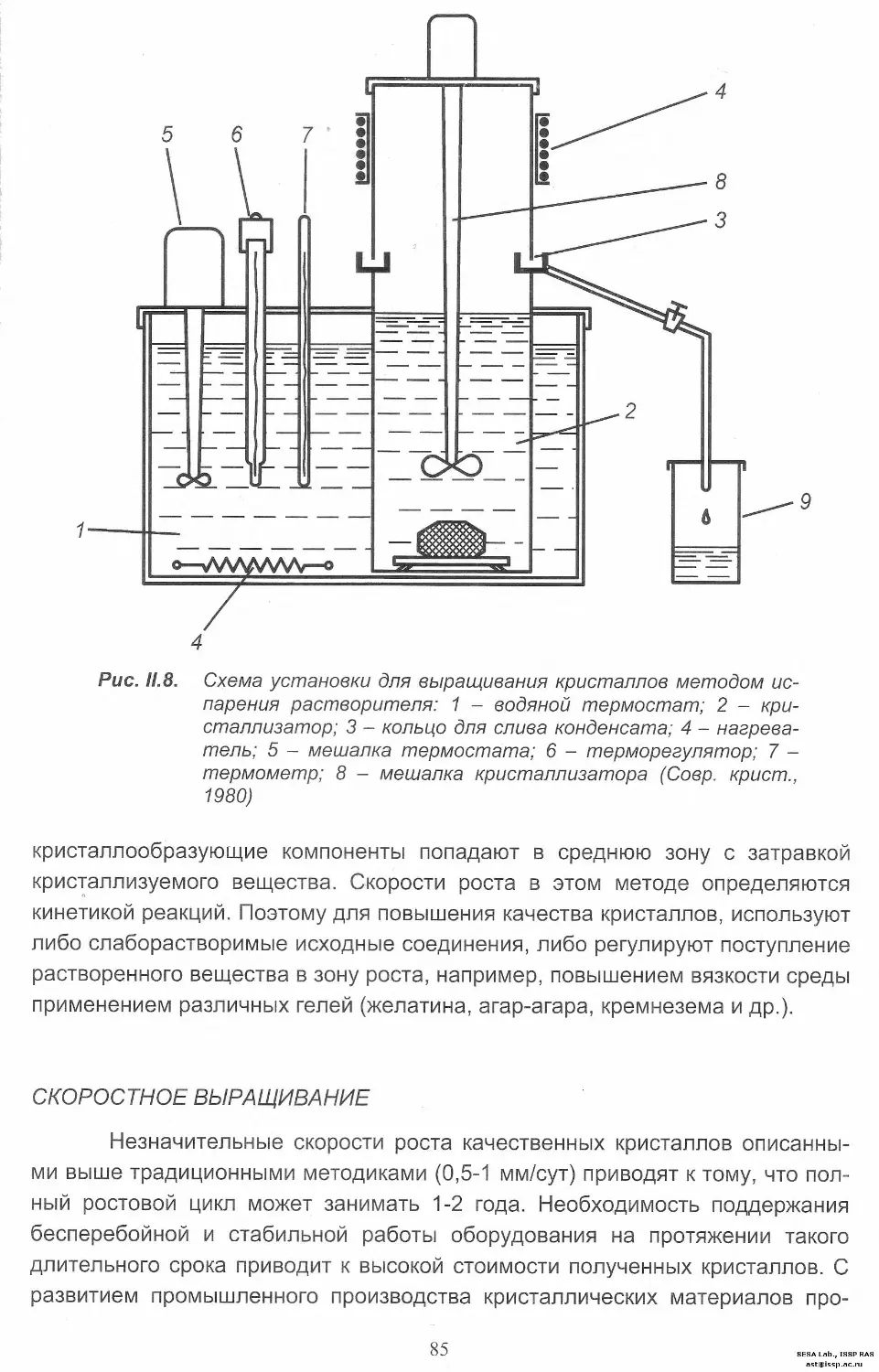
Выращивание кристаллов из низкотемпературных растворов
Классические разновидности метода....................... 81
Скоростное выращивание.................................. 85
Раствор-расплавная кристаллизация............................ 88
Кристаллизация из газовой фазы............................... 91
Методы изучения морфологии кристаллов........................ 94
III ЛАБОРАТОРНЫЕ РАБОТЫ
Задача 1. Ортотропизм при кристаллизации салола
из капли расплава........................................... 102
Задача 2. Влияние переохлаждения на форму роста
кристаллов салола и гипосульфита натрия..................... 104
Задача 3. Эпитаксиальный рост.................. 106
Задача 4. Построение кривых растворимости............ 108
Задача 5. Выращивание монокристаллов из водных растворов..... 111
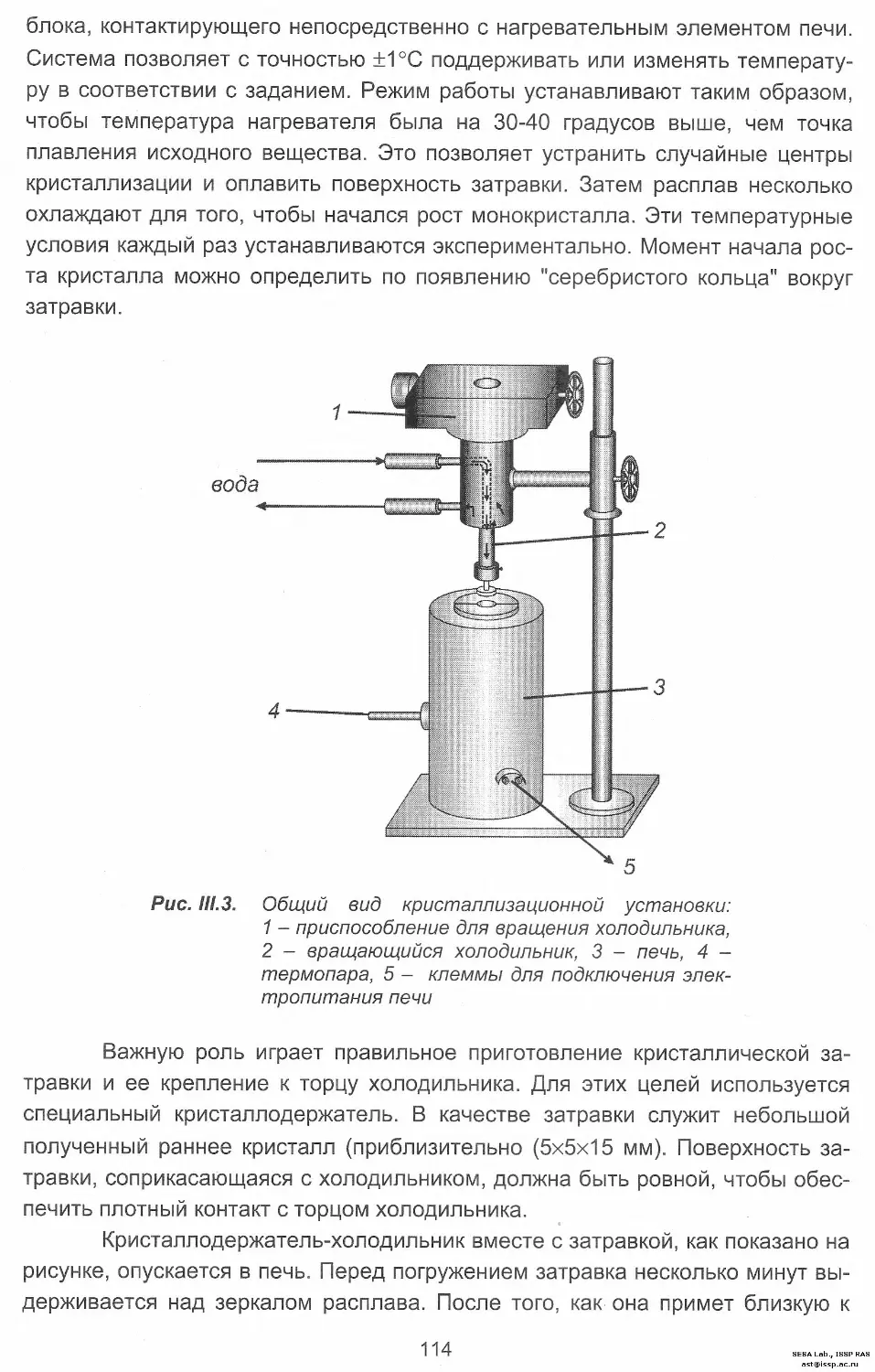
Задача 6. Получение кристаллов методом Киропулоса........ 113
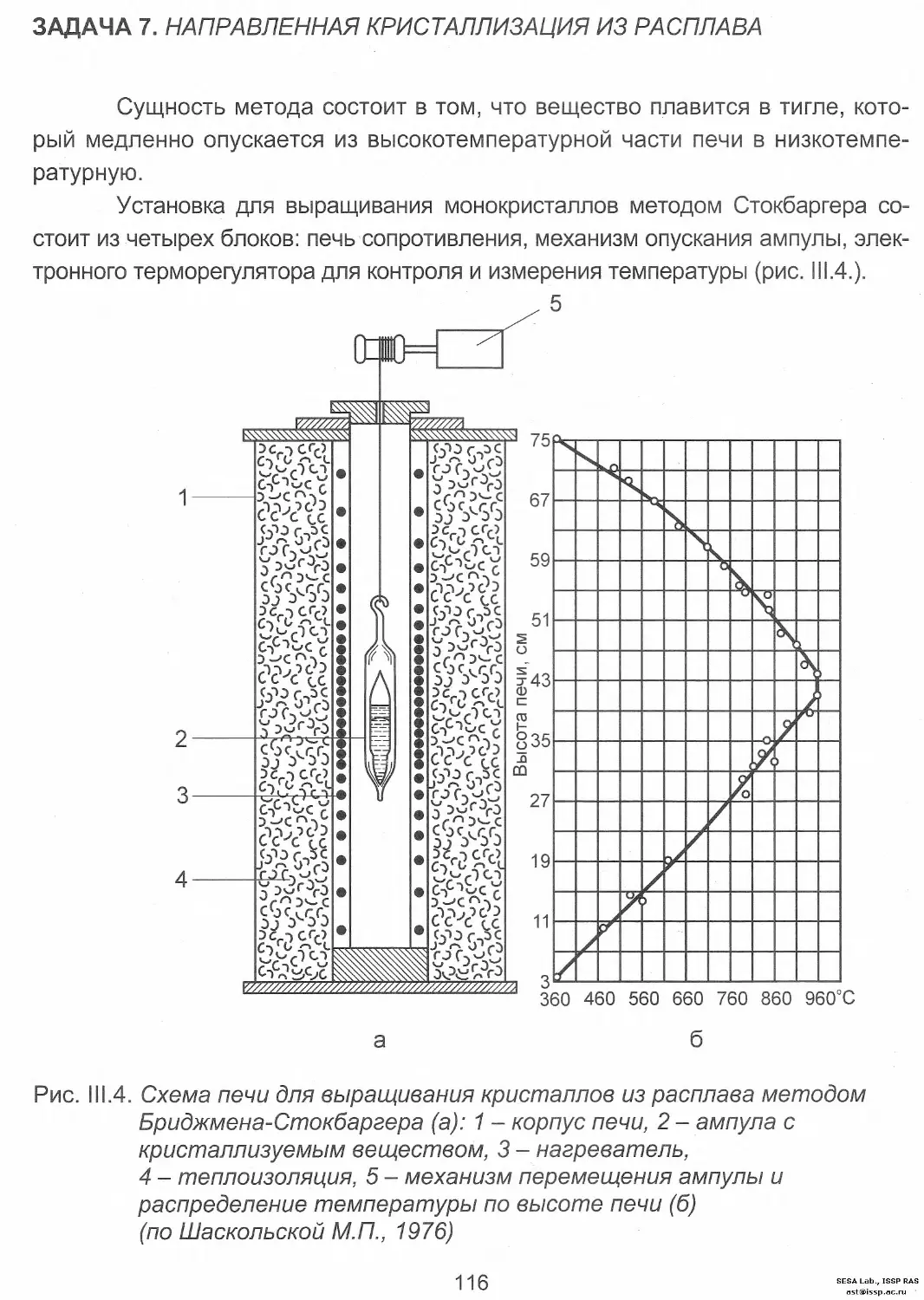
Задача 7. Направленная кристаллизация из расплава........ 116
Задача 8. Выращивание монокристаллов молибдата свинца
методом Чохральского........................................ 120
Задача 9. Выращивание кристаллов из раствора в расплаве..... 126
Задача 10. Кристаллизация из газовой фазы................... 128
Задача 11. Влияние концентрации раствора на форму кристаллов. 131
Задача 12. Влияние примесей на форму кристаллов............. 133
Задача 13. Изучение слоев роста на синтетических
кристаллах муассонита....................................... 135
Задача 14. Морфология эпитаксиальных пленок германия........ 137
Задача 15. Химическое травление кристаллов NaCI, KCI, CaF2.. 139
ПРАВИЛА БЕЗОПАСНОСТИ........................................ 142
РЕКОМЕНДУЕМАЯ И ЦИТИРУЕМАЯ ЛИТЕРАТУРА....................... 144
4
SESA Lab., ISSP RAS
ПРЕДИСЛОВИЕ
Многочисленные научные публикации в области роста кристаллов,
особенно в периодических изданиях, связаны с лавинообразно возросшим в
последние годы объемом экспериментальных исследований условий синтеза
новых функциональных кристаллических материалов. В то же время, учебная
литература, касающаяся кристаллизации вещества, крайне ограничена. В ча-
стности, это касается проблем кристаллогенезиса в лабораторных условиях и
природных системах. Попытки сократить образовавшийся пробел предприни-
мались авторами в учебных пособиях (Н.И. Леонюк, В.И. Лютин, В.В. Мальцев
«Выращивание монокристаллов и моделирование процессов минералообра-
зования», М, Изд. МГУ, 2005, 103 с. и Н.И. Леонюк, Е.В. Копорулина, Е.А.
Волкова, В.В. Мальцев «Зарождение, рост и морфология кристаллов, М, Изд.
МАКС Пресс, 2010, 143 с.), которые предназначались для учебной практики и
практических занятий в рамках многосеместрового курса «Рост и морфология
кристаллов» для студентов 3, 4 и 5 года обучения (специальность “Геохимия”,
специализация кристаллография и кристаллохимия) геологического факуль-
тета МГУ имени М.В. Ломоносова.
В настоящее время в связи с переходом на новые образовательные
программы появилась необходимость в адаптации учебной литературы, в том
числе и для новых курсов по направлению подготовки 020700 «Геология»
(профиль - «Геохимия»): «Рост кристаллов: основы теории и методы» - для
студентов-бакалавров (специализация кристаллография и кристаллохимия), и
«Синтез минералов-самоцветов» - для магистрантов-геммологов (специали-
зация геммология). Неотъемлемой частью программ является лабораторный
практикум, который проводится для студентов-кристаллографов в 6-м семе-
стре, а для геммологов - в 11-м, с целью более полного усвоения теоретиче-
ского материала. Предполагая, что некоторые разделы книги могут представ-
лять интерес не только для студентов этого профиля, но и для более широко-
го круга читателей, в ней уточнен список рекомендуемой и цитируемой лите-
ратуры.
В предлагаемом издании авторы стремились последовательно изло-
жить общие представления о кристаллообразовании, включающие зарожде-
ние, рост и морфологию кристаллов. В первой части пособия вкратце даны
физико-химические аспекты зародышеобразования, рассмотрены движущая
сила кристаллизации, структура межфазных границ, эпитаксия, кинетика нор-
SESA Lab., ISSP RAS
мального и послойного роста, влияние примесей на процессы кристаллиза-
ции. Овладев этими основами, студенты смогут найти более подробную ин-
формацию по этим проблемам в оригинальной литературе. Во втором разде-
ле показаны особенности ряда методов выращивания кристаллов, наиболее
широко применяемых в лабораторной практике и промышленности: кристал-
лизация из собственных расплавов, низкотемпературных водных растворов,
газовой фазы, из растворов в расплавах. Выбранный режим и технология вы-
ращивания должны обеспечивать заданный состав кристаллов, их размер и
степень совершенства. При этом каждой группе методов присущи свой меха-
низм и кинетика роста, а также типичные дефекты. Формат настоящего посо-
бия не позволяет систематически охарактеризовать все существующие на
сегодняшний день технологии практического выращивания кристаллов, так же
как и базовые принципы выбора подходящей методики. Поэтому главное вни-
мание акцентируется на приемах, необходимых для выполнения лабораторных
работ, которые приведены в третьей части учебного пособия. Предложенные
практические задачи, по мнению авторов, на конкретных примерах наглядно
демонстрируют процессы зарождения кристаллов, влияние внешних факторов
на их морфологию, а также особенности некоторых методов выращивания.
При подготовке пособия, наряду с оригинальной литературой, исполь-
зовались материалы лекций, читаемых на геохимическом отделении геологи-
ческого факультета МГУ уже на протяжении нескольких десятилетий. Авторы
совместно разрабатывали план и постоянно обсуждали его содержание. Пер-
вый раздел написан Н.И. Леонюком, а второй и третий - преимущественно Е.В.
Копорулиной, В.В. Мальцевым и Е.А. Волковой, хотя в целом, во многих местах
трудно выделить вклад каждого из авторов. Под общей редакцией Н.И. Леоню-
ка учебное пособие и предлагается читателю в окончательном виде.
Изложенный материал адресован, прежде всего, студентам-
кристаллографам геолого-минералогического направления, может быть поле-
зен минералогам и геологам, интересующимся генезисом природных моно-
кристаллов, а также физикам, химикам и материаловедам, занимающимся
кристаллизацией вещества.
Авторы признательны А.И. Жиляевой за кропотливую работу по
оформлению графического материала при подготовке рукописи и компьютер-
ного оригинал-макета, а также всем коллегам, способствовавшим появлению
этого пособия.
Любые замечания будут приняты авторами с благодарностью по ад-
ресу: 119991, г. Москва, ГСП-1, геологический факультет МГУ имени М.В. Ло-
моносова, кафедра кристаллографии и кристаллохимии, телефон/факс:
+7(495)9392980, e-mail: leon@geol.msu.ru.
6
SESA Lab., ISSP RAS
ast® issp.ac.ru
I ТЕОРЕТИЧЕСКИЕ АСПЕКТЫ
7
ТЕРМОДИНАМИЧЕСКИЕ ПРЕДПОСЫЛКИ
КРИСТАЛЛИЗАЦИЯ КАК ФАЗОВЫЙ ПЕРЕХОД
Как известно, равновесные состояния в однокомпонентных системах
определяются давлением Р и температурой Т и поддерживаются протекаю-
щими с одинаковой скоростью противоположными процессами. При анализе
сопутствующих им превращений, или переходов, обычно пользуются изобар-
но-изотермическим потенциалом Гиббса G:
G = U + pV- TS = H- TS,
где U - внутренняя энергия, V - объем, S - энтропия, Н - энтальпия (теплосо-
держание) системы. Для любого процесса
AG = АН - TAS.
Если он реализуется самопроизвольно, то AG < 0, а при равновесии - AG = 0.
Отсюда, в последнем случае
АН = TAS.
Образующаяся фаза отличается от исходной по своему строению. Часто ме-
няется и характер связи между частицами, хотя при рекристаллизации суще-
ствуют и исключения. AS - обычно величина отрицательная, следовательно,
такой же знак будет и у АН, что характерно для экзотермических случаев.
Изменение температуры и давления при обратимом процессе повлия-
ет на функцию G
dG = VdP - SdT + XjUidn,,
у которой pi - химический потенциал, а л, - содержание того или иного компо-
нента в системе, и отразится на ее внутренней энергии U:
dU = TdS- pdV + XjUidn,,
поскольку в ней меняется количество вещества с/л,.
Для изобарно-изотермического случая (pt=p2, Ti=T2) в однокомпонент-
ной системе при равновесии, когда химические потенциалы двух фаз одина-
ковы (Ар = pi - р2 = 0), молярные функции Гиббса (G? и G2) можно приравнять.
Следовательно, соотношение pi(p,~T) = р2(р:Т), или G, = G2, представляет со-
бой условие фазового равновесия. На этом основании
УДр-8ДТ= V2dp - S2dT,
т. е.
(VY - V2)dp = (St - S2)dT
и
dp _ AS
~dT~~SV’
§ SESA Lab., ISSP RAS
ast®issp.ac.ru
или
dp _ АН
~dT~7AV’
которое называется уравнением Клаузиуса-Клапейрона и широко применяет-
ся в термодинамических расчетах.
Из него определяют наклоны кривых сублимации, испарения и плав-
ления, т. е. в простейших ситуациях график равновесия можно построить на
основе этих данных. При возгонке они сильнее зависят от температуры, чем
при испарении, а еще это заметнее проявляется у кривой моновариантного
равновесия кристалл-расплав. Действительно,
AVucn ~ AVв03г — V'пара, АУПЛ« АУв03г(АУйен),
а
АНвозг АНПП + АНисп,
то есть
АН доза ** АНисп
И
АН’пл *'• АНисп(АНдоза).
Следовательно, при одной и той же температуре
dp} (dp} (dp 'i
dTL ИПвозг >[dT)ucn'
В бинарных и более сложных системах равновесное состояние зависит не
только от давления и температуры, но еще и от концентрации компонентов.
Таким образом, процессы, описываемые уравнением Клаузиуса-
Клапейрона, сопровождаются конечными изменениями объема AV, теплосо-
АН
держания, или скрытой теплоты превращения АН и энтропии (AS*-у-).
Иными словами, первые производные G, а именно
М =-3, М -V,
}dT)p (dp )т
а также
dG
Т
при фазовых переходах такого рода меняются скачкообразно (рис. 1.1а). Ана-
логично ведет себя молярная теплоемкость Ср (рис. 1.16).
SESA Lab., ISSP RAS
Рис. 1.1. Температурная зависимость энтальпии Н (а) и молярной теп-
лоемкости Ср (б) при фазовом переходе первого рода
Подобный характер переходов при постоянном давлении, а также не-
изменность температуры, объясняются принципом минимальности функции
Гиббса G (c/G = 0). Если Т < Тпп, то при заданном давлении Gme < G.s, а в слу-
чае Т > Тпл выполняется противоположное соотношение. При обратимом же
процессе, т. е. когда Gme = G«, устойчива та из фаз, у которой свободная энер-
гия меньше. Эти превращения, подчиняющиеся уравнению Клаузиуса-
Клапейрона, представляют собой фазовые переходы первого рода. Распро-
странёнными их примерами являются плавление и затвердевание, кипение и
конденсация, некоторые структурные изменения в твердых телах, а также
сублимация и десублимация.
Поскольку при равновесии свободные энергии единицы массы веще-
ства во всех состояниях должны быть одинаковыми, то в однокомпонентной
системе, согласно правилу фаз Гиббса, кристалл, жидкость и газ данного со-
става могут сосуществовать лишь при единственных значениях температуры
и давления - в тройной точке. У многих кристаллов давление паров в ней
очень мало и соответствующая температура по существу совпадает с точкой
их плавления при атмосферном давлении (у льда она отличается всего лишь
на 0,01°С).
В то же время, влияние давления на температуру превращения суще-
ственно для интерпретации процессов минералообразования. Оценивая ге-
незис минерала, следует учитывать значительные термобарические парамет-
ры в недрах Земли. Например, температура превращения кварца а-ф, кото-
рая при нормальном давлении составляет 573°С, смещается на несколько
сотен градусов при высоких его значениях.
В общем случае в трехмерных координатах G-T-p поверхности сво-
бодной энергии твердого тела, жидкости и газа (пара) совершенно независи-
мы друг от друга (рис. 1.2а). На практике удобно рассматривать не сами по-
верхности, а их сечения плоскостями постоянного давления или неизменной
10
температуры. Проекции линий пересечения этих поверхностей, например, при
р = const, имеют разный наклон (рис. 1.26), как и кривые сублимации, испаре-
ния и плавления, описываемые уравнением Клаузиуса-Клапейрона.
Рис. 1.2. G-T-p диаграмма (а) и зависимость условного энергетического со-
стояния G кристалла и его расплава от температуры Т при по-
стоянном давлении (б) (см. также Кубо, 1970)
Если линия пересечения для кристалла и его пара в пределах каких-то
температур расположена ниже соответствующей кривой, общей для поверх-
ностей свободных энергий твердого тела и жидкости, то в рассматриваемом
температурном интервале имеет место прямой переход его в газ, т. е. субли-
мация. Это объясняется относительно высокой свободной энергией жидкой
фазы, связанной с особенностями ее структуры.
С другой стороны, имеют место случаи, когда свободная энергия и эн-
тальпия характеризуются монотонной зависимостью от температуры (рис.
1.3а), тогда как скачкообразно меняются их вторые производные, например,
теплоемкость (рис. I.36):
сР
dH
dT
р
или
=_S
Up2 Л Т
Такие преобразования получили название фазовых переходов второго рода.
Их примерами являются переходы в точке Кюри из парамагнитного состояния
в ферромагнитное. Изменения не касаются расположения центров тяжести
атомов, а лишь "элементарных магнитов". К ним относятся также переходы
металлов и сплавов в состояние сверхпроводимости, переход жидкого гелия в
сверхтекучее состояние, застекловывание аморфных материалов и др.
11
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. 1.3. Изменение энтальпии Н (а) и молярной теплоемкости
Ср (б) при фазовом переходе второго рода
Распространенной иллюстрацией фазового перехода второго рода
служит изменение симметрии кристаллов титаната бария Е>аТЮ3, структура
которого выше 120°С реализуется в пространственной группе РтЗт. При ох-
лаждении ионы титана непрерывно перемещаются от одного кислородного
иона к другому, так что усредненные по времени их положения совпадают с
центром элементарной ячейки. Ниже 120°С энергия теплового движения не-
достаточна для их "переброса" из одного равновесного состояния в другое.
Из-за этого они локализованы вблизи отдельных окружающих их ионов ки-
слорода, смещаясь примерно на 0,1 А относительно своего анионного окру-
жения в направлении одной из вершин октаэдра. При согласованном их сме-
щении во всех октаэдрах ТЮ6, кубическая симметрия в расположении заря-
женных частиц нарушается, и элементарная ячейка вытягивается по направ-
лению оси четвертого порядка. В силу анизотропии, параметры его элемен-
тарной ячейки меняются с разной интенсивностью, в результате чего структу-
ра монотонно перестраивается из кубической (с/а = 1) (рис 1.4а) в тетраго-
нальную (с/а > 1) (рис. I.46). Такого типа переходы еще называют "переходами
смещения", в противовес фазовым переходам "порядок-беспорядок”, харак-
терным, например, для сплава CuZn.
Таким образом, при любом незначительном изменении структуры при
фазовом переходе второго рода скачкообразно меняется симметрия кристал-
лического вещества. Более симметричную модификацию условно называют
симметричной, а вторую диссимметричной. При низких температурах обыч-
но преобладают менее симметричные, но упорядоченные модификации, а
при высоких - более симметричные, разупорядоченные. В то же время при-
мером отклонения от этого правила является сегнетова соль. Поскольку сим-
метричная форма может превращаться в диссимметричную по разному, то
для удобства рассмотрения таких процессов кристалл принято "разбивать" на
ряд участков - доменов, в каждом из которых переход реализуется однотип-
но. Разбиение на домены кристалла титаната бария при фазовом переходе
второго рода, когда четыре типа доменов преобразуются друг в друга при по-
следовательном повороте на 90°, показано на рис. I.5(a-a).
SESA Lab., ISSP RAS
ast@issp.ac.ru
12
• Ba @ О • Ti
а б
Рис. 1.4. Изменение симметрии кристаллов ВаТЮз при нагревании
°©0©0©0©0®0©0
°®0®0©0©0®0©0
°©0©0©0©0©0©0
О^О^О^О^О^О^О
© © © © © ©
О^.О^.О^О^О_.ОЛО
© © © © © ©
ОлОлО^О~ОлОл~О
©©©©©©
о о о о о о о
а
Рис. 1.5.
О О О О О О О
© © © ® @ ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
б
о о о о о о о
oWoWo
oVoVoVo
oWoWo
oWoWo
0©0©0©0©0©0©0
oWoWo
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
@ © © © © ©
о о о о о о о
© © © © © ©
о о о о о о о
Схема преобразования доменов при фазовом переходе второго рода
в титанате бария (по данным Сиротина и Шаскольской, 1979)
в
г
В настоящее время рассматриваются также системы, характеризую-
щиеся фазовыми переходами третьего или более высоких порядков, где все
частные производные свободной энергии вплоть до л-1 порядка непрерывны,
а претерпевает разрыв лишь л-я производная. В таких ситуациях говорят о
фазовых преобразованиях л-го порядка.
Фазовый переход всегда осуществляется с конечной скоростью. Для
того, чтобы он не прекращался, требуется непрерывно отводить (подводить)
тепло, или компенсировать работой, совершаемой над системой, до полного
его завершения. Учитывая характер упорядочения вещества в различных фа-
зах, рассматривать этот процесс целесообразно с позиций статистической
механики, принимая во внимание кинетические особенности массопереноса.
13
SESA Lab., ISSP RAS
ast@issp.ac.ru
ПОВЕРХНОСТНАЯ ЭНЕРГИЯ
Со структурных позиций фазовый переход первого рода от превраще-
ний более высоких порядков отличается тем, что необходимым его условием
является формирование в первоначально гомогенной среде поверхности раз-
дела между исходной фазой и новой, в результате чего система превращает-
ся в гетерогенную, которая на рис. 1.6 для случая газ-жидкость ограничена
пунктирной кривой аа'а"Кб"б'б. Приведенная схема распространяется и на об-
разование кристаллических зародышей в исходной гомогенной жидкости.
Следовательно, кристаллизация слагается из двух основных актов: 1) зарож-
дения новой фазы и 2) роста кристалла.
V
Рис. 1.6. Превращение газа в пар с из-
менением температуры
Поскольку возникновение новой фазы в гомогенной системе сопряже-
но с изменением структуры и состава первичной среды, то в частном случае
однокомпонентной системы оно априори сопровождается лишь структурными
перестройками. Например, при рекристаллизации один тип модификации
меняется на другой, а переход жидкости в кристаллическое состояние связан
с установлением дальнего порядка в расположении частиц, которого не было
в исходной системе. Такая же ситуация имеет место и при кристаллизации из
собственного пара, хотя процесс связан с более радикальными трансформа-
циями. В сложных системах, где и состав новообразованной фазы отличается
от материнского, энергетическое состояние одной и той же частицы будет со-
вершенно иным.
SESA Lab., ISSP RAS
ast©issp.ac.ru
14
Таким образом, в результате этих преобразований возникает пере-
ходный слой, отделяющий первоначально гомогенную среду от зародыша но-
вой фазы. Вещество по разные стороны этой границы имеет различную
структуру, а часто - и разный состав. Вполне естественно, что при такой ре-
конструкции, сопровождающейся разрывом или деформацией существующих
связей и образованием новых, а также с перераспределением состава, тре-
буется совершить определенную работу, которая получила название поверх-
ностной энергии. Надо заметить, что она является результирующей взаимо-
действия между частицами, оказавшимися на границе сосуществующих фаз,
и определяет работу, затрачиваемую на образование этой границы в конкрет-
ных условиях. Минимальная ее величина, достаточная для создания единицы
такой поверхности при постоянном объеме и температуре, называется удель-
ной свободной поверхностной энергией. Она обычно обозначается через о,
или иногда через а применительно к кристаллам, чтобы не отождествлять ее
с поверхностным натяжением, когда речь идет о границе раздела жидкость-
жидкость.
При оценке поверхностной энергии между рассматриваемыми двумя
фазами исходят из ее значений на границе каждой из них с вакуумом (обычно
при Т = О К) и сравнивают для конкретного случая (рис. 1.7). В самом общем
виде максимальная энергия границы кристалл-вакуум при О К приближенно
равна полусумме работы разрыва всех связей между атомами, образующими
рассматриваемую поверхность при делении на две части исходной системы
(среды).
Рис. 1.7. Ненасыщенные связи на атомно гладкой плотно
упакованной поверхности кристалла на границе
с вакуумом (по данным Чалмерса, 1968)
Действительно, при таком условном сечении кристалла получаются
две равноценные поверхности, для которых В. Коссель (1927) ввел понятие о
полукристалле. Сила взаимодействия частицы с образовавшейся поверхно-
стью будет равна половине сил, уравновешивающих ее внутри кристалла.
Для гомеополярного кристалла с простой кубической решеткой, или кристал-
ла Косселя (рис. I.8, 1) - это грань октаэдра. Максимальное число связей у
любой из частиц, составляющих такую плоскость, будет три, в то время как в
объеме кристалла Косселя - шесть.
15
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. 1.8. Кристалл Косселя: 1 - общий вид; 2 - порядок координацион-
ных сфер (КС); а - центральный атом, б - атомы КС1, в -
атомы КС2; г - атомы КСЗ
Энергию связи, а значит и поверхностную энергию границ кристалл-
вакуум и кристалл-расплав можно оценить по теплоте испарения кристалла и
по скрытой теплоте его плавления, соответственно. Поскольку избыток энер-
гии поверхностной частицы пропорционален числу не скомпенсированных
связей, то, например, для гранецентрированной кубической решетки (коорди-
национное число атомов в структуре равно 12), характерной для многих ме-
таллов, энергия связи частицы с шестью соседями превышает ее энергию
внутри кристалла на половину теплоты испарения (-20-60 ккал/моль). У моле-
кулярных же кристаллов теплоты испарения составляют 10-20 ккал/моль,
межмолекулярные расстояния в 2-3 раза больше, а их поверхностные энергии
меньше на полтора-два порядка.
При вычислении поверхностной энергии ионных кристаллов, в силу
дальнодействующего кулоновского взаимодействия, предполагается сумми-
рование по большому числу соседей. Расчеты Хонигмана для грани (100)
простой кубической решетки, узлы которой заняты ионами с зарядом ± Ze,
приводят к значениям поверхностной энергии 0,0326 (Ze)2/a3, где е - 4,8-10’10
CGSE - заряд электрона и а - расстояние между ближайшими ионами разных
знаков по направлениям [100] (Хонигман, 1961).
Основной вклад в величину этой энергии вносят не скомпенсирован-
ные в силу поверхностных ограничений самые сильные связи между ближай-
шими атомами (ионами, молекулами), потенциальные возможности которых
полностью реализуются только в объеме кристалла. Оценить значения по-
верхностной энергии для разных граней наглядно можно на модели Косселя,
принимая во внимание взаимодействие произвольно выбранного "централь-
ного" атома с соседями первой, второй, третьей и последующих координаци-
онных сфер, которые, конечно, будут корректировать общую картину энерге-
16
SESA Lab., ISSP RAS
ast@issp.ac.ru
тического баланса (рис 1.8, 2). Например, в таком кристалле каждый атом в
его объеме взаимодействует с 6-ю ближайшими соседями (КС1), а также с 12-
ю и 8-ю соседями второго (КС2) и третьего (КСЗ) порядков, соответственно. В
поверхностном же слое грани (100) он имеет лишь 5 соседей из КС1, 8 - из
КС2 и 4 - из КСЗ. В результате, ненасыщенными (разорванными) в расчете на
каждый атом для грани куба оказываются следующие связи: 1 КС1 + 4 КС2 + 4
КСЗ. Для граней ромбододекаэдра и октаэдра ненасыщенных связей будет
больше, а именно: (110) - 2 КС1 +7 КС2 + 6 КСЗ; (111) - 3 КС1 + 9 КС2 + 7
КСЗ. Чем больше число нескомпенсированных связей, условно пересекающих
плоскость грани, тем больше ее поверхностная энергия.
Кристаллохимическую трактовку термодинамическому подходу дает
концепция Хартмана, согласно которой в каждой кристаллической структуре
можно выделить направления наиболее прочных связей - ПЦС-векторы (пе-
риодические цепочки связей, или periodic bond chain - РВС). Грани, парал-
лельные максимальному числу систем самых сильных связей из всех харак-
терных для данного кристалла ПЦС, имеют минимальную поверхностную
энергию. У рассматриваемого кристалла Косселя таковыми являются грани
куба {100}. Каждой из этих плоскостей принадлежат по две из трех систем
ПЦС-векторов. Например, для грани (100) - это цепочки, параллельные реб-
рам [010] и [001] (рис. I.9). Третья же система ПЦС с направлением [100] в
этом случае обрывается на границе плоскости (100) с окружающей средой. В
итоге создается избыточная поверхностная энергия.
Для большей корректности, как уже отмечалось, необходимо учиты-
вать взаимодействия и с более удаленными соседями, по крайней мере, с
SESA Lab., ISSP RAS
17
ПЦС2 и ПЦСЗ. Тогда гранью (100) будут отсекаться 4 системы из шести ПЦС2
и все 4 ПЦСЗ. Тем не менее, при грубых оценках поверхностной энергии го-
меополярных кристаллов останавливаются на первых членах этой бесконеч-
ной суммы, поскольку сила связи между частицами убывает обратно пропор-
ционально 7-й степени расстояния.
На границе кристалла с жидкостью или другой твердой фазой поверх-
ностная энергия значительно меньше, чем при контакте с газом из-за боль-
шей насыщенности связей поверхностных атомов кристалла (рис. 1.10).
’а’ ж’а’а’ГГ
• у> у» у» уе у* у# у» уф уе уф уе уф. у# уф
Рис. 1.10. Схема границы раздела между кристаллом и жидкостью
(по данным Чалмерса, 1968)
Однако даже для раздела кристалл-вакуум при близкой к абсолютно-
му нулю температуре она все же будет несколько ниже общей работы разрыва
связей, затрачиваемой на образование свободной поверхности. На самом де-
ле, после разрыва связей атомы в приповерхностных слоях будут перегруппи-
ровываться и при релаксации поверхностная энергия слегка уменьшится.
Следует заметить, что точных расчетов и надежных эксперименталь-
ных методов определения поверхностной энергии пока не существует. Из-
вестны лишь приближенные оценки для простейших моделей типа кристалла
Косселя. Трудоемкой методической и теоретической проработки требует ана-
лиз поверхностной энергии граней даже со сравнительно простыми индекса-
ми у кристаллов бинарных и тройных соединений. При разрыве связей между
разнородными атомами неоднозначно отнесение их к той или иной из обра-
зующихся поверхностей.
ДВИЖУЩАЯ СИЛА КРИСТАЛЛИЗАЦИИ
Поскольку процессы кристаллизации представляют собой преобразо-
вание газа (пара), жидкости или какого-то твердого вещества в кристалличе-
скую форму, энергетически более стабильную при заданных условиях, то они
18
SESA Lab., ISSP RAS
ast®issp.ac.ru
всегда имеют общие черты, несмотря на их специфику в конкретной обста-
новке. Равенство химических потенциалов кристалла и кристаллизацион-
ной среды цс, как термодинамической функции, характеризующей равновес-
ное состояние однокомпонентной системы при определенных температурах Т
и давлениях Р, можно записать в виде:
Ас(Р,Г) = АСР-Л-
Для двойных и более сложных систем добавляются еще и концентрации ком-
понентов. В частности, для бинарного случая A-В можно записать систему
уравнений:
pAk(PJ,XAk) = рАж(Р,Т,ХАж)
Рвк(Р ,Т,Хвк) = АВж(Р,Т,Хвж).
Если один из компонентов, например В, практически не присутствует в
твердой фазе, т. е. ХВк = 0, то эту физико-химическую систему можно предста-
вить в виде диаграммы растворимости "кристалл-раствор". Тогда из двух со-
отношений при неизменном давлении останется одно, в котором концентра-
цию растворенного вещества обычно обозначают через С:
//ж(Т,С)=а(Т,С).
За пределами кривых равновесия равенство химических потенциалов
частиц в кристалле и исходной системе нарушается:
А//= U,~Llk-
Условие Л// > 0, когда возможно зарождение и рост кристаллической фазы,
получило название движущей силы кристаллизации (д.с.к.) - меры отклоне-
ния среды от равновесия.
Однако пока не существует прибора, которым можно было бы опреде-
лять химические потенциалы, аналогично, например, измерению температур
- термометром или давления - манометром. Поэтому на практике удобнее
иметь дело с такими параметрами как давление, температура и концентра-
ция, функционально связанных с разностью химических потенциалов в близ-
ких к равновесным условиях. Так, для разбавленных растворов справедливо
выражение
А// = Ас - А = «Пт С - In Со> RT 1пИ =
О 7
fC-C0+CJ (АС
= RT In ---5---А \ = RT In -+1 ,
I J I J
где R - универсальная газовая постоянная, С - концентрация раствора в объ-
еме, а Со- равновесная концентрация на поверхности раздела фаз. При этом
надо иметь в виду, что при больших значениях Аа эта зависимость соблюда-
ется в меньшей степени.
19
SESA Lab., ISSP RAS
ast@issp.ac.ru
По аналогии с тем, что логарифмическая функция типа 1п(1+х) стре-
мится к х при х 0, здесь для разбавленных растворов (С -> 0), когда ДС/С0
« 1, выражение для А// принимает вид:
A/z«RT—.
Со
Подобные рассуждения справедливы и для идеального газа, если вместо
концентрации С использовать давление пара Р:
Ap^RT — .
Р
~0
Переходя от АР к АТ и принимая во внимание уравнение Клаузиуса-
АР АН
Клапейрона -~ = ^^AV, в котором А/7 - скрытая теплота фазового перехо-
да, AV - изменение объема при фазовом превращении, а также привлекая
уравнение состояния идеального газа PV=RT, можно проиллюстрировать за-
висимость А// от переохлаждения расплава:
А// = АН^-.
То
Это применимо к однокомпонентным системам кристалл-расплав при не-
больших отклонениях от равновесия.
Таким образом, в рассмотренном приближении движущей силой кри-
сталлизации может быть пересыщение и переохлаждение исходной среды.
Значения АС = С - Со, АР = Р - Ро и АТ = Т - То, где Со и Ро - соответственно
равновесная концентрация раствора и давление насыщенного пара при дан-
ной температуре, а То - температура плавления, называются абсолютным
пересыщением - АС или АР и абсолютным переохлаждением - АТ. Отклоне-
ние систем от равновесия часто описывают в виде безразмерных величин:
А&С0 и АР/Р0 (относительные пересыщения), АТ/Т0 (относительное пере-
охлаждение), а также С/Со и Р/Ро (коэффициенты пересыщения) и Т/То (ко-
эффициент переохлаждения).
Тем не менее, не всякое отклонение от равновесия спровоцирует кри-
сталлизацию. Минимально необходимая для этого величина Ар (АТ, АС или
АР) зависит от природы вещества и внешних факторов.
20
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАРОЖДЕНИЕ КРИСТАЛЛОВ В ГОМОГЕННЫХ СРЕДАХ
УРАВНЕНИЕ ТОМСОНА-ГИББСА
Одной из наглядных "изотропных" моделей фазообразования в гомо-
генной системе может служить взаимоотношение капли жидкости с окружаю-
щим ее паром аналогичного состава. В равновесных условиях для сфериче-
ских поверхностей раздела фаз, т. е. жидких капель с радиусом г, каждая их
них окружена собственным паром с давлением рг. В случае двух шарообраз-
ных капель с г( и г2 при переносе части жидкости dm из первой во вторую в
результате обратимого изотермического испарения при давлении рг1 и обра-
тимого сжатия от рГ1 до рг2, а также дальнейшей обратимо изотермической
конденсации при рг2 совершается работа:
dA, = —RT In
М рг2
где М - масса грамм-молекулы, R - универсальная газовая постоянная, а 7-
температура в градусах Кельвина. Ее суммарное значение тождественно ра-
боте сжатия пара, поскольку величины испарения и конденсации в этих усло-
виях равны, но различаются по знаку. При противоположном процессе спра-
ведливо соотношение
dA2 = - dA-i.
В итоге переноса даже малого количества вещества dm геометрические ха-
рактеристики капли - радиус и объем - возрастут соответственно на dr и dV:
dV = 4 л- fdr,
откуда
, dV dm
dr =---5- =---,
4лг 4лг p
где m - масса капли, ар- плотность жидкости. Поменяется и площадь S по-
верхности капли
, 2dm
dS = Qnrdr = --,
pr
что требует энергетических затрат на работу против сил поверхностного на-
тяжения о при увеличении поверхности.
Если размер второй капли очень мал по сравнению с первой (г7 » г2),
то добавление или изъятие одинакового количества частиц будет по разному
сказываться на относительном изменении площади их поверхностей. В пер-
вом случае оно незначительно, а во втором - весьма ощутимо. Поэтому ве-
личина dA2 становится практически сопоставимой с изменением ее поверхно-
стной энергии:
SESA Lab., ISSP RAS
ast@issp.ac.ru
21
о dm I 1 1 ''l
dA2 = odS = 2<t--------.
P V2 rj
Следовательно,
dA=^Rrin£i = -2aMl-J.'|,
M P,i P Vt 6)
ИЛИ
, pr1 2oM ( 1 1
pr2 pRT\r2 rj
После замены pri и pr2 на рГа° и рг, т. е. давления насыщенных паров над бес-
конечно большой каплей (в пределе - плоской поверхностью) и каплей конеч-
ных размеров, соответственно, получается выражение:
|п рг _2оМ _ 2оУ0
pra, rpRT rRT ’
в котором Уо- объем одной грамм-молекулы.
„ . р. 2oV0 _ ...
Соотношение Inизвестно как уравнение Томсона (Кельви-
на)-Гиббса. Оно свидетельствует о различии давлений насыщенного пара
вблизи искривленной и плоской поверхностей. В него входят кривизна по-
верхности (1/г) и поверхностная энергия о, из чего следует, что, чем больше
кривизна, тем больше относительная разница давлений пара. Возрастает она
так же при увеличении о. Поскольку выпуклая поверхность имеет положи-
тельную кривизну (знак "+"), а вогнутая - отрицательную (знак то это зна-
чит, что над выпуклой поверхностью давление пара больше, чем над плоской,
над вогнутой же - меньше. По аналогии, эти рассуждения можно распростра-
нить и на кристалл, находящийся в растворе. Уравнение Томсона-Гиббса бу-
дет характеризовать изменение растворимости вблизи искривленной границы
раздела фаз. При этом не надо забывать, что такое обобщение в анизотроп-
ном случае не всегда правомерно, тем более при заметном отклонении сис-
темы от равновесия.
Из графического представления этого уравнения видно (рис. 1.11), что
при увеличении в произвольно выбранном микрообъеме давления с рг1 до рг1'
радиус новой фазы уменьшается с величины г7 до г/. Такой скачок давления
будет компенсироваться его уменьшением с рг1 до pri" в соседнем микрообъ-
еме и поощрять рост другого зародыша (/у —> г-,"). Следовательно, это своего
рода подтверждение возможности увеличения крупных зародышей за счет
более мелких.
22
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. 1.11. Корреляция между равновесным дав-
лением рг и радиусом г новой фазы
РАБОТА И СКОРОСТЬ ЗАРОДЫШЕОБРАЗОВАНИЯ
Стартовое значение движущей силы, необходимой для формирования
минимального количества новой кристаллической фазы, способной к после-
дующему росту, можно трактовать как свободную энергию AG, или другими
словами - работу зародышеобразования. Ее легко найти из анализа работы
As, производимой для создания поверхности S:
As = crS,
где ст - удельная поверхностная энергия, или удельная свободная энергия
межфазной поверхности, и работы AGV, связанной с изменением объема за-
родыша V и свободной объемной энергии Agv при фазовом переходе - AGV =
VAgv. Первая из них всегда является положительной величиной, так как про-
тиводействует процессу фазового перехода, увеличивая энергию системы в
целом. Другая составляющая общей энергии касается эволюции объема за-
родыша, размеры которого при конденсации увеличиваются. Следовательно,
энергия AGV отрицательна, поскольку характеризует самопроизвольно проте-
кающий процесс. Таким образом, работа образования зародыша будет равна
алгебраической сумме этих величин:
AG = As — AGV.
В результате, в простом изотропном приближении энергия зародыше-
образования в гомогенной системе на примере конденсации из пара капли
жидкости с радиусом г может быть представлена в следующем виде:
23
SESA Lab., ISSP RAS
ast@issp.ac.ru
AG30M = As- AGV = oS - VAgv = oAxi2 - Agv--
(D
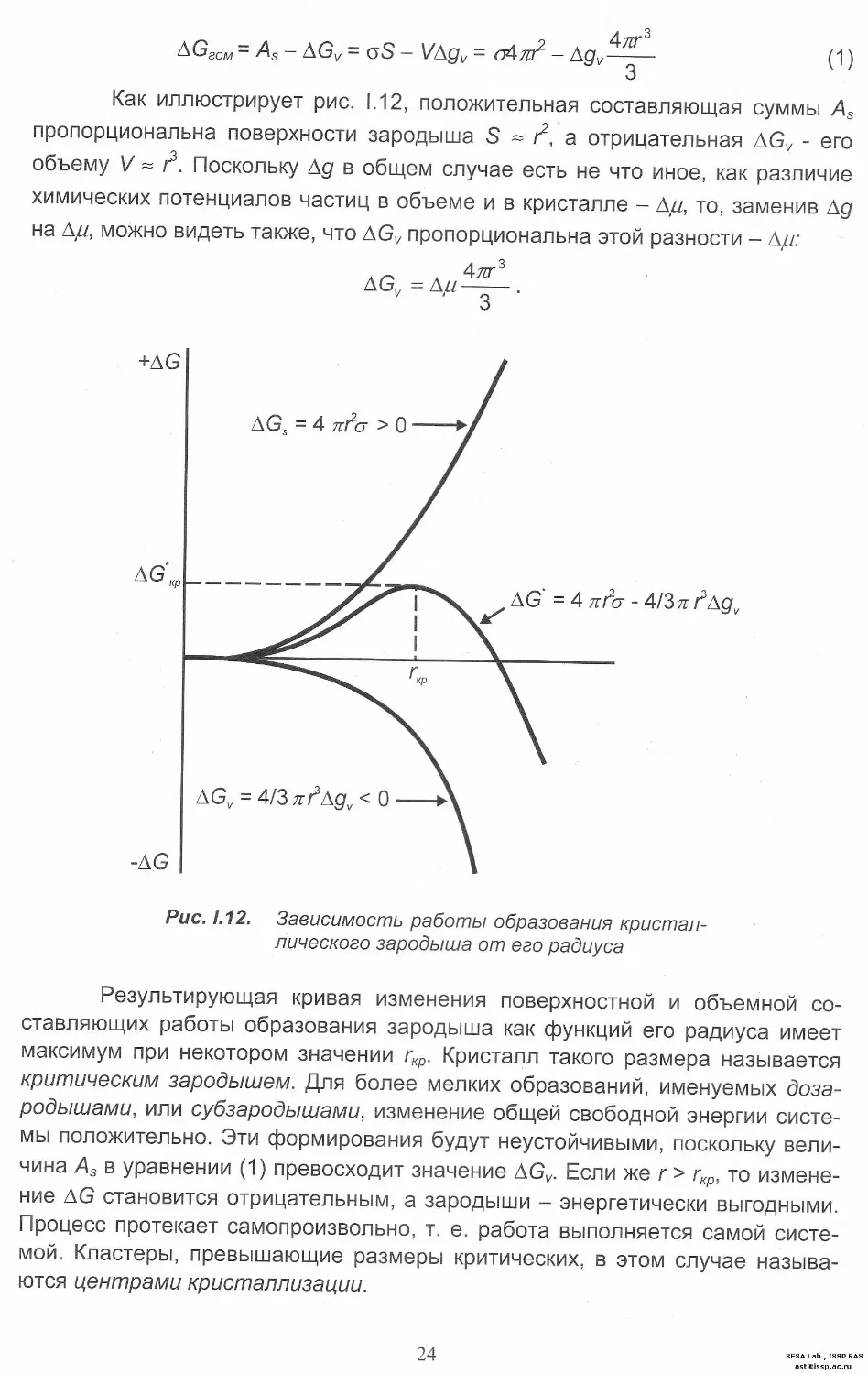
Как иллюстрирует рис. 1.12, положительная составляющая суммы As
пропорциональна поверхности зародыша S ~ г2, а отрицательная AGV - его
объему V = I2. Поскольку Ад в общем случае есть не что иное, как различие
химических потенциалов частиц в объеме и в кристалле - А//, то, заменив Ад
на Ад, можно видеть также, что AGV пропорциональна этой разности - Ад:
Рис. 1.12. Зависимость работы образования кристал-
лического зародыша от его радиуса
Результирующая кривая изменения поверхностной и объемной со-
ставляющих работы образования зародыша как функций его радиуса имеет
максимум при некотором значении гкр. Кристалл такого размера называется
критическим зародышем. Для более мелких образований, именуемых доза-
родышами, или субзародышами, изменение общей свободной энергии систе-
мы положительно. Эти формирования будут неустойчивыми, поскольку вели-
чина As в уравнении (1) превосходит значение AGV. Если же г > гкр, то измене-
ние AG становится отрицательным, а зародыши - энергетически выгодными.
Процесс протекает самопроизвольно, т. е. работа выполняется самой систе-
мой. Кластеры, превышающие размеры критических, в этом случае называ-
ются центрами кристаллизации.
24
SESA Lab., ISSP RAS
ast@issp.ac.ru
Работу образования критического зародыша можно найти из условия:
d^Gidr = 0. После подстановки Agv = 2о/гкр в выражение (1) (см. стр. 23) оно
примет вид:
. _ 4лг2сг aS
A(j =-----=----.
3 3
Следовательно, энергия формирования зародыша составляет третью часть
работы, затраченной на создание его поверхности, а само выражение извест-
но как формула Гиббса.
Также можно рассчитать значение гкр:
2V0cr 2оМ
Гкр Л// Д//р ’
где Vo- мольный объем , М- молекулярный вес, р- плотность зародыша.
Условие его равновесия со средой определяется равенством:
Гкр
Таким образом, размер критического зародыша тем меньше, чем
больше отклонение системы от равновесия (рис. 1.13).
AG
Рис. 1.13. Зависимость размера критического зародыша г и работы его
образования AG от величины движущей силы кристаллизации Ар
25
SESA Lab., ISSP RAS
ast@issp.ac.ru
На основе расчетов гкр оценивается на уровне 10-100 А. Например,
для никеля, свинца и ртути при переохлаждениях 300-500, 80 и 51-79°С раз-
меры зародышей составляют 6, 18 и 13 А соответственно. Следовательно,
это будут первые сотни атомов в каждом из них.
Изменение свободной энергии, связанное с образованием критическо-
го зародыша, представляет собой энергию активации зарождения, величину
которой можно найти, подставляя значения гкр в уравнение (1) на стр. 23:
3(М)2
Это позволяет сделать некоторые выводы, касающиеся зародышеобразова-
ния в различных условиях. Например, во-первых, аргументировать невозмож-
ность кристаллизации в равновесных условиях тем, что при Ад 0 значение
AG будет бесконечно большим. Во-вторых, принимая во внимание, что энер-
гия границы раздела кристалла с паром существенно превышает соответст-
вующую величину в случае раствора, и тем более - расплава, то и энергия
активации для зарождения кристаллов будет возрастать (кубическая зависи-
мость!) при переходе от расплава к раствору, и далее - к пару. В-третьих, это
выражение объясняет и отсутствие энергетического барьера при фазовом
переходе II рода, поскольку отсутствуют поверхности раздела (сг = 0, следова-
тельно, и AG = 0).
Скорость зародышеобразования определяется числом частиц новой
фазы, появляющихся в единицу времени в единице объема. Вероятность та-
кого события пропорциональна exp(-AG/RT), и уравнение скорости возникно-
вения зародышей имеет вид:
/ = Дехр^-^, (2)
где AG - работа формирования зародыша, R - универсальная газовая посто-
янная, Т - температура, а А - предэкспоненциальный множитель, зависящий
от свойств исходной среды, площади зародыша, интенсивности доставки
осаждающихся частиц на нем, а также от коэффициента их конденсации.
Уравнение предполагает, что в любой момент в результате флуктуа-
ций достигается равновесное распределение дозародышей по размерам.
Часть самых крупных индивидов превращается в зародыши и центры кри-
сталлизации. В то же время применение этого уравнения к зарождению кри-
сталлов в жидкостях имеет определенные ограничения, где из-за сравнитель-
но низкой подвижности атомов равновесное их распределение устанавлива-
ется гораздо медленнее.
Поскольку соотношение 2 (см. выше) для кинетики зародышеобразо-
вания идентично хорошо известному уравнению Аррениуса, характеризую-
щему зависимость константы скорости химической реакции к от абсолютной
температуры Т и энергии ее активации ЕА, т. е.
26
SESA Lab., ISSP RAS
ast@issp.ac.ru
к = A exp
RT ) ’
то энергия активации зарождения новой фазы оценивается графически ана-
логичным образом в достаточно наглядной форме. После логарифмирования
этого выражения можно построить график в координатах Ink - 1/7", и при вы-
полнении условий уравнения Аррениуса, получается прямая линия (рис. 1.14).
Рис. 1.14. Зависимость логарифма константы
скорости реакции Ink от обратной
температуры VT
Тангенс угла наклона этой прямой tgcr, очевидно, равен значению
AEa/R, а отрезок, отсекаемый ею на оси ординат - величине Ink. Константы
скоростей к находят экспериментально при разных температурах. Уравнение
Аррениуса в приведенной выше форме вполне приемлемо характеризует эту
зависимость в тех случаях, когда температурный интервал измерений состав-
ляет несколько десятков градусов.
ГЕОМЕТРИЧЕСКАЯ МОДЕЛЬ НУКЛЕАЦИИ
Физический смысл критического зародыша рельефно вырисовывается
при сравнительном моделировании идеализированных процессов формиро-
вания жидкости и кристалла из шарообразных частиц, особенно когда его
размер не превышает 2-4-х координационных сфер. В свое время еще Гиббс
не выражал особого оптимизма относительно возможности распространения
его макроскопической теории на микроскопические образования, подчерки-
вая, что она применима для зародышей "ощутимых размеров". Действитель-
но, когда эти кластеры содержат лишь до 5-6 частиц, т.е. практически все
27
SESA Lab., ISSP RAS
атомы и молекулы являются поверхностными, то уже по этой причине теряют
смысл рассуждения о соотношении объемной и поверхностной составляющих
в работе зародышеобразования. Ниже рассматриваются два варианта после-
довательного присоединения частиц друг к другу, причем таким образом, что-
бы в одном случае можно было бы в перспективе получить зародыш кристал-
лической структуры, а в другом - жидкости.
Эволюция объединения сферических частиц в жидкость, состоящую
из одного типа атомов, на самом раннем этапе не будет отличаться от про-
цесса формирования из них кристаллической фазы (рис. 1.15). Основным ус-
ловием является образование наиболее энергетически выгодного агрегата
жидкости и кристалла, т. е. чтобы атомы стремились к самому компактному
расположению. Поэтому каждый последовательно присоединяющийся атом
должен реализовать максимальное число связей в рамках геометрических
правил для жидкости и кристалла. В качестве "энергетического" критерия для
зародыша можно использовать следующий схематический подход: число свя-
зей и энергия взаимодействия определяется количеством точек касания ша-
ров (условных атомов) с соседями. Постройка будет тем прочнее, чем больше
среднее число "связей" (контактов) приходится на каждый ее "атом".
Рис. 1.15. Шариковая модель эволюции жидкого (а) и кристаллического (б)
зародышей (по данным Штернберга, 1965)
Соединение двух атомов всегда возможно только в виде гантели, а
энергетически выгодный тример будет представлять собой треугольник, в ко-
тором на любой атом приходится по две связи. Поэтому с этой точки зрения
он энергетически выгоднее гантели или цепочки из трех атомов. Присоедине-
ние четвертого атома превращает треугольник в тетраэдр, где каждая части-
ца имеет по три контакта. Следующей фигурой по плотности (и энергетике)
является сдвоенный тетраэдр. У трех его атомов возможно по четыре точки
соприкосновения и у двух - по три, т. е. в среднем на атом получается по 3,6
связей. Однако эта конструкция содержит в себе две соединенные плоско-
стью симметрии тетраэдрические пустоты, что допустимо для жидкости, но
исключает возможность дальнейшего развития зародыша в кристаллическую
упаковку, подчиняющуюся законам симметрии.
28
SESA Lab., ISSP RAS
ast@issp.ac.ru
Шестой атом у жидкости равновероятно может присоединяться к лю-
бой грани сдвоенного тетраэдра, преобразуя последний в незамкнутое коль-
цо, которое по тем же энергетическим причинам, скорее всего, замкнет седь-
мой атом, поскольку он немедленно приобретает четверых соседей. Однако
надо заметить, чтобы центральные атомы подобной группировки соприкаса-
лись друг с другом, все семь сфер необходимо слегка деформировать. Это
вполне реально, потому что на самом деле идеализированные строго сфери-
ческие частицы не очень правдоподобны. Поверхности такой пентагональной
дипирамиды содержат десять треугольных углублений. Добавление к любому
из них одного атома создает предпочтительные места для последовательного
присоединения еще пяти атомов - второго пятиугольного кольца. Возникает
икосаэдр с десятью осями симметрии пятого порядка. В силу небольшого
"сжатия" центрального атома диаметр этой конструкции без октаэдрических
пустот немного меньше утроенного размера каждого атома. Это некристалли-
ческое образование значительно компактнее тех же размеров фрагмента гек-
сагональной или кубической плотнейшей упаковки. Среднее количество свя-
зей на один атом составляет в нем 6,4. Дальнейшее прикрепление по тому же
принципу к икосаэдру атомов ведет к образованию более рыхлого слоя, проч-
ность фигуры понижается. Среднее число связей на атом сокращается до
6,28 для постройки из 21 атомов, т. е. она становится энергетически не вы-
годной.
С другой стороны, геометрическая модель показывает, что присоеди-
нение каждого очередного атома при построении кристаллической структуры
ведет к непрерывному росту среднего количества связей на один атом. Нако-
нец, с добавлением двадцать первого атома, когда среднее число связей на
атом достигает 6,28, он будет более стабильным по сравнению с любым не-
кристаллическим образованием того же размера (табл. 1, рис. 1.15 и 1.16).
Следовательно, жертвуя на первом этапе некоторой энергетической целесо-
образностью, кристаллический зародыш становится вполне жизнеспособным
в дальнейшем. Безусловно, большую роль сыграет природа объединяющихся
атомов и молекул, характер образующихся связей, тип структуры. Тем не ме-
нее, этот упрощенный подход также предостерегает от формального распро-
странения феноменологической теории Гиббса на субмикроскопические заро-
дыши, максимальный размер которых ограничивается двумя-четырьмя коор-
динационными сферами. На самом деле, начальные стадии в таблице 1 и со-
ответствуют особому случаю соотношения объемной и поверхностной энер-
гий при образовании зародышей. Именно на этом отрезке, все частицы, со-
ставляющие зародыш, являются поверхностными, с тем или иным количест-
вом ненасыщенных связей. Затем постепенно происходит их дифференциа-
ция на объемные (с насыщенными связями) и поверхностные (с нескомпенси-
рованной энергией).
29
SESA Lab., ISSP RAS
ast@issp.ac.ru
Можно полагать, что геометрическая модель, учитывающая лишь пер-
вую координационную сферу, с известной осторожностью может быть приме-
нима, например, к кристаллизации инертных газов и даже металлов. Вероят-
но, тот минимальный размер кристаллического зародыша, который становит-
ся энергетически выгоднее такого же по числу атомов "жидкого" некристалли-
ческого образования, и является предельным для этих веществ, поддающий-
ся термодинамическому описанию, когда речь идет о значительных отклоне-
ниях системы от равновесия.
Таблица 1. Прочность групп из небольшого числа атомов (среднее количест-
во связей, скрепляющих каждый из атомов с группой в целом)
Число атомов в груп- пе Плотнейшие некристалли- ческие группировки Плотнейшие кристалли- ческие упаковки
общее число свя- зей среднее число связей на один атом общее число связей среднее число связей на один атом
2 2 1 2 1
3 6 2 6 2
4 12 3 12 3
5 18 3,6 16 3,2
6 24 4 22 3,67
7 32 4,55 28 4
8 38 4,75 34 4,25
9 46 5,11 40 4,44
10 54 5,4 48 4,5
11 62 5,66 54 4,91
12 72 6 62 5,17
13 84 6,46 72 5,54
15 96 6,4 88 5,73
17 108 6,35 102 6
19 120 6,31 116 6,1
21 132 6,28 132 6,28
23 144 6,26 152 6,61
25 156 6,24 170 6,8
27 168 6,72 184 6,81
29 180 6,2 198 6,83
31 192 6,19 216 6,97
33 204 6,18 236 7,15
SESA Lab., ISSP RAS
ast@issp.ac.ru
30
Рис. 1.16. Зависимость среднего числа связей на один атом (пср) в
"жидкой" и кристаллической плотнейшей упаковке, т. е. ее
прочности, от общего числа атомов (Л/) в "зародыше"
ПРЕДЕЛЫ МЕТАСТАБИЛЬНОСТИ КРИСТАЛЛИЗАЦИОННОЙ СРЕДЫ
Приведенные выше рассуждения объясняют, почему пересечение на
фазовых диаграммах сплошных линий сосуществования фаз (рис. 1.17), явля-
ется, хотя и необходимым, но недостаточным условием инициирования кри-
сталлизации. Область, ограниченная линиями равновесия и предельных пе-
ресыщений/переохлаждений, получила название метастабильной. Правее
же линии равновесия находятся поля перегретого расплава и пара (рис. 1.17а)
или ненасыщенного раствора (рис. 1.176). Ширина метастабильной зоны в из-
вестном смысле условна. Она зависит от природы кристаллизуемого вещест-
ва, внешних условий, местоположения области на рассматриваемой диа-
грамме состояния и от других параметров. Например, повышение давления
пара при некоторой фиксированной температуре в окрестностях тройной точ-
ки О на диаграмме рис. 1.17а может сперва инициировать появления жидко-
сти, а затем кристалла, поскольку пересекается сначала граница метаста-
бильности жидкости и лишь потом - пара.
Кроме того, скорость образования зародышей пропорциональна не
только вероятности формирования кластеров критических размеров, опреде-
ляемой величиной AG в уравнении (2) (см. стр. 25). Она связана также с пре-
одолением энергетического барьера, обусловленного внешними по отноше-
нию к зародышу процессами, в частности, диффузией, что особенно сущест-
венно для конденсированных кристаллизационных сред. Поэтому выражение
для скорости образования зародышей будет иметь более общий вид:
, . ( AG + Е)
/ = А ехр-----;.
I кТ )
31
SESA Lab., ISSP RAS
Рис. 1.17. Схема фазовых равновесий для однокомпонентной системы (а) и
бинарной системы в области существования жидкости (б); пунк-
тирными линиями обозначены границы метастабильных состоя-
ний
б
Значение Е для растворов во многом зависит не только от диффузии,
но и от энергии разрыва сольватных оболочек. В расплавах она отождествля-
ется с энергией активации вязкого течения и самодиффузии.
Выше определенных переохлаждений и пересыщений, характерных
для конкретной системы, число зародышей, возникающих за единицу времени
в единице объема, также практически равно нулю. Например, максимальные
относительные пересыщения при кристаллизации из пара могут достигать
100%, в случае раствора - нескольких десятков процентов, а для расплавов
критические переохлаждения составляют до половины величины температу-
ры плавления вещества.
Предельные переохлаждения и пересыщения, выше которых начина-
ется лавинообразное формирование зародышей, называются критическими.
Их можно найти на основе логарифмирования выражения (2) на стр. 25. В
качестве граничного условия, обычно принимают скорость / = 1 см'3-сек'1. Для
kT ( Р
системы пар-сферический кристалл AG меняют на —In — и получают со-
Vo v о J
отношение:
. ( Р 1 fi6w02o-3y
[/%J kT{3kT\nA J
Следовательно, критическое пересыщение очень чувствительно к изменению
поверхностной энергии (о3'2!). Оно, естественно, будет зависеть и от присут-
ствия в такой системе поверхностно-активных веществ. Для газовой среды
эти соотношения могут быть представлены и в терминах переохлаждения при
постоянном давлении. В расплаве преобразование ближнего порядка в рас-
32
SESA Lab., ISSP RAS
ast@lssp.ac.ru
положении частиц в дальний лимитируется главным образом относительным
смещением частиц, а скорость формирования зародышей зависит не только
от переохлаждения, но и от абсолютного значения температуры.
Таким образом, необходимым и достаточным условием инициирова-
ния кристаллизации является отклонение гомогенного пара, раствора или
расплава от равновесия на величину, достаточную для преодоления актива-
ционного энергетического барьера по формированию устойчивой межфазной
границы, что имеет свою специфику у конденсированных и неконденсирован-
ных сред. Надо заметить, что количественные эксперименты по образованию
зародышей трудно реализовать. Прежде всего, за столь мелкими агрегатами
сложно осуществить прямое наблюдение. Кроме того, есть серьезные про-
блемы, связанные с очисткой среды от посторонних частиц. Требуется также
некоторое время для достижения стационарного распределения кластеров по
размерам в соответствии с заданным отклонением системы от равновесия.
Так, в газах при отсутствии химической реакции для зародыша размером по-
рядка 100 атомов оно составляет около одной тысячной или даже десятиты-
сячной доли секунды. У расплавов при размерах группировок до 1000 атомов,
оно еще меньше - около 10'7 сек. Однако в вязких средах, например, распла-
вах силикатов и боратов - своего рода неорганических полимерах - для заро-
дыша из 1000 атомов время релаксации может измеряться сутками (105 сек).
33
SESA Lab., ISSP RAS
ast@issp.ac.ru
ГЕТЕРОГЕННЫЕ СИСТЕМЫ
ОБРАЗОВАНИЕ НОВЫХ ЦЕНТРОВ РОСТА
В гетерогенных средах новая кристаллическая фаза обычно форми-
руется на инородных частицах, ранее появившихся кристаллах, на стенках
кристаллизатора и других поверхностях раздела. Прежде всего, это выгодно
энергетически. Более того, как в условиях природного минералообразования,
так и при лабораторных экспериментах нет недостатка в такого рода межфаз-
ных границах, по крайней мере, на микроуровне.
Предпочтительность этого процесса перед самопроизвольной флук-
туационной нуклеацией в собственно гомогенных системах обычно демонст-
рируется на упрощенной модели - устойчивости изотропного зародыша (на-
пример, капли жидкости) в виде шарового сегмента на плоской поверхности
(рис. 1.18). Воспользовавшись геометрическими соотношениями из этой схе-
мы и формулой Гиббса AG = oS/З, работу его формирования можно предста-
вить следующим образом:
AG = — (Str + S1a1 - S2cr2 ),
СС.Ш 3 ' ’
где <7, <7i, сг2 - соответственно поверхностные энергии границ раздела: заро-
дыш-среда, зародыш-подложка и подложка-среда; S - площадь сферической
поверхности сегмента, S7 = S2 - площадь его основания, в - контактный угол
между зародышем и подложкой.
777777Ш77777Ш7Л
R
Рис. 1.18. Схема определения формы равновесного изотропного зародыша
на плоскости
34
SESA Lab., ISSP RAS
ast®issp.ac.ru
Принимая во внимание, что R - радиус шара, h - высота сегмента, а 0
- контактный угол между зародышем и подложкой, можно записать следую-
щие соотношения:
ГТ 2 ГТи -
—------- = cos в ,
СУ
S = 2л/?Л = 2лЯ2(1 - cos0),
S-i = S2 = xR2sin20.
Тогда
AGaem = у (SrT + S,(T, - S2fT2 ) =
= -^-[2/zR2(1-cos(9)rT + xR2 sin2 0су1 -xR2 sin2 0cr2] =
1 г i
= — |2;tf?z(1-COS(9)rT + xR2 sin2 6>(гт, - гт2)] =
3
= — [zxR2 - cos 0)<y - xR2 sin2 6>(гт2 -rr()] =
= ^[?.xR2 (1 - cos 0)cr ~ xR2 sin2 <9 cos2 6*cr)] =
[l- cos 0(1 -sin2 6*)] =
3-
2 о 2 I
= — ;zf?2rT(1-cos6’-sin2 0COS2 0) = —xR2(y\
3 3
= — Scr — [l-cos<9(1-sin2 0)] = — Srr-f(0) = AG.
3 2
3
где
./(<?) = ту [1 -cos6»(1
-sin2 6»)]
- функция угла (9(рис. 1.19). Таким образом, если контактный угол вменяется
от 0 до 180°, то
0 < AGsem <AG
гом-
Рис. 1.19. Зависимость формы "гетерогенного" зародыша от
угла в
35
SESA Lab., ISSP RAS
astS>issp.ac.ru
Распространяя этот подход на анизотропную модель, можно сделать
вывод, что при полном кристаллохимическом соответствии подложки и кри-
сталлизуемого вещества (6“=0) зародышеобразование будет безактивацион-
ным (AG3em = 0). И, наоборот, при предельном несоответствии (<9=180°) AG3em
приравнивается к энергии образования зародышей в гомогенных системах
(рис. I.20).
ШШШ ШШй
а б в
Рис. 1.20. Форма "гетерогенного изотропного" зародыша: а - 0 = 0°;
б-в = 90°; в- 0 = 180°
Необходимо учитывать, что работа определяется так же и физическим
состоянием поверхности. Если на ней есть трещины, то работа может стать
даже отрицательной, т. е. конденсация будет происходить уже в ненасыщен-
ном паре (капиллярная конденсация).
Исходя из соотношения AG3em = AG3OM/(6>), кривизну поверхности кри-
тического зародыша (следовательно, и его размеры), способного к дальнейше-
му росту, можно оценить по аналогии с гомогенными средами. Характер зави-
симости AG3em от R такой же, как и для AG30M, но ее величина будет отличаться
на множитель f(0). Работа AG3em достигает максимума при R = RK, т.е.
ь 16<гт3-Ж
ЗАд2
AGZ = = 44
3 3 Ад
где RK- радиус критического зародыша при разности химических потенциалов
Ад, a Vo- удельный объем частицы вещества.
Равенство радиусов (степени кривизны поверхности) свободного за-
родыша и на подложке при заданном пересыщении обусловлены равновеси-
ем в каждой точке границы раздела фаз, в т. ч. и на линии контакта трех фаз в
гетерогенном случае. Поэтому величина зародыша всегда зависит только от
пересыщения (переохлаждения), уменьшаясь с увеличением Ад.
Форма зародыша, точнее, соотношение размеров его основания и вы-
соты зависит от угла (9 (см. рис.1.20 а, б и в). Чем больше кристаллохимиче-
ское подобие подложки и зародыша, тем более плоским будет последний.
36
SESA Lab., ISSP RAS
ast@issp.ac.ru
ДВУМЕРНЫЕ ЗАРОДЫШИ
Особый случай представляет возникновение точек роста на собствен-
ной подложке, т.е. на затравке. Для таких образований на атомно гладких гра-
нях кристалла Фольмер ввел понятие о двумерном зародыше, который можно
представить в виде островка плоской мономолекулярной сетки, находящегося
в состоянии равновесия с исходной фазой (рис. 1.21).
Рис. 1.21. Двумерный зародыш: а - дискообразная форма (изотропный слу-
чай), б - анизотропная модель Фольмера
Работу формирования двумерного зародыша с радиусом г = Vodfyi и
высотой h можно представить в виде
AG™X
лМосг2б
Ад
Этот процесс, как и в трехмерном случае в гомогенных средах, имеет
флуктуационную природу. Поэтому скорость такого зародышеобразования
пропорциональна ехр(- /кт), где к - постоянная Больцмана и Т - тем-
пература. Она в целом соответствует
/ = А ехр(- ЫЗ/кТ),
хотя предэкспоненциальный множитель имеет несколько иной вид и размер-
ность.
Таким образом, работа нуклеации в гетерогенной среде меньше, чем в
гомогенной жидкости на величину, зависящую от смачиваемости ею подложки
и от кристаллохимического соответствия сопрягающихся структур в системе
кристаллизационная среда-твердая фаза. При строгом рассмотрении в гете-
рогенных системах следует учитывать анизотропию поверхностной энергии, а
также ограничения при больших Ад, когда размер критического зародыша бу-
дет сопоставим с межатомными расстояниями.
SESA Lab., ISSP RAS
ЭПИТАКСИАЛЬНЫЕ ЯВЛЕНИЯ
Частным случаем формирования зародышей в гетерогенной системе
является эпитаксия - ориентированное нарастание вещества на кристалли-
ческую поверхность, или закономерное срастание кристаллов. Оно характе-
ризуется совпадением определенных, как правило, кристаллографически
простых плоскостей нового слоя и кристалла-подложки. На самом деле, все
кристаллы образуются в результате эпитаксиального роста, хотя термин
"эпитаксия", введенный Руайе, обычно используется для описания ориенти-
рованной кристаллизации на инородных подложках.
В ранних исследованиях этого явления большое внимание уделялось
размерному соотношению параметров решеток на границе срастания. Со-
гласно правилу Руайе-Фриделя, эпитаксия возможна лишь при геометриче-
ском соответствии срастающихся сеток, с разницей в их параметрах не более
15%. Тем не менее, упорядоченное нарастание наблюдается и при различиях
в десятки процентов, в частности, при кристаллизации ряда металлов на гра-
нях (100) щелочногалоидных кристаллов.
При описании эпитаксии указываются плоскости срастания и направ-
ления в них, например: [112] (111) Si//[1120] (0001) AI2O3. Это означает, что
грань (111) кристалла кремния с решеткой типа алмаза растет параллельно
пинакоиду (0001) кристалла А12О3 (решетка типа корунда), причем кристалло-
графическое направление [112] в нарастающем кристалле параллельно на-
правлению [1120] подложки.
Различают гомоэпитаксию - ориентированный рост на собственной
подложке (например, Si//Si) и гетероэпитаксию - на инородной (например,
GaN//AI2O3). Встречается и другое название гомоэпитаксии - автоэпитаксия,
хотя под этим термином чаще всего подразумевается ориентированное на-
ращивание кристаллического вещества, отличающегося от подложки только
примесным составом (Ge+Ag//Ge). Наряду с ними используются и такие поня-
тия, как хемоэпитаксия - ориентированная кристаллизация при химическом
взаимодействии подложки с нарастающим веществом (образование пленок
окислов на поверхности металлов), эндотаксия - ориентированный рост од-
ного кристалла внутри объема другого и двойниковая эпитаксия - законо-
мерное срастание кристаллов при образовании двойников. В этом случае
двойниковая граница проходит по граням простых форм, принадлежащих од-
ному кристаллографическому поясу (поясу двойникования). В качестве при-
мера можно привести систему [001] слюда//[010] гипс.
Выбор подложки при эпитаксиальном наращивании относится к числу
приоритетных условий при получении тонких пленок и определяется четырь-
мя факторами: кристаллографическим, физическим, химическим и экономи-
ческим. Точное совпадение структуры и параметров решеток двух сопрягаю-
щихся кристаллов в случае гетероэпитаксии реализуется довольно редко, и
эпитаксия зависит от такого важного параметра, как величина несоответствия
3 8 SESA Lob., ISSP RAS
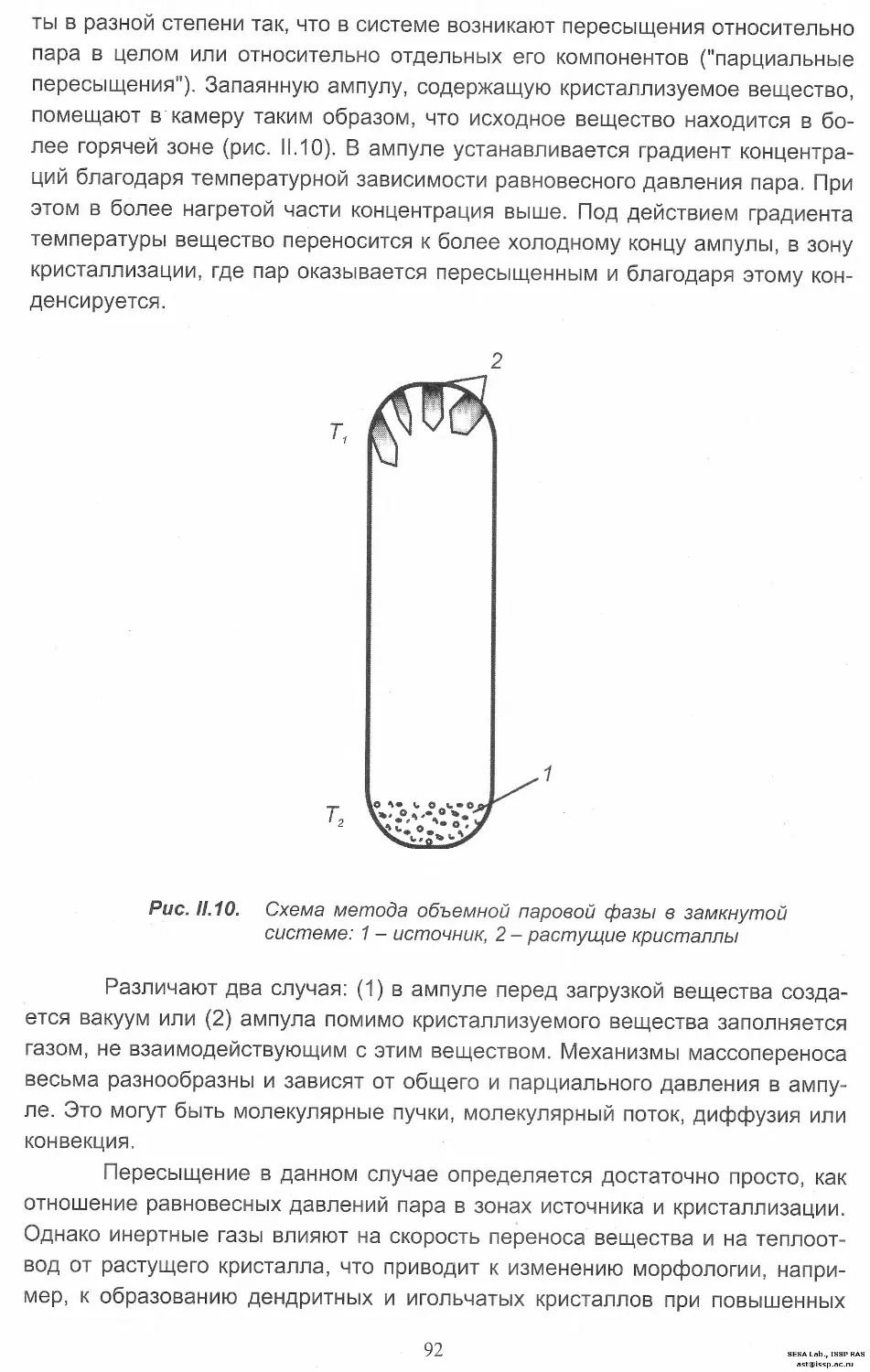
ast®issp.ac.ru
кристаллических решеток (другое название, часто встречающееся в литера-
туре - несоответствие межатомных расстояний). Хотя число изученных слу-
чаев эпитаксии растет, критерии определения их взаимной ориентации до сих
пор недостаточно разработаны, потому что точный характер сопряжения кри-
сталлических решеток не известен.
Таким образом, эпитаксия особенно легко осуществляется при разно-
сти постоянных обеих решёток до 10-15%. При больших расхождениях могут
сочленяться лишь самые плотноупакованные поверхности и направления.
При этом часть плоскостей одной из решёток не имеет продолжения в другой,
и края незавершенных слоев образуют дислокации несоответствия. Послед-
ние обычно формируют сетку, в которой можно оптимизировать плотность
дислокации, меняя периоды контактирующих решёток, например, модифици-
руя состав вещества. Следовательно, можно управлять и количеством дисло-
каций в нарастающем слое.
При эпитаксии суммарная энергия границы подложка-кристалл, кри-
сталл-среда и подложка-среда минимизируется. У веществ с очень близкой
структурой, например, при кристаллизации металлического золота на серебре
граница срастания не просматривается, поскольку структура нарастающего
слоя и подложки идентичны. Это явление получило название псевдоморфизм.
С ростом толщины упруго напряженной псевдоморфной пленки накапливае-
мая в ней энергия увеличивается и при толщине, превышающей критическую
(для Au на Ад ~ 600 А), нарастает пленка с собственной структурой.
Эпитаксиальные явления обычно провоцируются возникшими на под-
ложке отдельными кристалликами, которые, срастаясь друг с другом, образу-
ют сплошную плёнку. На одной и той же подложке возможны разные типы на-
растания, например [100] (100) Au // [100] (100) NaCI и [110] (111) Au // [110]
(100) NaCI. В качестве меры рассогласования кристаллических решеток на
границе раздела используется величина А = (Ь -а)/а, где а и b - значения
межатомных расстояний пленки и подложки соответственно.
39
SESA Lab., ISSP RAS
ast@issp.ac.ru
МЕХАНИЗМ И КИНЕТИКА КРИСТАЛЛИЗАЦИИ
АНИЗОТРОПИЯ ПОВЕРХНОСТНОЙ ЭНЕРГИИ
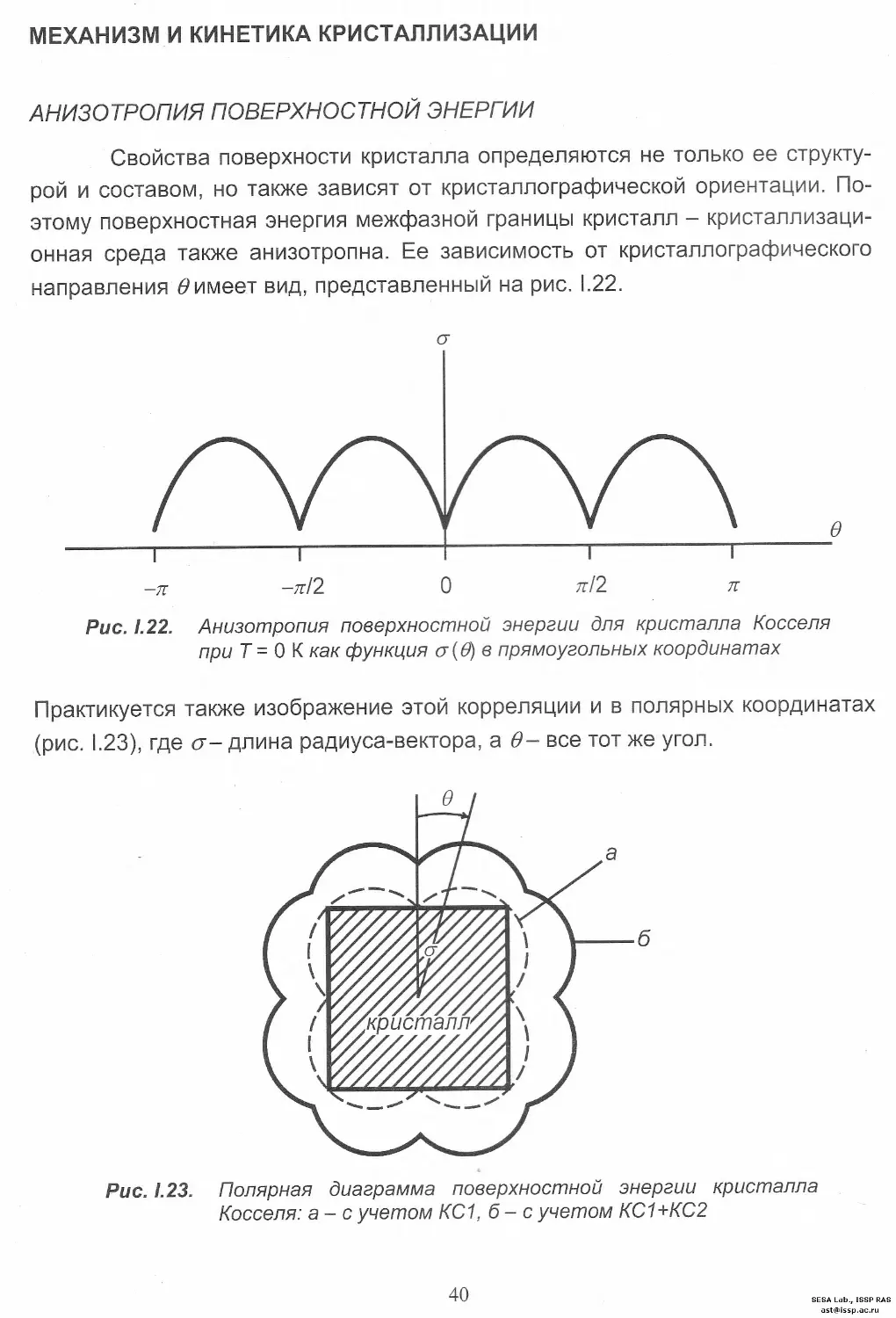
Свойства поверхности кристалла определяются не только ее структу-
рой и составом, но также зависят от кристаллографической ориентации. По-
этому поверхностная энергия межфазной границы кристалл - кристаллизаци-
онная среда также анизотропна. Ее зависимость от кристаллографического
направления 6>имеет вид, представленный на рис. 1.22.
Рис. 1.22. Анизотропия поверхностной энергии для кристалла Косселя
при Т - О К как функция <у(д) в прямоугольных координатах
Практикуется также изображение этой корреляции и в полярных координатах
(рис. 1.23), где <т- длина радиуса-вектора, а в- все тот же угол.
Рис. 1.23. Полярная диаграмма поверхностной энергии кристалла
Косселя: а- с учетом КС1, б - с учетом КС1+КС2
40
SESA Lab., ISSP RAS
ast®issp. ac.ru
В трехмерном полярном варианте, принимая во внимание только КС1, диа-
грамма имеет 6 острых сингулярных минимумов, отвечающим F-граням, С
учетом более удаленных соседей - КС2, КСЗ и т. д. - на схеме появляются
новые минимумы, скорректированные дополнительными системами ПЦС.
"Глубина" и "острота" их убывает с усложнением индексов граней.
ТИПЫ ГРАНЕЙ КРИСТАЛЛОВ
С позиций ПЦС-концепции Хартмана (см. также стр. 16), грани любого
кристалла, параллельные по меньшей мере двум системам ПЦС-векторов, яв-
ляются F-гранями, в случае одной - S-гранями, а если они не содержат ни од-
ного из таких векторов - К-гранями (F, S и К - аббревиатура английских слов
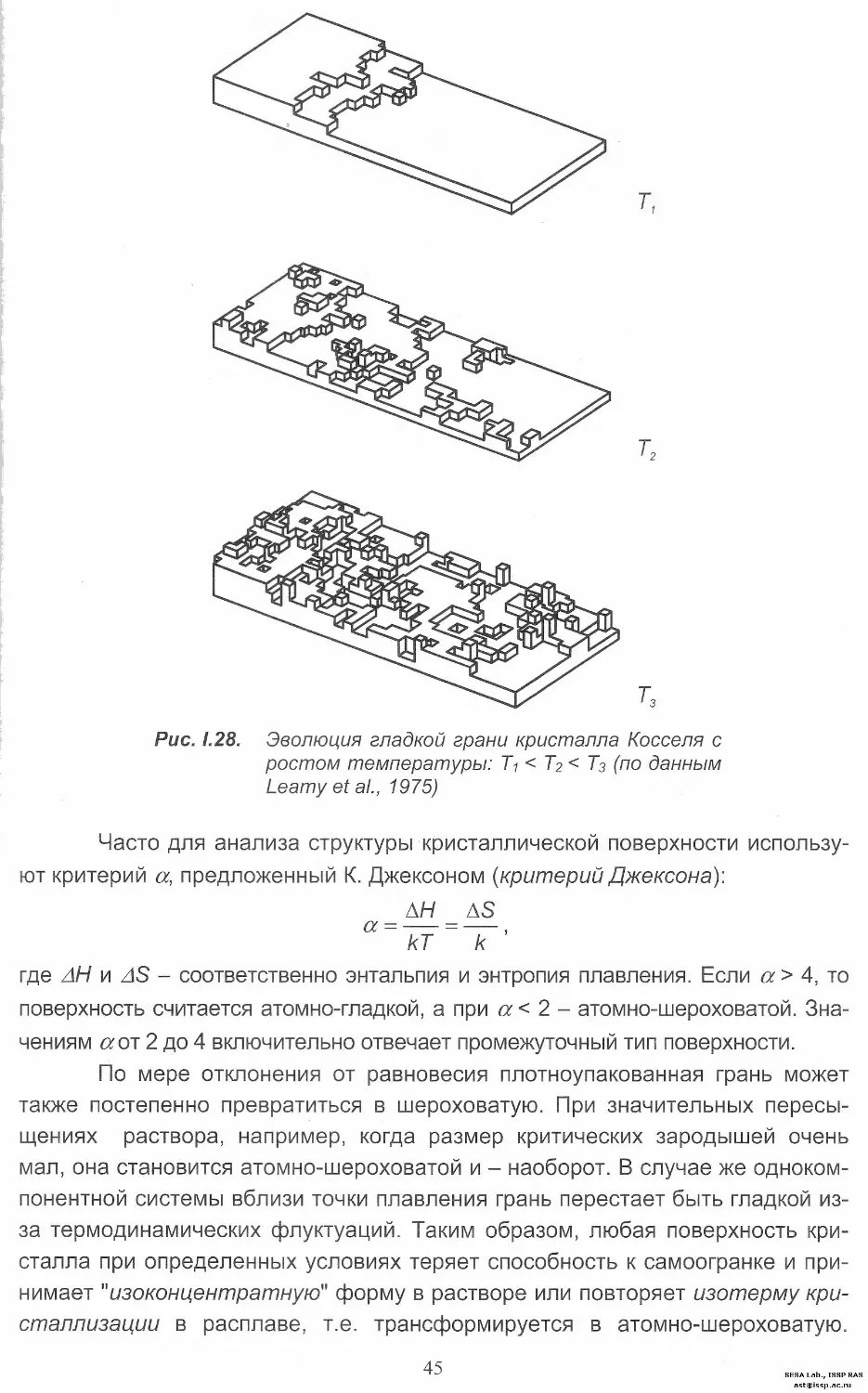
flat, stepped и kinked) (рис. I.24). Поверхностная плотность атомов, как правило,
максимальная у F-граней. Поэтому их еще называют атомно-гладкими, a S и К
- ступенчатыми и атомно-шероховатыми, соответственно.
Рис. 1.24. Классификация граней кристалла
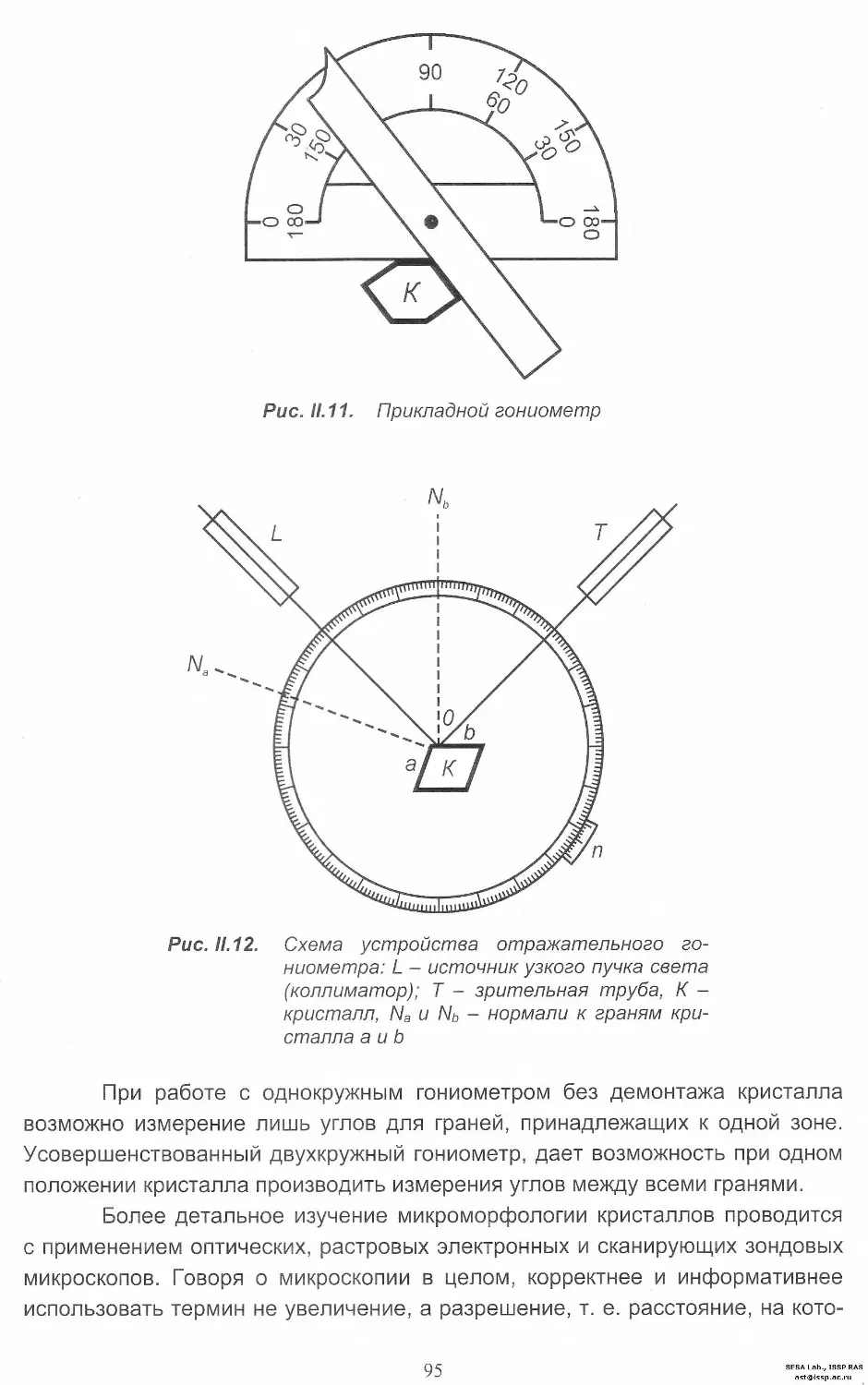
по П. Хартману
Полезную информацию о типах граней можно получить из анализа
морфологии тех или иных кристаллов. В частности, грани куба алмаза с уче-
том лишь первых ближайших соседей в его структуре являются атомно-
шероховатыми по классификации ПЦС, т. е. относятся к К-граням. Присутст-
вие же на них ступеней свидетельствует о важном вкладе и второй координа-
ционной сферы.
41
SESA Lab., ISSP RAS
ast@issp.ac.ru
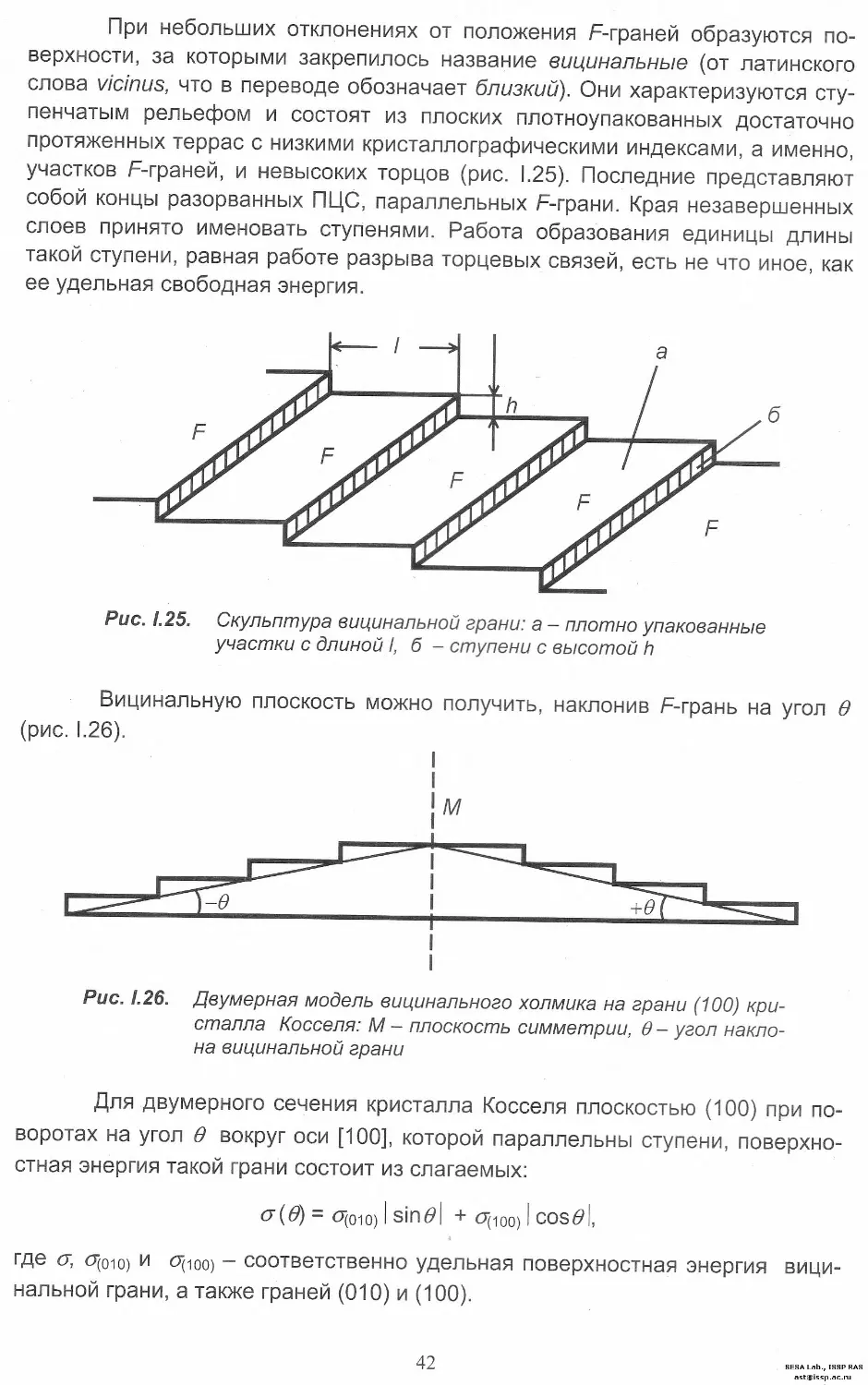
При небольших отклонениях от положения F-граней образуются по-
верхности, за которыми закрепилось название вицинальные (от латинского
слова vicinus, что в переводе обозначает близкий). Они характеризуются сту-
пенчатым рельефом и состоят из плоских плотноупакованных достаточно
протяженных террас с низкими кристаллографическими индексами, а именно,
участков F-граней, и невысоких торцов (рис. 1.25). Последние представляют
собой концы разорванных ПЦС, параллельных F-грани. Края незавершенных
слоев принято именовать ступенями. Работа образования единицы длины
такой ступени, равная работе разрыва торцевых связей, есть не что иное, как
ее удельная свободная энергия.
Рис. 1.25. Скульптура вицинальной грани: а - плотно упакованные
участки с длиной I, б - ступени с высотой h
Вицинальную плоскость можно получить, наклонив F-грань на угол в
Рис. 1.26. Двумерная модель вицинального холмика на грани (100) кри-
сталла Косселя: М - плоскость симметрии, 0 - угол накло-
на вицинальной грани
Для двумерного сечения кристалла Косселя плоскостью (100) при по-
воротах на угол 0 вокруг оси [100], которой параллельны ступени, поверхно-
стная энергия такой грани состоит из слагаемых:
<7(0 = 0(010) I Sin01 + 0(100) I cosFl,
где <у O(oio) и O(ioo) - соответственно удельная поверхностная энергия вици-
нальной грани, а также граней (010) и (100).
42
SESA Lab., ISSP RAS
Знаки модуля подчеркивают, что вклады ненасыщенных ПЦС от тер-
рас и ступеней положительны. Если вицинальная грань отклонена от F-грани
на такой же угол в противоположную сторону, то
<?(-#) = СГ(ОТО) I sin6»| + сг(100) I cos6»|,
где <Т(ото) - удельная поверхностная энергия грани (010).
Поскольку на рис. 1.26 плоскость М, перпендикулярная плоскости чер-
тежа, является плоскостью симметрии кристалла Косселя, то фото) = Фою>-
Как видно из обобщенных графиков на рис. I.22 и I.23 (см. стр. 39), у
этих двух функций при <7(001) = <7(ою) = фото), значения а имеют ярко выражен-
ные минимумы для (9=0, ±л/2, л. На языке математики такие точки называют
сингулярными. По аналогии, сингулярными названы и грани, соответствую-
щие этим ориентациям. Пользуясь тем же приемом, можно проанализировать
изменение поверхностной энергии и по другим сечениям кристалла.
НОРМАЛЬНЫЙ И ПОСЛОЙНЫЙ РОСТ
От характера кристаллической поверхности зависят механизм и кине-
тика роста кристалла. Ее структура определяется как природой вещества, так
и внешними условиями и прежде всего - степенью отклонения от равновесия,
температурой и составом среды. На поверхности кристалла можно выделить
геометрические и энергетические места предпочтительного присоединения
кристаллообразующих частиц. К таким особым положениям в первую очередь
относятся плоскости (а), ступени (б) и изломы (в) (рис. I.27).
Рис. 1.27. Основные структурные позиции на кри-
сталлической поверхности: а - плос-
кость, б - ступень, в - излом
43
SESA Lab., ISSP RAS
ast@issp.ac.ru
Для присоединений кристаллизующихся частиц энергетически самой
выгодной является позиция в - излом на рис. 1.27, т. е. по Косселю - положе-
ние полукристалла, где число связей у каждой из них составляет половину
всех возможных связей, приходящихся на частицу в объеме кристалла. Осо-
бая значимость излома состоит в том, что осаждение на нем новой молекулы
или атома оставляет неизменной начальную конфигурацию межфазной гра-
ницы. Поскольку при этом не меняется число нескомпенсированных связей,
то сохраняется прежней и поверхностная энергия кристалла. Это означает
также, что химический потенциал частицы в изломе равен химическому по-
тенциалу кристалла. Работа по ее перемещению из излома в среду (или об-
ратно) соответствует разности потенциалов среды и кристалла - Ад.
При значительном числе изломов грань становится атомно-
шероховатой, и рост кристалла не будет лимитироваться плотностью мест
присоединений. Поэтому при макроскопической оценке поверхность в процес-
се роста смещается по нормали к самой себе в каждой своей точке. Такое яв-
ление получило название нормального механизма роста кристалла.
Работа по переносу кристаллизующихся частиц из расплава, раство-
ра или пара в другие положения, а именно более "гладкие" поверхности кри-
сталла, уже не равна Ад, ибо в результате меняется величина ст. Следова-
тельно, при кристаллизации они сначала встраиваются в изломы, а затем - в
ступени, как энергетически наиболее выгодные места. После заполнения ими
всего слоя необходимо создать на завершенной плоскости новые ступени с
изломами. В этом случае требуется, как минимум, образование на гладкой
грани двумерного зародыша, который постепенно покрывает всю грань за
счет мигрирующих по ней частиц. Такие акты повторяются при росте гладкой
грани многократно. Процесс же кристаллизации, лимитируемый плотностью
изломов на растущей грани, основан на формировании и разрастании дву-
мерных зародышей, т. е. тангенциального перемещения ступени, называется
тангенциальным, или послойным ростом.
СТРУКТУРА МЕЖФАЗНЫХ ГРАНИЦ И ДИФФУЗИОННЫЕ ПРОЦЕССЫ
Концентрация изломов на поверхности кристалла, их конфигурация,
высота и взаимное расположение определяют структуру границы раздела
фаз, которая зависит от температуры (рис. 1.28). Среднее расстояние между
изломами с учетом энергии их образования GU3n при моноатомном росте мож-
но представить в виде
Я = а
1 (с
1 +—ехр
2 Ч кТ
где а - межатомное расстояние в кристалле, а к - постоянная Больцмана.
Следовательно, при нагревании плотность изломов возрастает экспоненци-
ально.
44
SESA Lab., ISSP RAS
ast@issp.ac.ru
Tt
Рис. 1.28. Эволюция гладкой грани кристалла Косселя с
ростом температуры: h < Тг< Тз (по данным
Leamy et al., 1975)
Часто для анализа структуры кристаллической поверхности использу-
ют критерий а, предложенный К. Джексоном (критерий Джексона):
Л.Н AS
а =---=-----,
кТ к
где АН и JS - соответственно энтальпия и энтропия плавления. Если а > 4, то
поверхность считается атомно-гладкой, а при а < 2 - атомно-шероховатой. Зна-
чениям аот 2 до 4 включительно отвечает промежуточный тип поверхности.
По мере отклонения от равновесия плотноупакованная грань может
также постепенно превратиться в шероховатую. При значительных пересы-
щениях раствора, например, когда размер критических зародышей очень
мал, она становится атомно-шероховатой и - наоборот. В случае же одноком-
понентной системы вблизи точки плавления грань перестает быть гладкой из-
за термодинамических флуктуаций. Таким образом, любая поверхность кри-
сталла при определенных условиях теряет способность к самоогранке и при-
нимает "изоконцентратную" форму в растворе или повторяет изотерму кри-
сталлизации в расплаве, т.е. трансформируется в атомно-шероховатую.
Следовательно, для исходно гладких граней острые минимумы на диаграмме
Вульфа сменяются плавными, и повышается вероятность прямого попадания
частиц из кристаллизационной среды в изломы.
В окружающей кристалл "размытой" зоне частицы находятся в проме-
жуточном состоянии. Плотность их практически та же, что и в кристалле, но
характер и энергия связи отличаются. Толщина границы раздела иногда со-
ставляет несколько молекулярных слоев, а степень ее огрубления непостоян-
на по всей протяженности. У органических кристаллов обычно она относи-
тельно ровная, в то время как для большинства металлов характерны шеро-
ховатые переходные слои, составляющие иногда десятки межатомных рас-
стояний.
При росте кристалла в некотором интервале пересыще-
ний/переохлаждений частицы при подходе к нему выделяют лишь часть
скрытой теплоты. В этом случае силы притяжения между твердой фазой и ее
окружением превышают энергию связи частиц в среде, и происходит их ад-
сорбция. Несмотря на сильное взаимодействие с кристаллом, они все же со-
храняют значительную свободу в перемещении по его поверхности. Согласно
Фольмеру, совокупность дрейфующих таким образом частиц представляет
собой адсорбционный слой, который расположен между фиксированной гра-
ницей растущего кристалла и прилегающей к ней кристаллизационной сре-
дой. Соответственно различают две стадии поверхностных процессов: (1) ми-
грацию вещества в адсорбционном слое и (2) встраивание непосредственно в
структуру кристалла. Частица, достигая его поверхности, либо сразу фиксиру-
ется в изломах, либо в силу остатка энергии мигрирует по ней {поверхност-
ная диффузия) и закрепляется где-нибудь в другой позиции. Ряд частиц от-
рывается (десорбируется) и возвращается в расплав, раствор или пар. Кон-
центрация их в адсорбционном слое зависит от многих факторов, основные из
которых связаны с энергетическими барьерами и температурными условиями
(рис. I.29).
Явления в адсорбционном слое недостаточно изучены. Принято счи-
тать, что там происходит миграция атомов и молекул, из них формируются
кластеры и центры кристаллизации. Характер поверхностных процессов оп-
ределяется свойствами адсорбционного слоя, в конечном счете, его составом
и плотностью.
Перенос вещества из среды к адсорбционному слою и рассеяние теп-
лоты кристаллизации обеспечивается объемной диффузией, представляю-
щей собой необратимый, самопроизвольно протекающий в системе процесс
выравнивания концентраций атомов, молекул и более сложных комплексов
под влиянием беспорядочного теплового движения. Молекулярная диффузия
превалирует в неподвижном растворе при малых пересыщениях, в вязких
средах, а также при росте кристаллов в тонких пленках жидкостей и капилля-
рах. Около растущего кристалла можно условно выделить так называемый
46
SESA Lab., ISSP RAS
ast@issp.ac.ru
Степень заполнения адсорбционного слоя
Рис. 1.29. Корреляция между плотностью частиц
в адсорбционном слое и энергетическим
состоянием поверхности кристалла
(см. также Jackson, 1958)
диффузионный слой, ограниченный с одной стороны поверхностью кристалла
(и адсорбционным слоем), а с другой - пересыщенным раствором. В идеаль-
ных условиях, когда раствор, окружающий кристалл, однороден, скорость рос-
та грани контролируется количеством вещества, продиффундировавшего в
единицу времени через диффузионный пограничный слой. Тогда рост и рас-
творение подчиняется соотношению:
^ = KS(C-C0),
dm 1 ,, „ _ _
где---------скорость диффузии через сечение переноса S; С-Со - гради-
dt S
ент концентрации, а К =----численный коэффициент, зависящий от интен-
d
сивности поступления D кристаллизуемого вещества к той или иной грани, d -
толщина пограничного слоя, которая также неодинакова для различных гра-
ней. Для водных растворов при комнатных температурах D составляет около
3-10'6 см2/сек, а величина d оценивается на уровне ~10'3см.
В пределах этого слоя концентрация раствора падает от С до Со -
концентрации насыщения раствора. Вокруг кристалла условно можно выде-
лить зоны, ограниченные линиями равных концентраций кристаллизационной
среды (рис. I.30).
47
SESA Lab., ISSP RAS
ast<$issp. ac.ru
Рис. 1.30. Изоконцентрационные зоны
в неподвижном растворе в
окрестности кристалла
По мере удаления от кристалла линии искажаются, и расстояние меж-
ду ними увеличивается. Диффузионный слой называют также "двориком кри-
сталлизации". С течением времени он становится более обширным и, как
следствие, градиент концентрации уменьшается, в этой связи снижается ско-
рость диффузии. Выступающие участки кристалла - вершины и ребра - нахо-
дятся в более выгодном положении для поступления кристаллизуемого мате-
риала по сравнению со средними областями граней.
Разность плотностей раствора в диффузионном слое и объеме, воз*
никающая за счет изменения концентрации раствора при росте и растворении
кристалла, приводит к возникновению концентрационных потоков. Если
плотность растворенного вещества больше плотности раствора, то они будут
восходящими у поверхности растущего кристалла и нисходящими при его
растворении (рис. 1.31).
Рис. 1.31. Концентрационные потоки вокруг расту-
щего (а) и растворяющегося (б) кристалла
48
SESA Lab., ISSP RAS
ast@issp.ac.ru
Концентрационные потоки следует отличать от конвекционных, кото-
рые также являются следствием градиентов плотности кристаллизационной
среды, но формирующихся уже не за счет изменения концентрации раствора
при росте и растворении кристалла, а в результате выделения или поглоще-
ния тепла, сопровождающего кристаллизацию и растворение. При воз-
никновении конвекции в растворе тоньше становится пограничный слой, воз-
растают градиенты концентраций, нормальные к его поверхности, увеличива-
ется скорость роста кристалла.
При принудительном движении кристалла в растворе или перемеши-
вании раствора, толщина пограничного слоя также уменьшается и увеличива-
ется нормальный градиент концентраций с вытекающими из этого последст-
виями, что используется на практике для скоростного выращивания относи-
тельно однородных кристаллов. С другой стороны, при больших скоростях
перемешивания, например, 20-110 см/с, исключается влияние объемной
диффузии.
Если скорость поверхностных процессов превышает интенсивность
диффузии, то пересыщение на фронте роста меньше, чем в объеме раствора.
Тогда кристаллизация контролируется (лимитируется) диффузией, т. е. имеет
место диффузионный режим кристаллизации, в противоположность кинети-
ческому, когда скорость диффузионного переноса вещества превалирует над
его реакционной способностью фиксироваться на растущей поверхности.
СКОРОСТИ НОРМАЛЬНОГО РОСТА
В реальных системах рассмотренная выше схема диффузионных про-
цессов осложняется характером взаимодействия атомов, ионов и молекул как
в кристалле, так и окружающей его среде. Волнистые линии на рис. I.32 сим-
волизируют флуктуацию средних энергий частиц в кристалле (Ек) и среде (Ес)
при их смещении из положений равновесия.
При переходе в равновесных условиях частицы из кристалла в рас-
плав, раствор, пар (или обратно) через пограничный слой Ас/, ее энергия ме-
няется на величину АН. Также она должна преодолеть потенциальный барь-
ер, связанный с различной конфигурацией ее координационных сфер в раз-
ных фазах, которые определяются структурой последних. На границе кри-
сталл - расплав значения АЕ обычно сопоставимы с энергией активации для
вязкого течения. Характерной чертой нормального роста является линейная
зависимость скорости кристаллизации от переохлаждения при малых его зна-
чениях как результат статистической независимости осаждения и отрыва час-
тиц на изломах.
Росту кристаллов из раствора сопутствуют дополнительные энергети-
ческие затраты на разрушение сольватных оболочек, и энергия активации
49
SESA Lab., ISSP RAS
ast@issp.ac.ru
может достигать нескольких десятков ккал/моль. Тем самым затрудняется и
реализация нормального механизма роста. В литературе приводятся отдель-
ные примеры такого рода, в частности, для базисной грани пинакоида кри-
сталлов а-кварца в гидротермальных условиях (рис. 1.33). Скорость ее роста
характеризуется линейной зависимостью логарифма кинетического коэффи-
циента /3 от обратной температуры. По наклону прямой на рис. 1.33 оценива-
ется энергия активации - 20±1 ккал/моль, а относительное пересыщение в
объеме кристаллизационной среды, исходя из кривой растворимости SiO2 в
0,5-молярном водном растворе NaOH при 385°С и перепаде температур 60°,
составляет 7%.
Рис. 1.32. Энергетическое состояние частиц (Еср) вбли-
зи межфазной границы (по данным Соер,
крист., 1980)
Рис. 1.33. Температурная зависимость кинетического коэффициента
роста базисной грани кварца в гидротермальном растворе
(по данным Соер, крист., 1980)
SESA Lab., ISSP RAS
ast@issp.ac.ru
50
При кристаллизации из газовой фазы, по крайней мере, "элементар-
ных" веществ и соединений с высокосимметричными молекулами, энергия
активации для фиксации частиц в изломах оценивается близкой к нулю. В то
же время, низкосимметричным молекулам потребуется преодолеть заметный
энергетический, так называемый энтропийный, барьер, связанный с необхо-
димостью их переориентации для адаптации к излому, т. е. даже в случаях,
когда в среде нет необходимости в десольватации и каких-либо кристаллохи-
мических преобразованиях.
ОСОБЕННОСТИ ПОСЛОЙНОГО РОСТА В РАЗЛИЧНЫХ СРЕДАХ
Вероятность возникновения элементарной ступени при двумерном за-
рождении на сингулярной грани определяется атомными конфигурациями на
ее поверхности, сформировавшимися в предшествующих актах присоеди-
нения и отрыва. По этой причине интенсивность такого "коллективного" про-
цесса зародышеобразования нелинейно зависит от переохлаждения. И как
результат, нелинейна и скорость кристаллизации, лимитируемая кинетикой
нуклеации.
В отличие от нормального механизма кристаллизации, при послойном
росте изломы сосредоточены лишь на торцах ступеней, разделенных атомно-
гладкими участками, как показано на рис. 1.34. Здесь угол 9 - локальное от-
клонение поверхности, обозначенной пунктирной линией, от ориентации син-
гулярной грани, a Vr и Vn - скорости роста рассматриваемой поверхности
вдоль нормалей к гладкой грани и к самой себе, соответственно. После по-
следовательного заполнения этих участков с энергетическими затратами,
близкими к условиям нормального роста, требуется образование новых сту-
пеней, т. е. двумерных зародышей, а следовательно, и значительное увели-
чение пересыщения/переохлаждения.
Рис. 1.34. Ступени на атомно-гладкой грани кристалла
SESA Lab., ISSP RAS
ast@issp.ac.ru
51
Таким образом, если каждая ступень распространяется вдоль грани со
скоростью v, то ступенчатая поверхность в целом перемещается параллельно
себе вдоль нормали к исходной сингулярной грани в среднем со скоростью
Vr = yi/ = |tgtf|i/,
где /- расстояние между ступенями, h — высота каждой из них (см. рис. 1.25,
стр. 41), а скорость v является функцией tg<9. Если кинетика перемещения
ступеней противоположного знака будет такой же, т. е. когда плоскость отра-
жения является плоскостью симметрии кристалла (см. рис. I.26, стр. 41), то
значение Vr будет также равно yiz. Следовательно, скорость роста вдоль
нормали к гладкой грани зависит только от абсолютного значения тангенса
угла локального отклонения рассматриваемой поверхности от ориентации
сингулярной грани (рис. I.35).
tg<9
Рис. 1.35. Анизотропия скоростей роста гладкой грани
В ситуации, когда поверхность растет послойно, функция V/tg#) имеет
острый минимум при tgв = 0, 1,2, ..., отвечающий сингулярным граням. С дру-
гой стороны, если грань покрыта вицинальными холмиками, то эта функция
отличается от нуля. Аналогичная картина наблюдается и в сильно пересы-
щенных растворах, в результате чего на грани образуется множество двумер-
ных зародышей. Поскольку
Vn = V/Cosd,
то при малых 6*, т. е. когда tg<9 « 1, Vn = Vr.
Анизотропия скорости послойного роста по своей сути качественно
иная, чем у нормального роста. Она подобна различию анизотропии поверх-
ностной энергии сингулярных граней и атомно-шероховатых поверхностей.
В случае кристаллизации из пара растущая поверхность, обычно
атомно-гладкая, где атомы, молекулы, кластеры формируют адсорбционный
газ (или жидкость), равновесный с паром, плотность которого определяется
равенством химических потенциалов частиц в окружающем трехмерном и ад-
52
SESA Lab., ISSP RAS
ast@issp.ac.ru
сорбированном двумерном газах. Если же на грани существует ступень с из-
ломами, то между ними и адсорбционным слоем происходит обмен частица-
ми до установления равновесия. В пересыщенном состоянии частицы диф-
фундируют в адсорбционном слое к ступеням, где при превышении их кон-
центрации над равновесной присоединяются к кристаллу. При недосыщении
среды идет обратный процесс - испарение. Обмен частицами между кристал-
лом и паром на ступенях возможен не только через адсорбционный слой, но и
напрямую. Однако в силу сравнительно небольшой плотности пара, малой
поверхности торца ступени и существенной энергии трехмерного испарения
по сравнению с двумерным, вероятность такого акта невелика. Например, в
простой кубической решетке при переходе частицы из излома в трехмерный
пар разрываются три связи ближайших соседей, а при переходе в двумерный
- всего две. Следовательно, частоты отрыва больше во втором случае, чем в
первом.
При среднем расстоянии между изломами, значительно меньшем, чем
средняя длина пробега адсорбированных частиц по поверхности, ступень мо-
жет рассматриваться для них как некий ограничительный шлюз. Поэтому на
расстоянии от ступени, большем чем lad, они сохраняют равновесную с паром
концентрацию, т. е. csv (рис. 1.36а). Вблизи же ступени, при интенсивном об-
мене с ней частицами, их концентрация в адсорбционном слое равна csc.
Рис. 1.36. Адсорбированные частицы на растущих ступенчатых по-
верхностях и кривые их распределения: а - диффузионные
области около ступеней не перекрываются (I > 2lad), б -
перекрываются (I < 2 lad) (по данным Соер, крист., 1980)
SESA Lab., ISSP RAS
ast@issp.ac.ru
Если высота ступени h значительно меньше длины диффузионного
пробега lad, то главным поставщиком атомов и молекул является поверхност-
ная диффузия. Высокие же ступени представляют собой своего рода неболь-
шие грани и при h » lad их скорость роста практически не зависит от высоты.
Эти соображения качественно справедливы и для роста из раствора,
контролируемого поверхностной диффузией. При определяющей роли объ-
емной диффузии вещества к ступени с высотой h величина диффузионного
потока слабо меняется с ростом h при небольших ее значениях, а скорость
перемещения ступени убывает обратно пропорционально h. Аналогичная
тенденция прослеживается и при кристаллизации из расплава, когда скорость
движения ступени лимитируется теплоотводом.
На самом деле, на поверхности есть огромное количество надвигаю-
щихся друг на друга ступеней. При расстояниях между ступенями / » lad, их
диффузионные поля не перекрываются. Если же / < lad, то соседние ступени
конкурируют друг с другом за поступающий из кристаллизационной среды
материал, в результате скорость перемещения каждой из них уменьшается
(рис. 1.366).
Поступающее из раствора к ступеням вещество может доставляться
путем объемной и поверхностной диффузии. Как отмечалось выше, даже без
принудительного перемешивания градиент концентрации раствора создается
за счет конвекции из-за его обеднения у поверхности растущего кристалла и,
как итог, изменения плотности (концентрационные потоки). С другой стороны,
в силу ощутимой вязкости большинства жидкостей, непосредственно на гра-
нице с кристаллом формируется достаточно устойчивый диффузионный по-
граничный слой для перемещения кристаллизующихся частиц.
В пределах диффузионного слоя концентрация раствора С прибли-
женно удовлетворяет уравнению диффузии. В реальности, если кинетика
движения ступени лимитируется лишь процессами на изломах, то для средне
концентрированных (-10%) и слабо пересыщенных растворов (~10-2) она
обычно составляет -10'4 см/сек. С учетом же диффузионного ограничения
скорость еще уменьшится, аналогично статическому случаю. В объеме же пе-
ремешиваемой жидкости, в особенности при турбулентном процессе, концен-
трация практически постоянна, хотя и варьирует во времени и пространстве.
Пренебрегая этим, можно считать, что на расстоянии d от кристалла д = дср,
где дср - значение химического потенциала в объеме раствора (рис. I.37). Ес-
ли I« d, то она обратно пропорциональна ее высоте и не зависит от кинети-
ческих процессов на ступени. Следовательно, кристаллизацию лимитирует
доставка вещества, а не его присоединение к кристаллу.
Рассматриваемая модель учитывает лишь прямое встраивание час-
тиц в ступени. Сравнение с экспериментом дает, однако, основание предпо-
лагать, что в некоторых случаях существенна также поверхностная диффузия
(Веппета, 1974). При ориентациях, сильно отличающихся от сингулярных
54
SESA Lab., ISSP RAS
ast@issp.ac.ru
граней, поверхность растущего кристалла обычно разбивается на макроуча-
стки (макроступени), составленные сингулярными гранями. В случае слабых
отклонений параметр анизотропии в (см. рис. 1.35, стр. 51) максимален для
направлений, близких к сингулярным минимумам.
Рис. 1.37. Линии равных концентраций (штриховые) и линии тока
(сплошные) в пограничном диффузионном слое, перпенди-
кулярном поверхности кристалла, над ступенчатой рас-
тущей поверхностью (см. также Соер, крист., 1980)
Кристаллизация из однокомпонентного расплава имеет много общего
с ростом из раствора, если массоперенос заменить на отвод теплоты кри-
сталлизации как через расплав, так и через кристалл, что бывает гораздо ча-
ще. Каждая ступень является цилиндрическим источником тепла, и темпера-
турное поле в кристалле у послойно растущей поверхности будет похоже на
концентрационное поле в растворе (рис. I.37), принимая при этом во внима-
ние теплопроводности кристалла и расплава, которые обычно на три порядка
выше значений коэффициента диффузии. Поэтому теплоотвод реализуется
гораздо быстрее, чем диффузия кристаллизующегося вещества. Кроме того,
значительно более низкие потенциальные барьеры для присоединения час-
тиц к кристаллу из расплава, чем из раствора, приводят в первом случае к
таким значениям кинетических коэффициентов, что при обычно используемых
переохлаждениях скорости роста из расплавов гораздо больше скоростей
роста из растворов. Например, в расплаве кремния, переохлажденном на АТ
= ГС т. е. при А// ~ 4,8-10'16 эрг, или безразмерной движущей силе /Ущ!кТ ~
2-10"3, скорость перемещения элементарных ступеней составляет десятки
сантиметров в секунду. В то же время под действием такой же движущей си-
лы в средне концентрированном растворе (~10’1) скорость передвижения сту-
пени находится, как правило, на уровне ~10'5-10’6 см/сек. Это связано не
55
SESA Lab., ISSP RAS
ast@issp.ac.ru
только с высоким потенциальным барьером, но и с небольшой плотностью
кристаллизующегося вещества в растворе по сравнению с кристаллом. Сле-
довательно, независимо от того, определяется ли скорость роста собственно
процессами кристаллизации, переносом частиц или теплоотводом, ступени
при росте из расплава при тех же Аи/кТ двигаются на несколько порядков
быстрее, чем в растворе.
SESA Lab., ISSP RAS
ast@issp.ac.ru
56
РОСТ РЕАЛЬНЫХ КРИСТАЛЛОВ
ДЕФЕКТЫ КРИСТАЛЛИЧЕСКОЙ СТРУКТУРЫ
У реальных кристаллов, в отличие от рассматривавшихся выше иде-
альных, всегда наблюдаются отклонения от периодичности в расположении
составляющих их частиц. Структурные дефекты классифицируют по их
размерности, принимая элемент структуры кристалла - атом, ион или моле-
кулу - за нулевой. Среди этих нарушений выделяют точечные (нульмерные),
линейные (одномерные), поверхностные (двумерные) и объемные (трехмер-
ные) дефекты.
К точечным дефектам относятся вакансии, или незанятые места в
структуре (рис. 1.38, 1), расположенные между узлами решетки ато-
мы/молекулы основного вещества (рис. I.38, 2), а также собственные и посто-
ронние частицы, замещающие в ней кристаллографические позиции или вне-
дряющиеся в междоузлия (позиции 3 и 4, соответственно, на рис. I.38). Такие
несовершенства появляются при тепловом движении или вхождении в кри-
сталл примесей с другой валентностью. При равном количестве вакантных
узлов решетки и атомов в междоузлиях они носят название дефектов по
Френкелю. Подобная ситуация в чистом виде, т. е. с равным количеством ва-
кансий и атомов в междоузлиях, имеет место лишь в кристаллах со стехио-
метрическим составом и редко наблюдается у окислов и ковалентных ве-
ществ. В ионных кристаллах возможны и дефекты по Шоттки - одновре-
менное образование вакансий как положительных, так и отрицательных ио-
нов, концентрации которых находятся в равновесии.
Нульмерные дефекты распределены в кристаллах неравномерно и
способны мигрировать: новая вакансия возникает в результате переноса со-
седнего атома в свободный узел, а междоузельные атомы в ряде случаев пе-
ремещаются исключительно по междоузлиям. Такого типа дефекты могут су-
ществовать в термодинамическом равновесии при конечной температуре.
Следовательно, кристалл всегда будет содержать точечные дефекты того или
иного вида.
SESA Lab., ISSP RAS
ast@issp.ac.ru
57
Рис. 1.38. Двумерная схема нульмерных дефектов в кристалле: 1 -
вакансия, 2 - междоузельный атом основного вещества, 3 -
примесный атом в узле решетки, 4 - чужеродный атом в
междоузлии
Линейные дефекты, или дислокации, связаны с разного рода смеще-
ниями уже большего числа атомов из нормальных узлов в промежуточные
между ними положения, например, под действием упругой деформации. Воз-
никновение дислокации можно представить, сдвигая одну часть кристалла
относительно другой на межатомное расстояние Ь, а затем снова соединяя
атомы на противоположных краях разреза (рис. I.39). Величина такого смеще-
ния характеризуется вектором Бюргерса Ь.
Рис. 1.39. Образование линейного дефекта при упругой
деформации
SESA Lab., ISSP RAS
Особенность этих дефектов обычно наглядно демонстрируется их
проекцией на плоскость. Через идентичные узлы решетки в идеальной кри-
сталлической структуре можно построить замкнутый контур, так называемый
контур Бюргерса, в котором количество "шагов" в положительном и отрица-
тельном направлениях будет равным вдоль каждой оси. Когда же при дефор-
мации контур разомкнется на отрезок, по абсолютной величине равный век-
тору Бюргерса, то это значит, что возникает одномерный дефект (рис. 1.40).
Как видно из рисунка, в кристалле появляется вертикально располо-
женная "лишняя" полуплоскость, край которой является линией, или осью
дислокации. Следовательно, такой тип несовершенств относят к линейным
дефектам. В этом частном случае вектор Бюргерса перпендикулярен к линии,
ограничивающей дополнительную полуплоскость, и такой одномерный де-
фект называется краевой дислокацией. Может быть "вставлено" и несколько
полуплоскостей, в результате чего увеличится и вектор Бюргерса. Наиболее
сильное искажение кристаллической решетки обычно распространяется на 2-
3 ее периода. Дислокации разделяют на положительные и отрицательные,
которые с их условными обозначениями представлены на рис. 1.40 справа и
слева, соответственно.
Рис. 1.40. Разомкнутый на отрезок b контур Бюргерса, выде-
ленный жирной линией, около двух краевых дислокаций
- положительной (справа) и отрицательной (слева) с
их условными обозначениями
Они могут перемещаться в кристаллах в направлении, перпендику-
лярном к "лишней" полуплоскости, за счет диффузии атомов или встречного
движения вакансий к ее краю (рис. 1.41). Поскольку скорость диффузии, как
правило, экспоненциально уменьшается с понижением температуры, то и ми-
грация дислокаций существенно усиливается при высоких ее значениях.
SESA Lab., ISSP RAS
ast@issp.ac.ru
59
0-00-0-0 -о- о -о- О -О- О
<^-<>-ф-Д-ф--о--6--6—6--ф
। । । । । । । ।
0--0 0 0-0-<У-0-0-0-0
а
I I I > I Illi!
0--0-00-0---0000-0
б
Рис. 1.41. Перемещение краевой дислокации в кристалле
Другую предельную разновидность линейных дефектов представляют
собой винтовые дислокации. В них, в отличие от краевых (рис. 1.42а), атомы
смещаются по схеме, показанной на рис. 1.426. Таким образом, только часть
верхнего блока атомов смещена на одно межплоскостное расстояние, а вто-
рая его половина осталась в исходном положении. Для кристалла Косселя это
иллюстрируется на рис. 1.43а и 1.436, соответственно. Линию раздела, вблизи
которой, естественно возникают сильные деформации, и называют винтовой
дислокацией, которая параллельна вектору Бюргерса.
а
Рис. 1.42. Смещение атомов при образовании краевой (а) и вин-
товой (б) дислокаций
60
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. 1.43. Схема образования краевой (а) и винтовой (б) дисло-
каций в кристалле Косселя
Более наглядное представление о ней дает рис. 1.44, где показанный
жирной линией контур Бюргерса, разомкнут на отрезок, по абсолютной вели-
чине равный вектору Ь. Краевые и винтовые дислокации - крайние разновид-
ности линейных дефектов. Чаще всего наблюдаются дислокации промежу-
точного типа, так называемые косые, или криволинейные дислокации.
Рис. 1.44. Контур Бюргерса (выделен жирной линией),
вектор Бюргерса b и ось (показана пунктиром)
винтовой дислокации
61
SESA Lab., ISSP RAS
ast@issp.ac.ru
Вектор Бюргерса вдоль дислокации остается неизменным, поэтому
она не может закончиться в кристалле. Появляются дислокации при дефор-
мациях в наиболее плотно упакованных плоскостях.
Энергия дислокации, обязанная деформациям вещества вблизи ее
ядра, зависит от механических свойств кристалла и прямо пропорциональна
квадрату вектора Бюргерса. Именно с этим связана энергетическая нерацио-
нальность дислокаций с большими (много больше параметров элементарной
ячейки кристалла) векторами Бюргерса. Поэтому тем или иным путем воз-
никшая дислокация с большим b во время роста обычно распадается на груп-
пу дислокаций, у которых сумма векторов Бюргерса равна вектору Бюргерса
исходной дислокации, а общая энергия меньше. Этим объясняется, напри-
мер, следующий факт: у кубических кристаллов бромата натрия, полученных
из водных растворов, иногда наблюдается зональность, фиксируемая по ано-
мальному двупреломлению. При достаточном увеличении под микроскопом
можно различить, что двупреломление распределено в этих зонах "кустико-
образно", вытянутыми линиями в направлении роста кристалла. На границе
зоны линии заканчиваются. По-видимому, образующиеся во время роста дис-
локации с большими векторами Бюргерса вызывают заметное двупреломле-
ние, а после их расщепления на более мелкие дислокации двупреломление
исчезает.
Взаимодействие между упругими полями возникших дислокаций с
одинаково направленными векторами Бюргерса приводит к их отталкиванию,
а дислокации с противоположными векторами Бюргерса притягиваются друг к
другу. Под действием внешних и внутренних напряжений в кристаллах дисло-
кации могут перемещаться. Их пространственная ориентировка зависит от
типа дислокаций и структуры кристаллов, от прочности химических связей в
разных кристаллографических направлениях. В результате всех указанных
процессов в кристалле возникает более или менее сложная пространственная
дислокационная сетка.
Концентрация дислокаций в достаточно однородных кристаллах, оп-
ределяемая числом дислокаций, пересекающих 1 см2 данной поверхности,
имеет обычно величину порядка 10-105 см'2, а у деформированных - 106-1012
см'2. С ростом температуры происходит относительно быстрое их перерас-
пределение и уменьшение числа. Это используется в практических целях для
снятия напряжений и называется "отжигом" кристалла. Нужно заметить, что в
случае заметного количества примесей в кристалле, они способны сущест-
венно снизить подвижность дислокаций.
Повышенная концентрация примесей вблизи ядра дислокации часто
называется "облаком Котрелла". В этой области вещество обладает и боль-
шей химической активностью. Следовательно, плавление, окисление, раство-
рение всегда начинается на дефектах и идет более интенсивно вдоль них. На
этом основан наиболее доступный способ выявления дефектов травлением,
62
SESA Lab., ISSP RAS
ast@issp.ac.ru
т. е. при медленном растворении кристалла. По форме возникающих ямок
травления, как правило, можно судить о породивших их дефектах. Так, на по-
верхности кристалла всегда можно различить два типа ямок. Первый тип -
это ямки с "острым" дном, т. е. пирамидальные, углубляющиеся по мере рас-
творения кристалла и появляющиеся вновь на прежних местах после поли-
ровки и повторных протравливаний поверхности. Они возникают на выходах
дислокаций, как винтовых, так и краевых. Смещение вершины пирамиды в
ходе травления относительно центра такой ямки указывает на отклонение оси
дислокации от нормали к поверхности грани. Второй тип ямок имеет плоское
дно в форме полой усеченной пирамиды. Эти ямки существуют кратковре-
менно и быстро исчезают в процессе растворения. Они образуются обычно в
местах скопления точечных дефектов.
Несколько забегая вперед, следует отметить, что выходы винтовых
дислокаций на поверхность кристалла играют большую роль при его росте.
Группы дислокаций и отдельные из них могут играть роль центров роста
грани.
К поверхностным дефектам относят границы зерен и двойников в мо-
нокристаллах, контакты между твердыми фазами и внешние поверхности кри-
сталлов. Как одномерные, так и двумерные дефекты, в отличие от точечных,
метастабильны и возникают при росте, механической деформации или вслед-
ствие термической обработки кристалла.
Объемные дефекты нарушают монокристалличность вещества, т. е.
трансформируют его в гетерогенную систему, поскольку связаны с образова-
нием побочной фазы. Все эти нарушения сказываются как на структурно-
чувствительных свойствах кристаллов, хотя трехмерные дефекты в меньшей
степени, так и отражаются на особенностях их роста.
ДИСЛОКАЦИОННЫЙ МЕХАНИЗМ РОСТА
Тангенциальные скорости роста гладкой грани идеального кристалла
при послойном росте пропорциональны интенсивности перемещения ступе-
ней на поверхности. Скорость роста в нормальном направлении зависит от
частоты возникновения двумерных зародышей, вероятность возникновения
которых определяется значением работы их образования. Факторами, сни-
жающими энергетический порог формирования зародышей и соответственно,
способствующими повышению скоростей роста, являются адсорбированные
на поверхности кристалла атомы или частицы, а также дислокации. В резуль-
тате кристаллы растут с заметными скоростями при пересыщениях, на поря-
док меньших теоретически рассчитанных значений.
Согласно теории Бартона-Франка-Кабреры, винтовая дислокация, вы-
ходящая на грань, создает на ней не зарастающую ступеньку, которая в про-
цессе роста перемещается параллельно самой себе за счет присоединения
63
атомов (рис. 1.45). При этом необходимости в формировании двумерных за-
родышей уже нет. Адсорбированные поверхностью кристалла атомы диф-
фундируют сначала к ступеньке, а затем и к изломам, где встраиваются в
структуру кристалла.
Рис. 1.45. Рост грани кристалла, содержащей
выход винтовой дислокации
В процессе роста форма ступени будет меняться в результате посте-
пенного уменьшения угловых скоростей перемещения ее участков по мере
удаления от точки выхода винтовой дислокации при сохранении значений ли-
нейных скоростей. В результате, со временем, исходная прямолинейная сту-
пень приобретает форму спирали, обеспечивающую постоянство угловой
скорости вращения вокруг точки зарождения. Дальнейший рост осуществля-
ется путем спирально-слоистого отложения вещества, увеличивающего число
оборотов спирали. Толщина слоев может изменяться в весьма широких пре-
делах - от одного параметра элементарной ячейки до нескольких тысяч таких
параметров.
На грань кристалла выходит большое число дислокаций, различаю-
щихся по своей способности генерировать ступени. При относительно ста-
бильных условиях роста на поверхности грани остается лишь несколько (или
даже один) центров роста. При повышении пересыщения дополнительно мо-
гут активизироваться сразу несколько новых мелких центров.
Краевая дислокация, выходящая на поверхность, не дает ступени. Но,
с одной стороны, в точке ее выхода на поверхность возможна адсорбция
примесей или макрочастиц, что в свою очередь, будет облегчать образование
двумерных зародышей. С другой, вокруг краевых дислокаций создается поле
значительных механических напряжений, наличие которых локально повыша-
64
SESA Lab., ISSP RAS
ast@issp.ac.ru
ет свободную энергию кристалла, при малых пересыщениях эти напряженные
участки оказываются термодинамически неустойчивыми: на них вместо роста
может наблюдаться растворение или возгонка кристалла.
В целом, любые нарушения на гладких гранях способствуют росту
кристалла, минуя энергозатратный процесс двумерного зародышеобразова-
ния. Однако постоянное увеличение скорости роста вызывает огрубление по-
верхностей граней, проявляющееся в большом числе ступенек, различимых
невооруженным глазом. При этом рост происходит уже не путем послойного
заполнения всей поверхности, а одновременно в различных ее местах. И со
временем, столь высокие скорости граней с повышенной концентрацией де-
фектов, приводят к их выклиниванию.
Детальное исследование микроморфологии реальных поверхностей
показало, что почти во всех случаях на этих поверхностях уже имеется боль-
шое число ступенек различной высоты и спиралей роста. Впервые такие спи-
рали были обнаружены Г.Г. Леммлейном в 1945 году.
ВХОЖДЕНИЕ ПРИМЕСЕЙ
Примеси, присутствующие в исходной среде или кристалле, оказыва-
ют влияние как на перенос вещества в объеме раствора, так и на процессы,
протекающие на поверхности растущего кристалла. В последнем случае они
воздействуют наиболее сильно, поскольку адсорбируются в любых положе-
ниях - в изломах, на ступенях, на гладких участках граней. Их концентрация
зависит от энергии адсорбции различными участками твердой фазы.
В 30-х годах прошлого столетия в трудах В.М. Гольдшмидта и А.Е.
Ферсмана были сформулированы правила "допуска" и "захвата" изоморфных
примесей в минералах, которые распространяются и на синтетические соеди-
нения. Согласно им замещающий ион меньшего размера или большего заря-
да "захватывается" кристаллической структурой и накапливается в ней, а ион
большего размера или меньшего заряда структурой "допускается" и, следова-
тельно, накапливается в остаточном расплаве или растворе (Goldschmidt,
1958). А. Е. Ферсман отмечал, что в первую очередь из расплава или раство-
ра выпадают в кристаллическую фазу те компоненты, которые увеличивают
абсолютную величину энергии ионной структуры. В ряде случаев правила
Гольдшмидта-Ферсмана согласуются с эмпирическими данными по геохимии
отдельных элементов, однако они не носят характера абсолютного закона, и
существует много фактов, находящихся в противоречии с ними.
В теоретических работах распределение изоморфных примесей
обычно анализируется для трех возможных условий - равновесных, близких к
равновесным и в условиях, относительно далеких от равновесия. Равновес-
ное распределение химических элементов между расплавом и твердой фазой
основывается на принципе равенства химических потенциалов всех компо-
65
SESA Lab., ISSP RAS
ast@issp.ac.ru
нентов в равновесно сосуществующих фазах. Однако экспериментально рав-
новесные условия практически не достижимы, и процессы распределения
примеси протекают, в основном, в условиях, близких к равновесным. В этом
случае процесс более сложен и связан с кинетическими явлениями, происхо-
дящими как в объеме раствора, так и на границе раздела фаз.
В ситуации, когда кристаллизация происходит недостаточно медлен-
но, так что примесь не успевает диффундировать в объем жидкой фазы, у
фронта роста создается градиент концентрации, а в дальнейшем идет обога-
щение элементом-примесью и других участков расплава за счет процессов
диффузии и механического перемешивания. Для характеристики распределе-
ния примеси при неравновесном процессе вводится понятие эффективного (в
противоположность равновесному) коэффициента распределения Keff, кото-
рый определяется отношением содержания примеси в кристалле к ее концен-
трации в жидкости. Величина Keff может меняться в значительных пределах и
имеющие место отклонения связаны обычно с различной растворимостью
примеси и основного соединения. В системах с коэффициентом распределе-
ния К<1 по мере увеличения переохлаждения захват примеси увеличивается,
для систем с К>1 - уменьшается. Эффективные коэффициенты распределе-
ния всегда ближе к единице по сравнению с равновесными величинами в свя-
зи с чем, при больших скоростях кристаллизации и недостаточном перемеши-
вании, накопление примеси к концу кристаллизации уменьшается.
При росте смешанных кристаллов примесь может сосредотачиваться
исключительно, на определенных гранях кристалла и входить в соответст-
вующие пирамиды роста. В частности, селективное распределение изоморф-
ных примесей по кристаллу с образованием структуры "песочных часов", так
называемая векториальная неоднородность (рис. I.46), наблюдалось при ис-
следовании природных кристаллов топаза, аметиста, барита, авгита, гипса.
Рис. 1.46. Пирамиды роста в кристалле ромбической сингонии
(по Леммлейну, 1973)
SESA Lab., ISSP RAS
ast@issp.ac.ru
66
Для оценки степени адсорбции составных частей раствора можно ис-
пользовать правило Панета: на кристалле наиболее прочно удерживаются
(фиксируются) те ионы, которые образуют с его компонентами наименее рас-
творимое соединение. В частности, скорость роста кристаллов AIK - квасцов
существенно уменьшается при ведении в раствор группы (ОН)’, поскольку при
этом образуется плохо растворимая гидроокись алюминия А1(ОН)3. Следова-
тельно, увеличение кислотности противодействует этой тенденции, и ско-
рость роста кристаллов возрастает. Среди органических примесей обычно
сильно адсорбируются красители, так как содержат много ненасыщенных хи-
мических связей.
Селективная адсорбция примеси разными гранями кристалла в ряде
случаев приводит к изменению как его габитуса, так и огранки в целом. На
рис. 11.47 представлены три основных типа развития пирамид нарастания
грани Ь. Пусть из чистого раствора растет кристалл только с гранями формы
а. Грань b появляется лишь в присутствии некоторой примеси. Если кристал-
лизация протекает в большом объеме или в непрерывном токе свежего рас-
твора, то в процессе роста обеспечивается непрерывное поступление приме-
си к поверхности растущего кристалла, и грань b будет расти с неизменной
скоростью (рис. 11.47, 7). При К<1 кристалл поглощает примесь относительно
меньше, чем ее содержится в растворе, и последний, в свою очередь, этой
примесью обогащается, грань b увеличивается в размере (рис. II.47, 2). Нако-
нец, на рис. II.47, 3 продемонстрирован случай, когда грань b постепенно вы-
клинивается в процессе роста. Следовательно, имеет место обратное соот-
ношение: кристалл поглощает примесь относительно больше, чем ее находи-
лось в растворе.
7 2
Рис. 1.47. Секториальное строение кристалла типа мальтийского
креста (по Леммлейну, 1973)
Примесь захватывается по-разному не только различными гранями, но
и не равномерно распределяется в пределах одной пирамиды роста из-за ко-
лебаний внешних условий. В результате образуются слои, параллельные гра-
67
SESA Lab., ISSP RAS
astQissp.ac.ru
ням с разной концентрацией примеси. Такая неоднородность называется зо-
нарным (полосчатым) строением кристалла.
Влияние примеси сказывается не только на макроморфологии кри-
сталла, но и на скульптуре его граней. В частности, присутствие в растворе
квасцов концентрированной соляной кислоты НО приводит к появлению гра-
ней пентагон-додекаэдра {210}. Примеси, адсорбируясь на поверхности, ме-
няют не только скорости роста граней и облик всего кристалла в целом, но и
морфологию послойно растущей грани. Например, грани куба щелочно-
галоидных кристаллов, растущих из водных растворов, покрыты крупными
ступенями, из-за чего они содержат много включений. Добавление в раствор
двухвалентных тяжелых ионов (Pb, Си, Sn и др.) превращает поверхность
роста в гладкую. Примеси, химически сходные с кристаллизующимся вещест-
вом и содержащие с ним общий ион, заметным образом не влияют на форму
кристаллов.
68
SESA Lab., ISSP RAS
ast@issp.ac.ru
II ТЕХНИЧЕСКИЕ ПРИЕМЫ
69
SESA Lab., ISSP RAS
КРИТЕРИИ ВЫБОРА СПОСОБА ВЫРАЩИВАНИЯ КРИСТАЛЛОВ
В общих чертах, многочисленные методы выращивания монокристал-
лов можно разделить на три большие группы как по способу выражения дви-
жущей силы кристаллизации (д.с.к.), так и по фазовому состоянию и составу
исходной среды. Принимая во внимание общепринятые принципы представ-
ления д.с.к., т. е. через переохлаждение расплава, пересыщение раствора
или пара, все методы, соответственно, распределяются по следующим кате-
гориям:
(1) выращивание монокристаллов из расплава, Л.Н(ДТ/Т0);
(2) выращивание монокристаллов из растворов, Д//= RTACIC0',
(3) кристаллизация из паровой (газовой) фазы, Д//= RT(APIP0).
В первом случае исходная среда представляет собой в идеале одно-
компонентную жидкость, а во втором - более сложную. Газофазная кристал-
лизация может осуществляться как из собственного пересыщенного пара, так
и из многокомпонентных систем. Изменение целого ряда параметров позво-
ляет перевести эти системы в неравновесное состояние.
В подавляющем большинстве методов процесс кристаллизации
управляется температурными условиями. При изменении давления, в частно-
сти, синтезируют новые фазы в результате полиморфных превращений (на-
пример, превращение графит-алмаз). Поскольку растворимость также зависит
от давления, то его вариации могут переводить систему из равновесного в
неравновесное состояние. Изменение концентрации кристаллизуемого веще-
ства может также провоцировать ее пересыщение. Снижение парциального
(индивидуального) давления паров растворителя над раствором ниже равно-
весного приводит к испарению растворителя и изменению концентрации рас-
твора. Электрический потенциал обуславливает химические реакции, которые
могут создавать концентрации нового вещества, превышающие равновесные,
например, электрохимические реакции, приводящие к получению металличе-
ских кристаллов. Гравитационный потенциал определяет разделение компо-
нентов среды по плотностям, что может приводить к созданию областей,
имеющих концентрацию некоторых компонентов выше равновесной.
Перечисленные факторы по-разному связаны с химическими потен-
циалами в среде и в кристалле. Поэтому для создания и поддержания необ-
ходимого постоянства д.с.к. нужны технические средства различной сложно-
сти. В связи с этим, хотя для получения кристаллической фазы одного и того
70
SESA Lab., ISSP RAS
же вещества можно предложить несколько методов, выбирают наиболее со-
ответствующий целям и возможностям.
Важную роль играет характер изменения д.с.к. в кристаллизационной
среде и во времени. Если она меняется лишь в среде, но стабильна во вре-
мени, то имеет место стационарный режим роста. В том случае, когда хими-
ческий потенциал изменяется как от точки к точке в среде, так и во времени,
то имеет место нестационарный режим кристаллизации. Получаемые в ста-
ционарном режиме кристаллы будут наиболее однородными, поскольку изме-
нения любых параметров (температуры, концентрации примесей и др.) нега-
тивно сказываются на ходе процесса роста.
Более детальное деление методов выращивания кристаллов учиты-
вает способ создания метастабильного состояния системы и поддержания
движущей силы кристаллизации на заданном уровне. Технические решения
зависят от выбранных устройств и характеризуется приемами работы, сово-
купностью и последовательностью применяемых операций, а также значе-
ниями параметров кристаллизации и режимами работы. Принимаются во
внимание концентрации вещества, пересыщение, температура, давление,
режимы перемешивания и т. д.
Критерии, которыми руководствуются при выборе метода выращива-
ния кристаллов, учитывают, как минимум, три момента:
(1) природу кристаллизуемого вещества, т. е. характер плавления, наличие
фазовых переходов, химическую активность и т. д.,
(2) технико-экономические показатели метода (сложность и стоимость ап-
паратуры, тип конструкционных материалов и др.),
(3) требования к реальной структуре, геометрической конфигурации и раз-
мерам получаемого монокристалла.
В любом из методов управляемой кристаллизации необходимо со-
блюдать, по крайней мере, три условия:
(1) создание метастабильного состояния в пределах требуемых значений
д.с.к.,
(2) введение затравки или ее формирование в кристаллизационной среде,
(3) обеспечение массопереноса.
Основные этапы экспериментов по выращивании кристаллов:
(1) приготовление исходной шихты (очистка, взвешивание, гомогенизация и
т. д.),
(2) подготовка затравки необходимого качества, размеров, конфигурации и
оптимальной кристаллографической ориентации,
(3) нагрев - охлаждение кристаллизационной камеры,
(4) контроль стабильности условий роста.
Процессу выращивания монокристаллов предшествует кропотливая
подготовительная работа: 1) очистка исходного сырья; 2) подбор легирующей
примеси; 3) приготовление расплава, раствора и т. п., фиксирование pH сре-
71
SESA Lab., ISSP RAS
ast@issp.ac.ru
ды; 4) подбор состава среды, в которой происходит кристаллизация (вакууми-
рованной, инертной, водородной и т. п.); 5) выращивание или приготовление
затравочных кристаллов необходимой формы и достаточной степени совер-
шенства; 6) выбор материала сосуда (в частности, тигля), в котором происхо-
дит кристаллизация; 7) монтаж затравочных кристаллов; 8) подготовка и пе-
ремешивание раствора или расплава; 9) выбор нагревательного устройства
(печи); 10) обеспечение правильного отвода тепла; 11) выбор устройства для
равномерного относительного перемещения кристалла в печи; 12) ста-
билизация и управление температурой кристаллизации; 13) учет и ис-
пользование закона геометрического отбора; 14) борьба с по-
сторонними кристаллами ("паразитами"); 15) обеспечение стерильности
на всех этапах подготовки и проведения процесса кристаллизации; 16) из-
влечение выращенных монокристаллов.
Перечисленные условия должны быть учтены для успешного решения
задачи получения кристаллов, отвечающих определенным требованиям. В
этих же целях уже выращенный кристалл подвергается последующей обра-
ботке: отжигу, контролю дефектов, обработке его объема и поверхности. Оче-
видно, что успешное решение задачи получения монокристаллов очень часто
может оказаться под силу лишь большому коллективу научных и технических
сотрудников ряда смежных специальностей.
К настоящему времени разработано много различных методов выра-
щивания кристаллов из расплавов в условиях изменения температуры при
неподвижном тигле (метод Киропулоса и др.); перемещения кристалла в тем-
пературном градиенте (метод Чохральского); перемещения тигля или печи в
температурном градиенте (метод Бриджмена-Стокбаргера; бестигельные ме-
тоды (метод Вернейля); методы зонной кристаллизации, как тигельные, так и
бестигельные.
В основе классификации методов выращивания кристаллов из рас-
творов всегда лежит способ задания пересыщения, в связи с чем различают
метод кристаллизации путем изменения температуры раствора в динамиче-
ском и статическом режимах, метод испарения растворителя, кристаллиза-
цию при тепловой конвекции раствора, в частности гидротермальный метод,
электрокристаллизацию и др.
Кристаллизацией из парообразного состояния получают сравнительно
совершенные кристаллы, но чаще эпитаксиальные пленки. Известно несколь-
ко приемов получения кристаллов из газовой фазы: путем сублимации данно-
го вещества, методом химических реакций в газе и химических транспортных
реакций.
Кристаллизацией вещества из твердого состояния пользуются значи-
тельно реже, чем из жидкого; отчасти, поэтому методы перекристаллизации
менее разработаны.
72
SESA Lab., ISSP RAS
ast@issp.ac.ru
В последнее время особым вниманием пользуются способы получе-
ния кристаллов из паров, жидкостей и твердого вещества путем химических
реакций. Обыкновенно кристаллический осадок выпадает в виде порошка из
очень мелких кристаллов. Однако если замедлить реакцию, то последующие
порции выделяющегося вещества осаждаются на уже готовые кристаллики, и
последние будут расти.
Различные процессы кристаллизации имеют много общего. Кристал-
лы, выращенные из водных растворов, из высокотемпературных растворов в
расплавах, из газовой фазы и с помощью электролиза, обладают сходными
особенностями роста. Благодаря общим чертам процессов кристаллизации,
например, успешное развитие получили комбинация метода Чохральского и
раствор-расплавной кристаллизации; использование метода Стокбаргера при
кристаллизации из газовой фазы; применение идеи зонной плавки в раствор-
расплавной кристаллизации; предложено много вариантов метода Вернейля
и т. п.
Работа по автоматизации процессов кристаллизации ведется, в сущ-
ности, вокруг ограниченного числа веществ, кристаллы которых наилучшим
образом зарекомендовали себя в соответствующих областях науки и техники.
Это, прежде всего, тугоплавкие материалы, кристаллизующиеся при высоких
температурах: нелинейно-оптические ниобаты и танталаты Li; совершенные
подложки из лейкосапфира (для эпитаксиального наращивания кремния) из
GdGa-граната (для пленок магнитной памяти); сверхтвердые материалы; YAl-
гранат (для лазерной техники); GdMoO4 и многие полупроводниковые кри-
сталлы. В совершенстве разработана технология выращивания гидро-
термальным методом монокристаллов кварца. Большую остроту приобрела
проблема получения высококачественных кристаллов алмаза и других мате-
риалов.
73
SESA Lab., ISSP RAS
ast@issp.ac.ru
КРИСТАЛЛИЗАЦИЯ ИЗ РАСПЛАВА
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
Выращивание кристаллов из собственных расплавов в исследова-
тельских лабораториях и в промышленности основаны на тех же закономер-
ностях, которые характерны для природных систем. Главное отличие состоит
в том, что экспериментатор или технолог имеет дело с более простыми по
химическому составу кристаллизационными средами, их объем ограничен
размерами кристаллизатора, а продолжительность процесса обычно не пре-
вышает нескольких суток. Поэтому в настоящее время большинство техниче-
ски важных объемных кристаллов получают из расплава, конечно, лишь в том
случае, если физико-химические свойства кристаллизуемого соединения по-
зволяют это сделать.
Фазовые соотношения в системе исходная среда - кристалл опреде-
ляются температурой, давлением и концентрациями компонентов, или хими-
ческими потенциалами кристалла (/4) и среды (/4). Для однокомпонентных
систем кристалл-расплав при температурах (7) и давлениях (Р), отвечающих
равновесному состоянию, равенство химических потенциалов записывается в
виде:
//С(Р,Т) = щ(Р,Т).
В случае расплава д.с.к. А// слабо зависит от давления и для состоя-
ний, близких к равновесным, выражается приближенным соотношением:
А//= АН(дТ/Т0),
где АН- скрытая теплота плавления, То- температура плавления, а АТ = Т-
То — переохлаждение.
Таким образом, как следует из приведенных рассуждений, чтобы на-
чалась кристаллизация собственного (однокомпонентного) расплава, его дос-
таточно слегка переохладить ниже температуры плавления. Это действи-
тельно произойдет, если в исходной среде уже есть центры кристаллизации.
В противном случае система может оставаться в состоянии метастабильного
равновесия, поскольку для образования зародышей новой фазы требуются
определенные энергетические затраты. Именно в пределах метастабильной
области возможно управляемое, т. е. контролируемое экспериментатором,
выращивание монокристаллов.
Методы выращивания монокристаллов из расплава условно можно
разделить на две группы: 1) методы с большим объемом расплава (методы
SESA Lab., ISSP RAS
ast@issp.ac.ru
74
Киропулоса, Чохральского, Стокбаргера, Бриджмена) и 2) методы с малым
объемом расплава (методы Вернейля и зонной плавки). Некоторые из них
рассмотрены ниже.
МЕТОД ЧОХРАЛЬСКОГО
В методе Чохральского д.с.к. создается за счет локального переохла-
ждения поверхности расплава в месте контакта с затравочным кристаллом
или теплоотводящим металлическим стержнем, а сам кристалл по мере роста
равномерно перемещается (вытягивается) вверх (рис. 11.1). Процесс протека-
ет в специальной камере, из которой откачивается воздух. С целью частично-
го подавления испарения расплава она может заполняться аргоном, гелием
или азотом с добавлением 1-2% кислорода. Необходимый температурный
режим поддерживается за счет высокочастотного или резистивного нагрева.
Рис. 11.1. Схема выращивания кристаллов методом
Чохральского (по Шаскольской, 1976)
75
SESA Lab., ISSP RAS
Особенность этого метода состоит также в том, что фронт кристалли-
зации находится несколько выше общего зеркала расплава, а именно на вы-
соту / столбика жидкой фазы, удерживаемой силой поверхностного натяже-
ния:
/ = 2<у/грд,
где ст - удельное поверхностное натяжение, г - радиус фронта кристаллиза-
ции, р - плотность расплава, ад- ускорение свободного падения. Верхний
предел скорости роста лимитируется максимально допустимой интенсивно-
стью отвода теплоты через кристалл в окружающее пространство. Важно со-
блюдать равенство скоростей роста и вытягивания кристалла. Возрастание
скорости вытягивания при сохранении заданного температурного градиента
приводит к уменьшению диаметра кристалла и, в конечном счете, вызывает
его отрыв от расплава. В противоположном случае, чрезмерное увеличение
площади фронта роста нарушает стабильность процесса и приводит к обра-
зованию поликристаллического агрегата. Определяющую роль при получении
совершенных кристаллов играет форма фронта кристаллизации. При плоской
границе раздела между твердой и жидкой фазой возникает минимальный ра-
диальный температурный градиент, а тепловой поток направлен к растущему
кристаллу снизу, т. е. изотермы располагаются перпендикулярно направле-
нию роста, что благоприятствует формированию монокристалла с малым ко-
личеством дефектов.
Выращивание кристаллов начинается с подготовки исходной шихты:
расчета ее состава, отжига, взвешивания и наплавления в тигель (чаще всего
изготовленного из иридия) для максимального заполнения его объема, а так-
же сборки по периферии тигля теплового узла из огнеупорного материала,
обеспечивающего необходимое распределение температуры в расплаве и в
зоне кристаллизации. Затем монтируется затравка на кристаллодержателе с
таким расчетом, чтобы она оказалась на расстоянии 5-10 мм над ожидаемым
зеркалом расплава, создается вакуум или соответствующая атмосфера в
кристаллизационной камере. Содержимое тигля плавится, и расплав выдер-
живается при постоянной температуре 2-3 часа для его гомогенизации.
Ответственной процедурой является затравливание и формирование
конуса кристаллической були, т. е. переход от затравки к заданному диаметру
кристалла. Для этого после погружения вращающейся затравки в расплав на
глубину 1-2 мм температура в зоне контакта постепенно понижается, что соз-
дает переохлаждение для начала кристаллизации. Затем кристаллодержа-
тель поднимается с такой скоростью, при которой монокристалл равномерно
разрастается в виде конуса до необходимого сечения були, обычно состав-
ляющего половину диаметра тигля с расплавом. Скорость вытягивания
зависит от физико-химических характеристик кристаллизуемого вещества и
диаметра монокристалла (були). В качестве достоинств этого метода необхо-
димо отметить: 1) отсутствие контакта со стенками тигля, что позволяет полу-
чать ненапряженные кристаллы, 2) возможность извлечения кристалла на
любом этапе выращивания, 3) возможность изменения геометрической фор-
мы кристалла при варьировании температуры расплава и скорости вытягива-
76
SESA Lab., ISSP RAS
ast@issp.ac.ru
ния. Последнее используется для получения малодислокационных и бездис-
локационных кристаллов. К недостаткам этого метода можно отнести разо-
греваемый контейнер, что может являться источником загрязнения расплава.
Для метода Чохральского, который является, самым распространен-
ным способом промышленной кристаллизации, создана система полной ав-
томатизации процесса, управляемая компьютером. Она основана на точном и
непрерывном взвешивании выращиваемого кристалла и/или тигля с распла-
вом и оперирует плотностью расплава и кристалла, его диаметром, скоростью
вытягивания.
Используя этот метод, можно вытягивать кристалл через так назы-
ваемую фильеру. Она представляет собой поплавок - формообразователь на
поверхности расплава и позволяет выращивать монокристаллы сложных гео-
метрических форм, включая пустотелые трубки, нити и т. д. Например, ско-
рость вытягивания монокристаллических корундовых волокон диаметром 0,1
мм достигает 50 см/мин.
МЕТОД КИРОПУЛОСА
Метод Киропулоса по своей сути близок к методу Чохральского. В
расплав, находящийся в соответствующем тигле, вводится затравка. Кристалл
растет на ней за счет того, что изотерма плавления вещества перемещается
от него вниз по тиглю. Это часто достигается простым охлаждением затравки
через держатель, который обеспечивает большой теплоотвод с поверхности.
Также тигель можно перемещать в зоне температурного градиента или пони-
жать температуру печи, создавая соответствующий перепад температуры
вблизи затравки. Существуют два варианта этого метода - со спонтанным за-
рождением, либо кристаллизация на затравку, опускаемую сверху до сопри-
косновения с расплавом. В первом случае обычно предусматривается ло-
кальное охлаждение дна контейнера водой или струей холодного газа. Такой
способ позволяет закристаллизовать весь объем расплава в условиях пони-
женных температурных градиентов.
Метод Киропулоса отличается от метода Чохральского следующим:
1. Фронт кристаллизации по Киропулосу ниже зеркала расплава, в от-
личие от метода Чохральского.
2. Метод Киропулоса более пригоден для выращивания кристаллов с
большим отношением диаметра к высоте, тогда как метод Чохральского удоб-
нее для получения кристаллов с большим отношением высоты к диаметру.
3. В методе Киропулоса сложнее контролировать направление роста и
размер кристаллов, чем при методе Чохральского.
4. В этом случае проще оборудование, поскольку, как правило, не
осуществляется вытягивание кристалла.
77
SESA Lab., ISSP RAS
ast@issp.ac.ru
При сравнительно простом техническом оформлении этим методом
выращивают весьма совершенные и достаточно крупные кристаллы некото-
рых металлов, солей щелочно-галоидных соединений, которые в настоящее
время находят широкое применение в оптике, радиотехнике, ядерной физике
и других отраслях науки и техники.
Качество выращенных кристаллов зависит от ряда условий: скорости
и равномерности отвода тепла (интенсивности циркуляции охладителя в хо-
лодильнике), чистоты исходного вещества, совершенства затравки, площади
контакта между холодильником и затравкой и т. д. Некоторые из этих приме-
ров не поддаются предварительному учету и выявляются только на практике.
При неправильном подборе скорости циркуляции охладителя (чаще всего во-
ды) резко ухудшается однородность кристалла. Ацентричность затравки при-
водит к искажению его формы, а неудачный режим ее оплавления и регене-
рации - к поликристаллизации.
Установка чаще всего состоит из печи сопротивления с холодильни-
ком, который представляет собой полый латунный цилиндр с вмонтированной
в него трубкой, охлаждаемой проточной водой. Предусмотрено приспособле-
ние для вращения холодильника вместе с растущим кристаллом, а также
система регулирования затравки по высоте, которая позволяет перемещать
холодильник по вертикали. В этом случае неоднородность температурного
поля, а, следовательно, и градиент движущей силы кристаллизации вокруг
растущего кристалла сказываются в меньшей степени.
Более подробно рабочая часть кристаллизационной установки пред-
ставлена на рис. II.2.
Рис. 11.2. Рабочая камера печи (1) и тигель с рас-
плавом и растущим кристаллом (2)
78
SESA Lab., ISSP RAS
ast@issp.ac.ru
Внутри алундовой трубы со спиральным нагревательным элементом
установлен тигель с исходной шихтой. Во время роста температурный режим
в печи контролируется таким образом, чтобы избежать начала кристаллиза-
ции в самом тигле, но вместе с тем не дать раствориться кристаллу, находя-
щемуся на теплоотводе. Регулируя температуру в печи и интенсивность ох-
лаждения штока, добиваются небыстрого устойчивого роста монокристалла
на теплоотводе. Эксперимент может продолжаться от нескольких часов до
нескольких суток в зависимости от типа кристаллизуемого вещества и скоро-
сти роста.
МЕТОД БРИДЖМЕНА-СТОКБАРГЕРА
Метод Стокбаргера-Бриджмена, или метод направленной кристаллиза-
ции, отличается от вышеописанных методов Киропулоса и Чохральского тем,
что закристаллизовывается весь объем расплава, помещаемого, как правило,
в цилиндрический контейнер. Этот метод технически прост и позволяет вы-
ращивать кристаллы заданного диаметра подбором соответствующего тигля.
Кристаллизация может осуществляться перемещением контейнера через зо-
ну плавления или плавным снижением температуры в условиях постоянного
градиента температурного поля (кристаллизация в вертикальном направле-
нии и горизонтальная направленная кристаллизация соответственно).
Наиболее часто применяется кристаллизация вертикальным переме-
щением (сверху вниз) контейнера с веществом через зону плавления. В этом
случае тигель с шихтой медленно опускается из высокотемпературной части
печи Т-1 в низкотемпературную Т2 через диафрагму (рис. 11.3).
Метод Стокбаргера-Бриджмена позволяет выращивать кристаллы, как
в результате спонтанного зародышеобразования, так и на затравках. В пер-
вом случае дну контейнера придают коническую форму. Кристаллизация на-
чинается в суженной донной части тигля. По мере опускания тигля в холод-
ную зону в вершине конуса возникают немногочисленные центры кристалли-
зации. В результате геометрического отбора остается один кристалл, кото-
рый, разрастаясь, занимает все сечение контейнера (рис. 11.4).
Иногда, для обеспечения выращивания единственного кристалла, на
некотором расстоянии от дна тигля делают еще одно сужение (рис. II.4е).
Как отмечалось выше, выращиваемые этим методом монокристаллы
принимают форму тигля. Поэтому в них неизбежны напряжения, которые ино-
гда приводят к растрескиванию монокристалла. Второй существенный недос-
таток метода Бриджмена-Стокбаргера заключается в невозможности контро-
ля ориентации кристалла. Несмотря на это, методы направленного охлажде-
ния контейнера с расплавом широко используются, т. к. позволяют путем
применения разного рода диафрагм и систем дополнительного нагрева
управлять температурными градиентами, особенно в зоне роста кристалла.
SESA Lab., ISSP RAS
ast©issp.ac.ru
79
Рис. 11.3 Схема метода направленной кристаллизации: 1 - нагре-
ватель; 2 - тигель; 3 - расплав; 4 - кристалл
Рис. 11.4. Приготовление монокристаллической затравки
методом геометрического отбора: а - кониче-
ская верхушка для "естественного" отбора; б -
отбор с помощью сужения; в - кварцевый ти-
гель с узкой изогнутой трубкой для отбора
Метод Стокбаргера-Бриджмена используется для выращивания широ-
кого класса веществ. Наиболее часто он применяется для получения метал-
лических, органических, а также ряда диэлектрических монокристаллов: оки-
слов, фторидов, сульфидов, галогенидов и др.
80
SESA Lab., ISSP RAS
ast@issp.ac.ru
ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ИЗ НИЗКОТЕМПЕРАТУРНЫХ РАСТВОРОВ
КЛАССИЧЕСКИЕ РАЗНОВИДНОСТИ МЕТОДА
К низкотемпературным растворам обычно относят такие среды, в ко-
торых кристаллизация осуществляется ниже 100°С, т.е. температуры кипения
воды - самого распространенного растворителя. Благодаря относительной
технической доступности и возможности широкого варьирования ростовых
параметров, этот способ выращивания кристаллов является наиболее рас-
пространенным.
В широком смысле под раствором подразумевается макроскопически
гомогенная смесь разных веществ. Получение кристаллов традиционно осно-
вано на бинарных системах, в которых жидкость является растворителем, а
другое соединение - растворяемым компонентом. Практически в любой тако-
го рода системе, помимо двух основных компонентов, в подчиненном количе-
стве содержатся примеси. Зачастую, с той или иной целью, их вводят в рас-
твор намеренно. Следовательно, при выращивании из растворов химический
состав кристаллов значительно отличается от состава исходной жидкой фа-
зы. На ход кристаллизации существенное влияние оказывает состав раство-
рителя. В частности, возможность его адсорбции на растущей поверхности
изменяет характер гетерогенных реакций на межфазной границе кристалл-
раствор.
В основу выращивания кристаллов из растворов положена зависи-
мость растворимости вещества от температуры и типа растворителя. Раство-
римость, или максимальное количество вещества, способное раствориться
при заданной температуре, у большинства соединений монотонно повышает-
ся при нагревании, т.е. они характеризуются положительным коэффициентом
растворимости (ТКР). В обратном случае речь идет об отрицательном ТКР.
Типичная диаграмма растворимости веществ с положительным коэф-
фициентом растворимости, построенная в координатах температура (Т) -
концентрация (С), приведена на рис. II.5. Все поле диаграммы делится кривой
насыщенных растворов (сплошная линия) на две области - ненасыщенных (Z.)
и пересыщенных растворов (S) - лежащие, соответственно, ниже и выше нее.
Растворы бесконечно долго могут находиться в равновесии с твердой фазой,
относительно которой они насыщены. Пересыщенные растворы содержат из-
быток растворенного вещества, по сравнению с равновесным. В зависимости
от степени этого избытка, область пересыщенного состояния можно разде-
SESA Lab., ISSP RAS
ast@issp.ac.ru
лить на две зоны - метастабильную (самая верхняя часть диаграммы - М) и
лабильную (Z-), находящуюся в крайне нестабильном состоянии, при котором
даже незначительные самопроизвольные флуктуации концентрации вещества
инициируют формирование кристаллических зародышей. Метастабильные
растворы достаточно устойчивы и для образования в них зародыша критиче-
ского размера требуется затрата определенной энергии. В растворах, отве-
чающих границе между метастабильной и лабильной областью на Т-С-
диаграмме (условная штриховая линия), несмотря на высокую концентрацию
растворенного вещества, самопроизвольная кристаллизация не происходит.
Ширина метастабильного участка не является постоянной и зависит от при-
роды раствора, протекающих в нем процессов, степени очистки используемых
реактивов и многих других факторов.
Рис. 11.5. Схема диаграммы растворимости вещества с
положительным коэффициентом растворимости
(Соер, крист., 1980)
Управляемый рост возможен только в метастабильной области. Пере-
сыщение раствора АС, характеризующее степень отклонения системы от рав-
новесия, является д.с.к. процесса. При расчетах чаще всего определяют, так
называемое, относительное пересыщение ДС/С0, однако на практике удобнее
использовать величину ДТ, представляющую разность между температурой
насыщения данного раствора То и температурой кристаллизации Г, т. е. пере-
охлаждение. Однако в тех случаях, когда растворимость вещества неизвест-
на, оценить степень отклонения системы от равновесия с помощью переох-
лаждения можно лишь весьма приблизительно.
Существующие методы получения кристаллов из растворов различа-
ются, прежде всего, способом задания пересыщения в зависимости от вели-
чин растворимости и ТКР (Совр. крист., 1980).
1. Если, независимо от величины растворимости, ТКР вещества суще-
ственно отличается от нуля, требуемое пересыщение создают изменением
температуры раствора. При этом возможно проведение кристаллизации
либо за счет перепада температуры между различными частями кристаллиза-
тора, либо повышением (или понижением) температуры во всем объеме рас-
твора.
82
SESA Lab., ISSP RAS
ast@issp.ac.ru
В первом варианте постоянное растворение вещества в одной зоне
кристаллизатора с повышенной температурой обеспечивает рост кристалла в
другой его более низкотемпературной зоне. Перенос вещества из одной сек-
ции в другую происходит в результате естественной или вынужденной кон-
векции. Для практической реализации метода, в основном, используют два
соединенных между собой сосуда (рис. 11.6) с термоизолированными соедини-
тельными трубками.
Рис. 11.6. Схема кристаллизационной установки для выращива-
ния кристаллов методом температурного перепада: 1
- сосуд для растворения вещества с температурой Тр
2 - исходное вещество; 3,4- соединительные трубки; 5
- сосуд для роста кристалла с температурой Тг, Ti >
Тр б - мешалка; 7 - растущий кристалл (Соер, крист.,
1980)
Вариант же равномерного изменения температуры во всем объеме
раствора целесообразно применять при высоких значениях как растворимо-
сти, так и ТКР. При этом скорость повышения или понижения рассчитывается
исходя из диаграмм состояния вещества, не допуская перемещения точки со-
став-температура из метастабильной в лабильную область. Для выращива-
ния кристаллов таким способом используется кристаллизатор с термостатом,
изображенный на рис. II.7.
Контроль за спонтанным выпадением кристаллов осуществляется
предварительным прогревом кристаллизатора и перегревом раствора выше
точки насыщения; затравочный кристалл либо подвешивается на специаль-
ном держателе, либо фиксируется на платформе на дне кристаллизатора.
Герметично закрытый сосуд термостатируют и задают программу снижения
температуры раствора, создавая необходимое для кристаллизации пересы-
щение. Равномерному притоку питающего вещества к растущему кристаллу и
83
SESA Lab., ISSP RAS
ast<$issp. ac.ru
повышению его качества способствуют устройства, позволяющие вращать
затравку и/или перемешивать раствор.
Рис. 11.7. Схема установки для выращивания кристаллов ме-
тодом изменения температуры раствора: 1 - тер-
мометр; 2 - крышка кристаллизатора с винтами; 3 -
терморегулятор; 4-6 - нагревательные элементы; 7
-подставка кристаллизатора (Соер, крист., 1980)
2. Если температура не оказывает значительного влияния на измене-
ние растворимости, иными словами ТКР вещества крайне мал, пересыщение
системы чаще всего задается путем испарения растворителя, используя
различия в скоростях испарения растворителя и растворенного вещества.
Особым требованием при этом является строгая изотермичность процесса,
исключающая влияние температуры окружающей среды на процессы испаре-
ния, а, соответственно, и на кинетику кристаллизации. Схема установки, ис-
пользуемой в этом методе, представлена на рис. II.8.
3. И, наконец, вещества с крайне низкой растворимостью кристалли-
зуют за счет химических реакций. Для создания необходимой концентрации
исходных компонентов в раствор переводят другие их более растворимые
соединения. При этом химическое взаимодействие растворенных компонен-
тов должно обеспечивать образование и кристаллизацию искомой малорас-
творимой твердой фазы. В кристаллизаторе создаются три зоны, разделен-
ные полупроницаемыми перегодродками-мембранами. Растворение исходных
соединений происходит в двух крайних отсеках, и в результате диффузии
SESA Lab., ISSP RAS
ast@issp.ac.ru
84
Рис. 11.8. Схема установки для выращивания кристаллов методом ис-
парения растворителя: 1 - водяной термостат; 2 - кри-
сталлизатор; 3 - кольцо для слива конденсата; 4 - нагрева-
тель; 5 - мешалка термостата; 6 - терморегулятор; 7 -
термометр; 8 - мешалка кристаллизатора (Соер, крист.,
1980)
кристаллообразующие компоненты попадают в среднюю зону с затравкой
кристаллизуемого вещества. Скорости роста в этом методе определяются
кинетикой реакций. Поэтому для повышения качества кристаллов, используют
либо слаборастворимые исходные соединения, либо регулируют поступление
растворенного вещества в зону роста, например, повышением вязкости среды
применением различных гелей (желатина, агар-агара, кремнезема и др.).
СКОРОСТНОЕ ВЫРАЩИВАНИЕ
Незначительные скорости роста качественных кристаллов описанны-
ми выше традиционными методиками (0,5-1 мм/сут) приводят к тому, что пол-
ный ростовой цикл может занимать 1-2 года. Необходимость поддержания
бесперебойной и стабильной работы оборудования на протяжении такого
длительного срока приводит к высокой стоимости полученных кристаллов. С
развитием промышленного производства кристаллических материалов про-
85
SESA Lab., ISSP RAS
ast@issp.ac.ru
блема повышения скоростей роста высококачественных монокристаллов
встала перед исследователями особенно остро. В связи с этим, благодаря
существенному прогрессу в понимании физико-химических аспектов кристал-
лизации, с 80-х годов прошлого столетия стал активно развиваться метод так
называемого, скоростного выращивания кристаллов. В частности, группой со-
трудников физического факультета МГУ им. М. В. Ломоносова на примерах
дигидрофосфатов калия (KDP) и аммония (ADP) разработаны приемы, обес-
печивающие рост монокристаллов из растворов со скоростями, на порядок
превышающими обычные. Как показали эксперименты, эта новая методика,
может быть использована для получения широкого круга материалов из вод-
ных растворов. Выращивание монокристаллов KDP и ADP, обеспечивающее
скорости более 50 мм/сут, проводится в "экстремальных" условиях, по срав-
нению с традиционными методиками: температурный интервал - 80-85°С, пе-
ресыщение - до 40%. Поскольку кристаллы KDP и ADP, как правило, растут
дислокационным механизмом роста, нормальная скорость роста их граней
напрямую зависит от угла наклона дислокационных холмиков р и тангенци-
альной скорости роста элементарной ступени V. Соответственно, увеличение
этих параметров, будет приводить к повышению скорости роста. Однако на-
прямую воздействовать на скорость роста кристалла путем увеличения кру-
тизны дислокационного холмика затруднительно из-за сложной зависимости
между структурой холмика, пересыщением и температурой (Рашкович, 1984).
При кинетическом режиме кристаллизации тангенциальная скорость
V, как было показано теоретически и экспериментально для многих систем,
линейно связана с пересыщением <т выражением: У - b/to(3), b - есть некая
константа для данного вещества, 0 = Дехр(-Еа//с7) (4) - кинетический коэф-
фициент кристаллизации (ККК), /30 = const, Еа - энергия активации. Согласно
(3) и (4) возрастания скорости V следует ожидать либо при повышении <т, ли-
бо Т. Поскольку пересыщение оказывает на процессы роста основное дейст-
вие, являясь движущей силой кристаллизации, то именно его изменение хо-
рошо известный путь увеличения скорости роста. Смещение же ростового
процесса в область более высоких температур влияет на скорость роста по-
средством возрастания ККК. На практике это приводит к тому, более высоких
температурах требуется более низкое пересыщение для получения той же
самой скорости роста.
Помимо рассмотренных факторов, также на скорость роста кристал-
лов оказывают влияние присутствующие в растворе примеси и массоперенос
или гидродинамические условия. Таким образом, повышение степени очистки
исходных материалов и активное перемешивание раствора, смещающее рос-
товой процесс в область кинетического режима, может несколько увеличивать
интенсивность осаждения вещества на гранях кристаллов. Вместе с тем,
варьирование в широких пределах количеств примеси и гидродинамического
режима недопустимо из-за ухудшения оптического качества кристаллов. В
86
SESA Lab., ISSP RAS
ast@issp.ac.ru
результате, изменение таких параметров, как химическая чистота реактивов,
дислокационная структура и гидродинамические условия не оказывает суще-
ственного влияния на скорости роста. Значительного увеличения скорости
роста следует ожидать только при повышении пересыщения. Однако в усло-
виях столь значительных отклонений растворов от равновесия проблема их
устойчивости к спонтанному зародышеобразованию встает достаточно остро.
И в связи с этим именно перемешивание раствора следует рассматривать как
серьезный внешний фактор, препятствующий спонтанному зарождению
вплоть до очень больших пересыщений.
Еще одной отличительной особенностью скоростных методик являет-
ся использование точечных затравок (обычно около 1 см3), позволяющее су-
щественно сузить околозатравочную дефектную зону регенерации и получать
кристаллы с более низкой плотностью дислокаций.
87
SESA Lab., ISSP RAS
ast@issp.ac.ru
РАСТВОР-РАСПЛАВНАЯ КРИСТАЛЛИЗАЦИЯ
Среди ценных по своим свойствам кристаллов, применяемых в совре-
менной технике, имеется много таких, синтез которых представляет большие
трудности, вследствие того, что они нерастворимы в воде, либо разлагаются
при нагревании, либо плавятся при очень высокой температуре. В ряде слу-
чаев метод высокотемпературной кристаллизации из раствора, или кристал-
лизации из раствора в расплаве, является единственным возможным спосо-
бом получения таких кристаллов.
Раствор-расплавная кристаллизация - весьма сложное и широко рас-
пространенное в природе явление, самый масштабный пример которого -
формирование минералов на первых стадиях магматического процесса.
Впервые такая методика была использована в конце XIX столетия для полу-
чения кристаллов магматогенных минералов. Впоследствии этот способ, яв-
ляясь чисто эмпирическим, начинает применяться в поисковых работах, так
как позволяет технически просто осуществить процесс кристаллизации слож-
ных многокомпонентных систем. Как правило, главной задачей работ явля-
лось получение кристаллов отдельных представителей различных классов
соединений для изучения лазерных, нелинейно-оптических, пьезоэлектриче-
ских, магнитных и других физических свойств. Характерной особенностью ме-
тода раствор-расплавной кристаллизации является использование раствори-
теля. Однако в отличие от выращивания кристаллов из традиционных водных
растворов, в данном случае в качестве растворителя используются расплавы
легкоплавких солей, оксидов и их смесей.
Очевидно, что успешное развитие раствор-расплавной кристаллиза-
ции обуславливается в первую очередь выбором подходящего растворителя.
В первую очередь необходимо изучить особенности диаграммы состояния
кристаллизуемое вещество-растворитель и установить фазовые соотношения
в системе. В идеальном случае диаграмма состояния должна представлять
собой достаточно простую бинарную систему, описывающую ход кристалли-
зации вещества В в расплаве А (рис. 11.9).
На практике нередко приходится работать с более сложными много-
компонентными системами. В итоге параллельно с кристаллизуемым вещест-
вом образуются сопутствующие фазы, которые влияют, в частности, на пере-
сыщение раствора-расплава. Ситуация сильно усложняется, если один из
компонентов системы входит и в состав растворителя, и в кристалл.
88
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. 11.9. Бинарная система А-В
При выборе расплава-растворителя прежде всего принимают во вни-
мание его физико-химические и кристаллохимические особенности, в частно-
сти:
1. Кислотные оксиды, как правило, являются эффективными раство-
рителями для кристаллов основных оксидов и - наоборот.
2. Комплексообразователи также представляют интерес в этом плане.
3. Снижению вязкости расплава могут способствовать соединения с
крупными одно- и двухвалентными катионами, способными «разрыхлять» в
нем полимерные цепочки и сетки.
К растворителю предъявляются и технологические требования, среди
которых следующие:
1. Расплав-растворитель должен существенно понижать температуру
процесса кристаллизации.
2. Он не должен формировать твердые растворы с кристаллизуемым
веществом.
3. Растворитель должен быть устойчивым в относительно широком
диапазоне кристаллизации.
4. Для него актуальна приемлемая растворяющая способность кри-
сталлизуемого вещества, желательно не менее 10 мае.%.
5. Он должен обеспечить ощутимый температурный коэффициент
растворимости (~1 мас.%/10°) в случае выращивания кристаллов при охлаж-
дении раствора-расплава.
6. Для растворителя важна низкая упругость пара и невысокая вяз-
кость при температуре кристаллизации.
7. Кроме того, он должен быть нетоксичен, инертен по отношению к
материалу тигля, хорошо растворяться в воде или других традиционных рас-
творителях.
Распространенным является применение в качестве растворителя из-
быточного компонента кристаллизуемого вещества. Например, при выращи-
89
SESA Lab., ISSP RAS
ast@issp.ac.ru
вании нелинейно-оптических инконгруэнтно плавящихся кристаллов трибора-
та лития LiB3O5 в роли растворителя выступает борный ангидрид В2О3.
Методы кристаллизации из раствора в расплаве можно разделить на
две группы: спонтанная кристаллизация и кристаллизация на затравку.
Спонтанная кристаллизация особенно востребована при поисковых
работах, хотя размеры и качество кристаллов не всегда удовлетворительные,
так как в этом случае условия высокотемпературных экспериментов трудно
поддаются контролю. Тем не менее, продолжительность экспериментов отно-
сительно невелика: 2-3 суток при синтезе кристаллов, пригодных для иссле-
дования физических свойств, и 2-3 недели - в случае более крупных выращи-
вание крупных индивидов. Получение кристаллов на затравках нашло раз-
витие в связи с практическими потребностями в достаточно крупных и совер-
шенных образцах, синтезировать которые другими методами не представля-
ется возможным. Разработано несколько способов затравливания. Наиболее
распространенный - полное погружение кристалла-затравки в раствор-
расплав. После предварительного частичного ее растворения рост осуществ-
ляют плавным понижением температуры системы. Развивается и модифици-
рованный метод Чохральского, который особенно эффективен применительно
к высококонцентрированным низколетучим системам, обеспечивая рост высо-
кокачественных кристаллов с определенной кристаллографической ориента-
цией.
Так же раствор-расплавная кристаллизация с успехом используется
для выращивания эпитаксиальных пленок и нитевидных кристаллов. Этот ме-
тод получил название жидкофазной эпитаксии (ЖФЭ) и зарекомендовал себя
как надежный способ получения тонких пленок различных оптических мате-
риалов и полупроводниковых соединений. В отличие от методов вакуумного
нанесения и ионной имплантации, кристаллизация пленок при ЖФЭ осущест-
вляется в близких к равновесным условиях, что обеспечивает их высокое ка-
чество.
90
SESA Lab., ISSP RAS
ast@issp.ac.ru
КРИСТАЛЛИЗАЦИЯ ИЗ ГАЗОВОЙ ФАЗЫ
Кристаллизация из газовой фазы используется для выращивания, как
массивных кристаллов, так и эпитаксиальных пленок, тонких поликристалли-
ческих или аморфных покрытий, нитевидных и пластинчатых кристаллов. Хо-
тя некоторые ее разновидности пригодны для получения только какого-то од-
ного вида кристаллов.
В отличие от других, эти методы более универсальны: практически
для любого вещества могут быть подобраны условия, обеспечивающие рост
монокристалла. Несомненным преимуществом является так же то, что меха-
низм роста из газовой фазы изучен достаточно хорошо. Кроме того, рост мо-
жет проходить при сравнительно низких температурах, т. е. кристаллы отли-
чаются малым содержанием дефектов (малой плотностью дислокаций, сни-
женной концентрацией вакансий). Так же действие тигля на процесс роста
минимально. При выращивании кристаллов из газовой фазы легко контроли-
руется их стехиометрия. Невысокая скорость процесса роста, обусловленная
низкой концентрацией вещества в среде, обеспечивает высокую частоту, од-
нородность состава и совершенство структуры получаемых кристаллов, что
играет существенную роль особенно при выращивании эпитаксиальных пле-
нок, в частности многослойных гетероструктур. Для получения таких структур,
состоящих из очень тонких слоев различного состава, наращивание каждого
слоя необходимо проводить отдельно. Тем не менее, с точки зрения эконо-
мичности процесса, малые скорости кристаллизации являются недостатком
этих методов.
Общим для всех методов этой группы является транспорт материала
из какого-либо локального источника в зону кристаллизации. Место, где нахо-
дится исходный материал, называется зоной источника', место, где вещество
осаждается - зоной кристаллизации. Все существующие разновидности
можно разделить на две большие группы: методы, физической конденсации и
методы кристаллизации с участием химических реакций. Тем не менее, в на-
стоящее время используется много комбинированных методик, направленных
на улучшение качества осаждающихся слоев, увеличение скорости их осаж-
дения или расширение круга распыляемых материалов. В настоящем пособии
рассмотрен один из методов физической конденсации, а именно, метод запа-
янной ампулы.
В сосуде, нагретом до сравнительно высоких температур, содержится
пар кристаллизуемого вещества, причем разные участки паровой фазы нагре-
91
SESA Lab., ISSP RAS
ast@issp.ac.ru
ты в разной степени так, что в системе возникают пересыщения относительно
пара в целом или относительно отдельных его компонентов ("парциальные
пересыщения"). Запаянную ампулу, содержащую кристаллизуемое вещество,
помещают в камеру таким образом, что исходное вещество находится в бо-
лее горячей зоне (рис. 11.10). В ампуле устанавливается градиент концентра-
ций благодаря температурной зависимости равновесного давления пара. При
этом в более нагретой части концентрация выше. Под действием градиента
температуры вещество переносится к более холодному концу ампулы, в зону
кристаллизации, где пар оказывается пересыщенным и благодаря этому кон-
денсируется.
Рис. 11.10. Схема метода объемной паровой фазы в замкнутой
системе: 1 - источник, 2 - растущие кристаллы
Различают два случая: (1) в ампуле перед загрузкой вещества созда-
ется вакуум или (2) ампула помимо кристаллизуемого вещества заполняется
газом, не взаимодействующим с этим веществом. Механизмы массопереноса
весьма разнообразны и зависят от общего и парциального давления в ампу-
ле. Это могут быть молекулярные пучки, молекулярный поток, диффузия или
конвекция.
Пересыщение в данном случае определяется достаточно просто, как
отношение равновесных давлений пара в зонах источника и кристаллизации.
Однако инертные газы влияют на скорость переноса вещества и на теплоот-
вод от растущего кристалла, что приводит к изменению морфологии, напри-
мер, к образованию дендритных и игольчатых кристаллов при повышенных
92 SESA Lab., ISSP RAS
ast@issp.ac.ru
давлениях газа. Так как ампулы запаиваются при высоких температурах, то
существует вероятность того, что затравка может испариться или распла-
виться. В связи с техническими сложностями при введении затравки для по-
лучения крупных одиночных кристаллов необходимо предотвратить спонтан-
ное образование зародышей. С этой целью разработан ряд приемов. Напри-
мер, предварительно ампулу нагревают до температуры выше температуры
кристаллизации, что позволяет избавиться от примесных атомов и их скопле-
ний либо от участков с нарушенной структурой, которые и являются центрами
зарождения. После этого температуру зоны кристаллизации медленно сни-
жают, опуская ее на несколько градусов ниже температуры зоны источника. В
ряде случаев прибегают к локальному снижению температуры с помощью ка-
кого-либо теплоотводящего стержня или тонкой струи холодного газа. В дру-
гих случаях, используют запаянную ампулу с оттянутым концом, которую пе-
ремещают в зону, где температура постепенно снижается, причем оттянутый
конец первым попадает в область сравнительно низкой температуры. В этом
конце может образоваться единственный кристалл, а если их оказывается
несколько, то благодаря геометрическому отбору, останется только один. По-
добный прием используют при выращивании монокристаллов из расплава
методом Бриджмена-Стокбаргера. На практике метод запаянной ампулы
обычно используют для выращивания массивных кристаллов, например,
PbSe.
93
SESA Lab., ISSP RAS
ast@issp.ac.ru
МЕТОДЫ ИЗУЧЕНИЯ МОРФОЛОГИИ КРИСТАЛЛОВ
Изучение морфологии реальных кристаллов начинается с анализа их
внешней формы. В дальнейшем, при необходимости, рассматриваются более
тонкие особенности морфологии, вплоть до элементарных слоев роста и ато-
марной структуры поверхности граней.
Огранка кристалла является важной характеристикой, позволяющей,
зачастую, диагностировать вещество, не прибегая к дополнительным видам
анализа. Самым первым методом исследования внешней морфологии кри-
сталлов был метод гониометрии, основанный на законе постоянства углов
между соответствующими гранями. Согласно этому закону, независимо от
разнообразия форм кристаллов одного и того же вещества углы между соот-
ветствующими гранями остаются постоянными. Для измерения используют
прикладные и отражательные гониометры. Несмотря на то, что первый при-
бор такого типа был сконструирован в 18 веке, проведение подобных иссле-
дований в наше время оказывается весьма актуальным, в частности для ус-
тановления зависимостей между условиями получения кристаллов и их
внешней формой.
Достаточно крупные образцы (более 0,5 см) с неровными и матовыми
гранями измеряют прикладными гониометрами (рис. 11.11.). Простейший при-
кладной гониометр представляет собой транспортир с подвижной линейкой.
Кристалл фиксируется таким образом, чтобы пара граней, между которыми
измеряется угол, была плотно зажата между нижней планкой транспортира и
линейкой. Двойная шкала на транспортире позволяет определять с достаточ-
но невысокой точностью, порядка 0,5° как углы между нормалями к граням,
отсчитывая показания слева направо, так и истинные межгранные углы, дви-
гаясь по шкале справа налево.
Для более точных измерений (от нескольких секунд до 1 минуты) и ра-
боты с мелкими кристаллами с блестящими гранями разработаны отража-
тельные гониометры (однокружные и двукружные), использующие хорошую
отражающую способность качественных кристаллических поверхностей и
геометрические принципы распространения падающих и отраженных свето-
вых лучей, (рис. 11.12).
SESA Lab., ISSP RAS
ast@issp.ac.ru
94
Рис. 11.11. Прикладной гониометр
Рис. 11.12. Схема устройства отражательного го-
ниометра: L - источник узкого пучка света
(коллиматор); Т - зрительная труба, К -
кристалл, Na и Nb - нормали к граням кри-
сталла а и b
При работе с однокружным гониометром без демонтажа кристалла
возможно измерение лишь углов для граней, принадлежащих к одной зоне.
Усовершенствованный двухкружный гониометр, дает возможность при одном
положении кристалла производить измерения углов между всеми гранями.
Более детальное изучение микроморфологии кристаллов проводится
с применением оптических, растровых электронных и сканирующих зондовых
микроскопов. Говоря о микроскопии в целом, корректнее и информативнее
использовать термин не увеличение, а разрешение, т. е. расстояние, на кото-
95
SESA Lab., ISSP RAS
ром два соседних наблюдаемых элемента могут быть различимы раздельно.
Предельно достигаемое разрешение определяется, в первую очередь, ис-
пользуемым излучением.
В оптической микроскопии для наблюдений используется видимое из-
лучение с диапазоном длин волн от 380 до 760 нм. С учетом того, что челове-
ческий глаз наиболее восприимчив к зеленой области, максимальная разре-
шающая способность оптических микроскопов составляет порядка 0,5-0,7 мкм
(500-700 нм).
Достаточно массивные керамические, а также моно- и поликристалли-
ческие образцы чаще всего изучают в отраженном свете. Изображение в этом
случае строится за счет поглощения света, а также зеркального и диффузного
рассеяния. При зеркальном отражении падающий свет только один раз отра-
жается от гладкой поверхности вещества, так что угол падения и угол отраже-
ния равны, а при диффузном - свет многократно отражается неоднородной
поверхностью, прежде чем попадет в объектив.
Схематическое изображение оптического микроскопа отраженного
света приведено на рис. 11.13. Он состоит из трех основных систем - освети-
тельной, штатива микроскопа с оптической системой и предметным столиком
и системы построения изображения.
Полупрозрачное
зеркало
Конденсор
Плоскость первого
промежуточного- -
изображения
Задняя
фокальная
плоскость
объектива
Рис. 11.13. Основные системы оптического микроскопа
отраженного света (Брандон, 2006)
Апертурная
диафрагма
Проекция конденсора
изображения
апертурной
диафрагмы
Объектив
2а Образец
96
SESA Lab., ISSP RAS
ast@issp.ac.ru
Изображение объекта в оптическом микроскопе формируется при по-
мощи совокупности стеклянных линз, имеющих более высокий показатель
преломления, чем воздух. Луч света, распространяющийся под углом к по-
верхности, на границе раздела двух фаз преломляется, и направление его
распространения в стекле определяется показателем преломления.
Сокращение длины волны излучения, направленного на объект ис-
следования, позволяет получать информацию о более тонких морфологиче-
ских деталях. В растровой электронной микроскопии источник света заменен
электронной пушкой, а световые лучи - пучком электронов. При этом длины
волн падающего пучка на порядки меньше, чем в оптической микроскопии.
Соответственно, в зависимости от ускоряющего напряжения, обеспечивается
четкость изображения при значительно больших увеличениях. Стандартные
сканирующие микроскопы обладают разрешением 10-50 нм и увеличением до
100 000 раз.
При падении электронного пучка на образец, в результате взаимодей-
ствия электронов с мишенью возникает целая группа излучений, включающая
отраженные, вторичные, Оже-электроны, рентгеновское излучение и люми-
несценцию в широком спектре.
Принципиальная схема взаимодействия падающего высокоэнергетич-
ного пучка электронов с массивным образцом приведена на рис. 11.14.
Для регистрации того или иного сигнала в приборе устанавливается от-
дельный детектор. Из всех перечисленных излучений, изображение, характе-
ризующее главным образом топографию поверхности, создают вторичные
электроны, выбитые с внешних уровней атомов образца падающим пучком.
Однако они обладают низкой энергией (до 50 eV) и столь же легко поглоща-
ются матрицей. Эмитировать с поверхности мишени имеют возможность
лишь те из них, которые образуются в тонком приповерхностном слое и име-
ют направление, позволяющее покинуть образец даже за счет столь незначи-
тельной начальной энергии.
В сканирующих зондовых микроскопах на смену оптическому лучу и
электронному пучку пришла тончайшая игла - зонд. Соответственно, разре-
шающая способность прибора определяется радиусом закругления этой иг-
лы-зонда (0,1-1 нм по горизонтали 0,01 нм по вертикали). Изучение образца с
помощью семейства зондовых микроскопов можно сравнить с ощупыванием,
и прежде всего этот прибор применяется для измерения рельефа и модифи-
кации поверхности, манипулирования микро- и нанообъектами на поверхно-
сти. Для работы исключительно с проводящими материалами разработан
сканирующий туннельный микроскоп. Метод атомно-силовой микроскопии яв-
ляется более универсальным и допускает работу как с проводящими, так и
непроводящими поверхностями. Кроме того, атомно-силовой микроскоп спо-
собен измерять рельеф образца, погружённого в жидкость, что позволяет, в
частности, изучать механизмы роста кристаллов из растворов in situ.
97
SESA Lab., ISSP RAS
ast@issp.ac.ru
PE
Рис. 11.14. Принципиальная схема взаимодействия падающего
(PE-Primary Electron) электронного пучка с массив-
ным образцом. SE (Secondary Electrons) - вторичные
электроны; BSE (Backscattering Electrons) - отра-
женные или обратно рассеянные электроны; X-Ray
- рентгеновское излучение; Auger - Оже-электроны;
F - катодолюминесценции
Микроскоп представляет собой систему образец + игла (зонд) (рис.
11.15). При подводе зонда к образцу на расстояние в несколько ангстрем, меж-
ду атомами, образующими острие, и атомами, расположенными на поверхно-
сти образца, начинает действовать Ван-дер-Ваальсова сила притяжения. В
результате зонд будет приближаться к образцу до тех пор, пока не начнется
электростатическое отталкивание одноименно (отрицательно) заряженных
электронных оболочек атомов зонда и поверхности. Величина возникающего
усилия экспоненциально зависит от расстояния образец-игла. При перемеще-
нии микрозонда вдоль поверхности образца острие шипа приподнимается и
опускается, очерчивая микрорельеф поверхности, подобно тому, как скользит
по грампластинке патефонная игла. На выступающем конце зонда (над ши-
пом) расположена зеркальная площадка, на которую падает и от которой от-
ражается луч лазера. Когда шип опускается и поднимается на неровностях
98
SESA Lab., ISSP RAS
ast@issp.ac.ru
поверхности, отраженный луч отклоняется, и это отклонение регистрируется
фотодетектором. Данные фотодетектора используются в системе обратной
связи, которая обеспечивает постоянную силу давления острия на образец.
Пьезоэлектрический преобразователь может регистрировать изменение
рельефа образца в режиме реального времени. В другом режиме работы ре-
гистрируется сила взаимодействия острия с поверхностью при постоянном
положении шипа над образцом. Добавив к этой системе устройство развёртки
по осям X и Y, получают сканирующий АСМ.
В зависимости от решаемой задачи и характеристик поверхности в
атомно-силовой микроскопии выделяют несколько методик. В контактном спо-
собе сканирования острие зонда находится в непосредственном соприкосно-
вении с поверхностью, при этом силы притяжения и отталкивания, действую-
щие со стороны образца уравновешиваются силой упругости консоли. Недос-
таток метода - непосредственное механическое взаимодействие зонда с по-
верхностью, что приводит как к быстрой поломке зонда, так и к частичному
повреждению поверхности; используется только для жестких образцов. На-
оборот, в безконтактном методе на колеблющийся с малой амплитудой зонд
при приближении к поверхности начинает действовать дополнительная сила
со стороны образца. Это приводит к сдвигу амплитудно-частотных и фазово-
частотных характеристик системы, что и регистрируется детектором. В полу-
контактном варианте, часто называемом режимом обстукивания, зонд входит
в контакт с поверхностью только в нижней точке траектории собственных ко-
лебаний и бесконтактного сканирования, практически не повреждая при этом
образец.
исследуемая
поверхность
лазер
секторный
Рис. 11.15. Принципиальная схема и общий
вид атомно-силового микроскопа
99
SESA Lab., ISSP RAS
ast@issp.ac.ru
Одним из важных преимуществ атомно-силовой микроскопии перед
растровой электронной и оптической микроскопией является возможность
проводить исследования без металлического проводящего напыления образ-
ца. Большинство режимов атомно-силовой микроскопии могут быть реализо-
ваны на воздухе и, что немаловажно, в жидкости, тогда как для нормальной
работы растрового электронного микроскопа требуется вакуум. Кроме того, в
отличие от оптической и растровой электронной микроскопии, которые дают
псевдо-трёхмерное изображение поверхности образца, атомно-силовая по-
зволяет получить реальный трёхмерный рельеф поверхности с регистрацией
z-координаты.
100
SESA Lab., ISSP RAS
ast@issp.ac.ru
Ill ЛАБОРАТОРНЫЕ РАБОТЫ
101
SESA Lab., ISSP RAS
ЗАДАЧА 1. ОРТОТРОПИЗМ ПРИ КРИСТАЛЛИЗАЦИИ САЛОЛА ИЗ КАПЛИ
РАСПЛАВА
Легкоплавкие органические соединения являются хорошими модель-
ными образцами для наблюдения под микроскопом широко распространенно-
го в природных процессах так называемого геометрического отбора. Суть его
сводится к тому, что после зарождения на какой-либо поверхности многих
кристаллических зародышей впоследствии сохраняются лишь те, у которых
направление наибольшей скорости роста ориентировано перпендикулярно к
этой поверхности. Это явление было названо Рине "ортотропизмом" (от греч.
слов "ортос" - прямой, "тропе" - поворот). Впоследствии, благодаря экспери-
ментам Г.Г. Леммлейна и А.В. Шубникова, удалось подтвердить предполагав-
шиеся ранее чисто геометрические причины этого явления. При ортотропизме
среди растущих на любой поверхности кристаллов в момент их соприкоснове-
ния начинает действовать геометрический отбор. В результате, кристаллики с
направлениями максимальной скорости роста, отличными от нормальных к
поверхности, постепенно прекращают свой рост. Сохраняются лишь те, у ко-
торых эти направления мало отличаются от перпендикулярного. Однако бо-
лее поздние исследования А.В. Нардова показали, что в процессе отбора вы-
живают те индивиды, у которых направление максимальной скорости роста
нормально не к поверхности подложки, а к фронту кристаллизации.
Явление геометрического отбора ответственно за образование таких
минеральных агрегатов как друзы, щетки, жеоды, параллельно-шестоватые
агрегаты и др. Облик всех этих кристаллов зависит от характера поверхности
нарастания (плоская, выпуклая, вогнутая, неровная), формы кристаллических
зародышей и степени влияния на их первоначальную ориентировку субстрата,
а также от последующего взаимодействия растущих индивидов и возможного
изменения их габитуса при росте. Все эти факторы определяют огромное
морфологическое разнообразие перечисленных минеральных агрегатов, об-
разующихся в различных условиях.
Цель работы: наблюдение процесса геометрического отбора при кристал-
лизации из расплава
Материалы: салол С6Н4(ОН) СООНС6Н5
Инструменты: предметные и покровные стекла, спиртовые или газовые го-
релки, бинокуляры
102
SESA Lab., ISSP RAS
ast@issp.ac.ru
Описание работы и основные приемы
1. Нанести на предметное стекло небольшое количество (на кончике
скальпеля) исследуемого вещества, например, салола. Равномерно разогреть
препарат до полного расплавления всей порции вещества (температура плав-
ления чистого салола составляет 41,7°С). Во избежание растрескивания стек-
ла, его необходимо все время перемещать над пламенем спиртовки или го-
релки.
2. После этого препарат несколько охладить, и, сверху на полученную
каплю поместить покровное стекло так, чтобы края расплава выступили за
границы стекла. Расплав салола способен сильно переохлаждаться и без
внесения затравки самопроизвольно не кристаллизуется. Для возбуждения
кристаллизации иглой, которой предварительно коснулись кристаллов салола,
быстро провести по одной стороне покровного стекла. После завершения
процесса кристаллизации зарисовать полученный препарат, отмечая направ-
ление роста кристаллов.
3. Повторно, не снимая покровного стекла, расплавить нанесенный в
предыдущем эксперименте салол. "Зараженной" иглой обвести все четыре
стороны покровного стекла. После полной кристаллизации во всем объеме
зарисовать и объяснить полученную картину.
Вопросы к задаче
1. В чем суть явления ортотропизма?
2. В чем заключаются геометрический отбор? Какие факторы, определяют
скорость роста кристаллов в различных направлениях?
3. Какую роль геометрический отбор играет в образовании минеральных агре-
гатов? Каковы механизмы формирования друз, щеток, жеод, сферолитов, па-
раллельно-шестоватых агрегатов?
103
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 2. ВЛИЯНИЕ ПЕРЕОХЛАЖДЕНИЯ НА ФОРМУ РОСТА КРИСТАЛ-
ЛОВ САЛОЛА И ГИПОСУЛЬФИТА НАТРИЯ
При выращивании кристаллов из расплава движущей силой кристал-
лизации (д.с.к.) является переохлаждение, которое оказывает заметное влия-
ние на их форму. В общем случае, чем больше переохлажден расплав, тем
быстрее протекает процесс кристаллизации и индивиды, полученные из пере-
охлажденных расплавов, менее однородные. При этом возможна и смена ме-
ханизмов роста. В частности, с увеличением переохлаждения, зародыши мо-
гут трансформироваться в нульмерные, за счет чего ускоряется рост граней
вплоть до их выклинивания. В результате, гладкая, послойно-растущая грань
становится кинетически шероховатой и реализуется нормальный механизм
роста. Кроме того, увеличение д.с.к. вызывает потерю устойчивости фронта
роста, и, как следствие, ведет к образованию дефектных структур.
Непосредственно влияние переохлаждения расплава на форму роста
кристаллов легко проследить при помощи микроскопа, на предметном столике
которого помещается капля легкоплавкого вещества. Так, при кристаллизации
салола, внесенные в перегретую каплю расплава затравки приводят к образо-
ванию ромбовидных кристаллов. В небольшой капле переохлажденного рас-
плава от выросших кристаллов отрываются микроскопические зародыши и,
разрастаясь, поднимаются к поверхности капли. До некоторой степени охлаж-
дения, а соответственно переохлаждения препарата, они сохраняют свою
форму. При дальнейшем понижении температуры, вершины ромба притупля-
ются новыми гранями, и при сильном же переохлаждении очертания кристал-
лов напоминают "лодочки".
Цель работы: изучение влияния переохлаждения на форму кристаллов са-
лола
Материалы: салол С6Н4(ОН)СООНС6Н5, гипосульфит натрия
(Na2S2O3-5H2O) (или другое легкоплавкое органическое ве-
щество)
Инструменты: предметные и покровные стекла, спиртовые или газовые го-
релки, бинокуляры
104
SESA Lab., ISSP RAS
astSJissp.ac.ru
Описание работы и основные приемы
1. На предметное стекло насыпать небольшое количество салола и
расплавить на спиртовой или газовой горелке. Иголкой внести в каплю рас-
плава крупинки салола - затравки. Под бинокуляром наблюдать за процессом
разрастания внесенных затравок, обращая внимание на характер взаимоот-
ношения сформировавшихся микрокристаллов.
2. Расплавить на предметном стекле 3 равные порции салола. Через
определенные промежутки времени вносить в каждую из получившихся ка-
пель затравки (через 1 мин, 3 и 5 минут соответственно). В процессе кристал-
лизации наблюдать за формой образующихся в каждой из капель индивидов.
Вопросы к задаче
1. Что такое тепловое и концентрационное переохлаждение?
2. Как объяснить выявленные различия в трех рассматриваемых случаях в
зависимости от степени переохлаждения расплава?
SESA Lab., ISSP RAS
ast@issp.ac.ru
105
ЗАДАЧА 3. ЭПИТАКСИАЛЬНЫЙ РОСТ
Эпитаксия - это закономерное нарастание одного кристаллического
материала на другой (от греч. его - на и тос^ю - упорядоченность). Закономер-
ность нарастания состоит в совпадении, как правило, кристаллографически
простых направлений. Эпитаксия определяется условиями сопряжения кри-
сталлических решёток нарастающего кристалла и подложки, причём немало-
важную роль играет их структурно-геометрическое соответствие.
Достаточно показательным в данном случае является пример кри-
сталлизации водных растворов галогенидов на различных подложках.
Цель работы: изучение влияния пересыщения, скорости роста, параметров
подложки на качественные и количественные характеристики
нарастающего соединения
Материалы: (1) пластинки слюды (мусковита, биотита);
(2) калий иодистый (KI), аммоний иодистый (NH4I), калий
бромистый (КВг), калий хлористый (KCI)
Инструменты: предметные стекла, капельницы, бинокулярные микроскопы
Основные приемы и описание работы
1. Приготовить насыщенные при комнатной температуре растворы:
(a) NH4I, (б) KI, (а) КВг, (а) КО. Для этого в пробирку налить 25 мл дистиллиро-
ванной воды. Небольшими порциями добавлять соль, каждый раз перемеши-
вая и добиваясь полного растворения. Когда раствор "насытится" - вещество
начнет выпадать в осадок. Профильтровать получившийся раствор через бу-
мажный фильтр.
2. Подготовить пластинки биотита и мусковита со свежим сколом.
3. Подготовить старые пластинки биотита и мусковита.
4. Нанести на свежий скол листочков слюды каплю насыщенных рас-
творов (а), (б), (в) и (а).
5. Рассмотреть под бинокуляром процесс медленного испарения кап-
ли и последующей кристаллизации на поверхности подложки. Подсчитать
число ориентированных и неориентированных кристалликов и число двойни-
ков.
6. Повторить опыты при быстром испарении капли при нагреве на
электрической печке.
106
SESA Lab., ISSP RAS
ast@issp.ac.ru
7. Сравнить результаты опытов.
8. Охарактеризовать качественные и количественные особенности
явлений и дать им систематическое объяснение, опираясь на данные, приве-
денные ниже в таблице.
Параметры плоской сетки (111), А NH4I KI KBr КС!
Параметр плоской сетки (001) мусковита - 5,18 А Разность между параметрами (001) мусковита и солей 0,02 0,13 0,53 0,74
Параметр плоской сетки (001) биотита - 5,30 А Разность между параметрами (001)биотита и солей 0,14 0,31 0,65 0,80
Вопросы к задаче
1. Что такое эпитаксия?
2. Какие разновидности эпитаксии вы знаете?
3. Чем гетероэпитаксиальный рост отличается от гомоэпитаксиального?
4. Что служит источниками дислокаций при гетероэпитаксиальном росте?
5. Что такое псевдоморфизм?
107
SESA Lab., ISSP RAS
ЗАДАЧА 4. ПОСТРОЕНИЕ КРИВЫХ РАСТВОРИМОСТИ
Для характеристики растворов очень важное значение имеет понятие
растворимости данного вещества в том или ином растворителе. Как отмеча-
лось выше, под растворимостью принято понимать максимальное количество
вещества (предельная концентрация), способное растворяться при данных
условиях в определенном количестве растворителя. Растворимость зависит
от природы растворителя и растворенного вещества и от условий, в которых
происходит растворение.
Большинство методов выращивания искусственных кристаллов из
растворов основано на использовании зависимости растворимости вещества
от термодинамических параметров (см. раздел "Рост кристаллов из низкотем-
пературных растворов"). Графическое представление температурной зависи-
мости растворимости вещества называется кривой растворимости. Все техни-
ческие расчеты основаны на ее использовании.
При определении температуры насыщения t раствора заданной кон-
центрации в перегретый раствор помещают кристалл-индикатор. Затем рас-
твор медленно охлаждают, отмечая при этом температуру исчезновения нис-
ходящих потоков "растворения" Т и температуру появления потоков "роста"
Л + ty
кристаллов f2- Среднее арифметическое —= Z,. - есть не что иное, как
температура насыщения раствора заданной концентрации.
Ср-раствор
Сд-дворик
кристаллизации
Для растворяющегося кристалла
Ср < Сз
Для растущего кристалла
Ср > С$
Оптический эффект сводится к различному преломлению света, про-
ходящего через раствор и "дворик" кристаллизации для этих двух случаев.
Наблюдение за концентрационными потоками осуществляется при
помощи оптического стенда, схематично приведенного на рис. 111.1. Луч света
от точечного источника света S, проходя через линзу Ц образует однородный
пучок.
108
SESA Lab., ISSP RAS
ast@issp.ac.ru
N
Рис. Ш.1. Ход лучей в установке для наблюдения
концентрационных потоков
На его пути располагается плоско-параллельная кювета J с исследуе-
мым раствором, В него погружается кристалл соли К, растворимость которой
определяется. Линза 1_2 дает изображение лампы в плоскости щели N. При
этом условии любые неоднородности в исследуемом растворе, в частности,
концентрационные потоки вокруг помещенного в раствор кристалла, вызыва-
ют искривление лучей света, которые фокусируются на экране F. В результате
получается изображение кристалла К и возникающих около него неоднород-
ностей среды в виде концентрационных потоков. Наиболее точным метод
становится в том случае, когда температура отмечается не по исчезновению и
появлению концентрационных потоков, а по погасанию ярко очерченного кон-
тура вокруг кристалла - "дворика" кристаллизации. Внутри этого слоя кри-
сталлизации концентрация изменяется от насыщенной (у поверхности кри-
сталла) до значения объемной концентрации, соответствующей данному рас-
твору (на внешней поверхности слоя). Таким образом, "дворик" представляет
собой оптическую неоднородность и четко виден на экране F.
Цель работы: построение кривой растворимости на примере алюмо-
калиевых квасцов или сегнетовой соли
Материалы: сегнетова соль KNaC4H4O6-4H2O, алюмо-калиевые квасцы
KAI(SO4)2-12H2O
Инструменты: оптический стенд для наблюдения, термометр, весы, бумаж-
ный фильтр, термостойкая колба, воронка для фильтрования
Основные приемы и описание работы
1. Приготовить и закрепить кристалл-индикатор.
2. Приготовить исходный (наиболее концентрированный) раствор ис-
следуемого вещества, используя выражение массовой доли т (мае.%) через
отношение массы твердого вещества (Ь) к массе всего раствора (а) т =
Ъ/ах100%. В выполняемой работе исходная концентрация раствора сегнето-
вой соли составляет 75 мас.%, а алюмо-калиевых квасцов - 24 мае.%
3. По описанной выше методике определить температуру насыщения
раствора.
109
SESA Lab., ISSP RAS
ast@issp.ac.ru
4. Путем разбавления исходного раствора приготовить 5-6 растворов
с промежуточными концентрациями таким образом, чтобы концентрация каж-
дого последующего раствора отличалась от предыдущего на 2-5 мас.%. До-
полнительное количество X растворителя определяется из расчета X = а(т/п
- 1), используя начальную (т) и последующую (л) концентрации.
5. Для каждого из полученных растворов определить температуру на-
сыщения.
6. На основании полученных результатов построить кривую раство-
римости С = /(Т).
Вопросы к задаче
1. Что такое растворимость?
2. Как различаются обратимые и необратимые процессы растворения?
3. Что понимают под фазовой диаграммой растворимости и что есть протя-
женность метастабильной области?
4. Что такое температурные коэффициенты растворимости и теплота раство-
рения?
5. Какими методами можно определить растворимость?
110
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 5. ВЫРАЩИВАНИЕ МОНОКРИСТАЛЛОВ ИЗ ВОДНЫХ РАСТВОРОВ
Предлагаемая задача посвящена выращиванию монокристаллов из
водных растворов при снижении температуры. В данном случае рассматрива-
ется положительный температурный ход кривой растворимости, когда равно-
весная (предельная) концентрация вещества в растворе, непрерывно возрас-
тает с увеличением температуры. Установка для выращивания кристаллов в
лабораторных условиях представляет собой герметично закрывающийся кри-
сталлизатор. Непосредственно в растворе находятся датчик температуры для
терморегулятора (медный термометр сопротивления), контрольный ртутный
термометр и устройство, обеспечивающее интенсивное перемешивание рас-
твора. Принципиальная схема установки приведены на рис. III.2.
Цель работы: - ознакомление с особенностями роста кристаллов из вод-
ных
растворов;
- выращивание монокристаллов алюмо-калиевых квасцов;
- анализ связи морфологии с условиями кристаллизации
Материалы: ограненные кристаллы KAI(SO4)2-12H2O, водостойкий клей,
исходные реактивы, дистиллированная вода.
Инструменты: весы, бумажный фильтр, термостойкая колба, воронка для
фильтрования.
Основные приемы и описание работы
1. Выбрать три хорошо ограненных кристалла алюмо-калиевых квас-
цов KAI(SO4)2-12H2O различной ориентации размером до 1 см.
2. Водостойким клеем прикрепить отобранные затравки к платформе.
3. Используя построенную раннее кривую, рассчитать массу кристал-
лизуемого вещества для получения насыщенного при 35-40°С раствора на 1 л
растворителя - воды.
4. Взвесить необходимое для проведения кристаллизации количество
вещества и поместить в термостойкую стеклянную колбу, добавить раствори-
тель.
5. Нагреть раствор до температуры, превышающей точку насыщения
и выдерживать до полной его гомогенизации.
SESA Lab., ISSP RAS
111
6. Быстро профильтровать раствор через бумажный фильтр, не до-
пуская спонтанного выпадения кристаллов.
7. Перегреть раствор на 5-7°С выше точки насыщения и осторожно
перелить раствор в кристаллизатор.
8. Поместить платформу в кристаллизатор, закрыть крышкой и уста-
новить термометр.
11. Основываясь на данных по растворимости, задать программу сни-
жения температуры.
Рис. III.2. Схема кристаллизационной камеры для
выращивания кристаллов из растворов:
1 - термометр, 2 - вращающее уст-
ройство; 3 - кристаллизатор; 4 - ме-
шалка; 5 - нагреватель
Вопросы к задаче
1. Что такое растворимость и ТКР?
2. Как классифицировать вещества по типу растворимости?
3. Какие дефекты характерны для кристаллов, выращенных из водных рас-
творов?
112
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 6. ПОЛУЧЕНИЕ КРИСТАЛЛОВ МЕТОДОМ КИРОПУЛОСА
В предлагаемой работе выращиваются кристаллы галогенидов ще-
лочных металлов, например КВг или KI. Следует иметь в виду, что эти соеди-
нения вблизи температуры плавления заметно разлагаются с выделением
ядовитых паров брома и йода. Поэтому кристаллизационная установка монти-
руется в вытяжном шкафу, который во время эксперимента должен быть
включен.
Установка для выращивания кристаллов состоит из печи сопротивле-
ния (3), в данном случае с нихромовым нагревателем, рассчитанным на тем-
пературы до 1000°С (рис. III.3). Она снабжена холодильником (2), который
представляет собой полый латунный цилиндр с вмонтированной в него труб-
кой, охлаждаемой проточной водой. Предусмотрено приспособление для
вращения холодильника вместе с растущим кристаллом, а также система ре-
гулирования затравки по высоте, которая позволяет перемещать холодильник
по вертикали (1).
Цель работы: получение монокристаллов методом Киропулоса на примере
галогенидов щелочных металлов.
Материалы: калий бромистый (КВг), калий йодистый (KI).
Инструменты: электропечь сопротивления с вертикальной кристаллизаци-
онной камерой и точным терморегулятором (±1°С), алундо-
вый тигель емкостью 500 мл, система охлаждения, вращения
и вытягивания растущего кристалла; держатель затравочного
кристалла; вытяжной шкаф для установки.
Основные приемы и описание работы
Измельченное исходное вещество для опыта взвешивается в количе-
стве в 2-3 раза превышающем предположительную массу кристалла. В пред-
ложенной задаче навеска составляет 250-300 г измельченного КВг или KI. Вы-
ращивание этих кристаллов относится к числу весьма "капризных" экспери-
ментов, если не соблюдать надлежащим образом рекомендуемые условия
опыта. Прежде всего, нагрев печи не должен быть слишком медленным. Его
скорость и температура, при которой осуществляется процесс, обеспечивает-
ся терморегулятором. Он состоит собственно из термоконтроллера с датчи-
ком (хромель-копелевой термопарой), помещенного внутри печи, и силового
113
SESA Lab., ISSP RAS
ast@issp.ac.ru .
блока, контактирующего непосредственно с нагревательным элементом печи.
Система позволяет с точностью ±1°С поддерживать или изменять температу-
ру в соответствии с заданием. Режим работы устанавливают таким образом,
чтобы температура нагревателя была на 30-40 градусов выше, чем точка
плавления исходного вещества. Это позволяет устранить случайные центры
кристаллизации и оплавить поверхность затравки. Затем расплав несколько
охлаждают для того, чтобы начался рост монокристалла. Эти температурные
условия каждый раз устанавливаются экспериментально. Момент начала рос-
та кристалла можно определить по появлению "серебристого кольца" вокруг
затравки.
Общий вид кристаллизационной установки:
1 - приспособление для вращения холодильника,
2 - вращающийся холодильник, 3 - печь, 4 -
термопара, 5 - клеммы для подключения элек-
тропитания печи
Рис. 111.3.
Важную роль играет правильное приготовление кристаллической за-
травки и ее крепление к торцу холодильника. Для этих целей используется
специальный кристаллодержатель. В качестве затравки служит небольшой
полученный раннее кристалл (приблизительно (5x5x15 мм). Поверхность за-
травки, соприкасающаяся с холодильником, должна быть ровной, чтобы обес-
печить плотный контакт с торцом холодильника.
Кристаллодержатель-холодильник вместе с затравкой, как показано на
рисунке, опускается в печь. Перед погружением затравка несколько минут вы-
держивается над зеркалом расплава. После того, как она примет близкую к
114
SESA Lab., ISSP RAS
ast@issp.ac.ru
расплаву температуру, ее медленно вводят в расплав на глубину 2-3 мм. Если
температура расплава слишком высока, то погруженная в расплав часть за-
травки может полностью расплавиться. В таком случае ее следует опустить
ниже и охлаждать до тех пор, пока не начнется процесс кристаллизации. В
чересчур переохлажденном расплаве будет формироваться поликристалл.
Следовательно, температуру необходимо повысить настолько, чтобы распла-
вить образовавшийся сросток.
Обычно в таких условиях кристалл диаметром около 6 см можно полу-
чить в течение 3-4 часов. Его извлекают из расплава и отжигают, соблюдая
ряд предосторожностей. После отжига отключают печь, и она охлаждается
самопроизвольно. Затем кристалл медленно поднимают из расплава. Щипца-
ми, обернутыми асбестом, отделяют кристалл от затравки и оставляют в печи
на асбестовой сетке. Печь плотно закрывают крышкой и дают кристаллу вме-
сте с печью остыть до комнатной температуры. Только после этого вынимают
кристалл из печи без риска его растрескивания.
Вопросы к задаче
1. Каковы особенности выращивания кристаллов из расплава методом
Киропулоса?
2. Какие преимущества и недостатки метода Киропулоса по сравнению с
методом Чохральского?
3. В каких областях применяются кристаллы, выращенных методом
Киропулоса?
115
SESA Lab., ISSP RAS
ast@issp.ac.ru*
ЗАДАЧА 7. НАПРАВЛЕННАЯ КРИСТАЛЛИЗАЦИЯ ИЗ РАСПЛАВА
Сущность метода состоит в том, что вещество плавится в тигле, кото-
рый медленно опускается из высокотемпературной части печи в низкотемпе-
ратурную.
Установка для выращивания монокристаллов методом Стокбаргера со-
стоит из четырех блоков: печь сопротивления, механизм опускания ампулы, элек-
тронного терморегулятора для контроля и измерения температуры (рис. Ш.4.).
а
б
Рис. III.4. Схема печи для выращивания кристаллов из расплава методом
Бриджмена-Стокбаргера (а): 1 - корпус печи, 2 - ампула с
кристаллизуемым веществом, 3 - нагреватель,
4 - теплоизоляция, 5 - механизм перемещения ампулы и
распределение температуры по высоте печи (б)
(по Шаскольской М.П., 1976)
116
SESA Lab., ISSP RAS
ast@issp.ac.ru
Печь сопротивления состоит из металлического каркаса цилиндриче-
ской формы. Внутри его помещают трубу диаметром 120 мм из огнеупорного
материала, которая в дальнейшем будет рабочей камерой печи. Пространство
между трубкой и каркасом заполняют шамотной крошкой, которая выдержива-
ет высокую температуру, а также является эффективным теплоизолятором,
что важно для уменьшения влияния колебаний температуры внутри помеще-
ния во время проведения эксперимента.
В асбоцементную трубу вставляют корундовую с нагревательным эле-
ментом. В качестве последнего используется высокотемпературный сплав:
нихром, ЭИ-626 и др. Нагревательный элемент распределен на трубе нерав-
номерно. Наиболее плотная часть его приходится на среднюю, а наименее
плотная - на нижнюю часть трубы. Этим создается необходимый для кри-
сталлизации температурный перепад (градиент) - зоны с относительно высо-
кой и низкой температурами.
Между асбоцементной трубой и нагревательным элементом - воздуш-
ная прослойка теплоизоляции. Концы нагревательного элемента подведены к
тоководам. Сверху алундовая труба закрывается керамической крышкой. В
ее центре предусмотрено отверстие для высокотемпературного стержня, на
котором подвешена стеклянная или кварцевая ампула с кристаллизуемым
веществом.
Механизм опускания зафиксирован в верхней части печи на штоке. Он
предназначен для медленного опускания ампулы с кристаллизуемым вещест-
вом в рабочее пространство печи и состоит из программно управляемого ме-
ханизма, имеющего различные скорости движения. На вращающуюся ось на-
сажен ступенчатый шкив, на нем крепится нить с подвешенной ампулой. Дер-
жатель служит для центрировки ампулы с веществом в печи и закрепления
механизма на заданной высоте.
Блок управления температурой состоит из микропроцессорного тер-
морегулятора типа ПРОТЕРМ-ЮО с тиристорным усилителем мощности, по-
зволяющим контролировать и управлять нагрузкой до 3 кВт. Для контроля и
измерения температуры использованы комплекты платинородий-платиновых
термопар. Точность поддержания температуры обычно составляет 0,1-0,2°С.
Перед работой с терморегулятором необходимо тщательно ознако-
миться с правилами пользования прибором.
Прежде, чем приступить к выращиванию кристаллов, следует отгра-
дуировать печь, т. е. измерить температуру внутри печи по всей ее высоте при
фиксированной мощности на нагревателе. Градуировка необходима для того,
чтобы знать, где и при какой температуре находится ампула с веществом в
данный момент, когда она пройдет зону высокой температуры и начнет кри-
сталлизоваться вещество.
117
SESA Lab., ISSP RAS
ast@issp.ac.ru
Цель работы: получение монокристалла металлического висмута методом
направленной кристаллизации
Материалы: запаянная вакуумированная ампула с металлом.
Инструменты: кристаллизационная установка с терморегулятором для под-
держания температурного градиента, устройство для движе-
ния ампулы
Описание работы и основные приемы
1. Градуировка печи.
Перед градуировкой температуру в печи необходимо довести до ста-
бильной и неизменной при заданной вручную с регулятора фиксированной
мощности. Время уравновешивания температуры в печи порядка 2,5 часа с
момента включения.
Градуировка производится путем опускания термопары вручную с ин-
тервалом в 1 см. После опускания на 1 см измерение температуры необходи-
мо проводить через 2 минуты. Полученные данные записываются в тетрадь
по схеме:
Расстояние в см
от начала опус-
кания
Показания тем-
пературы на эк-
ране регулятора
в °C
Примечание
После окончания градуировки печи строится график:
по оси ординат - расстояние в см;
по оси абсцисс - температура в °C.
2. Расчет скоростей движения ампулы:
Скорость вращения шкива 3 оборота за 168 часов. Если взять шкив
наибольшим диаметром (длина окружности 345 мм), а скорость вращения
шкива - 1 оборот за 168 часов, то скорость опускания ампулы рассчитывается
следующим образом:
345 мм х 1 оборот = 345 мм за 168 часов;
отсюда: за 1 час - 345 мм : 168 часов = около 2 мм/час.
Выращивание монокристалла
Предварительно печь выводится на рабочую температуру и выдержи-
вается около двух часов для стабилизации температуры и градиента.
Основные операции:
1. Извлечение термопары из печи.
2. Крепление ампулы с исходным веществом к проволочному
держателю на шкиве механизма.
118
SESA Lab., ISSP RAS
ast@issp.ac.ru
3. Проверка соответствия положения дна ампулы нижней части
участка на графике с наиболее высокой температурой (рис 111.4).
Сделать соответствующую отметку на проволоке с помощью
зажима.
4. Перемещение/опускание ампулы с веществом в рабочую зону
печи. Закрыть крышку печи.
5 Подгонка зажима на проволоке вращения шкива под уровень
крышки печи.
6. Контроль скорости опускания ампулы по второму зажиму,
расположенному на 10 см выше первого.
Вопросы к задаче
1. Какие преимущества и недостатки метода направленной кристаллизации из
расплава?
2. Что может быть источником дефектов в кристаллах, выращенных методом
направленной кристаллизации?
3. Что такое изотерма кристаллизации, в чем преимущество плоской ее фор-
мы?
4. Что такое "эффект грани" в кристаллах, выращенных методом направлен-
ной кристаллизации?
5. Как влияет переохлаждение расплава у фронта роста на форму и однород-
ность кристаллов?
SESA Lab., ISSP RAS
119
ЗАДАЧА 8. ВЫРАЩИВАНИЕ МОНОКРИСТАЛЛОВ МОЛИБДАТА СВИНЦА
МЕТОДОМ ЧОХРАЛЬСКОГО
Для демонстрации возможностей выращивания монокристаллов ме-
тодом Чохральского используется промышленная установка типа Кристалл-
ЗМ. Данная установка весьма сложна в использовании, поэтому эксперимен-
тальные работы на ней возможны лишь в присутствии подготовленного опе-
ратора.
В комплект установки входят: кристаллизатор, тиристорный преобра-
зователь частоты, силовой шкаф, пульт управления и высоковакуумный агре-
гат. Наличие высокоточного датчика веса и компьютерная обработка данных
(протока охлаждающей воды, ее давления, вес кристалла, напряжение на ин-
дукторе, скорость вытягивания монокристалла, скорость вращения кристал-
лодержателя и т. д.) позволяют осуществлять технологический процесс как в
полностью автоматическом режиме, так и в полуавтоматическом. Использо-
вание компьютерной обработки данных с выводом на экран монитора облег-
чает работу обслуживающего персонала и операторов.
Данная установка дает возможность получать монокристаллы (були)
промышленного размера практически для любых соединений, способных кри-
сталлизоваться из собственного расплава. Благодаря индукционному нагреву,
верхняя граница рабочих температур определяется лишь физико-
химическими особенностями кристаллизуемого вещества и собственно мате-
риалом тигля. Благодаря герметичной кристаллизационной камере есть воз-
можность проводить ростовой процесс под высоким вакуумом или же при за-
данной атмосфере.
Общий вид основной части установки представлен на рисунке III.5.
Герметичная кристаллизационная камера (1) имеет смотровые окна (2) для
возможности визуального контроля процесса выращивания кристалла. В
верхней ее части расположен механизм перемещения и вращения штока (3).
Установка имеет насосы для создания вакуума (4) и систему контроля и рас-
пределения газа, подающегося в кристаллизационную камеру (5). Для пере-
мещения тигля во время подготовки эксперимента предусмотрен механизм
перемещения теплового узла и тигля в кристаллизационной камере (6).
Схематично ростовая камера изображена на рисунке III.6. Источником
нагрева является индуктор, представляющий собой полую медную трубку в
виде спирали (1). По специальным герметизированным тоководам на индуктор
подается переменное напряжение высокой частоты, благодаря чему начина-
ется разогрев помещенного в центр тигля с кристаллизуемым веществом. Для
предотвращения разогревания от тигля сам индуктор охлаждается протекаю-
120
SESA Lab., ISSP RAS
ast@issp.ac.ru
щей по нему водой. Внутри индуктора помещается так называемый тепловой
узел (2), служащий для правильного и равномерного распределения тепла в
тигле. Тепловой узел устанавливается на площадке нижнего штока (3), верх-
ний шток (4), охлаждаемый водой, имеет механизм для крепления затравки и
автоматически регулируемые скорости вращения и вытягивания. Тигель (5)
может быть из различных материалов, определяемых прежде всего типом
кристаллизуемого вещества. Растущий кристалл (6) имеет форму цилиндра
(були).
Рис.III.5. Общий вид установки для выращивания монокристаллов
методом Чохральского «Кристалл-ЗМ»
121
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. III.6. Ростовая камера установки «Кристалл-ЗМ»
Для управления установкой Кристалл-ЗМ используется отдельная
стойка, показанная на рисунке II 1.7. В ее составе есть блок контроля мощности
на индукторе со встроенным терморегулятором (1) и (2), вычислитель с уст-
ройством ввода информации (3), показывающий текущие параметры процес-
са, самописец (4), непрерывно отображающий мощность на индукторе и диа-
метр растущего кристалла. Для контроля и управления составом атмосферы в
кристаллизационной камере используются анализаторы давления (5), для
управления вакуумом установлен блок (6) с мнемосхемой. Общий учет нара-
ботки осуществляется блоком (7).
Используются три основных приема приготовления исходной шихты:
- метод самораспространяющегося высокотемпературного синтеза (СВС);
- метод твердофазного синтеза (ТС);
- непосредственное наплавление смеси исходных реактивов в тигель.
Условием успешного осуществления СВС является самопроизвольное
достижение температуры, незначительно превышающей температуру плавле-
ния требуемого материала. Это значение определяется соотношением коли-
чества свободного металла, выделяющего тепло в процессе окисления, и ко-
личеством инертных к кислороду веществ, требуемых для синтеза вещества
заданного состава.
Исходные материалы для ТС процесса приготавливаются посредством
нагрева смесей соответствующих оксидов хорошей чистоты до определенной
температуры с последующей выдержкой при этой температуре в течение
времени, обеспечивающем полный синтез соединения, которое в дальнейшем
используется в качестве шихты для выращивания монокристалла. Процесс
проводится в высокотемпературной печи с рабочей температурой до 1550°С.
122
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис. III. 7. Стойка управления технологическим процессом
При непосредственном наплавлении шихты в тигель приготовленная
смесь исходных оксидов загружается в тигель, который устанавливается в
ростовую часть теплового узла. По мере плавления шихты происходит ее до-
загрузка, пока не наполнится весь объем тигля. Выбор того или иного способа
приготовления шихты зависит от материала тигля, от химического состава
исходных соединений и от других факторов.
При выращивании монокристаллов методом Чохральского возникает
проблема подбора керамики для изготовления теплового узла, которая была
бы устойчива к температуре роста и коррозионному воздействию паров рас-
плава, а с другой стороны, обладала бы механической прочностью, чистотой,
продолжительностью работы и низкой стоимостью. Из всего многообразия
керамики данным требованиям при выращивании вышеперечисленных моно-
кристаллов удовлетворяет корундовая.
Как один из наиболее ответственных элементов в технологии выращи-
вания крупногабаритных бездефектных кристаллов - тигель (контейнер) дол-
жен удовлетворять следующим требованиям: (1) температура плавления ма-
териала тигля должна быть существенно выше температуры кристаллизации
расплава; (2) он должен быть инертным по отношению как к расплавленной
шихте, так и к атмосфере, в которой выращивается кристалл; (3) количество
"окрашивающих" примесей в материале тигля не должно превышать 3x10'3
вес.%; (4) эллипсность тигля не должна превышать 3% от диаметра, а толщи-
123
SESA Lab., ISSP RAS
ast@issp.ac.ru
на стенок не должна изменяться более чем на 10% для предупреждения из-
менения симметрии электромагнитного поля индуктора системы нагрева и
угрозы его прогорания. При выращивании монокристаллов используются пла-
тиновые и иридиевые тигли различных типоразмеров.
Конструкция теплового узла обеспечивает создание необходимых теп-
ловых условий для роста були заданного диаметра при определенных кинети-
ческих условиях и характере роста. Эта комплексная задача решается прежде
всего путем подбора экранировки, формы, осевых и радиальных размеров
индуктора, целесообразностью использования дополнительного нагревателя,
скоростью выращивания и вращения кристалла.
Изменение температуры расплава путем регулирования напряже-
ния, подаваемого на индуктор во время роста, используется для оператив-
ного изменения условий, связанных с самим процессом роста: разращива-
ние були, корректировки изменения тепловых условий из-за снижения
уровня расплава в тигле по мере вытягивания и сведение слитка на конус в
конце вытягивания во избежание теплового удара. Поэтому правильно
разработанный тепловой узел, состоящий из нагревателя, тигля с подстав-
ками, экранов должен создавать нужное тепловое поле в зоне кристалли-
зации при всех вариантах изменения температуры и скорости выращива-
ния в процессе всего вытягивания.
Во многих случаях быстрое охлаждение були при переходе ее из зоны
роста, ограниченной экранировкой, в приемную зону теплового узла нежела-
тельно, так как это может привести к ее растрескиванию и изменению свойств.
Поэтому конструкция теплового узла должна учитывать и эти требования. Ча-
ще всего для экспериментального исследования тепловых полей при вытяги-
вании используются термопары.
Важнейшей характеристикой теплового поля служит осевой градиент
температуры у фронта кристаллизации, величина которого зависит, прежде
всего, от диаметра выращиваемого кристалла и использования дополнитель-
ного нагревателя в верхней приемной части теплового узла. Серьезным мо-
ментом при выращивании качественных кристаллов является изготовление и
крепление затравки к кристаллодержателю, обеспечивающей: (1) возможность
выращивания кристаллов необходимых размеров и веса; (2) минимальное
использование дорогостоящих материалов; (3) проведение как можно боль-
шего числа технологических циклов.
При конструировании конкретного теплового узла используются отрез-
ной станок с водяным охлаждением и алмазными отрезными кругами и шли-
фовальный станок для окончательной доводки элементов теплового узла. По-
сле изготовления каждого элемента теплового узла (экранов, колец, подставок
под тигель, крышек) производится их тщательная промывка в проточной, а
затем в дистиллированной воде. Затем они просушиваются при 100°С и про-
каливаются в течение 5 ч при 1000°С. Далее непосредственно в установке
производится сборка теплового узла.
Для примера, можно рассмотреть процесс выращивания молибдата
свинца.
124
SESA Lab., ISSP RAS
ast@issp.ac.ru
Цель работы: выращивание кристалла молибдата свинца методом Чох-
ральского
Материалы: шихта РЬМоО4
Инструменты: кристаллизационная установка «Кристалл-ЗМ»
Описание работы и основные приемы
Платиновый тигель с шихтой (РЬМоО4) помещается в кристаллизаци-
онную камеру и нагревается до температуры немного выше температуры
плавления молибдата свинца при обычной атмосфере. Затравка, закреплен-
ная на штоке вытягивающего механизма с помощью держателя, спускается в
перегретый расплав. Перед опусканием затравки в расплав включается меха-
низм вращения штока. В перегретом расплаве происходит оплавление за-
травки. Перемешивание расплава и создание однородного теплового поля
обеспечивается вращением затравки. Затем затравка медленно поднимается,
увлекая за собой расплав. Образующийся столбик расплава, попадая в об-
ласть пониженной температуры, кристаллизуется. Путем регулировки мощно-
сти на индукторе затравка разращивается до необходимого диаметра. Далее,
в кристаллизаторе устанавливается такой температурный режим, при котором
начинается рост кристалла. Это достигается регулированием мощности на
индукторе или скоростью движения верхнего штока (или одновременно). По-
сле достижения желаемого размера скорость подъема резко увеличивают или
поднимают температуру расплава, в результате чего выросший кристалл от-
рывается от расплава.
Вопросы к задаче
1. Какие основные достоинства и недостатки метода Чохральского?
2. Что такое асимметрия теплового поля и как она влияет на растущий кри-
сталл?
3. Каковы основные технологические приемы, способствующие получению
бездислокационных кристаллов методом Чохральского?
4. Какими способами можно регулировать диаметр растущего кристалла?
5. Какие факторы влияют на распределение примесей и возникновение де-
фектов в кристалле?
6. Как распределяются примеси по длине кристалла при нормальном росте?
7. Что такое бестигельные методы вытягивания кристаллов из собственных
расплавов?
8. Какие особенности выращивания монокристаллов соединений, диссоции-
рующих при высоких температурах?
9. Чем объясняется отсутствие огранки кристалла, полученного методом Чох-
ральского?
125
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 9. ВЫРАЩИВАНИЕ КРИСТАЛЛОВ ИЗ РАСТВОРА В РАСПЛАВЕ
При экспериментальных работах и промышленном производстве
очень часто используется метод раствор-расплавной кристаллизации. В отли-
чие от методов выращивания из собственного расплава, введение в систему
растворителя существенно понижает температуру плавления и кристаллиза-
ции в системе, что значительно упрощает требования к аппаратуре. Кроме
этого, этот метод незаменим при выращивании монокристаллов тугоплавких и
нестабильных при высоких температурах соединений.
Цель работы: получение монокристаллов методом раствор-расплавной
кристаллизации на примере выращивания шеелита CaWO4
из расплава СаС12
Материалы: реактивы WO4, СаС12
Инструменты: весы, тигель, электрическая печь сопротивления с терморегуг
тором
Основные приемы и описание работы
1. В соответствие с приведенной диаграммой растворимости (рис. III.8)
рассчитать состав шихты.
О 10 20 30 CaWO4, мол. %
Рис. III.8. Растворимость CaWO4 в СаС12.
2. Взвесить необходимые реактивы и тщательно перетереть в ступке
(масса навески 5 г).
SESA Lab., ISSP RAS
126
3. Поместить шихту в тигель. Взвесить тигель до начала эксперимента.
4. Тигель с шихтой загрузить в электрическую печь сопротивления,
нагреть до температуры 1150°С и выдержать в течение нескольких часов.
5. Снизить температуру в установке до 800°С.
6. Извлечь тигель и взвесить его.
7. Отмыть полученные кристаллы в воде.
8. Описать полученные результаты.
Вопросы к задаче
1. Какие достоинства и недостатки раствор-расплавного выращивания кри-
сталлов?
2. Что такое ширина метастабильной зоны, способы ее определения?
4. Применение раствор-расплавного метода кристаллизации как способа для
очистки химических веществ?
5. Как происходит кристаллизация в системе с образованием инконгруэнтно
плавящихся соединений?
6. Как происходит кристаллизация в системах с образованием химических со-
единений, плавящихся без разложения?
127
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 10. КРИСТАЛЛИЗАЦИЯ ИЗ ГАЗОВОЙ ФАЗЫ
Одним из разновидностей метода выращивания из газовой фазы яв-
ляется метод запаянной ампулы. Как технологически наиболее простой, он не
требует сложной аппаратуры и достаточно легко осуществим практически. На
практике метод запаянной ампулы обычно используют для выращивания мас-
сивных монокристаллов, поскольку операции по подготовке процесса (откачка,
загрузка, герметизация и т. д.) довольно трудоемки, и получать таким путем
тонкие пленки нецелесообразно. Для выращивания крупного кристалла жела-
тельно иметь в зоне осаждения единственную затравку. Технически, однако,
довольно затруднительно вводить затравку в ампулу, запаиваемую при высо-
ких температурах, когда затравка может расплавиться или испариться. По-
этому, как правило, используют спонтанно возникшие зародыши.
Запаянную (обычно кварцевую) ампулу (рис. III.9), содержащую кри-
сталлизуемое вещество, помещают в область температурного градиента. Ис-
ходный материал располагают на более горячем участке ампулы (1). Благо-
даря температурной зависимости равновесного давления пара в ампуле уста-
навливается градиент концентраций, причем в более нагретой части концен-
трация оказывается выше.
Рис.III.9 Распределение температуры по
высоте ампулы при росте методом
объемной паровой фазы
128
SESA Lab., ISSP RAS
ast@issp.ac.ru
Под действием этого градиента вещество переносится к более холод-
ному концу (зона кристаллизации), где пар оказывается пересыщенным и бла-
годаря этому может конденсироваться (2).
В одном из самых распространенных вариантов запаянную ампулу с
"оттянутым" концом перемещают в зоне, где температура постепенно снижа-
ется, причем этот конец первым попадает в область сравнительно низкой
температуры. В этом месте может сформироваться единственный кристалл, а
если их окажется несколько, то благодаря геометрическому отбору, "выжива-
ет" лишь один. Отметим, что проблема геометрического отбора (т. е. "выжи-
вания" отдельного кристалла) здесь сложнее, чем в случае кристаллизации из
расплава, например, по методу Бриджмена-Стокбаргера.
На рисунке 111.10 показана схематическая модель возникновения пара-
зитных кристаллов на стенках ампулы. При кристаллизации из пара доставка
материала в суженую часть ампулы затруднена, следовательно, велика веро-
ятность возникновения зародышей в той части ампулы, где сужение только
начинается (область между штриховыми линиями), в дальнейшем эти заро-
дыши (1) отбирают материал из пара, и пересыщение в оттянутом конце ам-
пулы оказывается недостаточным для зарождения кристаллов. Поэтому в по-
следнее время чаще используют ампулы с закругленным концом, а локальное
повышение пересыщения в них создают, помещая в нужном месте теплоотво-
дящий стержень.
Рис. III.10. Схема возникновения спонтанных
кристаллов на стенках ампулы
В качестве примера рассмотрим выращивание этим методом монокри-
сталлов селенида свинца.
Цель работы: получение монокристаллов селенида свинца методом объ-
емной паровой фазы
Материалы: откачанная ампула с шихтой PbSe
Инструменты: кристаллизационная установка, оснащенная терморегулято-
ром и механизмом вытягивания ампулы.
129
SESA Lab., ISSP RAS
Описание работы и основные приемы
1. Ампулу устанавливают в печь с градиентом температуры, причем
нижнюю часть ампулы (с шихтой) нагревают до ~1100°С, т. е. выше точки
плавления PbSe (1080°), а верхнюю часть - до 1000-1020°, т. е. разность тем-
ператур, определяющая пересыщение в зоне кристаллизации, составляет по
термопарным измерениям 80-100° (фактическая температура на фронте кри-
сталлизации, по-видимому, заметно выше из-за лучеиспускания с источника и
выделения скрытой теплоты превращения).
2. Ампулу вытягивают из печи со скоростью 0,5-1,5 мм/ч, причем в
верхней ее части образуется слиток, крупноблочный или монокристалличе-
ский, общим весом ~30 г.
Вопросы к задаче
1. Какие разновидности метода объемной паровой фазы вы знаете?
2. Какие методы применяют для локализации зародышеобразования при рос-
те данным методом?
3. В чем достоинства и недостатки метода объемной паровой фазы?
130
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 11. ВЛИЯНИЕ КОНЦЕНТРАЦИИ РАСТВОРА НА ФОРМУ
КРИСТАЛЛОВ
Многообразие форм кристаллов определятся, с одной стороны их хи-
мическими и структурными особенностями, а с другой - условиями роста
(движущей силой и температурой кристаллизации, величиной pH среды, при-
месями и т. д.).
При малых пересыщениях или переохлаждениях формируются полно-
гранные индивиды. С увеличением же этих значений или при кристаллизации
из низкоконцентрированных сред кристаллы могут изменять свой облик, пре-
вращаясь, в частности, в скелеты или дендриты. Одной из основных причиной
подобных трансформаций является неравномерное распределение пересы-
щения (переохлаждения) вдоль поверхности грани на фронте кристаллизации.
Выступающие элементы кристалла, его вершины и ребра, находятся в более
выгодном положении относительно поступления питающего вещества, по
сравнению с гранями, что, соответственно выражается в различных скоростях
их роста. Кроме того, при отсутствии дислокационных источников роста, но-
вые слои берут свое начало преимущественно на ребрах и вершинах. Возни-
кающая неоднородность на фронте кристаллизации препятствует полному
развитию граней, что в конечном итоге, приводит к смене полиэдрической
формы на скелетную (или ее расщепленную разновидность - дендритную) и
искажению облика кристалла в целом.
Напротив, при локализации точек роста в центральных частях граней
образуются антискелетные кристаллы с положительными гранными и отрица-
тельными вершинными или реберными формами, которые при своём идеаль-
ном развитии приобретают близкую к сферической. В отличие от скелетных
форм, в антискелетных рост слоёв направлен в сторону вершин и ребер.
Дальнейшее их расщепление так же приводит к образованию различных вет-
вистых дендритов, сферокристаллов и сферолитов.
Переход от полиэдрической формы кристаллов к скелетной или денд-
ритной, как правило, обратим. При определенных условиях возможна регене-
рация подобных вершинных или реберных образований в полногранные.
131
SESA Lab., ISSP RAS
ast@issp.ac.ru
Цель работы: наблюдение процесса кристаллизации в тонком слое жидко-
сти NH4CI, CuSO4'5H2O, K2Cr2O7, MgSO4'5H2O, KI, KCI
Материалы: насыщенные при комнатной температуре растворы NH4CI,
CuSO4'5H2O, K2Cr2O7, MgSO4'5H2O, KI, KCI; насыщенный при
75°C раствор алюмо-калиевых квасцов
Инструменты: предметные стекла, бинокуляры
Описание работы и основные приемы
1. Приготовить растворы трех концентраций путем последовательного
разбавления исходного насыщенного в 2 и 5-10 раз. Полученные растворы
нанести тонким слоем на предметное стекло. Образовавшиеся кристаллы
изучить под микроскопом и зарисовать. Объяснить изменение их формы в за-
висимости от концентрации раствора.
2. Приготовить растворы алюмо-калиевых квасцов, насыщенные при
температурах 75°, 50° и 30°С. Капли полученных растворов при температуре
~100°С нанести на предметное стекло и охладить. Зарисовать полученные
кристаллы и объяснить результаты опытов.
Вопросы к задаче:
1. Какие основные факторы определяют реальную форму кристаллов?
2. Что такое вершинные и реберные формы кристаллов?
3. Чем различаются условия образования положительных и отрицательных
многогранников?
4. Что такое футляровидные кристаллы?
132
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 12. ВЛИЯНИЕ ПРИМЕСЕЙ НА ФОРМУ КРИСТАЛЛОВ
При рассмотрении влияния примеси на формы роста кристаллов, сле-
дует учитывать три аспекта: термодинамический, кинетический и гидродина-
мический. Нередко, влияние одной и той же примеси проявляется в одновре-
менном действии нескольких механизмов. Наиболее сильно примесь влияет
на процессы кристаллизации на поверхности. Кинетическое воздействие при-
меси на рост кристалла, иными словами, ее влияние на скорость роста кри-
сталла в целом, или отдельных его граней, происходит через адсорбцию по-
верхностью кристалла - в изломах, на ступенях, на атомно-гладких участках и
т. д. Концентрация примеси в различных положениях зависит, прежде всего,
от энергии связи примесной частицы с кристаллической поверхностью.
В связи с этим выделяют химическую и физическую адсорбцию. Для
первой характерно образование стойких химических соединений между по-
верхностными частицами (ионами, атомами) кристалла и примеси. При физи-
ческой адсорбции взаимодействие осуществляется водородными или другими
слабыми связями, не приводящими к образованию химических соединений на
поверхности. Повышение температуры приводит к усилению хемадсорбцион-
ных процессов с одной стороны, и ослаблению интенсивности физической
адсорбции с другой. По характеру кинетического воздействия примеси разли-
чают неспецифическое и специфическое влияние. При неспецифическом,
скорости роста всех граней изменяются приблизительно одинаково. Специ-
фическое влияние примеси приводит к изменению скорости роста лишь от-
дельных граней, что приводит к искажению облика кристалла в целом.
Таким образом, влияние примеси на процессы роста кристалла опре-
деляется энергией образования химических соединений примесь-кристалл и
примесь-растворитель, растворимостью этих соединений, коэффициентом
распределения, pH раствора, температурой кристаллизации.
Цель работы: проанализировать изменение формы кристаллов от полиэд-
рической к дендритной и наоборот под влиянием примесей
Материалы: насыщенные при комнатной температуре растворы-
препараты следующих солей: MgSO4-nH2O, KNaC4H4O6-nH2O,
NH4CI, KAi(SO4)-12H2O, NaCi;
растворы-примеси Co(NO3)2, NiCI2, CuSO4-nH2O, Na2B4O7 и
NH2CONH2 (мочевины) трех концентраций: 2,5 г/1 см3, 1,0 г/1
см3 и 0,5 г/1 см3
Инструменты: предметные стекла, капельницы, бинокулярные микроскопы
133
SESA Lab., ISSP RAS
ast®issp. ac.ru
Основные приемы и описание работы
1. Нанести на предметное стекло капли растворов-препаратов
MgSO4nH2O - Н2О, KNaC4H4O6nH2O - Н2О, NH4CI - Н2О, KAI(SO4)-nH2O - Н2О,
NaCI - Н2О. После полного испарения воды зарисовать форму и оценить ве-
личину полученных кристаллов.
2. Нанести на предметные стекла по три капли растворов-
препаратов, добавив в каждую из них по капле раствора-примеси разной кон-
центрации согласно приведенной ниже таблице. Сравнить форму и размер
образовавшихся после испарения капли кристаллов с результатами первого
эксперимента.
Водные растворы-препараты Водные растворы-примеси
MgSO4-nH2O - Н2О Na2B4O7 — Н2О
KNaC4H4O6 nH2O - Н2О CuSO4 nH2O - Н2О
NH4CI - Н2О NiCI2 - Н2О Co(NO3)2 - Н2О NH2CONH2-H2O
KAI(SO4)-12H2O - Н2О nh2conh2- Н2О Na2B4O7- Н2О
NaCI - Н2О NH2CONH2-H2O
3. Проанализировать выявленные зависимости формы и размера
кристаллов от типа и концентрации примеси.
Вопросы к задаче
1. Чем определяется теоретически возможная, равновесная и реальная фор-
ма кристаллов?
2. В чем суть физической и химической адсорбции примесей?
3. Каковы механизмы формирования зонарного и секториального строения
кристаллов?
SESA Lab., ISSP RAS
ast@issp.ac.ru
134
ЗАДАЧА 13. ИЗУЧЕНИЕ СЛОЕВ РОСТА НА СИНТЕТИЧЕСКИХ КРИСТАЛ-
ЛАХ МУАССОНИТА
Синтетический муассонит - карбид кремния ос-SiC, представляет собой
черные или зеленоватые кристаллы, выращиваемые из расплава в высоко-
температурных дуговых печах. Исходным материалом при синтезе служит
кварцевый песок и антрацит. В угольный керн, засыпаемый кварцевым пес-
ком, вводятся электроды, к которым прилагается напряжение более двух ты-
сяч вольт, при этом в образующейся электрической дуге происходит плавле-
ние компонентов шихты и синтез муассонита по реакции:
SiO2 + ЗС -> SiC + 2СО
Чистые разновидности кристаллов а-SiC бесцветны; разлагаются при
2300°С.
Существует 45 политипных разновидностей SiC, что позволяет ис-
пользовать чистые разновидности кубического [З-SiC как полупроводниковый
материал, примесные - как материал абразивный.
Спирали на гранях кристаллов свидетельствуют о его дислокационной
структуре. Форма спирали (круговая или полигональная), расстояние между
витками спирали, высота ступеней зависят от условий кристаллизации, в ча-
стности, от переохлаждения расплава. В первую очередь спирали следует
искать на гладких плотноупакованных гранях {0001}. На кристаллах a-SiC на-
блюдаются одно-, двух- и трехзаходные спирали, возникающие из одной точ-
ки; если спираль возникает не из одной точки, образуются сложные спирали.
Торец ступени не всегда вертикален, в ряде случаев ее наклон вызывается
большим количеством дислокаций, образующих эшелон ступеней.
Во время роста кристалла по мере изменения условий роста может
произойти превращение многозаходной спирали в однозаходную. С уменьше-
нием переохлаждения спираль может расщепляться и т. п.
Наличие спиралей может быть вызвано и примесями, а также спи-
ральный рост a-SiC связывают с политипией. Вообще же дислокации возни-
кают в результате огибания препятствий слоями, когда имеет место несоот-
ветствие в решетках старого и наложившегося на него нового слоя. Дислока-
цию можно представить себе как шов срастания, образующийся при несоот-
ветствующем слиянии встречных слоев в результате зарастания скелетного
кристалла. Наиболее дефектны области сочленения пирамид роста.
135
SESA Lab., ISSP RAS
ast@issp.ac.ru
Цель работы: изучение влияния переохлаждения расплава на степень со-
вершенства кристаллов синтетического муассонита (гексаго-
нальной модификации карборунда) через изучение спиралей
роста
Материалы: кристаллы карбида кремния a-SiC, выращенные из расплава
Инструменты: бинокуляр, поляризационный микроскоп, окуляры, фотоаппа-
рат
Основные приемы и описание работы
1. На поверхности изучаемых образцов найти различные типы спира-
лей: круговые, полигональные, смешанные и двухзаходные.
2. Сфотографировать найденные спирали.
3. Измерить высоту и ширину витков спирали.
4. Связать форму и крутизну спиралей с условиями их образования.
Вопросы к задаче
1. Какие типичные дефекты возникают в кристаллах, выращенных из распла-
ва?
2. Каковы причины возникновения спиралей роста?
3. Для каких граней характерна спираль роста?
4. Связь полигональных и круглых спиралей с условиями роста?
5. Какова зависимость высоты ступени, расстояния между ступенями от пере-
охлаждения расплава?
6. Всегда ли спирали представляют собой бугорки роста?
136
SESA Lab., ISSP RAS
ast@issp.ac.ru
ЗАДАЧА 14. МОРФОЛОГИЯ ЭПИТАКСИАЛЬНЫХ ПЛЕНОК ГЕРМАНИЯ
Пленки германия получают кристаллизацией из газовой фазы с помо-
щью химической реакции восстановления (рис. 111.11). Температура подложек
~600±100°С, процесс роста длится около получаса.
Н2, ОеС\4-питающий поток,
скорость вхождения которого ~0,08 см/мин
Ge-затравка
графитовый нагреватель
выход продуктов реакции
кварцевый вращающийся
кристаллодержатель
(1 об/мин)
Рис. 111.11. Схема установки для выращивания пленок
германия из газовой фазы
Морфология кристаллов Ge, образующихся выше 700°С и ниже 700°С,
различается. В высокотемпературной области кристаллизация происходит по
схеме пар—жидкость—«кристалл.
На поверхности пластин наблюдаются а) дефекты упаковки, б) трипи-
рамиды, в) холмики роста. На гранях {110} дефекты упаковки представляют
собой равнобедренные треугольники; на гранях {100} - квадраты. В плоско-
стях, отклоненных от ориентации {111}, треугольники вырождаются в трапе-
ции, последние - в прямые. Дефект упаковки формально трехмерный дефект
- кубический тетраэдр, по существу слагается из частичных дислокаций (дис-
локаций на долю параметра элементарной ячейки). Трипирамиды (рис. 111.12)
имеют, по-видимому, двойниковую природу. На рис. 111.12 цифры 1, 2 и 3 стоят
у вершин трех пирамид, 4 - вершина пирамиды - впадина, грани которой не
имеют кристаллографического индекса.
Условия роста - высокие температуры, тепловые "удары" благоприят-
ствуют возникновению всевозможных дефектов на гранях кристаллов.
137
SESA Lab., ISSP RAS
ast@issp.ac.ru
Рис.III.12. Трипирамида на грани {111} германия
Основными внешними причинами возникновения микродвойников в
кристаллах, растущих из газовой фазы, являются 1) наличие на подложке
температурных тангенциальных градиентов; 2) примеси; 3) неровности, нару-
шение гладкой поверхности подложки.
Цель работы: установить связь морфологии эпитаксиальных пленок с ус-
ловиями роста из газовой фазы
Материалы: эпитаксиальные пленки германия, полученные из газовой
фазы в разных условиях (пересыщениях)
Инструменты: микроскоп МИИ-4, фотоаппарат, пинцеты
Основные приемы и описание работы
1. На поверхности изучаемых образцов найти три типа описанных
выше дефектов: холмики роста, трипирамиды, дефекты упаковки.
2. Сфотографировать дефекты.
3. Сделать выводы о причинах их образования.
Вопросы к задаче
1. Каковы типичные дефекты в кристаллах, выращенных из газовой фазы и
причины их возникновения?
2. Каким образом можно охарактеризовать дефекты германиевых эпитакси-
альных пленок с кристаллографических позиций?
3. Что такое политипия и дефекты упаковки?
4. Как зависит размер дефектов от условий роста эпитаксиальных пленок?
138
SESA Lab., ISSP RAS
ast<9>issp.ac.ru
ЗАДАЧА 15. ХИМИЧЕСКОЕ ТРАВЛЕНИЕ КРИСТАЛЛОВ NaCI, KCI, CaF2
Травление как избирательное растворение поверхности кристаллов с
целью выявления симметрии, а, иногда, и химического состава этой поверх-
ности впервые, предположительно, было использовано Даниэлем в 1816 г.
Впоследствии, этот метод стал широко использоваться физиками и минерало-
гами как инструмент, позволявший решать спорные вопросы в симметрии кри-
сталлов. После открытия рентгеновских лучей он отступил на задний план до
тех пор, пока в середине прошлого века не была показана связь распределе-
ния ямок травления по поверхности с дефектностью структуры кристаллов. С
1953 г. травление стало методом изучения совершенства структуры. В основе
такого подхода лежит связь между ямками травления и выходами на эту по-
верхность дефектов - винтовых и краевых дислокаций, точечных дефектов,
границ зерен в моно- и поликристаллах. Поскольку в области дефектов ионы,
атомы или молекулы обладают повышенной химической активностью, то в
этих местах в первую очередь и начинается растворение на поверхности кри-
сталла.
С помощью подходящих травителей можно выявить дислокационную
структуру в кристаллах, определить положение двойниковых границ. Установ-
ление полярных осей и заключение о форме ямок травления в связи с сим-
метрией кристалла позволяет идентифицировать минералы. С помощью
травления можно повысить прочность материалов, растворяя нарушенные
слои поверхности. Так же травление широко используется при обработке ис-
кусственных стекол для матирования и придания им необходимой формы,
создания на их поверхности орнаментов. Таким образом, области применения
травления обширны и разнообразны. Именно поэтому разработка методов и
изучение материалов для химического травления поверхностей занимают не-
маловажное место в такой области знаний как материаловедение.
Фигуры травления на гранях кристалла с целью выявления дислока-
ций можно получить путем подбора соответствующего растворителя (трави-
теля), который обеспечивал бы подходящее соотношение нормальной и тан-
генциальной скоростей растворения обрабатываемой поверхности. Чем
меньше соотношение VmIVH, тем лучше выбранный травитель подходит для
выявления дефектности структуры. Уменьшения отношения нормальной и
тангенциальной скоростей растворения можно добиться тремя способами:
применение ингибитора для уменьшения Vm, увеличения VH посредством вы-
свобождения энергии ядра дислокации или с помощью примесей и, наконец,
использование температурных зависимостей скоростей растворения.
Травитель должен удовлетворять ряду требований. В первую очередь,
он должен незначительно растворять кристалл (0,07-0,02 г на 100 см3). На-
139
SESA Lab., ISSP RAS
ast@issp.ac.ru
пример, иттрий-алюминиевые гранаты травят в разбавленной ортофосфорной
кислоте Н3РО4, а основой для травления хлорида натрия NaCI служит вода. К
растворителю необходимо добавить некоторое количество хорошо раство-
ряющегося в нем активатора. При этом катион добавки к травителю жела-
тельно иметь близкий по размеру к катиону кристалла. Ингибитор, адсорбиру-
ясь на поверхности растворяющегося кристалла, оседает на ступеньках рас-
творения, экранируя (блокируя) их, и тем самым замедляет дальнейшее про-
движение ступеньки вдоль поверхности. Подбирая концентрацию активатора,
можно обеспечить оптимальное соотношение нормальной и тангенциальной
скоростей растворения кристалла.
Помимо травления на дислокациях, используются термическое, ион-
ное (травление посредством ионной бомбардировки) травление, сквозная
коррозия (каналообразование), а также химическое полирование.
По форме ямок травления можно судить о направлении линий дисло-
каций (рис. 111.13).
фф фф фффф
в
а
Рис.111.13.
Форма ямок травления в зависимости от по-
ложения линий дислокаций относительно по-
верхности кристалла: (а) - линии дислокаций
перпендикулярны поверхности; (б) - косо рас-
положенные к поверхности дислокации; (в) -
гексагональная сетка дислокаций
Цель работы: изучение плотности и характера и распределения дефектов в
кристалле
Материалы: кристаллы хлорида калия КО, хлорида натрия NaCI, фторида
кальция CaF2; травители: водный раствор FeCI3, этиловый
спирт + РЬО2, бутиловый спирт, ледяная уксусная кислота
Инструменты: микроскоп МИИ-4, бинокуляры, фотоаппарат, фильтроваль-
ная бумага
140
SESA Lab., ISSP RAS
ast@issp.ac.ru
Основные приемы и описание работы
1. Приготовить свежие сколы кристаллов NaCI, КО и CaF2 по спайно-
сти {100} и {111} соответственно.
2. Поместить кристаллы KCI, NaCI и CaF2 в травители в соответствии
с таблицей. В процессе растворения необходимо перемешивать раствор у
поверхности кристалла, покачивая кристалл в разных направлениях.
Объект ис- следования Травитель т травления^ °C Время травления, мин
KCI Насыщенный раствор PbCI2 в этиловом спирте. Кристаллы промываются в бутиловом спирте комнатная 3-10
NaCI Ледяная уксусная кислота в V=25 мл + 1-2 капли HNO3 комнатная 3-5
CaF2 Слабый раствор FeClj комнатная или слегка подогретый раствор 30
3. Извлечь кристаллы из растворов, просушить фильтровальной бу-
магой, а в случае КО - предварительно промыть в растворе бутилового спир-
та.
4. На микроинтерферометре МИИ-4 посмотреть и сфотографиро-
вать ямки травления.
5. Под бинокуляром подсчитать плотность дислокаций.
6. Провести небольшое дополнительное травление для того, чтобы
убедиться в закономерности распределения ямок травления на поверхности
кристалла.
7. Охарактеризовать качественные и количественные изменения фи-
гур травления после дополнительного травления.
Вопросы к задаче
1. В чем суть физико-химического травления кристаллов?
2. В чем заключается молекулярно - кинетическая теория травления?
3. Какие факторы влияют на травление кристаллов?
4. Каковы особенности метода избирательного травления?
141
SESA Lab., ISSP RAS
ast@issp.ac.ru
ПРАВИЛА БЕЗОПАСНОСТИ
К помещению для роста кристаллов предъявляются те же требования,
что и к любой химической лаборатории. В нем должны быть шкафы с приточ-
ной и вытяжной вентиляцией, водопровод, а пол покрыт хорошо моющимся
пластиком без щелей на стыках листов, что относится также к стеллажам для
химических реактивов и столов для подготовительных работ. В кабинах же
для высокотемпературных кристаллизационных установок следует преду-
смотреть огнеупорное покрытие. Поскольку кристалл в ряде случае выращи-
вается в течение нескольких недель, а то и месяцев, то лаборатория должна
быть обеспечена бесперебойным круглосуточным снабжением электроэнер-
гией.
Приборная база для выращивания монокристаллов в каждом методе
имеет свои особенности, однако необходимо соблюдать общие требования к
выполнению любого эксперимента. Токопроводящие линии и клеммы следует
надежно изолировать, а корпуса всех находящихся под напряжением уст-
ройств - заземлить и обеспечить предохранителями или автоматическими
выключателями в целях пожарной безопасности при коротком замыкании по
какой-либо причине. Сечение проводов должно отвечать максимальному про-
текающему по ним току. Установки, работающие в условиях высоких давле-
ний, необходимо помещать в специальные бронированные кабины, а при по-
лучении монокристаллов радиоактивных и вредных веществ - в боксы, пред-
назначенные для работы с агрессивными и радиоактивными материалами.
Аппаратура должна быть не только удобна и безопасна в эксплуатации, но и
надежна в работе, поддерживая в течение длительного времени заданные
параметры эксперимента, и, по возможности, проста в изготовлении. Послед-
ние два условия находятся в известном противоречии друг с другом. Поэтому
в зависимости от целей конкретного опыта иногда ради надежности и просто-
ты аппаратуры приходится жертвовать в определенной степени точностью
поддержания того или иного параметра кристаллизации.
Требования к материалам, из которых изготавливаются кристаллиза-
ционные камеры, специфичны для конкретного метода. Они обусловлены
142
SESA Lab., ISSP RAS
ast@issp.ac.ru
температурой, давлением проводимого процесса, характером внешней среды
(окислительная, восстановительная, инертная), химической активностью кри-
сталлизационной среды.
Технически сложная аппаратура, соответственно, требует и более вы-
сокой квалификации и культуры работы технического персонала. Также надо
иметь в виду, что чем прецизионнее эксперимент, чем продолжительнее про-
цесс выращивания, тем больше вероятность непредвиденных аварий и тем
труднее выдержать заданный режим роста кристалла.
При выполнении практических задач в лаборатории предварительно
необходимо ознакомиться с условиями эксперимента, его оснащением и со-
блюдать все правила безопасной работы на электроустановках, находящихся
под напряжением, быть предельно осторожными при проведении опытов с
высокими температурами, давлениями и агрессивными химическими вещест-
вами. Перед началом следует убедиться в правильности схемы планируемого
эксперимента. Задание должно выполняться как минимум вдвоем и контроли-
роваться преподавателем. К работе не допускаются лица младше 18 лет. Со
студентами проводится инструктаж, после чего они расписываются в соответ-
ствующем журнале.
143
SESA Lab., ISSP RAS
ast@issp.ac.ru
РЕКОМЕНДУЕМАЯ И ЦИТИРУЕМАЯ ЛИТЕРАТУРА
Базаров И.П. Термодинамика. М: Высшая школа, 1991,376 с.
Брандон Д., Каплан У. Микроструктура материалов. Методы исследования и
контроля. М: Техносфера, 2006, 377 с.
Вильке К.Т. Методы выращивания кристаллов. М: Недра, 1977, 600 с.
Григорьев Д.П., Жабин А.Г. Онтогения минералов. Индивиды. М: Наука, 1975,
346 с.
Дорохова Г.И., Каплунник Л.Н. Морфометрия кристаллов. М: Изд. МГУ, 1986,
120 с.
Козлова О.Г. Рост и морфология кристаллов. М: Изд. МГУ, 1980, 368 с.
Козлова О.Г. Морфолого-генетический анализ кристаллов. М: Изд. МГУ, 1991,
224 с.
Костов И. Кристаллография. М: Мир, 1965, 528 с.
Краснова Н.И., Петров Т.П. Генезис минеральных индивидов и агрегатов. С.-
Петербург: Невский курьер, 1997, 228 с.
Кубо Р. Термодинамика. М: Мир, 1970, 304 с.
Леммлейн Г.Г. Морфология и генезис кристаллов. М.: Наука, 1973, 328 с.
Лодиз Р., Паркер Р. Рост монокристаллов. М: Мир, 1974, 540 с.
Медведев С.А. Введение в технологию полупроводниковых материалов, М:
Высшая школа, 1970, 504 с.
Мейер К. Физико-химическая кристаллография. М: Металлургия, 1972, 478 с.
Мюнстер А. Химическая термодинамика. М: Мир, 1971,296 с.
Палатник Л.С., Папиров И.И. Ориентированная кристаллизация. М: Метал-
лургиздат, 1964, 408 с.
Петров Т.П, Трейвус Е.Б., Пунин Ю.О., Касаткин А.П. Выращивание кристал-
лов из растворов. Л: Недра, 1983, 200 с.
Рашкович Л.Н. Скоростное выращивание из раствора крупных кристаллов для
нелинейной оптики. Вестник АН СССР, 1984, № 9, сс. 15-19.
144
SESA Lab., ISSP RAS
ast@issp.ac.ru
Сиротин Ю.И., Шаскольская М.П. Основы кристаллофизики. М: Наука, 1979,
640 с.
Современная кристаллография (в четырех томах). Том 3. Образование кри-
сталлов. М: Наука, 1980, 430 с.
Тимофеева В.А. Рост кристаллов из растворов-расплавов. М: Наука, 1978, 268
с.
Уббелоде А. Плавление и кристаллическая структура. М: Мир, 1969, 420 с.
Урусов В.С., Таусон В.Л., Акимов В.В. Геохимия твердого тела. М: ГЕОС, 1997,
500 с.
Хонигман Б. Рост и форма кристаллов. М: Иностранная литература, 1961,
224с.
Чалмерс Б. Теория затвердевания. М: Металлургия, 1968, 288 с.
Чернов А.А. Физика кристаллизации. М: Знание, 1983. 64 с.
Шаскольская М.П. Кристаллография. М: Высшая школа, 1976, 391 с.
Шафрановский И.И. Лекции по кристалломорфологии. М: Высшая школа,
1968, 172 с.
Штернберг А.А. К вопросу о строении жидкости. Рост кристаллов. Том 5. М:
Наука, 1965, сс.179-186.
Шубников А.В., Парвов В.Ф. Зарождение и рост кристаллов. М: Наука, 1969, 72
с.
Goldschmidt V.M. Geochemistry. Oxford Univ. Press, 1958
Jackson K.A. Interface structure. In: Growth and perfection of crystals. N. Y.: John
Wiley & Sons, Inc.; London: Chapman & Hall, Lim., 1958, pp. 319-323. Discuss, p.
324.
Leamy H.J., Gilmer G.H., Jackson K.A. Statistical thermodynamics of clean sur-
faces. In: Surface physics of materials, v. 1. New York, San Francisco, London:
Acad. Press, 1975, pp. 121-188.
Zaitseva N., Carman L. Rapid Growth of KDP-type crystals. Progress in Crystal
Growth and Characterization of Materials, 2001, pp. 1-118.
145
SESA Lab., ISSP RAS
ast@issp.ac.ru
Учебное издание
ЛЕОНЮК Николай Иванович
КОПОРУЛИНА Елизавета Владимировна
ВОЛКОВА Елена Александровна
МАЛЬЦЕВ Виктор Викторович
РОСТ КРИСТАЛЛОВ
Лабораторный практикум
с основами теории
Компьютерная подготовка оригинал-макета:
А.И. Жиляева
Напечатано с готового оригинал-макета
Подписано к печати 08.11.2014.
Формат 70x100 1/16. Бумага офсетная № 1, 80 г/м2
Гарнитура Таймс. Печать офсетная. Уч.-изд. л. 12,0.
Тираж 200 экз.
ООО “Издательство ГЕОС”
119017, Москва, Пыжевский пер., 7. к. 332
Тел./факс: (495) 959-35-16, (499) 152-19-14, 8-926-222-30-91.
E-mail: geos-books@yandex.ru,
www.geos-books.ru