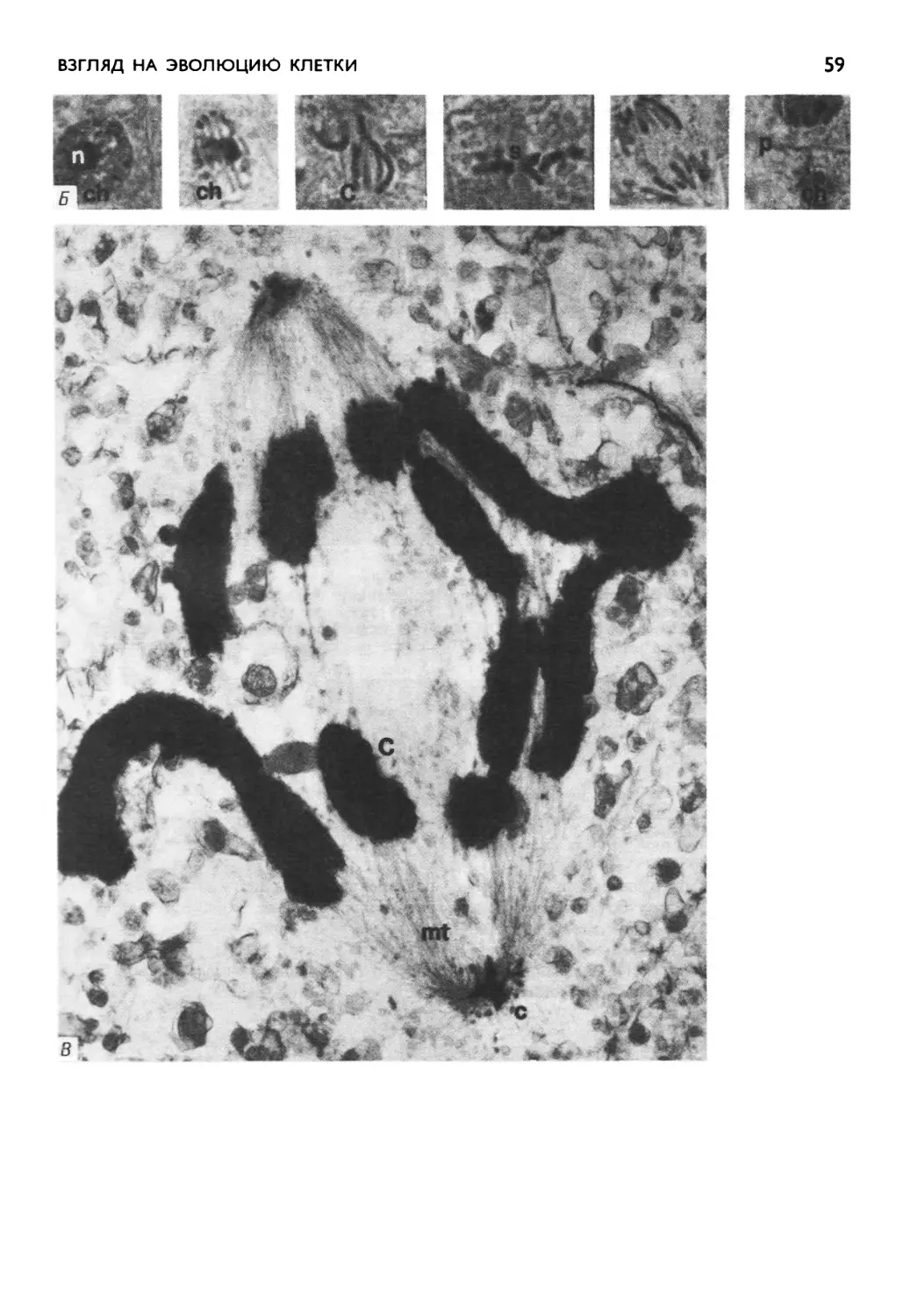
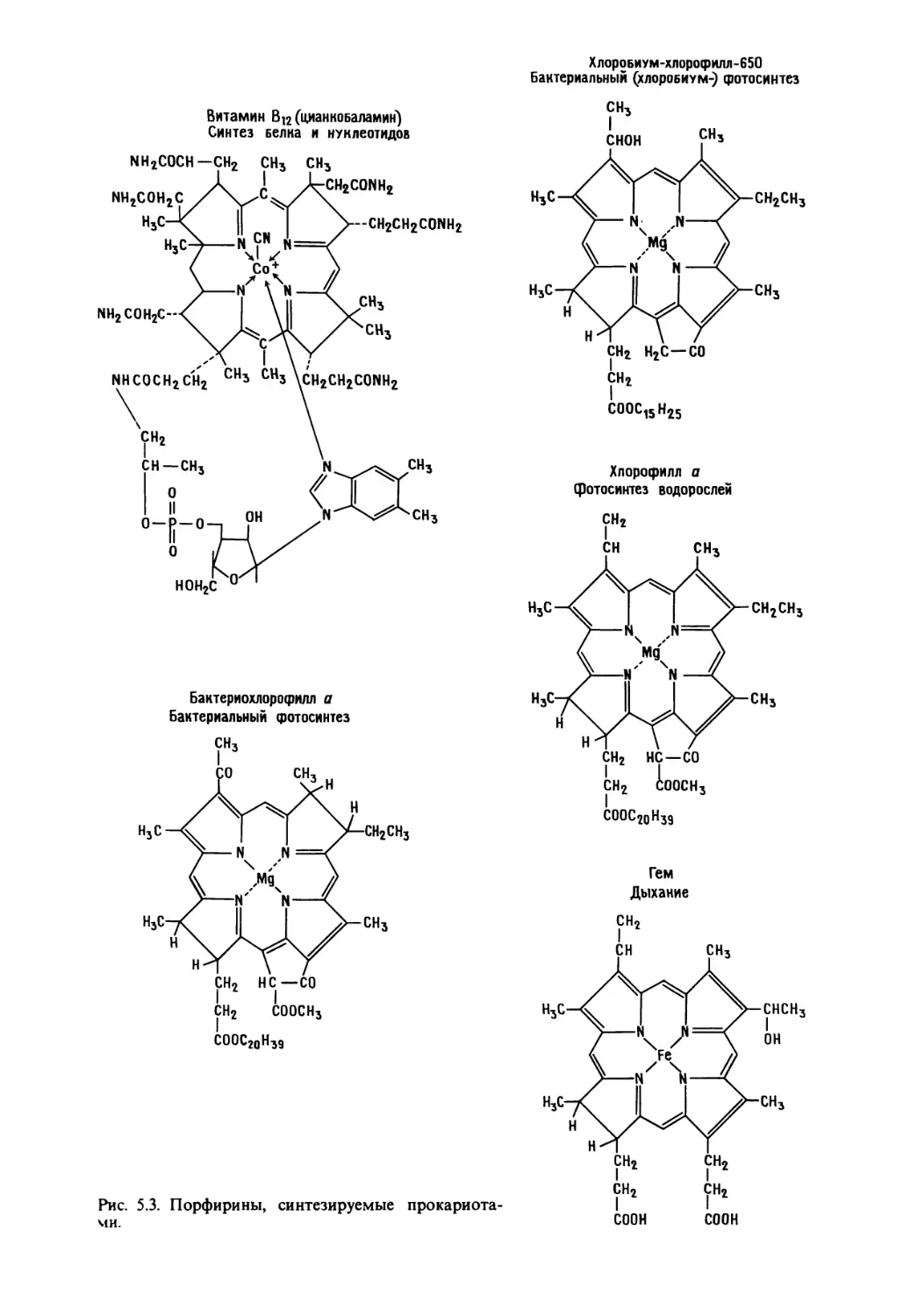
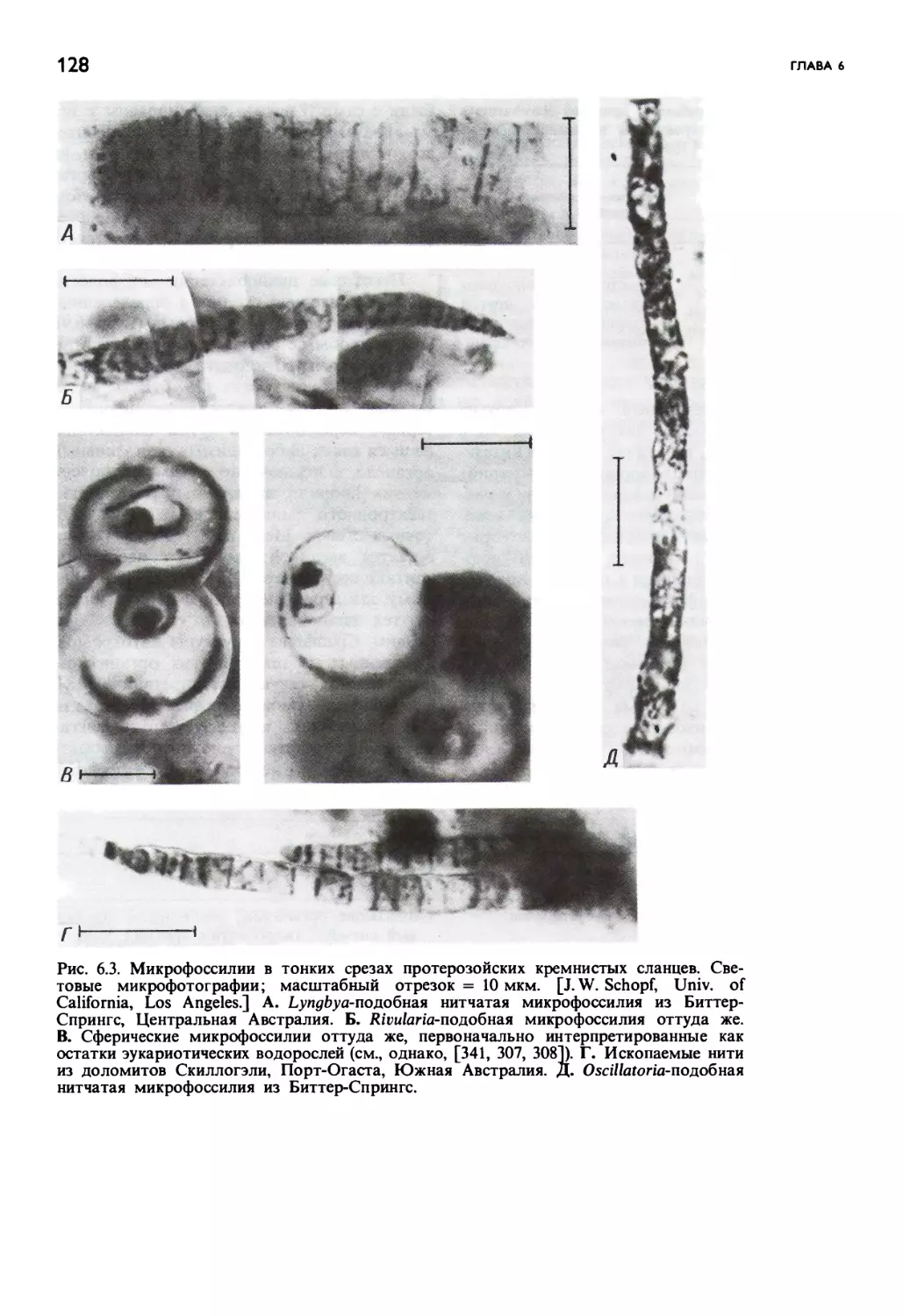
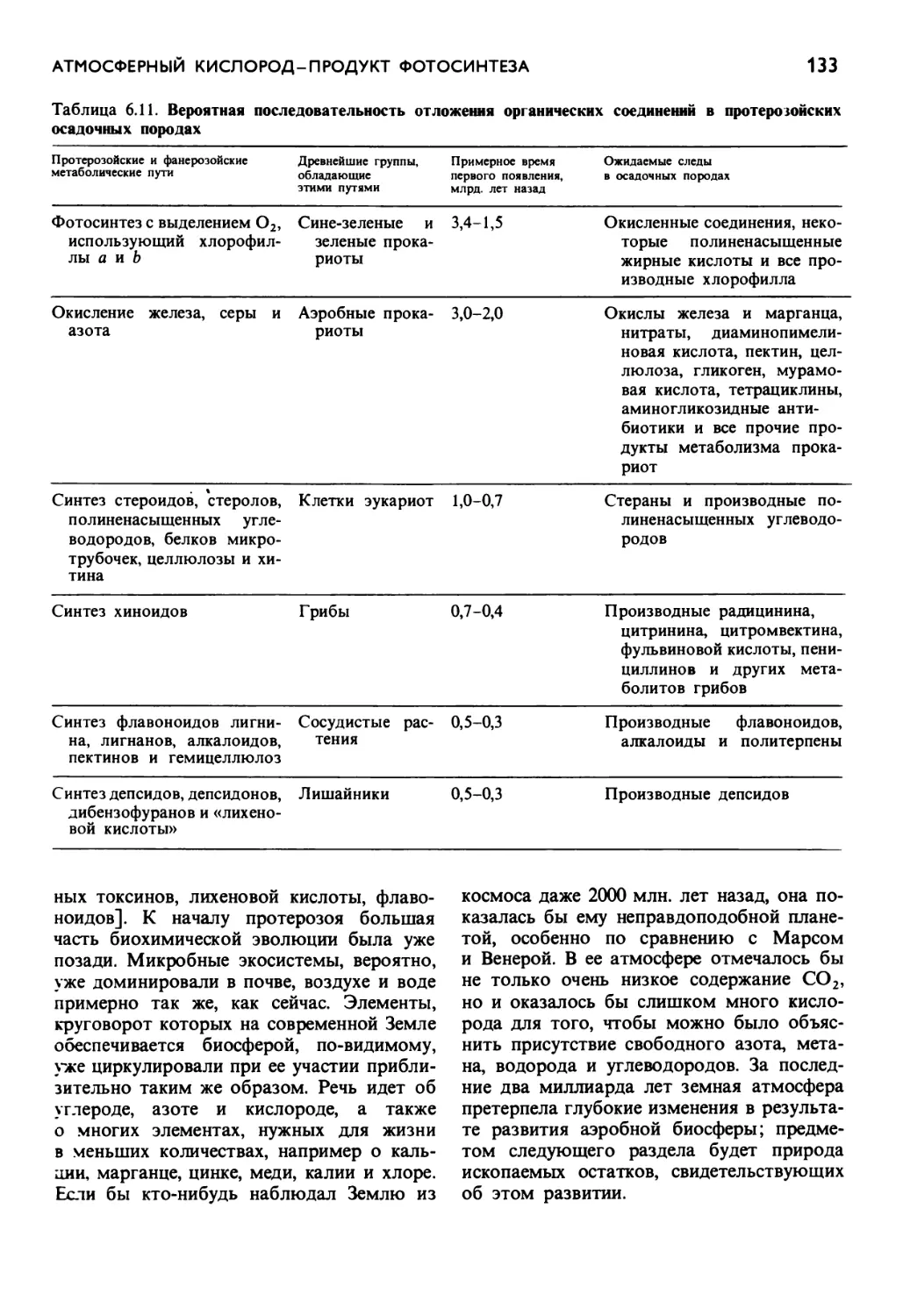
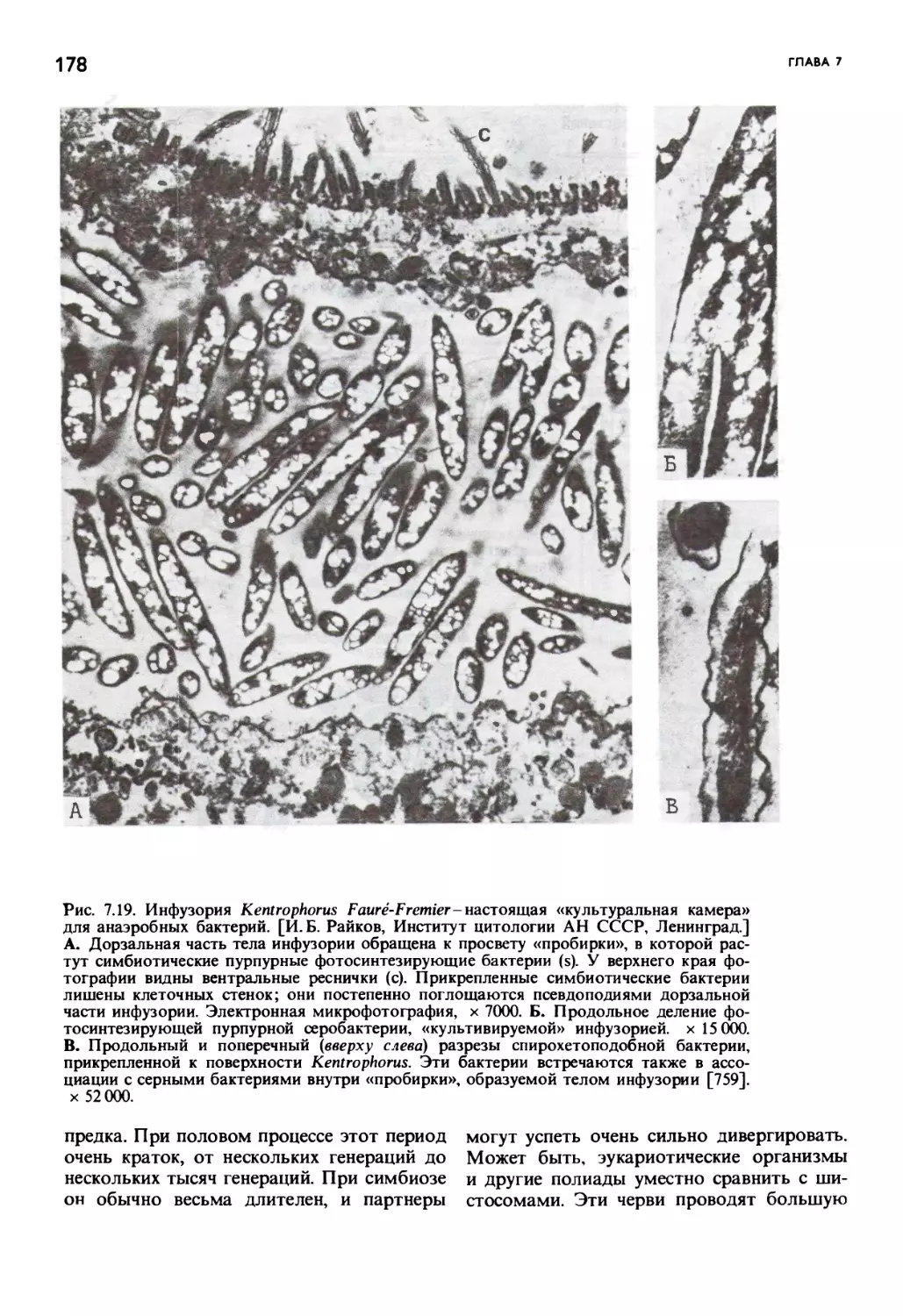
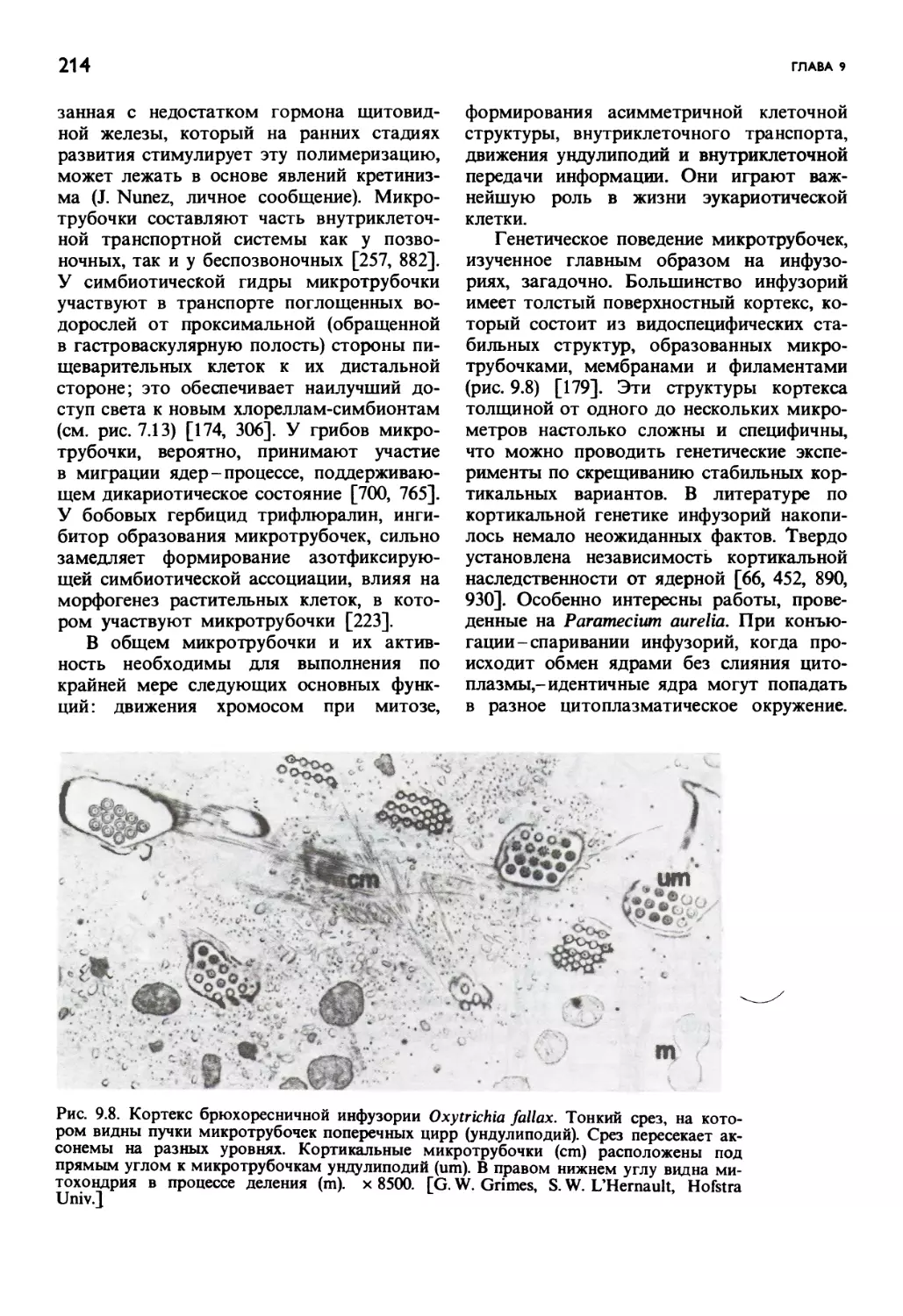
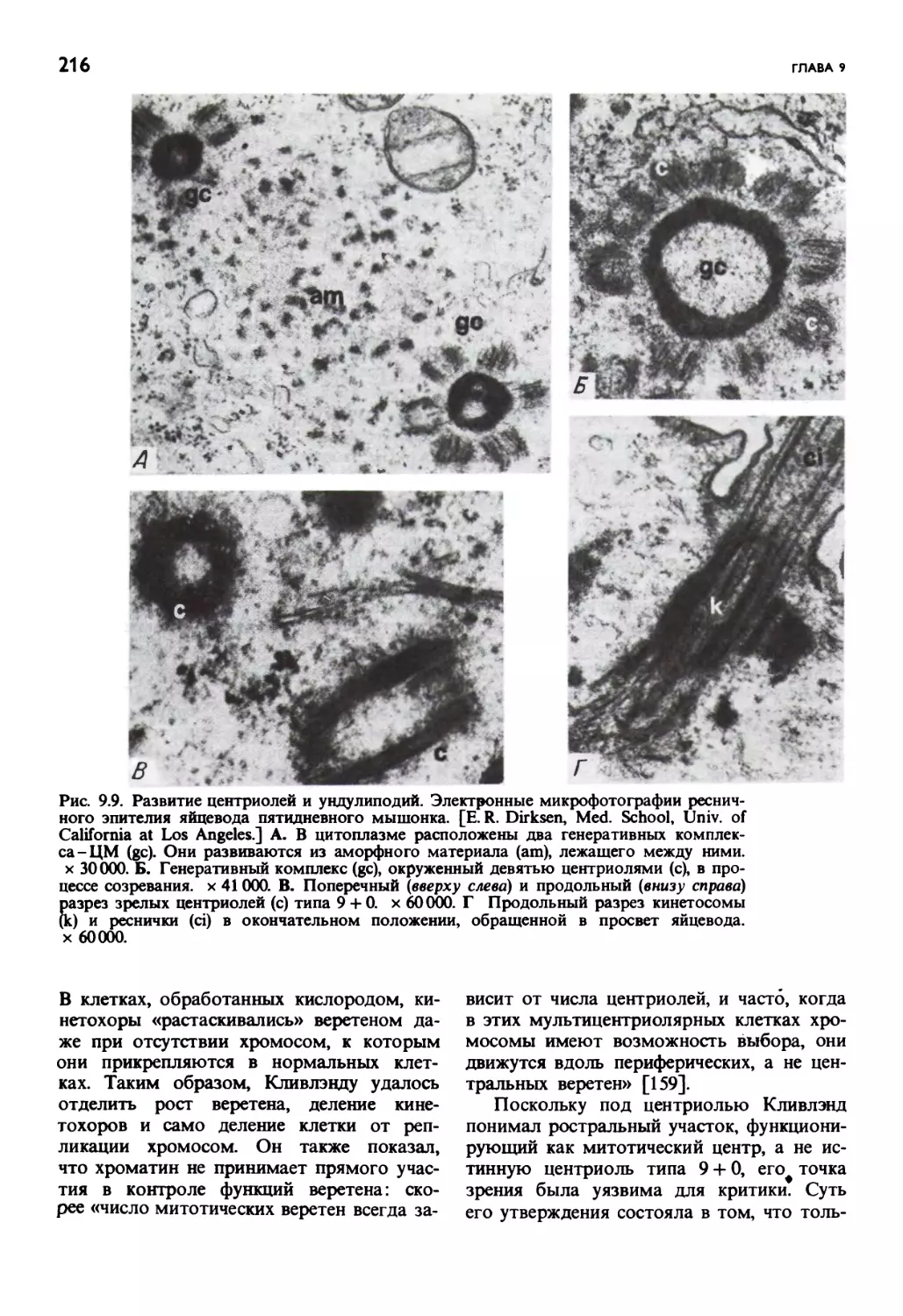
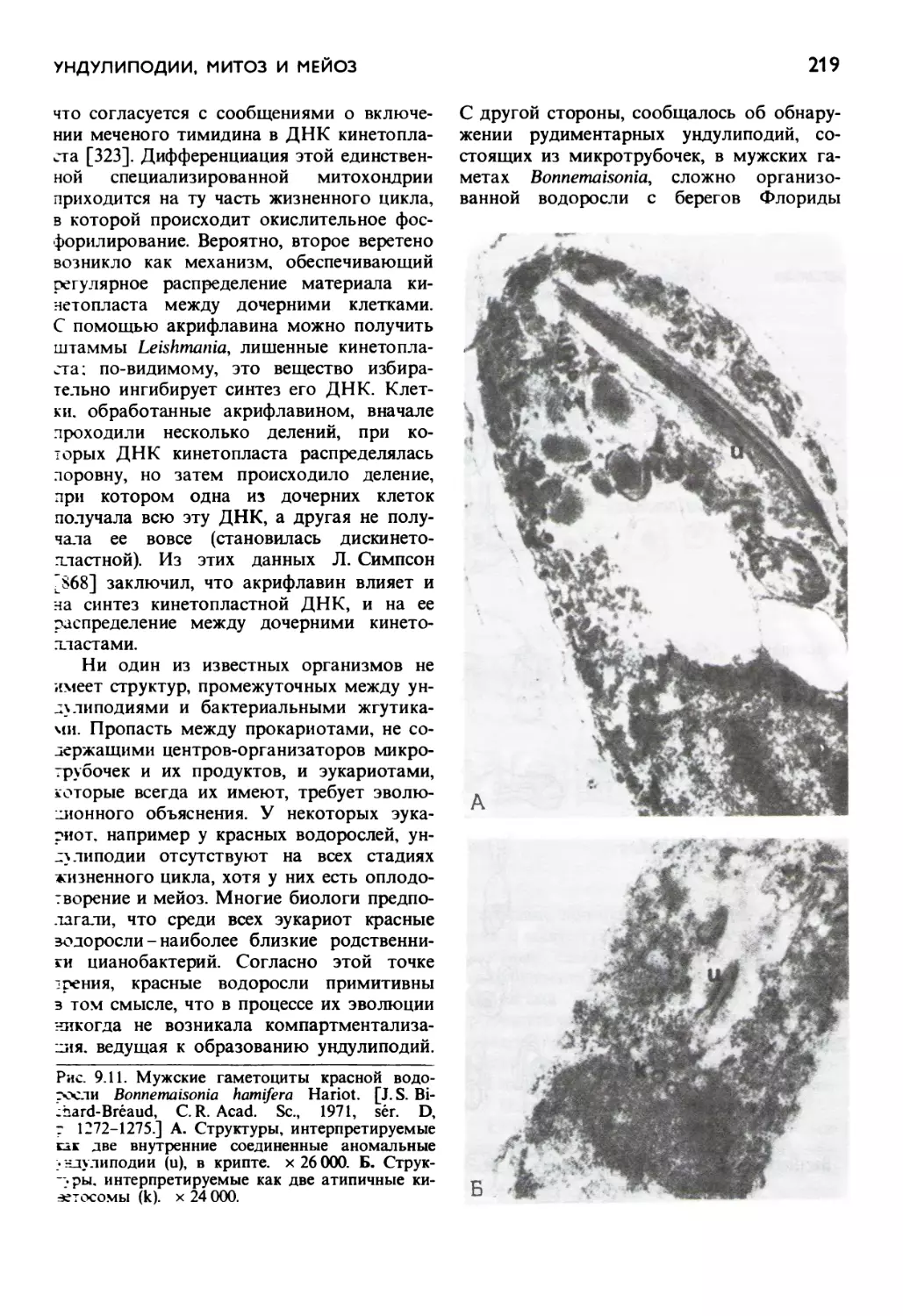
Автор: Маргулис Л.
Теги: биология клетки и субклеточных частиц цитология общая биология биология
Год: 1983
Текст
Symbiosis in Cell Evolution
Life and its Environment on the Early Earth
LYNN MARGULIS
Boston University
W. H. Freeman and Company
San Francisco
Роль симбиоза
в эволюции
клетки
Л.Маргелис
Перевод с английского
д-ра биол. наук
В. Б. КАСИМОВА
и
Е. В. КУНИНА
под редакцией
д-ра биол. наук
Б. М. МЕДНИКОВА
Москва «Мир» 1983
ББК 28.05
М 25
УДК 576.
Маргелис Л.
М 25 Роль симбиоза в эволюции клетки:
Пер. с англ.-М.: Мир. 1983.-352 с., ил.
Монография известного американского специалиста по
происхождению жизни посвящена интересной проблеме-
происхождению клеток эукариот в результате симбиоза.
В монографии детально излагаются суть теории симбиоза
и те фактические данные, на которых она основана, геологи-
ческие и физические предпосылки возникновения жизни, ран-
ние этапы формирования обмена веществ, история возникно-
вения различных клеточных органелл.
Книга предназначена для эволюционистов, цитологов,
молекулярных биологов, зоологов, ботаников, палеонтоло-
гов.
жж 2001000000-358
м-----------------123-83, ч. 1
041(01)-83
ББК 28.05
Редакция литературы по биологии
© 1981 by W.H. Freeman and Company
© Перевод на русский язык, «Мир», 1983
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
Идеи, развиваемые в книге Л. Маргелис, имеют в отечественной литерату-
ре давнюю историю. Более 100 лет назад крупный физиолог А. С. Фаминцын
при участии О. В. Баранецкого поставил простой опыт, имевший важные по-
следствия. Из него непосредственно вытекал вывод о двойственной природе
лишайников-комплексов гриба и водоросли. После статьи Фаминцына, уви-
девшей свет в 1867 г., С. Швенденеру двумя годами позже уже легко было
сделать этот вывод (термин «симбиоз» был введен А. де Бари еще 10 лет
спустя).
А. С. Фаминцын до конца своих дней (1918) живо интересовался проблема-
ми симбиоза и продолжал разрабатывать эту тему. Об этом можно судить
хотя бы по цитате из его последней работы 1918 г.: «... Растительная клетка
разложима на несколько самостоятельных организмов, другими словами, вы-
ясняется, что и растительная клетка (как и животная) суть симбиотический
комплекс» (цит. по Л.Н. Хахиной. Проблема симбиогенеза,-Л.: Наука, 1979).
Гипотеза симбиогенеза привлекала внимание также К. С. Мережковского,
|>, М. Козо-Полянского и ряда других русских и советских исследователей.
Жива эта традиция в какой-то мере и до сих пор, поэтому можно полагать,
что книга Л. Маргелис (или Саган-Маргулис, как мы ее привыкли называть)
встретит у советского читателя доброжелательный прием.
Я был вынужден остановиться на истоках учения о симбиогенезе в отече-
ственной (да и в мировой) литературе потому, что автор книги не упоминает
о работах А. С. Фаминцына, а К. С. Мережковского и Б. М. Козо-Полянского
цитирует лишь по статье А. Л. Тахтаджяна.
Это, однако, не умаляет заслуг Л. Маргелис. Известно, что нужна опреде-
ленная решимость для того, чтобы выдвинуть новую гипотезу, и еще боль-
шая решимость, чтобы воскресить на основе новых данных старую, по каким-
либо причинам ставшую непопулярной концепцию. Больше 100 лет прошло
после выхода в свет работ Фаминцына и Швенденера. Гипотеза симбиогенеза
митохондрий немногим моложе (обзор старых работ см. в книге: А. Ленинд-
жер. Митохондрия-М.: Мир, 1966). Однако в 30-е, 40-е и 50-е годы идея сим-
биогенеза явно не находила признания у большинства исследователей. Одна
лишь Л. Маргелис, в то время еще Саган, опираясь на последние данные мо-
лекулярной биологии и электронной микроскопии, воскресила эту непопуляр-
ную концепцию и смело продвинула ее вперед.
В этой книге автор смелыми мазками рисует величественную картину ста-
новления эукариотических клеток, начиная с момента возникновения жизни.
Как признает сама Л. Маргелис, ее взгляды являются «крайним» вариантом
теории симбиогенеза, поэтому они еще далеко не во всем обоснованы в оди-
наковой мере.
Л. Маргелис полагает, что три основные клеточные органеллы - митохон-
дрии, фотосинтезирующие пластиды и базальные тельца жгутиков, по-
строенных по схеме 9 + 2,- были когда-то свободноживущими прокариота-
6
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
ческими клетками. Более того, по ее мнению, возможно обнаружение
свободноживущих аналогов органелл среди современных микроорганизмов.
Симбиогенез фотосинтезирующих пластид в настоящее время можно счи-
тать практически доказанным. Было бы, однако, ошибкой считать, что эта
программа исчерпана до конца и в будущем работы по этой теме не имеют
перспектив. Остановимся хотя бы на одном вопросе-о наиболее вероятном
свободноживущем аналоге хлоропластов. Большинство авторов склоняются
к мысли, что такими аналогами должны быть цианофиты («сине-зеленые во-
доросли»). Л. Маргелис идет дальше и называет предком хлоропластов
Prochloron- фотосинтезирующий организм, лишенный синего пигмента. Одна-
ко предок хлоропластов мог утратить фикоцианин уже на стадии симбионта.
Первые исследователи симбиогенеза - те же Фаминцын и Мережковский-
полагали, что одним из критериев симбиогенетического происхождения орга-
неллы должна быть потенциальная возможность ее самостоятельного суще-
ствования вне клетки хозяина, в культуре, подобно «гонидиям» в опыте Фа-
минцына и Баранецкого. Это положение лишь повредило идее симбиогенеза,
так как, например, хлоропласты получить в культуре до сих пор не удается.
Однако на деле это не противоречит симбиотическому происхождению, так
как симбиоз, как и паразитизм, может быть обязательным, облигатным.
Облигатные паразиты, начиная от некоторых микоплазм и кончая солитером,
не могут существовать вне хозяина, однако они, несомненно, самостоя-
тельные организмы. То же и с симбионтами: наиболее распространенная
в составе лишайников симбиотическая водоросль Trebouxia не существует
в свободном состоянии, в отличие от представителей близкого рода
Chlorococcum. Число подобных примеров можно умножить. Для нормального
функционирования практически всех органелл необходимы продукты ядерных
генов. Это ограничение самостоятельности, с одной стороны, более экономно,
а с другой-синхронизирует темп роста и деления органелл и клеток хозяина.
Критерий существования свободноживущих аналогов органелл, предло-
женный Маргелис, на деле не обязателен. За миллиарды лет с момента стано-
вления симбиоза свободноживущая форма могла исчезнуть с лица Земли или
же настолько измениться, что в ней уже нельзя заподозрить «аналотЪ». Здесь,
как и в палеонтологии, значение имеют лишь положительные факты: поэтому
отсутствие свободноживущих аналогов, как и потеря способности к самостоя-
тельному существованию, не может считаться аргументом против симбиоза.
Сложнее дело обстоит с симбиогенезом митохондрий. В высшей степени
вероятно, что эти органеллы-дериваты каких-то аэробных бактерий, вроде
Paracoccus denitrificans. Однако многочисленные работы последних лет свиде-
тельствуют о том, что по крайней мере некоторые гены митохондрий дрож-
жей (например, ген цитохрома Ь) имеют несчитываемые участки нуклео-
тидных последовательностей (интроны), характерные для эукариот, но
отсутствующие у прокариотических организмов. У высших эукариот-млеко-
питающих-митохондриальные гены утрачивают сложную, мозаичную струк-
туру, приближаясь по строению к прокариотическим. Этот феномен еще не
получил исчерпывающего объяснения. Возможно, справедлива гипотеза Ду-
литла (Doolittle W. F. 1978. Nature, 271, 501), согласно которой простая струк-
тура прокариотического гена вторична. Сам до себе принцип вырезания из
транскрибированной РНК нефункциональных (или, вернее, уже выполнивших
свою функцию) участков (сплайсинг) не чужд прокариотам. Как известно,
РНК, слагающие большую или малую субъединицу рибосом, транскриби-
руются у них в виде единой последовательности, разделенной вырезаемым
позднее участком (транскрибируемым спейсером). Если это так, то прока-
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
риоты с самого начала пошли по пути регрессивного развития. У них не по-
лучил распространения процессинг - по-видимому, весьма эффективный меха-
низм регуляции генной активности,-что закрыло им путь к дифференцировке
и развитию многоклеточности. Эволюцию ДНК митохондрий в таком случае
можно трактовать как пример параллельного развития. Отсюда следует, что
> претендентов на роль предков или хотя бы свободноживущих аналогов ми-
тохондрий может быть обнаружена мозаичная структура гена-с интронами.
Впрочем, и здесь отрицательный результат не имеет значения, так как может
трактоваться как вторичный феномен.
Л. Маргелис полагает, что жгутики и реснички (ундулиподии) и по-
строенный из микротрубочек аппарат, обеспечивающий течение митоза
и мейоза,-это дериваты симбиотических организмов, аналогами которых
являются спирохеты. В этой области интересны ее исследования, показавшие
чрезвычайную распространенность у термитов своеобразных симбиотических
спирохет - пиллотин, легко вступающих в ассоциации с обитающими в кишеч-
нике термитов жгутиконосцами. Эти данные очень эффектны, но, как и всякая
аналогия, могут считаться лишь косвенным свидетельством. Гораздо более
убедителен тот факт, что микротрубочки спирохет связывают антитела к ту-
булину - белку, ранее считавшемуся совершенно чуждым миру прокариот. Од-
нако автор сама признает, что положительная иммунологическая реакция мо-
жет оказаться артефактом. В данном случае лучшим доказательством было
бы обнаружение гомологий в аминокислотных последовательностях сократи-
мого белка спирохет и тубулина эукариот (или же гомологий в нуклеотидных
последовательностях соответствующих генов). Так как тубулин очень консер-
вативен, эта попытка может иметь успех. Отметим, что еще Козо-Полянский
высказывал предположение, что центриоли и блефаропласт имеют бакте-
риальную природу (см. Б. М. Козо-Полянский. Новый принцип биологии.
Очерк теории симбиогенеза-М.: «Пучина», 1924).
С точки зрения редактора спорными кажутся представления автора о по-
лифилии митоза и особенно мейоза, а также о первичности отсутствия поло-
вого процесса у некоторых простейших. Описано много случаев вторичной
утраты митоза и мейоза (например, у штаммов инфузорий, потерявших ми-
кронуклеус). Как и во многих других случаях, первичную примитивность
можно смешать со вторичной, регрессивной. Механизм же возникновения га-
плоидных клеток (и ядер у инфузорий) выглядит настолько одинаковым
у всех эукариот, что трудно допустить его независимое возникновение в раз-
ных группах.
В заключение нужно сказать, что принятая автором классификация прока-
риот, в основу которой положена известная система Уиттэйкера, в настоящее
время уже устарела. Основы первой в истории микробиологии естественной,
филогенетической системы заложены в статье девятнадцати американских ав-
торов (Fox G.E. et al., Science, 209, № 25, 1980), взявших за критерий близости
первичную структуру 16S-рибосомной РНК. Из этой статьи видно, сколь
опасно микробиологу полагаться в систематических построениях на морфо-
логические признаки и особенности метаболизма. Теперь выделено новое
вадцарство архебактерий, эквивалентное по рангу прокариотам и эукариотам,
объединяющее столь разнородные по фенотипу группы, как термофильные
ацидофилы, метаногены и экстремальные галофилы. Лишенные клеточной
оболочки микоплазмы многими микробиологами считались самыми древни-
ми. первично примитивными организмами, а на деле оказались сборной груп-
пой дегенерировавших форм, близких к родам Bacillus и Lactobacillus. Бурное
развитие геносистематики приводит к тому, что многие систематические
8
ПРЕДИСЛОВИЕ РЕДАКТОРА ПЕРЕВОДА
и эволюционные построения устаревают, будучи едва опубликованными. Что
же, этому можно только радоваться!
Хочу высказать надежду, что публикация на русском языке интересной,
живо написанной сводки Л. Маргелис будет стимулировать работы советских
исследователей в этом направлении-традиционном для отечественной науки,
но сейчас несправедливо забытом. Она будет полезна для широкого круга чи-
тателей, интересующихся проблемами возникновения жизни и биосферы, для
микробиологов и цитологов, эволюционистов и биологов-теоретиков.
Б. М. Медников
Главы 1-4, 11 и 12 переведены В. Б. Касиновым, главы 5—10-Е. В. Куниным.
ПРЕДИСЛОВИЕ
Пятьдесят лет назад основные идеи, развиваемые в этой книге, казались,
как писал Э.Б. Вильсон, «слишком фантастичными для упоминания в кругу
благовоспитанных биологов» или, как позднее заявил А. Тахтаджян, настоль-
ко далекими от согласия с укоренившейся точкой зрения, что их «невозможно
было обсуждать на серьезных научных конференциях». Ныне эти идеи, хотя
кое-кто может их все еще отвергать, определенно стали вполне респектабель-
ной темой для научных дискуссий. Эта тихая революция в биологическом
мышлении-в первую очередь результат проницательности и энтузиазма ав-
тора настоящей книги Линн Маргелис. Хотя ее более ранние книги и статьи
пользуются теперь заслуженной известностью, все же в последние годы было
открыто множество новых фактов, имеющих отношение к данной проблеме.
В настоящей книге Л. Маргелис оценивает эти данные и приходит к выводу,
что они отлично согласуются с ее теоретической схемой.
Охват материала громаден: здесь и геология дофанерозоя, и молекуляр-
ная генетика, и таксономия всех главных групп низших организмов. Автор
сравнивает «сборку» эукариотического организма, при которой интеграция
исходных компонентов - простых организмов-в удачных случаях приводит
к новым и неожиданным результатам, с кулинарным творчеством, где тоже
могут использоваться готовые, давно известные ингредиенты. Л. Маргелис
называет это принципом гармонического смешивания (mix-match principle).
Этот же принцип явно применялся и при написании данной книги, и в резуль-
тате, несомненно, получилось весьма питательное «блюдо». Книга необычай-
но много даст для любого человека, интересующегося - подобно большинству
биологов-ее основной темой. Это поистине важный вклад в дело превраще-
ния нашей страшно раздробленной науки в единую согласованную дисципли-
ну. Кроме того, эта книга позволяет заглянуть во «внутреннюю лаборато-
рию» одного из наиболее конструктивно теоретизирующих умов, обладающе-
го огромной эрудицией и богатым воображением, подчас несколько
озорного, который поглощен изучением великих проблем, поставленных жи-
вой природой.
Июль 1980 г.
Эвелин Хатчинсон,
заслуженный профессор зоологии в отставке,
Йельский университет
БЛАГОДАРНОСТИ
Я чрезвычайно благодарна моим студентам (например, тем, кто слушал курсы по
эволюции окружающей среды, симбиозу, эволюционному учению и простейшим в Бо-
стонском университете) за их неожиданные вопросы, на которые было трудно отве-
тить. Такое непринужденное расспрашивание больше чем что-либо другое ведет к по-
становке важных научных проблем. Среди друзей, кто помог мне в подготовке этой
рукописи, были W. Ambrosino, D. Ashendorf, S. Campbell, P. Collins, A. Cortes-Lopez,
A. Grosovsky, B. D. D. Grosovsky, S. Fracek, S. Giovannoni, J. Giusto, E. Gong, E.
Hoffman, J. K. Kelleher, A. Lazcano-Araujo, К. E. Nealson, M. Rambler, M. San Francisco,
Wm. Solomon, J. Stolz, P. Strother, I. Taylor, Wm. Taylor, G. Thorington, L. P. To и осо-
бенно S. Francis и M. Zavitkovsky. Wm. Ormerod сделал больше, чем просто фотосним-
ки, a Laszlo Meszoly-больше, чем просто рисунки. Из моих коллег очень ценные заме-
чания высказали S. Awramik, S. Banerjee, D. G. Chase, R. Chesselet, P. E. Cloud, Jr,
J. O. Corliss, R. Dickerson, W. F. Doolittle, I. D. Gharagozlou, H. O. Halvorson, A. Hollande,
G. E. Hutchinson, A. Knoll, E. Ligon, C. Limoges, T. N. Margulis, E. G. Merinfeld,
M. McElroy, C. Monty, J. Ord, T. C. Owen, L. Ozin, C. Ponnamperuma, H. Ris, J. Wm.
Schopf, К. V. Schwartz, G. Small, D. C. Smith, M.-O. Soyer, T. Swain, N. Todd, R.
K. Trench, R. H. Whittaker и R. S. Yong. Следует особо упомянуть о моих преподавате-
лях К. Н. Nealson (микробиология), J. Е. Lovelock и J. С. G. Walker (наука об атмосфере),
S. Golubic и Н.А. Lowenstam (биогеология), однако они не несут ответственности за
пробелы в моих знаниях. Эта книга никогда не была бы написана без щедрых уроков
по каждому аспекту этой работы, которые мне давал Elso S. Barghoorn на протяжении
более 17 лет.
Помогали и все мои дети: Дорион-в художественном оформлении, составлении
перечней рисунков и таблиц, указателя и библиографических ссылок, Джереми - в полу-
чении разрешений и составлении ссылок, Зак и Дженни-в различных случайных рабо-
тах. Мой отец Моррис Александер помог в составлении указателя, G. Kline и J. Ho-
ward великолепно и быстро напечатали текст на машинке. Я признательна многим
коллегам, предоставившим таблицы и иллюстрации.
Большая часть исследований была поддержана прямо или косвенно субсидией
НАСА, Бостонским университетом и Отделом геологических и планетарных наук Ка-
лифорнийского технологического института. Некоторые исследования по спирохетам
и микротрубочкам были поддержаны, хотя и неохотно, Отделом клеточной биологии
Национального научного фонда. Трудно выразить в словах, насколько я обязана про-
грамме Sherman Fairchild Distinguished Fellowship Калифорнийского технологического
института и тем самым Barclay Kamb и Lea Sterrett. Покой, обеспеченный фондом Гуг-
генхейма, был необходимой предпосылкой для завершения рукописи, так же как и го-
рячая защита моего права заниматься этой работой со стороны Т. N. Margulis. Я бла-
годарю J. R. Williams и Wm. Bennett за ободрение и полезную, временами очень
жесткую, критику. Мой редактор Andrew Kudlacik привнес в рукопись логичность
и добился ее удобочитаемости. Я безмерно обязана ему и его коллегам John Staples,
Patricia Brewer, Robert Ishikawa из W. H. Freeman and Company, а также Arthur Bartlett.
Л.М.
ВВЕДЕНИЕ
Время от времени появлялись различные «теории симбиоза»; о них уместно
напомнить здесь, но не ради них самих, поскольку все они определенно принадле-
жат прошлому, а потому, что они подводят к другим вопросам. Важнейшие из
них-это теории Портье (1918), Уоллина (1927) и Шандерля (1948). Общим для всех этих
трех теорий было утверждение, что среди клеточных включений встречаются
бактерии и что внутриклеточный симбиоз с бактериями есть всеобщая особенность
растений и животных! Этому предполагаемому симбиозу так или иначе приписыва-
лось важное значение... Едва ли следует удивляться, что большинство авторитетных
специалистов игнорировало или в целом отвергало каждую из этих теорий одну
за другой.
Р. Ланге, 1966 [524]
В этой книге рассматривается в современном освещении одна старая идея,
а именно представление о том, что эукариотические клетки (т. е. клетки с ис-
тинным ядром)-те, из которых построены животные, грибы и растения,-раз-
вились из бактериальных предков путем ряда симбиозов. Таким образом,
происхождение эукариотических клеток мыслится как частный случай общего
феномена - эволюции микробных ассоциаций. Виды-партнеры появились и их
сопряженная эволюция началась по меньшей мере 3500 млн. лет назад, и эта
эволюция продолжается до настоящего времени. Взаимодействия микроорга-
низмов не только играли важную роль в эволюции клеток, но и оказали глу-
бокое влияние как на поверхностные отложения Земли, так и на ее атмосферу.
За десятилетие, прошедшее после выхода моей книги о происхождении эу-
кариотических клеток [601], отношение ученых к вопросу о значении
симбиоза и кооперации в эволюционных изменениях переменилось. Большин-
ство биологов теперь признает, что симбиоз привел к чему-то новому, хотя
согласия в деталях еще нет. Кроме того, почти все биологи согласны в том,
что различия между клетками эукариот (протистов, грибов, животных и рас-
тений) и лишенными настоящего ядра клетками прокариот (бактерий) гораз-
до глубже, чем различия между растительными и животными клетками. В от-
личие от прокариот все эукариотические клетки полигеномны; они содержат
разного рода органеллы, обладающие особыми генетическими системами.
Однако происхождение полигеномных эукариотических клеток все еще
остается предметом горячих споров. В этой книге представлена только одна
точка зрения - «крайний» вариант теории происхождения органелл путем по-
следовательных эндосимбиозов.
Когда появилась возможность детально изучать взаимодействия между
генетическими системами органелл и ядра, снова возник вопрос о происхож-
дении органелл. Недавние открытия в области развития органелл могут быть
истолкованы в эволюционном контексте. Многие явления можно понять как
результат все большей интеграции между ранее независимыми микроорганиз-
мами-партнерами. Биохимическая цитология 50-х годов превратилась в дис-
циплину, именуемую клеточной биологией. Юность уступила место изо-
12
бильной зрелости; теперь в этой новой области работают тысячи специали-
стов, большинство из которых не интересуется эволюцией. Однако они
непреднамеренно предоставили много данных для эволюциониста. В послед-
нее десятилетие мы были также свидетелями возрождения позиций мик-
робной экологии 19-го века, а также появления еще одной дисциплины-
эволюции микроорганизмов.
Человек побывал на Луне и наблюдал нашу планету из космоса; во-
прос о том, в какой степени Земля, сама изменяющаяся под действием биос-
феры, была ранее и остается сейчас надежным прибежищем жизни, проник
в наше сознание и тревожит совесть. А это приводит к тому, что изучение ми-
кробиологии и эволюции клеток-теперь уже не узкоспециальное, исключи-
тельно биологическое занятие. Если когда-то считалось, что микробиологиче-
ские данные представляют интерес лишь для медиков и почвоведов, то
теперь они входят в концептуальную схему всей органической эволюции.
В следующем десятилетии они будут включаться в еще более новую область
науки - сравнительную планетологию.
Химию клетки уже нельзя больше рассматривать просто как «фактиче-
скую основу» для исследований в области медицины, консервирования пи-
щевых продуктов, очистки сточных вод или сельского хозяйства. История
клетки неразрывно связана с историей поверхности Земли, и природу этих
связей мы только сейчас начинаем понимать. Экосистемы, слагающие био-
сферу, со временем изменяются; эволюция-это не только изменение
частот генов в популяциях организмов, но также изменение земной среды.
В этой книге будет сделана попытка сложить из отдельных, подчас фрагмен-
тарных научных данных целостную картину нашей древнейшей истории. Мы
проследим историю клеток, этих единиц живого, от их неясного начала через
нынешнее разнообразие и вездесущность до их влияния на планету в целом.
Здесь обсуждаются концепции клеточной эволюции, которые могут быть
проверены экспериментально и которые, как можно ожидать, приведут
к новым направлениям исследований. Миф 20-го века о месте человека в при-
роде, опирающийся на всю сумму научных знаний и доступный для проверки,
возможно, лучше, чем все прежние традиционные мифы, способен удовлетво-
рить человеческую любознательность. Основанный на детальных исследова-
ниях многих преданных науке людей, этот научный миф имеет то преимуще-
ство, что позволяет формулировать предсказания, допускающие проверку,
и намечать контуры Неведомого реалистичным образом. Воссоздаваемая
картина не только удивительна, но в отличие от прежних людских выдумок
она, если содержит ошибку, может быть видоизменена, перестроена, усовер-
шенствована и исправлена усилиями многих членов научного сообщества.
Эта книга написана для двух групп читателей: для студентов, имеющих
некоторую подготовку в области биологии, геологии и химии, и для специа-
листов, занятых распутыванием отдельных сцен эпической драмы ранней эво-
люции жизни на Земле. Приток новых данных будет приводить к постоянно-
му обновлению этого сценария. Я надеюсь, что предлагаемый его вариант
будет предметом обсуждений в учебных комнатах и на семинарах, что его бу-
дут оспаривать и видоизменять в соответствии с новыми данными. Ибо эта
книга, в отличие от многих сугубо ученых трудов, есть не столько собрание
истин, сколько изложение определенной концепции относительно вероятного
хода эволюции и роли симбиоза в возникновении эукариотических клеток.
Сентябрь 1980
Линн Маргелис
ГЛАВА 1
ТЕОРИЯ ЭНДОСИМБИОЗА
Эта книга посвящается
памяти моей матери
Лион Уайз Александер
1914-1977
Точно так же как репродукция обеспечивает сохранение существующих видов,
симбиоз, по мнению автора, приводит к возникновению новых видов.
И. Э. Уоллин, 1927 [995]
Симбиотическая теория происхождения
и эволюции клеток основана на двух кон-
цепциях, новых для биологии. Согласно
первой из этих концепций, самое фунда-
ментальное разграничение в живой приро-
де-это разграничение между прокариота-
ми и эукариотами, т.е. между бактериями
и организмами, состоящими из клеток
с истинными ядрами, - протистами, жи-
вотными, грибами и растениями. Вторая
концепция состоит в том, что источником
некоторых частей эукариотических клеток
была эволюция симбиозов, т.е. формиро-
вание постоянных ассоциаций между орга-
низмами разных видов. Предполагается,
что три класса органелл - митохондрии, ре-
снички и фотосинтезирующие пластиды —
произошли от свободноживущих бактерий,
которые в результате симбиоза были
в определенной последовательности вклю-
чены в состав клеток прокариот-хозяев.
Эта теория в большой мере опирается на
неодарвинистские представления, развитые
генетиками, экологами, цитологами и дру-
гими учеными, которые связали менделев-
схую генетику с дарвиновской идеей есте-
ственного отбора. Она опирается также на
совершенно новые или недавно возро-
жденные научные направления: на молеку-
лярную биологию, особенно на данные
о структуре белков и последовательности
аминокислот, на микропалеонтологию, из-
учающую наиболее ранние следы жизни на
Земле, и даже на физику и химию атмос-
феры. поскольку эти науки имеют отноше-
ние к газам биологического происхожде-
ния. Настоящая глава обрисовывает кон-
туры этой теории, которая в последующих
главах будет подробно разъяснена.
В главе 2 дается обзор многообразия
жизненных форм с точки зрения симбиоти-
ческой теории. Все организмы, состоящие
из клеток, могут быть сгруппированы
в пять царств: царство прокариот (Мопега,
куда относятся бактерии) и четыре царства
эукариот (Protoctista, Animalia, Fungi
и Plantae). Протоктисты-это эукариотиче-
ские организмы, не относящиеся к жи-
вотным, грибам или растениям. В царство
протоктистов входят водоросли1, прото-
зои, слизевики и другие эукариотические
организмы неясной принадлежности. Про-
тесты определены более ограничительно -
как одноклеточные эукариоты. Таким
образом, царство Protoctista включает не
только протистов-одноклеточных эука-
риот, но и их ближайших многоклеточных
потомков, таких как красные и бурые во-
доросли, а также многие микроорганизмы,
сходные с грибами, например хитридиевые.
Детальный перечень, определяющий эти
пять царств, классифицирующий типы,
подтипы и классы, а также содержащий
примеры наиболее изученных родов, при-
веден в Приложении.
В главе 3 сопоставляются симбиотиче-
ская теория и традиционные теории кле-
точной эволюции и прослеживаются их
переменчивые судьбы. Согласно тради-
ционному представлению о прямой филиа-
1 В этой книге термины водоросли и грибы
применяются исключительно к эукариотическим
организмам.
14
ГЛАВА 1
ции, такие клеточные органеллы, как мито-
хондрии и пластиды, возникли путем ком-
партментализации самой клетки. Симбио-
тические представления о происхождении
органелл были выдвинуты в 19-м веке,
и некоторые из них так же стары, как и от-
крытие самих органелл, происхождение ко-
торых они стремились объяснить.
В остальной части книги дается обзор
последних сведений о структуре и биохи-
мии клетки в контексте ранней эволюции.
Глава 4 посвящена геологической обста-
новке, в которой должны были возникнуть
эукариотические клетки. Она содержит так-
же отчет о состоянии нерешенного и весь-
ма каверзного вопроса о происхождении
самой жизни. В следующих двух главах
эволюция клетки излагается в более или
менее строгом соответствии с хроноло-
гией, насколько последняя известна по па-
леонтологическим находкам давностью до
3500 млн. лет. В главе 5 прослежены про-
исхождение и эволюция анаэробных мета-
болических путей у бактерий. В главе 6 ис-
следуется связь между эволюцией аэробно-
го обмена и накоплением атмосферного
кислорода. В главе 7 приведены критерии,
с помощью которых можно отличить ор-
ганеллы, возникшие из симбионтов, от ор-
ганелл, сформировавшихся путем внутри-
клеточной дифференциации; существую-
щие ныне симбиозы показывают мощь
симбиоза как механизма эволюционного
обновления. В главах 8-11 рассматривается
история основных типов эукариотических
органелл: митохондрий (гл. 8); ресничек,
микротрубочек и половых систем, осно-
ванных на митозе и мейозе (гл. 9 и 10); фо-
тосинтезирующих органелл и пластид (гл.
11). Наконец, в главе 12 кратко обсуждает-
ся эволюция клетки в фанерозойском эоне,
охватывающем последние 600 млн. лет.
В этой главе развернута перспектива глу-
боких планетарных изменений земной по-
верхности, вызванных биотой. Поверх-
ность Земли и нижние слои атмосферы,
которые мыслились раньше как пассивная
среда для живого, нельзя более считать
инертной физико-химической системой -
это часть области, находившейся под влия-
нием жизни, и свойства этой области регу-
лировались живой природой на протяже-
нии нескольких миллиардов лет.
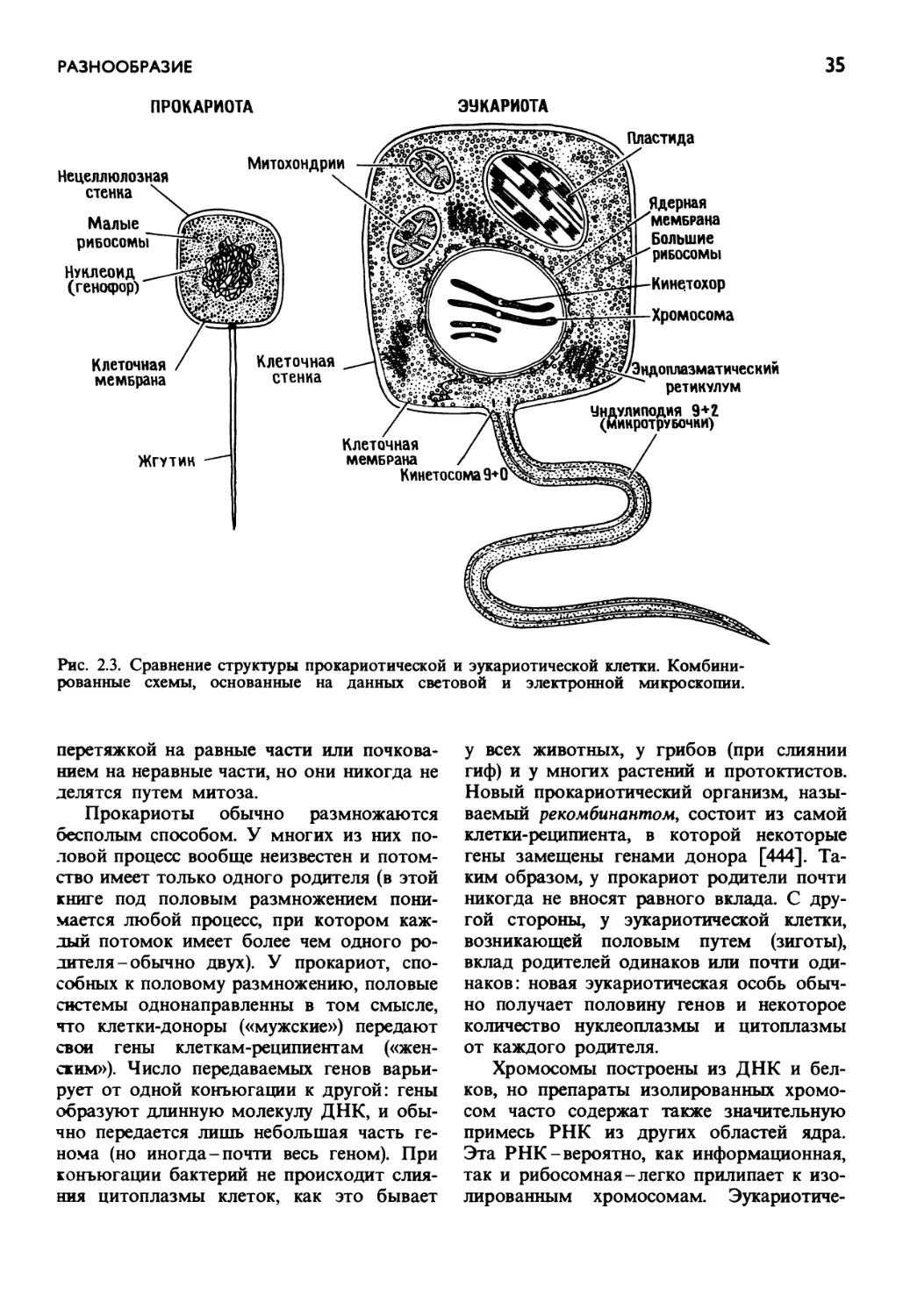
Несколько прокариот образуют одну эукариоту
Эукариотическая «клетка» есть многократное повторение прокариотической
«клетки»
Ф. Тэйлор, 1974 [932]
Клетки-это ограниченные мембранами
системы, наименьшие из биологических
единиц, способных к саморепродукции. Да-
же мельчайшие клетки содержат гены
в форме молекул ДНК (одной или не-
скольких) и белоксинтезирующий аппарат,
состоящий из нескольких типов РНК
и множества белков. Все клетки содержат
рибосомы - тельца диаметром около
0,02 мкм, состоящие из РНК по меньшей
мере трех типов и примерно пятидесяти
различных белков.
П рокариотиче ские организмы - наимень-
шие биологические единицы, которые удов-
летворяют этому определению клетки.
У них нет ядер. С другой стороны, оди-
ночные эукариотические (имеющие, ядро)
клетки в известном смысле вообще не
являются единицами. Это комплексы раз-
личных белоксинтезирующих единиц (на-
пример, нуклеоцитоплазмы, митохондрий
и пластид), тип и число которых варьирует
в зависимости от видовой принадлежно-
сти. Таким образом, прокариотические
клетки-это одиночные белоксинтезиру-
ющие системы, тогда как эукариотические
клетки - множественные белоксинтезирую-
щие системы. Эукариотические клетки
имеют ядро, в котором содержится боль-
шая часть клеточной ДНК, упакованная
в хромосомах. Они обычно содержат так-
же много (иногда сотни) митохондрий.
В клетках растений и водорослей имеются
не только те же органеллы, что и в клетках
ТЕОРИЯ ЭНДОСИМБИОЗА
15
грибов и животных, но еще и пластиды
• одна, несколько или много, иногда тыся-
чи). Митохондрии и пластиды содержат
ферменты для осуществления специальных
функций - дыхания в митохондриях и фото-
синтеза в пластидах. В пластидах, кроме
того, находятся пигменты, т. е. окрашенные
вещества, которые в сложном взаимодей-
ствии с ферментами поглощают энергию
солнечного света и превращают ее в хими-
ческую энергию. И митохондрии, и пла-
стиды можно рассматривать как неполно-
ценные клетки: хотя они содержат гены
и аппарат белкового синтеза, в них нет
полного набора компонентов, необхо-
димых для самоудвоения.
Согласно теории, выдвигаемой в этой
книге, пластиды произошли от самостоя-
тельно живших фотосинтезирующих бакте-
рий, а митохондрии приобрели способ-
ность к эффективному кислородному дыха-
нию тоже еще тогда, когда они были
свободноживущими бактериями. Таким
збразом, предполагается, что функции, ко-
торые выполняют ныне клеточные орга-
неллы, должны были выработаться задол-
го до появления самих эукариотических
клеток. Фотосинтез развился у анаэробных
эактерий на очень раннем этапе истории
тазни, когда еще не было молекулярного
кислорода. Тот тип фотосинтеза, при кото-
тюм выделяется кислород, появился позже.
Организмы, дышащие кислородом, возни-
кли только после того, как в среде нако-
пился фотосинтетически выработанный
кислород. При этом появилось множество
различных метаболических механизмов
гг1я защиты от воздействия кислорода-
?того химически высокоактивного и по-
тенциально ядовитого газа-и в конце
концов для его использования. Нуклеоци-
топлазматическая, «хозяйская» часть эука-
риотических клеток создавалась отдельно
органелл. Она не была способна ни
к фотосинтезу, ни к утилизации кислорода.
Олнако предки нуклеоцитоплазмы могли
выдерживать условия высокой темпера-
"ры и кислотности. Кроме того, предпо-
лагается, что бичевидные жгутики и ре-
снички, отсутствующие у прокариот
? имеющиеся почти у всех эукариот, про-
гзошли от еще одной группы свободножи-
вущих бактерий. Таким образом, согласно
этой теории, эукариотические клетки воз-
никли в результате кооперации первона-
чально независимых элементов, объединив-
шихся в определенном порядке. Члены
этого кооператива, уже весьма специализи-
рованные, со временем стали органеллами.
Ф. Тэйлор [932] назвал такое представле-
ние о раздельном происхождении и разви-
тии частей эукариотической клетки и их
последующем объединении теорией после-
довательных эндосимбиозов (serial endo-
symbiotic theory). Суть этой теории схе-
матически представлена на рис. 1.1.
Нуклеоцитоплазма была самым круп-
ным и наименее специализированным пред-
шественником. Однако условия высокой
температуры и кислотности привели к вы-
работке в ней особого класса белков-гис-
тонов-для защиты ее ДНК [843, 847].
Митохондрии были способны весьма эф-
фективно расщеплять трехуглеродные со-
единения до углекислоты и воды в цикле
трикарбоновых кислот. Эти трехугле-
родные фрагменты - отходы ферментатив-
ного расщепления сахаров нуклеоцито-
плазмой-стали пищей для митохондрий;
таким образом, благодаря кооперации ста-
ло возможным извлекать из исходных са-
харов больше энергии. Симбиотическая ас-
социация нуклеоцитоплазмы и митохон-
дрий закрепилась и начала изменяться
в сторону усиления их взаимной зависимо-
сти.
Этот комплекс либо в ходе своего раз-
вития, либо позднее включил в себя двига-
тельные органеллы-реснички и жгутики.
Структурное сходство ресничек и жгутиков
у эукариот и их неродственность бакте-
риальным жгутикам привели к нежелатель-
ной терминологической путанице. В этой
книге для обозначения эукариотических
жгутиков и ресничек, которые всегда раз-
виваются из структур, называемых кинето-
сомами, используется термин ундулиподия;
термин жгутик (flagellum) сохранен для
обозначения бактериальных жгутиков [179,
518, 609]. Соответственно термин жгути-
ковые (flagellate) применяется только по от-
ношению к бактериям. Для обозначения
эукариотических ундулиподиальных мик-
роорганизмов [их прежнее название-жгу-
16
ГЛАВА *
Таннин
Лигнин
Целлюлоза
РАСТЕНИЯ
Фотосинтез
Коккоидные
цианобактерии
Хлороксивактерии
Фагоцитоз
Дыхание
ПРОТОКТИСТЫ
(водоросли, водные
плесени, слизевики,
простейшие)
Внутриклеточная
подвижность
Эндомемвраны
Кость
Раковина
Зародыши Мышцы
ЖИВОТНЫЕ
Базидии
Аски
Соредии
ГРИБЫ
Дикариоз
Зиготический
мейоз—►споры
Многоклеточность
Подвижность
Термоплазмы
Паракокки
Бделловиврионы
Конъюгация
Митоз
Мейоз
Центриоли
Ундулиподии
Зооспоры
Споры
Брожение
Устойчивост
н теплу и
кислотности
Спирохеты
Спироплазмы
Гистогенез
МОНЕРЫ
Рис. 1.1. Схема происхождения эукариотических
клеток путем симбиоза.
тиковые простейшие (flagellated protozoa)]
используется традиционный термин мас-
тиготы.
Наименее признанный, самый ори-
гинальный и самый спорный аспект теории
последовательных симбиозов - это гипоте-
за о происхождении ундулиподий от
бактерий-спирохет1 Предполагается, что
спирохеты прикреплялись к митохон-
Примечание, добавленное в корректур.
Было обнаружено, что спироплазмы - спи-
ральные, подвижные, лишенные клеточной стеж-
ки и жгутиков бактерии-содержат фибрил-
лярные белки с мол. массой 50000. Нейзвесть:
гомологичны ли эти белки тубулину. На протя-
жении всей книги следует иметь в виду, чт*
предками ундулиподий могли быть спир:-
плазмы, а не спирохеты (см. [962], а также г.т -
и 10).
ТЕОРИЯ ЭНДОСИМБИОЗА
17
дриально-нуклеоцитоплазменному ком-
плексу для питания. Естественный отбор
трансформировал симбиозы между хозяе-
вами и спирохетами в высокоподвижные
агрегаты-в предшественников нынешних
мастигот. За этой трансформацией после-
довало морфогенетическое преобразова-
ние, которое состояло в развитии выра-
женных клеточных асимметрий. Это приве-
ло к далеко идущим последствиям: остат-
ки спирохет превратились в конце концов
во внутриклеточные структуры. В насто-
ящее время имеются лишь едва заметные
признаки того, что у ндулиподии - это
остатки симбионтов. С интеграцией взаи-
мозависимых нуклеоцитоплазмы, митохон-
дрий и ундулиподий завершилось создание
полигеномной структуры эукариотической
клетки. Первая эукариотическая клетка, как
и ее разнородные прародители, была гете-
ротрофной, т.е. питалась готовыми орга-
ническими соединениями. 'У этих ранних
эукариот возникли процессы митоза, а за-
тем и мейоза.
Самое последнее событие в этой эпо-
пее - приобретение эукариотами способно-
сти к фотосинтезу - имело место в процессе
становления основной эукариотической ор-
ганизации и после его завершения. Эука-
риоты-фотосинтетики могут быть описаны
просто уравнением: эукариота 4- фотосин-
тезирующая прокариота = водоросль или
растение. Приобретение эукариотами плас-
тид происходило неоднократно, и в этом
участвовали разные виды-партнеры.
Симбиотические комплексы, которые
превратились в растительные и животные
клетки, никогда не переставали эволюцио-
нировать. Прогрессивные изменения онто-
генеза и метаболизма этих комплексов со-
здавали новые уровни организации, недо-
ступные для изолированных партнеров.
Симбиозы становились все более и более
интегрированными, а партнеры-все более
зависимыми друг от друга. В настоящее
время зависимость каждой органеллы от
продуктов метаболизма других органелл
стала настолько полной, что только совре-
менные методы ультраструктурного анали-
за и биохимических исследований in situ
позволяют проследить метаболические пу-
ти исходных партнеров, да и то с трудом.
Эволюция биохимических путей в ос-
новном предшествовала эволюции жи-
вотных и растений. Эукариоты удивитель-
но разнообразны по своему строению, но
метаболически они остаются едино-
образными; большинство, а может быть,
и все метаболические ухищрения эукариот
были «разработаны» различными бакте-
риями еще до того времени, когда послед-
ние объединились, превратившись в хозя-
ина и его органеллы. Прокариоты, хотя
они структурно проще эукариот, всегда бы-
ли и теперь остаются гораздо более разно-
образными в отношении обмена веществ.
Сами же прокариотические клетки были
продуктами интригующе таинственного
события-возникновения жизни. Они до-
стигли большого разнообразия в способах
получения энергии и в тонкостях биосинте-
за и катаболизма. Они проникли в экстре-
мальные местообитания всех типов и обра-
зовали как тесные, так и слабые ассоциа-
ции. Они оставили след своего существова-
ния как в поверхностных отложениях, так
и в атмосфере задолго до того, как на ос-
нове эукариотической клетки сформирова-
лись такие крупные организмы, как жи-
вотные, обладающие скелетом.
Предшественники жизни
Нужно согласиться с тем, что никто еще не знает, как возникла жизнь.
С. Миллер и Л. Оргел, 1974 [650]
Общие предки нынешних организмов
возникли более трех миллиардов лет назад
из органических соединений, образовав-
шихся на поверхности Земли. Привлека-
тельность этой концепции отчасти связана
с ее доступностью для проверки. Гипотезу
панспермии, по которой жизнь была зане-
сена на Землю с других небесных тел, про-
2-39
18
ГЛАВА 1
верять гораздо труднее, если вообще воз-
можно. Наоборот, мысль о том, что
процесс формирования органических со-
единений из неорганических предшествен-
ников, происходивший на юной Земле,
можно воспроизвести в лаборатории, ока-
залась плодотворной.
Представление о «химической эволю-
ции» было выдвинуто русским ученым
А. И. Опариным в 2(Кх годах [696], но оно
не подвергалось экспериментальной про-
верке вплоть до 1953 г., когда С. Миллер
[648] и X. Юри показали, что при атмос-
ферных условиях, предположительно имев-
ших место на юной Земле, могут обра-
зовываться аминокислоты и различные
другие органические молекулы. Это напра-
вление работ заложило основу предбиоло-
гической химии - науки, экспериментально
изучающей происхождение жизни. С тех
пор из таких неорганических веществ, как
вода, метан, аммиак и цианистый водород,
были синтезированы самые разнообразные
органические соединения. Из неорганиче-
ских предшественников без каких-либо
ферментов или клеток были получены ами-
нокислоты, входящие в состав белков,
и некоторые компоненты нуклеиновых кис-
лот. Эти результаты подкрепляют мысль
о том, что различные типы органических
молекул, в том числе многие из тех, ко-
торые содержатся во всех современных
живых системах, образовывались спонтан-
но в течение первого миллиарда лет суще-
ствования Земли. Более того, многие не-
большие органические молекулы были об-
наружены в межзвездном пространстве и
в метеоритах; это значит, что органические
соединения неизбежно возникают при
взаимодействии легких элементов в при-
сутствии источников энергии. Таким ис-
точником скорее всего могло служить
ультрафиолетовое и видимое излучение
Солнца.
Предположению о том, что пребиотиче-
ские органические соединения сами собой
организовались в макромолекулярные си-
стемы, способные хранить и передавать
информацию, нельзя отказать в смелости.
Хотя возможные механизмы этого процес-
са доступны для изучения, мы не знаем и,
может быть, никогда не узнаем, как он
в действительности происходил. В любом
случае предполагается, что много раз-
личных органических соединений обра-
зовывались и концентрировались таким
способом, который привел к появлению
наименьших само реплицирующихся си-
стем - предков прокариотических клеток.
Универсальность химического механизма
биорепродукции означает, что все живое на
Земле происходит от общих предков: вся
нынешняя жизнь произошла от клеток
с информационными системами, осно-
ванными на репликации ДНК и на синтезе
белков, направляемом информационной
РНК. У нас почти нет данных для сужде-
ния об этапах, приведших к этим пер-
вичным клеткам; однако пути от самых
ранних бактерий к полигеномным клеткам
животных, грибов и растений становятся
более ясными.
Ферментирующие организмы
Жизнь без воздуха.
Л. Пастер, 1866 /717]
Среди древнейших неметаморфизо-
ванных осадочных пород на Земле лучше
всего изучена система Свазиленда близ
Барбертона в Южной Африке. Эти породы
содержат большое количество углерода.
Есть основания полагать, что этот углерод
биогенного происхождения и что он обра-
зовался путем микробного фотосинтеза
[771]. В чертах (кремнистых сланцах, где
часто сохраняются органические струк-
туры) из системы Свазиленда были най-
дены объекты, которые интерпретируют
как ископаемые микроорганизмы, иногда
даже на стадии клеточного деления [491].
Эти прямые следы жизни в системе Свази-
ленда-отнюдь не изолированный фено-
мен. В некоторых наиболее древних оса-
дочных породах встречаются стромато-
ТЕОРИЯ ЭНДОСИМБИОЗА
19
литы-структуры, которые считают остат-
ками окаменевших микробных сообществ.
Их находили на всех главных континентах,
и они составляют существенную часть ран-
них ископаемых. Строматолиты возрастом
около 3 млрд, лет найдены в породах
группы Понгола в Африке; в группе
Варравоона в районе Пилбара (Западная
Австралия) обнаружены еще более древние
строматолиты возрастом 3,5 млрд, лет
’998], а также микрофоссилии [41]. Если
это настоящие строматолиты и микроорга-
низмы, то бактерии должны были заро-
диться намного раньше, чем 3 млрд, лет
назад.
Возможно, что нуклеиновые кислоты
самого начала были отделены от окру-
жающей среды липопротеидными мембра-
нами. В какой-то момент биогенеза инфор-
мация стала кодироваться последователь-
ностью нуклеотидов в молекулах ДНК,
гсределяющих аминокислотную последо-
вательность белков-полимераз. Эти белки
могут катализировать полимеризацию ну-
клеотидов с образованием новых коли-
честв ДНК. Передача биологической ин-
зсрмации с самого начала должна была
.сновываться на какой-либо форме три-
глетного кода, так как у всех современных
тханизмов последовательность аминокис-
в белках детерминируется последова-
•елъностью троек нуклеотидов в ДНК.
Белковый синтез, управляемый ДНК, на-
?лъко консервативен, что его считают
тткмитивным механизмом, присущим
лев нейшим живым системам.
Откуда к самым ранним клеткам посту-
лгза энергия? Органические соединения,
ссизующиеся при лабораторном модели-
ровании. богаты энергией. Кроме того, при
моделировании были во многих усло-
ип получены такие необходимые для кле-
репродукции вещества, как адено-
жтрвфосфат (АТР) и аминокислоты, вхо-
тзглж в состав белков. Вероятно, древней-
гж клетки использовали такие вещества
t elk прямые источники энергии, и как
лгуктурные компоненты. Таким образом,
дхввеяшая жизнь существовала в форме
ллтчзтрофных бактерий, получавших пи-
и* ж эеергию из органического материала
мгшелиесжого происхождения.
Для неодарвиновской органической эво-
люции необходимы три феномена: доста-
точно точное воспроизведение, мутации
и селективное давление среды. Воспроизве-
дение-это непременное условие биологи-
ческой эволюции; при достаточно точной
репродукции мутации и естественный от-
бор неизбежны. Объяснить происхождение
такой репродукции - значит понять проис-
хождение самой жизни. Мы полагаем, что
она действительно зародилась на Земле.
Мутирование-первичный источник из-
менчивости в эволюционном процессе-ве-
дет к наследуемым изменениям в самовос-
производящейся системе. Мутации пред-
ставляют собой изменения в последова-
тельности нуклеотидов ДНК. Природные
мутагены, такие как тепло, определенные
органические соединения и радиация, сни-
жают точность репродукции и увеличи-
вают как смертность, так и частоту мута-
ций. Некоторые мутации, например дупли-
кации участков ДНК, увеличивают общее
количество генетического материала, при-
ходящееся на одну клетку, и таким обра-
зом создают «сырье», которое может быть
использовано для увеличения сложности.
Как только выработалось надежное
воспроизведение, началась неодарвинов-
ская эволюция. Самые обычные опасности
окружающей среды-колебания темпера-
туры, количества и качества солнечного
света, концентраций солей в воде-должны
были быть в числе многих факторов отбо-
ра, ведущих в различных условиях к обра-
зованию отдельных популяций, отличаю-
щихся от их общего предка благодаря
мутациям. Запасы абиотически образуемых
органических веществ в среде постепенно
истощались. Логично предположить, что
на ранней стадии эволюции клеток фер-
ментативное расщепление небольших мо-
лекул-таких универсальных метаболитов,
как ацетат и лактат,-обеспечивало синтез
нуклеиновых кислот углеродом и энергией.
Механизм эволюции многозвенных био-
синтетических цепей, вероятно, был таким,
каким его представлял себе Н. Горовиц
£425]. Любой организм, способный превра-
щать какое-либо доступное соединение
в вещество, необходимое для репродукции
клеток, смог бы в дальнейшем выживать
20
ГЛАВА 1
и в отсутствие этого ранее необходимого
вещества. Организмы, у которых вырабо-
тались пути синтеза нужных клетке компо-
нентов, имели селективное преимущество
перед другими. Таким образом появилось
много различных биосинтетических путей,
в том числе ферментативный синтез ами-
нокислот и предшественников нуклеиновых
кислот. Исходя из нынешнего распределе-
ния метаболических путей у прокариот, из
селективных преимуществ, доставляемых
их конечными продуктами, а также из фак-
та биохимического консерватизма, можно
представить себе вероятный ход эволюции
метаболизма у бактерий [111]. Детали его
обсуждаются в гл. 5, а здесь достаточно
будет сказать, что запас абиотической ор-
ганики на каком-то раннем этапе эволю-
ции, несомненно, оказался ограниченным,
и у клеток выработались другие способы
получения углерода и энергии.
Древнейшими автотрофами, т.е. орга-
низмами, способными удовлетворять свои
потребности в энергии и органических ве-
ществах за счет неорганических источни-
ков, возможно, были анаэробные метано-
образующие микроорганизмы. Для такого
предположения есть три основания. Во-
первых, эти организмы растут, используя
атмосферную углекислоту для окисления
водорода. Вероятно, 3 млрд, лет назад оба
этих газа благодаря вулканической актив-
ности имелись в большом количестве
[991]. Во-вторых, метанообразующие бак-
терии заметно отличаются от большинства
остальных бактерий по своей рибосомной
РНК, и это наводит на мысль, что их эво-
люция шла независимо от других бакте-
рий, начавшись, возможно, еще до того
времени, когда функция рибосом оптими-
зировалась и стабилизировалась [1028].
В-третьих, поскольку метанообразующие
бактерии не обладают никакими средства-
ми защиты от атмосферного кислорода,
они, вероятно, всегда избегали его с тех
самых пор, как он появился в изобилии.
Метаногенез не слишком долго служил ис-
точником энергии для биосферы - началось
использование других, более постоянных,
обильных и прямых источников. Это мета-
болическое новшество у бактерий имело
далеко идущие последствия и возвестило
наступление важнейшей революции в исто-
рии жизни на нашей планете.
Способность к фотосинтезу впервые
выработалась у бактерий, чувствительных
к кислороду. Первые фотосинтезирующие
бактерии использовали в качестве восста-
новителей водород, сероводород или же
небольшие органические молекулы; погло-
щая солнечный свет с помощью бакте-
риального хлорофилла, они превращали
углекислоту атмосферы в органические ве-
щества. Потомки этих бактерий все еще
процветают во многих анаэробных участ-
ках в иле, болотах, маршах, лиманах
и других местах, где достаточно света, но
запас кислорода исчерпан. Появление анаэ-
робного фотосинтеза необратимо измени-
ло поверхность и атмосферу Земли. Угле-
кислота удалялась из атмосферы и превра-
щалась в органическое вещество в соответ-
ствии с общим уравнением фотосинтеза:
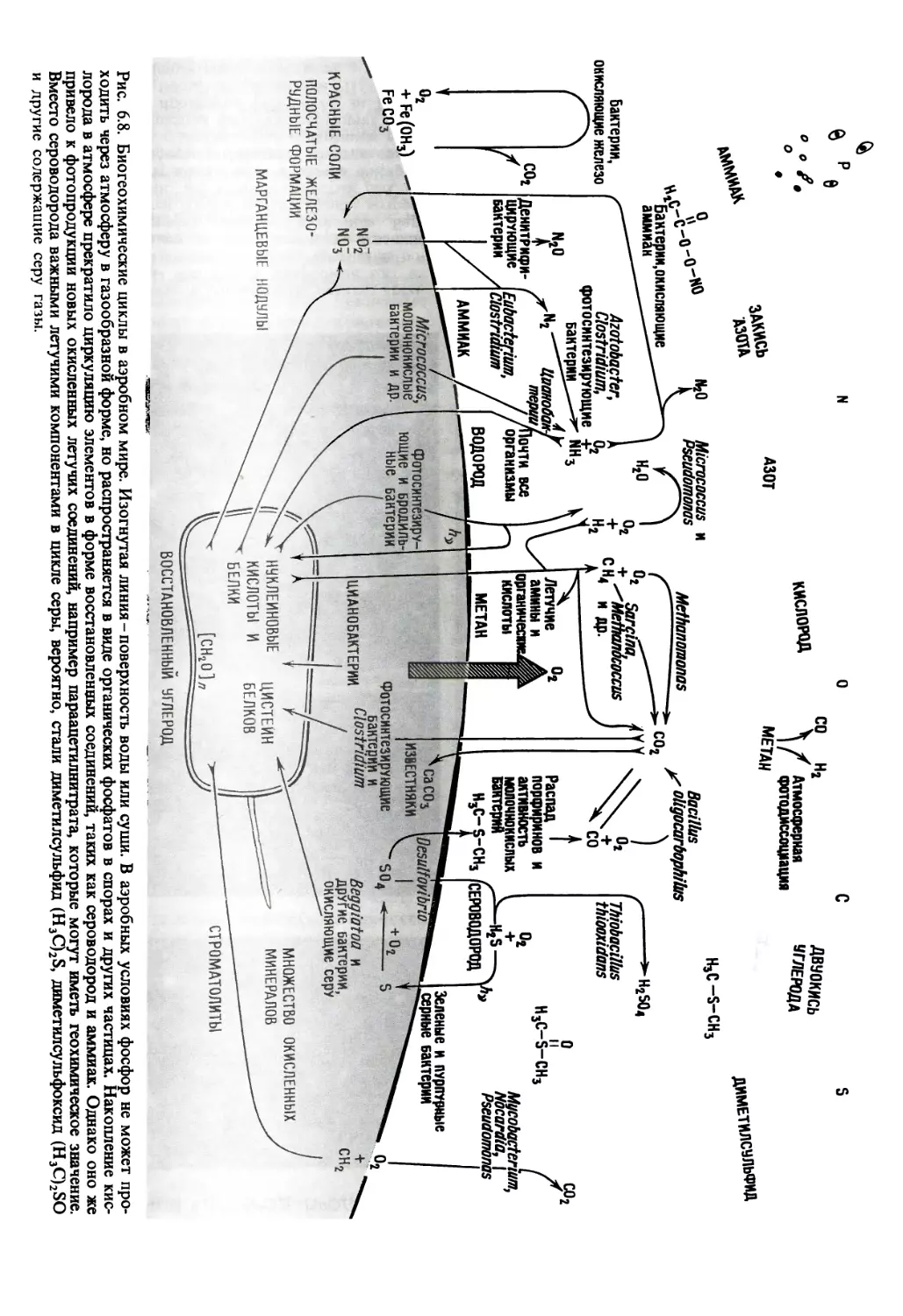
2Н2Х + СО2 -^СН2О + 2Х + Н2О
Появление новых источников углерода
и энергии привело в конце концов к пора-
зительному увеличению разнообразия ор-
ганизмов и формированию рада специфи-
ческих эволюционных стратегий.
Те фотосинтезирующие бактерии, ко-
торые использовали для восстановления
СО 2 сероводород, откладывали элементар-
ную серу. Они дали начало потомкам,
имеющим чрезвычайно важное значение,-
бактериям, способным к фотосинтезу с вы-
делением кислорода. По традиции этот
тип фотосинтеза, при котором выделяется
О2, называют «фотосинтезом зеленых рас-
тений» (или водорослей). Однако нет со-
мнений в том, что он возник не у растений
и не у водорослей. Вероятно, он зародился
в результате накопления мутаций у фо-
тосинтезирующих серных бактерий; этот
путь привел к возникновению сине-зеленых
водорослей, или цианобактерий 1
1 В этой книге прокариотические «во-
доросли» (иначе называемые Cyanophyta,
Суanophyсеае, или сине-зелеными бактериями)
мы будем вслед за Стейниером и Коэн-Базиром
[903] называть не сине-зелеными водорослями,
а цианобактериями, принимая во внимание их
бактериальную природу.
ТЕОРИЯ ЭНДОСИМБИОЗА
21
Десять лет назад была открыта и затем
изучена (R.A. Lewin, Scripps Institution of
Oceanography) новая группа фотосинтези-
рующих прокариот, выделяющих О2. Эти
микробы имеют цвет зеленой травы. Их
пигмент, как у зеленых водорослей и на-
земных растений, состоит только из хлоро-
филлов а и Ь; у них нет фикобилипротеи-
нов, которые придают цианобактериям их
синеватый оттенок. По ультраструктуре
они почти неотличимы от коккоидных циа-
нобактерий [1012]. Они были названы про-
хлорофитами или Prochloron, однако в этой
книге им будет дано название хлорокси-
бактерий (тип Chloroxybacteria)1 Ввиду
близкого родства этих микроорганизмов
с другими прокариотами и учитывая то,
что известно о древнейших микроиско-
паемых, следует полагать, что такие зе-
леные и сине-зеленые микробы, осущест-
вляющие фотосинтез с выделением кисло-
рода, были широко распространены на
Земле до возникновения эукариот.
Можно предполагать, что именно циа-
но- и хлороксибактерии были предками
пластид, находящихся в клетках водорос-
лей и растений. Источником атомов водо-
рода при фиксации СО 2 этими бактериями
служит вода. Кислород выделяется как не-
нужный продукт. На каждые 4 атома водо-
рода, используемые для восстановления
углекислоты до органических молекул, вы-
деляется одна молекула кислорода. После
начала кислородного фотосинтеза могло
потребоваться меньше нескольких тысяч
или больше нескольких миллионов лет для
окисления поверхностных горных пород
и вулканических газов. В конце концов-ве-
роятно, более 2 млрд, лет назад,-из при-
брежных морских вод, озер и почвы в ат-
мосферу стал выделяться избыток кисло-
рода. По мере накопления кислорода
в результате микробного фотосинтеза зем-
ная атмосфера становилась окислительной.
Повышение концентрации кислорода
вызвало кризис всей жизни до этого
времени мир был заселен анаэробными
бактериями. Чтобы выжить, все микроор-
ганизмы теперь либо должны были избе-
гать кислорода, укрываясь в болотах или
находя другие анаэробные местообитания,
либо должны были выработать обмен ве-
ществ, способный предохранить их от воз-
растающего количества кислорода.
Фотосинтез и воздух
Рассмотренные работы... иллюстрируют многообразие токсических эффектов,
наблюдаемых у живых организмов при воздействии концентраций кислорода выше
тех, к которым эти организмы приспособлены. Очевидно, кислород-это вещество,
в принципе токсичное для всех живых клеток.
Н. Хогард, 1968 [388]
Реакции представителей царства монер
(Мопега) на молекулярный кислород уди-
вительно разнообразны, особенно в срав-
нении с однотипным аэробиозом эукариот.
Группы микроорганизмов, дивергировав-
шие значительно раньше,-такие как акти-
нобактерии, бациллы, спирохеты и циано-
бактерии,-сумели по-разному, хотя и ана-
логичным образом приспособиться к нако-
Л. ван Вален [982] предложил называть
их пред водорослями (Proalgae), а не относящих-
ся к растениям эукариотических фотосинтети-
ков, выделяющих кислород,-настоящими водо-
рослями (Eualgae).
плению кислорода на планете. Развитие
устойчивости к кислороду, вероятно, нача-
лось прежде всего у фотосинтетиков, про-
дуцировавших этот газ. За механизмами
обезвреживания кислорода последовала
выработка дыхательного обмена и других
способов непосредственной утилизации О2.
Устойчивыми к кислороду и даже спо-
собными его использовать стали неко-
торые представители почти всех главных
групп анаэробных прокариот. По меньшей
мере одна из этих устойчивых форм оказа-
лась прародительницей бактерий, которые
позже превратились в митохондрии.
Соединения углерода, вырабатываемые
22
ГЛАВА 1
фотосинтезирующими микроорганизмами,
вероятно, создавали базу для сложных ми-
кробных сообществ. Прямым указанием на
существование в прошлом таких микрокос-
мов служат строматолиты - остатки
микробных сообществ, особенно обильно
представленные в осадочных породах воз-
растом от 2400 млн. до 500 млн. лет. При-
мерно 2 млрд, лет назад один за другим
происходили различные эволюционные
«эксперименты» по созданию метаболиче-
ского разнообразия. Почти любое органи-
ческое вещество, образуемое прокариота-
ми, может метаболизироваться другими
прокариотами-либо отдельными особями,
либо группами взаимодействующих видов.
Способность к выработке специфических
ферментов может передаваться в пределах
одного вида или группы родственных ви-
дов с помощью вирусоподобных частиц,
называемых плазмидами. Эти частицы со-
здают возможность быстрого распростра-
нения эволюционных новинок в бакте-
риальных популяциях даже без мутаций.
Микробы способны разлагать и такие про-
чные волокнистые материалы, как целлю-
лоза и хитин. Столь же поразительны био-
синтетические способности прокариот: из
углекислоты, нескольких солей и восстано-
вленных неорганических соединений, слу-
жащих источниками энергии, микроорга-
низмы-хемоавтотрофы могут синтезиро-
вать в содержащей кислород неосвещенной
воде все сложнейшие макромолекулы, не-
обходимые для роста и размножения. Для
одних прокариот окисление метана или
аммиака-единственный источник энергии,
другие же продуцируют метан или аммиак
в качестве конечных продуктов метаболиз-
ма. Некоторые бактерии окисляют метан
даже в отсутствие газообразного кислоро-
да; окислителем служит сульфат [713]. Во-
дород, азот, кислород и углекислота - все
они могут связываться, т.е. превращаться
в органические соединения. Сероводород
может окисляться до серы; сера, отложен-
ная анаэробными фотосинтезирующими
серобактериями, может быть затем аэроб-
но окислена в сульфат, который в свою
очередь может быть снова восстановлен до
сероводорода и возвращен в ил сульфат-
восстанавливающими организмами. Эти
биохимические процессы, протекавшие сна-
чала в отсутствие, а затем в присутствии
кислорода, приводили, как и ныне, к систе-
мам круговорота элементов еще тогда,
когда не было животных, грибов, растений
и даже протоктистов.
Ассоциации и эукариоты
Аргументы в пользу симбиотического происхождения [хлоропластов] представ-
ляются неоспоримыми.
П. Равен, 1970 /766]
Рис (1962) доказал присутствие ДНК в хлоропластах нескольких водорослей.
Он пришел к выводу, что эта ДНК представляет собой «генетическую систему
пластиды», и высказал предположение, что пластида Chlamydomonas... возможно,
представляет собой сине-зеленую водоросль, ставшую эндо симбионтом. Эта фальшивая
монета довольно долго находилась в обращении... Очевидно, что для такого
мнения нет никаких химических, структурных или филогенетических оснований.
Р. Клейн, А. Кронквист, 1967 [484]
К тому времени, когда в атмосфере
накопился кислород, разнообразные ми-
кробы жили в морях и озерах, покрывали
почву и выбрасывали споры в воздух.
Строматолиты и микроископаемые в крем-
нистых сланцах, обильные и широко рас-
пространенные во времени и пространстве,
неоспоримо свидетельствуют о золотом
веке прокариот, процветавших задолго до
появления животных. Подобно организ-
мам любого периода, виды взаимодейство-
1 В цитатах в квадратные скобки заклю-
чены пояснения автора книги-Прим. ред.
ТЕОРИЯ ЭНДОСИМБИОЗА
23
вали друг с другом. Биосфера в целом за-
висела от белков и углеводов, вырабаты-
ваемых пурпурными, зелеными и сине-зе-
леными фотосинтетиками и другими авто-
трофными бактериями. По мере накопле-
ния атмосферного кислорода абиотическая
продукция органических веществ сокраща-
лась, так как они быстро разрушались под
действием этого газа. Кроме того, теперь
большую часть ультрафиолетовой радиа-
ции, ранее доставлявшей энергию для
абиотических синтезов, поглощал озон.
Ионы многих элементов (например,
цинка, меди и мышьяка} ядовиты для кле-
ток и имеют тенденцию накапливаться
в них, так как они химически сходны
с ионами, используемыми в нормальном
метаболизме. Многие микроорганизмы,
возможно даже все они, выводят эти ядо-
витые элементы в форме газообразных ме-
тилированных производных, таких как три-
метиларсин. Бактерии оказались в прямой
и тесной зависимости друг от друга в том,
что касается притока газов, вентиляции
или удаления отходов метаболизма в га-
зообразном виде. Создалась также их
взаимная зависимость в отношении пита-
ния и защиты. Биосфера приобрела свое
мозаичное распознаваемое лицо. Возникло
много разного рода связей между орга-
низмами, включая симбиоз, паразитизм
и хищничество. Одна из этих связей,
а именно определенная серия симбиозов,
вела к формированию новых типов клеток.
Согласно «крайнему варианту» теории по-
следовательных симбиозов, все эукариоты
сформировались в результате симбиоза
между чрезвычайно далекими друг от дру-
га видами прокариот: нуклеоцитоплазма
образовалась из микроорганизмов-«хо-
зяев», митохондрии-из бактерий, дыша-
щих кислородом, пластиды-из хлорокси-
или цианобактерий, а уццулиподии-из
спирохет, прикреплявшихся к поверхности
хозяев. Митотическое деление клетки вы-
работалось только после того, как хозяева
стали поглощать спирохет и передислоци-
ровать их части. Таким образом, в начале
истории эукариот находились лишенные
клеточной стенки плейоморфные микроор-
ганизмы, способные сбраживать глюкозу
до двух- и трехуглеродных конечных про-
дуктов по метаболическому пути Эмбде-
на-Мейергофа. Эти организмы, которым
предстояло стать нуклеоцитоплазмой, при-
обретали эндосимбионтов. Можно пола-
гать, что хозяева были микроаэрофилами,
т.е. были приспособлены к меньшим кон-
центрациям кислорода в атмосфере, чем
нынешние 20%. Из современных микроор-
ганизмов с этими хозяевами наиболее
сходны такие микроаэрофилы, лишенные
клеточной стенки, как Thermoplasma. Их
считают хорошими кандидатами на эту
роль, так как они содержат гистонопо-
добные белки, богатые аргинином и лизи-
ном, которые защищают их ДНК от воз-
действия горячей кислоты. У микроорга-
низмов, превратившихся в нуклеоцитоплаз-
му, могло не быть обычного для большин-
ства других бактерий генома в форме
ДНК, замкнутой в кольцо. А какова при-
рода эндосимбионтов, дышавших кислоро-
дом? Эти протомитохондрии были
аэробными палочковидными организмами,
близкими к современным бактериям вроде
Paracoccus denitrificans. Они полностью
окисляли продукты брожения до углекис-
лоты и воды. Мы не знаем, какой путь
привел к симбиозу: ассоциация могла на-
чаться с хищничества, объектом которого
служили клетки-хозяева. Поскольку ни од-
на из известных прокариот не может по-
глощать другие живые клетки (иначе гово-
ря, все прокариоты неспособны к фагоци-
тозу), кажется вероятным, что протомито-
хондрии проникали в клетку-хозяина так
же, как современные «хищные» бактерии
Bdellovibrio вторгаются в бактерию-жертву.
Размножение симбионтов внутри осмо-
тически регулируемой нуклеоцитоплазмы
вело к отбору, направленному против со-
хранения ими клеточных стенок и биосин-
тетических путей, дублирующих пути хозя-
ина. Чтобы облегчить взаимодействие ме-
таболических функций, закодированных
в геномах хозяина и симбионтов, из
внутренних цитоплазматических мембран
дифференцировались эндоплазматический
ретикулум и его производные-аппарат
Гольджи и ядерная мембрана. Расхожде-
ние дочерних молекул ДНК происходило
у хозяина либо на плазматической мембра-
не, либо на мезосомальных мембранах (как
24
ГЛАВА 1
оно, видимо, происходит у прокариот
и сейчас). Таким образом, ядерная мембра-
на могла выработаться вначале для того,
чтобы обеспечивать надлежащее распреде-
ление вновь синтезируемых молекул ДНК
в глубине клетки, когда хромосом и мито-
за еще не было. Протомитохондрии увели-
чили площадь своих мембран, на которых
протекают окислительно-восстановитель-
ные реакции. Естественный отбор привел
к образованию крист - складчатых мем-
бран современных митохондрий. Итогом
этого приспособления к симбиозу было
образование двугеномных клеток - аэроб-
ных, содержащих митохондрии и ядра, но
неспособных к митозу крупных аме-
боидных микроорганизмов. Здесь мы для
простоты будем называть их амебоидами.
Следующим шагом к полному эукарио-
тическому статусу было симбиотическое
приобретение подвижности1. Некоторые
амебоиды вступали в ассоциации со спиро-
хетами, которые в поисках пищи прикре-
плялись к амебоидам, подобно тому как
многие спирохеты и теперь прикрепляются
к другим клеткам. К счастью для исследо-
вателей эволюции, в протоплазматических
цилиндрах этих особых спирохет имелись
микротрубочки. Эти микротрубочки, со-
стоявшие из упорядоченно расположенных
белковых молекул, возможно, уже образо-
вали структуру типа 9 + 2. Не исключено,
впрочем, что такая девятилучевая (на попе-
речном разрезе) симметрия создалась по-
сле установления симбиоза. Но когда бы
ни возникли эти структуры, их повсемест-
ное присутствие в ундулиподиях служит
веским доводом в пользу того, что все эти
органеллы эволюционно гомологичны -
будь то хвосты человеческих спермиев или
спермиев мха, реснички на выстилке тра-
хеи позвоночного или реснички на теле ин-
фузории. Хотя движение с помощью бакте-
риальных жгутиков или путем скольжения
1 Известны протисты с типичными ундули-
подиями типа 9 + 2, но лишенные митохондрий.
Поэтому возможно, что симбиотический пере-
ход к подвижному образу жизни предшествовал
приобретению митохондрий и структурно пре-
адаптировал предков эукариот к развитию фа-
гоцитоза и других систем внутриклеточной под-
вижности (обсуждение см. у Швеммлера [840]).
возникло гораздо раньше, ундулиподии
образовались только после того, как спи-
рохеты объединились с амебоидами и на-
всегда видоизменились.
Связь симбиотических спирохет, или
протоундулиподий, с их амебоидными хо-
зяевами становилась все более тесной. Как
и во всех устойчивых ассоциациях, репро-
дукция симбионтов стала протекать согла-
сованно с репродукцией хозяев; места их
прикрепления превратились в кинетосомы.
Таким образом появились новые ком-
плексы, содержащие три гетерологичных
генома: ядерный (принадлежащий хо-
зяину), митохондриальный и ундулипо-
диальный. Эти тригеномные комплексы
дали множество различных видов проте-
стов. В конце концов исходный геном спи-
рохеты дифференцировался, чтобы образо-
вать большое число структур разного
назначения, включая, например, придатки
кортекса у инфузорий, служащие органами
передвижения и питания. Кроме того, про-
тоундулиподии редуцировались в морфо-
логическом отношении; во многих случаях
они не остались на поверхности, а попали
внутрь своих хозяев и утратили способ-
ность к движению. Однако они сохранили
свою репликативную способность; нуклеи-
новые кислоты спирохет и их продукты
вначале дифференцировались благодаря
мутациям, и со временем они дали начало
реплицирующимся центриолям, кинетохо-
рам хромосомой веретену митотического
аппарата. Короче говоря, симбиотические
бактерии, ставшие ундулиподиями (см.
гл. 10), обеспечили преадаптацию к митозу
(см. гл. 9).
Сам митоз выработался путем длин-
ной, отнюдь не прямой серии мутаций
у протистов; этот процесс мог занять
больше полмиллиарда лет. Развитие меха-
низмов митоза, которое, несомненно, за-
вершилось более 500 млн. лет назад, при-
вело в результате адаптивной радиации
к образованию огромного множества
видов эукариотических микроорганизмов.
В конце концов гетеротрофные микробы-
эукариоты породили животных и грибы.
Беспозвоночные были широко распростра-
нены и весьма разнообразны еще до того,
как 500 млн. лет назад появились формы
ТЕОРИЯ ЭНДОСИМБИОЗА
25
с твердым скелетом [330, 436]. Ранние
многоклеточные животные были мягко-
телыми; твердые части выработались бо-
лее или менее одновременно у многих от-
даленно родственных животных и проти-
стов. Может быть, более активное исполь-
зование карбонатов и силикатов было
вызвано изменениями в окружающей сре-
де? Или же двигателем эволюции явилось
хищничество, которое потребовало защиты
от врагов [436, 905, 906]? Независимо от
причин интенсивного отложения скелетных
материалов у ископаемых многоклеточных
животных его необходимой предпосылкой
было возникновение митотических и,
в конце концов, мейотических половых си-
стем (см. гл. 12).
Другая серия симбиотических приобре-
тений привела к эукариотам-фотосинтети-
кам. Когда естественный отбор оптимизи-
ровал процессы митоза и мейоза, разно-
образные виды фотосинтезирующих прока-
риот (протопластиды) начали ассоцииро-
ваться с различными гетеротрофными про-
тестами. Последние «заглатывали» микро-
бов-фотосинтетиков, но не переваривали
их. Вероятно, зеленые фотосинтезирующие
прокариоты (хлороксибактерии) оказались
прародителями пластид независимо у эв-
гленоидных простейших, зеленых водорос-
лей и других организмов. Коккоидные
цианобактерии, сходные с современными
Gloeocapsa и Synechocystis, по-видимому,
стали предками красноватых пластид крас-
ных водорослей (тип Rhodophyta) и неко-
торых малоизученных протистов, таких
как криптомонады Glaucocystis и Суапа-
phora. Тесные ассоциации фотосинтезирую-
щих эндосимбионтов с различными хозяе-
вами постепенно становились все более
облигатными, что привело к образованию
различных типов водорослей. Хотя от-
дельные группы протистов (например, пе-
ранемиды), по-видимому, действительно
произошли путем вторичной утраты пла-
стид фотосинтезирующими формами вро-
де эвглены, только этих протистов и мож-
но рассматривать как «апохлоротичные»
водоросли. Согласно нашему варианту
теории последовательных симбиозов, ог-
ромное большинство эукариот эволюцио-
нировало непосредственно от гетеро-
трофных микробов, никогда не обладав-
ших способностью к фотосинтезу.
Все великие новшества в эволюции кле-
ток возникли еще до того, как появились
первые животные, растения и грибы. У не-
которых, хотя и не у всех, протистов сло-
жились главные биохимические пути и вы-
работались классические формы митоза,
мейоза и оплодотворения. Какие-то гете-
ротрофные эукариоты в результате погло-
щения фотосинтезирующих прокариот ста-
ли водорослями. О том, что это завершаю-
щее событие произошло более 400 млн.
лет назад, свидетельствуют ордовикские
ископаемые остатки крупных, хорошо
развитых фотосинтетиков - Dasycladaceae,
Codiaceae (сифоновые зеленые водоросли)
и Solenosporaceae (красные водоросли).
Около 400 млн. лет назад сложились все
главные типы животных и растений.
ГЛАВА 2
РАЗНООБРАЗИЕ
Классификация и эволюция
Глава 1, в которой говорится о четвероногих животных; глава 2, которая
повествует обо всех различных видах птиц всевозможного рода; глава 3, повествующая
обо всех животных, обитающих в воде; глава 4, где говорится о других животных,
живущих в воде, но несъедобных; глава 5, которая повествует о различных змеях
и других созданиях, живущих на земле; глава 6, повествующая о различных
деревьях и о присущих им разнообразных свойствах, таких как прочность; глава 7,
в которой говорится о всевозможных травах...
Фрэй Бернадино де Саагун, Флорентийский Кодекс, Всеобщая история живых
созданий Новой Испании, 16-й век
Разнообразие живой природы ошело-
мляет; по некоторым оценкам ныне суще-
ствует около 10 млн. видов. Необходимо
упорядочение знаний о живых организмах,
т. е. использование какой-либо схемы клас-
сификации. Ранние схемы классификации
крупных организмов чаще всего были про-
извольными и служили прямым практиче-
ским целям. Североамериканские цивили-
зованные народы, говорившие на языке
науатль, а также другие до прибытия
первых европейцев подробно знали свой-
ства более тысячи растений, животных
и минералов, а цивилизациям Дальнего
Востока и Евразии было известно много
тысяч организмов. Аристотель описал
около 540 животных, которых он объеди-
нил в ряд групп: животные с красной
кровью, без крови, живородящие, покры-
тые шерстью, похожие на растения и т.п.
Он выделял также мир неодушевленных
примитивных растений, обладающих
«большей жизненностью» [173]. К сожале-
нию, его ботанические труды утрачены,
и современному читателю его система
классификации может показаться ребяче-
ски неадекватной.
В европейской цивилизации до 18-го ве-
ка биологические знания в основном были
упорядочены очень сходно с классифика-
цией ацтеков, процитированной выше
в эпиграфе; живые организмы группирова-
лись в соответствии с признаками, оче-
видными для всех. Особое значение имели
признаки, связанные с потребностями че-
ловека - с получением пищи, волокон
и ядов. Небольшие прикрепленные орга-
низмы почти все авторы считали травами;
подвижные существа, независимо от их
размеров, относили к животным. Даже
в 20-м веке, после появления микроскопии
и эволюционных концепций, приведших
к осознанию того, что организмы имеют
общих предков, простая дихотомическая
схема «животные-растения» казалась ло-
гичной и достаточной.
По традиции считается, что начало со-
временной биологической 'классификации
положил Карл Линней (1707-1778). В своем
великом труде “Systema Naturae”, впервые
опубликованном в 1735 г., этот шведский
ботаник и учитель сгруппировал все из-
вестные ему организмы-около 36000-в
отдельные категории, названные видами,
а сходные виды в категории, названные ро-
дами. Он дал каждому виду родовое и ви-
довое название, например Homo sapiens (че-
ловек) или Pseudoplatanus acerifolium (явор).
На основе внешних признаков он объеди-
нил роды в семейства, семейства в поряд-
ки (отряды), а порядки - в еще более
обширные группы, названные клас-
сами.
В 1789 г. парижанин Антуан Лоран де
Жюссье (1748-1836) в своем труде “Genera
Plantarum” расширил классификацию Лин-
РАЗНООБРАЗИЕ
27
нея, охватив большее число видов, и под-
черкнул значение внутреннего строения ор-
ганизмов. Жорж Кювье (1769-1832), осно-
ватель сравнительной анатомии, применил
новый подход Жюссье к животным, при-
чем некоторые из них были известны толь-
ко по ископаемым остаткам. Он ввел еще
более широкое подразделение, основанное
на общей функциональной организации
животных,-ветвь (embranchement), которая
объединяла родственные классы. Кювье
выделил в царстве животных четыре ветви:
Vertebrata (позвоночные), Mollusca (мягко-
телые), Articulata (членистые, т. е. членисто-
ногие и черви) и Zoophyta (зоофиты-
формы с радиальной симметрией тела,
включая иглокожих, а также все. то, что не
вошло в остальные группы) [170]. Почти
все ископаемые животные отличаются от
ближайших к ним современных форм, но
для Кювье соответствие между ныне живу-
щими и вымершими организмами было
обычно настолько очевидным, что он мог
без колебаний поместить любое ископае-
мое в одну из своих четырех ветвей. Кювье
сыграл главную роль в объединении био-
логических данных с геологическими и по-
мог тем самым рождению палеонтологии.
Швейцарский ботаник Огюстен Пирам
Декандоль (1778-1841) ввел термин таксо-
номия -наука о названиях и классифика-
ции-и расширил анализ Кювье, создав
в пределах царства растений крупные, вме-
стительные подразделения; некоторые из
них все еще используются, по крайней ме-
ре неформально. Эти подразделения со-
ответствуют типам (phyla) зоологов.
Декандоль различал таллофиты, тайно-
брачные растения и явнобрачные расте-
ния-теперь их называют соответственно
водорослями, нецветковыми сосудистыми
растениями и цветковыми растениями. Все
эти ученые раннего периода верили в неиз-
менность видов, созданных богом, и при-
знавали разделение всей живой природы
на два больших царства (regna)-царства
растений и животных.
Во второй половине 19-го века неко-
торые ученые предлагали ввести третье
царство. Одним из них был Дж. Хогг
[410], который в 1861 г. ввел царство про-
токтистов (Regnum Primogeneum) для орга-
низмов, явно не относящихся ни к жи-
вотным, ни к растениям (он включал
в него губок).
Огромные последствия для самой ин-
терпретации классификационных схем име-
ло фундаментальное обобщение Дарвина,
согласно которому все организмы связаны
между собой родством и имеют общих
предков. Выдающийся немецкий философ
и биолог Эрнст Геккель (1834-1919) был
первым крупным эволюционистом, кото-
рый попытался создать классификацию,
основанную на эволюционной истории. Он
тоже сделал попытку заменить систему
двух царств (растения/животные) системой
трех царств [371]. В его третье царство
входили главным образом одноклеточные
организмы (протесты), но иногда он поме-
щал в него грибы и губок [369, 371]. Гек-
кель выделял среди протестов важную
группу организмов, лишенных ядра
(Мопега). В эту группу он включал бакте-
рий, сине-зеленые водоросли и некоторых
амеб (у которых впоследствии ядра были
найдены).
Грегор Мендель (1822-1884) открыл за-
коны, которым подчиняется передача неко-
торых дискретных признаков от родителей
потомкам. В основе менделевских правил
распределения наследуемых признаков
у потомства лежит поведение хромосом.
В 20-е годы нашего века «хромосомная
теория наследственности» получила широ-
кое признание. Вскоре после этого,
в 30-40-е годы, оформилась связь между
генетикой, эволюцией и таксономией, что
привело к созданию науки систематики.
Эго был «новый синтез» взаимосвязей ме-
жду организмами, их морфологией, физио-
логией, генетическими системами, исто-
рией ископаемых форм и экологическими
взаимодействиями. Биологи-систематики
являются неодарвинистами. Они разде-
ляют основную дарвиновскую концепцию
о механизме эволюции и имеют преимуще-
ство в том, что знают, каким образом ге-
нетические изменения - точечные мутации,
дупликации, хромосомные рекомбинации-
приводят к наследственным различиям
в популяциях организмов. Они разрабо-
тали математический язык для описа-
ния поведения генов в популяциях и соз-
28
ГЛАВА 2
дали новый раздел науки - генетику попу-
ляций.
По оценкам современных систематиков
несколько миллионов видов ныне живущих
организмов могут быть сгруппированы
в 50-100 типов. Число особей одного вида
варьирует от нескольких сотен у редких
крупных позвоночных до гигантских чи-
сел-например, Ю10 особей в 1 мл-для
мелких микробов в богатой питательными
веществами воде. На основании морфоло-
гических различий было идентифицирова-
но 130000 ископаемых видов; подавляю-
щее большинство из них можно отнести
к современным типам. Вероятно, эти ока-
меневшие организмы представляют собой
лишь очень незначительную выборку из
всего множества существовавших.
Как определяются виды? Хотя все осо-
би данного вида могут чем-то различаться,
каждая из них имеет с другими организ-
мами той же группы общие признаки. Те
эукариоты, которые выглядят очень сходно,
особенно если они способны скрещиваться
и давать жизнеспособное потомство, счи-
таются представителями одного вида. Та-
ким образом, организмы сначала распреде-
ляют по видам-группам, с которыми
можно работать дальше. Виды группи-
руют в более обширные таксоны, которые
объединяют в еще большие группы, так
что в целом классификация - это иерархия.
Это система подразделений, которые уве-
личиваются по своему объему и умень-
шаются в числе при переходе от каждого
уровня к уровню, лежащему выше. Ботани-
ки и зоологи обычно различают следую-
щие таксоны (от высших к низшим): цар-
ство, тип (в ботанике-отдел), класс, отряд
(в ботанике - порядок), семейство, род и вид.
Виды состоят из дивергирующих популя-
ций организмов; они могут подразделять-
ся на группы (называемые подвидами, раз-
новидностями или расами), дающими по-
томство при взаимном скрещивании.
Со времени основания систематики
предпринималось множество попыток
классифицировать необычайное разнообра-
зие жизни. Хотя каждому биологу знакомы
только некоторые группы организмов,
многие в наше время стараются. изобрести
систематические классификации, отражаю-
щие ход эволюции. Классификации, не ос-
нованные явно на эволюционных отноше-
ниях, называют искусственными; напри-
мер, организмы часто группируют в со-
ответствии с их полезностью (например,
различные растения), по размерам (де-
ревья, кустарники), окраске (цветы), эколо-
гической роли (напочвенный покров) и т.д.
Многие биологи пользуются и такими не-
систематическими классификациями. Тео-
рия клеточного симбиоза не оказывает за-
метного влияния на таксономические уров-
ни ниже класса или порядка. Однако
высшие таксоны-типы и царства-ока-
зываются очень глубоко затронутыми.
В табл. 2.1 приведен ряд широко исполь-
зуемых систем классификации, опублико-
ванных после 1955 года. В табл. 2.2 сопо-
ставлена классификация пяти организмов
в традиционной системе из двух царств и
в системе из пяти царств, принятой в на-
стоящей книге.
Эволюционисты согласны в том, что
между таксонами и временем имеется не-
посредственная связь. Симпсон и Бек [866]
писали:
«Систематическая единица организмов
в природе-это популяция или группа род-
ственных популяций. Их анатомические и фи-
зиологические особенности - это просто сумма
особенностей особей, составляющих популяцию.
Такой набор особенностей не является ни реаль-
ной особью, нй ее идеализированной абстрак-
цией. «Систематическая единица»-это распреде-
ление частот различных вариантов каждого
признака, существующих в действительности
в любой данный момент времени. Виды-это
популяции особей общего происхождения со
сходными экологическими отношениями, оби-
тающих совместно в сходных условиях среды
в определенной области,-популяции, проявляю-
щие тенденцию играть единообразную и про-
должительную эволюционную роль, отличную
от ролей других видов. Систематические еди-
ницы, более широкие, чем виды,-это группы,
состоящие из одного или многих видов общего
происхождения».
Говоря о «популяциях особей общего
происхождения», Симпсон и Бек затраги-
вают временной аспект. Уровень самого
низшего таксона, к которому принадлежат
два организма, должен в какой-то мере от-
ражать то, насколько давно соответствую-
щие две популяции дивергировали от об-
РАЗНООБРАЗИЕ
29
щего предка. Как правило, два организма,
принадлежащие к одному и тому же роду
(например, бобы Phaseolus vulgaris и Ph.
lunatus, лягушки Rana pipiens и R.
catesbiana), дивергировали от их общего
предка позже, чем два организма, принад-
лежащие только к одному и тому же се-
мейству (например, Phaseolus vulgaris и ви-
ка Vicia americana, Rana pipiens и жаба Bufo
terrestris). Но это-не непреложный закон,
поскольку скорость эволюции и критерии
классификации в разных группах неодина-
ковы.
Поразительное открытие молекулярной
биологии, сделанное в последние два де-
сяти летия, - это всеобщность фундамен-
тальных химических процессов, лежащих
в основе самых существенных биологиче-
ских феноменов, а именно способности
к достаточно точной репликации и тем
самым к эволюции. Генетический код, т.е.
правила, определяющие соотношение ме-
жду последовательностями нуклеотидов
в РНК и аминокислот в белке, по существу
одинаков у всех изученных организмов от
монер до обезьяны. Связывание информа-
ционных РНК, комплементарных генной
ДНК, с рибосомами в процессе синтеза
белков, очевидно, тоже универсально.
Представители всех царств используют
аденозинтрифосфат (АТР) в реакциях, тре-
бующих затраты энергии. Эти факты ука-
зывают на то, что в конечном счете все
живые организмы находятся в родстве ме-
жду собой.
Одна из целей эволюционных исследо-
ваний состоит в конструировании филоге-
нетических схем, которые точно отобража-
ли бы историю. Такие схемы (часто в виде
родословных деревьев, ветви которых схо-
дятся в единый ствол) представляют собой
резюме эволюционной информации. Они
графически связывают таксоны друг с дру-
гом во времени или в соответствии со сте-
пенью сходства по некоторому признаку.
Организм, помещенный в развилке эволю-
ционных путей,-это ближайший общий
предок тех организмов, которые находятся
на идущих от этого места ветвях. При по-
строении филогенетических схем может ис-
пользоваться информация из многих ис-
точников. Например, по числу и характеру
различий между аминокислотными после-
довательностями в белках, общих для двух
организмов (пусть это будут, скажем, ци-
тохром с или гемоглобин), можно оценить
число мутаций, которые произошли с тех
пор, как эти два организма дивергировали
от общего предка (см. рис. 2.1). Таким же
образом можно проанализировать нуклео-
тидную последовательность рибосомных
РНК тех же организмов, а затем с по-
мощью программы для компьютера полу-
чить сложные филогении, совместимые со
всеми известными последовательностями
в их белках и РНК [835]. При разработке
таких программ необходимо вводить опре-
деленные предположения и ограничения.
Так, частичные филогении, вытекающие из
макромолекулярных данных, нужно срав-
нивать с филогениями, основанными глав-
ным образом на скелетных структурах
и внешней морфологии ныне живущих
и ископаемых форм или на цитологии
хромосом.
Классификации, основанные на филоге-
нетических схемах, суммируют огромные
массивы информации, хотя, конечно, ну-
ждаются в пересмотре по мере появления
новых данных. Как ботаниками, так и зоо-
логами были составлены приемлемые фи-
логении. Палеонтология, сравнительная
анатомия, физиология и биохимия пришли
к согласию относительно общих контуров
эволюционной истории животных и расте-
ний за последние 600 млн. лет. Однако си-
стематика так называемых «низших» орга-
низмов (бактерий, протистов и грибов)
находится в брожении. Противоречия воз-
никают отчасти из-за профессиональной
организации микробиологов и ботаников.
Их традиции плохо отражают взаимосвязи
между организмами, которые они изучают
(табл. 2.3). Кроме того, подходы к опреде-
лению и классификации организмов в бо-
танике, зоологии и микробиологии суще-
ственно различны (табл. 2.4).
Однако нельзя вечно возлагать вину на
традиции. Только в начале 60-х годов ста-
ло известно, что ископаемая история ми-
кробной жизни простирается вспять по
меньшей мере на 2 млрд. лет. Многие ми-
кробы не имеют явно выраженной половой
стадии, поэтому определение вида должно
30
ГЛАВА 2
Таблица 2.1. Некоторые современные системы классификации. Цифра в верхней строке каждого
2 3 3 3 4
Традиционная По Кёртису По Стейниеру По Додсону По Коуплэнду
[19] [192] и сотр. [902] [239] [175]
Растения
Бактерии
Сине-зеленые
водоросли
Зеленые
водоросли
Хризофиты
Бурые
водоросли
Красные
водоросли
Слизевики
Настоящие
грибы
Мхи
Сосудистые
растения
Животные
Простейшие
Многоклеточ-
ные
Протисты
Бактерии
Сине-зеленые
водоросли
Простейшие
Слизевики
Растения
Зеленые
водоросли
Хризофиты
Бурые
водоросли
Красные
водоросли
Настоящие
грибы
Мхи
Сосудистые
растения
Животные
Многоклеточ-
ные
Протисты
Бактерии
Сине-зеленые
водоросли
Простейшие
Зеленые
водоросли
Хризофиты
Бурые
водоросли
Красные
водоросли
Слизевики
Настоящие
грибы
Растения
Мхи
Сосудистые
растения
Животные
Многоклеточ-
ные
Монеры (Mychota)
Бактерии
Сине-зеленые
водоросли
Растения
Зеленые
водоросли
Хризофиты
Бурые
водоросли
Красные
водоросли
Слизевики
Настоящие
грибы
Мхи
Сосудистые
растения
Животные
Простейшие
Многоклеточ-
ные
Монеры
Бактерии
Сине-зеленые
водоросли
Протоктисты
Простейшие
Зеленые
водоросли
Хризофиты
Бурые
водоросли
Красные
водоросли
Слизевики
Настоящие
грибы
Растения
Мхи
Сосудистые
растения
Животные
Многоклеточ-
ные
Таблица 2.2. Классификация пяти организмов в системах с пятью и с двумя царствами
Таксон Осциллятория Инфузория- трубач Шампиньон Человеи Кукуруза
Пять царств
Царство Мопега Protoctista Fungi Animalia Plantae
Ранг — Mitotica Coelomata Tracheophyta
Тип Cyanobacteria Ciliophora Basidiomycota Chordata Angiospermo-
phyta
Класс Hormogoneae Polyhymenophora Homobasidio- Mammalia Monocotyledonae
mycetae
Порядок Nostocales Heterotrichales Agaricales Primates Graminales
Семейство Nostocaceae Stentoridae Agaricaceae Hominidae Gramineae
Род Oscillatoria Stentor Agaricus Homo Zea
Вид marinus coeruleus campestris sapiens mays
Два царства
Царство Plantae Animalia Plantae Animalia Plantae
Тип Schizophyta Protozoa Eumycetes Chordata Spermatophyta
(Низшие таксоны-те же, что в системе пяти царств)
РАЗНООБРАЗИЕ
31
столбца указывает число царств в соответствующей системе
5 5 7 13
По Уиттэйкеру По Уиттэйкеру и Маргелис По Эдвардсу По Лидэйлу
[1018] [1020] (принята в настоящей книге) [272] [539]
Монеры Монеры Цианохлоробионты Монеры
Бактерии Бактерии Сине-зеленые Бактерии
Сине-зеленые Цианобактерии водоросли Сине-зеленые
водоросли и сколь- (сине-зеленые Эритробионты водоросли
зящие бактерии водоросли) Хлоробионты Красные водоросли
Протисты Хлорокси бактерии Зеленые Растения
Простейшие (зеленые прокарио- водоросли Зеленые водоросли
Хризофиты тические водоросли, Мхи Харовые
Эвгленовые или прохлорофиты) Сосудистые Мхи
Г ипохитриды Протоктисты или растения Сосудистые растения
Плазмодиофоры Протисты1 Эвгленовые Эвгленовые
Растения Простейшие Миксобионты Миксомицеты
Зеленые водоросли Ядросодержащие Слизевики Грибы
Бурые водоросли водоросли Грибы 1 Настоящие грибы
Красные водоросли Слизевики Безжгутиковые (без ундулиподий)
Мхи Гифомицеты грибы Гетероконты
Сосудистые растения Грибы Хитриды Оомицеты
Грибы Грибы с ундули- Грибы 2 Бурые водоросли
Слизевики подиями1 Гифомицеты Диатомовые
Оомицеты Зигомицеты Гипохитриды Желто-зеленые
Хитриды Аскомицеты Оомицеты водоросли
Настоящие грибы Базидиомицеты Хромобионты Эустигматофиты
Животные Лишайники Бурые водоросли Гаптофиты
Многоклеточные Растения Хризофиты Крипто монады
Водоросли1 Динофлагелляты
Мхи Мезозой
Сосудистые Животные Животные
Губки Metazoa
1 Данная классификация [1020] предусматривает две альтернативы: царство Protista или царство Protoctista. В первом случае
грибы с ундудиподиями следует включить в царство грибов, а эукариотические водоросли-в царство растений; во втором случае
эти организмы следует отнести к протоктистам, как это и сделано в настоящей книге.
всецело основываться на распределении ча-
стот морфологических и физиологических
признаков. Между тем многие микробы (в
сущности, большинство) не были выра-
щены и изучены в условиях чистой куль-
туры; поэтому решающие сведения часто
отсутствуют. Попытки использовать мор-
фологические критерии и данные о способе
питания (тактика, весьма успешная в систе-
матике животных и растений) не оказались
особенно полезными при построении фи-
логенетических схем для микробов. Хоро-
шо сохранившиеся микрофоссилии в боль-
шинстве групп бактерий и протоктистов
(за исключением динофлагеллят, радиоля-
рий, фораминифер, диатомей, цианобакте-
рий и нескольких других групп микроорга-
низмов, имеющих раковину или связываю-
щих осадки) исключительно редки, поэто-
му их филогению, а также таксономию
и систематику либо вообще избегали раз-
рабатывать, либо основывали главным
образом на сравнении ныне живущих
форм. Мы лишь совсем недавно узнали
кое-что о деталях метаболизма, ультра-
структурной морфологии, жизненных ци-
клов, питания, генетики и ископаемой ис-
тории мира микробов. Поэтому схемы
филогении бактерий и протоктистов не бы-
ли построены до самого последнего време-
32
ГЛАВА 2
/ч Дупликация и дифференциация
NZ с образованием отдельных генов
♦ Дупликация, приводящая
к удлинению генов
I—1 = 25 замен аминокислот
| | Удвоенный ген
А Предковый ген,
1—1 кодирующий ~39 аминокислот
Рис. 2.1. Филогения, основанная на сравнении последовательностей аминокислот
в белках. Эскиз эволюции гомологичных участков белков группы тропонина С по
Шварцу и Дэйхофу [835]. Длина ветвей пропорциональна числу замен аминокислот;
короткие ветви построены точнее, чем более длинные. Темп эволюции белков, выпол-
няющих различные функции, варьирует; более длинные ветви соответствуют быстрее
эволюционирующим белкам.
Таблица 2.3. Организмы и традиционные дисциплины, их изучающие
Организмы Традиционные дисциплины Области перекрывания
РАЗНООБРАЗИЕ
33
Таблица 2.4. Расхождения в классификации одного фотосинтезирующего протеста
Ботаники Зоологи
Таксономический уровень Таксон Критерий Таксон Критерий
Царство Plantae Фотосинтез Animalia Подвижность
Тип Chrysophyta Золотисто-желтая пигментация Protozoa Одноклеточное животное
Класс Chrysophyceae Phytomastigophorea Пластиды
Порядок Chrysamoebida Амебофлагеллят- ные подвижные стадии Chrysomonadina Золотисто-желтый цвет пластид
Род и вид Ochromonas danica Ochromonas danica
ни [756], и данные, приводимые в Прило-
жении, носят предварительный характер.
Несмотря на эти трудности, было опреде-
ленно достигнуто согласие по одному во-
просу: дихотомия между прокариотами
и эукариотами, несомненно, гораздо глуб-
же, чем традиционное разграничение жи-
вотные/растения.
Прокариоты и эукариоты
Многочисленные и фундаментальные различия между эукариотическими и про-
кариотическими организмами... были полностью осознаны лишь в последние несколько
лет. Действительно, это основное расхождение в структуре клетки, отделяющее
бактерий и сине-зеленые водоросли от всех остальных клеточных организмов,
вероятно, представляет собой величайший единичный эволюционный разрыв, который
можно найти в сегодняшней живой природе.
Р. Стейниер, Э. Адельберг и М. Дудоров, 1970 [902]
К прокариотическим организмам отно-
сятся бактерии-прежде всего бактерии
в традиционном смысле этого термина, за-
тем сине-зеленые водоросли (цианобакте-
рии) и недавно открытые зеленые водо-
рослеподобные организмы (хлороксибакте-
рии), а также некоторые многоклеточные
организмы, такие как актинобактерии (ак-
тиномицеты) и миксобактерии, образую-
щие плодовые тела. Все это-микробы. На-
звание «прокариоты» происходит от грече-
ских слов pro (перед) и кагуоп (семя, ядро).
Прокариотические клетки в большинстве
своем меньше эукариотических (рис. 2.2
и 2.3). Прокариотическую структуру, несу-
щую гены, иногда неправильно называе-
мую бактериальной хромосомой, следует
называть генофором [780]. Это кольцевая
цепь ДНК, которая не находится в ядре,
окруженном мембраной; в электронном
микроскопе генофор выглядит как сравни-
тельно прозрачная область, которую назы-
вают нуклеоидом. В эукариотической клет-
3-39
ке носителями генов служат хромосомы,
находящиеся в ядре, ограниченном мем-
браной. В исключительно тонких, про-
зрачных препаратах можно видеть живые
хромосомы с помощью светового микро-
скопа; чаще же их изучают в фиксиро-
ванных и окрашенных клетках (в отличие
от генофора прокариот хромосомы окра-
шиваются в красный цвет реактивом Фёль-
гена). Хромосомы построены из ДНК, ко-
торая находится в комплексе с пятью
гистонами - белками, богатыми аргинином
и лизином и составляющими у большин-
ства эукариот значительную часть массы
хромосом (более половины). Гистоны при-
дают хромосомам ряд характерных
свойств- упругость, способность к ком-
пактной укладке и окрашиваемость. Одна-
ко они непричастны к способности хромо-
сом передвигаться, за которую ответ-
ственны митотическое веретено или
сходные с ним системы микротрубочек.
Все широко известные организмы - во-
34
ГЛАВА 2
МОНЕРЫ Приблизительные размеры, мнм (наибольшее измерение)
Микоплазмы 0,1-0,3 СЭ
Бактерии
0,5-5,0
РАСТЕНИЯ
Тканевые клетки
10-50
ЖИВОТНЫЕ
Тканевые клетки 10-50
Яйцеклетки 100-105
Рис. 2.2. Сравнение размеров некоторых клеток.
доросли, простейшие, плесени, высшие гри-
бы, животные и растения-состоят из эука-
риотических клеток. Клетки этих организ-
мов (за исключением некоторых протокти-
стов) делятся путем митоза-так назы-
ваемым непрямым делением, при котором
хромосомы продольно «расщепляются»
и расходятся двумя группами к противопо-
ложным полюсам клетки. Слово митоз
в этой книге будет употребляться в класси-
ческом смысле-только тогда, когда речь
идет о хромосомах и митотическом аппа-
рате; в это понятие не входит точное пря-
мое распределение генов, составляющих
группу сцепления (генофор) у бактерий.
Прокариотические клетки могут делиться
РАЗНООБРАЗИЕ
35
Нецеллюлозная
стенка
ПРОКАРИОТА
ЭУКАРИОТА
Митохондрии
Кинетохор
Хромосома
Клеточная
мемврана
Ядерная
мемврана
Большие
РИБОСОМЫ
Нуклеоид
(генофор)
Жгутик
Клеточная
стенка
Рис. 2.3. Сравнение структуры прокариотической и эукариотической клетки. Комбини-
рованные схемы, основанные на данных световой и электронной микроскопии.
Клеточная
мемврана
КинетосомаЯ+О1
Эндоплазматический
ретикулум
Ундулиподия 9+Z
(микротрубочки)
перетяжкой на равные части или почкова-
нием на неравные части, но они никогда не
делятся путем митоза.
Прокариоты обычно размножаются
бесполым способом. У многих из них по-
ловой процесс вообще неизвестен и потом-
ство имеет только одного родителя (в этой
книге под половым размножением пони-
мается любой процесс, при котором каж-
дый потомок имеет более чем одного ро-
дителя-обычно двух). У прокариот, спо-
собных к половому размножению, половые
системы однонаправленны в том смысле,
что клетки-доноры («мужские») передают
свои гены клеткам-реципиентам («жен-
ским»). Число передаваемых генов варьи-
рует от одной конъюгации к другой: гены
образуют длинную молекулу ДНК, и обы-
чно передается лишь небольшая часть ге-
нома (но иногда-почти весь геном). При
конъюгации бактерий не происходит слия-
ния цитоплазмы клеток, как это бывает
у всех животных, у грибов (при слиянии
гиф) и у многих растений и протоктистов.
Новый прокариотический организм, назы-
ваемый рекомбинантом, состоит из самой
клетки-реципиента, в которой некоторые
гены замещены генами донора [444]. Та-
ким образом, у прокариот родители почти
никогда не вносят равного вклада. С дру-
гой стороны, у эукариотической клетки,
возникающей половым путем (зиготы),
вклад родителей одинаков или почти оди-
наков: новая эукариотическая особь обыч-
но получает половину генов и некоторое
количество нуклеоплазмы и цитоплазмы
от каждого родителя.
Хромосомы построены из ДНК и бел-
ков, но препараты изолированных хромо-
сом часто содержат также значительную
примесь РНК из других областей ядра.
Эта РНК-вероятно, как информационная,
так и рибосомная-легко прилипает к изо-
лированным хромосомам. Эукариотиче-
36
ГЛАВА 2
ское ядро содержит также ядрышки, со-
стоящие из предшественников цитоплазма-
тических рибосом-из цепей РНК различ-
ной длины и большого числа белков.
Другие органеллы, свойственные только
эукариотическим клеткам,-это митохон-
дрии, пластиды, центриоли и кинетосомы
с их ундулиподиями. За исключением ми-
кротрубочек, которые встречаются как вну-
три, так и вне ядра, все эти органеллы ле-
жат с наружной стороны от ядерной мем-
браны.
Все двигательные органеллы эукариоти-
ческой клетки имеют толщину около
0,25 мкм; из них более длинные (от 10 до
15 мкм) и представленные у каждой клетки
в небольшом числе по традиции называют
жгутиками, а более короткие и многочис-
ленные-ресничками. Электронная микро-
скопия выявила поразительное структур-
ное сходство всех эукариотических ресни-
чек и жгутиков: на поперечном разрезе во
всех случаях можно видеть одно и то же
расположение белковых микротрубочек
(9 + 2), диаметр каждой из которых соста-
вляет около 0,024 мкм. Эти органеллы го-
раздо сложнее бактериальных жгутиков
и имеют совершенно иную структуру
и иной белковый состав (рис. 2.4). Пришло
время, чтобы их названия отразили новые
сведения; поэтому в нашей книге для ре-
сничек, жгутиков и родственных им орга-
нелл эукариот (например, для осевой нити
в хвосте спермия, для структурных единиц
цирруса у инфузорий и других структур ти-
па 9 -I- 2 и их производных, развивающихся
из кинетосом, которые сами имеют на по-
перечном разрезе структуру 9 + 0) исполь-
зуется термин ундулиподия. Название жгу-
тик оставлено для тонких бактериальных
жгутиков и гомологичных им структур, та-
ких как аксиальные фибриллы спирохет;
обычно жгутики слишком малы, чтобы их
можно было видеть с помощью обычного
светового микроскопа. Эта менее дву-
смысленная терминология основана на
соображениях Т. Яна и его коллег
[179, 518].
ЖГУТИК
МЕСТО ПРИКРЕПЛЕНИЯ
Белок —
флагеллин
йетериалкиыИ Клеточная
стенка
жгутик
Осевая фибрилла
Осевая нить
ФиБР/илла /0Б0Л0Чна
Изгиб
Липо-
L полисахарид
Пептидогли- ' ДьТ
*-кан яме
Плазматическая мембрана
(липополисахаридная)
Рис. 2.4. Двигательные структуры бактерий (жгутик и бактериальное базальное тель-
це) и эукариот (ундулиподия и кинетосома). (Выражение «бактериальное базальное
тельце» двусмысленно.)
РАЗНООБРАЗИЕ
Таблица 2.5. Общеизвестные прокариоты и эукариоты
Прокариоты Эукариоты
Одноклеточные гетеротрофы Настоящие бактерии: сероводородные бактерии, Е. coli, псевдомонады, не- которые железобактерии, бациллы, метанообразующие бактерии, азот- фиксирующие бактерии, спирохеты, микоплазмы, риккетсии, Chlamydia, Bedsonia Про тис ты: амебы, радиолярии, фора- миниферы, инфузории, споровики, некоторые динофлагелляты. Некото- рые дрожжи
Автотрофы Сине-зеленые и зеленые прокариоти- ческие водоросли (т.е. цианобакте- рии и хлороксибактерии), другие фо- тосинтезирующие бактерии, хемоав- тотрофные бактерии Водоросли: красные, бурые, харовые, диатомовые; некоторые динофлагел- ляты, хлореллы, Cyanidium. Расте- ния: мхи, печеночники, папоротники, цикадовые, хвойные, цветковые
Мицелиальные и многоклеточ- ные организмы Актинобактерии (актиномицеты), неко- торые скользящие и почкующиеся бактерии Водные плесени, хитриды, шляпочные грибы, дождевики, аскомицеты, сли- зевики. Растения. Животные: губки, гребневики, кишечнополостные, пле- ченогие, мшанки, аннелиды, брюхо- ногие моллюски, членистоногие, иг- локожие, оболочники, рыбы, млеко- питающие
В табл. 2.5 приведены некоторые хоро-
шо известные про- и эукариоты, сгруппи-
рованные по способам питания и типу
клетки; в табл. 2.6 перечислены главные
различия между прокариотическими и эу-
кариотическими организмами.
Таблица 2.6. Различия между прокариотами и эукариотами
Признаки Прокариоты Эукариоты
Размеры клеток Клетки большей частью мелкие (1-10 мкм); некоторые больше 50 мкм Клетки большей частью крупные (10-100 мкм); некоторые больше 1 мм
Общие особенно- сти Исключительно микроорганизмы. Од- ноклеточные или колониальные. Морфологически наиболее сложны нитчатые или мицелиальные формы с «плодовыми телами». Нуклеоид без пограничной мембраны Некоторые-микроорганизмы; боль- шинство-крупные организмы. Од- ноклеточные, колониальные, мице- лиальные или многоклеточные. Мор- фологически наиболее сложны поз- воночные животные и покрытосе- менные растения. Все имеют ядро с пограничной мембраной
Клеточное деле- ние Немитотическое, прямое, чаще всего путем расщепления надвое или поч- кования. Генофор содержит ДНК, но не содержит белка; не дает ре- акции Фёльгена. Центриолей, мито- тического веретена и микротрубо- чек нет Различные формы митоза. Обычно имеется много хромосом, содержа- щих ДНК, РНК и белки и дающих ярко-красную окраску по Фёль- гену. У многих форм имеются цент- риоли, а также. митотическое вере- тено или упорядоченно расположен- ные микротрубочки
38
ГЛАВА 2
Продолжение табл. 2.6
Признаки Прокариоты Эукариоты
Системы пола У большинства форм отсутствуют; ес- ли имеются, то осуществляют од- нонаправленный перенос генетичес- кого материала от донора к ре- ципиенту У большинства форм имеются; рав- ное участие обоих родителей в оп- лодотворении
Развитие Отсутствует многоклеточное развитие, начинающееся от диплоидных зигот; нет выраженной дифференциации тканей. Только одиночные или ко- лониальные формы. Нет сложных межклеточных соединений. Мета- морфоз редок Гаплоидные формы образуются в ре- зультате мейоза, диплоидные разви- ваются из зигот; у многоклеточ- ных-далеко идущая дифференциа- ция тканей. Плазмодесмы, десмосо- мы и другие сложные межклеточ- ные соединения. Метаморфоз обы- чен
Устойчивость к кислороду Строгие или факультативные анаэро- бы, микроаэрофилы или аэробы В основном аэробы. Исключения-яв- но вторичные модификации
Обмен веществ Различные схемы метаболизма; нет специализированных, ограниченных мембранами органелл с ферментами, предназначенными для окисления ор- ганических молекул (нет митохонд- рий) Во всех царствах одинаковая схема окислительного метаболизма: име- ются мембранные органеллы (мито- хондрии) с ферментами окисления трикарбоновых органических кислот
Фотосинтез (если он имеется); липиды и др. Ферменты фотосинтеза связаны с кле- точными мембранами (хроматофо- ры), а не упакованы в виде от- дельных органелл. Встречается ана- эробный и аэробный фотосинтез с выделением серы, сульфата или кис- лорода. Донорами водорода могут быть Н2, Н2О, H2S или (Н2СО)„. Липиды: вакциновая и олеиновая кислоты, гопаны; стероиды крайне редки. Образуют аминогликозидные антибиотики Ферменты фотосинтеза находятся в пластидах, ограниченных мембрана- ми. Большей частью фотосинтез с выделением кислорода; донором во- дорода всегда служит Н2О. Липи- ды: обычны линолевая и линоле- новая кислоты, стероиды (эргосте- рол, ' циклоартенол, холестерол). Обычны (особенно у растений) ал- калоиды, флавоноиды, ацетогенины и другие вторичные метаболиты
Двигательные приспособле- ния Некоторые имеют простые бактериаль- ные жгутики, состоящие из флагел- лина; другие передвигаются путем скольжения. Внутриклеточное движе- ние встречается редко или отсут- ствует; нет фагоцитоза, пиноцитоза и циклоза У большинства имеются ундулипо- дии: «жгутики» или реснички типа 9 + 2. Структуры 9 + 0 или 6 + 0 представляют собой эволюционные модификации схемы 9 + 2. Обычны псевдоподии, содержащие актинопо- добный белок. Характерно внутри- клеточное движение (пиноцитоз, фа- гоцитоз, цикл оз), осуществляемое с помощью специализированных бел- ков-актина, миозина, тубулина
РАЗНООБРАЗИЕ
39
Продолжение табл. 2.6
Признаки Прокариоты Эукариоты
Клеточная стен- ка Гликопептиды - производные диамино- пимелиновой и мурамовой кислот; гликопротеиды редки или отсутству- ют; аскорбиновая кислота не требу- ется Хитин или целлюлоза; обычны глико- протеиды с гидроксилированными аминокислотами; необходима аскор- биновая кислота
Споры Устойчивы к высыханию; теплоустой- чивые эндоспоры содержат дипико- линат кальция; актиноспоры Сложные, варьируют в зависимости от типа; нет дипиколината каль- ция; в спорах спорополленин; эндо- спор нет
Пять царств
Некоторые люди считают, что в науке вряд ли стоит обсуждать вопросы,
на которые нет однозначного ответа, полученного в эксперименте. Такое мнение
наряду с консерватизмом, возможно, было причиной того, что в течение долгого
времени, почти не встречая возражений, господствовала система двух царств-растений
и животных... Однако прочное господство этой системы кончилось; сейчас широко
обсуждаются и другие возможные системы.
Р. Уиттэйкер, 1969 [1018]
В схемах классификации делается попы-
тка отобразить эволюционную историю,
но вместе с тем приходится учитывать ди-
дактические и экологические моменты.
Эволюционные соображения говорят ско-
рее в пользу монофилии, что означает
объединение организмов с их ближайшими
общими предками в наиболее узкие так-
соны. Если бы принцип строгой монофи-
лии твердо выдерживался, то представите-
ли каждого таксона были бы более род-
ственны (через своего общего предка)
другим представителям того же таксона,
чем любому организму, не относящемуся
к этому таксону. Число групп, особенно
в высших таксонах, оказалось бы огром-
ным, а определение таксонов стало бы на-
столько усложненным, что было бы при-
емлемо только для узких специалистов.
Нужны такие группы, которые можно
определить, система которых была бы обо-
зримой и доступной для усвоения. Эти ди-
дактические соображения заставляют отка-
заться от принципа строгой монофилии.
Следует учитывать также экологические
соображения. Когда Р. Уиттэйкер [1017]
впервые в 1959 г. предложил выделить
пять царств, он подчеркнул, что в сети
природных взаимодействий крупные орга-
низмы бывают или продуцентами, или
консументами, или редуцентами. Эти спо-
собы питания приблизительно соответ-
ствуют образам жизни представителей
трех царств макроскопических организмов.
А именно растения-это продуценты, жи-
вотные-консументы, а грибы-редуценты.
Продуценты могут быть или фото-, или хе-
моавтотрофами; они добывают пищу из
неорганических источников либо путем фо-
тосинтеза, либо прямым окислением вос-
становленных неорганических соединений.
Последний способ - хемоавтотрофию - ис-
пользуют только прокариоты. Таким обра-
зом, автотрофия эукариот-это всегда фо-
тоавтотрофия. И консументы, и редуценты
гетеротрофны; в качестве пищи им нужны
готовые органические соединения, но в не-
одинаковом виде. Консументам требуются
органические вещества в форме других ор-
ганизмов : если они питаются фотоавто-
трофами, их называют травоядными; если
же они поедают организмы, которые сами
едят фотоавтотрофов, то их называют
хищниками. Все консументы вводят пищу
40
внутрь своего тела, где она переваривается.
Редуценты-это гетеротрофы, которые не
заглатывают пищу; они секретируют пи-
щеварительные ферменты в окружающую
среду, чтобы разрушить свою пищу снару-
жи, и поглощают образующиеся неболь-
шие молекулы из раствора.
Предложенную Уиттэйкером характе-
ристику этих трех царств по способу пита-
ния дополняет их четкая классификация по
способу развития. У всех животных зигота,
образующаяся при оплодотворении жен-
ской гаметы мужской гаметой, развивается
в клеточный шар, именуемый бластулой.
Растения развиваются из многоклеточных
диплоидных зародышей, питаемых бес-
плодной фотосинтезирующей тканью. Гри-
бы, хотя они и способны к образованию
половых структур, на всех стадиях разви-
тия лишены ундулиподий; кроме того, они
образуют гифы из гаплоидных спор.
В этой модифицированной схеме Уиттэй-
кера три царства определены столь четко,
что нам остается охарактеризовать только
те организмы, которые не относятся ни
к животным, ни к растениям, ни к грибам.
Эти организмы распадаются на две
группы: 1) все прокариоты и 2) те остав-
шиеся эукариоты, у которых нет эмбриоге-
неза,-они не удовлетворяют строгому
определению животного, растения или гри-
ба. Вся совокупность прокариот образует
царство монер (Мопега), которое по пред-
варительной классификации, принятой
в настоящей книге, условно разделено на
16 типов. Эукариотические микроорга-
низмы и их прямые потомки составляют
царство протоктистов. В отношении пита-
ния протоктисты неоднотипны: среди них
есть всасывающие, фотосинтезирующие и
заглатывающие формы. У прокариот
встречаются все возможные способы пита-
ния, кроме заглатывания пищи; на клеточ-
ном уровне «заглатывание» зависит от
способности к фагоцитозу, которая у про-
кариот отсутствует. В табл. 2.7 предста-
влены отличительные особенности всех пя-
ти царств, а также примерное время их
появления в палеонтологической летописи.
Развернутая система пяти царств, доведен-
ная до уровня классов, дана в Приложении.
Вирусы не включены ни в одно из
о
X
*
S
&
S
Е
S
S
св
а
&
5 о
Надцарство Eukariota
Протоктисты (Protoctista) Эукариотические микро- организмы: водоросли, простейшие, грибы с ун- дулиподиями, водные гифомицеты Эукариотические хромо- сомы, иногда без гисто- нов. Митоз может от- сутствовать, может быть необычного типа или же стандартным. Чередование уровней плоидности; разнооб- разные мейотические половые системы Протерозой или фанеро- зой (1000-600) (датиров- ка ненадежна) Менделевские гене- тические систе- мы, митоз и мейоз, рекомби- нация в каждом поколении, внут- риклеточная под- вижность (фаго- цитоз и пиноци- тоз) Истощение запасов [307, питательных ве- 330, ществ 393, 561, 577, 578, 780]
Животные (Animalia) Метазои: животные, раз- вивающиеся из бластул Диплоидные организмы; мейоз предшествует га- метогенезу Поздний протерозой или фанерозой (750) Специализация тка- ней (а также де- смосомы или иные межклеточ- ные соединения) в связи с гете- ротрофным пита- нием путем за- хвата сложных пищевых объек- тов Переход от водно- [330- го образа жизни 332] к наземному и воздушному; стратегии пита- ния
Растения (Plantae) Метафиты: растения, раз- вивающиеся из зароды- шей; с многоклеточны- ми репродуктивными органами Чередование гаплоидной и диплоидной фаз Фанерозой. Риниофиты найдены в даунтоние- вых породах в Уэльсе, Чехословакии и штате Нью-Йорк (450) Специализация тка- ней в связи с ав- тотрофным, фо- тосинтетическим питанием Переход от водно- [47, го образа жизни 48] к наземному; проблема защи- ты от хищников
Грибы (Fungi) Amastigomycota: зигоми- цеты, аскомицеты, шля- почные грибы, дрожжи Гаплоидные и дикарио- тические организмы; за образованием зиготы следует мейоз. Образу- ются гаплоидные споры Фанерозой. Palaeomyces asteroxyli был найден в риниевых сланцах (400) Сложное мице- лиальное разви- тие, питание пу- тем всасывания веществ Переход от водно- [28, го образа жизни 752, к наземному; ис- 947] точники питания; природа хозяев
1 Геохронология, использованная в этой книге, представлена
в табл. 4.2.
42
ГЛАВА ;
царств, так как они не являются клетками
и не состоят из клеток. Минимальное чис-
ло ферментов, нуклеиновых кислот и дру-
гих макромолекулярных компонентов, не-
обходимое для самовоспроизведения тео-
ретической «минимальной клетки», соста-
вляет по. произведенной оценке около 50
[664, 665]. Это соответствует примерно
полсотне генов. Вирусы содержат еще мень-
ше генетической информации: все они-об-
лигатные паразиты клеток и, как полагают,
зарождались многократно у многих раз-
личных хозяев, после того как выработа-
лись механизмы клеточной репликации.
Вероятно, вирусы более родственны своим
хозяевам, чем друг другу [460], хотя неко-
торые из самых крупных и сложных виру-
сов, такие как вирус осповакцины, могли
произойти непосредственно от паразитиче-
ских бактерий путем длительной функцио-
нальной регрессии. Для полноты изложе-
ния несистематическая классификация ви-
русов приведена в табл. 2.8.
Важное новшество в системе Уиттэйке-
ра-признание громадных различий между
растениями и грибами, которые по тради-
ции относили к растениям. Зеленые расте-
ния-это фотоавтотрофные первичные про-
дуценты, тогда как грибы - всасывающие
редуценты; экологически и физиологически
у них мало общего, если не считать непо-
движного образа жизни. Однако Уиттэй-
кер, как и другие [175, 239, 539], столкнул-
ся с проблемой размытости границ между
растениями и грибами, с одной стороны,
и эукариотическими микроорганизмами, от
которых они, по-видимому, произошли,-с
другой. Многоклеточность - недостаточный
признак для того, чтобы отличать расте-
ния и грибы от протоктистов. Колониаль-
ная и многоклеточная организация возни-
кла во многих группах, включая бактерий.
Фактически ни одна из новых классифика-
ций не считает всех протистов одиночными
клетками (вспомним о вольвоксовых или
о колониальных инфузориях). Признавая
это затруднение, Уиттэйкер и я попыта-
лись разработать достаточно простую
(чтобы она могла быть общеполезной) си-
стематическую классификацию [1020]. Мы
предложили два варианта на выбор: с бо-
Таблица 2.8. Вирусы [1016]
Тип Структура Примеры
Рибови- Рибоспиральные Вирус табачной
русы (нуклеокапсид мозаики, мик-
(РНК- со спиральной совирус (вирус
виру- симметрией) гриппа А), ви-
сы) рус мозаики го- роха, вирус по- дорожника
Рибокубические Napoviridae (ви-
(нуклеокапсид с рус желтой мо-
кубической заики турнепса,
симметрией) Коксаки 1, эхо- вирус, РНК- фаг); Reoviridae (реовирус, нео- вирус); арбови- русы
Дезокси- Дезоксиспираль- Вирусы оспы, ку-
вирусы ные (нуклеокап- риной оспы,
(ДНК- сид со спираль- миксомы кро-
виру- ной симмет- лика; цианофа-
сы) рией) ги (фаг фХ174).
Дезоксикубиче- Вирусы папилло-
ские (нуклео- мы Шоупа, по-
капсид с куби- лиомы: адено-
ческой симмет- вирусы, вирус
рией) герпеса
Дезоксибиналь- Бактериофаги (Т,
ные (с головкой и хвостом) X, 434, ф80, Р22)
лее широким царством Protoctista и с бо-
лее узким царством Protista. Если выбрать
протоктистов, что я сделала в этой книге,
то три сложных царства получают строгие
определения и, возможно, даже оказы-
ваются монофилетичными. При этом из
царства грибов, которые позитивно опре-
делены как гаплоидные или дикариотиче-
ские мицелиальные организмы, размно-
жающиеся спорами, исключаются многие
формы, которые по традиции причисляли
к грибам,-все водные плесени и другие ор-
ганизмы, имеющие ундулиподии на какой-
либо стадии жизненного цикла. Царство
грибов (Fungi) в нашем понимании вклю-
чает только плесневые и высшие грибы
(например, зигомицеты, аскомицеты и ба-
зидиомицеты). В царство растений, как оно
здесь определено, входят только эмбрио-
РАЗНООБРАЗИЕ
43
фиты-многоклеточные зеленые растения,
которые развиваются из зародышей; это
главным образом наземные растения. В ре-
зультате этих ограничений царство проток-
тистов становится похожим на свалку:
в него попадают те оставшиеся разно-
родные типы, в которых происходили глу-
бокие эволюционные «эксперименты» на
тему митоза и мейоза (см. гл. 9 и 10). В со-
ответствии с таким определением, это цар-
ство включает бурые и красные водоросли,
слизевики и водные плесени, а также мно-
жество многоклеточных потомков эукарио-
тических микробов-ни при каком усилии
воображения невозможно счесть все эти
организмы одноклеточными. Как заметил
Коуплэнд (1956) [175], одобрив прецедент
Хогга (1861) [410], термин «протоктист»
используется именно потому, что термин
«протист» означает одиночную клетку.
Вместо этого можно выделить более
ограниченное царство протпистов, оставив
водоросли в царстве растений, а ди-
плоидные водные плесени-в царстве гри-
бов. Эта более традиционная схема откры-
то признает полифилетичность царств рас-
тений и грибов. Что предпочесть-более
ограниченное царство протестов или более
широкое царство протоктистов-дело вку-
са.
В классификации современных форм
жизни, приведенной в Приложении, имеет-
ся около сотни фундаментально различаю-
щихся планов строения тела или схем ме-
таболизма, представленных ныне живущи-
ми типами. По оценке палеонтологов, воз-
можно, к ним следует прибавить еще три
или четыре типа, которые полностью вы-
мерли (например, археоциатиды и хитино-
зои). Поразительно, что хотя ни одного из
видов, существовавших 500 млн. лет назад,
нет сегодня в живых, примерно в то же
время уже появились почти все типы, ко-
торые мы находим сейчас. Почему? Что
лежит в основе этой нестабильности видов
в сочетании с исключительной консерва-
тивностью типов? Какова бы ни была при-
чина, можно предположить, что быстрое
обновление низших таксонов и консерва-
тизм высших имеют место и в мире ми-
кробов. Комплексы признаков, определяю-
щих типы, сохраняются и служат основой
для построения филогенетических схем
и реконструкции ранней истории жизни.
ГЛАВА 3
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
Прямая филиация
Классическая точка зрения логично признавала, что все важнейшие эукариоти-
ческие органеллы образовались путем дифференциации вещества самой протоэу-
кариотической клетки, т. е. аутогенно.
Ф. Тэйлор, 1976 [933]
Традиционный взгляд на происхожде-
ние и эволюцию эукариотических клеток
заключается в том, что все живые орга-
низмы произошли прямым путем от един-
ственной предковой популяции в результа-
те накопления разного рода мутаций под
действием естественного отбора. Сторон-
ники этой идеи полагают, что точечные
мутации, дупликации, делеции и другие
наследственные изменения, как известно,
игравшие роль в эволюции животных
и растений, ответственны и за дифференци-
ровку эукариотических клеток из прока-
риотических. Можно указать ряд совре-
менных защитников такой прямой филиа-
ции, т.е. представления о несимбиотиче-
ском происхождении клеток [17, 139, 249,
769, 933, 978].
В отношении растений гипотеза прямой
филиации опирается на внушительную со-
вокупность данных. Такие формы, как
представители современного рода зеленых
водорослей Klebsormidium, возможно,
являются сравнительно мало изменивши-
мися потомками родоначальников всех
растений [727]. Многие особенности этих
водорослей наводят на мысль, что они
и растения имеют общего предка в со-
ответствии со схемой филогении, представ-
ленной на рис. 3.1.
Филогения животных сложнее, но кон-
цепция прямой филиации, вероятно, прило-
жима также и к их путям эволюции. Губки
с их особым несовершенным типом много-
клеточное™, очевидно, произошли от про-
тестов независимо от остальных групп жи-
вотных. На электронно-микроскопическом
уровне определенные воротничковые про-
тисты и родственные им колониальные
формы, которые зоологи называют хоано-
флагеллятами, а ботаники - краспедомона-
дами, обнаруживают поразительное сход-
ство с некоторыми клетками губок, и это
позволяет предполагать, что губки про-
изошли от таких протестов. Однако до сих
пор не найдено ни одной группы простей-
ших, которые были бы с очевидностью
близки к таким примитивнейшим много-
клеточным животным, как плакозои
Trichoplax. Недавно Э. Хэнсон [379] вновь
проанализировал вопрос о происхождении
животных от протестов. Он предлагает
превосходные критерии для оценки каче-
ства данных, используемых в эволюцион-
ном анализе, и предпочитает взгляд, со-
гласно которому путь происхождения на-
стоящих многоклеточных животных
(Eumetazoa) проходил через инфузорий
и плоских червей, обладавших псевдоцело-
мом. Однако он все же вынужден при-
знать, что вопрос о том, какие именно про-
тисты были предками настоящих много-
клеточных, еще не может быть решен.
В любом случае зоологи согласятся с тем,
что схема прямой филиации вроде пред-
ставленной на рис. 3.2, основанная на из-
учении ископаемых и ныне живущих орга-
низмов, в общих чертах верна.
Итак, по крайней мере для животных
и растений гипотеза, по которой сложные
эукариотические организмы развились из
более просто устроенных эукариот путем
накопления отдельных мутаций под дей-
ствием естественного отбора, вполне пра-
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
45
Кайнозой
Мезозой
Палеозой
Цветковые растения
Рис. 3.1. Филогения типов растений.
вомерна, хотя, вероятно, в ней преувеличе-
на роль случайности как прямого источни-
ка наследственной изменчивости. В проис-
хождении новых и более сложных функций
дупликации могли иметь большее значе-
ние, чем случайные точечные мутации, со-
стоящие в замене одного или нескольких
нуклеотидов. Произведенные недавно срав-
нения аминокислотных последовательно-
стей в белках организмов с хорошо уста-
новленным путем эволюционной истории
подтвердили тот принцип, что эволю-
ционные новшества опираются на сохране-
ние высокосовершенных благоприятных ге-
нов [835]. Белки, не имеющие общих
функциональных черт, оказываются явно
родственными друг другу по аминокислот-
ной последовательности. Дупликация ге-
нов, т.е. удвоение длинных нуклеотидных
последовательностей, сопровождалась диф-
ференциацией функций генных продуктов.
Итак, новые организмы с повышенной
способностью контролировать свою среду
обитания развивались больше благодаря
сохранению, дупликации и рекомбинации
высокоадаптированных генов, чем путем
приобретения новых свойств в результате
простых, случайных точечных мутаций.
Однако точечные мутации в условиях есте-
ственного отбора отшлифовывали непред-
виденно дуплицируемый генетический ма-
териал так, что создавались хорошо адап-
тированные геномы. Такие геномы дей-
ствительно эволюционируют путем пря-
мой филиации.
Однако я полагаю, что гипотеза пря-
мой филиации не позволяет объяснить
происхождение эукариот от прокариот.
Как в истории ископаемых форм, так и ме-
жду ныне живущими организмами имеется
громадная брешь. Например, хиатус между
неспособными к митозу цианобактериями
и такими формами с вполне развитым ми-
тозом, как красные водоросли, трудно по-
нять с позиций прямой филиации, но он
естественно вытекает из симбиотической
46
ГЛАВА 2
Дофанерозой Палеозой Мезозой Кайнозой
Рис. 3.2. Филогения типов животных.
CHAETOGNATHA
P060N0PH0RA
ECHINODERMATA
Arachnlda
Й
ftivalvia
NEMATOMORPHA
MESOZOA
CTENOPHORA
_ GNATHOSTOMUL1DA
PLATYHELMINTHES
_______NEMERTINA
Urochordata
Uochordata ~
PRIAPUL1DA 4.
SIPUNCULA
дай
fi.
ECHIURA
BRACH1OPODA
ECTOPROCTA
PHORONIDA
PENTASTOMA
ft TARDIGRADA________
ANNELIDA
ONYCHOPHORA
My ri apo da
Crustacea
Polyplacophora___ —
Cephalopoda
Gastropoda
ACANTHOCEPHALA______________
ENTOPROCTA
ROTIFERA
w s A GASTROTRICHA
«1---------------
KINORHYNCHA
NEMATODA
CNIDARIA
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
47
Рис. 3.3. Сопоставление филогений, соответствующих теории прямой филиации (А)
и теории симбиоза (Б).
теории. На рис. 3.3 теории прямой филиа-
ции и симбиоза противопоставлены друг
другу. В табл. 3.1 представлены различия
между этими концепциями. Критически об-
суждая теорию симбиоза, Ф. Тэйлор [932]
отверг симбиоз как источник возникнове-
ния ундулиподиальной подвижности и оха-
рактеризовал эту идею как “SET” («ком-
плекс»), но мы продолжаем пользоваться
этим сокращением1.
И теория прямой филиации, и теория
симбиоза приводят к одинаковым филоге-
ниям для бактерий, животных и растений.
Согласно им обеим, все организмы на Зе-
мле произошли от биохимически одно-
1 В подлиннике непереводимая игра слов:
set может означать «комплекс», нечто не вполне
нормальное; в то же время это аббревиатура
слов Serial Endosymbiotic Theory (теория после-
довательных симбиозов).- Прим, перев.
типных бактериальных предков, а расте-
ниям и животным дали начало эукариоти-
ческие микробы. Однако эти теории пол-
ностью расходятся в представлениях
о процессе перехода от прокариот к эука-
риотическим клеткам. Теоретики прямой
филиации расходятся между собой в дета-
лях и в степени разработанности своих
схем [79, 139, 249, 484, 755, 769, 933]. Одна-
ко все они согласны в том, что фотосинте-
зирующие бактерии дали начало водорос-
лям и в конце концов растениям,
а некоторые водоросли утратили свои пла-
стиды и превратились в предков грибов
и животных. Они согласны также в том,
что пластиды и другие органеллы эука-
риот, включая ядро, сформировались пу-
тем дифференциации (компартментализа-
ции) внутри самих клеток. Все они под-
писываются под тем, что я называю бота-
ническим мифом.
48
ГЛАВА 3
Таблица 3.1. Различия между положениями теории прямой филиации
и симбиотической теории
Теория прямой филиации Теория последовательных эндосимбиозов
Главная дихотомия: животные-растения Главная дихотомия: прокариоты-эукариоты
Фотосинтезирующие эукариоты (водоросли и зеленые растения) произошли от фотосин- тезирующих прокариот (сине-зеленых во- дорослей или гипотетических праводорос- лей) Фотосинтезирующие эукариоты (ядросодержащие водоросли и растения) и нефотосинтезирующие эукариоты (животные, грибы, простейшие) про- изошли от общих гетеротрофных предков (аме- бофлагеллят)
Растения и их фотосинтетические системы в докембрии эволюционировали монофи- летически Эволюция фотосинтеза в архее1 была монофиле- тической у бактерий (включая циано- и хло- роксибактерий); фотосинтезирующие протисты возникли внезапно, когда их гетеротрофные про- тисты-предки вступили в симбиоз с фотосинте- зирующими прокариотами (протопластидами)
Животные и грибы произошли от автотро- фов, утративших пластиды Животные и большинство водорослей и грибов произошли непосредственно от гетеротрофных протистов
Митохондрии дифференцировались внутри- клеточно у (фотосинтезирующих) праводо- рослей Митохондрии уже были у гетеротрофных про- тистов, когда последние в результате симбиоза приобрели пластиды. Протомитохондрии были ранее приобретены симбиотическим путем
У праводорослей внутриклеточно дифферен- цировались ундулиподии, митотический ап- парат и все прочие эукариотические ор- ганеллы Митоз выработался у гетеротрофных эукариоти- ческих протистов путем дифференциации унду- липодиальной системы
Все организмы произошли монофилетически от предков-прокариот путем накопления одиночных мутаций Прокариоты произошли от ранних прокариоти- ческих предков путем ряда одиночных мутацион- ных событий; эукариоты тоже произошли от эукариотических предков благодаря одиночным мутационным событиям; эукариотические же предки произошли от прокариот в результате серии симбиозов
Следствия
Согласно теории, должны существовать пра- водоросли; трудно связать эту теорию с ископаемой летописью и построить со- ответствующую филогению Теория объясняет биохимические пути и их избы- точность у органелл. Она позволяет построить последовательную филогению, объясняющую «биологический разрыв» между временами проте- розоя и фанерозоя* Теория предсказывает, что у органелл должны сохраняться остатки систем репликации
Использованная геохронология представлена в табл. 4.2
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ 49
Ботанический миф
Все организмы, более высокоразвитые, чем Schizophyta (бактерии) и Rhodophyta
(красные водоросли), вероятно, в конечном счете произошли от примитивных
во до рослей-
p. Клейн, А. Кронкв и ст, 1967 [484]
Со времен Жюссье «низшие растения»
называют таллофитами, а «высшие» —
бриофитами и трахеофитами. Согласно
ботаническому мифу, общие предки фото-
синтезирующих бактерий и сине-зеленых
водорослей (цианобактерий) путем прямой
филиации дали начало эукариотическим
водорослям, в том числе морским. Каковы
бы ни были детали той или иной идеи, ос-
нованной на прямой филиации, прямая
эволюционная связь между фотосинтези-
рующими прокариотами и фотосинтези-
рующими эукариотами концептуально не-
обходима. Группы организмов, филогению
которых в наибольшей мере затрагивает
концепция прямой филиации, оказались
в области ботаники-это бактерии, водо-
росли, грибы, растения. Те немногие, что
относятся к сфере зоологии,-фотосинтези-
рующие жгутиковые и родственные им
нефотосинтезирующие
простейшие-составляют лишь ничтожную
долю объектов, исследуемых зоологами,
которые поэтому и не особенно вникали
в проблему ранних стадий эволюции.
С другой стороны, на роль предков водо-
рослей выдающимися ботаниками были
предложены разные организмы [79, 248,
311]. Было построено много различных
частных филогений, особенно Р. Клейном
и А. Кронквистом [484], хотя в этих по-
строениях редко учитывался фактор вре-
мени. Гипотетические организмы, которые
могли бы быть связующим звеном между
цианобактериями и зелеными водоросля-
ми, были названы родоначальными фито-
монадами (ancestral phytomonads) или пра-
водорослями (Uralgae). Некоторые авторы
[484] утверждали, что подходящими кан-
дидатами на роль праводорослей могут
быть эукариоты Cyanidium и Cyanophora,
сходные по своим пигментным системам
с цианобактериями. Но по крайней мере
Cyanophora, вероятно, представляет собой
аномальный симбиотический комплекс
криптомонады с цианобактериями [967],
a Cyan idium- это, возможно, весьма специа-
лизированная красная водоросль, приспо-
собившаяся к жизни в горячих кислых во-
дах [142]. По существу, поиски праводо-
росли привели к тому, что признание
фундаментального разрыва между циано-
бактериями и всеми эукариотическими во-
дорослями лишь укрепилось.
Поскольку идея право доросли была вы-
двинута для того, чтобы найти связь ме-
жду цианобактериями и водорослями, спо-
собными к митозу, то предполагалось, что
данные о происхождении большинства спе-
цифических органелл эукариот (например,
пластид, митохондрий и митотического ве-
ретена) могут быть найдены при изучении
таллофитов. Ранние цитологи вскоре обна-
ружили, что клетки многих водорослей де-
лятся типичным митозом, но продолжали
искать более примитивные системы кле-
точного деления у микроскопических форм
жизни. Поскольку они полагали, что одно-
клеточные водоросли дали начало расте-
ниям, а также, путем утраты фотосинте-
за,-грибам и животным, то они ожидали
найти у водорослей свидетельства перехо-
дов от примитивной формы деления
к сложным формам митоза и мейоза, ти-
пичным для растений. Микроскописты на-
чала 20-го века изучили ядерные «фигуры
деления» у множества самых различных
водорослей, простейших и грибов; однако
их наблюдения так и не сложились в ка-
кую-либо легко интерпретируемую схему
[1025].
У таллофитов не было обнаружено
промежуточных форм между немитотиче-
ским состоянием цианобактерий и вполне
развитым типичным митозом зеленых во-
дорослей и растений. Исследования приве-
ли скорее к внутренне согласованным, но
обескураживающим результатам. Оказа-
50
ГЛАВА 3
лось, что митоз глубоко дуалистичен (см.
гл. 9); митотический аппарат (т.е. не окра-
шивающийся по Фёльгену «ахромати-
новый аппарат»-вероятно, центриоли и
т. д.) способен двигаться независимо от
собственно хромосом. Кроме того, многие
водоросли и простейшие не имеют ни ми-
тоза, ни генетической системы, сходной
с таковой животных и растений. Например,
было найдено, что инфузории (к которым
относятся Paramecium, Stentor, Euplotes
и Tetrahymena) имеют особую генетиче-
скую систему с ядрами двух типов, причем
клетки нередко многоядерные. Один тип
ядер - макронуклеусы, а другой - намного
меньшие микронуклеусы [64, 356, 889]
(рис. 3.4). Микронуклеусы физиологически
несущественны; однако они хранят копии
генов, а при половом процессе претерпе-
вают мейоз. Физиологически необходимые
макронуклеусы служат местом транскрип-
ции РНК и таким образом управляют фи-
зиологией клетки. Еще более неожиданное
поведение ядер было обнаружено в других
группах, например у динофлагеллят-эука-
риотических планктонных морских орга-
низмов, к которым относятся как фотосин-
тезирующие, содержащие пластиды водо-
рослеподобные формы, так и формы, ли-
шенные пластид и напоминающие простей-
ших [238, 781, 893, 895, 934]. Хромосо-
мы динофлагеллят не спирализуются, но
остаются темноокрашивающимися (кон-
денсированными) на протяжении всего кле-
точного цикла. В целом электронно-микро-
скопические, генетические и молекулярно-
биологические исследования за период
с начала 60-х годов до настоящего времени
подтвердили, что у протоктистов встре-
чаются необычные митотические и по-
ловые процессы, но что с наличием или
цветом пластид не удается связать ника-
кую примитивность или направленность
к типичному митозу, свойственному жи-
вотным и растениям.
Одна из трудностей при выяснении от-
ношений между цианобактериями и эука-
риотическими водорослями связана с от-
сутствием данных о происхождении унду-
липодий: не было найдено никаких проме-
жуточных звеньев между цианобактериями,
у которых никогда не бывает ундулиподий,
и множеством водорослей, которые их
имеют. Другая проблема-полное отсут-
ствие полового процесса у цианобактерий:
между бесполыми цианобактериями и во-
дорослями, большинству которых свой-
ствен половой процесс, не оказалось ника-
ких промежуточных форм. После того как
в 1963 г. вошла в обиход фиксация глута-
ральдегидом для электронно-микроскопи-
ческих исследований, выявилась неожидан-
ная взаимосвязь между ундулиподиями
и митозом (рис. 3.5 и гл. 9). Обнаружилось,
что большинство водорослей имеют унду-
липодии на какой-либо стадии жизненного
цикла. Подвижные структуры у водорос-
лей, простейших, животных и растений
оказались одинаковыми: все они состоят
из микротрубочек диаметром 0,024 мкм,
расположенных на поперечном разрезе по
типу 9 + 2 или же по несколько иному, но
явно родственному типу. Кроме того, вы-
яснилось, что митотическое веретено даже
у грибов, у которых нет ундулиподий, со-
стоит из белковых микротрубочек того же
диаметра, что и в увдулиподиях. Данные
электронной микроскопии и биохимии бел-
Рис. 3.4. Необычные ядра протистов. ГЕ. W. Daniels, Argonne Nat. Lab.] 1 А. Макро-
и микронуклеусы брюхоресничной инфузории Paraurostyla weissei. М - макронуклеус;
ш-микронуклеус; ch - хроматиновые тельца; mb-мембранеллы (упорядоченные
группы ресничек). Окраска протарголом, световой микроскоп, х 2000. Б. Ядро
Pelomyxa palustris. Ядра этой гигантской многоядерной амебы делятся прямым деле-
нием: ни разу не были обнаружены хромосомы, кинетохоры, центриоли, звезды или
митотическое веретено. Этот организм, единственный представитель типа Caryoblastea
(см. Приложение) - наиболее примитивный из известных эукариот. У него нет также
митохондрий. N-ядро; В - эндосимбиотические бактерии; PN - околоядерные бакте-
рии. Электронная микрофотография, х 4900.
В квадратных скобках указываются лица, любезно предоставившие данный
иллюстративный материал.
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
51
52
ГЛАВА 3
Рис. 3.5. Взаимоотношения кинетосом, центриолей и митотического веретена у гипер-
мастигот. A. Pseudotrichonympha на ранней стадии деления. Видно, что весь передний
(ростральный) конец клетки участвует в формировании веретена, ос-наружный кор-
текс; ic-внутренний кортекс; iw-внутренняя стенка, которую Л. Кливлэнд [160] счи-
тает «длинной центриолью». Эти стенки функционируют как митотические полюса,
между которыми строятся микротрубочки (t) веретена. Ряды кинетосом (к) распола-
гаются вдоль наружной стенки (ow). х 7300 [364]. Б. Несколько более поздняя стадия
деления родственного вида Barbulanympha. Видно, почему Кливлэнд назвал внутрен-
нюю стенку «длинной центриолью». Проксимальные части этих стенок можно считать
центрами организации микротрубочек (ЦМ). ub-пучки ундулиподий; n-ядро; s-ми-
тотическое веретено; iw- внутренняя стенка. Световая микрофотография, х 450. (Из
фильма, снятого Л. Кливлэндом, см. [364].)
ков указывали на теснейшую гомологию
между ундулиподиями и микротрубочками
всех эукариот.
Хотя грибы и цветковые растения пол-
ностью лишены ундулиподий, им свой-
ственны митоз и мейоз, для которых необ-
ходимы веретена, состоящие из микротру-
бочек. Ботаники обычно полагали, что
ундулиподии были утрачены грибами и
растениями в ходе эволюции, предположи-
тельно в связи с переходом от водного
образа жизни к наземному. Часто обсу-
ждался вопрос о том, первично или вто-
рично отсутствие ундулиподий у красных
водорослей, которые почти все-морские
организмы, но убедительных данных в по-
льзу того или другого взгляда представле-
но не было. Итак, имеется общее согласие
в том, что все многоклеточные организмы,
обладающие микротрубочками, происхо-
дят от эукариотических микроорганизмов
с ундулиподиями, но никто не знает, от ка-
кой именно группы протистов. Однако ни-
какие водоросли (да и никакие другие ор-
ганизмы) не содержат структур, которые
можно было бы истолковать как этапы
эволюционного развития ундулиподий. Ка-
кое селективное давление вело к выработке
этих образований, построенных на основе
микротрубочек ? Всегда предполагалось,
что происхождение ресничек и других ун-
дулиподиальных структур связано с пре-
имуществом подвижности. Подвижность,
когда бы она ни появлялась в эволюции,
была ассоциирована с поиском или пресле-
дованием добычи, т. е. с гетеротрофным
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
53
питанием. Гепарды, парамеции и жгутико-
носные бактерии подвижны благодаря ана-
логичным органам-ногам, ундулиподиям,
жгутикам, поскольку им необходимо разы-
скивать пищу. С другой стороны, деревья,
мхи и водоросли-это автотрофы, завися-
щие от воды, минеральных веществ, со-
лнечного света и атмосферной двуокиси
углерода. Фотоавтотрофы чаще всего по-
стоянно живут на одном месте; если не
считать скользящих цианобактерий, разве
только очень немногие подвижные орга-
низмы являются облигатными фотоавто-
трофами. Как же в таком случае можно
строить гипотезы о появлении ундулипо-
дий у автотрофных цианобактерий? Если
они дали начало праводорослям, предкам
жгутиконосных водорослей, то почему
у них всех отсутствуют митоз, ундулипо-
дии и остальные признаки эукариот?
Подкреплением ботанического мифа
служили древность и сложность фотосин-
теза, а также тот факт, что у многих орга-
низмов (например, у бактерий, эвгленовых,
паразитических растений) как в природе,
так и в лаборатории наблюдалась утрата
фотосинтеза в результате мутаций. По-
скольку фотосинтез-анаэробный процесс,
обеспечивающий в конечном счете суще-
ствование всех организмов, то он должен
был развиться очень рано в истории жизни
на нашей планете, еще до того как возник
митоз, для которого необходим кислород.
В фотосинтезе участвует множество пиг-
ментов, липидов и ферментов, упорядочен-
но расположенных в очень сложных мем-
бранах. При этом детали фотосинтетиче-
ских механизмов у водорослей и растений,
с одной стороны, и у цианобактерий, с дру-
гой - поразительно сходны. Все эти орга-
низмы освобождают газообразный кисло-
род из воды, которая служит источником
атомов водорода, используемых для вос-
становления СО2 до органических веществ
клетки. Всем им свойственны в точности
одинаковые этапы этого восстановления
с использованием рибулозобисфосфат-кар-
боксилазы [61]. Этот тонкий механизм фо-
тосинтеза во всей своей сложности не мог
выработаться независимо в обособленных
эволюционных линиях. Поэтому фотосин-
тетические аппараты цианобактерий, водо-
рослей и растений должны быть гомоло-
гичны. Однако клеточное деление у циано-
бактерий всегда происходит по бакте-
риальному типу. В 50-х годах появились
сообщения о том, будто некоторые циано-
бактерии делятся путем митоза, но они
оказались ошибочными. Ни у одного из
тысяч широко распространенных, крайне
разнообразных видов цианобактерий еще
не было найдено ядерных мембран, хромо-
сом, митохондрий, ундулиподий или ми-
кротрубочек веретена. По своей структуре,
химическому составу, генетической органи-
зации и отсутствию митоза сине-зеленые
водоросли, несомненно, относятся к бакте-
риям [16, 264, 266] (рис. 3.6-3.9).
Исследования зашли в тупик. Чем
больше искали морфологических и физио-
логических переходов от бесполых циано-
бактерий к фотосинтезирующим эукарио-
там, особенно к красным и зеленым
водорослям, способным к половому раз-
множению, тем надежнее устанавливалось
наличие разрыва между этими двумя груп-
пами. Особенно разительными оказались
различия в клеточном делении между циа-
нобактериями и всеми растениями, вклю-
чая водоросли (рис. 3.9 и 3.10; табл. 3.2).
В то же время гипотеза праводоросли по-
родила литературу по классификации и
возможным эволюционным отношениям
между таллофитами, настолько обременен-
ную противоречиями и путаницей, что
большинство биологов ее игнорировало.
Классификация водорослей на уровне выс-
ших таксонов (классов или порядков) тра-
диционно основывалась на различном цве-
те пигментов в их фотосинтезирующих
пластидах. Разные специалисты надеялись
найти предков растений среди зеленых во-
дорослей, красных водорослей, золотисто-
желтых водорослей или же среди еще не
открытых, гипотетических праводорос-
левых организмов. Между тем некоторые
натуралисты обратили внимание на то, что
надежным таксономическим критерием,
хорошо коррелирующим с другими биоло-
гическими аспектами, нередко служит по-
ложение жгутика (ундулиподии) у водорос-
ли или ее гамет [175, 583]. Почему?
В главе 9 мы увидим, что строение нефо-
тосинтезирующей части клетки, и особенно
54
ГЛАВА 3
Рис. 3.6. Структура прокариотических клеток. [David Chase, Sepelveda Veterans
Administration Hospital.] А. Неидентифицированная, сходная c Thiocapsa фотосинтези-
рующая пурпурная бактерия из микробных скоплений лагуны Фигероа (Нижняя Кали-
форния, Мексика) [611]. t-тилакоиды; s-капсула; п-нуклеоид; cw-клеточная стенка;
г-рибосомы; р-плазматическая мембрана, х 27 500. Б. Неидентифицированный нит-
чатый прокариотический организм из той же лагуны, х 23 000.
расположение ундулиподий (поскольку оно
связано с картиной митоза и половым про-
цессом), позволяет гораздо лучше судить
о связях водорослей с другими протеста-
ми, нежели цвет пластид.
На протяжении полувека казалось
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
55
Рис. 3.7. Структура прокариотиче-
ских клеток. A. Mycoplasma
gallisepticum-гетеротрофная бакте-
рия, не имеющая клеточной стенки,
п - нуклеоид; pm - плазматическая
мембрана. х 75 000. [Jack
Maniloff.] Б. Живые клетки
Sa prospira albida - флексибактерии,
очень напоминающей цианобак-
терию Spirulina. Фазовый кон-
траст, х 600. [Ralph A. Lewin.]
В. Escherichia coli- кишечная бакте-
рия, о которой известно больше,
чем о каком-либо другом живом
организме, f-перитрихальные жгу-
тики; cw-клеточная стенка; р-бо-
лее короткие и тонкие пили, воз-
можно играющие роль в прикреп-
лении клетки к субстрату. Особые
пили используются также в поло-
вом процессе, при котором совме-
стимые бактерии узнают друг дру-
га и «мужская» особь переносит
гены в «женскую». Электронная
микрофотография; негативное
окрашивание, х 11 150. [David
Chase.]
чрезвычайно правдоподобным, что эука-
риотические водоросли произошли от циа-
нобактерий. Этот ботанический миф при-
вел к имплицитным предположениям, ко-
торые многие годы служили как стимулом
для исследований, так и системой коорди-
нат, в которой производилась (а в неко-
торых кругах и до сих пор производится)
оценка получаемых результатов. Напри-
мер, согласно этому мифу, как ундулипо-
дии, так и митоз должны были развиться
у водорослей-где-то между цианобакте-
риями и зелеными водорослями. Поэтому
вариации митоза у гетеротрофов, напри-
мер у паразитических простейших, следо-
вало бы рассматривать как не относящиеся
к делу, поскольку эти организмы находят-
ся «в стороне от главного пути» эволюции
цианобактерий, приведшей к растениям.
Но если цианобактерии были предками во-
56
ГЛАВА 3
Рис. 3.8. Структура эукариоти-
ческих клеток. [David Chase.]
А. Плазматическая клетка из
выстилки кишечника крысы
(lamina propria слизистой).
N-ядро; с-хроматин; ег-эндо-
плазматический ретикулум;
G-тельце Гольджи; М-мито-
хондрия; г-рибосомы; g-гра-
нулы; р - плазматическая мем-
брана; L-лизосомы; NM-
ядерная мембрана. Электронная
микрофотография, х 2700. Б.
Протоктист Giardia muris, тип
Zoomastigina, класс Diplomo-
nadida) из тонкой кишки
крысы. Эти эукариоты при-
крепляются к стенке кишечника
своих хозяев - млекопитающих
(включая человека)-с помощью
адгезивных дисков (ad). Они
имеют по два ядра (показано
одно, п), 8 ундулиподий (и),
в основании которых находятся
кинетосомы (к) и пузырьки (v)
неизвестного назначения, но нет
митохондрий. NM-ядерная
мембрана, х 8750.
дорослей, то в какой популяции организ-
мов появились ундулиподии и близкая
к ним структура митотического веретена?
Едва ли можно ожидать, что этот велико-
лепный механизм для распределения хро-
мосом был утрачен после того, как возник.
Если же цианобактерии не были предками
водорослей-эукариот, то почему так сходен
их фотосинтез? На какие организмы и
в каких условиях действовало давление от-
бора, которое привело к зарождению как
фотоавтотрофного питания, так и ундули-
подиальной подвижности? Когда?
Утверждение, что все связующие звенья
между цианобактериями и эукариотически-
ми водорослями вымерли, не оставив ни
ископаемых следов, ни живых реликтов
[249, 484], становилось все менее убеди-
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
57
Рис. 3.9. Клеточное деление у прокариот. А. Хемоавтотрофная бактерия Nitrocystis
oceanus. М - внутриклеточные мембраны, предполагаемое местонахождение мультифер-
ментной системы транспорта электронов для окисления аммиака; С-клеточная стен-
ка; г-рибосомы; d-нити ДНК. х 57 000. [S. Watson, Woods Hole Oceanogr. Inst.]
Б. Mycoplasma gallisepticum- гетеротрофная бактерия, лишенная клеточной стенки, х
х 75 000. [Jack Maniloff, Univ, of Rochester.] В. Тонкий срез цианобактерии Anacystis
nidulans. с - новообразующаяся клеточная стенка; s-капсула; t-тилакоиды; г-рибо-
сомы. х 75 000. [М. М. Allen, Wellesley College.]
тельным по мере поступления новых
данных о живых микробах и об окаменело-
стях. Эти новые данные привели к пере-
смотру идеи о возникновении эукариот пу-
тем прямой филиации. Главные промежу-
точные формы между фотосинтезирующи-
ми прокариотами и эукариотами не вы-
мерли бесследно, как того требует ботани-
ческий миф; тезис этой книги заключается
в том, что они никогда не существовали.
58
ГЛАВА 3
Рис. 3.10. Клеточное деление у эука-
риот. А. Хромосомы Haplopappus
gracilis, растения из сем. Compositae.
Диплоидная клетка корня; 2N = 4.
К-кинетохор; s-сателлитный гете-
рохроматиновый участок. Митотиче-
ского веретена не видно. Одна пара
гомологов -метацентрики (ш), дру-
гая-субметацентрики (sm). Световая
микрофотография, увел. х 900.
[G. Jackson, Texas Tech, Lubbock,
Texas.] Б. Митоз в кончике корня
лука (Allium sativa). Слева направо:
интерфаза, профаза, ранняя метафа-
за, метафаза, анафаза, телофаза;
с-хромосомы; п-ядрышко; s-ми-
тотическое веретено; р-фрагмо-
пласт (клеточная пластинка-струк-
тура, предшествующая клеточной
стенке); ch-хроматин. Окрашенный
препарат, световая микрофотогра-
фия, х 800. В. Культивируемая тка-
невая клетка млекопитающего в ана-
фазе. С-хромосомы; с-центриоль;
mt-микротрубочки митотического
веретена, х 8000. [443].
Биологические системы удивительно кон-
сервативны, и данные о промежуточных
формах между двумя фундаментальными
типами клетки имеются в изобилии; их
нужно только привести в соответствие
с новыми парадигмами, например
с теорией последовательных эндосимбио-
зов. Согласно этой теории, цианобакте-
рии - действительно родоначальники, но
только пластид, а не остальных частей эу-
кариотической клетки и уж во всяком слу-
чае не ее ядра.
И все же в вопросе о происхождении
ядра гипотеза прямой филиации и теория
симбиоза совместимы. Как указал Тэйлор
[934], представления о прямой филиации
и о роли симбиоза не исключают друг дру-
га. Мыслимые модификации крайнего ва-
рианта теории симбиоза включают, напри-
мер, идею о симбиотическом происхожде-
нии пластид, но не митохондрий, или
о симбиотическом происхождении пластид
и митохондрий, но не ундулиподий. Сто-
ронники прямой филиации Хартман [382]
и Пиккет-Хипс [726] выдвинули даже пред-
положение о происхождении ядра путем
симбиоза. Тэйлор [932, 934] рассмотрел
еще и иные варианты этой концепции.
В любом случае эти альтернативные тео-
рии происхождения эукариот приводят ко
многим выводам, которые, как мы в под-
робностях увидим в последующих главах,
доступны для экспериментального анализа.
Взаимоисключающие парадигмы допу-
скают проверку, и в некоторой мере они
уже были проверены. Здесь достаточно
привести один пример. Если фотосинтези-
рующие прокариоты-это предки пластид,
но не нуклеоцитоплазмы фотосинтезирую-
щих эукариот, то между специфическими
белками современных прокариот и белка-
ми эукариотических пластид должна обна-
ружиться большая гомология (по амино-
кислотным последовательностям), чем ме-
жду белками пластид и другими белками
той же эукариотической клетки. Из идеи
прямой филиации выводится противопо-
ложное предсказание-о большей близости
пластид к собственным клеткам, чем к сво-
бодноживущим прокариотам. По этому
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
59
60
ГЛАВА 3
Таблица 3.2. Многоклеточность, репродукция, биохимические пути и клеточное деление в пяти
царствах. Обозначения: + вероятно, есть у всех представителей; вероятно, нет у всех пред-
ставителей; ± у одних представителей есть, у других нет
Монеры Протоктис- ты Грибы Животные Растения
Многоклеточность ± ± ± + +
8 OS-рибосомы — + + + +
Митоз: хромосомы, состоящие из ДНК и РНК ± + + +
Микротрубочки диаметром 0,024 мкм + + + +
Прямое присоединение хроматина к микротру- ± + + +
бочкам (центромеры)
Гистоны в хромосомах + + + +
Внутриядерное митотическое веретено ± +
Центриоли типа 9 -1- 0 в полюсах митоза + +
Кинетосомы типа 9-1-0 ± + ±
Зооспоры с ундулиподиями типа 9 + 2, спо- ± —
собные к прямому бесполому развитию
Фрагмопласт (клеточная пластинка) ± +
Фагоцитоз, пиноцитоз ± + +
Целлюлозные клеточные стенки ± +
Хитиновые клеточные стенки + +
Аппарат Гольджи, эндоплазматический ретику- + + +
лум
Мейоз ± + + +
Четырехспоровые мейотические тетрады ± + +
Синцитии ± +
Стабильный дикариоз ± +
Путь биосинтеза лизина через а-аминоадипино- + + +
вую кислоту
Путь биосинтеза лизина через диаминопиме- + + +
линовую кислоту
Смешанный поликетид/шикимовый путь + + +
Чередование диплоидного и гаплоидного по- + +
колений
Хлоро пласты + +
Митохондрии + + + +
1) О возможных исключениях см. гл. 9 и 10, а также [448].
пункту имеется много данных, и они гово-
рят в пользу отказа от ботанического ми-
фа (рис. 3.11, А). Точно так же, судя по го-
мологии нуклеотидных последовательно-
стей в рибосомных РНК, пластиды раз-
личных типов водорослей и растений более
родственны друг другу и свободноживу-
щим коккоидным цианобактериям, чем ци-
топлазме, в которой эти пластиды нахо-
дятся (рис. 3.11, Б и В). Пришло время
пересмотреть наше концептуальное снаря-
жение.
ФАКУЛЬТАТИВНО АЭРОБНЫЕ И
ФОТОСИНТЕЗИРУЮЩИЕ БАКТЕРИИ
Rhodomicrobium
vannielii
МИТОХОНДРИИ
Rhpdopseudomonas
palustris
Rhodospirillum rubrum
Neurospora
\ / Ginkgo
_УЛошадь/28
ПЛАСТИДЫ И ЦИАНОБАКТЕРИИ
(цитохромы в тилакоидах и
в системах транспорта
электронов)
45
Rhodopseud.
capsulata
Rhodopseud^___
sphaeroider"
.Rhodopseud:
\ viridis
Crithidia
/ Euglena
Spirulina
Paracoccus denitrificans
22,
Azotobacter
vinelandii
Pseudomonas
stutzeri s'
C551
C555
^Пластиды Euglena
Б9/
Plectonema
ЗО/Пластиды Porphyra
/ЧТ/^^-Ппасткды Maria
^^48
------------Пластиды Monochrysis
Chlorobium limicola
'C. thiosulfatophilum
Prosthecochloris
aestuarii
АЭРОБНЫЕ БАКТЕРИИ /
Pseudomonas mendocina
АНАЭРОБНЫЕ ФОТОСИНТЕЗИРУЮЩИЕ
БАКТЕРИИ
Предковый ген цитохрома с
Рис. 3.11. Филогении прокариот и органелл, основанные на гомологии макромолекул.
А. Филогения семейства генов цитохрома с. С, С2, С5 и т.д-различные типы цитохро-
ма. Длина ветвей пропорциональна числу точечных мутаций на 100 аминокислотных
остатков (числа указаны для наружных ветвей). (По [835].)
ПРОТОКТИСТЫ
Chlorella pyrenoidosa
РАСТЕНИЯ
Рожь
Pseudomonas tluorescens
Synechococcus
^\22
Хлоропласт Lemna
\ Escherichia
\bacterium , гпц .
25\tischeri / /
7V10 /
Torula
ГРИБЫ
saccharomyces
cerevisiae
Эукариотические
Рис. 3.11Б. Филогения
последовательностей
5S-PHK. У каждой ветви
указано число точечных
мутаций на 100 нуклеоти-
дов. Synechococcus - это
коккоидная цианобакте-
рия в культуре (№ 27 144
из Американской коллек-
ции типовых культур). Ее
называют также Anacystis
nidulans. Halobacterium
salinarium называют так-
же Н. cutirubrum. Видно,
что 5S-PHK хлоропла-
стов из Lemna (ряска,
цветковое растение) го-
раздо ближе к РНК кок-
---------27
МОНЕРЫ
Bacillus stearothermophilis
Bacillus megaterium
Clostridium pasteurianum
НУКлеоцитоплазматичеСКИе коидной цианобактерии
55" РНК (Synechococcus), нежели
к РНК из цитоплазмы зе-
леной водоросли Chlorella
или травянистого расте-
ния (ржи). (По [835].) По-
ка еще нет сведений о по-
следовательностях
митохондриальной
5S-PHK, но одна такая
последовательность рас-
тительного происхожде-
ния изучается. Митохонд-
Halobacterium salinarium
t
Предковая 5S-PHK
рии животных, по-види-
мому, полностью ли-
шены молекул 5S-PHK.
62
ГЛАВА 3
_i______L—
10 20
Цитоплазма эукариот (например,
Porphyridium, дрожжей,
Chlamydomonas^ млекопитающих)
Escherichia colt
Rhodopseudomonas sphaeroides
Bacillus subtilis
Процент гомологии
Рис. 3.11В. Филогения, основанная на гомологиях между молекулами 16S-PHK. Про-
цент гомологии подсчитан по каталогам последовательностей рибосомных РНК [92,
300]. [W.F. Doolittle.]
Дискредитированные теории клеточного
симбиоза
Эта книга, посвященная его светлости князю Монако, содержит живое изложение
ереси, по отношению к которой автор откровенно признается, что если бы несколько
лет назад ему довелось встретиться с ее провозглашением в начале какой-то
статьи, то он, вероятно, не продолжил бы чтения. Эта ересь состоит в том, что
все организмы, за исключением бактерий,-двойные, т. е. образованы путем ассоциа-
ции и «вложения» друг в друга («emboftement») двух различных типов созданий.
Внутри каждой клетки имеются партнеры-бактерии, которых автор называет
«симбиотами».
Вероятно, впервые научную идею
о том, что клеточные органеллы являются
продуктом наследственных симбиотиче-
ских ассоциаций, выдвинул в 1883 г.
А. Шимпер [816] (см. Вильсон [1025]). Ис-
следователей поразила картина деления
хлоропластов у зеленых водорослей и рас-
тений и сходство этих пластид со свобод-
ноживущими цианобактериями. Возникла
простая мысль, что хлоропласты произош-
ли в результате симбиоза. В 1909 г. Ме-
режковский [646] развил представление
о симбиотическом происхождении орга-
нелл; его концепция часто упоминается
в русской литературе, но англоязычные чи-
Nature, 1919 [25]. (Анонимный обзор работы
Портье 1918 г. [740])
татели всегда знакомились с его работой
лишь из вторых рук, по книге Э. Вильсона
[1025]. Книга Б. М. Козо-Полянского [496]
(см. [927]), который с энтузиазмом поддер-
живал идею о роли симбиоза в эволюции,
осталась совсем неизвестной за пределами
СССР. Теорию Р. Альтмана 1890-х годов
[20] о «биобластах» было очень трудно со-
отнести с детальными цитологическими
наблюдениями в то время, когда главное
внимание привлекали быстро расширяю-
щиеся сведения о роли ядра и его хромо-
сом в наследственности.
Уоллин, американский биолог, работав-
ший в медицинской школе Колорадского
ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ
63
университета, убежденно доказывал значе-
ние симбиоза в эволюции [995]. Примерно
так же, как до него Портье [740] \ Уоллин
предполагал, что деление маленьких телец
внутри растительных и животных клеток
(т. е. митохондрий; в то время их называли
хондриосомами, хондриоконтами и даже
пластидами) - это результат их бактериаль-
ного происхождения, хотя теперь они жи-
вут как симбионты внутри клеток своих
хозяев. Он ссылался на то, что по своему
внешнему виду, поведению и окрашивае-
мости митохондрии очень напоминают
бактерий. От внимания Уоллина не ус-
кользнула возможная роль таких симбио-
зов в происхождении новых сложных
групп организмов, в том числе видов и
в конечном счете высших таксонов. Одна-
ко его утверждения и игра воображения за-
ходили настолько дальше имевшихся фак-
тических данных, что биологи того време-
ни полностью ' отвергли его идеи, как
и теорию Портье. Его крах наступил, ког-
да он объявил, что ему удалось выделить
митохондрии из животных клеток и куль-
тивировать их в пробирках на искусствен-
ной среде. Критики обвинили его в крайне
небрежной технике экспериментов, и это,
несомненно, было правдой, так как выра-
щивать митохондрии вне клетки невоз-
можно даже при современных изощренных
методах. Для образования митохондрий
внутри клетки требуется множество раз-
личных макромолекул, значительная часть
которых синтезируется на рибосомах цито-
плазмы под контролем ядра [324]. Даже
некоторые белки митохондриальных мем-
бран еще не идентифицированы. Посколь-
ку условия, необходимые для роста и раз-
вития митохондрий, исключительно
сложны, еще далеко то время (если оно во-
обще наступит), когда митохондрии дей-
ствительно смогут расти in vitro.
Вероятно, важнейшим стимулом для
возвращения _ симбиотических теорий
к жизни были открытия поражающего
сходства между некоторыми органеллами
и симбионтами. Ультраструктурное сход-
ство между хлоропластами растений и сво-
1 Рецензия на книгу Портье была процити-
рована в начале этого раздела.
бодноживущих коккоидных цианобактерий
удивительно; особенно это касается их ну-
клеоидов-областей, содержащих ДНК. Та-
кие морфологические сравнения убедили
Риса и Плаута [782] в возможности того,
что пластиды произошли от цианобакте-
рий; ранее Рис отвергал эту идею на осно-
вании недостаточных данных. Дж. Ледер-
берг [535] в своей важной обзорной статье
отметил много черт сходства в поведении
известных симбионтов и клеточных орга-
нелл, особенно пластид водорослей. С. Ка-
ракашьяна [469] поразил факт генетиче-
ского контроля со стороны хозяина
Paramecium bursaria над эндосимбиотиче-
скими зелеными хлореллами, находящими-
ся в цитоплазме всех нормальных особей
этого вида [469]. Каракашьян и Зигель
[471] написали содержательную статью,
в которой отметили, что органеллы и ци-
клически передаваемые симбионты (т. е.
симбионты, проходящие весь свой жиз-
ненный цикл вместе с хозяином) с функ-
ционально-генетической точки зрения по
существу неразличимы.
Основа для сравнения органелл со сво-
бодноживущими микробами намного рас-
ширилась, когда дело дошло до анализа
эукариотических органелл и белоксинтези-
рующего аппарата бактерий на молекуляр-
ном уровне. В середине 1960-х годов мне
представилось полезным предположить
симбиотическое происхождение митохон-
дрий и пластид [793]; это привело к мысли
о том, что филогенетика протистов может
быть поставлена на экспериментальную
основу. Сходные мысли были высказаны,
но не получили развития, в работе Гоксёи-
ра [333].
В последние годы отмечается прогресс
в понимании важности и повсеместности
симбиотических ассоциаций, а также их
физиологии и генетики [172, 468, 608, 778].
Современные ассоциации могут служить
моделями механизмов происхождения, эво-
люции и функционирования клеток. Как
заметил Д. Смит, сторонники симбиотиче-
ских теорий еще не использовали в своих
интересах современную литературу по
симбиозу. Возможно, главы 7, 8, 10 и 11
настоящей книги несколько исправят поло-
жение.
64
ГЛАВА 3
Симбиотические теории то и дело воз-
никали и отвергались после открытия
в 19-м веке эукариотических органелл. Об-
суждая книгу Портье [740], скептически
настроенный анонимный обозреватель,
процитированный в начале этого раздела,
продолжает:
«Профессор Поль Портье утверждает, что
все организмы, исключая бактерий, обладают
двойственной природой [подобно лишайникам
с их партнерством гриба и водоросли]... Но ес-
ли все клетки таким образом двойственны, то
сразу возникает вопрос: почему до сих пор не
наблюдались повсеместно внутриклеточные
симбиотические бактерии? Ответ заключается
в том, что их видели часто, но интерпретирова-
ли всегда неверно. Это компоненты митохон-
дриального аппарата, те мельчайшие тельца (из-
вестные под многими названиями), которые
были описаны в клетках всех типов... Профес-
сору Портье хватает юмора процитировать па-
радокс, что теория не имеет ценности, если не
может быть показано, что она ложна. Мы без
колебаний предсказываем, что его теория до-
стигнет этой ценности - именно такой, какой он
ее представлял себе несколько лет назад. Мы
должны признать, что автор-весьма ловкий
спортсмен».
С 1919 г., когда появилась написанная
в резком тоне книга А. Люмьера «Миф
о симбионтах» [582], и до начала 70-х го-
дов эта манера с порога отвергать симбио-
тические теории была правилом в «обще-
стве благовоспитанных биологов» [1025].
Недавний беспрецедентный прогресс моле-
кулярной биологии повысил ценность та-
ких теорий, главным образом потому, что
теперь стало возможным доказать их пра-
вильность или ошибочность. Все основные
концепции, представленные в этой книге,
кроме одной (о бактериальном происхож-
дении ундулиподий), были выдвинуты дру-
гими авторами: симбиотическое происхо-
ждение органелл (Мережковский [646], По-
ртье [740], Уоллин [995], Ледерберг [535]);
роль симбиоза в возникновении эволю-
ционных новшеств (Уоллин, [995]); сопо-
ставление ранней эволюции клеток с иско-
паемыми находками из дофанерозоя (Барг-
хорн и Тайлер [51, 56]); неспособность
отдельного вида эволюционировать неза-
висимо от других видов (Рейнхеймер [772],
Уоллин [995]). Даже если во всем этом
мало нового, изменился характер рассмо-
трения вопроса. Теперь благодаря разви-
тию ультраструктурного анализа, химии
белков и нуклеиновых кислот, а также бла-
годаря техническим приемам и результа-
там современного генетического анализа
можно делать детальные предсказания на
основе концепции симбиоза или прямой
филиации. Таким образом, «спортивная
ловкость» (sportsmanship) Портье уступила
место эрудиции (scholarship), которая,
можно надеяться, избавит однажды ос-
меянную идею клеточного симбиоза от
поругания.
ГЛАВА 4
ДО КЛЕТОК
Геологический контекст
В геологии нет такой надежной хронологической шкалы, как та, которую
позволяет построить относительная степень изменения животных.
Ч. Лэпуорт, 1879 [527]
Геохронология - это измерение времени
и датирование событий на основе геологи-
ческой информации. В последние десятиле-
тия было достигнуто согласие относитель-
но возраста Земди, и современная геохро-
нология представила временную шкалу, на
которой мы можем расставлять события
биологической и даже микробиологической
эволюции. Здесь достаточно краткого вве-
дения в этот сложный предмет.
Каков возраст Земли? По общему мне-
нию Луна и Земля вместе с остальной
Солнечной системой сформировались из
солнечной туманности. Луна очень стара:
с помощью калий-аргонового, стронциево-
го, рубидиевого и свинцового методов да-
тирования установлено, что некоторые ее
породы имеют возраст более 4 млрд. лет.
Изучение лунных пород, полученных
в результате осуществления программы
«Аполлон», значительно прояснило ранний
период истории Солнечной системы. Как
полагают, Земля и Луна сформировались
как плотные тела приблизительно нынеш-
них размеров около 4600 млн. лет назад.
Оба тела подвергались интенсивной бом-
бардировке метеоритами с того момента,
когда они достигли современных размеров,
до момента отложения в первичных водах
Земли древнейших недислоцированных
осадочных пород, т. е. 3900 млн. лет назад.
Следы этой бомбардировки на поверхно-
сти молодой Земли были стерты после-
дующими процессами, но на Луне, Мерку-
рии и Марсе метеоритные кратеры ясно
видны. Нет оснований думать, что град
метеоритов, обрушившийся на соседние
планеты, каким-то образом обошел Землю
стороной. Древние шрамы, сохранившиеся
на этих планетах и на Луне, на Земле были
уничтожены исключительно активной де-
нудацией, а также горообразованием и
другими тектоническими процессами. Эро-
зию кратеров, образовавшихся при недав-
них столкновениях, можно наблюдать и се-
годня. Например, глубина огромного ме-
теоритного кратера между Уинслоу и
Флагстаффом в Аризоне, который образо-
вался около 25 тыс. лет назад, составляет
сейчас только половину первоначальной.
В осадочной геологии принято геохро-
нологическое подразделение толщ: можно
установить соответствие той или иной се-
рии осадочных слоев и фаций определенно-
му участку хронологической шкалы. Фа-
ции-это перемежающиеся массы осадоч-
ных пород внутри единого стратиграфиче-
ского подразделения, различные по лито-
логическим и палеонтологическим особен-
ностям. Выделяют следующие стратигра-
фические единицы (от больших к мень-
шим): надгруппу, группу, систему, серию,
ярус. Названия соответствующих вре-
менных интервалов (от больших к мень-
шим)-эон, эра, период, эпоха, век. Хотя
корреляция время-порода и соответ-
ствующая терминология остаются предме-
том дискуссий, особенно в отношении бо-
лее крупных единиц осадочных слоев
и временных интервалов, все же общепри-
нято называть самое крупное геохроноло-
гическое подразделение эоном. Продолжи-
тельность каждого эона более 600 млн.
лет. Фанерозой, самый последний и наибо-
лее изученный эон, начался примерно
600 млн. лет назад с кембрия - первого пе-
5-39
66
ГЛАВА 4
риода палеозойской эры (табл. 4.1). Для
самого раннего кембрия характерно массо-
вое появление трилобитов и других пред-
ставителей пяти или шести главных типов
животных, имеющих скелетные элементы.
Во многих музеях из всех эонов предста-
влен только фанерозой; более ранние эоны
объединяются под названием докембрия.
Я предпочитаю более логичный термин
Клауда [165]-дофанерозой.
Непрерывные осадочные разрезы, в ко-
торых была бы целиком представлена хотя
бы эра, крайне редки; один из немногих
примеров - палеозойские отложения Боль-
шого Каньона в Аризоне.
На Земле не известно ни одного места,
где был бы представлен целый эон в виде
полной непрерывной серии отложений1.
Поэтому хронологию эона приходится
конструировать по смешанным геологиче-
ским данным, в частности по осадочным
отложениям различного возраста (опреде-
ляемого радиологически) на нескольких
континентах. Кроме того, каждый эон ха-
рактеризуется совершенно особой приро-
1 Возможно, что целый эон (или по мень-
шей мере эра) представлен системой Свазилен-
да-последовательностью древних южноафри-
канских отложений толщиной 17 км. Период ее
формирования оценивают по меньшей мере
в 300-500 млн. лет (рис. 5.7); поскольку в ней
нет крупных ископаемых, ее отложения гораздо
труднее картировать и сопоставлять с отложе-
ниями Большого Каньона.
дой ископаемых остатков. Ископаемые фа-
нерозоя обильны и дают прямые сведения
о ходе эволюции, тогда как в дофанерозое
ископаемых остатков очень мало. Чтобы
понять как сами события дофанерозоя, так
и время, когда они происходили, необхо-
димы далеко идущие предположения и эк-
страполяции. В связи с этим названия и да-
тировка хронологических подразделений
дофанерозоя, а также вопрос о положении
нижней границы фанерозоя остаются пред-
метом дискуссии. Принятая в этой книге
хронология эонов (табл. 4.2) соответствует,
с небольшими изменениями, хронологии
Клауда [164, 165] и Харгрейвса [380].
Эон хаоса начался в неопределенно да-
леком прошлом; это период аккреции
и стабилизации Земли, в которой стало
возможным узнать планетарное тело. По-
род, относящихся к тому времени, нет; со-
бытиями, связанными с формированием
планеты, занимаются фактически не геоло-
ги, а космологи и астрономы. Эон хаоса
сменился гадейским эоном \ который на-
чался, когда Земля превратилась в сплош-
ное твердое тело, находившееся на рас-
стоянии около 150 млн. километров от
Солнца и имевшее примерно такие же диа-
метр и массу, как и сегодня. Никаких на-
земных гадейских пород не известно. Од-
нако имеются более или менее непрерыв-
1 Гадес-в греческой мифологии бог под-
земного царства,-При л*, перев.
Таблица 4.1. Фанерозойский эон
Эра Период Приблизительное начало, млн. лет назад Характерные ископаемые
Палеозой Кембрий 580 Трилобиты, плеченогие, коралловые полипы и мно-
Ордовик 500 гие другие беспозвоночные; водоросли
Силур 440
Девон 400 Первые наземные растения (хвощи, семенные па-
Карбон 345 поротники, саговники), первые позвоночные (ры-
Пермь 290 бы, амфибии)
Мезозой Триас 245 Рептилии (включая динозавров), первые млеко-
Юра 195 питающие, хвойные, гингко
Мел 138
Кайнозой Третичный 66 Цветковые растения, современные отряды млеко-
Четвертичный 2 питающих, человек
ДО КЛЕТОК
67
Таблица 4.2. Характеристика эонов [165, 380]
Эон
Временные границы,
млрд, лет назад
Главные события
Эон хаоса
бДП-^б1
Гадейский эон
4,6-3,9
Образование солнечной системы;
первые основные термальные со-
бытия; прямые измерения воз-
раста отсутствуют
Образование системы Земля - Луна;
формирование и дифференциация
Земли как планеты (ядро, кора,
атмосфера); океаны образовались
около 4 млрд, лет назад. Лун-
ные породы, полученные по прог-
раммам Аполлон-12, -14 и -15,
имеют возраст 4,5 млрд, лет, а
по программе Аполлон-11-
3,6 млрд, лет
Архейский эон
3,9-2,6
П ротерозойский
эон
2,6-0,6
Фанерозойский эон
0,6-0
Тектонизм; протоконтинентальные
образования (Гренландия);
«юная» геология; начальные фор-
мы микробной жизни; век ана-
эробов
Геологическая тектоника и процес-
сы выветривания современного
типа; сообщества строматоли-
тов; цианобактерии
Животные и растения; рифовые
сообщества (см. табл. 4.1 и 4.3)
Космологи полагают, что возраст Вселенной менее 20 млрд. лет.
ные серии пород и окаменелостей для
последующих трех эонов -архея, протеро-
зоя и фанерозоя (табл. 4.3). Палеонтология
г палеоботаника рассматривают почти ис-
ключительно самый последний эон-фане-
розой, тогда как этапы биологической эво-
люции, составляющие предмет этой книги,
протекали главным образом в двух пред-
пюствовавших эонах-в архее и протеро-
зое.
Гадейский эон продолжался приблизи-
тельно от 4650 млн. до 3900 млн. лет на-
зад. Этот эон, как удачно показывает само
его название, был периодом образования
концентрической структуры Земли - ее
ора. мантии и коры. Первичная атмосфе-
ра. составлявшая часть солнечной туман-
ээсти. из которой сконденсировались Зем-
nt и Луна, была утрачена. Источником
вторичной атмосферы послужил летучий
материал из недр Земли: произошло пер-
вое крупное выделение газов. Вулканы
и горячие источники выносили на поверх-
ность газообразный продукт-водяной пар.
Таким образом, обширная гидросфера
Земли, включающая океаны, моря, озера,
реки, ручьи и грунтовые воды, образова-
лась, как полагают, в гадее. Хотя прямых
сведений о роде или количестве газов в га-
дейской атмосфере нет, принято считать,
что по сравнению с современной она была
богаче водородом и гидридами и беднее
окисленными газами. В течение гадея, ве-
роятно, формировались временные породы
земной коры, но они глубоко преобразовы-
вались в условиях высоких температур
и давления. Так как сейчас на Земле нет
пород, сохранившихся со времен гадея, за-
68
ГЛАВА 4
Таблица 4.3. Эры архейского, протерозойского и фанерозойского эонов
Эон Эра Время, млн. лет назад Ископаемые остатки
Архей Ранний Поздний 3900 3000 Редки
Протерозой Афебий 2600] Высокоразвитые сообщества строматолитов; микрофос-
Рифей Венд 1800 > 1000 J силии в кремнистых и глинистых сланцах
Эдиакара 750 Песчаные отпечатки хорошо развитых мягкотелых мно- гоклеточных животных; микрофоссилии в кремнистых и глинистых сланцах
Фанерозой Палеозой 600 Обильные ископаемые остатки кремневых и известко- вых скелетов многоклеточных животных; представле- ны все типы животных; первые наземные животные и растения
Мезозой 225 Голосеменные растения и рептилии
Кайнозой 70 Цветковые растения и млекопитающие
ключения об этих событиях приходится
выводить из моделей, описывающих ран-
нюю эволюцию Солнечной системы. Пря-
мое исследование вещества, доставленного
с лунной поверхности по программе
«Аполлон», показало, что лунные породы
не подвергались переплавке после гадея
или раннего архея. Единственными поро-
дами гадейского возраста, кроме лунных,
являются те, что попадают из космоса, т. е.
метеориты. Поскольку метеориты, как по-
лагают, сформировались в гадее одновре-
менно с системой Земля-Луна, их древ-
нейший возраст подкрепляет предполагае-
мую хронологию гадея.
Архейский эон охватывает период при-
мерно от 3900 млн. до 2600 млн. лет назад,
хотя в некоторых местах на земной по-
верхности типично архейские процессы за-
кончились раньше-около 3 млрд, лет на-
зад. Многие архейские породы уникальны.
Это было время мощной магматической
активности; массы расплавленных пород
интенсивно перемещались под твердой по-
верхностью Земли. Многие из этих интру-
зий, по-видимому, не приходили в контакт
с атмосферой или водой раньше, чем от-
вердевали. Есть данные о том, что
сильный нагрев привел к значительному
метаморфизму в глубоких слоях коры. Для
архейских пород характерно то, что они
очень мало изменены выветриванием. Эти
характерные отложения были названы «не-
зрелыми». Богатые натрием лавы, извер-
гаемые в атмосферу и гидросферу, осажда-
лись вблизи первоначальных мест экстру-
зии. Обломки пород вулканического про-
исхождения формировали собственно вул-
канические (а не водноотложенные) оса-
дочные породы поблизости от выбросив-
ших их вулканов. Архейские вулканические
и осадочные породы, метаморфизованные
под действием тепла и давления до ме-
тавулканитов и метаосадков, обычно об-
разуют крутые, сложные, сильноскладча-
тые структуры, протягивающиеся в виде
поясов на огромные расстояния. Формации
этих в прошлом однажды расплавленных
пород были изучены в Канаде, Австралии
и Южной Африке. Такие зеленокаменные
пояса, как их называют по причине зелено-
ватого оттенка слагающих их метаморфи-
зованных пород, известны и в менее древ-
них отложениях, но там они не столь
обширны. В архейских породах обычны
вулканические пробки, богатые магнием
и железом. Архей геологически отличается
также почти полным отсутствием гра-
нитных и базальтовых магматических по-
род, богатых калием, которые типичны для
ДО КЛЕТОК
69
более поздних эонов. Большие стабильные
открытые водоемы в архее были, вероятно,
редки, хотя значительная часть коры была,
видимо, покрыта тонким слоем не очень
соленой воды.
В архее появляются своеобразные оса-
дочные породы, названные полосчатыми
железорудными формациями (ПЖФ), ко-
торые состоят из чередующихся окис-
ленных богатых железом и восстано-
вленных бедных железом слоев. После
метаморфизма они часто превращались
в чередующиеся слои богатого и бедного
железом кварцита метаморфизованного
песчаника. Дофанерозойские ПЖФ слу-
жат источником большей части желез-
ных руд во всем мире. Например, ПЖФ,
богатые минералом гематитом, встречают-
ся до верхнего протерозоя, однако в
более молодых отложениях их нет. Как
полагают, существование этих железо-
рудных формаций означает, что вос-
становленные формы железа, металличе-
ские и закисные, были связаны с поверх-
ностными водами. Отложение закисного
железа на земной поверхности было бы не-
возможно, если бы атмосфера, как ныне,
была богата кислородом, так как железо
быстро переходит в окисную форму даже
при очень низких концентрациях свободно-
го кислорода. Таким образом, существова-
ние ПЖФ-это общепризнанный прямой
довод в пользу отсутствия или чрезвычай-
но малого содержания кислорода в архей-
ской атмосфере и периодического появле-
ния местных источников О2 в моменты
формирования определенных отложений.
Некоторые архейские осадочные по-
роды (например, в формации Шеба вблизи
Барбертона, Южная Африка), особенно
глинистые сланцы, содержат значительное
количество органического углерода [771].
Встречаются даже углеобразные и извест-
няковые архейские отложения, хотя они
сравнительно редки. Известны харак-
терные ассоциации золота, марганца, меди,
алюминия и сульфидов железа с богатыми
углеродом осадочными породами архея.
Истолковать их трудно. Относительно зна-
менитых южноафриканских золотых рос-
сыпей Витватерсранда высказана мысль,
гто биогенное отложение органического
углерода здесь было непосредственно свя-
зано с привносом новых минералов в эти
неметаморфизованные осадки [376].
Протерозойский эон продолжался от
2600 млн. до 600 млн. лет назад. Его мож-
но подразделить на нижний протерозой
(2600-2000 млн. лет назад) и верхний про-
терозой (2000-600 млн. лет назад). Есть
убедительные данные о том, что в проте-
розое уже были обширные гранитные кон-
тиненты, типичные для современной
Земли.
Геологический режим протерозойского
типа существовал в некоторых областях
Земли уже 3 млрд, лет назад, например
в южноафриканском Зулуленде; в других
местах, например в северо-западной Кана-
де, этот режим сложился только 2500 млн.
лет назад. Для нижнего протерозоя харак-
терны обильные эпиплатформенные осад-
ки. Платформы - это обширные стабиль-
ные участки континентов, и эпиплат-
форменные отложения образуются за счет
выветривания платформ, т. е. не в ре-
зультате геотермального или океаническо-
го выветривания, как архейские зеленока-
менные пояса, а из твердых континен-
тальных масс. Эпиплатформенные отложе-
ния нижнего протерозоя отличаются от
современных тем, что они обычно менее
окислены. Однако им сопутствуют и в них
внедряются породы, типичные для более
молодых отложений,-богатые калием гра-
ниты и гнейсы. Специфические архейские
породы, богатые натрием, уже были к то-
му времени замещены современными вул-
каническими и магматическими породами.
По-прежнему часто встречались ПЖФ. От-
ложения верхнего протерозоя содержат
обильные окисленные осадки, которые бы-
ли выветрены из континентальных масси-
вов. Эта окисленность была истолкована
как свидетельство повышения концентра-
ции О2 в атмосфере [165, 990].
Во всех образованиях, сформировав-
шихся после нижнего протерозоя, главные
магматические интрузии представлены бо-
гатыми калием гранитами, а метаморфиче-
ские породы - гнейсами. После среднего
протерозоя ПЖФ, содержащие как закис-
ное, так и окисное железо, в основном сме-
няются отложениями, носящими название
70
ГЛАВА 4
красных пластов, которые содержат
главным образом окисное железо. Эти
пласты богаты оксидами железа, например
минералом магнетитом. В верхнем проте-
розое Западной Австралии, Южной Афри-
ки и Канады начинают в изобилии встре-
чаться строматолиты органоосадочные
структуры, представляющие собой сло-
истые породы, которые состоят из из-
вестняка (карбоната кальция) или, реже,
из богатой углеродом опаловой поро-
ды. В этой книге строматолиты ин-
терпретируются как фоссилизованные сле-
ды главным образом фотосинтезирую-
щих сообществ микроорганизмов. Их на-
ходят иногда и в архейских породах,
но в протерозое строматолитов гораздо
больше и они лучше развиты. Они имеют
характерную форму и структуру, что по-
зволяет использовать их в качестве страти-
графических маркеров [998]; геологи пы-
таются с их помощью идентифициро-
вать геохронологические подразделения
протерозоя путем установления корреля-
ций между географически изолированными
слоями. В течение верхнего протерозоя
разнообразие карбонатных и кремне-
земных строматолитов, а также занимае-
мая ими площадь в огромной степени уве-
личиваются. Интерпретация строматоли-
тов дофанерозоя как биогенных структур
имела большое значение для расшифровки
эволюционной истории микробных экоси-
стем [660, 661, 997, 998].
В отложениях верхнего протерозоя из
нескольких далеко отстоящих друг от дру-
га мест были найдены окаменевшие остат-
ки (возрастом около 680 млн. лет) многих
мягкотелых животных, относящихся к ряду
хорошо известных типов Metazoa [330, 331,
332]. Присутствие представителей осталь-
ных царств эукариот-протоктистов, расте-
ний и грибов-в дофанерозойских слоях по-
ка еще достоверно не установлено. Однако
сообщалось об изобилии трудно идентифи-
цируемых микрофоссилий в породах верх-
него протерозоя. Среди них обычны сле-
дующие своеобразные ископаемые: сфери-
ческие микрофоссилии, называемые акри-
тархами; луковицеобразные хитинозои; ги-
стрихосферы, которые, возможно, являют-
ся остатками цист динофлагеллят [561].
Такие ископаемые могут служить указа-
нием на то, что около 1 млрд, лет назад
уже существовали эукариоты.
Фанерозойский эон начался около
600 млн. лет назад и продолжается до на-
стоящего времени. Красные пласты пол-
ностью заместили ПЖФ. Для пород фане-
розоя характерны окисленные отложения,
образовавшиеся из материала крупных
континентальных массивов и содержащие
остатки животных, растений и протокти-
стов, часто в огромных количествах. Хотя
нам известны и архейские окаменелости,
во многих книгах только окаменелости фа-
нерозоя рассматриваются как «палеонто-
логическая летопись» или «классическая
палеонтологическая летопись». Первая эра
фанерозоя - палеозойская - выделяется по-
всеместным появлением многоклеточных
животных, обладающих скелетом; ее на-
звали «веком беспозвоночных». В ранних
породах фанерозоя отмечается уменьшение
численности и разнообразия строматоли-
тов и соответствующее увеличение распро-
страненности карбонатных рифовых фа-
ций. Эти рифы вначале строились главным
образом сообществами губок и других
многоклеточных животных с твердым ске-
летом, а позднее-колониальными кишеч-
нополостными (кораллами). К началу ме-
зозойской эры фанерозоя, около 225 млн.
лет назад, тропические океаны изобилова-
ли «современными» коралловыми рифами,
которые представляют собой саморегули-
рующиеся барьерные экосистемы.
В течение фанерозойского эона проис-
ходило начавшееся в основном в позднем
палеозое перемещение магнитных полюсов
Земли и изменение формы и положения
континентов, которые в разные времена за-
нимали различное географическое положе-
ние и оказывались в разных климатических
условиях. Вероятно, такое поведение зем-
ной коры установилось еще в дофанерозое,
но прямых указаний на это нет. Во всяком
случае дрейф континентов в фанерозое су-
щественно повлиял на распространение на-
земных животных, растений и морских ор-
ганизмов. После выяснения всей истории
движения земной поверхности в дофанеро-
зое откроется возможность проследить их
влияние на ход дофанерозойской эволюции.
ДО КЛЕТОК
71
Космическая кухня: органические соединения
небиологического происхождения
Не существует особой силы, свойственной исключительно живой материи, которую
можно было бы назвать жизненной силой;... вернее, эта сила возникает в
результате конфликта многих других сил, и органическая природа не подчиняется
никаким законам, отличным от законов неорганической природы.
И. Берцелиус, 1806 (цит. по [170])
Жизнь на Земле, вероятно, появилась
в гадее или раннем архее. Почти все совре-
менные ученые убежденно заявили бы, что
жизнь зародилась спонтанно как законо-
мерный результат космологических про-
цессов, что она была завершением химиче-
ской эволюции - естественного образова-
ния и накопления органических соедине-
ний. Хотя ученые редко приходят к согла-
сию относительно любого события в про-
шлом, все же физики, химики и биологи
согласны в том, что жизнь возникла из ор-
ганического вещества, образовавшегося на
юной Земле без участия живых организ-
мов. Открытие синтеза органических моле-
кул в межзвездном пространстве подкрепи-
ло эту идею. Говоря ретроспективно, при-
сутствия органики в космосе можно было
ожидать, так как было известно, что водо-
род, углерод, азот и кислород, входящие
в состав органических соединений и, следо-
вательно, живых систем, относятся
к самым распространенным элементам
1табл. 4.4). Другой довод в пользу обще-
принятых представлений о возникновении
жизни-это присутствие значительных ко-
личеств органического вещества в метеори-
тах, т.е. телах внеземного происхождения.
Еще один аргумент-легкость, с которой
может быть получено большинство моно-
меров, входящих в состав живых систем,
при лабораторном моделировании усло-
вий, которые, как полагают, существовали
на поверхности Земли в гадее и раннем ар-
хее. Результаты такого моделирования
привели к концепции спонтанного происхо-
ждения самых первых клеток -саморепли-
дирующихся систем, ограниченных мем-
бранами.
С помощью гигантских антенн радиоте-
лескопов радиоастрономы могут обнару-
живать и идентифицировать внеземные ис-
Таблица 4.4. Химический состав Солнца [736]
Элемент Количество (по отношению к водороду)
Водород 1,0
Гелий 1,0-10-1
Кислород 6,8 Ю’4
Углерод 3,7 10“4
Неон 2,8 10’4
Азот 1,2-10”4
Магний 3,4 10-5
Кремний 3,2 10-5
Железо 2,6 10-5
Сера 1,610-’
Аргон 3,7-10" 6
Кальций 2,3 Ю’6
Алюминий 1,9-10-6
Натрий 1,9-IO-6
Фосфор < IO’10
точники электромагнитного излучения. На-
чиная с 1932 года, когда Карл Джански
сообщил об открытии космического ра-
диоизлучения, межзвездное органическое
вещество стали выявлять все чаще. Были
обнаружены углеродсодержащие радикалы
значительной сложности; в табл. 4.5 приве-
ден список органических фрагментов, точ-
но идентифицированных методом радио-
спектроскопии. Однако прямой связи ме-
жду галактическим органическим веще-
ством и происхождением жизни на Земле,
вероятно, нет. Межзвездные органические
соединения, прежде чем они достигли бы
концентраций, достаточных для формиро-
вания самореплицирующихся систем, ско-
рее всего были бы разрушены в эоне хаоса,
когда на Земле, как полагают, господство-
вали условия крайних температур и давле-
ний, механических столкновений и общей
нестабильности. Открытие распространен-
ности органических соединений в космосе
просто означает, что химические предше-
72
ГЛАВА 4
Таблица 4.5. Молекулы в космическом пространстве [337]. Поскольку микроволновая спектроско-
пия выявляет только молекулы с постоянным дипольным моментом, неполярные молекулы (например,
СН| или N2) не были обнаружены этим способом; тем не менее они, вероятно, присутствуют
Числа атомов в моле- куле Неорганические Органические
Молекула или радикал Год от- крытия Молекула или радикал Год от- крытия
2 Гидроксил (ОН) 1963 Метилидин (СН) 1937
Водород (Н2) 1970 Ион метилидина (СН+) 1937
Моноксид кремния (SiO) 1971 Циан (CN) 1940
Сульфид азота (NS) 1975 Окись углерода (СО) 1971
Сульфид кремния (SiS) 1975 Сульфид углерода (CS) 1971
3 Вода (Н2О) 1968 Формил-ион (НСО+) 1970
Сероводород (H2S) 1972 Цианистый водород (HCN) 1970
N2Hv 1974 Изоцианистый водород (HNC) 1971
Диоксид серы (SO2) 1975 Карбонилсульфид (OSC) 1971
Этинил (ССН) 1974
Формил (НСО) 1976
4 Аммиак (NH3) 1968 Формальдегид (Н2СО) 1969
Изоциановая кислота (HNCO) 1971
Тиоформальдегид (H2CS) 1971
Ацетилен (С2Н2) 1976
5 Муравьиная кислота (НСООН) 1970
Цианацетилен (HC3N) 1970
Иминометан (H2CNH) 1972
Цианамид (H2NCN) 1975
6 Метанол (СН3ОН) 1970
Цианометан, или метилцианид (CH3CN) 1971
Формамид (HCONH2) 1971
7 Метилацетилен (СН3С2Н) 1971
Ацетальдегид (СН3СОН) 1971
Метиламин (CH3NH2) 1974
Винилцианид (акрилонитрил) H2CCHCN 1975
Цианодиацетилен (HC5N) 1976
8 Метилформиат (НСООСН3) 1975
9 Диметиловый эфир (СН3)2О 1974
Этанол С2Н5ОН 1974
Цианогексатераин HC7N 1977
11 Цианоктатераин HC9N 1978
ДО КЛЕТОК
73
ственники жизни не представляют во Все-
ленной редкости. А если они легко обра-
зуются в космосе, то, вероятно, с такой же
легкостью формировались и на Земле
в эоне хаоса.
Ключевая нерешенная проблема со-
стоит в том, каким образом органические
соединения организовывались в системы,
способные к самовоспроизведению. Несмо-
тря на то, что абиотический синтез органи-
ческого вещества весьма распространен,
возникновение самой жизни может быть
редким или уникальным событием. В на-
стоящее время нет данных о том, что
жизнь когда-либо возникла где-нибудь во
Вселенной, за исключением поверхности
Земли до или в течение раннего архея
около 3500 млн. лет назад.
Метеориты
Д-р Дж. Лоуренс Смит из Луисвилля (штат Кентукки) лично исследовал большой
метеорит, упавший в 1879 г. в округе Эмметт... По внешнему виду это была
неровная, узловатая масса, напоминающая тутовую ягоду, с округленными выступами
на поверхности. Более крупные части были серого цвета с беспорядочно разбро-
санными зеленьГми минеральными включениями. Общий вес найденных фрагментов
составлял 307 фунтов. Каменистая часть состояла в основном из бронзита и оливина;
тремя главными компонентами были кремнезем, закись железа и окись магния. Анализ
показал, что в состав этого метеорита не входит ничего необычного.
Science, 1880 [841]
Метеориты часто наблюдаются как
«падающие звезды», которые входят в ат-
мосферу и ярко горят, прежде чем достиг-
нут поверхности, если не сгорят пол-
ностью. Это единственный регулярный
источник внеземного вещества, доступного
для лабораторного изучения. Некоторые
из недавно упавших метеоритов были
взяты для исследования вскоре после паде-
ния. Метеорит Мерчисона, упавший в сен-
тябре 1969 г. в Австралии, был подвергнут
анализу уже через несколько дней.
Большинство найденных метеоритов
имеет алюмосиликатный каменистый со-
став. Примерно один из двадцати бывает
явно металлическим и в значительной ча-
сти представляет собой сплав железа с ни-
келем. В зависимости от содержания ме-
талла такие метеориты называют же-
лезными или железно-каменными. Около
двух процентов всех метеоритов составля-
ют углистые хондриты-разновидность ка-
менных метеоритов, имеющая прямое от-
ношение к вопросу о происхождении жиз-
ни. На самом деле углистые хондриты,
возможно, составляют гораздо большую
долю всех метеоритов, входящих в атмо-
сферу, но их находят редко, так как они
легко разрушаются. Фактически соотноше-
ние между углистыми хондритами
и остальными метеоритами, найденными
в полярных областях, где вероятность их
сохранения выше, чем в более низких ши-
ротах, составляет около 2:100. Хондриты
содержат хондрулы - сферические струк-
туры диаметром около 1 мм, состоящие из
минералов оливина и ортопироксена, ко-
торые, вероятно, образуются при быстром
охлаждении.
Метеориты интересны не только тем,
что они представляют собой древние вне-
земные вместилища природных органиче-
ских веществ небиологического происхож-
дения, но и тем, что это, вероятно,
единственные доступные для лабораторно-
го изучения объекты, сформировавшиеся
в Солнечной системе в гадейское время.
Широко распространено мнение, что ме-
теориты происходят из пояса астероидов,
но, пожалуй, столь же вероятно, что они
являются остатками комет. Они могут да-
же оказаться продуктами давних столкно-
вений Земли с другими плотными телами.
В табл. 4.6 представлены результаты проб
на органические вещества в углистых ме-
теоритах. Жизнь должна была возникнуть
74
ГЛАВА 4
Форма
Составные части
Таблица 4.6. Состав метеоритов, богатых углеродом [391,980]. Обозначения: + вещество обнаружено;
— вещество искали н не обнаружили; ? обнаружение сомнительно.
Весь углерод (35-50 мг/г) ? Карбонат + Экстрагируемый углерод + Полимерный углерод ? Графит — Алмаз + Карбиды
Экстрагируемый органический уг- + Метан, этан
лерод, обычно 1 мг/г; рацеми- + н-алканы, нечетные и четные (С10...С24)
ческие смеси + Жирные кислоты (С14, С16_20, С22, С24, С26, С28)
+ Фенольные соединения (ароматические углеводороды, спирты, эфиры, кислоты, бензол, толуол, нафталин)
+ Аминокислоты (глицин, этилглицин, аланин, Р-аланин, метилаланин, аминомасляная кислота, амино-н-масляная кислота, Р-аминоизомасляная кислота, валин, норвалин, изовалин, пролин, пипеколовая, аспарагиновая и глутами- новая кислоты, саркозин)
+ Гетероциклические соединения (меланин, аммелин)
-1- Сахара (манноза, глюкоза)
+ Насыщенные полиизопреноиды (пристан, норпристан, фи- тан)
+ Ванадилпорфирин Хлорин (обычное производное земного органического вещества)
+ Бензонитрил
+ Метилбензонитрил (или индол)
+ Алкилпиридин (или анилин)
+ Алкилпиррол
? Триазины Г идроксипиримидин1 Г идроксиметилпиримидин1
+ Ксантин (= 3 мг/г малеонитрил)
+ Гироксантин
-1- Гуанин
? Аденин
Полимерный углерод (нерегуляр- + С (70%) + N (2%) Вг
ный высокозамещенный аромати- + О (10%) + С1 (1%) I
ческий полимер неизвестной + S (7%) + F (%) Si
структуры) + Н (4%) К + остаток, «зола» (5%)
1 Пиримидины не обнаружены. Прежние сообщения сомнительны; вероятно, найденные пиримидины образовались из загрязнений.
на основе таких соединений углерода, ка-
кие образовывались на раннем этапе ис-
тории Солнечной системы.
Органические компоненты метеоритов,
так же как и межзвездные органические ве-
щества, вероятно, не были прямыми пред-
шественниками жизни на Земле, поскольку
тепло, ультрафиолет и другие излучения,
имевшиеся, как полагают, в гадее, должны
были разрушать эти нестойкие соединения
прежде, чем они накопятся в достаточной
концентрации. На поверхности Марса не
было найдено никаких следов метеоритно-
го органического вещества, хотя наличие
древних кратеров указывает на то, что ме-
теориты, в том числе и углистые, интенсив-
но бомбардировали поверхность этой пла-
неты в ранний период ее истории [708].
Лишь ничтожные количества углерода (от
1 до 70 частей на миллион) были обнару-
ДО КЛЕТОК
75
Рис. 4.1. Микроструктуры в ор-
ганическом материале из Ор-
гейльского метеорита. Световая
микрофотография, х 1825. [Е.
S. Barghoorn, Harvard Univ.]
жены в образцах лунного грунта и еще
меньшие (от 25 до 250 частей на мил-
лиард)-в образцах рыхлого лунного мате-
риала реголита (лунная «почва») и брекчии.
При пиролизе, т. е. нагревании в отсутствие
О2, большая часть углерода выделяется из
лунных образцов в виде СО2 и СО, а орга-
нический углерод составляет меньше мил-
лионной доли всего лунного углерода. Ор-
ганического углерода в лунных пробах
может даже вообще не быть, так как най-
денные в этих исследованиях количества
очень близки к пределам чувствительности
применявшихся методов измерения. Если
соединения углерода, вносимые при ударах
метеоритов, непосредственно предоставля-
ли органическое вещество для первичной
жизни, то они должны были каким-то
образом быть защищены от разрушающих
воздействий. Это было явно не так-и на
Луне, и на Марсе. Однако некоторые ис-
следователи полагают, что с метеоритами
на Землю было принесено 1023 г углерода,
т. е. количество, приблизительно равное
всему количеству углерода, запасенному
в нынешней биоте [703].
Как бы то ни было, углерод, нахо-
димый в метеоритах, служит свидетель-
ством того, что сложные органические со-
единения и абиотические структуры могут
создаваться естественным путем и действи-
тельно создавались в гадейское время. Од-
нако ввиду экстремальных условий, дей-
ствию которых всегда подвергаются ме-
теориты, большинство астрономов считает
крайне маловероятным, чтобы жизнь воз-
никла на них или на телах, из которых они
образовались. Органические соединения,
содержащиеся в углистых метеоритах, мо-
жет быть, лучше всего рассматривать как
некую форму естественного контроля для
экспериментов в области происхождения
жизни; они соответствуют тем формам
и количествам соединений и микрострук-
тур, которые, вероятно, создавались на
Земле в гадее и архее. Как видно из
рис. 4.1, самые сложные органические вклю-
чения в метеоритах довольно просты [789].
76
ГЛАВА 4
Создание жизни в лаборатории
В первых десятилетиях [19-го] века... спор по поводу витализма, видимо, играл
важную роль в зарождавшейся органической химии. Казалось, органические
вещества образуются только в организмах и поэтому являются продуктом той же
особой энергии, которая поддерживает саму жизнь.
Коулмен, 1971 [170]
В 1760-х годах Спалланцани показал,
что в гниющем органическом веществе, ес-
ли его предохранить от мышей и мух, не
заводятся ни мышата, ни черви (личинки
мух). В 1860-х годах Пастер доказал с по-
мощью изящных опытов, что даже мик-
робы происходят не из отбросов или хими-
ческих веществ, а только от предсуще-
ствующих микробов. Для мира, который
верил во всемогущего создателя, резуль-
таты этих опытов означали крах идеи
самопроизвольного зарождения жизни.
Вопрос о происхождении жизни возвратил-
ся из области науки в сферу философии,
к которой многие относят его до сих пор.
В нашем веке А. И. Опарин [696] и
Дж. Холдейн [372] выдвинули предположе-
ние о том, что жизнь возникла в результа-
те взаимодействия органических соедине-
ний, которые образовывались в бескисло-
родных условиях, преобладавших на юной
Земле. После опубликования этих гипотез
некоторые ученые стали рассматривать во-
прос о происхождении жизни как экспери-
ментальную проблему. Открытие Миллера
(1953 [648]), установившего, что аминокис-
лоты легко и довольно быстро образуются
из неорганических предшественников, при-
вело к новой области лабораторных иссле-
дований, которую называют «эксперимен-
тами по моделированию первичной Зе-
мли», «пребиотической химией» или «экс-
периментальной химической эволюцией»
и которая породила обширную литературу
[75, 278, 302, 427, 473, 650, 735-737, 853].
К проблеме происхождения жизни есть
несколько лабораторных подходов, хотя
о некоторых из них пуристы злословили,
что это якобы просто никуда не годная
экспериментальная органическая химия.
Один из подходов состоит в том, что соз-
дают среду, предположительно сходную
с гадейской, вносят в нее неорганические
реагенты и подводят энергию, а затем сре-
ди продуктов реакций разыскивают моле-
кулы, имеющие важное значение для со-
временной жизни. При другом подходе
точно задают все переменные-например,
количества и типы исходных веществ, pH,
физические условия (скажем, модель океан-
ского побережья с суточными изменениями
температуры и освещенности), содержание
солей в среде. При каждом добавлении ве-
ществ или изменении условий исследова-
тель пытается идентифицировать образую-
щиеся соединения, их выход и механизмы
их синтеза. В обоих подходах предпола-
гается, что вещества, важные для совре-
менных живых систем, были также важны-
ми предшественниками жизни. Тот факт,
что из водорода, кислорода, азота, источ-
ников углерода и энергии в лаборатории
можно легко получать углеводороды, жир-
ные кислоты, бензольные и фенольные со-
единения, аминокислоты и многие другие
хорошо известные органические вещества,
подкрепляет гипотезу о том, что жизнь
возникла из космических компонентов
в бескислородных условиях. Действитель-
но, органические соединения, находимые
в метеоритах, очень сходны с теми, ко-
торые образуются в модельных экспери-
ментах. Те и другие даже более сходны
между собой, чем с органическим веще-
ством, синтезируемым живыми клетками.
Однако провести четкую границу между
биотически и абиотически образуемыми
веществами невозможно. Как правило,
абиотическим путем почти независимо от
используемого источника энергии полу-
чаются рацемические смеси и более широ-
кое разнообразие изомеров и соединений,
чем то, которое имеется в современной
биоте. Не было найдено таких абиотиче-
ских условий, при которых получались бы
весьма специфические наборы изомеров
и высокомолекулярных веществ, образую-
щиеся в живых клетках.
ДО КЛЕТОК
77
В табл. 4.7 указаны (с количественной
оценкой) источники энергии, которые, как
полагают, могли использоваться для син-
Таблица 4.7. Источники энергии для пребиотиче-
ских синтезов [736]
Вид энергии Оценка потока, кал/см2 за год
Ультрафиолет 570
Электрические разряды 4,0
Радиоактивность 0,8
Тепло (геотермальная 0,13
энергия)
теза органического вещества в гадее и ран-
нем архее. По общему мнению, солнечный
ультрафиолет, с которым поступала боль-
шая часть энергии, играл более важную
роль, чем другие источники. Обычно счи-
тают (хотя по этому пункту нет единоду-
шия), что в архее поток ультрафиолетовой
радиации у поверхности Земли до накоп-
ления О2 в атмосфере, вероятно, был
главным источником энергии и для пре-
биотического органического синтеза, и для
таких ранних биологических процессов, как
индукция лизиса и трансдукция с по-
мощью бактериофагов [622, 761]. Были
сделаны оценки того, в какой степени по-
вышалась защита земной поверхности от
солнечного ультрафиолета кислородом и
озоном [74]. Однако вопрос о том, когда
закрылось ультрафиолетовое окно для
длин волн менее 310 нм, вызывал много
споров [162, 990]. Вероятно, где-то в архее
ультрафиолетовая радиация перестала
быть как угрозой для жизни, так и источ-
ником энергии для нее же [760].
В лабораторных опытах по абиогенезу
биологически важные органические веще-
ства получаются главным образом при
слабощелочных и полностью анаэробных
условиях [702]. В кислой среде образуются
пиперазины и другие соединения, обычно
не встречающиеся в живых организмах;
в присутствии же кислорода органические
соединения вообще не образуются [2]. Со-
держание водорода в реакционной смеси
также влияет на выход органических ве-
ществ: повышение количества Н2 приводит
к снижению общего выхода аминокислот,
хотя качественный состав их не изменяется
[736]. Наиболее вероятное исходное веще-
ство для синтеза определенных аминокис-
лот и нуклеотидов - цианистый водород
(рис. 4.2). Проблема образования низкомо-
лекулярных органических компонентов
представляется более или менее решенной,
но как происходила агрегация органиче-
ского вещества? Как полимеризовались
мономеры? Как к новым органическим
агрегатам передавалась информация и как
создался надежный механизм наследствен-
ности? Расстояние, отделяющее самую
сложную смесь органических веществ от
простейшей клетки, все еще предстоит пре-
одолеть как в теории, так и в лаборатории.
Появились сообщения о том, что в
предполагаемых условиях ранней Земли
происходила полимеризация аминокислот-
ных остатков с образованием как пеп-
тидных, так и непептидных связей [303,
304]. Формировались также сложные мик-
роструктуры, некоторые из них, по-види-
мому, с каталитической активностью. Од-
нако абиотическое образование каталити-
чески активных полимеров аминокислот
может не иметь прямого отношения к про-
исхождению жизни, так как полипептиды
не обладают тенденцией к самовоспроизве-
дению. Кроме того, поскольку все амино-
кислоты в современных белках соединены
только пептидными связями, трудно пове-
рить, что другие типы связей когда-либо
имели отношение к эволюционирующим
системам. Если не считать определенных
небольших пептидов, таких как грамици-
дин и пентапептиды в бактериальных кле-
точных стенках, аминокислоты полимери-
зуются в полипептиды на нуклеопроте-
идных рибосомах с участием транс-
портных и информационных РНК. Суще-
ствование первичной живой системы, син-
тезирующей белки в отсутствие реплика-
ции нуклеиновых кислот, кажется неправ-
доподобным; но если даже так было, то
катализ, возможно, осуществлялся «фер-
ментами» полинуклеотидной природы.
Уайт [1015] высказал предположение, что
ранние живые системы использовали поли-
нуклеотидные фрагменты, обладавшие
некоторыми каталитическими свойствами
в отношении полимеризации нуклеиновых
кислот. Этим можно объяснить тот факт,
78
ГЛАВА 4
2HCN
Тример
NH2
Н— C-CN HCN-> NC—C-CN
II Н
Димер
HCN
Цис-тетрамер
NCx NH2
cz
NC
NH
NC
NH2
Л HCN
Аминоимидазол- II
нарвонитрил II /
ZC-NZ
h2n н
fop (360 нм)
или NH3
NC NH2
HCN-полимер
Гидролиз
(Н20,НС1)
NH2
K^N
Н
Аденин
О
H2N -С
H2N/^N
H
4-имидазол-
5-кар Бонси амид
л HCN
^HC=C-C=N —
Цианоацетилен
H2N CN
Транс-тетрамер
ПУРИНЫ
Гуанин
н20
Чреидоакрилонитрил Цитозин
АМИНОКИСЛОТЫ
(глицин, аланин, серин,
аспарагин,треонин,
глутаминовая кислота)
Урацил
ПИРИМИДИНЫ
Рис. 4.2. Возможные пребиотические пути от цианистого водорода к основаниям ну-
клеотидов и аминокислотам. В абиотических экспериментах, в которых исходными ве-
ществами служат метан и аммиак, получаются лишь следовые количества аденина,
тогда как из IM HCN можно получить до 1% кристаллического аденина. Веским дово-
дом в пользу ключевой роли HCN в пребиотических синтезах служит и то, что это
самый обильный продукт, получаемый в большинстве опытов с искровыми разрядами.
Разбавленный цианистый водород легко концентрируется при температуре — 20°С,
при которой вода удаляется из смеси. В концентрированных растворах тетрамер обра-
зуется спонтанно.
что многие ферменты (52% из 1750, зане-
сенных в каталог) активны лишь в присут-
ствии коферментов, а большинство этих
коферментов-нуклеотиды или явно род-
ственные им вещества. Таким образом, ка-
жется вероятным, что самые ранние сис-
темы репликации всецело или в основном
базировались на полинуклеотидах-таких
же несовершенных и коротких, какими
могли быть ранние нуклеиновые кислоты
[207]. Нуклеотиды имеют тенденцию обра-
зовывать полимеры с комплементарно спа-
ренными основаниями не только по причи-
не их геометрического соответствия, но
и потому, что в неводных растворах пары
аденин-тимин и аденин-урацил образуются
ДО КЛЕТОК
79
легче, чем пары аденин-аденин, благодаря
свойствам электронных конфигураций
[777]. Даже очень небольшая точность
репликации нуклеиновых кислот, вероятно,
с самого начала была обусловлена их взаи-
модействием с аминокислотами, пептида-
ми [184, 698, 776] или каталитическими
нуклеотидами [1015].
Механизм спонтанного (в отличие от
ферментативного) образования нуклеотид-
ных полимеров из мономеров загадочен.
В результате большинства попыток синте-
зировать рибонуклеотидные полимеры из
мономеров под контролем матрицы полу-
чались «неестественные» 2',5'-связи между
нуклеотидами. Однако эксперименты Дэ-
вида Ашера, химика из Корнеллского уни-
верситета, привели к мысли о циклическом
пути синтеза ранних пребиотических оли-
гонуклеотидовх что позволило обойти эту
трудность [977]. Схема Ашера включает:
1) «сухой» безматричный синтез случайных
сополимеров, имеющих как 2', 5'-, так
и 3',5'-связи; 2) переход этих олигомеров
в раствор при низкой температуре; 3) пре-
имущественный гидролиз 2',5'-связей
в образующихся коротких спиралях. Эта
схема, которая действительно реализуется
в лабораторных условиях, могла некогда
закрепиться путем отбора как механизм
создания длинных комплементарных поли-
нуклеотидов «естественного» типа, т.е. со-
держащих только 3',5'-связи. Это означало
бы необходимость регулярного ежедневно-
го чередования условий: сухо и тепло
(56°С), влажно и тепло, сухо и холодно
(5°С), влажно и холодно, влажно и тепло,
сухо и тепло и т.д. Однако оценить, в ка-
кой степени циклические изменения среды
могли влиять на результат пребиотических
реакций, дьявольски трудно.
Никакая самореплицирующаяся систе-
ма (ограниченная мембраной и осущест-
вляющая сопряженную полимеризацию ну-
клеотидов и аминокислот) еще не была
получена в лаборатории из простых пред-
шественников. Однако биологически ак-
тивные реплицирующиеся полинуклеотиды
все же были получены в определенном
смысле абиотически. С. Спигелмен [897]
синтезировал инфекционные вирусы (как
ДНК-, так и РНК-содержащие) из гораздо
более простых предшественников. Ему по-
надобились только очищенный фермент
(«репликаза», т.е. РНК-зависимая РНК-по-
лимераза), матричная нуклеиновая кислота,
по меньшей мере один человек-исследова-
тель и уйма энергии в форме нуклеотидов-
предшественников и долларов. В подходя-
щих условиях были изготовлены РНК-ви-
русы, вполне способные к непрерывной
репликации. Аналогичные опыты были
проведены с ДНК-вирусами. Для этого по-
требовались два специфических фермента:
ДНК-полимераза и лигаза-фермент, со-
единяющий концы линейной нуклеиновой
кислоты с образованием кольца. Таким
образом, по крайней мере инфекционные
вирусы могут быть изготовлены в лабора-
тории [495]. Исследователи просто смеши-
вали в подходящих концентрациях веще-
ства, которые склонны взаимодействовать.
Если бы удалось найти естественный фено-
мен, при котором аккумулируются органи-
ческие вещества, и нечто такое, что выпол-
няло бы функции как самого исследовате-
ля, так и ферментов, которые он выделяет
из живых клеток, то проблема происхожде-
ния простых репликативных систем вели-
чиной с вирус была бы решена, по крайней
мере в принципе. В табл. 4.8 указаны при-
родные агенты, которые могли бы увели-
чивать концентрации абиотически синтези-
руемых органических соединений [75, 650]
(см. также гл. 10). Главным способом кон-
центрирования могло бь(ть заключение си-
стем белок - нуклеиновая кислота
в липопротеидные мембраны [708].
Почти все мономерные компоненты
живой клетки были получены эксперимен-
тально в достаточно обычных химических
условиях. В таких экспериментах синте-
зируются разнообразные аминокислоты
(табл. 4.9). Четыре из них образуются осо-
бенно легко (глицин, аланин, аспарагино-
вая и глутаминовая кислоты), и они же
чрезвычайно распространены в белках. Ве-
роятно, это не простое совпадение. До-
вольно несложные в химическом отноше-
нии, они, можно полагать, были «первы-
ми» аминокислотами. В табл. 4.10 перечис-
лены нуклеотиды и другие компоненты
нуклеиновых кислот, полученные в усло-
виях, моделирующих раннюю Землю; ны-
нешняя абсолютная необходимость адено-
80
ГЛАВА 4
Таблица 4.8. Способы концентрирования пребиотических органических соединений
Механизм Источники данных
Коацерваты и протобионты [218, 696, 697]; критическое обсуж- дение см. [207]
Поверхность апатита (заодно решается проблема нехватки фосфора) «Океанический путь» (термоклин) Микросферы (получаются при нагревании органических соеди- нений с целью обезвоживания) Возбудимые мембраны Подсыхающие кромки морей, соленые заводи, среды, богатые серой и железом Эвтектические механизмы концентрирования Липидные мембраны [75, 437] [1010] [305] [737] [278] [650, 699] [650]; Оро, неопубликованные дан- ные
Таблица 4.9. Синтез аминокислот и близких соединений в условиях, моделирующих юную Землю
[207, 473, 736, 737, 913]
Дата Исходные материалы1 Исследователи Источник энергии Продукты
1953 Метан, аммиак, водо- род Miller Электрический разряд Глицин, аланин, р-ала- нин, глутаминовая кис- лота
1955-1956 Водород, метан, СО или СО2, аммиак или азот, кислород Abelson Электрический разряд Аланин, глицин, сарко- зин, серин, аспараги- новая кислота (толь- ко в отсутствие кис- лорода)
1957 Метан, аммиак, серово- дород Walter, Mayer Подогрев до 1300 К Тиоцианат аммония
1957-1966 Трипептиды, эфиры по- лифосфорных кислот, 18 аминокислот Schram et al., Fox et al., Pon- namperuma Тепло (50-60 °C) Полипептиды, протеино- иды
1959 Формальдегид, цианис- тый водород Oro Комнатная тем- пература (процесс спон- танный) Глицин, аланин
1959 Метан, аммиак, окись углерода Павловская и Пасы некий Электрический разряд Глицин, аланин, амино- масляная кислота, ли- зин (отсутствие Н2 уси- ливает синтез амино- кислот)
1959-1965 Ангидриды и-карбокси- аминокислот, амино- ацетонитрил и его сульфат, каолин, ди- циандиамид, хлорис- тый водород Becker et al., Ha- nafusa et al., Ponnamperu- ma et al., Stein- man et al. Нагревание до 100 °C Аспарагиновая кислота, треонин, серин, глута- миновая кислота, про- лин, глицин, аланин, валин, изолейцин, лей- цин, тирозин, фенила- ланин
ДО КЛЕТОК
81
Продолжение табл. 4.9
Дата Исходные материалы1 Исследователи Источник энергии Продукты
1960 Метан, этан, аммиак Groth, Von Weyssenhoff Ультрафиолет (407 нм, 219,6 нм) Глицин, аланин, амино- масляная кислота
1963 Этан, метан, аммиак Ого Глицин, аланин, пролин, валин, лейцин, аспара- гин
1965 Метан, аммиак (про- пускание пузырьков сквозь NH4OH) Grossenbacher, Knight Глицин, аланин, треонин, серин, глутаминовая кислота, изолейцин
1965 Метан, аммиак Ого Тепло (1300 К) Аспарагиновая кислота, треонин, серин, алло- изолейцин, изолейцин, фенилаланин, р-ала- нин, глутаминовая кис- лота
1966 Метан, аммиак Ponnamperuma Электрический разряд Полипептиды
1966 Формиат аммония, NH4OH, NaCN, FeSO4 Abelson Ультрафиолет Глицин, глицинонитрил
1966 Метан, аммиак и вода с получением HCN; затем гидролиз Ponnamperuma, Flores Глицин, аланин, треонин, валин, фенилаланин
1968 Тиоцианат аммония, гидролизованный 6 н. НС1; в газовой фазе- азот Steinman et al. Ультрафиолет (260 нм, 3 ч) Метионин
1 В большинстве опытов присутствовала вода.
зинтрифосфата (АТР) и остальных три-
фосфатов - предшественников нуклеотидов
(GTP, UTP и СТР), вероятно, обусловлена
в конечном счете той легкостью, с которой
они образовывались в пребиотических хи-
мических процессах. На рис. 4.2 показаны
некоторые предполагаемые пути пребиоти-
ческого синтеза пуринов и пиримидинов.
Абиотическим путем были получены также
различные углеводы (табл. 4.11). Некото-
рые из источников энергии, использо-
ванные в этих экспериментах,-ультрафио-
летовые лучи и тепло (моделирующее
вулканы и горячие источники)-вероятно,
не были в гадее и архее обильными. Иных
источников, таких как частицы с высокой
энергией, получаемые в ускорителях, почти
наверняка не было. Однако точное выяс-
нение источников энергии, по-видимому, не
имеет решающего значения, если принять
во внимание число и разнообразие опытов,
в которых был получен довольно большой
выход органических соединений, играющих
сегодня важную роль в клеточном метабо-
лизме.
Поскольку такие вещества, как порфи-
рины и изопреноиды, не нужны для репли-
кации, их пребиотический синтез [404, 473],
подобно соединению аминокислотных ос-
татков непептидными связями, вероятно,
не играл существенной роли. Возможно,
что многие органические вещества, ко-
82
ГЛАВА 4
Таблица 4.10. Синтез предшественников нуклеиновых кислот в условиях, моделирующих юную Землю
Дата Исходные Исследователи материалы1 Источник энергии Продукты
1960 Цианистый аммоний Ого Спонтанно при высоких кон- центрациях Аденин
1961 Аминоимидазолкарбок- Ого си имид Тепло (100- 140 °C) Гуанин, ксантин
1961 Яблочная кислота, моче- Fox, Harada вина Тепло Урацил
1963 Метан, аммиак, водород Ponnamperuma et al. Ультрафиолет Аденин (выход увеличи- вается при удалении водорода)
1963 Акрилонитрил, семиаль- Ого дегидимин аминопро- пилмалонамида (най- ден в кометах) в вод- ных растворах NH4C1 Тепло (135 °C) Урацил
1963 Рибоза, аденин и фос- Ponnamperuma фат в разбавленных et al. водных растворах Ультрафиолет Аденозин
1963 Аденин, аденозин, AMP, Ponnamperuma, ADP, этилфосфат Sagan Аденозин, АМР, ADP, АТР
1964 Дезоксирибоза, аденин, Ponnamperuma, HCN Kirk Ультрафиолет Дезоксиаденозин
1964 Гидроксиапатит и циана- Miller, Parris ты (реакция идет на поверхности минера- ла) Пирофосфат
1965 Цианистый водород Ponnamperuma (разбавленный) Ультрафиолет ч Аденин, гуанин, мочеви- на
1968 Цианацетилен, цианат, Ferris et al. циан Электрический разряд (цик- лические из- менения тем- пературы до точки замер- зания воды, приводящие к эвтектическо- му концент- рированию) Пиримидины, цитозин, урацил
С 1974 до настоя- щего вре- мени Основания, рибоза, соли Orgel и другие морской воды (см. [207]) Тепловые цик- лы Инозин, гуанозин, адено- зин, ксантозин
В большинстве опытов присутствовала вода.
ДО КЛЕТОК
83
Таблица 4.11. Синтез углеводов в условиях, моделирующих юную Землю
Исходные Исследователи материалы1 Источник энергии Продукты2
Л61 Формальдегид в присут- Бутлеров, Leow ствии щелочей Смесь сахаров, оптиче- ски неактивные гексо- зы
уЗЗ Глицеральдегид, дигид- Orthner, Gerisch роксиацетон Эритроза, пентозы
Глицеральдегид, аце- Ого, Сох тальдегид (катализа- тор-ионы двухвалент- ных металлов или ам- миак) Дезоксирибоза
-64 Глюкоза, дициандиамид, Steinman et al. фосфорная кислота Ультрафиолет, спонтанно Дисахариды, глюкозо-6- фосфат
^5-1966 Формальдегид, цианис- Ponnamperuma тый водород * Глицеральдегид и глико- левый альдегид Ультрафиолет, рентгеновы лучи, гамма- лучи от ли- нейного уско- рителя Рибоза, дезоксирибоза Рибоза
Водные растворы фор- Ponnamperuma, мальдегида, омываю- Gabel щие каолинит (моде- лирование гидротер- мальных источников) Триозы, тетрозы, пенто- зы, гексозы (включая рибозу и дезоксирибо- зу)
3 большинстве опытов присутствовала вода.
Гххара нестабильны в щелочных водных растворах. В качестве предшественника требуется по меньшей мере 0,01 М формаль-
Зссмя. за которое сахара разрушаются, ненамного больше времени, необходимого для их синтеза [207, 650].
‘ встречаются не во всех живых клет-
сгт г не нужны для их репродукции, снача-
-1 зсзникали абиотически, а затем исполь-
\:в1лвсь в качестве пищи или же удержи-
микробами, поскольку давали им
<_и?е-то селективное преимущество. Эти
гелскзательные вещества стали вторичны-
метаболитами, а первичными были со-
необходимые для саморепродук-
353 производные аминокислот, компо-
нуклеиновых кислот и некоторые
Л5пзты L Однако независимо от того, мо-
.та исследователь идентифицировать
кх вещества, образующиеся в его абиоти-
чгл?! экспериментах, бактерии их распо-
Даже самые сложные полимеры,
-тдемые в таких экспериментах, будут
т-а2гс2^аны как пища и съедены, если их не
предохранить от носящихся в воздухе бак-
терий и грибов. В связи с этим опыты по
химической эволюции должны проводить-
ся в стерильных условиях.
Хотя на вопрос о том, каким образом
из агрегатов органических молекул прои-
зошли первые бактерии, еще нет детально-
го ответа, кое-что мало-помалу выясняется
[207]. В последующих главах этой книги
мы будем предполагать, что наименее
сложные прокариоты, жизнь которых под-
держивал первичный метаболизм, опи-
санный в гл. 5, действительно сформирова-
лись каким-то образом в результате небио-
логических процессов из абиотического
органического материала на раннем этапе
истории нашей планеты и что они являют-
ся предками всех современных организмов.
ГЛАВА 5
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
Критерии родства
Из этого эволюционного древа видно, что в некоторых ветвях изменения струк-
туры ферредоксина значительно больше, чем в других. У клостридиев аминоки-
слотные последовательности мало изменились за все представленное время, возможно
превышающее три миллиарда лет. Приспособление к бактериальному фотосинтезу
потребовало несколько больших изменений, к аэробному метаболизму-еще больших,
а максимальные изменения произошли при переходе к фотосинтезу с выделением
кислорода. У прокариот (в отличие от эукариот) накопление точечных мутаций
не служит показателем длительности эволюционных процессов.
Р. Шварц, М. Дэйхофф [835]
Если принять, что прокариоты интен-
сивно эволюционировали путем прямой
филиации, то какова была их ранняя эво-
люционная история? Каким образом соз-
давалось их метаболическое разнообразие?
Каковы критерии их родства между собой?
Что известно об анаэробных бактериях из
древнейших ископаемых остатков?
Все живое воспроизводится с невероят-
ной точностью, используя единую в своей
основе систему белкового синтеза, направ-
ляемого нуклеиновыми кислотами. Так как
точная репликация, или, что то же самое,
малая частота спонтанного мутирования,
характерна для всех клеток, обеспечиваю-
щие ее механизмы должны, во-первых,
быть древними и, во-вторых, постоянно
поддерживаться естественным отбором.
Исключая, возможно, митохондрии неко-
торых дрожжей, триплетный генетический
код в настоящее время универсален; у всех
изученных организмов одни и те же прави-
ла определяют трансляцию последователь-
ности трехнуклеотидных единиц - кодо-
нов-в линейной структуре ДНК в амино-
кислотную последовательность белка,
с указанием мест начала и окончания ее
синтеза [1001]. Некоторые участки моле-
кул ДНК, однако, не кодируют аминокис-
лотных последовательностей белков или
нуклеотидных последовательностей РНК,
а просто разделяют информационные от-
резки цепи ДНК. Даже эта нетранскриби-
руемая ДНК, вероятно, подвержена дей-
ствию естественного отбора; у эукариот
она скомплексирована с белками-гистона-
ми и образует часть хроматина, из которо-
го состоят хромосомы.
Генетический код мог возникнуть из
менее надежной трансляционной системы.
Предполагают, что в ранних кодах только
два первых основания каждого триплета
определяли аминокислоты в белках (Крик
[184]). Это выводят из того, что в совре-
менном коде третье основание часто бы-
вает избыточным: например, триплеты
CGU, CGC, CGA и CGG в информацион-
ной РНК все кодируют аргинин. На суще-
ствование еще более древнего и более при-
митивного кода может указывать тот
факт, что простейшие, самые распростра-
ненные аминокислоты часто определяются
вторым основанием кодона: большинство
кодонов с G во второй позиции кодируют
глицин, аргинин или серин; большинство
кодонов со вторым основанием С соответ-
ствуют серину, пролину или треонину;
и наконец, кодоны, содержащие во второй
позиции U, кодируют, как правило, лейцин
или валин. Стабилизация генетического ко-
да была, вероятно, одним из самых ранних
событий в эволюции клеток.
Когда у каких-то бактерий примитив-
ная белоксинтезирующая система на осно-
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
85
ве ДНК стала эффективно функциониро-
вать, эти организмы стали размножаться
быстрее всех других и дали начало всем
последующим клеткам. Только те стерео-
изомеры аминокислот, к которым была
приспособлена эта генетическая система,
могли в дальнейшем использоваться в не-
измененном виде. Первоначально клетки
могли использовать разные изомеры угле-
водов, например рибозы и дезоксирибозы.
Впоследствии, однако, либо в результате
избирательного поглощения из внешней
среды через белково-липидную мембрану,
либо благодаря избирательному использо-
ванию надлежащих изомеров из рацемиче-
ской смеси для воспроизведения клеток
стали использоваться только распростра-
ненные ныне L-аминокислоты и D-caxapa.
Так как все современные клетки с порази-
тельной точностью различают стереоизо-
меры сахаров и аминокислот, эта способ-
ность, вероятно, возникла очень рано. На
определенном этапе появились ферменты,
превращающие бесполезные изомеры
з нужные.
Древнейшие микробы были гетеротро-
фами, размножавшимися в среде с абио-
генными органическими и минеральными
мигательными веществами. Рассматривая
соединения, которые являются компонен-
тами любой клетки или их предшественни-
ками и легко получаются в экспериментах,
моделирующих пребиотические условия,
можно заключить, что список абиогенных
питательных веществ включал по крайней
мере рибозу, дезоксирибозу, фосфат, пу-
тины и их предшественники, оротовую
гйслоту и другие предшественники пири-
мидинов, а также разнообразные «бел-
ковые» и «небелковые» аминокислоты.
Фосфаты натрия, калия и кальция имелись,
вероятно, в изобилии как продукты разру-
тэеяия архейских пород. Кроме того, в ка-
честве пищи могло использоваться множе-
ство неизвестных или неидентифициро-
занных соединений, в том числе некоторые
столообразные длинные полимеры. На что
г^гча похожа минимальная клетка, про-
стейшая самореплицирующаяся система?
возможная реконструкция, основанная на
тгетпипах, предложенных Моровицем
665], представлена на рис. 5.1.
В табл. 5.1 перечислены некоторые веще-
ства и органеллы, которые должны были
присутствовать для обеспечения основных
функций, необходимых для репликации.
Минимальную клетку Моровица можно
сравнить с некоторыми ныне существую-
щими анаэробными бактериями. Даже
самые мелкие из известных бакте-
рий - Dialister (Bacteroides pneumosintes),
Veillonella и некоторые микоплазмы-в де-
сять раз больше по линейным размерам
и сложнее минимальной клетки Моровица,
отчасти, вероятно, потому, что ему не уда-
лось учесть все ферменты и белковые фак-
торы, необходимые для репликации. Тем
не менее анализ, проведенный Моровицем,
дает полезный ориентир для представле-
ний о первичном метаболизме, необходи-
мом для репродукции в настоящее время
и в прошлом.
Как мы можем реконструировать пути
дальнейшей эволюции после возникнове-
ния «минимальных» анаэробных гетеро-
трофных бактерий? Какие критерии сле-
дует использовать, чтобы проследить эво-
люционные взаимоотношения микробов?
Для ответа на эти вопросы могут быть
привлечены некоторые представления из
более изученных областей эволюции жи-
вотных и растений. В процессе эволюции
сложных признаков, таких как строение
легких, глаз или цветков, каждая закрепив-
шаяся мутация дает какое-то небольшое
селективное преимущество тому организ-
му, у которого она возникла. Такие
сложные признаки определяются метабо-
лическими взаимодействиями и поэтому
зависят от многих ферментов и соответ-
ствующего количества ДНК для их коди-
рования. У животных и растений эволю-
цию признаков, определяемых нескольки-
ми генами, можно проследить во времени.
Подобные мультигенные признаки назы-
вают семами. Тот же принцип - возникно-
вение новых сем путем накопления по-
лезных мутаций-должен был действовать
и в эволюции микробов. Микробы, спо-
собные синтезировать метаболиты, уча-
ствующие в репликации, выживали в про-
цессе отбора, так как использовали имев-
шиеся пищевые ресурсы эффективнее, чем
их конкуренты. После возникновения опре-
Рис. 5.1. Биохимические компоненты обобщенной минимальной клетки.
Функция Участвующие соединения
Репликация Дезоксирибоза, гуанин (пурин), аденин (пурин), тимин (пиримидин), цитозин (пиримидин), фосфорная кислота
Синтез белка Рибоза , гуанин, аденин, урацил (пиримидин), цитозин,фосфорная кислота, аминоа цил-тРНК-синтетазы
Катализ Белки, пептиды, аминокислоты, нуклеотидные коферменты
Внутриклеточ- ный гомеостаз Липиды, насыщенные и мононас^пценные жирные кислоты глицерин, белки
Растворитель, питание Все перечисленное выше в водном растворе, К+, метаболиты (лактат, ацетат и др.)
5
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
87
Таблица 5.1. Минимальный набор биохимических функций, необходимых для репликации
Функция Необходимые компоненты, реакции и системы Участвующие соединения и органеллы
Синтез ДНК Синтез нуклеозидов, нуклеоти- дов и их фосфорилирован- ных производных; ДНК-мат- рицы и затравки; ДНК-по- лимеразы; натриевый насос, поддерживающий высокую концентрацию ионов калия Нуклеозидтрифосфаты (ТТР, GTP, АТР, СТР), около 20 аминокислот; генофор (ну- клеоид)
Синтез информационной РНК Информационная РНК, РНК- полимераза Нуклеозид трифосфаты, белки
Синтез белка, кодируемый три- тРНК для каждой аминокисло- Около 4 РНК и 50 белков,
плетами нуклеотидов; синтез рибосом ты, аминоацил-тРНК-синтета- зы, аминокислоты; регуляция концентрации ионов магния организованных в рибосомы
Синтез мембран Различные липиды Ацетил-СоА, биотин, насыщен- ные и мононенасыщенные жирные кислоты, глицерин; клеточная мембрана
Расщепление питательных ве- ществ, дающее энергию для поддержания низкой энтро- пии Метаболиты Лактат, ацетат и многие дру- гие органические кислоты и сахара
□еденной семы - например, метаболическо-
го пути, ведущего к какому-либо нужному
веществу,-отбор обычно способствовал ее
закреплению. В процессе дальнейшей эво-
люции семы претерпевали незначительные
али же глубокие изменения. Популяции по-
томков становились новыми видами бла-
годаря накоплению изменений в семах
концепцию сем развил Хэнсон [379]; см.
также табл. 5.2).
Представление о том, что естественный
гтбор действует на признаки, т.е. фер-
менты, клеточные стенки, пигменты или
любые другие отдельные свойства орга-
низмов, абсурдно, как указывали Симпсон
'S61. 865] и другие. На самом деле он дей-
ствует на определенные популяции орга-
низмов в определенных условиях среды и
з определенное время, благоприятствуя
умножению одних членов популяции
* препятствуя размножению других. Эво-
люция микробов тоже направлена на со-
тганение или изменение сем в опреде-
ленных популяциях в конкретных про-
странственно-временных координатах. Так
же как и при построении филогении расте-
ний и животных, при исследовании эволю-
ционных отношений между микробами
следует задаваться вопросом, когда, при
каких условиях и в каких популяциях воз-
никли в процессе эволюции определенные
семы.
Семы родственных организмов можно
сравнивать: чем больше общих сем имеют
два организма, тем позже они дивергиро-
вали от общего предка. Однако прежде
чем сравнивать семы, их нужно идентифи-
цировать. Так, например, у ныне суще-
ствующих и вымерших позвоночных
имеются стабильные морфологические
особенности, в эволюции которых можно
проследить этапы, имеющие адаптивное
значение. Такие отличительные особенно-
сти, как шишковидная железа, копыта, сет-
чатка, рога, когти, волосы или перья, мож-
но идентифицировать как семы. У микро-
бов, однако, морфология так слабо разви-
та, что на ней невозможно основывать
идентификацию большинства сем. Возмож-
ное исключение составляют эндоспоры,
гормогонии, гетероцисты, стебельки и над-
земные плодовые тела. Как же в таком
88
ГЛАВА 5
Таблица 5.2. Семы и их эволюционные судьбы [379]
Эволюционное событие Примеры
Появление семы (неосема) Изменение семы1 Изменение признака (эписема) Повторение признака (полисема) Уменьшение выраженности признака (гипосема) Увеличение выраженности признака (гиперсема) Утрата признака Подвижность, фоточувствительность Позвоночные: возникновение легких из плавательного пу- зыря Членистоногие: дифференциация добавочных частей тела Аннелиды: увеличение числа сегментов Позвоночные: увеличение числа позвонков и сомитов Членистоногие: увеличение числа ног Млекопитающие: уменьшение размеров аппендикса, числа пальцев у лошадей, длины морды у приматов Млекопитающие: увеличение размеров и числа ветвле- ний рогов у оленей, увеличение размеров тела у ло- шадей Исчезновение глаз у пещерных животных
1 Семы, представляющие собой измененные формы ранее существовавших сем, называются апосемами.
случае можно идентифицировать семы
(главным образом метаболические пути,
конечные продукты которых дают опреде-
ленные селективные преимущества) у ми-
кробов?
Семы не эквивалентны тем метаболиче-
ским признакам, которые используют на
практике для идентификации видов бакте-
рий. Являются эти признаки семами или
нет, можно сказать лишь после детального
изучения метаболических путей. Если две
группы микробов синтезируют один и тот
же конечный продукт, то они имеют об-
щий признак. Однако гены, кодирующие
ферменты соответствующих биохимиче-
ских путей, могут не иметь никаких разли-
чий в первичной структуре ДНК, а могут
иметь десятки тысяч таких различий. На-
пример, и Zymomonas, и Escherichia окис-
ляют глюкозу с освобождением двуокиси
углерода и воды. Однако у бактерий этих
двух родов различны все ферменты ката-
болизма глюкозы. Таким образом, катабо-
лизм глюкозы не составляет единой семы:
один и тот же признак, дающий одни и те
же селективные преимущества, возник у
двух микроорганизмов путем метаболиче-
ской конвергенции. Многие микробы
имеют общие признаки, которые выглядят
как семы, но, вероятно, возникли конвер-
гентным путем (например, коккоидная
морфология или образование газообразно-
го азота из нитратов).
Единичные мутации, такие как потеря
способности синтезировать активный фер-
мент, могут быть обусловлены мини-
мальными генетическими и химическими
изменениями и тем не менее оказывать
сильнейшее влияние на организм. У бакте-
рий, которые имеют лишь один набор ге-
нов и поэтому формально эквивалентны
гаплоидным эукариотам, большинство воз-
никающих мутаций сразу же проявляются
в фенотипе; однако явление репрессии ге-
нов приводит к тому, что в каждый
данный момент может экспрессироваться
не весь геном бактерии. Оценки эволю-
ционных расстояний между бактериями
могут быть ошибочными, если при анализе
учитываются не семы, а репрессибельные
признаки или признаки, определяемые еди-
ничными мутациями. Именно такого рода
ошибками чревато использование для так-
сономических целей метаболических путей
бактерий в работах Де Лея [219, 220].
Далее в этой главе и в остальной части
книги мы будем пытаться идентифициро-
вать гомологичные семы. Если бы были
известны общее число и последователь-
ность нуклеотидных пар в ДНК для мно-
гих видов бактерий, можно было бы прямо
строить филогенетические схемы, не вводя
никаких далеко идущих предположений.
К несчастью, это находится за пределами
возможностей любого из существующих
методов и останется, вероятно, недостижи-
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
89
мой целью в ближайшем будущем-по
крайней мере для тысяч видов, многие из
которых даже не удается выращивать в ак-
сенических культурах. Если нет полных
данных о последовательностях ДНК, при-
ходится использовать другие источники
информации; их можно расположить в ряд
по степени приближения к прямой инфор-
мации о геноме. В табл. 5.3 перечислены
критерии родства, расположенные в при-
мерном соответствии с тем, насколько на-
дежно каждый из них отражает гомологию
транскрибируемых последовательностей
ДНК. Подходы к сравнению сем у мик-
роорганизмов предложены по аналогии
с теми, которые используются для жи-
вотных и растений (Хэнсон [379]).
Если семы в разных популяциях одина-
ковы, они не могут служить основой для
сравнения; если какие-либо семы есть
в одной популяции и отсутствуют в дру-
гой, их тоже нельзя использовать для этой
цели. Так, например, многие семы расте-
ний и животных первоначально возникли
у бактерий и сохранились без изменений:
триплетный код и синтез белка, сбражива-
ние глюкозы до пировиноградной кислоты,
аэробное дыхание, фотосинтез с выделе-
Таблица 5.3. Критерии родства между прокариотами1
Критерий Методы исследования
Гомология последовательностей нуклеотидных Прямое секвенирование ДНК (пока не осу-
пар в ДНК ществлено полностью ни для каких орга- низмов, кроме вирусов), исследование гомо- логий ДНК-ДНК и ДНК-РНК методом гибридизации, секвенирование РНК, изучение рекомбинации (классическая генетика)
Г омология метаболических путей и идентич- Биохимические методы, применение радиоизото-
ность ферментов пов, электрофорез, хроматография
Сходство ультраструктуры Трансмиссионная и сканирующая электронная микроскопия (изучение фиксированного мате- риала)
Сходство макроскопической морфологии и жиз- Световая микроскопия и цитология (прижиз-
ненных циклов ненные исследования)
Гомология отдельных цистронов Гибридизация ДНК/ДНК и ДНК/РНК, секвени- рование белков
Нуклеотидный состав ДНК Определение по плавучей плотности в градиен- тах CsCl и по денатурации (температуре плав- ления)
Идентичность механизмов трансляции (общ- Хроматография, электрофорез, применение ра-
ность генетического кода, идентичность тРНК для каждой аминокислоты, идентичность ами- ноацил-тРНК-синтетаз) диоизотопов
Идентичность молекулярной структуры опреде- Физико-химические методы (рентгеноструктур-
ленного пигмента или фермента ный анализ и др.)
Сходство ферментов, пигментов и т.п. Биохимические, энзимологические, иммунологи- ческие, спектроскопические методы, электро- форез, хроматография
Общие фенотипические признаки (способность Стандартные микробиологические методы иден-
к росту на одних и тех же углеводах, иден- тификации (культивирование, окрашивание и
тичность конечных продуктов, выделение на однотипных селективных средах, одинаковые способы спорообразования, сходные типы под- вижности и т.п.) др)
Применимы к любым организмам с единичным геномом и соответствующей белоксинтезирующей системой; перечислены
тгвблизительно в порядке их значимости.
90
ГЛАВА 5
нием О2. Некоторые семы имеются лишь
у определенных групп эукариот: мегаспо-
рофиллы, устьица на листьях, перья,
клювы, яйца амниот, хрящ, челюсти-вот
только немногие из возможных примеров.
Другие семы, такие как окостенение в про-
цессе развития скелета, полая дорсальная
нервная система хордовых и наличие сосу-
дистых пучков у сосудистых растений, воз-
никли в популяциях отдаленных эукарио-
тических предков и были унаследованы
всеми млекопитающими или всеми цвет-
ковыми растениями без существенных из-
менений. Такие ограниченные в своем рас-
пространении и неизменные семы непри-
годны для построения филогении микро-
бов. Наиболее полезны в эволюционных
исследованиях семы, претерпевшие за-
метные изменения в популяциях изучаемых
организмов. Идентификация популяции,
в которой возникла определенная сема, ос-
нована на выявлении групп родственных
организмов, у которых наблюдается целый
спектр небольших вариаций данной семы,
которым можно сопоставить определенные
селективные факторы среды. В сущности,
это метод сравнения «общих признаков»,
бессознательно используемый при построе-
нии филогенетических схем для растений
и животных [352, 861]. Примерами неко-
торых эукариотических сем, идентифициро-
ванных таким способом, могут служить:
триплобластическое (трехслойное) тело
у многоклеточных животных, четыре ко-
нечности с пятью пальцами у амфибий, эм-
бриогенез рептилий и млекопитающих
в условиях суши, форма ног и клюва у га-
лапагосских вьюрков, матка и молочные
железы млекопитающих, прямохождение
человекообразных обезьян, крышечки и
сеты на спорангиеносцах спорофитов
у грибов и растений, антеридии и архего-
нии у мхов, сложные цветки покрытосе-
менных, метаболизм цианогенных гликози-
дов у некоторых папоротников. Такие
семы могут подвергаться изменениям,
перечисленным в табл. 5.2; их исследова-
ние имеет решающее значение для выясне-
ния путей эволюции. Задача состоит в том,
чтобы идентифицировать сравнимые семы
и проследить их изменения в популяциях
микроорганизмов.
Эволюционные приобретения у анаэробов
Nihil ideo quoniam natumst in corpore, ut uti possemus, sed quod natumst id
procreat usum1.
Тит Лукреций Кар, 1-й век до н. э.
Универсальные биохимические функ-
ции, составляющие первичный метаболизм
минимальной клетки, требуют, по расче-
там Моровица, примерно пятидесяти ге-
нов 1 2. Действительно, древнейшие анаэ-
робные гетеротрофные бактерии, вероятно,
не содержали почти ничего, кроме ос-
новных метаболитов, перечисленных
в табл. 5.1. По-видимому, близкие род-
ственники этих первичных организмов до-
1 Ничто не возникает в теле для того,
чтобы мы могли воспользоваться этим: напро-
тив, тому, что возникло, находится применение.
2 Термин «ген» здесь означает цис-
трон-участок ДНК, кодирующий один опреде-
ленный продукт, РНК или белок.
жили до наших дней в почти неизменен-
ном виде - например, бактерии «S» из
метаногенной ассоциации [767] и неко-
торые из наиболее мелких бактерий, такие
как бактероиды и микоплазмы [665] \
Белки, содержащие железо и серу,-фер-
редоксины-лишены каких-либо кофермен-
тов и имеются у анаэробных гетеро-
трофных бактерий, так же как и у всех
других организмов. Их биосинтетические
функции, вероятно, возникли на очень ран-
них этапах эволюции и составляют очень
1 По последним данным, микоплазмы-де-
генерировавшие микроорганизмы, близкие к ба-
циллам; их примитивность вторична-Прим,
ред.
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
91
древние семы. Судя по гомологиям амино-
кислотных последовательностей, сравни-
тельно низкомолекулярные ферредоксины
относятся к продуктам наиболее древних
генов, и от них непосредственно произош-
ли рубредоксины и цитохромы в результа-
те дупликаций генов и последующей диф-
ференциации функций [1037]. Еще одна
очень древняя сема (возможно, несколько
сем)-это брожение, т.е. такой обмен низ-
комолекулярных органических соединений,
при котором кетоны и альдегиды превра-
щаются в органические кислоты и другие
небольшие молекулы с выделением энер-
гии, запасаемой в форме АТР. Брожение
можно определить как процесс фермента-
тивного превращения органических ве-
ществ, в котором акцепторами электронов
служат другие органические вещества. На-
личие таких превращений в промежуточ-
ном обмене едва ли не всех организмов
служит аргументом в пользу их древности.
После возникновения сем брожения нача-
лось создание путей гликолиза-катаболиз-
ма сахаров. Анаболизм и катаболизм пя-
тиуглеродных соединений, таких как рибо-
за и дезоксирибоза (необходимых для
репликации нуклеиновых кислот), вероят-
но, предшествовали в ходе эволюции мета-
болизму более крупных молекул, например
глюкозы, фруктозы и лактозы.
В то время как одни ранние анаэробные
бактерии приобрели в процессе эволюции
механизм анаэробного гликолиза, у других
выработалась способность фиксировать ат-
мосферную двуокись углерода с образо-
ванием различных восстановленных ор-
ганических соединений. Биосинтетическая
фиксация СО2 возникла по меньшей ме-
ре у трех больших групп бактерий. Фик-
сация по ацетатному пути, свойственная
клостридиям,-вероятно, наиболее древний
способ, так как мы находим ее у ог-
ромной группы процветающих организ-
мов. нечувствительных к видимому свету
S.J. Giovannoni, 1979, личное сообщение)
и не имеющих системы биосинтеза порфи-
ринов и других сем, которые никогда не
могли бы быть утрачены полностью, если
бы были однажды приобретены. Следую-
zkh в ходе эволюции, вероятно, возникла
фиксация СО2 при участии фосфоенолпи-
руват-карбоксилазы, так как она имеется
у анаэробных фотосинтезирующих бакте-
рий (хотя наиболее изучена у Escherichia
coli). Фиксация СО2 при участии рибулозо-
бисфосфат-карбоксилазы - путь, свой-
ственный многим аэробным организмам
и типичный для большинства фотосинтети-
ков и хемоавтотрофов,-по всей вероятно-
сти, возникла после обоих анаэробных пу-
тей. Различие путей фиксации СО2
у разных групп заставляет предполагать,
что эта способность выработалась конвер-
гентно у различных предковых форм
(рис. 5.2). Таким образом, эти пути, види-
мо, представляют собой по меньшей мере
три неродственные семы.
Так как карбоксилазы-ферменты, ката-
лизирующие у современных организмов
фиксацию двуокиси углерода,-реагируют
также с молекулярным водородом, Карр
(N.G. Сагг, 1977, личное сообщение) выска-
зал мысль, что первой функцией этих фер-
ментов, дававшей их обладателям селек-
тивные преимущества, было окисление во-
дорода до Н2О; только тогда, когда
запасы водорода были исчерпаны (в ре-
зультате улетучивания в космическое про-
странство и взаимодействия с другими га-
зами, в том числе кислородом), функцией
этих ферментов стало карбоксилирование.
Одновременно или вскоре после этого вы-
работалась фиксация атмосферного азота.
Карр предположил также, что первона-
чальной функцией ферментных комплек-
сов, необходимых для фиксации азота, бы-
ло окисление этилена до ацетилена
в предшествовавших более восстанови-
тельных условиях. В фиксации атмосфер-
ного азота всегда участвует нитрогеназный
комплекс-ферментная система, включаю-
щая ферредоксины. Нитрогеназы специфи-
чески и эффективно реагируют с ацетиле-
ном, богатым энергией соединением, кото-
рое в пребиотических условиях, вероятно,
синтезировалось в значительных количе-
ствах из цианида. Таким образом, нитроге-
назы и карбоксилазы у бактерий, возмож-
но, представляют собой преадаптации—
семы, которые сохранились, так как дава-
ли новые селективные преимущества
в изменившихся условиях.
Для объяснения выработки все более
92
ГЛАВА 5
Клостридии (гетеротрофы) Селен, н О
wit . вольфрам \ #
XH2 + С02 --------—* С 4- X --------------► Клеточный материал
формиат* I *
Связанный дегидрогеназа Л-------
с коферментом Н Связанный Неизвестный
продукт углерод продукт
УКСУСНОКИСЛОГО
брожения
Escherichia coli (гетеротроф)
сн2 II С—0—ро3н2 + со2 ФЕП- карвоксилаза СООН I сн2
СООН с=о
СООН
Фосфоенолпируват
(ФЕП).
Оксалоацетат
+ Р04
Аспартат,
глутамат,
* корриноиды,
порфирины и др.
Метаноовразующие Бактерии (хемоавтотрофы)
ХН +С02 -^->ХСООН ---------> ХСНО ---->ХСН2ОН -----> ХСН3 у—>СН4
Неизвестный /
носитель Метилкоьаламин+ HS03(CH2)2SM J
Кофермент М
Фотосинтезирующие Бактерии, водоросли, растения (фотоавтотрофы)
сн2о®
нос-соон
I
с=о
_ ... ... неон
СН20® СН20®
сн2о®
С=0 Рибулозо-1,5-
I nu . ла бисфосфат-карьонсилаза
। L (мол. вес большой
□С — он субъединицы ~ 54 000)
СН2®
неон
СООН
СООН
Рибулозо-1,5-
- висфосфат
2-карвокси-
3-оксиривитол-
1,5-Бисфосфат
нестабилен
неон
СН20®
Глицеральдегид-
3- фосфат
(2 молекулы)
Рис. 5.2. Разные пути фиксации СО2. Структура метил кобаламина идентична структу-
ре цианкобаламина с тем лишь отличием, что с атомом кобальта связана метильная
группа вместо цианидной (см. рис. 5.3).
длинных биосинтетических путей можно
привлечь гипотезу Горовица [425]. По ме-
ре истощения запасов абиогенного органи-
ческого материала возникала конкуренция
за органические вещества, необходимые
для размножения. После развития функций
карбоксилирования и азотфиксации стал
доступным новый прямой и обильный ис-
точник углерода и азота для синтеза орга-
нических соединений-атмосфера. Очевид-
но, что способность использовать этот
источник давала бы огромное селективное
преимущество, хотя было бы неоправ-
данным упрощением считать, что ход эво-
люции полностью определялся этим, бе-
зусловно сильным, селективным давле-
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
93
нием. Возможная последовательность по-
явления различных сем у анаэробных
бактерий представлена в табл. 5.4.
Для бактерий можно вывести филогене-
тическую схему, совместимую с данными
об отложениях биогенных органических ве-
ществ и изменениях атмосферы, происхо-
дивших в результате эволюции бакте-
риального метаболизма (см. рис. 6.3). Ко-
нечно, такая схема может быть только
гипотетической. Предлагаемая последова-
тельность может в лучшем случае базиро-
ваться на данных о тех соединениях, ко-
торые продуцировали бактерии в момент
их гибели, и нужно также выяснять
и учитывать изменения, происходящие
в отложениях в результате гниения, выве-
тривания и диагенеза. Реконструкция эво-
люции микробных экосистем по следам,
оставленным ими в осадочных породах,
остается главной задачей молодой научной
дисциплины, называемой геохимией. К не-
счастью, из таких данных пока трудно вы-
водить определенные заключения; пути
эволюции метаболизма анаэробных прока-
риот и их сообществ чаще становились по-
нятными в результате изучения совре-
менных микроорганизмов.
Следует считать, что ни одна сема, т. е.
ни одно фундаментальное метаболическое
новшество, определяемое большим числом
генов, однажды возникнув в процессе эво-
люции, никогда не исчезает бесследно. Это
подтверждается всем, что известно об эво-
люции растений и животных. Изменившие-
ся со временем семы-это результат взаи-
модействия многих генов; они хорошо от-
работаны и дают большие селективные
преимущества. После своего первого по-
явления семы могут претерпевать глубокие
Таблица 5.4. Последовательность приобретения сем анаэробными бактериями
Семы Группа, в которой появились семы Примерное время появления, млрд, лет назад Ожидаемые следы в осадочных породах
4,5-3,5 Абиогенное органическое ве- щество (оптическая актив- ность отсутствует, широкое разнообразие изомеров)
Синтез оптически активных соединений, система репли- кации нуклеиновых кислот, мембраны Первые анаэроб- ные микроорга- низмы 3,5-2,0 Диагенетически измененные производные нуклеиновых кислот и белков, органи- ческий фосфор, производ- ные липидов, моно- и ди- ненасыщенные жирные кис- лоты, фракционирование изотопов С и S, микрофос- силии
Фиксация СО2 (с использо- ванием молекулярного или органического водорода в качестве восстановителя), гликолитические пути, азотфиксация, метаногенез Анаэробные фер- ментирующие микроорганизмы 3,5-2,0 Восстановленные соединения углерода, отложения суль- фидов, промежуточные про- дукты путей восстановления СО2, промежуточные про- дукты гликолиза, молибдо- ферредоксины, метан, про- изводные кофермента М
Синтез каротиноидов, бакте- риохлорофиллов и цито- хромов Анаэробные бакте- рии-фотосинте- тики 3,5-2,0 Производные порфирина и изопрена, органические уг- лерод, сульфат, сера
Синтез цитохромов и катала- зы Анаэробы, способ- ные к дыханию 3,0-1,5 Производные порфирина и изопрена
94
ГЛАВА 5
изменения, но детальное исследование по-
зволяет выявить следы их древних форм.
Высшие таксоны, такие как типы
и классы,-это группы организмов, сохра-
нивших древние семы. Сформировавшиеся
группы такого ранга могут терять свое по-
ложение и в значительной мере вытеснять-
ся другими, но, как правило, они не выми-
рают полностью. Таким образом, живые
организмы и их сообщества хранят в своих
морфологических и метаболических семах
огромную информацию о своем эволю-
ционном прошлом1.
У ныне живущих микробов имеется
много анаэробных метаболических путей,
близко родственных аэробным путям. Это
свидетельствует о том, что метаболизм
бактерий возник еще до или во время обо-
гащения атмосферы кислородом и, следо-
вательно, до появления растений и жи-
вотных, которые все являются облигатны-
ми аэробами. Все клетки нуждаются, поми-
мо основных «строительных блоков», еще
в источниках энергии; по мере истощения
запаса богатых энергией веществ, образо-
вавшихся в пребиотических условиях, про-
исходила колоссальная адаптивная радиа-
ция: вырабатывались новые способы полу-
чения энергии, что в конце концов привело
к развитию фотоавтотрофии [111].
Существование фотогетеротрофии у
облигатных анаэробов позволяет предпо-
лагать, что видимый свет играл какую-то
роль в метаболизме еще до появления
строго автотрофного фотосинтеза. Фотоге-
теротрофы, такие как некоторые галобак-
1 Следует сказать несколько слов о гори-
зонтальном, или латеральном, переносе сем, т. е.
о передаче семы из одной популяции в другую
бактериальными вирусами или независимыми
генетическими элементами (плазмидами). В фи-
логении, представленной в настоящей книге (так
же как и в филогениях, основанных на первич-
ной структуре белков,-см. [228, 835]), эти меха-
низмы переноса игнорируются. Предполагается,
что латеральный перенос был в ходе эволюции
достаточно редким событием, мало влиявшим
на общую картину вертикальной филогении ми-
кробов. Таким образом, предполагаемая после-
довательность появления микробных неосем,
представленная в табл. 5.4, основана на принци-
пе вертикальной филогении (см. рис. 6.3) и на
последовательности отложения биогенных орга-
нических веществ в осадочных слоях.
терпи и несерные пурпурные бактерии, мо-
гут использовать свет для синтеза АТР
и создания осмотических градиентов, спо-
собных совершать работу, но им необхо-
димы в качестве компонентов пищи по
меньшей мере некоторые сложные соеди-
нения углерода. Некоторые фотогетеро-
трофы могут также фиксировать СО2. Та-
ким образом, как карбоксилирование ат-
мосферной двуокиси углерода, так и зави-
симый от света синтез АТР, вероятно,
возникли раньше, чем фотоавтотрофные
бактерии, у которых эти пути скомбиниро-
ваны. Некоторые анаэробные метанообра-
зующие бактерии удовлетворяют все свои
энергетические и трофические потребности,
используя водород и СО2. У них вырабо-
тались особые пути метаногенной фикса-
ции СО 2 с участием координационных со-
единений кобальта (например, метилкоба-
ламина; см. рис. 5.2). Как и фотогетеро-
трофы, они, очевидно, представляют собой
древнюю группу, приспособившуюся к ис-
пользованию архейских вулканических га-
зов. Существование фиксации СО2 у раз-
личных нефотосинтезирующих анаэробов
(например, Desulfovibrio), не способных или
ограниченно способных к синтезу гемов
и каротиноидов, указывает на то, что фо-
тосинтетическим системам предшествова-
ли другие типы метаболизма и соответ-
ствующие им эффекты: фракционирование
изотопов углерода и серы, образование се-
роводоррда из сульфата, тиосульфата и га-
зообразного водорода, образование метана
и отложение биогенных продуктов восста-
новления СО2.
Еще одна чрезвычайно древняя микроб-
ная сема-это изопреноидный путь. Этот
путь ведет от ацетата через мевалоновую
кислоту и изопентенилпирофосфат (см.
рис. 6.1) к различным производным изо-
прена, таким как сквален, убихинон (кофер-
мент Q), витамины А и К и фитольная
цепь. Производные изопрена есть у всех
фотосинтезирующих организмов, в том
числе у строгих анаэробов. Предполагает-
ся, что первоначально эти соединения ис-
пользовались для защиты органических ве-
ществ клетки от фотоокисления [503]. Они
широко распространены и до сих пор, так
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
95
как были приспособлены для выполнения
различных специфических функций. Напри-
мер, витамин А служит предшественником
родопсина (зрительного пигмента позво-
ночных), а также пурпурного мембранного
пигмента у галофильных бактерий. Неко-
торые изопреноиды участвуют у галобак-
терий в реакциях, использующих видимый
свет для выведения натрия из клетки про-
тив градиента концентрации [526].
На древность биосинтеза изопреноидов
указывает его наличие у архебактерий —
группы прокариот, которая, как полагают,
очень рано отделилась от эволюционных
линий, приведших к аэробным гетеро-
трофным бактериям и в конце концов к эу-
кариотам. В группу архебактерий входит
много различных метанообразующих
форм, два загадочных термо- и кислото-
устойчивых микроаэрофила Sulfolobus
и Thermoplasma и аэробные галобактерии
Halococcus и Halobacterium. Они отличают-
ся от других бактерий и от цитоплазмы
и органелл эукариот несколькими призна-
ками: уникальной нуклеотидной последо-
вательностью в рибосомной РНК 16S, при-
сутствием эфиров фитола вместо эфиров
жирных кислот в липопротеидных кле-
точных мембранах [472, 960], отсутствием
гликопептидов в клеточной стенке и не-
обычными особенностями посттранскрип-
ционной модификации тРНК. Эти черты
подкрепляют представление о метанообра-
зующих бактериях как о древней группе,
в которой окислительный метаболизм, то-
лерантность к крайним температурам
и концентрациям солей и даже фотогетеро-
трофия возникли независимо от анало-
гичных эволюционных приобретений
у других бактерий [300, 301]. У общих
предков архебактерий и остальных бакте-
рий до дивергенции нуклеотидных после-
довательностей рибосомных РНК, вероят-
но. уже выработались по крайней мере
генетическая система и механизмы синтеза
изопреноидов и ферредоксина. Так как
фракционирование легких изотопов угле-
рода при метаболизме метанообразующих
бактерий происходит более эффективно,
чем при любом другом известном процес-
се (Е. S. Barghoom, 1977, личное сообще-
ние), вероятно, можно было бы выявить
древний метаногенез, измеряя соотноше-
ние изотопов углерода в метане, содержа-
щемся в хорошо датированных древних
отложениях. Установление верхнего вре-
менного предела ответвления архебактерий
от других прокариот представляет чрезвы-
чайный интерес.
Фиксация азота-это идущий с затратой
энергии анаэробный процесс, обнару-
женный только у прокариот. Вероятно, он
возник в процессе эволюции очень рано.
Нитрогеназы имеются у клостридиев; зна-
чит, они появились раньше самого важно-
го из новых типов метаболизма-фотосин-
теза. Бактериальный фотосинтез, освобо-
дивший жизнь от зависимости от абио-
генных органических веществ, несомненно,
возник у анаэробных микробов, способных
к азотфиксации и вообще обладавших
весьма широким «метаболическим репер-
туаром». Различия в структуре 16S-PHK
и других признаках позволяют предпола-
гать очень раннюю дивергенцию, а воз-
можно, даже и конвергентную эволюцию
фотоавтотрофии у трех больших групп фо-
тосинтезирующих бактерий: пурпурных се-
робактерий (Chromataceae), зеленых серо-
бактерий (Chlorobiaceae) и пурпурных не-
серных бактерий (Rhodospirillaceae). Фикса-
ция СО2 в восстановительном цикле Креб-
са и соответственно отсутствие цикла
Кальвина-Бенсона у зеленых серобактерий
заставляет предполагать, что они находят-
ся лишь в очень отдаленном родстве с дру-
гими фотосинтетиками [18]. В результате
бактериального фотосинтеза происходило
отложение органического углерода, эле-
ментарной серы и, возможно, даже сульфа-
тов. В архее до перехода к окислительной
атмосфере должен был существовать пол-
ный анаэробный экологический круговорот
серы: сульфаты восстанавливались до се-
роводорода организмами типа Desul-
fovibrio, а этот газ в свою очередь исполь-
зовался как донор водорода фотосинтези-
рующими бактериями, которые продуци-
ровали сульфаты или серу и накапливали
углерод в виде органических соединений.
Открытие нового класса микроорганиз-
мов - десульфомонад, использующих эле-
ментарную серу в качестве конечного ак-
цептора электронов с образованием серо-
96
ГЛАВА 5
водорода, добавляет к этому круговороту
новое гетеротрофное звено. Элементарная
сера, вероятно, использовалась также как
донор электронов в анаэробном фотосин-
тезе, как это происходит у современного
Chromatium buderi и других микробов [969].
Одновременно с синтезом изопренои-
дов или даже раньше должны были воз-
никнуть пути синтеза корриноидов (в виде
одной или нескольких сем). Корриноиды,
биосинтез которых подводит совсем близ-
ко к образованию порфиринов, встречают-
ся, видимо, в живой природе повсюду. Ис-
ходя из их функций у современных орга-
низмов и учитывая всеобщую распростра-
ненность первых этапов их биосинтеза,
можно думать, что первоначальной функ-
цией корриноидов было восстановление
рибозы до дезоксирибозы.
Первые корриноиды могли быть анало-
гичны современному кобальт-корриноид-
ному коферменту, одной из форм витами-
на В12. Вероятно, у некоторых организмов
синтез корриноидов послужил преадапта-
цией для синтеза порфиринов; древнейший
порфирин мог представлять собой гем,
сходный с содержащим хелатный ион же-
леза кофактором фермента-антиоксиданта
каталазы. Производные порфирина-тетра-
пирролы, содержащие хелатные ионы ме-
таллов,-имеются у всех современных орга-
низмов, кроме некоторых анаэробных бак-
терий. У микробов, восстанавливающих
сульфаты, они служат переносчиками элек-
тронов от сульфида к сульфату. Таким
образом, производные порфирина, такие
как железосодержащие коферменты ката-
лазы, пероксидазы и цитохромов, гем суль-
фатредуцирующих белков и гемоглобинов,
а также магнийсодержащие хлорофиллы,
должны были синтезироваться микробами-
фотосинтетиками еще до появления
первых фотоавтотрофов, выделяющих кис-
лород. Отсутствие каких бы то ни было
порфиринов у клостридиев и наличие их
у родственных бактерий, например Desul-
fovibrio, заставляет рассматривать пути
биосинтеза порфиринов как семы. Порфи-
рин как таковой у живых организмов не
встречается [783]. Хотя он может обра-
зовываться в очень малых количествах
в условиях, имитирующих, условия пер-
вобытной Земли [404], производные пор-
фиринов, находимые в древних отложе-
ниях, имеют, вероятно, биогенное
происхождение. На рис. 5.3 приводится
структура некоторых биологически важных
порфиринов; взаимоотношения между пу-
тями биосинтеза изопреноидов и порфири-
нов показаны на рис. 5.4.
Факторы отбора, способствовавшие со-
хранению биосинтеза порфиринов, были,
вероятно, разнообразны. Вначале про-
изводные корриноидов использовались, ве-
роятно, при восстановлении рибозы до де-
зоксирибозы и при синтезе белка; затем
они были закреплены естественным отбо-
ром как переносчики метильных групп и
в процессах биосинтеза, и в процессах га-
зообмена: токсичные вещества могут быть
нейтрализованы и удалены путем образо-
вания и выведения их метилированных
производных, например метиларсената.
Несколько более сложные порфирины пер-
воначально могли быть сохранены отбо-
ром из-за их способности восстанавливать
мутагенные окислительные агенты, имев-
шиеся в окружающей среде. Каковы бы ни
были первоначальные функции этих соеди-
нений, генетически закрепленная способ-
ность к их синтезу явилась ценным при-
обретением, надолго сохранившим свое
значение. Все способные к фотосинтезу
бактерии синтезируют хлорофилл, являю-
щийся производным порфирина, и все они,
очевидно, произошли от предков, синтези-
ровавших порфирины. В конце концов спо-
собные к дыханию гетеротрофные бакте-
рии стали использовать порфиринсодержа-
щие белки как переносчики электронов при
анаэробном окислении веществ пищи:
атомы водорода от двух- и трехугле-
родных молекул, например ацетата, лакта-
та и пирувата, переносились порфиринсо-
держащими белками, такими как цито-
хромы, к конечному акцептору водорода-
нитрату; в качестве конечных продуктов
образовывались молекулярный азот и за-
кись азота. У архебактерий, которые рань-
ше отделились от главной линии эволю-
ции, конечным акцептором электронов сло-
жила двуокись углерода, а образовывала
и выделялся метан.
Присутствие производных порфирина.
Хлоровиум-хлорофилл-650
Бактериальный (хлоробиум-) фотосинтез
Витамин В12 (цианковаламин)
Синтез Белка и нуклеотидов
С00С15 ^25
Хлорофилл а
фотосинтез водорослей
Бактериохлорофилл а
Бактериальный фотосинтез
СООСгоНзд
Гем
Дыхание
Рис. 5.3. Порфирины, синтезируемые прокариота-
ми.
98
ГЛАВА 5
.Пируват
Лактат-*^ ।
Ацетил-СоА—>Мевалоновая кислота—>Изопентенилпирофосфат—^Изопреноиды
Цитрат
/
Оксалоацетат
Малат
ЦИКЛ КРЕБСА
фумарат
а-Кетоглутарат = Су кцинил-СоА= Сукцинат
\s- Глицин
d-Аминолевулиновая кислота
4
4
Пирролы
4
4
Протопорфирин
4
4
Порфирины
Рис. 5.4. Отношение путей синтеза порфиринов и изопреноидов к основным биосинте-
тическим процессам, связанным с промежуточными продуктами цикла Кребса.
используемых как переносчики электронов,
преадаптировало клетки для фотосинтеза
благодаря тому, что большинство порфи-
ринов поглощает видимый свет. Древней-
шие фотосинтезирующие микроорганизмы
были облигатными анаэробами, как и со-
временные фотосинтезирующие бактерии
на свету. Считают, что фотосинтез возник
у анаэробных бактерий, так как им свой-
ственна наиболее простая форма этого
процесса с участием только фотосистемы I.
У этих бактерий фотосистема I генерирует
АТР в результате циклического фосфори-
лирования; у цианобактерий и растений
она также продуцирует восстановитель
в форме NADP H2 (рис. 5.5). Относитель-
но простой переход энергии света в энер-
гию связей АТР-это своего рода наимень-
ший делитель: он происходит у всех
фотосинтезирующих организмов. У фото-
синтетиков, выделяющих кислород, таких
как цианобактерии, фотосистема II всегда
дополняет, но никогда не заменяет фотоси-
стему I. Таким образом, анаэробный фото-
синтез должен был предшествовать более
сложной кислородной форме, для которой
нужны как фотосистема I, так и фотосисте-
ма II. Кроме того, недавно обнаружены
связующие звенья между анаэробными
серными фотосинтезирующими бактерия-
ми и выделяющими О2 цианобактериями.
Oscillatoria limnetica, нитчатая цианобак-
терия, является облигатным автотрофом.
Однако она выделяет кислород лишь фа-
культативно [169] \ При фотосинтезе этот
организм вместо воды может использо-
вать в качестве донора электронов серово-
дород или сульфид натрия с образованием
элементарной серы. Возможно, он также
1 Возможно, что этот организм неверно
идентифицирован: он мог бы быть отнесен
к имеющему чехлы роду Phormidium (S. Golubic.
1978, личное сообщение).
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
99
овп
Циклическое
фосфорилирование
Циановактерии, хлороксибактерии,
водоросли и растения
Анаэробные фотосинтезирующие
Бактерии
Нециклическое
фосфорилирование
^\\\ I ///_ _1—
Свет - —> || 2Н Н20
О
Рис. 5.5. Фотосистемы I и II. Цифрами I и II в квадратиках представлены реак-
ционные центры соответствующих фотосистем, содержащие хлорофилл. Буквами е“
обозначены переносчики электронов, такие как ферредоксин, убихинон и цитохром с.
Не существует фотосинтезирующих организмов, которые имели бы только фотосисте-
му II. ОВП-окислительно-восстановительный потенциал.
использует газообразный водород как до-
нор протонов в темновой фазе фотосинте-
за и выделяет водород и сероводород
в процессе метаболизма в темноте (М.
Shilo. 1979, личное сообщение). В постоян-
но анаэробных условиях фотосинтезирую-
щие серобактерии успешно конкурируют
: цианобактериями, факультативно исполь-
зующими водород и сульфид, которые
процветают в периодически аэрируемых
зонах. Поэтому такие «мастера на все ру-
га \ как О. limnetica, проигрывали в борьбе
за существование во всех биотопах, кроме
весьма специфических, с высокой темпера-
урой и соленостью, временами бескисло-
тчэдных, которыми, по-видимому, и огра-
ничено ныне их распространение.
Изучение О. limnetica навело Стейниера
? его коллег на мысль изучить поведение
других цианобактерий при высоких кон-
центрациях сульфидов в анаэробных усло-
виях. Около половины исследованных ла-
зсраторных культур оказались способны-
ми к фотосинтезу в бескислородных усло-
виях и росли, используя серу в качестве
донора электронов (R.Y. Stanier, 1979, лич-
ное сообщение). Такие физиологические
данные подкрепляют основанную на мор-
фологии гипотезу о происхождении циано-
бактерий от фотосинтезирующих серных
бактерий.
До середины 70-х годов считалось, что
среди прокариот только цианобактерии
выделяют кислород при фотосинтезе.
Большинство этих организмов синтезирует
несколько фикобилипротеинов, таких как
фикоцианин, аллофикоцианин и фикоэри-
трин, и хлорофилл а, но никогда не хлоро-
филл Ь. В последнее время, однако, были
обнаружены прохлорофиты - выделяющие
О2 фотосинтезирующие прокариоты без
сине-зеленых пигментов [549, 550].
Prochloron, единственный описанный род
прохл орофитов,-это коккоидный прока-
риотический организм, сходный по физио-
логии фотосинтеза и пигментам с расте-
ниями. Он содержит хлорофиллы а и
b примерно в соотношении 1:4. У прохло-
рофитов нет типичных для цианобактерий
фикобилипротеинов и содержащих их
100
ГЛАВА 5
Рис. 5.6. Prochloron. А и Г-
Prochloron sp. Это внекле-
точный симбионт дидем-
ниды Diplosoma virens в воде
на глубине 1,5 м у побе-
режья Палау. Фото Ralph
A. Lewin. A. Prochloron sp.
(Р) в процессе деления в по-
лости клоаки оболочника-хо-
зяина ; h - клетка хозяина;
hn-ядро клетки хозяина;
t-тилакоид; cw-клеточная
стенка Prochloron; п-ну-
клеоид. Б. Популяция
Prochloron sp. (р) на стенке
клоаки дидемниды-хозяина
(с). Фото получено с по-
мощью сканирующего
электронного микроскопа,
х 1750. В. Prochloron sp.
в процессе деления (d). Рас-
положение тилакоидов на
периферии создает впечатле-
ние толстой клеточной стен-
ки. Световая микрофотогра-
фия искусственно силицифи-
цированных клеток [308].
Г Адгезия между тканью
хозяина и зелеными фото-
синтезирующими прокарио-
тами, х 2800. [Kitt Lee,
Univ, of Nebraska.]
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
101
структур - фикобилисом. Таким образом,
по пигментации, но не по строению клеток
эти организмы сходны с зелеными водо-
рослями (рис. 5.6.). Структурно они почти
не отличаются от цианобактерий и неко-
торых других бактерий1. Так как их еще не
выращивали в культуре, о них мало что
известно; не решен, например, вопрос
о том, произошли ли они от цианобакте-
рий или независимо от анаэробных фото-
синтезирующих бактерий. Тем не менее
1 По моему мнению, эти организмы заслу-
живают статуса типа-Chloroxybacteria. Во вся-
ком случае их следовало бы называть хлорокси-
бактериями или Prochloroplasta: эти названия
указывали бы на их принадлежность к прока-
риотам, но не наводили бы на мысль, что эти
организмы были прямыми предками зеленых
водорослей.
эти организмы образуют связующее звено
между фотосинтезирующими прокариота-
ми и хлоропластами зеленых водорослей,
других протистов и растений.
Открытие Prochloron намного повы-
шает вероятность того, что фотосинтетиче-
ские пигментные системы, содержащие
хлорофилл Ь, возникли у прокариот еще до
того, как последние в результате симбиоза
стали пластидами эукариот. Если это так,
то фотосинтез «растительного типа» с вы-
делением кислорода возник вовсе не у зе-
леных растений, а у выделяющих О2 фото-
синтезирующих бактерий-зеленых и сине-
зеленых.
Хотя у бактерий нет типичного полово-
го размножения, при котором каждый из
родителей передает потомству одинаковое
количество генетического материала, у них
102
ГЛАВА 5
может происходить рекомбинация ДНК на
молекулярном уровне (в отличие от «пере-
тасовки» хромосом, характерной для мейо-
за). Потомство, таким образом, получает
от родителей неравное число генов. Когда
в истории жизни возникла рекомбинация
молекул ДНК? Репарация повреждений
ДНК, вызываемых ультрафиолетом, и ре-
комбинация осуществляются отчасти оди-
наковыми ферментами; вероятно, эволю-
ция ферментативного аппарата репарации
повреждений, вызываемых ультрафиоле-
том, преадаптировала бактерий к разви-
тию механизмов рекомбинации [77, 1027].
Перенос ДНК между различными бакте-
риями могут осуществлять бактериофаги,
и этот процесс часто индуцируется ультра-
фиолетовым облучением. Таким образом,
важный компонент полового процесса-ме-
ханизм ферментативного образования ре-
комбинантных молекул ДНК-возник на
ранних этапах эволюции, задолго до мейо-
за, у факультативно и, возможно, облигат-
но анаэробных прокариот.
До накопления кислорода в атмосфере
микробам должен был угрожать сол-
нечный ультрафиолет, достигавший по-
верхности Земли. Механизмы защиты от
повреждения ультрафиолетом и репарации
ДНК, например фотореактивация, вероят-
но, возникли очень рано; многие из них
найдены даже у облигатных анаэробов
[762]. По крайней мере некоторые из этих
механизмов сохранились и в дальнейшем,
так как лежащие в их основе реакции ока-
зались очень полезными в связи с половы-
ми процессами, которые позднее закрепля-
лись благодаря своим собственным пре-
имуществам. Однако шансы найти в иско-
паемом материале прямые данные об
эволюции механизмов защиты от ультра-
фиолета крайне малы.
Филогению прокариот пытались рекон-
струировать различные авторы. Э. Брода
[111] основывался на многих признаках;
схема Олмэсси и Диккерсона [18] бази-
руется главным образом на амино-
кислотных последовательностях белков,
а Фокса и Вёзе-на первичной структуре
нуклеиновых кислот (Fox, в печати). В об-
щих чертах все эти схемы совпадают с фи-
логенией, представленной в гл. 6 настоя-
щей книги. По мере накопления новых
данных неизбежны будут уточнения, а воз-
можно, и крупные изменения. Однако нет
сомнений в том, что основные пути мета-
болизма, характерные для жизни в целом,
сложились у прокариот-скорее всего в ар-
хейское время. Есть ли прямые свидетель-
ства этих колоссальных метаболических
новшеств в архейских отложениях? Это мы
увидим в следующем разделе.
Дофанерозойские ископаемые
Нет, по-видимому, никаких указаний на то, чтобы метаболизм строматолитов и онко-
литов из карбонатных пород Булавайя (возраст около 2,7 млрд, лет), Вентерсдор-
па (около 2,3 млрд, лет) и Трансвааля (около 2 млрд, лет), а также почти всех более
поздних докембрийских карбонатов
зойских и современных аналогов.
Существуют три главных источника
сведений о жизни в дофанерозое: микро-
фоссилии, химические ископаемые и стро-
матолиты, ассоциированные с хорошо да-
тируемыми породами. Тщательное иссле-
дование этих ископаемых, а также окру-
жающих пород позволяет в какой-то мере
проследить раннюю историю жизни. Об-
ширные, хорошо сохранившиеся выходы
архейских и протерозойских осадочных по-
чем-либо отличался от метаболизма их палео-
Девидсон, 1965 [204]
род известны на многих континентах. Не-
которые места наиболее важных находок
перечислены в табл. 5.5.
Микрофоссилии исследуют в тонких пе-
трографических срезах (шлифах) с по-
мощью светового микроскопа. Наиболее
хорошо сохранившиеся образцы встре-
чаются в кремнистых сланцах. Эти микро-
кристаллические кварцевые породы рассе-
кают на более или менее прозрачные слои
Таблица 5.5. Ископаемые свидетельства дофанерозойской жизни
Примерный возраст, млрд, лет Формация Идентифицированные типы микробов Характер ископаемых1, 2 Источник данных
>3,7 >3,4 >3,4 3,0-2,7 2,5 2.0 Формация Исуа (Западная Грен- ландия) Формация Шеба (группа Фиг-Три, Южная Африка) Северный бассейн Варравоона (Зап. Австралия) Известняки Була- вайя (Зимбабве) Суданская железис- тая формация (се- веро-восток Миннесоты, за- пад Онтарио) Мичепокотен (Ву- мен-Ривер, Онта- рио) Трансвааль (Юж- ная Африка) Железистая форма- ция Ганфлинт (глинистые слан- цы, известняки) (Онтарио) Формация Набер- ру (Зап. Австра- лия) Нет; сильно мета- морфизованные отложения Неидентифициро- ванные формы Неидентифициро- ванные формы Цианобактерии, другие бактерии Бактериальные споры; бактерии, окисляющие ме- таллы Неидентифициро- ванные микро- структуры Petrasphaera - циа- нобактерии с ге- тероцистами Eoastrion, Kakabekia (Metallogenium- подобные микро- фоссилии; см. рис. 5.9,Ж)3 Siderocapsa-подоб- ные, Metalloge- ишт-подобные микрофоссилии; Sphaerotilus-подоб- ные и Siderococ- cus-подобные бактерии (желе- зобактерии) Значительно повышено отно- шение 12С/13С в графитах Микрофоссилии в процессе деления; отложения, бога- тые углеродом Микрофоссилии, стромато- литы, повышенное отно- шение 12С/13С, пристан, фитан, высокое содержа- ние восстановленного уг- лерода Строматолиты, водорослепо- добные микрофоссилии, повышенное отношение 12С/13С в органическом ве- ществе по сравнению с карбонатами из тех же образцов Обилие строматолитов, мик- рофоссилии, органические отложения 12С/13С и 34S/35S, биоген- ные железистые и серные отложения Строматолиты Марганцевые строматолиты, органические отложения Строматолиты, разные мик- рофоссилии; некоторые ас- социированы с окислами железа и пиритом [812] [35, 491, 771] [35, 256, 825] [81, 405, 676, 827] [675, 677, 678, 827, 997]; L.A. Na- gy, 1980 (личн. сообщ.) [166, 345] H.G. Tho- de, 1977 (личн. сообщ.) [675, 676] [38, 56, 522] [829] [554] [162, 827]
104
ГЛАВА 5
Продолжение табл. 5.5
Примерный возраст, млрд, лет Формация Идентифицированные типы микробов Характер ископаемых1,2 Источник данных
Цианобактерии Повышенное отношение 12С/13С, пристан, фитан [705]
2,0-1,9 Поясные формации (Вайоминг, Мон- тана); глинистые сланцы Nonesuch (северный Мичи- ган) Спороподобные цисты, многока- мерные формы, сходные с фора- миниферами, чех- лы цианобакте- рий, цианобакте- рии Строматолиты, повышенное отношение 12С/13С, раз- личные органические ве- щества, фитан, пристан, ванадилпорфирины, опти- чески активные органиче- ские соединения [101, 818, 823, 825]
1,8 Множество по все- му миру (найде- ны и более позд- ние ПЖФ) Как в железистой формации Ган- флинт (Eoastrion, Kakabekia) Исчезновение ПЖФ, их за- мещение красными слоями [162, 164, 165, 522]
1,8 Бек-Спрингс (Альберта, Кана- да) Цианобактерии; хризофиты (эука- риоты) Микрофоссилии в стромато- литах [165, 554]
1,0 Сланцы Nonesuch (Мичиган) Цианобактерии Микрофоссилии5, нефть, неф- тяные сланцы [54]
Формации Биттер- Спрингс, Алис- Спрингс (Цент- ральная Австра- лия) Цианобактерии, зе- леные водоросли (Chlorophyta)4, разные ассоциа- ции Микрофоссилии, стромато- литы [54, 828, 830]
0,75 Эдиакара (Южная Австралия) и не- сколько других местонахожде- ний в самых раз- ных районах Несколько основ- ных типов живот- ных Остатки высокоразвитых Metazoa [332]
50 млн. лет6 Глинистые слан- цы Г рин-Ривер, (Сев. Америка) Большое разнообразие орга- нических веществ, много необычных изопреноидов; линейные, разветвленные и циклические алканы; ка- ротан, фитан, пристан, про- изводные стероидов (си- тостан, тритерпены, стера- ны, холестан) [131, 132, 274, 275]
1 Обзор обширной литературы по дофанерозойским микрофоссилиям см. [826]. Известно около 60 местонахождений хорошо
развитых микрофоссилий в кремнистых сланцах, и это число растет.
2 Подробное обсуждение строматолитов, которые встречаются еще в архейских отложениях, но становятся доминирующими
в протерозойских, см. [997]. Известны сотни местонахождений протерозойских строматолитов. Полную библиографию дофанеро-
зойских находок см. [38].
3 Обсуждение удивительного Kakabekia-подобного организма, сложного прокариотического гетеротрофа диаметром 5-10 мкм
на центрально прикрепленном стебельке длиной 5-15 мкм, растущего в биотопах, богатых аммиаком, см. [857].
4 Автор не согласен с этими идентификациями [307, 308, 604].
3 Появляются сведения о Chitinozoa, Chamia, Chuaria и других крупных дофанерозойских ископаемых из глинистых и крем-
нистых сланцев; многие из этих форм, возможно, родственны эукариотам [488].
6 Хотя это не дофанерозойские ископаемые, они включены в таблиц) для сравнения. В фанерозойских отложениях встре-
чаются остатки представителей всех пяти царств организмов.
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
105
толщиной не более 100 мкм. Ископаемые
и минеральный матрикс, в котором они за-
ключены, исследуют при помощи обычной
световой и поляризационной оптики. Боль-
шинство лучших микрофоссилий вкра-
плены в черные кремнистые сланцы с вы-
соким содержанием углерода (обычно не-
сколько менее 1% по весу), хотя некоторые
встречаются и в глинистых сланцах. Из
глинистых сланцев микрофоссилии прихо-
дится освобождать мацерацией в соляной
и плавиковой кислотах, так как эти сланцы
непрозрачны. Если количество микрофос-
силий невелико или изучение тонких срезов
затрудняют сопутствующие минералы, то
и кремнистые сланцы растворяют путем
кратковременной обработки плавиковой
кислотой. Освобожденный органический
материал собирают для исследования. На-
ряду с морфологическим исследованием
микрофоссилий часть тех же образцов
можно исследовать методами газовой хро-
матографии и масс-спектроскопии. Анализ
и идентификация органических веществ,
выделенных из осадочных пород,-один из
крупных разделов работы в области орга-
нической геохимии. Обнаружение значи-
тельных количеств разнообразных органи-
ческих соединений в «каменном соке» из
древних отложений привело к созданию
концепции «химических ископаемых» [131,
675].
Можно ли отличить пребиотическую
органику от биотической? Сделать это не-
легко. Среди первичных органических со-
единений, необходимых для репликации,
которые синтезировались под действием
солнечного излучения, вероятно, были лег-
ко образующиеся мономеры-аминокис-
лоты и компоненты нуклеиновых кислот
(нуклеотиды и пары нуклеотидов). Многие
изомеры низкомолекулярных органических
веществ, более разнообразные, чем
в живых системах, скорее всего возникали
абиотическим путем. Наверное, должны
были также синтезироваться смолообраз-
ные полимеры, сходные с неидентифициро-
ванным материалом, часто образующимся
в «экспериментах по происхождению жиз-
ни». Их, однако, трудно отличить от изме-
ненных биогенных полимеров. Углеводо-
роды, в том числе ароматические, нахо-
димые в углистых метеоритах, вероятно,
синтезировались и в пребиотическую эпоху
на Земле. Изомеры сахаров и аминокислот
в отсутствие жизни скорее всего образовы-
вались в виде рацемических смесей [302].
В органических продуктах биосинтети-
ческих процессов, в частности фотосинтеза
и хемоавтотрофного метаболизма, отно-
шение 12С/13С выше, чем в абиотических
органических соединениях [53]. Восстано-
вление микробами сульфатов до сульфи-
дов приводит к обогащению 34S относи-
тельно 35S. Эти изотопные эффекты обыч-
но не возникают геохимическим, небиоло-
гическим путем [345], хотя нужно было бы
более детально изучить изотопный состав
различных абиотических смесей. Следует
ожидать, что в пребиотическом органиче-
ском материале из осадочных пород не бу-
дет полимеров аминокислот, соединенных
только пептидными связями, как в белках
живых клеток [1035]. Скорее можно ожи-
дать разнородности связей, как в соедине-
ниях вроде полиангидридных сополимеров,
полученных Фоксом и другими исследова-
телями [303, 304, 736]. Однако ни оптиче-
ская активность, ни обогащение изотопом
12С или 34S, ни отсутствие нормальных
пептидов не позволяют строго отличить
пребиотический органический материал от
биотического. Таким образом, при иденти-
фикации углерода в архейских отложениях
как пребиотического или биотического
в каждом случае необходима тщательная
оценка пригодности упомянутых критериев
биогенеза.
Сохранению органических веществ
в осадочных породах угрожает множество
опасностей. Вещества, которые отклады-
ваются одним видом организмов, могут
послужить пищей для других видов. Они
могут смешаться с остатками других орга-
низмов, их частей или продуктами их жиз-
недеятельности. Они могут также раство-
риться или улетучиться. Даже если они
защищены окружающими породами от
микробного разложения, на них могут по-
влиять физические и химические изменения
в самих породах, т.е. явления диагенеза.
Изменения, привносимые деградацией
и диагенезом, по-видимому, значительнее,
чем изменения, связанные с биологической
106
ГЛАВА 5
Кварцитизированный песчаник, конгломерат
Формация Бавианскоп Песчаник, сувграуванка, 5000
грит, глинистые сланцы
685 м
Кварцит, конгломерат
S о Формация СУБграувакка, грит, глинистые сланцы
о о го Осадочные породы, Джоз-Лак 740 м г * 1 N Железистые кварциты (джаспилит), 4000
в богатые « песчаником 3000 м амигдалоидные лавы, ко нгло ме р ат СуБграувакка, грит,
S СО С=
С L глинистые сланцы
L—
Формация Клипа Железистые кварциты (джаспилит) 3000
1600 м СУБграувакка, грит, глинистые сланцы,
кварциты
< Базальный конгломерат
"ж > « * »z* ♦ Z =х |Г* Агломераты, лавы 2000
Формация Шонгезихт Туфы
550 м Кпемнистые сланцы Брекчии
Z о IlkJvivinrIV 1 Mlw и/1Ы11Ци1«ОГ vn irlrl Темно-зеленые глинистые сланцы Туфы
ю Формация Бельвю-Роуд 600 м 7////////////Л
см Существенно - Песчаные сланцы Кремнистый сланец Кремнистый сланец с
X —
глинистая — железистыми слоями
L. X осадочная з толща бКЯЖЮИЙ Кремнистый сланец 1000
е 2150 м
со с Граувакка
5 £ Формация Шева 1000 м Глинистые сланцы Кремнистый сланец с
железистыми слоями Граувакка Глинистые сланцы 0 М
ии
Рис. 5.7. Разрез отложений системы Свазиленда (Барбертон Маунтен Лэнд, Южная
Африка) [164].
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
107
Ом
1000
— 2000
— 3000
— 4000
— 5000
— 6000
7000
вооо
9000
10 000
11 000
12000
— 13000
— 14000
— 15000М
эволюцией; поэтому их нужно выявить
и учесть, прежде чем делать какие-либо
выводы о сообществах древних организ-
мов. В настоящее время последователь-
ность отложения органических веществ
в дофанерозойских породах (см. табл. 6.11)
может быть выведена только из последо-
вательности, в которой могли возникнуть
в процессе эволюции основные метаболи-
ческие пути микробов, и неизбежно будет
лишь крайне упрощенным отражением ре-
альных судеб биогенных органических ве-
ществ в течение 3 млрд. лет.
После появления первых архейских ми-
кроорганизмов происходил постоянный
синтез оптически активных веществ, высо-
коспецифических изомеров органических
соединений. Полимеризация аминокислот
обязательно должна быть сопряжена с по-
лимеризацией нуклеотидов, так как для ре-
пликации клеток необходим одновремен-
ный синтез тех и других полимеров.
Ацетат, лактат, пируват, аланин, глицин,
рибоза, дезоксирибоза и другие низкомоле-
кулярные вещества должны были концен-
трироваться в клетках. Действительно, из
архейских пород можно выделить разно-
образные растворимые соединения-ами-
нокислоты, порфирины и изопреноиды, хо-
тя в связи с пористостью горных пород
108
ГЛАВА 5
маловероятно, что эти вещества сингене-
тичны с самими породами. Много древне-
го органического вещества сохранилось
в форме керогена - неэкстрагируемого,
чрезвычайно сложного органического по-
лимерного материала, в изобилии встре-
чающегося в сланцах и других богатых
углеродом осадочных породах. «Достоин-
ство» керогена в его автохтонности: он не
загрязнен более поздними органическими
веществами [676]. Возможно, кероген
скрывает тайны ранней эволюции организ-
мов и экосистем. Кероген был подвергнут
для исследования разложению довольно
жестким методом озонолиза [678]; трудно,
однако, оценить влияние этой процедуры
на исходные органические вещества.
Был проведен геохимический анализ
темных слоев строматолитов из Булавайя
в Южной Африке. Найдены значительные
количества разнообразных органических
соединений. Каково значение этих данных?
В богатых углеродом слоях строматолитов
сканирующий электронный микроскоп по-
зволил выявить структуры, напоминающие
споры [678]; считают, что строматолиты
Булавайя - это остатки высокоразвитых
разнообразных по составу сообществ фо-
тосинтезирующих микроорганизмов, в том
числе спорообразующих бактерий.
Включения, вероятно представляющие
собой остатки бактерий, обнаружены
в древнейших из известных неметаморфи-
зованных осадочных пород из системы
Свазиленда в Южной Африке (рис. 5.7).
Возраст этих мощных отложений соста-
вляет от 3400 до 3100 млн. лет. В крем-
нистых сланцах из Фиг-Три найдены, по-
видимому, остатки бактерий в процессе
клеточного деления [491] (рис. 5.8)1. Неко-
торые из этих сланцев, на нижней границе
формации Шеба, очень богаты восстано-
вленным и элементарным углеродом. Со-
держание углерода в этих отложениях
чрезвычайно велико: видимо, условия
и скорость его отложения близки к тем,
которые характерны для гораздо более мо-
Еще более интересные микрофоссилии
возрастом 3400 млн. лет недавно были обнару-
жены в формации Варравоона в северо-запад-
ной Австралии (см. [35]).
лодых пород. Эти наблюдения позволяют
предположить, что разнообразные экоси-
стемы, основанные на микробном фото-
синтезе, функционировали в архее пример-
но 3400 млн. лет назад [771]. Структуры,
интерпретируемые как остатки бактерий,
в том числе цианобактерий, к настоящему
времени обнаружены в богатых углеродом
кремнистых сланцах во всех дофанерозой-
ских слоях. Многие из них великолепно со-
хранились [818, 822, 825]. Простейшие
и наиболее древние из них-это сфериче-
ские образования из скальных формаций
группы Фиг-Три. Шопф [826] утверждал,
что эти сферы-не бактерии, а остатки пре-
биотических структур, сходных с микро-
сферами, которые образуются спонтанно
в лабораторных условиях при смешивании
некоторых органических соединений. Воз-
можно, что в этих ранних сообществах со-
вместно существовали и пребиотические,
и биотические образования. Во всяком слу-
чае детальное исследование системы Сва-
зиленда [771] и изучение изотопного со-
става углерода из еще более древней
(возраст около 3800 млн. лет) формации
Исуа в Гренландии [811] позволяют ду-
мать, что жизнь возникла задолго до обра-
зования системы Свазиленда.
Хотя архейских ископаемых известно
еще очень мало-возможно, из-за геологи-
ческих условий, не благоприятствующих
образованию и сохранению больших ми-
кробных «матов» [489],- протерозойские
находки многочисленны. Ко времени фор-
мирования отложений Ганфлинт в южном
Онтарио и соседних отложений в северной
Миннесоте (около 2 млрд, лет назад) были
широко распространены различные типы
фотосинтезирующих прокариот (рис. 5.9)
[56, 488]. В кремнистых сланцах Трансваа-
ля в Южной Африке, возраст которых со-
ставляет около 2300 млн. лет, по-видимо-
му, сохранились акинеты и гетероцисты-
специализированные структуры нитчатых
цианобактерий [676]. Обширные слои до-
фанерозойских строматолитов формирова-
лись, вероятно, так же, как формируются
такие слои сейчас-путем улавливания,
связывания и осаждения материала субли-
торальными и литоральными сообщества-
ми цианобактерий и других бактерий
Рис. 5.8. Сравнение современных бактерий и микро-
фоссилий. А-Е, Л. Световые микрофотографии микро-
фоссилий в тонких срезах кремнистых сланцев возра-
стом более 3400 млн. лет из системы Свазиленда
в Южной Африке (в одинаковом масштабе). Ж-К. Со-
временные коккоидные цианобактерии (в том же
масштабе). Внизу слева-электронные микрофотогра-
?)ии предполагаемых бактерий, возраст 2 млрд, лет
829]. (А-Л из [491].)
110
ГЛАВА 5
Рис. 5.9. Микрофоссилии из крем-
нистых сланцев формации Ган-
флинт. А. Скалы Ганфлинт близ
Шейбера, Онтарио. Б. Петрографи-
ческий тонкий срез кремнистого
сланца с многочисленными микро-
фоссилиями. х 300. В. Gunjlintia
grandis Barghoorn - микрофоссилии,
чрезвычайно распространенная
в некоторых фациях, х 750. Г. Два
образца Kakabekia umbellata
Barghoorn, тоже очень многочис-
ленной в некоторых фациях. Эти
ископаемые имеют разнообразные
звездчатые формы; некоторые из
них внещне неотличимы от совре-
менных бактерий, окисляющих Мп
и Fe, предположительно относя-
щихся к роду Metallogenium. х 750.
Д. Leptoteichus golubicii Barghoorn,
недавно идентифицированный мик-
роорганизм, часто встречающийся
в кремнистых сланцах Ганфлинт.
х 750. Е. Eoastrion, микрофоссилия
из фации Фрастрейшн Бэй; орга-
низм, поразительно сходный
с Metallogenium. х 750. Ж. Слева:
Eoastrion на тонком срезе, сделан-
ном Е.S. Barghoorn. Справа: осад-
ки, образуемые загадочными окис-
ляющими марганец организмами
(Metallogenium), предоставленными
А. Заварзиным и выращенными
Е. Gong на бактоагаре с 0,000001%
ацетата марганца. Дифферен-
циальный фазовый контраст по
Номарскому, х 300. [Р. Е. Cloud,
Jr., Univ, of California, Santa
Barbara (A); E. S. Barghoorn, Har-
vard Univ. (Б-Е).]
ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ
111
(главным образом нитчатых форм с чехла-
ми) [659, 997].
Некоторые протерозойские микрофос-
силии поразительно сходны с современны-
ми микробами по размерам, морфологии,
типу распада, распространению и другим
признакам [37, 491, 829]. Например, кок-
коидная цианобактерия Eosynococcus из по-
роды возрастом 2300 млн. лет (о. Белчер
в Гудзоновом заливе) настолько похожа на
современную коккоидную водоросль
Gloeothece, что только специалист может
их различить [342]. Фотосинтез с выделе-
нием О2 был широко распространен в ли-
га
Н
С
S
р
АММИАК
МЕТАН
Clostridium и
фотосинтезирующие
Бактерии
Sercina,
Methanococcus
ДР' х С02
аглЕРодд
СО
NH3
СН.
все
Почти
организмы
Пурины, пиримидины
и аминокислоты
учие амины и
органические кислоты
Распад порфиринов
и активность
молочнокислых
ч_____Бактерий
Бактерии,
осуществляющие
фотосинтез
или смешанное
кислотное и
Бутиленгликолевое
Брожение
Micrococcus,
молочнокислые
бактерии и др.
v
Нуклеиновые Цистеин
кислоты и Белков
БеЛНИ [СН2О]л
Са2*
Фотосинтезирующие
Бактерии и
Clostridium
S042"
Фотосинтезирующие
Бактерии, зеленые
серные Бактерии и
пурпурные серные
^Бактерии
СаСОч Desulfovtbrio „ „
п™™., I Desulfurgmontn
Осадок 1
ИЗВЕСТНЯКИ
S04
СУЛЬФИДЫ ЖЕЛЕЗА
ВОССТАНОВЛЕННЫЙ УГЛЕРОД
Рис. 5.10. Биогеохимические циклы в анаэробном мире. Изогнутая линия-горизонт,
выше-атмосфера, а ниже-вода и осадочные породы. Так как для фосфора летучая
форма неизвестна (за исключением, возможно, фосфина РН3), он мог распространяться
в атмосфере в виде смеси фосфатов актиноспорами, эндоспорами и другими частицами.
112
ГЛАВА 5
торальных, подводных и наземных биото-
пах в раннем протерозое, если не раньше.
Первыми создали кислородную атмосферу
именно фотосинтезирующие прокариоты,
а не растения. Прямые геологические сви-
детельства в виде окисленного железа
и других минералов подкрепляют предста-
вление о том, что 2000 млн. лет назад зем-
ная атмосфера уже была богата кислоро-
дом [164]. Присутствие железистых слоев
в Свазилендской последовательности (а
возможно, даже в породах из Исуа) может
означать, что фотосинтез с выделением
кислорода возник намного раньше. Поло-
счатые железорудные формации (ПЖФ),
в которых чередуются слои, богатые
окисным и закисным железом, характерны
для позднеархейских и раннепротерозой-
ских отложений [164]. Их образование
прямо связывают с выделением О2 прока-
риотами [522]. В более молодых породах
такие отложения встречаются значительно
реже; в позднем протерозое их сменяют
полностью окисленные отложения, что го-
ворит о формировании атмосферы, бога-
той кислородом.
Весьма возможно, что в архейском эо-
не, во времена анаэробов, когда сине-зе-
леные и зеленые фотосинтезирующие бак-
терии еще не выделяли в атмосферу моле-
кулярный кислород, уже сформировались
все главные метаболические и фермента-
тивные системы прокариот: брожение, био-
синтез липидов с эфирными и сложноэфир-
ными связями, метаногенез, гликолиз, глю-
конеогенез, образование клеточных стенок
и стенок спор (для которого нужны диами-
нопимелиновая кислота, глюкозамин, пек-
тины, т. е. полимеры D-галактуроновой
кислоты, и дипиколиновая кислота), пути
обмена трикарбоновых кислот, служащие
для различных синтезов и для генерации
АТР, различные пути фиксации азота,
анаэробный фотосинтез и связанные с ним
пути биосинтеза производных изопрена
и порфирина и соответствующих белков,
а также окисление сероводорода до серы
и отложение элементарной серы, сульфа-
тов и сульфидов. Некоторые возможные
экологические циклы в анаэробном мире
схематически представлены на рис. 5.10.
Так обстояло дело в протерозое накануне
революции, произведенной синтетиками,
выделяющими О2.
ГЛАВА 6
АТМОСФЕРНЫЙ КИСЛОРОД-
ПРО ДУ кт ФОТОСИНТЕЗА
Аэробиоз у микробов
Кислород ядовит! Нам, чья жизнь зависит от получения значительных количеств
кислорода, трудно осознать его токсичность. Наше видимое благополучие в при-
сутствии высоких концентраций 02 обеспечивают сложные механизмы защиты от
его достаточно сильного токсического действия.
Фридович, 1977 [309]
Выделение микробами кислорода, на-
чавшееся в протерозое и продолжающееся
доныне, имело колоссальные последствия.
Накопление кислород^ в атмосфере в ре-
зультате использования воды как донора
водорода в микробном фотосинтезе приве-
ло не только к коренному изменению хода
эволюции, но и к преобразованию всей по-
верхности планеты.
В настоящее время доминирующим
формам жизни необходим кислород. Все
представители растительного и животно-
го царств-облигатные аэробы; они по-
гибают, если содержание кислорода в ок-
ружающей среде падает ниже того диа-
пазона концентраций, к которому они
приспособлены1. Среди грибов и протокти-
стов виды, весь жизненный цикл которых
проходит в отсутствие кислорода, редки;
среди прокариот, однако, они обычны.
Многие роды прокариот состоят исключи-
тельно из строгих анаэробов; другие вклю-
чают как анаэробные, так и аэробные
виды, а отдельные штампы могут обла-
дать способностью расти как в отсут-
ствие, так и в присутствии кислорода;
и наконец, есть роды, состоящие толь-
ко из облигатных аэробов, в том чис-
ле микроаэрофилов - организмов, приспо-
собленных к росту при концентраци-
ях О 2 ниже, чем в нынешней атмосфере
(табл. 6.1).
1 Многие кишечные паразиты вторично
вернулись к анаэробиозу. На этом основан один
из методов дегельминтизации-насыщение ки-
шечника кислородом-Прим. ред.
Для эукариот нельзя составить список,
подобный табл. 6.1: все организмы, обла-
дающие митохондриями,-строгие аэробы.
Очень немногие высшие эукариоты, про-
токтисты и грибы толерантны к анаэ-
робным условиям, однако в таких усло-
виях митохондрии съеживаются (иногда
становясь невидимыми) и перестают функ-
ционировать. Эта дедифференцировка
обратима - организм способен восстана-
вливать свои митохондрии. У многих про-
тистов, живущих как симбионты термитов,
митохондрий вообще нет [86, 363]. Неко-
торые свободноживущие амебы тоже не
имеют митохондрий и превосходно живут
в иле в отсутствие кислорода [199]. К бес-
кислородным условиям приспособился и
ряд инфузорий, обитающих в песке. Так
как анаэробные эукариоты произошли от
аэробных предков, анаэробиоз у них-эво-
люционно вторичное состояние. Хотя неко-
торые растения и животные могут времен-
но переносить отсутствие О2, нет данных
о прохождении каким-либо растением или
животным полного жизненного цикла
в бескислородных условиях.
Распределение прокариот по их отно-
шению к атмосферному кислороду легче
всего понять, исходя из представления
о том, что растущая концентрация кисло-
рода была существенным селективным
фактором в то время, когда происходили
важнейшие процессы адаптивной радиации
прокариот. На то, что толерантность
к кислороду и в дальнейшем способность
к его утилизации выработались конвер-
8-39
114
ГЛАВА 6
Таблица 6.1. Аэробиоз у прокариот*
Группы организмов Облигатные анаэробы Факультативные анаэробы М икроаэрофил ы Аэробы
Тип 1. Aphragmabacteria. Не образуют клеточ-
ных стенок
Класс 1. Микоплазмы
Mycoplasma; в основном факультативные 4- 4- +
анаэробы1
Thermoplasma 4-
Archoleplasma 4-
Bartonella 4-
Anaplasma 4-
Тип 2. Ферментирующие бактерии; не синтези-
руют порфиринов
Класс 1. Молочнокислые бактерии
Streptococcus* l 2 4-
Pediococcus 4-
Leuconostoc 4-
Lactobacillus3 4- 4-
Класс 2. Клостридии
Clostridium4 4- 4-
Класс 3. Veillonellaceae
Veillonella 4-
Класс 4. Peptococcaceae
Sarcina 4-
Peptococcus5 4-
Peptostreptococcus 4-
Ruminococcus +
Класс 5. Анаэробные вибрионы
Butyrivibrio +
Lachnospira 4-
Succinivibrio 4-
Selenomonas +
Класс 6. Bacteroidaceae6. Облигатные ана-
эробы
Bacteroides +
Leptotricha 4-
Fusobacterium 4-
*В этой таблице классификация организма как аэробного и т.д. относится к тем условиям, в которых он растет и проходит
полный жизненный цикл, а не к тем, к которым он только толерантен (если не указано иное). Автор глубоко признателен
D. Ashendorf за помощь при составлении таблицы.
lM. hypopneumoniae-аэроб; М. salivarium-факультативный анаэроб, лучше растущий в анаэробных условиях.
2S. pneumoniae ранее входил в род Diplococcus.
3L. /iomo/iioc/ш-микроаэрофил; L. ruminis- анаэроб.
4C. histolyticum аэротолерантен, не образует спор в анаэробных условиях. С. adversis, С. lentoputrescens, С. sphenoides, С. tertium
и С. cannis ранее входили в род Plectridium; С. регеппе и С. putrefaciens-в род Acuformis; С. lituseburense, С. mangenoti, С. plagarum
и С. rectum-в род Inflabilis; С. malacosomase ранее включали в род Paraplectrum; С. kluyveri, С. indolis, С. thermosaccharolyticum-в род
Terminos porous; Endosporous, в настоящее время species incertae sedis, ранее включался в род Clostridium.
5Р. constellates и Р. anaerobius ранее относились к роду Diplococcus.
6B.fragilis, В. hypermegas, В. termitidis, Е. nucleatum, F. varium, F. gonadiaformans, F. necrophorum, F. perfoetens, F. necrogenes и F. russi-к
роду Sphaerophorous; B.fragilis, B. ochraceus, B. oralis, B. biacutus, B. clostridiiformis, B. putredinis, B. coordens, B. nodosa, B.Jurcosus, B. capillosus,
B. melaninogenica, B. niger, F. naviforme, F. glutinosum, F. perfoetens и Eubacterium cylindroides-к роду Pialister; B. serpens, B. clostridiiformis
mobilis, B. contellas, B. praeacutus, F. aquatile, F. symbiosum и F. plauti-к роду Zuberella.
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
115
Продолжение табл. 6.1
Группы организмов Облигатные анаэробы Факультативные Микроаэрофилы Аэробы анаэробы
Тип 3. Спирохеты7 4- 4-
Тип 4. Анаэробные сульфатвосстанавливающие организмы. Синтез гемопротеидов ограничен Класс 1. Desulfovibrio; не образуют спор Класс 2. Desulfotomaculum; образуют споры8 4- 4-
Тип 5. Метанобактерии; строгие анаэробы Metanobacterium 4-
Тип 6. Фотосинтезирующие бактерии. Синтезируют железо- и магнийсодержащие тетрапирролы, хлорофиллы и каротиноиды Класс 1. Пурпурные несерные бактерии. Фотогетеротрофы; используют органичес- кие доноры водорода Rhodospirillum* Rhodopseudomonas9 Класс 2. Зеленые серные бактерии. Используют сероводород как донор водо- рода; анаэробы Chlorobium Класс 3. Пурпурные серные бактерии; донор водорода - сероводород10 * Chromatium Thiocystis + + + 4- 4-
Тип 7. Цианобактерии (Cyanophyta)11 4-
Тип 8. Chloroxybacteria (Prochlorophyta) 4-
Тип 9. Аэробы-азотфиксаторы Azotobacter12 4-
Тип 10. Псевдомонады. Аэробные хемоавтотро- фы; метаболизм дыхательный Pseudomonas13 4-
Тип И. Аэробные грам-положительные палоч-
ки, образующие эндоспоры
Bacillus14 4- +
Sporolactobacillus +
’’Leptospira и Leptonema-единственные аэробные роды в этом типе.
“D. nigrificans ранее входил в род Sporovibrio.
9 Некоторые виды способны также осуществлять окислительный метаболизм в темноте в аэробных и микроаэрофильных
условиях.
10 Большинство видов-строгие анаэробы; только один вид, Thiocapsa roseopersicina, может расти в темноте в микро-
хэрофильных условиях.
"Многие виды растут фототрофно в анаэробных условиях, используя в качестве донора водорода Н2, Na2S или H2S.
В каждый момент фотосинтез у них исключает аэробное дыхание.
12 Строгие аэробы, но способны расти и фиксировать азот при пониженном давлении кислорода.
13 Строгие аэробы, за исключением видов, способных к дыханию путем денитрификации, например Р. aeruginosa. P.facilis,
Р saccharophila, Р. ruhlandi, P.flava и Р. palleronii ранее входили в род Нydrogenomonas.
|4Аэробы, хотя возможен органический рост в анаэробных условиях в присутствии глюкозы и нитрата; В. subtilis-строгий
хзроб; В. cereus- факультативный анаэроб. Вид В. anthracis ранее входил в род Bacterium.
116
ГЛАВА 6
Продолжение табл. 6.1
Группы организмов Облигатные Факультативные Микроаэрофилы Аэробы
анаэробы анаэробы
Тип 12. Микрококки. Имеют полный цикл
Кребса
Micrococcus +
Staphylococcus +
Тип 13. Хемоавтотрофные бактерии. Аэробы
Класс 1. Бактерии, окисляющие серу15 4- +
Класс 2. Аммоний- и нитритокцсляющие +
бактерии
Класс 3. Железоокисляющие бактерии
Siderocapsa16 4-
Gallionella 4-
Класс 4. Метилокисляющие бактерии
Methylomonas 4-
Тип 14. Omnibacteria. Гетеротрофные грам-от-
рицательные бактерии; содержат гем
Класс 1. Энтеробактерии; все аэробы или
факультативные анаэробы
Escherichia 4-
Класс 2. Простекобактерии
Н yphomicrobium 4-
Pedomicrobium +
Caulobacter 4-
Ancalomicrobium 4-
Класс 3. Группа Sphaerotilus. Имеют чехлы 4-
из гидроокиси железа или органических
веществ; образуют агрегаты клеток; стро-
гие аэробы17
Класс 4. Уксуснокислые бактерии. Имеют
прямоугольные чехлы; строгие аэробы
Acetobacter 4-
Класс 5. Группа Moraxella- Neisseria; аэро-
бы
Neisseria18 4- +
Moraxella 4-
Класс 6. Бактерии-хищники; размножаются
внутри клеток хозяина
Bdellovibrio 4-
Класс 7. Спиральные клетки; имеют поляр-
ные жгутики19
Spirillum 4- 4-
Campylobacter 4- 4- 4-
15 Большинство родов-аэробы. Thiovulum и, вероятно, Thiospira -микроаэрофилы.
16 В основном аэробы; могут расти при пониженном давлении кислорода.
,7У некоторых родов (например, Sphaerotilus и Leptothrix) можно наблюдать интенсивный рост при низком давлении
кислорода.
i8N. gonorrhoeae, N. mucosa и N. sicca ранее входили в род Diplococcus.
19 Некоторые виды-либо строгие аэробы, либо облигатные микроаэрофилы; другие могут расти аэробно, но предпочитают
микроаэрофильные условия. Большинство видов Spirillum - аэробы. S. voltans-микроаэрофил. Campylobacter-формы от микроаэро-
фильных до аэробных.
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
117
Продолжение табл. 6.1
Группы организмов Облигатные анаэробы Факультативные анаэробы Микроаэрофилы Аэробы
Класс 8. Vibrionaceae и родственные группы
V ibrio +
Aeromonas +
Photobacterium 4-
Вепескеа Класс 9. Аэробные и факультативно анаэ- +
робные палочки Pasteurella + 4-
Actinobacillus + 4-
Chromobacterium20 + 4-
Flavobacterium21 + 4-
Haemophilus Класс 10. Хламидии и риккетсии. Окисли- 4- 4-
тели глутамата 4-
Chlamydia Rickettsia 4-
Tun 15. Актинобактерии (Actinomycota, Actino-
mycetes)
Класс 1. Коринеформные бактерии
С orin ebacterium2 2 Eubacterium23 + + 4-
Propionibacterium2* Класс 2. Проактиномицеты +
Mycobacterium Bifidobacterium2 5 + +
Actinomyces26 + 4- 4-
Arachnia 4-
Streptomyces21 Micromonospora28 + 4-
Tun 16. Миксобактерии. Гетеротрофные сколь-
зящие формы
Класс 1. Нитчатые и одноклеточные сколь-
зящие формы Beggiatoa 4-
Saprospira 4-
Cytophaga29 4- 4-
Achromatium Класс 2. Миксобактерии с «плодовыми те- 4-
лами» 4-
;оС liridum-аэроб; С. violaceum-факультативный анаэроб.
21F aquatile-аэроб; F. lutescens-факультативный анаэроб.
22С. fascians -строгий аэроб; С. diphteria? может быть как аэробом, так и факультативным анаэробом.
23 Е. monilijorme, Е. multiforme, Е. cellulosolvens. Е. combesii, Е. tenue и Е. endocard it id is ранее входили в род Cillobacterium; Е.
wnj-в род Ramibacterium; Е. saburreum, Е. contort urn, Е. helminthoides и Е. ruminantium - в род Catenabacterium.
-4 Ранее- Actinobacterium; формы от анаэробных до аэротолерантных.
:'Анаэробы, хотя некоторые виды могут быть аэротолерантными в присутствии СО2.
4. humiferus-строгий аэроб; A. bovis-факультативный анаэроб, как и большинство видов Actinomyces.
:'Есть данные, что S. хронс/пйуа-факультативный анаэроб.
•* Большинство видов-факультативные анаэробы, но М. propionici-облигатный анаэроб.
;'С. hutchinsonii-строгий аэроб, как и большинство видов этого рода; С. fermentans-факультативный анаэроб.
118
ГЛАВА 6
гейтно в нескольких линиях прокариот,
указывает тот факт, что разные типы отно-
шения к кислороду встречаются в группах
близко родственных форм, например у ак-
тинобактерий. Хотя большинство циано-
бактерий использует О2, на некоторые
виды Phormidium кислород, который они
сами выделяют, может оказывать токсиче-
ское действие. Существование множества
облигатных аэробов в царстве Мопега го-
ворит о том, что дивергентная эволюция
прокариот продолжалась во время и после
образования окислительной атмосферы.
Единственным источником накопления
О 2 в протерозойской атмосфере около
2 млрд, лет назад мог быть биологический
фотосинтез [162, 164, 165, 290, 991]. Таким
образом, токсичная кислородная среда,
к которой должны были приспосабливать-
ся организмы, создавалась ими самими.
В середине протерозоя эти организмы бы-
ли прокариотами.
Почему кислород токсичен? Каковы
способы защиты от его отравляющего дей-
ствия? По-видимому, на эти вопросы нет
однозначных ответов [309, 388]. С кисло-
родом реагируют многие молекулы, обра-
зуя короткоживущие токсичные продукты,
такие как супероксидные (О2-) и гидрок-
сильные (ОН) радикалы и синглетный кис-
лород (О). Некоторые механизмы отравле-
ния кислородом связаны с образованием
перекиси водорода, которая окисляет такие
повсеместно распространенные метабо-
литы, как липоевая кислота и ацетил-ко-
фермент А. Кроме того, кислород ингиби-
рует флавопротеиды, содержащие железо
и сульфгидрильные группы; он реагирует
с углерод-углеродными двойными связями
и соответственно атакует полиненасыщен-
ные жирные кислоты [309]. Интактность
этих белков и липидов необходима для ре-
пликации клеток. Высказывалось предпо-
ложение, что некоторые классы соединений
первоначально возникли в процессе эволю-
ции как средства защиты от воздействия
повышающейся концентрации кислорода:
люциферины, которые излучают свет в хо-
де ферментативных реакций и реагируют
с кислородом таким образом, что ток-
сичные радикалы не образуются; суперок-
сиддисмутазы - железо-, марганец- или
медьсодержащие ферменты, расщеп-
ляющие супероксидные радикалы; неко-
торые изопреноиды и производные пор-
фирина. Биолюминесценция привлекала
внимание исследователей в течение более
чем полувека [385]. Свет могут излучать
бактерии, динофлагелляты, светляки,
грибы, кишечнополостные, пиросомы (из
оболочников) и рыбы (табл. 6.2.). Какова
физиологическая основа этого холодного
свечения?
Одна из интерпретаций связывает био-
люминесценцию с механизмом обезврежи-
вания кислорода [641]. Люминесцентная
система бактерии Photobacterium fischerii
нуждается в кислороде и чувствительна
к его очень низкому давлению-0,0005 мм
рт. ст. В результате реакции образуется
перекись, которая, однако, тотчас же реаги-
рует с альдегидной формой люциферина
с образованием соответствующей карбоно-
вой кислоты и воды. В итоге токсических
радикалов не образуется и излучается свет.
Предполагалось, что, поскольку функция
обезвреживания и в дальнейшем утилиза-
ции кислорода перешла к более прогрес-
сивным механизмам (использование перок-
сидаз, каталаз, эпоксидов, флавинов, изо-
преноидов и т.п.), большинство организ-
мов утратило способность к биолюминес-
ценции.
Существование неродственных систем
биолюминесценции у самых разнообраз-
ных организмов можно интерпретировать
в том смысле, что они представляют собой
древние, независимо возникшие механизмы
обезвреживания кислорода, которые под
действием отбора приобрели новые функ-
ции. Известно несколько разных систем
субстрат - фермент (люциферин - люцифе-
раза). Использование люминесценции свет-
ляками для привлечения брачного партне-
ра - сравнительно недавнее эволюционное
приобретение. С другой стороны, у неко-
торых эукариот сохранились люминес-
центные системы, возникшие, вероятно, на
ранних этапах эволюции у прокариот. На-
пример, у рыбы Photoblepharon под глаза-
ми имеются камеры, в которых растут лю-
минесцирующие фотобактерии. Эти ка-
меры могут закрываться «ставнями», пре-
граждающими путь свету. Если здоровая
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
119
рыба содержит нормально функционирую-
щих бактерий, то система в целом ведет
себя как мигающий фонарь [683]. Обнару-
жено много люминесцентных систем, осно-
ванных на симбиозе бактерий с животны-
ми, например с оболочниками или глубо-
ководными рыбами [385, 402], хотя
в целом неясно, в какой доле случаев лю-
минесценция эукариот обусловлена прока-
риотическими симбионтами. Данные табл.
6.2, где сопоставляются некоторые си-
стемы биолюминесценции, определенно го-
ворят в пользу конвергентного происхож-
дения этих систем. Последние безусловно
не гомологичны, независимо от того,
имеют ли они отношение к обезврежива-
нию кислорода.
Производные изопреноидов, широко
распространенные у прокариот (табл. 6.3),
синтезируются в крнечном счете из ацета-
та. Молекулы ацетил-кофермента А соеди-
няются последовательно с образованием
промежуточного соединения - мевалоновой
кислоты. Спиртовая группа мевалоновой
кислоты пирофосфорилируется с после-
дующим декарбоксилированием, в резуль-
тате чего образуется универсальная биоло-
гическая изопреновая единица - изопенте-
нилпирофосфат (рис. 6.1). Изопрен как
таковой не является промежуточным про-
дуктом при биосинтезе изопреноидов, тог-
да как изопентенилпирофосфат служит ис-
ходным веществом для синтеза сотен про-
изводных изопрена. К числу основных ко-
нечных продуктов биосинтеза изопренои-
дов у анаэробных бактерий относятся ко-
фермент Q (убихинон), витамин К, не-
сколько типов насыщенных и мононенасы-
щенных жирных кислот и другие род-
ственные соединения. Фитол - 20-угле-
родный изопреноидный спирт, присоеди-
ненный к различным хлорофиллам,-имеет-
ся у всех фотосинтезирующих организмов,
так же как и каротиноиды - разнообразные
40-углеродные циклические изопреноидные
пигменты оранжевого, желтого или крас-
ного цвета.
Насколько известно, замыкание кон-
цевых колец каротиноидов требует присут-
ствия кислорода. Как синтезируются каро-
тиноиды у облигатно анаэробных фотосин-
тетиков, остается загадкой; возможно, ис-
точником энергии для их биосинтеза слу-
жит свет. Есть данные, что каротиноиды
предохраняют клетку от процессов фото-
окисления (табл. 6.4.). Некоторые анаэ-
робные гетеротрофы (например, Spirochaeta
aurantia) не пигментированы, если растут
в анаэробных условиях, но синтезируют
каротиноиды в присутствии кислорода.
В то же время многие виды несерных пур-
пурных бактерий, факультативные анаэ-
робы, ярко окрашены только в анаэробной
среде. В присутствии кислорода у Rho-
dospirillaceae синтез каротиноидов подав-
ляется и они переходят к гетеротрофно-
му росту; в темноте они тоже не способны
синтезировать каротиноиды и поэтому
утрачивают пигментацию. Кислород
влияет не только на синтез каротиноидов
у отдельных организмов, но и на их рас-
пределение среди разных организмов.
Связь между аэробным метаболизмом
и способностью синтезировать витамин
К и хиноны иллюстрирует табл. 6.5. Неко-
торые изопреноиды представляют собой
сложные изомеры, весьма стабильны
и встречаются лишь у очень немногих ор-
ганизмов; они могут служить превос-
ходными биохимическими и эволюционны-
ми маркерами [960].
Стероиды, образующиеся из изопренои-
да сквалена,-это в структурном отноше-
нии тоже изопреноиды. Эти сложные поли-
циклические соединения, растворимые
в липидах, входят в состав мембран всех
эукариотических клеток. Клетки должны
либо сами синтезировать стероиды, либо
получать их извне. До недавнего времени
считалось, что у прокариот синтез этих ве-
ществ полностью отсутствует; теперь из-
вестно, что некоторые аэробные метан-
окисляющие бактерии синтезируют сте-
роиды в значительных количествах (То,
в печати). По-видимому, пути их синтеза
появились на довольно поздних этапах
эволюции метаболизма. Благодаря своей
способности непосредственно реагировать
с кислородом стероиды тоже могли перво-
начально служить для обезвреживания
малых количеств О2 и лишь позднее были
отобраны эволюцией как вещества, при-
дающие пластичность мембранам.
Порфирины имеются почти у всех орга-
120
ГЛАВА 6
Таблица 6.2. Биолюминесценция
Организмы
Структура люциферина
Возможные функции
Мопега н н н н н н н Н3С—С—С—С—С—С—С—С=О Поддержание сим-
Photobacterium Вепескеа Н Н Н Н Н Н биоза с рыбой Та же, что у Photobacterium, но необходим также флавинмононуклеотид-Н2 Привлечение хозяи- на (живут в ки- шечнике рыб)
Protoctista Dinoflagellata Gonyaulax (и другие) Actinopoda Aulosphaera Cytocladus Неизвестна, мол. масса меньше 1000 Неизвестна ?
Animalia
Cnidaria (кишечнополостные)
Anthozoa
Renilla
Stylatula
Ptylosareus
Cavernularia
Acanthoptilum
Hydrozoa
Aeuquorea
Obelia
Ct enopho ra
Mnemiopsus
Beroe
Mollusca
Самые различные,
например маски-
ровка и сигнали-
зация
Watasenia (и более 75 дру-
гих головоногих)
Arthropoda
5 видов Decapoda (кревет-
ки)
Gnatophausia
Chordata
Neoscopelus, Diaphus
Arthropoda
Cypridina (Ostracoda)
Chordata
Apogon
С-СН2-СН3
Н
H
CH2-CH2-CH2-N-
C-NHo
II
NH
Привлечение парт-
неров, межвидо-
вая сигнализа-
ция, защита, ос-
вещение
Parapriacanthus
Porichthys
Pyrosoma (оболочник)
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
121
Продолжение табл. 6.2
Организмы Структура люциферина Возможные функции
Hemichordata
Balanoglossus Ptychodera Неизвестна
Привлечение парт-
неров
Arthropoda
Фонарницы (Fulgoridae)
Грибные комары (Мусе-
tophilidae)
Жуки (Elateroidea, Cantha-
roidea, более 1000 видов)
Photinus (светляк)
Annelida Diplocardia Octochaetus Несколько видов дожде- вых червей Н1С\Н н J ? ^С—CHj—С—N—СНг—СНг—С—Н Н3С Н
Mollusca Latia и другие брюхоногие Н,С СН3 V ? ^^СНг-СН2-С=С-0—С= 0
Fungi Ascomycota Xylaria Basidiomycota (более 40 ви- дов) Неизвестна, у базидиомицетов для реакции ? необходим NAD или NADP
Armellaria
Pleurotus
Растения
Светящихся форм нет
низмов. Высказано предположение, что
они тоже возникли как средство защиты от
фотоокисления, индуцируемого видимым
светом [346].
Поскольку биосинтез дитерпеновых
изопреноидов не требует никаких метабо-
лических новшеств по сравнению с биосин-
тезом ацетил-кофермента А, тогда как
в биосинтезе порфиринов используется
сукцинат, являющийся промежуточным
продуктом как при образовании аминокис-
лот, так и в цикле Кребса; возможно, что
биосинтез изопреноидов возник в процессе
эволюции раньше, чем биосинтез порфири-
нов. Отрезок пути биосинтеза порфиринов
от ацетил-кофермента А до сукцината, ве-
роятно, возник как часть пути, ведущего
через сукцинат к соответствующему семей-
ству аминокислот (рис. 6.2). Поэтому
данный анаболический путь можно считать
преадаптацией к позднейшему развитию
пути дыхания [18], так что присутствие
у какой-либо прокариоты ферментов цикла
Кребса само по себе еще не доказывает,
что у нее функционирует этот цикл.
У всех организмов, от фотосинтезирую-
щих бактерий до человека, начальные эта-
пы синтеза порфиринов из сукцината, по-
видимому, одинаковы независимо от дета-
лей структуры конечного продукта. У ни-
122
ГЛАВА 6
Н
о ^х /СН*“
II /С\
но—с—сн2 он
Мевалоновая кислота
О О
н3с
^С—СН2 — СН2-0-1>-0-Р-0Н
Н*С ОН ОН
Изопентенилпирофоарат
Изопрен, С5Н8
Рис. 6.1. Мевалоновая кислота является пред-
шественником изопентенилпирофосфата - уни-
версального строительного блока в биосинтезе
изопреноидов. Изопрен как таковой в этом био-
синтезе не используется.
версальные этапы того или иного метабо- под сомнение часто упоминаемую мысль
лического пути следует считать самыми древними [75]; в биосинтезе порфиринов это этапы, идущие от сукцината через 5-аминолевулиновую кислоту. В табл. 6.6 перечислены некоторые производные пор- фирина, синтезируемые прокариотами. Структурные формулы некоторых из них приведены на рис. 5.3. Понятное в эволю- ционном аспекте распространение среди микробов способности синтезировать пор- фирины (как адаптация к аэробиозу) ставит о том, что эти соединения были необхо- димы для химической эволюции до воз- никновения жизни [130, 131, 278, 404]. Так же как люциферины, изопреноиды и порфирины можно связать с приспособ- лением прокариот к возрастающей концен- трации кислорода, появление других клас- сов соединений на более поздних этапах эволюции можно рассматривать как адап- тацию к использованию свободного кисло- рода в метаболизме. Формирование аэроб-
Таблица 6.3. Распространение изопреноидов у прокариот [647, 503, 960]
Соединение Расп ространение
Вакценовая кислота: СН3(СН2)5СН=СН(СН2)9СООН У большинства бактерий
Олеиновая кислота: СН3(СН2)7СН=СН(СН2)7СООН То же
СН3 1
1 Витамин К: С10Н4О2СН3(СН2—СН=С—СН2)ИН См. табл. 6.5.
Кофермент Q„: С9Н9О4(СН2—СН=С—СН2)ИН См. табл. 6.5.
। сн3 Фитол: С20Н39ОН Сквален и фитиловые эфиры Каротиноиды (например, Р-каротин, С40Н56) В составе хлорофилла у всех фотосинтезирующих бак- терий; у архебактерий1 У архебактерий1 У всех фотосинтезирующих бактерий; у многих гетеро- трофов
Метанообразующие бактерии, галобактерии и термоплазмы.
Таблица 6.4. Защитное действие производных изопрена
Соединение Организм Функция Примечание Источник данных
Каротины СН3 rXxlzCH3 сн3 сн3 СН3 СНз СНз СНз Н3с4^ СНз Фотосинтезирующие бактерии Защита от фотоокис- ления Мутанты, не содержащие каро- тиноидов, жизнеспособны в темноте в аэробных и на све- ту в анаэробных условиях, но гибнут на свету в присутст- вии О2 [503]
Р-Каротин Гетеротрофные бак- терии Chlorella, Chlamydo- monas То же Каротиноиды защищают толь- ко от видимого света, но не от ультрафиолета или рент- геновских лучей [503] [503]
Зеаксантин СН3 сн5 Г JbCHj Н0 ОН, сн3 сн3 СНз НьсхГ] СН3 СНз Zea (кукуруза) 'ОН Защита от фотоокис- ления У бесцветных мутантов хлоро- филл и каталаза разрушаются на свету в присутствии О2, но не в атмосфере азота [503]
Антераксантин CHj СН3 ЦТ СЩ СН, сн3 СНз сн, CHS CHj Водоросли Защита хло- рофилла на свету в присутст- вии О2 [42]
Витамин Е СН3 Н3С СНз сн3 CHj ^CHj Крысы (жгутики спер- матозоидов) Защита от окисления Число центриолей увеличивает- ся при недостатке витамина Е и высоком давлении О2 [403]
сн3
124
ГЛАВА 6
Таблица 6.5. Изопреноиды и аэробный метаболизм [647]
Организмы Способность к синтезу кофермента Q (убихинона) Способность к синтезу витамина К Реакция на кислород Состояние митохондрий
П рокариоты
Все исследованные облигат- Не перено-
ные анаэробы (например, Clos- tridium) сят
Rhodospirillum1 +
Н ydrogenomonas + — Факульта-
Escherichia coli + тивные
анаэробы
Bacillus mesentericus +")
Streptomyces + У Облигатные
Mycobacterium Эукариоты + J аэробы
Saccharomyces cerevisiae (дрож-
жи) при анаэробном росте Факульта- Дедиффе-
тивный ренциру-
анаэроб ются
при аэробном росте + Функциони-
руют
Neurospora crassa (аскомицет) + Облигатные Функциони-
Mucor corymbias (зигомицет) + аэробы руют
1 См. табл. 6.1, примечание 9.
ной среды открыло множество новых ме-
таболических возможностей. В царстве
прокариот стероиды в настоящее время
синтезируются в значительных количествах
только облигатно аэробными метанокис-
ляющими бактериями и, возможно, неко-
торыми цианобактериями, растущими в аэ-
робных условиях. Полиненасыщенные жир-
ные кислоты, свойственные всем эукарио-
там, вероятно, впервые появились у аэ-
робных цианобактерий. На эту мысль
наводит тот факт, что у цианобактерий,
когда у них вообще бывают полиненасы-
щенные жирные кислоты, они синтези-
руются в период автотрофного роста, т.е.
в присутствии кислорода, образующегося
в качестве отхода фотосинтеза (табл. 6.7,
[421]). Синтез тетрациклина, по-видимому,
осуществляют только аэробные актинобак-
терии, например Streptomyces [647]. То, что
синтез стероидов, полиненасыщенных
жирных кислот и тетрациклинов свойствен
только аэробам, видимо, означает, что
приобретение способности синтезировать
эти вещества было связано с доступностью
молекулярного кислорода.
Эукариоты, обладающие митохондрия-
ми, либо синтезируют нужные им сте-
роиды, либо получают их с пищей1 Около
7% сухого веса эндоплазматической мем-
бранной системы у эукариот приходится
на стероиды; по-видимому, полиненасы-
щенные жирные кислоты и стероиды необ-
ходимы всем эукариотам. Без этих соеди-
нений вряд ли вообще мог бы осущест-
вляться митоз [21, 22]. Так, например, хотя
у дрожжей в отсутствие кислорода воз-
можны мейоз и оплодотворение, в этих ус-
ловиях у них дедифференцируются мито-
хондрии и не происходит синтеза стерои-
дов и полиненасыщенных жирных кислот.
Без митохондрий и продуктов их аэробно-
го метаболизма ферментирующие дрожжи
не размножаются, если не получают нуж-
Некоторые микоплазмы содержат сте-
роиды, однако нет данных, что они их синтези-
руют. Потребность микоплазм в стероидах - ве-
роятно, следствие их паразитической жизни
в среде, богатой стероидами.
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
125
о
СООН
I
с=о
сн2
СООН
Оксалоацетат
/
f
Жирные кислоты
Глюкоза
Аминокислоты
CHy-C-SCoA
Ацет и л-СоА
Цитрат
Н2СС00Н
НО^СООН
I
Н2СС00Н
Н2ССООН
нссоон
I
с=о
I
СООН
Оксалосукцинат
СООН
Цикл Креьса
Малат
неон
J:h2
СООН
Рис. 6.2. Связь биосинте-
за порфиринов с циклом
Кребса и с синтезом не-
которых аминокислот.
ных метаболитов извне (табл. 6.8). Из этих
наблюдений можно сделать два вывода.
Во-первых, пути синтеза полиненасы-
щенных жирных кислот, стероидов, тетра-
циклинов и других соединений, для образо-
вания которых необходим молекулярный
кислород, возникли лишь после того, как
в результате фотосинтеза стал доступен
кислород. Во-вторых, эукариоты появились
только во время или после перехода к кис-
лородной атмосфере.
Вероятно, у каких-то фотосинтезирую-
щих серных бактерий накопились мутации,
позволившие использовать в качестве до-
нора водорода при восстановлении СО2
воду вместо H2S. Создание фотосистемы II
привело к появлению сине-зеленых и зе-
леных прокариот, выделяющих кислород.
Этот кислород вначале никак не использо-
вался.
В отличие от аэробных водорослей циа-
нобактерии переносят различные усло-
вия-от анаэробных до полностью аэ-
робных. Так, в водоемах приливной зоны
Мексиканского залива, полуострова Кали-
форния и в районе Абу-Даби (Персидский
залив) цианобактерии обычно находятся
в слоях, лежащих непосредственно над ме-
стообитаниями анаэробных фотосинтези-
рующих бактерий, где кислорода очень
мало или нет вовсе [423, 424]. Физиологию
цианобактерий лучше всего можно понять,
если предположить, что аэробиоз в этой
группе возник независимо в результате ме-
таболических новшеств, аналогичных тем,
которые возникали у эубактерий, актино-
мицетов и архебактерий.
У цианобактерий аэробное окисление
углеводов происходит только в темноте;
фотосинтез, осуществляемый ими на све-
Таблица 6.6. Биосинтез корриноидов и порфиринов у прокариот
Синтезируемое производное Порфирин или корриноид1 Хелатный ион металла Синтезирующие данное вещество организмы и его функция
Не синтезируется никаких произ- водных У очень немногих: у некоторых клостридиев, молочнокислых бактерий, некоторых риккет- сий и спирохет. Все эти организмы не пе- реносят О2
Витамин В}2 к Кобальт Только у пропионовокислых бактерий, стреп- томицетов и клостридиев. У эукариот не синтезируется, хотя необходим, видимо, всем организмам. Используется при метилирова- нии РНК, биосинтезе пуринов и пиримидинов, восстановлении рибозы в дезоксирибозу и син- тезе белка
Кофермент катала- зы п Железо У большинства прокариот имеется каталаза. Ее нет у некоторых молочнокислых бакте- рий, некоторых клостридиев и Ruminococcus; все они совершенно не переносят О2. Фер- мент защищает от окисления, расщепляя пе- рекись водорода на кислород и воду
Кофермент перок- сидазы п Железо У многих, если не у всех, факультативных и облигатных аэробов. Фермент расщепляет пе- рекиси и воду
Хлорофиллы п Магний У всех фотосинтезирующих бактерий. Основной светопоглощающий пигмент фотосинтеза
Гемы (коферменты цитохромов) п Железо У многих, если не у всех, факультативных и облигатных аэробов. Участвуют в окисле- нии 2- и 3-углеродных молекул, дыхании, фо- тофосфорилировании ADP. Цитохромы есть у всех организмов, осуществляющих фотосин- тез или дыхание
1 П-порфирин, К-корриноид.
Таблица 6.7. Образование ненасыщенных жирных кислот
Организмы Мононенасыщенные кислоты (в основном Cig и Cig)1 Полиненасыщенные кислоты1
с двумя двойными связями (в основном линоленовая) с тремя двойными связями (в основном линолевая)
Гетеротрофные бактерии (многие) + (В)
Фотосинтезирующие бактерии (мно- + (В)
гие)
Beggiatoa (окисляет серу) Цианобактерии [421] + (О)
Synechococcus + (О)
Haplosiphon Chlorogloea + (о)
автотрофный рост + (О) + +
гетеротрофный рост + (О)
Nostoc + (О) + +
Oscillatoria + (О) + +
Эукариотические водоросли + (О) + +
- менее 1% всех жирных кислот; + более 1% всех жирных кислот; о-олеиновая кислота; в-вакценовая кислота.
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
127
Таблица 6.8. Потребность дрожжей Saccharomy-
ces cerevisiae в стероидах и полиненасыщенных
жирных кислотах [750]
Условия роста Необходимые добавки к основной среде
Аэробные Нет
Анаэробные Эргостерол и линолевая кислота (или другой стероид и полиненасы- щенная жирная кисло- та)
ту-процесс анаэробный, как и у других
фотосинтезирующих бактерий [266, 903].
Таким образом, в отличие от фотосинтези-
рующих эукариот (водорослей и растений),
которые нормально дышат на свету, у циа-
нобактерий фотосинтез и дыхание - взаи-
моисключающие процессы. Некоторые
цианобактерии (например, Anacystis) чрез-
вычайно чувствительны к перекиси водоро-
да [623]. Эти физиологические различия
понятны с эволюционной точки зрения:
как и другие бактерии, цианобактерии эво-
люционировали в период, когда концен-
трация кислорода в окружающей среде
возрастала, в то время как эукариоты,
у которых произошла компартментализа-
ция функций фотосинтеза и дыхания, воз-
никли уже в кислородном мире и поэтому
были с самого начала адаптированы к не-
му. Взаимоотношения между фотосинте-
зом и дыханием у Prochloron изучены не
полностью, но, по-видимому, этот орга-
низм совмещает дыхание с фотосинтезом
и синтезирует гликолат так же, как расте-
ния и зеленые водоросли (R. К. Trench,
1979, личное сообщение).
Некоторые цианобактерии морфологи-
чески удивительно сходны с определенны-
ми гетеротрофными микробами (табл. 6.9).
Эти микробы не содержат хлорофилла, но
синтезируют каротиноиды, а многие окис-
ляют серу до сульфата [298]. Есть виды,
которые, подобно аналогичным цианобак-
териям, передвигаются путем скольжения,
не имея каких-либо видимых двигательных
органелл, за исключением, возможно, очень
мелких фибрилл, выявляемых с помощью
электронного микроскопа вблизи кле-
точных стенок. Механизм этого движения
остается загадкой; для него необходим
контакт с субстратом [953, 996]. По-види-
мому, эти аэробные организмы произошли
от тех цианобактерий, с которыми они
сходны. Сравнение структуры цитохромов,
выделенных из тех и других организмов,
подкрепляют такую интерпретацию [18].
То, что эти хемоавтотрофы, так же как
и цианобактерии, используют путь фикса-
ции СО2 с участием рибулозобисфосфат-
карбоксилазы, тоже совместимо с предста-
Таблица 6.9. Гетеротрофные аналоги некоторых цианобактерий1
Цианобактерия Гетеротрофный аналог Описание аналога
Lyngbya [419] Her petosi phon Скользящие организмы; синтезируют оранже- вый пигмент; гидролизуют крахмал, желати- ну, казеин и трибутирин, но не целлюлозу; нити, покрытые чехлами
Oscillatoria [902] Vitreoscilla Beggiatoa Скользящие прямые нити Прямые нити; окисляют H2S; откладывают сульфат
Rivularia [902] Leucothrix Thiothrix Нити, организованные в розетки Нити, организованные в розетки; окисляют H2S
Spirulina [546] Saprospira Thiospirillopsis Скользящие морские и пресноводные организ- мы; синтезируют каротиноиды; спиральная структура Скользящие организмы; окисляют H2S; спираль- ная структура
Хотя их окраска варьирует от белой до ярко-оранжевой, все эти организмы, вероятно, способны к биосинтезу каротиноидов.
128
ГЛАВА 6
Рис. 6.3. Микрофоссилии в тонких срезах протерозойских кремнистых сланцев. Све-
товые микрофотографии; масштабный отрезок = 10 мкм. [J. W. Schopf, Univ, of
California, Los Angeles.] А. ЬуидЬуа-подобная нитчатая микрофоссилия из Биттер-
Спрингс, Центральная Австралия. Б. Яшм/апа-подобная микрофоссилия оттуда же.
В. Сферические микрофоссилии оттуда же, первоначально интерпретированные как
остатки эукариотических водорослей (см., однако, [341, 307, 308]). Г. Ископаемые нити
из доломитов Скиллогэли, Порт-Огаста, Южная Австралия. Д. Оscillatorш-подобная
нитчатая микрофоссилия из Биттер-Спрингс.
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
129
Время - >
Рис. 6.4. Филогения прокариот.
130
ГЛАВА 6
влением об их происхождении от циано-
бактерий в результате потери способности
к фотосинтезу. В протерозойских отложе-
ниях найдены прямые свидетельства суще-
ствования цианобактерий и, вероятно, их
морфологических аналогов (рис. 6.3).
Такие хемоавтотрофные микроорганиз-
мы, как Beggiatoa и Thiothrix, могли воз-
никнуть в результате замены фотосинтеза
хемосинтезом с использованием энергии
окисления сульфида до сульфата. По такой
схеме окисление сульфида, очевидно, выра-
боталось конвергентно в нескольких ли-
ниях прокариот. То же можно сказать
о других формах хемоавтотрофии и о мик-
сотрофии - способности использовать энер-
гию прямого окисления неорганических ве-
ществ, сопряженной с потребностью
в определенном небольшом наборе орга-
нических соединений. В конце концов была
достигнута вершина биосинтетических воз-
можностей: возникло много родов обли-
гатных аэробов-хемоавтотрофных бакте-
рий, которые растут, используя О2 и СО2
из атмосферы, немногочисленные соли,
восстановленный неорганический источник
энергии и воду (например, Nitrocystis, см.
рис. 3.9). Эти организмы даже в темноте
способны синтезировать все нужные им
органические вещества. На рис. 6.4 пред-
ставлена возможная схема филогении про-
кариот, основанная на сравнительном изу-
чении метаболизма, первичной структуре
макромолекул и концепции центральной
роли атмосферного кислорода как селек-
тивного агента.
Свидетельства органической геохимии
Поистине история кислорода-это история жизни!
Траубе (1826-1894), цит. по [170]]
Одна из задач органической геохимии
состоит в том, чтобы проследить ранние
стадии эволюции путем анализа органиче-
ских соединений, содержащихся в хорошо
датируемых отложениях. У этого подхода
есть свои достоинства и свои ограничения.
Каковы перспективы проследить эволю-
цию микробов протерозоя по подробным
данным органической геохимии? Чтобы
органические соединения могли быть по-
лезны для реконструкции путей эволюции,
они должны быть сингенетичны тем поро-
дам, в которые они включены. Они дол-
жны быть биохимическими компонентами
живших ранее организмов или по крайней
мере их экскретами. Из таких веществ
и нужно стараться извлечь информацию
о той популяции организмов, которая их
синтезировала, что редко бывает воз-
можным. К счастью для исследователей
эволюции, живые организмы имеют тен-
денцию к крайнему консерватизму, как
биохимическому, так и морфологическому.
Так, практически для всех паразитов, сим-
бионтов и ископаемых организмов нахо-
дятся свободноживущие или соответствен-
но современные морфологические аналоги.
Некоторые биогенные соединения
и классы соединений чрезвычайно редки;
другие широко распространены [292].
Само по себе присутствие какого-либо со-
единения в организме еще не означает, что
организм способен его синтезировать. Та-
ким образом, эволюционные выводы, ос-
нованные только на распространении опре-
деленных веществ, легко могут быть оши-
бочными. Например, микоплазмы ну-
ждаются в стероидах, но не синтезируют
их: они получают стероиды от хозяина или
из культуральной жидкости. Некоторые гу-
сеницы приобретают оранжевую окраску,
питаясь морковью. Отложения неперева-
ренных каротиноидов, которых сама гусе-
ница не синтезирует, видны через ее про-
свечивающую кожу. Розовая окраска фла-
минго непосредственно определяется каро-
тиноидами их пищи. Присутствие значи-
тельного количества каротиноидов не оз-
начает, что гусеницы или фламинго имеют
гены, кодирующие ферменты биосинтеза
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
131
этих ярко-оранжевых пигментов. Есть
много других примеров, когда различные
вещества находят в клетках и тканях, не
способных синтезировать их. Многие био-
синтетические процессы, которые приписы-
вали клеткам-хозяевам, на самом деле осу-
ществляются незаметными симбионтами
[608, 756]. Обнаружение даже весьма спе-
цифических каротиноидов в осадочных по-
родах само по себе не говорит о существо-
вании в данный период ни гусениц, ни
моркови, ни фламинго.
Если бы мерой эволюционного про-
гресса служили только биосинтетические
возможности, многоклеточных животных
следовало бы считать гораздо менее про-
двинутыми по пути эволюции, чем хемоав-
тотрофных бактерий, которые живут в со-
леной воде, используя простейшие газы.
Как мы видели, однако, дртотрофные бак-
терии возникли на Земле задолго до чело-
века, хотя их метаболические возможности
намного шире. Как и все Metazoa, мы
имеем сложные пищевые потребности и за-
висим от микроорганизмов и растений,
снабжающих нас веществами, которые мы
не можем сами синтезировать. У жи-
вотных, как и у большинства эукариот, от-
сутствует прямая корреляция между слож-
ностью метаболизма и временем возник-
новения в ходе эволюции.
Используя продукты известных нам
биохимических путей как индикаторы эво-
люционного процесса, нужно остерегаться
«подводных рифов». Некоторые пути и их
продукты имеются у всех организмов,
а многие другие-у большинства. Такие
широко распространенные метаболические
пути или их отдельные ферменты и мета-
болиты не могут служить эволюционными
маркерами. Распространение большинства
биогенных соединений не имеет никакого
или почти никакого филогенетического
значения. Например, теперь известно, что
целлюлоза, раньше считавшаяся универ-
сальным полимером стенок растительных
клеток, отсутствует у некоторых зеленых
и красных водорослей [747]; в то же время
она синтезируется некоторыми бактериями
[902] и имеется у ряда протоктистов, таких
как миксомицеты, а также у многих грибов
[12]. Более того, хитин, который считали
характерным для экзоскелетов животных,
оказался главным компонентом клеточных
стенок многих грибов [12]. Почти любое
соединение, синтезируемое животными,
растениями или грибами, является также
метаболитом какого-нибудь прокариотиче-
ского организма [647].
В определенных случаях, однако, вариа-
ции специфических метаболических способ-
ностей могут отражать дивергенцию орга-
низмов. Так, животные, растения и грибы
в значительных количествах синтезируют
стероиды, но их циклические стеролы-пред-
шественники в этих трех царствах раз-
личны: у животных это холестерол, у рас-
тений - циклоартенол, а у грибов, как пра-
вило,-эргостерол. Эти соединения, являю-
щиеся предшественниками всего много-
образия стероидов, разве только в редких
случаях синтезируются бактериями. Сте-
роиды, найденные у метанокисляющих
бактерий и у цианобактерий, образуются
в меньших количествах, чем стероиды эу-
кариот, и отличаются от них. Таким обра-
зом, с определенной острожностью специ-
фические стероиды можно использовать
как полезные индикаторы химической фи-
логении.
К сожалению, такие индикаторные со-
единения не сохраняются в осадочных по-
родах в том виде, в каком они когда-то
синтезировались. Органические вещества,
экстрагируемые из сланцев и других оса-
дочных пород, представляют собой хими-
ческие ископаемые; как и прочие иско-
паемые, они изменились с того времени,
когда входили в состав живых организмов.
Установить, как именно они изменились,
всегда сложно. До тех пор пока не выяс-
нены химические детали микробиологиче-
ского разложения и диагенеза, идентифика-
ция источников органических веществ, на-
ходимых в осадочных породах, может
быть только предположительной. Эволю-
ционную историю микроорганизмов по-
прежнему приходится реконструировать
в основном путем сравнения современных
форм. Ископаемые остатки удается ис-
пользовать только для подтверждения вы-
водов и для установления грубой хроноло-
гии. Посмертные изменения организмов,
возможность загрязнения в поле и в лабо-
132
ГЛАВА 6
ратории, трудности исследования керагено-
вой фракции, малое число стабильных со-
единений, строго приуроченных к опреде-
ленным таксонам, и другие факторы огра-
ничивают возможности реконструкции
древних сообществ организмов по данным
органической геохимии. Приводимый спи-
сок соединений, потенциально полезных
в качестве филогенетических маркеров
(табл. 6.10), следует рассматривать с уче-
том этих трудностей. Как правило, при
анализе и сравнении древних и совре-
менных микробных экосистем изучение по-
смертных химических изменений у совре-
менных организмов методами газовой
хроматографии и масс-спектроскопии с вы-
соким разрешением нужно сочетать с хи-
мическими, седиментологическими и мине-
ралогическими исследованиями. Такие пол-
ные исследования проводятся редко; при-
мером могут служить работы по изучению
микробных сообществ Солнечного озера
в Израиле [168] и лагуны Фигероа в Ниж-
ней Калифорнии [423] (полную библиогра-
фию см. в [508]).
Биологические идентификации по
данным органической геохимии основы-
ваются на предположении, что морфоло-
гия отражает биохимию и физиологию,
а эти последние в свою очередь отражают
генетическую структуру. Большой репер-
туар метаболических возможностей тре-
бует соответственного количества уникаль-
ного генетического материала для кодиро-
вания нужных ферментов. Полагают, что
прокариоты с более крупными геномами
и более сложным метаболизмом возникли
позже. Однако у недавно возникших пара-
зитов и симбионтов геном может быть
меньше в результате утраты излишнего ге-
нетического материала. Поэтому в эволю-
ционных исследованиях обычно сравни-
вают свободноживущие формы. Изложен-
ные предположения были использованы
при построении табл. 6.11, где указана та
последовательность, в которой можно
ожидать появления ископаемых остатков
аэробных организмов в протерозойских
отложениях.
К началу протерозойской эры сообще-
ства прокариот достигли такого разно-
образия, что уже должны были проявлять-
ся экологические последствия их деятель-
ности-влияние на атмосферу и образова-
ние осадочных пород Поражает тот факт,
что у различных прокариот представлено
почти все, что достигнуто жизнью в обла-
сти биосинтеза, за немногими исключения-
ми [нет, например, некоторых уникальных
алкалоидов (в том числе печально знаме-
нитых галлюциногенных веществ), лигнина
и других полифенолов, экзотических нерв-
Таблица 6.10. Продукты метаболизма как филогенетические маркеры
Группы организмов Продукты метаболизма
Прокариоты
Все
Толерантные к кислороду (см. табл. 6.1)
Фотосинтетики (Мопега, типы 6, 7 и 8)
Актинобактерии (тип 15)
Все типы, кроме Aphragmabacteria (т.е. ти-
пы 2-16)
Споры (Мопега, типы 2, 4 и 11)
Эукариоты
Все
Обладающие ундулиподиями
Покрытосеменные (растения, тип 9)
Нуклеотиды, аминокислоты, ДНК, РНК, АТР
и т.д. (рис. 5.1)
Производные порфирина, флавопротеиды, изо-
преноиды
Хлорофилл, каротиноиды
Производные тетрациклина
Диаминопимелиновая кислота, мурамовая кис-
лота, N-ацетилглюкозамин
Дипиколинат
Стероиды, стераны, тубулин, полиненасыщен-
ные жирные кислоты, ЕгАТРазы
АТРаза динеина
Флавоноиды, терпеноиды высших порядков, по-
лифенолы (лигнаны), беталаины
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
133
Таблица 6.11. Вероятная последовательность отложения органических соединений в протерозойских
осадочных породах
Протерозойские и фанерозойские метаболические пути Древнейшие группы, обладающие этими путями Примерное время первого появления, млрд, лет назад Ожидаемые следы в осадочных породах
Фотосинтез с выделением О2, использующий хлорофил- лы а и b Сине-зеленые и зеленые прока- риоты 3,4-1,5 Окисленные соединения, неко- торые полиненасыщенные жирные кислоты и все про- изводные хлорофилла
Окисление железа, серы и азота Аэробные прока- риоты 3,0-2,0 Окислы железа и марганца, нитраты, диаминопимели- новая кислота, пектин, цел- люлоза, гликоген, мурамо- вая кислота, тетрациклины, аминогликозидные анти- биотики и все прочие про- дукты метаболизма прока- риот
Синтез стероидов, стеролов, полиненасыщенных угле- водородов, белков микро- трубочек, целлюлозы и хи- тина Клетки эукариот 1,0-0,7 Стераны и производные по- линенасыщенных углеводо- родов
Синтез хиноидов Г рибы 0,7-0,4 Производные радицинина, цитринина, цитромвектина, фульвиновой кислоты, пени- циллинов и других мета- болитов грибов
Синтез флавоноидов лигни- на, лигнанов, алкалоидов, пектинов и гемицеллюлоз Сосудистые рас- тения 0,5-0,3 Производные флавоноидов, алкалоиды и политерпены
Синтез депсидов, депсидонов, дибензофуранов и «лихено- вой кислоты» Лишайники 0,5-0,3 Производные депсидов
ных токсинов, лихеновой кислоты, флаво-
ноидов]. К началу протерозоя большая
часть биохимической эволюции была уже
позади. Микробные экосистемы, вероятно,
уже доминировали в почве, воздухе и воде
примерно так же, как сейчас. Элементы,
круговорот которых на современной Земле
обеспечивается биосферой, по-видимому,
уже циркулировали при ее участии прибли-
зительно таким же образом. Речь идет об
углероде, азоте и кислороде, а также
о многих элементах, нужных для жизни
в меньших количествах, например о каль-
ции, марганце, цинке, меди, калии и хлоре.
Если бы кто-нибудь наблюдал Землю из
космоса даже 2000 млн. лет назад, она по-
казалась бы ему неправдоподобной плане-
той, особенно по сравнению с Марсом
и Венерой. В ее атмосфере отмечалось бы
не только очень низкое содержание СО2,
но и оказалось бы слишком много кисло-
рода для того, чтобы можно было объяс-
нить присутствие свободного азота, мета-
на, водорода и углеводородов. За послед-
ние два миллиарда лет земная атмосфера
претерпела глубокие изменения в результа-
те развития аэробной биосферы; предме-
том следующего раздела будет природа
ископаемых остатков, свидетельствующих
об этом развитии.
134
ГЛАВА 6
Протерозойские ископаемые
Эти скопления водорослей широко распространены в докембрийских отложениях.
Сейчас я демонстрирую вам тонкий срез кремнистого туфа из Йеллоустона. Как
вам известно, термофильные сине-зеленые водоросли, населяющие эти термальные
воды, отличаются значительным видовым разнообразием и большой биомассой; они,
по-видимому, растут при температурах вплоть до 75°С... Силикат, который в этих пере-
насыщенных растворах может составлять 800 частей на миллион, выпадает в осадок,
составляющий основу матрикса для колоний водорослей. Сине-зеленые водоросли про-
должают расти на верхней поверхности этого матрикса, в то время как силикат
замуровывает нижние колонии. В результате возникает своеобразная организация с
образованием «столбов». Этот современный феномен в Йеллоустоне, мне кажется,
удивительно сходен со структурой пород в формации Ганфлинт, образовавшейся
2 млрд, лет назад.
Баргхорн, 1967 [50]
Хотя количественные оценки затруд-
нены, считается несомненным, что в префа-
нерозое атмосферный кислород накапли-
вался в глобальных масштабах [162, 164].
Утверждали даже [204, 232], что атмосфе-
ра содержала значительные количества
свободного кислорода уже в архее. Оби-
лие, разнообразие и сложность стромато-
литов-самое прямое свидетельство того,
что в протерозойском ландшафте домини-
ровали микроэкосистемы, состоявшие из
цианобактерий ([997]; см. также табл. 5.5).
Поразительное изобилие хорошо сохра-
нившихся цианобактерий в протерозойских
кремнистых сланцах [822, 823, 825] тоже
позволяет думать, что выделяющие О2
прокариоты-фотосинтетики существовали
не менее двух миллиардов лет назад. Вели-
чины отношения 12С/13С в древних оса-
дочных породах и следы изопреноидов,
возможно образовавшихся из липидов пу-
тем декарбоксилирования, также интерпре-
тируются как доказательство раннего воз-
никновения «кислородного» фотосинтеза
[8П].
Общая геологическая картина среднего
и позднего протерозоя (горообразова-
тельные процессы, формирующиеся конти-
ненты, профили осадкообразования,
океаны и озера с нейтральными или слабо-
щелочными водами, типы выветривания),
по-видимому, носила уже в основном со-
временный характер. Мощные протерозой-
ские отложения были исследованы у во-
сточного рукава Большого Невольничьего
озера в северо-западной Канаде. В этом
районе, у северо-западного края Канадско-
го щита, обнаружена последовательность
неметаморфизованных осадочных и вулка-
нических пород толщиной более 15 км. Да-
тировка была проведена путем измерения
отношения калий/аргон в биотите из маг-
матических интрузий. Возраст последова-
тельности пород составляет от 2,5 до 1,7
млрд. лет. Обсуждая эти отложения, Хоф-
ман из Канадского геологического упра-
вления делает следующие выводы (Р. Hoff-
man, неопубликованная рукопись, 1969):
«1. Красные слои преобладают в форма-
циях возрастом 2,17-1,70 млрд, лет; они спора-
дически встречаются и в более древних форма-
циях (2,55-2,17 млрд. лет).
2. Кристаллические гнезда каменной соли
и гипса обильны в некоторых формациях возра-
стом 2,17-1,85 млрд. лет.
3. Железняки, находимые в некоторых фор-
мациях возрастом 2,17-1,85 млрд, лет, состоят
из сцементированных кальцитом оолитовых
и гранулярных гематитовых песчаников, харак-
теризующихся горизонтальной слоистостью,
а не из слоистых кремнистых железорудных
формаций, которые обычно считаются типичны-
ми для докембрия.
4. В одной формации возрастом 2,17-1,85
млрд, лет в дельтовом песчанике, характеризую-
щемся горизонтальной слоистостью, обнаружен
в виде пеллет глауконит.
5. Строматолиты обильны во многих фор-
мациях, образовавшихся 2,55-1,70 млрд, лет на-
зад. В одной формации они образуют главный
«рифовый» комплекс толщиной 1500 футов, раз-
деляющий мелководную карбонатную платфор-
му и глубоководный бассейн, заполненный гли-
нистыми сланцами. В морских формациях стро-
матолиты относятся к типу «улавливающих
осадки», а в неморских формациях они образо-
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
135
вались за счет осаждения карбоната кальция in
situ Гем. рис. 6.5].
6. Шельфовые архейские породы, образо-
вавшиеся более 2,5 млрд, лет назад, в том числе
10000 футов ортокварцита и доломита, указы-
вают на то, что отсутствие таких пород в боль-
шинстве других известных архейских отложений
обусловлено малой вероятностью их сохране-
ния, а не тем, что они вообще не формирова-
лись.
7. В составе описанных выше глаукони-
товых включений в песчаниках встречаются
трубки типа Skolithus, сходные с нижнепалеозой-
скими структурами, которые связывают с дея-
тельностью роющих Metazoa».
Хофман далее отмечает, что гео-
синклинальная модель этих пород «удиви-
тельно напоминает таковую для Аппала-
чей. Изучение отложений не выявляет
существенных отличий по тектонике от фа-
нерозойских геосинклиналей». Эти и дру-
гие данные, указывающие на отсутствие
резкого изменения условий среды на гра-
нице фанерозоя, позволяют предполагать,
что «кембрийский разрыв» в палеонтоло-
гической летописи обусловлен в первую
очередь тем, что в процессе эволюции по-
явились биоценозы, остатки которых обла-
дают высокой способностью к длительно-
му сохранению.
Кембрийский разрыв-внезапное и по-
всеместное появление скелетов Metazoa
в томмотском ярусе (нижний кембрий)-
Рис. 6.5. Сравнение древних и современных кар-
бонатных строматолитов. А. Протерозойские
строматолиты с Большого Невольничьего озера
• Канада). Длина геологического молотка на фо-
тографии около одного фута. Справа внизу
плейстоценовая ледниковая ложбина. Б. Эти
незда строматолитов возрастом 2 млрд, лет из
-ого же района были срезаны плейстоценовым
-едником. Внутренняя пластинчатая структура
•тих дофанерозойских строматолитов очень
сходна со структурой молодых строматолитов.
В. Недавно образовавшиеся карбонатные стро-
матолиты в теплой, сильно соленой воде (Хэм-
тин Пул, Шарк Бэй, Западная Австралия). Осе-
дающие частицы захватываются и связываются
микробами, главным образом нитчатыми фото-
синтезирующими прокариотами с развитыми
=ехлами. Они цементируются в результате
хаждения неорганического арагонита. Эти со-
именные литифицируемые строматолиты при-
тивной зоны содержат сообщества живых ми-
гозорганизмов, в том числе разрушающих
гдрбонат и замедляющих рост строматолитов.
Paul Hoffman, Geol. Survey of Canada.]
следует интерпретировать прежде всего
как .внешнее проявление каких-то неиз-
вестных нам биологических событий
(Lowenstam, Margulis [577]). Наличие этого
разрыва не противоречит представлению
136
ГЛАВА 6
о предшествовавшем накоплении кислоро-
да в атмосфере в результате фотосинтети-
ческой активности прокариот. Высказыва-
лось предположение, что кембрийский раз-
рыв был результатом увеличения концен-
трации О2 выше минимума (около 1%
нынешней концентрации), необходимого
для поддержания жизни простейших
и многоклеточных животных [74, 165, 290].
Хотя для животной жизни безусловно не-
обходима по меньшей мере такая концен-
трация кислорода, это само по себе еще не
позволяет объяснить кембрийский разрыв
[577, 578, 622]. Кажется сомнительным,
чтобы ультрафиолетовая радиация или не-
достаток кислорода когда-либо прямо
ограничивали эволюцию Metazoa.
Животные и сосудистые растения не
могли возникнуть до тех пор, пока у одно-
клеточных организмов не выработались
необходимые для этого генетические си-
стемы; появлению многоклеточных жи-
вотных, обладающих скелетом, должно
было предшествовать усовершенствование
систем репродукции клетки, приведшее
к «нормальному» митозу. Аэробные эука-
риоты возникли только после того, как
в атмосфере накопилось значительное ко-
личество кислорода, а у аэробных гетеро-
трофных протистов выработалась менде-
левская генетическая система; сами эти
протисты явились продуктом симбиоза,
приведшего к появлению клеточных орга-
нелл. Если функции фотосинтеза и дыха-
ния впервые возникли у прокариот и лишь
позднее, в результате симбиоза, были при-
обретены эукариотами, то ископаемые сви-
детельства существования облигатно анаэ-
робных микробов, выделяющих О2 циано-
бактерий и множества различных факуль-
тативно и облигатно аэробных микробов
должны хронологически намного предше-
ствовать появлению остатков животных
и растений. Неизвестного большого таксо-
на фотосинтетиков, который служил бы
связующим звеном между цианобактерия-
ми или Prochloron и водорослями-эукарио-
тами, никогда не существовало; поэтому
он и не может быть обнаружен ни в виде
ископаемых остатков, ни среди ныне живу-
щих форм. Свидетельства своеобразных
метаболических достижений грибов и рас-
тений - например, синтеза лигнина, гиббе-
релловой кислоты, некоторых специфиче-
ских тритерпенов, стероидов, флавоноидов,
индольных алкалоидов и их производных-
должны появиться в летописи органиче-
ской геохимии лишь в достаточно позднем
фанерозое.
Существуют заметные различия между
архейским и протерозойским геологически-
ми режимами; однако начиная со времени
около 1,5 млрд, лет назад осадочные по-
роды приобретают сходство с современны-
ми, хотя прямые следы существования
многоклеточных животных, обладающих
скелетом или мягкотелых, появляются
лишь значительно позже [163]. Суще-
ствуют ли прямые ископаемые свидетель-
ства того, что эукариотический уровень ор-
ганизации был достигнут протоктиста-
ми - предполагаемыми предками растений
и грибов? Если существуют, то каков их
возраст?
Ископаемые «пятнистые клетки», «мей-
отические тетрады» и другие микрофосси-
лии, принятые за остатки дофанерозойских
эукариот [830], скорее всего идентифици-
рованы неверно [307, 308, 341]. Есть, одна-
ко, интересные свидетельства появления
эукариот раньше эдиакарских Metazoa
(возраст около 680 млн. лет). Акритархи-
вероятно, протоктисты-обычны в обло-
мочных фациях», сформировавшихся около
1,4 млрд, лет назад и позднее. Chuaria, спе-
цифические глобулярные ископаемые до
1 мм в диаметре, имеют возраст не менее
1 млрд, лет [409]. В позднепротерозойских
отложениях (группа Даль) на северо-западе
Канады обнаружены макроскопические ор-
ганические прослойки, напоминающие зе-
леную водоросль UIva. В Большом Каньо-
не [831], а также фосфатных конкрециях
позднего протерозоя Швеции [488] было
найдено огромное число остатков хитинсо-
держащих организмов, вероятно каких-то
протоктистов.
По-видимому, все это вместе взятое по-
зволяет думать, что первые эукариоты по-
явились больше миллиарда лет назад и да-
ли начало нескольким группам организ-
мов, в том числе только что упомянутым
загадочным существам. Хотя ни для одной
из этих форм нельзя считать строго дока-
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
137
занным эукариотический уровень организа-
ции, он все же представляется вероятным.
Кроме того, изменения среды, вызванные,
по-видимому, непрямым взаимодействием
микробных сообществ, прокариотических
и эукариотических, позволяют предпола-
гать, что современный этап эволюции жиз-
ни шел полным ходом еще до появления
знакомых нам высокоразвитых организ-
мов-большинства беспозвоночных, позво-
ночных и растений, ископаемые остатки
которых мы столь высоко ценим. Их от-
сутствие - основное различие между верх-
ним протерозоем и нижним фанерозоем.
Нужно признать, что влияние ми-
кробных ценозов на состав атмосферы
и осадочных пород еще плохо изучено. Мы
упомянем здесь лишь некоторые эффекты,
главным образом как стимул для будущих
детальных исследований. Необходима ра-
бота соответственно оснащенных групп ис-
следователей, включающих по крайней ме-
ре седиментологов, геохимиков, микробио-
логов и химиков атмосферы, чтобы можно
было оценить влияние биосферы на харак-
тер поверхности планеты и эволюцию это-
го влияния во времени. Без координиро-
ванных усилий мы не сумеем понять
палеоклиматические условия и состояние
среды в древние эпохи; мы не сможем так-
же понять характер современных взаи-
моотношений человека со средой и клима-
том. Возможно, что к пониманию дофане-
розойской эволюции нас больше всего
приблизит не исследование микрофосси-
лий, а изучение влияния микроорганизмов
на образование осадочных пород в совре-
менных условиях.
Метаболизм микробов в эвапоритовых
осадках мелких водоемов и «себхах» мог
даже играть решающую роль в образова-
нии экономически важных залежей минера-
лов [775]. Из многих тысяч известных ми-
нералов около тридцати являются пол-
ностью биогенными [576]. Присутствие
этих минералов в породах, не измененных
высокой температурой и давлением, гово-
рит о существовании в соответствующий
период организмов, способных их синтези-
ровать (табл. 6.12).
Бактерии могут восстанавливать суль-
фаты марганца и кальция до сульфидов;
в морях это часто приводит к образова-
нию пирита (FeS2) и металлического мар-
ганца. Концентрированные растворы NaCl
очищаются от сульфатов под действием
микробов. В пресной воде биогенные суль-
фиды могут осаждаться в форме гидро-
троилита (FeSHOH). Железо может восста-
навливаться из окисного состояния в за-
кисное и даже осаждаться в металлической
форме [286]. Ион закисного железа может
непосредственно окисляться до окислов
железа [111], которые осаждаются раз-
личными «железобактериями». Тодорокит,
магнетит, кальцит, арагонит и барит-по
крайней мере частично биогенные мине-
ралы, присутствующие в осадочных поро-
дах в виде включений. По-видимому, их
постоянно игнорировали как потен-
циальные индикаторные ископаемые не
только в протерозойских, но и в фанеро-
зойских отложениях [578]. В дофанерозой-
ских породах иногда выявляется серия от-
ложений, соответствующих разным глуби-
нам древнего водоема: при переходе от
больших глубин к меньшим откладыва-
лись последовательно сульфид железа, кар-
бонат железа и окислы железа (Fe2O3). То,
что сульфид является продуктом жизнедея-
тельности микроорганизмов, следует из
данных изотопного анализа серы, исследо-
вания условий, в которых происходило от-
ложение, а иногда и прямого исследования
сопутствующих строматолитов и вклю-
ченных микрофоссилий [345]. Изучение
стратиграфии, седиментации, условий
образования отложений и изотопный ана-
лиз железа и серы в составе минералов по-
зволяют предполагать, что в раннем про-
терозое значительная часть территории
современной провинции Онтарио была за-
нята обширными стабильными водоемами,
в которых процветали разнообразные ми-
кробные ценозы.
В настоящее время отложение карбона-
та кальция является полностью биогенным
и, вероятно, так же обстояло дело в проте-
розое или даже раньше. Карбонат кальция
осаждается из морской воды при уменьше-
нии содержания в ней СО2 в результате
фотосинтеза или при других биологических
процессах, защелачивающих среду. Сте-
пень осаждения карбоната кальция в от-
Таблица 6.12. Распространение бнонеорганнческих минералов [576]
Мопе- га Protoctista
Sarcodina Dinoflagellate Haptophyta Bacillariophyta Phaeophyta Rhodophyta Chloroph yta Gamophyta Rhizopoda Heliozoa Actinopoda
Карбонаты кальция Кальцит + Арагонит + Фатерит Моногидрокальцит + Аморфный гидратиро- ванный карбонат Фосфаты Даллит + Франколит Ca3Mg3(PO4)4 Брушит Аморфный предшествен- ник даллита Аморфный предшествен- ник брушита Аморфный предшествен- ник витлокита Аморфный гидратиро- ванный окисный фосфат железа + + + + + ? + + + +
+ + + Tracheophyta
/ H h>. (pjlioopil 1 Аморфный предшествен- ник флюорита Оксалаты Уэвеллит Уэдделит + +
Сульфаты Гипс Целестит
Барит Силикаты + + +
Опал 0кислы железа Магнетит + Маггемит ? Гетит Лепидокрокит Ферригидрит- + Аморфные ферригидраты Окислы марганца Бурнесит + Сульфиды железа Пирит, гидротроилит + + ? +
+ +
+ ? + + +
+ + + +
+ +
+
+ + + + + + + +
+ + +
+
+ +
+ + + + + + +
+ + +
140
ГЛАВА 6
сутствие живых организмов никогда точно
не определялась. Такие расчеты были бы
полезны для сравнения Земли с Марсом
и Венерой, в атмосфере которых содержит-
ся значительно больше СО2.
Биоценозы обменивают азот главным
образом с воздухом. Органический азот,
содержащийся в осадочных породах, на-
пример в торфе и угле, выделяется в ат-
мосферу в результате жизнедеятельности
микробов. Нитраты, образующиеся абио-
тически под действием атмосферного элек-
тричества или же биотически из аммиака,
удаляются из атмосферы в виде раство-
римых солей и фиксируются в форме орга-
нического азота фотосинтезирующими ор-
ганизмами.
Водород и метан образуются в боль-
ших количествах в результате процессов
бактериального брожения; продуктами
этих процессов являются также кислород
и кислоты. Возможно, эти процессы приво-
дят к переносу восстановленных раство-
римых минеральных веществ в бескисло-
родных местообитаниях [776]. Накопление
минералов, содержащих медь, алюминий,
марганец, никель, ванадий, золото и уран,
частично может быть обусловлено дей-
ствием биогенных восстановителей. Мно-
гие из этих руд встречаются в ассоциации
с хорошо сохранившимися отложениями,
богатыми углеродом. Глубоководные мор-
ские конкреции с высоким содержанием
марганца, железа и никеля могут частично
быть продуктами деятельности бактерий;
не исключено, что пресноводные и морские
слоистые конкреции по сути дела предста-
вляют собой глубоководные строматолиты
[659]. Уменьшение содержания кремния
в поверхностных водах в результате дея-
тельности диатомей и радиолярий дости-
гает внушительных размеров: количество
кремния в зоне фотосинтеза может пони-
зиться на несколько порядков величины
и оказаться недоступным для аналитиче-
ского выявления (меньше 0,0001%). Биоло-
гические процессы влияют даже на содер-
жание суспендированных частиц в глуби-
нах океанов. Например, железо, марганец,
ванадий, кобальт, хром, никель, медь, сере-
бро, сурьма, золото и ртуть обнаружи-
ваются в концентрациях, превышающих
ожидаемые в результате процессов выве-
тривания и физического осаждения; пола-
гают, что живые организмы играют боль-
шую роль в этом обогащении [117].
Короче говоря, различия между лунными
и марсианскими реголитами и земными
почвами и осадочными породами чрезвы-
чайно велики; многие из этих различий
(возможно, большинство) являются
прямым следствием активности микробов,
главным образом прокариот. Детали этих
различий заслуживают более глубокого ис-
следования.
Сходство между некоторыми древними
отложениями и современными биотопами,
в которых доминируют бактерии, порази-
тельно, хотя оно может быть только по-
верхностным. На рис. 6.6 сравниваются
кремнистый сланец из древних пород
группы Фиг-Три (Южная Африка) и живые
микробные маты из Нижней Калифорнии.
Сильное взаимодействие между микроба-
ми и осадочными породами легко доку-
ментировать, но оно часто бывает не очень
заметным и не привлекает внимания. На-
пример, тонкая темная корка микробного
происхождения покрывает и укрепляет ры-
хлые пустынные почвы во многих районах
на юго-западе США и на севере Нижней
Калифорнии. На рис. 6.7 показан пласт
мергеля, уплотненный цианобактериями
и другими бактериями. Высказывалось
мнени^, что первые обширные наземные
биоценозы, укреплявшие древние почвы,
вероятно, включали именно таких пустын-
ных прокариот, представленных в совре-
менную эпоху родом Microcoleus [134].
На рис. 6.8 схематически представлены
взаимодействия анаэробных и аэробных
прокариот с осадочными породами и ат-
мосферой. Эти биогеохимические циклы
должны были быть хорошо развиты уже
в протерозое; они сохранялись в течение
всего фанерозоя, и мы можем наблюдать
их до сих пор. Микробиологические циклы
газообмена и формирования отложений
и поныне доминируют в биосфере, но ис-
следователи обращают гораздо больше
внимания на крупных и более заметных эу-
кариот, появившихся в дополнение к ми-
кробам. В очень важных, но не бросаю-
щихся в глаза местах-мелких илистых
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
141
Рис 6.6. Древние и современные осадки: крем-
нистые сланцы Фиг-Три и микробный мат из
Нижней Калифорнии. А. Слева: архейский по-
гссчатый сланец из Сварткоппе, на границе
Фжг-Три Онвервахт, система Свазиленда, Бар-
бертон Маунтен Лэнд (Южная Африка), возраст
эсазо 3400 млн. лет. Справа: слоистый рыхлый
жалок из микробного мата в лагуне Фигероа,
Нижняя Калифорния (Мексика). В этих совре-
менных матах с интенсивным испарением воды
эснтают сообщества фотосинтезирующих и ге-
теротрофных прокариот [423, 611]. Б. Те же
эсразпы при большем увеличении. На шкале
сказаны миллиметровые интервалы.
Рис. 6.7. Захват и связывание частиц нитчатыми
микробами. А. Рыхлый мергель, образующий
живой микробный мат, из южной Флориды.
Диаметр образца около 15 см. Б. Нижняя сто-
рона мата, показанного на фото А. Темные пят-
на-цианобактерии, скрепляющие мат благода-
ря захвату и связыванию оседающих частиц.
В. Вид нитчатых цианобактерий, захватываю-
щих и связывающих богатые карбонатами осе-
дающие частицы, в световом микроскопе
(х 200). Подобные живые маты могли быть
предшественниками ископаемых окаменевших
строматолитов.
0>
а %
N
о
С
S
АЗОТ
кислород
CO H2
V Атмосферная
Фотодиссоциация
МЕТАН
ДВУОКИСЬ
УГЛЕРОДА
ДИМЕТИЛСУЛЬФЛД
Бактерии,
окисляющие железо
но
АЗОЛА
О
** бактерии,окисляющие
аммиак _—
Azatobacter,
Clostridium,
фотосинтезирующие
Бактерии^-^
xN2 Цианобак-ь
С ямТЛчти все
Eubacterium, / / организмы
N20
„ *
Денитрифи
цирующие
Бактерии
Micrococcus и
Pseudomonas
Methanomonas
+ ^Me§mn6coccus
\н4 и др.
: со2
А V У
Bacillus
oligocarbophilus
H3C-S-CH3
со2
От
°2
+ Ее(ОНз)
FeC03
КРАСНЫЕ СОЛИ
ПОЛОСЧАТЫЕ ЖЕЛЕЗО-
РУДНЫЕ ФОРМАЦИИ
Ог
Н2
ВОДОРОД
NH3
Летучие
амины и
органич
кислоты
С02
СО
02
МЕТАН
Зеленые и пурпурные
серные бактерии
/^^-H2S —
СЕРОВОДОРОД
Распад 1
порфиринов и
активность
молочнокислых
Бактерий
H3C-S-CH3
Г--------^Н250д
Thiobacillus
thiooxidans
Desulfovibruj
5
лсасо3
ИЗВЕСТНЯКИ
Фотосинтезирующие
Бактерии и
ЦИАНОБАКТЕРИИ Clostridium
so4 ^-+°г-
Beggiotoa и
другие бактерии,
окисляющие серу
о
H3C-S-CH3
Mycobacterium.
No cardia, |
Pseudomonas
о2
+
СН2
Micrococcus,
молочнокислые
Бактерии и др.
Фотосинтезиру-
ющие и Бродиль-
ные бактерии
МНОЖЕСТВО ОКИСЛЕННЫХ
МИНЕРАЛОВ
МАРГАНЦЕВЫЕ
СТРОМАТОЛИТЫ
ВОССТАНОВЛЕННЫЙ УГЛЕРОД
Рис. 6.8. Биогеохимические циклы в аэробном мире. Изогнутая линия - поверхность воды или суши. В аэробных условиях фосфор не может про-
ходить через атмосферу в газообразной форме, но распространяется в виде органических фосфатов в спорах и других частицах. Накопление кис-
лорода в атмосфере прекратило циркуляцию элементов в форме восстановленных соединений, таких как сероводород и аммиак. Однако оно же
привело к фотопродукции новых окисленных летучих соединений, например параацетилнитрата, которые могут иметь геохимическое значение.
Вместо сероводорода важными летучими компонентами в цикле серы, вероятно, стали диметилсульфид (H3C)2S, диметилсульфоксид (H3C)2SO
и другие содержащие серу газы.
МОДУЛЫ
НУКЛЕИНОВЫЕ
КИСЛОТЫ И
БЕЛКИ
[СНгО]
ЦИСТЕИН
БЕЛКОВ
АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИНТЕЗА
143
Рис. 6.9. Ландшафт, в ко-
тором доминируют про-
кариоты.
водоемах, болотах, засоленных лагунах,
:<ту ариях, соленых маршах-до сих пор
можно наблюдать ландшафты времен про-
ерозоя (рис. 6.9). В таком мире, в мрачных
-рстерозойских водах, совершались неза-
метные эволюционные преобразования, ко-
торые привели к возникновению наших
эукариотических предков. В следующей гла-
ве мы попытаемся объяснить, как это могло
произойти.
ГЛАВА 7
СИМБИОЗЫ В ЭВОЛЮЦИИ
Взаимодействия в природе; симбиоз
как парасексуальносгь
Если живым существам свойственно объединять свои ресурсы, сливаться, когда
это возможно, то это могло бы быть еще одним путем прогрессивного усовер-
шенствования и усложнения организмов.
Томас, 1974 [941J
Симбиоз был впервые определен в про-
шлом веке как «совместное существование
организмов, принадлежащих к разным ви-
дам» [907]. Симбиоз, полезный для обоих
партнеров, был назван мутуализмом; сим-
биоз, всего лишь безвредный для обоих
партнеров, получил наименование коммен-
сализма или форезии. Было много споров
относительно выгод мутуализма, коммен-
сализма и форезии по сравнению с вредны-
ми последствиями других ассоциаций, где
речь идет о паразитизме или патогенности.
Согласно более современному определе-
нию, симбиоз-это «ассоциация между осо-
бями разных видов, сохраняющаяся в тече-
ние значительной части жизненного ци-
кла». Определения и дискуссии мало что
проясняли и не стимулировали новых ис-
следований. Партнеры при симбиозе могут
относиться к самым различным таксонам,
а детали их взаимоотношений могут быть
очень разнообразными. Это разнообразие
возможностей в чем-то напоминает много-
образие человеческих культур, каждая из
которых уникальна и которые так же не
поддаются описанию при помощи простой
терминологии. Осознание исключительной
распространенности явлений симбиоза,
длительности существования большинства
его форм и глубоких последствий для
партнеров заставило автора пересмотреть
роль симбиоза в эволюции (Маргелис, 1976
[608]).
В этом разделе мы рассмотрим пред-
ставление о симбиозе как о своеобразной
форме парасексуальности - объединении и
слиянии различных особей. В следующем
разделе будет сделан выборочный обзор
литературы, касающейся симбиотического
приобретения клетками трех классов орга-
нелл: митохондрий, ундулиподий и пла-
стид. В третьем разделе обсуждаются не-
которые свободноживущие организмы,
возможно, родственные предкам органелл.
Наконец, последний раздел посвящен тер-
минологии; мы предлагаем здесь термины
для описания ассоциаций между особями
разных видов в соответствии с числом,
происхождением и состоянием взаимодей-
ствующих геномов; применение этой тер-
минологии приводит к вопросам, до-
ступным для экспериментального разреше-
ния.
Симбиоз оказал такое же глубокое
влияние на ход эволюции, как и бисек-
суальность [610, 994]. С эволюционное
точки Прения эти явления аналогичны
в обоих случаях происходит формирование
нового индивидуума, несущего гены от
двух или более партнеров. У организма,
возникшего путем слияния двух особей
(или их клеток) в ходе полового процесса,
родители имеют очень недавних общих
предков; при симбиозе же общими буд\т
лишь гораздо более отдаленные предки
Когда родительские особи или гаметы сли-
ваются с образованием ядра зиготы, на ка-
кой-то из последующих стадий жизненного
цикла происходит мейоз, и в результате
вновь создаются индивидуальности, спо-
собные к половому слиянию. При симбио-
зе цикличность гораздо менее регулярна
в некоторых случаях симбионты никогда
не возвращаются к индивидуальному сс-
СИМБИОЗЫ В ЭВОЛЮЦИИ
145
стоянию, хотя в других случаях имеются
вполне определенные способы, обеспечи-
вающие чередование индивидуального
и симбиотического состояний. Однако ни
для каких форм симбиоза не существует
столь изящных способов восстановления
индивидуальности партнеров, как циклы
мейоз - оплодотворение у вполне сложив-
шихся эукариот. Генетики определяют па-
расексуальность как процесс, который при-
водит к рекомбинации геномов по мень-
шей мере двух родительских особей, но не
включает цикла мейоз-оплодотворение,
характерного для бисексуальности. Этот
термин был введен для описания, напри-
мер, конъюгации у бактерий или образова-
ния рекомбинантных монокарионов из ди-
карионов без аскоспорогенеза у грибов
[739]. Таким образом, парасексуальность,
понимаемая в широком смысле, включает
некоторые формы симбиоза.
Стабильные симбиотические ассоциа-
ции обладают большей приспособлен-
ностью, чем каждый из партнеров, в том
смысле, что симбионты оставляют больше
потомства при совместном, чем при раз-
дельном существовании. Гены симбионтов
тесно связаны: естественный отбор дей-
ствует на них как на единый геном. У ор-
ганизмов с мейотическим половым процес-
сом родительские гены на определенных
стадиях жизненного цикла находятся
в одном и том же ядре. В профазе мейоза
V многих (если не у всех) организмов про-
исходит кроссинговер: в результате разры-
ва и воссоединения хромосом отрезки
ДНК одного родителя включаются в со-
став ДНК другого. При симбиозе генети-
ческое взаимодействие партнеров бывает
гораздо менее тесным и не столь жестко
отрегулировано; и все же некоторые пред-
ставления теории пола применимы и к ана-
лизу симбиоза (рис. 7.1).
Экологи, биогеографы и фитопатологи,
пораженные разнообразием и сложностью
взаимодействий между видами, испыты-
вают большие затруднения из-за скудости
информации о природных сообществах.
Можно математически показать, что при
различиях в скорости роста при по-
стоянных внешних условиях и отсутствии
взаимодействия между организмами ка-
кой-то один вид всегда будет доминиро-
вать и вытеснять другие. Однако наблюде-
ния над природными популяциями, особен-
но в пресноводных биотопах, показывают
обратное: редко бывает так, что один вид
вытесняет все остальные [438]. Каким
образом поддерживается стабильное дина-
мическое равновесие между многими сот-
нями видов в самых различных экологиче-
ских нишах морей, пресноводных и на-
земных местообитаний, остается не вполне
ясным. Несмотря на практически безгра-
ничный потенциал размножения, баланс
сохраняется. Пусть лягушка откладывает
10000 икринок, а один плесневый гриб рас-
пространяет миллион спор; все равно
ДИПЛОИДНАЯ
ФАЗА
СИМБИОЗ
РАЗДЕЛЕНИЕ
ПАРТНЕРОВ
Рис. 7.1. Чередование по-
колений с мейозом и его
аналог-симбиоз как па-
расексуальность. N - га-
плоидное число хромо-
сом; G, G'- гетероло-
гичные геномы.
146
ГЛАВА 7
в следующем сезоне выживает в среднем
только одна лягушка и один гриб, вновь
рассеивающий споры.
Естественный отбор неумолимо дей-
ствует на всех стадиях жизненных циклов
всех организмов, и при этом все виды ну-
ждаются в других видах для нормального
прохождения этих циклов. Никогда, даже
в таком малом объеме пространства, как
один кубометр, сообщество живых орга-
низмов не может состоять из особей одно-
го вида. Разнообразие, как морфологиче-
ское, так и метаболическое, является пра-
вилом. Большинство организмов зависит
от других непосредственно, нуждаясь в пи-
тательных веществах и газах. Только фото-
и хемоавтотрофные бактерии синтезируют
все необходимые им органические веще-
ства из неорганических; однако даже они
нуждаются для жизни в таких веществах,
как кислород, двуокись углерода и аммиак,
которые, хотя и относятся к неорганиче-
ским, являются конечными продуктами
жизнедеятельности других организмов. Ге-
теротрофам органические вещества нужны
как компоненты пищи; если исключить
редкие случаи каннибализма, эта пища со-
стоит из особей других видов или их
остатков. Многие гетеротрофы в высшей
степени разборчивы в отношении пищи;
например, некоторые заднежаберные брю-
хоногие моллюски питаются только стро-
го определенными водорослями и скорее
погибнут от голода, чем попытаются уто-
лить голод другими, близко родственными
видами [270]. Границы между пищевой за-
висимостью, паразитизмом, симбиозом
и другими формами ассоциации разных
видов весьма зыбки; эти взаимоотношения
постоянно изменяются под влиянием усло-
вий среды. Предложено много терминов,
определяющих разные виды симбиоза,-на-
пример, мутуализм, патогенность, коммен-
сализм, паразитизм, парасимбиоз, форезия
и биотрофизм [399, 553]. В той мере, в ка-
кой эти термины описывают только меж-
видовые экологические отношения, они
являются дезориентирующими, так как за-
темняют генетическую природу ассоциа-
ций.
Симбиоз был предметом многих иссле-
дований [171, 399, 553, 554, 778], однако
нам известно очень мало генетических, фи-
зиологических и биохимических деталей.
Если основной тезис этой книги верен, то
клеточная биология и генетика органелл
могут дать самую подробную информа-
цию о длительно эволюционирующих сим-
биотических ассоциациях, особенно о вну-
триклеточном наследственном симбиозе1
Метаболические пути эукариот, опреде-
ляемые нуклеиновыми кислотами орга-
нелл, окажутся тогда остатками древнего
облигатного эндосимбиоза. Как будет по-
казано в последующих главах, представле-
ние о происхождении органелл от внутри-
клеточных симбионтов позволяет объяс-
нить их «генетически автономное» поведе-
ние.
Хотя симбиотические отношения часто
рассматривают в биологической литерату-
ре как нечто необычное, они распростра-
нены очень широко. Многие из них оказы-
вают влияние на целые экосистемы; напри-
мер, Фергюсон-Вуд [286] отмечает:
«В тропиках многие водные животные -
возможно, большинство их-содержат симбио-
тические водоросли; последние встречаются
у большинства типов беспозвоночных... Вероят-
но, симбиотические водоросли количественно
имеют большее значение, чем фитопланктон
и свободные бентосные водоросли в корал-
ловых рифах и других мелководных биотопах
с известковыми отложениями, и продуктивность
таких вод определяется в основном именно та-
кими симбионтами, более известными под на-
званием зооксантелл1 2».
Найменее изучены симбиозы, в кото-
рых участвуют микробы. Поверхность
практически всех водорослей и листьев, ко-
ра растений и кожа животных имеют свою
специфическую микрофлору. Не изучены
ни значение этих ассоциаций для макро-
скопических партнеров, ни численность
различных симбионтов, которую они пере-
носят, ни степень специфичности симбиоза,
ни пищевые и другие взаимоотношения.
В большинстве случаев даже виды микро-
1 Прямое отношение к этой проблеме
имеет обширный обзор Гилхэма по биогенезу
и генетическому контролю митохондрий и пла-
стид [324].
2 Большинство этих зооксантелл - симбио-
тические динофлагелляты рода Symbiodinium
(Gymnodinium) [964].
ПИ^БИОЗЫ В ЭВОЛЮЦИИ
147
>?* не идентифицированы. Зубные врачи,
ктречаясь с исключительным богатством
микрофлоры на поверхности зубов и десен,
хтро осознают значение этих форм сим-
'*оза. но большинство экологов игнори-
г*ет их. Однако несколько очевидных при-
меров симбиоза были исследованы (табл.
Симбиотические ассоциации есть в лю-
бом биоценозе; партнерами могут быть
представители всех высших таксонов. Од-
нако некоторые группы особо склонны
вступать в симбиотические отношения.
Аскомицеты чаще других грибов входят
в состав лишайников. Динофлагелляты ро-
да Symbiodinium (Gymnodinium) и зеленая
io лица 7.1. Обзоры литературы по симбиозу
Симбионты Литература
Инфузории Микроб-эндосимбионт «каппа» и грам-отрица- тельные бактерии [743, 889]; [742] (сопоставление раннего генетического анализа «цитоплазмати- ческих генов» с позднейшими морфо- логическими и биохимическими дан- ными)
*1нфузории Внутриклеточные хлорел- лы (см. рис. 7.12) [471]; об эволюционном значении наслед- ственного эндосимбиоза у Paramecium bursaria см. [468]
Морские беспозвоночные Внутриклеточные дино- флагелляты [270, 964, 1038]
Бактерии, водоросли, гри- Бактерии, грибы, водо- [399, 608]; [172] (межмикробный сим-
бы и простейшие росли и простейшие биоз)
?1зные грибы Цианобактерии и зеленые водоросли (см. рис. 7.2) [10, 373, 778] (образование лишайников)
~р«бы, актиномицеты и цианобактерии Растения [552, 553]; [752] (микоризы и другие фор- мы симбиоза у растений)
Зеленые водоросли и ди- Протоктисты и животные [873, 874, 964, 967] (о зоохлореллах и
нофлагелляты (см. рис. 7.13) зооксантеллах, особенно у морских организмов)
Багтериоподобные мик- робы и «тельца Блох- мана» Тараканы и другие насе- комые [525, 840]
Светящиеся бактерии и морские животные Костистые рыбы, голово- ногие и другие моллюс- ки; прочие морские жи- вотные [385, 402, 683]
Зодоросли и растения Грибы, растения и жи- вотные [775, 878]; о переносе углеводов от ав- тотрофов к гетеротрофам см. [172]
Бактерии, протоктисты и Птицы, насекомые и мле- [399]; [840] (ассоциация микробов с бес-
другие микробы копитающие позвоночными, птицами, жвачными и другими животными)
Протоктисты Многие организмы (глав- ным образом бактерии) [480, 608]
.anaphora (криптомона- ды| Cyanocyta (цианеллы), ано- мальные сине-зеленые водоросли [967, 968]; см. рис. 7.5
A
Б
Г
СИМБИОЗЫ В ЭВОЛЮЦИИ
149
водоросль Chlorella чаще других водорос-
лей становятся внутриклеточными сим-
бионтами кишечнополостных; Nostoc чаще
остальных нитчатых цианобактерий всту-
пает в ассоциации с папоротниками, сагов-
никами и грибами, образующими лишай-
ники. Склонность фотосинтезирующих во-
дорослей из родов Trebouxia и Pseudotre-
bouxia (входящих в состав многих лишайни-
ков) вступать в симбиотические отношения
с разнообразными аско- и бази диоми цета-
чо1 должна иметь параллели в эволюцион-
ной истории: вероятно, некоторые фото-
синтезирующие прокариоты вступали
з симбиоз с многими хозяевами, в резуль-
тате чего возникли одноклеточные эука-
риотические водоросли; именно поэтому
Рис. 7.2. Симбиотические светящиеся бактерии.
На схемах изображены различные ниши, зани-
маемые бактериями.‘ Неидентифицированные
симбионты, представленные на фотографиях,
культивировать не удается. Масштабный отре-
зок везде равен 1 мкм [681]. А. Случайные ас-
социации. Свободноживущие и сапрофитные
Photobacterium fischeri. Сапрофитные ассоциации
бывают ни видоспецифическими, ни по-
стоянными. Б. Внеклеточные кишечные сим-
бионты. Xenorhabdus luminescens (X) в глоточной
z злости одной нематоды. Люминесцирующие
нематоды внедряются в ткани гусениц, в резуль-
тате чего последние светятся. Это повышает ве-
роятность того, что гусеницы будут съедены
птицами и бактерии попадут в самое богатое
тяшей местообитание. После выделения из ки-
шечника птиц бактерии могут быть вновь по-
'.тошены нематодами. В. Внеклеточные сим-
' ионты в светящихся органах. Вверху: клетки
Photobacterium leiognathi (Р), окруженные тканя-
ми светящегося органа рыбы; свет скрывает эту
рью\ от хищников, плавающих на большей глу-
гине. В середине: неидентифицированные сим-
бионты (L) образуют светящийся орган рыбы
Ptotoblepharon sp.; эта рыба использует свет при
т-зисках добычи, а также дает вспышки для об-
схния с сородичами и для отпугивания хищни-
п-нуклеоид бактерии. Внизу слева: неиден-
~>£ицированные симбионты рыбы морского
«ерта. использующей свет для привлечения до-
точи. Внизу справа: неидентифицированные бак-
"ер«и- симбионты кальмара Heteroteuthis
siiensis. который выбрасывает их в виде све-
~к_1ихся «чернил» для отпугивания хищников
э ’емноте. Г Внутриклеточные симбионты (S)
1 сэетящихся органах оболочника Pyrosoma; се-
\±зтивная ценность для оболочника не ясна.
V - митохондрия; В - бактероиды - видоизме-
симбиотические бактерии; N-ядро клет-
<з хозяина.
сходные или даже идентичные пластиды
встречаются у организмов, которые по
всем другим критериям состоят лишь в от-
даленном родстве.
Неясно, почему представители неко-
торых таксонов особенно предрасполо-
жены к симбиозу. В некоторых случаях
о причинах такой тенденции можно только
гадать, в других они очевидны. Многочис-
ленные ассоциации между светящимися
бактериями и морскими животными всегда
дают хозяину явное селективное преиму-
щество. Животное может использовать ис-
точник света в качестве «фонаря» для осве-
щения потенциальной добычи, для отпуги-
вания хищников или для привлечения
полового партнера. Во всех случаях свет
излучается в результате реакции бакте-
риальной люциферазы с люциферином (см.
табл. 6.2). Бактерии испускают свет не-
прерывно, однако некоторые рыбы могут
давать вспышки, пользуясь специальными
заслонками из своих собственных тканей.
Уникальность бактериальных люцифераз
в большинстве случаев позволяет иденти-
фицировать симбионтов, даже когда их не
удается выращивать вне организма хозя-
ина [683]. Эти морские симбиозы обра-
зуют непрерывный ряд по степени близо-
сти отношений-от случайного попадания
свободноживущих светящихся бактерий
в кишечник морских животных до тесных
ассоциаций, когда люминесцирующие бак-
терии растут в специальных испускаю-
щих свет органах в организме хозяина,
но вне его клеток; и наконец, по край-
ней мере в одном случае-у оболочника
Pyrosoma - бактерии являются внутрикле-
точными симбионтами. Многие из таких
бактерий могут расти в лабораторных ус-
ловиях, и, значит, сохраняют способность
к автономному существованию; другие
симбиотические бактерии культивировать
не удается, вероятно в связи с утратой ка-
ких-то метаболических путей за время дли-
тельной ассоциации с хозяином [681].
Учитывая легкость идентификации партне-
ров в этих симбиозах и отдаленность род-
ства между животными-хозяевами, можно
полагать, что эти ассоциации возникли не-
зависимо друг от друга. Хотя нет данных
об эволюции какого-либо конкретного
150
ГЛАВА 7
симбиоза, многочисленность таких ассо-
циаций позволяет проследить возможные
пути эволюции от автономии к тесной ин-
теграции (рис. 7.2) [681, 937].
Только в одном случае документирова-
но возникновение нового симбиоза в лабо-
раторных условиях ([449-451], см. также
стр. 187); неизвестно, связана ли уникаль-
ность этого случая с недостатком подоб-
ных исследований или с тем, что новые
симбиозы действительно возникают очень
редко.
От симбионтов к органеллам
Все живые существа, все животные от амебы до человека, все растения от
тайнобрачных до двудольных образовались из ассоциации путем «включения»
одного организма в другой. Каждая живая клетка содержит в цитоплазме тельца,
которые цитологи называют «митохондриями». На мой взгляд, эти органеллы-не
что иное как симбиотические бактерии, и потому я называю их «симбиотами»...
Вполне понятно, что бактериологи с некоторым недоверием относятся к столь
новой и даже, может быть, опасной для их науки концепции; весьма естественно
с их стороны требовать строгих доказательств и надлежащей интерпретации
фактов. Возникает, следовательно, методическая проблема, имеющая первостепен-
ное значение.
П. Портье, 1918 [740]
Этот эксперимент, являющийся центральной отправной точкой симбиотической
теории, с нашей точки зрения, совершенно неубедителен.
Утверждение, что этот микроорганизм абсолютно необходим для клеточной жизни
и содержится в каждой клетке,-неоправданное обобщение, что мы надеемся пока-
зать в настоящей работе.
А. Люмьер, 1919 [582]
Если в ходе эволюции происходило
много модификаций в морфологии и фи-
зиологии симбионтов или если симбиоз
является множественным, т. е. включает
представителей нескольких видов, опреде-
лить происхождение партнеров может
быть очень трудно. Существуют два класса
хорошо изученных симбиотических ассо-
циаций-лишайники и симбиоз бактерий
с инфузорией Paramecium-где идентифика-
ция партнеров не вызывает сомнений. Оба
класса возникли в результате процессов,
которые могут иметь отношение к эволю-
ции органелл.
В 19-м столетии симбиотическая приро-
да лишайников оспаривалась. Большин-
ство лишайников морфологически очень
несходны как с фикобионтами (водоросля-
ми), так и с микобионтами (грибами), из
которых они состоят (рис. 7.3). Симбионта-
ми в составе лишайников может быть
около четверти всех грибов - примерно
25 000 видов! Лишь очень немногие фико-
и микобионты лишайников были экспери-
ментально раздоены, так как тонкое рав-
новесие в этих ассоциациях и их мед-
ленный рост делают разделение и культи-
вирование партнеров чрезвычайно трудной
задачей [9, 10]. Лишайники служат порази-
тельным примером возникновения новых
качеств в результате симбиоза: у них
много морфологических, химических и фи-
зиологических признаков, отсутствующих
у обоих партнеров при их независимом ро-
сте. Целое здесь-нечто гораздо большее,
чем сумма частей.
Фактор каппа (х) был открыт в конце
40-х годов как генетический феномен
у Paramecium aurelia. Природа его остава-
лась загадкой вплоть до 70-х годов. Перво-
начально обозначение х было присвоено
генетическому детерминанту, о присут-
ствии которого можно было судить по по-
ведению несущих его инфузорий и ко-
торый передавался при бесполом размно-
жении. При наличии ядерного гена
СИМБИОЗЫ В ЭВОЛЮЦИИ
151
Рис. 7.3. Симбиоз у лишайников. A. Cladonia
cristatella, лишайник из лиственных лесов севе-
ро-востока США. Плодовые тела (темные
округлые объекты на фото, в действительности
красные) состоят в основном из ткани гриба.
[J.G. Schaadt, Univ, of Delaware.] Б. Изолиро-
ванный микобионт Cladonia cristatella, растущий
на агаре в чашке Петри. Плодовые тела и дру-
гие сложные морфологические структуры никог-
да не образуются у гриба, растущего отдельно.
SV. Ahmadjian, Clark Univ.] В. Изолированный
)икобионт - зеленая водоросль Trebouxia, расту-
щая на агаре в чашке Петри. [V. Ahmadjian.]
А парамеции, несущие х, вели себя как
•убийцы» (киллеры) по отношению к пара-
мециям, не имеющим фактора х: при сов-
местной инкубации х-содержащие параме-
ции отравляли парамеций, не содержащих
и последние погибали. Так как ядерная
еретическая система парамеций была изу-
чена и было возможно контролировать
перенос цитоплазмы в процессе конъюга-
ции. удалось подробно выяснить наследо-
вание х. Оказалось, что «генетический де-
терминант» фактора х не подчиняется
травинам менделевского наследования;
<наче говоря, передача признака «киллер»
не контролируется ядерными генами. Кро-
че того, передача генетического детерми-
нанта этого признака от особей, несущих
*_ ххэбям. лишенным х, происходила толь-
ко в том случае, если между конъюгирую-
щими инфузориями образовывался цито-
плазматический мостик, по которому пере-
давалось значительное количество цито-
плазмы.
Фактор х рассматривали как ген пара-
меции, который вел себя неклассическим
образом, так как передавался по наслед-
ству исключительно с цитоплазмой. Кроме
того, признак «киллер» проявлялся только
у тех особей, которые содержали и сам ци-
топлазматический фактор х, и ядерный ген
К. Если фактор х присутствовал в клетке
с генотипом К К или К к, то образование
его продолжалось. Если же из х-содержа-
щей инфузории ядерный ген К генети-
ческими методами удаляли, так что полу-
чался рецессивный диплоид кк, то фактор
152
ГЛАВА 7
х постепенно исчезал из популяции потом-
ков. Зная число N генераций, необходимых
для полной утраты х после удаления ядер-
ного гена, можно подсчитать исходное чис-
ло х-частиц (2n), содержавшихся в цито-
плазме инфузории-киллера. Благодаря
этим исследованиям фактор х стал своего
рода прототипом «цитоплазматических ге-
нов»-классическим примером эффективно-
сти генетических методов при изучении
природы цитоплазматической наследствен-
ности. Это было задолго до установления
физической природы фактора х. Прошло
больше 10 лет после его открытия, прежде
чем удалось установить связь между его
присутствием и наличием в клетке особых
частиц, проходящих определенный цикл
развития; была исследована их морфоло-
гия и даже биохимия [743, 889]. Теперь
известно, что х-частицы - это симбионты,
грам-отрицательные палочковидные бакте-
рии, в которых размножаются специфиче-
ские вирусы и которые способны к авто-
номному росту на сложной среде, х-Ча-
стицы не уникальный феномен: сейчас
известно около двадцати разных бактерий,
вступающих в более или менее тесные эн-
досимбиотические отношения с разными
видами Paramecium [65, 743]. Лишайники
и х-содержащие инфузории-это примеры
симбиозов, природа которых стала очевид-
ной только после детального изучения.
Симбиоз между крупными организ-
мами легко выявить морфологическими
методами, но в отношении микробов эти
методы могут быть недостаточными или
приводить к ошибочным выводам. Часто
бывают нужны другие критерии, чтобы от-
личить эндогенные органеллы или моди-
фикации тканей от симбионтов или пара-
зитов. Какими свойствами могли бы отли-
чаться органеллы симбиотического проис-
хождения от внутриклеточных структур,
возникших в ходе эволюции самой клетки?
Всякого рода симбиотические ассоциа-
ции закрепляются естественным отбором
потому, что в определенный период и
в определенных условиях среды они про-
являют какой-то признак или признаки
(семы), дающие им преимущество перед
независимыми особями. При «свободных»
симбиотических отношениях ассоциация
может легко распадаться, когда условия
роста для одного из партнеров становятся
более благоприятными, чем для ассоциа-
ции в целом. Ахмаджян тщательно иссле-
довал детали отношений такого рода у ли-
шайников. В их формировании и распаде
могут играть роль различные факторы —
влажность, условия питания, температура
и т. п. Ахмаджян [8] приходит к следую-
щим выводам:
«Грибы и водоросли, образующие ли-
шайники, не являются облигатными симбионта-
ми. В подходящих условиях каждый организм
может существовать независимо. Конкретные
обстоятельства могут заставить гриб и водо-
росль вступить в симбиоз. Если лишайник вы-
держивать некоторое время в лаборатории при
высокой влажности, он вскоре диссоциирует на
отдельно растущие компоненты. Такое разделе-
ние может происходить даже в естественных ус-
ловиях, частично или полностью, в зависимости
от характера и длительности изменений ма-
кро- и микроклимата. Развитие лишайника - это
длительный сбалансированный рост гриба или
водоросли. Это позволяет понять, почему ли-
шайники столь многочисленны в засушливых
местностях и редко встречаются в районах с
большим количеством осадков».
В некоторых случаях важнейшие ус-
ловия среды, определяющие выгоду сим-
биоза по сравнению с раздельным суще-
ствованием, очевидны: свойства комплекса,
благоприятные для выживания, отсут-
ствуют у обоих свободноживущих партне-
ров. Например, симбиотические ассоциа-
ции бактерий с растениями (клубеньки на
корнях бобовых) осуществляют азотфикса-
цию, хотя ни один партнер в отдельности
не способен фиксировать атмосферный
азот. В табл. 7.2 перечислены метаболиче-
ские приобретения, характерные для неко-
торых микробных симбиозов.
Любой симбионт, возникший в процес-
се эволюции как свободноживущая клетка,
когда-то должен был иметь все минималь-
но необходимое для клеточной репродук-
ции (см. рис. 5.1): ДНК, колинеарную ей
мРНК, какие-то источники АТР и других
нуклеотидов, а также малых молекул, не-
обходимых для построения белков и ну-
клеиновых кислот, систему сборки клеточ-
ной мембраны и белоксинтезирующуь?
систему, которая включает РНК-полимера-
зу, тРНК, аминоацил-тРНК-синтетазы
СИМБИОЗЫ В ЭВОЛЮЦИИ
153
Таблица 7.2. Метаболические новоприобретения как результат симбиоза
Макроскопический партнер Микроскопический партнер Метаболиты или метаболические пути, которых нет ни у одного из партнеров в отдельности
Hydra viridis Chlorella sp. Маннит
Жгутиконосец-криптомонада Peliaina Цианобактерия Синтез крахмала [535]
Бобовые растения Rhizobium Леггемоглобин [231, 983]
Psychotria Klebsiella Азотфиксация [859]
Аскомицеты или базидиомице- ты в составе разных лишай- ников Trebouxia (зеленая водоросль); Anabaena или другие циано- бактерии Депсиды и депсидоны [9, 373, 647]
Горгонии (Coelenterata) (напри- мер, Pseudoplexaura porosa) с межклеточными водорослями Gymnodinium (Symbiodinium) mic- roadriaticum Стероид «горгостерол» (С30Н5О) и терпеноид крас- синацетат [643]
Paramecium aurelia Лямбда (неидентифициро ван- ный бактериоподобный сим- бионт) Синтез фолиевой кислоты [885]
Crithidia Бактерия Синтез лизина через диамино- пимелиновую кислоту
Тараканы и другие насекомые Включения (вероятно, бакте- рии) в мицетоцитах По-видимому, симбионты ис- пользуют отходы азотного обмена насекомых [525, 838, 840]
Термиты (подземные и питаю- щиеся сухой древесиной) Протисты и бактерии Расщепление целлюлозы и азот- фиксация [105, 1036]
и рибосомы, состоящие из многих белков
и по меньшей мере трех РНК. После всту-
пления в ассоциацию симбионт может со-
хранить все эти синтетические возможно-
сти, а может и утратить их, за исключе-
нием способности синтезировать свои ну-
клеиновые кислоты-как правило, ДНК
и комплементарную ей мРНК. Существует
широко распространенный фермент обрат-
ная транскриптаза, катализирующий обра-
зование ДНК на матрице комплементар-
ной РНК. Таким образом, для репликации
в принципе может быть достаточно одной-
ели нственной информационной макромо-
лекулы. Следовательно, если органеллы
произошли от свободноживущих симбион-
тов, нуклеиновая кислота симбионта дол-
жна присутствовать где-то в клетках хозя-
ина на любой стадии его жизненного ци-
кла.
Скорости роста партнеров по симбиозу
должны быть примерно одинаковыми. Ес-
ли симбионт будет расти быстрее хозяина,
это, естественно, приведет к лизису хозя-
ина или к гибели симбионта. Если же бы-
стрее будет расти хозяин, то с каждым его
поколением число особей симбионта на
одну особь хозяина будет уменьшаться, и
в конце концов появятся потомки, не со-
держащие симбионта. Если симбиотичес-
кая ассоциация в данных условиях среды
не дает селективных преимуществ, она ис-
чезнет. Но даже в том случае, если сим-
биоз дает партнерам большие преимуще-
ства по сравнению со свободноживущими
особями, он не сохранится, если быстро не
выработаются механизмы, координирую-
щие рост симбионта и хозяина.
В длительно существующих симбиозах
животных и растений естественный отбор,
154
ГЛАВА 7
Рис. 7.4. Glaucocystis nostochinareum. «Аномальная водоросль» с сине-зеленой пигмента-
цией, но эукариотическим типом структуры клетки. По-видимому, это типичная зеле-
ная водоросль, сходная с Oocystis, в которой находятся ЛрАоиогЛесе-подобные кок-
коидные цианобактерии, функционирующие как цианеллы. Наличие толстой стенки,
окружающей комплекс, указывает на то, что ассоциация, видимо, стабильна и циа-
неллы являются постоянными «жильцами», с-цианелла; s-крахмал; п-ядро;
nm-ядерная мембрана. Электронная микрофотография. [W.T. Hall, George Claus.]
по-видимому, не благоприятствует сохра-
нению избыточности. На это указывают
трудности разделения тесно ассоцииро-
ванных партнеров и сложность или необы-
чность ростовых потребностей симбионта.
Признаки, не необходимые для комплекса
в целом, имеют тенденцию утрачиваться.
Например, у водорослей-эндосимбионтов
очень часто происходит редукция клеточ-
ной стенки; водоросли, живущие в симбио-
зе с простейшими и беспозвоночными,
имеют округлую форму и напоминают
пластиды (рис. 7.4 и 7.5, [964]). Морфоло-
гическая редукция при симбиозе часто за-
трудняет идентификацию меньшего парт-
нера. Как видно из табл. 7.3, фотосинте-
СИМБИОЗЫ В ЭВОЛЮЦИИ
155
7.5. Cyanophora paradoxa. [W.T. Hall, G. Claus.] А. Комплекс в целом: криптомо-
^моподобные простейшие с цианеллами, которые сходны с цианобактериями, но поч-
~л лишены клеточной стенки. Ассоциация облигатна; имеет место обмен метаболита-
ми и интеграция продуктов обоих геномов [967]. х 11500. с-цианелла; и-ундулипо-
zzje. п-нуклеоид цианеллы. Б. Цианелла в процессе деления, t-тилакоиды; г-рибо-
- мы цианеллы; п - нуклеоид цианеллы. х 35 000.
:грующие симбионты беспозвоночных и
гестейших имеют самое различное проис-
- кдение; защита, предоставляемая им хо-
.?:ном. ведет к утрате (иногда обратимой)
некоторых признаков, имеющих функцио-
нальное значение только для свободножи-
вущих водорослей [643]. Зооксантеллы по-
сле высвобождения из обычной для них
156
ГЛАВА 7
Таблица 7.3. Фотосинтезирующие симбионты простейших, растений и животных [399, 549, 608,
933, 964]
Царство Хозяева Тип _ Фотосинтезирующие представители Симбионты (определены после освобождения из хозяина)1 Царство, к кото- рому принадле- жит симбионт1
Protoctista Actinopoda Многие радиолярии (Кс) Gymnodinium (Symbio- dinium) (динофлагелля- ты) Рг
Foraminifera Globigerinoides ruber (Кс) Вероятно, динофла- гелляты Рг
Ciliophora Paramecium bursaria, Stent or polymorphus (Хл) С hlorella-noдобные зеленые водоросли Рг
Bacillariophyta Rhizoselenia (СЗ) Richelia, заключенные в пятислойную оболоч- ку М (?)
Animalia Cnidaria (кишеч- нополостные) Paulinella (СЗ) «Цианеллы» М
Platyhelminthes (турбеллярии) Mollusca Chordata Cladocora (Kc) Gymnodinium Acropora Неизвестные организмы Тихоокеанская актиния (Кс) Регййишт-подобные динофлагелляты Anthopleura xanthogram- (Хл) Десмомонадо-подоб- mica ные флагелляты Convoluta (Хл) Platymonas2 (жгути- ковые) Ophioglypha Неидентифицированные водоросли * в эпидер- мальных пластинках Tridacna3 (Кс) Gymnodinium Tridachia3, Elysia, Pla- (Хл) Хлоропласты-захва- chobranchia ченные чужеродные ор- ганеллы Дидемниды (асцидии) (Хл) Prochloron4 Рг Рг Рг Рг Рг Рг М (?) м
Plantae Cycadophyta Все Nostoc и Anabaena, циано- бактерии в корнях5 м
1 (Кс)-зооксантеллы; (Хл)-зоохлореллы; (СЗ)-сине-зеленые организмы; М-Мопега; Pr-Protoctista.
См. рис. 7.8.
3 См. рис. 7.7.
4 См. рис. 5.6.
5 См. рис. 12.3.
СИМБИОЗЫ В ЭВОЛЮЦИИ
157
Рис. 7.6. Интеграция партнеров при симбиозе. При переносе генных продуктов пер-
вичный продукт (РНК или белок) или вторичный продукт (метаболит) генома одного
из партнеров захватывается другим партнером для прямого использования или для
дальнейшей переработки в продукт (g), полезный для комплекса в целом. Такой пере-
нос облегчает симбиоз, но не обязателен для него. При переносе генов интеграция
симбионтов становится более тесной. Часть генома одного из симбионтов включается
в геном другого. Новый геном может обеспечить создание метаболических путей, при-
водящих к образованию полезных продуктов (bjd), которые не способен синтезировать
ни один из партнеров в отдельности. Л, В, С...Z-гены одного партнера; Л', В',
С ...Z'-гены другого партнера; а, 0, у... со-ферменты; а, Ь, с... z - субстраты в мета-
болических путях.
ассоциации с радиоляриями восстанавли-
вают форму, типичную для динофла-
геллят: вновь появляются поперечные и
поясковые ундулиподии, которых не вид-
но, когда зооксантелла находится внутри
хозяина. Переход от свободной жизни
к симбиозу может сопровождаться измене-
нием продуктов метаболизма, характера
питания, пигментации или дыхания. Эти
изменения не всегда легко предсказуемы:
например, хотя у большинства симбиоти-
ческих водорослей клеточные стенки реду-
цируются, в некоторых случаях они, наобо-
рот. становятся более выраженными. Тем
не менее подобно тому, как паразитические
черви часто утрачивают свои сенсорные
и двигательные придатки, специализируясь
на продукции яиц и спермы, внутрикле-
точные симбионты имеют тенденцию ут-
рачивать свои генетические и биосинте-
тические функции, которые, по-видимому,
возлагаются на хозяев; пример-Cyanophora
paradoxa [903, 967] (рис. 7.6). По ме-
ре утраты функций, необходимых для
независимого существования симбионтов,
симбиоз становится все более облигат-
ным. Постоянное действие факторов сре-
ды, делающих ассоциацию выгодной,- низ-
кой влажности и холода для лишайни-
ков, анаэробиоза для тканевых парази-
тов - способствует ускоренному росту за-
висимости симбионтов друг от друга.
Организмы или органеллы, приобре-
тенные в результате симбиоза, будут со-
храняться только в том случае, если при
каждом делении репродуктивных клеток
хозяина каждая новая клетка будет полу-
чать хотя бы одну копию генома симбион-
та. Любое наследственное изменение, обес-
печивающее передачу этого генома потом-
158
ГЛАВА 7
кам хозяина, будет выгодно для комплекса
в целом. Весьма обычный эффективный, но
иногда «дорогостоящий» способ сохране-
ния симбионтов в популяции хозяина со-
стоит в том, что в каждой особи хозяина
содержится много экземпляров симбионта.
Это повышает вероятность того, что
каждый из потомков хозяина получит по
крайней мере одну копию генома симбион-
та. В механизмах деления центриолей, ми-
тохондрий, хлоропластов и бактериальных
эндосимбионтов можно видеть (и действи-
тельно видели) способы обеспечения гене-
тической непрерывности органелл (сим-
бионтов) (см. табл. 8.6 и 11.1).
Эукариоты, обладающие сложными ме-
ханизмами распределения ядерных генов,
имеют также тенденцию эффективно со-
хранять симбионтов. Например, часто на-
блюдается синхронное деление или прохо-
ждение других стадий жизненного цикла
симбионтом и хозяином; нередко яйца
снабжаются набором симбионтов, что
обеспечивает генетическую преемствен-
ность ассоциации [840]. Вероятно, в этих
процессах участвуют тонкие химические
механизмы. Например, гаметогенез у неко-
торых протоктистов-гипермастигот (тип
Zoomastigina) - симбионтов, расщепляющих
целлюлозу в кишечнике термитов,-ре-
гулируется гормоном экдизоном, обра-
зующимся у насекомого-хозяина непо-
средственно перед линькой. Линяющий
термит отбрасывает задний отдел киш-
ки, содержащий симбионтов; экдизон сти-
мулирует образование у них резистент-
ных покоящихся гамет, которые затем
заглатываются новыми хозяевами [157].
Если какая-то органелла приобретена
путем симбиоза, то не может быть никако-
го современного или ископаемого организ-
ма, содержащего промежуточные стадии ее
развития. Весь набор метаболических
функций симбионта приобретается хозяи-
ном одновременно, как бы в виде одного
«пакета». Как это часто бывает и в класси-
ческих случаях паразитизма, эволю-
ционный прогресс для эндосимбионта со-
стоит не в приобретении новых признаков
и дифференциации, а наоборот, в утрате
функций и дедифференциации.
Возникающий симбиотический комплекс
не имеет единственного прямого предка,
его предки-по меньшей мере два нерод-
ственных организма, иногда даже из раз-
ных типов. Например, не существует фото-
синтезирующей инфузории, которая была
бы прямым предком Paramecium bursaria;
лишайники также не обязательно происхо-
дят от лишайников. Однако сильное давле-
ние отбора, поддерживающее симбиоз, мо-
жет приводить к множеству одновре-
менных изменений у обоих партнеров,
которые, таким образом, эволюционируют
совместно. Это может затруднять иденти-
фикацию первоначальных партнеров. Лег-
кость разделения парамеции и внутрикле-
точных хлорелл [468, 471], вероятно,
указывает на то, что в случае Р. bursaria
симбиотический комплекс возник позже,
чем большинство лишайников, однако
и здесь и там произошли необратимые на-
следственные изменения. Сложные жиз-
ненные циклы некоторых эндосимбионтов
так «ловко» и точно следуют за циклами
развития их хозяев (примерами могут слу-
жить малярийный плазмодий или плоский
червь Diplostomum, живущий в трех проме-
жуточных хозяевах: морских чайках, рыбах
и улитках), что ранние исследователи не
могли придумать для объяснения происхо-
ждения этих организмов ничего лучшего,
чем божественное или демоническое вме-
шательство. Из-за столь интимного харак-
тера и сложности ассоциации многие хо-
зяйственно-важные симбиотические орга-
низмы до сих пор не идентифицированы
и их жизненные циклы не изучены [497].
Симбиотические ассоциации могут воз-
никать, а затем распадаться; их стабиль-
ность отчасти зависит от времени и от ин-
тенсивности давления отбора. Более круп-
ный партнер, если его собственному сущест-
вованию грозит опасность, может иногда
использовать симбионтов как пищу-пере-
варить их. Аналогичным образом в гетеро-
трофной среде с минимальным содержа-
нием фосфата Euglena gracilis может не-
обратимо утрачивать пластиды, перевари-
вая их [282]. При утрате внутриклеточного
симбионта утрачиваются также все мета-
болические функции, для которых необхо-
димы одновременно оба генома. Если ка-
кой-то метаболический путь реализуется
СИМБИОЗЫ В ЭВОЛЮЦИИ
159
частично одним, а частично другим парт-
нером, то утрата или повреждение одного
из партнеров может привести к накоплению
характерных промежуточных продуктов.
Вначале у каждого симбионта-соб-
ственные гены, генные продукты (РНК
и белки) и разнообразные продукты обме-
на, в том числе отходы. Поэтому возмож-
но много путей последующей интеграции
партнеров с образованием нового целого.
Один партнер может предоставлять друго-
му нужный метаболит. Д. Льюис [552, 553]
изучил использование продуктов фотосин-
теза гетеротрофами, существующими в
симбиозе с автотрофами,-главным обра-
зом грибами в симбиозе с растениями.
Один партнер может утилизировать по-
бочный продукт метаболизма другого. На-
пример, в системе Metanobacterium
omelianski водород-конечный продукт бро-
жения у «S-организма»-используется как
субстрат метанообразующим партнером
[116, 767]. В некоторых случаях один парт-
нер синтезирует кофермент, а другой-апо-
фермент. Например, в корневых клубень-
ках бобовых растений бактероиды Rhizo-
Ыит синтезируют гем леггемоглобина,
в то время как растение продуцирует белок
глобин. Хотя свободноживущие Rhizobium
не связывают азот, их можно стимулиро-
вать к этому, выращивая в чистых культу-
рах на среде с арабинозой. Синтез и нако-
пление арабинозы растениями, по-видимо-
му, дерепрессируют нитрогеназную систе-
му бактерий. Таким образом, симбиоз
может реализоваться одновременно на не-
скольких уровнях: в данном случае на
уровне генного продукта и метаболита.
Гены одного из партнеров могут переме-
щаться в геном другого. Детали такого
переноса еще не ясны. В наиболее изучен-
ном случае гены Agrobacterium переносятся
бактериальными плазмидами в клетки во-
сприимчивых растений [608, 809]. Проис-
ходящая в природе передача генов отда-
ленным видам заслуживает гораздо боль-
шего внимания, чем до сих пор уделялось,
особенно в связи с недавними волнениями
по поводу «рекомбинантной ДНК». У эу-
кариот можно осуществить эксперимен-
тальный перенос генов в виде изолирован-
ной ДНК [296, 297, 608].
Ассоциация организмов может приво-
дить к возникновению новых метаболиче-
ских путей (табл. 7.2). Субстрат для био-
синтетической реакции, осуществляемой
одним из партнеров, иногда бывает про-
дуктом биосинтеза другого партнера; ре-
зультатом может быть синтез какого-либо
соединения, уникального именно для сим-
биотической ассоциации. Если этот про-
дукт имеет высокую селективную цен-
ность, ассоциация стабилизируется. Или же
партнеры, дополняя друг друга, осущест-
вляют полный катаболизм компонентов
пищи. Такой симбиоз был бы аналогичен
взаимоотношениям между гликолитиче-
ским путем Эмбдена - Мейергофа, реакции
которого протекают в цитоплазме клетки,
и циклом Кребса, осуществляемым в мито-
хондриях. На рис. 7.6 схематически пред-
ставлены три уровня интеграции партне-
ров: метаболический, уровень генных про-
дуктов (белков или РНК) и генетический.
У животных известна также поведенческая
интеграция.
По мере укрепления ассоциации и уси-
ления взаимной функциональной зависи-
мости симбионтов симбиоз становится все
более облигатным и менее склонным
к диссоциации; соответственно более инте-
грированные симбиозы исследовать труд-
нее, чем факультативные. Ирония судьбы
состоит в том, что если принять симбиоти-
ческую теорию происхождения органелл,
окажется, что для выяснения механизмов
переноса генетического материала лучше
всего изучать взаимоотношения между ор-
ганеллами и ядром. (Такие данные о мито-
хондриях см. [49, 119]; об эксперимен-
тальной генетической трансформации у хо-
рошо изученных организмов, таких как
Drosophila, см. [296, 297].)
Симбионт никогда не может образо-
ваться в результате действия одних лишь
генов хозяина. Будучи однажды утрачен,
он не появится вновь, если только не будет
приобретен заново, например поглощен
с пищей. Но если такое повторное при-
обретение не произойдет вскоре (в геологи-
ческих масштабах времени) после утраты,
то вновь приобретенный симбионт уже бу-
дет чем-то отличаться от прежнего. Описа-
на экспериментальная индукция потери
160
ГЛАВА ’
и повторного приобретения «чужих» эндо-
симбиотических хлорелл инфузорией
Paramecium bursaria и зеленой пресновод-
ной гидрой [174, 306, 469]. Гидра обладает
поразительной способностью узнавать и
вновь захватывать утраченных симбионтов
этого рода.
В начале 20-го века в ботанической ли-
тературе обсуждались аналогичные гипо-
тезы об утрате и повторном приобретении
различных симбионтов для объяснения
эволюционного происхождения некоторых
аномальных водорослей. Например, Фрич
[311] утверждал, что водоросль Glau-
cocystis nostochinareum представляет собой
продукт «повторного поглощения». Как
указывает родовое название, эта водоросль
имеет признаки «хозяина», которые позво-
ляют однозначно отнести ее к семейству
зеленых водорослей Oocysticeae; однако
она содержит не зеленые хлоропласты,
а сине-зеленые хроматофоры, напоминаю-
щие цианобактерии. Аналогичным образом
Gloeochaete-это «организм, который долго
рассматривали как аномальный род
Myxophyceae [Cyanophyceae], но который
теперь идентифицирован как бесцветный
представитель Tetrasporaceae [зеленые во-
доросли] с сине-зелеными хроматофорами,
представляющими собой симбиотические
сине-зеленые водоросли». Фрич предполо-
жил, что у этих организмов за утратой зе-
леных хлоропластов последовало поглоще-
ние сине-зеленых водорослей, которые ста-
ли эндосимбионтами. Изящные ультра-
структурные исследования Glaucocystis
nostochinareum подтвердили и уточнили
первоначальное объяснение Фрича [375]
(рис. 7.4).
Подобным же образом обстоит дело
с Cyanophora paradoxa. Это сходный
с криптомонадами жгутиконосец, содержа-
щий сине-зеленые цианеллы; он встречается
в больших количествах при цветении воды
в теплых кислых пресных водоемах. Циа-
неллы, видимо, представляют собой реду-
цированные коккоидные цианобактерии,
сохранившие остатки своих чувстви-
тельных к пенициллину стенок. Детальные
исследования Тренча [967] позволяют
предполагать, что Cyanophora-это уни-
кальный «тупиковый» симбиотический
комплекс, в котором синтез пигмента циа-
нелл находится, по крайней мере частично,
под контролем рибосом хозяина. На рис
7.5 показаны цианеллы в процессе делении
Следует ли именовать их сине-зелеными
эндосимбионтами, цианеллами, хромато-
форами или пластидами? Видимо, в дан-
ном случае выбор названия-дело вкуса
Морфологическое сходство этих фотосин-
тезирующих структур со свободноживущи-
ми цианобактериями очевидно: они даже
имеют тонкие типично прокариотические
клеточные стенки из пептидогликана.
Клеточные стенки хозяев - Cyanophora
и Glaucocystis- исключают возможность
фагоцитоза и пиноцитоза. Если фотосинте-
зирующие симбионты были приобретены
путем фагоцитоза, то клеточные стенки хо-
зяев должны были образоваться уже после
создания ассоциации и должны были бы
отличаться от клеточных стенок, типичных
для зеленых водорослей.
Проблема идентификации эндосимби-
онтов стала еще острее, когда выяснилось,
что самые настоящие органеллы, такие как
полученные с пищей хлоро пласты, мог>^
функционировать в тканях животных как
автотрофы в течение многих недель. У не-
которых морских моллюсков и одного ви-
да инфузорий то, что принимали за сим-
биотические водоросли, оказалось не целы-
ми водорослями, а отдельными хлоропла-
стами; это явление было названо «захва-
том чужеродных органелл» (табл. 7J
рис. 7.7) [932, 935].
Цианофора-это не только пример ре-
шения уравнения гетеротрофный пр-
тист -I- фотосинтезирующая прокариота =
водоросль; это также модель редукпи*
генома. По-видимому, изолированные пиь-
неллы содержат не более 10% коли-
чества ДНК, характерного для типич-
ных цианобактерий [401, 933]. Эту тенден-
цию к редукции генома у облигат-
ных симбионтов необходимо иметь в ви-
ду при рассмотрении в последующих
главах митохондрий, ундулиподий и ielc-
стид.
Следует четко различать утрату сим-
бионтов и их дедифференцировку. Когд^
симбионт доставляет хозяину метаболиче-
ские возможности, нужные не на всех ста-
СИМБИОЗЫ В ЭВОЛЮЦИИ
161
Рис. 7.7. Захват чужеродных органелл: фотосинтезирующие моллюски. А. Брюхоно-
гий моллюск Elysia viridis, способный к фотосинтезу благодаря хлоропластам, находя-
щимся в дивертикуле кишки. Свет проникает сквозь эпителий и кишечную стенку.
Этот моллюск может при достаточной освещенности обходиться без пищи больше
трех месяцев. Б. Пищеварительная клетка моллюска Tridachia crispata, в которой ви-
тен один интактный хлоропласт и несколько других хлоропластов, перевариваемых
?агоцитозным пузырьком, х 8200. В. Пищеварительная клетка Elysia viridis с ин-
-зктными хлоропластами, полученными от съеденной сифоновой водоросли, х 8000.
днях жизненного цикла, естественный от-
'ор приводит в конце концов к тому, что
тех стадиях, когда хозяин может обхо-
диться без симбионтов, последние сохра-
няются в дедифференцированном, неактив-
ном состоянии. Утрата симбионта и его
недифференцировка могут быть морфоло-
гически неразличимы. Например, дедиффе-
ренцированные митохондрии у анаэробно
растущих дрожжей невидимы даже в элек-
тронный микроскоп. Однако с генетичес-
кой точки зрения дедифференцировка и
утрата симбионта - вещи совершенно раз-
ные. Утрата, подобно смерти, необратима.
162
ГЛАВА 7
Хозяин теряет возможность восстанавли-
вать симбиотические организмы или
любые фенотипические проявления их ге-
номов. Это связано с отсутствием в орга-
низме хозяина нуклеиновой кислоты сим-
бионта. С другой стороны, при дедиффе-
ренцировке хозяин сохраняет способность
вновь сформировать органеллу при со-
ответствующих условиях развития и внеш-
ней среды. Хозяин сохраняет геном сим-
бионта хотя бы в виде единственной
молекулы нуклеиновой кислоты. Орга-
неллы, развивающиеся путем дифференци-
ровки под управлением ядерных генов, или
метаболические пути, функцию которых
можно выявить по каким-либо морфологи-
ческим признакам (образование секре-
торных гранул, материала клеточной стен-
ки, лизосом и т.п.), в случае их утраты на
какой-либо стадии жизненного цикла мо-
гут быть восстановлены в результате взаи-
модействия ядерных генов с цитоплазмой.
Но подобно тому как не происходит сей-
час самопроизвольного зарождения клеток,
так же и органеллы симбиотического про-
исхождения никогда не могут восстано-
виться при участии одних только ядерных
генов.
Любой эндосимбионт, передающийся
потомству, должен реплицировать свои
гены в промежутке между делениями хозя-
ина. Поэтому в принципе можно выявить
связь между метаболическими или морфо-
логическими признаками наличия сим-
бионта и генетическими маркерами, по-
являющимися у хозяина. Этот подход
позволил установить физическую природу
каппа-частиц у парамеций и других цито-
плазматических генов, например у дрож-
жей. У эукариот внеядерные (неменделев-
ские) генетические факторы, многие из
которых наследуются лишь от одного из
родителей, в большинстве случаев (если не
всегда) имеют симбиотическую или вирус-
ную природу. Примерами могут служить
пластиды пестролистных растений (гл. 11)
[181], «ген» отношения полов (sex-ratio)
у дрозофилы, оказавшийся на самом деле
популяцией симбиотических бактерий
[690], ц-частицы парамеций [743], генети-
ческий детерминант биосинтеза лизина
у Crithidia oncopelti, у-частицы у Blasto-
cladiella [135] и, возможно, даже В-хромо-
сомы кукурузы (см. обзор Маргелис [608]).
Корреляция между питанием и ультра-
структурной морфологией послужила ос-
нованием для вывода об эндосимбиотиче-
ском происхождении трихоцист у простей-
шего Chilomonas [834].
Теория симбиоза предсказывает, что
фенотипический признак, кодируемый ге-
ном органеллы, должен наследоваться от
того из родителей, который передает по-
томству эту органеллу. Например, если
в митохондриях морских ежей различимы
дыхательные фенотипы родителей, то мож-
но предсказать, что на 32-клеточной ста-
дии развития личинки только один опреде-
ленный бластомер будет иметь отцовский
фенотип, а все остальные бластомеры - ма-
теринский. Это предсказание основано на
классических данных о том, что на 32-кле-
точной стадии эмбрионального развития
у морских ежей все отцовские митохон-
дрии сосредоточены в одном бластомере
[1025]. С выявлением большего числа био-
химических маркеров митохондрий нача-
лось более полное исследование соответ-
ствующих неменделевских генетических си-
стем не только у дрожжей, но и у других
эукариот [119].
Гипотеза о том, что некоторые орга-
неллы когда-то были свободноживущими
клетками, позволяет сделать еще одно
предсказание. Исходя из видимого консер-
ватизма эволюции, особенно на уровне
высших таксонов, можно думать, что сво-
бодноживущие родственники органелл
должны существовать и ныне. Превос-
ходным примером служат фотосинтези-
рующие симбионты, живущие в тканях
морского плоского червя Convolute
roscoffensis. Эти черви издали похожи на
водоросли (рис. 7.8). Каждый червь содер-
жит зеленые водоросли Platymonas, окру-
глившиеся и едва различимые в тканях хо-
зяина. Когда эти платимонады выходят
в морскую воду, у них отрастают уцдули-
подии и восстанавливается морфология,
типичная для празинофитов. Платимонады
подплывают к яйцам червя, внедряются
в развивающиеся ткани и растут в них. Та-
ким образом, хотя эти комплексы выгля-
дят как водоросли, на самом деле это ассо-
ИМБИОЗЫ В ЭВОЛЮЦИИ
163
циации морских червей и платимонад.
Полагают, что Convoluta paradoxa-тоже
фотосинтетик - содержит фотосинтезирую-
щие диатомеи, которые придают червям
желтоватый цвет. Хотя об ассоциации С.
wradoxa мало что известно, здесь иденти-
фицированы оба партнера. Возможно, не
во всех случаях удастся найти истинных
родственников симбионтов. Можно, одна-
ко. ожидать, что по генетическим и физио-
логическим особенностям симбионты ока-
жутся близкими к представителям из-
вестных таксонов.
Есть и другие особенности, обычно ха-
рактерные для симбиотических ассоциаций,
хотя, возможно, и менее значимые как при-
знаки симбиоза. Так, например, в гармо-
ничной ассоциации партнеры нередко рас-
тут медленнее, чем подобные им свободно-
живущие организмы. Лишайникам свой-
ствен чрезвычайно медленный рост, хотя
они состоят из грибов и водорослей, ко-
торые сами по себе растут намного бы-
стрее [9]. Не исключено, что характерное
для эукариот большое время удвоения (из-
меряемое часами и днями) по сравнению
с прокариотами (как правило, минуты)
больше определяется многокомпонентной
симбиотической природой эукариот, чем
их крупными размерами.
Критерии симбиотического происхож-
дения органелл можно применить также
к ядрам, окруженным мембранами. Ядра-
важнейшие органеллы эукариотических
клеток-содержат нуклеиновые кислоты
двух типов: ДНК и различные РНК. Одна-
ко для объяснения их происхождения нет
необходимости привлекать гипотезу об эн-
Рзк. 7.8. Convoluta roscoffensis-фотосинтезирующий червь. [D.C. Smith, Oxford Univ.]
к. Пятна «водорослей» в дренажных канавах на пляжах Бретани и Чэннел-Айлендс.
Б. Пробка в дренажной канаве. «Водоросль» стремится зарыться в песок при отливе.
К Хотя «водоросль»-настоящий фотосинтетик, она при ближайшем рассмотрении
созывается симбиотическим комплексом плоского червя (Convoluta) и зеленой водо-
zvxz.in-празинофита (Platymonas).
164
ГЛАВА 7
досимбиозе. Весь колоссальный массив
имеющихся данных по цитологии и генети-
ке эукариот указывает на то, что цитоплаз-
матические синтезы под контролем ядра
обеспечивают удвоение ДНК в ядре и рост
клетки перед очередным делением [100,745,
1001, 1016]. Информационная РНК синте-
зируется в ядре и созревает в результате
образования «шапочки» (capping) и присое-
динения poly (А). Она переходит через
ядсрныс поры в цитоплазму и определяет
аминокислотные последовательности син-
тезируемых там белков. Многочисленные
хромосомные локусы, разбросанные по
всему геному, программируют синтез ин-
формационных и рибосомных РНК. Про-
дукты генов рибосомной РНК обычно на-
капливаются в ядрышках, причем запа-
саются в значительных количествах, по
крайней мере в ооцитах некоторых амфи-
бий [114, 976, 1001]. Ядро и цитоплазма
эукариотической клетки составляют, таким
образом, части единой интегрированной
белоксинтезирующей системы, контроли-
руемой генами. Мембранные структуры,
отделяющие генофор и часть цитоплазмы
от другой ее части, богатой рибосомами,
были найдены у Prochloron [1012], а также
у некоторых эукариот, как, например, ядер-
ная «шапочка», содержащая рибосомы,
у Blastocladiella [135] и содержащий хло-
ропласты эндоплазматический ретикулум
у многих бурых водорослей. У Pelomyxa
имеются даже специальные мембранные
трубочки, по-видимому являющиеся про-
должением эндоплазматического ретикулу-
ма, которые тянутся от мембран пери-
нуклеарных эндосимбиотических бактерий
к ядерным порам хозяина. Эти трубчатые
образования, по-видимому, обеспечивают
надлежащее распределение бактерий-сим-
бионтов при делении ядра [1013]. Все эти
наблюдения позволяют предполагать кон-
вергентную эволюцию внутриклеточных
мембранных образований, в том числе
ограниченных мембранами ядер. Возмож-
но, что ядро и цитоплазма эволюциониро-
вали совместно как части интегрированной
мембранной системы, причем ядерная
мембрана могла возникнуть одновременно
с остальной системой эндомембран уже
после того, как были приобретены мито-
хондрии, а значит, и пути биосинтеза сте-
роидов.
Примеры симбиозов
Я привык видеть в них [клеточных органеллах] таинственные крошечные
машины внутри моих клеток, принадлежащие мне и управляемые мной или моими
представителями-клетками, субмикроскопические кусочки моего мыслящего существа.
Теперь вдруг оказывается, что некоторые из них, к тому же самые важные,
мне совершенно чужеродны.
Томас, 1974 [941]
В этом разделе обсуждается несколько
ярких примеров симбиоза, иллюстрирую-
щих эволюцию клеточных новоприобрете-
ний. Mixotricha- подвижный симбиотиче-
ский комплекс протистов и спирохет-слу-
жит моделью возникновения ундулиподий.
Paramecium bursaria и Hydra viridis демон-
стрируют, как гетеротрофы могут решать
проблему питания, вступая в союз с фото-
синтетиками. Взаимодействия между гете-
ротрофами и эндосимбиотическими водо-
рослями аналогичны отношениям между
пластидами и остальной частью клетки,
в которой они находятся. Вплоть до по-
следнего десятилетия считалось, что ни
одно живое существо (исключая, разумеет-
ся, вирусы) не может проникнуть внутрь
прокариотической клетки. И вот были от-
крыты бактерии (род Bdellovibrio)- обли-
гатные хищники, питающиеся другими
бактериями. Их проникновение внутрь
жертвы может служить моделью того, как
попали в клетки хозяев протомитохондрии.
Mixotricha paradoxa- это жгутиконосец
СИМБИОЗЫ В ЭВОЛЮЦИИ
165
из группы полимастигот, обитающий в ки-
шечнике Mastotermes darwinensis, своеобраз-
ного австралийского термита из семейства
Mastotermitidae. Так как это простейшее
покрыто тысячами волосовидных выро-
стов, вначале думали, что это спе-
циализированная гипермастигота (из типа
Zoomastigina). Более детальное исследова-
ние показало, однако, что «волоски» на ее
поверхности - не что иное, как скопление
спирохет. Как и полимастиготы, тоже от-
носящиеся к Zoomastigina, Mixotricha
имеет лишь несколько настоящих ундули-
подий (в данном случае четыре), однако ее
прямолинейное движение в кишечнике тер-
мита не типично ни для каких других по-
лимастигот или гипермастигот. Кливлэнд
я Гримстоун [161] описывают это следую-
щим образом:
«Если на пути нет препятствий, Mixotricha
гхользит вперед не останавливаясь, с постоян-
зон скоростью и обычно по прямой линии. Эта
хюбенность, неоднократно наблюдавшаяся на
живом материале и весьма ясно видимая в на-
кинофильмах, существенно отличает дан-
=>ю форму от других флагеллят, таких как раз-
данные виды Thchonympha, которые плавают
изменяющейся скоростью, переворачиваясь
одного бока на другой, меняя направление
I иногда останавливаясь. Исключительная плав-
=сетъ движения тоже контрастирует с рывками,
характерными для других флагеллят, имеющих,
подобно Mixotricha, лишь несколько жгутиков
Ундулиподий] на переднем конце. Движение
Mixotricha, очевидно, не связано с активностью
х жгутиков и может продолжаться даже тогда,
ьосда последние неподвижны. Таким образом,
жгутики в данном случае не могут быть ответ-
ственны за локомоцию-вывод, который едва
гя. покажется удивительным, если учесть огром-
ьх несоответствие величины жгутиков и всей
иеткн. Кажется вероятным, что жгутики могут
только изменять направление движения, что мы
«зогда и наблюдали.
Mixotricha перемещается не благодаря жгу-
тикам, а благодаря волнообразным движениям
связанных с нею спирохет. Главный довод
1 пользу этого утверждения - то, что у всех ак-
пгано плавающих особей спирохеты энергично
с координированно ундулируют, тогда как
» гибнущих особей, которые не движутся или
дзккутся медленно, спирохеты перестают унду-
1ароватъ или колеблются медленно, плохо
сгч^ртшшрованным образом. В общем наблю-
дается четкая корреляция между степенью ак-
-ввости и координации спирохет и скоростью
□жжения их хозяина. Несмотря на самое де-
-ъжвое изучение, не удалось обнаружить ника-
пз других возможных средств локомоции».
Как почти все протесты-симбионты
термитов, Mixotricha не может расти вне
организма хозяина. Однако ее система-
тическое положение прояснили ультра-
структурные данные, показавшие, что это
чрезвычайно своеобразный симбиотиче-
ский комплекс [161]. Протест-хозяин
имеет один жгутик, направленный вперед,
три «волочащихся» жгутика и другие
структуры, типичные для полимастигот
(рис. 7.9,Л). За его своеобразное движение
ответственны прикрепленные к нему трепо-
немоподобные спирохеты, регулярно рас-
положенные на его кортексе. Четыре унду-
липодии, крохотные по сравнению с клет-
кой, действуют как рули, изменяя иногда
направление ее движения (рис. 7.9, Л и Б).
К клетке хозяина прикреплено около
500 тыс. мелких спирохет, каждая из них
связана со специфическим выступом на по-
верхности клетки и одновременно с вне-
клеточной симбиотической бактерией
(рис. 7.9, В и Г). Кое-где к клетке прикре-
плены другие крупные симбиотические
спирохеты (пиллотины)- вероятно, пред-
ставители нового рода (см. гл. 10); они то-
же подвижны, но, по-видимому, не при-
частны к локомоции хозяина.
Mixotricha обычно живет при низком
парциальном давлении кислорода в кишеч-
нике термитов и потому не имеет мито-
хондрий. Однако у каждой особи имеются,
помимо кортикальных симбионтов, еще
структуры, сходные с бактериями, каждая
из которых окружена эндоплазматическим
ретикулумом и рибосомами хозяина. На
основании морфологических данных они
были идентифицированы как внутрикле-
точные симбиотические бактерии. Было
высказано предположение [161], что они
замещают в функциональном отношении
Отсутствующие МИТОХОНдрии-возможно,
удаляют лактат или пируват, служат до-
полнительным источником АТР или пре-
доставляют ферменты, необходимые для
биосинтеза мембран, в анаэробных или
микроаэрофильных условиях кишечника
термитов.
Таким образом, «клетка» Mixotricha -
это комплекс по меньшей мере пяти гете-
рологичных организмрв. Каждая особь
в норме несет на себе три группы прока-
Рис. 7.9. Mixotricha paradoxa-подвижный симбиотический комплекс из задней кишки
Mastotermes darwinensis (Австралия). В ассоциации с Mixotricha постоянно встречаются
три типа кортикальных симбионтов (два типа спирохет и одна эубактерия) и один тип
эцдосимбиотических бактерий, так что весь комплекс-по меньшей мере пентада.
А. Схематический рисунок. Б. Живая Mixotricha [158]. Микрофотография из кино-
фильма, х 900. В. Электронная микрофотография кортекса Mixotricha; видно располо-
жение кортикальных бактерий (с) и мелких спирохет (s), ответственных за прямолиней-
ное движение простейшего, х 45 000. Г. Поперечные срезы крупной спирохеты,
нерегулярно ассоциированной с Mixotricha, и более мелкой трепонемоподобной спиро-
хеты, ответственной за движение, х 270000. Д. Выступающий участок кортекса-место
прикрепления спирохеты (s) и кортикальной бактерии (с), х 78000. (В, Г и Д-
[А. V. Grimstone, Cambridge Univ.].)
СИМБИОЗЫ В ЭВОЛЮЦИИ
167
ряотических кортикальных симбионтов:
крупных и мелких спирохет (рис. 7.9, А и Г)
а ассоциированных с ними «якорных» бак-
терий (рис. 7.9, В и Д), которые создают
Аномальное движение, а также эндосим-
бионтов четвертого типа (на рисунках не
□оказаны), возможно замещающих мито-
хондрии. Кроме того, Mixotricha- сама по
jeoe симбионт, живущий только в кишеч-
нике насекомого-хозяина. Мixotricha - наи-
эолее изученный, но вряд ли единственный
пример симбиоза спирохет с другими клет-
ками, обеспечивающего подвижность. На
рис. 7.10 показана другая пара симбион-
тов - неидентифицированный протист и
тпирохеты из кишечника термита
Kalotermes schwartzi (из Флориды). Под-
вижные симбиотические комплексы с про-
стейшими образуют даже жгутиконосные
бактерии (рис. 7.11). Для спирохет же ха-
рактерна тенденция к вступлению в разные
аилы симбиотических отношений, как слу-
чайных, так и специфических. В микрофло-
термитов можно наблюдать целые ряды
норм симбиоза от нерегулярного прикре-
пления к поверхности хозяина до локомо-
-орных ассоциаций и даже эндосимбиоза
10) [612, 954].
Paramecium bursaria, симбиотическая ас-
социация водоросли и инфузории, изуча-
юсь с 20-х годов, когда Прингсгейм разра-
-<‘тал неорганическую среду для ее культи-
вирования [399]. Зеленые фотосинтезирую-
щие парамеции содержат симбиотические
зс доросли, число которых специфично для
каждого штамма: на свету симбионты де-
лятся примерно с той же скоростью, что
и хозяин, поддерживая тем самым прибли-
зительно постоянное численное отношение
симбионт/хозяин, которое у разных штам-
мов варьирует в пределах от 60 до 2000
и более (рис. 7.12) [470]. Симбиотические
«зоохлореллы», освобожденные из параме-
ции-хозяина, напоминают свободноживу-
щие хлореллы. Эти водоросли могут не-
определенно долго расти за счет фотосин-
теза на стерильных агаровых косячках со
сравнительно простой средой. При пита-
нии бактериями в темноте Р. bursaria
имеет тенденцию обгонять в росте своих
симбионтов; в конце концов в потомстве
инфузорий, растущих в темноте, появляют-
ся клетки без зоохлорелл. При надлежа-
щих условиях содержания и питания па-
рамеции (бывшие хозяева) могут расти
в культуре сколь угодно долго в отсут-
ствие прежних симбионтов; в этом случае
они сохраняют морфологические признаки
Р, bursaria, которую в природе никогда не
находили без симбиотических водорослей.
При недостатке пищи и обилии света пара-
меции с внутриклеточными водорослями
растут значительно быстрее особей того
же штамма, экспериментальным путем ли-
шенных симбионтов. По-видимому, в при-
роде при недостатке пищи симбиотические
комплексы получают преимущество перед
отдельными партнерами [469].
Взаимоотношения между штаммами Р.
bursaria и их симбиотическими хлореллами
специфичны. Парамеции способны отли-
чать своих эндосимбионтов от свободно-
живугцих хлорелл и от хлорелл, высвобож-
даемых другими парамециями или гид-
рами. Когда апосимбиотических, экспери-
ментально лишенных хлорелл особей Р.
bursaria помещают в среду с хлореллами
из различных источников, они неизменно
поглощают и затем не переваривают и не
выбрасывают обратно «своих» симбион-
Рис. 7.10. Подвижный симбиотический ком-
плекс простейшего и спирохеты. Оба партнера,
выделенные из питающегося сухой древесиной
термита Kalotermes schwartzi, не идентифициро-
ваны. Микрофотография из прижизненного ки-
нофильма. Масштабный отрезок = 1 мкг.
168
ГЛАВА 7
тов. Они отказываются от симбиоза со
свободноживущими и многими другими
гетерологичными хлореллами, выбрасывая
или вообще не поглощая их. В то же время
симбиоз между ранее взаимно адаптиро-
ванными партнерами легко восстанавли-
вается, иногда даже если хлореллы были
прежде адаптированы к другому типу хо-
зяина. Число хлорелл в каждой парамеции
увеличивается после их повторного погло-
щения; затем скорость размножения хло-
релл снижается, приспосабливаясь к скоро-
сти роста хозяина. Способна ли апосим-
биотическая Р. bursaria вступать в симбиоз
с хлореллами из губок, гидр или других
штаммов Р. bursarial Как правило, легче
СИМБИОЗЫ В ЭВОЛЮЦИИ
169
всего восстанавливается ассоциация с пер-
воначальными симбионтами. Однако в не-
которых экспериментах по неясным при-
чинам образуются быстро растущие сим-
биотические комплексы между парамеция-
ми и хлореллами, экспериментально выде-
ленными из зеленых гидр [469, 470].
Ставились также опыты по лишению
пресноводного кишечнополостного Hydra
viridis его симбиотических хлорелл и вос-
становлению симбиозов с хлореллами,
аналогичными симбионтам Р. bursaria [171,
174]. В некоторых, хотя и не во всех слу-
чаях гетерологичные водоросли, получен-
ные как из парамеций, так и из отдаленно
родственных штаммов зеленых гидр, ока-
зались способными вступать в стабильный
симбиоз с гидрами [306].
Установлены генетические различия
между симбиотическими и свободноживу-
гдими формами как парамеций, так и хло-
релл [471]. Для полового процесса у Р.
bursaria необходимо присутствие хлорелл.
Характерный для инфузорий сложный по-
ловой цикл с участием микронуклеуса,
в котором за мейозом, приводящим
к образованию гаметических ядер, следует
аутогамия или конъюгация, никогда не на-
блюдался и не мог быть индуцирован у па-
рамеций, лишенных хлорелл, хотя у зе-
леных форм половой процесс легко наблю-
дается. Из этого был сделан вывод, что
симбиотическая ассоциация приводит к не-
обратимым генетическим изменениям
у обоих партнеров. Этот вывод был под-
твержден ультраструктурными исследова-
ниями. Эндосимбионты составляют не-
отъемлемую часть генетического аппарата
парамеций. Даже если бы можно было чет-
ко разграничить вклады хозяина и хлорелл
в генетическую систему, это не имело бы
особого смысла, как убедительно показано
в работе Каракашьяна и Зигеля [471].
В результате симбиоза каждая клетка
зеленой парамеции должна содержать
ДНК двух типов: специфическую для ин-
фузории и специфическую для хлореллы.
При равновесном центрифугировании ли-
затов зеленых парамеций в градиенте
плотности хлористого цезия были обнару-
жены две четко различимые полосы ДНК:
положение одной соответствовало пример-
но 60% GC, а другой-20% GC1 * (Маргелис,
1963, неопубликованные данные). Послед-
няя величина близка к опубликованным ве-
личинам плотности ядерной ДНК инфузо-
рий [815], а первая-к соответствующим
данным для зеленых водорослей [921]; та-
ким образом, очевидно, что одна из полос
содержит ДНК хлореллы, а другая-ДНК
1 Плотность ДНК зависит от содержания
нуклеотидных пар гуанин-цитозин (GC).
?зс. 7.11. Подвижные симбиотические комплексы протиста с бактериями. Неиденти-
звпированная девесковинида (d) с жгутиконосными палочковидными и веретеновидны-
бактериями-симбионтами выделена из подземного термита Cryptotermes cavifrons
^28]. А. Фазово-контрастная микрофотография девесковиниды. Длина клетки
- 100 мкм; u-ундулиподия. Параллельные ряды палочковидных бактерий распола-
потея косо на поверхности тела (Ь) и приблизительно поперечно на поверхности «го-
57вки» (h). Между «головкой» и телом имеется поясок мембраны, свободный от бакте-
рий- Веретеновидные бактерии не видны. Б. Поперечный срез кортекса девесковиниды.
. палочковидные бактерии (г) лежат в специальных карманах, покрытых густым «пуш-
тогда как веретеновидные бактерии (f) прикреплены своей длинной стороной
* ребрам на поверхности хозяина. Обращенная наружу поверхность каждой палочко-
кдной бактерии несет жгутики; место прикрепления жгутика в ворсистом гликокалик-
зг «дно у палочковидной бактерии слева. На той части клетки, которая окружена кар-
дезом девесковиниды, жгутиков нет, а гликокаликс редуцирован или тоже отсутствует.
3 клеточных стенках веретеновидных бактерий имеются желобки, соответствующие
зебрам на поверхности хозяина, в результате чего образуется соединение пазового ти-
IX Бактерии делятся in situ на поверхности простейшего, х 42 000. В. Негативно-кон-
-зьстный препарат, на котором видны бактериальные жгутики (f), идущие от края тела
лэесковиниды. х 10000. Г. Палочковидные бактерии, отделенные с помощью детер-
-дЕта от протиста. У каждой бактерии около дюжины жгутиков, расположенных толь-
« за той стороне, которая не была спрятана в кармане протиста. Длина жгутиков
* * мкм. Длина палочковидных бактерий ~ 3 мкм, диаметр ~ 0,75 мкм. Для сравне-
вн показаны дублеты микротрубочек из ундулиподий девесковиниды (mtd).
170
ГЛАВА 7
Рис. 7.12. Paramecium bursaria - фотосинтезирующая инфузория. [S.J. Karakashian.]
А. Живая клетка. В цитоплазме находятся сотни симбиотических хлорелл, cv-сокра-
тительные вакуоли; m - макронуклеус. Световая микрофотография, х 750. Б. Симбио-
тические хлореллы (с) в глотке парамеции. Электронная микрофотография тонкого
среза, х 2500. т-макронуклеус; g-глоточные реснички. В. Клеточная стенка симбио-
тической водоросли отслаивается в окружающую вакуоль, ограниченную мембраной,
х 5600. Г. Симбиотическая хлорелла на ранней стадии деления внутри вакуоли. Хло-
ропласт (с) уже разделился, пиреноид (центр отложения крахмала) регрессировал, на
каждом конце клетки видна борозда деления (fl), а вакуоли (v) лежат около формирую-
щейся плоскости деления, х 15 300. Д. Зрелая хлорелла внутри вакуоли. Обратите вни-
мание на чашевидный хлоропласт (с), эллипсоидальные крахмальные зерна (g),
крупный пиреноид (р) и митохондрию (т). х 14900.
инфузории. Интенсивность полосы, соот-
ветствующей 60% GC, указывает на то, что
ДНК хлореллы составляет около 30% всей
ДНК клетки. Столь высокая величина от-
ражает, вероятно, «молодость» ассоциа-
ции; она совместима также с тем фактом,
что обоих партнеров удается культивиро-
вать независимо друг от друга [470]. Не-
давно опубликован обзор данных по сим-
биотическим зеленым парамециям [468].
С течением геологического времени сим-
биоз, очевидно, будет «стареть» и все боль-
ше метаболических функций будет передо-
веряться ядру парамеций; можно ожидать,
что при этом дополнительная полоса ДНК
(специфичная для хлорелл) постепенно
уменьшится до размеров «сателлитных по-
лос», типичных для ДНК хлоропластов
или митохондрий, которая составляет
в лучшем случае несколько процентов от
СИМБИОЗЫ В ЭВОЛЮЦИИ
171
количества ядерной ДНК того же организ-
ма. Тот факт, что цианеллы из Glaucocystis
nostochinareum содержат лишь около 10%
от количества ДНК, характерного для сво-
бодноживущих коккоидных цианобактерий,
от которых они произошли, указывает на
ту же самую тенденцию-на редукцию ге-
номов симбионтов [401]. Таким образом,
прямое изучение ДНК может быть по-
лезным для определения эволюционного
возраста симбиозов и степени взаимозави-
симости партнеров (такие попытки пред-
принимались в ряде работ [269, 401, 845]).
Различие между симбиотическими зелены-
ми водорослями, которые удается культи-
вировать независимо от хозяев, и хлоро-
пластами водорослей и высших растений
частично может быть связано с эволю-
ционным возрастом симбиоза: ассоциации
между клетками растений и хлоропласта-
ми намного древнее.
В результате наследственного эндосим-
?иоза водоросли с Paramecium bursaria воз-
ник подвижный фотосинтезирующий про-
тает. Ассоциация гидры с хлореллой -
фотосинтезирующее животное (рис. 7.13).
В обоих случаях меченая двуокись углеро-
да, поглощенная хлоропластами водорос-
лей, вскоре может быть обнаружена в бел-
ках гетеротрофа. Перенос питательных
веществ от хлорелл к хозяину аналогичен
обмену метаболитами между пластидами
и нуклеоцитоплазмой водорослей и выс-
ших растений [469, 873, 942, 964].
С точки зрения теории симбиоза поиски
фотосинтезирующего организма, филогене-
тически связывающего цианобактерии
с водорослями и растениями,-это погоня
за призраком. Такие поиски имеют смысл
только в рамках представления о прямой
филиации. Симбиотическая парадигма ста-
вит другие вопросы. Какие автотрофы бы-
ли предками пластид зеленых водорослей?
Какие протисты впервые приобрели сим-
бионтов-фотосинтетиков? Какие видоизме-
нения претерпели хозяева и симбионты по-
'13. Hydra viridis—фотосинтезирующая гидра. А. Зеленая пресноводная гидра,
кг-течающаяся в природе, и бесцветная гидра, «излеченная» от внутриклеточных хло-
Х1- к 30. Если зеленых гидр подвергать действию сильного света в присутствии ин-
тс-торов фотосинтеза, они выбрасывают своих симбионтов. Б. Гастро дермальная
стггз бесцветной Н. viridis (штамм Каролина) примерно через 5 ч после кормления
седлами. Если таким гидрам предоставить взвесь подходящих хлорелл, они погло-
^iix-T водоросли, которые попадают в гастродермальные клетки. Водоросли мигри-
к дистальному концу каждой клетки. Миграцию подавляют агенты, ингибирую-
пае полимеризацию белка микротрубочек [174, 306]. Световая микрофотография,
:?л» В. Гастро дермальная клетка Н. viridis с нормальным распределением
-ряклеточных симбиотических водорослей; они концентрируются в периферической
клетки, где освещенность максимальна. Световая микрофотография, х 3200.
172
ГЛАВА 7
еле возникновения ассоциации? В каких
отношениях хозяева и симбионты сохрани-
ли генетическую и метаболическую авто-
номию? Сколько раз в истории жизни и
с какими партнерами гетеротрофы и фото-
синтезирующие прокариоты вступали
в симбиоз? В гл. И эти вопросы будут по-
ставлены в связи с рассмотрением пластид
водорослей и высших растений.
Bdellovibrio bacteriovorans удивитель-
ный пример «включения» одной прока-
риотической клетки в другую без фаго-
цитоза. Подобно вирусам, эти крошечные
жгутиконосные бактерии образуют бляшки
на газонах грам-отрицательных бактерий.
Внешне эти бляшки очень похожи на
бляшки, образуемые бактериофагами,
и они были обнаружены в ходе рутинных
вирусологических манипуляций. Бделлови-
брионы образуют такие бляшки, лизируя
бактерию-хозяина. Однако в отличие от
фаговых эти бляшки продолжают расти,
пока не покроют всю поверхность чашки
Петри. Клетки бделловибрионов имеют
около 0,5 мкм в диаметре при типичной
вибрионной форме; каждая несет един-
ственный полярный жгутик. После откры-
тия и выделения первых бделловибрионов
в морских и пресноводных биотопах были
обнаружены и другие представители этой
группы. К настоящему времени описаны
три вида с сильно различающимся содер-
жанием GC в ДНК (28, 38 и 51%, что
указывает на конвергентную эволюцию
хищничества): В. bacteriovorans, В. starrii
и В. stolpii [917]. Бделловибрионы дикого
типа прикрепляются к более крупной бак-
териальной клетке и затем проникают
внутрь ее. Они не очень разборчивы по от-
ношению к добыче: это могут быть коли-
формные бактерии, спириллы и другие эу-
бактерии [907]. В последних сообщениях
утверждается даже, что бделловибрионы
могут размножаться в комплексе с эука-
риотами-внутри нитей Spirogyra и на по-
верхности некоторых хлорелл.
Бделловибрионы - облигатные аэробы,
способные к дыханию. Проникнув внутрь
бактерии, они репарируют наружную мем-
брану жертвы липидными «заплатами»
и продвигаются дальше в глубину клетки.
Они заставляют своих хозяев образовы-
вать сферопласты, растворяют пептидогли-
кановый слой клеточной стенки хозяина
и затем размножаются, окруженные его
наружной оболочкой,-топологически вне
клетки, но внутри периплазмы, т.е. про-
странства между клеточной стенкой и мем-
браной (рис. 7.14). Образуются несколько
нуклеоидов бделловибриона и связанные
с ними белоксинтезирующие системы в ви-
де длинных нитей; последние затем разде-
ляются на бделловибрионы нормальной
величины путем образования поперечных
стенок. В конце концов они вызывают ли-
зис хозяина. Хотя удалось выделить му-
тантные формы бделловибрионов, расту-
щие на среде без хозяев, скорость их роста
была намного ниже оптимальной, дости-
гаемой внутри бактерий. Очевидно, их пи-
щевые потребности достаточно сложны.
У прокариот никогда не наблюдались пи-
ноцитоз или фагоцитоз, так что проникно-
вение этих дышащих кислородом гетеро-
трофных бактерий в периплазматическое
пространство других бактерий - важная мо-
дель приобретения протомитохондрий
протоэукариотическими клетками.
Молекулярные детали дыхательной си-
стемы бделловибрионов не изучены. При
наличии таких данных некоторые бделло-
вибрионы, возможно, оказались бы канди-
датами на роль предков митохондрий.
В настоящее» время, однако, наиболее
вероятный кандидат - бактерия Paracoccus
denitrificans1, свободноживущий факульта-
тивный аэроб, способный к дыханию [454,
455, 457]. Основанием для такого вывода
служит удивительное сходство этой бакте-
рии с митохондриями животных и дрож-
жей по деталям организации дыхательной
системы (табл. 7.4) [456]. Сходны не толь-
ко хиноны и цитохромы в цепи переноса
электронов (рис. 7.15), но и трехмерная
конфигурация цитохромов и строение мем-
бранной АТРазы Fr, что сближает мито-
хондрии с Р. denitrificans в большей степе-
ни, чем с другими бактериями. Имеются
три явных различия между Р. denitrificans
и митохондриями: бактерии имеют клеточ-
ную стенку, они способны восстанавливать
1 Эти грам-положительные кокки раньше
назывались Micrococcus denitrificans [102].
ИМБИОЗЫ В ЭВОЛЮЦИИ
173
Рис. 7.14. Bdellovibrio, хищная бактерия. На
всех электронных микрофотографиях мас-
штабный отрезок равен 0,5 мкм. [Н. Stolp.]
А. Одиночный паразит в периплазме хозя-
ина. Б. Клетка Bdellovibrio, прикрепленная
к жгутиконосной палочковидной бактерии-
хозяину. Негативный контраст. В. Клетка,
частично проникшая в периплазму хозяина
(р)-
^<трат и нитрит до азота и закиси азота
анаэробных условиях, и у них нет си-
емы транспорта АТР. В митохондриях
^ая система переносит АТР, синтези-
• емый внутри органеллы, в цитоплазму.
различия легко объяснить, если мито-
хондрии произошли от предков, сходных
с Р. denitrificans. Клеточные стенки и спо-
собность восстанавливать нитрат были
утрачены, так как они оказались излишни-
ми во внутриклеточной среде древних про-
тоэукариот-в аэробной, богатой азотом
Цитохромоксидаза
. Цепь транспорта электронов, общая для митохондрий и Paracoccus denitri-
174
ГЛАВА 7
Таблица 7.4. Особенности, сближающие Paracoccus denitrificans с митохондриями (456, 457]1
Дыхательная цепь
Сукцинат- и NADH-дегидрогеназы; трансгидрогеназы и FeS-белки
Два цитохрома типа b и два типа с, легко различимые спектроскопически;
Убихинон-10-единственный хинон
Цитохромы а и а3 функционируют как оксидазы
Чувствительность к низким концентрациям антимицина
Окисление NADH ингибируется ротеноном и пиерицидином А
Окисление сукцината ингибируется карбоксином и теноилтрифторкетоном
Окислительное фосфорилирование
Отношение Н+ :О равно 8 в присутствии NADP H
Регуляция дыхания снимается ADP и разобщителями окислительного фосфорилирования
АТРаза содержит прочно связанный нуклеотид, обмениваемый при энергизации; АТРаза
ингибируется вентурицидином и 7-хлор-4-нитробензол-2-окси-13-Диазолом
Синтез, но не гидролиз АТР ингибируется ауровертином
Мембранные фосфолипиды
Основной компонент - фосфатидилхолин
Все жирные кислоты с неразветвленной цепью, насыщенные или мононенасыщенные 5
Многие из этих особенностей встречаются и у других бактерий, но полный список, насколько известно, свойствен только
Р. denitrificans и митохондриям.
среде со сбалансированным солевым со-
ставом. Что касается транспорта АТР, то
для Р. denitrificans выделять АТР во внеш-
нюю среду-все равно что для нас раз-
брасывать деньги на улице. Таким обра-
зом, современная митохондриальная систе-
ма транспорта АТР должна была возник-
нуть в процессе эволюции вместе с самим
симбиозом. Если бы нам были известны
аминокислотные последовательности бел-
ков этой системы, то мы, вероятно, могли
бы распознать в них видоизмененные ма-
кромолекулы, первоначально выполнявшие
какие-то другие функции. Во всяком случае
предков митохондрий следует искать среди
бактерий, которые способны проникать
внутрь клеток хозяина и размножаться
в них и сходны по особенностям дыхатель-
ной системы с Paracoccus denitrificans.
Генетический анализ симбиоза: терминология
Наиболее ясную и прямую интерпретацию данных о первичной структуре
[5S-PHK, ферредоксина, цитохрома с] дает симбиотическая теория происхождения
эукариот.
Шварц, Дэйхофф, 1978 [835]
В связи с полигеномной природой эука-
риотических клеток Ф. Тэйлор [932] выска-
зал мнение, что термин «клетка» неадеква-
тен и должен быть исключен из нашего
лексикона. Это простое короткое слово за-
темняет тот факт, что прокариотическая
«клетка» составляет одну белоксинтези-
рующую единицу, а эукариотическая со-
держит много таких единиц. Тэйлор со-
ответственно предложил заменить слово
кле/пка терминами монада, диада, триада,
квадрада и т.д. в зависимости от числа раз-
ных типов белоксинтезирующих единиц,
контролируемых генами и ведущих себя
как индивидуумы в составе ассоциации
(рис. 7.16). Большинство бактерий состоят
из одной такой единицы и с полным пра-
вом могут называться монадами. Слово
многоклеточный, обозначающее организм,
состоящий из множества клеток, тоже не-
СИМБИОЗЫ В ЭВОЛЮЦИИ
175
Монада Диада Триада Тетрада
дигеномные—тригеномные-тетрагеномные —пентатеномные-----гексагеномные —ютльтигеномиые
Полимонада Полидиада Политриада Политетрада
расположение произвольное
Рис. 7.16. Классификация симбиотических комплексов. (По [932].)
адекватно. Его следует заменить серией
терминов: полимонада, полидиада, поли-
триада и т.д. Например, если нуклеоцито-
длазму, митохондрии и пластиды считать
монадами, то растительные клетки следует
называть триадами, а сами растения-по-
литриадами. «Многоклеточные» бакте-
рии - например, миксобактерии и нитчатые
дианобактерии-будут тогда полимонада-
ми.
При традиционной классификации
рюрм симбиоза основное внимание уделя-
тось относительным скоростям роста
партнеров (паразитизм, мутуализм и ком-
менсализм). Некоторые авторы подразде-
ляли симбиозы по способам питания парт-
неров и по их воздействию друг на друга
^екротрофизм, биотрофизм и т.д., [552,
55?]). Однако относительные скорости ро-
гтз и даже способы питания могут зави-
_етъ от изменений среды. Например, в экс-
периментах Джиона с амебами вчерашний
5агтериальный патоген становился вполне
безвредным симбионтом (см. стр. 187). На
жгу зеленые гидры получают от своих
оетосинтезирующих симбионтов питатель-
нее вещества; однако другие метаболиты
err на свету, так и в темноте переходят от
гидры к водорослям [944]. Более того, при
очень интенсивном освещении зеленые
гидры полностью утрачивают своих фото-
синтезирующих симбионтов и нефотосин-
тезирующих бактерий; таким образом, за
несколько дней могут измениться многие
генетические и метаболические аспекты их
ассоциации [612]. Мы видим, что тради-
ционные термины часто не подходят для
описания тонких изменений в реальных
взаимоотношениях.
По числу полифилетических белоксин-
тезирующих систем, контролируемых гена-
ми, легко группировать не только полиге-
номные клетки, но и симбиозы вообще.
Схема Тэйлора описывает симбиозы
в терминах, позволяющих ставить во-
просы, ответ на которые может быть полу-
чен в молекулярно-биологических экспери-
ментах
1 Дальнейшее обсуждение и многочис-
ленные примеры монад, диад, полимонад и т.д.
см. в нашей статье 1976 г. [608]. В ней содер-
жится также словарь и обсуждаются дополни-
тельные геномы, число которых больше числа
белоксинтезирующих единиц (например, вирусы
в зараженных ими клетках).
176
ГЛАВА
МОНО-ди- ТРИ- ТЕТРА- ПЕНТА- ГЕКСА- ГЕПТА- ПОЛИГЕНОМНЫЕ
.#pla+
S pU
n+mi+
b+sb+
b+pro
Reticulitermes
IF ' a+f+f'
Actinoplana Drosophila Eubostrichus ^acteriophila Cassiopeia Cuscufa Sargassum natans
гЖ b+v
pro+b+v
n+mi+pis+
pro+v
Paramecium aurelia
Escherichia coli
>pla+?
*4
Lyngbya Homo sapiens Zea mays,
В-хромосомы?
Рис. 7.17. Матрица симбиозов.
Peridinium batticum
inv+sb+
v+v
Drosophila
КЛЮЧ:
Число Сокра- Тип организма
геномов, щение
монад
w
1,1
11
1,1
1,1
10
2,2
2,2
2,2
3,3
3,3
2Л
b
sb
cy
n
pls
ml
v
ve
inv
f
a
pla
pro
Бактерии
Спирохеты
Цианобактерии
Нуклеоцитоплазма
Фотосинтетические
пластиды
Митохондрии
Вирусы
Позвоночные
животные (n-mi)
Беспозвоночные
животные (n-mi)
Гривы (n-mi)
Водоросли(п-|й5-1т)
Зеленые
растения(п-р1з~пп)
простейшие
Полигеномные системы вообще распро-
странены в природе чрезвычайно широко;
эукариотические клетки производят в этом
плане наибольшее впечатление скорее по-
тому, что мы хорошо знакомы с ними,
а не по причине их особой уникальности
(рис. 7.17). На самом деле существует не-
прерывный ряд ассоциаций от лабильных
экологических и физиологических симбио-
зов, не требующих прямого контакта, до
столь тесных пространственно-временных
комплексов, что нелегко установить проис-
хождение партнеров. На рис. 7.18 схемати-
чески представлены некоторые примеры
ассоциаций разной степени прочности ме-
жду гетеротрофами и фотосинтетиками.
На рис. 7.19 представлена довольно неожи-
данная и необычная диада-ресничная ин-
фузория, свернутая в трубку, внутри кото-
рой растут фотосинтезирующие бактерии,
используемые инфузорией в пищу.
Взаимодействие генетических систем
при образовании симбиотических комплек-
сов во многих отношениях аналогично по-
ловому процессу, при котором разде-
ленные ранее гены объединяются в одной
особи [610]. Парасексуальный аспект осо-
бенно очевиден в тех случаях, когда парт-
неры регулярно вступают в ассоциацию
и выходят из нее. Таковы паразитические
цветковые растения; бобовые и их азот-
фиксирующие ризобии; грибы и водоросли
в составе лишайников; фотосинтезирую-
щий плоский червь Convoluta/Platymonai
Образуются новые индивидуумы - про-
дукты слияния независимых генетических
систем. Естественный отбор далее дей-
ствует уже на комплексы, сохраняя и моди-
фицируя их, так как они оставляют больше
потомства, чем обособленные партнеры
Первоначальное или повторное возникно-
вение симбиоза можно сравнить с оплодо-
творением, распад симбиоза-с мейозом
Принципиальная разница состоит, однако
в длительности периода, прошедшего по-
сле дивергенции партнеров от общег:
СИМБИОЗЫ В ЭВОЛЮЦИИ
177
РгосМогоп
на дидемнидах
МинроБы рувца
жвачных или
кишечника
термитов
Цианобактерии
в морских
ГУБках
Люминесцентные
Бактерии у
Pyrosoma
Плоский червь
Amphiscolops langerhansi
с Amphidlnium
симбиотических симбиотические
хлоропластов хлоропласты
Elysia Elysia
7.18. Уровни интеграции симбионтов. А. Симбиозы между грибами и растения-
чз. Б. Симбиозы между протистами или монерами и животными или растениями.
К Гипотетический ряд возрастания интеграции, иллюстрируемый конкретными при-
зерами симбиозов. (Из [874], с изменениями.)
178
ГЛАВА 7
Рис. 7.19. Инфузория Kentrophorus Faure-Fremier-настоящая «культуральная камера»
для анаэробных бактерий. [И. Б. Райков, Институт цитологии АН СССР, Ленинград.]
А. Дорзальная часть тела инфузории обращена к просвету «пробирки», в которой рас-
тут симбиотические пурпурные фотосинтезирующие бактерии (s). У верхнего края фо-
тографии видны вентральные реснички (с). Прикрепленные симбиотические бактерии
лишены клеточных стенок; они постепенно поглощаются псевдоподиями дорзальной
части инфузории. Электронная микрофотография, х 7000. Б. Продольное деление фо-
тосинтезирующей пурпурной серобактерии, «культивируемой» инфузорией, х 15 000.
В. Продольный и поперечный (вверху слева) разрезы спирохетоподобной бактерии,
прикрепленной к поверхности Kentrophorus. Эти бактерии встречаются также в ассо-
циации с серными бактериями внутри «пробирки», образуемой телом инфузории [759].
х 52000.
предка. При половом процессе этот период
очень краток, от нескольких генераций до
нескольких тысяч генераций. При симбиозе
он обычно весьма длителен, и партнеры
могут успеть очень сильно дивергировать.
Может быть, эукариотические организмы
и другие полиады уместно сравнить с ши-
стосомами. Эти черви проводят большую
СИМБИОЗЫ В ЭВОЛЮЦИИ
179
*лсть своего жизненного цикла в парах-
2амиы и самки соединены в позе копуля-
ции. Эукариоты, за редкими исключениями
как, например, водоросли, не содержащие
цластид, или анаэробные гипермастиготы,
•тратившие митохондрии), не теряют
ж»их органелл-партнеров. Ни у кого из
-уд не обнаружено циклов регулярной
•траты и приобретения органелл. Как
i шистосомы, они обречены рождаться,
кить и умирать в вечном копулятивном
сиянии!
Симбиоз, как и половой процесс,-мощ-
ш сила эволюции, объединявшая пре-
i-цаптированные генетические комбинации
> отсутствие мутаций (по крайней мере
зеачале). Симбиотические комплексы - важ-
нейший источник «сырья» для возникнове-
ния истинных эволюционных новшеств.
Портье в 1918 г. [740] и Уоллин в 1927 г.
[995], несмотря на допущенные в энтузи-
азме преувеличения, правильно оценили
огромную роль, которую сыграл симбиоз
в возникновении новых видов, а через них
в конечном счете-и новых высших таксо-
нов.
ГЛАВА 8
АЭРОБИОЗ И МИТОХОНДРИИ
Митохондрии: кто приобрел их впервые?
Позднее Уоллин (1922) утверждал, что хондриосомы [митохондрии] можно рас-
сматривать как симбиотические бактерии, ассоциация которых с другими компонен-
тами цитоплазмы могла создаться на самых ранних этапах эволюции... Без сомне-
ния, многим сейчас такие спекуляции могут показаться слишком фантастическими,
чтобы упоминать о них в кругу благовоспитанных биологов; и тем не менее
вполне возможно, что придет день, когда они будут обсуждаться более серьезно.
Удовлетворяют ли митохондрии крите-
риям, по которым можно распознать орга-
неллы, возникшие путем эндосимбиоза?
Для решения этого вопроса можно при-
влечь обширнейшую литературу по мито-
хондриям (табл. 8.1). Представление о ми-
тохондриях как о тесно интегрированных
эндосимбионтах ставит новые вопросы.
Что представляли собой нуклеоцитоплаз-
матические хозяева, у которых появились
протомитохондрии? Какие аэробные бак-
терии стали митохондриями? Было ли их
приобретение полифилетическим? С каки-
ми генетическими изменениями была свя-
зана интеграция митохондриальной и ну-
клеоцитоплазматической систем? Почему
так вариабельна генетическая организация
митохондрий?
Хотя у эукариот невозможно вызвать
утрату митохондрий, у некоторых дрож-
жей, получающих энергию за счет броже-
ния, может происходить их дедифференци-
ровка в промитохондрии (рис. 8.1). Хотя
эти дрожжи сохраняют способность вос-
станавливать свои митохондрии, они мо-
гут расти и без дыхательного метаболиз-
ма. Как высокие концентрации субстратов
для брожения (например, глюкозы), так
и отсутствие кислорода подавляют разви-
тие митохондрий из промитохондрий, хотя
и разными путями. Этот необычный для
эукариот факультативно анаэробный образ
жизни делает возможной передачу по на-
следству летальных или очень вредных ми-
тохондриальных мутаций в условиях, ког-
Э. Вильсон, 1925 [1025]
да происходит брожение, а не дыхание;
у других эукариот такие мутации не могли
бы передаваться: облигатные аэробы с та-
кими генами погибли бы. Поэтому почти
вся конкретная информация о генетике
и развитии митохондрий получена в иссле-
дованиях на дрожжах. Нам неизвестны
растения, животные или грибы, у которых
никогда не было бы митохондрий. Немно-
гие эукариоты, у которых они отсутствуют,-
это протоктисты: некоторые инфузории
и амебы, а также некоторые симбионты,
обитающие в анаэробных или микроаэро-
фильных условиях в кишечнике термитов
и питающихся древесиной тараканов.
Очень немногие из этих организмов, кроме
ряда форм, расщепляющих целлюлозу
[1036], были получены в виде чистых куль-
тур, и о них нет никаких генетических
данных.
У истинно примитивных протоэука-
риот - нуклеоцитоплазматических хозяев,
не имевших митохондрий,-должны были,
вероятно, отсутствовать также митоз и ун-
дулиподии; если они не приобрели уже
симбионтов, способных к дыханию, то они
были микроаэрофилами или анаэробами.
Можно ли отличить такие организмы от
других прокариот или протистов, утратив-
ших митохондрии после вторичного засе-
ления анаэробных биотопов? Вероятно,
нет. Д. Сирси и его сотрудники утвержда-
ли, что превосходным кандидатом на роль
современного потомка протоэукариот мо-
жет быть Thermoplasma acidophila -термо-
АЭРОБИОЗ И МИТОХОНДРИИ
181
Таблица 8.1. Симбиотическое происхождение митохондрий
Что представляла собой свободноживу- щая форма протомитохондрий? Это могла быть аэробная грам-отрицательная эубак- терия, содержавшая ферменты цикла Кребса и сис- тему цитохромов для полного окисления углеводов до СО2 и Н2О. Примеры: Paracoccus denitrificans [454, 455, 457] (см. табл. 7.4); Bdellovibrio [907].
У какого свободноживущего хозяина впервые появились протомитоховдрии? У микробов, способных анаэробно сбраживать глюко- зу до пирувата по пути Эмбдена - Мейергофа (т.е. с гетеротрофным метаболизмом, основанным на брожении, который характерен для нуклеоци- топлазмы эукариот). Пример: Thermoplasma acidophilum [846].
Какие факторы среды способствовали закреплению симбиоза в эволюции? Присутствие кислорода в атмосфере, недостаток пи- тательных веществ, наличие специфических источ- ников питания.
Когда сформировались эти симбиозы? В протерозое, во время или после перехода к окис- лительной атмосфере.
Является ли симбиоз облигатным? В аэробных условиях-да. Только в особых случаях эукариотические микроорганизмы могут переносить де дифференцировку или утрату митохондрий; при- меры: Saccharomyces, Mixotricha, некоторые жгутико- носцы-полимастиготы [86, 608].
Какие признаки свободноживущих прока* риотеческих клеток сохранились у ми- тохондрий? Кольцевая ДНК, не связанная с гистонами [96, 324, 507, 679] (см. также табл. 8.4). ДНК синтезируется на всем протяжении жизненного цикла и поровну распределяется между дочерними митохондриями [768]. По «частоте ближайших соседей» и доле GC ДНК митохондрий ближе к ДНК бактерий, чем к ядерной ДНК эукариот [189]. «Цитоплазмати- ческие гены», неменделевское наследование мито- хондрий у эукариот, имеющих мейоз [255, 281, 323, 452, 669]. (Исследованы главным образом митохонд- рии дрожжей, Neurospora, Tetrahymena, Physarum и клеток млекопитающих).
Какие компоненты митохондрий коди- руются ядерными генами? Цитохром с [851], малатдегидрогеназа, фумараза [151], полипептиды Fj-АТРазы [119, 255].
Какие новые синтезы оказались возмож- ными благодаря появлению митохонд- рий? Синтез производных стероидов и некоторых полине- насыщенных жирных кислот (см. табл. 6.8), убихино- на и, вероятно, других вторичных метаболитов, особенно у растений.
182
ГЛАВА 8
Продолжение табл. 8.1
Почему митохондрии имеются в сперма- тозоидах, спорах плесневых грибов, се- менах и других клетках, служащих для размножения? Они (или по крайней мере их генетический мате- риал) должны сохраняться на протяжении всего жизненного цикла, так как ядерные гены не способны обеспечить формирование митохондрий; последние нужны также для синтеза АТР и регуляции рас- пределения кальция.
Какие внутриклеточные механизмы обес- печивают сохранение митохондрий на протяжении всего жизненного цикла организма-хозяина? Как можно индуци- ровать утрату митохондрий? Механизмы сохранения перечислены в табл. 8.6. Ин- дуцировать утрату митохондрий обычно нельзя, так как симбиоз почти всегда бывает облигатным; одна- ко у некоторых организмов можно необратимо уменьшить количество митохондриальных структур и их ДНК с помощью мутагенов, например ак- рифлавина [281, 786], к которым эта ДНК более чувствительна, чем ядерная [515].
В какой степени могут митохондрии дедифференцироваться ? У большинства уэкариот не могут или почти не могут. У факультативных анаэробов, таких как дрожжи и трипаносомы, возможна дедифференцировка вплоть до неразличимости в электронном микро- скопе. У дрожжей вся система дифференцировки митохондрий индуцибельна и чувствительна к кон- центрации глюкозы и О2 [786].
Какие виды РНК синтезируются в мито- хондриях? Рибосомные и транспортные РНК, отличные от ядер- ных [49, 189, 351, 869, 1023]. Последовательности рибосомных РНК митохондрий более сходны с та- ковыми у бактерий, чем с последовательностями рРНК из цитоплазмы тех же клеток [119, 246].
Какие белки синтезируются в митохонд- риях? (О синтезе белка in vitro см. [96, 507, 786].) Как рибосомные белки, *гак и ферменты; Митохонд- рии содержат специфические «миторибосомы», отли- чающиеся по структуре и по составу РНК и белков от «циторибоеом» [324, 558]. Синтез белка чувст- вителен к хлорамфениколу, но не к циклогекси- миду [151, 234].
Происходит ли в митохондриях синтез липидов? Синтезируются липиды наружной мембраны мито- хондрий [151, 715]. Липидные фракции митохондрий дочерних клеток получают равные количества мече- ного холина, введенного в родительскую клетку [768, 786].
Почему нуклеиновые кислоты и ферменты «упакованы» в митохондриях всех гри- бов, животных и растений? Они были приобретены в комплексе в составе внутри- клеточных симбионтов гетеротрофными предками всех современных эукариот.
АЭРОБИОЗ И МИТОХОНДРИИ
183
Продолжение табл. 8.1
Почему некоторые митохондриальные функции контролируются ядром? Облигатным симбионтом свойственна тенденция пере- кладывать на хозяина функции, ставшие избыточ- ными. Это позволяет объяснить ядерный контроль физиологии митохондрий (например, в летательных мышцах насекомых [366]), кодирование митохонд- риальной РНК-полимеразы ядерным геномом [49] и интеграцию ядерных и митохондриальных функ- ций [324].
Почему число и размеры митохондрий в разных клетках различны? Как и во всех симбиотических ассоциациях, соотно- шение симбионт/хозяин не вполне постоянно.
Чем объясняется сходство митохондрий у растений, животных и грибов? Протомитохондрии вступили в симбиоз с ферменти- рующими гетеротрофами раньше, чем предки водо- рослей и растений приобрели фотосинтезирующие пластиды. Общие предки всех эукариот были гетеро- трофными амебоидами, обладавшими митохондрия- ми. Сходство митохондрий говорит в пользу их монофилии, но не доказывает ее однозначно.
Почему митохондриальные гены имеют мозаичную структуру? Возможно, это результат сотен миллионов лет эволю- ции эндосимбионтов; а может быть, так были орга- низованы гены протомитохондрий; вопрос не ясен.
Почему внутри митохондрий имеются кристы? Это приспособления для увеличения поверхности, несущей окислительные ферменты; кристы - эволю- ционные аналоги мезосомальных мембран многих прокариот.
Почему митохондрии дрожжей и регене- рирующей печени крысы чувствительны к ингибиторам прокариотического син- теза белка, но не к циклогексимиду? Протомитохондрии были прокариотическими клетка- ми ; поэтому такие ингибиторы (стрептомицин, хлор- амфеникол, спектиномицин, паромомицин и др.) действуют и на белоксинтезирующую систему мито- хондрий. Циклогексимид же действует на рибосомы эукариот.
Если митохондрии возникли как эндо- симбионты, то почему у них нет кле- точных стенок? Клеточные стенки не нужны в контролируемой, осмотически регулируемой, забуференной среде ци- топлазмы, в которой находятся митохондрии. По- этому они были элиминированы естественным отбором.
Почему одна митохондрия часто содер- жит несколько геномов, а размеры ми- тохондрий варьируют? Митохондрии произошли от внутриклеточных симби- онтов типа Bdellovibrio, у которых часто образуется несколько копий генома до формирования плаз- матической мембраны и поперечных стенок.
184
ГЛАВА 8
Рис. 8.1. Дрожжи с митохондриями и без них. [A.W. Linnane.] А. У дрожжей, расту-
щих в анаэробных условиях или при высокой концентрации глюкозы, развитие мито-
хондрий подавлено. Способность к редифференцировке митохондрий сохранена, так же
как и митохондриальная ДНК, хотя нет никаких морфологических признаков сущест-
вования митохондрий. N-ядро. х 14000. Б. Когда условия вновь становятся аэробны-
ми и запасы глюкозы истощаются, митохондрии появляются снова. Митохондрия
в правой нижней части клетки, по-видимому, делится, х 20 000.
и ацидотолерантная микоплазма [846,
847]. Они обнаружили у этого лишенного
клеточной стенки прокариотического орга-
низма гистоноподобные и актиноподобные
белки. Сочетание признаков: отсутствие
клеточной стенки, брожение по пути Эмб-
дена-Мейергофа, склонность к вступле-
нию в ассоциации, потребность в стеролах,
толерантность к кислотам и высоким тем-
пературам [201], а также чувствительность
к цитохалазину В [317]-подкрепляет гипо-
тезу Сирси. Предполагали даже, что Sulfo-
lobus, окисляющая серу термо- и ацидоре-
зистентная бактерия, способна в отличие
от других прокариот поглощать частицы.
Однако нуклеотидные последовательности
16S-PHK Thermoplasma и Sulfolobus указы-
вают на то, что эти микробы ближе к архе-
бактериям (метаногенам и галобактериям),
чем к нуклеоцитоплазме эукариот [1029].
Возможно, что ближайший ныне жи-
вущий родственник протоэукариот-это
крупная анаэробная амеба Pelomyxa
palustris. У нее нет митоза и митохондрий,
но ее, к сожалению, не удается культивиро-
вать [199, 1011]. Поскольку этот организм
имеет ядерные мембраны, его формально
следует считать эукариотой, хотя отсут-
ствие других эукариотических черт делает
его аномальным. Не исключено, что
Pelomyxa никогда не имела митохондрий и,
таким образом, является прямым связую-
щим звеном с теми организмами, которые
когда-то приобрели протомитохондрии
в качестве эндосимбионтов. Но возможно
и то, что в процессе эволюции Pelomyxa
утратила центриоли, митотическое верете-
но, митохондрии и прочее. Трудно понять,
как могло все это бесследно исчезнуть, но,
строго говоря, пока еще нельзя сделать
АЭРОБИОЗ И МИТОХОНДРИИ
185
выбора между двумя упомянутыми воз-
можностями.
Сравнение микроаэрофильного метабо-
лизма, характерного для цитоплазмы эука-
риот [216], с метаболизмом кандидатов
на роль протоэукариот, таких как Ther-
moplasma, может помочь в поиске по-
следних. Критериями могут быть: гомоло-
гия последовательностей ДНК и рибо-
сомных РНК, организация генома, присут-
ствие нуклеосом, гомология аминокис-
лотных последовательностей в ферментах
гликолитического пути Эмбдена-Мейерго-
фа, наличие характерных цитоплазматиче-
ских окислительных органелл пероксисом,
присутствие в цитоплазме и аминокис-
лотные последовательности «двигатель-
ных» белков, таких как актины и миозины,
а также кальмодулинов [501] и фосфоли-
пидно-белковый состав плазматической
мембраны. Особенно интересно предполо-
жение Де Дюва [215, 216], что перокси-
сомы могли возникнуть у микроаэро-
фильных протоэукариот еще до приобрете-
ния митохондрий.
Показано [715], что внешний слой
двойной мембраны митохондрий более
сходен с мембранами эндоплазматического
гхггикулума (ЭР), чем с внутренней мито-
хондриальной мембраной (табл. 8.2). О чем
свидетельствует сравнение ЭР и внутрен-
них митохондриальных мембран с плаз-
матическими мембранами Bdellovibrio,
Paracoccus и Thermoplasma? Предсказание
теории симбиоза состоит в том, что вну-
тренняя мембрана должна быть гомоло-
гична мембране протомитохондрий, а на-
ружная и мембраны ЭР-мембранам про-
тоэукариот.
Важная и почти уникальная особен-
ность метаболизма эукариот-это их спо-
собность к синтезу стероидов. Все мем-
браны эукариот содержат значительное
количество этих циклических липидов.
Синтез стероидов, вероятно, является про-
дуктом взаимодействия разных геномов
на метаболическомдуровне (см. рис. 7.6).
Дрожжи с дедифференцированными мито-
хондриями, выращенные в анаэробных ус-
ловиях, нуждаются в стероидах, тогда как
ге же организмы, растущие аэробно
к имеющие нормальные митохондрии, мо-
->т их синтезировать.
Стероиды, такие как холестерол, по-ви-
димому, незаменимы для построения гиб-
ких динамичных мембран эукариот. При
всем их поразительном разнообразии все
стероиды можно произвести от общего
биосинтетического предшественника - ла-
ностерола. Это соединение превращается
в холестерол у животных и в цикло-
артенол у растений. Ланостерол обра-
зуется из универсального предшественника
изопреноидов сквалена, продукта метабо-
лического пути, ведущего от ацетата через
изопентенилпирофосфат. Для замыкания
кольца при синтезе ланостерола из сквале-
на необходим свободный молекулярный
кислород. В митохондриях присутствует
атмосферный или растворенный кислород,
используемый на последнем этапе аэроб-
ного дыхания.
Дитерпеновые спирты, вероятно, синте-
зировались протоэукариотами до приобре-
тения митохондрий, так как они образу-
ются в нуклеоцитоплазме дрожжей и
у большинства прокариот. Значит, их син-
тез, вероятно, должен теперь находиться
под генетическим контролем нуклеоцито-
плазмы. Следовательно, биосинтетический
путь от ацетата к сквалену скорее всего
контролируется ядерными генами, тогда
как ферменты пути, ведущего от ланосте-
рола к холестеролу, вероятно, находятся
(или по крайней мере первоначально нахо-
дились) под генетическим контролем про-
томитохондрий.
Биосинтез сложных терпеноидов - почти
исключительная прерогатива растений
(табл. 8.3). Биосинтез масел, дитерпенов
и тритерпенов, возможно, требует присут-
ствия более чем одного типа геномов: спо-
собность синтезировать циклические и окис-
ленные терпены, столь характерные для
растений, может быть обусловлена их три-
геномной природой-наличием нуклеоци-
топлазмы, митохондрий и пластид. Для
проверки этой концепции следует изучать
биосинтез терпенов при подавлении (фи-
зиологическом или мутационном) метабо-
лизма митохондрий, пластид или тех
и других. У дрожжей метаболизм мито-
хондрий может быть полностью обратимо
блокирован, а у некоторых эвгленовых
метаболизм фотосинтезирующих пластид
можно блокировать как обратимо, так
186
ГЛАВА 8
Таблица 8.2. Сравнение мембран митохондрий, бактерий н эндоплазматического ретикулума (ЭР) [715]
Внутренняя мембрана Наружная мембрана Гладкий ЭР Бактериальная мембрана1
митохондрий митохондрий
Толщина, нм 5,5 5,5 5,5
Тонкая структура «Глобулы», «Глобулы», «Глобулы»,
мембранные поры (2,8 нм), полисахарид-
субъединицы мембранные ная кайма
(9,0 нм) субъединицы (6,0 нм)
Плотность, г/см3 1,21 1,13 1,13
Отношение белок: липид 1 :0,275 1 :0,829 1 :0,385
Кардиолипин, % от всех 21,5 3,2 0,5 Много
фосфолипидов Фосфатидилинозитол, от 4,2 13,5 13,4
всех фосфолипидов Фосфатидилхолин, % от всех Не найден Не найден 4,5
фосфолипидов Фосфатидилэтаноламин — Много
Цитохром а + а3, мкмоль/г 0,24 <0,02 0,0
Цитохром Ь5, мкмоль/г 0,17 0,51 0,79
Проницаемость Для малых мо- Вероятно, для Для малых мо- Для малых мо-
лекул малых моле- кул и макро- молекул лекул лекул
Реакция на изменение осмо- Реагирует Не реагирует Слабо реагиру- Реагирует
тического давления ет
Действие АТР Вызывает со- Не действует Не действует
кращение
Холестерол Очень мало Присутствует Много ч Отсутствует2
1 По [884]. Изучалась бактерия Serratia.
2 Кроме микоплазм.
и необратимо. Установление корреляции
между способностью к синтезу стероидов
и терпеноидов и функционированием орга-
нелл помогло бы понять как распределе-
ние функций генетического контроля ме-
жду разными органеллами, так и происхо-
ждение соответствующих метаболических
путей. (См. в табл. 11.2 сводку анало-
гичных данных по каротиноидам.)
Если органеллы начинали свой путь как
свободноживущие организмы, то в момент
возникновения ассоциации важнейшие
метаболические системы должны были
иметься у обоих партнеров. По мере того
как естественный отбор устранял эту неиз-
бежную вначале избыточность, партнеры
становились все более зависимыми друг от
друга. Любое вещество, необходимое для
развития и размножения симбионта, дол-
жно либо поступать к нему из окружаю-
щей среды (из внешней среды или из клет-
ки хозяина), либо синтезироваться самим
симбионтом. Общая тенденция состоит
в том, что любой важный метаболит или
фермент, необходимый как хозяину, так
и симбионту, и синтезируемый вначале
обоими, будет со временем поставляться
только одним из партнеров, обычно хозяи-
ном. Метаболическая избыточность может
устраняться отбором до тех пор, пока
партнеры остаются вместе и между ними
возможен обмен продуктами генов и мета-
болитами. Если хозяин-эукариотический
организм, размножающийся половым пу-
тем, то он должен обладать механизмами,
обеспечивающими точное распределение
генов между дочерними клетками. В таком
случае эндосимбионту «удобно» использо-
КЭРОБИОЗ И МИТОХОНДРИИ
187
голица 8.3. Распространение способности к синтезу терпеноидов
единения1
Организмы, их синтезирующие
£итерпены (фитил, олеиновая кислота, витамин К)
Циклические терпены и их оксигенированные произ-
водные (воск восковницы, масло цитронеллы, розо-
вое масло, «эфирные масла», ликопин, каучук)
Шквален
Моноциклические терпены (масла лимона, мяты, им-
биря)
Дициклические терпены (скипидарное, камфорное, эв-
калиптовое масло)
Сесквитерпеновый спирт фарнезол
Все, кроме некоторых бактерий
Некоторые покрытосеменные
Все эукариоты; универсальный пред-
шественник стероидов (через циклоарте-
нол у растений и эргостерол у живот-
ных)
Некоторые покрытосеменные
Терпены (по традиции)-С10; сесквитерпены-С,5; дитерпены-С20; тритерпены-Сзо; политерпены
зать метаболические механизмы хозяина.
Если хозяин - нормальная диплоидная
клетка с. генетической системой менделев-
ского типа и синтез определенного метабо-
лита зависит от присутствия доминантных
генов, то рецессивные мутации могут отри-
цательно сказываться на размножении,
развитии или функционировании симбион-
та. Разумеется, фенотип таких хромо-
сомных рецессивов может проявиться
только в том случае, если симбионт
еще присутствует в цитоплазме: повтор-
ное приобретение доминантного гена, конт-
ролирующего синтез метаболита, необ-
ходимого для развития симбионта (на-
пример, определенной аминокислоты), ни-
когда не приведет к восстановлению утра-
ченного симбионта. Эти соображения по-
зволяют объяснять тот факт, что многие
метаболиты, синтез которых контроли-
руется ядром, имеют решающее значение
для передачи по наследству признаков,
определяемых цитоплазматическими орга-
неллами
Патоген становится органеллой:
аналогия с митохондриями
Патогенность-не правило. Напротив, она встречается так редко, у такого
относительно малого числа видов среди бесчисленных бактерий, населяющих
Землю, что кажется чем-то вроде каприза природы.
Томас, 1974 [941 ]
Настоящее возникновение новой си-
стемы органелл, в некоторых отношениях
аналогичное образованию митохондрий,
было изящно продемонстрировано цито-
биологом К. Джионом из Университета
штата Теннесси [449, 451]. В конце 60-х
а начале 70-х годов он исследовал ядерно-
1ШТ о плазматические отношения у Amoeba
proteus. Амебы, годами прекрасно себя чув-
ствовавшие, внезапно стали страдать от
бактериальной инфекции, которая, по-ви-
цимому, была занесена в лабораторию
случайно с новой партией амеб. Электрон-
но-микроскопическое исследование гибну-
щих амеб показало, что в каждой клетке
содержалось около 150 тыс. бактерий. Ско-
рость роста зараженных амеб резко пада-
ла ; некоторые, однако, выжили, и через не-
сколько лет у них восстановилась первона-
1 Так можно интерпретировать передачу
лизиновой ауксотрофности у некоторых штам-
мов дрожжей. Генетические детали таких воз-
действий на митохондрии и пластиды см. у Гил-
хэма [324].
188
ГЛАВА 8
Рис. 8.2. Зараженные амебы. Тонкий срез амебы штамма, живущего в стабильном
симбиозе с бактериями (В), которые раньше были агрессивными патогенами. Эти
амебы содержат в норме также «D-тельца» (D) и митохондрии (М). Как D-тельца, так
и митохондрии содержат ДНК и являются, вероятно, потомками более древних внут-
риклеточных бактерий-симбионтов. Электронная микрофотография. [К. Jeon, Univ, of
Tennessee.]
чальная скорость роста. Выжившие амебы,
которые в конце концов стали такими же
здоровыми, как и незараженные, по-преж-
нему содержали неидентифицированных
симбионтов, теперь в количестве около
50 тыс. на клетку (рис. 8.2).
В серии изящных экспериментов с
трансплантацией ядер Джион сумел пока-
зать, что ядро амеб, которые к тому вре-
мени уже около пяти лет жили в ассо-
циации с новыми бактериальными сим-
бионтами, стало зависимым от этих сим-
бионтов. Пересаженное ядро хозяина боль-
ше не могло поддерживать функциониро-
вание и деление цитоплазмы, если послед-
няя не содержала патогенных в прошлом
бактерий; в присутствии симбионтов, одна-
ко, такое ядро функционировало неопреде-
ленно долго. К сожалению, симбионты не
были выделены в культуре, и поэтому
осталось неизвестным, какие полезные для
ядра амебы функции выполняют эти грам
отрицательные бактерии. После стабилиза-
ции симбиоза увеличилась чувствитель-
ность комплекса к повышенным темпера-
турам и к некоторым антибиотикам [450]
Среда для получения аксенической куль-
туры амеб не разработана, и к тому же
у них неизвестен половой процесс. Это не
позволяет провести генетический и метабо-
лический анализ симбиоза. Поэтому сом-
нительно, что мы когда-нибудь узнаем
точно, что же получает нуклеоцитоплазма
амебы от своих 50 тысяч симбионтов. Этот
фактор, чем бы он ни был, амебы, очевид-
но, могли раньше производить сами. Для
того чтобы глубже понять отношения ме-
жду нуклеоцитоплазмой и органеллами,
нам следует обратиться к данным о мито-
хондриях грибов.
АЭРОБИОЗ И МИТОХОНДРИИ
189
Мутантные митохондрии
Аргументы в пользу того, чтобы считать митохондрии бактериями, основывают*
ся на следующих их свойствах: общие черты их поведения в клетках сходны
с таковыми у известных микроорганизмов, которые живут как симбионты в
клетках высших организмов, например клубеньковых бактерий в корнях бобовых.
Когда их выращивают независимо на искусственной среде, они во всех отношениях
ведут себя как бактерии. Они делятся подобно бактериям. Они сходны с бак*
териями по структуре и форме. Они не проявляют никаких культуральных
свойств, не типичных для бактерий.
Дж. Уоллин, 1927 [995]
Все митохондрии содержат ДНК, РНК
и рибосомы (рис. 8.3). Митохондриальная
ДНК двухцепочечная, обычно образует за-
мкнутое кольцо и имеет 5-50 мкм в длину
в зависимости от вида организма. Это со-
ответствует мол. массе 107—108 и недоста-
точно для кодирования всех белков, имею-
щихся в митохондриях. Нормально раз-
витые митохондрии-это продукт взаимо-
действия по крайней мере двух геномов-
митохондриального и ядерного. Показано,
что ряд структурных генов, кодирующих
митохондриальные компоненты, находится
в хромосомах (табл. 8.4) [254, 768, 851].
Таким образом, если митохондрии имеют
симбиотическое происхождение, то они
стали облигатными симбионтами.
Известно около 50 хромосомных генов,
называемых генами pet, контролирующих
дыхание у дрожжей. Дрожжи с мутациями
з этих генах (обозначаемых pet 1, pet 2
и т.д.) проявляют фенотип petite-мелкие
колонии при выращивании на чашках. Эти
гены не сцеплены, т. е. локализованы в раз-
ных хромосомах. Дрожжевые клетки, со-
держащие рецессивные аллели генов pet, не
могут расти на несбраживаемых субстра-
тах, таких как этанол, лактат и глицерин.
Они нуждаются в шестиуглеродных саха-
рах и родственных соединениях, которые
они анаэробно сбраживают до двух-
и трехуглеродных соединений. Такие дрож-
жи не способны к дыханию, хотя генетиче-
ские эксперименты показывают, что они
содержат митохондриальный генетический
детерминант, характерный для дикого типа
(р +). Симбиотическая теория может объяс-
нить это явление редукцией метаболиче-
ской избыточности, неизбежной у симбион-
тов; его можно сравнить с передачей
неизвестных функций хозяина симбиотиче-
ским бактериям у амеб, описанных Джио-
ном. Митохондрии, очевидно, имеют по-
требности, которые удовлетворяет окру-
жающая цитоплазма под контролем
ядерных генов. Ядра, гомозиготные по ре-
цессивным мутантным аллелям генов pet,
не способны поставлять необходимые ве-
щества, и поэтому митохондрии не могут
нормально развиваться, функционировать
Рис 8.3. Кольцевая ДНК, выделенная из митохондрий куриной печени. Негативное
контрастирование по методу Клейншмидта. [Е. F.J. van Bruggen, Biochem. Lab.,
Riikuniversitet, Groningen.]
190
ГЛАВА 8
Таблица 8.4. Некоторые продукты, кодируемые митохондриальной ДНК
Митохондриальные белки
Цитохром-с-оксидаза
CoQH 2-цитохром-с-редуктаза
CoQH 2-цитохром-Ь- редуктаза
Fj-АТРаза (три полипептида кодируются геномом митохондрий, четыре-ядерным геномом)
Формилметионил-тРНК-трансфераза (?)
Митохондриальные тРНК
Метионил I
Метионил I аргинил
Метионил I аспартил
Метионил I цистеил
Формилметилглутамил1 (глутаминовая кислота)
Формилметилглутамин
Формилметил глицил
Формилметилгистидил
Формилметилизолейцил
Формилметиллейцил
Формилметиллизил
или размножаться. Тот факт, что в культу-
рах дрожжей, несущих мутации pet, всегда
одновременно изменяется активность не-
скольких родственных ферментов [цито-
хромоксидазы (т.е. цитохромов а и а3)
и цитохрома Ь], позволяет предполагать,
что эти ферменты либо сами кодируются
митохондриальным геномом, либо нахо-
дятся под контролем какого-то фактора,
кодируемого этим геномом.
Интересно, что одна из ядерных мута-
ций pet вызывает как развитие фенотипа
petite, так и возникновение потребности
в лизине [669]. Лизин, синтез которого
контролируется ядерными генами, очевид-
но, необходим для нормального развития
митохондрий; в клетках, несущих рецес-
сивные аллели, лизин не синтезируется со-
всем или образуется лишь в малых количе-
ства. Если к культуральной среде доба-
вить лизин, можно получить фенокопии
дикого типа, у которых восстанавливается
активность митохондрий. Опять приходит
на ум аналогия с амебами Джиона: репро-
дукция митохондрий возможна только
в том случае, если предоставляется
нужный метаболит. Кроме синтеза лизина,
под ядерным контролем находится синтез
ряда митохондриальных белков. Хлорам-
феникол-мощный ингибитор белкового
синтеза, специфически действующий на ри-
босомы прокариот,-селективно подавляет
синтез ферментов в редифференцирующих-
ся митохондриях дрожжей [151], в мито-
хондриях регенерирующей печени крыс
[289, 558], а также, вероятно, в митохон-
дриях клеток человека [288]. Однако поли-
пептидная цепь рибосомного белка, с ко-
торым связывается этот антибиотик, коди-
руется ядром. Эти наблюдения не только
указывают на то, что рибосомы митохон-
дрий более сходны с рибосомами свобод-
ноживущих прокариот, чем с рибосомами
цитоплазмы собственных клеток, но и сви-
детельствуют о том, что информация для
синтеза белка, связывающего хлорамфени-
кол, была перенесена из митохондрий
в ядро.
Описана еще одна группа несцепленных
рецессивных мутаций ядерных генов-се-
рия маркеров pl. Дрожжевые клетки с му-
тациями pl более эффективно окисляют не-
сбраживаемые субстраты. Высокие концен-
трации этих субстратов могут подавлять
анаэробный гликолиз, который, по нашей
гипотезе, гомологичен цитоплазматичес-
ким, немитохондриальным функциям, ко-
торые когда-то были присущи протоэука-
риотам. Повышенную эффективность ми-
тохондрий можно рассматривать как сред-
ство компенсации дефектов в механизме
брожения. Еще одна серия мутантов, р“,
АЭРОБИОЗ И МИТОХОНДРИИ
191
тоже имеет фенотип petite: у этих дрожжей
необратимо утрачена способность к дыха-
нию, и они могут расти только на среде,
содержащей субстрат для брожения. По-
требовались почти три десятилетия ра-
боты, чтобы установить, что у р“ отсут-
ствует наследуемый с цитоплазмой генети-
ческий детерминант репликации и функ-
ционирования митохондрий - в их мито-
хондриях нет функциональной ДНК [255,
324, 669].
Если митохондрии имеют бактериаль-
ное происхождение, у них должно быть
больше черт сходства с определенными
свободноживущими аэробными бактерия-
ми (кандидатами в протомитохондрии),
чем с нуклеоцитоплазмой, в которой они
находятся. По ряду признаков митохон-
дрии действительно ближе к некоторым
аэробным бактериям, чем к окружающей
их цитоплазме. Например, по нуклеотид-
ной последовательности рибосомных
16S-PHK и аминокислотным последова-
тельностям цитохромов митохондрии го-
раздо ближе к некоторым аэробным, спо-
собным к дыханию грам-отрицательным
эубактериям, чем многие другие бактерии
(см. рис. 3.11); с другой стороны, по этим
признакам митохондрии не обнаруживают
никакой гомологии с цитоплазмой эука-
риотических клеток. То же самое можно
сказать о чувствительности митохондрий
и цитоплазмы к антибиотикам (табл. 8.5)
[262] и о составе липидов митохон-
дриальных мембран (данные о мембранах
см. в табл. 8.2).
Таблица 8.5. Чувствительность бактериальных, митохондриальных и цитоплазматических рибосом
к антибиотикам
Кнтибиотики РпйосОМЫ
бактериальные цитоплазматические
Пуромицин (а) + + +
Тиострептин (г. з) [сиомицин] Циклогексимид (б) [эметин] + + +
Анизомицин (в) Хлорамфеникол (г, е) [хлоромицетин] + + +
Макролиды, например эритромицин (6) + +
Линкомицин (а) + +
Аминогликозиды, например неомицин, паромоми- цин, стрептомицин, канамицин (Э, ж) Ауреомицин (Э, е) [тетрациклин] + +
+ +
Вероятные механизмы действия: а-преждевременная терминация растущего полипептида и распад полисом; б-блокирование
^мяслокации пептидил-тРНК; к-ингибирование образования пептидной связи; г - присоединение к 505-субчастице рибосомы;
-^«соединение к ЗОБ-субчастице рибосомы; е-блокирование аминоацилирования тРНК; ж - образование абортивного комплекса;
-остановка трансляции. Обсуждение см. [119, 324].
192
ГЛАВА 8
«Промискуитет» у митохондрий дрожжей
Обычно на митохондрии смотрят как на порабощенные существа, взятые в
плен, чтобы снабжать АТР клетки, не способные дышать самостоятельно, или
предоставлять углеводы и кислород клеткам, не приспособленным для фотосинтеза.
С этой рабовладельческой точки зрения смотрят на дело солидные биологи,
которые все-сами эукариоты. Но есть и другая сторона медали. С их собствен*
ной точки зрения органеллы можно рассматривать как существа, давным-давно
нашедшие для себя и своего потомства лучшее из возможных пристанищ, где
можно жить, затрачивая наименьшие усилия и подвергаясь наименьшему риску.
Л. Томас, 1974 [941].
Открытие своеобразной формы полово-
го поведения у митохондрий совместимо
с теорией симбиоза. Генетическая рекомби-
нация у этих органелл гораздо больше на-
поминает половой процесс у фагов и бак-
терий, чем у ядер эукариот. Все четкие
данные получены на Saccharomyces, так как
дрожжи могут размножаться в чистой
культуре, на среде определенного состава,
как стабильные гаплоиды или диплоиды.
В таких митотически делящихся клетках
ядерный геном остается неизменным, и это
позволяет следить за сегрегацией рекомби-
нантной ДНК, образующейся при скрещи-
ваниях между маркированными родитель-
скими митохондриями. Рекомбинация ми-
тохондриального генетического материала
происходит у дрожжей регулярно и часто
независимо от мейоза.
Так как большинство других эукариот
не переносит серьезных нарушений функ-
ционирования митохондрий и не может
расти без полового процесса в виде оди-
ночных гаплоидных или диплоидных кле-
ток, генетическое поведение их митохон-
дрий исследовать не удается. Однако если
результаты, полученные на дрожжах, мож-
но экстраполировать на другие эукариоти-
ческие организмы, то рекомбинация мито-
хондрий должна быть обычным явлением.
Ваши собственные органеллы, возможно,
ведут свою тайную половую жизнь.
Уже построена генетическая карта ми-
тохондрий дрожжей (рис. 8.4). Почти по-
ловина охарактеризованных митохондри-
альных мутаций затрагивает белоксинтези-
рующую систему этих органелл: они выра-
жаются в изменении резистентности
к антибиотикам, изменении транспортных
и рибосомных РНК. Другие мутации
влияют на комплексы дыхательных белков,
связанные с мембраной. Известно около
700 независимо выделенных митохонд-
риальных мутантов. Комментируя половое
поведение митохондрий дрожжей, Б. Дю-
жон (личное сообщение, 1978) писал:
«Я полагаю, что следует с осторожностью
применять термин «пол» по отношению к мито-
хондриям, но при том определении, которое Вы
ему даете [регулярное образование индивиду-
умов, имеющих более одного родителя], я пол-
ностью согласен с употреблением этого тер-
мина. Интактные митохондриальные геномы
дрожжей рекомбинируют столь активно, что по-
сле недолгого [асексуального] роста [стабильно
диплоидных родительских дрожжей, образую-
щихся в результате спаривания] возникают все-
возможные множественные рекомбинанты [ми-
тохондрий]. Но следует отметить, что реком-
бинация может происходить и между разными
молекулами митохондриальной ДНК, происхо-
дящими от одного родителя, а не только между
молекулами от разных родителей. Под словом
«пол» часто также понимают половую диффе-
ренциацию, и хотя мы всегда говорим о «гомо-
сексуальных» и «гетеросексуальных» скрещива-
ниях, нет никаких данных о существовании
среди митохондрий двух (или нескольких) по-
ловых типов. По нашей терминологии «половой
тип»-это тип, способный рекомбинировать
только с противоположным половым типом.
Система омега (со), контролирующая поляр-
ность рекомбинации вблизи самого омега-локу-
са, вначале была принята за половой тип. Те-
перь мы знаем, что различие между со + и со"
связано с включением определенной нуклеотид-
ной последовательности (около 1000 пар) в точ-
но локализованный участок митохондриальной
ДНК. Наконец, в сознании многих исследовате-
лей существует параллель между митохон-
дриальной наследственностью и материнской
наследственностью [митохондриальные гено-
типы передаются потомству только одним ро-
дителем, обычно самкой или родителем, проду-
цирующим яйца]. Все наши результаты указы-
вают на то, что у дрожжей оба родителя вносят
равный вклад в передачу митохондрий потом-
ству независимо от их ядерных половых типов...
АЭРОБИОЗ И МИТОХОНДРИИ
193
Рис. 8.4. Генетическая карта митохондрий Saccharomyces. Во внешнем круге представ-
лена карта генов резистентности к антибиотикам. (По [254].)
а. следовательно, нет смысла говорить об эф-
фекте материнской наследственности. У других
видов это, очевидно, не так».
Рекомбинацию у митохондрий обычно
изучают, используя маркеры резистентно-
сти к антибиотикам или мутации белков,
участвующих в дыхании и окислительном
фосфорилировании. Первые, например ре-
зистентность к аминогликозидным анти-
биотикам, которые, как известно, по-
давляют рост свободноживущих и пато-
генных бактерий, присоединяясь к их рибо-
сомам, считаются мутациями, затрагиваю-
щими митохондриальные рибосомы. Вто-
рые, называемые мутациями mit~, пред-
ставляют собой дефекты митохон-
дриальных генов, кодирующих такие бел-
ки, как цитохромоксидаза, олигомицин-
чувствительная мембранная АТРаза, ци-
тохром b и различные редуктазы. Биологи-
ческие особенности дрожжей и большое
число митохондриальных маркеров обус-
ловили возможность многофакторных
скрещиваний, в которых можно одновре-
менно прослеживать передачу многих ми-
тохондриальных генетических детерминан-
194
ГЛАВА 8
тов. Более чем десятилетняя работа ряда
исследователей позволяет нарисовать инте-
реснейшую картину митохондриального
полового процесса. Нижеследующее резю-
ме основано в первую очередь на работе
Дюжона и Слонимского [255].
Митохондриальная генетическая систе-
ма мультигеномна: каждая дрожжевая
клетка содержит несколько идентичных ко-
пий функциональной митохондриальной
ДНК. Их число не фиксировано. Число ге-
нетически активных копий может варьиро-
вать в разных клетках одного штамма
дрожжей; оно зависит также от внешних
условий, таких как температура и присут-
ствие различных веществ, и от скорости
роста дрожжей. Межштаммовые различия
в числе митохондриальных геномов на
клетку по крайней мере частично опреде-
ляются несколькими взаимодействующими
ядерными генами. Спаривание и реком-
бинация митохондриальных ДНК, по-ви-
димому, происходит часто и случайным
образом. Рекомбинация нереципрокна;
действительно, число двойных рекомби-
нантов в двухфакторных скрещиваниях
всегда более чем вдвое (часто намного бо-
лее) превышает ожидаемое на основании
реципрокной модели. Продукты рекомби-
нации быстро сегрегируют при митотиче-
ском делении клеток; клетка, содержавшая
вначале по-разному маркированные мито-
хондрии, через несколько делений дает до-
черние клетки с митохондриями только
одного типа. Причина этой сегрегации, ко-
торая происходит без добавления каких-
либо селективных агентов, не ясна. В неко-
тором смысле это проявление внутрикле-
точного отбора, при котором остальная
часть клетки - нуклеоцитоп лазма - служит
для митохондрий внешней средой. Показа-
но, что внутриклеточный отбор может
приводить к сегрегации некоторых марке-
ров резистентности к антибиотикам [751].
По-видимому, небольшое число сегреги-
рующих митохондриальных генетических
единиц, содержащихся в каждой дрожже-
вой клетке, распределяется при митотиче-
ском делении случайно. Каждая сегреги-
рующая единица, очевидно, состоит из
нескольких молекул ДНК. Организация
этой ДНК не вполне понятна, но наиболее
правдоподобная гипотеза состоит в том,
что сегрегирующая единица-это группа
молекул митохондриальной ДНК, прикре-
пленных в определенном месте к внутрен-
ней мембране митохондрии. Это согла-
суется с данными электронной микроско-
пии.
Можно сформулировать следующие об-
щие правила наследственной передачи
и рекомбинации митохондриальных марке-
ров у Saccharomyces cerevisiae.
1. Передача двух или большего числа
аллелей различных локусов, если они полу-
чены от одного родителя (дрожжевой клет-
ки), всегда происходит коррелированно.
Часто, но отнюдь не всегда, наблюдается
линейная корреляция; если корреляция не-
линейна, ее вид предсказывается моделью
Дюжона и Слонимского [255].
2. Верхний предел частоты рекомбина-
ции между двумя маркерами 20-25%. Этот
предел может быть превышен только тог-
да, когда два реципрокных рекомбинанта
появляются с существенно разной часто-
той. Такое явление получило название по-
лярности рекомбинации. Если полярность
высока, максимальная частота рекомбина-
ции может достигать 80%, причем в этом
случае число типов рекомбинантов намно-
го больше числа родительских типов.
3. Существует нелинейное функцио-
нальное отношение между частотой ре-
комбинации между двумя локусами и пере-
дачей аллелей каждого локуса. Вид этого
отношения предсказывается моделью Дю-
жона и Слонимского [255].
4. В трехфакторных скрещиваниях, ког-
да отсутствует полярность рекомбинации,
число двойных рекомбинантов по крайней
мере вдвое больше ожидаемого, равного
произведению частот появления двух оди-
ночных рекомбинантов.
Эти четыре правила позволяют по-
строить физическую и генетическую карту
митохондриальной ДНК дрожжей (см.
рис. 8.4). Все мутации, подчиняющиеся
этим правилам, локализуются в одной
группе сцепления, т. е. в одной молеку-
ле митохондриальной ДНК. Митохон-
дриальный геном состоит из уникальных
нуклеотидных последовательностей, разде-
ленных повторяющимися последователь-
АЭРОБИОЗ И МИТОХОНДРИИ
195
зостями. Имеется 60-70 уникальных генов
со средней длиной 530 нуклеотидов; они
чередуются с повторяющимися последова-
тельностями средней длиной 680 нуклеоти-
дов. Каждая повторяющаяся последова-
тельность состоит из спейсера, богатого
АТ (около 600 нуклеотидов), короткого
кластера примерно из 30 нуклеотидов
г кластера, богатого GC, длиной около 50
нуклеотидов. Спейсеры, богатые АТ, ве-
роятно, играют важную роль в рекомбина-
ции; две другие последовательности в со-
ставе повторов могут, помимо прочего,
регулировать инициацию синтеза ДНК.
Подводя итоги, можно сказать, что ми-
тохондрии дрожжей представляют собой
чультигеномную генетическую систему,
третерпевающую много циклов спарива-
ния и характеризующуюся высокой эффек-
тивностью генетической рекомбинации
и случайной, но очень быстрой сегрега-
цией. Этот своеобразный «промискуи-
тет» - случайность рекомбинаций и быстро-
та сегрегации - напоминает генетическое
поведение бактериофагов.
Однако в других отношениях митохон-
дриальная ДНК не похожа на фаговую.
Например, близко родственные штаммы
дрожжей могут сильно различаться по об-
пзему содержанию митохондриальной
ДНК. не различаясь при этом по функции
митохондрий. У близких штаммов даже
=утлеотидный состав митохондриальной
ДНК может быть разным, так что значи-
тельная часть этой ДНК должна быть из-
быточной для функционирования генома.
Кроме того, как и у эукариот, митохон-
дриальные гены имеют мозаичную органи-
зацию. Иначе говоря, генетический мате-
риал, кодирующий разные участки одного
и того же белка, может находиться в обо-
собленных отрезках ДНК, и соответствую-
щие транскрипты объединяются путем
сплайсинга [254]. Эти и другие черты гене-
тической организации митохондрий приве-
ли Бернарди [76] к следующему заключе-
нию:
«Можно сделать два основных вывода... Во-
первых, митохондриальному геному дрожжей
свойствен эукариотический, а не прокариотиче-
ский тип организации... Во-вторых, в такой си-
стеме, как митохондриальный геном дрожжей,
где чередуются уникальные и повторяющиеся
последовательности, чрезвычайно важную роль
играют рекомбинации, основанные на гомоло-
гии повторяющихся участков. Это основной ме-
ханизм дивергенции и эволюции геномов, ко-
торый обеспечивает на несколько порядков
величины более высокую скорость этих процес-
сов, чем механизм, основанный на точечных
мутациях».
Бернарди, видимо, полагает, что генети-
ческая организация митохондрий сформи-
ровалась таким образом, чтобы их эволю-
ция могла происходить быстрее. Однако
нам кажется, что, каково бы ни было зна-
чение всех этих фактов для симбиотиче-
ской теории, было бы неразумно объяс-
нять их, наделяя эволюцию способностью
к предвидению.
Усовершенствование и смешение:
принцип объединения разнородного
Живые существа склонны соединяться, устанавливать связи, жить внутри друг
друга, возвращаться к прежней организации, приспосабливаться, как только можно.
Так уж устроен мир.
Некоторые исследователи считают, что
«вписанные выше черты организации мито-
хондриальной генетической системы свиде-
тельствуют против симбиотической теории
’’6]. Однако основная масса данных
указывает на более близкое родство-по
организации дыхательной цепи [457] и по
первичной структуре белков [228] и РНК
Томас, 1974 [941]
[301, 836]-между некоторыми аэробными
бактериями и митохондриями, чем между
последними и нуклеоцитоплазмой эука-
риот. Кроме того, теория симбиоза не тре-
бует, чтобы эволюция митохондрий была
телеологичной, она должна быть просто
«оппортунистичной». Вопреки интуитивно-
му представлению, естественный отбор,
196
ГЛАВА 8
по-видимому, накладывал меньше ограни-
чений на структуру генома митохондрий,
чем на их координированную многокомпо-
нентную физиологическую организацию;
тот факт, что организмы, почти иден-
тичные физиологически и плодовитые при
скрещивании, например комары рода
Chironomus [1016] или свиньи [957], генети-
чески могут существенно различаться, по-
зволяет думать, что быстрая реакция гене-
тической системы на факторы отбо-
ра-обычное явление. Согласно теории
симбиоза, эволюция митохондрий не пре-
кратилась после их вступления в ассоциа-
цию с протоэукариотами. Существование
внутри клетки, способной к рекомбинации
хромосом и многим сложным биосинтети-
ческим процессам, привело к тому, что ми-
тохондрии передоверили большую часть
своей белоксинтезирующей активности ну-
клеоцитоплазме и выработали орга-
низацию генома, в некоторых отноше-
ниях сходную с организацией генома
хозяина.
Как знают создатели великих цивилиза-
ций или больших компьютеров, для по-
строения нового нет нужды повторно
изобретать колесо. Быстрые изменения бы-
вают результатом объединения, переком-
бинирования, подгонки ранее созданных
блоков. Возможны и кулинарные аналогии.
Для приготовления спагетти используют
пшеничную лапшу, пришедшую в Европу
из Китая, красные помидоры, полученные
путем селекции дикорастущих пасленовых
в доколумбовой Мексике, и чеснок среди-
земноморского происхождения. Так вот,
для того чтобы приготовить макароны по-
флотски, нужно ли начинать с доместика-
ции пшеницы?
Принцип объединения разнородного —
вездесущий преадаптивный механизм эво-
люции. В каждом случае сложные, эффек-
тивно функционирующие системы, дающие
в определенное время и в определенных ус-
ловиях большое селективное преимуще-
ство, соединялись в новых комбинациях.
Этот принцип можно привлечь и для
объяснения эволюции генетической органи-
зации митохондрий у дрожжей. Он приме-
ним и к ряду других процессов, к которым
относятся:
1) . возникновение групп сцепления,
объединяющих цистроны в хромосомах
[314] и сохраняющихся в процессе эволю-
ции в результате отбора коадаптиро-
ванных комплексов [95];
2) образование сотен симбиотических
комплексов, объединяющих далеко дивер-
гировавшие формы (см. рис. 7.17) [608];
3) возникновение мейоза и полового
диморфизма, обеспечивающих регулярное
объединение незначительно различающих-
ся геномов;
4) происхождение парасексуального
процесса у грибов, тоже приводящего
к слиянию близких геномов [739];
5) возникновение мозаичной организа-
ции генов в животных клетках, микрону-
клеусах инфузорий, митохондриях дрож-
жей [244]. Такая организация создает
возможность «перетасовки» цистронов
(обычно на уровне генных продуктов или
мРНК) в процессе онтогенеза;
6) формирование новых кариотипов пу-
тем полиплоидизации и кариотипического
расщепления. Этот процесс создает новые
группы сцепления в незначительно дивер-
гировавших геномах (см. гл. 12);
7) колонизация островов и другие про-
цессы реколонизации, в результате ко-
торых возникают новые сообщества;
8) происхождение трансдуцирующих
и лизогенных бактериофагов, а также плаз-
мид, переносящих фрагменты высокоадап-
тивных геномов иЗ одной бактерии в дру-
гую [887, 888] и из бактерии в растение
[809].
Легко заметить важную черту всех этих
явлений: то, что решения эволюционных
проблем, как и обычно в биологии, опи-
раются на прошлую историю. Испы-
танные, надежные компоненты комбини-
руются по-новому, и одна и та же пробле-
ма может решаться аналогичным образом
в разных системах, возможно, много раз
в ходе эволюции. Принцип «дифференциа-
ция, усовершенствование, отбор и переком-
бинирование» использовался за время эво-
люции жизни на Земле миллионы раз на
многих уровнях-на уровне клеток, видов,
сообществ, экосистем. Он должен был най-
ти применение и в эволюции митохон-
дрий.
АЭРОБИОЗ И МИТОХОНДРИИ
197
Цитоплазматическая наследственность:
клетки внутри клеток
В генетике сейчас идет спор между сторонниками признания решающей роли
[ядерных] генов и их противниками. Часто в результате этих дискуссий их участни-
ки поддаются искушению поддержать общепринятую доктрину вместо направленного
и систематического поиска рационального объяснения.
Линде грен, 1966 [556]
Цитоплазматическая наследствен-
^ллъ-это наследование признаков, неза-
висимых от ядерных генов [452]. Во мно-
случаях это материнская наследствен-
-хтть. т.е. признаки передаются по жен-
кой линии. Многие явления, которые
тоньше рассматривали как цитоплазмати-
ческую наследственность, теперь связы-
с унипарейтальной или неменделев-
ггзй бипарентальной передачей митохон-
ст«и или же пластид, которые в этом
'-ношении весьма сходны с митохондрия-
wz Обсуждая причины большого отстава-
исследований по цитоплазматической
наследственности от изучения ядерной ге-
нетики тех же самых организмов, Р. Сэд-
хгр [795] писала:
«Есть две группы технических трудностей,
1 збе весьма серьезны. Во-первых, оказалось
**ень сложно индуцировать мутации цитоплаз-
матических генов. Большинство до сих пор изу-
ченных цитоплазматических мутантов возникло
ггентанно; некоторые были индуцированы
ирединовыми красителями и нитрозогуаниди-
вслс Единственный из описанных мутагенов,
1о«лывающий широкий спектр цитоплазматиче-
m мутаций,-это антибиотик стрептомицин,
действующий на одноклеточную зеленую водо-
>гсль Chlamydomonas... Почему этот агент спе-
^>>&«чески действует на цитоплазматическую
Ретему и не вызывает мутаций в ядерных ге-
остается столь же загадочным, как свое-
тссазный спектр действия различных про-
оаодных акридина... Второе серьезное затруд-
•esae на пути анализа цитоплазматической
•лследственности состоит в материнской пере-
лазе большинства цитоплазматических генов...
'Тот факт, что во многих группах организмов
лароко распространена тенденция к унипарен-
~1>льному наследованию таких генов] указывает
£1 какое-то эволюционное значение этой осо-
-«яости их передачи».
Симбиотическая концепция происхож-
деяия органелл объясняет, в чем именно
-агтоит селективное преимущество переда-
ла цитоплазматических генов от одного
родителя. Для репродукции органеллы
симбиотического происхождения никогда
не может быть достаточно действия одних
лишь ядерных генов; поэтому в процессе
коэволюции хозяина и протоорганеллы
должны были создаться механизмы, обес-
печивающие сохранение хотя бы одной ко-
пии генома органеллы на всех стадиях
жизненного цикла хозяина (табл. 8.6). Ког-
да у эукариотических микроорганизмов
впервые возникло оплодотворение с обра-
зованием зиготы, общим правилом, ве-
роятно, была изогаметическая передача ор-
ганелл от обоих родителей. Естественный
отбор стремился по возможности умень-
шить избыточность, неизбежно возникав-
шую при слиянии гамет, каждая из ко-
торых содержала по меньшей мере одну
копию генома симбионта. У многих эука-
риот в результате этой тенденции произо-
шел переход от изогамет к анизогаметам,
что устранило необходимость подвижно-
сти обеих гамет и в конце концов привело
к передаче геномов органелл с неподвиж-
ной гаметой, по определению женской.
Половой диморфизм возник во многих
линиях эволюции: у вольвоксовых
и конъюгат среди зеленых водорослей,
у сосущих инфузорий, хитрид, оомицетов.
Во всех случаях женская гамета содержит
геном органелл, запас пищи и прочий ци-
топлазматический багаж, в то время как
мужская отбрасывает столько цитоплазма-
тического материала, сколько возможно
без ущерба для функции оплодотворения.
Во многих случаях пол-донор и пол-реци-
пиент не прямо гомологичны, а лишь ана-
логичны, т.е. их дифференциация явилась
результатом действия одних и тех же фак-
торов отбора-таковы пыльцевая трубка
и зародышевый мешок покрытосеменных;
подвижные спермин и содержащие запасы
пищи яйца насекомых; ядра антеридия,
198
ГЛАВА 8
Таблица 8.6. Механизмы сохранения митохондрий на разных стадиях жизненного цикла клеток
Организмы
Механизм сохранения митохондрий
Tetrahymena, Neurospora,
дрожжи, многие животные
и растительные клетки, де-
лящиеся эмбриональные
клетки позвоночных (ста-
дия дробления)
Дрожжи в анаэробных усло-
виях
Множество митохондрий случайным образом распределены по
всей клетке Г151, 716, 1025]
Некоторые инфузории
Зеленая водоросль Micromo-
nas
Бобовое растение Vicia
Спермин харовой водоросли
Nitella
Клоп Hydrometra
Сперматоциты червя Ascaris
Скорпион Centrums: сперма-
тоциты 1-го порядка
Скорпион Centrums: сперма-
тоциты 2-го порядка
Сперматоциты скорпиона
Opisthacanthus
Не видны ни зрелые митохондрии, ни протомитохондрии;
распределение генетического материала, обеспечивающее пе-
редачу митохондрий дочерним клеткам, происходит на
субэлектронно-микроскопическом уровне [786]
Многочисленные митохондрии делятся одновременно с ядром
Единственная митохондрия делится одновременно с клеточным
ядром [323]
Во время клеточного деления две группы митохондрий соби-
раются на противоположных полюсах [1025]
Единственная митохондрия окружена микротрубочками, обра-
зованными одной центриолью [972]
Митохондрии в виде палочек ориентируются вдоль нитей
веретена; некоторые из митохондрий пересекаются эквато-
риальной плоскостью клетки [1025]
Митохондрии собираются на нитях веретена, идущих к центрио-
лям; они не делятся, а распределяются между дочерними
клетками в зависимости от их расположения на нитях
веретена [1025]
Митохондрии собираются вместе, образуя кольцо, ориенти-
рованное на веретене; клеточное деление рассекает это кольцо
на два полукольца; каждое полукольцо образует тяж
Каждый тяж, состоящий из митохондрий, прикрепляется к нити
веретена и при делении клетки делится пополам [1025]
В первичных сперматоцитах многочисленные мелкие митохонд-
рии собираются вместе, образуя 24 сфероида
проникающие в трихогину и затем в осно-
вание аскогония у грибов-аскомицетов; ан-
теридий, трубка оплодотворения и ооспора
пероноспоровых водных плесеней (ооми-
цеты); яйцеклетка, освобождающаяся из
яичника и встречающаяся с подвижным
спермием в матке, у млекопитающих.
Стратегии органелл и симбионтов ана-
логичны: при передаче от родителей по-
томству женские генеративные клетки их
обычно сохраняют, а мужские отбрасы-
вают, если только, как в случае митохон-
дрий спермия, органеллы не нужны для
самого процесса оплодотворения. Если же
это не так, как в случае хлоропластов и не-
обходимых для хозяина симбионтов насе-
комых, естественный отбор отдает пред-
почтение тем органеллам или симбионтам,
которые способны дедифференцироваться
до минимального уровня (возможно, до
одного полного генома на особь потом-
ства). Многие симбионты отсутствуют
в сперме и передаются с яйцами-либо
внутри яйцеклетки, либо на ее оболочках,
как, например, симбионты зеленой гидры
[945]. У ряда хорошо изученных насе-
АЭРОБИОЗ И МИТОХОНДРИИ
199
комых существуют сложные механизмы,
обеспечивающие перенос симбионтов
в яичники и затем в яйца [840]. Таким
образом, в материнской передаче митохон-
дрий и пластид нет ничего непонятного;
это результат одновременного действия
двух селективных давлений-в пользу ани-
зогамии и против избыточности.
Граник и Джайбор [351] утверждают,
что внутриклеточные органеллы произош-
ли путем дифференциации, в процессе упа-
ковки метаболических систем в специали-
зированные единицы. Они полагают, что
такого рода компартментализация дает эу-
кариотам селективные преимущества, так
как обеспечивает «дополнительную мута-
ционную стабильность и регуляторную
гибкость». Как и Берна'рди [76], эти ав-
торы наделяют эволюцию предусмотри-
тельностью. Нет никаких данных о том,
чтобы ДНК органелл в целом отличалась
по чувствительности к мутагенам от ядер-
ной ДНК. Правда, как отмечает Сэджер,
некоторые ядерные мутагены не индуци-
руют цитоплазматических мутаций, но это
можно объяснить относительно малой чув-
ствительностью генома, представленного
.множеством копий, к любым мутагенным
воздействиям. Это явление можно срав-
нить с неуязвимостью симбионтов, число
которых значительно превышает число их
хозяев. Как правило, в каждой митохон-
дрии содержится несколько копий мито-
хондриальной ДНК, а в каждой клет-
ке-много митохондрий.
Если мутация органеллы приводит
к утрате ее функции, то она фенотипически
проявится лишь в том случае, если все
нормальные органеллы в клетке будут за-
менены мутантными. Такое замещение
происходит редко-возможно, лишь у не-
которых организмов, например у Chlamy-
domonas, сразу после оплодотворения.
У Chlamydomonas и Ulva признаки пластид
передаются потомству от одного родителя,
и развитие органелл, по-видимому, нахо-
дится в зиготе под строгим контролем
[547]. Такое замещение органелл вряд ли
может произойти случайно, особенно если
популяция органелл велика.
Тот факт, что синтез ДНК в митохон-
дриях не синхронизирован с прерывистым
циклом роста ядра [655], тоже вполне
естествен в случае прокариотического про-
исхождения митохондрий: у бактерий
ДНК синтезируется непрерывно.
Результаты исследований развития пла-
стид и митохондрий подтверждают пред-
ставление о том, что «цитоплазматические
мутагены» и «необратимо обесцвечиваю-
щие факторы» влияют непосредственно на
способность органелл репродуцироваться
в цитоплазме клеток хозяина [813, 814]. На
обработку химическими агентами члены
однородной популяции склонны реагиро-
вать одинаково: в определенной концен-
трации агент может быть либо без-
вредным, либо летальным, либо мута-
генным. С точки зрения симбиотической
теории «аномальное стопроцентное мути-
рование» цитоплазматической генетичес-
кой системы [323]-это однотипная реак-
ция клона микроорганизмов, которые по
той или иной причине живут внутри клеток
других микроорганизмов. Воздействия, не-
обратимо лишающие организм хозяина
нормальных пластид и митохондрий с «ча-
стотой мутирования» 100%, следует рас-
сматривать как «эффективные лекарства»,
а не как мутагены. Именно это имел в ви-
ду Дж. Ледерберг [535], утверждая, что
обесцвечивающие факторы «излечивают»
эвглен от их пластид. Такие факторы
(стрептомицин, высокая температура, уль-
трафиолетовое облучение, нитрозогуани-
дин) просто сильнее действуют на геномы
пластид, чем на нуклеоцитоплазму. Эту ин-
терпретацию подтверждает невозможность
обнаружить обратные мутации цитоплаз-
матических генов. Вероятность обратной
мутации р" -► р+ у дрожжей или по-
явление хлоропластов у эвглен, лишенных
пластид, так же мала, как вероятность
спонтанного возникновения прокариот!
Почему при ряде воздействий эвглены
полностью теряют свои пластиды и их
ДНК [814], в то время как в клетках, не-
обратимо утративших функции митохон-
дрий, обычно сохраняется хотя бы некото-
рая часть митохондриальной ДНК? Боль-
шинство эукариот - облигатные аэробы;
очевидно, воздействия, приводящие к пол-
ной утрате митохондрий, для них де-
тальны. С другой стороны, фотосинтези-
200
ГЛАВА 8
рующие эукариоты являются факульта-
тивными автотрофами: они могут жить,
потеряв способность к фотосинтезу. У эв-
глен нет мейоза и имеется необычная фор-
ма митоза. Вероятно, взаимоотношения
между нуклеоцитоплазмой и пластидами
у эвглен носят менее облигатный характер,
чем отношения между нуклеоцитоплазмой
и органеллами у животных и растений, ко-
торым свойствен мейоз; возможно, это
связано с отсутствием у эвглен менделев-
ской генетической системы, для которой
характерна централизация контроля функ-
ций органелл в ядре. Дрожжи-это эука-
риоты, обладающие мейозом, у которых
митохондрии почти полностью интегриро-
ваны с генетической системой нуклеоцито-
плазмы. Антибиотики и другие агенты
уменьшают количество митохондриальной
ДНК, но не вызывают полной ее утраты,
хотя в клетках р ” фенотипическая экспрес-
сия митохондриального генома необрати-
мо нарушена. Никакая ядерная мутация не
может восстановить «ген» р + , т.е. не мо-
жет вызвать повторного появления утра-
ченной или поврежденной митохондриаль-
ной ДНК. Возможно, что нефункциональ-
ная митохондриальная ДНК, сохраняемая
дрожжами после воздействий, вызываю-
щих утрату митохондрий, имеет исходно
ядерное происхождение - гипотеза, поддаю-
щаяся в принципе экспериментальной про-
верке.
Симбиотическая теория позволяет так-
же по-новому интерпретировать предста-
вление о том, что стрептомицин вызывает
у Chlamydomonas широкий спектр цито-
плазматических мутаций, в частности по-
явление ацетат-зависимых мутантов.
Стрептомицин-это не мутаген, подобный
акридинам или рентгеновским лучам, а ин-
гибитор прокариотического белкового син-
теза; он подавляет освобождение вновь
синтезированных белковых цепей, присое-
диняясь к малой субчастице рибосомы
[476]. Потеряв способность поддерживать
существование пластид, клетки Chlamy-
domonas в своем питании больше не зави-
сят от фотосинтеза. После утраты функ-
ционирующих пластид нуклеоцитоплазма
начинает испытывать потребность в ацета-
те, том самом ацетате, который клетки ди-
кого типа получают как продукт фотосин-
теза. Ингибирование синтеза белка в хло-
ропластах эвглены постепенно приводит
к полной потере пластидной ДНК, а тем
самым и к необратимой утрате способно-
сти образовывать пластиды. У Chlamy-
domonas ингибирование синтеза белка
стрептомицином тоже в конце концов на-
рушает синтез нуклеиновых кислот, в ре-
зультате чего образуются нефункцио-
нальные хлоропласты. Однако ДНК хло-
ропластов не теряется полностью: цито-
плазматическая мутация «стабильна», т.е.
необратимо поврежденные хлоропласты
передаются в ряду поколений [795]. По-
добно людям, страдающим тяжелыми на-
следственными болезнями, в природе эти
дефектные органеллы не могли бы сохра-
ниться даже в одной генерации; они обя-
заны своим существованием богатой пита-
тельными веществами среде, которой слу-
жит для них цитоплазма клеток хозяина, и,
конечно, ученым, которые заботятся о «му-
тантных» штаммах.
АЭРОБИОЗ И МИТОХОНДРИИ
201
Митохондрии и нуклеоцитоплазма:
навеки счастливый союз
Вот они, они движутся в моей цитоплазме, дышат для нужд моего тела, но
они-чужие. Мне жаль иногда, что я не могу познакомиться с моими митохонд-
риями поближе. Когда я сосредоточусь, я могу представить себе, что ощущаю
их; не то чтобы я по-настоящему чувствовал, как они извиваются, но время от
времени я воспринимаю какой-то трепет. Я не могу отделаться от мысли, что
если бы я знал больше о них и о том, как они достигают своей гармонии,
я бы по-другому понимал музыку.
Л. Томас, 1974 [941]
Митохондрии дрожжей отличаются от
митохондрий других эукариот своей реак-
цией на экзогенные (находящиеся внутри
клетки, но вне митохондриальной мем-
браны) кислород и глюкозу. У дрожжей,
растущих в анаэробных условиях, мито-
хондрии дедифференцируются и превра-
щаются в генетические единицы, не разли-
чимые даже в электронный микроскоп. Эти
дрожжи обходятся без дыхания и растут,
используя субстраты брожения. Однако
изучение дрожжевой клетки может в конце
концов облегчить нам понимание природы
контроля со стороны ядерного генома
в других системах, например развиваю-
щихся эмбрионах. Судя по качественным
и количественным изменениям митохон-
дриальных ферментов у крыс, подверг-
нутых гипербарической оксигенации, кон-
центрация экзогенного кислорода (а воз-
можно, и глюкозы) может влиять на
дифференцировку и функционирование тка-
невых митохондрий.
Если предположить, что митохондрии
были приобретены клетками в результате
симбиоза, то в принципе можно опреде-
лить, насколько с тех пор продвинулись
создавшиеся комплексы в своей эволюции.
По-видимому, ДНК протомитохондрий
должна была иметь не больше гомологий
с ДНК протоэукариот, чем ДНК аэробных
бактерий с ДНК любой произвольно вы-
бранной анаэробной или микроаэрофиль-
ной бактерии. Первоначально все митохон-
дриальные функции кодировались мито-
хондриальной ДНК. Утрату митохондрия-
ми полной автономии можно интерпрети-
ровать как результат последующей эволю-
ции контроля со стороны нуклеоцито-
плазмы.
Можно предполагать, что митохондрии
эукариот, обладающих мейозом и мито-
зом, в большей степени зависят от ядра,
чем митохондрии тех протоктистов, у ко-
торых мейоза нет. Поэтому при попытках
культивировать митохондрии in vitro сле-
довало бы начать с митохондрий бесполых
протистов. У генетически высокоразвитых
организмов, таких как диатомовые, дрож-
жи, базидиомицеты, животные и растения,
интеграция ядра и органелл должна быть
более тесной, чем у таких первично бес-
полых эукариот, как амебы, эвгленовые,
силикофлагелляты, клеточные слизевики
и динофлагелляты. Это предсказание сим-
биотической теории прямо противополож-
но тому, что следовало бы из гипотезы
прямой филиации [755, 978]. С точки зре-
ния последней, метаболическая компарт-
ментализация и автономия митохондрий-
прогрессивные признаки. Согласно теории
симбиоза, компартментализация и генети-
ческая автономия митохондрий - прими-
тивное состояние, а ядерный контроль
и сложная интеграция функций нуклеоци-
топлазмы и органелл-прогрессивное, эво-
люционно более новое.
Обобщение, состоящее в том, что утра-
та митохондриями автономии означает
эволюционный прогресс, можно проиллю-
стрировать на своеобразной группе проти-
стов-трипаносомах, которые содержат
единственную длинную митохондрию, на-
зываемую кинетопластом (рис. 8.5).
Предложена филогения трипаносом;
наиболее древними являются, вероятно,
наименее специализированные и наименее
«привередливые» роды, такие как Crithi-
dia- паразиты насекомых. По-видимому,
эти организмы дали начало предкам пара-
202
ГЛАВА 8
Рис. 8.5. Специализированная митохондрия трипаносомы - кинетопласт (к). D-ДНК
кинетопласта; с-кристы кинетопласта.
зитов крови, таких как Trypanosoma lewesii,
Т vivas и Т congolense,- линии, заканчи-
вающейся Т brucei [196]. Внутри этой
группы прогресс, понимаемый как напра-
вление эволюции, связан со все менее пол-
ным окислением субстратов. Гипотезу
о происхождении митохондрий путем пря-
мой филиации трудно совместить с такой
эволюционной тенденцией. В то же время
дедифференциацию кинетопласта можно
понять на основе представления симбиоти-
ческой теории об отборе против избыточ-
ности. В данной линии простейших-гемо-
паразитов процесс заключается в редукции
митохондриального дыхательного метабо-
лизма. У потребляющих О2, чувстви-
тельных к цианиду трипаносом, обладаю-
щих цитохромом а, по-видимому, нет
цитохрома с. Между тем этот белок, не-
прочно связанный с митохондриальной
мембраной, есть у подавляющего боль-
шинства животных и растений. Четко по-
казано, что у дрожжей кодирующий его
ген находится в ядре, хотя точная локали-
зация его в хромосомах не установлена.
Возможно, что присутствие цитохрома с
и его структурного гена в ядре характерно
только для эукариот, обладающих мейо-
зом. Развития свойств, характерных для
трипаносом: гликолиза с образованием пи-
АЭРОБИОЗ И МИТОХОНДРИИ
рувата и глицерина, отсутствия (у неко-
торых представителей) цитохромов а и b
и цитохромоксидазы, отсутствия выделе-
ния в кровь СО2 и других [196]-можно
ожидать, если имеется эволюционная тен-
денция к полному переходу на перокси-
сомный метаболизм, первоначально харак-
терный для нуклеоцитоплазмы. Специали-
зированная митохондрия, обратимо дедиф-
ференцирующаяся на некоторых стадиях
жизненного цикла (кинетопласт), не функ-
ционирует. Несмотря на сложность жиз-
ненных циклов, у трипаносом нет оплодо-
творения и мейоза. Возможно, они пред-
203
ставляют собой группу протистов, которая
отделилась на ранних этапах эволюции от
основной линии, ведущей к митозу, и у ко-
торой создались необычные взаимодей-
ствия между митохондриями и нуклеоци-
топлазмой.
Чтобы понять взаимоотношения мито-
хондрий и нуклеоцитоплазмы, требуется
понимание истории митоза и мейоза-ус-
ловия sine qua поп эукариотического со-
стояния. В следующих двух главах будет
подробно рассмотрена сложная проблема
происхождения ундулиподий и эволюции
митоза.
ГЛАВА 9
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
Деление клеток протоктистов
В цитоплазме многих видов клеток давно обнаружены одно или несколько
мелких округленных палочковидных телец, сильно преломляющих свет, более
плотных, чем окружающая цитоплазма, и сильнее красящихся; это центросомы, или
центриоли... Во время клеточного деления центросома и окружающая ее область
играют, как мы увидим позже, важную роль... В амебоидных клетках, таких как
лейкоциты, центросома занимает центр клетки и от нее тянутся многочисленные
радиальные линии к периферии; в клетках с подвижными ресничками центросому
(базальное тельце, блефаропласт) можно обнаружить у основания каждой реснички;
в сперматозоидах центросома расположена между головкой и хвостом.
Л. Эн неги, 1923 [398]
Каждого, кто наблюдал живую клетку
в процессе митоза, поражают упорядочен-
ность и изящество этого процесса. Физико-
химического объяснения митоза до сих пор
нет; и тем не менее, подобно рождению
и росту ребенка, феноменология митоза
изумляет своей внутренней логикой.
Механизм образования новых молекул
ДНК путем рекомбинации возник еще
у прокариот. Ферментативная репарация
ДНК, поврежденной ультрафиолетом, воз-
можно, послужила преадаптацией для по-
явления различных форм генетической ре-
комбинации у бактерий, например транс-
дукции фагами и конъюгации. Однако
митоз, «танец хромосом», выработался
только у протистов. Мейоз, представляю-
щий собой модификацию митоза, должен
был возникнуть у организмов, уже спо-
собных к митозу.
Ядра большинства животных и расти-
тельных клеток содержат два полных го-
мологичных, но не идентичных набора
хромосом, в каждом из которых находятся
104-106 генов. Клетки с двумя наборами
хромосом в ядре называют диплоидными,
а с одним набором-гаплоидными. При
митотическом делении каждая дочерняя
клетка получает по одной копии каждой
хромосомы родительской клетки. Таким
образом, клетки, образующиеся при мито-
зе, бывают либо гаплоидными, либо ди-
плоидными, в зависимости от плоидности
родительской клетки. С другой стороны,
клетки, образующиеся в результате мейоза
диплоидных клеток, всегда гаплоидны; при
мейозе хромосомы распределяются таким
образом, что в каждую дочернюю клетку
попадает один, и только один член каждой
пары гомологичных хромосом исходной
клетки. При оплодотворении слияние двух
гаплоидных клеток (каждая из которых —
продукт мейоза) ведет к восстановлению
диплоидного набора хромосом. При мейо-
зе может происходить кроссинговер, т.е.
обмен ДНК между гомологичными хромо-
сомами, а кроме того, и без кроссинговера
возможна «перетасовка» хромосом. Одна-
ко любое видоизменение митоза, приводя-
щее к неточной сегрегации хромосом или
к утрате генетического материала, тотчас
же отбраковывается отбором.
Митоз и мейоз требуют тесной коор-
динации функций двух клеточных систем:
одна система обеспечивает удвоение коли-
чества хромосомной ДНК путем ее синте-
за, а другая - расхождение хромосом к про-
тивоположным полюсам делящейся клетки
при участии митотического веретена. Вере-
тено состоит из нитей, центриолей, цен-
триолярных бляшек (или иных «митотиче-
ских центров») и мест прикрепления нитей
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
205
веретена к хромосомам, называемых кине-
тохорами или центромерами. Детали ми-
тоза и мейоза значительно варьируют от
вида к виду и могут быть весьма сложны-
ми. Назначение этих процессов, однако,
всегда одно и то же: митоз обеспечивает
равное распределение генетического мате-
риала между дочерними клетками, а мей-
оз - образование гаплоидных клеток из ди-
плоидных. В любом стабильном жизнен-
ном цикле мейоз должен чередоваться
с оплодотворением, т.е. слиянием клеток,
восстанавливающим диплоидный набор
хромосом. Если в какой-либо группе орга-
низмов обнаружены мейоз и оплодотворе-
ние (диплоидно-гаплоидный цикл), то это
верный признак того, что в этой группе су-
ществует митоз. Митотические организмы
можно распознать по характерному для
них, так называемому менделевскому, типу
наследственности независимо от того, из-
учено ли поведение хромосом в их по-
ловых циклах.
Из-за сложности и консерватизма ми-
тоза и мейоза их эволюционную историю
можно представить себе лишь в общих
чертах. Изменения в поведении хромосом
были сопряжены с изменениями организа-
ции митотического веретена: постепенно
развивались механизмы распределения
хромосом при клеточном делении. Микро-
скопическое исследование живых делящих-
ся клеток приводит к предположению, что
мейоз и оплодотворение возникли анало-
гичными путями в разное время в несколь-
ких различных линиях эукариотических ми-
кробов. Вначале давление отбора было,
вероятно, направлено на редукцию ди-
плоидных наборов хромосом, получавших-
ся при слиянии двух гаплоидных наборов
[156]. У животных и растений митоз
и мейоз происходят по классической схеме,
приведенной во всех учебниках (ортоми-
тоз, по французской терминологии); изуче-
ние митоза и мейоза у грибов (рис. 9.1) ча-
сто оказывалось очень сложным делом,
а разнообразные необычные типы митоза
у простейших известны уже много лет
[1025]. Биологи обычно игнорировали ати-
пичные формы митоза у эукариотических
Рве 9.1. Митоз у базидиомицета Armillaria те Ilea. Обратите внимание на сходные
: центриолями, но аморфные тельца на полюсах. Вероятно, это ЦМ (МС на фото).
Ch-хроматин, х 54000. [J. Motta, Univ, of Maryland.]
206
ГЛАВА 9
микробов, так как их значение было неяс-
но. Наличие вариаций митоза, как правило,
не зависит от присутствия фотосинтетиче-
ских пигментов, и такие вариации часто
встречаются у плохо изученных простей-
ших. Эти идиосинкратические типы клеточ-
ного деления можно считать реликтами,
отражающими возникновение и эволюцию
митоза. Информацию об эволюции митоза
и мейоза следует искать при изучении не-
которых организмов, традиционно отно-
симых к растениям, животным или гри-
бам; полная интерпретация таких данных
требует сотрудничества биологов различ-
ного профиля. Задачу усложняет то, что
представители разных стран и разных дис-
циплин часто пользуются для описания од-
них и тех же структур и процессов взаимно
непонятными специальными терминами1
О существовании своеобразной связи
В качестве примеров можно назвать
криптомитоз (клеточное деление у протистов,
отличающееся от деления животных клеток), ар-
хеоплазматические сферы (сферические тельца,
появляющиеся вблизи веретена при делении не-
которых жгутиковых), блефаропласты (кинето-
пласты, кинетосомы или предшественники кине-
тосом) и «органеллы, ассоциированные
с ядрышками» (центры организации микротру-
бочек у грибов [329]).
Рис. 9.2. Центриоли и гомологичные микроту-
булярные структуры.
между ундулиподиями и митотическими
центриолями было известно уже много
лет, хотя значение этих наблюдений стано-
вится ясным только теперь (рис. 9.2). Все
ундулиподии растут из кинетосом, назы-
ваемых также базальными тельцами (см.
рис. 2.4). Во многих, хотя далеко не во всех
случаях можно наблюдать развитие кине-
тосом из митотических центриолей. Элек-
тронно-микроскопические исследования
подвели общую базу под многие из этих
наблюдений: теперь известно, что центрио-
ли, кинетосомы, ундулиподии, нити мито-
тического веретена и другие родственные
образования все построены из микротру-
бочек-длинных полых структур диаме-
тром около 24 нм. Последние в свою оче-
редь состоят из нескольких близко род-
ственных белков, называемых белками ми-
кротрубочек, микротубулинами или просто
тубулинами [257]. Микротрубочки обра-
зуют не только структуры, связанные с ми-
тозом, но и поразительное разнообразие
других видоспецифических органелл. Ми-
кротрубочки часто развиваются из ясно
видимых центров, таких как кинетосомы
и центриоли. Электронная микроскопия
выявляет на поперечном сечении центрио-
лей и кинетосом одну и ту же организацию
микротрубочек: 9 + 0. Центриоли часто
можно видеть у полюсов митотического
веретена в клетках животных и протистов,
но присутствие центриолей sensu stricto не-
обязательно для нормального митотиче-
ского деления. У многих организмов нор-
мальное митотическое веретено образуется
при отсутствии центриолей типа 9 + 0.
У некоторых организмов центриоли, по-
видимому, заменены другими аналогичны-
ми структурами, такими как «центросомы»
некоторых базидиомицетов и центрио-
лярные бляшки дрожжей и красных водо-
рослей [726]. У растений на полюсах кле-
ток при митозе обычно не обнаруживается
никаких признаков центриолей. У спорови-
ков имеется полярная коническая структу-
ра, сходная с типичными центриолями, но
явно уникальная для этой группы (рис. 9.3).
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
207
Рис. 9.3. Митоз у грегарин и микроспоридий. [S. Molon-Noblot, I. Desportes, Lab. d’Evo-
lution des Etres Organise, Paris.] А. Центральный конус на митотическом полюсе спо-
ровика грегарины (тип Apicomplexa). Митоз у грегарин начинается с удвоения и диффе-
ренциации своеобразной структуры, называемой центральным конусом (с) и, вероятно,
представляющей собой ЦМ. Она состоит из конического пучка микротрубочек, в вер-
шине которого лежит центриоль с 9 одиночными микротрубочками, окружающими
одну аксиальную трубочку (9 + 1). Дистальная часть пучка микротрубочек соприкасает-
ся с ядерной оболочкой (пе), дезорганизация которой находится в обратном отноше-
нии к степени развития микротрубочек. У большинства Apicomplexa ядерная мембрана
остается почти интактной (закрытый митоз) из-за слабого развития микротрубочек.
У некоторых грегарин более полное развитие микротрубочек приводит к тому, что ми-
тоз происходит почти так же, как у многоклеточных животных, х 40 000. Б. Митоз
у микроспоридии Stempellia mutabilis (тип Cnidosporidia). Видны бляшки (р) на полюсах
веретена; ch-хромосомы; mt - микротрубочки веретена, х 15000.
208
ГЛАВА 9
Для того чтобы как-то объединить эти на-
блюдения, Пиккет-Хипс выдвинул концеп-
цию центров, организующих микротрубоч-
ки; так предлагается называть структуры,
дающие начало системам микротрубочек,
независимо от того, представляют ли они
собой центриоли, их аналоги или
аморфный гранулярно-фибриллярный ма-
териал [726, 727].
В результате применения новых мощ-
ных методов структурного и биохимиче-
ского анализа исследователи могут теперь
пересмотреть имеющуюся литературу по
митозу в эволюционном контексте [159,
175, 356, 509, 780, 781]. Эти ученые идут по
следам тех цитологов, которые в конце
19-го и начале 20-го столетия интересова-
лись происхождением и эволюцией митоза,
но не могли вплотную подойти к этой про-
блеме из-за отсутствия ультраструктурных
и биохимических данных (Белар, Добелл,
Шаудин, Вильсон; обзор см. у Вильсона
[1025]).
С начала 30-х годов до своей смерти
в 1971 г. Л. Кливлэнд бился над вопросом
о природе и эволюции митоза и мейоза.
Индивидуалистический стиль его исследо-
ваний, а также выбор необычного и плохо
изученного объекта - протистов-симбион-
тов из кишечника термитов - помешали
объединению его работ с трудами других
цитологов при его жизни, но его вклад
имел огромную ценность. Кливлэнд [154.
155, 160] установил, что митотические си-
стемы изученных им протистов-гиперма-
стигот функционально эквивалентны более
ортодоксальным системам животных
и растений. Он придумал эксперименты,
позволившие как бы отделить ядерную
хромосомную систему от митотической си-
стемы, обеспечивающей движение хромо-
сом. Последняя, как мы теперь знаем,
является компонентом той части клетки,
которую образуют микротрубочки и унду-
липодии. Кливлэнд описал у Trichonympha
структуру, которую он назвал длинной
центриолью; он показал, как эта структура
реплицируется и образует источник роста
нитей митотического веретена. Теперь мы
можем идентифицировать нити веретена
как пучки микротрубочек, а длинную цен-
триоль-как центр-организатор микротру-
бочек. Хотя эти структуры функционируют
как центриоли, показано [364], что они го-
раздо больше обычных центриолей типа
9 + 0. Они эквивалентны аттрактофорам
различных жгутиковых, описанным Хол-
ландом и Карюэт-Валентеном [416, 417]:
это сложные белковые структуры на пере-
днем конце клетки, так называемом ро-
стру ме. По сути дела, весь разделенный на
две части ростральный участок у гиперма-
стигот ' Trichonympha и Pseudotrichonympha
функционирует так, как, по-видимому, дей-
ствуют и центриоли млекопитающих: две
противоположные половинки рострума ве-
дут себя подобно митотическим полюсам,
образуя «якоря» для нитей веретена.
Рис. 9.4. Образование веретена и деление клет-
ки в отсутствие хромосом [158]. Хромосомы
Barbulanympha были разрушены высокой
концентрацией кислорода (гипермастигота
Barbulanympha - один из главных симбионтов
древоядных тараканов, она сходна с гиперма-
стиготами из кишки термитов- Trichonympha
и Pseudotrichonympha). Даже в отсутствие хромо-
сом формируется полный митотический аппа-
рат: «длинные центриоли» (1) и веретено (2).
развивающиеся в тесной связи с ундулиподиями
(3) и кинетосомами (4) (см. рис. 3.5, Б). Деление
этой клетки демонстрирует автономию митоти-
ческой системы.
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
209
У этих и других гипермастигот ундулипо-
дии присоединены дистально к половин-
кам рострума и работают во время деле-
ния клетки (рис. 9.4). Между половинками
рострума формируется веретено, состоя-
щее из типичных микротрубочек. Помимо
гипермастигот Кливлэнда известно очень
мало организмов, у которых ясно была бы
видна прямая связь между ундулиподиями
и митотическим веретеном. Большинство
из них-это необычные простейшие, незна-
комые исследователям, работающим с рас-
тениями и животными. Однако новые
данные о микротрубочках подтвердили
ранние наблюдения, говорившие о пря-
мом родстве между микротубулярными
системами ундулиподий, митотического ап-
парата и других структур у всех эука-
риот.
Микротрубочки, кинетосомы и митоз
Не только ахроматическая фигура, но и все другие внеядерные органеллы,
такие как жгутики, парабазальные тельца, аксостили и т. п., образуются центриоля-
ми; таким образом, центриоль явно представляет собой автономную органеллу
и своего рода центр клетки, так как она воспроизводит сама себя и другие
клеточные органеллы, за исключением ядра.
Р. Кливлэнд, 1935 [154]
Исследование микротрубочек началось задолго до их открытия.
Д. Мэзия, 1975 [634]
Микротрубочки-полые структуры, со-
стоящие из тубулина,-имеются, по суще-
ству, во всех эукариотических клетках.
Обычно они «растут» из центриолей или
других менее заметных центров-организа-
торов, исчезают и вновь появляются на
определенных стадиях развития клетки.
Для прокариот характерно отсутствие ту-
булиновых микротрубочек (см., однако,
стр. 261-265). Некоторые структуры с ми-
кротрубочками перечислены в табл. 9.1.
Представление о гомологии микротрубо-
чек и образуемых ими структур в настоя-
щее время общепринято и хорошо освеще-
но в ряде обзоров [213, 257, 283, 334, 596,
731, 803, 871].
Диаметр микротрубочек 24 нм; они
образованы спирально уложенными субъе-
диницами, состоящими из димеров тубу-
лина, 13 субъединиц на виток. Микротру-
бочки из всех изученных источников
в химическом отношении удивительно
сходны: они состоят из двух близко род-
ственных белков, а и 0-тубулина, каждый
из которых имеет мол. массу 55000-60000
(рис. 9.5). Эти два тубулина часто обнару-
живаются в комплексе с динеином, Mg2+-
чувствительной АТРазой. Тубулины не-
редко бывают ассоциированы также с дру-
гими, хуже охарактеризованными высоко-
молекулярными белками, так называемы-
ми БАМ (белки, ассоциированные с микро-
трубочками). Существует поразительная
физиологическая гомология между систе-
мами микротрубочек у организмов, при-
надлежащих к весьма отдаленным таксо-
нам. Микротрубочки обычно чувстви-
тельны к изменениям температуры и да-
вления. Так, при высоком гидростатиче-
ском давлении они имеют тенденцию
растворяться, а при восстановлении нор-
мального давления могут образовываться
снова. Как правило, микротрубочки наибо-
лее стабильны при 37°С и растворяются
х-39
210
ГЛАВА 9
Таблица 9.1. Некоторые структуры, состоящие из микротрубочек или содержащие их
Структура Организмы (или их части)
Ундулиподии и кинетосомы Инфузории, эпителии позвоночных, жабры моллюсков, хвосты спермиев (гинкго, мхов, позвоночных и многих других ор- ганизмов)
Аксоны и дендриты Киноцилии Обонятельные антенну л ы Механорецепторы Аксоподии (органеллы пита- ния) «Весла» (локомоторные ор- ганеллы) Аксостили Отростки меланоцитов Гаптонемы Митотическое веретено, звезда Прикрепительные структуры (стебельки) и щупальца Нервные клетки Metazoa Внутреннее ухо позвоночных Ракообразные Насекомые Heliozoa, Phaeodaria, Acantharia, Foraminifera (см. рис. 9.20) Sticholonche Пизонимфиды (см. рис. 9.20) Пигментные клетки Metazoa Eustigmatophyta (кокколитофоры) Почти все эукариоты (см. рис. 9.15) Carchesium, вортицеллиды и сосущие инфузории
примерно при 4°С. Они чувствительны
к концентрации ионов кальция и к неко-
торым химическим соединениям, таким
как алкалоид колхицин. Не все эти свой-
ства наблюдаются у всех микротрубочек,
но в результате интенсивного исследова-
ния обнаружено много гомологий [257].
Микротрубочки и образуемые ими
структуры чувствительны к следующим
циклическим соединениям, каждое из ко-
торых содержит по меньшей мере один ме-
токсизамещенный атом углерода: к колхи-
цину, колцемиду, винбластину, винкристи-
ну, гризеофульвину, мелатонину, мейтанзи-
ну, подофиллотоксину и многим их про-
изводным (рис. 9.6) [227, 591, 1026]. Эти
препараты, так же как некоторые карба-
маты, нокодазол и другие вещества [213],
ингибируют полимеризацию белка микро-
трубочек. Показано, что колхицин и транк-
вилизатор хлорпромазин непосредственно
присоединяются к тубулину [257]. Чув-
ствительность систем микротрубочек к фи-
зическим факторам и химическим препара-
там сильно варьирует в зависимости от
концентрации последних, вида организма,
стадии его развития и многих других фак-
торов, но, как правило, эти агенты вызы-
вают растворение митотического веретена
и прекращают движение хромосом, не дей-
ствуя на сами хромосомы. Упомянутые
выше вещества даже в очень малых кон-
центрациях могут влиять и на другие кле-
точные функции, связанные с микротрубоч-
ками (например, на питание и поддержание
структурной асимметрии у солнечников).
Бактерии размножаются прямым деле-
нием; в нем не участвуют микротрубочки,
и оно не чувствительно к действующим на
них агентам. Как полагают, ДНК у прока-
риот распределяется между дочерними
клетками благодаря тому, что она прикре-
плена к растущей мембране. У делящихся
бактерий никогда не наблюдались ни цен-
триоли, ни митотическое веретено, ни ми-
кротрубочки, ни какие-либо формы цен-
тров, организующих микротрубочки.
Первоначальное использование микро-
трубочек в ундулиподиях и их последую-
щая эволюция в составе митотического ап-
парата преадаптировали их для выполне-
ния многих функций у протоктистов, жи-
вотных, растений и грибов. Чувствитель-
ность полимеризации тубулина к ингиби-
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
211
Тубулин (а,Ji-гетеродимер)[мол.масса М20 ООО]
г г г Динеин [125000(0 СП субъсдиниц ; АТРазная
1 1 1 сУБъединица-Г600 ООО дальтон])
-------Белок нексин[150 000-165 000]
-------Белки центральной пары(16-17 ьелков)[15000-360 000]
-------Белки яспиц”(17 Белков) [17000-130 000]
Рис. 9.5. Ундулиподия и ее
микротрубочки. Схематиче-
ский поперечный разрез ак-
сонемы типа 9 + 2.
торам была использована для выяснения
роли микротрубочек в жизни эукариоти-
ческой клетки. Микротрубочки, чувстви-
тельные к колхицину, образуются у проти-
стов, когда они вытягивают аксоподии для
захвата пищи [124, 948]. Микротрубочки
фактически образуют «весла», которыми
гребут похожие на галеры радиолярии
Sticholonche [127]; они участвуют в регене-
рации полиплоидного ядра у ресничных
инфузорий [617] и в формировании «зуба-
стой» глоточной корзинки у Nassula-инфу-
зории, которая «пережевывает» нитчатые
цианобактерии [970, 971]. Микротрубочки
поддерживают «ножки» инфузорий, по-
лзающих по листьям растений; ряды ми-
кротрубочек образуют щупальца хищных
сосущих инфузорий. «Рты» других проток-
тистов, такие как мембранеллы разнорес-
ничных инфузорий, состоят из пучков ун-
дулиподий [929].
У животных микротрубочки являются
важными компонентами нервной системы:
они образуют дендриты и аксоны нейро-
нов и принимают участие в аксонном
транспорте [213, 259, 882]. Один из самых
удивительных примеров использования
модифицированных ресничек, состоящих
из микротрубочек,-это сенсорные клетки
млекопитающих. Вкусовые и обонятельные
рецепторы, органы равновесия, механоре-
цепторы насекомых-все они содержат ви-
доизмененные ундулиподии с микротру-
бочками (рис. 9.7). Изучение анатомии и
функционирования этих сенсорных систем
привело к микротубулярной теории пре-
образования стимулов (Дж. Атема [31,
32]). Согласно этой теории, различные сен-
212
ГЛАВА 9
С—СН3 Колхицин
О СНз Колцемид
С = О Винкристин
Н
Рис. 9.6. Структура некоторых ингибиторов образования микротрубочек. Эти меток-
сильные соединения ингибируют полимеризацию белка микротрубочек. Колхицин
и колцемид действуют на клетки растений и животных, но обычно неэффективны в от-
ношении грибов. Мелатонин и трифлюралин действуют на растения и некоторых пу-
стейших, но, по-видимому, не оказывают влияния на животных. Подофиллотокси!Гин-
гибирует полимеризацию микротрубочек in vitro во всех исследованных системах.
Винбластин и винкристин осаждают белки микротрубочек и другие белки, связываю-
щие кальций. (См. [257, 213].)
сорные стимулы вызывают конформа-
ционные изменения в белке микротрубо-
чек, которые передаются от начала послед-
них (на периферии сенсорной клетки) к их
основанию и трансформируются в нервные
импульсы.
Неспособность тубулина полимеризо-
ваться с образованием микротрубочек, свя-
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
213
Рис. 9.7. Ресничные сенсорные клетки.
А. Палочка из сетчатки крысы. Видна
кинетосома (к) у основания аксонемы
(а) неподвижной реснички (с). Цент-
риоль расположена под прямым
углом к кинетосоме реснички. В осно-
вании кинетосом находятся поперечно
исчерченные фибриллярные корешки
(г) (ср. рис. 10.7, Б). Вдоль этих фиб-
рилл расположены митохондрии (т).
Светочувствительная палочка (rod)
образована складками мембраны рес-
нички; она содержит большое количе-
ство светочувствительных пигментов,
связанных с белком, х 17 000. [David
Chase.] Б. Ресничные сенсорные клет-
ки. 7-ресничный поясок; 2-микротру-
бочки; 3-митохондрия; 4 -плотное
соединение; 5 - микроворсинки;
б-ядро сенсорной клетки; 7-кинето-
сома; 8- базальная часть реснички;
9 - корешки реснички; 10 - вспомога-
тельная клетка. (Детали см. [32].)
214
ГЛАВА 9
занная с недостатком гормона щитовид-
ной железы, который на ранних стадиях
развития стимулирует эту полимеризацию,
может лежать в основе явлений кретиниз-
ма (J. Nunez, личное сообщение). Микро-
трубочки составляют часть внутриклеточ-
ной транспортной системы как у позво-
ночных, так и у беспозвоночных [257, 882].
У симбиотической гидры микротрубочки
участвуют в транспорте поглощенных во-
дорослей от проксимальной (обращенной
в гастроваскулярную полость) стороны пи-
щеварительных клеток к их дистальной
стороне; это обеспечивает наилучший до-
ступ света к новым хлореллам-симбионтам
(см. рис. 7.13) [174, 306]. У грибов микро-
трубочки, вероятно, принимают участие
в миграции ядер-процессе, поддерживаю-
щем дикариотическое состояние [700, 765].
У бобовых гербицид трифлюралин, инги-
битор образования микротрубочек, сильно
замедляет формирование азотфиксирую-
щей симбиотической ассоциации, влияя на
морфогенез растительных клеток, в кото-
ром участвуют микротрубочки [223].
В общем микротрубочки и их актив-
ность необходимы для выполнения по
крайней мере следующих основных функ-
ций : движения хромосом при митозе,
формирования асимметричной клеточной
структуры, внутриклеточного транспорта,
движения ундулиподий и внутриклеточной
передачи информации. Они играют важ-
нейшую роль в жизни эукариотической
клетки.
Генетическое поведение микротрубочек,
изученное главным образом на инфузо-
риях, загадочно. Большинство инфузорий
имеет толстый поверхностный кортекс, ко-
торый состоит из видоспецифических ста-
бильных структур, образованных микро-
трубочками, мембранами и филаментами
(рис. 9.8) [179]. Эти структуры кортекса
толщиной от одного до нескольких микро-
метров настолько сложны и специфичны,
что можно проводить генетические экспе-
рименты по скрещиванию стабильных кор-
тикальных вариантов. В литературе по
кортикальной генетике инфузорий накопи-
лось немало неожиданных фактов. Твердо
установлена независимость кортикальной
наследственности от ядерной [66, 452, 890,
930]. Особенно интересны работы, прове-
денные на Paramecium aurelia. При конъю-
гации-спаривании инфузорий, когда про-
исходит обмен ядрами без слияния цито-
плазмы,-идентичные ядра могут попадать
в разное цитоплазматическое окружение.
Рис. 9.8. Кортекс брюхоресничной инфузории Oxytrichia fallax. Тонкий срез, на кото-
ром видны пучки микротрубочек поперечных цирр (ундулиподий). Срез пересекает ак-
сонемы на разных уровнях. Кортикальные микротрубочки (ст) расположены под
прямым углом к микротрубочкам ундулиподий (urn). В правом нижнем углу видна ми-
тохондрия в процессе деления (т). х 8500. [G. W. Grimes, S. W. L’Hernault, Hofstra
Univ.]
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
215
Некоторые кортикальные признаки пере-
даются только тем родителем, от которого
наследуется цитоплазма. Генетические де-
терминанты кортикальной наследственно-
сти инфузорий находятся не в цитозоле
и не в митохондриях, а в самом кортексе.
У одной и той же клетки и, видимо, под
контролем одного и того же ядра могут
быть ундулиподии двух типов: 9 + 0 и 9 +
* 2 [803]. У экспериментально энуклеиро-
ванных гипермастигот происходит рост
групп ундулиподиальных поясов, число ун-
дулиподий увеличивается и в процессе га-
метогенеза образуются митотические вере-
тена [158]. М икротубулярные структуры
можно разрушить облучением или химиче-
скими агентами, действующими на нуклеи-
новые кислоты [452, 535, 868], и они никог-
да не восстанавливаются при участии
одних только ядерных генов. Эти факты
подкрепляют представление о генетической
автономии системы ундулиподии-митоти-
ческий аппарат.
Известно, что реплицирующиеся струк-
туры всегда содержат нуклеиновую кисло-
ту; репродукция центров, организующих
микротрубочки ундулиподий и других ком-
понентов микротубулярной системы, ве-
роятно, тоже контролируется нуклеиновой
кислотой, даже если не находится под
прямым ядерным контролем. Центры-ор-
ганизаторы микротрубочек, судя по их ви-
ду и окрашиваемости, состоят из белка;
возможно, что в них есть и нуклеиновые
кислоты.
Центриоли и кинетосомы образуются
либо из предсуществующих структур типа
9 + 0, либо из центров-организаторов с ме-
нее определенным строением. Хотя перво-
начально было описано «деление» кинето-
сом [585, 1025], теперь установлено, что
гни не претерпевают деления как такового.
Они являются продуктами сложного про-
цесса, детали которого варьируют в зави-
симости от вида организма и стадии жиз-
ненного цикла (рис. 9.9). Центриоли могут
формироваться из мелких аморфных пред-
шественников, которые развиваются в про-
центриоли, большей частью непосред-
ственно связанные с предсуществующими
зрелыми кинетосомами или центриолями
\85. 657, 891]. На одну исходную кинето-
сому может приходиться от 1 до 250 и бо-
лее совместно созревающих процентрио-
лей или прокинетосом; их бывает много
в так называемых блефаропластах в спер-
матоцитах растений [657, 1025]. В элек-
тронном микроскопе процентриоли до то-
го, как они приобретают типичную девяти-
лучевую симметрию, выглядят как гра-
нулярно-фибриллярные образования; их
можно рассматривать как центры-органи-
заторы микротрубочек. У самих процен-
триолей может вовсе не быть морфологи-
чески различимых микротубулярных пред-
шественников. Таким образом, отсутствие
центриолей отнюдь не означает отсутствия
генетического потенциала для их построе-
ния. Некоторые жгутиковые амебы, такие
как Naegleria и Tetramitus, не имеют на
амебоидных стадиях каких бы то ни было
кинетосом, но сохраняют генетический по-
тенциал для формирования кинетосом, ун-
дулиподий и других родственных структур.
Если популяцию клеток Naegleria встряхи-
вать в среде, не содержащей питательных
веществ, например в дистиллированной во-
де, то происходит быстрое формирование
кинетосом, из которых развиваются унду-
липодии. Таким образом, у некоторых ор-
ганизмов генетические детерминанты унду-
липодий могут дедифференцироваться до
элементов, неразличимых в электронном
микроскопе [707, 833].
У большинства животных и растений
у каждой хромосомы имеется дифферен-
цированный участок - кинетохор (центро-
мера, место прикрепления нитей вере-
тена) (рис. 9.10). Только интенсивное ис-
следование подходящих объектов, таких
как некоторые протисты из кишечника тер-
митов, изученные Кливлэндом, позволило
понять взаимоотношения между кинетохо-
ром и остальной частью митотического
веретена. Кливлэнд пришел к выводу, что
в плане онтогенеза и филогенеза кинето-
хоры составляют часть митотического ап-
парата и системы ундулиподий, а не часть
хромосомной системы, в которую они
обычно включены. Он показал, что у сим-
бионтов термитов под действием кислоро-
да происходит селективное разрушение
хроматина, но на пучках микротрубочек
тем не менее образуются кинетохоры.
216
ГЛАВА 9
Рис. 9.9. Развитие центриолей и ундулиподий. Электронные микрофотографии реснич-
ного эпителия яйцевода пятидневного мышонка. [Е. R. Dirksen, Med. School, Univ, of
California at Los Angeles.] А. В цитоплазме расположены два генеративных комплек-
са-ЦМ (gc). Они развиваются из аморфного материала (ат), лежащего между ними.
х 30000. Б. Генеративный комплекс (gc), окруженный девятью центриолями (с), в про-
цессе созревания, х 41 000. В. Поперечный (вверху слева) и продольный (внизу справа)
разрез зрелых центриолей (с) типа 9 + 0. х 60 000. Г Продольный разрез кинетосомы
(к) и реснички (ci) в окончательном положении, обращенной в просвет яйцевода,
х 60000.
В клетках, обработанных кислородом, ки-
нетохоры «растаскивались» веретеном да-
же при отсутствии хромосом, к которым
они прикрепляются в нормальных клет-
ках. Таким образом, Кливлэнду удалось
отделить рост веретена, деление кине-
тохоров и само деление клетки от реп-
ликации хромосом. Он также показал,
что хроматин не принимает прямого учас-
тия в контроле функций веретена: ско-
рее «число митотических веретен всегда за-
висит от числа центриолей, и часто, когда
в этих мультицентриолярных клетках хро-
мосомы имеют возможность выбора, они
движутся вдоль периферических, а не цен-
тральных веретен» [159].
Поскольку под центриолью Кливлэнд
понимал ростральный участок, функциони-
рующий как митотический центр, а не ис-
тинную центриоль типа 9 + 0, егоф точка
зрения была уязвима для критики. Суть
его утверждения состояла в том, что толь-
?ис. 9.10. Кинетохоры и центриоли. Электронные микрофотографии. А. Кинетохоры
и в делящейся клетке млекопитающего; видно место прикрепления хромосом к ми-
кротрубочкам веретена. [J. R. McIntosh, Univ, of Colorado.] Б. Фибробласт китайского
юмячка в процессе митоза; видна двуслойная (dl) структура кинетохора. В. Центриоли
поздней интерфазе. Расположение дочерней центриоли (справа) типично: на этом
~родольном разрезе она лежит под прямым углом к материнской центриоли. Г. Цент-
Г-НО.1И лежащие под прямым углом друг к другу (одна в поперечном разрезе) в клетке
с и тайского хомячка, обработанной колцемидом. Большинство митотических микро-
р»бочек растворилось, но микротрубочки центриолей не поддались действию колце-
чида. Центриоли находятся в центре метафазной группы хромосом (с) из-за невозмож-
:<ти формирования нормального веретена. Б, В и Г-[В. R. Brinkley, Е. Stubblefield,
. niv. of Texas].)
218
ГЛАВА 9
ко растущие нити веретена (как теперь из-
вестно, это микротрубочки, растущие от
структур, прикрепленных к пучкам ундули-
подий) определяют расхождение хромосом
в дочерние клетки. Сам хроматин, хотя он
и может скручиваться и раскручиваться,
конденсироваться и разрыхляться, не спо-
собен к внутриклеточному движению; хро-
мосомы, таким образом, не ответственны
за свой собственный переход в дочерние
клетки. Передвижение хромосом у расте-
ний, животных, грибов и многих протистов
всецело осуществляют структуры, свя-
занные с ундулиподиальной системой. Так,
например, Кливлэнд [160] писал:
«...Кислород в концентрации 70-80% разру-
шает все хромосомы жгутиконосца-гипермасти-
готы Т richonympha, если обработка производит-
ся на ранних стадиях гаметогенеза, когда
хромосомы находятся в процессе удвоения. При
такой обработке утрата хромосом не ведет
к повреждению цитоплазмы и ее органелл. В ре-
зультате функционирования центриолей обра-
зуются ахроматическая фигура [веретено и дру-
гие части митотического аппарата], жгутики
[ундулиподии] и парабазальные тельца [тельца
Гольджи]. Затем цитоплазма делится с образо-
ванием двух безъядерных гамет, которые прохо-
дят некоторые стадии цитоплазматической диф-
ференцировки, характерной для мужских
и женских гамет Trichonympha».
С другой стороны, наблюдения Кливлэнда
[160] над двуядерной клеткой, содержав-
шей пять центриолей, показали, что
«...без центриолей не образуется ахроматиче-
ской фигуры [веретена] и не происходит движе-
ния хромосом к полюсам, приводящего к фор-
мированию дочерних ядер. Хромосомы репро-
дуцируются, а ядра-нет. Для репродукции ядра
нужно, чтобы в клетке было не меньше двух
центриолей и они находились достаточно близ-
ко к ядру».
Таким образом, Кливлэнду была ясна ве-
дущая роль веретена и системы ундулипо-
дий в сегрегации хроматина, но, к сожале-
нию, он редко сообщал о своих открытиях
современникам в четкой форме.
Функция кинетохоров состоит в прикре-
плении хромосом к митотическому верете-
ну. Многие цитогенетические исследования
показали, что хромосомы, лишенные кине-
тохоров, будучи неспособны прикрепиться
к нитям веретена, просто не попадают на
полюса делящейся клетки и потому не
включаются в дочерние ядра. При движе-
нии хромосом к полюсам кинетохоры всег-
да находятся впереди [584]. У некоторых
аномальных хромосом бывает два кине-
тохора, которые стремятся направиться
к противоположным полюсам; такие ди-
центрические хромосомы обычно разры-
ваются, и каждый фрагмент со своим кине-
тохором включается в одно из дочерних
ядер.
Хотя детали этих процессов чрезвычай-
но разнообразны, функция центриолей, ки-
нетохоров, а также центров, организующих
микротрубочки, и их производных в про-
цессе митоза состоит в распределении хро-
мосом между дочерними клетками. Мито-
тическое веретено может, кроме того,
использоваться для распределения мито-
хондрий и пластид (см. табл. 8.6). Наличие
единственной большой митохондрии мо-
жет быть причиной удивительного явле-
ния, наблюдаемого у трипаносом, напри-
мер у Trypanoplasma [67]. При каждом
клеточном делении здесь образуется вто-
рое веретено более или менее обычного ви-
да; структура, из которой оно растет, рас-
положена в основании ундулиподии (эти
клетки имеют одну ундулиподию на пере-
днем конце). Деление этой структуры
(“Blepharoplastteilung”) происходит одно-
временно с делением обычного веретена,
участвующего в делении ядра, и столь же
хорошо заметно. Таким образом, у этих
протистов, по-видимому, формируется вто-
рой митотический аппарат, прикрепленный
или по крайней мере точно направленный
к ундулиподии. Кинетопласт, или блефа-
ропласт,- единственная длинная митохон-
дрия, содержащая большое количество по-
вторяющихся последовательностей ДНК,
тоже ориентирована в направлении унду-
липодии.
У другой трипаносомы, Leishmania, ки-
нетопласт делится синхронно с каждым де-
лением ядра и остальной клетки [867] 1.
В градиенте плотности хлористого цезия
была обнаружена сателлитная полоса
ДНК, связанной с кинетопластом [252],
Дж. Кьюзел выделил этот кинето-
пласт - вероятно, самую большую из известных
одиночных митохондрий [515].
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
219
что согласуется с сообщениями о включе-
нии меченого тимидина в ДНК кинетопла-
ста [323]. Дифференциация этой единствен-
ной специализированной митохондрии
приходится на ту часть жизненного цикла,
в которой происходит окислительное фос-
форилирование. Вероятно, второе веретено
возникло как механизм, обеспечивающий
регулярное распределение материала ки-
нетопласта между дочерними клетками.
С помощью акрифлавина можно получить
штаммы Leishmania, лишенные кинетопла-
ста; по-видимому, это вещество избира-
тельно ингибирует синтез его ДНК. Клет-
ки. обработанные акрифлавином, вначале
проходили несколько делений, при ко-
торых ДНК кинетопласта распределялась
поровну, но затем происходило деление,
при котором одна из дочерних клеток
получала всю эту ДНК, а другая не полу-
чала ее вовсе (становилась дискинето-
пластной). Из этих данных Л. Симпсон
’868] заключил, что акрифлавин влияет и
на синтез кинетопластной ДНК, и на ее
распределение между дочерними кинето-
пластами.
Ни один из известных организмов не
имеет структур, промежуточных между ун-
дх диподиями и бактериальными жгутика-
ми. Пропасть между прокариотами, не со-
держащими центров-организаторов микро-
трубочек и их продуктов, и эукариотами,
которые всегда их имеют, требует эволю-
ционного объяснения. У некоторых эука-
риот. например у красных водорослей, ун-
дутиподии отсутствуют на всех стадиях
жизненного цикла, хотя у них есть оплодо-
творение и мейоз. Многие биологи предпо-
лагали, что среди всех эукариот красные
водоросли - наиболее близкие родственни-
ки цианобактерий. Согласно этой точке
зрения, красные водоросли примитивны
в том смысле, что в процессе их эволюции
никогда не возникала компартментализа-
дия. ведущая к образованию ундулиподий.
Рис. 9.11. Мужские гаметоциты красной водо-
росли Bonnemaisonia hamifera Hariot. [J. S. Bi-
ihard-Breaud, C. R. Acad. Sc., 1971, ser. D,
г 1272-1275.] А. Структуры, интерпретируемые
как две внутренние соединенные аномальные
• ндулиподии (и), в крипте. х 26 000. Б. Струк-
;.ры. интерпретируемые как две атипичные ки-
зетосомы (к), х 24 000.
С другой стороны, сообщалось об обнару-
жении рудиментарных ундулиподий, со-
стоящих из микротрубочек, в мужских га-
метах Bonnemaisonia, сложно организо-
ванной водоросли с берегов Флориды
тип
РОД
00
Царство
Protoctista
Caryoblastea Pelomyxa
Dinoflagellate* Oxyrrhis
Sarcodina
Amoeba
Euglypha
Cryptophyta
Chilomunas
Euglenophyta
Peranema
Zoomastigina
Naegleria
Tetramttus
Collodictyon
Zoomastigina
Polymastix
Bacillariophyta Surirella
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
221
Rhodophyta
Porphyra
• ооффф$ •
(только ядро)
Actinopoda
Acanthocystis
Ciliophora Paramecium
Царство
Fungi:
Ascomycota
Saccharomyces
Царство Ascaris
Animalia:
Nematoda
Царство Allium
Plantae:
Angiospermophyta
Рис. 9.12. Вариации на тему митоза. (* Хотя детали еще не известны, у некоторых ди-
нофлагеллят сейчас обнаружено оплодотворение [896].)
|рис. 9.11) [860]. Хотя из этих наблюдений
был сделан вывод, что красные водоросли
произошли от предков, обладавших ундули-
подиями, низкое качество электронных ми-
крофотографий не позволяет считать эти
данные однозначными. Однако на митоти-
ческих полюсах в клетках красных водо-
рослей были обнаружены сложные центры-
организаторы, состоящие из кольца микро-
трубочек [588], и это заставляет думать,
что предками Rhodophyta действительно
были организмы, передвигавшиеся ранее
помощью ундулиподий. Может быть,
они пожертвовали жгутиками ради разви-
тия полового процесса? Во всяком случае
у красных водорослей имеются митохон-
дрии и микротубулярные структуры, гомо-
логичные таковым других эукариот. Их
высокоразвитая половая система, безуслов-
но, весьма прогрессивна: это никак не
промежуточное звено между делением
прокариот, не имеющих микротрубочек,
и митозом и мейозом эукариот, обладаю-
щих ими. Гдё же тогда промежуточное зве-
но? Откуда произошли ундулиподии?
Если бы центриоли, кинетохоры и ми-
тотическое веретено образовались как эпи-
сомы из ядра, то они, вероятно, были бы
более чувствительны к факторам, влияю-
щим на ядро, чем к воздействиям, повре-
222
ГЛАВА 9
ждающим ундулиподии, однако фактиче-
ски наблюдается как раз обратное [158,
1006]. Центриоли, звезды, веретёна, кине-
тохоры и кинетосомы - все эти органеллы
по своему составу, поведению и разви-
тию родственны микротубулярно-ундули-
подиальной системе, а не системе хро-
матина.
Важное различие между митозом и рас-
пределением генофора прокариот при де-
лении состоит в количестве ДНК, которое
необходимо передать дочерним клеткам
[121]. Если бы ДНК прикреплялась к авто-
реплицирующейся внутриклеточной орга-
нелле, копии которой были бы способны
к сегрегации при клеточном делении, такой
механизм обеспечил бы равное распределе-
ние больших количеств генетического
материала независимо от содержащейся
в нем информации. Гипотеза, развиваемая
в этой книге (см. гл. 10), состоит в том, что
прикрепленные к клеткам симбиотические
микробы - спирохеты - предоставили свою
реплицирующуюся нуклеиновую кислоту
для репродукции мест своего прикрепле-
ния, и последние эволюционировали затем
в кинетосомы, а сами клетки спирохет-в
ундулиподии. Эта гипотеза при всей ее
кажущейся экстравагантности совместима
с тем принципом, что эволюция оппорту-
нистична (т. е. пользуется уже имеющимися
возможностями), а не телеологична.
Представление о симбиотическом про-
исхождении ундулиподий помогает объяс-
нить ряд необычных фактов, например
прямую морфологическую связь между
митозом, аксоподиями и ундулиподиями
у протистов (рис. 9.12, 9.16) [154, 155]. Су-
ществование тубулиновых микротрубочек,
вариации в числе, но не в размерах ундули-
подий и отсутствие каких-либо организ-
мов, которые могли бы быть промежу-
точным звеном между прокариотами и
эукариотами в эволюции подвижности
и клеточного деления,-все это совместимо
с гипотезой о симбиотическом происхо-
ждении ундулиподий. Согласно этой гипо-
тезе, геном прокариотического организма,
ставшего первой ундулиподией, превратил-
ся в нуклеопротеид центра-организатора
микротрубочек. Если признать гомологию
между ундулиподиями и митотическим ап-
паратом (которую признает большинство
биологов) и принять гипотезу о том, что
митоз выработался путем прогрессивной
дифференциации поверхностных симбион-
тов (с чем большинство биологов не со-
гласно), то можно построить грубую схему
филогении протоктистов. Эта схема осно-
вана на представлении о том, что эволю-
ция митоза определила главные пути диф-
ференциации клеточной структуры и жиз-
ненных циклов.
На пути к митозу
В явлении митоза существует фундаментальный дуализм: возникновение и транс-
формации ахроматической фигуры в значительной мере независимы от того, что
происходит с хроматиновыми элементами. Митоз, по существу, состоит из двух
тесно коррелирующих, но раздельных рядов событий.
Э. Вильсон, 1925 [1025]
Первые прижизненные наблюдения ми-
тоза были сделаны в начале нашего века.
Кульминацией этих ранних изящных работ
явилась хромосомная теория наследствен-
ности [1025]. Информацию о делении кле-
ток у водорослей суммировал Фрич [311].
Позднейшие ультраструктурные исследова-
ния, как правило, подтверждают, расши-
ряют и уточняют выводы, сделанные на
основе данных световой микроскопии в
конце 19-го и начале 20-го веков. Напра-
шиваются два ярких примера. Первый-это
доказательство того, что блефаропласты
растений, долгое время считавшиеся гомо-
логами центриолей (и кинетосом, из ко-
торых образуются хвосты у сперматозои-
дов растений), действительно при созрева-
нии превращаются в крупные сферические
структуры, состоящие из множества ориен-
тированных центриолей [657]. Второй при-
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
223
мер-это подтверждение того, что у одной
диатомеи существует специализированное
внеядерное веретено с перекрывающимися
пучками микротрубочек [728, 729], впервые
описанное Лаутерборном в 1896 г. [528].
Какого рода давление отбора привело
к выработке митоза? Интеграция симбион-
тов-протомитохондрий с протоэукариота-
ми привела к образованию микробов
с ядром, все еще не способных к митозу.
Осуществляя аэробный гликолиз сахаров
до СО2 и воды, эти клетки смогли извле-
кать из пищи больше энергии, чем про-
тоэукариоты. Это создало возможность
появления крупных клеток - крупнее каждо-
го из прокариотических партнеров. Если
предком нуклеоцитоплазмы был микроб,
сходный с термоплазмой, и если, как пред-
полагают Сирси и сотр. [846], у термо-
плазмы имеется актомиозин, то, значит,
некоторые элементы внутриклеточной си-
стемы подвижности эукариот - возможно,
филаменты, ответственные за циклоз,-воз-
никли еще до приобретения митохондрий,
пластид и ундулиподий (гомологи компо-
нентов этой системы пока не установлены).
Однако размеры клеток и разнообразие их
белков должны были лимитироваться об-
щим количеством кодировавшей их ДНК.
Без эффективных механизмов равного рас-
пределения больших количеств вновь син-
тезируемой ДНК между дочерними клет-
ками генетическая сложность первых эу-
кариот неизбежно была ограниченной.
У ныне живущих организмов можно найти
ряд примеров ранних, немитотических
стратегий, обеспечивающих получение до-
черними клетками равных количеств ДНК
при общем высоком ее содержании. Сюда
относятся многоядерность, дупликация ге-
нов и даже целых геномов, как в макрону-
клеусах инфузорий [757, 759] и у бесполых
гигантских амеб, например у Pelomyxa
palustris [198, 199]. Повторение генов или
геномов повышает вероятность того, что
каждая дочерняя клетка получит по край-
ней мере одну из их копий. Доказана, од-
нако, неэффективность случайной сегрега-
ции множественных генов и геномов [314].
Даже после организации хроматина в
группы сцепления оставалась проблема
правильной сегрегации этих групп, а также
проблема распределения органелл, пред-
ставленных многими копиями, таких как
митохондрии.
Так как же возник митоз? У некоторых
ядерных организмов он так никогда и не
появился. У других же картина деления
ядра (то, что в начале 20-го века называли
фигурами деления) сама подсказывает
вероятную последовательность событий
в эволюции митоза. Нижеследующий
очерк, несомненно, будет гипотетическим
и упрощенным, но его положения до-
ступны для проверки.
Древнейшие эукариоты- нуклеоцито-
плазматические организмы с митохондрия-
ми, но без митотического аппарата,- прио-
брели поверхностных симбиотов из группы
спирохет. Эти спирохеты, будучи свобод-
ноживущими организмами, уже обладали
микротрубочками. С течением времени
возникшие комплексы - первые про-
тисты - приобрели чрезвычайно выгод-
ную способность к быстрому передвиже-
нию, позволявшую им активно разыски-
вать пищу. Возникло много таких под-
вижных симбиотических комплексов, и по
мере их усовершенствования под дей-
ствием отбора спирохеты превращались
в ундулиподии. Нуклеиновая кислота спи-
рохет стала предшественником центров-ор-
ганизаторов микротрубочек в эукариотиче-
ских клетках, чем и объясняется характер-
ная и практически однотипная структура
ундулиподий. В основе вид ©специфичности
и автономного генетического поведения
кортекса инфузорий лежат взаимодействия
популяций поверхностных спирохет, став-
ших ундулиподиями. Взаимодействие ге-
нов спирохет с геномом нуклеоцито-
плазмы привело постепенно к дифферен-
циации кинетохоров, центриолей и верете-
на. Отбор работал неутомимо: преимуще-
ство точного распределения хромосом ве-
ло к дальнейшему совершенствованию ме-
ханизма митоза. Естественный вывод из
этой гипотезы состоит в том, что все спо-
собные к митозу организмы из поколения
в поколение сохраняют и реплицируют ге-
нетические детерминанты, полученные пер-
воначально от спирохет.
Каким образом в результате дифферен-
циации генома симбионтов сформировался
224
ГЛАВА 9
митотический аппарат? Логически для это-
го необходимы были по меньшей мере две
серии мутаций (реально же их, вероятно,
было намного больше). Одна серия дол-
жна была вести к установлению связи меж-
ду нуклеиновыми кислотами хозяина
и симбионта. В результате возникли соеди-
нительные структуры, из которых в конце
концов образовались кинетохоры. Вторая
серия мутаций должна была обеспечить
расхождение нуклеиновых кислот симбион-
та к противоположным полюсам клетки-
хозяина. У современных эукариот тубулин
не синтезируется во время митоза. Нити
веретена образуются из микротрубочек —
продуктов полимеризации заранее синте-
зированного тубулина. По крайней мере
некоторые митотические движения являют-
ся прямым следствием удлинения микро-
трубочек в результате полимеризации ту-
булина ([633, 642]; Goode, неопубликован-
ная рукопись, 1980). Веретено, таким обра-
зом, можно считать продуктом экспрессии
генов, первоначально привнесенных в клет-
ку симбионтами. При каждом делении от-
бирались те из дочерних клеток, которые
содержали хотя бы один полный эу-
плоидный геном, т. е. не менее одной копии
каждого гена. Жесткий отбор против не-
точного распределения генов все время
способствовал усовершенствованию меха-
низмов сегрегации хроматина. Исходя из
многообразия митотических фигур у совре-
менных эукариот, особенно у протокти-
стов, можно думать, что «стандартный»
митоз возник в разное время в разных ли-
ниях эволюции.
На рис. 9.13 приведена схема филоге-
нии, основанная на прогрессивной эволю-
ции организмов в направлении полного
развития механизмов митоза. Эта схема
строилась с учетом общих биологических
особенностей организмов, хотя пластиды
не учитывались. Предполагается, что пла-
стиды приобретались, как правило, уже по-
сле полного развития митоза. На после-
дующих страницах представлен пятиста-
дийный «сценарий» дифференциации кине-
тохоров и центриолей под контролем
нуклеиновой кислоты симбионта. Он по-
казывает, как можно рассматривать раз-
личные эукариотические микроорганизмы
в качестве примеров адаптивной радиации,
приведшей к развитию и стабилизации ми-
тоза и мейоза. Хотя это, безусловно, силь-
но упрощенная и умозрительная схема, ав-
тор надеется, что она послужит ориенти-
ром для поиска новых данных1
При обсуждении этого сценария термин
«центр-организатор микротрубочек», или
ЦМ, будет относиться к нуклеопротеиду,
детерминирующему образование кинето-
сом, центриолей или других органелл, со-
стоящих из микротрубочек и формирую-
щихся из процентриолей или иного грану-
лярно-фибриллярного материала. Мы
предполагаем, что такие структуры служат
вместилищем нуклеиновой кислоты, проис-
ходящей от генов спирохет. Данные элек-
тронной микроскопии указывают на то.
что так называемый «центр деления»
[1025] тоже относится к структурам, ко-
торые можно рассматривать как ЦМ. Та-
ким образом, термин ЦМ употребляется
здесь в самом общем смысле и означает
способную к репликации систему, детерми-
нирующую образование кинетосом, их ун-
дулиподий, центров деления, центриолей
или любых других специализированных
органелл подобного рода1 2.
Рис. 9.14 иллюстрирует возможные вза-
имоотношения между первоначальным ге-
номом нуклеоцитоплазмы и геномами ЦМ
в процессе клеточного деления на каждом
этапе эволюционного сценария. Указано
число функционально различных геномов
ЦМ, приходящееся на один геном нуклео-
цитоплазмы в каждом поколении. Иными
словами, хотя для обеспечения эуплоидно-
сти требуется по одному способному к де-
лению ЦМ (кинетохору) на каждую группу
1 Хотя я просмотрела много протоктистов.
мне удалось наблюдать митоз лишь у очень не-
многих из числа рассматриваемых здесь; поэто-
му я в большой мере основываюсь на наблюде-
ниях других исследователей [175, 393, 710, 727.
780].
2 Это расширенное толкование термина,
первоначально предложенного Пиккет-Хипсом
просто в качестве функционального обозначе-
ния для организующего микротрубочки центра,
без указания на авторепликацию или симбиоти-
ческое происхождение. Я надеюсь, что Пиккет-
Хипс простит мне смелость предложить родо-
словную для его крестника.
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
225
Рис. 9.13. Филогения митоза. Буквы в кружках-Б, 3, К и Ж-означают соответственно
приобретение бурых, зеленых, красных и золотисто-желтых пластид.
сцепления, множественность хромосом ра-
ди ясности изложения в схеме не учтена;
организованный в виде хроматина геном
нуклеоцитоплазматического хозяина рас-
сматривается как единое целое, а митохон-
дрии и пластиды временно игнорируются.
Во всяком случае общее число хромосом
может быть различным даже у очень близ-
ких видов (гл. 12), так что число любых ре-
плицирующихся структур на клетку-пло-
хой таксономический критерий [230].
Этап I. ЦМ использовались как кинето-
сомы для ундулиподий. В древнейшей груп-
пе эукариот, обладавших ундулиподиями,
ЦМ (нуклеиновая кислота подвижных по-
верхностных симбионтов) использовались
только для своего собственного синтеза
и для репликации ундулиподий. Селектив-
ное преимущество, появившееся сразу по-
сле приобретения этих симбионтов, состоя-
ло в подвижности симбиотического ком-
плекса. Микротрубочки не использовались
для сегрегации хроматина; таким образом,
половой процесс, включающий мейоз, был
невозможен. Реликты этого периода, воз-
можно, сохранились в некоторых изолиро-
ванных группах мелких жгутиковых, таких
как динофлагеллята Prorocentrum [894].
Дальнейшее развитие состояло в использо-
вании ЦМ для дифференциации сложной
микротубулярной кортикальной морфоло-
гии многих протистов [707, 358].
Этап II. ЦМ включались в ядро для се-
грегации хроматина хозяина; это приводи-
ло к необратимой утрате ундулиподий. Ну-
клеиновые кислоты спирохет и нуклеоци-
226
ГЛАВА Ч
ййй
Некоторые
4.4 Dinof lagellata, + +
напр.Ян0гос№ -
trum
V1
1:1
Sarcodina,
Acrasiomycota
Rhodophyta
Gamophyta
ГРИБЫ
Myxosporida
1:1 Naegleria
2:1 Kinetoplastida 4- +
vi Uhioropnyta + + +
Ciliophora + + +
(внутриядерные
центры деления)
2И
Некоторые Heliozoa
Bactlloriophyta
ЖИВОТНЫЕ
(внеядерные
центры деления)
Hypermastigotes
Opalinidae
Рис. 9.14. Возможные этапы эволюции на пути к митозу. Римские цифры-номера эта-
пов, описанных в тексте. Справа указаны некоторые особенности деления и подвижно-
сти современных представителей каждого эволюционного этапа (+ данная особен-
ность имеется у всех исследованных видов; + только у некоторых; - ни у одного).
топлазмы каким-то образом объединились,
в результате чего нуклеиновая кислота
спирохет оказалась внутри или на поверх-
ности ядра, где и использовалась хозяином
в качестве внутриядерного центра деления.
В процессе эволюции возникло несколько
типов внутриядерных ЦМ. Некоторые из
них видны при окрашивании железным ге-
матоксилином [1025] или как гранулярно-
фибриллярный материал.
УНДУЛИПОДИИ, МИТОЗ И СЕЙОЗ
227
В результате включения нуклеиновой
кислоты симбионта в ядро хозяина внача-
ле образовались голые амебы, не имевшие
ундулиподий ни на каких стадиях жизнен-
ного цикла, но содержавшие внутриядер-
ные ЦМ и связанные с ними микротрубоч-
ки, которые могли использоваться при
делении клеток. Реликтами этой премито-
тической стадии могли бы быть много-
ядерные и другие бесполые амебы. Напри-
мер, Добелл в 1912 г. так писал о делении
Amoeba lacertae [235]:
«Никакой экваториальной пластинки не обра-
зуется, и «хромосомы» или хроматиновые гра-
нулы неупорядоченно движутся к полюсам, в то
время как вся кариосома растягивается, прини-
мая веретеновидную форму, и в конце концов
делится. Сомнительно, чтобы здесь можно было
говорить о хромосомах и даже о митозе, но та-
кой тип деления вцолне может быть отправной
точкой для эволюции истинного митотического
процесса».
Постепенно в ходе эволюции от таких
амеб произошли различные группы мито-
тических организмов: другие амебы, кле-
точные слизевики, возможно также ми-
кроспоридии, основные типы безжгути-
ковых грибов, сцеплянки (из зеленых водо-
рослей) и два больших класса красных
водорослей (Bangiales и Floridea). Все эти
организмы ни на каких стадиях своих жиз-
ненных циклов не имеют ундулиподий, хо-
тя многие из них обитают в воде. При на-
личии полового процесса он происходит
в форме конъюгации. Уиттэйкер [1018]
возвел красные водоросли (Rhodophyta)
и группы безжгутиковых грибов
• Zygomycota, Ascomycota и Basidiomycota)
в ранг типов. Зеленые водоросли-сцеплян-
ки (Gamophyta), вероятно, тоже достаточно
отличаются от других водорослей, чтобы
заслуживать статуса типа. Нефотосинтези-
рующие части клеток красных водорослей
могут быть непосредственными гомолога-
ми безжгутиковых грибов [222]; соедине-
ния между клеточными стенками, форма
запасания углеводов и детали процесса
конъюгации подкрепляют это представле-
ние [493].
Как возник митоз у организмов, совсем
эе имеющих ундулиподий? После включе-
ния в ядро ЦМ вначале реплицировались
асинхронно с репликацией хроматина и де-
лением ядра. В результате возникал избы-
ток внутриядерных ЦМ. Затем накаплива-
лись мутации, приводившие к ассоциации
ЦМ с хроматином и в конце концов к пре-
вращению ЦМ в кинетохоры. Другие ЦМ,
не связанные с хроматином, функциониро-
вали как морфогенетические центры, по-
добные центриолям. Реликтом этой стадии
может быть сходная с центриолями, но не
имеющая субструктуры типа 9 + 0 вну-
триклеточная структура у базидиомицета
Armillaria (см. рис. 9.1). Локализация этого
тельца на полюсах внутриядерного верете-
на позволяет предполагать, что оно функ-
ционально эквивалентно другим центрам
деления. Аналогичная полярная структура
описана у красных водорослей [113].
Сходные с центриолями образования
у Penicillium также не имеют субструктуры
типа 9 + 0; они расположены на ядерной
мембране и выглядят как двойные скобки.
Сходная структура, участвующая в деле-
нии, идентифицирована как ЦМ у гриба
Catenaria [329]. Если теория симбиоза со
спирохетами верна, то мейотические эука-
риоты, в том числе те, у которых совсем
нет ундулиподий, должны были произойти
от подвижных предков, поглотивших соб-
ственные ундулиподии.
Этап III. ЦМ использовались и как вну-
триядерные центры деления, и как кинето-
сомы ундулиподий, но на разных стадиях
жизненного цикла. У какой-то группы про-
тистов возник митоз с использованием ну-
клеопротеидов спирохет как центров деле-
ния, но им пришлось на время деления
отказаться от подвижности. На подвижных
стадиях эти организмы были неспособны
к делению; а во время деления ЦМ перехо-
дили в ядро и временно использовались
как центры деления для сегрегации хро-
матина. После репликации ЦМ продукты
этой репликации дифференцировались в
кинетосомы, дававшие начало обычным
ундулиподиям, и подвижность восстана-
вливалась. В качестве центра деления мо-
гла функционировать (по-видимому, нахо-
дясь в ядре) только недифференцированная
«репликативная» форма ЦМ. Эта линия
эволюции привела к некоторым жгути-
ковым амебам, которые и сейчас неспо-
собны делиться во время подвижных ста-
228
ГЛАВА 9
дий; у ряда таких форм можно наблюдать
прямую морфологическую связь между ун-
дулиподией и ядром в виде чувствительно-
го к кальцию сократимого ризопласта.
У других во время деления может изме-
няться плавательное или пищевое поведе-
ние, связанное с функцией микротрубочек.
Реликтами этой линии развития могут
быть: Naegleria [833, 1025], анизонемиды
или перанемиды [175], некоторые дино-
флагелляты [1025], одноядерные Metazoa,
такие как Dimastigamoeba, Mastigella
и Mastigina [336].
Этап IV. Одни ЦМ использовались для
формирования кинетосом ундулиподий, а
другие необратимо дифференцировались,
становясь независимыми внутриядерными
центрами деления. У жгутиковых амеб
в результате мутаций возникли клетки, со-
державшие два разных «клона» ЦМ. По-
томство одного из них постоянно выпол-
няло функции внутриядерных центров де-
ления. Другой «клон» давал потомство,
выполнявшее только роль кинетосом. Вну-
триядерные ЦМ, а затем митоз и мейоз
возникли в той линии эволюции, в которой
ЦМ сохранились и в качестве кинетосом
независимых органелл движения. Эта се-
рия мутаций (происходившая, вероятно, не
однажды) привела к возникновению мно-
гих групп протоктистов, таких как бодо,
трипаносомы, хлорофиты и хризофиты.
У некоторых из них, например у эвгле-
новых, наблюдается необычное поведение
автономных хромосом и массивной эндо-
сомы (гомолог ядрышка). Как правило,
морфологические и временные взаимоот-
ношения между ундулиподиями и деля-
щимся ядром сохраняются. У более древ-
них представителей этой линии мейоз
отсутствует. В типичных случаях ундулипо-
дии находятся на переднем конце клетки,
хотя они могут быть направлены в сто-
роны или назад.
Один или, возможно, несколько таких
протоктистов стали предками митотиче-
ских зеленых водорослей, а затем и расте-
ний, для которых характерны подвижные
стадии с жгутиками на переднем конце
клетки и внутриядерные ЦМ. От других
представителей этой линии, вероятно, про-
изошли некоторые споровики [175]. Отсут-
ствие в растительных клетках центриолей
типа 9-1-0 (за исключением стадий, пред-
шествующих формированию спермиев) за-
ставляет предполагать, что гомологу ЦМ
у растений такой фенотип, как правило, не
свойствен. Однако стандартный митоз, по-
явление чувствительных к колхицину ми-
кротрубочек при образовании фрагмопла-
ста или клеточной пластинки (рис. 9.15)
[400] и наличие в некоторых группах гамет
с ундулиподиями позволяют думать, что
нуклеопротеиды ЦМ, происходящие от ге-
нофоров спирохет, есть у всех растений
и будут со временем идентифицированы.
Инфузории с их двумя типами ядер, по-
видимому, возникли в результате серии
мутаций этапа IV; возможно, они про-
изошли от примитивных динофлагеллят,
как предположил Ф. Тэйлор [934]. Генети-
ческую непрерывность у них обеспечивает
митотическое деление микронуклеуса при
участии внутриядерных веретен, однако
многочисленные кинетосомы кортекса
репродуцируются независимо от деления
ядер. Митотический «зачатковый путь» ми-
кронуклеусов и премитотическая «сома»
макронуклеусов удивительным образом
различаются между собой. Хромосомы ма-
кронуклеуса не делятся в продольном на-
правлении; макронуклеус содержит множе-
ство копий коротких фрагментов ДНК-
это настоящий мешок с генами [745, 746].
Так как в процессе деления макронуклеуса
происходит удлинение микротрубочек, чув-
ствительных к колхицину, сегрегацию хро-
матина здесь, по-видимому, осуществляет
какая-то своеобразная система, в принципе
гомологическая обычным ЦМ [446, 685].
Серия мутаций, закрепленных отбором
в ходе эволюции митоза микронуклеуса,
должна была начаться в двуядерной клет-
ке, в которой одно ядро регулярно проду-
цировало множество копий генома, а дру-
гое - макрону клеус - запасало и непосред-
ственно использовало их для управления
синтезом белка. Микронуклеусы не содер-
жат цитохимически выявляемой РНК и не
синтезируют мРНК; они не нужны ни для
каких процессов, кроме мейоза и конъюга-
ции [348]. В эволюции макронуклеуса ни-
когда не возникал ни митоз, ни мейоз. Ис-
торию дифференциации ядер у инфузорий
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
229
Рис. 9.15. Взаимоотнощения между микротрубочками веретена и стенкой раститель-
ной клетки. Электронные микрофотографии ранней (А, х 12 000), средней (Б, х 15 500)
и поздней (В, х 12 000) стадий развития стенки эндосперма африканской красной ли-
тии Haemanthus. [Р. К. Hepler, Univ, of Massachusetts; Rockfeller Univ. Press.] Целлю-
лозные стенки у растений образуются под прямым углом к митотическому веретену
предыдущего деления. Wall - клеточная стенка; mt-микротрубочки.
можно проследить на некоторых при-
митивных «кариореликтовых» формах.
У самых примитивных из них дифферен-
циация макронуклеуса и микронуклеуса
происходит после каждого клеточного де-
ления; у более продвинутых форм макро-
нуклеус может делиться, но только амито-
тически [179, 759]. Хотя эволюция шла
подчас окольными путями, конечное селек-
тивное преимущество очевидно: инфузории
и другие представители этого этапа сохра-
нили как подвижность, так и способность
г делению, причем главным достижением
?ыло сохранение подвижности во время
самого деления. У некоторых из них в кон-
це концов выработались собственные
специфические формы полового процесса
мейозом.
Этап V. Некоторые продукты реплика-
ции ЦМ дифференцируются с образованием
центриолей, которые превращаются в кине-
чосомы, кинетохоры или иные микротубу-
^рные структуры. Другие продукты
стаются в недифференцированной форме,
входной к репликации. В некоторых эво-
•иионных линиях клетки с дифференциро-
иными ЦМ не способны более к митозу.
организмов, уже имевших внутри-
шерные центры деления-ЦМ в форме ки-
нетохоров, в результате мутаций возникли
клетки, в которых другие ЦМ стали вне-
ядерными центрами деления. Эти вне-
ядерные ЦМ функционировали как мито-
тические центры, т.е. либо как центриоли
в строгом смысле слова, либо как иные
микротубулярные тельца типа центрио-
лярных бляшек. После того как ЦМ диф-
ференцируется в центриоль или кинетосо-
му, он навсегда теряет способность
к репликации. Поэтому внеядерная репли-
кативная форма должна репродуцировать-
ся в каждом поколении и сохраняться до
того, как произойдет необратимая диффе-
ренцировка.
Световой микроскоп позволяет выявить
кинетосомы, функционирующие как внея-
дерные центры деления, у многих организ-
мов-у Dimorpha mutans [725], Clathrina
[1025], Ochromonas и Centropyxis [242].
У Acanthocystis и Wagnerella фигуры деле-
ния напоминают таковые у Metazoa, но
центриоли сходны с кинетосомами [1025].
Во время деления ундулиподии могут быть
прикреплены к центриолям на полюсах
митотического веретена (рис. 9.16). При ис-
следовании их ультраструктуры иногда
можно видеть, что один из продуктов де-
ления продолжает функционировать как
230
ГЛАВА 9
Рис. 9.16. Ранние стадии деления жгутиконосца Dimorpha mutans. Следует отметить
связь между кинетосомами (Ц ундулиподиями (2) и митотическим веретеном (3). (По
[242].)
репродуктивная форма, а другой дает на-
чало кинетосомам, которые дифференци-
руются и теряют способность к дальней-
шей репликации, как было показано [774]
для одного из оомицетов (рис. 9.17).
Некоторые специализированные про-
токтисты с кинетосомами, играющими
роль центриолей, вероятно, непосредствен-
но возникли на этапе V. Среди них есть та-
кие, у которых в течение всего жизненного
цикла сохраняется связь между жгути-
ковым аппаратом и митотической фигу-
рой, как, например, у Trichomonas [1025],
Polymastix [1025], Heteromita [1008],
Prowazkia [68] и Eudorina [1008]. У других
эта связь могла быть впоследствии утра-
чена, например у Cryptobia [175],
Herpetomonas [1008], Vaucheria [311],
Dictyota [1025], Paramoeba [336] и Gurleya
[1008]; хорошей иллюстрацией могут слу-
жить гипермастиготы с их «длинными цен-
триол'ями» [158, 160, 175]. Исследовав жиз-
ненный цикл центриолей у Barbulanympha,
Кливлэнд [158] резюмировал:
Рис. 9.17. Развитие кинетосомы у хитриды Allomyces. (По [774].)
ИДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
231
Только что описанный процесс реорганизации
центриолей] определенно позволяет сделать
гяд выводов: несомненно родство между цен-
-риолями гипермастигот и высших организмов;
* некоторых случаях центриоль способна неод-
нократно функционировать при образовании
жгутиков, аксостилей и парабазальных телец,
-?чно так же как она всегда функционирует при
>?рмировании ахроматической фигуры [мито-
тического аппарата]; центриоли могут участво-
вать в образовании внеядерных органелл без
лмовоспроизведения и без одновременной ре-
тро дукции ядра и цитоплазмы; жгутики, пара-
'ззальные тельца и аксостили не способны
к самовоспроизведению; и наконец, что самое
важное, передний конец этих необычно крупных
центриолей жгутиковых представляет собой их
репродуцирующуюся часть».
Солнечники обладают сократимыми ак-
соподиями, состоящими из упорядоченной
системы микротрубочек, чувствительных
к низким температурам, высокому давле-
нию и колхицину [948, 949]. Эти аксоподии
гомологичны другим микротубулярным
структурам; они образуются из грануляр-
ного материала ЦМ. Ранние исследования
9.18. Аксоподия (актиноподия) солнечника Echinosphaerium nucleophilum. Сокра-
•мые аксоподии чувствительны к ингибиторам образования веретена, например кол-
-1ГИН). Аксоподия состоит из сотен микротрубочек толщиной около 24 нм. Электрон-
<1» микрофотография, поперечный разрез.
232
ГЛАВА 9
показали, что в некоторых случаях аксопо-
дии служат организующими центрами для
митотических веретен (рис. 9.18-9.20). Та-
ким образом, солнечники и родственные
им Actinopoda, видимо, принадлежат к
«внеядерной группе», возникшей на этапе V.
Внеядерные центриоли и амфиастеры,
типичные для митоза многоклеточных жи-
вотных, вероятно, появились у организ-
мов, возникших на этапе V, возможно
у Actinopoda. Возникали разные клоны
ЦМ; некоторые из них давали начало цен-
триолям, которые при надлежащих физио-
логических условиях превращались в кине-
тосомы, а от последних в свою очередь
отрастали ундулиподии. После такой диф-
ференцировки, однако, ЦМ не могли боль-
ше продуцировать центриоли. Клетка,
содержащая только дифференцированные
ЦМ, уже не способна к делению; пользуясь
терминологией А. Вейсмана [1007], кинето-
сомы с их ундулиподиями можно сравнить
с сомой, а недифференцированные ЦМ-с
элементами зачаткового пути. У млекопи-
тающих аморфный материал, дающий на-
чало сотням кинетосом при образовании
ресничного эпителия трахеи, в конечном
счете, возможно, происходит от центрио-
лей, сформировавшихся во время предше-
ствовавших митозов [891]; сами же цен-
триоли образуются из генеративных форм
ЦМ, неразличимых в микроскоп.
У Metazoa дифференцированные клетки
с ундулиподиями и некоторыми другими
специализированными микротубулярными
системами (например, нейротубулами), не
способны делиться. Вероятно, неспособ-
ность к делению после дифференциации
микротубулярных базальных структур са-
ма по себе не дает никаких селективных
преимуществ, но таким образом решается
сложная проблема, стоявшая перед боль-
шинством протоктистов: как сохранить ор-
ганеллы движения и питания (ундулипо-
дии, аксоподии и т. п.), если их компоненты
нужны при клеточном делении? Одну по-
Рис. 9.19. Митоз у солнечника Actinophrys sol. Одноядерная клетка во время митоза
отбрасывает свои аксоподии (1). Микротрубочки, по-видимому, растворяются, а затем
реполимеризуются сразу после цитокинеза. 2-ядро, 3-веретено. (По [69].)
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
233
пытку решения этой проблемы мы уже ви-
дели на примере дифференциации микро-
нуклеуса у инфузорий. Для одноклеточного
организма потеря способности к делению
означала бы скорую гибель и никак не
могла быть закреплена отбором. По край-
ней мере у некоторых протоктистов была
утрачена подвижность, когда произошла
необратимая редукция ундулиподий. Дру-
гие решили проблему, разделив во времени
стадии деления, на которой они непо-
движны, и подвижную стадию, когда они
не способны делиться. Третьи нашли пол-
ное и изящное решение этого вопроса,
дифференцировав эти две функции: унду-
липодии были сохранены, а деление осу-
ществлялось какими-то способами, от-
личными от стандартного митоза. У 8000
инфузорий, например, подвижность и кле-
точное деление возможны одновременно.
Однако инфузории с их сложным кортек-
сом и специфическим поведением ядер ока-
зались настолько специализированными,
что эта группа представляет собой эволю-
ционный тупик. Организмы, обладающие
митозом и внеядерными центрами деле-
ния, в некотором смысле так никогда и не
разрешили проблему: ни одна животная
клетка, несущая ундулиподии, не способна
делиться.
Если и митотическое деление, и клеточ-
ная подвижность желательны, но исклю-
чают друг друга, то одно из решений со-
стоит в возникновении двуклеточного ор-
ганизма; при этом одна из клеток сохра-
няет способность делиться, а другая-по-
движность. Эта вторая клетка не способна
к делению после дифференциации двига-
тельных органелл, но эти органеллы могут
обеспечить передвижение обеих клеток. Та-
ким образом, невозможность решить проб-
лему совмещения подвижности с делением
на одноклеточном уровне могла привести
к возникновению в нескольких группах эу-
кариот многоклеточное™. По крайней ме-
эе одной из этих групп была линия хоано-
□лагеллят - губок, а другой - наша соб-
ственная линия бластулообразующих
Metazoa.
К какой бы группе ни принадлежали
ваши предки к Placozoa, кишечнопо-
лостным, инфузориям, плоским червям или
иным животным [379], все равно какие-то
простейшие превратились в многокле-
точных, чтобы иметь возможность пере-
двигаться, сохранив как делящиеся клетки,
так и неделящиеся клетки, снабженные ун-
дулиподиями.
Способность клеток недифференциро-
ванных тканей формировать ундулиподии
широко распространена, но у Metazoa
клетки с ундулиподиями никогда не делят-
ся. Эта проблема заслуживает дальнейше-
го внимания исследователей. Многие ви-
ды дифференцированных животных клеток
имеют сложные системы микротрубочек
диаметром 24 нм: это реснички, нейроту-
булы нейронов, а также микротрубочки
меланоцитов, клеток органов равновесия,
палочек и колбочек. Я интерпретирую
столь широкое распространение связываю-
щих колхицин, осаждаемых винбластином
микротубулярных белков в дифференциро-
ванных клетках, например в развивающем-
ся мозгу [259, 334] и в органах чувств [32],
следующим образом: некоторые фенотипи-
ческие продукты генома, когда-то принад-
лежавшего спирохетам-симбионтам, стано-
вились излишними (в своей прежней роли)
в недедящихся клетках животных и начина-
ли широко использоваться для диффе-
ренциации тканей. Образование дополни-
тельных кинетосом и ундулиподий у кле-
ток при дефиците а-токоферола и избытке
кислорода [403], а также в гипофизе [258],
мне кажется, свидетельствует о лабильно-
сти фенотипической экспрессии генома
бывшего симбионта.
Диатомовые - еще одна процветающая
группа организмов, способных к митозу
и мейозу,-образуют подвижные гаметы (с
ундулиподиями), которые, подобно спер-
миям животных, не могут делиться до
оплодотворения. Во время деления диато-
мовые лишены ундулиподий. Они имеют
сложные, хорошо видимые центриолярные
бляшки (ЦМ), формирующие веретено. Ве-
роятно, диатомовые произошли от общих
с животными предков,-гетеротрофов, спо-
собных к митозу. Так как диатомовые
обладают сложным половым процессом,
они, вероятно, приобрели симбиотическим
путем пластиды лишь после стабилизации
цикла мейоз-оплодотворение. Этим мо-
234
ГЛАВА 9
жет быть обусловлено позднее (в меловом
периоде) появление этой большой одно-
родной группы водорослей среди иско-
паемых. Если для образования фоссилизи-
руемых кремневых структур необходим
метаболизм пластид, то не исключено, что
диатомовые - относительно молодая груп-
па протоктистов.
Некоторые протоктисты, например хи-
триды, имеют жгутики на заднем конце.
Возможно, они находятся в более близком
родстве с Metazoa, чем губки. Губки с их
передними жгутиками, как у хоанофлагел-
лят, могут быть ближе к зеленым расте-
ниям. При исследовании взаимоотношений
между протоктистами и их более крупны-
ми потомками нужно обращать внимание
не столько на цвет пластид, сколько на
цитологию митоза гетеротрофной части
клетки. На рис. 9.14 приводятся данные
УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ
235
Рис. 9.20. Структуры, состоящие из микротру-
бочек (mt). Хотя эти органеллы внутриклеточно-
, го движения приспособлены для выполнения
разных функций, все они состоят из микротру-
бочек, организация которых генетически детер-
минирована. На всех фото диаметр микротру-
бочек около 24 нм. А. Аксоподии солнечника-
центрохелиды Acanthocystis chaetophora (на боль-
шой электронной микрофотографий в продоль-
ном, на врезке-в поперечном разрезе). Б. Аксо-
подии фораминиферы Allogromia, служащие для
захвата пищи (на большом фото в продольном,
на врезке-в поперечном разрезе). В. Сокра-
тимый аксостиль (а) полимастиготы Pyrso-
nympha (на большом фото в продольном, на
врезке-в поперечном разрезе).
числе различных генеративных ЦМ на
эднн хромосомный набор в разных груп-
пах организмов. Теоретически это число
равно численному соотношению между ге-
номами симбионта и хозяина, которое за-
фиксировалось ко времени дивергенции
представителей данной группы от их обще-
го предка. Конечно, положение любой
группы в этой филогенетической схеме -
предположительное; во многих случаях
гно основано на интерпретации фигур де-
ления, известных лишь по цитологическим
зарисовкам и описаниям более чем полуве-
ковой давности. Однако в принципе кажет-
ся несомненным, что среди эукариотиче-
ских микроорганизмов наблюдается адап-
тивная радиация, каждый из путей которой
ведет к стабилизации митоза и менделев-
ской генетической системы. Объединенны-
ми усилиями протистологов-ученых, ко-
торые сейчас сами считают себя цитолога-
ми, ботаниками, протозоологами, миколо-
гами или фикологами,-на этом принципе
может быть построена филогения, отра-
жающая истинную эволюционную исто-
рию. Обширные подборки данных по кле-
точному делению у эукариотических
микробов, составленные Хитом [392,
393],-превосходное начало такой работы
(см. табл. 9.2).
°2
2222
2
о о о о
X
® х х х
о о о о
Тип клеток3
Полярные структуры4
II
fa •<> ж ж ж Ж ж ж ю » Ж -о
•о •о о -о .о •о •о ->э N) Чч) •о -о
□ Ж н н s ж ж □ я ж я я яя я
о оо оо
•>э жж о о ж ж Ф и
+ + + -О -о
+ 4- 4- + + + 4- 4- + + + ,>э +
ОО ОООО О ОО ЖЖ 0 0-^2
н н н ti fa н н ГЗ
+ + + + + + + + +
.^3 *—L h-* Н- N) ь- -о
1 1 им
+ ++-о-о + ++ ++ +
*0 *0 *0 *0
О ООО
5 5 5 Г) П
О О О XX
XJ XJ
Миграция полярных структур5
Число веретен
Ядерная мембрана6
Перинуклеарный ЭР
оо Поведение в телофазе7
о Везикулы веретена
о Метафазная пластинка
Распределение хромосом8
ГЗ Кинетохоры9
Отношение микротрубочки/кинетохор1 °
£ Локализация кинетохора11
Центральное веретено13
Sh Элонгация веретена
Организация микротрубочек13
оо Миграция хромосом в анафазе14
~ Внеядерное веретено
£ Ядрышко15
Таблица 9.2. Вариации митоза у простейших1
14 AhMt >1 »l< ll*tH >t<< >М < (НА (Pr24) Sorosphacra veronicae M Цнт = = д 2 ПО + Нов 4- 4- М 4- Мн НП 4- 7 Схр
Polymyxa betae M 7 7 7 И? 7 7 7 4- М 7 7 7 7 7 7 Схр
Plasmodiophora brassicae M Цнт = = по 4- 4- 4- 7 7 7 7 7 Схр
ZYGNEMATOPHYTA (Pr-14) Spirogyra spp. (3) 0 Нет н 2-5 Аф 4- 4- От 4- Мн НП 4- 7 4- Асе
Mougeotia sp. 0 Нет н 2-5 ПО Иск 4- От 4- Мн НП 4- 7 4- Рс
Closterium littorale 0 Нет н 5 Пф 4- 4- От 4- 1? НП 4- 7 Рс
Cosmarium botrytis 0 Нет н 5 Пф + 4- От 4- 0 Вне 4- 7 4- Рс
PRASINOPHYTA (Pr-15) Pyramimonas parkeae 0 Рз д 2 Рас- 4- М 7 7 7 4- 7 7 Рс
над?
Pedinomonas minor 0 Цнт || = 7 1 И 7 7 7 7 7 7 7 4- _ 7 + ? 7
Platymonas subcordiformis 0 Рз? 7 7 7 7 4- м 7 7 7 4- 7 + ? Рс
Heteromastix angulata 0 Рз д 2 ПО 7 4- м 4- 1 НП 4- _ 7 4- Рс
CHAROPHYTA (Pr-15) Nite Ila missouriensis 0 Цнт || = д 7 Рас- 7 4- 4- От 4- Мн НП 7 7 ? Рс
пад?
Chara sp. 0 Нет Н 5 Пф 4- 4- От 4- 7 НП 4- 7 + 1 Асе
PHAEOPHYTA (Pr-12) Zonaria far low ii 0 Цнт II = ? 7 ПО 7 7 4- 4- 7 4- 7 7 7 7 Рс
Pylaiella littoralis 0 Цнт || = д 2 по Иск 4- 4- м 4- 7 7 4- 7 7 Рс
RHODOPHYTA (Pr-13) Griffiths ia floculosa 0 Сф и 4- 4- м 7 7 7 7 7 7 7 Рс
Membranoptera platyphylla 0 Кл д? 7 по + Э 4- м 4- Мн НП 4- 7 4- Рс
Porphyridium purpureum 0 Гр д 2 по Иск 4- 4- Нд 4- 1 НП 4- 4- 4- 4- Рс
Polysiphonium spp. (2) 0 Кл д 2 по 4- Иск 7 4- От 4- 7-8 НП 7 4- 7 4- Рс
Продолжение табл. 9.2
2 3 4 5 6
SPOROZOA (Рг-19) Gregarinida
Stylocephalus longicollus M Гр В 6 И
Nosema vivieri M Нет? 7 ? и
Coccidida
Sarcocystis dispersa M ЦК + Цнт|| = 7 ? и
Eimeria spp. (6) M ЦК + Цнт|| = в ? и
E. aubemensis M ЦК + Цнт II = Д? ? и
E. necatrix M ЦК + Цнт|| = в 2 по
E. Falciformis M ЦК + Цнт|| = 7 ? по? -
Hepatozoon domerguei 0 Кл в 2 по ?
Globidium gilruthi M Цнт Д 3? и
Haemosporida
Plasmodium spp. (4) M Вну-Бл Ве .1 и
Pl. elongatum M Бл 7 ? и
Pl. cynomolgi M Вну-Бл ? ? и
Haemoproteus colombae 0 Вну-Кл + Цнт Ве 1 и
Parahaemoproteus velans 0 Сф ? ? и ?
Leucocytozoon spp. (2) M Бл Ве 1 и
Haplosporida
Toxoplasma gondii 0 ЦК ? ? и
Minchinia spp. (2) M Вну-Бл ? ? и
- С С К
8 9 10
12 13 14 16 18 19 20
7 От Нд + + Мн 1? ЯМ нп 7 + 7 7 7 + 7 Рс? 7
От ? 7 7 7 7 7 Схр
— От + 1 нп 7 + 7 + Схр
7 ? ? ? 7 7 7 7 7 ?
— От + 1 нп 7 + 7 + Схр
7 От ? ? 7 7 7 7 7 7
7 ? ? ? 7 7 7 7 7 ?
7 ? + 1 нп 7 7 7 7 ?
э 7 7 Нд От + + 1 1? НП нп 7 + ? ? + ? Схр ?
7 7 От + ? нп 7 + ? + ?
э? 7 От + 7 нп — ? ? ? ?
7 7 7 + ? нп 7 ? ? ? ?
7 7 Нд + 1? нп ? ? ? Схр
7 7 Нд ? 7 ? ? ? —
э 7 Нд + 1 нп + + + ? ? Схр
CNIDOSPORIDIA (Рг-20)
Stempellia mutabilis M Вне-Бл ? 1 и
Gurleya chironomi 0 Вне-Бл ? 7 и
G luge a weiissenbergi M Вне-Бл ? 7 и
Thelohania bracteata M Вну-Бл ? 7 и
Metchnicovella hovassei M Вне-Бл ? 7 и
Pelomyxa spp. (2) (Pr-1) M Нет Н 7 7
Naegleria gruberi (Pr-8) 0 Нет Н 7 и
? — От + 1 НП ? _ ? + ?
? 7 От + Мн нп + ? ? + ?
? _ ? От ? 1? нп ? + ? + ?
п ? ? ? ? ? ? ? ? ? ? ?
? ? ? ? ? ? ? ? ? ? Схр
Иск? + + От + 1? нп ? + ? ? Рс
? ? ? ? ? ? ? + ? ? Схр
Л< IINOI'OOA 0*1 1Г>)
Rrtdlohiridu
Collozoum pelagicum 0 Бл 4- Цнт|| = Be 1 И
Aulacantha scolimantha 0 7 7 7 Пф
Acantharida
Acanthochiasma rubescens 0 Б л 4- Цнт|| = Be 1 и
Acantholithium stellatum 0 Be 1 и
Astrolonche serrata 0 Be 1 и
Gigartacon mUlleri 0 Be 1 и
Heteracon biformis 0 Be 1 и
Conacon sp. 0 Be 1 и
Amphilonche elongata 0 Бл 4- Цнт|| = Be 1 и
Lithoptera mUlleri 0 Be 1 и
FORAMINIFERA (Pr-17)
Myxotheca arenilega M Цнт|| = 7 7 и
Iridia lucida 7 Сф 4- Цнт B? 1 и
Allogromia laticollaris 0 Большая Сф 7 7 и
BACILLARIOPHYTA (Pr-11) Pennales
Diatoma vulgare 0 ИП В 5 Пф
Surirella ovalis 0 ИП в 5 Пф
Nitzschia sigmoideae 0 ИП 7 7 Пф
Synedra ulna 0 ИП в 5 Пф
Pinnularia sp. 0 ИП в 5 Пф
Fragilaria sp. 0 ИП в 5 Пф
Centrales
Lithodesmium undulatum 0 ИП в 5 Пф
Melosira varians 0 ИП в 5 Пф
CHLOROPHYTA (Pr-15) Chlorococcales
Chlorella pyrenoidosa 0 Цнт || = д 7 по
Kirchneriella lunaris M Цнт д 2 по
Hydrodictyon reticulatum M Цнт || = д 2 по
Tetraedon bitridens M »» д 2 по
Pediastrum boryanum M д 2 по
Sorastrum sp. M д 2 по
Scenedesmus spp. (2) M д 2 по
э? 7 4- От От 4- 2 4- 0 нп Вне 4- 7 7 7 7 7 7
п От 4- 1 НП + ? + 7 Рс
п От 4- 1 НП + ? ± 7 Рс
п От 4- 1 НП + ? ± 7 Рс
п От 4- 1 НП + ? ± 7 Рс
п От 4- 1 НП 4- ± 7 Рс
п От 4- 1 НП 4- + 7 Рс
п От 4- 1 НП + ? + 7 Рс
п От 4- 1 НП + ? + 7 Рс
7 От 7 7 7 7 7 4- Рс
э 4- От 4- 7 НП 4- 7 + ?
7 7 От 7 7 7 4- 7 7 От
4- 4- М — 0 Вне 4- 4- 4- 4- Рс
4- 4- М в 7 НП 4- 4- 4- 4- Рс
7 4- м 4- Мн НП 4- 4- 4- 7 Рс
7 4- м 0 Вне 4- 4- 4- 4- Рс
4- м 4- 4- 4- 4- Рс
4- м 4- 4- 4- + Рс
4- 4- м 0 Вне 4- 4- 4- 4- Рс
4- 4- м 0 Вне 4- 4- 4- 4- Рс
4- 7 7 7 7 7 7 7 7 7 7 ? 7
4- Иск 4- От 7 7 7 4- 7 4- Рс
4- Иск 4- М 4- Мн НП 4- 7 4- Рс
4- Иск 4- От 7 7 7 4- ? 7 Рс
4- Иск 4- От 7 7 7 4- 7 4- Рс
4- Иск 4- От 4- 7 НП 4- 7 + Рс
4- 7 4- От 7 7 7 7 7 7 Рс
4
6
Volvocales
Chlamydomonas reinhardi 0 7 ПО
Ch.' moewusii 0 д 1 и
Tetraspora sp. 0 7 2 по
Volvbx aureus 0 Нет Н 7 по
Ulotrichales
Ulothrix fimbriata 0 Цнт || = ? Пф
Ulva mutabilis 0 »* ? 7 по
Klebsormidium subtilissimum 0 д 7 Пф
K. flaccidum 0 7 Пф
Microspora sp. 0 д 2 по
Stichococcus ch lor an thus 0 Нет? ? 7 Пф
Cylindrocapsa involuta 0 Цнт || = д по
Chae to pho rales
Trentepohlia aurea M Цнт 7 7 и
Coleochaeta scutata 0 Цнт || = д 2 Пф
Stigeoclonium helveticum 0 *» 7 7 и
Siphonocladales Cladophora spp. (2), вегетативные
клетки M проЦнт д 1 -и
Cladophora spp. (2), подвижные
клетки M Цнт || = д 1 и
Pleurastrum sp. M Нет 5 7
Acrosiphonia spinescens M Цнт д 2 по
Bryopsis hypnoides M Цнт •> по
Dasycladales
Batophora oerstedii M Нет? 7 и
Acetabularia mediterranea M 7 *> 7 и
Oedogoniales
Oedogonium spp. (2) 0 Внутри- ядерн. Сф д 3? и
Bulbochaete hiloensis 0 Нет н и
Продолжение табл. 9.2
8 9 10 12 14 15 16 18 19 20
7 4- От 7 7 7 4- 7 4- Рс
Иск 4- От 4- Мн НП 4- 7 4- Рс
Э? 4- м? 4- м НП — 4- 7 4- Рс
7 7 7 7 7 7 7 4- 7 4- Рс
+ 4- м 7 7 7 4- 7 7 Рс
4- м 7 7 7 4- 7 4- Рс
4- м 7 7 7 4- 7 Рс
— + 4- м 7 7 7 4- — Рс
Иск 4- От 4- Мн НП — 4- 7 7 Рс?
— + 4- м 7 7 7 7 4- 7 7 Рс
Иск 4- м 7 7 7 4- 7 Рс
7 7 7 7 7 4- 7 7 Рс
— + 4- м _ 7 0 Вне 4- 7 — Рс
Э + 4- м 7 7 7 4- 7 7 Рс
Иск 4- От 4- Мн НП 7 4- 7 4- фр
Иск 4- От 4- Мн НП ± 4- 7 4- фр
7 4- От 7 7 7 7 4- 7 4- Рс
7 4- М 7 7 7 4- 7 4 Рс
7 От 7 Схр
7 4- От 7 7 7 4- 7 — Рс?
7 7 От 7 7 7 7 7 7 Рс?
Иск От 4- Мн НП 4- 7 4- фр
Иск + От 4- Мн НП 4- 7 4- Схр
Hill'
II iHKHIKlhM
к "Ih'iiimi
ундулиподий
II
1 *i < И < »ni< Hind Id и
Trlshmanla tropica 0 ? и
Trypanosoma spp. (5) 0 Нет Н и
Polymastigida Dientamoeba fragilis 0 Ат ? и
Trichomonadida Trichomonas vaginalis 0 At В 6 и
Hypermastigida Barbulanympha ufala 0 At В 6 и
Trichonympha agilis 0 At В 6 и
Staurojeonina caulleryi S pirotrichonympha 0 At В 6 и
psammotermitid is 0 At В 6 и
Holomastigatoides hemigynum o. At В ? и
Lophomonas striata 0 At В 6 и
CILIOPHORA 16 (Pr-18) Gymnostomatida Nassula spp. (2) p M Внутриядерн. везикула ? ? и
N. ornata p M ? ? ? и
Alloizona trizona p M ? ? ? и
Dileptus anser p M Нет н ? и
Didinium nasutum p M См. [393] ? 3 и
Hymenostomatida
Ichthyophtirius multifiliis p M Нет н ? и
Paramecium aurelia p M Нет н ? и
P. aurelia, мейоз p M Нет н ? и
P. bursaria p M Нет? н ? и
Tetrahymena pyriformis p M ? ? ? и
Heterotrichida Blepharisma spp. (2) p M Нет ? ? и
Oligotrichida Diplodinium sp. p M ? ? ? и
Hypotrichida Gastrostyla steinii p M Нет ? ? и
Peritrichida Epistylis anastatica p M Нет? 0 ? и
Vorticella nebulifera p M Нет? 0 ? и
Suctorida Tokophrya infusionum p M Нет 0 ? и
э 9 От + ? 1 ? НП + + + + ? ? ? ? 2/2
? ? ? ? ? ? ? ? ? ? + ?
э От + Мн ям + + + + + ?
э От + Мн ям + + + + ?
э От + Мн ям + + + +
? 9 ? ? ? + ? ? ? + ?
? От + Мн ям + ? + ? +
? ? ? ? ? + + + ?
От + Мн ям 4- ? + ?
э + От + 1 нп + 4- + ?
Нов От ? ? ?
? ? От ? ? ? ? 4- ?
Нов От _ ? 0 Вне + ? ?
Иск + От + ? НП + ? 4-
? ? ? От ? ? ? + ?
Иск + От + ? НП + + ?
Э + От + ? ? нп + ? —
? ? От ? ? ? ? ? ?
? От + 10 нп + +
Нов + От 0 Вне + 4-
? ? ? От ? ? ? ? ? ?
Нов От ? ? + 4- ?
? ? От ? ? ? ? ?
? ? От ? ?
Э ? От ? ? 4- 4- ? ?
2 4 5 6
Paracineta limbata p. Gymnostomatida M Нет 0 7 И
Nassula spp. (2) M M Нет 0 7 и
Didinium nasutum M M Her 0 7 и
Loxodes magnus M Trichostomatida M Нет 0 7 и
Isotricha sp. M Hymenostomatida M ? 7 7 и
Paramecium aurelia M M Нет H 7 и
Tetrahymena pyriformis M Heterotrichida M ? ? 7 и
Blepharisma spp. (3) M M ? 7 7 и
Protocrucia sp. M Oligotrichida M ? 7 7 7
Diplod in ium sp. M Hipotrichida M ? 7 7 и
Gastrostyla steinii M M Нет H 7 и
Stylonychia mytilis M Peritrichida M Нет H 7 и
Campanella umbellaria M Suctorida M Нет? H 7 и
Tokophrya infusionum M M Нет H 7 и
Acineta tuberosa M M Нет H 7 и
LABYRINTHULOMYCOTA
(Pr-21)
Labyrinthula sp., мейоз Labyrinthula sp., вегетативные 0 Цнт || = Д 7 ПО
клетки 0 проЦнт? ? 7 ПО
Sorodiplophrys stercorea 0 проЦнт|| = д 7 и
Thraustochytrium sp. 0 Цнт || = д 2 по
Продолжение табл. 9.2
8 9 10 12 14 15 16 18 19 20
7 ? ? От ? ? 7 4- 7 7
э ? От ? ? ? 4- 4- 7 Схр
э От 0 Вне 4- 7 _ 7 4- Фр
Нов 4- От 4- Мн НП 4- 7 4- 7
7 7 7 ? От ? 7 7 7 + 7 7 7
— э — От — ? 0 Вне 4- 7 _ 7 — Схр
7 ? ? От 7 7 7 7 7 7 7 7
— ? — ? От ? 7 7 4- 7 4- 7
7 э ? От ? 7 4- 7 7
7 ? ? ? ? ? 7 7 ? 7 7 7 7 7
э? От — ? 0 Вне 4- 4- 7 Схр
э? От — ? 0 Вне 4- 4- 7 Схр
? От - ? 0 Вне 4- 4- 7
э От ? 7 7 4- 7 7
э От ? 7 4- 7 7
7 4- 7 7 7 7 7 7 Рс
7 4- 7 7 4- 1? НП 4- — 7 Рс
7 7 7 7 7 7 + ? 7 Рс
Иск 4- м? 4- 1 НП 4- 7 4- Рс
( H iNhl (НА ||'|
Siipi < ilcgn udch Saprolcgnia spp. (3) M Цнт = = В 1 И э Нд + 1 НП + 4- Схр
Thraustotheca c la vat a M о В 1 И э Нд + 1 нп — + — 4- Схр
Achy la ambisexualis M ? ? И ? Нд + ? ? ? + ? ? Схр
Aphanomyces spp. (2) M В? 1 и Нд + 1 нп + + Схр
Lagenidiales Apodachila sp. M Цнт = = д ? и ? ? ? ? ? ? ? ? ? Схр
Sapromyces elongatus M д ? и э? Нд + 1 нп + 4- Схр
Lagemisma coscinodisci M д ? и э? Нд + ? нп + ? Схр?
Peronos porales
Phytophthora palmivora M в ? и э От + 1? нп + — 4- Схр
Albugo Candida M ? ? и ? Нд 4- ? нп ? ? 4- Схр
HYPHOCHYTRIDIOMYCOTA
(Pr-25) Rhizidiomyces apophysatus M Цнт || = д ? по ? Иск 4- + ? 4- 1 нп ? ? ? ? Рс
CHYTRIDIOMYCOTA (Pr-26) Chy tridiales Phlyctochytrium irregulare M Цнт|| = д 2 по + Нов + м + ? нп + ? 4- Отб
Entophlyctis sp. M д 2 по + Нов + От + ? нп + ? 4- ?
Blas toe lad iales Blastocladiella emersonii M Цнт || = ? ? и ? ? ? ? ? ? + ? ? Схр
Catenaria anguillulae M »» д ? и Иск + От? + ? нп + ? + Отб
Allomyces spp. (3) M ? ? и Иск + От + ? нп — + _ ? 4- Рс
Coelomomyces indicus M Цнт? ? ? и ? ? От ? ? ? ? ? ? ? ?
Harpochytridiales Harpochytrium hedinii M Цнт || = д 2 по э 4- М 4- 1? нп 4- ? 4- Рс
EUGLENOPHYTA (Pr-6) Astasia long a 0 Нет ? ? и э От ? ? ? 4- + ? 4- Схр
Euglena gracilis 0 Нет д 1 и Иск — От + 2 + нп — 4- + ? 4- Схр
Scytomonas pus ilia 0 ? ? ? и ? ? ? ? ? ? ? ? ? ? Схр
Isonema nigricans 0 Цнт|| = ? ? и ? ? От ? ? ? ? ? ? ? Схр
Phacus longicaudus 0 Нет д ? и Иск От _ ? 0 Вне 4- + ? ? Схр
1 2 3 4 5 6
DINOFLAGELLATA (Рг-2) Prorocentrales Prorocentrum spp. (2) 0 Нет н ? И
Exuviella sp. 0 ? ? ? и ?
Gymnodiniales Amphidinium spp. (2) 0 Нет н ? и
Cryptothecodinium cohnii 0 Нет н 6 и
Peridiniales Woloszynskia micra 0 ? ? ? и
Blastodinium sp. 0 Сф в 6 и
Amoebophrya acanthometrae 0 Исчерчен- ? ? и
ная Бл
A. rosei 0 ? ? и —
Glenodinium foliaceum 0 ? и ?
Oodinium fritillariae 0 Сф в ? и
Haplozoon axiothellae 0 Нет н ? и
Syndinium sp. 0 Цнт || = в 6 и
Solenodinium fallax 0 в 6 и
Peridinium balticum, динонуклеус M Нет н ? и
P. balticum, эукариотическое M Нет н и
ядро
CRYPTOPHYTA (Pr-7) Chroomonas salina 0 Нет н 5 Пф
Cryptomonas sp. 0 Нет н 5 Пф
RAPHIDIOPHYTA (Pr-4) Vacuolaria virescens 0 Нет н ? по.
Тф
Продолжение табл. 9.2
8 9 10 12 13 14 15 16 18 19 20
э От ? ? ? 0 4- ? ? 4- ?
? ? От ? ? ? 0 ? ? ? 4- ?
э От 4- 1 ЯМ 0 4- ? ? 4- ?
э От ? ? ? 0 ? ? ? 4- Схр
? От + ям 0 4- 4- Схр
э От 9 9 0 4- 4- ? + 9
? От 9 0 Вне 0 4- ? о ? 4-
? — м? 4- ? ЯМ 0 + ? ? ? 4- ?
? ? От 4- ? ЯМ 0 ? 4- ?
э От 4- 1 ЯМ 0 4- ? + ? 4- ?
э От 4- ? ЯМ 0 4- ? ? 4- ?
э От 4- Мн ЯМ 0 4- 4- 4- ?
э — От 4- Мн ЯМ 0 4- ? 4- 9
? ? От ? ? ? 0 4- 4-
э От Истинно амито- 0 4- Схр
тивеские
4- м 4- ? НП 4- - ? 4- Рс
4- м 4- 1 НП 4- 4- Рс
4- 4- От 4- Мн НП + ? ?
Фр
CHRYSOPIIYTA (Рг-4) Ochromonas danica 0 Рз Д 5 Пф + + От ? ? + -? + Рс
HAPTOPHYTA (Рг-5) Prymnesium parvum 0 Цнт || = ? Пф + + От? ? ? ? + ? + Рс
XANTHOPHYTA (Pr-9) Vaucheria litorea M Цнт || = д 1 Инт ипз Нд ? ? ? + + _ ? фр
По Хиту [393], с изменениями.
2 Рг-Protoctista. Цифры после Рг относятся к типам, пере-
численным в Принижении, которые несколько отличаются от ти-
пов, принятых в системе классификации Хита. В скобках указано
число исследованных видов.
3 О-одноядерная; М - многоядерная (ценоцит).
4 Морфология органелл, интерпретируемых как центры деле-
ния. Цнт|| = -две центриоли расположены приблизительно под
прямым углом друг к другу; Цнт = = - центриоли лежат при-
близительно в одной плоскости; ЦК-имеется центральный конус
(см. рис. 9.3); Бл-бляшка; Кл-кольцо; Рз-ризопласт; Сф-сфе-
ра; Гр-гранула; ИП-исчерченная палочка; Ат-аттрактофоры;
Вну-Бл - центриолярная бляшка расположена в соответствующей
ей по размеру поре ядерной мембраны; Вне-Бл-центриолярная
бляшка находится вне ядерной мембраны. Некоторые организмы
имеют кинетосомы с ундулиподиями, сохраняющиеся во время
деления и локализованные иногда вблизи полюсов веретена; та-
кие организмы отмечены как не имеющие полярных структур.
Схемы сфер, аттрактофоров и колец см. на рис. 4 в работе Хита
[393]. Ризопласты представляют собой чувствительные к каль-
цию поперечно исчерченные структуры, непосредственно связы-
вающие кинетосомы с ядром.
5 Н-понятие неприменимо; Д-миграция к полюсам до
образования веретена; В-миграция во время образования верете-
на; Ве-веерообразное расположение микротрубочек, которое из-
меняется при образовании веретена.
6 ПО-полярные «окна», т.е. большие отверстия на полюсах
ядерной мембраны, через которые проходит формирующееся ве-
ретено; Пф, Мф, Аф, Тф-распад ядерной мембраны в профазе,
метафазе, анафазе или телофазе соответственно; В-кратковре-
менное вскрытие и последующее замыкание ядерной мембраны;
И-мембрана остается интактной.
7 В телофазе ядерная мембрана может стягиваться в плоско-
сти экватора (Э) или в двух разных областях таким образом, что
промежуточная зона исключается из дочерних ядер (Иск); может
формироваться новая независимая ядерная мембрана внутри ста-
рой (Нов) или же центрипетально формируется стягивающая
перегородка (П). Если ядерная мембрана распадается раньше те-
лофазы, то не происходит ни одного из этих событий (-).
8 М-слитная масса; От-отдельные хромосомы; Нд-кон-
денсация хроматина недостаточна для наблюдения его распреде-
ления.
9 В месте взаимодействия микротрубочек с хроматином мо-
гут быть различимы структурные образования ( + ) или их может
не быть (-); Вр-структура типа воротничка на слитной массе
хромосом.
10 Мн-более 20.
11 НП-в нуклеоплазме; ЯМ-в ядерной мембране; Вне-вне
ядерной мембраны.
12 Пучок не связанных с кинетохорами микротрубочек фор-
мируется раньше телофазы.
13 Плотная упаковка микротрубочек, не связанных с кинето-
хорами, по-видимому, при участии поперечных «мостиков» между
микротрубочками (см. рис. 5 у Хита [393]).
14 Простая элонгация микротрубочек веретена (-) наблю-
дается у тех организмов, у которых хромосомы в анафазе не рас-
ходятся к полюсам.
15 Судьба ядрышка в митозе: Схр-сохраняется; Рс-рассеи-
вается; Отб-отбрасывается; Фр-фрагментируется; Нет-ядрыш-
ко отсутствует; Асе-фрагменты ядрышка ассоциированы с хро-
матином, что обеспечивает их распределение; 2/2-род содержит
два вида, у которых ядрышко сохраняется, и два вида, у которых
фрагменты ядрышка рассеиваются.
16 Все обозначения относятся к поведению макронуклеуса
(М) или микронуклеуса (ц).
Внимание! Во всей таблице вместо «0» (нуль) следует читать О.
ГЛАВА 1 О
СПИРОХЕТЫ И УНДУЛИПОДИИ
Микротубулярные системы:
симбиотическое происхождение?
Насколько мне известно, впервые на этот вопрос попытался ответить Б. М. Козо-
Полянский в своей, теперь уже почти забытой, книге «Новый принцип биологии».
Касаясь происхождения центриолей и блефаропластов, которые он справедливо
рассматривает как вполне гомологичные структуры, Козо-Полянский приходит к
выводу, что они представляют собой «жгутиконосные цитоды» (под цитодами он
вслед за Геккелем понимал неядерные организмы-бактерии и цианеи). Краткое
изложение своей гипотезы он заканчивает замечательными словами: «По меньшей
мере, подозрение в бактериальной природе и этих «киноплазматических» (двига-
тельных) органоидов, без сомнения, является вполне закономерным» (стр. 57).
Эта более чем смелая для своего времени гипотеза не нашла сторонников и прошла
незамеченной. Она настолько не соответствовала установившимся представлениям,
что не могла в то время серьезно обсуждаться на респектабельных научных
собраниях. Но вот через 43 года эту же мысль совершенно независимо выдвигает
молодой биолог из Бостонского университета (США)...
А. Л. Тахтаджян, 1973 [927]
В литературе по биологии клетки мож-
но встретить две теории происхожде-
ния микротубулярных систем - «эндоген-
ную» и «экзогенную». Они сравниваются
в табл. 10.1. Согласно теории эндогенной
компартментализации, или прямой филиа-
ции, микротрубочки дифференцировались
в клетках фотосинтезирующих организмов
в процессе эволюции митотического аппа-
рата красных водорослей, происходящих
от цианобактерий; позднее из них сформи-
ровались ундулиподии [82, 726, 934]. Та-
ким образом, согласно этому представле-
нию, эволюция митоза предшествовала
появлению ундулиподий. Из «эндогенной»
теории неизбежно вытекают определенные
следствия, касающиеся развития пластид
и митохондрий [933]: по существу, это
часть «ботанического мифа» (см. гл. 2).
В настоящей главе мы детально рассмот-
рим только вторую теорию-теорию про-
исхождения уццулиподий от спирохет.
В ней предполагается, что свободноживу-
щие спирохеты, уже содержавшие микро-
трубочки в своих протоплазматических ци-
линдрах, стали поверхностными симбион-
тами протоэукариот. Эти спирохеты инте-
грировались с клетками будущих проток-
тистов и образовали ундулиподии, цен-
триоли, кинетохоры и другие микротубу-
лярные продукты генома бывших сим-
бионтов.
Спирохеты, существующие в ассоциа-
ции с другими организмами, часто с про-
тистами, и с клетками тканей животных,
давно известны. Например, семейство, к ко-
торому принадлежат Dienympha и Pyrsonym-
pha (Dienymphida), было описано как «вытя-
нутые жгутиконосцы, у которых 4 или
8 передних жгутиков прилегают к телу
и спирально обвиваются вокруг него, сво-
бодные на дистальных концах. Часто клет-
ка бывает усеяна спирохетами, которых
принимают за дополнительные жгутики;
семейство было ошибочно отнесено к от-
ряду Hypermastigina» [175]. Это относится
и к другому семейству простей-
ших - Devescovinida: «Спирохеты, обитаю-
щие совместно с этими организмами, ча-
сто встречаются в ассоциации с их кле-
точными мембранами и при первоначаль-
ном описании некоторых родов были
ошибочно приняты за добавочные жгути-
ки» [175]. Изучение комплексов спирохе-
СПИРОХЕТЫ И УНДУЛИПОДИИ
247
Таблица 10.1. «Экзогенная» и «эндогенная» теории происхождения микротубулярных систем
Экзогенная (симбиотическая) теория Эндогенная теория (теория прямой филиации)
Появление ундулиподий как эктосимбиотиче- ских спирохет предшествовало эволюции микротубулярных систем у эукариот Микротрубочки и центры их организации по- явились раньше ундулиподий, которые воз- никли эндогенным путем - возможно, из ядер- ной мембраны
Микротрубочки будут обнаружены у спирохет; возможно, будет найдена спирохета с внутри- клеточными трубочками, организованными по типу 9 + 2 Микротрубочки будут обнаружены у прокариот, близких к предкам эукариот. Нет оснований ожидать их наличия у спирохет
ЦМ реплицируются; «репродукция» центриолей, ЦМ-это системы для самосборки структур из
кинетосом, кинетохоров и т. п. сопровождается белков
репликацией РНК
Все мейотические организмы происходят от
предков, обладавших ундулиподиями; у них
могут быть обнаружены органеллы типа
9 + 2 или может быть индуцировано их раз-
витие
Некоторые мейотические организмы первично
неподвижны (красные водоросли, высшие гри-
бы); у них принципиально невозможно инду-
цировать развитие органелл типа 9 + 2
ены, кодирующие тубулин и другие микро-
тубулярные белки, гомологичны генам, коди-
рующим сходные белки у определенных
спирохет
Гены, кодирующие тубулин и сопутствующие
белки, находятся в ядре, где они и возникли.
Такие гены могут оказаться только у фото-
синтезирующих прокариот, родственных пря-
мым предкам эукариот
Ундулиподии имеют монофилетическое проис-
хождение; митоз и мейоз полифилетичны и
возникли в нескольких линиях ундулиподиаль-
иых простейших
Митоз монофилетичен; ундулиподии возникли
у митотических организмов и были закрепле-
ны отбором благодаря преимуществу, которое
дает подвижность
?жз возникнув, способность к митозу никогда
зе утрачивалась; флагелляты и амебоиды, у
которых нет митоза,-примитивные формы.
Первые эукариоты, обладавшие микротрубоч-
ками, были гетеротрофами и имели ундули-
зодии
Митоз был утрачен в нескольких линиях эво-
люции ундулиподиальных простейших. Пер-
вые эукариоты, обладавшие микротрубочка-
ми, были неподвижными фотоавтотрофами
та-хозяин возобновилось с использова-
жем современных методов лишь совсем
яелавно. В этой главе будут рассмотрены
следующие вопросы: Что такое спиро-
хеты? Могут ли некоторые из них, в част-
ности пиллотины, быть родственниками
предков ундулиподий? Каковы свидетель-
ства в пользу происхождения ундулиподий
от спирохет и возникновения микротрубо-
чек у прокариот? Как связать результаты
изучения нуклеиновой кислоты кинетосом
с симбиотической теорией происхождения
ундулиподий? И наконец, как можно было
бы проверить эту теорию?
248
ГЛАВА 10
Что такое спирохеты?
Я наблюдал также род анималькул, похожих по форме на речных угрей:
их было чрезвычайно много, и они были столь малы, что я думаю, если сложить
500 или 600 их конец к концу, то они не достигнут длины взрослой угрицы,
вроде тех, что встречаются в уксусе. Движутся они очень проворно, изгибаются,
как змеи, и плавают так же быстро, как щуки в воде.
А. ван Левенгук, 1681 [540]
Соответственно, я взял (с помощью увеличивающего зеркала) вещество, на-
копившееся на зубах и между ними глубже у меня во рту, куда не достигало
тепло кофе. Это вещество я смешал с небольшим количеством слюны изо рта
(без пузырьков воздуха)...; тогда я увидел с изумлением, какого никогда до того не
испытывал, огромнейшее число крошечных анималькул... все вещество представля-
лось живым и движущимся... тела их сильно и быстро изгибались, они плавали
взад и вперед, часто вращаясь при этом вокруг своей длинной оси, так что
сколько бы я на них ни смотрел, я не уставал изумляться и восхищаться.
А. ван Левенгук, 1692 [540]
Спирохеты-это тонкие, гибкие и очень
подвижные одноклеточные бактерии спи-
ральной формы, делящиеся поперечно. Ле-
венгук первым увидел эти микробы в про-
бе собственных «таких жидких экскремен-
тов» и в слюне. На рисунках, присланных
им в 1681 г. Лондонскому королевскому
обществу, ясно видны спирохетоподобные
формы. Позднее спирохет изучали Добелл
[235], Кёрби [480] и многие другие иссле-
дователи. Они были идентифицированы
как возбудители фрамбезии, возвратного
тифа и сифилиса [118]. Все они состоят из
протоплазматического цилиндра, окружен-
ного плазматической мембраной и сложно
устроенной грам-отрицательной стенкой.
В отличие от жгутиков других бактерий
жгутики спирохет лежат в периплазматиче-
ском пространстве и поэтому окружены
внешними слоями клеточной стенки, так
называемым чехлом (рис. 10.1 и 10.2). Спи-
рохеты-хемогетеротрофы. Они не обра-
зуют спор, хотя могут выдерживать замо-
раживание (Smibert, в [118]). Часто они
растут в длину, не образуя поперечных сте-
нок. Поэтому диаметр является для них
более постоянным, надежным и штаммо-
специфическим признаком, чем длина.
В последнем издании «Определителя Бер-
ги» спирохеты разделены на пять родов
[И8]:
Spirochaeta - свободноживущие морские или
пресноводные микробы диаметром от 0,25 до
0,75 мкм. Имеют небольшое число жгутиков,
расположенных по типу 1-2-1 или 2-4-2 .
Cristispira- комменсалы моллюсков. Мно-
жество жгутиков (до нескольких сотен) обра-
зуют пучок-кристу. Клетки крупные, диаме-
тром от 0,5 до 3,0 мкм. Обычно обитают
в жестком студенистом кристаллическом
стебельке - органе пищеварительной системы
устриц и других двустворчатых моллюсков.
Treponema -тонкие спирохеты диаметром
от 0,05 до 0,17 мкм. Анаэробы, живут внутри
других организмов; патогены или симбионты
многих млекопитающих. Некоторые виды вы-
зывают фрамбезию и сифилис. Расположение
жгутиков обычно сходно с таковым у рода
Spirochaeta, от которого они, вероятно, про-
изошли.
Borrelia- патогены или симбионты млекопи-
тающих; переносчиками часто служат членисто-
ногие. Боррелии, переносимые клещами, возбу-
дители возвратного тифа. Диаметр от 0,2 до
0,5 мкм. Жгутиков немного, не более восьми.
Leptospira -единственный известный строго
аэробный род спирохет. Диаметр около 0,1 мкм.
Могут быть патогенными, часто встречаются
у млекопитающих. Имеют загнутые концы и не-
многочисленные жгутики.
1 Эти цифры относятся к трем последова-
тельным поперечным сечениям: конец, середина,
конец. Места прикрепления жгутиков у спиро-
хет-концы клетки. Спирохеты, имеющие на ка-
ждом конце по одному жгутику, заходящему за
середину клетки, принадлежат к типу 1-2-1; те,
у которых на каждом конце по 2 жгутика, захо-
дящих за середину, принадлежат к типу 2-4-2.
СПИРОХЕТЫ И УНДУЛИПОДИИ
249
Амплитуда
Желобок
Протоплазматический
Гревни
Нуклеоид
Рибосомы
Жгутики
~18нм
Чехол
Клеточная мембрана
Экстраплазматичесний
слой чехла
Микротрувочни
~21 НМ
Аксиальная нить
~10нм
Двуслойная наружная
мембрана
периплазматическии
слой чехла)
Рис. 10.1. Схема строения крупной спирохеты (Pillotina). Дальнейшие детали см. [620,
954].
Протозоологи, изучавшие микрофлору
заднего отдела кишечника термитов, давно
уже наблюдали крупных спирохет [235,
251, 544]. Их относили ко многим родам.
Электронная микроскопия и повторные ис-
следования прижизненного материала при-
вели к пересмотру представлений о род-
ственных отношениях этих организмов
другими спирохетами.
Если принять систему пяти царств,
предложенную Уиттэйкером, то спирохеты
заслуживают статуса типа в царстве
Мопега. По нашей классификации (см.
Приложение) роды спирохет распадаются
на три класса: свободноживущие анаэробы
Spirochaetes), облигатные аэробы
Leptospires) и крупные анаэробные сим-
бионты (Cristispires). Недавно было созда-
но несколько новых родов для необычных
представителей этой последней группы:
Pillotina [418], Diplocalyx [316], Hollandina
[954] и Clevelandina [620]. Все эти спиро-
хеты, обитающие как симбионты в задней
кишке термитов, принадлежат к семейству
Pillotaceae [418]; их объединяют под на-
званием пиллотин. Поразительно то, что
в протоплазматическом цилиндре у неко-
торых из них содержатся продольно рас-
положенные микротрубочки диаметром
около 21 нм [612]. Пока неизвестно, есть
ли виды, имеющие микротрубочки, в дру-
гом семействе-Cristispiraceae. Наличие ми-
кротрубочек, распространение и поведение
делают пиллотин кандидатами на роль
250
ГЛАВА 10
Рис. 10.2. Крупные симбиотические спирохеты терми-
тов. Электронные микрофотографии; масштабный от-
резок равен 0,5 мкм. Поперечные (слева) и продольные
(справа) разрезы. А, Б. Pillotina; В, Г Hollandina; Д, Е.
Diplocalyx. (А, Б и Г-[David Chase]; В-[L.P. То];
E-[I. D. Charagozlou].)
родственников ундулиподий-если вообще
есть какая-то связь между спирохетами
и ундулиподиями.
Спирохета Pillotina calotermitidis, ради
которой и был создан род, описана Хол-
ландом и Гарагозлу в 1967 г. [418]. Этот
организм был найден в больших количе-
ствах в задней кишке необычного термита
Calotermes ргаесох (по современной класси-
фикации Proelectrotermes ргаесох), встре-
чающегося только в лесистой западной ча-
сти острова Мадейра. Таким образом, этот
организм в течение многих лет был недо-
ступен для исследования.
Изучая микротубулярный аксостиль по-
лимастиготы Pyrsonympha- симбионта зад-
ней кишки Reticulitermes flavipes, обычного
подземного термита северо-востока
США,-Бладгуд [85] обнаружил крупных
спирохет. Рассматривая превосходные ми-
крофотографии Бладгуда, я заметила, что
некоторые из сфотографированных спиро-
хет, выделенных из R. flavipes, чрезвычайно
похожи на спирохету Pillotina calotermitidis
СПИРОХЕТЫ И УНДУЛИПОДИИ
251
с Мадейры, описанную Холландом и Гара-
гозлу, если не идентичны ей. Это открытие
стимулировало систематические поиски,
в результате которых спирохеты-пилло-
тины были найдены у ряда североамери-
канских и европейских термитов [954, 955].
У более чем 30 изученных видов терми-
тов, обитающих в сухой или влажной
древесине, а также под землей, спирохеты-
пиллотины оказались важным компонен-
том микрофлоры задней кишки. Они были
обнаружены у 21 вида термитов из сухой
древесины (калотермитид) и у 5 видов под-
земных ринотермитид [954]. Таким обра-
зом, остается исследовать еще 323 вида
древесных и 180 видов подземных терми-
тов из самых различных районов мира!
Хотя пиллотины столь же обычны для
питающегося древесиной таракана
Cryptocercus punctulatus \ их не оказалось
совсем или оказалось очень мало у терми-
тов с разнообразным рационом, включаю-
щим гнилую древесину (например, годо-
термитид и назутитермитид). Пиллотины,
тднако, всегда входят в состав обильной
разнообразной симбиотической микро-
флоры тех насекомых, рацион которых
зграничивается древесиной. Микробные
сообщества задней кишки у этих насе-
комых обычно включают наряду с пилло-
тинами протистов-гипермастигот (особен-
но трихонимфид), протистов-полимастигот
главным образом девесковинид) и часто
также несколько типов прокариот -азот-
фиксирующие бактерии, крупные подвиж-
ные палочки с перитрихальными жгутика-
ми. грам-положительные кокки, длинные
нитчатые неподвижные спорообразующие
оактерии рода Arthromitus и множество
трепонемоподобных спирохет [104, 951,
^54, 955].
Представителей семейства Pillotaceae
можно узнать в живых термитах по
крупным размерам и по тому, как они пла-
вают, изгибаясь; для идентификации видов
1 Тонкая структура большой неидентифи-
сзфованной спирохеты из задней кишки крупно-
о североамериканского колониального дре-
к? яд но го таракана Cryptocercus punctulatus [362]
соответствует новому описанию рода Hollan-
2ina [954].
необходима, однако, электронная микро-
скопия. Пиллотины, вероятно, не покидали
своих экосистем в кишечнике насекомых
более 200 млн. лет. Так как вне организма
хозяина, если не принять специальных
предосторожностей, они погибают за не-
сколько часов, кажется вероятным, что они
эволюционировали и специализирова-
лись в составе симбиотической ассоциации
с термитами-хозяевами.
Как мастотермитид, так и калотерми-
тид на основании энтомологических дан-
ных считают примитивными формами, т. е.
близкими родственниками питающихся
древесиной тараканов Cryptocercidae из от-
ряда Blattaria, от которых, как полагают,
произошел отряд термитов, Isoptera. Все
питающиеся деревом личинки, нимфы и су-
бимаго калотермитид всегда буквально на-
биты громадными популяциями крупных
спирохет. Солдаты и крылатые особи тоже
их содержат, но у них спирохет и проти-
стов часто бывает меньше [955]. К сожа-
лению, нет никаких данных о генетике или
метаболизме этих микробов; поэтому их
роды приходится различать по морфологи-
ческим признакам: длине, диаметру, ам-
плитуде движений, степени зазубренности
чехла и числу и расположению жгутиков.
Большинство термитов одной популяции
содержит одни и те же роды спирохет
в сходных количествах, но отмечены се-
зонные различия, а также различия между
термитами из разных географических рай-
онов. Опубликовано наше предварительное
сообщение о распространении спирохет
у термитов [954]. Они встречаются в боль-
шом числе между ундулиподиями обычных
крупных гипермастигот, таких как
Trichonympha agilis (Leidy). Они постоянно
«снуют» среди ундулиподий и даже про-
никают внутрь клетки протиста-хозяина
[612] (рис. 10.3).
Двигаясь наподобие штопора, пилло-
тины могут проникать в пучки трихомов
Arthromitus, так же как они проникают
в пучки ундулиподий жгутиковых. Крайний
пример такого явления наблюдали у тер-
мита из Аликанте (Испания), в котором
было очень мало протистов, но много пуч-
ков Arthromitus. Спирохеты проникали
в эти пучки в продольном направлении,
252
ГЛАВА 10
Рис. 10.3. Спирохеты Pillotina (р), живущие в цитоплазме неидентифицированного про-
тиста из задней кишки термита Reticulitermes hesperus, питающегося сухой древесиной
(из Сан-Диего, Калифорния). Пиллотины также свободно плавают в просвете кишки.
Природа ассоциации между спирохетами и протистами неизвестна, хотя такую ассо-
циацию часто можно наблюдать в живом материале, х 12 000. n-ядро жгутиконосца;
и - ундулиподия жгутиконосца. [David Chase.]
двигаясь сначала вперед, а затем назад, но
оставаясь внутри пучков. В нескольких ми-
крометрах от этих пучков было очень
мало «свободных» пиллотин. Факторы,
влияющие на распределение пиллотин в
кишке насекомого, выявить пока не удает-
ся, так как их невозможно выращивать
в культуре. Однако можно добиться обога-
СПИРОХЕТЫ И УНДУЛИПОДИИ
253
щения кишечника термитов пиллотинами,
выдерживая насекомых без пищи при вы-
сокой температуре [365].
До сих пор все спирохеты, у которых
имеются микротрубочки, были выделены
из кишечника термитов и принадлежат
к семейству Pillotaceae. Конечно, эти тру-
бочки видны не на всех тонких срезах, но
то же относится и к жгутикам. Частота
встречаемости микротрубочек в разных ро-
дах семейства Pillotaceae неизвестна. Воз-
можно, однако, что тубулин содержат
и другие свободноживущие спирохеты.
В анаэробных участках микробных матов
из лагуны Фигероа в Нижней Калифорнии
были найдены спирохеты диаметром
около 0,4 мкм [424]. Имеются весьма
предварительные данные о том, что эти
спирохеты тоже реагируют с флуоресци-
рующими антителами к тубулину мозга.
В микробных матах, в отличие от кишеч-
ника термитов, эукариоты отсутствуют;
поэтому присутствие тубулина вряд ли мо-
жет быть обусловлено примесью эукариот.
Эти спирохеты выращены в культуре; они
близки к Spirochaeta littoralis как по нук-
леотидному составу ДНК (С 4-С = 50%;
М. Mandel, личное сообщение), так и по
метаболическим особенностям (S. Francis,
личное сообщение). Проводятся экспери-
менты с целью выяснить, обусловлена ли
их реакция с мечеными антителами при-
сутствием тубулина и микротрубочек, го-
мологичных микротрубочкам эукариот.
Поведение спирохет: переход от свободного
существования к симбиотическому
Важный вопрос... состоит в том, всегда ли жгутики, реснички, цирры, мем-
бра неллы и другие сходные структуры пропорциональны по величине соответствую-
щим простейшим, растут ли они вместе с клеткой или имеют одинаковые раз-
меры у нормальных животных, крошечных регенерантов и гигантских форм? Принято
считать, что величина ресничек и цирр всегда пропорциональна размерам клетки...
В действительности же есть достаточно данных о том, что ресничные органеллы
каждого типа имеют постоянную величину, хотя их число варьирует. Так, например,
у самых крупных инфузорий-трубачей (около 750 мкм, почти миллиметр) и у самых
мелких регенерировавших фрагментов (около 7 мкм) длина и ширина мембранелл,
состоящих из рядов ресничек [см. рис. 10.4], и соответственно длина состоящего
из мембранелл перистома, расположенного около ротового отверстия одноклеточ-
ного организма, варьируют в очень
В кишечнике термитов встречаются
з свободно плавающие спирохеты-сим-
бионты, и сильно модифицированные фор-
чы. прикрепленные к специфическим про-
тестам. Можно видеть и переходные ста-
дии между этими двумя состояниями.
Феномен «локомоторного» симбиоза,
когда спирохеты присоединяются к поверх-
ности хозяина, полностью или частично
эбеспечивая его движение, описан у про-
тжта-полимастиготы Mixotricha paradoxa,
кишечного симбионта Mastotermes
birwinensis (см. рис. 7.8) [161]. Такие под-
мятые симбиотические ассоциации обы-
чны. и их существование можно было бы
широких пределах.
В. Тартар, 1961 [929]
даже предсказать, исходя из некоторых
особенностей каждого партнера [612, 954].
У всех эукариот на диаметр тубули-
новых микротрубочек наложено, по-види-
мому, строгое ограничение: эта величина
всегда лежит в пределах от 15 до 30 нм
[124, 619]. Толщина ундулиподий типа 9 +
4- 2, состоящих из микротрубочек, еще бо-
лее постоянна (0,2 мкм). В некоторых слу-
чаях (например, тип Zoomastigina, класс
Parabasalia) организация клетки и меха-
низм деления накладывают ограничение на
число ундулиподий у протистов: не более
чем около 4 на одно ядро. Если подвиж-
ность необходима для выживания в кишеч-
нике термита, то у таких протистов выбор
254
ГЛАВА 10
W9WWWW
Контроль Сбрасывание 0i2345rVq
& мемвранелл °
5
4
6
7
8
6U мкм
СПИРОХЕТЫ И УНДУЛИПОДИИ
255
решений невелик. Чтобы не оказаться вы-
брошенными при дефекации, эти полима-
стиготы могут сохранять малые размеры
и передвигаться с помощью своих несколь-
ких обычных ундулиподий, как это делает
Tricercomitus. Вместо этого можно было
бы увеличить число ундулиподий за счет
увеличения числа ядер, как у многих поли-
монад [158]. Однако многоядерное состоя-
ние создает проблему распределения генов,
делая невозможным прохождение нор-
мального диплоидно-гаплоидного жизнен-
ного цикла. Таким образом, для сочетания
крупных размеров и подвижности у поли-
мастигот в богатой микробами среде вы-
работалась способность вступать в локо-
моторные симбиозы; такие симбиотиче-
ские ассоциации возникли конвергентно
и в ряде случаев весьма эффективны. Осо-
бенно поразительнр это явление у девеско-
винид, которые могут вступать в локомо-
торный симбиоз не только со спирохетами,
но и с бактериями, обладающими перитри-
хальными жгутиками (см. рис. 7.10) [928].
В задней кишке термитов, где плот-
ность популяции бактерий (включая спиро-
хет) может превышать 1011 на 1 мм* 3
жидкого содержимого, легко наблюдать
преадаптации к регулярному симбиозу.
Так, например, спирохеты могут образовы-
вать живое покрытие на поверхности уми-
рающих трихомонад или девесковинид.
Спирохеты выстраиваются правильными
рядами, непрочно присоединяясь к проте-
сту; через некоторое время биения спиро-
хет в каждом ряду становятся синхронны-
ми, хотя фазы колебаний в разных рядах
не совпадают (неопубликованный фильм,
снятый L. Margulis и J.G. Schaadt, 1977;
[612]). После гибели хозяина число прикре-
пленных к нему спирохет резко возрастает,
так что трупы полностью покрываются
пучками синхронно ундулирующих спиро-
хет. При малом увеличении эти скопления
координированно движущихся спирохет
напоминают картины дифракции (рис.
10.5). Такие «пакеты» спирохет прикре-
пляются не только к простейшим, но и
к кусочкам дерева, жировым шарикам
и другим частицам детрита. Временный ха-
рактер подобных ассоциаций очевиден, так
как периодически отдельные особи поки-
дают пучок и уплывают. Иногда, по-види-
мому, спирохеты соединяются только друг
с другом, образуя пучок, движущийся
в кишке термита за счет более или менее
синхронных биений. Спирохеты, по-види-
мому, имеют «липкую» поверхность: часто
они в течение некоторого времени транс-
портируют на себе других бактерий. Пучки
Рис. 10.4. Оральные мембранеллы разноресничной инфузории Stentor coeruleus.
А. Мембранеллы - упорядоченные ряды ресничек - образуют у стентора оральный по-
ясок и служат для направления частиц пищи в глотку этой гигантской одиночной клет-
ки. Б. При обработке определенными веществами, например сахарозой, глицерином,
мочевиной или морской водой, стенторы синхронно отбрасывают свои оральные мем-
бранеллы. После переноса на свежую среду начинается синхронная регенерация
оральных кинетосом и аксонем - около 20 000 в каждой клетке. Морфогенез орального
пояска при 22°С занимает около 8 ч. Регенерирующий поясок всегда появляется в зоне,
где широкие кортикальные пигментированные полосы сходятся с узкими. Числа-вре-
мя после утраты мембранелл (в часах) [929]. В. Живой стентор. Видны узелки макро-
нуклеуса и поясок мембранелл (МВ). Фазово-контрастная микрофотография. Г. Реге-
нерирующий оральный поясок. Редкие реснички слева-это реснички тела, которые
з данном опыте не отбрасываются и не регенерируют. [J. Paulin, Univ, of Georgia.]
Д. Изолированный поясок мембранелл, сброшенный стентором. Пояски мембранелл
и их кинетосомы можно собирать для цитологических и биохимических исследований.
Если для индукции сбрасывания пояска используется 12,5%-ный раствор сахарозы, рес-
нички остаются прикрепленными к пояску. Фазово-контрастная микрофотография.
ГС. Van Wie.] Е. Сброшенный поясок мембранелл. 2%-ный раствор глюкозы вызывает
сбрасывание пояска, но при этом от него отделяются аксонемы ресничек. Фазово-кон-
трастная микрофотография. [С. Van Wie.] Ж. Зона контраста полос: справа широкие
полосы, слева узкие. Примерно через полтора часа после того, как стентор сбросил
вновь образовавшиеся реснички, в зоне контраста можно видеть зачаток пояска мем-
бранелл (в белой рамке). Такой зачаток виден также на рис. Б как наклонная белая ли-
ния слева от зоны контраста. Микрофотография получена с помощью сканирующего
электронного микроскопа. [J. Paulin.]
256
ГЛАВА 10
Рис. 10.5. Неприкрепленные спирохеты из Pterotermes occidentis. Даже не будучи при-
креплены к протисту-хозяину, соседние спирохеты-пиллотины ундулируют синхрон-
но-вероятно, исключительно благодаря их физическому сближению (см. [954]). Фазо-
во-контрастная микрофотография по Nomarski; масштабный отрезок равен 5 мкм.
пиллотин и более мелких спирохет со-
здают достаточную силу, чтобы вращать
близлежащих протистов. Склонность групп
спирохет и других подвижных клеток унду-
лировать синхронно наблюдали и раньше,
и ее можно объяснить законами гидро-
динамики [103,555]. Таким образом, пилло-
тины преадаптированы к симбиозу.
Локомоторные симбиозы
Клетку Mixotricha движут не собственные жгутики, а прикрепленные к ней
спирохеты.
А. Гримстоун, Л. Кливлэнд, 1964 [363]
Многие симбиотические спирохеты в
кишечнике термитов постоянно прикре-
плены к клеткам более крупных микробов,
часто в виде пучков, но иногда образуя
каемки, покрывающие всю поверхность хо-
зяина. Электронная микроскопия выявляет
несколько типов специфических мест при-
крепления мелких спирохет (рис. 10.6) [86,
877-879]. Некоторые прикрепленные спи-
рохеты поляризованы в том смысле, что
один из концов у них сильно дифференци-
рован. В цитоплазме некоторых хозяев
дифференцируются соответствующие «при-
чалы» [612, 619]. Иногда спирохеты имеют
уплощенный проксимальный конец, несу-
щий фибриллярный аппарат прикрепления
к хозяину. Так как сами спирохеты, их хо-
зяева и места прикрепления различны,
весьма вероятно, что эти ассоциации воз-
никли полифилетически.
Увеличивают ли прикрепленные спиро-
хеты подвижность их жгутиковых хозяев
Прямое наблюдение ясно показывает, что
очень крупную полимастиготу Mixotricha
par ado ха продвигают вперед не четыре
собственные ундулиподии, а синхронное
биение полумиллиона прикрепленных спи-
рохет [161]. На микрофотографиях видна
упорядоченная структура мест связи межд\
выступающими участками кортекса хозя-
СПИРОХЕТЫ И УНДУЛИПОДИИ
257
Рис. 10.6. Модификации спирохет для прикрепления к другим клеткам. А. Спирохета,
видоизмененная для прикрепления (at) к Pyrsonympha из Reticulitermes flavipes. х 70 500.
Б. Прикрепительная органелла (г) внедряется глубоко в цитоплазму хозяина. При жиз-
ни организмы прикреплены так, как показано на рис. 10.7, Б. ах-аксостиль хозяина.
В. Конец (t) неидентифицированной спирохеты из Reticulitermes hesperus, видоизме-
ненный для прикрепления, f-жгутик. Негативный контраст, х 96000. (А и Б-Н. Smith
и H.J. Arnott]; В-[David Chase.].)
ина. спирохетами и другими эктосим-
бионтами-бактериями, которые, возмож-
но. «заякоривают» спирохет или предоста-
вляют питательные вещества для получе-
ния энергии (рис. 7.8).
Двигательную эффективность ундули-
подии данной длины лимитирует длина
глетки; организмы, передвигающиеся при
помощи одной или очень малого числа ун-
дулиподий, имеют длину не более 50 мкм,
обычно значительно меньше [555]. Если
сравнить длину четырех или меньшего чис-
ла ундулиподий полимастиготы с длиной
всей клетки, станет ясно, что за подвиж-
ность комплекса ответственны пучки по-
верхностных спирохет. При длине проте-
ста больше 100 мкм вряд ли можно сом-
неваться, что спирохеты служат двига-
258
ГЛАВА 10
тельными органеллами; известно много
примеров, аналогичных Mixotricha. Как
показывают 16-миллиметровые фильмы,
снятые в 1956 г. Кливлэндом [158], спи-
ральные движения прикрепленных спиро-
хет точно коррелируют с продвижением
Mixotricha вперед.
Кёрби [479], описывая в 1936 г. деве-
сковиниду Pseudodevescovina uniflagellata Su-
therland из австралийского термита
Kalotermes (Neotermes) insularis, фактически
описал локомоторный симбиоз. Он отме-
тил, что это простейшее в норме покрыто
«...плотным слоем коротких спирохет... Они
в основном весьма однородны по длине, кото-
рая составляет 8-10 микрон... Часто этот слой
бывает особенно плотным на бугорках. Движе-
ние спирохет чрезвычайно ^быстрое, но при не-
благоприятных условиях замедляется, причем
активность жгутиковых тоже снижается... При-
крепленные концы спирохет, по-видимому, по-
гружены в тело жгутикового, хотя и очень не-
глубоко. При окрашивании железным гематок-
силином по Шаудину погруженная часть
[рис. 31 у Кёрби] кажется более плотной
и окрашивается интенсивно, в то время как сво-
бодная часть микроорганизма остается бледной.
Таким образом, при этом способе окраски до-
вольно равномерный слой спирохет почти не
отличается от слоя ресничек с базальными
гранулами».
Средние размеры этого протиста составля-
ли 73 х 41 мкм. Ундулиподии, одна из ко-
торых направлена назад, а три-вперед,
имеют длину около 30 мкм, т. е. не более
половины полной длины тела. Напра-
вленные вперед ундулиподии действуют
как хлысты и не обеспечивают продви-
жения вперед. Организм передвигается
чрезвычайно активно, и Кёрби делает вы-
вод, что за это движение ответственна
единственная ундулиподия, направленная
назад. С гидродинамической точки зрения
это крайне мало вероятно [555]. Скорее
всего Кёрби описал локомоторный сим-
биоз между спирохетами и девесковини-
дой. То, Шадт и я наблюдали и в неко-
торых случаях снимали на кинопленку
аналогичные комплексы у трех других тер-
митов; к сожалению, ни спирохеты, ни
протисты не были здесь идентифициро-
ваны. Исследовались термиты Kalotermes
schwartzi из Флориды (см. рис. 7.9)
и Pterotermes occidentis и Marginitermes
hubbardi из Аризоны. Локомоторные сим-
биозы, описанные Гримстоуном и Кли-
влэндом [363], нельзя больше считать
странным и исключительным феноменом.
Как возникли эти симбиозы? В кишеч-
нике термитов спирохеты часто собирают-
ся вокруг чувствительного поглощающего
древесину конца клетки протиста. Нахо-
дясь в этом богатом пищей месте, спиро-
хеты имеют шанс воспользоваться отхода-
ми. Поглощающие древесину участки мно-
гих протистов из кишечника термитов
плотно покрыты временно присоединив-
шимися подвижными спирохетами; причем
в большинстве случаев здесь нет признаков
локомоторного симбиоза. Так как контакт
задней области протиста с частицами дре-
весины тотчас приводит к специфической
реакции поглощения [529], подвижные спи-
рохеты, возможно, вначале удерживались
протестами потому, что их движения спо-
собствовали поглощению древесины. Со
временем многие ассоциации спирохет
с протестами стали упорядоченными и
в конце концов-постоянными. Синхрон-
ность движения спирохет в этих комплек-
сах не представляет загадки. Показано
[555, 589], что при достаточно тесном
сближении подвижных микробов или спер-
миев между ними возникают механические
взаимодействия, вынуждающие синхронное
поведение.
Спирохеты вообще проявляют тенден-
цию прикрепляться ко многим поверхно-
стям и образовывать ассоциации [612].
Описаны сложные формы прикрепления
спирохет к пирсонимфцдам [86, 878, 879].
И. Б. Райков [758] описал присоединение
спирохет к анаэробным комплексам мор-
ских инфузорий с бактериями. Хорошо
известно, что трепонемы прикрепляются
к эпителию кишечника и семенных каналь-
цев млекопитающих. Спирохеты «прили-
пают» к гипермастиготам, полимастиго-
там, разнообразным частицам детрита,
стенкам кишечника термитов, другим бак-
териям и друг к другу. В микробных матах
живые спирохеты встречаются в ассоциа-
ции с нитчатыми цианобактериями. Часто
можно видеть подвижные трепонемопо-
добные формы, присоединенные к мезоглее
пресноводных гидр. Их присутствие было
подтверждено с помощью электронной ми-
?дс. 10.7. Сравнение места прикрепления спирохеты с местами прикрепления жа-
'ерных ресничек двустворчатого моллюска. А. Жаберная ресничка моллюска.
62 000. г-корневая фибрилла; k-кинетосома; ах-аксостиль. Б. Прикрепление спи-
те хе ты к Pyrsonympha-подобному простейшему из задней кишки калифорнийского под-
емного термита Reticulitermes hesperus. х 52 000. к-структура, сходная с корневой
Т1ёсриллой; s - протоплазматический цилиндр спирохеты; at-место прикрепления.
К Ряд жаберных ресничек моллюска, х 35 000. ах-аксостиль; г-структура, сходная
. 1?рневой фибриллой. (А и В-[Fred Warner, Univ, of Syracuse]; Б-[David Chase].)
260
ГЛАВА 10
кроскопии [431]. По-видимому, потреб-
ность спирохет в жирных кислотах и иные
сложные пищевые потребности преадапти-
ровали некоторых из них к ассоциации
с другими клетками. Каким образом спи-
рохеты и их хозяева обеспечивают сохра-
нение ассоциации при клеточном делении?
Некоторые спирохеты при своем попереч-
ном делении остаются прикрепленными.
Несомненно, часть из них реплицирует или
по крайней мере редифференцирует свои
участки прикрепления. Это можно считать
аналогичным, например, поведению кине-
тосом при развитии жаберных ресничек
у двустворчатых моллюсков; как реснички,
так и спирохеты имеют характерные фи-
бриллярные прикрепляющие системы
(рис. 10.7).
Интересно сравнить движения спирохет
и ундулиподий. Пиллотин можно наблю-
дать даже при сравнительно малых увели-
чениях. Многие из них закручены, так что
их движение можно видеть непосредствен-
но; в других случаях они имеют «липкую»
поверхность, и метками при наблюдении
движения могут служить прилипшие бакте-
рии и частицы детрита (аналогичным обра-
зом X. Берг [72] использовал полистиро-
ловые шарики для демонстрации вращения
бактериальных жгутиков). Свободно пла-
вающие спирохеты продвигаются вперед,
вращаясь, причем направление вращения
может быть любым. По телу этих активно
плавающих организмов распространяется
спиральная волна. Она возникает около
каждого из концов, что, вероятно, обусло-
влено субапикальным прикреплением пери-
плазматических жгутиков.
Напротив, ундулиподии в большинстве
случаев совершают рабочий ход в плоско-
сти, а возвратный ход-вне этой плоскости
[112, 871]. Но это не всегда так: описано
спиральное движение ундулиподий у опа-
линид, паразитирующих у амфибий [145],
хвостов отмирающих зооспор гифохитрид
и ресничек на теле погибающих инфузорий
Stentor coeruleus. Спиральная волна наблю-
дается при перемещении вперед под-
вижных (хотя и имеющих в поперечном се-
чении структуру типа 9 + 0) хвостов спер-
матозоидов у грегарин; эти представители
типа Apicomplexa царства Protoctista пара-
зитируют у беспозвоночных [225]. Частота
биений большинства ундулиподий (при-
мерно от 10 до 20 Гц), продольное распро-
странение волны, размеры и морфология,
тенденция к синхронизации, потенциально
спиральный тип волны и структура мест
прикрепления (с фибриллярными «кореш-
ками»)-все это указывает на возможную
аналогию между симбиотическими спиро-
хетами и «настоящими» ундулиподиями.
Движение бактерий основано, по-види-
мому, на прямом преобразовании электро-
движущей силы в механическую работу
в месте соединения клеточной мембраны
с базальным диском жгутика [72, 654].
С другой стороны, движение ундулиподий
основано на генерации механической энер-
гии за счет гидролиза АТР. В этом процес-
се участвуют по крайней мере два белка-
тубулин и динеин, взаимодействие ко-
торых, активируемое магнием и связанное
с гидролизом АТР, обусловливает сколь-
жение микротрубочек друг относительно
друга [804]. Для выяснения механизма
движейия спирохет, особенно крупных,
сложных пиллотин, нужна еще большая
работа. Не известно, например, зависит ли
движение пиллотин от синтеза АТР и есть
ли среди ферментов пиллотин гомологи
АТРазы динеина. Если ундулиподии дей-
ствительно произошли от пиллотинопо-
добных спирохет, то должны существовать
гомологи в первичной структуре белков
и РНК этих спирохет и ЦМ микротубу-
лярных систем митотических эукариот.
Кроме того, гомологичными должны быть
механизмы генерации спиральных волн.
Если же микротубулярные системы возни-
кли у самих эукариот путем компартмен-
тализации, то нет никаких оснований ожи-
дать гомологий между геномами и систе-
мами движения этих необычных спирохет
и ундулиподий.
СПИРОХЕТЫ И УНДУЛИПОДИИ
261
Микротрубочки у прокариот?
При абсолютном симбиозе партнеры полностью приспособлены друг к другу,
что делает затруднительным установление их истинной природы.
Дж. Уоллин, 1927 [995]
Данные о наличии микротрубочек
у спирохет-пиллотин получены тремя раз-
ными методами. Во-первых, это прямое
электронно-микроскопическое наблюдение
фиксированных глутаральдегидом микро-
трубочек у Pillotina, Diplocalyx и род-
ственных видов спирохет [316, 418, 619,
953]. Во втором методе использовались
флуоресцентные антитела к различным ту-
булинам эукариот. Эти антитела прямо до-
бавляли к разнообразным препаратам спи-
рохет и наблюдали их распределение
с помощью флуоресцентного микроскопа.
Третий метод состоит в выделении из спи-
рохет растворимых белков, мигрирующих
в полиакриламидном геле вместе с тубули-
ном из мозга млекопитающих. Предпола-
гаемый тубулиноподобный белок был вы-
делен из содержимого кишечника терми-
тов, из фракций, где находились только
прокариоты, главным образом те крупные
спирохеты, у которых наблюдались микро-
трубочки.
На рис. 10.2 приведены электронные
микрофотографии представителей трех ро-
дов спирохет из кишечника термитов.
В норме эти спирохеты всегда подвижны.
В некоторых случаях на срезах этих пилло-
тин, взятых из подземных термитов
Reticulitermes flavipes и R. hesperus и питаю-
щихся сухой древесиной термитов
Kalotermes (Incisitermes) schwartzi, I. minor
a Pterotermes occidentis, были видны микро-
трубочки (рис. 10.8). Эти микротрубочки
обычно уложены в продольном направле-
нии, и часто кажется, что они повторяют
спиральные контуры спирохеты; однако
они видны далеко не на всех срезах и не-
многочисленны. Сходные, если не иден-
тичные, внутрицитоплазматические микро-
трубочки наблюдались у неидентифициро-
ванных длинных, тонких безжгутиковых
бактерий, выделенных от термитов. Ми-
кротрубочек не находили у мелких трепо-
эемоподобных спирохет, а также у размно-
жающихся в культуре спирохет Treponema
reiteri. Однако более мелкие трубочки опи-
саны у Leptonema [428].
Антитела к белкам микротрубочек бы-
ли получены несколькими исследователя-
ми. Эти антитела, связанные с флуоресцеи-
ном, использовались в качестве цитологи-
ческого маркера для флуоресцентной ми-
кроскопии. Этот метод сходен с тем,
который применяли Фуллер и его сотруд-
ники [107] для идентификации тубулина
митотического веретена. В результате бы-
ли получены предварительные данные,
указывающие на присутствие у спирохет из
Kalotermes schwartzi и Pterotermes occidentis
материала, дающего перекрестную реак-
цию с антителами к тубулину [619]
(табл. 10.2).
По всей длине крупных спирохет регу-
лярно наблюдалась интенсивная флуорес-
ценция. Положительную реакцию давали
также длинные палочковидные бактерии.
Свечение спирохет было сравнимо по ин-
тенсивности со свечением ундулиподий по-
лимастигот и гипермастигот, неизбежно
присутствующих в препаратах задней киш-
ки термитов. Столь интенсивная флуорес-
ценция заставляет предполагать, что пил-
лотины и неидентифицированные палочко-
видные бактерии содержат значительные
количества тубулина, не организованного
в трубочки (рис. 10.9).
Хотя для проверки того, что флуорес-
ценция обусловлена именно тубулином,
было поставлено много контролей, резуль-
таты опытов с иммунофлуоресценцией не-
льзя считать бесспорными. Для более пря-
мого биохимического сравнения предпола-
гаемого тубулина спирохет с хорошо изу-
ченными тубулинами эукариот был приме-
нен электрофорез в полиакриламидном
геле с додецилсульфатом натрия. Однако
эта работа не дала однозначных результа-
тов из-за невозможности выращивания
пиллотин в чистой культуре.
262
ГЛАВА 10
Рис. 10.8. Продольно расположенные микротрубочки (mt) толщиной около 21 нм
у спирохет и неидентифицироваиных бактерий из задней кишки термитов, питающихся
сухой древесиной [619]. р-фаг.
Предпринималось много попыток вы-
делить эти спирохеты из поверхностно сте-
рилизованных термитов, но без достаточ-
ного успеха. Опубликован состав лучшей
из использованных сред, на которой удает-
ся поддерживать небольшое число активно
движущихся крупных спирохет в смешан-
ной культуре в течение 3-5 дней [951, 954].
Эта среда далеко не адекватна. Однако
в герметизированных препаратах для ми-
кроскопирования пиллотины выживали
в течение суток и более, что позволило из-
СПИРОХЕТЫ И УНДУЛИПОДИИ
263
Рис. 10.9. Флуоресцирующие клетки Pillotina sp. из Kalotermes schwartzi [619]. Препа-
рат задней кишки обрабатывали антителами к тубулину, связанными с флуоресцеином,
и облучали ультрафиолетом.
учить их поведение. Дольше других выжи-
вали спирохеты, выделенные из крупных
термитов с более концентрированным со-
держимым кишечника.
Так как нормальные термиты содержат
огромные количества спирохет, их удается
отделить от остальных микробов кишечни-
ка дифференциальным центрифугирова-
нием [85]. Растворимые белки из спирохет,
жгутиковых и тканей термитов исследова-
ли стандартными методами электрофореза
в полиакриламидном геле с додецилсуль-
фатом натрия. В этих опытах использова-
ли максимально очищенную фракцию спи-
рохет из термитов каждого вида. Во всех
случаях, кроме тех, где исследовали чи-
стую культуру трепонемы Рейтера или же
единственным источником белка служил
срез кишки термита, среди примерно дю-
жины выявленных полос была интенсивная
полоса белка, мигрирующего вместе с ту-
. лином из мозга млекопитающего [619].
Но это указывает лишь на присутствие
з препаратах спирохет белка, сходного
тубулином по заряду и молекулярной
массе; доказать, что это действительно ту-
ту лин, можно только с помощью более
прямых биохимических методов.
Те же методы использовались для по-
иска белка микротрубочек у Treponema
--ueri. выращенной в аксенической культу-
р? Была сделана попытка выявить флуо-
ресценцию спирохет, обработанных анти-
елами к тубулину мозга, а белок трепо-
нем выделяли и подвергали электрофорезу
? полиакриламидном геле. Кроме того,
в опытах с этими трепонемами применяли
подофиллотоксин, Р-пельтатин и винбла-
стин - вещества, ингибирующие полимери-
зацию белков микротрубочек. Treponema
reiteri не флуоресцировала при обработке
антителами к тубулину, у нее не оказалось
белка, мигрирующего вместе с тубулином,
и ее рост не подавлял ни один из исследо-
ванных антимитотических агентов. Эти ре-
зультаты согласуются с очень четкими
данными ультраструктурного исследова-
ния [428], при котором в протоплазмати-
ческих цилиндрах этих спирохет не было
найдено микротрубочек с диаметром
20 нм. Трубочки и тубулиноподобные бел-
ки, несомненно, имеются не у всех спиро-
хет; свойственны ли они всем пиллотинам
или каким-либо другим прокариотам, пока
неизвестно.
В этих исследованиях может быть не-
сколько источников ошибок. Прокариоты
могут содержать отличный от тубулина
белок с очень близкой молекулярной мас-
сой, мигрирующий при гель-электрофорезе
вместе с тубулином; флуоресценция может
быть артефактом; микротубулярные струк-
туры могли возникнуть конвергентно, и их
сходство с соответствующими структура-
ми эукариот может быть чисто случайным.
Пожалуй, еще труднее исключить возмож-
ность того, что тубулин получен пиллоти-
нами от протистов в результате переноса
некой плазмиды в перенаселенном кишеч-
нике термита. Окончательно решить во-
прос смогут только детальные биохимиче-
ские исследования на чистых культурах
Таблица 10.2. Перекрестная реакция антител к тубулину с крупными спирохетами [619]1
Источник антител Антиген Антигены, использованные для предварительно- Вид термита, микробы и результат пробы с иммунофлуоресценцией Примечания
го испытания, и полученный результат
G. М. Fuller, В. R. Brink- 68-тубулин из бычьего Эмбриональные клетки человека, + ley, Univ. ofTexas Med. мозга кенгуру, мыши, обезьяны, крысы Branch, Galveston и хомячка на стадиях деления и интерфазы Kalotermes schwartzi Пиллотины + Холландины + Мелкие трепонемоподоб- ные спирохеты Флагелляты + Спириллы — Arthromitus sp. Тонкие палочковидные + жгутиконосные бакте- рии Kalotermes schwartzi Только флуоресцеин Только козий IgG-флуо- ресцеин Только буферный раствор Непрямой метод-(кро- личьи антитела к ту- булину бычьего моз- га 4- козий IgG-флуо- ресцеин)
К. Fujiwara, Harvard Осаждаемый винблас- Гомогенат яиц Strong ylocentrotus + Med. School тин ом тубулин из не- Реснички Tetrahymena Kalotermes schwartzi-то же, что выше Прямой метод. (Комп- лекс кроличьих анти-
оплодотворенных яиц Семенники комара-долгоножки + Pterotermes occidentis тел к тубулину яиц
морского ежа Strongy- (хвосты спермиев) Холландины + морского ежа с флуо-
locentrotus Аксонемы хвостов спермиев мор- + ского ежа Актин из мышц кролика Миозин из мышц кролика Бычий сывороточный альбумин Тубулин из мозга курицы, крысы, + мыши, рыбы, лягушки Митотическое веретено из клеток + Hela Тонкие палочковидные + жгутиконосные бакте- рии Разнообразные мелкие бактерии и спирохеты Arthromitus (два вида) Тreponema reiteri (чистая куль- тура) ресцеином2. Лучшие результаты получены с этими антителами)
о
6
265
спирохет, содержащих микротрубочки. Од-
нако гипотезу о том, что ундулиподиаль-
ная система эукариот была приобретена
в результате ассоциации со спирохетами
и лишь позднее сильно модифицирована
и использована в механизме митоза, мож-
но проверить и с помощью косвенных
данных.
Можно сделать несколько предсказа-
ний, определенно отличающих симбиоти-
ческую гипотезу от гипотезы прямой фи-
лиации. Так, должны быть найдены спиро-
хеты, содержащие тубулин, гомологичный
тубулину обычных микротрубочек эука-
риот. Должна быть обнаружена гомология
нуклеотидных последовательностей ну-
клеиновых кислот, участвующих в реплика-
ции ЦМ, и каких-то нуклеиновых кислот
соответствующих спирохет. Тубулина не
должно быть в «микротрубочках» клеточ-
ной стенки цианобактерий [82]. Быть мо-
жет, найдутся даже такие спирохеты, ко-
торые содержат тубулин, связывающий
колхицин, или дублеты микротрубочек, ор-
ганизованные в структуру с девятилучевой
симметрией! Во всяком случае вероятность
того, что некоторые спирохеты содержат
тубулин, образующий внутриклеточные
микротрубочки, за последнее время значи-
тельно возросла.
266
ГЛАВА 10
Происхождение РНК ундулиподий и центров-
организаторов микротрубочек (ЦМ)
Имеет смысл рассмотреть колонизацию клеток-хозяев современными симбионтами.
Между внутриклеточными и внеклеточными симбионтами нет резкого морфологи-
ческого различия, и можно составить непрерывный ряд ассоциаций с возрастающей
степенью морфологической интеграции симбионта и клетки-хозяина. Если не считать
некоторых случаев паразитарных инвазий, подавляющее большинство симбионтов
находится в вакуоли и окружено мембраной клетки-хозяина. Симбионтов, не
заключенных в вакуоль, обычно не удается культивировать вне клетки.
Поэтому можно думать, что вакуолярные мембраны исчезают (если это вообще
происходит) лишь на поздних стадиях эволюции внутриклеточных организмов.
О. Смит, 1979 [874J
Если ундулиподии ведут свое начало от
симбиотических спирохет, то что произош-
ло с их ДНК, аппаратом белкового синте-
за, плазматической мембраной и прочими
компонентами? Безусловно, симбиотиче-
ская гипотеза оставляет ряд вопросов без
ответа, но тем не менее накопленные
данные заслуживают рассмотрения
(табл. 10.3). Ранние описания репликации
кинетосом - базальных телец ундулиподий
[585] - стимулировали поиск кинетосомной
ДНК. Эти исследования привели к осозна-
нию того факта, что кинетосомы не делят-
ся: они развиваются из ЦМ. Даже у инфу-
зории Stentor, у которой можно стимули-
ровать развитие 20000 оральных кинето-
сом за два часа, образование огромного
числа структур типа 9 + 0 не сопровож-
дается синтезом ДНК. В настоящее время
нет никаких данных о присутствии в этих
структурах специфической кинетосомной
или центриолярной ДНК. Ранние сообще-
ния о кинетосомной ДНК оказались оши-
бочными; в некоторых из этих работ на
самом деле выявлялась, вероятно, мито-
хондриальная ДНК [1039]. Однако цен-
триоли и кинетосомы содержат РНК [233]
в форме рибонуклеопротеида, и образова-
ние новых оральных кинетосом, по-види-
мому, всегда сопровождается синтезом
РНК [1039]. РНК в кинетосомах и цен-
триолях имеет, вероятно, спиральную
структуру. У инфузорий, видимо, есть
и другие кортикальные РНК (Н. Hartman,
1979, личное сообщение).
Функция, размеры, структура, нуклео-
тидная последовательность, степень гомо-
генности, распределение и способ синтеза
молекул кинетосомной РНК пока не выяс-
нены. Не исключено, что кинетосомная
РНК, а возможно, и другие типы корти-
кальной РНК имеют ядерное происхожде-
ние [383]. Эти вопросы представляют ин-
терес как в связи с симбиотической тео-
рией происхождения ундулиподий, так и
в связи с теорией прямой филиации. На-
пример, симбиотическая теория предсказы-
вает, что РНК центриолей, кинетосом
и более аморфных ЦМ должны быть го-
мологичны по нуклеотидной последова-
тельности между собой и с нуклеиновыми
кислотами пиллотин. Все ЦМ, способные
к репликации, должны по крайней мере ча-
стично состоять из такого рода РНК или
рибонуклеопротеида. Подобные предста-
вления не вытекают из теорий прямой фи-
лиации. Показано, что очищенные эле-
менты кортекса Tetrahymena, состоящие из
кинетосом и кинетосомных фибрилл (без
примеси митохондрий), содержат специфи-
ческую РНК с коэффициентом седимента-
ции около 7S, прикрепленную к опреде-
ленным участкам кортекса. Возможно,
именно эта кортикальная РНК была выя-
влена при электронно-микроскопическом
исследовании кортекса, обработанного
РНКазой [233]. Очищенные кинетосомы
были выделены и из других инфузорий
[395]. Эти изолированные кинетосомы
функционируют как ЦМ: будучи доба-
влены к препаратам микротубулярного
белка из веретен яиц морского ежа, они
вызывают образование цитоплазматиче-
ских звезд с расходящимися лучами ми-
кротрубочек! Кинетосомы утрачивают эту
способность после обработки РНКазой
Таблица 10.3. Симбиотическое происхождение центров-организаторов микротрубочек (ЦМ) и
родственных органелл
Что представляла собой свобод- ноживущая форма протоунду- липодий? Это были анаэробные или микроаэрофильные подвижные про- кариоты-спирохеты или спироплазмы, способные к движению при участии АТРаз, содержащие АТР, тубулин (в микро- трубочках) и, возможно, актиноподобные белки
У каких клеток-хозяев впервые У гетеротрофных аэробных клеток; некоторые из этих клеток
появились протоундулипо- дии? обладали митохондриями
Какие факторы внешней среды способствовали возникнове- нию и сохранению симбиоза? Недостаток пищи: простейшие, ставшие подвижными в резуль- тате ассоциации со спирохетами, могли более эффективно искать пищу
Когда возникли эти симбиозы? В протерозое, после перехода к окислительной атмосфере, необходимой для возникновения митоза
Является ли подобный симбиоз облигатным? Да-у всех митотических организмов, так как «белки подвиж- ности» спирохет используются при митозе
Какие особенности свободножи- вущих прокариотических кле- ток сохранились у ЦМ и ун- дулиподий? Нет данных о присутствии ДНК [763, 880, 881]; ранние сообщения о «кинетосомной» ДНК можно объяснить нали- чием примеси митохондриальной ДНК [1039] и РНК [383]. Однако кинетосомы содержат РНК (скорее всего в своей внутренней полости) [233, 920]; это указывает на то, что образование новых кинетосом сопровождается синтезом РНК и что кинетосомная РНК участвует в формировании ЦМ [395]
Что утратили протоундулипо- дии, став симбионтами? Клеточные стенки и плазматические мембраны. Вероятно, боль- шинство биосинтетических функций, включая синтез ДНК и рибосомных белков, было переложено на нуклеоцито- плазму, контролируемую ядерными генами; возможно, сохра- нилась только функция синтеза рибонуклеопротеидов
Что может изменять исходное отношение числа геномов хо- зяина (теперь это нуклеоцито- плазма) к числу ЦМ? Недостаток витамина Е и высокие концентрации О2 [403]; обработка колцемидом [919], паргилином (ингибитор моно- аминоксидазы) [658], гормонами гипофиза [257]; нормальная дифференцировка тканей [891] и стадия жизненного цикла [185]
Как можно вызвать утрату сим- бионта эукариотическим орга- низмом-хозяином ? По-видимому, такая утрата легальна для всех митотических организмов. Кливлэнд [158] выдерживал гаметы гипермасти- гот при низкой концентрации О2; это приводило к изби- рательному разрушению ундулиподиальной системы, так что получалась клетка с ядром, не способная делиться (хотя ДНК, очевидно, синтезировалась, так как происходило обра- зование хроматина). Хроматиды разделялись, но не расходи- лись к полюсам. Об утрате кинетопласта см. [515, 868].
Продолжение табл. 103
До какой степени могут дедиф- ференцироваться структуры типа 9 4-2? Вплоть до неразличимости в электронном микроскопе [185, 833, 919]; у растений и грибов ЦМ, по-видимому, дедиф- ференцированы до этого уровня в норме и состоят только из рибонуклеопротеида
Как образуются дочерние ЦМ? Обычно они формируются из родительских ЦМ; например, новые кинетосомы образуются под прямым углом к роди- тельским в ходе довольно сложного, весьма вариабельного процесса [185, 657] (см. табл. 9.2). По-видимому, в центриолях и ассоциированных с ними ядерных органеллах (которые у митотических организмов редуплицируются, прежде чем становятся видимыми) происходит репликация нуклеиновой кислоты
Какие организмы произошли от аэробов, обладавших эктосим- Почти все эукариоты: все растения, животные и грибы и почти все протоктисты (все организмы с митозом и микротрубоч-
бионтами-спирохетами и ми- тохондриями? ками, чувствительными к колхицину)
Что кодируют геномы бывших спирохет-симбионтов? Неизвестно; во всяком случае не тубулин; возможно, РНП кинетосом и РНК 808-рибосом. Ассоциированный с мембра- нами синтез РНК, вероятно, имеет отношение к репли- кации кинетосом [233, 383, 395]
Являются ли тубулины и дру- гие белки ундулиподий гомо- логами соответствующих бел- ков определенных спирохет [619], например динеина [318]? Согласно нашей гипотезе, чувствительность к определенным алкалоидам (например, к колхицину у тубулина Tetrahymena [788] и у регенерирующих стенторов [685]) должна быть свойственна и некоторым спирохетам
Что свидетельствует о генети- ческой автономности кинето- сом? Независимое от ядра наследование ундулиподий у стенторов [929, 931]; независимое наследование кортикальных структур у парамеций [66]т. Рост и развитие рядов ундулиподий и родственных микротубулярных структур у гамет гипермасти- гот при полном отсутствии ядра [158]. Регулярное распре- деление ЦМ или их продуктов между дочерними клетками при делении
Каким образом передаются ЦМ от родителей потомкам? Центриоли имеются в спермиях многих животных [803, 972, 1025]. Вопрос о том, от которого из родителей передаются ЦМ у эукариот с половым диморфизмом, не исследовался современными методами (данные о хитриде А Ноту се s см. [774])
Почему большинство функций ундулиподий находится под ядерным генетическим конт- Для митоза нужна очень точная координация между ядерным хроматином и ЦМ, ответственными за его сегрегацию; кроме того, действовал отбор против избыточности
ролем?
СПИРОХЕТЫ И УНДУЛИПОДИИ
269
Продолжение табл. 10.3
Какие функции бывшего сим-
бионта были передоверены
ядру хозяина?
Ядерные гены контролируют развитие двух внутренних микро-
трубочек в аксонемах Chlamydomonas [764]. Вероятно, окажет-
ся, что почти все функции бывшего симбионта находятся
под прямым контролем ядра; пока данных мало
Почему число центриолей и ун-
дулиподий в разных клетках
варьирует, тогда как размеры
структурных единиц микро-
трубочек, кинетосом и унду-
липодий почти постоянны?
Вначале вариации были связаны с тем, что отношение сим-
бионт/хозяин редко бывает равно 1:1. Когда выработался
контроль, число этих органелл стало варьировать потому, что
они дифференцировались для выполнения функции движения
и для участия в митозе. Величина же их определяется
геномом исходной спирохеты; размеры особей в популяции
спирохет почти постоянны
1 Было высказано, однако, предположение [764] о ядерном контроле цитоплазматического кинетосомного гена, сходном
с ядерным контролем митохондрий.
в мягких условиях (такая обработка не из-
меняет их морфологии, но достаточна для
растворения внутреннего рибонуклеопро-
теида). По-видимому, специфическая кине-
тосомная РНК принимает какое-то участие
в организации микротрубочек центрами-
организаторами или по крайней мере кине-
тосомами. В этих наблюдениях порази-
тельно то, что кинетосомы инфузорий
оказались способными выполнять роль
ЦМ для звезд в яйцах морских ежей;
значит, гомология сохранилась несмотря
на то, что предки этих организмов дивер-
гировали, вероятно, более 700 млн. лет
назад.
Какие функции выполняет РНК при
образовании кинетосом и дифференциров-
ке других ЦМ и даже есть ли у нее такие
функции вообще, пока неизвестно. Возмож-
но, что удвоение ЦМ начинается, когда
при участии кортикальной РНК-полиме-
разы, связанной с мембраной, происходит
репликация кинетосомной РНК, фиксиро-
ванной в кортексе; в дальнейшем при со-
зревании кинетосом в этих участках кор-
текса мог бы происходить синтез белка на
матрицах РНК. Эта гипотеза объясняет не-
зависимость наследования кортикальных
признаков от ядерных и митохон-
дриальных генов у инфузорий. Она совме-
стима также с представлением о том, что
рибонуклеопротеид ЦМ ундулиподий
и других микротубулярных органелл про-
исходит от генома бывших спирохет. Син-
тез нуклеотидов, аминокислот и белков,
необходимых для образования новых унду-
липодий,-даже синтез самого тубулина-
осуществляется в нуклеоцитоплазматиче-
ской системе. Многие рассматривают это
как свидетельство в пользу эндогенной
теории происхождения ундулиподий. Я по-
лагаю, однако, что дупликация ЦМ дол-
жна определяться каким-то реплика-
тивным событием, независимым от ядра
и митохондрий, и что это событие-пос-
ледний остаток прошлой независимости —
должно происходить в специфических ЦМ
в цитоплазме и на клеточной мембране.
Если это верно, то РНК кинетосом должна
быть гомологичной каким-то РНК спиро-
хет, обладающих микротрубочками, и, сле-
довательно, комплементарной их ДНК. Ес-
ли ундулиподии произошли от симбиоти-
ческих спирохет, то, конечно, следует при-
знать, что они чрезвычайно сильно измени-
лись. Почти во всех аспектах своего роста
и синтетических процессов они положились
на хозяев. Как бы ни решился вопрос об
ундулиподиях, нас ждут годы увлека-
тельных исследований.
ГЛАВА 11
ФОТОСИНТЕЗ В ПЛАСТИДАХ
Генетическая непрерывность пластид
Для создания в ходе эволюции автотрофных планктонных жгутиковых, с
которых начинают изучать типы водорослей, потребовалось так же много времени
и творческих усилий природы, как и для развития из такого жгутикового высших
и наземных растений,-возможно это заняло миллиард лет; и вряд ли эту историю
можно описать на нескольких страничках.
А. Чёрч, 1919 [149]
В растительных клетках всегда имеются
ограниченные мембранами пластиды, со-
держащие фотосинтетические пигменты.
Клетки корней, семян, пыльцы и т.п., ли-
шенные хлоропластов, должны либо сохра-
нять способность к образованию хлоро-
пластов, либо объединяться с клетками,
обладающими этой способностью; иначе
они не смогут произвести потомков. Отку-
да появились пластиды? Ботаники
А. Шимпер и В. Мейер, впервые подробно
описавшие хлоропласты растений, пришли
к выводу, что пластиды никогда не возни-
кают de novo, а всегда образуются в ре-
зультате роста и деления предсуществую-
щих пластид [1025]. С самого начала
сложилось представление, что хлоропла-
стам свойственна непреходящая индиви-
дуальность; подобно клеткам, ядрам или
хромосомам, они подчиняются общему за-
кону генетической преемственности. Неред-
ко приходится наблюдать рост и деление
таких дифференцированных пластид, как
зрелые хлоропласты. У некоторых водо-
рослей и мхов, например у Zygnema или
Anthoceros, пластиды делятся регулярно
при каждом клеточном делении. Часто
проводили аналогию между пластидами
растений и водорослями-эндосимбионтами
гетеротрофов - проистов и животных. Ка-
ракашьян [469] в 1963 г. писал:
«В эволюции симбиоза парамеции с хлорел-
лой произошла значительная интеграция парт-
неров. Присутствие симбиотических водорослей
оказывает глубокое влияние на рост хозяина...
Более того, темп деления парамеции и водорос-
лей стал настолько согласованным, что ни один
из партнеров не опережает другого, и таким
образом сохраняется наследственная ассоциа-
ция. Если между хозяином и плазмидами1
1 Когда писались эти строки, плазмидами
называли органеллы или цитоплазматические
включения, обладающие генетической непрерыв-
ностью. Теперь значение этого слова обычно
сужают: так называют вирусоподобную ДНК,
способную реплицироваться независимо от
остальной ДНК клетки (в большинстве случаев
имеются в виду бактериальные клетки).
Рис. 11.1. Хлоропласты и их развитие из пропластид. (А-Г-электронные микрофото-
графии тонких срезов [D. von Wettstein, К. W. Henningsen, J. Е. Boynton].) А. Зрелый
хлоропласт из клетки мезофилла листа табака. Видны рибосомы хлоропласта (г)-мно-
гочисленные темные гранулы. Крупное зерно (g) указывает на включение 3Н-уридина
в РНК хлоропласта; с-мембрана хлоропласта. Б. Проламеллярное тельце (р) в хлоро-
пластах 7-дневных листьев ячменя, освещавшихся полчаса слабым светом. В. Хлоро-
пласт ячменя через 2 ч после помещения на свет. Проламеллярное тельце распалось.
Г Вполне зрелый хлоропласт ячменя после 12 ч развития на свету. Вдоль первичных
ламеллярных слоев сформировались граны (g), появились крахмальные зерна (s).
Д. Дифференциация пропластид в этиолированных листьях ячменя при низкой (слева)
и высокой (справа) интенсивности света. Приведены названия мутантов, у которых про-
цесс развития хлоропластов прекращается на соответствующих стадиях (большинство
мутаций - ядерные). В середине-нормальные хлоропласты. (По [989].)
272
ГЛАВА 11
водорослей происходит свободный обмен мета-
болитами, на что, видимо, указывают экспери-
ментальные данные, то естественный отбор дол-
жен благоприятствовать тем мутациям у хозя-
ина или симбионта, которые уменьшают дубли-
рование метаболических путей, и оба партнера
должны становиться все более зависимыми друг
от друга».
В 20-м столетии представления Шимпе-
ра и Мейера были подтверждены и уточ-
нены, и сейчас имеется обширная литера-
тура по биохимии, генетике, и развитию
пластид [321, 481, 813, 1011, 1013]. Пла-
стиды образуются из предсуществующих
хлоропластов или из меньших телец, назы-
ваемых пропластидами, которые разви-
ваются, превращаясь в хлоропласты (рис.
11.1). Пластиды содержат ДНК, информа-
ционную РНК и системы белкового синте-
за. Белки пластид синтезируются на малых
рибосомах, которые чувствительны к анти-
биотикам, подавляющим рост прокариоти-
ческих микробов. Эти факты согласуются
с эндосимбиотической теорией происхож-
дения пластид, согласно которой гетеро-
трофные протисты приобрели пластиды
в виде прокариот, обладавших полностью
развитым фотосинтезом с выделением О2.
Сходство в деталях между пластидами
и фотосинтезирующими прокариотами
указывает на то, что протопластиды были,
вероятно, приобретены хозяевами позднее,
чем протомитохондрии и протоундулипо-
дии.
Нуклеиновые кислоты были выявлены
в хлоропластах с помощью многих мето-
дов [279, 939, 989]. Обработка специфичес-
кими нуклеазами в сочетании с электрон-
ной микроскопией позволила обнаружить
пластидные нуклеоиды и определить лока-
лизацию пластидной ДНК [782]. Методом
центрифугирования в градиенте плотности
удалось выявить ДНК, отличающуюся от
ядерной и прочно связанную с пластидами
[147]. Присутствие ядерной и пластидной
ДНК в одной и той же клетке было дока-
зано в опытах с эвгленами путем введения
меченных 3Н предшественников нуклеи-
новых кислот, с последующей обработкой
клеток ДНКазами и РНКазами [794].
В конце 50-х и начале 60-х годов экспери-
ментаторы вызывали исчезновение хлоро-
пластов у Euglena gracilis, воздействуя уль-
трафиолетом, повышенной температурой
или стрептомицином; при этом клетки на-
всегда утрачивали способность к образова-
нию пластид [267, 268]. ДНК из нор-
мальных эвглен дает в градиенте плотно-
сти хлористого цезия две полосы-главную
(ядерная ДНК) и сателлитную (пластидная
ДНК) [794]; у «бесцветных» клеток, т.е.
у эвглен, неспособных формировать хлоро-
пласты, сателлитная ДНК отсутствует
[542]. Установление связи между присут-
ствием неядерной ДНК и способностью
к образованию пластид стимулировало
прямые поиски ДНК хлоропластов. Ныне
такие ДНК в виде замкнутых ковалентно
связанных колец уже выделены из многих
растений [87, 939]; их молекулярная масса
варьирует в пределах от 85 до 96 млн. Вы-
яснить свойства этих ДНК позволили три
метода: равновесная седиментация в при-
сутствии додецилсульфата натрия, элек-
тронно-микроскопические измерения и из-
учение кинетики ренатурации. ДНК пла-
стид удается даже синтезировать in vitro,
добавляя предшественники к выделенным
из клеток и солюбилизированным хлоро-
пластам. Для этого синтеза требуется при-
сутствие по меньшей мере трех белков
хлоропластов. По-видимому, одиночные
кольцевые молекулы ДНК хлоропластов
содержат обширную информацию для син-
теза соответствующих продуктов. Эта
ДНК, подобно ДНК почти всех прокариот,
не находится в комплексе с гистонами или
РНК [939].
У хлоропластов есть также ряд других
особенностей, совместимых с их эндосим-
биотическим происхождением. Хлоро-
пласты содержат рибосомы и рибосомную
РНК прокариотического типа [325, 587].
Имеются данные о том, что изолиро-
ванные хлоропласты осуществляют ДНК-
зависимый синтез РНК и включают ами-
нокислоты в белки [246, 346, 351]. После-
довательность нуклеотидов в РНК малых
(16S) субчастиц рибосом из пластил
Porphyridium не родственна их последова-
тельности в РНК малых субчастиц нуклео-
цитоплазматических рибосом того же ор-
ганизма. Между РНК пластид и некоторых
коккоидных цианобактерий даже больше
сходства, чем между 16S-PHK цианобакте-
ФОТОСИНТЕЗ В ПЛАСТИДАХ
273
Рис. 11.2. Нуклеоцитоплазматические отношения у эвглены. А. Пе-
ренос метаболитов и генных продуктов между органеллами Euglena
gracilis. Р - неорганический фосфат; тРН К-информационная РНК;
tPHK-транспортная РНК; гРНК-рибосомная РНК; рДНК-пла-
стидная ДНК; тДНК-митохондриальная ДНК; пДНК-ядерная
ДНК. Парамил-углевод, характерное для эвглен резервное веще-
ство, продукт фотосинтеза [81]. Б. Тонкий срез Е. gracilis, выра-
щенной на свету. Виден хорошо развитый хлоропласт (р); п-ядро.
х 24 800. В. Тот же штамм Е. gracilis, росший в течение недели
в темноте. Хлоропласты дедифференцировались в пропластиды
(рр); m - митохондрия. Этот процесс обратим: пропластиды регене-
рируют и дифференцируются в зрелые хлоропласты после инкуба-
ции на свету в течение трех суток, х 32 000. [Y. Ben Shaul, Tel Aviv
Univ.]
тРНК
г рни
Парамил
ШРНК
tPHK
грнк
РДНК
ID РНК
tPHK
ГРНК
пДНК
рий и 16S-PHK других бактерий (см. рис.
3.11) [91, 92].
Подводя итоги данным о репликации
и биохимии хлоропластов, можно сказать
следующее. Содержащие ДНК и РНК пла-
стиды-это самоудваивающиеся тельца; их
ДНК представляет собой мультигенную
систему, которая не произошла от ядерной
системы и частично ответственна за биохи-
мические свойства органеллы; дифферен-
цировка зрелого хлоропласта из пропла-
стиды-это адаптивная система, реагирую-
274
ГЛАВА 11
щая на видимый свет [323, 324].
У некоторых протистов пластиды могут
дедифференцироваться или же необратимо
утрачиваться; у многих растений они де-
дифференцируются, превращаясь в пропла-
стиды. Взаимоотношение между геномом
и пластидами у эвглены, на которой было
проведено большинство важнейших работ,
схематически представлено на рис. 11.2, Л;
нет сомнений в том, что системы нуклео-
цитоплазмы и пластид на молекулярном
уровне полностью взаимозависимы.
В табл. 11.1 перечислены механизмы, обес-
печивающие попадание по меньшей мере
одной копии пластиды в каждую дочер-
нюю клетку у растений и протоктистов.
Скорости деления геномов хозяина
и симбионта варьируют в зависимости от
условий, но они должны оставаться при-
близительно равными, для того чтобы ас-
социация сохранялась? В этом отношении
пластиды ведут себя подобно симбионтам.
У эвглен при недостатке витамина В12 воз-
растает число хлоропластов и сильно уве-
личиваются размеры клеток. Возможно,
что контролируемый пластидами синтез
этого витамина достаточен, чтобы обеспе-
чить репликацию самих пластид, но недо-
статочен для деления всей клетки. Это
объяснение согласуется с распределением
биосинтеза витамина В12 среди прокариот
(см. табл. 6.6). У эвглен, лишенных вита-
мина В12, по-видимому, не происходит по-
лимеризации пелликулярных и других
микротрубочек, несмотря на большие раз-
меры клетки, что, вероятно, и способствует
подавлению процесса деления (G. Le
Fort-Tran, 1977, личное сообщение).
Известны организмы, лишенные
пластид, но явно гомологичные клеткам,
содержащим пластиды (рис. 11.3). Эти бес-
пластидные гомологи аналогичны апосим-
биотическим инфузориям, кишечнопо-
лостным, плоским червям и многим дру-
гим гетеротрофам, которых находили
в природе как с фотосинтезирующими
симбионтами, так и без них. Несмотря на
интенсивные поиски неуловимой праводо-
росли, не было найдено ни ископаемых, ни
ныне живущих промежуточных форм меж-
ду лишенными пластид цианобактериями
и содержащими пластиды водорослями.
Таблица 11.1. Механизмы сохранения пластид на протяжении жизненного цикла у фотосинтези-
рующих эукариот
Тип Организм Механики
Euglenophyta Euglena при росте в тем- ноте Euglena при росте на свету Распределение многочисленных дедифферен- цированных пропластид диаметром 1 мкм [814] Деление хлоропластов, распределение от 10 до 12 зрелых пластид
Chlorophyta Micromonas Chlamydomonas Единственный хлоропласт делится синхронно с ядром [323] Единственный крупный хлоропласт разреза- ется плоскостью деления [323]
Charophyta Спермин Nitella Заключение пластиды в пучок микротрубочек (производных центриоли) внутри тела спер- мия [972]
Chrysophyta Dinobryon Пластида заключена в тройную мембрану, наружный слой которой-складка ядерной мембраны [1034]
Bacillariophyta Многие диатомовые Малое и постоянное число пластид, поровну распределяемых при митозе [202]
Phaeophyta Chorda Пластида заключена в тройную мембрану, наружный слой которой-складка ядерной мембраны [1034]
Tracheophyta Большинство растений Множество хлоропластов, распределяющихся при митозе случайно ([1025], р. 162)
ФОТОСИНТЕЗ В ПЛАСТИДАХ
275
Рис. 11.3. Протисты с пластидами и без них. Ochromonas-золотисто-зеленая водо-
росль; Oikomonas-«протозойный» жгутиконосец; Botridiopsis-колониальная желто-зе-
леная водоросль; Euglena и Astasia - эвгленовые; Cryptomonas, Chilomonas
a Cyathomonas- криптомонады, имеющие пластиды соответственно с коричневым пиг-
ментом, без пигмента и с сине-зеленым пигментом. Gymnodinium- динофлагеллята, ко-
торая может быть с пластидами или без пластид.
Напротив, было выявлено еще большее
число симбиозов, аналогичных предпола-
гаемому симбиозу, давшему начало клет-
кам растений (например, Cyanophora
paradoxa [967], симбиотические радиоля-
рии и фораминиферы [932], ксантеллы
и хлореллы коралловых полипов [967], гу-
бок и инфузорий [932, 935], а также гидр
[171]).
Неменделевская наследственность
впервые была описана у растений; позже
выяснилось, что она обусловлена переда-
чей хлоропластов только от одного из ро-
дителей [324]. Передача пластид зиготе
женским родителем-естественное след-
ствие полового диморфизма и генетичес-
кой непрерывности органелл, которые не
могут быть воссозданы ядерным геномом
(сходным образом можно объяснить пере-
дачу по материнской линии митохондрий;
см. раздел «Цитоплазматическая наследст-
венность» в гл. 8). По этому вопросу
имеется много обзоров [381, 452, 481].
Один из самых давних аргументов
в пользу эндосимбиотического происхож-
дения пластид-это их морфология и раз-
меры: пластиды и прокариоты-фотосинте-
тики очень сходны между собой. Фотосин-
тезирующие симбионты радиолярий, отно-
276
ГЛАВА 11
сящиеся к динофлагеллятам, в ходе эволю-
ции изменились: это морфологически
упрощенные родственники свободноживу-
щих динофлагеллят [643, 873]. Аналогич-
ное видоизменение описано у симбионтов-
водорослей в лишайниках [8]. Во многих
случаях у автотрофного симбионта можно
отметить увеличение поверхности тилакои-
дов, редукцию нуклеоида или ядра и упро-
щение внешней морфологии. Подобных же
изменений следует ожидать у симбионтов,
которые превращаются в органеллы. Срав-
ним, например, растительную клетку, со-
держащую хлоропласты (рис. 11.4) с гете-
ротрофными протестами, в которых оби-
тают симбиотические цианобактерии (см.
рис. 7.12). Различия в основном количе-
ственные: симбиоз эвглена/пластиды отли-
чается более высокой степенью интегра-
ции, вероятно потому, что он более древ-
ний.
Размножение хлоропластов делением
связано с биосинтезом нуклеиновых кис-
лот, белков и многих метаболитов. Мало-
вероятно, чтобы столь сложные и крупные
(по сравнению с молекулами) структуры
смогли спонтанно образовать мульти-
генные системы путем компартментализа-
ции в растительной протоплазме. Джайбор
и Граник [323], обсуждая причины органи-
зации пластид и их ДНК в виде «пакетов»,
утверждали, что «определенные мутации
могут происходить независимо в каждой
отдельной пластидной ДНК и передавать-
ся далее, так что при резких изменениях
условий среды может происходить отбор
наиболее подходящих органелл. Таким
образом, множественность мутантных ор-
ганелл в клетке может способствовать бо-
лее быстрым эволюционным изменениям».
Это объяснение не только наделяет эволю-
цию способностью предвидения, но и игно-
рирует трудность экспрессии появляющих-
ся мутантных пластид в условиях, когда их
партнеры дикого типа присутствуют
в большом числе. Альтернативная точка
зрения, согласно которой пластидные
мультигенные системы-это остатки гене-
тических систем, позволяет избежать те-
леологических объяснений.
Консервативность микробов, хорошо
приспособленных к стабильным условиям
среды, подкрепляет гипотезу о том, что
предками пластид водорослей и растений
были прокариоты. Цианобактерии могут
рассматриваться как свободноживущие
прокариотические аналоги пластид
красных водорослей, тогда как зеленые
прокариоты вроде Prochloron были, вероят-
но, предками пластид зеленых водорослей
и растений [946, 1012, 1013]. После откры-
тия Prochloron [549] стало почти несом-
ненным, что П. Равен [766] был прав
в своем предположении о полифилетиче-
ском происхождении пластид. Prochloron-
коккоидная прокариота, способная к фото-
синтезу с выделением О2, обладает именно
такими особенностями, какие можно пред-
полагать у протохлоропластов: у нее
имеются хлорофиллы а и Ь, мелкие рибо-
сомы, липиды, типичные для прокариот,
и она склонна вступать в симбиотические
ассоциации [1013]. Не исключено, что
дальнейшее изучение тропических прока-
риот приведет к открытию свободноживу-
щих «бурых» или «желто-зеленых» фото-
синтезирующих форм, содержащих хлоро-
филл с или фукоксантин. С другой сто-
роны, пигментные системы у водорослей
могли видоизмениться уже после образо-
вания ассоциации с прокариотами. Позд-
ним и независимым приобретением фото-
синтезирующих симбионтов можно было
бы объяснить существование аномальных
пигментных систем у некоторых малоизу-
ченных протестов [1013], а также адаптив-
ную радиацию диатомовых, динофлагел-
лят и желто-зеленых водорослей в фанеро-
зое [561].
Митоз, для которого необходим кисло-
род, появился спустя миллионы лет после
возникновения фотосинтеза - анаэробного
по своей сущности процесса. Полифилию
эукариотических водорослей можно легко
объяснить, предположив, что различными
гетеротрофными протестами были при-
обретены различные фотосинтезирующие
симбионты-прокариоты. Образование этих
стабильных симбиозов не было одновре-
менным; разнородность как пластид, так
и нефотосинтезирующих частей клетки
у водорослей позволяет думать, что сим-
биозы формировались в разное время в пе-
риод эволюции митоза. У всех водорослей
ФОТОСИНТЕЗ В ПЛАСТИДАХ
277
?ис. 11.4. Ультра структура хлоропласта из клетки мезофилла листа кукурузы.
40000. n-ДНК; сг-рибосомы; g-граны; t-тилакоиды; s-включения; ст-мембра-
хлоропласта; гл-митохондрия; ег-эндоплазматический ретикулум; cw-клеточная
тенка. [М. A. Walsh, Utah State Univ.]
278
ГЛАВА 11
и растений симбиозы эволюционировали
таким образом, что в большинстве случаев
возможности гетеротрофного питания ре-
зко уменьшились, но не исчезли пол-
ностью. Зависимость нуклеоцитоплазмы от
пластид наиболее выражена у наземных
растений, которые в случае утраты способ-
ности к фотосинтезу могут выживать толь-
ко при очень специальных условиях. На-
пример, жизнь растений-альбиносов куку-
рузы можно поддерживать до созревания,
питая их стерильным раствором сахара не-
посредственно через листья. Повреждение
фотосинтетического аппарата у хламидо-
монады («фотосинтетические минус-му-
танты») может компенсироваться предо-
ставлением ацетата, которым клетки дико-
го типа снабжает нуклеоцитоплазма,
а мутантные клетки, вынужденные расти
фотоавтотрофно, должен снабжать экспе-
риментатор. Зеленые гидры с хлореллами
в эктодермальных клетках неопределенно
долго поддерживают рост своих эндосим-
биотических водорослей в темноте, снаб-
жая их питательными веществами [943].
Эти наблюдения вскрывают гетеротроф-
ную в своей основе природу эукариот,
у которых выключена функция пластид.
По мере того как молекулярно-биоло-
гические методы (особенно определение
последовательности аминокислот в белках)
все шире применяются при изучении про-
блем эволюции, становится возможным
выявление гомологий между пластидами
и специфическими цианобактериями и хло-
роксибактериями (см. рис. 3.11) [228, 245,
269, 835]. Непластидную же часть клеток
растений и протоктистов можно надеяться
идентифицировать с отдельными видами
ныне живущих гетеротрофов на основе
биохимии, морфологии, жизненного цикла
и цитологии митоза. Наличие или отсут-
ствие фикопласта, характерные способы
прикрепления ундулиподий и морфология
(особенно клеточное деление)-все это под-
крепляет мнение о том, что зеленые водо-
росли представляют собой результат кон-
вергентной эволюции после нескольких
независимых симбиотических событий. Од-
на группа, представленная родом
Klebsormidium, характеризуется многослой-
ностью тела, образованием фрагмопласта
при клеточном делении и по ряду других
признаков кажется близкой к бриофитам
и трахеофитам [727]. Арсенал совре-
менных методов молекулярной биологии
позволяет проверить, действительно ли
Klebsormidium стоит ближе всех других ны-
не живущих водорослей к предкам расте-
ний.
Конвергентная эволюция облика зе-
леных водорослей аналогична эволюции
лишайников, в которой партнеров-фико-
бионтов приобрели грибы, относящиеся
более чем к 20000 видов. Эти фикобионты
принадлежат в основном к двум родам зе-
леных водорослей - Trebouxia и Pseudotre-
bouxia, тогда как грибы-хозяева крайне
разнообразны. Очевидно, как протисты,
приобретавшие фотосинтезирующих про-
кариот, чтобц стать водорослями, так
и грибы, приобретавшие водоросли, чтобы
стать лишайниками, были ограничены
в своем выборе «фикобионтов» лишь очень
небольшим числом фотосинтезирующих
видов.
ФОТОСИНТЕЗ В ПЛАСТИДАХ
279
Гены хлоропластов: многочисленные геномы
растений
Естественный отбор сам по себе недостаточен для того, чтобы определить
направление органической эволюции... Естественный отбор может иметь дело только
с тем, что уже было создано; он не обладает творческой силой. Любое направ-
ляющее влияние, которое естественный отбор может оказывать в ходе органиче-
ской эволюции, должно-по самой сути этого процесса-быть вторичным по отно-
шению к какому-то неизвестному фактору.
Дж. Уоллин, 1927 [995]
Если пластиды были приобретены в ре-
зультате симбиоза, то растения генетиче-
ски и метаболически более сложны, чем
представляли себе многие физиологи. Если
гетеротрофные эукариоты тригеномны
благодаря своим митохондриям, ундулипо-
диям и нуклеоцитоплазме, то растения уже
квадригеномны благодаря дополнитель-
ной органелле-своим фотосинтезирующим
пластидам (рис. 11.5 и 7.16).
Работы, в которых несколько геномов
растения и их продукты гомогенизируют,
а затем их функции реконструируют, исхо-
дя из отдельных химических реакций, неиз-
бежно должны приводить к путаным
и противоречивым результатам. Разве био-
химик может ожидать успеха в изучении
брожения при производстве вина, если он
просто закладывает «фермент», который
состоит из нескольких организмов, разли-
ПЛАСТИДА
(велон, хлорофилл,
каротиноиды, ферре-
доксины, ДНК, РНК,
рибосомы, фикса-
ция С02)
9+0
МИТОХОНДРИИ
(цикл Кребса, цитохром-
ная система транспорта
электронов, синтез ДНК,
РНК,белков)
ЯДРО и
ЦИТОПЛАЗМА
(синтез ДНК,РНК,
белков)
Целлюлозная стенка
Мембрана
УНДЧЛИПОДИЯ и
МИТОТИЧЕСКИЙ АППАРАТ
[РНК, динеин (АТРаза),
структурные и матриксные
белки микротрубочек]
Рис. 11.5. Растительные клетки-квадригеномные?
280
ГЛАВА 11
чающихся по возрасту, физиологическому
состоянию, степени взаимозависимости
и многим другим переменным? Нужно
рассортировать вторичные метаболиты
растений (флавоноиды, алкалоиды, ацето-
генины и лигнаны) в соответствии с тем,
кодируются ли они только одним из гено-
мов, двумя, тремя или всеми четырьмя.
Пример такого подхода к анализу данных,
имеющихся в литературе по физиологии
растений, представлен в табл. 11.2. Анало-
гичный анализ белков пластидной мем-
браны [81] указывает на то, что многие из
них, вероятно, находятся под прямым или
косвенным генетическим контролем плас-
тид. А поскольку со степенью текучести
мембран связана морозоустойчивость
и холодочувствительность сельскохозяй-
ственных растений [872], ясно, что разли-
чение уровней интеграции партнеров
в этих древних множественных симбиозах
представляет не только академический ин-
терес.
Почти все важные работы по передаче,
сегрегации и рекомбинации генов хлоро-
пластов были проведены на гаплоидном
зеленом протисте Chlamydomonas. Недавно
появился критический обзор впечатляю-
щих достижений в этой области более чем
за 20 лет [324]. Геном хлоропласта у хла-
мидомонады содержит достаточное коли-
чество уникальных последовательностей
ДНК, чтобы кодировать, возможно, не-
сколько сотен белков. Для сравнения от-
метим, что у большинства митохон-
дриальных ДНК кодирующая способность
примерно в 10 раз меньше. Однако интер-
претацию данных генетического изучения
хлоропластов сильно затрудняет то, что
у всех известных организмов, обладающих
хлоропластами, имеются также митохон-
дрии (эволюционное объяснение этого фак-
та будет дано в конце раздела). Не только
у хламидомонады, но и у любого растения
или водоросли неядерные генетические эф-
фекты могут быть обусловлены одними
хлоропластами, одними митохондриями,
взаимодействием между этими органелла-
ми или между ними и ядром; возможно
даже участие иных симбионтов или виру-
сов. Однако с помощью остроумных мето-
дов было показано, что некоторые генные
продукты, находящиеся в митохондриях
растущих клеток, кодирует ДНК хлоропла-
стов и что для образования пластидных
рибосом у хламидомонады нужны про-
дукты как ядерных, так и пластидных ге-
нов [324, 381].
Клеточная эволюция идет в направле-
нии большей взаимозависимости; в осо-
бенности органеллы становятся зависимы-
ми от продуктов ядерных геномов. По
меньшей мере несколько белков совместно
кодируются пластидными и ядерными ге-
нами [119, 324]. Например, важный белок
рибулозобисфосфат-карбоксилаза (РБК),
ответственный за первый шаг на пути фик-
сации атмосферной СО2,- продукт двух ге-
номов, ядерного и пластидного [429].
У хламидомонады и у пшеницы ген, коди-
рующий большую субъединицу этого фер-
мента, находится в хлоропласте, а малую
субъединицу-в ядре. РБК служит приме-
ром интеграции партнеров на уровне ген-
ного продукта. Этот чрезвычайно важный
белок, который очень мало изменился
в. процессе эволюции, обещает стать от-
личным средством для построения схем
филогении фотосинтезирующих организ-
мов. Из хламидомонады можно выделить
кодирующий РБК ген; путем инкубации
с надлежащими ферментами и малыми мо-
Таблица 11.2. Пластидный генетический контроль каротиноидов у эвглены [504]
Клетки Каротин Неоксантин Зеаксантин Антераксантин
Нормальные (рост на свету, зеленые) Нормальные (рост в темноте, бесцвет- ные, хлоропласты дедифференциро- ваны) Необратимо обесцвеченные + + + + + + + < + + + + -(?) +1
Обозначения: + + составляет по меньшей мере 10°о по весу от всех каротиноидных пигментов: + имеется; - отсутствует;
отсутствует, но появляется по мере дифференцировки пластид при повторном позеленении.
ФОТОСИНТЕЗ В ПЛАСТИДАХ
281
лекулами его можно клонировать in vitro
в присутствии радиоактивного фосфата
и получить достаточное количество мече-
ной ДНК для того, чтобы испытать ее
в реакциях гибридизации с ДНК других
организмов. Это позволяет оценить сте-
пень гомологичности нуклеотидных после-
довательностей в генах РБК многих фото-
синтезирующих организмов. Стэн Джел-
вин, аспирант Океанографического инсти-
тута Скриппса, написал нам (личное сооб-
щение, 16 мая 1977 г.):
«Как я Вам объяснил, я выделил информа-
ционную РНК и клонировал ген, кодирующий
большую субъединицу рибулозобисфосфат-кар-
боксилазы из Chlamydomonas reinhardi. Я смог
получить, введя в качестве метки 32РО4, мРНК
очень высокой удельной активности (1-2-106
имп/мин на 1 мкг РНК), чтобы использовать ее
как гибридизационный зонд. В прошлый уик-
энд я поставил предварительные опыты, резуль-
таты которых оказались чрезвычайно инте-
ресными. Как Вы знаете, большая субъединица
РБК чрезвычайно консервативна; у всех изу-
ченных организмов от фотосинтезирующих бак-
терий до высших растений она имеет один
и тот же (приблизительно) аминокислотный со-
став и дает перекрестные иммунологические ре-
акции. Я представил себе, что если это так, то
моя мРНК для большой субъединицы из С.
reinhardi должна была бы перекрестно гибриди-
зоваться с ДНК из других фотосинтезирующих
организмов. Я гибридизовал свою мРНК
с ДНК, выделенной из Rhodopseudomonas sphero-
ides [фотосинтезирующая несерная пурпурная
бактерия], и с ДНК хлоропластов салата, шпи-
ната, цикория, мангольда, С. reinhardi и моего
клонированного гена. Во всех случаях гибриди-
зация произошла, тогда как с ДНК из молок
сельди и в контроле она была ничтожной. Весь-
ма предварительные кривые плавления указы-
вают на то, что исследованная мРНК С. reinha-
rdi с большей специфичностью гибридизуется
с ДНК высших растений, чем с бактериальной
ДНК. Разумеется, это лишь самые предвари-
тельные результаты, но их следовало бы обна-
родовать после более тщательных и полных
опытов. Эти результаты волнуют (по крайней
мере меня) потому, что мы имеем теперь реаль-
ную молекулярную отмычку к белку, который
важен как в сельскохозяйственном, так и в эво-
люционном отношении.
После того как я прослушал Ваш семинар
и прочел Вашу книгу, я подумал, что детальное
изучение молекулярной эволюции этого гена
может быть полезно для Вашей работы. Конеч-
но, нас интересует эволюционная дивергенция
этого гена не только в сопоставлении с С.
reinhardi, но и во всех других парных комбина-
циях фотосинтезирующих организмов, особенно
между сине-зелеными и зелеными водорослями.
Для этого нужно было бы выделить соответ-
ствующий ген из нескольких организмов (и, ве-
роятно, клонировать его, чтобы получить доста-
точный материал для анализа). Тот факт, что
мРНК для большой субчастицы РБК С. reinha-
rdi перекрестно гибридизируется с гомоло-
гичным геном других организмов, означает, что
она может послужить средством для обнаруже-
ния искомого гена с целью его изоляции».
Тот факт, что не найдено водорослей
или растений с пластидами, но без
митохондрий, вероятно, обусловлен той
последовательностью, в которой эти орга-
неллы были приобретены. Для фагоцитоза,
который важен не только для питания, но
и для захвата протопластид, нужны гибкие
стероидные мембраны. У организмов, ли-
шенных митохондрий, таких мембран, по-
видимому, не было, поскольку фагоцитоз
не обнаружен ни у каких прокариот, даже
у тех бактерий, окисляющих метан, ко-
торые способны синтезировать стероиды.
Значит, прото пластиды были захвачены те-
ми способными к фагоцитозу организма-
ми, которые имели митохондрии и синте-
зировали стероиды. Если бы водоросли
произошли прямо от цианобактерий, то
среди ныне живущих организмов нашлись
бы эукариотические формы, имеющие пла-
стиды, но лишенные митохондрий.
282
ГЛАВА 11
Переход от симбионтов к органеллам:
редкое или обычное явление?
Некоторые структуры, такие как мицетоциты, бактериоциты и мицетомы насе-
комых, могут быть следом глубоких патологических изменений.
Происходили ли симбиотические собы-
тия, приведшие к формированию органелл,
лишь миллионы лет назад, или же они все
еще происходят? Ответ ясен: такие ассо-
циации образуются и распадаются не-
прерывно. Всего лишь за пять лет удалось
наблюдать происхождение органелл из
бактерий (см. раздел «Патогенный микро-
организм становится органеллой» в гл. 8)
[449, 451]. Своеобразными объединениями
фотосинтезирующих и подвижных орга-
низмов являются динофлагеллята Peridini-
ит balticum и морская инфузория Mesodi-
nium rubrum. На основании их ультраструк-
туры и географической изменчивости
Ф. Тэйлор [934] интерпретирует их как ас-
социации, находящиеся ныне в процессе
формирования. Зеленые гидры-это резуль-
тат симбиоза между бактериями-аэромона-
дами, хлореллами и пресноводными гидра-
ми. Эта ассоциация должна быть довольно
молодой, поскольку все три партнера спо-
собны расти независимо [73, 618]. В неко-
торых симбиозах партнерами служат даже
не целые клетки-заимствуются органеллы.
Например, хлоропласты съедобных сифо-
новых водорослей передают продукты фо-
тосинтеза тканевым клеткам моллюсков
Elysia, Tridachia и Plachobranchus. Хозяева-
животные поддерживают существование
только самих хлоропластов, но не
остальных компонентов клеток водоросли.
Хлоропласты активно фотосинтезируют
в дивертикулах кишки моллюсков [932].
Активные хлоропласты сохраняются здесь
неделями, превращая взрослых моллюсков
в «животнорастения». Но поскольку ген,
кодирующий большую субъединицу РБК,
и, вероятно, другие гены остались в ядре
водоросли, моллюски должны периодиче-
ски обновлять свой запас хлоропластов.
Иными словами, ткань моллюска способна
сохранять чужеродные хлоропласты, но не
способна их выращивать. Было высказано
предположение, что даже хлоропласты эв-
Л. Кливлэнд, 1926 [153]
глены не произошли от цианобактерий;
они могли быть, как и у моллюсков, полу-
чены от зеленых водорослей [320].
Некоторые симбиотические комплексы
эволюционировали до столь высокой
сложности, что главной опорой ассоциации
стал обмен информацией, а не физически-
ми продуктами. В одной хорошо изучен-
ной ассоциации между растениями и бакте-
риями не требуется непрерывная физи-
ческая близость партнеров-происходит
лишь обмен плазмид ной ДНК. В почве
встречается несколько видов грам-отрица-
тельных палочковидных бактерий, относя-
щихся к роду Agrobacterium. Эти бактерии
прикрепляются к стеблям или ветвям
своих хозяев, большинство которых дву-
дольные растения. Бактерии передают рас-
тительной ткани быстро распространяю-
щиеся плазмиды. Эти плазмиды - неболь-
шие кусочки голой ДНК-вызывают де-
дифференцировку растительной ткани
и образование характерных уродливых
разрастаний, называемых корончатыми
галлами. Плазмиды вносят гены, обеспечи-
вающие не только их собственную репли-
кацию, но и синтез особых, богатых угле-
родом и азотом аминокислот, не входящих
в состав белков,-таких, как нопалин и ок-
топин. Эти соединения могут служить для
агробактерий единственным источником
углерода и азота. Когда эти продукты из-
мененного растительного метаболизма
просачиваются в почву, они поддерживают
рост и репликацию агробактерий, послу-
живших источниками плазмид [809].
Симбиотические ассоциации, перенос
генов и удержание чужеродных органелл
открывают колоссальные возможности.
Эти феномены дополняют генетическую
изменчивость, обусловленную точечными
мутациями и рекомбинацией. Проявятся
ли новые генетические потенции, зависит
от естественного отбора. Если отбор уже
оптимизировал популяции организмов, то
ФОТОСИНТЕЗ В ПЛАСТИДАХ
новые источники изменчивости-симбиоз
и перенос генов-не будут часто приводить
к появлению лучше адаптированных форм,
чем уже устоявшиеся. Темп накопления
и исчезновения ассоциаций в биосфере из-
меняется в соответствии с селективными
давлениями, многие из которых создаются
другими организмами, не участвующими
в данной ассоциации.
Дофанерозойская биота состояла из
мелких организмов, но была эволюционно
могущественной: в ней определились
главные направления и новации клеточной
эволюции. К тому времени брожение, фо-
тосинтез, аэробиоз, симбиозы, митоз, мей-
оз, морфогенез и эмбриогенез сделали воз-
283
можным функционирование биосферы со-
временного типа и видоизменение земной
поверхности сообществами организмов.
В фанерозое история развертывается даль-
ше: появляются крупные морские беспо-
звоночные и, наконец, наземные растения,
грибы и животные-беспозвоночные и по-
звоночные. Эта история нам хорошо зна-
кома-о ней рассказывает палеонтология.
В следующей, заключительной главе будет
рассмотрена лишь очень ограниченная
часть этой сложной и длительной истории,
а именно последствия, к которым привело
возникновение определенных новых мета-
болических путей и форм поведения хро-
мосом.
ГЛАВА 1 2
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ
Кальций и скелеты
В нижнекембрийских морских отложениях (возраст 0,6 Ю9 лет) повсеместно
появляются свидетельства изобилия животной жизни... Это внезапное появление
разнообразных форм животных было самой интригующей загадкой в палеонтоло-
гии.
А. Фишер, 1965 [290]
Ископаемые самого раннего кембрия-это в основном не целые организмы,
а лишь их твердые части... Появление в начале фанерозоя скелетов, способных
фоссилизироваться, отражает возникновение хищничества; до этого времени биосфера
была в общем мирным царством, в котором панцири не были нужны, и потому
почти ничего не оставалось в качестве эпитафии.
Хатчинсон, 1965 [437]
Жизнь фанерозоя оставила хорошо ви-
димые окаменелости. По образцам, сохра-
нившимся в осадочных отложениях, можно
проследить эволюционные тенденции
в четырех главных подразделениях-в цар-
ствах протоктистов, животных, грибов
и растений. Многоклеточность выработа-
лась независимо в нескольких группах про-
кариот и протистов задолго до возникно-
вения многоклеточных эукариот; по край-
ней мере Metazoa появились, вероятно, во
времена эдиакарской фауны, т.е. 680 млн.
лет назад. Причина внезапного изменения
на границе дофанерозоя и кембрия около
600 млн. лет назад заключается в выработ-
ке скелетных структур-в явлениях биоми-
нерализации в больших масштабах.
Есть ли связь между эволюцией эука-
риотических клеточных механизмов, имею-
щих дело с кальцием, и появлением извест-
ковых скелетов? В дофанерозое произошел
взрыв эволюции эукариот, но поскольку
организмы были мягкотелыми и главные
пути расхождения находились на биохими-
ческом уровне, они оставили очень слабые
следы. Многоклеточные животные могли
возникнуть в протерозое раньше, чем
обычно считают [152], или же они могли
не появляться вплоть до времен эдиакар-
ской фауны. В любом случае факт внезап-
ного появления эукариот, имеющих
твердые части, в томмотском ярусе (ран-
ний кембрий) остается в силе. Были пред-
ложены многочисленные объяснения этого
факта, от уничтожения более ранних сле-
дов в результате различных геологических
процессов до физических или средовых
факторов и эволюции экосистем [905, 906].
Ответ на эту интригующую загадку заклю-
чается, по крайней мере отчасти, в природе
сохранившихся частей. Образованию ске-
летов должна была предшествовать вну-
тренняя способность к минерализации.
Клеточное регулирование обмена каль-
ция-вот возможный ключ к разгадке
[577].
Неорганические компоненты твердых
частей у современных организмов, отда-
ленно родственных ранним эукариотам фа-
нерозоя,-это безводные карбонаты каль-
ция, кристаллические карбонаты (кальцит
и арагонит), фосфаты кальция (апатиты)
и кремнезем в форме кварца. Организмы
позднего дофанерозоя и начала кембрия
больше синтезировали апатиты, чем после-
дующие организмы. Карбонаты кальция,
которые исходно синтезировались лишь
несколькими эукариотами, к середине
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ
285
кембрия стали самыми обыкновенными
продуктами биоминерализации. С тех пор
и до сегодняшнего дня они остаются
главными компонентами твердых частей.
Со временем на основе биогенных карбо-
натов кальция возникли новые обширные
сообщества-микроскопические и макро-
скопические, из которых лучше всего из-
вестны коралловые рифы. Появились эндо-
литы-цианобактерии, грибы и черви,
образ жизни которых связан с проникнове-
нием вглубь карбонатных субстратов
[343].
Кремний вначале откладывался только
губками [571]. Позднее он стал использо-
ваться более широко, например хризофита-
ми, солнечниками (рис. 12.1), радиолярия-
ми, диатомовыми, а также некоторыми
зелеными растениями, откладываясь в их
клеточных стенках. Хотя кремний всегда
играл важную роль в биоминерализации,
он неизменно уступал кальциевым минера-
лам в обилии и разнообразии соединений
и в непрерывности ископаемой летописи.
Поскольку клеточные механизмы исполь-
зования кремния недостаточно хорошо по-
няты, широко распространенное полифиле-
тическое появление в фанерозое кремневых
остатков пока не имеет объяснения.
Как бы то ни было, соединения каль-
ция, главным образом карбонаты и фос-
фаты, всегда были самыми важными био-
минеральными веществами. В последние
годы понимание метаболизма кальция на-
столько улучшилось, что появились новые
возможности для понимания взаимосвязи
между усовершенствованием клеток и фос-
силизацией. В оставшейся части этого раз-
дела приводятся некоторые рабочие гипо-
тезы о происхождении и диверсификации
твердых частей и тканей, содержащих
кальций [578]. Последние сведения
самых ранних палеонтологических
данных, относящихся к организмам с из-
вестковыми скелетами и другими мине-
ральными компонентами, приведены на
рис. 12.2.
Биоминеральные вещества создаются
главным образом многоклеточными жи-
вотными и протестами. Минерализация
находится под генетическим контролем;
она часто зависит от стадии развития ор-
ганизма. Наиболее обычное местонахожде-
ние биоминералов-это скелет, но они мо-
гут находиться также в отолитах или
статолитах, зубах и других твердых частях.
Было идентифицировано около трех десят-
ков биоминеральных веществ разного рода
[574]. В состав почти двух третей из них
входит кальций (табл. 6.14 и 12.1). Наи-
большим количеством и разнообразием
биоминеральных кальциевых материалов
отличается царство животных. Проток-
тисты и растения минерализованы меньше.
У грибов в естественных условиях кальцие-
вая биоминерализация, по-видимому, со-
ставляет исключение и носит в основном
экскреторный характер [353]. У монер
биосинтез кальциевых твердых частей поч-
ти полностью отсутствует [577]. Содержа-
щие кальций биоминерализованные про-
дукты впервые, по-видимому, появились (в
томмотии) в твердых частях у довольно
крупных морских животных, первично-
ротых целомат, и лишь затем (в атдаба-
нии)-у морских вторичноротых и менее
сложных форм (рис. 12.2). У более мелких
и предположительно раньше развившихся
протестов обызвествленные части, возмож-
но, возникли только в позднем девоне и уж
во всяком случае не раньше позднего кем-
брия [561]. Почему содержащие кальций
минералы доминировали в биоминерализа-
ции от начала фанерозоя до настоящего
времени?
В эукариотических клетках, и особенно
явно у животных, регуляция концентрации
ионов кальция необходима для многих
важных физиологических процессов (так ли
это и у прокариот, неизвестно). Кальций
в регулируемом количестве нужен для аме-
боидного движения клеток, мышечного со-
кращения, секреции, клеточной адгезии
и многих других клеточных процессов
[396, 499, 500, 999]. Кроме того, кальций
играет информационную роль. Внутрикле-
точная концентрация свободного Са2 +
у эукариот варьирует в пределах от 10"7
до 10"8 М. Внеклеточные концентрации
кальция обычно гораздо выше. Например,
в тканевой жидкости и плазме крови со-
держание кальция близко к его концентра-
ции в морской воде и колеблется от 10"2
до 10" 4 М. Клетки используют это раз л и-
286
ГЛАВА 12
Рис. 12.1. Кремневые чешуйки солнечников. Верхний ряд (слева направо): Radiophrys
ambigua, пресноводный вид, культивируется; R. marina, морской вид; R. elegans, пресно-
водный; R. neapolitana, новый вид. Нижний ряд (слева направо): Acanthocystis myriospina
(предположительно), пресноводный вид; A. turfacea, пресноводный; A. aculeata, пресно-
водный, культивируется; Acanthocystis, два вида; A. crinoides, пресноводный, культиви-
руется. Электронные микрофотографии, масштабный отрезок равен 1 мкм. [С. F. Ва-
rdele, Inst, fur Biologie III, Tubingen.]
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ
287
Верхний протерозой Нижний кемврий Высший
Венд Томистский ярус Атдаьанский ярус; Ленский » ярус
ТИП таксон
Chancelloriida
с Г! PORIFERA Stromatoponndea Pa
с с с с РМН с?^ви р-^ с ™ Inarticulate BRACHIOPODA РГ Articulata
с
Monoplacophora mollusca рг Rostroconcnia Bivalvia
М?Н1 МВ с р с с Ш м?вм
Ostraroda ARTHR0P0DA Pr
Eocrinida Helicoplacoidea Edrioasteroidea ECH1N0DERMATA De Lepidocystoidea Ophiocystoidea
и и и
Археоциатиды Angustiochreida Cribricyathida Hiolithelminthes Coleolidae Mobergella ПРОБЛЕМАТИЧНЫЕ Stenothecoida (степень близости к Протоконодонты существующим Tommotiida ЙЖтн^ Fomitchia Sachitidae Sunnaginia Fummulduria Роды и виды неизвестны Lenargyrion Stenothecopsis
Р"и
с
р р р р р р
рвии р » Р""И
Рис. 12.2. Появление животных с твердыми частями в палеонтологической летописи,
с-образующие кальциевый материал; р-образующие фосфатный материал. Ра-под-
царство Parazoa; Рг-серия Proterostoma; De-серия Deuierusiuina. (См. [578].)
чие на 4 порядка величины в информа-
ционных процессах: любое раздражение
поверхности клетки вызывает сдвиг мем-
бранного электрического потенциала, что
сопровождается быстрым переходом Са2 +
внутрь клетки. Ответ на этот приток каль-
ция зависит от природы клетки; он может
привести к движению, к разряду нервных
импульсов, к биолюминесценции, опреде-
ленным биосинтезам и т.д. [499, 500]. Ре-
гуляция Са2+ нужна и для самого митоза.
Полимеризация белка микротрубочек (по
крайней мере in vitro) очень чувствительна
к концентрации Са2+ [882]. Таким обра-
зом, если бы внутренняя концентрация
кальция повысилась до уровней, харак-
терных для окружающей среды, то многие
фундаментальные процессы были бы
подавлены [443].
Содержание ионов кальция играет так-
288
ГЛАВА 12
Таблица 12.1 Кальциевые биомииералы
Типы (см. Приложение) Карбонаты Фосфаты Окса- латы Галоге- ниды Суль- фаты
АК Ф А К МГК AKA АУ Д Фр CMP CP УВ у АФ Ф Г
Монеры
Ферментирующие бактерии +
Псевдомонады 4- 4-
Omnibacteria ?
Actinobacteria ? +
Протоктисты ( = Протисты)
Dinoflagellata 4-
Haptophyta ? +
Phaeophyta 4-
Rhodophyta 4- 4-
Zygnematophyta 4-
Chlorophyta 4- 4-
Siphonophyta 4- +
Charophyta +
Foraminifera 4- +
Myxomycota 4- 4-
Ciliophora 4-
Растения
Bryophyta + +
Tracheophyta 4-4-4- ? 4- 4-
Грибы
Basidiomycota 4- 4-
Deuteromycota 4- ? ?
Животные
Porifera 4- +
Cnidaria 4- 4- 4-
Platyhelminthes 4- + + +
Bryozoa 4- 4-
Brachiopoda + +
Annelida 4- + 4-4- +
Sipuncula 4- +
Mollusca 4- 4- 4- 4- + -1-4- + + 4- +
Arthropoda 4- + + 4- 4- +
Echinodermata 4- 4-
Chordata 4- 4- 4- 4- 4- 4- 4-4- 4- 4- 4-
Обозначения: АК-аморфный СаСО3; Ф-фатерит; А-арагонит; К-кальцит; МГК-моногидрокальцит; АКА-аморфный карбонатаа
апатит; АУ-аморфный уитлокит; Д-даллит; Фр-франколит; CMP-Ca3Mg3(PO<)2; СР-СавН2(РО4)б-5Н2О; У-уэдделлит; УВ-уэвехяг
АФ-аморфный флюорит; Ф-флюорит; Г-гипс
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ
289
же важную роль в агрегации клеток губок.
Например, у Microciona и Haliciona каль-
ций влияет на видоспецифическую агрега-
цию клеток через посредство гликопротеи-
да с мол. массой около 20 млн., богатого
уроновой кислотой, каждая молекула кото-
рого имеет 1150 мест, связывающих Са2 +
Если концентрация Са2 + в среде падает
ниже 10"5 М, клетки губок диссоциируют;
после восстановления прежней концентра-
ции кальция они реагрегируют, образуя
студенистую массу [499].
Таким образом, внутриклеточная регу-
ляция Са2+ имеет решающее значение для
функций митоза и клеточной агрегации —
непременных условий для поддержания
многоклеточное™ у животных. Почему же
кальций играет столь важную роль? Это
неизвестно, однако Р. Кретсингер высказал
несколько соображений. Он полагает, что
из ионов именно катионы лучше подходят
для быстрой передачи внутриклеточной
информации, поскольку «в биологических
молекулах значительно преобладают отри-
цательно заряженные лиганды, и поэтому
есть больше возможностей для специфиче-
ского сродства к катаонам» [500]. Но по-
чему именно к Са2+, а не к другим широко
распространенным и физиологически
важным катионам, таким как Na+ К +
или Mg2 + ?
Одно из предположений состоит в том,
что карбонаты и фосфаты кальция первы-
ми выделялись в гидросферу и были ис-
пользованы как скелетный материал; их
откачка из клетки и внутриклеточная регу-
ляция развились позднее, и это привело
к использованию Са2 + во внутриклеточной
информационной системе. Этот сценарий
не очень правдоподобен, так как явно не
все эукариоты эволюционировали от пред-
<ов с кальциевыми скелетами, а между тем
внутриклеточная регуляция кальция имеет-
ся у всех изученных эукариот. Например,
мышечная ткань требует регулируемого
освобождения и секвестрирования внутри-
клеточного кальция, а ведь мышцы более
характерны для многоклеточных жи-
вотных, чем скелет.
Позднепротерозойская фауна Эдиа-
кары, впервые описанная по образцам из
Южной Австралии [331], теперь обнаруже-
на в нескольких других местах, разбро-
санных по всему свету: в Англии, Канаде
[656] и Намибии (Н.А. Lowenstam, 1979,
личное сообщение). Около 700 млн. лет на-
зад произошла диверсификация в несколь-
ких главных топах Metazoa (по меньшей
мере среди кишечнополостных, аннелид
и членистоногих) и наступил их расцвет
[152]. Эти животные, в основном обитате-
ли морской литорали, достигали размеров
в несколько дециметров. По крайней мере
некоторые из них были подвижны. Как и
у ближайших современных форм, их под-
вижность, вероятно, обеспечивалась мы-
шечной тканью. Эти животные предшест-
вовали первым биоминерализованным жи-
вотным и намного превосходили их по
размерам. Это значит, что механизмы вну-
триклеточной регуляции кальция появи-
лись еще до образования скелетов. Мы-
шечная ткань состоит из ряда гомоло-
гичных белков. Легкие цепи миозина
и тропонин-это белки, связывающие каль-
ций; они оба нужны для преобразования
химической энергии в механическую.
В этих белках имеются гомологичные аль-
фа-спиральные участки, которые непосред-
ственно связывают кальций и могут
влиять на его внутриклеточные концентра-
ции [498]. Наличие мускулатуры у пред-
ставителей эдиакарской фауны означает,
что регуляция внутриклеточного кальция
получила развитие по меньшей мере за 150
млн. лет до появления твердых скелетных
частей; более того, она должна была пред-
шествовать развитою мышечной ткани.
Инфузории обладают необычной ядер-
но-генетической системой [179, 757, 759];
вероятно, они возникли раньше, чем
Metazoa. Они тоже используют кальций
в информационных целях: сдвиги внутри-
клеточных концентраций Са2+ определяют
характер поведения этих животных
[806-808], включая конъюгацию [186]. Из-
менения в концентрации кальция сильно
влияют также на поведение протистов-сол-
нечников [205] и вызывают сокращение
ризопласта у Platymonas [801]. Эти наблю-
дения согласуются с гипотезой о том, что
модулирование кальция у протистов разви-
лось раньше, чем появились твердые ске-
леты у многоклеточных животных. Что
290
ГЛАВА 12
еще требовалось для развития биоминера-
лизации в нескольких типах?
Хотя на этот вопрос еще нельзя оконча-
тельно ответить, данные ископаемой лето-
писи поучительны. В слоях, содержащих
древнейшие минерализованные скелеты,
встречаются самые ранние недвусмыс-
ленные свидетельства хищничества, напри-
мер просверленные твердые ткани Colellela
billingsi [625] и одной гиполитиды [741].
Ранние Metazoa, обладавшие скелетом,
имели небольшие размеры; это, разумеет-
ся, означает, что на единицу объема у них
приходилась большая поверхность, чем
у бесскелетных форм. Хотя ранние много-
клеточные со сложными скелетами хорошо
известны, они часто предваряют направле-
ние развития сообществ организмов с пло-
хо развитым или слабым скелетом; приме-
рами служат губки, остракоды и трило-
биты, которые появились чуть позже том-
мотия, в атдабании. У них у всех фракция
органического вещества намного больше
биоминеральной фракции (Lowenstam, не-
опубликованные данные). В совокупности
эти наблюдения означают, что предпосыл-
ка для скелетизации, а именно потребность
в выделении во внешнюю среду раство-
римых ионов кальция, во многих группах
организмов возникла очень рано, и она
привела к фактическому образованию ске-
лета, когда появились другие факторы от-
бора, одним из которых, вероятно, было
усиление хищничества, как отмечают Хат-
чинсон [436] и Стэнли [905]. Как действо-
вали эти факторы? Жертва, вынужденная
избегать более эффективных хищников,
развивала высокоинтегрированные сенсор-
ные и двигательные системы, которые уве-
личивали координацию и скорость движе-
ний. Высвобождение кальция непосред-
ственно вызывает сокращение мышц.
Клетки мышечной ткани контролируют
секвестрацию и высвобождение кальция;
в них дифференцировались места накопле-
ния кальция (в саркоплазматическом рети-
кулуме и в митохондриях). У протестов
и мелких Metazoa такие специализиро-
ванные клеточные комплексы располага-
лись вблизи их обширных поверхностей,
тогда как у крупных многоклеточных каль-
ций накапливался во внутренних областях
организма. Некоторые группы организмов
разрешили проблему регуляции кальция
путем экскреции его на кутикулы и по-
кровные ткани [576].
У водорослей, росших в богатой карбо-
натами воде, создавались сходные, но, ве-
роятно, менее жесткие ограничения на вну-
триклеточную концентрацию кальция. Не
имея мышечной и сенсорной систем, непос-
редственно реагирующих на кальций, водо-
росли могли быть более устойчивыми, чем
Metazoa, к изменениям внутриклеточной
концентрации этого иона. Было бы полез-
но узнать ее величины и пределы колеба-
ний у близко родственных обызвест-
вленных и необызвествленных видов
красных, бурых и зеленых водорослей. Не-
которые группы, такие как известковые во-
доросли, либо были неспособны перево-
дить в раствор образующийся внутри них
карбонат кальция, либо получали преиму-
щество от его присутствия, поскольку этот
карбонат предохранял их от поедания жи-
вотными. Возможно, что развитие вос-
ковых кутикулярных веществ у водорослей
было прогрессивным усовершенствова-
нием, которое противодействовало более
примитивной тенденции нагружаться каль-
цием просто в результате его экскреции
[578].
Кретсингер проводит различие между
кальций-модулирующими и кальций-свя-
зывающими белками. Первые содержат
конформацию, называемую «EF-ловуш-
кой» (“EF hand”)-петлю, содержащую
шесть кислородных лигандов, координи-
рующих Са2+, и вторую альфа-спираль
(“thumb”, т.е. «большой палец»). Многие
другие белки, большей частью внекле-
точные, связывают кальций. У них нет EF-
ловушек, и связывание кальция, видимо,
приводит у них в основном к их собствен-
ной структурной стабилизации. Они не
имеют конформации, которая была бы не-
посредственно чувствительна к кальцию,
и потому они не влияют на его внутрикле-
точную концентрацию. Стабильные каль-
ций-связывающие белки, вероятно, не го-
мологичны ни друг другу, ни белкам
с EF-ловушкой. Например, был описан
гликопротеид, который, по-видимому,
образует матрицу для осаждения карбона-
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ
291
та кальция, но, вероятно, не имеет EF-ло-
вушки [1005]. С другой стороны, амино-
кислотная последовательность и трехмер-
ная структура определенных белков, о род-
стве которых даже не подозревали, дают
веские основания полагать, что они на
самом деле произошли от общего предка,
у которого возникла EF-ловушка. К этим
гомологичным чувствительным к кальцию
белкам относятся тропонин, мышечный
парвальбумин карпа, миозин, бычий
Са2 +-связывающий белок, индуцируемый
витамином D, и, вероятно, мембранная
Са2+-АТРаза [499, 501]. Эти белки распре-
делены между организмами, относящими-
ся к весьма отдаленным группам. В на-
стоящее время исследуется возможность
того, что этим белкам гомологичен и бе-
лок микротрубочек. Что касается прока-
риот, неизвестно, есть ли у них белки с EF-
ловушкой или внутриклеточная регуляция
Са2 +
Быстрая выработка твердых скелетов
в фанерозое была поздним достижением
в длинной серии новаций, которые боль-
шей частью происходили внутри клеток
и не оставили следов в ископаемой летопи-
си. К этим новациям относится появление
атмосферного кислорода в количествах,
достаточных для дыхания [164, 990], за ко-
торым последовало симбиотическое при-
обретение митохондрий [246, 608]; даль-
нейшим результатом явилась дифферен-
циация внутриклеточных мембранных си-
стем ядра, эндоплазматического ретикулу-
ма и наружной митохондриальной мемб-
раны. Такие мембранные системы предпо-
лагают способность к синтезу стероидов
и полиненасыщенных жирных кислот; они,
вероятно, послужили преадаптацией для
эндо- и экзоцитоза. Эти эволюционные
усовершенствования привели к возникнове-
нию первых протестов. Приобретение си-
стемы микротрубочек сопровождалось уси-
ленным давлением отбора в направлении
точной регуляции внутриклеточного каль-
ция. Возможно, что первоначально каль-
ций выводился для защиты магнийсодер-
жащих ферментов, которые участвуют
в репликации нуклеиновых кислот и синте-
зе белка, а также для того, чтобы
предотвратить осаждение апатита. Однако
регулирование уровня кальция было необ-
ходимым условием полимеризации микро-
трубочек при обилии кальция в среде.
В связи с этим регулированием у основа-
ния ресничек возникли особые пузырьки,
изолирующие ионы Са2+ [686, 804]. По-
явление митоза в нескольких группах про-
тестов привело к выработке гаплоидно-ди-
плоидных жизненных циклов и в конце
концов-к многоклеточное™, гистогенезу
и органогенезу, включая развитие специа-
лизированных межклеточных соединений:
десмосом, плотных и щелевых контактов
и т.д. Усилению межклеточной и внутри-
клеточной регуляции и высвобождению
кальция сопутствовало повышение специа-
лизации мембранных систем, в том числе
саркоплазматического ретикулума в мы-
шечной ткани. Увеличение подвижности,
в частности ускорение процессов ретрак-
ции (втягивания отростков) у сидячих
многоклеточных животных, привело к эво-
люции более эффективных хищников. Воз-
никло давление отбора, стимулировавшее
развитие более действенных механизмов
избегания. К тому времени все эти сен-
сорные и двигательные приспособления су-
щественно зависели от кальций-модули-
рующих белков с EF-ловушкой. Таким
образом, внутриклеточное образование
и транспорт кристаллов кальцита и араго-
нита с построением из них сложных из-
вестковых скелетов, как У Кириллов [347],
было важным эпифеноменом. Такие ске-
леты могли появиться лишь после того,
как в популяциях эукариот позднего дофа-
нерозоя хорошего развития достиг ряд
других клеточных физиологических процес-
сов.
292
ГЛАВА 12
Растения, животные и хромосомы
Когда я рассматриваю все существа не как результаты отдельных актов творения,
а как прямых потомков немногих существ, живших задолго до отложения первых
пластов кембрийской системы, они облагороживаются в моих глазах. Судя по
прошлому, мы можем с уверенностью заключить, что ни один ныне живущий
вид не передаст своего неизменного подобия отдаленному потомству... Мы можем
даже настолько далеко пророчески заглянуть в будущее, чтобы предсказать, что наибо-
лее обыкновенные и широко распространенные виды, принадлежащие к господствую-
щим группам в пределах каждого класса, окончательно возьмут верх и породят новые
господствующие виды. Так как все современные формы жизни являются прямыми
потомками тех, которые жили задолго до кембрийской эпохи, то мы можем быть
уверены, что обычная последовательность поколений ни разу не была прервана
и что никогда никакие катаклизмы не опустошали всю Землю. Отсюда мы можем
с доверием рассчитывать на безопасное и продолжительное будущее.
Усложненность кембрийской фауны оз-
начает, что «взрыв» в фанерозое стал воз-
можен благодаря бесчисленным предше-
ствовавшим биохимическим усовершенст-
вованиям у мягкотелых организмов [163,
165, 711]. Для самого фанерозойского эона
характерны гораздо более наглядные эво-
люционные тенденции, о которых можно
судить, изучая ныне живущие организмы
и сопоставляя их с ископаемыми находка-
ми. К выдающимся эволюционным фено-
менам, появившимся в последние 500 млн.
лет, относятся агрегация тканей, диффе-
ренцировка органов и систем органов,
сложные формы полового диморфизма,
полиморфные жизненные циклы, достиже-
ние огромных размеров, переходы из во-
дной среды обитания в наземную и воз-
душную, а также сложные поведенческие
взаимодействия особей одного вида и со-
циальная организация [629, 631]. Эти фе-
номены в фанерозойское время важнее
любых новшеств на клеточном уровне.
Имеются данные о том, что по мере воз-
никновения новых уровней биологической,
а затем и социальной организации темп
эволюции ускорялся [721-723]. Подобно
тому как новые тканевые паразиты и сим-
бионты не могли возникнуть, пока не
сформировались подходящие хозяева, так
и сложные феномены зависели от кле-
точных и других усовершенствований, ко-
1 Перевод цитаты взят из «Сочинений»
Ч. Дарвина, т. 3, с. 666, Изд. АН СССР,
1939-Прим. пере в.
Ч. Дарвин, 1859 [203]1
торые им предшествовали на более низких
уровнях организации. Для обширных био-
синтетических путей метаболизма у расте-
ний нужна была предварительная эволю-
ция полигеномных растительных клеток;
системы циркуляции жидкостей у жи-
вотных и сосудистых растений могли
сформироваться только на основе субстра-
тов, созданных предшествующей эволю-
цией структурных материалов-хряща, ко-
сти и лигнина. Животные и растения
фанерозоя смогли заселить Землю только
благодаря тому, что уже имелся мир, под-
готовленный эволюцией наземных, под-
земных, воздушных и водных сообществ
микроорганизмов, которые господствовали
на протяжении трех предыдущих эонов.
Сама клеточная эволюция не прекрати-
лась, хотя стала менее заметной. Сим-
биозы все еще играли важную роль в про-
исхождении новых групп, таких как цика-
довые-шишконосные растения, в корнях
которых поддерживаются симбиотические
ассоциации с цианобактериями из порядка
Nostocales (рис. 12.3). Репликативная при-
рода генетических детерминантов ундули-
подий (центров-организаторов микротру-
бочек, ЦМ) позволяет создать разумную
схему для объяснения ряда эволюционных
феноменов фанерозоя, например понять
клеточную основу определенных эпизодов
видообразования у растений и животных
[629, 912]. Явления адаптивной радиации,
связанные с полиплоидией (у растений)
и кариотипическим расщеплением (у жи-
вотных) [957], могут быть поняты как
Рис. 12.3. Симбионты саговников. А. Саженец
Macrozamia communia с коралловидными корня-
ми (с), в которых обитают цианобактерии.
[С. Р. Nathaniels, I. A. Staff, La Trobe Univ.,
Melbourne.] Б. Поперечный срез коралло-
видных корней; виден внутренний слой коры (i),
наружный слой (о) и слой с цианобактериями
(cb).
сдвиги отношения нуклеоцитоплазма/ЦМ,
сравнимые с вариациями отношения хо-
зяин/симбионты, которые обсуждались в
гл. 7 и 9.
Митоз-это поддержание нормального
соотношения 1/1 между нуклеоцитоплаз-
мой и ЦМ. Мейоз, как впервые предполо-
жил Кливлэнд [156], возник в результате
неразделения кинетохора, а затем-контро-
лируемого пропуска его репликации, кото-
рая в норме сопутствует репликации хро-
матина, т. е. в результате установления
соотношения 2/1 между хроматином и ки-
нетохорами (ЦМ). Хотя широкая рас-
пространенность спаривания соматических
хромосом могла эволюционно предше-
ствовать кроссинговеру между мейотиче-
скими гомологами [899], мейоз, вероятно,
был вначале подхвачен отбором потому,
что он избавлял диплоидные клетки от из-
бытка хроматина. Диплоидизация происхо-
дила, когда родственные клетки были
вынуждены сливаться,-вероятно, первона-
чально в актах каннибализма, который
обычен у протестов. Благодаря генетиче-
ской комплементации продукты слияния
лучше выдерживали воздействие факторов
отбора, чем соответствующие гаплоиды.
Подавление репликации всех имеющихся
в клетке кинетохоров в течение одного кле-
точного деления-это изящный и эффек-
тивный механизм, освобождающий ка-
ждую клетку в точности от одного га-
плоидного набора хромосом [156].
Нарушения численных соотношений
кинетохор/хромосома, по-видимому, лежат
также в основе более поздних эволю-
ционных феноменов. Для нескольких групп
млекопитающих, испытавших эпизоды по-
разительно обильного видообразования,
имеются отличные ископаемые летописи.
Н. Тодд [956, 957] отметил поразительную
корреляцию между этими процессами
адаптивной радиации, с одной стороны,
и увеличением числа и уменьшением раз-
меров хромосом (в обоих случаях пример-
294
ГЛАВА 12
но вдвое)-с другой. В хорошо аргументи-
рованных статьях он высказал предполо-
жение, что основой таких эпизодов видо-
образования у млекопитающих служит ка-
риотипическое расщепление (karyotypic
fissioning) и что эти хромосомные измене-
ния преадаптировали соответствующие
эволюционные линии млекопитающих к
адаптивным радиациям, наступающим
в результате географической или иной изо-
ляции. Кариотипическое расщепление- это
удвоение кинетохоров, приводящее к раз-
рыву каждой хромосомы на две половин-
ки. Его можно рассматривать как резуль-
тат изменения отношения нуклеоцитоплаз-
ма/МЦ или хроматин/кинетохор от 1/1 до
1/2. Экстрарепликация кинетохоров приво-
дит к образованию двух полухромосом
только у медиоцентрической хромосомы
(рис. 12.4); акроцентрические хромосомы
остаются неизмененными. Уже изучено так
много кариотипов и ископаемых историй
млекопитающих, что можно более обосно-
ванно судить об эволюционных отноше-
ниях между этими животными. Тодд [956]
пишет следующее:
«...преобладало мнение, что эволюция кариоти-
па происходит в направлении от больших ди-
плоидных чисел с обилием акроцентрических
хромосом к малым диплоидным числам и уве-
личению числа элементов (хромосом) с субтер-
минальными центромерами. Для объяснения не-
обходимых преобразований обычно привлека-
лась гипотеза центрического слияния Робертсо-
на. Однако по мере накопления кариологиче-
ских данных эта теория становится все более
несовместимой с классическими филогениями
млекопитающих, основанными на данных срав-
нительной анатомии и палеонтологии. Поэтому
следует рассмотреть альтернативную теорию,
по которой из метацентрической хромосомы
в результате расщепления центромерных участ-
ков образуются два маленьких телоцентрика
[см. рис. 12.4], а кариотип эволюционирует от
малых диплоидных чисел к большим; эта тео-
рия заслуживает внимания, несмотря на недо-
статочность цитологических данных о механиз-
ме, лежащем в основе расщепления».
Фактически, согласно представлениям об
истории клетки, изложенным в гл. 9 и 10,
такие цитологические механизмы суще-
ствуют, хотя в литературе по эволюции
млекопитающих они не обсуждались.
Большую часть дискуссий об отношениях
хроматин/кинетохор следует искать в лите-
ратуре по протозоологии, цитологии и
ультраструктуре; однако представление
о том, что предками кинетохора (ЦМ) бы-
ли свободноживущие симбиотические спи-
рохеты, либо игнорируется, либо одобряет-
ся без обсуждения. Между тем теория
Тодда полностью согласуется с независи-
мой, но координированной репликацией
хроматина и ЦМ.
Расщепление рассматривается как ред-
кое событие, происходящее в сперматоге-
незе у всех хромосом одной клетки, кото-
рой суждено дать начало одной особи.
Теория не требует, чтобы после каждого
нового расщепления все новые хромосомы
включались в кариотип всех особей попу-
ляции. Например, крупные Х-хромосомы
несут много коадаптированных групп
сцепленных генов, которые существенно
влияют на столь большое число функций
млекопитающих, что они не смогли бы
перенести расщепления; поэтому в новых
популяциях эти хромосомы остаются неиз-
мененными. Данные о кариотипическом
расщеплении в эволюции хищных, напри-
мер при видообразовании в семействе со-
бачьих, подкрепляют идеи Тодда [957]. На
рис. 12.5 показано, как могли таким спосо-
бом произойти от своих ископаемых пред-
ков различные приматы [327, 328]. Расще-
пление может лежать в основе связи между
близко родственными друг другу широко-
носыми обезьянами, например между коа-
той (2N = 34) и шерстистой обезьяной
(2N = 62). Кариотипическое расщепление
как внутренний механизм изоляции,
играющий важную роль в видообразова-
нии млекопитающих, и далее будет оста-
ваться предметом тщательного исследова-
ния.
Возникновение новых видов растений
путем полиплоидизации [911, 912] тоже
можно рассматривать как подавление ре-
пликации ЦМ при делении цитоплазмы.
При формировании полиплоидов хрома-
тин и кинетохоры реплицируются, но цито-
кинез не наступает. Вероятно, это обусло-
влено тем, что в клетке не образуются
центриоли или эквивалентные им центрио-
лярные ЦМ, а значит, и митотические ве-
ретена. Обычно при этом два новых по-
лных диплоидных кариотипа оказываются
=£ЗУЛЬТАТЫ ФАНЕРОЗОЯ
295
с 12.4. Хромосомные механизмы, преадаптирующие к видообразованию. Кариоти-
з^еское расщепление удваивает число хромосом, сохраняя вместе с тем прежнее коли-
чество генетического материала в диплоидной клетке. Полиплоидия удваивает как чис-
хромосом, так и количество генетического материала. Для сравнения показаны
1гже митоз и мейоз.
296
ГЛАВА 12
МЕЗОЗОЙ КАЙНОЗОЙ
Рис. 12.5. Эволюция кариотипа у приматов [328]. Цифры в скобках-диплоидные числа хромосом.
внутри одной ядерной мембраны, т.е. из
диплоида получается тетраплоид (4N).
Последующая дифференциация хроматина
приводит к новому кариотипу (2N")
(рис. 12.4). Подобно кариотипическому
расщеплению, полиплоидизация служит
преадаптацией к эпизодам видообразова-
ния.
У животных кариотипическое расще-
пление более распространено, чем поли-
плоидизация, так как оно гораздо меньше
нарушает их облигатную диплоидность.
Особи, возникающие в результате расще-
пления, отличаются от своего ближайшего
предка только числом групп сцепления
и кинетохоров; генетический материал
остается тем же самым как в количествен-
ном, так и в качественном отношении, про-
сто он организуется в большее число групп
сцепления. Вероятно, расщепление лежит
в основе адаптивных радиаций гоминоидов
и представителей рода Cercopithecus
(рис. 12.5) [328]. Полиплоидия, наоборот,
примерно удваивает общее количество ге-
нетического материала, что должно немед-
ленно и существенно отражаться на содер-
жании многих генных продуктов и метабо-
литов. По-видимому, эти последствия ле-
гальны для животных, но переносимы для
растений. Каков был вклад кариотипиче-
ского расщепления в видообразование у
растений и беспозвоночных, еще предстоит
выяснить.
Как было отмечено в нескольких кни-
гах по данному вопросу [237, 352], эволю-
ция клетки оказала влияние и на многие
другие стратегии видообразования у расте-
ний и животных. Хотя фанерозой и возве-
стил наступление «Века животных и расте-
ний», но только потому, что задолго до
него монеры и протисты создали со-
ставные части, обмен веществ и меха-
низмы, сделавшие возможными поздней-
шие эволюционные новации.
РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ 297
Гея сегодня: протяженность биосферы
Таким образом, атмосфера-это таинственная связь, которая соединяет животных
с растениями, растения-с царством животных.
Мы рассмотрели эволюцию клетки
в фанерозое, как бы глядя на нее из дофа-
нерозоя. Крупные ископаемые, леса, корал-
ловые рифы и просторы степей-все это
в некоторой мере эпифеномен: коренные
новации в клеточном метаболизме и пове-
дении происходили в архее и протерозое.
Теперь с этого же удобного наблюдатель-
ного пункта (дофанерозоя) мы бегло рас-
смотрим эволюцию фанерозойских экоси-
стем. Мы можем задаваться вопросом,
прогрессировала ли жизнь в последние три
миллиарда лет, но что она расширила свои
владения-это несомненно. Биосфера раз-
рослась, фррмы жизни стали намного раз-
нообразнее, заселенные области увеличи-
лись. Микроорганизмы и даже рыбы были
найдены в океанской бездне на глубине
10 км. Вверх биосфера распространяется
до высоты около 77 км; на этой окраине
она представлена сильно пигментиро-
ванными спорами грибов (Circinella,
Aspergillus, Penicillium, Papulaspora) и аэ-
робными бактериями (Mycobacterium,
Micrococcus) [442]. В сухих долинах Ан-
тарктики обитают эндолитические водо-
росли и грибы, удовлетворяющие свою по-
Ж. Дюма и Ж. Буссенго, 1844 (цит. по [34])
требность в воде конденсирующейся росой
[310]. Населены даже кипящие горячие ис-
точники; разнообразие видов в них невели-
ко, но термофильные микробы здесь выжи-
вают и растут. К своеобразному сообще-
ству организмов привел естественный от-
бор в сернокислых водах с pH 1;
в аммиачных источниках с pH 9 имеются
большие популяции устойчивых форм
[212]. В табл. 12.2 приведены некоторые
физические пределы для роста и выжива-
ния организмов.
Организмы, находящиеся на окраинах
биосферы, полностью зависят от ее сердце-
вины - тропических и умеренных областей.
Как правило, первопроходцами оказы-
ваются монеры. Они все еще в целом луч-
ше, чем эукариоты, адаптируются к экстре-
мальным физическим условиям. Кроме
того, монеры и сегодня снабжают почву
и атмосферу дефицитными элементами
в подходящей форме и достаточном коли-
честве, как делали это в архее и протеро-
зое. Круговорот элементов зависит от про-
кариот как количественно, так и качествен-
но; эукариоты вообще не могли бы суще-
ствовать в мире, лишенном прокариот.
Таблица 12.2. Физические пределы для роста и выживания организмов [635]
Фактор
Пределы для выживания (при экспозиции 1 ч)
Пределы для роста ------------------------------------------
Вегетативные клетки Споры
Температура, °C
Активность воды, aw
Давление, бар
pH
Ультрафиолетовое излу-
чение (260 нм)
Ионизирующее излучение
Питательные вещества
От - 15 до -1-85 0,9—1,0п 600 От -269 до -1-5 0-1 3000 От — 269 до -I-160 0-1 20000
1,5-11,5 1-12 Максимум: 13-14 в 15,3 MNH4OH в те-
Неизвестны 0,1 Дж/см2 чение трех недель 0,1 Дж/см2
Неизвестны 2-4 мрад 2-4 мрад
Варьируют в зависимости от вида; требуется более 25 элементов в оп-
тимальных количествах
1 Для галофильных бактерий 0,6—1,0. Активность воды (аш)-это отношение Рраствора/Рчистой воды- Она зависит только от
количества растворенных веществ, температуры и давления и не зависит от природы растворенных веществ. Для роста всегда
нужна жидкая вода.
298
ГЛАВА 12
По традиции считалось, что условия
среды определяются геологическими и ме-
теорологическими факторами и что жизнь
должна была приспособиться к ним или
погибнуть. Однако по мере более глубоко-
го познания тропосферы, а также благода-
ря догадкам, которыми мы в значительной
мере обязаны английскому ученому и из-
обретателю Джеймсу Лавлоку, станови-
лось все более очевидным, что нижняя ат-
мосфера Земли была сильно модифициро-
вана жизнью, причем так, чтобы поддер-
живать жизнь в еще больших масштабах.
Иначе говоря, живое создает существен-
ную часть своей собственной среды обита-
ния. Эта концепция-«гипотеза Геи»-тема
недавно вышедшей книги Лавлока [567].
Гипотеза Геи заключается попросту
в том, что определенные свойства атмо-
сферы, осадочных отложений и гидро-
сферы контролируются биосферой и для
биосферы. Состав земной атмосферы, если
исключить благородные газы, выглядит
явно аномальным в сравнении с атмосфе-
рами Марса и Венеры, которые предста-
вляют собой миры двуокиси углерода
(табл. 12.3). Например, концентрация кис-
лорода в атмосфере Земли остается по-
стоянной, несмотря на присутствие азота,
метана, водорода и других потенциальных
реагентов. Стабильная щелочность и от-
сутствие крайних температурных отклоне-
ний-это тоже свойства земной поверхно-
сти, в основном, вероятно, обусловленные
жизнью. В противоположность этому нет
данных о том, чтобы жизнь когда-либо вы-
зывала пертурбации атмосферы или оса-
дочных слоев на Марсе [635] или Венере.
Очевидно, Гея существует только на Земле.
Аномалии земной атмосферы далеко не
случайны. По крайней мере в «сердцеви-
не»-в тропических и умеренных обла-
стях-характеристики поверхности и ат-
мосферы отклоняются от значений, выве-
денных путем интерполяции из соответ-
ствующих данных для Марса и Венеры,
и притом отклоняются в направлениях,
благоприятных для большинства видов ор-
ганизмов. Содержание О2 поддерживается
на уровне около 20%, средняя температура
нижней атмосферы-около 22°, а pH-чуть
выше 8. Эта всепланетные аномалии суще-
Таблица 12.3. Атмосферы Венеры, Земли и Марса1
Земля Марс
Венера (н аблюден ия) наблюден ия реконструкция2 наблюдения реконструк- ция2
Двуокись углерода Азот Кислород Вода (осаждаемая), мкм 98% 0,03% 1,9% (Be)3 79% Следы 21% Выше обла- Атмосфера: ков: 5 5 -104 Ниже обла- Океаны: ков: 10 ЗЮ9 98% 1,8% Следы То же, что и по наблюде- ниям 95°/ 2,7% (Ви)4 0,13% 10-20 98% 1,8% Следы 9-Ю6
Температура, К 750 + 10 290 ± 50 220 ± 40
Отношение массы пере- шедших в газ летучих компонентов к массе планеты х 106 100 60 0,7*
Полное атмосферное дав- ление, бар 90 1 65 0,0064 0,1
1 Я признательна T. Оуэну [T.C. Owen, State Univ, of New York] за помощь в составлении этой таблицы.
2 Расчетные предсказания, основанные на возвращении в атмосферу литосферных летучих компонентов (например, льда i
карбонатов).
3 По данным космического корабля «Венера», СССР, 1975.
4 По данным космического корабля «Викинг», США, 1976.
* На Марсе после его сформирования летучих компонентов было, вероятно, недостаточно.
I iiChiiiiui 114 Pvnkiihoiiikm'ikm'oAiimv i м IM ivmiioM М1М<н*(|нфм 1276, 56H, 613, 7H4, 990, 10301
Газ Концентрация Небиологические источники, млрд, тонн/год Биологические источники млрд, тонн/год Время - удержания, годы Основные источники Баланс
Гея1 человек и его деятельность
Азот (N2) 0,79 0,001 1 0 106-107 Денитрифицирующие бактерии 0
Кислород (О2) 0,21 0,00016 ПО 0 103 Фотосинтез водорослей «и растений 0
Двуокись углерода 3,2-10-* 0,01 140 16 2-5 Дыхание и сжигание топлива +
Окись углерода (СО) 8-10"’ 0,001 1,5 0,15 0,3 Окисление метана, сжигание растений (незначительный источник), аэроб- ное бактериальное разложение ге- ма 0
Метан (СН4) 1,5-10-6 0 2 0 5-7 Анаэробные метановые бактерии 0
Углеводороды (СН2)„ 10“9 0 0,2 0,2 0,003 Растения и промышленность ?
Закись азота (N2O) з-ю- <0,01 0,3 10 10 Денитрифицирующие бактерии, бакте- рии, окисляющие аммиак, гетеро- трофные бактерии и грибы +
Окис л ы азота (NOX) ю-’ 0,7 (биологические источ- ники + Гея) 0,16 0,01 Морские бактерии ?
Аммиак (NH3) 6-ю-’ 0 1,5 0 0,01 Бактерии и грибы ?
Сероводород (H2S) и ди- сульфид углерода < 10"“ 0,01 0 0,001 Анаэробные бактерии (например, De- sulfovibrio и фотосинтезирующие бактерии) ?
Двуокись серы (SO2) и карбонилсульфид (COS) ~ Ю’10 0,03 0,07 0,01 Атмосферное окисление, горение +
Диметил сульфид (CH3)2S < 10'“ 0 0,01 0 0,003 Морские водоросли и растения 0
Хлористый метил (СН3С1) ю-’ 0 0,01 0,005 1 Морские водоросли, степные и лесные пожары ?
Йодистый метил (СН31) IQ- 0 0,003 0 0,003 Морские водоросли
Водород (Н2) S'10’ 0,00016 1,0 ? 2 Фотосинтезирующие и ферментирую- щие бактерии, леса, атмосферное окисление метана, фотолиз воды ?
Деятельность всех организмов, кроме человека. Приводимые цифры-весьма приближенные оценки; ведется работа по их уточнению.
300
ГЛАВА 12
ствуют очень длительное время;
«странный» состав земной атмосферы под-
держивается миллионы лет, хотя периоды
обновления реагирующих газов измеряют-
ся годами и месяцами [615].
Крайне невероятно, чтобы поддержание
температуры, pH, концентрации пита-
тельных элементов на оптимальном для
жизни уровне в течение громадных перио-
дов времени было результатом одной
лишь случайности. Это кажется особенно
неправдоподобным в связи с тем оче-
видным фактом, что главные пертурбации
атмосферных газов вызывают сами орга-
низмы-прежде всего микробы (табл. 12.4).
Гораздо более вероятно, что биота актив-
но расходует энергию, чтобы поддержи-
вать эти условия. Возможные механизмы
поддержания оптимумов среды обитания
были рассмотрены в ряде статей Лавлока,
Уотсона и автора этой книги [566, 569, 570,
613-615, 1000]. Мы еще не можем описать
множество взаимодействующих систем об-
ратных связей, которые должны поддер-
живать газы земной атмосферы в состоя-
нии, столь отличном от состояния атмос-
фер Венеры и Марса. Однако мы убе-
ждены в том, что способность выделять
и поглощать химически активные газы вы-
работалась у организмов очень рано и что
атмосферные равновесия типа нынешнего
существовали на нашей планете уже в том
отдаленном прошлом, до которого может
быть прочитана палеонтологическая ле-
топись.
В архейском эоне гомеостатические ме-
ханизмы, вероятно, были иными: опти-
мумы соответствовали анаэробным усло-
виям и, возможно, более высоким темпера-
турам. Активность Солнца на протяжении
последних 3 млрд, лет не была постоян-
ной, хотя детали ее отклонений реконструи-
ровать трудно [299]. Однако жизнь все
это время сохраняла свои позиции: процес-
сы адаптивной радиации вели к появлению
новых видов, которые со временем давали
начало высшим таксонам-современным
типам. Биота оптимизировала условия так.
что сохранялась непрерывность биосферы
во времени. Общее число видов, вероятно,
возросло, хотя во многих группах, несом-
ненно, происходило значительное вымира-
ние. Согласно гипотезе Геи, предполагаю-
щей необходимость регуляции атмосферы,
разнообразие видов - это не роскошь. Мил-
лионы различных видов нужны для под-
держания гибкости, реактивности и избы-
точности перед лицом неизбежных астро-
номических и геологических возмущений,
стремящихся нарушить сложившиеся на
планете условия.
Хотя жизнь распределена неравномер-
но, ее настоящее кипение, ограниченное
в основном метровым слоем около водной
и твердой земной поверхности, прости-
рается на площади около 500 млн. км2
Возможный следующий успех в распро-
странении жизни-это ее выход за пределы
тропосферы в холодные пространства
остальной Солнечной системы, а может
быть, и дальше. Но вот что должно слу-
жить нам предостережением: чтобы про-
должать существовать, жизнь должна
увлажнять и видоизменять среду своего
обитания. Без поддержания разнообразия
видов, способности к быстрому размноже-
нию, взаимодействиям, гибкости и избы-
точности жизнь перестанет поддерживать
сама себя. Было убедительно показано, что
выжить можно и в космосе, но выжива-
ние-это еще не самовоспроизведение.
Вторгнется ли когда-нибудь биосфера в
космическое пространство-это, конечно,
открытый вопрос.
ПРИЛОЖЕНИЕ
ТИПЫ И КЛАССЫ В СИСТЕМЕ С ПЯТЬЮ
ЦАРСТВАМИ ПО УИТТЭЙКЕРУ,
С ИЗМЕНЕНИЯМИ
Надцарство PROKARIOTA (хромонемная организация)
Царство MONERA (МОНЕРЫ)
Прокариотические клетки, бактерии. Питание гетеротрофное, хемоавтотрофное, фото-
-тгеротрофное или фотоавтотрофное. Метаболизм анаэробный, факультативно анаэ-
хюный или аэробный. Размножение бесполое, хромонемное; рекомбинация однона-
правленная или опосредованная вирусами. Неподвижные либо движутся путем
лольжения или с помощью бактериальных жгутиков, состоящих из белка флагеллина.
Эдиночные одноклеточные, нитчатые, колониальные или мицелиальные формы. Неко-
-?рые обладают капсулами, образуют эндоспоры или «плодовые тела».
ТИП 1. Aphragmabacteria: неспособны к образованию клеточных стенок; микоплазмы
(Thermoplasma, Bartonella, Anaplasma)
~ИП 2. Бактерии, осуществляющие брожение: неспособны к синтезу порфиринов; не-
которые молочнокислые бактерии (Clostridium)
~ИП 3. Spirochaetae (спирохеты)
Класс 1. Spirochaetaceae: факультативные или облигатные анаэробы (Spirochaeta,
Treponema, Borrelia)
Класс 2. Cristispiraceae: крупные симбионты (Cristispira, Pillotina, Hollandina)
Класс 3. Leptospiraceae: облигатные аэробы (Leptospira, Leptonema)
~ИП 4. Thiopneutes: анаэробы, восстанавливающие сульфат или серу до H2S; ограни-
ченный синтез гемопротеидов
Класс 1. Desulfovibrio: восстанавливают сульфат, не образуют спор
Класс 2. Desulfotomaculum: восстанавливают сульфат, образуют эндоспоры
Класс 3. Desulfomonas: восстанавливают элементарную серу, не образуют спор
П(П 5. Methaneocreatrices: метансинтезирующие бактерии; анаэробные хемотрофы;
используют СО 2 как акцептор электронов для анаэробного дыхания, восстанавли-
вая его до СН4; некоторые архебактерии (Methanococcus, Methanosarcina,
Methanobacterium)
6. Анаэробные фотосинтезирующие бактерии: синтез Fe- и Mg-тетрапирролов,
хлорофиллов и каротиноидов; фотосистема I.
Класс 1. Пурпурные несерные бактерии: фотогетеротрофы; используют органиче-
ские доноры водорода (Phodopseudomonas, Rhodomicrobium, Rhodospirillum)
Класс 2. Зеленые серные бактерии: в качестве донора водорода используют HaS
• Chlorobium, Chloroflexus)
Класс 3. Пурпурные серные бактерии: в качестве донора водорода используют H2S
iChromatium)
~ИП 7. Cyanobacteria (Cyanophyta): сине-зеленые бактерии (сине-зеленые водоросли);
фотосинтез с выделением кислорода; хлорофилл а и фикобилипротеиды в фикоби-
лисомах; фотосистема I и использование Н2О или H2S как доноров водорода; аэ-
робные или факультативно анаэробные фотосинтетики
Класс 1. Coccogoneaea: коккоидные цианобактерии (Chroococcus, Chamaesiphon,
Pleuricapsa)
Класс 2. Hormogoneaea: нитчатые цианобактерии (Nostoc, Oscillatoria, Stigonema)
8. Chloroxybacteria (Prochlorophyta): прокариотические зеленые водоросли; в ка-
честве донора водорода используют Н2О; фотосинтез с выделением кислорода,
хлорофиллы а и Ь, фикобилипротеидов нет (Prochloron)
“ИП 9. Азотфиксирующие аэробные бактерии (Azotobacter, Beijerinckia, Rhizobium)
Вымершие формы опущены. Перечислены классы только основных типов. Ви-
как не имеющие клеточной организации исключены из списка; см. табл. 2.8.
302
ПРИЛОЖЕНИЕ
РАСТЕНИЯ
(ran ло-дипл оидные)
ЖИВОТНЫЕ
диплоидные)
'ARTHROPODA/*^-
/ М ZSSMOLUJSCA
ГРИБЫ
s'* -"^(гаплоидные,
WC0PHYC0PHYTA \ДИЮРИОТИЧСС'
/тйл Ткие)
ANGIOSPERMOPHYTA |runDn.,5
CYCAOOPHYYA / CHORDATA
I / I ^CHINOOERMATAlwHEUO?^ /
\ / I X. \ \ \ TARDIGRADA
X/SPHENOPHYTA HEMICHORDATA BRACHIOPODA / /
- • ‘ ‘ * PRIAPULIDA (
У ACHIURA \
cTSIPUNCULA
TH0R0NIDA )
CONIFEROPHYTA
Гистогенез 1gnetophyta^
NEMATODA Ч
/ ROTIFERA
BASIDIOMYCOTA
ASC0MYC0TA
ЭмБриогенез\ГГСО₽ОООРМ¥ТА
,--------
/ У-GASTRQTRICHA) *
>£>kinorhyncha 7
'ACANTHOCEPHALAУ
ZYGOMYCOTA
NEMERTINA
ПРОТОКТИСТЫ/
I RHODOPHYTA
\ PHAEOPHYTA
МеиозХ
Гаструлы
бластулы
Дикариоз
/OOMYCOTA
'gamophyta
Гаметогенез
Митоз
Стероидогенез,
f CNIDOSPORIDIA
AMcoMPiexA chyyrioiomycota
PLASMODIQPHOROMYCOTA^^
HYPHOCHYTR1OIOMYCOTA
KCTINOPODA J». Мицелии
•У ----- FORAMINIFERA Ж'
< CHRYSOPHYTA Л JwDMYCOTA,
rXiHAPTOPHYTAKS EUGLENOPHYTA ACRASlOMYCOTA
EUSTIGMATOPHYTA LABYRINTHULAMYt
k CILIOPHORA
CYANOBACTERIA ^y DINOFLAGELLATA
'антп
X. Аэровиоз
ITERIA X
MYXOBACTER1A1
Фотосинтез
. ФОТОСИНТЕЗИРУЮ"
1ЩИЕ БАКТЕРИИ
' < микрококки J
^^“псевдомонАды У
/ Споры
Фототаксис
\ THIOPNETES
Подвижность X
METHANEOCREATRICES /
SPIROCHAETAE
AEROENDOSPORA
WMNIBACTERIA
I
/ АЗОТфИКСИРУЮЩИЕ
I БАКТЕРИИ
БРОДИЛЬНЫЕ
БАКТЕРИИ
Хемотаксис
-Хромонемные —-----------------------------------------------------------------------------------------------------► ----------------------------------------------------------------------Хромосомные
МОНЕРЫ
APHRAGMABACTERIA
Брожение
%
Репродукция
ТИП 10. Псевдомонады: аэробные гетеротрофы; грам-отрицательные, метаболизм
дыхательный (Pseudomonas, Hydrogenomonas, Halobacterium)
ТИП 11. Aeroendospora: аэробные эндоспоровые бактерии (Bacillus).
ТИП 12. Micrococci: грам-положительные аэробы; имеется цикл Кребса (Paracoccus,
Sarcina, Gaffkya)
ТИП 13. Хемоавтотрофные бактерии
Класс 1. Бактерии, окисляющие серу (Thiobacillus)
Класс 2. Бактерии, окисляющие аммиак (Nitrobacter, Nitrosomonas, Nitrosocystis)
Класс 3. Бактерии, окисляющие железо (Ferrobacillus)
ТИП 14. Omnibacteria: аэробные грам-отрицательные гетеротрофные бактерии
Класс 1. Enterobacteria: колиформные, факультативные анаэробы (Escherichia,
Salmonella, Serratia)
Класс 2. Бактерии с простеками (Caulobacter, Hyphomicrobium).
Класс 3. Группа Sphaerotilus: образуют характерные клеточные агрегаты (Sphae-
rotilus, Leptothrix)
СИСТЕМА С ПЯТЬЮ ЦАРСТВАМИ
303
Класс 4. Уксуснокислые бактерии: имеют прямоугольные капсулы (Cluconobacter,
Acetobacter)
Класс 5. Группа Moraxella-Neisseria: безжгутиковые (Neisseria, Moraxella, Aci-
netobacter)
Класс 6. Хищные бактерии: размножаются внутри хозяина, имеют полярные жгути-
ки (Bdellovibrio)
Класс 7. Микроаэрофильные бактерии: спиральные клетки с полярными жгутиками
(Spirillum); единственный толстый полярный жгутик (Campylobacter)
Класс 8. Vibrioaceae и родственные группы (Aeromonas, Photobacterium, Вепескеа)
Класс 9. Аэробные и факультативно аэробные палочки (Pasteurella, Actinobacillus)
Класс 10. Хламидии и риккетсии: окислители глутамата (Coxiella)
ТИП 15. Actinobacteria (Actinomycota): грам-положительные коринеформные и мице-
лиальные бактерии
Класс 1. Коринеформные бактерии (Arthrobacter, Propionibacterium)
Класс 2. Proactinomycetes (Mycobacterium, Actinomyces, Nocardia, Streptomyces)
ТИП 16. Myxobacteria: гетеротрофные аэробные скользящие бактерии
Класс 1. Нитчатые и одноклеточные скользящие бактерии: цитофаги и флексибак-
теры (Beggiatoa, Saprospira, Vitreoscilla)
Класс 2. Миксобактерии, образующие «плодовые тела» (Myxococcus, Chondromyces,
Polyangium)
Надцарство EUKARIOTA (хромосомная организация)
Царство PROTOCTISTA (ПРОТОКТИСТЫ)
Эукариотические клетки. Питание путем заглатывания, всасывания или если автотроф-
ное, то с помощью фотосинтезирующих пластид. Размножение бесполое, премитотиче-
ское или эумитотическое половое1. У эумитотических форм имеются мейоз и оплодо-
творение, но детали цитологии, жизненного цикла и уровня плоидности варьируют от
одной группы к другой. Организмы одиночные одноклеточные или многоклеточные.
Большинство обладает ундулиподиями (эукариотическими жгутиками или их более ко-
роткими аналогами - ресничками), состоящими из микротрубочек, расположенных по
схеме 9 4- 2. У всех представителей отсутствуют зародышевые стадии и сложные меж-
клеточные соединения (например, десмосомы). Большинство видов-обитатели вод.
Первично одноклеточные формы иногда относят к более ограниченному царству
Protista (протистов)2.
ТИП 1. Caryoblastea (Pelobiontida): амйтотические амебы (Pelomyxa palustris). Пр
ТИП 2. Dinoflagellata (Mesokaryota): динофлагелляты (Gymnodinium, Peridinium). Пр
ТИП 3. Sarcodina (Gymnamoebida) и Rhizopoda: голые амебы (Entamoeba, Paramoeba,
Flabellula); голые и раковинные амебы-корненожки и глубоководные
ксенофиофоры3 (Amoeba, DiJJlugia, Rhizochrysis, Entamoeba, Chrysarachnion, Arcella,
Psametta, Stannophyllum). Пр
ТИП 4. Chrysophyta: хризофиты, золотисто-желтые водоросли и Raphidiophyta (хлоро-
монады) (Ochromonas, Echinochrysis, Sarcinochrysis). Пр
ТИП 5. Haptophyta: гаптофиты, или кокколитофориды; имеют гаптонемы (Нуте-
nomonas, Pontosphaera). Пр
ТИП 6. Euglenophyta: эвгленовые (Euglena, Peranema, Astasia). Пр
ТИП 7. Cryptophyta: криптомонады (Cryptomonas, Cyanomonas, Cyathomonas). Пр
ТИП 8. Zoomastigina: «зоофлагелляты», мастиготы. Пр
Класс 1. Schizopyrenida: лишены телец Гольджи, или диктиосом (Vahlkamfiidae); аме-
бофлагелляты (Naegleria)
Класс 2. Opalinida: двуядерные; с многочисленными ундулиподиями; опалиниды
(Opalina)
Класс 3. Choanoflagellida, или краспедомонады: воротничковые мастиготы, неко-
торые содержат пластиды (Monosiga, Desmarella)
304
ПРИЛОЖЕНИЕ
Класс 4. Bicoecidea: раковинные бимастиготы; одна ундулиподия прикрепленная,
другая свободная
Класс 5. Kinetoplastida: бодо и трипаносомы (Bodo, Crithidia, Trypanosoma)
Класс 6. Diplomonadida: дипломонады; двойные ядра и органеллы (Diplomonas,
Giardia)
Класс 7. Pyrsonymphida (Oxymonadida): нет парабазальных телец; длинные аксости-
ли (Oxymonas, Pyrsonympha, Notila, Saccinobaculus)
Класс 8. Parabasalia: с характерными парабазальными тельцами (аппарат Гольджи)1
Отряд 1. Trichomonadida: трихомонады (Hexamastix, Histomonas, Trichomonas)
Отряд 2. Polymonadida: многоядерные полимонады (Calonympha, Coronympha)
Отряд 3. Hypermastigida: гипермастиготы (Lophomonas, Joenia, Barbulanympha,
T richonympha).
ТИП 9. Xanthophyta: желто-зеленые водоросли (Tribonema, Botryococcus). Пр
ТИП 10. Eustigmatophyta: водоросли с настоящим «глазком» (стигмой) (Pleurochloris,
Vischeria). Пр
ТИП И. Bacillariophyta: диатомовые водоросли (Surirella, Navicula, Planktoniella). Пр
ТИП 12. Phaeophyta: бурые водоросли (Fucus, Dictyota). Р
ТИП 13. Rhodophyta: красные водоросли (Bangia, Porphyra, Nemalion). Р
ТИП 14. Gamophyta (Zygnematophyta, или Conjugaphyta): конъюгирующие зеленые во-
доросли (Spirogyra, Zygnema, десмидиевые). Р
ТИП 15. Chlorophyta: зеленые водоросли. Р
Класс 1. Chlorales (Chlamydomonas, Tetraspora, Oedogonium, Ulva, Vblvox)
Класс 2. Siphonales: сифоновые синцитиальные зеленые водоросли (Acetabularia,
Penicillus, Caulerpa, Codium)
Класс 3. Charales: харовые зеленые водоросли (Nitella, Chara)
ТИП 16. Actinopoda: солнечники (Echinosphaerium, Actinophrys); акантарии (Acantharia);
полицистины, или спуммеларии (Thalassicola) и фео дарии (прежнее название-ра-
диолярии). Пр
ТИП 17. Foraminifera: фораминиферы (Globigerina, Nodosaria) и филозии (голые
и имеющие сетчатую раковину амебы). Пр
ТИП 18. Ciliophora: инфузории. Пр
Класс 1. Kinetofragminophora: гимностомы1, вестибулиферы, гипостомы и сосущие
инфузории (Entodiniomorpha, Tokophrya)
Класс 2. Oligohymenophora: гименостомы и перитрихи \Tetrahymena, Chilodenella,
Paramecium, Vorticella, Epistylis)
Класс 3. Polyhymenophora: спиротрихи (Stentor, Blepharisma, Stylonychia, Euplotes,
тинтинниды)
ТИП 19. Apicomplexa (Sporozoa, или Telosporidea): паразиты. Пр
Класс 1. Sporozoasida: грегарины и кокцидии (Gregarina, Eimeria, Isospora, Plasmo-
dium)
Класс 2. Piroplasmasida (Babesia)
ТИП 20. Cnidosporidia: паразитические книдоспоридии; с полярными капсулами. Пр2
Класс 1. Микроспоридии (Nosema)
Класс 2. Миксоспоридии (Myxobolus, Henneguya)
Класс 3. Актиномиксидии (Sphaeractinomyxon)
Класс 4. Мартейлиидии (Marteilia)
ТИП 21. Labyrinthulamycota: водные гифомицеты; траустохитриды (Labyrinthula,
Labyrinthorhiza, Тhraustochytrium). Пр
ТИП 22. Acrasiomycota: свободноживущие миксамебы (Guttulinopsis, Acrasia). Гр
ТИП 23. Myxomycota: пл аз мо ди а льны е слизевики, Гр
Класс 1. Протостелиды (Protostelium, Ceratiomyxa)
Класс 2. Диктиостелиды (Dictyostelium, PolysphondyHum)
Класс 3. Миксогастриды: миксомицетные плазмодиальные слизевики (Physarum,
Echinostelium)
ТИП 24. Plasmodiophoromycota: плазмодиофоромицеты (Plasmodiophora, Spongospora,
Woronina, Polymyxa). Гр
СИСТЕМА С ПЯТЬЮ ЦАРСТВАМИ
305
ТИП 25. Hyphochytridiomycota: гифохитридиевые; на переднем конце одиночная хлы-
стовидная ундулиподия (Rhizidiomyces, Anisolpidium). Гр
ТИП 26. Chytridiomycota: хитридиевые; одиночная ундулиподия на заднем конце; вод-
ные плесени. Гр
Класс 1. Хитриды (Olpidium, Synchytrium)
Класс 2. Бластокладиевые (Allomyces, Blastocladielld)
Класс 3. Моноблефариды (Monoblepharis, Gonapodya)
Класс 4. Гарпохитриды (Нarpochytrium)
ТИП 27. Oomycota: оомицетные водные плесени (Saprolegnia, Albugo, Achlya, Pythium,
Phytophthora). Гр
Царство FUNGI (ГРИБЫ)
Гаплоидные или дикариотические, мицелиальные или вторично одноклеточные орга-
низмы. Имеют хитиновые клеточные стенки и всегда питаются путем всасывания ве-
ществ. Никогда не имеют ресничек или ундулиподий типа 9 + 2. Тело часто развет-
вленное, состоящее из гиф - ценоцитных нитей, которые могут быть разделены
перфорированными септами^ Пиноцитоз и фагоцитоз отсутствуют. Энергичное движе-
ние цитоплазмы. Зиготический мейоз; размножаются гаплоидными спорами.
ТИП 1. Zygomycota: зигомицетные плесени (Phycomyces, Rhizopus, Mucor)
ТИП 2. Ascomycota: сумчатые грибы, или аскомицеты.
Класс 1. Hemiascomycetae: дрожжи и грибы, скручивающие листья (Endomyces,
Saccharomyces, Sch izosaccharomyces)
Класс 2. Euascomycetes: плесневые и другие грибы (Aspergillus, Penicillium,
Neurospora, Sordaria, чашевидные грибы, сморчки, трюфели, Ascobolus)
Класс 3. Loculoascomycetae: локулоаскомицеты (Elsinoe, Ophiobus, Cucurbitana)
Класс 4. Laboulbeniomycetae: паразиты насекомых (Laboulbenia, Herpomyces)
ТИП 3. Basidiomycota: базидиальные грибы
Класс 1. Heterobasidiomycetae: студенистые, ржавчинные, головневые (Puccinia, Usti-
lago)
Класс 2. Homobasidiomycetae: шляпочные грибы и др. (Agaricus, Schizophyllum,
Coprinus)
ТИП 4. Deuteromycota: несовершенные грибы (Cryptococcus, Candida, Monilia,
Histoplasma, Rhizoctonia)
ТИП 5. Mycophycophyta: лишайники; гриб + сине-зеленая водоросль (часто Nostoc)
или гриб + зеленая водоросль (часто Trebouxia или Pseudotrebouxia)
Царство ANIMALIA (ЖИВОТНЫЕ)
Многоклеточные гетеротрофы. Гаметический мейоз; анизогамное оплодотворение;
лкрматозоид и яйцеклетка образуют зигрту, которая дробится, образуя диплоидную
гластулу, после чего обычно следует гаструляция. Питание гетеротрофное: иногда
□пца поглощается путем фагоцитоза и пиноцитоза, в других случаях всасывается.
Далеко идущая клеточная и тканевая дифференцировка; десмосомы, щелевые соеди-
нения и другие дифференцированные межклеточные связи.
Подцарство Parazoa
ТИП 1. Placozoa: двуслойные с дорсовентральной организацией; полярность и билате-
ральная симметрия отсутствуют
ТИП 2. Porifera: губки
Класс 1. Calcarea: с известковыми спикулами
306
ПРИЛОЖЕНА
Класс 2. Demospongiae: скелет-спонгиновая сеть с кремневыми спикулами или без
них
Класс 3. Sclerospongiae: скелет-спонгиновая сеть с кремневыми спикулами или без
них; базальный скелет из арагонита
Класс 4. Hexactinellida: с кремневыми трехосными спикулами
Подцарство Eumetazoa
Ветвь Radiata: радиально симметричные организмы
ТИП 3. Cnidaria: кишечнополостные
Класс 1. Hydrozoa: гидроидные полипы
Класс 2. Scyphozoa: настоящие медузы
Класс 3. Anthozoa: коралловые полипы и актинии
ТИП 4. Ctenophora: гребневики
Ветвь Bilateria: билатерально симметричные организмы
Ранг Acoelomata: полость тела отсутствует
ТИП 5. Mesozoa: мезозой
ТИП 6. Platyhelminthes: плоские черви
Класс 1. Turbellaria: планарии
Класс 2. Trematoda: сосальщики
Класс 3. Cestoda: ленточные черви
ТИП 7. Nemertina: немертины
ТИП 8. Gnathostomulida: челюстноротые черви
Ранг Pseudocoelomata: мезодермальный целом отсутствует
ТИП 9. Gastrotricha: брюхоресничные
ТИП 10. Rotifera: коловратки
ТИП 11. Kinorhyncha: киноринхи
ТИП 12. Acanthocephala: скребни
ТИП 13. Entoprocta: камптозои
ТИП 14. Nematoda: круглые черви (Ascaris, Caenorhabditis)
ТИП 15. Nematomorpha (Gordiaceae: волосатиковые)
Ранг Coelomata: имеют мезодермальный целом
Серия Первичноротые: бластопор становится ртом
ТИП 16. Ectoprocta: мшанки
ТИП 17. Phoronida: форониды
ТИП 18. Brachiopoda: плеченогие
Класс 1. Inarticulata
Класс 2. Articulata
ТИП 19. Mollusca: моллюски
Класс 1. Monoplacophora: моноплакофоры (Neopilina}
Класс 2. Aplacophora: бороздчатобрюхие
Класс 3. Polyplacophora: хитоны
Класс 4. Scaphopoda: лопатоногие
Класс 5. Gastropoda: брюхоногие, или улитки
Класс 6. Bivalvia: двустворчатые (мидии, устрицы)
Класс 7. Cephalopoda: головоногие (кальмары, осьминоги)
ТИП 20. Priapulida: приапулиды
ТИП 21. Sipuncula: сипункулиды
ТИП 22. Echiura: эхиуриды (Urechis)
СИСТЕМА С ПЯТЬЮ ЦАРСТВАМИ
ТИП 23. Annelida: кольчатые черви
Класс 1. Oligochaeta: малощетинковые кольчецы
Класс 2. Polychaeta: многощетинковые кольчецы
Класс 3. Clitellata (Hirudinea): пиявки, дождевые черви
ТИП 24. Tardigrada: тихоходки
ТИП 25. Pentastoma: циноглоссовые, морские языки
ТИП 26. Onychophora: онихофоры (Peripatus)
ТИП 27. Arthropoda: членистоногие
[Надкласс 1. Chelicerata]
Класс 1. Mero stomata: ракоскорпионы
Класс 2. Pycnogonida: морские пауки
Класс 3. Arachnida: скорпионы, сенокосцы, клещи, пауки
[Надкласс 2. Mandibulata]
Класс 4. Crustacea: ракообразные
Класс 5. Myriapoda: многоножки
Класс 6. In sect а: насекомые
Серия Вторичноротые: бластопор становится анальным отверстием
ТИП 28. Pogonophora: погонофоры
ТИП 29. Echinodermata: иглокожие
Класс 1. Crinoidea: морские лилии
Класс 2. Asteroidea: морские звезды
Класс 3. Ophiuroidea: змеехвостки
Класс 4. Echinoidea: морские ежи
ТИП 30. Chaetognatha: щетинкочелюстные
ТИП 31. Hemichordata: (Balanoglossus, Rhabdopleura, Cephaladiscus)
ТИП 32. Chordata: хордовые
Подтип 1. Urochordata: оболочники, асцидии, сальпы, Didemnis
Подтип 2. Cephalochordata: бесчерепные (Amphioxus)
Подтип 3. Craniata (Vertebrata): позвоночные
Класс 1. Agnatha: круглоротые (миноги, миксины)
Класс 2. Chondrichthyes: хрящевые рыбы
Класс 3. Osteichthyes: костные рыбы
Класс 4. Amphibia: амфибии
Класс 5. Reptilia: рептилии
Класс 6. Aves: птицы
Класс 7. Mammalia: млекопитающие
Царство PLANTAE (РАСТЕНИЯ)
Многоклеточные автотрофы; содержат хлорофиллы а и Ь. Преимущественно наземные
формы. Развитая тканевая дифференциация. Гаметический мейоз и анизогамное опло-
дотворение; диплоидная фаза развивается путем эмбриогенеза. Нередко синтезируют
сложные вторичные вещества (например, антоцианы и терпеноиды).
Ранг Bryophyta
ТИП 1. Bryophyta
Класс 1. Anthocerotae: роголистники
Класс 2. Hepaticeae: печеночники
Класс 3. Musci: мхи
Ранг Tracheophyta: сосудистые растения
ТИП 2. Lycopodophyta: плауны (Lycopodium, Selaginella, Isoetes)
ТИП 3. Sphenophyta (Equisetophyta): хвощи (Equisetum)
ТИП 4. Filicinophyta (класс Filicinae): папоротники (Polypodium, Osmunda)
ТИП 5. Cycadophyta: саговники (Zamia, Cycas)
308
ПРИЛОЖЕНИЕ
ТИП 6. Coniferophyta: хвойные
Класс 1. Taxales: тис (Taxus)
Класс 2. Pinales: сосна, ель, пихта, Tsuga. Cedrus
ТИП 7. Gnetophyta
Класс 1. Ephedrales (Ephedra)
Класс 2. Welwitschiales (Welwitschia)
Класс 3. Gnetales (Gnetum)
ТИП 8. Angiospermophyta: Anthophyta, Magnoliophyta, или цветковые растения
Класс 1. Liliatae (Monocotyledoneae): однодольные (злаки, орхидные, лилейные,
пальмы)
Класс 2. Magnoliatae (Dicotyledoneae): двудольные (кактусы, розы, маргаритки,
бобовые)
ЛИТЕРАТУРА
1. Aaronson S., Hutner S.H. Biochemical markers
and microbial phylogeny, Q. Rev. Biol., 41,
13-46 (1966).
2. Abelson P. H. Organic geochemistry, J. Wash.
Acad. Sci., 53, 105-115 (1963).
3. Abelson P. H. Abiogenic synthesis in the
Martian environment, Proc. Natl. Acad. Sci.
USA, 54, 1490-1494 (1965).
4. Abelson P. H., Hoering T. C. Carbon-isotope
fractionation in formation of amino acids by
photosynthetic organisms, Proc. Nat. Acad. Sci.
USA, 47, 623-632 (1961).
5. Ahmadjian V. Experimental observations on the
algal genus Trebouxia de Puymaly, Sven. Bot.
Tidskr., 53, 71-80 (1959).
6. Ahmadjian V. Lichens: Natur’s pioneers, Mass.
Audubon Society Newsletter (Winter), 1961.
7. Ahmadjian V. The fungi of lichens, Scientific
American, 208, 122-132 (1963).
8. Ahmadjian V. Lichens in symbiosis. In:
Symbiosis, vol. 1, S.M. Henry, ed., New York,
Academic Press, pp. 35-97, 1966.
9. Ahmadjian V. The Lichen Symbiosis, Waltham,
Mass., Blaisdell, 1967.
10. Ahmadjian V. Separation and artificial synthesis
of lichens. In: Cellular Interactions in
Symbiosis and Parasitism, С. B. Cook et al.,
eds., Columbus, The Ohio University Press,
pp. 3-29, 1980.
11. Ainsworth G. C., Sneath P. H. A., eds. Microbial
Classification, 12th Symposium of the Society
for General Microbiology, Cambridge,
Cambridge University Press, 1962.
12. Alexopoulos C.J. Introductory Mycology, 2nd
ed, New York, John Wiley and Sons, 1962.
13. Alexopoulos C. J., Bold H.C. Algae and Fungi,
New York, Macmillan, 1967.
14. Allen J.R., Roberts T.M., Loeblich A.R., III,
Klutz C. G. Characterization of the DNA from
the dinoflagellate Cryptothecodinium cohni and
implication for nuclear organization, Cell, 6,
161-169 (1975).
15. Allen M.M. Ultrastructure of the cell wall and
cell division of unicellular blue-green algae, J.
Bacteriol., 96, 842-852 (1968).
16. Allen R. D. A reinvestigation of cross-sections of
cilia, J. Cell Biol., 37, 935-831 (1968).
17. Allsopp A. Phylogenetic relationships of the
procaryotes and the origin of the eucaryotic
cell, New Phytologist, 68, 591-612 (1969).
18. Almassy R.J., Dickerson R.E. , Pseudomonas
cytochrome c 551 at 2.0 A resolution.
Enlargement of the cytochrome c family, Proc.
Natl. Acad. Sci. USA, 75(6), 2674-2678 (1978).
19. Altman P. L, Dittmer D.S., eds. Biology Data
Book, Bethesda, Md.: Federation of American
Societies for Experimental Biology, 1972.
20. Altmann K. Die Elementarorganismen und ihre
Beziehungen zu den Zellen, Leipzig, Viet, 1890,
1894.
21. Amoore J. E. Arrest of mitosis by oxygen-lack
or cyanide, Proc. R. Soc. Lond., В 154, 95-108
(1961).
22. Amoore J. E. Dependence of mitosis and
respiration in roots upon oxygen tension, Proc.
R. Soc. Lond., В 154, 109-116 (1961).
23. Anders E., Owen T Mars and Earth: origin and
abundance of volatiles, Science, 198, 453-465
(1977).
24. Andreasen A. A., Stier T. J. B. Cited in
D. E. Green and D. W. Allman, 1968.
Biosynthesis of fatty acids. In: Metabolic
Pathways, vol. 2, D. Greenberg, ed., New York,
Academic Press, 1954.
25. Anonymous, “Our bookshelf’ [review of
Portier (1918)], Nature, 103, 482-483 (1919).
26. Appelquist L. H., Boynton J. E., Stumpf P. K., van
Wettstein D. Lipid biosynthesis in relation to
chloroplast development in barley, J. Lipid
Res., 9, 425-436 (1968).
27. Appelquist L. H., Stumpf P. K., von Wettstein D.
Lipid synthesis and ultrastructure of isolated
barley chloroplasts, Plant Physiol., 43, 163-187
(1968).
28. Arnold C. A. Introduction to Paleobotany, New
York, McGraw-Hill, 1949.
29. AshendorfD. Are sulfur isotope ratios
sufficient to determine the antiquity of sulfate
reduction? Origins of Life. In press.
30. Asimov I. Biographical Encyclopedia of Science
and Technology, New York, Avon Books, 1972.
31. Atema J. Microtubule theory of sensory
transduction, J. Theor. Biol., 38, 181 (1973).
32. Atema J. Stimulus transmission along
microtubules in sensory cells: an hypothesis.
In: Microtubules and Microtubule Inhibitors,
M. Borgers and M. De Brabander, eds.,
Amsterdam, North-Holland, pp. 247-257, 1975.
33. Atsatt P. R. Hemiparasitic flowering plants:
phenotypic canalization by hosts, Nature, 225,
1161-1163 (1970).
34. Aulie R. P. Boussingault and the nitrogen cycle,
Proc. Am. Philos. Soc., 114, 435-478 (1970).
35. Awramik S. M. The pre-Phanerozoic biosphere:
310
ЛИТЕРАТУРА
three billion years of crises and opportunities.
In: Biotic Crises in Ecologic and Evolutionary
Time, M. H. Nitecki, ed., New York, Academic
Press, 1980.
36. Awramik S. M. Evidence for pre-Phanerozoic
life, Proceedings of the Field Museum
Conference. In press.
37. A wramik S. M., Barghoorn E. S. The Gunflint
microbiota, Precambrian Res., 5, 121-143
(1977).
38. Awramik S. M., Barghoorn E. S. Bibliography of
Precambrian Paleontology and Paleobiology,
Botanical Museum Leaflet, Harvard University,
26, 1-175 (1978).
39. Awramik S. M., Barghoorn E. S., Margulis L.
Evolutionary processes in the formation of
stromatolites. In: Stromatolites (Developments
in Sedimentology, vol. 20), M. Walter, ed.,
Amsterdam, Elsevier, Ch. 4.4, 1976.
40. Awramik S. M., Haupt A., Hofinann H. J.,
Walter M. R. Stromatolite bibliography 2,
Precambrain Res., 9, 105-166 (1979).
41. Awramik S. M., Schopf J. W., Walter M. R.,
Buick R. Filamentous fossil bacteria, 3.5 • 109
years old from the Archean of Western
Australia, Science. In press.
42. Bamje M.S., Krinsky N.I. Carotenoid deepo-
xidation in algae: Enzymatic conversion of
antheraxanthin to zeaxanthin, J. Biol. Chem.,
240, 467-470 (1965).
43. Banerjee S., Kelleher J. K., Margulis L. The
herbicide trifluralin is active against
microtubule-based oral morphogenesis in
Stentor, Cytobios, 12, 171-178 (1975).
44. Banerjee S., Margulis L. IPC reversibly inhibits
cilia regeneration in Stentor coeruleus, Nature,
224, 180-181 (1969).
45. Banks H. P. Evolution and Plants of the Past,
Belmont, Calif., Wadsworth, 1970.
46. Banks H. P. Major evolutionary events and the
geological record of plants, Biol. Rev. (Camb.),
45, 451-454 (1970).
47. Banks H. P. Evolutionary History of Plants,
Belmont, Calif., Wadsworth, 1972.
48. Banks H. P. The stratigraphic occurence of
early land plants, Palaeontology, 15, 365-397
(1972).
49. Barath Z., Kuntzel H. Cooperation of mito-
chondrial and nuclear genes specifying the
mitochondrial genetic apparatus in Neurospora
crassa, Proc. Natl. Acad. Sci. USA, 69,
1371-1374 (1972).
50. Barghoorn E. S. In: The Origins of Life, L.
Margulis, ed., 1st Interdisciplinary
Communications Program, New York, Gordon
and Breach, 1970.
51. Barghoorn E. S. The oldest fossils, Scientific Ame-
rican, 224, 30-42 (1971).
52. Barghoorn E. S. Two billion years of
prokaryotes and the emergence of eukaryotes,
Taxon, 23, 259 (1974).
53. Barghoorn E. S., Knoll A. H., Dembicki H.,
Meinschein W.G. Variation in stable carbon
isotopes in organic matter from the Gunflint
Iron Formation, Geochim. Cosmochim. Acta,
41, 425-430 (1977).
54. Barghoorn E. S., Schopf J. W. Microorganisms
from the late Precambrian of Central Australia,
Science, 150, 337-339 (1965).
55. Barghoorn E. S., Schopf J. Microorganisms
three billion years old from the Precambrian of
South Africa, Science, 152, 758-763 (1966).
56. Barghoorn E. S., Tyler S. A. Microorganisms
from the Gunflint chert, Science, 14, 563-577
(1965).
57. Barker W. C., Dayhoff M. O. Evolution of
proteins deduced from protein sequence data,
Comp. Biochem. Physiol., 57B, 309-315 (1977).
58. Barker W. C., Ketcham L. K., Dayhoff M. O.
Evolutionary relationships among cal-
cium-binding proteins and calcium function. In:
Calcium-Binding Proteins and Calcium
Function, R. H. Wasserman, ed., Amsterdam,
Elsevier, North-Holland, 1977.
59. Basden E. H., Tourtellotte M. E., Plastridge
W. N., Tucker V. S. Genetic relationships among
bacteria classified as vibrios, J. Bacteriol., 95,
439-443 (1968).
60. Bassham J. A. Photosynthesis: the path of
carbon. In: Plant Biochemistry, J. Bonner and
J. E. Verner, eds., New York, Academic Press,
pp. 875-902, 1965.
61. Bassham J. A. Photosynthesis and biosynthetic
pathways to chemicals. In: Future Sources of
Organic Raw Materials (IUPAC), L. E. St.
Pierre and G.R. Brown, eds., New York,
Pergamon Press, pp. 601-612, CHEMRAWN
1, 1980.
62. Bassham J. A., Jensen R. G. Photosynthesis of
carbon compounds. In: Harvesting the Sun, A.
San Pietro, T. Greer and J. Army, eds., New
York, Academic Press, pp. 79—110, 1967.
63. Beadle G., Beadle M. The Language of Life,
New York, Doubleday, 1965.
64. Beale G. The Genetics of Paramecium,
Cambridge, Cambridge University Press, 1954.
65. Beale G. H., Jurand A., Preer J. R. The classes
of endosymbionts of Paramecium aurelia, J. Cell
Sci., 5, 65-91 (1969).
66. Beisson J., Sonneborn T. M. Cytoplasmic
inheritance of the organization of the cell
cortex in Paramecium aurelia, Proc. Natl. Acad.
Sci. USA, 53, 265-282 (1965).
67. Belar K. Protozoenstudien. 1, Arch. Pro-
tistenkd., 36, 13-51 (1915).
68. Belar K. Protozoenstudien. 2. Arch. Pro-
tistenkd., 36, 24-39 (1915).
69. Belar K. Untersuchungen an Actinophrys sol
Ehrenberg. 1, Die Morphologie des Formwe-
chsels, Arch. Protistenkd., 46, 1-96 (1923).
70. Benemann J. R. Nitrogen fixation in termites,
Science, 181, 164-165 (1973).
71. Bengtson S. Aspects of problematic fossils in
the early Paleozoic, Acta Univ. Ups. Abstr.
Upps. Diss. Sci., 415, 71 (1977).
72. Berg H. C. Bacterial behaviour, Nature, 254,
389-392 (1975).
ЛИТЕРАТУРА
311
73. Berger В., Thorington G., Margulis L. Two
aeromonads: growth of symbionts from Hydra
viridis, Current Microbiol., 3, 5-10 (1979).
74. Berkner L. V Marshall L. On the origin and
rise of oxygen concentration in the earth’s
atmosphere, J. Am. Sci., 22, 225-261 (1965).
75. Bernal J. D. Origin of Life, Cleveland, Ohio,
World, 1967. (Имеется перевод: Бернал Дж.
Возникновение жизни-М.: Мир, 1969.)
76. Bernardi G. The mitochondrial genome of
yeast: organization and recombination. In:
Genetics and Biogenesis of Chloroplasts and
Mitochondria, T. Biicher et al., eds.,
Amsterdam, North-Holland, pp. 503-510, 1976.
77. Bernstein H. Germ line recombination may be
primarily a manifestation of DNA repair
process, J. Theor. Biol., 69, 371-380 (1977).
78. Berry W.B.N. Growth of a Prehistoric Time
Scale, San Francisco, W. H. Freeman and
Company, 1968.
79. Bessey E. A. Morphology and Taxonomy of
Fungi, Philadelphia, Blakiston, 1950 (reprinted
1961).
80. Bibring T., Baxandall J. Mitotic apparatus: the
selective extraction of protein with mild acid,
Science, 161, 377-379 (1968).
81. Bingham S., Schiff J. A. Cellular origins of
plastid membrane polypeptides in Euglena. In:
Genetics and Biogenesis of Chloroplasts and
Mitochondria, T. Biicher et al., eds.,
Amsterdam, North-Holland, pp. 79-86, 1976.
82. Bisalputra T., Oakley B.C., Walker D.C.,
Shields С. H. Microtubular complexes in blue-
green algae, Protoplasma, 86, 19-28 (1975).
83. Blackbourn D. J., Taylor F. J. R., Blackbourn J.
Foreign organelle retention by ciliates, J.
Protozool, 20, 286-288 (1973).
84. Blackwelder R.E. Taxonomy, New York, John
Wiley and Sons, 1967.
85. Bloodgood R. A. Ultrastructural, biochemical
and physiological studies of axostyle motility,
Ph. D. thesis, University of Colorado, Boulder,
1974.
86. Bloodgood R. A., Fitzharris T. P. Specific asso-
ciations of prokaryotes with symbiotic flagellate
protozoa from the hindgut of the termite
Reticulitermes and the wood-eating roach
Cryptocercus, Cytobios, 17, 103-122 (1976).
87. Bogorad L. Chloroplast structure and
development. In: Harvesting the Sun, F.A. San
Pietro, T. Greer and J. Army, eds., New York,
Academic Press, pp. 191-210 (1967).
88. Bold H. C. Morphology of Plants, 3rd ed., New
York, Harper and Row, 1973.
89. Bonen L., Cunningham R. S., Gray M. W.,
Doolittle W.F. Wheat embryo mitochondrial
16S ribosomal RNA: evidence for its
prokaryotic nature, Nucleic Acids Research, 4,
663-671 (1977).
90. Bonen L., Doolittle W. F. On the prokaryotic
nature of red algal chloroplasts, Proc. Natl.
Acad. Sci. USA, 2, 2310-2314 (1975).
91. Bonen L., Doolittle W.F. Partial sequences of
16S rRNA and the phylogeny of blue-green
algae and chloroplasts, Nature, 261, 669-673
(1976).
92. Bonen L., Doolittle W. F. Ribosomal RNA
homologies and the evolution of the
filamentous bluegreen bacteria, J. Mol. Evol.,
10, 283-292 (1979).
93. Bonen L., Doolittle W. F., Fox G.E. Cyano-
bacterial evolution: results of 16S ribosomal
ribonucleic acid sequence analysis, Can. J.
Biochem, 57, 879-888 (1979).
94. Borisy G. G., Taylor E.W The mechanism of
action of colchicine-H3 to cellular protein, J.
Cell Biol., 34, 525-533 (1967).
95. Borisy G.G., Taylor E.W. The mechanism of
action of colchicine: colchicine binding to sea
urchin eggs and the mitotic apparatus, J. Cell
Biol, 34, 535-548 (1967).
96. Borst P., Kroon A. M., Ruttenberg G. J. С. M.
Mitochondrial DNA and other forms of
cytoplasmic DNA. In: Genetic Elements:
Properties and Function, D. Shugar, ed,
London, Academic Press, pp. 81—116, 1967.
97. Boyer P. D., Chance B., Ernster L., Mitchell P.,
Racker G., Slater E. C. Photophosphorylation,
Annu. Rev. Biochem, 46, 955-1026 (1977).
98. Boynton J.E. Chlorophyll-deficient mutants in
tomato requiring vitamin B12: abnormalities in
chloroplast ultrastructure, Hereditas, 56,
238-254 (1966).
99. Boynton J. E., Gillham N.W., Harris E.H.,
Tingle C.L., van Winkle-Swift K., Adams G.
M. W. Transmission, segregation and
recombination of chloroplast genes in
Chlamydomonas. In: Genetics and Biogenesis of
Chloroplasts and Mitochondria. Biicher et al,
eds, Amsterdam, North-Holland, pp. 313-322,
1976.
100. Brachet J. Biochemical Cytology, New York,
Academic Press, 1957. (Имеется перевод:
Браше Ж. Биохимическая цитология-М.:
ИЛ, 1960.)
101. Bradbury Р. С., Olive L.S. Fine structure of
the feeding stage of a sorogenic ciliate,
Sorogena stoianovitchae gen. n, sp. n, J.
Protozool, 27, 267-277 (1980).
102. Breed R.S., Murray E.G.D., Smith N.R.
Bergey’s Manual of Determinative Bacteriol,
7th ed.. London, Bailliere, Trudall and Cox,
1957.
103. Brennan C., Winet H. Fluid mechanics of
propulsion by cilia and flagella, Annu. Rev.
Fluid Meeh, 9, 339-398 (1977).
104. Breznak J. A. Biology of non-pathogenic
host-associated spirochetes, Crit. Rev.
Microbiol, 2, 457^489 (1973).
105. Breznak J. A., Brill W. J., Mertias J.W
Cnpppl H. D. Nitrogen fixation in termites,
Nature, 244, 577-580 (1973).
106. Breznak J. A., Pankratz H.S. In situ
morphology of the gut microbiota of
wood-eating termites (Reticulitermes flavipes
Kollar and Coptotermes formosanus Shiraki), J.
Appl. Env. Microbiol, 33, 406-426 (1977).
107. Brinkley B. R., Fuller G. M., Highfield D. P.
312
ЛИТЕРАТУРА
Studies of microtubules in dividing and
nondividing mammalian cells using antibody
to G - S bovine brain tubulin. In:
Microtubules and Microtubule Inhibitors,
N. Borger and M. De Brabander, eds.,
Amsterdam, North-Holland, pp. 297-312,
1975.
108. Brinkley B.R., Stubblefield E., HsuT.C. The
effects of Colcemid inhibition and reversal on
the fine structure of the mitotic apparatus of
Chinese hamster cells in vitro, J. Ultrastruct.
Res., 17, 1-18 (1967).
109. Britten R., Kohne D. E. Repeated sequences in
DNA, Science, 161, 529-540 (1968).
110. Brock T.D. Biology of Microorganisms,
Englewood Cliffs, N.J., Prentice-Hall, 1970.
111. Broda E. The Evolution of the Bioenergetic
Process, Oxford, Pergamon Press, 1975. (Име-
ется перевод: Брода E. Эволюция биоэнер-
гетических процессов-М.: Мир, 1978.)
112. Brokaw С. J., Gibbons I.R. Mechanisms of
mov:ment in flagella and cilia. In: Swimming
and Flying in Nature, vol. 1, T.T.T. Wu,
C.J. Brokaw, and C. Brenner, eds., New York,
Plenum, pp. 89-129, 1975.
113. Bronchart R., Demoulin V. Unusual mitosis in
the red alga Porphyridium purpureum, Nature,
268, 80-81 (1977).
114. Brown D.D., Weber C.S., Sinclair J. H.
Ribonucleic acid and protein synthesis during
amphibian development, Washington, D.C.,
Carnegie Institute of Washington Yearbook,
pp. 8-17, 1967.
115. Brown J. P., Edwards M.R., van Demark P. J.
Ultrastructure and sites of tetranitro-blue
tetrazolium reduction of lactobacillus casei,
Can. J. Microbiol., 14, 823-836 (1968).
116. Bryant M.P., Wolin E.A., Wolin M. J., Wol-
fe R. S. Methanobacillus omelianski,
a symbiotic association of two spesies of
bacteria, Arch. Mikrobiol., 59, 20-31 (1967).
117. Buat-Menard P., Chesselet R. Variable inf-
luence of the atmospheric flux on the trace
metal chemistry of oceanic suspended matter,
Earth and Planetary Science Letters, 42,
399-411 (1979).
118. Buchanan R.E., Gibbons N.E., eds. Bergey’s
Manual of Determinative Bacteriology. 8th
ed., Baltimore, Williams and Wilkins, 1974.
119. BUcher T., Neupert W., Sebald W., Werner S.,
eds. Genetics and Biogenesis of Chloroplasts
and Mitochondria, Amsterdam, North-
Holland, 1976.
120. Buchner P. Endosymbiosis of Animals with
Plantlike Microorganisms, New York, Wiley
Interscience, 1965.
121. Bullough T.S. Evolution of Differentiation,
London, Academic Press, 1968.
122. Buringame A.L., Schnoes H. K. Mass
spectrometry in organic geochemistry. In:
Organic Geochemistry: Methods and Results,
G. Eglinton and M.T.J. Murphy, eds., New
York, Springer-Verlag, pp. 89-160 (1968).
123. Bumham B.F. Metabolism of porphyrins and
corrinoids. In: Metabolic Pathways, vol. 3,
D. M. Greenberg, ed., New York, Academic
Press, pp. 403-537, 1969.
124. Cachon J., Cachon M. Les systemes
axopodiaux, Annee Biolog., 13, 523-560
(1975).
125. Cachon J., Cachon M. Sticholonche zanclea
Hertwig: A reinterpretation of its phylogenetic
position based upon new observations on its
ultrastructure, Arch. Protistenkd., 120,
148-168 (1978).
126. Cachon J., Cachon M. Axopod regeneration in
Sticholonche zanclea: transport and
positioning of cytoplasmic structures, Arch.
Protistenkd. In press.
127. Cachon J., Cachon M., Tilney L.G.,
Tilney M.S. Movement generated by
interactions between the dense material at the
ends of microtubules and non-actin-containing
microfilaments in Sticholonche zanclea, J. Cell
Biol., 72, 314-338 (1977).
128. Caldwell D.E., Caldwell S.J. Fine structure of
in situ microbial iron deposits, Geo-
microbiology J., 2, 39-53 (1980).
129. Calkins G.N. Biology of the Protozoology,
2nd ed., Philadelphia, Lea and Febiger, 1933.
130. Calvin M. Chemical evolution, Proc. Roy.
Soc., A 228, 441-466 (1965).
131. Calvin M. Chemical Evolution: Molecular
Evolution towards the Origin of Living
Systems on the Earth and Elsewhere, New
York, Oxford University Press, 1969. (Име-
ется перевод: Кальвин M. Химическая
эволюция.-М.: Мир, 1971.)
132. Calvin М. Molecular paleontology, Perspect
Biol. Med., 13, 45-62 (1969).
133. Campbell L. L., Postgate J. R. Classification of
the spore forming sulfate reducing bacteria,
Bacteriol. Rev, 29, 359-363 (1965).
134. Campbell S.E. Soil stabilization by
a prokaryotic desert crust: implications for
Precambrian land biota, Origins of Life, 9,
335-348 (1979).
135. Cantino E. C., Myers R. B. The gamma particle
and intracellular interactions in Blastocladiella
emersoni. Brookhaven Symp. Biol, 25, 51-74
(1973).
136. CarellE.F. Studies on chloroplast
development and replication in Euglena. I.
Vitamin B12 and chloroplast replication, J.
Cell Biol, 41, 431-440 (1969).
137. Carlile M.J., Skehel J. J., eds. Evolution in the
Microbial World. Symp. Soc. Gen. Microbiol,
24, Cambridge, Cambridge University Press,
1974.
138. Carr N.G., Whitton B.A. The Biology of Blue-
Green Algae, Berkeley, University of
California Press, 1973.
139. Cavalier-Smith T The origin of nuclei and of
eukaryotic cells, Nature, 256, 463-467 (1975).
140. Cavalier-Smith T. The evolutionary origin and
phylogeny of microtubules, mitotic spindles
and eukaryotic flagella, Biosystems, 10, 93-114
(1978).
ЛИТЕРАТУРА
313
141. Chao F., Shepro D. Alterations of platelet fine
structure during clot retraction, J. Cell Biol.,
39, 23a (1968).
142. Chapman D., Ragan D. A Biochemical Phylo-
geny of the Protists, New York, Academic
Press, 1978.
143. Chase D.G., Erlandsen S.L. Evidence for
a complex life cycle and endospore formation
in the attached, filamentous, segmented
bacterium from murine illeum, J. Bact., 127,
572-583 (1976).
144. Chase D. G., Margulis L. Ultrastructure of
pillotina spirochetes of termites, Current
Microbiol. In press.
145. Cheung A. T W., Jahn T. L. Helical nature of
the continuous ciliary beat of Opalina, Acta
Protozool, 14, 111-125 (1975).
146. Chiang K.S. On the search for a molecular
mechanism for cytoplasmic inheritance: Past
controversy, present progress and future
outlook. In: Genetics and Biogenesis of
Chloroplasts and Mitochondria, T. Bucher et
al., eds., Amsterdam, North-Holland,
pp. 305-312, 1976.
147. Chun E.H.L., Vaughn M.H., Jr., Rich A. The
isolation and characterization of DNA
associated with chloroplast preparations, J.
Mol. Biol., 7, 130-141 (1963).
148. Chunsoff L., Hirshfleld H. I. Nuclear structure
and mitosis in the dinoflagellate Gonyaulax
monilate, J. Protozool., 14, 157-165 (1967).
149. Church A. H. The building of an autotrophic
flagellate, Oxford Botanical Memoirs, 1, 4-27
(1919).
150. Clark F., Synge R.L., eds. The origin of Life
on the Earth, Moscow Symposium.
International Union Biochemistry, New York,
Pergamon Press, 1966.
151. Clark-Walker G. C., Linnane A.W. The
biogenesis of mitochondria in Saccharomyces
cerevisiae. A comparison between cytoplasmic
respiratory-deficient mutant yeast and
chloramphenicol-inhibited wild type cells, J.
Cell Biol, 34, 1-14 (1967).
152. Clemmey H. World’s oldest animal traces,
Nature, 261, 576-578 (1976).
153. Cleveland L.R. Some problems which may be
studied by oxygenation, Science, 63, 168-170
(1926).
154. Cleveland L. R. The centriole and its role in
mitosis as seen in living cells, Science, 81,
597-600 (1935).
155. Cleveland L. R. Longitudinal and transverse
division in two closely related flagellates, Biol.
Bull, 74, 1-24 (1938).
156. Cleveland L.R. The origin and evolution of
meiosis, Science, 105, 287-288 (1947).
157. Cleveland L.R. Hormone-induced sexual
cycles of flagellates, J. Morph, 88, 385-440
(1951).
158. Cleveland L. R. The flagellates of termites,
Parts 1 and 2. North American termites; Part
3, Australian termites, 16mm films available
from Dept, of Zoology, University of
Massachusetts, Amherst, 1956.
159. Cleveland L. R. Types and life cycles of
centrioles of flagellates, J. Protozool, 4,
230-240 (1957).
160. Cleveland L. R. Function of flagellate and
other centrioles in cell replication. In: The
Cell in Mitosis, L. Levin, ed. New York,
Academic Press, 1963.
161. Cleveland L.R., Grimstone A. V. The fine struc-
ture of the flagellate Mixotricha paradoxa and
its associated microorganisms, Proc. R. Soc.
Lond. B, 157, 668-683 (1964).
162. Cloud P.E., Jr. Atmospheric and hydrospheric
evolution on the primitive earth, Science, 160,
729-736 (1968).
163. Cloud P.E., Jr. Premetazoa evolution and the
origin of Metazoa. In: Evolution and
Environment, E.T. Drake, ed. New Haven,
Yale University Press, pp. 1-72, 1968.
164. Cloud P.E., Jr. Evolution of ecosystems, Am.
Sci, 62, 54-66 (1974).
165. Cloud P.E., Jr. Cosmos, Earth and Man:
A Short History of the Universe. New Haven,
Yale University Press, 1978.
166. Cloud P.E., Jr., Holland H.D., Commoner B.,
Davidson C. F., Fischer A. F., Berkner L. V.,
Marschall L. C. SymGosium on the Evolution
of the Earth’s Atmosphere, Proc. Natl. Acad.
Sci. USA, 53, 1169-1226 (1965).
167. Coder D.M., Starr M.P. Antagonistic
association of the chlorellavorus bacterium
(“Bdellovibrio” chlorellavorus) with Chlorella
vulgaris, Current Microbiol, 1, 59-64
(1978).
168. Cohen Y, Krumbein WE., Shilo M. Solar Lake
(Sinai) 4. Stromatolitic cyanobacterial mats,
Limnology and Oceanography, 22, 635-656
(1977).
169. Cohen Y, Padan E., Shilo M. Facultative
anoxygenic photosynthesis in the cyano-
bacterium Oscillatoria limnetica, J. Bacteriol,
123, 855-861 (1975).
170. Coleman W. Biology: The Nineteenth Century,
New York, John Wiley and Sons, 1971.
171. CookC.B. Infection of invertebrates with
algae. In: Cellular Interactions in Symbiosis
and Parasitism, C.B. Cook et al, eds,
Columbus, The Ohio University Press, 1980.
172. Cook С. B., Pappas P. W., Rudolph E. D., eds.
Cellular Interactions in Symbiosis and
Parasitism, Columbus, The Ohio University
Press, 1980.
173. Coonen L.P. Aristotle’s biology, BioScience,
27, 733-738 (1977).
174. Cooper G., Margulis L. Delay in migration of
symbiotic algae in Hydra viridis by inhibitors
of microtubule protein polymerization,
Cytobios, 19, 7-19 (1978).
175. Copeland H.F. Classification of the Lower
Organisms, Palo Alto, Calif, Pacific Books,
1956.
176. Corliss J. 0. Taxonomic procedures in
classification of protozoa. In: Microbial
Classification, G. C. Ainsworth and
P. H. A. Sneath, eds, Cambridge, Cambridge
University Press, pp. 37-67, 1962.
314
ЛИТЕРАТУРА
177. Corliss J. О. The changing world of ciliate
systematics, Syst. Zool., 23, 91—138 (1974).
178. Corliss J. 0. Taxonomic characterization of
the suprafamilial groups in a revision of
recently proposed schemes of classification for
the phylum Ciliophora, Trans. Am. Microsc.
Soc., 94, 224-267 (1975).
179. Corliss J. 0. The Ciliated Protozoa.
Characterization, Classification and Guide to
the Literature, 2nd ed., London and New
York, Pergamon Press, 1979.
180. Corneo G., Moore C., Sanadi D.R., Gros-
sman L. I., Marmur J. Mitochondria DNA in
yeast and some mammalian species, Science,
151, 687 (1966).
181. Correns C. Vererbungsversuche mit blass
(gelb) griinen und buntblatrigen Sippen bei
Mirabilis Jalapa, Urtica pilulifera und Lunaria
annua, Z. Ind. Abst. Vererb-lehre, 1, 291-329
(1909).
182. Cox E. C.t Yanofsky C. Mutation gene studies
in E. coli, J. Bacteriol., 100, 390-397 (1969).
183. Craig H. The geochemistry of stable carbon
isotopes, Geochim. Cosmochim. Acta, 3, 53-92
(1953).
184. Crick F. H. C. The origin of the genetic code,
J. Mol. Biol., 38, 367-379 (1968).
185. Crocker T T., Dirksen E.R. Cilia development
in fetal rat tracheal epithelium, J. Microsc.
(Paris), 5, 629-644 (1966).
186. Cronkite D.L. A role of calcium ions in
chemical induction of mating in Paramecium
tetraurelia, J. Protozool., 23, 431-433 (1976).
187. Cronquist A. Evolution and Classification of
Flowering Plants, Boston, Houghton Miffin,
1968.
188. Cronquist A. Introductory Botany, 3rd ed.,
New York, Harper and Row, 1972.
189. Cummins J. E., Rusch H.P., Evans T.E.
Nearest neighbor frequencies and the phylo-
genetic origin of mitochondrial DNA in
Physarum polycephalum, J. Mol. Biol., 23,
281-284 (1967).
190. Cunningham R. S., Bonen L., Doolittle W. F.,
Gray M.W Unique species of 5S, 18S and
26S Ribosomal RNA in wheat mitochondria,
FEBS Lett, 69, 116-121 (1976).
.191 . Cunningham R. S., Gray M.W., Doolittle W.F.,
Bonen L. The prokaryotic nature of wheat
embryo mitochondrial 18S ribosomal RNA.
Acides nucleiques et synthese des proteins
chez les vegetaux. Colloques intemationaux,
C.N.R.S., No. 261 (1978).
192. Curtis H. The Science of Biology, New York,
Worth, 1968.
193. Cutting J. A., Schulman H.M. Biogenesis of
leghemoglobin. The determination of the
rhizobium-legume symbiosis for leghe-
moglobin specificity, Biochim. Biophys. Acta,
229, 58-62 (1971).
194. Cutting J. A., Schulman H. M. The control of
heme synthesis in soybean root nodules,
Biochim. Biophys. Acta, 261, 321-327 (1972).
195. Cutting W.C. Handbook of Pharmacology,
New York, Meredith, 1967.
196. Danforth W.F. Respiratory metabolism. In:
Research in Protozoology, vol. 1, T.T. Chen,
ed., Oxford, Pergamon Press, pp. 201-306,
1967.
197. Daniels E. W. Variations in the fine structure
and function of amoeba, 2nd International
Conference on Protozoology, Progress in
Protozoology, Abs., 86, 87-88, 1965.
198. Daniels E. W., Breyer E. P. Ultrastructure of
the giant amoeba, Pelomyxa palustris, J.
Protozool., 14, 167-179 (1967).
199. Daniels E. W., Breyer E. P., Kudo R. R. Pe-
lomyxa palustrisGreef: its ultrastructure,
Z. Zellforsch., 73, 367-383 (1966).
200. Daniels E. W, Roth L. E. Electron microscopy
of mitosis in a radiosensitive giant amoeba, J.
Cell Biol., 20, 75-84 (1964).
201. Darland G., Brock T. D., Samsenoff W.,
Conti S.F. A thermophilic acidophilic myco-
plasma isolated from a coal refuse pile,
Science, 170, 1416-1418 (1970).
202. Darlington C. D. Evolution of Genetic Systems,
New York, Basic Books, 1958.
203. Darwin C. The Origin of Species by Means of
Natural Selection, or the Preservation of Fav-
oured Races in the Struggle for Life, London,
John Murray, 1859.
204. Davidson C. F. Geochemical aspects of
atmospheric evolution, Proc. Natl. Acad. Sci.
USA, 53, 1194-1204 (1965).
205. Davidson L. The ultrastructure and energetics
of the contractile axopodia of the
centrohelidan helizoan Heterophrys marina.
Progress in Protozoology, Abstracts of papers
read at the 4th International Congress on
Protozoology, Clermont-Ferrand, 2-10 Sept.,
1973, Uni versite de Clermont-Uer-Sciences,
Exactes et Naturelles, P. de Puytorac and
J. Grain, eds., 1973.
206. Davson H. A Textbook of General Physiology,
Boston, Little, Brown, 1964.
207. Day W. Genesis on Planet Earth. East
Lansing, Mich., House of Talos, 1979.
208. Dayhoff M. 0. Atlas of Protein Sequence and
Structure. Bethesda, Md., National
Biochemical Research Foundation, 1969.
209. Dayhoff M. O. The origin and evolution of
protein superfamilies, Fed. Proc., 35,
2132-2138 (1976).
210. Dayhoff M.O., McLaughin P.J., Barker W.C.,
Hunt L. T Evolution of sequences within
protein super-families, Naturwissenchaften, 62,
154-161 (1975).
211. Dayhoff M.O., Schwartz R. M. Atlas of Protein
Sequence in Structures, 2nd ed., Bethesda Md.,
National Biomedical Research Foundation, in
press.
212. Deal P.H., Souza K.A., Mack H.M. High pH,
ammonia toxicity and the search for life on
the Jovian planets, Origins of Life, 6, 561-573
(1975).
213. DeBradander M., Borgers M., eds. Inter-
national Symposium on Microtubules and
Microtubular Inhibitors, Amsterdam, North-
Holland, 1975.
ЛИТЕРАТУРА
315
214. DeBrabander М., DeMey J., Van de Veire R.,
Aerts F., Geuens G. Microtubules in mam-
malian cell shape and surface modulation: an
alternative hypothesis, Cell Biology
International Reports, 1, 453-461 (1977).
215. DeDuve C. Evolution of the peroxisome, Ann.
N.Y. Acad. Sci., 168, 369-381 (1969).
216. DeDuve C. A re-examination of the physio-
logical role of peroxisomes. In: Tocopherol,
Oxygen and Biomembranes, Proceedings of
the International Symposium, C. DeDuve and
O. Hayashi, eds., Elsevier/North-Holland,
Biomedical Press, pp. 351-361, 1978.
217. Degens E. T. Molecular mechanisms of
carbonate, phosphate and silica deposition in
the living cell, Top. Curr. Chem., 64, 3-112
(1976).
218. De Jong B. Cited in J. D. Bernal, Origin of
Life, Cleveland, World, 1967, p. 126, 1932.
219. Del£yJ. Biochemistry and enzymology in
bacterial classification. In: Microbial
Classification, G. C. Ainsworth and
P. H.A. Sneath, eds., 12th Symposium of the
Society for General Microbiology, Cambridge,
Cambridge University Press, 12, 164-195,
1962.
220. DeLey J. Molecular biology and bacterial
phylogeny. In: Evolutionary Biology,
T. Dobzhansky, M. K. Hecht and W. C. Steere,
eds., New York, Appleton-Century-Crofts,
pp. 104-154, 1968.
221. Demoulin V Quelque aspects modemes de
la phylogenese des champignons, Les Natu-
ralistes Beiges, 51, 338-350 (1970).
222. Demoulin V. The origin of ascomycetes and
basidiomycetes. The case for a red algal
ancestry, Bot. Rev., 40, 315-345 (1978).
223. De Rosa F., Haber D., Williams C., Margulis L.
Inhibitory effects of herbicide trifluraline on
the establishment of the clover root module
symbiosis, Cytobios, 21, 37-43 (1978).
224. DeSouza N. J., NesW.R. Sterols: isolation
from a blue-green alga, Science, 162, 363
(1968).
225. Desportes I. Ultrastructure des gregarines du
genre Stylocephalus; la phase enkystee,
Ann. Sci. Nat. Zool. Boil. Anim., 12,
73-170 (1970).
226. De Terra N. Leucine incorporation in the
membraneliar bands of regenerating and
nonregenerating Stentor, Science, 153, 543
(1966).
227. Deysson G. Antimitotic substances, Int. Rev.
Cytol., 24, 99-148, New York, Academic Press
(1968).
228. Dickerson R. E. Cytochrome C and
serendipity. In: Evolution of Protein Structure
and Function, D.S. Sigman and
M.A.B. Brazier, eds., UCLA Forum in Me-
dical Science, 21, New York, Academic Press,
1980.
229. Dilke F. W. W., Gough D. 0. The solar spoon,
Nature, 240, 262-263 (1972).
230. Dillon L. S. Comparative cytology and the
evolution of Life, Evolution, 16, 102-117 (1962).
231. Dilworth M. J., Parker C. A. Development of
nitrogen-fixing system in legumes, J. Theoret.
Biol., 25, 208-218 (1969).
232. Dimroth E., Kimberley M. Precambrian at-
mospheric oxygen: evidence in the
sedimentary distributions of carbon, sulfur,
uranium and iron, Can. J. Earth Sci., 13,
1161-1185 (1976).
233. Dippell R. V. Effects of nuclease and protease
digestion on the ultrastructure of Paramecium
basal bodies, J. Cell Biol., 69, 622-637 (1976).
234. Dirksen E. R. Observations on centriole
formation in developing ciliated epithelium of
the mouse oviduct (abs.), J. Cell Biol., 39, 34a
(1968).
235. Dobell C. Researches on the spirochaetes and
related organisms, Archiv. Protistenkd., 26,
119-230 (1912).
236. Dobell C. Antony von Leeuwenhoek and His
Little Animals, New York, Russell and
Russell, 1958.
237. Dobzhansky T. Genetics of the Evolutionary
Process, New York, Columbia University
Press, 1970.
238. Dodge J.E. In: The Chromosomes of Algae,
M. В. E. Godward, ed., London, Edward
Arnold, pp. 96-115, 1966.
239. Dodson E. 0. The kingdoms of organisms,
Syst. Zool., 20, 265-281 (1971).
240. Dodson E. 0. Crossing the pro-
caryote-eucaryote border, endosymbiosis or
continuous development? Can. J. Microbiol.,
25, 652-674 (1979).
241. Doetsch R.N., Hageage G. J. Motility in
prokaryotic organisms: problems, points of
view and perspectives, Biol. Rev. (Camb.), 43,
317-362 (1968).
242. Doflein F., Reichenow E. Lehrbuch der
Protozoenkunde. Ein Darstellung der Natur-
geschichte der Protozoen mit besonderen
Beriicksichtigung der parasitischen und patho-
genen Formen, Jena, Fischer, 1929.
243. Doolittle W.F. Sequence studies on 16S
Ribosomal RNA from a blue-green alga, J.
Mol. Evol., 4, 307-315 (1975).
244. Doolittle W.F. Genes in pieces: were they ever
together? Nature, 272, 581-582 (1978).
245. Doolittle W.F. The cyanobacteria! genome, its
expression and the control of that expression.
In: Advances in Microbial Physiology, 20,
1-102, A. H. Rose and J. G. Morris, eds.,
London, Academic Press, 1979.
246. Doolittle W. F., Margulis L. Problems in the
Prokaryotic-eukaryotic transition, Microbio-
logical Reviews, in press.
247. Doolittle W.F., Sapienza C. Selfish genes, the
phenotype paradigm and genome evolution,
Nature, 284, 601-607 (1980).
248. Dougherty E.C., Allen M.B. The words protist
and protista, Experientia, 14, 78-81 (1953).
249. Dougherty E. C., Allen M. B. Is pigmentation
a clue to protistan phylogeny? In:
Comparative Biochemistry of Photoreactive
Systems, M. B. Allen, ed., New York,
Academic Press, pp. 129-144, 1960.
316
ЛИТЕРАТУРА
250. Droop М. R. Algae and invertebrates in
symbiosis, Symp. Soc. Gen. Microbiol., 13,
171-199 (1963).
251. Dubosq 0., Grasse P. Flagelles et schizophytes
de Calotermes (Glyptotermes) iridipennis Frogg,
Arch. Zool. Exp. Gen., 66, 451-496 (1927).
252. DuBuy H. G., Mattern C. F. T., Riley F. L.
Isolation and characterization of DNA from
kinetoplasts of leishmania enrietti, Science,
147, 754-755 (1965).
253. Dujon B. Transmission, recombination and
segregation of mitochondrial genes in
Saccharomyces cerevisiae. In: Genetics, Bio-
genesis and Bioenergetics of Mitochondria,
W. Brandlow, ed., Berlin, Walter de Gruyter,
pp. 1-6, 1976.
254. Dujon B., Colson A. M., Slonimski P. P. The
mitochondrial genetic map of Saccharomyces
cerevisiae: compilation of mutations, genes,
genetic and physical maps. In: Mitochondria,
1977; Genetics and Biogenesis of
Mitochondria, W. Brandlow, R.J. Schwegen,
K. Wolf and F. Kaudewitz, eds., Berlin,
Walter de Gruyter, 1977.
255. Dujon B., Slonimski P. P. Mechanisms and
rules for transmission, recombination and
segregation of mitochondrial genes in
Saccharomyces cerevisiae. In: Genetics and
Biogenesis of Chloroplasts and Mitochondria,
T. Bucher et al., eds., Amsterdam, North-
Holland, pp. 392-404, 1976.
256. Dunlop J. S. R., Muir M. D., Milne V. A., Gro-
ves D. I. A new microfossil assemblage from
the Archaean of Western Australia, Nature,
274, 676-678 (1978).
257. ’ Dustin P. Microtubules. Heidelberg and New
York, Springer-Verlag, 1978.
258. Dustin P., Hurbert I.-P., Flament-Durand J.
Centriole and cilia formation in rat pituicytes
after treatment with colchicine and vincristine.
Studies in vivo and in vitro. In: Microtubules
and Microtubule Inhibitors, M. Borgers and
M. De Brabander, eds., Amsterdam, North-
Holland, pp. 289-296, 1975.
259. Dutton G. R., Barondes S. Microtubule protein
synthesis and metabolism in developing brain,
Science, 166, 1637-1638 (1969).
260. Dyer B. Reticulitermes flavipes hindgut
ecosystem flagellate niches analyzed by
selective defaunation. Master’s Thesis, Boston
University, Boston, Mass., 1978.
261. Earthart C.F., Tremblay G. У, Daniels M.J.,
Schaechter M. DNA replication studied by
a new method for the isolation of cell
membrane-DNA complexes, Cold Spring
Harbor Symp. Quant. Biol., 33, 707-710
(1968).
262. Ebringer L. Are plastids derived from
prokaryotic microorganisms? Action of
antibiotics on chloroplasts of Euglena gracilis,
J. Gen. Microbiol., 71, 35-52 (1972).
263. Ebringer L. Effects of drugs on chloroplasts.
In: Progress in Molecular and Subcellular
Biology, F. E. Hahn, ed., Berlin, Springer-
Verlag, pp. 271-350, 1978.
264. Echlin P. The origins of plants. In: Phyto-
chemical Phylogeny, J. Harbome, ed., New
York, Academic Press, pp. 1-19, 1970.
265. Echlin P. The photosynthesis apparatus in
prokaryotes and eukaryotes. In: Organization
and Control in Prokaryotes and Eukaryotes,
H. P. Charles and B. D. Knight, eds., Symp.
Soc. Gen. Microbiol., 20, 221-248, Cambridge,
Cambridge University Press, 1970.
266. Echlin P., Morris I. The relationship between
blue-green algae and bacteria, Biol. Rev., 40,
143-187 (1965).
267. Edelman M., Cowan C., Epstein H. T.,
Schiff J. A. Studies of chloroplast development
in Euglena, 8. Chloroplast associated DNA,
Proc. Natl. Acad. Sci. USA, 52, 1214-1219
(1964).
268. Edelman M., Schiff J. A., Epstein H. T. Studies
of chloroplast development in Euglena, 12.
Two types of satellite DNA, J. Mol. Biol., 11,
769-771 (1965).
269. Edelman M., Swinton D., Schiff J. A.,
Epstein H. T., Zeldin M. B. DNA of the blue-
green algae (Cyanophyta), Bacteriol. Rev., 31,
315-331 (1967).
270. Edmundson W. T., ed. Marine Biology. 3. Proc.
3rd International Interdisciplinary Conference
(Ecology of Invertebrates), N.Y. Acad. Sci.
Interdiscip. Commun. Program., 1966.
271. Edwards M.R., Gordon M.A., Papa E. W.,
Ghiorse W. C. Micromorphology of
Cryptococcus neoformans, J. Bacteriol., 94,
766-777 (1967).
272. Edwards P. E. A classification of plants into
higher taxa based on cytological and
biochemical criteria, Taxon, 25, 529-542
(1976).
273. Egami F. Anaerobic respiration and photo-
autotrophy in the evolution of prokaryotes,
Origins of Life, 8, 169-171 (1977).
274. Eglinton G., Calvin M. Chemical fossils,
Scientific American, 216, 32-43 (1967).
275. Eglinton G., Murphy M.T. J. Organic Geo-
chemistry: Methods and Results, New York,
Springer-Verlag, 1969.
276. Ehhalt D.H., Schmidt U. Sources and sinks of
atmospheric methane. In: Influence of the
Biosphere on the Atmosphere, H. U. Diitsch,
ed., Basel and Stuttgart, Birkhauser Verlag,
1978.
277. Ehlers E.G., Stiles D.V., BirleJ.B. Fossil
bacteria in pyrite, Science, 148, 1719-1720
(1965).
278. Ehrensvaard G. Life: Origin and Development,
Chicago, University of Chicago Press, 1960.
279. Eisenstadt J., Braverman G. The incorporation
of amino acids into protein of chloroplasts
and chloroplast ribosomes of Euglena gra-
cilis, Biochim. Biophys. Acta, 26, 319-322
(1963).
280. Engel A. E. J., Nagy B., Nagy L. A. Algal-like
forms in Onverwacht Series, So. Africa: Oldest
recognizable life-like forms on Earth, Science,
161, 1005-1006 (1968).
281. Ephrussi B. Nucleo-Cytoplasmic Relations in
ЛИТЕРАТУРА
317
Microorganisms, Oxford, Oxford University
Press, 1953.
282. Epstein H. T., Alloway E. Properties of
selectively starved euglena, Biochim. Biophys.
Acta, 142, 195-207 (1967).
283. Fawcett D. Cilia and flagella. In: The Cell,
vol. 2, J. Brachet and A. Mirsky, eds., New
York, Academic Press, pp. 217-297, 1962.
284. Ferguson S. J., John P. The inhi-
bitor-sensitivity of the plasma-membrane
adenosine triphosphatase of Paracoccus
denitrificans: comparison with the
mitochondrial adenosine triphosphatase,
Biochem. Soc. Trans., 5, 1525-1527 (1977).
285. Ferguson-Wood E.J. Significance of marine
microbiology, Bacteriol. Rev., 22, 1-19 (1958).
286. Ferguson-Wood E.J. Microbiology of Oceans
and Estuaries, Elsevier Oceanography Series,
vol. 3, Amsterdam Elsevier, 1967.
287. Ferris J. P., Sanchez R. A., Orgel L. E. Studies
in prebiotic synthesis, 3. Synthesis of
pyrimidines from cyanoacetylene and cyanate,
J. Mol. BioL, 33, 693-704 (1968).
288. Fine P. E. M. Mitochondrial inheritance and
disease, Lancet, Sept., p. 659 (1978).
289. Firkin F. C., Linnane A. W. Biogenesis of
mitochondria 8. Effect of chloramphenicol on
regenerating rat liver mitochondria, Biochem.
Biophys. Res. Commun., 32, 398-419 (1968).
290. Fischer A. G. Fossils, early life and
atmospheric history, Proc. Natl. Acad. Sci.
USA, 53, 1205-1215 (1965).
291. Fitch F.W., Anders E. Observations on the
nature of the “organized elements” in
carbonaceous chondrites, Ann. N.Y. Acad.
Sci., 108, 495-513 (1963).
292. F lorkin M., Mason H. S. Comparative
Biochemistry. A Comprehensive Treatise, vols.
1-7, New York, Academic Press, 1960-1964.
293. F lorkin M., Stolz E. H., eds. Comprehensive
Biochemistry, vols. 1-22, Amsterdam, Elsevier,
1962-1971.
294. Fogel S., Hurst D. D., Mortimer R. K. Gene
conversion in unselected tetrads from
multipoint crosses, In: Stadler Genetics
Symposia, vols. 1 and 2, G. Kimber and
G. P. Redei, eds., 1971, Columbia, Mo. :
University of Missouri Argricultural
Experiment Station, pp. 89-110, 1970.
295. Ford T.D. The Pre-Cambrian fossils of
Cham wood Forest, Leicester Literary and
Philos. Soc, 57, 57-62 (1963).
296. Fox A. S., Valencia J. E. Gene transfer in
Drosophila melanogaster, Cytological alter-
ations in the salivary chromosomes of
transformed stocks, Chromosoma, 51, 279-289
(1975).
297. Fox A. S., Yoon S. B., Dugglesby W. F., Gelbart
W.M. Genetic transformation in Drosophila.
In: Informative Molecules in Biological
Systems, L. G. H. Ledoux, ed, Amsterdam,
North-Holland, 1974.
298. Fox D. L., Lewin R. A. A preliminary study of
the carotenoids of some flexibacteria, Can. J.
Microbiol, 9, 753-768 (1963).
299. Fox G.E. Bacterial evolution based on
sequence data. In: Proceedings of the Fifth
Conference “El origen de la vida”, A.
Lazcano-Araujo, ed, in press.
300. FoxG.E., Magrum L. J., Balch W. E., Wolfe
R. S, Woese C. R. Classification of metha-
nogenic bacteria by 16S ribosomal RNA
characterization, Proc. Natl. Acad. Sci. USA,
74, 5088-5090 (1979).
301. FoxG.E., Pechman K.R., Woese C.R. Com-
parative cataloging of 16S ribosomal
ribonucleic acid: molecular approach to
prokaryotic systematics, Int. J. Syst. Bacteriol,
27, 44-57 (1977).
302. Fox S. W, ed. Origins of Prebiological Systems
and Their Molecular Matrices, New York,
Academic Press, 1965.
303. Fox S. W. The origin and nature of protolife,
the nature of life. 13th Annual Nobel
Conference, Gustavus Adolphus, College, St.
Peter, Minn, 1977.
304. Fox S. W, Harada K. Thermal copo-
lymerization of amino acids common to
protein, J. Am. Chem. Soc, 82, 3745-3751
(1960).
305. Fox S.W., McCauley R.J. Could life orginate
now? Natural History, Sept, pp. 26-33 (1968).
306. Fracek S., Margulis L. Colchicine, nocadazole
and trifluralin: different effects of microtubule
polymerization inhibitors on the uptake and
migration of endosymbiotic algae in Hydra
viridis, Microbios, 25, 7-15 (1979).
307. Francis S., Margulis L., Barghoom E. S. On
the experimental silicification of mic-
roorganisms. II. Implications for the
appearance of eukaryotes in the fossil record,
Precambrian Res, 6, 65-106 (1978).
308. Francis S., Margulis L., Barghoom E. S. On
the experimental silicifications of mic-
roorganisms. Ш. Implications of the
preservation of the green prokaryotic alga
Prochloron and other coccoids for the
interpretation of the microfossil record,
Precambrian Res, 7, 377-382 (1978).
309. Fridovitch I. Oxygen is toxic, BioScience, 27,
462-465 (1977).
310. Friedman E. I., Ocampo R. Endolithic blue-
green algae in the dry valleys: primary
producers in the Antarctic desert ecosystem,
Science, 193, 1247-1249 (1976).
311. Fritsch F.E. Structure and Reproduction of
the Algae, vols. 1 and 2, Cambridge,
Cambridge University Press, 1935.
312. Frobischer M. Fundamentals of Microbiology,
Philadelphia, W.B. Saunders, 196». (Имеет-
ся перевод издания 1962 г.: Фробишер
М. Основы микробиологии-М.: Мир,
1965.)
313. Fuller H.J., Tippo О. College Botany, New
York, Holt, Rinehart and Winston, 1949.
314. Gabriel M. Primitive genetic mechanisms and
the origin of chromosomes, Am. Nat, 94,
257-269 (1960).
315. Gqffron H. The origin of life. In: Evolution
after Darwin, Evolution of Life, 1, 39-84. S.
318
ЛИТЕРАТУРА
Tax. ed., Chicago, University of Chicago
Press, 1960.
316. Gharagozlou I.D. Aspect infrastructural de
Diplocalyx calotermitidis nov. gen. nov. sp.,
Spirochaetale de 1’intestin de Calotermes
flavicollis, Acad. Sci. Paris, 266, 494—496
(1968).
317. Ghosh A., Maniloff J., Gerling D. A. Inhibition
of mycoplasm cell division by cytochalasin B,
Cell, 13, 57-64 (1978).
318. Gibbons I. R. Chemical dissection of cilia,
Arch. Biol. (Liege), 76, 317-340 (1965).
319. Gibbons I. R., Rowe A. J. Dynein: a protein
with adenosine triphosphatase activity from
cilia, Science, 149, 424 (1965).
320. Gibbs S. P. The chloroplasts of Euglena may
have evolved from symbiotic green algae, Can.
J. Bot., 56, 2883-2889 (1978).
321. Gibbs S.P. The route of entry of
cytoplasmically synthesized proteins into
chloroplasts of algae possessing chloroplast
ER, J. Cell Sci., 35, 253-266 (1979).
322. Gibor A. Inheritance of cytoplasmic organelles.
In: Formation and Fate of Cell Organelles,
К. B. Warren, ed., New York, Academic Press,
pp. 305-316, 1967.
323. Gibor A., Granick S. Plastids and mito-
chondria: heritable systems, Science, 145,
890-897 (1964).
324. Gillham N. W. Organelle Heredity, New York,
Raven Press, 1978.
325. Gillham N. W., Boynton J. E., Harris E. H.,
Fox S. B., Bolen P. L. Genetic control of
chloroplast ribosome biogenesis in
Chlamydomonas. In: Genetics and Biogenesis
of Chloroplasts and Mitochondria, T. Bucher
et al., eds., Amsterdam, North-Holland,
pp. 69-76, 1976.
326. Gillham N. W., Fifer W. Nonchromosomal
genes in Chlamydomonas: a three point cross,
Science, 162, 683-685 (1968).
327. Giusto J. Chromosomal mechanisms in
catarrhine evolution, Master’s thesis, Boston
University, Boston Mass., 1978.
328. Giusto J. P., Margulis L. Karyotypic fissioning
theory and evolution of old world monkeys
and apes, BioSystems, 13, 200-250 (1981).
329. Girbardt M., Hadrich H. Ultrastructur des
Pilzkemes III. Genese des Kemassoziierten
Organells (NAO-“KCE”), Z. allg. Microbiol.,
15, 157-173 (1975).
330. Glaessner M. F. Biological events and the
Precambrian time scale, Can. J. Earth Sci., 5,
585-590 (1968).
331. Glaessner M.F. Geographic distribution and
time range of the Ediacaran Precambrian
fauna, Bull. Geol. Soc. Am., 82, 509-514
(1971).
332. Glaessner M. F. Early Phanerozoic annelid
worms and their geological and biological
significance, J. Geol. Soc. Lond., 132, 259-275
(1976).
333. Goksoyr J. Evolution of eucaryotic cells,
Nature, 214, 1161 (1967).
334. Goldman R., Pollard T, Rosenbaum J., eds. Cell
Motility, vols. А, В, C, New York, Cold
Spring Harbor, 1976.
335. Goldschmidt R. B. Theoretical Genetics,
Berkeley, University of California Press, 1955.
336. Goldschmidt R., Popoff M. Die Caryokinese
der Protozoa und der Chromialapparat der
Protozoen und Metazoenzelle, Arch.
Protistenkd., 8, 321 (1907).
337. Goldsmith D., Owen T. C. The Search for Life
on Earth, Menlo Park, Calif., W.A. Benjamin,
1980.
338. Golubic S. The relationship between blue-
green algae and carbonate deposits. In: The
Biology of the Blue-Green Algae, N. S. Carr
and B.A. Whitton, eds., Oxford, Blackwell,
pp. 434—472, 1973.
339. Golubic S. Organisms that build stromatolites.
In: Stromatolites, vol. 20, M.R. Walter, ed.,
Amsterdam, Elsevier, pp. 113-126, 1976.
340. Golubic S. Taxonomy of extant stromatolite
building cyanophytes. In: Stromatolites, vol.
20, M. R. Walter, ed., Amsterdam, Elsevier,
pp. 127-140, 1976.
341. Golubic S., Barghoorn E.S. Interpretation of
microbial fossils with special reference to the
Precambrian. In: Fossil Algae, E. Flugel, ed.,
Berlin, Springer-Verlag, pp. 1-13 (1977).
342. Golubic S., Campbell S. Analogous microbial
forms in recent subaerial habitats and in
Precambrian cherts: Gloeothece coerulea and
Eosynechococcus moorei (Hofmann),
Precambrian Res., 8, 201-217 (1979).
343. Golubic S., Perkins R.D., Lukas K. J. Boring
microorganisms and microborings in carbo-
nate substrates. In: The Study of Trace
Fossils, R.W. Frey, ed., New York, Springer-
Verlag, 1977.
344. Goode D. A directional turnover model for the
mechanisms of mitotic movements,
BioSystems, in press.
345. Goodwin A. M., Monster J., Thode H. G.
Carbon and sulfur isotope abundances in
Archean iron formations and early
Precambian life, Economic Geology, 71,
870-891 (1976).
346. Goodwin T. W. Chemistry of Chloroplasts,
vol. 1, London, New York, Acad. Press, 1966.
347. Goreau T.J. Coral skeletal chemistry:
physiological and environmental regulation of
stable isotopes in Monoastrea annularis, Proc.
R. Soc. Lond, B, 196, 291-315 (1976).
348. Gorovsky M. A., Woodard J. Radioautographic
studies of RNA synthesis in macro- and
micronuclei of Tetrahymena (abs. 126), J. Cell
Biol., 39, 54a (1968).
349. Gottschalk G. Bacterial metabolism, New
York, Heidelberg, Berlin, Springer-Verlag,
1978. (Имеется перевод: Готтшалк Г. Мета-
болизм бактерий-М.: «Мир», 1982.)
350. Goulian М., Kornberg A., Sinsheimer R. L.
Enzymatic synthesis of DNA, 24, Synthesis of
infectious phage фХ174 DNA, Proc. Natl.
Acad. Sci. USA, 58, 2321-2328 (1968).
ЛИТЕРАТУРА
319
351. Granick S., Gibor A. The DNA of chloroplasts,
mitochondria and centrioles, Adv. Nucl. Acid.
Res., 1, 143-186 (1967).
352. Grant V. Plant Speciation, New York,
Columbia University Press, 1971.
353. Graustein W. C., Cromack K., Soilins P.
Calcium oxalate: occurrence in soils and effect
on nutrient and geochemical cycles, Science,
198, 1252-1254 (1977).
354. Green D. E., Allman D. W. Biosynthesis of fatty
acids. In: Metabolic Pathways, 2, 38-68, D.
Greenberg, ed., New York, Academic Press,
1968.
355. Greenwood P.H., Rosen D.E., Wietzman S.H.,
Mayer G.S. Fishes, Bull. Am. Mus. Natl. Hist.,
121, 345-354 (1966).
356. Grell K. Sexual reproduction in protozoa. In:
Research in Protozoology, 2, 147-214, T.T.
Chen, ed., Oxford and London, Pergamon
Press, 1967.
357. Grell K. Trichoplax adhaerens and the origin
of metazoa, Proc. 4th Int. Congr. Protozool.,
Clermont-Ferrand, France, Sept, 1973.
358. G'ellK. Protozoology, Heidelberg and New
York, Springer-Verlag, 1974.
359. Griffin J. L. Microfilaments, microtubules,
pseudopods, villi, cilia and cytoplasm of
various amoebae, J. Cell Biol., 55, 99a
(abstract) (1972).
360. Grimes G. W., Adler J. A. Regeneration of
ciliary pattern in longitudinal fragments of the
hypotrichous ciliate, Stylonichia, JI Exp. Zool.,
204, 57-79 (1978).
361. Grimes G. W., EHernault S. W. Cytogeometrical
determination of ciliary pattern formation in
the hypotrich ciliate Stylonichia mytilis, Dev.
Biol., 70, 372-395 (1979).
362. Grimstone A.V A note on the fine structure of
a spirochaete, Q.J. Microsc. Sci., 105, 145-153
(1964).
363. Grimstone A. V., Cleveland L. R. The structure
of Myxotricha and its associated microorga-
nisms, Trans. R. Soc. Lond. Ser. B, 159,
668-686 (1964).
364. Grimstone A. V., Gibbons I. R. The fine struc-
ture of the centriolar apparatus and associated
structures in the complex flagellates
Trichonympha and Pseudotrichonympha, Trans.
R. Soc. Lond. Ser. B, 250, 215-242 (1966).
365. Grosovsky B. D. D., Margulis L. Termite micro-
bial communities: heat, starvation and
antibiotic-induced alteration. Tn: Methods in
Microbial Ecology R. G. Bums and
J. H. Slater, eds., Oxford, Blackwell Scientific
Publications, 1981.
366. Grossman I. W., Heitkamp D. H. Electron mic-
roscopy and biochemistry of developing
mitochondria (abs.), Fed. Proc., 27, 247 (1968).
367. Gutstadet A. M., Schopf J. W. Possible algal
microfossils from the late Precambrian of
California, Nature, 223, 165-167 (1969).
368. Haas W.J. Evolution by symbiosis: the
organismic view of H. Reinheimer, Unpubli-
shed manuscript, Boston University, 1977.
369. Haeckel E. Generale Morphologic der
Organismen, vols. 1, 1, Berlin, Reiner, 1866.
370. Haeckel E. Cited in R.H. Whittaker, 1959. On
the broad classification of organisms, Q. Rev.
Biol., 34, 210-226 (1872).
371. Haeckel E. Das Protistenreich, Leipzig, Gun-
ther, 1878.
372. Haldane J. B. S. The Origin of Life, Reprinted
in J. D. Bernal, 1967, The Origin of Life,
Cleveland, World, 1929.
373. Hale M.E., Jr. The Biology of Lichens,
London and New York, Edward Arnold, 1967.
374. Hall W. T., Claus G. Ultrastructural studies on
the blue-green algal symbiont in Cyanophora
paradoxa Korshikoff, J. Cell Biol., 19, 551-563
(1963).
375. Hall W.T., Claus G. Ultrastructural studies on
the cyanelles of Glaucocystis nostochinearum, J.
Phycol., 3, 37-51 (1967).
376. Hallibauer D. K., van Warmelo К. T Fossilized
plants in thucholite from Precambrian rocks
of the Witswatersrand, So. Africa,
Precambrian Res., 1, 199-212 (1974).
377. Hamlin R. M., Lord R. C., Rich A. Hydrogen
bonded dimers of adenine and uracil
derivatives, Science, 148, 1734-1737 (1965).
378. Hana wait P. C., Pettjohn D.E., Pauling E.C.,
Brunk C. F., Smith D. W., Kanner L. C.,
Couch J. L. Repair-replication of DNA in
vivo, Cold Spring Harbor Symp. Quant. Biol.,
33, 187-194 (1968).
379. Hanson E. D. Origin and Early Evolution of
Animals, Middletown, Conn., Wesleyan
University Press, 1977.
380. Hargraves R. B. Precambrian geologic history,
Science, 193, 363-371 (1976).
381. Harris E.H., Boynton J.E., Gillham N. W. The
genetics of algae, Bot. Monogr., 12, 119-144,
R. A. Lewin, ed., Oxford, Blackwell, 1976.
382. Hartman H. The centriole and the cell, J.
Theor. Biol., 51, 501-509 (1975).
383. Hartman H., Gurney T., Puma T. Evidence for
the association of RNA with the ciliary basal
bodies of Tetrahymena, J. Cell Sci., 16,
241-259 (1974).
384. Hartwell L. H. Saccharomyces cerevisiae cell
cycle, Bacteriol. Rev., 38, 164-198 (1974).
385. Harvey E. N. Biolumenescence, New York,
Academic Press, 1952.
386. Hastings J. TK, Nealson K.H. Bacterial
bioluminescence, Annu. Rev. Microbiol., 31,
549-595 (1977).
387 Hatanaka П. Eg ami F. Selective formation of
certain amino acids from formaldehyde and
hydroxylamine in a modified sea medium
enriched with molybdate, J. Biochem., 82,
499-502 (1977).
388. Haugaard N. Cellular mechanisms of oxygen
toxicity, Physiol. Rev., 48, 311-373 (1968).
389. Hawkins S. E., Wolstenholme D. R. Cytoplas-
mic DNA-containing bodies and the
inheritance of certain cytoplasmically
determined character in Amoeba, Nature, 214,
928-929 (1967).
390. Hayatsu R., Studier M. H., Moore L. P., An-
ders E. Purines and triazines in the Murchison
320
ЛИТЕРАТУРА
metiorite, Geochim. Cosmochim, Acta, 39,
471-488 (1975).
391. Hayes J. M. Organic constituents of meteori-
tes: a review, Geochim. Cosmochim. Acta, 31,
1395-1440 (1967).
392. Heath 1. B. Mechanisms of nuclear division in
fungi. In: The Fungal Nucleus, K. Gull and
S. Oliver, eds, Cambridge, Cambridge
University Press, 1980.
393. Heath I. B. Variant mitosis in lower
eukaryotes: indication of the evolution of
mitosis? Int. Rev. Cytol., 64, 1-80 (1980).
394. Heath I. B., Darley W. M. Observations on the
ultrastructure of the male gemetes of Biddul-
phia levis, Ehr. J. Phycol., 8, 51-57 (1972).
395. Heidemann S.R., Sander G., Kirschner M.W.
Evidence for a functionalrole of RNA in
centrioles, Cell, 10, 337-350 (1977).
396. Heilbrunn L. V. The Dynamics of Living
Protoplasm, New York, Academic Press, 1956.
397. Hendrickson J. B. The Molecules of Nature,
New York, W. A. Benjamin, 1965.
398. Henneguy L. F. La Vie Cellulaire, Paris,
Collection Payot, 1923.
399. Henry S. M. Association of microorganisms,
plants and marine organisms. In: Symbiosis,
vol. 1, S. M. Henry, ed., New York, Academic
Press, 1966.
400. Hepler P. K., Jackson W. T. Microtubules and
early stages of cell-plate formation in the
endosperm of Haemanthus katerinae Baker,
J. Cell. Biol., 38, 437-446 (1968).
401. Herdman M.t Stonier R. Y. The cyanelle:
chloroplast or endosymbiotic prokaryote?
Fed. Eur. Microbiol. Soc. Letters, 1, 7-12
(1977).
402. Herring P.J. Bioluminescence in Action, New
York, Academic Press, 1978.
403. Hess R. T, Menzel D.B. Rat kidney centrioles:
vitamin E intake and oxygen exposure,
Science, 159, 985-987 (1967).
404. Hodgeson G. W., Ponnamperuma C. Prebiotic
porphyrin genesis: porphyrin from electric
discharge in methane, ammonia, and water
vapor, Proc. Natl. Acad. Sci. USA, 59, 22-28
(1968).
405. Hoering T. Organic Geochemistry of Precam-
brian Rocks. Researches in Geochemistry, vol.
2, P. Abelson, ed., New York, Wiley,
pp. 87-111, 1967.
406. Hojfinan E. J. The nucleic acids of the basal
bodies isolated from Tetrahymena, J. Cell
Biol., 25, 217 (1965).
407. Hofftnan P. F. Oral communication, meeting
on Environment of the Primitive Earth, cited
in R. Siever 1968, See Science, 164, 711-712
(1968).
408. Hofftnan P. F. Stratigraphy of the Great Slave
Lake. Supergroup (Aphebian) East Arm of
Great Slave Lake, District of Mackensie,
Geological Survey of Canada, Paper 68-42,
1969.
409. Hofftnan H. J. On Aphebian stromatolites and
Riphean stromatolite stratigraphy, Pricambri-
an Res., 4, 175-207 (1977).
410. Hogg J. On the distributions of a plant and
an animal and on a fourth kingdom of nature,
Edinb. New Philos. J. (N.S.), 12, 216-225
(1861).
411. Holdeman L.V., Moore W.E. Anaerobe Labo-
ratory Manual, Blacksburg: Virginia Polv-
technic Institute Anaerobe Laboratory, 1972.
412. Holland H.D. Origin and evolution of the
atmosphere, McGraw-Hill Yearbook of
Science and Technology, pp. 53-59, New
York, McGraw-Hill, 1967.
413. Holland H.D.Chemistry of the Atmosphere
and Oceans, New York, Wiley Interscience,
1978.
414. Hollande A. Le deroulement de la cryptmitose
et les modalites de la segregation des
chromatides dans quelques groupes de
protozoaires, Ann. Biol., 11, 427-466
(1972).
415. Hollande A., Cachon J., Cachon M., Carruette-
Valentin J. Infrastructure des axopodes et
organisation generale de Sticholonche zanclea,
Protistologica, 3, 155-166 (1967).
416. Hollande A., Carruette-Valentin J. Interpretati-
on generale des structures rostrales des
Hypermastigines et modalites de la
pleuromitose chez les flagelles du genre
Trichonympha, C. R. Acad. Sci. Paris, 270,
1476-1490 (1970).
417. Hollande A., Carruette-Valentin J. Les atracto-
phores, fin duct ion du fuseau et la division
cellulaire chez les Hypermastingines. Etude
infrastructurale et revission systematique des
Trichonymphines et des Spirotrichon у m-
phines, Protistologica, 7, 5-100 (1971).
418. Hollande A., Gharagozlou I. D. Morphologie
infrastructurale de Pillotina calotermitidis nov.
gen., nov. sp. Spirochaetale de 1’intestine
de Calotermes praecox, C. R. Acad. Sci. Paris,
265, 1309-1312 (1967).
419. Holt J., Lewin R. A. Herpetosiphon aurantia sp.
nov. A new filamentous gliding organism, J.
Bact., 95, 2407 (1968).
420. Holt S. The anatomy and biochemistry of
spirochetes, Microbiol. Res., 42, 114-160
(1978).
421. Holton R. W., Blecker H.H., Stevens T.S. Fatty
acids in blue-green algae: possible relationship
to taxonomic position, Science, 160, 545-547
(1968).
422. Honigberg В. M., Balamuth W., Bovee E. C.,
Corlis J. G., Gogjics M., Hall R.P., Kudo R. R.,
Levine N.D., Loeblich A. R., Weister J.,
Wenrich D. H. A revised classification of the
phylum Protozoa, J. Protozool., 11, 7-29
(1964).
423. Horodyski R. J. Lyngbya mats at Laguna
Mormona, Baja California, Mexico: compari-
son with Proterozoic stromatolites, J.
Sediment, Petrol., 47, 1305-1320 (1977).
424. Horodyski R. J., Vonder Haar S. P. Recent
calcareous stromatolites from Laguna
Mormona (Baja California, Mexico), J.
Sediment. Petrol., 45, 894 (1975).
425. Horowitz N. H. On the evolution of biochemi-
ЛИТЕРАТУРА
321
cal synthesis, Proc. Natl. Acad. Sci. USA, 31,
153-157 (1945).
426. Horowitz N. H. The search for life on Mars,
Scientific American, 237, 52-61 (1977).
427. Horowitz N. H., Miller S. L. Current theories
on the origin of life, Fortschr. Chem. Org., 20,
423-459 (1962).
428. Hovind-Hougen K. Determination by means of
electron microscopy of morphological criteria
of value for the classification of some
spirochetes, in particular treponemes, Acta
Pathol. Microbiol. Scand. B, Suppl., 255
(1976).
429. Howell S.H., Heizmann P., Gelvin S. Localiza-
tion of the gene coding for the large subunit
of ribulose biphosphate carboxylase on the
chloroplast genome of Chlamydomonas
reinhardi. In: Genetics and Biogenesis of
Chloroplasts and Mitochondria, T. Bucher et
al., eds., Amsterdam, North-Holland,
pp. 625-628, 1976.
430. Howell S. H., Moudrianakis E. N. Hill reaction
site in chloroplast membranes: Non-participa-
tion of the quantasome particle in photo-
reduction, J. Mol. Biol., 27, 323-333 (1967).
431. Hufriagel L., Myhal M.L. Observations on
a spirochete symbiotic in Hydra attenuata,
Trans. Am. Microsc. Soc., 96, 406-411 (1977).
432. Hungate R. E. The Rumen and Its Microbes,
New York, Academic Press, 1966.
433. Hunt L. T., Dayhoft M. 0. Amino-terminal
sequences density of ubiquitin and the
nonhistone components of nuclear protein
A24, Biochem. Biophys. Res. Commun., 74,
650-655 (1977).
434. Huntington R. W., Jr. Proceedings of the
Second Coccidiomycosis Symposium, Phoenix,
Ariz. Dec., 1965, Phoenix, University of
Arizona Press, 1967.
435. Hurley P. How Old Is the Earth? New York,
Doubleday-Anchor, 1959.
436. Hutchinson G. E. The biologist poses some
problems. In: Oceanography, M. Sears, ed.,
Washington, D. C., Am. Assoc. Adv. Sci. Publ.
No. 67, pp. 85-94 (1961).
437. Hutchinson G. E. The Ecological Theatre and
the Evolutionary Play, New Haven, Yale
University Press, 1965.
438. Hutchinson G. E. Treatise on Limnology, vol.
2, New York, John Wiley and Sons, 1967.
439. Hitchinson G. E. Treatise on Limnology, vol. 3,
New York, John Wiley and Sons, 1976.
440. Hutchinson J. The Families of Flowering
Plants, vol. 1, Dicotyledons, 2nd ed., Oxford,
Clarendon Press, 1959.
441. Hutch inson J. Evolution and Phylogeny of
Flowering Plants. Dicotyledons: Facts and
Theory, New York, Academic Press, 1969.
442. Imshenetsky A. A., Lysenko S. V., Kozakov G.A.
Upper boundary of the biosphere, Appl.
Environ. Microbiol., 35, 1-5 (1978).
443. Inoue S., Stephens R. E., eds. Molecules and
Cell Movement, New York, Raven Press,
1975.
444. Jacob F., Wollman E. L. Sexuality and
21-39
Genetics of the Bacteria, New York, Academic
Press, 1961. (Имеется перевод: Жакоб Ф.,
Вольман Э. Пол и генетика бактерий-М.:
«Мир», 1962.)
445. Jellinck Р. Н. Cellular Role of Macromole-
cules, Glenview, III, Scott, Foresman, 1967.
446. Jenkins R. A. The role of microtubules in
macronuclear division in Blepharisma (abs. 18),
J. Protozool., 16, Supplement, 1969.
447. Jennings D., ed. Symbiosis, Proc. Soc. Exp.
Biol., 29, Cambridge, Cambridge University
Press, 1975.
448. Jensen T. E., Ayala R. P. Microtubule-like
inclusions in isolates of the blue-green bacteria
Anabaena and Nostoc, Cytologia, 45, 315-326
(1980).
449. Jeon K. W. Development of cellular
dependence in infective organisms: microsur-
gical studies in amoebas, Science, 176,
1122-1123 (1972).
450. Jeon K. W., Ahn T.I. Temperature sensitivity:
A cell character determined by obligate
endosymbionts in amoebas, Science, 202,
635-637 (1978).
451. Jeon K. W., Jeon M.S. Endosymbiosis in
amoebae: Recently established endosymbionts
have become required cytoplasmic
components. J. Cell Physiol., 89, 337-344
(1976).
452. Jinks J. L. Extrachromosomal Inheritance,
Englewood Cliffs, N.J., Prentice-Hall, 1964.
453. John P., Para S. Rapid oxygen-induced
reduction of b-type cytochromes in Paracoc-
cus denitrificans, FEBS Lett., 85, 179-182
(1978).
454. John P., Whatley F. R. Paracoccus denitrificans
and the evolution of mitochondrion, Nature,
254, 995-998 (1975).
455. John P., Whatley F.R. Paracoccus denitrifi-
cans: a present-day bacterium resembling the
hypothetical free living ancestor of the
mitochondrion. Symbiosis, Proc. Soc. Exp.
Biol., 29, 39-40, Cambridge, Cambridge
University Press (1975).
456. John P., Whatley F.R. The bioenergetics of
Paracoccus denitrificans, Biochim. Biophys.
Acta, 463, 129-153 (1977).
457. John P., Whatley F. R. Paracoccus dentrificans
(Davis) (Micrococcus denitrificans) (Beijerinck)
as a mitochondrion, Adv. Bot. Res., 4, 51-115
(1977).
458. Johnson R. C. The spirochaetes, Annu. Rev.
Microbiol., 31, 89-106 (1977).
459. Johnson U., Porter K.R. Fine structure of cell
division in Chlamydomonas reinhardi, J. Cell
Biol., 38, 403-425 (1968).
460. Joklik W.K. Evolution in viruses. In:
Evolution in the Microbial World,
M. J. Carlile and J. J. Skehel. eds., Symp. Soc.
Gen. Microbiol., 24, 293-320, Cambridge,
Cambridge University Press (1974).
461. Jollow D., Kellerman G.M., Linnane A. W. The
biogenesis of mitochondria, 3. The lipid
composition of aerobically and anaerobically
grown Saccharomyces cerevisiae as related to
322
ЛИТЕРАТУРА
the membrane systems of cells, J. Cell Biol.,
37, 221-230 (1968).
462. Joly A. B. Botanica: Introducao a Taxonomia
Vegetal. Companhia Editora Nactional, Sao
Paulo, Brasil: Editora da Universidade de Sao
Paulo, 1966.
463. Jones L. W., Myers J. A common link between
photosynthesis and respiration in a blue green
alga, Nature, 199, 670-672 (1963).
464. Kamen M. D. Primary Processes in
Photosynthesis, New York, Academic Press,
1963.
465. Kane R.E. The mitotic apparatus: fine struc-
ture of the isolated unit, J. Cell Biol., 15, 279
(1962).
466. Kane R.E. The mitotic apparatus: identifi-
cation of the major soluble component of the
glycol-isolated mitotic apparatus, J. Cell Biol.,
32, 243-254 (1967).
467. Kaplan N.O. Lactate dehydrogenase - struc-
ture and function, Brookhaven Symp. Biol, 17,
131-153 (1964).
468. Karakashian M. Symbiosis in Paramecium
bursaria. In: Symbiosis, Proc. Soc. Exp. Biol.,
29, D. Jennings, ed., Cambridge, Cambridge
University Press (1975).
469. Karakashian S.J. Growth of Paramecium
bursaria as influenced by the presence of algal
symbionts, Physiol. Zool., 36, 52-68 (1963).
470. Karakashian S.J., Karakashian M., Rudzin-
ska M. Electron mikroscopic observations on
the symbiosis of Paramecium bursaria and its
intracellular algae, J. Protozool., 15, 113-128
(1968).
471. Karakashian S.J., Siegel R.W. A genetic
approach to endocellular symbiosis, Experi-
ment. Parasit. Rev., 17, 103-122 (1965).
472. Kates M., Palameta B., Joo C. N., Kush-
ner D. J., Gibbons N. E. Aliphatic diether
analogs of glyceride-derived lipids, IV. The
occurrence of Dj-O-dihydrophytylglycerol
ether containing lipids in extremely halophilic
bacteria, Biochemistry, 5, 4092-4099 (1966).
473. Keeosian J. The Origin of Life, 2nd ed., New
York, Reinhold, 1968.
474. Keifer B., Sakai H., Solari A. J., Mazia D. The
molecular unit of the microtubules of the
mitotic apparatus, J. Mol. Biol., 20, 75-79
(1966).
475. Kelleher J. K., Bloodgood R. A. Microtubules.
In: Biochemistry and Physiology of Protozoa,
2nd ed., vol. 2, New York! Academic Press,
pp. 151-180 (1979).
476. Kelley W. S., Schaechter M. The “life cycle” of
bacterial ribosomes. In: Advances in
Microbial Physiology, 2, 89-142, A. H. Rose
and J. F. Wilkinson, eds., New York,
Academic Press, 1968.
477. Kenyon G. H., Steinman G. Biochemical
Predestination, New York, McGraw-Hill,
1969.
478. Khorana G. Research summaries of the
biology department, Mass. Inst. Tech.
Cambridge, Mass., p. 139, 1977.
479. Kirby H., Jr. Two polymastigote flagellates of
the genera Pseudodevescovina and Caduceia,
Q. J. Microscop. Sci., 19, 309-335 (1936).
480. Kirby H., Jr. Organisms living on and in
protozoa. In: Protozoa in Biological Research,
G. N. Calkins and F. M. Summers, eds., New
York, Columbia University Press,
pp. 1009-1113, 1941.
481. Kirk J.T.O., Tilney-Basset R. A. E. The Plas-
tids, San Francisco, W. H. Freeman and
Company, 1967.
482. Kislev N., Swift H., Borogad L. Nucleic acids
of chloroplasts and mitochondria in Swiss
chard, J. Cell Biol., 25, 327-344 (1965).
483. Kitching J. A., Craggs S. The axopodial
filaments of the heliozoan Actinosphaerium
nucleofilum, Exp. Cell Res., 40, 658-660 (1965).
484. Klein R., Cronquist A. A consideration of the
evolutionary and taxonomic significance of
some biochemical, micromorphological and
physiological characters in the Thallophytes,
Q. Rev. Biol., 42, 105-296 (1967).
485. Kleineberger-Nobel E. Pleuropneumonia-like
Organisms (PPLO), Mycoplasmataceae, New
York, Academic Press, 1962.
486. Kluyver A. S., van Niel С. B. The Microbes
Contribution to Biology, Cambridge, Mass.,
Harvard University Press (1956).
487. Knauth L. P., Epstein S. Hydrogen and oxygen
isotope ratios in nodular and bedded cherts,
Geochim. Cosmochim. Acta, 40, 1095-1108
(1976).
488. Knoll A. H. Archean autotrophy: some
alternatives and limits, Origins of Life, 9,
313-327 (1979).
489. Knoll A. H. Geological evidence for early
evolution. Cosmochemistry of the origin of
life, 3rd Mexican M,eting on the Origin of
Life, 11-13 Jan. 1979, University of Mexico, in
press.
490. Knoll A. H., Barghoorn E. S. Precambrian eu-
karyotic organisms: a reassessment of the
evidence,' Science, 190, 52-54 (1975).
491. Knoll A. H., Barghoorn E.S. Archean micro-
fossils showing cell division from the
Swaziland system of South Africa, Science,
198, 396-398 (1977).
492. Knoll A. H., Barghoorn E. S., Awramik S. New
microorganisms for the Aphebian Gunflint
Iron Formation, Ontario, J. Paleontol., 52,
976-992 (1978).
493. Kohlmeyer J. New clues to the possible origin
of ascomycetes, BioScience, 25, 86-93 (1975).
494. Kohlmeyer J., Kohlmeyer E. Is Ascophyllum
nodudum lichenized? Bot. Mar., 15, 109-112
(1972).
495. Kornberg A. DNA Replication, San Francisco,
W. H. Freeman and Company, 1980. (Имеется
перевод издания 1974 г.: Корнберг А. Син-
тез ДНК.-М.: «Мир», 1977.)
496. Козо-Полянский Б.М. Новый принцип био-
логии. Очерк теории симбиогенеза-Л.-М.:
«Пучина», 1924.
497. Kreier J., ed. The Parasitic Protozoa, New
York, Academic Press, 1978.
498. Kretsinger R.H. Hypothesis: Calcium
ЛИТЕРАТУРА
323
modulated proteins contain EF hands. In:
Calcium Transport in Contraction and
Secretion, E. Caraboli, ed., Amsterdam,
North-Holland, pp. 469-478, 1975.
499. Kretsinger R. H. Calcium binding proteins,
Annu Rev. Biochem., 45, 239-262 (1976).
500. Kretsinger R. H. Why does calcium play an
informational role unique in biological
systems? 9th Jerusalem Symposium. In:
Metal-Ligand Interactions in Organic and
Biochemistry, Jerusalem, 1976.
501. Kretsinger R.H. Evolutionary considerations
of calcium pumping by biological membranes.
In: The Proceedings of a Joint US-USSR
Conference, D. C. Tortenson, ed., New York,
Raven Press, 1977.
502. Krinsky N. I. Carotenoid de-epoxidations in
algae. 1. Photochemical transformation of
antheraxanthin to zeaxanthin Biochem.
Biophys. Acta, 88, 487-491 (1964).
503. Krinsky N. I. The role of carotenoid pigments
as protective agents against photosensitized
oxidations in chloroplasts. In: Biochemistry of
Chloroplasts, 1, 423-430, T. W. Goodwin, ed.,
New York, Academic Press, 1966.
504. Krinsky N. I., Gordon A., Stern A. The appea-
rance of neoxanthin during the regreening of
dark grown Euglana, Plant Physiol., 39,
441-445 (1964).
505. Krinsky N.I., Margulis L. Visible light: mu-
tagen or killer? Science, 160, 1256 (1968).
506. Kriss A. E. Marine Microbiology (Deep Sea),
New York, Wiley Interscience, 1963.
507. Kroon A. M. Protein Synthesis in Mito-
chondria. Ph. D. thesis, University of
Amsterdam, North-Holland, Netherlands,
1966.
508. Krumbein WE., ed. Environmental Biogeo-
chemistry and Geomicrobiology, vols. 1, 2,
Ann. Arbor. Mich.: Ann. Arbor Science Publi-
shers, 1978.
509. Kubai D. F. Evolution of the mitotic spindle,
Int. Rev. Cytol., 43, 167-230 (1975).
510. Kubai D.F. Mitosis and fungal phylogeny. In:
Nuclear Division in the Fungi, I. B. Heath, ed.,
New York, Academic Press, 1978.
511. Kubai D.F., Ris H. Division in the Dinofla-
gellate Gryodinium cohnii (Schiller), A new
type of nuclear reproduction, J. Cell Biol., 40,
508-528 (1969).
512. Kudo R.R. Protozoology, 4th ed., Springfield,
Charles Thomas and Sons, 1954.
513. Kuhn T. The Structure of Scientific
Revolutions, Chicago University of Chicago
Press, 1962.
514. Kummell B. History of the Earth, San
Francisco, W.H. Freeman and Company,
1961.
515. Kusel J. P., Moore К. H.t Weber M. M.
Ultrastructure of Crithidia fasciculata and
morphological changes induced by growth in
acriflavin, J. Protozool., 14, 283-296 (1967).
516. Kushner D. J. Life in extreme environments.
In: Chemical Evolution and the Origin of
Life, R. Buvet and C. Ponnamperuma, eds.,
Amsterdam, North-Holland, pp. 485-491,
1971.
517. Kuznetsov S.I., Ivanov M. V., Lyalikova N.N.
Introduction to Geological Microbiology,
New York, McGraw-Hill, 1962.
518. Kuznicki L., JahnT.L., Fumesca J.R. Helical
nature of the ciliary beat of Paramecium
multimicronucleatum, J. Protozool., 17, 16-24
(1970).
519. Kvenvolden K.A., Peterson E., Pollack G.E.
Optical configuration of amino acids in
Precambrian Fig Tree chert, Nature, 221,
141-143 (1969).
520. Kyogoku Y., Lord R.C., Rich A. Hydrogen
bonding specificity of nucleic acid purines and
pyrimidines in solution, Science, 154, 518-520
(1966).
521. Laane M.M. The nuclear division in
Penicillium expansum, Can. J. Cytol., 9,
342-351 (1967).
522. La Berge G. L. Microfossils and Precambrian
iron formations, Geol. Soc. Am. Bull., 78,
331-342 (1967).
523. Lamb A. J., Clark-Walter G.D., Linnane A. W.
The biogenesis of mitochondria. The
differentiation of mitochondrial and cytoplas-
mic protein synthesizing systems in vitro by
antibiotics, Biochim. Biophys. Acta, 161,
415-427 (1968).
524. Lange R. Bacterial symbiosis with plants. In:
Symbiosis, vol. 1, S.M. Henry, ed., New York,
Academic Press, pp. 99-170, 1966.
525. Lanham U.N. Blochmann bodies: hereditary
intracellular symbionts of insects, Biol. Rev.
Camb. Phil. Soc., 43, 261-286 (1968).
526. Lanyi J. K. Physical chemistry and evolution
of salt tolerance in halobacteria. In: Limits of
Life, Proc. Fourth College Park Symposium,
C. Ponnamperuma and L. Margulis, eds.,
Dordrecht, Holland, Reidel, pp. 61-67,
1980..
527. Lapworth Ch. On the tripartite classification of
the Lower Paleozoic rocks, Geol. Mag., 6,
1-15 (1879).
528. Lauterborn R. Untersuchungen fiber Bau,
Kemteilung und Bewegung der Diatomeen,
Leipzig, W. Engelman, 1896.
529. Lavette A. Recherches sur les constituants
cytoplasmiques des flagelles termiticoles et sur
la digestion du bois, Ann. Sci. Nat. Zool. Paris
(12th Series), 9, 457-528 (1967).
530. Lazarides E., Revel J. P. Molecular basis of
cell movement, Scientific American, 240,
100-113 (1979).
531. Leak L. V. Studies on the preservation and
organization of the DNA-containing regions
in a blue-green alga, a cytochemical and
ultrastructural study, J. Ultrastruct. Res., 20,
190-205 (1967).
532. Leak L. V. Fine structure of the mucilaginous
sheath of Anabeana sp., J. Ultrastruct. Res., 21,
61-74 (1968).
533. Ledbetter M. C. Disposition of microtubules in
plant cells during interphase and mitosis. In:
Formation and Fate of Cell Organelles,
324
ЛИТЕРАТУРА
К. В. Warren, ed., New York, Academic Press,
pp. 55-70, 1967.
534. Lederberg J. Genetic Studies with Bacteria in
the 20th Century, L. W. Dunn, ed., New York,
Macmillan, 1951.
535. Lederberg J. Cell genetics and hereditary
symbiosis, Physiol. Rev., 32, 403-430 (1952).
536. Ledoux L., ed. Informative Molecules in
Biological Systems, Amsterdam, North-Hol-
land, 1972.
537. Lee R. E. Evolution of algal flagellates with
chloroplast endoplasmic reticulum from the
ciliates, S. Afr. J. Sci., 73, 179-182 (1977).
538. Leedale G. Euglenoid Flagellates, Englewood
Cliffs, N.J., Prentice-Hall, 1967.
539. Leedale G. How many are the kingdoms of
organisms? Taxon, 23, 261-270 (1974).
540. Leeuwenhoek A. van. Letters in Antony van
Leeuwenhoek and his Little Animals, by
C. Dobell, New York, Russell and Russell,
1958.
541. Leff J., Krinsky N.I. A mutagenic effect of
visible light mediated by endogenous pigments
in Euglena gracilis, Science, 158, 1332-1334
(1967).
542. Leff J., Mandel M., Epstein H.T., Schiff J. A.
DNA satellite from cells of green and
aplastidic algae, Biochem. Biophys. Res.
Commun., 13, 126-130 (1963).
543. Lehninger A. The Mitochondrion, New York,
W.A. Benjamin, 1964. (Имеется перевод:
Ленинджер А. Митохондрия.-M.: «Мир»,
1966.)
544. Leidy J. The parasites of the termites, J. Acad.
Nat. Sci. (Philadelphia New (Second) Series),
8, 425-447 (1881).
545. Lerner I. M. Heredity, Evolution and Society,
San Francisco, W. H. Freemen and Company,
1968.
546. Lewin R. A. Saprosira grandis, J. Microbiol., 8,
555-567 (1962).
547. Lewin R. A. Freshwater species of Saprospira,
Canad. J. Microbiol., 11, 135-139 (1965).
548. Lewin R. A. Genetics of Algae. Botanical
monographs, vol. 12, Oxford, Blackwell, 1976.
549. Lewin R. A. Prochlorophyta as a proposed
new division of algae, Nature, 261, 697-698
(1976).
550. Lewin R. A. Prochloron, type genus of the
Prochlorophyta, Phycologia, 16, 217 (1977).
551. Lewin R. A., Withers N.W. Extraordinary
pigment composition of a prokaryotic alga,
Nature, 256, 735-737 (1975).
552. Lewis D. H. Concepts in fungal mutation and
the origin of biotrophy, Biol. Rev. Camb. Phil.
Soc., 48, 261 (1973).
553. Lewis D. H. The relevance of symbiosis to
taxonomy and ecology with particular
reference to mutualistic symbiosis and the
exploitation of marginal habitats. Taxonomy
and Ecology, V. H. Heywood, ed., New York,
Academic Press, 1973.
554. Licari G. R., Cloud P. E., Jr. Reproductive
structures and taxonomic affinities of some
nannofossils from the Gun flint iron formation,
Proc. Natl Acad. Sci. USA, 59, 1053-1060
(1968).
555. Leghthill M.J. Flagellar hydrodynamics,
SIAM Rev., 18, 161-230 (1976).
556. Lindegren С. C. Cold War in Biology, Ann.
Arbor, Planarian Press, 1966.
557. Linnane A. W. Aspects of the biosynthesis of
the mitochondria of Saccharomyces cerevisiae.
In: Oxidases and Related Redox Systems,
T. E. King, H. Mason and H. Morrison, eds.,
New York, John Wiley and Sons,
pp. 1102-1128 (1965).
558. Linnane A. W. The nature of mitochondrial
RNA and some characteristics of the protein-
synthesizing system of the mitochondria
isolated from antibiotic sensitive and resistant
yeasts. In: E.C. Slater, J. M. Tager, S. Papa
and E. Quagliariello, eds., Bari, Italy,
Adriatica Editrice, 1968.
559. Linnane A. W., Briggs D. R., Huang M., Clark-
Walker G. D. The effect of choramphenicol on
the differentiation of the mitochondrial
organell. In: Aspects of Yeast Metabolism,
R. K. Mills, ed., New York, Oxford University
Press, pp. 217-245, 1967.
560. Linnane A. W., Saunders G. W, Gingold E. B.,
Lukins H. B. The biogenesis of mitochondria,
V. Cytoplasmic inheritance of erythromycin
resistance in Saccharomyces cerevisiae, Proc.
Natl. Acad. Sci. USA, 59, 903-910 (1968).
561. Lipps J.H. Plankton evolution, Evolution, 24,
1-22 (1970).
562. Listgarten M. A., Socransky S. S. Electron
microscopy of axial fibrils, outer envelope and
cell division of certain oral spirochaetes, J.
Bacteriol., 88, 1087-1103 (1964).
563. Listgarten M. A., Socransky S. S. Electron
microscopy as an aid in the taxonomic
differentiation of oral spirochaetes, Arch. Oral
Biol., 10, 127-138 (1965).
564. Livingston W.C. Emanations from the sun,
Science, 199, 1429-1430 (1977).
565. Loewy T., Siekevitz P. Cell Structure and
Function, New York, Holt, Rinehart and
Winston, 1969. (Имеется перевод: Лёви A.,
Сикевиц Ф. Структура и функции клет-
ки-М.: «Мир», 1971.)
566. Lovelock J. Е. Gaia as seen through the
atmosphere, Atmosphere and Environment, 6,
579-580 (1972).
567. Lovelock J. E. Gaia, Oxford, Oxford
University Press, 1979.
568. Lovelock J.E., Maggs R.J., Wade R.J.
Halocarbons in and over the Atlantic, Nature,
241, 194-196 (1973).
569. Lovelock J. E., Margulis L. Atmospheric
homeostasis by and for the biosphere: the
Gaia hypothesis, Tellus, 26, 1-10 (1974).
570. Lovelock J. E., Margulis L. Homeostatic
tendencies of the earth’s atmosphere, Origin of
Life, 1, 12-22 (1974).
571. Lowens tam H.A. Biologic problems relating to
the composition and diagenesis of sediments.
In: Problems and Progress in Current
Research, T. W. Donnell, ed., Chicago,
ЛИТЕРАТУРА
325
University of Chicago Press, pp. 137-195,
1963.
572. Lowenstam H. A. Evolutionary changes in
hard part mineralogy of some marine
invertebrates, Geol. Soc. Am. (Abstracts with
program), 5, 719 (1972).
573. Lowenstam H. A. Phosphatic hard tissues of
marine invertebrates: their nature and
mechanical function and some fossil
implications, Chem. Geol., 9, 153-166 (1972).
574. Lowenstam H. A. Impact of life on chemical
and physical processes. In: The Sea (Marine
Chemistry), vol. 5, E. Goldberg, ed., New
York, John Wiley and Sons, pp. 715-796,
1974.
575. Lowenstam H. A. What, if anything, happened
at the transition from the Precambrian to the
Phanerozoic? Precambrian Res., 11, 89-91
(1980).
576. Lowenstam H. A. Bioinorganic constituents of
hard parts, Biogeochemistry of Amino Acids,
P. E. Hare, ed., New York, John Wiley and
Sons, pp. 3-16, 1980.
577. Lowenstam H. A., Margulis L. Calcium
regulation and the appearance of calcareous
skeletons in the fossil record, Proc. Third
Internatl. Symp. Meeh., Biomineralization
invertebrates and plants, Kashikoyima, Mie,
Japan, pp. 289-300, 1980.
578. Lowenstam H. A., Margulis L. Evolutionary
prerequisites for Phanerozoic skeletons,
BioSystems, 12, 27-41 (1980).
579. Luck D. J. L., Reich E. DNA in mitochondria
of Neurospora crassa, Proc. Natl. Acad. Sci.
USA, 52, 931-938 (1964).
580. Lucretius T. 1st century В. C. De Rerum
Natura, W. E. Leonard and S. B. Smith, eds.
Madison, University of Wisconsin Press, 1965.
581. Luduena R.F. Biochemistry of microtubule
protein. In: Microtubules, K. Roberts and
J. Hyams, eds., New York, Academic Press,
1979.
582. Lumiere A. Le Myth des Symbiotes, Paris,
Masson et Cie, Editeurs, 1919.
583. Lund J. W. G. Classical and modern criteria
used in algal taxonomy with special reference
to genera of microbial size. In: Microbial
Classification, G. C. Ainsworth and P. H. A.
Sneath, eds., Cambridge, Cambridge
University Press, pp. 68-110, 1964.
584. Luykx P. Cellular mechanisms of chromosome
distribution, Internatl. Rev. Cytol. Supplemt.,
2, 1-173, New York, Academic- Press, 1970.
585. Lwoff A. Problems of Morphogenesis in
Ciliates: The Kinetosomes in Development,
Reproduction and Evolution, New York, John
Wiley and Sons, 1950.
586. Lwoff A., Tournier M. Claccification of
viruses, Annu. Rev. Microbiol., 20, 45-74
(1966).
587. Lyttleton J. W. Isolation of ribosomes from
spinach chloroplasts, Exp. Cell Res., 26,
312-317 (1962).
588. MacDonald K. The ultrastructure of mitosis in
the marine red alga Membranoptera
platyphylla, J. Phycol., 8, 156-166 (1972).
589. Machin K. G. The control and synchronization
of flagellar movement, Proc. R. Soc. Lond. B,
158, 88-104 (1963).
590. Maiorana V.C., Van Valen L. M. The archae-
bacteria and eukaryotic origins, Nature, 287,
248-250 (1980).
591. Malawista S. E., Sato H., Bensch K.G.
Vinblastine and griseofulvin reversibly disrupt
the living mitotic spindle Science, 160,
770-771 (1968).
592. Mailer J., Pocera D., Nishioka D., Kidd P.,
Gerhart J., Hartman H. Spindle formation and
cleavage in X enopus eggs injected with
centriole-containing fractions from sperm,
Exp. Cell Res., 99, 285-294 (1976).
593. Mandel M. New approaches to bacterial
taxonomy: perspective and prospects, Annu.
Rev. Microbiol., 23, 239-274 (1969).
594. Maniloff J., Morowitz H. J. Cell biology of the
mycoplasmas, Bacteriol. Rev., 36, 263-290
(1972).
595. Maniloff J., Morowitz H., Barnett R. J.
Ultrastructure and ribosomes of Mycoplasma
gallisepticum, J. Bacteriol., 90, 193-204 (1965).
596. Manton I. Further observations on the fine
structure of Chrysochromelina chiton with
special reference to the haptonema, “peculiar”
Golgi structure and scale production, J. Cell
Sci., 2, 265-272 (1967).
597. Margulis L. Evolutionary criteria in Thallo-
phytes: a radical alternative, Science, 161,
1020-1022 (1968).
598. Margulis L. New Phylogenies of the lower
organisms implications for deposition of
organic matter in Precambrian sediment, J.
Geol., 77, 606-613 (1969).
599. Margulis L. Early cellular evolution. In:
Exobiology, vol. 1, C. Ponnamperuma, ed.,
Amsterdam, North-Holland, pp. 342-368,
1970.
600. Margulis L. Nonchromosomal genes in
Chlamydomonas: Reassortment of mito-
chondria and chloroplasts? J. Theor. Biol., 26,
337-342 (1970).
601. Margulis L. Origin of Eukaryotic Cells, New
Haven, Yale University Press, 1970.
602. Margulis L, ed. The Origins of Life First
Interdisciplinary Communications Program,
New York, Gordon and Breach, 1970.
603. Margulis L. Whittaker’s five kingdoms of the
organisms: minor revisions suggested by
consideration of the origin of mitosis,
Evolution, 25, 242-245 (1971).
604. Margulis L. Classification and evolution of
prokaryotes and eukaryotes. In: Handbook of
Genetics, vol. 1, R. King, ed., New York,
Plenum Press, pp. 1-41, 1974.
605. Margulis L. Five-kingdom classification and
the origin and evolution of cells, Evol. Biol., 7,
45-78, W. Steere, M. Hecht and T. Dobz-
hansky, eds., New York, Plenum Press, 1974.
606. Margulis L. On the origin and possible
326
ЛИТЕРАТУРА
mechanism of colchicine-sensitive mitotic
movements, BioSystems, 6, 16-36 (1974).
607. Margulis L. Microtubules and evolution. In:
International Symposium on Microtubules
and Microtubule Inhibitors, M. De Brabander
and M. Borgers, eds., Amsterdam, North-
Holland, pp. 3-18, 1975.
608. Margulis L. The genetic and evolutionary
consequences of symbiosis, Exp. Parasit. Rev.,
39, 277-349 (1976).
609. Margulis L. Flagella, cilia and undulipodia,
BioSystems, 12, 105-108 (1980).
610. Margulis L. Symbiosis as parasexuality. In:
Cellular Interactions in Symbiotic and
Parasitic Associations. Proceedings of the
Fifth Annual Colloquium on Biology Sciences,
Clayton Cook, ed., Columbus, The Ohio
University Press, 1980.
611. Margulis L., Barghoom E. S., BanerjeeS., Gi-
ovannoni S., Francis S., Ashendorf D., Chase D.,
Stolz J. The microbial community in the
layered banded sediments at Laguna Figueroa,
Baja California, Mexico: does it have
Precambrian analogues? Precambrian Res.,
11, 93-123 (1980).
612. Margulis L., Chase D., To L. Possible
evolutionary significance of spirochetes, Trans.
R. Soc. Lond. (Ser. B), 204, 189-198 (1979).
613. Margulis L., Lovelock J. E. Biological modula-
tion of the earth’s atmosphere, Icarus, 21,
471-489 (1974).
614. Margulis L., Lovelock J. E. The biota as
ancient and modem modulator of the earth’s
atmosphere, Pure Appl. Geophys., 116,
239-243 (1978).
615. Margulis L., Lovelock J. E. Atmospheres and
evolution. Proceedings of the NASA meeting
on Life in the Universe, J. Billingham and
M. Stoll, eds., in press.
616. Margulis L., Margulis T.N. A note on the
equivalence of characters: phylogeneticist vs.
pheneticist, Syst. Zool., 17, 477-479 (1968).
617. Margulis L., Neviackas J.!., Banerjee S. Cilia
regeneration in stentor: Inhibition, delay and
abnormalities induced by griseofulvin, J.
Protozool., 16, 660-667 (1969).
618. Margulis L.t Thorington G., Berger B., Stolz J.
Endosymbiotic b.cteria associated with the
intracellular green algae of Hydra viridis,
Curr. Microbiol., 1, 227-232 (1978).
619. Margulis L., T^oL., Chase D. Microtubules
in prokaryotes, Science. 200. 1118-1123 (1978).
620. Margulis L., To L. P., Chase D. Large spiro-
chaetes symbiotic in wood eating insects:
the genera Pillotina, Hollandina and Diplocalyx.
In: The Prokaryotes. A Handbook on
Habitats, Isolation and Identification of
Bacteria, M!P. Starr, H. Stolp, H.G. Truper.
A. Balows and H. G. Schlegel., eds., New
York, Springer-Verlag, in press.
621. Margulis L., To L., Chase D. Microtubules, un-
dulipodia and Pillotina spirochetes, Ann.
N.Y. Acad. Sci., 361, 356-368 (1981).
622. Margulis L., Walker J. C. G., Rambler M.
Reassessment of the rofes of oxygen and
ultraviolet in Precambrian evolution, Nature,
264, 620-624 (1976).
623. Marler J. E., van Baalen C. Rofe of H2O2
in simple cell growth of the blue-green algae,
Anacystis nidulans, J. Phycol., 1, 180-185
(1915).
624. Marmur J. S., Falkow S, Mandel M. New
approaches of bacterial taxonomy, Annu. Res.
Microbiol., 17, 329-372 (1963).
625. Mathews S. C., Missarzhevsky V V. Small shelly
fossils of late Precambrian and early
Cambrian age: a review of recent work, J.
Geol. Soc. Lond., 131, 289-304 (1975).
626. Mattern C. F. T., Honigberg В. M., Daniel W. A.
The mastigont system of Trichomonas gallinas
(Rivolta) as revealed by electron microscopy,
J. Protozool., 14, 320-339 (1967).
627. May H. G., Goodner K. Cillia as pseudospiro-
chaetes, Trans. Am. Microscop. Soc., 45,
302-305 (1926).
628. Mayr E. Numerical phenetics and taxonomic
theory, Syst. Zool., 14, 73-97 (1965).
629. Mayr E. Populations, Species and Evolution,
Cambridge, Harward University Press, 1970.
(Имеется перевод: Майр Э. Популяции,
виды и эволюция.-М.: «Мир», 1974.)
630. Mayr Е. Nature of the Darwinian revolution,
Science, 176, 981-989 (1974).
631. Mayr E. Evolution and the Diversity of Life:
Selected Essays, Cambridge, Balknap Press,
1976.
632. Mazia D. The physiology of cell division. In:
he Cell, vol. 3, J. Brachet and A. Mirsky,
eds., New York, Academic Press, pp. 78-114,
1961.
633. Mazia D. Fibrillar structure in the mitotic
apparatus. In: Formation and Fate of Cell
Organelles, К. B. Warren, ed., New York,
Academic Press, pp. 39-54, 1967.
634. Mazia D. Microtubule research in perspective,
N.Y, Acad. Sci, 253, 2-13 (1975).
635. Mazur P., Barghoom E. 5, Halvorson H. 0.,
Jukes T. H., ' Kaplan I. R., Margulis L.
Biological implications of the Viking mission
to Mars, Space Science Reviews, 22, 3-34
(1978).
636. McCall G.J.H., ed. The Archean: Search for
the Beginning, Stroudsburg Dowden, Hut-
chinson and Ross, 1977.
637. McCarthy E. D., Calvin M. Organic geo-
chemical studies. Molecular criteria for
hydrocarbon genesis, Nature, 216, 642-647
(1967).
638. McCarthy E. D., Van Hoeven W., Calvin M.
The synthesis of standards in the characteriza-
tion of a C21 isoprenoid alkane isolated from
Precambrian sediments, Tetrahedron Lett, 45,
4437-4442 (1967).
639. McDaniel R.G., Sarkissian I. V. Heterosis:
complementation by mitochondria, Science,
152, 1640-1642 (1966).
640. McElroy M. B., Wofsy S.C., Yung YL. The
nitrogen cycle: perturbations due to man and
the impact on nitrous oxide and ozone, Phil.
Trans. R. Soc. Lond, 277, 159-181 (1977).
ЛИТЕРАТУРА
327
641. McElroy W.D., Seliger Н.Н. Origin and
evolution of bioluminescence. In: Horizons in
Biochemistry, M. Kasha and B. Pullman; eds.,
New York, Academic Press, pp. 91-101, 1962.
642. McIntosh R., Hepler P. K., Van Wie D. Model
for mitosis, Nature, 224, 659-661 (1969).
643. McLaughlin J. J. A., Zahl P.A. Endozoic algae.
In: Association of Microorganisms, Plants and
Marine Organisms. Symbiosis, vol. 1, S.
M. Henry, ed., New York, Academic Press,
pp. 257-298, 1966.
644. McLean R. C., Ivimy-Cook W. R. Textbook of
Theoretical Botany, London, Longmans, 1967.
645. Mereschkovsky K.C. Le plant considere
comme un complex symbiotique, Bull. Soc.
Nat. Sci. Quest, 6, 17-98 (1905).
646. Мережковский К. С. Теория двух плазм как
основа симбиогенеза, нового учения о про-
исхождении микроорганизмов, Казань,
1909.
647. Miller М. W. The Pfizer Handbook of
Microbial Metabolites, New York, McGraw-
Hill, 1961.
648. Miller S. L. A production of amino acids
under possible primitive earth conditions,
Science, 117, 528-529 (1953).
649. Miller S. L. The formation of organic compou-
nds on the primitive earth, Ann. N.Y. Acad.
Sci., 69, 260-275 (1957).
650. Miller S. L., Orgel L. E. The Origins of Life on
Earth, Englewood Cliffs, N.J. Prentice-Hall,
1974.
651. Mills D.R., Kramer F.R., Spiegelman S.
Complete nucleotide sequence of a replicating
RNA molecule, Science, 180, 916-927 (1973).
652. Minchin E. A. An Introduction to the Study of
Protozoa, London, Edward Arnold, 1912.
653. Minchin E. A. Cited in E. B. Wilson, The Cell
in Development and Heredity, New York,
Macmillan, p. 728, 1925.
654. Mitchell P. Proton translocation, phos-
phorylation in mitochondria, chemoplasts and
bacteria: natural fuel cells and solar cells, Fed.
Proc, 26, 1370-1380 (1967).
655. Mitchison J. M. The Biology of the Cell Cycle,
Cambridge, Cambridge University Press, 1971.
656. Mizra S.B. Late Precambrian (?) fossils from
south-eastern Newfoundland, Geol. Soc. Am.
Bull, 80, 2133-2140 (1969).
657. Mizukami L, Gall J. Centriolar replication, 2.
Sperm formation in the fem Marsilia and the
cycad Zamia, J. Cell Biol, 29, 97-111
(1966).
658. Monaud M., Pappas G. D. Cilia formation in
the adult cat brain after pargyline treatment,
J. Cell Biol, 35, 599-602 (1968).
659. Monty C. L. V. Les nodules de manganese sont
des stromatolithes oceaniques, C.R. Acad. Sci.
Paris (Series D), 276, 3285-3288 (1973).
660. Monty C. L. V. Precambrian background and
Phanerozoic history of stromatolite
communities, an overview, Ann. Soc. Geol.
Belg, 96, 585-624 (1973).
661. Monty C.L.V. Remarques sur la nature, la
morphologic et la distribution spatiale de
stromatolithes, Sciences de la Terre, 18,
189-212 (1973).
662. Moore J. A. Heredity and Development, New
York, Oxford University Press, 1963.
663. Moore R. C. Introduction to Historical Geol-
ogy, New York, McGraw-Hill, 1958.
664. Morowitz H. J. Biological self-replicating
systems, Prog. Theor. Biol, 1, 35—58 (1967).
665. Morowitz H. J., Wallace D. C. Genome size
and life cycle of the mycoplasm, Ann. N.Y.
Acad. Sci, 225, 62-73 (1973).
666. Mortenson L. E., Morris J. A., Kennedy I. R.
Properties of molybdoferredoxin,
Bacteriological Proceedings, 68th Ann.
Meeting of Amer. Soc. for Microbiology, Abf
pp. 126, 133 (1968).
667. Motta J. A note on the mitotic apparatus in
the rhizomorph meristem of Armillaria mellea,
Mycologia, 59, 370-375 (1967).
668. Motta J. Somatic nuclear division in
Armillaria mellea, Mycologia, 61, 873-886
(1969).
669. Mounolou J. C, Jakob H., Slonimski P. P.
Molecular nature of hereditary cytoplasmic
factors controlling gene expression in
mitochondria. In: Control of Nuclear Activity,
L. Goldstein, ed, Englewood Cliffs, N. J.
Prentice Hall, pp. 413-431, 1967.
670. Muller E. Taxonomy and phylogeny of fungi.
In: Progress in Botany, H. Ellenberg,
K. Esser, H. Merxmuller, E. Schnepf and
H. Ziegler, eds. New York, Springer-Verlag,
1976.
671. МйПег K.J. Phosphatische Gehause bei
Ostracoden aus oberen Kambrium und Be-
deutung von Apatit als Schalenbildner
altpalaeozoischer Metazoa, Naturwissenschaf-
ten, 51, 36-60 (1964).
672. Muscatine L., Karakashian S. J., Karakashian
M. W. Soluble extracellular products of algae
symbiotic with a ciliate, a sponge and
a mutant hydra, Comp. Biochem, Physiol, 20,
1-12 (1967).
673. Nagy B. Investigation of the Orgueil
carbonaceous meteorite, Geologiska Foreni-
ngens Stockholm Forhandlingar, 88, 235-272
(1966).
674. Nagy B. Carbonaceous meteorites, Endeavor,
27, 81-86 (1968).
675. Nagy B., Nagy L. A. Interdisciplinary search
for early life forms and for the beginnings of
life on earth, Interdiscip. Sci. Rev, 4, 291-307
(1976).
676. Nagy B., Nagy L. A., Zumberge J. E.,
Sklarew D. S.. Anderson P. H. Indications of
a biological and biochemical evolutionary
trend during the Archean and early
Proterozoic, Precambrian Res, 5, 109-121
(1977).
677. Nagy B., Urey H. C. Organic geochemical
investigations in relation to the analyses of
returned lunar rock samples, 8th COSPAR
meeting, Life Sciences and Space Research,
Amsterdam, North-Holland, 7, 31-46 (1968).
678. Nagy L. A., Zumberge J. E. Fossil
328
ЛИТЕРАТУРА
microorganisms from the approximately 2800
to 2500 million year old Bulawayan
stromatolite: application of
ultramicrochemical analyses, Proc. Natl. Acad.
Sci. USA, 73, 2973-2976 (1976).
679. Nass M.M.K. Mitochondrial DNA: advances,
problems and goals, Science, 165, 25-35
(1969).
680. Nass M. M. K., Nass S., Afselius B. A. The
general occurrence of mitochondrial DNA,
Exp. Cell Res., 37, 516-539 (1965).
681. Nealson K.H. Symbioses between luminous
bacteria and marine animals, N. Y. Acad. Sci.,
in press.
682. Nealson К. H., Hastings J. R. Bacterial
bioluminescence: its control and ecological
significance, Microbial. Rev., 43, 496-518
(1979).
683. Nealson К. H., Hastings J. R. The symbiotic
luminous bacteria. In: The Prokaryotes:
A Handbook on Habitats. Isolation and
Identification of Bacteria, M.P. Starr,
H. Stolp, H.G. Truper, A. Balows and
H. G. Schlegel, eds., New York, Springer-
Verlag, in press.
684. Nealson К. H., Tebo B. Structural features of
manganese precipitating bacteria. In: Limits of
Life. Proceedings of the Fourth College Park
Symposium, C. Ponnamperuma and L. Ma-
rgulis, eds., Durdrecht, Holland, Reidel,
pp. 173-182, 1980.
685. Neviackas J., Margulis L. The effect of
colchicine on membranellar band regeneration
in Stentor coeruleus, J. Protozool., 16, 165-171
(1969).
686. Nilsson J., Coleman J.R. Refractile granules in
Tetrahymena pyriformis and their possible role
in the intracellular ion regulation, J. Cell Sci.,
24, 311-325 (1977).
687. Nolan C., Margoliash E. Comparative aspects
of primary structures of proteins, Annu. Rev.
Biochem., 37, 684-790 (1968).
688. Noland L.E., Godjics M. Ecology of free living
Protozoa. In: Research in Protozoology,
vol. 2, T.T. Chen, ed., Oxford and London,
Pergamon Press, pp. 215-266, 1967.
689. Oakley B. R., Taylor F. J. R. Evidence for
a new type of endosymbiotic organization in
a population of the ciliate Mesodinium rubrum,
from British Columbia, Biosystems, 10,
361-369 (1978).
690. Oishi K. Spirochaete-mediated abnormal
sex-ratio condition in Drosophila. A second
virus associated with spirochaetes and its use
in the study of the SR condition, Genet. Res.,
18, 45-56 (1971).
691. Olive L.S. The Mycetozoa: a revised
classification, Bot. Rev., 36, 59-89 (1970).
692. Olive L. S. The Mycetozoans, New York,
Academic Press, 1975.
693. Olive L. S. Sorocarp development by a newly
discovered ciliate, Science, 202, 530-532
(1978).
694. Olive L.S., Blanton R.L. Aerial Sorocarp
development by the aggregative ciliate,
695.
696.
697.
698.
699.
700.
701.
702.
703.
704.
705.
706.
707.
708.
709.
710.
Sorogena stoianobitchae, J. Protozool., 27,
293-299 (1980).
Olson J. M. Precambrian evolution of
photosynthetic and respiratory organisms. In:
Evolutionary Biology, vol. 11, M. K. Hecht,
W.C. Steere and B. Wallace, eds., New York,
Plenum Press, 1978.
Oparin A. I. The origin of life. Translated from
Russian and reprinted in J. D. Bernal, 1967.
Origin of Life, Cleveland, World, pp. 199-241,
1924.
Oparin A. I. Biogenesis and Early
Development of Life, New York, Academic
Press, 1969.
Orgel L. Evolution of the genetic apparatus, J.
Mol. Biol., 38, 381-393 (1968).
Orgel L. In: Origins of Life. 1st
Interdisciplinary Communications Program.
L. Margulis, ed., New York, Gordon and
Breach, 1970.
Ormerod W., Francis S., Margulis L. Delay in
the appearance of clamp connections in
Schizophyllum commune by inhibitors of
microtubule protein assembly, Microbios, 17,
189-205 (1976).
Ord J. Stages and mechanisms of prebiological
organic syntheses. In: Origins of Prebiological
Systems and their Molecular Matrices, S. Fox,
ed., New York, Academic Press, pp. 137-161,
1965.
Oro J. In: Origins of Life. 1st Interdisciplinary
Communications Program, L. Margulis, ed.,
New York, Gordon and Breach, 1970.
Oro J., Holzer G., Laze ano-Araujo A. The
contribution of cometary volatiles to the
primitive Earth. In: COSPAR Life Sciences
and Space Research, 18, 67-82, R. Holmquist,
ed., New York, Pergamon Press, 1980.
Ord J., Nooner D. W. Aliphatic hydrocarbon
in Precambrian rocks, Nature, 213, 1082-1085
(1967).
Orb J., Nooner D. W., Zlatkin A., Wikstrom
S.A., Barghoorn E.S. Hydrocarbons of
biological origin in sediments about 2 billion
years old, Science, 148, 77-79 (1965).
Ord J., Sherwood E., Eichberg J., Epps D.
Formation of phospholipids under primitive
Earth conditions and the role of membranes
in prebiological evolution. In: Light Iransdu-
cing Membranes, D. Deamer, ed., New York,
Academic Press, 1978.
Outka D., Kluss B.C. The amoeba to flagellate
transformation in Tetramitus rostratus, J. Cell
Biol., 35, 325-345 (1967).
Owen T., Biemann K., Rushneck D.R.,
Biller J.E., Howerth D. W., LaFleur A.L. The
composition of the atmosphere at the surface
of Mars, J. Geophys. Res., 82, 4635-4639
(1977).
Page F. C. Redefinition of the genus
Acanthoamoeba with description of three
species, J. Protozool., 14, 709-724 (1967).
Page F. C. A revised classification of the
Gymnamoebia (Protozoa: Sarcodina), Zool. J.
Linn. Soc., 58, 61-77 (1976).
ЛИТЕРАТУРА
329
711. Palmer A. R. Oral Communication. (See
R. Siever, 1968. Environment of the primitive
earth), Science, 161, 711-712 (1968).
712. Panaganiban A. J., Hanson R. S. Isolation of
a bacterium that oxidizes methane in the
absence of oxygen, Ann. Meeting Am. Soc.
Microbiol. Abs. 1 59, p. 121 (1976).
713. Panaganiban A. J., Patt T.E., Hart W., Han-
son R. S.A bacterium capable of oxidizing
methane in the absence of oxygen in lake
water samples, Appl. Envir. Microbiol., 37,
303-309 (1977).
714. Parke M., Manton I. Specific identity of the
algal symbiont in Convoluta roscoffensis, J.
Mar. Biol. Assoc. U.K., 47, 445-469 (1967).
715. Parsons D.E. Ultrastructure and molecular
aspects of cell membranes, Canadian
Conference, Honey Harbor, Ontario, 7,
192-246, Oxford and New York, Pergamon
Press, 1966.
716. Parsons J. A., Rustad R.C. The distribution of
DNA among dividing mitochondria of
Tetrahymena pyriformis, J. Cell Biol., 35,
683-695 (1968).
717. Pasteur L. See: The Pasteur Fermentation
Centennial, 1857-1957. A scientific sym-
posium, New York Charles Pfizer, 1958 (1866).
718. Pavan C. Polytene chromosomes in the
development of normal and infected cells of
diptera, Proc. XII Internal. Cong. Gen., 2,
98-99 (1968).
719. Perry E.C., Monster J., Reimer T Sulfur
isotopes in Swaziland system barites and the
evolution of the earth’s atmosphere, Science,
171, 1015-1016 (1971).
720. Pesce A., Fondy T.P., Stolzenbach F., Cas-
tillo Fk, Kaplan N. I. The comparative
enzymology of lactic dehydrogenases, J. Biol.
Chem., 242, 2151-2167 (1967).
721. Pettersson M. Major integrative levels and the
Fo-so series. Aslib Proceed., 30, 215-237
(1977).
722. Pettersson M. Acceleration in evolution,
before human times, J. Social Biol., 1, 201-206
(1978).
723. Pettersson M. Intermediate entities-of a level
intermediate between that of eukaryotic cells
and that of molecules, J. Theoret. Biol., in
press.
724. Phillips D. 0., Carr N. G. Nucleic acid analysis
and the endosymbiotic hypothesis, Taxon, 26,
3-42 (1977).
725. Picken L. The Organization of Cells and
Other Organisms, Oxford, Clarendon Press,
1962.
726. Pickett-Heaps J. D. Evolution of mitosis and
the eukaryotic condition, BioSystems, 6, 37-48
(1974).
727. Pickett-Heaps J. D. Green Algae: Structure,
Reproduction and Evolution, Sunderland,
Sinauer Associates, 1975.
728. Pickett-Heaps J. D., Tippett D. H., And-
reozzi J. A. Cell division in the pennate
diatom Pinnularia, II. Later stages of mitosis,
Biologie Cellulaire, 33, 79-84 (1978).
729. Pickett-Heaps J. D., Tippett D. H., Andreoz-
zi J. A. Cell division in the pennate diatom
Pinnularia, V. Observations on live cells,
Biologie Cellulaire, 35, 295-304 (1979).
730. Pigott G. H., Carr N. G. Homology between
nucleic acids of blue-green algae and
chloroplasts of Euglena gracilis, Science, 10,
1259-1261 (1972).
731. PitelkaD.R. Electron Microscopy of Pro-
tozoa. International series of monographs on
pure and applied biology, London and New
York, Pergamon Press, 1963.
732. Ponnamperuma C. A biological synthesis of
some nucleic acid constituents, In: Origin of
Prebiological Systems, S. Fox, ed., New York,
Academic Press, pp. 221-242, 1965.
733. Ponnamperuma C. Some recent work on
prebiological synthesis of organic compounds,
Icarus, 55, 450-454 (1966).
734. Ponnamperuma C. On the origin of life. In:
Infections Diseases, Aidan Cockburn, ed.,
Springfield, Charles Thomas, pp. 1-9, 1967.
735. Ponnamperuma C. Origins of Life, London,
Thames and Hudson, 1972.
736. Ponnamperuma C. Cosmochemistry and the
origin of life, Proc. Robert A. Welch
Foundation Conferences on Chemical
Research, 21, 137-197, Houston, Welch
Foundation, 1977.
737. Ponnamperuma C., Gebel N. Current status of
chemical studies on the origin of life, Space
Life Sciences, 1, 64-96 (1968).
738. Ponnamperuma C., Sagan C., Mariner R. Syn-
thesis of ATP under possible primitive earth
conditions, Nature, 199, 222-226 (1963).
739. Pontecorvo G. Trends in Genetic Analysis,
New York, Columbia University Press, 1958.
740. Portier P. Les Symbiotes, Paris, Masson et
Cie, 1918.
741. Poulsen V. Fossils from the lower Cambrian of
Bornholm, Mat. fys. Skr., 36, 5-48 (1967).
742. Preer J. R., Jr. The hereditary symbionts of
Paramecium aurelia. In: Symbiosis, D. H. Jen-
ning and D. L. Lee, eds., Symp. Soc. Exper.
Biol., 29, 125-145, Cambridge, Cambridge
University Press 1975.
743. Preer J. R., Jr., Preer L., Jurand A. Kappan
and other endosymbionts in Paramecium
aurelia, Bacteriol. Rev., 38, 113-163 (1974).
744. Preiss W. V. The biostratigraphic potential of
Precambrian stromatolites, Precambrian Res.,
4, 207-216 (1977).
745. Prescott D. M. Cellular sites of RNA synthesis,
Prog. Nucleic Acid Res. and Mol. Biol., 3,
33-38 (1964).
746. Prescott D. M., Murti K. G. Chromosome stru-
cture in ciliated protozoans, Cold Spring
Harbor Symp. Quant. Biol., 38, 609-618
(1973).
747. Preston N. Plants without cellulose, Scientific
American, 218, 102-108 (1968).
748. Prevot A. R., Fredette V. Manual for the
Classification and the Determination of the
Anaerobic Bacteria, Philadelphia, Lea and
Febiger, 1966.
330
ЛИТЕРАТУРА
749. Pridham J. В., ed. Terpenoids in Plants, New
York, Academic Press, 1967.
750. Proudlock J. W., Wheeldon L. W., Jollow D.J.,
Linnane A. W. Role of sterols in
Saccharomyces cerevisiae, Biochim. Biophys.
Acta, 152, 434—437 (1968).
751. Putrament A., Polakowska R., Baranowska H.,
Ejchart A. On homozygotization of
mitochondrial mutations in Saccharomyces
cerevisiae. In: Genetics and Biogenesis of
Chloroplasts and Mitochondria, T. Bucher et
al., eds., Amsterdam North-Holland,
pp. 415-418, 1976.
752. Pyrozinski K., Malloch D. On the origin of
land plants: a question of mycotrophy,
BioSystems, 6, 153-164 (1975).
753. Rabinovitch M., Plant W. S. Cytoplasmic DNA
synthesis in Amoeba proteus, J. Cell Biol., 15,
525-540 (1962).
754. Radinsky L., Carlson S. S., Wilson A. C., Ma-
xon R.D. Do albumin clocks run on time?
Science, 200, 1182-1183 (1978).
755. Raff R. A., Mahler H.R. The non-symbiotic
origin of mitochondria, Science, 177, 575-582
(1972).
756. Ragan M. A., Chapman D. J. A Biochemical
Phylogeny of the Protists, New York,
Academic Press, 1978.
757. Raikov J.B. The macronucleus of ciliates, Res.
Protozool., 3, 1-128, Oxford, Pergamon Press,
1968.
758. Raikov I. B. Bacteries epizoiques et mode de
nutrition de cilie psammophile Kentrophoros
flstulosum Faure-Fremier (etude au microscope
electronique), Protistologica, 7, 365-378 (1971).
759. Raikov I. B. Nuclear phenomena during
conjugation and autogamy in ciliates, Res.
Protozool., 4, 147-289 (1972), Oxford, Per-
gamon Press.
760. Rambler M. Ultraviolet light and oxygen in
the pre-Phanerozoic, Ph. D. thesis, Boston
University, Boston Mass., 1980.
761. Rambler M., Margulis L. Ultraviolet inducible
bacteriophage of Beneckea, Origins of Life, 93,
235-240 (1979).
762. Rambler M., Margulis L. Bacterial resistance
to UV irradiation under anaerobiosis:
Implications for pre-Phanerozoic evolution,
Science, 210, 638-640 (1980).
763. Randall Sir J., Disbrey C. Evidence for the
presence of DNA at basal body sites in
Tetrahymena pyriformis, Proc. R. Soc. Lond.,
В 162, 473-491 (1965).
764. Randall Sir J., Warr J. R., Hopkins J. M.,
McVittie A. A single gene mutation of
Chlamydomonas reinhardi affecting motility:
a genetic and electron microscope study,
Nature, 204, 912-914 (1964).
765. Raudaskoski M. Occurrence of microtubules in
the hyphae of Schizophyllum commune during
intracellular nuclear migration, Arch.
Mikrobiol., 86, 91-100 (1972).
766. Raven P. H. A multiple origin for plastids and
mitochondria, Science, 169, 641-645 (1970).
767. Reddy C. A., Bryant M.P., Wolin M. J.
Characteristics of the S organisms isolated
from Methanobacillus omelianski, J. Bacteriol.,
109, 539-545 (1972).
768. Reich E., Luck D. J. L. Replication and
inheritance of mitochondria DNA, Proc. Natl.
Acad. Sci. USA, 55, 1600-1608 (1966).
769. Reijnders L. The origin of mitochondria, J.
Mol. Evol., 5, 167-176 (1975).
770. Reimer T. Untersuchungen uber Abtragung,
Sedimentation und Diagenese im Friihen
Prakambrium am Beispiel der Sheba-
Formation (Siidafrika), Geologisches Jahr-
buch, Reihe B, 17, 3-108 (1975).
771. Reimer T, Barghoorn E. S., Margulis L. Pri-
mary productivity in an early Archean
microbial ecosystem, Precambrian Res., 9,
93-104 (1979).
772. Reinheimer H. Symbiosis: A Sociophysiol-
ogical Study of Evolution, London, Headley
Brothers, 1920.
773. Remsen С. C., Valois F. W., Watson S. W. Fine
structure of the cytomembranes of
N itrosocystis oceanus, J. Bacteriol., 94,
422-433 (1967).
774. Renaud F. H., Swift H. The development of
basal bodies and flagella in Attomyces arbus-
culus, J. Cell Biol., 23, 339-349 (1964).
775. Renfro A. R. Genesis of evaporite-associated
stratiform metalliferous deposits-a sabkha
process, Econ. Geol., 69, 33-45 (1974).
776. Rich A. On the problems of evolution and
biochemical conformation transfer. In:
Horizons in Biochemistry, M. Kasha and
B. Pullman, eds., New York, Academic Press,
pp. 103-126, 1962.
777. Rich A. In: Origins of Life. 1st
Interdisciplinary Communications Program,
L. Margulis, ed., New York, Gordon and
Breach,' 1970.
778. Richmond M., Smith D. C. The Cell as
a Habitat, London, The Royal Society, 1979.
779. Ris H. Interpretation of ultrastructure in the
cell nucleus. In: The Interpretation of
Ultrastructure, vol. 1, R.J. Harris, ed., New
York, Academic Press, pp. 69-88, 1962.
780. Ris H. Primitive mitotic systems, BioSystems,
7, 298-304 (1975).
781. Ris H., Kubai D. An unusual mitotic
mechanism in the parasitic protozoa
Syndinium sp., J. Cell Biol., 60, 702-720 (1974).
782. Ris H., Plaut W. Ultrastructure of
DNA-containing areas in the chloroplast of
Chlamydomonas, J. Cell Biol., 13, 383-392
(1962).
783. Roberts J. D., Caserio M. C. Basic Principles of
Organic Chemistry, New York, W.A. Bejamin,
1965.
784. Robinson E., Robins R.C. In: Global Effects of
Environmental Pollution, S. F. Singer, ed.,
New York, Reidel, Dordrecht and Springer-
Verlag, 1971.
785. Romer A. S. The Procession of Life, Cleveland,
World (1972, Anchor Books), 1968.
786. Roodyn D.B., Wilkie D. The Biogenesis of
Mitochondria, London, Metheun, 1968.
787. Rosenbaum J. L., Carlson K. Cilia regeneration
ЛИТЕРАТУРА
331
in Tetrahymena and its inhibition by
colchicine, J. Cell Biol., 40, 415-425 (1969).
788. Rosenbaum J. L., Child F. M. Flagellar re-
generation in protozoan flagellates, J. Cell
Biol., 34, 345-364 (1967).
789. Rossignol-Strick M., Barghoorn E. S. Ext-
raterrestrial abiogenic organization of organic
matter: the hollow spheres of the Orgeuil
Meteorite, Space Life Sciences, 3, 89-107
(1971).
790. Roth L. E., Obertz S. W Daniels E. W Electron
microscopic studies of mitosis in amoebae, J.
Biophys. Biochem. Cytol., 8, 207-220 (1960).
791. RothL.E., Pihlaja D. J. Gradionation: hypo-
thesis for positioning and patterning, J.
Protozool., 29, 2-9 (1977).
792. Ryter A. Association of the nucleus and the
membrane of bacteria: a morphological study,
Bacteriol. Rev, 32, 39-54 (1968).
793. Sagan L, Margulis L. On the origin of
mitosing cells, J. Theor. Biol, 14, 225-275
(1967).
794. Sagan L., Ben-Shaul Y, Schiff J., Epstein H. T.
Autoradiographic localization of the DNA in
the chloroplasts of Euglena, J. Plant Physiol,
40, 1257-1259 (1965).
795. Sager R. Cytoplasmic genes and organelle
formation. In: Formation and Fate of Cell
Organelles, К. B. Warren, ed, Internatl. Soc.
Cell Biol, 6, 322-333, New York, Academic
Press, 1967.
796. Sager R., Ramanis Z. Recombination of
nonchromosomal genes in Chlamydomonas,
Proc. Natl. Acad. Sci. USA, 53, 1053-1061
(1965).
797. Sager R., Ramanis Z. The pattern of se-
gregation of cytoplasmic genes in
Chlamydomonas, Proc. Natl. Acad. Sci. USA,
61, 324-331 (1968).
798. Sager R., Ryan F. Cell Heredity, New York,
John Wiley and Sons, 1965.
799. Sahagun Fray Bernadino, de. 16th century.
Horentine Codex, General History of the
Things of New Spain, С. E. Dibble and
A. J. O. Anderson, trans, (from Nahuatl), Salt
Lake City, University of Utah Press (1963).
800. Sakai H. Studies of sulfhydryl groups during
cell division of sea urchin eggs. 8. Some
properties of mitotic apparatus proteins,
Biochim. Biophys, 112, 132-145 (1966).
801. Salisbury J. L., Floyd G.L. Calcium-induced
contraction of the rhizoplast of a quadrifla-
gellate green alga, Science, 202, 975-977
(1978).
802. Sanchez R. A., Ferris J. P., Orgel L. E. Studies
in prebiotic synthesis. 2. Synthesis of purine
precursors and amino acids from aqueous
hydrogen cyanide, J. Mol. Biol, 30, 223-253
(1967).
803. Satir P. Structure and function of cilia and
flagella: facts and problems, Protoplasmalogia,
3, 1-52 (1965).
804. Satir P. How cilia move, Scientific American,
231, 45-52 (1974).
805. Satow Y, Kung C. Mutants with reduced Ca
activation in Paramecium aurelia, J. Membr.
Biol, 28, 277-294 (1976).
806. Schein S. J. Calcium channel stability
measured by gradual loss of excitability in
pawn mutants of Paramecium aurelia, J. Exp.
Biol, 65, 725-736 (1976).
807. Schein S. J. Nonbehavioral selection for
pawns, mutants of Paramecium aurelia with
decreased excitability, Genetics, 84, 453-468
(1976).
808. Schein S.J., Bennet M. V.L., George C.,
Katz M. Altered calcium conductance in
pawns, behavioral mutants of Paramecium
aurelia, J. Exp. Biol, 65, 699-724 (1976).
809. Schell J., van Montagu M., DeBenckeleer M.,
DeBloch M., Depicker A., DeWilde M., En-
gler G., Genetillo G., Hernalsteens J. P.,
Holsters M., Seurinck J., Silva B., van Vliet F.,
Villarroel R. Interactions and DNA transfer
between Agrobacterium tumefaciens, the Ti
plasmid and the plant host, Proc. R. Soc.
Lond. В 204, 251-266 (1979).
810. Schidlowski M. Antiquity and evolutionary
status of bacterial sulpahte reduction: sulfur
isotope evidence, Origins of Life, 9, 299-311
(1979).
811. Schidlowski M., Appel P. W. U., Eichmann R.,
Junge С. E. Carbon isotope geochemistry of
the 3.7 x 109 year old Isua sediments,
W. Greenland: Implications for the Archean
carbon and oxygen cycles, Geochim.
Cosmochim. Acte, 43, 189-199 (1979).
812. Schidlowski M., Eichmann R, Junge C.E.
Precambrian sedimentary carbonates: carbon
and oxygen isotope geochemistry and
implications for the terrestrial oxygen budget,
Precambrian Res, 2, 1-69 (1975).
813. Schiff J. A. Photocontrol of chloroplast
development in Euglena. In: Chloroplast
development, G. Akoykhoglou, ed, Am-
sterdam, Elsevier/North-Holland Biomedical
Press, 1978.
814. Schiff J. A., Epstein A. T. Continuity of the
chloroplast in Euglena. Reproduction:
Molecular, Submolecular and Cellular, M.
Locke, ed. New York, Academic Press,
pp. 131-189, 1967.
815. Schildkraut C., Mandel M., Levisohn S., Smith-
Sonneborn J., Marmur J. DNA composition
and taxonomy of some protozoans, Nature,
196, 795-797 (1962).
816. Schimper A.E.W. Uber die Entwickelung der
Chlorophyllkorner und Farbkorper, Bot. Ztg,
41, 105-114 (1883).
817. SchnepfE., Brown R.M. On relationships
between endosymbiosis and the origin of
plastids and mitochondria. In: Origin and
Continuity of Cell Organelles. J. Reinert and
H. Ursprung, eds, Heidelberg, Springer-
Verlag, pp. 299-322, 1971.
818. Schopf J. W. Antiquity and Evolution of
Precambrian Life, New York, MsGraw-Hill
Yearbook of Science and Technology,
pp. 46-55, 1967.
819. Schopf J. W. Microflora of the Bitter Springs
332
ЛИТЕРАТУРА
Formation, Late Precambrian, Central
Australia, J. Paleontol., 42, 651-688 (1968).
820. Schopf J. W. Precambrian microorganisms
from Central and South America, Am. J.
Botany, 55, 722-723 (1968).
821. Schopf J. W. Microorganisms from the late
Precambrian of South Australia, J. Paleontol.,
43, 111-118 (1969).
822. Schopf J. W. Precambrian paleobiology. In:
Exobiology, C. Ponnamperuma and R. Buvet,
eds., Amsterdam, North-Holland, 1972.
823. Schopf J. W. Development and diversification
of Precambrian life, Origins of Life, 5, 119-135
(1974).
824. Schopf J. W Biostratigraphic usefulness of
stromatolite Precambrian mjcrobiotas:
a preliminary analysis, Precambrian Res., 5,
143-175 (1975).
825. Schopf J. W. Precambrian paleobiology:
problems and perspectives, Annu. Rev. Earth
Planet. Sci, 3, 213-249 (1975).
826. Schopf J. W. Are the oldest “fossils” fossils?
Origins of Life, 7, 19-36 (1976).
827. Schopf J. W., Barghoom E. S. Algal-like fossils
from the early Precambrian of So, Africa,
Science, 156, 508-512 (1967).
828. Schopf J. W., Barghoom E. S. Microorganisms
from the late Precambrian of So, Australia,
J. Paleontol, 43, 111-118 (1969).
829. Schopf J. W., Barghoom E. S., Maser M. D.,
Gordon R. 0. Electron microscopy of fossil
bacteria two billon years old, Science, 149,
1365-1367 (1965).
830. Schopf J. W., Blade J. M. New microorganisms
from the Bitter Springs Formation (Late
Precambrian) of the North Central Amadeus
Basin, Australia, J. Paleontol, 45, 925-961
(1971).
831. Schopf J. W„ FordT.D., Bread W. J. Micro-
organisms from the late Precambrian of the
Grand Canyon, Arizona, Science, 179,
1319-1321 (1973).
832. Schulthorpe C. D. The Biology of Aquatic
Vascular Plants, London, Edward Arnold,
1967.
833. Schuster F. L. An electron microscope study of
the amoeboflagellate, Naegleria gruberi
(Schardinger), 1. The amoeboid and flagellate
stages, J. Protozool, 10, 297-312 (1963).
834. Schuster F. L. The gullet and trichocysts of
Cyathomonas trancata, Exp. Cell Res, 49,
277-284 (1968).
835. Schwartz R. M., Dayhoff M. 0. Origins of
prokaryotes, eukaryotes, mitochondria and
chloroplasts, Science, 199, 395-403 (1978).
836. Schwartz R. M., Dayhoff M. O. Phylogenies of
Organellar Molecules: Implication for
Symbiotic Origin, New York, New York
Academy of Sciences, in press.
837. Schwartzbach S.D., Schiff J. A. Chloroplast
and cytoplasmic ribosomes of euglena:
selective binding of dihydrostreptomycin to
chloroplast ribosomes, J. Bacteriol, 120,
334-341 (1974).
838. Schwemmler W. Ecological significance of
endosymbiosis: an overall concept, Acta
Biotheoretica, 22, 113-119 (1973).
839. Schwemmler W. Die zelle: Ele-
mentarorganismus oder endosy mbiose?
Biologie in Unserer Zeit, 7, 7—14 (1977).
840. Schwemmler W. Mechanismen der Zel-
levolution, Berlin, Walter de Gruyter, 1978.
841. Science, July, 1880. [An investigation of
a meteorite.]
842. Searcy D. G. Histone-like protein in the
prokaryote Thermoplasma acidophilum,
Biochim. Biophys. Acta, 395, 535-547 (1975).
843. Searcy D., Delange R. J. Thermoplasma
acidophilum histone-like protein: partial
amino acid sequence suggestive of homology
to eukaryotic histones, Biochim. Biophys.
Acta, 609, 197-200 (1980).
844. Searcy D. G., Doyle E. K. Characterization of
Thermoplasma acidophilum DNA. Int, J. Syst.
Bacteriol, 25, 286-289 (1975).
845. Searcy D. G., Maclnnis A. J. Measurements by
DNA hybridization in vitro of the genetic
basis of parasitic reduction, Evolution, 24,
207-219 (1970).
846. Searcy D. G., Stein D. B., Green G. R. Phylo-
genetic affinities between eukaryotic cells and
a thermoplasmic mycoplasm, BioSystems, 10,
19-28 (1978).
847. Searcy D.G., Stein D.B. Nucleoprotein subunit
structure in an unusual prokaryotic organism:
Thermoplasma acidophilum, Biochim. Biophys.
Acta, 609, 180-195 (1980).
848. Seliger H. H. The origin of bioluminescence,
Photochem. Photobiol, 21, 355-361 (1975).
849. Shelanski J., Taylor W. Properties of protein
sub-unit of central-doublet microtubules of sea
urchin flagella, J. Cell Biol, 38, 304-345
(1968).
850. Shemin D. The biosynthesis of porphyrins: the
succinate-glycine cycle. In: Currents in
Biochemical Research, D. E. Green, ed. New
York, Academic Press, pp. 518-536, 1956.
851. Sherman F., Stewart J. W., Margoliash E.,
Parker J., Campbell W. The structural gene for
cytochrome c, Proc. Natl. Acad. Sci. USA, 55,
1498-1504 (1966).
852. Shimomura 0., Johnson F. H., Masugi T.
Cypridina bioluminescence: light-emitting
oxyluciferan-luciferase complex, Science, 164,
1299-1300 (1969).
853. Shklovskii I., Sagan C. Intelligent Life in the
Universe, San Francisco, Holden-Day, J967.
854. Sibley C. G. Proteins: history books of
evolution, Discovery, 3, 5-20 (1967).
855. Siegel R. W., Karakashian S. J. Dissociation
and restoration of symbiosis in P. bursaria,
Anat. Rec, T34, 639 (1959).
856. Siegel S., Giumarro C. Kakabekia-like orga-
nisms from Harlech Castle, Wales. On the cul-
ture of a microorganism similar to the
pre-Cambrian microfossil Kakabekia umbellata
Barghoom in NH3-rich atmospheres, Proc.
Natl. Acad. Sci. USA, 55, 349-353
(1966).
857. Siegel S., Roberts K., Nathan H., Daly 0.
ЛИТЕРАТУРА
333
Living relative of microfossil Kakabekia,
Science, 156, 1231-1233 (1967).
858. Sievers A., Volkmann D. Ultrastructure of
gravity perceiving cells in plant roots, Proc. R.
Soc. Lond., В 199, 525-536 (1977).
859. Silver W.S., Postgate J. R. Evolution of
asymbiotic nitrogen fixation, J. Theor. Biol.,
40, 1-10 (1973).
860. Simon-Bichard-Breaud J. Un appareil cinetique
dans les gametocytes males d’une Rhodo-
phycee: Bonnemaisonia hamifera Hariot,
Cytologie Vegetale, C. R. Acad. Sci. Paris, 273,
1272-1275 (1975).
861. Simpson G.G. Major Features of Evolution,
New York, Simon and Schuster, 1953.
862. Simpson G. G. The Meaning of Evolution, New
York, Harper and Row, 1954.
863. Simpson G. G. Evolution after Darwin, S. Tax,
ed., Chicago, University of Chicago Press,
pp. 177-180, 1960.
864. Simpson G. G. Principles of Animal Taxonomy,
New York, Columbia University Press,
1961.
865. Simpson G. (j. The crisis in biology, American
Scholar, 36, 363-377 (1967).
866. Simpson G. G., Beck W. S. Life, An Int-
roduction to Biology, 2nd ed., New York,
Harcourt Brace Jovanovich, 1965.
867. Simpson L. Behavior of the kinetoplast of
Leishmania tarentolae upon cell rupture, J.
J. Protozool., 15, 132-136 (1968).
868. Simpson L. The effect of acriflavin on the
kinetoplast of Leishmania tarentolae, J. Cell
Biol., 37, 662-682 (1968).
869. Sinclair J. H., Stevens B. J., Gross N., Ra-
binowitz M. The constvnt size of circular
mitochondrial DNA in several organisms and
different organs, Biochim. Biophys. Acta, 145,
528-531 (1967).
870. Sinnot E. W., Dunn L. C., Dobzhansky T.
Principles of Genetics, 5th ed., New York,
McGraw-Hill, 1958.
871. Sleigh M.A. The Biology of Cilia and Flagella,
New York, Pergamon Press, 1962.
872. Smillie R. M. Temperature control of
chloroplast development. In: Genetics and
Biogenesis of Chloroplasts and Mitochondria,
T. Bucher et al., eds., Amsterdam, North-
Holland, pp. 103-110, 1976.
873. Smith D. C. The green hydra symbiosis I.
Isolation, Culture and characteristics of the
Chlorella symbiont of “European” Hydra
viridis, New Phytol., 81, 637-645 (1978).
874. Smith D. C. From extracellular to intracellular,
the establishment of symbiosis, Trans. R. Soc.
Lond., Ser. В 204, 115-130 (1979).
875. Smith D. C., Muscatine L., Lewis D. Carbohyd-
rate movement from autotrophs to
heterotrophs in parasitic and mutualistic
symbiosis, Biol. Rev. Camb. Phil. Soc., 44,
17-90 (1969).
876. Smith D. C., Richmond M., eds. The Cell as
a Habitat, London, The Royal Cociety, 1979.
877. Smith H.E., Arnott H. J. Epi- and endobiotic
bacteria associated with the external surface of
Pyrsonympha vertens, a symbiotic protozoan
of the termite Reticulitermes flavipes, Trans.
Am. Microsc. Soc., 93, 180-189 (1974).
878. Smith H. E., Buhse H.E., Jr., Stamler S.J.
Possible formation and development of
spirochaete attachment sites found on the
surface of symbiotic polymastigote flagellates
of the termite Reticulitermes flavipes,
BioSystems, 7, 374-379 (1975).
879. Smith H.E., Stamler S.J., Buhse H.E., Jr.
A scanning electron microscopy survey of the
surface features of polymastigote flagellates
from Reticulitermes flavipes, Trans. Am.
Microsc. Soc., 94, 401^110 (1975).
880. Smith-Sonneborn J., Plaut W. Evidence for the
presence of DNA in the pellicle of
Paramecium, J. Cell Sci., 2, 225-234
(1967).
881. Smith-Sonneborn J., Plaut W.S. Studies on the
autonomy of pellicular DNA in Paramecium,
J. Cell Sci., 5, 365-372 (1969).
882. Soifer D., ed. The Biology of Cytoplasmic
Microtubules, New York, New York Academy
of Sciences, 253, 1-848, 1975.
883. SokalR.R., SneathP.H.A. Principles of
Numerical Taxonomy, San Francisco,
W.H. Freeman and Company, 1963.
884. Sokatch J. R. Bacterial Metabolism, New
York, Academic Press, 1969.
885. Soldo A. Axenic culture of Paramecium-some
observations on the growth and behavior and
nutritional requirements of a particle-bearing
strain of P. aurelia, Ann. N.Y. Acad. Sci., 108,
299-380 (1963).
886. Solomon F. Characterization of the calcium
binding activity of tubulin. In: Cell Motility,
R. Goldman, T. Pollard and J. Rosenbaun,
eds., Cold Spring Harbor, Cold Spring Harbor
Laboratory, pp. 1139-1148, 1976.
887. Sonea S. Bacterial plasmids instrumental in
the origin of eukaryotes? Can. Rev. Biol., 31,
61-63 (1972).
888. Sonea S., Panisset M. Manifesto for a new
bacteriology, Rev. Can. Biol., 35, 159-161
(1976).
889. Sonneborn T.M. Kappa and related particles
in Paramecium, Adv. Virus Res.. 6, 229-338
(1959).
890. Sonneborn T. M. Ciliate morphogenesis and its
bearing on general cellular morphogenesis,
Actualites Protozoologiques J. 1, 337-355
(1974).
891. Sorokin S. P. Reconstruction of centriole
formation and ciliogenesis in mammalian
lungs, J. Cell Sci., 3, 207-236 (1968).
892. Souza K.A., Deal P.H., Mack H.M., Turnbull
С. E. Growth and reproduction of
microorganisms under extremely alkaline
conditions, Appl. Microbiol., 28, 1066-1068
(1975).
893. Soyer M.-O. Les ultrastructures nucleates de
la Noctiluque (dinoflagelle fibre) au cours de
la sporogenesis, Chromosoma, 39, 419-441
(1972).
894. Soyer M.-O. Titres et travaux scientifiques.
334
ЛИТЕРАТУРА
Chargee de Recherche au C. N. R. S. Banyuls-
sur-Mer, France, Laboratoire Arago, 1974.
895. Soyer M.-O., Haapala 0. K. Division and
function of dinoflagellate chromosomes,
J. Microscopic, 19, 137-146 (1974).
896. Spector D.L., Pfiester L.A., Triemer R. E.
Ultrastructure of fertilization in Peridinium
conctum, BioScience, 31, 47-49 (1981).
897. Spiegelman S. An in vitro analysis of
a replicating molecule. 80th Jubilee Lecture,
Am. Sci., 55, 3-68 (1967).
898. Srb A., Owen R., Edgar R. General Genetics,
2nd ed., San Francisco, W. H. Freeman and
Company, 1967.
899. Stack S. M., Brown M. V. Somatic pairing,
reduction and recombination: an evolutionary
hypothesis of meiosis, Nature, 222, 1275-1276
(1969).
900. Stafieu F.A. International Code of Botanical
Nomenclature, Utrecht, Netherlands, A. Oos-
thock, 1972.
901. Stanier R. Y. Toward a definition of the
bacteria. In: The Bacteria: A Treatise on
Structure and Function, I.C. Gunsalus and
R. Y. Stanier, eds., New York, Academic Press,
pp. 445-462 (1964).
902. Stanier R. Y., Adelberg E., Doudoroff M. The
Microbial World. 3 rd ed. Englewood Cliffs,
N. J.: Prentice-Hall.
903. Stanier R. Y., Cohen-Bazire G. The phototrop-
hic prokaryotes: the cyanobacteria, Annu.
Rev. Microbiol., 31, 225-274 (1977).
904. Stanier R. Y, van Niel С. B. The concept of
a bacterium, Arch. Microbiol., 42, 17-35
(1942).
905. Stanley S. M. Fossil data and the
Precambrian-Cambrian evolutionary transiti-
on, Am. J. Sci., 276, 56-76 (1976).
906. Stanley S. M. Ideas of timing of metazoan
diversification, Paleobiology, 2, 209-219
(1976).
907. Starr M. P. Bdellovibrio as symbiont: the
associations of Bdellovibrios with other
bacteria interpreted in terms of a generalized
scheme for the classifying organismic
associations, Symp. Soc. Exp. Biol., 29, 93-124
(1975).
908. Starr M. P. A generalized scheme for
classifying organismic associations, Symp. Soc.
Exp. Biol., 29, 1-20 (1975).
909. Starr M. P., Chatterjee A. K. The genus
Erwinia', enterobacteria pathogenic to plants
and animals, Annu. Rev. Microbiol., 26,
389-426 (1972).
910. Starr M.P., Seidler R.J. The Bdellovibrios,
Annu. Rev. Microbiol., 25, 649-678 (1971).
911. Stebbins G.L. Variation and Evolution in
Plants, New York, Columbia University Press,
1950.
912. Stebbins G.L. Process of Organic Evolution,
Englewood Cliffs, N.J., Prentice-Hall, 1966.
913. Steinman G., Smith A. E., Silver J. J. Synthesis
of a sulphur-containing amino acid under
simulated prebiotic conditions, Science, 159,
1108-1109 (1968).
914. Stephens R.E. The mitotic apparatus. Physical
chemical chacterization of the 22S protein
component and its subunits, J. Cell Biol., 32,
255-267 (1967).
915. Stephens R.E. Reassociation of microtubule
protein, J. Mol. Biol., 33, 517-519 (1968).
916. Steudle E., Lauchli A., Sievers A. X-ray
microanalysis of barium and calcium in plant
material: Significance for the analysis of
statoliths, Zeit. Naturforsch, 33, 444-446
(1978).
917. Stolp H. Interaction between Bdellovibrio and
its host cell, Proc. R. Soc. Lond., В 204,
211-217 (1979).
918. Strickberger M. Genetics, New York,
Macmillan, 1968.
919. Stubblefield E., Brinkley B.R. Cilia formation
in Chinese hamster fibroblasts in vitro as
a response to Colcemid treatment, J. Cell
Biol., 30, 645-652 (1966).
920. Stubblefield E., Brinkley B. R. Architecture and
function of the mammalian centriole. In:
Formation and Fate of Cell Organelles,
К. B. Warren, ed., Symp. Internatl. Soc. for
Cell Biology, 6, 172-217, New York, Academic
Press, 1967.
921. Sueoka N. Variation and heterogeneity of
basic composition of DNA. A compilation of
old and new data, J. Mol. Biol., 3, 31-40
(1961).
922. Sueoka N. Compositional variation and
heterogeneity of nucleic acids and protein in
bacteria. In: The Bacteria, vol. 5, I.C. Gunsa-
lus and R. Y. Stanier, eds., New York,
Academic Press, 1964.
923. Sueoka N., Quinn W. G. Membrane attachment
of the chromosome replication origin in
Bacillus subtilis, Cold Spring Harbor Symp.
Quant. Biol., 33, 695-705 (1968).
924. Sussman A. S., Halvorson H. O. Spores, Their
Dormancy and Generation, Ney York, Harper
and Row, 1966.
925. Swain T. Biochemical evolution in plants. In:
Comprehensive Biochemistry, 29, 125-302,
A. M. Florkin and E. H. Stoltz, eds.,
Amsterdam, Elsevier, 1974.
926. Sylvester-Bradley P. Carbonaceous chondrites
and the prebiological origin of food. In:
Molecular Evolution, R. Buvet and
C. Ponnamperuma, eds., Amsterdam, North-
Holland, pp. 499-504, 1971.
927. Тахтаджян А. Л. Четыре царства органи-
ческого мира-Природа, № 2, с. 22-32, 1973.
928. Татт S. Membrane specializations associated
with the attachment of prokaryotes to
a eukaryote cell, J. Cell Biol., 79, 216a (1978)
(abs. MS 1403).
929. Tartar V. The Biology of Stentor, New York,
Pergamon Press, 1961.
930. Tartar V. Morphogenesis in Protozoa. In:
Research in Protozoology, vol. 2, T.T. Chen,
ed., Oxford, Pergamon Press, pp. 116-205,
1967.
931. Tartar V. Regeneration in situ of
ЛИТЕРАТУРА
335
membraneliar cilia in Stentor coeruleus, Trans.
Am. Microsc. Soc., 87, 297-306 (1968).
932. Taylor F. J. R. Implications and extensions of
the serial endosymbiosis theory of the origin
of eukaryotes, Taxon, 23, 229-258 (1974).
933. Taylor F. J. R. Autogenous theories for the
origin of eukaryotes, Taxon, 25, 377-390
(1976).
934. Taylor F. J. R. Problems in the development
of an explicit phylogeny of the lower
aukaryotes, BioSystems, 10, 1-23 (1978).
935. Taylor F. J.R. Symbionticism revisited:
a discussion of the evolutionary impact of
intracellular symbioses, Trans. R. Soc. Lond.,
Ser. В 204, 267-286 (1979).
936. Taylor F.J.R., Blackbourn D.J., Blackbourn J.
The red water ciliate Mesodinium rubrum and
its “incomplete symbionts” A review including
new ultrastructural observations, J. Fisheries
Research Board of Canada, 28, 291-407
(1971).
937. Tebo B.T., Linthicum D.S., Nealson K.H.
Luminous bacteria and light emitting fish:
ultrastructure of tne symbiosis, BioSystems,
11, 269-280 (1979).
938. Tendal O.S. A Monograph of the Xenophyo-
pharia. Galathea Report, 12, 7-99, Copen-
hagen, Danish Science Press, 1972.
939. TewariK.K., Kolodner R.D., Dobkin W.
Replication of circular chloroplast DNA. In:
Genetics and Biogenesis of Chloroplasts and
Mitochondria, T. Bucher et al., ed., Am-
sterdam, North-Holland, pp. 379-386, 1976.
940. Thomas D. Y, Wilkie D. Recombination of
mitochondrial drug-resistance factors in
Saccharomyces cerevisiae, Biochem. Biophys.
Res. Comm., 30, 368-370 (1968).
941. Thomas L. The Lives of a Cell. Notes of
a Biology Watcher, New York, Bantam
Books, 1974.
942. Thorington G. The algal and bacterial
symbionts of Hydra viridis: metabolic
relations and transmission through the host
sexual cycle, Ph. D. thesis, Boston University,
Boston, Mass., 1980.
943. Thorington G., Margulis L. Transmission of
the algal and bacterial symbionts of green
hydra through the host sexual cycle. In:
Symbiosis and Evolution of Cell Organelles,
W. Schwemmler, ed., Berlin, W. Gruyter, 1981.
944. Thorington G., Margulis L. Nutrient transfer
in Hydra viridis, Biol. Bull., in press.
945. Thorington G., Margulis L., Berger B.
Transmission of symbionts through the sexual
cycle of Hydra viridis. I. Observations of live
organisms, Trans. Am. Microsc. Soc., 98,
401-413 (1979).
946. Thorne S. W., Newcomb E.H., Osmond C.B.
Identification of chlorophyll b in prokaryotic
algae from Diplosoma virens, Proc. Natl. Acad.
Sci. USA., 74, 575-578 (1977).
947. Tiffney B.H., Barghoom E.S. The fossil record
of the fungi. Occasional Papers of the Farlow
Herbarium of Cryptogamic Botany, # 7.
Cambridge, Mass., Harvard University, 1974.
948. Tilney L.G., Hiramoto Y, Marsland D. Studies
on the microtubules in Heliozoa. 3. A pressure
analysis of the role of these structures in the
formation and maintenance of the axopodia of
Actinosphaerium nucleofllum (Barrett), J. Cell
Biol., 29, 71 (1966).
949. Tilney L.G., Porter K.R. Studies on the
microtubules in Heliozoa. 2. The effect of low
temperature on these structures in the
formation and maintenance of axopodia,
J. Cell Biol., 34, 327-343 (1967).
950. Tippett D.H., Pickett-Heaps J. D. Apparent
amitosis in the binucleate dinoflagellate
Peridinium balticum, J. Cell Sci., 21, 273-289
(1976).
951. To L. The large pillotina spirochaetes of the
dry wood termites and their microtubules, Ph.
D. thesis, Boston University, Boston, Mass.,
1978.
952. To L.P., Evolution of steroidogenesis, Q. Rev.
Biolk, in press.
953. TuL.P., Margulis L. Ancient locomotion:
prokaryotic motility systems, Int. Rev. Cytol.,
55, 267-293, New York, Academic Press, 1978.
954. To L.P., Margulis L., Cheung A.T.W. Pillotina
and Hollandina: distribution and behavior of
large spirochaetes symbiotic in termites,
Microbios, 22, 103-133 (1978).
955. To L.P., Margulis L., Nutting W.L., Chase D.
The symbiotic microbial community of the
Sonoran desert termite: Pterotermes occidentis
(Walker), BioSystems, 13, 109-137 (1980).
956. Todd N. A theory of karyotypic fissioning.
Genetic potentiation and eutherian evolution,
Mammalian Chromosome Newsletter, 8,
268-279 (1967).
957. Todd N. Karyotypic fissioning and carnivore
evolution, J. Theor. Biol., 26, 445-480 (1970).
958. Tomas R. N., Cox E. R. Observations on the
symbiosis of Peridinium balticum and its
intracellular algae. 1. Ultrastructure, J.
Phycol., 9, 304-323 (1973).
959. Tomas R. N., Cox E. R., Steidinger K. A.
Peridinium balticum (Levander) Lemmermann,
an unusual dinoflagellate with a mesocaryotic
and an eucaryotic nucleus, J. Phycol., 9, 91-98
(1973).
960. Tornabene T. G., Langworthy T. A., Holzer G.,
Ord J. Squalenes, phytanes and other
isoprenoids as major neutral lipids of metha-
nogenic and thermoacidophilic “Archae-
bacteria”, J. Mol. Evol., 13, 73-83 (1979).
961. Towe K..M. Early Precambrian oxygen: a case
against photosynthesis, Nature, 274, 657-661
(1978).
962. Townsend R., Archet D. B., Plaskitt K. A. Puri-
fication and preliminary characterization of
spiroplasma fibrils, J. Bacteriol., 142, 694-700
(1980).
963. Trager W. The cultivation of a cellulose-
degesting flagellate, Trichomonas termopsidis
and of certain termite protozoa, Biol. Bull., 66,
182-190, Woods Hole, Mass. (1934).
336
ЛИТЕРАТУРА
964. Trench R. К. The cell biology of plant-animal
symbiosis, Annu. Rev. Plant Physiol., 30,
485-532 (1979).
965. Trench R. K., Boyle J. E„ Smith D.C. The
association between chloroplasts of Codium
fragile and the mollusc Elysia viridis.
1. Characteristics of isolated chloroplasts,
Proc. R. Soc. Lond., 184, 51-61 (1973).
966. Trench R.K., Boyle J. E., Smith D.C. The
association between chloroplast of Codium
fragile and the mollusc Elysia viridis.
2. Chloroplast ultrastructure and photo-
synthetic carbon fixation in E. viridis, Proc. R.
Soc. Lond., 184, 63-81 (1973).
967. Trench R. K., Pool R.R., Logan M., Engel-
land A. Aspects of the relationship between
Cyanophora paradoxa and its endosymbiotic
cyanelles Cyanocyta korschikoffiana (Hall and
Claus) I. Growth, ultrastructure,
photosynthesis and the obligate nature of the
association, Proc. R. Soc. Lond., 202, 423-443
(1978).
968. Trench R.K., Siebens H.C. Aspects of the
relationship between Cyanophora paradoxa
(Korschikoff) and its endosymbiotic cyanelles
Cyanocyta korschikoffiana (Hall and Claus)
IV. The effects of rifampicin, chloramphenicol
and cycloheximide on the synthesis of
ribosomal ribonucleic acids and chlorophyll,
Proc. R. Soc. Lond., 202, 473-482 (1978).
969. Тгйрег H. G., Jannasch H. W. Chromatium
buderi nov. spec., eine neue Art der “grossen”
Thiorhodaceae, Archiv. Microbiol., 61,
363-372 (1968).
970. Tucker J. B. Fine structure and function of the
cytopharyngeal basket in the ciliate Nassula,
J. Cell Sci., 3, 493-514 (1968).
971. Tucker J. B. Development and deployment of
cilia basal bodies and other microtubular
organelles in the cortex of the ciliate Nassula,
J. Cell Sci., 9, 539-567 (1971).
972. Turner F.R. An ultrastructural study of plant
spermatogenesis. Spermatogenesis in Nitella,
J. Cell Biol., 37, 370-392 (1968).
973. Tyler S. A., Barghoorn E.S. Occurrence of
structurally preserved plants in Precambrian
rocks of the Canadian shield, Science, 119,
606-608 (1954).
974. Tzagoloff A., Foury F., Akai A. Genetic deter-
mination of mitochondrial cytochrome b. In:
Genetics and Biogenesis of Chloroplasts and
Mitochondria, T. Bucher et al., eds.,
Amsterdam, North-Holland, pp. 419-426,
1976.
975. Urey H.C., Meinschein W.G., Nagy B. Com-
ments on meteorite hydrocarbons, Geochim.
Cosmochim. Acta, 32, 665 (1968).
976. Ursprung H., Smith K.D., Soifer W.H., Sullivan
D. T. Assay systems for the study of gene
function, Science, 160, 1075-1081 (1968).
977. Usher D. Early chemical evolution of nucleic
acids: a theoretical model, Science, 196,
311-313 (1977).
978. Uzell T, Spolsky C. Mitochondria and plastids
as endosymbionts: a revival of special
creation? Am. Sci., 62, 334-343 (1974).
979. van Baahlen C. Mutations of the blue-green
algae, Anacystis nidulans, Science, 149, 70
(1965).
980. van der Velden W., Schwartz A. W. Search for
purines and pyrimidines in Murchison
meteorite, Geochim. Cosmochim. Acta, 41,
961-968 (1977).
981. van NielC.B. The bacterial photosyntheses
and their importance for the general problem
of photosynthesis, Adv. Enzymol., 1, 263-328
(1941).
982. van Valen L.M., Maiorana V.C. Cells: Then-
Lives and Evolution, New York, Harper and
Row, in press.
983. Verma D. P. S., Nash D. T, Schulman H. M.
Isolation and in vitro translation of soybean
leghaemoglobin mRNA, Nature, 251, 74-77
(1974).
984. Vidal G. Late Precambrian microfossils from
the Visingso beds in southern Sweden, Fossils
and Strata, 9, 1-57 (1976).
985. Villee C. A. Biology, 7th ed., Philadelphia,
W. W. Saunders, 1977.
986. Vishniac W., Reazin G. A. Photoreduction in
Ochromonas malhamensis. In: Research in
Photosynthesis, H. Gaffron, ed., New York.
Wiley Interscience, pp. 239-242, 1957.
987. Vogel H.J., Lampen J.O., Bryson V. Organiza-
tional Biosynthesis, New York, Academic
Press, 1967.
988. Vogel H., Vogel A. Some chemical glimpses of
evolution, Chemical and Engineering News,
60, 90-97 (1967).
989. von Wettstein D. Chloroplast structure and
genetics. In: Harvesting the Sun, J. San Pietro,
ed., New York, Academic Press, pp. 153-190.
1967.
990. Walker J. C. G. Evolution of the Atmosphere.
New York, Macmillan, 1977.
99 ls Walker J. C. G. Metabolic and atmospheric
evolution. In: Limits to Life: Proceedings of
the 5th College Park Symposium,
C. Ponnamperuma and L. Margulis, eds.,
Amsterdam, Reidel, 1980.
992. Walker J. C. Earth History. Portola Valley
Calif., Science Books International, in press.
993. Wallace P.G., Huang M., Linnane A. W.
Biogenesis of mitochondria. 2. The influence
of medium composition on the cytology of
anaerobically grown Saccharomyces cerevisiae,
J. Cell Biol., 37, 207-220 (1968).
994. Wallin J. E. On the nature of mitochondria
(American Naturalist): Symbionticism and
protaxis (Anatomical Record), Cited in
E.B. Wilson, 1925 (1923).
995. Wallin J. E. Symbionticism and the Origin of
Species, Baltimore, Williams and Wilkins.
1927.
996. WalsbyA.E. Mucilage secretion and
movement of blue-green algae, Protoplasma.
65, 223-238 (1968).
997. Walter M.R., ed. Stromatolites, vol. 20.
ЛИТЕРАТУРА
337
Developments in Sedimentology, Amsterdam,
Elsevier, 1976.
998. Walter M.R. Recognition and significance of
Archean stromatolites in Archean cherty
metasediments: their sedimentology, micropa-
leontology, biogeochemistry and significance
to mineralization, J. E. Glouer and
D. I. Groves, eds., Pub. Geol. Dep. Ext.
Service, Canberra, University of West
Australia, pp. 1-9, 1978.
999. Wasserman R. H., ed. Calcium-Binding Pro-
teins and Calcium Function, Amsterdam,
Elsevier/North-Holland, 1977.
1000. Watson A., Lovelock J. E., Margulis L.
Methanogenesis, fires and the regulation of
atmospheric oxygen, BioSystems, 10, 293-298
(1978).
1001. Watson J.D. Molecular Biology of the Gene,
2nd ed, San Francisco, W.A. Benjamin, 1976.
(Имеется перевод: Уитсон Дж. Молеку-
лярная биология гена.-М.: «Мир», 1979.)
1002. Watters С. W. Studies on the motility of the
Heliozoa, J. Cell Sci., 3, 231-244 (1968).
1003. Webster D. A., HdckettD.P. Respiratory
chain of colorless algae. 2. Cyanophyta,
Plant Physiol., 41, 599-605 (1966).
1004. Weier ТЕ. Changes in the fine structure of
chloroplasts and mitochondria during phylo-
genetic and ontogenetic development, Am. J.
Bot., 50, 604-611 (1963).
1005. Weiner S., Hood L. Soluble protein of the
organic matrix of mollusk shells: A potential
template for shell formation, Science, 190,
987-989 (1975).
1006. Weinrich D. H., ed. Sex in protozoa.
A comparative review. In: Sex in Microorga-
nisms, Washington, D. C., American
Association for the Advancement of Science,
pp. 134-265, 1954.
1007. Weissman A. Das Keimplasma. Eine Theorie
der Vererbung, Jena, Gustav Fischer, 1892.
1008. WenyonC.M. Protozoology, London,
Balliere, Tindall and Cox, 1926.
1009. Wessenberg H.S. Opalinata. In: Parasitic
Protozoa, J.P. Kreier, ed., 2, 551-581, New
York, Academic Press, 1978.
1010. Weyl P. Organic particles in the ocean,
Science, 162, 587-588 (1968).
1011. Whatley F. R. Chloroplasts. In: Energy
Transportation Biological Systems, CIBA
Symposium, 31, 41-68, Amsterdam, Elsevier,
1975.
1012. Whatley J. M. The fine structure of
Prochloron, New Phytologist, 79, 309-313
(1977).
1013. Whatley J. M., John P., Whatley F.R. From
extracellular to intracellular: the establish-
ment of mitochondria and chloroplasts, Proc.
R. Soc. Lond., В 204, 165-187 (1979).
1014. White B. Stratigraphy and microfossils of the
Precambrian Altyn Formation of Glacier
National Park, Montana. In: Proc. First
Conference on Scientific Research in the
National Parks, 2, 727-735 (1979).
1015. White H. B., III. Coenzymes as fossils of an
earlier metabolic state, J. Mol. Evol., 7,
101-104 (1976).
1016. Whitehouse A. Towards an Understanding of
the Mechanism of Heredity, New York: St.
Martin’s Press, 1974.
1017. Whittaker R. H. On the broad classification
of organisms, Q. Rev. Biol., 34, 210-226
(1959).
1018. Whittaker R. H. New concepts of kingdoms
of organisms, Science, 163, 150-159 (1969).
1019. Whittaker R. H., Feeny P.P. Allelochemics:
Chemical interactions between species,
Science, 171, 757-770 (1971).
1020. Whittaker R. H., Margulis L. Protist classifi-
cation and the kingdoms of organisms,
BioSystems, 10, 3-18 (1978).
1021. Wicksramasinghe R. H. Model role for
bacteriorhodopsin for solar energy utilization
by primordial organisms, Cytobios, 17, 31-33
(1976).
1022. Wildy P. Unity and variety in virology,
J. Gen. Virol., 20, 1-5 (1973).
1023. Wilkie D. Cytoplasmic genetic systems of
eukaryotic cells, British Medical Bulletin, 29,
263-268 (1973).
1024. Wilkie D., Saunders G., Linnane A. W. Inhibi-
tion of respiratory enzyme synthesis in yeast
by chloramphenicol: relationship between
chloramphenicol tolerance and resistance to
other antibacterial antibiotics, Genet. Res.
Camb., 10, 199-203 (1967).
1025. Wilson E. B. The Cell in Development and
Heredity, New York, Macmillan, 1925.
1026. Wilson L. In: The Biology of Cytoplasmic
Microtubules, D. Soifer, ed., New York, New
York Academy of Sciences, 253, 1-848
(1975).
1027. Witkin E.M. Ultraviolet-induced mutation
and DNA repair, Annu. Rev. Microbiol., 23,
487-514*(1969).
1028. WoeseC. R., Fox G.E. The concept of
cellular evolution, J. Mol. Evol., 10, 1-6
(1977).
1029. Woese C.R., Fox G.E., Zablen L.. Uchida T,
Bonen L., Pechman K., Lefts B. J., Stahl D.
Conservation of primary structure in 16S
rRNA, Nature, 254, 83-86 (1975).
1030. Wofsy S. C., McConnell J. C., McElroy M. B.
Atmospheric CH4, CO and CO2, J. Geo-
phys. Res., 77, 4477-4493 (1972).
1031. Wolstenholme D. R. A DNA and RNA-con-
taining cytoplasmic body in Drosophila
melanogaster and its relation to flies,
Genetics, 52, 949-975 (1965).
1032. Wolstenholme D. R. Cytoplasmic DNA
containing bodies in amoebae, Nature, 211,
652-653 (1966).
1033. Wolstenholme D.R., Plaut W Cytoplasmic
DNA-synthesis in Amoeba proteus. 3. Fur-
ther studies on the nature of the
DNA-containing element, J. Cell Biol., 22,
505-513 (1964).
1034. WujekD.E. Ultrastructure of flagellated
22-39
ЛИТЕРАТУРА
338
chrysophytes. I. Dinobryon, Cytologia, 34,
71-79 (1969).
1035. Yamanaka T. Evolution based on compara-
tive biochemical studies of cytochrome c,
Ann. Report of Biol. Works, Science Faculty
of Osaka Univ., 14, 1-37 (1966).
1036. Yamin M. A. Cellulose metabolism by the
termite flagellate Trichomitopsis termopsidis,
Appl. Environ. Microbiol., 39, 859-863
(1980).
1037. Yqas M. On certain homologies between
proteins, J. Mol. Evol., 7, 215-244 (1976).
1038. YongeC.M. Symbiosis, Geol. Soc. Am.
Mem., 67, 429-442 (1957).
1039. Younger K.B., BanerjeeS., Kelleher J. K.,
Winston M., Margulis L. Evidence that the
synchronized production of new basal bodies
is not associated with DNA synthesis in
Stentor coeruleus, J. Cell Sci., 11, 621-637
(1972).
1040. Zablen L. B., Kissil M. S., Woese C. R„
Buetow D. E. Phylogenetic origin of the
chloroplast and prokaryotic nature of its
ribosomal RNA, Proc. Natl. Acad. Sci. USA,
72, 2418-2422 (1975).
1041. Zinder S., Brock T. Dimethyl sulfoxide as an
electron acceptor for anaerobic growth,
Archiv. Mikrobiol., 116, 35-50 (1978).
предметный указатель
Абиотические органические вещества 19, 20, 23
Автотрофные бактерии 131
Автотрофы 20, 53
Агрегация (клеток) 289, 292
Агробактерии 282
Адаптивная радиация 292-296
Адгезия (клеток) 285
Аденин 74, 78-79, 82
Аденозин 82
Аденозинмонофосфат (АМР) 82
Аденозинтрифосфат (АТР) 173, 174, 260
и симбиозы 152, 165
и фотосинтез 94, 98
и эволюция 19, 29, 81, 82, 112
- необходимость для репликации 87
Аденозинтрифосфатаза (АТРаза) 174, 181, 190,
193, 260, 267, 291
Азот 71
- фиксация 91-93, 95, 112, 152
Акинеты 108
Акридиновые красители 197
Акритархи 70, 136
Акрифлавин 182, 219
Аксиальная нить (фибрилла) 36, 249
Аксонема 206, 213, 214, 255
Аксонный транспорт 211
Аксоподии 210, 211, 231-236
Аксостиль 166, 210, 231, 235, 250, 257
Актин (и сходные белки) 307
Актинобактерии 21, 33, 118, 124
Актиномицеты 147
Актомиозин 223
Аланин 79-81, 107
Алкалоиды 132-133, 280
- чувствительность к ним 268
Аллоизолейцин 81
Аллофикоцианин 99
Альфа-спираль 289, 290
Алюминий 71
Амеба 184, 187-188, 223, 227
Амебоиды 24
Аминокислоты 19, 20, 23, 74, 80, 81, 85, 125
полимеризация 107
Аммиак 146
- в пребиотической химии 18, 72, 80, 82
Амфиастеры 232
Анафаза 60, 236-245
Анаэробное дыхание 93
Анаэробные организмы 20, 21, 93, ИЗ
Анаэробный фотосинтез 20, 112
Анизогамия 197
Анизонемиды 228
Аннелиды 289
Антераксантин 123
Апатиты 80, 284
Апосимбиотические инфузории 274
Арабиноза 159
Арагонит 284, 291
Аргинин 84
Архебактерий 95, 96
Архегонии 90
Архейские ископаемые 102
Архей(ский эон) 67, 68, 297, 300
Археоплазматические сферы 206
Аскомицеты 31, 42, 147, 198
Аспарагин 81
Аспарагиновая кислота 79-81
Атмосфера 297-300. См. также Кислород
Аттрактофоры 208
Ахроматиновый аппарат 50
Ахроматическая фигура 209, 218, 222, 231
Ацетат 87, 107, 119, 200
Ацетил-СоА 87, 118
Аэробиоз 21, 113-130, 283
- у прокариот 114
Аэробные бактерии 113-117, 129
Аэробный гликолиз 223
- метаболизм 124
Базальные тельца 36, 204, 206. См. также
Кинетосомы
Базальный диск 260
Базидиомицеты 206
Бактерии 19, 23-25, 37
- аэробиоз 118, 297
- классификация 30-32
- метаболизм 90-104
- метанокисляющие 122
- светящиеся 148-149
- симбиотические 147, 152, 158, 189
фотосинтезирующие 20
Бактериофаги 42, 196
Бактериоциты 282
Бактероиды 90
Бациллы 21
Бделловибрионы 172-173
Белки 13, 19
- эволюция 32
Бензонитрил 74
Биобластов теория 62
Биогенные минералы (биоминералы) 137-140,
285, 288
Биогеохимические циклы 111, 140, 142
Биолюминесценция 118, 120, 287
Биосинтез, пути 19, 20, 24
340
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Биосфера 21, 23, 137, 283, 297-300
- дофанерозоя 284
Биотрофизм 146, 175
Бластула 40, 233
Блефаропласты 204, 206, 215
Блохмана тельца 147
Бобовые 152, 159, 176
Брожение 91, 283
- у прокариот 112
Брюхоресничные инфузории 214
Бурые водоросли 13, 30, 31
Вакценовая кислота 122
Валин 80, 81, 84
Ванадилпорфирин 74
Венера 140, 298, 300
Веретено 33-34, 50, 52, 56, 198, 204-209, 229.
230, 266
происхождение 221-223
у трипаносом 218-219
Вид 28, 30
Видообразование 292-296
Винбластин, винкристин 210, 212, 233, 263
Вирусы 40, 42, 79, 152
Витамин А 94, 95
Bi2 96, 97, 126, 274
Е 134
- К 94, 119, 124
Внутриклеточная передача информации 214
Внутриклеточные симбионты 148-149, 266
Внутриклеточный отбор 194
- транспорт 214
Водород 20, 71, 72, 80, 140
доноры 38
- цианистый 18, 77-83
Водоросли 25, 270, 290
- аномальные 154, 160
- апохлоротичные 25
- симбиотические 66, 146, 147, 147, 149, 154,
155, 195, 202
в лишайниках 150-152, 278
эволюция 44, 48-50, 53, 278
Вспомогательная клетка 213
Вторичноротые, минерализация 285
Вторичные метаболиты 83
Вулканические породы 68
Выживание 297, 300
Вьюрки Галапагосских островов 90
Гадей(ский эон) 66-67
Галактобактерии 94, 95
Гал акту ро новая кислота 112
Гаметические ядра 169
Гаметогенез 158
Гаметоциты 219
Гаметы 144
Гаплоидная фаза 145, 204
Гаптонемы 210
Гаптофиты 31
Гастро дермальные клетки 171, 278
Гексозы 83
Гемоглобины 96
Гемы 94, 96, 97, 126
Генеративные комплексы 216
Генетическая система, организация 194-196
Генетический код 84
Геномы 24, 145, 223
редукция 160, 171
Генофор 33, 34, 37, 87, 222
Гены 35, 144, 145, 159, 224, 229
- перенос 283
Геохимия 130
Геохронология 65
- таблицы 67, 68
Гетероконты 31
Гетеротрофные бактерии 19
- организмы 52-53, 146
Гетероцисты 108
Гея 297-300
Гидра 160, 171, 175, 214, 258, 275, 278, 282
Гидроксильные радикалы 118
Гидросфера 67, 298
Гипермастиготы 52, 215
гаметы 158, 267, 268
как симбионты 251
митоз 158, 267, 268
центриоли 230-231
Гиперсема 88
Гипоксантин 74
Гипосема 88
Гистогенез 291
Гистоноподобные белки 23
Гистоны 15, 33, 58, 84, 272
Гистрихосферы 70
Гифохитриды 31, 260
Гликокаликс 169
Гликолиз 93, 112
Гликопротеиды 289, 290
Глицеральдегид 83
Глицин 79-81, 107
Глутаминовая кислота (глутамат) 79-81
Глюкоза 23, 74, 83, 180, 184
Глюкозамин 112
Глюкозо-6-фосфат 83
Головоногие 147
Голосеменные 68
Гольджи аппарат 23
- тельце 218
Гомологии 24, 89, 278
Гормогонии 87
Гормон щитовидной железы 214
Горячие источники 49, 81, 297
Грамицидин 77
Грам-отрицательные бактерии 147, 152, 248, 282
Грам-положительные бактерии 251
Грегарины 207, 260
Грибы 41, 42, 49, 58, 285, 297
как симбионты 147, 149-152
классификация 13, 22, 30-34, 305
микротрубочки 210, 213, 214
Гризеофульвин 210
Группы сцепления 196, 222
Гуанозинтрифосфат (GTP) 81, 87
Губки 31, 275, 285, 290
Датирование 65
Двигательные приспособления 36
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
341
Девесковиниды 169, 291, 255
Дезоксирибоза 83, 85, 107
Дезоксирибонуклеиновая кислота см. ДНК
Дендриты 211
Десульфомонады 95
Диады 174-176
Диаминопимелиновая кислота 112
Диатомеи (диатомовые) 31, 201, 233-234, 276, 285
Дидемниды 100
Дикариоз 58, 214
Динеин 209, 211, 260
Динофлагелляты 31, 118, 221, 228
- как симбионты 147, 157
митоз 225
- эволюция 225, 276
- ядро 50
Дипиколиновая кислота 112
Диплоидизация 293
Диплоидная фаза 145
Диплоидно-гаплоидный цикл 204-205, 255, 291
ДНК 7, 14, 19, 23, 35, 84-85, 163, 164, 199, 210, 222
бделловибрионов 172
кинетопласта 202
кинетосом *267
- митохондрий 181, 192-194, 199
плазмид 282
- пластид 22, 272, 281
- симбионтов 152, 153, 160, 169-171
- сравнение у эукариот и прокариот 37
Докембрий см. Дофанерозой
Дофанерозой 66, 70, 283, 291
Дробление 198
Дрожжи, митохондрии 180, 184, 189-193, 201
- фенотип petite 189, 191
Дупликация генов 45, 223
- геномов 223
Дыхательная цепь (цепь транспорта электронов)
173, 174
Дыхательный обмен 21
Естественный отбор 87, 146, 197, 198, 279, 282-283
Зачатковый путь 232
Звезды (при делении клеток) 222, 266, 269
Зеаксантин 123
Зеленые водоросли (хлорофиты) 24, 30, 31, 44,
160, 228, 276
— как симбионты 147, 149
сцеплянки 227
- серобактерии 142
Земля 65-57, 133, 298
Земля-Луна 65, 68
Зигомицеты 42
Зигота 35, 40, 144
Зооксантеллы 146, 147, 155, 157
Зооспоры 58
Зоохлореллы 147, 167
Зубы 285
- микрофлора 147
Изогаметы 197
Изолирующие механизмы 29
Изопентинил пирофосфат 94, 98, 122, 185
Изопрен 122
- производные 94, 112
Изопреноиды 81, 96, 98, 107,118, 119, 122, 124, 134
- биосинтез 95, 98
Инозин 82
Информационная РНК 18, 164/228
синтез 87
Инфузории 24, 147, 150-152, 180
- классификация 30
- колониальные 42
- кортикальная наследственность 214-215, 233,
269
комплексы с бактериями 258
- микротрубочки 210, 211
происхождение 228
РНК 266
- ядра 196, 223, 228, 289
Ископаемые микроорганизмы см. Микрофосси-
лии
Жгутики 15, 24, 53, 230-231, 249, 251, 253, 260
- бактериальные 36, 169
Железо 71, 137, 140
- окисляющие его бактерии 142
Железосодержащие ферменты 118
Желто-зеленые водоросли 31, 276
Животные 13, 58, 292-296
- биоминеральные компоненты 288
- классификация 30-33, 305-307
- клетки 34
- микротрубочки 210, 211
- симбионты 150
Жирные кислоты 74, 87, 174
моно ненасыщенные, насыщенные 119
ненасыщенные 126
полиненасыщенные 118, 124, 127, 181, 191
Заднежаберные моллюски 146
Зародыш (у растений) 40
Захват чужеродных органелл 160, 161, 282
Калий-аргоновый метод 134
Кальвина-Бенсона цикл 95
Кальциевые биоминералы 288
Кальций и скелеты 284-292
- сульфаты 137
Кальцит 284, 291
Каннибализм 293
Каппа-частицы 150-152
Карбаматы 210
Карбиды 74
Карбоксилазы 91, 92
Карбон 66
Карбонаты 25, 135, 284
Кариогамия 145
Кариосома 227
Кариотип, эволюция 294-296
Кариотипическое расщепление 292, 294, 295
Каротиноиды 94, 122, 123, 127, 130-131
пластидный контроль 280
- синтез 93, 119
Каталаза 93, 96
Кембрий(ский период) 65, 66, 284, 285, 292
342
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
«Кембрийский разрыв» 135-136
Кероген 108, 132
Кетоглутаровая кислота 136
«Киллер» 151-152
Кинетопласт 201-203, 206, 218-219
Кинетосомы 15, 36, 58, 127, 206, 208, 215, 229-230,
232, 233, 269
- происхождение 24, 222, 225, 227-228, 247
- развитие 206
- репликация 266
- у гипермастигот 52, 208
- у растений 222
Кинетохоры 58, 205, 206, 215-217, 293, 294
- происхождение 24, 222-224
- репликация 293, 294
- соотношение с хроматином 293
- функция 218
Киноцилии 210
Кислород атмосферный 69, 291, 298, 299
- и синтез стероидов 185
- токсичность и обезвреживание 21, ИЗ, 118,
119, 123
Кишечнополостные 149, 233, 289
Классификация 26-33
Клетки 13-14, 19-20, 23-24, 34, 35, 214
- новая терминология 174-176
- эволюция 280
Клеточная пластинка 58
- стенка 58, 227, 229
Клеточное деление 18, 218, 222, 274, 278
Коацерваты 80
Кодоны 84
Колхицин 210-212
Колцемид 210-212, 217
Конъюгация 169, 204, 214, 227, 228
Коралловые полипы 66, 275, 291
- рифы 70, 285, 297
Корончатые галлы 282
Корриноиды 96, 126
Костистые рыбы 147
Кость 292
Кофермент Q 119, 122
Красные водоросли 24, 30, 31, 52, 208, 219, 221
225, 227, 322
Краспедомонады 44
Кребса цикл 95, 98, 121, 125
Кремний 140, 285, 286
Криптомитоз 206
Криптомонады 25, 31, 173
Криптомонадоподобные простейшие 155
Кристы 24, 248
Кроссинговер 204, 293
Ксантеллы 275
Ксантин 74, 82
Кутикула 290
Лактат 87, 107
Ланостерол 185
Лейкоциты 204
Лейцин 80, 81, 84
Лигнаны, лигнин 280, 292
Лизосомы 162
Липиды мембран 186
Липоевая кислота 118
Липопротеидные мембраны 79, 80
Лишайники 31, 149-153, 158, 278
Люциферин, люцифераза 118, 120, 122, 149
Макронуклеус 50, 170, 223, 228, 229
Малатдегидрогеназа 181
Манноза 74
Марс 65, 74, 140, 298, 300
Мевалоновая кислота 94, 119, 122
Медь 23
Межзвездное органическое вещество 71
- пространство 18, 71
Межклеточные соединения 41, 291
Мезозой(ская эра) 66
Мейоз 41, 43, 50, 144, 145, 203-205, 224, 228, 229
- и симбиоз 176
- происхождение 200, 283, 293
- у диатомовых 233
- у инфузорий 169
Меланоциты 233
Мелатонин 210, 212,
Мембраны 23-24, 214, 291
- и стероиды 281
- мезосомальные 23
- хлоропластов 270, 280
Менделевская наследственность 41, 136, 187, 205
Метаболизм 132
Метаболические новоприобретения как резуль-
тат симбиоза 153
Метан 18, 22, 74, 80-82, 140
Метаногенез 20, 93, 95, 112
Метанообразующие бактерии 20, 95, 159
Метафаза 59, 236-245
Метиларсенат 96
Метилбензонитрил 74
Метилкобаламин 94
Метильные группы 96
Метионин 81
Механорецепторы 210-213
Микобионты 150, 151
Микоплазмы 85, 90, 130
Микориза 147
Микроаэрофильные организмы 23, ИЗ
Микробные маты 141, 258, 292
- сообщества 70, 251
Микроворсинки 213
Микрококки 172-174
Микронуклеусы 50, 169, 228-229
Микроспоридии 207, 227
Микросферы 80
Микротрубочки 36, 50, 52, 206-211, 253. См.
также Центр-организатор микротрубочек
- белки 176, 209, 291
в нитях веретена 206-208, 218
- их ингибиторы 211, 212
- потребность в Са2+ 287
- происхождение 233, 246-248
-содержащие их структуры 210, 215, 234-235
- у прокариот 24, 249, 261-265
- у эвглены 274
М икротубулярная система 246-247
- теория 211
Микрофоссилии 19, 22, 31, 102-108, ПО, 136, 137
Миксобактерии 33, 175
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
343
Минерализация 284, 285, 289
«Минимальная» клетка 85, 86, 90
Миозин 185, 264, 289, 291
Митоз 34, 35, 37, 58, 203-245, 293
- атипичный 205
- вариации 220-221, 225, 236-245
- потребность в Са2+ 287, 289
- филогения 225
- эволюция 23, 24, 215, 222-235, 276, 283
у водорослей 48-50, 52
Митотический аппарат 23, 24, 204-205, 209, 215,
231. См. также Веретено
Митохондрии 14, 15, 21, 38, 48, 49, 58, 60, 63,
113, 180-203, 280-281. См. также Кинето-
пласт
- гены 193-196
- дрожжей 124, 189-195, 201
- мембраны 185, 186, 291
- нуклеиновые кислоты 182, 189-191, 195, 266,
269
- передача 198-199, 213, 218
- половое поведение J92
- рибосомы 182, 217
- эволюция 291
Мицетомы, мицетоциты 282
Млекопитающие 66, 68, 147, 303
- эволюция 294
Многоклеточность 42, 58, 289
- вопросы терминологии 174-176
- эволюция 44, 45, 284, 291
Многоядерные клетки 223, 245
Моллюски, симбиоз 282
Монада 31, 174-176
Монеры 13, 21, 285, 297
- классификация 27, 30-32, 301-303
Монокарионы 145
Монофилия 39, 42
Морфогенез 283
Мочевина 82
Мутагены природные 19
Мутации 19, 190, 197, 199
Мутуализм 144, 146
Мхи 90
Мышьяк 23
Насекомые 147, 183
Неменделевская наследственность 162
у дрожжей 192-195
Неодарвиновская эволюция 19, 27
Неосема 88
Нервные клетки 210, 211, 233
Никотинамидадениндинуклеотид (NAD) 173, 174
Нитраты 96, 140
Нитрогеназы 91, 95, 159
Нитрозогуанидин 196, 199
Нопалин 282
Нуклеиновые кислоты 18, 19, 24, 215. См. также
ДНК и РНК
Нуклеоид 33, 249
Нуклеокапсид 42
Нуклеотиды 19
Нуклеоцитоплазма 15, 23, 195, 201, 325
Нуклеоцитоплазматические отношения 273, 293
Облигатные анаэробы 114-117
Озон 23
Окислительное фосфорилирование 174
Октопин 282
Олеиновая кислота 122
Оомицеты 31, 198
Оплодотворение 197, 204, 219
Органеллы, генетика 146, 197, 199
- и ядро 159
- нуклеиновые кислоты в них 146
- эволюция 14, 15, 23-24, 150-164
Органические молекулы (вещества, соединения)
18, 19, 22, 76
- микрофоссилии 102, 105
Органический углерод 18, 19
Оротовая кислота 85
Остракоды 290
Палеонтологическая летопись 285, 287
Панспермия 17
Папоротники 90
Парабазальные тельца 218, 231
Паразитизм 23, 144, 146, 152, 158
Паразиты тканевые 158, 292
Парамеции 167-169
Парасексуальность 144, 145, 196
Парасимбиоз 146
Парвальбумин 291
Патогенность 144, 146, 187-188
Пектины 112
р-Пельтатин 212
Пентозы 83
Пептидные связи 77
Пептидогликан 160
Первичные продуценты 42
Первичный метаболизм 83
Перекись водорода 118, 127
Периплазма 172, 173
Периплазматические жгутики 260
Пероксисомы 185
Пиллотины 165, 247, 249-253, 256, 260
Пиноцитоз 41, 58
Пиреноид 170
Пиримидины 74, 81, 82
- предшественники 85
Пирофосфат 82
Пирсонимфиды 258
Пируват 98, 107
Питание, способы 39-40
Плазматическая мембрана 23, 266
Плазмиды 22, 159, 196, 270, 282
Пластиды 21, 200, 218, 274, 279-281. См. также
Хлоропласты
генетика 160, 197, 276, 280
- генетическая непрерывность 199, 270-278
ДНК и РНК 272
- симбиоз с эвгленой 276
- у пестролистных растений 162
у протистов 275
- утрата 199, 220
- эволюция 13-15, 49, 50, 58, 61, 63, 144, 146,
149, 223, 272, 276, 278
Плесневые грибы 34
Плодовые тела 87
344
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Плоидность 39
Подвижность 24, 38, 41, 223, 233, 256, 260, 285
- и симбиоз 165
Подофиллотоксин 210, 212, 263
Позвоночные 66
Пол 35
Полиада 175
Полигеномные (мультигеномные) системы 18,
175, 176
Полиизопреноиды 74
Полимастиготы 56, 164, 165, 181, 235, 250, 251,
253, 255, 258
Полимонады 175, 176
Полинуклеотиды 77, 78
Полипептиды 80
Полиплоидия 196, 292, 294-296
Полисема 88
Полифилия 276, 285
Полифосфорных кислот эфиры 80
Половой диморфизм 197, 292
Полосчатые железорудные формации (ПЖФ)
69-70, 112
Порфирины 81, 93, 96-98, 107, 112, 119, 121-122,
125, 126
Последовательных симбиозов теория 15, 16, 25,
48, 58
Праводоросли 48, 49, 53, 274
Пребиотическая химия 18, 76
Пребиотические олигонуклеотиды 79
- органические вещества 105
Приматы, эволюция 294, 296
Пристан 74
Продуценты 39
Происхождение жизни 14, 17
Прокариоты 22-23, 33, 37-39, 291
- влияние на круговорот элементов 297
- зеленые, выделяющие О2 20, 21, 276
и эукариоты, промежуточное звено 221-222
классификация 30-32, 301-303
- микротрубочки 24, 249, 261-265
- предковые 42, 49
- сравнение с эукариотами 33-39
- фагоцитоз 23
- филогения 60, 129
- эволюция метаболизма 20, 22, 90-102
Прокинетосомы 215
Пролин 80, 81, 84
Простейшие 25, 30, 31, 41, 48-50, 147
Протеиноиды 80
Протерозойский эон) 41, 67, 69, 111, 284, 297
- атмосфера 118
- ископаемые 130, 133, 134
Протисты 13, 25, 44
- микротрубочки 206-209, 211
минерализация 285
- мутации 24
- необычные ядра 50
- пигменты 276
- ундулиподии 24, 260
- фотосинтезирующие
- эволюция 13, 48, 205
Протобионты 80
Протоктисты 13, 42, 43, 58
классификация 30-32, 303-305
- минерализация 285
- митоз 34, 58, 205, 220, 232-245
- симбиозы 147
- эволюция 22, 222, 233, 234, 246
Протомитохондрии 22-24, 48, 164, 180-182, 184,
201
Протоорганеллы 197
Протопластиды 25, 48, 272, 273
Протоундулиподии 24, 267
Протохлоропласты 276
Протохлорофиты 21, 99
Протоэукариоты 184, 185
Процентриоли 215
Прямая филиация 13-14, 44—48, 57, 59, 84
Пурины 81, 85
Пурпурные бактерии несерные 94, 129
серные 129, 142
«Пятнистые клетки» 136
Равновесия органы 233
Радиолярии 31, 211, 275, 276, 285
Растения 13, 22, 40-42, 58, 67, 292-297
классификация 30, 31, 307-308
- микротрубочки 210, 229
- минерализация 285
- симбиоз 147, 152, 153
- филогения 45, 49
- цветковые 45, 66
Растительные клетки 214, 270, 279
Редуценты 40, 42
Рекомбинация 196, 282
Репликаза 79
Рептилии 66, 68
Реснички 36, 52, 204, 213, 233, 253, 259, 260
Ресничные сенсорные'клетки 213
Ресничный эпителий 216, 232
Рибоза 82, 83, 85, 107
Рибонуклеиновая кислота см. РНК
Рибосомы 77, 276
- РНК 20, 58, 77, 95
- спирохет 249
- хлоропластов 270
- чувствительность к антибиотикам 191
Рибулозобисфосфат-карбоксилаза (РБК) 53, 91,
127, 280-282
Ризопласт 228
РНК 35, 36, 79, 163, 164
- кинетосом 266, 269
- митохондрий 182, 273
- рибосомная 59, 164, 182, 193, 273
- симбионтов 152-153
- хлоропластов 270, 272, 273, 281
- 5S 61; 16S 184, 272, 273
РНК-полимераза 152, 269
Родства критерий 89
Рост организмов 297
Рубредоксин 91
Рыбы 118, 119, 149
Саговники (цикадовые) 66, 292, 293
Самореплицирующиеся системы 71, 79
Саркозин 80
Светляки 118
Светящиеся организмы 147-149
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
345
Сегрегация (генов) 280
Семенные папоротники 66
Семы 85, 87-91, 93-94
Сера 20, 22, 71
Серин 80, 81, 84
Сероводород 19, 20, 22, 98, 112
Силикофлагелляты 201
Силур(ийский период) 66
Симбиоз 144-147, 150
и парасексуальность 144—145, 176
- между микробами 147
- эволюция 22-25, 149, 282-283
Симбионты (интеграция) 177
- фотосинтезирующие 167, 175
- экспериментальные 151-152
Симбиотическая теория 13-16, 22, 25, 45-48, 58
Симбиотические ассоциации 282
партнеры 151-153, 157-160, 196, 197
Сине-зеленые водоросли 20-21, 30, 31, 49. См.
также Цианобактерии
Систематика 27-29
Сквален 94, 122, 185
Скользящие бактерии 127
Слизевики 13, 30, 31
Солнечная система (?6
Солнечники 210, 231-232, 285, 286
Солнце, химический состав 71
Сома 232
Сосудистые растения 292
Сосущие инфузории 197, 211
Сперматозоиды (спермин) 204, 210, 258
Сперматоциты 198
Спириллы 264
Спироплазмы 16, 267
Спирохеты 164-167, 246-260. См. также Пилло-
тины
как предки ундулиподий 23, 24, 222-226
классификация 248
- филогения 129
Споровики 206-207
Спорофиты 90
Споры 22, 40
Стероиды 130, 136
- биосинтез 119, 164, 185, 281
Стрептомицин 197, 199, 200
Строматолиты 14, 18—19, 22, 68, 70, 102, 103, 108
Сульфатвосстанавливающие бактерии 129
Сульфаты 22, 112, 139
Сульфид натрия 98
Супероксиддисмутазы 118
Супероксидные радикалы 118
Сфероп ласты 172
Тайнобрачные растения 27
Таксономия 27
Таксоны 27, 28, 30, 39
Тал л офиты 27, 49, 53
Тараканы 147, 180
Телофаза 60, 236-245
Термиты 158, 164, 215, 249-253, 262, 263
Термо- и кислотоустойчивые микроаэрофилы 95
Термоклин 80
Термоплазма 223
Терпеноиды 185, 187
Тетрапирролы 96
Тетрациклин 135, 191
Тетрозы 83
Тилакоиды 155
Тимидинтрифосфат (ТТР) 87
Тирозин 80
Токоферол 233
Точечные мутации 282
Транспортные РНК 152-153
Треонин 80, 81, 84
Трептонемы 258
Трикарбоновых кислот путь 112
Триозы 83
Триплетный код 19, 84
Трифлюралин 212, 214
Трихомонады 255
Трихонимфиды 251
Тропонин 289, 291
Тропосфера 298
Тубулин 206, 209, 210, 212, 253, 260-265
Убихинон 94, 99, 119, 124
Углеводы 83
Углекислота (двуокись углерода) 20, 21, 80, 92,
146, 171, 223, 298
- фиксация 21, 91-93, 95
Углерод 71
изотопы С12 и С13 105, 108, 134
- соединения 21-22
Углерода двуокись см. Углекислота
Углистые хондриты (метеориты) 73
Ультрафиолет 23, 40, 76, 136
и пребиотическая химия 81
- повреждение ДНК 102
Ундулиподии 15-17, 36, 40, 42, 53, 211, 218
гомологии 206, 210, 211
- и происхождение митоза 215, 225
- происхождение 23, 24, 56, 64, 222, 223, 246,
260, 266
- у водорослей 50, 53, 221
- у грибов 41
- у инфузорий 214
у симбионтов термитов 208-209, 250, 251, 255
Фагоцитоз 24, 41, 58, 172, 281
Факультативные анаэробы 114—117
Фанерозой(ский эон) 65-68, 276, 291
Фенилаланин 81
Фенольные соединения 74
Ферментирующие организмы 18-21
Ферредоксин 84, 91, 96, 99, 174
Фикобилипротеины 21, 99
Фикобилисомы 101
Фикобионты 150, 151, 278
Фикопласт 278
Фикоцианин, фикоэритрин 99
Фитол 95, 119, 122
Фитомонады 49
Флавинадениндинуклеотид (FAD) 173
Флавоноиды 118
Фораминиферы 31, 275
Форезия 144, 146
Формальдегид 80, 83
346
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Фосфатидилинозит, -серин, -этаноламин 186
Фосфатид ил холин 174, 186
Фосфаты 85, 138, 289
Фосфоенолпируват 91, 92
Фосфор 71
Фотоавтотрофия 39, 94
Фотоавтотрофы 53, 92, 95
Фотогетеротрофы 94
Фотосинтез 20, 38, 48, 53, 274, 278
- и атмосферный воздух 21-22
- у прокариот 15, 20, 49, 98-99, 112, 121, 124,
127, 275, 276
- эволюция 40, 283
Фотосинтезирующие организмы 21, 22 25, 95,
119, 123
Фотосистемы I и П 98, 99
Фрагмопласт 58, 228, 278
Фукоксантин 276
Фумараза 181
Хаоса эон 66
Хемоавтотрофы 22, 127, 129, 130, 146
Химическая эволюция 18, 71
Химические ископаемые 105, 131
протерозойские 133
Хитин 22, 131
Хитинозои 43, 70
Хитриды 197, 230, 234
Хищничество 23, 290, 291
Хищные, эволюция 294
Хламидомонады 278, 280-281
Хлореллы 160, 167, 170, 275
Хлоробионты 31
Хлоробиум-хлорофилл 97
Хлороксибактерии 21, 25, 31, 33, 101, 278
Хлоропласты 170, 270-281
- в роли симбионтов 177, 274
- гены и нуклеиновые кислоты 270, 272, 279-281
- деление 158
- происхождение 22, 62, 270
- утрата функции 200
Хлорофиллы 21, 93, 96, 97, 99, 119, 123, 126, 276
Хлорпромазин 210
Хоанофлагелляты 44, 233, 234
Холестерол 131, 185, 186
Холин 182
Хондрулы 73
Хризофиты 30, 31, 228, 285
Хроматин 84, 215, 216, 218, 222, 223, 293, 294, 296
Хромосомная теория наследственности 222
Хромосомные гены (локусы) 27, 164
— дрожжей 189-191
Хромосомы 33-35, 41, 59, 60, 292-296. См. также
Мейоз, Митоз
- движение 210, 218
- репликация 218
- эволюция 14, 24, 56, 84, 283
В-хромосомы 162
Царства (организмов) 13, 30, 39-43
Целлюлоза 22, 131
Целоматы, минерализация 285
«Центр деления» 224
Центральный конус 207
Центриоли 50, 58, 204, 206, 208, 209, 236-245,
267-269
- генетическая основа 215
- происхождение 24, 221-224, 246, 266
- репликация и передача 216, 217
- у грибов 227
- у инфузорий и гипермастигот 214-215, 230-231
Центриолярные бляшки 229
Центромера см. Кинетохоры
Центросомы 204, 206
Центры-организаторы микротрубочек (ЦМ) 208,
215, 222, 293, 294
- как предшественники кинетосом 229-230
- происхождение 215, 267-269
- репликация 234-235, 265
- РНК 266-269
- структура 215, 216
- терминология 224
- у водорослей 221, 233
- у Armillaria 205
- эволюция 227-232
Цианеллы 154, 155, 160, 171
Цианкобаламин 97
Цианобактерии 20, 21, 31, 33, 49, 50
- и кислород 99, 115, 118
- ископаемые 33, 108, 134
- нитчатые 149, 175
- симбиоз 292
- эволюция 25, 49, 53, 55-59
Цианогенные гликозиды 90
Цианофаги 40
Циклоартенол 131, 185
Циклоз 223
Цинк 23
Циррус 36
Цирры 214, 253
Цитидинтрифосфат (СТР) 81, 87
Цитоды 246
Цитозин 82
Цитоплазма 191
- деление 294
Цитоплазматическая наследственность 147, 181,
197-200, 275
Цитохром а 174, 202, 203
- b 186, 193
- с 99, 173, 174, 181
Цитохром-с-редуктаза 190, 193
Цитохромоксидазы 190, 193, 203
Цитохромы 91, 96, 127, 202-203
Человек 30, 121
Черви 285
Чередование поколений 58
Четвертичный период 66
Членистоногие 289
Шистосомы 179
Эвглена 199, 200, 273, 274
- пластиды 25, 282
Эвгленовые 53, 228
Эдиакарская фауна 284, 289
Экзоцитоз 291
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
347
Эмбдена - Мейергофа путь 23, 181
Эмбриогенез 40, 283
Эндоплазматический ретикулум 23, 186, 291
Эндосимбиоз 22, 23, 25, 160, 162, 278
Эндосома 228
Эндоспоры 87
Эндоцитоз 291
Эоны 65-67
Эписема 88
Эпи сомы 221
Эпоксиды 118
Эритробионты 31
Эритроза 83
Этан 74, 80
Этиопласт 271
Эукариотические клетки 14, 16, 33
Эукариоты 17, 23-25, 35-39, 162
- анаэробные ИЗ
- место в биосфере 297
- систематика 303-308
Эуплоидия 224
Эустигматофиты 31
Ядерная мембрана 23, 24
Ядро 35-36, 154, 163, 164, 291
- трансплантация 188
Ядрышко 36
Ячмень 270, 271
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИИ
Acanthocystis 229, 235, 286
Actinophrys 232
Agrobacterium 159, 282
Allium 58
Allogromia 235
Allomyces 230, 268
Amoeba 187, 227
Anacystis 57, 61, 127
Anthoceros 270
Armillaria 205, 227
Arthromitus 251, 264
Ascaris 198
Aspergillus 297
Barbulanympha 52, 208, 230
Bdellovibrio 25, 164, 172, 173, 181, 185
Beggiatoa 126, 130
Blastocladiella 164
Bonnemaisonia 219
Borrelia 248
Botryococcus 275
Bufo 29
Calotermes 250
Catenaria 227
Centropyxis 229
Centrums 198
Cercopithecus 296
Chilomonas 162, 275
Chironomus 196
Chlamydomonas 22, 123, 197, 199, 200, 269, 280, 281
Chlorella 61, 123, 149
Chromatium 96
Chuaria 136
Circinella 297
Cladonia 151
Clathrina 229
Clevelandina 249
Colellela 290
Convoluta 156, 162, 163, 176
Cristispira 248
Crithidia 61, 153, 162, 201
Cryptobia 230
Cryptocercus 251
Cryptomonas 275
Cryptotermes 169
Cyanidium 49
Cyanophora 25, 49, 147; 155, 157, 160, 275
Cyathomonas 275
Desulfovibrio 94-96
Dictyota 230
Dienympha 246
Dimastigamoeba 228
Dimorpha 229, 230
Diplocalyx 249, 250, 261
Drosophila 159
Echinosphaerium 231
Elysia 156, 161, 282
Eoastron 103, 110
Eosynococcus 111
Escherichia 55, 61, 88, 91
Eudorina 230
Euglena 158, 272, 273, 274, 275
Giardia 56
Glaucocystis 25, 254, 160, 171
Gloeocapsa 25
Gloeochaete 160
Gloeothece 111
Gunflintia 110
Gurleya 230
Gymnodinium 146, 147, 153, 156, 275
Haemanthus 229
Halicona 289
Halobacterium 61, 95
Halococcus 95
Haplopappus 58
Herpetomonas 230
Heteromita 230
Heteroteuthis 149
Hollandina 249, 250
Homo 26
Hydra viridis 153, 164, 169, 171
Hydrometra 198
Incisitermes 261
Kakabekia 103, 110
Kalotermes 167, 258, 261, 263, 264
Kentrophorus 178
Klebsormidium 44, 278
Leishmania 218, 219
Lemna 61
Leptonema 261
Leptospira 248
Leptoteichus 110
Leucothrix 127
Lyngbia 127
Macrozamia 293
Marginitermes 258
Mastigella 228
Mastigina 228
Mastotermes 164, 253
Mesodinium 282
Metallogenium 110
Methanobacillus 159
УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ
349
Microciona 289
Micrococcus 172, 297
Microcoleus 140
Micromonas 198
Mixotricha 164-167, 253, 256
Monochrysis 61
Mycobacterium 297
Mycoplasma 55, 57
Naegleria 215
Neurospora 61, 181, 198
Nitella 198
Nitrocystis 57, 130
Nostoc 149
Ochromonas 229, 275
Oikomonas 275
Opisthacanthus 198
OsciUatoria 30, 98, 99, 127'
Oxytricha 214
Palaeomyces 41
Papulaspora 297
Paracoccus 25, 61, 172-174
Paramecium 150, 152
aurelia 150, 153, 214
bursaria 63, 156, 158, 160, 164, 167-171
Paramoeba 230
Paraurostyla 50
Peliaina 153
Pelomyxa 50, 164, 184, 223
Penicillium 227, 297
Peridinium 282
Phaseolus 29
Phormidium 118
Photobacterium 61, 118, 120, 149
Photoblepharon 118, 149
Physarum 181
Pillotina 249, 250, 252, 261, 263
Plachobranchus 282
Platymonas 156, 162, 163, 176, 289
Plectonema 61
Polymastix 230
Porphyra 61
Porphyridium 62, 272
Prochloron 21, 99-101, 127, 136, 164, 276
Proelectrotermes 250
Prorocentrum 225
Prowazkia 230
Pseudodevescovina 258
Pseudomonas *61
Pseudoplatanus 26
Pseudotrebouxia 149, 278
Pseudotrichonympha 52, 208
Pterotermes 256, 258, 261, 264
Pyrosoma 149
Pyrsonympha 235, 246, 250, 257
Radiophrys 286
Rana 29
Reticulitermes 250, 252, 257, 259, 261
Rhizobium 159
Rhodopseudomonas 61, 281
Rivularia 127
Saccharomyces 192-194
Saprospira 55, 127
Serratia 186
Skolithus 135
Spirochaeta 119, 248, 253
Spirogyra 172
Spirulina 55, 127
Stempellia 207
Stentor 30, 156, 255, 260
Sticholonche 210, 211
Streptomyces 124
Strongylocentrotus 264
Sulfolobus 95, 184
Symbiodinium 146, 147, 153, 156
Synechococcus 61
Synechocystis 25, 62
Tetrahymena 181, 198, 264, 266, 268
Tetramitus 215
Thermoplasma 25, 95, 180, 181, 184, 185
Thiocapsa 54
Thiospirillopsis 127
Thiothrix 127, 130
Trebouxia 149, 151, 153, 278
Treponema 248, 263, 264
Tricercomitus 255
Trichomonas 230
Trichonympha 165, 208, 218, 251
Trichoplax 44
Tridachia 156, 161, 282
Trypanoplasma 218
Trypanosoma 202
Ulva 136, 199
Vaucheria 230
Veillonella 85
Vicia 29, 198
Vitreoscilla 127
Wagnerella 229
Xenorhabdus 149
Zygnema 270
Zymo monas 88
ОГЛАВЛЕНИЕ
Предисловие редактора перевода 5
Предисловие 9
Благодарности 10
Введение 11
Глава 1. ТЕОРИЯ ЭНДОСИМБИОЗА 13
Несколько прокариот образуют одну эукариоту 14
Предшественники жизни 17
Ферментирующие организмы 18
Фотосинтез и воздух 21
Ассоциации и эукариоты 22
Глава 2. РАЗНООБРАЗИЕ 26
Классификация и эволюция 26
Прокариоты и эукариоты 33
Пять царств 39
Глава 3. ВЗГЛЯД НА ЭВОЛЮЦИЮ КЛЕТКИ 44
Прямая филиация 44
Ботанический миф 49
Дискредитированные теории клеточного симбиоза 62
Глава 4. ДО КЛЕТОК 65
Геологический контекст 65
Космическая кухня: органические соединения небиологичес-
кого происхождения 71
Метеориты 73
Создание жизни в лаборатории 76
Глава 5. ЭВОЛЮЦИЯ В БЕСКИСЛОРОДНУЮ ЭПОХУ 84
Критерии родства. 84
Эволюционные приобретения у анаэробов 90
Дофанерозойские ископаемые 102
Глава 6. АТМОСФЕРНЫЙ КИСЛОРОД-ПРОДУКТ ФОТОСИН-
ТЕЗА 113
Аэробиоз у микробов 113
Свидетельства органической геохимии 130
Протерозойские ископаемые 134
ОГЛАВЛЕНИЕ
351
Глава 7. СИМБИОЗЫ В ЭВОЛЮЦИИ 144
Взаимодействия в природе; симбиоз как парасексуальность 144
От симбионтов к органеллам 150
Примеры симбиозов 164
Генетический анализ симбиоза: терминология 174
Глава 8. АЭРОБИОЗ И МИТОХОНДРИИ 180
Митохондрии: кто приобрел их впервые? 180
Патоген становится органеллой: аналогия с митохондриями 187
Мут^йтные митохондрии 189
«Промискуитет» у митохондрий дрожжей 192
Усовершенствование и смешение: принцип объединения
разнородного 195
Цитоплазматическая наследственность: клетки внутри клеток 197
Митохондрии и нуклеоцитоплазма: навеки счастливый союз 201
Глава 9. УНДУЛИПОДИИ, МИТОЗ И МЕЙОЗ 204
Деление клеток протоктистов 204
Микротрубочки, кинетосомы и митоз 209
На пути к митозу 222
Глава 10. СПИРОХЕТЫ И УНДУЛИПОДИИ 246
Микротубулярные системы: симбиотическое происхождение? 246
Что такое спирохеты? 248
Поведение спирохет: переход от свободного существования
к симбиотическому 253
Локомоторные симбиозы 256
Микротрубочки у прокариот? 261
Происхождение РНК ундулиподий и центров-организаторов
микротрубочек (ЦМ) 266
Глава 11. ФОТОСИНТЕЗ В ПЛАСТИДАХ 270
Генетическая непрерывность пластид 270
Гены хлоропластов: многочисленные геномы растений 279
Переход от симбионтов к органеллам: редкое или обычное
явление? 282
Глава 12. РЕЗУЛЬТАТЫ ФАНЕРОЗОЯ 284
Кальций и скелеты 284
Растения, животные и хромосомы 292
Гея сегодня: протяженность биосферы 297
Приложение. ТИПЫ И КЛАССЫ В СИСТЕМЕ С ПЯТЬЮ ЦАРСТВА-
МИ ПО УИТТЭЙКЕРУ, С ИЗМЕНЕНИЯМИ 301
Литература 309
Предметный указатель 339
Указатель латинских названии 347
УВАЖАЕМЫЙ ЧИТАТЕЛЬ!
Ваши замечания о содержании книги, ее
оформлении, качестве перевода и другие просим
присылать по адресу:
129820, Москва, И-110, ГСП
1-й Рижский пер., д. 2,
издательство «Мир»
Линн Маргелис
РОЛЬ СИМБИОЗА В ЭВОЛЮЦИИ КЛЕТКИ
Ст. научный редактор Ю. Лашкевич.
Мл. научный редактор Р. Куликова.
Художник С. Голубев. Художественный редактор А. Лисицын.
Технический редактор И. Кренделева, Е. Я щук.
Корректор Н. В. Андреева.
ИБ № 349
Сдано в набор 11.01.83. Подписано к печати 30.06.83.
Формат 70 х 1001/16. Бумага офсетная № 1. Гарнитура тайме.
Печать офсетная. Объем 11 бум. л.
Усл. печ. л. 28,6. Усл. кр.-отт. 28,6. Уч.-изд. л. 33,54.
Изд. № 4/2379. Тираж 4300 экз. Зак. 39. Цена 5 руб.
ИЗДАТЕЛЬСТВО «МИР». Москва, И-110, ГСП, 1-й Рижский пер., 2.
Можайский полиграфкомбинат Союзполиграфпрома
при Государственном комитете СССР по делам издательств,
полиграфии и книжной торговли.
143200, г. Можайск, ул. Мира, 93.