Автор: Абрамова Л.И. Байбурдов Т.А. Григорян Э.П.
Теги: синтетические продукты полимеризации полимеризационные смолы синтетические каучуки химия
ISBN: 5-7245-0684-Х
Год: 1992
Текст
ПОЛИАКРИЛАМИД
МОСКВА
’’ХИМИЯ”
1992
Авторы:
Л.И.Абрамова, Т.А.Байбурдов, Э.П.Григорян,
Е.Н.Зилъберман, В.ф.Куренков, В.А.Мягченков
Под редакцией проф.В.Ф.Куренкова
УДК 678.745.842.088.8
Полиакриламвд/Л.И.Абрамова, Т.А.Байбурдов, Э.П.Григорян и др.;
Под ред. В.Ф.Куренкова - М.:Химия,1992-192с.- ISBN 5-7245-0684-Х
Рассмотрены наиболее перспективные пути синтеза акриламида и его производных, а
также полимеров на их основе с учетом технологических особенностей процессов, хими-
ческие, физико-химические и физические свойства (со)полимеров и области их примене-
ния. Проанализированы закономерности полимеризации и сополимеризации мономеров и
химических превращений полимеров.
Для научных и инженерно-технических работников, преподавателей, аспирантов и
студентов университетов и технических вузов, занимающихся изучением химии и техно-
логии высокомолекулярных соединений.
Табл. 20. Ил. 63. Библиогр. 759 назв.
^р. 50 X-
2804070100-450
П 050(01)—92 50-92
ISBN 5-7245-0684-Х
© Л.И.Абрамова, Т.А.Байбурдов,
Э.П.Григорян, Б.Н.Зильберман,
В.ф.Куренков, В.А.Мягченков, 1992
ОГЛАВЛЕНИЕ
Предисловие редактора.............................................. 5
Глава 1
АКРИЛАМИД И ЗАМЕЩЕННЫЕ АКРИЛАМИДЫ.................................. 3
1.1. Акриламид..................................................... 1
1.2. Замещенные акриламиды..........................................20
Библиографический список........................................... 29
Глава 2
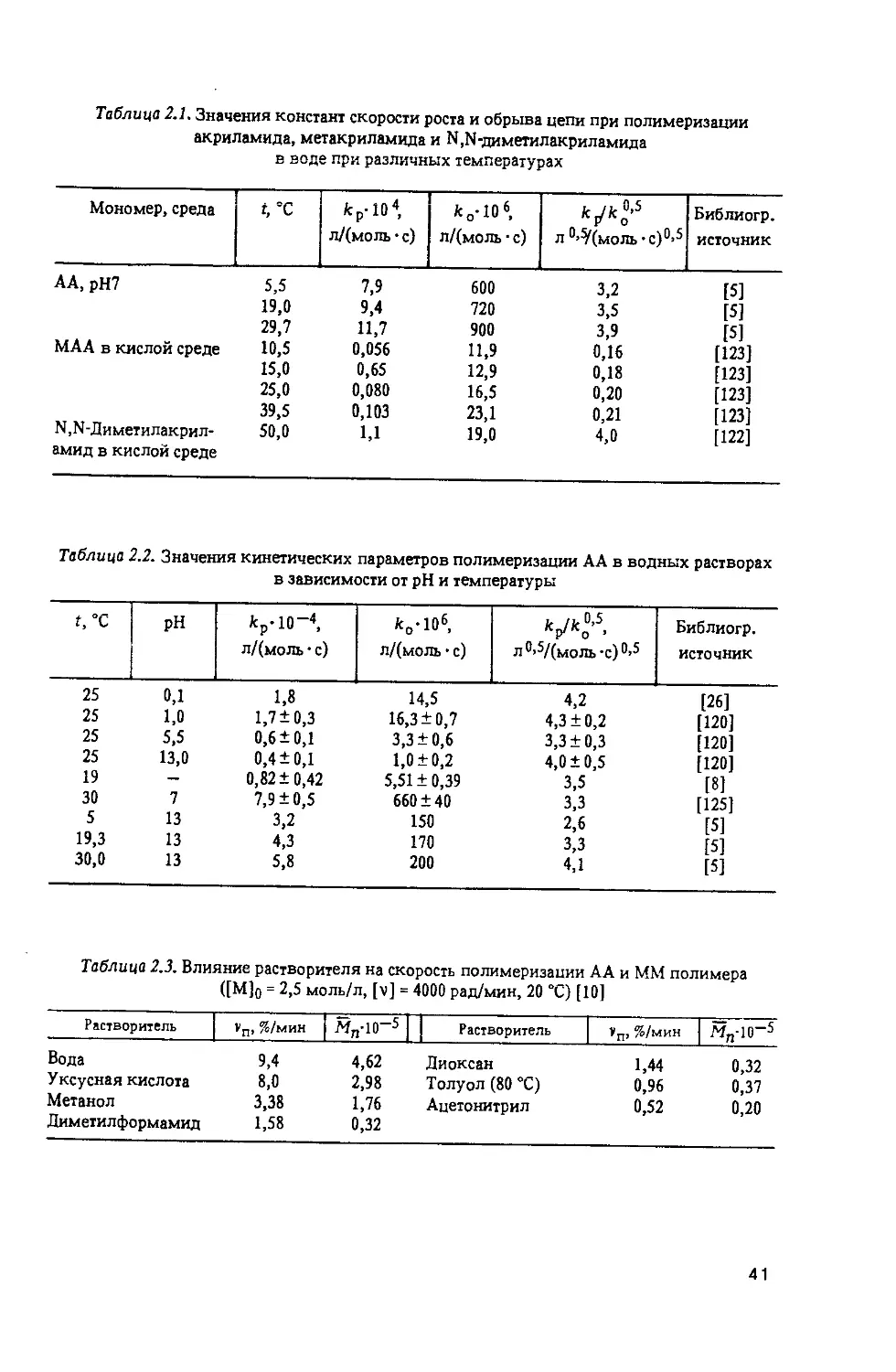
СИНТЕЗ ПОЛИМЕРОВ АКРИЛАМИДА И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ...............33
2.1. Гомогенная полимеризация......................................33
2.2. Гетерофазная полимеризация................................... 38
2.3. Сополимеризация...............................................83
2.4. Прививочная сополимеризация..................................104
Библиографический список..........................................107
Глава 3
ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ПОЛИАКРИЛАМИДА И ЕГО ПРОИЗВОДНЫХ .... 118
3.1. Полимераналогичные превращения...............................118
3.2. Деструкция и стабилизация....................................133
Библиографический список..........................................143
Глава 4
ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ПОЛИМЕРОВ АКРИЛАМИДА
И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ..........................................146
4.1. Молекулярные параметры и особенности фракционирования........146
4.2. Свойства разбавленных растворов полимеров....................133
4.3. Свойства концентрированных растворов полимеров и гелей...... 163
Библиографический список..........................................166
Глава 5
ПРИМЕНЕНИЕ ПОЛИМЕРОВ АКРИЛАМИДА И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ .. 168
Библиографический список...........................................186
Заключение.........................................................188
ОСНОВНЫЕ СОКРАЩЕНИЯ
АА — акриламид
АК — акриловая кислота
АКН — акрилат натрия
АН — акрилонитрил
ГЛБ — гидрофильно-липофиль- ный баланс
ГПАА — частично гидролизованный полиакриламид
ГХ ДМАЭМА — гидрохлорид диметил- аминоэтилметакрилата
ГХ ДЭАЭМА — гидрохлорид диэтил- аминоэтилмет акрилата
ДАК — динитрил азодиизомасля- ной кислоты
ДМСО — диметилсульфоксид
ДМФА — диметилформамид
ДМАЭМ — диметиламиноэтилметакри • лат
ДЭАЭМ — диэтиламиноэтилметакри- лат
ДС — дисперсная система
ИКРС — интегральная кривая рас- пределения по составу
КВАЯК — калиевая соль винилами- доянтарной кислоты
ККМ — критическая концентра- ция мицеллообразования
МАА — метакриламид
МАК — метакриловая кислота
МАН — метакрилонитрил
мм — молекулярная масса
ММА — метилметакрилат
ММР — молекулярно-массовое распределение
НС — неоднородность по составу
ПАА — полиакриламид
ПАВ — поверхностно-активное ве- щество
ПБ — пероксид бензоила
ПКВАЯК — полимер калиевой соли виниламидоянтарной кис- лоты
ПМАА — полиметакриламид
ПСА — персульфат аммония
ПСК — персульфат калия
САА — сульфат акриламида
СВ — сточные воды
сск — калиевая соль п -стирол- сульфокислоты
ССН — натриевая соль п-стирол- сульфокислоты
СТ — стирол
ТГФ — тетрагидофуран
ТКА — трис-(2-карбамоил- этил)амин
УФ — ультрафиолетовый
ЭПР — электронный парамагнит- ный резонанс
ЯМР — ядерный магнитный ре-
зонанс
ПРЕДИСЛОВИЕ РЕДАКТОРА
Под названием ’’полиакриламид” обычно объединяется группа
полимеров и сополимеров на основе акриламида и его производных.
Полиакриламид относится к числу доступных и сравнительно
недорогих водорастворимых полимеров с уникальным комплексом
прикладных свойств. Сегодня трудно найти какую-либо область
техники и технологии, где не применялись бы полиакриламидные
реагенты. В частности, они являются высокоэффективными флоку-
лянтами при извлечении и обогащении полезных ископаемых, при
очистке питьевой и промышленных сточных вод. Они нашли широкое
применение в качестве загустителей буровых растворов, дегидратан-
тов, агентов, снижающих гидравлическое сопротивление жидкостей в
нефте- и газодобывающей промышленности, в качестве структурообра-
зователей почв в сельском хозяйстве и дорожном строительстве. Как
пленкообразователи, они используются в производстве минеральных
удобрений и лекарственных аппаратов пролонгированного действия,
при создании фоторезисторных композиций и микросхем в радио-
электронной промышленности. Приведенные примеры являются
далеко не полным перечнем областей применения полиакриламида.
Промышленное производство полиакриламида началось в начале
50-х годов и в течение последних 30 лет интенсивно развивалось на
качественном и количественном уровнях. Мировое производство
полиакриламидных реагентов в настоящее время продолжает неук-
лонно возрастать, однако темпы роста далеко не достаточны для
удовлетворения растущих потребностей в нем (ежегодная потребность
в полиакриламидных реагентах возрастает более чем на 6%). Поли-
акриламидные реагенты выпускаются в виде растворов, дисперсий,
гранул или порошка с широким диапазоном свойств - в зависимости
от назначения могут получаться растворимыми, ограниченно набухаю-
щими каучукоподобными гелями и нерастворимыми. В настоящее вре-
мя мировое производство полиакриламидных реагентов превышает
200 тыс. т/год.
В отечественной литературе вопросам синтеза, применения и свой-
ствам полиакриламида посвящена известная книга М.Н.Савицкой и
Ю.Д.Холодовой (Полиакриламид. Киев: Техника, 1969). Однако приве-
денные в этой книге сведения характеризуют уровень знаний, который
в настоящее время значительно превзойден.
В последние годы достигнуты существенные успехи в области
5
синтеза исходных мономеров и полимеров: разработан принципиально
новый способ, основанный на гидратации акрилонитрила в присутст-
вии медьсодержащих катализаторов и обладающий значительными
преимуществами перед устаревшим сернокислотным способом; воз-
росло значение метакриламида и N-замещенных (мет)акриламида;
разработаны прогрессивные методы полимеризации в обратных эмуль-
сиях и суспензиях, а также в концентрированных растворах акрил-
амида; получили развитие методы химической модификации полиме-
ров. Кроме того, появилась новая обширная информация на количест-
венном уровне о закономерностях известных и новых методов по-
лимеризации, получены сополимеры, обладающие рядом ценных
свойств, выявлены новые аспекты процессов сополимеризации, разви-
лись и углубились научные представления о химических, физико-хи-
мических и физических свойствах полимеров и расширились области
их применения. В связи с вышеизложенным представляется целесооб-
разным выпуск настоящей монографии, отражающей современное
состояние вопросов синтеза мономеров и (со)полимеров акриламида и
его производных, их свойства и применение.
При написании монографии большим авторским коллективом, не
представляющим одну научную школу, уже в силу внутренней специ-
фики научного творчества возникает неизбежный субъективизм в
преподнесении материала. В определенной мере эти субъективные
тенденции в изложении материала нашли свое отражение и при напи-
сании данной монографии, хотя авторы по целому ряду наиболее
сложных вопросов искали и находили компромиссные решения. Ввиду
ограниченного объема книги авторы не всем вопросам уделили оди-
наковое внимание и не смогли отразить все многообразие литературы,
выпущенной за последние годы.
Монография написана коллективом сотрудников Казанского
химико-технологического института им. С.М.Кирова (В.ф.Куренков и
В.А.Мягченков), Дзержинского филиала Горьковского политехничес-
кого института (Л.И.Абрамова и Е.Н.Зильберман) и Саратовского фи-
лиала НИИ химии и технологии полимеров им. В.А.Каргина (Т.А.Бай-
бурдов и Э.П.Григорян) и отражает результаты многолетних исследо-
ваний, выполненных под руководством авторов в этих организациях.
Раздел 1.1. написан Е.Н.Зильберманом и Э.П.Григорян, разделы 1.2,
1.3 и 2.3 - Е.Н.Зильберманом, раздел 2.1 - Л.И.Абрамовой, раздел 2.2 и
глава 3 - В.Ф.Куренковым и Т.А.Байбурдовым, главы 4 и 5 - В.А’.Мяг-
ченковым.
Считаю своим долгом от имени авторов поблагодарить рецензента
проф. д-ра физ.-мат. наук С.Я.Френкеля за ценные рекомендации,
сделанные при просмотре рукописи, а также проф. д-ра хим. наук
Э.Н.Телешова за полезные пожелания.
Авторский коллектив будет глубоко признателен тем читателям,
которые выскажут конструктивные замечания по существу рассмот-
ренных в монографии вопросов.
В. Куренков
Глава 1
АКРИЛАМИД И ЗАМЕЩЕННЫЕ АКРИЛАМИДЫ
Среди амидсодержащих акриловых мономеров наибольшее значе-
ние имеет незамещенный акриламид. Важным промышленным моно-
мером является и метакриламид, одновременно растет внимание к
различным N-замещенным (мет)акриламидам. В настоящее время в
промышленном масштабе выпускаются такие N-замещенные амиды,
как N, N-диметилакриламид, 2-акриламидо-2-метилпропансульфокис-
лота, М-(1,1-диметил-3-оксобутил)акриламид(диацетонакриламид),
N-гидроксиметилакриламид, N-изобутоксиметилакриламид, N, N'-ме-
тилен-бис-акриламид [1], №(диметиламинометил)акриламид, 1Ч-(ди-
метиламинопропил)метакриламид [2] и др.
1.1. Акриламид
Наиболее современный способ получения АА основан на гетероген-
но-каталитический жидкофазной гидратации акрилонитрила. Не
утратили еще своего значения и более старые и менее эффективные
способы сернокислотной гидратации АН. Данный раздел книги посвя-
щен в основном промышленным методам получения АА.
1.1.1 Физические свойства
Кристаллический А А имеет т.пл. 84,5±0,3 ’С, его плотность при 30 ’С
1,122 г/мл. Упругость паров АА составляет [3,4]:
Температура, °C 25 40 50 87 103 115 125 135
Упругость, Па 0,9 4,4 9,3 270 670 1060 2100 3050
Растворимость АА при 30 °C (в г/100 мл растворителя) составляет:
215,5 в воде, 155 в метаноле, 124 в диметилсульфоксиде, 119 в диме-
тилформамиде, 86,2 в этаноле, 63,1 в ацетоне, 61,9 в пиридине, 39,6 в
ацетонитриле, 30 в диоксане, 12,6 в этилацетате, 2,66 в хлороформе,
0,346 в бензоле, 0,038 в тетрахлориде углерода, 0,0068 в н-гептане [3,5].
В 100 г АН при 20 °C растворяется 11,3 г А А [6]. Растворимость АА в
большинстве растворителей с повышением температуры резко увели-
чивается. Температурная зависимость растворимости АА описывается
уравнением [7]
lgC = A + B/T + ET + DlgT,
где С — концентрация АА, % (мае.), Т — температура, К.
7
Таблица 1.1. Значения коэффициентов уравнения (1) зависимости растворимости
акриламида от температуры в различных растворителях
Раство- ритель А В Е Д Коэффи- циент корре- ляции Темпера- турный интервал, •с
Нитрометан -8,938 4305,063 0,0857 -12,107 0,9971 0-40
Этилацетат 8,167 -1247,98 0,009 -2,269 0,9972 0-75
Трихлорэтилен -24,066 2529,61 0,0509 0 0,9986 10-85
Бензор -34,904 4991,47 0,079 -2,367 0,9974 20-80
Толуол -26,991 3117,36 0,053 0 0,9974 20-85
Хлорбензол -21,229 2493,06 0,055 -1,671 0,9974 10-85
Тетрахлорид -18,098 1858,9 0,038 0 0,9969 10-75
углерода
н-Бутанол -0,941 -186,43 0,0098 0 0,9985 0-70
Вода -0,964 -941,22 -0,01044 3,656 0,9976 0-85
Хлороформ -102,089 10263,29 0,121 12,926 0,9987 0-60
Дихлорэтан -45,418 7183,93 0,114 -5,071 0,9945 0-70
Коэффициенты А, В, Е, D уравнения для различных растворителей
приведены в табл. 1.1.
При изучении взаимной растворимости в системах АА-вода-ди-
хлорэтан и АА - вода - хлороформ найдено (8], что растворимость АА
в водной фазе значительно превышает его растворимость в равновес-
ной органической фазе, причем с повышением общей концентрации АА
растет его способность гомогенизировать воду и органический раство-
ритель, а также уменьшается отношение растворимостей АА в указан-
ных фазах. Аналогичное влияние на отношение растворимостей ока-
зывает повышение температуры. АА гомогенизирует также смеси
акрилонитрила и воды. При 100 °C полная взаимная растворимость
нитрила и воды, независимо от их соотношения, достигается при
содержании в смеси 9,9% АА.
Диаграмма плавкости системы АА - вода характеризуется наличи-
ем эвтектической точки при - 8,9 °C при содержании АА - 33% (мае.)
[6]. Растворение АА в воде - эндотермический процесс. При растворе-
нии 1 и 6 молей АА в 10 молях воды интегральная теплота растворения
составляет 11,1 и 9,1 кДж/моль соответственно [9]. В работе [4] приве-
дены данные по равновесию между жидкостью и паром в системе АА -
вода. Эта система характеризуется положительным отклонением от
закона Рауля.
8
1.1.2. Получение акриламида гетерогенно-каталитической
гидратаиией акрилонитрила
Гидратация некоторых нитрилов успешно осуществляется в присут-
ствии оксидных катализаторов, в первую очередь - диоксида марган-
ца. Однако АН и другие ненасыщенные нитрилы превращаются в
амиды на MnJ2 с недостаточными для практических целей выходами
главным образом из-за параллельно протекающего окисления [10].
Из известных металлсодержащих катализаторов наиболее актив-
ными при гидратации алифатических нитрилов являются катализато-
ры на основе нульвалентной меди [10]. В 1968 г. был заявлен первый
патент [11] по гидратации АН и других нитрилов в присутствии ката-
лизаторов, в состав которых наряду с солями меди, которые авторы
ошибочно считали главными носителями каталитических свойств,
входила нульвалентная медь. С тех пор описаны [5, 10] многочислен-
ные варианты медных катализаторов гидратации нитрилов (медь на
оксидных, а также на органических полимерных носителях, медь
Ренея, порошкообразная медь с развитой поверхностью, коллоидная
медь [12] в виде стабильной дисперсии в воде в присутствии поливи-
нилпирролидона в качестве стабилизатора дисперсии и др.).
Наибольшее распространение находят катализаторы на носителях.
Последние способствуют сохранению длительной каталитической
активности. Действие носителей основано, в частности, на том, что они
разделяют дисперсии кристаллической меди. Носители также влияют
на формирование структуры катализатора, его механические и другие
свойства. В качестве носителей используются оксиды алюминия, хро-
ма, цинка и других металлов, смеси оксидов, а также природные мате-
риалы, такие как кизельгур. Катализаторы можно получать путем
восстановления смесей тонкодисперсных оксида меди и других
оксидов. Наиболее часто применяемый восстановитель - водород.
Процесс проводят при 170-230°С, причем активность катализатора
увеличивается при снижении содержания водорода в его смеси с
азотом или другим инертным газом [13]. При температуре восстанов-
ления 210 °C оптимальное содержание водорода в азотно-водородной
смеси 3% (мол.). Скорость гидратации растет с увеличением степени
восстановления СиО, но наличие небольших количеств СиО и СиО в
медном катализаторе не оказывает заметного влияния на его актив-
ность [14,15].
При исследовании процесса восстановления СиО, полученного
осаждением гидроксида меди (из раствора нитрата меди под дейст-
вием NaOH) на кизельгуре, найдено, что предварительная термичес-
кая обработка в атмосфере азота увеличивает активность катализато-
ра, несмотря на некоторое снижение его удельной поверхности [16].
Получение активных медьсодержащих катализаторов достигается
путем восстановления солей меди (сульфатов, хлоридов, ацетатов и
др.) гидридами металлов, боргидридами щелочных металлов, метал-
лами, гидразином, формальдегидом и другими восстановителями [5].
9
Активность и стабильность действия этих катализаторов также увели-
чивается в присутствии носителей - оксидов хрома, молибдена и др.
[17,18].
Медные катализаторы получают обработкой щелочью сплавов меди
и алюминия, обычно в соотношении 1:1 (мае.). При этом наиболее
эффективные медьсодержащие катализаторы получаются на слабовы-
щелоченных образцах (на глубину*», 0,85 мм в частицах размером 2,0 -
2,3 мм). При увеличении степени выщелачивания удельная скорость
гидратации, отнесенная к единице поверхности катализатора, умень-
шается. С другой стороны, скорость дезактивации катализатора снижа-
ется при использовании образцов, полученных при высокой степени
выщелачивания и имеющих поры большого диаметра [19].
Площадь поверхности медьсодержащих катализаторов гидратации
АН составляет 10 - 120 м2/г. У катализаторов на носителях она боль-
ше, чем у выщелоченных сплавов. Прямой зависимости активности
катализаторов от площади поверхности нет, поскольку активность
определяется также дисперсностью кристаллитов меди, количеством и
характером пор в катализаторе и, конечно, химическими свойствами
компонентов катализатора.
Высокую селективность гидратации при низкой активности обеспе-
чивают серебряные катализаторы. На катализаторах на основе железа,
кобальта и никеля вода присоединяется как к CN-группе, так и к
С=С-связи [10, 20]. Вместе с тем, использование ренеевских медно-ни-
келевых сплавов (20 - 70% Си) в качестве катализаторов позволяет
увеличить скорость гидратации по сравнению со скоростью гидратации
на меди, при сохранении высокой селективности, свойственной про-
цессам на меди [20].
На активность медьсодержащих катализаторов и продолжитель-
ность их жизни большое влияние оказывают добавки различных солей
[17, 21]. Катионы по их влиянию на процесс можно разделить на две
основные группы. Катионы первой группы содержат на внешней
орбите один $- или р-электрон и полностью заполненные остальные
энергетические уровни. При увеличении концентрации этих ионов (Li,
Na, К, Си, Al, In) активность катализатора сначала увеличивается,
потом понижается и снова возрастает. Катионы второй группы имеют
во внешнем слое один s-электрон, но в них остаются частично неза-
полненные орбитали. При увеличении концентрации катионов этой
группы (Сг, Со) скорость гидратации сначала увеличивается, затем
резко понижается [22]. Влияние соли на скорость гидратации АН
зависит также от природы анионов [21 - 23]. Добавка фосфорной
кислоты приводит к полному прекращению реакции, добавка серной
кислоты ускоряет образование АА [22].
При длительном использовании в непрерывных процессах медьсо-
держащие катализаторы гидратации постепенно дезактивируются, что
объясняется окислением меди следами кислорода воздуха, растворен-
ного в реакционной смеси, и блокированием поверхности катализато-
ра оксидом меди (II). Регенерация окисленных катализаторов заклю-
10
чается в их восстановлении, в первую очередь, водородом, как описа-
но выше. Может оказаться полезным доокисление частично отработан-
ного катализатора кислородом воздуха перед его восстановлением.
Было показано [24], что каталитическая активность окисленной меди
почти полностью восстанавливается при обработке ее иодидом калия.
Эффективность регенерации катализаторов, потерявших свою
активность, в большей степени зависит от природы носителя. Так,
катализатор, полученный термолизом (в присутствии водорода)
формиата меди, нанесенного на сшитый сополимер 4-винилпиридина и
1,4-дивинилбензола, содержит мелкодисперсную медь и обладает
высокой начальной активностью при гидратации [25]. Однако после
дезактивации катализатора не удается полностью восстановить его
активность путем пропускания водорода, в то время как полученные
в тех же условиях менее диспергированные медные катализаторы на
оксидах металлов легко регенерируются. Предполагается [25], что
мелкодисперсная медь на полимерном носителе при контакте с кисло-
родом воздуха частично агрегирует. Возможно также, что в условиях
высокотемпературного восстановления носитель подвергается хими-
ческим превращениям, а это обусловливает изменение его влияния на
активность меди.
Выходы АА при гидратации на медьсодержащих катализаторах
высоки. Так, на Си - Сг20з при температуре не выше 120 °C до 90%
акрилонитрила превращается в АА при многократном использовании
катализатора [6]. Выходы такого же порядка достигаются при гидрата-
ции на катализаторах Си - MgO, Си - ZnO - AI2O3, меди Ренея и др.
[6,25 - 27]. При длительной гидратации на катализаторе Си - SiO2 -
MgO выход АА составляет 85% [25].
В условиях синтеза АА наряду с гидратацией нитрильной группы
происходит присоединение воды по С=С-связи с образованием 3-гидро-
ксипропионитрила, который далее частично реагирует со второй
молекулой АН или подвергается гидратации. При этом получаются
2,2' - дициандиэтиловый эфир и 3-гидроксипропионамид [28]:
Н2О СН2=СНС=N
CH2=CHCs N —*НОСН2СНС= N------------* О(СН2СН2С= N)2
Си Н2О
hoch2ch2conh2
При гидратации на катализаторе Си - ZnO - AI2O3 эти реакции
изучены количественно [28]. Найдено, что благодаря их протека-
нию в интервале температур 80 - 120 °C селективность гидратации в
А А составляет 97 - 93%. При 100 °C в непрерывном процессе вследст-
вие вымывания из катализатора следов щелочи, катализирующих
присоединение воды по С=С-связи, селективность увеличивается до
99,5% (при конверсии АН 90%). Гидратация по двойным связям в
некоторой степени ускоряется также оксидом меди (II), содержащемся
11
в медном катализаторе [29]. Однако возможность побочной реакции
образовании 3-гидроксипропионитрила зависит не только от примесей
в катализаторе, но также от строения его основных компонентов. Если
при гидратации в присутствии коллоидной меди АА является прак-
тически единственным продуктом реакции [12], то при использовании
катализаторов на некоторых носителях 3-гидроксипропионитрила
образуется в заметных количествах; при этом чем более основным
является носитель, тем меньше селективность гидратации АА. Напри-
мер, присоединение воды по С=С-связи особенно интенсивно идет на
катализаторе Си-Mg О [25, 30]. Замена основного Mg О носителем
Si Ог - MgO, проявляющим кислотные свойства, позволила в значи-
тельной степени подавить образование 3-гидроксипропионитрила: в
сравнимых условиях приготовления и испытания катализаторов
селективность образования АА повысилась с 75 до 97% [25]. При ис-
пользовании смешанного носителя MgO - Мех Оу селективность
повышается в ряду (для МехОу): AI2O3, ZnO, TiO2, SiO2, WO3, МоОз
[31].
При гидратации АН в малых количествах образуются и другие
побочные продукты. Так, в реакционной смеси находят следы продук-
тов гидролиза АА - акриловой кислоты и аммиака [28, 32]. Лишь при
температуре гидратации выше 120 °C эти вещества образуются в более
или менее заметных количествах [6]. В АА обнаружены [33] микропри-
меси ряда ненасыщенных амидов - гептатриенамида, пентадиенамида
и 5-циан-2-пентенамида, которые могут быть продуктами каталитичес-
кой гидратации соответствующих нитрилов, являющихся примесями в
исходном АН. В условиях гидратации на меди Ренея, содержащей
адсорбированный водород, возможно побочное гидрирование АН, что
приводит к появлению в акриламиде примесей н-пропиламина [5]. При
изучении гидратации на Си - SiC>2 найдено [34], что в условиях реак-
ции образуются также полимерные вещества, ответственные за неко-
торую первоначальную дезактивацию катализатора.
Кинетика начального периода гидратации АН в избытке воды
описывается уравнением первого порядка по нитрилу [6, 15]. В избыт-
ке АН порядок реакции по воде также первый [15]. По данным разных
авторов, энергия активации гидратации колеблется в пределах 50,6 -
86,7 кДж/моль [6, 12, 15]. При гидратации АН, как и других нитрилов, в
избытке воды до глубоких степеней превращения кинетика реакции
не подчиняется уравнению, выведенному для начального периода
гидратации, что объясняется торможением реакции образующимися
амидами вследствие значительной и предпочтительной адсорбции АА
на поверхности катализатора [12, 15, 25, 26, 30, 35]. Согласно [12],
коэффициенты адсорбции АН и АА на меди относятся как 1:13. АА не
является единственным продуктом реакции, тормозящим гидратацию
АН. Образующаяся при гидролизе АА акриловая кислота уже в коли-
честве 0,7% (мол.) от исходного нитрила в сравнимых условиях вызы-
вает уменьшение скорости гидратации более чем в два раза. Под
действием АА такой же эффект достигается при его содержании,
12
равном ~ 15%. Другой побочный продукт - 3-гидроксипропионитрил -
не оказывает влияния на скорость гидратации АН [15].
Следует отметить, что при гидратации на медно-никелевых сплавах
константа скорости реакции не уменьшается по мере повышения
конверсии АН ввиду того, что никель способствует десорбции АА от
поверхности катализатора [12].
Из данных о каталитической гидратации различных нитрилов
следует схема реакции, согласно которой процесс включает стадии
взаимодействия активных центров на поверхности медьсодержащего
катализатора с CN-группой нитрила и последующего присоединения
воды, причем вторая стадия является лимитирующей [10]. Из исследо-
вания влияния различных добавок на гидратацию следует, что в
образовании активных центров принимают участие катионы добавлен-
ных солей, адсорбированные на поверхности медьсодержащих катали-
заторов; при отсутствии же добавок активные центры состоят из
атомов нульвалентной меди и адсорбированных на поверхности
катализатора ионов меди [23].
При осуществлении гетерогенно-каталитического процесса в про-
мышленности применяют АН, по возможности очищенный от содержа-
щихся в нем примесей, в том числе от ацетонитрила, цис-кротононит-
рила, акролеина, ацетона, оксазола. Из АН, как и из обессоленной
воды, перед гидратацией удаляется кислород.
Соотношение нитрила и воды при гидратации в большой мере
зависит от их взаимной растворимости (7,3 и 16,1% нитрила в воде, 3,1
и 16,7% воды в нитриле, соответственно при 20 и 100 °C [6]). Из двух
возможных вариантов исходных смесей (раствор нитрила в воде или
раствор воды в нитриле) практическое значение имеет только первый.
При этом для получения высококонцентрированных водных раство-
ров АА используется способность АА гомогенизировать АН и воду, для
чего можно вводить АД в исходную рабочую смесь или добавлять
свежий АН по мере протекания гидратации. Ввиду того, что АА замед-
ляет гидратацию, второй способ предпочтителен.
В первом случае гидратацию проводят при 75 - 115 °C под давле-
нием, достигающим 0,7 МПа в трубках вертикального реактора с
неподвижным слоем катализатора или в реакторе с суспендированным
катализатором. В первом случае в трубки (длина 2 - 6 м, диаметр
50 мм) обычно загружают таблетки оксидных катализаторов типа
СиО - МехОу, причем восстановление СиО проводится непосредствен-
но в реакторе. Режим внутри трубок близок к режиму идеального
смешения [36]. Тепло гидратации (тепловой эффект - 70 кДж/моль)
снимается циркулирующей нагретой водой. Процесс осуществляется
успешно в трех последовательных реакторах, в каждый из которых
подается свежий АН. Температура в реакторах 80, 90 и 100 °C, конвер-
сия - 27, 53 и 81%, объемная скорость потока 2-10 ч-1, содержание
АА в реакционной смеси 38 - 41% [37].
Количественные зависимости степени гидратации в непрерывном
процессе с неподвижным слоем катализатора от температуры, линей-
13
ной скорости потока в реакторе и начальной концентрации АН приве-
дены в работах [6, 30, 38]. По мере дезактивации катализатора несколь-
ко повышают температуру гидратации. После того как повышением
температуры не удается увеличить конверсию АН, катализатор под-
вергается регенерации. Продолжительность одного цикла до регенера-
ции зависит главным образом от того, насколько катализатор был
предохранен от действия кислорода.
Во втором случае гидратация проводится на мелкодисперсных
скелетных катализаторах, которые хранят под водой и подают в
реактор в виде суспензии в воде. Наиболее простым является синтез в
периодическом реакторе с мешалкой. При этом АН добавляется к
суспензии меди Ренея в воде со скоростью, обеспечивающей регулиро-
вание температуры в реакторе. В данном процессе конверсия нитрила
находится в пределах 65 - 80%, содержание АА в конечном растворе -
до 45%, кратность использования катализатора (до регенерации) - 15
[39]. Имеются также данные о непрерывном синтезе в двух или трех
последовательных реакторах с циркуляцией катализатора в каждом
из них при противоточном движении реакционной смеси и катализато-
ра [40]. Очевидно, что аппаратурное оформление процессов с суспенди-
рованным катализатором более сложно, чем процессов с неподвижным
слоем катализатора. Закономерности гидратации на скелетной меди в
проточно-циркуляционной системе, в том числе эмпирическое уравне-
ние кинетики процесса, описаны в работе [41].
На стадии каталитической гидратации образуются 20 - 40%-е раство-
ры АА, содержащие также непрореагировавший АН. Для полимериза-
ции же требуются растворы с концентрацией АА до 50%, освобожден-
ные от АН (остаточное содержание АН - не более 0,1%). Поэтому
растворы, получаемые на стадии гидратации, в дальнейшем концент-
рируются под вакуумом. При этом отгоняют АН и часть воды, которые
возвращают на гидратацию. Концентрирование до 30%-го содержания
АА проводят при остаточном давлении не более 40 кПа, дальнейшее
упаривание - при остаточном давлении 6,7 - 10,7 кПа. Концентриро-
вание осуществляют в аппаратах различной конструкции, например в
емкостных сепараторах с выносными теплообменниками [42], ротор-
но-пленочных испарителях [43].
Концентрированные растворы АА до использования их в процессе
полимеризации очищаются от следов ионов меди (из продуктов прев-
ращения катализаторов гидратации) и железа (аппаратура). Для этого
растворы АА пропускают через колонки, наполненные катионитом. В
связи с тем, что часть ионов меди связана в комплексы с АА, АН и
примесями, обработка только катионитом недостаточна для достиже-
ния глубокой очистки, и ее сочетают с обработкой анионитом [44].
Комбинированные способы ионообменной очистки позволяют довести
содержание меди до Г10-4 % и менее. В последние годы появились
описания способов глубокой и очень эффективной очистки АА, осно-
ванных на использовании мембранной технологии [45, 46].
Сравнительно небольшая часть АА выпускается в виде кристал-
14
Рис. 1.1. Блок-схема гетерогенно-каталитической гидратации акрилонитрила
лического продукта. Его получают кристаллизацией из водных раство-
ров. Ввиду вышеупомянутого высокого содержания АА в эвтектичес-
кой точке системы АА - вода, его выделение кристаллизацией целесо-
образно проводить лишь из растворов, содержание АА в которых
значительно больше 33%. Кристаллизацию ведут при НН-5 'С и
интенсивном перемешивании. Используя центрифуги фильтрующего
типа (из-за малой разницы плотностей воды и кристаллов АА), полу-
чают продукт с влажностью 2 - 3%. Сушку проводят в кипящем слое
или в трубе-сушилке. Маточные растворы процесса кристаллизации
используют для приготовления рабочей смеси, а также упаривают до
концентрации около 50%, смешивают с очищенной от акрилонитрила и
сконцентрированной реакционной массой и подают в кристаллизатор
[6]. Кристаллический АА можно хранить длительное время без ингиби-
тора.
На рис. 1.1 приведен один из вариантов схемы процесса гетероген-
но-каталитической гидратации акрилонитрила.
Получение АА гидратацией АН на медьсодержащих катализаторах
имеет ряд существенных преимуществ .по сравнению с альтернатив-
ным более старым промышленным синтезом АА сернокислотной
гидратацией АН. К ним относятся относительная простота аппаратур-
ного оформления, замкнутость схемы (возврат в цикл дистиллятов,
15
промывных вод и маточников), легкость автоматизации процесса,
сравнительно невысокие капитальные и эксплуатационные затраты.
Общий выход АА по нитрилу составляет 98% и более, расход катализа-
тора 0,5 - 3 кг на 1 т АА. В процессе не образуются в больших коли-
чествах такие малоценные побочные продукты, как соли серной
кислоты. Ввиду отсутствия газовых выбросов (при получении АА в
виде водных растворов), жидких отходов и сточных вод, процесс в
экологическом плане весьма совершенен.
1.1.3. Получение акриламида сернокислотной гидратацией
акрилонитрила
Получение акриламида сернокислотной гидратацией АН основано
на протонировании нитрила с образованием нитрилиевой соли, кото-
рая с водой дает сульфат акриламида (САА) [47]:
CH2=CHC=N + H2SO4^CH2=CHCsN...H2SO43*
^nh2
"он.
u. Н2°
^[CH2=CHCsNH]+HSO4"—► сн2=снс
HSO4
Скорость превращения АН в АА пропорциональна концентрациям
всех трех компонентов исходной смеси, эффективная энергия актива-
ции процесса в интервале температур 60 - 73 °C составляет
149 кДж/моль [48]. Тепловой эффект при гидратации сернокислотным
способом, включающий также теплоту смешения реагентов, составля-
ет около 130 кДж/моль [5].
Практические условия синтеза САА определяются зависимостью
выхода целевого продукта от соотношения между реагентами, темпе-
ратуры и продолжительности реакции [5,49 - 52]. АН, серная кислота и
вода обычно берутся в мольном соотношении 1:1:1. Для синтеза
используют 84,5%-ю серную кислоту, к которой при перемешивании
малыми порциями добавляют нитрил. Гидратация проводится в
присутствии солей меди или других ингибиторов свободно-радикаль-
ной полимеризации.
При сернокислотной гидратации АН в качестве побочного продукта
реакции может образоваться 3 -аланин [53]. По-видимому, присутствие
серной кислоты благоприятствует межмолекулярному N-алкилирова-
нию АН с получением гетероцепного полиамида, гидролизующегося в
3-аланин. Выход последнего повышается с увеличением концентрации
серной кислоты от 92 до 98%, а также при увеличении избытка серной
кислоты. При использовании для гидратации серной кислоты концент-
рации более 92% взаимодействие с АН протекает с большой скоростью,
которую иногда становится невозможно контролировать, и приводит к
образованию сульфированных соединений. Концентрация серной
кислоты ниже 80% уже ведет к гидролизу АА в АК. Оптимальная
температура гидратации - 90 - 100 °C. В этом интервале температур
продолжительность реакции не превышает 1 ч. Понижение температу
16
ры гидратации до 60 °C приводит к удлинению периода, в течение
которого происходит присоединение воды, до ~ 2,5 ч. Повышение
температуры гидратации (более 100 °C) и увеличение длительности
процесса (более 1 ч) способствуют понижению выхода САА ввиду
протекания вторичных превращений АА - его автоконденсации в
диакриламид (СН2=СНСО)2 NH, который частично распадается с
образованием АК. Согласно [48], выход кислоты достигает 4%. Гидра-
тацию проводят в освинцованных, эмалированных и других реакто-
рах, внутренняя поверхность которых устойчива к действию кислот.
Для выделения свободного АА из его сернокислой соли [54] серную
кислоту связывают путем обработки реакционной смеси аммиаком,
гидроксидами или карбонатами щелочных или щелочноземельных
металлов. Наиболее часто нейтрализацию проводят аммиаком или
водным раствором аммиака (’’аммиачный способ”):
^NH2
СН2=СНС^0р|
+
HSO4+2NH3-
-*CH2=CHCONH2 + (NH4)2SO4
При достаточном разбавлении реакционной смеси водой можно
после нейтрализации получить водный раствор АА и сульфата ам-
мония. АА в этом растворе (без выделения) подвергают полимериза-
ции. В промышленности практикуется также выделение кристалличес-
кого АА из того же раствора. Выделение основано на том, что с повы-
шением концентрации АА в воде растворимость в ней сульфата ам-
"д^мония, как и сульфатов щелочных металлов, ухудшается (в насыщен-
^"ном растворе АА при 50 °C она составляет менее 1 %). САА в присутст-
Sj>bhh ограниченного количества воды, достаточного для получения
^высококонцентрированного (близкого к насыщенному) водного
"^раствора АА, нейтрализуют аммиаком при 45 - 50 °C до pH реакцион-
ной смеси 5,5, при той же температуре отфильтровывают выпавший
сульфат аммония, полученный раствор при слабом перемешивании
охлаждают до 10 - 12 °C, выкристаллизовывающийся при этом АА
отделяют от маточного раствора и подвергают сушке. Маточный
раствор и растворы, использованные для промывки сульфата аммония,
возвращают на стадию нейтрализации (рис. 1.2). По данной схеме АА,
содержащий не более 0,4% сульфата аммония, получают с выходом 85%
от теоретического (в расчете на АН). При этом содержание АА в сухом
промытом сульфате аммония составляет менее 0,35% от всего получен-
ного АА [55].
Среди других способов получения кристаллического АА из САА
следует отметить способ, состоящий из стадий обработки САА ледяной
водой, а затем известковым молоком (’’известковый способ”), фильт-
рования сульфата кальция (’’захватывающего” с собой заметное
количество АА), концентрирования водного раствора АА упариванием
при пониженном давлении, кристаллизации и сушки АА. Предложено
проводить нейтрализацию САА в присутствии-органических расувори-
84,5%-ная
Готовый продукт
Рис. 1.2. Блок-схема получения акриламида сернокислотной гидратацией акрилонитрила
телей, в которых АА растворим, например спиртов, кетонов, аромати-
ческих углеводородов и др. При этом после нейтрализации отфильтро-
вывают сульфат аммония, отгоняют растворитель и получают АА.
Серную кислоту, входящую в состав САА, можно нейтрализовать
карбонатом натрия в присутствии воды в количестве, недостаточном
для образования декагидрата NajSO^ из смеси кристаллических АА и
соли первый выделяют экстракцией метанолом [3, 5, 49,50, 56].
При необходимости сульфатный АА освобождают от примесей
перекристаллизацией из бензола и других растворителей. Очистку
мономера можно проводить также пропусканием его водного раствора
через ионообменные смолы.
Основной недостаток сернокислотного способа гидратации АН в
АА - образование больших количеств неутилизируемых или трудно-
утилизируемых малоценных отходов.
18
1.1.4. Другие способы синтеза
До разработки технологии сернокислотной гидратации АН большое
внимание уделялось превращению в АА различных производных 3- и
2-замещенных пропионовых кислот [3, 5, 6]. К ним относится синтез,
основанный на гидроцианировании оксида этилена, обработке образу-
ющегося 3-гидроксипропионитрила эквивалентным количеством
серной кислоты и последующей нейтрализации реакционной смеси
аммиаком. Этот способ, как и способы, по которым АА непосредствен-
но образуется из 2-гидроксипропионитрила, 3- и 2-гидрокси-, 3-хлор-,
3-аминопропионамидов, не нашел практического применения в про-
мышленности ввиду многостадийности, малой доступности исходных
веществ, недостаточной селективности процессов, образования труд-
ноутилизируемых отходов или по другим причинам.
В некоторых работах удавалось получить АА по методу Реппе из
ацетилена, оксида углерода (П) и аммиака в присутствии карбонилов
металлов и других катализаторов. Однако эти результаты оказались
плохо воспроизводимыми [3].
В области гидратации нитрилов в последнее время проводятся
широкие исследования присоединения воды к CN-группе координаци-
онно связанных нитрилов с получением координационно связанных
амидов. Было показано, что нитрильная группа гидратируется в
мягких условиях и с высокими выходами в пентааминокобальтовых
(III) и пентааминорутениевых (III) комплексах с АН и другими а,
₽-ненасыщенными нитрилами.
Другим новым направлением химии нитрилов и в том числе АН
является гомогенно-каталитическая гидратация в присутствии комп-
лексов платины, родия, иридия, палладия. Гидратация АН в присутст-
вии ряда фосфиновых комплексов платины неселективна: вода
присоединяется не только по нитрильной группе, но и по С=С-связи. Из
гетерогенной смеси АН и воды в присутствии каталитического коли-
чества растворимого в нитриле комплекса Pb(H2O)(bipy)(OH)2 при
60 °C А А образуется с выходом 80%; в ходе выделения амида из реак-
ционной смеси катализатор разрушался [10].
Среди новых способов гидратации АН наибольшее внимание в
настоящее время привлекает энергосберегающая гидратация в присут-
ствии микроорганизмов с нитрилазной активностью [57, 58]. Процесс
осуществляется в гомо- и гетерофазных условиях. Во втором случае
синтез А А проводят в присутствии сополимера А А с NjN4 -ме-
тилен-бис-акриламидом, содержащим иммобилизованные микроорга-
низмы. Описана технологическая схема гидратации в трех последова-
тельных реакторах с неподвижным слоем биокатализатора при темпе-
ратуре не выше 15 °C, pH 7 - 8 и времени контакта около 2 ч. Указыва-
ется, что для сохранения биологической активности микроорганиз-
мов, которая быстро убывает в присутствии АН, часть реакционной
массы, содержащей АА, добавляется к раствору исходного нитрила.
Воду применяют обессоленную и насыщенную кислородом. Продукт
реакции, содержащий ~ 20% АА, поступает в кристаллизатор, где
19
при 9 °C часть воды кристаллизуется. После отделения льда на центри-
фуге получают 28%-ой раствор АА, который непосредственно исполь-
зуется для полимеризации или подвергается концентрированию до
60%. Гидратация может проводиться непрерывно в течение ~ 200 ч.
Конверсия и селективность при гидратации близки к 100%. Уже су-
ществует промышленная установка гидратации АН в присутствии
биокатализатора указанного типа [59].
1.2. Замещенные акриламиды
Среди С-замещенных акриламидов практическое значение в насто-
ящее время имеет только метакриламид. Этот амид получают из
ацетонциангидрина в присутствии избытка серной кислоты, из метил-
акрилата путем его амидирования аммиаком, а также гидратацией
метакрилонитрила. Современное состояние производства МАА рас-
смотрено [60].
1.2.1. Получение N-замешенных амидов (мет) акрилоилированием
аминов
Ацилирование хлорангидридами. Наиболее универсальный препара-
тивный метод получения N-замещенных акриламидов и метакрилами-
дов основан на ацилировании первичных и вторичных аминов хлоран-
гидридами соответствующих ненасыщенных кислот (реакция Шоттен -
Баумана). Амиды, как правило, получаются с высокими выходами.
(Мет)акрилоилированию обычно не препятствует наличие в молекулах
аминов различных кислород-, азот- и серусодержащих группировок
[49]. Обработкой аминосахаров (мет)акрилоилхлоридами получены
мономеры, используемые для синтеза водорастворимых ’’поливинил-
сахаридов” [61, 62]. N-Метакрилоилированию подвергались трипсин и
другие ферменты [63], N-акрилоилированию - ферментсодержащие
клетки бактерий [64]. Продукты (мет)акрилоилирования этих и других
полимерных физиологически активных веществ используются в
качестве макромеров (макромономеров).
Необходимо отметить, что в отдельных случаях рассматриваемый
способ оказывается неэффективным или малоэффективным. Так, этим
способом не удалось получить Г4-(2-нитрофенил)метакриламид [65], а
при (мет)акрилоилировании «-аминокетонов выходы амидов могут
быть низкими из-за протекания побочной реакции автоконденсации
аминокетонов с образованием замещенных пиразинов [66].
Кроме аминов Г4-(мет)акрилоилированию подвергаются и другие
соединения с азотсодержащими группами, подчас обладающими
весьма слабой нуклеофильной реакционной способностью, например
лактамы [67, 68], сукцинимид [67], диметилмочевина [69].
Поскольку хлорид водорода, выделяющийся при ацилировании,
может образовать с амином соль, практически не взаимодействующую
с ацилирующим агентом, то для достижения высокой степени превра-
20
щения последнего в реакционной смеси обычно должен присутство-
вать акцептор хлорида водорода. Роль акцептора может играть вторая
молекула ацилируемого амина (хлорангидрид и амин берут в мольном
соотношении 1:2) или любое другое основание, как правило, раствори-
мое в реакционной смеси, превосходящее по основности ацилируемый
амин и с хлорангидридом непосредственно не взаимодействующее. В
случае аминов с относительно высокой основностью (алкиламины,.
Кь ~ 10-4) чаще всего берут его двухкратный избыток. Для ацилиро-
вания аминов с Кь Ю-5 и менее (например, бензиламина) высокие
выходы метакриламидов получены при связывании НС1 эквимольным
количеством третичного алифатического амина, например триэтила-
мина (Кь~10~4)- При Кь ацилируемого амина 10-12 и менее (трихлор-
анилин, дифениламин) функция акцептирования НС1 успешно выпол-
няется М,М-диметиланилином (Кь ~ 10~9) [70 - 72]. В ряде случаев,
особенно при ацилировании водорастворимых аминов, в качестве
акцепторов хлорида водорода удается использовать неорганические
основания - гидроксиды, бикарбонаты щелочных металлов и др. [73 -
78]. Для ацилирования слабоосновных аминов можно обойтись экви-
мольным количеством хлорангидрида или его небольшим (до 20%)
избытком [79]. Однако показано, что двухкратный избыток амина и в
этом случае позволяет повысить выход амида [70].
Для ускорения образования N-замещенных (мет)акриламидов
использованы добавки пиридина [79]. При осуществлении реакции
Шоттен - Баумана, как и при получении N-замещенных (метакрила-
мидов другими способами, во многих работах синтезы проводились в
присутствии гидрохинона или других ингибиторов радикальных
реакций.
N-Дкрилоилирование алифатических аминов проводят при темпера-
туре не выше 10 °C, поскольку повышение температуры способствует
понижению выхода акриламидов за счет присоединения аминов по
двойным связям акриламидов. Низкая температура синтеза препятст-
вует также вовлечению в реакцию гидроксильных групп при
№(мет)акрилоилировании гидроксиаминов [80]. При использовании
слабоосновных аминов в синтезе N-замещенных метакриламидов
смешение реагентов проводили при комнатной температуре, а затем
реакционную смесь нагревали до кипения растворителя, например
бензола [71, 79].
Кроме бензола в качестве растворителей применяются эфир, ацето-
нитрил, хлороформ, метиленхлорид, ацетон, тетрагидрофуран, мета-
нол, другие органические вещества и их смеси. При этом исходные
реакционные смеси, как правило, являются гомогенными. Однако
синтезы проходят также успешно, когда N-ацилированию подвергают-
ся суспензии аминов в этих растворителях [79, 81]. При проведении
синтеза в присутствии воды одновременно с амидированием в боль-
шей или меньшей степени идет гидролиз хлорангидридов. Поскольку
гидролиз метакрилоилхлорида протекает с меньшей скоростью, чем
его реакция с алифатическими и такими ароматическими аминами,
21
как 4-толуидин и 4-хлоранилин, оказалось возможным получать с
высокими выходами N-замещенные метакриламиды в присутствии
воды, в которой исходные амины растворимы, образуют эмульсии или
дисперсии [72, 74, 82]. Методика неэффективна, если в воде хорошо
растворимы не только исходные амины, но и образующиеся амиды, что
затрудняет получение последних в чистом виде. В присутствии воды
не удалось получить N-арилметакриламиды из таких слабоосновных
аминов, как дифениламин.
Межфазная конденсация хлорангидрида с амином обладает преи-
муществами (повышение выхода, более простая методика) перед
конденсацией в одном растворителе [77, 78]. При межфазной конден-
сации к гетерогенной смеси воды и органического растворителя,
содержащей ацилируемый амин и гидроксид натрия, по каплям добав-
ляют (мет)акрилоилхлорид.
Поскольку реакция хлорангидридов с аминами сильноэкзотермич-
на, для предотвращения разогрева при конденсации один из реагентов
необходимо дозировать в реактор. В большинстве случаев не сущест-
венно, какой именно реагент вводится вначале, а какой добавляется к
нему постепенно. Наиболее часто в интенсивно перемешиваемую
реакционную смесь по каплям вводят хлорангидрид или его раствор.
Иногда предпочтение отдается обратной последовательности ввода
исходных веществ. Так, если ацилированию подвергается амин с
высокой основностью, для ограничения аминирования акриловых
производных по С=С-связи синтез проводят путем медленного добав-
ления амина к хлорангидриду в присутствии органического раствори-
теля, из которого по мере образования выделяется гидрохлорид амина
[72, 83]. Обратная последовательность введения исходных веществ
оказалась полезной и при синтезе 1Ч-(2-амино-2-метилпропил)- и раз-
личных стереоизомеров №(2-амино-2-метилбутил)акриламида по схеме
[84]: СН3 СН3
СН2=СНСОС1 + H2NCH2-6-NH2-*CH2=CHCONHCH2CN Н3СГ
сн3 сн3
В указанном диамине более реакционноспособной является стеричес-
ки менее затрудненная аминогруппа. Если при добавлении акрило-
илхлорида к раствору диамина в хлороформе выделяющийся НС1
связывается с еще не прореагировавшей молекулой диамина, вследст-
вие чего исходные вещества необходимо брать в мольном соотноше-
нии 1:2, то при введении диамина в раствор акрилоилхлорида в
хлороформе НС1 нейтрализуется свободной аминогруппой у третич-
ного атома углерода, что позволяет получать амид с высоким выходом
(80 - 90%) уже при соотношении исходных веществ 1,05:1.
Для избирательного М-(мет)акрилоилирования соединений, содер-
жащих ряд способных к ацилированию функциональных групп,
практикуется ’’защита” групп, которые необходимо сохранить. Для
получения б-метакрилоил-L -лизина предварительно синтезируют
22
комплекс L-лизина с медью (II). Водный раствор этого комплекса, в
котором 2-аминогруппа защищена, обрабатывают метакрилоилхлори-
дом, поддерживая в реакционной смеси pH ~ 8 путем добавления к
ней гидроксида натрия. В водную суспензию медного комплекса
б-метакрилоил-L-лизина пропускают сероводород, что ведет к выде-
лению целевого продукта [85].
Ацилирование ангидридами кислот. Для М-(мет)акрилоилирования
аминов по реакции Шоттен - Баумана применяются также ангидриды
АК и МАК. Кроме аминов в реакцию с ангидридами вступают моноза-
мещенные амиды [86]. Синтез N-замещенных (мет)акриламидов прово-
дят в присутствии неорганических [87] и органических [88] оснований
или без них [80, 89] в среде растворителей (тетрагидрофурана, метано-
ла, пиридина, диметилформамида и др.). При этом ацилируемое соеди-
нение часто образует с растворителем суспензию [87, 90].
По сравнению с хлорангидридами ангидриды АК и МАК менее
доступны. Необходимо также иметь в виду, что продажные препараты
акрилового и метакрилового ангидридов могут содержать примеси
соединений с ацетильной группой, что приводит к загрязнению про-
дуктов реакции N-ацетилпроизводными [61]. С другой стороны, N-ме-
такрилоилирование акриловым ангидридом может иметь и преиму-
щества над метакрилоилированием хлорангидридом. В работе [91] из
продуктов реакции с акриловым ангидридом образованный амид был
легко выделен, в то время как из продуктов реакции с хлорангидри-
дом это сделать не удалось. В некоторых работах, в которых реакция
Шоттен - Баумана проводилась с ангидридами кислот, указывается,
что при наличии в субстрате кроме аминогрупп других ацилируемых
групп этот способ позволяет избирательно проводить Ы-(мет)акрило-
илирование [88, 89]. Так, из аминофенолов и метакрилового ангидрида
при 0 °C в ацетоне или эфире с хорошими выходами получены N-гидро-
ксифенилметакриламиды [89].
Ацилирование сложными эфирами, амидами и кислотами. N-Заме-
щенные (мет)акриламиды можно с хорошими выходами получать
путем высокотемпературного переацилирования, протекающего при
взаимодействии (мет)акриловых эфиров и незамещенных у азота
амидов с первичными и вторичными аминами. Поскольку одновремен-
но с амидированием часто происходит аминирование по С=С-связям с
получением аминоамидов, вслед за амидированием и аминированием
проводят термическое деаминирование:
-нх • , ,
CH2=CRCOX+2R'R"NH st R'R"NCH2CHRCONR R -
- CH2=CRCONR'R" + R'R"NH.
X=OR'"(R'" - низшие алкилы), NH2.
Ввиду доступности алкил(мет)акрилатов способы, основанные на
приведенной реакции [92], являются наиболее подходящими для
получения многих N-замещенных амидов, в частности диалкиламино-
23
алкиламидов АК и МАК в промышленном масштабе. Различные вари-
анты амидирования сложных эфиров и переамидирования амидов
описаны главным образом в патентной литературе (например, [93]). Мы
ниже коснемся только небольшой части опубликованных данных.
N-Монозамещенные акриламиды и метакриламиды получают с
высокими выходами амидированием сложных эфиров при 90 - 120 °C в
присутствии катализаторов - оксидов [94] и алкоксидов [95] металлов
переменной валентности и алкилпроизводных этих металлов, и в пер-
вую очередь - оксидов и алкоксидов диалкилолова. Предложено в
качестве катализаторов использовать и соединения других классов
[93]. Указывается, что вода способствует присоединению аминов по
С=С-связи эфиров, и поэтому предлагается проводить синтез в присут-
ствии осушителей - алкоксидов кремния, титана, циркония [95].
При взаимодействии ММА с этанойамином [96] и этилендиамином
[97] в отсутствие каких-либо катализаторов с высокими выходами
получаются соответственно 2-гидрокси- и 2-аминоэтилметакриламиды.
Амидирование происходит уже при комнатной температуре.
При получении Ы-(диметиламинопропил)акриламида или N-метак-
риламида и других N-монозамещенных амидов переамидированием
АА соответствующими аминами (130 - 170 *С) во избежание присоеди-
нения амина по двойной связи мономера предложено защитить ее с
помощью этиленгликоля (45 - 50 *С, КОН). После переамидирования
двойная связь регенерируется в результате пиролиза (200 - 210 °C)
[98].
В препаративных целях удобно получать N-замещенные (метакри-
ламиды из кислот и аминов в присутствии дициклогексилкарбо-
диимида в качестве активатора карбоксильной группы и акцептора
воды при температурах ниже 10 °C в среде органических растворите-
лей. Так, например, получен №(4-гидроксифенил)метакриламид [99]:
СН3
C6H11N=C=NC6H11
ОН---------------•
СН3
CH2=CCONH-/ VoH + CeHnNHCONHCgHn
1.2.2. Получение N-замещенных амидов реакциями (мет)акриламида
и (мет)акрилонитрила с карбонильными соединениями
В основе синтеза большого числа N-замещенных (мет)акриламидов
лежит реакция соответствующих незамещенных амидов с формаль-
дегидом и некоторыми другими карбонильными соединениями.
Взаимодействием АА и МАА с параформальдегидом в органических
растворителях в присутствии коллоидного натрия, амида натрия,
этоксида натрия, третичных аминов и других анионных катализаторов
24
при 50 - 70 °C с хорошими выходами получают N-гидроксиметиламиды
[100- 103]: CH2=CRCONH2 + CH2O CH2=CRCONHCH2OH
N-Гидроксиметиламиды образуются также в водной среде [100, 103].
При получении N-гидроксиметилметакриламида из МАА и эквимоль-
ного количества формальдегида (в виде 37%-го водного раствора) в
присутствии метанола оптимальными являются следующие условия:
температура 40 °C, концентрация метанола 1,5 моль/л, pH 9,8 - 10,1
[Ю4].
Реакцией АА и МАА с хлоралем получают №(1-гидрокси-2,2,2-три-
хлорзтил)амиды. Хлораль в этой реакции активнее формальдегида,
ввиду чего реакция с ним идет с достаточно большой скоростью без
катализатора [103,105].
Высокая реакционная способность N-гидроксиметиламидов позво-
ляет использовать их в качестве исходных продуктов для получения
других, более стабильных мономеров.
Взаимодействием N-гидроксиметиламидов с избытком спирта в
присутствии сильных кислот при нагревании получают N-алкоксиами-
ды [106, 107], например: +
CH2=CHCONCH2OH+(СН3)2СНСН2ОН ” CH2=CHCONHCH2OCH2CH(CH3)2
—НХ)
Наряду с незамещенными насыщенными спиртами в данном синтезе
использованы 2-хлорзтанол, 3-гидроксипропионитрил, аллиловый
спирт [106]. Удобно синтезировать N-алкоксиметиламиды двухстадий-
ным способом, согласно которому вначале из акрил- или метакрилами-
да и параформальдегида (50 °C, pH 9- 10) получают N-гидроксиметил-
амид, после чего реакционную смесь без выделения продукта реак-
ции обрабатывают спиртом (85°С, pH 3,5-4,5) [108]. N-Бутоксилметил-
акриламид с хорошим выходом получен в одну стадию кипячением
раствора акриламида и формальдегида в бутаноле. Побочным продук-
том реакции является ^^-оксидиметилендиакри ламид
(CH2=CHCONHCH2)2O.
При нагревании N-гидроксиметиламидов в присутствии минераль-
ных кислот образуются N,N-мети лен-бис-амиды [101]. Наиболее
высокие выходы бис-(мет)акриламидов достигаются при проведении
синтеза в неводных растворителях. Реакция протекает через промежу-
точное образование простых эфиров [100]:
СН3 / СН3 \
| НС! / । । -СН2О
2CH2=CCONHCH2OH——* 3H2=CCONHCH2 о--------------••
~~ Н2** I /
/ СН3 \ ' ‘ '2
I । )
—►Ich2=cconhIch2
\ /2
^^-Метилен-бис-акриламид и -метакриламид могут быть получе-
ны в результате непосредственного взаимодействия а, ₽-ненасыщен-
25
ных амидов и формальдегида в водных растворах хлористоводород-
ной кислоты, т.е. без промежуточного выделения N-гидроксиметила-
мидов [109]. Для получения монозамещенных М,М'-метилен-бис-акри-
ламидов (CH2=CHCONH)2CHR кислотной конденсации с акриламидом
подвергают высшие альдегиды. Дизамещенные алкильными и ариль-
ными группами М,М'-метилен-бис-акриламиды образуются с хорошими
выходами при взаимодействии АА с кетондиалкилацеталями в присут-
ствии протонных или апротонных кислот [ПО]:
2CH2=CHCONH2 + RR'C(OR")2 * (CH2=CHCONH)2CRR' + 2R "OH
М,М'-Метилен-бис-акриламид удобно получать с выходом более 90%
также из АН. Синтез обычно проводят в присутствии неорганических
кислот [47,111,112]: j н SQ
2. Н2О 4
2CH2=CHCN + СН2О---------^(CH2=CHCONH)2CH2
Обработкой АА и МАА формальдегидом и вторичным амином в
водном растворе [106] или параформальдегидом в органических
растворителях [113] получают основания Манниха:
CH2=CRCONH2 + СН2О + R'2 NH - ch2=crconhch2nr'2
1.2.3. N-Алкилирование (мет)акрилонитрила
Для получения большого числа Н-алкил(мет)акриламидов широко
используется реакция Риттера [114], основанная на взаимодействии
нитрилов с алкилирующими агентами в присутствии протонных
кислот, например: . „ оп
1 • >»2OU^
2 . Н2О
CH2=CHCN+(CH3)2C=CH2----------*- CH2=CHCONHC(CH3)3
Эта реакция подробно рассмотрена в монографии [47]. В рамках
данной книги необходимо отметить, что с помощью реакции Риттера
получают М-алкил(мет)акриламиды, содержащие в алкильном остатке
карбонильные [115], карбоксильные [116, 117], трет-аминогруппы [118].
Реакция Риттера используется для получения из АН и ацетона
промышленного мономера - М-(1,1-диметил-3-оксобутил)акриламида
(диацетонакриламида) [119]. Необходимый алкилирующий агент,
очевидно, образуется в условиях синтеза в результате альдольной
конденсации ацетона, протекающей под действием серной кислоты:
О 0 1.CH2=CHCN,H2SO4
И H2SO4 п 2. н2о
2СН3ССН3-----(СН3)2С = СНССН3------------------*
СН3 °
—► CH2=CHCONHCCK2CCH3
I
сн3
26
Согласно [119], оптимальное мольное соотношение АН, ацетона и
серной кислоты составляет 1:2,4:2,4 а температура синтеза равна 50 -
60 ’С.
Практически важным мономером, получаемым по реакции Риттера,
является 2-акриламидо-2-метилпропансульфокислота. В качестве
исходных продуктов в этом синтезе используются изобутилен, триок-
сид серы, серная кислота и АН [120]. Процесс протекает через промежу-
точное получение кислого ацетилсульфата и 2-метилпропен-2-сульфо-
кислоты:
SO3 + CH3COOH-CH3COOSO2OH
CH3COOSO2OH + СН2=С(СН3)2
Н2С-С(СН3)2 н2о
-------*- 1 _• I ——»
-СН3СООН 02S-0
СНз 1-CH2-CHCN, HjSO4 СН3
J 2. Н2О I
---- HOO2SCH2C=CH2-------------* CH3=CHCONHCCH2SO2OH
CH3
В продуктах реакции Риттера амиды связаны с серной кислотой в
виде солей. Для получения свободного амида реакционную смесь
обрабатывают основаниями или их водными растворами при темпера-
туре не выше ~ 50 °C (во избежание гидролиза амидов), после чего
амиды отгоняют, отфильтровывают или экстрагируют органическим
растворителем. Для выделения водонерастворимых свободных ами-
дов из их солей иногда достаточно обработать реакционные смеси
водой.
1.2.4. Модификация N-замещенных (мет)акриламидов
Возможности получения новых N-замещенных (мет)акриламидов за
счет химических превращений заместителей у азота других (метакри-
ламидов по существу безграничны. Функциональные группы N-замес-
тителей амидов вступают практически во все реакции, свойственные
этим группам.
Из амидов, имеющих гидроксильную группу в заместителе у азота,
получают, в первую очередь, простые и сложные эфиры [89, 121].
Амиды с карбоксильной группой в заместителях подвергаются
этерификации, амидированию и другим превращениям. Карбоксиль-
ная группа N-метакрилоилаланина этерифицируется обычным спосо-
бом, т.е. нагревается со спиртом в присутствии растворителя (хлоро-
форма), образующего азеотропную смесь с водой, выделяющейся в
ходе реакции [122].
Биоактивные мономеры синтезированы взаимодействием №(4-мета-
криламидо)бензойной кислоты с N-гидроксисукцинимидом и другими
N-гидроксизамещенными гетероциклическими соединениями в при-
сутствии дициклогексилкарбодиимида в смеси тетрагидрофурана и
диметилформамида при комнатной температуре [123].
27
Вторая амидная группа в молекулу N-замещенного (метакрилами-
да вводится также путем обработки аминами соответствующих моно-
меров, содержащих сложноэфирную группу в заместителе [81].
1Ч-(1-3-замещенные-2-оксопропил)акриламиды и метакриламиды
синтезированы с хорошими выходами из соответствующих
N-ацил-а-аминокислот, таких как DL-лейцин, DL -фенилаланин, DL-ва-
лин, по реакции Дэкина - Веста, которая протекает через промежуточ-
ную стадию образования 2-алкенил-4-ацетил-5-оксазолонов, выделять
которые, однако, нет необходимости, по следующей схеме [66, 124]:
CW2 = CR
I
С
CH2=CRCONHR'COOH------* (СНзС0)£
-H2°R'HC-CO
CH2=CR
--* N\ /° -7§*CH2=CRCONHCHR'COCH3
R'C-CO “COz
COCH3
N-Оксоалкилакриламиды на оксиде платины подвергались катали-
тическому гидрированию в соответствующие гидроксипроизводные
N-замещенных амидов, на никеле Ренея - восстановительному амини-
рованию (обработка вторичным амином и водородом) в N-диалкила-
миноалкилакриламиды [125].
Галоформное расщепление N-оксоалкилакриламидов использовано
для получения З-алкиламидо-З-метилбутановой кислоты [117] и
других карбоксилсодержащих N-алкилакриламидов [126]:
СН3 О СН3
CH2=CHCONHCCH2CCH3-^^- CH2=CHCONHCCH2COONa^SL
| -снх3 ।
СН3 СН3
сн3
—*CH2=CHCONHCCH2COOH
сн3
Х=С1, Вг
Из двух N-замещенных акриламидов с кислотными и основными
свойствами получают соли - ионные пары, катион и анион которых
могут самостоятельно полимеризоваться. Такой водорастворимый
’’сомономер” - З-метакриламидопропилтриметиламмоний-2-акрила-
мидо-2-метилпропансульфонат - образуется при нейтрализации
водного раствора четвертичного аммониевого основания сульфоновой
28
кислотой [127]:
СН3 сн3
CH2 = CCONH(CH2)3N(CH3)3OH' +ch2 = chconhcch2so2oh-^
сн3 2
СН3 СНз
—»CH2 = CCONH(CH2)3N(CH3)3“OO2SCH2CNHCOCH = CH2
СНз
Подобные”сомономерные” соли синтезированы также из пар моно-
меров, один из которых не является производным АА. Например, в
тетрагидрофуране при - 10 °C получен 4-винилпиридиний-2-акрилами-
до-2-метилпропансульфонат [128].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. 'Thomas W. М., WangD. ^.//Encyclopedia of Polymer Science and Engineering. 2nd ed.
V. 1. N. Y.: Interscience, 1985. P. 169-211.
2. Haherson F., Panzer H. P.//Kirk—Othmer Encyclopedia of Chemical Technology. 3rd ed.
V. 10. N. Y.: Wiley and Sons, 1980. P. 489-523.
3. Carpenter Б. L„ Davis H. S.//i. Appl. Chem. 1957. V. 7. N 12. P. 671—676.
4. Матин Н.Б., Траченко В.И., Григорян Э.П. и др. //ЖПХ. 1978. Т. 51. № 8.
С. 1900-1902.
5. MacWilliams D. C.//Kirk-Othmer Encyclopedia of Chemical Technology. 3rd ed V. 1.
N. Y.: Wiley and Sons, 1978. P. 298-311.
6. Траченко В. И., Зильберман Е.Н., Матин Н. Б. и др.//Хим. пром-сть. 1979. № 4.
С. 197-199.
7. Матин Н. Б., Зильберман Б. Н., Траченко В. И. и др.//ЖПХ. 1979. Т. 52. № 10.
С. 2352 - 2354.
8. Матин Н. Б., Зильберман Е. Н., Траченко В. И. и др.//ЖПХ. 1980. Т. 53. № 8.
С. 1880-1882.
9. Островский В. Е., Артамонов С. В., Корнеева С. П. и др.//Изв. АН Каз.ССЕ 1974. № 4.
С. 84 - 86.
10. Зильберман Е. Н.//Успехи химии. 1984. Т. 53. № 9. С. 1548-1571.
11. Пат. 3381034 США; С. А. 1968. V. 69. 35492.
12. Hirai Н., Wakabayashi Н., Komiyama М.//Polymer Letters. 1983. N 7. P. 1047—1050.
13. Григорян Э. П., Данов С. М., Лифанова В. А.//Основной органический синтез и
нефтехимия. № 12. Л.: Изд-во ЛТИ им. Ленсовета, 1979. С 39—41.
14. Михайлишин И. О., Мокривский Т. М., Толопко Д. К.//Вестник Львовского поли-
техи. ин-та. Химия и технол. веществ и их применение. 1982. № 163. С. 108—110.
15. Лифанова В. А., Темкин О. Н. //Кинетика и катализ. 1982. Т. 23. № 4. С. 868— 873.
16. Nino Е., Lapena A., Martinez J. et al.//Prep. of Catalysts. Ш. Sci. Bases Prep. Hetero-
geneous Catal. Proc. 3 Int. Symp. Louvain-la-Neuve. Sept. 6 — 9. 1982. Amsterdam, 1983.
P. 745-755; РЖХ. 1985. 6Б4337.
17. Пат. 3869511 США; С. A. 1975. V. 82. 171677.
18. Пат. 53-43927 Япония; РЖХ. 1980.4Н78П.
19. Onuoha N. 1., Wainwright М. 5.//Appl. Catalysis Л 985. V. 14. N 1. P. 361—369.
20. Сигияма К., Химури X., СэкибаХ. и др. //Секубай. 1985. Т. 27. № 6. С. 365-367;
РЖХ. 1986. 5Б4387. Sagiyama К., Miura Я., Watanabe У. et el.//Bull. Chem. Soc. Japan.
1987. V. 60. N 5. P. 1579-1583.
21. Траченко В. И., Зильберман Б. Н., Данов М. Л4.//Химия и хим. технол. 1978. Т. 21.
№11. С. 1627—1630 (Изв. вузов).
29
22. Михайлишин И. О., Явна И. М., Мокривский Т. М. и др.//ЖПХ. 1983. Т. 56. № 10.
С. 2292—2295; Кучер В. В., Михайлишин И. О., Явна И. М. и др.//ДАН УССР. Сер. Б. 1983.
№ 8. С. 43 - 45.
23. Мокривский Т. М., Михайлишин И. О. Кинетические закономерности и механизм
гидратации нитрилов “-алкилакриловых кислот в присутствии медьсодержащих катали-
заторов. Киев 1985.9с. Дел. в Укр. НИИНТИ. 5.09.85. 2073.
24. А. с. 719686 СССР. Б. И. 1980. № 9. С. 38.
25. Hayashi Н., NishiH., Watanabe У. etal.//l. Catal. 1981. V. 69. N. 1. P. 44 - 50.
26. Elsemongy M. M., Onsager O. T.//Acta. Chem. Scand. B. 1978. V. B32. N 3. P. 167—170.
27. Мокривский T. M., Толопко Д. К, Михайлишин И. О.//Умы. технология. 1987. № 2.
С. 26-29.
28. Траченко В. И., Григорян Э. П., Зильберман Е. Н. и др.//Основной органический
синтез и нефтехимия. № 13. Л.: Изд-во ЛТИ им. Ленсовета, 1980. С. 24—26.
29. Григорян Э.П., Андреева Н.А., Данов C.M.U др.//ЖПХ. 1984. Т. 57. № 2. С. 375—379.
30. Траченко В. И. Дис.... канд. хим. наук. Горький: Горьковский политех, ин-т,
1979.132 с.
31. Sagiyama К., Miura Н., Sana S. et a/.//Sekiyu Gokkaishi. 1987. V. 30. N 2. C. 126—131;
РЖХ. 1987.20Б4384.
32. Onuoha N. I., Chaplin R. P., Wainwright M. S.//Chromatographia. 1979. V. 12. N 11.
P. 709-712.
33. Пат. 4010142 США; С. A. 1977. V. 86. 156189.
34. Kohler M. A., Lee J., Wainwright M. S. et al.//Appl. Surface Sc. Process, and Manuf.
Conf., Perth, 7-12 Dec. 1986. Abstr. Perth, s. a. 52; РЖХ. 1988.4H52.
35. Джозеф А. Д., Михайлишин И. О., Мокривский Т. М. и др.//Изв. Химия и хим.
техноп. 1984. Е. 27. № 1. С. 116-117 (Изв. вузов).
36. Григорян Э. П. и др.//Тезисы докл. Всесоюз. конф. „Химреактор-9”. Гродно:
ВЦОСУ, 1986. Ч. 1. С. 26-32.
37. Пат. 817648 Бельгии. С. А. 1975. V. 83.28819.
38. Ткаченко В. И.//ЖПХ. 1979. Т. 52. № 7. С. 1570-1574.
39. Пат. 3894084 США; С. А. 1975. V.83. 148016.
40. Пат. 2036126, 2329011 ФРГ; С. А. 1971. V.75.35176; РЖХ. 1975.20Н54П.
41. Wainright М. S., Onuoha N. I., Chaplin R. P.//Natl. Conf. Chem. Eng. Prepr. Pap. New-
castle. 1979. P. 109-113.
42. Пат. 3887425 США. РЖХ. 1976. 5Н77П.
43. Пат. 4188339 США. РЖХ. 1980.20Н68П.
44. Guzman Р., Ortiz I., Irabien A.//Ind. Eng. Chem. Process. 1986. V. 25. N 3. P. 771—776.
45. Пат. 62-115058 Японии; РЖХ. 1987. 19Н48П.
46. Краснова М. А., Тезиков И. И.//Соврем. технол. процессы и оборуд. пищевой и хим.
пром-сти Кузбасса М.: 1983. С. 48—54.
47. Зильберман Е. Н. Реакции нитрилов. М.: Химия, 1972.448 с.
48. Григорян Э. П., Битное Г. ф., Родюкова Р. Н. и др.//ЖПХ. 1976. Т. 49. № 9.
С. 2043- 2047.
49. MacWilliams D. S.//Functional Monomers. Their Preparation, Polymerization and Appli-
cation. V. 1. Ed. by R. H. Yokum. New York: M. Decker. 1973. P. 1-197.
50. Савицкая M. H., Холодова Ю. Д. Полиакриламид. Киев: Технжа, 1969; 188 с.
51. Слепцова О. М., Сенюшева 4. М., Шакина 3. И. и др.//Хюл. пром-сть. 1968. Н° 7.
С. 504-506.
52. Zahora J., Bielkowa М„ Kalab V.//Chem. Prum. 1970. T. 20/45. N 11. S. 534-535. •
53. Zilkha A., Barzilayl., Naiman J. et al//J. Org. Chem. 1968. V. 33; N 4. P. 1686—1689.
54. Мичурин А. А., Зильберман E. Н.//Хтшя и хим. технол. 1966. Т. 9. № 5. С. 775— 778
(Изв. вузов).
55. Якубович И. А., Парадня П.И., Пасхин Н. П. и др.//Хим. пром-сть. 1963. № 8.
С. 570-572.
56. Bikales N.M. //High Polymers. 1970. V. 24. Р. 84-104.
57. Пат. 2912292, 3022912 ФРГ; С. А. 1980. V. 92. 47200; Пат. 80-144889 Японии; С. А. 1981.
V. 94. 82203.
30
58. Bui К., Arnaud D.,GalzyPУ/Enzyme Microb. Technol. 1982. V. 4. N 3. P. 195—197; C. A.
1982.V. 97. 53948.
59. Носкова И. Б.//Хим. пром-сть. за рубежом. М.: НИИТЭХИМ, 1987. № 2. (290). С. 1 -35.
60. Зильберман Е. Н., Скворцов Б. Н.//Хим. пром-сть. 1989. № 4. С. 14-19.
61. Whistler R. L., Panzer Н. Р„ Roberts Н. Org. Chem. 1961. V. 26. N 5. Р. 1583-1588.
62. Iwakura Y., Imai Y„ Yagi K.//I. Polymer Sci.: A-l. 1968. V. 6. N 6. P. 1625-1632.
63. Платз H. А., Валуев Л. И., Егоров H. С. и <Зр.//Прикладная биохимия и микробио-
логия. 1977. Т. 13. № 5. С. 673-676.
64. Усова А. В., Чупов В. В., Валуев Л. И. и др.//ВМС. Б. 1988. Т. 30. № 4. С. 304 - 307.
65. Patai S„ Benton М„ Reichmann М. В. //J. Am. Chem. Soc. 1952. V. 72. N 3. Р. 845- 847.
66. Iwakura Y., Toda F., Suzuki H.//I. Org. Chem. 1967. V. 32. N 2. P. 440—443.
67. Ogata N:, Azuma C., Itsubo H.//J. Polymer Sci. Polymer Chem. Ed. 1975. V. 13.
P. 1959-1962.
68. Sur. G. S„ Noh S. K., Choi S. K.//J. Polymer Sci. Polymer Chem. Ed. 1981. V. 19. N 2.
P. 223-233.
69. Otsu T., Ohya T.//I. Macromol. Chem. A. 1084. V. 21. N 1. P. 1 - 14.
70. Хотон M. M., Соколова T. А., Четыркина Г. М.//ЖОХ. 1957. T. 27.№ 1. С. 185-180.
71. Соколова Т. А.//ЖОХ. 1957. Т. 27. № 8. С. 2205-2208.
72. Котон М. М., Соколова Т.А., Савицкая М. Н. и др./ТЖОХ. 1957. Т. 27. № 8.
С. 2239 -2242.
73. Kulkami R. К., Morawetz H.//I. Polymer Sci. 1961. V. 54. N160. P. 491—503.
74. RehseH., Ritter//.//Makromol. Chem. 1988. Bd. 189. N 3. S. 529-539.
75. Ishikara K., Muratomo N., Fuyii H. et. al//I. Polymer Sci. Polymer Chem. Ed. 1985. V. 23.
N11. P. 2841-2850.
76. Yamada B., Tanaka T., Mori S. et al.//I. Macromol. Sci. A. 1986. V. 23. N 6. P. 697-710.
77. Kodaira T., Sumiya Y.//Makromol.Chem. 1986. Bd. 187. N 4. S. 933—942.
78. Kodaira T., Sakai M., Yamazaki K.//J. Polymer Sci. Polymer Lett. Ed. 1975. V. 13. N 9.
P. 521-524.
79. Patel K., Desai T., Suthar B.//Makromol. Chem. 1985. Bd. 186. N 6. S. 1151-1156.
80. Klein J., Herzog D//Makromol. Chem. 1987. Bd. 187. N 6. S. 1217 - 1232.
81. Lange K., Ritter H.//Makromol. Chem. 1987. Bd. 188. N 7. S. 1641-1650.
82. Соколова T. А., Овсянникова Л. А.//ЖОХ. 1958. T. 28. № 3. C. 779- 782.
83. Moens L, Smets G.//1. Polymer Sci. 1957. V. 23. N 2. P. 931-948.
84. Overberger C. G., Femg W., Chi M.-S.//J. Polymer Sci. Polymer Chem. Ed. 1986. V. 24.
N 12. P. 3365-3379.
85. Morawetz H., Sammak E.//J. Phys. Chem. 1957. V. 61. N10. P. 1357-1360.
86. Соколова T. А., Рутковская Г. Д.//ЖОХ. 1961. T. 31. № 7. С. 2224-2226.
87. GuilbaultL. L, Brooks N. W.//I. Makromol. Sci. A. 1973. V. 7. N 8. P. 1581-1590.
88. Touet J„ Pierre C., Brown E. et a/.//Makromol. Chem. Rapid. Commun. 1987. Bd.8. N 8.
S. 377 - 382.
89. Панарин E. Ф., Беров M. Б.//ЖОХ. 1968. T. 4. № 5. C. 824-826.
90, Inaki Y., Sugita S.-L, Tanahara T. et al.//J. Polymer Sci. Polymer Chem. Ed. 1986. V. 24.
N12. P. 3201-3217.
91. Соколова T. А., Овсянникова Л. А.//ДАН СССР. 1966. T. 143. № 1. С. 140-142.
92. Erickson J. G.//I. Am. Chem. Soc. 1952. V. 74. N 24. P. 6281-6282.
93. Подгорнова В. А., Фарафонтова В. И., Халистова И. Д. Синтез и применение N-за-
мещенных акриламидов. Черкассы: НИИТЭХИМ, 1987. 67 с. Дел. № 299хп-85.
94. Европ. 0216966. РЖХ. 1987.24Н49П.
95. Пат. 4549017 США. РЖХ. 1986. 16Н66П.
96. Кулагина Т. С., Савранская С. Д., Аскаров М. А.//Узб. хим. ж. 1966. № 2. С. 35-39.
97. Пат. заявка 61-68454 Японии; С. А. 1986. V. 105. 134491..
98. Европат. заявка 151967; С. А. 1986. V. 104. 129645.
99. RitterH., RodewcidS.//Makromol. Chem. 1986. Bd. 187. N 4. S. 801-807.
100. NyquistB. E.//Functional Monomers. Their preparation, Polymerization and Application.
V. 1. Ed. by R. H. Yocum. New York: M. Decker, 1973. P. 299-487.
31
101. Feuer H., Lynch U. E.//J. Am. Chem. Soc. 1953. V. 75. N 20. P. 5027-5029.
102. Kamogawa H., Sekiya T.//1. Polymer Sei. 1961. V. 50. N 153. P. 211-225.
103. Фарафонтова В. И., Подгорнова В. А., Уставщиков В. Ф.//ЖПХ. 1975. Т. 48. № 1.
С. 240-243.
104. Matejicek А., Сету /.//Collect. Czechosl. Chem. Commun; 1986. V. 51. N 8.
P. 1656-1664.
105. JedlinskiZ., PaprotnyJ., Groszek S.//Roczn. Chem. 1967. V. 41. N 6. P. 1115 — 1117.
106. Muller E., DingesK., Graulich W.//Makromol. Chem. 1962. Bd. 57. S. 27—51.
107. Новичкова Л. M., Ковальская А. Г., Ростовский E. H.//BMC. A. 1967. T. 9. № 6.
C. 1386-1389.
108. Dowbenko R., Christenson R. M„ Salem A. H.//J. Org. Chem. 1963. V. 28. N 12.
P. 3458-3460.
109. Kamogawa H.//Kogyo Kagaku Zasshi. 1956. V. 60. P. 1197—1201; Chem. Abstr. 1960.
V. 54. P. 12808.
110. Murfin D. L., Hayashi K., Miller L. E.//I. Polymer Sci. A-l. 1970. V. 8. N 8.
P. 1967-1980.
111. Magat E. E., Faris B. F., Reith J. E. et at //j. Am. Chem. Soc. 1951. V. 73. N 3.
P. 1028-1031. _ ____________
112. Подгорнова В. А., Халистова И. Д., Ильичева Е. Н. и др.//Осн. орг. синтез. Ярос-
лавль: нзд-во политех, ин-та, 1981. № 14. С. 29—32.
113. Bortoli М., Sebille В., Audebert R. et c/.//Makromol. Chem. 1975. Bd. 176. N 9.
S. 2579-2593.
114. Ritter J. J., Minieri P. P.//J. Am. Chem. Soc. 1948. V. 70. N 12. P. 4045-4048.
115. HokeD. I.//I. Polymer Sci. Polymer Chem. Ed. 1973. V. 11. N 10. P. 2711-2712.
116. Green B. W., Sheetz D. P., Filer T.D. //1. Colloid Interface Sci. 1970. V. 32. NLP.90-95.
117. Hoke D. I., Robins R. D.//J. Polymer Sci. jPolymer Chem. Ed. 1972. V. 10. N 11.
P. 3311-3315.
118. HokeD. L, SurbeyD. L„ Oriatt W. R.//J. Polimer Sci. A-l. 1972. V. 10. N 2. P. 595-604.
119. Coleman L. E., Bork J. F., Wyman D. P. et aL//J. Polymer Sci. A-l. 1965. V. 3. N 4.
P. 1601-1608.
120. Пат. 3506707 США.
121. Yasuzawa M., Nakaya T., ImotoM.//1. Macromol. Sci. 1986. V. A23. N 8. P. 963— 972.
122. Ritter H., Siebel C.//Makromol. Chem. Rapid Commun. 1985. Bd. 6. N 8. S. 521—525.
123. Lu С. X., Yang J., Leng L. et al.//J. Polymer Sci. Polymer Chem. Ed. 1981. V. 19. N 12.
P. 3333-3343.
124. Iwakura Y„ Toda F„ Suzuki H.//1. Polymer Sci. A-l. 1967. V. 5. N 7. P. 1599-1607.
125. HokeD. I.//J. Polymer Sci. A-l. 1971. V. 9. N 10. P. 2949-2955.
126. McCormick C. L., Blackmon K. P.//J. Macromol. Sci. A. 1986. V. 23. N12. P. 1451-1467.
127. Salamone J. C., Mahmud N. A., Mahmud M. U. et ^.//Polymer. 1982. V. 23. N 6.
P. 843-846.
128. Salamone J. C., Watterson A. C., Hsu T. D. et aL//J. Polymer Sci. Polymer Lett. Ed. 1977.
V. 15. N 8. P. 487-491.
32
Глава 2
СИНТЕЗ ПОЛИМЕРОВ АКРИЛАМИДА И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ
Основным методом синтеза полимеров на основе АА и других
ненасыщенных амидов является радикальная полимеризация, кото-
рую можно проводить всеми известными способами: в массе кристал-
лических и расплавленных мономеров, в растворе, эмульсии и сус-
пензии. Каждый из способов имеет свои особенности, обусловливаю-
щие свойства полимеров и технико-экономические показатели произ-
водства. Ниже рассмотрены закономерности и технологические аспек-
ты гомополимеризации АА и других ненасыщенных амидов при раз-
личных способах синтеза. Кроме того, в эту главу включены разделы,
касающиеся специфики сополимеризации АА с другими мономерами и
прививки АА к различным полимерам.
2.1. Гомогенная полимеризация
К гомогенной полимеризации относятся процессы полимеризации в
растворителях, в которых растворимы и мономер, и полимер. Для ПАА
число таких растворителей невелико: вода, формамид, уксусная и
муравьиная кислоты, ДМСО, а также некоторые водно-органические
смеси [1-5]. Кроме того, ПАА ограниченно растворяется в ДМФА,
этиленгликоле и глицерине [6]. ПМАА значительно хуже растворим,
чем ПАА. Полимеры 1Ч,1Ч-диметил- и М,1Ч-диэтилакриламида раствори-
мы в воде и нерастворимы в углеводородах. Поли-М,1Ч-диэтилакрил-
амид растворим в ацетоне. Полимеры с более длинным алкильным
заместителем у атома азота хуже растворяются в воде, но более раст-
воримы в органических растворителях. Поли-М-метил- и поли-М-н-бу-
тилметакриламид хорошо растворяются в ДМФА, полимер 1Ч-(2-этил-
гексил)-метакриламида- в толуоле. Полимеры акрил- и метакрилмо-
чевин растворимы в концентрированных растворах хлороводородной
кислоты [7].
N-Замещенные акриламиды, как правило, полимеризуются значи-
тельно быстрее соответствующих метакриламидных производных.
Акриламиды с объемными, например антрахиноновыми, заместите-
лями не вступают в гомополимеризацию.
В данном разделе обобщены сведения, относящиеся к синтезу поли-
меров на основе АА и замещенных амидов в гомогенных условиях при
различных способах инициирования, влиянию среды на кинетические
параметры полимеризации, вопросам передачи цепи на компоненты
реакционной смеси, протеканию в системе побочных реакций, влия-
нию различного рода добавок, комплексообразователей и ПАВ на
полимеризацию и свойства образующихся полимеров.
Среди способов синтеза полимеров на основе АА важное место
занимает полимеризация в водных растворах. Основными факторами,
определяющими распространенность этого способа полимеризации,
являются высокие скорости образования полимера и возможность
33
получения в этих условиях полимера с высокой молекулярной мас-
сой. Предполагается [5, 8, 9], что причиной специфического влияния
воды на полимеризацию АА является протонирование радикала,
приводящее к локализации неспаренного электрона, в результате чего
повышается реакционная способность макрорадикала
~сн2-сн-сСкн’
выражающаяся в высоких значениях константы скорости роста цепи
(разд. 2.1.2). Взаимное отталкивание одноименно заряженных ради-
калов ответственно за ограничение константы скорости бимолеку-
лярного обрыва цепи. В непротонированном радикале, существующем
при полимеризации в неводных растворителях, сопряжение неспарен-
ного электрона с л-электронами группы С=О приводит к стабилизации
радикала и уменьшению его активности. Кроме того, высокая реакци-
онная способность АА в водных растворах может быть связана с
подавлением автоассоциации молекул этого мономера ввиду образо-
вания ими водородных связей с молекулами воды. В неполярных же
растворителях, неспособных образовывать такие связи с АА, мономер
находится преимущественно в ассоциированном состоянии в виде
циклических димера, тримера и линейных многомолекулярных
ассоциатов [10]. С этим предположением согласуются и данные, полу-
ченные при полимеризации N-замещенных акрил- и метакриламидов.
Так, N-o-метокси- и N-о-этоксифенилметакриламиды полимеризуются
в массе значительно быстрее, чем их м- и n-изомеры, поскольку у пер-
вых ассоциация молекул отсутствует, а молекулы вторых ассоцииро-
ваны посредством водородных связей [11]. В свою очередь, диметил-
гидразиды АК и МАК, в отличие от их гидрохлоридов, не полимери-
зуются в массе, поскольку молекулы этих мономеров сильно ассоци-
ированы. В водных же растворах в полимеры превращаются как соли,
так и свободные основания [12].
В связи с вышеизложенным АА имеет довольно высокое значение
соотношения констант fcp/fc®’5 (по данным разных авторов для интер-
вала температур 30-60 °C оно составляет 3,2-4,4), что наряду с ма-
лыми величинами констант передачи цепи на мономер и воду обус-
ловливает возможность получения в водных растворах ПАА со
скоростью и ММ, недостижимыми при полимеризации в органических
растворителях.
К другим причинам широкого распространения полимеризации в
воде следует отнести сокращение энергетических затрат на выделение
исходного мономера в кристаллическом виде, которое к тому же
связано с вероятностью его спонтанной полимеризации, и на регене-
рацию органических растворителей, снижение загрязнения окружаю-
щей среды, а также исключение стадии растворения полимерных
реагентов, использующихся, как правило, в виде водных растворов.
34
2.1.1. Способы инициирования
Радикальная полимеризация АА так же, как и полимеризация
других ненасыщенных амидов и прочих виниловых мономеров, может
инициироваться активирующим действием на мономер различных
видов радиации, света видимой и ультрафиолетовой областей спектра,
ультразвука, электрического тока, а также при помощи веществ,
легко распадающихся на радикалы в условиях полимеризации. Кроме
того, часто используются комбинированные способы инициирования,
заключающиеся в сочетании физического воздействия и вещественных
инициаторов.
Описываемые ниже способы могут быть использованы для иници-
ирования полимеризации и сополимеризации АА и других ненасы-
щенных амидов при проведении процесса как в водных растворах, так
и в других условиях синтеза.
Известно [13- 17], что при воздействии на кристаллический АА X- и
у-облучения, а также электронов с высокой энергией происходит его
полимеризация с образованием частично сшитого ПАА [13]. Добавки к
кристаллическому АА небольших количеств воды приводят к сущест-
венному увеличению скорости радиационной полимеризации [17- 19].
С увеличением содержания в системе воды уменьшается доля нераст-
воримой фракции в полимере. Для улучшения растворимости (сопо-
лимеров АА предлагается вводить в реакционную смесь спирты [19],
которые легко участвуют в передаче цепи, ослабляя действие фактора
передачи цепи на макромолекулу.
Скорость радиационной полимеризации АА в водных растворах, как
правило, пропорциональна концентрации мономера и дозе облучения
в степени 0,5. Инициирование процесса осуществляется не только в
результате непосредственного воздействия X- и у-облучения на моно-
мер, но и под действием гидроксильных радикалов, образующихся при
радиолизе воды [20].
С целью получения полностью растворимого полимера в водные
растворы АА, подвергаемые радиационному облучению, так же как и
при полимеризации в двухфазных системах, вводят спирты, в част-
ности метанол [21], значительные количества (10-20%) нейтральных
солей (КС1, KF, NajSO4 и др.) [22], аммиак, гидроксиды щелочных
металлов, амины, аминокислоты и их соли [17,23,24 и др.].
Радиационной полимеризации подвергаются и МАА, трет- бутил-
акриламид [25], метилен-бис-акриламид [14] и другие замещенные
амиды.
Фотоинициирование полимеризации АА протекает в основном в
присутствии сенсибилизаторов, которые, переходя при облучении
светом УФ- и видимой областей спектра в возбужденное состояние,
способны генерировать свободные радикалы. В качестве сенсибили-
заторов наиболее часто используется ДАК [8, 17], возможно также
использование для этих целей пероксида бензоила [26], алкиловых
эфиров надбензойной кислоты [27] и других соединений. В присутст-
вии солей трехвалентного железа инициирующие полимеризацию
35
радикалы НО-возникают в результате разложения под действием
света гидратированного иона железа [28]:
Fe3+HO--^ Fe-2+4-НО-.
Фотополимеризацию АА сенсибилизируют и комплексы аминокольбата
(III) с тиоцианатом калия [29], различные красители и восстанавли-
вающие агенты [30- 34] и др.
При полимеризации АА в воде под действием ультразвука [35]
инициирующие реакцию гидроксильные радикалы образуются в
результате частичного распада молекул воды. На начальных стадиях
полимеризации получается полимер с максимальной степенью поли-
меризации, который затем, по-видимому, подвергается окислительной
деструкции вследствие появления в растворе пероксида водорода.
Под действием электрического тока АА в воде, присоединяя атом
водорода, может превращаться в радикал и инициировать полимери-
зацию в приэлектродном пространстве. Электрохимическое иницииро-
вание полимеризации осуществлено и в присутствии ПСК в результате
его восстановления на катоде до сульфатного анион-радикала, иници-
ирующего полимеризацию [36]. В условиях электролиза АА в смеси
уксусной кислоты и ацетата калия могут быть получены олигомеры с
ММ 4- 6 тыс. Добавки в систему солей железа (III) способствуют уве-
личению скорости полимеризации и ММ полимеров до 6-8 млн. [37].
Электрохимическая полимеризация АА в ДМФА в присутствии
(C^g^NClO* протекает и на аноде, и на катоде, причем катодный
полимер растворяется в реакционной массе, а анодный- осаждается.
Полимер, образующийся на аноде, представляет собой карбоцепной
ПАА, а катодный полимер - гетероцепной полиамид формулы
-[-CH2-CH2-CONH-]n-, образующийся в результате полимеризации
мономера по анионному механизму [38].
При повышенных температурах а а и МАА в отсутствие инициаторов
способны подвергаться спонтанной полимеризации как в массе рас-
плавленного мономера, так и в растворе ДМФА, очевидно, за счет
гомолитического распада полипероксидов, образующихся при взаимо-
действии этих мономеров с кислородом воздуха [39]. Образование
полипероксидов способствуют повышенная температура и УФ-облу-
чение. В воде полипероксиды легко распадаются, инициируя поли-
меризацию [40].
В водных растворах полипероксиды образуются только в присут-
ствии инициаторов [41]. При этом полимеризации мономера предшест-
вует индукционный период, в течение которого происходит образо-
вание полипероксидов. Продолжительность индукционного периода
пропорциональна количеству присутствующего кислорода и обратно
пропорциональна концентрациям мономера и инициатора. В условиях
последующей полимеризации при температурах 60-80 °C полиперок-
сиды стабильны и не оказывают влияния на кинетику процесса.
Образование полипероксидов в присутствии кислорода характерно
36
и для предварительно подвергнутого у-облучению при -196 °C трет-
бутилакриламида [25].
Известно [42], что полимеризация в массе расплавленного АА как с
инициаторами, так и в их отсутствие при температурах 90- 150 °C
сопровождается изменением химического состава полимера за счет его
структурирования, связанного с образованием внутри- и межмолеку-
лярных вторично-амидных группировок и выделением аммиака. Для
предотвращения этих процессов, а также с целью увеличения ММ
синтез полимеров АА и других ненасыщенных амидов проводят при
температурах 30-70 °C в присутствии термически разлагающихся
инициаторов, из которых наиболее часто используются ПСК и ПСА
[43-47]. Кроме персульфатов для инициирования полимеризации в
водных растворах используется пероксид водорода, в присутствии
которого скорость процесса существенно зависит от pH среды [48].
Применяются также и некоторые водорастворимые азосоединения,
например 4,4'-азо-бис-(4-цианпентановая кислота) [49] и ее динатрие-
вая соль [50], гидрохлориды 2,2'-азо-бис-(2-амидинопропана) и 2,2'-азо-
бис-(№Лт-диметиленизобутирамидина) [51] и др. В некоторых случаях
используется плохо растворимый в воде ДАК [8, 52].
Возможно протекание полимеризации АА под действием серной,
фосфорной и хлорной кислот с образованием высокомолекулярного
ПАА [53]. В разбавленных водных растворах азотной кислоты АА
также подвергается полимеризация, однако образующийся при этом
продукт подвергается структурированию [54]. Нерастворимые набуха-
ющие в воде полимеры получены и при полимеризации АА в присут-
ствии диоксида азота [55]. Проведение же полимеризации, инициируе-
мой диоксидом азота, в среде ДМФА или ДМСО позволяет синтезиро-
вать водорастворимый ПАА [56]. Инициирующие полимеризацию
радикалы генерируются в таких системах за счет протекания окисли-
тельных процессов.
Взаимодействие АА с нитратами железа (III), лития, никеля, скандия
и церия приводит к образованию комплексов, при разложении кото-
рых возникают активные частицы, инициирующие полимеризацию
[57— 59]. Возможность использования ацетата марганца (III) в качестве
термического инициатора полимеризации АА и МАА показана в рабо-
тах [60, 61]. Ацетат и сульфат кобальта (III) в кислых растворах спо-
собны инициировать полимеризацию АА даже при температурах,
близких к нулю [62].
Полимеризация АА и МАА в кислых водных растворах может
инициироваться комплексами кобальта (III), марганца (III) и меди (II)
[63, 64], перхлоратом таллия (III), железа (II) и ванадия [65], перйода-
том натрия [66], ванадатом аммония [67] и др.
Наибольшее распространение среди возможных способов иниции-
рования полимеризации АА и других ненасыщенных амидов получило
инициирование окислительно-восстановительными системами, исполь-
зование которых позволяет проводить синтез при значительно более
низких температурах и не требует применения сложного аппаратур-
37
ного оформления, необходимого для фото-, радиационного и других
способов инициирования.
К настоящему времени предложено огромное число окислительно-
восстановительных систем. Наиболее широко применяемые из них
состоят из соединений пероксидного типа (особенно солей пероксиди-
сульфокислоты), броматов, хлоратов, перманганатов в качестве окис-
лителя и соединений двух- и четырехвалентной серы (сульфидов,
сульфитов [68-71], бисульфитов, тиосульфатов [72-74], гидросуль-
фитов [75], метабисульфитов [76- 80] и др.) в качестве восстановите-
лей. Возможно также применение в качестве восстанавливающего
компонента аминов [81-89], органических окси- [90-96] и тиокислот
[97- 101], мочевины [102], тиомочевины [ЮЗ], сульфонильных [104] и
других соединений. Описана полимеризация АА в воде с использова-
нием в качестве окислителя хлора, брома, иода, а в качестве восста-
новителя-сероводорода, оксалата калия, 2-метилпропанола-1, серо-
углерода [105].
Многочисленны системы, содержащие в своем составе соли метал-
лов переменной валентности, способные в зависимости от степени
окисления выступать как в роли окислителя, так и восстановителя.
Так, известны системы на основе солей церия (IV) с персульфатом
[106], 2-меркаптоэтанолом [107], оксикислотами [108], глицерином
[109], пинаколом [110] и др. Соли серебра образуют редокс-системы с
персульфатами [111, 112] и пропанолом-2 [113].
Особенно часто для инициирования полимеризации используются
соли железа (И). Соли железа (II) являются восстановителем в редокс-
системах с персульфатами [46, 114]. Хлорид железа (II) совместно с
оксазираном способен инициировать полимеризацию АА в водно-спир-
товом растворе при температурах - 30 +- + 40 °C [115]. Ионы железа (III)
используются в качестве окислителей, например, в системе, содержа-
щей органическую кислоту и метабисульфит натрия [116].
Соли меди также широко используются в качестве компонентов
инициирующих систем. Реакции, протекающие в тройной системе
персульфат-метабисульфит- сульфат меди (II), изучены в работе
[117], из которой следует, что система является частично обратимой,
поскольку восстанавливаемые бисульфитными ионами ионы меди (II)
превращаются в ионы меди (I), а затем окисляются персульфатом снова
до ионов меди (II). В результате в системе появляется дополнительное
по сравнению с системой персульфат-метабисульфит количество
радикалов, инициирующих полимеризацию.
Перечисление окислительно-восстановительных систем, исполь-
зующихся для инициирования полимеризации АА и родственных ему
амидов, представленное в данном разделе, является далеко не пол-
ным ввиду их большого и все возрастающего количества. Закономер-
ности инициирования окислительно-восстановительными системами,
как правило, являются более сложными, чем при использовании
термически разлагающихся инициаторов, и кинетические параметры
процесса часто являются функцией концентраций компонентов систе-
мы, pH среды и других факторов.
38
2.1.2. Кинетические особенности полимеризации в воде,
водно-органических и органических средах
Скорость полимеризации АА и других ненасыщенных амидов
определяется температурой, pH среды, природой используемого
растворителя, наличием в системе комплексообразователей, поверх-
ностно-активных веществ, агентов передачи цепи и др.
В большинстве работ, посвященных изучению кинетики полимери-
зации АА и других ненасыщенных амидов, констатируется первый
порядок полимеризации по концентрации мономера. Однако поли-
меризация А А может описываться уравнением с порядком по моно-
меру, превышающим единицу, что объясняется эффектом клетки [44,
45], диффузионным контролем протекания элементарных стадий
процесса [118, 119] и образованием комплекса АА с инициатором,
обусловливающим участие мономера в стадии инициирования [47, 96].
Отмечено [120], что кинетический порядок по мономеру зависит от его
концентрации и составляет 1 при [M]q = 0,3 - 0,7 моль/л и 1,3 при [M]q <
< 0,7 моль/л. Согласно же данным, приведенным в работе [121], при
концентрациях АА, меньших ~ 0,5 моль/л, сохраняется первый поря-
док полимеризации по мономеру, при увеличении же его содержания
порядок возрастает, что может быть связано с увеличением вязкости
исходных растворов и вызванным им ростом соотношения k^/kg’5.
Кроме того, константы элементарных стадий полимеризации могут
меняться и в результате изменения характера ассоциации мономера в
растворах различной концентрации. Различие порядков по АА при
полимеризации в концентрированных и разбавленных растворах
наблюдалось и в других работах [69]. Непостоянство кажущихся
констант скорости элементарных стадий кр и к0 при варьировании
концентрации мономера является первопричиной осложненного
характера процессов (со)полимеризации в системах с участием в
качестве (со)мономера АА и его производных. Кинетический порядок
по инициатору, а в случае фото- и радиационного инициирования-по
интенсивности облучения в большинстве случаев близок к 0,5.
Влияние температуры. Зависимость скорости полимеризации от
температуры характеризуется энергией активации элементарных
стадий процесса. Для полимеризации, описываемой классическим
кинетическим уравнением, суммарная энергия активации Е& равна
Бр + 1/2(Би - Ео). При фото- и радиационном инициировании энергия
активации стадии инициирования практически равна нулю и Ей =
= Ер- 1/2 Ео. Значения энергии активации роста и обрыва цепи при
полимеризации АА в воде, вычисленные на основании данных, пред-
ставленных в табл. 2.1, равны и составляют 11-12 кДж/моль [5, 8], а
суммарная энергия активации процесса при фото- и радиационном
инициировании равна 5,5- 6,0 кДж/моль, откуда следует, что влияние
температуры на скорость полимеризации очень мало. Энергии акти-
вации и обрыва цепи при фотосенсибилизированной пероксидом
водорода полимеризации МАА в кислом водном растворе составляют
39
15,5 и 16,8 кДж/моль соответственно [122], а Е& = 7,1 кДж/моль. При
вещественном инициировании полимеризации энергия активации
полимеризации при использовании гомолитически разлагающихся
инициаторов значительно больше-60-80 кДж/моль, а при окисли-
тельно-восстановительном инициировании - 20- 40 кДж/моль.
Влияние pH. В отличие от наблюдаемых при полимеризации мало-
полярных мономеров, кинетические параметры полимеризации АА и
других амидсодержащих мономеров существенно зависят от pH среды.
Влияние pH среды на скорость полимеризации может быть обуслов-
лено изменением скорости вещественного инициирования при различ-
ной концентрации ионов водорода в растворе. Известно, например, что
распад широко применяемого в качестве инициатора ПСК существенно
ускоряется в кислых растворах по сравнению с распадом в нейтраль-
ных и щелочных средах [124]; изменение pH ведет к изменению ско-
рости инициирования, а следовательно, и скорости полимеризации
мономеров, инициируемой пероксидом водорода [48], перйодатом
натрия [66] и различными окислительно-восстановительными система-
ми [68, 781.
С другой стороны, при полимеризации АА в растворах с различными
pH в значительной степени изменяются и скорости протекания элемен-
тарных реакций роста и обрыва цепи (табл. 2.1 и 2.2).
Из данных табл. 2.2 можно заключить, что повышение кислотности
среды интенсифицирует как реакции роста, так и реакции обрыва
цепи. Соотношение же констант kp/fc®’5 в зависимости от величины pH
меняется незначительно, что определяет практически постоянную
скорость процесса в средах с разным pH при условии независимости
скорости инициирования от этого параметра.
Влияние природы растворителя. Частичная или полная замена воды
на органический растворитель приводит, как правило, к замедлению
полимеризации и снижению ММ полимеров (табл. 2.3). Эта тенденция
проявляется в тем большей степени, чем меньшей способностью
растворять АА и образовывать с ним водородные связи обладает
растворитель.
При исследовании полимеризации АА в воде, метаноле и водно-ме-
танольных смесях показано, что скорость гомогенной полимеризации
в смеси вода-метанол (8,5:1,5) несколько ниже, чем в воде. Дальней-
шее увеличение доли метанола в смеси (3:7 и 1:4) приводит к смеще-
нию реакции в гетерогенную область и к существенному ее замедле-
нию, одновременно наблюдается снижение ММ полимера [21, 126], что
объяснено авторами протеканием в системе реакции передачи цепи на
метанол.
Полимеризация N-замещенных метакриламидов в метаноле и ДМСО
изучена в работе [127]. Порядок реакции полимеризации по мономеру
зависит от природы растворителя и вязкости реакционной смеси и не
зависит от типа заместителя при атоме азота у мономера, порядок по
инициатору (ДАК) во всех случаях равен 0,5. Скорость полимеризации,
отношение кр/к%>5 и эффективность инициирования уменьшаются в
40
Таблица 2.1. Значения констант скорости роста и обрыва цепи при полимеризации
акриламида, метакриламида и К,Н-диметилакриламида
в воде при различных температурах
Мономер, среда г, °C кр-104, л/(моль • с) fco'lO6. л/(моль с) Vfco’5 Л °’^(моль -с)°>5 Библиогр. источник
АА, рН7 5,5 7,9 600 3,2 [5]
19,0 9,4 720 3,5 [5]
29,7 11,7 900 3,9 [5]
МАА в кислой среде 10,5 0,056 11,9 0,16 [123]
15,0 0,65 12,9 0,18 [123]
25,0 0,080 16,5 0,20 [123]
39,5 0,103 23,1 0,21 [123]
М,М-Диметилакрил- амид в кислой среде 50,0 1,1 19,0 4,0 [122]
Таблица 2.2. Значения кинетических параметров полимеризации АА в водных растворах
в зависимости от pH и температуры
Г, °C pH fcp-10-4, л/(моль-с) ко-106, л/(моль • с) Mfco’5- Л °>5/(моЛЬ-с) 0,5 Библиогр. источник
25 0,1 1,8 14,5 4,2 [26]
25 1,0 1,7 ±0,3 16,3 ±0,7 4,3 ±0,2 [120]
25 5,5 0,6 ±0,1 3,3 ±0,6 3,3 ±0,3 [120]
25 13,0 0,4 ±0,1 1,0 ±0,2 4,0 ±0,5 [120]
19 — 0,82 ±0,42 5,51 ± 0,39 3,5 [8]
30 7 7,9 ± 0,5 660 ±40 3,3 [125]
5 13 3,2 150 2,6 [5]
19,3 13 4,3 170 3,3 [5]
30,0 13 5,8 200 4,1 [5]
Таблица 2.3. Влияние растворителя на скорость полимеризации АА и ММ полимера
([М]о = 2,5 моль/л, [у] = 4000 рад/мин, 20 °C) [10]
Растворитель | Vn, %/мин 1 Мп-10"5 | j Растворитель | тп, %/мин | Мп-10-5
Вода 9,4 4,62 Диоксан 1,44 0,32
Уксусная кислота 8,0 2,98 Толуол (80 °C) 0,96 0,37
Метанол 3,38 1,76 Ацетонитрил 0,52 0,20
Диметилформамид 1,58 0,32
41
последовательности N-фенилметакриламид > N-этилметакриламид >
> N-бутилметакриламид.
При проведении полимеризации АА и МАА в различных раство-
рителях выявлено снижение скорости полимеризации в ряду вода >
> ДМСО > ТГФ, основной причиной которого служит уменьшение
отношения kp/k®>5 [8]. Значительные различия в величинах kp/k®>5 при
полимеризации этих мономеров отмечены и для ряда других раство-
рителей (формамид, диоксан) и их смесей с водой [5, 52, 128]. Отмече-
но, что добавки небольших количеств воды к раствору АА в ДМСО
позволяют заметно повысить скорость полимеризации и вязкость
растворов полимеров [52, 129]. В случае же полимеризации N, N-ди-
метилакриламида добавки воды не оказывают заметного влияния на
скорость образования полимера в среде этанола [128]. Предположено
[130, 131], что роль воды при полимеризации А А связана с сольватаци-
ей его растущих цепей, ограничением столкновений между растущими
макрорадикалами и обрывом цепи. Изменение состава смеси вода-
ДМСО оказывает сильное влияние на значение кинетических парамет-
ров полимеризации АА (табл. 2.4), причем наблюдается более значи-
тельное уменьшение кр, чем к0, с увеличением доли ДМСО в реакцион-
ной смеси. Более высокие значения кр в водных растворах свидетель-
ствуют о большей реакционной способности в них акриламидного
радикала, а также меньшей степени автоассоциации мономера. В
растворах ДМСО сольватация молекул АА ниже, чем в воде, в связи с
чем мономер в них существует в виде ассоциатов, на разрушение
которых при полимеризации затрачивается дополнительная энергия,
что выражается в увеличении энергии активации роста цепи при
переходе от водных растворов к растворам в ДМСО. Согласно [125], в
твердом состоянии АА существует в виде димера. В водных же раство-
рах, вследствие образования водородных связей с водой, димер
распадается на молекулы. В то же время в формамиде и ДМСО АА в
некоторой степени димеризуется, на что указывают теплоты растворе-
ния, равные -12,2, -10,5 и -4,6 кДж/моль в воде, формамиде и ДМСО
соответственно и характеризующие степень разрыва водородных
связей в димере.
Таким образом, взаимодействием между молекулами растворителя
и мономера или макрорадикалами можно в принципе объяснить
влияние растворителя на кинетику полимеризации в различных
средах. Кинетические параметры полимеризации АА в разных раство-
рителях представлены в табл. 2.5. Следует отметить, что если к? не
зависит от вязкости исходной реакционной смеси, то между к0 и
вязкостью существует определенная зависимость. Так, минимум к0
при полимеризации АА в смесях ДМСО - вода соответствует макси-
муму вязкости исходной смеси (ДМСО:вода = 35:65). Однако нелиней-
ность зависимости к0 от вязкости раствора указывает на то, что диф-
фузионный контроль является не единственным фактором, опреде-
ляющим скорость обрыва цепи.
Основываясь только на выводах о влиянии природы растворителя
42
Таблица 2.4. Кинетические параметры полимеризации АА в смесях вода — ДМСО (20 °C,
фотоинициирование, ДАК) [8]
Н2О:ДМСО кр-юЗ | Ар-107 ко-io7 i i lo-io’ Eq, кДж/моль
л/(моЛЬ’С) лДмоЛЬ’С)
100:0 66,6 0,8 11,7 55,1 68 11,7
88:12 31,5 2,6 16,3 26,8 23 10,9
65:35 14,1 3,3 18,9 6,5 5,7 10,9
38:62 5,4 2,4 20,5 8,8 2,3 15,1
0:100 2,5 7,8 25,1 16,7 0,17 0
Таблица 2.5. Параметры роста и обрыва цепи при полимеризации АА в разных средах
(30 °C, фотоинициирование, ДАК) [125]
Растворитель V104 Ар-107 ЕР’ кДж/моль ко-10Ь ( Ао-1010 Бо> кДж/моль
л/(мс )ЛЬ-с) л/(м оль°с)
Вода (pH 7) 7,9 0,8 И.7 6,6 6,8 11,7
Вода (pH 13) 5,8 2,2 15,1 2,0 0,097 4,2
Формамид 1,2 4,4 21,0 2,3 0,072 3,4
Вода:ДМСО - 90:10 4,3 2,4 15,9 3,5 2,87 10,9
Вода:ДМСО = 95:5 1,9 3,3 18,9 0,8 0,57 10,9
Вода:ДМСО = 38:62 0,7 2,4 20,5 1,0 0,23 8,0
ДМСО 0,37 7,8 25,1 1,7 0,017 0
Вода:диоксан = 95:5 5,7 1,9 14,7 4,5 3,4 10,9
Вода:диоксаи = 90:10 3,3 3,4 17,6 2,3 1,5 10,5
Вода:ТГФ = 96:4 4,1 2,4 15,9 3,2 2,9 11,3
Вода:ТГФ = 92:8 2,3 5,0 19,3 1,6 1,2 10,9
Вода:ТГФ = 90:10 1,9 5,0 19,3 1,4 1,2 10,9
Вода:ДМСО:беизол = 1,4 — — 0,7 — —
= 64,4:34,7:0,9 Вода:ДМСО:беизоп = 0,48 — — 0,7
- 36,8:59,9:3,3 ДМСО:беизол = 95:5 0,24 - - 1,4 - -
на константы скорости реакций роста и обрыва цепи, нельзя, однако,
объяснить столь значительное уменьшение скорости полимеризации
АА и ММ полимеров при введении в водные растворы малых коли-
честв органических растворителей. Трудно предположить, что малые
добавки растворителей могут существенным образом увеличить сте-
пень ассоциации молекул мономера или уменьшить число активных
акриламидных радикалов, образовавшихся за счет взаимодействия с
протонами воды. Очевидно, что роль таких добавок заключается в
изменении степени свернутости макрорадикалов в полимерном
клубке. Вискозиметрические исследования растворов ПАВ в различ-
ных средах свидетельствуют об уменьшении приведенной вязкости
(рис. 2.1), а следовательно, уменьшении размеров полимерного клубка
при переходе от воды к ее смесям с ДМСО, диоксаном и ТГФ. Увеличе-
ние же плотности полимерного клубка ведет к снижению реакционной
43
Рис. 2.1. Зависимость приведенной вязкости раствора ПАА с Яп = 2,09-II)6 от концентра-
ции в воде (1) н в смесях вода — ДМСО 8:2 (2), 6:4 (3), 5:5 (4) [129]
Рис. 2.2. Зависимость относительной скорости полимеризации АА в растворе ДМСО (а) и [т| j
(в воде) образующегося полимера (б) от концентрации LiBr (3), LiCl (2), CaClj (1)и ZnCl? (4)
([АА] = 0,5 моль/л; [ДАК] = 3-10-3 моль/л, 30 °C) [132]
способности макрорадикалов, выражающейся в уменьшении значений
кр ик0 [125].
Влияние комплексообразователей. Кинетические параметры поли-
меризации АА могут существенно изменяться при наличии в системе
комплексообразующих агентов. Чаще всего в роли комплексообразо-
вателей выступают галогениды лития и щелочноземельных металлов
[132, 133]. Влияние таких солей на полимеризацию А А зависит от при-
роды растворителя и обусловлено образованием комплексов между
солью - с одной стороны и макрорадикалом и мономером - с другой.
Полимеризация АА в органических растворителях резко ускоряется
при введении в них небольших количеств LiCl, LiBr и CaClj. Кривая за-
висимости скорости полимеризации от содержания соли имеет мак-
симум (рис. 2.2, а), величина и положение которого определяются по-
лярностью растворителя. Добавление LiBr в водный раствор не отра-
жается на скорости процесса. Значения константы скорости роста при
полимеризации АА в ДМСО с увеличением содержания LiCl и LiBr
проходят через максимум, обусловленный конкурирующим влиянием
повышения реакционной способности закомплексованных макроради-
калов и изменения конформации макромолекул и размера клубка при
добавлении больших количеств соли, приводящих к снижению скорос-
ти взаимодействия растущей части с мономером [132]. Скорость поли-
меризации в ДМСО под действием различных солей увеличивается в
ряду LiBr < LiCl < CaClj, а порядок реакции полимеризации по кон-
центрации соли меняется от 0 до 2 в зависимости от соотношения
реагентов. Обрыв цепи в системах, содержащих LiCl, LiBr и CaClj и
имеющих вязкость больше вязкости ДМСО без добавок (рис. 2.2,6),
лимитируется диффузией, а также изменением конформационных
характеристик молекул под действием солей. Введение ZnClj в этих
44
условиях на скорость полимеризации влияния не оказывает [133]. В
среде же полярных органических растворителей (кетоны, спирты) эта
соль в результате комплексообразования с А А и N-метилолакрилами-
дом меняет основные параметры полимеризации, увеличивая скорость
процесса и ММ полимеров [134].
Относительно влияния солей калия и натрия на полимеризацию АА
литературные данные носят противоречивый характер: так, например,
указывается, что введение солей NaCl, КС1, Na2SC>4 и NaF в водные
растворы приводит к снижению общей скорости полимеризации [93, 98,
100], в то же время, по данным [135], введение в систему NaCl или
Na2SO4 в количествах от 1% до насыщения способствует увеличению
скорости полимеризации и ММ. Ацетат натрия, добавленный в систему
при полимеризации АА под действием ПСК в воде и водно-толуольных
эмульсиях, образует с растущими макрорадикалами комплексы,
обусловливающие рост fcp, одновременно способствуя уменьшению
размеров макромолекулярных клубков ПАА. Вследствие этих конку-
рирующих воздействий зависимость начальной скорости полимериза-
ции АА имеет максимум в интервале концентраций ацетата натрия от
0,012 до 0,12 моль/л [136,137].
Введение в полимеризационную систему комплексообразователей
(салицилат и фторид натрия, этилендиаминтетрауксусная кислота и
ее динатриевая соль и др.), связывающих ионы железа и других метал-
лов, способствует в зависимости от типа используемого инициатора
либо увеличению, либо уменьшению скорости инициирования и всего
процесса в целом [93, 100, 138].
Влияние ПАВ. Согласно имеющимся в литературе данным, до-
бавление ПАВ может отражаться как на скорости гомогенной полиме-
ризации АА, так и на ММ образующихся в этих условиях полимеров.
Установлено [139], что все типы ПАВ при содержании ниже крити-
ческой концентрации мицеллообразования (ККМ) не влияют на поли-
меризацию (ПСК, 50 ’С). При концентрациях, превышающих ККМ,
катионные ПАВ, в отличие от неионогенных и анионных, снижают
скорость полимеризации. При этом замедляющий эффект ПАВ и поря-
док реакции по мономеру возрастают с увеличением длины углево-
дородного заместителя в молекуле ПАВ (рис. 2.3).
С другой стороны, показано, что инициируемая редокс-системой
полимеризация АА замедляется катионными ПАВ. Это объясняется
сорбцией первичных радикалов на поверхности положительно заря-
женных мицелл и уменьшением скорости инициирования. Роль анион-
ных ПАВ, ускоряющих процесс при концентрациях, превышающих
ККМ, сводится, видимо, к повышению pH среды, что влечет за собой
рост скорости генерирования радикалов данной редокс-системой.
Уменьшение скорости и ММ в присутствии неионогенных ПАВ объясне-
но протеканием реакций передачи цепи на эти добавки [140].
По данным [141], катионные ПАВ увеличивают скорость полимериза-
ции, инициируемой ПСК при температурах 10-20 °C. Увеличение
объяснено активирующим действием ПАВ на образование комплекса с
45
Рис. 2.3. Зависимость начальной скорости полиме-
ризации от концентрации АА в отсутствие (1) и в
присутствии 0,0484 М додецил- (2), тетрадецил- (3) и
гексадецилтриметиламмонийбромида (4) [139]
переносом заряда между мономером и инициатором, который распада-
ется на радикалы, инициирующие полимеризацию.
Некоторые ПАВ принимают участие в окислительно-восстановитель-
ных реакциях с инициатором. Так, неионогенный ПАВ (синтамид-5)
реагирует с персульфатом по схеме [142]:
S20g~ + ~ СН2-О-СН2 ~ - HSO4 + SOf + ~ СН2-О-СН ~
Участие ПАВ в стадии инициирования полимеризации отмечено в
ряде работ, например [143]. Увеличение скорости процесса и снижение
степени полимеризации наблюдалось в системе, инициированной
персульфатом, и под действием анионных ПАВ. При этом уменьшается
значение энергии активации [143], что свидетельствует об изменении
механизма инициирования процесса. Возникновение же радикала в
макромолекуле неионогенных ПАВ в результате взаимодействия с
инициатором или передачи цепи обусловливает возможность привив-
ки акриламидной цепи к ПАВ, что отражается на свойствах получаю-
щегося полимера [144].
Введение в полимеризационную систему, инициируемую бисульфи-
том натрия, катионного ПАВ- цетилтриаммонийбромида- приводит к
ускорению процесса и увеличению ММ. Причиной увеличения скорос-
ти, вероятно, является интенсификация инициирования при образова-
нии мицеллярного комплекса ПАВ с бисульфитом и взаимодействие
его с АА. Связывание же бисульфита - активного агента передачи
цепи - в комплекс с ПАВ обусловливает увеличение ММ полимера
[145].
При полимеризации N, N-метилен-бис-акриламида в разбавленных
водных растворах присутствие анионных ПАВ приводит к снижению
скорости процесса (в отличие от катионных ПАВ, ускоряющих полиме-
ризацию). Обнаруженный эффект объяснен действием электростати-
ческих сил [146].
Из вышеизложенного следует, что влияние ПАВ на гомогенную по-
лимеризацию АА обусловлено сочетанием различных факторов, таких
как возможность участия ПАВ в инициировании вследствие образова-
46
ния ряда комплексов и редокс-систем с компонентами смеси, сорбция
их на поверхности мицеллы, а также электростатические эффекты.
Влияние вязкости. Проведение гомогенной полимеризации обуслов-
ливает многократное по сравнению с исходной смесью возрастание
вязкости реакционного раствора. Между тем известно, что элементар-
ные стадии полимеризации, особенно стадия обрыва цепи, диффузион-
но контролируемы, что выражается в уменьшении констант скорости
элементарных реакций и изменении кинетики процесса в целом.
При исследовании гомогенной полимеризации АА, МАА и N-гидрок-
симетилметакриламида, инициируемый УФ-облучением, в воде и
глицерине отмечено [6], что полимеризация в глицерине протекает с
более высокой скоростью, а образующиеся в нем полимеры обладают
большей ММ. Причина наблюдаемого эффекта заключается, видимо, в
воздействии диффузионных факторов'на обрыв, а возможно, и на рост
цепи. Снижение температуры синтеза с 40 до 1 °C, способствующее
увеличению вязкости исходной смеси примерно в 20 раз, при сохране-
нии постоянной скорости инициирования в еще большей степени
замедляет диффузию макрорадикалов и приводит к увеличению ММ.
В ходе глубокой полимеризации АА под действием ПСК по мере
накопления в системе полимера и увеличения вязкости наблюдается
„скрытый гель-эффект”, выражающийся в постепенном росте соотно-
шения fcp/k®’5 при одновременном уменьшении скорости инициирова-
ния. [т] ] полимеров, образующихся на различных степенях превраще-
ния мономера, практически не меняется, хотя при отсутствии диффу-
зионного контроля длина кинетической цепи по мере расходования
АА должна уменьшаться [43]. Следует, однако, отметить, что сохране-
нию постоянной [и] полимеров может способствовать протекание в
системе межмолекулярного сшивания макромолекул за счет образова-
ния вторично-амидных группировок [43] и реакций передачи цепи на
полимер.
Понижение константы скорости обрыва цепи с ростом вязкости сис-
темы при полимеризации АА отмечено и в ряде других работ [125, 133].
Адиабатическая полимеризация. С целью сохранения высокой
скорости полимеризации на глубоких степенях превращения, умень-
шения количества остаточного мономера, а также для предотвращения
нежелательных процессов структурирования ПАА полимеризацию
проводят в адиабатическом режиме [44, 69, 79, 80, 117, 147, 148]. По-
вышение температуры смеси за счет теплоты, выделяющейся при
полимеризации, способствует снижению вязкости системы, несмотря
на увеличение концентрации в ней полимера; макромолекулы приоб-
ретают большую гибкость и подвижность. Гель-эффект при этом смеща-
ется в область глубоких превращений или исчезает вообще. Длина
кинетической цепи с ростом температуры и с уменьшением концентра-
ции мономера уменьшается, что также обусловливает повышение вяз-
кости в меньшей степени, чем при изотермическом режиме. Снижение
ММ полимера обеспечивается и возрастающей ролью реакций передач!;
цепи на мономер, инициатор и другие низкомолекулярные компонен-
ты системы.
47
Анализ кинетики процесса адиабатической полимеризации прове-
ден в работах [147, 148]. Количественное описание полимеризации в
адиабатическом режиме основано на допущениях о равенстве тепло-
емкостей мономера и полимера, отсутствии испарения воды из реакци-
онного сосуда и отсутствии потерь тепла в окружающую среду [147].
На основании данных об изменении температуры смеси в ходе
процесса, которое описывается уравнениями [69]:
dT/dT = Коехр[-(Д£а/й)(1/Т- 1/Г0)](Д Г)°([М]0/Д Гтах)«-1[1]ь,
или [117]: .
dT/dT=yM]“[I]b ехр(-£сумт
где Г = Ттахе(А. а и Ь — кинетические порядки полимеризации по мономеру и инициа-
10₽у: ' WW2
определяют концентрации мономера в любой момент времени. При
этом конверсия за время полимеризации определяется выражением
P = (Tf-r0)/(Tmax - Го),
где Tq, Гтах и Г — температуры реакционной массы — начальная, максимальная и в
момент времени t.
Начальная скорость адиабатической полимеризации АА, иницииру-
емой редокс-системой ПСК - бисульфит (БС) [69], описывается уравне-
нием с порядками по мономеру, ПСК и БС 1,53; 0,53; 0,47 соответствен-
но. Изменение концентрации мономера в ходе реакции подчиняется
зависимости
dM/dt= 99,7ехр[5767(1/303,6- 1/Т)][М]^53[ПСК]0>53[БС]°Л7,
где концентрации измеряются в моль/кг, температура — в К; время — в мин.
Кинетические порядки полимеризации в концентрированных
водных растворах АА, инициируемой системой ПСК - метабисульфит
[77], составляют 1,37 по АА, 0,53 по ПСК и 0,44 по метабисульфиту, что
хорошо согласуется с данными по адиабатической сополимеризации
АА с метилсульфатом 2-метакрилоксиэтилтриметиламмония [149], и
близки к значениям этих величин для изотермической полимериза-
ции.
В присутствии трехкомпонентной инициирующей системы скорость
адиабатической полимеризации в концентрированных водных раство-
рах АА описывается уравнением [117]
-dM/dt = kn[M]1>27[nCK]0>46[Na2S2O5]0’51[CuSO4]0’40.
Суммарная энергия активации уменьшается с увеличением концен-
трации CuSO4-
Изменения ММ полимеров в зависимости от концентрации мономе-
ра и компонентов инициирующей системы носят тот же характер, что и
при изотермическом режиме полимеризации, т.е. ММ растет с увели-
£ЯЯ],М0Л1гЛ~’
Рис. 2.4. Зависимость средневязкостной молекулярной массы от концентрации K2S2OJ
(1)> (2), АА (3) и C11SO4 (4’5) для инициирующих систем Naj^O; — C11SO4 (а) и
KjSjOg-Na^Os -C11SO4 ^Л1171
чением концентрации мономера и с понижением концентрации иници-
атора. Это, в частности, подтверждается данными [117] (рис. 2.4).
Влияние содержания №28265 на ММ можно объяснить усилением
передачи цепи с участием ионов HSO^, образующихся при взаимо-
действии метабисульфита с водой. Уменьшение ММ с ростом концент-
рации CuSO4 обусловлено протеканием обрыва макрорадикалов на
ионах меди (см. ниже).
Следует отметить, что при синтезе в адиабатическом режиме
ММР ПАА существенно шире, чем у полимеров, получаемых при
неизменной температуре.
2.1.3. Факторы, определяющие молекулярную массу полимера
ММ полимеров и соответствующая ей степень полимеризации
определяются рядом факторов - прежде всего соотношением скорос-
тей роста цепи и инициирования, способом обрыва цепи, а также
протекающими в системе реакциями передачи цепи на мономер,
растворитель, инициатор, различные примеси и специально вводимые
добавки.
Количественная зависимость среднечисленной степени полимери-
зации (Рп) от перечисленных выше параметров описывается уравнени-
ем _ п
1/Рц = [(1 + X)vH/2vn] + kM + ks[S]/[M] + ki[I]/[M] + *аДА,]/[М].
Обрыв цепи при полимеризации АА, согласно [49, 119, 150, 151],
происходит путем диспропорционирования макрорадикалов, т.е. при
49
Таблица 2.6. Значения к м при полимеризации АА в воде
г, °C kM'105 Библиогр. источник t,‘C км’!»5 Библиогр. источник
18 4,4 [153] 30 6,8 [153]
25 0,79 [44] 40 1,2 [44]
25 1,2 [26] 50 1,45 [И9]
25 1,6 [49] 50 1 [156]
25 2,0 [154] 60 6,0 [154]
25 2,0 [155] 60 1,2 [152]
25 7,8 [153]
а = 1. Однако в работе [152], исходя из данных о ММР ПАА, по методу
Куо установлено, что 74,6% макромолекул образуется в результате об-
рыва макрорадикалов рекомбинацией и только 25,4%- при диспропор-
ционировании и передаче цепи.
Константы передачи цепи на АА (код) определялись разными авто-
рами (табл. 2.6), однако их значения колеблются в широких пределах
(км, найденные в работах [157 - 160], в таблице не указаны).
Интенсивность протекания в системе реакции передачи цепи на
мономер обусловливает максимально возможную степень полимери-
зации, которая в отсутствие других реакций передачи цепи и скорости
полимеризации, стремящейся к нулю, равна величине, обратной км:
IimPn= 1/км.
vn -* 0
Исходя из данных табл. 2.6, максимально возможная Мп ПАА,
синтезируемого при 25 'С в массе, составляет от 3,5 до 9 млн. Повыше-
ние температуры синтеза приводит к увеличению км и снижению Мп.
Между тем, по приводимым в литературных источниках данным
ММ ПАА может составлять 20 - 30 млн. Причин, обусловливающих это
несоответствие, по-видимому, несколько. Следует иметь в виду, что
для .высокомолекулярных полимеров, как правило, определяют Ми
или// q, численные значения которых тем больше превышают величи-
ну Мп, чем шире ММР полимера. В свою очередь, увеличению полидис-
персности, выражающемуся в росте доли высокомолекулярных фрак-
ций, способствуют реакции, ведущие к образованию редких межмоле-
кулярных сшивок или разветвлению цепи. К первому типу реакций
можно отнести образование вторично-амидных мостиков между
макромолекулами и реакции, протекающие при наличии в мономере
примесей или специально вводимых сополимеризующихся соедине-
ний, в состав которых входят две двойные связи (типа метилен-бис-ак-
риламида) или функциональные группировки (типа метилольных
производных), способные реагировать с амидами, а также несополиме-
ризующихся веществ, например альдегидов, реагирующих с амидными
группировками и образование которых возможно in situ в результате
50
превращений компонентов некоторых редокс-систем [84, 87]. К развет-
влению же макромолекул приводит реакция передачи цепи на поли-
мер, особенно интенсивно протекающая на глубоких степенях прев-
ращения. Вероятно, передача цепи на полимер осуществляется посред-
ством отрыва водорода от атомов углерода, находящихся в а -положе-
нии по отношению к амидной группе. Подвижность таких атомов
особенно возрастает в кислых средах благодаря оттягиванию элект-
ронной плотности к протонированной амидной группе. В щелочных же
растворах передача цепи на полимер происходит в значительно мень-
шей степени, что и используется для получения водорастворимых
полимеров в концентрированных водных растворах. Косвенно об
уменьшении разветвленности ПАА в щелочных растворах свидетельст-
вуют данные о невозмущенных размерах полимерных клубков [161].
Передача цепи на инициатор вносит небольшой вклад в уменьшение
ММ полимеров ввиду малых его концентраций в реакционной массе.
Известно, что широко используемый инициатор ДАК не способен к
передаче цепи. Константы передачи цепи на ПСК составляют 4,12 • 10-4
при 25 °C и 2,63-10-3 при 40 °C [45], 2,6-10~2 при 50 °C, на
4,4'-азо-бис-(4-цианпентанат натрия) - 8,5ф10~3 при 50 °C [156], а на
пероксид водорода - 5 * 10~4 при 25 °C [26].
При использовании воды в качестве растворителя передача цепи на
нее невелика: по данным [150], константа передачи цепи на воду
(^н2о) практически равна нулю, в [85] указывается величина 10~7.
Согласно другим работам, ^нгО имеет ббльшие значения: 1,2 * 10—5 [26]
и 2’10-5 [96]. Константы передачи цепи на различные органические
соединения, использующиеся в качестве растворителей и регуляторов
роста цепи (метанол, пропанол-2, диоксан), а также вещества, специ-
ально в полимеризационную смесь не добавляемые, но присутствую-
щие в ней в виде примесей в мономере, представлены в табл. 2.7.
Установлено, что органические примеси в АА, синтезируемом путем
гетерогенно-каталитической гидратации акрилонитрила (ТКА, ацетон,
этиленциангидрин, 2,2'-дициандиэтиловый эфир, ацетонитрил, му-
равьиная кислота), наряду с уменьшением ММ в той или иной степени
обусловливают замедление полимеризации. Наиболее нежелательными
примесями в АА, предназначенном для получения высокомолекуляр-
ных полимеров, являются ацетон и 2,2'-дициандиэтиловый эфир [166].
Еще более существенное влияние на проектирование полимериза-
ции АА и родственных ему мономеров оказывают ионы металлов пере-
менной валентности, таких как железо, медь, церий, хром, никель и
др. В зависимости от способа инициирования и типа используемого
инициатора ионы металлов способны как увеличивать, так и умень-
шать скорость полимеризации. Ускорение полимеризации наблюдается
в тех случаях, когда ионы металлов способствуют генерированию
радикалов, например при образовании ими смеси с компонентами
редокс-системы или при гомолитическом разложении солей под
действием тепла, света или других физических факторов [28, 60, 79].
Замедление же процесса связано с активно протекающими реакциями
51
Таблица 2.7. Константы передачи цепи на органические соединения
при полимеризации АА в воде
Агент передачи цепи t, "С кА Библиогр. источник Агент передачи цепи f,°C кА Библиогр. источник
Метанол 30 1,3-IO”5 [21] Пропионамид 50 7,0-10—5 [159]
Пропанол-2 30 2,0-10-4 [162 70 1,3-10-4 [159]
50 6,9-10-4 '163] Ацетонитрил 50 5,5-10-4 [165]
Диоксан 60 6,7-10-3 [65] Этиленциангидрин 30 3,8-10-3** [166]
ТКА 25 1,5-10-3 [18] » 35 6,0-10-4** [161]
» 25 1,1-ю-з [164 » 50 8,6-10—5 [167]
м 50 8,5-10-3 156 2,2' -Дициандиэтило- 50 5,7-10-3 [167]
Пропионамид 25 2,2-10-2* 154 вый эфир
» 60 6,4-10-3* 154: АцеТон 50 3,7-10-3 [167]
Муравьиная 50 1,5-10-4 [167]
* В твердой фазе.
** В водно-щелочных растворах.
обрыва цепи на ионах металлов, сопровождающегося уменьшением
степени окисления иона:
~ CH2CHR + Меп+-* ~CH=CHR + Me(n~1)+ + Н+.
Ионы таких металлов, как медь и железо, содержащиеся в водных
растворах в значительных количествах, ингибируют полимеризацию
АА, что используется для предотвращения спонтанной полимеризации
в процессе синтеза этого мономера. Вычисленные на основании кине-
тических данных полимеризации АА, инициированной азоинициато-
ром, константы ингибирования ионами Cu+, Cu2+, Fe2+ и Fe3+ состав-
ляют при 50 °C 1,46±0,17; 0,40±0,03; 5,8 ± 1,9; 6,3± 1,2 соответственно
[168]. Высокие значения этих величин определяют необходимость
тщательной очистки растворов АА перед его полимеризацией.
Влияние ионов металлов, в частности меди и железа, на ММ ПАА
может быть ослаблено или полностью устранено при введении в
систему хелатирующих агентов, таких как салицилат натрия [138] и
динатриевая соль этилендиаминтетрауксусной кислоты [79].
На ММ и ММР полимеров влияют и такие вторичные факторы, как
деструкции и структурирование, которые в определенных условиях
могут протекать в ходе их синтеза. Преобладание того или иного
направления макромолекулярных реакций, протекающих, как и
полимеризация, по радикальному механизму под действием Х-, у-,
фотооблучения, ультразвука, механических нагрузок и специально
вводимых веществ, определяется концентрацией и ММ полимера: в
разбавленных растворах более интенсивно протекает деструкция [169],
увеличение же концентрации и ММ полимера способствует образова-
нию разветвленных и сшитых структур [170].
52
Таким образом, статистические параметры полимеров, прежде всего
ММ и ММР, являются функцией не только констант элементарных
реакций полимеризации, но и глубины протекания в системе структу-
рирующих и деструктивных процессов. Более подробные сведения о
макромолекулярных превращениях ПАА и аналогичных полимеров
приведены в гл. 3.
2.1.4. Побочные реакции, протекающие при полимеризации
В процессе синтеза (со)полимеров АА возможно протекание различ-
ных побочных превращений, способных оказывать существенное
влияние на кинетику процессов и свойства получаемых полимеров.
Выше уже было отмечено ухудшение растворимости ПАА, получае-
мого при повышенных температурах, вследствие внутри- и межмоле-
кулярной конденсации амидных групп полимера, приводящей к
нарушению линейной структуры полимера за счет включения в основ-
ную цепь шестичленных имидных циклов и образования вторич-
но-амидных мостиков между макромолекулами [42]:
г s
НоСч /СН2
2 ch-co-nh2 + h2n-co-hc
f ;СН2
> h2n-co-hc( —*
U М ГП ЧГ^Н2 3
HoN-CO-nG
2 1
г I
H2CX /СН2
—* CH-CO-NH-CO-HC
r pc-cp/Q^2
HN 4CH2
4OC-CH
$
Активизации таких превращений способствует подкисление водных
растворов. В заметной степени имидизации ПАА протекает при повы-
шении температуры до 75 °C, существенно ускоряется при 85 °C и очень
быстро проходит при 110 °C. ПММА подвергается глубокой имидизации
при 65 °C. Полимеры N-алкилакриламидов таким превращениям
практически не подвержены.
Следует отметить, что сшивание полимера вторично-амидными
группами не является необратимым, поскольку они легко разрушают-
ся при обработке полимера слабощелочным раствором:
~ CONHCO- + NaOH - ~ CONH2 + ~ COONa.
Однако в большинстве случаев такая обработка не позволяет пол-
ностью восстановить растворимость, так как структурирование поли-
мера часто обусловлено не столько этой побочной реакцией, сколько
53
передачей цепи на полимер, приводящей к образованию углерод-угле-
родных связей. Последнюю, тем не менее, нельзя относить к побочным
превращениям, поскольку она является одной из элементарных
реакций полимеризации.
С целью предотвращения сшивания полимеров, синтезируемых в
концентрированных водных растворах, полимеризацию проводят в
присутствии щелочных добавок, которые обусловливают частичный
гидролиз амидных групп (закономерности гидролиза ПАА более
подробно изложены в гл. 3). Аммиак, выделяющийся в результате
гидролиза или специально вводимый в реакционную смесь для улуч-
шения растворимости ПАА, присоединяясь по двойной связи АА,
последовательно образует первичный, вторичный и третичный амины:
АА АА
NH3 + ch2=chconh2 - H2NCH2CH2CONH2 -* HN(CH2CH2CONH2)2 -*
- N(CH2CH2CONH2)3.
Третичный амин (ТКА) оказывает значительное влияние на процесс
полимеризации. Он, в частности, образует с пероксидными инициато-
рами редокс-системы и тем ускоряет инициирование полимеризации и
понижает ММ полимера [171]. В присутствии инициаторов, не образую-
щих с аминами редокс-систем, например азосоединений, ТКА обуслов-
ливает снижение скорости полимеризации АА и ММ ПАА вследствие
передачи цепи на это соединение (см. табл. 2.7). В концентрированных
водных растворах в присутствии щелочей и аммиака ТКА может
образовываться в количествах, достаточных для оказания ощутимого
влияния на кинетику полимеризации и ММ ПАА [171]. По данным [164],
для заметного снижения ММ при полимеризации в 15%-х растворах А А
содержание ТКА должно составлять « 0,2% (мол.) от АА. Следует
отметить, что при использовании в качестве щелочной добавки,
препятствующей сшиванию полимера, карбоната натрия гидролиз
амидных групп и образование ТКА заметно уменьшаются, и примене-
ние этого реагента является более предпочтительным по сравнению с
NaOH или NH3 для получения высокомолекулярного ПАА [80].
По двойной связи АА в слабощелочной среде легко присоединяется
сероводород, образуя 2,2'-тиодипропионамид [172] и сульфит натрия
[173], способные быть компонентами редокс-систем.
Аналогичное действие на полимеризацию, инициируемую пероксид-
ными соединениями, оказывают и другие восстановители (амины,
тиолы, спирты, бисульфит-ион и др.), являясь, с одной стороны, аген-
тами передачи цепи, а с другой - увеличивая скорость инициирования
за счет образования редокс-систем с инициатором. Константы передачи
цепи, определяемые в системах, инициируемых пероксидными соеди-
нениями, как, например, в работах [70, 71, 81, 84, 85], не являются
истинными, поскольку наблюдаемое снижение степени полимеризации
в присутствии добавок обусловлено не только передачей цепи на эти
соединения, но и существенным уменьшением длины кинетической
цепи в результате значительного роста скорости инициирования.
54
Из солей стерически незатрудненных третичных аминов и АА в воде
и органических растворителях в присутствии свободных аминов легко
образуются четвертичные аммониевые соли [174]. Замещенные амиды,
например N-додецилакриламид, при взаимодействии с гидрохлорида-
ми триметиламина и пиридина в метаноле также могут образовывать
четвертичные аммониевые соли [175].
К наиболее нежелательным побочным реакциям, протекающим при
полимеризации, относятся реакции с участием веществ, попадающих в
полимеризационные смеси как примеси в исходных веществах или
вследствие изъянов в технологии и аппаратурном оформлении процес-
са. К ним относятся реакции дополнительного обрыва цепи на ионах
различных металлов, сшивание макромолекул, полученных из раство-
ров АА, содержащих в качестве примеси акролеин, за счет взаимодейст-
вия альдегидных группировок звеньев акролеина с амидными груп-
пировками полимера [167], и другие реакции.
Обобщение приведенных данных позволяет заключить, что продукты
побочных превращений мономера и других компонентов полимериза-
ционных смесей, участвуя в различных процессах, могут изменять
параметры инициирования, обрыва и передачи цепи, а следовательно,
скорость брутто-процесса, длину кинетической цепи, молекулярные и
другие свойства. Некоторые побочные реакции могут приводить к
неконтролируемым отклонениям химического состава и строения
макромолекул (со)полимеров на основе АА.
2.1.5. Технология гомогенной полимеризации
Получение акриламидных полимеров путем гомогенной полимери-
зации АА в водных растворах является исторически первым, наиболее
простым и экологически чистым методом. Полимеры, синтезируемые
этим методом, получают в виде гелей с различной концентрацией
полимера. В случае необходимости сухой полимер из них можно
выделить осаждением органическими растворителями, сушкой пред-
варительно измельченного геля или азеотропной отгонкой воды с
органическими растворителями. В большинстве же случаев стадия
выделения полимера отсутствует и гели ПАА используют как товар-
ный продукт.
Как уже было отмечено выше, при сернокислотном способе получе-
ния АА концентрация его в растворе не превышает 6 - 8%, что и
обусловливает низкое содержание ПАА в готовом продукте. Кроме
того, наряду с полимером в гелях обычно присутствуют значительные
количества сульфата аммония (при аммиачной нейтрализации сульфа-
та АА) или сульфата натрия (при содовой нейтрализации).
Полимеризацию АА в разбавленных водных растворах проводят в
присутствии инициаторов радикального типа, чаще всего используют
редокс-систему ПСА - сульфит натрия при pH 8,0 - 9,5. Реактор пред-
ставляет собой емкостной аппарат с рубашкой и мешалкой. Полимери-
зацию начинают при 20 - 25 °C. По мере протекания реакции темпера-
55
тура достигает 35 - 45 °C. После окончания синтеза реакционная масса
выдавливается из реактора и упаковывается в мешки.
(Со)полимеризацию АА в высококонцентрированных (20 - 45%)
водных растворах, содержащих вещества, препятствующие сшиванию
полимера, можно проводить в тонких слоях (до 20 мм), нанесенных на
стальную пластинку или движущуюся ленту [176 - 179] и др. Для
уменьшения адгезии полимера к подложке в исходный реакционный
раствор добавляют ПАВ [177], Пропанол-2, глицерин [178] и плохо
совмещающиеся с ПАА полиэфиры [179] или предварительно покрыва-
ют стальную ленту пленкой на основе фторсодержащих полимеров.
Инициирование полимеризации осуществляется вещественными
инициаторами, у- и УФ-излучением. Снимаемая с ленты пленка поли-
мера подвергается измельчению и сушке.
При проведении фотоинициируемой полимеризации водный раствор
АА с концентрацией « 50%, освобожденный от кислорода, содержащий
фотосенсибилизатор и другие необходимые добавки, пропускают через
колонный аппарат, охлаждаемый снаружи водой. В зоне, облучаемой
ртутной лампой, раствор движется в виде слоя небольшой толщины в
течение =* 15 мин.
Реакционная смесь при этом приобретает консистенцию пластичной
пленки, которая может быть пропущена через вторую зону облучения,
после чего ее измельчают и сушат. Получаемые таким образом ПАА и
сополимеры АА хорошо растворяются и имеют низкое содержание
остаточного мономера.
Для получения (со)полимеров АА в концентрированных водных
растворах можно использовать и герметичный цилиндрический аппа-
рат, снабженный поршнем, перемещающимся вдоль оси аппарата [180].
Образующийся полимер с вязкостью 103 - 104 Па-с выдавливается
поршнем из реактора и затем поступает на дробление и сушку.
Разновидностью гомогенной полимеризации АА в концентрирован-
ных водных растворах, осуществимой в промышленных условиях,
является процесс с радиационным инициированием, разрабатываемый
в НИФХИ им. Л.Я.Карпова. Получение хорошо растворимых в воде и
обладающих хорошими эксплуатационными свойствами полимеров
достигается путем введения в реакционную смесь различных добавок
(аммиака, гидроксидов щелочных металлов, солей, аминов и др.).
Главным достоинством метода является возможность регулирования
скорости инициирования по ходу реакции, а следовательно, скорости
процесса в целом и ММ полимера. Причины, препятствующие широко-
му внедрению метода, заключаются в усложнении аппаратурного
оформления и необходимости радиационной защиты.
Перспективным является способ, позволяющий вести процесс в
высококонцентрированных растворах АА в адиабатическом режиме.
Повышение температуры синтеза при высоких конверсиях способству-
ет снижению вязкости и увеличению подвижности макромолекул, что
в благоприятных условиях ограничивает действие диффузионного
фактора, интенсифицирует протекание реакций передачи цепи на
56
низкомолекулярные компоненты реакционной смеси и обеспечивает
сохранение растворимости получающихся концентрированных гелей.
Технологический процесс состоит из стадий приготовления и уда-
ления кислорода из раствора мономеров и добавок, полимеризации,
компаундирования (стабилизация и грануляция), сушки, дробления и
упаковки готового продукта.
Очистка растворов АА от кислорода достигается продувкой их
углекислым газом, азотом или другими инертными газами, или добав-
лением в них перед вводом инициатора бисульфита, сульфита или
метабисульфита.
(Со)полимеризацию АА в адиабатическом режиме проводят в 20 -
35%-х водных растворах в реакторе из нержавеющей стали с мешалкой.
Для уменьшения адгезии полимера к стенкам и улучшения выгрузки
полимера внутреннюю поверхность реактора полируют или покрывают
синтетическими материалами и смазками (силиконовое и вазелиновое
масла, полиэфирный воск, парафин и высшие алифатические кислоты),
кроме того, возможно введение в реакционную смесь 0,1-5% поли-
этиленгликоля с ММ=3- 102- 3- 10б, солей жирных кислот или 0,2 - 2%
от АА сульфата аммония. Можно проводить адиабатическую полимери-
зацию АА в 20 - 30%-х растворах в мешках из синтетического матери-
ала.
Поскольку в условиях адиабатической полимеризации температура
реакционной массы может достигать 100 °C и более, и полимер выдер-
живается при этом длительное время (до 20 ч), для предотвращения
гидролиза полимера процесс проводят при pH 4 - 6 в присутствии
солей аммония и аминов, моно-, ди- и триэтаноламинов, нитрилпропи-
оновой кислоты, ТКА и др. С этой же целью иногда полимеризацию
начинают при низкой температуре — 10 °C, или после достижения
максимальной температуры раствор полимера резко охлаждают,
выгружая в лед.
После полимеризации гель измельчают в экструдерах, где к грану-
лам полимера добавляют стабилизаторы (2-меркаптобензимидазол,
5,5-диметил-1,3-циклогександион, фтороглюцин, барбитуровую кисло-
ту, мочевину, этилендиаминтетрауксусную кислоту и ее соли) и
добавки, предотвращающие слипание гранул (глицин, Р-аланин и
другие аминокислоты, полиэтиленгликоЛи, жирные кислоты и др.).
Стабильные при хранении и исслеживающиеся гели могут быть полу-
чены без сушки путем измельчения до частиц размером 0,2 - 5 мм и
покрытия их порошком активной кремнекислоты, крахмалом, декст-
рином и др. в количестве 0,5 - 30% от массы полимера.
Сушку полимера осуществляют в сушилках различного типа. При
использовании двухступенчатой ленточной сушилки на первую
ступень непрерывно подаются гранулы полимера с влажностью 50 -
90% при толщине слоя 10 - 200 мм, затем гранулы в сушилке специаль-
ными ворошителями перемешивают и полимер с влажностью 5 - 40%
поступает на вторую ступень, на которой досушивается до заданной
остаточной влажности. Температура воздуха на первой стадии сушки
57
может достигать 120 - 130 °C. Возможна также сушка полиакриламид-
ных гранул в барабанной сушилке, снабженной полками для пересы-
пания гранул. Для исключения прилипания полимера к стенкам
сушилок их изнутри хромируют или покрывают полимерными матери-
алами (полиэтиленом, полистиролом, ПЭТФ, ПВХ).
Предложена также азеотропная осушка геля ПАА, диспергирован-
ного в среде органического растворителя, не смешивающегося с водой
(циклогексане, толуоле), после которой предусмотрено отделение и
сушка полимера от растворителя.
После сушки полимер при необходимости измельчают, смешивают с
добавками и упаковывают.
Из вышеизложенного следует, что выделение ПАА из его водных
гелей сопряжено с известными трудностями, а использование гелей
ПАА удорожает транспортировку продукта. Однако, несмотря на это,
процесс гомогенной полимеризации АА и родственных ему мономеров
имеет и еще длительное время будет иметь широкое распространение
в связи с простотой аппаратурного оформления и сравнительно низкой
энергоемкостью; кроме того, использование воды позволяет синтези-
ровать высокомолекулярные полимеры и исключает возможность
загрязнения окружающей среды органическими растворителями и
необходимость их регенерации.
2.2. Гетерофазная полимеризация
2.2.1. Осадительная полимеризация
Осадительную полимеризацию проводят в индивидуальных и
смешанных с водой органических средах, которые являются раство-
рителями для мономеров и осадителями для полимеров. Поэтому в
начале полимеризации реакционная смесь гомогенна, а по мере проте-
кания полимеризации происходит выделение полимера и процесс
проходит в гетерофазных условиях [181]. В качестве среды применяют
индивидуальные и смешанные с водой органические растворители -
низшие алифатические спирты (метанол, этанол, изопропанол, трет-бу-
танол), диоксан, ацетон, ацетонитрил и тетрагидрофуран. В качестве
инициаторов применяют персульфаты и пербораты щелочных метал-
лов и аммония, пероксид бензоила, ДАК, УФ- и У-излучение.
Скорость полимеризации АА в водно-ацетоновой смеси под дейст-
вием 7-излучения 6“Со возрастает с увеличением содержания воды до
20%, а АММ полимера возрастает с увеличением содержания воды до
10% и не изменяется при содержании воды от 30 до 70%. Порядок
реакции по мономеру равен 0,54 в ацетоне и 1,6 в смеси вода:ацетон =
=40:60(182]. В интервале концентраций АА24 - 34% и при конверсии
менее 20% получают нерастворимые в воде полимеры вследствие
протекания реакции имидизации. При содержании ацетона в
водно-ацетоновой смеси 30 - 70% полимер осаждается в ходе полиме-
ризации в виде хлопьев и наблюдается образование крупных комков.
Для получения стабильной суспензии и исключения агрегации хлопь-
58
ев полимера в реакционную массу вводят водорастворимые соедине-
ния (КС1, NaCl, Na2SO4, Na2CO3, NH4OH, NH4C1, CH3COONa, CH3COOH).
Хорошо растворимый в воде ПАА с высоким выходом (90 - 99%) и
ММ = 6-106 - 6‘107 получают при полимеризации в 10 - 30%-х раство-
рах АА в водно-ацетоновой смеси, содержащей 23 - 30% ацетона, при
20 - 60 °C в присутствии стабилизатора - поливинилового спирта
(0,5 - 4% от АА). Выпавший в осадок полимер отфильтровывают и
сушат при 50 - 60 °C или промывают метанолом и сушат при 60 °C под
вакуумом.
Полимеризация АА в присутствии инициатора 2,2' -азо-бис-(2,4-диме-
тил-1, 4-метоксивалеронитрила) в среде ацетонитрила и в водно-ацето-
нитрильных смесях при 30 - 40 °C изучена в работе [183]. Показано, что
скорость гомогенной полимеризации не изменяется при содержании
ацетонитрила 10 - 30% и сильно уменьшается при увеличении концен-
трации ацетонитрила до 40 - 50% (гетерофазная полимеризация).
Подобное изменение скорости полимеризации АА отмечено и в
водно-метанольных смесях [181]. ММ полимера уменьшается от 2-Ю6
до 0,8-106 при увеличении содержания ацетонитрила от 0 до 50%, а
затем повышается до 1,7’106 при содержании ацетонитрила 80%. В
бинарном растворителе ацетонитрил: вода = 40:60 порядки реакции
полимеризации по мономеру и инициатору соответственно равны 2,16
и 0,44.
Скорость электроинициированной полимеризации АА при 30 °C в
отсутствие и в присутствии электролитов (тетрабутиламмония, перхло-
рата) резко уменьшается при замене ацетонитрила на формамид,
ацетон, ДМФА [184].
При гетерофазной осадительной сополимеризации АА со СТ под
действием ДАК при 70 °C отмечено уменьшение содержания АА в
сополимере при переходе от диоксана к смеси диоксана с этанолом и
затем к этанолу [185, 186]. В исследованных средах процесс сополиме-
ризации сопровождался имидизацией. При исследовании сополимери-
зации АА со СТ в гетерофазных (растворитель - диоксан, инициатор -
пероксид бензоила) в гомогенных условиях (растворитель - уксусная
кислота, инициатор - ДАК) [187] отмечено существенное влияние
условий проведения процесса на состав и неоднородность сополиме-
ров по составу. В случае гетерофазного процесса активность СТ су-
щественно возрастает по сравнению с гомогенным процессом. Влияние
условий сополимеризации на неоднородность по составу сополимеров
АА со СТ количественно подтверждается значениями дисперсии по
составу f (табл. 2.8) п
f = Z to.af- ( 2 to,.а,)2,
1=1 1=1
где (о,- и а, — массовая доля и состав i-й фракции сополимера; п - число анализируемых
фракций.
Данные табл. 2.8 свидетельствуют о зависимости неоднородности
сополимеров по составу от состава исходной мономерной смеси и
59
Таблица 2.8. Параметры неоднородности сополимеров по составу
Состав моно- мерной смеси АА:СТ Конверсия / 102 У
диоксан уксусная кислота
4:1 0,71 0,015 0,014 о,п
3:2 0,41 0,128 0,085 0,50
2:3 0,18 0,629 0,323 0,95
1:4 0,31 0,339 0,212 0,60
большей полидисперсности сополимеров, полученных в гетерофазных
условиях. Особенно наглядно это иллюстрируют значения относитель-
ного параметра неоднородности:
Y-f/f- 1,
где f и f — параметры неоднородности по составу сополимеров для гетерофазного и
гомогенного процессов.
При гетерофазной сополимеризации различие условий роста макро-
молекул в различных фазах (в растворе и внутри глобул) существенно
влияет на состав образующихся макромолекул сополимера. Кроме
того, при гетерофазной сополимеризации на неоднородность по соста-
ву существенно влияют различия в растворимостях и сорбционных
способностях сомономеров на полимерных частицах. Так, согласно
уравнению Ленгмюра, поверхностные концентрации сомономеров на
глобулах [nj|]a связаны с их объемными концентрациями в жидкой
фазе [щ i ] соотношением
[mja =kai[mi]/(l + kai [mJ),
где kai — константа изотермы адсорбции мономера на глобулах.
Из последнего уравнения следует, что если ка1 =# ка2, то состав
сополимера, образующегося в глобулах ([m Ja/[m21a)> будет отлича-
ться от состава сополимера в жидкой фазе ([mi[/[тг])- Неоднород-
ность сополимеров по составу будет тем больше, чем больше различие
в константах kai. На неоднородность сополимера по составу при
гетерофазной сополимеризации может также влиять и различие коэф-
фициентов диффузии сомономеров в различных фазах.
В случае гетерофазной сополимеризации АА с малеиновой кислотой
в диоксане также была зафиксирована ’’аномально” большая неодно-
родность по составу [188 - 190]. При этом экспериментальные интег-
ральные кривые распределения по составу сополимеров, полученные
по данным препаративного фракционирования и по данным определе-
ния состава сополимеров в процессе сополимеризации, хорошо согла-
суются между собой (рис. 2.5, а). Сопоставление экспериментальных и
60
Xi
Рис. 2.5. Интегральные кривые распределения по составу сополимеров АА с малеиновой
кислотой (Xf—интегральная массовая доля фракции; а—массовая доля МК в сополимере;
ф - конверсия по АА):
а —АА:МК = 4:1 (1, 2), 3;2 (3, 4), 1:1 (5, 6); ф - 0,74 (1), 0,85 (2), 0,36 (3), 0,71 (4), 0,35 (5), 0,43
Ю (сплошные кривые — по кинетическим данным, пунктирные — по данным фракционирования);
АА:МК = 5:1 (1) при ф = 0,46; 2:3 (2) при ф= 0,44 (сплошные кривые — экспериментальные,
пунктирные — теоретические по Скейсту)
теоретических кривых распределения по составу, рассчитанных по
методу Скейста (для фиксированных значений ri и гг) для различных
составов мономерной смеси выявило их несоответствие и большую
полидисперсность экспериментальных кривых (рис. 2.5,6). Это свиде-
тельствовало о невозможности корректного описания гетерофазной
сополимеризации АА с малеиновой кислотой при помощи одной пары
значений и и Г2, поскольку в исследуемой системе (для гетерофазного
процесса) заведомо не выполнялось необходимое условие классичес-
кой сополимеризации, а именно - стационарность стадии роста макро-
цепей.
Аналогичная повышенная неоднородность по составу сополимеров
АА с КВАЯК, полученных в гетерофазных условиях (смеси воды с
этанолом, диоксаном и ацетоном), по сравнению с гомогенными
условиями (в воде, глицерине и этиленгликоле) была отмечена и в
работе [191].
Закономерности осадительной сополимеризации МАА с МАК и ее
натриевой солью в водных растворах при глубоких конверсиях рас-
смотрены в работе [192]. Кинетические кривые расхода МАА и МАК
свидетельствуют, что концентрация амида, как менее реакционноспо-
собного мономера, убывает медленнее, чем кислоты. Расчеты показа-
ли, что мономерная смесь с увеличением степени превращения обога-
щается амидом и обедняется кислотой в меньшей степени, чем предпо-
лагается на основании значений констант сополимеризации, найден-
ных при неглубоких степенях превращения. А значит, с изменением
соотношения мономер/полимер в реакционной смеси происходит
сближение значений относительных активностей мономеров ri и гг-
’епостоянство п и г2 наблюдается и при гомогенной сополимеризации
61
МАА и метакрилата натрия. В этой системе амид является более
реакционноспособным мономером, чем соль, однако обеднение моно-
мерной смеси амидом происходит в большей степени, чем это следует
из расчета, т.е. и здесь отношение между относительными активностя-
ми амида и второго компонента увеличивается по мере образования
сополимера. Сравнение кинетических кривых расхода мономеров при
сополимеризации МАА с МАК и ее солью указывает на то, что в первой
системе образуется более однородный по составу сополимер.
Осадительная полимеризация может использоваться для получения
с высоким выходом высокомолекулярных сополимеров АА с АК или
ее солями и АА с третичными или четвертичными солями аминоакри-
латов [193, 194]. При этом сополимеризацию проводят в 10 - 30%-х
растворах мономеров в присутствии радикальных инициаторов в
смеси воды с трет-бутанолом (при содержании последнего до 35 -
70%) при непрерывном перемешивании. Образующийся полимер
выпадает в осадок, отделяется фильтрованием и сушится. При концен-
трации грет-бутанола менее 35% полимер образуется в виде гелеобраз-
ной массы, а при концентрации трет-бутанола более 70% - в виде
мелких комков. Для получения порошкообразного полимера в реак-
ционную массу вводят водорастворимые соли - ацетаты, карбонаты,
хлориды аммония и щелочных металлов, а также буферные растворы.
Возможно также получение сополимеров АА в водно-органических
растворителях (ацетоне, ацетонитриле, трет-бутаноле, тетрагидрофу-
ране, диоксане) в присутствии поливинилового спирта и КагЗОд с
дробным вводом мономеров и органической фазы в процессе полиме-
ризации. В этом случае при использовании в качестве органического
растворителя ацетона достигается высокий (до 95%) выход сополиме-
ров.
2.2.2. Суспензионная полимеризация
Исходную систему получают диспергированием водного раствора
мономера в виде мелких капель с диаметром 0,1-5 мм в органичес-
кой жидкости при механическом перемешивании в присутствии
стабилизаторов (защитных коллоидов). В качестве дисперсионной
среды могут использоваться ароматические и алифатические насыщен-
ные углеводороды, а также смеси углеводородов с Cj - Сю и др.
Инициирование полимеризации обеспечивается применением различ-
ных водорастворимых инициаторов, УФ- и У-облучения. Процесс
полимеризации протекает в микрореакторах, которыми являются
капли водного раствора мономера, и имеет в кинетическом отношении
некоторое сходство с полимеризацией в массе, однако при этом прояв-
ляется влияние защитных коллоидов на процесс.
Кинетические закономерности полимеризации в обратных суспен-
зиях изучены недостаточно [2, 195, 196]. В работе [197] было показано,
что суспензионная полимеризация АА в присутствии стабилизаторов -
солей жирных кислот является реакцией первого порядка. Константы
скорости полимеризации мало отличаются от найденных для водных
растворов.
62
Скорость полимеризации АА в водно-толуольных смесях (1:4 по
объему) в присутствии инициатора - персульфата и стабилизатора -
стиролсульфоната натрия (калия) подчиняется уравнению [198]
-(dM/dt) = kn[M]1>3[I]0’5
и хорошо согласуется с результатами полимеризации АА в водных
растворах. Однако, в отличие от водных растворов, где ионогенные
добавки не влияли на скорость полимеризации, в водно-толуольных
средах увеличение концентрации стиролсульфоната натрия (калия) в
пределах (1,1 - 4)’1О-3 моль/л приводило к увеличению скорости
полимеризации и ММ полимера. По сравнению с водными растворами
скорость полимеризации АА в обратных суспензиях и ММ полимера
являются (рис. 2.6) более низкими [199]. Можно допустить, что это -
следствие влияния органического растворителя, поскольку его добав-
ление уменьшает скорость полимеризации и ММ полимеров в водных
растворах [121,125].
Существенное влияние на суспензионную полимеризацию АА
оказывает природа эмульгатора. В зависимости от гидрофильно-липо-
фильного баланса эмульгатора и степени распределения его между
водной и органической фазами полимеризация в суспензиях может
приводить к полному разделению фаз, осуществляться без обращения
и с обращением фаз [200]. Так, полимеризация в обратных суспензиях,
полученных при диспергировании 50%-х водных растворов АА в
уайт-спирите в присутствии эмульгаторов - стеариновой кислоты,
оксиэтилированной этиленоксидом (8 моль/моль), или нонилфенола,
оксиэтилированного этиленоксидом (4 моль/моль), с ГЛБ > 12 - 15
сопровождалась инверсией фаз [199]. Повышение температуры может
также приводить к инверсии фаз. Если полимеризация А А в водно-то-
луольных средах, стабилизированных натриевой или кальциевой
солями жирной кислоты, протекает при температурах ниже точки
Крафга [201] (для стеарата натрия < 60 °C, для лауратг натрия < 8 °C), то
процесс не сопровождается инверсией фаз и получается полимерная
суспензия типа ’’вода в масле” [202]. Если же полимеризацию прово-
дить при температуре выше точки Крафта, или если вследствие тепло-
выделения при полимеризации температура реакционной среды
повышается до точки Крафта, то процесс сопровождается инверсией
фаз и непрерывной становится водная фаза. Превращение суспензии
типа ’’вода в масле” в суспензию типа ’’масло в воде” может фиксиро-
ваться по повышению вязкости и уменьшению электропроводности
реакционной смеси [203], а также по данным оптической микроскопии.
Образующийся в результате полимеризации гелеобразный полимер
разрушается при перемешивании на частицы малого размера. При этом
на размер частиц полимера существенное влияние оказывает содержа-
ние эмульгатора [199]. При концентрации эмульгатора Сэ меньше 2% (от
органической фазы) получаются большие частицы с диаметром 4 -
5 мм, для Сэ от 3 до 12% диаметр частиц равен 0,5 - 1,2 мм, а при
Сэ> 12% получается стабильная суспензия с широким распределением
63
[KjSzOe] 10,моль!л
Рис. 2.6. Зависимость Мп для ПАА от концентрации инициатора при полимеризации А А в
водном растворе (1) и в обратной суспензии (2):
1, 2— [АА]:[Н2О] = 1:1; [KjSjOgJrINaHSOj] = 2:1 (мольн. отношение), 30‘С; 2—[вода]:[уайт-
спирит]=30:70 (объемн. отношение); [Э] = 5,6% (к общей массе) [199]
Рис. 2.7. Зависимость Мп для ПАА от концентрации эмульгатора (Э) MYRJ 45 при полиме-
ризации АА в обратной суспензии ([K^SjOg] - 7,35-10—4 моль/л, остальные условия
аналогичны приведенным для рис. 2.6 [199])
частиц по размеру. При суспензионной полимеризации АА, получен-
ной при диспергировании водного раствора мономера в смеси бензола
с тетрахлоридом углерода с плотностью, близкой к плотности водной
фазы, с увеличением содержания стабилизатора - стеарата кальция
повышалась устойчивость суспензии. Это приводило к сужению
дифференциальных кривых распределения частиц полимера по разме-
ру [204]. В то же время изменение содержания стабилизатора не влия-
ло на значения предельных чисел вязкости полученных полимеров,
что свидетельствовало о протекании полимеризации в водной фазе.
Отмечено также, что размер частиц полимера и плотность покрытия их
поверхности стабилизатором не меняются при изменении концентра-
ции АА в интервале 35 - 60%.
На ММ полимеров, полученных при полимеризации АА в обратных
суспензиях, влияют природа и концентрация эмульгатора, концентра-
ция инициатора, соотношение водной и органической фаз, добавки
солей и др. Влияние различных факторов на ММ полимера при поли-
меризации в обратных суспензиях проанализировано в работе
Димонье и др. [199]. Отмечено, что с увеличением концентрации
эмульгатора MYRJ 45 [стеариновая кислота, оксиэтилированная
этиленоксидом] ММ полимера уменьшается (рис. 2.7). Очевидно, это
может быть связано с участием групп эмульгатора -СН2-СН2-О- в
реакции передачи цепи. С увеличением отношения концентраций
компонентов инициирующей системы [K2S2O8]:[NaHSO3] возрастает
ММ и при мольном их отношении > 3,5 - 4 приводит к получению
нерастворимых в воде полимеров. Увеличение содержания водной
фазы по отношению к органической фазе вне зависимости от способа
ввода водного раствора в реакционную смесь (непрерывно, порционно
64
Рис, 2,8, Зависимость Wn для ПАА от концентрации
добавок полиакрилата натрия (1), ацетата натрия (2), g
оксалата натрия (3) и акрилата натрия (4) при поли- ’fi
меризации АА в обратной суспензии [199] ([Э] = 3%
(1,2) и 5,6% (мае.) (3,4); [K2S2O8] = 7,35-lfl-4моль/п,
остальные условия аналогичны приведенным для
рис. 2.6)
или одновременно) приводит к увеличению ММ. Показано существен-
ное увеличение ММ при добавлении солей - полиакрилата натрия,
ацетата натрия, акрилата натрия и оксалата калия (рис. 2.8). Увеличе-
ние ММ наиболее значительно в случае добавления полиакрилата
натрия [196, 199]. По сравнению с солями слабых органических, кислот
добавки солей сильных кислот (F3CCOOH, С13ССООН) оказывают
меньшее влияние на ММ полимера, полученного в обратных эмуль-
сиях [200]. Зависимость ММ от концентрации ацетата натрия выража-
ется кривой с максимумом. При этом максимальное значение ММ
соответствует концентрации солевой добавки, при которой наблюдает-
ся минимум поверхностного натяжения реакционной смеси [200].
Можно допустить, что наряду с действием в качестве соэмульгатора
соли органических кислот участвовали и в комплексообразовании с
растущими макрорадикалами. Это способствовало, по аналогии с
данными по полимеризации АА в водных растворах [136], увели-
чению ММ.
Природа дисперсионной среды не оказывает значительного влияния
на ММ полимера при суспензионной полимеризации АА (например, при
применении тетрахлорида углерода и бензола [ л ] раствора полимера
одинакова и равна 1200 см3/г [202]), что свидетельствовало об отсутст-
вии передачи кинетической цепи на используемые растворители.
ММ полимера, полученного полимеризацией АА в обратных суспен-
зиях в присутствии персульфата, уменьшается при увеличении кон-
центрации гидроксида натрия вследствие увеличения вклада реакции
передачи цепи на трис-(2-карбамоилэтил)амин, образующийся в поли-
меризационной системе при взаимодействии АА с аммиаком - продук-
том гидролиза мономера и полимера [171].
На основании данных математического моделирования эксперимен-
та оценено влияние различных факторов на ММ полимера, получаемо-
го в водно-циклогексановых суспензиях в присутствии эмульгатора -
сорбиталя С-20 [205]. Показано, что ММ уменьшается с увеличением
концентрации компонентов инициирующей системы и температуры,
при этом степень влияния указанных факторов на ММ уменьшается в
ряду [К2$20в]> [Na2S2Qs] > температура. Найдены оптимальные
условия получения в обратных суспензиях с высокой конверсией
(98%) ПАА_ с = 5,2-10® и однородным распределением частиц по
размеру (d = 1,3 м-3).
65
2.2.3. Эмульсионная полимеризация
При полимеризации в обратных эмульсиях водный раствор гидро-
фильного мономера диспергируется (до размера частиц 1-10 мкм) в
гидрофобной органической фазе (ароматические, алифатические и
галогенсодержащие углеводороды) в присутствии эмульгаторов
эмульсий типа ’’вода в масле”. Процесс инициируется маслораствори-
мым или водорастворимым инициатором. Важным преимуществом
получения полимеров в обратных эмульсиях является возможность
использования концентрированных растворов мономеров при условии
облегченного теплоотвода с проведением процесса в маловязких
средах. Кроме того, полимеризация может протекать с большими
скоростями и с образованием высокомолекулярного водорастворимо-
го полимера. В результате полимеризации получается коллоидная
дисперсия частиц гидрофильного полимера в непрерывной органичес-
кой фазе. Этот латекс характеризуется широким распределением
частиц по размеру и стабилен в течение нескольких часов или дней.
Латекс может быть использован непосредственно как готовый про-
дукт, либо полимер получают в сухом виде после азеотропной дистил-
ляции, удаления растворителя и сушки. По сравнению с полимерами в
сухом виде в некоторых случаях применение латексов более предпоч-
тительно, поскольку они имеют малую вязкость, характеризуются
легкостью хранения и растворения при добавлении избытка воды.
Заслуживает также внимания полимеризация в обратных микро-
эмульсиях, стабилизированных ПАВ, которая позволяет получать
термодинамически стабильные и оптически прозрачные микролатексы
(размер частиц 0,005 - 0,01 мкм), содержащие до 25% полимеров с
высокой ММ (106 - 107) и однородным распределением частиц по
размеру, а также с особыми реологическими свойствами. Несмотря на
наличие патентной информации, сведения о кинетике и механизме
полимеризации АА в обратных микроэмульсиях крайне ограничены
[206 - 208]. Кроме того, существенным ограничением промышленному
получению микролатексов является необходимость применения
высоких концентраций эмульгаторов.
Механизм полимеризации в обратных эмульсиях мало изучен [2,
195, 196], отсутствует количественная теория полимеризации. Некото-
рые особенности полимеризации водорастворимых мономеров в
обратных эмульсиях на примере п -стиролсульфоната натрия рассмот-
рены в работе Вандерхофа и др. [209]. Обратные эмульсии получали
при диспергировании 20%-го водного раствора мономера в ксилоле
(объемное соотношение вода:ксилол = 30:70) в присутствии эмульга-
тора - сорбитана моностеарата (Span-60) с ГЛБ = 4,7. В качестве иници-
атора применяли пероксид бензоила или персульфат калия и проводи-
ли процесс при 40 - 70 °C. По данным электронной микроскопии,
капли эмульсии имели размер ~ 0,02 мкм, соизмеримый с размером
мицелл. Протекание полимеризации в таких малых частицах обеспе-
чивало эффективный отвод тепла и характеризовалось малым влия-
66
Рис. 2.9. Сравнение скорости поли-
меризации п-стиролсульфоната нат-
рия в присутствии персульфата при
50 °C в водно-толуольной эмульсии
(I) и в водных растворах (2) [209]
нием реакции обрыва цепей. Поэтому скорость полимеризации в
обратных эмульсиях в сравнимых условиях почти в 4 раза больше, чем
в водных растворах (рис. 2.9). Закономерности полимеризации в
обратных эмульсиях в исследуемой системе в присутствии персульфа-
та описываются теорией Смита - Эварта (модель 2) [210], за исключе-
нием температур > 60 °C, а при использовании пероксида бензоила-
теорией Смита - Эварта (модель 1). Найденное очень малое число
радикалов на латексную частицу (п = 0,008 - 0,2) позволило предпо-
ложить, что инициирование обусловлено малой растворимостью
пероксида бензоила в каплях водного раствора мономера.
Каждая частица латекса, полученного при полимеризации АА в
микроэмульсиях типа ’’вода в масле”, содержит в среднем одну
макромолекулу ПАА [208], и это дает основание утверждать, что
кинетика такого процесса не подчиняется теории Смита - Эварта [210].
На кинетику полимеризации АА в обратных эмульсиях и характерис-
тики образующихся полимеров влияют природа и концентрация
инициатора и эмульгатора, природа используемого в качестве диспер-
сионной среды растворителя, температура, скорость перемешивания
и др.
Водорастворимые инициаторы обладают высокой эффективностью
инициирования в эмульсионных процессах. При инициировании
персульфатом скорость полимеризации АА в водно-толуольных обрат-
ных эмульсиях (вода:толуол = 1:4 по объему) в присутствии неионо-
генного эмульгатора синтамида-5 (оксиэтилированный амид стеарино-
вой кислоты) описывается уравнением [142]
- (dM/dt) = kn[M]1>7[I]°>9.
Замена толуола на гептан, а синтамида-5 на сорбиталь С-20 (смесь
полиэтиленгликолевых эфиров моно- и дистеаратов гидросорбитов)
при сравнимых условиях полимеризации не изменила существенно
порядка по инициатору (0,8) [211]. Отмеченное увеличение кинетичес-
ких порядков по мономеру и инициатору по сравнению с полимериза-
цией АА в водных растворах свидетельствует об изменении механизма
полимеризации.
Порядок по инициатору (0,8; 0,9) свидетельствует об увеличении
67
Таблица 2.9. Влияние условий полимеризации АА в обратных эмульсиях на Му, ПАА [212]
(вода: толуол = 1:7,5; [С-20] = 3% к толуолу, 50 °C, 4 ч;
концентрации компонентов указаны по водной фазе)
[АА] [K2S2O8]-103 [Na2S2O5]-103 [П]-10-2, см^/г мл-10-« Р,%
моль/л
7,04 1,85 2,63 7,3 3,2 80,5
7,04 3,70 2,63 4,7 1,8 90,8
7,04 4,63 2,63 3,1 1,0 98,2
7,04 1,85 1,34 П,7 5,9 83,1
7,04 1,85 2,63 7,3 3,2 80,5
7,04 1,85 5,26 5,8 2,4 —
4,23 1,85 2,63 1,0 0,3 82,4
5,66 1,85 2,63 4,7 1,8 88,3
7,04 1,85 2,63 7,3 3,2 80,5
8,03 1,85 2,63 8,0 4,0 87,0
доли мономолекулярного обрыва в общем балансе реакций обрыва
кинетических цепей.
Повышенные значения экспонент в уравнении скорости полимери-
зации отмечены и при применении водорастворимой редокс-системы в
водно-толуольных эмульсиях (вода:толуол = 1:7,5; АА:вода = 1:1) в
присутствии эмульгатора сорбиталя С-20 [212]:
-(dM/dr) = fcn[M]1-4[I][Na2S2O5]1-5.
Использование редокс-системы персульфат - метабисульфит обеспе-
чивало получение с высоким выходом высокомолекулярного ПАА,
который обладает высокой флокулирующей активностью [212]
(табл. 2.9).
Видно, что ММ возрастает с увеличением концентрации мономера и
с уменьшением концентрации компонентов редокс-системы.
По данным Бааде и др. [213], максимальная скорость полимеризации
АА в водно-изопарафиновых эмульсиях в присутствии эмульгатора
сорбитана моноолеата и водорастворимого азо-инициатора -
2,2-азо-бис-[М-(2-гидроксиэтил)-бутирамидина] - имеет первый поря-
док по мономеру и половинный - по инициатору. Однако, как отме-
чают авторы [213], реакционная система не может рассматриваться как
обратная эмульсия (в случае водно-толуольных сред).
Наиболее изучена кинетика полимеризации АА в обратных эмуль-
сиях в присутствии таких распространенных маслорастворимых
инициаторов, как динитрил азобисизомасляной кислоты и пероксид
бензоила. При использовании ДАК скорость полимеризации в вод-
но-гептановых эмульсиях в присутствии эмульгатора Spin-60 описы-
вается уравнением [214]
- (c/M/dT)= кп[М]1’3°-1>34[1]°>5.
Повышенный порядок реакции по мономеру частично обусловлен
повышением концентрации ДАК в водной фазе при увеличении содер-
жания мономера.
Не изменился порядок по инициатору и в случае применения
2,2'-азо-бис(2,4-диметилвалеронитрила) в водно-толуольных эмуль-
сиях в присутствии сорбитана моностеарата как эмульгатора, порядок
по мономеру равнялся 1,0 [213]. Однако порядок по ДАК увеличивался
до 1,0 при переходе от толуола к изопарафинам, порядок по мономеру
сохранялся неизменным. В работе Бааде и др. [213] высказано предпо-
ложение, что первый порядок по инициатору обусловлен взаимодейст-
вием его молекул с эмульгатором на границе раздела фаз.
Высокий порядок по инициатору - пероксиду бензоила (2,0) также
отмечен и в водно-ксилольных эмульсиях (эмульгатор - Тетро-
ник-1102 - аддукт полиэтиленоксида и полиоксипропиленэтиленди-
амина) [215]. Обнаруженное сильное влияние инициатора на скорость
полимеризации не может быть связано с изменением числа полимер-
ных частиц, которое пропорционально концентрации инициатора в
степени 0,3. Таким образом, полимеризация в обратных эмульсиях не
описывается теорией Смита - Эварта (модель 2) [210], согласно кото-
рой скорость эмульсионной полимеризации не зависит от концентра-
ции инициатора, а число частиц пропорционально концентрации
инициатора в степени 0,4. Порядок по инициатору 2,0 не может быть
отнесен к мономолекулярному обрыву цепей, которому обычно
способствует высокая вязкость реакционной среды, г протекание
полимеризации в каплях мономера малого объема исключает ее.
Наблюдаемое увеличение скорости полимеризации с увеличением
концентрации инициатора должно было бы сопровождаться и значи-
тельным уменьшением ММ полимзга, однрк« сно было гебо. ьлим ^л]
полимера пропорциональна концентрации инициатора в сте; ею. 0,2;.
Кроме того, при больших концентрациях инициатора получался
нерастворимый полимер вследствие протекания реакций разветвле-
ния и сшивки макромолекул. На основании экспериментальных
данных можно заключить, что инициирование полимеризации осу-
ществлялось радикалами, образующимися при термическом распаде
пероксида бензоила, растворенного или солюбилизированного в
водных каплях мономера (присутствие АА способствовало растворе-
нию маслорастворимого инициатора в водной фазе). Косвенным
подтверждением этому являлось и увеличение ММ в ходе полимериза-
ции (рис. 2.10) [215-217], которое обычно, за исключением особых
случаев [218, 219], не наблюдается при нуклеации частиц в мицеллах.
Еще одним доводом в пользу более предпочтительной нуклеации
частиц в водной фазе является неизменность размера частиц при
полимеризации [215]. В случае нуклеации частиц в мицеллах, которая
осуществляется при полимеризации АА в обратных водно-толуольных
микроэмульсиях (эмульгатор Aerosol ОТ), размер частиц возрастает в
ходе полимеризации (до полимеризации размер частиц составлял
0,002 + 0,006 мкм, а после полимеризации - 0,014 -ъ 0,026 мкм) [220].
69
Mw-10'e
Рис. 2.10. Изменение Яц/ ПАА с конверсией (ф)
при полимеризации АА в водно-ксилольных
эмульсиях в присутствии эмульгатора (Э)
Tetronik 1102 (1, 3) и Span 60 (2) и инициатора
пероксида бензола [215] ([Э] = 7,5 (1, 3) и 8,75%
(2);[I] = 0,01 (2), 0,015 (3) и 0,02% (1))
По сравнению с водорастворимыми инициаторами (персульфатами
калия и аммония) использование маслорастворимых азоинициаторов
при полимеризации АА в обратных водно-толуольных эмульсиях в
присутствии смесей эмульгаторов (Montan-83 и Montanox-85) обеспе-
чивало в сравнимых условиях меньшую степень конверсии [221].
Отмечено, что природа и концентрация азоинициаторов практически
не влияют на скорость полимеризации. Сделано допущение, что
причиной необычного нулевого порядка полимеризации по ДАК
является протекание реакций передачи цепи на примеси в мономере
или в инициаторе, а также специфика процесса инициирования. Выд-
винуто предположение, что инициирование осуществляется радика-
лами, образующимися в толуольной фазе или на границе раздела фаз.
В первом случае образовавшиеся радикалы могут захватываться
каплями мономера или реагировать с АА, растворенным в толуоле, а
во втором случае радикалы диффундируют внутрь капель водного
раствора мономера. Таким образом, при применении маслораствори-
мых инициаторов концентрация растущих радикалов в водной фазе
меньше, чем для водорастворимых инициаторов, и поэтому при ис-
пользовании маслорастворимых инициаторов образуются более
высокомолекулярные полимеры [216].
Сложным является влияние эмульгатора на полимеризацию в
обратных эмульсиях, в частности, оно зависит от природы растворите-
лей, используемых в качестве дисперсионной среды. При использова-
нии толуола скорость полимеризации возрастает с ростом концентра-
ции эмульгатора синтамида-5 [142] и сорбитана моностеарата (порядок
реакции равен 0,45) [213]. Подобное влияние эмульгаторов
Tetronic-1102 (порядок равен 1,0) зафиксировано и при использовании
в качестве дисперсионной среды ксилола [215].
Обнаруженное увеличение скорости полимеризации и уменьшение
ММ с ростом концентрации эмульгатора [142] может быть связано с его
участием в актах инициирования.
70
Участие эмульгатора Aerosol ОТ в актах инициирования с персуль-
фатом отмечалось также в работе Кандау и др. [222] при обратной
микроэмульсионной полимеризации АА в водно-толуольных средах,
однако добавка самого инициатора мало изменяет скорость иницииро-
вания. Полимеризация в микроэмульсиях типа ’’вода в масле” обычно
требует использования больших концентраций эмульгатора ([М]: [Э] -
— 2,5) и с увеличением концентрации эмульгатора ММ полимера
возрастает. Полимеризация в таки^ системах осуществляется с высо-
кой скоростью и с образованием. высокомолекулярных полимеров
(ММ = 106 - IO’), установлено [221], что скорость полимеризации АА в
водно-толуольных эмульсиях увеличивается при добавлении смеси
эмульгаторов Montan -83 с низким ГЛБ (сорбитан сексвиолеат) и Monta-
nox-85 с высоким ГЛБ (полиоксиэтиленсорбитан триолеат) или олиго-
меров АА со степенью полимеризации’ 20. Увеличение содержания
эмульгатора с высоким ГЛБ мало отражалось на скорости полимериза-
ции. Электронные микрофотографии исходной эмульсии и латекса
ПАА, полученные в этой системе, показаны на рис. 2.11. Видно, что
капли исходной эмульсии (рис. 2.11,а) и кинетического латекса (рис.
2.11,5) имели широкое распределение частиц по размеру и включали
как малые частицы, так и большие, полученные при коалесценции
малых. При этом диаметр частиц латекса во всех случаях был меньше
диаметра частиц исходной эмульсии, что несколько противоречит
предположению других авторов о протекании полимеризации в вод-
ных каплях мономера.
При применении смеси эмульгаторов Span-80 и Twin-80 также
достигалась хорошая стабильность водно-ксилольных эмульсий при
полимеризации АА, полученная эмульсия имела размер частиц
0,15 мкм и вязкость 1,5'10~2 Па-с [223].
Если, применять в качестве дисперсионной среды алициклические
углеводороды, то характер влияния эмульгаторов на полимеризацию
меняется. Так, с увеличением концентрации сорбиталя С-20 скорость
полимеризации уменьшается, а ММ увеличивается при использовании
толуола (порядок по эмульгатору -0,66) [211] и циклогексана (поря-
док по эмульгатору - 0,55) [217]. Аналогичный характер изменения
скорости полимеризации от концентрации эмульгатора подтвержден
при использовании ангидросорбитстеарата (Span-60) в водно-гептано-
вых эмульсиях [214] и сорбитана моноолеата в водно-изопарафиновых
эмульсиях [213]. Однако величина порядка реакции по эмульгатору
меняется в зависимости от условий полимеризации. По данным работы
[213], порядок по эмульгатору равен -0,1 и -0,2 в зависимости от
природы азоинициаторов, а по данным работы [214], порядок равен
- 0,26 и - 0,55 при концентрациях АА в водной фазе 2,16 и 7,14 моль/л
соответственно. Отмеченное уменьшение скорости полимеризации и
увеличение ММ полимера (рис. 2.12) с увеличением содержания
эмульгатора объясняется уменьшением эффективной концентрации
радикалов в системе по причине связывания фрагментов инициатора
^гО2^ оксиэтиленовыми группами эмульгатора и более медленного их
71
fuc. 2.11. Электронные микрофотографии эмульсии водного раствора АА в толуоле (а) и
латекса ПАА после полимеризации (б) [221]
распада по сравнению со свободными ионами $2О28" . Помимо отмечен-
ного химического эффекта не исключается также роль физического
эффекта, заключающегося в уменьшении коэффициентов диффузии
радикалов в капле водной фазы вследствие увеличения толщины и
плотности пограничных слоев эмульгатора при увеличении его кон-
центрации [216]. При увеличении содержания в реакционной смеси
эмульгатора Span -60 зафиксировано и некоторое увеличение общей
энергии активации полимеризации [214].
В условиях обратной микроэмульсионной сополимеризации АА с
экрилатом натрия АКН в системе водный раствор мономеров - изопа-
рафиновое масло использование в качестве эмульгаторов смеси
Arlacel-83 (сексвиолеинатсорбитан) и G-1086 (полиоксиэтиленсорбитол-
гексаолеат с ГЛБ = 10,2), образующих на границе раздела фаз высоко-
конденсированные пленки, ГЛБ которых определяется соотношением
эмульгаторов, позволяло получать устойчивые латексы с диаметром
частиц 0,06 мкм и вязкостью 5,0’10“2 Па-с [224]. При этом оптималь-
ным значением ГЛБ смеси эмульгаторов является 8,5 - 10,2, однако с
увеличением концентрации АН ГЛБ увеличивается. Сополимеризация
в этой системе под действием ДАК при 45 °C протекает с высокой
скоростью и конверсией [225]. С увеличением концентрации смеси
эмульгаторов возрастает [ц ] сополимера, уменьшается диаметр латек-
сных частиц и число макромолекул в одной латексной частице. Ука-
занные характеристики латекса и полимера не изменяются при измене-
нии концентрации ацетата натрия [226]. Кроме того, значения [г] ] для
сополимера АА с АН уменьшаются с увеличением содержания ионоген-
ного мономера в исходной мономерной смеси (рис. 2.13) [226].
При проведении полимеризации в обратных эмульсиях нужно
72
20 60 100
[э],г!л
Рис. 2.12. Зависимость ПАА от концентрации эмульгатора сорбитана моноолеата при
полимеризации АА в обратных водно-изопарафиновых эмульсиях [199] ([ДА1"] = 0,86 г/л в
масляной фазе, [вода]:[isopar М] = 43:57 (объемн. отношение), 47 °C)
Рис. 2.13. Зависимость [л] сополимеров АА с акрилатом натрия, полученных ; обратных
микроэмульсиях, от состава мономерной смеси [226]. Серии 1—3 различаются концентра-
цией мономеров и эмульгаторов
учитывать изменение точки инверсии фаз с изменением концентрации
эмульгатора. Например [227], точка инверсии фаз, определяемая
объемол! толуола, диспергированного в воде, возрастает с увеличе-
нием концентрации эмульгатора- блок-сополимера стирола и этилен-
оксида.
Следует также отметить, что на стабильность обратных эмульсий и
их поведение при полимеризации оказывает влияние АА как соэмуль-
гатор, который локализуется на границе раздела фаз. Данные светорас-
сеяния и вискозиметрии подтвердили это [220].
При полимеризации в обратных эмульсиях важно также учитывать
роль органического растворителя, используемого в качестве диспер-
сионной среды. Для обеспечения лучшей стабильности обратных
эмульсий плотности водного раствора мономера и органической фазы
должны быть близки. Например, разность плотностей водной и органи-
ческой фаз возрастает в ряду хлорбензол < толуол < циклогексан < геп-
тан. Поскольку хлорбензол является агентом передачи цепи и не
позволяет получать высокомолекулярные полимеры, то предпочти-
тельным из приведенных растворителей является толуол. При таком
подходе, естественно, не учитывались другие достоинства и недостат-
ки рассматриваемых растворителей.
При использовании в качестве дисперсионной среды декана ско-
рость полимеризации АА в эмульсиях (в присутствии моноолеата
сорбита в качестве ПАВ) выше, чем в водных растворах, а ММ несколь-
ко ниже, что может быть отнесено к влиянию передачи цепи на ПАВ
[228].
При переходе от толуола к IsoparМ (смесь изопарафинов с Ткип = 204-
247 °C) скорость эмульсионной полимеризации уменьшается в 3,5 раза
73
Рис. 2.15. Зависимость площади поверхности (А) сферических частиц эмульсии от скорос-
ти перемешивания (у) при 47 °C (1) и температуры (2) при 1000 с-1 [216] ([I] = 0,86 г/л
масла, [Э] = 57,4 г/л масла; [вода]: [масло] = 0,57:0,43)
Рис. 2.14. Конверсионные кривые полимеризации АА в эмульсиях при использовании в
качестве дисперсионной среды толуола (1) и Isopar М (2) [213] ([М] = 5,63 моль/л; [I] =
= 8-10 ~4 моль/л, [Э] = 0,2 моль/л; [АА]:[Н2О] = 1:1, 47 °C, 1000 с-1)
(рис. 2.14), а средний размер латексных частиц возрастает в 5 раз - от
0,23 мкм (в толуоле) до 1,12 мкм [213]. В случае толуола и маслораство-
римого инициатора полимеризация может рассматриваться как типич-
ная инверсионная эмульсионная полимеризация, а в случае Isopar М и
водорастворимых инициаторов образования мицелл не обнаружено и
процесс подобен суспензионному [213].
Изменение соотношения водной и органической фаз сказывается на
реакции полимеризации. При увеличении содержания толуола в
водно-толуольной смеси скорость полимеризации АА увеличивается, а
ММ уменьшается [142]. Это - следствие увеличения степени дисперги-
рования водной фазы в дисперсионной среде, которое должно способ-
ствовать уменьшению размера частиц эмульсии и увеличению суммар-
ной насыщенности адсорбционных слоев эмульгатора, в котором
осуществляются элементарные акты полимеризации. Изменение
соотношения фаз может приводить и к инверсии фаз эмульсий. Напри-
мер, легко происходит инверсия латекса, полученного в обратных
эмульсиях, при добавлении избыточных количеств воды, которая
облегчает растворимость набухших в воде частиц полимера [229].
С увеличением скорости перемешивания скорость полимеризации в
эмульсиях возрастает [216]. Это является следствием уменьшения
суммарной насыщенности адсорбционных слоев эмульгатора, что
подтверждалось увеличением поверхности раздела фаз (рис. 2.15,
кривая 1). Указанный эффект способствовал уменьшению диффузии
радикалов, образовавшихся при распаде маслорастворимого инициа-
тора, через двойные слои эмульгатора и приводил к увеличению
скорости полимеризации. Увеличение размера частиц эмульсии и
латексных частиц с повышением скорости перемешивания отмечено и
в работе [215]. Это явилось еще одним доводом, свидетельствующим о
74
протекании полимеризации в каплях водного раствора мономера, а не
в мицеллах, так как размер мицелл не зависит от скорости перемеши-
вания. Следует отметить, что с уменьшением размера частиц эмульсии
уменьшается ММ полимера [215] и при очень высоких скоростях
перемешивания (1000 об/с) получается низкомолекулярный полимер с
широким ММР [221]. Поэтому в целях получения высокомолекуляр-
ных полимеров в некоторых случаях [221] для лучшего диспергирова-
ния водной фазы в дисперсной среде первоначально проводят
диспергирование при высокой скорости перемешивания (1000 об/с), а
затем ведут полимеризацию при умеренном перемешивании (250 об/с).
Скорость полимеризации в обратных эмульсиях симбатна темпера-
туре. Ускоряющее полимеризацию повышение температуры связано, с
одной стороны, с увеличением скорости распада инициатора, а с
другой - с уменьшением скорости диффузии радикалов маслораство-
римого инициатора в водную фазу через пограничные эмульсионные
слои вследствие уменьшения их адсорбционной насыщенности. Пос-
леднее обстоятельство подтверждалось увеличением межфазной по-
верхности с ростом температуры (рис. 2.15, кривая 2) [216]. При сохра-
нении постоянства межфазной поверхности суммарная энергия актива-
ции полимеризации АА в водно-изопарафиновых эмульсиях равна
26 кДж/моль, что характерно для диффузионно-контролируемых реак-
ций. При несоблюдении постоянства межфазной поверхности суммар-
ная энергия активации равна 88,2 кДж/моль [216]. Близкие значения
энергии активации были получены и в работах [142, 211, 214].
Уменьшение адсорбционной насыщенности эмульсионных слоев с
увеличением температуры может сопровождаться дестабилизацией
эмульсии и обращением фаз. Так, при полимеризации в прямых эмуль-
сиях в присутствии неионогенного эмульгатора с ГЛБ = 13 - 18 вслед-
ствие тепловыделения температура повышается до 40 - 50 °C (конвер-
сия 40 - 60%) и происходит обращение фаз с образованием обратной
эмульсии [230].
Обычно с увеличением температуры ММ уменьшается, а при высо-
ких температурах (> 60 °C) возрастает вероятность имидизации [231],
которая приводит к получению нерастворимых полимеров.
Кинетика (со)полимеризации АА в дисперсных системах, а также
характеристики получающихся полимеров зависят от pH среды.
Скорость сополимеризации АА с МАК в щелочной области pH больше,
чем в кислой [232]. Являются функцией pH и кажущиеся относитель-
ные активности этих мономеров при сополимеризации. При увеличе-
нии pH от 4 до Ю кажущиеся относительные активности для А А мало
изменялись (от 0,58 до 0,59), а для МАК уменьшались от 4,0 до 0,15
[232]. Следует отметить, что найденные в эмульсиях и в водных раст-
ворах кажущиеся относительные активности мономеров при сополи-
меризации обычно различаются между собой, что обусловлено разли-
чием скоростей диффузии мономеров в гетерофазных и гомогенных
условиях. Кроме того, на реакционную способность мономеров в
эмульсиях влияет и растворимость мономеров в водной и органичес-
75
кой фазах, которая меняется в зависимости от pH. Например, при
рассмотрении сополимеризации АА с АК и МАК нужно учитывать, что
при низких значениях pH растворимость этих кислот в органической
фазе зависит от состава мономерной смеси. Поэтому кажущиеся
относительные активности АА (И = 0,58) и АК (г2 = 3,80) [233] отличают-
ся от найденных в водных растворах (Г1 = 0,20 и гг = 2,8) [234]. Размер
латексных частиц в кислой области pH увеличивался с увеличением
содержания ионогенного мономера в реакционной системе и латекс
имел плохую стабильность [232]. При высоких pH (> 10) мономеры при
сополимеризации в эмульсиях находятся в основном в водных каплях
(растворимостью в органической фазе можно пренебречь), и поэтому
г1=1,06 и г2 = 0,29 [233], т.е. близки найденным в водных раство-
рах (Г1 = 0,95; г2 = 0,3) [234], а размер латексных частиц в щелочной
области pH не зависел от состава мономерной смеси, и латекс характе-
ризовался хорошей стабильностью [233].
Полимеризация АА в эмульсиях в присутствии гидролизующих
добавок приводит к получению частично гидролизованного ПАА. В
патентной литературе имеются сведения о принципиальной возмож-
ности и различных способах осуществления такого синтеза [196, 231].
Различные аспекты полимеризации АА в эмульсиях в присутствии
щелочных агентов исследовались в ряде работ [88, 137, 217, 235-239].
Процесс полимеризации АА под действием свободных радикалов R',
образующихся при распаде инициатора, и в присутствии катализи-
рующих гидролиз ионов ОН- , образующихся при диссоциации щелочи
(NaOH, КОН, L1OH), можно представить упрощенной схемой:
R' он-
---------* -(-СН2-СН-)П- ----------
( CONH2
ch2=ch-!U-ch2=ch + сн2=сн-5*-(-сн2-сн-)х-(-сн2-сн-)у-
CONH2 CONH2 СООМе CONH2 СООМе
---* СН2=СН + СН2=СН----► -(-СН2-СН-)х+а-(-СН2-СН-у-а
ОН- t I I 1 „ .
CONH2 СООМе CONH2 СООМе
Здесь Me = Na, К, Li.
В работах [235 - 237] показано, что из трех возможных направлений
реакции основным является маршрут III. Вклад в общий процесс
составляющей по маршруту I зависит от конверсии (ф ): для малых ф
(< 0,03) эта составляющая может быть соизмерима по порядку величи-
ны с составляющей по маршруту III, а для достаточно больших ф
(> 0,3 - 0,4) вкладом этой составляющей можно пренебречь. Учитывая
тот факт, что время синтеза несоизмеримо со временем жизни макро-
76
радикала т0 (выполнение условия т » т0 очевидно), а также то, что
скорость гидролиза ПАА выше скорости гидролиза АА [231, 240],
можно прийти к выводу о небольшом вкладе реакции по маршруту II
по сравнению с маршрутом III.
Таким образом, анализ вышеприведенной схемы приводит к заклю-
чению, что рассматриваемый процесс правомерно называть (сополиме-
ризацией. Следует также отметить, что одна из стадий маршрута III
является заведомо осложненной, поскольку сополимеризация с
участием ионогенного мономера является неизоионным процессом
[241, 242].
Ь В работе [236] показано, что при малых добавках МагСОз, когда
степень гидролиза незначительна, скорость полимеризации АА в
t концентрированных водных растворах, диспергированных в толуоль-
* ном растворе эмульгатора ОП-Ю (смесь моно- и диалкилфенолов со
степенью оксиэтилирования 10%) практически неизменна. Следует
отметить, что АА в исследуемой системе являлся эффективным со-
эмульгатором. Этот факт, очевидно, связан с возможностью образова-
ния при высоких концентрациях АА линейных олигомерных ассоциа-
товАА R R R
Сх
...H-N О...н-N ''О...
। । ।
н н н
При высоких концентрациях NaOH степень гидролиза мономера и
полимера возрастает, скорость полимеризации увеличивается, а ММ
уменьшается (табл. 2.10) [235, 236]. Табличные данные свидетельству-
ют, что обнаруженная зависимость ММ от концентрации гидролизую-
щих агентов в обратных эмульсиях хорошо согласуется с установлен-
ной в сравнимых условиях в водных растворах. Причиной отмеченных
особенностей может быть увеличение скорости распада персульфата
под действием образующегося в реакционной системе трис(2-карбо-
моилэтил)амина, который также является передатчиком цепи и спо-
собствует уменьшению ММ [18]. При этом должно также усиливаться
влияние образующегося при гидролизе АН, так как скорость полиме-
ризации последнего в щелочной среде возрастает с ростом концентра-
ции NaOH [243], а скорость полимеризации АА в щелочных водных
растворах не зависит от pH [244]. Ускорение полимеризации АА при
добавлении АН отмечалось и в обратных суспензиях в работе [199].
Влияние природы гидролизующего агента на полимеризацию АА
в обратных водно-толуольных эмульсиях (эмульгатор - сорбиталь
С-20) в присутствии редокс-системы персульфат - метабисульфит
рассмотрено в работе [137]. Отмечено (рис. 2.16), что начальная ско-
рость (со)полимеризации возрастает в ряду NaOH < КОН< LIOH .
Другой ряд активностей Na+ > К+ > Li+ получен в работе [245] при
гомогенной сополимеризации АА с акрилатами в водной среде. Перво-
причина такого различия в ряду активностей катионов связана с более
77
Таблица 2.10. Влияние природы и концентрации гидролизующих агентов иа Мц
и состав частично гидролизованного ПАА [236]
Среда Гидролизующий агент Содержание звеньев, % (мол.) мп-1о
амида акрилата натрия
Вода* — 98,4 1,6 9,70
п 0,003 MNaOH 92,4 7.6 2,54
» 0,005 ” 83,2 16,8 0,83
0,025 ” 72,6 27,4 0,18
Вода: толуол **=1:8 — 99,5 0,5 3,00
То же 0,028 MNaOH 98,0 2,0 1,66
» 0,083 » 96,6 3,4 1,53
п 0,220 ” 92,0 8,0 0,32
п 0,443 ” 79,0 21,0 0,20
» 0,052 MNa2CO3 96,5 3,5 2,60
» 0,083 " 94,6 5,4 1,73
» 0,150 ” 90,9 9Д 1,09
м 0,300 ” 81,6 18,4 0,27
* Для полимеризации в воде: [АА] = 0,704 моль/л, [(NH^JjSjOg ] = 0,1% от АА; 50 "С, 5 ч.
"Для полимеризации в эмульсии: [АА] = 0,625 моль/л; [K^Og] = 0,1% от АА;40 'С; [ОП-Ю]=2%
от толуола, 2 ч.
сложным протеканием синтеза [137] (инверсионная эмульсионная
полимеризация, несколько маршрутов реакции и др.). Немаловажным
обстоятельством является и различие в характере противоионной
ассоциации в рассмотренном ряду катионов [246]. Интересно отметить,
что увеличение ионной силы растворов (за счет добавок ацетата
натрия) не приводило к ожидаемому нивелированию влияния приро-
ды катиона на сополимеризацию ионогенного мономера [247], что
является следствием конкурирующего влияния комплексообразую-
щей и соэмульгирующей функции добавки.
В работе [137] также отмечено, что вне зависимости от природы
щелочного агента (NaOH, КОН) добавление NaCl и ацетата натрия
увеличивает скорость полимеризации и ММ полимера, что объясняет-
ся их комплексообразованием с амидными звеньями макрорадикалов.
Зависимость скорости полимеризации АА от концентрации добавок
ацетата натрия, п-стиролсульфоната натрия и малеината натрия выра-
жается кривой с максимумом (рис. 2.17), что хорошо согласуется с
аналогичным влиянием других органических солей при суспензион-
ной полимеризации А А [199].
Анализ вышеприведенных данных свидетельствует о сложном,
неоднозначном влиянии природы и концентрации инициатора, эмуль-
гатора, дисперсионной среды, гидролизующих добавок и солей, pH
78
[ЯЯ], моль/л
Рис. 2.16. Кинетические кривые расхода АА в процессе полимеризации в обратных водно-
толуольных эмульсиях в присутствии NaOH (1, 4), КОН (2, 5) и LiOH (3, 6) ([щелочь] =
= 0,5 моль/л, [CH3COONa] = 0 (1 -3) и 1,4 моль/л (4-6); [KjSjOj] = 0,05 (4-6) и 0,2% к АА,
60 °C) [137]
Рис. 2.17. Зависимость Mq ПАА от концентрации ацетата натрия (1, 4), стиролсульфоната
натрия (2) и малеината натрия (3) при полимеризации АА в обратных водно-толуольных
эмульсиях [137] ([АА] — 2,82 (4) и 5,64 моль/л (1—3); [KjS^Og] = 7,35-10“4 моль/л,
[N^SjOj] = 6,75-10-4 моль/л; [ОП-10] =1,5 (1—3) и 3% к толуолу (4), 25 ’С, время
реакции 2 ч)
водной фазы, температуры и скорости перемешивания на кинетику
процесса полимеризации АА в обратных суспензиях и эмульсиях, а
также на характеристики образующихся полимеров. Рассмотренные
закономерности позволяют на научной основе наметить рациональные
пути управления кинетикой и топохимией исследованных процессов.
Ясно и то, что обнаруженные закономерности не могут быть описаны в
рамках общепринятых представлений о суспензионной и эмульсион-
ной полимеризации. Дальнейшее развитие экспериментальных и
теоретических исследований в намеченных направлениях будет
способствовать созданию количественной теории полимеризации АА в
обратных суспензиях и эмульсиях. Очевидна и практическая значи-
мость такой теории.
2.2.4. Технология гетерофазной полимеризации
Суспензионную (со)полимеризацию проводят в водных растворах
мономеров, диспергированных при перемешивании в несмешиваю-
щихся с водой органических жидкостях, в присутствии водораствори-
мых инициаторов. В качестве органических жидкостей, не растворя-
ющих мономеры и (со)полимеры, применяются растворители, как
образующие азеотропные смеси с водой (бензол, толуол, гептан,
79
циклогексан и др.), так и не образующие азеотропа (гексан, парафины,
керосин и другие насыщенные углеводороды), а также смеси органи-
ческих растворителей. Инициаторами являются растворимые в воде
соединения - персульфаты, пероксиды, азосоединения, редокс-систе-
мы и др. Стабилизаторами суспензии служат ПАВ неионогенного
характера с низким ГАБ (полиоксиэтилированные жирные спирты и
алкилфенолы, сорбитановые эфиры жирных кислот), полимеры (эфиры
целлюлозы, желатина), сополимеры, а также твердые тонкодисперсные
и жидкие вещества с низким ГАБ (диоксид кремния, кремниевые
глины, бентонит и их модифицированные производные). На практике
применяются также смеси различных стабилизаторов, которые помимо
основного назначения способствуют уменьшению коркообразования
на стенках реактора и мешалки, улучшению растворимости и регули-
рованию ММ полимера, стабилизации полимера при сушке и др. В
зависимости от концентрации и природы стабилизаторов, а также от
скорости перемешивания полимеры образуются в виде гранул или
порошка.
Технологический процесс получения суспензионного ПАА состоит
из стадий подготовки сырья (приготовление растворов мономера,
инициатора, стабилизатора и специальных добавок, а также удаление
из приготовленных растворов растворенного кислорода), полимериза-
ции, удаления воды азеотропной дистилляцией, центрифугирования,
сушки полимера, просева, расфасовки и упаковки готового продукта.
Суспензию приготовляют в реакторе, снабженном мешалкой,
рубашкой и холодильником. Первоначально осуществляют загрузку в
реактор смеси органических растворителей (например, н -гексана,
петролейного эфира и изопентана) и растворение в ней при нагревании
стабилизатора (неионогенного ПАВ) (2 - 3% от органической фазы).
Затем при перемешивании в органической фазе диспергируют 50%-й
водный раствор АА и после ввода раствора инициатора - ПБ подни-
мают температуру реакционной смеси до кипения при 45 °C и выдер-
живают 4 ч. Далее суспензию подают в другой реактор, где при темпе-
ратуре 70 °C удаляют растворитель и сушат полимер, который получа-
ется в порошкообразном виде.
Возможно также получение порошкообразных (со)полимеров АА со
средним размером частиц 0,5 мм суспензионным методом при ис-
пользовании в качестве дисперсионной среды органических раствори-
телей, образующих азеотропные смеси с водой (толуола, ксилола,
хлорбензола и др.). Стабилизатором суспензии служит моноолеат
ангидросорбита (1,5 - 6% от реакционной массы). (Со)полимеризацию
проводят при температуре кипения азеотропной смеси (например, для
азеотропа воды с толуолом - при 85 °C) в присутствии ПСА. Реакцию
ведут при интенсивном перемешивании (200 - 700 об/мин) турбинной
мешалкой, непрерывно удаляя азеотропной дистилляцией воду.
При получении катионоактивного сополимера АА с размером частиц
0,1-1 мм суспензионную сополимеризацию проводят в среде гидро-
фобного органического растворителя с плотностью 0,95 - 1,25 г/см3 в
80
присутствии смеси стабилизаторов моноолеата ангидросорбита с ГЛБ =
=4,3 и производных целлюлозы (0,01- 1% от органического растворите-
ля). В реактор загружают органический растворитель и растворяют в
нем стабилизатор. Смесь тщательно перемешивают, удаляют из раство-
ра кислород продувкой азотом и нагревают до 45 - 70 °C. Затем вводят
водный раствор смеси АА и соли аминоалкилметакрилата (суммарная
концентрация мономеров в водном растворе ~ 80%) и раствор инициа-
тора и проводят реакцию в течение< 1,5 ч. После охлаждения реакцион-
ной смеси гранулы полимера отфильтровывают и сушат. Выход про-
дукта составляет более 99%.
При применении ПАА в качестве стабилизатора суспензионной
полимеризации в гидрофобный органический растворитель при пере-
мешивании добавляют порошкообразный ПАА с [т) ] = 15,6 • 102 см3/г и
размером частиц 0,4 - 1,5 мм. Затем при перемешивании вводят
водный раствор мономера в количестве, при котором ПАА не раство-
ряется в водной фазе. Реакционную смесь тщательно перемешивают,
добавляют ПБ и проводят полимеризацию при 60 °C в течение 6 ч,
отгоняя воду. В результате получают полимер с [Ц ] = 17,7-102см3/г и
размером частиц 0,5 - 1,8 мм.
Для уменьшения размера частиц полимера при суспензионной
полимеризации в водную фазу добавляют Na2SC>4. Например, при
проведении суспензионной полимеризации в 65%-х водных растворах
АА, диспергированных в н-гексане (водная фаза: н-гексан = 1:5)в
присутствии стабилизатора - сорбитана моностеарата (1,4% от н-гекса-
на) и инициатора-солянокислого 2,2'-азо-бис-М,Ь1'-диметиленизобути-
ламидина при 65 °C в течение 3 ч с последующей выдержкой при ПО °C
получают порошкообразный продукт в виде гранул с размером 0,5 мм,
а в присутствии Na2SC>4 (50% от мономера) получают мелкодисперсный
порошок с размером частиц 2*10—3 мм. За счет эндотермического
фазового перехода Na2SC>4 обеспечивается частичный отвод теплоты
полимеризации. Подобным свойством обладают также другие соеди-
нения - бораты, карбонаты, фосфаты, силикаты и ацетаты щелочных
металлов, которые могут использоваться в качестве добавок при
суспензионной полимеризации.
Эмульсионную полимеризацию и сополимеризацию АА с другими
виниловыми мономерами проводят, используя в качестве дисперсион-
ной среды гидрофобные органические растворители (гептан, циклогек-
сан, толуол, уайт-спирит, тетрахлорид углерода и др.).
Эмульгаторами полимеризации служат сорбитан моноолеат, стеарг
ты с ГЛБ = 1-10, полиалкиленовые производные высших одноатомных
спиртов и монокарбоновых кислот, эфиры на основе жирных кислот и
многоатомных спиртов и др.
В качестве инициаторов используют масло- и водорастворимые
азосоединения, ПБ, окислительно-восстановительные системы и др.
Эмульсионную полимеризацию в основном проводят периодичес-
ким способом. Технологический процесс производства эмульсионных
(со)полимеров АА по периодическому способу состоит из стадий
81
подготовки исходных компонентов (приготовление растворов инициа-
тора и эмульгатора), (со)полимеризации, концентрирования эмульсии
и/или замены органического растворителя, фильтрования от коагу-
люма, расфасовки и упаковки готового продукта.
В реактор, снабженный рубашкой для термостатирования, мешал-
кой и обратным холодильником, подают раствор эмульгатора в орга-
ническом растворителе (содержание эмульгатора составляет 5 - 10% от
массы эмульсии) и диспергируют в нем водный раствор мономеров
(20 - 60%). Полученную эмульсию освобождают от растворенного
кислорода продуванием азотом или многократным вакуумированием
и термостатируют при 30 - 60 °C. Затем в реакционную массу вводят
раствор инициатора и проводят полимеризацию в инертной среде при
30 - 60 °C в течение 3 - 6 ч, а затем выдерживают дополнительно
реакционную смесь 1 - 5 ч.
С целью ускорения процесса полимеризации в реакционную систему
дополнительно вводят водорастворимые соли тяжелых металлов Fe,
Со, Ni, Pb в количестве 0,01 - 1% от массы мономеров. Эти соединения
позволяют проводить реакцию при невысоких температурах и облег-
чают отвод тепла полимеризации.
Для уменьшения образования коагулюма и отложения полимера на
стенках реактора в реакционную массу вместе с раствором мономеров
вводят водорастворимые соли (NaCl, NaBr, Li Cl, LiBr) в количестве 2%
от массы эмульсии, борат натрия в количестве 0,08 - 0,11% от водной
фазы и силикат натрия.
В целях уменьшения содержания остаточных мономеров в эмульсии
проводят гидрирование двойных связей в присутствии катализаторов-
Ni Ренея, Ni на кизельгуре, медных катализаторов Циглера, солей
Ru, Со, Fe, Pd, Pt, Ir, Ro, Co на глиноземе. Возможно также уменьшение
остаточного мономера при добавлении в эмульсию амидазы.
В результате эмульсионной (со)полимеризации получаются высоко-
молекулярные полимеры (ММ достигает 25’ 106), легко диспергируе-
мые в воде (содержание полимера 20 - 60%). При хранении эмульсия
расслаивается, однако при перемешивании легко происходит редис-
пергирование.
Полученную эмульсию концентрируют различными способами. По
одному способу концентрирование проводят при нагревании эмульсии
под вакуумом путем удаления из нее воды и органического раствори-
теля. В случае использования органического растворителя, образую-
щего азеотроп с водой, эффективность концентрирования может быть
повышена, а температура снижена. В результате концентрирования
содержание полимера в эмульсии можно увеличить до 70%.
Другим способом концентрирования является удаление органичес-
кого растворителя после расслоения эмульсии при ее отстаивании.
Полимерный латекс в гидрофобном органическом растворителе
вследствие присутствия эмульгатора с низким ГЛБ плохо дисперги-
руется в воде. Поэтому перед растворением в эмульсию или в воду
добавляют смачивающий агент (ПАВ с высоким ГЛБ) - оксиэтилиро-
82
ванные алкилфенолы, жирные спирты и кислоты, которые способст-
вуют обращению фаз латекса и образованию эмульсии прямого типа.
Для улучшения растворимости латекса в воде проводят замену
органического растворителя. Для этого первоначально удаляют из
латекса воду, а затем заменяют гидрофобный органический раствори-
тель на гидрофильный, имеющий температуру кипения более 100 °C. В
качестве гидрофильного органического растворителя используют
этиленгликоль, диэтиловый эфир диэтиленгликоля, моноэтиловый
эфир этиленгликоля и полиэтиленгликоли. В результате замены
растворителей получается пастообразная композиция, которая легко
смешивается с водой и используется как готовый продукт.
Полимер из эмульсии редко выделяют в виде порошка вследствие
высокой гигроскопичности последнего и трудности приготовления из
него водных растворов. В случае необходимости выделения полимера
в виде мелкодисперсного порошка в эмульсию при непрерывном
перемешивании вводят метанол, изопропанол и ‘другие осадители.
Выпавший осадок полимера отфильтровывают и сушат.
2.3. Сополимеризация
Свободнорадикальной сополимеризацией АА, МАА и соответствую-
щих N-замещенных амидов с другими мономерами получают линейные
разветвленные и сшитые сополимеры, растворимые в воде или органи-
ческих растворителях. Карбоцепные полиамидные гомо- и сополимеры
превосходят соответствующие сложноэфирные аналоги по прочност-
ным свойствам, имеют более высокие температуры стеклования,
труднее гидролизуются. Показано [248] также, что исходные амидные
мономеры CH2=CRCONR'R" отличаются от близких по строению
сложных эфиров большей скоростью полимеризации.
Технология получения акриламидных сополимеров в основном
такая же, как и гомополимеров. Однако сополимеризация АА или
МАА с различными мономерами протекает, как правило, медленнее,
чем гомополимеризация акриламидов, что может повлечь за собой
повышение содержания в сополимерах остаточных мономеров, обычно
являющихся токсичными. Нежелательным является также образова-
ние при сополимеризации полимеров с меньшей средней ММ, чем при
гомополимеризации АА. Это обусловлено более высокими значениями
константы передачи цепи км на сомономеры, чем на АА, для которого
значение км очень незначительно (см. разд. 2.1.3).
2.3.1. Основные типы сополимеров
На основе акриламидов получен большой ассортимент как ионоген-
ных (катионных и анионных), так и неионогенных сополимеров.
К наиболее распространенным водорастворимым катионным сопо-
лимерам относятся сополимеры АА с №(диалкиламиноалкил)акрила-
тами и метакрилатами (в первую очередь, с М,№диметиламиноэтил-
метакрилатом) в нейтрализованной или квартернизованной форме. В
последнее время стали привлекать внимание аналогичные сополиме-
83
ры с №(диалкиламиноалкил)акриламидами. Сополимеры с Г4-(диме-
тиламинопропил)метакриламидом превосходят сополимеры с диме-
тиламиноалкилметакрилатами по устойчивости к гидролизу в щелоч-
ной среде.
Анионные сополимеры получают сополимеризацией АА или МАА, в
первую очередь, с АК или МАК и их солями. Из МАА и МАК в промыш-
ленности получают сополимер ’’Метас”, применяемый как защитный
реагент в буровой технике и для других целей. Полимеры, макромо-
лекулы которых состоят из элементарных звеньев амида и соли АК
или МАК, образуются и в результате гидролиза ПАА и ПМАА (см. гл. 3),
а также при полимеризации АА и МАА в присутствии гидролизующих
агентов. Однако эти полимеры отличаются от сополимеров АА, полу-
ченных радикальной сополимеризацией, характером распределения
элементарных звеньев в макромолекулах. Анионные сополимеры,
водные растворы которых обладают повышенной устойчивостью к
разделению фаз под действием двухвалентных металлов, синтезиро-
ваны сополимеризацией АА с мономерами, в которых кислотная
группа непосредственно не связана с винильной группой, например с
З-акриламидо-З-метилбутаноатом натрия и 2-акриламидо-2-метилпро-
пансульфонатом натрия. Сополимеры N-н-алкилакриламида (алкиль-
ная группа - С8, Сю, С12) и З-акриламидо-З-метилбутаноата натрия
образуют водные растворы, вязкость которых не уменьшается под
действием электролитов [249].
При сополимеризации 2-акриламидо-2-метилпропансульфокислоты
со стиролом [250] и с 9-винилфенантреном или 1-винилпиреном [251] в
органических растворителях получены полимеры, в состав которых
входят как гидрофильные, так и гидрофобные сегменты, причем
первые (в виде солей) обладают высокой способностью солюбилизиро-
вать вторые в воде. Эти сополимеры служат средой для фотосенсиби-
лизированных реакций переноса электрона. Широко известны сополи-
меры АА с п-стиролсульфокислотой и ее солями [241].
Среди ионогенных акриламидных сополимеров все больший инте-
рес представляют полиамфолиты. Так, сополимеризацией в воде АА с
метакрилатом натрия, 5-винил-1,2-диметилпиридинийметилсульфатом
и N, N'- метил ен-бис-акриламидом получены набухающие и коллапси-
рующие полиамфолитные сетки [252, 253]. Полиамфолиты синтезиро-
ваны из смесей мономеров, содержащих соли (’’сомономеры”), катион
и анион которых имеют винильные группы, участвующие в сополиме-
ризации, например, 3- метакриламидопропилметиламмоний, 2-акрила-
мидо-2-метилпропансульфонат [254, 255].
На основе акриламидов получают различные неионогенные сополи-
меры. К ним относятся сополимеры АА или МАА с N-замещенными
акриламидами, не содержащими или содержащими в заместителе
функциональные группы, сополимеры, для получения которых ис-
пользуются только замещенные амиды, сополимеры АА и МАА с «,
P-ненасыщенными нитрилами, сложными эфирами и другими моно-
мерами.
84
АА сополимеризуют с N-н -алкилакриламидами (алкильная группа -
Cg, Cjq , Ci2) для получения ’’гидрофобно ассоциирующих” полимеров.
Наличие в сополимерах всего 0,25 - 0,5% (мае.) звеньев вторых моно-
меров способствует сохранению или даже увеличению вязкости
водных растворов полимеров при добавлении к ним электролитов
[256, 257].
На основе АА и М-(1,1-диметил-3-оксобутил)акриламида получают
сополимеры, предельные числа вязкости которых при нулевом сдвиге
возрастают в результате добавления одно- и двухвалентных солей.
Предположено, что этот эффект связан с наличием в макромолекулах
циклов за счет образования водородных связей [258].
Для межмолекулярного сшивания полимеров на основе АА, заме-
щенных акриламидов и других мономеров широкое применение
находят N,N'-метилен-бис-акриламид, N,N'-метилен-бис-метакрила-
мид и другие мономеры на основе АА, содержащие две и более поли-
меризующихся группы. С увеличением доли сшивающих агентов в
смеси мономеров снижается степень превращения, при которой эти
агенты вызывают образование геля.
На основе АА и акрилата натрия с применением аллилового эфира
карбоксиметилцеллюлозы в качестве полифункционального сшиваю-
щего агента синтезированы гидрогели с большой степенью набухания
(влагоабсорбенты), причем набухшие гидрогели имели хорошие
деформационно-прочностные характеристики [259].
Для получения термореактивных ариловых и других полимеров в
макромолекулы путем сополимеризации часто вводятся элементарные
звенья N-гидроксиметакриламида или N-гидроксиметилметакрила-
v ща [260, 261]. Структурированию полимеров, содержащих N-гидрок-
' иметиламидные группировки, способствует наличие в макромолеку-
лах незамещенных амидных групп. При сополимеризации акрилонит-
рила и 0,5 - 0,7% N-гидроксиметилметакриламида в отсутствие [262]
или в присутствии 1-8% АА [263] образуются термически сшиваемые
волокнообразующие сополимеры. При сополимеризации метилметак-
рилата, N-гидроксиметилметакриламида и N,N'-метилен-бис-метакри-
ламида может быть получено модифицированное органическое
стекло [260].
К новым направлениям синтеза сополимеров АА относится сополи-
меризация АА с макромономерами (Мп = 1100 - 4600) строения
CH2=CHCOOCH2CH2S(CH2CH)nH
СООСЕН 25
синтезированными теломеризацией додецилакрилата в присутствии
2-меркаптоэтанола в качестве телогена с последующим ацилирова-
нием теломеров акрилоилхлоридом. При этом получены сополимеры с
соотношением элементарных звеньев в основной цепочке
160: (2,5- 1) [264].
85
2.3.2. Закономерности сополимеризации
Закономерности сополимеризации определяются, в первую очередь,
строением исходных мономеров и средой, в которой проводится
процесс. Оба фактора в полной мере проявляются при сополимериза-
ции непредельных амидов. Для ’’классических” вариантов сополи-
меризации вклад этих факторов оценивается по их влиянию на ско-
рость сополимеризации, степень полимеризации и относительные
активности мономеров (константы сополимеризации) ri и Г2. При этом
rl = кц/ки и г2 = kj2/fc21, где кн, kj2 - константы скоростей реакций
макрорадикала ~ М{ с ’’собственным” (Mj) и чужим (М2) мономерами;
к 22 , k2i - константы скоростей реакций макрорадикала ~ М2 с моно-
мерами М2 и Mi.
Показателями активности мономеров при сополимеризации, как
известно, являются также полуэмпирические параметры Q и е, предло-
женные Алфреем и Прайсом и характеризующие резонансный (наличие
сопряжения) и полярный эффекты соответственно.
Необходимо отметить, что многие реальные процессы полимериза-
ции и сополимеризации с участием АА и замещенных акриламидов
являются осложненными (’’особыми”) процессами [242, 265]. Поэтому
приводимые значения п, r2, Qi, Q2, ei> е2, кц, кп, к 22, к 21 часто
представляют собой усредненные (эффективные) величины.
Влияние строения акриламидов на их реакционную способность при
сополимеризации. Реакционная способность замещенных АА изменяет-
ся в широких пределах в зависимости от природы заместители.
Влияние последних выражается в виде полярного, резонансного и
стерических эффектов. Рассматривая сополимеризацию в ряду заме-
щенных непредельных амидов, удается вывести закономерности
влияния отдельных эффектов и в тех случаях, когда одновременно
значительное влияние оказывают и другие эффекты.
При исследовании радикальной сополимеризации АА с МАА было
найдено, что при 25 °C ti = 0,74 ± 0,11 и г2 = 1,1 ± 0,2. Несколько боль-
шую реакционную способность второго мономера связывают с тем, что
замещение а-водородного атома в А А метильной группой приводит к
повышению стабильности переходного состояния за счет сверхсопря-
жения. Вместе с тем, при взаимодействии с одним и тем же мономером
метакриламидный радикал значительно менее реакционноспособен,
чем акриламидный.
В данном случае определяющую роль, очевидно, играет стёрический
эффект [266]. При взаимодействии с ММА-радикалом N-арилметакри-
ламид также оказался более активным, чем имеющий тот же замести-
тель АА [267].
При сополимеризации замещенных акриламидов CH2=CHCONR' R" с
АН в среде ДМФА величина п уменьшается в том же ряду, в котором
изменяется скорость гомополимеризации этих же амидов (даны R' и
R") [268]:
• Н, СН3 > Н,Н> Н, Н-С4Н9 > С6Н5,С6Н5> СН3,СН3.
86
Реакционные способности пара-замещенных N-фенилметакрилами-
дов (1/Г2) при сополимеризации в массе этих мономеров с ММА (Мг)
также убывают с уменьшением электронодонорной и увеличением
электроноакцепторной способности пара-заместителя [269]:
СН3О> СН3>Н> С1.
При изучении сополимеризации N-замещенных метакриламидов с
АН были установлены линейные зависимости реакционных способнос-
тей lg(l/r2) 4-замещенных N-фенилметакриламидов от о-констант
Гаммета и N-алкилметакриламидов и N-фенилметакриламида от
о‘-констант Тафта. Константы, характеризующие резонансный (Er) и
стерический (Eg) эффекты в уравнениях Гаммета и Тафта, не оказыва-
ли заметного влияния на значение 1/г2, т.е. изменение реакционных
способностей рассматриваемых мономеров зависит в основном от
полярного эффекта заместителей. Малые абсолютные значения р (-0,13)
и р* (- 0,033) в уравнениях Гаммета и Тафта характерны для гомоли-
тических реакций. Отрицательные же значения этих констант, как и
константы р* для реакции N-монозамещенных амидов с метилметакри-
латным радикалом [270], связаны с тем, что при переходе к амиду с
более электроноакцепторным заместителем уменьшается его реакцион-
ная способность по отношению к акрилонитрильному или метилме-
такрилатному радикалам, у которых заместитель также является
электроноакцептором [268]. Следует отметить, что в ИК-спектрах
N-монозамещенных амидов полосы поглощения \с=с и vc=0смещаются
в сторону более длинных волн с ростом электронодонорных свойств
заместителей [270].
При изучении бинарной сополимеризации___1-акриламидо-1-дезок-
си-П-глюцита и 1-дезокси-1-метакриламидо-Г)-глюцита с различ-
ными виниловыми мономерами найдено, что при исполь-
зовании винилацетата в качестве сомономера решающую
роль играет наличие резонансной стабилизации в молекуле первого
мономера и ее отсутствие во втором (ri> г2); в случае же, когда оба
мономера являются сопряженными (М2 - СТ, ММА), способность к
сополимеризации определяется главным образом тем, что в первом
мономере стерические препятствия играют значительно большую роль,
чем во втором (г} г2) [271].
Константы сополимеризации N-акрилоилпирролидона со СТ в
бензоле (60 °C) оказались равными 1,5 и 0,35. Вычисленные на основа-
нии этих данных значения Q = 0,42 и е = 1,60 для N-акрилоилпирроли-
дона указывают, что этот мономер является высокополярным, но не
проявляет существенной тенденции к резонансной стабилизации
(эффект сопряжения мал). Замена в указанной паре мономеров акри-
лоильного производного метакрилоильным производным того же
лактама изменяет относительные активности мономеров (г2<1;г2> 1),
что, очевидно, связано с возникновением в системе заметных стери-
ческих препятствий [272]. При сополимеризации N-метакрилоил-б-кап-
ролактама со СТ [273] эти препятствия еще более существенны, и
87
поэтому г 1 становится равной нулю (замещенный амид не подвергает-
ся гомополимеризации). Значение г2 = 1 в данной паре мономеров
указывает, что отношение констант скоростей стирольного радикала с
обоими мономерами в значительной степени определяется противо-
положной полярностью этих мономеров.
При исследовании сополимеризации N-(h-октил [акриламида,
Г4-(1,1,3,3-тетраметилбутил)акриламида [274] и Г4-(н-октадецил)акрил-
амида [275] с ММА и СТ найдено, что в этих системах г < 1 и г2 > 1, т.е.
указанные замещенные акриламиды по реакционной способности
уступают сомономерам. Близость rj и г2 в указанных парах мономеров
и парах М-(н-октадецил)акриламид - ММА (СТ) и н-октадецилакри-
лат - ММА (СТ) позволяет считать, что стерический эффект (препятст-
вия, создаваемые алкильными группами) определяет реакционную
способность акриламидов, имеющих Длинные объемные заместители у
азота.
Наличие двух заместителей у азота АА не препятствует ни гомо-, ни
сополимеризации мономеров, но вызываемые этими заместителями
стерические препятствия сильно сказываются на кинетических пара-
метрах образования полимеров. Так, константы сополимеризации в
ДМФА (60 °C) М,М-диметил- и N.N-дибутилакриламидов со СТ [276]
равны соответственно 0,23 и 1,23; 0,32 и 1,65. В этих системах сопряжен-
ных мономеров вопреки противоположной полярности соединений сти-
рольный радикал предпочтительно реагирует со СТ (г2 > 1)> очевидно,
вследствие пространственных затруднений в N, N-дизамещенных
акриламидах. На основании констант сополимеризации ряда N, N-ди-
замещенных акриламидов и констант скоростей роста при гомополи-
меризации соответствующих мономеров были вычислены константы
скорости взаимодействия замещенного амидного радикала с ’’чужи-
ми” мономерами (fcn) и ’’чужих” радикалов с амидами (к 21) [277].
Оказалось, что к 12 очень сильно зависит от природы заместителей в
амиде. Например, при сополимеризации в массе (30 °C) с ММА для
N-акрилоилзамещенных диметиламина, пирролидона и пиперидина
значения к 12 относятся как 66:14:1. Поскольку же значения к 21 для
всех трех N, N-дизамещенных амидов при взаимодействии с одним и
тем же мономером имеют один порядок, можно сделать вывод, что
убывание к 12 обусловлено возрастанием стерических препятствий в
амидном радикале, создаваемых заместителями у азота.
NjN-Диалкил- и №алкил-№арилметакриламиды, которые не под-
вергаются радикальной гомополимеризации [270, 278, 279], сополи-
меризуются с некоторыми сопряженными мономерами, например со
СТ, ММА [278], АН [268], N,N' -метилен-бис-акриламидом [278, 280].
Однако, получаемые при низких конверсиях сополимеры обеднены
звеньями амидов по сравнению с их содержанием в мономерных
смесях. Так, при сополимеризации ^№диметилметакриламида и ММА
в диоксане (80 °C) п = 0,175, г2 = 8,92 [281]. Преобладающий вклад
стерического фактора в реакционную способность N, N-дизамещенных
метакриламидов подтверждается тем, что N-метакрилоилазиридин, в
88
котором ограничена подвижность заместителей у азота (поскольку они
входят в состав напряженного трехчленного гетероцикла), в отличие
от указанных N, N-дизамещенных метакриламидов, подвергается не
только со-, но и гомополимеризации по радикальному механизму
[282]. Получены также сополимеры двух дизамещенных метакрилами-
дов - N-метакрилоилпиперидина и N-метакрилоиланабазина [283],
N-заместители каждогоиз которых входят в состав гетероциклов.
Предположение о том, что устойчивость к гомополимеризации
N, N-дизамещенных метакриламидов обусловлена превышением
температуры опытов над критической температурой полимеризации,
опровергается тем, что ^№диметилметакриламид не превратился в
полимер под действием УФ-излучения и при - 78 °C [268].
Сополимеризация с неионогенными мономерами. На закономернос-
ти сополимеризации большое влияние оказывают условия проведе-
ния процесса. Известно [284], что появление при сополимеризации
границы раздела фаз даже при отсутствии межфазного взаимодействия
часто приводит к изменению состава сополимера и отклонению процес-
са в целом от схемы Майо - Льюиса. При гомофазной сополимериза-
ции, если мономеры не подвергаются диссоциации, ассоциации или
специфической сольватации молекулами растворителя, и при соблю-
дении ляда других условий [285] процесс образования сополимеров
описьь ется уравнениями, вытекающими из классической теории
сололим. оизации. Ниже рассматривается, в какой мере от схемы
Майо - Льюиса отклоняется сополимеризация а, 0-ненасыщенных
амидов с неионогенными мономерами, а именно с мономерами, кото-
рые в условиях сополимеризации, как правило, не диссоциируют и
проявляют слабую склонность к автоассоциации и взаимодействию с
растворителем. В таких системах отклонения от указанной схемы
определяются в основном строением акриламидного компонента.
Наиболее показательно для отклонения закономерностей сополи-
меризации от схемы Майо - Льюиса наличие зависимости п и г2 от
природы растворителя. В ряде работ приведены данные по зависимости
И и Г2 от природы растворителя при сополимеризации АА и СТ [286 -
289]. Как видно из табл. 2.11, значения q уменьшаются и г2 увеличи-
ваются при переходе от бензола и 1,2-дихлорбензо ла к бензонитрилу,
простым эфирам, ДМСО и спиртам. Приблизительно в той же последо-
вательности увеличивается смещение полос NH амидной группы в
ИК-спектре растворов АА в перечисленных растворителях в сторону
более длинных волн по сравнению с поглощением в тетрахлориде
углерода, отнесенным к бесконечно разбавленному раствору. Однов-
ременно наблюдается и некоторое смещение полосы С=О, но по своему
абсолютному значению оно значительно уступает смещению полос NH.
Из этих данных вытекает, что зависимость rj и г2 от природы раствори-
теля связана в основном с образованием водородных связей между
амидными атомами водорода и молекулами растворителей, а также
диполь-дипольным взаимодействием между этими же соединениями.
В отличие от указанных факторов, диэлектрическая постоянная и
89
Таблица 2.11. Относительные активности АА и СТ при сополимеризации в различных
растворителях при 30 °C (10%-е растворы) [286 — 288]
Среда Г1 г2 Д поглощения, см
с=о NH1 NH11 (NH! + +NHu)/2
Бензол * 12,5 0,25 1 15 10 12,5
1,2-Дихлорбензол 12,5 0,25 3 5 5 5
Бензонитрил 2,4 1,35 12 70 55 62,5
Диоксан 1,38 1,27 10 205 170 187,5
Диметиловый эфир диэтилен- 1,09 1,40 10 190 206 198
гликоля
Этанол 0,30 1,44 13 205 230 217,5
2-(2-Метоксиэтокси)этанол 0,27 1,66 22 205 230 217,5
Вода—трет-бутанол 0,78 2,93 28 205 230 217,5
ДМСО 0,16 2,01 17 245 235 240
Метанол 0,20 1,05 13 205 230 217,5
• В 1%-м растворе [289] г! = 9,14 ± 0,27, г 2 = 0.67 ± 0,08.
дипольный момент [286] не оказывают решающего влияния на измене-
ние состава образующихся сополимеров. Оттягивание атомов водоро-
да от амидного атома азота приводит к увеличению его отрицатель-
ности, которая распространяется на всю молекулу амида, обусловли-
вает смещение л-электронов группы СН2=СН к метилену и удлинение
углерод-кислородной связи [288]. Поскольку направления поляриза-
ции молекул АА и СТ противоположны, то уменьшение электроноак-
цепторной способности амидной группы в АА должно приводить к не-
которому сближению полярностей обоих мономеров и к уменьшению
значений констант кп и кгь Что касается к.21, то при малой зависимости
реакционной способности СТ от среды (кгг^ const) ее уменьшение
должно приводить к росту Г2, что и имеет место. Судя по тому, что с
увеличением связывания молекул А А растворителем rj уменьшается,
можно предположить, что понижение к 12 сопровождается еще боль-
шим понижением кц, в частности, из-за роста стерических затрудне-
ний при столкновении специфически сольватированных мономера и
радикала акриламида.
При сополимеризации АА и ММА в ДМСО и хлороформе добавка
небольших количеств воды приводит к заметному увеличению rj и
мало влияет на г2, что связано с ускорением гомополимеризации АА
(рост к н) и, вероятно, обусловлено сольватированием растущих цепей
молекулами воды [290]. С другой стороны, при сополимеризации АА и
N-винилпирролидона в воде частичная замена последней глицерином,
способным к специфической сольватации АА, также приводит к
значительному росту ri и некоторому понижению Г2- Так, с увеличе-
90
Таблица 2.12. Относительные активности М-(1,1-диметил-3-оксобутил)акриламида и СТ
при сополимеризации в разных растворителях при 70 °C (общая концентрация
мономеров- 0.8 моль/л) [2951
Среда Ч г2 Среда Ч ч
Бензол 0,49 1,77 Этанол 0,30 1,80
Диоксан 0,47 1,85
нием содержания глицерина в растворителе от 0 до 80% (мае.) при 60 °C
ri увеличивается от 0,60 до 10,6; г2 падает от 0,17 до 0,11 [291]. Приве-
денные данные указывают на очень сильную зависимость rj и г2 от
природы растворителя и сложный характер этой зависимости: одни и
те же вещества в зависимости от природы системы в целом могут
вызывать противоположные эффекты.
При изучении эмульсионной сополимеризации АА и этилакрилата
найдено [292], что состав сополимера отличается от получаемого в
сравнимых условиях в растворе, а под действием добавок ацетона,
этанола, диоксана и других растворителей он изменяется.
При сополимеризации МАА [293] и N-метилакриламида [294] со СТ и
ММА наблюдается заметное влияние среды на значения rj и г2, по
характеру такое же, как при сополимеризации АА со СТ.
Изучение сополимеризации №(1,1-диметил-3-оксобутил)акриламида
со СТ (табл. 2.12) и ММА в разных растворителях показало, что относи-
тельная активность второго мономера практически не зависит от
реакционной среды, первого же - в бензоле и диоксане несколько
больше, чем в этаноле, т.е. наблюдается та же закономерность, что и
при сополимеризации АА со СТ, но она слабее выражена. Это может
быть обусловлено как сравнительно большим объемом заместителя у
атома азота, так и тем, что в молекуле М-(1,1-диметил-3-оксобутил)ак-
риламида и соответствующего радикала имеется внутримолекулярная
Н-связь [295], вследствие чего
/Н "О
CH2=CHCON С-СНз
(СН3)2С-СН2
и сольватация в спиртовой среде молекулами растворителя подавле-
на. Напомним, что такая сольватация приводит к резкому изменению
кц и ri при сополимеризации незамещенного у азота А А.
Влияние природы растворителя на скорость сополимеризации
изучено на примере системы АА - АН. В растворителях, способных
образовывать автоассоциаты посредством водородных связей (вода,
91
уксусная кислота, метанол, ДМФА), скорость полимеризации резко
понижается при добавлении небольших количеств АН к АА. В раство-
рителях, не способных к автоассоциации, но способных к сольватации
(диоксан, ацетон, ацетонитрил), скорость образования сополимера
постепенно уменьшается пропорционально доле АН в мономерной
смеси. В инертных растворителях (н-гексан, бензол, толуол) скорость
практически не меняется до достижения содержания АА в смеси
мономеров «40% (мае.), а при дальнейшем обеднении смеси амидом
процесс замедляется [10].
Для дизамещенных у азота акриламидов и метакриламидов, в
амидной группе которых нет подвижных атомов водорода, активно
участвующих в образовании различного рода ассоциатов и комплек-
сов с молекулами среды, нехарактерна заметная зависимость реакци-
онной способности от природы растворителя. М,М-Дизамещенные
амиды образуют сополимеры одинакового состава и одинакового
распределения по составу при сополимеризации в массе и в различных
растворителях [294, 296, 297]. Исключение могут составить протонные
растворители. Природа растворителя не оказывает влияния на значе-
ния Г1 и Г2 при сополимеризации также N-монозамещенных акрил- и
метакриламидов, если заместитель стерически препятствует незаме-
щенному амидному атому водорода участвовать в образовании комп-
лексов с молекулами растворителя. Например, значения q и rj не
зависят от природы растворителя при сополимеризации №(н-октаде-
цил) акриламида с ММА и СТ [275].
Зависимость констант сополимеризации незамещенных и многих
монозамещенных у азота амидов от природы растворителей позволяет
отнести системы, содержащие эти мономеры, к категории осложненных
(’’особых”) систем [284], не подчиняющихся классической теории
сополимеризации Майо - Льюиса. Для таких систем схема Алфрея -
Прайса неприменима, поскольку значения Q и е становятся неодно-
значными [121, 284]. Например, для МАА в литературе приведены
следующие значения Q и е: 1,46 и 1,24 [298], 0,88 и 0,74 [266], 0,57 и
- 0,06 [269]. Очевидно, что пользоваться значениями Q и е как констан-
тами, характеризующими данный мономер, в случае соединений,
обладающих значительной склонностью к ассоциации и к сольватации
(особенно, специфической), не следует. При рассмотрении ’’особых”
систем параметры Q и е могут служить лишь в качестве условных
величин, отражающих влияние тех или иных факторов на поведение
данного мономера при сополимеризации.
Более или менее стабильные значения Q и е могут быть характерны
для N, N-дизамещенных амидов, а также для N-монозамещенных
амидов, у которых вследствие большого объема заместителей подав-
ляется или резко ограничивается ассоциация мономера и доступ к
амидным атомам водорода молекул растворителя. Постоянство Q и е в
разных средах наблюдается при сополимеризации N, N-диметилакри-
амида с различными мономерами [122, 292 - 299], масляного эфира
N-гидроксиметилметакриламида с ММА и АН, №(н-октадецил)акрил-
92
амидов с ММА и СТ [275]. Однако, учитывая значительный вклад
стерических эффектов в реакционную способность N, N-дизамещенных
амидов, а также то, что Q, е-схема не применима к системам, содержа-
щим стерически сильно затрудненные мономеры, параметры Que
рассматриваемых амидов не являются константами, характеризующи-
ми их резонансную стабилизацию и полярность.
Заслуживает специального внимания вопрос о зависимости значе-
ний Г1 и г2 от конверсии мономеров. Было вполне естественно ожи-
дать, что при сополимеризации мономеров, образующих ’’особые”
системы, по мере увеличения содержания полимера в реакционной
среде будет изменяться характер взаимодействия между компонента-
ми смеси и, следовательно, будут изменяться значения относительных
активностей мономеров. Данные по гомофазной и гетерофазной сопо-
лимеризации АА и АН [5 - 20 и 30 - .80% (мол.) соответственно] в
водных растворах [300] полностью подтвердили эти ожидания. Для
ряда степеней превращения были определены текущие отношения
концентраций амида и нитрила в мономерной смеси (М1/М2 =F) и
соответствующие им отношения количеств мономеров (mj/mj = /),
вошедших в состав сополимера в данный момент времени (’’мгновен-
ный” состав сополимеров). Далее, пользуясь уравнением состава
сополимера в форме, предложенной в работе [301], найденные зависи-
мости изобразили графически. Лри всех соотношениях мономеров,
независимо от того, выделялся сополимер в виде твердой фазы или
нет, не были получены линейные зависимости (рис. 2.18). Одновремен-
но было показано [300], что найденные по начальным скоростям
при 20 °C константы сополимеризации в гомофазной среде в отсутствие
и в присутствии сополимера резко отличаются:
ч ч
Без добавок сополимера 0,65 ± 0,04 2,34 ± 0,35
С добавкой сополимера 0,027 ± 0,003 1,45 ± 0,41
Необходимо отметить, что основную ответственность за осложнен-
ный (’’особый”) характер системы АА - АН несет первый мономер. На
это указывают результаты исследования гомофазной сополимеризации
АН и СТ до глубоких степеней превращения, согласно которым отно-
сительные активности в ходе процесса меняются (г^ уменьшается)
лишь при преобладании нитрила в смеси мономеров [281]. Кроме того,
при сополимеризации ММА с М,М-диметилметакриламидом, в амидной
группе которого нет атомов водорода, участвующих в образовании
амидных ассоциатов переменного состава, значения q и г 2 в ходе
процесса оставались постоянными [302].
В ходе сополимеризации АА и МАА с ММА в растворах ДМСО отно-
сительная активность амидов падает, а эфира-растет [303]. Предполо-
жено, что для систем (мет)акриламид и мономера, не участвующего
или слабо участвующего в образовании автоассоциатов или комплек-
сов, изменение относительной активности мономеров обусловлено
тем, что по мере протекания гомофазной сополимеризации уменьшает-
ся доля более активного амида, входящего в состав автоассоциатов
93
F(f ~l)/f ?uc' Зависимость состава сополимера АА и АН
от состава мономерной смеси в координатах
уравнения Файнмена—Росса [300] при сополиме-
ризации до глубоких степеней превращения (вода,
20 °C, начальные концентрации: АА — 0,42,
АН — 0,95 моль/л)
Рис. 2.19. Зависимость вычисленного (1) и най-
денного экспериментально (2) состава терполимера
от состава моиомерной смеси (3) в системе АА
(M)i—акрилонитрил (Mj) — метакриловая кис-
лота (М3) [307]
О 0,2 0,Mz
этого мономера, и увеличивается доля менее активного мономера,
образующего смешанные ассоциаты с акриламидными звеньями
сополимера.
На примере системы МАА - ММА была предложена методика
количественной оценки изменения относительных активностей моно-
меров при сополимеризации: использование способа Келена и Тюдоша
[304] определения Г} и г2 по данным среднего состава сополимеров при
глубоких степенях превращения позволило определить изменяющи-
еся ’’интегральные” значения г1иг2, достигаемые при каждой степени
превращения мономеров в сополимер (при близких конверсиях в
различных сериях опытов). Для рассматриваемой системы найдено,
что при конверсии до 32% rj постепенно уменьшается от 0,50 до 0,26, а
94
гз увеличивается от 4,2 до 5,0. При оценке относительных реакционных
способностей в системе АА - СТ на основании данных о составе сопо-
лимера при высоких степенях превращения [305] в различных раство-
рителях получены [306] значения, заметно отличающиеся от найден-
ных при малых конверсиях [289]. Значения, найденные в работе [306],
можно отнести к интегральным rj и Г2
Обратим внимание еще на одну особенность сополимеризации
амидсодержаших систем, которые можно отнести к ’’особым”. В
тройных системах [307], в состав которых входят амиды, имеющие
склонность к образованию различного рода ассоциатов, реакционная
способность компонентов отличается от их реакционной способности в
соответствующих бинарных системах, причем направление и степень
отклонений зависят от характера межмолекулярных взаимодействий.
Очевидно, природа ассоциатов, образованных в растворе двумя соеди-
нениями, может изменяться при появлении в системе третьего соеди-
нения. В связи с этим использование метода Алфрея и Голдфингера
[308] вычисления составов тройных сополимеров на основании значе-
ний и и Г2 соответствующих трех бинарных систем для амидсодержа-
щих систем может давать результаты, заметно отличающиеся от экспе-
риментальных. Это положение экспериментально подтверждено на
примере тройных смесей мономеров, содержащих наряду с амидом
также кислоту или аммониевую соль. Для системы А А - АН - МАК
уже при малых степенях превращения характерно большее обогаще-
ние сополимеров нитрилом и кислотой, чем это следует из расчета
(рис. 2.19). В системе МАА - гидрохлорид N ,№диэтиламиноэтилметак-
рилат-2-гидроксиэтилметакрилат получаемый сополимер содержал
звеньев второго мономера меньше, а третьего - больше, чем по расче-
ту [307].
При радикальной сополимеризации N-н-оксиакриламида и N,N-ah-
бутилакриламида со СТ в среде толуола (25 °C) в присутствии этила-
люминийсесквихлорида в качестве комплексообразователя получают-
ся чередующиеся сополимеры [309].
Сополимеризация с ненасыщенными кислотами и их солями. Важ-
ной особенностью сополимеризации АА с мономерами, содержащими
свободную или нейтрализованную кислотную группу, например, с
n-стиролсульфокислотной, а, р-ненасыщенными одно- и двухоснов-
ными карбоновыми кислотами и их солями, является мультикомпо-
нентность процесса в ионизирующих средах. Она заключается в том,
что в системе имеет место зависящее от характера среды равновесие
между различными формами сосуществования положительно и отри-
цательно заряженных частиц:
6-6+
А X А~Х+ А~|1Х+ А' + Х+
Общая схема ионизационного равновесия не постулирует одновремен-
ного существования в системе всех четырех форм ионогенного моно-
мера [молекулярной, ионной (контактные и разделенные пары) и
свободных ионов], таких форм может быть три или две (например,
95
A HIX+и A ~+X +) в зависимости от характера реакционной среды. Следст-
вием мультикомпонентности системы является осложненный [285, 310]
характер сополимеризации. Поэтому активность мономеров в реакции
сополимеризации зависит от общей концентрации мономеров и состава
исходной мономерной смеси [198, 241, 311, 312], ионной силы растворов
[241, 314 - 318], полярности растворителя [319] и степени превращения
[320, 321]. При сополимеризации с ионогенными мономерами наблю-
дается также сильная зависимость конформационного состояния
макромолекул от характера реакционной среды [241, 322, 323].
С уменьшением диэлектрической постоянной смеси воды и ДМСО
начальная скорость сополимеризации АА с натриевой и калиевой
солями п-стиролсульфокислоты понижается. Наблюдаемое при этом
понижение реакционной способности амида связано со смещением
равновесия между ассоциацией амида и его сольватацией в сторону
последней, ростом комплексообразования между макрорадикалами и
ДМСО, уменьшением размеров макромолекулярных клубков, веду-
щим к понижению локальной концентрации амида в области, где
имеются активные центры [241, 319].
Ввиду практической значимости сополимеров МАА и МАК целесо-
образно более подробное рассмотрение их синтеза. При получении этих
сополимеров в 40%-х водных растворах (85 °C) по мере увеличения
степени нейтрализации кислоты гидроксидом натрия (росте pH) отно-
сительная активность амида растет (от 0,28 до 0,64), а кислоты - падает
(от 2,6 до 0,4) [312]. По-видимому, с повышением pH уменьшается доля
протонированных молекул амида и радикалов, на концах которых
находятся элементарные звенья протонированного амида, и увеличи-
вается степень диссоциации кислоты и соответствующего макроради-
кала, т.е. имеют место ослабление отталкивания амидного радикала и
молекулы амида, усиление отталкивания кислотного радикала и
молекулы кислоты (анионов). Следовательно, увеличение Г] и умень-
шение г2 могут быть обусловлены ростом к ц и падением к22 [312].
При сополимеризации АА и МАК наблюдается качественно такая же
картина, как и при сополимеризации МАА и той же кислоты: при
рН< 3, когда кислота очень слабо ионизирована, а константы скорос-
тей роста и обрыва при ее гомополимеризации не зависят от концент-
рации ионов водорода, величины ri и г2 практически постоянны при
изменении pH. При этом г2 превышает в еще большей степени, чем в
системе МАА - МАК. При pH > 3 значение г2 резко понижается [324].
Поскольку в системах амид - кислота оба компонента могут обус-
ловливать ’’особый” характер систем, вполне естественно, что при
сополимеризации до глубоких конверсий значения ц и г2 непрерывно
меняются. Непостоянство г\ и г2 в ходе сополимеризации АА и ненасы-
щенных кислот впервые было установлено при использовании малеи-
ната натрия, сукцината натрия и других солей [285, 316, 325] в качестве
второго мономера.
На основании кинетических данных по сополимеризации АА и АК
до 80%-й конверсии была сделана попытка определить относительные
96
активности мономеров по методу Келена - Тюдоша [304], что,однако,
не удалось (значения Г] и Г2 оказались равными соответственно
0,50+0,06 и 0,79+ 1,67). Колебания г 2 в столь широких пределах,
очевидно, обусловлены изменением реакционной способности в ходе
сополимеризации, хотя сами авторы такого вывода не делают [326].
Экспериментальные данные по кинетике начального периода
сополимеризации в 7%-х (мае.) водных растворах МАА и метакрилата
натрия, взятых в различных соотношениях, удовлетворительно описы-
ваются [327] известным уравнением [308, с. 377], которое предложили
Мелвилл, Нобл и Уотсон. Согласно данному уравнению, обрыв контро-
лируется химическими реакциями, а диффузионные процессы не
учитываются. Вместе с тем, именно ввиду влияния диффузии на
закономерности обрыва цепи указанное уравнение очень часто оказы-
вается неприменимым к описанию кинетики сополимеризации. Пред-
положено [327], что возможность использования уравнения при сопо-
лимеризации МАА и метакрилата натрия связана с тем, что в данной
системе константы скоростей реакций обрыва (за счет взаимодействия
одинаковых и различных радикалов) близки между собой [243]. В
системе МАА - метакрилат натрия кривая зависимости начальной
скорости сополимеризации от соотношения между мономерами прохо-
дит через слабо выраженный максимум, что при относительной близос-
ти констант скоростей обрыва определяется предпочтительностью
перекрестного роста по сравнению с ростом за счет любой гомополиме-
ризации (и и г2< 1 [312]). Для системы АА - АК (вода, pH = 4,6) также
наблюдается превышение скоростью сополимеризации скоростей
гомополимеризации обоих мономеров [328].
Сополимеризация МАА и МАК (или ее соли) протекает без самоуско-
рения [192]. Гель-эффект, по-видимому, перекрывается уменьшением
отдельных констант скоростей роста при увеличении конверсии
мономеров.
При сополимеризации в воде АА и акрилата калия в присутствии
твердого инициатора, нерастворимого в реакционной смеси, образует-
ся сополимер, содержащий меньше АА, чем сополимер, полученный в
присутствии водорастворимого инициатора, что, по-видимому, связа-
но с избирательной адсорбцией акрилата калия на твердом инициаторе
[329].
Сополимеризация с ненасыщенными аминами и их солями. Предс-
тавляют практический интерес катионные сополимеры АА с аллил-
амином и замещенными аллиламинами. При их получении АА оказы-
вается значительно более активным в сополимеризации, чем сомоно-
мер. Так, при сополимеризации с АА гидрохлорида алллиламина
(вода; pH = 3,0, 40 °C) q = 13,35 ± 0,26 и г2 = 0,08 + 0,02 [330], диаллил-
диметиламмонийхлорида (вода; pH = 6,1; 40 °C) = 6,7 и г2 = 0,58 [331].
В отличие от мономеров, содержащих фрагменты аллиламина и даю-
щих при сополимеризации относительно стабильные радикалы, другие
амин- и аммонийсодержащие сомономеры обычно превосходят по
активности АА. При сополимеризации АА с 4-диметиламиностиролом
97
(метанол; 60 °C) и = 0,15 и Г2 = 3,35 [332], с 5-винил- 1-метил-2-пиколи-
нийметилсульфатом (вода; 48 °C) п = 0,19 и г2 = 2,7 [333].
Весьма подробно изучена сополимеризация АА и МАА с мономера-
ми, в молекулах которых аминогруппа отделена от винильной группы
цепочками из 4 и более атомов, в первую очередь - с диалкиламино-
алкил(мет)акрилатами. При гетерофазной сополимеризации в ацетоне
МАА с диалкиламиноэтилметакрилатами в виде неионизированных
оснований процесс близок к идеальному (и и Г2 мало отличаются от
единицы) [334]. Такая же картина наблюдается при сополимеризации
N.N-диметиламиноэтилметакрилата (ДМАЭМ) с ММА. Близость относи-
тельных активностей к единице указывает на то, что скорости роста
цепей в этих системах контролируются скоростью диффузии молекул
мономеров в макромолекулярные клубки, причем скорости диффузии
сомономеров мало различаются между собой [335].
Переход от диалкиламиноэтилметакрилатов к их солям при сопо-
лимеризации в воде приводит к резкому изменению значений относи-
тельных активностей мономеров. Так, при сополимеризации (вода;
70 °C) МАА с гидрохлоридом ДМАЭМ = 0,26 ± 0,13 и Г2 = 2,6 ± 0,14, с
гидрохлоридом М,М-диэтиламиноэтилметакрилата (ДЭАЭМ) - п -
=0,17 ± 0,04 и г 2=0,39 ±0,01 [335,336]. Предположено, что положительные
заряды макромолекулы соли способствуют выпрямлению цепи и
освобождению конца макрорадикала, что делает его более доступным
для молекул мономера, благодаря чему скорость роста контролирует-
ся скоростью химической реакции и зависит от строения реагирующих
частиц, т.е. константы скорости элементарных реакций роста при
сополимеризации, как правило, уже не могут быть равны между собой
[335]. Уменьшение и и увеличение в отдельных случаях Г2 при перехо-
де от свободных оснований к их солям связано с тем, что амиды в
целом менее реакционноспособны при взаимодействии со свободными
радикалами, чем стерически затрудненные соли на основе М,М-диал-
киламиноэтилметакрилатов. Это может быть обусловлено образова-
нием в молекулах солей замкнутых систем (за счет притяжения между
аммонийным атомом азота и карбонильным атомом кислорода),
способствующих делокализации неспаренного электрона на «-угле-
родном атоме и, тем самым, относительно большей стабильности
соответствующих радикалов, чем амидных радикалов, в результате
чего /сц <к 12 и 1с22>^21- Вместе с тем, значение г2 < 1 в системах
МАА - соль на основе ДЭАЭМ указывает, что рассматриваемые конс-
танты сополимеризации зависят и от других факторов. Одним из них
может быть электростатическое отталкивание между одноименно
заряженными молекулой и радикалом солеобразного производного
ДЭАЭМ [334].
Значения ri и Г2 для а, 3-ненасыщенных амидов с ДЭАЭМ или его
солеобразными производными оказались независящими от степени
превращения мономеров при сополимеризации [336, 337], в то время
как при сополимеризации с кислотами или нитрилами они в ходе
процесса резко изменяются. Данное различие, вероятно, объясняется
98
тем, что диалкиламиноалкил(мет)акрилатные звенья вследствие
наличия в них занимающих сравнительно большой объем диалкила-
миноалкильных остатков в условиях сополимеризации стерически
препятствуют ассоциации мономерного амида с амидной группой в
сополимере [336].
Сополимеризация амидов с солеобразными производными диалкил-
аминоалкил(мет)акрилатов протекает со значительно большей
скоростью и приводит к получению более высокомолекулярных
сополимеров, чем при сополимеризации со свободными основаниями.
Это можно объяснить меньшей (из-за электростатического отталкива-
ния) скоростью реакций обрыва, в которых участвуют два макрока-
тионрадикала, чем реакции обрыва, основанной на столкновении
незаряженных частиц, а также имеющим место при переходе от сво-
бодных оснований к солям развертыванием растущих макроцепей и
освобождением реакционных центров, способствующим реакции роста
при сополимеризации. Вместе с тем, сополимеризация амидов с диал-
киламиноалкилметакрилатами в присутствии двухкратного избытка
НС1 по отношению к аминам не дает заметного эффекта по сравнению с
сополимеризацией в отсутствие НС1. Очевидно, благодаря экраниро-
ванию положительных зарядов избытком противоионов хлора расту-
щие цепи свернуты в клубки и подход к ним молекул мономера так
же стерически затруднен, как и при сополимеризации со свободными
основаниями. Таким образом, для получения сополимеров амидов с
диалкиламиноалкил(мет)акрилатами с большой скоростью и достаточ-
ной вязкостью следует предварительно нейтрализовать основание,
либо перевести его в четвертичную аммониевую соль. Аналогичный
результат достигается путем совмещения процессов алкилирования
диалкиламиноалкил(мет)акрилата и сополимеризации его с амидом
[334 - 336].
Сополимеризацию с солями на основе диалкиламиноалкил(мет)ак-
рилатов проводят в присутствии пероксидных инициаторов, с диал-
киламиноалкил(мет)акрилатами в виде свободных оснований - в при-
сутствии инициаторов, не взаимодействующих с аминогруппой (азо-
соединений). Сополимеризация МАА и не нейтрализованных диалкил-
метакрилатов в ацетоне практически прекращается по достижении
60 - 70%-й конверсии мономеров, несмотря на наличие инициа-
тора [335].
В работе [338] при сополимеризации АА и МАА с гидрохлоридом
ДЭАЭМ (мольное соотношение 4:1) в водных растворах до глубоких
степеней превращения получены сополимеры, плохо растворимые в
воде. Очевидно, в обеих системах ввиду протекания процесса в кис-
лой среде возможно сшивание макромолекул за счет образования
межмолекулярных вторично-амидных (-CONHCO-) мостиков. Кроме
того, в случае системы на основе ММА, вследствие более высоких
значений г 2 по сравнению с г1э при больших конверсиях образуются
плохо растворимые в воде фракции, обогащенные звеньями амида.
Данное объяснение согласуется с тем, что улучшить растворимость
99
сополимера МАА и гидрохлорида оказалось возможным путем дози-
рования при сополимеризации более активного мономера - гидрохло-
рида ДЭАЭМ. При этом одновременно повышалась степень однород-
ности по составу макромолекул сополимера.
2.3.3. Способы сополимеризации
Для сополимеризации АА и замещенных акриламидов с другими
мономерами применяются способы, рассмотренные выше для полиме-
ризации амидных мономеров. Однако различие в реакционной способ-
ности и в физических свойствах сополимеризующихся мономеров
накладывает свой отпечаток на протекание процессов синтеза сополи-
меров.
Полимеризация в массе - малопривлекательный способ сополиме-
ризации. Практически он может представить интерес для модифика-
ции полиметилметакрилатного органического стекла путем введения
в макромолекулы небольших количеств амидсодержащих звень-
ев [260].
Широкое применение находит сополимеризация в растворителях,
которые растворяют как мономеры, так и образующиеся сополимеры.
К растворителям, в которых можно проводить гомофазную сополи-
меризацию, относятся ДМФА, ДМСО и их смеси с водой. Вода и другие
полярные растворители используются при гомофазной сополимериза-
ции смесей, содержащих незамещенный АА и мономеры, в состав
которых входит гидроксильная, карбоксильная и сульфогруппа.
Существует ряд вариантов гомофазной сополимеризации, отличаю-
щихся по методу загрузки исходных веществ, которая может быть
разовой (в начале процесса) или дробной (в течение всего процесса), и
по температурному режиму (изотермическая и адиабатическая сопо-
лимеризация). Сополимеризация в растворителях вызывается как
облучением, так и вещественными инициаторами. При необходимости
получаемые сополимеры осаждают из воды или другого растворителя
веществом или смесью веществ, в которых сополимеры нерастворимы
(ацетон, эфир и др.).
Сополимеризация в воде часто протекает с постоянной скоростью до
степеней превращения, достигающих 50%. Такой характер зависимости
скорости сополимеризации от степени превращения определяется
одновременным воздействием ряда компенсирующих друг друга
факторов. С одной стороны, уменьшение концентрации мономеров в
ходе процесса должно привести к снижению скорости сополимериза-
ции. С другой стороны, гель-эффект, иногда в сочетании с обеднением
реакционной смеси компонентом, замедляющим процесс, должен
привести к его ускорению [339].
Наиболее высокие ММ сополимеров достигаются при их получении
в водной среде, поскольку вода в отличие от большинства органичес-
ких растворителей практически не участвует в реакциях передачи це-
пи. При сополимеризации в воде гидрофильных и гидрофобных мономе-
100
ров максимальное содержание звеньев гидрофобных компонентов
ограничивается растворимостью соответствующих мономеров и сопо-
лимеров в реакционной среде. Например, при сополимеризации АА и
АН в воде в сополимер можно ввести до 20 - 25% (мае.) звеньев второ-
го мономера, не нарушая гомофазности реакционной смеси [339].
Особенностью гомофазной сополимеризации в растворах по сравне-
нию с сополимеризацией в массе является большая вероятность
исключения значительной сшивки макромолекул в условиях синтеза.
Эта вероятность растет с увеличением степени разбавления реакцион-
ной смеси растворителем, а также с понижением температуры.
При сополимеризации смесей, содержащих мономеры с реакцион-
носпособными функциональными группами, в частности такими,
которые придают сополимерам термореактивные свойства, во избежа-
ние сшивки макромолекул на стадии синтеза сополимеров поддержи-
ваются определенные значения pH. Так, гелеобразование при сополи-
меризации N-гидроксиметилакриламида или МАА с другими мономе-
рами в воде в большой степени подавляется, если среда реакционной
смеси близка к нейтральной. Особенно нежелательна кислая среда в
сочетании с повышенными температурами [340].
Поскольку обычно не удается полностью избежать частичного
сшивания макромолекул в условиях сополимеризации N-гидрокси-
металзамещенных амидов с другими мономерами, для сополимериза-
ции используют мономеры с защищенной (блокированной) ОН-груп-
пой - соответствующие простые и сложные эфиры
CH2=CRCONHCH2OR' (R' - алкил, ацил)
и тналоги - М,Ы-диалкиламинометил(мет)акриламиды (основания
Манниха), CH2=CRCONHCH2NR'2,\>Г-метилен-бис-а!!,иламилы с одной
участвующей в сополимеризации двойной связью
CH2=CRCONHCH2NHCOR' (R' - алкил)
Эти мономеры можно подвергнуть гомо- и сополимеризации, не сопро-
вождающейся сшиванием в условиях синтеза при температуре до
80 °C, ограничивая кислотность среды:для простого эфира - pH не
более 4, для основания Манниха - pH > 6, для 1Ч,М'-мети-
лен-бис-амида - pH не более 3-4 [340].
Природа среды при сополимеризации в водных растворах может
явиться важным фактором ограничения и предотвращения других
побочных химических превращений мономеров и сополимеров и, в
первую очередь, - реакций гидролиза. Было показано [341], что в
условиях сополимеризации АА и ДМАЭМА ввиду наличия во втором
мономере аминогруппы, обусловливающей щелочную среду реакцион-
ной смеси, происходит гидролиз как амида, так и сложного эфира.
Образующийся при гидролизе амида аммиак реагирует с амидом и
вторым продуктом его гидролиза - АК с получением соответственно
трис-(2-карбамоилэтил)амина. К АК присоединяется также ДМАЭМА с
101
образованием 3-( N, N-диметил-N-метакрилоилэтиламмонийпропионата)
СН3
1 +
CH2=CCOOCH2CH2N (СН3)2СН2СН2СОО"
Продукт гидролиза ДМАЭМА - NjN-диметиламиноэтанол взаимодейст-
вует с АК с образованием еще одного бетаина - №гидроксиэтил-М, N-ди-
метиламмонийпропионата
HOCH2CH2N(CH3)2CH2CH2COO-.
Ненасыщенный бетаин и МАК, очевидно, вступают в сополимеризацию
с основными мономерами, остальные побочные продукты являются
примесями в продукте сополимеризации. При сополимеризации с
ДМАЭМА не АА, а стерически затрудненного МАА при 60 °C гидроли-
тические побочные реакции не сопровождаются присоединением
оснований по связи С=С. Проведение сополимеризации АА или МАА с
ДМАЭМА в слабокислой среде также исключает заметное протекание
гидролиза.
Сополимеризацию АА и замещенных акриламидов с другими моно-
мерами проводят также в среде растворителей, из которых сополиме-
ры по мере образования выделяются в виде твердых продуктов
(осадительная сополимеризация). Так, при сополимеризации в воде
получен сополимер АА с 4,8% N-гидроксиметилметакриламида [262].
При сополимеризации в изопропиловом спирте бутил- или этилакрила-
та с 10 - 15% АК и 4 - 8% А А осаждается пленкообразующий сополи-
мер, макромолекулы которого после N-гидроксиметилирования
формальдегидом легко сшиваются при нагревании [342].
При сополимеризации смесей мономеров, в которых АА или водо-
растворимые замещенные акриламиды содержатся в меньших коли-
чествах по сравнению с водонерастворимыми сомономерами, успешно
используется эмульсионный способ. Этим способом получают латексы
сополимеров низших алкилакрилатов с N-гидроксиметилированными
АА [261] и МАА [343], легко подвергающиеся структурированию в
кислой среде. Наличие в сополимере звеньев N-гидроксиметилметак-
риламида приводит к повышению коллоидной стабильности и морозо-
стойкости латекса [343]. Эмульсионный способ применяется для
синтеза тройных сополимеров на основе: 1) н-бутилакрилата, втор-бу-
тилакрилата или другого алкилакрилата [«90% (мае.)]; 2) ММА; 3) А А
или МАА. Получаемые эластомеры удобно вулканизовать формаль-
дегидом [344].
В качестве эмульгаторов в рассмотренных примерах сополимериза-
ции используются те же мыла, что и при полимеризации других моно-
меров, в первую очередь - высшие алкилсульфаты и алкилсульфона-
ты. При сополимеризации гидрофильных и гидрофобных мономеров,
что имеет место при получении сополимеров на основе АА и замещен-
ных акриламидов, часто проводят процесс без введения в исходную
смесь эмульгаторов, поскольку их роль выполняют продукты сополи-
меризации.
102
З-Метакриламидопропилтриметиламмоний 2-акриламидо-2-метил-
пропансульфонат при сополимеризации со СТ [254] и н-бутилакрилатом
или ММА [255] в присутствии водной фазы и водорастворимого иници-
атора без добавок ПАВ образует полиамфолиты. При сополимеризации
указанной катион-анионной пары со СТ или н-бутилакрилатом в ходе
процесса происходила самостабилизация системы и были получены
латексы, которые отличались высокой стабильностью, если содержа-
ние ионогенных мономеров в смеси превышало 2%. Аналогичная
картина наблюдалась при сополимеризации со СТ ионной пары, обра-
зованной М,М-диметил-3-метакриламидопропиламином и 2-акрилами-
до-2-метиППропансульфоновой кислотой [255].
Как и при полимеризации амидов, все большее внимание при
сополимеризации привлекают гетерофазные инверсионные процессы, в
которых исходные смеси представляют собой водные растворы, дис-
пергированные в бензоле, толуоле, тетрахлориде углерода или других
не смешивающихся с водой жидкостях (разд. 2.2). Существуют вариан-
ты сополимеризации в присутствии специально вводимых стабилиза-
торов дисперсии и в их отсутствие (происходит коллоидная стабили-
зация системы образующимися сополимерами). Рассматриваемые
способы обладают рядом достоинств, поскольку они сочетают преиму-
щества полимеризации в воде и гетерофазных системах (см. разд. 2.2)
[198].
В двухфазной системе вода - толуол в присутствии ДАК, сорбитан-
сесквиолета в качестве эмульгатора и олигомера АА с С18 - меркапто-
концевыми остатками в качестве соэмульгатора - проводили сополи-
меризацию А А и МАК. При pH = 10 получили более стабильные латек-
сы, чем при pH = 4. При pH = 10 оба мономера находились в водных
каплях, где и происходила сополимеризация. Получены сополимеры с
высокими значениями ММ. Относительные активности амида и кисло-
ты при обратной эмульсионной полимеризации не отличались от
аналогичных значений в водном растворе при условии, что среда в
обоих случаях была щелочной [232]. Необходимо отметить, что при
полимеризации в дисперсных системах обычно сомономеры по-разно-
му распределяются между водой и органической фазами, и поэтому в
общем случае кажущиеся константы сополимеризации в дисперсной
системе и в воде не совпадают [345]. Интересные данные получены при
исследовании изменения состава сополимера в ходе сополимеризации
при pH = 4 [232]. На ранних стадиях образуется сополимер, обогащен-
ный АА, в дальнейшем происходит диффузия МАК из органической
фазы в полимерные частицы, в которых соотношение кислоты и амида
увеличивается, а это приводит к получению статистического сополи-
мера; одновременно в органической фазе образуются небольшие
количества сополимера, обогащенного кислотой.
Латексный сополимер получен при безэмульгаторной сополимери-
зации АА и СТ в водной среде (pH = 9) под действием водорастворимо-
го инициатора. Процесс при этом делится на три стадии. Первоначально
преимущественно происходит полимеризация А А в водной фазе; затем
103
в образовавшихся частицах полимера полимеризуется главным
образом СТ; исчерпание капель СТ как источника СТ для полимерных
частиц приводит к тому, что полимеризация АА в воде вновь становит-
ся основной реакцией. Повышение температуры полимеризации и
понижение pH обусловливает удлинение первой стадии. С увеличе-
нием доли амида в мономерной смеси уменьшаются размеры частиц
полимера и растет их дисперсность [346]. Замена АА N-гидроксимети-
лакриламидом или N, N-диметилакриламидом не изменяет характер
процесса сополимеризации [347]. Естественно, что и в первом [346], и
во втором случае [347] процесс сополимеризации является заведомо
осложненным (’’особые” системы второго рода).
Подобная многостадийность наблюдается при безэмульгаторной
сополимеризации в воде и других пар мономеров, один из которых
является гидрофильном амидом, а второй - гидрофобным. При сопо-
лимеризации N-акрилоилпирролидона и СТ (3:7 по массе) амид всту-
пает в реакцию главным образом в начальный период. Такая особен-
ность процесса обусловливает разделение фаз в латексных частицах и
образование частиц неправильной формы. В присутствии же неболь-
ших количеств толуола (при сохранении прочих условий сополимери-
зации неизменными) образуются частицы сферической формы [348].
Безэмульгаторная инверсионная эмульсионная сополимеризация
А А и щелочных солей п-стиролсульфокислоты осуществлена в смеси
воды и толуола в присутствии как персульфата калия, так и ДАК [198].
2.4. Прививочная сополимеризация
АА и замещенные акриламиды прививаются как к гидрофильным,
так и к гидрофобным полимерам. Прививка к гидрофильным полиме-
рам часто проводится в водной среде и имеет целью повышение гидро-
динамических объемов макромолекул, а значит, и вязкости водных
I астворов. Прививка к гидрофобным полимерам обычно является
гетерофазной. В качестве субстратов могут быть использованы волок-
на, пленки, печатные платы и др. При этом прививке подвергается
только поверхностный слой субстрата, что позволяет сохранить основ-
ные физико-механические свойства материала неизменными. Такого
рода прививка цепочек ПАА улучшает окрашиваемость, понижает
гидрофобность, увеличивает адгезию к другим материалам, повышает
устойчивость к действию микроорганизмов. Привитые полиакрил-
амидные сополимеры на основе гидрофобных субстратов могут быть
использованы в качестве эмульгаторов и диспергаторов [349].
Способ осуществления прививочной сополимеризации определяет-
ся, в первую очередь, назначением получаемого сополимера.
Синтез водорастворимых сополимеров проводится в водной среде,
в которой субстрат растворим, но может быть и диспергирован. Сопо-
лимеризация инициируется главным образом окислительно-восстано-
вительными системами. Так, проводилась прививочная сополимери-
зация А А и мети лцел лю лозы в водных растворах [350, 351] в присутст-
вии инициирующей системы персульфат калия - гидросульфит
104
натрия - триэтаноламин. Степень вовлечения субстрата в процесс,
равная 86,6%, достигнута при его концентрации в исходной смеси 2%,
концентрации мономера 20%, температуре 40 °C. При обработке, полу-
ченных водных растворов ацетоном наряду с ПАА осаждалась большая
часть привитого сополимера [351]. Используя для инициирования
редокс-систему Fe(II) - Н2О2, получен декстран-пр-полиакриламид
[352].
Высокая эффективность прививки к водорастворимым гидроксил-
содержащим полимерам достигается при использовании соли церия
(IV) в качестве инициатора. В результате окисления солью Ce(IV)
ОН-групп в макромолекулах образуются свободные радикалы. Для
гомофазной прививки АА к полисахаридам в растворе азотной кисло-
ты смешивают субстрат и аммонийцерийнитрат, после чего добавляют
мономер и выдерживают реакционную смесь в течение определенного
времени [353 - 355]. Изменяя соотношение Ce(IV) и субстрата, напри-
мер декстрана, регулируют частоту прививки и длину привитых
цепей. По данным [356], при прививочной сополимеризации АА и
декстрана в воде в присутствии церийаммонийнитрата получен поли-
мер, в котором на одну цепочку декстрана приходится всего одна
цепочка ПАА, что, по-видимому, обусловлено малой реакционной спо-
собностью немодифицированных ангидроглюкозных структур. Для дос-
тижения высокой частоты прививки в качестве исходного полимера
использовали высокореакционноспособную поли-(3-о-метакри-
лоил-И-глюкозу). Из этого полимера и АА в воде получены сополи-
меры с максимальным содержанием привитых цепочек - 29 на одну
макромолекулу исходного полимера при частоте прививки 12 на 100
мономерных звеньев З-о-метакрилоил-О-глюкозы [357].
Представляет интерес прививка цепей ПАА на водонерастворимую
оксиэтилцеллюлозу, инициируемая редокс-системой, в которой
окислителями являются комплексы Со(Ш), а роль восстановителя
играет субстрат. Обрыв цепей протекает в результате их взаимодейст-
вия с Со(Ш). Сополимеризация проводится в водных растворах
хлорной кислоты и А А при 0 °C в соответствие и в присутствии однооснов-
ных органических кислот в качестве комплексообразователей. Путем
варьирования pH среды и содержания органических кислот можно в
широких пределах менять скорость сополимеризации и длину приви-
ваемых цепочек [160].
Повышение эффективности прививки (уменьшение доли гомополи-
мера в продуктах реакции) достигается путем предварительного
введения в макромолекулы субстрата пероксидных групп, которые
при нагревании или в результате взаимодействия с восстановителями
дают свободные радикалы, инициирующие прививку. Обработка
целлюлозы озоном при 100 - ПО °C обусловливает появление в
полимере гидропероксидных и пероксидных групп, гомолитический
распад которых приводит к прививочной сополимеризации с АА. При
использовании 20%-го водного раствора АА максимальная эффектив-
ность прививки была 67% [358]. Предварительное создание пероксид-
105
ных групп в целлюлозном волокне осуществлено путем его обработки
тетраоксидом рутения и пероксидом водорода. Прививочная сополи-
меризация А А проводилась в присутствии (NH^Fe (SO^ в качестве
восстановителя [359]. Изотактический полипропилен обрабатывали
озонсодержащим кислородом при 70 °C. Прививочную сополимериза-
цию окисленного полимера, который содержал гидропероксидные
группы, и АА проводили в присутствии эмульгированной жидкой
фазы, состоящей из воды, этилацетата и хелатных комплексов железа
[360]. Прививка МАА к полиуретанам инициируется пероксидными
соединениями, образующимися в результате автоокисления МАА при
его длительном пребывании на воздухе [361]. Значительная прививка
цепочек ПАА происходит при нагревании до 85 °C целлюлозы и раство-
ра АА в воде, насыщенной хлоридом натрия, в отсутствие специально
добавленного инициатора [362].
Для прививки АА-содержащих цепочек к различным полимерам
очень широко применяется радиационный метод, причем облучение
субстрата и прививочная сополимеризация проводятся как одновре-
менно, так и последовательно. Описана прививка АА к пленке полиэ-
тилена низкой плотности под действием излучения60 Со в присутствии
воды как растворителя мономера [363]. Основным условием высокой
эффективности прививки является присутствие ингибитора гомопо-
лимеризации - соли Мора. В отсутствие ингибитора образующийся
ПАА препятствует диффузии мономера в полимерную матрицу во
время радиационного облучения, ввиду чего практически происходит
только гомополимеризация. Ингибирование же обеспечивает низкую
вязкость жидкой фазы реакционной смеси и, следовательно, высокую
скорость диффузии АА в полимерную пленку, что способствует обра-
зованию привитого сополимера. Скорость образования привитых
цепочек в полимере увеличивается с ростом концентрации ингибито-
ра. Скорость прививки была пропорциональна дозе облучения и
концентрации мономера в степенях 1,43 и 1,4 соответственно. Увели-
чение массы пленок в результате прививки достигало 140%. С ростом
содержания привитых цепочек ПАА в макромолекулах полученного
полимера уменьшалась его растворимость в л-ксилоле. Ингибирование
гомополимеризации при получении поли(акриламид-пр-этилена)
осуществлено также с помощью нитрата меди (I) [364].
Прививку N, N-диметилакриламида на пленку политетрафторэтиле-
на инициировали у-лучами из источника 60 Со. При использовании
этилацетата или ацетона в качестве растворителя достигнут 14%-й
привес пленки [365].
Для прививки смесей АА и СТ к пленке ацетата целлюлозы пленку
предварительно облучали у-лучами в присутствии воздуха при ком-
натной температуре. При этом в полимере появились пероксидные
группировки, которые при последующем нагревании (до 50 °C) в
присутствии водно-спиртовых растворов мономеров распадались на
свободные радикалы, инициировавшие прививочную сополимериза-
цию. Значения и и г2 для АА и СТ в указанных условиях заметно
106
отличались от соответствующих значений в отсутствие .субстрата и
менялись в зависимости от природы спирта, использованного совмест-
но с водой для растворения мономеров [366].
Наряду с V-лучами для инициирования прививочной сополимериза-
ции используются и другие частицы высокой энергии. Прививка АА на
целлюлозные материалы, предварительно облученные электронами
высокой энергии, дает увеличение массы до 210%. Пероксидные груп-
пы, образующиеся в молекулах целлюлозы при облучении в присутст-
вии воздуха, не принимают заметного участия в прививке при темпе-
ратуре ниже 60 °C [367]. Для получения полимеров с высоким набуха-
нием в воде использовали облученный пучком электронов гетероцеп-
ной полиамид, к которому прививали А А и мети лен-бис-акри ламид;
продукт реакции при нагревании обрабатывали муравьиной кислотой
[368]. Для получения поли(акриламид-пр-этилена) пленку полиэтилена
подвергали плазменной обработке, а затем воздействию воздуха, что
привело к образованию в макромолекулах пероксидных групп,
ответственных за инициирование последующей прививочной сополи-
меризации [369].
При получении полиакриламидных привитых сополимеров широкое
применение находит фотохимическое инициирование. Описана [370]
фотохимическая прививка ПАА на натуральный каучук, растворенный
в циклогексане. Прививка АА к поверхности пленок из полиэтилена
низкой плотности и изотактического полипропилена осуществлена
путем облучения при 50 °C УФ-лучами пленок в присутствии мономе-
ра и синсибилизатора (бензофенона) в газовой фазе или растворе
ацетона [371]. Фотоинициированная сополимеризация АА и гидрокси -
этилметакрилата в водно-ацетоновых растворах в присутствии целлю-
лозы и с использованием изопропилтиоксантона в качестве сенсибили-
затора привела к образованию привитого сополимера [372].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Polymer Handbook/Ed. By. J. BrandrupE.H.Immergut New York—London—Sydney: Inter-
science Publishers. 1966. Part IV. P. 205.
2. MacWilliams Г).С.Ц Functional monomers/Ed. by. R.H. Vacum, E.V. Nyguist. New York:
M. Dekker, 1973. V.l. Ch.l. P.197.
3. Куренков В.Ф., Байбурдов T.A., Мягченков В. A.//Химическая энциклопедия. М.:
Советская энциклопедия, 1990. 800 с.
4. Савицкая М.Н., Холодова Ю.Д. Полиакриламид. Киев: Техгика, 1969. 188 с..
5. Громов В.Ф., Хомиковский П.М., Абкин А.Д.Ц ВМС. Сер. Б. 1970. Т. 12. №10.
С. 767-770.
6. Арбузова И.А., Ефремова В.Н., Улезло И.К. // ВМС 1957. Т. 112. № 4. С. 645-648.
7. Schildknecht G.E. Vinyl and related polymers. New-York: J. Wiley and Sons; London:
Chapman and Hall, 1952. P. 314-322.
8. Громов В.Ф., Хомиковский Л.М., Розанова H.A. 11 ВМС. Сер. Б. 1968. T.10. C. 754—757.
9. Громов В. Ф., Матвеева А.М., Абкин А.Д. и др. //ДАН СССР. 1968. Т. 179. № 2. С. 374—377.
10. Chapiro A., Perec-Spitzer I.// Eur. Polym. 1. 1975. V. 11. N1. Р. 59-69.
11. Соколова Т.А., Овсянникова Л.А., Никитин В.Н. // ВМС 1964. Т. 6. № 6. С. 1150—1152.
12. Соколова Г.А., Овсянникова Л.А., Запевалова Н.П.//ВМС. Сер. А. 1968. Т.10. №4.
С. 955-959.
13. Schulz R„ Henglein A., Steinwehr H.E.V. et al. 11 Angew. Chemie. 1955. Bd. 67. S.232.
107
14. Restaino A.J., Mesrobian R.B., Morawetz H.E.V. etalj/l. Amer. Chem. Soc. 1956. V. 78.
N 13. P. 2939-2943.
15. Chapiro A., Zumer M.//J. Chim. Phys. 1965. V. 62. N 9. P. 947-950.
16. Жаров A.A., Чистотина Н.П. //ДАН CCCPJ988. Т. 299. №5. С. 1158-1161.
17. Нехорошее В.Г., Шейнкер А.П., Абкин А.Д.ЦВМС. Сер. Б. 1969. Т.П. №10.
С. 736-740.
18. Громов В.Ф., Шейнкер А.П., ХомиковскийП.М. и др. // ВМС. Сер. А. 1974. Т. 16. № 2.
С. 365-369.
19. JshigakiFukuzakiH., Okada Т. et al.//1. Appl. Polym. Sci. 1981. V.26. N 5.
P. 1585-1594.
20. Collinson E., Dainton F.S., McNaughton G. I I J. Chim. Phys. 1955. V. 52. P. 556-565.
21. Громов В.Ф., Матвеева A.B., Хомиковский П.М. u др.//ВМС. Сер. А. 1967. Т.9. № 7.
С. 1444-1449.
22. Пат. 7895802 Японии; С.А. 1979. V. 90. 124350 s.
23. Пат. 1492037Франции; С.А. 1968. V. 68. 1152058.
24. Корнеева Г.П., Мамин Е.Б., Шейнкер А.П. и др. //Пластмассы. 1973. № 5. С. 12—15.
25. KilicS., Baysal В.М.//1. Macromol. Sci. 1986. V. 26. N 4. P. 483-522.
.26. DaintonF.S., Totdoff M.//Trans. Far. Soc. 1957. V.53. N4. P. 499-511.
27. Baumann H., Strehmel B., Timpe H. // Acta polymerica. 1982. Bd. 33. N 9. S. 531-533.
28. DaintonF.S., TordoffM.HTttns. Far. Soc. 1957. V.53. P.666-678.
29. Takemura F., SakaguchiK.//1. Chem. Soc. Japan. Chem. and Ind. Chem. 1976. N9.
P.1470-1475.
30. Oster G.K., Oster G„ Plati G. // J. Amer. Chem. Soc. 1957. V. 79. N 3. P. 595-598.
31. Kubota H„ Ogiwara Y., MatsuzakiK.//]. Appl. Polym. Sci. 1978. V. 22. N11. P. 3327-3333.
32. Charberek S„ Shepp A., Allen R.J. // J. Phys. Chem. 1965. V. 69. N 2. P. 641-647.
33. Hsia Chen C.S.//J. Polym. Sci. Part A. 1965. V. 3. P. 1107-1125.
34. Delzenne G., Dewinter W., ToppetS. etal./ll. Polym. Sci. 1964. Part A. V. 2. N3.
P. 1069-1083.
35. Henglein A. //Makromol. Chem. 1954. Bd. 14. S. 15-39.
36. Скобец E.M., Нестюк Г.С. // У кр. хим. ж. 1963. Т. 29. № 3. С. 302 — 306.
37. Joshizawa S., TakenaraZ., OgumiZ. et al. //J. Appl. Elektrochem. 1976. V. 6. N2.
P. 147-153.
lb. Bhadani S.N., Prasad J.K., RunduS.Hl. Polym. Sci. Pol. Chem. Ed. 1980. V. 18. N 5.
P. 1459-1469.
39. Egboh S.H. H Angew. Makromol. Chem. 1983. B. 117. S. 95-101.
40. Nakano A., Minoura J. //Polymer. 1969. V.10. N 1. P. 1-10.
41. George M.H., Ghosh A. //J.Polym. Chem. Ed. 1978. V. 16. N 5. P. 981 - 995.
42. Jones G.D., Zomlefer J., Hawkins K. //J. Org. Chem. 1944. V. 9. P. 500-512.
43. Зильберман E.H., Абрамова Л.И., Некрасова T.А. //ВМС. Сер. А. 1978. Т.20. №10.
С.2331-2337.
44. Riggs J.P., RodriguezF. III. Polym. Sci. 1967. Pad A-l. V.5. N12. P. 3151-3165.
45. Shawki S.M., Hamielec A.E. III. Appl. Polym. Sci. 1979. V. 23. N 11. P. 3341-3354.
46. Thomson R.A.M., Ong Ch.K., Rossar C.M. et al. //Makromol. Chem. 1983. Bd. 184.
S.1885-1892.
47. Manickam S.P., Subkaratnam N.R., Venkatarao K./Makromol. Chem. 1979. Bd. 180.
S.589.
48. Chou K.-F. //Kobunshi Kagaku. 1973. V. 30. N 339. P. 437-440; РЖХ 1974. 3C 130.
49. Covell E. A.S. //Makromol. Chem. 1962. Bd. 54. S. 70-77.
50. Зильберман E.H., Абрамова Л.И., Лешин B.B. 11 ВМС. Сер. А. 1985. Т. 27. №6.
С. 1160-1165.
51. Пат. 80135104Японии; С.А. 1981. V. 94. 848511.
52. De Schryter F.C., Smets G., Van Thielen J. Hl. Polym. Sci. Part B. 1968. V. 6. N 8.
P. 547-550.
53. A.c. 648565 СССР//Открытия. Изобретения. Пром, образцы. Тов. знаки. 1979. № 7.
С. 89.
108
54. Bhadani S.N., Prasad J.K. //J. Polym. Sci. Polym. Lett. Ed. 1979. V. 17. N 8. P. 493-500.
^.Bhadani S.N., Prasad J.K Hl. Polym. Sci. Polym. Lett. Ed. 1978. V. 16. N12. P. 639-642.
56. Mishra M.K. Hl. Appl. Polym. Sci. 1985. V. 30. N2. P. 723-729.
57. Narita H., Okimoto T., Machida S. //Makromol. Chem. 1972. В 157. S. 153-163.
58. Пат. 30214419 США; C.A. 1966. V. 64. 8341 c.
59. Пиддубный B.K., Сторож Г.Ф., Тополъницка Л.Л. //Biсник Льв1в. ун-ту. Сер. Хим.
1975. Вып. 17. С. 50-52.
60. Elayaperumal Р., Balakrishman Т., Santappa М. И Makromol. Chem. 1977. Bd. 178.
S. 2271-2273. Curr. Sci. 1977. N4. P. 849-850.
61. Сторож Г.Ф., Пиддубный B.K., Луцевич Д.Д. и др. //Bi сник Льв1в. ун-ту. Сер. Хим.
1972. Вып. 13. С. 50-52, 92.
62. Ревельская Л.Г., Курлянкина В.И. /ВМС. Сер. А. 1987. Т. 29. № 5. С. 1086-1090.
63. Gnanasundaraman Р., Kothandaraman Н. //Eur. Polym. J. 1979. V. 15. N 4. P. 399-404.
Cnanasundaraman P., Kothandaraman H. //Polym. J. 1979. V. 11. N4. P. 261-265.
te-Misra S„ Sahu G. Hl. Polym. Sci. Polym. Chem. Ed. 1985. V. 23. N 10. P. 2647-2657.
56. Chou K.-F. //Kobunshi Kagaku. 1973. V. 30. N 339. P. 429-433.
67. Пиддубный B.K., Сторож Г.Ф. //йсник Льв1в. ун-ту. Сер. Хим. 1974. Вып. 15.
С. 63-67.
68. Коростелева Е.А., Дымарчук Н.П., Мишенко К.П. //ЖПХ. 1976. Т.49. №6.
С. 1404-1406.
69. Pohl К., Rodriguez F. Hl. Appl. Polym. Sci. 1981. V. 26. N 2. P 611-618.
70-Suen T.I., Jen Y„ Lockwood J.V. Hl. Polym. Sci. 1958. V. 31. N 123. P. 418-497.
71. Добрынин H.A., Дымарчук Н.П., Мишенко К.П. //Химия и хим. технол. 1970. Т.13.
№ 11. С. 1596-1599 (Изв. вузов).
72. Riggs J.P., Rodriguez F. Hl. Polym. Sci. Part A-l. 1967. V.5. N 12. P. 3167-3181.
73. Яковлев B.A., Дымарчук Н.П., Мишенко К.П. //ЖПХ. 1972. Т. 45. № 11. С. 2560-2562.
74. Коростелева Е.П., Дымарчук Н.П., МишенкоК.П.//ЖПХ. 1975. Т.48. №7.
С. 1642-1643.
75. Минеев Л.В., Масленников В.А., Городнов В.П. //Тр. Гипровостокнефть/Добыча,
сбор и подготовка нефти и газа. Куйбышев, 1975. Вып. 24. С. 180-184.
76. RodriguezF., Givey R.D. Hl. Polym. Sci. 1961. V. 55. N 12. P. 713-719.
77. Куренков В.Ф., Байбурдов T.A., Ступенъкова Л.Л. //ВМС. Сер. А. 1987. Т. 29.
№ 2. С. 348-351.
78. Wooten W.C., Blanton R.B., CooverH.W. Hl. Polym. Sci. 1957. V.25. Nlll. P.403-412.
79. Куренков В.Ф., Байбурдов T.A., Ступенъкова Д.Д. //Химия и технол. элементоорг.
соед. и полимеров: Межвуз. сб. Казань: Изд-во КХТИ, 1989. С. 106-112.
80. Kurenkov V.F., Baiburdov Т.А., Stupenkova L.L. //Eur. Polym. J. 1990. V. 26.P. 1229—1239.
81. Акопян P.M., Бейлерян H.M., Оганян И.М. И Арм. хим. журн. 1975. Т. 28. № 4.
С. 263-268.
82. Beres J., Olkowska J., Poniewierska H. et al. //Przemysl Chemiczny. 1979. V.58.
N 7. P. 356-359.
83. Акопян P.M., Бейлерян H.M., Бояджян П.З. И Арм. хим. журн. 1975. Т. 28. №7.
С. 522-526.
84. Меликсетян Р.П., Бейлерян Н.М. И Арм. хим. журн. 1978. Т. 31. № 11. С. 803—810.
85. Акопян Р.М., Бейлерян Н.М. //Арм. хим. журн. 1979. Т. 32. № 5. С. 343-347.
86. Pegon Y., Quiney С. И J. Chromatography. 1974. V. 100. N 1. Р. 11-18.
87. Зильберман Е.Н., Абрамова Л.И., Петрова Т.Н. И ВМС. Сер. А. 1982. Т. 24.
№ 7. С. 1511-1515.
88. Kurenkov V.F., Trifonova M.N., Myagchenkov V.A.HEur. Polym. J. 1987. V.23. N9.
P. 685-688.
89. AtidasS.W., Karl.K., PalitS.R. Hl. Indian Chem. Soc. 1974. V.51. N3. P.393-400.
90. Misra G.S., RebelloJ.J. //Makromol.Chem. 1974. Bd. 175. S. 3117-3131.
91. Misra G.S., Rebello J.J. //Makromol. Chem. 1976. Bd. 177. S. 21-37.
H.Misra G.S., Rebello J.J.I/Makromol. Chem. 1976. Bd. 176. S. 2203-2223.
93. Баджпай У.Д.Н., Миера Г.С.// ВМС. Сер. Б. 1979. Т. 21. № 7. С. 419 - 423.
109
94. Palit S.R., Ranjit S. 11 J.Polym. Sci. 1962. V. 57. N 165. P. 609-615.
95. Elayaperumal P., Balakrishnan T., Santappa M. et al. Hl. Polym. Sci. Polym. Chem. Ed.
1979. V. 17. N12. P. 4099-4105.
96. Gezy G.S., NasrH. //Kolor. Ert. 1970. V. 12. N 78. P. 138-144.
97. Misra G.S., DubeyS.L. III. Polym. Sci. Polym. Chem. Ed. 1979. V. 17. N 5. P. 1393-1400.
98. Husain M.M., Misra S.N. IIJ. Indian Chem. Soc. A. 1979. V. 17. N 2. P. 188-121.
99. Misra G.S., Bhasilal N.M. //Europ. Polym. J. 1978. V. 14. N 11. P. 901-904.
100. Husain M.M., Gupta A., Misra S. //Makromol. Chem. 1975. Bd. 176. S. 2861-2870.
101. Shukla J.S., Singh К. I'll. Polym. Sci. Polym. Chem. Ed. 1979. V. 17. N 2. P. 531-538.
102. Пат. 59267 Румынии; C.A. 1978. V. 88. 1532536.
103. Shukla J.S., Misra D.S. //Makromol. Chem. 1973. Bd. 173. S. 91-99.
104. Пат. 1129196 Великобритании; C.A. 1968. V. 69. 1073477v.
105. Sengupta T.K., PalitS.R. 111. Indian. Chem. Soc. 1976. V.53. N7. P.726-727.
106. Husain M.M., Misra S.N., Gupta A. //Makromol. Chem. 1976. Bd. 177. S. 2919-2926.
107. Husain M.M., Gupta A. 1/1. Macromol. Sci. Chem. A. 1977. V. 11. N 12. P. 2177-2187.
108№ ra G.S., Arya B.D. III. Macromol. Sci. Chem. A. 1983. V. 19. N 2. P. 253-264.
109. Rout S.P., Rout A., MallickN. etal. //Makromol. Chem. 1977. Bd. 178. S. 1971-1977.
110. Narita H, Okimoto T., Machida S. Hl. Polym. Sci. 1970. Part A. V. 8. N 10. P. 2725-2731.
111. 9маритян Д.З., Бейлерян H.M. Ц Арм. хим. журн. 1977. Т. 30. № 2. С. 120—127.
112. Whitby G.S., GrossM.D., Miller J.R. et al. III. Polym. Sci. 1955. V. 16. P. 549-576.
113. SarathyP., Rao K.N., SethuramB. et al.lll. Macromol. Chem. A. 1986. V.23. N8.
P. 955-961.
114. Turska E., Matuszewska-Czerwik J. //Makromol. Chem. 1967. Bd. 104. S. 167-176.
115. Sakai S., Fujii S., Kitamura M. et al. // J. Polym. Sci. 1965. Part. В. V. 3. N 11. P. 955-958.
116. Cyetkoyska M., Crcey T., Petroy G. //Makromol. Chem. 1984. Bd. 185. S. 429-439.
117. Куренков В.Ф., Байбурдов T.А., Ступенькова Л.Л. //ЖПХ. 1987. T. 60. №10.
C. 2311-2316.
118. Allen P.E.M., Patrick C.R. //Makromol. Chem. 1961. B. 47. S. 154-167.
119. Ishige T., HamielecA.E. /11. Appl. Polym. Sci. 1973. V. 17. N 3. P. 1479-1506.
120. Currie D.J., Dainton F.S., Watt W.S. H Polymer. 1965. V. 6. N 9. P. 451-453.
121. Kurenkoy V.F., Myagchenkoy V.A. II Europ. Polym. 1. 1980. V. 16. N11. P. 1229-1239.
122. North A.M., Scallam A.M. //Polymer. 1964. V. 5. N 9. P. 447-455.
123. Dainton F.S., Sisley W.D. //Trans. Far. Soc. 1963. V. 59. P. 1369-1376.
124. Kolthoff I.M., MillerI.K. 111. Amer. Chem. Soc. 1951. V. 73. N 7. P. 3055-3059.
125. Gromoy V.F., Galperina N.J., Osmanoy T.O. et al.//Eur. Polym. J. 1980. V.16. N 6.
P. 529-535.
126. SchulzR., RennerG., Henglein A. etal. 11Makromol. Chem. 1959. Bd. U.S. 20.
127. Ulbrich K„ Kopecek l.HBut. Polym. J. 1976. V. 12. P. 183-187.
128. lacoyM., SmetsG., De SchryyerF.C.H 1. Polym. Sci. 1972. PartB. V. 10. N 9.
P. 669-673.
129. Куренков В.Ф., Ахмедьянова P.A., Северинов A.B. и др. //Химия и технол. элемен-
тоорг. соед. и полимеров: Межвуз. сб. Казань: изд-во КХТИ, 1977. С. 20—23.
130. Османов Т.О., Громов В.Ф., Хомиковский П.М. и др//ДАНСССР.1978. Т. 240. №4.
С. 910-913.
131. Османов Т.О., ГромовВ.Ф., ХомиковскийП.М. и др.Ц ВМС. Сер. Б. 1978. Т.20. №4.
С. 263-267.
132. Османов Т.О., Громов В.Ф., Хомиковский П.М. и др.//ВМС. Сер. А. 1979. Т.21.
№ 8. С. 1766-1773.
133. Османов Т.О., Громов В.Ф., Хомиковский П.М. и др. //ВМС. Сер'. А. 1980. Т. 22. № 3
С. 668-675.
134. Новичкова Л.М., Покровский Е.И., Ковальская А.Г. и др. //ВМС. Сер. Б. 1968. Т. 10.
№ 10. С. 813-816.
135. Пат. 3509114 США; С.А. 1970. V. 73. 448г.
136. Куренков В.Ф., Алеева Ю.В., Верижникова А.С. и др. //Химия и хим. технол. 1989.
Т. 32. №2. С. 67-70 (Изв.вузов).
110
137. Куренков В.Ф., Верижникова А.С., Мягченков В.А.//Физико-хим. процессы
синтеза и свойства полимеров: Межвуз. сб. Горький; изд-во ГГУ, 1988. С. 35-40.
138. Пат. 3332922 США; С.А. 1970. V. 67. 91246 g.
139. Friend J.F., Alexander А.Е. //J. Polym. Sci. Part A-l. 1968. V. 6. N 7. P. 1833-1839.
140. Narain H, Shukla J.S., Misra G.S. //Makromol. Chem, 1970. Bd. 134. S. 179-192.
141. Трубицына C.H., Исмаилов И., Аскаров М.А.//ВМС. Сер. А. 1978. Т. 20. № 11.
С. 2608-2611.
142. Куренков В.Ф., Осипова Т.М., Кузнецов Е.В. и др. //ВМС. Сер. Б. 1978. Т. 20. № 9.
С. 647-650.
143. Vaskova V., Juranicova V., Barton J. //Chem. Papers. Chemicke zvesti. 1986. T. 40.
N4.S. 435-441.
144. Barton J., Vaskova V., Juranicova V. //Makromol. Chem. 1986. Bd. 187. S. 257-262.
145. Kim O.K., Griffith J.R. //J. Polym. Sci. Polym. Lett. Ed. 1975. V. 13. N 9. P. 525-531.
146. Gupta K.C., Raja G.D., BehariK.//}. Macromol. Chem. Part A. 1987. V. 24. N 5.
P. 587-592.
147. Kay T.A., Rodriguez F.J. // Appl. Polym. Sci. 1983. V. 28. N 2. P. 663-646.
148. Тоноян A.O., Лейкин А.Д., Давтян С.П. и др.//ВМС. Сер. А. 1973. Т. 15. №8.
С. 1847-1851.
149. Байбурдов Т.А., Куренков В.Ф., Ступенькова Л.Л. и др. //Химия и хим. техноло-
гия. 1988. Т. 31. № 10. С. 105-108 (Изв. вузов).
150. Dainton F.S. Ц J. Chem. Soc. 1952. N 4. Р. 1533-1546.
151. Suen J.T., RosslerD.F.// J. Appl. Polym. Sci. 1960. V. 3. N 7. P. 126.
152. Chen C. Y„ Kuo J.F. //J. Polym. Sci. Part A. 1988. V. 26. N 4. P. 1115-1123.
153. Качалова Г.С., Дымарчук Н.П., Мищенко К.П.// Химия и хим. технол. 1971. Т. 14.
№ 3. С. 427-430 (Изв. вузов).
154. FadnerN.A., Morawetz Н. Ц i. Polym. Sci. 1960. V. 45. N 146. P. 475-501.
155. Cavell E.A.S., Gilson J.T. // J. Polym. Sci. Part A-l. 1966. V. 4. N 3. P. 541-550.
156. Абрамова Л.И., Зильберман E.H., Лешин B.B. //ВМС. Сер. А. 1985. Т. 27.
№ 6. С. 1160-1165.
157. Chou K.F. //Kobunshi Kagaku. 1972. V. 29. N 4. P. 233-236; С.А. 1972. V. 77. 623704.
158. Молотков В. А., Курлянкина В.И., Кленин С.И. //ВМС. Сер. А. 1972. Т. 14. № 11.
С. 2478-2487.
159. Fanood R.M..H., GeorgeМ.Н.//Polymer. 1988. V. 29. N 1. Р. 128-133.
160. Немчинов И.А., Молотков В.А., Курлянкина В.И. //ВМС. Сер. А. 1989. Т. 31. № 1.
С. 123-128.
161. Громов В.Ф., Микова О.Б., Изюмников А.Л. и др. //Пластмассы. 1989. № 1. С. 4-8.
162. Sejci М„ Taksuka Т. // П. Soc. Fiber. Sci. and Technol. Japan. 1965. V. 21. N 10.
P. 536-540.
163. Белоногов A.B., Зильберман E.H., Абрамова Л.И. и др. //Акриловые олигомеры.
Синтез, свойства, применение: Межвуз. сб. Горький: изд-во ГГУ, 1990. С. 48-51.
164. Шапиро Л.В., Луховицкий В.И., Поликарпов В.В. //ВМС. Сер. А. 1984. Т. 26.
№ 4. С. 650-654.
165. Абрамова Л.И., Зильберман Е.Н., Лешин В.В. //Химия и хим. техиол. 1987. Т. 30.
№ 7. С. 117—119 (Изв. вузов).
166. Микова О.Б., Громов В.Ф., Телешов Э.Н. // Пластмассы. 1986. № 8. С. 10—12.
167. Абрамова Л.И., Зильберман Е.Н., Емелин И.С. и др. //ЖПХ. 1988. Т. 61. №8.
С. 1942-1944.
168. Абрамова Л.И., Зильберман Е.Н., Иванова В.И.//ВМС. Сер. А. 1989. Т. 31.
№ 7. С. 1436-1439.
169. Мягченков В.А., Куренков В.Ф., Ахмедьянова Р.А. //ВМС. Сер. Б. 1984. Т. 26. № 5.
С. 340-344.
170. Needles H.L., WhitfieldR.E. Hi. Polym. Sci. Part A. 1965. V. 3. N 10. P. 3543-3548.
111. Зильберман E.H., Абрамова Л.И., Афоньшин F.H. //ВМС. Сер. Б. 1980. Т. 22. № 10.
С. 774-778.
172. Пат. 347419 Австралии; С.А. 1979. V. 90. 137289d.
111
m.HueN.D., Hoa T.V., Quy Ph.T. //Tap San. Hoa-Hoc. 1975. V.13. N4. P.365-340.; C.A.
1976.V. 85. 143545 x.
174. Le Berre A., Delacroix A. //Bull. Soc. Chim. France. 1973. N 2. P. 640-647.
175. Oda R., Ito J., Kawada M. HI. Japan Oil Chem. Soc. 1961. V. 10. N 8. P. 494-498.
176. Пат. заявка 61-155406 Японии; РЖХ. 1987. 13С521П.
177. Пат. заявка 52-89193 Японии; РЖХ. 1978. 18С317П.
178. Пат. заявка 2348227 Франции; РЖХ. 1978. 19С549П.
179. Пат. заявка 2184054 Великобритании; РЖХ. 1988. 7Т140П.
180. Пат. 1218157 ФРГ; РЖХ. 1972. 12С359П.
181. Дисперсионная полимеризация в органических средах.: Пер. с англ. Под ред. К.Е.
Дж.Барретта. Л.: Химия, 1979. 338 с.
182. Wada Т., Sekiya Н., Mach S. III. Polym. Sci. Polym. Chem. Ed. 1975. V. 13. P. 2375-2389.
183. Eva F. Tai., Caskey J.A., Allison B.D.HI. Polym. Sci. Polym. Chem. Ed. 1986. V. 24.
P. 567-577.
184. Samal S.K., Navak B. //Polym. Sci. 1988. A26. N 4. P. 1035-1049.
135. Johnston N.W., McCarthy N.J. Ir.N.J. I/Am. Chem. Soc. Polym. Prep. 1972. V.13. N2.
P. 1278-1283.
186. Johnston N. W., Ir.N.J. McCarthy //Niova Chim. 1973. V. 49. N 9. P. 47-49.
187. Куренков В.Ф., Александрова И.А., Кузнецов E.B. и др. //Химия и хим. технол.
1975. Т. 18. № 11. С. 1788-1791 (Изв. вузов).
188. Myagchenkov V.A., Kurenkov V.F. III. Polym.Sci. A-l. 1969. V. 7. P. 3279-3286.
189. Myagchenkov V.A., Kurenkov V.F., Frenkel S.Ya. //Eur. Polym. J. 1970. V. 6.
P.1649-1654.
190. Френкель С.Я., Мягченков B.A., Куренков В.Ф. И Труды проблемной лаборато-
рии/ЛИТЛП. Л., 1971. Вып. 13.С.133-140.
191. Myagchenkov V.A., Vagapova А.К., Frenkel S. Ya. //Intern. Symp. Macromol. Helsinki.
1971. Preprint 1-71. P.427-429.
192. Зильберман E.H., Новолокина P.A., Кубарзина О.П. //ВМС. 1980. Т.22. №9.
С. 2006-2011.
193. Громов В.Ф., Хомиковский П.М. //Успехи химии. 1979. Т.48. № 11. С. 1943—1967.
194. Kirk-Othmer. Encyclopedia of chemical Technology. 3rd ed. 1980. V. 10. P. 489-523.
195. Bikales N.M. Preparation of acrylamide polymers.//Water soluble polymers. N.Y.—
London. 1973. P. 213.
196. Громов В.Ф., Телешов Э.Н. И Пластмассы. 1984. № 10. С. 9—13.
197. ШапироЛ.В., Луховицкий В.И., Поликарпов В.В. и др. //Тезисы докл. II конферен-
ции "Водорастворимые полимеры и их применение”. Иркутск: Иркутский ии-т орг.химии,
1982. С. 42.
198. Куренков В.Ф., Верижникова А.С., Кузнецов Е.В. и др. //Химия и хим. техноло-
гия. 1982. Т. 25. № 2. С. 221-226. (Изв. вузов).
199. Domonie M.V., Boghina С.М., Marinescu N.N. et al. //Eur. Polym. J. 1982. V. 18. N. 7.
P. 639-645.
200. Boghina C.M., Marinescu N.M., Marinescu M.M. et al. //Supac Macro-83. Bucharest.
1983. Abstr. Sec. 1. S. 133-117.
201. Поверхностно-активные вещества: Справочник. Л.: Химия, 1979. С. 21.
202. Поликарпов В.В., Шапиро Л.В., Луховицкий В.И. и др. //Пластмассы. 1984. № 11.
С. 5-8.
ЗОЗ.МаШ S., Nerro J., Riess G. //Progr. Coll. Polym. Sci. 1975. V.58. P. 114.
204. Шапиро Л.В., Луховицкий В.И., Поликарпов B.B. //Пластмассы. 1986. № 8. С. 15—16.
205. Куренков В.Ф., Байбурдов Т.А., Ступенъкова Л.Л. и др. //Химия и хим. технол.
1989. № 10. С. 80-84 (Изв.вузов).
206. Candau F. III. Chim. phys. et phys-chim. biol. 1987. V. 84. N9. P. 1095-1099.
207. Hunkeler D., Hamielec A.E., Baade W. //Polymer. 1989. V. 30. P. 127-142.
208. Candau F.//Encyclopedia of Polymer Science and Engineering. 2nd ed. J. Wiley and Sons.
1987. V.9.P. 718-724.
209. Vanderhoff J.W., Bradford E.B., Tarkowski M.L. et al. //Ad. Chem. Ser. 1962. V.34.
P.32-51.
112
210. Smith W., Ewart R. 111. Chem. Phys. 1948. V. 16. P. 592-599.
211. Куренков В.Ф., Нуруллина E.B., Мягченков B.A. //Химия и хим. технол. 1989.
Т. 32. № 4. С. 96-100 (Изв. вузов).
212. Куренков В.Ф., Байбурдов Т.А., Гарипова Н.С. //Химия и хим. технология. 1986.
Т. 29. № 8. С. 92-95 (Изв. вузов).
213. Baade W., Reichert К.-Н. //Makromol. Chem. Rapid Commun. 1986. Bd. 7. S. 235-241.
214. Громов В.Ф., Османов T.O., Глазкова И.В. и др.//ВМС. Сер. А. 1988. Т. 30. №6.
С. 1164.
215. Vanderhoff J.W., Distefano F.V., El-Aasser M.S. et al.Hi. Dispers. Sci. and Technol.
1984. V. 5. N 3-4. P. 323-363.
216. Baade W., Reichert K.-H. // Eur. Polym. J. 1984. V. 20. N 5. P. 505-512.
217. Куренков В.Ф., Трифонова M.H., Байбурдов T.А. и др.//ВМС. Сер. А. 1989.
Т. 31. № 9. С. 1898-1903.
218. James H.L., Burma I. И ACS Symp. Ser. 1976. V. 24. P. 197.
219. Arai M., Arai K., Saito S. 11 J. Polym. Sci. 1980. V. 18. P. 2811.
220. Сапфц F., Leong Y.S., Pouyet G. et al. // J. Colloid and Interface Sci. 1984. V. 101. N 1.
P. 167-183.
221. Graillat C., Pichot C., Guyot A. et al. III. Polym. Sci. Polym. Chem. Part A. 1986. V. 24.
N 3. P. 427-449.
222. Candau F., Leong Y.S., Fitch R.M. 111. Polym. Sci. Polym. Chem. Ed. 1985. V. 23. N 1.
P. 193-214.
223. McKechnie M.I.//Proceedings of the Conference on Emulsion Polymers. London. June
1982. Paper N3.
224. Candau F., Zekhnini Z., Durand J.P. П J. Colloid and Interface Sci. 1986. V. 114. N2.
P. 398-408.
225. Candau F., Zekhnini Z., Durand J.-P. //Progr. Colloid and Polym. Sci. 1987. V.73.
P. 33-36.
226. Holtzscherer C., Durand J.-P., Candau F.//Colloid and Polym. Sci. 1987. V.265. N 12.
P. 1067-1074.
227. Riess G., Nerro J., Rogez D. // Polym. Eng. Sci. 1977. V. 17. N 8. P 634-638.
228. Kim Kyu-Jun, Ruckenstein Eli.//Makromol. Chem. Rapid. Commun. 1988. Bd. 9. N 4.
S.285-290.
229. Fratt W.J., BerrotR./l Soc. Pet. Eng. Repr. 1975. P. 5338.
230. Пат. 1476466 Англии.
231. Куренков В.Ф., Байбурдов Г.4.//Химия и хим. технология, 1989. Т. 32. №7.
С. 3—15 (Изв. вузов).
232. Glukhikh V., Graillat С., Pichot С.1/1. Polym. Sci. Part A. Polym. Chem. 1987. V. 25. N 4.
P. 1127-1161.
233. Pichot C., Graillat G., Glukhikh V. et ak. //Polymer Latex II, Plastics Pubber Institute.
London. 1985. P. 11/1.
234. Ponratnam S., Kapur S.L. 11 Makromol. Chem. 1977. Bd. 178. S. 1029.
235. Куренков В.Ф., Верижникова A.C., Мягченков B.A. //ВМС. Сер. А. 1984. Т. 26. № 3.
С. 535-540.
236. Kurenrov V.F., Verihznikoya A.S., Myagchenkov V.A.//Eur. Polym. J. 1984. V. 20. N 4.
P. 357-360.
237. Куренков В.Ф., Верижникова A.C., Мягченков B.A. //ДАН CCCP.1984. T. 278. № 5.
С. 1173-1178.
238. Куренков В.Ф., Верижникова А.С., Мягченков В.А. //ВМС. Сер. А. 1986. Т. 28. № 3.
С. 488-492.
239. Куренков В.Ф., Трифонова М.Н., Вагапова А.К. и др.//ВМС. Сер. А. 1986. Т. 28.
№ 3. С. 105-109.
240. Smets G., Hesbain A.M. //J. Polym. Sci. 1959. V. 40. N 136. P. 217-226.
241. Kurenkov V.F., Myagchenkov V.A.//Acta Polymerica. 1986. Bd. 37. N 8. S. 517-524.
242. Бектуров E.A., Мягченков B.A., Куренков В.Ф. Полимеры и сополимеры стирол-
сульфокислоты. Алма-Ата: Наука, 1989. 200 с.
113
243. Кабанов В.А., Топчиев Д.А. Полимеризация ионизующихся мономеров. М.: Наука,
1975.224 с.
244. Blauer G. //Trans. Faraday Soc. 1960. V. 56. N. 4. P. 606.
245. Plochocka K, Wojnarowsky T.L//Eur. Polym. J. 1971. V. 7. P. 797-804.
246. Марина Н.Г., Монаков Ю. Б.//Химия и физикохимия высокомол. соед. Уфа. 1976.
С. 116-146.
247. Кигепкот V.F., Vagapoia А.К., Myagchenkor V.A.//Eur. Polym. J. 1982. V.20. N 8.
P. 763-767.
248. Четыркина Г.М., Соколова T.A., Котон M.M. // ВМС. 1960. Т. 2. № 8. С. 1207-1212.
249. McCormick C.L., Johnson С.В. //Polymer Mater. Sci. Eng. 1986. V. 55. P. 366-370; Chem.
Abstr. 1986. V. 105. 191686.
250. Morishima Y., Itoh Y., Nozakura S.//Makromol. Chem. 1981. Bd. 182. N11. S. 3135-3147.
251. Iton Y., Morishima Y., Nozakura S. //J. Polymer Sci. Polym. Chem. Ed. 1982. V. 20. N 2.
P.467-476.
252. Hanky M. // Macromolecules. 1982. V. 15. N 3. P. 782-788.
253. Стародубцев С.Г., Рябина B.P. //ВМС. Сер. А. 1987. Т. 29. № 11. С. 2281-2285.
254. Salamone J.C., Tsai С.С., Watterson А.С. et о/.//Polymeric Amines and Ammonium
Salts/Ed. by E.J.Goethals. Oxford: Pergamon Press, 1980. P. 105-112.
255. Salamone J.C., Mahmud N.A., Mahmud M.U. et al.//Polymer. 1982. V. 23. N 6.
P. 843-848.
256. Bock J., SianoD.B., SchulzD.H. etal. //Polymer Mater. Sci. Eng. 1986. V. 55. P.355-360;
Chem. Abstr. 1986. V. 105. 191685.
257. McCormick C.L., Nonaka T., Johnson С.В.Ц Polymer. 1988. V. 29. N 4. P. 731-739.
258. McCormick C.L., Hutchinson B.H., Morgan S.E.// Makromol. Chem. 1987. Bd. 188. N 2.
S. 357-370.
259. Буянов А.Л., Ревелъская Л.Г., Петропавловский Г.А. и др.//ВМС. Сер. Б. 1989.
Т. 31. If 12. С. 883-887. ____
260. Nyquist В.Е. Functional Monomers. Their Preparation, Polymerization and
Application /Ed. by R.H.Yokum. New York: M. Decker, 1973. V. 1. 745 p.
ZM.Kamogawa H., Sekiya T. HI. Polymer Sci. 1961. V.50. N 153. P. 211-225.
262. Глазомицкий КЛ., Кирпиченко K.P., Толщин Б.Э. и др. //ЖПХ. 1971. Т. 44. № 5.
С. 1192-1195.
263. Feldman D., Ungureanu С., Grusos A. et al. //Mater, plast. 1976. T. 13. N 2. P. 69-73;
РЖХ 1977. 4T739.
264. Bonardi C., Bouteiin B., Pietrasanta Y. et al. // Makromol. Chem. 1985. Bd. 186. N 2.
S. 261-271.
265. Мягченков В.А., Френкель С.Я. Композиционная неоднородность сополимеров. Л.:
Химия, 1988.248 с.
266. Dainton F.S., Sisley W.D. //Trans. Faraday Soc. 1969. V. 59. N 486. Part 6. P. 1385-1389.
267. Hartl?., Timmerman D. //J. Polymer Sci. 1960. V. 48. N 150. P. 151-157.
268. Otsu T., Inoue M., Yamada B. et al. // J. Polymer Sci. Polymer Lett. Ed. 1975. V. 13. N 8.
P. 505-510.
269. Петрова Г.А., Штрайхман Г.А., Ваншейдт A. A. И ЖФХ. 1959. T. 33. If 6. C. 1246-1252.
270. Yokoda K., Oda /.//Kogyo Kagaku Zasshi. 1970. V. 73. N 1. P. 224-228; Chem. Abstr.
1970.V. 72.122003.
271. WhistlerR.I., GoatleyJ.I. //J. Polymer Sci. 1961. V. 50. N153. P. 127-132.
272. SurG.S., Noh S.K., Choi S.K./II. Polymer Sci. Polymer Chem. Ed. 1981. V. 19. N 2.
P. 223-233.
273. Wichterle 0., Gregor V. //J. Polymer Sci. 1959. V. 34. N 127. P. 309-317.
274. Bork J.F., Wyman D.P., Coleman L.E. //J.Appl. Polymer.Sci. 1963. V.7. N 2. P. 451-459.
275. Jordan B.F., Bennett R., Shuman A.C. et al. HI. Polymer Sci. A-l. 1970. V. 8. N 11.
P. 3113-3121.
276. Oishi T., Fujimoto M. HJ. Polymer Sci. Polymer Chem. Ed. 1982. V. 20. N 9.
P. 2727-2730.
277. Yamada B., Yoshioka M., Otsu T. H J. Polymer Sci. Polymer Chem. Ed. 1984. V. 22. N 2.
P. 463-473.
114
т. Соколова Т.А., Четыркина Г.М. И ВМС. 1961. Т. 3. № 2. С. 244-247.
279. Gipstein Е., Hewett W.A., Need O.U. Hl. Polymer Sci. A-l. 1970. V. 8.N 11. P. 3285-3294.
280. Zabransky J., Houska M„ Kalal J. /Makromol. Chem. 1985. Bd. 186. N 2. S. 247-253.
281. Наволокина P.A., Зильберман E.H., Кузнецова T.A. //Физико-хим. основы синтеза
и переработки полимеров. Горький: изд-во ГГУ, 1983. С. 15—17.
282. Watanabe N., Sakai М., Sakakibara Y. et al. I I Kogyo Kagaku Zasshi. 1970. V. 73. N 5.
P. 1056-1058; Chem. Abstr. 1970. V. 72. 122003.
283. Хван P.M., Мусаев У.Н., Бабаев T.M. и др.//Физико-хим. основы синтеза и перера-
ботки полимеров. Горький: изд-во ГГУ, 1979. С. 13-18.
2Ы. Мягченков В.А., Френкель С.Я. Z/Усп. химии. 1973. Т. 42. № 5. С. 827—853.
285. Л£ягченков В.А., Френкель С.Я. //Yen. химии. 1978. Т. 47. № 7. С. 1261-1292.
286. Saini G„ Leoni A., Franco ЗУ/Makromol. Chem. 1971. Bd. 144. S. 235-244.
287. Chung K.H. Hl. Korean Chem. Soc. 1970. V. 14. N 4. P. 333-339; Chem. Abstr. 1971.
V. 75. 118647.
288. Minsk L.M., Kotlarchik C„ Darlak R.S. Hl. Polymer Sci. Polymer Chem. Ed. 1973. V. 11.
N 2. P. 353-365.
289. Minsk K.M., Kotlarchik C., Meyer G.N. H J. Polymer Sci. Polymer Chem. Ed. 1973.
V. 11. N 12. P. 3037.
290. Jacob M., SmetsG., DeSchryrerF. Hl. Polymer Sci. B. 1972. V. 10. N 9. P. 669-673.
291. Chatterjee A.M., Bums C.M. //Can. J. Chem. 1971. V. 49. N 20. P. 3249-3251.
292. Kamogawa H. //Kogyo Kagaku Zasshi. 1958. V. 61. P. 1024-1027 ; Chem. Abstr. 1961.
V. 55. P. 17077.
293. Saini G., Leoni A., Franco S. //Makromol. Chem. 1971. Bd. 147. S. 213-218.
294. Leoni A., Franco S., Saini G. //Makromol. Chem. 1973. Bd. 167. S. 97-104.
295. Franco S., Leoni A. //Polymer. 1973. V. 14. N1. P. 2-4.
296. Knobloch F. W. Hl. Polymer Sci. 1957. V. 25. N 10. P. 453-464.
297. Saini G., Leoni A., Franco S. //Makromol. Chem. 1971. Bd. 146. S. 165-171.
298. Хэм Д. Сополимеризация. M.: Химия, 1971. 616 с.
299. Saini G., Polla-Mattiot G„ MeironeM. Hl. Polymer Sci. 1961. V. 50. N 153. P. 812-813.
300. Абрамова Л.И., Зильберман E.H., Чугунова Л.С. I/ВМС. Б. 1979. Т. 21. №11.
С. 813-817.
301. Fineman М., RossS.D. Hl. Polymer Sci. 1950. V. 5. N 2. Р. 259-262.
302. Наволокина Р.А., Зильберман Е.Н., Масленникова Т.Н. //ВМС. Сер. Б. 1982. Т. 24.
№ 8. С. 609-612.
303. Зильберман Е.Н., Наволокина Р.А., Абрамова Н.А. //ВМС. Сер. Б. 1983. Т. 25. № 4.
С. 279-283.
304. Kelen Т., Todds Р., Turesanyi В. et al. // J. Polymer Sci. Polymer Chem. Ed. 1977. V. 15.
N12. P. 3047-3074.
305. Tidwell P.W., Mortimer C.A. Hl. Polymer Sci. A. 1965. V. 3. N1. P. 369-387.
306. Park K. Y., Santee E.R., Harwood H.J. //Polymer Prepr. 1986. V. 27. N 2. P. 81-82.
307. Зильберман E.H., Абрамова Л.И., Черненкова Ю.П. и др. //ВМС. Сер. А 1984. Т. 26.
№ 7. С. 1365-1368.
308. Оудиан Дж. Основы химии полимеров. М.: Мир, 1974. 614 с.
309. Hirooka М., Yabuuchi Н., Kawasumi S. et al. Ц J. Polymer Sci. Polymer Chem. Ed. 1973.
V. 11. N 6. P. 1281-1306.
310. Мягченков B.A., Френкель С.Я. //Усп. химии. 1968. Т. 37. № 12. С. 2247—2271.
311. Мягченков В.А., Ларионова Л.А., Вагапова А.К. и др. // ДАН СССР 1972. Т. 207.
С. 337-380.
312. Басова Т.Г., Зильберман Е.Н., Шварева Г.Н. и др. //ВМС. Сер. Б. 1975. Т. 17. № 5.
С. 379-383.
313. Мягченков В.А., Куренков В.Ф., Френкель С.Я. //ВМС Сер. А. 1968. Т. 10. №8.
С. 1740-1748.
314. Мягченков В.А., Куренков В.Ф., Кузнецов Е.В. и др.//ВМС. Сер. А. 1969. Т. 11.
№ 8. С. 1789-1792.
315. Мягченков В.А., Куренков В.Ф., Френкель С.Я. //ДАН СССР 1969. Т. 184. №4.
С. 880-882.
115
316. Мягченков В.А., Вагапова А.К., Кузнецов Е.В. и др. //ДАН. 1973. Т. 210. № 1.
С. 151-153.
317. Куренков В.Ф. // Химия и технол. злементоорганич. соед. и полимеров. 1974. Т. 314.
С. 113-117.
318. Kurenkov V.F., Akhmedjanova R.A., Myagchenkov V.A. 11 Acta Polymerica. 1981. Bd.
32. N 10. S. 612-615.
319. Мягченков B.A., Куренков В.Ф., Кукушкина И. А. и др.//ДАН СССР 1977. Т. 236.
№ 1. С. 157-160.
320. Куренков В.Ф., Кукушкина И.А., Кузнецов Е.В. и др. //Химия и технол. элементо-
органич. соед. и полимеров. Т. 5. Казань: КХТИ, 1976. С. 72—76.
321. Myagchenkov V.A., Vagapova А.К., Kurenkov V.F. et al.//Europ. Polymer. J. 1978.
V. 14. N 2. P. 169-171.
322. Myagchenkov V.A., Kurenkov V.F., Frenkel S.Ya. //Acta Polym. 1982. Bd. 33. N 6.
S. 388-394.
323. Kurenkov V.F., Myagchenkov V.A. //Acta Polym. 1986. Bd. 37. N 7. S. 424-435.
324. Rajan C.R., Srinivas Y.S., Ponrathman S. et al. Hl. Polymer Sci. Polymer Lett. 1987.
V. 25. N 2. P. 73-77.
325. Куренков В.Ф., Кузнецов E.B., Мягченков B.A. // Tp. Казанского хим.-технол.
ин-та. Казань: КХТИ, 1969. № 40. Часть II. С. 38-43.
326. Truong N.D., Calin J.C., Francois J. etal. //Polymer. Y. 1986. V. 27. N3. P. 467-475.
327. Басова Т.Г., Зильберман E.H., Шварева Г.Н. и др. //ВМС. Сер. Б. 1977. Т. 19. № 1.
С. 22-25.
328. Barton J., Gutanicova V. //Chem. Papers. 1987. V. 41. N1. P. 113-117.
329. Каргин B.A., Платэ H.A., Патрикеева Т.Н. //ВМС. 1964. Т. 6. № 11. С. 2040-2045.
330. Abe Z., Tanaka Н., Sumimoto М. Hl. Polymer Sci. Polymer Chem. Ed. 1978. V. 16. N1.
P.305-308.
331. Tanaka H. //1. Polym. Sci. Polym. Chem. Ed. 1986. V. 24. N1. P. 29-36.
332. Yukawa J., Kataoka K, Tsuruta T. //Polymer J. 1979. V. 11. N11. P. 895-900.
333. Shyluk W.P. H J. Polymer Sci. A. 1964. V. 2. N 5. P. 2191-2206.
334. Зильберман E.H., Черненкова Ю.П., Шварева Г.Н. и др. //Физ.-хим. основы синтеза
и переработки полимеров. № 3. Горький: изд-во ГГУ, 1978. С. 20—22.
335. Черненкова Ю.П., Зильберман Е.Н., Шварева Г.Н. Н Физ-хим. основы синтеза и
переработки полимеров. Горький: изд-во ГГУ, 1984. С. 27-31.
336. Черненкова Ю.П. Синтез сополимеров на основе диалкиламиноалкилметакрила-
тов: Автореф. дис.... канд. хим. наук. Казань: Казанский хим.-технол. ин-т, 1984. 32 с.
337. Черненкова Ю.П., Зильберман Е.Н., Шварева Г.Н. //ВМС. Сер. Б. 1982. Т. 24. № 2.
С. 119-122.
338. Черненкова Ю.П., Зильберман Е.Н., Шварева Г.Н. и др. //ЖПХ. 1980. Т. 53. № 2.
С. 378-382.
339. Зильберман Е.Н., Абрамова Л.И., Траченко В.И. и др. И Физ.-хим. основы синтеза и
переработки полимеров. № 3, Горький: изд-во ГГУ, 1978. С. 31-34.
340. Muller Е., DingesK, Graulich W. //Makromol. Chem. 1962. Bd. 57. S. 27-51.
341. Зильберман E.H., Казанцев О.А., Салов B.H. и др.//Физ.-хим. основы синтеза и
переработки полимеров. Горький: Изд-во ГГУ, 1987. С. 68-71.
342. Jedlinski Z., Paprothy J. //Plaste u. Kautchuk. 1966. Bd. 13. N 4. S. 203-205.
343. Елисеева В.И., Петрова С.А., Пинская И.С. //Лакокрас. мат-лы и их применение.
1968. № 1. С. 11-13.
344. Leonard F., Nelson }., Brandes G. //Ind. Eng. Chem. 1958. V. 50. N 7. P. 1053-1058.
345. Uchida M„ Nagao H. //Kogyo Kagaku Zasshi. 1957. V. 60. P. 945-946; Chem. Abstr. 1959.
V. 53. P. 9723.
346. Ohtsuka Y„ Kawaguchi H., Sugi Y. Hl. Appl. Polymer Sci. 1981. V. 26. N 5. P. 1637-1647.
347. Kawaguchi H., Sugi Y., Ohtsuka Y. Hl. Appl. Polymer Sci. 1981. V. 26. N5.
P. 1649-1657.
34?, .Kawaguchi H., Hoshino F., Ohtsuka Y. //Makromol. Chem. Rapid Commun. 1986. Bd. 7.
N 3. S. 109-114.
116
349. Thomas W.M., Wang D. W. Acrylamide polymers. // Encyclopedia of Polymer Science and
Engineering. V. l./Ed. by H.F.Mark, N.M.Bikales, Ch.G.Overberger N.Y. 1985. P. 169-211.
350. Bardhan K., Mukhopadyay S., Chatterjee S.R. Hl. Polymer Sci. Polymer Chem. Ed. 1977.
V. 15. N 1. P. 141-148.
351. Старков A.A., Зильберман E.H., Капустина И.Д. // Физ.-хим. основы синтеза и
переработки полимеров. Горький: изд-во ГГУ, 1978. С. 95-97.
352. McCormick C.L., ParkL.S. Hl. Appl. Polymer Sci. 1981. V. 26. N 5. P. 1705-1717.
353. McCormick C.L., Lin K.C. Hl. Macromol. Sci. 1981. V. A16. P. 1441-1462;
McCormick C.L., Park L.S. Hl. Polymer Sci. Polymer Chem. Ed. 1981. V. 19. N 9. P. 2229-2241.
354. Deshmukh S.R., Singh R.P. //J. Appl. Polymer Sci. 1986. V. 32. N 8. P. 6163-6176.
355. Patil D., Hogen-Esch T.E., Butler G.B. //Polymer Preprints. 1986. V. 27. N 2. C. 34-35.
356. Wallace R.A., Young D.G. Hl. Polymer Sci. A-l. 1966. V. 4. N5. P. 1179-1190.
357. Kim O.K., Griffith J.R. Hl. Polymer Sci. Polymer Chem. Ed. 1975. V. 13. N 1. P. 151-160.
358. Simionescu C.I., Oprea S. Hl. Polymer Sci. C. 1972. N 37. P. 251-263.
359. Daneault C., Kokta V. V., Cheradame H.H1. Wood Chem. Technol. 1986. V. 6. N 2.
P. 269-291; Chem. Abstr. 1986. V. 105. 80963.
360. Citovicky P., Mikulasova D. et al. //Angew. Makromol. Chem. 1983. Bd. 117. S. 131-144;
Coll. Czechosl. Chem. Commun. 1986. T. 51. N 8. S. 1648-1655.
361. Egloh H.S. //Angew. Makromol. Chem. 1983. Bd. 117. S. 95-101.
362. Kohdo K., Nishigaki H., Ouchi T. et al. //Kobunshi Ronbunshu. 1980. V.37. N 5.
P. 357-361; Chem. Abstr. 1980. V. 93. 95692.
363. Hegazy E.S.A., DessoukyA.M., El-Sharabasy S.A. HRadiat Phys. Chem. 1986. V. 27. N5.
P. 323-328; Hegazy E.A., Dessouky A.M. El-Boohy H.A. Hl. Polymer Sci. Polymer Chem. Ed.
1986. V. 24.N8. P. 1933-1942.
364. Hoffman A.S., Ratner B.D. //Radiat. Phys. Chem. 1979. V. 14. N 3-6. P. 831-840.
365. Razzak M.T., Otsuhata K., Tabata Y. Hl. Appl. Polymer Sci. 1987. V.33. N7.
P. 2345-2351.
366. Bhattacharyya S.N., Maidas D. Hl. Polymer Sci. Polymer Chem. Ed. 1982. V.20. N4.
P.939-950.
367. Lawrence K.D.N., Verdin D. Hl. Appl. Polymer Sci. 1973. V. 17. N 9. P. 2653-2666.
368. Haruvy Y., Rajbenbach L.A., Jagur-Grodzinski J. //I. Appl. Polymer Sci. 1986. V 32. N 4.
P. 4649-4656.
369. Suzuki M„ Kishida A., Iwata H. et al. //Makromolecules. 1986. V. 19. N 7. P. 1804-1808.
370. Oster G., Shibata O. //J. Polymer Sci. 1957. V. 26. N113. P. 233-234.
371. RandyB., GaoZ.M., HultA. etal. //Polymer Preprints. 1986. V. 27. N2. P. 38-39.
372. Da Silia M.A., Gil M. G., Lapa E. et al. H J. Appl. Polymer Sci. 1987. V. 34. N 2. P. 871-880.
117
Глава 3
ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ ПОЛИАКРИЛАМИДА
И ЕГО ПРОИЗВОДНЫХ
3.1. Полимераналогичные превращения
Реакции полимераналогичных превращений широко используются
для химической модификации природных и синтетических полиме-
ров, а также для изучения строения полимеров и их химической
стабильности [1, 2]. Полимераналогичные превращения ПАА являются
сравнительно простым и доступным методом получения анионных и
катионных производных ПАА, которые в ряде случаев обладают более
ценными прикладными свойствами, чем ПАА. Среди различных поли-
мераналогичных превращений ПАА и его производных наиболее
важными и изученными являются реакции кислотного и щелочного
гидролиза для получения анионных производных ПАА [3] и реакции
аминометилирования и гипогалоидирования для получения катион-
ных производных ПАА.
3.1.1. Кислотный и щелочный гидролиз
Кислотный гидролиз. ПАА в водных растворах при комнатной
температуре устойчив к гидролизу [4,5], однако при высоких темпера-
турах (> 93’С) гидролиз осуществляется с заметной скоростью даже в
отсутствие гидролизующих агентов [6- 9].
Реакцию гидролиза ПАА в кислых средах можно упрощенно пред-
ставить следующей схемой:
-(-СН2-СН-)П- + mH2O—*-(-CH2-CH-)n_m-(-CH2-CH)m + mNH3
CONH2 conh2 cooh
В качестве гидролизующих агентов могут использоваться различ-
ные низкомолекулярные (H2SO4, НС1, Н3РО4 и др.) и полисульфоновые
кислоты [10, 11]. Степень гидролиза ПАА под действием кислот может
достигать высоких значений.
Кинетику кислотного гидролиза ПАА и сополимеров АА с АК в
0,05 М ацетатном буфере при 10 °C исследовали Смете и Хасбейн [12].
Было установлено, что начальная скорость гидролиза является невы-
сокой (константа скорости равна 2,6-10-2с-*) и пропорциональна
концентрации уксусной кислоты в буферном растворе. При достиже-
нии степени превращения 3- 5% гидролиз автокаталитически ускоря-
ется. Аналогичный характер изменения скорости гидролиза ПАА и
ПМАА был также зафиксирован в работах [13, 14]. В случае сополиме-
ров АА с АК различного состава и разной степени нейтрализации
гидролиз протекает в две стадии, причем скорость гидролиза на
первой стадии в 50 раз больше, чем на второй.
Отмеченное ускорение реакции на первой стадии гидролиза ПАА и
высокая начальная скорость гидролиза сополимеров АА с АК объяс-
118
няются „эффектом соседа” [2] - анхимерным содействием гидролизу
амидных групп соседними карбоксилатными группами. Следует также
отметить, что общий эффект ускорения реакции кислотного гидролиза
(со) полимеров может несколько компенсироваться замедляющим
эффектом электростатических отталкиваний между ведущими гидро-
лиз гидроксониевыми ионами Н30+ и положительно заряженными
атомами азота:
~СН2-СН ~ + HCI-*~СН2-СН ~
CONH2 CON Н3 Cl-
Одной из особенностей кислотного гидролиза ПАВ является образо-
вание частично или полностью нерастворимых продуктов реакции
вследствие протекания имидизации [15-18], которая приводит к
образованию структур следующего строения:
сн2 ~СН2-НС-СН2-СН~
''СН2-НС СН~
ОС СО HN NH
^NH чС0 ОС'
I I
~сн2-нс-сн2-сн
Имидизация с образованием трехмерных структур более интенсивно
происходит при высоких концентрациях полимера. В кислых средах
имидизации ПАА медленно протекает при 75 °C, ускоряется при 85 °C и
очень быстро проходит при ПО °C [13]. ПМАА более склонен к имиди-
зации по сравнению с ПАА и подвергается ей при 65 °C [15]. В отличие
от ПАА и ПМАА, кислотный гидролиз низкомолекулярных алифати-
ческих амидов и глутарамида не сопровождается образованием
имидных структур [13].
При сопоставлении энергий активации кислотного (Ен+) и щелочно-
го (Бон") гидролиза различных амидов было зафиксировано, что
наибольшая разность А Е=Еи+-Еон_характерна для ПАА и ПМАА
(АЕ = 28,8 кДж/моль). Для других иследованных полимеров и
низкомолекулярных амидов А £ составляет 8-18 кДж/моль. Установ-
лено также, что для ПАА и ПМАА энергия активации имидизации
выше энергии активации гидролиза [13].
Вследствие осложняющего влияния имидизации метод кислотного
гидролиза не нашел практического применения для получения гидро-
лизованных производных ПАА. Для их получения наиболее целесооб-
разным является гидролиз в щелочных средах.
Щелочной гидролиз. В результате щелочного гидролиза ПАА обра-
зуются макромолекулы сополимеров АА с солями АК, имеющие ста-
тистическое распределение звеньев в цепи при отсутствии блочных
структур [19]. Реакцию щелочного гидролиза ПАА можно представить
следующей схемой:
-(-СН2-СН-)Й + mNaOH-*-(-CH2-CH-)n_m~ (-CH2-CH-)m- + mNH3
CONH2 CONH2 COO_Na+
119
Кинетика гидролиза ПАА в разбавленных водных растворах NaOH
рассматривалась в ряде работ [10, 13, 19-26]. Было отмечено, что для
ПАА. в отличие от низкомолекулярных амидов (изобутирамида и
глутарамида), можно выделить две основные стадии гидролиза.
Наиболее быстрая первая стадия заканчивается при 40%-м превраще-
нии амидных групп в карбоксилатные. Скорость гидролиза на этой
стадии зависит от концентрации полимера в первой степени и гидро-
лизующего агента в первой степени, т.е. щелочной гидролиз ПАА
является реакцией второго порядка [20- 22, 24, 26, 27]. Вторая стадия,
несмотря на избыток щелочи, осуществляется в десять раз медленнее
первой [28] и завершается при степени гидролиза 70% [15, 19]. Высокие
значения начальной скорости гидролиза обусловлены „эффектом
соседних звеньев” по механизму анхимерного содействия [2]. Умень-
шение скорости на второй стадии гидролиза является следствием
усиления электростатических отталкиваний между накапливающими-
ся в ходе гидролиза карбоксилат-анионами -СОО~ и катализирующи-
ми гидролиз ионами ОН- [2, 29]. На реакцию гидролиза ПАА влияет
также изменение конформации макромолекул - разворачивание
цепей по мере увеличения заряда вдоль цепи в процессе гидролиза
ПАА [13]. Это приводит к возрастанию вязкости, затрудняет диффузию
ионов ОН- и способствует уменьшению скорости гидролиза. По срав-
нению с ПАА скорость гидролиза АА значительно меньше [12].
Кинетика макромолекулярных реакций с учетом „эффекта сосед-
них звеньев” рассмотрена в монографии Платэ и др. [2], а влияние
этого эффекта на реакцию щелочного гидролиза ПАА показано в
работе Хигуши и Сенью [21]. Была проанализирована реакционная
способность амидных звеньев, имеющих 0, 1 и 2 соседних карбокси-
латных звена, которые характеризуются соответствующими констан-
тами скорости гидролиза Ко, и к2. Начальная скорость гидролиза
ПАА может быть описана уравнением
dx/dx = fc0[a - (3 - 2fci/fc0)*][OH“], (3.1)
где х — концентрация прореагировавших групп в момент времени т; а — начальная кон-
центрация амидных групп.
В интервале значений степени гидролиза 0,43-0,57 (при степени
гидролиза 0,43 исчезают амидные группы, находящиеся между двумя
другими амидными группами, а при степени гидролиза 0,57 - амидные
группы, соседствующие с одной карбоксилатной группой) скорость
гидролиза ПАА описывается уравнением
dx/dx = 2fc2(0,57a - х)[ОН~]. (3.2)
Полученные в работе [21] экспериментальные данные по гидролизу
ПАА под действием NaOH хорошо согласуются с теоретическими.
Экспериментально найденное соотношение к0:к1:к2 = 1: 0,2 : 0 свиде-
тельствует о замедляющемся с конверсией влиянии групп — СОО~
(отталкивание ионов ОН~) на гидролиз соседних амидных групп в
макромолекуле.
120
Рис. 3.1. Зависимость состава триад от степени гидролиза
ПАА:
I — ААА; 2 — (ААВ + ВАА); 3 — ВАВ (точки — эксперимен-
тальные, кривые — расчет на основе модели Хигуши и Сенью [97]
для Kq : К*: #2 = 1:0,2:0, С, о, х — концентрации триад, амидных и
карбоксилатных групп соответственно)
С/а
Другое уравнение для описания кинетики щелочного гидролиза
ПАА, учитывающее „эффект соседних звеньев”, было предложено
Фуоссом, Ватанабе и Колеманом [30].
Лс/[(а - х)(Ь - х)] = [koe~at + fc2(l - e-“9]di, (3.3)
где а, b — начальные концентрации ПАА и NaOH соответственно, а — вероятностями
параметр.
В работе [27] было показано, что экспериментальные кинетические
данные для гидролиза ПАА в щелочных средах хорошо описываются
уравнениями (3.1) и (3.3). При этом также подтверждено хорошее
соответствие экспериментально найденного по данным ЯМР распреде-
ления ионогенных звеньев в макромолекулах гидролизованного ПАА
(точки) с рассчитанным (пунктирные линии) для соотношения
fc(j:fci:fc2 = 1: 0,2:0 (рис. 3.1), что свидетельствует об определяющей
роли „эффекта соседних звеньев” в кинетике щелочного гидролиза
ПАА.
Найденные в работах [21, 27] соотношения fc0 :fcr :k2 хорошо согла-
суются между собой. Следует отметить, что значения к0, полученные в
работах [13, 20-24, 27], несколько различаются по величине, что
объясняется различием условий гидролиза, а также использованием
образцов ПАА с различными ММ. Значения эффективной энергии
активации Е гидролиза ПАА, найденные в различных работах, также
различаются. Наряду с обычным влиянием температуры на скорость
гидролиза изменение с температурой степени диссоциации карбокси-
латных групп, характера их электростатических взаимодействий с
ионами ОН- и изменение конформационного состояния макромоле-
кул, несомненно, отражались на значениях Е. Следует также отметить,
что значение Е растет с увеличением степени конверсии при гидролизе
ПАА и равно 59,5; 74,0; 81,5; и 99,5 кДж/моль, для степеней гидролиза
ПАА 2, 8, 12 и 19% соответственно [23]. Аналогичный характер измене-
ния Е с глубиной превращения при щелочном гидролизе ПАА зафикси-
рован и в работе [26].
121
Таблица 3.1. Изменение состава сополимеров АА с АК при щелочном гидролизе
(Условия гидролиза:[сополимер] = 1,67%, [NaOH] = 2,5 моль/л, 100°C, 1 ч.)
Доля амида в сополимере, % (мол.) Доля амидных групп, участвующих в гидролизе, % Доля амида в гидролизованном продукте, % (мол.)
92,30 66,42 30,98
66,21 60,77 25,96
46,55 45,81 25,20
30,63 21,85 23,94
11,78 14,65 16,89
14,25 12,54 12,53
8,32 8,00 7,25
Еще одним фактором, способным влиять на скорость гидролиза ПАА
в щелочных средах, является строение макромолекул. Так, в работе
[29] было выдвинуто предположение, позднее подтвержденное в
работах [31, 32], что щелочной гидролиз ПАА и ПМАА по аналогии с
гидролизом низкомолекулярных амидов (например, амида янтарной
кислоты) включает промежуточную стадию имидизации. В работе [32]
были найдены константы скорости реакций имидизации кк и гидроли-
за к для сукцинамида, глутарамида и ПАА при 25 °C, которые соответ-
ственно равны: ки’1О4, с-1=2,7;0,62;44икг‘104, с~1 = 1,03; 1,78; 1,06.
Сравнение констант скоростей гидролиза имидов изученных соедине-
ний свидетельствовало, что в ПАА наряду со звеньями, соединенными
по типу „голова к хвосту”, имеются звенья с типом присоединения
„голова к голове”, которые могут способствовать высоким начальным
скоростям гидролиза.
В обычных условиях гидролиз полимеров в щелочной среде не
доходит до конца - предельная степень гидролиза ПАА и ПМАА не
превышает 70%, тогда как соответствующие им низкомолекулярные
аналоги гидролизуются практически полностью [12]. Отмеченная для
полимеров особенность является следствием потери реакционной
способности амидными группами, блокированными соседними карбо-
ксилатными группами [20]. В случае ПАА это можно изобразить схемой
~СН2-СН-СН2-СН-СН2-СН~
О = С С=О С=О
I I ।
О~... H-N-H ... О"
Подтверждением отмеченному могут служить результаты гидролиза
в щелочных растворах сополимеров А А с АК (табл. 3.1) [10] и МАА с
МАК [33]. По данным табл. 3.1 доля амидных групп сополимера, участ-
вующих в гидролизе, уменьшается с уменьшением их содержания в
сополимере до гидролиза.
ПАА, в отличие от ПМАА, может быть прогидролизован в 10 М
растворе NaOH практически полностью при увеличении температуры
122
до 100 °C, однако при этом не исключается деструкция макромолекул
[10, 34]. Можно также достигнуть высокой степени гидролиза (до 96%),
если проводить гидролиз ПАА в две стадии: первоначально в присут-
ствии NaOH при 20°C до степени гидролиза 60%, а затем - в присутст-
вии НС1 при 100 °C [35]. В этих условиях авторы не обнзр.ужил’? замет-
ной деструкции полимера и других побочных реакции, приводящих к
изменению химического состава и линейного характера исходных
макромолекул. Зильберман и др. [36] также показали возможность
достижения высокой степени гидролиза ПАА (~ 100%) при двухста-
дийном ведении реакции. На первой стадии проводится щелочной
гидролиз при 95- 97 °C в течение 2 ч до степени конверсии 65%, а затем
гидролиз продолжают при 120- 250°C.
Значительное влияние на гидролиз ПАА оказывает ионная сила ц.
Влияние ц, создаваемой добавками NaCl, на кинетику гидролиза ПАА
с различными Мл показано на рис. 3.2 [37]. Видно, что в отсутствие
NaCl изменение в пределах (0,4- 9,2)106 практически не отражалось
на кинетике гидролиза (кривые 1, Г, 1"), что соответствует данным
[19, 25, 26]. Из рис. 3.2 также видно, что при малых Ц начальная ско-
рость гидролиза не меняется, а с увеличением ц - возрастает, что
согласуется с отмеченным привысоких температурах [38]. Указанный
эффект усиливается с ростом Мл. Это - следствие изменения конфор-
мационного состояния макромолекул, что косвенно подтверждается
изменениями динамической вязкости реакционных растворов
(рис. 3.3), которая возрастает из-за усиления электростатических
отталкиваний между накапливающимися в ходе реакции карбокси-
лат-анионами в макромолекуле. Это приводит к разрыхлению макро-
молекулярных клубков [39]. Отмеченные изменения усиливаются с
ростом Мл (кривые 1", Г и 1 на рис. 3.3) вследствие усиления способ-
ности макромолекул к конформационным превращениям [39]. Естест-
венно, что при малой степени гидролиза электростатические эффекты
не проявляются в заметной степени и вязкость растворов мало зависит
от ц(см. рис. 3.3). Это являлось причиной неизменности начальной
скорости гидролиза при изменениях ц (см. рис. 3.2). По мере накопле-
ния в макромолекуле ионогенных звеньев увеличение ц нивелирует
электростатические отталкивания между зарядами макромолекулы и
способствует сокращению эффективных размеров макромолекуляр-
ных клубков. Это фиксируется уменьшением значений динамической
вязкости (переход от кривой 1 к кривой 3, от 1' к 3' и от 1" к 2" на
рис. 3.3).
Несомненную практическую значимость представляют и экспери-
ментальные данные совместной деструкции и щелочного_гидролиза
ПАА [40]. Реакцию проводили в водных растворах ПАА с = 3-106,
[ПАА] = 0,343 осново-моль/л, [NaOH] = 0,734 моль/л в присутствии
деструктирующего агента - персульфата (0,3% к ПАА) при_30- 70 °C.
Введение персульфата приводило к уменьшению Мп для ПАА,
однако это заметно не влияло на скорость гидролиза. В то же время
деструктивные процессы с разрывом скелетных связей макромолекул
123
Рис. 3.2. Зависимость состава сополимера АА с АН от продолжительности гидролиза ПАА
при_различных концентрациях NaCl [113]:
• 10-6 = 9,2(1 —3); 3,4 fl’ -3'); 0,4 fl"-2~); [NaCl] = Ofl, Г); 1,711 (2, 2'); 3,422 моль/л (3, 3',
Т); [ПАА] = 0,139 осново/моль/л; [NaOH] = 0,139 моль/л, 60 °C
Рис. 3.3. Кинетические кривые изменения динамической вязкости растворов в процессе
гидролиза ПАА с различными значениями и концентраций NaCl (остальные условия
гидролиза — см. для рис. 3.17):
• 10“6 = 9,2fl - 3); 3,4fl' - 3'); 0,4fl", 2"); [NaCl] = 0 (1, !’, Г); 1,711 (3, 3’); 3,422 моль/л (3,
3f,i')
т, мин
Рис. 3.4. Изменение состава сополимера АА с АН (I — 4) и М^(1' - 3') в процессе гидролиза
и деструкции ПАА при [ПАА] = 0,343 осново-моль/л, [KnSjOg] = 0,033% к ПАА, 60 °C и
различных концентрациях NaOH, моль/л: 0,(1,1'); 0,116 (2); 0,437 (3, 2'); 0,734 (4, 3')
усиливались с увеличением концентрации NaOH (рис. 3.4). Зафиксиро-
ванные результаты являются следствием влияния ц, создаваемой
добавками NaOH, на процесс деструкции под действием ион-радика-
лов SO^, образовавшихся при термическом распаде персульфата. С
увеличением ц возрастала плотность экранирования акрилат-анионов
124
в цепи макромолекул ионами Na+ и уменьшались электростатические
отталкивания между акрилат-анионами и ион-радикалами SO4, что
усиливало деструкцию полимера. Деструкция приводила к сущест-
венному уменьшению )%] полимера (до порядка). Таким образом,
используя метод совместных деструкции и гидролиза, можно регули-
ровать и химический состав макромолекул.
Большой практический интерес представляют исследования процес-
са щелочного гидролиза ПАА в концентрированных системах, который
'Ч в кинетическом плане менее изучен по сравнению с гидролизом в
£ разбавленных водных растворах. Ряд реакций гидролиза ПАА, прово-
димого в концентрированных системах различными способами, описан
в обзорных статьях [3, 41]. Возможно получение гидролизованных
полимеров при полимеризации АА в концентрированных водных
растворах ([АА] > 18%) в присутствии щелочей (при pH < 13,5) и кислот
(борной, фосфорной) или их солей. При введении радикальных иници-
аторов температура реакционной массы вследствие выделения тепла
полимеризации повышается, что приводит к высокой скорости процес-
са и получению высокомолекулярных полимеров со степенью гидро-
лиза 13,0%. Для увеличения степени гидролиза полимеров до 30-35%
после полимеризации реакционную массу выдерживают при повы-
шенной температуре в течение 4- 20 ч.
В концентрированных водных растворах можно также получать
гидролизованные полимеры со степенью гидролиза до 30% и
ММ = 12-106 при радиационной полимеризации А А в присутствии
едкого натра и борной кислоты [42]. В работе [43] также подтверждена
возможность получения ПАА с различной степенью гидролиза при
полимеризации А А в 20-50%-х водных растворах в присутствии
буферной смеси (pH >12) под действием V-излучения 60Со при хими-
ческом инициировании. При полимеризации, проводимой при невысо-
кой концентрации NaOH, гидролиз солевого компонента буферной
смеси приводит к дополнительному увеличению концентрации NaOH и
способствует увеличению степени гидролиза полимеров.
Получить гидролизованные полимеры можно двухстадийным
методом, используя предварительно полученные (со)полимеры. В
одних случаях первоначально проводят полимеризацию АА или
сополимеризацию его с виниловыми мономерами в 10%-х водных
растворах и полученную вязкую массу (со) полимера обрабатывают
щелочью при 50- 90 °C. В других случаях проводят полимеризацию А А
в 10-50%-х водных растворах, преимущественно в адиабатических
условиях, и резинообразную массу полимера измельчают в экструдере
до размера частиц 2- 20 мм, затем гранулы обрабатывают растворами
щелочи, карбонатов или бикарбонатов щелочных металлов. Последу-
ющими стадиями являются повторная грануляция полимера до разме-
ра частиц 2-5 мм, сушка при 40-130 °C и дробление полимера до
размера частиц 0,1-1 мм. Возможно также смешение гелеобразной
массы полимера с твердой щелочью в шнековом экструдере, что
позволяет осуществлять равномерный гидролиз полимера.
125
Возможно получение ПАА со степенью гидролиза, в 1,3-3 раза
превышающей рассчитанную на количество NaOH, путем обработки
гранул полимера раствором щелочи при 55-99 °C в течение 12 ч с
последующей сушкой. При этом в качестве активаторов гидролиза
могут использоваться NaCl и КС1.
Особый интерес представляет получение частично гидролизованно-
го ПАА на стадии полимеризации АА в обратных эмульсиях в присут-
ствии щелочных гидролизующих агентов. При этом концентрирован-
ный водный раствор мономера с добавкой щелочи диспергируют в
присутствии эмульгаторов типа „вода в масле” в гидрофобных жид-
костях (бензоле, ксилоле, тетрахлориде углерода, циклогексане и др.).
В работах [44- 49] были изучены кинетические закономерности одно-
временно протекающих процессов полимеризации АА и гидролиза в
обратных водно-толуольных эмульсиях в присутствии NaOH. Установ-
лено [46, 47], что скорость гидролиза и содержание звеньев акрилата
натрия в выделенных сополимерах возрастают с увеличением концен-
трации NaOH и температуры. Увеличение концентрации АА вследствие
ассоциации мономера приводило к блокированию амидных групп
Н-связями, что способствовало уменьшению степени гидролиза.
Показана также возможность получения сополимеров АА с АН различ-
ного состава и с ММ в интервале (104- 5,6) 106 [49].
Гидролизованный ПАА можно получить щелочным гидролизом ПАА
в обратных эмульсиях и суспензиях. Для этого приготовляют эмуль-
сию концентрированного водного раствора ПАА в органической фазе
(10-40%-м растворителе - бензоле, толуоле, циклогексане, гептане,
СОЦ и др.), содержащей маслорастворимый эмульгатор с низким ГЛБ. В
эмульсию дополнительно вводят ПАВ, устойчивое к щелочам, водный
раствор гидролизующего агента (NaOH, КОН, Na2CO3, К2СО3 и др.) и
проводят гидролиз при 10-70°C или при 125°C под давлением для
предотвращения кипения реакционной смеси. Возможен также гидро-
лиз ПАА в обратной эмульсии, полученной при смешении ее с эмуль-
сией водного раствора щелочи в гидрофобной органической фазе,
аналогичной эмульсии полимера. Дополнительными стабилизаторами
могут служить изопропиламид олеиновой кислоты, а также оксиэти-
лированные спирты (олеиновый и лауриловый). Проводят также
гидролиз ПАА (размер частиц 0,01-10 мм) под действием щелочных
агентов в виде растворов или эмульсии.
Щелочной гидролиз порошкообразного ПАА и его производных
можно проводить в водно-органической смеси с использованием в
качестве органического компонента спиртов, кетонов, простых эфи-
ров, нитрилов и других растворителей, хорошо смешивающихся с
водой. В таких системах с ростом содержания воды в смеси увеличи-
вается степень набухания частиц полимера и облегчается при этом
доступ гидролизующего агента к амидным группам макромолекул,
что приводит к увеличению скорости гидролиза и предельной степени
гидролиза полимера [50].
В работах [51, 52] изучены кинетические закономерности щелочного
126
гидролиза ПАА в водно-толуольных дисперсиях при 60 °C в присутст-
вии сульфанола НП-3 (алкилбензолсульфонат натрия с общей форму-
лой СПН2П + iQHaSOsNa, где п = 10- 12). Показано, что скорость гидро-
лиза ПАА в дисперсиях выше по сравнению с АА и с увеличением
конверсии уменьшается. Реакция гидролиза ПАА в дисперсиях подчи-
няется закономерностям реакций второго порядка (первый порядок
по щелочи и первый - по ПАА). Эффективная энергия активации
гидролиза равна 63 кДж/моль. Отмечено, что на начальных стадиях
гидролиза [< 40% (мол.)] неоднородные (интервал изменения размера
частиц d = 0,15- 2,4 мм) и однородные по размеру частиц образцы ПАА
имели различную степень гидролиза. С уменьшением размера частиц
ПАА скорость гидролиза возрастает вследствие ускорения набухания
полимера и увеличения доступности гидролизующего агента к амид-
ным группам макромолекулы. Однако при степени гидролиза
> 40% (мол.) неоднородные и однородные по размерам частиц образцы
имели практически одинаковую степень гидролиза. Это, очевидно,
связано с достижением близкой предельной степени набухания раз-
личных образцов ПАА в водной фазе и выравниванием доступности
гидролизующего агента к амидным группам ПАА.
3.1.2. Гипогалоидирование
Реакция гипогалоидного расщепления амидов носит название
перегруппировки Гофмана и достаточно хорошо изучена на примере
низкомолекулярных амидов [53]. Реакцию проводят в присутствии
гипогалогенита и щелочи. В качестве гипогалогенита используют
гипохлориты и гипобромиты щелочных металлов, причем применение
первых более предпочтительно ввиду большей скорости реакции [54].
Схема реакции может быть представлена в следующем виде:
O=C-NH2
R
НаЮ" ~
---*O=C-N
/Н ____
хНа1
O=C=N—>RNH2 + С02
R
I
R
Гипогалоидирование ПАА и его производных исследовалось в ряде
работ. Было проанализировано [55] влияние на процесс соотношения
компонентов реакционной смеси, порядка их дозировки, добавок
уретана, температуры и продолжительности реакции. Установлено, что
реакция протекает с невысокой конверсией - содержание азота
9,7-15% (для сравнения - содержание азота в ПАА и поливиниламине
соответственно равно 19,7 и 32,5%). При гипогалоидном превращении
ПАА образуется амфотерный продукт, содержащий небольшое коли-
чество аминогрупп (5,5%) и большое количество карбоксилатных,
алкилацилмочевинных и амидных групп [54]. Позднее [56] было
доказано, что алкилацилмочевинные группы разлагаются с образова-
нием ы-бутиролактамных групп.
При превращении ПАА по реакции Гофмана использование NaOCl
является более эффективным, чем NaOBr (табл. 3.2) [57].
В работе [57] показано, что скорость реакции Гофмана для ПАА в
127
Таблица 3.2. Влияние введения NaOCl и NaOBr на гипогалоидное расщепление ПАА
([ПАА] = 0,6; [NaOCl] = [NaOBr] = 0,61; [NaOH] = 3,6 моль/л, 24 ч)
т, °с Степень аминирования, % (мол.) Т, °C Степень аминирования, % (мол.)
NaOCl NaOBr NaOCl NaOBr
0 10 85 83 52 50 15 81 40
100- 1000 раз выше по сравнению с низкомолекулярными амидами.
Это, очевидно, связано с более легким превращением N-хлорамидных
групп в аминные для полимера По сравнению с низкомолекулярными
амидами в температурном интервале от -15 до 0°С. Скорость реакции
аминирования возрастает с ростом температуры, константа скорости
превращения N-хлорамидных групп в аминные группы составляет
3,3° Ю-1; 1,7-10~2 и 4,6* 10-4мин-1 при температурах соответственно
15,0 и -15°С. Энергия активации реакции в указанном интервале
температур равна 176 кДж/моль. Однако с повышением температуры
возрастает и скорость побочной реакции - гидролиза амидных звеньев
[58]. Поэтому для предотвращения гидролиза реакцию гипогалоидиро-
вания проводят при комнатной температуре [59] или не выше 10 °C [57].
Возможность получения при комнатной температуре полимеров с
высоким содержанием аминных звеньев (60-70%) при обработке не
только ПАА, но и ПМАА, полиэтилакриламида и сополимера АА с АН
подтверждена в работах [60, 61]. При этом продукты реакции выделяют
из реакционной массы нейтрализацией минеральными кислотами с
последующим высаждением одноатомными спиртами (метанолом,
этанолом, пропанолом), ацетоном или диоксаном.
По сравнению с ПАА реакция Гофмана для ПМАА протекает быстрее
и до более глубоких конверсий [56].
На состав продуктов гипогалоидного расщепления ПАА существен-
ное влияние оказывает соотношение компонентов реакционной смеси
(табл. 3.3). Согласно данным [62- 64], для получения ПВА с высоким
выходом (> 90%) в температурном интервале от - 15 до 50 °C должно
использоваться соотношение [ПАА]:[NaOCl]:[NaOH] = 1:(0,95-1,1):8.
При этом реакция гипогалоидного расщепления ПАА может быть
упрощенно представлена схемой:
z ) NaOH
CONH2
-CH2-CH-
NH2
-CH2-CH-
NaOOC
/СН2
-сн2-нс сн-
hn >н
со
+ Na2CO2 + Na Cl
Для уменьшения образования мочевинных групп предложено
проводить реакцию в две стадии [65]. На первой стадии проводят
128
Таблица 3.3. Зависимость состава продуктов гипогалоидного расщепления ПАА
от соотношения исходных компонентов (О °C, 24 ч) [57]
[ПАА] I [NaOCl] [ [NaOH] [HAA]:[NaOCl]: ;[NaOH] Степень алкилиро- вания, % (мол.) Содержание функциональных групп в полимере, % (мол.)
моль/л
-nh2 —COONa -conh2 Другие
1,1 о,п 0,22 1:0,1:0,2 45 4,0 8,5 73,5 14,0
0,9 0,36 0,72 1:0,4:0,8 66 23,8 10,0 49,0 17,2
0,84 0,42 0,84 1:0,5:1,0 71 32,0 10,0 40,0 18,0
0,67 0,53 1,07 1:0,8; 1,6 68 49,0 11,0 12,0 28,0
0,60 0,60 1,20 1:1:2,0 62 55,8 и,о 0 33,2
0,71 0,71 2,30 1:1:3,2 76 68,4 10,2 0 21,4
0,50 0,50 3,00 1:1:6,0 85 76,5 9,0 0 14,5
0,30 0,30 6,00 1:1:22,0 95 85,9 8,0 0 6,5
гипогалоидирование полимера при температурах < 10 °C и при концент-
рации щелочи < 4 моль/л, а на второй стадии увеличивают концентра-
цию щелочи и температуру. Например, для получения ПВА с конверси-
ей 95% (5% карбоксилатных звеньев) первоначально проводят реакцию
при -5 °C и при [ПАА] = 0,38; [NaOCl] = 0,88; [NaOH] = 0,63 моль/л в
условиях интенсивного перемешивания в течение 30 мин. Затем
добавляют при охлаждении по каплям концентрированный раствор
щелочи (17,6 моль/л) до содержания NaOH в реакционной смеси
9,0 моль/л. После выдержки при 0°С в течение 3 ч высаживают полу-
ченный полимер метанолом.
Помимо протекания рабочих реакций гипогалоидирование полиме-
ров сопровождается уменьшением вязкости растворов вследствие
деструкции макромолекул под действием NaOCl [63, 64]. Установлено,
что в условиях гипогалоидного расщепления ПАА с Мп = 5,25’105 в
интервале температур от -15 до 50 °C, осуществляемого до высоких
конверсий (степень аминирования 0,86- 9,4%), предельное число
вязкости растворов уменьшалось с увеличением мольного отношения
[NaOCl]:[ПАА] и с уменьшением концентрации NaOH. Количество
разрывов основных цепей полимера резко возрастало при молярном
отношении([NaOCl]:[ПАА])> 1.Увеличение концентрации NaOH приво-
дит к увеличению числа разрывов цепей при ([NaOCl]:[nAA]) > 1 и их
уменьшению при ([NaOCl]: [ПАА]) < 1.
Для уменьшения деструкции макромолекул под действием оста-
точных количеств NaOCl после реакции Гофмана проводят нейтрали-
зацию избытка щелочи растворами кислот, а также вводят NaHSOj,
Na2SO3, Na^C^, Na2SQi и NaCl или высаживают полимер метанолом
[65]. Возможно также выделение полимера в смеси ацетона с хлорово-
дородной кислотой, а затем переосаждение образовавшейся хлористо-
водородной соли ПВА в ацетон [66].
Протекание деструктивных процессов при гипогалоидировании
129
ПАА является существенным недостатком, ограничивающим примене-
ние этого метода. Наибольшее практическое значение при получении
катионных производных ПАА получил метод аминометилирования по
Манниху.
3.1.3. Аминометилирование
Реакция аминометилирования амидов вторичным амином и фор-
мальдегидом носит название реакции Манниха [66]. Реакцию аминоме-
тилирования ПАА можно упрощенно представить следующей схемой
[67]: г
— + СН2О + R2NH“—*•
- -СН2-СН—
conh2
л
-сн2-сн—
CONH
-СН2-СН--
conh-ch2-nr2
-1Л7
Вместо ПАА могут использоваться его производные, а вместо
формальдегида применяют другие альдегиды - ацетальдегид, фурфу-
рол, акролеин и др. [34]. Кроме вторичных аминов (диметиламина,
диэтиламина или пиперидина) можно применять первичные амины, и
аммиак, а также использовать карбоциклические амины (бензиламин,
циклогексиламин, нафтиламин, фенилендиамин) и аминокислоты [34].
Наиболее изучена реакция Манниха для низкомолекулярных
амидов. В настоящее *, :мя принята следующая концепция механизма
реакции Манниха [67]. Первоначально свободный амин реагирует с
формальдегидом с образованием катиона с делокализованным положи-
тельным зарядом, являющимся азотистым аналогом формальдегида.
Полученный аддукт (Ш) вступает в реакцию с соединением, содержа-
щим активный водород [67], и образует основание Манниха:
НО НО Н ОН
R2NH + ch2o-»r2n:ch2-> R2N-CH2-* R2N-CH2
I II
—► [R2N-CH2^R2N=CH2]
III
r2n =ch2+ r'conh2-r'conh-ch2-nr2
' Основание Манниха
В работе [68] было изучено аминометилирование ПАА с Мп - Ю5 в
20%-х водных растворах при pH = 10. На основании данных ЯМР-спек-
троскопии показано, что реакция начинается со взаимодействия
диметиламина с формальдегидом по приведенной схеме, а затем
образовавшийся аддукт вступает в реакцию с ПАА с образованием
130
основания Манниха - поли-М-диметиламинометакрилата
(3.4): fcl
(ch3)2nh + СН2О (CH3)2NCH2OH
по схеме
(3.4)
(3.5)
*2
-СН2-СН -+ (CH3)2NCH2OH
conh2
- -*л
СН2-СН---- -+ Н20
CONH-CH2-N(CH3)2
Проведение реакции Манниха в избытке диметиламина приводит к
образованию N, N, N' ,М'-тетраметилдиаминометана:
(CH3)2NH + (CH3)2NCH2OH - (CH3)2N-CH2-N(CH3)2 + Н2О, (3.6)
который затем взаимодействует с ПАА с образованием основания
Манниха: t
Г -1 К4
- -СН2—СН — - + (CH3)2N-CH2-N(CH3)2₽
conh2
Jn
(3.7)
—сн2-сн-----
CONH-CH2-N(CH3)2
+ (CH3)2NH
Jn
В работе [68] также отмечено, что при образовании основания
Манниха вклад реакций (3.4) и (3.5) несравнимо выше, чем реакций
(3.6) и (3.7).
Скорость реакции Манниха для ПАА описывается уравнением
второго порядка с константой скорости fc = 9,6* 10-5 л/(моль‘с) (при
20’С). Энергия активации реакции в интервале температур 10-29 °C
равна 92 ± 17 кДж/моль. При проведении реакции Манниха исходная
концентрация полимера определяется вязкостью водных растворов,
которая возрастает с увеличением ММ полимера. Поэтому реакцию
Манниха для ПАА и сополимеров АА с АКН, АН или метакриламидом,
имеющих ММ в интервале 5-105 - 8 • 10 , проводят в малоконцентриро-
ванных водных растворах [69]. Например, при проведении реакции
Манниха для ПАА с ММ = 8 -10® в 2%-х растворах полимера при 50 °C в
течение 4 ч при эквимолярном соотношении [ПАА]: [(CH3)2NH]: [СН2О]
получают продукт с содержанием 65% аминных звеньев, 19% метилол-
амидных звеньев и 16% амидных звеньев [69]. С целью сокращения
продолжительности процесса реакцию проводят при высоких темпера-
турах (60-70°С) и pH (12,1- 12,5) в течение 30-40 мин /используется
мольное соотношение [ILAA]:[(CH3)2NH]:[CH2O].= 1:(0,95-1,05):(1-1,1)/.
Однако при этом необходимо учитывать протекание побочной реакции
гидролиза амидных групп [34].
131
Наличие в продуктах реакции Манниха метилольных звеньев
способствует также повышению вязкости растворов за счет протека-
ния реакции между N-метилолакриламидными и амидными группами
с образованием устойчивых циклических структур [70].
-сн2-сн-сн2-сн-
CONH2 conh-ch2oh
/СН2
-сн2-нс I ЧСН- 1
о=с с=о 1
I HNV J4H ^Сп2
+ Н2О
Реакция циклизации ускоряется с увеличением концентрации поли-
мера и приводит к образованию гель-фракции - нерастворимого
продукта. Для предотвращения сшивки макромолекул в процессе
реакции и при хранении полимера используют добавки м- и п-фени-
лендиамина.
Высокомолекулярные основания Манниха получают различными
методами. При непрерывном методе получения 1 - 15%-х растворов
катионного производного ПАА в скоростной смеситель непрерывно
подают обратную эмульсию ПАА с ММ = 104-25’106, водорастворимое
ПАВ (оксиэтилированный нонилфенол), водные растворы вторичного
амина и формальдегида. Реакцию проводят при мольном соотношении
[R2NH];[CH2O] = 1:1 или 1:1,1. Для предотвращения сшивки полимера
в реакционную смесь вводят м- или п-фенилендиамин.
Возможно получение катионного производного ПАА с использова-
нием эмульсии, содержащей 5- 60% ПАА, 5- 75% гидрофобной органи-
ческой жидкости, 0,1-21% неионогенного эмульгатора и 2- 90% воды.
В эмульсию вводят соль вторичного амина, а затем добавляют твердую
композицию параформальдегида, МагСОз, эмульгатора с высоким ГЛБ
и воду.
Реакцию Манниха можно проводить в обратных эмульсиях [70].
По одному варианту водный раствор полимера диспергируют в
гидрофобном органическом растворителе в присутствии эмульгатора
(например, полигликольстеарата) с последующим введением отдель-
ной эмульсии аддукта вторичного амина и формальдегида. После
проведения реакции эмульсию в случае необходимости концентриру-
ют, нейтрализуют кислотами или алкилирующими агентами.
По другому варианту эту реакцию проводят в растворе с последую-
щим диспергированием его в гидрофобной органической фазе в при-
сутствии эмульгатора. Затем проводят концентрирование эмульсии
упариванием под вакуумом до остаточного содержания воды в поли-
мере <15%.
Реакция Манниха является обратимой (константа равновесия
к2 = 7,9-103), и поэтому для стабилизации основания Манниха его
переводят в солевую форму нейтрализацией сильными кислотами или
алкилирующими агентами. В качестве алкилирующих агентов приме-
няют диметилсульфат, алкилгалогениды, эпигалогенгидрин, бензил-
галогениды, эфиры серной и сульфоновой кислот или их смеси, допол-
132
нительно также вводят стабилизаторы типа мочевины или соли орга-
нических кислот. В качестве примера ниже приведена схема кватер-
низации основания Манниха диметилсульфатом:
- -СН2-СН----
O=C-NH-CH2-N(CH3)2
(CH3)2SO4
—сн2-сн-----
I +
O=C-NH~CH2-N (СН3)3 -CH3SO4
Полимеры, полученные по реакции Манниха в виде основания или в
солевой форме, используют как готовый продукт или выделяют в
порошкообразном виде.
Порошкообразный продукт получают при высаживании модифици-
рованного полимера из растворов добавкой неорганических солей-
К2СО3, Na2SO4, MgSO4 или неорганических растворителей, не раство-
ряющих полимер. Затем полимер отжимают на центрифуге и сушат при
температуре 80 °C.
В порошкообразном виде можно также получить основание Манни-
ха после проведения реакции ацетилирования в обратных суспензиях.
Для этого полученный продукт отделяют от гидрофобной органичес-
кой жидкости фильтрованием, промывают и сушат под вакуумом.
3.2. Деструкция и стабилизация
Деструкция ПАА и его производных может происходить при получе-
нии, хранении, переработке и применении полимеров под действием
тепла, света, ионизирующего излучения, механических напряжений и
биологических факторов, а также при одновременном действии ука-
занных факторов. Деструкция приводит к уменьшению ММ полимера,
изменению его строения и физико-химических характеристик, что
может ухудшать прикладные свойства полимеров. Однако деструкция
может осуществляться и направленно с целью регулирования ММ
полимеров, получения информации о ММР, а также при изучении
проблемы стабилизации полимеров [2, 71, 72].
Деструкция в водных растворах. Вязкость водных растворов ПАА и
его производных уменьшается со временем [73- 80]. Это изменение
наблюдается как для технического продукта, так и для очищенного
ПАА с ММ = 1,5- 10б при комнатной температуре в темноте в отсутствие
перемешивания и ускоряется при перемешивании. В отличие от
высокомолекулярных полимеров, вязкость растворов низкомолеку-
лярного ПАА неизменна при хранении [81-83]. Нестабильность раст-
воров ПАА при хранении детально исследована в работах [84, 85] и
обобщена в [86]. Наблюдаемые изменения предельного числа вязкости
растворов ПАА при хранении объяснены изменением конформацион-
ного состояния макромолекул вследствие изменения внутримолеку-
133
Рис. 3.5. Схема внутримолекулярных конфор-
мационных изменений макромолекулы ПАА в
воде [163]:
а — начальное состояние; б — переходное состоя-
ние; в — конечное состояние (X, Y, Z — различные
типы Н-связи)
лярных взаимодействий за счет Н-связей различного типа. Схема
конформационных превращений макромолекулы ПАА показана на
рис. 3.5. В исходных растворах ПАА предполагается образование
Н-связей различного типа (X, Y, Z), при этом растворы ПАА имеют
высокую вязкость. Со временем происходит разрушение Н-связей типа
X и Y и сохраняются только Н-связи типа Z, что сопровождается
уменьшением размера макромолекулярного клубка и понижением
вязкости раствора полимера.
Для придания стабильности водным растворам ПАА и его производ-
ным применяют различные стабилизирующие добавки: нитриты и
иодиды щелочных металлов, тиоцианаты, тиомочевину, дитиониты,
бензотиазол, сульфиты, пиросульфиты, тиосульфиты, смеси производ-
ного гуанидина с 50%-м меркаптобензотиазолом или его солями,
гликоли, эфиры, кетоны и др. В качестве стабилизаторов ПАА при
сушке его растворов используют цианамид, гуанидин и сукцинамид.
В присутствии бактерий и плесени растворы ПАА со временем
мутнеют и в них образуется розоватый рыхлый осадок. В результате
жизнедеятельности микроорганизмов ММ у ПАА может уменьшаться в
4-5 раз [87]. Для предотвращения действия микроорганизмов в
растворы полимеров вводят бактерициды-гексахлорофен, диафен,
пентахлорофенол и др. [88].
Неустойчивы водные растворы ПАА и к действию гидродинамичес-
кого поля, что приводит к ухудшению эксплуатационных свойств. В
работе [89] по данным адсорбционной УФ-спектроскопии показано
ослабление взаимодействий ПАА с водой после воздействия на водные
растворы полимера гидродинамического поля. Это связано с образо-
ванием полимер-полимерных связей, приводящих к уменьшению
размеров макромолекулярных клубков и гибкости макромолекул. В
результате отмеченных изменений затрудняются деформация и ориен-
тация макромолекул в потоке, что снижает гидродинамическую
эффективность ПАА.
Возможна деструкция ПАА в растворах и в результате воздействия
ультразвука [90]. Механическая деструкция ПАА усиливается с уве-
личением ММ полимера и с уменьшением растворяющей способности
среды. Уменьшение ММ сополимера АА с АКН наблюдалось при тече-
нии его раствора через пористую среду [91].
134
Таблица 3.4. Изменение характеристик частично гидролизованного ПАА в процессе
термической деструкции в присутствии кислорода при 60 °C и pH 7 [98]
Характеристики Время, сут.
0 3 10 1 34 40 51 75 100
Мы-10-6 3,4 2,2 1,9 1,5 1,2 0,9 0,7 0,5
% 0 35 45 56 64 73 79 83
Степень гидролиза, % 31 31 31 31 34 37 39 41
Деструкция растворов ПАА при сдвиговых воздействиях проанали-
зирована в работе [86]. При одинаковой скорости сдвига при течении
разбавленных растворов сополимеров АА с АКН в 1М растворе NaCl
происходит уменьшение ММ в 3 раза, в меньшей степени - в полураз-
бавленных растворах сополимеров [92].
При радиационном воздействии происходят деструкция высокомо-
лекулярного ПАА в разбавленных растворах ([ПАА] < 0,5%) и сшивка в
концентрированных растворах, а в случае ПМАА наблюдается только
деструкция [93].
Существенное влияние на стабильность водных растворов полиме-
ров оказывает температура. Исследование процесса термической
деструкции ПАА с = 2,9 • 10® в водных растворах с помощью гель-про-
никающей хроматографии показало, что после выдержки растворов
полимера при 50 °C в течение 5 сут. кривые ММР мало изменялись [94].
При 75 °C деструкция полимера очень заметно проявлялась для ПАА с
Мл = 2,9-10®и4,8-105. _
При выдержке водных растворов ПАА с Мд = 3,4-10® и степенью
гидролиза 31% при 60 °C в присутствии кислорода наблюдается умень-
шение ММ во времени (табл. 3.4) [95]. Наиболее резко уменьшается ММ
в течение первых 10 сут., а затем - в течение 10-100 сут. - медленно.
* Уменьшение ММ не может быть связано с изменением степени гидро-
лиза полимера, так как за первые 10 сут. 1% уменьшалась на ~ 65%, а
степень гидролиза возрастала всего на ~ 10%. Полученные результаты
являются следствием наличия в промышленных образцах полимеров
загрязнений (например, остатков инициаторов), которые вступают в
окислительно-восстановительные реакции с кислородом и вызывают
деструкцию макромолекул [96]. В случае очищенных от загрязнений
полимеров кислород не вызывал деструкции макромолекул и
сохранялась неизменной в интервале 60- 100 °C [97].
На основании экспериментальных данных [97, 98] можно заключить,
что процесс деструкции исследованных полимеров объясняется
синергическим эффектом температуры, кислорода и остаточных
примесей в полимере. Поэтому для предотвращения деструктивных
процессов необходимо удалять остатки катализаторов после получе-
ния полимеров. Это может быть достигнуто очисткой растворов поли-
меров диализом, ионным обменом с применением ионитов или уль-
трацентрифугированием. Исключение попадания в растворы полиме-
135
ров кислорода или удаление его из растворов также может предот-
вращать деструкцию [99]. Необходимо учитывать и влияние структуры
полимеров на термическую стабильность [100].
Эффективными стабилизаторами термической деструкции ПАА и
сополимеров АА с АКН с Ма = 7,6'10® в водных растворах при 150°С
являются добавление МагБОз для нейтрализации кислорода и хелати-
рующее добавление Трилона Б для связывания ионов металлов [101].
При хранении в сухом виде в темноте полиакрилглицинцианамида,
полученного полимеризацией в присутствии персульфата, наблюда-
лось уменьшение предельного числа вязкости растворов [102]. Умень-
шение концентрации персульфата при полимеризации приводит к
стабильности вязкости растворов высокомолекулярного ПАА при
хранении [76].
Наряду с негативными моментами, связанными прежде всего с
ухудшением эксплуатационных показателей полимеров, процесс
деструкции может сопровождаться и позитивными изменениями
отдельных (в частности, технологических) свойств полимеров и
композиций на их основе [103-105]. Так, метод деструкции может
оказаться весьма перспективным при получении полимерных образ-
цов с фиксированными значениями ММ и определенным характером
ММР. Получение с препаративной целью полимеров с известным ММР
по методу деструкции в ряде случаев имеет несомненные преимуще-
ства по сравнению с традиционным методом фракционирования [106].
Это связано как со временным фактором (процессы фракционирования
при препаративном получении полимеров, как известно [106], весьма
продолжительны), так и с отсутствием трудностей, связанных с поис-
ком оптимальных систем растворитель - осадитель. Немаловажным
обстоятельством является и то, что массы образцов полимеров, полу-
чаемых методом деструкции, могут в десятки и даже в сотни раз
превышать массы препаративно выделенных фракций. Возможность
варьирования ММ ПАА путем направленной деструкции его в 0,4%-х
юдных растворах под действием персульфата при 50 °C показана в
работе [107]. Анализ данных рис. 3.6 свидетельствует об усилении с
увеличением концентрации персульфата деструктивных процессов,
сопровождающихся разрывом основных (скелетных) связей -уС-С- в
цепях ПАА, поскольку интервал изменения ММ в процессе деструкции
составляет два порядка. Таким образом, подобранные условия позво-
ляют в широких пределах изменять ММ для ПАА. Процесс деструкции
ПАА под действием радикалов R', генерируемых персульфатом, может
быть описан следующей упрощенной схемой [108]:
O=C-NH2 o=c-nh2
I . (q . I kz
~CH2-CH-CH2-CH~ + R —* ~CH-C-CH2-CH~ —*
I -RH i
O=C-NH2 , O=C-NH2
— ~CH2-CH + CH2=C~
o=c-nh2 o=c-nh2
Рис. 3.6. Изменение Mq в процессе деструкции ПАА при различных концентрациях дест-
руктирующего агента [184],[ K2S2OJ, % к ПАА:
0(1); 0,5 (2); 1(3); 2 (4); 5 (5)
Рис. 3.7. Изменение предельного числа вязкости раствора сополимера А А сп-стирольсуль-
фонатом калия (91,6:8,4) в процессе деструкции при концентрации сополимера 0,4%, кон-
центрации K2S2O8 — 1,5% от сополимера при различных температурах, °C [187]:
30 (1); 40 (2); 50 (3); 60 (4)
Разрыв связей - С- С- в цепях ПАА под действием персульфата осуще-
ствляется по закону случая.
Необходимо особо обратить внимание на то обстоятельство, что
деструктивные процессы в растворах ПАА под действием персульфата
развиваются при 25 °C [80] и интенсифицируются при 50 °C [107], а
значит, они заведомо имеют место и при синтезе ПАА в случае исполь-
зования в качестве инициатора персульфата, поскольку температура
синтеза, как правило, > 25 °C, при этом, естественно, вклад деструк-
тивных процессов при полимеризации возрастает с ростом температу-
ры. Отсюда следует, что ММ и ММР полимеров будут зависеть от
интенсивности деструктивных процессов при полимеризации.
Интенсивные деструктивные процессы под действием персульфата
отмечены и в случае ПАА с различной степенью гидролиза при прове-
дении процесса в 0,1 и 0,4%-х водных растворах при 40-70 °C [109].
Проведенные исследования показали возможность регулирования ММ
для образцов ПАА с различной степенью гидролиза при сохранении
постоянства химического состава макромолекул в результате частич-
ной их деструкции. Подобно деструкции ПАА с различной степенью
гидролиза в случае сополимера АА с п-стиролсульфонатом калия
разного состава, отмечено [110] уменьшение предельного числа вязкос-
ти с увеличением концентрации деструктирующего агента - персуль-
фата, продолжительности деструкции и с повышением температуры
(рис. 3.7).
137
Заслуживает внимания также возможность регулирования ММ и
химического состава макромолекул при проведении совместной
деструкции и щелочного гидролиза ПАА в 2,5%-х водных растворах в
присутствии персульфата и NaOH при 30-70°C [111]. Отмечено ускоре-
ние деструктивных процессов с ростом концентрации NaOH. Это
связано с увеличением ионной силы растворов, что повышает плот-
ность экранирования акрилат-анионов гидролизованного ПАА, умень-
шает электростатические отталкивания с ион-радикалами SO^ и
должно способствовать усилению деструктивных реакций. По данным
[112], деструкция ПАА в щелочном растворе сопровождается перво-
начально образованием, а затем исчезновением имидных группиро-
вок.
Влияние концентрации солевых добавок (NaCl, КС1, LiCl, СаС1г) на
деструкцию ПАА со степенью гидролиза 2, 13, 29 и 51% в 0,1 %-х водных
растворах под действием персульфата при 50 °C изучено в работе [113].
С увеличением концентрации солевых добавок установлено уменьше-
ние ММ. При малых ионных силах эффективность деструктивных
процессов с разрывом скелетных связей ^С- С- макромолекул умень-
шается в ряду К+ > Na+ > Li+, а при больших ионных силах мало
зависит от природы катиона солей. При фиксированных концентраци-
ях солевых добавок и продолжительности деструкции зависимость
ММ от степени гидролиза полимера имеет экстремальный характер
(рис. 3.8). Аналогичные зависимости, которые становились менее
выраженными в результате деструкции, получены и в присутствии
NaCl и LiCl. Можно допустить, что на характер зависимости ММ от
химического состава полимера влияет конформационное состояние
макромолекул и плотность зарядов на полиионе, которые сказывают-
ся на электростатических взаимодействиях в системе и отражаются на
интенсивности процессов деструкции исследуемых полимеров в
присутствии солевых добавок.
Было также отмечено [114], что добавки NaCl по сравнению с ацета-
том натрия приводят к более существенному уменьшению ММ. Об
этом свидетельствует приведенная на рис. 3.9 зависимость числа
разрывов, приходящихся на макромолекулу at, от времени деструк-
ции в присутствии солевых добавок. Здесь a( = {[G'f^o/f^h] - 1}, где
(^)О и (MB)t - молекулярная масса полимера до и после деструкции
за время t. Наибольшая интенсивность деструктивных процессов,
происходящих в присутствии NaCl, по сравнению с ацетатом натрия
является следствием более эффективного уменьшения электростати-
ческих взаимодействий в системе. Косвенно это подтверждается более
явным снижением значений т|уд/С в присутствии NaCl по сравнению с
ацетатом натрия вследствие уменьшения размеров макромолекуляр-
ных клубков. Очевидно, на характер электростатических взаимодей-
ствий в системе влияет и природа аниона у низкомолекулярных солей.
Подвергается ПАА и озонолитической деструкции. При этом ско-
рость деструкции под действием озона зависит от концентрации
138
Рис. 3.8. Зависимость Hj] от содержания звеньев АН в сополимере АА с АН в водных
растворах КС1 (1% к полимеру) в различные моменты времени деструкции, мин [190]:
20 (У, 115 [2), 200(3), 320(4)
Рис. 3.9. Зависимость числа разрывов, приходящихся на макромолекулу at, от времени
деструкции ПАА с СГ = 51% в присутствий NaCl (Г, 2', З')и CHjCOONa (7, 2, 3) [191]
([ПАА] - 0,1%; [K2S2O8] = 1,5% к ПАА, 50 °C; [соль], % к ПАА - 5 (1, Г), 10 (2, 2'), 15 (3,3-)
растворенного озона и ионов ОН , температуры, ММ и структуры
полимера [115]. Скорость деструкции ПАА в водных растворах при
pH 5,75 не зависит от концентрации ионов ОН~, а в интервале pH от 5,8
до 8,9 определяется уравнением
-dM^ldt = кр^ОзИон-]0’5^’5,
где кРАА= 1,44• 1014ехр(-94• 104/ЯТ)-
Реакция озонолиза ПАА сМд = 3,5’ 105 в 0,1 и 1%-х водных буферных
растворах при pH 2 осуществляется медленно и более эффективно -
при pH 10 [116]. С увеличением расхода озона возрастает число разры-
вов макромолекул и уменьшается предельное число вязкости раство-
ра полимера (рис. 3.10).
Деструкция полимеров (ПАА, ПАН и сополимеров АА с АН) в твер-
дом состоянии исследовалась в широком температурном интервале -
от 115 до 500 °C [117]. Термогравиметрические кривые гомополимеров
характеризуются наличием двух областей разложения, а сополимера -
трех (рис. 3.11). Первая область разложения ПАА с ММ = 5 -106 находит-
ся в интервале 220-335 °C, и ей соответствует выделение аммиака в
результате имидизации амидных групп [3, 118, 119]. Вторая стадия
расположена выше 335 °C и около 450 °C завершается, при этом разру-
шаются образовавшиеся на первой стадии имидные группировки и
происходят разрывы цепей. В случае полиакрилата натрия первая
область (от 260 до 400 °C) соответствует разложению карбоксилатных
групп, а вторая (от 400 до 500 °C) отвечает деструкции цепей. Термо-
139
О 10 20 30 4Z7
[Оз] -10 3, моль/л
Рис. 3.10. Зависимость предельного числа вязкости раствора ПАА (1) и числа разрывов
макромолекул 62) от концентрации поглощенного озона при pH 10 [193]
Рис. 3.11. Термогравиметрические кривые для ПАА (1), ПАН (3) и сополимера АК с АН
(2) [194]
гравиметрическая кривая сополимера является суперпозицией кривых
гомополимеров. Для сополимера и ПАА первые области деструкции
совпадают и относятся к разрушению амидных групп (см. рис. 3.11),
вторая область для сополимера соответствует интервалу от 320 до
400 °C и связана с разрушением карбоксилатных групп, а третья об-
ласть совпадает со второй температурной областью деструкции поли-
акрилата натрия (от 400 до 480 °C) и соответствует распаду цепей.
Анализ продуктов разложения, проведенный с помощью газовой
хроматографии, масс-спектрометрии и 13С ЯМР в твердом теле, позво-
лил идентифицировать следующие соединения: для ПАА - Н2О, NH3,
СО, СО2 и шестичленные гетероциклические соединения с ММ = 113,
Таблица 3.5. Реакция деструкции ПАА и сополимеров АА с АН [117]
(Со) полимер т/с Основные реакции
ПАА 220—335 Имидизация, образование нитрила (побочные реакции: дегидратация, образование имида, нитрила,^С=С^и имина)
335 Распад основной цепи полимера, имидных и амидных групп, образование нитрилов, углеводородов — (— СН2~)п—, п > 4
Сополимер ААсАН 220-320 Имидизация и дегидратация амидных групп, образование имида, нитрила, изоцианида, алифатических цепей, карбо- нила карбоксильных и амидных групп
То же 320-400 Декарбоксилирование акрилата, распад имидных и амид- ных групп; образование алифатических цепей, карбонил- амидных групп исчезает, карбонилкарбоксильных групп — еще существует
Сополимер 400 Окончательное декарбоксилирование акрилата, разрыв основных цепей полимера, образование парафиноподобных материалов
140
125 и 139; для полиакрилата натрия - доминирующий продукт - СОг, а
для сополимера - смесь продуктов разложения. Основные химичес-
кие реакции разложения гомополимеров и сополимера приведены в
табл. 3.5.
На основании полученных данных была предложена схема терми-
ческой деструкции ПАА.
1. Выделение аммиака и дегидратация:
СН2
-СН2-СН-СН2-СН —*СН2-СН СН-СН2- + NH3
conh2 conh2 ос .со
'"NH
-сн2-сн-сн2-сн- —*-сн2-с ХС-СН2-
I I -NH3 II I
CONH2 CONH2 /С .СО
H2N О
ХСН2
*^-сн2-сн сн-сн2-
.с со
HN ''° Н>сх/сх2
сн2-сн-сн2-сн-сн2-сн- —-*-сн2-сн сн сн-сн2—*
conh2 conh2 conh2 ос J: с
>JHpNH|XNH2
ZC\2/С\2 он он
—*-сн2-сн сн сн-сн2-
. "С ,
''N/
2. Образование нитрила:
-СН2-СН---*-СН2-СН- + Н20
CONH2 CN
3. Образование насыщенных и ненасыщенных алифатических
соединений:
-СН2-СН- —*-СН2-СН- +NH2
CONH2 хС‘
°|.
-сн2-сн- +со
< 1 1
-сн=сн-+ NH3 -сн2-сн2 + -сн=сн-
141
4. Распад имида:
/СН2
-сн2-нс хсн-—-сн2-сн-сн2-сн —*
ОС >со CN СООН
''NH
—► -сн2-сн-сн2-сн2- + со2
CN
В работе [120] на основании данных масс-спектрометрических
исследований также подтверждено, что при термической деструкции
ПАА с ММ = 3-105 в вакууме образуются NH3, СО, СО2, Н2О, HCN,
циклические имиды и другие трудноидентифицируемые соединения.
Подобно ПАА термическая деструкция ПМАА также осуществляется
в две стадии [81]. На первой стадии (260-310°С) потеря массы состав-
ляет 14% и обусловлена реакцией имидизации. На второй стадии
(> 310 °C) происходит распад цепей с выделением газообразных лету-
чих продуктов, который наиболее интенсивен между 360 и 450 °C.
Термогравиметрический анализ ПАА и сополимеров АА с малеино-
вым ангидридом [121] показал в токе аргона, что массовые потери
начинаются при ~ 50 °C и при 500 °C достигают 60%, а полное разложе-
ние завершается при 650 °C. Нагревание образцов сопровождалось
потерей воды, реакциями имидизации с выделением аммиака, декар-
боксилирования и расщепления макромолекул.
Для стабилизации ПАА от термической деструкции в атмосфере
азота могут использоваться ионы металлов [122]. Термическая ста-
бильность ПАА с А?ы = 7,1 • 10* возрастает в присутствии абсорбирован-
ных ионов в ряду Ni(II)<Co(II)<Fe(II)<Cu(II)<Zn(n) ~ Мп(П) и не
изменяется в присутствии ионов Tl(l), Hg(I) и Ni(II).
Изложенные экспериментальные данные свидетельствуют о проте-
кании процессов деструкции ПАА и сополимеров АА в водных раство-
рах и в твердом состоянии в широком температурном интервале под
влиянием различных физических и химических воздействий. Дест-
руктивные процессы сопровождаются уменьшением молекулярной
массы и изменением структуры полимера при умеренных температу-
рах и глубоким разложением полимера при высоких температурах.
Эти изменения ухудшают прикладные свойства полимеров. Поэтому
нужно учитывать и предупреждать возможность деструкции различ-
ными технологическими решениями и применением стабилизаторов
[171, 123, 124] при (со) полимеризации АА, хранении, _ переработке и
применении ПАА, его производных и сополимеров.
142
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Феттес Е. //.Химические реакции полимеров: Т. 1: Пер. с англ. М.: Мир, 1974,
2. Плата НА., Литманович А.Д., Ноа О.В. Макромолекулярные реакции. М.: Химия,
1977.256 с.
3. Куренков В.Ф., Байбурдов Т.А.//Химия и хим. технология. 1989. Т. 32. №7. С. 3—15
(Изв. вузов).
4. Скальская У.Л., Кравчук Ю.М., Круглицкий Н.Н.//Укр. хим. журн. 1966. Т. 32. №3.
С. 299-301.
5. Вейцер Ю.И., Минц Д.М. Высокомолекулярные флокулянты в процессах очистки
сточных вод. М.: Стройиздат, 1984.201 с.
6. Зильберман Е.Н., Старков А.А., Померанцева Э.Г. //ВМС. Сер. А. 1977. Т. 19. №12.
С. 2714-2718.
7. Зильберман Е.Н., Старков А.А., Еремеев И.В. и др.//ВМС. Сер. Б. 1979. Т. 21. № 1.
С. 30 -33.
8. А.с. 643512 СССР; РЖХ 1979. 19 С309П.
9. Пат. заявка 54-11083 Японии; РЖХ. 1979. 24С444П.
10. Фун Синъ-то, Тё-Шу-коу//Химия и технология полимеров. 1959. № 9. С. 80—94.
11. Sakurada I., Ohmara Y., Sakaguchi У./ZKobunshi Kagaku. 1967. V. 24. P. 618.
12. Smets G., Hesbain A.M.//J. Polym. Sci. 1959. V. 40. N 136. P. 217-226.
13. Moens J., Smets G.//J. Polym. Sci. 1957. V. 23. N 4. P. 931-948.
14. Ratchford W.P., Fischer C.H.//3. Am. Chem. Soc. 1949. V. 69. P. 1911.
15. MacWilliams D.C.//Functional Monomers Acrylamide and other alpha, beta unsaturated
amides./Ed. by R.H. Vacum, E.B. Nyguist. N.Y.: Marcel Dekker, 1973. V. 1. P. 1—197.
16. Minsk L. M., Kotlarchic C., Meyer G. M.//1. Polym. Sci. Polym. Chem. Ed. 1974. V. 12.
Nl.P. 133-140.
17. HaasH. C., MacDonald R. L.//J. Polym. Sci. Part A. 1971. V. 9. N12. P. 3583-3593.
18. Зильберман E. H. и др.//Физ-хим. основы синтеза и переработки полимеров: Меж-
вуэ. сб. Горький: изд-во ГГУ, 1977. № 2. С. 78—81.
19. Klein J., Heitzman R.//Makromol. Chem. 1978. Bd. 179. N 8. S. 1895-1904.
20. NagaseK., Sakaguchi К.//J.Polym. Sci. Part A. 1965. V. 3. N 7. P. 2475 - 2482.
21. HiguchiM., Senju R.//Polym. J. 1972. V. 3. N 3. P. 370-377.
22. Мамедов M. Ф., Серебряков Б. P., Буният-заде A. A. и dp.//BMC. Cep. A. 1972. T. 14.
№1. C. 107-110.
23. Коростелева E. А., Мищенко К. П.//ЖПХ. 1980. T. 53. № 8. С. 1921-1923.
24. Gunari A. A., Gundiah S.//Makromol. Chem. 1981. Bd. 182. N1, S. 1—8.
25. Muller G., Laine J. P., Fenyo J. С.П1. Polym. Sci. Polym. Chem. Ed. 1979. V. 17. N 3.
P. 659-672.
26. WentP. M., Evans R., Nappe D. H.//1. Polym. Sci. Polym. Symp. 1975. N 49. P. 159—167.
27. Truong N. D., Galin J. C., Francois J.//I. Polym. 1986. V. 27. N 3. P. 459—466.
28. Смете Г. Химические реакции полимеров. М.: Мир, 1967. Т. 1.398 с.
29. Моравец Г.//Там же. С. 16—46.
30. FuossR. М. et al.//1. Polym. Sci. 1960. V. 48. N 1. P. 5—15.
31. MoroweteH.//Chimie. 1982. Bd. 6. N12. S. 659-660.
32. SawantS., Morawetz H.//J. Polym. Sci. Polym. Letters Ed. 1982. V. 20. P. 385—388.
33. Pinner S. H.//J. Polym. Sci. 1953. V. 10. N 4. P. 379-384.
34. Савицкая M. H., Холодова Ю. Д. Полиакриламид. Киев: Техтка, 1969. 188 с.
35. Kulicke VJ.-M., Horl H.-H.//Colloid and Polym. Sci. 1985. V. 263. N 7. P. 530-540.
36. Зильберман E. H., Старков А. А., Гладышев H. M.//BMC. Сер. Б. 1976. T. 18. № 6.
C. 453- 454.
37. Куренков В. Ф., Байбурдов Г. .4., Ступенькова Л. Д//ЖПХ. 1985. Т. 58. № 3.
С. 701-703.
38. Mourer J. L, Barvey С. D„ Klemann J. P.//Polym. Mater Sci. and Eng. Proc. ACS Div.
Polym. Mater. Sci. and Eng. V. 55.: Fall Meet. Ariaheim, Calif., 1986. Washington, 1986.
P. 705, 709.
143
39. Моравец Г. Макромолекулы в растворе. М.: Мир, 1967.398 с.
40. Куренков В. Ф., Байбурдов Т. А., Ступенъкова Л. Л. и др.//Химия и технол. эле-
ментоорганич. соед. и полимеров: Межвуз. сб. Казань: КХТИ, 1985. С. 47—51.
41. Громов В. Ф., Телешов Э. //.//Пластмассы. 1984. № 10. С. 9—13.
42. Wada Т. et al.//Radiat. Phys. and. Chem. 1983. V. 22. P. 1064.
43. Шейнкер А. П., Бунэ E. В., Толстоухова Л. П. и др.//Тезисы докл. Ш Всесоюз. конф.
„Водорастворимые полимеры и их применение”. Иркутск: изд-во ИОХ, 1987. С. 10.
44. Куренков В. Ф., Верижникова А. С., Мягченков В. А.//ВМС. Сер. А. 1984. Т. 26. № 3.
С. 535-540.
45. Kurenkov V. F., Verihznikova A. S., Myagchenkov V. A.//Europ. Polym. J. 1984. V. 20.
N4. P. 357-360.
46. Куренков В. Ф., Верижникова А. С., Мягченков В. А.//ДАН СССР 1984. Т. 278. № 5.
С. 1173-1178.
47. Куренков В. Ф., Верижникова А. С., Мягченков В. А.//ВМС. Сер. А. 1986. Т. 28. № 3.
С. 488-492.
48. Куренков В. Ф., Трифонова М. Н., Вагапова А.К. и др.//Химия и хим. технол. 1986.
Т. 29. № 10. С. 105-109 (Изв. вузов).
49. Kurenkov V. F., Trifonova М. N., Myagchenkov V. A.//Eur. Polym. J. 1987. V. 23. N 9.
P. 685-688.
50. Cincu G. et aL//Mater pla3t. 1982. V. 1. N3. S. 151-157.
51. Куренков В. Ф., Байбурдов Т. А., Ступенъкова Л. Л.//Химия и технол. электроор-
ганич. соед. и полимеров: Межвуз. сб. Казань: КХТИ. 1983. С. 50—53.
52. Куренков В. Ф., Байбурдов Т. А., Ступенъкова Л. Л.//Ризико-хим. основы синтеза и
переработки полимеров: Межвуз. сб. Горький: Изд-во ГГУ, 1985. С. 79—86.
53. К. Ингольд.//Георетические основы органической химии/Под ред. И. Н. Белецкой.
М.: Мир, 1973.
54. Arcus G. D.//J. Polym. Sci. 1952. V. 8. N 4. P. 365-370.
55. Jones G. D., J. Zomlefer and K. Hawkins//!. Org. Chem. 1944. V. 9. P. 500—506.
56. Muller M., SmetsG./A. Polym. Sci. 1957. V. 23. P. 915.
57. Tanaka H., Senya R.//Kobyhan pohye. 1976. V. 33. N 6. P. 309-316.
58. Tanaka H., Suzankik, Senyu R.//Kamuna rukece. 1976. V. 30. N 7. P. 392—400.
59. Schiller A. M., Suen T. Y./And. Eng. Chem. 1956. V. 48. P. 2132-2137.
60. Пат. 2729560 США; C. A. 1956. V. 50. 7459.
61. Пат. 2890978 CHIA; C. A. 1959. V. 53. 184856.
62. Tanaka H„ Senyu R.//Bull. Chem. Soc. Jap. 1976. V. 49. N 10. P. 2821-2823.
63. Tanaka H./A. Polym. Sci. Polym. Letters Ed. 1978. V. 16. N 2. P. 87-89.
64. Tanaka H./A. Polym. Sci. Polym. Chem. Ed. 1979. V. 17. N 4. P. 1239-1245.
65. Пат. заявка 52-152493 Японии; РЖХ. 1978. 212358П.
66. Кушнер Э.И., Шведова В. Н., Бондаренко В. М. Технология ВМС. Л., 1982. С. 129—
137. Деп. в ВИНИТИ. V. 82. Т 829 ХП-Д.
67. Сайкс //.//Механизмы реакции в органической химии. М.: Химия, 1971. С. 183—187.
68. McDonald С. J., Beaver R. //.//Macromolecules. 1979. V. 12. N 2. Р. 203—208.
69. Пат. 1354349 Великобритании; РЖХ. 1975. 21Т832П.
70. Duthigwica J./A. Makromol. Sci. Chem. 1983. V. A20. N 9. P. 957-965.
71. Грасси H., Скот Дж. Деструкция и стабилизация полимеров: Пер. с англ. М.: Мир,
1988. 246 с.
72. Берлин А. А., Вольфсон С. А., Ениколопян Н. С. Кинетика полимеризационных
процессов. М.: Химия, 1978. 320 с.
73. NarkisN., Rebhuhn М.//Polymer. 1966. V. 10. N 6. Р. 507.
74. Shyluk W. P., Stow F. S./A. Appl. Polym. Sci. 1969. V. 13. P. 1023.
75. Gardner K. L„ Murphy W. R„ Geehan T. G.//J. Appl. Polym. Sci. 1978. V. 22. P. 881.
76. HaasH. C„ MacDonald R. L./A. Polym. Sci. Polym. Letters. Ed. 1972. V. 10. P. 461-467.
77. Recasens F., Subirana J. A.//IUPAC Int. Symp. Macromol. Chem. Madrid, 1974. V. 1.
P. 466.
78. DarscusR. L., Jordan D. O., Kurucsev T. etal.//]. Polym. Sci. Part A3. 1965. P. 1941.
144
79. Alfrey T., FuossR. M., Morawetz H. et al.//J. Am. Chem. Soc. 1952. V. 74. P. 438.
80. Chemelir M., Kunschner A., Barthell E.ZZAngew. Makromol. Chem. 1980. Bd. 89. S. 145.
81. McNeill I. C., Zulfigar M.//J. Polym. Sci. Polym. Chem. Ed. 1978. V. 16. P. 2465—2474.
82. Montgomery h'. H.ZZWater Soluble Resin/Ed. by R. L Davidson, M. Sittig. New York:
Reinhold. 1968. P. 175.
83. Короткина О. 3., Магдинец В. В., Савицкая М. Н. и др. //ЖПХ. 1965. Т. 38. № 11.
С. 2533.
84. Kulicke W.-M., Klein J.ZzAngew. Makromol. Chem. 1978. Bd. 69. S. 189.
85. Kulicke W.-M., Kniewske R.ZZMakromol. Chem. 1980. Bd. 181. S. 823.
86. Kulicke W.-M., Kniewske R., Klin J.ZZFrogr. Polym. Sci. 1982. V. 8. N 4. P. 373-468.
87. Гарейшина A. 3., Яюс Л. И., Газизов A. IB. и <Эр.//Нефтепромысл. дело и граней,
нефти. 1984. № 8. С. 17-19.
88. Праздников 3. Ф., Вебер В. И., Костюк Т. В.//Нефтепромысл. дело и трансп. нефти.
1985. №6. С. 61-63.
89. ПовхИ. Л., Макогон Б. П., Ступникова Т. В. и dp.ZZ.HAH УССР. Сер. Б. Геол., хим. и
биол. науки. 1986. № 10. С. 31 — 33.
90. Henglein A.//Makromol. Chem. 1954. Bd. 14. S. 15.
91. Hashemzadeh A., Kulicke K-M.ZZChem. Ing. Nechn. 1986. V. 58. N 4. P. 325—327.
92. Farinato R., Yen Wei S.//I. Appl. Polym. Sci. 1987. V. 33. N 7. P. 2353-2368.
93. AlexanderP., Charlesby A.//I. Polym. Sci. 1957. V. 23. P. 355.
94. Klein J., Westerkamp А.И1. Polym. Sci. Polym. Chem. Ed. 1981. V. 19. P. 707.
95. Davison P., Mentzer E.//SPE 9300. 5th Annual Fall Technical Conference of AIME. Dallas.
Sept. 1980.
96. Foshee W.C., JenningsR.R., West T.J.//SPE 6202. 51-th Annual Fall Meeting. New Orlean.
3-6 Oct. 1976.
97. Muller G.//Polymer Bulletin. 1981. V. 5. P. 39—45.
98. Muller G.//Polymer Bulletin. 1981. V. 5. P. 31 — 37.
Ю. Knight B.L.//J. Pet. Tech. 1973. V. 25. P. 618.
100. Bhuiyan A.I.//Polymer. 1984. V. 25. N 12. P. 1699-1710.
101. Martischius F.-D., Heide IV.//Drag reduction. 3 Int. Conf. Bristol. 2—5 July. 1984. D 9.
P. 1-3.
102 HaasH.C., MacDonaldR.L., Schuler A.N.IIJ. Polym. Sci. Part A-l. 1970. V. 8. P. 3405.
103. Грасси H./Z Химия процессов деструкции полимеров. М.: ИЛ, 1962. С. 252.
104. Fuchs O.//Dtsch. Farben Z. 1970. Bd. 24. N 5. S. 24.
105. Моисеев Ю.В., Зайков Г.В.// Химическая стойкость полимеров в агрессивных
средах. М.: Химин, 1979. С. 288.
106. Хоггинс М., Окамото Н.//Фракционирование полимеров/Под ред. М.Кантова М.:
Мир, 1971. С. 3.
107. Мягченков В.А., Куренков В.Ф., Ахмедьянова Р.А.//ВМС. Сер. А. 1984. Т. 26. № 5..
С. 340 - 344.
108. Cameron G.G., Капе DJ?.//Makromolek. Chem. 1967. Bd. 109. S. 194.
109. Куренков В.Ф., Нагель М.А., Костерина Е.Н. и др.// Химия и технол. элементоорга-
нич. соед. и полимеров: Межвуз. сб. Казань: КХТИ, 1984. С. 34 - 38.
ПО. Куренков В.Ф., Орлова И.Б., Мягченков В.А.// ВМС. Сер. А. 1986. Т. 28. № 6.
С. 1186-1191.
111. Куренков В.Ф., Байбурдов Т.А., Ступенъкова Л.Л. и др.// Химия и технол. эле-
ментоорганич. соед. и полимеров: Межвуз. сб. Казань: КХТИ, 1985. С. 47 — 51.
112. SawantS., Moraetz Н.//Macromolecules. 1984. V. 17. N 11. Р. 2427—2431.
113. Куренков В.Ф., Трифонова М.Н., Терентьева Г.И. и др.//Физ.-хим. основы синтеза
и переработки полимеров.: Межвуз. сб. Горький изд-во ГГУ, 1987. С. 74 — 78.
114. Куренков В.Ф., Трифонова М.Н., Кропотова Н.А. и др.// Химия и технол. элемен-
тоорганич. соед. и полимеров: Межвуз. сб. Казань: КХТИ, 1987. С. 106 - 112.
115. Morooka S., Ikemizu К., Kato Y.III Pacih. Chem. Eng. Congr. Seoul. May 8—11. 1983.
Proc. V. 4. P. 289-294.
116. Suzuki J., Hzuka S., Suzyki S. HI. Appl. Polym. Sci. 1978. V. 22. P. 2109 - 2117.
145
117. Leung W.M., Axelson D.E., VanDyke J.D.I/J. Polym. Sci. Part A. Polym. Chem. 1987.
V. 25. N 7. P. 1825-1846.
118. Zurakowska-Orszagh H., Buse W., Soerjosoeharto K.//Bulletin De I'academie, Polonaise
Des Science_Serie des Science Chimigues, 1977. V. 11. P. 845.
119. BurrowsH.D., FlissH.A., Utan SJ.//Polymer. 1981. V. 22. P. 1740.
120. Корсаков B.H., Евтюков H.3., Кузнина E.B. и др.//ЖПХ. 1984. С. 38 — 84. Деп. в
ВИНИТИ. № 61.
121. Vilcu R., BujorLL, Olteanu М. etal.Hl. Appl. Polym. Sci. 1987. V. 33. N 7. P. 2431-2437.
122. Flies H.A., Burrows H.D., Utah 5.7.//Polymer Degradation and Stability. 1984. V. 8.
P. 229-239.
123. Фойгт И. Стабилизация синтетических полимеров против действия света и тепла:
Пер. с нем./Под ред. Б.М. Коварской. Л.: Химия, 1972.544 с.
124. Шляпников Ю.А., Кирюшкин С.Г., Марьин АЛ. Антиокислительиая стабилизация
полимеров. М.: Химия, 1986.256 с.
Глава 4
ФИЗИЧЕСКИЕ И ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА
ПОЛИМЕРОВ АКРИЛАМИДА И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ
При рассмотрении различных аспектов получения и применения
(со)полимеров АА всегда нужно иметь в виду возможность перехода
(по крайней мере, на одной из стадий процесса) к водным растворам.
Поэтому вполне естественно, что при изучении физических и физи-
ко-химических свойств (со)полимеров АА основной акцент должен
быть сделан на изучении специфических особенностей поведения
макромолекул именно в водных растворах. Для получения надежной
и систематизированной информации о конформационном состоянии
макромолекул (со)полимеров АА необходим достаточно большой
набор образцов, различающихся между собой по молекулярным
параметрам [1]. Поэтому следует специально остановиться на вопросах
фракционирования (со)полимеров АА. Дополнительным аргументом в
пользу этого служит и то обстоятельство, что именно для этого класса
полимерных объектов за последние десятилетия получена очень
ценная информация о молекулярных параметрах, которая позволила с
новых позиций подойти к оценке закономерностей и механизма их
синтеза [2]. В частности, различные варианты осложненных процессов
сополимеризации всесторонне изучены для систем, в которых одним
из мономеров был АА.
4.1. Молекулярные параметры и особенности фракционирования
При обобщении литературных данных по фракционированию (сопо-
лимеров А А необходимо выделить одно существенное обстоятельство-
имеется достаточно большой экспериментальный материал по
фракционированию (со)полимеров АА по молекулярной массе (ММ). В
гораздо меньшей степени изучены другие виды неоднородности - по
составу (а), степени разветвленности, микроструктуре макромолекул
и др. В связи с этим, учитывая, что во многих случаях влияние неод-
146
породности по а на результирующие свойства сополимеров намного
превосходит влияние полидисперсности по ММ, в данном разделе
основное внимание будет акцентировано на особенностях фракциони-
рования сополимеров по и.
Для препаративного фракционирования (со)полимеров АА по ММ,
как правило, применяют метод последовательного осаждения фрак-
ций с использованием в качестве растворителя воды и осадителей -
ацетона и спиртов (метилового, этилового, пропилового, бутилового и
др.) [3]. Для „смягчения” осадителя (т.е. для снижения параметра
взаимодействия полимер-осадитель го) в ряде случаев осадителями
служили водно-ацетоновые и водно-спиртовые среды. По мере выде-
ления фракций ММ снижается и антибатно этому меняется п?кр. Если 1,
2, 3,..., i,..., к- 1, к- номера фракций; Му М2, М3,..., М,, ..., Мк- ц
Мк - молекулярные массы фракций;
ЧР> ЧР> •••Хр> — . J> ^р - значения для фракций,
то Му > М2 > М3 > ... > Мк _ 1 > Мк и п4р < п£р < ... <
<ткр"1<п^р-
Для более эффективного фракционирования первые 2-3 фракции (с
наибольшими ММ) переосаждают с целью снижения в них доли низко-
молекулярных примесей. С этой же целью после четкой фиксации
помутнения (т.е. после введения определенной дозы осадителя)
систему целесообразно нагреть на 10- 15 °C [4]. После прогрева помут-
нение исчезает, а при охлаждении системы до первоначальной темпе-
ратуры начинается плавное выпадение осадка, т.е. соответствующей
фракции полимера. При таком режиме фракционирования (с включе-
нием цикла нагревание-охлаждение) практически устраняются
нежелательные эффекты, связанные с локальным выделением (сопо-
лимера АА вблизи зон ввода осадителя. Поскольку для большинства
реальных систем приходится иметь дело с достаточно высокомолеку-
лярными образцами (со)полимеров АА:ММ> 2’ 105, то для выполнения
условия (первое - переосаждение первых 2- 3 фракций) эффективного
фракционирования приходится работать с достаточно разбавленными
(С <0,5%) исходными водными растворами (со)полимеров АА. Досто-
инствами метода последовательного осаждения применительно к
анализу ММР (со)полимеров АА являются: простота и доступность
аппаратурного оформления, возможность визуального контроля за
объемом выделяемой фракции и получения достаточно больших (по
массе) фракций. К недостаткам метода следует отнести большую
продолжительность процесса фракционирования (до 5-10 сут.), что в
принципе способствует развитию нежелательных деструктивных
процессов (в частности, процессов гидролиза). Недостатком метода
является и необходимость переосаждения наиболее высокомолеку-
лярных фракций (со)полимеров АА.
Применительно к (со)полимерам АА гораздо меньшее распростране-
ние получил метод последовательного растворения. Это объясняется
главным образом двумя причинами. Первая - сравнительно неболь-
147
шие объемы фракций, что связано с необходимостью работы с высоко-
дисперсными гетерогенными системами. Полимер в виде тонкоиз-
мельченного порошка, очень тонких пленок или волокон, а также при
нанесении его на инертную подложку должен иметь удельную поверх-
ность не менее нескольких м2/г. Только при этом условии можно
рассчитывать на установление термодинамического равновесия между
набухшим полимером и ячейкой раствора с 1-й фракцией. Вторая
причина - отсутствие визуального контроля за объемом выделенной
фракции. В методе последовательного растворения по мере выделения
фракций (со)полимеров АА происходит непрерывное увеличение и
падение т.е. М1<М2<Мз<... <Mk~i <Мк и >m2Kp >т^р >... >
> ... > mfc-KP > ткр - Потенциальным достоинством этого метода
является то, что он может быть сравнительно легко автоматизирован.
Помимо этого здесь нет необходимости в переосаждении последних,
наиболее высокомолекулярных фракций.
В последнее время большие надежды исследователей были связаны
с использованием гель-проникающей хроматографии для анализа ММР
(со)полимеров АА [5 - 7]. В целом эти надежды оправдались, и метод
гель-проникающей хроматографии был успешно применен в качестве
экспресс-метода для оценки ММР ряда (со)полимеров АА. Однако на
пути широкого внедрения метода гель-хроматографии применительно
к анализу ММР (со)полимеров АА имеются существенные осложнения,
связанные прежде всего с осложнениями при калибровке прибора и
при переходе к анализу полиэлектролитных систем. Последнее ослож-
нение можно в принципе устранить переходом от водных к водно-со-
левым средам. Необходимо особо отметить и такую деталь - сополи-
меры АА могут быть использованы не только в качестве объекта
изучения ММР, но и в качестве полимерного геля [1].
При переходе от ПАА к сополимерам АА прежде всего необходимо
акцентировать внимание на том, что процесс фракционирования
осуществляется уже не по одному (а именно по ММ, как это имело
место для ПАА), а по двум параметрам - ММ и а. Естественно, что при
таком подходе мы сознательно умалчиваем о других, ранее отмечен-
ных, видах неоднородности, характерных как для ПАА, так и для
(со)полимеров АА [2]. Для сополимеров отношение объемных долей 1-й
фракции в осадке и в растворе А, зависит отМ/ и <*i по соотношению:
А, = ехр[Л/,(о + А.а,)], (4.1)
где о и X — параметры, зависящие от энергетических и энтропийных взаимодействий в
системе сополимер—растворитель—осадитель.
В явном виде выражение (4.1) впервые применено Литмановичем [8]
и в принципе может быть получено из теории Флори- Хаггинса и без
учета взаимодействия разнородных звеньев макромолекулы сополи-
мера. С увеличением параметра X (по модулю) повышается эффектив-
ность разделения макромолекул по составу. Случай X = 0 свидетельст-
вует о независимости термодинамических характеристик от состава
макромолекул сополимера. Из анализа соотношения следует и важная
148
практическая рекомендация - для преимущественного фракциониро-
вания сополимеров по ММ необходимо применять системы с низкими
значениями параметра а для получения надежной информации о
химической гетерогенности сополимера необходимо работать с систе-
мами растворитель - осадитель, для которых | Л | велик. Наиболее
успешное фракционирование сополимеров по составу достигается при
перекрестном фракционировании [8, 9], когда используются одно-
временно две различные системы растворитель-осадитель с большими
|ЛI, при этом необходимо различие в знаке параметра А. [9].
Говоря о сополимерах АА, необходимо выделить и еще одно очень
важное в практическом плане обстоятельство - с увеличением разли-
чия в свойствах компонентов сополимера возрастает эффективность
фракционирования по а, облегчается подбор чувствительных к а
осадителей. Так, для ионогенных сополимеров АА (как анионных, так
и катионных) высокая эффективность фракционирования по а во
многом предопределена большим различием физико-химических
показателей полиэлектролита (анионного или катионного) и ПАА [10].
В то же время проведение эффективного фракционирования по а для
сополимеров АА с близкими по свойствам компонентами (например,
сополимерами АА с метакриламидом) сопряжено с огромными экспе-
риментальными трудностями и практически достижимо далеко не во
всех случаях. Влияние качества осадителя на вид интегральных
кривых распределения по составу (ИКРС) показано на рис. 4.1 на
примере статистических сополимеров АА с калиевой солью винилами-
доянтарной кислоты (КВАЯК). Видно, что при переходе от однокомпо-
нентного осадителя (ацетон, кривая 3) к бинарному осадителю (смеси
ацетон - метанол переменных соотношений, кривые 2 и 1) ИКРС
существенно размываются. А это означает, что смеси ацетон- метанол
более эффективны для фракционирования из водных растворов
сополимера АА - КВАЯК. И, как следствие этого, кривые 2 и 1 дают
более надежную информацию о полидисперсности по составу сополиме-
ра АА - КВАЯК. Дополнительной иллюстрацией высокой чувствитель-
ности подобранной системы растворитель - осадитель к составу
макромолекул сополимера АА - КВАЯК могут служить данные
рис. 4.2. Сказанное подтверждает хорошее соответствие эксперимен-
тальной (кривая 1) и расчетной (по методу суперпозиции, кривая 2)
ИКРС. Для сополимеров АА - КВАЯК было проведено эффективное
фракционирование по а при использовании в качестве осадителя
водно-ацетоновых смесей, при этом по мере развития процесса фрак-
ционирования доля ацетона У в бинарном осадителе непрерывно
увеличивалась вплоть до У = 1 [12]. На рис. 4.3 показаны ИКРС - для
гомофазного (1,2,3) и гетерофазного (4-7) процессов сополимериза-
ции. Из сопоставительного анализа кривых 1-7 был сделан вывод об
осложненном (’’особом”) характере сополимеризации, который имеет
место при гетерофазном процессе синтеза. Помимо гетерофазности, еще
одним осложняющим фактором является то, что один из мономеров
(КВАЯК) является ионогенным, а значит, и процесс сополимеризации
149
Рис. 4.1. ИКРС сополимера АА—КВАЯК, полученные методом последовательного осаж-
дения фракций [11]. Растворитель — вода, осадители — смеси ацетон — метанол с макси-
мальным содержанием спирта 60 fl) и 20 (2), ацетон (3)
Рис. 4.2. ИКРС смесей двух сополимеров АА — КВАЯК [И]:
1 — экспериментальная ИКРС (осадитель — смеси ацетон — метанол переменных составов); 2 —
Рис. 4.3. ИКРС сополимеров АА —КВАЯК [12]. Состав исходной мономерной смеси для
всех кривых ₽в = 0,6; Г= 50 °C:
гомофазный процесс синтеза в глицерине ф = 0,79 (1), в этиленгликоле ф = 0,80 (2), в воде
ф = 0,57(5) (3”, 3", 3"', 3"" —расчетные ИКРС для ф соответственно 0,4; 0,5; 0,6; 0,7); гетерофазный
процесс синтеза для смесей: вода — этанол 1:3, ф = 0,64 (4); вода — диоксан 1:2, ф=0,56 (5), вода—
ацетон 1:1, ф = 0,44 (6); вода — ацетон 1:2, ф = 0,43 (7)
является неизоионным, поэтому относительные активности мономе-
ров не остаются постоянными.
При очень сильном различии в свойствах компонентов сополимера
достаточно полную информацию о полидисперсности по составу можно
получить и при применении метода ступенчатого фракционирования
[1,13]. Так, ИКРС получены для статистических сополимеров АА с
Na-малеинатом методом ступенчатого фракционирования [14]. Рис. 4.4
иллюстрирует схему фракционирования одного из образцов сополи-
меров АА с Na-малеинатом. Разработанный метод фракционирования
позволил получать достаточно большое количество различных по
составу фракций сополимеров АА с Na-малеинатом. В частности, для
образца сополимера, схема фракционирования которого приведена на
рис. 4.4, число выделенных фракций оказалось равным 40. Из сопостав-
150
Рис. 4.4. Схема ступенчатого фракционирования сополимера АА—Na-малеинат (₽п =
= 0,6) [14]:
А — исходный образец, 1—40 — выделенные фракции
ления ширины экспериментальных ИКРС, а также экспериментальных
кривых с теоретическими (для различных моделей сополимеризации
при вариации в широких пределах констант сополимеризации Гд и гв)
был сделан принципиально важный вывод о неадекватности реального
процесса сополимеризации классической схемы Майо - Льюиса [14].
Отклонение реального процесса сополимеризации от схемы Майо -
Льюиса связано с внутренней неизоионностью процесса синтеза сополи-
меров ввиду наличия в системе ионогенного мономера - Na-малеина-
та.
Метод последовательного осаждения фракций был успешно приме-
нен в работе [15] для фракционирования по составу статистических
сополимеров АА с натриевой солью n-стиролсульфокислоты (ССН).
Наиболее эффективное разделение фракций по составу было достиг-
нуто при использовании в качестве осадителя ацетоновых растворов
Nal, при этом концентрация Nal'постепенно повышалась от 1% в
начале фракционирования до 10% — в конце процесса. Было показано,
что ИКРС сополимеров АА - ССН существенно различны без добавки и
при введении соли (NaCl). ИКРС, полученные в присутствии большого
избытка NaCl (10%), существенно менее полидисперсны по составу по
сравнению с ИКРС, полученными в неизоионных условиях (без NaCl)
[15]. Сопоставление ИКРС, естественно, проводилось для одинаковых
151
Рис. 4.5. ИКРС сополимеров АА — КВАЯК
[16]. Реакционные среды: вода — метанол
(1:3), р в = 0,2 (1); вода - диоксан (1:1), р =
= 0,2 (2); вода — диоксан (1:2), Pg= 0,2 (3);
вода—метанол (1:5), Pg =0,6 (4); вода —
диоксан (1:3), Рв = 0,6 (5); вода — диоксан
(1:3), Р в = 0,8 (6); вода - метанол (1:5),
₽В = 0>8(7)
степеней конверсии. Количественной характеристикой полидисперс-
ности по составу образцов сополимеров АА с ССН служила величина
дисперсии по составу о.
В случае гетерофазной сополимеризации АА с КВАЯК наиболее
полная информация о полидисперсности сополимеров по составу
достигнута пофазным фракционированием, т.е. путем раздельного
фракционирования образцов сополимеров, выделенных из разбавлен-
ной (раствор) и концентрированной (осадок) фаз. Растворителем
служила вода, селективным осадителем - смеси ацетона с метанолом
переменных составов [16]. Используемая в качестве осадителя смесь
ацетона с метанолом обеспечивала эффективное фракционирование по
составу, ввиду того что один из компонентов смеси - метанол являлся
жестким осадителем для ПАА и растворителем для другого гомополи-
мера - ПКВАЯК. На рис. 4.5 приведены экспериментальные ИКРС
сополимеров АА - КВАЯК, каждая из кривых получена суперпози-
цией двух ИКРС - из раствора и из осадка. Из пофазного анализа ИКРС
можно заключить, что состав макромолекул АА - КВАЯК зависит не
только от природы органического компонента в бинарной реакцион-
ной смеси, но и от тогв^ какой фазе (в растворе или в осадке) осу-
ществляется синтез конкретной фракции сополимера. Наблюдаемый в
эксперименте характер изменения состава макромолекул сополимера
может быть понят при учете специфики действия органического
компонента бинарной водно-органической смеси. Диоксан является
осадителем для ПАА и ПКВАЯК, а метанол - осадителем для ПАА и
растворителем ПКВАЯК. Это и предопределяет более высокое содер-
жание КВАЯК в фазе осадка в средах вода - диоксан по сравнению с
водно-метанольными средами. Необходимо особо отметить, что ИКРС
для сополимеров АА - КВАЯК дают несравненно более емкую инфор-
мацию об особенностях синтеза по сравнению с даваемой для той же
системы кривыми ММР [16]. К сожалению, можно констатировать, что
такой уровень информации (пофазный) о процессе сополимеризации в
гетерофазных средах достигнут пока лишь для двух систем - помимо
системы АА - КВАЯК еще и для системы МАН - МАК [17].
Для сополимерной системы АА - малеиновая кислота фракциони-
рование проведено при использовании в качестве растворителя воды,
152
осадителем служил ацетон [18J. Построенные по данным фракциониро-
вания ИКРС были сопоставлены с аналогичными кривыми, построен-
ными по данным кинетического анализа (при раздельном контроле за
расходом каждого из мономеров [19]), а также с расчетными ИКРС,
построенными по методу Скейста. Осложненный характер процесса
сополимеризации для системы АА - малеиновая кислота был зафикси-
рован при сопоставлении экспериментальных и теоретических ИКРС и
дополнительно подтвержден наличием концентрационного эффекта
[20].
Таким образом, данные фракционирования по составу сополимеров
АА позволили сделать принципиально важные заключения о механиз-
ме статистической сополимеризации, в частности об осложненном
(’’особом”) характере процесса, связанном с гетерофазностью и присут-
ствием в системе сополимера ионогенного мономера [2].
4.2. Свойства разбавленных растворов полимеров
Основная задача исследований - оценить специфику конформаци-
онного состояния макромолекул (со)полимеров АА в растворе. Для
достижения цели могут быть использованы разнообразные физико-хи-
мические и физические методы анализа [6, 21, 22]: вискозиметрия,
ультрацентрифугирование, диффузия, светорассеяние, двойное луче-
преломление в потоке, осмометрия и др. Особо следует остановиться
на вискозиметрическом методе анализа (со)полимеров АА, поскольку
этот метод является наиболее доступным и продуктивным.
Вискозиметрический анализ полимеров. Естественно, обсуждение
следует начать с наиболее простых объектов - ПАА и полиметакрил-
амида (ПМАА), которые являются типичными водорастворимыми
неионогенными полимерами [23]. Для водных, водно-солевых и вод-
ао-органических растворов ПАА и ПМАА концентрационная зависи-
мость числа вязкости (г|уд /С) подчиняется соотношению Хаггинса:
дуд/С = [д] + К'[д]2С, (4.2)
где [ П1 = (П vn /£) — предельное число вязкости, К' — константа Хаггинса.
Г1-* Л 7,4
В общем случае [д] зависит от концентрации и химической природы
соли [24]. Поскольку [д] связано симбатной зависимостью с размерами
макромолекулярного клубка, например, с радиусом инерции (R2)0,5
или со среднеквадратичным расстоянием между концами макромоле-
кулы (712)0,5 [23], то влияние конкретных ионов солей на [д] можно
связать с эффектами поджатия (так называемым ’’высаливанием”) или
разбухания (так называемым ’’всаливанием”) макромолекулярных
клубков в водно-солевых средах. На рис. 4.6 продемонстрировано
влияние различных по химической природе солей на [д ]. Обобщая
данные рис. 4.6, а также ряд других данных, авторы [24] предложили
следующий ряд ионов (по их действию на макромолекулы ПАА):
Увеличение [д ], (R2 )0,5 ’ N°3 Уменьшение [д ], (R2 )°.5.
Mg2+,Li+,Na+,K + ,(CH3)4N +
153
Сх, моль/л
Рис. 4.6. Концентрационная зависимость [ И ] для солей [24] при 25 °C (1 — 5) и 60 “С (1' — 5');
а - MgNO3 (1,1'); LiC104 (2, 2'); NaNO3 (3, 3'); б - NaCl (1, 1'); КС1 (2, 2'); КВт (3, 3’); Lid (4, 4');
LiBr (5,5'); MgSO4 (1,1'); г - Li2SO4 (1,1’); Na2SO4 (2,2')
Увеличение [И ] и (R2)°>5 с добавкой солей можно объяснить адсорб-
цией ионов на макромолекулах ПАА, что приводит к повышению
растворимости, симбатно этому меняются и объемные эффекты. Умень-
шение [и ] и (R2 )0.5 логичнее всего связать со структурирующим дейст-
вием ионов на молекулы воды, которое приводит к уменьшению
объемных эффектов, т.е. качество воды как растворителя для ПАА
ухудшается. Чувствительной к конформационному состоянию макро-
молекул ПАА является и константа Хаггинса К' (см. ур-ние 4.2). Так,
уменьшение [п ] и (R2 )0»5 за счет солевых добавок сопровождается
антибатным изменением К' - наблюдается ее увеличение от 0,3 до
0,6. Такой характер изменения К' под действием солей можно объяс-
нить ухудшением качества растворителя при переходе от водных к
водно-солевым средам [24]. Резкое увеличение К', уменьшение [л ] и
(R2 )°>5, подобное фазовому переходу клубок - глобула, имело место и
при переходе от водных к водно-ацетоновым растворам ПАА [25].
Наблюдаемый эффект связан с резким ухудшением термодинамичес-
кого качества растворителя для фиксированной области составов
бинарной смеси вода - ацетон.
Для оценки конформационного состояния макромолекул ПАА в
водных растворах необходимо прежде всего проанализировать урав-
нение Марка - Хувинка [п ] = КМа (4.3), где К и а - константы. Кон-
станта а в приведенном уравнении в существенной мере зависит от
специфики конформационного состояния макромолекул в растворе.
Так, для макромолекул в виде сплошных глобул а = 0, для макромо-
лекулы в виде Гауссова клубка, непрозрачного для растворителя, а =
154
=0,5, а для макромолекулы в виде протекаемого (прозрачного для
молекул растворителя) клубка а = 1. Для макромолекулы в виде очень
вытянутого эллипсоида вращения а = 1,7. Поскольку вискозиметричес-
кий метод анализа не является абсолютным методом оценки М, то для
нахождения констант Киа необходимо построение зависимостей
1g [П ] = /(IgM). Такой подход подразумевает необходимость фракци-
онирования образца ПАА по ММ, а также нахождение ,М2,..., и
[Л ]1, [П ]г> • • •, [П ]k (fc - число фракций в образце) из концентрацион-
ных зависимостей Л уд/С для отдельных фракций. Для водных раство-
ров ПАА рядом ученых независимо друг от друга получены константы
Киа уравнение (4.3), приводимые ниже:
0,63-10-2 8 [26];
6,8 • 10-2 мо.бб [27] (при 30 °C);
9,3-lO-3?10,75;(R2)0,5=7,49-10-2^0,64 [28] (в 0,1М NaCl);
3,02-10-3 Af0,82 J (Й2)О,5 = 2,46 №>« [29] (в 1%-MNaCl);
6,5 • 10-3 д/0,82 [30] (при 30 °C).
Несмотря на различие значений констант К и а в работах [26 - 30], мак-
ромолекулы ПАА в водных, водно-солевых средах следует пред-
ставлять в виде сильно набухших клубков, частично прозрачных для
молекул растворителя, или, что эквивалентно, в виде клубков с частич-
но иммобилизованным растворителем. Это непосредственно следует
из того, что 0,6 < а < 0,82 для всех рассмотренных эмпирических
соотношений Марка - Хувинка [26 - 30]. Еще одно обстоятельство
заслуживает внимания - для ПАА b¥= (а + 1)/3 [(R2)0>5 ~ (/j2)0,s ~
~М6][28, 29], что свидетельствует о негауссовом характере макромо-
лекулярных клубков в водных и водно-солевых средах.
Установлено, что [т] ] для ПАА в воде зависит от градиента скорости
[31]. В работе [32] оценены невозмущенные размеры и параметр свер-
нутости для ПАА в воде. Для интервала температур 10 - 50 °C найдено,
что температурный коэффициент вязкости и dlg[r| ]/dT = 3,6-10-3, т.е.
с ростом Т качество воды как растворителя для ПАА улучшается [33].
Методом меченых атомов проведена оценка длинноцепочечных
разветвлений в ПАА и показано, что для М = const с увеличением
концентраций узлов ветвления [q] уменьшается [34]. Для некоторых
специфических добавок типа мочевины отмечено увеличение [п ] с
ростом концентрации добавки [35]. Этот эффект нельзя объяснить
’’всаливающим” действием мочевины, он связан с разрушением
селективных физических узлов, а также водородных связей.
Наиболее информативно емок и интересен в научном плане вязкост-
ный анализ сополимеров АА. И особый интерес вызывают анионные и
катионные сополимеры АА, поскольку появление ионогенных групп в
макромолекулярных сополимерах АА приводит к существенным
изменениям конформационных параметров макромолекул. Остано-
вимся подробнее на вязкостных свойствах анионных сополимеров АА.
155
Рис. 4.7. Концентрационная зависимость чисел вязкости для фракций сополимерон А А с
Na-малеинатом в воде [36] (1—10 — номера фракций)
Рис. 4.8. Зависимость (цуд/С ~ О)-1 от \[С для фракций сополимеров АА с Na-малеина-
том [36]
Речь будет идти главным образом о сополимерах АА с акриловой
кислотой (АК) и ее солями - наиболее изученных и перспективных в
практическом плане ионогенных сополимерах АА.
На рис. 4.7 показаны зависимости Пуп/С от С для водных растворов
различных фракций сополимеров АА с Na-малеинатом [36]. Зависимос-
ти Пуд/С от С явно нелинейны и заведомо не могут быть описаны
уравнением Хаггинса. Кривые цуд/С = /(С) на рис. 4.7 имеют типично
полиэлектролитный вид и достаточно хорошо описываются трехпара-
метровым уравнением Фуосса:
Пуд/С = А/(1 + В/С) + D. (4.4)
В уравнении Фуосса константы А, В, D имеют определенный физичес-
кий смысл. Параметр D характеризует взаимодействие макромолеку-
лярных клубков с ингредиентами системы, параметры А и В характе-
ризуют вязкостные свойства полиэлектролита для двух экстремаль-
ных ситуаций: ц -* 0 и ц -* <», где ц - ионная сила раствора.
О хорошем соответствии экспериментальных данных уравнению
(4.4) свидетельствует рис. 4.8. В табл. 4.1 приведены обобщенные
константы В и А для изученной системы.
156
Таблица 4.1. Параметры А и В обобщенного уравнения Фуосса
для фракций статистических сополимеров АА с Na-малеинатом
Фракция,№ 1 Содержание i Na-малеината, % | А-104, см3/г В-104, сыЗ/2г-1/2 В/А, г’^см-372
1 0,73 0,04 0,008 0,200
2 0,102 0,08 0,010 0,125
3 0,114 0,14 0,011 0,078
4 0,119 0,17 0,012 0,071
5 0,132 0,32 0,023 0,071
6 0,124 0,45 0,028 0,062
7 0,068 0,49 0,025 0,052
8 0,090 0,62 0,032 0,051
9 0,064 1,24 0,036 0,029
10 0,053 1,66 0,046 0,027
Для расчета константы D строились зависимости [Л ]1/3 от JV-V2 (N -
нормальность электролита). Экстраполяцией прямой к ц -► « по
отрезку, отсекаемому по оси ординат, рассчитывали D [36].
Для статистических сополимеров АА с акрилатом натрия (АН)
зависимость Луд/С = f(C) подчиняется уравнению Фуосса [37]. При
введении электролитов, в частности АН, наблюдается резкое падение
т]у /С, а значит, и (R2)°>5. Меняется и характер зависимости Луд/С =
=/(С)~полиэлектролитная зависимость С/т]уд ~ у/с в чистой воде при
добавке АН (и других электролитов) трансформируется в обычную
зависимость типа уравнения Хаггинса (т] уд / С ~ С).
Несомненный интерес представляет и характер зависимости [Л] =
= f(N)(N- [АН]). При использовании обычных предельных электроли-
тов для статистических сополимеров АА - АН достаточно хорошо
выполняется соотношение Штокмайера - Фиксмана [38]:
[Л ]/М = Ко + О,51(Во + А/ (4.5)
где Ко, Во, А — константы.
Принимая М = const, соотношение (4.5) переходит в
[Л] = К, +K,R-0.5, (4.6)
где Kj и К 2 — константы.
Из рис. 4.9 видно, что и при использовании в качестве внешнего
электролита АН выполняется соотношение Штокмайера - Фиксмана
([Л]~М,5). Уменьшение [Л] с ростом [АН] свидетельствует об умень-
шении эффективных размеров макромолекулярных клубков, что
непосредственно следует из уравнения Флори:
М[Л] = Ф(Й2)3/2.
Подразумевается, что выполняется условие И = const - с изменением
качества растворителя меняются [Л] и (R2)°>5. При переходе от бинар-
ных сополимеров АА - АК к тройным сополимерам АА - АК - АН
157
10
Рис. 4.9. Зависимость [п] от концентрации ионогенного мономера (АН) [37]:
1 — ПАН; 2 — сополимер АА с АН (<Xg = 0,27); 3 — сополимер АА с АН (а в = 0,39)
Рис. 4.10. Зависимости чисел вязкости от степени нейтрализации для сополимеров АА — АК
(«в = 0,28) при концентрации сополимеров [39]
происходит существенное изменение конформационных параметров
макромолекул [39]. Об этом можно судить по данным рис. 4.10. Нали-
чие максимума на кривых т]уд/С- степень нейтрализации у вблизи у=
^0,7 - 0,8 - связано со спецификой взаимодействия макроиона с
противоионами Na+, поскольку по мере изменения у происходит
изменение соотношения свободных и связанных катионов Na+. Для
специально подобранных модельных сополимерных систем с М ®
= const, ав = const и у = const было показано, что константы А и В в
уравнении Фуосса зависят от полидисперсности сополимеров по
составу (рис. 4.11). Количественным критерием полидисперсности
сополимеров по составу служила дисперсия по составу о [40]. Появ-
ление зависимостей А (о) и В (о) является результатом взаимодейст-
вия между собой макромолекул сополимеров с различными значения-
ми у. Фиксированная макромолекула - „реактор” - реагирует на
появление макромолекулы с другим значением у перераспределением
свободных и связанных противоионов, что сопровождается автомати-
ческим изменением (R2)°>5, а значит, меняются и вязкостные показа-
тели системы.
Полиэлектролитные свойства (в том числе и по данным вязкостного
анализа) для сополимеров АА со стиролсульфокислотой и ее Li, Na, К
солями подробно рассмотрены в монографии [41]. Вязкостные свойства
сополимеров АА с КВАЯК в водных и неводных средах изучены в
работе [42].
Другие методы анализа полимеров. Методы светорассеяния, виско-
зиметрии и скоростной седиментации применены для изучения ПАА в
трех растворителях: воде, 10%-м NaCl и формамиде [43]. По данным
светорассеяния и седиментации, в формамиде определены молекуляр-
ные массы фракций с наибольшими значениями ММ (> 5-106). Разли-
158
Рис. 4.1Z Диаграмма Зимма для фракции ПА А в воде [5]
Рис. 4.11. Зависимость параметров А (1) и В (2) в уравнении Фуосса от дисперсии по составу
О для сополимеров АА — АК — АН с ав = 0,28 (1) и (0,5) (2) [39]
чие значений ММ по данным двух методов составляет не более 10%. На
рис. 4.12 для примера приведена диаграмма Зимма для одной из
фракций ПАА в воде (падающий свет имел длину волны Л. =546,1 нм) [5].
В работе [44] установлена связь между коэффициентом диффузии Dg и
молекулярной массой фракций ПАА в 0,1 М NaCkDg = 1,24-10-4 М~“>53
[44]. Получено эмпирическое соотношение между константой седимен-
тации So и ММ для фракций ПАА в 0,5 М NaCl при 20 ’С (Sq =
= 8,17 • 10-20,32 м) [45]. Более обстоятельно и систематизирование про-
анализирована взаимосвязь между Sg, М, Dg [л] для ПАА в различных
водно-солевых, водных и органических средах в обзоре [5].
Был проведен сопоставительный анализ заторможенности внутрен-
него вращения у ПАУ и ряда его замещенных [23, 46]. Было показано,
что длина статистического сегмента по мере усложнения повторяю-
щегося фрагмента макромолекулы увеличивается в ряду ПАА>
> ПМАА > полиизопропиламид > полидиметилакриламид. В указан-
ном ряду слева направо возрастает гидрофобность полимера и падает
растворимость в сильнополярных жидкостях. Так, ПМАА, в отличие от
ПАА, в воде не растворяется и растворяется лишь в концентрирован-
ных водных растворах мочевины и перхлората мочевины £47]. Зависи-
мость [л] от ММ имеет вид [л] = 3,28-10—40,55 м (в о,4 м перхлорате
мочевины). Существенно более низкие значения экспоненты а (0,55) в
уравнении Марка - Хувинка по сравнению с ПАА свидетельствуют о
более поджатых конформациях макромолекул при введении в боко-
вую цепь макромолекул гидрофобных метильных групп. Было также
отмечено, что с повышением гидрофобности повторяющегося фрагмен-
та в замещенных ПАА происходит уменьшение второго вириального
коэффициента Аз вплоть до А2 < 0 [23].
Наиболее интересными в прикладном и научном планах являются
ионогенные сополимеры АА. Достаточно хорошо известно, что конфор-
мационное состояние макромолекул ионогенных сополимеров вомно-
159
1-10-Pl
Рис. 4.13. Зависимость АС от (1 — 10 ₽*) при диали-
зе ионов Cd2+ (50] ([Cd2+] = 2,5.10-3 моль/п) [КС1],
моль/л = 0(1); 0,05 (2); 0,25(3)
гом предопределено особенностями взаимодействия в системе мак-
роион - противоионы [10, 48]. Основные термодинамические и гидро-
динамические свойства полиэлектролитов зависят прежде всего от
вида распределения противоионов внутри объема макромолекуляр-
ного клубка, а также в непосредственной близости от поверхности
клубка. Количественная информация о взаимодействии полиионов с
противоионами может быть получена с помощью различных методов:
ИК-, ЯМР-, УФ-спектроскопии, осмометрии, потенциометрии, гель-хро-
матографии, диализа, поглощения ультразвука, потенциометрии,
вискозиметрии, кондуктометрии, диэлектрической дисперсии, дила-
тометрии, ультрацентрифугирования и диффузии с мечеными проти-
воионами, полярографии [48, 49]. Большинство из перечисленных
методов оценки противоионного связывания успешно применены и
для изучения анионных и катионных сополимеров АА. Наиболее
подробно изучалось противоионное связывание у статистических
сополимеров АА с АК и п-стиролсульфокислотой (ССК) различной
степени нейтрализации. Для сополимеров АА - АК и АА - ССК различ-
ными методами проведена оценка доли свободных / и связанных
(1 - /) противоионов. Наиболее продуктивными из этих методов
оказались методы полярографии и кинетики диализа. На рис. 4.13
приведены результаты диализа ионов кадмия (в одной из камер
диализатора - Cd-AK, во второй - сополимер АА с Cd-AK с ив =
= 28,2%) [50]. Здесь А С- усредненное (по двум камерам диализатора)
изменение концентрации ионов Cd2+ в процессе диализа, р- прони-
цаемость мембраны для Cd2+ (Р = 0,07 ч-1). Экстраполяцией прямых 1 -
3 на рис. 4.13 к значению 1- 10-pf= 1 определяли g0- разность
концентраций свободных ионов Cd2+ между первой и второй камерами
диализатора в момент времени /= 0. Доля связанных ионов Cd2+
рассчитывалось по формуле:
1 - /= 1 - (СР - 2gQ)/C2,
где С® и — концентрации ионов Cd 2+ соответственно в первой и второй камерах диа-
лизатора для t = 0.
В табл. 4.2 приведены результаты полярографического анализа для
сополимеров А А с Cd-AK.
160
Таблица 4.2. Влияние ионной силы на степень связывания ионов Cd2+ сополимерами АА
с Cd -АК [i, мкА — числитель; (1 — /) — знаменатель]
[КС! ], моль/л Содержание Ud-AK в сополимере, %
17,6 28,2 39,5 54,4
0 3,76/0,63 3,20/0,69 2,83/0,72 2,20/0,78
0,005 4,46/0,32 3,70/0,43 3,31/0,49 2,98/0,54
0,010 5,00/0,22 4,58/0,28 4,28/0,33 3,56/0,44
0,025 5,50/0,14 5,32/0,17 5,17/0,19 4,30/0,33
0,050 5,86/0,08 5,88/0,08 6,22/0,03 5,76/0,10
0,100 6,20/0,03 6,30/0,02 6,30/0,02 6,14/0,04
0,250 6,40/0 6,40/0 6,40/0 6,40/0
0,500 6,40/0 6,40/0 6,40/0 6,40/0
Из приведенных в табл. 4.2 данных (аналогичные по характеру
зависимости получены и по данным кинетики диализа) видно, что для
статистических сополимеров АА с Cd = AK доля свободных ионов f
резко возрастает с увеличением ионной силы. Это в первую очередь
связано с резким уменьшением размеров макромолекул и отторже-
нием связанных противоионов и переходом их в свободные ионы. О
справедливости сказанного можно судить и по данным полярографи-
ческих измерений (рис. 4.14). Необходимо отметить, что с увеличением
концентрации ионогенных групп в макромолекулах сополимеров АА с
Cd=AK (для фиксированной ионной силы раствора) повышается доля
связанных ионов Cd2+ (см. табл. 4.2). Это в принципе понятно, так как
повышение ав сопровождается увеличением электростатического
потенциала полианиона [10]. В обзорных работах [48, 51] на примере
сополимеров АА - АК и АА - ССК и их солей проанализировано
влияние на противоионную ассоциацию целого ряда параметров
сополимеров: концентрации, состава, молекулярной массы, степени
нейтрализации и химической природы противоиона, способа ввода в
макромолекулы ионогенных групп и др. Все это позволило разрабо-
тать новый полярографический метод контроля кинетики полимери-
зации и сополимеризации ионогенных мономеров, основанный на
существовании однозначной зависимости между степенью связывания
и конверсией ф. Применимость разработанного метода контроля
кинетики (со)полимеризации, по данным полярографического опреде-
ления степени связывания катионов Cd2+, In3+, проиллюстрирована на
примере ПАК, ПССК и сополимеров АА с АК и ССК [52].
По данным ЯМР-спектроскопии 13 С, определено содержание ионо-
генных звеньев в макромолекулах сополимеров АА с АК [53]. Оценка
состава сополимеров АА с АК оказалась успешной по причине сущест-
венного различия в химических сдвигах метиловых13 С в акриламид-
ных и акрилатных последовательностях (соответственно 41-45 и
45- 48 млн-1). Было показано, что температура стеклования Тс су-
161
Рис. 4.14. Зависимость предельного тока вос-
становления ионов Cd+2 для мономера
—Cd=AK (7) и сополимеров АА с Cd=AK с а в,
% (мае.) [50]: 17,6 (2); 28,2 (5); 39,5 (4); 54,5 (5)
[Cd2+] = 2,5.10“3 моль/л
щественно зависит от состава сополимера АА - АК [53]. При построен-
ной градуировочной зависимости Тс =/(ав) можно по эксперименталь-
ным значениям Тс провести оценку состава макромолекул сополиме-
ров АА - АК.
Для гидролизованного ПАА двух марок (Puscher 700 и Puscher 500),
различающихся между собой по ММ и «в, изучены зависимости Луд/С =
=f(C) в интервале 30 — 60 °C [54]. Установлено, что для образцов сопо-
лимеров Puscher 500 и Puscher 700 зависимости [и] от 1/Т линейны.
Катионные флокулянты на основе АА изучены методами двойного
лучепреломления в потоке и вискозиметрии [551 При увеличении_рН и
ионной силы происходило уменьшение [я] и (к2)°>5. На [л] и (R2)°>5
влияние оказывают температура, освещенность и длительность хране-
ния растворов.
В работе [56] были изучены двойные и тройные ионогенные сополиме-
ры АА и найдено, что гидродинамические объемы макромолекул
уменьшаются в ряду противоионов NH| > Na+ > Mg2* > Са2+. На вели-
чину противоионной ассоциации влияют концентрация и природа
ионогенных групп и ММ сополимеров.
Метод ЯМР-спектроскопии (при использовании в качестве раствори-
теля дейтерированной воды) был успешно применен для оценки
состава двойных и тройных сополимеров АА с N-замещенными акрил-
амидами [57]. Спектры ЯМР снимались на частоте 22,5 МГц, связанная
вода и остатки растворителя не оказывали существенного влияния на
точность определения состава сополимера АА.
Термодинамические (фазовое равновесие и растворимость) и гидро-
динамические (вязкость растворов, зависимость ее от температуры)
свойства (со)полимеров АА изучены в бинарных смесях растворителей
и водно-солевых средах в работе [58].
Для катионных сополимеров АА показано, что с повышением
концентрации ионогенных групп происходит повышение жесткости
макромолекул, увеличивается и длина статистического сегмента [59].
При увеличении ионной силы наблюдается снижение оптической
анизотропии макромолекул, что доказано данными двойного луче-
162
преломления в потоке. Электростатический: эффект взаимодейст-
вия между группами, заряженными вдоль по цепи макромолекулы
сополимера, в сильной степени зависит от эффективной ионной силы
раствора ц эфф: с ростом ц эфф электростатический эффект ослаб-
ляется.
Введение флуоресцентных меток в макромолекулы сополимеров
АА с виниламином позволило провести оценку макромолекулярной и
сегментальной подвижности в водно-ацетоновых смесях с содержа-
нием ацетона от 20 до 50% [60]. По данным квазиупругого светорассея-
ния и вискозиметрии показано, что при увеличении концентрации
ацетона (а значит, при ухудшении термодинамического качества
растворителя) происходит скачкообразное уменьшение [п] и (R2)°>5, а
также внутреннего трения в макромолекулах сополимеров.
4.3. Свойства концентрированных растворов полимеров и гелей
Полиакриламидные гели с диаметром пор d от 0,7 до 5,8 нм изучены
методом ЭПР в присутствии ионов Си2+ на частотах 2,4 и 9 ГГц [61].
Остаточная ширина линий ЭПР зависит от диаметра пор при 0,7 нм <
нм, а для d> 3 нм остается практически неизменной. Этот ре-
зультат можно объяснить зависимостью степени гидратации ионов
Сц2+ от d.
Из анализа коэффициентов диффузии в сшитых гелях на основе ПАА
сделан вывод о неприменимости к ним теории Танаки, описывающей
кинетику набухания сшитых полимерных сеток [62]. Неприменимость
теории Танаки связана с невыполнением условия /Соб 3* G (G - мо-
дуль сдвига геля, Коб - объемный осмотический модуль упругости).
На полуколичественном уровне проанализированы варианты, когда
Ко6 сопоставим по порядку с G.
С помощью дилатометрического метода изучено фазовое состояние
сшитого геля изопропиламида в диапазоне температур от 0 до 42 °C.
Показано, что в смесях вода - метанол наблюдаются два перехода.
Вначале наблюдается скачкообразное сжатие, а затем также скачко-
образно реализуется набухание геля [63].
Лазерное светорассеяние применено для изучения геля ПАА, при-
веденного в равновесие с бычьим альбумином [64]. Макромолекулы
бычьего альбумина располагаются преимущественно в менее плотных
участках геля, что приводит к более высоким (по сравнению с расчет-
ными) значениями коэффициентов диффузии молекул бычьего аль-
бумина в гелевой матрице ПАВ.
В систему NajC^O? - N% Sy О4, в которой происходит восстановление
иона С^+ до Сг3+, вводили ГПАА. Под действием Сг3+ происходила
сшивка макромолекул ГПАА с образованием геля. В зависимости от
концентрации ГПАА и Сг3+ свойства геля могут сильно различаться
вплоть до перехода от гомогенного к гетерогенному [65].
Изучен размытый во времени золь-гель переход для ГПАА, сшивка
макромолекул осуществлялась ионами Сг3+ [66]. Для контроля за
163
гелеобразованием в системе применены вискозиметрический и УФ-
спектроскопический методы. Примененная в работе [66] техника
эксперимента позволила осуществлять непрерывный контроль за
модулем упругости и вязкостью вблизи гель-точки.
Механические показатели и кинетика набухания гелей катионных
сополимеров АА различных составов проанализированы в водно-аце-
тоновых средах с содержанием ацетона 0 - 90% [67]. Наблюдаемое в
эксперименте резкое увеличение равновесного модуля упругости геля
сопряжено с фазовым переходом в системе. Эффект коллапсирования
зависит от содержания катионных ионогенных групп в макромолеку-
лах сополимера АА, а также от содержания ацетона в смеси.
По данным интенсивности процесса комплексообразования геля
ГПАА с ионами Си2+ разработан метод оценки степени гидролиза ГПАА
[68]. Плотность сшивки геля существенно зависит от pH среды. Так,
для гелей ГПАА, полученных при pH 11,2, характерны гораздо более
высокие значения скорости и максимальной степени гелеобразования
по сравнению с гелями, полученными при pH 8.
В водно-глицериновой смеси по данным электронной микроскопии
изучены структурные особенности гелей на основе ПАА, в качестве
сшивающего агента был использован N,N'-мети лен-бис-А А [69]. Зафик-
сировано широкое распределение по размерам пор в геле ПАА, а также
наличие в системе кластерных образований из мелких пор.
Гели поли-№изопропилакриламида изучены в водно-диметилсульф-
оксидных (ДМСО) средах [70]. С повышением содержания ДМСО в
смеси наблюдается вначале резкое уменьшение объема геля, т. е.
переход в компактное состояние. Дальнейшее увеличение содержа-
ния ДМСО сопровождается разбуханием геля. В чисто водных средах
при температуре 33,2 ’С гель коллапсирует, переходя из набухшего в
очень компактное состояние.
Методом спиновых меток зафиксировано, что при переходе от
водного раствора к гелю ПАА за счет химической сшивки полимерных
цепей наблюдается снижение сегментальной подвижности [71]. Этот
эффект зависит от условий синтеза гелей, а также от объемной кон-
центрации сшивок.
Методами ультрацентрифугирования, вискозиметрии и квазиупру-
гого рассеяния света изучены макролатексы ПАА в толуоле [72].
Каждая частица латекса содержит 1 макромолекулу ПАА с MMs
- (1 - 10) 106. Размеры макромолекул ПАА ~ 5 нм, а значит, макромо-
лекула имеет глобулярную конформацию. Напомним, что в водном
растворе для ПАА (R2)°>5 > 130 нм.
Рассмотрены некоторые теоретические вопросы фазовых перехо-
дов в заряженных сополимерных гелях на основе АА [73]. Одними из
наиболее сильных параметров, влияющих на положение и амплитуду
фазового перехода в гелях ПАА, являются диэлектрическая проницае-
мость среды, плотность заряда вдоль по цепи макромолекулы, ионная
сила.
Метилольные производные ПАА в течение продолжительного
164
Рис. 4.15. Зависимость температуры
фазового расслоения Гп от концент-
рации Ca(NO-j)2 для ГПАА с «в =
= 0,5 [75]:
1 — область гомогенных растворов;
2 — область фазового расслоения
времени вблизи нейтральных pH ( «7,0 ±1,5) сохраняют неизменными
[л] и ММ, в то же время при кислых pH ( <5) наблюдается переход их в
водонерастворимые гидрогели [74]. Этот переход связан с процессами
структурирования в системе за счет конденсационных процессов
между метилольными группами в макромолекулах.
Фазовое разделение в растворах ГПАА под действием катионов
Mg2+, Са2+, Ва2+ изучено в работе [75]. О фазовом разделении судят по
помутнению системы. Было установлено, что по высаливающему
действию катионы щелочноземельных металлов располагаются в ряд:
Ва2+ >Са2+ » Mg2+,T.e. высаливающий эффект симбатен поляризуемос-
ти соответствующих катионов. Согласно [75], критическая концентра-
ция соли (Скр, при которой начинается фазовое расслоение, пропор-
циональна концентрации карбоксильных групп в ГПАА:
О)Скр ~ А + ВС0,
где А и В — константы.
При изучении зависимости Скр( Т) для тех же систем ГПАА - вода -
соль зафиксировано наличие верхней и нижней критических темпера-
тур фазового расслоения. Иля фиксированной концентрации поли-
мера [при низких концентрациях соли (< 0,1)] увеличение Сс сопро-
вождается снижением температуры помутнения Тп, а при высоких
Сс- наоборот - повышением Тп(рис. 4.15). Введение добавок диметил-
формамида (ДМФА) и формамида (ФА) оказывало влияние на характер
взаимодействия карбоксилатных групп ГПАА с катионами Са2+, Ва2+,
Mg2+, что сказывалось и на величине Скр - добавки ДМФА приводили
к снижению Скр, а добавки ФА - к увеличению Скр [76].
Влияние сывороточного альбумина (СА) на структуру гелей ПАА
изучено в работе [77]. Зафиксировано резкое возрастание степени
набухания, снижение равновесного модуля упругости и увеличение
расстояния между узлами пространственной сетки геля ПАА при
введении в субст ?ат непредельных производных СА. Эти данные
объяснены преимущественным агрегированием блоков ПАА и ПСА в
отдельные элементы структуры, хотя блоки ПАА и ПСА связаны между
собой химической связью. Для оценки подвижности блоков ПСА в
непредельные производные СА вводили специальные флуоресцент-
ные метки.
165
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Фракционирование полимеров/Под ред. М. Кантова. М.: Мир, 1971.444 с.
2. Мягченков В.А., Френкель С.Я., Композиционная неоднородность сополимеров. Л.:
Химия, 1988.247 с.
3. Справочник по химии полимеров/Липатов Ю.С., Нестеров А.Е., Гриценко Т.М.,
Веселовский Р. А. Киев: Наукова думка, 1971.536 с.
4. Методы исследования полимеров/Под ред. П. Аллена. М.: ИЛ, 1981.334 с.
5. Kulicke W., KniewskyR., Klein J.//?rogr. Polym. Sci. 1982. V. 8. N 4. P. 373—468.
6. Нефедов П.П., Лавренко П.Н. Транспортные методы в аналитической химии полиме-
ров. Л.: Химия, 1979.232 с.
7. Беленький Б.Г., Биленчик Л.З. Хроматография полимеров. М.: Химия, 1978.343 с.
8. Litmanovich A., Stem V.//I. Polym. Sci. Part С. 1967. V. 15. N 4. P. 1375-1384.
9. Плата H.A., Литманович А.Д., Hoa О.В. Макромолекулярные реакции. М.: Химия,
1977.256 с.
10. Тенфорд Ч. Физическая химия полимеров. М.: Химия, 1965.772 с.
11. Мягченков В.А. Неоднородность по составу бинарных статистических сополимеров:
Дис.... д-ра хим. наук. Казань: КХТИ, 1974.213 с.
12. Myagchenkov V.A., Vagapova А.К., Kurenkov V.F. et aL//Europ. Polym. J. 1978. V. 14.
Nl.P. 169-171.
13. Серенсон У., Кемпбел T. Препаративные методы химии полимеров. М.: ИЛ, 1963.
399 с.
14. Myagchenkov V.A., Kurenkov V.F., Kuznetsov E.V. et al.// Europ. Polym. J. 1970. V. 6.
N 1. P. ЬЗ—68.
15. Мягченков B.A., Куренков В.Ф., Кукушкина И.А. и др.//Химия н технол. элемен-
тоорганич. соед. и полимеров. Вып. 7. Казань: КХТИ, 1979. С. 25—28.
16. Мягченков В.А., Вагапова А.К., Кузнецов Е.В. и др.//ДАН 1973. Т. 210. № 1.
С. 151-153.
17. Bayoras G.J., Makuska R.Yu., Myagchenkov V.A.//Act a Polymerica, 1986. Bd. 37. N 2.
S. 103-108.
18. Мягченков В.А., Куренков В.Ф., Кузнецов E.B.//Промышленность химреактивов н
особо чистых веществЛып. 12. М.: ИРЕА, 1968. С. 2040 —2045.
19. Мягченков В.А., Куренков В.Ф., Кузнецов Е.В. и др.//ВМС. 1962. Т. Б9. № 4.
С. 251-252.
20. Мягченков В.А., Куренков В.Ф,ЦКимия и технол. элементоорганич. соед. и поли-
меров. Казань: КХТИ, 1984. С. 54-58.
21. Новейшие методы исследования полимеров/Под ред. Б.Кн. М.: Мир, 1966.571 с.
22. Цветков В.Н., Эскин В.Е., Френкель С.Я. Структура макромолекул в растворах. М.:
Наука, 1964.719 с.
23. Бектуров Е.А., Бакауова З.Х. Синтетические водорастворимые полимеры в раство-
рах. Алма-Ата: Наука, 1981.247 с.
24. КабоВ.Я., Масленников Б.Л.//ВМС. 1982. Т. Б24. № 5. С. 326 -328.
25. Tanaka Т.//Polymer. 1979. V. 20. Р. 1404-1409.
26. Scholtan K./ZMakromol. Chem. 1954. Bd. 14. S. 169-177.
27. Collinson E., Danton F., Nangton G.//Trans. Faraday Soc. 1957. V. 53. P. 489—495.
28. Francois J. etal. //Polymer. 1980. V. 21. P. 247-253.
29. Мягченков B.A., Кузнецов E.B., Куренков В.Ф.//Тр. КХТИ им. С.М. Кирова,
Казань. 1967. Вып. 36. С. 336-339.
30. Misra G.S., Bhattacharya S.N./ZEurop. Polym. J. 1979. V. 15. P. 125-129.
31. SakisM., Hamielec A.//J. Appl. Polym. Sci. 1979. V. 23. P. 3323-3328.
32. Winston A., Winston R.//S. Polym. Sci. Polym. Lett. Ed. 1980. V. 18. P. 119—122.
33. Brauda P., Quadratt O.Z/Coll. Czech. Chem. Comm. 1977. V. 42. P. 456-459.
34. Cieanson E., Miller M., Shets G.//J. Polym. Sci. 1959. V. 28. P. 133-141.
35. Muller G„ Laine J., Fenyo J.//I. Polym. Sci. 1979. V. 17. P. 659-667.
36. Мягченков B.A., Куренков В.Ф., Антонова Л.Ф. и др.//ВМС. 1970. Т. А12. № 8.
С. 1745-1750.
166
37. Мягченков В.А., Вагапова А.К.//ДАН. 1986. Т. 286. № 4. С. 918-921.
38. Кленина О.В., Лебедева Л.Г.//ВМС. 1983. Т. А25. N 10. С. 2053-2060.
39. Мягченков В.А.. Вагапова А.К., Куренков В.Ф. и др.ЦВМС. 1988. Т. АЗО. № 4.
С. 755-759.
40. Мягченков В.А., Куренков В.Ф., Френкель С.Я.ЦВАН СССР. 1968. Т. 181. № 1.
С. 147-150.
41. Бектуров Е.А., Мягченков Б.А., Куренков В.Ф. Полимеры и сополимеры стирол-
сульфокислоты. Алма-Ата: Наука, 1989.
42. Вагапова AJC. Автореф. дис.... канд. хим. наук. Казань: КХТИ, 1974.16 с.
43. Алдошин В.Г., Савицкая М.Н., Френкель С.Я.//ВМС. 1960. Т. 2. № 8. С. 1133-1139.
44. Francois]., Conrad К.//Makromol. Chem. 1989. Bd. 13. S. 564— 572.
45. Klein ]., Conrad KJ/Makromol. Chem. 1980. Bd. 181. S. 227—238.
46. Chiantore O., Gnaita M., Trossarelli Z.//Makromol. Chem. 1979. Bd. 180. S. 960—967.
47. Tikova L. et oI.//Europ. Polym. J. 1978. V. 14. P. 145-149.
48. Мягченков B.A., Куренков В.Ф., Ахмедьянова P.А.//Физические методы исследо-
вания полимеров. Киев: Наукова думка, 1981. С. 129—142.
49. Марина Н.Г., Монаков Ю.Б.Химия и физикохимия высокомоп. соед. Уфа: изд-во
АН Башк. АССР, 1976. С. 116-146.
50. Myagchenkov V.A., Kurenkov V.F., Achmedjanova R.A.HA<i& Polymerica. 1984. Bd. 35.
N 2. S. 145-149.
51. Kurenkov V.F., Myagchenkov V.A.//Acta Polymerica. 1987. Bd. 38. N 12. S. 679—689.
52. Мягченков B.A., Куренков В.Ф., Ахмедьянова P.A.//BMC. 1982. T. А24. № 5.
С. 612-618.
53. Leung W., Axelson D., Shyme D.//Colloid. Polym. Sci. 1985. V. 263. N 10. P. 812—817.
54. DeyNimal Chandra!/J. Indian Chem. Soc. 1984. V. 61. N 9. P. 774 - 776.
55. Касъяненко H.A., Фрисман Э.В. //Процессы студнеобразования в полимерных
системах. Ч. 2. Саратов: изд-во Саратовского ГУ, 1985. С. 69—70.
56. Peiffer D., Lundberg R.//J. Polym. Sci. Polym. Chem. Ed. 1984. V. 22. N 7. P. 1757-1773.
57. Hutchinson B., McCormick C.//Polymer. 1986. V. 27. N 4. P. 623- 626.
58. Bekturov E., Khamzamulina RJU. Macromol. Chem. 1987. V. 27. N 2. P. 253 —312.
59. Касьяненко H.A., Фрисман Э.В., Кленин С.И. и др.//ВМС. 1987. Т. А29. № 6.
С. 1129-1135.
60. Rieka ]., Gusel Н., Scheider J. et al.//Macromolecules. 1987. V. 20. N 6. P. 1407—1411.
61. Rex G.//Amer. Chem. Soc. Polym. Prepr. 1986. V. 27. N 1. P. 339-340.
62. Peters A., Kandau S.//Macromolecules. 1986. V. 19. N 7. P. 1952-1955.
63. Amija T., Hirokawa Yu., Li S. et al.//]. Chem. Phys. 1987. V. 86. N 4. P. 2375-2379.
64. Sellen D.//J. Polym. Sci. Polym. Phys. Ed. 1987. V. 25. N 4. P. 699-716.
65. Attains., SalomeL.//Polym. Comm. 1987. V. 28. N 4. P. 109 — 112.
66. Attain S., Salome £.//Macromolecules. 1987. V. 20. N 11. P. 2957-2958.
67. Havsky M., Bouchal K.//Polym. Bull. 1985. V. 14. N 3. P. 301-308.
68. Mallo P., Candau S., Cohen K.//Polym. Comm. 1985. V. 26. N 8. P. 232-235.
69. Hsu Tsong-Pin, Cohen KJ/Polymer. 1984. V. 25. N 10. P. 1419-1423.
70. Hirokawa Y„ Tanaka T.//J. Chem. Phys. 1984. V. 81. N 12. P. 6379-6380.
71. Александрова T.A., Вассерман A.M., Стародубцев С.Г. и др.//ВМС. 1985. Т. Б27.
№ 10. С. 780-782.
72. CandauF., HoltschererC.Hl. Chim Phys. et. Phys-chim. Biol. V. 82. N 6. P. 691—694.
73. Стародубцев С.Г., Хохлов A.P., Василевская В.В.//ЦАН СССР. 1985. Т. 282. № 2.
Q.392 -395.
74. Кузнецов Л.Е., Новичкова Л.М., Ишмухамедова Н.К.ЦТАзв. АН Каз. АССР. Сер.
Химия. 1987. № 6. С. 45 - 48.
75. Кабо В.Я., Городнов В.П.//ВМС. 1977. Т. А19. № 5. С. 1109-1112.
16. Кабо В.Я., Масленников В.А., Румянцев Е.А. и др.ЦВМС. 1981. Т. Б23. №13.
С. 203 - 206.
77. Синани В.А., Валуев Л.И., Чупов В.В. и др.ЦВМС. 1988. Т. АЗО. № 10. С. 2088-2094.
167
Глава 5
ПРИМЕНЕНИЕ ПОЛИМЕРОВ АКРИЛАМИДА
И ЗАМЕЩЕННЫХ АКРИЛАМИДОВ
(Со)полимеры АА нашли широкое применение в различных облас-
тях промышленности и сельского хозяйства, однако потенциальные
возможности этих полимеров раскрыты и проанализированы далеко не
в полной мере. Это особенно ощущается при использовании (сополи-
меров А А в наиболее важном их качестве - флокулянтов, поэтому
именно эта область применения освещена нами более обстоятельно.
Мы уже отмечали, что для фракционирования (со)полимеров АА по
ММ был успешно применен метод гель-проникающей хроматографии.
Была найдена возможность использования сополимеров АА и в ка-
честве адсорбента для гель-проникающей хроматографии. По ряду
показателей гели на основе пространственно сшитых (со)полимеров
АА превосходили наиболее широко применяемые гели Sefadexfl, 2].
Важным позитивным фактором при использовании сшитых гелей ПАА
в качестве адсорбента оказалась их высокая биологическая стой-
кость- они не поддерживают роста бактерий [1, 3]. В отличие от дек-
страновых гелей полиакриламидные гели не дают большой усадки при
высоких ионных силах (сопоставление проводится для слабосшитых
гелей) [4]. Проницаемость (р) полиакриламидных гелей может регу-
лироваться не только концентрацией сшивающего агента, но и кон-
центрацией мономера в исходном субстрате С Для 3% < С <30% спра-
ведливо эмпирическое соотношение: р=КС~0>5, К-константа [4].
Промышленный выпуск полиакриламидных гелей различной порис-
тости освоен фирмой „ Biorad Laboratories (США). Преимуществом этих
гелей является отсутствие ионогенных групп, что резко снижает вероят-
ность селективной адсорбции в процессе фракционирования полиме-
ров (и особенно сополимеров) по ММ. Рабочая область pH для гелей на
основе ПАА находится в пределах от 2 до И, равновесное набухание
гелей при резких изменениях ионной силы изменяется не более чем на
2-3% [4].
Другая область широкого применения (со)полимеров АА-нефте-
добывающая промышленность [5, 6]. Полимеры и сополимеры АА в
этой области находят применение как добавки многоцелевого назна-
чения, например, на стадии бурения. Добавки (со)полимеров А А в
буровые растворы (например, глинистые суспензии) способствуют
повышению реологических свойств буровых растворов, изменению в
нужном направлении размеров частиц суспензии, фильтруемости, что,
в конечном итоге, позволяет ускорить стадию подготовки к эксплуа-
тации скважины. На этой же стадии добавки (со)полимеров АА вы-
полняют и другую важную функцию- структурообразователя почвы,
что способствует укреплению стенок скважины. При бурении твердых
пород малоэффективно использование в качестве дисперсной фазы
глинистых материалов (типа бентонита), гораздо более эффективны
168
1
суспензии, в которых дисперсной фазой являются добавки. В этом
плане наиболее действенными оказались бинарные добавки полиме-
ров, одним из компонентов которых были (со)полимеры АА. Напри-
мер, очень хорошие результаты получены при использовании ГПАА и
карбоксиметилцеллюлозы (либо полисахаридов) [7], а также ПАА +
+ KCl-Положительный эффект при введении (со)полимеров АА наблю-
дается при вторичной добыче нефти, поскольку эти добавки способст-
вуют снижению подвижности закачиваемых водных рассолов, являясь
агентами уменьшения гидравлического сопротивления. Последнее
обстоятельство способствует более полному вытеснению нефти из
пористых сред. Использование (со)полимеров АА, в отличие от других
водорастворимых полимеров, не сопровождается значительной ад-
сорбцией полимера на породе, а значит, не так существенны эффекты,
связанные с закупоркой („пломбировкой”) пор. С технологической
точки зрения, вместо водных растворов (со)полимеров АА предпочти-
тельнее использование эмульсии второго рода („вода в масле”),
поскольку такой подвод полимерного компонента существенно
облегчает закачивание его в скважину - вязкость эмульсии намного
меньше вязкости водных растворов (со)полимеров АА. Для снижения
эффекта деструкции при закачивании полимеров вместо ПАА пред-
почтительнее использовать сополимер АА с метилольными производ-
ными АА, который получают взаимодействием ПАА с формальдегидом
[5]. Наиболее выгодно в нефтедобыче применять добавки (сополи-
меров АА при разработке нефтеносных пластов в водонапорном
режиме, поскольку введение полимерных добавок способствует
заметному снижению содержания влаги в сырой нефти. Простая тех-
нология ввода (со)полимеров и небольшие затраты при таком услож-
нении процесса дают большой экономический эффект. Немаловажно и
то обстоятельство, что интенсификация нефтедобычи за счет введения
(со)полимеров АА не сопровождается ухудшением экологической
обстановки на местности, в нефтеносном слое и в слоях породы над
ним. В последнее десятилетие для повышения нефтедобычи исполь-
зованы и другие, бопее активные способы ввода полимерных компо-
нентов. Так, анионные и катионные производные ПАА использованы
для создания защитного экрана для водоносного слоя. При этом
методе осуществляется одновременный или поэтапный ввод двух
различных полимеров, образующих между собой нерастворимый (или
ограниченно растворимый) в воде комплекс, который способствует
забивке пор породы, что приводит к ограничению водопритока в
нефтеносный слой. Потенциально интересным, хотя и неапробирован-
ным на практике вариантом создания подвижного экрана на границе
водного и нефтяного слоев представляется такой, когда полимерные
ПАВ вводятся раздельно в нефтяной (I) и водный (II) слои. Необходи-
мыми условиями являются слабая растворимость полимерных ПАВ в
фазах I и II, а также образование между полимерными компонентами
интерполимерного комплекса [8]. При такой постановке эксперимента
образующийся на границе раздела между нефтеносным и водным
169
слоями интерполимерный комплекс будет работать как подвижный
экран, препятствующий заводнению нефтеносного слоя. Преимущест-
вами рассматриваемого варианта ввода полимеров с целью интенси-
фикации нефтедобычи являются сравнительно малый расход поли-
меров и более надежная и гибкая защита нефтяного слоя от водного
по сравнению с описанным ранее методом „пломбирования”.
В целлюлозно-бумажной промышленности (со)полимеры АА приме-
няются для улучшения физико-механических свойств бумаги. Поло-
жительный эффект достигается благодаря более полному удержанию
наполнителя (главным образом, каолина) в бумажной массе, что
приводит к улучшению структуры поверхностного слоя бумажного
листа. Для ГПАА с сГв = 2- 23% в области pH от 6 до 9 степень удержа-
ния каолина повышалась на 30 - 35% [9]. Для улучшения технологи-
ческих свойств поверхностного слоя бумаги помимо ГПАА нашли
применение и статистические сополимеры АА с этиленом и ви-
нилхлоридом, а также блок-сополимеры АА с винилпирролидо-
ном [5]. Сополимеры АА с виниламином не только улучша-
ют свойства поверхности бумаги, но и повышают прочностные
показатели бумажного листа. Эффект повышения прочностных пока-
зателей зависит от содержания в сополимерах АА аминных групп, и
наиболее сильно выражен (1000% и более) во влажном состоянии
бумаги. Упрочнение бумаги при введении (со)полимеров АА обуслов-
лено образованием комплексов между полимерной добавкой и иона-
ми Сг3+ и Си2+, которые входят в состав бумажной массы. Наряду с
прямым эффектом упрочнения и улучшения поверхностных свойств
бумажных листов добавки (со)полимеров АА (и прежде всего ГПАА и
аминированного ПАА) способствуют извлечению из оборотной воды
ионов металлов (помимо перечисленных, еще и ионов железа и ко-
бальта) и снижению концентрации взвешенных частиц. Понятно, что
такое многофункциональное действие сополимеров АА способствует
улучшению качества оборотной и сточной вод - особенно, если учесть
жесткие ПДКионовметаллов.
Одной из наиболее перспективных областей применения водораст-
воримых (со)полимеров АА является использование их в качестве
агентов уменьшения гидравлического сопротивления в турбулентном
режиме течения. Сополимеры АА являются одними из наиболее до-
ступных и высокоэффективных (наряду с полиэтиленом) водораство-
римых полимеров, используемых для этой цели [5]. Указанный эффект
находит широкое практическое применение: в пожарном деле (глав-
ным образом, в США) для повышения „дальнобойности” водных струй
из шлангов брандспойтов, для повышения скорости движения судов и
подводных лодок - водные растворы (со)полимеров АА впрыскиваю-
тся в воду перед носовой частью судов. Используется он и при быстрой
перекачке в турбулентном режиме течения водных суспензий и
эмульсий по трубам. Эффект снижения гидравлического сопротивле-
ния жидких сред позволяет уменьшить время проходки скважин,
снизить потребляемую мощность приводных систем.
170
1
Для количественной характеристики эффекта снижения гидравли-
ческого сопротивления потоку полимерными добавками (так назы-
ваемого эффекта Томса) удобно оперировать безразмерным парамет-
ром В = - яо)/по, где Яо и я - вязкости жидкостей соответственно с
добавкой полимера и без нее. Чем больше параметр В (естественно,
речь идет о случае В > 0), тем больше эффект Томса. Было показано
[10], что для ламинарных потоков жидкостей (число Рейнольдса
Re<3-103) В<0, т. е. полимерные добавки не работают в качестве
агентов, снижающих сопротивление потоку. Эффект Томса срабаты-
вает для Re > 5 -103, и с ростом Re симбатно изменяется и параметр В
вплоть до Re = Re^. При Re > Re^ наблюдается постоянство В, т. е.
эффект достигает своего максимального значения (В^). Величина В^
зависит от природы полимерной добавки, концентрации полимера и
ряда параметров дисперсной среды. С помощью лазерного микроане-
мометра была проведена оценка профиля скоростей водных сред в
присутствии ГПАА в прямоугольном стеклянном капилляре. В непо-
средственной близости от стенки капилляра наблюдается не проскаль-
зывание растворов ГПАА, а резкое снижение вязкости в пристенном
слое [11].
Влияние соли (NaCl) на величину эффекта Томса для ГПАА изучено
при варьировании напряжения сдвига [12]. Показано, что при прочих
равных условиях величина эффекта Томса (оцениваемая по парамет-
ру В) зависит прежде всего от размеров (R2)°.5 и асимметрии макромо-
лекулярных клубков ГПАА [12, 13]. Характер наблюдаемой зависи-
мости В = ДNaCl] для [ГПАА] = const может быть понят, если базиро-
ваться на данных зависимости (Й2)°.5 =/[NaCl] [14]. Эффект снижения
гидродинамического сопротивления потоку при малых добавках ППА
и полиэтиленоксида (ПЭО) изучен при более сложном режиме дефор-
мации: вначале при сдвиговом, а затем - при продольном течении
растворов [15]. Для ПЭО такой режим деформации приводит к заметно-
му изменению ReKp, а для ПАА это влияние незначительно. Добавки
Na+ и Са2+ изменяли конформационное состояние макромолекул в
поверхностном слое, что косвенно отражалось и на величине эффекта
Томса.
Эффект Томса для различных чисел Рейнольдса (Re< 1-105) изучен
при введении ПАА, ГПАА, полиакрилата Na и смесей ПАА и полиак-
рилата натрия. Зафиксирована неаддитивность вклада отдельных
гомополимеров и фракций ГПАА в результирующий эффект снижения
сопротивления течению в случае турбулентного потока (Re> 3-103) [15].
Использование ГПАА в качестве добавки для подавления эффекта
турбулентности изучено при варьировании Т и Re. Стабильность
эффекта Томса была достигнута при 150 °C в течение 21 сут. путем
введения в раствор восстановителя №3803 и комплексообразователя -
трилона BVT, связывающего ионы металлов, прежде всего Fe3+. Лишь
совместное применение трилона и Na2SQ3 позволяет использовать
образцы ГПАА в качестве агентов снижения сопротивления течению в
турбулентном режиме при повышенных температурах (~ 150 °C) [16].
171
Использованные добавки (трилон и МагЗОз) позволяли успешно про-
тиводействовать процессам термической и механической деструкций
макромолекул ГПАА, ММ оставалась практически неизменной и
равной 7,7-106. Необходимо особо отметить, что эффект Томса выра-
жен тем сильнее, чем больше ММ. Для подавляющего большинства
водорастворимых полимеров, если ММ < ЫО5, то В^О, т. е. эффект
Томса пренебрежимо мал. Поскольку для ПАА, ГПАА и других сопо-
лимеров АА можно синтезировать образцы с ММ>5-106 и даже
ММ> 1- 107, то (со)полимеры А А являются весьма перспективными в
качестве высокоэффективных агентов, снижающих гидравлическое
сопротивление. Но необходимо учитывать и то обстоятельство, что при
практическом применении (со)полимеров АА происходит механичес-
кая деструкция макромолекул. Последнее обстоятельство сильно
затрудняет использование (со)полимеров АА для снижения гидравли-
ческого сопротивления в замкнутых системах.
Эффект Томса зависит от (R2)°>5, а значит, для ионогенных сополиме-
ров АА он должен зависеть от pH. И действительно, для ГПАА изме-
нение pH от 2,0 до 11,0 приводит к резкому увеличению (R2)°>5, сим-
батно этому изменяется и эффект Томса (параметр В увеличивается
более чем в два раза) [17]. Интересной представляется зависимость
эффекта Томса от полидисперсности полимеров по ММ, а сополиме-
ров- по ММ и а. Априори можно предполагать осуществление для (со)-
полимеров АА сложной зависимости В = / (ММР) и В = / (неоднород-
ность по составу), поскольку эффективные размеры макромолекул
сложным образом зависят от указанных видов неоднородности по ММ
и «.Последнее особенно выражено для ионогенных (со)полимеров АА, в
частности для ГПАА. Эффект Томса зависит также от концентрации
водорастворимого полимера. С практической точки зрения, наиболее
важным представляется то, что заметный вклад в гашении турбулент-
ности потока при введении (со)полимеров АА имел место уже для
концентраций полимера порядка тысячных и даже десятитысячных
долей процента. А для (со)полимеров АА с высокой молекулярной
массой (ММ > 1 • 107) значения В > 0,2 наблюдаются и для концентраций
порядка 10-5%.
Вот уже более 20 лет (со)полимеры АА успешно применяются в США
как эффективные структуранты почвы. Небольшие добавки (10-3 -
10-1% от массы поверхностного слоя почвы) (со)полимеров АА
высокой молекулярной массы (> 5 • 105) позволяют значительно по-
высить устойчивость ее к ветровой и водной эрозии, приблизиться к
оптимальным показателям по дисперсности, воздухо- и влагопрони-
цаемости [5]. Все вместе взятое позволяет в нужном направлении
измерить структурные параметры почвы, что способствует заметному
повышению урожайности в сельском хозяйстве. Эффективность
действия (со)полимеров А А в качестве стр уктурантов почвы зависитот
природы сомономеров, состава макромолекул, ММ, ионной силы, pH и
др. Наиболее эффективными в качестве структурантов оказались
ионогенные сополимеры АА, прежде всего ГПАА. Помимо эффекта
172
структурирования добавки (со)полимеров АА (особенно при содержа-
нии > 0,1%) способствуют и упрочнению грунтов. Этот эффект находит
практическое применение при создании дорожных покрытий. По срав-
нению с другими агентами, действующими как упрочнители грунтов
(такими как лигнин, битумы, торф), сополимеры АА гораздо более
эффективны - для достижения одинакового эффекта упрочнения
необходимо расходовать сополимеров АА в десятки раз меньше.
(Со)полимеры АА находят применение в строительной индустрии
для повышения механических показателей композиций из гипса и
цемента, а также для более плавного регулирования процесса отверж-
дения, для интенсификации процесса обезвоживания асбоцементной
массы и для улучшения качества водоэмульсионных красок.
(Со)полимеры АА нашли широкое применение и в текстильной
промышленности. Для защиты нитей при переработке на них наносится
защитный слой крахмала и желатины. В качестве защитного слоя при
шлихтовании нитей более перспективно использование (со)полимеров
АА, которое позволяет значительно сократить объемы дефицитных
пищевых продуктов - крахмала и желатины. Для шлихтования нитей
используются и сополимеры АА с винилацетатом (0 < ав < 0,82), при
этом можно использовать некондиционные ПАА и сополимеры АА с
низкими значениями ММ. Шлихта с низкомолекулярными (сополиме-
рами АА быстро сохнет с образованием прочной пленки, обладающей
повышенным влагопог лощением [18]. Высокомолекулярные (сополи-
меры АА используются в качестве аппретивов для тканей, при этом
особенно хорошие результаты получены для метилольных производ-
ных АА. При взаимодействии метилольных групп макромолекул
сополимеров АА с гидроксильными группами целлюлозы образуется
особая сетчатая структура композиционного материала, придающая
аппретированному волокну упругость и несминаемость. Сульфомети-
лированный ПАА, сополимеры АА с этиленсульфокислотой и стирол-
сульфокислотой успешно применяются для придания тканям антиста-
тических свойств и для повышения их огнестойкости, а также для
уменьшения загрязняемости. Экспериментально было показано, что
при переходе от ПАА к статистическим сополимерам АА со стирол-
сульфокислотой резко изменяется (на четыре и пять и более порядков
в сторону уменьшения) поверхностное сопротивление, в меньшей
степени - объемное сопротивление волокон и пленок.
Было найдено, что добавки (со)полимеров АА (порядка 10-3%) в
воду приводят к резкому повышению эффективности резания сталь-
ных и мраморных пластин водной струей под большим давлением.
Замена обычно используемого для этих целей песка на (со)полимеры
АА не только повышает производительность резания, но и способст-
вует сохранности труб и насосов установки [19].
(Со)полимеры АА используются в качестве высокоэффективных
загустителей, как защитные коллоиды (например, при эмульсионной
полимеризации; особенно хорошо зарекомендовали себя при синтезе
каучуков) для облегчения диспергирования пигментов и других
173
дисперсных материалов, не обладающих большой механической проч-
ностью. В то же время олигомеры и низкомолекулярные (со)полимеры
АА успешно применяются в совершенно другом качестве - как раз-
жижители нефти.
Сополимеры АА с винилсульфоновой кислотой применяются для
удаления ржавчины и накипи как ингибиторы коррозии и солеотло-
жения. Для этих же целей могут быть использованы и другие сопо-
лимеры АА, в частности ГПАА. Эффективность действия (со)полимеров
АА в качестве ингибиторов солеотложения сильно зависит от молеку-
лярной массы, при этом наиболее эффективны низкомолекулярные
продукты и даже олигомеры.
Небольшие добавки (со)полимеров АА существенно замедляют ис-
парение воды. Так, введение сотых долей процента высокомолекуляр-
ного ГПАА (ММ^5-106) позволило уменьшить скорость испарения
воды из бассейна более чем на 10%. Этот эффект уже нашел практи-
ческое применение для улучшения микроклимата в плавательных
бассейнах и при искусственном орошении в зонах пониженной влаж-
ности. Нетромбогенные гранулированные гели на основе ПАА находят
применение в медицинской практике для заполнения послеопераци-
онных полостей, изготовления контактных офтальмологических линз,
как оболочки водорастворимых фармакологических препаратов
(микрокапсулирование), при изготовлении высококачественных там-
понов, пеленок и пр. [5].
Полимеры и сополимеры АА являются одними из наиболее перспек-
тивных физиологически активных водорастворимых полимеров [20],
наиболее широко применяются в составе плазмозащищающих раство-
ров [21]. Особенно эффективны они при больших потерях крови для
поддержания основных физиологических функций организма, под-
держания давления крови и повышения защитных функций организма
[20]. Перспективными представляются (со)полимеры АА и для созда-
ния на их основе функциональных полимеров-носителей. Это предпо-
ложение подтверждается двумя обстоятельствами: высокой гидро-
фильностью и малой токсичностью (со)полимеров АА и возможностью
проведения на (со)полимерах А А широкого спектра реакций полимер-
аналогичных превращений с выходом на физиологически активные
функциональные группы. Следует отметить, что переход от (сополиме-
ров АА к физиологически активным полимерам в принципе требует и
очень высокого уровня информации об исходном и конечном сополи-
мере, во всяком случае, необходима информация о кривых распреде-
ления по молекулярной массе и по составу, данные о микроструктуре
макромолекул [22].
ПАА, ГПАА находят применение в качестве защитного слоя на гра-
нулах минеральных удобрений. Такая обработка гранул в принципе
позволяет наносить на поверхностный (полиакриламидный) слой
гранул различные фунгициды и гербициды. Надлежащий подбор
режима обработки гранул полиакриламидными препаратами позво-
ляет в нужном направлении изменять режим подачи в почву мине-
ральных удобрений, фунгицидов и гербицидов.
174
1
Сополимеры АА находят применение как покрытия для натуральной
и синтетической кож, а сшитые гидрогели АА используются в биохими-
ческих исследованиях [23].
Основное применение (со)полимеров АА - использование в качестве
флокулянтов. Большая часть производимых в СССР и во всем мире
(со)полимеров АА находит практическое применение в качестве
флокулянтов в горнодобывающей, бумажной, металлургической,
легкой, пищевой, угольной, нефтедобывающей промышленности.
Более подробно остановимся именно на этой области применения
(со)полимеров АА. Действие высокомолекулярных водорастворимых
флокулянтов [в том числе и (со)полимеров АА] основано главным
образом на двух механизмах. Первый - мостичный механизм флоку-
ляции: макромолекулы адсорбируются на взвешенных частицах,
связывая их в единый ансамбль - флокулы [24]. Второй - нейтрали-
зационный механизм флокуляции: заряженные макроионы адсорбиру-
ются на заряженных дисперсных частицах, нейтрализуя их и тем самым
снижая кинетическую (седиментационную) устойчивость системы [25].
Для (со)полимеров АА высокой молекулярной массы определяющим
является, как правило, мостичный механизм флокуляции. Эффек-
тивность действия (со)полимеров АА для реальных дисперсных систем
зависит от большого числа параметров, во многих случаях затруднена
оценка влияния каждого конкретного фактора на результирующий
макроскопический флокулирующий эффект, поэтому возникла необ-
ходимость всесторонних исследований (со)полимеров АА как флоку-
лянтов прежде всего на модельных дисперсных системах (ДС). В ка-
честве модельных ДС были апробированы охра, каолин и оксид меди.
Влияние различных факторов на флокулирующие показатели (со)-
полимеров АА приведено в обзоре [26]. Эксперименты были сплани-
рованы таким образом, чтобы обеспечить конкретную оценку влияния
лишь одного параметра системы при сохранении неизменными всех
других параметров. Рассмотрим влияние отдельных факторов на
процесс флокуляции (со)полимеров АА в модельных ДС. При исполь-
зовании ПАА и сополимеров на основе АА для ускоренной седимента-
ции реальных ДС концентрация дисперсной фазы Сд может изменяться
в широких пределах - от 0,002 до 40-50%. С ростом Сд закономерно
уменьшается расстояние между частицами, растет суммарная поверх-
ность раздела фаз. На модельных ДС были изучены особенности фло-
куляции (со)полимерами АА при варьировании Сд включая и область
стесненного оседания (Сд>3%) [25]. Для количественной оценки
флокулирующего эффекта используется безразмерный параметр D [27]:
D = v/Vo-1, где v и Vq- скорость седиментации соответственно с
добавкой и в отсутствие флокулянта. Если D > 0, то полимерная
добавка выступает в роли флокулянта, и чем больше D, тем выше
флокулирующий эффект за счет вводимой добавки. Если же D < 0, то
вводимая добавка полимера работает как стабилизатор, т. е. способст-
вует повышению седиментационной устойчивости системы. Исполь-
зование относительного параметра D вместо v для оценки флокули-
175
Рис. 5.1. Кривые зависимости флокулирующего эффекта Л от концентрации охры Сд [28]
при концентрации ТПАА = 0,4 и степени гидролиза ГПАА, % (мол.): 37 (1), 13 (2)
и 2(3)
Рис. 5.2. Зависимость степени осветления суспензии охры от времени в присутствии ГПАА
(2-10-2%. «в = 0,09) при концентрации NaCl, моль/л [29]:
0 (1); 3,4-Ю-3 (2); 6,8-Ю-3 (3); 1,7-Ю-2 (4); 3,5-lQ-2 (5); 6.8-10-2 (6); 0,17 (7); 0,34 (3)
рующей способности полимера несомненно предпочтительнее, по-
скольку при таком подходе во многом устраняются эффекты, связан-
ные с различием параметров частиц дисперсной фазы (распределение
по размерам, степень асимметрии и др.) в различных сериях экспери-
ментов. При необходимости переход от относительного параметра D к
скорости седиментации v осуществляется с помощью простого соот-
ношения:
v = v0(D+ 1).
Предполагается, что v0 известно. На рис. 5.1 приведена зависимость
величины флокулирующего эффекта от tj, при использовании образ-
цов ГПАА различной степени гидролиза. Снижение флокулирующего
эффекта по мере увеличения Q наблюдалось для всех образцов ГПАА.
Наблюдаемый в эксперименте характер зависимости П = Л<^) нельзя
связать с повышением „стесненного” оседания частиц охры, посколь-
ку этот эффект практически симбатен для v и Vq , а в выражение для D
входит отношение v/v0. Снижение De ростом Q связано, по-видимо-
му, с уменьшением отношения (где Q - концентрация поли-
мера), что сопровождается снижением концентрации и размеров
флокул [28]. При использовании (со)полимеров АА как флокулянтов
реальных ДС приходится иметь дело с многокомпонентными систе-
мами, содержащими различного вида включения, в том числе и ионоген-
ного соединения. Поэтому важно оценить закономерности седимента-
ции модельных ДС в присутствии (со)полимеров АА в водно-солевых
средах. На рис. 5.2 показаны кинетические кривые седиментации охры
в присутствии ГПАА (ав = 0,09) в водно-солевых (NaCl) средах. С уве-
личением концентрации NaCl (ионная сила Ц ~ [NaCl]) для всех соста-
Рис. 5.3. Зависимость флокулирующего эффекта по охре от концентрации ГПАА ( С-) [31]:
0,168 (1); 0,231 (2); 0,219 (3); 0,351 (4); 0,416 (5); 0,437 (6); 0,458 (7)
Рис. 5.4. Зависимость флокулирующего эффекта по охре от состава ГПАА [29]:
[ГПАА]• 10« = 4 (1 - 3) и 2% (Г —3 *); [NaCl] = 0 (1,1'); 3,4 • 10~2 (2, 2'); 0,34 моль/л (3, 3')
вов ГПАА наблюдалось снижение скорости седиментации охры. При-
кидочные расчеты показывают, что наблюдаемый в эксперименте
эффект снижения скорости седиментации охры (в присутствии ГПАА)
нельзя объяснить уменьшением вязкости и увеличением плотности
дисперсной среды за счет введения соли. Основной причиной наблю-
даемого эффекта снижения флокулирующей способности ГПАА при
повышении ц является снижение эффективных макромолекулярных
клубков ввиду экранирования карбоксильных анионов ионами
Na+ [29]. Дополнительным доказательством тесной взаимосвязи между
D и конформационным состоянием макромолекул ГПАА может слу-
жить и зависимость флокулирующего эффекта от порядка введения
компонентов в систему, а именно - введения полимера до или после
добавки соли [29, 30].
Флокулирующий эффект по охре в существенной мере зависит от
концентрации флокулянта (рис. 5.3). Для зависимости D=f ([ГПАА])
характерно наличие двух областей. Для первой области концентраций
ГПАА ([ГПАА] < 8 -10—4%) наблюдается резкое возрастание D по мере
увеличения [ГПАА] для сополимеров любых составов, а для второй
области концентраций ([ГПАА] > 1 • 10~3%) значения D практически
стабилизируются [31]. Для катионных сополимеров АА (статистические
сополимеры АА с гидрохлоридом диэтиламиноэтилметакрилата) для
зависимости D=f(C) (С - концентрация сополимера) также характерно
наличие двух концентрационных областей [32]. В отличие от ГПАА,
177
для них значения параметра D существенно ниже, а рабочая область
концентраций сдвинута в сторону более высоких значений С. Анало-
гичные кривые D = [(C) с запределиванием при С > Скр были полу-
чены и для других модельных ДС - каолина и оксида меди [26].
В разд. 3.1- 3.3 мы уже отмечали, что с изменением химической
природы сомономера, а также при варьировании состава сополимера «в
могут резко меняться термодинамические и гидродинамические
показатели системы. Природа второго сомономера и состав сополимера
в большой степени сказываются и на адсорбционных и флокули-
рующих показателях сополимера АА.Не требует особых доказательств,
что зависимость адсорбционных [33] и флокулирующих [26] показа-
телей будет выражена тем сильнее, чем больше различие физико-хи-
мических характеристик гомополимеров, т. е. ПАА и гомополимера
второго компонента. Следует иметь в виду, что для получения наи-
более корректных зависимостей П=/(ив) необходимо проводить
эксперименты при условии постоянства у сополимеров АА других
молекулярных характеристик - прежде всего ММ и ММР, что выпол-
нить далеко не просто. При работе с ГПАА для достижения условий
ММ = const и ММР = const процесс щелочного гидролиза ПАА необхо-
димо осуществлять в мягком режиме (Т < 60 °C). Для доказательства
постоянства ММ и ММР у продуктов гидролиза ПАА проведена оценка
ММ ГПАА различных составов по данным вискозиметрического
анализа. Константы К и а в уравнении Марка - Хувинка [п] = =К№
зависят от ив [34]. В табл. 5.1 приведены значения К, а и для от-
дельных образцов ГПАА.
Видно, что подобранные условия гидролиза ПАА позволили устра-
нить деструктивные процессы и тем самым обеспечить практическую
идентичность ММ и ММР для всех образцов ГПАА. Для зависимости
флокулирующего эффекта от йв характерно наличие максимума
вблизи ив = 0,2 (рис. 5.4). Величина D уменьшается с ростом ионной
силы и при снижении [ГПАА] [29] характер зависимости £>=/(«в)
логично связать с изменением среднеквадратичных размеров макро-
молекулярных клубков ГПАА. И действительно, для зависимости
(R2)o,5 = /(ив) также характерен максимум, связанный со спецификой
взаимодействия противоионов (Na+) с макроанионом ГПАА [35]. Для
более аргументированного объяснения характера зависимости
D =/(ив) необходимо привлечь и данные по адсорбции ГПАА на части-
цах дисперсной фазы, поскольку процессы флокуляции и адсорбции
тесно взаимосвязаны между собой [26, 36, 37]. Фиксируемый в экспе-
рименте характер соотношения между зависимостями Ь(«в) и Г(йв) во
многом определяется не только природой второго компонента сопо-
лимеров АА, но и природой адсорбционных центров на частицах
дисперсной фазы. Так, при использовании в качестве флокулянта
ГПАА наблюдается практическая симбатность указанных зависимос-
тей при флокуляции каолина и плохая корреляция между зависимос-
тями D(aB) и Г(ив) для охры [26]. В общем случае не следует ожидать
простой зависимости (типа, например, симбатной для каолина) между
178
Таблица 5.1. Влияние состава сополюлера на константы уравнения Марка—Хувинка
и Мр для ГПАА [29]
«в К-102 а Mq-iO-6 «В К-102 а Мл-10-6
0,17 0,69 0,78 6.3 0,351 0,65 0,83 5,4
0,090 0,65 0,80 6,2 0,382 0,67 0,83 5,8
0,168 0,62 0,81 6,2 0,416 0,70 0,83 4,3
0,237 0,62 0,82 5,2 0,437 0,71 0,83 4,5
0,279 0,63 0,82 5,3 0,458 0,72 0,84 5,0
D и Г, поскольку флокулирующая способность характеризуется не
общим количеством адсорбированных макромолекул (определяемых
величиной Г), а количеством макромолекул, участвующих в создании
„мостичных” связей между двумя и более частицами дисперсной
фазы. Величина D зависит прежде всего от концентрации и размеров
образующихся флокул, что, в свою очередь, зависит от расстояния
между частицами дисперсной фазы, природы и концентрации локали-
зованных центров адсорбции, плотности сегментов макромолекул в
адсорбционном слое, подвижности макромолекул, от эффективной
степени сольватации функциональных групп макромолекул на по-
верхности (или в непосредственной близости от нее) частиц дисперс-
ной фазы, а также от целого ряда других трудноконтролируемых фак-
торов [37]. Для катионных сополимеров АА, а именно статистических
сополимеров АА с гидрохлоридом диметиламиноэтилметакрилата
(ГХ ДМАЭМА), также изучена зависимость скорости седиментации от
состава сополимера-флокулянта [32].
Один из наиболее действенных факторов управления процессом
седиментационной устойчивости ДС связан с изменением молекуляр-
ной массы полимерного флокулянта. Для получения строгих зависи-
мостей D = необходимо эксперименты ставить таким образом,
чтобы исключить влияние других факторов (помимо М) на седимента-
ционную устойчивость системы. И прежде всего надо зафиксировать
состав и неоднородность сополимера по составу, степень разветвлен-
ности макромолекул и др. Для устранения осложняющих факторов
образцы сополимеров АА с различными значениями М получали
методом деструкции под действием инициаторов радикального харак-
тера (Kj S2 С>8).Варьируя время реакции, концентрацию инициатора и
температуру, удалось получить образцы ГПАА с разбросом молекуляр-
ных масс более чем на два порядка [38]. На рис. 5.5 проиллюстрирована
зависимость D=f(M) для ГПАА. Как видно из рисунка, флокулирую-
щая способность ГПАА повышается с ростом М. Это, в принципе, и
понятно, так как увеличение М сопровождается симбатным измене-
нием (R2p>5, а значит, повышается и способность макромолекул к
актам мостикообразования. После достижения Мкр ~ 106 наблюдается
заметное ослабление зависимости D =f(M). Помимо ГПАА зависимость
179
Азо %
Рис. 5.5. Зависимость флокулирующего эффекта по охре от молекулярной массы ГПАА
([СГПАА] = 0,01%) с ав [26]: 0,091 (1); 0,35 (2); 0,165 (3); 0,42 (4); 0,026 (5)
Рис. 5.6. Зависимость флокулирующего эффекта по охре от степени нейтрализации ГПАА
У[40]:
= 0,17 (1—3) и 0,35 (1—3'); нейтрализующий агент: LiOH (1, Г); NaOH (2, 2');
КОН (3, 3')
Азо %
D =f(M) изучена и для других сополимеров АА - с ГХ ДМАЭМА [26] и
стиролсульфонатом натрия [39].
Полиакриламидные флокулянты находят применение в средах с са-
мыми различными значениями pH. Для ионогенных сополимеров при
варьировании pH изменяется и степень нейтрализации V, а значит, и
(R2)0,5, и вероятность мостикообразования, что находит свое отраже-
ние в значении параметра D. Для определенности рассмотрим влия-
ние у на примере хорошо изученного слабого полиэлектролита —
ГПАА. В качестве исходного эталонного сополимера возьмем сополи-
мер АА с АК (т. е. с У = 0), который получали из ГПАА длительным
диализом против 0,01 М НС1. Процесс частичной нейтрализации сопо-
лимеров АА с АК протекает по схеме:
-СН2-СН— -
CONH2
J л
-СН2-СН- -
conh2
—* л
-СН2-СН- - + аМеОН
СООН
-* т
-аН2О
-сн2-сн- - -сн2-сн-
СООН СООМе
-im—а и
где Me — Na, К, Li, а У = а/т.
На рис. 5.6 приведены данные о зависимости флокулирующих
свойств сополимеров АА с АК от У для нейтрализующих агентов NaOH,
LiOH, КОН. Для всех нейтрализующих агентов зависимости D=f(y) име-
ют максимум. Это однозначно свидетельствует о том, что заряд макро-
иона не является однозначной характеристикой флокулирующего эф-
фекта, поскольку между величиной заряда и У зависимость симбатная.
Для объяснения природы максимума на кривых D=f(y) проанализиру-
ем зависимость Пуд/С=/(Р). Для нее также характерен максимум, что
180
позволяет объяснить специфику действия флокулянта изменением
эффективных размеров макромолекулярных клубков [40].
Известно [22], что неоднородность по составу оказывает сильное
влияние на важнейшие свойства сополимеров и композиций на их
основе, при этом во многих случаях влияние НС выражено сильнее,
чем ММР. В последние годы появилась информация и о влиянии НС на
флокуляцию модельных и реальных ДС [22, 41, 42]. Для получения
образцов сополимеров АА с АК с фиксированными ММ и ММР исполь-
зовали в качестве базисных 10 образцов ГПАА с различными ав,
которые охарактеризованы в табл. 5.1. Искомые образцы с определен-
ными значениями ~а в - const получали смешением базисных образцов.
Количественным критерием НС служила величина дисперсии по
составу о [22]: к к
о = Z ы, а в i - (2 Ч а в, j)2,
1=1 ’ i=l
где w j — массовая доля базисного образца состава a g к — общее число базисных образцов
в сополимере.
С повышением параметра о увеличивается НС сополимера.
В качестве примера на рис. 5.7 приведены данные о зависимости
флокулирующего эффекта по оксиду меди как функции о для компо-
зиций ГПАА с ~ав= ОД7 (кривые 1,1') и -ав = 0,42 (кривые 2,2'). Наб-
людаемая в эксперименте сильная зависимость D~f(o) связана прежде
всего с резким различием физико-химических свойств компонентов
сополимера, т. е. ПАА и ПАН. О резких различиях вязкостных свойств
ПАА и ПАН мы уже говорили в предыдущей главе. Поскольку про-
цессы флокуляции и адсорбции между собой тесно взаимосвязаны,
представлялось интересным установить, имеется ли корреляция
между D и Г для различных значений дисперсии по составу о (рис. 5.8).
Специальными опытами было показано, что основные особенности
флокуляции и адсорбции полидисперсных по составу образцов ГПАА
могут быть поняты лишь при учете эффекта фракционирования макро-
молекул по составу в актах адсорбции на частицах дисперсной фазы. И
действительно, данные эксперимента показывают, что на каолине
преимущественно адсорбируются макромолекулы с малым содержа-
нием акрилатных групп, а на частицах охры - наоборот, с большим
содержанием АН [36]. Микроскопическими исследованиями было
показано, что концентрация и размеры образующихся флокул с учас-
тием макромолекул ГПАА и частиц суспензии охры и каолина зависят
от о, т. е. от полидисперсности сополимеров АА по составу.
Процессу флокуляции сопутствует процесс адсорбции макромоле-
кул (со)полимеров АА на частицах дисперсной фазы. По крайней мере,
частичная необратимость процесса адсорбции (со)полимеров АА в
конечном итоге обусловливает появление зависимости флокулирую-
щего эффекта от ряда технологических параметров. Это положение
нашло оригинальное подтверждение при совместной флокуляции
анионными (ГПАА) и катионными (сополимерами АА с ГХ ДМАЭМА)
производными АА. Было показано, что флокулирующий эффект по
181
Рис. 5.7. Зависимость флокулирующего эф-
фекта по оксиду меди от дисперсии по сос-
таву ГПАА о ([ГПАА]=2.10~’%) [42]:
аВ=0,П (1, Г) и 0,42 (2, Z); [NaCl]=0 (1, 2) и
0,34 моль/л (/, 2")
Рис. 5.8. Зависимость флокулирующего эф-
фекта Д (2) и адсорбции Г (мг/г) (2) от дис-
персии по составу ГПАА о (дисперсная
фаза—охра) [36]
охре зависит от порядка введения анионного и катионного сополи-
меров АА (естественно, при одних и тех же дозировках сополимеров
АА) [30]. А это означает, что эффективность мостикообразования
зависит также и от порядка ввода ионогенных компонентов полимер-
ной композиции (анионных и катионных сополимеров АА).
Переход от модельных к реальным ДС неизбежно сопровождается
существенным усложнением процесса флокуляции. Это связано с ус-
ложнением как дисперсионной среды, так и ансамбля частиц дисперс-
ной фазы. При изучении флокуляции (со)полимерами АА реальных ДС
приходится иметь дело с заведомо неполной информацией о составе
дисперсионной среды и ансамблей частиц дисперсной фазы. Естествен-
но, такое положение требует более емких поисковых исследований
для нахождения оптимальных условий флокуляции. Действие (сопо-
лимеров АА в качестве флокулянтов изучено для очень большого
числа реальных ДС. Мы остановимся лишь на отдельных из них. Отмыв
ка тиокольной дисперсии от различного рода включений [№28203,
Mg(OH)2, полисульфидов N^Sro NaOH, NaCl и др.] проводится в
несколько этапов и является длительным процессом. Для ускорения
седиментации частиц тиокольной дисперсии были успешно применены
в качестве эффективных флокулянтов ПАА и статистические сополи-
меры АА с калиевой солью виниламидоянтарной кислоты (КВАЯК)
[27]. Как видно из рис. 5.9, флокулирующий эффект зависит от состава
сополимеров АА- КВАЯК. Флокулирующий эффект (со)полимеров АА
по тиоколу зависит от целого ряда других параметров: концентрации
полимеров, pH, ММ [43], неоднородности сополимеров по составу [27].
Одной из лимитирующих стадий красильно-отделочного производства
(КОП) льнокомбината является стадия очистки сточных вод (СВ). Для
182
Рис. 5.9. Кинетика седиментации тиокольной дисперсии ТСД в присутствии флокулянтов
(С = 0,002%) [27]:
ПАА (1), сополимеров АА-КВАЯК с ав = 0,79 (2) и 0,51 (3), ПКВАЯК (4) и без добавки флоку-
лянта (5)
Рис. 5.10. Зависимость флокулирующего эффекта В СВ КОП от содержания ионогенных
звеньев в катионных сополимерах АА с ГХ ДМАЭМА. (1) и в анионных сополимерах
АА — ГПАА (2) при [флокулянт] = 4 • 10 ~5 [44]
интенсификации осаждения СВ КОП обычно используется известь.
Переход к флокулянтам на основе ГПАА позволил не только достиг-
нуть определенного экономического эффекта, но и успешно решить
ряд вопросов экологического (снижение концентрации взвешенных
частиц и примесей тяжелых металлов) и социального (снижение доли
тяжелого физического труда) планов. Использование ГПАА, несомнен-
но, способствует решению важной проблемы - переходу к замкнутому
циклу водоснабжения на льнокомбинате [44]. Обобщенные данные о
зависимости флокулирующего эффекта от состава сополимеров АА
приведены на рис. 5.10. Для катионных сополимеров А А с ГХ ДМАЭМА
(кривая 1) характерно уменьшение D с ростом а в- Такой характер
зависимости D =Дав) связан с электростатическим эффектом отталки-
вания между макрокатионом сополимера и положительно заряженны-
ми частицами СВ КОП (знак заряда частиц определен по данным элект-
рофореза), и эффект отталкивания тем сильнее, чем больше заряд
макроиона (~ Ив). Наличие электростатического эффекта отталкивания
обусловливает и малые значения параметра D. Для ГПАА (кривая2)
зависимость D=f(a^) более сложная-для нее характерен максимум и
величины D для ГПАА существенно выше, чем для сополимера АА с ГХ
ДМАЭМА. Это связано, главным образом, с тем, что между макро-
молекулами ГПАА и частицами СВ КОП имеет место эффект притяже-
ния. Последнее способствует мостикообразованию между макроанио-
нами ГПАА и частицами дисперсной фазы. По данным рис. 5.11 можно
вынести суждение об изменении концентрации взвешенных частиц
СВ КОП в разных зонах отстойника как функции времени седимента-
183
Рис. 5.11. Зависимость концентрации взвешенных частиц СВ КОП в верхней (1,1') и
данной (2,2') зонах отстойника без (1', 2') и в присутствии ГПАА (1,2) с aR = 0,31, [ГПАА] =
= 0,5 мт/л [45]
а,°/о
Рис. 5.12. Зависимость степени осветления фосфоритовых шламов от времени [46] без
добавок флокулянтов (1); с добавкой ГПАА (ав = 0,39) (1 — 4); с добавкой сополимера АА
с ГХ ДМАЭМА (ав=0,45) (2' — 4") при [флокулянт] = 0,2-10-"* (2,2'); 1-10—4 (3,3');
2-10~4% (4,4')
ции. Видно, что добавление ГПАА приводит к снижению концентрации
взвешенных частиц Свзв в верхней части отстойника и более быстрому
накоплению их в донной части [45]. Кинетика седиментации фосфори-
товых шламов изучена в присутствии анионных и катионных сополи-
меров АА. На рис. 5.12 приведены кинетические кривые седиментации
шламов в присутствии анионных и катионных сополимеров АА раз-
личных концентраций [46]. Флокуляция минеральных суспензий в
присутствии ГПАА* изучена при ультразвуковом воздействии на
систему [47]. Уточним, что ультразвуковая обработка является необ-
ходимым элементом технологического цикла в процессе обогащения
минералов. При достаточно интенсивной ультразвуковой обработке
системы происходила деструкция макромолекул ГПАА, что сопровож-
далось резким снижением ГПАА и параметра D вплоть до D = 0. Кати-
онные сополимеры АА оказались весьма эффективны в качестве
флокулянтов промышленных суспензий марганцевых шламов [48].
Уже отмечалось [5], что флокулянты на основе (со)полимеров АА
нашли широкое применение в СССР и за рубежом на различных
стадиях производства бумаги. Необходимо отметить и положительный
побочный эффект при использовании полиакриламидных флокулян-
тов - наблюдалось заметное улучшение фильтрационных свойств
бумажной массы [49]. Анионные сополимеры АА нашли применение
для ускоренного осаждения и концентрирования угольных суспензий
различной дисперсности. Для повышения флокулирующих показате-
лей и селективности процесса в систему вводили дополнительно
высокодисперсные порошки магнетита. Сформировавшиеся флокулы
из частиц магнетита, угольной суспензии и макромолекул ГПАА
обладали определенной намагниченностью, что позволяло осуществ-
184
Рис. 5.13. Зависимость скорости
осаждения (») взвешенных частиц от
расхода ГПАА при концентрации
дисперсной фазы, г/л [55]: 10 (1);
16 (2); 50 (3); 100 (4—медленная,
5—быстрая подача ГПАА)
пять более эффективное разделение частиц с помощью магнитного
сепаратора [50]. Изучена флокуляция волокон отбеленной сульфатной
целлюлозы с длиной волокон /=(1-2)103 м в присутствии катионных
сополимеров АА (с 1^,М,М-триметиламинопропилметакриламидом) [51].
Максимальный флокулирующий эффект был достигнут для сополи-
мера АА с ав = 0,2 вблизи pH 6,0. Наряду с максимальной флокулирую-
щей способностью для ав = 0,2 и pH 6,0 наблюдались наибольшая
адсорбция и максимальные размеры флокул [51]. Сопоставительный
анализ процессов адсорбции и флокуляции ПАА и ионогенных сополи-
меров АА (ГПАА) проведен на суспензиях глины [51]. Оценено влияние
плотности заряда на макромолекулах сополимеров АА с АН, величин^!
электрокинетического потенциала частиц глины, ионной силы, темпе-
ратуры, интенсивности перемешивания на скорость седиментации
дисперсной фазы. Сопоставлена эффективность действия различных
флокулянтов (в том числе и ПАА) при осаждении белков из сыворотки
[53]. С использованием в качестве флокулянта ГПАА были предприня-
ты попытки селективной флокуляции из смесей гематита с кварцем
[54]. Было установлено, что между макромолекулами ГПАА и поверх-
ностью частиц гематита имеются гораздо более сильные по сравнению с
частицами кварца взаимодействия. Из этого следует, что для таких
смесей ГПАА может быть в принципе использован как селективный
флокулянт гематита. Рассмотрено влияние pH и ионной силы на
селективность процесса флокуляции [54].
ПАА и ГПАА были успешно применены в качестве высокоэффектив-
ных флокулянтов для интенсификации процессов извлечения драгме-
таллов из россыпных месторождений [55]. Эффективность действия
полиакриламидных флокулянтов зависит от концентрации полимера и
частиц дисперсной фазы, что иллюстрируют данные рис. 5.13. Примене-
ние ГПАА позволило существенно уменьшить расход воды в техноло-
гическом цикле и повысить эффективность извлечения из руды це-
левого продукта - драгметалла [56]. При содержании взвешенных
веществ 20- 60 г/л расход ГПАА составил 1-2 мг/л, а при уменьшении
Сд менее 15 г/л расход полимера можно снизить до 0,1 - 0,5 мг/л.
Применение полиакриламидных флокулянтов для очистки СВ в про-
185
цессе металлодобычи позволяет в принципе осуществить переход к
прогрессивной технологии добычи драгметаллов, базирующейся на
оборотном водоснабжении [55, 57].
Проанализированы флокулирующие показатели ПАА и модифици-
рованного ПАА на примере промышленных дисперсий [58]. Эффектив-
ность действия полиакриламидных флокулянтов зависит от степени
гидрофобизации (гидрофобизация осуществлялась эпоксидирован-
ными жирными кислотами) и от степени сшивки макромолекул
ПАА [58].
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Determan Н.//Angew. Chem. 1964. Bd. 76. S. 635—643.
2. Бреслер С. Н., Рубина X. М., Граевская Р. А. и др.//Биохимия. 1961. Т. 26. С. 745—749.
3. Boman И., Hjerten 5.//Acta Biochem. Biophys. Suppl. 1962. V. 1. P. 276—284.
4. Morris C., Morris P. Separation Method in Biochemistry. New. York: Wiley, Interscience,
1963.
5. Николаев А. Ф., Охрименко Г. И. Водорастворимые полимеры. М.: Химия, 1979.
145 с.
6. Norman £).//Petrol. Int. 1976. V. 34. Р. 44—47.
7. Зильберман Е. Н., Старков А. Е., Злотник Д. Е. и др.//Груды по химии и химия,
технол. Горький, 1975. Вып. 3. С. 94—96.
8. Бектуров Е. А., Бимендина Л. А. Интерполимерные комплексы. Алма-Ата: Наука,
1977. 264 с.
9. Васильева Е. И.//Тр. ВНИИ целлюлозно-бумажной промышленности. М.: ВНИИБ,
1975. Вып. 68. С. 89.
10. Нои H.//Drag Reduct. 3rd Int. Conf. Bristol, 2—5 July 1984. Bristol, 1984. C. 2/1 —C 2/6.
11. Muller-Monssen H„ LoblH.//J. Reol. 1987. V. 31. N 4. P. 323-326.
12. Ait-Cady A., Carreau P., Chauveteau G.//J. Reol. 1987. V. 31. N 7. P. 537—561.
13. Макогон Б. П., Павеленко M. M., Бондаренко Т. А. и др.//Инж.-физ. журн. 1986.
Т. 51. №1. С. 47- 52.
14. Brunn P.//Physicochem. Hydrodyn. 1987. V. 8. N 4. P. 449—459.
15. Kulicke K, Grager H.//Drag. Reduct. 3rd Int. Conf. Bristol. 2—5 July 1984. Bristol, 1984.
A5/1-A5/2.
16. Martischius F., Heide W.//Drag. Reduct. 3rd Int. Conf. Bristol. 2—5 July 1984. Bristol,
1984. D9/1-D9/3.
17. Balakrisch C., Gordon R.//J. Appl. Polym. Sci. 1975. V. 19. P. 909—913.
18. Глубиш П. А./ЛТрименение полимеров акриловой кислоты и ее производных в
текстильной и легкой промышленности. М.: Легкая индустрия, 1975. С. 205.
19. Кудин А. М., Баренблатт Г. И., Калашников В. Н. и др.//Инж.-физ. журн. 1973. Т. 25.
№6. С. 1090-1092.
20. Панарин Е. Ф.//Синтез, структура и свойства полимеров. Л.: Наука, 1989. С. 187—198.
21. Sprince L., ExnerJ., Sterba О. etal.//I. Biomed. Mat. Res. 1976. V. 10. N 6. P. 953—963.
22. Мягченков В. А., Френкель С. Я. Композиционная неоднородность сополимеров. Л.:
Химия, 1988. 271 с.
23. Graham К./ДаЬ. Eguip. Dig. 1975. V. 13. Р. 67.
24. Вейцер Ю. М., Мини Д. М. Высокомолекулярные флокулянты в процессе очистки
природных и сточных вод. М.: Стройиздат, 1984. 200 с.
25. Баран А. А. Полимерсодержащие дисперсные системы. Киев: Наукова думка, 1986.
203 с.
26. Нагель М. А., Куренков В. Ф., Мягченков В. А.// Химия и хнм. техноп. 1988. Т. 31.
№ 7. С. 3—13 (Изв. вузов).
27. Мягченков В. А., Богданова Л. В., Русяева В. А. и др.//Химия и технология эле-
ментоорганических соединений и полимеров. Вып. 3—4. Казань: КХТИ, 1974. С. 69—74.
186
28. Нагель М. А., Валиуллина Ф. И., Куренков В. ф. и др.//ЖПХ. 1987. Т. 60. № 1.
С. 157-161.
29. Мягченков В. А., Куренков В. ф., Нагель М. А.//Физико-химические основы син-
теза и переработки полимеров. Горький: изд-во ГГУ, 1983. С. 86—94.
30. Куренков В. ф., Ефремова Л. В., Мягченков В. А.//ЖПХ. 1989. Т. 62. № 10.
С. 2298-2303.
31. Мягченков В. А., Куренков В. Ф., Нагель М. А.//ЖПХ. 1984. Т. 57. № 2. С. 471-474.
32. Куренков В. Ф., Нагель М. А., Байбурдов Т. А. и др.//Химия и технология элемен-
тоорганических соединений и полимеров. Казань: КХТИ, 1987. С. 90—95.
33. Липатов Ю. С. Межфазные явления в полимерах. Киев: Наукова думка, 1980.258 с.
34. Klein J., Conrad K.//Makromol. Chem. 1978. Bd. 179. S. 1635-1638.
35. Мягченков В. А., Куренков В. Ф., Ахмедьянова Р. А.//ВМС. 1982. Т. А24. № 3.
С. 656-661.
36. Нагель М. А., Куренков В. Ф., Мягченков В. А.//ЖПХ. 1987. Т. 60. № 7. С. 1500—1504.
37. Запольский А.К., Баран А.А. Коагулянты и флокулянты в процессах очистки воды.
Л.: Химия, 1987. 208 с.
38. Myagchenkov V. A., Kurenkov V. F., Nagel М. AJ/keXa Polym. 1984. Bd. 35. N 12.
S. 724-728.
39. Куренков В. Ф., Орлова Б. И., Мягченков В. А.//ВМС. 1986. Т. А28. № 6.
С. 1186-1191.
40. Мягченков В. А., Куренков В. Ф., Нагель М. А.//ЖПХ. 1986. Т. 59. № 3. С. 535- 539.
41. Мягченков В. А., Куренков В. ф., Нагель М. А.//ДАН СССР. 1983. Т. 272. № 3.
С. 417-420.
42. Мягченков В. А., Куренков В. ф., Нагель М. А. и др.//Химия и хим. технол. 1987.
Т. 30. № 9. С. 108-110 (Изв. вузов).
43. Мягченков В. А., Русяева В. А., Савельева С. Д. и др.//Пром-сть синтетического
каучука. 1975. № 5. С. 8-11.
44. Нагель М. А., Куренков В. ф., Мягченков В. А.//ЖПХ. 1986. Т. 59. № 7. С. 1579—1584.
45. Чуриков Ф. И., Нагель М. А., Куренков В. Ф. и др.//Исследование гидродинамики
сооружений для очистки природных и сточных вод. Казань: КХТИ, 1986. С. 34— 37.
46. Нагель М. А., Куренков В. Ф.//Физикохимия процессов синтеза и свойства поли-
меров. Горький: изд-во ГГУ, 1988. С. 108—106.
47. Небера В. П. Флокуляция минеральных суспензий. М.: Недра, 1983. 288 с.
48. Величанская Л. А., Соломениева Н. М., Запольский А. К.//Химия и технол. воды.
1987. Т. 9. №4. С. 317-320.
49. Игнатенко В. Г., Нарымская Р. А., Чернобережная Ю. А. и др.//Бум. пром. 1985.
№ 12. С. 20-21.
50. Bustamante Н„ RuterP. R.//Chem. Eng. Sci. 1987. V. 42. N 4. P. 809-812.
51. WagbergL., Lindstrom T.//Nord. Pulp. and. Paper Res. J. 1987. V. 2. P. 154—160.
52. Alesok G., Somasudaran P., Morgan L.//Power Technol. 1988. V. 54. N 2. P. 77 — 83.
53. Baranjak B.//Presem. Spoz. 1987. V. 41. N 7. P. 192—193.
54. Jin R., Hu W., Hou X//Colloid, nd Surfaces. 1987. V. 26. N 1. P. 317-331.
55. Ковалев А. А., Лебухов В. И., Денисова М. И.//Химия и технол. воды. 1989. Т. 11.
№ 5. С. 445-448.
56. Ковалев А. А., Лебухов В. И., Денисова М. И.//Колыма. 1989. № 7. С. 24—25.
57. Лебухов В. И., Ковалев А. А.//Химия и технол. воды. 1990. Т. 12. № 1. С. 21-26.
58. Аксельруд Г. А., Берлин А. А., Кисленко В. Н. и др.//Химияи технол. воды. 1990.
Т. 12. № 1. С. 19-21.
ЗАКЛЮЧЕНИЕ
За последние 10-15 лет произошел значительный скачок в разви-
тии науки о полимерах, который прежде всего связан с расширением и
углублением научных представлений о процессах полимеризации и со-
полимеризации. Необходимость более углубленного подхода к анализу
процессов (со)полимеризации отчетливо просматривается и на при-
мере полимерных объектов, рассмотренных в данной монографии, -
полиакриламида и его производных. В частности, было показано, что в
ряде водно-органических и органических сред имеет место подвижное
динамическое равновесие между мономерной и ассоциированными
формами акриламида - ди-, три-, тетрамерами и олигомерными агре-
гатами. Поскольку ассоциированные и неассоциированные формы
мономера в общем случае обладают различной реакционной способ-
ностью в актах роста кинетических цепей, то отсюда следует важное
положение об усложненном характере самой схемы процесса полиме-
ризации, что отражается и на статистических параметрах образующих-
ся полимеров (прежде всего - на ММ, ММР и пространственной упоря-
доченности заместителей). Понятно, что осложненный характер про-
цесса по той же причине будет иметь место в тех же средах и в реак-
циях сополимеризации с участием (мет)акриламида в качестве сомо-
номера. К заметному усложнению полимеризации и сополимеризации
приводят и акты комплексообразования (мет)акриламида с компонен-
тами реакционной среды или с другим сомономером. Механизм про-
цесса синтеза заметно усложняется, если (со)полимеризация сопро-
вождается процессом гидролиза акриламида. В монографии рассмот-
рены и другие варианты осложненного характера полимеризации и со-
полимеризации акриламида с ионогенными мономерами, обусловлен-
ные неизоионностью и мультикомпонентностью системы, а также
гетерофазностью процесса. Теоретический и экспериментальный
анализ осложненных процессов (со)полимеризации с участием акрил-
амида трудоемок и сложен, но несомненно одно - экспериментальные
и теоретические исследования в этом направлении должны быть в
значительной мере интенсифицированы. В свете современных теорети-
ческих воззрений на процессы (со)полимеризации акриламида с
большой осторожностью следует относиться к значениям констант
(со)полимеризации - для осложненных („особых”) вариантов синтеза
они являются попросту некими усредненными или даже кажущимися
188
характеристиками процесса. Что касается процессов сополимеризации,
то переход от среднего состава макромолекул к кривым распределе-
ния по составу и микроструктуре макромолекул в принципе позво-
ляет проводить более достоверный анализ закономерностей процесса
сополимеризации. Несомненно, что учет конкретных осложняющих
факторов процесса (со)полимеризации акриламида и его производных
будет способствовать разработка рациональных технологий синтеза и
получению (со)полимеров с оптимальным комплексом полезных
свойств.
Научное издание
Абрамова Людмила Ивановна
Байбурдов Тельман Андреевич
Григорян Эльвира Петровна
Зильберман ЕхнэлНаумович
Куренков Валерий Федорович
Мягченков Виталий Алексеевич
ПОЛИАКРИЛАМИД
Редактор И.Ю. Соловьев
Художественный редактор Л.А. Леонтьева
Технический редактор АЛ Шелудченко
Корректор О.Е. Русакова
Набор выполнен в издательстве
на наборно-печатаюшей технике
ИБ 2616
Подписано в печать 06.12.91. Формат 60*88 1/16
Бумага офсетная № 1. Гарнитура Пресс-Роман
Печать офсетная
Усл. печ.л. 11,76. Усл. кр.-отт. 12,01. Уч.-изд.л. 13,99
Тираж 1400. Заказ 32 9 6 Цена 3 р. 80 к.
Ордена „Знак Почета” издательство „Химия”
107076, Москва, Стромынка, 21, корп. 2
Московская тип. № 9 НПО „Всесоюзная книжная палата”
Госкомпечати СССР
109033, Москва, Волочаевская ул., дом 40
ВНИМАНИЕ
ПРЕДПРИЯТИЙ И ОРГАНИЗАЦИЙ!
Издательство ’’Химия” предлагает публикацию в книгах
рекламы:
- новых видов продукции предприятий
- машин и оборудования для химической промышлен-
ности
- научных разработок в области химии
- новых технологий
Стоимость 1 полосы опубликованного рекламного
материала 1,5-3 тыс. руб. в зависимости от тиража и вида
издания.
Адрес издательства ’’Химия”:
107076, Москва, Стромынка, д. 21, корп. 2
Телефон: 268-57-34
268-29- 78
В книжном магазине № 21 ’’Книги по химии” по адресу:
198147, Санкт-Петербург, Московский пр., 54 можно приоб-
рести за наличный и безналичный расчет, а также наложен-
ным платежом книгу:
Химические реактивы и высокочистые химические ве-
щества. Каталог/О.А.Гольдина, Ю.С.Кузнецова, Т.Г.Иванова и
др. - 3-е изд., перераб. и доп. М.: Химия, 1990, 688 с. ISBN
5- 7245- 0527- 4 (в пер.). 4 р. 20 к.
Каталог включает более 12 тысяч наименований неоргани-
ческих и органических реактивов, выпуск которых освоен в
СССР. В Каталоге приведены химические формулы, квали-
фикации, номера ГОСТ или ТУ, номенклатурные номера, а
также десятичные коды по Общесоюзному классификатору
промышленной и сельскохозяйственной продукции. Объем
нового материала по сравнению с предыдущим изданием (2-е
изд. - 1983 г.) составляет около 50%.
Предназначен для широкого круга потребителей химичес-
ких реактивов и высокочистых веществ.