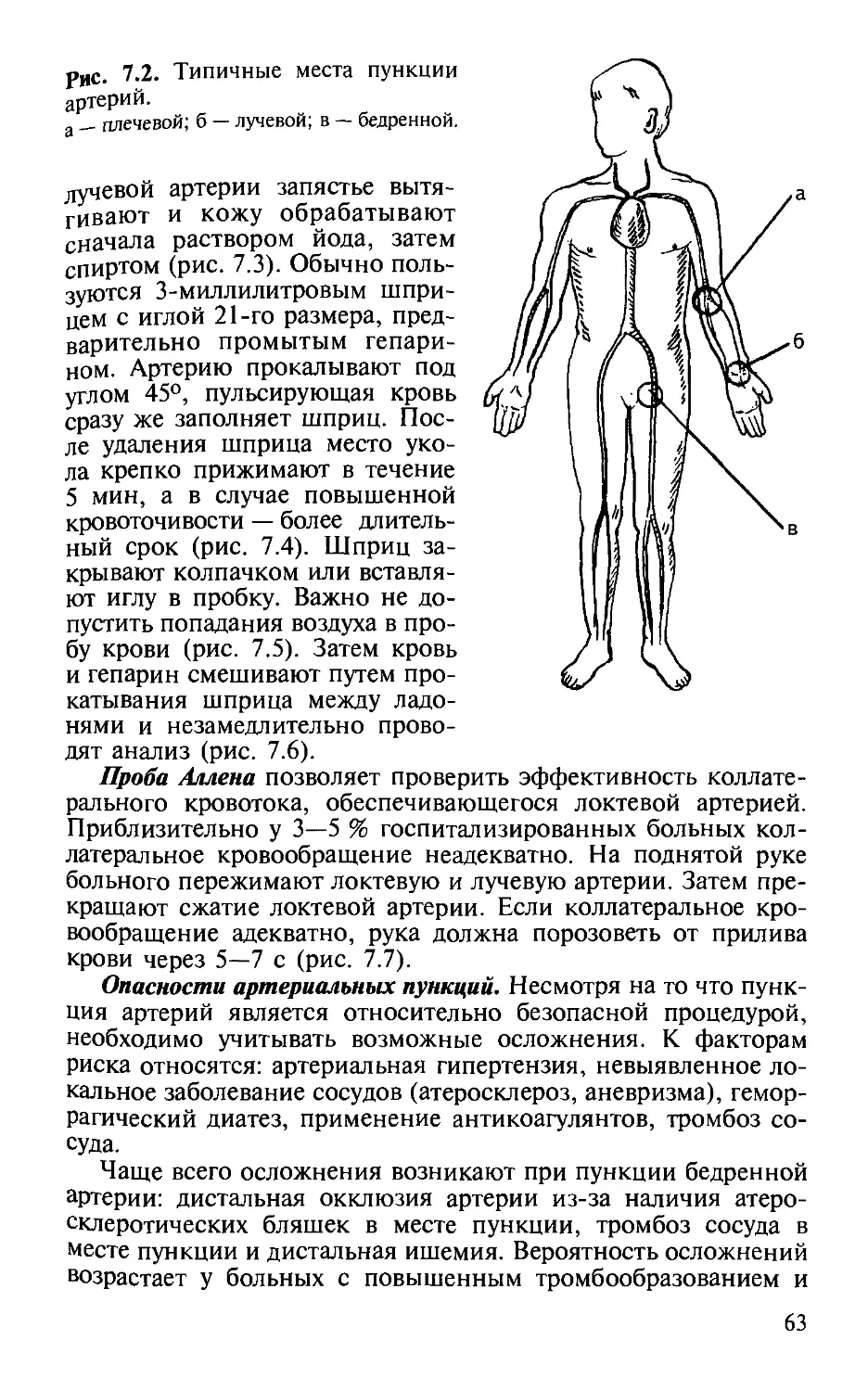
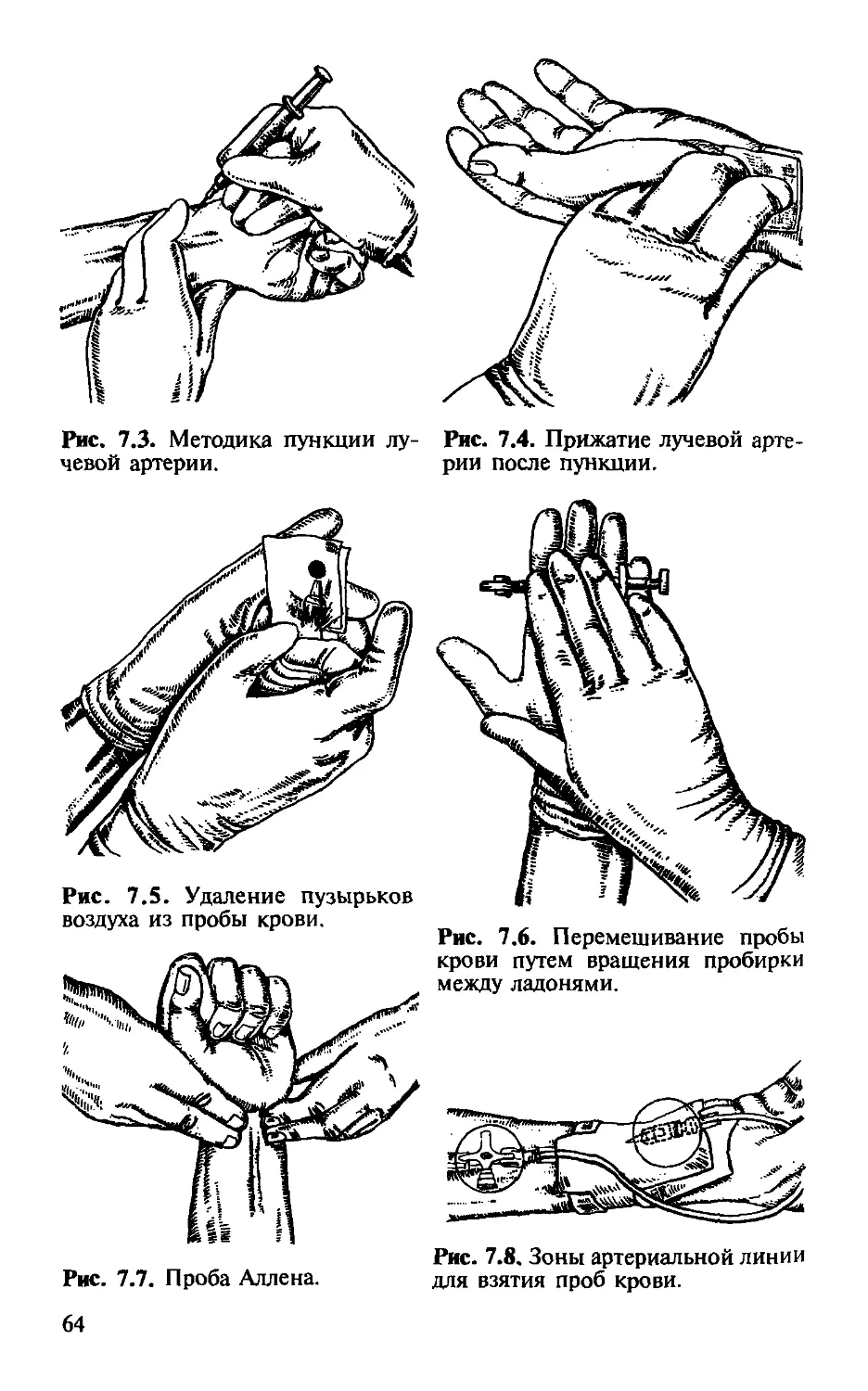
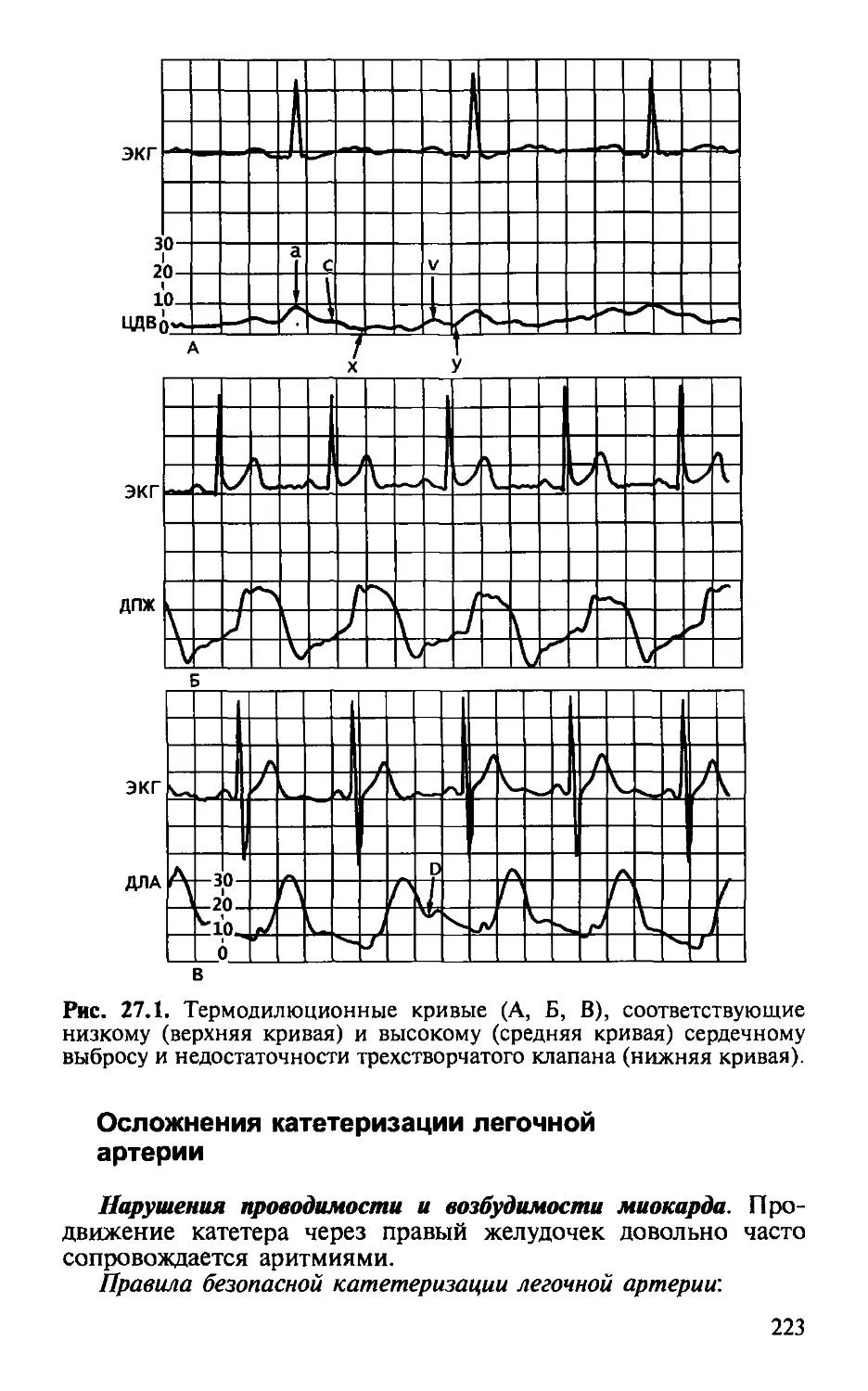
Автор: Малышев В.Д.
Теги: функциональные расстройства расстройства обмена веществ патологическая физиология формы развития заболеваний патогенез учение о происхождении заболеваний физиология сравнительная физиология хирургия медицина диагностика советы пособие лечение кислотно-основное состояние коррекция
ISBN: 5-225-04698-3
Год: 2005
<5<5r
Данный файл представлен исключительно
в ознакомительных целях.
Все авторские права на данный файл
сохраняются за правообладателем.
Любое коммерческое и иное использование
кроме предварительного ознакомления запрещено.
Публикация данного документа не преследует
никакой коммерческой выгоды. Но такие документы
способствуют быстрейшему профессиональному и
духовному росту читателей и являются рекламой
бумажных изданий таких документов.
Все авторские права сохраняются за правообладателем.
ПОСВЯЩАЕТСЯ
100-летию Российского государственного медицинского университета,
240-летию городской клинической больницы №4 г.Москвы
и 25-летию кафедры анестезиологии и реаниматологии РГМУ
Всеволод Дмитриевич Малышев - известный ученый, педагог, один из
виднейших анестезиологов-реаниматологов нашей страны. Окончил 2-ой
МОЛГМИ им. Н.И.Пирогова в 1951 г. В 1961 г. защитил кандидатскую, в
1968 г. - докторскую диссертации по актуальным проблемам анес-
тезиологии и реаниматологии.
Работал в крупных клиниках Центрального института усовер-
шенствования врачей, Институте сердечно-сосудистой хирургии АМН
СССР и Российском государственном медицинском университете,
создал и возглавлял курс, а затем кафедру анестезиологии и
реаниматологии с 1974 по 1999 г. Под его руководством защищены 28
кандидатских и 4 докторские диссертации.
Автор более 200 научных трудов, в том числе 10 монографий и
руководств.
Основное направление научной деятельности автора и его коллектива -
интенсивная терапия критических состояний. Большой популярностью
пользуются книги, написанные в соавторстве с коллегами: «Интенсивная
терапия острых водно-злектролитных нарушений» (1985), «Острая
дыхательная недостаточность» (1989), пособие для врачей
«Интенсивная терапия. Реанимация. Первая помощь» (2000), первое в
России руководство для врачей «Интенсивная терапия» (2002), в
котором обобщены основные положения этой новой отрасли медицины,
учебник для студентов медицинских вузов «Анестезиология и
реаниматология» (2003).
Учебная литература для студентов
медицинских вузов
В.Д. МАЛЫШЕВ
^Сислотно-основное
состояние
и водно-электролитный
баланс
в интенсивной терапии
Рекомендуется Учебно-методическим
объединением по медицинскому
и фармацевтическому образованию вузов России
в качестве учебного пособия для студентов
медицинских вузов
К
Москва
«Медицина»
2005
УДК 616-008.82+616-092:612.014.462.6]-08-039.72
ББК 54.5
М34
Рецензенты:
И.Г. Бобринская — зав. кафедрой анестезиологии и реанимато-
логии МГМСУ, д-р. мед. наук, профессор; В.А. Михельсон —
д-р. мед. наук, профессор кафедры хирургических болезней дет-
ского возраста педиатрического факультета РГМУ, академик
РАМН
Малышев В.Д.
М34 Кислотно-основное состояние и водно-электролитный
баланс в интенсивной терапии: Учебное пособие. — М.:
ОАО «Издательство «Медицина», 2005. — 228 с.: ил. —
(Учеб. лит. Для студ. мед. вузов). ISBN 5-225-04698-3
В учебном пособии представлены современные подходы к диагнос-
тике и лечению острых нарушений кислотно-основного состояния и
водно-электролитного баланса. Уделено внимание методам коррекции
выявленных нарушений, инфузионно-трансфузионной терапии, оказа-
нию медицинской помощи при неотложных состояниях (шок, септичес-
кий синдром, лактат- и кетоацидоз, отек легких, недостаточность кро-
вообращения, почечная недостаточность, кровотечение и др.). Сформу-
лированы вопросы и даны краткие ответы, позволяющие усвоить
синдромные нарушения при различных клинических состояниях.
Для студентов медицинских вузов, врачей отделений интенсивной
терапии и реанимации и других специальностей.
ББК 54.5
ISBN 5-225-04698-3 © В.Д. Малышев, 2005
Все права авторов защищены. Ни одна часть этого издания не может
быть занесена в память компьютера либо воспроизведена любым спосо-
бом без предварительного письменного разрешения издателя.
ОГЛАВЛЕНИЕ
Предисловие. — В.Д.Малышев..................................... 7
Основные сокращения, символы и понятия. — В.Д.Малышев 9
Введение. — ВД.Малышев..................................... 14
Часть I. Кислотно-основное состояние
Глава 1. Физиологические аспекты. — ВД.Малышев......... 16
Глава 2. Дыхательные (газовые) и метаболические компо-
ненты кислотно-основного состояния. — В.Д. Ма-
лышев..................................................... 21
Глава 3. Первичные нарушения дыхательного компонента
кислотно-основного состояния. — ВД.Малышев. ... 29
Глава 4. Метаболический ацидоз. — ВД.Малышев............... 35
Глава 5. Метаболический алкалоз. — ВД.Малышев....... 46
Глава 6. Современное оборудование для анализа кислотно-
основного баланса, газов крови и других парамет-
ров лабораторной экспресс-диагностики неотлож-
ных состояний. — В. А. Торшин............................. 51
Глава 7. Забор проб для исследования цельной крови. —
И. В. Веденина...................................... 60
Вопросы и ответы. — ВД.Малышев, И.В.Веденина 66
Список литературы................................... 75
Часть II. Водно-электролитный баланс
Глава 8. Физиологические аспекты водного и электролит-
ного обмена. — ВД.Малышев................................. 77
Глава 9. Расстройства водного и электролитного обмена. —
ВД.Малышев................................................ 88
Глава 10. Расстройства обмена калия. — В.Д.Малышев.. 102
Глава 11. Расстройства обмена магния. — ВД.Малышев .... 106
Глава 12. Расстройства обмена кальция. — ВД.Малышев. . . . 109
Глава 13. Расстройства обмена фосфора. — ВД.Малышев ... 113
Глава 14. Острая почечная недостаточность. — ВД.Малышев 117
Вопросы и ответы. — ВД.Малышев..................... 126
Список литературы.................................. 133
Часть III. Недостаточность кровообращения
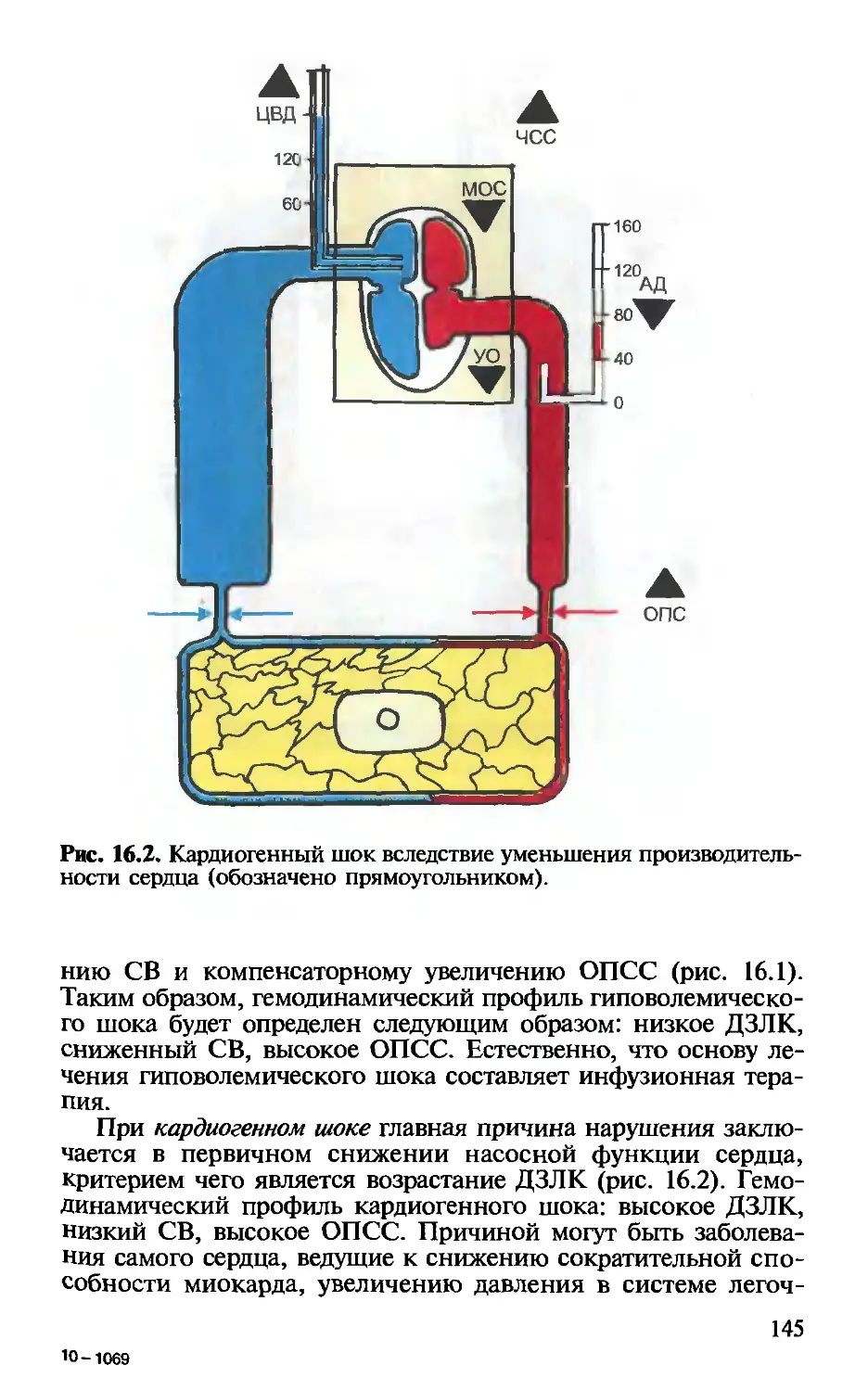
Глава 15. Инвазивный мониторинг и параметры централь-
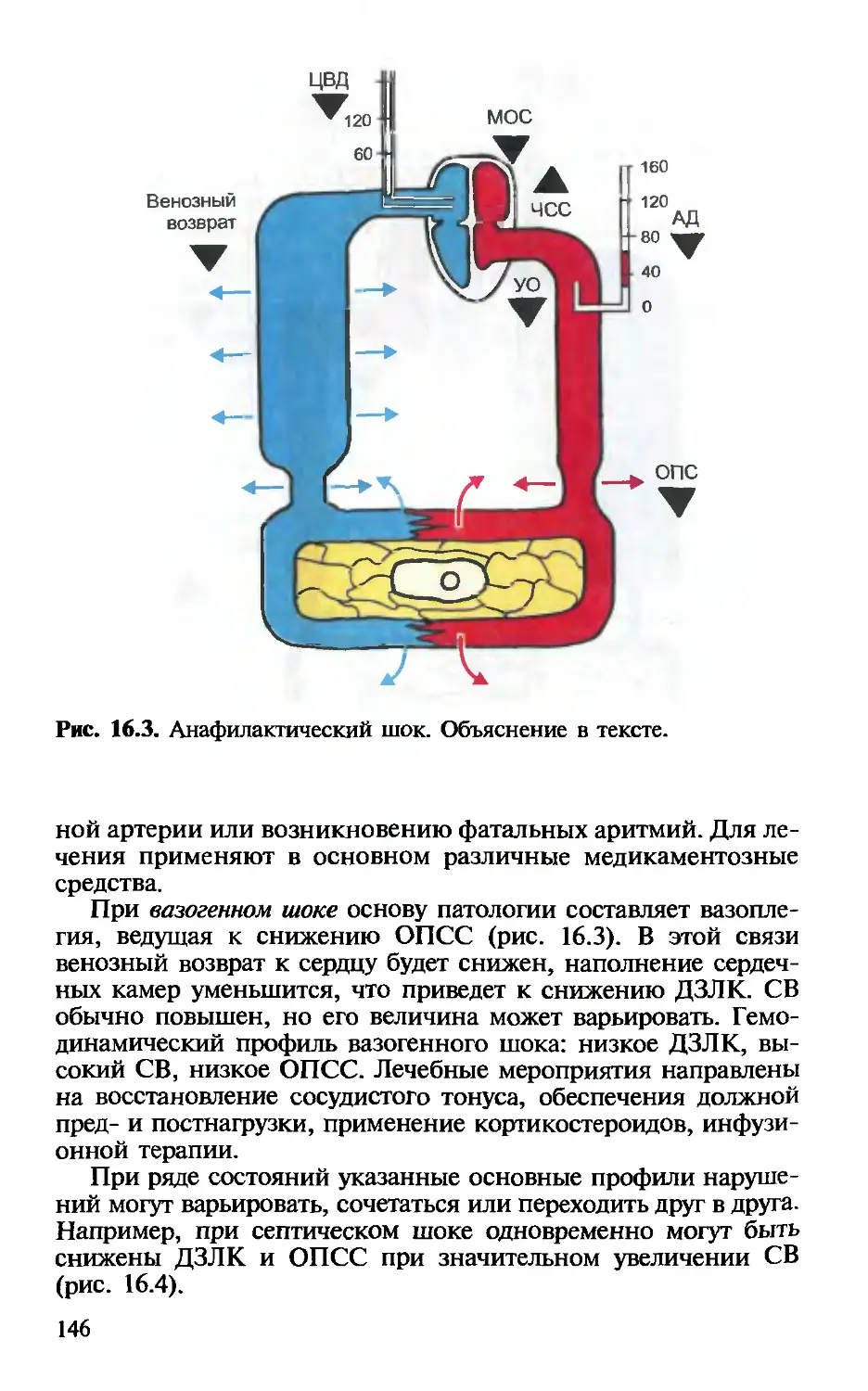
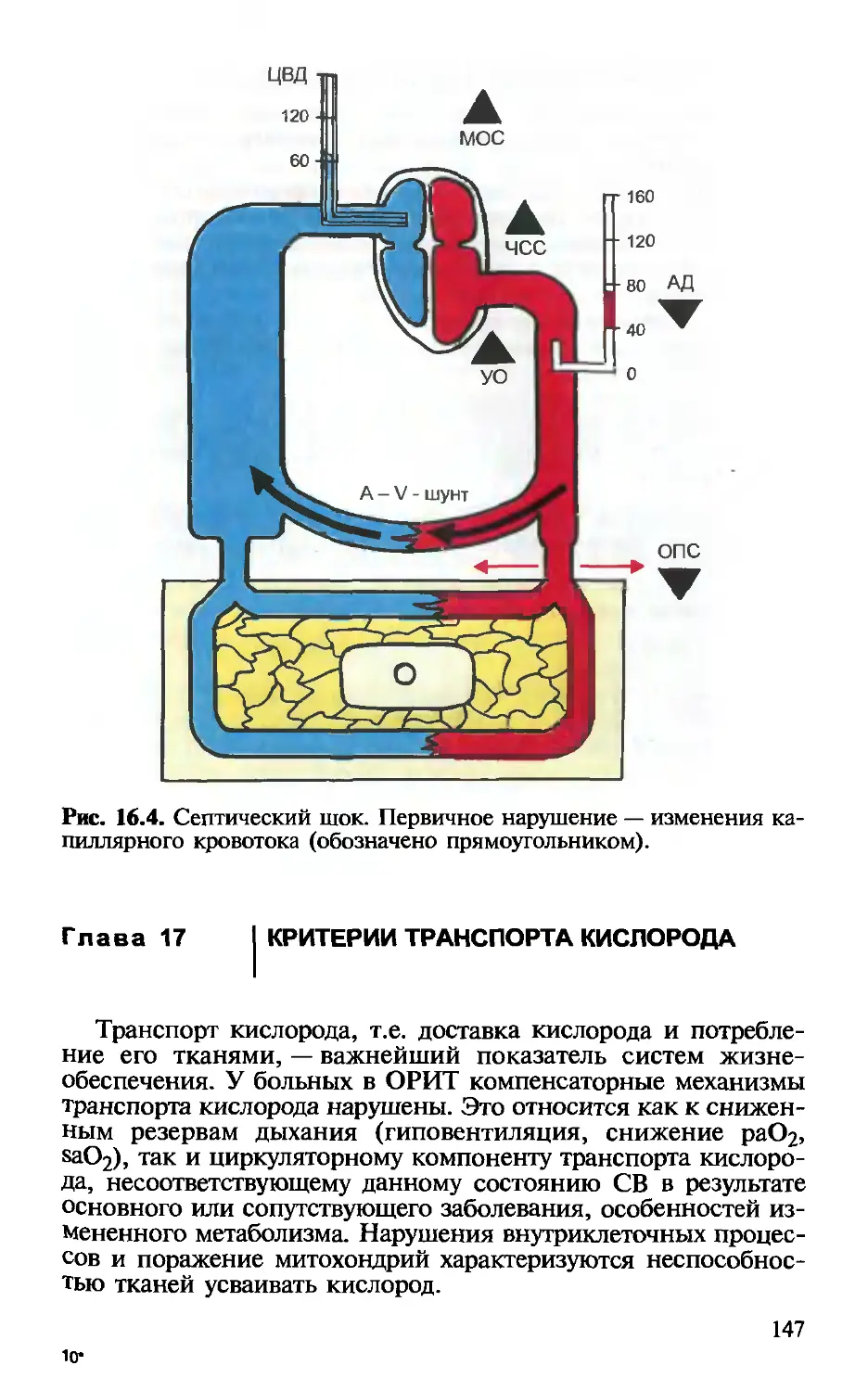
ной гемодинамики. — ВД.Малышев, А.П.Плесков . 135
Глава 16. Неинвазивный мониторинг центральной гемоди-
намики. — В.Д.Малышев, С.В.Свиридов.................... 142
Глава 17. Критерии транспорта кислорода. — ВД.Малышев . 147
5
Глава 18. Острая сердечная недостаточность. — ВД.Малы-
шев, И.В.Веденина........................................ 151
Глава 19. Кардиогенный отек легких. — ВД.Малышев....... 155
Глава 20. Терапия недостаточности кровообращения. —
В.Д.Малышев, И.В.Веденина................................ 159
Глава 21. Антиаритмическая терапия. — ВД.Малышев,
И.В.Веденина............................................. 165
Глава 22. Острая надпочечниковая недостаточность. —
ВД.Малышев............................................... 171
Вопросы и ответы. — ВД.Малышев, И.В.Веденина 176
Список литературы.............................. 181
Часть IV. Инфузионно-трансфузионная терапия
Глава 23. Применение кристаллоидных растворов в прак-
тике интенсивной терапии. — ВД.Малышев,
Х.Т.Омаров............................................... 184
Глава 24. Использование коллоидных растворов в практике
интенсивной терапии. — ВД.Малышев, Х.Т.Омаров 189
Глава 25. Клинические аспекты трансфузионной терапии. —
ВД.Малышев............................................... 199
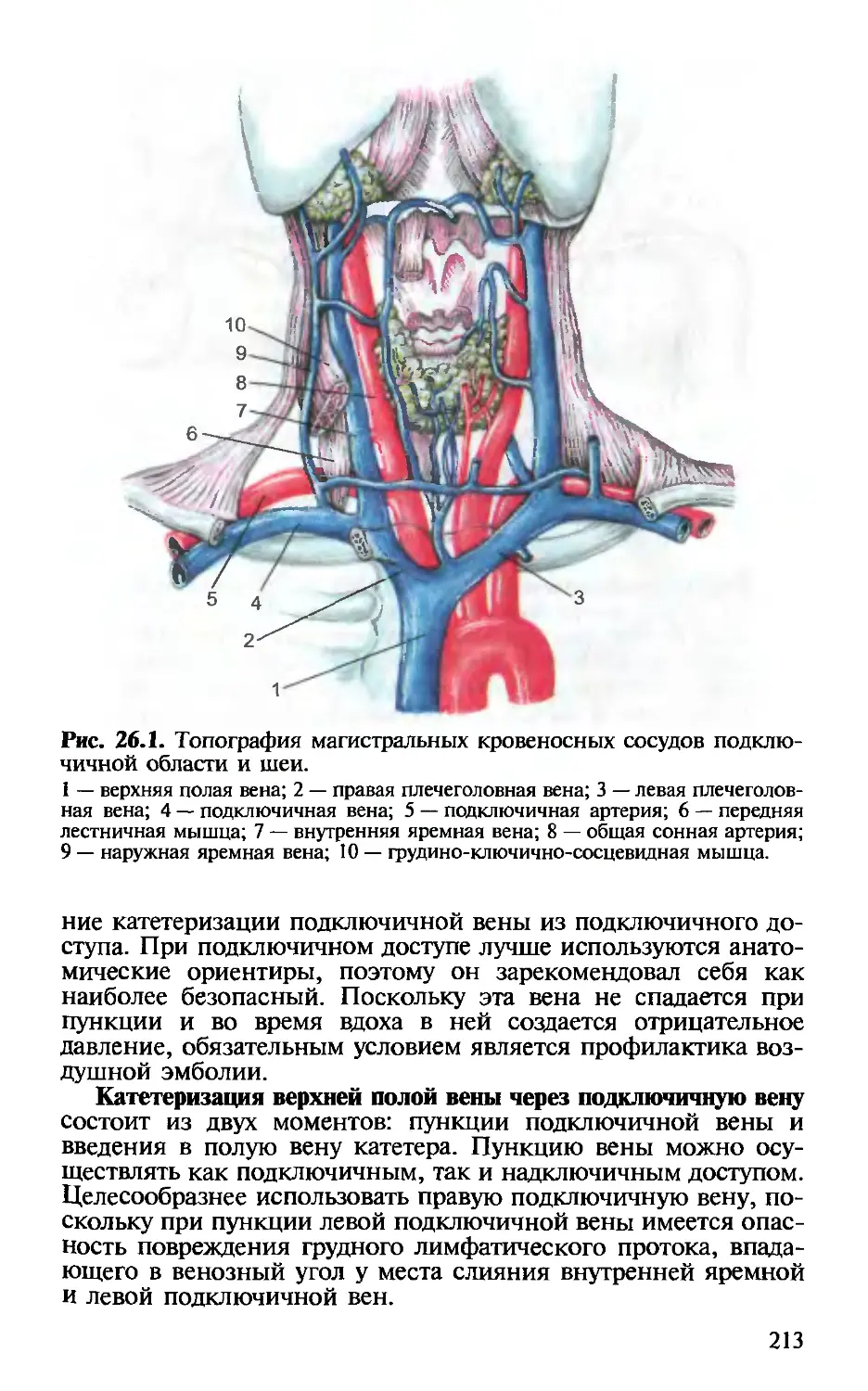
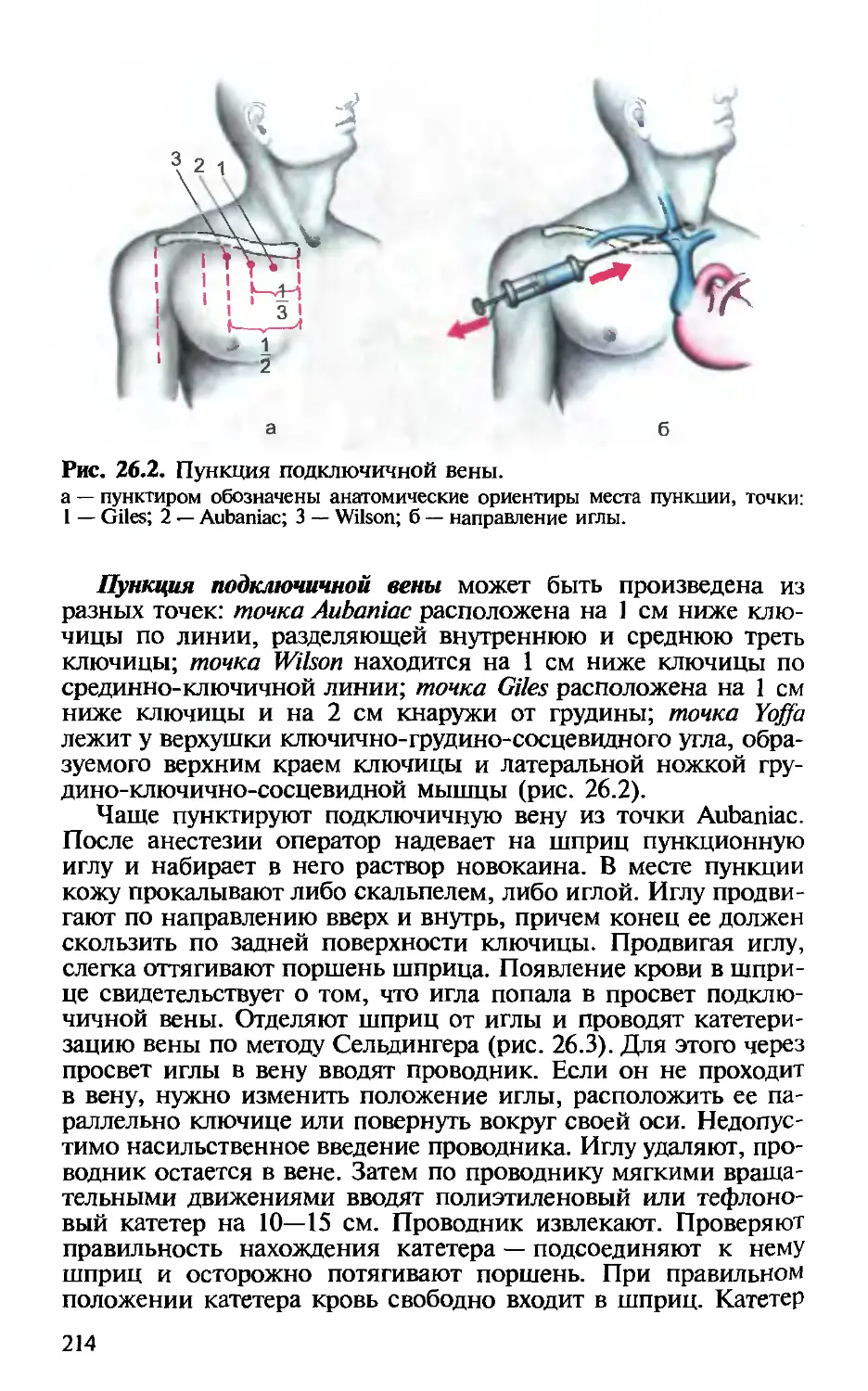
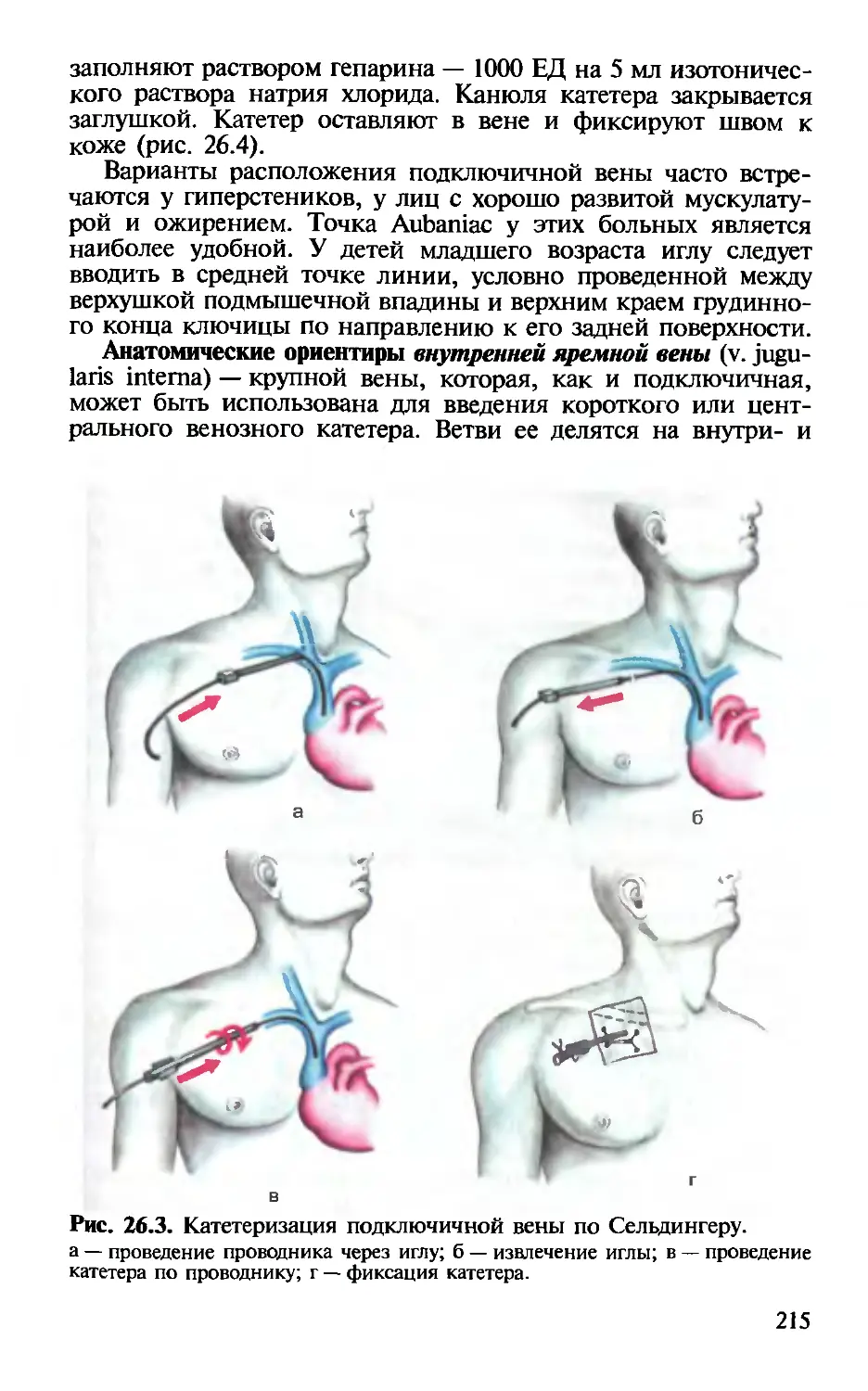
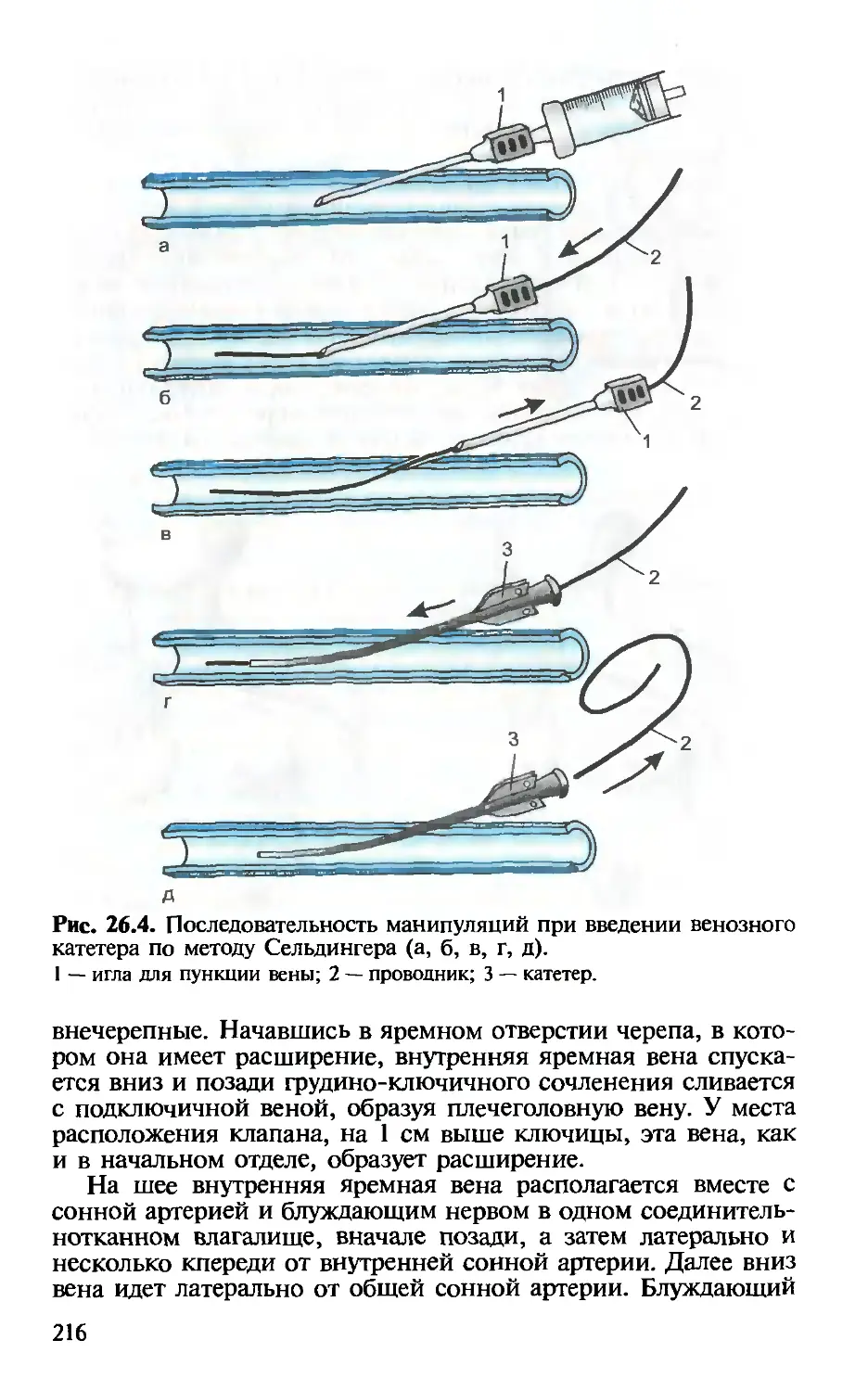
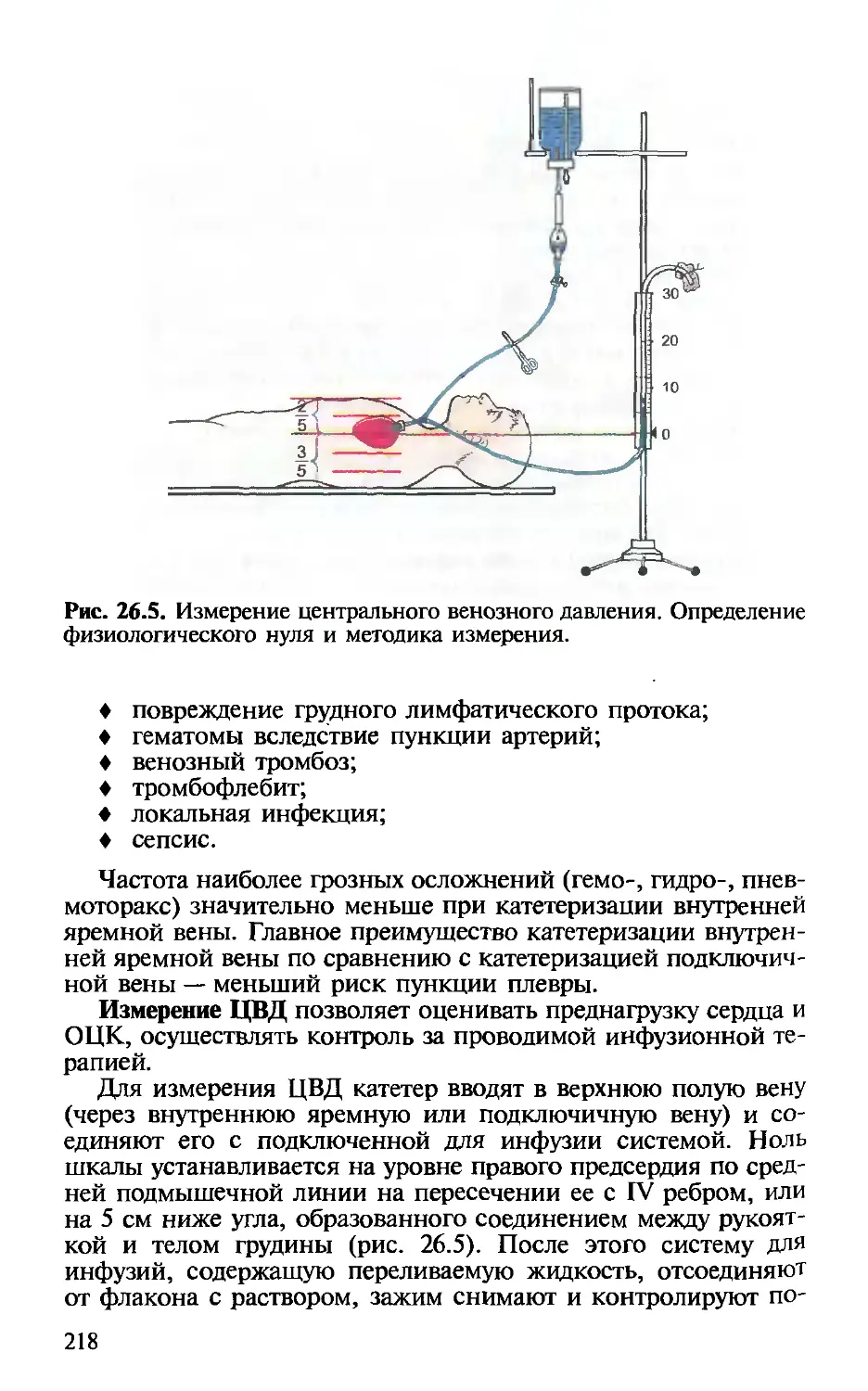
Глава 26. Катетеризация центральных вен. — Х.Т.Омаров,
И.В.Веденина............................................. 211
Глава 27. Катетеризация легочной артерии. — А.П.Плесков,
ВД.Малышев............................................... 219
Вопросы и ответы. — ВД.Малышев................. 225
Список литературы.............................. 229
Часть V. Алгоритмы неотложных лечебных мероприятий
Глава 28. Диагностика и терапия метаболических наруше-
ний кислотно-основного состояния. — В.Д. Ма-
лышев ................................................... 230
Глава 29. Проблема лечения острой гипоксемии и гипер-
капнии при обструктивных заболеваниях легких. —
ВД.Малышев............................................... 236
Глава 30. Острый приступ бронхиальной астмы. — ВД.Ма-
лышев ................................................... 239
Глава 31. Острая гипотензия. — ВД.Малышев, И.В.Веденина 242
Глава 32. Острый генерализованный сепсис и септический
шок. — ВД.Малышев, В.А.Бочаров................. 249
Глава 33. Анафилактический шок. — ВД.Малышев, В.А.Бо-
чаров.......................................... 254
Глава 34. Острая печеночная недостаточность. — ВД.Малы-
шев...................................................... 256
Глава 35. Показания к неотложному гемодиализу. — ВД.Ма-
лышев.................................................... 261
Глава 36. Нарушения водного, электролитного и кислотно-
основного баланса у хирургических больных. —
ВД.Малышев..................................... 265
Вопросы и ответы. — ВД.Малышев, И.В.Веденина 278
Список литературы.............................. 283
ПРЕДИСЛОВИЕ
Нарушения кислотно-основного состояния и водно-элек-
тролитного баланса являются скорее правилом, чем исключе-
нием у больных, находящихся в отделениях интенсивной те-
рапии. Всегда, когда имеется дисфункция важнейших систем —
респираторной, сердечно-сосудистой и почечной, становится
невозможной ауторегуляция баланса кислот, оснований,
электролитов и воды. Будучи нераспознанными и неустранен-
ными, расстройства водно-электролитного обмена и кислотно-
основного состояния во многом предопределяют исход лече-
ния основного заболевания.
Учебное пособие состоит из 5 частей. В первой части посо-
бия излагаются современные критерии экспресс-диагностики
различных форм нарушений кислотно-основного состояния,
их этиология, патогенез, клинические проявления и лечение.
Во второй части рассматриваются часто встречающиеся в прак-
тике интенсивной терапии нарушения баланса воды и натрия,
гипо- и гиперосмолярные синдромы, расстройства обмена
калия, магния, кальция и фосфатов. Большое внимание уделе-
но центральной и почечной регуляции водно-электролитного
обмена, диагностике и лечению различных клинических нару-
шений.
В третьей части пособия обсуждаются современные методы
гемодинамического мониторинга, необходимого для диагнос-
тики гиповолемических и сердечно-сосудистых нарушений. На
основании данных инвазивного и неинвазивного мониторинга
выделены клинические формы (профили) гемодинамических
нарушений, позволяющие определить наиболее рациональную
тактику интенсивной терапии того или иного состояния.
В четвертой части пособия изложены проблемы современ-
ной парентеральной жидкостной и трансфузионной терапии.
Показаны возможности управления жидкостным балансом,
сердечным выбросом, сосудистым сопротивлением для созда-
ния наиболее оптимальных условий транспорта кислорода —
главного критерия адекватности интенсивной терапии.
В пятой части пособия представлены алгоритмы неотлож-
ных действий при различных угрожающих жизни состояниях.
Разделы заканчиваются контрольными вопросами и ответа-
ми на них. В краткой форме представлены основные положе-
ния, вытекающие из изложенного материала.
7
Цель учебного пособия — изложение в доступной форме
современных научных положений синдромных нарушений кис-
лотно-основного и водно-электролитного баланса при имею-
щемся тяжелом основном заболевании. Руководство предна-
значено для студентов медицинских вузов, клинических орди-
наторов и интернов, специализирующихся по анестезиологии
и реаниматологии, а также для широкого круга врачей различ-
ных специальностей, особенно для врачей интенсивной тера-
пии, скорой медицинской помощи.
Выражаю благодарность доцентам кафедры анестезиологии
и реаниматологии Российского государственного медицинско-
го университета И.В.Ведениной и Х.Т.Омарову, принимавшим
участие в написании отдельных глав, техническом и иллюстра-
тивном оформлении пособия, а также фирме “Радиометр”
(Дания) и ее представителю В.А.Торшину за содействие в ос-
вещении современных технических средств диагностики рес-
пираторных и метаболических нарушений кислотно-основного
состояния.
Профессор В.Д.Малышев
ОСНОВНЫЕ СОКРАЩЕНИЯ, СИМВОЛЫ И ПОНЯТИЯ
АВ-блокада АДсР- АКТГ АР АЧТВ — атриовентрикулярная блокада — среднее артериальное давление — адренокортикотропный гормон — анионная разница — активированное частичное тромбопластиновое время
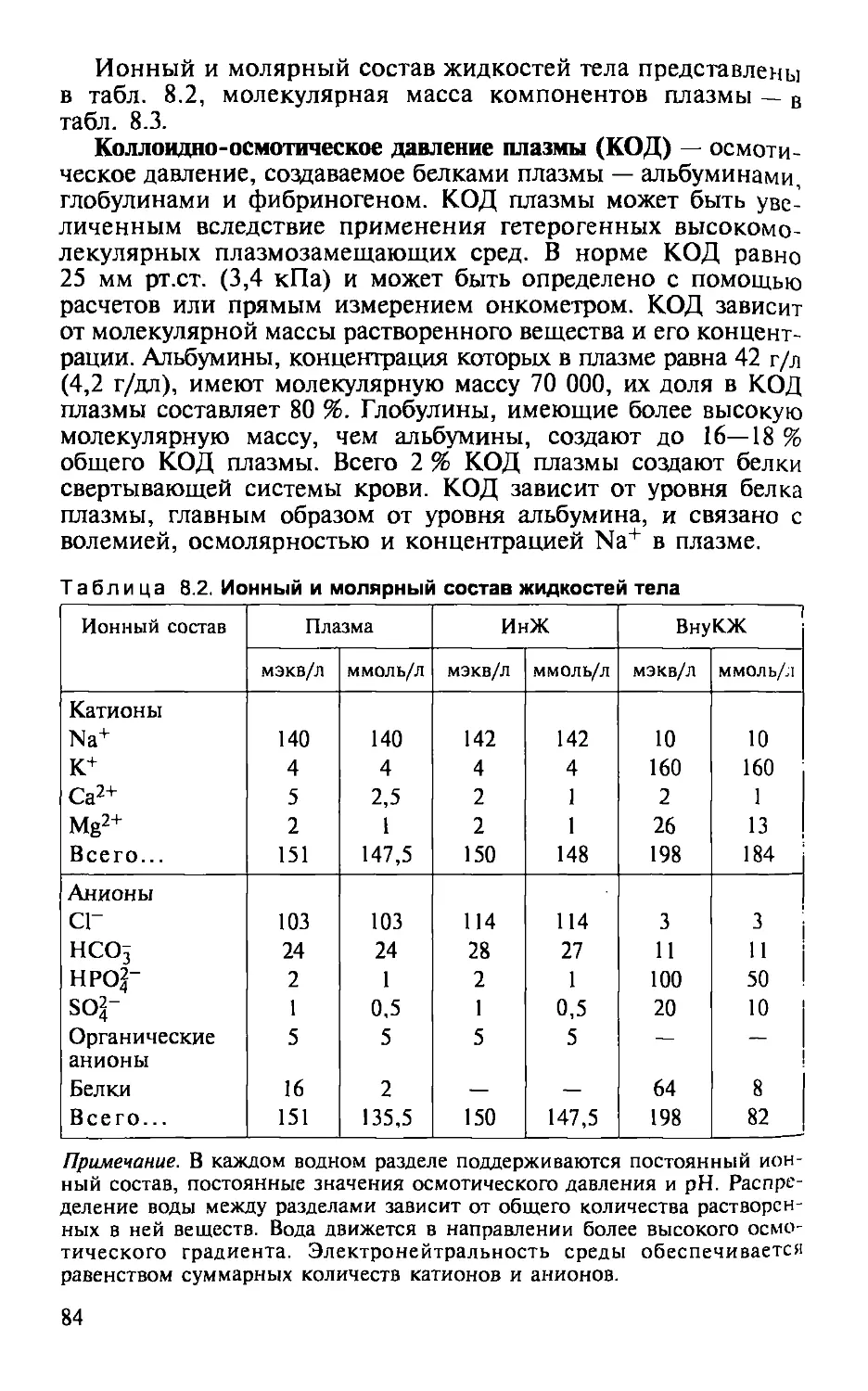
Белки плазмы, г/л Буферы — общий белок 65—85, альбумин 37—50, глобулин 20—30, фибриноген 2—4 — смеси слабых кислот и их солей, поддерживаю- щие постоянный pH раствора
BE ВнеКЖ ВнуКЖ Гематокрит (Ht) — избыток или дефицит буферных оснований — внеклеточная жидкость — внутриклеточная жидкость — отношение объемов эритроцитов и плазмы, вы- ражается в процентах или в виде десятичной дроби (единица СИ). Нормальные величины: у мужчин 40—54 % (0,40—0,54), у женщин 37-47 % (0,37-0,47)
Гипертонический раствор Гипотонический раствор ДЗЛА ДЗЛК ДЛА ДНЛЖ До (VT) ЖЕЛ жкт жт ИВЛ Изотонический раствор ИнЖ — раствор, который обладает более высокой по сравнению с плазмой осмолярностью — раствор, имеющий меньшую по сравнению с плазмой осмолярность — давление заклинивания в легочной артерии — давление заклинивания в легочных капиллярах — давление в легочной артерии — давление наполнения левого желудочка — дыхательный объем — жизненная емкость легких — желудочно-кишечный тракт — желудочковая тахикардия — искусственная вентиляция легких — раствор, который имеет одинаковую с плазмой осмолярность — интерстициальная жидкость
9
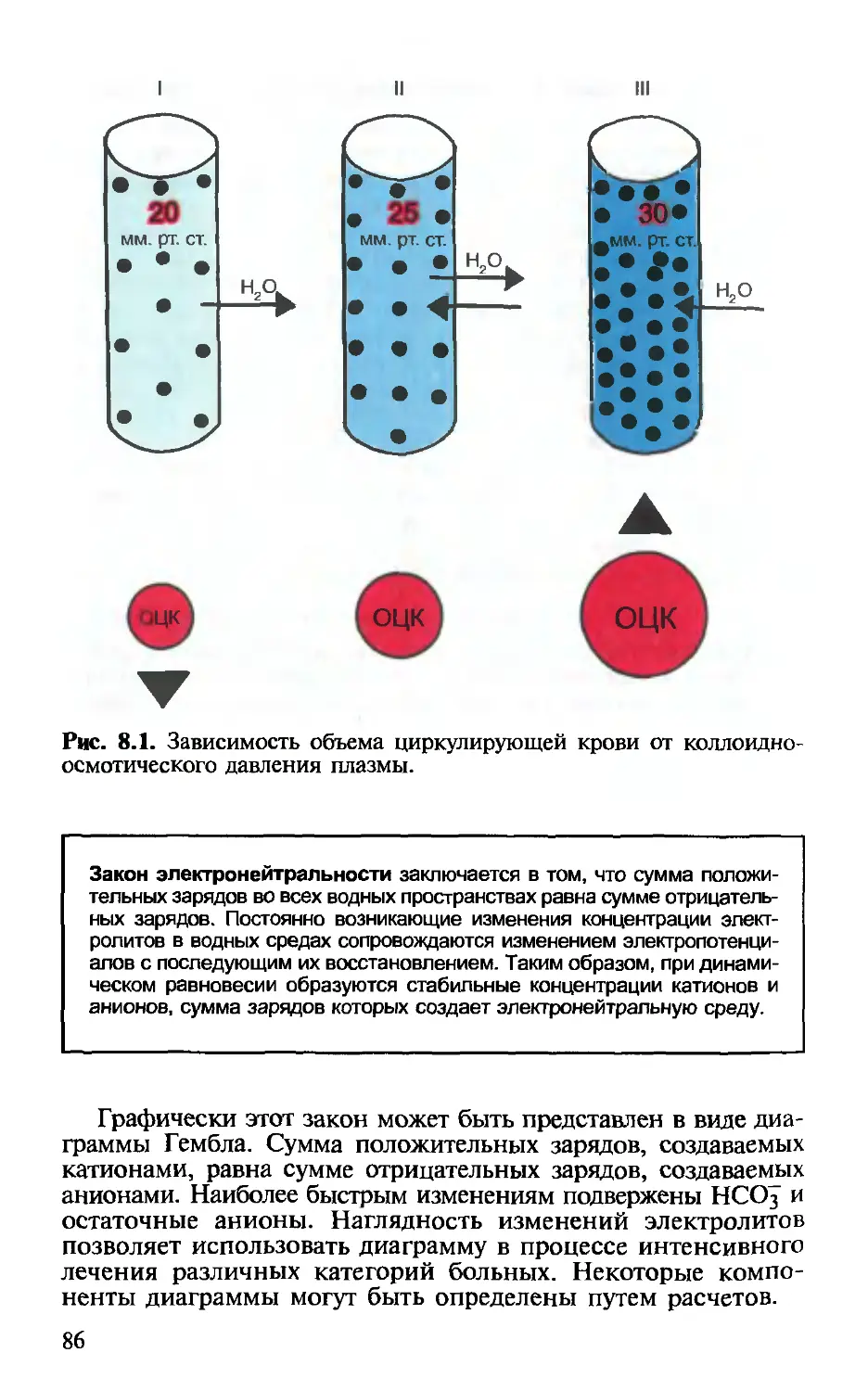
ИУРЛЖ ИУРПЖ кдд код — индекс ударной работы левого желудочка — индекс ударной работы правого желудочка — конечное диастолическое давление — коллоидно-осмотическое (онкотическое) давле- ние, определяется степенью участия белков в осмолярности. КОД плазменных белков состав- ляет 25 мм рт.ст. Несмотря на незначительную величину, оказывает существенное влияние на распределение воды между плазмой и межтка- невой жидкостью
кос — кислотно-основное состояние (процесс образо- вания и выделения кислот)
кПа и мм рт.ст. — единицы измерения давления. Чтобы перевести кПа в мм рт.ст. следует величину давления в кПа умножить на 7,5. Чтобы перевести мм рт.ст. в кПа следует величину давления в мм рт.ст. разделить на 0,133
ммоль/л — обозначение концентрации вещества. 1 ммоль равен количеству миллиграммов вещества, со- ответствующему атомной или молекулярной массе
Моляльный раствор Молярный раствор МОС МП мэкв/л — содержит 1 моль растворенного вещества в 1 кг растворителя (моль/кг) — содержит 1 моль растворенного вещества в 1 л раствора (1 моль/л) — минутный объем сердца — мертвое пространство — обозначение концентрации электролитов, их заряда. 1 мэкв предполагает количество элект- ролита, эквивалентное его положительному или отрицательному заряду. Для одновалентных ионов (Н+, К+, Na+) значения моль и мэкв не изменяются (1 ммоль = 1 мэкв), для много- валентных ионов они будут другими (для Са2+ 1 ммоль = 2 мэкв и т.д.). 1 мэкв = относитель- ная атомная или молекулярная масса/валент- ность
Нормальный раствор одн ОПН ОПСС — содержит 1 грамм-эквивалент растворенного вещества в 1 л раствора — острая дыхательная недостаточность — острая почечная недостаточность — общее периферическое сосудистое сопротивле- ние
Осмоль — единица осмотического давления, которая упот- ребляется в биологии. Осмоль — это осмоти-
10
ческое давление — 1 моль вещества в 1 л раст- ворителя. 1 мл этого раствора содержит 1 мил- лиосмоль, сокращенно мосмоль (моем)
ОСМОЛЯЛЬНОСТЬ — обозначается в мосм/кг Н2О. В биологических жидкостях разница между осмолярностью и ос- моляльностью невелика
Осмолярность плазмы — составляет в среднем 290 мосм/л. Зависит в ос- новном от количества электролитов, при этом на долю натрия приходится примерно % ос- молярности плазмы. Обозначается мосм/л
Осмос — проникновение растворителя в раствор, кото- рый отделен полупроницаемой мембраной
Осмотическое давление — определяется количеством свободных частиц, соприкасающихся с мембраной, и не зависит от заряда ионов, выраженных в миллиэквива- лентах. Обозначения мосм/л и мэкв/л равно- значны только для одновалентных ионов. Для многовалентных ионов расчет концентрации раствора в мосм/л производится путем деления величины концентрации в мэкв/л на валентность
ОССН ОЦК оцп пв пг ПОН РДСВ РЛЖ св СИ УО ЦВД ЦГД чсс чтв Электролиты — острая сердечно-сосудистая недостаточность — объем циркулирующей крови — объем циркулирующей плазмы — протромбиновое время — простагландины — полиорганная недостаточность — респираторный дистресс-синдром взрослых — работа левого желудочка — сердечный выброс — сердечный индекс — ударный объем — центральное венозное давление — центральная гемодинамика — частота сердечных сокращений — частичное тромбопластиновое время — соли, кислоты, основания, диссоциирующие в водном растворе на ионы
АВЕ — концентрация титруемых оснований крови (ак- туальный избыток оснований)
Anion Gap Anion Gap (K+) cCa2+, [Ca2+] — разница концентраций Na+ и СГ + НСО3‘ — разница концентраций К+ + Na+ и СГ + НСО3 — концентрация ионов кальция в плазме
11
сСГ, [Cl ] cGlu — концентрация ионов хлора в плазме — концентрация глюкозы в плазме — 0,8— 1,2 г/л; 4,44—6,66 ммоль/л
c Lak cK+, [K+] cNa+, [Na+] ctHb — концентрация лактата в плазме — концентрация ионов калия в плазме — концентрация ионов натрия в плазме — концентрация общего гемоглобина (содержа- ние в крови): у мужчин 135—175 г/л; 8,4— 10,9 ммоль/л; у женщин 120 — 160 г/л; 7,4 — 9,9 ммоль/л
ctO2 — общая концентрация кислорода крови (содер- жание кислорода)
caO2 do2 FiO2 — содержание кислорода в артериальной крови — доставка кислорода — фракционная концентрация кислорода во вды- хаемом (ингалируемом) воздухе (дыхательной смеси)
FHbF — фракция фетального гемоглобина в общем ге- моглобине
FHHb, FRHb — фракция деоксигемоглобина в общем гемогло- бине
FMetHb FO2Hb H+ — фракция метгемоглобина в общем гемоглобине — фракция оксигемоглобина в общем гемоглобине — ион водорода (протон). В норме концентрация Н+ в крови равна 0,000040 ммоль/л, или 40 нмоль/л, что соответствует pH 7,40
[H+] Het — концентрация ионов водорода — фракция объема эритроцитов к объему цельной крови
paO2 — парциальное давление кислорода в артериаль- ной крови
paCO2 — парциальное давление углекислого газа в арте- риальной крови
pH — отрицательный десятичный логарифм молярной концентрации водородных ионов, величина активной реакции крови. pH артериальной кро- ви 7,40 (7,35—7,45), венозной крови 7,37 (7,32— 7,42). pH = -log[H+]
pCO2 pO2 p50 — напряжение двуокиси углерода — напряжение кислорода — напряжение кислорода при 50 % насыщении крови
12
Рх — напряжение экстракции кислорода артериаль- ной крови
saO2 — насыщение гемоглобина артериальной крови кислородом
SBC, сНСОз (Pst) — концентрация гидрокарбоната в плазме при
стандартных условиях (стандартный бикарбонат)
SBE, cBase (Ecf) — концентрация титруемых оснований внеклеточ- ной жидкости (стандартный избыток основа- ний)
cHCOj sO2 — концентрация ионов гидрокарбоната в плазме — насыщение гемоглобина кислородом
ВВЕДЕНИЕ
Для успешного лечения нарушений водного, электролитно-
го и кислотно-основного состояния (КОС), наблюдаемых
почти у всех пациентов отделений интенсивной терапии, хотя
и важно, но совершенно недостаточно одного лишь клиничес-
кого наблюдения и общего обследования. Фактически невоз-
можно обойтись без динамических измерений pH, раС>2,
раСС>2, электролитов, осмолярности, уровней глюкозы, моче-
вины, лактата и кетоновых тел. Для правильной оценки ука-
занных синдромных нарушений необходимо учитывать данные
анамнеза, историю настоящего заболевания, физикального об-
следования и состояние основных систем жизнеобеспечения:
функции ЦНС, дыхательной и сердечно-сосудистой систем,
почек. Выявление нарушений КОС, служащих примером хо-
рошо сбалансированной системы, требует особой осторожнос-
ти в трактовке обнаруженных отклонений, поскольку позволя-
ет ошибочно диагностировать ацидоз при имеющемся алкало-
зе, недооценить значение дополнительных факторов при
смешанных формах нарушений. Правильный диагноз наруше-
ния КОС не может быть поставлен без исследования электро-
литов крови и (нередко) мочи. Избыток или дефицит свобод-
ной воды, расстройства натриевого и калиевого обмена сами
по себе, независимо от основного заболевания, могут привести
к летальному исходу.
В пособии изложены теоретические и практические аспекты
нарушений КОС, их интерпретация и коррекция, представле-
ны формы нарушений баланса воды и электролитов, их этио-
логия, клинические проявления и лечение, освещены вопросы
выявления и лечения недостаточности кровообращения, иг-
рающей важную роль в возникновении нарушений водно-
электролитного баланса и КОС, обсуждаются критерии аде-
кватности инфузионно-трансфузионной терапии, представле-
ны алгоритмы неотложных лечебных мероприятий при различ-
ных состояниях, сопровождающихся нарушениями водного,
электролитного и кислотно-основного баланса. В конце каж-
дой части сформулированы вопросы и ответы, способствующие
лучшему усвоению материала.
После введения новой интернациональной системы единиц
измерения (СИ) попытка обозначать концентрации электроли-
тов только в миллимолях не увенчалась успехом. Полный пере-
14
ход на обозначения в миллимолях сложен, а иногда и невоз-
можен. В миллиэквивалентах обозначается заряд клеточных
мембран- С учетом закона электронейтральности (число поло-
жительных зарядов в растворе всегда соответствует числу от-
рицательных) расчеты анионной разницы (важнейшего крите-
рия КОС) проводятся только в миллиэквивалентах. В настоя-
щем пособии, как и во многих современных интернациональ-
ных изданиях, мы пользовались как системой единиц СИ, так
и ранее принятыми обозначениями (моль, мэкв, г/дл, г/л,
мг/дл, мм рт.ст., см водн.ст., кПа).
Безусловно, основные положения, освещенные в книге, не
могут считаться единственно правильным толкованием описы-
ваемых нарушений. Врач может принять их или не принять,
или использовать частично, поскольку в состоянии каждого
тяжелобольного множество загадок, которые требуют индиви-
дуального подхода. Авторы намеренно избегали рекомендовать
читателю большое количество источников литературы, а ото-
брали лишь фундаментальные, которые, по-нашему мнению,
наиболее полно освещают рассматриваемую проблему.
Часть I.
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
Глава 1 I ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ
Кислотно-основное состояние (КОС) — сбалансированный
процесс образования и выделения кислот. Кислотность зависит
от изменения компонентов, которые определяют концентра-
цию Н+ в жидкостных средах организма. Концентрацию водо-
родных ионов выражают в миллимолях/л (ммоль/л), наномо-
лях/л (нмоль/л) или миллиэквивалентах/л (мэкв/л) и наноэк-
вивалентах/л (нэкв/л).
Интегральный показатель КОС — pH, предложенный С.Се-
ренсеном в 1909 г., является отрицательным десятичным лога-
рифмом концентрации Н+. В норме концентрация Н+ в крови
составляет 0,000040 ммоль/л или 40 нмоль/л, что соответствует
pH 7,40. Содержание Н+ в плазме крови определяется отно-
шением рСО2 (в мм рт.ст.) и концентрации НСОу (в ммоль/л).
Это отношение можно выразить следующим образом:
Н+, нмоль/л = 24 х (рСО2/НСОз).
Представленное выше отношение известно как уравнение
Гендерсона (логарифмическая форма называется уравнением
Гендерсона — Гассельбаха) и используется для оценки точнос-
ти измерения КОС. Оно указывает на то, что содержание Н+
прямо пропорционально концентрации рСО2 и обратно про-
порционально концентрации HCOJ. Биологический смысл
компенсаторных процессов состоит в поддержании отношения
на постоянном уровне. При изменении одного из компонентов
отношения происходят соответственно изменения другого ком-
понента. При повышении уровня рСО2 возрастает содержание
НСОу, а снижение уровня рСО2 сопровождается снижением
содержания НСОу. Эти изменения представляют собой ком-
пенсаторные реакции, ограничивающие диапазон изменений
pH, но не всегда предотвращающие их. Таким образом, кис-
лотность зависит от изменений уровней компонентов, которые
определяют концентрацию Н+, а именно рСО2 и HCOJ. рСО2
регулируется легкими, а НСО^ в плазме регулируется почками.
Продукция летучих (угольная кислота) и нелетучих (фикси-
рованных) кислот. Потребление питательных веществ — бел-
ков, жиров и углеводов — приводит к продукции летучих и
фиксированных кислот. Первые удаляются из организма лег-
кими в виде двуокиси углерода (углекислого газа), вторые —
выводятся почками.
Суточная скорость продукции СО2 в клетках в здоровом
16
взрослом организме при основном обмене приблизительно
15 000 ммоль. Во время максимальной нагрузки продукция СО2
увеличивается в 20 раз, но компенсаторное гиперпноэ поддер-
живает рСО2 в жидкостях организма на относительно посто-
янном уровне. Во время тяжелого стресса (травма, операция,
шок) компенсаторные респираторные механизмы для поддер-
жания нормального уровня рСО2 могут оказаться недостаточ-
ными.
Если продукция СО2 превышает скорость выведения этого
газа, возникает гиперкапния, т.е. дыхательный ацидоз. Если
скорость выведения СО2 на каком-либо этапе превышает ско-
рость образования СО2, развивается гипокапния (дыхательный
алкалоз). Если же скорость продукции СО2 в тканях соответ-
ствует скорости элиминации этого газа легкими, то изменений
рСО2 в жидкостях организма не наступает (нормокапния).
В нормальных условиях источником энергии является аэро-
бный гликолиз:
СбН12Об + 6О2 -> 6СО2 + 6Н2О.
В результате реакции СО2 с водой образуется угольная кис-
лота, которая диссоциирует на Н+ и НСО3. Поскольку СО2
легко диффундирует через полупроницаемые мембраны, рСО2
во всех жидкостных средах организма приблизительно одина-
ково.
Суточная продукция нелетучих кислот, которые должны
выделяться из организма, в норме невелика и составляет у
здоровых взрослых от 70 до 100 ммоль. Уровень образующегося
СО2 примерно в 200 раз превышает уровень тяжелых кислот,
которые выделяются почками. Значительная разница между
скоростью образования и выделения СО2 и метаболических
кислот оказывает влияние на КОС. Вслед за гиповентиляцией
почти немедленно возникает респираторный ацидоз. Однако
после прекращения почечной функции потребуется несколько
дней, чтобы изменить кислотность плазмы до такой же сте-
пени.
В условиях анаэробного гликолиза, часто сопровождающего
различные состояния (шок, кровопотеря, остановка сердца),
количество образующихся тяжелых кислот может быть чрезвы-
чайно большим.
Роль дыхательной системы в поддержании нормального газо-
обмена и КОС. Главная функция системы дыхания заключается
в доставке воздуха в альвеолы легких, что обеспечивает газо-
обмен с кровью легочных капилляров. Доставляется кислород
и удаляется СО2, поддерживается оптимальное функциониро-
вание клеток во всех тканях и органах. Дыхательная система
поддерживает оптимальные уровни кислорода и СО2 в артери-
альной крови. Механизмы регуляции газообмена включают
17
2-1069
альвеолярную вентиляцию и соотношение вентиляция/крово-
ток. Содержание СО2 в атмосферном воздухе практически
равно нулю. Эффективную альвеолярную вентиляцию можно
рассчитать следующим образом:
VA = VE х рЕСО2/раСО2,
где Vc — минутный объем дыхания,
рЕСО2 — парциальное давление СО2 в выдыхаемом газе,
раСО2 — парциальное давление СО2 в артериальной крови.
Нормальный минутный объем дыхания зависит от пола,
возраста, антропометрических данных. Он составляет прибли-
зительно 6,5 л/мин и равен дыхательному объему (=380 мл),
умноженному на частоту дыхания (в среднем 17 в 1 мин).
Кислород требуется для химических реакций, в результате
которых образуется энергия, потребляемая клетками и всем
организмом. Кислород участвует в биосинтезе АТФ и является
необходимой субстанцией для поддержания жизнедеятельнос-
ти организма. Молекулы АТФ служат универсальным источни-
ком энергии для большинства клеточных функций.
Большая часть поглощенного легкими кислорода в процессе
метаболизма превращается клетками в СО2 и воду. Существует
прямая связь между потреблением кислорода и продукцией
СО2, которая выражается показателем дыхательного обмена и
дыхательным коэффициентом.
Аэробная энергия образуется при процессах, которые тре-
буют одновременного потребления кислорода. Напротив, анаэ-
робная энергия образуется без одновременного потребления
кислорода. В основном синтез АТФ происходит в результате
использования кислорода в дыхательной цепочке, находящейся
в митохондриях живых клеток. Блокаторами последней ступе-
ни переноса электронов по дыхательной цепочке являются
окись углерода и цианид.
В анаэробных условиях для синтеза АТФ могут быть ис-
пользованы углеводы. При расщеплении 1 моля глюкозы или
гликогена образуется 2—3 моля АТФ. При аэробном обмене (в
присутствии кислорода) на каждый моль глюкозы образуется
38 моль АТФ (полный цикл Кребса). Таким образом, в усло-
виях аэробного обмена возникает значительно большее коли-
чество энергии, чем при анаэробном гликолизе.
В среднем атмосферное рО2 составляет 150 мм рт.ст., аль-
веолярное — 100—110 мм рт.ст., рО2 артериальной крови — 95
(80—110) мм рт.ст., рО2 смешанной венозной крови — 40—
45 мм рт.ст. В среднем внутриклеточное рО2 равно 20 мм рт.ст.
(в норме 5—40 мм рт.ст.). Уровень рО2, требуемый для аэро-
бного внутриклеточного метаболизма, равен 1—3 мм рт.ст. Для
безопасности доставки кислорода жизненно важным тканям
существуют широкие пределы нормального состояния. Мини-
18
альный уровень раО2, обеспечивающий нормальный внутри-
М,н*точный метаболизм у здорового человека, 55 мм рт.ст. [Анд-
Sre ГДж., Тобин МДж., 2003].
Центральная регуляция дыхания. Управляющие центры рас-
положены в стволе головного мозга. Наиболее важная часть
находится в продолговатом мозге. Они содержат нейроны, ко-
торые получают информацию от хеморецепторов, перифери-
ческих сенсорных рецепторов и коры головного мозга. В ре-
зультате обобщения информации создается эфферентный сиг-
нал, передаваемый на дыхательную мускулатуру и легкие, что
определяет уровни раО2 и раСО?. Центральные хеморецепторы
реагируют прежде всего на раСО2, а периферические — на
раО2. Последние расположены в каротидном синусе и аорте
(каротидные и аортальные тельца), стенках грудной клетки,
дыхательных путях и легких.
Роль почек в регуляции КОС. Почки непосредственно экс-
кретируют Н+ из кислой среды и HCOJ — из щелочной. При
снижении уровня бикарбоната в плазме проксимальные ка-
нальцы реабсорбируют его до концентрации 24 ммоль/л, в
результате чего восстанавливается бикарбонатный буфер (ме-
ханизм щажения оснований путем ионогенеза). На каждый
восстановленный ион НСОу с мочой экскретируется один
ион Н+. Значительное количество Н+ выделяется почками в
связанной форме в виде кислот. Экскреция Н+ почками очень
мала. За сутки почками в виде кислот и отдельных ионов
выделяется 100—200 ммоль Н+. Биологическое равновесие до-
стигается в том случае, если количество образованных в тканях
кислот равно количеству выделенных.
Буферные системы — это биологические жидкости организ-
ма. Их защитная роль в поддержании нормального pH клеточ-
ной и внеклеточной сред чрезвычайно велика.
Любая буферная система представляет собой смесь слабой
кислоты и ее соли, образованной сильным основанием. Попа-
дание в плазму сильной кислоты вызывает реакцию буферных
систем, в результате которой сильная кислота превращается в
слабую. То же происходит и при действии на биологические
жидкости сильного основания, которое после взаимодействия
с буферными системами превращается в слабое основание.
В результате указанных процессов изменения pH либо не на-
ступают, либо бывают минимальными.
Бикарбонаты обеспечивают 53 % буферной способности кро-
ви, 47 % их относятся к небикарбонатным системам: гемогло-
биновой (35 %), протеиновой (7 %) и фосфатной (5 %). Кровь
составляет только 1/з общей буферной емкости организма.
Бикарбонатная система. Происхождение бикарбонатной
системы тесно связано с метаболизмом органического углеро-
да. поскольку конечным продуктом его является СО2 или
НСО3 • Бикарбонатный буфер — главная и единственная сис-
2"
19
тема внеклеточной жидкости (ВнеКЖ). Образующаяся в клет-
ках СО2 вступает в реакцию с водой, в результате чего обра-
зуется угольная кислота, которая диссоциирует на Н+ и
НСО3. В определенных условиях (сдвиг реакции вправо или
влево) преобладает тот или иной тип реакции:
Н2О + СО2 Н2СО3 Н+ + НСО3.
СО2 выделяется через легкие, Н+ и НСО3 — через почки.
Существует ошибочное мнение, что приращение HCOJ во вре-
мя гиперкапнии происходит только в результате реакции почек
на первичное увеличение рСО2. Однако даже при полном от-
сутствии функции почек при острой гиперкапнии наблюдается
прирост НСО3. Установлено, что Н+ до некоторой степени
связываются небикарбонатными буферами, что поддерживает
реакцию и приводит к приращению НСО^:
НСО3 + Н+ + Buf BufH+ + НСО3.
Эта реакция, известная как “реакция взаимодействия” бу-
ферных систем организма, ответственна за повышение содер-
жания НСО3 в плазме при острой гиперкапнии [Adrogue H.J.,
Tobin MJ., 2003].
Гемоглобиновая система. Гемоглобин играет главную роль в
транспорте кислорода. В норме в 1000 мл артериальной крови
содержится приблизительно 200 мл кислорода. В этих случаях
молекула гемоглобина насыщена кислородом на 100 % (т.е.
150 г НЬ х 1,34 мл кислорода = 200 мл). В нормальных условиях
в периферических тканях высвобождается только 50 мл кисло-
рода из 1 л артериальной крови (25 % от полной величины,
называемой коэффициентом утилизации). Потребление кисло-
рода (VO2) в норме составляет около 250 мл/мин.
Содержание кислорода в артериальной крови — саО2 — это
объем кислорода, связанного с гемоглобином и находящегося
в растворенном состоянии:
саО2 = 1,34 х НЬ (г/л) х saO2 + 0,003 х раО2.
Нетрудно заметить, что влияние величины раО2 на содер-
жание кислорода в артериальной крови несущественно. Гораз-
до более информативным в оценке транспорта кислорода яв-
ляется показатель saO2. Сдвиг кривой диссоциации оксигемо-
глобина является важнейшим физиологическим механизмом,
обеспечивающим транспорт кислорода. Транспорт кислорода
из легких к тканям и из тканей к легким обусловлен измене-
ниями, которые воздействуют на сродство кислорода к гемо-
глобину. На уровне тканей из-за снижения pH это сродство
уменьшается (эффект Бора) и вследствие этого улучшается
отдача кислорода. В крови легочных капилляров сродство ге-
моглобина к кислороду увеличивается из-за снижения рСО2 и
возрастания pH по сравнению с аналогичными показателями
20
иозной крови, что приводит к повышению насыщения арте-
риальной крови кислородом.
" Протеиновая система. Белки плазмы крови — амфолиты —
обладают свойствами кислот. Они составляют большую часть
оуда анионов плазмы. Изменение содержания альбуминов, про-
теинов и аномальных белков плазмы оказывает существенное
влияние на величину анионной разницы (АР).
фосфатная система — это система, при которой первич-
ный и вторичный фосфаты имеют значение для внутриклеточ-
ного пространства и при повышении буферности мочи. Анио-
ны РО|~, как и органические кислоты, относятся к группе
неизмеряемых анионов, играющих важную роль в изменениях
метаболического компонента КОС.
Глава 2
ДЫХАТЕЛЬНЫЕ (ГАЗОВЫЕ)
И МЕТАБОЛИЧЕСКИЕ КОМПОНЕНТЫ
КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
.pH — отрицательный десятичный логарифм концентрации
Н+-ионов, величина активной реакции крови. В норме pH
артериальной крови 7,40 (7,35—7,45), венозной крови — 7,37
(7,32—7,42). Внутриклеточное значение pH 6,80—7,00.
раСОг — парциальное давление СО2 в артериальной крови,
респираторный компонент КОС. В норме рСО2 артериальной
крови равно 40 (35—45) мм рт. ст., венозной крови — 46 (41—
51) мм рт. ст. Показатель выше нормального уровня свидетель-
ствует о гиперкапнии, вызванной гиповентиляцией легких. По-
нижение раСО2 (гипокапния) обусловлено гипервентиляцией
легких.
НСО3 — содержание аниона бикарбоната в плазме крови,
метаболический компонент КОС. Средний нормальный уро-
вень НСОу 24 (22—26) ммоль/л. Увеличение содержания
НСО3 в плазме крови указывает на метаболический алкалоз, а
снижение — на метаболический ацидоз.
BE — избыток или дефицит оснований в крови, метаболи-
ческий компонент КОС. В норме нет ни избытка, ни дефицита
оснований, и BE равен нулю с диапазонами нормальных величин
У мужчин и женщин от —2,4 до +2,2 и от —3,3 до +1,3 мэкв/л.
Показатель означает количество щелочи или кислоты, которое
Должно быть добавлено к 1 л полностью оксигенированной in
v,tro крови с рСО2, равным 40 мм рт.ст. при 38 °C, чтобы достичь
нормального pH (7,40). Этот показатель обозначают символом
"Е- Символ анализатора — АВЕ.
_ Стандартный НСО3 — концентрация бикарбоната в плазме
“Робы крови, полностью насыщенной кислородом и in vitro
21
уравновешенный при 38 °C рСО2, равном 40 мм рт.ст. Его
средняя величина равна 24 ммоль/л, что идентично фактичес-
кому уровню HCOJ у пациента с рСО2, равным 40 мм рт.ст.
ВВ — величина буферных оснований в крови — сумма зна-
чений буферности плазмы и буферности гемоглобина. Буфер-
ность плазмы определяется суммой концентрации буферных
анионов — бикарбоната и белков — в плазме. Средняя нор-
мальная величина равна 41,7 мэкв/л.
ВВ плазмы = буферность HCOJ (24) + буферность белков
(17,7) = 41,7 мэкв/л.
ВВ плазмы = буферность плазмы (41,7) + буферность ге-
моглобина (0,42 х [НЬ]), где 0,42 — постоянный коэффициент,
который позволяет вычислить ВВ гемоглобина для каждого
грамма гемоглобина на 100 мл крови; [НЬ] — концентрация
гемоглобина (в г/дл). Если концентрация гемоглобина равна
15 г/дл, то сумма буферных оснований крови составит:
ВВ = 41,7 + (0,42 х 15) =41,7 + 6,3 = 48 мэкв/л.
Дыхательный компонент оценивается по уровню раСО2.
Для оценки метаболического компонента определяют: факти-
ческий HCOJ, стандартный уровень HCOJ или BE [Adroque H.J.,
Tobin M.J., 2003]. Эти три компонента КОС тесно взаимосвя-
заны, их изменения происходят одновременно в одном направ-
лении. Отношение между изменениями в стандартном HCOJ
и BE не полностью линейно. Так, при низком уровне гемо-
глобина крови изменения стандартного бикарбоната пример-
но соответствуют изменениям BE. При нормальной концент-
рации гемоглобина это соотношение может быть выражено как
Д[ВЕ] = 1,3 х Д стандартного [HCOJ].
Проверка точности определения параметров КОС осущест-
вляется путем анализа значений pH, раСО2 и HCOJ, их соот-
ветствия уравнению Гендерсона. Это особенно важно при
несоответствии величин pH, дыхательных и метаболических
компонентов.
Чтобы преобразовать значение pH в [Н+] в наномолях на
1 л (нмоль/л), пользуются правилом: для каждой 0,01 единицы
pH (ниже или выше нормальной величины) добавляют или
вычитают 1 нмоль/л (табл. 2.1). Нормальному значению pH
7,40 соответствует [Н+] 40 нмоль. Значениям pH 7,50 и 7,30
соответствуют [Н+] 30 и 50 нмоль/л. К сожалению, это правило
относительно точно для ограниченного диапазона изменений
pH от 7,20 до 7,60. Для более точной калькуляции значений
pH и [Н+] пользуются методом 80 % (метод 0,8). Необходимо
помнить, что значения pH 7,40 и 7,00 соответствуют [Н+] 40
и 100 нмоль/л. Точка отсчета pH 7,00.
Для того чтобы при увеличении pH на каждые 0,10 единицы
получить соответствующее значение [Н+], величину начально-
го [Н+] (100) умножают на 0,8. Таким образом, значение [Н+]
22
Таблица 2.1. Концентрация ионов водорода: перевод единиц pH
в нмоль/л [Спригинс Д. и др., 2000]
pH Концентрация ионов водорода, нмоль/л
0 1 2 3 4 5 6 7 8 9
7,0 99 97 95 93 91 89 87 85 83 81
7,1 79 78 76 74 72 71 69 68 66 65
7,2 63 62 60 59 58 56 55 54 53 51
7,3 50 49 48 47 46 45 44 43 42 41
7,4 40 39 38 37 36 35 35 34 33 32
7,5 31 30 30 30 29 28 28 27 26 26
7,6 25 25 24 23 23 22 22 21 21 20
для pH 7,10 будет равно 0,8 х 100 = 80 нмоль/л. Для того чтобы
рассчитать значение [Н+] для pH 7,20, величину 100 умножают
на 0,8 дважды:
0,8 х 0,8 х 100 = 64 нмоль/л.
При pH ниже 7,00 величину 100 умножают на 1,25. Таким
образом, при pH 6,90 величина [Hj составит: 100 х 1,25 =
= 125 нмоль. Значения [Н+] для pH 7,50, определенные опи-
санными выше методами, следующие: 1) правило “0,01" — pH
7,50 соответствует 30 нмоль/л; 2) метод 80 % — pH 7,50 соот-
ветствует 32 нмоль/л.
Коррекция артериального pH и газов крови с учетом тем-
пературы тела: при повышении на 1 °C pH ниже на 0,015,
раО2 — выше на 4,4 %, раСО2 — выше на 7,2 %; при пониже-
нии температуры на 1 °C — pH выше на 0,015, раО2 — ниже
на 4,4 %, раСО2 — ниже на 7,2 %.
Всегда учитывают концентрацию кислорода во вдыхаемом
воздухе вместе с раО2: фактически нормальное значение
раО2 при дыхании кислородом повышенной концентрации
является патологией! Нормальные значения раО2 могут под-
держиваться гипервентиляцией. РаО2 менее 60 мм рт.ст. (8
кПа) свидетельствует о респираторной недостаточности. Аб-
солютная величина раСО2 имеет меньшее значение, чем
отношение раСО2/рН. Сравните раСО2 и pH или постройте
график раСО2 против pH на номограмме. Учитывайте из-
быток оснований, чтобы подтвердить свой диагноз.
Анионная разница (АР). В основе клинического применения
показателя АР лежит предположение, что любой раствор,
включая плазму, должен быть электронейтральным, т.е. сумма
катионов равна сумме анионов. В случаях увеличения [Н+]
неравенство между измеряемыми в плазме концентрациями
23
катионов и анионов (дефицит анионов или АР) выйдет за
пределы нормального диапазона 9—13 мэкв/л. Плазма содер-
жит один главный измеряемый катион (Na+) и два главных
измеряемых аниона (Cl-, HCOJ). Вклад других измеряемых
катионов (К+, Са2+, Mq2+) невелик. Число остальных анионов
обычно не определяют. Неизмеряемые анионы состоят из бел-
ков плазмы (главным образом альбуминов), фосфатов, сульфа-
тов, лактатов, кетоновых кислот и других неизмеряемых ком-
понентов (например, лекарственные средства) (табл. 2.2). Зна-
чение АР, рассчитываемой по формуле:
АР = Na+ — (СГ + НСО3).
Этот показатель может быть полезен для выявления этио-
логии метаболического ацидоза.
Как правило, чем больше АР, тем легче определить причину
ацидоза. Ацидоз при увеличенной АР можно быстро диагности-
ровать по клинической картине и ограниченному числу биохи-
мических исследований (т.е. по уровням лактата, кетона и креа-
тинина в плазме). Высокая АР характерна для лактат-ацидоза,
вызванного анаэробным гликолизом. Диабетический кетоацидоз
и уремия также сопровождаются увеличением АР. Если при
высокой АР уровень лактата, кетона и креатинина нормаль-
ный, наиболее вероятно, что причиной ацидоза является прием
токсичных веществ (метанол, паральдегид, этанол и этиленгли-
коль, лекарственные средства). Высокий уровень салицилатов
в плазме сопровождается значительным увеличением АР.
Таблица 2.2. Анионная разница [по П. Марино, 1998]
Концентрация неизмеряемых анионов (НА), мэкв/л Концентрация неизмеряемых катионов (НК), мэкв/л
Белки 15 К 4,5
РО| 2 Са2+ 5
so|- 1 Mg2+ 1,5
Органические кислоты 5
Всего ... 23 И
АР = НА - НК = 12 мэкв/л
НА + (СГ + НСОр = Na+ + НК
НА - НК = Na+ - (СГ + НСО3)
Другие факторы, влияющие на АР. Гипоальбуминемия. Наи-
большую часть неизмеряемого пула анионов составляют белки,
поэтому даже небольшое снижение их концентрации в плазме
приводит к изменению АР. Уменьшение содержания в плазме
крови альбуминов на 50 % приводит к снижению АР на 5—
24
6 мэкв/л. При этом истинная величина АР будет превышать
измеренную АР на 5—6 мэкв/л.
Гипонатриемия. Одной из причин снижения АР является
гипонатриемия, но механизм данного феномена до конца не
изучен. Снижение концентрации натрия в крови может возни-
кать в результате гемодилюции — инфузии растворов, не со-
держащих натрий. Очевидно, что повышение в плазме двухва-
лентных катионов магния и кальция при гипонатриемии и
расход анионов хлора для поддержания нейтральности среды
также могут привести к уменьшению АР.
Газы артериальной крови. Анализ газов артериальной кро-
ви — универсальный метод оценки функции легких, в том чис-
ле респираторного компонента КОС.
Нормальные значения газов артериальной крови на уровне
моря:
раО2 = 95 + 5 мм рт.ст.
раСО2 = 40 ± 5 мм рт.ст.
saO2 = 97 ± 2 %.
Клинически выраженная гипоксемия возникает при раО2 ни-
же 60 мм рт.ст. и saO2 ниже 90 %. Гипоксемия может проявляться
в результате действия одного или нескольких механизмов:
♦ снижение парциального давления кислорода во вдыхае-
мом газе;
♦ альвеолярная гиповентиляция и апноэ;
♦ нарушение отношения вентиляция/кровоток;
♦ шунтирование крови справа налево.
Для того чтобы дать оценку рО2 крови, обычно исследуют
пробу артериальной крови, потому что она характеризует спо-
собность легких оксигенировать кровь. раО2 и saO2 — важней-
шие критерии транспорта кислорода от легких к тканям. раСО2
характеризует способность легких к элиминации СО2, а также
обеспечивает информацию о содержании СО2 во всей артери-
альной системе. рО2 и sO2 смешанной венозной крови —
показатели степени оксигенации всего коллектора венозной
крови после прохождения ее через капиллярное русло. Арте-
риовенозная разница по кислороду — важный показатель по-
требления кислорода тканями. рСО2 смешанной венозной
крови служит хорошим индикатором среднего уровня СО2 в
органах и периферических тканях. Произведение артериове-
нозной разницы HCOJ (ммоль/л) и сердечного выброса (СВ,
л/мин) позволяет рассчитать продукцию СО2 (ммоль/мин). Для
определения ежесуточной продукции СО2 следует эту величи-
ну умножить на 1440 мин. Если артериовенозная разница равна
2 ммоль/л, а СВ — 5 л/мин, то суточная продукция СО2
составляет: 2 ммоль/лх5 л/минх1440 мин/сут = 14 400 ммоль/суг
(=15 000 ммоль/сут).
25
Первичные изменения компонентов КОС
и компенсаторные реакции
Изменения КОС вначале происходят либо в респираторном,
либо в метаболическом его компонентах. В ответ на этот сдвиг
возникает компенсаторная реакция, направленная на преодо-
ление нарушения. При этом pH крови остается в пределах
нормальных колебаний или имеет незначительное отклонение
от нормы. Естественно, что эта компенсаторная реакция воз-
можна до какого-то предела; все зависит от компенсаторных
возможностей организма, главным образом от функции легких
и почек, силы первичного воздействия и времени, в течение
которого происходит этот процесс.
Компенсаторные реакции немедленного типа. Изменение
метаболического компонента КОС — дефицит или избыток ос-
нований — приводит к быстрой реакции со стороны дыхатель-
ной системы.
Снижение уровня НСО3 в плазме крови (метаболический
ацидоз), возникающее первично, компенсируется увеличением
легочной вентиляции и снижением раСО2, при этом соотно-
шение рСО2/НСОз остается неизменным. При тяжелом ме-
таболическом ацидозе стимуляция вентиляции легких доходит
до крайнего предела (раСО2 ниже 20 мм рт.ст. и даже ниже
10 мм рт.ст.), и дальнейшая компенсация становится невоз-
можной.
Увеличение содержания НСОу в плазме крови (метаболи-
ческий алкалоз), возникающее первично, сопровождается сни-
жением легочной вентиляции и увеличением раСО2. Следует
указать на относительность этой реакции. Как правило, выра-
женный дыхательный ацидоз не развивается. Тем не менее при
выраженном метаболическом алкалозе существует опасность
гиповентиляции и гиперкапнии.
Компенсаторные реакции замедленного типа обеспечивают-
ся функцией почек (аммониогенез, титрование Н+, реабсорб-
ция). Первичное снижение раСО2 (дыхательный алкалоз) по-
давляет реабсорбцию бикарбоната в канальцах почек, в резуль-
тате чего снижается содержание НСОу в плазме крови (мета-
болический ацидоз). Первичная гиперкапния сопровождается
реакцией небикарбонатных буферных систем, а следовательно,
уменьшением содержания Н+, увеличением реабсорбции би-
карбоната и содержания его в плазме крови.
Эти компенсаторные реакции в отличие от реакций немед-
ленного типа происходят длительное время (6 — 12 ч) и дости-
гают максимума через несколько суток. Быстрое возрастание
раСО2 (острый дыхательный ацидоз) не компенсируется по-
чками и может привести к летальному исходу без заметного
увеличения содержания бикарбоната в крови. В отличие от
26
острого медленно прогрессирующий дыхательный ацидоз (хро-
нический) компенсируется увеличением уровня бикарбоната в
крови и прямой угрозы для жизни не представляет (табл. 2.3).
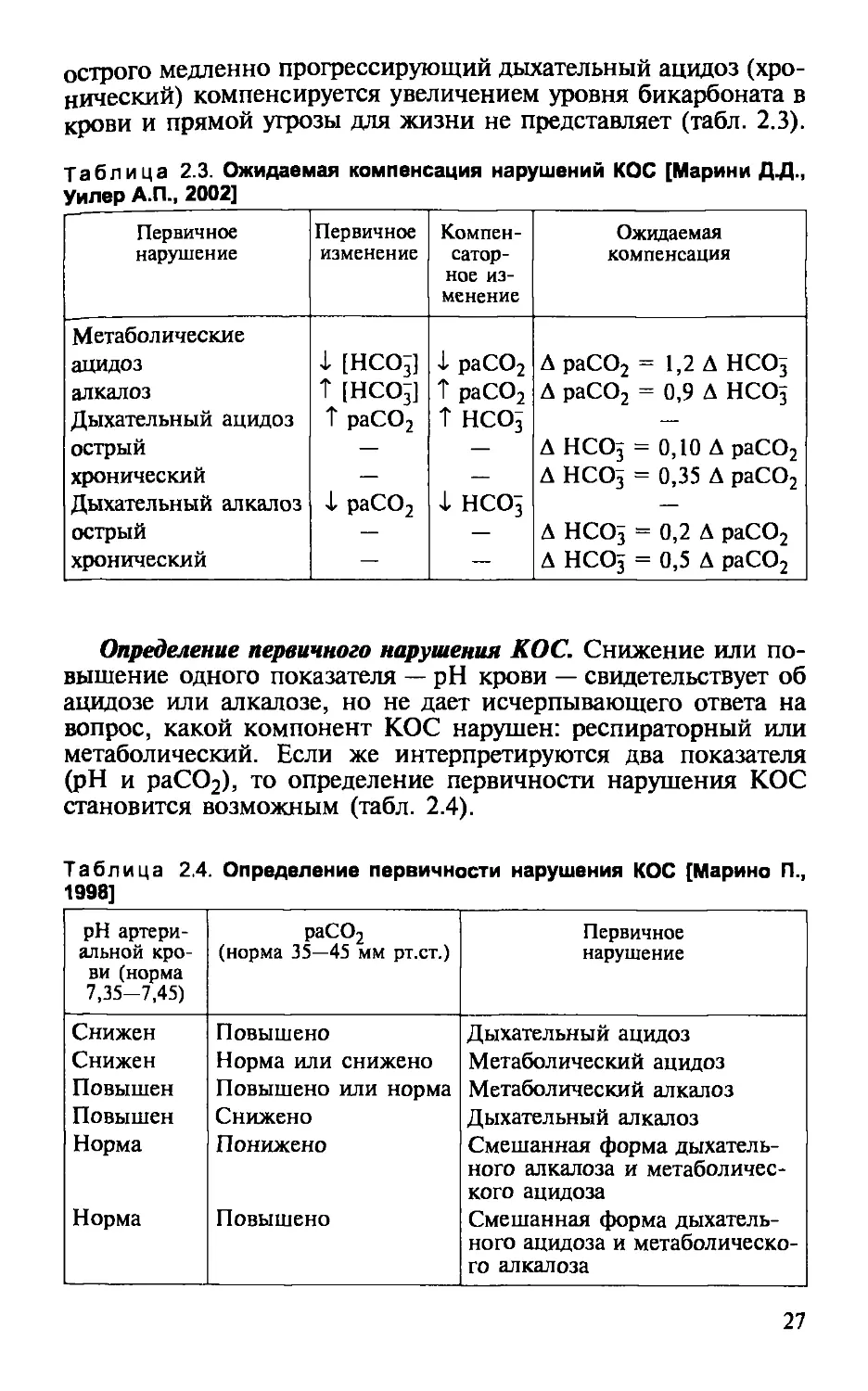
Таблица 2.3. Ожидаемая компенсация нарушений КОС [Марини ДД.,
Уилер А.П., 2002]
Первичное нарушение Первичное изменение Компен- сатор- ное из- менение Ожидаемая компенсация
Метаболические
ацидоз X [НСО3] 1 раСО2 Д раСО2 = 1,2 Д НСОз
алкалоз Т [НСО3] Т раСО2 Д раСО2 = 0,9 Д НСО5
Дыхательный ацидоз ? раСО2 ? НСО3 —
острый — — Д НСО3 = 0,10 Д раСО2
хронический — — Д НСО3 = 0,35 Д раСО2
Дыхательный алкалоз 1 раСО2 X НСОз —
острый — — Д НСОз = 0.2 д раСО2
хронический — — Д НСО3 = 0,5 Д раСО2
Определение первичного нарушения КОС. Снижение или по-
вышение одного показателя — pH крови — свидетельствует об
ацидозе или алкалозе, но не дает исчерпывающего ответа на
вопрос, какой компонент КОС нарушен: респираторный или
метаболический. Если же интерпретируются два показателя
(pH и раСО2), то определение первичности нарушения КОС
становится возможным (табл. 2.4).
Таблица 2.4. Определение первичности нарушения КОС [Марино П.,
1998]
pH артери- альной кро- ви (норма 7,35-7,45) раСО2 (норма 35—45 мм рт.ст.) Первичное нарушение
Снижен Снижен Повышен Повышен Норма Норма Повышено Норма или снижено Повышено или норма Снижено Понижено Повышено Дыхательный ацидоз Метаболический ацидоз Метаболический алкалоз Дыхательный алкалоз Смешанная форма дыхатель- ного алкалоза и метаболичес- кого ацидоза Смешанная форма дыхатель- ного ацидоза и метаболическо- го алкалоза
27
Нормальная величина pH и нормальный уровень раСО2
могут свидетельствовать о том, что КОС полностью компен-
сировано, но при этом не исключаются смешанные метаболи-
ческие ацидозы/алкалозы. В этих случаях весьма полезно оп-
ределение АР.
Смешанные формы метаболических нарушений характерны
для пациентов ОИТ. При этом лактат-ацидоз может сочетаться
с кетоацидозом, а последний — с гиперхлоремическим ацидо-
зом и т.д.
Системный подход к анализу кислотно-основных
нарушений
Вначале необходимо оценить клиническую картину заболе-
вания: состояние дыхания, кровообращения, ментального ста-
туса, что особенно важно у больных, находящихся в критичес-
ком состоянии. При наличии показаний реанимационные ме-
роприятия проводят немедленно, не ожидая результата анализа
КОС и газов крови. При стабильном состоянии изучают анам-
нез и проводят полное физикальное обследование, чтобы най-
ти ключ к тому или иному нарушению КОС. Важно оценить
функцию внешнего дыхания, установить, имеются ли у боль-
ного легочные заболевания, которые могут повысить раСО2
или снизить раО2. Для установления метаболических наруше-
ний важно выявить наличие диабета, принимал ли больной
мочегонные средства или токсичные вещества, страдает ли
алкоголизмом, были ли у него рвота или понос, имеются ли
симптомы, указывающие на нарушение функции почек. Анам-
нез и клиническое обследование могут дать исчерпывающую
информацию, которая позволит сформулировать правильный
диагноз и установить первичное расстройство КОС.
♦ Проверьте точность показателей КОС путем подтвержде-
ния того, что имеющиеся значения pH, раСО2, НСО^
соответствуют математическим ограничениям уравнения
Гендерсона.
♦ Применяя метод 80 %, рассчитайте значение Н+ для каж-
дого изменения pH.
♦ Оцените значение АР.
♦ Определите первичное нарушение, сопоставив для этого
все имеющиеся у Вас данные. Поставьте правильный
диагноз нарушения КОС.
Терминология. Термины “ацидемия” и “алкалемия” отно-
сятся к pH крови. Снижение pH ниже границы нормальных
значений, т.е. ниже 7,35, определяет ацидемию, а повышение
pH выше 7,45 — алкалемию. По одной величине pH невозмож-
но диагностировать ацидоз или алкалоз. Последние зависят от
28
основных патофизиологических изменений, приводящих к раз-
витию дыхательных или метаболических компонентов КОС, а
также компенсаторных реакций. Например, у больного с пер-
вичным метаболическим ацидозом и одновременно существу-
ющим первичным дыхательным алкалозом могут быть ациде-
мия, алкалемия или нормальный pH в зависимости от уровней
раСО2 и НСО3.
Глава 3
ПЕРВИЧНЫЕ НАРУШЕНИЯ ДЫХАТЕЛЬНОГО
КОМПОНЕНТА КИСЛОТНО-ОСНОВНОГО
СОСТОЯНИЯ
Термин “первичный” в данном случае относится к перво-
начальному изменению КОС, вызванному увеличением или
уменьшением рСО2 в жидкостных средах организма.
Дыхательный ацидоз. Термины “дыхательный (газовый)
ацидоз” и “первичная гиперкапния” являются синонимами.
Дыхательный ацидоз распознается по уровню раСО2 выше 45
мм рт.ст. в условиях покоя и на уровне моря. В то же время
нормокапния не всегда свидетельствует об отсутствии дыха-
тельного ацидоза. Например, у больных с метаболическим аци-
дозом нормальное раСО2 характерно для первичной гиперкап-
нии. У них гипокапния является ожидаемой реакцией на
первичный метаболический ацидоз. При острой сердечной не-
достаточности и снижении сердечного выброса (СВ) возможно
нарушение элиминации СО2 в легких при нормальных пока-
зателях рСО2 артериальной крови и одновременно высоком
уровне рСО2 венозной крови.
Вторичная гиперкапния, возникающая при метаболическом
алкалозе, не является дыхательным ацидозом. Это физиологи-
ческая компенсаторная реакция на алкалемию метаболическо-
го происхождения.
Первичное увеличение уровня рСО2 развивается в том слу-
чае, если выделение СО2 недостаточно и неадекватно скорости
продукции СО2 в тканях. Таким образом, эти два механизма
могут вызывать первичную гиперкапнию или дыхательный
ацидоз. Однако при адекватном состоянии легочного газооб-
мена, механики дыхания, функции дыхательных мышц, цент-
ральной регуляции дыхания увеличение продукции СО2 в тка-
нях не приводит к дыхательному ацидозу.
Важно подчеркнуть, что основным фактором развития ды-
хательного ацидоза является снижение альвеолярной вентиля-
ции (VA). Снижение VA может возникать при нормальной и
даже увеличенной общей вентиляции легких (VE). Это связано
29
с возрастанием мертвого пространства (МП) при изменениях
отношения вентиляция/кровоток (эффект МП).
Острый дыхательный ацидоз представляет собой наиболее
опасное нарушение КОС, развивающееся быстро в связи с
декомпенсацией функции внешнего дыхания. Характеризуется
он первичным острым накоплением СО2 в жидкостных средах
организма из-за снижения альвеолярной вентиляции, ограни-
чивающей элиминацию СО2. Эти формы нарушения также
называют гиперкапнической дыхательной недостаточностью.
Однако наряду с увеличением содержания в крови СО2, как
правило, наблюдается снижение раО2 и saO2-
Причины острого дыхательного ацидоза:
♦ угнетение центральных механизмов регуляции дыхания
наркотическими, седативными средствами, барбитурата-
ми или в связи с заболеваниями мозга, черепно-мозговой
травмой (мозговой инсульт, отек мозга, повышенное внут-
ричерепное давление, последствия аноксии мозга, кома
различной этиологии);
♦ нарушения проведения нервных импульсов к дыхатель-
ным мышцам вследствие травматического повреждения
спинного мозга, инфекции, нервно-мышечной блокады,
вызванной мышечными релаксантами, миастенией и
прочими факторами;
♦ слабость или дисфункция дыхательной мускулатуры, “ус-
талость” диафрагмы вследствие длительной ИВЛ, недо-
статочного энергетического обеспечения, применения
кортикостероидов, дисбаланса калия, магния и фосфора,
накопления свободных радикалов;
♦ травма или деформация грудной клетки, пневмоторакс,
плевральный выпот, паралич диафрагмы;
♦ нарушения в дыхательных путях и легких вследствие об-
струкции верхних или нижних дыхательных путей, нару-
шение аэрации легких в результате тяжелой двусторонней
пневмонии или бронхопневмонии, острого респиратор-
ного дистресс-синдрома или выраженного отека легких;
нарушение перфузии легких при тяжелой недостаточнос-
ти кровообращения, остановке сердца, массивной тром-
боэмболии легочной артерии, жировой или воздушной
эмболии сосудов легких.
В ряде случаев (при остром респираторном дистресс-син-
дроме, эмболии сосудов легких, тяжелой пневмонии, массив-
ной бронхолегочной аспирации, тяжелом отеке легких) в раз-
витии клинической картины и исходе заболевания решающую
роль играет гипоксемия (гипоксемическая дыхательная недо-
статочность).
Физиологическая реакция на острую гиперкапнию. Гиперкап-
ния сопровождается увеличением кислотности жидкостных
30
сред организма в связи с накоплением угольной кислоты. В от-
вет на острую гиперкапнию происходит вторичное компенса-
торное увеличение уровня НСО3 путем титрования небикар-
бонатного буфера, что снижает степень ацидемии. Эта компен-
саторная реакция происходит за счет эритроцитов и буферных
механизмов внеклеточной жидкости (ВнеКЖ), но главным об-
разом за счет тканевых буферных систем. При острой гипер-
капнии “вклад” почек в эту реакцию невелик, однако реаб-
сорбция бикарбоната наблюдается уже через несколько минут
от начала гиперкапнии. Концентрация HCOJ увеличивается
приблизительно на 0,1 мэкв/л на каждый 1 мм рт.ст. острого
прироста раСО2. Однако общая метаболическая компенсация
завершается в течение 5—10 мин, при этом концентрация
НСО3 повышается только на 3—4 мэкв/л, несмотря на значи-
тельную гиперкапнию. При длительной гиперкапнии (хрони-
ческий дыхательный ацидоз) под влиянием почечных адапта-
ционных механизмов наблюдается более значительное увели-
чение НСО3.
Клинические проявления. Остро возникшее увеличение со-
держания СО2 в крови и других жидкостных средах организма
в первую очередь проявляется изменениями функции ЦНС и
в меньшей степени сердечно-сосудистой системы. Симптомы
гиперкапнии многообразны и неспецифичны: беспокойство,
возбуждение, одышка, психоз, нарастающая заторможенность
и кома. Помимо ключевой роли в регуляции вентиляции, кли-
ническое значение содержания СО2 связано с влиянием на
церебральный кровоток, pH и тонус адренергической системы.
Гиперкапния вызывает дилатацию сосудов мозга, что имеет
чрезвычайное значение для больных с повышенным внутриче-
репным давлением. Потеря сознания является результатом
интраневрального ацидоза, усиления мозгового кровотока и
увеличения ВЧД. Системное сосудорасширяющее действие ги-
перкапнии проявляется гиперемией кожных покровов, повы-
шенной потливостью, тахикардией.
Медленно развивающаяся гиперкапния переносится лучше,
поскольку в этом случае есть время для действия буферных
систем. Больные с почечной недостаточностью особенно плохо
переносят гиперкапнию, поскольку нарушенные почечные ме-
ханизмы адаптации не могут компенсировать образование
угольной кислоты.
По мере снижения pH возникают электролитные наруше-
ния с тенденцией к увеличению содержания в плазме крови
фосфатов и калия. Повышение уровня катехоламинов в крови
приводит к возрастанию СВ и ОПСС. Эти эффекты могут
частично компенсировать действие Н+ на функцию сердечно-
сосудистой системы, обеспечивая некоторую толерантность к
снижению pH.
Гиперкапния, как правило, сочетается с гипоксемией. Моз-
31
говые симптомы и сердечно-сосудистые нарушения прогресси-
руют значительно быстрее при сочетании ацидоза с гипоксе-
мией. Констрикция клубочковых артериол, вызванная гипер-
капнией, у некоторых больных может привести к олигурии.
При критических уровнях раСО2 и электролитных нарушениях
возможны мышечные судороги, преходящий тремор и эпилеп-
тиформные припадки.
Патофизиологические механизмы этих симптомов изучены
не полностью, но очевидно, что они зависят от уровня раСО2,
скорости его нарастания, а также от тяжести гипоксемии и
ацидоза. В то же время все эти симптомы нельзя считать
специфичными для гиперкапнии.
Диагностические критерии. При сниженном pH повышение
раСО2 указывает на развитие первичного дыхательного аци-
доза:
♦ при остром дыхательном ацидозе происходит сдвиг pH
на 0,008 при изменении раСО2 на 1 мм рт.ст.;
♦ при хроническом компенсированном дыхательном аци-
дозе наблюдается сдвиг pH на 0,003 при изменении
раСО2 на 1 мм рт.ст.
Одновременно с раСО2 проводят измерение раО2 и saO2,
что необходимо для выбора адекватного метода лечения.
Лечение. Основная цель — восстановление адекватной вен-
тиляции легких и оксигенации крови. Для этого необходим
постоянный контроль уровней раСО2, раО2 и saO2. Одновре-
менно проводят лечение основного заболевания, вызвавшего
острый дыхательный ацидоз.
Хронический дыхательный ацидоз развивается длительное
время, достаточное для включения почечного механизма ком-
пенсации. Компенсация может быть полной, и тогда pH не
выходит за пределы нормы при повышенном раСО2 и соответ-
ствующем возрастании HCOJ. При отсутствии достаточных
механизмов компенсации хронический дыхательный ацидоз
может быть субкомпенсированным. Обычно повышение раСО2
сопровождается умеренным снижением pH и увеличением
уровня HCOJ. Из организма при этом выводятся Н+, С1- и
NH4CI, обладающий свойствами сильной кислоты. Компенса-
торный характер метаболического алкалоза очевиден. Несмот-
ря на почечную компенсацию, дыхательные нарушения могут
прогрессировать. Хронический дыхательный ацидоз может
перейти в острый, и тогда он представляет непосредственную
угрозу для жизни больного.
К хроническому дыхательному ацидозу часто приводят об-
структивные легочные заболевания, и главное в купировании
возможных дыхательных нарушений — постоянное наблюде-
ние пульмонолога и лечение основного заболевания.
Дыхательный алкалоз (первичный или компенсаторный) оп-
32
ределяется гипокапнией, обусловленной альвеолярной гипер-
вентиляцией. Термин “первичная гипокапния” — синоним по-
нятия “дыхательный алкалоз”. Первичная гипокапния сопро-
вождается вторичной метаболической реакцией. Вторичная ги-
покапния, развивающаяся при метаболическом ацидозе,
представляет собой компенсаторную реакцию и ее не следует
смешивать с дыхательным алкалозом.
Причины: нарушения функции ЦНС, болевой синдром, воз-
буждение, гипоксемия, ИВЛ в режиме гипервентиляции и
изменения растяжимости грудной клетки и легких. Другие
причины первичной гипокапнии, которые упоминаются как
“смешанные”, — это беременность, грамположительный и грам-
отрицательный сепсис, печеночная недостаточность и восста-
новительный период после метаболического ацидоза. Полага-
ют, что в клинической практике первичная гипокапния явля-
ется наиболее частым нарушением КОС. У больных, находя-
щихся в критическом состоянии, гипокапния со снижением
раСОг до 20—25 мм рт.ст. может быть плохим прогностическим
признаком.
Патофизиологические изменения. Установлено, что остро
развивающаяся гипокапния сопровождается ощелачиванием всех
сред организма, включая внутриклеточную жидкость (ВнуКЖ).
Однако внутриклеточный pH изменяется значительно меньше,
чем во ВнеКЖ. Одновременно происходит умеренное сниже-
ние содержания HCOJ, главным образом в результате титро-
вания небикарбонатных буферов. При хронической гипокап-
нии снижение HCOJ более выражено, что обусловлено адап-
тационной реакцией окисления со стороны почек.
Было показано, что острая гипокапния сопровождается сни-
жением содержания бикарбонатов и концентрации Н+ не толь-
ко в артериальной крови, но и в цереброспинальной жидкости,
причем эти изменения происходят параллельно. При этом
рСО2 в цереброспинальной жидкости несколько выше, чем
раСО2 (но все же ниже, чем при нормокапнии).
Острая гипокапния снижает мозговой кровоток, величина
которого может быть ниже 50 % нормы, что приводит к гипок-
сии мозга и увеличению образования в мозге лактата. Сниже-
ние кислотности во всех жидкостных средах организма сопро-
вождается смещением кривой диссоциации оксигемоглобина,
связанным с повышением pH, гипокальциемией и гипокалие-
мией.
При острой гипокапнии возможны значительное снижение
СВ, повышение ОПСС, что ведет к значительному уменьше-
нию перфузии тканей и увеличению содержания лактата в
плазме.
Клинические проявления. Обычными признаками острого
дыхательного алкалоза являются тахипноэ и часто одышка.
33
3-1069
В хроническом случае частота дыхания (ЧД) может оставаться
нормальной при повышенном дыхательном объеме.
Признаки дыхательного алкалоза (синдром гипервентиля-
ции) отличаются от таковых метаболического алкалоза своей
интенсивностью и прежде всего нарушением нейромышечной
функции (парестезии, судороги, тремор). Могут быть и другие
признаки: головокружение, “рука акушера”, беспокойство, но
все они не специфичны и требуют обязательного лабораторно-
го исследования.
Диагностические критерии. Как и при любом нарушении
КОС, необходимы изучение анамнеза, тщательное клиничес-
кое обследование и обязательное исследование газов артери-
альной крови. В интерпретации изменений компонентов КОС
требуется определенная осторожность.
Гипокапния может отражать реакцию адаптации на метабо-
лический ацидоз. Следует убедиться в том, что снижение
раСОз — основной признак дыхательного алкалоза — является
первичным и возник в начале изменений КОС. Определение
причины дыхательного алкалоза столь же важно, как и диагноз
этого расстройства метаболизма.
Сложности определения первичности нарушений возника-
ют при хроническом дыхательном алкалозе и метаболичес-
ком ацидозе с нормальной АР. При этих изменениях присут-
ствует гиперхлоремическая гипобикарбонатемия. При этом
исследуют концентрацию калия в плазме. Нормальная кон-
центрация калия характерна для хронического дыхательного
алкалоза, а гипокалиемия или гиперкалиемия часто сопровож-
дают различные типы гиперхлоремического метаболического
ацидоза.
Первичная гипокапния обычно ассоциируется с алкалеми-
ей, т.е. с повышением pH крови. Однако первичная гипокап-
ния может ассоциироваться с нормальной и даже увеличенной
кислотностью плазмы в результате другого сопутствующего
нарушения КОС. При умеренном хроническом дыхательном
ацидозе pH крови не выходит за пределы нормальных колеба-
ний.
Никакой результат анализа газов артериальной крови и
КОС не должен оцениваться в качестве единственно правиль-
ного диагноза состояния. Содержание каждого компонента
КОС следует оценивать в соответствии с клинической карти-
ной и электролитным балансом.
Лечение. Специального лечения первичный дыхательный
алкалоз не требует, важно выявить и устранить основную при-
чину, вызвавшую это нарушение.
Воздействие острой гипокапнии используют для лечения
отека мозга после нейрохирургических операций, при череп-
но-мозговой травме, менингите или энцефалите.
34
Глава 4 I МЕТАБОЛИЧЕСКИЙ АЦИДОЗ
Метаболический ацидоз развивается вследствие нарушения
почечных механизмов регуляции выделения Н+ и НСО3, уве-
личения образования Н+ и потребления НСО3, потери HCOJ.
Снижение выделения Н+ и повышение потребления НСО3.
В нормальных условиях почки выводят Н+ в виде титруемой
кислоты (фосфаты, сульфаты) и аммиака. Этот механизм
может быть нарушен при заболеваниях почек, недостаточности
ряппочечников. дистальном почечном канальцевом ацидозе и
гиперальдостеронизме. При почечной недостаточности, умень-
шении числа функционирующих нефронов адекватная фильт-
рация и выведение Н+ отсутствуют.
При почечном ацидозе I типа (дистальный канальцевый аци-
доз) гломерулярная фильтрация в проксимальных канальцах и
реабсорбция НСО3 в норме, а секреция Н+ в дистальных
канальцах нарушается. Поскольку экскреция Н+ в дистальных
канальцах зависит от обмена Na+, уменьшение объема жид-
кости способствует нарастанию ацидоза. Посредством такого
же механизма, связанного с уменьшением поставки Na+ в
канальцы почек, адреналовая недостаточность и селективный
гипоальдостеронизм также приводят к ухудшению экскреции
Н+. При этом метаболический ацидоз сочетается с другими
формами нарушений электролитного обмена: гиперкалиемией,
гипонатриемией и гиперкальциемией.
При почечном ацидозе II типа (проксимальный канальцевый
ацидоз) развивается метаболический ацидоз, обусловленный
главным образом потерей бикарбонатов. Концентрация НСОу
В сыворотке крови снижается до 12—20 ммоль/л. Ухудшение
реабсорбции Na+ затрудняет коррекцию pH и приводит к по-
явлению щелочной реакции мочи. Помимо развития метабо-
лического ацидоза и щелочной реакции мочи, проксимальный
канальцевый ацидоз характеризуется снижением уратов, фос-
фатов и калия в сыворотке крови, глюкозурией и аминоаци-
дурией. В табл. 4.1 показано, каким образом с помощью вели-
чины АР мочи можно отличить потери HCOJ при диарее от
потерь НСО3, вызванных почечным канальцевым ацидозом.
Таблица 4.1. Анионная разница мочи по (П. Марино, 1998)
АР = (Na+ + К+) - СГ
АР мочи pH мочи Диагноз
Отрицательная <5,5 Патологии нет
Положительная >5,5 Почечный канальцевый ацидоз
Отрицательная >5,5 Диарея
з*
35
Прямые потери HCOj возникают при заболеваниях желудоч-
но-кишечного тракта (ЖКТ), диарее, наличии кишечных и
желчных свищей, неправильном применении слабительных
средств.
Увеличение образования Н+ и потребления HCOj. Увеличение
продукции и содержания Н+ приводит к метаболическому аци-
дозу. По величине АР можно судить об этиологии ацидоза.
Так, ее высокий показатель указывает на наличие ацидоза,
вызванного повышением уровня органических кислот (напри-
мер, молочной). Нормальная величина АР при ацидозе свиде-
тельствует об истощении бикарбонатного буфера.
АР >30 мэкв/л говорит о возможности лакгат-ацидоза. АР
в пределах 15—20 мэкв/л наблюдается при кетоацидозе. Умень-
шение АР на 5—6 мэкв/л отмечается при гипоальбуминемии
(см. главу 2).
При метаболическом ацидозе и нормальном показателе АР
нет тяжелых метаболических нарушений. Это состояние мо-
жет быть обусловлено почечной недостаточностью средней
степени, избыточным введением хлоридов, диареей, почеч-
ным канальцевым ацидозом. Высокий показатель АР сви-
детельствует о возможных глубоких нарушениях КОС —
лактат-ацидозе, кетоацидозе, почечной недостаточности, от-
равлении салицилатами, метанолом, этиленгликолем.
Формы метаболического ацидоза:
♦ увеличение содержания в плазме молочной кислоты
(лакгат-ацидоз);
♦ увеличение содержания кетоновых кислот (бета-гидроок-
сибутират, ацетоацетат);
♦ гиперхлоремический ацидоз;
♦ почечный канальцевый ацидоз — накопление титруемых
кислот;
♦ ацидоз в результате потерь бикарбоната;
♦ ацидоз при рабдомиолизе (накопление неорганических
кислот HSO4, ЩРСХр;
♦ парадоксальный ацидоз ЦНС вследствие введения бикар-
боната;
♦ ацидоз, вызванный другими причинами (уремические
токсины, салицилаты, спирты, лекарства, например пре-
параты железа, изониазид).
Смешанные формы метаболического ацидоза. У больных,
находящихся в отделениях интенсивной терапии, часто наблю-
даются смешанные формы метаболических нарушений. Напри-
мер, диабетический кетоацидоз может сочетаться с гиперхло-
ремическим ацидозом или ранней формой почечной недоста-
точности. Очень высокий уровень анионных молекул салици-
лата может способствовать развитию лакгат-ацидоза. В случае
36
поступления в организм щелочных растворов возможно соче-
тание различных форм метаболического ацидоза и алкалоза.
Компенсаторные механизмы метаболического ацидоза. Под-
ключение буферных систем, преимущественно HCOJ, препят-
ствует снижению pH. Активизация дыхательной системы с
увеличением МОД приводит к снижению раСО2, которое про-
исходит в соотношении 1,2 мм рт.ст. на каждый 1 мэкв/л
снижения НСО3 в сыворотке крови. Предел снижения раСО2 —
10 мм рт.ст. (редко ниже). При хроническом метаболическом
ацидозе ожидаемая величина раСО2 приблизительно равна двум
последним цифрам значения pH (например, при pH 7,20 ожи-
даемая величина раСО2 равна 20 мм рт.ст.).
При остром и хроническом метаболическом ацидозе pH
крови снижается на 0,15 на каждые 10 мэкв/л снижения НСО3.
Отличие заключается в том, что при остром метаболическом
ацидозе быстро развивается гипервентиляция, ограничиваю-
щая снижение pH. При хроническом метаболическом ацидозе
эффекты гипервентиляции длятся всего несколько суток, так
как снижение раСО2 вызывает дальнейшее снижение реабсорб-
ции НСО3 в почках.
Внутриклеточные белковые буферные системы и фиксиро-
ванные в костной ткани буферы (соли кальция) представляют
собой третий основной механизм, позволяющий ограничить
снижение pH.
Активная экскреция Н+ (в среднем 50—100 ммоль/сут) в
сочетании с фосфатами и аммонием в целом соответствует
нормальному темпу образования минеральных кислот.
Клинические проявления. При метаболическом ацидозе
включаются дыхательные механизмы компенсации: увеличива-
ется частота и глубина дыхания, снижается раСО2 до тех пор,
цока не произойдет угнетение этих механизмов.
В отличие от респираторного ацидоза влияние метаболичес-
кого ацидоза на ЦНС менее выражено. Очевидно, это обу-
словлено тем, что СО2 свободно проникает через гематоэн-
цефалический барьер, вызывая выраженные изменения
функции ЦНС, а сопутствующая гипоксемия усиливает их.
Тем не менее, при глубоком метаболическом ацидозе могут
возникнуть делирий и кома. При pH <7,10 может развиться
гипотензия как следствие угнетения сердечно-сосудистой сис-
темы.
Диагностические критерии. Диагноз метаболического ацидоза
устанавливают на основании следующих положений:
♦ при сниженном pH нормальный или пониженный уро-
вень раСО2 указывает на первичный метаболический
ацидоз;
♦ при нормальной величине pH пониженный уровень
37
раСОг указывает на смешанную форму дыхательного ал-
калоза и метаболического ацидоза;
♦ при нормальной величине pH нормальный уровень
раСОг может свидетельствовать о том, что показатели
КОС находятся в пределах нормы, но не исключается
возможность смешанных метаболических алкалозов/аци-
дозов. В этих случаях определяют АР и по этому пока-
зателю судят об изменения КОС.
Общие терапевтические мероприятия. При выраженных из-
менениях pH, обусловленных снижением уровня НСО3 в сы-
воротке крови, могут потребоваться терапевтические меры,
направленные на коррекцию выявленных нарушений. В то же
время снижение pH является маркером метаболических нару-
шений, а не первичной патологией.
Важнейшим звеном лечения метаболического ацидоза явля-
ется устранение его основной причины. Введение натрия
бикарбоната (натрия гидрокарбоната) может устранить наи-
более опасные проявления метаболического ацидоза, но не
причину, вызвавшую его.
Показания к назначению раствора натрия бикарбоната (на-
трия гидрокарбоната):
♦ pH <7,20;
♦ выраженные нарушения функций органов и систем в
условиях ацидоза;
♦ чрезмерная работа дыхательной системы, направленная
на поддержание pH.
Следует напомнить, что некоторые виды ацидоза (например,
проксимальный канальцевый ацидоз) трудно корригируются
экзогенным введением НСО3. При лечении диабетического
кетоацидоза основное внимание уделяется инсулинотерапии, а
введение натрия бикарбоната может привести к алкалозу.
Больные с диабетическим кетоацидозом часто переносят паде-
ние pH артериальной крови ниже 7,20 без серьезных послед-
ствий. В то же время при лактат-ацидозе необходимо поддер-
живать рН>7,20.
Побочные эффекты при введении раствора натрия бикар-
боната:
♦ гиперосмолярность плазмы;
♦ артериальная гипотензия;
♦ снижение сердечного выброса;
♦ увеличение содержания лактата в крови.
Неэффективность раствора натрия бикарбоната, наблюдае-
мая в отдельных случаях, объясняется способностью препарата
образовывать СО2. Артериальная гипотензия и снижение сер-
38
дечного выброса объясняют связыванием ионов кальция анио-
нами бикарбоната. В то же время одним из показаний к на-
значению натрия бикарбоната считают артериальную гипотен-
зию, устойчивую к инфузионной терапии и адреномиметикам.
Повышение артериального давления после быстрого введения
раствора натрия бикарбоната является основанием для его
применения.
Расчет дозы HCOj (по П.Марино). Количество бикарбоната
(НСО3), необходимое для коррекции pH, вычисляют по фор-
муле:
Дефицит НСО3 = 0,5 х масса тела (кг) х (желаемая концентрация
НСО3 — фактическая концентрация НСО3 в сыворотке крови),
где 0,5 х масса тела (кг) — среднее количество общей воды в
организме.
Если имеется смешанный ацидоз — метаболический и ды-
хательный, последний устраняют в первую очередь без приме-
нения натрия бикарбоната. В противном случае может увели-
читься образование СО2, что повысит раСО2. При метаболи-
ческом ацидозе важно повысить содержание HCOJ в сыворотке
крови, чтобы поддерживать рН>7,20. При отсутствии дыхатель-
ного ацидоза или алкалоза достаточна концентрация НСО3
15—20 мэкв/л. Обычно используют молярный (8,4 %) раствор
NaHCO3, в каждом миллилитре которого содержится 1 мэкв
Na+ и 1 мэкв НСО3. Вначале устраняют половину выявленного
дефицита HCOJ путем внутривенного введения раствора на-
трия бикарбоната в течение 30 мин. Затем под контролем содер-
жания HCOJ в сыворотке крови продолжают коррекцию в тече-
ние 4—6 ч. Если образование кислот будет продолжаться, то
указанная доза, возможно, будет недостаточной.
Быстрое болюсное введение препарата может привести к
двухфазному ответу: вначале к угнетению дыхания и росту
периферического pH, а затем, вследствие избытка СО2, к его
диффузии через ГЭБ, что приводит к снижению pH в головном
мозге и стимуляции дыхания (“парадоксальный ацидоз ЦНС”).
При болюсном введении раствора натрия бикарбоната возможны
резкий сдвиг кривой диссоциации оксигемоглобина влево, ухуд-
шение гемодинамики головного мозга, развитие гипокалиемии,
угрожающей жизни [Marini J.J., Wheeler А.Р., 1997]. Имеются
некоторые различия в методике применения бикарбоната при
лактат-ацидозе и кетоацидозе (см. в следующих разделах).
Лактат-ацидоз
Молочная кислота является конечным продуктом анаэроб-
ного гликолиза в организме, в норме ее концентрация в сыво-
39
ротке крови составляет менее 2 ммоль/л. (Концентрация лак-
тата у взрослых в норме — 0,5—1,6 ммоль/л.) Большая часть
молочной кислоты метаболизируется печенью в процессе глю-
конеогенеза. Как энергетический материал молочная кислота
поглощается сердечной мышцей. Увеличение количества мо-
лочной кислоты в сыворотке крови наблюдается при значи-
тельных метаболических нарушениях, вызванных усилением
анаэробного гликолиза.
Причины лактат-ацидоза:
♦ снижение оксигенации тканей — тканевая гипоксия. Наи-
большее значение придают циркуляторным нарушениям
(кардиогенный, септический, гиповолемический шок).
Возможность лактат-ацидоза при артериальной гипоксе-
мии, особенно при кратковременной и неглубокой, со-
мнительна. Также нет прямых доказательств увеличения
уровня лактата в крови при анемии, если отсутствуют
клинические симптомы шока. Однако наличие всех форм
гипоксии теоретически способствует развитию лактат-
ацидоза. Последний предполагают во всех случаях тяжелого
течения заболевания, у больных с нестабильной гемодина-
микой, инотропной поддержкой, синдромом сдавления и
пр. Остановка сердца во всех случаях сопровождается
анаэробным обменом веществ и лактат-ацидозом;
♦ нарушения функции печени снижают ее способность к
превращению молочной кислоты в глюкозу и гликоген.
Нормально функционирующая печень перерабатывает
значительные количества лактата, а при шоке эта спо-
собность нарушается;
♦ недостаток тиамина (витамин В0 при отсутствии сердеч-
но-сосудистой недостаточности. Дефицит тиамина отме-
чается в критических состояниях, нередко у больных,
злоупотребляющих алкоголем, при симптомокомплексе
Вернике. Недостаток тиамина способствует увеличению
уровня молочной кислоты вследствие угнетения окисле-
ния пирувата в митохондриях;
♦ повышение уровня правовращающего изомера молочной
кислоты (D-лактат-ацидоз), не определяемого стандарт-
ными лабораторными методиками. Этот изомер образу-
ется в результате действия микроорганизмов, расщепля-
ющих глюкозу в кишечнике. Чаще всего встречается у
больных после обширных операций на кишечнике, при
дисбактериозе, нарушениях функции ЖКТ. По-видимо-
му, это более распространенное нарушение КОС, но оно
часто не диагностируется [Marino Р., 1998];
♦ другие возможные причины лактат-ацидоза в отделениях
интенсивной терапии. Не исключается возможность лак-
тат-ацидоза при длительных инфузиях адреналина и дру-
40
гих сосудосуживающих средств. Лактат-ацидоз может
развиться в случаях использования натрия нитропрусси-
да, при метаболизме которого образуются цианиды, спо-
собные нарушать процессы окислительного фосфорили-
рования.
Диагностика. На возможность лактат-ацидоза указывают
следующие признаки:
♦ наличие метаболического ацидоза, связанного с повы-
шенной АР;
♦ выраженный дефицит оснований;
♦ АР>30 мэкв/л, в то время как другие причины, вызываю-
щие ацидоз (кетоацидоз, почечная недостаточность, вве-
дение токсичных веществ), отсутствуют;
♦ уровень молочной кислоты в венозной крови превышает
2 мэкв/л.
Этот показатель отражает интенсивность образования лак-
тата в тканях.
Лечение этиологическое, т.е. направлено на устранение при-
чины лактат-ацидоза. При шоке, циркуляторной недостаточ-
ности следует принять меры, способствующие улучшению тка-
невой перфузии, доставки и потребления кислорода тканями.
Необходимо устранять все возможные причины гипоксии, что
способствует восстановлению аэробного обмена. Больные ал-
когольной энцефалопатией нуждаются в лечении тиамином.
Средняя доза тиамина при его дефиците 100 мг/сут.
Введение натрия бикарбоната показано при рН<7,20, содер-
жании НСО3 <15 ммоль/л. Расчет дозы и методика введения
описаны выше. В отдельных случаях из-за неэффективности
терапии раствором натрия бикарбоната применяют другие
средства — карбикарб или натрия дихлорацетат. Преимущество
карбикарба в том, что он по сравнению с бикарбонатом вы-
зывает меньшее образование СО2. Дихлорацетат снижает об-
разование лактата и оказывает положительное инотропное дей-
ствие.
Кетоацидоз
Недостаточность эндогенного инсулина и/или недостаточ-
ное поступление экзогенного инсулина ведут к повышению
содержания в плазме крови глюкагона и прогрессирующей
декомпенсации обмена веществ, вплоть до комы. Причиной
кетоацидоза является образование кетоновых тел — группы ор-
ганических соединений, являющихся промежуточными про-
дуктами обмена жиров, белков и углеводов. Синтез кетоновых
тел (кетогенез) в основном происходит в печени. Главные
кетоновые тела — ацетоуксусная и бета-оксимасляная кислоты.
41
Причины кетоацидоза:
♦ диабет;
♦ голодание;
♦ алкоголизм;
♦ неадекватное парентеральное питание;
♦ послеоперационный период.
Диабетический кетоацидоз представляет собой грозное ос-
ложнение диабета, обусловленное чаще всего неправильно
подобранной дозой инсулина. Изменения метаболизма при
этом могут развиваться очень быстро. Возможен летальный
исход.
Основные звенья нарушений:
♦ гипергликемия;
♦ повышение осмолярности плазмы;
♦ гипертоническая дегидратация: потери воды достигают 6—
8 л вследствие осмотического диуреза, рвоты и поноса;
♦ метаболический ацидоз, обусловленный образованием
кетоновых тел, может усиливаться при лактат-ацидозе;
♦ гипервентиляция (дыхание Куссмауля), стимуляция ды-
хательного центра Н+ приводит к значительному сниже-
нию рСО2 крови;
♦ потеря минералов: калия, магния, натрия, кальция, фос-
фатов.
Клинические симптомы кетоацидоза:
♦ слабость, жажда, тошнота и др.;
♦ диабетическая прекома;
♦ диабетическая (гиперосмолярная, ацидотическая) кома.
Следует заметить, что гиперосмолярность может приводить
к коматозному состоянию и без наличия кетоацидоза (кома
гиперосмолярная, неацидотическая).
В диагностике кетоацидоза основное значение имеют сле-
дующие симптомы: гипергликемия, появление сахара в моче,
метаболические изменения (снижение pH, HCOJ, раСО2, вы-
раженный дефицит оснований), появление ацетона в плазме и
моче, осмолярность плазмы >300 мосм/л, повышение уровня
гематокрита (если не было анемии или кровотечения), лейко-
цитоз со сдвигом влево.
Типичные варианты кетоацидоза:
♦ концентрация глюкозы в крови выше 19,4 ммоль/л
(350 мг/дл);
♦ наличие кетоновых тел в крови;
♦ pH <7,00, содержание НСО3 менее 10 ммоль/л, раСО2
<20 мм рт.ст.;
♦ АР >20 мэкв/л.
42
Атипичные варианты кетоацидоза:
♦ концентрация глюкозы в крови ниже 19,4 ммоль/л;
Ф сдвиг pH в щелочную сторону;
♦ АР <20 мэкв/л.
Важно учитывать, что величина АР во многом зависит от
экскреции кетоновых тел с мочой и усиленной реабсорбции
хлоридов в почечных канальцах. У лиц с обезвоживанием и
олигурией нарушено выведение кетоновых тел, и этот показа-
тель более выражен. Напротив, выведение кетоновых тел с
мочой способствует его уменьшению.
Лечение. Главные факторы лечения тяжелого кетоацидоза,
в том числе гиперосмолярной кетоацидотической комы: при-
менение инсулина, компенсация потерь жидкости, возмещение
потерь калия и других электролитов.
Инсулин. Введение инсулина является основой лечения ке-
тоацидоза, гипергликемии, липолиза и протеолиза, а также
возникающих в связи с этим нарушений водного и электро-
литного баланса.
Дозировка и способ введения инсулина. Инсулин вводят внут-
ривенно или внутримышечно. Наиболее распространен внут-
ривенный метод введения, наиболее безопасна первоначальная
доза 10 ЕД. Последующую инфузию инсулина проводят со
скоростью 0,1 ЕД/кг/ч, полупериод усвоения простого инсу-
лина при внутривенном введении около 4 — 5 мин, время
действия около 60 мин.
Инфузии инсулина проводят в изотоническом растворе на-
трия хлорида или 5 % растворе глюкозы. В первом случае
рекомендуют добавлять в раствор 0,1—0,2 г человеческого аль-
бумина для предотвращения адсорбции инсулина на инфузи-
онной системе. Если уровень глюкозы в крови снижается до
19,4 ммоль/л (350 мг/дл), то противопоказаний к назначению
раствора глюкозы для терапии инсулином нет. В качестве
лечебного средства глюкозу используют при снижении ее кон-
центрации до 13,9 ммоль/л (250 мг/дл). Уже через 1 ч после
введения инсулина выявляются положительные изменения
КОС.
Осложнение — резкое уменьшение концентрации глюкозы в
крови. Для предупреждения данного осложнения необходим
постоянный контроль этого показателя.
Введение жидкости. Дефицит внеклеточной и внутрикле-
точной жидкости у больных с диабетическим кетоацидозом
может быть очень большим — до 10 % массы тела. Лечение
следует начинать с введения изотонических растворов, содер-
жащих Na+ и С1~ (раствор Рингера, 0,9 % раствор натрия
хлорида), как можно раньше, еще до получения ответа о со-
держании глюкозы в крови. При инфузии этих растворов, даже
без введения инсулина, уровень глюкозы в крови понижается
43
на 5—10 ммоль/л [Хартиг В., 1982]. При гиповолемии показано
введение изотонического раствора альбумина. Гипотонические
растворы натрия хлорида применяют лишь при гипернатрие-
мии с концентрацией Na+ в крови выше 150 ммоль/л.
Инфузионную терапию проводят под контролем централь-
ного венозного давления, диуреза, секторального распределе-
ния жидкости и осмолярности плазмы. Процесс регидратации
тесно связан с коррекцией содержания глюкозы в крови и
может проводиться в течение 1 сут и более. Опасность чрез-
мерного введения кристаллоидных растворов заключается не
только в перегрузке объемом, но и в дисбалансе концентраций
натрия и глюкозы. При сниженном объеме плазмы показано
введение растворов, поддерживающих онкотическое давление
плазмы (5 % раствор альбумина). Растворы крахмала приме-
нять не рекомендуется из-за их способности повышать уровень
амилазы в сыворотке крови. Важно контролировать концент-
рацию Na+ в сыворотке крови.
При быстром снижении осмолярности плазмы и концент-
рации Na+ ниже 125 ммоль/л может развиться синдром
дисэквилибрирования, приводящий к отеку мозга. Этот син-
дром возникает при осмолярности плазмы ниже 280 мосм/л
и сохраненной гиперосмолярности в цереброспинальной
жидкости и клетках мозга.
Калий. Потери К+ при кетоацидозе достигают 200—700
ммоль и продолжаются на фоне восстановленного диуреза. По
мере устранения ацидоза развивается гипокалиемия, представ-
ляющая опасность для больного. Поступление глюкозы в клет-
ки опережает поступление в них К+. В связи с этим калиевой
терапии придается большое значение. Если нет противопока-
заний к назначению растворов калия (почечная недостаточ-
ность, выраженная гиперкалиемия), введение их начинают с
ранних этапов лечения (табл. 4.2). При достаточном диурезе
эти растворы вводят при концентрации калия в сыворотке
крови 6 ммоль/л.
Таблица 4.2. Применение растворов калия при диабетическом кето-
ацидозе
Концентрация К+ в сыворотке крови, ммоль/л Скорость введения К+, ммоль/ч
> 6 0
5-6 10
4-5 20
3-4 30
< 3 40
44
Следует помнить! Средняя или безопасная скорость внут-
ривенного введения раствора калия — поляризующего кок-
тейля — 20 ммоль/ч, а при ее увеличении возникает опас-
ность гиперкалиемии, нарушений сердечного ритма и даже
остановки сердца. Введение раствора калия необходимо
проводить под контролем монитора. Дозы подбирают инди-
видуально. Относительно безопасная доза калия — до 200
ммоль/сут, максимальная — 250—350 ммоль/сут.
Введение натрия бикарбоната не рекомендуется, так как это
неэффективно. Ацидоз является следствием дефицита инсулина
в крови, поэтому назначение раствора натрия бикарбоната, как
правило, не показано. Главное в лечении кетоацидоза — пра-
вильная инсулиновая терапия, которая позволяет снизить уро-
вень глюкозы в крови до 6—12 ммоль/л уже в первые 6 ч.
Одновременно без применения раствора натрия бикарбоната
происходит увеличение содержания HCOj во внеклеточной
жидкости. Поспешная компенсация ацидоза раствором натрия
бикарбоната может сопровождаться падением pH цереброспи-
нальной жидкости, гипокалиемией и алкалозом, проявляю-
щимся позднее и трудно поддающимся коррекции. Раствор
натрия бикарбоната следует назначать только в тех случаях,
когда pH крови<7,00, а АДСИСТ ниже 90 мм рт.ст., несмотря
на возмещение жидкости. Вводят 8,4 % раствор натрия бикар-
боната в дозе 1 мл/кг в течение 30 мин и вновь проверяют pH
артериальной крови.
Уровень неорганического фосфора в сыворотке крови у боль-
ных с кетоацидозом снижен. Общие потери фосфора состав-
ляют в среднем 1—1,5 ммоль/кг. При значительной гипофос-
фатемии показано введение растворов фосфора. Конечная цель
лечебных мероприятий заключается в нормализации уровня
глюкозы, восстановлении водного и электролитного баланса.
Инсулин вводят до того момента, пока уровень HCOj не под-
нимется до 20 ммоль/л. Нормализация НСО3 в сыворотке
крови при диабетическом кетоацидозе является конечной
целью лечебных мероприятий.
Алкогольный кетоацидоз
Причины алкогольного кетоацидоза:
♦ превращение этанола в процессе метаболизма в печени
в ацетальдегид с образованием НАД Н, способствующего
выработке кетоновых тел;
♦ сопутствующее голодание, сопровождающееся усилением
кетогенеза и кетонемией;
♦ обезвоживание, ведущее к олигурии и снижению экскре-
ции кетоновых тел с мочой [Marino P.L., 1998].
45
Диагностика. Алкогольный кетоацидоз обычно развивается
через 1—3 дня после чрезмерного потребления спиртных на-
питков. При этом показатели pH, HCOJ и BE могут быть резко
сниженными, а концентрация этанола и кетоновых тел в крови
очень низкой. Увеличивается АР, и ее колебания могут быть
значительными. Как правило, уровень глюкозы в крови не-
сколько повышен (до 300 мг/дл, или 16,7 ммоль/л).
Лечение. Показано внутривенное введение изотонического
раствора натрия хлорида и 5 % раствора глюкозы. Глюкоза
угнетает образование кетоновых тел в печени, а солевые рас-
творы повышают экскрецию их с мочой. Коррекцию К+ про-
водят по его содержанию в сыворотке крови. Необходимость
в применении натрия бикарбоната, как правило, отсутствует.
Глава 5 МЕТАБОЛИЧЕСКИЙ АЛКАЛОЗ
Метаболический алкалоз представляет собой тяжелое нару-
шение КОС, которому, к сожалению, часто не уделяется до-
статочного внимания. Главной патогенетической особеннос-
тью метаболических нарушений является несоответствие уве-
личенного уровня HCOJ предполагаемому уровню раСО2 и
всего внеклеточного пространства. Если метаболический аци-
доз компенсируется гипервентиляцией и снижение HCOJ в
сыворотке крови сопровождается соответствующим снижением
рСО2, то при тяжелой форме метаболического алкалоза такая
компенсация (увеличение уровня HCOJ — увеличение рСО2)
часто невозможна. Компенсаторное увеличение раСО2 более
60 мм рт.ст. само по себе опасно, но, к счастью, оно встреча-
ется редко. При этом раО2 может снизиться до 60 мм рт.ст. и
начинает регулировать дыхание гипоксемия. При метаболичес-
ком алкалозе раСО2 обычно возрастает на 0,6 мм рт.ст. на
каждый 1 ммоль увеличения HCOJ. Соотношение HCOJ на-
рушается, и pH сыворотки крови становится выше нормальных
значений. Это состояние трудно поддается коррекции; в слу-
чаях с повышением pH >7,55 летальность может достигать 40 %
[Galla J.H., Luke R.G., 1987].
Основным моментом в развитии метаболического алкалоза
является не столько значение pH (>7,45), сколько уровень
HCOJ сыворотки крови, превышающий предполагаемое раСО2.
Сложность проблемы заключается в том, что устранение
некоторых этиологических факторов состояния не означает
ликвидацию опасных проявлений нарушенного метаболизма,
поскольку метаболический алкалоз обладает способностью са-
моподдерживаться. Почечные механизмы почти никогда не
вызывают метаболического алкалоза, но почти всегда ответст-
46
ренны за его поддержание. В ответ на повышение уровня
НСО3 здоровые почки быстро выделяют щелочную мочу при
условии нормального содержания в сыворотке крови С1_, К+
и Mg2+. Однако при гипокалиемии, гипомагнезиемии или ги-
похлоремии этот механизм нарушается и избыток НСО3 оста-
ется некомпенсированным.
При метаболическом алкалозе создаются неблагоприятные
условия для оксигенации тканей. В результате снижения сер-
дечного выброса (СВ) и сдвига кривой диссоциации оксиге-
моглобина влево доставка кислорода снижается. В то же время
потребность тканей в кислороде при алкалозе увеличивается,
что может привести к неадекватной оксигенации тканей.
Причины метаболического алкалоза:
♦ потеря хлористоводородной кислоты (НС1). Значитель-
ные потери НС1 наблюдаются при рвоте, длительной
постоянной аспирации желудочного содержимого с по-
мощью назогастрального зонда, гастростомы и др. Поте-
ря желудочного сока, имеющего низкий pH и концент-
рацию Н+ до 100 ммоль/л, может привести к значитель-
ному дефициту Н+. Интенсивное использование Нг-бло-
каторов редко приводит к алкалозу;
♦ потеря электролитов и жидкости. Применение диурети-
ков может вызвать метаболический алкалоз, обусловлен-
ный потерей жидкости и электролитов. Важное значение
в патогенезе алкалоза имеют потери хлоридов, калия и
магния;
♦ гипохлоремия. Экскреция хлоридов почками возрастает
с повышением диуреза, поскольку хлориды выводятся с
мочой пропорционально выделению натрия. При этом ио-
ны СГ в почечных канальцах не реабсорбируются. Для
сохранения электронейтральности ионы С1~ замещаются
ионами бикарбоната. Последний реабсорбируется в кровь,
повышая его уровень в жидкостных средах организма;
♦ гипокалиемия. Гипокалиемия увеличивает проксималь-
ную канальцевую реабсорбцию HCOJ и повышает дис-
тальную канальцевую секрецию Н+, продлевая алкалоз;
♦ гипомагнезиемия. Магний, как и калий, также выводится
с мочой. Потеря Mg2+ способствует потере К+. Дефицит
К+ и Mg2+ поддерживает уже возникший метаболичес-
кий алкалоз. В этих условиях почки не способны выде-
лять большое количество бикарбоната для компенсации
алкалоза;
♦ потеря жидкости. Снижение объема циркулирующей
жидкости, которое почти всегда сопровождает дефицит
С1“, стимулирует секрецию ренина и альдостерона, под-
держивая выведение Н+. Повышение уровня альдостеро-
на увеличивает секрецию Н+, а высокая скорость канал fa-
47
ц евого потока поддерживает этот патологический меха-
низм на фоне имеющегося дефицита калия;
♦ другие возможные механизмы потерь Н+. В редких слу-
чаях потери Н+ могут быть следствием почечных нару-
шений. Они происходят из-за избытка минералкортико-
идов, увеличения экскреции дистальными отделами ка-
нальцев Na+ или чрезмерной фильтрации неспособных
к реабсорбции анионов;
♦ избыточное введение бикарбоната натрия. Уровень экзо-
генных оснований может быть очень большим в тех
случаях, когда вводят избыточное количество натрия би-
карбоната, цитрата, лактата или ацетата.
Таким образом, метаболический алкалоз обусловлен и под-
держивается указанными патогенетическими механизмами. Он
всегда возникает из-за увеличения HCOJ, потери Н+ или по-
тери организмом жидкости, в которой по сравнению с плазмой
содержание хлоридов больше.
Развитие и поддержание метаболического алкалоза. В наи-
более тяжелых случаях уровень калия в сыворотке крови сни-
жается до критического (<2,0 ммоль/л), что вызывает генера-
лизованный внутриклеточный ацидоз. Последний оказывает
отрицательное влияние на функцию почечных канальцев и
способствует задержке HCOJ. К дефициту калия обычно при-
водит и избыток минерал кортикоидов. Истощение внеклеточ-
ного жидкостного объема вызывает гиперальдостеронизм (за-
держку HCOJ и потерю К+). Альдостерон также поддерживает
максимальную реабсорбцию Na+ на Н+, что еще более усугуб-
ляет алкалоз. Этот эффект может усиливаться вследствие
применения диуретиков на фоне сниженного объема циркули-
рующей крови (ОЦК). Глюкокортикоиды обладают слабым
альдостероноподобным свойством. После их применения мо-
жет развиться задержка HCOJ, но если ОЦК и содержание К+
нормальные, то почки сохраняют способность к выделению
избытка HCOJ.
Метаболический алкалоз может поддерживаться теми же
механизмами, которые приводят к его развитию: 1) дефицит
С1_; 2) избыток минералкортикоидов; 3) снижение интраваску-
лярного объема; 4) дефицит К+. Однако часто метаболический
алкалоз поддерживается каким-либо другим механизмом (на-
пример, сохраняющейся гиповолемией, несмотря на прекра-
щение потерь жидкости).
Клинические формы. Различают три формы метаболического
алкалоза: легкую, среднюю и тяжелую.
Легкая форма метаболического алкалоза представляет собой
кратковременное увеличение содержания HCOJ в сыворотке
крови, не требующее специального лечения.
48
Алкалоз средней тяжести характеризуется увеличением
уровня HCOJ до 30—40 ммоль/л и относительно легким кли-
ническим течением. Чаще всего это так называемый хлорид-
зависимый алкалоз, который соответствует снижению уровня
хлоридов в сыворотке крови до 90 ммоль/л и более. Как
правило, он связан с потерей жидкости и хлоридов. Уменьше-
нию содержания С1~ в сыворотке крови соответствует увели-
чение количества бикарбоната.
Алкалоз с тяжелым клиническим течением характеризуется
увеличением содержания HCOJ в сыворотке крови (более 50
ммоль/л) и увеличением pH (до 7,6). Возможны судороги,
нарушения сердечного ритма и респираторный алкалоз.
Метаболический алкалоз ухудшает проведение нервного им-
пульса и сократимость мышечного волокна, особенно в тех
случаях, когда он сочетается с гипокалиемией и гипофосфате-
мией, часто встречающимися нарушениями. Симптомы мета-
болического алкалоза могут напоминать таковые при гипокаль-
циемии. Часто наблюдаются изменения ментального статуса и
жажда, связанная с дефицитом жидкости.
Особую форму тяжелого нарушения КОС представляет ме-
таболический алкалоз, возникающий на фоне сопутствующего
дыхательного алкалоза. Сочетание двух первичных алкалеми-
ческих расстройств может привести к чрезвычайно выражен-
ному повышению pH крови. Увеличенная возбудимость ЦНС
и миокарда при чрезмерной алкалемии — причина плохого
прогноза этого состояния. Метаболический алкалоз может со-
четаться с хроническим дыхательным алкалозом, характерным
для сердечной недостаточности, заболеваниями легких и пече-
ни. Особенностью данного вида нарушения КОС является
сочетание двух первичных нарушений — первичных гипокап-
нии и метаболического алкалоза [Adrogue H.J., Tobin M.J.,
2003].
Диагностика. Для метаболического алкалоза характерны сле-
дующие признаки:
♦ HCOJ в артериальной крови более 25 ммоль/л, в веноз-
ной крови — более 30 ммоль/л (наиболее важный пока-
затель);
♦ pH выше нормального уровня;
♦ раСОг нормальное или повышенное, в наиболее тяжелых
случаях может быть сниженным;
♦ С1 менее 100 ммоль/л (хлоридзависимый алкалоз) в не-
которых случаях соответствует норме (хлоридрезистент-
ный алкалоз);
♦ часто бывает гипокалиемия.
Лабораторные анализы позволяют выявить хлоридзависи-
мый и хлоридрезистентный алкалоз.
Хлоридзависимый алкалоз обычно обусловлен потерей жид-
49
4-1069
кости и электролитов: Н+, Cl , К+, Mg2+ (рвота, назогастраль-
ная аспирация, диуретики) и сопровождается дефицитом СГ
и К+.
Хдоридрезистентный алкалоз наблюдается при чрезмерной
минералкортикоидной активности, гиперальдостеронизме,
применении глюкокортикоидов, минералкортикоидов, синдро-
ме Кушинга и характеризуется увеличением объема внеклеточ-
ной жидкости и дефицитом К+ и Mg2+. В отделениях интен-
сивной терапии клинические проявления расстройств, обу-
словленные этим видом алкалоза, встречаются редко.
Лечение должно быть направлено на устранение основной
причины алкалоза. Восстановление уровня хлоридов, натрия и
калия в сыворотке крови достигается инфузиями соответству-
ющих растворов (изотонический раствор натрия хлорида, рас-
твор калия хлорида, калия и магния аспарагината и др.). Все
эти растворы имеют низкий pH и способствуют снижению pH
крови.
Дефицит хлоридов можно вычислить по следующей фор-
муле:
Дефицит СГ (ммоль/л) = 0,27 х масса тела (кг) х
х (100 — фактическое содержание С1 ).
При этом необходимый объем изотонического раствора на-
трия хлорида может быть определен по формуле:
Объем 0,9 % раствора NaCl (л) = дефицит СГ/154,
где 154 — содержание СГ (ммоль) в 1 л 0,9 % раствора натрия
хлорида.
Восстановление объема внеклеточного водного пространст-
ва проводят одновременно с использованием вышеуказанных
растворов. Объемы и качественный состав применяемых для
инфузии средств определяют в каждом конкретном случае в
соответствии с имеющимися потерями. Для этой цели может
быть рекомендован компьютерный мониторинг водных секто-
ров. Контролируют содержание в сыворотке крови Na+, К+,
Mg2+, СГ, глюкозы, мочевины. Периодически исследуют вели-
чину осмоляльности плазмы. Введение диуретических средств
противопоказано.
Терапия избытка минералкортикоидов при хлоридрезис-
тентном алкалозе направлена на устранение источника гормо-
нов (выявление опухоли, прекращение стероидной терапии)
или эффектов минералкортикоидов (спиронолактон).
Иногда при длительно существующем метаболическом ал-
калозе с выраженной симптоматикой может потребоваться
внутривенное введение раствора НО. Обязательное условие
для его назначения — нормальное содержание жидкости в ор-
ганизме и нормальная концентрация К+ в сыворотке крови.
50
Дефицит Н+ определяют по следующей формуле:
Дефицит Н+ = 0,5 х масса тела (кг) х
х (имеющееся содержание НСО3 — желаемое содержание НСО3).
В 1 л 0,1 н. раствора НС1 содержится 100 ммоль Н+, в 0,25 н.
растворе — 250 ммоль Н+.
Скорость введения раствора НО — 0,2 ммоль/кг/ч.
При неосложненном метаболическом алкалозе содержание
HCOj в сыворотке крови менее 35 ммоль/л считают относи-
тельно безопасным. Если концентрация НСОу в сыворотке
крови равна 45 ммоль/л (при массе тела 70 кг), то дефицит Н+
составит 350 ммоль. Применяя 0,1 н. раствор HCI (100 мэкв
Н+/л), можно ожидать, что введение 3,5 л раствора окажется
достаточным для нивелирования алкалоза (при отсутствии даль-
нейших потерь электролитов и Н+). Для уменьшения объема
вводимой жидкости можно использовать более концентриро-
ванные растворы, например 0,25 н. Вместо НС1 можно вводить
аммония хлорид, но его не следует применять у больных с
почечной или печеночной недостаточностью.
Глава 6 СОВРЕМЕННОЕ ОБОРУДОВАНИЕ ДЛЯ АНАЛИЗА КИСЛОТНО-ОСНОВНОГО
БАЛАНСА, ГАЗОВ КРОВИ И ДРУГИХ ПАРАМЕТРОВ ЛАБОРАТОРНОЙ
ЭКСПРЕСС-ДИАГНОСТИКИ НЕОТЛОЖНЫХ СОСТОЯНИЙ
“Анализ газов крови и pH оказывает наиболее прямое и важное
воздействие на лечение больного, чем любое другое лабораторное
исследование”.
Национальный комитет по клиническим лабораторным стандар-
там (NCCLS, Document С 27-A, Approved Guideline, April, 1993).
Сакраментальная фраза из Документа международной со-
гласительной комиссии — Национального комитета по клини-
ческим лабораторным стандартам взята в качестве эпиграфа к
данной главе в связи с тем, что такие три измеряемых пара-
метра, как pH, рО2, рСО2 в артериальной крови, уже более
полувека остаются “золотым стандартом” лабораторной экс-
пресс-диагностики или STAT-анализа неотложных состояний
(STAT-Short-Turn-Around Time). Поэтому основным анализа-
тором в экспресс-лаборатории остается анализатор КОС и га-
зов крови.
Эра современной лабораторной экспресс-диагностики неот-
ложных состояний связана с пандемией полиомиелита в 50-е
годы XX в., массовым поступлением больных с необходимое -
51
4*
тью проведения длительной ИВЛ. Это явилось стимулом для
разработки анализаторов для измерения основных параметров
КОС и газов крови: pH, рОг, рСОг в артериальной крови.
Содружество врачей (группа доктора Пола Аструпа) и инжене-
ров компании “Радиометр” (Дания) обеспечило создание пер-
вых анализаторов газов крови и КОС уже в 50-е годы. В за-
мечательной книге Пола Аструпа и Джона Северингхауса “The
History of Blood Gases, Acids and Bases” (1986) описывается
работа Университетской клиники г.Копенгагена по приему по-
страдавших от пандемии с бульбарными нарушениями и пара-
личом дыхательных мышц. В сутки поступали до 10 подобных
больных, рекрутировались все ординаторы, интерны, студенты
для проведения ИВЛ первыми несовершенными вентилятора-
ми, включая мешки Амбу с адсорберами. В лаборатории же
Пола Аструпа круглосуточно проводился анализ газов крови и
базовых параметров КОС. Первые несовершенные анализаторы
с большим перечнем ручных процедур тем не менее должны были
отвечать требованиям экспресс-диагностики неотложных состо-
яний или так называемого STAT-анализа:
♦ короткий цикл измерения (1—2 мин);
♦ быстрое получение результата от момента принятия ре-
шения о выполнении анализа до получения распечатки
данных (5—10 мин);
♦ минимальный объем пробы крови — до 200 мкл, учиты-
вая необходимость достаточно частого повторения забора
пробы.
Эти требования в дальнейшем сохранились и для последу-
ющих поколений анализаторов, выполняющих уже более ши-
рокий спектр измерений параметров STAT-анализа. Развитие
анестезиологии и реаниматологии, попытки замещения наряду
с функцией дыхательной системы функции почек и появление
отделений гемодиализа стимулировало разработку электролит-
ных электродов. В состав газоанализаторов были включены
ионоселективные электроды с возможностью измерения в той
же микропробе цельной крови таких параметров, как сК+,
cNa+, сСа2 , сС1'. Были созданы также литиевый и магниевый
электроды. Но так как литий остается наиболее востребован-
ным лишь в ургентной психиатрии, а магниевый электрод, при
интересе к этому параметру ряда специалистов, достаточно
нестабилен и “противоречив”, к принятым в медицинской
практике параметрам STAT-анализа были причислены четыре
вышеназванных электролита.
Традиционный параметр лабораторной экспресс-диагности-
ки для диабетиков — уровень глюкозы в крови оказался инте-
ресным для интенсивистов как показатель оценки уровня
стресс-реакции в критическом состоянии. Наиболее показатель-
на в этом отношении работа бельгийских авторов, проиллюстри-
52
повавших на большой группе больных в критическом состоянии
ценность уровня глюкозы как показателя стресс-реакции и не-
обходимость поддерживать этот параметр в пределах нормы, т.е.
на уровне 4—6 ммоль/л [Green van den Berghe et al., 2001}.
При необходимости оценки риска развития гипоксии или
“задолженности” тканей по кислороду решающим становится
такой современный маркер уровня гипоксии, как уровень лак-
тата в крови [Торшин В.А., 2001]. Впервые возможность опре-
деления уровня лактата в крови млекопитающих продемон-
стрировал Gaglio в 1886 г. [Jjhn Toffaletti, 1991]. Определение
этого показателя занимало несколько дней и требовало около
200 мл крови животного. В 1940 г. Barker и Summerson суще-
ственно упростили методику, что позволило Broder и Weil в
1964 г. сделать заключение о корреляции между уровнем лак-
тата крови и тяжестью шока. Значение уровня лактата крови
в оценке шоковых больных требовало применения метода в
режиме STAT-анализа из небольшой пробы цельной крови в
комплексе с показателями КОС, электролитного баланса и
кислородного статуса. Возможность решения этих проблем
возникла с развитием амперометрического, энзиматического
метода с применением субстрат-спепифического электрода.
Работами ряда авторов доказана роль уровня лактата крови у
больных в критическом состоянии в качестве:
• показателя кислородной задолженности тканей;
• показателя эффективности проводимой терапии;
• прогностического признака неблагоприятного исхода.
Доказана роль лактата в качестве показателя кислородной
задолженности тканей при:
• интенсивных физических упражнениях;
• циркуляторном шоке (геморрагическом, кардиогенном,
септическом);
• остановке сердца;
• выраженной гипоксемии;
• выраженной анемии;
• больших судорожных припадках;
• астматическом статусе;
• отравлении моноксидом углерода;
• сепсисе;
• дефиците витамина В];
• определенных типах опухолей;
• ряде заболеваний печени;
• врожденных метаболических нарушениях;
• отравлении рядом веществ (этанолом, метанолом, мет-
формином, этиленгликолем).
Наиболее же интересны накапливаемые данные о значении
лактата в качестве прогностического признака неблагоприят-
53
ного исхода шока. Рядом авторов доказано более раннее по-
вышение уровня лактата по сравнению с другими показателями
развивающегося шока (гипотензия, олигурия, снижение pH и
др.). Также отмечена четкая корреляция между уровнем лактата
крови у больных в критическом состоянии и уровнем смерт-
ности [Javier Aduen et al., 1994]. Повышенное содержание лак-
тата является признаком гипоксии тканей. Информацию же об
уровне нарушения транспорта кислорода к клетке дают пара-
метры ко-оксиметрии — оптической технологии, основанной
на методе абсорбционной спектрофотометрии и включенной
технологически в современные газоанализаторы. Основными
параметрами оценки транспорта кислорода, измеренными ко-
оксиметром, являются:
• общая концентрация гемоглобина в крови ctHb (рефе-
рентный уровень у взрослых мужчин 8,4—10,9 ммоль/л;
у женщин — 7,4—9,9 ммоль/л);
• измеренная сатурация или насыщение гемоглобина кис-
лородом sO2 % — 95—99 %.
Относительно последнего параметра необходимо помнить о
пределах его достоверности. Показатель sO2 % адекватен при
отсутствии в крови дисгемоглобинов (карбоксигемоглобина —
СОНЬ, метгемоглобина — MetHb, фетального гемоглобина —
FHb и др.). При наличии в крови дисгемоглобинов, не спо-
собных переносить кислород и резко сдвигающих кривую дис-
социации оксигемоглобина (КДО) влево, заключение врача о
риске развития гипоксии на основании уровня sO2 % может
оказаться дезориентирующим. Обычно измеряемый с помо-
щью одноволновой эмиссионной пульсоксиметрии параметр
sO2 % определяется соотношением оксигемоглобина (О2НЬ) и
суммы окси- и деоксигемоглобина (ННЬ). При наличии дис-
гемоглобинов адекватным для оценки риска развития гипоксии
будет такой показатель, как фракция О2НЬ, измеряемый с
помощью многоволнового ко-оксиметра:
сО2НЬ
F°2Hb = cO2Hb + cHHb + cCOHb + cMetHb ’
Расчетным показателем транспорта кислорода кровью яв-
ляется содержание или концентрация кислорода в артериаль-
ной крови ctO2 (референтный уровень у взрослых мужчин
8,4—9,9 ммоль/л; у женщин — 7,1—8,9 ммоль/л).
Для суждения о последнем звене транспорта кислорода —
доступности кислорода для тканей — выведен расчетный пока-
затель р50 — напряжение полунасыщения или напряжение О2
при 50 % десатурации крови. Референтный уровень р50 для
взрослых 24—28 мм Hg. Показатель р50 выражает аффинитет
гемоглобин — кислород, определяемый положением КДО.
54
факторы, сдвигающие КДО влево с соответствующим сниже-
нием р50 (метаболический алкалоз, гипокапния, гипотермия,
гипофосфатемия, наличие дисгемоглобинов), увеличивают аф-
финитет гемоглобин — кислород и, следовательно, затрудняют
освобождение кислорода в тканях. Факторы, сдвигающие КДО
вправо с соответствующим повышением значения р50 (мета-
болический ацидоз, гиперкапния, гипертермия, увеличение
концентрации 2,3-ДФГ)., облегчают освобождение кислорода в
тканях. Роль дисгемоглобинов в положении КДО и соответст-
венно в процессе отдачи кислорода тканям и развитии гипо-
ксии требует определения их фракций в ряде клинических
дисциплин. Например, трудно себе представить адекватную
работу ожогового центра без определения FCOHb, центра ток-
сикологии — без определения FmetHb, современной реанима-
ции новорожденных — без определения FCOHb, FmetHb,
FHbF. Определение всех перечисленных фракций дисгемогло-
бинов в реанимации новорожденных крайне важно в силу
незрелости ферментных систем (в том числе карбокси- и мет-
гемоглобинредуктазы). Даже при отсутствии контакта с угар-
ным газом или метгемоглобинообразующими ядами у недоно-
шенных новорожденных могут быть значительно повышены
FCOHb, FmetHb [Челноков С.Б. и др., 2002].
Современная концепция лабораторной экспресс-диагности-
ки неотложных состояний основана на понятии РОСТ (Point-
of-Care-Testing), т.е. на проведении анализа “непосредственно
у постели больного”. В практике интенсивной терапии кон-
цепция РОСТ подразумевает инсталляцию и работу анализато-
ров КОС, газов крови, электролитов, метаболитов (глюкозы,
лактата), ко-оксиметров непосредственно в операционной, от-
делении реанимации, отделении гемодиализа и т.д. (табл. 6.1).
Характеристики современных анализаторов, отвечающие
этим требованиям:
• портативность;
• простота обслуживания;
• программное обеспечение/информационные технологии;
• малый объем пробы крови;
• получение результата измерения в течение 1—2 мин после
введения пробы.
Таблица 6.1. Сравнительная характеристика условий работы анали-
заторов в лаборатории и в режиме РОСТ
Тестирование в лаборатории Тестирование в режиме РОСТ
Небольшое число анализаторов Ограниченное число операторов Персонал, обученный работе в лаборатории Большое количество портатив- ных анализаторов Большое число операторов Персонал, ориентированный на решение клинических проблем
55
Рис. 6.1. Газоанализатор “ABL-5”
(“Радиометр”, Дания).
Рис. 6.2. Газо- и электролит-
ный анализатор “ABL-555”
(“Радиометр”, Дания).
Рис. 6.3. Анализатор “ABL-
800” (“Радиометр”, Дания).
Новый режим работы анализаторов в практике РОСТ воз-
можно обеспечить с необходимым условием сохранения каче-
ства проводимых измерений только с применением информа-
ционных технологий.
Современные информационные технологии в составе ана-
лизаторов позволяют:
• создавать и обрабатывать обширную базу данных;
• быстро в режиме on-line передавать обработанную инфор-
мацию лечащему врачу (с включением анализаторов в
LIS/HIS системы);
• проводить дистанционное обслуживание анализаторов;
• автоматизировать контроль качества.
Наибольшими коммуникативными возможностями в насто-
56
яшее время наряду с простотой в обслуживании обладают
анализаторы газов крови “ABL-800” серии производства дат-
ской компании “Радиометр” с программным обеспечением на
базе Windows ХР, поддерживающим протокол TCP/IP с воз-
можностью включения анализатора в сеть интернет.
При выборе современного газоанализатора специалисты, ад-
министраторы лечебно-профилактических учреждений (ЛПУ)
должны учитывать следующие основные моменты.
1. Измеряемые параметры
Измерение трех параметров “золотого стандарта” pH, рО2,
рСО2 артериальной крови необходимо при наличии хирурги-
ческой активности в ЛПУ, проведении оперативных вмеша-
тельств под общей анестезией с И ВЛ; проведении продленной
ИВЛ в послеоперационном периоде; наличии коек интенсив-
ной терапии в ЛПУ. В большинстве развитых стран необходи-
мость измерения этих параметров закреплена законодательно
как стандартный непреложный минимум. В частности, опре-
деление рСО2 необходимо для констатации диагноза “смерть
мозга”. Потребность подобных стационаров решается инстал-
ляцией базовых моделей газоанализаторов, например “ABL-5”
компании “Радиометр” (рис. 6.1), “Compact” компании “Рош”
или “Bayer-248” компании “Байер”.
Замещение функции почек, создание отделений гемодиали-
за, применение методов экстракорпоральной детоксикации (ге-
мосорбции, ультрагемофильтрации и др.) требуют проведения
контроля основных электролитов (К+, Na+, iCa2+, С1~) в ре-
жиме STAT-анализа. В подобных случаях инсталлируются мо-
дели среднего класса, сочетающие в себе газоанализатор и
электролитный анализатор, например ABL-555 компании “Ра-
диометр”. Компоновка анализатора позволяет включить также
один из метаболитов (глюкозу или лактат) в спектр измеряемых
параметров (рис. 6.2).
При поступлении больных с полиорганной недостаточнос-
тью, шоком различной этиологии, т.е. пациентов с системной
гипоксией разного генеза, требуется документальное подтверж-
дение кислородного статуса. Параметры кислородного статуса
могут быть получены при включении в состав газоанализатора
так называемого ко-оксиметра, т.е. оптической системы для
измерения параметров ко-оксиметрии (ctHb, sO2%, FO2Hb,
FHHb, FCOHb, FmetHb, FHbF), наряду с традиционными па-
раметрами STAT-анализа из одной микропробы цельной кро-
ви. Анализатор “ABL-735” производства компании “Радиометр”
(Дания) измеряет параметры КОС, электролиты, метаболиты
(глюкозу, лактат), параметры ко-оксиметрии (рис. 6.3). Совре-
менный 128-волновой ко-оксиметр, включенный в состав ана-
лизатора, позволяет в той же микропробе крови измерить ко-
57
личественно общий билирубин — показатель, необходимый в
STAT-анализе в трансплантологии, реанимации новорожден-
ных, развитии острой печеночной недостаточности у больных
в критическом состоянии.
2. Режим работы анализатора
При выборе газоанализатора специалист должен представ-
лять, в каком режиме будет работать оборудование. Если ана-
лизатор устанавливается стационарно и должен работать по-
стоянно, исходя из ежедневной потребности 10—20 и более
измерений в сутки, целесообразно остановиться на так назы-
ваемой классической модели, что предполагает наличие:
долгоживущих стабильных электродов (желательно с га-
рантией от производителя не менее одного года; что
наиболее актуально для метаболитных электродов глюко-
зы и лактата);
упаковку жидких реагентов с возможностью использова-
ния каждого реагента “до донышка”;
калибровочных газов в баллонах (обеспечивающих наи-
более точные результаты калибровок по летучим газам
О2 и СО2).
Соблюдение указанных принципов, по данным различных
производителей, обеспечивает стоимость проведения одной
пробы в пределах от 0,5 до 1 дол. США.
Применение паковых моделей, когда жидкие реагенты упа-
кованы в контейнеры в смеси с летучими газами, а тем более
картриджных моделей с применением вместо долгоживущих
электродов одноразовых картриджей или сенсорных кассет,
рассчитанных на определенное число измерений, может быть
оправдано при необходимости соблюдения таких параметров,
как:
• портативность и мобильность;
• возможность работать автономно от электрической сети.
Работа этих портативных анализаторов связана со стоимос-
тью проведения одной пробы не менее 3 дол. США, а при
применении одноразовых кассет — более 7—10 дол. США.
В работе мобильных анализаторов также возникает ряд про-
блем по логистике:
• пакеты с эквилибрированными жидкими реагентами и
газами имеют ограниченные сроки хранения;
• сенсорные кассеты некоторых производителей требуется
хранить в холодильнике.
Итак, работа этих дорогостоящих по расходным материалам
систем может быть оправдана в определенных условиях: авиа-
58
Рис. 6.5. Анализатор “NPT-7”
(" Радиометр”, Дания).
◄
Рис. 6.4. Анализатор “ABL-77”
(“Радиометр”, Дания).
транспортная медицина, мобильные реанимационные бригады,
развертывание полевых госпиталей и т.д. В последние годы эти
портативные анализаторы становятся все более популярными
в стационарах: кардиохирургических, нейрохирургических и
других профилей — при условии работы анализатора, согласно
концепции РОСТ, непосредственно в отделении реанимации,
операционной, отделениях гемодиализа. Примером подобного
анализатора может служить “ABL-77” производства компании
“Радиометр” (рис. 6.4). Работая от сети и автономно от акку-
муляторной батареи, сохраняя портативность и мобильность,
анализатор измеряет широкий спектр параметров: pH, рС>2,
рСО2, К+, Na+, Са2+- Cl~, Het и рассчитывает до 42 парамет-
ров, включая такие ценные параметры в оценке больного,
находящегося в критическом состоянии, как Anion Gap, ctO2,
sO2%, ctHb, pO2(A-a), RL
В последние годы был разработан уникальный анализатор
Кос, газов крови и ко-оксиметрии NPT-7. Работа анализатора
полностью базируется на оптической технологии, что обуслов-
ливает отсутствие газов и жидких реагентов. Уникальна логис-
тика анализатора и единственного расходного материала — ка-
ртриджа на 30 измерений. Срок хранения картриджа — 2 года
при комнатной температуре и 3 мес после инсталляции в
анализатор. Вышесказанное, а также отсутствие проблем в
обслуживании анализатора делают его незаменимым для рабо-
ты в отдаленных регионах и в клиниках с небольшим числом
Измерений в день (рис. 6.5).
59
Глава 7
ЗАБОР ПРОБ ДЛЯ ИССЛЕДОВАНИЯ
ЦЕЛЬНОЙ КРОВИ
“Взятие образцов крови, равно как обращение с ними и транспор-
тировка, являются ключевыми факторами точности клинического ла-
бораторного анализа и в конечном счете качества предоставляемой
медицинской помощи пациенту”.
Национальный Комитет по клиническим лабораторным стандар-
там, Дания (NCCLS, Document С 27-А, Approved Guideline, April
1993)
Для наиболее точного определения газов крови, pH, пара-
метров оксиметрии, электролитов и метаболитов необходимо
обеспечить тщательный забор и обращение с пробами крови.
При исследовании цельной крови для установления диагноза
в критическом состоянии больного можно выделить три этапа:
♦ принятие решения о взятии пробы крови, забор пробы
и в некоторых случаях ее хранение и транспортировка;
♦ исследование пробы;
♦ интерпретация данных и последующее лечение больного
в соответствии с полученными результатами.
Наибольшее число отклонений в измерениях цельной крови
связано с первым этапом. Неподходящее оборудование и не-
правильное обращение с пробой могут привести к существен-
ной погрешности анализа крови.
Факторы, приводящие к ошибкам при исследовании цельной
крови:
♦ пузырек воздуха, остающийся в пробе несколько минут,
может оказать существенное влияние на значения рО2-
Крайне важно, чтобы пробы содержались в анаэробных
условиях и чтобы в них не оставались пузырьки воздуха.
Отклонение результатов увеличивается по мере возраста-
ния времени пребывания пузырька в шприце, особенно
велико — при хранении пробы в холоде из-за повышения
сродства гемоглобина и кислорода. В связи с тем что рО2
в атмосферном воздухе составляет 150 mmHg/20 kPa.
отклонение будет положительным, так как нормальное
значение рО2 в артериальной крови составляет 90—100
mm Hg/12—13 kPa. Однако в случаях сверхвысоких зна-
чений рО2 крови у пациента возможно и отрицательное
отклонение результата анализа;
♦ неоднородная проба, которая была осаждена и не пере-
мешана, способствует изменению значения ctHb.
♦ гемолиз, который влияет на концентрацию ионизирован-
ного кальция и калия. Гемолиз развивается при высоком
60
давлении при наполнении через узкий канал (например,
через иглу малого диаметра, соединение катетера, вход
анализатора и т.д.), слишком энергичном растирании или
сжатии кожи при взятии пробы в капилляр, охлаждении
пробы непосредственно на льду и замерзании части кро-
ви, слишком энергичном перемешивании пробы. Риск
отклонения особенно вероятен при взятии пробы у па-
циентов с высокими значениями гематокрита, так как
объем плазмы сравнительно мал;
нарушение условий хранения при невозможности иссле-
дования пробы сразу же после взятия. После забора
пробы крови метаболические процессы в эритроцитах
продолжаются. Это изменяет значения газов крови, pH
и метаболитов: рО2 снижается за счет потребления клет-
ками крови кислорода, а вследствие выработки ими дву-
окиси углерода рСО2 повышается; pH снижается из-за
изменений рСО2 и гликолиза; сСа2+ увеличивается в
результате влияния изменений pH на связывание Са2+ с
белками; cGlucose снижается, так как глюкоза метаболи-
зируется; cLactate увеличивается вследствие гликолиза.
При высоком уровне лейкоцитов, например у больных
лейкемией, метаболизм особенно высок, и поэтому хра-
нить пробы не рекомендуется. На газы крови также вли-
яет диффузия через пластиковые стенки шприца, что
может приблизить измеренные значения газов крови к
значениям в атмосферном воздухе. При хранении пробы
более 10 мин рекомендуется охлаждать ее до 0—4 °С/32—
39 °F, что замедляет скорость метаболизма в 10 раз. Про-
бы не следует хранить более 30 мин во избежание откло-
нения из-за угнетения калий-натриевого насоса;
применение жидкого гепарина для проб цельной крови
приводит к разведению крови и занижению значений
электролитов, ctHb, рСО2 и метаболитов по сравнению
с действительными их значениями в пробе. Для предот-
вращения данных ошибок рекомендуется использовать
прегепаринизированные шприцы с сухим гепарином.
При разведении пробы на 10 % изменение значения
рСО2, ctHb и метаболитов происходит на 10 %, а электро-
литов на 14 % по сравнению с истинными значениями
(в зависимости от исходного Ht). Изменения сСа2+ не-
сколько меньше из-за компенсаторного буферного эф-
фекта Са2+, связанных с гепарином.
смешивание артериальной крови с венозной при пунк-
ции приводит к несоответствию измеренных значений
параметров (особенно газов крови) действительности,
что нередко является причиной неправильной трактовки
результатов (рис. 7.1);
нестабильное состояние пациента перед и во время взя-
61
Рис. 7.1. Значения рО2 и sO2 в
артерии и вене.
тия пробы влияет на заклю-
чение исследования и не
может отражать реальное
состояние больного; интер-
претация серии измерений
при этом становится спор-
ной. После изменения ре-
жима вентиляции и других
видов лечения, например ин-
фузионной терапии, кото-
рые могут повлиять на изме-
ряемые параметры, пробы не
следует брать по крайней мере в течение 15— 20 мин,
пока состояние пациента не стабилизировалось.
При выборе места взятия пробы ориентируются на следую-
щие критерии:
• наличие коллатерального кровообращения;
• доступность сосуда и его размер;
• риск осложнений (особенно инфицирования при повтор-
ных пункциях);
• возможность развития отека.
Наиболее удобные для пункции артерии представлены на
рис. 7.2.
Взятие пробы артериальной крови для анализа. Перед иссле-
дованием необходимо измерить температуру тела, так как из-
меренное раО2 увеличивается, если кровь нагрета. Увеличение
раО2 происходит из-за смещения кривой диссоциации вправо.
Гипотермия вызывает сдвиг кривой диссоциации влево, что
может влиять на точность анализов раО2 и раСО2. Однако
температурная коррекция обычно не нужна, за исключением
экстремальных температур, и физиологическая обоснованность
такой коррекции остается спорной.
Чтобы обеспечить стабильное раО2, пациенты должны, как
минимум, в течение 10 мин дышать с постоянной FiO2 (фрак-
ция ингалируемого кислорода). Неравномерная вентиляция
легких (эпизоды гипо- или гипервентиляции, задержка дыха-
ния) может существенно повлиять на точность измерения
раСО2. При изменении положения тела показатели раО2 и saO2
могут сильно варьировать. Насыщение крови кислородом
обычно снижается у лежащего на спине больного.
При взятии крови из лучевой артерии необходимо убедиться
в достаточности коллатерального кровоснабжения кисти, обес-
печиваемого локтевой артерией (проба Аллена). Для пункции
62
рис. 7.2. Типичные места пункции
артерий.
а — плечевой; б — лучевой; в — бедренной.
лучевой артерии запястье вытя-
гивают и кожу обрабатывают
сначала раствором йода, затем
спиртом (рис. 7.3). Обычно поль-
зуются 3-миллилитровым шпри-
цем с иглой 21-го размера, пред-
варительно промытым гепари-
ном. Артерию прокалывают под
углом 45°, пульсирующая кровь
сразу же заполняет шприц. Пос-
ле удаления шприца место уко-
ла крепко прижимают в течение
5 мин, а в случае повышенной
кровоточивости — более длитель-
ный срок (рис. 7.4). Шприц за-
крывают колпачком или вставля-
ют иглу в пробку. Важно не до-
пустить попадания воздуха в про-
бу крови (рис. 7.5). Затем кровь
и гепарин смешивают путем про-
катывания шприца между ладо-
нями и незамедлительно прово-
дят анализ (рис. 7.6).
Проба Аллена позволяет проверить эффективность коллате-
рального кровотока, обеспечивающегося локтевой артерией.
Приблизительно у 3—5 % госпитализированных больных кол-
латеральное кровообращение неадекватно. На поднятой руке
больного пережимают локтевую и лучевую артерии. Затем пре-
кращают сжатие локтевой артерии. Если коллатеральное кро-
вообращение адекватно, рука должна порозоветь от прилива
крови через 5—7 с (рис. 7.7).
Опасности артериальных пункций. Несмотря на то что пунк-
ция артерий является относительно безопасной процедурой,
необходимо учитывать возможные осложнения. К факторам
риска относятся: артериальная гипертензия, невыявленное ло-
кальное заболевание сосудов (атеросклероз, аневризма), гемор-
рагический диатез, применение антикоагулянтов, тромбоз со-
суда.
Чаще всего осложнения возникают при пункции бедренной
артерии: дистальная окклюзия артерии из-за наличия атеро-
склеротических бляшек в месте пункции, тромбоз сосуда в
месте пункции и дистальная ишемия. Вероятность осложнений
возрастает у больных с повышенным тромбообразованием и
63
Рис. 7.3. Методика пункции лу-
чевой артерии.
Рис. 7.4. Прижатие лучевой арте-
рии после пункции.
Рис. 7.5. Удаление пузырьков
воздуха из пробы крови.
Рис. 7.6. Перемешивание пробы
крови путем вращения пробирки
между ладонями.
Рис. 7.7. Проба Аллена.
Рис. 7.8. Зоны артериальной линии
для взятия проб крови.
64
атеросклерозом. После пункций бедренных или плечевых ар-
терий может возникнуть скрытое кровотечение в смежные
мягкие ткани при очень незначительных клинических прояв-
лениях. Риск увеличивается в тех случаях, когда используется
постоянная катетеризация сосуда.
Наименьшая частота осложнений отмечена при пункции
лучевой артерии, поэтому следует предпочесть ее использова-
ние. Окклюзии артерии можно избежать, меняя места взятия
пробы, используя самую маленькую из игл и проверяя перед
пункцией наличие коллатерального кровотока. Однако даже
при соблюдении всех правил могут возникать те или иные
осложнения, связанные с преморбидным сосудистым наруше-
нием (например, болезнь Рейно), применением вазопрессоров
и другими причинами. Артериальные пробы могут быть взяты
как при помощи пункции артерии, так и путем аспирации
крови из артериальной канюли или катетера. Оба метода имеют
преимущества и недостатки. При пункции артерии меньше
погрешностей, чем при использовании катетеризированной ар-
терии и взятии капиллярной крови. Катетеризация артерии
(создание артериальной линии) обеспечивает легкость взятия
йробы, безболезненность процедуры и устраняет осложнения,
Связанные с множественными пункциями (рис. 7.8).
Проба капиллярной крови. Во время взятия крови (обычно
из мякоти III или IV пальца кисти) в ее образец часто попадает
воздух, что оказывает существенное влияние на все респира-
торные параметры. В зависимости от состояния периферической
циркуляции капиллярное рО2 нередко отличается от артери-
ального. Капиллярную кровь часто используют для анализа
газового состава у новорожденных и в педиатрической интен-
сивной терапии.
г Основные положения
1. Для постановки точного диагноза нарушения КОС требуются следую-
щие условия:
* корректная интерпретация клинических проявлений, включая
анамнез, историю развития настоящего заболевания и физикальных
методов исследования;
* соблюдение правил забора крови (артериальной или венозной)
с учетом возможности ошибок и ложной трактовки результата ана-
лиза;
* проверка результата анализа с использованием известных урав-
нений и расчетов;
♦ не следует считать анализ артериальной крови единственно точ-
ной информацией для постановки диагноза нарушения: помимо кли-
нических данных, необходимо исследовать содержание электроли-
тов крови.
65
5- 1069
2. КОС в нормальных условиях — хорошо сбалансированная и саморе-
гулирующаяся система. Первичные нарушения дыхательного компонен-
та в условиях патологии компенсируются метаболическими изменения-
ми, и, наоборот, метаболические нарушения компенсируются измене-
ниями дыхательной системы. Обычно дыхательная система быстрее
реагирует на метаболические изменения, однако эта компенсация часто
недостаточна. Почки медленнее компенсируют нарушения дыхания, но
способны намного лучше обеспечивать эту компенсацию.
3. Нарушения дыхательного компонента КОС проявляются в виде пер-
вичной гипокапнии или гиперкапнии: и то и другое опасно для больного.
4. Метаболический ацидоз связан с потерей бикарбоната или его рас-
ходованием на усиленное образование органических и неорганических
кислот. Определение АР позволяет определить указанные механизмы
нарушений, а также дифференцировать клинические формы послед-
них: лактат-ацидоз, кетоацидоз, ацидоз, вызванный другими причинами.
5. Метаболический алкалоз, часто наблюдаемый а отделениях интен-
сивной терапии (ОИТ), представляет собой опасное нарушение КОС,
которому не всегда уделяется достаточное внимание. Наиболее часто
он возникает в результате потерь жидкости, HCI и хлоридов. Метаболи-
ческий алкалоз, несмотря на устранение первичной причины, может
поддерживаться в течение длительного времени и лечение его не всег-
да эффективно.
ВОПРОСЫ И ОТВЕТЫ
1. Определите градиенты рОг между атмосферным воздухом, аль-
веолами, артериальной и венозной кровью и периферическими
тканями.
рО2 атмосферного воздуха в среднем равно 150 мм рт.ст., аль-
веолярного воздуха — 104 мм рт.ст., артериальной крови и в
артериальном конце капилляров — 95 мм рт.ст., в капиллярах
= 40 мм рт.ст., оно соответствует величине рО2 в венозном
конце капилляров и в венозной крови. Среднее рО2 в тканях
23 мм рт.ст.
2. Сравните уровни рСОз в тканях, венозной и артериальной крови,
альвеолярном газе.
рСО2 в тканях равно 46 мм рт.ст., в капиллярах — 45 мм рт.ст.
Градиент давления СО2 между тканями и капиллярами равен
только 1 мм рт.ст. и обеспечивает диффузию СО2. рСО2 в
венозной крови равно также 45 мм рт.ст., рСО2 в артериальной
крови и в альвеолах равно 40 мм рт.ст.
3. Какое количество кислорода может транспортироваться гемо-
глобином в нормальных условиях? Сравните величины заОг и
раОз.
В 100 мл артериальной крови, когда молекула гемоглобина
насыщена кислородом на 100 %, содержится приблизительно
66
20 мл кислорода (т.е. 15 г НЬ х 1,34 мл кислорода = 20 мл).
В нормальных условиях только 5 мл из 20 мл кислорода, со-
держащихся в 100 мл артериальной крови (25 % от полной
величины), высвобождается в периферических тканях. При
этом величина растворенного кислорода при артериальном рО2
95 мм рт.ст. равна приблизительно 0,3 мл/дл. Таким образом,
величина кислорода, переносимого в растворенном состоянии
по сравнению с величиной, переносимой НЬ крови в нормаль-
ном состоянии, значительно меньше.
4. Каковы нормальные значения газов артериальной крови и основ-
ных компонентов КОС?
раОг = 95 ± 5 мм рт.ст.; раСО2 = 40 ± 5 мм рт.ст.; saC>2 =
= 97 ± 2 % pH = 7, 40 ± 0,05; НСО2 = 24 ± 2 ммоль/л; BE =
= 0 ± 2,3 ммоль/л.
5. Какую кровь — артериальную или венозную — необходимо иссле-
довать, чтобы оценить КОС и функции легких?
Для определения КОС может быть использована проба артери-
альной или венозной крови и обе пробы. Однако при оценке
функций легких, ее дыхательного компонента рСО2 и уровня
оксигенации требуется взятие пробы артериальной крови. рСО2
артериальной крови — точный критерий способности легких к
элиминации СО2. Одновременно этот показатель обеспечивает
информацию относительно уровня СО2 в крови, который посту-
пает во все ткани организма. Венозная кровь по сравнению с
артериальной имеет более высокий уровень рСО2. Венозное рСО2
зависит от метаболизма в каждой отдельной ткани или органе.
Уровень артериального рСО2 идентичен для всех тканей.
6. От каких факторов зависит уровень рСОз в жидкостных средах
организма?
Уровень рСО2 в жидкостных средах организма, в том числе в
артериальной и венозной крови, зависит от двух факторов:
скорости образования СО2 в тканях и ее выделения легкими.
Продукция СО2 в тканях зависит от состояния клеточного
метаболизма, а элиминация СО2 легкими — от величины аль-
веолярной вентиляции. В нормальных условиях любое количе-
ство образованной СО2 в тканях немедленно и полно компен-
сируется легкими. Нормальный уровень рСО2 артериальной
крови свидетельствует об адекватной, т.е. соответствующей ско-
рости образования СО2, вентиляции легких (нормокапния).
Снижение рСО2 говорит об избыточной вентиляции легких
(гипервентиляция). Уровень рСО2 выше нормы (гиперкапния)
свидетельствует о том, что продукция СО2 превышает скорость
ее выделения легкими.
7. Почему венозное рСОз выше артериального?
Величина венозного рСО2 почти равна тканевому рСО2, по-
скольку двуокись углерода (углекислый газ) образуется в тка-
нях. рСО2 смешанной венозной крови отражает величину сред-
67
5'
него венозного рСО2 всей венозной системы и равно 45 мм рт.ст.
Артериальное рСО2 меньше венозного, поскольку часть СО2,
проходя через легочные капилляры, выделяется легкими. Сред-
няя величина артериального рСО2 40 мм рт.ст.
8. Как определяют основные компоненты КОС: pH, рСОз и
НСОз?
pH пробы крови определяют с помощью стеклянного электро-
да. рСО2 определяют специальным электродом или косвенным
методом, применяя “интерполяционную” технику Сиггарда —
Андерсена. НСО2 рассчитывают по измеренному pH и рСО2,
используя уравнение Гендерсона — Гассельбаха. НСО3 можно оп-
ределить прямым измерением его содержания в плазме крови.
9. Сравните величины рСОг выдыхаемого воздуха (капнография) и
артериального рСОз-
Результат капнографического измерения парциального давле-
ния СО2 в конце выдоха (PetCO2), за которое принимают
значение на плато кривой, приближается у здоровых людей к
значению раСО2 (разница в пределах 1—4 мм рт.ст.). Однако
при легочных заболеваниях из-за нарушений отношения венти-
ляция/кровоток это различие может увеличиваться до 10 мм рт.ст.
или больше.
10. Насколько точен метод пульсоксиметрии?
В тех случаях, когда saO2 выше 70 %, точность определения
оксигемоглобина с помощью пульсоксиметрии колеблется в
пределах 2—3 %. Необходимое условие точности измерения:
проведение исследования у больных без гемодинамических на-
рушений и при saO2 >70 %. Точность уменьшается, если saO2
становится ниже 70%.
11. Дайте определение дыхательного ацидоза.
Дыхательный (респираторный, газовый) ацидоз — нарушение
КОС, вызванное увеличением рСО2 в жидкостных средах орга-
низма. Он характеризуется первичной гиперкапнией и повыше-
нием кислотности в жидкостных средах организма, включая
цереброспинальную жидкость. Увеличение раСО2 в церебро-
спинальной жидкости обусловлено проникновением СО2 через
гематоэнцефалический барьер (ГЭБ), что сопровождается вы-
раженными неврологическими проявлениями. Различают ост-
рый и хронический дыхательный ацидоз. При остром дыхатель-
ном ацидозе происходит небольшой прирост бикарбоната в
плазме, pH крови всегда ниже нормы. При хроническом дыха-
тельном ацидозе раСО2 увеличивается медленно, что сопровож-
дается более значительным увеличением уровня НСО2 в плазме
за счет почечного механизма компенсации. pH при этом может
быть умеренно сниженным (субкомпенсированный дыхатель-
ный ацидоз). При нормальной величине pH повышенный уро-
вень раСО2 указывает на смешанную форму дыхательного аци-
доза и метаболического алкалоза.
68
12. Как лечат острый дыхательный ацидоз? Можно ли ограничить-
ся оксигенотеранией или введением натрия бикарбоната?
Основное правило лечения острого дыхательного ацидоза —
восстановление адекватной вентиляции легких. Если причину
острого нарушения дыхания можно устранить быстро (напри-
мер, дренирование грудной полости при напряженном пневмо-
тораксе, коникотомия при обструкции голосовой щели инород-
ным телом и пр.), то ограничиваются этими мероприятиями.
Во всех других случаях при нарушениях центральных и пери-
ферических механизмов регуляции дыхания (черепно-мозговая
травма, действие наркотических и седативных средств, кома,
остановка сердца, нарушение целостности грудной клетки, тя-
желые поражения легких и др.), когда невозможно быстро
устранить причину гиповентиляции легких и связанную с ней
гепоксемию, проводят ИВЛ в режиме:
ДО (мл) = масса тела (кг) х 10—12 (иногда 15);
ЧД (мин) = 16-20.
Концентрация кислорода во вдыхаемом газе (FiO2) — от 40 до
100 % в зависимости от степени гипоксемии.
Адекватность выбранного режима ИВЛ контролируют путем
повторных анализов газов артериальной крови и КОС. Окон-
чательно установленные параметры ДО и ЧД, а также FiO2
должны поддерживать раСО2 на уровне 30—40 мм рт.ст., раО2 —
100 мм рт.ст. Оксигенотерапия без ИВЛ не устраняет гиперкап-
нию. Назначение NaHCOj приведет к еще большему увеличе-
нию уровня СО2.
13. Что такое “первичная гипокапния”?
Первичная гипокапния — синоним понятия “первичный дыха-
тельный алкалоз”. Считают, что это нарушение КОС наиболее
часто встречается в ОИТ. Оно характеризуется первичным сни-
жением раСО2, иногда до крайне низкого уровня (15—20 мм
рт.ст.). Причиной первичной гипокапнии могут быть скрытые
нарушения: гипоксия, расстройства центральной регуляции ды-
хания, болевой синдром, сепсис и др. Характеризуется повыше-
нием pH крови и ощелачиванием жидкостных сред организма.
Является плохим прогностическим признаком. Первичную ги-
покапнию не следует смешивать с вторичной, развивающейся
при метаболическом ацидозе.
14. Установите первичность нарушения КОС, пользуясь показате-
лями pH и pCOi артериальной крови.
При сниженном pH пониженный или нормальный уровень
раСО2 указывает на первичный метаболический ацидоз, а по-
вышенное раСО2 — на первичный дыхательный ацидоз.
При повышенном pH повышенный или нормальный уровень
раСО2 указывает на первичный метаболический алкалоз, а сни-
женное раСО2 — на первичный дыхательный алкалоз.
При нормальной величине pH повышенный уровень раСО2 сви-
детельствует о смешанной форме респираторного ацидоза и ме-
таболического алкалоза, а пониженный — о смешанной форме
69
дыхательного алкалоза и метаболического ацидоза; нормальный
уровень раСО2 может указывать на то, что показатели КОС
находятся в пределах нормы, но не исключают смешанных
метаболических алкалозов/ацидозов. В данной ситуации необ-
ходимо исследовать величину АР.
15. Определите значение ЛР плазмы в интерпретации кислотно-ос-
новных нарушений.
АР представляет собой разность между измеренными катиона-
ми и измеренными анионами плазмы. АН = Na+ — (СГ +
HCOJ). Нормальное значение АР составляет 12 мэкв/л. По-
вышение АР указывает на увеличенное количество неизмерен-
ных анионов, что обусловлено присутствием органических или
неорганических кислот. В случае отдачи Н+ в количестве
1 ммоль/л связанными кислотами (например, молочной кисло-
той) в плазме крови содержание HCOJ снижается на 1 ммоль/л,
а АР увеличивается. Высокая АР плазмы при метаболическом
ацидозе характерна для лактат-ацидоза, кетоацидоза, почечной
недостаточности, отравления, салицилатами, метанолом, эти-
ленгликолем. Нормальное значение АР при метаболическом
ацидозе может наблюдаться при умеренных потерях бикарбо-
натов, диарее, введении жидкостей с избытком хлоридов, по-
чечном канальцевом ацидозе.
16. Укажите наиболее вероятные причины лактат-ацидоза в прак-
тике отделений интенсивной терапии.
Избыточное накопление молочной кислоты (более 2 мэкв/л) в
сыворотке крови свидетельствует об усилении анаэробного ме-
таболизма, т.е. о кислородной недостаточности. Как правило,
лакгат-ацидоз сопровождает глубокую артериальную гипотен-
зию (шок), остановку сердца, но может возникать при сепсисе,
полиорганной недостаточности, судорожных припадках, дли-
тельном внутривенном введении адреналина или нитропруссида.
К лакгат-ацидозу также приводят дефицит тиамина и глубокий
алкалоз. Следует помнить о возможности D-лактат-ацвдоза, не-
диагностируемого при обычных лабораторных исследованиях.
17. Какими основными положениями следует руководствоваться в
лечении лактат-ацидоза?
При лечении лактат-ацидоза следует принять все срочные и
необходимые меры к устранению тяжелых гемодинамических
нарушений, улучшить с помощью инфузионно-трансфузион-
ной терапии и инотропных агентов доставку кислорода к тка-
ням, восстановить нормальные значения газов артериальной
крови, восстановить диурез, т.е. проводить интенсивное лече-
ние полиорганной недостаточности. Применение раствора би-
карбоната натрия показано при pH крови ниже 7,20.
18. Какие осложнения могут быть при лечении диабетического ке-
тоацидоза?
При назначении инсулина и отсутствии контроля за уровнем
глюкозы в крови может возникнуть гипогликемия. Несмотря
70
на то что у большинства больных, находящихся в отделениях
интенсивной терапии, есть сопутствующие заболевания, стре-
мительно возникающие изменения в организме часто становят-
ся следствием неправильно подобранной дозировки инсулина.
Для устранения дефицита жидкости, достигающего при диабе-
тическом кетоацидозе до 10 % массы тела, лечение всегда сле-
дует начинать с инфузионной терапии солевыми растворами
(изотонический раствор хлорида натрия и др.). Однако при
этом существует опасность развития отека мозга или легких.
Для предупреждения этого осложнения рекомендуют приме-
нять коллоидные растворы (например, 5 % раствор альбумина),
способные удерживаться в сосудистом русле и поддерживать
онкотическое давление. Использование гипотонических соле-
вых растворов опасно из-за возможности развития гипоосмо-
лярного состояния на фоне предшествующей гиперосмоляр-
ности, обусловленной гипергликемией.
Истощение запасов калия — частое явление при кетоацидозе,
несмотря на то что уровень калия в сыворотке крови может
быть нормальным или повышенным. Потерю калия следует
восполнять как можно скорее (см. главу 4).
19. Определите основные причины хлоридзависимого метаболическо-
го алкалоза.
К метаболическому хлоридзависимому алкалозу приводят:
• потери желудочного сока (потери Н+ и СГ);
• применение диуретиков, ведущих к потере жидкости и
электролитов: хлора, калия и магния;
• уменьшение общего объема жидкости;
• введение щелочных растворов.
20. Укажите к какому нарушению КОС может привести ИВЛ в
режиме гипервентиляции с одновременным введением раствора
бикарбоната натрия?
Режим гипервентиляции сопровождается первичным дыхатель-
ным алкалозом, а введение бикарбоната натрия без учета КОС
может привести к первичному метаболическому алкалозу. Со-
четание этих форм нарушений приводит к значительному по-
вышению pH жидкостных сред организма.
21. У больного острым панкреатитом через назогастральный зоид
выделяется большое количество желудочного сока. Установите
вид нарушения КОС и электролитного баланса:
pH 7,50 Na+ 137 ммоль/л
раСО2 44 мм рт.ст. К+ 3,5 ммоль/л
НСО3 38 ммоль/л СГ 89 ммоль/л
BE +15,2 ммоль/л
В связи с потерей желудочного сока у больного развились
хлоридзависимый метаболический алкалоз, гипохлоремия и ги-
покалиемия.
71
22. Укажите вид нарушения КОС в данном случае. Какой механизм
компенсации присутствует?
pH 7,52 НСО3 37,0 ммоль/л
раСО2 47 мм рт.ст. BE +12,5 ммоль/л
У пациента имеется частично компенсированный метаболичес-
кий алкалоз. Увеличение уровня раСО2 указывает на то, что в
действие вступили не только буферные механизмы, но и легоч-
ный механизм компенсации (гиповентиляция), направленный
на задержку СО2 в организме. Это состояние можно харак-
теризовать как хронический метаболический алкалоз. Часто
встречается при хронических заболеваниях ЖКТ, а также после
больших операций.
23. Определите возможную причину метаболического ацидоза у
больного с представленными изменениями КОС:
pH 7,15 Na+ 140 ммоль/л
раСО2 30 мм рт.ст. К+ 5 ммоль/л
HCOJ 10 ммоль/л СГ 100 ммоль/л
АР 30 мэкв/л
Уровни кетона, лактата и креатина нормальные.
Если при высокой АР (дефиците анионов) уровни креатина,
кетона и лактата нормальные, наиболее вероятной причиной
метаболического ацидоза у больного является прием токсичных
веществ (этиленгликоль, метанол, этанол и др.).
24. В сыворотке крови больного обнаружено снижение НСОз до
16 ммоль/л (норма — 24 ммоль/л). Пользуясь формулой опреде-
лите общий дефицит бикарбоната, если известно, что масса
тела больного равна 70 кг.
Общий дефицит бикарбоната (НСО3) вычисляют по формуле:
Дефицит НСО3 = 0,5 массы тела (кг) х
х (24 — НСО3 в сыворотке крови), т.е. 35 х
х (24 — 16) = 35 х 8 = 280 ммоль.
25. Укажите наиболее частые причины смешанных нарушений КОС.
Смешанные нарушения КОС возникают чаще всего в тех слу-
чаях, когда одновременно имеются заболевания легких и почек,
когда подавлено действие компенсаторных механизмов или
когда используется ИВЛ. Компенсаторную реакцию можно по-
давить или изменить назначением каких-либо препаратов
(седативных средств, бикарбоната, аспирина и пр.). Термин
“тройное нарушение КОС” не имеет единой интерпретации.
Так называемое тройное нарушение КОС обычно является ре-
зультатом двух метаболических сдвигов и расстройства венти-
ляции.
26. У пациента с тяжелой формой диабета имеются значительные
изменения КОС и увеличение АР. Установите вид нарушения
КОС и объясните причину высокой АР.
72
pH 7,20 Na+ 134 ммоль/л
paCO2 12,5 мм рт.ст. K+ 4,7 ммоль/л
HCO7 5 ммоль/л СГ 100,0 ммоль/л
BE 22 ммоль/л АР 29 мэкв/л
Глюкоза крови 21 ммоль/л.
У больного имеется кетоацидоз с частичной дыхательной ком-
пенсацией. Причиной увеличения АР, обусловливающей раз-
витие метаболического ацидоза, по-видимому, явилось накоп-
ление кетокислот.
27. Определите нарушения КОС и электролитов крови у больного с
острой почечной недостаточностью.
pH 7,28 Na+ 132 ммоль/л
раСО2 28 мм рт.ст. К+ 6 ммоль/л
НСО3 14,0 ммоль/л СГ 98 ммоль/л
BE 10 ммоль/л АР 20 мэкв/л
Увеличение АР, т.е. концентрации остаточных анионов: суль-
фатов, фосфатов и других метаболических кислот — явилось
причиной развития метаболического ацидоза.
28. Определите нарушение КОС и укажите возможную причину его
развития.
pH 7,15 Na+ 138 ммоль/л
рСО2 74 мм рт.ст. К+ 5,4 ммоль/л
НСО3 25 ммоль/л СГ 100 Ммоль/л
АР 13 мэкв/л
Данное нарушение КОС — острый (некомпенсированный) ды-
хательный ацидоз — возникает в результате альвеолярной гипо-
вентиляции, не соответствующей темпу образования СО2 в
тканях. Может наблюдаться при ИВЛ с неправильно подобран-
ными параметрами или при значительном увеличении мертвого
пространства. Повышение уровня НСОу,очевидно, является
компенсаторной реакцией. Острый респираторный ацидоз
всегда сопровождается увеличением концентрации калия в сы-
воротке крови, однако величина АР остается в пределах нормы.
Расчеты: 1) определение концентрации Н+ согласно уравнению
Гендерсона.
. раСО2 та
Н , нмоль = 24 х----= 24 х = 71 .
НСО3 25
2) Величина Н+ = 71 нмоль, соответствует pH 7,15.
29. Больной 68 лет, страдающий хроническим бронхитом в течение
последних 8 лет, доставлен в больницу в связи с резким ухудше-
нием состояния: усиление одышки, возбуждение и психические
отклонения. При поступлении состояние тяжелое, ЧД 30 в
минуту, ЧСС — 104 в минуту, АД 170/100 мм рт.ст., невыра-
женный цианоз, потливость, речевой контакт с больным за-
труднен.
73
Газы крови: pH 7,27; раСО2 84 мм рт.ст.; раО2 40 мм рт.ст.;
HCOJ плазмы 38 ммоль/л; гематокрит 60 %.
а) рассчитайте на основе уравнения Гендерсона концентрацию IH;
б) объясните изменения HCOj',
в) дайте заключение о характере изменений КОС и газов крови.
а) расчет концентрации Н+ по уравнению Гендерсона:
, раСО2
[Н+] = 24 х -
HCOJ
т.е. 24 х (84 : 38) = 52,8 нмоль.
Эта величина соответствует величине pH 7,27;
б) компенсаторные изменения HCOJ зависят от быстроты из-
менений раСО2. При остром повышении раСО2 от 40 до 84 мм
рт.ст. концентрация HCOJ увеличивается приблизительно на
0,1 ммоль/л на 1 мм рт.ст. увеличения раСО2, т.е. ожидаемое
увеличение HCOJ должно быть равно: 0,1 х 44 = 4,4 или 24 +
+ 4,4 = 28,4 ммоль/л. В данном случае произошло более зна-
чительное изменение уровня HCOJ (примерно 0,3 ммоль/л на
каждый 2 мм рт.ст. увеличения раСО2), т.е. 24 + 14 = 38 ммоль/л,
что характерно для предшествующей компенсации хроническо-
го дыхательного ацидоза;
в) на основании данных анамнеза, клинического обследования
и проведенных расчетов можно утверждать, что у больного
имеется острый дыхательный ацидоз, возникший на фоне хро-
нического. Снижение раО2 до 40 мм рт.ст. свидетельствует о
глубокой гипоксемии.
30. Больная 38 лет доставлена в клинику с острым приступом
бронхиальной астмы. При обследовании: ЧД 32 в минуту, нульс
132 в минуту, “парадоксальный пульс” 20 мм рт.ст. Больная из-за
одышки не может произнести целую фразу. АД 160/95 мм рт.ст.
При аускультации: разнотональные звуки, прослушиваемые над
всей поверхностью легких.
Газы крови и КОС: pH 7,35; раО2 50 мм рт.ст. при дыхании
воздухом; раСО2 45 мм рт.ст.
Оцените тяжесть астматического состояния.
Несмотря на то что показатели КОС в пределах нормы, ряд других
признаков — выраженная одышка, значительное увеличение час-
тоты дыхания и пульса, “парадоксальный пульс” и снижение раО2
до 50 мм рт.ст. — указывает на тяжелую форму астмы.
31. Больной 66 лет с гипертензией и ишемической болезнью сердца
(ИБС) доставлен в отделение интенсивной терапии с тяжелой
одышкой и цианозом.
Три года назад перенес инфаркт миокарда. При поступлении
предъявляет жалобы на нехватку воздуха. Отмечается повышен-
ное потоотделение, ЧД 30 в минуту, ЧСС 112 в минуту, АД
170/115 мм рт.ст. Шейные вены набухшие. При аускультации в
74
обоих легких влажные хрипы, тоны сердца приглушены, акцент
второго тона на аорте. Границы печени в пределах нормы, незна-
чительные отеки в области голеней. На ЭКГ— “старый" ин-
фаркт нижней стенки миокарда. Газы артериальной крови и
показатели КОС: pH 7,35, рСО2 45мм рт.ст., НСО^ 25 ммоль/л,
рО2 37 мм рт.ст.
Электролиты и другие показатели плазмы крови: Na+ — 132 ммоль/л,
К+ — 3,4 ммоль/л, С1~ — 90 ммоль/л, глюкоза — 5,0 ммоль/л,
азот мочевины — 30 ммоль/л, креатинин — 116 мкмоль/л, АР —
17 мэкв/л.
Объясните возможную причину ухудшения состояния больного
и данные газового состава крови, КОС и других показателей.
Изменения в состоянии больного: выраженная одышка, харак-
терный анамнез (артериальная гипертензия, ИБС, “старый”
инфаркт миокарда), данные физикального обследования (влаж-
ные хрипы в легких, периферические отеки), скорее всего,
свидетельствуют о левожелудочковой недостаточности и отеке
легких. Тяжелая гипоксемия указывает на ухудшение альвео-
лярного газообмена и возможном отеке легких. Умеренно вы-
раженная гиперкапния (раСО2 45 мм рт.ст.) явно не соответст-
вует имеющейся гипоксемии и свидетельствует о расстройстве
необходимой дыхательной компенсации, возможно, из-за утом-
ления дыхательных мышц. Отсутствие дыхательного алкалоза и
соответственно снижения HCOJ также указывает на отсутствие
компенсаторных резервов у больного. Несмотря на то что фор-
мально показатели КОС находятся в пределах нормы, можно
считать состояние больного очень тяжелым, требующим немед-
ленного лечения. Исследования азота мочевины и креатинина
крови необходимы для исключения почечной недостаточности.
СПИСОК ЛИТЕРАТУРЫ
Взятие проб цельной крови (руководство) Радиометр. — Копенгаген,
2000. — 71 с.
Горасио Дж. Адроге, Мартин Дж. Тобин. Дыхательная недостаточность:
Пер. с англ. — М.: Медицина, 2003. — 510 с.
Дементьева И.И. Клинические аспекты состояния регуляции кислот-
но-основного гомеостаза. — М.: “ЮНИМЕД-Пресс”, 2002. —
80 с.
Дон X. Метаболический алкалоз. / В кн.: Принятие решения в интен-
сивной терапии. — М.: Медицина, 1995. — С.178—180.
Интенсивная терапия (руководство для врачей). / Под ред. В.Д.Малы-
шева. — М.: Медицина, 2002. — 689 с.
Клиническая лабораторная аналитика. / Под ред. В.В.Меньшикова. —
М.: Медицина, 2000. — 180 с.
Марини Джон Дж., Артур П., Уилер. Медицина критических состоя-
ний: Пер. с англ. — М.: Медицина, 2002. — 978 с.
Марино П.Л. Интенсивная терапия: Пер. с англ. доп. / Под ред.
А.И.Мартынова. — ГЭОТАР Медицина, 1998. — 639 с.
Справочник по газам крови. Радиометр. — Копенгаген, 2002. — 108 с.
Торшин В.А. Уровень лактата крови как показатель STAT-анализа. /
Лаборатория. — № 4. — 2001. — С.17.
75
Челноков С.Б. и др. Случай тяжелой метгемоглобинемии у недоношен-
ного новорожденного ребенка / Вести, интенс. тер. — 2002 —
№ 2. - С.18-21.
Astrup Р., J.Severighaus. The History of Blood Gases, Acids and Bases. —
Munrsgaard, 1986. — 198 p.
Blick K.E. Information Management for Point-of-Care/Critical Care Tes-
ting. Blood Gas News. — 2000. — Vol.9. — N 1. — P.4—13.
Campbell C.H. The severe lactic acidosis of thiamine deficiency: Acute
pernicious or fulminating beriberi / Lancet. — 1984. — N 3. — P.446—
449.
Green van den Berghe et al. Intensive Insulin Therapy in Critically III
Patients. New Engl. J. Med. — Vol.35, N 19. — Nov.8. — 2001. —
P. 1359-1367.
Javeheri S., Kasemi H. Metabolic alkalosis and hypoventilation in hu-
mans / Amer. Rev. Respir. Dis. — 1987. — N 136. — P.1011—1016.
Krisberg R.A. Diabetic ketoacidosis: An update / Crit Care Clin. — 1987. —
N 3.-P.817-834.
Marini J.J., Wheller A.P. Acid-base disorders. Critical Care Medicine,
Second Edition, 1997. — P.209—222.
Toffaletti J. Blood Lactate: Biochemistry, Laboratory Methods and Clini-
cal Interpretations. Critical Reviews in Clinical laboratory Sciences. —
Vol.28, Issue 4. - 1991. - P.253-268.
Часть II. ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС
Вода с растворенными в ней электролитами, питательными
и энергетическими веществами находится в постоянном дви-
жении. Несмотря на то что жидкостные константы организма
относительно постоянны, это постоянство достигается непре-
рывным движением, обновлением, нарушением и последую-
щим восстановлением. Термин “гомеостаз” не означает посто-
янное и непрерывное состояние. Гомеостаз — динамическое
постоянство внутренней среды организма. Это внутренний мир
(клетки, клеточная и внеклеточная среда), связанный со всеми
органами и системами. Во внутренней среде происходят слож-
ные метаболические процессы и транспорт различных веществ.
Клетки получают кислород и питательные вещества и выделя-
ют шлаки, которые выводятся из организма посредством вы-
делительной системы.
Клетка — живой организм, связанный с макроорганизмом,
от функции каждой клетки зависит и состояние важнейших
систем жизнеобеспечения: центральной нервной, дыхательной,
сердечно-сосудистой и эндокринной систем, функции почек.
Электролиты — катионы и анионы — играют важнейшую роль
в биоэлектрическом мембранном потенциале клеток, осмоляр-
ности жидкостных сред, поддержании секторальных объемов
жидкости. Каждый электролит выполняет свою специфичес-
кую функцию. Во всех случаях, когда пациент находится на
парентеральном обеспечении, поддержание водного и электро-
литного баланса является важнейшей задачей лечения. Знание
основ водно-электролйТного обмена позволит врачу оказать
эффективную помощь больному, находящемуся в критическом
состоянии.
Глава 8
ФИЗИОЛОГИЧЕСКИЕ АСПЕКТЫ ВОДНОГО
И ЭЛЕКТРОЛИТНОГО ОБМЕНА
Водный баланс организма
Водный баланс организма поддерживается благодаря аде-
кватному поступлению воды в соответствии с ее потерями.
Организм получает воду с питьем, пищей и в результате об-
менных процессов, а выделяется вода с мочой и калом, через
легкие и кожу.
Количество потребляемой воды в среднем в сутки состав-
77
ляет до 2,5 л. В виде питья в норме в организм должно
поступать примерно 1300 мл, с пищей — 100 мл, в процессе
метаболизма образуется 200 мл воды.
При нормальной температуре тела и отсутствии водно-
электролитных нарушений суточная потребность организма
в воде составляет 1,5 л/м2.
Минимальное поступление воды, обеспечивающее водно-
электролитное равновесие, равно 1500 мл. Суточный диурез
составляет 1200—1500 мл, почасовой диурез — 0,7 мл/кг массы
тела. Через кожные покровы и легкие выделяется 100 мл воды,
с калом — 100 мл.
Суточная потребность в воде зависит от многих факторов:
массы тела, пола, возраста, температуры тела и окружающей
среды и др. В связи с этим суточная потребность организма
человека в воде в норме колеблется от 1 до 3 л и более. При
выработке 1000 ккал образуется приблизительно 100 мл воды
[Moore F.D., 1959]. Поскольку пищевой режим взрослого че-
ловека составляет в среднем 1500—2200 ккал, то количество
образующейся эндогенной воды в среднем равно 150—220 мл.
Количество выпиваемой воды приблизительно соответствует
диурезу, а количество воды, поступающей с пищей, примерно
равно потерям при дыхании и через кожу [Rooth G., 1978].
Нормальные показатели неощутимых потерь воды у взрос-
лых при дыхании и с поверхности кожи с потом составляют
около 15 мл/кг массы тела в сутки. Их объем зависит от
интенсивности обменных процессов, количества эндогенной
воды и внешних факторов. Средняя суточная потеря воды
через легкие равна 0,4—0,5 л, через кожу — 0,5—0,7 л. Таким
образом, объем неощутимых (незаметных) потерь у взрослого
человека с массой тела 70 кг в нормальных условиях составляет
примерно 1 л/сут. Физиологические колебания потерь воды
довольно значительны. При повышении температуры тела уве-
личивается количество эндогенной воды и возрастают потери
воды через кожу и при дыхании. На каждый градус повышен-
ной температуры тела эти потери увеличиваются примерно на
500 мл. У новорожденных потери воды более значительны, чем
у взрослых, и достигают 50 мл/кг в сутки. Ежедневный обмен
внеклеточной жидкости у новорожденных составляет 50 %, а у
взрослого — только 15 %.
В условиях тяжелого стресса, гиперметаболизма, патологи-
ческих жидкостных потерь потребность в воде значительно
возрастает. Одновременно увеличиваются и потери воды. От-
сутствие энтерального пути усвоения жидкости делает эту про-
блему более сложной. У больного в критическом состоянии
нередко отсутствуют чувство жажды и возможность самостоя-
тельного обеспечения водой. Если здоровому человеку, стра-
дающему жаждой, нужна только вода, то больному с нарушен-
78
-«ил водно-электролитным равновесием, нужен врач, хорошо
«избирающийся в этой проблеме.
**При уменьшении поступления воды возникает олигурия, по-
вышается концентрация мочи, включаются механизмы, направ-
ленные на сохранение воды в организме. При избыточном по-
етупдении воды, наоборот, происходит ее активное выделение.
Здоровый человек легко переносит умеренный дефицит или
увеличенное потребление воды, в несколько раз превышающее
физиологическую норму. У больных в отделениях интенсивной
терапии (ОИТ), как правило, нарушена саморегуляция водного
баланса. Даже небольшой дефицит воды или ее избыток со-
провождаются выраженными изменениями гомеостаза и орган-
ных функций.
Вода с растворенными в ней веществами представляет собой
функциональное единство как в биологическом, так и в
физико-химическом отношении, является важнейшей реакци-
онной средой и выполняет роль основного пластического эле-
мента тела. Общее количество воды зависит от общего количества
катионов, особенно натрия и калия, регулирующих содержание
анионов и связанной воды. Выделительная функция почек зави-
сит от содержания воды и натрия. При дегидратации в резуль-
тате действия антидиуретического гормона (АДГ) возникает
олигурия. АДГ обычно не влияет на экскрецию К+ и Na+.
Общее содержание воды в организме. У новорожденного
Общее количество воды составляет 80 % массы тела. С возрас-
том содержание воды в тканях уменьшается: в организме здо-
рового мужчины ее содержится в среднем около 60 %, а у
женщин около 50 % массы тела. При ожирении содержание
воды уменьшается у мужчин до 50 %, у женщин до 42 %. При
Пониженном питании содержание воды в тканях увеличивается
(до 70 % у мужчин и до 60 % — у женщин). Жировая ткань
содержит приблизительно 30 % воды, обезжиренная масса —
72—73 %. Этим, по-видимому, можно объяснить тот факт, что
тучные люди переносят потери воды значительно тяжелее, чем
люди с нормальным питанием.
Водные разделы организма. Примерно 2/з воды находится
внутри клеток (внутриклеточное водное пространство) и 1/3 —
вне клеток (внеклеточное водное пространство) (табл. 8.1).
•; Внеклеточное водное пространство. Внеклеточное прост-
ранство — это окружающая клетки жидкость, объем и состав
которой поддерживается с помощью регулирующих механиз-
мов. Основной катион внеклеточной жидкости — натрий, ос-
новной анион — хлор. Натрию и хлору принадлежит главная
Роль в поддержании осмотического давления и объема жид-
кости этого пространства. Через внеклеточное пространство
обеспечиваются транспорт кислорода, питательных веществ и
Ионов к клеткам и доставка шлаков к органам выделения.
Внеклеточная среда негомогенна (кровеносные и лимфатичес-
79
Таблица 8.1. Секторальное распределение воды в организме человека
Водные секторы Сокра- щение Процент от массы тела
у мужчин у женщин
Общая жидкость тела ОбщЖ 60 54
Внутриклеточная жидкость ВнуКЖ 40 36
Внеклеточная жидкость ВнеКЖ 20 18
Интерстициальная жидкость ИнЖ 15 14
Плазматическая жидкость ПЖ 4-5 3,5-4
Объем циркулирующей крови ОЦК 7 6,5
Примечание. ВнуКЖ = ОбщЖ - ВнеКЖ; ИнЖ = ВнеКЖ - ПЖ.
кие сосуды, межтканевая жидкость, жидкость в плотных со-
единительных тканях) и имеет зоны разной интенсивности
обмена. В связи с этим определение внеклеточного объема в
известной степени условно, хотя и имеет большое практичес-
кое значение. Принято считать, что ВнеКЖ составляет при-
мерно 2—22 % массы тела, однако ее общий объем превышает
эту величину [Рябов Г.А., 1979; Хартиг В., 1982].
Внеклеточное пространство включает в себя следующие вод-
ные секторы.
Внутрисосудистый водный сектор — плазма, имеющая по-
стоянный катионно-анионный состав и содержащая белки,
удерживающие жидкость в сосудистом русле. Объем плазмы у
взрослого человека составляет 4—5 % массы тела.
Интерстициальный водный сектор — межклеточная жид-
кость, которая является своего рода буфером между внутрисо-
судистым и клеточным секторами. Интерстициальная жидкость
отличается от плазмы значительно меньшим содержанием белка.
Мембраны сосудов легко проницаемы для электролитов и ме-
нее проницаемы для белков плазмы (эффект Доннана). Тем не
менее между белками плазмы и межтканевой жидкостью про-
исходит постоянный обмен. В двух секторах — внутрисосудис-
том и интерстициальном — создается изотоничность жидкости,
то же наблюдается и в клеточном секторе. Через интерстици-
альный сектор осуществляются транзит ионов, кислорода, пи-
тательных веществ в клетку и обратное движение шлаков в
сосуды, по которым они доставляются к органам выделения.
Интерстициальный сектор является значительной “емкос-
тью”, содержащей V4 всей жидкости организма (15 % массы
тела). Эта “емкость” как вместилище воды может значительно
увеличиваться (при гипергидратации) или уменьшаться (при
дегидратации). За счет жидкости интерстициального сектора
происходит компенсация объема плазмы при острой крово- и
плазмопотере. Переливание большого количества кристаллоид-
ных растворов не сопровождается значительным увеличением
80
нутрисосудистого объема вследствие их проникновения через
сосудистые мембраны в интерстициальный сектор.
С Трансцеллюлярный сектор (межтканевая жидкость) — жид-
кость, которая располагается в полостях организма, в том числе
пищеварительном тракте. Общее количество трансцеллюляр-
ной жидкости, по данным разных авторов, составляет 1—2,3 %
массы тела, хотя интенсивность выделения и реабсорбции ее
из ЖКТ велика —до 8—10 л/сут. Значительное увеличение
трансцеллюлярного сектора происходит при нарушениях реаб-
сорбции и депонировании жидкости в ЖКТ (перитонит, ки-
шечная непроходимость).
Внутриклеточное водное пространство. Вода в клетках ок-
ружает внутриклеточные структуры (ядро и органеллы), обес-
печивает их жизнедеятельность и фактически является состав-
ной частью протоплазмы клеток. В отличие от внеклеточной
во внутриклеточной жидкости — более высокий уровень белка
и калия и небольшое количество натрия. Основной клеточный
катион — калий, основные клеточные анионы — фосфат и бел-
ки. Калий составляет примерно 2/з активных клеточных кати-
онов, около !/з приходится на долю магния. Концентрация
калия в мышечных клетках равна 160 ммоль/л, в эритроци-
тах — 87 ммоль/л, в сыворотке крови только 4,5 ммоль/л. Ка-
лий в клетках или находится в свободном состоянии, или связан
с СГ или двумя фосфатными буферными ионами (К2НРО4 и
КН2РО4). СГ в здоровых клетках отсутствует либо содержится
в очень небольшом количестве. Содержание СГ в клетках
увеличивается только при патологических состояниях. Кон-
центрация калия в эритроцитах не полностью отражает его
баланс в клеточном пространстве, так как изменения содержа-
ния калия в эритроцитах происходят медленнее, чем в других
клетках.
Таким образом, концентрация К+ и Na+ в клеточной жид-
кости значительно отличается от концентрации этих ионов во
внеклеточном водном пространстве. Это различие обусловлено
функционированием натриево-калиевого насоса, локализую-
щегося в клеточной мембране. В связи с разностью концент-
раций образуется биоэлектрический потенциал, необходимый
Для возбудимости нервно-мышечных структур. Вследствие ре-
поляризации клеточной мембраны К+ и Na^ свободно прони-
кают в клетку, однако Na+ сразу же “изгоняется” из клетки.
Натриево-калиевый насос как бы постоянно перекачивает нат-
рий из клеток в интерстиций, а калий, наоборот, — в клетки.
Для осуществления этого процесса необходима энергия, кото-
рая образуется путем гидролиза аденозинтрифосфата (АТФ)
При усвоении жиров, углеводов и витаминов, при отсутствии
Же энергетического материала расходуются тканевые белки.
Изменения концентрации К+ и Mg2+ в сыворотке крови не
Полностью соответствуют изменениям концентрации этих
81
6- 1069
ионов в клеточной жидкости. Снижение концентрации К+ в
сыворотке крови при ацидемии означает дефицит калия не
только в плазме, но и в клетках. Нормальный уровень калия
в сыворотке крови не всегда соответствует его нормальному
содержанию в клетках.
Осмотическая активность плазмы
Осмотическая активность биологической жидкости опреде-
ляется концентрацией биологически активных веществ и со-
здается преимущественно диссоциированными электролитами
(имеющими относительно высокую молекулярную концентра-
цию и незначительную молекулярную массу) и недиссоции-
рующими соединениями. Данная активность (соответствующая
1 л раствора) выражается в миллиосмолях (моем), равных мил-
лиэквивалентам (мэкв) одновалентных ионов, при этом отно-
шение мэкв/л — ммоль/л.
Плазма крови представляет собой сложный раствор, содер-
жащий ионы (Na+, К+, СГ, HCOJ и др.), молекулы неэлектро-
литов (глюкоза, мочевина и др.) и протеины.
Соли типа натрия хлорида полностью диссоциируют в воде,
поэтому осмотическая активность раствора вдвое больше кон-
центрации каждого электролита. Глюкоза не диссоциирует в
воде, осмотическая активность ее количества, равного 1 ммоль
и содержащегося в 1 л растворе, составит 1 моем.
Общая концентрация плазмы составляет 285—295 мосм/л.
Осмотическую концентрацию обозначают терминами осмоляр-
ность и осмоляльность.
Осмолярность — число осмолей растворенного вещества, со-
держащегося в 1 л раствора (мосм/л).
Осмоляльность — число осмолей растворенного вещества, со-
держащегося в 1 кг растворителя (мосм/кг Н2О).
Примерно 50 % осмотического давления плазмы обусловле-
но наличием Na+ и 30 % — СГ. Одновалентные ионы образуют
в растворе количество осмолей, равное числу эквивалентов.
Двухвалентные ионы образуют по два эквивалента, но по одно-
му осмолю. У биологических жидкостей разница между осмо-
лярностью и осмоляльностью невелика и может иметь одина-
ковое значение.
Поскольку натрий является главным осмотически активным
внеклеточным катионом и составляет в среднем '/г осмоляр-
ности плазмы, последнюю определяют в большей степени пу-
тем соотношения Na+ и Н2О.
Осмолярность плазмы можно вычислить, исходя из содер-
жания в ней натрия, глюкозы и мочевины — основных онко-
тических компонентов внеклеточной жидкости. Для этого ис-
пользуют следующую формулу:
82
Осмоляльность = 2 х Na+ + глюкоза + мочевина, т.е.
осмоляльность = 2x 40 + 5 + 5 = 290 мосмоль/кг Н2О.
Если концентрации глюкозы, мочевины и других веществ
даиы в миллиграммах на децилитр (мг/дл, или мг%), то для
перевода их в осмоли следует эти величины разделить на мо-
лекулярную массу, деленную на 10.
При наличии токсемии осмоляльность плазмы возрастает в
результате возможного присутствия в ней таких веществ, как
этанол, этиленгликоль, сложных углеводов и недифференци-
руемых “неизмеряемых осмолей”.
Более точно осмоляльность плазмы измеряется посредством
осмометрии с использованием криоскопических констант (оп-
ределение точек замерзания осмотически активных веществ,
которые ниже точки замерзания воды).
Осмоляльная разница. Разность между измеренным и под-
считанным по формуле значением осмоляльности плазмы в
норме составляет 10 мосм/кг Н2О или меньше. Повышенная
осмоляльная разница свидетельствует о присутствии токсинов
(этанол, метанол, этиленгликоль) или других осмотически ак-
тивных веществ, таких как маннит, трудно дифференцируемых
средних молекул, наблюдаемых при хронической почечной не-
достаточности. Умеренное повышение осмоляльной разницы
Может возникать в результате уменьшения жидкой части плаз-
Мы при гиперпротеинемии или гиперлипидемии.
Осмотическое давление плазмы. Под осмотическим давлени-
ем следует понимать разницу осмотической активности двух
растворов, разделенных полупроницаемой мембраной, через
которую свободно проходят только молекулы Н2О. В резуль-
тате образующегося градиента давлений будет происходить
движение Н2О из сектора с низкой осмолярностью в сектор с
высокой осмолярностью до тех пор, пока осмолярность, т.е.
концентрация растворенных веществ, не станет одинаковой в
обоих водных секторах. Однако ряд веществ свободно проходит
через мембрану, приводя к гиперосмолярности растворов без
Повышения осмотического давления. К таким веществам от-
носятся мочевина и спирты.
У здорового человека разница между осмолярностью плазмы
и осмотическим давлением незначительна из-за малой кон-
центрации мочевины во ВнеКЖ. Так, если уровень мочевины
крови равен 5 мосм/кг Н2О, а общая осмоляльность плазмы
290 мосм/кг Н2О, то осмотическое давление плазмы в этом
случае будет равно 290 — 5 = 285 мосм/кг Н2О.
Таким образом, осмолярность плазмы и ее ионный состав
играют важную роль в лечении тяжелобольных. Снижение
или повышение осмолярности плазмы всегда сопровожда-
ются значительными гидропонными нарушениями и требу-
ют принятия неотложных мер.
«•
83
Ионный и молярный состав жидкостей тела представлены
в табл. 8.2, молекулярная масса компонентов плазмы — в
табл. 8.3.
Коллоидно-осмотическое давление плазмы (КОД) — осмоти-
ческое давление, создаваемое белками плазмы — альбуминами,
глобулинами и фибриногеном. КОД плазмы может быть уве-
личенным вследствие применения гетерогенных высокомо-
лекулярных плазмозамещающих сред. В норме КОД равно
25 мм рт.ст. (3,4 кПа) и может быть определено с помощью
расчетов или прямым измерением онкометром. КОД зависит
от молекулярной массы растворенного вещества и его концент-
рации. Альбумины, концентрация которых в плазме равна 42 г/л
(4,2 г/дл), имеют молекулярную массу 70 000, их доля в КОД
плазмы составляет 80 %. Глобулины, имеющие более высокую
молекулярную массу, чем альбумины, создают до 16—18 %
общего КОД плазмы. Всего 2 % КОД плазмы создают белки
свертывающей системы крови. КОД зависит от уровня белка
плазмы, главным образом от уровня альбумина, и связано с
волемией, осмолярностью и концентрацией Na+ в плазме.
Таблица 8.2. Ионный и молярный состав жидкостей тела
Ионный состав Плазма ИнЖ ВнуКЖ
мэкв/л ммоль/л мэкв/л ммоль/л мэкв/л ммоль/л
Катионы Na+ 140 140 142 142 10 10
К+ 4 4 4 4 160 160
Са2+ 5 2,5 2 1 2 1
Mg2+ 2 1 2 1 26 13
Всего... 151 147,5 150 148 198 184
Анионы СГ 103 103 114 114 3 з
нсо5 24 24 28 27 11 Н
HPOf 2 1 2 1 100 50
SO^- 1 0,5 1 0,5 20 10
Органические 5 5 5 5 — -
анионы Белки 16 2 64 8
Всего... 151 135,5 150 147,5 198 82
Примечание. В каждом водном разделе поддерживаются постоянный ион-
ный состав, постоянные значения осмотического давления и pH. Распре-
деление воды между разделами зависит от общего количества растворен-
ных в ней веществ. Вода движется в направлении более высокого осмо-
тического градиента. Электронейтральность среды обеспечивается
равенством суммарных количеств катионов и анионов.
84
Таблица 8.3. Концентрация компонентов плазмы и их молекулярная
масса
Компоненты плазмы Концентрация, ммоль/л Мол. масса
Na+ 140 23
СГ 103 35,5
нсо3 24 61
к+ 4,5 39
Са2+ 2,5 40
Mg2+ 1,0 24,3
pot 1,0 95
sot 0,5
Органические кислоты 5,0
Глюкоза 4,0 180
Белок 1,5-2,0 70 000-400 000
Мочевина 5,0 60
Всего... 292 —
КОД (онкотическое давление), несмотря на свою малую
величину, играет' важную роль в поддержании объема водных
секторов и тургора тканей, в процессах транскапиллярного
обмена. Имеется прямая зависимость между объемом плазмы
и величиной КОД (рис. 8.1). Соотношение КОД и гидростати-
ческого давления определяет процессы фильтрации и реаб-
сорбции. Снижение концентрации белков плазмы, особенно
альбумина, сопровождается уменьшением внутрисосудистого
объема и развитием отеков. Липоидорастворимые вещества
осмотической активностью не обладают.
КОД плазмы — важнейший гомеостатический показатель,
имеющий прямое отношение к лечению больных, находя-
щихся в критическом состоянии. Известно, что снижение
уровня альбумина плазмы ниже 30 г/л и соответственно
снижение КОД ниже 14—16 мм рт.ст. сопровождаются зна-
чительным увеличением летальности.
Количество положительных зарядов ионов в водных разде-
лах организма должно быть равно количеству отрицательно
заряженных. На этом основании делаются различные расчеты
в тех случаях, когда необходимо определить количество “неиз-
меряемых” ионов. Изменения жидкостных секторальных объ-
емов обусловлены сложными биологическими процессами,
Подчиняющимися физико-химическим законам электронейт-
Ральности и изоосмолярности.
85
Рис. 8.1. Зависимость объема циркулирующей крови от коллоидно-
осмотического давления плазмы.
Закон электронейтральности заключается в том, что сумма положи-
тельных зарядов во всех водных пространствах равна сумме отрицатель-
ных зарядов. Постоянно возникающие изменения концентрации элект-
ролитов в водных средах сопровождаются изменением электропотенци-
апов с последующим их восстановлением. Таким образом, при динами-
ческом равновесии образуются стабильные концентрации катионов и
анионов, сумма зарядов которых создает электронейтральную среду.
Графически этот закон может быть представлен в виде диа-
граммы Гембла. Сумма положительных зарядов, создаваемых
катионами, равна сумме отрицательных зарядов, создаваемых
анионами. Наиболее быстрым изменениям подвержены HCOJ и
остаточные анионы. Наглядность изменений электролитов
позволяет использовать диаграмму в процессе интенсивного
лечения различных категорий больных. Некоторые компо-
ненты диаграммы могут быть определены путем расчетов.
86
Закон изоосмолярности. Осмолярность в секторах, между которыми
происходит перемещение воды, должна быть одинаковой, несмотря на
различие в ионном составе.
ВнеКЖ должна быть изотонична ВнуКЖ, несмотря на то
что заряженных частиц внутри клеток больше. Это объясняется
тем, что часть ионов внутри клетки связана с протеинами.
Многие молекулы поливалентны, что увеличивает число заря-
дов, а не осмотически активных частиц.
Если в одном из пространств осмолярность повысится, т.е.
увеличится количество растворенных частиц, то вода перейдет
в это пространство из другого пространства с меньшей осмо-
лярностью. В результате устанавливается новая величина ос-
молярности, образуются новые объемы жидкости и концент-
рации электролитов.
Регуляция водно-электролитного обмена
У здоровых людей количество принимаемой воды и соли
значительно варьирует, однако при этом фактически неизме-
ненными остаются все параметры гомеостаза. У тяжелоболь-
ных, находящихся на парентеральном обеспечении, часто воз-
никают клинически выраженные нарушения водного баланса,
отражающиеся на объемах воды в водных секторах и на уровне
натрия в сыворотке крови, что позволяет считать его маркером
водных расстройств.
Снижение объемов жидкости и повышение осмолярности
плазмы вызывают жажду и повышенную секрецию АДГ систе-
мой гипоталамус—гипофиз. АДГ (вазопрессин) воздействует на
собирающий проток мозгового слоя почек, стимулируя резорб-
цию воды. В результате АДГ во взаимодействии с ренин-ангио-
тензин-альдостероновой системой в ответ на снижение жид-
костного циркулирующего объема восстанавливает его. Совмест-
ное действие этих двух систем вызывает сбалансированную
задержку натрия и воды.
При снижении осмолярности плазмы секреция АДГ снижа-
ется. При этом избыточная вода выделяется и осмолярность
плазмы возвращается к норме.
У больных ОИТ центральные и почечные механизмы регу-
ляции водного и натриевого обмена часто нарушены. В резуль-
тате перенесенной гипоксии, травмы головы, инфекции и дру-
гих причин система гипоталамус—гипофиз может терять спо-
собность к выработке достаточного количества АДГ; в этих
случаях развивается несахарное мочеизнурение — признак не-
сахарного диабета. При заболеваниях почек (поликистоз, хро-
87
нический пиелонефрит, амилоидоз), гипокалиемии и гипо-
кальциемии почки утрачивают способность реагировать на АДГ.
Это состояние так же, как и несахарный диабет, сопровожда-
ется мочеизнурением и классифицируется как “нефрогенный
несахарный диабет”. Надпочечниковая недостаточность (дефи-
цит АКТГ) может сопутствовать несахарному диабету, обуслов-
ленному травмой.
С другой стороны, неадекватная повышенная секреция АДГ,
наблюдаемая в ОИТ у больных с различными заболеваниями^
сопровождается задержкой воды в организме и снижением
концентрации натрия во ВнеКЖ.
Одной из возможных причин нарушений водно-электролит-
ного обмена является надпочечниковая (адреналовая) недоста-
точность, которая часто отмечается у больных в критическом
состоянии. Физиологические проявления недостаточности над-
почечников обусловлены дефицитом кортизола и(или) альдо-
стерона. Минералкортикоиды альдостерон и дезоксикортико-
стерон активно влияют на водно-электролитный баланс. Лю-
бые изменения водно-электролитного гомеостаза восприни-
маются осмо- и волюморецепторами, локализованными в
сосудистой системе.
Глава 9
РАССТРОЙСТВА ВОДНОГО
И ЭЛЕКТРОЛИТНОГО ОБМЕНА
Изотонические нарушения объемов внеклеточной
жидкости
Изотоническая дегидратация. Гиповолемия и гиповолеми-
ческий шок (ГШ) обусловлены патологическими потерями
жидкости, в основном из внеклеточного пространства. Это
приводит к дегидратации с характерной клинической симпто-
матикой. Изотонические потери — это потери не только воды,
но и связанных с ней осмотически активных электролитов
Na+, СГ.
Причины изотонической дегидратации:
♦ гастроинтестинальные потери (рвота, диарея, кишечные
свищи, зонд и др.);
♦ крово- и плазмопотери (в этом случае потери происходят
из сосудов, что приводит к быстрому развитию циркуля-
торных нарушений);
♦ почечные потери (избыточные потери в результате осмо-
тического диуреза, вызванного диабетом или назначени-
88
ем диуретиков; вследствие нарушений регулирующих ме-
ханизмов водно-электролитного обмена);
♦ секвестрация изотонической жидкости в тканевые про-
межутки и полости тела — так называемое третье водное
пространство. Объем циркулирующей жидкости при этом
снижается, а общий объем жидкости может быть нор-
мальным или даже повышенным. Внутренняя секвестра-
ция жидкости наблюдается при перитоните, паралити-
ческой кишечной непроходимости, ожогах, повреждени-
ях мягких тканей и печеночных нарушениях.
Изотонические потери распознаются по клиническим симп-
томам, подтвержденным соответствующими анализами. Наи-
более характерны гемодинамические и неврологические нару-
шения. Острая потеря изотонической жидкости всегда сопро-
вождается теми или иными нарушениями гемодинамики, кото-
рые зависят от снижения ОЦК. и(или) ОЦП. Гиповолемия
может достигать крайней степени и приводить к снижению
центрального венозного давления (ЦВД), давления наполне-
ния левого желудочка (ДНЛЖ), артериального давления (АД),
сердечного выброса (СВ) и, наконец, к развитию шока.
Симптомы значительного изотонического дефицита: жажда,
холодная кожа, снижение температуры тела, слабый пульс,
иногда отсутствие его на периферических артериях. Диурез
снижен до выраженной олигурии при уменьшении содержания
натрия в моче.
Несмотря на значительные потери натрия и воды, концент-
рация натрия в плазме крови остается в пределах нормы или
в пределах незначительных колебаний. Если дегидратация про-
должается более суток, то соотношение азота крови и мочи
возрастает, клиренс мочевины снижается, что обусловлено
уменьшением гломерулярной фильтрации.
Неврологические проявления (адинамия, снижение сухо-
жильных рефлексов, нарушение сознания вплоть до комы)
зависят от степени дефицита ВнеКЖ и обусловлены уменьше-
нием церебральной перфузии.
Выделяют три степени изотонического обезвоживания
(В.Хартиг):
♦ I степень (дефицит около 2 л): утомляемость, тахикардия,
слабость, апатия, анорексия, наклонность к ортостати-
ческим коллапсам, АД в положении лежа нормальное;
♦ II степень (дефицит около 4 л): апатия, анорексия, рвота,
падение АД даже в положении лежа;
♦ III степень (дефицит 5—6 л): помрачение сознания, шок,
АДРИРТ в положении лежа ниже 90 мм рт.ст.
Клиническая картина является основой диагностики. Осмо-
лярность плазмы в пределах нормы (280—300 мосм/л), ОЦП
89
снижен, гематокрит (если не было кровотечения) часто по-
вышен. Ионограмма без существенных изменений. Возможно
увеличение содержания К4 в плазме.
Лечение. Принципиальная терапия — восстановление объе-
ма ВнеКЖ путем введения сбалансированных солевых раство-
ров, содержащих натрий и хлор.
При изотоническом обезвоживании 1 степени проводят
внутривенные инфузии — вводят 0,9 % раствор натрия хлори-
да, раствор Рингера или лактат-Рингера.
При обезвоживании II степени необходимо быстро восста-
новить нормальный уровень АД и ликвидировать изотоничес-
кую дегидратацию. В этих случаях лечение начинают с быстрой
инфузии гетерогенных коллоидных растворов — декстранов или
крахмала в объеме 500—600 мл и 800—1000 мл изотонических
солевых растворов, содержащих натрий и хлор. При улучшении
гемодинамики и общего состояния больного дальнейшую те-
рапию проводят преимущественно кристаллоидными раствора-
ми натрия хлорида в более медленном темпе до полного заме-
щения жидкостных потерь. На этом этапе важно контролиро-
вать гемодинамические показатели и содержание основных
электролитов в сыворотке крови.
При ГШ без кровопотери (III степень изотонической дегид-
ратации) назначают гетерогенные коллоидные растворы путем
быстрой инфузии в объеме до 1 — 1,2 л, комбинируя высоко-
или среднемолекулярные среды с реологически активными пре-
паратами (реополиглюкин, HAES-steril) и одновременно пере-
ливаемыми кристаллоидными, натрийсодержащими раствора-
ми. На начальном этапе важно устранить циркуляторные на-
рушения, восстановить параметры гемодинамики, почечный
кровоток и диурез. На последующих этапах инфузионную те-
рапию проводят в более медленном темпе, ориентируясь на
степень гемодилюции, ионограмму и осмолярность плазмы.
Важно не допустить больших изменений содержания натрия в
плазме крови. Исследуют газы артериальной крови и показа-
тели КОС. При выявлении нарушений КОС показана соответ-
ствующая коррекция. Продолжительность лечения тяжелой де-
гидратации 2—3 сут. Коррекцию содержания калия в плазме
крови обычно проводят после устранения наиболее опасных
проявлений дегидратации. Обязателен мониторинг важнейших
систем жизнеобеспечения.
Изотоническая гипергидратация возникает при вливании боль-
ших количеств изотонических растворов, содержащих Na+, и
заболеваниях, сопровождающихся отеками (сердечно-сосудис-
тая недостаточность, токсикозы беременности, вторичный аль-
достеронизм и др.). При этом общее содержание Na+ и НгО в
организме повышено, но концентрация Na+ в плазме и ин-
терстициальной жидкости остается нормальной.
Патофизиологические изменения заключаются в значитель-
90
м увеличении объема интерстициального пространства за
счет депонирования в нем изотонической жидкости. В наибо-
лее тяжелых случаях появляются отеки тела, легких, увеличи-
вается масса тела. Несмотря на гипергидратацию, потребность
организма в свободной воде полностью не удовлетворяется —
возникает жажда. Наводнение организма больного изотоничес-
кой жидкостью может привести к таким осложнениям, как
острая сердечно-сосудистая и почечная недостаточность, осо-
бенно у больных с заболеваниями сердца и почек; трудно
Предсказуемым нарушениям секторального распределения
между сосудистым и интерстициальными секторами. Это во
многом зависит от КОД плазмы.
Диагностика состояния не всегда проста. При внешнем ос-
мотре больного отеков можно не обнаружить. Иногда первым
симптомом гипергидратации является одышка, затем возника-
ют застойные хрипы в легких. ЦВД может быть нормальным
или пониженным. Диурез, как правило, снижен. Осмолярность
Плазмы крови в пределах нормы. Это осложнение нередко
возникает у больных пожилого возраста, особенно при прове-
дении инфузионной терапии без учета введенной и выделенной
Жидкости.
Лечение. Прекращают или резко ограничивают введение
^унфузионных растворов. Назначают фуросемид (20 мг), посте-
пенно увеличивая дозу до получения эффекта. При снижении
насосной функции сердца показаны инотропные средства. Про-
водят мониторинг сердечно-сосудистой и дыхательной систем,
функции почек.
* Расстройства обмена натрия и осмолярности
•/i .•
Нарушения водного обмена всегда обусловлены изменения-
ми содержания Na+ — главного осмотического компонента
Плазмы крови и всего объема внеклеточной жидкости, что
позволяет считать его маркером таких расстройств. Содержа-
ние Na+ в сыворотке крови у взрослых 135—145 ммоль/л, в
.Клетках — 10 ммоль/л. Суточная потребность в Na+ в условиях
Основного обмена 50—70 ммоль/м2.
: Гипонатриемия определяется как снижение концентрации
Na+ в сыворотке крови ниже 135 ммоль/л. Высокая распро-
страненность этого состояния в ОИТ, особенно у хирургических
больных, вероятно, объясняется высвобождением вазопресси-
Иа (АДГ), вызванным стрессом. Важно установить, имеется ли
Истинная или ложная гипонатриемия, поскольку первая обу-
словлена избытком воды и представляет собой опасное нару-
шение водно-электролитного баланса, требующее немедленной
терапии.
Псевдогипонатриемия. Концентрация Na+ может быть
91
уменьшена в сыворотке крови в результате увеличения объема
плазмы за счет осмотически активных частиц, протеинов, ли-
пидов, изотонических растворов глюкозы, глицина и крахмала
Увеличение объема плазмы происходит за счет ее безводной
части, в то время как Na+ находится в водной части (фазе).
Такая гипонатриемия не связана с избытком воды, это состо-
яние не является истинной гипонатриемией, сопровождаю-
щейся снижением осмолярности плазмы.
Гипертоническая гипонатриемия возникает в результате ин-
фузий гипертонических растворов глюкозы, маннитола, крах-
мала, увеличения уровня глюкозы в плазме крови при диабете.
Повышение уровня мочевины также сопровождается увеличе-
нием осмолярности и снижением концентрации Na+, она про-
никает в клетки и уравнивает потенциальный осмотический
градиент.
Этот вид нарушения сопровождается возрастанием осмоляр-
ности плазмы выше 300 мосм/л, но, как правило, не вызывает
опасной гипонатриемии. Последняя возможна при повышении
уровня глюкозы выше 200—300 мг/дл. Отличительной особен-
ностью этого вида нарушения является повышенная осмоляр-
ность плазмы крови при сниженной концентрации натрия.
Для предупреждения гипертонической гипонатриемии сле-
дует учитывать концентрации всех переливаемых растворов и
контролировать осмолярность плазмы крови.
Гипотоническая гипонатриемия представляет собой наибо-
лее опасное нарушение водно-электролитного обмена. Она оп-
ределяется как избыток свободной Н2О по отношению к ко-
личеству Na+ во внеклеточном пространстве. В то же время
этот вид нарушений не всегда является признаком избытка
Н2О. Так, при снижении объема ВнеКЖ гипонатриемия часто
соответствует общему снижению уровня Na+ и Н2О и требует
применения инфузий изотонических растворов натрия хло-
рида.
Гипотоническая гипонатриемия подразделяется на гипово-
лемическую, изоволемическую и гиперволемическую [J.J.Mari-
ni, A.P.Wheeler, 2002].
Гиповолемическая гипонатриемия характеризуется снижени-
ем концентрации Na+ в сыворотке крови ниже 130 ммоль/л,
низкой осмоляльностью плазмы и одновременным уменьше-
нием объема ВнеКЖ; возникает в результате потерь изотони-
ческой жидкости в сочетании с инфузионной терапией без-
электролитными или гипотоническими солевыми растворами.
Причиной могут быть крово- и плазмопотеря, потери из ЖКТ.
К “почечным” причинам снижения ОЦК и гипонатриемии
относят нефропатию, применение салуретиков, дефицит мине-
ралкортикоидов и осмотический диурез, вызванный повыше-
нием уровня глюкозы, кетонов, мочевины или маннитола.
92
К этому виду нарушения может приводить канальцевый аци-
почечные потери солей, б и карбонатур ия.
Снижение циркулирующего жидкостного объема сопровож-
дается стимуляцией секреции АДГ, который преодолевает про-
тивоположно направленные стимулы — гипотоничность и
таким образом уменьшает клиренс свободной воды. Инфузии
гипотонической жидкости (гипотонические растворы электро-
литов, изотонические растворы глюкозы) в сочетании с умень-
шенным выделением свободной воды вызывают гипонатрие-
мию.
Клинические признаки: жажда, артериальная гипотензия, на-
клонность к постуральным реакциям, возможен шок.
Диагностические критерии (кардинальные признаки): снижение
ОЦК, содержание Na+ в сыворотке крови меньше 130 ммоль/л,
осмоляльность плазмы<280 мосм/л.
Малые объемы гипертонической мочи с очень низкой кон-
центрацией натрия (менее 10 мэкв/л) отражают адекватную
реакцию организма, направленную на интенсивное сохранение
воды и натрия. Если концентрация натрия в моче превышает
20 мэкв/л и осмоляльность мочи нормальна, вероятная причи-
на снижения ОЦК и гипонатриемии — почечные потери солей
(например, в результате назначения салуретиков). Если же
концентрация натрия и осмоляльность мочи повышены, то
наиболее вероятной причиной гиповолемической гипонатрие-
мии является недостаточность надпочечников.
Изоволемическая гипонатриемия характеризуется неболь-
шим (клинически не определяемым) увеличением количества
свободной воды (3—4 л), значительным снижением натрия в
Сыворотке крови (ниже 125—120 ммоль/л). Осмоляльность плаз-
мы всегда снижена. Термин не соответствует истинной пато-
физиологической сущности состояния, поскольку ОЦК может
выть нормальным или сниженным, что зависит от темпа ин-
фузионной терапии. Избыток жидкости локализуется во вне-
клеточном и внутриклеточном водных пространствах.
Причины изоволемической гипонатриемии:
♦ безэлектролитная инфузионная терапия при наличии
электролитных потерь, которая в наиболее тяжелых слу-
чаях может сопровождаться острым водным отравлением.
Водная интоксикация часто возникает при заболеваниях
почек в результате уменьшения выведения воды;
♦ синдром несоответствующей секреции АДГ (СНС АДГ)
возникает вследствие длительного неосмотически стиму-
лированного высвобождения гормона в кровь. Его основ-
ным проявлением является чрезмерная продукция АДГ,
приводящая к увеличению внеклеточных и внутрикле-
точных объемов жидкости, гипонатриемии, снижению
осмоляльности плазмы и водной интоксикации. При уве-
93
Рис. 9.1. Гипо- (1) и гиперосмолярный (2) синдромы.
N — осмолярность в норме.
личении ОЦК возрастают СВ и скорость клубочковой
фильтрации, это в конечном счете приводит к избыточ-
ной потере натрия и натриевому истощению. Содержа-
ние натрия в сыворотке крови, креатинина, мочевой
кислоты ниже нормы. Количество теряемого натрия с
мочой равно количеству вводимого натрия. Таким образом,
развивается “патологический осмостат” с упорной гипо-
натриемией и гипоосмолярным синдромом (рис. 9.1).
СНС АДГ можно наблюдать у больных с разнообразными
заболеваниями (цирроз печени, злокачественные опухоли), он
может быть вызван тяжелым стрессом, хроническими инфек-
циями (туберкулез, пневмония), нарушениями в гипоталамо-
гипофизарной системе в результате травмы или инсульта.
Изоволемическую гипонатриемию может вызвать примене-
ние диуретиков, особенно салуретиков, усиливающих выделение
с мочой натрия, но в связи с активностью АДГ снижается выде-
ление свободной воды; применение лекарственных средств
(наркотики, винкристин). Водная интоксикация может возни-
кать при полидипсии, заболеваниях почек, сопровождающихся
уменьшением выделения воды.
Диагноз СНС АДГ труден и нередко бывает ошибочным.
Для СНС АДГ характерно выделение концентрированной мочи
(осмолярность мочи>100 мосм/л) с высоким содержанием на-
трия (> 20 ммоль/л), соответствующим ежедневному его вве-
дению. Восстановление нормальной осмолярности плазмы у
больных без синдрома несоответствующей секреции АДГ
может наступить после проведения водной нагрузки или огра-
ничения жидкости. В ответ на водную нагрузку у больных с
гипонатриемией без СНС АДГ полностью подавляется выброс
АДГ и выделяется максимально разбавленная моча с осмоляр-
ностью менее 100 мосм/л.
Терапия СНС АДГ сводится к ограничению поступления
воды и лечению основного заболевания. В менее тяжелых
случаях применяют демеклоциклин (600—1200 мг/сут).
Гиперволемическая гипонатриемия характеризуется избыт-
94
<оМ свободной воды и натрия, причем прирост количества
«оды превышает избыток натрия. Главными клиническими
признаками являются увеличение объемов внеклеточного и
пиутриклеточного пространств и отеки тела.
Поскольку примерно 2/з общей воды сосредоточено в клет-
иах, избыток воды, который можно установить при внешнем
осмотре больного, должен достигать очень больших размеров
(более 10—12 л). Несмотря на значительное увеличение общей
роды в клетках и интерстициальном секторе, ОЦК обычно
снижен.
Причины гиперволемической гипонатриемии:
« застойная сердечная недостаточность (депонирование
жидкости и развитие отеков);
< заболевания почек или уменьшение почечного кровотока
(почки не выводят натрий и воду со скоростью, соответ-
ствующей скорости их введения);
< заболевания и(или) состояния, характеризующиеся сни-
жением КОД (цирроз печени, печеночная недостаточ-
ность, нефротический синдром, невосполняемые потери
альбумина и белка плазмы); при этом происходит транс-
локация воды из сосудов в интерстиций и клетки;
♦ применение мочегонных средств (диуретики ухудшают
способность почек к сохранению натрия и его баланса с
водой).
i Для установления истинной причины состояния определи-
;10т содержание натрия в моче. Так, при сердечной недостаточ-
ности и циррозе печени концентрация натрия в моче меньше
$0 ммоль/л, а при почечной недостаточности всегда больше 20
Ммоль/л.
Г:; Основу терапии составляет ограничение соли и жидкости.
При нарушениях функции почек могут потребоваться мочегон-
ные средства и гемодиализ.
(Независимо от типа гипонатриемии снижение содержания
натрия ниже 120 мэкв/л (ммоль/л) следует рассматривать
как тяжелую форму гипонатриемии.
Истинная гипонатриемия означает избыток свободной
роды, сопровождающийся отеком головного мозга и других
ЗКаней, проявлениями водной интоксикации, способной при-
вести к летальному исходу независимо от основного заболева-
*°1Я- При этом выраженность неврологической симптоматики
Зависит от скорости снижения натрия в сыворотке крови: чем
Острее развивается гипонатриемия, тем более выражены ее
Проявления — от мышечных судорог, тошноты, рвоты и ано-
рексии до спутанности сознания и глубокой комы. К цирку-
ляторной недостаточности приводят главным образом потери
изотонической жидкости, гиповолемическая гипонатриемия,
95
т.е. те формы нарушений баланса воды и натрия, которые
сопровождаются снижением ОЦК.
Лечение гипонатриемии. Быстрое устранение гипонатрие-
мии само по себе вызывает грозное осложнение, определяемое
как центральный миелинолиз. Для него характерна демиелини-
зация ствола головного мозга, вызывающая выраженные невро-
логические расстройства и способная приводить к смерти.
Скорость коррекции должна быть по возможности пропорци-
ональна скорости, с которой возникло нарушение. При этом врач
должен сопоставить риск, связанный со степенью имеющегося
отека мозга, с риском развития центрального миелинолиза.
Рекомендуемая терапия: повышение содержания натрия в плазме
крови должно осуществляться со скоростью 1—2 ммоль/л/ч, до тех пор
пока его уровень не достигнет 125—130 ммоль/л. У больных высокого рис-
ка уровень натрия не должен превышать 125 ммоль/л. У больных алко-
голизмом содержание натрия в сыворотке крови, равное 125 ммоль/л,
является нормой!
При гиповолемической гипонатриемии (малый объем ВнеКЖ,
снижение ОЦК) переливают 0,9 % раствор натрия хлорида под
контролем ЦВД. В случае циркуляторных расстройств возмож-
но применение коллоидных растворов.
При изоволемической гипонатриемии (небольшое повыше-
ние свободной воды, умеренное снижение ОЦК, выраженная
гипонатриемия) вначале вводятся диуретики. При тяжелом со-
стоянии показана инфузия 3 % раствора натрия хлорида, в
состоянии средней тяжести, а также при отсутствии клиничес-
кой симптоматики — 0,9 % раствор натрия хлорида. Необходи-
мы ограничение воды, лечение основного заболевания. При
выявленном синдроме несоответствующей (повышенной) сек-
реции АДГ назначают демеклоциклин 600—1200 мг/сут.
При гиперволемической гипонатриемии (большой объем вне-
клеточной и внутриклеточной воды) показаны диуретики (фу-
росемид) до повышения содержания натрия в сыворотке крови
до 125—130 ммоль/л, лечение сердечной и почечной недоста-
точности, при сниженном КОД плазмы — альбумин.
Режим внутривенного введения 3 % раствора хлорида натрия
при глубокой гипонатриемии с тяжелыми неврологическими син-
дромами [Спригинс Д. и др., 2001]. Основное условие для
применения гипертонического раствора хлорида натрия — глу-
бокая гипонатриемия и неврологические нарушения, не свя-
занные с какими-либо другими причинами (кома, обусловлен-
ная субарахноидальным кровоизлиянием, менингит, печеноч-
ная и острая почечная недостаточность, гипергликемический
синдром). Лечение 3 % раствором хлорида натрия проводят
при нормоволемии и нормальной функции сердца.
96
Пример. Больной 55 лет с массой тела 70 кг. Уровень натрия в
плазме крови ПО ммоль/л. Необходимо повысить его до 125 ммоль/л,
чтобы уменьшить неврологические проявления. Уровень натрия сле-
дует повышать на 1 ммоль/ч, таким образом вся коррекция будет
произведена за 15 ч.
« Вычислите общий объем воды организма больного, ис-
ходя из положения, что он в среднем равен 50 % массы
тела. У данного больного он равен: 70 х 0,5 = 35 л.
« Вычтите количество натрия, содержащегося в плазме,
ПО ммоль/л из 125 ммоль/л, т.е. 125 — 110 = 15 ммоль/л.
Это означает требуемую коррекцию уровня натрия в плаз-
ме в миллимолях натрия на литр и время в часах (15 ч),
в течение которого следует корригировать уровень натрия
в плазме.
♦ Умножьте общий объем воды в литрах (35 л) на требуе-
мую коррекцию уровня натрия в плазме в моль/л. Таким
образом, 35 х 15 = 525 ммоль. Это есть количество мил-
лимолей натрия, необходимое для коррекции уровня на-
трия в плазме до 125 ммоль/л.
♦ Разделите количество миллимолей натрия, необходимое
для коррекции на 513 (число миллимолей натрия в 1 л
3 % раствора хлорида натрия): 525 : 513 = 1,02. Затем
умножьте на 1000, чтобы получить количество миллилит-
ров 3 % раствора хлорида натрия, необходимое для кор-
рекции натрия плазмы до 125 ммоль/л: 1,02 х 1000 =
= 1020 мл.
♦ Разделите количество миллилитров 3 % раствора хлори-
да натрия, которое следует ввести, на число часов, необ-
ходимых для коррекции уровня натрия в плазме крови:
1020 : 15 = 68 мл/ч. Это число обозначает скорость инфузии.
Вводят препарат с помощью волюметрического насоса.
♦ Контролируйте фактическое содержание натрия в плазме
каждые 1—2 ч. Не допускайте увеличения или уменьше-
ния скорости инфузии.
♦ Вводите фуросемид вместе с 3 % раствором хлорида на-
трия, если у больного имеются перегрузка объемом или
нарушение функции сердца.
Примечание. У больных алкоголизмом не следует повышать уровень на-
трия в плазме выше 125 ммоль/л.
Некоторые расчеты и формулы
Расчет количества натрия для коррекции изоволемической и
гиповолемической гипонатриемии:
Дефицит Na+ (ммоль) = 0,5 х масса тела (кг) х (125 — Na+ ф.),
где 0,5 х МТ (кг) — среднее количество общей воды тела, 125 —
97
7-1069
желаемая концентрация Na+ в плазме крови, Na+ ф. — факти-
ческое изменение содержание натрия в плазме.
Желаемая концентрация Na+ в плазме составляет 125 ммоль/л,
так как ее нельзя сразу повышать до нормального (или даже
близко к нему) уровня!
Расчет избытка воды для коррекции гиперволемической и
изоволемической гипонатриемии:
Избыток воды = 0,5 х масса тела (кг) х (125 / Na+ ф.).
Гипернатриемия — тяжелый патофизиологический синдром,
сопровождающийся клеточной дегидратацией и выраженными
неспецифическими нарушениями функции ЦНС. В ОИТ глав-
ной причиной гипернатриемии является обезвоживание —
“невосполнение” потерь гипотонической жидкости, ограниче-
ние доступа к воде (тяжелобольные, неспособные пить воду;
больные в бессознательном состоянии или с нарушенным чув-
ством жажды, особенно в тех случаях, когда происходит уве-
личенная потеря жидкости). К дефициту свободной воды также
приводит применение осмотических диуретиков, реже — на-
значение гипертонических солевых растворов, в том числе
гидрокарбоната натрия. Дегидратация может возникнуть при
увеличении неощутимых потерь воды, ожогах, гипертермии.
Гипернатриемия может быть обусловлена нарушениями
центральных и почечных механизмов регуляции водно-натри-
евого баланса: центральный несахарный диабет (уменьшение
или полное прекращение секреции АДГ) и нефрогенный не-
сахарный диабет, который развивается при неспособности по-
чек реагировать на поступление АДГ.
При нефрогенной или периферической форме несахарного
диабета почки теряют восприимчивость к АДГ (вазопрессину),
нарушается концентрационная способность почек, что ведет к
потерям свободной воды. Такой тип нарушений характерен для
больных с поражениями почек, вызванных аминогликозидами,
амфотерицином В, наблюдается при хронической почечной не-
достаточности, гиперкальциемии, гипокалиемии. Центральная
форма несахарного диабета, являющаяся вторичной при травме
ЦНС, операциях, инсульте, опухоли или грануломатозе, сопро-
вождается потерей воды в результате нарушения гипоталамо-
гипофизарного механизма освобождения АДГ. Симптомы
центрального несахарного диабета обычно возникают на 3—7-й
день после травмы, операций, тяжелого стресса и гипоксии.
Клиническое проявления гипернатриемии. Независимо от при-
чины общими симптомами гипернатриемии являются жажда,
тошнота, рвота, возбуждение, ступор и кома. Все эти симптомы
неспецифичны, их нередко относят к числу других причин.
В типичных случаях диагноз устанавливают на основании дан-
ных анамнеза, физикального обследования больного и лабора-
торных показателей. Содержание натрия в сыворотке крови
выше 150 мэкв/л — объективный признак гипернатриемии.
98
Повышение осмотического давления ВнеКЖ приводит к
клеточной дегидратации (потере ВнуКЖ), чем и объясняется
клиническая симптоматика. Симптомы наиболее ярко выраже-
ны при расстройствах ЦНС и обычно проявляются нарушени-
ем сознания. Неспецифические неврологические симптомы уг-
лубляются пропорционально выраженности гиперосмолярнос-
ти. При осмоляльности плазмы, превышающей 350 мосм/кг
НгО, часто отмечаются глубокая кома и судороги. Усиленный
диурез (до 1—2 л/ч) почти всегда соответствует большим по-
терям воды, обусловленным наличием несахарного диабета.
Тем не менее при постановке диагноза диабета должна быть
проявлена осторожность. У больных в ОИТ часто проводят
“тест с отнятием воды”, который может быть выполнен только
при восполнении циркулирующего объема и постановке эмпи-
рической пробы АДГ. При стабильной гемодинамике добавоч-
ный избирательный эндокринный тест, включающий “тест с
отнятием воды”, может быть безопасно выполнен. Хотя гипер-
натриемия обычно не создает диагностических трудностей, оп-
ределение осмолярности мочи и содержания в ней натрия
может существенно помочь в выяснении этиологии состояния
(табл. 9.1). Важно детально изучить историю заболевания, со-
брать анамнез и установить истинную причину состояния.
Таблица 9.1. Осмолярность мочи при гипернатриемии (по Д.Д.Марини,
А-П.Уиллер, 2000)
Осмолярность мочи, мосм/л Дифференциальный диагноз Терапия
>800 Дегидратация, сниженное по- ступление воды, интоксика- ция натрием Введение свобод- ной воды
300-800 Осмотические диуретики, частичный или легкий неса- харный диабет Введение свобод- ной воды, проба АДГ
<300 Центральный или нефроген- ный несахарный диабет Замещение свобод- ной водой и АДГ- терапия
Уточнению генеза заболевания могут помочь исследования
водных секторов, ОЦК, мониторинг показателей гемодинами-
ки, в частности определение давления наполнения левого же-
лудочка и СВ. При падении содержания натрия в моче ниже
10 ммоль/л можно предположить уменьшение объема ВнеКЖ.
Высокая концентрация натрия в моче нехарактерна для сни-
женного объема экстрацеллюлярной жидкости (если не при-
менялись диуретики и отсутствует почечная недостаточность).
Уменьшение объема ВнеКЖ (гиповолемическая гипернатрие-
мия) свидетельствует о том, что причиной нарушения является
99
г
потеря натрия и воды с преобладанием дефицита последней
Причиной могут быть усиленный диурез, потери из ЖКТ
(рвота, диарея), обильное потоотделение.
Нормальный объем ВнеКЖ (нормоволемическая гипернатрие-
мия) указывает на отсутствие дальнейшей потери свободной
воды.
Увеличение объема ВнеКЖ (гиперволемическая гипернатрие-
мия) свидетельствует об избытке натрия и воды с преоблада-
нием избытка натрия.
Лечение гипернатриемии заключается в восстановлении объ-
ема свободной (безэлектролитной) воды и уровня натрия в
сыворотке крови. Введение свободной воды энтерально или
внутривенно в виде растворов с низкой осмолярностью и не
содержащих натрий (например, 2,5—5 % раствор глюкозы) с
частой оценкой электролитов и осмолярности плазмы.
Скорость коррекции содержания натрия в сыворотке крови —
приблизительно 2 ммоль/л/ч. Очень быстрое устранение гипер-
натриемии, особенно давней, как и гипонатриемии, может
провоцировать демиелинизацию ствола головного мозга. Тера-
пия также зависит от формы выявленной гипернатриемии
(гиповолемической, нормоволемической и гиперволемической).
При гиповолемической гипернатриемии важно быстро устра-
нить гиповолемию и имеющийся дефицит натрия с целью
предотвращения развития гиповолемического шока и медлен-
но восполнять недостаток свободной воды. Нужно иметь в
виду, что гиповолемия (и одновременно уменьшение объема
ВнеКЖ) указывает на выраженный дефицит натрия даже на
фоне гипернатриемии. Потери солей делают гемодинамику
крайне неустойчивой. Для быстрого восстановления внутрисо-
судистого объема применяют коллоидные растворы (растворы
крахмала — 6 % раствор ХАЕС-стерила), 5 % раствор альбуми-
на, дополняя их инфузией изотонических растворов натрия
хлорида. Гипотонические растворы натрия хлорида применять
не следует, так как они приводят к ликвидации дефицита воды,
но не устраняют дефицит натрия. При лечении гиповолеми-
ческой гипернатриемии необходимо восстановить СВ и гемо-
динамические показатели, а также нарушенный водно-натри-
евый баланс.
При нормоволемической гипернатриемии необходимо вычис-
лить дефицит свободной воды и обеспечить его медленное
возмещение (см. расчеты и формулу).
При гиперволемической гипернатриемии (избыток натрия и
воды во ВнеКЖ с преобладанием излишка натрия) необходимо
прекратить введение гипертонических растворов натрия хлори-
да, в том числе бикарбоната натрия, и проводить медленную
инфузию изотонических растворов глюкозы. При сниженном
диурезе показано применение салуретиков.
100
расчет дефицита воды при гиперволемической и изоволеми-
tfgctwu гипернатриемии:
Дефицит воды (л) = 0,5 х масса тела (кг) х [(1Ма+ф. /140) — 1],
где Ма+ф- — фактическое (измеренное) содержание Na+ в
плазме крови.
Расчет избытка натрия, поступившего при введении натрия
гидрокарбоната:
Избыток Na+ (ммоль) = 0,5 х масса тела (кг) х (1Ча+ф. — 140),
где Ка+ф. — фактическое содержание натрия в плазме крови.
Гипергликемический синдром. Выраженная гипергликемия
возникает при избыточном введении глюкозы (например, при
парентеральном питании), а также у больных сахарным диабе-
том. В последнем случае гипергликемия может быть без кетоза
и с наличием кетоацидоза.
Гипергликемия всегда способствует повышению осмоляль-
ности плазмы и выходу воды из клеток (клеточная дегидрата-
ция). У больных сахарным диабетом средней тяжести обычно
наблюдается более выраженная гипергликемия, превышающая
50 ммоль/л (9000 мг/л) в отличие от диабетического ацидоза, при
котором уровень глюкозы в крови обычно ниже 33 ммоль/л
(6000 мг/л). Повышенный уровень глюкозы в крови приводит
к осмотическому диурезу, что вызывает гиповолемию и может
обусловить изменения водно-электролитного баланса. Глюкоза
в отличие от воды, К+ и Mg2+ не может самостоятельно про-
никнуть через клеточную мембрану (ее переносит в клетки
специальный белок, погруженный в клеточные мембраны).
Повышение содержания глюкозы в плазме сопровождается гемо-
дилюционным эффектом в связи с выходом жидкости из клеток
в экстрацеллюлярное пространство. Одновременно снижается
уровень натрия в сыворотке крови на 1,6—2,0 ммоль/л при
каждом повышении содержания глюкозы на 5,6 ммоль/л
(1000 мг/л) [Марино П, 1998].
П.Марино рекомендует при содержании глюкозы в плазме
крови 28 ммоль/л и натрия 145 ммоль/л повышать концентра-
цию последнего до 153 ммоль/л.
Гипогликемия. У всех госпитализированных в ОИТ больных
следует определить содержание глюкозы в моче. Уровень глю-
козы плазмы крови необходимо исследовать у всех больных с
глюкозурией, диабетом, при нарушенном сознании, судорогах,
а также при подозрении на инсульт, метаболическом ацидозе,
сепсисе, гипонатриемии, печеночной недостаточности, гипо-
термии, проведении парентерального питания, в послеопера-
Ционном периоде.
101
Наиболее частые причины гипогликемии:
• избыток инсулина;
• прием алкоголя;
• сепсис;
• сульфонилурия;
• панкреатит;
• недостаточность надпочечников;
• отравление салицилатами.
При подтвержденной гипогликемии показаны внутривенное
введение 50 мл 50 % раствора глюкозы (декстрозы), повторное
исследование уровня глюкозы в плазме крови (через 30 мин).
При рецидивирующей гипогликемии показано внутривенное
введение 1 л 10 % раствора глюкозы каждые 12 ч с регуляцией
скорости введения в зависимости от уровня глюкозы в плазме
крови.
Глава 10 I РАССТРОЙСТВА ОБМЕНА КАЛИЯ
Расстройства обмена калия. Концентрация калия в сыворот-
ке крови 3,5—5,1 ммоль/л, в клеточной жидкости 120—160
ммоль/л; 98 % калия находится в клетках и лишь 2 % — вне-
клеточно. Общее содержание калия у взрослого человека с мас-
сой тела 70 кг равно 150 г. Уровни калия во ВнеКЖ и ВнуКЖ
должны постоянно поддерживаться, чтобы не вызывать нару-
шений сердечной и нейромышечной функций. Суточная по-
требность в калии — 50—70 ммоль/м2; 40 ммоль/1000 ккал.
Гипокалиемия — концентрация калия в сыворотке крови ни-
же 3,5 ммоль/л. Истинный дефицит калия (калиевое истоще-
ние) может не соответствовать данным исследования калия
сыворотки. Тем не менее результаты динамического определения
уровня калия в сыворотке и клинические данные позволяют
установить нарушения баланса этого иона. Механизм калиевого
истощения включает в себя недостаточное поступление этого
иона, почечное выделение калия и его наружные потери. В усло-
виях нормального метаболизма снижение уровня калия может
возникать только при его недостаточном поступлении.
Причинами калиевого истощения могут быть потери из
ЖКТ (рвота, постоянная аспирация, кишечные свищи, понос,
язвенный колит, перитонит), с мочой (заболевания почек, про-
текающие с полиурией, осмотический диурез, назначение
диуретиков), первичный или вторичный альдостеронизм, син-
дром Барттера, синдром Лиддла, нарушения гуморальной ре-
гуляции (гиперкортицизм, синдром Кушинга, лечение гормона-
ми), перемещение калия во внутриклеточное пространство
102
после лечения глюкозой и инсулином (подтверждается сниже-
нием уровня калия в сыворотке), метаболический алкалоз,
дефицит магния, недостаточное поступление калия. Гипока-
лиемию могут вызывать некоторые антибиотики (карбеницил-
ллн в больших дозах, амфотерицин В, возможно — гентами-
цин). Нормальный уровень калия в сыворотке у больного с
ацидозом, как правило, свидетельствует о дефиците калия
[Knochel J.P., 1987; Solomon R., 1987].
При умеренной гипокалиемии и дефиците калия внешние
клинические симптомы могут отсутствовать. При прогрессиро-
вании дефицита калия клинические проявления связаны с
изменениями в трансмембранном потенциале и возбудимости
нейромышечных тканей. Вначале больной жалуется на мышеч-
ную слабость, особенно в мышцах ног. При более выраженной
гипокалиемии и дефиците калия развивается генерализованная
слабость скелетных мышц. Мышечная слабость может продол-
жаться вплоть до общей арефлексии, паралича и смерти от
недостаточности дыхательных мышц. Особенно опасна острая
гипокалиемия, при которой указанные симптомы могут быстро
прогрессировать. При остром дефиците калия могут возникать
паралитическая непроходимость кишечника, рабдомиолиз и
миоглобинурия.
Гипокалиемия и дефицит калия обычно сопровождаются
расстройствами деятельности сердца, связанными с измене-
ниями проводимости: брадикардией, суправентрикулярными и
вентрикулярными нарушениями. На ЭКГ определяются типич-
ные изменения: уплощение и инверсия зубца Т, увеличение
выступа зубца U и прогиб сегмента ST. Дефицит калия усили-
вает кардиотоксическое действие препаратов наперстянки. Кли-
нические симптомы могут быть обусловлены как снижением
уровня калия в плазме, так и общим уменьшением содержания
его в организме. Быстрое снижение уровня калия в плазме
крови до 2,2 ммоль/л способно вызвать остановку сердца [Ro-
oth G., 1978; Flaked G. et al., 1986].
Важным почечным механизмом калиевого истощения явля-
ется снижение концентрирующей способности почек, приво-
дящей к полиурии, никтурии и полидипсии.
Более выраженные симптомы дефицита калия наблюдаются
при сопутствующем метаболическом ацидозе. При метаболи-
ческом алкалозе общее состояние больного и мышечный тонус
нарушаются меньше.
Лечение. Следует помнить, что гипокалиемический синдром
легче предупредить, чем лечить. Постоянное наблюдение за
Уровнем калия в плазме крови и другими электролитами, вы-
явление калиевых потерь позволяют вовремя начать профилак-
’Ическое лечение. При отсутствии энтерального пути усвоения
Необходимо обеспечить суточную потребность калия, равную
50-70 ммоль/м2.
103
При выявленном дефиците калия и гипокалиемии первич-
ная задача заключается в осторожной коррекции дефицита
калия и предупреждении его дальнейшего дисбаланса. Прово-
дят внутривенные инфузии поляризующих калиевых коктей-
лей, имеющих в своем составе калий, глюкозу и инсулин.
Обычно требуется от 100 до 150 ммоль калия в сутки. Скорость
введения растворов не должна превышать 20 ммоль калия в
час. Необходимо проводить кардиомониторинг, постоянные
измерения уровня калия в плазме.
Если не нарушена функция ЖКТ, хлорид калия назначают
в виде добавок в дневной рацион питания (эликсир или таб-
летки). Максимальное количество калия, вводимого внутри-
венно, не должно превышать 200 ммоль в сутки, при этом
следует соблюдать большую осторожность, контролировать
ЭКГ, чтобы избежать токсического эффекта калия. Нередко
требуется коррекция не только калия, но и других ионов.
Одновременное развитие гипокалиемии и гипомагниемии мас-
кируется нервно-мышечными нарушениями, характерными
для дефицита каждого из этих ионов, поэтому одновременно
проводят коррекцию содержания калия и магния.
Гиперкалиемия — увеличение концентрации калия в сыво-
ротке крови свыше 5,1 ммоль/л. Причинами гиперкалиемии
могут быть: почечная недостаточность, олигурия, анурия лю-
бого происхождения, недостаточность надпочечников, массив-
ные травматические повреждения тканей, быстрое перелива-
ние консервированной крови, усиленный распад белков (ката-
болизм) и мобилизация гликогена из клеток (гликогенолиз),
интоксикация препаратами наперстянки, ацидоз, гиперосмо-
лярность жидких сред, дефицит инсулина, избыточное введе-
ние калия.
Как и при гипокалиемии, клинические симптомы гиперка-
лиемии (слабость, повышение тонуса мышц, вплоть до пара-
лича) развиваются в результате нарушений функции попере-
чнополосатой мускулатуры. К наиболее существенным призна-
кам гиперкалиемии относятся сердечные аритмии. Самые
ранние изменения на ЭКГ — появление высокоамплитудного
зубца Т, затем — расширение комплекса QRS, удлинение ин-
тервала P—R и слияние QRS и зубца . Г (рис. 10.1). Вслед за
этим наступают фибрилляция желудочков (ФЖ) и асистолия.
Остановка сердца возможна в том случае, если концентра-
ция калия в плазме крови равна или превышает 7 ммоль/л.
Наиболее опасны быстрые изменения концентрации калия в
сыворотке. Метаболический ацидоз способствует развитию ги-
перкалиемии. Опасность последней возрастает при гипонат-
риемии и гипокальциемии.
Лечение. Выраженная интоксикация сердечной мышцы
наиболее эффективно снимается назначением кальция. Для
этого 10—20 мл 10 % раствора глюконата кальция вводят внут-
104
Рис. 10.1. Электрокардиографические признаки гипер- и гипокалие-
мии.
ривенно в течение 1—5 мин под контролем ЭКГ. Лактат натрия
«ли бикарбонат повышают pH ВнеКЖ и способствуют пере-
ходу калия в клетки. Таким же действием обладают декстроза
и глюкоза. Если олигурия не связана с органической почечной
Недостаточностью, на фоне инфузионной терапии (глюкоза,
гидрокарбонат и хлорид натрия) назначают диуретики. В слу-
чаях выраженной почечной недостаточности и кардиотоксич-
Ности показан перитонеальный диализ или гемодиализ.
105
Глава 11
РАССТРОЙСТВА ОБМЕНА МАГНИЯ
Средняя концентрация магния в сыворотке крови равна
0,7—1 ммоль/л. Нормальное содержание магния в сыворотке
крови у здоровых людей в возрасте от 20 до 60 лет — 0,66—
1,07 ммоль/л, от 60 до 90 лет — 0,66—0,99 ммоль/л, старше
90 лет — 0,70—0,95 ммоль/л [Энциклопедия клинических ла-
бораторных тестов, 1997]. Общее содержание магния у взрос-
лого человека с массой тела 70 кг составляет 20—28 г. Поло-
вина магния находится в костной и хрящевой ткани, осталь-
ная часть — преимущественно в клетках, небольшая часть — во
ВнеКЖ. Ежедневная потребность взрослого человека в магнии
составляет 10—30 мэкв/м2, или 5—15 ммоль/м2. На каждые
1000 ккал необходимо 2,5—4 ммоля магния. Недостаточность
магния в организме не всегда подтверждается уменьшением его
уровня в плазме.
Гипомагниемия и дефицит магния. Концентрация магния в
сыворотке крови ниже 0,7 ммоль/л называется гипомагние-
мией. В тех случаях, когда снижение концентрации магния в
сыворотке крови сопровождается дефицитом этого иона, воз-
никают характерные симптомы.
Дефицит магния — наиболее часто встречающееся наруше-
ние электролитного баланса у госпитализированных больных.
Главной причиной, вызывающей недостаток магния, является
снижение его поступления в организм. К причинам дефицита
магния, не всегда определяемого по анализам сыворотки
крови, относят интенсивную инфузионную терапию, часто без
магния, проводимую на фоне действия диуретиков, примене-
ние антибиотиков (в частности, аминогликозидов, воздейству-
ющих на почечную функцию) и других препаратов, повышаю-
щих экскрецию магния почками.
Исходя из многих исследований содержания сывороточного
магния, можно сделать вывод о том, что дефицит магния почти
всегда встречается у больных в ОИТ. Это связано с прекраще-
нием поступления магния с пищей и энергичным применени-
ем диуретиков.
Наиболее частые причины дефицита магния у больных
ОИТ:
♦ внутривенное введение жидкостей;
♦ заболевания ЖКТ (диарея, кишечные свищи, перито-
нит);
♦ применение антибиотиков (аминогликозиды, амфотери-
цин В, тикарциллин);
♦ заболевания почек (полиурическая стадия почечной не-
достаточности);
♦ назначение осмотически активных диуретиков и салуре-
106
тиков (фуросемид, этакриновая кислота, тиазидные диу-
ретики);
* недостаточное поступление в организм магния.
Снижение содержания магния в крови часто наблюдается у
пациентов, страдающих алкоголизмом, циррозом печени, пан-
креатитом, гиперпаратиреоидизмом. Дефицит магния часто со-
четается с другими нарушениями электролитного баланса —
гипокалиемией, гипофосфатемией, гипонатриемией, гипокаль-
циемией. Одно из главных проявлений магниевого дефицита —
стойкая гипокалиемия, устранение которой следует начинать с
предварительной коррекции недостатка магния. При этом вос-
полнение магния приводит внутриклеточное содержание калия
в норму. Полагают, что без Mg2+ нарушается работа натрий-
калиевого насоса (т.е. Na+, К+-АТФазы), восстанавливающего
содержание К+ в клетках. Связь гипокальциемии и гипомаг-
ниемии нарушается под влиянием паратгормона, что было
обнаружено у больных с магниевым дефицитом [Elin R.J.,
1988].
Дефицит магния следует считать одним из факторов риска
в отношении развития нарушений ритма и проводимости при
остром инфаркте миокарда. Уменьшение содержания магния в
сыворотке крови повышает риск коронароспазма вследствие
повышения транспорта Са2+ внутрь гладкомышечных клеток.
Иногда выраженные нарушения сердечного ритма поддаются
Определенной коррекции препаратами магния при внутривен-
ном введении, причем даже тогда, когда обычная противоарит-
мическая терапия не приводит к положительному результату.
В лечении стойких аритмий внутривенному введению препара-
тов магния придают большое значение (исключая синусовую
тахикардию), в том числе и при нормальном содержании Mg2+
в сыворотке [Марино П., 1998].
Клинические проявления. Дефицит магния характеризуется
изменчивостью симптоматики и возможен при нормальном
Уровне магния в сыворотке. Недостаток магния в организме
часто сочетается со снижением в сыворотке других катионов:
калия, фосфора, натрия и кальция. Выделяют несколько форм
Дефицита магния: церебральную (депрессия, страх, нервоз-
ность, оглушенность, потеря сознания); висцеральную (ларин-
ГО- и бронхоспазм, дискинезия желчных путей, спазм сфинк-
тера Одди, судорожные сокращения желудка, диарея); сердеч-
но-сосудистую (аритмии, коронароспазм, наклонность к ФЖ,
Удлинение интервала Q—T на ЭКГ) и мышечно-тетаническую
(парестезии, судороги, тремор, нервно-мышечная возбуди-
мость, положительные симптомы Хвостека и Труссо, тетанус)
Формы.
Наибольшее клиническое значение имеют следующие про-
явления дефицита магния:
107
♦ сердечные аритмии;
♦ повышенная нервно-мышечная возбудимость, судороги-
♦ гипокалиемия.
Функционирование многих ферментов связано с участием
Mg2+, он также вовлечен во все реакции, протекающие с
участием АТФ. Магний называют “скрытым” ионом, посколь-
ку до сих пор нет достоверных точных методов определения
его общего содержания в организме. Не все клинические про-
явления дисбаланса магния объяснимы.
Лечение. Для профилактики и лечения дефицита магния
применяют 25 % раствор сульфата магния (1 мл раствора со-
держит 2 ммоль магния). Для профилактики дефицита магния
следует вводить внутривенно по 3—12 мл этого раствора.
При умеренном дефиците магния без клинических симпто-
мов и отсутствии нарушений баланса других электролитов пре-
параты магния вводят в следующем порядке:
1) внутривенно — 6 г сульфата магния (24 мл 25 % раствора
MgSO4 на 500 мл изотонического раствора хлорида натрия) в
течение 3 ч;
2) продолжить внутривенную инфузию препарата медленно
(5 г магния сульфата на 500 мл изотонического раствора хло-
рида натрия) в течение последующих 6 ч;
3) внутривенно — 5 г сульфата магния через каждые 12 ч
(продолжительная инфузия) в течение последующих 6 сут.
При угрожающих состояниях (развитие сердечных аритмий
или судорожных приступов), вызванных гипомагниемией, ре-
комендуется (по П.Марино, 1998):
1) внутривенно ввести 4 мл 50 % или 8 мл 25 % раствора
сульфата магния в течение 1—2 мин;
2) внутривенно вливать раствор сульфата магния (10 мл 50 %
или 20 мл 25 % раствора MgSO4 на 500 мл изотонического
раствора хлорида натрия) в течение последующих 6 ч;
3) продолжать вводить внутривенно указанный выше рас-
твор сульфата магния каждые 12 ч (продолжительная инфузия)
в течение последующие 5 сут.
Несмотря на первое болюсное введение раствора сульфата
магния, концентрация его в крови после короткого повышения
быстро снижается, что и требует дальнейшей продолжительной
инфузии этого раствора. Для пополнения запасов магния тре-
буется несколько суток, хотя содержание Mg2+ в сыворотке
крови может нормализоваться уже в первый день заместитель-
ной терапии. Для разбавления концентрированных растворов
сульфата магния ни в коем случае нельзя использовать раствор
Рингера с лактатом, поскольку он содержит Са2+.
При выраженном дефиците магния у больных с почечной
недостаточностью лечение необходимо проводить с особой ос-
торожностью, избегая быстрых инфузий препарата. При этом
108
лоза сульфата магния должна быть снижена в 2 раза. Больным
с почечной недостаточностью и выраженными аритмиями внут-
ривенно вводят 2 г сульфата магния в течение 5 мин, затем
через 15 мин определяют концентрацию Mg2+ в сыворотке
Крови. Если содержание Mg2+ в сыворотке не повышается или
аритмия сохраняется, то повторяют внутривенное введение
2 г сульфата магния в течение 5 мин. При ФЖ и желудочковой
тахикардии (ЖТ), вызванных дефицитом магния, доза сульфата
магния составляет 1—2 г в разведении на 100 мл изотоничес-
кого раствора хлорида натрия. В экстренных случаях этот рас-
твор вводят в течение 1—2 мин, в менее экстренных — в тече-
ние 60 мин; поддерживающая доза вводится со скоростью
0,5—1 г/ч в течение 24 ч.
Следует помнить, что в условиях дефицита магния (как и
дефицита калия) организм повышенно чувствителен к сердеч-
ным гликозидам, потенцирует их аритмогенное действие и
кардиотоксический эффект. Внутривенное введение сульфата
магния может сопровождаться артериальной гипотензией, ча-
ще всего зависящей от нарушения скорости инфузий.
Гипермагниемия — концентрация Mg2+ в сыворотке крови
более 1,1 ммоль/л.
Причины: почечная недостаточность, диабетический кетоа-
цидоз, патологические состояния, способствующие выходу
Mg2+ из клеток, феохромоцитома.
Симптомы: гипотензия, сонливость, гипорефлексия, угнетение
дыхания, при глубокой гипермагниемии — кома и остановка
сердца. Стойкая артериальная гипотензия возникает при увели-
чении содержания Mg2+ в сыворотке крови до 3—5 ммоль/л. При
концентрации магния в сыворотке крови до 7,5 ммоль/л наступает
полная сердечная блокада, а при возрастании до 10 ммоль/л
отмечаются угнетение дыхания и кома [Reinhart R.A., 1988].
Лечение. Проводят терапию основного заболевания, восста-
навливают водный и электролитный баланс, при отсутствии
противопоказаний вводят диуретики. Артериальную гипотен-
зию можно устранить с помощью препаратов кальция. Для
этого внутривенно вводят медленно 10—20 мл 10 % раствора
глюконата кальция. Как основной метод лечения показан ге-
модиализ.
Глава 12 | РАССТРОЙСТВА ОБМЕНА КАЛЬЦИЯ
Концентрация общего кальция в сыворотке крови равна
«5—102 мг/л, или 2,1—2,5 ммоль/л; кальция ионизированно-
110 — 48—72 мг/л, или 1,1—1,3 ммоль/л; 99 % кальция находит-
ся в скелете. Общее содержание кальция в организме человека
109
с массой тела 70 кг 1000—1500 г. Общая концентрация кальция
в сыворотке крови представлена сочетанием трех компонентов:
кальция, связанного с белком, в основном с альбуминами;
кальция, связанного с другими веществами (например, фос-
фат); кальция ионизированного. Почти 50 % общего кальция
находится в ионизированном состоянии, и эта форма отве-
чает за регулирование нейромышечной функции. В клетках
кальций не содержится. Ежедневная потребность взрослого че-
ловека в кальции составляет 15—40 мэкв/м2, или 7,5—20 ммоль/м2,
и находится в зависимости от энергозатрат — 2,2—4 ммоль/
1000 ккал [Zaioga G.P., Chemow В., 1985].
Коррекция содержания общего кальция. Определение только
ионизированного кальция в крови без учета его общего содер-
жания может привести к неправильному заключению. Напри-
мер, при уменьшении уровня альбуминов крови содержание
общего кальция может оставаться неизменным. Для определе-
ния общего содержания кальция при снижении содержания
белка в крови используют поправку, которая предусматривает
увеличение содержания кальция на 8 мг/л при снижении кон-
центрации сывороточного альбумина на 1 мг/л. Эта поправка,
используемая в клинике, не может быть применена для опре-
деления уровня ионизированного кальция [Landenson J.H., Le-
vins J.W., Boyd J.C., 1978].
При лабораторных исследованиях ионизированного (сво-
бодного) кальция требуются особая тщательность и наличие
специальных ионоселективных электродов.
Гипокальциемия — уменьшение концентрации общего каль-
ция в сыворотке крови ниже 2,1 ммоль/л. Гипокальциемия
ионизированной формы (ниже 1,1 ммоль/л) в ОИТ — наиболее
частая форма нарушений. Снижение уровня свободного каль-
ция в крови характерно для таких состояний, как сепсис,
гипомагниемия, почечная недостаточность, алкалоз и острый
панкреатит. К другим причинам, вызывающим гипокальцие-
мию, относятся жировая эмболия, ожоги, массивные гемо-
трансфузии, искусственное кровообращение, лекарственные
средства. При жировой эмболии отмечается повышение кон-
центрации неэстерифицированных жирных кислот, связываю-
щих кальций. При массивных гемотрансфузиях гипокальциемию
вызывают натрия гидроцитрат, связывающий Са2+ с образова-
нием кальция цитрата. Гипокальциемия может возникать после
обширных операций на органах ЖКТ, невозмещенных потерь
кальция и парентеральном питании.
При сепсисе гипокальциемию связывают с выходом кальция
через нарушенную систему микроциркуляции. Обычно это со-
стояние сопровождается нестабильной гемодинамикой и явля-
ется плохим прогностическим признаком.
При дефиците магния снижение содержания кальция в
ПО
ипови объясняют угнетением секреции паратгормона (ПТГ) и
уменьшением реакции на него органов-мишеней.
Гипокальциемия, возникающая в результате дефицита магния,
резистентна к проводимой терапии. При этом кальций ин-
тенсивно выходит с мочой в результате ослабленного дейст-
вия ПТГ, а гипокальциемия поддерживает недостаток магния
в организме. Коррекция содержания свободного кальция в крови
невозможна без предварительного устранения магниевого де-
фицита.
Проблема состоит в том, что уровень магния в сыворотке
крови может быть нормальным при общем его дефиците в
организме. В этом случае необходимо восполнить недостаток
магния. Почечная недостаточность не является противопока-
занием к контролируемой терапии магнием.
При острой и хронической почечной недостаточности сни-
жение уровня ионизированного кальция в крови возникает в
результате задержки фосфата почками и нарушения превраще-
ния витамина D в его активную форму. Повышение уровня
фосфора в крови способствует образованию нерастворимых
фосфатно-кальциевых кристаллов, накапливающихся в мягких
тканях. В этом случае главное в терапии гипокальциемии за-
ключается в снижении уровня фосфатов в сыворотке крови
путем назначения антацидов, блокирующих всасывание фос-
фора из кишечника [Марино П., 1998].
(Коррекция уровня ионизированного кальция при гиперфосфате-
мии должна быть направлена на снижение уровня фосфатов
в сыворотке крови до нормальных значений.
На фоне ацидоза связывание свободного кальция снижает-
ся, что способствует увеличению его содержания.
При остром панкреатите снижается секреция ПТГ, что
приводит к гипокальциемии.
Клинические признаки гипокальциемии могут отсутствовать и
выявляться только при лабораторных исследованиях. С другой
стороны, гипокальциемия может сопровождаться чрезвычайно
острыми и опасными проявлениями.
Основным клиническим признаком гипокальциемии явля-
ется повышение нейромышечной возбудимости, приводящее к
тетании. Возможны онемение и покалывание пальцев и ногтей,
спазм свода стопы, судороги мышц (“рука акушера”, “конская
стопа”, ларингоспазм, боли в области живота, головная боль,
толовокружение), психические нарушения и др. С дефицитом
ионизированного кальция связывают снижение СВ, возникнове-
ние периферической вазодилатации, артериальной гипотензии,
левожелудочковой недостаточности, удлинение интервала Q—T.
•Печение. Внутривенное введение препаратов кальция может
111
оказаться либо полезным, либо вредным. Применение кальция
может дать отрицательный эффект — нарушить функцию сер-
дечно-сосудистой системы: вызвать снижение СВ, сопровож-
дающееся периферической вазодилатацией. Препараты каль-
ция могут снижать растяжимость желудочков, что приводит к
усилению существующей ранее диастолической формы сердеч-
ной недостаточности. Однако полного доказательства связи
этих явлений с гипокальциемией пока нет, несмотря на от-
дельные сообщения об улучшении сердечной деятельности по-
сле введения препаратов кальция. Кальций крайне редко при-
меняют при выраженной артериальной гипотензии или оста-
новке сердца. Следует помнить о повышении чувствительности
сердца к кальцию при дигиталисной терапии (возможно появ-
ление желудочковой экстрасистолии, ФЖ и остановки сердца
во время систолы).
Применение препаратов кальция показано при гипокаль-
циемии и систолической форме сердечной недостаточности,
устойчивой к другим лекарственным средствам. Введение этих
препаратов можно рекомендовать при кардиогенном шоке,
возникающем после прекращения экстракорпорального крово-
обращения. Их вводят только в центральные вены (табл. 12.1).
Таблица 12.1. Лечение препаратами кальция (внутривенное введение)
по П. Марино, 1998)
Препарат (раствор) солей кальция Содержание ионизированного кальция (Са2+) в 10 мл раствора Максимальная скорость введения, мл/мин
Кальция хлорид (10 % раствор) Кальция глюконат (10 % раствор) 272 мг (13,6 мэкв) 90 мг (4,5 мэкв) 1,0 0,5
Разбавить 10 мл готового раствора соли кальция в 100 мл 5 %
раствора глюкозы (во избежание раздражения вен). Нагреть
полученный раствор до комнатной температуры (для предот-
вращения осадка). Рекомендуемые дозы: при острой гипокаль-
циемии начальная доза 100—200 мг Ca2-f в течение 10 мин.
Поддерживающая доза 1—2 мг/(кг ч). При хронической форме
гипокальциемии назначают соли кальция и витамин D внутрь.
Гиперкальциемия. В основном две причины чаще всего вы-
зывают гиперкальциемию: злокачественные опухоли и гипер-
паратиреоз. Клинические симптомы — изменение психическо-
го статуса (от отклонений в умственной деятельности и эмо-
циональной неустойчивости до глубокого угнетения сознания),
паралитический илеус, снижение АД и почечная недостаточ-
ность. Гиперкальциемия сопровождается обильным диурезом
112
по осмотическому механизму и одновременной потерей каль-
ция с мочой. Это приводит к дегидратации и требует жидкост-
ого возмещения. В связи с потерей жидкостного объема па-
раллельно усиливается гемоконцентрация, что способствует
еще большему повышению уровня кальция в крови.
Показанием для коррекции тяжелой формы гиперкальцие-
мии является повышение уровня кальция в крови до 130 мг/л
и более.
Основой лечения является объемозамещающая терапия со-
левыми растворами, содержащими натрий (изотонический рас-
твор хлорида натрия, раствор Рингера и др.). Выведение натрия
с мочой само по себе усиливает экскрецию кальция. Для уси-
ления последней добавляют петлевые салуретики (фуросемид
от 40 до 100 мг каждые 2 ч — за час до введения солевых
растворов). При этом определяют почасовой диурез и поддер-
живают водный баланс, контролируют уровень кальция в кро-
ви. Скорость внутривенной инфузии солевых растворов долж-
на соответствовать скорости мочеотделения.
При отсутствии эффекта от проводимой терапии применяют
кальцитонин (полипептидный гормон щитовидной железы ги-
покальциемического действия). Кальцитонин уменьшает выход
кальция из костей при состояниях с повышенной скоростью
их резорбции (включая остеопороз). Синтетический кальцито-
нин способствует нормализации уровня кальция в сыворот-
ке крови в течение 2—3 ч [Roswell R.H., 1987]. Обычно вводят
4 ЕД/кг препарата внутримышечно или двойную дозу подкож-
но каждые 12 ч. В случае неэффективности дозу кальцитонина
можно удвоить по истечении 2 сут с начала лечения.
Противоопухолевым препаратом, снижающим резорбцию
костной ткани, является митрамицин. Он более эффективен,
чем кальцитонин, однако лечебное действие его развивается
только через 24—36 ч после введения. При безуспешности всех
способов лечения прибегают к гемодиализу.
Глава 13 РАССТРОЙСТВА ОБМЕНА ФОСФОРА
У взрослых людей нормальная концентрация неорганичес-
кого фосфора в сыворотке крови, представляющего фосфаты
(в основном в виде НРО4 и в утренние часы Н2РО4), со-
ставляет 22—44 мг/л с некоторым снижением в пожилом воз-
расте и различием у мужчин и женщин.
Фосфор — преимущественно внутриклеточный ион (основ-
ной внутриклеточный анион), как К+ и Mg2+. В составе фос-
фолипидов он входит в структуру клеточных мембран. В орга-
низме человека фосфор существует в органической и неорга-
нической формах. Основная органическая составная фосфора
ИЗ
а-10в9
есть в структуре каждой клетки. Внутриклеточный неоргани-
ческий фосфор, являющийся малой частью общего фосфора
обеспечивает образование сложного субстрата, включающего в
себя АТФ для синтеза энергии.
Суточная потребность в фосфоре 0,15 ммоль/кг.
Биологическая роль фосфора огромна. Этот элемент вовле-
чен в энергетический обмен организма, участвует в переносе
энергии. В критических ситуациях, когда возрастает потреб-
ность в энергии и кислороде, происходят изменения в фос-
форном обмене, что сопровождается усиленным транспортом
энергии и кислорода к тканям.
Фосфор важен для структурной целости клеток, для синтеза
метаболических и синтетических процессов, регулирует актив-
ность большого количества ферментов; соединяясь с кальцием,
он образует нерастворимые соли, необходимые для формиро-
вания костей; является частью мочевого буфера, что обеспечи-
вает экскрецию связанных кислот; участвует в процессах им-
мунитета и свертывания крови.
Гипофосфатемия — это снижение содержания фосфора в
сыворотке крови ниже обычного уровня. Гипофосфатемия мо-
жет протекать при отсутствии дефицита фосфора в клетках, но
может ассоциироваться и с истинным истощением запасов
фосфора в организме.
В основе гипофосфатемии лежат три основных механизма:
перемещение фосфатов в клетки и кости, уменьшение интес-
тинальной фосфорной абсорбции или увеличение потерь фос-
фора из кишечника, увеличение экскреции фосфатов с мочой
вследствие уменьшения их реабсорбции в почках.
Перемещение фосфатов в клетки происходит при паренте-
ральном назначении растворов глюкозы или фруктозы, особен-
но при длительном непрерывном их введении. Недостаточное
поступление фосфора чаще всего наблюдается при длительном
парентеральном питании, выраженном истощении, заболева-
ниях и дисфункциях ЖКТ. Рвота, диарея, длительная назога-
стральная аспирация также могут быть причинами тяжелой
формы гипофосфатемии. Увеличение экскреции фосфатов с
мочой возникает при объемной нагрузке и применении диуре-
тиков. Снижение концентрации калия, кальция и магния в
сыворотке крови сопровождается гипофосфатемией. Сдвиг
фосфатов в клетки и нарушение почечной реабсорбционной
способности отмечаются при ацидозе. У больных с тяжелыми
ожогами задерживается большое количество солей и воды. По
мере выздоровления и резком повышении диуреза происходит
потеря фосфора. При анаболических процессах последний ак-
тивно включается в состав клеток и переходит во внеклеточную
среду. Дыхательный алкалоз — обычная причина гипофосфате-
мии. Это особенно важно учитывать у больных, находящихся
на ИВЛ. Повышение pH внутри клеток стимулирует гликолиз,
114
"в, усиление фосфорилирования способствует трансмембранно-
му переходу фосфатных ионов. Сепсис часто сопровождается
движением концентрации фосфора в крови. Снижение почеч-
ной фосфатной реабсорбции и уменьшение интестинальной
абсорбции фосфатов и кальция характерны для дефицита ви-
тамина D. Увеличение внутриклеточного фосфатного сдвига
часто наблюдается у больных с диабетическим кетоацидозом,
когда в фазе декомпенсации внутриклеточный фосфор и калий
Проходят в экстрацеллюлярный сектор и выделяются почками
При осмотической полиурии, что приводит к потере жидкости,
калия и фосфора. Хронический алкоголизм и алкогольная абс-
тиненция — частые причины снижения сывороточной кон-
центрации фосфора. Антациды, содержащие алюминий, спо-
собны связывать фосфор в кишечнике и тем самым вызывать
его дефицит в организме. В многочисленных публикациях по-
казано, что обширные оперативные вмешательства связаны с
Изменениями баланса фосфора в организме. Авторы едины во
мнении, что оперативное вмешательство приводит к гипофос-
фатемии, которая развивается во время операции и продолжа-
ется в послеоперационном периоде. Причина хирургической
Гипофосфатемии окончательно не выяснена.
В ряде случаев гипофосфатемия приобретает характер тяже-
лого патофизиологического синдрома и сопровождается высо-
кой летальностью.
К основным причинам тяжелой гипофосфатемии с падением
уровня РО4 ниже 5 мг/л следует отнести следующие состоя-
ния, наблюдаемые в ОРИТ:
> ♦ интра- и послеоперационный периоды у больных с по-
ражением органов брюшной полости (перитонит, острая
кишечная непроходимость и др.);
♦ обширная хирургическая операция с осложненным по-
слеоперационным периодом (необходимость повторных
операций, многодневной ИВЛ в режиме гипервентиля-
ции, длительность инфузии растворов глюкозы);
♦ длительное парентеральное питание;
♦ сепсис;
♦ диабетический кетоацидоз.
При сепсисе, вызванном грамположительными и грамотрица-
явльными микроорганизмами, уровень фосфатов в крови снижа-
йся, механизм гипофосфатемии до конца не выяснен. Полагают,
’ГГо он связан с возросшей потребностью организма в фосфатах
следствие повышенного метаболизма при сепсисе. Очевидно,
'гг° обширные оперативные вмешательства у септических боль-
ных могут сопровождаться тяжелой гипофосфатемией.
У бальных с диабетическим кетоацидозом, сочетающимся с
п®офосфатемией, имеется существенное истощение запасов
Фосфатов в организме, что служит показанием к немедленной
115
г
фосфатвосполняющей терапии. Причины дефицита фосфатов
при кетоацидозе: глюкозурия, усиливающая экскрецию фосфа-
тов с мочой, и инсулинотерапия, приводящая к перемещению
фосфатов из крови в клетки, что очень быстро вызывает ги-
пофосфатемию.
Клиническая картина. Из наиболее значимых проявлений
заболевания можно выделить следующие:
♦ гипоксию органов и тканей в связи с нарушением транс-
порта кислорода, необходимого для выработки энергии.
Истощение запасов фосфатов сопровождается, в частнос-
ти, недостатком 2,3-дифосфоглицерата в эритроцитах,
что приводит к смещению кривой диссоциации гемогло-
бина влево и снижению тканевой оксигенации;
♦ нарушения деятельности ЦНС (парестезии, тремор, атак-
сия, страх, спутанность сознания вплоть до комы);
♦ возможность сердечной недостаточности вследствие уг-
нетения сократительной способности миокарда;
♦ возможность дыхательной недостаточности в связи с на-
рушением функции диафрагмы и дыхательных мышц;
♦ возможность нарушения свертывающей системы крови
(в эксперименте показано, что гипофосфатемия приво-
дит к изменениям функции тромбоцитов, нарушению
ретракции сгустка крови, увеличению скорости исчезно-
вения тромбоцитов из кровотока). Предполагают, что
гипофосфатемия является одним из этиологических фак-
торов ДВС-синдрома.
Лечение. При тяжелой форме гипофосфатемии рекомендуется
только внутривенное введение растворов фосфора (табл. 13.1).
Поскольку гипофосфатемия часто сочетается с гипокалиемией
Таблица 13.1. Лечение гипофосфатемии препаратами, содержащими
фосфор (внутривенное введение) (по П. Марино, 1998)
Препарат Содержание
фосфор другие электролиты, ммоль/мл
Натрия фосфат Калия фосфат Натрия фосфат ней- тральный 3 ммоль (93 мг/мл) 3 ммоль (93 мг/мл) 0,09 ммоль (2,8 мг/мл) Na+ = 4 К+ = 4,3 Na+ = 0,16
Примечание. 1 ммоль = 31 мг.
Содержание РОд~ в сыворотке
крови:
<5 мг/л
5—10 мг/л
Рекомендуемые дозы:
15 мг/кг (0,5 ммоль/кг) через 4 ч
7,7 мг/кг (0,25 ммоль/кг) через 4 ч
116
гипомагниемией, используются фосфатные растворы, содержа-
ние калий, натрий и магний. Внутривенное введение растворов,
содержащих Фосфор, показано всем бальным, у которых уровень
фосфата (РО4 ) в сыворотке крови ниже 10 мг/л, или 0,3 ммоль/л
лцдке при отсутствии клинических проявлений).
'^Гиперфосфатемия. Наиболее частой причиной гиперфосфа-
темии является почечная недостаточность. К другим вероят-
ным причинам относятся состояния, сопровождающиеся тяже-
лым повреждением тканей, рабдомиолиз, распад опухоли и т.д.
Гиперф°сФатемия’ как и гиперкалиемия, может наблюдаться
при диабетическом кетоацидозе, но после начала лечения ин-
сулином уровень фосфора в крови начинает снижаться.
Лечение. В первую очередь проводят терапию основного
заболевания, гемодиализ. При хронической почечной недоста-
точности показано применение алюминийсодержащих анта-
цидных средств с целью связывания в кишечнике поступаю-
щего в организм фосфора.
Глава 14 | ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Острая почечная недостаточность (ОПН) классифицируется
как олигурическая (мочи меньше 15 мл/ч) и неолигурическая.
Смертность при олигурической форме почечной недостаточ-
ности составляет приблизительно 50 % и по крайней мере в
2 раза выше, чем в случае ее неолигурической формы. По-
скольку ОПН часто связана с гиповолемией или использованием
нефротоксических препаратов, профилактика этого состояния
играет ключевую роль. ОПН может быть вызвана разнообразны-
ми причинами, действующими через один из 3 общих механизмов:
• недостаточная перфузия (преренальная форма);
• преграда (препятствие) для мочеотделения (постреналь-
ная форма);
• поражение почек (интраренальная форма).
Преренальная форма ОПН. Недостаточная перфузия почек
составляет примерно 50 % всех случаев ОПН, поэтому предот-
вращение гипотензии представляется наиболее рациональным
Методом лечения. Хотя длительная почечная ишемия может
приводить к ОПН, в большинстве случаев этиология прере-
Нальной формы мультифокальна (шок, гиповолемия, сепсис,
воздействие лекарственных средств). Полагают, что АД ниже
00—70 мм рт.ст. продолжительностью более 30 мин может вы-
звать ОПН. Почечная недостаточность возникает вслед за недо-
статочностью кровообращения, обусловленной общими причи-
нами (кровопотеря, сердечная недостаточность и др.); жидкост-
117
ным перераспределением, несмотря на высокую производи-
тельность сердца; или может быть обусловлена наличием сосудис-
тых преград (стеноз почечной артерии, васкулит, эмболия).
Постренальная форма ОПН встречается более редко и со-
ставляет примерно от 1 до 10 % всех случаев, однако она
должна быть своевременно диагностирована. И при пререналь-
ной, и при интраренальной формах развитие олигурии или
анурии происходит постепенно — от нескольких часов до не-
скольких дней. У больных с постренальной формой ОПН
обычно наблюдается резкое прекращение оттока мочи, связан-
ное с уретральной преградой (аденома предстательной железы,
травма, закупорка сгустком крови). Препятствие в верхних
отделах мочевых путей, вызывающее анурию, наблюдается в
тех случаях, когда имеется двустороннее поражение мочевыво-
дящих путей или при наличии у больного единственной почки.
Немедленно должна быть исключена обструкция уретры
(например, с помощью попытки введения катетера в мочевой
пузырь). Обструкция мочевого катетера также может быть при-
чиной внезапной олигурии.
Интраренальная форма ОПН возникает в результате пора-
жения паренхимы почек различными повреждающими факто-
рами. В большинстве случаев ОПН с олигурией вызывают два
заболевания: острый некроз канальцев и острый интерстици-
альный нефрит. Острый гломерулонефрит нечасто встречается
у больных, находящихся в О ИТ [Рябов Г.А., 1994; Марино П.,
1998].
Острый некроз канальцев (ОНК) — недостаточно изученное
заболевание, чаще всего развивающееся при ишемии, сепсисе,
гиповолемии, оперативных вмешательствах, применении неф-
ротоксических веществ или отравлении ядами.
Острый интерстициальный нефрит (ОИН) связывают с ре-
акцией гиперчувствительности, развивающейся в почках вслед-
ствие воздействия различных лекарственных веществ (пени-
циллины, нестероидные противовоспалительные препараты,
фуросемид; химиотерапевтические средства, обладающие неф-
ротоксическим действием; контрастные вещества, ангиотеьп
зинпревращающий фермент и др.). Острый интерстициальный
нефрит в 40 % случаев сопровождается лихорадкой, кожными
высыпаниями и суставными болями. Однако ОНК и ОИН
часто имеют сходную клиническую картину.
Причиной часто не диагностируемой аллергической реак-
ции, поражающей почечный интерстиций, может быть какое-
либо лекарственное средство. Сообщается о случаях ОИН в
связи с применением сульфаниламидов, тиазидов, фуросемида
и др. [Linton A.L., Driedger А.А., 1980]. Часто единственными
признаками ОИН являются олигурия и повышение уровня
креатинина в крови. Лабораторные признаки — эозинофилия
и эозинофилурия.
118
Гломерулонефрит и васкулит у больных ОИТ может быть
обусловлен подострым бактериальным эндокардитом, систем-
ной волчанкой, риккетсиозной инфекцией, стрептококковой
флорой, злокачественной гипертензией. Васкулит может быть
связан с назначением лекарственных средств. В анализе мочи
определяется осадок, содержащий лейкоциты, белок, эритроци-
ты, цилиндры. Проводят серологические исследования. Терапия
должна быть направлена на лечение основного заболевания.
Индексы почечной функции (табл. 14.1). Наиболее важная
клиническая задача состоит в том, чтобы дифференцировать
преренальную форму ОПН от острого тубулярного некроза.
Объем мочи обычно отражает интенсивность почечного кро-
вообращения и часто соответствует плотности мочи, поэтому
почечный кровоток, вероятно, адекватен у неолигурических
пациентов, а выделение концентрированной мочи вряд ли мо-
жет указывать на поражение почечных структур. Снижение
почечного кровотока сопровождается увеличением реабсорб-
ции натрия и уменьшением его экскреции с мочой. Наоборот,
при интраренальной форме почечной недостаточности проис-
ходит снижение реабсорбции этого электролита и его выделе-
ние с мочой увеличивается.
Таблица 14.1. Индексы функции почек при ОПН [Marini J.J., Wheeler G.,
1»97]
Лабораторный показатель Преренальная форма Интраренальная форма
'.Ft1 Азот мочевины крови/креатинин Концентрация натрия в моче Осмолярность мочи Креатинин мочи/креатинин Плазмы '^^Na Осадок мочи > 10:1 < 20 ммоль/л > 500 мосм/л > 40 < 1 нормальный 10:1 > 40 ммоль/л <300—400 мосм/л < 20 > 2 активный
Содержание натрия в моче менее 20 ммоль/л при олигурии
Указывает на преренальную патологию, а уровень натрия выше
40 ммоль/л свидетельствует о возможности (не всегда) реналь-
ной формы ОПН.
Ошибки в трактовке повышенного уровня натрия в моче
Могут возникать на фоне применения салуретиков и у больных
Пожилого возраста. Однако, используя только один этот пока-
затель, нельзя установить причину ОПН, если концентрация
Патрия в моче составляет около 40 ммоль/л.
Соотношение концентрации азота мочевины крови и креа-
?®HHa при преренальной форме ОПН обычно более 10:1, а
Яри интраренальных причинах — менее 10:1. Общими руково-
119
дящими принципами при этом служат следующие: при прекра-
щении диуреза концентрация азота мочевины увеличивается
на 10—15 мг/(длсут), а креатинина — на 1—2,5 мгДдл суг)
Увеличение концентрации калия в сыворотке крови происхо-
дит со скоростью около 0,5 ммольДлсут) и снижение НСО3 _
приблизительно на 1 ммольДлсут). Ежедневный анализ этих
показателей дает важную информацию о динамике развития
ОПН. Высокая осмолярность мочи (более 500 мосм/л) свиде-
тельствует о преренальной причине ОПН, а низкая (менее
300—400 мосм/л) — о наличии интраренальных этиологичес-
ких факторов. Соотношение креатинин мочи/креатинин плаз-
мы более 40 указывает на преренальную форму ОПН, а сни-
жение этого показателя ниже 20 — на ренальную.
Фракционная экскреция натрия (O3Na) — это часть электро-
лита, проходящая через клубочковый фильтр и экскретируемая
с мочой. ФЭма вычисляют, сравнивая почечный клиренс на-
трия с клиренсом креатинина:
ФЭ№(%) =
(КМ/КП)На
(КМ/КП)Кр
х 100,
где КМ — концентрация натрия в моче, КП — концентрация
натрия в плазме, Кр — креатинин.
ФЭма менее 1 % свидетельствует о преренальной азотемии,
а более 2 % — об интраренальной ОПН. Это один из инфор-
мативных показателей [Espinel С.Н., Gregory A.W., 1980].
Микроскопическое исследование осадка мочи (табл. 14.2).
При наличии преренальных факторов осадок мочи содержит
неспецифические элементы — гиалиновые или зернистые ци-
линдры. При остром некрозе почечных канальцев в осадке
мочи много эпителиальных клеток и цилиндров (грубых зер-
нистых). При ОПН осадок мочи может содержать лейкоциты
и лейкоцитарные цилиндры. Наличие в моче эритроцитов и
эритроцитарных цилиндров характерно для острого гломеруло-
нефрита, но может встречаться и при других патологических
процессах, приводящих к ОПН [Марино П., 1998].
Таблица 14.2. Признаки усиленного катаболизма или некроза скелет-
ных мышц при ОПП [Schrier R.W., 1979]
Биохимические показатели сыворотки крови Ежедневное увеличение Конечная концентрация
Мочевина >300 мг/л —
Креатинин >10 мг/л —
Калий >1 ммоль/л —
Мочевая кислота — >150 мг/л
Фосфор — >100 мг/л
120
Рабдомиолиз. Острый некроз скелетных мышц сопровожда-
ется миоглобинурией, возрастанием содержания креатинина,
азота мочевины, калия и других биохимических показателей в
сыворотке крови.
При тяжелой форме рабдомиолиза в кровь выделяется боль-
шое количество миоглобина и креатинина, что вызывает по-
вышение активности ряда мышечных ферментов, в том числе
креатинфосфокиназы. Источник их происхождения (сердечная
мышца или скелетная мускулатура) можно определить по ак-
тивности альдолазы. Повышенная активность альдолазы по-
зволяет считать скелетные мышцы ее источником. Основное
лечение ОПН, обусловленной рабдомиолизом и повышенным
катаболизмом, заключается в правильной инфузионной тера-
пии и коррекции водно-электролитного баланса.
Лечение ОПН. Начальный подход к лечению продолжаю-
щейся почечной недостаточности должен полностью исклю-
чить наличие преренальных и постренальных причин. При
первых же симптомах олигурии или анурии необходимо убе-
диться в нормальном функционировании катетера, введенного
В мочевой пузырь. Это важно при выделении мочи менее
500 мл/сут (олигурия) и особенно при выделении мочи менее
100 мл/сут (анурия). Следует помнить, что острая олигурия обыч-
но не вызывается почечными паренхиматозными нарушениями.
Первоначальная задача состоит в нормализации гемогидро-
динамических показателей, устранении гиповолемии, дегидра-
тации, возможных нарушений секторального жидкостного рас-
пределения.
Для нормальной функции почек необходимы определенный
резерв жидкости в организме и достаточно высокий СВ. Важно
установить гемодинамический профиль и принять меры к его
нормализации. Потребность в инвазивном контроле спорна,
поскольку никакие специфические уровни ДЗЛА, функцио-
нального состояния сердца не гарантируют достаточного по-
чечного кровотока. На практике часто пользуются неинвазив-
ными методами оценки гемодинамического профиля, измеряя
величины СВ, СИ, ОПСС, САД, ДНЛЖ. Динамическое изме-
рение ЦВД, как и ДЗЛА, позволяет оценить адекватность на-
полнения желудочков кровью. Если оба показателя снижены
на 4 мм. рт.ст. и более, необходимость инфузионной терапии
не вызывает сомнений. ОЦК можно считать адекватным при
ЦВД 10—12 и ДЗЛА — 15—20 мм рт.ст. Если после нормали-
зации этих показателей СВ остается сниженным, необходимо
немедленно определить причину этого (инфаркт миокарда,
тампонада сердца и др.) и провести соответствующую терапию.
Добутамин и допамин. При сниженном СВ и нормальном
АД показано введение добутамина в дозе 10—20 мкг/(кг мин).
При сниженном АД и низком СВ назначают допамин из рас-
чета 5—15 мкгДкг мин). При достаточно высоком СВ показан
121
допамин в дозе 2—5 мкг/(кгмин), поскольку эта доза оказы-
вает вазодилатирующее действие на почечные сосуды и таким
образом улучшает почечную перфузию.
Наличие олигурии при нормальной гемодинамике свиде-
тельствует о возможном интраренальном механизме почечной
недостаточности. В этих случаях предлагается вводить малые
дозы допамина (дофамина) — 1 мкг/(кг мин) для устранения
вазоконстрикции, сопровождающей ОПН. Одновременное вве-
дение фуросемида, способствующего активизации канальцевых
процессов мочеобразования, ускоряет процессы мочеотделе-
ния, но не приводит к улучшению функции почек.
Маннитол обеспечивает достаточный диурез даже при сни-
жении среднего АД до 30 мм рт.ст. Введение маннитола спо-
собствует повышению почечного кровотока. Осмотическое дей-
ствие проявляется торможением абсорбции воды в канальцах
и образованием гипотонического фильтрата. Маннитол назна-
чают при появлении ранних признаков почечной недостаточ-
ности. Диуретический эффект этого препарата связан с по-
вышением клубочковой фильтрации. Увеличение диуреза обычно
наступает в течение 2 ч после введения 50—100 мл 25 % раствора.
При этом важно поддерживать адекватный объем плазмы, при-
менять средства, улучшающие реологические свойства крови.
Фуросемид применяют в начальной дозе 100 мг. Диуретичес-
кий эффект наступает в течение 1 ч. Общая доза при внутри-
венном введении не должна превышать 600 мг. Имеются све-
дения, что препарат в больших дозах вызывает вазоконстрик-
цию и снижает СВ. Фуросемид также оказывает нефротокси-
ческое действие. Обязательным условием перед назначением
фуросемида является нормализация СВ и ОЦК.
Нарушения электролитного баланса. Главными признаками
дисбаланса электролитов при ОПН являются гиперкалиемия,
гипонатриемия, гипермагнезиемия и гиперфосфатемия. Ежесу-
точный контроль за содержанием этих электролитов в сыворотке
крови важен как для определения динамики процесса, так и для
ограничения введения растворов, содержащих электролиты. При
стойкой олигурии введение калия и магния прекращают.
Медикаментозная терапия при ОПН. Потребность в назна-
чении любого лекарственного средства должна быть подверг-
нута сомнению. Введение любого лекарственного средства,
которое может вредить почечной функции, должно быть пре-
кращено и заменено назначением другого альтернативного пре-
парата (табл. 14.3). Дозировка лечебного средства должна осу-
ществляться с учетом возможностей почечной функции и эли^
минации этого вещества в соответствии со степенью почечной
дисфункции. Дозирование каждого препарата, связанного с его
выделением почками, проводят на основании номограмм. Да-
же в тех случаях, когда дозы точно рассчитаны, требуется
определение концентрации этих веществ в сыворотке крови.
122
Таблица 14.3. Лекарственные препараты, которые отменяют при раз- аитми ОПН
Нефротоксические препараты Альтернативные препараты
д^НОГЛИКОЗИДЫ Амфотерицин В Пентамидин Аллергический ин Все пенициллины Цефалотин фуросемид Тиазидные диуретики Циметидин Нестероидные противовоспа- лительные средства (НПВС) Азтреонам Нет (уменьшить его дозу наполовину) Триметоприм + сульфаметоксазол терстициальный нефрит Эритромицин, ванкомицин Ванкомицин Буфенокс Сукральфат, антациды Парацетамол
Не следует назначать аминогликозиды, так как есть альтер-
нативные антибиотики. Их можно с успехом заменить азтрео-
намом или другими антибиотиками, не обладающими нефро-
токсическими свойствами. Если препарат не имеет альтерна-
тивной замены (например, амфотерицин В), лечение им вре-
менно прекращают и возобновляют через 24 ч в половинной
дозе. Следует иметь в виду, что аллергический интерстициаль-
ный нефрит может быть вызван пенициллинами, фуросеми-
дом, тиазидными диуретиками и нестероидными противовос-
палительными препаратами. Во всех случаях интерстициально-
го нефрита нужно отказываться от применения вышеуказан-
ных средств и заменять их другими, не обладающими нефро-
токсическими свойствами. На основании табл. 14.3 можно
подобрать альтернативное лечение (по П. Марино, 1998).
;; При невозможности замены дозу аминогликозидов следует
уменьшить до 3—5 мг/(кгсут) и применять с 8-часовым интер-
валом при ежедневном контроле уровня креатинина в плазме
Крови.
: Дигоксин отменяют или заменяют добутамином. Дозы эу-
филлина должны быть уменьшены до 0,2 мг/(кг ч) с контролем
содержания в плазме крови. При почечной недостаточности
натрия нитропруссид не следует вводить более 3 сут из-за
опасности развития токсемии.
Инфузионная терапия. При ОПН требуется скрупулезное
вЫполнение всех условий инфузионной терапии с обязатель-
ным контролем как объема вводимой жидкости, так и качест-
венного его состава. Главная цель дозированной жидкостной
Нагрузки — ликвидация гиповолемии. При этом восстановлен-
ный диурез может не являться признаком улучшенной почеч-
ной функции. Но сам по себе этот факт иногда служит инди-
123
катором общего статуса пациента и значительно упрощает ин-
фузионную терапию. Нагрузочный объем целесообразно соче-
тать с введением петлевых мочегонных средств, например фу.
росемида (1 мг/кг). Хотя отдельные дозы осмотических средств
(25—50 г маннита) также могут быть эффективны, но эта
перегрузка опасна, так как вызывает гиперосмолярность. От-
сутствие эффекта нагрузочной терапии в течение 8 ч указывает
на паренхиматозную почечную недостаточность. В этих случаях
дальнейшее введение маннитола противопоказано из-за опас-
ности сердечной недостаточности и развития острого отека
легких.
При выраженной почечной недостаточности ежедневная
инфузия жидкости не должна превышать 500—700 мл. Допол-
нительные потери (через дренажи, фистулы и пр.) должны быть
возмещены. В этой фазе ОПН возможны осложнения: гипер-
гидратация (отек легкого), гиперкалиемия, гипофосфатемия,
метаболический ацидоз, инфекционные осложнения.
Из инфузионных жидкостей предпочтение отдается раство-
рам сахаров. Электролиты вводят, ориентируясь на показатели
ионограммы. Растворы, содержащие калий и магний, проти-
вопоказаны. Необходимо контролировать гематокрит, кон-
центрацию белка в плазме, ЦВД, массу тела. Увеличение массы
тела свидетельствует о гипергидратации. При прогрессивном
повышении уровней калия, магния, нарастании уремии требу-
ется диализ.
Осложнения 0/7/7 [Марино П., 1998]: метаболические — ги-
понатриемия, гиперкалиемия, гипокальциемия, гиперфосфате-
мия; кардиоваскулярные — избыток жидкости, гипертензия, арит-
мии, перикардит; неврологические — невропатия, деменция, уре-
мическая кома; гематологические — анемия, коагулопатия;
гастроинтестинальные — тошнота и рвота, кровотечения; ин-
фекционные — мочевого тракта, сепсис, пневмония.
ОПН, связанная с инфекцией, — одна из частых причин
смерти в ОИТ. Приобретенные в ОИТ сепсис, перитонит,
пневмония и другие заболевания самым существенным обра-
зом влияют на возникновение ОПН, в том числе дисфункции
почек. Возможными причинами сепсиса и сопровождающей
его ОПН могут быть инфекция мочевых путей, катетерный
сепсис, инфекция ВДП.
Диализ. Применяют три метода: ультрафильтрацию, гемоди-
ализ и перитонеальный диализ.
Ультрафильтрацию проводят при избытке жидкости и элек-
тролитов. Она может быть использована для коррекции мета-
болического ацидоза путем замены отфильтрованной жидкости
введением NaHCO3.
Гемодиализ показан при жидкостной перегрузке, гиперка-
лиемии и гипернатриемии, угрожающем жизни ацидозе, симп-
томатической уремии (тошнота, рвота, перикардит, кома) и
124
повышении уровня салицилата, метанола, этиленгликоля. Этот
метод применяют при содержании креатинина в сыворотке
дтови более 8 мг/дл и в тех случаях, когда показатель мочевины
крови приближается к 100 мг/дл.
^Деритонеальный диализ значительно менее эффективен, чем
гемодиализ, в удалении токсинов или коррекции электролит-
ного баланса.
Для большинства больных с уремическими признаками вре-
менный гемодиализ является лучшим выбором для устранения
уремии, нормализации электролитных и кислотно-основных
нарушений. Если имеется жидкостная перегрузка, то гемо-
фильтрация представляет разумную альтернативу.
Основные положения
1, Нарушения водно-электролитного баланса ведут к расстройствам
основных констант гомеостаза: pH, секторальных объемов жидкости,
осмолярности и КОС. Дисбаланс воды и электролитов сопровождается
полиорганными нарушениями, изменениями клеточного мембранного
потенциала и требует точной диагностики и адекватного лечения.
' 2. Изотоническая дегидратация возникает при потерях жидкости, содер-
жащей эквивалентные количества воды и натрия. Наиболее частыми
' причинами изотонической дегидратации являются патологические по-
' тери из ЖКТ, назначение диуретиков, полиурия, множественные травмы,
i ожоги, секвестрация жидкости в третье водное пространство. Изотони-
ческая дегидратация сопровождается выраженными циркуляторными и
неврологическими нарушениями, шоком и требует незамедлительного
t лечения.
i 3. Острая гипонатриемия со снижением содержания натрия в сыворотке
крови ниже 120 ммоль/л и осмолярности плазмы ниже 280 мосм/л пред-
ставляет собой угрожающее жизни состояние и характеризуется избыт-
ком свободной воды и дефицитом натрия. Основные причины: инфузи-
онная терапия безэлектролитными растворами или синдром несоответ-
ствующей секреции АДГ.
- 4. Гипернатриемия в ОИТ обычно связана с обезвоживанием, ошибками
в проведении инфузионной терапии. Гипернатриемия может быть обу-
словлена нарушениями центральных и почечных механизмов регуля-
ции водно-электролитного обмена — несахарным и (или) нефрогенным
несахарным диабетом, которые ведут к потерям воды. Как и гипонат-
риемия, гипернатриемия сопровождается выраженными неспецифичес-
кими неврологическими проявлениями и может привести к летальному
исходу.
5. Некетоновый гипергликемический синдром с выраженной гипергли-
кемией (содержание глюкозы крови более 30 ммоль/л) встречается у
больных диабетом. Осмотический диурез приводит к выраженной гипо-
волемии, часто возникают изменения психического статуса, у полови-
ны больных развивается некетоновая гиперосмолярная кома. Лече-
ние заключается в быстром устранении гиповолемии, осторожном
применении инсулина, восстановлении уровня натрия в плазме, при
125
недостатке свободной воды медленная инфузия 0,45 % раствора хло-
рида натрия.
6. Расстройства обмена кальция, магния и фосфатов часто возникают
у больных с полиорганными нарушениями, сопровождаются изменения-
ми водного баланса, КОС, нарушениями психического статуса. Общая
концентрация ионов магния и кальция не является точным отображе-
нием их возможных нарушений, поскольку последние зависят главным
образом от их ионизированных форм. Гипофосфатемия наблюдается
при несбалансированном парентеральном питании, истощении, кето-
ацидозе, сепсисе.
7. К основным причинам ОПН в ОИТ относятся: 1) преренальные при-
чины — гипотензия, низкий СВ, стеноз почечной артерии, тромбоз по-
чечной вены; 2) постренальные причины — мочевые камни, опухоли,
гипертрофия простаты; 3) интраренальные причины — острый тубуляр-
ный некроз, интерстициальный нефрит, гломерулонефрит, лекарствен-
ные средства.
8. ОПН может возникать как “изолированное" состояние, но чаще свя-
зана с полисистемными нарушениями. Развитие ОПН, особенно олигу-
рической формы, сопровождается значительным увеличением леталь-
ности, несмотря на возможность диализной поддержки. При ОПН не
существует специфической терапии, поэтому важно осуществлять стро-
гий контроль жидкостного и электролитного баланса, диуреза, уровня
мочевины и креатинина. Лечение ОПН не всегда эффективно, поэтому
важно предотвратить ее развитие.
9. ОПН в ОИТ, не связанная с преренальными и постренальными
причинами, в основном зависит от двух факторов: 1) недостаточная
перфузия почек, вызывающая азотемию и способствующая острому
канальцевому некрозу; 2) лекарственные средства (особенно ан-
тибиотики, НПВС и фуросемид), обладающие нефротоксичностью, сни-
жающие перфузию почек и способные вызывать интерстициальный
нефрит.
ВОПРОСЫ И ОТВЕТЫ
1. Возможно ли повышение осмолярности плазмы нри гипонатрие-
мии?
Осмодиуретики, спирты, мочевина, глюкоза, недифференциро-
ванные “неизмеряемые” осмоли обладают высокой осмотичес-
кой активностью и могут приводить к гиперосмолярному со-
стоянию при гипонатриемии.
2. Укажите причины, которые приводят к снижению коллоидно-
осмотического давления плазмы.
Коллоидно-осмотическое (онкотическое) давление (КОД) плаз-
мы зависит от содержания в ней белков. Альбумины обеспечи-
вают 80 % КОД плазмы. Поэтому основной причиной сниже-
ния этого показателя является гипоальбуминемия. Снижение
содержания альбумина в плазме характерно для многих состо-
126
яний: сепсис, обширные ожоги, послеоперационный период,
истощение, повышенная проницаемость капилляров. Гипоаль-
буминемия с падением уровня альбумина до 30 г/л и ниже
сопровождается снижением КОД до 14—16 мм рт.ст. и является
плохим прогностическим признаком.
3. Какие факторы при лечении тяжелобольных в ОИТ могут при-
водить к натриевому истощению и отравлению организма
водой?
К гипонатриемии и соответствующему увеличению общего ко-
личества воды в клеточном и внеклеточном пространствах при-
водят: 1) инфузии безэлектролитных растворов при имеющихся
потерях натрия и хлора; 2) синдром несоответствующей (избы-
точной) секреции АДГ. СНС АДГ может иметь место при
нарушениях в гипоталамо-гипофизарной системе при травмах,
заболеваниях, стрессе.
4. Какие нарушения центральной регуляции водно-натриевого обме-
на приводят к избыточной потере воды и гипернатриемии?
К избыточной потере воды приводят нарушения в гипоталамо-
гипофизарной системе, сопровождающиеся недостаточной вы-
работкой АДГ и несахарным мочеизнурением. Это состояние
классифицируется как “несахарный диабет”. Может возникать
после травмы головы, заболеваний ЦНС, перенесенных опера-
ций.
5. Объясните этиологию нефрогенного несахарного диабета.
Нефрогенный несахарный диабет характеризуется неспособ-
ностью почек реагировать на выработанный гипоталамо-гипо-
физарной системой АДГ. Причинами могут быть заболевания
почек, длительное применение салуретиков, карбоната лития,
демеклоциклина и аминогликозидов. Клинические симптомы
включают полиурию и полидипсию. Осмоляльность мочи
менее 200 мосм/кг.
6. Как отличить центральную форму несахарного диабета от неф-
рогенной?
Диагноз несахарного диабета может быть подтвержден с помо-
щью пробы с вазопрессином. Если в течение 2 ч после введения
5 ед. водного раствора вазопрессина или 1 мкг дезаминоарги-
нинвазопрессина осмоляльность мочи повышается на 50 % —
это указывает на центральный несахарный диабет. Если же
осмоляльность мочи повышается менее чем на 50 %, то это
свидетельствует о нефрогенном характере диабета.
7. Может ли быстрая коррекция гипонатриемии и гипернатриемии
до нормального уровня натрия в сыворотке крови (135—145
мэкв/л) привести к летальному исходу?
Быстрая коррекция гипо- или гипернатриемии, проводимая в
течение часа или нескольких часов, может привести к цент-
ральному миелинозу и к смерти больного. Скорость коррекции
127
уровня натрия в сыворотке крови при остро возникающих ег
изменениях (ниже 120 или выше 150 мэкв/л) не должна пре°
вышать 1—2 мэкв/л/ч.
<?. Как отличить гиперосмолярную некетоновую гипергликемию ощ
диабетического кетоацидоза?
Уровень глюкозы в крови выше 30 ммоль/л при наличии следов
кетоновых тел или их уровня 1+ в плазме или моче; осмоляль-
ность плазмы более 350 мосм/кг. Дополнительные признаки-
тяжелая дегидратация и сонливость, pH обычно >7,2.
При диабетическом кетоацидозе уровень глюкозы >15 ммоль/л.
Дегидратация выражена в меньшей степени, уровень кетоновых
тел высокий, рН<7,2.
9. Какие критерии могут подтвердить наличие синдрома несоот-
ветствующей секреции АДГ?
Синдром НС АДГ обычно гипердиагностируют. Критерии СНС
АДГ: а) концентрация натрия в плазме ниже 130 ммоль/л; б)
осмоляльность плазмы ниже 275 мосм/кг; в) концентрация
натрия в моче выше 20 ммоль/л; г) осмоляльность мочи больше
осмоляльности крови; д) нет отеков или признаков гиповоле-
мии; е) нормальные функции почек, щитовидной железы, над-
почечников; ж) больной не принимает диуретиков.
10. Какие симптомы и лабораторные исследования характерны для
гиперкальциемии ?
Тяжелую форму гиперкальциемии (общий кальций>3 ммоль/л)
обычно наблюдают у больных со злокачественными опухолями
костей, молочной железы, бронхов, миеломой, лимфомой, реже
она обусловлена первичным гиперпаратиреозом. Общие симп-
томы неспецифичны: анорексия, тошнота, рвота, запор, жажда,
полиурия, слабость, недомогание, спутанность сознания.
11. Определите последовательность лечебных мероприятий при тя-
желой форме гиперкальциемии:
а) внутривенное введение 3—4 л 0,9 % раствора натрия хлорида
в течение 24 ч; б) форсированный солевой диурез: в централь-
ную вену вводят 0,9 % раствор натрия хлорида по 1 л каждые
2 ч, фуросемид внутривенно по 40 мг/ч, если ЦВД превышает
10 см вод. ст., уменьшают скорость инфузии или назначают
дополнительную дозу диуретика; в) каждые 4 ч контролируют
уровень натрия и кальция; г) контролируют уровень калия в
плазме крови и по показаниям вводят его внутривенно. Фор-
сированный диурез потенциально опасен. Его применяют толь-
ко для быстрого снижения уровня кальция в крови при угро-
жающих жизни симптомах.
12. Определите последовательность неотложных лечебных меро-
приятий при диабетическом кетоацидозе. Больной заторможен,
дыхание частое, АДсист. 70 мм рт.ст., умеренно выраженная
дегидратация, раОг — 60 мм рт.ст., раСОг — 10 мм рт.ст.,
128
НСОз — 7 ммоль/л, pH артериальной крови 6,90; глюкоза кра-
ди — 25 ммоль/л, кетоны +++.
f Оксигенотерапия через носовой катетер — 2 л/мин.
♦ Срочная катетеризация центральной вены.
ф 500 мл раствора декстрана 60 в течение 15—30 мин.
♦ Определите АД, АДсист.. повысилось до 90 мм рт.ст.
♦ Внутривенно 0,9 % раствор натрия хлорида 1 л в течение
часа.
♦ Внутривенно 10 ЕД инсулина.
* Установите назогастральный зонд для постоянной аспира-
ции содержимого желудка.
♦ Разведите 50 мл растворимого инсулина в 50 мл 0,9 % рас-
твора натрия хлорида (1 ЕД/мл). Промойте систему 10 мл
этого раствора. Начните инфузию со скоростью 6 мл/ч.
♦ При pH крови 6,90 или меньше введите 8,4 % раствор гад-
рокарбоната натрия из расчета 0,5 ммоль/кг массы тела за
30 мин (т.е. 0,5 мл/кг за 30 мин). Желательно достичь уровня
НСОз = 15—18 ммоль/л, а pH повысить до 7,20. После этого
введение раствора гидрокарбоната натрия прекращают.
♦ Проверяйте уровень глюкозы в крови не реже 1 раза в
2 ч, регулируйте скорость введения инсулина в зависимости
от уровня глюкозы крови. Если уровень глюкозы крови
снизился до 10—15 ммоль/л, инсулин вводят на 5 % рас-
творе глюкозы.
♦ Если АДсист. >90 мм рт.ст., вводят 1 л 0,9 % раствора натрия
хлорида в течение часа, затем 1 л 0,9 % раствора натрия
хлорида в течение 2 ч и определяют уровень калия в крови.
♦ В последующем вводят 1 л 0,9 % раствора натрия хлорида в
течение 4 ч, добавляя в него хлорид калия (скорость введе-
ния хлорида калия зависит от концентрации калия в плазме
крови).
♦ В последующие 8 ч вводят 1 л 0,9 % раствора хлорида натрия
с добавлением калия.
♦ Ежечасно проверяют уровень сознания до его полного воз-
вращения, АД и пульс до стабилизации, ЦВД до тех пор,
пока скорость инфузии изотонического раствора хлорида
натрия не достигнет 1 л за 8 ч или менее.
♦ Каждые 2 ч исследуют уровень глюкозы в плазме крови до
достижения уровня <20 ммоль/л, затем каждые 4 ч; pH
артериальной крови — до достижения уровня >7,30; контро-
лируют кетогенез по уровню кетоновых тел в моче.
13. Какие лечебные мероприятия следует проводить при установ-
ленной гипогликемии?
♦ Внутривенно вводят 50 мл 50 % раствора глюкозы (декстро-
зы) через крупную вену.
♦ Через 5 мин вновь определяют уровень глюкозы в крови
“полосочным” методом, а через 30 мин — лабораторным
путем.
129
♦ Устанавливают возможные причины гипогликемии (диабет
сниженное поступление инсулина, прием алкоголя, о<(а1’.
инфекции).
♦ Если гипогликемия рецидивирует, через центральную bchv
вводят 10% раствор глюкозы (декстрозы) по 1 л каждые
12 ч. При этом скорость инфузии регулируют по концент-
рации глюкозы в плазме крови, которую поддерживают от
5 до 10 ммоль/л.
♦ Если гипогликемия реагирует лишь на инфузию 10 % рас-
твора глюкозы, через центральную вену вводят 20—30 %
раствор глюкозы (декстрозы), устраняют возможные причи-
ны гипогликемии [Спригинс Д., 2000].
14. Объясните патофизиологические изменения, возникающие при
некетоновом гипергликемическом синдроме.
Возникает часто у больных сахарным диабетом средней тяжес-
ти, однако клинические проявления могут быть очень тяжелы-
ми вплоть до развития гиперосмолярной неацидотической ко-
мы. Содержание глюкозы в плазме крови в этих случаях часто
превышает 50 ммоль/л в отличие от диабетического кетоаци-
доза, при котором уровень глюкозы обычно ниже 30 ммоль/л.
Осмотический диурез сопровождается значительными наруше-
ниями водно-электролитного баланса, возможен гиповолеми-
ческий шок. Кома наблюдается примерно у половины больных.
В то же время нет прямой зависимости между степенью нару-
шений сознания и гиперосмоляльностью плазмы. Составной
частью синдрома могут быть генерализованные тонико-клони-
ческие судороги и локальные неврологические расстройства.
К предрасполагающим факторам синдрома относятся инфек-
ция, осложнения парентерального питания, применение диуре-
тиков, бета-адреноблокаторов и кортикостероидов.
15. Как проводить лечение некетонового гипергликемического син-
дрома?
♦ Быстрое устранение гиповолемии путем внутривенного вве-
дения изотонического раствора хлорида натрия. 5 % или
10 % раствор декстрозы применяют, если уровень глюкозы
в крови меньше 15 ммоль/л.
♦ Внутривенно 10 ЕД инсулина (при содержании глюкозы в
плазме крови >50ммоль/л).
♦ Последующая терапия инсулином — 3 ЕД/ч на изотоничес-
ком растворе хлорида натрия.
♦ Каждый час контролируют содержание глюкозы в крови.
♦ Если через 2 ч уровень глюкозы в крови не снизился, дозу
инсулина увеличивают до 5—6 ЕД/ч. После коррекции ги-
поволемии потребность во введении инсулина может не
возникнуть.
♦ Восстанавливают уровень натрия в плазме крови. При вы-
раженном дефиците свободной воды применяют 0,45 % рас'
твор хлорида натрия (возможно развитие отека мозга после
быстрого снижения уровня глюкозы крови).
130
4 Уровень калия в плазме контролируют через 30 мин после
начала введения инсулина, а затем каждые 2 ч. Осуществля-
ют коррекцию калия, не допуская снижения его ниже нор-
мального уровня.
16. Как возмещают потери калия при кетоацидозе?
Возмещение потерь калия при кетоацидозе проводят в зависи-
мости от его содержания в сыворотке крови.
Содержание К+ в сыворотке крови Инфузия К+, ммоль/ч
> 6 0
5-6 10
4-5 20
3-4 30
< 3 40
17. Какие электролитные нарушения сопровождаются мышечной
слабостью?
Мышечную слабость могут вызвать пониженное или повышен-
ное содержание ионов калия, натрия, кальция и магния, а
также гипофосфатемия. Выраженная мышечная слабость харак-
терна для гипокалиемии, гипофосфатемии и гиперкальциемии.
Паралич с вовлечением дыхательных мышц возможен при ги-
покалиемии, гиперкалиемии и гипомагнезиемии.
18. Какие изменения ЭКГ возникают при гипокалиемии?
При гипокалиемии могут возникать любые сердечные аритмии,
особенно при применении препаратов дигиталиса. Гипокалие-
мия значительно увеличивает порог для ФЖ и поддерживает
возникновение ранней деполяризации. Умеренная гипокалие-
мия (содержание К+ в плазме от 3,5 до 2,5 ммоль/л) задержи-
вает желудочковую реполяризацию и проявляется в смещении
вниз сегмента ST, уменьшении или инверсии зубца Т, увели-
чивает длительность интервала Q—U. При глубокой гипокалие-
мии (содержание К+ менее 2,5 ммоль/л) отмечается депрессия
интервала S—T ниже изолинии, высокий зубец U, возрастают
амплитуда зубца Р, интервал P—Q и длительность комплекса
ORS. Тахикардия, экстрасистолия и другие нарушения ритма.
Возможность остановки сердца.
19. Какие изменения ЭКГ возникают при гиперкалиемии?
Гиперкалиемия любой степени тяжести может вызвать внезап-
ную остановку сердца — асистолию или ФЖ, или остановку
дыхания из-за паралича дыхательной мускулатуры. Ацидоз и
повышенная концентрация натрия, кальция и магния усили-
вают влияние гиперкалиемии на нервно-мышечные синап-
сы. У каждого больного с повышением уровня калия выше
131
9*
5,5 ммоль/л необходимо контролировать ЭКГ. Из-за поздней
деполяризации комплекс ORS расширен, зубец Т сужен и уве-
личен. Сокращение предсердий часто исчезает.
При повышении содержания К+ в плазме до 6 ммоль/л — острый
зубец Т, при дальнейшем повышении калия (7—8 ммоль/л) —
удлинение интервала P—R, при уровне К+ в плазме 9 ммоль/л —
отсутствует зубец Р, комплекс ORS расширен. Дальнейшее уве-
личение содержания калия в плазме сопровождается фибрил-
ляцией желудочков.
20. Опишите лечение гиперкалиемии медикаментозными сред-
ствами.
Применяют глюконат кальция (20 мл 10 % раствора) внутри-
венно в течение 10 мин. Введение солей кальция — хлорида или
глюконата — уменьшает возбудимость тканей, расширяя разни-
цу между потенциалом покоя и пороговым потенциалом. Внут-
ривенное введение кальция определенно показано, если содер-
жание К+ плазмы достигает 7 ммоль/л или выявляются суще-
ственные отклонения ЭКГ.
Наиболее важное фармакологическое средство, которое стиму-
лирует поступление калия в клетки, — инсулин. В 500 мл 20 %
раствора глюкозы добавляют 10 ЕД обычного инсулина и осу-
ществляют внутривенную инфузию со скоростью 100 мл/ч.
Содержание в плазме глюкозы и калия должно тщательно кон-
тролироваться каждые 30 мин. Действие инфузии гидрокарбо-
ната натрия на калий непостоянно. В то же время медленная
инфузия изотонического солевого раствора при гиперкалиемии
может оказать положительное действие, но необходимо учиты-
вать возможность увеличения содержания натрия в плазме кро-
ви и объема внеклеточной жидкости. Поскольку гиперкалиемия
обычно обусловлена почечной недостаточностью, применяют
фуросемид (40—60 мг), иногда в более высоких дозах. Фуросе-
мид неэффективен при явной почечной недостаточности.
21. Какие лекарственные препараты, часто применяемые в интен-
сивной терапии, могут вызвать ОПН или способствовать ее
возникновению ?
Нефротоксичностью обладают аминогликозиды, амфотерицин В,
сульфаниламиды, рентгеноконтрастные вещества. Потенциаль-
ная опасность при их применении — острый некроз канальцев.
Ухудшение перфузии почек вызывают диуретики, НПВС, инги-
биторы ангиотензинпревращающего фермента.
Аллергический интерстициальный нефрит может развиться при
применении пенициллинов, цефалотина, фуросемида, тиазид-
ных диуретиков, циметидина, НПВС.
22. Какие причины приводят к заболеванию почек и к ОПН?
Изменения клубочков: первичное заболевание или проявление
системного заболевания.
Изменения сосудов: васкулит, коагулопатия.
Изменения канальцев: острая ишемия или воздействие нефро-
токсинов.
132
Изменения интерстиция: острый лекарственный аллергический ин-
терстициальный нефрит. Острый бактериальный пиелонефрит.
23. Перечислите отравления, вызывающие нефротоксический ост-
рый некроз канальцев.
Отравления парацетамолом, аспирином, этиленгликолем, мета-
нолом, бледной поганкой.
24. Какие изменения обмена электролитов могут возникать при
ОПН?
При осложнениях ОПН наиболее часто возникают: гипонат-
риемия, гиперкалиемия, гипермагниемия, гиперфосфатемия,
гипокальциемия.
25. Перечислите возможные осложнения ОПН.
Гипонатриемия, гиперкалиемия, анемия, коагулопатия, пере-
грузка жидкостью, перикардит, тошнота и рвота, желудочно-
кишечное кровотечение, энцефалопатия, судороги, инфекция
мочевых путей, сепсис, инфицирование венозных катетеров,
пневмония.
СПИСОК ЛИТЕРАТУРЫ
Малышев В.Д. Интенсивная терапия водно-электролитных наруше-
ний. — М.: Медицина, 1985. — 157 с.
Малышев В.Д., Андрюхин ИМ., Копылов П.М., Сиротинская А.Ю. Ги-
пофосфатемия: этиология, патогенез, клинические проявления и
лечение (обзор) / Анест. и реаниматол. — 1995. — № 5. — С. 44—
51.
Марини Дж.дж., Уиллер А.П. Медицина критических состояний: Пер.
с англ. — М.: Медицина, 2002. — 977 с.
Марино П. Интенсивная терапия: Пер. с англ. — М.: ГЭОТАР Меди-
цина, 1998. - С. 415-424; 639.
Рябов Г.А. Острый нефротический синдром (острая почечная недоста-
точность) / В кн.: Синдромы критических состояний. — М.: Ме-
. дицина, 1994. — С. 305—324.
Хартиг В. Современная инфузионная терапия и парентеральное пи-
тание: Пер. с англ. — М.: Медицина, 1982. — 231 с.
Энциклопедия клинических лабораторных тестов: Пер. с англ. // Под
ред. проф. Норберга У. Тица. — М.: Лабинформ, 1997. — 960 с.
Arieff A., Ayus J.C. Pathogenesis of hyponatremic encephalopathy — cur-
rent concepts. / Chest. — 1993. — N 103 (2). — P. 607—610.
Bilezikian J.P. Management of hypercalcemia / J. clin. Endocr. Metab. —
1993. - N 77 (6). - P. 1445-1449.
Marini J.J., Wheller A.P. Fluid and Electrolyte disorders. Critical Care
Medicine, Second Edition, 1997. — P. 223—240.
Часть III. НЕДОСТАТОЧНОСТЬ
КРОВООБРАЩЕНИЯ
Водный баланс организма, сохранение постоянной темпе-
ратуры тела, доставка кислорода тканям, освобождение клеток
от шлаков достигаются постоянной циркуляцией крови по
сосудам. Кровь приносит тканям кислород, ионы, витамины,
питательные и биологически активные вещества. Благодаря
крови сохраняется постоянство физических и химических
свойств жидкостей организма.
Общее количество жидкости в организме человека достаточ-
но велико. У здорового мужчины с массой тела 70 кг, напри-
мер, оно составляет 42 л. Этот громадный резервуар воды
может существенно изменяться как в сторону увеличения при
застойной сердечной недостаточности и депонировании жид-
кости в третьем водном пространстве, так и в сторону умень-
шения при потерях жидкости и крови.
Внутрисосудистая жидкость, составляющая лишь '/ю обще-
го объема жидкости, тем не менее играет основную роль в
обеспечении динамического постоянства внутренней среды ор-
ганизма. Изменения объема внутрисосудистой жидкости —
плазмы, воды плазмы и эритроцитов — приводят к нарушени-
ям деятельности сердечно-сосудистой системы. Недостаточ-
ность кровообращения, вызванная любой причиной, в том
числе нарушением насосной функции сердца и сосудов, всегда
сопровождается теми или иными расстройствами баланса воды
и электролитов.
Недостаточность кровообращения и шок можно определить
как несоответствие перфузии метаболическим потребностям
тканей. У больного, находящегося в критическом состоянии,
физиологические критерии СВ, доставки и потребления кис-
лорода, АД и жидкостных объемов часто неадекватны для
обеспечения жизненных систем организма. Поэтому главной
целью устранения нарушений кровообращения должно быть
обеспечение перфузии жизненно важных органов и гомеоста-
тических параметров организма. Это может быть достигну-
то путем своевременной диагностики механизма нарушения,
соответствующей медикаментозной или инфузионной тера-
пии.
134
Глава 15
ИНВАЗИВНЫЙ МОНИТОРИНГ
И ПАРАМЕТРЫ ЦЕНТРАЛЬНОЙ
ГЕМОДИНАМИКИ
Метод катетеризации легочной артерии Свана—Ганца (Svan-
Ganz) признан “золотым” стандартом исследования централь-
ной гемодинамики (ЦГД). Суть его сводится к продвижению
катетера специальной конструкции через полую вену, правое
предсердие и правый желудочек в одну из центральных ветвей
легочного ствола. Катетеризация легочной артерии показана в
критических ситуациях (шок, гипотензия, отек легких, застойная
сердечная недостаточность, респираторный дистресс-синдром и
пр.), когда данные инвазивных исследований необходимы для
выявления механизма критического состояния и выбора наибо-
лее эффективного и рационального метода лечения: продолжить
введение жидкостей, перейти к инотропной поддержке, ввести
диуретики или воспользоваться вазодилататорами.
В табл. 15.1 представлены нормальные значения величин
давления в камерах сердца и легочной артерии и их физиоло-
гические диапазоны.
Таблица 15.1. Нормальные показатели давления в малом круге кро-
вообращения, измеренного прямым методом
Отдел Давление Интервал нормы, мм рт.ст.
Правое предсердие Правый желудочек Легочная артерия Левое предсердие Левый желудочек Систолическое Диастолическое Систолическое Диастолическое Конечно-диастолическое Систолическое Диастолическое Среднее Заклинивания Систолическое Диастолическое Систолическое Диастолическое Конечно-диастолическое 2—6 0-2 15-25 0-7 0-2 15-25 8-15 10-20 5-12 7-17 0-2 100-140 0-2 2-12
Параметры центральной гемодинамики
Измеряемые параметры:
♦ сердечный выброс (СВ) измеряют термодилюционным ме-
тодом с помощью термистора, который находится рядом
135
с дистальным концом катетера. Инертный раствор в
объеме 5—10 мл более низкой температуры, чем кровь,
вводят болюсно через проксимальный конец катетера в
полость правого предсердия. СВ определяют по скорости
изменения температуры крови в легочной артерии. В то
же время абсолютная величина СВ не может служить
точным критерием для оценки гипо- или гиперкинети-
ческого состояния гемодинамики;
♦ центральное венозное давление (ЦВД) — давление в пра-
вом предсердии, измеренное с помощью катетера. Дав-
ление в правом предсердии в норме соответствует конеч-
ному диастолическому давлению (КДО) в правом желу-
дочке. В положении лежа на спине среднее ЦВД фак-
тически идентично среднему давлению в правом пред-
сердии, отражающему преднагрузку правого желудочка.
Сравнение ЦВД и давления заклинивания полезно при
диагностике инфаркта правого желудочка и легочного
сердца (cor pulmonale). При отсутствии сердечно-легоч-
ных заболеваний ЦВД служит хорошим индикатором
степени сосудистого заполнения при гиповолемии. ЦВД
отражает изменения внутриплеврального и перикарди-
ального давления, используется для расчета системного
сосудистого сопротивления;
♦ давление заклинивания в легочных капиллярах (ДЗЛК) —
давление в дистальной ветви легочной артерии, измеряе-
мое при раздутом баллончике. В норме это давление
соответствует давлению в левом предсердии или КДД в
левом желудочке. КДД в левом желудочке (ДЗЛК) явля-
ется надежным критерием преднагрузки левого желудоч-
ка, но только в тех случаях, когда растяжимость левого
желудочка нормальна. В большинстве случаев значение
ДЗЛК соответствует КДД левого желудочка (КДДЛЖ).
Однако этого может не быть при недостаточности аор-
тального клапана, при дыхательной недостаточности у
больных с легочной патологией, ригидности стенки ле-
вого желудочка. ДЗЛК используют в качестве показателя
гидростатического давления в легочных капиллярах, что
позволяет оценить возможность развития гидростатичес-
кого отека легких.
Производные параметры. Сердечный индекс — отношение
показателей СВ к площади поверхности тела. Его определяют
путем деления показателя СВ на величину поверхности тела:
СИ [л/(мин м2] — СВ / площадь поверхности тела.
СИ — более точный показатель насосной функции сердца, чем
СВ, поскольку он сопоставляется с величиной поверхности и
массы тела.
136
Ударный объем — количество крови, выбрасываемое серд-
цем за одну систолу.
Ударный индекс (УИ) — значение объема крови, выбрасы-
ваемой во время каждой систолы, делят на величину площади
поверхности тела.
Работа левого желудочка (РЛЖ) — механическая работа, вы-
полняемая сердцем за 1 мин. Индексы ударной работы левого
и правого желудочков характеризуют работу каждого желудочка
при выбросе крови в аорту и легочную артерию за 1 сокра-
щение.
Индекс общего периферического сопротивления сосудов (ИОПСС)
характеризует сопротивление сосудов большого круга кровооб-
ращения выбрасываемому сердцем потому крови:
ИОПСС [дин е / (см5м2)] = [(САД - ЦВД) / СИ] х 80.
С помощью коэффициента 80 показатели объема и давления
переводят в дин с/см5.
Термин “общее периферическое сопротивление сосудов”
(ОПСС) обозначает суммарное сопротивление артериол боль-
шого круга кровообращения. ОПСС — важный регулятор гра-
диента давления между артериальной и венозной системой.
Возрастание этого показателя приводит к подъему, а снижение
его — к уменьшению среднего АД (САД). Показатель зависит
от скорости потока крови, т.е. СВ и сопротивления сосудов.
Данную зависимость можно выразить следующей формулой:
САД = СВ- ОПСС. Этот важный регуляторный механизм может
быть нарушен как в сторону преобладания вазоконстрикции,
так и в сторону преимущественной вазодилатации. Увеличение
ОПСС происходит всегда при снижении ОЦК, острой крово-
и плазмопотере, травматическом шоке, повышении уровня ка-
техоламинов в крови. Такая физиологическая реакция может
сопровождаться выраженной централизацией кровообращения,
вплоть до полного прекращения кровотока в коже, мышцах,
ренальной и чревной областях. При длительной вазоконстрик-
ции создаются условия для анаэробного обмена в ишемизиро-
ванных тканях. При значительном повышении ОПСС возрас-
тает постнагрузка, что создает неблагоприятные условия для
работы сердца. При увеличении ОПСС в 3 раза СВ может
уменьшиться наполовину при тех же значениях давления в
правом предсердии.
Многие состояния (анафилактический шок, сепсис, цирроз
печени) приводят к снижению ОПСС, что сопровождается
падением АД. Изменение тонуса артериальных сосудов в отде-
лах может быть различным: в одних областях возможна выра-
женная вазоконстрикция, в других — вазодилатация. Тем не
менее ОПСС имеет большое значение для дифференциальной
Диагностики вида гемодинамических нарушений.
137
Индекс сопротивления легочных сосудов (ИСЛС) характери-
зует сопротивление сосудов малого круга кровообращения (от
легочной артерии до левого предсердия) и определяется как
отношение разницы давления в легочной артерии (ДЛА) и
ДЗЛК к потому крови (СИ):
ИСЛС [дин с/(см5м2] = [(ДЛА - ДЗЛК) / СИ] х 80.
В функциональном смысле понятие ИСЛС соответствует
понятию постнагрузки правого сердца, но не исчерпывает его
полностью. В норме сопротивление легочных сосудов очень
мало, но значительно возрастает при поражениях легких, ле-
гочном сердце, повышении ДЗЛК. В легочном круге в отличие
от большого круга кровообращения фактически нет сосудов
сопротивления [Уэст Дж., 1988]. Среднее давление в легоч-
ном стволе около 15 мм рт.ст., в то время как в аорте — около
100 мм рт.ст., т.е. примерно в 6—7 раз выше. Функция правого
сердца состоит в обеспечении эффективного газообмена в лег-
ких.
Среднее артериальное давление (САД, АДср) — это усреднен-
ное значение всех колебаний кровяного давления в маги-
стральной (например, плечевой) артерии на протяжении сис-
толы и диастолы сердца:
Аналогичным образом рассчитывают среднее давление в
легочной артерии, используя для этого показатели систоличес-
кого и диастолического давления в легочной артерии.
Доставка кислорода (DO2) определяет количество кислоро-
да, доставляемого к капиллярам за 1 мин. Рассчитывается
путем умножения величины СИ на содержание кислорода в
артериальной крови (саОг).
Потребление кислорода (VO^ является заключительным эта-
пом транспорта кислорода. Рассчитывается как произведение
СИ на артериовенозную разницу по кислороду.
Коэффициент утилизации кислорода (КУО2) определяют
как отношение потребления кислорода к показателю его до-
ставки.
Преднагрузка применительно к миокарду определяется как
сила, растягивающая сердечную мышцу перед ее сокращением.
В соответствии с законом Франка—Старлинга сила сердечного
сокращения зависит от длины мышечных волокон в конце
диастолы. При повышении давления наполнения (например,
при проведении пробы с нагрузкой объемом) увеличивается
объем выброса, что является важным механизмом адаптации в
ответ на изменения венозного возврата. Для интактного желу-
дочка преднагрузкой по сути становится конечный диастоли-
ческий объем (КДО), который определяется растяжимостью
138
утенок и давлением в полости желудочка — трансмуральным
давлением. Последнее представляет собой разницу между внут-
риполостным и юкстакардиальным (внекардиальным) давлени-
ем. Поскольку КДО трудно определить у постели больного,
обычно пользуются такими показателями, как конечное диа-
столическое давление левого или правого желудочка. Если
растяжимость стенок желудочков нормальная и сократительная
способность миокарда не изменена, то проба с объемом будет
сопровождаться улучшением гемодинамических показателей.
При нормальной растяжимости левого желудочка ДЗЛК будет
равно КДДЛЖ. У больных, находящихся в ОИТ, растяжимость
левого желудочка, как правило, снижена. Это особенно харак-
терно для ИБС, действия блокаторов кальциевых каналов,
влияния положительного давления во время ИВЛ. Таким об-
разом, ДЗЛК определяет давление в левом предсердии, но не
всегда является показателем преднагрузки на левый желудочек
[Марино П., 1998].
В правом желудочке по сравнению с левым в норме связь
между трансмуральным давлением и внутрижелудочковым объ-
емом крови относительно более выражена. При малой растя-
жимости желудочка, как и при повышении внутригрудного
давления, требуется большее давление внутри камеры сердца
для достижения определенного конечно-диастолического объе-
ма и степени растяжения мышечных волокон, предшествую-
щих сокращению. Снижение эластичности стенок желудочка
может быть следствием поражения миокарда, ограничения со
стороны перикарда или сдавления сердца извне. В условиях
сердечной недостаточности для достижения средних значений
СВ требуется большее давление наполнения. В положении боль-
ного лежа на спине резерв преднагрузки снижается. В этом
случае дальнейшее увеличение СВ в основном достигается
увеличением ЧСС и(или) фракции УО. Наибольшее значение
механизм Франка—Старлинга приобретает при гиповолемии и в
вертикальном положении больного [Marini J.J., Wheeler А.Р.,
1997].
Постнагрузку определяют как силу, препятствующую или
оказывающую сопротивление сокращению желудочков и вы-
бросу крови. Она эквивалентна напряжению, возникающему в
стенке желудочка во время систолы. Это трансмуральное на-
пряжение стенки желудочка зависит от систолического АД,
радиуса камеры (желудочка), импеданса аорты и его составля-
ющих, растяжимости и сопротивления артерий. Постнагрузка
включает преднагрузку и давление в плевральной полости.
Нагрузочные характеристики применительно к сердцу описы-
вают в единицах давления и объема крови.
Умеренное увеличение постнагрузки сопровождается по-
вышением сократительной способности миокарда, преднагруз-
ки или ЧСС. У здорового человека при этом СВ изменяется
139
мало, однако при истощении резервов преднагрузки и увели-
чении постнагрузки он может значительно уменьшиться. Пра-
вый желудочек по сравнению с левым в норме оказывается
более чувствительным к изменениям постнагрузки.
Дилатированные камеры сердца как правых, так и левых
отделов при декомпенсации чрезвычайно чувствительны к изме-
нениям постнагрузки. Кардиомегалия, отек легких и митральная
регургитация — клинические симптомы, указывающие на необхо-
димость медикаментозного снижения постнагрузки.
В такой ситуации большое значение имеет определение
ОПСС и сопротивления легочных сосудов (СЛС). Возросшее
сосудистое сопротивление в этом случае само по себе оказы-
вает отрицательное воздействие на СВ. Увеличение СЛС спо-
собствует прогрессированию сердечной недостаточности.
Размер камер сердца также влияет на постнагрузку. В дила-
тированном сердце для создания необходимого внутрипо-
лостного давления требуется большее растяжение волокон во
время систолы. Диуретики или селективные венодилататоры
(нитроглицерин) способны снизить как пост-, так и предна-
грузку.
Помимо влияния сосудистой сети, важным показателем
реологии, оказывающим влияние на постнагрузку, является
вязкость крови. Вязкость крови возрастает при увеличении
гематокрита. Эта зависимость имеет нелинейный характер.
При увеличении гематокрита эритроциты медленнее продвига-
ются по капиллярам, и эффективный транспорт кислорода,
значение которого зависит от ОЦК и сосудистой емкости,
может достигать максимальных значений. Однако при возрас-
тании постнагрузки СВ может снизиться, в результате чего
уменьшится и транспорт кислорода. Ткани обладают различ-
ной толерантностью к изменениям гематокрита и поступления
кислорода [Marini J.J., Wheeler А.Р., 1997].
Объем циркулирующей крови (ОЦК) — динамическая вели-
чина, постоянно изменяющаяся в широких пределах. В состо-
янии покоя не вся кровь участвует в циркуляции, а лишь
некоторый ее объем, совершающий полный кругооборот за
относительно короткий промежуток времени, необходимый
для поддержания кровообращения. В практике интенсивной
терапии ОЦК — важнейший критерий состояния кровообра-
щения. При дефиците ОЦК лечение начинают с немедленного
восполнения сосудистого объема, а не с медикаментозной те-
рапии возникающей при этом недостаточности кровообраще-
ния. От плазматического объема и объема крови зависит ве-
нозный приток к сердцу, снижение которого сопровождается
уменьшением наполнения сердечных камер и, следовательно,
УО. В табл. 15.2 приведены средние физиологические нормы
ОЦК в зависимости от пола, возраста и конституции человека
[Тарроу А.Б., Эриксон Дж.К., 1977].
140
Таблица 15.2. Средние значения ОЦК в норме
Субъект ОЦК, мл/кг массы тела
Двухлетний ребенок 75
Взрослый мужчина 70
Взрослая женщина 65
Тучный мужчина 65-69
Тучная женщина 55-59
Атлетически сложенный мужчина 75
Пожилой мужчина 65
Пожилая женщина 60
В норме 65—70 % крови содержится в венах, 15—20 % — в
артериях и 5—7 % — в капиллярах.
Параметры центральной гемодинамики. Основными факто-
рами, характеризующими кровообращение, являются СВ,
ДЗЛК и ОПСС (рис. 15.1). Имея эти показатели, можно опре-
делить гемодинамический профиль и составить алгоритм тера-
певтических мероприятий. В табл. 15.3 представлены основные
показатели ЦГД.
ЦВД,
Капилляры
Рис. 15.1. Система кровообращения.
141
Таблица 15.3. Основные показатели кровообращения
Обозначения Характеристика Интервал нормы
СВ Сердечный выброс 5—7 л/мин
СИ Сердечный индекс 2,5—4,0 л/(минм2)
УО Ударный объем 70—80 мл
ЧСС Частота сердечных сокращений 60—80 уд/мин
РЛЖ Работа левого желудочка 6—7 кгм/мин
ОЦК Объем циркулирующей крови 65—70 мл/кг
ДЗЛК, ДЗЛА Давление заклинивания легоч- ных капилляров (легочной арте- рии) 5—12 мм рт.ст.
САД, АДср Среднее артериальное давление 90—95 мм рт.ст.
ЦВД Центральное венозное давление 6—12 см водн. ст.
ИОПСС Индекс общего перифериче- ского сопротивления сосудов 1200-2500 дин е/ (см5м2)
ислс Индекс сопротивления легочных сосудов 100 дин с/(см5 м2)
Глава 16
НЕИНВАЗИВНЫЙ МОНИТОРИНГ
ЦЕНТРАЛЬНОЙ ГЕМОДИНАМИКИ
Среди современных неинвазивных методов мониторирова-
ния центральной гемодинамики ведущее место отводится им-
педансометрическому контролю. Биоимпедансный способ
оценки параметров ЦГД хорошо известен в практической ме-
дицине. Основой метода явилась тетраполярная реография по
W. Kubicek.
Современные реографические анализаторы — это компью-
теризированные комплексы, одновременно регистрирующие,
размечающие и обрабатывающие сигналы ЭКГ, измерения АД
и реографических каналов, мониторирующих параметры ЦГД.
В режиме реального времени могут быть получены следую-
щие параметры ЦГД:
♦ показатели состояния насосной функции сердца — УО.
УИ, СВ, СИ, ЧСС, индекс механической работы левого
желудочка (ИМРЛЖ), индекс ударной работы левого же-
лудочка (ИУРЛЖ);
♦ состояние сосудистого русла — общее периферическое
сосудистое сопротивление (ОПСС) и индекс ОПСС
(ИОПСС);
♦ давление в стратегически важных точках системы крово-
обращения, в том числе давление наполнения левого
желудочка (ДНЛЖ);
142
4 базовый импеданс грудной клетки, центральный объем
кровообращения;
♦ визуальная траектория динамики состояния левого желу-
дочка в виде кривой Франка—Старлинга и др.
Погрешность абсолютных значений СВ с помощью биоим-
педансометрического метода — не более 15 %. Ошибки данно-
го метода главным образом связаны с методическими наруше-
ниями проводимых исследований. Однако не следует рассмат-
ривать фактор точности в качестве доминирующего. В большей
степени важна динамика исследуемых показателей [Мишу-
нин Ю.В., 1996; Лебединский К.М., 2000].
Методика тетраполярной реоплетизмографии — надежный
метод динамического контроля за параметрами ЦГД и может
использоваться как гемодинамический мониторинг на этапах
интенсивной терапии.
Гемодинамический мониторинг инфузионной терапии. Прове-
дение любой инфузионной терапии сопряжено с определенной
гидродинамической (водной) нагрузкой на сердечно-сосудис-
тую систему, оценить которую при отсутствии специального
оснащения не всегда просто. Импедансометрический контроль
позволяет своевременно корригировать инфузионную терапию
и предотвращать перегрузку сердца и развитие отека легких
[Федоров С.В., 2000].
Мониторирование инотропной поддержки. Инотропная под-
держка — необходимая часть современной интенсивной тера-
пии тяжелых и критических состояний в тех случаях, когда
миокард без применения инотропных препаратов не способен
на должном уровне обеспечить СВ и адекватное перфузион-
ное давление. Как правило, выбор лекарственного средства,
его начальной и поддерживающей дозы осуществляется на
основе клинической картины. При невозможности осущест-
вления инвазивного контроля ЦГД на фоне инфузий пре-
паратов, например допамина или добутамина, неинвазивный
импедансный метод контроля гемодинамики позволяет свое-
временно и наглядно оценить эффективность проводимой тера-
пии и оптимизировать скорость введения инотропных средств.
Регулировать состояние пред- и постнагрузки возможно пу-
тем применения вазоактивных средств, измеряя давление
наполнения левого желудочка (ДНЛЖ), а также ОПСС и
САД-
Гемогидродинамический мониторинг. При проведении ин-
тенсивной терапии у больных, находящихся в критическом
состоянии в ОИТ, обязательны неинвазивный или инвазивный
гемодинамический мониторинг. Перспективным, но пока еще
сложным методом является одномоментное определение всех
143
водных пространств организма. Гомеостатические параметры:
объем жидкостей — общей, внеклеточной, внутриклеточной, ин-
терстициальной, плазматической; ОЦК, осмолярность, элек-
тролиты, КОД плазмы, диурез. Одновременное исследование
параметров ЦГД (комплексом “Реодин-Медасс”) и водных
секторов (комплексом “АВС — 01 — Медасс”) позволяет вы-
работать наиболее рациональную тактику инфузионной те-
рапии и при необходимости осуществлять инотропную под-
держку.
Структурный подход к проблеме шока — определение меха-
низма гемодинамических нарушений. Для определения характе-
ра гемодинамического нарушения или гемодинамического
“профиля” достаточно воспользоваться тремя основными ге-
модинамическими показателями: ДЗЛК, СВ и ОПСС [Мари-
но П., 1998]. В качестве примера представим изменения этих
показателей при гиповолемическом, кардиогенном и вазоген-
ном шоке.
При гиповолемическом шоке снижается давление наполнения
желудочков сердца (низкое ДЗЛК), что приводит к уменьше-
цвд
Рис. 16.1. Гиповолемический шок.
Прямоугольником обозначено первичное звено нарушений. Объяснение в
тексте.
144
Рис. 16.2. Кардиогенный шок вследствие уменьшения производитель-
ности сердца (обозначено прямоугольником).
нию СВ и компенсаторному увеличению ОПСС (рис. 16.1).
Таким образом, гемодинамический профиль гиповолемическо-
го шока будет определен следующим образом: низкое ДЗЛК,
сниженный СВ, высокое ОПСС. Естественно, что основу ле-
чения гиповолемического шока составляет инфузионная тера-
пия.
При кардиогенном шоке главная причина нарушения заклю-
чается в первичном снижении насосной функции сердца,
критерием чего является возрастание ДЗЛК (рис. 16.2). Гемо-
динамический профиль кардиогенного шока: высокое ДЗЛК,
низкий СВ, высокое ОПСС. Причиной могут быть заболева-
ния самого сердца, ведущие к снижению сократительной спо-
собности миокарда, увеличению давления в системе легоч-
Ю-1069
145
Рис. 16.3. Анафилактический шок. Объяснение в тексте.
ной артерии или возникновению фатальных аритмий. Для ле-
чения применяют в основном различные медикаментозные
средства.
При вазогенном шоке основу патологии составляет вазопле-
гия, ведущая к снижению ОПСС (рис. 16.3). В этой связи
венозный возврат к сердцу будет снижен, наполнение сердеч-
ных камер уменьшится, что приведет к снижению ДЗЛК. СВ
обычно повышен, но его величина может варьировать. Гемо-
динамический профиль вазогенного шока: низкое ДЗЛК, вы-
сокий СВ, низкое ОПСС. Лечебные мероприятия направлены
на восстановление сосудистого тонуса, обеспечения должной
пред- и постнагрузки, применение кортикостероидов, инфузи-
онной терапии.
При ряде состояний указанные основные профили наруше-
ний могут варьировать, сочетаться или переходить друг в друга.
Например, при септическом шоке одновременно могут быть
снижены ДЗЛК и ОПСС при значительном увеличении СВ
(рис. 16.4).
146
Рис. 16.4. Септический шок. Первичное нарушение — изменения ка-
пиллярного кровотока (обозначено прямоугольником).
Глава 17 I КРИТЕРИИ ТРАНСПОРТА КИСЛОРОДА
Транспорт кислорода, т.е. доставка кислорода и потребле-
ние его тканями, — важнейший показатель систем жизне-
обеспечения. У больных в ОРИТ компенсаторные механизмы
транспорта кислорода нарушены. Это относится как к снижен-
ным резервам дыхания (гиповентиляция, снижение paOj,
saO2), так и циркуляторному компоненту транспорта кислоро-
да, несоответствующему данному состоянию СВ в результате
основного или сопутствующего заболевания, особенностей из-
мененного метаболизма. Нарушения внутриклеточных процес-
сов и поражение митохондрий характеризуются неспособнос-
тью тканей усваивать кислород.
10*
147
Факторы, нарушающие транспорт кислорода:
♦ низкое содержание кислорода в артериальной крови;
♦ низкий или несоответствующий данному состоянию СВ;
♦ анемия;
♦ гиповолемия, нарушения водно-электролитного баланса;
♦ расстройства сосудистой регуляции регионарного и об-
щего кровотока (вазоспазм, вазодилатация, системное
поражение эндотелия с интерстициальным отеком);
♦ алкалоз;
♦ уменьшение рСО2 крови;
♦ возрастание сродства гемоглобина к кислороду;
♦ ДВС-синдром;
♦ периферические артериовенозные шунты;
♦ сдвиг кривой диссоциации оксигемоглобина (НЬО2);
♦ патология внутриклеточных процессов (поражение мито-
хондрий).
Гипоксическая гипоксия характеризуется снижением всех
показателей кислородного уровня артериальной крови: раО2,
saO2 и саО2.
Алгоритм при гипоксемии:
♦ увеличить FiO2 до 0,5—1,0 в зависимости от степени
гипоксемии;
♦ выявить причину (гиповентиляция, обструкция дыха-
тельных путей, однолегочная вентиляция, смещение эн-
дотрахеальной трубки, дыхание аноксической смесью);
♦ восстановить проходимость дыхательных путей, увели-
чить ДО и ЧД, провести аускультацию легких, аспири-
ровать содержимое бронхов, измерить давление в дыха-
тельных путях;
♦ если раО2 остается сниженным, исключить возможность
бронхиолоспазма, применить бронхолитики или корти-
костероиды;
♦ если раО2 снижено, исключить поражение самих легких
(аспирация, пневмония, ателектаз, пневмоторакс), кото-
рое сопровождается внутрилегочным шунтированием кро-
ви. Если выбранный режим FiO2 равен или превышает
0,6, следует применить вспомогательную или искусствен-
ную вентиляцию легких в режиме ПДКВ;
♦ если раО2 равно 80 или 90 мм рт.ст. при FiO2 = 0,5, не
следует увеличивать концентрацию кислорода во вдыха-
емом газе. Вынужденное увеличение FiO2 до 0,6 и выше
свидетельствует о критическом состоянии пациента;
♦ приемлемый уровень FiO2 равен 0,5 при раО2
около 90 мм рт.ст.;
♦ снижение раО2 ниже 60 мм рт.ст. и соответственно saO2
ниже 90 % свидетельствует о неустраненной гипоксемии.
148
Циркуляторная гипоксия возникает вследствие снижения СВ
или сосудистой недостаточности, что ведет к уменьшению до-
ставки кислорода к тканям. При этом кислородные параметры
артериальной крови не изменены, однако pvO2 значительно
снижено. Следует учитывать возможность региональной гипок-
сии при отсутствии или резком снижении циркуляции крови
в отдельных частях тела. Термином “ишемия” обозначается
любое снижение кровотока, достаточное для появления кли-
нических симптомов. У больных, пребывающих в критическом
состоянии, клинические симптомы ишемии могут указывать
на нарушение функции различных органов: почек, кишечника,
печени, легких, сердца и головного мозга.
Недостаточность вазомоторного тонуса и/или регуляции рас-
пределения может вызвать синдром шока даже в тех случаях,
когда СИ находится в пределах нормы или выше нормы.
К этому состоянию наиболее часто приводят сепсис, ана-
филактическая реакция, общая и спинномозговая анестезия,
применение препаратов, вызывающих генерализованный спазм
сосудов или вазоплегию. К циркуляторной недостаточности
могут приводить выраженный метаболический ацидоз и меди-
аторы критических состояний, вызывающие угнетение миокар-
да, резистентное к катехоламинам. В последующем может уве-
личиться постнагрузка правого желудочка и происходит рас-
ширение прекапиллярных артериол. Последнее сопровожда-
ется массивной транссудацией жидкости во внеклеточное
пространство и повреждением клеточных структур. Не следует
упускать из виду возможность развития надпочечниковой не-
достаточности и микседемы.
Алгоритм при циркуляторной гипоксии:
♦ установите основную причину циркуляторных нарушений
(гиповолемия, вазоплегия, сердечная недостаточность);
♦ выраженная гиповолемия характеризуется снижением
ЦВД, ДНЛЖ, ДЗЛК, ударного, а затем и минутного
объема кровообращения, САД;
♦ проведите пробу с объемом: внутривенно быстро введите
200—250 мл коллоидного раствора и измерьте гемодина-
мические показатели;
♦ если показатели гемодинамики улучшились, это говорит
в пользу имеющейся гиповолемии и дальнейшая терапия
должна быть направлена на ее устранение;
♦ критерии нормоволемии: стабильное САД (около 100 мм
рт.ст.), ЧСС в пределах 60—100 уд/мин, ЦВД 10—12 см
вод.ст., ДЗЛК в пределах 6—12 мм рт.ст., ДНЛЖ 10—
12 мм рт.ст., СИ 3—4 л/(мин м2), улучшение диуреза;
♦ устраните анемическую гипоксию. Ее отличительной
чертой является снижение содержания кислорода в арте-
149
риальной крови при нормальном раО2 и saO2. Удовле-
творительный уровень транспорта кислорода достигается
при концентрации гемоглобина крови 100 г/л, гемато-
крите 0,30 и нормальном СВ. Однако транспорт кисло-
рода зависит от индивидуальных компенсаторных воз-
можностей организма. Часто гематокрит в пределах 0,25
обеспечивает достаточную оксигенацию тканей. С другой
стороны, ряд состояний (сепсис, гиперметаболизм, шок)
для адекватной доставки кислорода к тканям требует
создания гипердинамического режима кровообращения,
при котором нормативные показатели транспорта кисло-
рода будут недостаточными;
♦ рассчитайте Г)О2 и во возможности определите VO2 и
КУО2;
♦ при циркуляторных нарушениях, связанных с вазопле-
гией или первичным снижением СВ, примените медика-
ментозную терапию.
Метаболические причины нарушений транспорта кислорода.
Неспособность тканей усваивать кислород относится к поня-
тию тканевой гипоксии. Этот вид гипоксии у больных, нахо-
дящихся в критическом состоянии, изучен недостаточно. Оче-
видно, он может возникать при поражениях митохондрий,
отравлении цианидами, шоке и тяжелых метаболических рас-
стройствах. К часто встречающимся факторам, которые могут
вести к тканевой гипоксии, относятся:
♦ алкалоз дыхательный и алкалоз метаболический. Первый
возникает в результате гипервентиляции (при самостоя-
тельном дыхании и ИВЛ), второй часто связан с приме-
нением раствора натрия бикарбоната. Это ведет к по-
вышению pH крови, сдвигу кривой диссоциации оксиге-
моглобина влево и повышает сродство гемоглобина к
кислороду;
♦ гипероксигенация — одна из причин образования кисло-
родных радикалов;
♦ “физиологическая зависимость потребления кислорода”
может быть обусловлена имеющейся гиповолемией и низ-
ким СВ. При ликвидации гиповолемии и сердечной не-
достаточности потребление кислорода тканями возраста-
ет;
♦ повышение уровня 2,3-ДФГ в эритроцитах уменьшает
сродство гемоглобина к кислороду, а понижение кон-
центрации 2,3-ДФГ приводит к увеличению этого срод-
ства;
♦ некоторые синдромы сопровождаются выраженными изме-
нениями уровня 2,3-ДФГ. При хронической гипоксии со-
держание 2,3-ДФГ в эритроцитах возрастает и соответст-
венно уменьшается сродство гемоглобина к кислороду;
150
♦ трансминерализация: выход калия, фосфатов из клеток и
перемещение в клетки натрия, хлора и воды — факторы
нарушенного клеточного метаболизма и гипоксии кле-
ток;
♦ системная воспалительная реакция.
Глава 18 I ОСТРАЯ СЕРДЕЧНАЯ НЕДОСТАТОЧНОСТЬ
Наиболее частые причины острой сердечной недостаточнос-
ти [Марино П., 1998]:
♦ суправентрикулярные аритмии;
♦ эмболия легочной артерии;
♦ полная атриовентрикулярная блокада;
♦ ишемия (инфаркт миокарда, желудочковые аритмии);
♦ тампонада сердца;
♦ острая митральная недостаточность;
♦ острая аортальная недостаточность;
♦ расслаивание аорты.
Самый ранний признак острой сердечной недостаточнос-
ти — повышение ДЗЛК. Затем снижается УО, но МОС (СВ)
поддерживается за счет увеличения ЧСС. При дальнейшем
прогрессировании желудочковой дисфункции тахикардия не
компенсирует уменьшение УО, а МОС начинает снижаться.
Для того чтобы отличить правожелудочковую недостаточность
от левожелудочковой, используют различные критерии. Для
правожелудочковой недостаточности характерно ЦВД выше
10 мм рт.ст. Последнее становится равным ДЗЛК или превы-
шает его. Применяется также инфузионный тест: внутривенное
введение жидкости при правожелудочковой недостаточности
ведет к повышению ЦВД и относительно незначительному
повышению ДЗЛК. Левожелудочковая недостаточность под-
тверждается увеличением ДЗЛК (выше 12 мм рт.ст.), которое
становится выше ЦВД.
Важно подчеркнуть, что сердечная недостаточность может
быть обусловлена снижением сократительной способности ми-
окарда в период систолы (систолическая сердечная недостаточ-
ность) или снижением растяжимости желудочка во время диа-
столы (диастолическая сердечная недостаточность). Эта форма
сердечной недостаточности часто наблюдается в отделениях
ИТ и может быть связана как с заболеванием сердца (гипер-
трофия левого желудочка, ИБС, выпот в полость перикарда),
так и с режимом ПДКВ при ИВЛ.
Левожелудочковая недостаточность может быть вызвана как
изменением систолической функции левых отделов сердца, так
151
и другими причинами, не относящимися непосредственно к
систолической функции, например диастолической дисфунк-
цией, перегрузкой объема, влиянием правого желудочка, нали-
чием выпота в перикарде.
Клинически застойная сердечная недостаточность характе-
ризуется слабостью, одышкой в покое или при незначительной
физической нагрузке, а инструментально подтверждается уве-
личением давления наполнения левого желудочка или ДЗЛК.
При этом адекватная перфузия не всегда свидетельствует о
нормальной систолической функции сердца, если она дости-
гается путем возросшей преднагрузки и застойных явлений в
легких. При прогрессировании застойных явлений может воз-
никнуть необходимость в проведении ИВЛ и инвазивного мо-
ниторинга. Эти мероприятия могут снизить потребность тка-
ней в кислороде, а также преднагразку левого желудочка за
счет увеличения внутригрудного и среднего плеврального дав-
ления. Наибольшее значение приобретают восстановление
нормального содержания кислорода в крови, коррекция по-
требности тканей в кислороде, pH крови, водного и электро-
литного баланса, оптимизация нагрузки на сердце. При гипо-
тензии оправдано применение инотропной терапии, а больным
с гипертензией и повышенным системным сосудистым сопро-
тивлением следует назначать вазодилататоры.
Механизмы нарушений циркуляции крови при застойной
сердечной недостаточности различны, но все они в конечном
итоге сопровождаются симптомами гипоперфузии органов, ве-
дущими к их дисфункции.
Диастолическая дисфункция представляет собой особую
форму сердечной недостаточности, обусловленной снижением
растяжимости желудоча во время диастолы. Обычно диастола
осуществляется пассивно, но в связи с утратой сердечной мыш-
цей способности к расслаблению в достаточной мере диастола
становится энергозависимой, активной. При этом на ранних
этапах у 30—40 % больных регистрируется нормальная систо-
лическая функция.
Возможные этиологические факторы диастолической дис-
функции [Gottdiener J., 1993]:
♦ гипертрофическая миопатия;
♦ ИБС;
♦ длительная артериальная гипертензия;
♦ выпот в полости перикарда;
♦ ИВЛ в режиме ПДКВ;
♦ перегрузка жидкостью.
Клиническая симптоматика: наличие застойных явлений в
легких при сохраненной систолической функции. Лучший ме-
тод диагностики — эхокардиография. Однако получение точ-
152
ной информации у больных, находящихся в критическом со-
стоянии, затруднено и практически невозможно.
Лечение: 1) строгий контроль инфузионной терапии (опас-
ность перегрузки); 2) изменение режимов ИВЛ — снижение
ПДКВ при допустимом saO2; 3) больным с гипертрофической
кардиомиопатией показаны блокаторы кальциевых каналов
(верапамил, дилтиазем, нифедипин). Инотропные препараты
улучшению диастолической функции не способствуют.
Правожелудочковая недостаточность. Инфаркт правого же-
лудочка и легочное сердце — две основные причины, вызываю-
щие дисфункцию правого желудочка.
Для инфаркта правого желудочка характерны системная ве-
нозная гипертензия, изменения ЭКГ (подъем сегмента ST,
волн Q над зоной правых отделов сердца — V4P) и измене-
ния соответствующих ферментов. По мнению J.J. Marini и
АР. Wheeler (1997), при инфаркте правого желудочка для под-
держания гемодинамики требуется достаточно большой объем
инфузионной терапии. Работу по “проталкиванию” крови как
в артерии большого круга (прямо), так и в легочные артерии
(непрямым методом за счет взаимодействия обоих желудочков)
выполняет левый желудочек. В то же время дилатация и на-
грузка жидкостью правого желудочка осложняют поступление
крови по обоим путям вследствие стеснения желудочков в
пределах сердечной сорочки, растяжения участвующих в со-
кращении циркуляторных мышечных волокон и смещения
межжелудочковой перегородки. В течение нескольких дней
формируются механизмы компенсации.
При первичной правожелудочковой недостаточности лечеб-
; ные мероприятия существенно не отличаются от таковых при
левожелудочковой недостаточности. Исключение составляет вто-
ричная правожелудочковая недостаточность, возникшая, на-
пример, при избыточной инфузии жидкости. Основными ори-
ентирами служат ДЗЛК и ЦВД. Использование неизвазивного
мониторинга гемодинамики также важно, поскольку позволяет
•в динамике оценивать такие показатели, как СВ, ОПСС и
’ДНЛЖ. При повышении ЦВД, давления заклинивания и ДНЛЖ
^необходимо уменьшить темп инфузионной терапии или пол-
ностью прекратить инфузии до нормализации ЦВД. В этих
случаях наиболее показан добутамин, доза которого определя-
ется тем эффектом, который он оказывает (от 5 до 15 мкг/
(кгмин).
При сниженном ЦВД и ДЗЛК инфузионная терапия может
оказать нормализующее влияние на гемодинамику. Добутамин
применяют при инфаркте миокарда и эмболии легочной арте-
рии. От использования вазодилататоров следует воздерживать-
ся, поскольку они снижают венозный приток к правому серд-
цу, что может привести к дальнейшему падению СВ. Если
Удается поддерживать СВ в течение нескольких дней, то про-
153
гноз для больных при отсутствии других сердечно-легочных
заболеваний, как правило, благоприятный. Исход зависит не
только от размеров инфаркта, но и от наличия или отсутствия
сопротивления легочных сосудов [Setaro J., Cabin Н., 1992].
Легочное сердце — патологическое состояние, являющееся
результатом паренхиматозных сосудистых заболеваний легких,
приводящее к уменьшению функционирующих легочных ка-
пилляров и легочной гипертензии. При этом развиваются ги-
пертрофия, дилатация или недостаточность правого желудочка.
В понятие “легочное сердце” не включаются вторичные изме-
нения правого желудочка при гипертензии легочных вен или
недостаточности левого желудочка.
К основным причинам легочной гипертензии относятся со-
кращение числа легочных капилляров, возникновение альвео-
лярной гипоксии и ацидоз. Во всех этих случаях возможно
значительное повышение давления в системе легочной арте-
рии. В норме правый желудочек не может обеспечить адекват-
ный выброс, если давление в легочной артерии более 35 мм
рт.ст. Постепенно включаются компенсаторные механизмы:
развивается гипертрофия стенок правого желудочка, что созда-
ет давление, сопоставимое с таковым в системной циркуляции.
Гладкие мышечные волокна легочных артерий также гипертро-
фируются, усиливая ответ на альвеолярную гипоксемию.
Острое легочное сердце развивается в течение короткого
периода времени, и компенсаторные реакции при этом могут
отсутствовать. Самая частая причина острого легочного серд-
ца — массивная тромбоэмболия легочной артерии (ТЭЛА). Об-
ширный инфаркт легкого также может быть причиной острого
легочного сердца.
Хроническое легочное сердце развивается при хронических
обструктивных заболеваниях легких любой этиологии (ХОЗЛ
и др.), вызывающих облитерацию легочных капилляров. Ос-
новные признаки — одышка и хроническая артериальная ги-
поксемия. Это заболевание всегда может перейти в фазу острой
декомпенсации.
Диагностика. Главными ориентирами правожелудочковой
недостаточности служат показатели ЦВД, давления в правом
предсердии (Рпп), в легочной артерии (Рла) и вычисление ле-
гочного сосудистого сопротивления. Они помогают отличить
правожелудочковую недостаточность от левожелудочковой.
Физикальные данные легочного сердца — гипоперфузия, ритм
галопа, громкий второй тон, пульсирующая гепатомегалия и
венозный застой в большом круге кровообращения. К сожале-
нию, многие исследования в ОРИТ не всегда возможны. Дан-
ные физикального исследования можно подтвердить, выявив
Рпп, Рла (СЛС) и определив СВ, ДЗЛК (ДНЛЖ), ОПСС, а
также показатель насыщения кислорода в смешанной венозной
крови.
154
Лечение острого легочного сердца. Ключевые направления
терапии: создание адекватного наполнения правого желудочка,
коррекция гипоксемии и ацидоза, установление нормального
сердечного ритма и лечение основного заболевания.
Глава 19 I КАРДИОГЕННЫЙ ОТЕК ЛЕГКИХ
Отек легких — патологическое увеличение внесосудистой
жидкости в легких. Основную роль при этом играет высокое
давление в легочных капиллярах из-за сердечного заболевания
или гипергидратации (избыточная инфузия, почечная недоста-
точность). Факторы, способствующие отеку легких: уменьше-
ние КОД плазмы, повышенная проницаемость легочных ка-
пилляров. Последнее характерно для некардиогенного отека
легких, вызванного развитием шокового легкого (респиратор-
ного дистресс-синдрома).
Кардиогенный отек легких возникает в результате значитель-
ного повышения давления в левом предсердии, легочных венах
и системе легочной артерии. Главный его признак — острая
левожелудочковая недостаточность, сопровождающаяся ростом
градиента давления в легочных сосудах и интерстициальном
пространстве и выходом части жидкости из сосудов в ткань
легкого. Кардиогенный отек легких можно рассматривать как
крайнее проявление застойной сердечной недостаточности.
Причины кардиогенного отека легких:
♦ инфаркт миокарда (слабость левого желудочка может
быть обусловлена не только острой, но и хронической
коронарной недостаточностью);
♦ заболевания мышцы сердца;
♦ аритмия, исходящая из левого желудочка, или вследствие
порока клапанов (приступ фибрилляции предсердий у
больных с тяжелым митральным или аортальным стено-
зом);
♦ повышенная нагрузка на сердце при общей гипоксии,
стрессе, анемии, артериальной гипертензии;
♦ острая аортальная или митральная регургитация;
♦ избыточное переливание жидкостей и крови (значитель-
ный положительный баланс жидкости во время общей
анестезии или интенсивной терапии), снижение лимфа-
тического дренажа легких;
♦ почечная недостаточность, неэффективность диуретичес-
кой терапии;
♦ лекарственные препараты, вызывающие задержку жид-
кости (НПВС, стероиды);
155
♦ применение инотропных средств, создающих нагрузку на
сердечную мышцу (например, при общей гипоксии,
стрессе, анемии, артериальной гипертензии);
♦ центрогенный (центральный, нейрогенный) отек легких
относится к формам отека легких, которые возникают у
больных с тяжелыми неврологическими нарушениями
(черепно-мозговая травма или эпилептический статус).
Одновременно с дисбалансом в уравнении Старлинга в
легочных капиллярах возникает повышение их проница-
емости (смешанный генез отека легких);
♦ эклампсия (выраженные нарушения симпатических
функций, гиперволемия, острая системная гипертензия);
♦ тромбоэмболия легочной артерии;
♦ высотный отек легких (“горная болезнь”) — синдром,
который может развиться вскоре после быстрого подъема
на высоту более 2700 м. Ингаляции высоких концентра-
ций кислорода или спуск на меньшую высоту устраняют
все признаки (кашель, одышка, боли в груди, тахикар-
дия) через 1—2 дня. В качестве дополнительного лечения
показан диуретик диакарб;
♦ отек легких иногда возникает после кардиоверсии.
Стадии отека легких:
I стадия — чрезмерное усиление нормального физиологи-
ческого выхода жидкости из легочных капилляров в интерсти-
циальное пространство;
II стадия — скорость перемещения жидкости и белков пре-
восходит максимальную скорость оттока лимфы, что вызывает
расширение интерстициального пространства. Именно в этой
стадии наступает резкое ухудшение общего состояния: усили-
вается одышка, появляются новые шумы и хрипы в легких;
III стадия — “затопление” альвеол жидкостью.
Клинические признаки. Застойные явления в легких:
♦ одышка — наиболее ранний симптом отека легких, в
поздней стадии — удушье;
♦ новые шумы и хрипы в легких, в поздней стадии —
влажные хрипы, клокочущее дыхание;
♦ иногда стридорозное дыхание (часто приводит к поста-
новке ложного диагноза бронхиальной астмы);
♦ кашель с прозрачной водянистой мокротой, иногда со
следами крови (в поздней стадии);
♦ тахикардия, возможна аритмия;
♦ АД чаще повышено, но может быть нормальным или
сниженным; во многих случаях раздутые шейные вены,
холодные конечности, потоотделение;
♦ снижение диуреза;
♦ возможны отеки на ногах, увеличение размеров печени.
156
Рентгенологические признаки:
♦ часто — изменения конфигурации сердца, кардиомега-
лия;
♦ увеличение размеров легочных сосудов, расплывчатость
их очертаний, появление линий Керли;
♦ наличие жидкости в плевральных полостях свидетельст-
вует не о легочной, а о системной венозной гипертензии.
Электрокардиография:
♦ аритмия, признаки инфаркта миокарда или другого за-
болевания сердца;
♦ исследование обычно свидетельствует о расширении ле-
вого предсердия и полой вены, ухудшении сократимости
миокарда или о диастолической дисфункции.
Лабораторные признаки:
♦ раО2 снижено;
♦ раСО2 в начальной стадии снижено, в поздней — по-
вышено;
♦ pH крови в поздней стадии снижен;
♦ уровень мочевины в крови у больных с почечной недо-
статочностью повышен;
♦ уровни натрия и калия в крови могут быть изменены.
Наиболее достоверные признаки кардиогенного отека легких:
♦ высокое ДЗЛК (выше 18—20 мм рт.ст., резко повышаю-
щееся при водной нагрузке);
♦ повышенное ЦВД — более 12 см вод.ст.
♦ снижение СВ.
Неотложные лечебные мероприятия.
I этап (АДсист. выше 100 мм рт.ст.):
1) оксигенотерапия через трансназальный катетер или маску
с FiO2 0,35-0,5;
2) внутривенно медленно — морфин 3—5 мг или диаморфин
2,5—5 мг;
3) внутривенно — фуросемид 40—80 мг;
4) нитраты — сублингвально (нитроглицерин 1 таблетка со-
держит 0,005 г, применяют 1—2 таблетки);
5) ЭКГ-мониторинг, устранение аритмии;
6) провести все необходимые исследования (лабораторные,
рентгенографию грудной клетки — см. выше);
7) если отек вызван избыточной инфузией — кровопускание
иглой с широким просветом;
8) необходимо исключить почечную недостаточность. Если
Концентрация мочевины в крови превышает 20 ммоль/л, обыч-
ные дозы фуросемида неэффективны;
157
9) необходимо исключить респираторный дистресс-син-
дром, лечение которого имеет существенные отличия от лече-
ния отека легких.
II этап:
1) если отек легких прогрессирует, раО2 ниже 60 мм рт.ст.,
следует увеличить FiO2 до 0,6; при необходимости произвести
интубацию трахеи и вспомогательную ИВЛ;
2) при АДСИСТ выше 100 мм рт.ст. — нитроглицерин внутри-
венно с начальной скоростью 0,3 мкгДкгмин) или динитрат
изосорбита по 2 мг/ч с увеличением на 2 мг/ч каждые 15—
30 мин до максимальной скорости 10 мг/ч, пока не восстано-
вится респираторная функция легких и АДСИСТ не снизится до
100 мм рт.ст. [Sprigings D., Chambers J., Jeffrey, 2000];
3) при АДСИСТ 90—100 мм рт.ст. вводят добутамин через
периферическую или центральную вену в дозе 5 мкгДкгмин),
постепенно увеличивая дозу (в среднем на 2,5 мкгДкгмин)
каждые 10 мин) до повышения АДСИСТ выше 100 мм. рт.ст.
или
4) при АДСИСТ ниже 80 мм рт.ст. следует быстро ликвиди-
ровать проявленйя шока. Ввести в центральную вену 0,5—1 мг
адреналина, разведенного в 10 мл изотонического раствора на-
трия хлорида, затем допамин (дофамин) в дозе 10 мкгДкгмин).
При отсутствии повышения АДСИСТ до 100 мм рт.ст. и выше
продолжать введение допамина, увеличивая дозу на 5 мкгДкгмин)
каждые 15 мин до тех пор, пока АДСИСТ не поднимется выше
100 мм рт.ст. Если при введении максимальной дозы 20 мкг/
(кг мин) АДСИСТ остается ниже 90 мм рт.ст., вместо допамина
показано капельное введение раствора норадреналина. Если
АДсист. продолжает оставаться ниже 90 мм рт.ст., это указывает
на снижение коронарного, мозгового и почечного кровотока.
Важно поддерживать АДСИСТ выше 90 мм рт.ст. При высоком
АД целесообразно добавить к инфузии допамина нитраты;
5) определите pH, рО2 и рСО2 артериальной крови. Если
раОэ<60 мм рт.ст., несмотря на дыхание смесью с содержанием
60 % кислорода, а раСО2 повышено, показана принудительная
вентиляция легких в режиме ПДКВ.
III этап:
1) при АДСИСТ выше 100 мм рт.ст. и недостаточной эффек-
тивности терапий в качестве дополнительного средства может
быть использован амринон — 0,75 мг/кг одномоментно внут-
ривенно, затем капельно по 5—15 мкгДкгмин) или эуфиллин —
по 3—5 мг/кг в течение 20 мин;
2) дигоксин — внутривенно по 1 мл 0,025 % раствора при
фибрилляции предсердий и наджелудочковой тахикардии;
3) если АДСИСТ ниже 90 мм рт.ст. и диурез отсутствует более
158
1 ч, нужно ввести мочевой катетер и определить почасовой
диурез. Последний отражает величину СВ и должен быть не
меньше 30 мл/ч, т.е. 0,5 мл/(кгч);
4) при установленном тяжелом метаболическом ацидозе,
рН<7,20 показано введение 40—50 ммоль (40—50 мл) 8,4 %
раствора бикарбоната натрия в течение 30 мин;
5) при отсутствии эффекта от проводимой терапии необхо-
дима консультация кардиохирурга для исключения клапанной
патологии или разрыва межжелудочковой перегородки, воз-
можно, требующей оперативного вмешательства. Устанавлива-
ют показания для введения катетера Свана—Ганца.
Глава 20
ТЕРАПИЯ НЕДОСТАТОЧНОСТИ
КРОВООБРАЩЕНИЯ
Три основных механизма развития недостаточности кровооб-
ращения: 1) гиповолемия; 2) недостаточность нагнетательной
функции сердца; 3) недостаточный сосудистый тонус.
При гиповолемии и дегидратации в первую очередь прово-
дят заместительную терапию — назначают коллоидные и(или)
кристаллоидные растворы. Цель этой терапии — восстановле-
ние объема и качественного состава всех жидкостных секторов
организма: внутрисосудистого, интерстициального и внутри-
клеточного. Благодаря этому обеспечиваются адекватный ве-
нозный приток к сердцу, заполнение сердечных камер и СВ,
достаточный для адекватной перфузии органов и тканей (см.
часть IV).
Фармакотерапия гемодинамических нарушений
Вазопрессоры и препараты положительного инотропного дей-
ствия. Истинная цель вазопрессорной и инотропной терапии
состоит в поддержании адекватного СВ, достижении достаточ-
ного сосудистого тонуса, обеспечивающих определенный уро-
вень давления крови и перфузию жизненно важных органов.
Эти препараты малоэффективны и их не следует применять
при неустраненной гиповолемии. Одним из условий назна-
чения вазопрессоров является устранение глубокого ацидоза
(рН<7,00) и электролитных нарушений. Каждый из назначае-
мых препаратов требует знания его фармакокинетики и ясного
понимания сердечно-сосудистой патологии. Большинство из
этих препаратов являются агонистами а- и Р-рецепторов, в
разной степени обладают инотропным и сосудосуживающим
действием.
159
Агонисты а-рецепторов оказывают сосудосуживающее дей-
ствие на периферическое кровообращение. Активация pj-pe-
цепторов обладает хронотропным и инотропным действием.
Агонисты р2-рецепторов стимулируют расширение сосудов и
бронхов (табл. 20.1). Допаминергическая (D) активация рецеп-
торов увеличивает почечный кровоток. В зависимости от пре-
обладания того или иного патологического синдрома осущест-
вляют выбор необходимого медикаментозного средства. При
этом следует учитывать, что один и тот же препарат в зависи-
мости от дозировки и свойств может оказывать влияние на
различные рецепторы. В некоторых случаях допустима комбина-
ция препаратов. Эффекты действия лекарственных средств долж-
ны постоянно контролироваться. Препараты, обладающие силь-
ным сосудосуживающим действием (адреналин, норадреналин,
допамин), лучше вводить в центральные вены.
Таблица 20.1. Инотропные препараты (по Марини Дж., 1998)
Инотропные средства Активация ад- ренергических рецепторов Относительная эффективность при средней дозировке
инотроп- ная хроно- тропная сосудосужи- вающая
Адреналин а, Р1, Р2 +++ +++ +
Амринон 0 +++ 0 —
Добутамин а> Рь Р2 ++ + + от — до +
Допамин а, Р], D +++ ++ от — до +
Изопротеренол Р1> Р2 ++++ ++++ —
Норадреналин а, Pi 4-4~ + 4-4-4- ++++
Фенилэфрин а, Р1 + 0 ++++
Вазопрессоры. Адреналин — универсальный агонист а- и р-
рецепторов, служит стандартом, с которым сравнивают все
другие вазопрессоры. Часто бывает незаменим в критических
ситуациях, поскольку он может восстановить спонтанную сер-
дечную деятельность при асистолии, повысить АД во время
шока, улучшить автоматизм работы сердца и сократимость
миокарда, увеличить ЧСС. Этот препарат может купировать
бронхоспазм и нередко является средством выбора при анафи-
лактическом шоке.
Дозы адреналина гидрохлорида для внутривенного введения:
1) при любой форме остановки сердца (асистолия, ФЖ,
электромеханическая диссоциация) начальная доза составляет
1 мл 0,1 % раствора, разведенного в 10 мл изотонического
раствора натрия хлорида;
2) при стойкой артериальной гипотензии, анафилактичес-
ком шоке и анафилактоидных реакциях — 0,3—0,5 мл 0,1 %
160
раствора, разведенного в 10 мл изотонического раствора натрия
хлорида;
3) для длительной внутривенной инфузии 1 мл 0,1 % рас-
твора адреналина гидрохлорида разводят в 250 мл изотоничес-
кого раствора натрия хлорида, что создает концентрацию, рав-
ную 4 мкг/мл. При артериальной гипотензии начальная ско-
рость инфузии — 0,05 мкгДкгмин), при отсутствии эффекта
скорость увеличивают до достижения требуемого результата,
а-адреностимулирующее действие адреналина наступает при
скорости введения от 0,05 до 5 мкгДкгмин).
Побочное действие. При введении адреналина возможно тре-
петание предсердий и желудочков, аритмии и стенокардия,
вызванная несоответствием между доставкой и потреблением
кислорода миокардом. Описаны случаи субэндокардиальной
ишемии.
Норадреналин стимулирует а- и Pj-адренорецепторы, почти
не воздействует на Рз-адренорецепторы. Отличается от адрена-
лина более сильным вазоконстрикторным и прессорным дей-
ствием, меньшим стимулирующим влиянием на автоматизм и
контрактильную способность миокарда. СВ обычно остается
устойчивым благодаря тому, что ЧСС и сократимость увели-
чиваются. Препарат вызывает значительное повышение ОПСС,
снижает кровоток в кишечнике, почках и печени, что обуслов-
ливает выраженную ренальную и мезентериальную вазокон-
стрикцию. Добавление малых доз допамина 1 мкгДкгмин)
способствует сохранению почечного кровотока.
Показания к применению: стойкая и значительная гипотензия
(АДрИрТ ниже 70 мм рт.ст.), а также выраженное снижение
ОПСС. Норадреналин часто показан на ранних стадиях септи-
ческого шока, когда СВ остается нормальным или повышен-
ным, а ОПСС снижено. При тяжелом шоке препарат часто
комбинируют с допамином или с другими вазопрессорными
средствами.
Дозы при внутривенном введении: содержимое 2 ампул (4 мг)
норадреналина гидротартрата разводят в 500 мл изотони-
ческого раствора натрия хлорида, что создает концентрацию
16 мкг/мл.
II Растворы норадреналина, адреналина, допамина, добутамина
I вводят через центральную вену!
Доза норадреналина варьирует от 0,05 до 5 мкгДкгмин).
Побочное действие: при длительной инфузии в перифери-
ческую вену может развиться гангрена конечности. При
экстравазальном введении норадреналина возможно появление
Некроза, что требует обкалывания участка экстравазата раство-
ром фентоламина.
Инотропные средства. Допамин (дофамин, допмин) стимули-
рует а- и Pi-рецепторы, оказывает специфическое воздействие
161
11 -1069
на дофаминергические рецепторы. Эффективность этого пре-
парата во многом зависит от дозы.
Показания к применению: 1) острая сердечная недостаточ-
ность, кардиогенный и септический шок; 2) начальная (олигу-
рическая) стадия ОПН.
Допамина гидрохлорид выпускается в ампулах по 200 мг.
Содержимое 2 ампул (400 мг) разводят в 500 мл изотонического
раствора натрия хлорида. В полученном растворе концентра-
ция допамина 800 мкг/мл.
Дозы при внутривенном введении: 1) начальная скорость вве-
дения 1 мкгДкгмин), затем ее увеличивают до получения же-
лаемого эффекта; 2) малые дозы 1—3 мкгДкгмин) действуют
преимущественно на чревную и особенно на почечную об-
ласть, вызывают вазодилатацию этих областей и способствуют
увеличению почечного и мезентериального кровотока; 3) при
постепенном увеличении скорости введения до 10 мкгДкгмин)
возрастают периферическая вазоконстрикция и легочное ок-
клюзионное давление; 4) большие дозы 10—15 мкгДкгмин)
стимулируют [^-рецепторы миокарда, оказывают опосредован-
ное действие за счет высвобождения норадреналина в миокар-
де, т.е. проявляют отчетливое инотропное действие; 5) в дозе
более 10 мкгДкгмин) допамин может вызвать спазм сосудов
почек и брыжейки.
Если возникает тахикардия, рекомендуется снизить дозы
или прекратить дальнейшее введение допамина. Нельзя сме-
шивать препарат с раствором бикарбоната натрия, поскольку
он инактивируется. Длительное применение а- и р-агонистов
снижает эффективность p-адренергической регуляции, мио-
кард становится менее чувствительным к инотропному воздей-
ствию катехоламинов, вплоть до полной утраты гемодинами-
ческого ответа.
Побочное действие: повышает ДЗЛК, возможна тахиарит-
мия; в больших дозах может вызвать выраженную вазокон-
стрикцию.
Противопоказания: не рекомендуется вводить препарат
больным, страдающим аритмиями; следует соблюдать осторож-
ность при высоком ДЗЛК.
Добутамин (добутрекс, инотрекс). Основные механизмы
его действия — стимуляция p-рецепторов и повышение сокра-
тительной способности миокарда (инотропный эффект). В от-
личие от допамина у добутамина отсутствует спланхнический
вазодилатирующий эффект, но имеется тенденция к системной
вазодилатации. Он в меньшей степени увеличивает ЧСС и
ДЗЛК. В связи с этим добутамин показан при лечении сердеч-
ной недостаточности с низким СВ, высоким периферическим
сопротивлением на фоне нормального или повышенного АД.
Показания к применению: острая и хроническая сердечная
недостаточность, обусловленная кардиальными (острый ин-
162
фаркг миокарда, кардиогенный шок) и некардиальными при-
чинами (острая недостаточность кровообращения после трав-
мы, во время и после хирургической операции), особенно в
тех случаях, когда не ниже 80—100 мм рт.ст., а давление
в системе малого круга выше нормальных величин. Назначают
при повышенном давлении наполнения желудочка и риске
перегрузки правых отделов сердца, для профилактики и лече-
ния отека легких, при сниженном СВ, обусловленном режи-
мом ПДКВ при ИВЛ.
Противопоказан при гипертрофической кардиомиопатии. Из-
за короткого периода полураспада добутамин вводят непрерывно
внутривенно. Действие препарата наступает через 1—2 мин.
Дозы. Содержимое флакона добутамина (250 мг препарата)
разводят в 250 мл 5 % раствора глюкозы до концентрации
1 мг/мл или 1000 мкг/мл. Скорость внутривенного введения
препарата, необходимая для повышения УО и СВ, колеблет-
ся от 5 до 10 мкг/(кг мин). Часто требуется увеличение дозы
до 20 мкгДкгмин), реже более 20 мкгДкгмин). Дозы более
40 мкгДкгмин) могут быть токсичными.
Добутамин можно использовать в сочетании с допамином
для повышения системного АД при гипотензии, увеличения
почечного кровотока и мочеотделения, предотвращения риска
перегрузки малого круга кровообращения, наблюдаемой при
введении только допамина.
Побочное действие. Возможны желудочковые аритмии,
иногда гипотензия.
Вазодилататоры. В качестве быстродействующих вазодила-
таторов используют нитраты. Препараты этой группы, вызывая
расширение просвета сосудов, в том числе коронарных, ока-
зывают влияние на состояние пред- и постнагрузки, а при
тяжелых формах сердечной недостаточности с высоким давле-
нием наполнения могут существенно повысить СВ.
Нитроглицерин. Основное действие нитроглицерина — рас-
слабление гладкой мускулатуры сосудов. В малых дозах обес-
печивает венодилатирующий эффект, в больших дозах также
расширяет артериолы и мелкие артерии, что вызывает сниже-
ние ОПСС и АД. Оказывая прямое сосудорасширяющее дей-
ствие, нитроглицерин улучшает кровообращение ишемизиро-
ванной области миокарда. Использование нитроглицерина в
комбинации с добутамином [10—20 мкгДкгмин)] показано у
пациентов с высоким риском развития ишемии миокарда.
Показания к применению: стенокардия, инфаркт миокарда, сер-
дечная недостаточность при адекватном уровне АД, легочная
гипертензия, высокий уровень ОПСС при повышенном АД.
Дозы при внутривенном введении: 200 мг нитроглицерина
разводят в 500 мл растворителя, что соответствует концентра-
ции 400 мкг/мл. Дозы подбирают методом титрования. Началь-
ная доза 5 мкг/мин (малые дозы нитроглицерина). Постепенно
163
IV
каждые 5—15 мин дозу увеличивают до 10 мкг/мин до получе-
ния отчетливого влияния на гемодинамику. Обычная доза 5—
400 мкг/мин. При передозировке возможны развитие гипотен-
зии и обострение ишемии миокарда. Терапия прерывистыми
введениями часто бывает более эффективной, чем длительны-
ми. Для внутривенных вливаний используют системы из плас-
тика (полиэтилен) или стеклянные флаконы. При длительном
(более суток) внутривенном введении раствора нитроглицери-
на возможно развитие тахифилаксии, приводящей к снижению
лечебного эффекта в случаях повторного введения.
Побочное действие. Вызывает превращение части гемогло-
бина в метгемоглобин. После применения нитроглицерина при
отеке легких может возникать гипоксемия. Считают, что сни-
жение раО2 обусловлено увеличением шунтирования крови в
легких.
Противопоказания: повышенное внутричерепное давление,
гипотензия, глаукома, гиповолемия.
Натрия нитропруссид — быстродействующий сбалансиро-
ванный вазодилататор, расслабляющий гладкую мускулатуру
как вен, так и артериол. Не оказывает выраженного влияния
на ЧСС и сердечный ритм. Под влиянием препарата снижа-
ются ОПСС и возврат крови к сердцу. Одновременно увели-
чиваются коронарный кровоток и СВ, но потребность миокар-
да в кислороде снижается.
Показания к применению. Натрия нитропруссид является
средством выбора у больных с выраженной гипертензией на
фоне низкого СВ. Даже незначительное снижение ОПСС при
ишемии миокарда со снижением насосной функции способст-
вует нормализации СВ. Натрия нитропруссид не оказывает
прямого влияния на сердечную мышцу. Является одним из
лучших препаратов при лечении гипертонических кризов. При-
меняется при острой левожелудочковой недостаточности без
признаков гипотензии.
Дозы при внутривенном введении. Растворить 100 мг в 500 мл
растворителя (концентрация 200 мкг/мл) и хранить в защищен-
ном от света месте. Начальная скорость введения 0,5 мкг/
(кгмин), при низком СВ — 0,2 мкгДкгмин). При гипертони-
ческом кризе лечение начинают с 2 мкгДкгмин). Начало дей-
ствия 1—2 мин, продолжительность действия 1—10 мин после
окончания внутривенной инфузии. Обычная доза 0,5—5 мкг/
(кгмин). Средняя скорость введения 0,7 мкгДкгмин). Макси-
мальная скорость введения 10 мкгДкгмин). Общая доза менее
1—1,5 мг/кг за 3 ч.
Побочное действие. При длительном применении препарата
возможна интоксикация цианидами и тиоцианатом. Цианиды,
образующиеся в организме в процессе метаболизма натрия
нитропруссида, превращаются в тиоцианат. Накопление пос-
леднего происходит при почечной недостаточности.
164
Другие препараты, применяемые для лечения недостаточнос-
ти кровообращения и шока
Амринон является производным бипиридина — ингибитора
фосфодиэстеразы. Он повышает содержание цАМФ и свобод-
ных ионов кальция в клетках миокарда. Обладает кардиотони-
ческой и вазодилатирующей активностью, оказывает прямое
расширяющее действие на артериолы и вены. Повышает со-
кратительную способность миокарда.
Показания к применению. Наиболее эффективен в качестве
дополнительного средства при левожелудочковой недостаточ-
ности. Основным условием его применения является нормаль-
ный уровень АД (АДСИСТ более 100 мм рт.ст.).
Дозы при внутривенном введении. Препарат выпускается во
флаконах вместимостью 20 мл, содержащих 100 мг амринона.
Разводят только (!) в изотоническом растворе натрия хлорида
до концентрации 1—3 мг/мл.
Начинают лечение с введения препарата в дозе 0,75—1,5 мг/кг
в течение 3—5 мин, а затем проводят инфузию со скоростью
5—10 мкгДкгмин). Через 15—20 мин возможно повторное
введение препарата в дозе 0,75 мг/кг по показаниям.
Начало действия через 5—10 мин, продолжительность дей-
ствия при болюсном введении 0,5—2 ч.
Побочное действие. При лечении амриноном возможно раз-
витие тромбоцитопении и изменений желудочкового ритма,
вплоть до трепетания или мерцания предсердий. Препарат
противопоказан при тромбоцитопении.
Лабеталон. Блокирует аг, |3]-и р2_аДРеноРеЦептоРы> сни-
жает ОПСС, оказывает гипотензивное действие, существенно
не влияя на сердечный ритм. Применяется при артериальной
гипертензии, для купирования гипертонических кризов, осо-
бенно в послеоперационном периоде.
Дозы. Начальная доза 20 мг. Через 10—20 мин препарат
можно вводить повторно в дозах от 20 до 80 мг. Общая доза
не должна превышать 300 мг. При длительном внутривенном
введении инфузию начинают со скоростью 2 мг/мин. Лечеб-
ный эффект достигается при введении 50—200 мг.
Глава 21 I АНТИАРИТМИЧЕСКАЯ ТЕРАПИЯ
Сердечные аритмии встречаются довольно часто при лече-
нии больных в ОИТ в интра- и послеоперационном периодах.
Точно определить причины аритмий не всегда возможно. Они
непостоянны, симптоматичны, но в ряде случаев оказывают
сильнейшее влияние на системную гемодинамику. Своевре-
менное распознавание вида аритмии и соответствующая тера-
165
пия — важные условия гемодинамического гомеостаза. Неред-
ко выбор антиаритмической терапии имеет эмпирический
характер. Во всех случаях необходимо принимать меры к уст-
ранению таких хорошо известных причин аритмий, как гипок-
семия, гиперкапния, нарушения pH и электролитного баланса
К+, Са2+, Mg2+. Введение внутрисердечного катетера, повреж-
дение кардиостимулятора, лечение дигиталисом и теофилли-
ном вызывают широкий спектр аритмий, которые прекраща-
ются с устранением вышеназванных факторов. Ряд антиарит-
мических препаратов (хинидин, флеканид и др.) могут вызы-
вать аритмии. Нарушение коронарного кровотока, ишемия
миокарда — наиболее частые причины аритмий. Последние
могут возникать при гипотензии или гипертензии и зависеть
от волемического статуса. Ниже представлены наиболее частые
нарушения ритма, в том числе тахикардия и брадикардия.
Тахиаритмии. Синусовая тахикардия. Учащение сердечного
ритма до 120 ударов в минуту и более представляет одну из
форм диастолической сердечной недостаточности в связи с
сокращением времени диастолы. При этом уменьшаются диа-
столическое наполнение и коронарный кровоток. Причинами
тахикардии могут быть ноцицептивный и нейровегетативный
стимулы, болевой синдром, гиповолемия (реже гиперволемия),
лихорадка, сепсис, кислородная недостаточность, гипермета-
болизм.
Требуется выяснение причины этого состояния и устране-
ние его. При возникновении стойкой синусовой тахикардии
прежде всего необходимо восстановить ОЦП путем инфузий
плазмозамещающих сред и альбумина. При превалировании
анемии переливают эритроцитную массу.
Важнейшие факторы лечения: адекватная аналгезия и ней-
ровегетативная защита. С этой целью применяют морфин и
другие анальгетики центрального действия, НПВС, усиливают
регионарную анестезию, применяют бензодиазепины, устраня-
ют избыточные вегетативные реакции.
Больным с симптоматической ишемией могут быть показа-
ны p-блокаторы, анаприлин или эсмолол, верапамил или дил-
тиазем. Однако при гипотензии, остром инфаркте миокарда,
дисфункции миокарда Р-блокаторы следует применять с чрез-
вычайной осторожностью, поскольку тахикардия может отра-
жать начальную стадию заболевания и быть компенсаторной
реакцией.
Наджелудочковые аритмии опасны потерей предсердной
систолы, что может иметь значимые гемодинамические по-
следствия. Такие аритмии могут быть в виде предсердных экстра-
систол, предсердной пароксизмальной тахикардии, предсерд-
ной многоочаговой (мультифокальной) пароксизмальной тахи-
кардии, узловой пароксизмальной тахикардии, мерцания и
трепетания предсердий. В некоторых случаях наджелудочковые
166
аритмии носят упорный рецидивирующий характер. Все эти
нарушения, несинусовые и синусовые тахикардии, могут вы-
звать значительное снижение АД и СВ, резкое падение УО.
Основные методы лечения наджелудочковой аритмии:
♦ при аритмогенном шоке (в том числе при ширококом-
плексной тахикардии неясного происхождения у больных
с неопределяемым пульсом или симптоматической гипо-
тензией) самым эффективным и безопасным методом
восстановления синусового ритма является синхронизи-
рованная кардиоверсия. Начинают ее с разряда 50 Дж,
при мерцании предсердий — 100 Дж и выше, при трепе-
тании предсердий удовлетворительный эффект может
быть получен от кардиоверсии разрядом меньшей энер-
гии (25 Дж);
♦ внутривенное быстрое введение аденозина в дозе 6—12 мг;
♦ при тахиаритмии более 140 ударов в минуту и АДСИСТ не
ниже 100 мм рт.ст. показаны блокаторы кальциевых ка-
налов: верапамил и дилтиазем;
♦ р-адреноблокаторы: анаприлин или эсмолол. При безус-
пешности 2—3 попыток фармакологического восстанов-
ления синусового ритма у больных со стабильной гемо-
динамикой показана дигитализация (по схеме быстрого
насыщения);
♦ дигоксин по 0,25 мг внутривенно дробно до максималь-
ной дозы 1 — 1,5 мг. Этот препарат урежает ЧСС, но
действует не сразу;
♦ к средствам, подавляющим распространенные наджелу-
дочковые аритмии, относятся также препараты подгруп-
пы 1а антиаритмических средств (новокаинамид, хини-
дин, дизопирамид). При применении этих препаратов
необходима большая осторожность.
Частые желудочковые экстрасистолы сопровождаются
весьма умеренным снижением производительности сердца. Од-
нако для поддержания необходимого СВ требуются дополни-
тельные энергетические затраты. У больных ИБС или с другой
сердечной патологией может возникать несоответствие между
повышенным потреблением кислорода и его доставкой.
Желудочковая тахикардия (ЖТ) опасна полным прекраще-
нием насосной функции сердца и остановкой кровообращения.
Симптомы тахикардии, возникшие после инфаркта миокарда,
скорее всего, связаны с желудочковой тахикардией.
Лечение желудочковой тахикардии, не сопровождающейся
остановкой сердца:
1. Если ЖТ не сопровождается остановкой кровообраще-
ния, гемодинамика стабильна (АДСИСТ выше 90 мм рт.ст., ЧСС
140—170 ударов в минуту) и сознание сохранено, просят боль-
167
ного покашлять. Кашель может восстановить синусовый ритм.
Прекордиальный удар с этой целью применять не следует, так
как ЖТ может трансформироваться в ФЖ или электромехани-
ческую диссоциацию (ЭМД).
2. Если ЖТ продолжается, а гемодинамика стабильна, про-
водят антиаритмическую терапию лидокаином. Внутривенно
вводимый лидокаин является препаратом выбора у пациентов
с ЖТ и стабильным АД. Начальная насыщающая доза 50—
100 мг внутривенно до 1—1,5 мг/кг массы тела. Поддерживаю-
щая доза 50—70 мг каждые 5—10 мин до общей дозы 3 мг/кг,
или около 225 мг. При рецидиве ЖТ могут потребоваться
дополнительное струйное введение и увеличение скорости ин-
фузии до 3 мг/мин.
3. Прокаинамид — антиаритмическое средство “второго ря-
да”. Применяют при неэффективности лидокаина. Вводят дроб-
но по 100 мг путем медленной инфузии в течение 5 мин.
Прекращают введение, если ЖТ устранена, доза достигла 17 мг/кг
(500—1000 мг) или развилась гипотензия и(или) комплекс QRS
расширился более чем на 50 %.
4. Если ЖТ не поддается действию лидокаина или прокаин-
амида, показано введение бретилия. Осуществляют поиск уст-
ранимой причины ЖТ. Иногда положительный эффект может
быть достигнут введением магния сульфата или аденозина.
5. Если антиаритмическая медикаментозная терапия не дала
эффекта, проводят синхронизированную кардиоверсию: внача-
ле применяют разряд мощностью 50 Дж, затем увеличивают
его до 100—200 Дж. Процедуру выполняют с участием анесте-
зиолога.
6. При появлении нарушения гемодинамики во время про-
ведения медикаментозной антиаритмической терапии требует-
ся немедленная синхронизированная кардиоверсия, при этом
предпочитают разряды более высокой мощности 100—200 Дж.
При ЖТ, сопровождающейся артериальной гипотензией, при-
менение вазопрессорных средств (адреналин, допамин) проти-
вопоказано.
7. После успешного купирования ЖТ необходимо дополни-
тельное обследование: ЭКГ (инфаркт миокарда?), рентгеногра-
фия грудной клетки (отек легких, кардиомегалия?), определе-
ние электролитов крови, сердечных ферментов, pH, газов ар-
териальной крови, эхокардиография.
8. Поддерживают уровень калия крови, равный 4—5 ммоль/л,
и раОг, равный 100 мм рт.ст. Устраняют тяжелый металличес-
кий ацидоз. Назначают поддерживающую антиаритмическую
терапию.
Если желудочковая тахикардия сопровождается остановкой
кровообращения (отсутствие пульса на сонной артерии), прово-
дят такие же лечебные мероприятия, как и при фибрилляции
желудочков (ФЖ). Первым важнейшим пунктом этой терапии
168
является немедленная дефибрилляция сердца электрическими
разрядами 200, 300, 360 Дж. Вместо несинхронизированного
электрического разряда в определенных условиях выполняют
синхронизированную кардиоверсию, однако при этом имеется
опасность попадания разряда на зубец Т. Если синхронизиро-
ванная кардиоверсия не может быть быстро выполнена, сле-
дует применить несинхронизированную кардиоверсию. Пре-
кордиальный удар может прекратить ФЖ или ЖТ (без пульса),
но этот прием редко бывает эффективным. Если ЖТ продол-
жается и нет пульса на сонной артерии, проводят весь ком-
плекс реанимационных мероприятий, включая повторные раз-
ряды дефибриллятора и антиаритмическую терапию.
Фибрилляция желудочков — одна из наиболее частых причин
внезапной смерти. Если у пациента отсутствуют пульс и дыха-
ние, следует немедленно произвести “слепую дефибрилля-
цию”. Все остальное — восстановление проходимости дыха-
тельных путей, ИВЛ, массаж сердца — имеют второстепенное
значение и даже вначале могут играть отрицательную роль.
Успех дефибрилляции уменьшается с каждой последующей
минутой. Рекомендуется серия быстрых разрядов повышаю-
щейся интенсивности (200, 300, 360 Дж), тем более если ФЖ
обнаружена на мониторе. Задачей кардиоверсии является уст-
ранение хаотической активности миокарда, чтобы восстано-
вить активность собственного водителя ритма. “Слепая дефиб-
рилляция” не нанесет вреда взрослым больным с брадикардией
или асистолией, но принесет пользу при ФЖ или ЖТ. Если
ФЖ сохраняется, проводят весь комплекс реанимационных
мероприятий, включая ИВЛ, наружный массаж сердца, кате-
теризацию вены, введение адреналина, проведение повторных
разрядов и антиаритмическую терапию.
Синусовая брадикардия может быть вызвана как внекарди-
альными (вагусные рефлексы, гипотермия, гипотиреоидизм,
истощение, действие [3-блокаторов, блокаторов кальциевых ка-
налов или дигоксина), так и кардиальными причинами (сла-
бость синусового узла, нарушение атриовентрикулярной про-
водимости).
“Физиологическая брадикардия” может быть обусловлена
снижением основного обмена. Синусовая брадикардия харак-
теризуется нормальным зубцом Р и скоростью проведения с
ЧСС менее 60 ударов в минуту. Может проявляться на фоне
гипоксемии, боли и быть одной из причин снижения СВ. При
этом системное и легочное АД в связи с повышением ОПСС
может оставаться в пределах нормы.
Для лечения синусовой брадикардии обычно применяют ат-
ропин или катехоламины. Начальная доза атропина 0,5—1 мг.
Вводят раствор внутривенно в течение 3—5 мин под контролем
ЧСС до нормализации ее уровня. Проводят также инфузии
допамина (5—20 мкгДкгмин), или адреналина (2—10 мкг/мин)
169
или изопротеренола (2—10 мкг/мин). Все эти препараты могут
увеличить потребление кислорода миокардом, если они при-
меняются при ишемии миокарда. Если начальная терапия не
приводит к желаемому эффекту, следует прибегнуть к внешне-
му водителю ритма. У больных с синусовой брадикардией,
вызванной интоксикацией сердечными гликозидами, показана
антидигиталисная терапия. Если брадикардия вызвана р-бло-
каторами, применяют глюкагон. При передозировке блокато-
ров кальциевых каналов лечение проводят внутривенным вве-
дением раствора хлорида кальция в общей дозе 1—3 г.
Узловая брадикардия может быть связанной и не связанной
с острым инфарктом миокарда. Часто развивается после ин-
фаркта нижней стенки миокарда или вызывается лекарствен-
ными препаратами (Р-блокаторы) или слабостью синусового
узла. Если брадикардия является причиной гипотензии, низкого
СВ или выпадения желудочкового ритма, требуется немедлен-
ная терапия. В этих случаях вводят внутривенно 0,5—1 мг
атропина; если ЧСС остается ниже 60 в 1 мин, увеличивают
дозу и вводят атропин через 5-минутные интервалы до макси-
мальной дозы 3 мг. Если брадикардия остается, устанавливают
временный кардиостимулятор.
При желудочковой брадикардии более 40 в 1 мин, не свя-
занной с инфарктом миокарда, и отсутствии клинической симп-
томатики недостаточности кровообращения лечение не требу-
ется. Если желудочковый ритм менее 40 в 1 мин, имеются
симптомы недостаточности кровообращения (гипотензия, об-
морочное состояние), прекращают введение препаратов, кото-
рые могут быть причиной брадикардии, и устанавливают вре-
менный кардиостимулятор. Обсуждают с кардиологом тактику
дальнейшего лечения.
Атриовентрикулярная блокада. АВ-блокада I степени — по-
стоянный интервал Р— Я>200 мс. Изолированная АВ-блокада
I степени лечения не требует. Однако, если она сопровождает
блокаду правой ножки пучка Гиса и блокаду передней ветви
левой ножки пучка Гиса при остром инфаркте миокарда, мо-
жет развиться полная АВ-блокада. В этом случае показана
чрескожная или трансвенозная кардиостимуляция.
АВ-блокада II степени типа Mobitz I (Wenkebach) — про-
грессивно удлиняющийся интервал P—R с последующим вы-
падением сокращений. Установка временного кардиостимуля-
тора показана больным, если имеется атропинрезистентная
гипотензия.
АВ-блокада II степени типа Mobitz II— постоянный интер-
вал P—R с выпадением сокращений. Если данный вид блокады
обусловлен острым инфарктом миокарда, показана установка
временного кардиостимулятора.
АВ-блокада II степени, не связанная с инфарктом миокарда,
возможна при интоксикации дигоксином или р-блокаторами.
170
Если АВ-блокада II степени сопровождается обмороком или
нарушением сознания, устанавливают временный кардиости-
мулятор и осуществляют непрерывную кардиостимуляцию.
АВ-блокада III степени (полная блокада) — взаимоотноше-
ния зубца Р и комплекса ORS вариабельны, интервалы Р—Р и
R—R постоянны, но отличаются друг от друга. Показано сроч-
ное введение трансвенозного стимулятора.
Глава 22
ОСТРАЯ НАДПОЧЕЧНИКОВАЯ
НЕДОСТАТОЧНОСТЬ
С момента установления роли защитной реакции и стресса
[Ганс Селье, 1936] и до сих пор проводятся интенсивные
исследования, имеющие целью способствовать выживанию ор-
ганизма в чрезвычайных ситуациях. При стрессе надпочечники
играют главную роль. Надпочечники продуцируют глюкокор-
тикоиды, минералокортикоиды и катехоламины. Благодаря этим
механизмам происходит поддержание СВ, сосудистого тонуса,
ОЦП и уровня глюкозы в крови, обеспечивающей метаболи-
ческие потребности мозга. При этих состояниях содержание
стресс-гормона кортизола в плазме крови значительно превы-
шает норму.
Этиология. Физиологические эффекты надпочечниковой
недостаточности возникают в результате дефицита кортизола
и/или альдостерона. Первичная надпочечниковая (адренало-
вая) недостаточность наблюдается при деструкции желез, вы-
деляющих гормоны. Это может быть при туберкулезе, грибко-
вых заболеваниях, оперативном вмешательстве, инфаркте, ме-
тастатических опухолевых поражениях, аутоиммунном забо-
левании и кровотечениях. Надпочечниковая недостаточность
может возникать в результате применения искусственного кро-
вообращения. Больные с иммунодефицитным состоянием в
критическом состоянии также могут иметь недостаточность
этой системы.
Вторичная надпочечниковая недостаточность является ре-
зультатом недостаточной секреции адренокортикотропного
гормона (АКТГ), что ведет к снижению нормального уровня
кортизола, но не влияет на альдостерон, поскольку он не
регулируется АКТГ. Вторичная надпочечниковая недостаточ-
ность может возникать при травме, росте опухоли (особенно
аденомы гипофиза) или инфаркте железы гипофиза. Внезапное
прекращение терапии стероидами стимулирует вторичную над-
почечниковую недостаточность, поскольку секреция АКТГ
снижается в результате экзогенно вводимых кортикостероидов.
К состояниям, при которых, как правило, поражаются над-
почечники, относят артериальную гипотензию, сепсис, тяже-
171
лую коагулопатию (ДВС-синдром) и низкий СВ. Несмотря на
большой запас “прочности” надпочечников (клинически явная
надпочечниковая недостаточность возникает при разрушении
90 % их ткани), эти состояния в практике ОРИТ — наиболее
частая причина острой надпочечниковой недостаточности.
При этом следует иметь в виду, что больные в исходном
состоянии могут иметь скрытую форму надпочечниковой не-
достаточности.
Поскольку уровень альдостерона остается нормальным или
близок к норме при вторичной адреналовой недостаточности,
эта форма надпочечниковой недостаточности редко является
причиной дегидратации и гиперкалиемии. В то же время пер-
вичная надпочечниковая недостаточность часто имеет эти при-
знаки. У большинства больных адреналовый криз возникает
при интеркуррентном заболевании, приводящем к уменьше-
нию жидкостного объема (рвота, диарея) или вазодилатации
(сепсис). Оперативные вмешательства увеличивают риск адре-
налового криза путем этих двух механизмов и путем возраста-
ния уровня кортизола.
Клинические проявления. Слабость, усталость, анорексия,
лихорадка и тошнота — наиболее общие признаки адреналовой
недостаточности. Шок может быть первичным симптомом ост-
рой недостаточности надпочечников, вызванной осложнением
инфекции или дегидратации. Артериальная гипотензия — наи-
более типичное и более других угрожающее жизни состояние,
обусловленное острой надпочечниковой недостаточностью.
Артериальная гипотензия возникает, в частности, вследствие
гиповолемии и пониженного ОПСС. Ортостатическая гипо-
тензия может быть проявлением гиповолемии, но чаще возни-
кает из-за неспособности организма поддерживать сосудистый
тонус в соответствии со сниженным СВ. Рефрактерная гипо-
тензия также типична для острой надпочечниковой недоста-
точности.
Острую недостаточность надпочечников следует подозре-
вать в любом случае рефрактерной гипотензии независимо от
ее причины.
Дополнительные признаки: гиперпигментация кожи, потеря
волос у женщин, гипонатриемия, гиперкалиемия и др.
Гиперпигментация кожи возникает только при первичной
адреналовой недостаточности (функционирующая железа ги-
пофиза продуцирует АКТГ-подобные меланоциты, стимули-
рующие гормон, вызывающий гиперпигментацию), признак
бывает не всегда.
Потеря волос у женщин может быть связана с первичной
недостаточностью надпочечниковой функции вследствие поте-
ри адреналового андрогена.
Болевой синдром может привести к летальному исходу даже
172
при необширных оперативных вмешательствах (например, экс-
плоративная лапаротомия).
Гипонатриемия и гиперкалиемия (на фоне дефицита альдосте-
рона снижаются реабсорбция ионов натрия и секреция ионов
калия в собирательных трубках и дистальных почечных ка-
нальцах).
Диагностика. Точная диагностика недостаточности коры над-
почечников возможна при применении пробы-теста с АКТГ. При
подозрении на недостаточность надпочечников может быть ис-
пользовано прямое измерение показателей гемодинамики с по-
мощью катетера, введенного в легочную артерию. По гемодина-
мическим профилям судят о степени гемодинамических наруше-
ний, возникающих при недостаточности надпочечников:
♦ низкое ДЗЛК (низкий СВ), низкое ОПСС — характерны
для коллапса при аддисоническом кризе;
♦ низкое ДЗЛК (низкий СВ), нормальное ОПСС — соче-
тание гиповолемии и неспособности к периферической
вазоконстрикции в ответ на низкий СВ. Характерен для
легких форм недостаточности надпочечников;
♦ низкое или нормальное ДЗЛК (высокий СВ), низкое
ОПСС — характерны для септического шока, предраспо-
лагающего к некрозу надпочечников.
Изменения электролитного баланса чаще всего проявляются
снижением концентрации ионов натрия и повышением кон-
центрации ионов калия в сыворотке крови. У любого больного
с развивающейся гипонатриемией и гиперкалиемией необхо-
димо исследовать концентрацию натрия и калия в моче. Если
содержание натрия в моче высокое или уровень калия в моче
низкий, то, вероятно, имеется недостаточность надпочечников.
Проба-тест с АКТГ (по П. Марино, 1998). Определяют
базальное содержание кортизола в сыворотке крови. После
этого внутривенно вводят препарат АКТГ кортикотропин (ко-
ртрозин) в дозе 250 мкг. Через 1 ч снова определяют уровень
кортизола.
Базальная концентрация кортизола в сыворотке крови более
220 мкг/л свидетельствует о нормальной реакции надпочечни-
ков на стресс. У больных без стресса уровень кортизола выше
140 мкг/л после введения АКТГ расценивают как нормальный
ответ коры надпочечников. В некоторых случаях достаточно
только определения базальной концентрации кортизола.
При уровне кортизола ниже 220 мкг/л критерием становит-
ся скорость изменения содержания кортизола после введения
АКТГ.
Повышение концентрации кортизола менее чем на 70 мкг/л за
1 ч после введения АКТГ — признак первичной недостаточнос-
ти коры надпочечников.
173
Лечение. Основой лечения являются глюкокортикоиды и
сольсодержащие растворы (NaCl). Если инфузия сольсодержа-
щими растворами была адекватной, нет необходимости вводить
немедленно минералокортикоидные гормоны. У людей с нор-
мально функционирующим гипофизом уровни кортизола мо-
гут значительно возрасти сверх базовой линии, что соответст-
вует ежедневному эквиваленту 300—400 мг гидрокортизона.
Если АД снижено и не поддается восстановлению после
проведенной инфузионной терапии, следует сразу начать вве-
дение глюкокортикоидов, даже до определения результатов
теста. В качестве начальной ударной дозы применяют 10 мг
дексаметазона внутривенно в виде болюса. Дексаметазон прак-
тически не влияет на результаты определения содержания кор-
тизола в пробах крови.
При установлении надпочечниковой недостаточности начи-
нают терапию гидрокортизоном внутривенно в ударной дозе
250 мг с последующим введением по 100 мг через каждые 6 ч
до выведения больного из стрессового состояния. После ста-
билизации состояния дозу гидрокортизона постепенно умень-
шают до 20 или 30 мг/сут. Данная доза соответствует суточному
количеству кортизола, вырабатываемому корой надпочечни-
ков. При нормальной реакции надпочечников на введение
АКТГ применение гидрокортизона не показано.
Опасности кортикостероидной терапии. Высокие дозы кор-
тикостероидов предрасполагают пациентов к инфекции и пло-
хому заживлению ран, изменению ментального статуса, пре-
рыванию сна и неусвоению (интолерантности) глюкозы. Дли-
тельное назначение глюкокортикоидов также может быть
причиной интракраниальной гипертензии, изменений костной
структуры, асептических некрозов, панкреатита, глаукомы и
формирования катаракты. Для избежания подобных эффектов
кортикостероидной терапии или их снижения необходимо:
♦ использовать самые низкие эффективные дозы;
♦ использовать коротко действующие препараты, такие как
гидрокортизон;
♦ если возможно, использовать альтернативные методы ле-
чения.
Основные положения
1. Гемодинамический мониторинг — обязательное условие адекватной
терапии больных, находящихся в критическом состоянии. Получаемые
данные измерений параметров центральной гемодинамики позволяют
установить механизм критического состояния и помогают в выборе наи-
более рационального и эффективного метода лечения. Катетеризация
легочной артерии показана при лечении наиболее тяжелых синдромных
174
нарушений: шока, системной воспалительной реакции, респираторного
дистресс-синдрома, а также при торакоабдоминальных высокотравма-
тичных оперативных вмешательствах.
2. Неинвазивный мониторинг центральной гемодинамики с помощью
тетраполярной реоплетизмографии и компьютеризированных комплек-
сов обеспечивает в режиме “on line” регистрацию параметров насосной
функции сердца — СВ, УО, УИ, СИ, ЧСС, индекс механической работы
левого желудочка, состояния сосудистого русла — ОПСС, давление на-
полнения левого желудочка и позволяет осуществлять контроль инфу-
зионной терапии и инотропной поддержки. Тетраполярная реоплетиз-
мография — безопасный, но, к сожалению, менее точный метод оценки
параметров ЦГД.
3. Использование трех основных параметров гемодинамики — СВ,
ДЗЛК (или ДНЛЖ) и ОПСС позволяет установить 'гемодинамический
профиль”, на основании которого определяют механизм нарушения и
соответствующий алгоритм лечения. Использование жидкостной пробы
позволяет установить показания к проведению инфузионной терапии
или инотропной поддержки.
4. Одновременное использование гемодинамического мониторинга и
одномоментного определения объемов всех водных секторов организ-
ма — клеточного, внеклеточного, интерстициального, внутрисосудисто-
го, а также объема общей воды организма создает новые предпосылки
для контролируемой инфузионной терапии.
5. Полное исследование гемодинамики должно включать взятие пробы
артериальной крови, смешанной венозной крови, сравнение ЦВД и
ДЗЛК (ДНЛЖ), измерение СВ, вычисление системного и легочного со-
судистого сопротивления, контроль АД и определение доставки и по-
требления кислорода. Получаемая информация позволяет установить
адекватность СВ, выявить право- и левожелудочковую недостаточность,
гиповолемию, состояние пред- и постнагрузки и определить основные
направления интенсивной терапии.
6. Острая левожелудочковая недостаточность сопровождается ростом
ДЗЛК и ведет к отеку легких. Наиболее распространенные причины
кардиогенного отека легких: инфаркт миокарда, миокардит, аритмии.
Отек легких в ОРИТ возможен в результате несбалансированной инфу-
зионной терапии, при избыточном вливании жидкостей, особенно у лиц
с сердечной патологией. В связи с быстрым развитием отека наиболь-
шее значение в диагностике приобретают экстренные лабораторные
исследования раОг, раСОг, pH крови, неинвазивный гемодинамический
и ЭКГ-мониторинг, рентгенография органов грудной клетки. В лечении
отека легких основное значение придают адекватной оксигенотерапии,
снятию психического стресса, применению диуретиков, нитратов и ино-
тропных агентов.
7. Три основных механизма могут вызвать недостаточность кровообра-
щения: 1) гиповолемия, 2) недостаточность нагнетательной функции
сердца, 3) недостаточный сосудистый тонус. При гиповолемии в первую
очередь проводят заместительную терапию коллоидными и кристалло-
идными растворами, обеспечивающими адекватный венозный приток к
сердцу. Исходя из выявленных механизмов снижения нагнетательной
175
функции сердца и изменений сосудистого тонуса, применяют инотроп-
ные или антиаритмические препараты, вазопрессоры или вазодилата-
торы, создающие возможность управления СВ и состоянием пред- и
постнагрузки.
8. Диастолическая сердечная дисфункция часто предшествует симпто-
мам сердечной недостаточности, развивается на фоне системной арте-
риальной гипертензии в тех случаях, когда нарушено “пассивное” рас-
слабление желудочков во время диастолы. Даже при сохраненной сис-
толической функции желудочков диастолическая дисфункция может
привести к развитию острого отека легких.
9. Сердечные аритмии в процессе лечения больных в ОРИТ встреча-
ются довольно часто и в ряде случаев оказывают сильнейшее влияние
на системную гемодинамику. Во всех случаях необходимо применять
меры к устранению таких известных причин аритмий, как гипоксемия,
гиперкапния, нарушение pH и электролитного баланса: К+, Са2+, Мд2+.
Необходимо учитывать, что ряд препаратов — дигиталис, теофиллин,
антиаритмические средства (например, хинидин, флекамид) могут вы-
звать аритмии.
10. Наджелудочковые аритмии, включая синусовую тахикардию, могут
вызвать значительное снижение АД и СВ, резкое падение УО. При
аритмогенном шоке проводят синхронизированную кардиоверсию с на-
чальной энергией разряда 50 Дж. При мерцании предсердий энергия
разряда 100 Дж и выше.
11. При желудочковой тахикардии с определяемым пульсом и стабиль-
ной гемодинамикой показано проведение антиаритмической медика-
ментозной терапии. При ЖТ без пульса проводят весь комплекс реани-
мационных мероприятий, который начинают с кардиоверсии. Если
пульс не определяется, тактика лечения та же, что при ФЖ (серия
несинхронизированных электрических разрядов мощностью 200, 300 и
360 Дж с последующей антиаритмической терапией).
12. Брадикардия (синусовая и узловая) может быть вызвана как внекар-
диальными факторами (вагусные рефлексы, действие дигиталиса,
антиаритмических препаратов), так и кардиальными причинами (сла-
бость синусового узла, инфаркт миокарда, нарушение АВ-проводимос-
ти). Если брадикардия является причиной гипотензии, низкого СВ, по-
казано немедленное внутривенное введение 0,5—1 мг атропина (мак-
симальная доза 3 мг). Если ритм менее 40 в 1 мин и имеются симптомы
продолжающейся недостаточности кровообращения, показано приме-
нение временного кардиостимулятора. Дальнейшая тактика лечения
обсуждается совместно с кардиологом.
ВОПРОСЫ И ОТВЕТЫ
1. Опишите влияние пред- и постнагрузки на правый и левый желу-
дочки при отсутствии кардиальной п внекардиалъной патологии.
Правый желудочек в нормальных условиях более чувствителен
к изменениям преднагрузки и постнагрузки. Левый желудочек
относительно чувствителен к изменениям преднагрузки и не-
чувствителен к колебаниям постнагрузки.
176
2. Перечислите основные и расчетные данные, получаемые при
катетеризации легочной артерии.
Измеряемые параметры: СВ, насыщение смешанной венозной
крови кислородом, давление в правом предсердии, правом же-
лудочке, легочной артерии, давление заклинивания легочных
капилляров.
К расчетным параметрам относятся: сердечный индекс, индекс
ударной работы, индекс ОПСС и сопротивление легочных со-
судов.
3. Опишите методику жидкостной пробы.
В некоторых критических ситуациях величина ДЗЛК не позво-
ляет точно проследить объем и преднагрузку левого желудочка.
В этих случаях используют жидкостную пробу путем быстрого
вливания коллоидного или кристаллоидного раствора. До и после
вливания исследуют ДЗЛК, системное давление крови, СВ, ЧСС
и проводят физикальное обследование. 50—200 мл коллоидного
или изотонического раствора натрия хлорида вводят за 5—20 мин
в зависимости от предполагаемой сердечной недостаточности
[Марини Дж., Уилер А.П., 2002]. Улучшение гемодинамических
показателей после жидкостной пробы при малом изменении
ДЗЛК указывает на целесообразность введения дополнительно-
го объема жидкости, а возрастание ДЗЛК на 5—7 мм рт.ст.,
заметное увеличение ЧСС с увеличением СВ и АД — на воз-
можность перегрузки сердца и развития отека легких.
4. Опишите определение сердечного выброса методом термодилю-
ции.
Принципиально определение СВ методом термодилюции не
отличается от метода разведения индикатора (синий Эванс,
индоцианин зеленый и др.), поскольку в качестве индикатора
применяют охлажденный раствор и на экране создается кривая,
подобная кривой после введения красителя. В качестве термо-
индикатора применяют охлажденный 0,9 % раствор натрия хло-
рида или 5 % раствор глюкозы. У взрослых объем вводимого
раствора составляет от 5 до 10 мл. Раствор может иметь ком-
натную температуру. Продолжительность введения раствора не
должна превышать 4 с. Температура индикатора не играет
принципиальной роли. Важно, чтобы она не была выше ком-
натной температуры.
Раствор вводят через проксимальный канал катетера в полость
правого предсердия. Этот болюс смешивается с окружающей
кровью и охлаждает ее. Далее охлажденная кровь попадает в
легочную артерию. Термистор, расположенный на дистальном
конце катетера, регистрирует изменение температуры и посы-
лает информацию в компьютер СВ. Последний фиксирует раз-
ницу температур крови и введенного раствора и на экране
выводит ее в виде термодилюционной кривой, отражающей
температуру и время. Площадь под кривой разведения обратно
пропорциональна величине СВ. Чем больше крови изгоняется
из правого желудочка, тем больше степень разведения индика-
177
’2-1069
тора и тем быстрее его пассаж через легочную артерию. Изме-
нения температуры крови будут незначительными и скоротеч-
ными, а кривая разведения — низкоамплитудной и скоротеч-
ной. При малом СВ кривая разведения приобретает форму
относительно высокой и широкой волны.
5. Какие симптомы указывают на целесообразность ИВЛ и гемо-
динамического мониторинга?
Нарушение перфузии органов, сопровождающееся симптома-
ми полиорганной недостаточности, снижение СВ, АДСИСТ ниже
90 мм рт.ст., гипоксемия, гиперкапния, ацидоз, необходймость
применения инотропной поддержки и(или) антиаритмической
терапии. Неинвазивный мониторинг — одно из обязательных
условий проведения анестезии или лечения больных в ОПТ.
Для определения терапевтической тактики важна информация,
которую дают повторные определения состояния психического
статуса, диуреза, цвета кожных покровов, изменения таких по-
казателей, как ЦВД, ДНЛЖ, среднее АД.
6. От каких факторов зависит венозный возврат к сердцу?
Венозный возврат к сердцу зависит от градиента давления в
артериальной и венозной системе. Составляющей венозного
возврата является среднее системное давление, которое пред-
ставляет собой объемозависимое среднее давление во всем сис-
темном сосудистом русле. Венозный приток зависит от вели-
чины капиллярного кровотока и градиента давлений в капил-
лярах и правом предсердии. Давление в капиллярах и
капиллярный кровоток определяются величиной СВ и пропуль-
сивным действием артерий. Градиент давления между каждым
участком сосудистой системы и правым предсердием различ-
ный. Он равен примерно 100 мм рт.ст. в артериальном русле,
25 мм рт.ст. — в капиллярах и 15 мм рт.ст. — в начале венул.
Нулевой точкой для измерения давления в венах считают его
уровень в правом предсердии. Эта точка была названа “физио-
логическим нулем гидростатического давления”.
7. Может ли недостаточность вазомоторного тонуса и(или) ре-
гуляции распределения вызвать шок?
Первично возникшие нарушения сосудистого тонуса (вазопле-
гия) или распределения регионарного кровотока могут привес-
ти к шоку при нормальном или даже повышенном СВ. Такое
состояние характерно для сепсиса, анафилактического шока,
глубокого метаболического ацидоза. Оно может возникать при
спинномозговой анестезии. Существенное несоответствие ОЦК
и емкости кровеносного русла может наблюдаться при относи-
тельном (не связанном с потерей крови) дефиците внутрисосу-
дистого объема.
8. Как объяснить механизм первичного гиповолемического шока?
Первичный гиповолемический шок возникает в результате кро-
вотечения или патологических потерь ВнеКЖ. Последние име-
178
ют место при острых хирургических и нехирургических заболе-
ваниях органов брюшной полости, сопровождающихся рвотой,
поносом, депонированием жидкости в кишечнике и третьем
водном пространстве.
Гиповолемические состояния характерны для множественных
травм, обширных ожогов, гипопротеинемии. Гиповолемия
ведет к недостаточному венозному возврату и снижению СВ.
9. Какие факторы характеризуют недостаточность кровообраще-
ния и шок?
Недостаточность кровообращения и шок возникают при сни-
жении кровотока до уровня, неадекватного потребностям тка-
ней. Однако шок можно наблюдать и при повышенном СВ.
Очевидно, что недостаточность кровообращения, ведущую к
шоку, можно охарактеризовать как несоответствие кровотока
метаболическим потребностям тканей. Отдельно взятые расчет-
ные показатели доставки кислорода к тканям или потребность
в нем не могут быть абсолютными критериями шока. Основные
признаки недостаточности кровообращения и шока очевидно
должны определяться по дисфункции жизненно важных орга-
нов и систем.
10. Приведите основные патогенетические факторы отека легких.
Отек легких может быть вызван: 1) повышением легочного
капиллярного давления (сила “выталкивания” крови из сосу-
дов) и снижением онкотического давления крови (сила, удер-
живающая кровь в сосудах); 2) повышением проницаемости
альвеолярно-капиллярной мембраны; 3) недостаточностью
лимфатического дренажа. Каждый из приведенных факторов
может наблюдаться при различных заболеваниях и состояниях.
Повышение давления в легочных капиллярах характерно для
застойной сердечной недостаточности, снижение онкотическо-
го давления зависит от уровня белков плазмы, в основном от
уровня альбумина. Однако сама по себе гипоальбуминемия при
отсутствии других способствующих факторов не приводит к
отеку легких. Повышение проницаемости легочных капилляров
характерно для некардиогенного отека легких, наблюдаемого
при респираторном дистресс-синдроме. Нарушение лимфати-
ческого оттока может наблюдаться у онкологических больных
после обширных торакальных операций, при фиброзирующем
лимфангоите.
11. Как объяснить возникновение центрогенного отека легких?
Центрогенный (центральный, нейрогенный) отек легких может
возникать у больных с тяжелыми поражениями ЦНС — при
черепно-мозговой травме или эпилептическом статусе [Андроге
Г.Дж., Тобин М.Дж., 2003]. Патогенез центрогенного отека
легких включает следующие основные механизмы: 1) спазм
артериол и вен системного кровообращения, приводящий к
увеличению постнагрузки левого желудочка и сбросу части
крови из системного кровотока в легочный; 2) повышение
179
12“
гидростатического давления в легочных капиллярах и выход
жидкости в ткань легкого; 3) повышение проницаемости ка-
пилляров под влиянием спазма сосудов большого и малого
круга кровообращения.
Главные факторы — повышение гидростатического давления и
увеличение проницаемости легочных капилляров — связаны с
импульсами, исходящими из ЦНС.
12. В каких случаях следует применять лидокаин? Укажите дози-
ровку препарата.
Лидокаин — препарат выбора при рефрактерной ЖТ и ФЖ,
используется также для профилактики ФЖ после успешной
дефибрилляции. Относится к классу IB антиаритмических
средств. Механизмы действия: подавление внутрисердечной
проводимости и ускорение реполяризации. Это препарат корот-
кого действия, поэтому при отсутствии непрерывной инфузии
раствора лидокаина нужно повторять струйные введения его не
реже чем каждые 10 мин. При остановке кровообращения кли-
ренс лидокаина резко уменьшается, поэтому достаточно одно-
двукратной инъекции, чтобы поддержать его терапевтическую
концентрацию в крови. Применяют в виде 2 % раствора. Доза
для насыщающего внутривенного введения 1,5 мг/кг струйно
(обычно 75—100 мг). Одновременно начинают инфузию лидо-
каина в поддерживающей дозе 2 мг/кг. Общая доза 3 мг/кг.
Увеличение дозы и повторные болюсные введения препарата
за короткий промежуток времени могут привести к токсичес-
кому уровню при минимальной циркуляции, вызвать перифе-
рическую вазодилатацию и увеличить порог дефибрилляции.
13. В каких случаях показано применение временных кардиостиму-
ляторов?
Временные кардиостимуляторы показаны для: лечения АВ-бло-
кады второй и третьей степени после инфаркта миокарда; по-
давления устойчивых к лекарственным препаратам предсерд-
ных тахиаритмий; подавления трепетания — мерцания, вызван-
ного брадикардией; лечения слабости синусового узла;
контроля аритмий после операций на сердце.
14. Определите состояние пациента и укажите возможные причи-
ны, вызвавшие его: АДСист<80 мм рт.ст., спутанность сознания,
холодные кожные покровы, олигурия и метаболический ацидоз.
Данное состояние следует расценивать как шок, вызванный
циркуляторной недостаточностью. Причинами шока могут
быть: 1) недостаточность насосной функции сердца (аритмия,
острый инфаркт миокарда, острое поражение клапанного ап-
парата, массивная эмболия легочной артерии, тампонада серд-
ца, напряженный пневмоторакс); 2) гиповолемия (кровотече-
ние, потери ВнеКЖ, секвестрация жидкости в третьем водном
пространстве); 3) вазодилатация (сепсис, анафилаксия, острая
надпочечниковая недостаточность, передозировка лекарствен-
ных препаратов).
180
15. Определите план неотложных лечебно-диагностических меро-
приятий у этого пациента.
Несмотря на неясный диагноз лечебно-диагностические меро-
приятия на первом этапе должны проводиться одновременно:
а) срочная подача кислорода через трансназальный катетер или
маску; ЭКГ-мониторинг; взятие крови из лучевой артерии для
анализа; физикальное обследование; катетеризация вены, луч-
ше центральной; определение содержания глюкозы, гемоглоби-
на крови; измерение ЦВД; провести нагрузочную внутривен-
ную жидкостную пробу — ввести 200—300 мл коллоидного рас-
твора; повторно определить АД;
б) при физикальном обследовании пневмоторакс исключен, вен-
тиляция легких определена во всех отделах, раО2 60 мм рт.ст.,
раСО2 45 мм рт.ст., pH 7,15. На ЭКГ — синусовая тахикар-
дия. ЧСС 140 в минуту. ДД после нагрузочной пробы —
90 мм рт.ст. ЦВД 2 см Н2О;
в) предварительный диагноз “гиповолемический шок”. Следует
исключить возможность внутреннего кровотечения или значи-
тельных жидкостных потерь. Со слов лиц, доставивших боль-
ного, удалось установить, что пациент страдает язвенной болез-
нью желудка, но в последние годы не обследовался и не лечил-
ся. Через 20 мин после поступления больного в ОРИТ появи-
лась рвота с кровью. Через назогастральный зонд отмечено
поступление крови. Срочно определены группы крови и резус-
фактор;
г) диагноз “геморрагический шок”. Продолжено переливание
изотонического раствора натрия хлорида. Поскольку гемато-
крит снижен до 20 %, начато переливание эритроцитной массы
и плазмы. При гастроскопии диагноз кровоточащей язвы же-
лудка был подтвержден, удалось эндоскопическим путем про-
извести остановку кровотечения;
д) через 1 ч после поступления АД 100/70 мм рт.ст., ЦВД
6 см вод. ст., ЧСС 120 в минуту, пульс ритмичный, гематокрит
25 %, pH 7,18, раО2 80 мм рт.ст., раСО2 38 мм рт.ст., диурез
30 мл/ч (масса тела 70 кг). Продолжена инфузионная терапия,
с целью коррекции имеющегося метаболического ацидоза мед-
ленно в 2 приема введено 50 ммоль гидрокарбоната (50 мл
8,4 % раствора);
е) дополнительные исследования: мониторинг гемодинамики,
повторные исследования концентрации гемоглобина, определение
КОС и газов артериальной крови, рентгенография грудной клетки,
определение осмоляльности, мочевины, электролитов крови.
СПИСОК ЛИТЕРАТУРЫ
Болезни сердца и сосудов / Под ред. Е.И. Чазова. — М.: Медицина,
1992. - Т. 3. - 490 с.
Бунятян А.А., Шитиков И.И., Флеров Е.В. Некоторые аспекты по-
вышения безопасности во время анестезиологического пособия //
Клин. вест. — 1996. — № 2. — С. 25—28.
Гайтон А. Физиология кровообращения. Минутный объем сердца и
его регуляция: Пер. с англ. — М.: Медицина, 1969. — 472 с.
181
Дон X. Принятие решения в интенсивной терапии: Пер. с англ. — М.-_
Медицина, 1995. — 223 с.
Леви Дж.Х. Анафилактические реакции при анестезии и интенсивной
терапии: Пер. с англ. — М.: Медицина, 1990. — С. 96—105.
Малышев В.Д. Интенсивная терапия. Реанимация. Первая помощь. —
М.: Медицина, 2000. — 463 с.
Рябов ГА. Гипоксия критических состояний. — М.: Медицина, 1998. —
С. 462-463.
Спригинс Д., Чемберс Д., Джефри Э. Неотложная терапия: Пер. с англ. /
М.: ГЭОТАР, Медицина, 2000. — 333 с.
Fiddian-Green R.C. et al. Goals for the resuscitation of shock // Crit. Care
Med. - 1993. - Vol. 21. - P. 25-31.
Shoemaker ИКС. et al. Oxygen transport measurements to evaluate tissue
perfusion and titrate therapy: dobutamine and dopamine effects //
Ibid. - 1991. - Vol. 19. - P. 672-688.
Часть IV. ИНФУЗИОННО-ТРАНСФУЗИОННАЯ
ТЕРАПИЯ
Значение инфузионно-трансфузионной терапии (ИТТ) в
практике ОРИТ трудно переоценить. Это первая ступень в
лечении острой гиповолемии, шока, тяжелой травмы, крово-
течений, нарушений водно-электролитного и кислотно-основ-
ного баланса. При этом медикаментозное лечение является
второй терапевтической ступенью. Проводя ИТТ, врач всегда
должен иметь четкое представление о показаниях, способах
введения, дозах и отрицательных свойствах применяемых рас-
творов и препаратов крови.
ИТТ — это не что иное, как активное вторжение во внут-
реннюю среду организма, что может иметь как положитель-
ные, так и отрицательные результаты.
В настоящее время задачи ИТТ значительно расширились.
Это не только возмещение кровопотери и коррекция дефицита
жидкости, но и создание нового гемодинамического фона,
обеспечивающего адекватную гемодинамику и аэробный мета-
болизм в органах и тканях.
Цели современной ИТТ:
♦ восстановление и поддержание обмена и качественного
состава во всех водных разделах организма — сосудистом,
интерстициальном и клеточном (соблюдение принципа
дозированного и секторального возмещения);
♦ оптимизация параметров ЦГД — восстановление аде-
кватного венозного возврата, СВ и микроциркуляции;
♦ коррекция нарушений КОС и водно-электролитного ба-
ланса — осмолярности и онкотического давления;
♦ лечение острой кровопотери;
♦ обеспечение адекватного транспорта кислорода к орга-
нам и тканям (главное условие адекватной ИТТ).
Данная часть книги состоит из 4 глав, в которых приведены
сведения о кристаллоидных и коллоидных растворах, приме-
няемых в практике интенсивной терапии, методах трансфузи-
онной терапии и технике катетеризации центральных вен.
183
Глава 23
ПРИМЕНЕНИЕ КРИСТАЛЛОИДНЫХ
РАСТВОРОВ В ПРАКТИКЕ
ИНТЕНСИВНОЙ ТЕРАПИИ
Кристаллоидные растворы. К этой группе относятся инфу-
зионные растворы сахаров и электролитов. С помощью этих
растворов обеспечиваются физиологическая потребность в
воде и электролитах и коррекция нарушений водного, электро-
литного и кислотно-основного равновесия.
Растворы сахаров. К растворам сахаров относятся изотони-
ческие (5 %) и гипертонические (10 % и более) растворы глю-
козы и фруктозы. Эти растворы применяют главным образом
в двух целях: 1) для обеспечения организма свободной (без-
электролитной) водой в тех случаях, когда энтеральный путь
усвоения воды невозможен или недостаточен; 2) для обеспе-
чения энергетических потребностей при парентеральном пита-
нии.
Растворы глюкозы 5 % и 10 % используют как донаторы
воды. Концентрированные растворы глюкозы (20 %, 30 %, 40 %
и 50 %) применяют как донаторы энергии. Минимальная су-
точная потребность организма в воде, необходимая для под-
держания водно-электролитного баланса, 700 мл/м2, а макси-
мальная толерантность на каждый 1м2 — 2700 мл.
Растворы глюкозы 5 % — изотонический безэлектролитный
раствор, 1 л которого содержит 950 мл свободной воды и 50 г
глюкозы. Последняя метаболизируется с образованием Н2О и
СО2- 1 л раствора дает 170 ккал. Осмолярность 278 мосм/л,
несколько ниже нормальной осмолярности плазмы. Большая
часть внутривенно введенного раствора глюкозы быстро пере-
мещается из сосудистого русла в интерстиций и клетки, фак-
тически не увеличивая внутрисосудистый объем. Так, из 1 л
внутривенно введенного раствора глюкозы в сосудах остается
примерно 150 мл, 400 мл переходит в интерстициальный сек-
тор, а остальные 450 мл — в клетки. Быстрое усвоение глюкозы
сопровождается гипотоничностью внеклеточного пространст-
ва, что может вести к гипоосмоляльности плазмы.
Применяют как средство обеспечения организма свободной
водой, необходимой для метаболических процессов в клетках
и органах, а также при гипертонической дегидратации, обез-
воживания с дефицитом свободной воды. Переливание этого
раствора противопоказано при гипотонической дегидратации
и гипергидратации, гипергликемии, непереносимости глюко-
зы, отравлении метанолом.
Дозу определяют в зависимости от конкретной ситуации.
Скорость введения 4—8 мл/кг/ч. Существует опасность отрав-
ления водой!
184
Мозг — глюкозозависимый орган. Однако углеводы способ-
ствуют развитию ишемических повреждений в мозге. В случае
церебральной ишемии, например, при гипотензии или оста-
новке сердца, тяжелой черепно-мозговой травме, инфузия рас-
творов глюкозы будет стимулировать анаэробный гликолиз,
который ведет к образованию большого количества молочной
кислоты. Эксперименты, проведенные на животных, получав-
ших растворы глюкозы при сердечно-легочной реанимации,
доказали, что в таких случаях существенно увеличивается ле-
тальность [Lundi E.F., Kuhn J.E., Kwon J.M. et al., 1987].
Таким образом, может утверждать, что инфузии растворов
глюкозы при проведении реанимационных мероприятий не
показаны [Marino Р., 1998].
Растворение 50 г глюкозы в изотоническом растворе натрия
хлорида увеличивает осмолярность раствора до 586 мосм/л.
Если же в качестве растворителя применяют раствор Ринге-
ра с лактатом, то осмолярность раствора увеличивается до
527 мосм/л, т.е. осмолярность этих растворов по сравнению с
таковой плазмы крови увеличивается почти вдвое.
Раствор глюкозы 10 % — гипертонический безэлектролитный
раствор. Осмолярность раствора 555 мосм/л. Показания и про-
тивопоказания такие же, как для введения 5 % раствора глю-
козы. Скорость введения 2,5 мл/кг/ч в зависимости от пока-
заний. Существует опасность отравления водой!
Раствор фруктозы 5 %, как и растворы глюкозы, является
донатором воды и энергии. Показания к применению те же,
что и для растворов глюкозы. Обеспечивает замещение без-
электролитной воды при лихорадке, в процессе операции. 10 %
раствор фруктозы широко применяют в педиатрии. Противо-
показания, дозы и скорость введения те же, что и для растворов
глюкозы. Фруктоза не может заменить глюкозу для обеспече-
ния энергетических потребностей головного мозга.
Гипертонические растворы глюкозы применяют при гипогли-
кемии и при парентеральном питании. Основная опасность —
гипергликемия и гиперосмолярный синдром (см. часть II).
Растворы электролитов. Солевые натрийсодержащие рас-
творы используют главным образом для поддержания и вос-
становления объема ВнеКЖ, основными компонентами кото-
рой являются натрий и хлор. Следует особо подчеркнуть, что
эти растворы не способны значительно увеличивать внутрисо-
судистый объем, поскольку большая часть внутривенно вве-
денного раствора натрия хлорида быстро переходит в интерс-
тициальное пространство, а в сосудах остается примерно 20 %
раствора. Изотонические растворы натрия и хлора (тем более
гипертонические) фактически не содержат свободной воды, их
применение в качестве основного компонента инфузионной
терапии может привести к клеточной дегидратации, гиперхло-
ремии и дефициту свободной воды. Тем не менее солевые
185
растворы фактически незаменимы при проведении любых ре-
анимационных мероприятий и лечении тяжелобольных. Для
восполнения изотонического объема ВнеКЖ применяют элек-
тролитные, натрийсодержащие растворы, осмолярность и со-
став которых близки к этим показателям плазмы и ВнеКЖ.
Оптимальными для этой цели растворами являются изотони-
ческие и изоионные растворы со сбалансированным составом.
Однако опыт показывает, что использование в острых ситуа-
циях несбалансированных растворов (изотонический раствор
натрия хлорида, раствор Рингера) дает положительные резуль-
таты. В некоторых ситуациях применяют гипертонические и
гипотонические растворы натрия и хлора, а также растворы
калия, магния, кальция и фосфора.
Изотонический (0,9 %) раствор натрия хлорида был первым
раствором, применяемым для лечения кровопотери. 1 л рас-
твора содержит Na+ 154 ммоль; СГ — 154 ммоль. Общая ос-
молярность 308 мосм/л, что несколько выше осмолярности
плазмы, pH 5,5—7,0. Концентрация хлора в растворе также
выше, чем концентрация этого иона в плазме, поэтому эту
инфузионную среду нельзя считать абсолютно физиологичной.
Тем не менее это основной раствор, используемый в различных
случаях, в частности при острой гиповолемии.
Раствор натрия хлорида 0,9 % применяют при потерях
ВнеКЖ для быстрого восстановления ее объема и ионного
состава. При кровопотерях и гиповолемических состояниях обыч-
но комбинируется с коллоидными растворами. Показан при ги-
похлоремии с метаболическим алкалозом, при олигурии в связи
с гипотонической и изотонической дегидратацией. Раствор хоро-
шо совмещается со всеми кровезаменителями и кровью. Проти-
вопоказан при гипернатриемии и гиперхлоремии.
Общая доза препарата определяется конкретной ситуацией
(до 2—3 л и более в сутки). Вводят внутривенно со средней
скоростью 4—8 мл/кг массы тела в час.
Возможные осложнения: внутривенное введение большого
количества данного раствора может вызвать депонирование его
в третьем водном пространстве, сопровождаться отеком легких
и мозга, развитием гиперхлоремического ацидоза^
Гипотонический (0,45 %) раствор натрия хлорида содержит
приблизительно 50 % свободной воды. Применяют главным
образом с целью возмещения потерь воды и натрия, особенно
в тех случаях, когда введение растворов глюкозы противопо-
казано (гипергликемический синдром, сопровождающийся ги-
понатриемией). Введение гипотонических растворов требует
особой осторожности в связи с реальной угрозой отека голов-
ного мозга и синдрома демиелинизации (см. часть II).
Гипертонические растворы натрия хлорида. Раствор натрия
хлорида 3 % применяют обычно в целях коррекции глубокой
гипонатриемии при уровне Na+<120 ммоль/л. Снижение уров-
186
ня натрия плазмы ниже 120 ммоль/л обычно сопровождается
отеком мозга. Использование гипертонического солевого рас-
твора, так же, как и введение гипотонического раствора натрия
хлорида, требует особой осторожности в связи с угрозой деми-
елинизации ствола головного мозга. Внутривенное введение
раствора проводят под постоянным контролем уровня натрия
в плазме крови, который не должен возрастать более чем на
1—2 ммоль/ч. Менее выраженную гипонатриемию устраняют
путем медленной инфузии изотонического раствора натрия
хлорида.
Растворы натрия хлорида 7,2 % и 7,5 % путем дробного
болюсного введения по 50 мл с одновременным введением
раствора декстрана или крахмала применяют при лечении ги-
поволемического шока (см. ниже).
Раствор Рингера — изотонический электролитный раствор,
1 л которого содержит: Na+ — 140 ммоль, К+ — 4 ммоль,
Са2+ — 6 ммоль, С1~ 150 ммоль. Осмолярность 300 мосм/л.
В отличие от изотонического раствора натрия хлорида имеет в
своем составе калий и кальций. Этот раствор используют в
качестве кровезаменителя с конца XIX в. Раствор Рингера и
его модификации широко применяют и в настоящее время.
Обладает слабовыраженными кислотными свойствами.
Используют для замещения потерь ВнеКЖ, в том числе
крови, и как раствор-носитель электролитных концентратов.
Его не следует смешивать с фосфатсодержащими электролит-
ными концентратами и донорской кровью. Противопоказан
при гипернатриемии и гиперхлоремии.
Доза — до 3000 мл/сут в виде продолжительной внутривен-
ной инфузии при скорости введения 4—8 мл/кг/ч.
Раствор Рингера с лактатом имеет более физиологичный
состав, чем изотонический раствор натрия хлорида и раствор
Рингера. Он представляет собой сбалансированный комбини-
рованный препарат, содержащий, кроме натрия хлорида, рас-
творы солей калия и кальция. Но самое важное его отличие в
том, что в него в качестве буфера добавлен лактат, pH 6,7.
Осмолярность раствора 273 мосм/л. Препарат широко приме-
няется при лечении пострадавших с травмами различной этио-
логии.
“Лактасол ” отличается от раствора Рингера лактата только
тем, что в его состав включен магний. 1 л раствора содержит:
Na+ — 139,5 ммоль: К+ — 4 ммоль, Са2+ — 1,5 ммоль, Mg2+ —
1 ммоль, С1“ — 115 ммоль, НСО3~ — 3,5 ммоль, лактат —
30 ммоль. Осмолярность 294,5 мосм/л, pH 6,5.
Растворы Рингера с лактатом и лактосол способны компен-
сировать изотонические нарушения гидропонного равновесия.
Они показаны в целях замещения дефицита внеклеточного
объема при уравновешенном кислотно-основном балансе или
легком ацидозе. Анионы слабой молочной кислоты связывают
187
водородные ионы, затем молочная кислота метаболизируется,
сгорает или превращается в печени в глюкозу. При этом pH
крови умеренно возрастает.
При назначении растворов Рингера с лактатом или лакта-
сола следует иметь в виду некоторые особенности. Эти раство-
ры, имеющие в своем составе калий, не следует применять у
больных с почечной недостаточностью и гиперкалиемией.
Ионы кальция способствуют развитию феномена невосстанов-
ленного органного кровотока вследствие накопления их в глад-
ких мышцах сосудов во время вазоконстрикции (например,
при гиповолемическом шоке), поэтому применение указанных
растворов для лечения острой гиповолемии представляет оп-
ределенный риск.
С Са2+ полностью несовместимы этиловый спирт, тиопен-
тал-натрий, кислота аминокапроновая, цефамандол, амфоте-
рицин В. Частично или относительно несовместимы многие
антибиотики, норадреналина гидротартрат, маннитол, нитро-
глицерин и натрия нитропруссид. Поэтому нет оснований счи-
тать, что растворы Рингера с лактатом и лактасол имеют какие-
то особые преимущества перед изотоническим раствором натрия
хлорида. По мнению П. Марино, нет никаких достоверных
подтверждений, что имеющийся в растворе Рингера лактат
обеспечивает достаточную емкость буферной системы при шо-
ке. По-видимому, эти выводы можно отнести и к другим
растворам, имеющим состав электролитов и лактата, аналогич-
ный раствору Рингера с лактатом.
Раствор “Нормосоль” имеет вместо Са2+ в своем составе
магний. Обладает более выраженными буферными свойствами,
чем раствор Рингера с лактатом. pH 7,4, соответствует pH
плазмы. Его состав: Na+ — 140 ммоль/л, С1- — 98 ммоль/л,
К+ — 5 ммоль/л, Mg2+ — 1,5 ммоль/л, ацетат 27 ммоль/л, глю-
конат — 23 ммоль/л. Осмолярность 296 мосм/л. Этот раствор
нормализует pH среды. Ионы магния препятствуют кальцию
вызвать вазоконстрикцию. При назначении нормосоля следует
помнить о возможности его умеренного гипотонического эф-
фекта, присущего ионам магния.
Базисные растворы. К этой группе относятся растворы, при-
меняемые для базисной терапии, т.е. физиологического обес-
печения организма водой и электролитами.
Базисный раствор (“Фрезениус”) содержит электролиты, по-
вышенное количество калия, достаточное количество свобод-
ной воды. В 1 л раствора содержится: Na+ — 49,1 ммоль, К+ —
24,9 ммоль, Mg2+ — 2,5 ммоль, С1— — 49,1 ммоль, фосфат
9,9 ммоль, лактат — 20 ммоль, сорбит — 50,0 г. Калорийность
200 ккал/л. Осмолярность 423 мосм/л.
Широко используется для поддержания водно-электролитного
равновесия при стабильном состоянии больного. Обеспечивает
потребность организма в воде и электролитах. Противопоказан
188
при шоке, почечной недостаточности, избытке свободной
воды, непереносимости сорбита, отравлении метанолом.
Применяют в виде медленной капельной инфузии, средняя
доза — 1500 мл/м2 поверхности тела в сутки.
Полуэлектролитный раствор с глюкозой (“Фрезениус”) обес-
печивает введение воды и электролитов с малой дозой углево-
дов. Состав 1 л раствора: Na+ — 68,5 ммоль, К+ — 2 ммоль,
Са2+ — 0,62 ммоль, Mg2+ — 0,82 ммоль, С1_ — 73,4 ммоль,
глюкоза 55 г. Осмолярность 423 мосм/л.
Применяют в целях возмещения потерь воды и жидкости,
бедной электролитами. Можно использовать как раствор-но-
ситель для электролитов. Противопоказан при гипергликемии,
избытке воды, гипотонических нарушениях.
Доза: до 2 л в сутки путем медленного внутривенного вве-
дения (3 мл/кг/ч).
Электролитный инфузионный раствор (раствор Хартига)
обеспечивает потребность в воде и электролитах в тех случаях,
когда нет значительных нарушений водно-электролитного ба-
ланса. Состав 1 л раствора: Na+ — 45 ммоль, — 25 ммоль,
Mg2+ — 2,5 ммоль, С1_ — 45 ммоль, ацетат — 20 ммоль, фосфат
10 ммоль. Осмолярность 150 мосм/л.
Используют для возмещения безэлектролитных потерь и
легких нарушений баланса электролитов. Противопоказан при
гипотонической дегидратации и гипергидратации.
Доза: до 2 л в сутки путем медленной внутривенной инфу-
зии (3—4 мл/кг/ч).
Глава 24
ИСПОЛЬЗОВАНИЕ КОЛЛОИДНЫХ
РАСТВОРОВ В ПРАКТИКЕ
ИНТЕНСИВНОЙ ТЕРАПИИ
По сравнению с кристаллоидами коллоиды имеют большую
молекулу, а коллоидные растворы имеют большую молекуляр-
ную массу, препятствующую выходу раствора из сосудистого
русла. Если переход кристаллоидного раствора из сосудов в
интерстиций происходит почти немедленно после внутривен-
ного введения, то циркуляция коллоидных растворов в сосу-
дистом русле поддерживается в течение времени, зависящего
от свойств этих растворов. Оставаясь в сосудистом русле, кол-
лоидные растворы повышают КОД плазмы, что также сохра-
няет количество введенного раствора в сосудистом русле. Име-
ется прямая зависимость так называемого волемического ко-
эффициента и плазмоэкспандерного действия коллоидного
раствора в зависимости от его молекулярной массы и концент-
рации раствора.
189
Показания к применению коллоидных растворов. Коллоидные
растворы намного эффективнее кристаллоидных растворов при
лечении острой кровопотери, плазмопотери, острой гиповоле-
мии любой этиологии. Как правило, коллоидные растворы
используют одновременно с кристаллоидными растворами, со-
держащими натрий и хлор, для восстановления объема ВнеКЖ.
Классификация коллоидных растворов
Коллоидные растворы делятся на две основные группы: 1)
гетерогенные (т.е. “чужеродные”) и 2) аутогенные (вещества
человеческой природы).
К группе гетерогенных коллоидных растворов относятся
растворы крахмала, декстрана и желатина. В группу аутогенных
растворов входят растворы альбумина, протеина и плазма.
Гетерогенные коллоидные растворы. Растворы на основе
крахмала. Эти плазмозамещающие растворы созданы на осно-
ве оксиэтилированного крахмала путем частичного гидролиза
кукурузного крахмала. Препараты нетоксичны, не оказывают
отрицательного действия на коагуляцию крови и очень редко
могут вызывать аллергические реакции. Они имеют тесное
структурное сходство с гликогеном, что объясняет высокую
переносимость оксиэтилкрахмала организмом. Способны рас-
щепляться с освобождением незамещенной глюкозы. В отли-
чие от декстранов молекулярная масса оксиэтилкрахмала зна-
чительно выше, но после внутривенного введения она снижа-
ется примерно до 60 000. По гемодинамическому и противо-
шоковому действию растворы крахмала схожи с декстранами.
Коллоидное действие 6 % гидрооксиэтилового крахмала сходно
с таковым человеческого альбумина.
Плазмастерил. После инфузии 1 л плазмастерила (мол. мас-
са 450 000, степень замещения 0,7) повышение объема плазмы
продолжается более 6—8 ч. Инфузии растворов крахмала, в
частности плазмастерила, способствуют снижению перифери-
ческого системного и пульмонального сосудистого сопротив-
ления. В противоположность растворам декстрана и подобно
человеческому альбумину 6 % гидрооксиэтиловый крахмал
очень незначительно повышает среднее легочное давление,
обеспечивая при этом увеличение систолического объема серд-
ца. Вызывает легкое замедление свертывания крови в рам-
ках физиологических параметров и противодействует после-
операционной патологической гиперкоагуляции. Инфузии
плазмастерила активируют функции почек и стимулируют ди-
урез.
HAES-steril — 6 % и 10 % растворы имеют среднюю молеку-
лярную массу 240 000 и 200 000 соответственно, осмолярность
309 мосм/л. Объемозамещающая терапия с использованием
190
HAES-steril сопровождается значительным улучшением сис-
темной гемодинамики: повышается объем крови, что ведет к
увеличению венозного возврата. В связи с этим повышаются
среднее АД, ЦВД, ДЗЛК, УО и СИ. Возрастает величина КОД.
Уровень гематокрита снижается.
Назначение HAES-steril приводит также к снижению вяз-
кости крови, гиперкоагуляционных свойств плазмы, агрегаци-
онных свойств тромбоцитов. Все это сопровождается улучше-
нием микроциркуляции, перфузии органов и тканей, условий
транспорта кислорода.
Волювен (ГЭК 130/0,4) — раствор гидроксиэтилового крах-
мала со средней молекулярной массой 130 000 Д, степенью
замещения — в среднем 0,4. Это усовершенствованный пре-
парат с улучшенным профилем безопасности, длительной цир-
куляцией в сосудистом русле и минимальным влиянием на
гемостаз (на уровни VIII фактора гемостаза и фактора Вилле-
бранда). Содержит значительно меньше крупных молекул, на-
капливаемых в плазме, и мелких, которые эквестрируются поч-
ками, не поддерживая объемного эффекта.
Назначают препарат при острой гиповолемии, гиповолеми-
ческом шоке, кровопотере, травме, потерях жидкости, ожогах,
сепсисе, интраоперационных потерях; может быть использован
для нормоволемической гемодилюции и профилактики гипо-
волемии.
Волювен можно вводить многократно в течение нескольких
дней в зависимости от потребностей больного. Следует избе-
гать смешивания с другими препаратами и чрезмерной пере-
грузки организма жидкостью.
Осмолярность растворов гидрооксиэтилированного крах-
мала (ГЭК) незначительно превышает осмолярность плазмы и
составляет в среднем 300—309 мосм/л, а значения КОД для
6 % и 10 % растворов крахмала равны соответственно 36 и
68 мм рт.ст., что в целом подтверждает высокую эффектив-
ность растворов ГЭК для возмещения дефицита ОЦК
(табл. 24.1).
Таблица 24.1. Сравнительный состав и характеристика 1 л раствора
плазмастерила и 6 % раствора HAES-steril
Состав и характеристика Плазмастерил HAES-steril, 6 % раствор Волювен
Гидрооксиэтилкрахмал Натрия хлорид Степень замещения Средняя молекулярная масса Осмолярность 60,0 г 9,0 г 0,70-0,80 450 000 309 мосм/л 60,0 г 9,0 г 0,40-0,55 200 000 309 мосм/л 60,0 г 9,0 г 0,38-4,50 130 000 308 мосм/л
191
Показания к применению растворов ГЭК: терапия и про-
филактика дефицита объема (гиповолемия) и шок (геморраги-
ческий, травматический, септический, ожоговый).
Противопоказания: тяжелые заболевания крови, застойная
сердечная недостаточность, нарушения свертывания крови. Мо-
жет вызвать анафилактоидные реакции. Частота серьезных ре-
акций при назначении ГЭК составляет 0,006 %.
Дозы: до 20 мл/кг массы тела в сутки; 1500 мл/75 кг массы
тела, в среднем 500—1000 мл/сут.
Дальнейшее повышение эффективности гемодинамического
действия растворов крахмала связывают с разработкой ком-
плексного препарата на основе ГЭК и гипертонического рас-
твора (7,5 %) натрия хлорида.
Растворы на основе декстрана. Декстран вырабатывается
микробами на сахарсодержащих средах и является водораство-
римым высокомолекулярным полимером глюкозы. В 1943 г.
путем гидролиза нативного декстрана была получена фракция
“макродекс”, водные растворы которой по свойствам были
близки плазме крови. Декстран быстро распространился по
всему миру и уже в 1953 г. в СССР был получен раствор
декстрана, названный полиглюкином.
Полиглюкин — 6 % раствор декстрана со средней молекуляр-
ной массой 60 000. В его состав входят: декстран среднемоле-
кулярный — 6 г, натрия хлорид — 9 г, этиловый спирт (0,3 %),
вода для инъекций (до 1000 мл). Относительная вязкость 2,8—
4; КОД 58 мм рт.ст.; pH 4,5—6,5; осмолярность 308 мосм/л.
Зарубежные аналоги — макродекс, интрадекс, инфукол и др. —
имеют среднюю молекулярную массу от 60 000 до 85 000.
Большая молекулярная масса и высокое КОД обеспечивают
удержание его в сосудах и увеличение ОЦП. Молекулы поли-
глюкина длительно удерживаются в сосудистом русле и оказы-
вают выраженное гемодинамическое действие. При шоке сред-
немолекулярные декстраны оказывают положительное влияние
на кровообращение в течение 5—7 ч. Низкомолекулярная
фракция полиглюкина оказывает положительное действие на
реологические свойства крови и улучшает микроциркуляцию.
После инфузии полиглюкин начинает покидать сосудистое рус-
ло. Основная же его масса выделяется с мочой в неизмененном
виде в течение первых суток.
Полиглюкин показан во всех случаях острой гиповолемии
(кровопотеря, плазмопотеря, гиповолемический шок).
Разовая доза от 400 до 1000 мл. Доза и скорость введения
зависят от конкретной ситуации. Максимальная доза декстра-
нов 60—85 1,5—2 г/кг в сутки. Превышение этой дозы может
сопровождаться кровоточивостью. Несмотря на то что раство-
ры полиглюкина нетоксичны и апирогенны, их введение может
сопровождаться аллергическими и анафилактическими реак-
циями. Для их предотвращения следует проводить такую же
192
биологическую пробу, как и при введении цельной крови.
Однако важнейшим условием профилактики является улучше-
ние технологии производства декстранов — создание декстра-
нов с узконаправленным действием, не содержащих высоко-
молекулярных фракций.
К этой же группе препаратов относятся полифер, рондекс,
полиглюсолъ.
Реополиглюкин — 10 % коллоидный раствор декстрана со
средней молекулярной массой 35 000. В его состав входят
декстран низкомолекулярный (100 г), натрия хлорид (9 г),
глюкоза (60 г), вода для инъекций до 1000 мл. Относительная
вязкость 4,0—5,5; pH 4,0—6,5. Осмолярность препарата на
0,9 % растворе натрия хлорида 308 и 667 мосм/л, если препарат
на 0,9 % растворе натрия хлорида с глюкозой.
Декстраны с молекулярной массой 40 000 и меньше отно-
сятся к группе низкомолекулярных декстранов. Повышая
ОЦП, они обеспечивают наибольший, но кратковременный
эффект. Благодаря высокой концентрации низкомолекулярные
декстраны (реомакродекс и др.) обладают быстрым и мощным
экспандерным действием. Сила связывания воды превышает
физиологическую силу связывания с белками крови, что при-
водит к перемещению жидкости из интерстициального сектора
в сосудистый (1г декстрана 40 связывает 20—25 мл воды).
Увеличение объема плазмы при применении декстрана 40 наи-
более выражено в первые 90 мин после введения. Через 6 ч
после инфузии содержание реополиглюкина в крови уменьша-
ется примерно в 2 раза, в первые сутки с мочой выводится до
80 % препарата. Реополиглюкин оказывает дезагрегационное
действие на тромбоциты. Он образует молекулярный слой на
поверхности форменных элементов крови, клеточных мембра-
нах и эндотелии сосудов, что уменьшает опасность внутрисо-
судистого свертывания крови и развития ДВС-синдрома. От-
рицательной стороной этого действия является возможность
кровотечения. Опасность такого осложнения возрастает при
назначении больших доз как низко-, так и среднемолекуляр-
ных декстранов.
Показания к применению: состояния, сопровождающиеся
гиповолемией и микроциркуляторными нарушениями (различ-
ные виды шока), тромбоэмболические процессы, шоковое лег-
кое, перитонит, панкреатит и др.
Противопоказания: низкомолекулярные декстраны не сле-
дует применять при неостановленном кровотечении, угрозе
кровотечения (кровоточащая язва ЖКТ), геморрагических диа-
тезах, тяжелых заболеваниях печени и почек, застойной сер-
дечной недостаточности. Применение декстранов в качестве
основного метода лечения дегидратации без назначения крис-
таллоидных растворов может приводить к образованию “вяз-
193
13-1069
ких” коллоидов и нарушать пассаж канальциевой мочи вплоть
до развития анурии (“декстрановая почка”).
Дозировка и скорость введения: безопасная доза любого
низкомолекулярного декстрана — до 500, максимум 800 мл/сут.
Предпочтительнее дробное введение препарата. Большую до-
зу следует вводить под контролем функции почек. При уве-
личении дозы до 1 л/сут возможно усиление кровоточивости.
Растворы на основе желатина. Желатин — высокомолеку-
лярное водорастворимое вещество животного происхождения,
не являющееся полноценным белком. В отличие от других
белков он не обладает специфичностью и поэтому применяется
как кровезаменитель.
Желатиноль — 8 % раствор частично гидролизованного пи-
щевого желатина с добавлением солей. Содержит пептиды
средней молекулярной массы. Средняя молекулярная масса
20 000. Относительная вязкость 2,4—3,5; pH 6,7—7,2.
Механизм действия желатиноля обусловлен его коллоидны-
ми свойствами. КОД растворов желатиноля позволяет им удер-
живать воду в сосудах и способствовать нормализации ОЦК.
Тем не менее сила связывания воды у растворов желатиноля
меньше, чем у декстранов, экспандерное действие не характер-
но. Активное действие продолжается несколько часов. Через
24 ч в крови остаются лишь следы желатиноля. Растворы
желатиноля по сравнению с растворами декстрана и крахмала
обладают меньшей объемозамещающей способностью, волеми-
ческий коэффициент 0,5. Они быстрее распределяются во вне-
клеточном пространстве, благодаря чему менее опасны в смыс-
ле возможности перегрузки сердца. При введении желатиноля
возникает эффект гемодилюции без нарушения свертывания
крови. Частично расщепленный желатин выводится почти весь
через почки. Развивается полиурия с относительно низкой
плотностью мочи и ускоряется выведение токсичных метабо-
литов. Непременное условие для реализации этого дезинток-
сикационного действия — достаточная выделительная функция
почек.
Другие растворы на основе желатина: гелофузин, плазма-
гель, геможель, неоплазмажель, модифицированная жидкая
желатина (МЖЖ) и др.
Показания к применению: введение желатиноля показано
при гиповолемии, травматическом и ожоговом шоках. Исполь-
зуется как средство “второго ряда” для восстановления гемо-
динамики при тяжелых кровопотерях, а также для заполнения
аппарата искусственного кровообращения. В отличие от пре-
паратов “первого ряда” растворов крахмала и декстрана жела-
тиноль обладает менее выраженным противошоковым дейст-
вием.
Противопоказан при острых заболеваниях почек и жировой
194
АДср.
мм рт. ст.
Гипертонический
солевой раствор
Т" I... ..I------
О 60 120
Время, мин
Рис. 24.1. Изменения САД при внутривенном введении гипертони-
ческого солевого раствора.
эмболии. Частота анафилактических реакций при назначении
желатиновых растворов — 0,038 %.
Дозировка и скорость введения: вводят капельно или струй-
но в зависимости от показаний, однократно или повторно в
дозе до 2 л/сут.
Методы малообъемных инфузий. Переливание кристаллоид-
ных и коллоидных растворов с целью лечения кровопотери и
любой формы гиповолемии основано на концепции “высоко-
объемных инфузий”, обычно значительно превышающих фак-
тический объем крово- и плазмопотери. Этот необходимый для
компенсации объем не может быть перелит без риска развития
отека тканей и депонирования в третьем водном пространстве.
В последнее время стала широко использоваться методика
“малообъемных инфузий” солевыми гипертоническими рас-
творами. Как в эксперименте, так и в клинике была доказана
способность гипертонического 7,5 % раствора натрия хлорида
повышать системное АД, СВ, улучшать микроциркуляцию и
выживаемость (рис. 24.1). Новизна предлагаемой концепции
состоит в действии на микроциркуляцию, в получении не-
медленного улучшения центральной гемодинамики при объе-
ме первичной инфузии всего 4 мл/кг массы тела у больных
с гиповолемией и шоком. Внутривенная инфузия небольшо-
го объема 7,5 % раствора натрия хлорида приводит к недол-
говременному, но существенному повышению осмолярности
плазмы (7,5 % раствор натрия хлорида имеет осмолярность
2400 мосм/л).
Одновременно применяют гетерогенные коллоидные рас-
творы (обычно декстраны 60 или 70), которые повышают он-
котическое давление плазмы и тем самым оказывают гемоди-
намическое действие. Одновременное применение гипертони-
ческого раствора натрия хлорида и коллоидов проявляется в
195
13"
сочетанном эффекте, связанном с повышением осмолярности
и онкотического давления плазмы. При этом удержание воз-
мещенного внутрисосудистого объема происходит в течение
длительного времени за счет мобилизации эндогенной внесо-
судистой жидкости вследствие создаваемого осмотического
градиента через мембраны клеток и стенки сосудов. М.С. Maz-
zani и соавт. (1990) продемонстрировали, что смесь 7,5 % на-
трия хлорида и 6 % раствора декстрана 70, введенная внутри-
венно в течение 10 с в количестве '/7 кровопотери 20 % ОЦК,
восстанавливает последний в течение 1 мин. В других клини-
ческих работах показано, что солевым гипертоническим рас-
творам присуще свойство уменьшать отек эндотелиальных кле-
ток капилляров, возникающий вследствие предшествующей ише-
мии [Nolte D. et al., 1992]. Экстренная инфузия малых объемов
гипертонических солевых растворов повышает СВ и восстанав-
ливает микроциркуляцию за счет высвобождения сосудорасши-
ряющих субстанций эйкозаноидной природы. За счет гиперпер-
фузии кишечника [Marticabrera М., Ortiz J.L., 1991] уменьша-
ется также бактериальная транслокация из кишечника.
Методика малообъемной инфузии гипертоническо-гиперон-
котического раствора при тяжелой гиповолемии:
♦ общий объем 7,5 % раствора натрия хлорида составляет
4—6 мл/кг массы тела;
♦ вводят раствор дробно болюсно по 50 мл с небольшими
перерывами (10—20 мин);
♦ введение раствора комбинируют с 6 % раствором дек-
страна 60 или 70 (лучше иметь готовую смесь гиперто-
нического раствора с декстраном);
♦ введение раствора прекращают при стабильных показа-
телях АД, гемодинамики.
Основные эффекты сочетанного применения 7,5% раствора
натрия хлорида с коллоидными растворами:
♦ быстрое повышение АД и СВ;
♦ увеличение преднагрузки и снижение ОПСС;
♦ повышение эффективной тканевой перфузии;
♦ снижение риска отсроченной полиорганной недостаточ-
ности.
Возможные осложнения: 1) быстрое введение 7,5 % раствора
натрия хлорида свыше указанных доз может оказывать отри-
цательное инотропное действие, возможно, в связи с наруше-
нием калиево-натриевого баланса в миокарде [Краймейер У.,
1997]; 2) гиперосмолярное состояние; 3) возможность усиления
кровопотери в случае неостановленного кровотечения.
С этой же целью может быть использован новый гиперто-
нический изоонкотический раствор ГиперХаес (HyperHaes),
производимый фирмой “Фрезениус Каби”. Он представляет
196
собой гипертонический 7,2 % раствор хлорида натрия и 6 %
изоонкотический раствор гидроксиэтилкрахмала (ГЭК). 1000 мл
раствора ГиперХаес содержат 60 г поли(1—2-гидроксиэтил)
крахмала, 1232 ммоль/л Na+, 1232 ммоль/л С1“, осмолярность
2464 мосм/л, pH 3,5—6,0, титруемая кислотность 1 ммоль
NaOH/л. Выпускается препарат в мешке (Фрифлекс) по 250 мл,
обладает выраженным объемозамещающим действием, но не
является плазмо- или кровезамещающим раствором. Благодаря
высокой осмолярности жидкость ГиперХаес (в основном из
межклеточного пространства) быстро перемещается в крове-
носные сосуды, что ведет к быстрому увеличению АД, СВ и
других показателей гемодинамики до нормальных значений.
Однако увеличение внутрисосудистого объема длится короткое
время и требует дополнительного введения достаточного объе-
ма жидкости (в том числе солевых и коллоидных растворов).
Применение раствора противопоказано при застойной сердеч-
ной недостаточности, выраженных печеночной и почечной
недостаточности, гиперосмолярности крови, гипернатриемии
и гиперхлоремии, обезвоживании, повышенной чувствитель-
ности к ГЭК. Могут наблюдаться анафилактоидные реакции,
реакции со стороны дыхательной (бронхоспазм) и сердечно-
сосудистой системы. При использовании этого раствора сле-
дует контролировать осмолярность крови.
Аутогенные коллоидные растворы. Альбумин представляет со-
бой фракционированный препарат плазмы человека. В Россий-
ской Федерации выпускается в виде 5%, 10 % и 20 % растворов
во флаконах.
Альбумин крови — основной мелкодисперсный белок. Как
известно, из белков в наибольшем количестве в крови содер-
жатся альбумины, которые определяют КОД плазмы. Молеку-
лярная масса препарата 68 000—70 000. От концентрации аль-
бумина в плазме зависят ее КОД и удержание жидкости в
сосудистом русле. По своему осмотическому давлению 1 г
альбумина равноценен 18 мл жидкой плазмы, 25 г эквивалент-
но 500 мл плазмы.
Альбумин участвует в обмене между кровью и тканями,
является резервом белкового питания и универсальным сред-
ством транспорта ферментов, гормонов, ионов, токсинов и
лекарственных средств. Он играет основную роль в поддержа-
нии КОД плазмы, поэтому особенно необходим при снижении
объема плазмы, вызванном гипоальбуминемией; 5 % раствор
альбумина имеет такое же онкотическое давление, как и плаз-
ма. Чем выше концентрация раствора, тем больше его объемо-
замещающее действие. В качестве растворителя используют
изотонический раствор натрия хлорида. Высококонцентриро-
ванные растворы альбумина (20 % и 25 %) дают очень слабую
солевую нагрузку, так как их используют в малых объемах (от
50 до 100 мл).
197
КОД раствора альбумина в зависимости от его концентрации:
• 5 % раствора альбумина — порядка 20 мм рт.ст.;
• 10 % раствора альбумина — порядка 40 мм рт.ст.;
• 20 % раствора альбумина — 60 мм рт.ст.
Внутривенное введение 5 % раствора альбумина ведет к
незначительному увеличению внутрисосудистого объема пример-
но соответствующему объему введенного раствора. Внутривенная
инфузия всего 100 мл 20 % раствора альбумина позволит увели-
чить ОЦК более чем на 400 мл. При дегидратации введение
10 % и 20 % растворов альбумина необходимо сочетать с введе-
нием 2—3-кратных объемов кристаллоидных растворов. Пре-
парат не может быть контаминирован вирусом гепатита.
Показания к назначению растворов альбумина: состояния
(шок, гиповолемия, ожоги, сепсис), сопровождающиеся сни-
жением объема плазмы, гипоальбуминемией.
Противопоказания: тромбозы, продолжающееся внутреннее
кровотечение, аллергические реакции.
Скорость введения растворов альбумина должна быть мед-
ленной (после проведения биологической пробы). При умерен-
ной гипоальбуминемии общая суточная доза составляет 200—
300 мл 5 или 10 % раствора. При более значительных потерях
белка и гиповолемии доза может быть увеличена до 400, 600 мл
и более. 20 % раствор альбумина (50 или 100 мл) вводят внут-
ривенно путем медленной капельной инфузии, скорость кото-
рой не должна превышать 40—60 капель/мин.
Протеин — это пастеризованный 4,3—4,8 % раствор белков
плазмы, в состав которого входят альбумины (75—80 %), гло-
булины (20—25 %) с добавлением альбумината трехвалентного
железа и эритропоэтических веществ. По своим свойствам
протеин занимает промежуточное положение между плазмой и
альбумином. Инфузии протеина могут сопровождаться аллер-
гическими реакциями, поэтому следует проводить биологичес-
кую пробу и соблюдать медленный темп инфузий.
Другие аутогенные коллоидные растворы — см. следующую
главу.
Плазма — жидкая часть крови, выполняющая в организме
транспорт питательных и жизненно важных веществ к тканям
и органам и выведение продуктов обмена. Плазма содержит
факторы свертывания, необходимые для процессов коагуляции
и участвует в защитных, в частности иммунных реакциях.
Содержит 90 % воды, 7—8 % белка, 1,1 % небелковых органи-
ческих веществ и 0,9 % неорганических веществ.
Нативная плазма содержит не менее 6 г общего белка на
100 мл. Несмотря на все показания, применение нативной
плазмы сдерживается малым сроком ее хранения (до суток),
возможностью инфицирования вирусами гепатита В и СПИДа.
Свежезамороженная плазма (см. главу 25).
198
Глава 25
КЛИНИЧЕСКИЕ АСПЕКТЫ
ТРАНСФУЗИОННОЙ ТЕРАПИИ
В последние десятилетия кардинально изменились показа-
ния к гемотрансфузиям. Если раньше кровь нередко исполь-
зовали как основной и иногда единственный источник возме-
щения кровопотери, то в настоящее время для восстановления
ОЦК применяют коллоидные и кристаллоидные растворы, а
кровь назначают в зависимости от степени анемии и наруше-
ния транспорта кислорода. Оказалось, что снижение гемато-
крита до 30 % и гемоглобина до 100 г/л, способствует улучше-
нию микроциркуляции и доставки кислорода к тканям. Вместе
с тем эти показатели не должны быть догмой, поскольку мно-
гие пациенты хорошо переносят снижение гемоглобина крови
ниже 100 г/л. Кроме того, гемотрансфузии могут сопровож-
даться иммунодепрессивными состояниями, требующими бо-
лее осмысленного подхода к назначению тех или иных компо-
нентов крови.
Существует несколько неоспоримых показаний для перели-
вания крови и ее компонентов: 1) обеспечение адекватной кис-
лородтранспортной функции крови, нарушенной в результате
анемии; 2) восполнение ОЦК; 3) восполнение ОЦП; 4) вос-
полнение дефицита факторов свертывания крови и тромбо-
цитов.
Для определения зависимости изменений гемодинамики от
кровопотери удобно пользоваться 4-степенной классификаци-
ей (американская коллегия хирургов, табл. 25.1).
Таблица 25.1. Степени кровопотери
Степень Потеря ОЦК, %
I 15 и менее
II 20-25
III 30-40
IV Более 40
Потеря 15 % ОЦК. Клинические признаки кровопотери мо-
гут отсутствовать. У больного, находящегося в горизонтальном
положении, нет симптомов кровопотери. Единственным при-
знаком может быть увеличение частоты пульса не менее чем
на 20 в минуту, возникающее при вставании с постели.
Потеря от 20 до 25 % ОЦК. Основной симптом — орто-
статическая гипотензия — снижение АДСИСТ не менее чем на
15 мм рт.ст. В положении лежа АД обычйо сохранено, но
может быть несколько снижено. Это состояние при продолжа-
199
ющемся кровотечении может быстро перейти в следующую
фазу. АДСИСТ обычно в пределах 100 мм рт.ст., частота пульса
100—110 в минуту, индекс шока (ЧСС/АДсист ) примерно ра-
вен 1.
Потеря от 30 до 40 % ОЦК. Клиническая картина соответ-
ствует шоку: холодные кожные покровы, симптом “бледного
пятна”, частота пульса более 100 в минуту, АДСИСТ в положении
лежа ниже 100 мм рт.ст. Индекс шока>1.
Потеря более 40 % ОЦК. Клиническая картина тяжелого
шока: резкая бледность, мраморность кожи, холодные кожные
покровы, нарушение сознания, отсутствие пульса на перифе-
рических артериях, падение АД, СВ, анурия, метаболический
ацидоз. Индекс шока>1,5.
|| Потеря более 40 % ОЦК потенциально опасна для жизни!
Лечение. Главнейшее звено, которое должно восстанавли-
ваться при гиповолемическом шоке в первую очередь, —
транспорт кислорода. Нарушения транспорта кислорода при
гиповолемическом шоке (ГШ) зависят от:
♦ недостаточного венозного притока к сердцу, связанного
с ним низкого СВ и гиподинамического состояния кро-
вообращения;
♦ низкого содержания кислорода в артериальной крови в
связи с потерей гемоглобина;
♦ важную роль играет дефицит интерстициальной жидкос-
ти, нарушающий транскапиллярный обмен жидкости и
кислорода.
Программа интенсивного лечения ГШ:
♦ быстрое восстановление внутрисосудистого объема;
♦ улучшение функции сердечно-сосудистой системы;
♦ восстановление объема циркулирующих эритроцитов;
♦ коррекция нарушенных систем гемостаза.
Для быстрого восстановления внутрисосудистого объема
применяют гетерогенные коллоидные растворы: декстран и
крахмал, обладающие выраженным гемодинамическим проти-
вошоковым действием. Коллоидные растворы значительно бы-
стрее, чем кристаллоидные, восстанавливают ОЦП и таким
образом обеспечивают достаточный приток крови к сердцу.
Доказано, что СВ повышается быстрее в тех случаях, когда
первично проводят инфузию коллоидных растворов, обладаю-
щих объемозамещающим и реологическим действием (рис.
25.1). По сравнению с цельной кровью и эритроцитной массой
эти препараты имеют несомненное преимущество [Marino Р.,
1998].
При умеренно сниженной концентрации гемоглобина крови
возросший СВ может обеспечить адекватную доставку кисло-
200
Рис. 25.1. Изменения
ОЦК при внутривенной
инфузии коллоидных и
кристаллоидных раство-
ров.
Прирост индекса ОЦК, мл/м2
200 600 1000
I-----1------1-----1-----1-----1
объем
инфузионной
среды, мл
—►1000
Раствор Рингера с лактатом
рода к тканям. При
первичном возмеще-
нии коллоидные рас-
творы комбинируют с
электролитными рас-
творами, содержащи-
ми Na+ и С1“. Элект-
ролитные растворы,
среди которых наи-
более распространен 0,9 % раствор натрия хлорида, необходи-
мы для коррекции интерстициального объема. Скорость инфу-
зии плазмозамещающих и электролитных растворов определя-
ется состоянием больного. При тяжелом шоке показано струй-
ное введение растворов.
Несмотря на все имеющиеся ограничения к гемотрансфу-
зии, показанием к переливанию крови является значительное
уменьшение гемоглобина, снижающее доставку и потребление
кислорода тканями. Полагаем, что старое правило: чем больше
кровопотеря, тем больше показаний к гемотрансфузии, пока
еще остается в силе. Даже здоровые люди редко могут выдер-
жать острую, но умеренную кровопотерю 1—1,5 л без перели-
вания. Что же касается более значительной кровопотери —
более 30 % ОЦК, то это является абсолютным показанием к
переливанию цельной крови или эритроцитной массы.
Возможные причины фатальной кровопотери
Плановая хирургическая операция, особенно если она об-
ширна по своему объему и сопровождается кровопотерей, всег-
да требует тщательной предоперационной подготовки. В пер-
вую очередь эта подготовка должна предусмотреть восстанов-
ление уровня гемоглобина при его снижении. Так, при
концентрации гемоглобина выше 100 г/л и имеющейся в запасе
крови или ее компонентов риск вмешательства относительно
невелик. Если же предстоит обширная плановая операция у
пациента с исходно низким гемоглобином (менее 80 г/л), риск
операции чрезвычайно высок и вряд ли он оправдан. Гемоди-
люционный эффект во время операции может еще более сни-
зить концентрацию гемоглобина, и если у пациента исходно
был низкий уровень общего белка и альбумина, то все это
201
может вести к выходу жидкой части крови в экстравазальные
пространства и приводить к шоку.
Кровотечение в послеоперационном периоде может быть
связано с неполным гемостазом во время операции. Источник
кровотечения и общий объем кровопотери у пострадавших с
множественной травмой нередко трудно определить. В ОИТ
наиболее частые источники видимой потери крови — верхний
и нижний отделы ЖКТ (язвенная болезнь, эрозивный гастрит
и эзофагит, варикозное расширение вен, синдром Маллори-
Вейсса, стрессовые язвы, опухоли и др.). Острый панкреатит
часто осложняется массивным кровотечением в ЖКТ, брюш-
ную полость или забрюшинное пространство. Независимо от
источника кровотечения идентифицировано несколько факто-
ров, предопределяющих плохой прогноз: большой объем кро-
вопотери, кровотечение из невыясненного очага, преклонный
возраст или полиорганная недостаточность.
Во всех случаях при нестабильном состоянии больного по-
иск источника кровотечения должен сопровождаться одновре-
менным введением компонентов крови. Если лабораторные
данные подтверждают наличие кровотечения (быстрое сниже-
ние гематокрита), следует подозревать легочное кровотечение,
кровоизлияние в забрюшинное пространство или гемолиз. Во
всех случаях необходимо провести определение факторов свер-
тывания и количества тромбоцитов. Забрюшинное кровотече-
ние может быть спонтанным при тромбоцитопении или дефи-
ците факторов свертывания. Легочное кровотечение из альвеол
чаще всего бывает у больных с тромбоцитопенией или нару-
шенным иммунитетом. Операции на сосудах, установка фильт-
ров в нижней полой вене, ангиография, проводимые на фоне
антикоагулянтной терапии, могут осложниться значительным
кровотечением. Пункция бедренных сосудов, артерий и вен
может быть причиной незамеченной кровопотери, поскольку
в мягких тканях бедра иногда скрывается большое количество
крови. Гемолиз может возникать спонтанно, но чаще всего он
обусловлен применением лекарственных средств или трансфу-
зионной терапии.
Острая тромбоцитопения, развивающаяся в течение корот-
кого периода (менее суток), обычно указывает на ДВС-син-
дром, когда потребление тромбоцитов значительно опережает
их выработку. Значительное падение числа циркулирующих
тромбоцитов может быть связано с применением гепарина,
пенициллина и других лекарственных средств. Развитие коагу-
лопатии и ДВС-синдрома нередко обусловлено системной вос-
палительной реакцией (например, при сепсисе). Массивные
трансфузии сопровождаются разбавлением факторов свертыва-
ния и могут приводить к острой коагулопатии.
202
Методы ограничения трансфузий донорской крови
Известно много отрицательных сторон, связанных с транс-
фузией донорской крови. Прежде всего это риск иммунизации
передачи вирусных инфекций, длительное иммуносупрессив-
ное состояние. Чтобы ограничить объем трансфузий донорской
крови, необходимо строго соблюдать правила, способствующие
сохранению крови больного.
Использование донорской крови можно уменьшить за счет
предоперационной заготовки аутокрови. В течение 4 нед у
больного может быть забрано до 600—1000 мл крови, которую
впоследствии используют во время операции. Но этот метод
недостаточно изучен с позиций иммунной системы.
С помощью аппаратов “cell savers” у получивших травму и
больных во время операций, сопровождающихся значитель-
ной кровопотерей, можно реинфузировать до 75 % теряемой
крови.
Уменьшить объем интраоперационной гемотрансфузии или
отказаться от ее применения можно, используя методы нормо-
волемической или гиперволемической гемодилюции.
Кровопотеря менее 20 % ОЦК должна возмещаться с помо-
щью коллоидных и кристаллоидных растворов. Заборы крови
для анализов из центральных вен и артерий должны прово-
диться только по строгим показаниям. Всегда следует широко
использовать методы неинвазивного мониторинга (пульсокси-
метрия, капнография и др.).
Компоненты крови
Цельная кровь. Трансфузиологическая концепция, принятая
в России, практически исключает использование цельной до-
норской крови для трансфузий. Тем не менее в западных
странах ее применяют и рассматривают как замещающую среду
при сильных кровотечениях. Обычно цельную кровь разделяют
на компоненты в течение нескольких часов после взятия. Боль-
шинству больных, нуждающихся в трансфузии, не требуются
все компоненты, имеющиеся в свежей цельной крови.
Составляющая цельной крови (по Дж. Марини): эритроциты,
концентраты фактора VIII свертываемости, тромбоциты, кон-
центрат фактора IX свертываемости, свежезамороженная плаз-
ма, криопреципитат, белковая фракция плазмы, альбумин,
лейкоциты, иммуноглобулин, антитромбин III.
“Единица” крови (500 мл) содержит 450 мл цельной крови,
в которую добавлено от 50 до 60 мл жидкости, предотвращаю-
щей свертывание. Основные добавки: натрия гидроцитрат, глю-
коза и фосфат. Цельную кровь хранят при температуре от 1 до
6 °C. Срок хранения 21 сут, но тромбоциты теряют жизнеспо-
203
собность уже через 24—48 ч. Факторы V и VII присутствуют в
крови в меньших количествах. Таким образом, цельная кровь
подходит для экстренного восстановления объема и транспорта
кислорода, но уже после хранения в течение 24 ч не может
служить источником факторов свертывания и тромбоцитов.
Единственное показание для использования цельной крови —
массивное кровотечение, но в этом случае необходимо допол-
нить трансфузию переливаниями тромбоцитов, плазмы, плаз-
мозамещающих препаратов или использовать эритроцитную
массу. Цельную кровь не следует применять при почечной и
застойной сердечной недостаточности. Цельная кровь не об-
ладает гемодинамическим действием, ее объемный эффект мо-
жет быть причиной снижения СВ. Следует помнить, что цель-
ная кровь содержит микроагрегаты лейкоцитов и тромбоцитов,
оказывающих вредное влияние на микроциркуляцию. При хра-
нении цельной крови калий постепенно выходит из эритроци-
тов, приводя к увеличению его концентрации.
Эритроцитная масса (ЭМ). Этот клеточный компонент
крови получают после отделения плазмы от цельной крови.
Стандартная упаковка содержит 200 мл форменных элементов
крови (эритроциты и лейкоциты) и 100 мл плазмы. Гематокрит
65—75 %. “Единица” консервированных эритроцитов — 200—
300 мл. Эритроцитная масса содержит мало тромбоцитов, фак-
торов свертывающей системы крови или лейкоцитов и неэф-
фективна как средство увеличения объема. Ее главное назна-
чение — увеличение переносчиков кислорода (эритроцитов) для
улучшения кислородтранспортной функции крови. Перелитая
“единица” ЭМ повышает гематокрит приблизительно на 3 %.
Как и цельную кровь, после определения на совместимость ее
можно переливать быстро. Сердечная и почечная недостаточ-
ность не служат противопоказаниями к назначению ЭМ. По
сравнению с цельной кровью содержит меньшее количество
натрия и цитрата, что уменьшает потенциальный риск токсич-
ности. Малое количество плазмы уменьшает риск вирусного
гепатита.
Эритроцитная масса с малым количеством лейкоцитов. От-
деление лейкоцитов от эритроцитов ЭМ необходимо для транс-
фузий больным, имеющим антилейкоцитарные антитела. К со-
жалению, ни одна методика не обеспечивает полного отделе-
ния лейкоцитов от эритроцитов. ЭМ с малым количеством
лейкоцитов содержит 10—30 % лейкоцитов. Показатель гема-
токрита на 10—30 % ниже, чем в ЭМ.
Показаниями к применению эритроцитной массы, обеднен-
ной лейкоцитами, служат гемотрансфузионные реакции феб-
рильного или негемолитического характера в анамнезе, по-
скольку эти реакции чаще всего связаны с наличием антител
к лейкоцитам донорской крови. Но даже обедненная лейкоци-
тами ЭМ содержит некоторое количество жизнеспособных
204
лейкоцитов. В связи с этим препараты крови перед их приме-
нением у больных с подавленным иммунитетом должны быть
подвергнуты облучению, чтобы предотвратить реакцию “транс-
плантат против хозяина”.
Отмытые эритроциты существенно снижают риск аллер-
гических реакций при трансфузиях. В них отсутствуют белки
плазмы и большая часть лейкоцитов. Показатель гематокрита
ниже, чем у эритроцитной массы. Срок хранения не превышает
24 ч. Переливание отмытых эритроцитов показано больным с
аллергическими реакциями в анамнезе, больным с дефицитом
иммуноглобулина А. Аллергические реакции чаще всего связа-
ны с предшествующей сенсибилизацией белками плазмы до-
норской крови, но могут быть обусловлены недостаточностью
иммуноглобулина А.
Свежезамороженная плазма по сравнению с нативной имеет
ряд преимуществ. Может храниться при температуре —30 °C в
течение года в герметичной упаковке, содержит фактически
все факторы системы гемостаза II, V, VII, VIII, IX, X, XI, XIII
и фактор Виллебранда. Факторы V, VIII, а также фибриноген
присутствуют в высоких концентрациях.
Показания к применению свежезамороженной плазмы: 1) ди-
люционная коагулопатия после массивных инфузий; 2) чрез-
мерная антикоагулянтная терапия варфарином или гепарином;
3) врожденный или приобретенный дефицит факторов коагу-
ляции; 4) болезнь Виллебранда. Ранее свежезамороженную
плазму широко применяли при массивной кровопотере, ожо-
говой болезни, гнойно-септических процессах, тяжелой трав-
ме, синдроме сдавления с угрозой развития ОПН. В настоящее
время свежезамороженную плазму не рекомендуют применять
для повышения ОЦК, поскольку существуют менее дорого-
стоящие и столь же эффективные препараты для лечения ги-
поволемических состояний [Marini J.J., Wheeler А.Р., 2002].
Использование свежезамороженной плазмы показано для
восполнения дефицита многих факторов, определяющих свер-
тывающую систему крови.
Доза свежезамороженной плазмы, как правило, определяет-
ся величиной удлинения протромбинового времени или час-
тично тромбопластинового времени. При этом плазму вводят,
если дефицит определяемого фактора менее 25 % от нормы.
Если протромбиновое время менее 18 с, а тромбопластиновое
время менее 55 с и нет интенсивного кровотечения, показаний
для применения плазмы нет. При наличии кровотечения свеже-
замороженную плазму вводят до тех пор, пока протромбиновое
и тромбопластиновое время не нормализуются. Если протром-
биновое время более 18 с, а тромбопластиновое более 55 с,
вводят 2 ЕД свежезамороженной плазмы до повторного кон-
троля in vitro времени свертывания крови даже при отсутствии
205
кровотечения (1 ЕД свежезамороженной плазмы содержит
180—300 мл плазмы) [Marini J.J., Wheeler А.Р., 2002].
Противопоказанием к назначению плазмы служит сенси-
билизация больного к парентеральному введению белка. На-
значая трансфузии плазмы, необходимо иметь в виду, что
плазма может быть контаминирована вирусом гепатита. По
возможности следует пользоваться концентратом выявленно-
го фактора свертывания крови, поскольку 1 мл перелитой
плазмы содержит 1 ЕД фактора свертывания и требуются
большие объемы свежезамороженной плазмы для устранения
дефицита.
Криопреципитат представляет собой концентрированную
смесь факторов свертывания крови, полученную из свежезамо-
роженной плазмы методом криопреципитации. Как и свежеза-
мороженную плазму, ее хранят при температуре —18 °C. Кри-
опреципитат насыщен фибриногеном и фактором VTII, а также
имеет в своей составе и фактор Виллебранда. Его часто пере-
ливают при гемофилии. Он может быть использован при ги-
пофибриногенемии и коагулопатии потребления, при упорном
кровотечении при уремии или экстракорпоральном кровооб-
ращении. В неотложных ситуациях используют редко вследст-
вие высокого риска заражения вирусом гепатита.
Тромбоцитная масса. Подсчет числа тромбоцитов хотя и
имеет важное значение, тем не менее не во всех случаях может
служить основанием для определения этиологии кровотечения.
Тромбоцитопения — снижение числа тромбоцитов ниже 150 000
в 1 мм3. Однако способность обеспечивать гемостаз сохраня-
ется до тех пор, пока количество тромбоцитов не уменьшится
до 100 000 в 1 мм3. В то же время процесс гемостаза может
быть нарушен при уменьшении способности кровяных плас-
тинок к адгезии, несмотря на то, что общее количество тром-
боцитов может превышать 100 000 в 1 мм3.
Таким образом, один подсчет числа тромбоцитов не дает
оснований для определения их адгезивной способности. В кли-
нике часто прибегают к переливанию тромбоцитов, не пользу-
ясь при этом определением времени кровотечения. Время кро-
вотечения в норме составляет 4,5±1,5 мин. Длительность кро-
вотечения увеличивается, когда количество кровяных пласти-
нок в циркулирующей крови уменьшается до 100 000 в 1 мм3
или нарушена адгезивная способность тромбоцитов [Lee V.S.
et al., 1998].
Число тромбоцитов более 100 000 в 1 мм3 редко сопровож-
дается существенным кровотечением у травмированных или
оперируемых пациентов. Поэтому в этих случаях нет показа-
ний к переливанию тромбомассы. Если число тромбоцитов
более 50 000 в 1 мм3, то это достаточно для обеспечения ин-
вазивных процедур, спонтанное кровотечение бывает редко.
206
По данным Д. Марини и А. Уилер (2002), содержание тром-
боцитов ниже 50 000 в 1 мм3 может сопровождаться спонтан-
ным кровотечением, особенно если их индекс ниже 5000 в 1 мм3.
Переливание тромбоцитов показано фактически во всех слу-
чаях, если индекс тромбоцитов падает ниже 5000 в 1 мм3, и
часто, если этот индекс находится в пределах 5000—20 000 в
1 мм3. При кровотечении или предстоящем оперативном вме-
шательстве уровень тромбоцитов должен быть высоким. Сле-
дует также учитывать, что нарушения адгезивных свойств
тромбоцитов часто возникают у больных с уремией, печеноч-
ной недостаточностью и получающих НПВС.
Тромбоцитную массу (концентрат кровяных пластинок) го-
товят из цельной крови. Ее можно хранить около 7 дней, но
через 3 сут жизнеспособность тромбоцитов начинает снижать-
ся. Ее можно переливать достаточно быстро. Тромбоцитную
массу получают от крови нескольких доноров. Это увеличивает
вероятность заражения как гепатитом, так и вирусом иммуно-
дефицита человека. Возможны лихорадочные и анафилакти-
ческие реакции, обусловленные сенсибилизацией белками плаз-
мы, в которых находятся тромбоциты.
Массивные гемотрансфузии. Этот термин подразумевает
полную замену ОЦК в течение 24 ч. Это означает переливание
5 л крови (10 стандартных упаковок по 500 мл) для среднего
взрослого человека. Следует учитывать, что массивная гемо-
трансфузия может сопровождаться фактором дилюции — тром-
боцитопенией и коагулопатией, гипокалиемическим алкалозом
вследствие того, что перелитый цитрат продуцирует НСОз-;
гипокальциемией (редко); гипотермией; возможным развитием
РДСВ; связанной с переливанием крови инфекцией. Гиперка-
лиемию при массивных гемотрансфузиях наблюдают редко.
Нельзя с уверенностью утверждать, что использование фильт-
ров крови уменьшает количество легочных осложнений, но
при массивных трансфузиях их следует использовать.
Нарушения свертывающей системы крови начинают прояв-
ляться после переливания примерно 2,5 л цельной крови, при
этом содержание факторов свертывающей активности крови
опускается ниже 30 %, а число тромбоцитов становится мень-
ше 100 000 в 1 мм3.
При массивных гемотрансфузиях следует придерживаться
определенных правил: 1) после переливания каждых 2,5 л кро-
ви необходимо исследовать число тромбоцитов, протромбино-
вое время и частичное тромбопластиновое время; 2) чтобы
поддерживать нормальный характер свертывания, на каждые
6—10 ЕД эритромассы (1 ЕД ЭМ составляет 200—300 мл)
переливать 2 ЕД свежезамороженной плазмы (1 ЕД СЗП =
200—300 мл) и 6 ЕД тромбомассы (1 ЕД тромбомассы = 40 мл)
[Marini J.J., Wheeler А.Р., 2002].
207
Техника гемотрансфузии
Общие положения. Ответственность за предупреждение ос-
ложнений гемотрансфузии несет врач, который ее проводит.
Для оценки качества гемотрансфузионной среды необходимо
проверить паспорт (этикетку), который должен содержать све-
дения о наименовании среды, учреждении-изготовителе, дате
заготовки и сроке годности, групповой и резусной принадлеж-
ности. На ней должны быть указаны фамилии донора и врача,
заготавливающего среду, и стоять отметка “стерильно”. При
внешнем осмотре гемотрансфузионной среды не должно быть
признаков гемолиза, посторонних включений, помутнения и
т.п. [Мокеев И.Н., 2002]. Предтрансфузионное тестирование
включает определение групповой принадлежности гемотранс-
фузионной среды и крови реципиента по системам АВО и
резус, а также проведение пробы на индивидуальную совмес-
тимость. Для трансфузий, как правило, используют централь-
ные или периферические вены. Общее правило: чем больше
диаметр катетера, короче сам катетер и меньше вязкость гемо-
трансфузионной среды — тем больше скорость трансфузии.
Скорость трансфузии может быть увеличена при повышении
давления в системе, например при использовании надувной
манжеты. Вязкость среды можно существенно уменьшить, если
применять V-образные соединительные трубки, позволяющие
смешивать форменные элементы и изотонический раствор на-
трия хлорида в равных объемах.
Для разведения форменных элементов крови необходимо при-
менять только изотонический раствор натрия хлорида. Ис-
пользование других растворов, содержащих ионы кальция (рас-
твор Рингера, раствор Рингера с лактатом, лактасоль), мо-
жет приводить к агглютинации. Изотонические растворы
глюкозы (5% раствор) могут вызвать лизис и агрегацию кле-
ток.
Фильтры. Системы для гемотрансфузий должны иметь
фильтр, служащий для предотвращения попадания разрушен-
ных форменных элементов, накапливающихся в крови при
хранении, в сосуды реципиента. Фильтры следует менять после
переливания 3—4 стандартных упаковок крови. Обычно ис-
пользуют капельницы, снабженные фильтром с размером пор
170 мкм. Микрофильтры с диаметром 20—40 мкм, как правило,
не применяют, исключением является профилактика пироген-
ных осложнений у сенсибилизированных больных [Мокеев И.Н.,
2002].
Подогревание крови. Согревание снижает вязкость охлаж-
денной крови, но, самое главное, предупреждает развитие тя-
208
желой гипотермии, при которой могут возникать желудочко-
вые аритмии и ацидоз. В ходе гемотрансфузии переливаемую
среду подогревают до температуры 37 °C. Существует ряд уст-
ройств, позволяющих осуществлять контроль за процессом со-
гревания.
|| Перегревание крови может привести к гемолизу!
Гемотрансфузионные реакции
По данным различных авторов, при массивных гемотранс-
фузиях примерно в 10 % случаях наблюдаются немедленные и
поздние побочные реакции. Реакции немедленного типа воз-
никают обычно либо во время трансфузии, либо вскоре после
ее окончания. К ним относятся лихорадка, крапивница, острое
повреждение легких и острый гемолиз. Причиной гипертерми-
ческой реакции считают наличие антител к лейкоцитам доно-
ра. Крапивницу связывают с сенсибилизацией к белкам плаз-
мы донора, а повреждение легких — с лейкоагглютининами в
донорской крови.
Наиболее опасны гемолитические реакции, которые могут
быть немедленными или поздними. Немедленные реакции воз-
никают из-за групповой несовместимости (АВО-антитела к
эритроцитам донора). Наиболее тяжелые реакции развиваются
после переливания 50—100 мл гемотрансфузионной среды, но
их проявления возможны и при переливании 10—20 мл крови.
Эти реакции вызывают внутрисосудистый гемолиз, коагулопа-
тию, шок, почечную недостаточность, дисфункцию легких и
могут привести к смерти больного. В тяжелых случаях возмож-
но развитие ДВС-синдрома. Наиболее частые симптомы — об-
щее недомогание, лихорадка, одышка, боли за грудиной, в
пояснице и костях. У тяжелобольных в ОИТ эти симптомы
могут быть незамеченными. У больных, находящихся в кома-
тозном состоянии, реакция может проявиться резким падени-
ем АД.
Лечение. При любом осложнении, связанном с трансфу-
зией, следует: 1) немедленно прекратить переливание крови;
2) при снижении АД как можно скорее начать устранение
дефицита ОЦК, предпочтение следует отдавать плазмозамеща-
ющим гетерогенным коллоидным растворам; 3) при наруше-
нии дыхания проводят ВИВЛ или ИВЛ с FiO2 = 50 %; 4) начать
внутривенную инфузию допамина со скоростью 5 мкгДкгмин)
для поддержания сердечной деятельности и улучшения почеч-
ной гемодинамики; 5) введение раствора бикарбоната натрия
для ощелачивания мочи, чтобы предотвратить осаждение сво-
бодного гемоглобина в почечных канальцах и развитие острой
209
14-1069
почечной недостаточности; 6) по показаниям могут быть при-
менены салуретики — важно восстановить выведение мочи и
тем самым предотвратить почечную недостаточность.
После стабилизации состояния больного донорская кровь и
кровь из системы с соблюдением правил асептики должны
быть возвращены в кабинет переливания крови (в банк крови)
вместе с уведомлением о реакции на трансфузию. Взять пробу
крови и проверить плазму на свободный гемоглобин. Провести
лабораторный анализ первой порции мочи на гемоглобин.
Поздние гемолитические реакции обусловлены малым ко-
личеством антител, не всегда выявляемых тестом Кумбса. Они
возникают у больных, которым часто переливали кровь, или у
многорожавших женщин. Это осложнение нередко проявляет-
ся приблизительно через 2 нед после гемотрансфузии внезап-
ным, но не очень большим падением гематокрита.
Пирогенные реакции. Лихорадочные негемолитические ре-
акции на трансфузию наиболее часто обусловлены воздействи-
ем поверхностных антигенов лейкоцитов или тромбоцитов.
Как правило, температура повышается в течение промежутка
времени от 1 до 6 ч после начала переливания крови. Причи-
ной пирогенных реакций также может быть бактериальное
заражение препаратов крови, но это бывает редко. В некоторых
случаях повышение температуры может быть значительным и
требует проведения дифференциальной диагностики, направ-
ленной на исключение гемолитической реакции. Первые ме-
роприятия аналогичны тем, которые применяют при лечении
гемолитических реакций. При наличии в анамнезе лихорадоч-
ных реакций на повторное переливание крови используют
эритроцитную массу, обедненную лейкоцитами, или отмытые
эритроциты.
Аллергические реакции. Аллергические реакции могут быть
умеренно выраженными (крапивница, зуд), значительными и
тяжелыми (повышение температуры, гипотензия, нарушение
функции внешнего дыхания вплоть до развития анафилакти-
ческого шока). При появлении первых признаков аллергичес-
кой реакции немедленно прекращают гемотрансфузию и вво-
дят антигистаминные средства. При анафилактическом шоке
применяют внутривенное введение адреналина, восполняют
ОЦК, при бронхоспазме используют агонисты р2-адренорецеп-
торов. У больных с аллергическими проявлениями по возмож-
ности стараются избегать переливаний крови. Если гемотранс-
фузия неизбежна, применяют отмытые эритроциты. В наибо-
лее сложных случаях необходима консультация трансфузио-
лога. Больных с проявлениями анафилаксии в анамнезе обсле-
дуют на предмет выявления дефицита иммуноглобулина А,
поскольку анафилаксия обычно возникает при его недостаточ-
ности.
210
Другие неблагоприятные последствия
гемотрансфузии
Гипотермия. Снижение температуры тела после массивной
трансфузии наблюдается нечасто, но может иметь много не-
благоприятных последствий: вазоконстрикция и дрожь, угне-
тение метаболизма, нарушение сердечной проводимости, за-
медление реполяризации и увеличение возбудимости миокарда
и др. Согревание крови до 37 °C особенно оправдано при
массивном переливании с большой скоростью. Согревание
должно проводиться с осторожностью, поскольку повышение
температуры гемотрансфузионной среды до 38 °C и выше мо-
жет привести к гемолизу.
Гиперкалиемия возможна при применении эритромассы
долгих сроков хранения. При переливании “свежей” крови,
отмытых эритроцитов гиперкалиемия не наблюдается.
Гипокальциемия, вызванная цитратами, редко возникает да-
же после массивных гемотрансфузий. Профилактическое вве-
дение кальция не рекомендуется. Тем не менее определение
содержания ионизированного кальция в крови после массив-
ных гемотрансфузий представляется оправданным.
Метаболический алкалоз может возникнуть в результате пре-
образования цитрата, применяемого как средство против ко-
агуляции, в бикарбонат. Иногда метаболический алкалоз со-
провождается гипокалиемией. Обычно эти изменения не су-
щественны и не требуют специального лечения.
Острое повреждение легких проявляется в виде острой ды-
хательной недостаточности (ОДН). Иногда развивается отек
легких вследствие повышенной проницаемости капиллярной
стенки (состояние, напоминающее респираторный дистресс-
синдром взрослых). ОДН может возникнуть даже после одно-
кратного переливания крови или эритроцитной массы. Это
редкое осложнение — 1 на 5000 гемотрансфузий.
Глава 26 I КАТЕТЕРИЗАЦИЯ ЦЕНТРАЛЬНЫХ ВЕН
Обязательным условием современного интенсивного лече-
ния больных является внутривенное введение быстродейству-
ющих лекарственных веществ и инфузионных растворов.
Врачи в своей практике широко используют как периферичес-
кие, так и центральные вены. Нередко прибегают к пункции
артерий, катетеризации аорты и легочной артерии. Для выбора
наиболее оптимального метода при лечении больных, находя-
щихся в тяжелом состоянии (и в терминальной стадии), необ-
ходимы знания анатомо-топографического расположения со-
211
14"
судов и сердца, основ пункции и техники катетеризации вен
и артерий.
Показания к катетеризации центральных вен:
♦ измерение ЦВД (т.е. давления в верхней полой вене);
♦ потребность в переливании больших объемов жидкости,
в том числе крови;
♦ введение некоторых лекарственных средств (допамин,
растворы калия и др.) и растворов для парентерального
питания;
♦ введение в легочную артерию катетера для измерения
давления или временного электрокардиостимулятора;
♦ отсутствие периферических вен, пригодных для инфузи-
онной терапии.
Анатомические ориентиры подключичной вены (v. subclavia),
которая является непосредственным продолжением подмы-
шечной вены. Она начинается на нижней поверхности I ребра,
располагается на его передней поверхности и, переходя на
верхний край ребра, отклоняется кнутри, вниз и немного кпе-
реди (рис. 26.1). Располагаясь в предлестничном пространстве
(spatium antescalenum), впереди прикрепления передней лест-
ничной мышцы к I ребру, подключичная вена входит в груд-
ную полость, где позади грудино-ключичного сочленения со-
единяется с внутренней яремной веной, образуя с ней плече-
головную вену (v. brachiocephalica). Место слияния подключич-
ной вены с внутренней яремной называется левым или правым
венозными углами. На всем протяжении подключичная вена
спереди прикрыта ключицей. В ней не бывает ни клапанов, ни
склеротических изменений. Направление ее напоминает дугу,
наивысшая часть которой расположена на середине ключицы,
где вена поднимается до ее верхней границы.
На всем протяжении вену сопровождает подключичная ар-
терия. Латеральная ее часть расположена кзади и кверху от вены.
Артерия и вена вместе пересекают верхнюю границу I ребра.
Медиальная часть артерии лежит кзади от подключичной вены
и отделена от нее волокнами передней лестничной мышцы.
Позади артерии располагается купол плевры, возвышающийся
над грудинным концом ключицы.
Врач, производящий катетеризацию подключичной вены,
должен помнить об опасности ранения не только купола плев-
ры, но и грудного протока, идущего слева над верхушкой
легкого и впадающего в левый венозный угол.
Позади подключичной вены расположен диафрагмальный
нерв, пересекающий вену в вертикальном направлении.
Подклйчичная вена имеет большой диаметр (15—25 мм у
взрослых) и легко пунктируется из надключичного или под-
ключичного доступа. Большинство врачей отдают предпочте-
212
Рис. 26.1. Топография магистральных кровеносных сосудов подклю-
чичной области и шеи.
1 — верхняя полая вена; 2 — правая плечеголовная вена; 3 — левая плечеголов-
ная вена; 4 — подключичная вена; 5 — подключичная артерия; 6 — передняя
лестничная мышца; 7 — внутренняя яремная вена; 8 — общая сонная артерия;
9 — наружная яремная вена; 10 — грудино-ключично-сосцевидная мышца.
ние катетеризации подключичной вены из подключичного до-
ступа. При подключичном доступе лучше используются анато-
мические ориентиры, поэтому он зарекомендовал себя как
наиболее безопасный. Поскольку эта вена не спадается при
пункции и во время вдоха в ней создается отрицательное
давление, обязательным условием является профилактика воз-
душной эмболии.
Катетеризация верхней полой вены через подключичную вену
состоит из двух моментов: пункции подключичной вены и
введения в полую вену катетера. Пункцию вены можно осу-
ществлять как подключичным, так и надключичным доступом.
Целесообразнее использовать правую подключичную вену, по-
скольку при пункции левой подключичной вены имеется опас-
ность повреждения грудного лимфатического протока, впада-
ющего в венозный угол у места слияния внутренней яремной
и левой подключичной вен.
213
Рис. 26.2. Пункция подключичной вены.
а — пунктиром обозначены анатомические ориентиры места пункции, точки:
1 — Giles; 2 — Aubaniac; 3 — Wilson; б — направление иглы.
Пункция подключичной вены может быть произведена из
разных точек: точка Aubaniac расположена на 1 см ниже клю-
чицы по линии, разделяющей внутреннюю и среднюю треть
ключицы; точка Wilson находится на 1 см ниже ключицы по
срединно-ключичной линии; точка Giles расположена на 1 см
ниже ключицы и на 2 см кнаружи от грудины; точка Yoffa
лежит у верхушки ключично-грудино-сосцевидного угла, обра-
зуемого верхним краем ключицы и латеральной ножкой гру-
дино-ключично-сосцевидной мышцы (рис. 26.2).
Чаще пунктируют подключичную вену из точки Aubaniac.
После анестезии оператор надевает на шприц пункционную
иглу и набирает в него раствор новокаина. В месте пункции
кожу прокалывают либо скальпелем, либо иглой. Иглу продви-
гают по направлению вверх и внутрь, причем конец ее должен
скользить по задней поверхности ключицы. Продвигая иглу,
слегка оттягивают поршень шприца. Появление крови в шпри-
це свидетельствует о том, что игла попала в просвет подклю-
чичной вены. Отделяют шприц от иглы и проводят катетери-
зацию вены по методу Сельдингера (рис. 26.3). Для этого через
просвет иглы в вену вводят проводник. Если он не проходит
в вену, нужно изменить положение иглы, расположить ее па-
раллельно ключице или повернуть вокруг своей оси. Недопус-
тимо насильственное введение проводника. Иглу удаляют, про-
водник остается в вене. Затем по проводнику мягкими враща-
тельными движениями вводят полиэтиленовый или тефлоно-
вый катетер на 10—15 см. Проводник извлекают. Проверяют
правильность нахождения катетера — подсоединяют к нему
шприц и осторожно потягивают поршень. При правильном
положении катетера кровь свободно входит в шприц. Катетер
214
заполняют раствором гепарина — 1000 ЕД на 5 мл изотоничес-
кого раствора натрия хлорида. Канюля катетера закрывается
заглушкой. Катетер оставляют в вене и фиксируют швом к
коже (рис. 26.4).
Варианты расположения подключичной вены часто встре-
чаются у гиперстеников, у лиц с хорошо развитой мускулату-
рой и ожирением. Точка Aubaniac у этих больных является
наиболее удобной. У детей младшего возраста иглу следует
вводить в средней точке линии, условно проведенной между
верхушкой подмышечной впадины и верхним краем грудинно-
го конца ключицы по направлению к его задней поверхности.
Анатомические ориентиры внутренней яремной вены (v. jugu-
laris interna) — крупной вены, которая, как и подключичная,
может быть использована для введения короткого или цент-
рального венозного катетера. Ветви ее делятся на внутри- и
Рис. 26.3. Катетеризация подключичной вены по Сельдингеру.
а — проведение проводника через иглу; б — извлечение иглы; в — проведение
катетера по проводнику; г — фиксация катетера.
215
д
Рис. 26.4. Последовательность манипуляций при введении венозного
катетера по методу Сельдингера (а, б, в, г, д).
1 — игла для пункции вены; 2 — проводник; 3 — катетер.
внечерепные. Начавшись в яремном отверстии черепа, в кото-
ром она имеет расширение, внутренняя яремная вена спуска-
ется вниз и позади грудино-ключичного сочленения сливается
с подключичной веной, образуя плечеголовную вену. У места
расположения клапана, на 1 см выше ключицы, эта вена, как
и в начальном отделе, образует расширение.
На шее внутренняя яремная вена располагается вместе с
сонной артерией и блуждающим нервом в одном соединитель-
нотканном влагалище, вначале позади, а затем латерально и
несколько кпереди от внутренней сонной артерии. Далее вниз
вена идет латерально от общей сонной артерии. Блуждающий
216
церв находится между ними и кзади. Весь сосудисто-нервный
пучок располагается на глубоких мышцах шеи. На своем пути
в области шеи внутренняя яремная вена прикрыта грудино-
ключично-сосцевидной мышцей. Нижняя часть вены располо-
жена между ножками грудинной и ключичной головок этой
мышцы и прижата фасцией к задней поверхности мышцы.
Позади вены у основания шеи находятся подключичная арте-
рия с ее ветвями, диафрагмальный и блуждающий нервы, ку-
пол плевры. В левый венозный угол впадает грудной, а в
правый — лимфатический (правый грудной) проток. Вена об-
ладает способностью к значительному изменению своего внут-
реннего объема в зависимости от притока крови. Обе плечего-
ловные вены образуют верхнюю полую вену.
Анатомические ориентиры не всегда различимы. У тучных
больных с короткой шеей может быть не видна грудино-клю-
чично-сосцевидная мышца. В этом случае рекомендуется паль-
пация других, более различимых образований — щитовидного
хряща, сонной артерии [Роузен М. и др., 1986].
Методика катетеризации верхней полой вены через внутрен-
нюю яремную вену. Внутренняя яремная вена располагается
под грудино-ключично-сосцевидной мышцей и покрыта шей-
ной фасцией. Вену можно пунктировать из трех точек, но для
избежания пневмоторакса наиболее удобен высокий доступ.
Больного укладывают в горизонтальное положение, убрав по-
душку, голову пациента опускают вниз насколько это возмож-
но для “заполнения” вены и уменьшения риска воздушной
эмболии при гиповолемии. Голову больного поворачивают в
противоположную от места пункции сторону. Правая внутрен-
няя яремная вена предпочтительнее для пункции, так как она
коллатеральна грудному протоку. Далее находят правую сон-
ную артерию, которая расположена параллельно вене глубже
и медиальнее. В асептических условиях инфильтрируют кожу
и подкожные ткани выше переднего угла грудино-ключично-
сосцевидной мышцы на уровне щитовидного хряща 5 мл 0,5 %
раствора новокаина. Пальпируют сонную артерию левой рукой.
Пункцию производят латеральнее сонной артерии под углом
45° к коже. Иглу направляют на правый сосок у мужчин и на
правую верхнюю переднюю подвздошную ость — у женщин.
Медленно продвигают шприц с иглой, аспирируя в то же время
кровь. Внутренняя яремная вена расположена поверхностно,
поэтому иглу продвигают всего на несколько сантиметров. По
методу Сельдингера катетер проводят на глубину 10—12 см.
Осложнения катетеризации центральных вен:
♦ воздушная эмболия;
♦ гемоторакс;
♦ гидроторакс;
♦ пневмоторакс;
217
Рис. 26.5. Измерение центрального венозного давления. Определение
физиологического нуля и методика измерения.
♦ повреждение грудного лимфатического протока;
♦ гематомы вследствие пункции артерий;
♦ венозный тромбоз;
♦ тромбофлебит;
♦ локальная инфекция;
♦ сепсис.
Частота наиболее грозных осложнений (гемо-, гидро-, пнев-
моторакс) значительно меньше при катетеризации внутренней
яремной вены. Главное преимущество катетеризации внутрен-
ней яремной вены по сравнению с катетеризацией подключич-
ной вены — меньший риск пункции плевры.
Измерение ЦВД позволяет оценивать преднагрузку сердца и
ОЦК, осуществлять контроль за проводимой инфузионной те-
рапией.
Для измерения ЦВД катетер вводят в верхнюю полую вену
(через внутреннюю яремную или подключичную вену) и со-
единяют его с подключенной для инфузии системой. Ноль
шкалы устанавливается на уровне правого предсердия по сред-
ней подмышечной линии на пересечении ее с IV ребром, или
на 5 см ниже угла, образованного соединением между рукоят-
кой и телом грудины (рис. 26.5). После этого систему для
инфузий, содержащую переливаемую жидкость, отсоединяют
от флакона с раствором, зажим снимают и контролируют по-
218
ступление жидкости в кровеносное русло до тех пор, пока не
прекратится дальнейшее ее движение. Величина ЦВД соответ-
ствует высоте уровня жидкости в трубке системы над уровнем
правого предсердия (средняя подмышечная линия). Нормаль-
ная величина ЦВД — 0,58—1,17 кПа (5—12 см вод. ст.). Сла-
бозаметные колебания ритма дыхания указывают на его нор-
мальное функционирование. Высокий уровень ЦВД с больши-
ми размахами колебаний свидетельствует о слишком глубоком
введении катетера. Когда катетер достигает полости правого
желудочка, его необходимо подтянуть. Низкое ЦВД (0—3 см
вод. ст.) свидетельствует о гиповолемии. Критической величи-
ной ЦВД является 15—20 см вод. ст. Повышение ЦВД за
пределы 1,47 кПа (15 см вод. ст.) расценивается как признак
вероятной недостаточности сердца.
Глава 27 | КАТЕТЕРИЗАЦИЯ ЛЕГОЧНОЙ АРТЕРИИ
Инвазивный гемодинамический мониторинг занимает одно
из ведущих мест в современной интенсивной терапии. Такой
мониторинг превращает общие, зачастую неоднозначные,
представления о сути и течении патологического процесса в
конкретную диагностическую концепцию. Под контролем по-
казателей ЦГД инфузионная и/или кардиотропная терапия
становится по настоящему управляемой и высокоэффективной
[Рябов Г.А., 1998].
Катетеризация легочных отделов сердечно-сосудистой сис-
темы давно уже вошла в практику, доступную любому лечеб-
ному учреждению. При этом “золотым” стандартом при иссле-
довании ЦГД признан метод катетеризации легочной артерии
по Свану—Ганцу. Суть его сводится к продвижению катетера
специальной конструкции через полую вену, правое предсер-
дие и правый желудочек в одну из центральных ветвей легоч-
ного ствола [Плесков А.П., 2003].
Показания:
♦ тяжелая артериальная гипотензия при неэффективности
пробной нагрузки жидкостью;
♦ тяжелая форма кардиогенного отека легких;
♦ респираторный дистресс-синдром взрослых;
♦ септический шок;
♦ операции на открытом сердце;
♦ обширные торакоабдоминальные операции, сопровож-
дающиеся нестабильной гемодинамикой;
♦ критические состояния, при которых данные инвазивных
исследований помогают в выборе рационального, наибо-
лее эффективного метода лечения.
219
Противопоказания:
♦ тяжелая неконтролируемая коагулопатия;
♦ выраженная гипотермия (температура тела <34 °C);
♦ воспаление в зоне предполагаемого венозного доступа;
♦ отсутствие необходимого оборудования — дефибриллято-
ра, ЭКГ-монитора, блока измерения прямого внутрисо-
судистого давления.
Методика катетеризации легочной артерии
1. В качестве доступа можно использовать любую крупную
вену (подключичную, внутреннюю яремную, общую бедрен-
ную). Если Вы выбрали центральную вену после ее пункции и
введения в ее просвет металлической струны, входное венозное
отверстие расширяют с помощью специального бужа. Далее,
используя буж в качестве направителя, в просвет вены вводят
короткий катетер диаметром до 3 мм. Буж со струной удаляют,
через короткий катетер внутрь вены вводят катетер Свана-
Ганца примерно на 10 см и раздувают баллончик. Далее про-
двигают его под контролем электронно-оптического преобра-
зователя или формы кривой давления и с учетом длины кате-
тера, введенного в венозную канюлю. Не следует продвигать
катетер более чем на 10—15 см, если форма кривой не изме-
няется из-за риска узлообразования. Перед удалением катетера
необходимо распустить баллончик для предотвращения разры-
ва им трехстворчатого или легочного клапана.
2. Стандартный катетер Свана—Ганца имеет по меньшей
мере два сквозных канала. Один из них открывается на самом
кончике катетера, а другой — на 30 см проксимальнее. Эти
каналы заполняются жидкостью (изотоническим раствором на-
трия хлорида), посредством которой все колебания кровяного
давления передаются на тензометрический датчик. После пере-
работки механического момента электрический сигнал посту-
пает в монитор, на экране которого все изменения давления
отображаются графически в режиме реального времени (в виде
синусоидальной кривой). Гемодинамика правого предсердия,
правого желудочка и легочной артерии принципиально различ-
на. Соответственно для каждого из этих отделов сердечно-со-
судистой системы характерна особая кривая кровяного давле-
ния.
3. Правое предсердие. Для полой вены и правого предсердия
типична низкоамплитудная кривая давления, которая подвер-
жена существенному влиянию на вдохе и выдохе. На такой
кривой принято выделять 2 синусоидальные волны. Положи-
тельный пик первой такой волны (пик а) обусловлен предсерд-
ной систолой. На ЭКГ он проецируется вслед за зубцом Р.
220
Далее пик а сменяется углублением %, которое возникает при
диастоле предсердия. При высокой разрешающей способности
монитора в этой фазе можно отметить дополнительный поло-
жительный пик с, соответствующий моменту закрытия клапа-
на. По мере заполнения предсердия кровью давление в нем
начинает повышаться. На кривой давления появляется вторая
синусоидальная волна с положительным пиком v, максимум
которого приходится на систолу желудочка. Соответственно
пик v совпадает с зубцом Т. После систолы желудочка и
открытия трикуспидального клапана кровь из предсердия уст-
ремляется самотеком в полость правого желудочка (фаза бы-
строго наполнения). В этот момент на кривой давления воз-
никает углубление у. Размах колебаний кровяного давления в
правом предсердии составляет 2—10 мм рт.ст. Усредненное их
значение и есть собственно ЦВД.
4. Правый желудочек. После продвижения кончика катетера
за трикуспидальный клапан форма кривой давления карди-
нально меняется. В систолу давление в правом желудочке (ДПЖ)
повышается до 15—30 мм рт.ст., в диастолу оно также быстро
снижается до значения, равного ЦВД. На экране монитора при
этом высокоамплитудные колебания остроконечной формы.
Прохождению трикуспидального клапана иногда может помочь
глубокий вдох больного.
5. Легочная артерия. Следующий этап — продвижение кате-
тера в ствол легочной артерии. Кривая давления вновь претер-
певает изменения. В систолу давление в легочной артерии
(ДЛА) повышается до того же уровня, что и в правом желу-
дочке. Однако скорость такого подъема замедляется. Кривая
давления приобретает более наклонный и сглаженный контур.
На нисходящей части этой кривой появляется отчетливая дик-
ротическая вырезка, соответствующая моменту закрытия кла-
пана легочной артерии и началу диастолы правого желудочка.
В отличие от миокарда легочная артерия в диастолу не рас-
слабляется, и давление в ней остается относительно высоким
(8—15 мм рт.ст.). Одномоментный подъем нижней границы
колебаний кровяного давления по мере продвижения катетера
Свана — Ганца и служит наиболее убедительным признаком
его флотации в ствол легочной артерии.
6. Положение заклинивания. Дальнейшее продвижение ка-
тетера Свана—Ганца приведет к его заклиниванию в одной из
центральных ветвей легочной артерии, диаметр которой будет
соответствовать диаметру раздутого баллончика (1—1,5 см). На
экране монитора появится кривая давления, напоминающая
таковую в полости правого предсердия. Аналогичные синусо-
идальные волны (с тем же буквенным обозначением) будут
обусловлены деятельностью левых отделов сердца. Усреднен-
ное значение всех указанных колебаний — это ДЗЛА. Среднее
221
давление заклинивания ниже или равно диастолическому дав-
лению в легочной артерии. Оно ниже среднего давления в
легочной артерии. Форма волны кривой заклинивания быстро
исчезает при сдувании баллончика и вновь появляется при
повторном его раздувании.
7. При достижении положения заклинивания процедура счи-
тается законченной. Баллончик катетера сдувается, начинается
мониторное наблюдение за давлением в легочной артерии
(через дистальный канал). Все остальные измерения выполня-
ются дискретно, по необходимости. Нормальные показатели
кровяного давления в правых отделах сердца — см. в табл. 15.1.
Катетер следует удалить не позже чем через 72 ч для снижения
риска инфекции. При необходимости можно ввести новый
катетер, используя вену противоположной стороны.
Клинический смысл измерения ДЗЛА (ДЗЛК)
1. Заклинивание проксимального, артериального отдела ле-
гочного кровотока позволяет измерить давление в его дисталь-
ной, венозной части. С клинической точки зрения на основе
этого измерения можно дать оценку: 1) диастолического на-
полнения левых отделов сердца; 2) гидростатического давления
в легочных венах.
2. Определение ДЗЛА позволяет установить этиологию ге-
модинамических нарушений. При ДЗЛА менее 6 мм рт.ст.
наполнение левого желудочка признается недостаточным.
Производительность сердца будет заведомо ограничена столь
низкой преднагрузкой. В этой ситуации необходимо интенси-
фицировать введение жидкости. При ДЗЛА более 12 мм рт.ст.
форсированные инфузии считаются нецелесообразными. По-
вышение этой величины, как правило, не приводит к приросту
работы сердца. Усугубляется опасность объемной перегрузки
сердца. ДЗЛА в пределах 6—12 мм рт.ст. считается неким
физиологическим оптимумом. В то же время практика исполь-
зования ДЗЛА в качестве критерия волемии сталкивается с
многочисленными обстоятельствами (как технической, так и
физиологической природы), которые отменяют тождествен-
ность ДЗЛА и конечно-диастолического давления левого же-
лудочка (КДДЛЖ).
3. С помощью катетера Свана—Ганца можно измерить СВ,
а на его основе рассчитать показатели сосудистого тонуса и
удельной работы сердца (рис. 27.1). При совокупности всех
этих данных гемодинамическая картина приобретает цельный
характер, позволяющий установить гемодинамический про-
филь при разных видах шока и применить целенаправленную
терапию.
222
Рис. 27.1. Термодилюционные кривые (А, Б, В), соответствующие
низкому (верхняя кривая) и высокому (средняя кривая) сердечному
выбросу и недостаточности трехстворчатого клапана (нижняя кривая).
Осложнения катетеризации легочной
артерии
Нарушения проводимости и возбудимости миокарда. Про-
движение катетера через правый желудочек довольно часто
сопровождается аритмиями.
Правила безопасной катетеризации легочной артерии'.
223
♦ подготовка дефибриллятора;
♦ установка электрокардиостимулятора (при необходи-
мости);
♦ коррекция ишемических и электролитных расстройств;
♦ болюсное введение лидокаина (1—2 мг/кг массы тела)
перед процедурой.
Необходимо также придерживаться следующего правила: путь
катетера от одной позиции до другой не должен превышать
20 см. Так, при доступе через правую внутреннюю яремную
вену кривая давления правого желудочка появляется обычно
в пределах первых 20 см, кривая легочной артерии — в преде-
лах первых 40 см и кривая заклинивания — в пределах первых
60 см от поверхности тела; по данным Д. Спригинс и соавт.
(2000) — в пределах 40—50 см. Несоблюдение этого стандарта
свидетельствует либо о скручивании катетера в камерах сердца,
либо о его внесердечном продвижении.
Разрыв легочной артерии. При оставлении свободного хода
(петли) катетера в одной из камер сердца он со временем
вытягивается в дистальном направлении. Подобная миграция
остается по большей части незамеченной, и последующее фор-
сированное раздувание баллончика в просвете мелкой ветви
легочной артерии приводит к ее разрыву.
Инфарктная пневмония. Основная причина инфаркта лег-
кого — образование в просвете (или на кончике) катетера
тромба с последующим его вымыванием в дистальные ветви
легочной артерии.
Инфицирование катетера. Пребывание катетера в легочной
артерии в течение 2—3 сут, как правило, не вызывает гнойно-
септических осложнений. При появлении гипертермии в от-
сутствие явного источника инфекции следует сразу же пред-
положить инфицирование катетера и удалить его.
Основные положения
1. Важнейшими целями ИТТ являются: 1) восстановление и поддержа-
ние объема и качественного состава среды во всех водных разделах
организма: сосудистом, интерстициальном и клеточном; 2) оптимизация
параметров центральной и периферической гемодинамики (восстанов-
ление адекватной преднагрузки, наполнения сердечных камер, артери-
ального давления и микроциркуляции); 3) поддержание ионного и кис-
лотно-основного равновесия, осмолярности и онкотического давления;
4) обеспечение адекватного транспорта кислорода к органам и тканям
(главное условие ИТТ).
2. При необходимости быстро ликвидировать дефицит ОЦК предпочти-
тельно внутривенное вливание коллоидных растворов. При проведении
реанимационных мероприятий для достижения одинакового прироста
ОЦК потребуется перелить кристаллоидных растворов в 2—4 раза
224
больше по сравнению с коллоидными растворами, причем инфузия
кристаллоидных растворов будет в 2 раза дольше, чем инфузия колло-
идных растворов. Во всех случаях острой гиповолемии показано при-
менение как коллоидных растворов, так и изотонических электролитных
растворов (обычно 0,9 % раствор натрия хлорида) для возмещения
ОЦК и дефицита объема внеклеточного пространства.
3. Использование гипертонического 7,5 % раствора натрия хлорида в
общей дозе 4 мл/кг с одновременным введением декстрана 70 оказа-
лось весьма эффективным в лечении геморрагического шока. 7,5 %
раствор натрия хлорида целесообразно вводить дробно по 50 мл через
каждые 10—20 мин в зависимости от полученного эффекта. Для увели-
чения продолжительности действия гипертонического раствора его ком-
бинируют с декстраном 70 или применяют комбинированный препарат,
содержащий 7,5 % раствор натрия хлорида и 6 % раствор декстрана 70.
4. Показания к переливанию крови и ее компонентов: 1) обеспечение
адекватной кислородтранспортной функции крови; 2) восстановление
ОЦК; 3) восполнение факторов свертывания крови и тромбоцитов.
У больных, находящихся в критическом состоянии, с коронарной болез-
нью, ограниченным сердечным резервом целесообразно поддерживать
показатель гематокрита не ниже 30 % (оптимальный гематокрит состав-
ляет 33—35 %), что уменьшает вязкость крови и улучшает транспорт
кислорода к тканям. Для разведения донорской крови применяют изо-
тонический раствор натрия хлорида.
5. Свежезамороженная плазма, содержащая фибриноген и факторы
свертывающей системы крови, не должна первично использоваться для
повышения ОЦК, поскольку для этого есть менее дорогостоящие, но не
менее эффективные препараты. Свежезамороженная плазма необхо-
дима для восполнения дефицита многих факторов. Дозировка, как пра-
вило, определяется величиной удлинения протромбинового и частич-
ного тромбопластинового времени.
6. В случае интенсивного кровотечения или в случае высокого риска
его возникновения необходимо поддерживать число тромбоцитов —
50 000 в 1 мм3 или выше.
7. Применение компонентов крови в отличие от применения цельной
крови позволяет эффективно восполнять дефицит конкретных ингреди-
ентов и в целом более рационально использовать ограниченные запасы
крови.
8. При переливании крови и ее компонентов необходимо часто измерять
показатель гематокрита, параметры коагуляции и число тромбоцитов.
Дж.Марини и А. Уилер рекомендуют в начале переливания руководст-
воваться следующим эмпирическим отношением: 6 ЕД консервирован-
ных эритроцитов/2 ЕД свежезамороженной плазмы/6 ЕД тромбомассы.
ВОПРОСЫ И ОТВЕТЫ
1. Сравните распределение коллоидных и кристаллоидных раство-
ров в водных секторах при внутривенном введении.
Растворы декстранов 60 или 70, имеющие волемический коэф-
фициент, близкий к единице, после внутривенного введения
225
15-1069
остаются в сосудистом русле в течение нескольких часов, что
определяет их гемодинамическое действие. Изотонический рас-
твор натрия хлорида быстро покидает сосудистое русло и рас-
пределяется главным образом в интерстициальном пространст-
ве. Так, после внутривенного введения 1 л 0,9 % раствора
натрия хлорида в сосудах остается приблизительно 200 мл, а
800 мл переходит в интерстиций. 5 % раствор глюкозы после
внутривенного введения переходит в интерстиций и клетки,
лишь малая часть его остается в сосудах.
2. Какие свойства коллоидных растворов следует учитывать при
их внутривенном введении?
Клинический эффект внутривенного введения коллоидного
раствора зависит от следующих основных характеристик:
а) молекулярная масса (чем выше молекулярная масса, тем
дольше данный раствор циркулирует в сосудистом русле). Ис-
ключение составляют растворы гидрооксиэтилкрахмала, по-
скольку их высокая молекулярная масса быстро снижается до
40 000, 60 000, поэтому их действие сходно с таковым растворов
декстрана;
б) концентрация раствора (чем выше концентрация раствора,
тем более выражен плазмоэкспандерный эффект — перемеще-
ние жидкости из внесосудистых областей в сосуды). 6 % кол-
лоидные растворы не обладают плазмоэкспандерным действи-
ем. 10 % растворы коллоидов, а также растворы 20 и 25 %
оказывают выраженное плазмоэкспандерное действие. Напри-
мер, 1 л 10 % реомакродекса, введенного внутривенно, повы-
шает внутрисосудистый объем на 1400—1500 мл;
в) КОД (чем выше этот показатель раствора, тем больше его
сила связывания воды и удержание жидкости в сосудистом
русле).
3. Приведите пример увеличения объема плазмы в зависимости от
КОД коллоидного раствора (альбумина).
5 % раствор альбумина имеет КОД (онкотическое давление),
близкое к таковому плазмы — 20 мм рт.ст. Его внутривенное
введение приведет к незначительному увеличению ОЦК даже
при использовании относительно большого объема. При внут-
ривенном введении всего 100 мл 25 % альбумина ОЦК увели-
чится более чем на 500 мл.
4. Как может изменяться осмолярность плазмы в зависимости
от осмолярности растворов глюкозы и электролитов, вводимых
внутривенно?
5 % раствор глюкозы имеет осмолярность 278 мосм/л, т.е. почти
изотоничен плазме (осмолярность плазмы 285—295 мосм/л).
Следует учесть, что глюкоза быстро метаболизируется, что мо-
жет вести к снижению осмолярности плазмы. Применение ги-
пертонических растворов глюкозы (20, 30, 40 %) сопровождает-
ся гиперосмолярностью плазмы. Растворение 50 г глюкозы в
0,9 % растворе натрия хлорида, имеющего осмолярность
226
308 мосм/л, увеличивает осмолярность раствора почти вдвое
(278 мосм/л + 308 мосм/л = 586 мосм/л.). Любой изотоничес-
кий электролитный раствор на 5 % глюкозе имеет соответст-
венно повышенную осмолярность. Все изложенное свидетель-
ствует о важности учета осмолярности растворов при проведе-
нии интенсивной инфузионной терапии. Введение высокоос-
молярных растворов существенно увеличивает вероятность рез-
кого подъема осмотического давления крови.
5. Оцените эффективность использования коллоидных растворов
по сравнению с кристаллоидпыми электролитными растворами
при лечении острой кровопотери.
При острой кровопотери наибольшую опасность для жизни
представляет гиповолемия из-за сниженных венозного возвра-
та, ударного и минутного объемов сердца. Внутривенная инфу-
зия коллоидных растворов (крахмал, декстран) с целью поддер-
жания ОЦК значительно эффективнее, чем использование крис-
таллоидных растворов электролитов. Тем не менее программа
реанимационных мероприятий при острой кровопотере включает
сочетанные вливания как коллоидных, так и кристаллоидных
электролитных растворов с целью восстановления ОЦК и всего
объема внеклеточного пространства.
6. При каком объеме кровопотери необходима гемотрансфузия?
Во многих источниках указано, что кровопотеря от 15 до 20 %
ОЦК, как правило, не требует кровезамещения. При этом до-
статочно переливать кристаллоидные растворы в большем объе-
ме, чем объем кровопотери, или комбинировать коллоидные и
кристаллоидные растворы. При кровопотере более 20—30 %
ОЦК, кроме коллоидных и кристаллоидных растворов, необхо-
димо применять эритроцитную массу с целью восстановления
объема циркулирующих эритроцитов, как переносчиков кисло-
рода. Контролем может служить показатель гематокрита, кото-
рый желательно поддерживать на уровне 30 %, что обеспечивает
снижение вязкости крови и создает лучшие условия для транс-
порта кислорода.
7. В чем преимущество использования компонентов крови по срав-
нению с использованием цельной крови?
Большинству больных, нуждающихся в трансфузии, не требуются
все многочисленные компоненты, имеющиеся в цельной крови
(факторы свертываемости, тромбоциты, криопреципитат, лейко-
циты, иммуноглобулин и др.). Компонентная терапия (эритроцит-
ная масса, свежезамороженная плазма, альбумин и пр.) уменьшает
риск перегрузки жидкостью, опасность инфицирования, требует
меньшего количества антикоагулянта. От одного донора реципи-
енты могут получить определенные компоненты, в которых они
нуждаются. Допускаются более длительные сроки хранения, рас-
ширяются возможности снабжения кровью.
227
15*
8. Каков риск инфекции при переливании крови?
Бактериальные инфекции чаще всего обусловлены нарушени-
ем стерильности во время трансфузии и большой продолжи-
тельностью переливаний. Возможны вирусные инфекции у
больных, которым переливалась кровь: цитомегаловирус, виру-
сы гепатита, СПИД. К передаваемым через кровь инфекциям
относятся малярия, сифилис, бруцеллез, токсоплазмоз и вирус
Эпштейна—Барр.
9. Определите концентрации молярных растворов глюкозы, калия
хлорида, магния сульфата, натрия хлорида и натрия гидрокар-
боната.
Молярные растворы: 1) глюкоза 18 % — 1000 мосм/л; 2) калия
хлорид 7,46 % — 2000 мосм/л; 3) магния сульфат 12 % — 2000
мосм/л; 4) натрия хлорид 5,85 % — 2000 мос/л; 5) натрия гид-
рокарбонат 8,4 % — 2000 мосм/л.
10. Определите понятия “базисная инфузионная терапия” и “кор-
ригирующая инфузионная терапия”.
Базисная инфузионная терапия подразумевает обеспечение фи-
зиологической суточной потребности пациента в воде и
электролитах. Ее объем составляет 1,5 л/м2. В ее состав входит
глюкоза, 5 % раствор и электролиты натрия, калия, хлора,
кальция, магния и фосфата. Корригирующая инфузионная те-
рапия направлена на восстановление объема и качественного
состава жидкостей организма в зависимости от патологических
потерь (потери жидкости, крови, электролитов). Общий суточ-
ный объем инфузионной терапии складывается из объемов
базисной и корригирующей терапии.
11. Определите наказания к переливанию тромбоцитной массы.
При индексе тромбоцитов (число тромбоцитов в 1 мм3) менее
5000 имеется высокий риск спонтанного кровотечения. Пока-
зано переливание тромбоцитов.
Если индекс тромбоцитов составляет 5000—20 000, риск спон-
танного кровотечения может быть как умеренным, так и высо-
ким. Необходимо перелить тромбоциты для увеличения индек-
са до 20 000 и более [Марини Д., Уилер А., 2002].
Если индекс тромбоцитов в пределах 50 000—100 000, риск
спонтанного кровотечения низкий. Переливание тромбомассы
показано в случае интенсивного кровотечения, перед предсто-
ящей инвазивной процедурой или при имеющейся вторичной
коагуляции.
Если индекс тромбоцитов более 100 000, риск кровотечения
низкий, если не нарушены функции тромбоцитов, не усилен
фибринолиз и не предстоит инвазивная процедура. В этих
случаях тромбоциты используются редко, но необходимо учи-
тывать все перечисленные факторы.
228
СПИСОК ЛИТЕРАТУРЫ
Интенсивная терапия / Под ред. В.Д.Малышева. — М.: Медицина,
2002. - 581 с.
Малышев В.Д. Интенсивная терапия острых водно-электролитных на-
рушений. — М.: Медицина, 1985. — 192 с.
Марини Джон Дж., Уилер Артур П. Медицина критических состояний:
Пер. с англ. — М.: Медицина, 2002.
Марино П. Интенсивная терапия: Пер. с англ. — М.: ГЭОТАР-Меди-
цина, 1998.
Макеев И.Н. Инфузионно-трансфузионная терапия. — М., 2002. —
230 с.
Роузен М., Латта Я.П., Шэнг Нг У. Чрескожная катетеризация цент-
ральных вен: Пер. с англ. — М.: Медицина, 1986. — С. 158.
Спрингс Д., Чемберс Д., Джефри Э. Неотложная терапия: Пер. с
англ. — М.: ГЭОТАР-Медицина, 2000. — 333 с.
Abraham W. Т., Schrier Р. Ж Body volume regulation in health and disea-
se / Adv. Intern. Med. — 1994. — N 39. — P. 23—47.
Marini J.J., Wheller A.P. Transfusion and Blood Component Therapy I
Critical Care Medicine. — 1997. — P. 241—250.
Часть V. АЛГОРИТМЫ НЕОТЛОЖНЫХ
ЛЕЧЕБНЫХ МЕРОПРИЯТИЙ
В данном разделе представлены методы построения диагно-
за на основе наиболее демонстративных клинических и лабо-
раторных показателей нарушения КОС и водно-электролитно-
го баланса (ВЭБ). Сознательно исключена дополнительная ин-
формация, которая не способствует, с нашей точки зрения,
полному пониманию ситуации. При ведении тяжелобольных
врач сталкивается с дефицитом времени и необходимостью
срочного принятия решения по клиническим вопросам. Как
диагностика состояния, так и этапы оказания срочной помощи
были тщательно отобраны, исходя из опыта работы ОРИТ.
Нарушения КОС и ВЭБ значительно осложняют течение лю-
бого заболевания, поэтому важно не только уметь их диагнос-
тировать, но и соотносить с тем или иным патологическим
процессом.
Глава 28
ДИАГНОСТИКА И ТЕРАПИЯ
МЕТАБОЛИЧЕСКИХ НАРУШЕНИЙ
КИСЛОТНО-ОСНОВНОГО СОСТОЯНИЯ
Острый метаболический ацидоз
Метаболический ацидоз характеризуется первичным умень-
шением содержания в крови бикарбоната. Вторичное сниже-
ние HCOJ в ответ на респираторный алкалоз не является
метаболическим ацидозом, а имеет компенсаторный харак-
тер. Измеряемый уровень HCOJ в крови, равный в норме
24±2 ммоль/л, при метаболическом ацидозе ниже этого уровня.
Следует измерить непосредственно HCOJ в крови и сопоста-
вить его с расчетными данными. Если pH артериальной крови
выше 7,43, то имеющееся снижение HCOJ в крови возникло
в ответ на первичный дыхательный алкалоз. Если при снижен-
ном HCOJ pH 7,39 или ниже, то это говорит об ацидемии,
связанной с метаболическим ацидозом [Дон X., 1995].
В наиболее тяжелых случаях острого ацидоза pH может
снизиться до 6,8, a HCOJ — до 7—11 ммоль/л. Снижение pH
стимулирует дыхание. Компенсация достигается легочной ги-
первентиляцией и снижением раСО2 до 10—15 мм рт.ст. Наи-
более важный механизм компенсации метаболического ацидо-
230
за — экскреция кислот почками — может быть нарушен из-за
повышенной скорости образования нелетучих кислот в тканях,
неспособности буферных систем нейтрализовать кислоты, за-
болеваний или функциональной неполноценности самих по-
чек.
В установлении этиологии метаболического ацидоза важную
роль играет определение анионной разницы (АР), в норме
составляющей 12 мэкв/л. Сниженный уровень HCOJ крови
при нормальном показателе АР указывает на умеренные нару-
шения при почечной недостаточности средней степени, избы-
точном введении хлоридов, потере HCOJ в связи с диареей
или почечном канальцевом ацидозе. Увеличение содержания
кислых анионов (лактат или ацетоацетат) приводит к повыше-
нию АР на такое же количество молей, на которое снижается
HCOJ. Наиболее частой причиной ацидоза с высокой АР яв-
ляется кетоацидоз и лактат-ацидоз. Кроме того, высокая АР
может быть связана с введением/приемом лекарственных пре-
паратов (салицилаты, железо, изониазид) и токсичных веществ
(метанол, этиленгликоль, паральдегид), действием уремических
токсинов (главы 2, 4).
Предрасполагающие факторы развития острого метаболичес-
кого ацидоза-.
♦ длительная гипоксемия, неполноценная перфузия тканей
из-за гипотензии, низкого сердечного выброса или сеп-
сиса;
♦ к диабетическому кетоацидозу приводят необоснованное
сокращение инсулинотерапии, инфекция, операция, ин-
фаркт миокарда, эмоциональный стресс;
♦ алкогольный кетоацидоз возникает в результате приема
алкоголя и голодания; часто связан с панкреатитом, гипер-
гликемия возможна, но бывает небольшой (< 15 ммоль/л);
♦ потери HCOJ (диарея, дренирование желчных протоков
и поджелудочной железы, уретральное дренирование,
сигмоидо- или илеостомия);
♦ болезни почек, ОПН — почечный канальцевый ацидоз;
♦ отравления окисью углерода, этанолом, этиленгликолем,
метанолом, парацетамолом, салицилатами, трицикличес-
кими антидепрессантами [Спрингинс Д. и др., 2000].
Острый метаболический ацидоз всегда сопровождается теми
или иными клиническими проявлениями, которые зависят от
тяжести нарушений КОС: 1) нарушение функции ЦНС — от
легких изменений до спутанности сознания и комы; 2) цирку-
ляторные нарушения: снижение АД, холодная влажная кожа,
олигурия, шок; 3) гиперпноэ, дыхание Куссмауля, в поздней
стадии олигопноэ.
231
Неотложные лечебные мероприятия:
♦ если предполагается метаболический ацидоз, то необхо-
димо определить уровни pH, раСО2, раО2, HCOJ, Na+,
К+, Cl~, BE, рассчитать АР;
♦ если pH <7,39, а раСО2 = 40 мм рт.ст. или меньше этого
уровня, то диагноз “метаболический ацидоз” установлен;
♦ если при этом АР меньше или равна 12 мэкв/л, причиной
метаболического ацидоза и истощения бикарбонатного
буфера могут быть: 1) диарея; 2) почечная недостаточ-
ность средней степени тяжести; 3) канальцевый ацидоз;
4) гипергидратация, обусловленная избыточным введе-
нием жидкости, содержащей хлориды; 5) действие лекар-
ственного препарата. Возможен дефицит альдостерона с
гипонатриемией. Во всех этих случаях необходимо про-
водить лечение, исходя из основной причины, вызвавшей
ацидоз. При гипергидратации необходимо ограничить
введение жидкостей. Отменить препарат, вызывающий
ацидоз. При дефиците альдостерона следует определить
уровень кортизола в крови, и при его снижении назна-
чить гидрокортизон по 100 мг каждые 6 ч;
♦ если АР >12 мэкв/л, то возможны: 1) отравление сали-
цилатами, метанолом, этиленгликолем; 2) лактат-ацидоз
или кетоацидоз (если не было приема лекарственных
препаратов, алкоголя, токсичных веществ); 3) для исклю-
чения или подтверждения диагноза кетоацидоза или лак-
тат-ацидоза необходимо проверить содержание кетоно-
вых тел в крови и моче, определить уровень L-лактата в
крови. При их повышении проводят лечение кетоацидоза
или лактат-ацидоза (см. главы 4,5);
♦ если в моче и в крови нет кетоновых тел, а уровень
L-лактата меньше 2,5 ммоль/л, определяют содержание
D-лактата в крови. Если уровень D-лактата больше 0, то
предполагают наличие патологической кишечной флоры
и назначают “невсасывающиеся” антибиотики;
♦ если все уровни лактата нормальны, для установления
причины метаболического ацидоза следует исключить
почечную недостаточность. Этот диагноз подтверждает-
ся, если повышен уровень креатинина, азота мочевины
крови (см. главу 14). При pH <7,1 внутривенно вводят
раствор бикарбоната натрия. Для лечения почечной не-
достаточности может потребоваться гемодиализ;
♦ анализ газов смешанной венозной крови позволяет оп-
ределить наличие гиперкапнического метаболического
ацидоза. После перенесенной остановки сердца или при
застойной сердечной недостаточности и шоке содержа-
ние СО2 в крови легочной артерии может значительно
превышать раСО2. Этот вид острого метаболического
232
ацидоза свидетельствует о повышенной продукции СО2
на клеточном уровне и таким образом подтверждает не-
достаточную элиминацию СО2 легкими;
♦ при шоке, сердечной, дыхательной и/или почечной не-
достаточности проводят весь комплекс неотложных ле-
чебных мероприятий, направленных на восстановление
циркуляции, дыхания, почечной функции;
♦ введение бикарбоната натрия показано при pH крови
менее 7,2 при лактат-ацидозе и при pH крови менее 7,1
при кетоацидозе. Начальная доза раствора бикарбоната
натрия 1 ммоль/кг массы тела больного в течение 30 мин
с последующим контролем pH крови и уровня HCOJ.
Вводить этот препарат следует с осторожностью из-за
возможности развития отека легких и изменений кон-
центрации Na^ в плазме крови. При тканевой гипоксии
целесообразность введения раствора бикарбоната натрия
спорна;
♦ механическая вентиляция легких может быть необходи-
мой для поддержания компенсаторного механизма дыха-
ния. Обычно ДО устанавливают из расчета 10—15 мл/кг,
а ЧД должна быть меньше частоты спонтанного дыхания
больного;
♦ контролируют содержание основных электролитов и про-
водят их коррекцию при выявлении отклонений от нормы;
♦ во всех случаях метаболического ацидоза проводят лече-
ние основного заболевания.
Иронический метаболический ацидоз наблюдается при хро-
нической почечной недостаточности, когда почки не в состо-
янии экскретировать нелетучие кислоты при увеличении их
образования. В конечной стадии ОПН HCOJ в крови снижается
до 12—20 ммоль/л. При снижении HCOJ до 12 ммоль/л пока-
зано осторожное введение раствора натрия бикарбоната с уче-
том ограниченной функциии дыхательной системы и возмож-
ной гипергидратации, связанной с почечной недостаточнос-
тью. При нарастании почечной недостаточности показано
проведение гемодиализа. При хроническом метаболическом
ацидозе раСО2 <35 мм рт.ст.; pH <7,40; в терминальной стадии
pH <7,30. Возможно развитие гипокальциемии и изменений
уровня калия в плазме крови.
Острый метаболический алкалоз
Метаболический алкалоз с pH >7,45 и с нормальным или
увеличенным раСО2 обычно обусловлен и поддерживается раз-
личными патогенетическими механизмами. При высоком pH
метаболический алкалоз — угрожающее жизни состояние.
233
При метаболическом алкалозе содержание НСО3 в крови
повышено, избыток оснований увеличен, что ведет к повыше-
нию pH. Компенсаторное увеличение НСО3 в ответ на острый
дыхательный ацидоз не следует считать метаболическим алка-
лозом. Для точной оценки результатов анализа КОС расчетную
величину НСО3, определяемую по уравнению Гендерсона:
[Н+ (нмоль/л) = 24 х раСО2 (мм рт.ст.) / НСО^ (ммоль/л)],
следует сопоставить с определяемым уровнем НСО3 в
крови. Значение pH <7,39 свидетельствует о том, что повыше-
ние уровня НСО3 является компенсаторным по отношению к
возникшему респираторному ацидозу. Значение pH >7,43 сви-
детельствует в пользу первичного метаболического алкалоза.
Если pH находится между этими цифрами, то могут иметь
место смешанные расстройства. При метаболическом алкалозе
возникает компенсаторное увеличение раСО2, редко до уровня
60 мм рт.ст., раО2 снижен часто до 60 мм рт.ст., что необходимо
учитывать при лечении.
При остром метаболическом алкалозе уровень НСО3 может
быть >46 ммоль/л, а pH >7,50.
Алкалоз, возникающий в результате потери хлористоводо-
родной кислоты (НС1) желудка, при использовании диуретиков
(тиазиды, этакриновая кислота, фуросемид) сопровождается
гиповолемией и реципрокным повышением НСО3 (гиповоле-
мический алкалоз). Обычно внутривенное введение изотони-
ческого раствора натрия хлорида приводит к ликвидации ал-
калоза. При коррекции алкалоза необходимо с осторожностью
применять растворы калия хлорида, ориентируясь на уровень
калия в плазме крови.
Если внутривенное введение раствора натрия хлорида не
устраняет алкалоз, то следует проверить уровень СГ~ в моче.
Его высокий уровень может указывать на другие причины
алкалоза: повышенное содержание минералкортикоидов, сте-
ноз почечных артерий, введение щелочей при почечной недо-
статочности, выраженный дефицит К+. В редких случаях для
коррекции значительного избытка оснований применяют 0,1 н.
или 0,25 н. раствор НС1.
Клинически метаболический алкалоз может не сопровож-
даться выраженными изменениями, но в ряде случаев в связи
с изменениями ионного баланса (гипокалиемия, гипомагние-
мия), уменьшением объема жидкости, снижением раО2 и по-
вышением раСО2 могут наблюдаться разнообразные проявления:
парестезии, угнетение сознания, судороги. На фоне гиповоле-
мии возможно развитие сердечных аритмий. По-видимому, не
последнюю роль играет сдвиг кривой диссоциации влево, что
ухудшает доставку кислорода к тканям.
234
Неотложные лечебные мероприятия:
♦ если предполагается метаболический алкалоз, необходи-
мо определить pH, раО2, раСО2, НСО3, BE, Na+, К+,
СГ;
♦ метаболический алкалоз подтверждается, если pH >7,40,
содержание HCOJ в плазме повышено, BE со знаком +,
уровень раСО2 не выше предполагаемой компенсации
(изменение раСО2 = 0,6 х изменение уровня HCOJ).
Ожидаемые значения раСО2 при различном содержании
HCOJ в сыворотке крови: если HCOJ 30 ммоль/л, раСО2
должно быть около 44 мм рт.ст.; если HCOJ 40 ммоль/л,
раСО2 должно быть около 50 мм рт.ст.;
♦ в наиболее тяжелых случаях алкалоза уровень HCOJ в
крови может возрасти до 46 ммоль/л и выше, pH — до
7,6 и выше, раСО2 может превысить 55—60 мм рт.ст.
Гйповентиляция, как правило, сопровождается снижени-
ем раО2 до 60 мм рт.ст., что необходимо учитывать при
лечении;
♦ при установленной гипоксемии необходима оксигеноте-
рапия;
♦ хлоридзависимый метаболический алкалоз подтверждает-
ся, если содержание СГ в крови меньше 100 ммоль и
(или) содержание СГ и Na+ в моче ниже 10—15 ммоль/л.
Все это характеризует состояние чувствительности к хло-
ридам и позволяет предположить снижение ОЦК. Часто
при этом развивается гипокалиемия. Причины: рвота или
аспирация через назогастральный зонд, введение щело-
чей, применение диуретиков. В последних двух случаях
следует прекратить введение препаратов. Все указанные
причины обычно сопровождаются гиповолемией и тре-
буют заместительной терапии. Лечение: инфузия изото-
нического раствора натрия хлорида с целью восполнения
дефицита жидкости и СГ. Метаболический алкалоз труд-
но ликвидировать, если не восполнены объемы жидкости
и дефицит хлора. При снижении уровня калия в сыво-
ротке крови показано введение раствора калия хлорида
до нормализации его содержания в крови. Для снижения
продукции соляной кислоты в желудке могут быть исполь-
зованы антагонисты Н2-гистаминорецепторов (цимети-
дин, ранитидин и др.);
♦ хлоридрезистентный метаболический алкалоз характери-
зуется первичным повышением содержания минералкор-
тикоидов, часто выраженным дефицитом К+, гиперволе-
мией. Содержание СГ в моче более 15 ммоль/л. Повы-
шенное содержание минералкортикоидов может зависеть
от введения стероидов (следует прекратить их введение),
болезни Кушинга или первичного альдостеронизма (ле-
235
чить основное заболевание). Лечение, внутривенно вводят
раствор К.С1, применяют антагонисты минералкортикои-
дов — спиронолактон (альдактон) 25—100 мг внутрь,
возможно введение Mg^+, назначают диакарб — 500 мг
(препарат подавляет реабсорбцию бикарбоната в прокси-
мальных канальцах). В тяжелых случаях алкалоза при
pH >7,5 применяют раствор НО. Используют различные
концентрации HCL но чаще 0,1 н. (100 мэкв Н+/л) или
0,2 н. (200 мэквН^/л). Если алкалоз вызван введением
щелочей, на фоне почечной недостаточности возможен
гемодиализ.
Хронический метаболический алкалоз может возникать при
длительном применении диуретических средств. Тиазидные
диуретики приводят к потере С1~, К+, Н+. Хронический
метаболический алкалоз развивается также при хронической
рвоте, хронических потерях желудочного содержимого при
длительном зондировании желудка, чрезмерном примене-
нии абсорбирующих средств, нарушении экскреции НСО3
почками вследствие эффекта минералкортикоидов, гиперад-
ренокортицизме. При хроническом метаболическом алкалозе
pH >7,4; раСО2 >45 мм рт.ст.
Глава 29
ПРОБЛЕМА ЛЕЧЕНИЯ ОСТРОЙ
ГИПОКСЕМИИ И ГИПЕРКАПНИИ
ПРИ ОБСТРУКТИВНЫХ ЗАБОЛЕВАНИЯХ
ЛЕГКИХ
Острая дыхательная недостаточность (ОДН) — одна из ве-
дущих причин смерти больных с хроническими обструктивны-
ми заболеваниями легких (ХОЗЛ). Современные методы ин-
тенсивной терапии позволяют снизить смертность от ОДН у
больных с ХОЗЛ. Основное лечение в этой ситуации включает
ингаляцию кислорода с целью уменьшения гипоксемии и уст-
ранения прогрессирующей гиперкапнии. Если состояние па-
циента относительно стабильно и pH не ниже 7,3, а раСО2
равно 50 мм рт. ст., не следует прибегать к инвазивной ИВЛ,
поскольку эта категория больных особенно восприимчива к
осложнениям ИВЛ. При обострении заболевания обычно на-
значают ингаляционные антихолинергические и симпатоми-
метические средства, кортикостероиды, чтобы уменьшить
обструкцию дыхательных путей. При наличии инфекции на-
значают антибиотики широкого спектра действия. Выжи-
ваемость увеличивается за счет неинвазивной ИВЛ с переме-
236
жающимся положительным давлением, проводимой через но-
совую или лицевую маску [Horacio J. Adrogue, Martin J. Tobin,
2003].
Лечение гиперкапнической дыхательной недостаточности
должно основываться на устранении основной причины. Не-
медленные терапевтические мероприятия должны быть на-
правлены на восстановление проходимости дыхательных путей,
подачу обогащенной кислородом вдыхаемой газовой смеси и
на восстановление адекватной вентиляции, чтобы достичь ис-
ходного состава газов крови. Исходные параметры газов крови,
как правило, свидетельствуют об относительной компенса-
ции. Примерно они могут быть следующими: pH 7,34, раО2
75 мм рт.ст, раСО2 52 мм рт. ст., НСО3 30 ммоль/л. При
обострении ХОЗЛ следует учитывать все уровни газов крови
и pH, поскольку терапия должна быть строго индивидуаль-
ной. Главные терапевтические меры при saO2 82 %, раО2
49 мм рт.ст., раСО2 56 мм рт.ст., pH 7,3: контролируемая
кислородная терапия и консервативные мероприятия, способст-
вующие улучшению проходимости дыхательных путей. В данном
случае главная задача состоит в ликвидации гипоксемии.
Острый дыхательный ацидоз у больных ХОЗЛ создает главную
угрозу выживаемости не из-за гиперкапнии или ацидемии, а
из-за сопутствующей гипоксемии.
При более значительной гиперкапнии и значительной аци-
демии и гипоксемии (например, раО2 48 мм рт.ст., раСО2
70 мм рт.ст., pH 7,21) показана вспомогательно-управляемая
вентиляция легких с FiO2 0,5. При этом важно избегать нормо-
и особенно гипокапнии, что может привести к новым ослож-
нениям (изменения психического статуса, снижение СВ, судо-
роги и пр.). Необходимо повысить раО2 до уровня более 60 мм
рт.ст. и стремиться к восстановлению исходных значений газов
крови и pH. При этом стараются избегать высокого ПДКВ,
поскольку часто наблюдается ауто-ПДКВ.
Наибольшие трудности при возникновении острой гипер-
капнии и гипоксемии возникают при лечении больных с со-
путствующей ХОЗЛ в послеоперационном периоде, когда тре-
буются неотложные лечебные мероприятия.
Пациент 72 лет (масса тела 70 кг) с сопутствующей ХОЗЛ опери-
рован по поводу рака восходящего отдела толстой кишки. Произве-
дена правосторонняя гемиколонэкгомия под общей внутривенной
анестезией (пропофол, дормикум, фентанил, мышечные релаксанты)
с эндотрахеальной интубацией и ИВЛ. Течение анестезии без ослож-
нений, интраоперационные потери полностью возмещены. Во время
операции проводилась пульсоксиметрия (saO2 в пределах 95—97 %
при FiO2 0,5; раСО2 в пределах 30—33 мм рт.ст., pH 7,47). При
дооперационном обследовании выявлены умеренная гиперкапния и
237
компенсированный дыхательный ацидоз с незначительной гипоксе-
мией (pH 7,35; раСС>2 50 мм рт.ст., раО2 75 мм рт.ст.). После операции
и восстановления самостоятельного дыхания и сознания больной
был экстубирован. Доставлен в палату постнаркозного наблюдения
(ППН).
При поступлении в ППН: пациент в сознании, ЧД 30 в мину-
ту, ЧСС 88 в минуту, дыхание в легких прослушивается во всех
отделах, АД 140/80 мм рт.ст., раС>2 50 мм рт.ст., раССЬ 40 мм рт.ст.,
pH 7,42.
Начата оксигенотерапия через трансназальный катетер — FiO;
0,35.
Через 1 ч состояние пациента ухудшилось: отмечалась сонливость,
ЧД 32 в 1 мин, ЧСС — 100 в 1 мин, несмотря на проводимую окси-
генотерапию раО2 снизилось до 48 мм рт.ст., раСС>2 70 мм рт.ст., pH
7,27. Через лицевую маску начата вспомогательно-управляемая вен-
тиляция легких с FiC>2 0,5, дыхательным объемом 900 мл, с частотой
16 дыханий в 1 мин и ПДКВ 6 см вод.ст. Несмотря на принятые ме-
ры, состояние больного еще более ухудшилось: отмечалась затор-
моженность, появились эпизоды суправентрикулярной тахикардии и
мышечные подергивания. Повторный анализ выявил гипокапнию:
раСС>2 30 мм рт.ст., pH 7,5; раО2 70 мм рт.ст.
Данное состояние расценено как проявление ятрогенного острого
дыхательного алкалоза у пациента, неадаптированного к гипокапнии.
Известно, что острая гипокапния уменьшает мозговой кровоток, с чем
могут быть связаны вышеупомянутые изменения функции ЦНС. Сни-
жение раСОг, особенно у больных с исходной компенсированной
гиперкапнией, может вызвать значительное снижение СВ, спазм ар-
териол, недостаточную перфузию тканей и вторичное повышение
уровня лактата в плазме. Могут быть явления ишемии миокарда и
другие изменения ЭКГ.
В связи с этим параметры вентиляции были изменены: ДО умень-
шен с 900 мл до 600 мл, ЧД 15 в 1 мин, FiO2 0,5. Желательно достичь
тех значений газов артериальной крови, которые были у больного до
операции: pH 7,35—7,4; раСОг 50 мм рт.ст., раО2 70 мм рт.ст. Ука-
занные действия привели к положительному результату.
Общие выводы: при выборе метода анестезии следует избе-
гать инвазивной ИВЛ с эндотрахеальной интубацией, посколь-
ку у больных с ХОЗЛ этот метод часто приводит к инфекци-
онным осложнениям. Предпочтительно проводить эпидураль-
ную анестезию с сохраненным спонтанным дыханием или
вспомогательным дыханием через лицевую или ларингеальную
маску. После проведения инвазивной ИВЛ требуется более дли-
тельный период адаптации больного, поскольку во время опе-
рации часто используются режимы нормо- и гипервентиляции.
Следует избегать алкалемии (повышенного pH крови), потому
что она угнетает самостоятельное дыхание, увеличивает возбу-
димость миокарда и нервно-мышечных синапсов. Желательно
часто контролировать уровень газов крови и КОС и подбирать
режимы вентиляции и FiO2, соответствующие исходным пока-
зателям pH, раСО2 и раО2.
238
Глава 30
ОСТРЫЙ ПРИСТУП БРОНХИАЛЬНОЙ АСТМЫ
Приступ астмы необходимо заподозрить у любого больного
с остро возникшей одышкой и стридорозным дыханием. Диа-
гноз может быть подтвержден, если у больного имелись при-
знаки заболевания в анамнезе, он наблюдался у пульмонолога,
пользовался ингалятором. Всегда необходимо исключать псев-
доастматические состояния, сопровождающиеся одышкой: об-
струкция верхних дыхательных путей (аспирация инородного
тела, отек Квинке, острый эпиглоттит), обострение ХОЗЛ, отек
легких, эмболия ветвей легочной артерии, анафилактическая
реакция. Обнаружение хрипов на выдохе, тахипноэ, ослаблен-
ного дыхания в легких при аускультации указывает на обостре-
ние астмы. Тяжесть астмы может быть различной — от легкой
до тяжелой и угрожающей жизни.
Тяжелая астма характеризуется нарастанием одышки, учас-
тием в акте дыхания вспомогательной мускулатуры грудной
клетки и передней брюшной стенки, ЧД более 25 в минуту,
пульс более 120 в минуту, парадоксальный пульс (снижение
АД во время вдоха) более 20 мм рт.ст. (не всегда). Пациент не
в состоянии произнести целую фразу. Измененный цвет кож-
ных покровов — бледность, гиперемия, позднее цианоз. Состо-
яние больного может быстро стать угрожающим; признаками
ухудшения являются втянутые межреберные промежутки, иногда
эмфизематозное расширение грудной клетки, резкое снижение
либо полное прекращение поступления воздуха в дыхательные
пути и угнетение сознания вплоть до комы. В этом случае
необходимо проводить реанимационные мероприятия: немед-
ленно начать вспомогательную вентиляцию легких с помощью
лицевой маски, а затем произвести интубацию трахеи и прово-
дить ИВЛ во вспомогательном или управляемом режиме. Следует
заметить, что инвазивную ИВЛ при астматическом статусе при-
меняют как крайний вариант лечения при отсутствии эффекта
от всего комплекса терапевтических мероприятий.
Неотложные лечебные мероприятия (по Д. Спригинс и со-
авт., 2000):
♦ немедленно определите раО2, раСО2 и pH. По возмож-
ности у больного или у лиц, доставивших его, соберите
краткий анамнез (когда начался приступ, провоцирую-
щие факторы, например повышение температуры тела
или отмена кортикостероидов, какие препараты он ис-
пользовал). Если состояние больного позволяет, опреде-
лите максимальную скорость выдоха (МСВ). Если
МСВ<50 %, показана срочная госпитализация. Обяза-
тельна рентгенография грудной клетки — “темные легоч-
239
ные поля” в связи с большой воздухонаполненностью
легких подтверждают диагноз;
♦ на основании клинической картины и данных pH и газов
артериальной крови определяют степень тяжести астмы.
Легкая-. раО2 >75 мм рт.ст., раСО2 <30 мм рт.ст., pH >7,45.
Средняя-. раО2 60—75 мм рт.ст., раСО2 <30 мм рт.ст.,
pH >7,45.
Тяжелая: раО2 <60 мм рт.ст, раСО2 >45 мм рт.ст., pH <7,35
(истощение компенсаторных возможностей дыхания).
Наиболее важные признаки тяжелого обострения бронхиаль-
ной астмы:
♦ МСВ <50 % от должного;
♦ ЧД более 25 в минуту;
♦ ЧСС более 110 в минуту;
♦ одышка при разговоре (невозможность произнести фра-
зу, предложение на одном выдохе).
Состояние, угрожающее жизни:
♦ МСВ <33 % от должного;
♦ “немое легкое”;
♦ цианоз;
♦ слабые респираторные усилия;
♦ брадикардия и гипотензия;
♦ спутанность сознания или кома;
♦ раО2 <60 мм рт.ст;
♦ раСО2 >45 мм рт.ст.;
♦ pH <7,35;
♦ парадоксальный пульс — более 20 мм рт.ст.;
♦ участие в акте дыхания вспомогательной дыхательной
мускулатуры.
Для диагностики тяжелого состояния достаточно несколь-
ких симптомов (необязательно всех!). Более того, респиратор-
ные маркеры (раО2, раСО2) не всегда соответствуют тяжести
состояния, они могут удерживаться на относительно благопо-
лучном уровне (благодаря чрезмерным респираторным усили-
ям), в то время как другие симптомы свидетельствуют об
угрожающем жизни больного состоянии.
Алгоритм “Лечение больных с тяжелым
приступом астмы”
1. Увлажненный кислород с помощью носовых катетеров
или масок (FiO2 0,4—0,6) с контролируемым объемом поступ-
ления. При необходимости увеличивайте концентрацию кис-
лорода до достижения раО2 более 75 мм рт.ст.
2. С целью бронходилатации назначьте Р2-агонисты — аэро-
240
зольный сальбутамол с помощью распылителя, так как при
этом препарат подается под давлением. Доза его 2,5—5 мг в
виде 0,1—0,2 % раствора в течение 3 мин с повторным приме-
нением через 15 мин, затем каждый час до значительного
улучшения состояния, после чего повторно каждые 4 ч. При
недостаточном эффекте добавляют ипратропий бромид 250—
500 мкг в виде аэрозоля каждые 4 ч. Эти препараты можно
применять вместе или поочередно через каждые 2 ч. При
длительном недостаточном эффекте следует начать внутривен-
ное введение эуфиллина (если ранее пациент не принимал этот
препарат) или сальбутамола, если уже был применен эуфиллин.
3. Для ликивидации дегидратации назначьте внутривенно
изотонический раствор натрия хлорида и 5 % раствор глюкозы
в равных соотношениях в общей дозе 2—3 л/сут. Питье. Кон-
троль: гематокритное число не должно быть выше 0,40; ди-
урез — не менее 0,5 мл/кг массы тела в час. ЦВД следует
поддерживать в пределах 6—12 см вод.ст.
4. Эуфиллин — нагрузочная доза: 250—500 мг (5 мг/кг) внут-
ривенно в течение 10—15 мин. Не применяйте эуфиллин, если
систолическое АД менее 100 мм рт.ст.! Для снижения риска
аритмий введение раствора эуфиллина следует сопровождать
ингаляцией кислорода. Поддерживающая доза: 0,5 мг/(кг ч)
внутривенно. Дозу следует снизить вдвое при невозможности
определения концентрации препарата у больных с застойной
сердечной недостаточностью или заболеванием печени. Тера-
певтические пределы концентрации теофиллина в сыворотке
крови равны 10—15 мкг/мл. Взрослым со средней массой тела
следует проводить инфузию 240 мг эуфиллина (10 мл 2,4 %
раствора) на 1 л изотонического раствора натрия хлорида или
5 % раствора глюкозы (декстрозы) в течение 8 ч. Общая доза
растворов натрия хлорида и глюкозы указана в п.З. Сальбута-
мол — 5 мг растворяют в 500 мл изотонического раствора на-
трия хлорида или в 500 мл 5 % раствора глюкозы. Начальная
скорость введения 1 мл/мин, при необходимости увеличьте
скорость введения до 3 мл/мин.
5. При рефрактерном течении приступа назначайте кортико-
стероиды внутривенно: гидрокортизон по 200 мг каждые 6 ч или
метилпреднизолон по 125 мг каждые 6 ч. При тяжелом приступе
введите 200 мг гидрокортизона в самом начале лечения.
6. При неэффективности проводимой терапии обеспечьте рес-
пираторную поддержку неинвазивным (вспомогательно-управляе-
мая ИВЛ) или инвазивным путем (интубация трахеи, ДО 7 мл/кг,
ЧД 12 в минуту, давление на вдохе не выше 30 см вод.ст.).
7. Мониторирование состояния больного.
8. На следующий день после поступления больного опреде-
лите у него уровни электролитов плазмы. Кортикостероиды, а
также сальбутамол могут вызвать значительную гипокалиемию.
При уровне калия ниже 3,5 ммоль/л назначьте препараты калия.
241
16-1069
Риск смерти от астмы высок у пациентов, длительно ис-
пользовавших системные кортикостероиды или недавно пре-
кратившие их применение. Причины смерти могут зависеть как
от тяжести основного заболевания, так и от неадекватного
лечения. К последнему относятся:
применение морфина, промедола и больших доз седатив-
ных средств;
недостаточная терапия (например, отказ от назначения
кортикостероидов при прогрессировании процесса);
слишком массивная терапия (превышение доз адреноми-
метиков и теофиллина, необоснованный перевод на
ИВЛ);
нераспознанные (в том числе ятрогенные) осложнения:
пневмоторакс, нарастание ауто-ПДКВ при ИВЛ и др.;
отсутствие современных респираторов;
отсутствие респираторного и гемодинамического мони-
торинга.
Глава 31 I ОСТРАЯ ГИПОТЕНЗИЯ
При остром снижении артериального давления (АД) ниже
75 мм рт.ст. с признаками снижения СВ, спутанностью созна-
ния, холодными кожными покровами, олигурией, метаболи-
ческим ацидозом требуется проведение неотложных лечебно-
диагностических мероприятий. Снижение АД свидетельствует о
недостаточном кровоснабжении таких важных органов, как
сердце и мозг, и должно быть расценено как угрожающее жизни
состояние.
Во всех случаях острой гипотензии немедленно начинают
оксигенотерапию. Если есть подозрение на острую гиповоле-
мию или вазодилатацию, ставят катетер в вену (предпочтитель-
но в центральную) и вводят 250 мл коллоидного раствора.
(План неотложных мероприятий представлен ниже.)
Информация, позволяющая определить причину гипотен-
зии, может быть получена из данных физикального обследова-
ния и анамнеза (последнее не всегда возможно). Причину
гипотензии определяют путем исключения трех основных па-
тофизиологических состояний, вызывающих эту патологию.
1. Гипотензия в результате снижения насосной
функции сердца: аритмии, острый инфаркт миокарда левого
или правого желудочка, повышенное сопротивление легочных
сосудов, острое поражение клапанного аппарата сердца, мас-
сивная эмболия легочной артерии, тампонада сердца, напря-
женный пневмоторакс, перераздувание легких при ИВЛ поло-
жительным давлением. Повышенное сопротивление легочных
242
сосудов и правожелудочковая недостаточность считаются ос-
новной причиной развития осложнений и смертности у боль-
ных с острыми легочными заболеваниями (острая пневмония,
респираторный дистресс-синдром взрослых). Гипотензия
может возникать в результате острой гипоксемии и гиперкап-
нии при нарушениях дыхания и вторичной сердечной недоста-
точности.
2. Гипотензия в результате острой гиповолемии: по-
теря жидкости наружу — кровотечение, ожоги, рвота, диарея,
полиурия, избыточное потоотделение; потеря жидкости внутри
тела — внутреннее кровотечение, травма, депонирование жид-
кости в кишечнике (кишечная непроходимость), брюшной по-
лости (перитонит), забрюшинном пространстве (панкреатит).
3. Гипотензия в результате вазодилатации: сепсис,
лекарственные препараты, отравления, анафилаксия, острая
надпочечниковая недостаточность.
Принципы лечения гипотензии:
♦ устранение гипоксемии и гиперкапнии, вызванных ост-
рыми нарушениями дыхания;
♦ восстановление сердечного ритма при аритмии;
♦ оптимизация ОЦК и водно-электролитного баланса;
♦ проведение инотропной/вазопрессорной терапии;
♦ устранение метаболических нарушений;
♦ выявление и устранение других причин, вызвавших ги-
потензию.
Неотложные лечебные мероприятия:
(АДсист. меньше 75 мм рт.ст., Адср. меньше 60 мм рт.ст.):
♦ уложить больного на спину, придать ногам возвышенное
положение;
♦ дать кислород. При необходимости — вентиляция с по-
мощью маски. Эндотрахеальная интубация (см. ниже);
♦ катетеризация вены;
♦ внутривенно 250 мл коллоидного раствора;
♦ ЭКГ-мониторинг;
♦ если АД не определяется, внутривенно медленно вводят
1 мг адреналина (1 мл 0,1 % раствора развести в 10 мл
0,9 % раствора натрия хлорида);
♦ исключить напряженный пневмоторакс, повышенное дав-
ление в дыхательных путях, если проводится ИВЛ;
♦ наладить контроль ЦВД;
♦ измерять диурез;
♦ нормализовать сердечный ритм при аритмии (см. главу 21).
Высокое ЦВД (более 12 см вод.ст.) указывает на возмож-
ность недостаточности правого и левого сердца, эмболии ле-
гочной артерии, инфаркта правого желудочка, тампонады серд-
ца и напряженного пневмоторакса, повышения давления в
243
дыхательных путях при ИВЛ. Некоторые из этих состояний
подтверждаются при ЭКГ-исследовании.
При напряженном пневмотораксе делают пункцию плевраль-
ной полости. Наиболее часто это осложнение возникает при
травме грудной клетки. Клиническая картина очень похожа на
таковую при тампонаде сердца с низким или неопределяемым
АД. Для поврежденной половины грудной клетки характерны
гиперинфляция и отсутствие расширения при вдохе. Трахея и
сердце смещены в сторону здорового легкого, а дыхательные
шумы значительно ослаблены. Может возникать при отсутст-
вии травмы грудной клетки при ИВЛ. Пункцию плевральной
полости проводят иглой большого диаметра во втором межре-
берном промежутке по среднеключичной линии для устране-
ния положительного давления в этой половине грудной клетки.
К игле присоединяют резиновую трубку, конец которой опус-
кают в сосуд с водой, или же используют выпускной клапан,
чтобы исключить попадание воздуха в плевральную полость.
Иглу в плевральной полости оставляют до установления по-
стоянного дренажа.
При повышении давления в дыхательных путях в результате
неисправности респиратора отключите респиратор, проводите
ручную вентиляцию и аускультацию легких, устраните неисправ-
ность, осуществите контроль давления в трахее во время ИВЛ.
Тампонада сердца проявляется одышкой в сочетании с па-
радоксальным пульсом (падение АДСИСТ более чем на 10 мм
рт.ст. на вдохе), повышением давления в яремных венах и
гипотензией. Наиболее частые причины тампонады сердца:
острый инфаркт миокарда (на фоне введения гепарина), эндо-
вазальные процедуры с перфорацией сердца и перикардит.
Тампонада сердца может возникнуть после установки цент-
рального венозного катетера при продвижении его в полость
правого предсердия.
Дайте кислород, катетеризируйте периферическую вену,
осуществите постоянный ЭКГ-контроль, произведите рентге-
нографию грудной клетки, эхокардиографию, при значитель-
ном выпоте в полости перикарда немедленно произведите
пункцию перикарда. При невозможности немедленного пара-
центеза применяйте медикаментозную инотропную поддержку
и введите внутривенно коллоидный раствор. При малом объе-
ме выпота пункция не показана. При проведении пункции
перикарда возможны опасные осложнения: пункция камеры
сердца, повреждение коронарной артерии, аритмия, пневмото-
ракс, перфорация желудка.
Сердечные аритмии. Показана противоаритмическая тера-
пия (см. ч.З).
Если гипотензия возникла по неустановленным причинам,
нужно ввести 250 мл коллоидного раствора в течение 5 мин и
вновь измерить ЦВД. Если при этом ЦВД повысилось на 2—
244
4 см вод.ст., но отмечается клиническое улучшение (подъем АД),
следует предположить гиповолемию и продолжать инфузион-
ную терапию, исходя из данных мониторинга ЦВД, АД, ЧСС.
Если после введения коллоидного раствора улучшения нет,
следует вновь провести нагрузку объемом. При отсутствии
улучшения причиной гипотензии является нарушение насо-
сной функции сердца. Рассмотрите возможность установки
катетера в легочную артерию и другие меры поддержки гемо-
динамики (добутамин, допамин, вазопрессоры).
Центральное венозное давление — важное звено диагностики
состояния и определения объема инфузионной терапии.
Давление заклинивания легочных капилляров, измеренное с по-
мощью катетера Свана—Ганца, при сердечной недостаточности
служит ориентиром терапии при продолжающейся гипотензии.
Срочно определите рО2, рСО2 и pH артериальной крови.
Если раО2 меньше 60 мм рт. ст., a saO2 меньше 90 %, несмотря
на дыхание 60 % кислородом, примените вспомогательную ИВЛ
или, при недостаточной эффективности указанных мероприя-
тий, — интубацию трахеи с ИВЛ 100 % кислородом. Если при
этом раСО2 выше 45 мм рт.ст., то ИВЛ обязательна. При
повышении раО2 до 90—100 мм рт.ст. и saO2 выше 90 % умень-
шите концентрацию вдыхаемого кислорода до 60 %. Если по-
казатели раО2 и saO2 на нормальном уровне, раСО2 равно
40 мм рт.ст. или ниже этого уровня, а АДСИСТ повысилось до
100 мм рт.ст., то причиной гипотензии была гипоксемия. Про-
должайте ИВЛ с FiO2 0,5 при условии сохранения уровня раО2,
равного или выше 75 мм рт.ст. Выясните причину респиратор-
ных нарушений (пневмония, РДСВ, передозировка наркоти-
ческих средств, миорелаксантов или других препаратов).
Если pH артериальной крови ниже 7,2, введите 50 мл 8,4 %
раствора бикарбоната натрия в течение 15 мин. Выраженный
метаболический ацидоз дает отрицательный инотропный эф-
фект и способствует возникновению гипотензии.
Недостаточность насосной функции сердца. Если АД остает-
ся низким, вводят допамин в режиме 5—15 мкгДкгмин) или
добутамин 10 мкгДкгмин), при необходимости увеличивая до-
зу. Высокие ЦВД и ДЗЛК указывают на недостаточность на-
сосной функции сердца. Важно дифференцировать острую
правожелудочковую от острой левожелудочковой недостаточ-
ности, ведущей к отеку легких.
Острая правожелудочковая недостаточность чаще возника-
ет у больных с острым нижним или нижнезадним инфарктом
миокарда и при тромбоэмболии легочной артерии, иногда при
острых легочных заболеваниях. Нарушения гемодинамики при
острой правожелудочковой недостаточности вначале заключа-
ются в диспропорциональном повышении давления в правом
предсердии по сравнению с изменением легочного капилляр-
ного давления заклинивания, что ведет к уменьшению пред-
245
нагрузки левого желудочка и уменьшению системного выброса.
Системное венозное давление повышено, имеются симптомы
трехстворчатой недостаточности (ритм галопа). При стойком
снижении СВ следует ввести в легочную артерию плавающий
катетер (катетер Свана—Ганца), установить внутриартериаль-
ный катетер. Внутривенно вводят жидкость до достижения
давления в правом предсердии 20—25 мм рт.ст. Внутривенное
введение добутамина начинают с 3 мкгДкгмин), при повыше-
нии АД свыше 100 мм рт.ст. вводят нитропруссид, начиная с
10 мкгДкгмин), продолжают введение жидкости. Если гипо-
тензия и низкий СВ сохраняются, необходимо рассмотреть
вопрос о возможности контрпульсации в легочной артерии.
Острая левожелудочковая недостаточность у взрослых боль-
ных наиболее часто встречается в острой стадии инфаркта
миокарда при стенозирующем коронарном атеросклерозе. Вы-
раженная ишемия значительного участка левого желудочка
также может привести к транзиторной левожелудочковой не-
достаточности. Остро возникающая недостаточность митраль-
ного или аортального клапана также может быть причиной
острой левожелудочковой недостаточности. Лечение — см. ч. 3.
Если гипотензия продолжается, необходимо предположить
возможность аортальной контрпульсации (предположительно
гипотензия может быть обусловлена разрывом межжелудочко-
вой перегородки или митральной регургитацией).
Если ЦВД низкое или нормальное, а кожные покровы теп-
лые, то возможной причиной гипотензии является сепсис или
передозировка наркотических, седативных средств, возможно
отравление.
Снижение ЦВД ниже нормы (тем более, если и ДЗЛК ниже
6 мм рт.ст.) свидетельствует о гиповолемической природе ги-
потензии. Непосредственными причинами могут быть крово-
течение, патологические потери жидкости с мочой, через ЖКТ,
кожу, секвестрация жидкости в третьем водном пространстве
(например, при панкреатите). Относительная гиповолемия,
возникающая вследствие вазодилатации, перераспределения
жидкости в водных пространствах характерна для сепсиса, ана-
филактического шока. Гипотензия может возникать в острых
ситуациях (сепсис, кровопотеря, операция) в результате пер-
вичной или вторичной надпочечниковой недостаточности.
При кровотечении, гиповолемическом шоке проводят весь
комплекс неотложных лечебных мероприятий, главным звеном
которого является ИТТ (см. ч. 4). Если, несмотря на адекват-
ную ИТТ, ЦВД 10—12 см вод.ст., ДЗЛК 15—20 мм рт.ст.,
АДсист остается ниже 90 мм рт.ст., следует начать применение
инотропных и вазопрессорных препаратов (табл. 31.1).
Адреналин обладает сбалансированным а- и р-агонистичес-
ким действием, при отсутствии аритмий повышает среднее
артериальное давление, ОПСС и СВ.
246
Таблица 31.1. Дозы инотропных и вазоактивных препаратов (по D. Spri-
gings et al., 2000)
Препарат Доза, мкг/(кг-мин) Действие (эффекты)
Адреналин Норадреналин Допамин1 Добутамин1 0,05 0,05-5 0,05-5 2,5 5-10 10-40 2-5 10-20 Инотропный (pj) +++ Вазопрессорный (а]) +++ Вазодилатационный (Р2) ++ oq ++++, Р] +++ Паренхиматозная вазодилатация Р] +++, D-действие oq +++ Pj +++, D-активность, р2 + Р( ++, cq +++
1 Действие зависит от дозировки, “+” слабое действие, “++” умеренное
действие; “+++” сильное действие; D — допаминергическое действие.
Норадреналин — преимущественно cq-агонист с умеренной
Р1 -активностью.
Допамин — предшественник норадреналина, его действие
зависит от скорости введения. В дозах 2—5 мкгДкгмин) об-
ладает pj-активностью и в меньшей степени р2-активностью-
В этих дозах препарат стимулирует почечные допаминовые
рецепторы, усиливая скорость клубочковой фильтрации и спо-
собствуя выделению Na\ При увеличении дозы преобладает
oq-действие.
Добутамин — аналог изопротеринола, вызывает гораздо мень-
шую а!-стимуляцию, чем допамин. В отличие от изопротери-
нола добутамин повышает СВ за счет ударного объема, тем не
менее при гиповолемии может возникать увеличение ЧСС.
Более всего препарат подходит для лечения больных с низким
СВ и почти нормальным АД (АДСИСТ 90—100 мм рт.ст), спо-
собствует снижению ОПСС при высоких его значениях.
Во время лечения гипотензии, при назначении инфузион-
ных и медикаментозных средств необходимо контролировать
диурез. Введите катетер в мочевой пузырь. Нормальный диурез
должен составлять около 50 мл/ч или 0,7 млДкгч), при гипо-
тензии всегда ниже. Диурез является хорошим индикатором
почечного кровотока и СВ. Желательно, чтобы мочеотделе-
ние при лечении острой гипотензии было не меньше 30 мл/ч
(0,5 мл/(кгч).
Острая надпочечниковая недостаточность — одна из причин
рефрактерной гипотензии, часто наблюдаемой в ОИТ. Шок
может быть первичным симптомом острой недостаточности
надпочечников, вызванной осложнением инфекции или дегид-
ратации. Гипотензия — наиболее типичное и более других уг-
рожающее жизни состояние, обусловленное острой надпочеч-
247
никовой недостаточностью. Гипотензия возникает, в частнос-
ти, вследствие гиповолемии и пониженного ОПСС, неспособ-
ности организма поддерживать сосудистый тонус в соответст-
вии со сниженным СВ. О степени гемодинамических наруше-
ний, возникающих при недостаточности надпочечников, судят
по гемодинамическим показателям:
♦ низкое ДЗЛК (малый СВ), низкое ОПСС характерны
для коллапса при аддисоническом кризе;
♦ низкое ДЗЛК (малый СВ), нормальное ОПСС — сочета-
ние гиповолемии и неспособности к периферической
вазоконстрикции в ответ на малый СВ характерны для
легких форм недостаточности надпочечников;
♦ нормальное или низкое ДЗЛК (большой СВ), низкое
ОПСС характерны для септического шока, предраспола-
гающего к некрозу надпочечников.
Концентрация Na+ в сыворотке крови чаще всего снижена,
а концентрация К+ повышена. Если при этом в моче содер-
жание натрия высокое или уровень калия низкий, то вероятна
недостаточность надпочечников. Используют пробу-тест с
АКТГ с определением уровней кортизола в сыворотке крови
[Марино П., 1998].
Основой лечения являются глюкокортикоиды и сольсодер-
жащие растворы (NaCl). Если АД снижено и после проведен-
ной инфузионной терапии не поддается восстановлению, сле-
дует сразу же начать введение глюкокортикоидов, даже до
определения результатов теста. Применяют ударную дозу дек-
саметазона (10 мг внутривенно болюсно). Этот препарат прак-
тически не влияет на определение содержания кортизола в
пробах крови.
При установлении надпочечниковой недостаточности: гид-
рокортизон 250 мг с последующим введением препарата по
100 мг до выведения больного из стрессового состояния. После
стабилизации АД дозу гидрокортизона постепенно уменьшают
до 10 или 20 мг/сут. При нормальной реакции надпочечников
на введение АКТГ применение гидрокортизона не показано.
Во всех случаях лечения больных с надпочечниковой недоста-
точностью следует применять только короткодействующие
кортикостероиды в самых низких эффективных дозах.
Если причина гипотензии не ясна, проведите дополнитель-
ные исследования:
♦ рентгенографию грудной клетки;
♦ анализ мочевины, натрия и калия;
♦ определите уровень глюкозы в крови;
♦ определите осмоляльность плазмы;
♦ общий анализ крови (уровень гемоглобина, количество
нейтрофилов);
248
♦ продолжайте определение pH, компонентов КОС, газов
артериальной крови;
♦ путем сопоставления гемодинамических параметров оп-
ределите профиль ЦГД;
♦ оцените полученные данные с возможностью септичес-
кого синдрома (температура тела, количество лейкоци-
тов, сдвиг формулы крови, посев крови и мочи);
♦ более детально изучите историю болезни, особое внима-
ние следует обратить на возможность передозировки ле-
карственных средств или отравления.
Глава 32
ОСТРЫЙ ГЕНЕРАЛИЗОВАННЫЙ СЕПСИС
И СЕПТИЧЕСКИЙ ШОК
Клиническая симптоматика часто неспецифична. Важные
признаки — нарушения психики и гипервентиляция с дыха-
тельным алкалозом, лихорадка и озноб — встречаются не всегда
(до 15 % больных имеют нормальную или пониженную темпера-
туру тела); ЧСС более 90 в минуту, АДсИСТ менее 90 мм рт.ст.
Ранними признаками септического состояния могут быть уве-
личение СВ, снижение ОПСС. По мере прогрессирования про-
цесса нейропсихические расстройства (дезориентация, эйфо-
рия, возбуждение, сопор) прогрессируют, АД значительно сни-
жается (АДСИСТ <90 мм рт.ст. или падение АД более чем на
40 мм рт.ст., устойчивое к восполнению ОЦК), ухудшающийся
газообмен по типу РДСВ (отношение раО2/ F1O2 <300); мета-
болический ацидоз или лактат-ацидоз, олигурия или почечная
недостаточность (диурез<0,5 мл/(кгч), гипербилирубинемия,
лейкоцитоз или лейкопения (число лейкоцитов больше 10 000
в 1 мм3 или меньше 4000 в 1 мм3), коагулопатия (число
тромбоцитов<100 000 в 1 мм3; МНО>2,0; АЧТВ>1,5 от кон-
трольного или повышение продуктов деградации фибриноге-
на—фибрина). Некоторые клиницисты выделяют триаду симп-
томов, которая служит продромой септического шока: нарушение
сознания (изменение поведения и дезориентация), гипервен-
тиляцию, определяемую на глаз, и наличие очага инфекции в
организме.
Неотложные лечебные мероприятия:
♦ если раО2 ниже 60 мм рт.ст. или отмечается цианоз,
немедленно начните оксигенотерапию: подача газовой
смеси с 50 % кислородом. В дальнейшем контролируйте
раО2 или проводите пульсоксиметрию — обеспечьте по-
249
дачу кислорода с концентрацией, которая обеспечивает
уровень раО2 75 мм рт.ст., a saO2 должно быть не ниже
90 %;
♦ если АДсист меньше 90 мм рт.ст., быстро произведите
катетеризацйю центральной вены и введите 500 мл кол-
лоидного раствора в течение 15—30 мин с постоянным
определением ЦВД и АД. Показатель ЦВД ниже 6 см
вод.ст. подтверждает наличие гиповолемии (и, возможно,
вазодилатации). Поэтому продолжайте инфузионную те-
рапию преимущественно изотоническим раствором 0,9 %
натрия хлорида. При недостаточном эффекте повторно
введите 250 мл коллоидного раствора. Желательно, чтобы
уровень ЦВД достиг 10 см вод.ст.;
♦ наладьте гемодинамический мониторинг, определите СВ,
СИ, давление наполнения левого желудочка, ОПСС;
♦ введите катетер в мочевой пузырь для регистрации поча-
сового диуреза. Диурез менее 30 мл/ч или 0,5 млДкг-ч)
свидетельствует о недостаточной перфузии почек и под-
тверждает недостаточность кровообращения. Желатель-
но, чтобы скорость мочеотделения была не менее 30 мл/ч
(норма 50 мл/ч);
♦ с помощью неинвазивного мониторинга определите ге-
модинамический профиль. Если СИ высокий (больше
4 лДминм2), а ОПСС ниже 1000 дин с/(см5 м2 и ДНЛЖ
меньше 12 мм рт.ст., АДСИСТ остается меньше 90 мм
рт.ст., то это указывает на вазодилатацию и, возможно,
некорригированную гиповолемию. Продолжайте инфу-
зионную терапию и примените вазопрессоры (например,
норадреналин в дозе 0,05—5 мкгДкгмин);
♦ если у больного ЧД приближается к 30 в минуту, а пока-
затели газообмена указывают на гипоксемию (раО2<60 мм
рт.ст., saO2<90 %, то это требует применения вспомогатель-
ной или искусственной вентиляции легких с FiO2 0,5—0,6.
Полная респираторная поддержка обеспечивает лучшее
распределение кровотока к дыхательным мышцам, стра-
дающим от гипоксии и усиленной работы. Необходи-
мость в полном выключении дыхания встречается редко,
если есть возможность тщательной регулировки ДО, ЧД
и объемной скорости потока. Следует стремиться к оп-
тимизации газообмена и созданию дыхательного ком-
форта, при котором не требуется применения мышечных
релаксантов. Не следует повышать внутриальвеолярное
давление выше 30—35 см вод.ст., saO2 должно быть >88 %.
Необходимо поддерживать режим нормокапнии или кон-
тролируемой гиперкапнии. Если saO2 остается низким,
показано применение ПДКВ [Бочаров В.А., 2003];
♦ определение гемодинамического профиля по величине
СИ, ДЗЛК (ДНЛЖ) и ОПСС и показателей транспорта
250
кислорода служит ориентиром для дальнейшей тактики
лечения. Следует учитывать, что оптимальные значения
СВ, индекс ОЦК при септическом шоке должны превышать
нормальные показатели для обеспечения повышенных пара-
метров транспорта кислорода. Так, оптимальные значения
СИ должны быть более 4,5 л/(минм2), индекс доставки
кислорода DO2 >600 мл/(минм2), индекс потребления кисло-
рода VO2 >170 мл/(минм2); индекс ОЦК у мужчин >3 л/м2,
у женщин >2,8 л/м2;
♦ у больных с септическим шоком до начала активной
терапии наблюдается значительное снижение объема об-
щей жидкости, ОЦК при сниженном ОПСС. Потери
жидкости при сепсисе обусловлены алиментарными фак-
торами, большими внешними потерями (одышка, потли-
вость, рвота, диарея), повышенной эндотелиальной про-
ницаемостью, депонированием в третьем водном про-
странстве. Общие потери достигают 4—6 л и требуют
замещения преимущественно изотоническим раствором
натрия хлорида с применением коллоидных растворов, в
том числе альбумина. В критических ситуациях может
быть использован 7,5 % раствор натрия хлорида путем
дробного болюсного введения по 50 мл в общей дозе 4—
6 мл/кг массы тела, с одновременным введением раство-
ра декстрана с молекулярной массой 60 000 или 70 000
Дальтон;
♦ контролем правильности избранной тактики лечения
служат повторные измерения значений СИ, ДЗЛК или
ДНЛЖ, ЦВД, ОПСС, а также pH, раОг, saO2, расчеты
транспорта кислорода. Если ЦВД меньше 10 см вод.ст.,
ДЗЛК ниже 6 мм рт.ст., требуется дальнейшая инфузион-
ная терапия до достижения значений ЦВД = 10—12 см
вод.ст., ДЗЛК выше 12 мм рт.ст. При этом, если СВ не
достигает должных значений, показана инотропная под-
держка добутамином или допамином. Если же АДСИСТ
остается низким (что чаще всего связано со снижением
ОПСС), примените вазопрессоры (наиболее выражен-
ным вазопрессорным действием обладают норадрена-
лин, а также допамин и добутамин в дозах более 10 мкг
(кгмин);
♦ при исходной анемии или кровопотере необходимо про-
ведение гемотрансфузии. Переливают преимущественно
эритроцитную массу с таким расчетом, чтобы поддержать
уровень гемоглобина в пределах 100—120 г/л или гема-
токрита (0,30—0,35). Для улучшения гемоциркуляции
применяют реологические инфузионные среды (реопо-
лиглюкин, плазмастерил, HAES-steril). Допустимый уро-
вень диуреза должен составлять не менее 0,5 мл/(кг ч).
ДВС-синдром следует заподозрить у больных с длитель-
251
ным подтеканием крови из мест пункции или кровоте-
чением из операционной раны. Подтверждается тромбо-
цитопенией, повышенным протромбиновым индексом и
АЧТВ, повышенной концентрацией продуктов деграда-
ции фибрина. По показаниям назначают свежезаморо-
женную плазму (см. ч. 4);
♦ рассчитайте значения доставки и потребления кислоро-
да. Доставка кислорода к тканям (без учета растворенно-
го кислорода, влияние которого на содержание кислоро-
да в артериальной крови несущественно) определяется по
формуле:
Ьо2 [млДмин м2)] = 1,34 X НЬ (г/л) х СИ.
В норме индекс Ьо2 = 500—600 мл/(минм2).
Потребление кислорода (VO2) — количество кислорода,
поглощаемого тканями в течение 1 мин. Этот показатель
рассчитывают как произведение СИ на артериовенозную
разницу.по кислороду. При нормальных значениях СИ
индекс VO2 колеблется от НО до 160 млДминм2);
♦ определите компоненты КОС. Наличие метаболического
ацидоза, чаще всего связанного с повышенным уровнем
L- и D-лактата, указывает на гипоперфузию органов и
тканей, повреждение органелл и общую гипоксию. Это
требует более активной терапии, направленной на улуч-
шение макро- и микроциркуляции. При рН<7,2 показано
введение 50 мл 8,4 % бикарбоната натрия, поскольку сам
ацидоз оказывает отрицательное влияние на инотропную
функцию миокарда;
♦ стойкая олигурия, не поддающаяся простой коррекции
при устранении шока, является плохим прогностическим
признаком и требует целенаправленной терапии. На-
значьте допамин в малых дозах (1—3 мкгДкгмин) для
обеспечения почечной вазодилатации, определите уров-
ни натрия, калия, креатинина и глюкозы плазмы, исклю-
чите гиперкальциемию, инфекцию и обструкцию моче-
вых путей, не применяйте нефротоксичные препараты
(см. главу “Острая почечная недостаточность”);
♦ определите источник — “ворота” инфекции. Наиболее
частые источники инфекции, приводящие к тяжелому
сепсису: легкие (до 45 % от всех случаев сепсиса), ЖКТ
и органы брюшной полости (15 %), мочевые пути (15 %),
кожа и кости (5 %), ЦНС (2 %). К сожалению, не всегда
удается обнаружить очаг инфекции. Особое внимание
следует обратить на возможность “катетерного сепсиса”,
нозокомиальной пневмонии. Иногда причинами септи-
ческого синдрома могут быть эндокардит, менингит, сеп-
252
тический артрит. Осмотрите весь кожный покров, про-
екцию внутривенного катетера, полость рта и синусы.
При подозрении на инфицирование катетера удали-
те его и направьте кончик катетера на исследование
флоры.
II Без обнаружения, удаления или дренирования очага инфекции
|| лечение сепсиса малоперспективно!
♦ До выделения и идентификации флоры проводят эмпи-
рическую терапию антибиотиками широкого спектра
действия. Используют комбинации цефалоспоринов 3—
4-го поколения (лонгацеф, роцефин, цефтаксин и др.) с
аминогликозидами (амикацин или гентамицин) или без
них. Широко применяют и другие цефалоспорины — кла-
форан, цефтазидим. В тех случаях, когда удалось иденти-
фицировать микрофлору, возможно использование моно-
терапии (например, цефалоспоринами 3-го поколения,
карбапенемами и другими антибиотиками, имеющими
узкий спектр действия). При длительной лихорадке до-
бавьте эмпирическую противогрибковую терапию амфо-
терицином В. При подозрении на анаэробную флору
назначают антианаэробные препараты (метронидазол,
флагил — до 1,5 гв сутки). Применяют также средства,
усиливающие иммунные свойства организма: гамма-
глобулин или полиглобулин, специфические антиток-
сические сыворотки (антистафилококковые, антисине-
гнойные);
♦ отмену сердечно-сосудистой поддержки можно начинать
через 24—36 ч после стабилизации состояния. У некото-
рых пациентов сосудистая поддержка требуется в течение
нескольких дней;
♦ неотложные исследования при септическом шоке:
1) общий анализ крови (количество лейкоцитов при сеп-
тическом шоке может быть снижено, снижение количества
тромбоцитов может свидетельствовать о ДВС-синдроме);
2) коагулограмма при симптомах кровоточивости;
3) исследование содержания в крови мочевины, натрия и
калия;
4) рентгенография грудной клетки;
5) определение уровня амилазы (при болях в животе);
6) определение газового состава и pH артериальной крови,
компонентов КОС многократно в процессе лечения шока;
7) мониторинг ЦГД, ЭКГ;
8) посевы крови;
9) микроскопия и посев мочи;
10) исследование цереброспинальной (спинномозговой)
жидкости при подозрении на менингит.
253
Глава 33
АНАФИЛАКТИЧЕСКИЙ ШОК
Анафилактическая и анафилактоидная реакции на лекарст-
венные препараты клинически неразличимы. Аллергические
реакции немедленного или анафилактического типа обуслов-
лены наличием гуморальных антител, которые образуются в
ответ на повторное поступление в организм аллергена (гапте-
на), получившего свойства полного антигена после соединения
с белками (аминокислотами) сыворотки или тканей. Анафи-
лактоидные реакции обусловлены прямым запуском высво-
бождения медиаторов самим лекарственным средством и поэ-
тому могут развиваться после первой дозы. Очевидно, что эти
реакции также могут протекать по типу анафилактического
шока и клинически неразличимы.
Следует подозревать анафилактическую реакцию, если
после внутривенной или внутримышечной инъекции, укуса
насекомых и контакта с соответствующим аллергеном возник-
ли следующие клинические симптомы:
♦ крапивница кожи и слизистых оболочек, зуд, отек типа
Квинке, ангионевротический отек гортани;
♦ стридор, одышка, возможна асфиксия;
♦ тахикардия, гипотензия, возможна потеря сознания, в то
время как другие симптомы анафилактической реакции
могут отсутствовать (кожные высыпания, бронхоспазм);
Среди прочих возможных симптомов анафилактической ре-
акции выделяют церебральную форму (психомоторное возбуж-
дение, страх, резкая головная боль, потеря сознания и судоро-
ги), а также абдоминальную форму (боль в животе, симптома-
тика “острого живота”).
Чем меньше времени прошло от момента поступления аллер-
гена в организм, тем тяжелее клиническая картина шока.
Реакция может быть молниеносной. Наибольшее число ле-
тальных исходов наблюдается через 3—10 мин с момента
поступления аллергена в организм. При внутривенном введении
клинические проявления возникают быстро (в пределах 3 мин).
Наиболее опасные из них: острая гипотензия, отек гортани,
бронхоспазм и ангионевротический отек. Крапивница чаще
всего наблюдается в легких случаях аллергии; это часто воз-
никающее проявление аллергии может отсутствовать при
анафилактическом шоке.
Причины анафилактической и анафилактоидной реакции:
• антибиотики: пенициллины, ванкомицин; цефалоспори-
ны, чаще всего класса р-лактамов;
254
• рентгеноконтрастные вещества;
• стрептокиназа;
• нервно-мышечные блокаторы;
• тиопентал-натрий;
• растворы желатина;
• препараты крови;
• витамин К;
• экстракты аллергенов;
• укусы перепончатокрылых насекомых;
• любые лекарственные средства.
Неотложные лечебные мероприятия
При гипотензии или коллипсе:
♦ адреналин 0,5—1 мг (5—10 мл раствора 1: 10 000 или
0,5—1 мл 0,1 % раствора) внутривенно. При невозмож-
ности внутривенной инъекции препарат вводят внутри-
мышечно или подкожно;
♦ дайте кислород: при угрожающем жизни состоянии —
100 % кислород (если превалируют симптомы обструк-
ции верхних и/или нижних дыхательных путей — см. раз-
дел 2);
♦ произведите катетеризацию любой доступной вены
(предпочтительно центральной). Короткий периферичес-
кий катетер по сравнению с длинным центральным ве-
нозным катетером позволяет быстрее вводить раствор.
Введите 500 мл гетерогенного коллоидного раствора (рас-
творы крахмала, декстран 40), можно использовать 5 %
раствор альбумина — 250 мл;
♦ продолжайте внутривенную инфузию раствора адренали-
на со скоростью 2—4 мкг/мин;
♦ присоедините ЭКГ-монитор (поскольку возможны арит-
мии, связанные с введением адреналина);
♦ при сохраняющейся гипотензии — гидрокортизон 100—
200 мг каждые 6 ч, продолжайте введение коллоидного
раствора и 0,9 % раствора натрия хлорида через централь-
ную вену, скорость введения сопоставляют с данными
систолического и среднего АД, а также ЦВД;
♦ во всех случаях анафилактической реакции следует не-
медленно устранить действие провоцирующего фактора
(немедленно прекратить введение лекарственного пре-
парата, наложить жгут проксимальнее места укуса насе-
комого, осторожно удалить жало с ядовитым мешочком,
если ужалила пчела, место укуса обколоть 0,1 % раство-
ром адреналина в количестве 0,3—1 мл и приложить к
нему лед).
255
При обструкции верхних (отек или спазм гортани) или ниж-
них дыхательных путей (бронхоспазм) необходимо:
♦ дать больному кислород и ввести адреналин;
♦ произвести интубацию трахеи при первых признаках на-
рушения проходимости дыхательных путей. Инспира-
торный стридор указывает на отек гортани, что угрожа-
ет жизни больного. Стридор возникает при обструкции
80 % просвета верхних дыхательных путей. Отсутствие
стридора не означает имеющейся обструкции дыхатель-
ных путей;
♦ начать искусственную или вспомогательную вентиляцию
легких с FiOn 0,5—0,6 под контролем раО2, раСО2 и pH.
Если раО2 >75 мм рт.ст., необходимо уменьшить FiO2 до
0,4-0,5;
♦ ввести эуфиллин. Начальная доза внутривенного введе-
ния составляет 5 мг/кг в течение 20 мин; поддерживаю-
щая — 0,5 мг/(кг ч);
♦ назначить гидрокортизон — 100—200 мг внутривенно че-
рез 4—6 ч. Следует учитывать, что кортикостероиды про-
являют свое действие через несколько часов;
♦ димедрол применяют в дозе 25—50 мг внутривенно через
4-6 ч.
Глава 34 I ОСТРАЯ ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ
Наиболее частая причина острой печеночной недостаточ-
ности — обострение хронического заболевания печени, вы-
званное разными причинами. В отделениях интенсивной тера-
пии печеночная недостаточность, часто сочетаемая с энцефа-
лопатией и даже комой, может возникать после больших
операций и анестезии, приема алкоголя, действия различных
лекарственных веществ: диуретиков, снотворных, седатив-
ных и наркотических средств, при отравлении парацетамолом.
К печеночной недостаточности приводят спонтанный бактери-
альный перитонит, интеркуррентная инфекция, острый вирус-
ный гепатит, желудочно-кишечное кровотечение.
Печеночная недостаточность сопровождается нарушением
распределения жидкости, часто наличием асцита (при циррозе
печени), задержкой воды и натрия, гипогликемией, гипокалие-
мией и другими возможными нарушениями электролитного
баланса, изменениями как метаболических, так и дыхательных
компонентов кислотно-основного состояния.
Предположить возможность развития острой печеночной
недостаточности можно у любого больного, страдающего забо-
256
леванием печени, особенно при наличии желтухи и неадекват-
ного поведения бального. Течение заболевания может быть
различным, возможна молниеносная печеночная недостаточ-
ность, которая, как правило, развивается вследствие вирусного
гепатита или действия гепатотоксинов. При прогрессирующей
печеночной недостаточности печень перестает выполнять свои
функции. Повышение концентрации билирубина в сочетании
с уменьшением секреции желчи приводит к развитию желтухи
и дефициту жирорастворимых витаминов F, D и К. Снижается
синтез печенью некоторых факторов свертывания крови. За-
медленный клиренс активирующих факторов свертывания и
тромбоцитопения проявляются склонностью к кровотечениям.
Гипоальбуминемия и внутрипеченочная обструкция сосудов
вызывают асцит и гиповолемию. В результате снижения объема
циркулирующей крови стимулируется выброс ренина, ангио-
тензина, альдостерона и антидиуретического гормона, что ве-
дет к задержке в организме воды и натрия.
Острая печеночная недостаточность сопровождается глубо-
кой дисфункцией важнейших органов и систем. Нарушаются
функции головного мозга, легких и почек. Печень не способна
обезвреживать продукты метаболических процессов в организ-
ме (в том числе аммиак), оказывающие токсическое воздейст-
вие на головной мозг. Полагают, что гепаторенальный синдром
(вид острой почечной недостаточности, которая развивается на
фоне тяжелого заболевания печени) возникает вследствие ва-
зоконстрикции в почечной ткани, обусловленной постоянным
выбросом ренина, АДГ и норадреналина [Горн М.М. и др.,
2000]. Этот синдром может возникать как при хронической,
так и острой печеночной недостаточности. Характеризуется
снижением экскреции соли и воды. Усугубляющими фактора-
ми являются введение нестероидных противовоспалительных
препаратов, дегидратация, повышение диуреза. При прогрес-
сировании процесса развиваются стойкая олигурия, азотемия,
снижение натрия мочи менее 10 ммоль/л.
Энцефалопатия может проявляться умеренной сонливостью,
нарушением внимания и психомоторной функции до более
выраженных симптомов (спутанность сознания, сильная сон-
ливость, глубокая кома — гепатаргия).
Гипотензия обусловлена гиповолемией и, возможно, сердеч-
но-сосудистой недостаточностью.
Почечная недостаточность может быть обусловлена прере-
нальными и интраренальными механизмами.
Гипогликемия часто возникает у больных с печеночной не-
достаточностью.
Коагулопатия связана с дефицитом витамина К, тромбоци-
топенией, снижением факторов свертывания.
Из других проявляющихся осложнений следует отметить
257
17-1069
возможность образования стрессовых язв желудка, гипоксемию
(в связи с отеком легких, образованием ателектазов, кровоиз-
лияний и пр.) и присоединение инфекции.
Нарушения водного баланса и распределения жидкости в
организме проявляются развитием периферических отеков, ас-
цита (часто у больных с циррозом), одновременно снижением
объема циркулирующей плазмы и гиповолемией.
Гипонатриемия может наблюдаться у больных с циррозом
печени, асцитом и периферическими отеками. Развивается по
механизму разведения (дилюции) в результате патологической
регуляции водного обмена почками.
Гипокалиемия также часто наблюдается у больных с асцитом
и отеками. Возможны значительные потери калия с мочой в
связи с высоким уровнем альдостерона и назначением диуре-
тиков. Одновременно с гипокалиемией снижается и содержа-
ние магния в крови.
Гиперкалиемия возникает в том случае, если печеночная
недостаточность осложняется развитием почечной недостаточ-
ности.
Экстренное обследование при подозрении на печеночную не-
достаточность:
• Определите уровень глюкозы крови. Если концентрация
глюкозы крови менее 3,5 ммоль/л, немедленно введите
40—60 мл 40 % раствора глюкозы. В дальнейшем следует
проводить инфузию 10 % раствора глюкозы или декстро-
зы под контролем уровня глюкозы крови каждые 2—4 ч.
Во избежание тромбофлебита пользуйтесь крупной пери-
ферической веной.
• Проведите полный клинический анализ крови, уровней
билирубина, альбумина, аминотрансфераз. При необхо-
димости определяют уровень аммиака в сыворотке крови.
• Определите тромбоциты и протромбиновое время.
• Определите уровни мочевины, креатинина, натрия и
калия в крови. При этом уровень мочевины может быть
низким в связи со сниженным синтезом мочевины в
печени. При повышении уровня мочевины и нормальном
креатинине следует исключить возможность кровотече-
ния из верхнего отдела желудочно-кишечного тракта.
• Определите кислотно-основное состояние и газы артери-
альной крови.
• Определите уровень парацетамола.
• Произведите микроскопию и посев мочи и асцитической
жидкости (при имеющемся асците).
• Проведите рентгенографию грудной клетки.
• При необходимости осуществите токсикологический ана-
лиз сыворотки и мочи, функциональные пробы печени,
маркеры вирусного гепатита.
258
Неотложные лечебные мероприятия
Оцените общее состояние пациента, найдите и устраните
причины, вызвавшие печеночную недостаточность.
• При угрожающем состоянии — выраженной энцефалопа-
тии, гипоксемии, сниженном АД — осуществите немед-
ленный перевод больного в ОИТ.
• Произведите катетеризацию центральной вены, определи-
те глюкозу крови, измерьте центральное венозное давле-
ние. До установки центральных и венозных катетеров
перелейте тромбоцитную массу, если число тромбоцитов
менее 50,0 109/л.
• При снижении уровня глюкозы в крови ниже 3,5 ммоль/л
необходимо немедленно внутривенно ввести раствор глю-
козы (см. “экстренное обследование при подозрении на
печеночную недостаточность”).
• При спутанном сознании или сильной сонливости следу-
ет поднять головной конец кровати на 20°, немедленно
определить pH и газы артериальной крови. При saC)2<90
мм рт.ст., или раС>2<70 мм рт.ст. проводите оксигеноте-
рапию до восстановления нормального уровня кислорода
крови. При усилении энцефалопатии и развитии прекомы
или комы показана интубация трахеи и ИВЛ в режиме
нормокапнии. Главной опасностью при глубокой энцефа-
лопатии является развитие фатального отека мозга, кото-
рый отмечается у 75—80 % больных. При этом может
наблюдаться пароксизмальная гипертензия, расширение
зрачков, устойчивый клонус стопы.
• При отеке мозга следует ввести внутривенно капельно
20 % раствор маннитола — 100—200 мл (0,5 г/кг) в тече-
ние 10 мин, если диурез превышает 30 мл/ч. При этом
следует проводить гипервентиляцию с раСОг 30 мм рт.ст.
Дальнейшее введение маннитола показано под кон-
тролем давления заклинивания, которое не должно пре-
вышать 15 мм рт.ст., и осмоляльности плазмы (до
320 мосм/кг).
• Лечение энцефалопатии требует устранения усугубляю-
щих факторов (ограничения или прекращения приема
белка, дегидратации, седативных препаратов, гипокалие-
мии). Следует вводить ежедневно 1400 ккал в виде угле-
водов. Перорально или через зонд вводят лактулозу и/или
неомицин, назначают клизмы с водой или прием слаби-
тельных.
• При наличии устойчивой гипоксемии следует исключить
патологию со стороны легких: пневмонию, ателектаз,
внутрилегочное кровоизлияние, плохое дренирование ды-
хательных путей. Следует увеличить FiO2 до 0,5—0,6 и
принять меры к лечению легочных осложнений.
259
При гемодинамических нарушениях, низком АД показана
катетеризация легочной артерии (так как ЦВД не может
отражать адекватное наполнение левого желудочка). При
наличии гиповолемии показано переливание раствора
альбумина или 5—10 % растворов глюкозы или декстрозы,
при снижении гемоглобина крови ниже 100 г/л показа-
но переливание крови. На основании критериев ЦВД и
ДЛА следует поддерживать адекватный ОЦК. Не реко-
мендуется назначать изотонический раствор натрия хло-
рида.
Поддерживайте уровень калия в плазме крови >3,5 ммоль/л,
глюкозы в крови также >3,5 ммоль/л.
Для лечения коагулопатии вводят витамин К внутривенно
по 10 мг/сут. Переливание тромбоцитов показано, если
их число <50,0 109/л. Свежезамороженную плазму пере-
ливают только при активном кровотечении.
Больные с печеночной недостаточностью весьма чувстви-
тельны к бактериальным инфекциям. Появление лихо-
радки или лейкоцитоза требует проведения интенсивного
поиска очага инфекции и немедленного лечения.
Если имеется асцитическая жидкость, аспирируйте 10 мл
для микроскопии и посева. Если в асцитической жидкос-
ти обнаружены лейкоциты (более 250 г/л, преимущест-
венно полиморфно-ядерные), то это подтверждает диа-
гноз бактериального перитонита, который может проте-
кать бессимптомно (без клинических признаков раздра-
жения брюшины). Начинайте лечение комбинацией из
амоксициллина, гентамицина и метронидазола. Если име-
ется лихорадка без очаговых признаков инфекции, также
показана антибактериальная терапия.
При асците назначают спиролактон и при необходимости
петлевые диуретики. Следует учитывать, что диуретики
могут привести к развитию гипокалиемического алкалоза.
Следует стремиться к тому, чтобы масса тела больного
снижалась примерно на 0,5 кг/сут.
Проводите мониторинг: ЦНС, пульс и АД, диурез, тем-
пература тела, saC>2, раСС>2, pH.
Показаны низкосолевая и безбелковая диета, профилак-
тика образования стрессорных язв желудка (в качестве
профилактической меры следует поддерживать внутриже-
лудочный pH >5) путем внутривенного введения цимети-
дина или ежечасным введением антацидов через назога-
стральный зонд.
Глава 35
ПОКАЗАНИЯ К НЕОТЛОЖНОМУ
ГЕМОДИАЛИЗУ
Почки являются единственным органом, полная недоста-
точность которых не всегда приводит к летальному исходу.
Гемодиализ может восстановить выделительную функцию
почек в случаях, когда поддерживающая терапия становится
недостаточной. Диагноз ОПН ставят на основании быстрого
повышения мочевины и креатинина в плазме, развития олигу-
рии в течение 3 ч (диурез ниже 200 мл/12 ч или 30 мл/ч), но
в части случаев возможна неолигурическая почечная недоста-
точность.
Неотложные лечебные мероприятия:
♦ решая вопрос о применении гемодиализа, рассмотрите
все возможные причины ОПН; некоторые из них, воз-
можно, являются обратимыми. При этом следует учиты-
вать и относительный риск осложнений гемодиализа,
опасность инфекционных и геморрагических осложне-
ний, вероятность быстрой регрессии ОПН, например при
остром тубулярном некрозе;
♦ исключите преренальные факторы почечной недостаточ-
ности. К ним относится недостаточная перфузия почек,
обусловленная гипотензией, гиповолемией, низким СВ,
нарушенной ауторегуляцией кровообращения (например,
при сепсисе), вазодилатацией (см. ч.2, гл. “Острая по-
чечная недостаточность”);
♦ АДСИСТ ниже 90 мм рт. ст., АДср ниже 60—70 мм рт. ст. —
вполне возможные причины преренальной недостаточ-
ности. Произведите катетеризацию центральной вены,
измерьте ЦВД и введите 250 мл коллоидного раствора в
течение 15 мин. Если ЦВД повысилось на 2—4 см и
достигло нормы (в среднем 10 см вод ст.) и АД также
повысилось, то причиной преренальной ОПН является
гиповолемия. Продолжайте инфузионную терапию изо-
тоническим раствором натрия хлорида;
♦ если АД после вливания коллоидного раствора не повы-
силось, а ЦВД возросло, это указывает на кардиогенную
причину гипоперфузии. Начните инотропную поддержку
и примените вазопрессоры до достижения стойкой нор-
мотензии.
При проведении инфузионной терапии соблюдайте осто-
рожность, так как возможна перегрузка жидкостью. Наблюдай-
те за скоростью диуреза. Появление влажных хрипов в базальных
261
отделах легких или (редко) периферических отеков указывает
на избыточную инфузию. Уровень ЦВД не всегда соответствует
степени гипергидратации, особенно при инфузии кристалло-
идных растворов;
♦ если водная нагрузка не привела к ускорению мочеотде-
ления, диурез ниже 40 мл/ч, начните терапию фуросеми-
дом и малыми дозами допамина. Эти препараты могут
восстановить диурез, перевести олигурическую форму
ОДН в неолигурическую и способствовать нормализации
водно-электролитного баланса. В течение 1 ч введите
шприцевым методом 250 мг фуросемида. В последующие
30—60 мин наблюдайте за темпом диуреза. Если темп
диуреза по-прежнему низкий, то в течение последующих
2 ч продолжайте вводить фуросемид с той же скоростью —
250 мг/ч. Если диурез увеличивается, можно продолжить
введение фуросемида со скоростью 30—60 мг/ч до мак-
симальной суточной дозы 2 г. Если диурез по-прежнему
низкий и имеется тенденция к анурии, прекратите вве-
дение фуросемида. При олигурии показано введение до-
памина в дозе 2,5 мкгДкг ч), который улучшает почечное
кровообращение;
♦ кроме анамнеза, физикального обследования, сведений о
применяемых лекарственных препаратах, необходимо
определять pH, раО2, раСО2, HCOJ, BE, уровень глюко-
зы крови, ОЦК в динамике. В сыворотке крови опреде-
ляют содержание калия, натрия, азота, мочевины, креа-
тинина. Необходимы также рентгенография грудной
клетки и ЭКГ. Проводят общий анализ крови и мочи,
исследуют показатели свертывающей системы крови, а
при подозрении на рабдомиолиз — креатинкиназу;
♦ к общим мероприятиям относится коррекция метаболи-
ческого ацидоза, которую необходимо начинать при
pH <7,0. В качестве первой дозы назначают 50 мл 8,4 %
раствора бикарбоната натрия в течение 15 мин с после-
дующим определением компонентов КОС. Одновремен-
но проводят лечение гиперкалиемии и связанных с ней
нарушений ЭКГ: вводят раствор глюконата кальция, глю-
козу, изотонический раствор натрия хлорида (см. главы
10, 11, 12, 13);
♦ исключите постренальную недостаточность. Фактически
она представляет собой преграду для мочеотделения: мо-
чевые камни, опухоль, гипертрофия предстательной же-
лезы, забрюшинное кровотечение, обструкция мочевого
катетера, сгусток крови или гноя. Проверьте проходи-
мость мочевого катетера. Обсудите с урологом дальней-
шее лечение. Может потребоваться УЗИ брюшной по-
лости;
262
Таблица 35.1. Анализ мочи при острой почечной недостаточности
Показатель Этиология ОПН
Эритроциты, протеинурия Миоглобинурия, гемоглобинурия Лейкоцитарные цилиндры Канальцевые цилиндры, клетки канальцев Мутный зернистый осадок Лейкоциты Острый гломерулонефрит, васку- лит, травма Рабдомиолиз Пиелонефрит Острый канальцевый некроз Острый канальцевый некроз Инфекция мочевого тракта, ин- терстициальный нефрит
♦ после исключения пре- и постренальной недостаточнос-
ти подтвердите диагноз интраренальной недостаточности
путем проведения биохимических анализов крови и мочи
(см. главу 14). Одновременно проведите анализ и микро-
скопию осадка мочи (табл. 35.1).
Нормальный или незначительно измененный анализ и оса-
док мочи при клинической картине ОПН может указывать на
преренальные причины, обструкцию мочевых путей, закупорку
канальцев, гиперкальциемию, атероэмболию почек.
♦ Если установлена ОПН, определите показания к неот-
ложному гемодиализу. Основными показаниями к про-
ведению неотложного гемодиализа при ОПН являются
уремическая энцефалопатия с перикардитом, повышен-
ной кровоточивостью, уровнем азота мочевины крови
выше 36 ммоль/л, уровнем креатинина 600 мкмоль/л,
содержанием калия более 6 ммоль/л, угрожающим жизни
ацидозом или наличии значительной перегрузки жид-
костным объемом (например, отек легких), которая со-
храняется несмотря на все усилия, предпринимаемые в
рамках интенсивной терапии. Заместительную терапию
почек лучше всего начинать рано, когда еще не развилась
полная анурия;
♦ вторым по частоте показанием к проведению гемодиали-
за является выраженная интоксикация низкомолекуляр-
ными диализируемыми веществами (этанол, этиленгли-
коль, изопропаноловый спирт, салицилат, литий);
♦ определите противопоказания к гемодиализу: а) выра-
женные гемодинамические нарушения; б) продолжаю-
щееся выраженное кровотечение (в этих случаях прово-
дят либо перитонеальный диализ, либо гемодиализ под
контролем коагулограммы, применяя низкие дозы гепа-
рина или без применения антикоагулянтов);
263
♦ гемодиализ обеспечивает высокую скорость кровотока
через большую мембрану, обладающую избирательной
проницаемостью. Эффективность удаления растворен-
ных в плазме веществ с низкой молекулярной массой
очень высокая. Гемодиализ — фактически единственный
метод быстрого удаления избытка жидкости и уремичес-
ких токсинов. Изменяя диализат, находящийся на про-
тивоположной стороне частично проницаемой мембра-
ны, можно быстро корректировать КОС и концентрацию
электролитов. Потери протеина отсутствуют. К пробле-
мам, обусловленным применением гемодиализа, отно-
сятся гемодинамическая нестабильность, связанная с бы-
стрыми перемещениями жидкости между внутриклеточ-
ным и внеклеточным пространствами, изменения осмо-
лярности, дисэквилибрационный синдром, гипотензия,
гипоксемия.
Наиболее удобным доступом для проведения гемодиализа
является катетеризация бедренной или подключичной артерии.
Кровь возвращается через катетер, установленный в перифе-
рической вене. В настоящее время чаще используют двупро-
светный катетер.
Коррекцию гипотензии проводят введением гипертоничес-
кого раствора хлорида натрия или маннита. Гипоксемию час-
тично можно отнести за счет потери СО2 диализирующей
жидкостью и последующего снижения минутной вентиляции.
Устранить гипоксемию можно, восстановив рСС>2 на уровне
35—42 мм рт.ст. или назначив оксигенотерапию.
Гемодиализ обычно возможен в специализированных уро-
логических отделениях, но во многих ОИТ общего профиля в
настоящее время проводят гемофильтрацию, которая нередко
бывает адекватной;
♦ гемофильтрацию применяют в тех случаях, когда пресле-
дуется первичная цель — удаление избытка внутрисосу-
дистого объема, включая не только воду, но и соли.
Используя механизм прерывистой или непрерывной ар-
териовенозной гемофильтрации (или вено-венозной
ультрафильтрации), можно ожидать эффективного удале-
ния растворенных веществ с малой и большой молеку-
лярной массой. Ультрафильтрацию используют для лече-
ния метаболического ацидоза путем замещения отфильт-
рованной жидкости бикарбонатом. Недостатком метода
является то, что уремические токсины, имеющие малую
и среднюю молекулярную массу, удаляются неэффектив-
но. Гемофильтрация становится неэффективной, когда
АДср падает ниже 60 мм рт.ст.
264
Глава 36
НАРУШЕНИЯ ВОДНОГО, ЭЛЕКТРОЛИТНОГО
И КИСЛОТНО-ОСНОВНОГО БАЛАНСА
У ХИРУРГИЧЕСКИХ БОЛЬНЫХ
Основная цель данной главы — изложение наиболее частых
нарушений водно-электролитного и кислотно-основного ба-
ланса у хирургических больных, возникающих в периопераци-
онном периоде, а также при острых заболеваниях брюшной
полости (острый панкреатит, кишечная непроходимость, пери-
тонит). Автор не ставил своей задачей детальное описание
методов коррекции выявленных нарушений, поскольку они
изложены в соответствующих главах.
Периоперационный период
Периоперационный период включает ведение больного
перед, во время и после операции.
Факторы предоперационного периода:
1) заболевания, по поводу которых предстоит операция, могут
приводить к значительным сдвигам жидкостного и электролит-
ного баланса. Хронические истощающие заболевания (рак, яз-
венная болезнь желудка и двенадцатиперстной кишки, болезни
печени и желчевыводящих путей и пр.) обычно сопровожда-
ются дефицитом основных электролитов, снижением содержа-
ния общего белка и альбумина плазмы, вторичной гиповоле-
мией и дегидратацией. Наиболее выраженные расстройства
водно-электролитного обмена возникают при тяжелых заболе-
ваниях ЖКТ, патологических процессах, приводящих к маль-
абсорбции, хронической потере крови и белка. Потери жид-
кости могут намного увеличиваться, если у больного имеют-
ся патологические потери (рвота, диарея, секвестрация жид-
кости);
2) сопутствующие заболевания, такие как сахарный диабет,
болезни сердца, печени и почек приводят к тем или иным
расстройствам общего и секторального баланса воды и элект-
ролитов, их течение становится более тяжелым в условиях
хирургического стресса. Ряд препаратов, назначаемых в пред-
операционном периоде (например, диуретики, кортикостерои-
ды) могут также влиять на состояние водного и электролитного
обмена;
3) подготовка к оперативному вмешательству: аспирация
содержимого желудка через зонд, промывание желудка, назна-
чение клизм и слабительных сопровождаются увеличением по-
терь жидкости. Обычно взрослые больные не должны есть
твердую пищу с полуночи накануне операции (соблюдение
правила “ничего через рот после полуночи”). В течение 2—4 ч
265
прекращения приема жидкости физиологические потери у взрос-
лого человека составляют 300—500 мл. С учетом всех вышеизло-
женных факторов дефицит жидкости может быть значительным;
4) анемия и гипопротеинемия. Нет единого мнения о мини-
мально допустимом для проведения плановой анестезии уровне
гематокрита. Соматически здоровые лица обычно хорошо пе-
реносят ее при гематокрите 25—30 %, но это может сопровож-
даться ишемией миокарда у больных ИБС. Снижение альбу-
мина плазмы ниже 30 г/л свидетельствует о значительной опас-
ности операции.
Подготовка больного к плановой операции включает коррек-
цию выявленных нарушений водного и солевого баланса, а
также КОС путем назначения соответствующей терапии. Уро-
вень белка восстанавливают путем регулярных трансфузий про-
теина и альбумина. Каждый случай анемии необходимо оцени-
вать индивидуально с учетом ее этиологии и продолжительности.
Если нет очевидных объяснений происхождения анемии, мо-
жет потребоваться отсрочка операции. Снижение уровня ге-
моглобина ниже 90 г/л требует заместительной терапии. У боль-
ных с мальабсорбцией, нарушением питания, кахексией может
потребоваться проведение парентерального питания.
При подготовке к экстренным операциям стараются ликви-
дировать или уменьшить наиболее опасные нарушения водно-
электролитного баланса (острая дегидратация, гиповолемия,
шок). Несмотря на непродолжительное время подготовки к
экстренной операции, все же удается значительно уменьшить
дегидратацию и гиповолемию, принять меры к ликвидации
метаболических и респираторных нарушений КОС, улучшить
состояние периферической и центральной гемодинамики, вос-
становить диурез.
Факторы операционного периода:
1) влияние анестезии. На фоне некорригированной гипово-
лемии при вводном наркозе и на других этапах анестезии
может развиться гипотензия вследствие влияния самих анесте-
тиков на сердечный выброс и ОПСС, нарушения компенса-
торных механизмов (вазоконстрикция или тахикардия);
2) кровопотеря, особенно внезапная и массивная, может
значительно осложнить течение операции. Ее объем не всегда
достаточно ясен при продолжающемся кровотечении. Следует
учитывать, что кровопотеря при больших оперативных вмеша-
тельствах имеет наибольшее значение как источник острого
дефицита жидкости;
3) депонирование жидкости в третье водное пространство
происходит постепенно, причем темп его зависит от характера
оперативного вмешательства (стресс) и, очевидно, от объема
инфузионной терапии. Даже небольшие по объему полостные
операции могут сопровождаться секвестрацией 1,5—3 л жид-
кости;
266
4) потери жидкости с дыханием, через кожу и раневую по-
верхность обычно превышают физиологические в 1,5—2 раза.
В среднем они составляют 60—100 мл/ч;
5) потери жидкости через почки — хороший индикатор во-
лемического статуса и состояния клубочковой фильтрации.
Нормальный темп диуреза должен быть равен 0,7 мл/кг/ч.
Скорость диуреза <30 мл/ч свидетельствует о снижении клу-
бочковой фильтрации, часто возникающей в результате гипо-
волемии и/или низкого СВ.
Инфузионно-трансфузионная терапия во время операции
должна проводиться с учетом всех основных положений и
правил возмещения жидкости. Дооперационные потери жид-
кости должны быть по возможности возмещены в процессе
предоперационной подготовки. При операциях целесообразно
применять в основном изотонические электролитные раство-
ры, содержащие натрий и хлор, с добавлением растворов са-
харов, обеспечивающих свободную воду. В целом объем замес-
тительной инфузионной терапии при неосложненных опера-
циях типа резекции желудка и резекции кишечника составляет
примерно 8 мл/кг в час, если нет патологической кровопотери.
При гипотензии используют коллоидные растворы. Кровь (пре-
параты крови) переливают при кровопотере, равной 20 % ОЦК
и более с учетом дооперационных показателей гемоглобина и
гематокрита (см. главы 23, 24, 25).
Факторы послеоперационного периода:
1) хирургический стресс и болевой синдром. В первые дни
после операции в результате усиленной продукции АДГ отме-
чаются задержка жидкости в тканях, снижение диуреза, воз-
можна гипонатриемия. Одновременно увеличивается количе-
ство образующейся эндогенной воды (до 300—400 мл/сут),
возрастают неощутимые потери. Характерна катаболическая
фаза белкового обмена. Наблюдаются значительные потери
плазменного и интерстициального альбумина. В то же время
концентрация глобулинов (всех фракций) в плазме возрастает.
На 3—5-й день после операции экскреция натрия почками
уменьшается;
2) изменения углеводного обмена в первые дни после операции
заключаются в развитии диабетогенного состояния обмена ве-
ществ. В плазме повышается концентрация жирных кислот, од-
новременно возникает гиперкетонемия. Потери калия и магния
с мочой увеличиваются, начиная со 2-го дня после операции;
3) гиповолемия и артериальная гипотензия часто связаны с
недостаточной инфузионной терапией во время операции, а
также могут возникать вследствие кровотечения, потери плаз-
менных белков и жидкости (депонирование в третьем водном
пространстве, выделение жидкости по дренажам, парез кишеч-
ника и секвестрация в нем жидкости, увеличение перспираци-
онных потерь в связи с повышением температуры тела);
267
4) нарушения водно-электролитного баланса возникают в ре-
зультате продолжающихся потерь жидкости из ЖКТ (рвота,
диарея, аспирация жидкости из желудка и кишечника), разви-
тия паралитической кишечной непроходимости и других при-
чин. В отдельных случаях могут наблюдаться прямо противо-
положные изменения баланса воды и электролитов: увеличение
массы тела в результате гиперинфузий, застойной сердечной
недостаточности, олигурической формы почечной недостаточ-
ности. При увеличении массы тела на 10 % и выше по срав-
нению с исходными данными послеоперационная летальность
значительно возрастает [Lowell J.J. et al., 1990];
5) гиперкалиемия, развивающаяся в раннем послеопераци-
онном периоде в результате хирургической травматизации тка-
ней и перехода калия из клеток во внеклеточное пространство
(см. главу 10);
6) гипокалиемия и гипомагнезиемия могут возникать на 3—5-й
день после операции в связи с увеличением выведения этих
ионов с мочой;
7) метаболический ацидоз, возникающий при гипотензии,
циркуляторной недостаточности, гипоксии;
8) дыхательный ацидоз и гипоксемия характерны для раннего
послеоперационного периода, возникают при угнетении дыха-
ния препаратами, используемыми для анестезии, зависят также
от объема и характера самой операции;
9) дыхательный алкалоз может развиться в результате гипок-
сии при легочных осложнениях (пневмония, ателектаз, отек лег-
ких, эмболия легочной артерии), а также при застойной сердеч-
ной недостаточности, сепсисе и метаболическом ацидозе.
Послеоперационный мониторинг включает тщательное на-
блюдение за уровнем сознания, характером дыхания, циркуля-
цией и состоянием водно-электролитного и кислотно-основ-
ного баланса. Все отмеченные осложнения должны быть бы-
стро устранены.
Острый панкреатит
Острый панкреатит — потенциально опасное для жизни за-
болевание. Независимо от причины любой панкреатит являет-
ся результатом повреждения органа аутопериваривающими
энзимами. Трипсин и химотрипсин, липаза и эластаза вызы-
вают повреждение белков, липидов и эластина. Панкреатит
возникает при многих заболеваниях, включая травмы и ин-
фекции, но наиболее часто, в 80 % всех случаев, причиной
острого панкреатита считают воздействие алкоголя и вызван-
ное желчными конкрементами попадание желчи в панкреати-
ческий проток. К менее частым причинам панкреатита относят
опухоли поджелудочной железы и общего желчного протока,
268
стеноз фатерова соска, травму брюшной полости, оперативные
вмешательства и действие лекарственных средств (например,
прокаинамида, ранитидина, ингибиторов ангиотензинпреоб-
разующего фермента, кортикостероидов, метронидазола, тетра-
циклина, тиазидов, фуросемида, этакриновой кислоты и др.).
Степень повреждения поджелудочной железы различна — от
острого отека ткани до некроза и кровоизлияний. Больные
острым панкреатитом обычно поступают с постоянной, тяже-
лой болью в животе и(или) в пояснице, которые усиливаются
в положении лежа на спине. Обычно наблюдаются тошнота,
рвота, тахикардия, снижение АД и небольшое повышение тем-
пературы тела. Иногда признаки панкреатита бывают невыра-
женными, но, как правило, отмечаются повышение темпера-
туры тела и постепенное снижение гематокрита. В некоторых
случаях острый панкреатит трудно отличить от холецистита,
мезентериальной ишемии и обострения язвенной болезни же-
лудка или двенадцатиперстной кишки. Один из довольно по-
стоянных признаков панкреатита — болезненность при паль-
пации в эпигастральной области (с признаками раздражения
брюшины или без них). Изменения лабораторных показателей
включают повышение активности амилазы и липазы в сыво-
ротке крови, количества лейкоцитов крови (обычно в пределах
от 10,0 до 25,0- 109/л), снижение концентрации кальция и уров-
ня альбуминов в сыворотке крови.
Для острого панкреатита характерны разнообразные нару-
шения баланса жидкости и электролитов. В результате высво-
бождения вазоактивных аминов происходит увеличение про-
ницаемости сосудов, что приводит к выходу альбумина и жид-
кости из сосудистого русла в интерстициальное пространство.
Потеря воды и электролитов происходит вследствие рвоты,
депонирования в тканях и полостях, паралитической непрохо-
димости, постоянного истечения и аспирации желудочного
сока. Выпоты в брюшную и плевральную полости, отечная
жидкость в пара- и ретропанкреатическом пространствах со-
держат большое количество белка. Воспаление и ложные кисты
поджелудочной железы могут разрушить главные сосуды, что
приводит к массивным кровотечениям в ЖКТ, брюшную по-
лость или в забрюшинное пространство. Гиповолемия и гипо-
тензия, инфекционные осложнения, воздействие лекарствен-
ных средств могут вызвать острую почечную недостаточность.
Наряду с потерей жидкости (4 л и более) после начала
острого панкреатита часто снижается уровень кальция в крови.
Гипокальциемия может сохраняться в течение нескольких не-
дель, но самый низкий уровень общего и ионизированного
кальция (7—8 мг/дл) отмечается приблизительно на 5-й день
после начала болей. Содержание натрия и хлоридов в крови,
особенно при деструктивных формах панкреатита, уменьшается.
Содержание магния и калия в сыворотке может быть снижен-
269
ным вследствие потерь из ЖКТ и недостаточного поступления
этих электролитов в процессе лечения. Снижение содержания
магния также связывают с его депонированием в некротизиро-
ванной жировой клетчатке. Гипомагнезиемия наиболее часто на-
блюдается при остром панкреатите, вызванном приемом алкого-
ля [Marini J.J., Wheeler А.Р., 2002]. Гипомагнезиемия может про-
воцировать резистентную гипокалиемию и гипокальциемию.
Острый панкреатит может привести к легочным осложне-
ниям: развитию инфильтратов, ателектазов или плеврального
выпота. Нередко встречаются пневмония и жировая эмболия.
Острый респираторный дистресс-синдром представляет собой
наиболее тяжелое осложнение, встречается в 10—20 % случаев
панкреатита, чаще у больных с тяжелым течением заболевания.
У большинства больных острым панкреатитом отмечаются ги-
поксемия и вызванный ею дыхательный алкалоз.
Наиболее опасны инфекционные осложнения, являющиеся
частой причиной смерти при остром панкреатите: панкреати-
ческий или поддиафрагмальный абсцесс, холангит, инфекция
мочевых путей, перитонит, сепсис.
Возможные нарушения водного, электролитного и кислотно-
основного баланса при остром панкреатите:
1) острая гиповолемия и гиповолемический шок. Дегидратация.
Первоочередной задачей является быстрое устранение гипово-
лемии и связанной с ней циркуляторной недостаточности. Для
этих целей особенно показаны раствор альбумина, плазма,
протеин или растворы декстранов и крахмала. Одновременно
назначают инфузионные электролитные растворы (раствор
Рингера, изотонический раствор натрия хлорида, “Лактасол”,
ионостерил), при отсутствии гипергликемии переливают раст-
воры глюкозы. Количественный и качественный состав инфу-
зионных сред может варьировать в зависимости от состояния
больного, степени гиповолемии, осмотического и онкотичес-
кого состояния крови. После ликвидации острой гиповолемии
проводят поддерживающую инфузионную терапию. Общий
объем инфузий в среднем составляет 50 мл/кг массы тела в
сутки при скорости введения 40—60 капель/мин. При необхо-
димости проводят стимуляцию диуреза. Переливание эритро-
цитной массы необходимо при снижении гематокрита ниже
30 %. Свежезамороженную плазму используют при кровотече-
ниях. Парентеральное питание назначают больным с тяжелым
течением панкреатита. Несмотря на все показания к проведе-
нию инфузионной терапии необходимо помнить, что гиперин-
фузия при остром панкреатите вполне возможна при имею-
щейся почечной или сердечной недостаточности, недостаточ-
ном учете всех потерь и поступлений жидкости. Так, по
данным шкалы Рансона (табл. 36.1), избыточный ОЦК (> 6 л)
является одним из критериев неблагоприятного прогноза при
остром панкреатите;
270
2) гипонатриемия возможна при потерях жидкости, содер-
жащей натрий, обусловленных повышением секреции антиди-
уретического гормона (АДГ) на фоне гиповолемии;
3) гипокальциемия возникает в результате отложений каль-
ция в очагах жирового некроза, уменьшения секреции парати-
реоидного гормона, являющегося основным регулятором уровня
кальция в сыворотке крови. К другим причинам гипокальцие-
мии относят гипоальбуминемию и почечную недостаточность,
если это осложнение имеет место. Выраженная гипокальцие-
мия (кальций<8 мг/дл) является одним из критериев неблаго-
приятного прогноза при остром панкреатите (также как и
снижение альбумина крови ниже 3,2 г/дл, раО2 <60 мм рт.ст.,
уровень глюкозы >180 мг/дл, число лейкоцитов >15,0- 109/л,
дефицит оснований >4 мэкв/л) (см. табл. 36.1). Для лечения
выраженной гипокальциемии внутривенно вводят раствор
кальция глюконата. У некоторых больных с гипотензией, ус-
тойчивой к восполнению ОЦК и вазопрессорной терапии,
введение 10 % раствора кальция хлорида может быстро повы-
сить АД [Горн М.М. и др., 2000; Марини Д.Д., Уилер А.П.,
2002];
4) гипомагнезиемия и гипокалиемия являются часто наруше-
нием баланса электролитов при остром панкреатите (см. главы
Ю, 11);
5) метаболический ацидоз — следствие гиповолемии, гипо-
тензии и шока. Наиболее вероятен лактат-ацидоз (см. главу 4).
Таблица 36.1. Критерии неблагоприятного прогноза при остром пан-
креатите
Показатели Шкала Рансона Упрощенная шкала Глазго
Возраст > 55 лет > 55 лет
Кальций < 8 мг/дл < 8 мг/дл
Глюкоза крови > 200 мг/дл > 180 мг/дл
Острый РДСВ + —
Лейкоцитоз > 16109/л > 15109/л
Рост мочевины крови > 5 мг/дл > 45 мг/дл
Лактатдегидрогеназа > 350 ед/дл > 600 ед/л
Падение гематокрита + —
Альбумин — < 3,2 г/дл
Дефицит оснований > 4 мэкв/л —
Избыточный ОЦК > 6 л —
раО2 — 60 мм рт.ст.
Примечание. “+” — критерий входит в данную шкалу; ” — критерий не
входит в данную шкалу.
271
Кишечная непроходимость
Кишечная непроходимость представляет собой нарушение
пассажа в ЖКТ в результате механических или функциональ-
но-динамических причин. Тяжесть клинической картины за-
висит от уровня кишечной непроходимости, ее причин, про-
водимой терапии. Различают тонкокишечную непроходимость
с острым началом и триадой признаков (тошнота, рвота и
острые боли в животе) и толстокишечную непроходимость,
которая встречается преимущественно в пожилом возрасте,
сопровождается острой болью в животе, запором (50 %) и
рвотой (50 %). Тонкокишечная непроходимость бывает обтура-
ционной, странгуляционной и спаечной. В большинстве слу-
чаев (примерно в 75 %) причинами тонкокишечной непрохо-
димости являются спайки, в остальных — ущемленные грыжи,
злокачественные новообразования и др. Чаще всего причинами
толстокишечной непроходимости являются рак толстой киш-
ки, дивертикул или заворот кишки.
Потери жидкости при кишечной непроходимости возника-
ют в результате рвоты, при толстокишечной непроходимости
происходит секвестрирование жидкости в растянутой кишке.
Задержка жидкости (до нескольких литров) и газов приводит
к резкому повышению давления в кишке и в конечном итоге —
к повреждению слизистой оболочки кишечной стенки. Секве-
стрирование значительного количества жидкости, потеря жид-
кости с рвотными массами часто сопровождаются прогресси-
рующим дефицитом жидкости, ведущим к шоку. Через повреж-
денную стенку кишечника в брюшную полость способны
проникать бактерии, вызывая перитонит. Общий объем поте-
рянной жидкости может быть очень большим. Учитывая то,
что эти потери носят изотонический характер, они быстро
приводят к нарушениям центральной и периферической ге-
модинамики, вначале по типу гиповолемического шока.
Нарушения микроциркуляции во многом зависят от гемо-
концентрации, повышения вязкости крови, приводящих к ста-
зу крови во всех мелких сосудах (особенно кишечника). Это
приводит к значительному уменьшению объема внеклеточного
пространства, т.е. объема плазмы и интерстициального секто-
ра. При этом потеря главного осмотического катиона (натрия)
может быть очень большой. Она связана с повышением актив-
ности антидиуретического гормона, часть натрия уходит в клет-
ки. Потери натрия с мочой в остром периоде заболевания
незначительны ввиду олигурии или анурии, состояния гипер-
альдостеронизма. Одновременно с потерей натрия развивается
дефицит калия и магния, связанный в основном с потерей
жидкости из ЖКТ. Гиповолемия и циркуляторная недостаточ-
ность сопровождаются метаболическим ацидозом. При высо-
272
кой кишечной непроходимости возможен метаболический ал-
калоз. Причинами алкалоза могут быть рвота, назогастральная
аспирация, потери Н+ и С1~. Чем ниже располагается участок
обструкции, тем более выражены нарушения водно-электро-
литного баланса.
Возможные нарушения водного, электролитного и кислотно-
основного баланса при кишечной непроходимости:
1) острая гиповолемия и дегидратация возникают в связи с
потерей жидкости и депонированием ее в просвете кишечника;
2) гипонатриемия обусловлена потерей жидкости с высоким
содержанием натрия и недостаточным поступлением его в про-
цессе лечения. Развитие гипонатриемии также связывают с
гиповолемией, жаждой и повышенной секрецией антидиурети-
ческого гормона [Горн М.М. и др., 2000]. Может быть нор-
мальное содержание натрия в сыворотке крови, что свидетель-
ствует об изотонических жидкостных потерях (см.главу 9);
3) гипокалиемия обусловлена потерями калия из ЖКТ и
недостаточным его возмещением. Вторичный гипоальдостеро-
низм, обусловленный гиповолемией, вызывает увеличение по-
терь калия с мочой (см. главу 10);
4) гипомагниемия обусловлена потерями из ЖКТ и обычно
возникает вместе с гипокалиемией. Как и дефицит калия,
уменьшение содержания магния в сыворотке крови требует
обязательной заместительной терапии. Несмотря на значитель-
ные потери, концентрация Mg2 , К+ в плазме крови в отдель-
ных случаях может быть нормальной (см. глава 11);
5) метаболический ацидоз может быть результатом циркуля-
торной недостаточности и прямыми потерями НСО3 из ЖКТ
(см. главу 4);
6) метаболический алкалоз возможен при рвоте и аспирации
желудочного содержимого в связи с потерями ионов водорода
и хлора (см. главу 5).
Перитонит
Перитонит — грозное осложнение различных заболеваний и
травматических повреждений органов брюшной полости.
Любое деструктивное поражение органов брюшной полости
является по своей сути абдоминальным инфекционным забо-
леванием, часто приводящим к развитию инкурабельного сеп-
сиса. Плотность микробной флоры возрастает от верхних от-
делов (желудок, тонкая кишка) к нижним отделам (слепая
кишка, толстая кишка) ЖКТ. Нарушение целостности толстой
кишки приводит к массивной инвазии бактерий и их токсинов
в портальный и системный кровоток. Паралитический илеус
сопровождается нарушением барьерное™ кишечной стенки и
273
18-1069
приводит к сепсису и полиорганной недостаточности [Balk R.,
1995].
Нарушение водно-электролитного баланса. Преобладают по-
тери из внеклеточного пространства, которые, постепенно про-
грессируя, приводят к ранним гемодинамическим нарушениям.
Картина гиповолемического и дегидратационного шока может
быстро перейти в состояние септического шока и полиорган-
ной недостаточности, при которых смертность превышает 50 %.
Общая потеря жидкости при отсутствии заместительной тера-
пии достигает 4—6 л и более. Дегидратация обусловлена депо-
нированием секвестрированной жидкости в просвете ЖКТ,
отеком подслизистого слоя брюшины. Паралич кишечника,
рвота, лихорадка, алиментарные факторы усугубляют наруше-
ния водно-электролитного баланса. Для перитонита характер-
ны значительные нарушения центральной (снижение СВ и АД,
тахикардия, снижение ЦВД) и периферической (стаз микро-
циркуляции, внутрисосудистое свертывание крови) гемодина-
мики, ведущие к кислородной недостаточности клеток. Общие
патофизиологические изменения проявляются токсемией, по-
вышением активности протеолитических ферментов, выражен-
ным нарушением метаболических процессов.
Перитонит сопровождается прогрессированием дефицита
натрия, калия и магния. Натрий уходит в воспалительный очаг,
экссудат и клетки. В результате активации АДГ и образования
эндогенной воды возможно развитие гипотонической дегидра-
тации. Однако чаще перитонит сопровождается изотонической
дегидратацией. Дефицит ионов калия и магния поддерживает
паралитическую непроходимость.
Нарушения КОС возникают при любом диффузном пери-
тоните. Чаще развивается метаболический ацидоз, связанный
с образованием кетоновых тел, молочной и серной кислот.
Однако возможен и метаболический алкалоз, когда преоблада-
ют потери калия и хлоридов. Точное установление вида нару-
шения КОС возможно лишь при исследовании проб крови. В
наиболее тяжелых случаях (вздутие живота, паралитическая
непроходимость, высокое стояние диафрагмы) развиваются
выраженная гипоксемия и дыхательный ацидоз, требующие
проведения механической вентиляции легких с высоким FiO2-
Пневмония и острый респираторный дистресс-синдром — час-
тые осложнения перитонита.
Возможные нарушения водного, электролитного и кислотно-
основного баланса, обусловленные перитонитам:
1) выраженная изотоническая дегидратация, гиповолемичес-
кий шок требуют проведения экстренных противошоковых ме-
роприятий. Вначале вводят в основном коллоидные растворы
(декстраны, растворы крахмала, альбумин), комбинируя их с
растворами электролитов, содержащими натрий и хлор. Общий
объем коллоидных растворов зависит от степени выраженности
274
гемодинамических нарушений и обычно не превышает 1 л.
Объем изотонических растворов натрия хлорида должен быть
очень большим (2—3 л), но форсировать их введение не сле-
дует, если выраженные гемодинамические нарушения уже уст-
ранены. Дозировка препаратов осуществляется в соответствии
с клиническими данными, показателями гемодинамики и ди-
урезом. При распространенном перитоните общий объем ин-
фузионных растворов составляет примерно, включая и раство-
ры глюкозы, 2,4—3 л/м2 поверхности тела в сутки. Темп ин-
фузий соответственно снижают при достижении нормального
ЦВД. При достаточной инфузионной терапии, но низком СВ
и АД показано применение допамина;
2) олигурия, олигурическая форма почечной недостаточности —
частое осложнение перитонита. Во всех случаях, когда на фоне
перитонита резко снижен диурез и, несмотря на инфузию
достаточного количества растворов, он равен 30 мл/ч и менее,
необходима его стимуляция. Обычно применяют маннитол или
лазикс. Маннитол, помимо своего диуретического действия, в
комбинации с низкомолекулярными декстранами приводит к
уменьшению отечности кишечной стенки и улучшению мезен-
териального кровообращения. Если почечная недостаточность
прогрессирует, необходим своевременный гемодиализ;
3) нарушения баланса натрия. Несмотря на то что содержа-
ние натрия в плазме крови часто остается в пределах нормы,
общие потери этого иона всегда значительны. В отдельных
случаях наблюдается гипонатриемия, возникающая в результа-
те самих потерь натрия, или связанная с недостаточной замес-
тительной терапией и действием антидиуретического гормона.
Гиперосмолярное состояние с повышением уровня натрия в
сыворотке крови возможно при полиорганной недостаточности
(см. главу 9);
4) гипокалиемия и гипомагнезиемия при перитоните обычно
развиваются на 2—3-й день после операции и требуют прове-
дения заместительной терапии (см. главы 10, 11);
5) метаболический ацидоз — результат потерь оснований и
тенденции к развитию анаэробного гликолиза. Его развитию
способствуют снижение оксигенации тканей, септический син-
дром, сердечно-сосудистая, дыхательная и печеночная недоста-
точность (см. главу 4);
6) гипоальбуминемия и анемия. Гипоальбуминемия развива-
ется в первые дни заболевания и требует постоянной коррек-
ции вливаниями альбумина. Предпочтительно использовать кон-
центрированные растворы альбумина (20—25 %), поскольку они
способствуют быстрому увеличению уровня альбумина в крови
и значительно повышают ОЦК. Анемия — нередкое осложне-
ние перитонита. При снижении уровня гематокрита ниже 0,3
(30 %) показана трансфузия эритроцитной массы.
Острый дыхательный ацидоз характерен для наиболее тяже-
275
18*
лых форм перитонита. Как и другие возможные нарушения
требует постоянного контроля уровней раО2, раСО2, pH,
HCOJ и других клинических и лабораторных исследований.
При выраженной дыхательной недостаточности проводят про-
лонгированную ИВЛ с уточненными параметрами газов крови.
При развитии острого респираторного дистресс-синдрома по-
казана комплексная терапия.
Примерная схема лечения. В 1-й день — терапия шока и
экстренная операция. Вводят плазму, плазмозамещающие и
электролитные растворы, растворы глюкозы. При сниженном
диурезе — маннитол или другие диуретики. Применение анти-
биотиков — с момента поступления больного в стационар (по
возможности с учетом антибиотикограммы) в течение 10 дней.
Инфузионная терапия — в среднем 4—6 дней. При снижении
гематокрита ниже 0,3 (30 %) — гемотрансфузия. Парентераль-
ное питание сразу же после ликвидации острой дегидратации
и шока, продолжительность 4—5 дней. После прекращения
инфузионной терапии — переход на слизистые отвары и посте-
пенное расширение диеты.
Основные положения
1. При всех предполагаемых изменениях КОС необходимо сопоставить
данные анамнеза и клинического обследования. Обязательными явля-
ются определение pH, рОг, рСОг, НСОз артериальной крови. Дополни-
тельно исследуют содержание лактата, кетоновых тел и креатинина
крови. Последние три анализа позволяют сразу же исключить (или под-
твердить) наличие лактат-ацидоза, кетоацидоза или почечной недоста-
точности. Обязательно определяют концентрацию Na+, К+, СГ. Для вы-
яснения этиологии метаболического ацидоза большое значение имеет
определение АР. Дефицит объема ВнеКЖ с одновременным снижени-
ем концентрации хлоридов в крови, повышение уровня pH и НСОз —
характерные признаки метаболического алкалоза.
2. Лечение ОДН у больных с ХОЗЛ представляет большие трудности.
Проведение ИВЛ в режиме гипервентиляции на фоне общей алкалемии
приводит к замедленному восстановлению спонтанного дыхания и со-
знания больного. Рекомендуемые режимы ВИВЛ или ИВЛ должны со-
ответствовать исходным (до обострения заболевания) значениям раОг
и раСОг. Умеренная контролируемая гиперкапния не является абсолют-
ным показанием к ИВЛ. В то же время снижение раОг ниже 50 мм рт.ст.
представляет большую угрозу для жизни больного и должно быть уст-
ранено. По данным литературы неинвазивная вентиляция легких (через
лицевую маску) у больных с ХОЗЛ более предпочтительна по сравне-
нию с инвазивной (эндотрахеальной) ИВЛ, так как последняя часто
сопровождается инфекционными осложнениями.
3. Алгоритм лечения больных с тяжелым приступом бронхиальной аст-
мы предусматривает проведение немедленной оксигенотерапии, инга-
ляций Рз-агонистов, внутривенное введение этих препаратов при неэф-
276
фективности ингаляционной терапии, применение кортикостероидов,
инфузионной терапии и при необходимости ВИВЛ или ИВЛ. Важно по-
стоянно контролировать pH и газы артериальной крови. Вместо частых
пункций артерий для определения раОг целесообразно использовать
пульсоксиметрию.
4. Острая гипотензия со снижением АД смет, до 75 мм рт.ст., независимо
от причины, представляет значительную угрозу для жизни больного.
Наиболее ясные причины — острые нарушения дыхания, гипоксемия,
напряженный пневмоторакс — должны быть устранены немедленно.
При неясных причинах гипотензии предполагают: 1) гиповолемию (про-
водят тест с внутривенным введением коллоидного раствора), 2) пер-
вичное нарушение работы сердца как насоса (острый инфаркт миокар-
да, право- и левожелудочковая недостаточность, аритмии); проводят
антиаритмическую терапию, применяют инотропные препараты и вазо-
прессоры; 3) вазоплегию, связанную с сепсисом или другими причина-
ми, например с острой надпочечниковой недостаточностью.
5. При септическом шоке целесообразно катетеризировать легочную
артерию катетером Свана—Ганца и постоянно контролировать пара-
метры ЦГД, pH и газы артериальной крови, определять доставку и
потребление кислорода. Следует учитывать, что нормативные показа-
тели СВ, ДЗЛК обычно не обеспечивают должный транспорт кислорода,
а имеющаяся исходная гиповолемия и вазодилатация также способст-
вуют глубокой тканевой гипоксии и лактат-ацидозу. Под контролем по-
казателей ЦГД проводят инфузионную терапию, которая должна пре-
вышать верхние нормальные показатели ДЗЛК, обеспечивают повы-
шенную преднагрузку и контролируют ОПСС, которое обычно бывает
сниженным. На фоне достаточной инфузионной терапии, применения
инотропных препаратов и вазопрессоров стараются оптимизировать до-
ставку и потребление кислорода тканями. Важно установить источник
инфекции и принять меры к его устранению.
6. При анафилактическом шоке выделяют два главных звена патогене-
тических нарушений: 1) тяжелую гипотензию (шок) и 2) обструкцию
верхних и/или нижних дыхательных путей (асфиксия). В первом случае
внутривенно вводят адреналин, кортикостероиды, прибегают к инфузии
коллоидных и кристаллоидных препаратов. Во втором случае при уг-
розе асфиксии интубируют трахею и проводят ИВЛ под контролем газов
крови. Обязательна антигистаминная терапия.
7. Применение временного гемодиализа, особенно на ранних этапах
развития ОПН (когда мочевина около 40 ммоль/л, а креатинин около
600 мкмоль/л), является эффективным средством восстановления жид-
костного баланса, лечения азотемии, электролитных и кислотно-основ-
ных нарушений. Гемофильтрация эффективна при жидкостной пере-
грузке, может быть использована для коррекции электролитных и кис-
лотно-основных нарушений, но мало эффективна при азотемии.
8. При ОПН до того, как потребуется гемодиализ, необходимо ограни-
чить суточное потребление жидкости до 500 мл + измеренные потери
(моча, назогастральное дренирование и т.д.) и + 500 мл на каждый
градус повышенной температуры тела, энергетическое обеспечение до
2000 ккал/с; содержание белка должно быть не более 20—40 г/сут,
натрия и калия менее 50 ммоль/сут.
277
ВОПРОСЫ И ОТВЕТЫ
1. Опишите последовательность реанимационных мероприятий
при фибрилляции желудочков (ФЖ) и желудочковой тахикардии
(ЖТ) без пульса.
Реанимация может быть начата с прекордиального удара и
серии дефибрилляций: 1-я — 200 Дж, 2-я — 300 Дж, 3-я —
360 Дж. Проводят интубацию трахеи, ИВЛ 100 % кислородом,
внутривенный доступ, вводят внутривенно 1 мг адреналина.
Если ФЖ и ЖТ без пульса сохраняются, показана сердечно-ле-
гочная реанимация (10 циклов: 2 вдоха, 15 компрессий грудной
клетки), затем повторная серия дефибрилляций: 4-я — 360 Дж,
5-я — 360 Дж, 6-я — 360 Дж.
2. Опишите последовательность реанимационных мероприятий
при асистолии. На ЭКГ — прямая линия.
Кроме известных приемов А, В, С, D в условиях реанимаци-
онного отделения необходимо провести срочную интубацию
трахеи, наладить ИВЛ 100 % кислородом, обеспечить венозный
доступ, ввести внутривенно 5 мг адреналина и 3 мг атропина
однократно. При наличии признаков электрической активнос-
ти сердца показана кардиостимуляция.
3. Опишите последовательность реанимационных мероприятий
при электромеханической диссоциации (ЭМД).
Начальный этап лечения не отличается от общепринятых алго-
ритмов СЛР. Показаны интубация трахеи, ИВЛ 100 % кисло-
родом, внутривенное введение 1 мг адреналина. Поскольку
ЭМД часто связана с побочными факторами (гиповолемия,
нарушение режима ИВЛ, напряженный пневмоторакс, тампо-
нада сердца, электролитный дисбаланс, эмболия легочной ар-
терии, переохлаждение), необходимо выявить эти факторы и
устранить их наиболее опасные проявления, не прекращая при
этом проведения СЛР.
4. Каковы методы поддержания сердечной деятельности во время
реанимационных мероприятий?
Во всех случаях показано быстрое устранение гипоксемии и
гиперкапнии. Во время СЛР через каждые 2—3 мин вводят 1 мг
адреналина внутривенно. Если нет доступа к венам, адреналин
и атропин вводят эндотрахеально. При этом дозу препаратов
удваивают и разводят в 10 мл 0,9 % раствора натрия хлорида.
После трех неудачных циклов СЛР внутривенно вводят 8,4 %
раствор бикарбоната в дозе 1 мл/кг массы тела. Если имеет
место гиперкалиемия (калий плазмы >6 ммоль/л) внутривенно
вводят 10 мл 10 % раствора кальция хлорида, эту дозу можно
ввести 2—3 раза через каждые 5 мин. Дополнительно вводят
растворы бикарбоната натрия и глюкозы для снижения уровня
калия плазмы. Если же уровень калия в плазме<3,5 ммоль/л,
показана инфузия 20 ммоль К+ (1,5 г) в центральную вену в
100 мл 5 % раствора глюкозы. При этом введение кальция абсо-
278
лютно противопоказано! При рефрактерной ФЖ применяют
медикаментозную терапию (лидокаин и др., см. ч. 4). Введение
растворов кальция при СЛР показано в двух случаях: 1) при
гиперкалиемии, 2) при гипокальциемии.
5. Какие мероприятия проводят при гипоксемии (раОз <75 мм
рт.ст.)?
РаО2 75 мм рт.ст. может быть нормой у больных пожилого
возраста и в целом не представляет серьезной угрозы для боль-
ных молодого возраста. Нормальное раО2 при дыхании ат-
мосферным воздухом на уровне моря составляет: раО2 = 100 -
- 0,3 х (возраст в годах) мм рт.ст. Устойчивая к повышению
FiO2 гипоксемия свидетельствует о наличии внутрилегочного
шунта, когда часть СВ не контактирует с альвеолярным газом.
В шунтируемой крови, независимо от напряжения кислорода в
альвеолах, сохраняется то же содержание кислорода, что и в
смешанной венозной крови. Снижение раО2 менее 40 мм рт.ст.
является угрожающим для жизни состоянием. Вначале увели-
чивают FiO2 до 1,0; проводят ИВЛ перемежающимся положи-
тельным давлением, затем — в режиме положительного давле-
ния в конце выдоха (ПДК.В). В результате принятых мер
увеличивается объем вентилируемых участков легких и умень-
шается объем шунтируемой крови. FiO2 снижают до того уров-
ня, который обеспечивает раО2 >60 мм рт.ст. Желательный
уровень FiO2 — не более 0,5, максимум 0,6. Увеличение содер-
жания кислорода в крови (артериальной и венозной) можно
достичь путем внутривенного введения жидкости, повышения
сократительной способности миокарда, трансфузии эритроци-
тов при анемии.
6. Объясните возможные причины гиперкапнии.
Гиперкапнией называется состояние, при котором раСО2
>45 мм рт.ст. Повышение раСО2 может быть компенсаторным
при первичном метаболическом ацидозе и в результате первич-
ного уменьшения альвеолярной вентиляции. При дыхании
атмосферным воздухом у пациентов с гиперкапнией всегда
имеется гипоксемия, при которой требуется соответствующая
терапия. Гиперкапния часто встречается у больных с хроничес-
ким бронхитом, особенно при обострении легочного заболева-
ния. Спровоцировать гиперкапнию могут ингаляция кислорода
(не рекомендуется повышать раО2 выше 60 мм рт.ст.), назна-
чение седативных или наркотических препаратов. При угнете-
нии центральной регуляции дыхания наркотическими и седа-
тивными средствами наступает брадипноэ и снижение уровня
сознания больного. Если причиной гиперкапнии являются нар-
котики, то показано введение налоксона. К центральным ме-
ханизмам угнетения дыхания следует отнести тяжелую череп-
но-мозговую травму, при которой наиболее эффективными
методами лечения являются ранняя интубация и ИВЛ. Причи-
нами гиперкапнии могут быть гипотиреоз, обструкция верхних
дыхательных путей, центральное угнетение дыхания, а также
слабость периферической мускулатуры. Слабость дыхательной
279
мускулатуры — обычное состояние при длительной ИВЛ. Отлу-
чение больного от респиратора в этих случаях представляет
большую проблему. Потеря способности к автоматическому
самопроизвольному дыханию (синдром “проклятие Ундины”)
может возникать после операций на верхних отделах шеи и
продолжаться от нескольких часов до 6 сут. Злокачественная
гипертермия также сопровождается ростом раСО2.
7. Определите показания к проведению искусственной вентиляции
легких.
Абсолютные показания к ИВЛ:
♦ глубокая гипоксемия, не устраняемая при максимальном
F1O2 с помощью лицевой маски или носового катетера;
♦ повышенное ВЧД, обусловленное отеком мозга или череп-
но-мозговой травмой. Повышение раСОг сопровождается
ростом ВЧД. Индуцированная гипокапния при метаболи-
ческом ацидозе служит временным средством для коррек-
ции КОС во время лечения основного заболевания;
♦ травма грудной клетки с нарушением реберного каркаса,
сопровождающаяся падением раОг и возможным увеличе-
нием раСОг;
♦ пролонгированная ИВЛ показана после обширных хирурги-
ческих операций, в частности после операций на сердце,
необходима для профилактики ацидоза и гипоксемии в пе-
риод адаптации больного к самостоятельному дыханию;
♦ острая обструкция верхних и/или нижних дыхательных пу-
тей, не устраняемая другими консервативными методами;
♦ кома любой этиологии, сопровождающаяся гипоксемией и
гиперкапнией;
♦ пролонгированнное действие миорелаксантов, наркотичес-
ких и седативных средств, повышенная работа дыхания,
уменьшение объема легких, особенности конституциональ-
ного статуса больного (ожирение, истощение);
♦ гиперкапния на фоне повышенного легочного сосудистого
сопротивления или повышенного внутричерепного давле-
ния. Тем не менее гиперкапния сама по себе необязательно
требует коррекции, главное при этом — устранение опасной
гипоксемии, к которой не адаптирован пациент;
♦ апноэ или гиповентиляция любой этиологии.
8. Объясните, какие лечебно-диагностические мероприятия следу-
ет проводить при олигурии.
Олигурия характеризуется снижением выделяемой мочи — ме-
нее 400 мл/сут или менее 20 мл/ч. Различают преренальную,
постренальную и ренальную форму олигурии (см. ч. 2, гла-
ву 14). Важно установить, является ли причина олигурии по-
тенциально обратимой (гиповолемия, гипотензия) или связана
с ОПН (например, острый тубулярный некроз), которая не
поддается быстрой коррекции. Важно знать, что истинная ги-
поволемия является физиологической реакцией на необходи-
280
мость задержки воды и натрия; состояний, при которых идет
образование внутриклеточных и внеклеточных отеков (застой-
ная сердечная недостаточность, цирроз печени или нефроз). Во
всех случаях необходимо определить ОЦК. Для дифференци-
альной диагностики вида нарушения важнейшее значение при-
дается анализу мочи. Преренальная олигурия характеризуется
уменьшением содержания натрия в моче менее 20 ммоль/л, в
то время как ренальная олигурия соответствует высокому уров-
ню натрия в моче — более 40 ммоль/л. Отношение креатинин
мочи/креатинин плазмы больше 40 при преренальной форме
нарушения и ниже 20 при ренальной олигурии. Осмоляльность
мочи при преренальной олигурии более 500 мосм/кг Н2О и
менее 350 мосм/кг Н2О при ренальной олигурии. При неодно-
значных результатах анализа S.M. Lindenfeld рекомендует опре-
делять показатель почечной недостаточности [(ППН = Na+M :
(креат.м./креат.пл.)], а также фракционную экскрецию натрия
|(ФЭ^а = (КМ/КП)^а: (КМ/КП)кр , значения которых <1,0
при преренальной и >1,0 при ренальной форме олигурии. При
нормо- и гиперволемии больному с олигурией противопоказано
избыточное введение жидкости. При неолитурической форме
острого тубулярного некроза введение петлевых диуретиков мо-
жет значительно улучшить результаты лечения. В некоторых
случаях введение больших доз фуросемида (150—300 мг) может
улучшить диурез при истинной олигурической форме почечной
недостаточности. Тест с применением диуретиков должен вы-
полняться с осторожностью и лишь после получения всех вы-
шеуказанных проб крови и мочи. Основным показанием к
проведению неотложного гемодиализа являются почечная не-
достаточность с уремической энцефалопатией, кровоточивос-
тью, уровнем азота мочевины крови свыше 36 ммоль/л либо
содержанием калия более 6 ммоль/л, НСО^ менее 15 ммоль/л;
значительная перегрузка объемом с угрозой отека легких, не-
устраняемая путем консервативной терапии. Показанием к ге-
модиализу также может быть выраженная интоксикация низ-
комолекулярными диализируемыми веществами (этанол, эти-
ленгликоль, изопропаноловый спирт, салицилат, литий).
9. Какое влияние оказывает длительный ностельный режим на
системы организма?
Отсутствие привычной дневной активности скелетных мышц в
конечном счете приводит к их атрофии, потере тонуса и мио-
фибриллярного протеина. Продолжительный нервно-мышеч-
ный паралич сопровождается “разрушительной слабостью”.
Постоянная поддерживающая двигательная активность и фи-
зиотерапия могут замедлить темп истощения мышечной ткани.
Выделение многих гормонов, подчиняющихся суточному рит-
му, нарушается. В положении лежа происходит перемещение
до 10 % ОЦК от ног по направлению к голове. Большая часть
этого объема мигрирует к грудной клетке, остальная — в об-
ласть головы и шеи. Уже в первый день лежачего положения
теряется приблизительно 600 мл ВнеКЖ. Постельный режим
вызывает потерю натрия и калия, приводит к постепенному
281
выщелачиванию кальция, изредка к гиперкальциемии. Наруша-
ется функция глотания и провоцируется желудочный рефлюкс.
Ухудшается сопротивляемость инфекции. Уменьшается эритро-
поэз, усиливается склонность к тромбозам. Происходит пере-
полнение сосудов легких, ухудшается вазомоторный тонус,
увеличиваются преднагрузка и УО. Уменьшается функциональ-
ная остаточная емкость легких, изменяется распределение ле-
гочных объемов и ухудшается естественный дренаж дыхатель-
ных путей.
10. Какие осложнения могут возникать нри проведении полного па-
рентерального питания (ППП)?
Все осложнения ППП можно условно разделить на механичес-
кие и метаболические, связанные с введением углеводов, жи-
ровых эмульсий и аминокислот. Кроме того, отсутствие энте-
рального питания приводит к дегенеративным изменениям сли-
зистой оболочки тонкой кишки уже через несколько дней.
Атрофия кишечника при ППП может сопровождаться наруше-
нием барьерности кишечной стенки и поступлением микроор-
ганизмов кишечника в системный кровоток. Для введения ги-
пертонических растворов кончик катетера должен находиться в
верхней полой вене, что не всегда достижимо. Другие ослож-
нения, связанные с техникой катетеризации центральных вен, —
см. ч. 3.
Осложнения, обусловленные введением глюкозы, многочис-
ленны. Из них основными являются: 1) непреносимость глю-
козы; 2) гипергликемия (вплоть до развития гиперосмолярной
некетоацидотической комы); 3) гипофосфатемия (механизм ее
связывают с повышенным поступлением фосфата в клетки,
ассоциированным с увеличенным поглощением глюкозы); 4) жи-
ровая дистрофия печени (может возникнуть при превышении
суточной потребности в энергии); 5) гиперкапния (возможна
при введении избыточного количества глюкозы у больных с
тяжелой легочной патологией); 6) дефицит жирных кислот (при
длительном ППП с использованием растворов декстрозы без
добавления жировых эмульсий).
Осложнения, связанные с введением жировых эмульсий, вклю-
чают гипертриглицеридемию, усиление процессов перекисного
окисления свободных жирных кислот. Риск поражения легких
жировыми эмульсиями на практике представляется минималь-
ным.
Несбалансированность белкового состава и избыточное введе-
ние аминокислот может вызвать нарушение усвоения белков.
У больных с печеночной недостаточностью избыточная инфу-
зия аминокислот сопровождается печеночной энцефалопатией.
Выделяют три главных симптома непереносимости белка: азо-
темию, легочную дисфункцию и ухудшение состояния психики.
Подавляющее количество растворов для ППП имеют низкий
pH, это необходимо учитывать при назначении их пациентам
с уже имеющимися метаболическим ацидозом. Возможны раз-
личные нарушения КОС и водно-электролитного баланса.
282
11. Опишите методику кортикотропинового теста для диагности-
ки первичной надпочечниковой недостаточности.
Методом выбора в диагностике первичной надпочечниковой
недостаточности является тест быстрой стимуляции надпочеч-
ников адренокортикотропным гормоном (АКТГ, кортикотро-
пин) [Marino P.L., 1998].
Определяют базальное содержание кортизола в сыворотке кро-
ви. После этого внутривенно вводят АКТГ, кортикотропин
(кортрозин) в дозе 250 мкг. Через 1 ч снова определяют уровень
кортизола.
Базальная концентрация кортизола в сыворотке крови более
220 мкг/л свидетельствует о нормальной реакции надпочечни-
ков на стресс. У пациентов без стресса уровень кортизола выше
140 мкг/л после введения АКТГ расценивают как нормальный
ответ коры надпочечников. Иногда бывает достаточно опреде-
лить базальную концентрацию кортизола.
При уровне кортизола ниже 220 мкг/л критерием недостаточ-
ности надпочечников становится скорость изменения его со-
держания после введения АКТГ. Повышение концентрации
кортизола в крови менее чем на 70 мкг/л за 1 ч после введения
АКТГ — признак первичной недостаточности надпочечников.
СПИСОК ЛИТЕРАТУРЫ
Анестезиология и реаниматология (Учебник для студентов медицин-
ских вузов РФ) / Под ред. В.Д.Малышева, С.В.Свиридова. — М.:
Медицина, 2003. — 528 с.
Ван Дайк Р.В., Фитц Дж.Г., Лейк Дж.Р., Шаршмидт Б.Ф. Печеночная
недостаточность / В кн.: Принятие решения в интенсивной тера-
пии. — М.: Медицина, 1995. — С. 136—138.
Клейн Р.Ф., Харрис С.Т. Гиперкальциемия / В кн.: Принятие решения
в интенсивной терапии. — М.: Медицина, 1995. — С. 172—174.
Клейн Р.Ф., Харрис С.Т. Гипокальциемия / В кн.: Принятие решения
в интенсивной терапии. — М.: Медицина, 1995. — С. 170—172.
Линденфелд С.М. Гиперкалиемия / В кн.: Принятие решения в интен-
сивной терапии. — М.: Медицина, 1995. — С. 168—170.
Линденфелд С.М. Острая почечная недостаточность / В кн.: Принятие
решения в интенсивной терапии. — М.: Медицина, 1995. — С. 156—
158.
Лоуренс Д.Р., Бенитт П.Н. Клиническая фармакология: Пер. с англ.
В 2-х томах. — М.: Медицина, 1993.
Люс Дж.М. Декомпенсация дыхания у больных с хроническими об-
структивными заболеваниями легких / В кн.: Принятие решения
в интенсивной терапии. — М.: Медицина, 1995. — С. 100—102.
Маттей М.А. Катетеризация легочной артерии плавающим катете-
ром / В кн.: Принятие решения в интенсивной терапии. — М.:
Медицина, 1995. — С. 60—62.
Омачи Р.С. Неотложный гемодиализ / В кн.: Принятие решения в
интенсивной терапии. — М.: Медицина, 1995. — С. 158—160.
Рябов Г.А. Гипоксия критических состояний. — М.: Медицина, 1988.
Спригинс Д., Чемберс Д., Джефри Э. Неотложная терапия: Пер. с
агл. — ГЭОТАР-Мед., 1995.
283
Хансен Р.М. Гиперосмоляльность / В кн.: Принятие решения в интен-
сивной терапии. — М.: Медицина, 1995. — С. 174—176.
Хансен Р.М. Гипонатриемия / В кн.: Принятие решения в интенсив-
ной терапии. — М.: Медицина, 1995. — С. 166—168.
Чартье К. Острая левожелудочковая недостаточность / В кн.: При-
нятие решения в интенсивной терапии. — М.: Медицина, 1995. —
С. 50-52.
Kitabchi А.Е., Wall В.М. Diabetic ketoacidosis. Med. / Clin. North. Amer. —
N 79(1). - P. 9-37.
Marini J.J., Wheller A.P. Acute Renal Failure and Dialysis. Critical Care
Medicine. — 1997. — P. 465—475.
Учебное пособие
Всеволод Дмитриевич Малышев
КИСЛОТНО-ОСНОВНОЕ СОСТОЯНИЕ
И ВОДНО-ЭЛЕКТРОЛИТНЫЙ БАЛАНС
В ИНТЕНСИВНОЙ ТЕРАПИИ
Зав. редакцией Т. П. Осокина
Научный редактор И. В. Веденина
Художественный редактор С. М. Лымина
Технический редактор Н.А. Биркина
Корректор О. С. Гварамадзе
Подписано к печати 14.07.2005. Формат бумаги 60х90‘/16. Бумага офсетная
№ 1. Гарнитура Таймс. Печать офсетная. Усл. печ. л. 18,0. Усл. кр.-отт. 34,0.
Уч.-изд. л. 19,43. Тираж 3000 экз. Заказ № 1069.
ОАО «Издательство «Медицина». 119992, Москва, ул. Б. Пироговская, д. 2,
стр. 5
Отпечатано в ОАО “Можайский полиграфический комбинат”. 143200, Мо-
жайск, ул. Мира, 93.
<5c?r