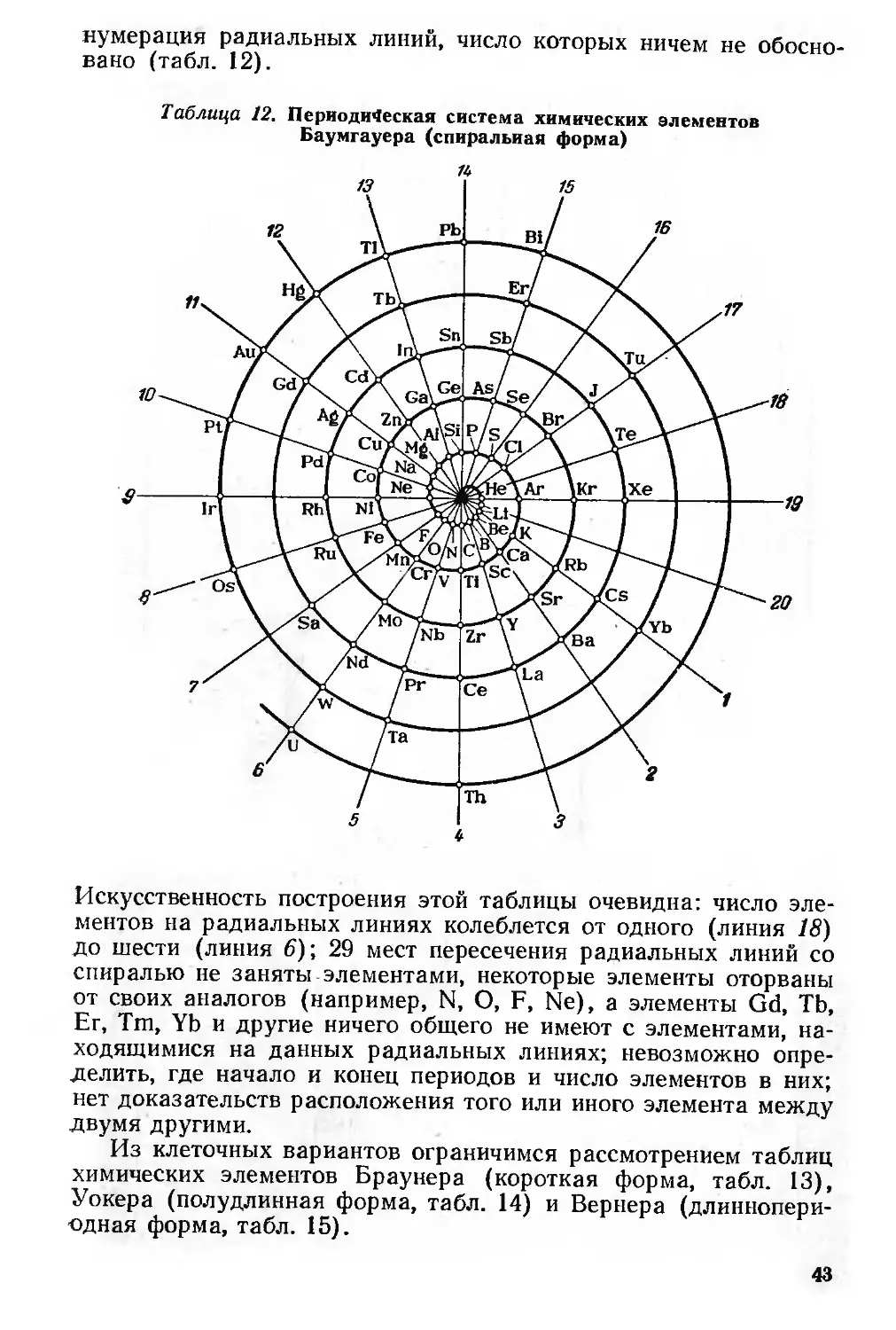
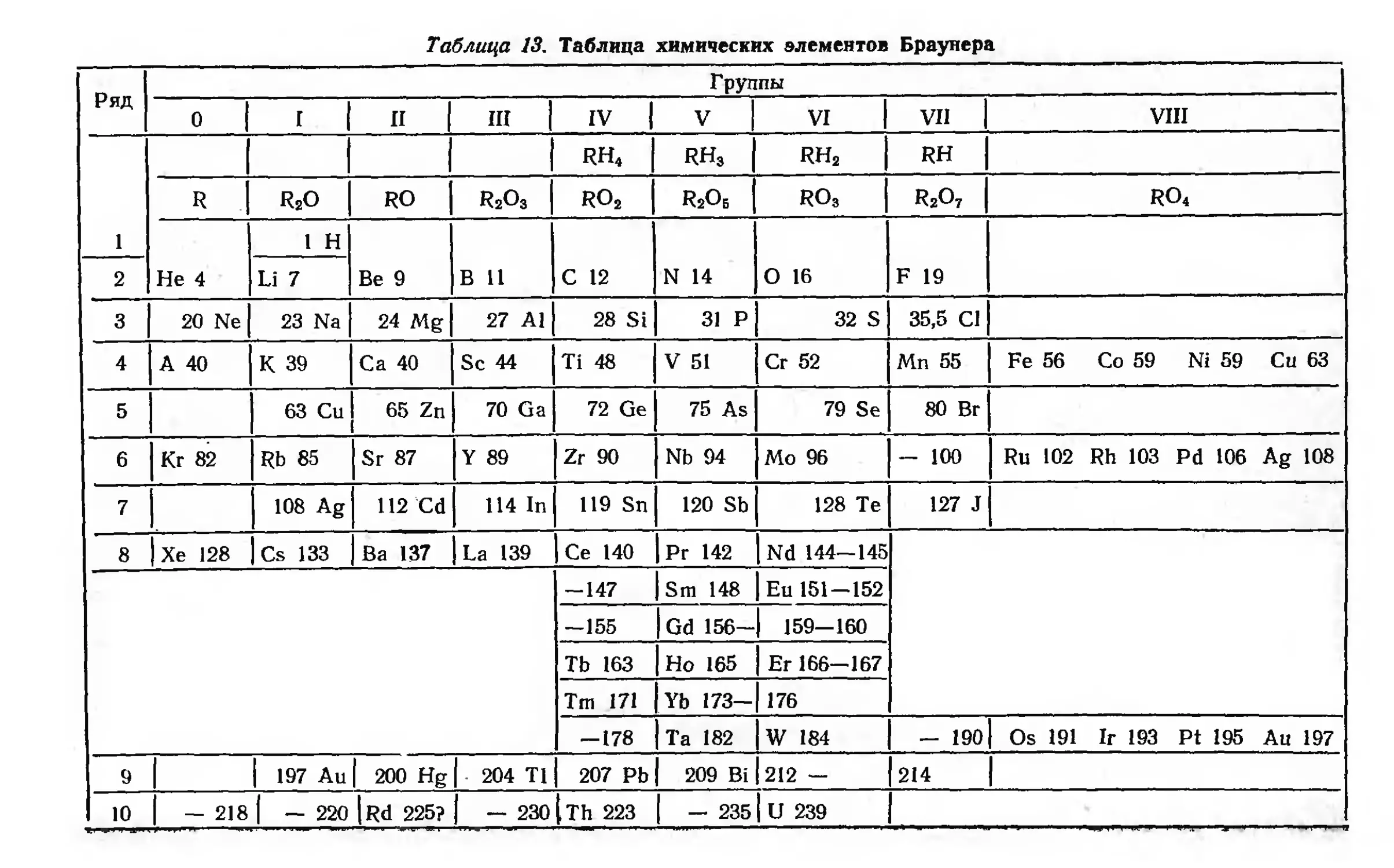
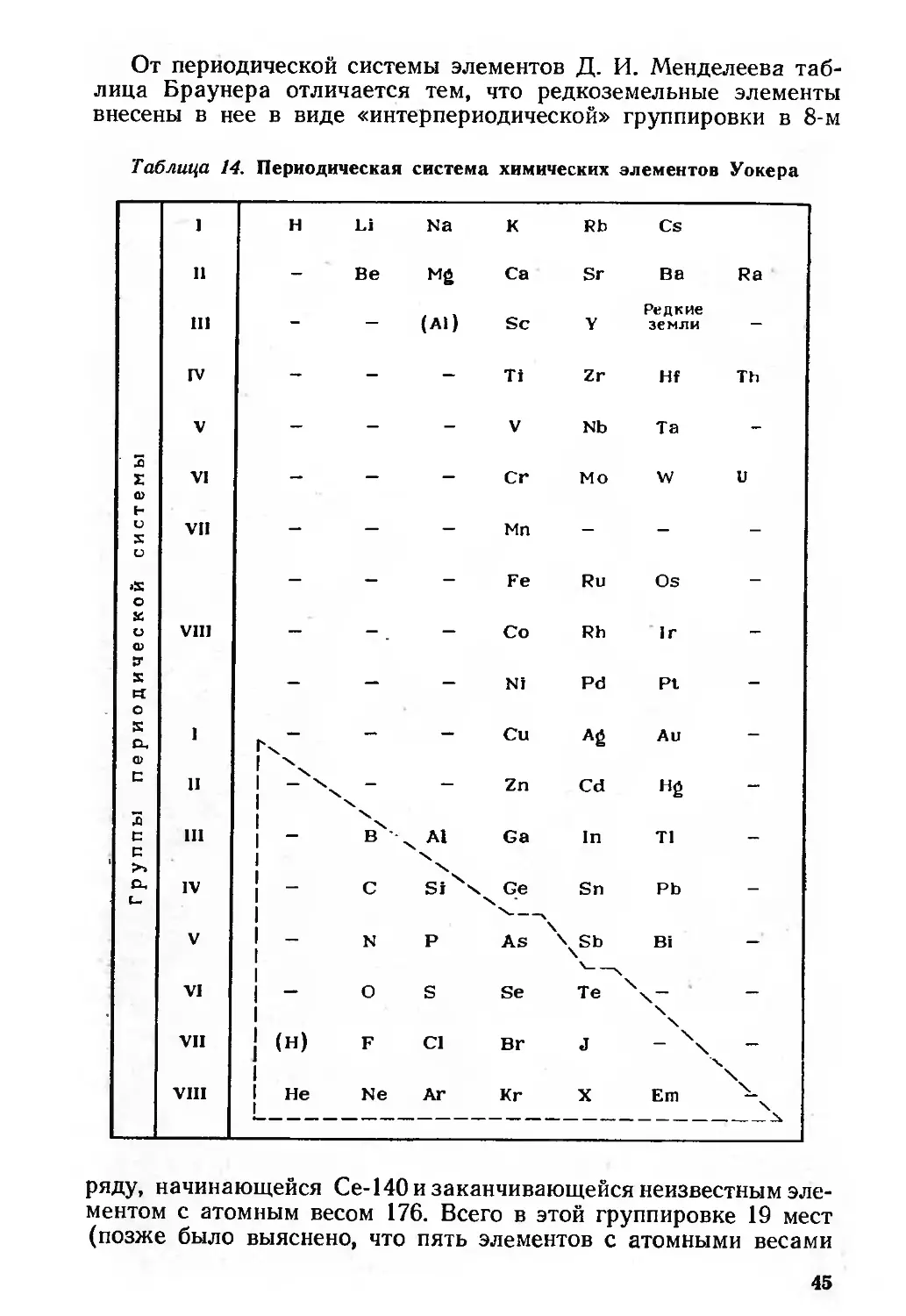
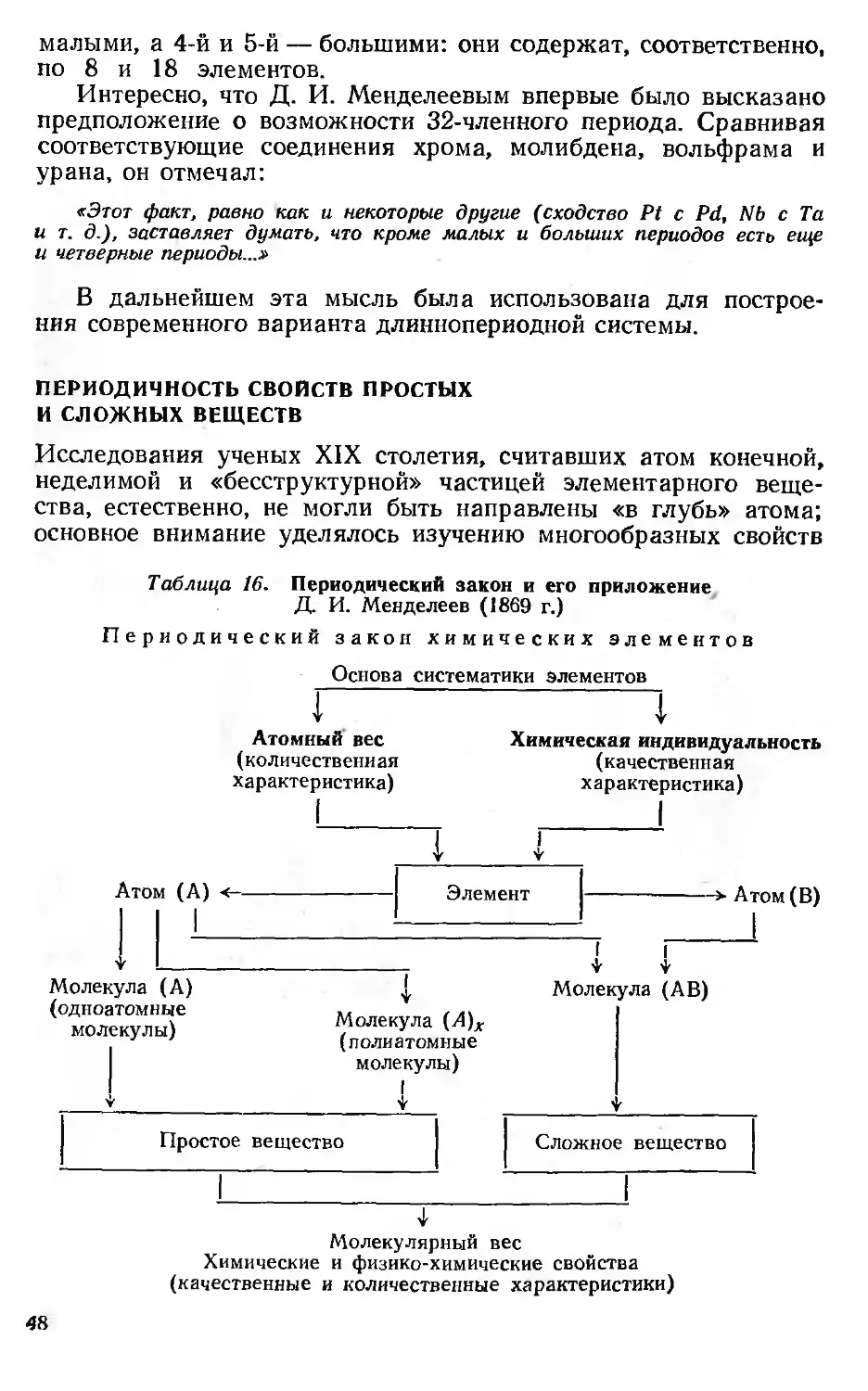
Автор: Семишин В.И.
Теги: химия неорганическая химия периодическая система химических элементов
Год: 1972
Текст
ПЕРИОДИЧЕСКАЯ СИСТЕМА
ВИ-Семишип ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Д ^МЕНДЕЛЕЕВА
ВИСе
ПЕРИОДИЧЕСКАЯ СИСТЕМА
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Д ИМЕНДЕЛЕЕВА
ИЗДАТЕЛЬСТВО «ХИМИЯ»
МОСКВА 19 72
УДК 541.9:546
С 30
Семиишн В. И., Периодическая система химических
элементов Д. И. Менделеева. Изд-во «Химия», 1972 г.
В книге освещены предыстория периодического
закона и его развитие на протяжении более 100 лет после
открытия. В ней отражены три основных этапа в
эволюции периодического закона: периодический закон и
элемент, периодический закон и строение атома,
периодический закон .и строение ядра атома. В книге
приведены цитаты из трудов творца периодической системы
элементов — Дмитрия Ивановича Менделеева, а также
из работ, посвященных его трудам и периодическому
закону. Книга снабжена портретами ученых, сделавших
вклад в открытие закона, его утверждение и развитие,
многочисленными рисунками и графиками, различными
вариантами таблиц системы элементов.
Книга рассчитана на широкий круг читателей,
знающих основы химии и желающих ближе познакомиться
с историей открытия великого закона химии —
периодического закона элементов, с его значением для развития
химии и смежных наук.
Книга содержит 48 иллюстраций, 52 таблицы, 38
библиографических ссылок.
2-5-1
118-72
"~?
СОДЕРЖАНИЕ
Предисловие 7
Химические элементы и попытки их классификации до Д. И.
Менделеева 9
Химические элементы 9
Попытки классификации элементов. Международный съезд химиков
в 1860 г 13
От Международного съезда до открытия Д. И. Менделеева .... 16
Периодический закон и система химических элементов Д. И. Менделеева 24
На пути к открытию периодического закона 24
Основной принцип систематики элементов и первый вариант
периодической системы 25
Периодический закон химических элементов 27
Периодический закон Д. И. Менделеева и «Основы химии» .... 30
О приоритете в открытии периодического закона 40
Варианты периодической системы 41
Периодичность свойств простых и сложных веществ . 48
Периодический закон и строение атома 51
Концепция неделимости атома 51
Строение атома и новая количественная характеристика элементов 53
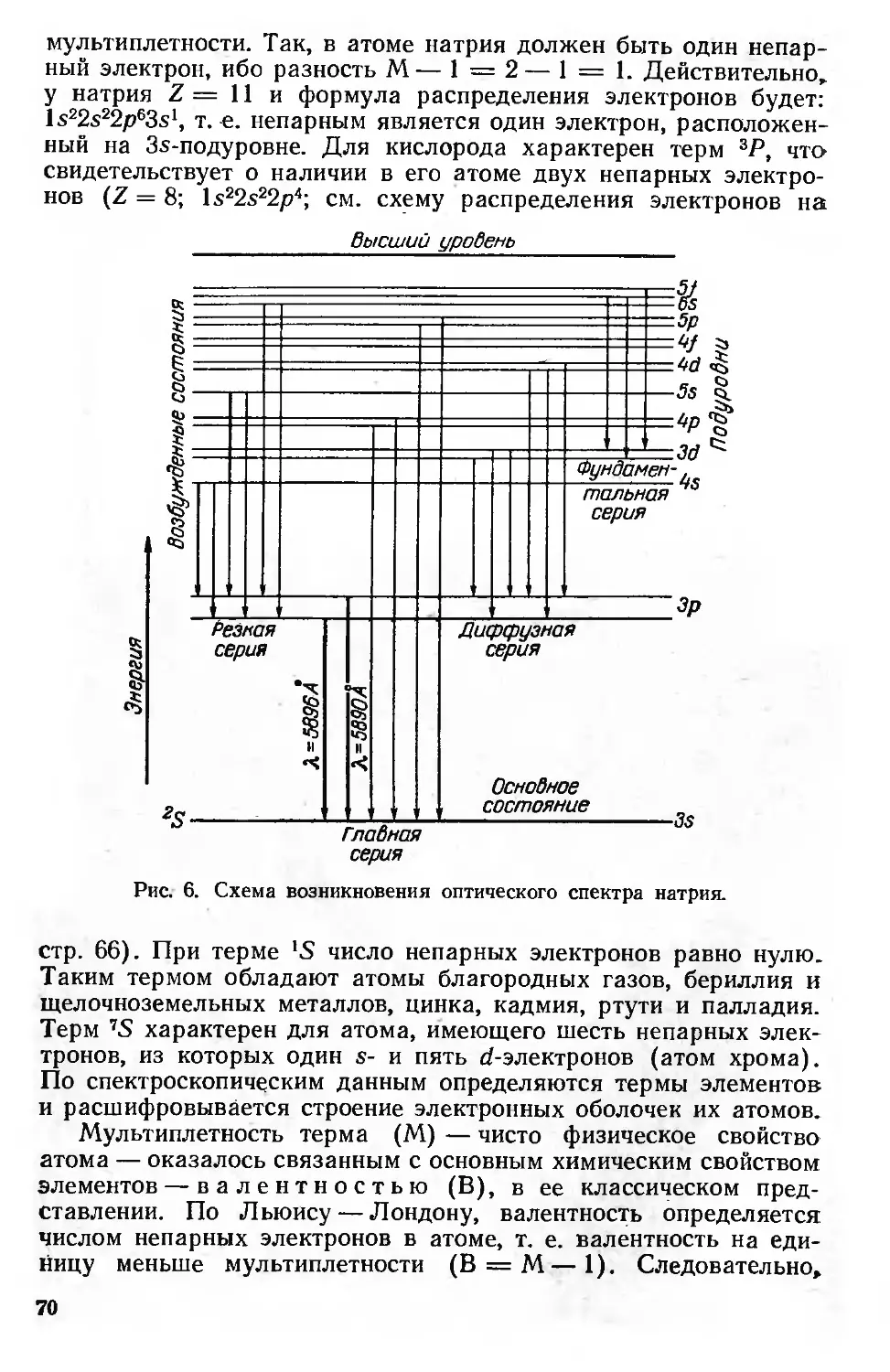
Электронная оболочка атома и спектры 58
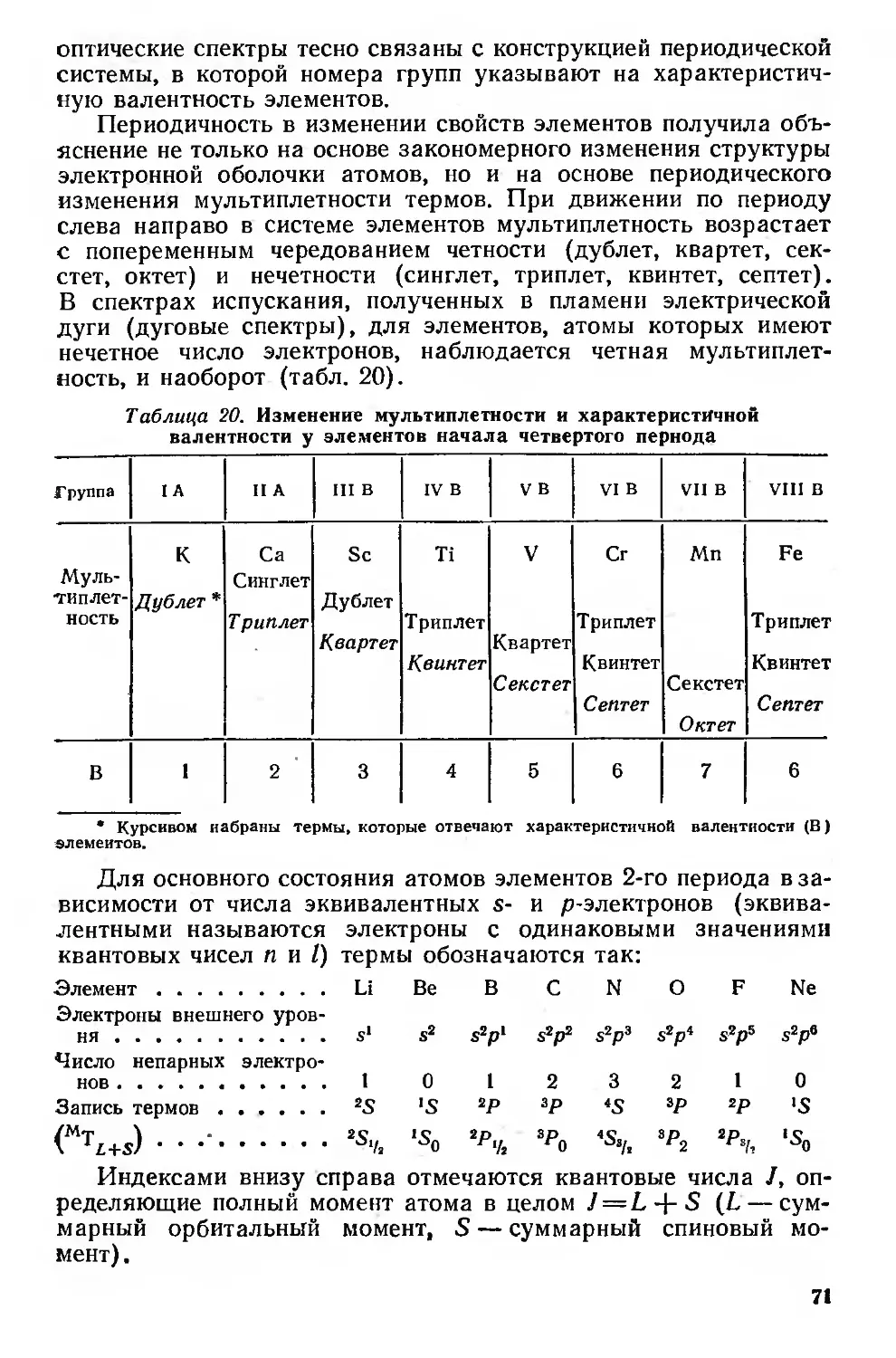
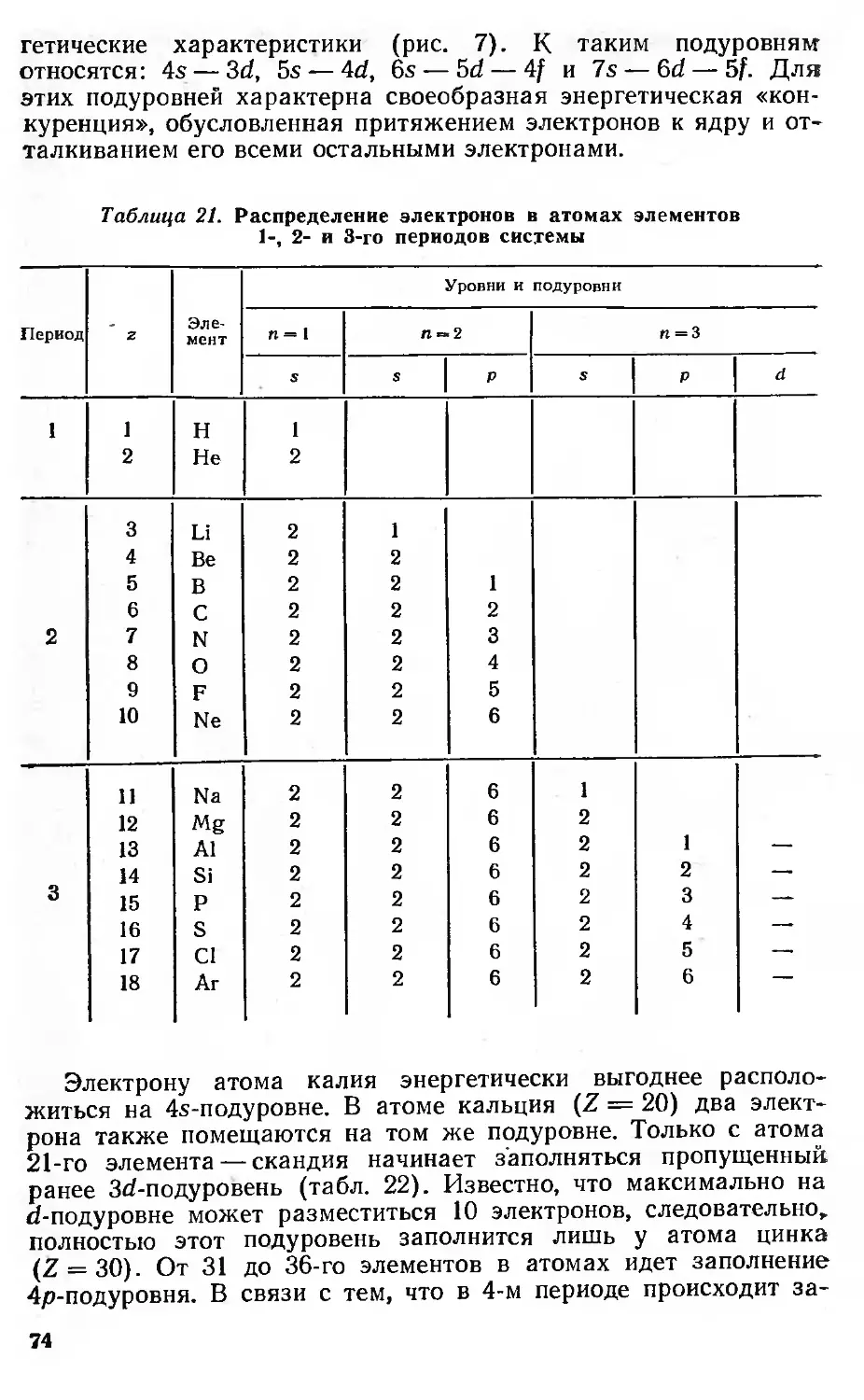
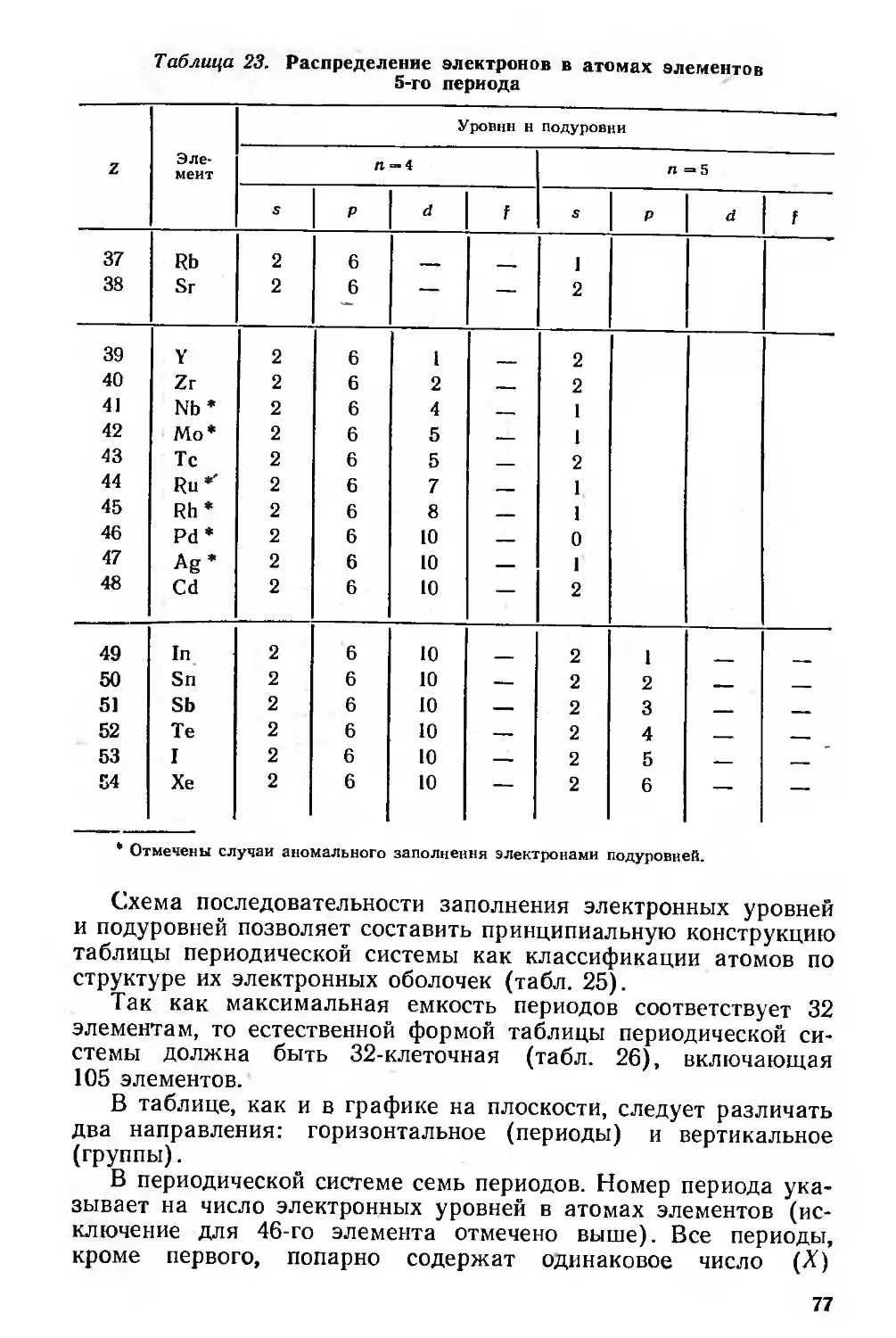
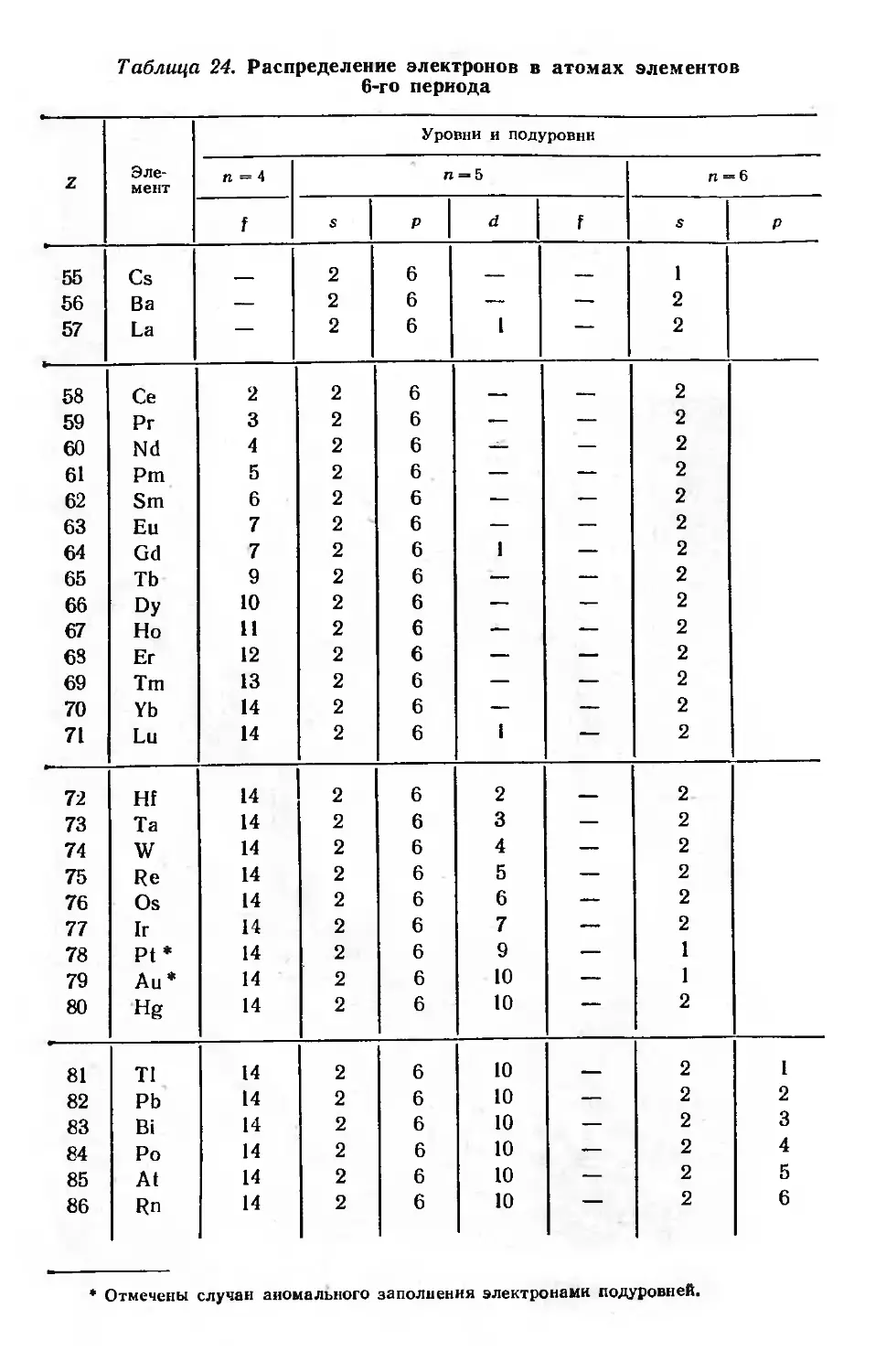
Периодическая система элементов и структура электронной оболочки
атомов 73
Химические свойства нейтральных атомов 87
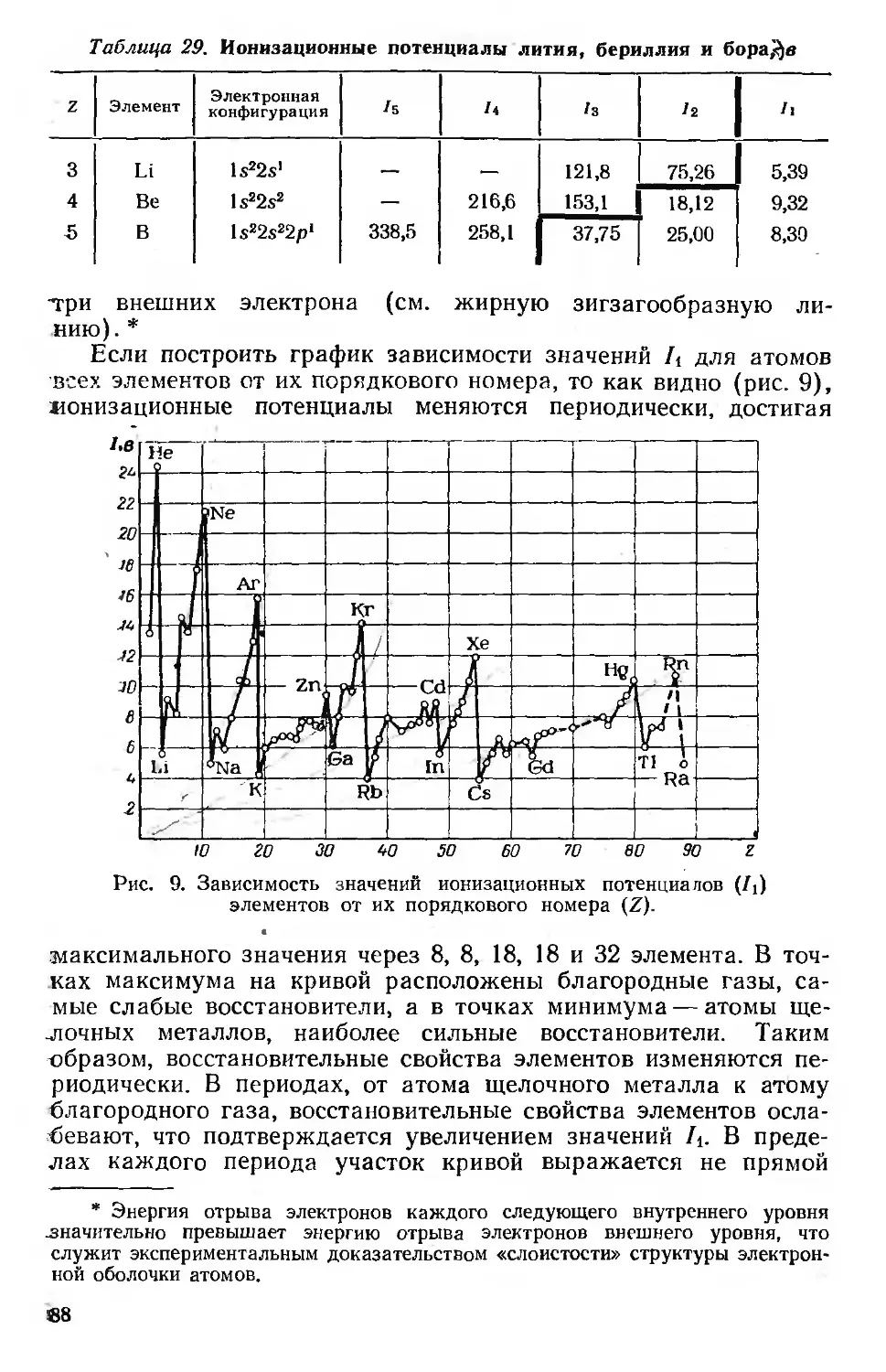
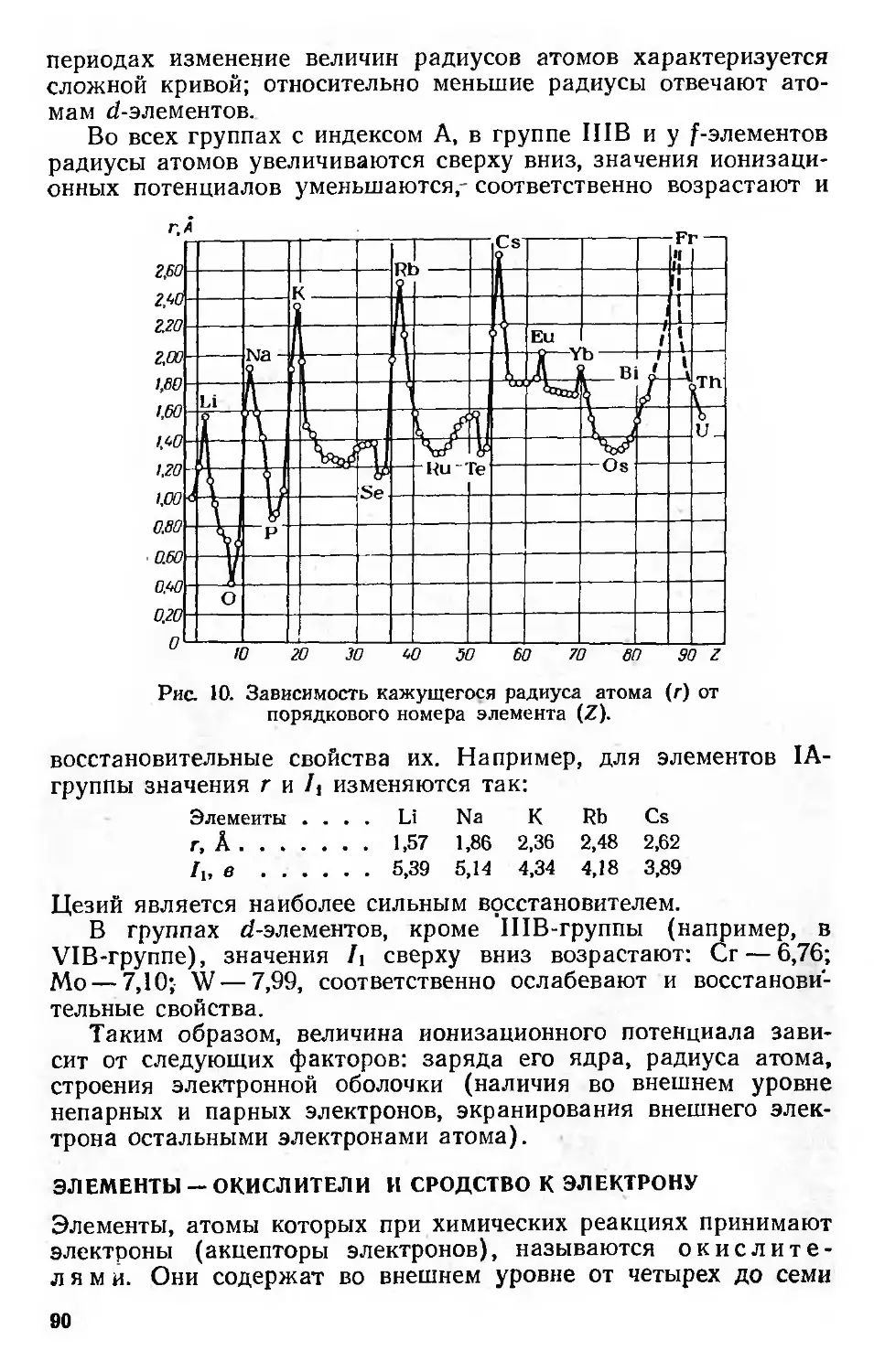
Элементы — восстановители и энергия ионизации 87
Элементы — окислители и сродство к электрону 90
Валентность и вторичная периодичность 92
Водород 92
Благородные газы 93
Триады элементов VIII группы 97
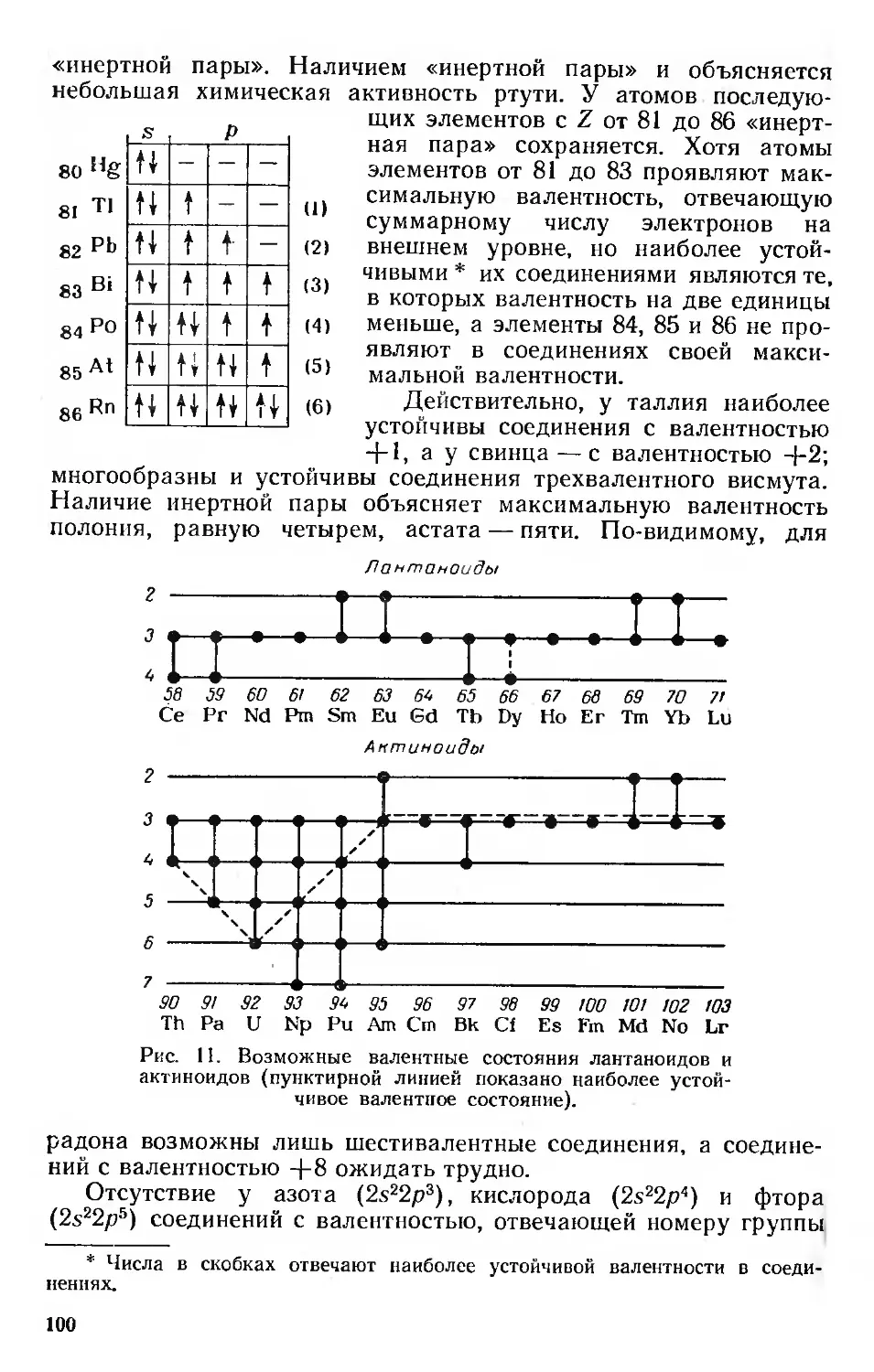
Валентность 99
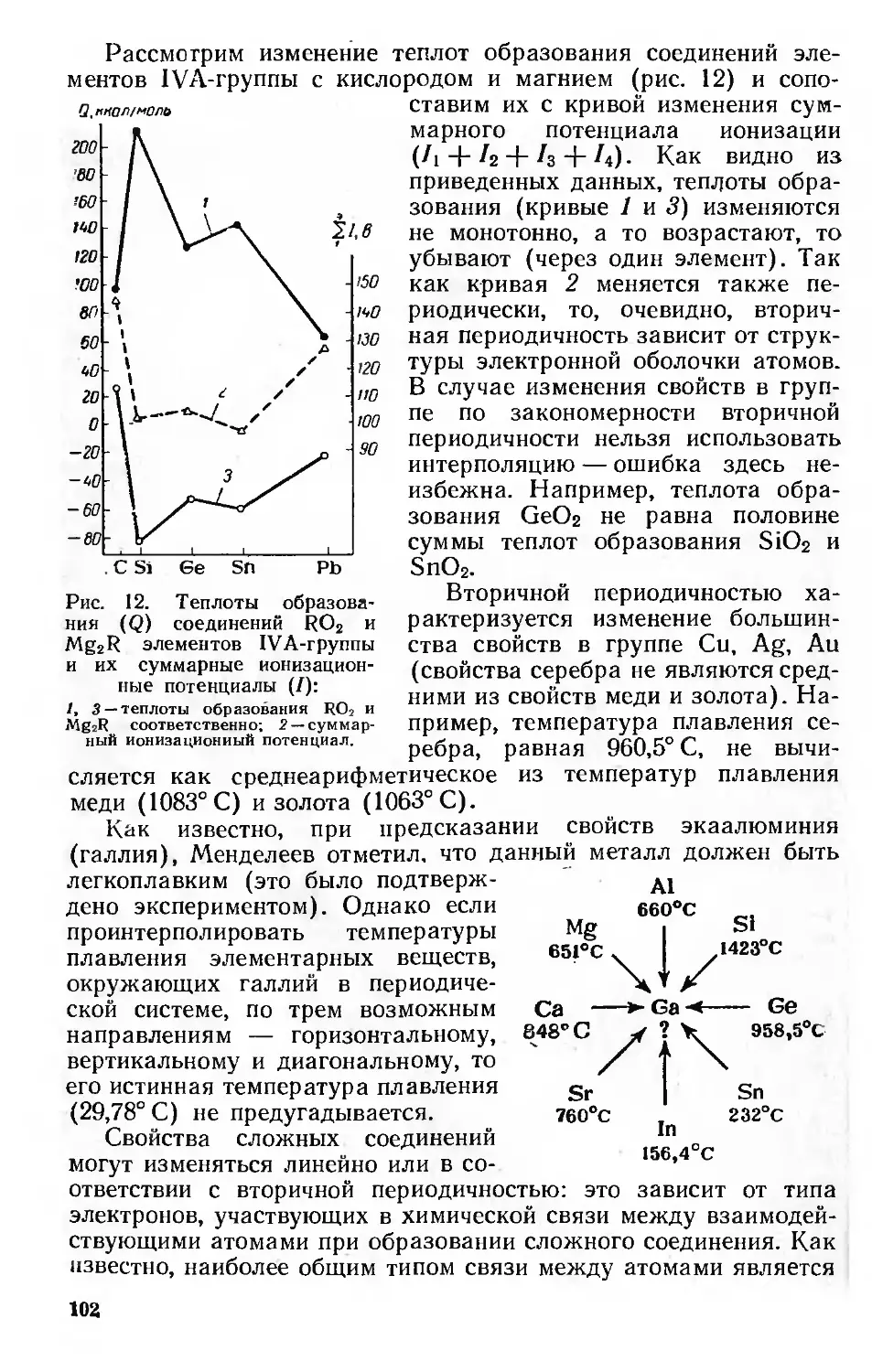
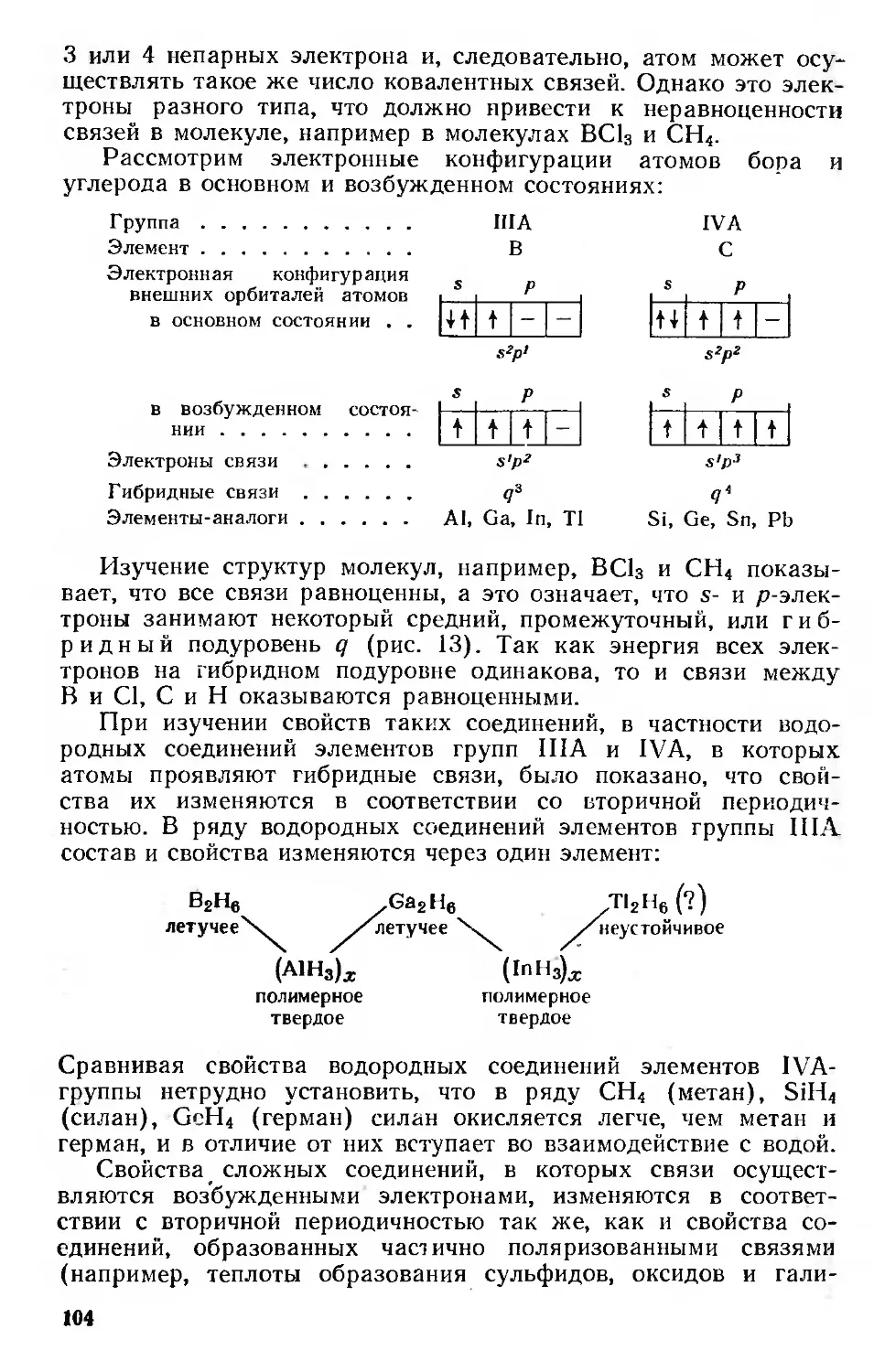
Вторичная периодичность 101
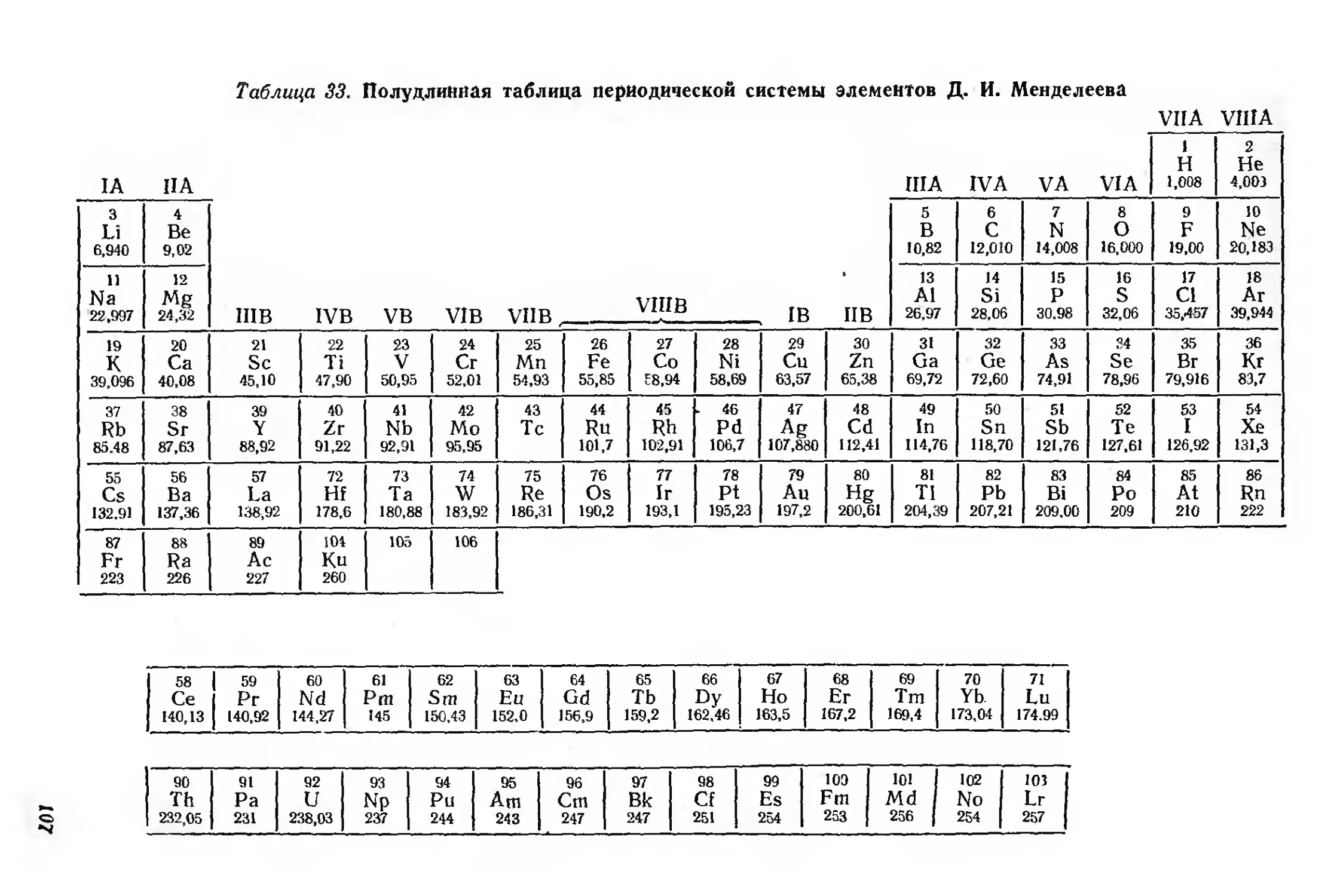
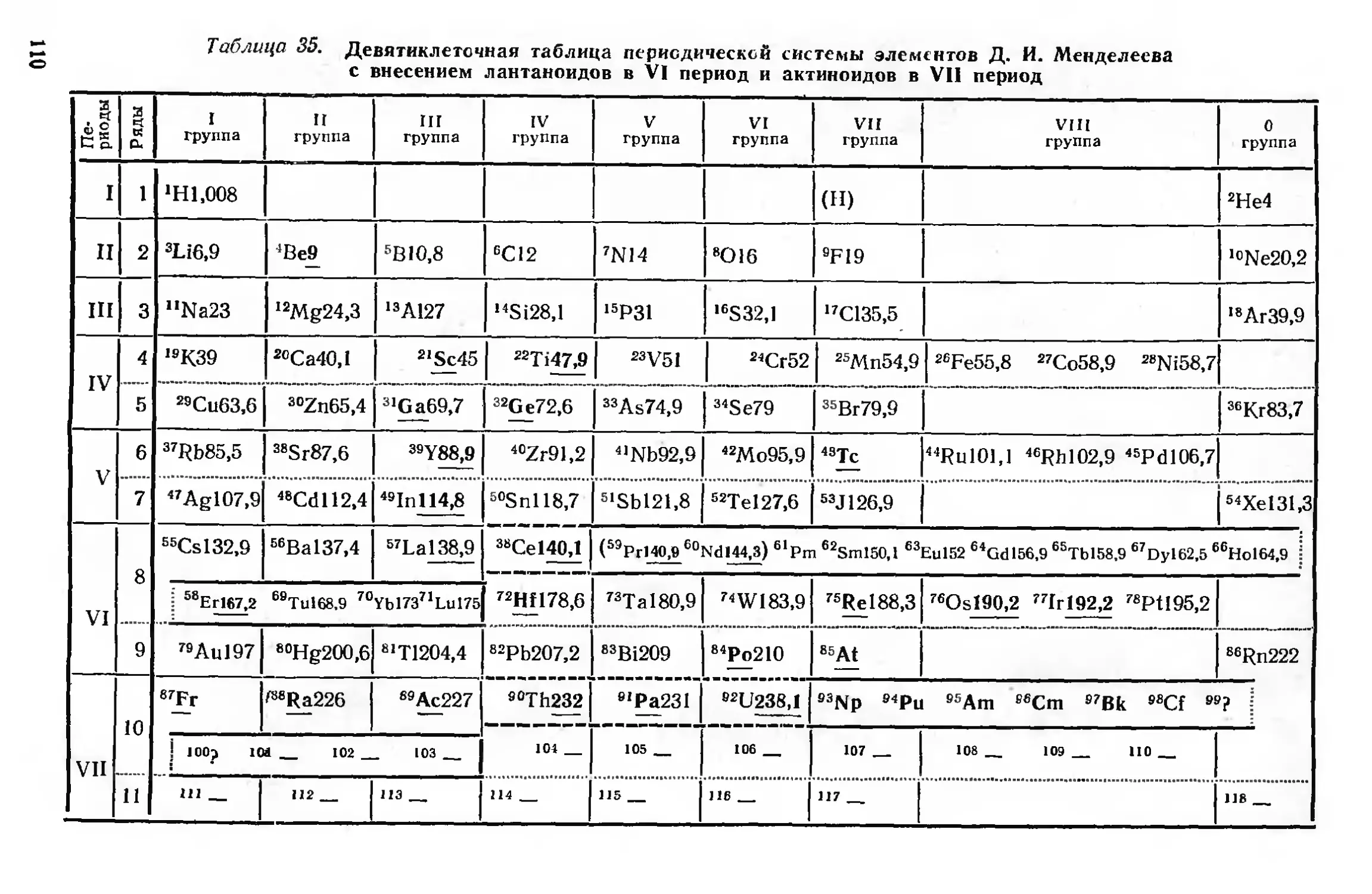
Варианты таблиц периодической системы Д. И. Менделеева 100
Периодическая система и изучение отдельных проблем в химии элементов 114
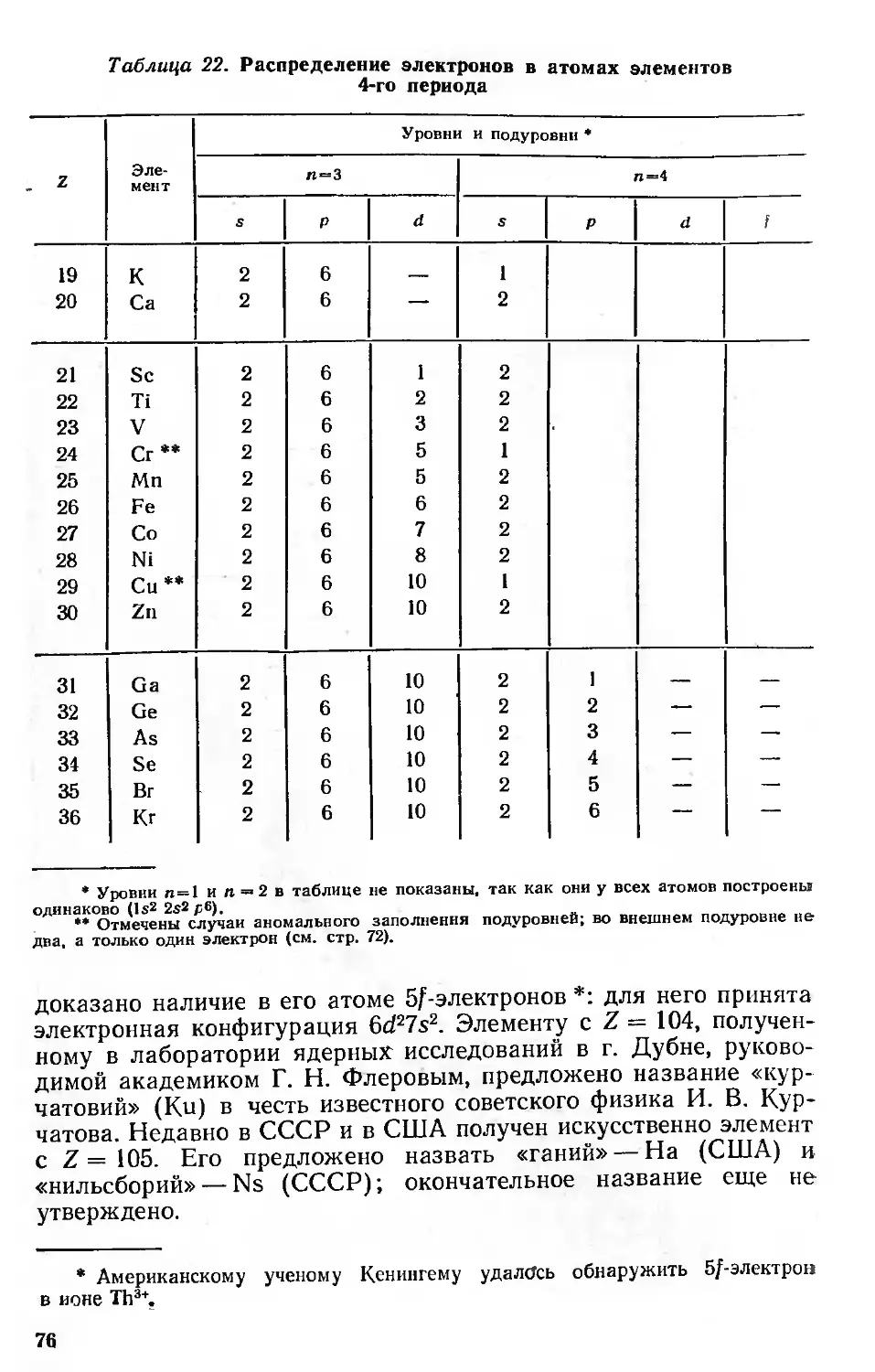
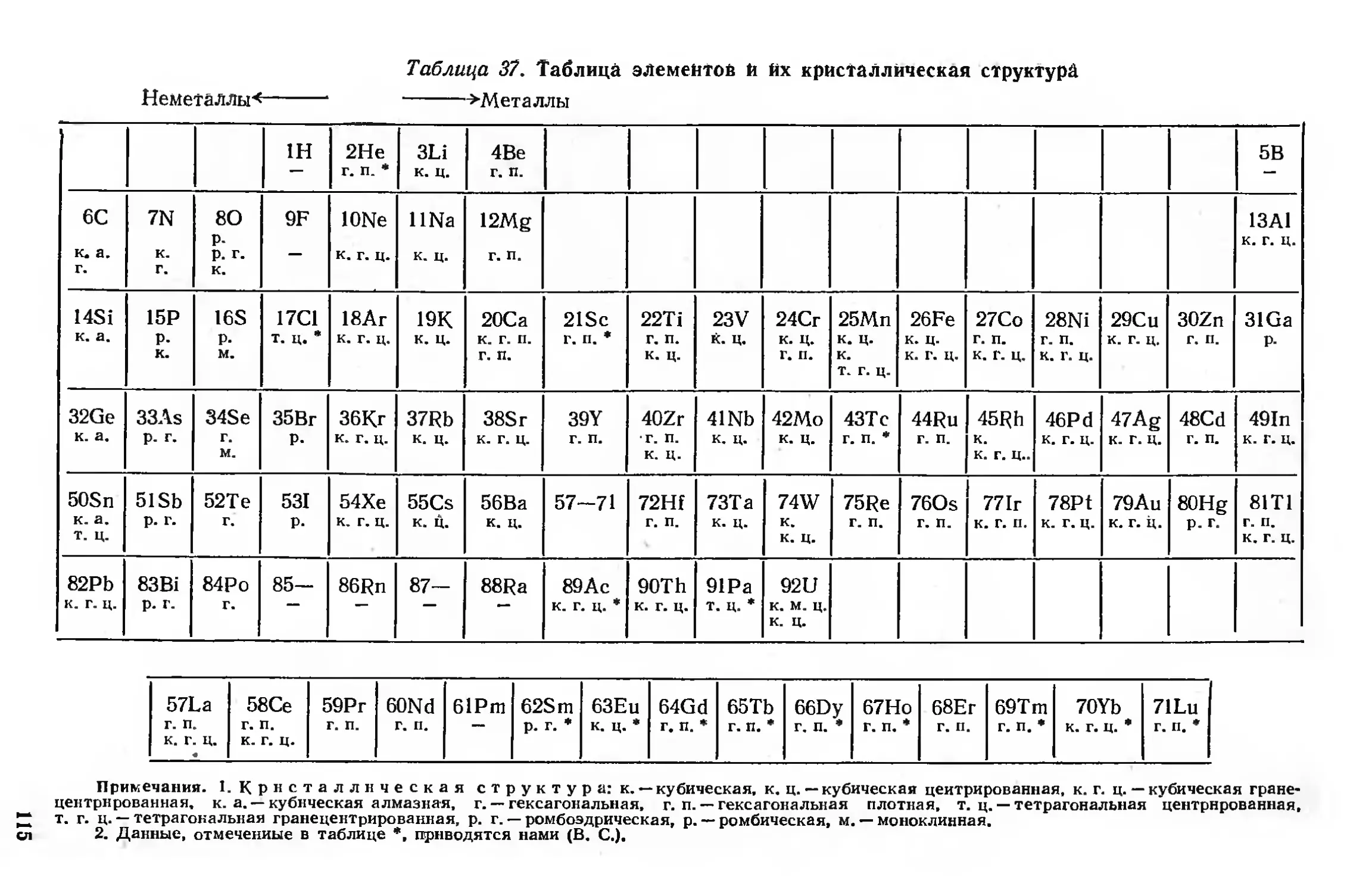
Металлы, сплавы и интерметаллиды 114
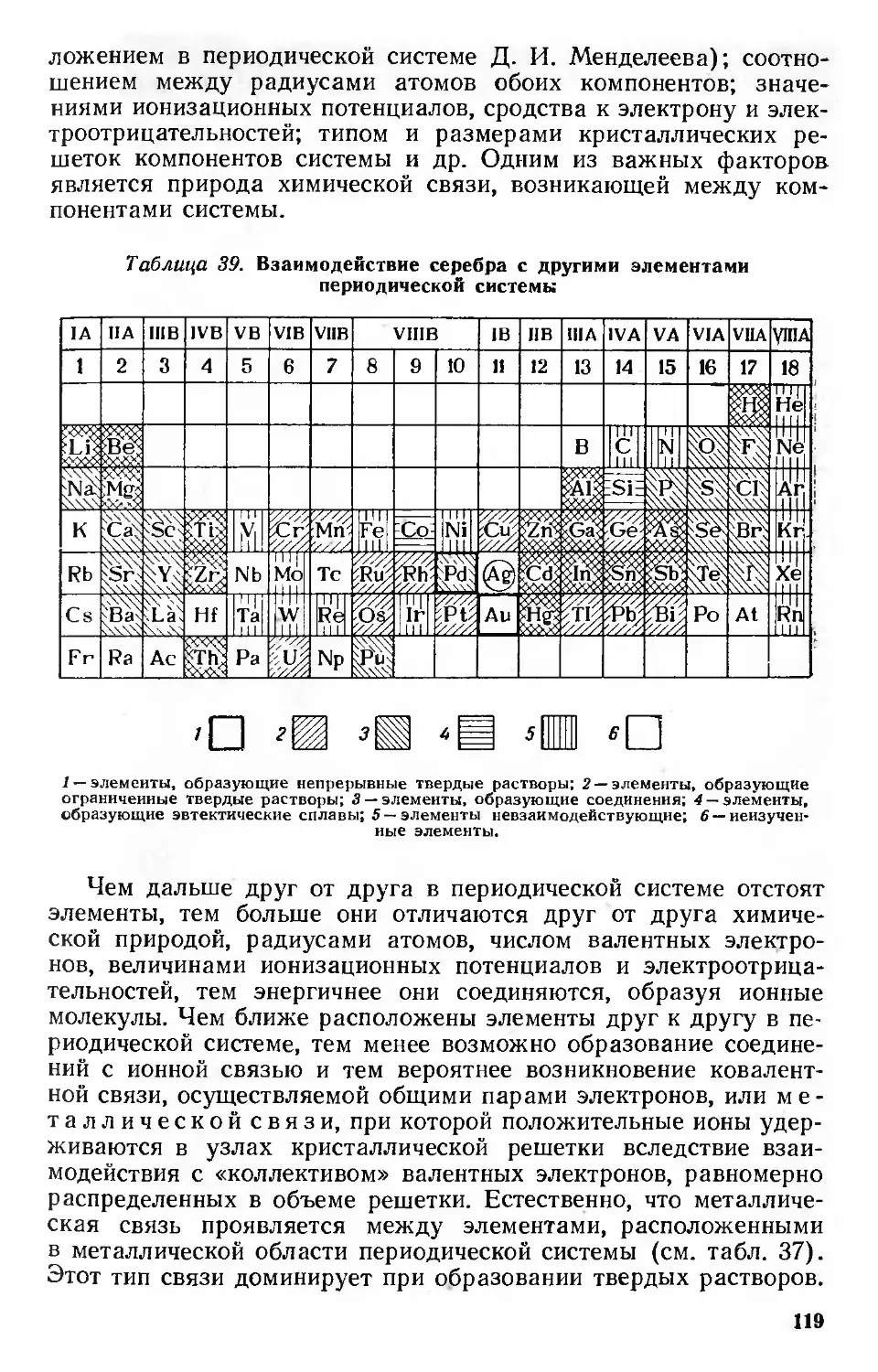
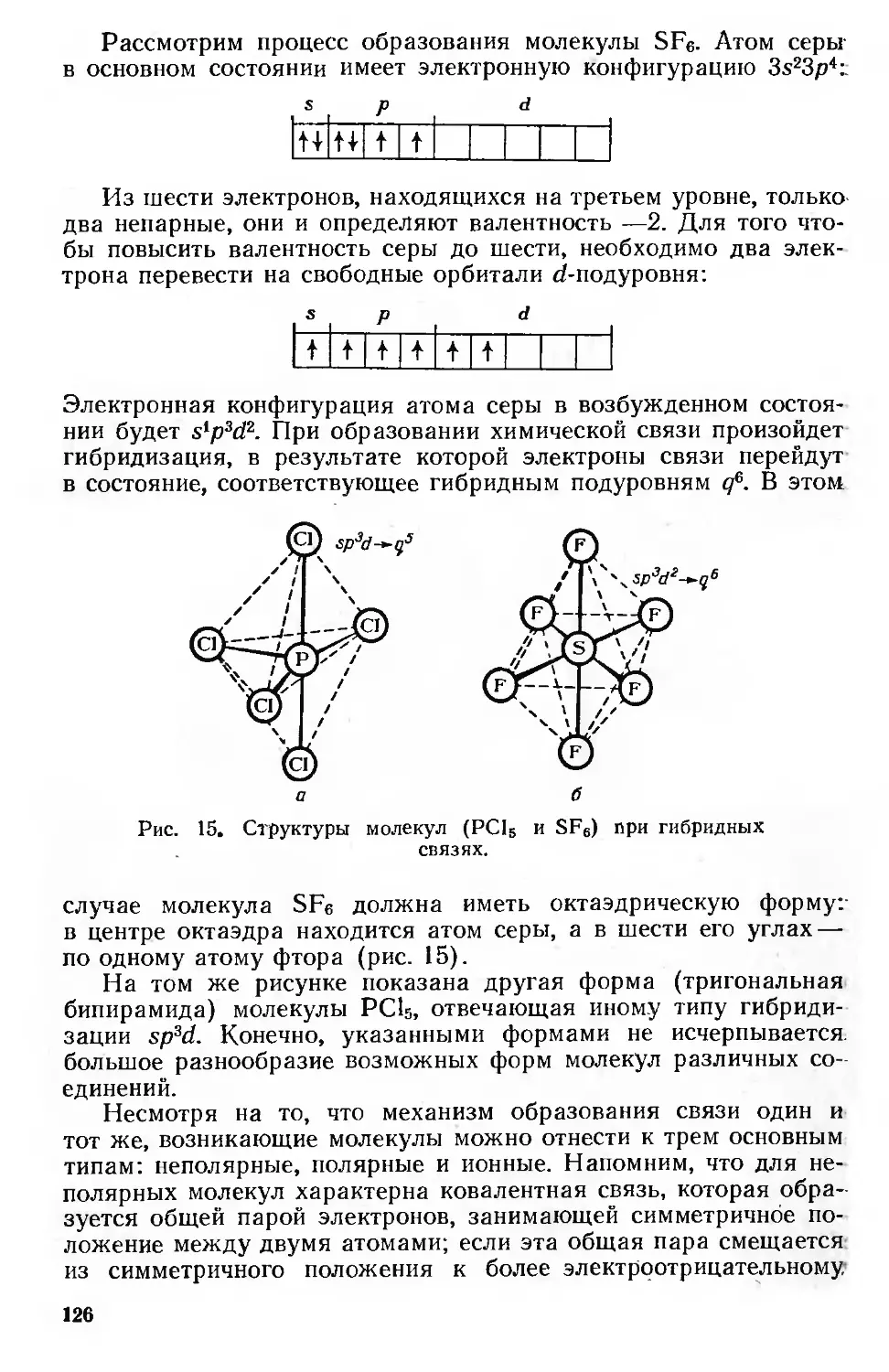
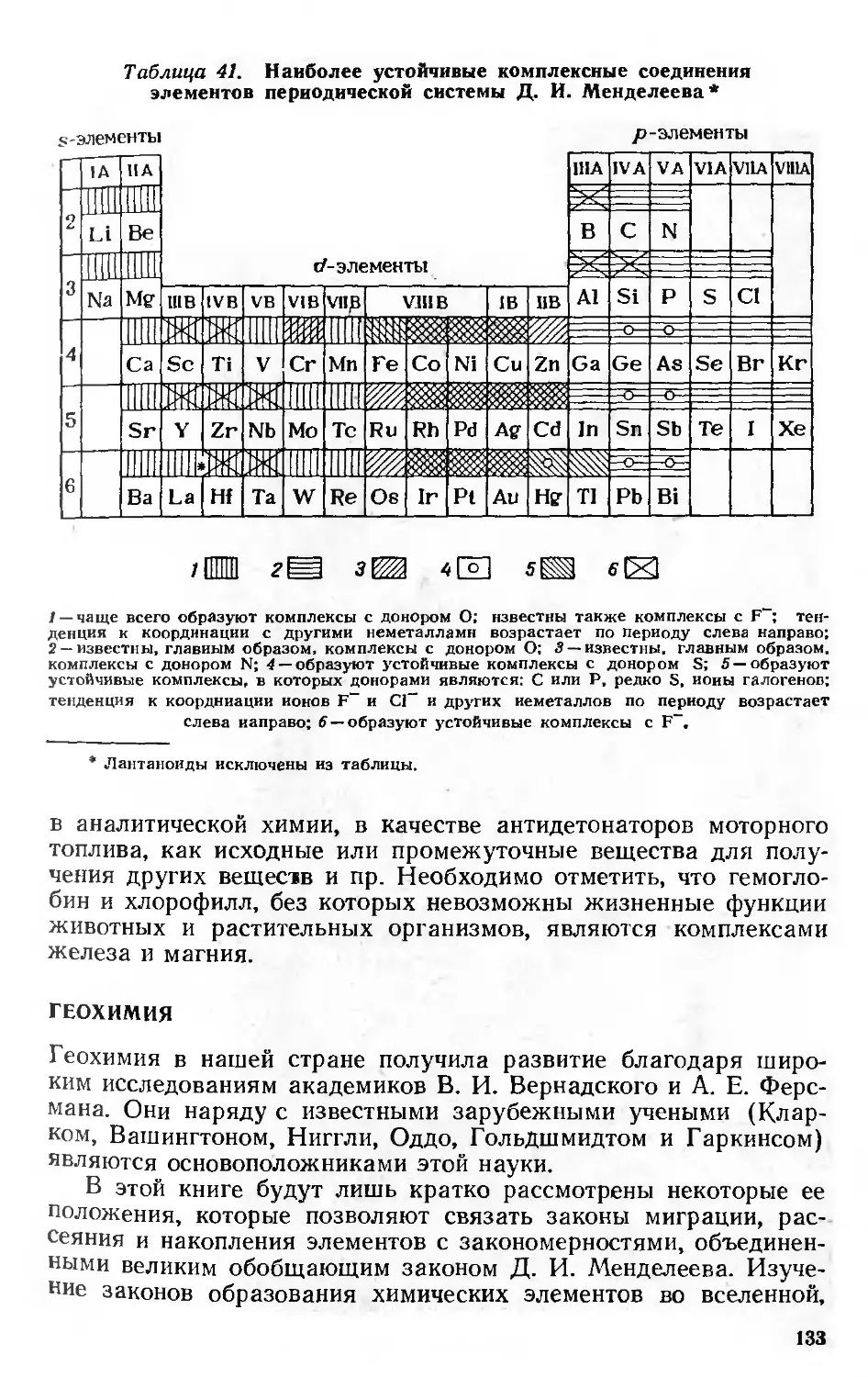
Простые и комплексные соединения 123
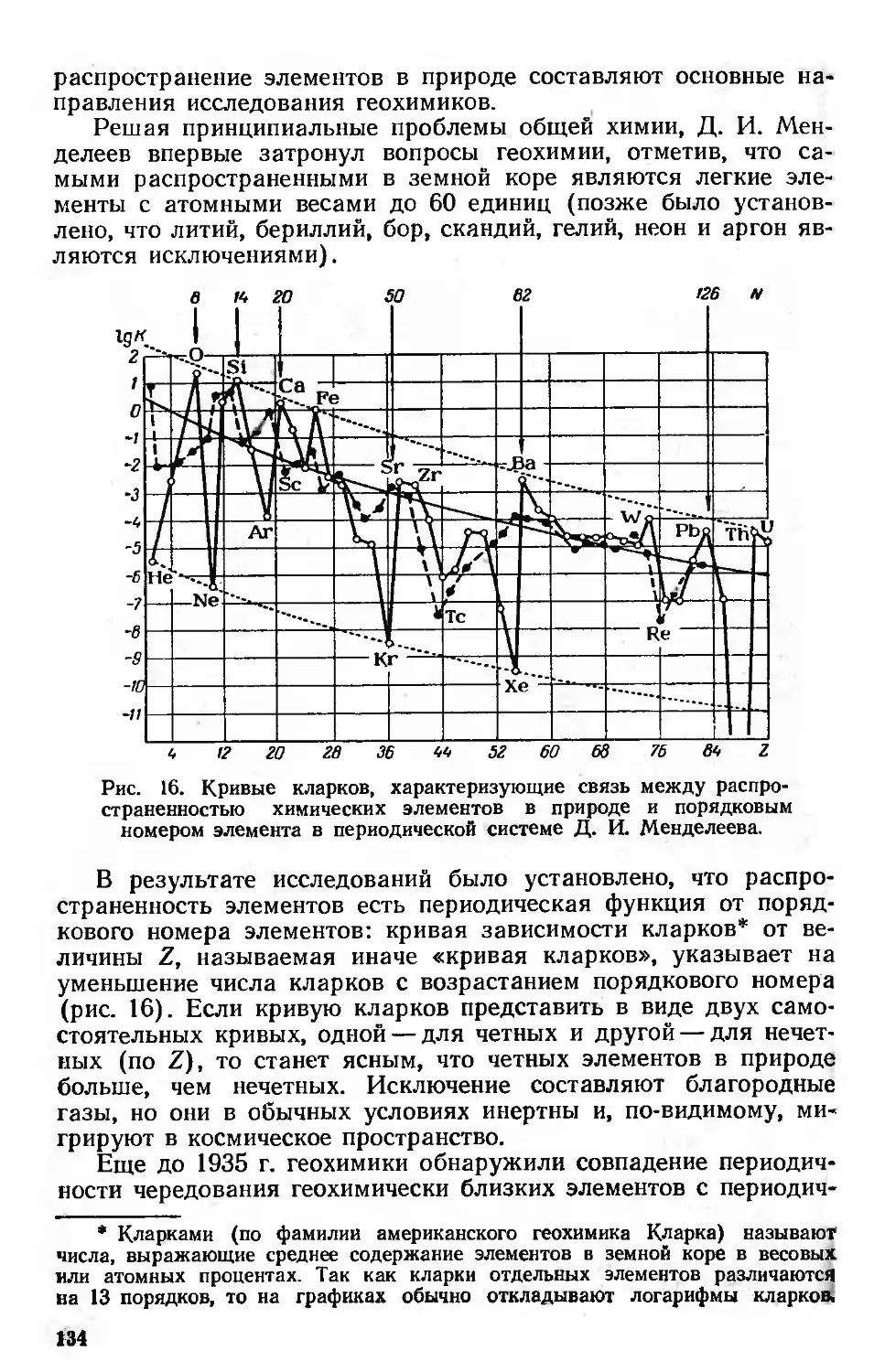
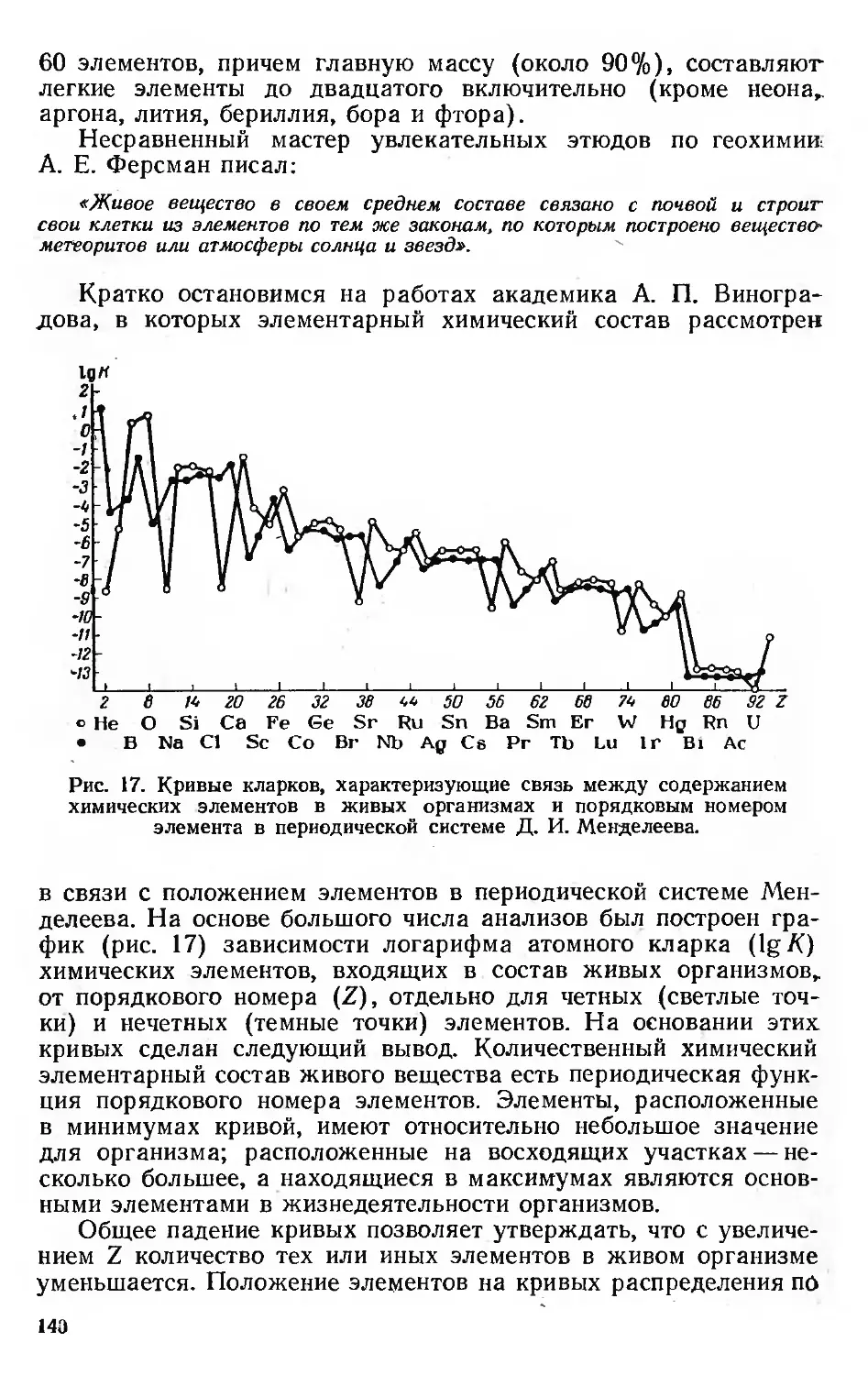
Геохимия 133
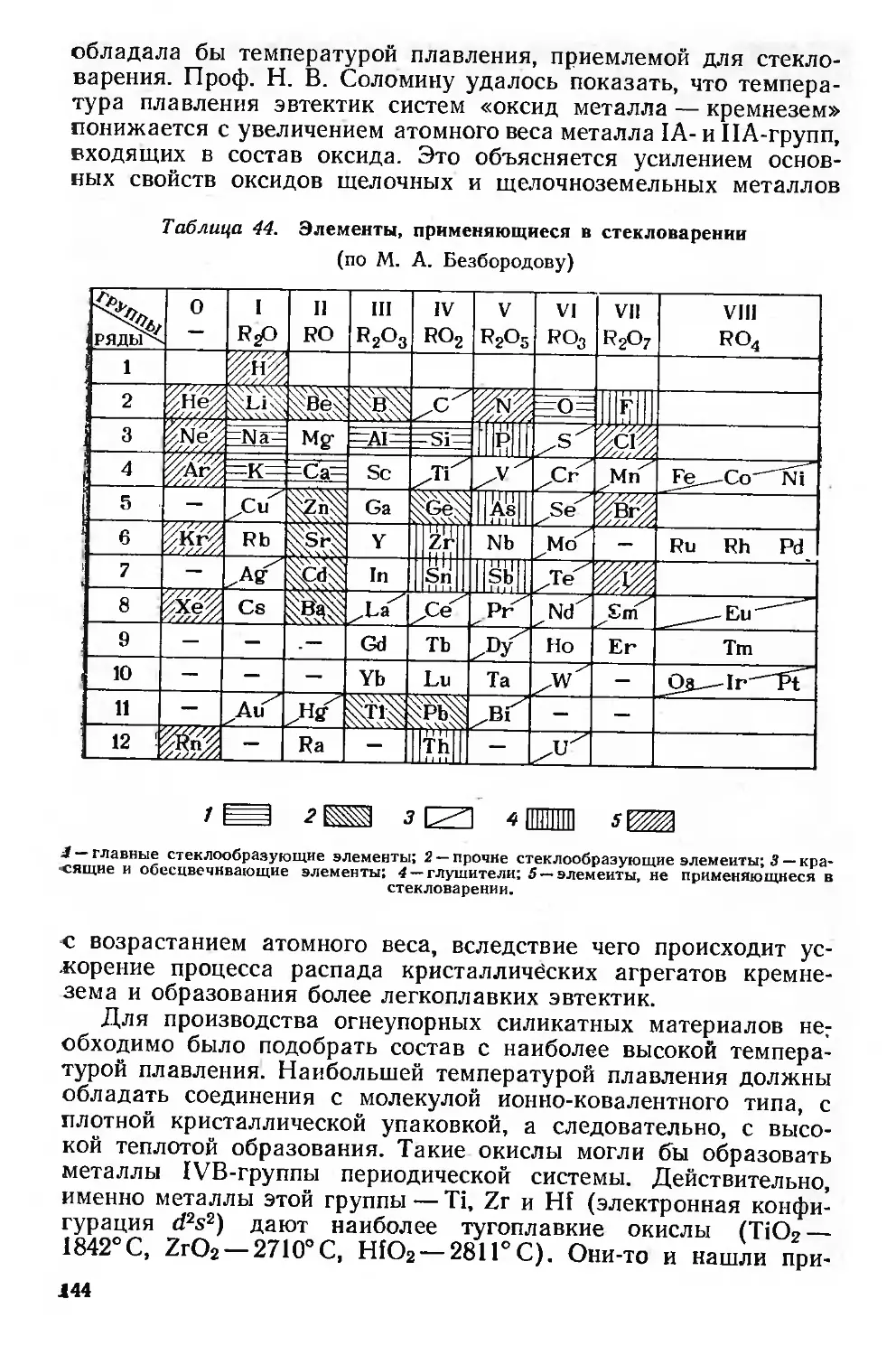
Химическая технология 142
Периодический закон и ядра атомов 147
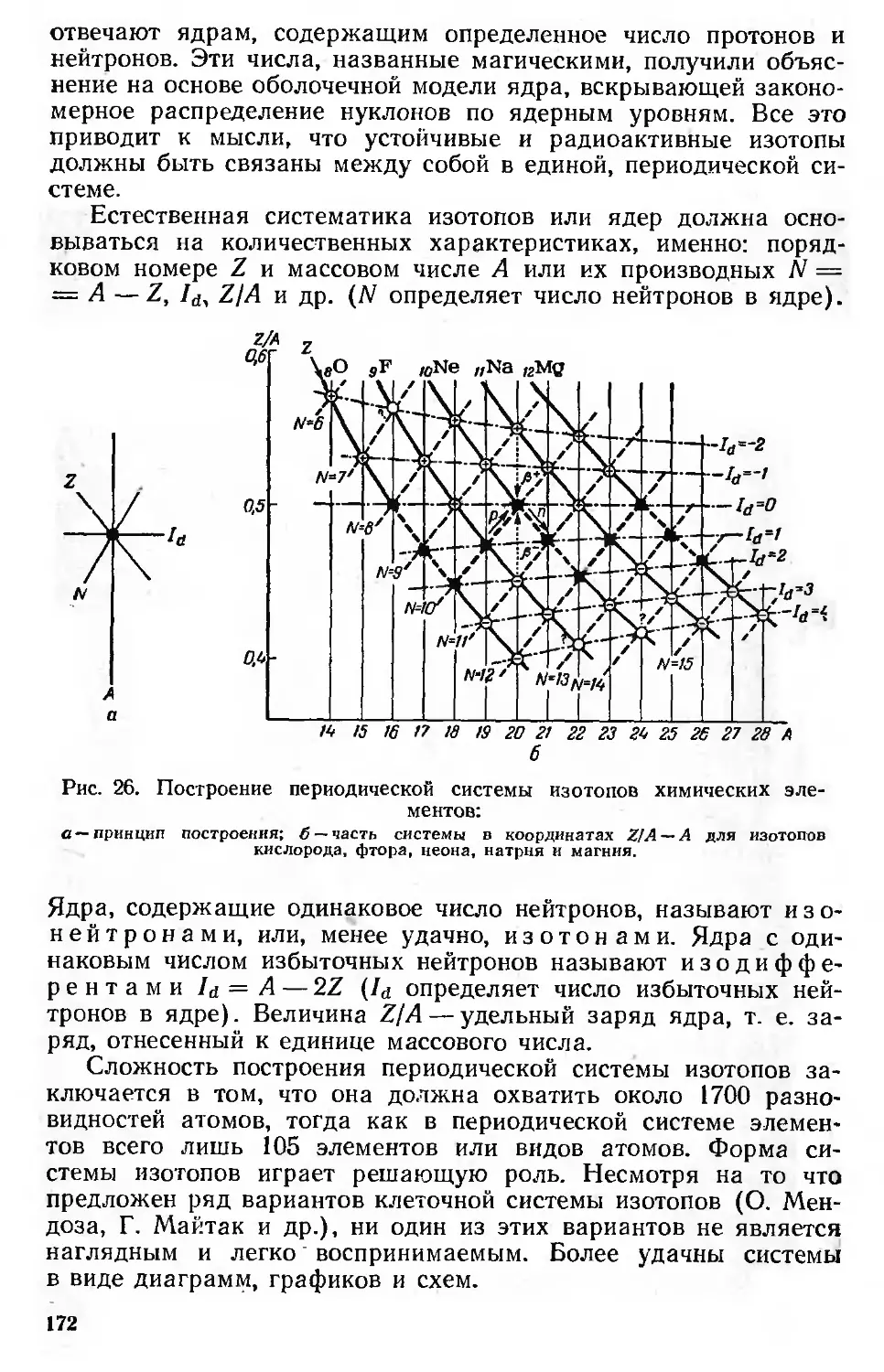
Изотопы и изобары 149
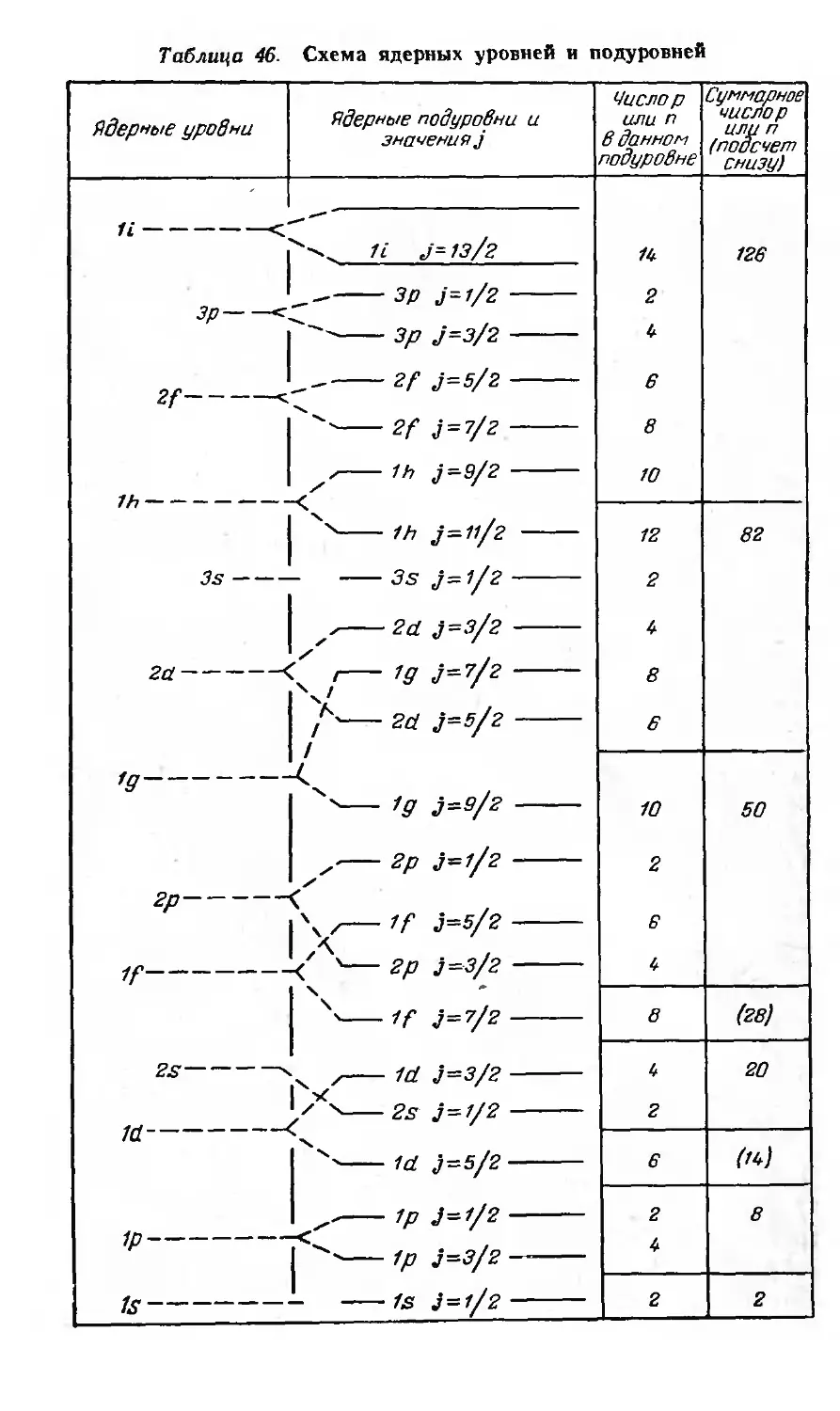
Ядерные уровни и магические числа 152
Периодически изменяющиеся свойства ядер . 155
Распространенность и устойчивость ядер 155
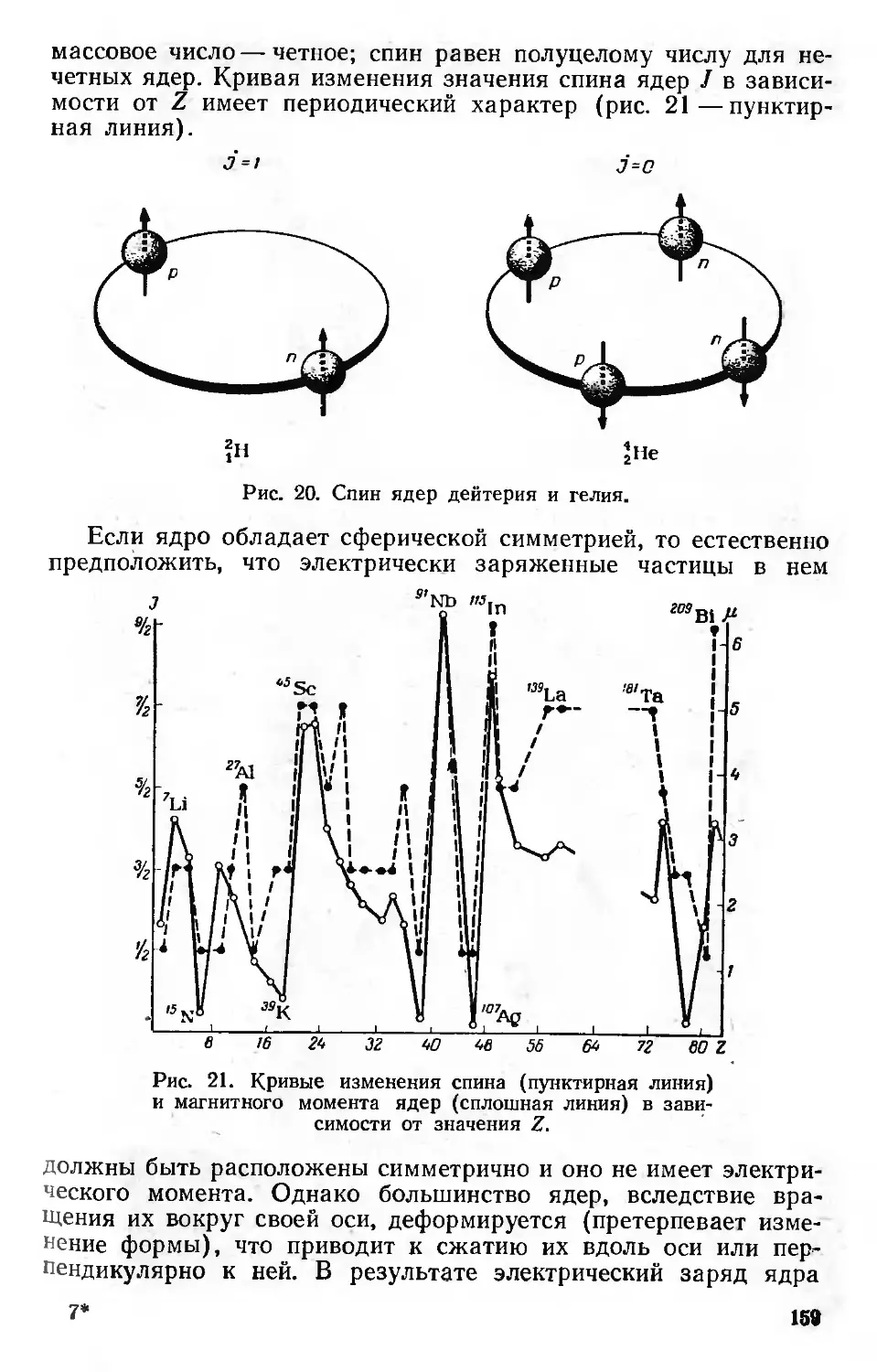
Моменты ядер 158-
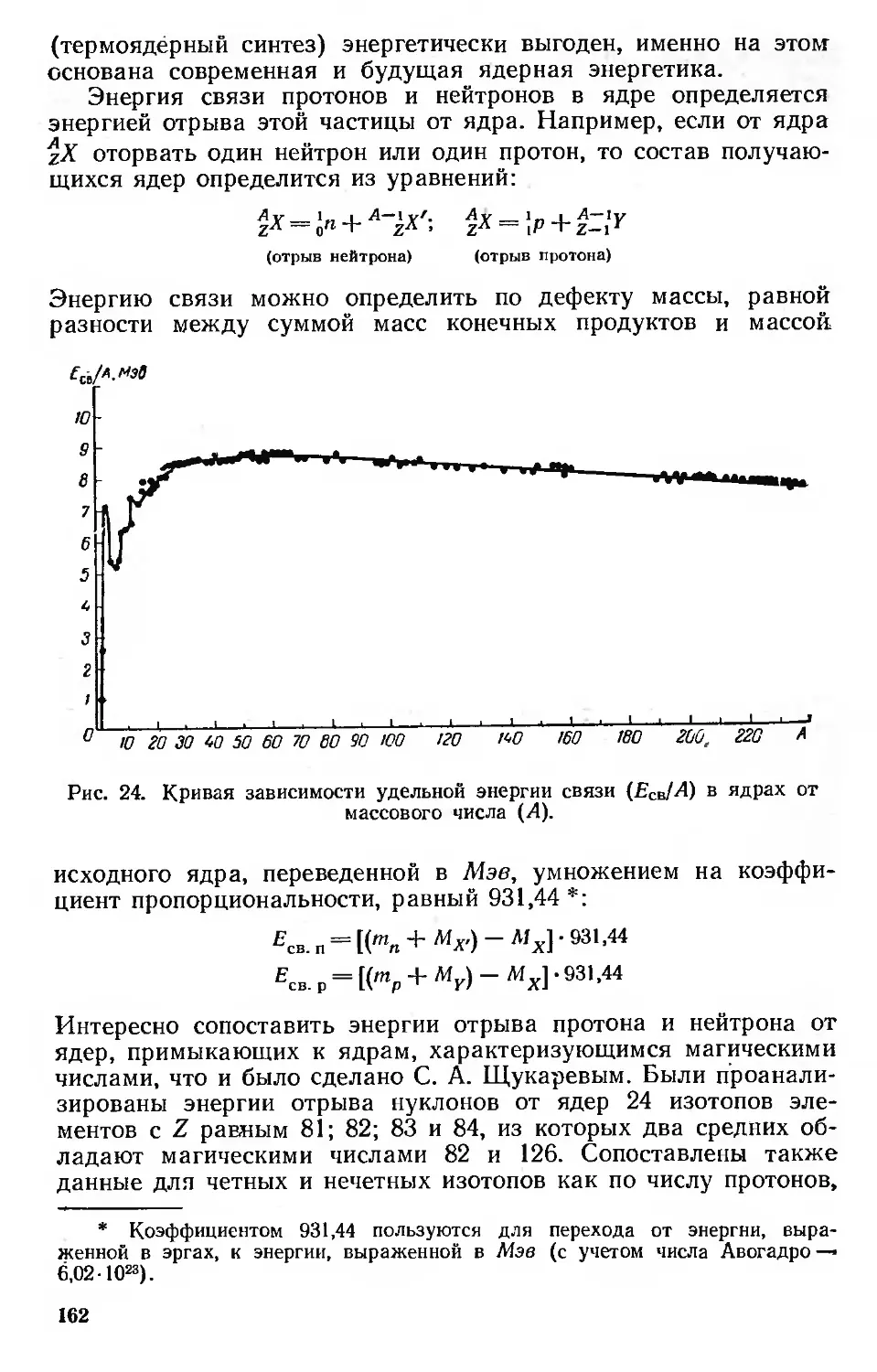
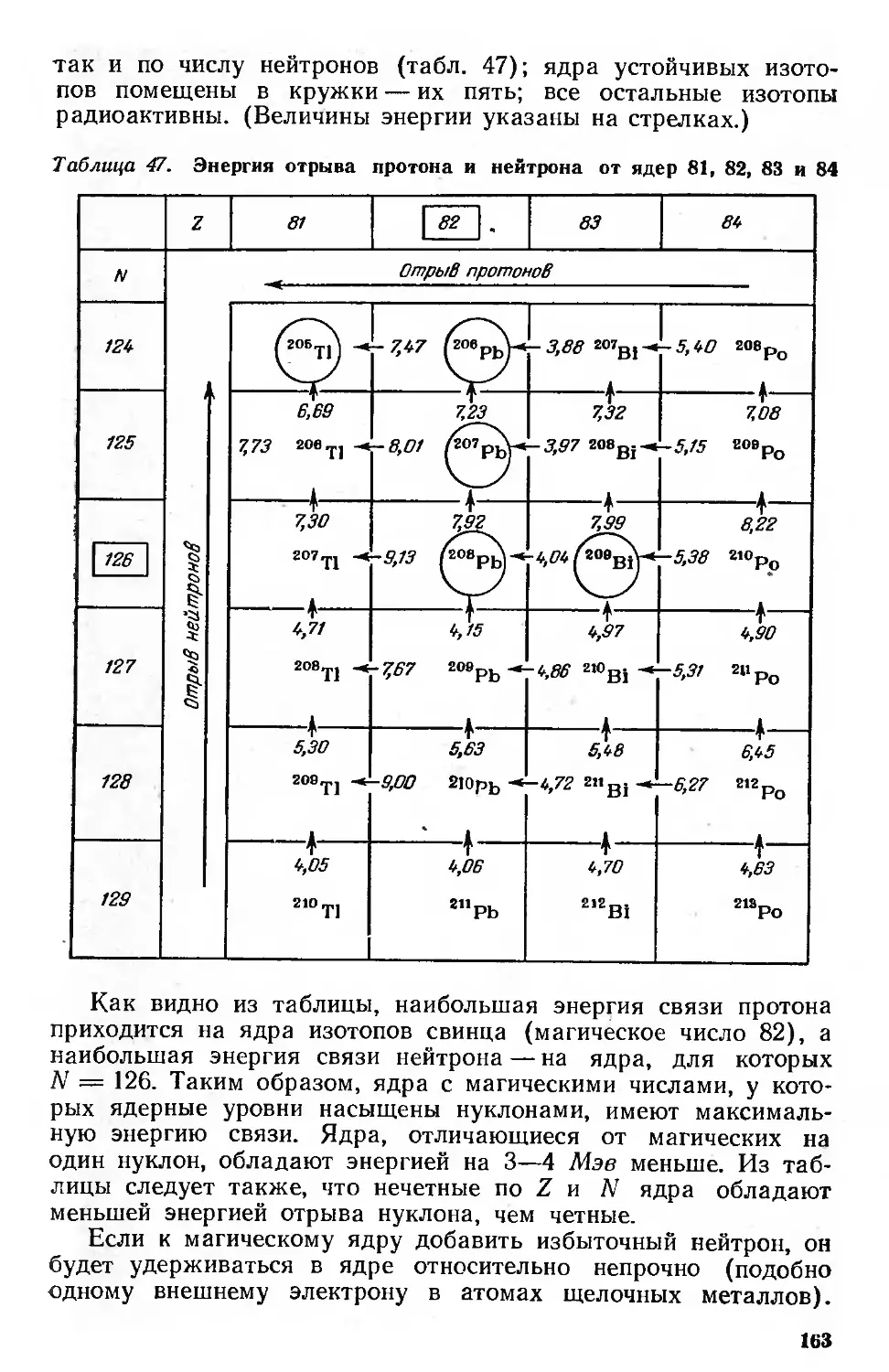
Энергия связи ядер 161
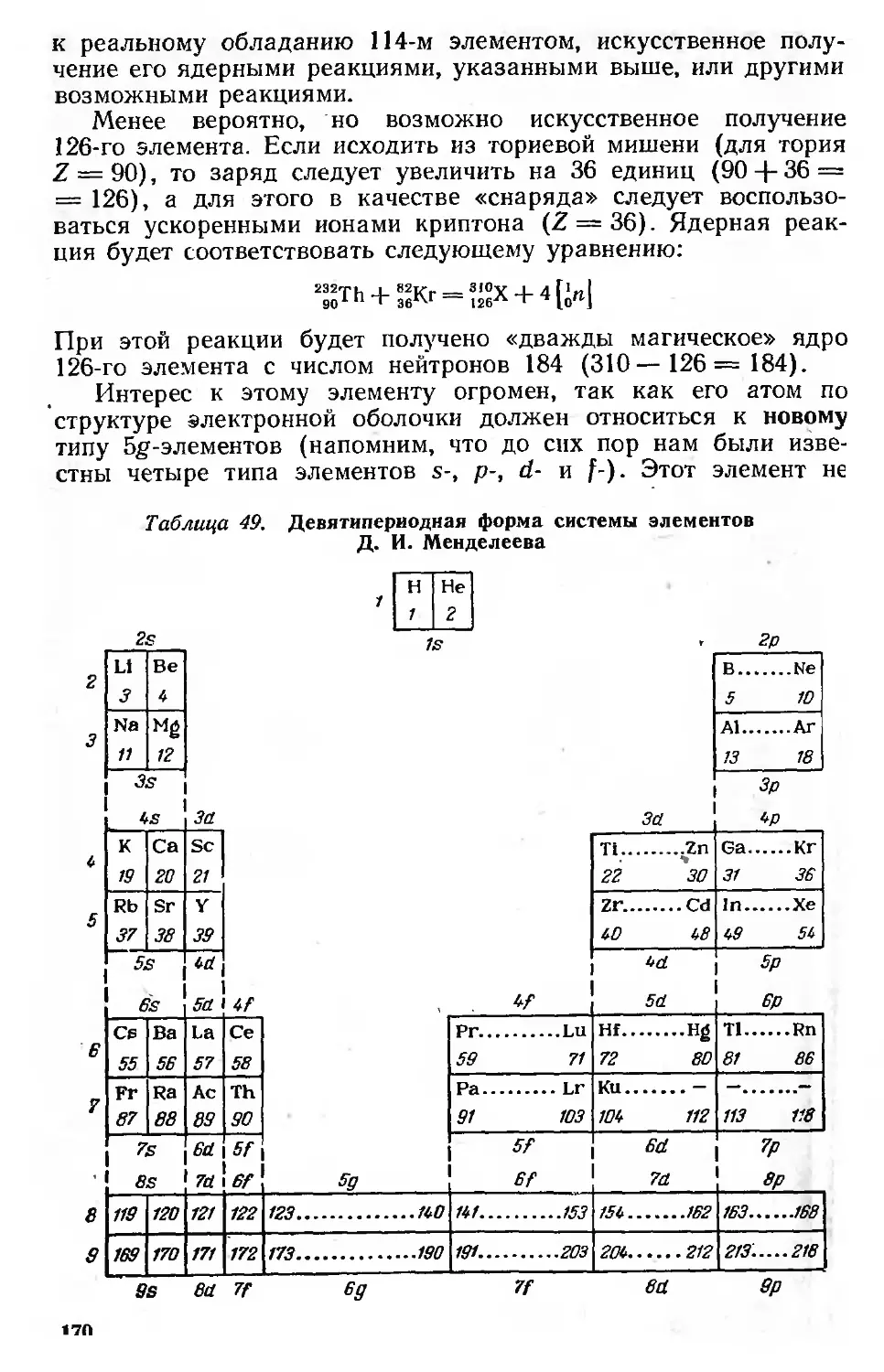
Искусственное получение трансурановых элементов 164
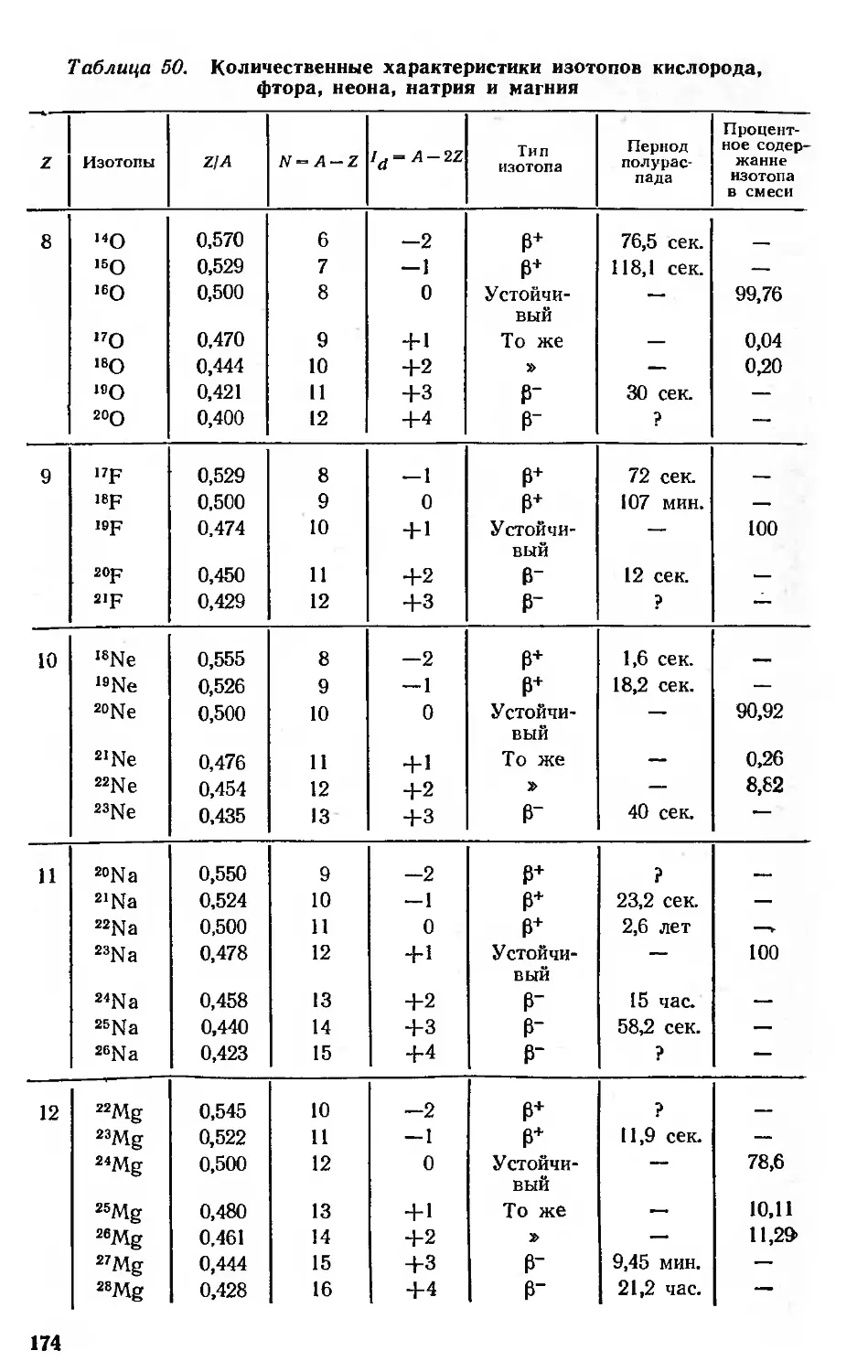
Система изотопов (ядер) 171
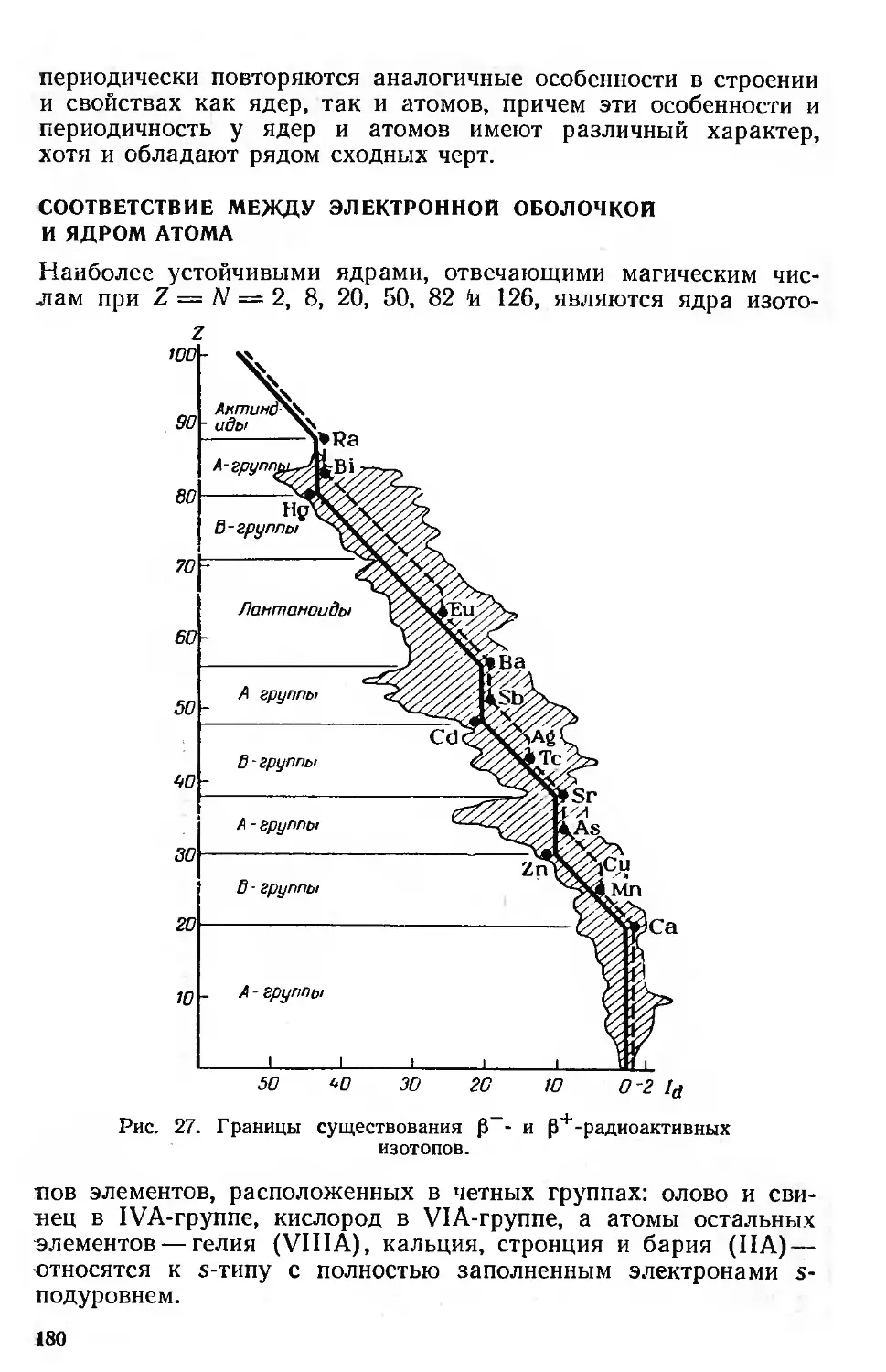
Соответствие между электронной оболочкой и ядром атома .... 180
Неисчерпаемость периодической системы элементов Д. И. Менделеева 182
Обзор работ по периодическому закону и периодической системе
химических элементов Д. И. Менделеева • . 184
Рекомендуемая литература 187
Популярные книги и брошюры 187
Сборники" и монографии 187
ПРЕДИСЛОВИЕ
Периодический закон химических элементов, открытый Д. И.
Менделеевым более 100 лет назад (1869 г.), является одним из
фундаментальных законов естествознания, имеющим огромное
значение не только для химии, но и для многих других наук.
Открытие периодического закона положило начало новому этапу в
истории химии и оказало большое влияние на ее последующее
развитие и проникновение в другие отрасли науки и
производства.
На основе периодического закона Д. И. Менделеевым была
создана периодическая система химических
элементов в форме таблицы, принципы построения которой
сохранились до наших дней. Наряду с обоснованием естественной
классификации известных в то время химических элементов,
система Д. И. Менделеева имела и предсказательную силу, что
впоследствии послужило наиболее убедительным
подтверждением ее неоспоримости и привело к всеобщему ее признанию в
мировой науке.
Со времени открытия Д. И. Менделеевым периодического
закона и опубликования им первого варианта периодической
системы неизмеримо расширилось и углубилось познание человеком
окружающего мира. Наука обогатилась многими выдающимися
открытиями, изменившими все представления о строении
вещества. Новые методы научных исследований, развитие и
совершенствование технических средств для проведения сложнейших
научных измерений и экспериментов привели к возникновению
новых отраслей науки. Все это позволило разработать теорию
строения вещества, осуществить разложение и синтез атомов
некоторых элементов, а также найти способы использования
выделяющихся при этом колоссальных количеств энергии.
Происшедшие изменения в представлениях о строении
вещества тесно связаны с более глубоким пониманием
периодического закона Д. И. Менделеева и применением периодической
системы химических элементов. С другой стороны, развитие
химии и накопление новых научных сведений не мргло не
отразиться в периодическом законе. Порядковый номер элемента в
7
периодической системе приобрел значение физической константы,
характеризующей заряд ядра атома и определяющей природу
элементов, что привело к изменению основной формулировки
закона. В то же время все вновь открытые и полученные
искусственно элементы нашли место в периодической системе.
Таким образом, периодический закон получил ^дальнейшее
развитие, а периодическая система продолжает оставаться
незаменимой естественной системой классификации химических
элементов, на основе которой строится изучение химии и
решение ее практических задач.
Периодическому закону Д. И. Менделеева посвящено
несколько тысяч научных работ и исследований, освещающих
разные стороны его развития и применения в различных отраслях
науки и производства. И, тем не менее, интерес к истории
открытия и развития этого закона не ослабевает и в наши дни.
Поэтому представлялась благодарной задача осветить, кратко и
в возможно популярной форме, как историю открытия и
развития периодического закона, так и современную его трактовку и
наметившиеся направления дальнейших исследований. Такая
книга, по мнению автора, может быть полезной для учащихся и
преподавателей средней школы, студентов вузов и учащихся
техникумов, а также для широкого круга лиц, имеющих
элементарные знания в области химии и физики, интересующихся
вопросами истории химии и современным состоянием представлений
о строении вещества.
В. И. СЕМИШИН
J971 г-
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
И ПОПЫТКИ ИХ КЛАССИФИКАЦИИ
ДО Д. И. МЕНДЕЛЕЕВА
ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ
Представления о единой основе всей природы и строении ее тел
из нескольких простых веществ известны с весьма давнего
времени. Различные философские учения о строении природы
отражали стремление объяснить в той или иной мере ее
происхождение и многообразие, понять сущность окружающего мира.
Наиболее материалистичными были воззрения греческого философа
Демокрита, полагавшего, что все природные вещества состоят
из мельчайших неделимых и несжимаемых частиц—ато м о в
различной формы и величины, но одинакового состава. Однако
значительно большее распространение получило философское
учение Аристотеля о первоматерии и ее началах
(качествах),сочетанием которых можно получить четыре основных
элемента — землю, воду, огонь и воздух. Это учение позже
поддерживалось и католической церковью, так как в известной мере оно
не противоречило библейским легендам о сотворении мира.
Атомы и элементы, принятые в учениях древних философов
в качестве первичной основы строения материи, были, конечно,
чисто умозрительными, абстрактными понятиями, никаким
опытом не подтвержденными. Несостоятельной была и идея
алхимиков о возможности превращения одних элементов в другие,
а именно неблагородных металлов в золото, возникшая в
средние века.
Новые, более близкие к современным, понятия и
терминология, основанные на исследованиях и результатах опытов,
появляются в химии только начиная с работ Р. Бойля. В своей книге
«Скептический химик» он утверждал, что любая химическая
теория может быть принята или отвергнута только на основе
наблюдений или опыта. Понятие «элемент» было впервые
использовано Р. Бойлем в качестве научного термина в 1661 году.
«... я теперь понимаю под элементами некоторые примитивные или
простые или совершенно несмешанные вещества; эти вещества, не будучи
составленными из других веществ или друг из друга, являются составными
частями, из которых непосредственно состоят все те тела, называемые
совершенными смесями, и на которые эти последние в конечном результате
разлагаются».
9
Следовательно, под химическим элементом Р. Бойль
подразумевает нечто материальное, входящее в состав сложных
веществ и не разлагающееся на составные части. По этому поводу
Ф. Энгельс писал: «Бойль делает из химии науку».
К 1694 г. в соответствии с определением Р. Бойля было
известно 14 химических элементов:
золото серебро медь углерод олово
железо ртуть сера сурьма цинк
фосфор мышьяк свинец висмут
Великому русскому ученому М. В. Ломоносову принадлежит
заслуга дальнейшего развития опытных исследований в химии
и преобразования ее в точную науку. На основе измерения
количеств веществ, участвующих в химических превращениях,.
М. В. Ломоносов установил закон сохранения веса
вещества, подтверждающий неуничтожаемость материи. На
основе представлений об элементах (соответствующих атомам)
и собраниях элементов — корпускулах (молекулах) М. В.
Ломоносов создал корпускулярную теорию строения вещества, во
многом совпадающую с современными представлениями атомно-мо-
лекулярного учения.
Количественные приемы изучения химических, реакций
широко использовались и выдающимся французским ученым А.
Лавуазье, научная деятельность которого открыла новый этап в
развитии химии. Только со времен Ломоносова и Лавуазье
процессы взаимодействия веществ стали изучаться в химии
количественным методом, позволяющим определять состав
химических соединений. При помощи этого метода был открыт/
еще ряд элементов:
водород кислород азот хлор платина кобальт
никель марганец вольфрам хром теллур
Таким образом, к концу XVIII века было достоверно
обнаружено существование уже двадцати пяти элементов.
Следует отметить, что в учебнике по химии Лавуазье,
изданном в 1789 г., впервые была приведена таблица химических
элементов и сделана попытка их классификации на основе
физических свойств (металлы и неметаллы) и типа образующегося
окисла.
Начало XIX столетия ознаменовалось открытием новых очень
важных количественных закономерностей, позволяющих
определять весовые соотношения между элементами, вступающими во
взаимодействие, что сыграло большую роль в развитии атомно-
молекулярной теории — основы химической науки.
Разработка атомно-молекулярной теории во многом обязана
выдающимся ученым: Дальтону, Авогадро, Жерару, Берцелиусу,
Канниццаро и др. Особенно большое значение имели
исследования английского естествоиспытателя Дальтона, который на
основе атомной гипотезы впервые ввел в химию понятие об
относительном атомном весе элементов. Используя результаты
анализа различных соединений, Дальтон определил атомные веса
некоторых элементов, показав тем самым, что это свойство
атомов доступно для экспериментальных определений.
В «Диалектике природы» Ф. Энгельс отмечал:
«В химии, особенно благодаря дальтоновскому открытию атомных весов,
мы находим порядок, относительную устойчивость однажды достигнутых
результатов и систематический, почти планомерный натиск на еще не
завоеванные области, сравнимый с правильной осадой какой-нибудь крепости».
«Новая эпоха начинается в химии с атомистики (следовательно, не
Лавуазье, а Дальтон — отец современной химии)...» *
* Ф. Энгельс, Диалектика природы, Издательство политической
литературы, 1969, стр. 92, 257.
11
Таким образом, качественное своеобразие химических
элементов начинает связываться с их количественной
характеристикой — относительным атомным весом, ставшим впоследствии
основой классификации элементов. Однако экспериментальное
определение точных атомных весов оказалось нелегким делом
и нередко давало разноречивые результаты, так как
предварительно требовалось установить количественный состав ряда
летучих соединений данного элемента, их молекулярные веса и
истинные формулы. В то время химики-органики не считались
с атомными весами элементов, принятыми неорганиками, а
многие ученые предпочитали пользоваться «собственными»
атомными весами или же эквивалентными весами элементов,
введенными английским естествоиспытателем Волластоном в 1814 г.
Под эквивалентным весом подразумевалось такое весовое
количество элемента, которое может соединиться с одной весовой
частью водорода или заместить ее. Значения эквивалентных весов,
найденные опытным путем, все же вызывали сомнения в их
правильности.
С течением времени экспериментальные методы определения
атомных весов элементов совершенствовались, становились
более точными и приводили к достоверным значениям.
В первой половине XIX столетия был открыт еще 31
элемент, т. е. больше, чем за все предшествовавшее время:
церий родий палладий осмий иридий калий
натрий кальций стронций барий магний бор
иод кадмий селен литий кремний бром
торий алюминий цирконий лантан бериллий рутений
фтор титан иттрий тантал ванадий уран
молибден
12
Изучение свойств этих элементов и их соединений, а также
синтез ряда соединений элементов, открытых ранее, дали много
новых сведений и позволили накопить большой фактический
материал, но вместе с тем выявили и необходимость его
систематизации. Прежде всего нужно было решить основной вопрос;
являются ли химические элементы разрозненными, независимыми
«началами» или они закономерно связаны между собой в еди-j
ную систему.
ПОПЫТКИ КЛАССИФИКАЦИИ ЭЛЕМЕНТОВ
МЕЖДУНАРОДНЫЙ СЪЕЗД ХИМИКОВ В 1860 г.
Многочисленные исследования, относящиеся к началу и середине
прошлого века, привели к установлению сходства химических
свойств ряда элементов и некоторых закономерностей в
изменении значений их атомных весов *.
Так, Деберейнер (1829 г.) ввел понятие о триадах — группах
из трех сходных в химическом отношении элементов, в которых
величина атомного веса среднего элемента близка к
среднеарифметическому значению атомных весов двух крайних элементов.
Позже было установлено наличие группировок из большего
числа элементов, чем в триадах, например группировка — магний,
кальций, стронций, барий (Гмелин); отмечено особое значение
в химии чисел 8 и 18, так как разности между эквивалентными
весами сходных элементов равны 8и 18или кратны этим числам
(Петтенкофер). Было замечено также, что элементы, атомные
веса которых близки по величине, сходны по химическим
свойствам и часто в природе встречаются вместе (Глэдстон),
например платиновые металлы (платина, родий, иридий, осмий,
* О специальной литературе, посвященной этим исследованиям, см.
стр. 187.
13
палладий и рутений), группа железа (железо, кобальт, никель).
Для нахождения атомных весов всех элементов, входящих в
данную группу химических аналогов, были предложены общие
формулы (Кук, Дюма). Введено понятие об артиадах — четные
элементы и периссадах — нечетные (Кук). Дано графическое
изображение системы, охватывающей 41 элемент, в которой
обращает внимание деление одной группы на две подгруппы: каль-
цоиды — Са, Sr, Ва и кадмоиды — Zn, Cd, Pb (Гинрихс).
Указывалась возможность естественной связи не только между
элементами одной триады, но и элементами трех соседних триад
(такие группировки были названы эннеадами *) на основе
эквивалентных весов (Ленссен).
Английский химик Одлинг расположил 48 элементов в
^группах (табл. 1) по сходству химических свойств (горизонтальные
строки).
Таблица 1. Естественная группировка элементов Одлинга (1857 г.)
I
п
ш
IV
V
VI
VII
VIII
IX
X
XI
XII
XIII
F 19
О 16
N 14
В 14,5
Li 6,5
Са 20
Mg 12,2
G* 4,7
Al 13,7
Cr 26,3
Mo 46
Hg 100
Pd 53,2
Si
Na
Sr
Zn
Y
Mn
Fe
V
Pb
Pt
—
28,5
23
43,8
32,5
32
—
27,6
—
28
68,5
106,6
98,0
CI
S
P
Ti
К
Ba
Cd
Th
Zr
Co
Ni
W
Ag
35,5
32
31
48,4
39
68,5
55,5
59,6
33,6
29,5
—
29,5
92
108
"
Br 80
Se 79,2
As 75
—
—
—
—
—
Ce 46
—
Си 31,6
—
—
—
Au 196,6
I 127
Те 128
Sb 120
Sn 117,8
—
—
—
—
U 60
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
—
Bi 213
—
—
—
—
—
—
—
—
—
—
—
—
* G или Gl —Прежний символ элемента бериллия (Be) от названия глюциний
(Glucinium).
В таблице Одлинга отсутствуют 11 известных в то время
элементов и среди них такие, как углерод и водород. В первых пяти
группах Одлинг пользуется атомными весами, а в остальных —
эквивалентными (кроме золота). Слева направо все элементы
расположены в порядке возрастания атомных весов, но в
вертикальных колонках значения атомных весов изменяются
бессистемно. Элементы: Мп, Со и Fe, Ni помещены вне групп
системы; число групп не имеет обоснования. Только первые семь
групп включают элементы, являющиеся химическими аналогами
* От греческого эннеа — девять.
14
(кроме В в IV группе). Элементы, символы которых набраны
курсивом (курсив наш— В. С), химически не сходны между
собой и большинством элементов данной группы. Нельзя
обосновать заполнение одним элементом седьмой вертикальной
колонки и отсутствие элементов в шестой колонке.
Из критического рассмотрения таблицы Одлинга следует, что
она не является естественной группировкой элементов ввиду
непоследовательности ее построения и произвольных допущений в
размещении элементов.
Известен и еще ряд попыток раскрыть взаимосвязь между
свойствами и атомными весами элементов. Все они оказались
безуспешными, хотя и признавалось, что обнаруженные
зависимости между атомными (или эквивалентными) весами
элементов и их химическими свойствами не могут быть случайными.
Эти исследования лучше всего были охарактеризованы Штрек-
кером в 1859 г.:
«Трудно предположить, что все вышеприведенные зависимости между
атомными весами (или эквивалентными) в химических свойствах сходных
элементов — просто случайны.
Нахождение намечающихся в этих числах закономерностей мы,
однако, должны предоставить будущему» (подчеркнуто нами — В. С).
Неудачу попыток систематизации элементов можно объяснить
неточными значениями их атомных весов и ограниченностью
известных небольших группировок элементов со сходными
химическими свойствами. О классификациях подобного типа
Д. И. Менделеев писал:
«Отсутствие твердого руководящего начала при этом становится
очевидным, сходство не предугадывается, а подыскивается».
Огромные затруднения в систематизации элементов создавало
также отсутствие у ученых того времени единства взглядов и
согласованных определений основных понятий в химии.
Путаница в представлениях и терминологии была так велика, что
для каждой научной статьи по химии нужен был «свой ключ».
В то же время состояние и развитие науки настоятельно
требовало решения этих вопросов.
Поворотным этапом в развитии химии явился первый
Международный съезд химиков, состоявшийся в немецком городе
Карлсруэ в сентябре 1860 г. Ясное представление о задачах этого
съезда дает выдержка из текста официального приглашения,
разосланного 10 июля 1860 г. организационным комитетом:
«Химия дошла до такой точки, что нижеподписавшимся кажется
целесообразным при помощи встречи возможно большого числа химиков, научно
работающих и преподающих, положить начало соглашению по отдельным
важным вопросам... и, в частности, облегчить согласование относительно
следующих главных вопросов: более точного определения понятий,
выражаемых словами — «атом», «молекула», «эквивалент», «атомность», «основность»;
исследования действительного эквивалента тел и их формул; начала более
однотипного обозначения и рациональной номенклатуры».
15
СТАНИСЛАО КАННИЦЦАРО
(1826—1910)
Съезд в Карлсруэ привлек большое чи'сло участников из
разных стран—127 человек. Русскую химическую науку
представляли: А. П. Бородин, Н. Н. Зинин, Т. Лесинский, Д. И.
Менделеев, Я. Ф. Натансон, В. Савич и Л. Н. Шишков.
Наиболее выдающимся событием на съезде было
выступление итальянского химика Канниццаро, убедительно показавшего
необходимость введения в химию представлений Авогадро,
подтвержденных и развитых Жераром, о молекулярном строении
вещества. Еще до съезда Канниццаро опубликовал брошюру
«Конспект курса химической философии» (1858 г.), в которой
придал гипотезе Авогадро (1811 г.) о равном числе молекул —
наимельчайших самостоятельно существующих частиц
вещества— в равных объемах газа значение закона, показал его
применимость для разрешения ряда основных вопросов химии и
предложил способы точного определения молекулярных и
атомных весов.
Взгляды Канниццаро получили признание и одобрение как
на съезде, так и по мере ознакомления широких кругов химиков
с его работами. Впоследствии Д. И. Менделеев говорил:
«•... решающим моментом в развитии моей мысли о периодическом законе
я считаю 1860 год — съезд химиков в Карлсруэ, в котором я участвовал, и
на этом съезде — идеи, высказанные итальянским химиком Канниццаро».
ОТ МЕЖДУНАРОДНОГО СЪЕЗДА
ДО ОТКРЫТИЯ Д. И. МЕНДЕЛЕЕВА
Принятые съездом химиков единые определения основных
понятий химии, установление разграничений между молекулами и
атомами способствовали распространению атомно-молекулярных
воззрений, что в дальнейшем привело к всеобщему признанию и
утверждению атомно-молекулярного учения. Постепенно
становятся более ясными различия между простыми и сложными ве-
16
ществами. Начинает использоваться понятие об атомности—■
свойстве атома данного элемента присоединять или замещать
определенное число атомов водорода, введенное в химию
английским химиком Э. Франкландом еще в 1852 г. * Исходя из
валентности элементов, можно было уточнять данные о составе
веществ и по их молекулярным весам (определяемым по методу
Канниццаро) находить точные значения атомных весов
элементов.
Все это, естественно, расширяло возможности
классификации элементов и приводило к появлению новых гипотез и таблиц,
более или менее спорных или уже приближающихся по форме
к первоначальным вариантам периодической системы
Д.И.Менделеева. Рассмотрим некоторые из предложенных теорий и
таблиц.
Таблица 2. Таблица химических элементов де Шанкуртуа
(Н20) Водород
(НО) Водород
О 2 и 6 8 10 12 П 18
Латай.
(Вео) Бериллий
Бор
Углерод
дзот
кислород
Фтор
(SiO;
Натрий
магний
Алюминий
) Кремний
Фоарор
Сера
Хлор
Калий
кальций
(SiOg) кремний
Углерод
Титан
Хром
Марганец
Железо
Никель
Кобальт
медь
Цинк
(2гг03) Циркон
Мышьяк
Ю 12 » 1В
Si
медь -'- -^ 82
(YO) иттрий I I I—Л I I Li-Jile/
О 2 4 6 810 12 П 16
Бром
Селен
Рубидий
Стронций
(ZrOj Циркон
(LaO) Лантан
(СеО) Церий
молибден
(ОЮ)Мидим
Таллий
Родий
Палладий
Серебро
Кадмий
Олово
(ThO) Торий
Уран
Сурьма
Иод
. Теллур
0 2 4 В 8 10 12 П 16
Равнозначный термин валентность был предложен в 1868 г. EU
хельгаузом.
ЮЛИУС ЛОТАР МЕЙЕР
(1830—1895)
Система элементов, предложенная де Шанкуртуа (1863 г.),
основывалась на выдвинутой им гипотезе, что каждому
целочисленному значению атомного веса отвечает особый элемент;
каждые 16 элементов составляют группу, при этом атомные веса
замыкающих элементов групп кратны 16 и соответственно равны
16, 32, 48, 64, 80, 96, 112 и 128. Система элементов де Шанкуртуа
изображена на цилиндре (табл. 2), развернутом в плоскость.
Параллельно основанию цилиндра проведены линии, отвечающие
значениям атомных весов от 0 до 128, а параллельно оси
цилиндра идут образующие линии, обозначенные от 0 до 16. На
поверхности цилиндра под углом в 45° проведена спиральная
линия, точки на которой отвечают определенным элементам.
Сходные по свойствам элементы, например, кислород, сера, селен и?
теллур, располагаются на одной образующей линии или рядом!
с ней. Однако находящиеся на этой же линии титан и медь к
данной группе никакого отношения не имеют. Вместе с углеродом
и кремнием в одну группу неудачно помещены кобальт, церий
и серебро, а в одну группу со щелочными металлами —
марганец и т. д.
Отмечая явный произвол расположения элементов в системе
де Шанкуртуа, Л. А. Чугаев все же нашел, что:
«... с?е Шанкуртуа сделал попытку построить систему, объединяющую ее»
элементы и устанавливающую закономерную связь между их атомными
весами... в этой системе заключается уже зародыш периодического закона».
В таблице элементов, опубликованной немецким химиком
Л. Мейером в книге «Новейшие теории в химии и их значения
для химической статики» (1864 г.), были использованы канниц-
царовские атомные веса с указанием разности атомных весов:
двух соседних элементов и впервые отмечена их атомность. В вер«
18
тикальных столбцах Мейер расположил элементы, которые он
считал аналогами. Ниже приведены данные Л. Мейера:
дтомность .
Элемент , .
Разность . .
Элемент . . .
разность . .
Элемент , . .
Разность. .
Элемент . . .
Разность. . .
Элемент . .
Разность . .
Элемент . .
Атомность .
Элемент . .
Разность. .
Элемент . .
Разность . .
Элемент . . .
Атомность .
Элемент . .
Разность . .
Элемент . .
Разность . ,
Элемент . •
4 3
С = 12,0 N = 14,02
16,5 16,98
Si=28.5 P=3t,00
44,55 44,00
- As = 75,00
44,55 45,6
Sn = 117,6 ■ Sb = 120.6
2-44,7 2-43,7
Pb=207,0 Bl=203,0
4
Mn=55,l Fe = 56,0 Ni
49,2 48,3
Rli = 104,3 Ph
2-46,4 2
Pt « 197,1 Ir =
4 6
Ti = 48,0 Mo - 92
42,0 45
Zr = 90.0 V = I37
47,6 47
. Ta = 137,6 W-184
г
0 = 16,00
16
S=32,00
46,8
Se = 78,8
49,5
Te = 128,3
—
—
4
■ 58,7 Co
15,6
= 104,3 Pd
46,4 5
197,1 Os
1
F = 19,00
16,46
CI =35,46
44,51
Br = 79,97
46,83
1 = 126,8
—
—
4
= 58.7
47,3
= 106,0
• 46,5
= 199,0
Zn
Cd
2
Hg
1
Li =7,03
16,02
Na =23,05
16,08
K = 39,13
46,3
Rb - 85,43
47,6
Cs = 133,03
(2-35,5)
(Tl=204?)
2
=65,0
46,9
-111,9
•44,15
=200,2
2
(Be=9,3?)
(14,7)
Mg = 24,0
16,0
Ca - 40,0
47,6
Sr=»87,6
49,5
Ba = 137,1
—
—
1
Cu = 63,5
44,4
Ag = 107,9
2-44,4
Au - 196,7
Разность в атомных весах двух соседних по вертикали
элементов-аналогов более или менее постоянна (исключение составляет
пара Tl—Cs). Марганец н железо занимают одно место (?).
Никель и кобальт, платину и осмий следовало бы поменять
местами, но оснований к этому у Л. Мейера в то время не было.
Места тантала и ванадия указаны неправильно: они должны
были бы находиться в столбце пятиатомных элементов, но такого
столбца нет. В таблице отсутствуют элементы: водород, бор,
алюминий и др. Периодичность изменения свойств элементов из
таблицы Л. Мейера не вытекает.
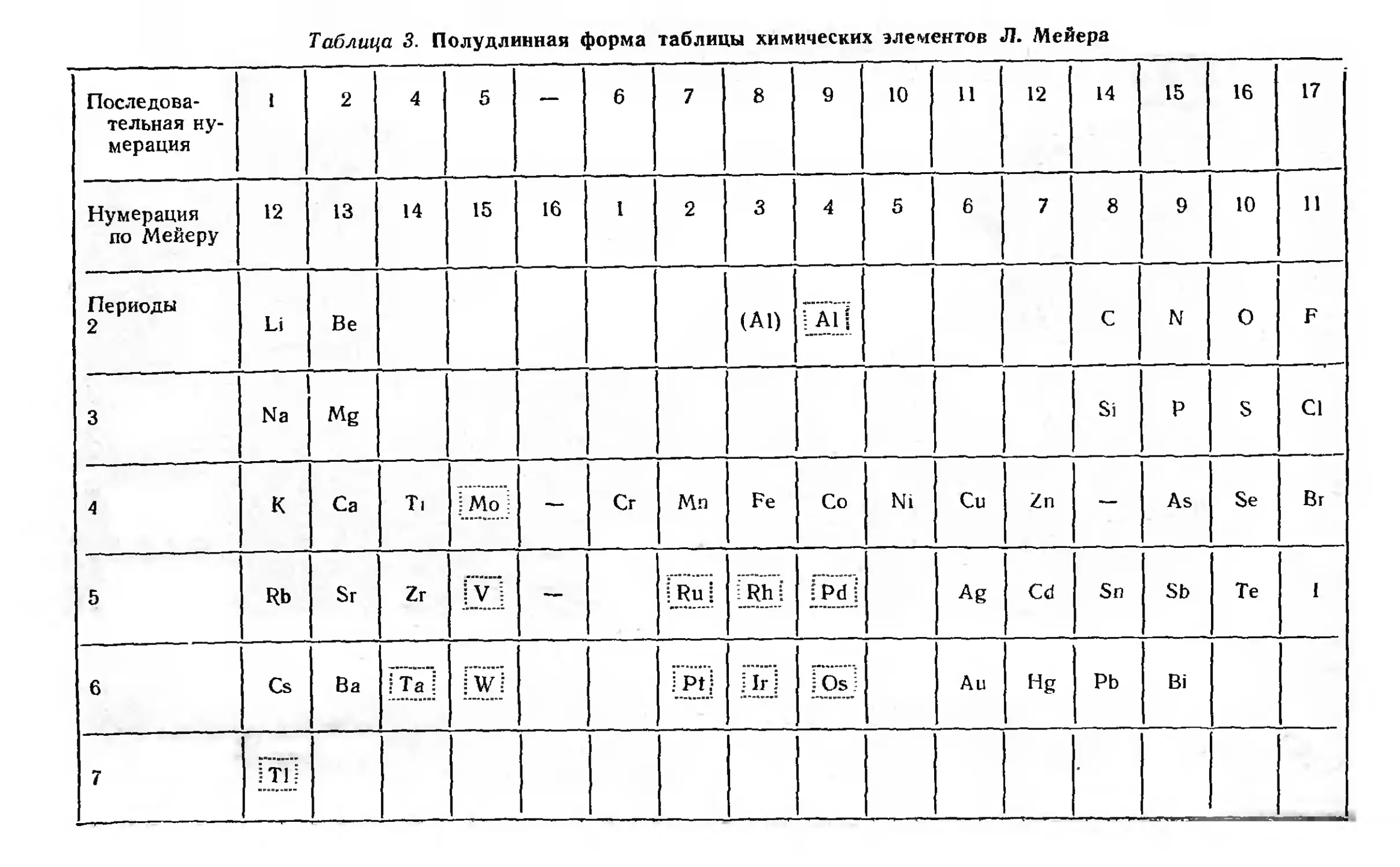
Спустя четыре года (1868 г.) Л. Мейер опубликовал
полудлинную форму таблицы (табл. 3), в которой впервые были
указаны периоды. Эта таблица должна состоять из 18 групп, но в
данной таблице Мейера пропущены группы 3-я, 13-я и 18-я, а
лишней оказалась 16-я группа, так как в ней нет ни одного
элемента. В таблицу не включены известные в то время элементы—
Н, В, In, Y, Nb, Th и U. Отсутствует первый период, в
котором по общему смыслу всех данных должен быть только один
элемент — водород, но, по-видимому, Мейер сомневался в
возможности комплектования периода одним элементом.
Неправильно размещены 12 элементов, заключенные нами в
пунктирные прямоугольники. Из приведенных замечаний видно, что
Таблица 3. Полудлинная форма таблицы химических элементов Л. Мейера
Последовательная
нумерация
Нумерация
по Мейеру
Периоды
2
3
4
5
6
7
1
12
Li
Na
К
Rb
Cs
Iff;
2
13
Be
Mg
Ca
Sr
Ba
4
14
Ti
Zr
|Та]
5
15
Mo
iv |
Iwl
—
16
—
—
6
1
Cr
7
2
Mn
!Ru[
j'ptj
8
3
(Al)
Fe
[Rhl
fir]
9
4
| A if
Co
I.Pd|
Os
10
5
Ni
11
6
Cu
Ag
Au
12
7
Zn
Cd
Hg
14
8
С
Si
—
Sn
Pb
15
9
N
P
As
Sb
Bi
16
10
0
s
Se
Те
17
11
F
CI
Br
1
таблица Л. Мейера не охватывала всех известных элементов и
была еще далека от правильного завершения их классификации.
Несколько новых вариантов таблицы элементов, в которых
элементы располагались в порядке возрастания их атомных
весов, были опубликованы Одлингом, начиная с 1864 г. В таблице,
относящейся к 1868 г. (табл. 4), изолированное место занимает
Таблица 4. Таблица химических элементов Одлинга (1868 г.)
Н 1
Li 7
G 9
В 11
С 12
N 14
О 16
F 19
Na 23
Mg 24
Al 27,5
Si 28
P 31
S 32
CI 35,5
К 39
Ca 40
Ti 48
Cr 52,5
Mn 55 и др.
Zn 65
As 75
Se 79,5
Br 80-
Rb 85
Sr 87,5
Zr 89,5
Mo 96
Pd 106,5
Ag 108
Cd 112
Sn 118
Sb 122
Те 129
I 127
Cs 133
Ba 137
V 138
W 184
Au 196,5
Pt 197
Hg 200
TI 203
Pb 207
Bi 210
Th 231
водород; в горизонтальных рядах сгруппированы химические
аналоги, пунктирными линиями отграничена центральная часть
таблицы. В таблице отсутствуют 9 элементов: Fe, Ni, Co, Cu, Ru,
Rh, Ir, Os, Та; элементы Li и Na отделены от других щелочных
металлов (К, Rb, Cs); неправильно расположен ванадий (V).
В таблице имеется ряд интересных сближений элементов по их
природе, например, Т1 помещен в одном ряду с В и Al, a Pb—
вместе с С и Si и др. К сожалению, автор не дал к таблице
какого-либо пояснительного текста.
Английскому ученому Ньюлендсу принадлежит
формулировка закона «октав», согласно которому свойства элементов
повторяются приблизительно через каждые семь элементов на-
восьмой, подобно повторению звуков в музыкальной октаве.
Перенумеровав элементы в порядке возрастания значений
атомных весов, он ввел в таблицу последовательные номера
элементов от водорода до тория (табл. 5).
Ввиду того что расположить 62 элемента по одному на 56
местах невозможно, Ньюлендс был вынужден в шести случаях
ставить на одно место по два элемента, что являлось существен-
21
Таблица 5. Октавы химических элементов Ныоленд,са (1865 г.)
м
Н 1
Li 2
G 3
Во 4
С 5
N 6
О 7
№
F 8
Na 9
Mg 10
Al 11
Si 12
P 13
S 14
№
CI 15
К 16
Ca 17
Cr 19
Ti 18
Mn 20
Fe 21
№
Co, Ni 22
Cu 23
Zn 25
Y 24
In 26
As 27
Se 28
№
Br 29
Rb 30
Sr 31
Ce, La 33
Zr 32
Di.Mo 34
Ro, Ru 35
№
Pd 36
Ag 37
Cd 38
U 40
Sn 39
Sb 41
Те 43
№
I 42
Cs 44
Ba, V45
Та 46
W 47
Nb 48
Au 49
№
Pt, Ir 50
Tl 53
Pb 54
Th 56
Hg 52
Bi 55
Os 51
ным недостатком его таблицы. Вторым недостатком таблицы
было отсутствие свободных мест между первым и пятьдесят
шестым элементами, что не допускало предположения о
возможности существования в природе каких-либо элементов, кроме
уже открытых. Нарушение последовательности номеров
элементов (19—18, 25—24, 33—32, 40—39, 43—42 и в последней
вертикальной колонке) также не получило объяснений. Закон октав
не был принят современниками, хотя в нем правильно
указывались периодические закономерности в изменении свойств
химических элементов с возрастанием их атомного веса. Известно,
что когда Ньюлендс выступал с докладом в Лондонском
химическом обществе, профессор Фостер иронически спросил его:
«Не пробовал ли он расположить в таблице элементы в алфавитном
порядке и не заметил ли при таком расположении каких-либо новых
закономерностей?»
К концу 60-х годов прошлого столетия насчитывалось около
50-ти попыток классификации элементов, но периодическая
система элементов все еще не была создана. К этому времени
кроме ранее упомянутых 56 элементов были открыты методом
спектрального анализа * 4 элемента:
цезий рубидий таллий индий
и получили подтверждение еще три элемента:
ниобий эрбий дидим (?) **
Итак, всего к 1869 г. стало известно 63 элемента, атомные
веса которых, благодаря успехам физической и аналитической
химии, можно было определить с достаточной точностью.
Предоставлялась возможность группировать элементы по сходным
* Открытие спектрального анализа явилось значительным событием
в науке. Изучение состава солнца и звезд показало, что химические элементы
земли являются элементами космоса; тем самым подтверждалось единство
материального мира.
** Впоследствии из дидима были выделены два элемента: празеодим
и неодим.
22
свойствам, пользуясь большим запасом практических сведений,,
которым уже располагала химия, а также и на основе
открытых закономерностей в изменении свойств элементов в
зависимости от возрастания значений атомных весов. Казалось, а
впоследствии и утверждалось в некоторых высказываниях, что для
установления правильной классификации требовалось сделать,
совсем немного. Тем не менее для построения системы
элементов, основанной на общей принципиальной
закономерности и охватывающей все элементы, требовалось нечто
значительно большее, чем нахождение более или менее удачного
варианта расположения элементов в таблицах самой
разнообразной формы.
ПЕРИОДИЧЕСКИЙ ЗАКОН
И СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Д. И. МЕНДЕЛЕЕВА
НА ПУТИ К ОТКРЫТИЮ
ПЕРИОДИЧЕСКОГО ЗАКОНА
Систематикой химических элементов Д. И. Менделеев стал
заниматься в самом начале своей научной деятельности. В 1855—
1856 г. он опубликовал две работы, посвященные исследованию
изоморфизма и удельных объемов. В первой работе *,
рассматривая кристаллическую форму веществ в связи с их составом и!
свойствами, Менделеев разбил 50 элементов на 11 сходных
групп, т. е. сделал попытку классификации элементов, хотя и
довольно далекой от будущей периодической системы. Во
второй работе (магистерская диссертация) он установил
разнотипную зависимость между удельными объемами и свойствами
элементов: близость удельных объемов элементов, мало
отличающихся по свойствам и величинам атомных весов (Fe, Co, Ni, Си;
Os, Ir, Pt), и возрастание их с увеличением атомного веса
элементов, сходных по свойствам (щелочные, щелочноземельные
металлы и др.). Изучение кристаллической формы веществ
в связи с учением об изоморфизме и принятие удельных
объемов в качестве количественных критериев сходства и различия
веществ представляют начальные этапы научного творчества
Д. И. Менделеева на пути к открытию периодического закона.
Касаясь истории открытия закона, он писал:
«... я пользовался прежними исследованиями Дюма, Глэдстона, Петтен-
кофера, Кремерса и Ленссена. ... считаю, что обязан преимущественно двум:
Ленссену и Дюма. Я изучил их исследования и они побудили меня искать
действительный закон».
«Писать начал, когда стал после Воскресенского читать неорганическую
химию и когда, перебрав все книги, не нашел, что следует рекомендовать
студентам... Тут много самостоятельного в мелочах, а главное периодичность
■элементов, найденная именно при обработке «Основ химии».
«Я вижу ныне ясно, что Штреккер, де Шанкуртуа и Ньюлендс стояли
впереди на дороге к периодическому закону и им недоставало только
решимости поставить дело на подобающую ему высоту, с которой видны рефлексы
закона на факты».
* «В Главном педагогическом институте требовалась при выходе
диссертация на свою тему — я избрал изоморфизм... Составление этой
диссертации вовлекло меня более всего в изучение химических отношений. Этим она
определила многое». (Архив Д. И. Менделеева, т. I, Изд-во ЛГУ, 1951,
стр. 43.)
24
Таким образом, изучение работ предшественников,
материалов международного съезда химиков в Карлсруэ и подготовка
к написанию учебника «Основы химии» явились решающими
моментами на пути Д. И. Менделеева к открытию периодического
закона. Изучая сведения, факты и явления, известные к тому
времени в химической науке, Менделеев на основе тщательного
и критического анализа не только дал соответствующую им
опенку, но систематизировал и обобщил их. В своем дневнике
он отмечал:
^Наука состоит в отыскании общего. В элементах есть общее... Но
признают чересчур многое индивидуальным... связать эти индивидуальности
общею идеею — цель моей естественной системы».
ОСНОВНОЙ ПРИНЦИП СИСТЕМАТИКИ ЭЛЕМЕНТОВ
И ПЕРВЫЙ ВАРИАНТ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Приступая к систематике элементов, Д. И. Менделеев принял
в качестве основного (точно измеримого и бесспорного) их
свойства— атомные веса. Он писал:
«•Л между тем всякий из нас понимает, что при всей перемене в
свойствах простых тел в свободном их состоянии нечто остается постоянным и-
при переходе элемента в соединение это нечто — материальное и составляет
характеристику соединений, заключающих данный элемент. В этом
отношении поныне известно только одно числовое данное, это именно атомный вес,
свойственный элементу... Вот по этой причине я и старался основать систему
на величине атомного веса».
Задача, которую Менделеев ставил перед собой,
заключалась в том, чтобы найти функциональную зависимость между
атомными весами элементов и их химическими свойствами,
проявляющимися в способности элементов к образованию
различных соединений, отвечающих по составу значениям атомности,
или валентности элементов.
Для осуществления решающей фазы познания
периодического закона Д. И. Менделееву предстояло изучить взаимосвязь
между всеми группами элементов, т. е. раскрыть диалектику
перехода от «особенного» (группа элементов) к «всеобщему»
(система элементов). В первую очередь следовало сопоставить
группы несходных элементов, резко отличающихся своими
химическими свойствами, а именно — группы щелочных металлов и
галогенов. Сопоставление этих групп в их «единстве
противоположностей» обеспечило Д. И. Менделееву успех в решении
проблемы естественной систематики элементов.
Группируя рядом с этими двумя группами несходных
элементов другие элементы в порядке закономерного
изменения их химических свойств, Менделеев приблизился к
осуществлению первой и центральной задачи — составлению системы
элементов.
«Днем рождения» системы Д. И. Менделеева считается
18 февраля 1869 г. В этот день Менделеев составил первый
вариант таблицы, названный им «Опыт системы элементов,
основанной на их атомном весе и химическом сходстве» и
разосланной ряду известных химиков*.
6 марта на заседании Русского химического общества было
заслушано сообщение ученого секретаря общества Н. А. Мен-
шуткина о предложенной Д. И. Менделеевым системе
классификации химических элементов.
ОПЫТЪ СИСТЕМЫ ЭЛЕМЕНТОВЪ,
ОСНОВАННОЙ НА ИХЪ АТОМНОМЪ ВЬСЬ И ХИМИЧВСКОМЪ СХОДСТВЕ
Ti=50 Zr = 90 ? - 180
V=5l Nb = 94 Та-182
Cr=52 Mo = 96 W=186
Mn = 55 № = 104* Pt-197,4
Fe = 56 Ru = 104,4 lr= 198
Nt = Co=59 Pi = 106,6 OS = 199
H-l Cu =63.4 Ag = 108 Hg =200
Be = 9,4 Mg=24 Zn = 65.2 Cd=ll2
В =11 Al = 27.4 ?=68 Ur = U6 AU=197?
С =12 Si = 28 ? = 70 Sn-118
N=14 P = 3l As = 75 Si>-122 Bi-2I0?
0=16 S=32 Se=79,4 Te = l28?
F=l9 CI =35.5 Br =80 3=127
Li-7Na = 23 К =39 Rb=85,4 CS = I33 T!=204
Ca = 40 Sr = 87.6 Ba=137 Pb = 207
?=45 Ce=92
?Er = 56 U=94
?Yt=60 Di=95
?In = 75.6 Th= 118?
В первом варианте таблицы 63 элемента расположены в
порядке возрастания их атомных весов (сверху вниз и слева
направо). Расположение элементов в системе отражает, как писал
Менделеев, «явственную периодичность свойств». Это был
принципиально новый и неожиданный вывод, так как химики,
занимавшиеся классификацией элементов до Менделеева, отмечали
лишь линейное изменение свойств элементов в сходственных
группах.
Принятый Д. И. Менделеевым принцип систематизации
элементов позволил ему предположить возможность открытия
четырех неизвестных элементов с атомными весами, равными 45,
68, 70 и 180 и указать их место в таблице. На такие
предсказания никто до него не решался. Тем не менее он назвал свою
таблицу, представленную на обсуждение, «опытом системы
элементов» и не считал ее окончательной и безупречной.
* Подробно это событие описано в книге Б. М. Кедрова «День одного
великого открытия». Это название малоудачное: речь идет о завершающем
дне открытия, над которым Д. И. Менделеев работал около 15 лет.
26
Действительно, в первом варианте таблицы Д. И.
Менделеева имеются явные отклонения от установленного
впоследствии расположения элементов: ртуть помещена в группу меди,
уран и золото — в группу алюминия, таллий — в группу
щелочных металлов, свинец —в группу щелочноземельных металлов,
марганец — в одну группу с родием и платиной, а кобальт и
никель занимают одно место. Менделеев высказывает сомнение в
правильности атомных весов тория, теллура и золота, ставя после
них знак вопроса; он считает также спорными положения в
таблице эрбия, иттрия и индия.
Большинство современников Д. И. Менделеева, особенно
в первые десять лет, отнеслись к его открытию периодичности и
системе элементов более чем сдержанно. В 1869 г. известный
русский химик Н. Н. Зинин в письме к Д. И. Менделееву
выразил сожаление в том, что он забросил успешные
экспериментальные исследования и предался «абстрактному
теоретизированию». Н. Н. Любавин — автор учебника по физической химии
(1877 г.), исходя из ряда противоречий и несообразностей в
первом варианте системы элементов, считал периодический закон
грубоприближенным.
По свидетельству Браунера, для его учителя — известного
химика Бунзена:
«•... Официально не существовал закон Менделеева. Когда я, работая в
то время у него в лаборатории над элементами редких земель, упомянул о
том, какими хорошими оказываются атомные веса этих элементов, предло-
окенные Менделеевым, он сказал: „Уйдите от меня с этими догадками. Такие
правильности найдете также между числами биржевого листка".»
ПЕРИОДИЧЕСКИЙ ЗАКОН ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
Продолжая упорно работать над разрешением спорных
вопросов, устранением противоречий и несоответствий в
расположении элементов, Д. И. Менделеев составляет еще четыре
наброска таблицы, являющихся как бы новыми эскизами «опыта
системы», приближающимися к естественной системе
элементов.
Основные свои мысли Д. И. Менделеев изложил в статьях
«Об атомном объеме простых тел» и «О количестве кислорода
в соляных окислах и об атомности элементов» и высказал их на
втором съезде русских естествоиспытателей в августе 1869 г.
Во-первых, ему удалось выявить двойные сходственные
отношения между элементами, первоначально расположенными в
различных группах. Например, подгруппа элементов Be, Mg, Ca,
Sr, Ba по свойствам сходна с подгруппой элементов Zn, Cd, Hg,
и, следовательно, эти две подгруппы должны составлять одну
группу, характеризующуюся максимальной валентностью
элементов, равной двум. Принципиально новым здесь было
комплектование одной группы элементов из двух подгрупп
(развитие мысли Гинрихса). Во-вторых, Д. И. Менделеев принял,
что удельные и атомные объемы простых веществ, образованных
из элементов, стоящих в одной группе, изменяются закономерно
с изменением атомных весов. Это позволило ему исправить
атомные веса для 11 элементов и изменить местоположение в
системе 20 (!) элементов.
Наконец, Менделеев отмечает, что все свойства того или
иного элемента закономерно связаны со свойствами четырех
соседних элементов, а именно: двух аналогов по валентности,
стоящих в одной группе, и двух соседей в горизонтальном ряду.
На основании этого он делает важное обобщение:
«Атомные веса, как и аналогии, определяются не по свойствам элементов,
а по свойствам и составу соединений».
Такими соединениями, состав которых наглядно выражает
закономерное изменение важнейшего свойства элементов —
валентности, Менделеев считает высшие окислы элементов:
R20, R202 (RO), R203, R204 (RO)2> R205, R206 (R03), R207
Из формул окислов следует, что валентность элементов по
кислороду изменяется от 1 до 7.
Сопоставляя высшие окислы элементов и их водородные
соединения, Менделеев приходит к заключению, что чем больше
атомов кислорода присоединяет атом данного элемента, тем
с меньшим числом атомов водорода он соединяется:
R20 RO R203 R02 R205 R03 R207
- - - RH4 RH3 RH2 RH
Повторяющиеся изменения типа высшего кислородного и
водородного соединения по рядам элементов в таблице служат
убедительным доказательством периодического изменения
свойств элементов.
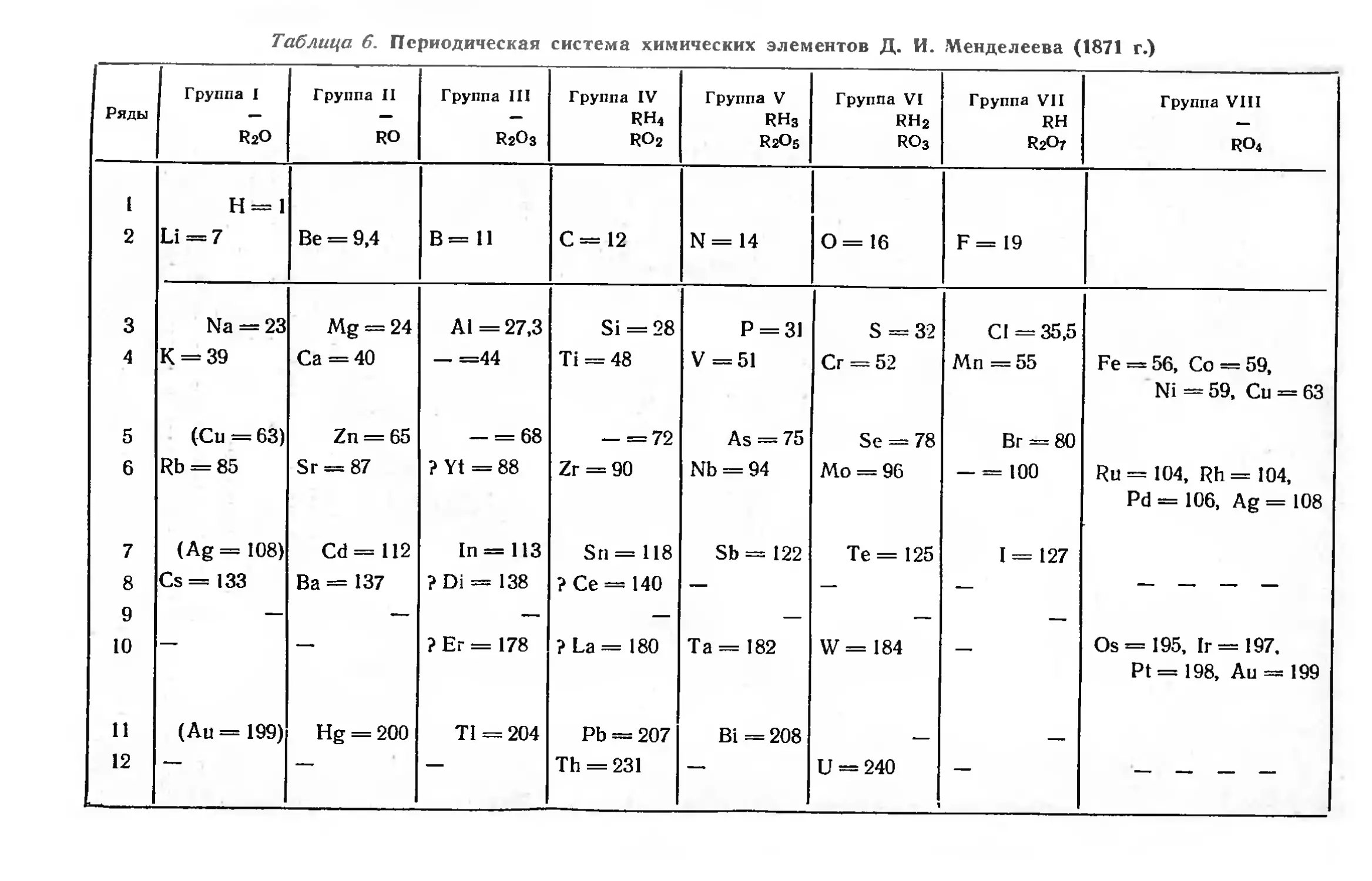
В 1871 г. Д. И. Менделеев в статье «Периодическая
законность химических элементов» опубликовал новый вариант
периодической системы (табл. 6), в которой нашли отражение
найденные им закономерности.
В этом варианте в систему введена восьмая группа
элементов, так как все известные элементы не могли быть размещены
в семи группах.
В той же статье Д. И. Менделеев приводит расширенную
формулировку периодического закона:
«Свойства элементов, а потому и свойства образуемых
ими простых и сложных тел, стоят в периодической
зависимости от их атомного веса».
28
Таблица. 6. Периодическая система химических элементов Д. И. Менделеева (1871 г.)
Ряды
1
2
3
4
5
6
7
8
9
10
11
12
Группа I
RjO
Н=1
Li = 7
Na = 23
К = 39
(Си = 63)
Rb = 85
(Ag=108)
Cs = 133
(Аи=199)
Группа И
RO
Be = 9,4
Mg = 24
Са = 40
Zn = 65
Sr = 87
Cd = 112
Ba = 137
Hg = 200
Группа III
R2O3
В=П
Al = 27,3
-=44
- = 68
? Yt = 88
In = 113
? Di = 138
?Er= 178
Tl = 204
Группа IV
RH4
R02
С =12
Si = 28
Ti = 48
— ==72
Zr = 90
Sn= 118
?Ce = 140
?La= 180
Pb = 207
Th = 231
Группа V
RH3
R2O5
N=14
P = 31
V=51
As = 75
Nb = 94
Sb= 122
Та = 182
Bi = 208
Группа VI
RH2
R03
0 = 16
S=32
Cr = 52
Se = 78
Mo = 96
Te= 125
W=184
U = 240
Группа VII
RH
R2O7
F= 19
CI =35,5
Mn=55
Br = 80
— = 100
1= 127
Группа VIII
R04
Fe = 56, Co = 59,
Ni — 59, Си = 63
Ru = 104, Rh= 104,
Pd — 106, Ag = 108
Os=195, Ir = 197,
Pt= 198, Au = 199
^v^
в
D — X
7^
н
ПЕРИОДИЧЕСКИЙ ЗАКОН Д. И. МЕНДЕЛЕЕВА
И «ОСНОВЫ ХИМИИ»
«„Основы химии" и периодический закон неотделимы
один от другого, и правильное понимание
периодического закона без „Основ химии" является совершенно
невозможным». *
Открытие Д. И. Менделеевым периодического закона совпало
повремени и неразрывно связано с его работой над книгой
«Основы химии», изданной (в двух томах) в 1869—1871 г. При жизни
Дмитрия Ивановича она издавалась,
восемь раз с его исправлениями, заме-
чаниями и большим количеством
дополнений (8-е издание вышло в-
1906 г.). В течение многих лет книга
«Основы химии» служила настольным,
руководством и пособием для русских
химиков; она была переведена на ряд.
иностранных языков, причем
троекратно издавалась в переводе на
английский (1891, 1897 и 1905 г.). За годы
Советской власти книга Д. И.
Менделеева издавалась с соответствующими!
дополнениями еще пять раз (5-е
советское издание в 1947 г.), она
интересна и в настоящее время.
Во втором томе первого издания
«Основ химии» изложены основные
идеи периодичности и помещена
естественная система элементов. Принципиально она мало
отличается от предыдущего варианта; в ней также введены
координаты «ряд» — «группа», а места пересечений линий ряда и
группы отвечают определенному элементу. Под символами
элементов помещены формулы наиболее типичных соединений, что
загромождало таблицу (в последующих вариантах формулы
были исключены).
Последним элементом в системе стал уран, для которого
Д. И. Менделеев, основываясь на периодическом законе,
изменил атомный вес со 116 на 240. В отношении урана он писал:
«Интерес дальнейшего изучения возрастает при изменении атомного веса
еще и потому, что его атом оказывается тяжелейшим из всех известных
элементов ...Убежденный в том, что исследование урана, начиная с его
природных источников, поведет еще ко многим новым открытиям, я смело
рекомендую тем, кто ищет предметов для новых исследований, особо тщательно
заниматься урановыми соединениями»...
За ураном Д. И. Менделеев поставил пять черточек,
отвечающих пяти еще неизвестным элементам с атомными весами
Рис. 1. Свойство любого
элемента X находится в
закономерной связи со
свойствами соседних элементов
по горизонтали (D, Е),
вертикали (В, F) и диагонали
(А, Н и СО).
* А. А. Банков, Труды Юбилейного Менделеевского съезда, т. I, Изд.
АН СССР, 1936, стр. 28.
30
'245—250, что было указанием на возможность открытия
трансурановых элементов, подтвердившимся впоследствии (после
1940 г. искусственно получено 12 элементов, стоящих за
ураном).
Исходя из того, что свойства любого элемента X находятся
в закономерной связи со свойствами соседних элементов (рис. 1)
по горизонтали (D, Е), вертикали (В, F) и диагоналям (А, Н и
C,G), Д. И. Менделеев использует эту «звездность», или ато-
маналогию*, для предсказания 11 еще неизвестных элементов:
экацезия, экабария, экабора, экаалюминия, экалантана, экаси-
лиция, ькатантала, экателлура, экамарганца, двимарганца и
экаиода **. В отношении трех из них — экабора, экаалюминия и
экасилиция (условные символы которых Eb, Еа, Es) —у
Менделеева была особенно твердая уверенность в возможности их
открытия.
В период между выходом в свет второго (1872 г.) и третьего
(1877 г.) изданий книги «Основы химии» предсказание
Д. И. Менделеева подтвердилось. Французский химик Лекок де
Таблица 7. Свойства галлия
Предсказан Менделеевым (1871 г.)
Зкаалюминий Еа
Атомный вес — около 68
Простое тело должно быть
низкоплавко
Плотность — близка к 5,9
Атомный объем— 11,5
Не должно окисляться в воздухе
Должно разлагать воду при красно-
калильном жаре
Формулы соединений: ЕаС13; Еа203,
Ea2(S04)3
Должно образовать квасцы Ea2(S04)3,
Me2S04 -24Н20, но труднее, чем A1
Окись Еа203 должна легко
восстанавливаться и давать металл,
более летучий, чем А1, а потому
можно ожидать, что Еа будет
открыт путем спектрального
анализа
ЕаС13— летуч
Открыт Лекоком де Буабодраном (1875 г.)
Галлий Ga
Атомный вес — 69,72
Точка плавления свободного галлия
30° С
Плотность — 5,904 (твердый), 6,095
(жидкий)
Атомный объем— 11,7
Слегка окисляется только при
красном калении
Разлагает воду при высокой
температуре
Формулы соединений: GaCl3, Ga203;
Ga2(S04)3
Образует квасцы NH4Ga(S04)2- 12H20
Ga восстанавливается из окиси
прокаливанием в токе водорода;
открыт при помощи спектрального
анализа
GaCl3, т. кип. 215—220° С
* Свойства элемента должны быть среднеарифметическими из свойств
окружающих его элементов.
** Приставка эка означает — еще один, а дви — второй.
31
ПОЛЬ ЭМИЛЬ
ЛЕКОК ДЕ БУАБОДРАН
(1838—1912)
Буабодран в 1875 г. открыл новый элемент — галлий, свойства
которого, установленные экспериментально, поразительно
совпали со свойствами предсказанного экаалюминия (табл. 7).
Первоначально де Буабодран определил плотность галлия —
4,7. Менделеев в письме к нему указал, что это значение
ошибочно и является результатом ра0оты с нечистым образцом,
а в действительности плотность галлия должна быть равной
5,9—6,0. При вторичном определении плотности очищенного от
примесей галлия была получена величина 5,904.
Работы Менделеева не были известны де Буабодрану и его
открытие не связано с периодическим законом. Тем не менее
он позднее писал:
«Я думаю нет необходимости настаивать на огромном значении
подтверждения теоретических выводов г. Менделеева относительно плотности но-
вого элемента».
Гениальность предвидения Д. И. Менделеева восторгает
К. А. Тимирязева:
«Менделеев объявляет всему миру, что где-то во вселенной... должен
найтись элемент, которого не видел еще человеческий глаз, и этот элемент
находится, и тот, кто его находит при помощи своих чувств, видит его на
первый раз хуже, чем видел его умственным взором Менделеев». *
Открытие галлия дало Д. И. Менделееву уверенность в
истинности периодического закона и в третьем издании «Основ
химии» он вводит новую главу — «Сходство элементов и их
система (изоморфизм), форма соединений, периодический закон,
удельные объемы». В другой главе приведены все известные
данные о свойствах галлия. Этот элемент впервые был введен
в вариант системы, названной «Периодическая система химиче-
* К. А. Тимирязев, «Научные задачи современного естествознания»,
Изд. 3-е, Москва, 1908, стр. 14.
32
ЛАРС ФРЕДЕРИК
НИЛЬСОН
(1840—1899)
ских элементов, основанная на их атомном весе и химическом
сходстве».
В конце 1879 г. шведский ученый Нильсон открыл
предсказанный Д. И. Менделеевым экабор и назвал новый элемент
скандием (табл. 8). Нильсон писал о совпадении предсказанных
и экспериментально найденных свойств нового элемента:
«... не остается никакого сомнения, что в скандии открыт экабор...; так
подтверждаются самым наглядным образом мысли русского химика,
позволившие не только предвидеть существование названного простого тела, но и
наперед дать его важнейшие свойства».
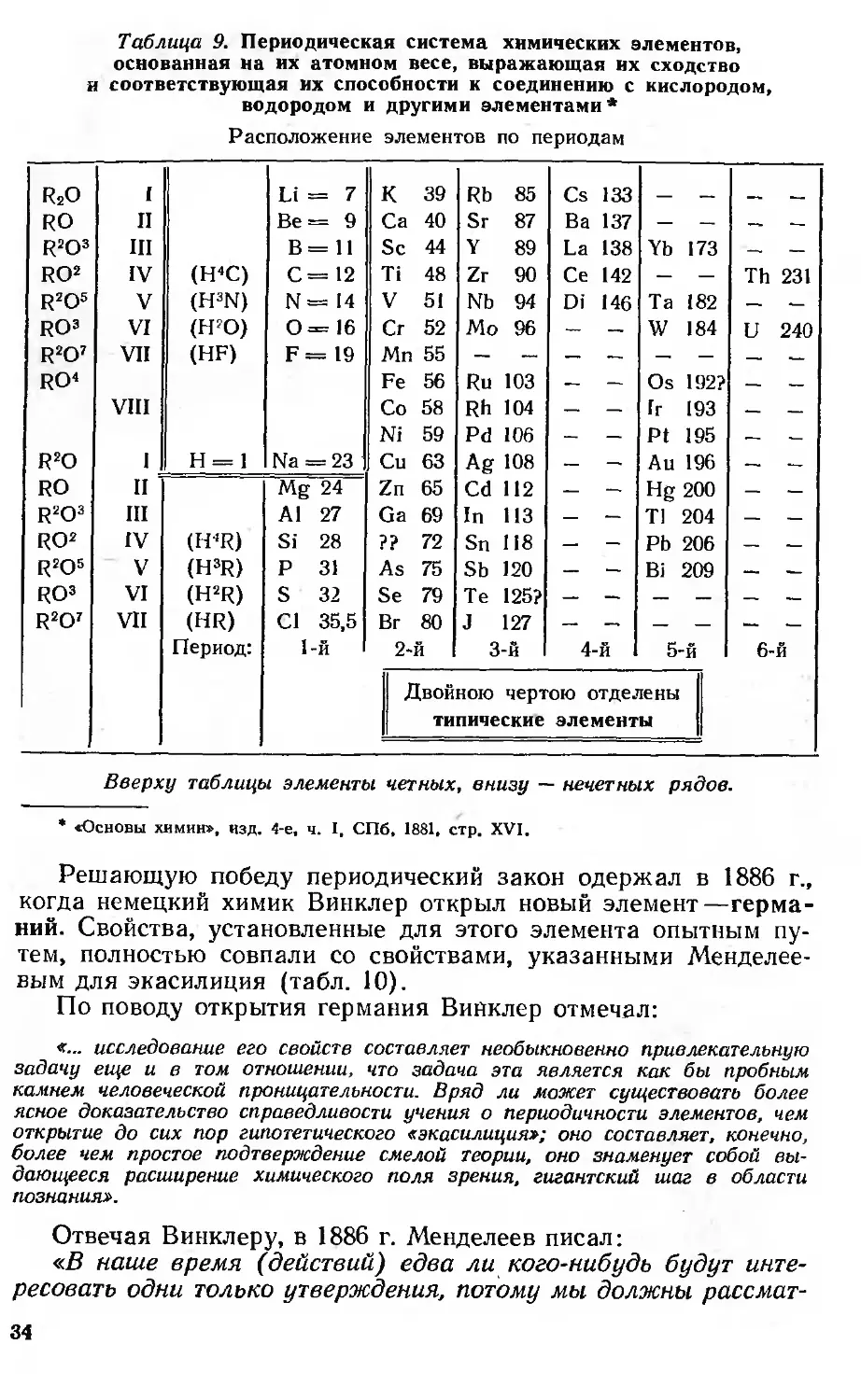
В четвертом издании «Основ химии» (1882 г.) новый элемент
включен в систему элементов и приведены данные о его
свойствах. Перед значением атомного веса 72 Менделеев, ожидая
открытия этого элемента, поставил знаки вопроса (табл. 9).
Таблица 8. Свойства скандия
Предсказан Менделеевым (1871 г.)
Открыт Нильсоном (1879 г.)
Экабор ЕЬ
Атомный вес — 44
Окись экабора ЕЬ203
Плотность окиси — 3,5
Гидрат ЕЬ(ОН)3 нерастворим в
щелочах
Сернокислая соль Eb2(S04)3 мало
растворима
Двойная сернокислая соль
Кз[ЕЬ(504)3] не будет изоморфна
с октаэдрами квасцов
Скандий Sc
Атомный вес — 45,1
Окись скандия Sc203
Плотность окиси — 3,864
Гидрат Sc(OH)3 нерастворим в
щелочах
Сернокислая соль Sc2(S04)3 • 6Н20
мало растворима
Двойная соль 3K2S04 • Sc2(S04)3.
кристаллизуется в призмах
2 Зак. 39.
33
Таблица 9. Периодическая система химических элементов,
основанная на их атомном весе, выражающая их сходство
и соответствующая их способности к соединению с кислородом,
водородом и другими элементами *
Расположение элементов по периодам
RsO
RO
R203
RO2
R205
RO3
R207
RO4
R20
RO
R203
RO2
R205
RO3
R207
1
I
II
III
IV
V
VI
VII
VIII
I
II
III
IV
V
VI
VII
(H4C)
(H3N)
(WO)
(HF)
H = l
(H<R)
(H3R)
(H2R)
(HR)
Период:
Li = 7
Be= 9
В = 11
C=12
N= 14
0=16
F= 19
Na=23
Mg 24
Al 27
Si 28
P 31
S 32
Gl 35,5
1-й
К 39
Ca 40
Sc 44
Ti 48
V 51
Cr 52
Mn 55
Fe 56
Co 58
Ni 59
Cu 63
Zn 65
Ga 69
?? 72
As 75
Se 79
Br 80
2-й
Rb 85
Sr 87
Y 89
Zr 90
Nb 94
Mo 96
Ru 103
Rh 104
Pd 106
Ag 108
Cd 112
In 113
Sn 118
Sb 120
Те 125?
J 127
3-й
Двойною черт
типические
Cs 133
Ba 137
La 138
Ce 142
Di 146
_ _
— —
— —
— —
— —
- -
— —
_ _
4-й
- -
Yb 173
- -
Та 182
W 184
Os 192?
Гг 193
Pt 195
Au 196
Hg200
Tl 204
Pb 206
Bi 209
5-й
ою отделены
элементы
_ _
— —
_ _
Th 231
— —
U 240
— —
— —
— —
— —
— —
— —
_ _
6-й
1
Вверху таблицы элементы четных, внизу — нечетных рядов.
* «Основы химии», изд. 4-е, ч. I, СПб, 1881, стр. XVI.
Решающую победу периодический закон одержал в 1886 г.,
когда немецкий химик Винклер открыл новый
элемент—германий. Свойства, установленные для этого элемента опытным
путем, полностью совпали со свойствами, указанными
Менделеевым для экасилиция (табл. 10).
По поводу открытия германия Винклер отмечал:
«•... исследование его свойств составляет необыкновенно привлекательную
задачу еще и в том отношении, что задача эта является как бы пробным
камнем человеческой проницательности. Вряд ли может существовать более
ясное доказательство справедливости учения о периодичности элементов, чем
открытие до сих пор гипотетического «экасилиция»; оно составляет, конечно,
более чем простое подтверждение смелой теории, оно знаменует собой
выдающееся расширение химического поля зрения, гигантский шаг в области
познания».
Отвечая Винклеру, в 1886 г. Менделеев писал:
«5 наше время (действий) едва ли кого-нибудь будут
интересовать одни только утверждения, потому мы должны рассмат-
34
-" , •
КЛЕМЕНС ВИНКЛЕР
(1833—1904)
Таблица 10. Свойства германия
Предсказан Менделеевым (1871)
Экасилиций Es
атомный вес — 72
плотность — 5,5
атомный объем —
Высшая окись — Es02
плотность — 4,7
удельная теплота
Хлористое соединение
жидкое
т. кип. около 90° С
плотность — 1,9
Металлоорганическое
Es (C2H5)4
т. кип. 160° С
плотность — 0,96
13
- 0,073
— EsCl4,
соединение
Открыт Винклером (1886 г.)
Германий Qe
атомный вес — 72,60
плотность ■— 5,35
атомный объем — 13,4
Высшая окись — Ge02
плотность — 4,703
удельная теплота — 0,076
Хлористое соединение — GeCl4,
жидкое
т. кип. 85° С (86,5° С)
плотность — 1,887
Металлоорганическое соединение
Ge (C2H5)4
т. кип. 163,5° С
плотность — 0,991
ривать как делающие эпоху утверждения, получившие свое
реальное осуществление». (Подчеркнуто нами — В. С.)
В пятом издании книги «Основы химии» (1889 г.) германий
был включен в систему элементов на заранее предназначенное
ему место и описаны его свойства.
После открытия германия периодический закон Д. И.
Менделеева получил всемирное признание, а периодическая система
стала необходимым пособием при изучении курса химии.
Однако дальнейшее развитие химии, открытие новых элементов и
изучение их свойств вызывали необходимость в дополнениях и
изменениях периодической системы, определении в ней места
новых элементов и разрешения возникавших спорных вопросов,
2*
35
что не проходило без сомнений и затруднений. Примером этому
служит открытие инертных газов.
В 1894 г. английские ученые Рэлей и Рамзай обнаружили,
что при нормальных условиях литр азота, выделенного из
воздуха (после удаления из него паров воды, двуокиси углерода и
кислорода), весит 1,2572 г, а литр азота, полученного
разложением азотсодержащих веществ, .весит меньше—1,2505 г. Эта
разница не могла быть объяснена ошибкой опыта, в связи
с чем было сделано предположение, что в азоте, полученном из
воздуха, содержится неизвестный более тяжелый газ. Пропуская
азот через накаленный магний (при этом получается нитрид
магния), ученые химически связали азот и изолировали
неизвестный газ. Было установлено, что молекула этого газа
одноатомна, атомный вес равен 40 и атомы газа не соединяются
между собой и с атомами других элементов. Газ оказался
химически недеятельным, а потому был назван аргоном («ленивый»)
и обозначен символом А (впоследствии Аг).
В первое время Д. И. Менделеев не считал аргон
элементом * и принимал его за полимеризованный азот N3 с атомным
весом в 1,5 раза большим, чем у N2, подобно озону 03,
являющемуся аллотропическим видоизменением кислорода Ог, но в
дополнении к V главе шестого издания (1896 г.) «Основ химий»
он все же дал описание нового элемента — аргона.
Дальнейшие исследования Рамзая подтвердили
элементарную природу аргона, и на основании периодической системы он
высказал мысль о существовании группы таких элементов:
«По образцу нашего учителя Менделеева, я описал, поскольку возможно
было, ожидаемые свойства и предполагаемые отношения».
* Клетка, отвечающая атомному весу 40 в периодической системе, была
занята кальцием.
36
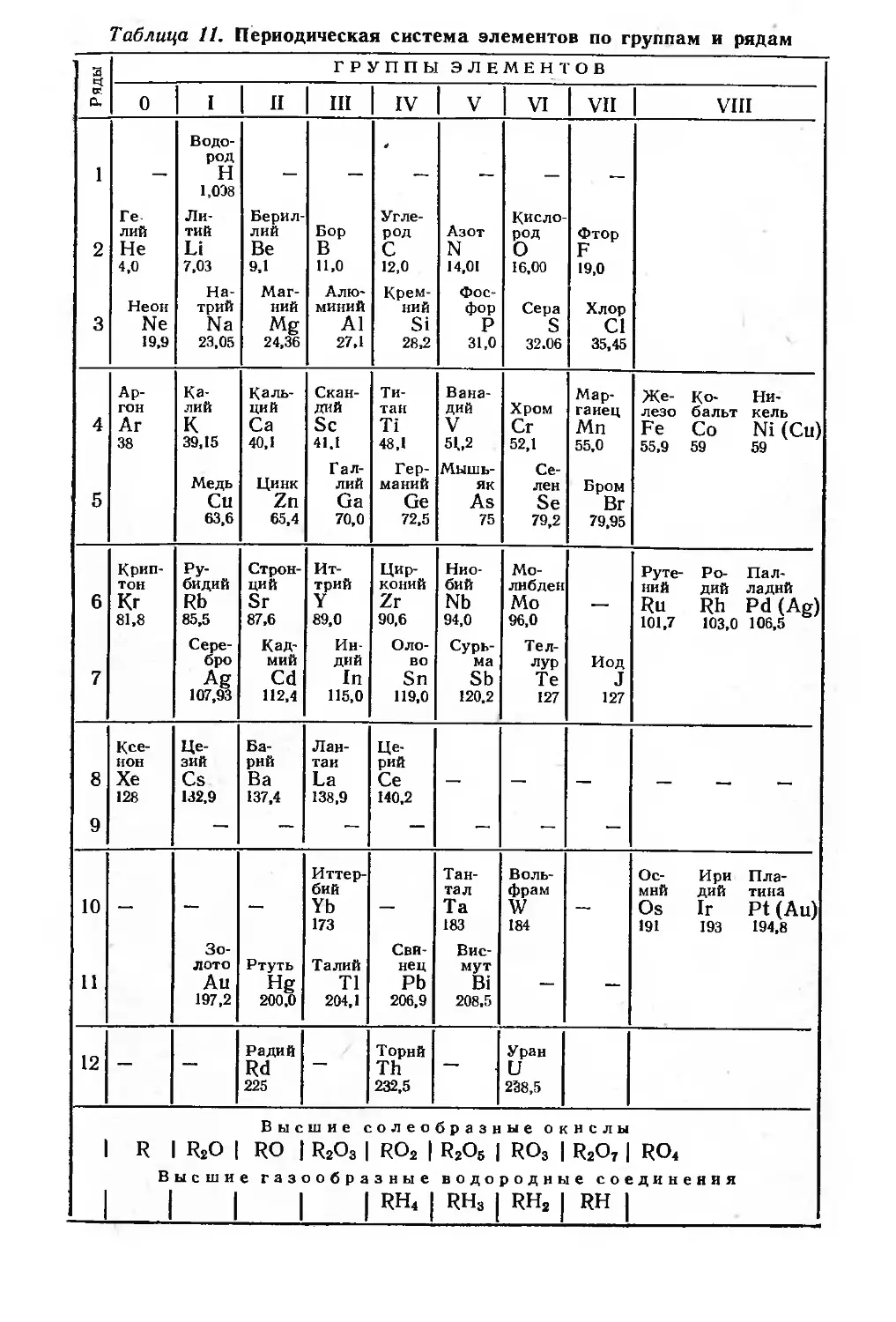
Таблица 11. Периодическая система элементов по группам и рядам
Ряды
1
2
3
4
5
6
7
8
9
10
11
12
ГРУППЫ ЭЛЕМЕНТОВ
0
Ге
ЛИЙ
Не
4,0
Неон
Ne
19,9
Аргон
Аг
38
Криптон
Кг
81,8
Ксенон
Хе
128
-
-
I
Водород
н
1.0Э8
Литий
Li
7,03
Натрий
Na
23,05
Калий
К
39,15
Медь
Си
63,6
Рубидий
Rb
85,5
Серебро
Ag
107,93
Цезий
Cs
132,9
Золото
Au
197,2
-
Бериллий
Be
9,1
Магний
Mg
24,36
Кальций
Са
40,1
Цинк
Zn
65,4
Стронций
Sr
87,6
Кадмий
Cd
112,4
Барий
Ва
137,4
Ртуть
Hg
200,0
Радий
Rd
225
III
Бор
В
11,0
Алюминий
А1
27,1
Скандий
Sc
41,1
Галлий
Ga
70,0
Иттрий
Y
89,0
Индий
In
115,0
Лантан
La
138,9
Иттербий
Yb
173
Талий
Т1
204,1
IV
Углерод
С
12,0
Кремний
Si
28,2
Титан
Ti
48,1
Германий
Ge
72,5
Цирконий
Zr
90,6
Олово
Sn
119,0
Церий
Се
140,2
Свинец
РЬ
206,9
Торий
Th
232,5
V
Азот
N
14,01
Фосфор
р
31,0
Ванадий
V
51,2 .
Мышьяк
As
75
Ниобий
Nb
94,0
Сурьма
Sb
120,2
-
Тантал
Та
183
Висмут
Bi
208,5
-
VI
Кислород
о
16,00
Сера
S
32,06
Хром
Сг
52,1
Селен
Se
79,2
Молибден
Мо
96,0
Теллур
Те
127
-
Вольфрам
W
184
Уран
и
238,5
VII
Фтор
F
19,0
Хлор
С1
35,45
Марганец
Мп
55,0
Бром
Вг
79,95
Иод
J
127
-
\
VIII
! '■ ■
Же- Ко- Ни-
лезо бальт кель
Fe Co Ni(Си)
55,9 59 59
Руте- Ро- Пал-
ний дий ладий
Ru Rh Pd(Ag)
101,7 103,0 106,5
- - -
Ос- Ири Пла-
мий дий тина
Os Ir Pt (Au)
191 193 194,8
Высшие солеобразные окислы
1 R | R20 | RO J R203 | R02 | R206 | R03 | R207 | R04
Высшие газо об разные водородные соединения
| | RH4 | RH3 | RH2 | RH |
Пользуясь менделеевским методом, Ю. Томсен предсказывает
атомные веса предполагаемых элементов.
Вскоре Рамзай и Траверс открыли еще четыре инертных
газа: гелий, неон, криптон и ксенон. Эррера предложил ввести для
этих элементов нулевую группу в системе, другие же считали
возможным включение их в VIII группу (как принято это и
в настоящее время).
Открытие инертных газов явилось неожиданным событием
(если не считать предвидения Н. А. Морозова, см. стр. 51) и
их место в периодической системе Менделеевым не было
предусмотрено. Тем не менее он пришел к следующему выводу:
«...Я более, чем прежде, стал склоняться к тому, что аргон и его аналоги,
суть элементарные вещества с особой совокупностью свойств, стоящие отнюдь
не в VIII группе (как думают некоторые), а образующие особую (нулевую)
группу».
В седьмом издании «Основ химии» инертные газы в
периодической системе помещены в нулевую группу. Эта группа в
одном варианте (с вертикальными периодами) поставлена после
группы галогенов, а в другом (с горизонтальными периодами) —
перед щелочными металлами (табл. 11). В систему включен
также радий, открытый М. Кюри-Склодовской и П. Кюри в 1898 г.
Всего в системе 71 элемент. Так как аргон стоит в системе до
калия, атомный вес которого 39,15, Менделеев принимает
атомный вес для аргона равным 38, хотя опытные данные
приводили к значению 39,9.
Этот вариант системы без изменений был воспроизведен и
в восьмом, последнем издании «Основ химии» (1906 г.),
вышедшем при жизни Д. И. Менделеева, в которое он включил ряд
примечаний: «Об аргоновых элементах», «Как найден был
периодический закон», «О первичной материи», «Об атомных
весах никеля и кобальта, теллура и иода и о редкоземельных эле-
38
ПЬЕР КЮРИ
(1859—1906)
ментах», «О формах изображения периодического закона»,
«Законы природы не терпят исключений», «Периодичность
принадлежит элементам, а не соединениям». Все эти вопросы имели
немаловажное значение для проблемы периодического закона.
Объективная оценка истории открытия периодического
закона дана самим Менделеевым:
«Таким образом, периодическая законность прямо вытекала из запаса
сближений и проверенных сведений, существовавших к концу 60-х годов, она
есть свод их в одно более или менее систематическое, цельное выражение...»
Важнейшими событиями в развитии и утверждении
периодического закона Д. И. Менделеев считал открытие галлия,
скандия, германия и инертных газов:
«Писавши в 1871 г. статью о приложении периодического закона к
определению свойств еще не открытых элементов, я не думал, что доживу до
оправдания этого следствия периодического закона, но действительность
ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и эка-
силиций, и не прошло 20 лет, как я имел уже величайшую радость видеть все
три открытыми и получившими имена от тех стран, где найдены редкие
минералы, их содержащие, и где сделано их открытие: галлия, скандия и
германия. Л. де Буабодрана, Нильсона и Винклера, их открывших, я, со своей
стороны, считаю истинными укрепителями периодического закона. Без них он
не был бы признан в такой мере, как это случилось ныне. В такой же мере
я считаю Рамзая утвердителем справедливости периодического закона, так
как он открыл Не, Ne, Ar, Kr и Хе, определил их атомные веса, и эти числа
вполне подходят к требованиям периодической системы элементов». («Основы
химии», изд. 13, т. II, 389—390).
К «укрепителям» периодического закона Менделеев относит
также чешского ученого Браунера, экспериментальные работы
которого были связаны с периодической системой, с разработкой
методов определения атомных весов и изучения свойств
редкоземельных элементов. Д. И. Менделеев упоминает и о работах
Л. В. Писаржевского в области изучения строения и свойств пе-
39
рекисей и надкислот, имевших немаловажное значение для
периодического закона.
«Основы химии» Д. И. Менделеева — это не только учебник,
излагающий в логической и исторической последовательности
процесс развития химии как науки, но и замечательный
основополагающий труд, вносящий в эту науку принципиально новое
содержание, систему и средство познания всего накопленного
ею материала.
О ПРИОРИТЕТЕ В ОТКРЫТИИ
ПЕРИОДИЧЕСКОГО ЗАКОНА
Подтверждение и всеобщее признание периодического закона
вызвали в некоторых странах попытки оспаривать приоритет
Д. И. Менделеева в этом открытии. Во Франции открытие
закона периодичности приписывали де Шанкуртуа, в Англии — Од-
лингу и Ньюлендсу, в Германии — Л. Мейеру. О своих
претензиях заявляли также Бломстранд и Баумгауер.
В связи с этим Менделеев в двух своих статьях показал
необоснованность такого рода претензий и привел убедительные
доказательства того, что приоритет открытия периодического
закона принадлежит русской химической науке. Возникшие споры,
продолжавшиеся в течение многих лет (отзвуки которых
слышатся иногда и в настоящее время), закончились тем, что
большинство ученых во всех странах признало правоту и приоритет
Д. И. Менделеева. Даже наиболее настойчивый претендент
Л. Мейер в конце концов вынужден был признать:
«В 1869 году, раньше, чем я высказал свои мысли о периодичности
свойств элементов, появился реферат статьи Менделеева, в которой
написано: 1) при расположении элементов в порядке восходящих атомных весов
наблюдается ступенчатое (в оригинале Менделеева — периодическое — В. С.)
изменение свойств элементов; 2) величина атомных весов определяет свойства
элементов; 3) атомные веса некоторых элементов требуют исправления;
4) должны существовать некоторые еще неоткрытые элементы..: Это все
было Менделеевым опубликовано до меня и вообще впервые. Я открыто
сознаюсь, что у меня не хватило смелости для таких дальновидных
предположений, какие с уверенностью высказал Менделеев».
Известные ученые П. Вальден и Аббег заслугу открытия
периодического закона признавали только за Менделеевым.
Выдающийся русский химик Н. Н. Бекетов в речи на I
Менделеевском съезде (1909 г.) о значении работ и открытия Менделеева
сказал:
«Это предсказание некоторые ученые сравнивают с открытием Леверрье...»
открытие Леверрье есть не только его слава, но, главным образом, слава
совершенства самой астрономии, ее основных законов и совершенства тех
математических приемов, которые присущи астрономам. Но здесь, в химии, не
существовало того закона, который позволял бы предсказывать существование
того или другого вещества... Этот закон был открыт и блестяще разработан,
самим Д. И. Менделеевым».
40
Л. А. Чугаев писал:
«Система элементов имеет не только педагогическое значение, является не
■одним только средством, облегчающим запоминание разнообразных,
систематически расположенных и связанных между собой фактов, но имеет также
и научное значение, ибо открывает новые аналогии и тем самым намечает
пути для познания элементов».
Английский ученый Торп говорил:
«Ни один русский не оказал более важного, более длительного влияния
на развитие физических знаний, чем Менделеев.. Способ работы и мышление
у него настолько самобытны, его Метод преподавания и чтения лекций так
оригинален, а успех великого обобщения, с которым связано его имя и слава,
так поразительно полон, что в глазах ученого мира Европы и Америки он
стал для России тем же, чем был Берцелиус для Швеции, Либих для
Германии, Дюма для Франции».
Подобных высказываний можно было бы привести очень
много, но в этом нет надобности. Честь открытия
периодического закона, называемого именем Менделеева, принадлежит
Дмитрию Ивановичу Менделееву и это нашло признание во всем
мире. Исчерпывающую оценку периодического закона дал Па-
нет на заседании немецкого научного общества в 1930 г.:
«Самым крупным завоеванием естествознания в XIX веке
надо считать открытие периодического закона».
ВАРИАНТЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Периодическая система химических элементов открыла новые
возможности для научного поиска в области химии.
Вместе с тем возник и ряд затруднений в вопросах
размещения в таблице новых элементов.
С 1869 по 1907 г. были открыты следующие элементы:
галлий, скандий, германий, гелий, неон, аргон, криптон, ксенон, радий,
полоний, радон, актиний, иттербий, неодим, празеодим, самарий, тулий, европий,
гольмий, гадолиний, диспрозий, тербий, лютеций.
Общее число известных элементов достигло 85, что
значительно расширило периодическую систему. К этому времени
форма таблицы, предложенная Д. И. Менделеевым, не
полностью удовлетворяла химиков. Так, сведенные в таблицу данные
об элементах были недостаточны для определения числа
редкоземельных элементов и их мест в системе; нельзя было пои
помощи таблицы определить и общее количество элементов,
расположенных между самым легким из них — водородом и самым
тяжелым — ураном. Аномалии в расположении трех пар
элементов, в которых более легкий элемент помещается после более
тяжелого (Аг = 39,9 и К = 39,15; Со = 58,94 и № = 58,69;
Те = 127,6 и I = 126,9) не находили объяснений. Кроме того,
возникали и другие вопросы, связанные не только с
расположением элементов в таблице, но и их свойствами. Непонятны были
41
причины того, что не всегда соблюдается максимальная
валентность элементов, отвечающая номеру группы. Вызывали
недоумение отсутствие какой-либо закономерности в изменениях
разности атомных весов двух соседних элементов, расположенных
как в одном ряду, так и в параллельных группах, а также
дробные значения атомных весов для большинства элементов.
Большой интерес представлял вопрос, возможно ли существование
элемента с атомным весом и свойствами, позволяющими
поместить его между водородом и гелием. Некоторые химики, в том
числе и Д. И. Менделеев, допускали возможность открытия
галогена с атомным весом, равным трем.
Можно указать и еще на ряд вопросов, например, почему
у элементов-аналогов большинство свойств среднего элемента
не совпадает со среднеарифметическими значениями свойста
крайних элементов (подгруппа Си — Ag—Аи); почему не
сходные по своей природе элементы помещены в одной и той же
группе (калий и медь, марганец и хлор) и т. д.
В связи с этим многие ученые, принимая за основу те же
закономерности, что и Менделеев, пытались отыскать такой
вариант системы, который в большей мере удовлетворял бы
требованиям науки.
Периодическая система может быть представлена как в
аналитической, так и в графической формах, отражающих
взаимозависимость атомных весов элементов и их свойств.
Графические формы весьма разнообразны: это таблицы на
плоскости, на поверхности сложных геометрических фигур или
их проекций. Они имеют вид концентрических колец, спиралей
самых разнообразных конфигураций, пространственных клеток
и т. п. Каждый из этих видов может иметь короткую,
полудлинную и длиннопериодную форму.
Д. И. Менделеев отрицательно относился к геометрическим
построениям периодической системы:
«Геометрически можно выразить сказанное таким образом: всякое
изложение представляет линию, а система требует телесной формы, допускающей
сближения по всем направлениям».
Спустя 20 лет после открытия закона свое отношение
к этому вопросу он резюмировал, говоря, что периодический
закон
«...следует выражать не геометрическими линиями, всегда
подразумевающими сплошность, а вроде того, как поступают в теории чисел — прерывно.
По этим соображениям, я никогда не выражал и выражать не буду
периодических отношений никакими геометрическими фигурами».
Действительно, ни одна из предложенных новых
геометрических форм построения таблицы элементов не нашла сколь-
нибудь широкого применения.
В качестве примера приведем спиральную таблицу
химических элементов Баумгауера (1870 г.), в которую нами введена
42
нумерация радиальных линий, число которых ничем не
обосновано (табл. 12).
Таблица 12. Периодическая система химических элементов
Баумгауера (спиральная форма)
Искусственность построения этой таблицы очевидна: число
элементов на радиальных линиях колеблется от одного (линия 18)
до шести (линия 6); 29 мест пересечения радиальных линий со
спиралью не заняты элементами, некоторые элементы оторваны
от своих аналогов (например, N, О, F, Ne), а элементы Gd, Tb,
Er, Tm, Yb и другие ничего общего не имеют с элементами,
находящимися на данных радиальных линиях; невозможно
определить, где начало и конец периодов и число элементов в них;
нет доказательств расположения того или иного элемента между
двумя другими.
Из клеточных вариантов ограничимся рассмотрением таблиц
химических элементов Браунера (короткая форма, табл. 13),
Уокера (полудлинная форма, табл. 14) и Вернера (длиннопери-
одная форма, табл. 15).
43
Таблица 13. Таблица химических элементов Браунера
Ряд
1
2
3
4
5
6
7
8
Группы
0
R
Не 4
20 Ne
А 40
Кг 82
Хе 128
I
R20
1 Н
Li 7
23 Na
К 39
63 Си
Rb 85
108 Ag
Cs 133
II
III
1
RO
Be 9
24 Mg
Ca 40
65 Zn
Sr 87
112 Cd
R203
IV | V
RH4
R02
В 11
27 Al
Sc 44
70 Ga
Y 89
114 In
Ba 137 JLa 139
9
10
197 Au | 200 Hg
— 218 — 220 Rd 225?
204 Tl
- 230
С 12
28 Si
Ti 48
72 Ge
Zr 90
119 Sn
Ce 140
-147
-155
Tb 163
Tm 171
-178
RH3
R205
N 14
31 P
V 51
75 As
Nb 94
120 Sb
Pr 142
Sm 148
Gd 156-
Ho 165
Yb 173—
Та 182
207 Pb | 209 Bi
Th 223 — 235
VI
RH2
R03
О 16
32 S
Cr 52
79 Se
Mo 96
128 Те
Nd 144-145
Eu 151-152
159-160
Er 166-167
176
W 184
212 —
U 239
VII
RH
R207
F 19
35,5 CI
Mn 55
80 Br
- 100
127 J
VIII
R04
Fe 56 Co 59 Ni 59 Си 63
Ru 102 Rh 103 Pd 106 Ag 108
- 190
Os 191 Ir 193 Pt 195 Au 197
214
От периодической системы элементов Д. И. Менделеева
таблица Браунера отличается тем, что редкоземельные элементы
внесены в нее в виде «интерпериодической» группировки в 8-м
Таблица 14. Периодическая система химических элементов Уокера
3
X
0)
ь
и
и
>х
о
X
о
в
9
X
Я
О
S
о.
ф
с
Л
с
с
>.
а.
(_
1
и
111
rv
V
VI
VII
VIII
I
11
III
IV
V
VI
VII
VIII
н
-
"
-
-
—
-
-
-
—
_
[Ч_
ч
ч.
— N.
N
—
—
1 —
| (н)
Не
Li
Be
-
-
—
—
-
—
—
—
\
\
"V
в
с
N
О
F
Ne
Na К
Mg Ca
(Al) Sc
Ti
V
Cr
Mn
Fe
Co
- Ni
Cu
Zn
ч Al Ga
V
4.
Si s Ge
V
P As
S Se
CI Br
Ar Kr
Rb
Sr
Y
Zr
Nb
Mo
-
Ru
Rh
Pd
4
Cd
In
Sn
ч
\ Sb
N ,
Те
J
X
Cs
Ba
Редкие
земли
Hf
Ta
W
-
Os
Ir
Pt
Au
"U
Tl
Pb
Bi
ч
\
\
Em
Ra
Th
-
U
-
-
—
—
-
-
-
—
—
ч
\
\
ряду, начинающейся Се-140 и заканчивающейся неизвестным
элементом с атомным весом 176. Всего в этой группировке 19 мест
(позже было выяснено, что пять элементов с атомными весами
45
Таблица 15. Таблица химических
-
н
1,003
Li
7,03
Na
23,05
К
39,15
Rb
84,5
Cs
133
Са
40,1
Sr
87,6
Ва
137,4
Ra
225
La
138
La a
?
Ce
140
Th
232,5
Nd
143,6
-
Pr
140,5
-
-
-
-
-
Sa
150,3
-
Eu
151,79
U
239,5
Gd
156
-
Tb
160
-
Ho
162
-
Er
166
-
-
-
Tu
171
Ac
?
Yb
173,0
-
147, 152, 155, 160, 167 — лишние). Браунер отнес их к IV
группе, что неверно. Элементы Си, Ag и Аи повторяются
в VIII группе.
В таблице химических элементов Уокера редкоземельные
элементы расположены в III группе — между Ва и Ш, но число их
не указывается. Пунктирной линией отделены неметаллические
элементы *. Водород помещен в-1 и VII группы.
В таблице Вернера семь периодов с числом элементов 2, 8,
8, 18, 18, 33 (VII период незакончен). В клетках, обведенных
жирными линиями, расположены элементы с аномалиями в
величинах атомных весов (символы Nd и Рг следует поменять
местами). В последнем периоде стоящий в 16-й клетке Ас должен
быть перенесен на место Laa, а уран помещен за торием.
Стремление создать новые варианты периодической системы
внесло полезный вклад в химическую науку, так как позволило
шире раскрыть идеи периодичности. Вместе с тем неудачи во
многих попытках создать совершенную систему, лишенную
недостатков и отвечающую на все вопросы химиков, показывали
недостаточность знаний, которыми располагала наука в то
время, и говорили о необходимости более глубокого изучения
* X и Em — прежние обозначения ксенона (Хе) и радона (Rn).
•46
элементов Вернера (1905 г.)
Sc
44,1
Y
89,0
-
Ti
48,1
Zr
90,7
-
V
51,2
Nb
94
Та
183
Cr
52,1
Mo
96,0
W
184,0
Mn
55,0
-
-
Fe
55,9
Ru
101,7
Os
191
Co
59,0
Rh
103,0
Ir
193,0
Ni
58,7
Pd
106
Pt
194,8
Cu
63,6
Ag
107,93
Au
197.2
Be
9,1
Mg
24,36
Zn
65,4
Cd
112,4
Hg
200,3
В
11
Al
27,1
Ga
70
In
114
Tl
204,1
С
12
Si
28,4
Ge
72
Sn
118,5
Pb
206,9
Pba
?
N
14,04
P
31,0
As
75,0
Sb
120
Bi
20S.5
Bi a
?
O
16,00
s
32,06
Se
79,1
Те
127,6
-
Те a
?
-
Fl
19
CI
35,45
Br
79,96
J
126,95
-
-
He
4
Ne
20
A
39,9
Kr
81,12
X
128
-
закономерностей изменения масс атомов элементов, чередования
их свойств, пропорционального изменения объемов и плотности
простых веществ и ряда других явлений.
При этом приобретала немаловажное значение и форма
периодической системы, отражающая изменения свойств как самих
элементов, так и их соединений. Надо сказать, что Д. И.
Менделеев не отдавал предпочтения тому или иному варианту
системы. Почти во всех изданиях «Основ химии» горизонтальный
и вертикальный, короткий и полудлинный варианты таблицы
помещались им на равных основаниях, хотя и отличались длиной
периодов. Для решения вопроса о длине всех периодов в
системе необходимо было сопоставить разности между атомными
весами начальных и конечных элементов различных периодов:
2-й период 3-й период 4-й период 5-й период
Li=7 1 Na = 23 1 К = 39 1 Rb = 85 )
F=19 J U 01 = 35,5/^ Br = 80 j 41 1=127 \^
Из данного сопоставления следовало, что 4-й и 5-й периоды
должны содержать большее число элементов, чем 2-й и 3-й, но
в каждой из этих пар периодов число элементов должно быть
одинаково, так как разности атомных весов для каждых этих
пар почти тождественны. Периоды 2-й и 3-й были названы
47
малыми, а 4-й и 5-й—большими: они содержат, соответственно,
по 8 и 18 элементов.
Интересно, что Д. И. Менделеевым впервые было высказано
предположение о возможности 32-членного периода. Сравнивая
соответствующие соединения хрома, молибдена, вольфрама и
урана, он отмечал:
«Этот факт, равно как и некоторые другие (сходство Pt с Pd, Nb с Та
и т. д.), заставляет думать, что кроме малых и больших периодов есть еще
и четверные периоды...»
В дальнейшем эта мысль была использована для
построения современного варианта длиннопериодной системы.
ПЕРИОДИЧНОСТЬ СВОЙСТВ ПРОСТЫХ
И СЛОЖНЫХ ВЕЩЕСТВ
Исследования ученых XIX столетия, считавших атом конечной,
неделимой и «бесструктурной» частицей элементарного
вещества, естественно, не могли быть направлены «в глубь» атома;
основное внимание уделялось изучению многообразных свойств
Таблица 16. Периодический закон и его приложение
Д. И. Менделеев (1869 г.)
Периодический закон химических элементов
Основа систематики элементов
Атомный' вес
(количественная
характеристика)
Химическая индивидуальность
(качественная
характеристика)
Атом (А) <-
Молекула (А)
(одноатомные
молекулы)
Элемент
I
i
Молекула (А)х
(полиатомные
молекулы)
1
Простое вещество
-> Атом (В)
Молекула (А В)
Сложное вещество
48
Молекулярный вес
Химические и физико-химические свойства
(качественные и количественные характеристики)
элементарных и сложных веществ, в зависимости от
расположения элементов в периодической системе. Помимо основных
химических свойств, например, валентности, изменения
металлического и неметаллического характера элементов, изменения
состава и химического характера окислов и гидроокисей,
изучались многочисленные физические свойства веществ: температуры
кипения и плавления, плотности и атомные объемы, удельные
объемы и коэффициенты сжатия, спектры элементов, магнитные
и электрические свойства, теплоты образования и теплоемкости
и т. д. *.
Табл. 16 дает представление о приложимости периодического
закона к изучению веществ и их свойств.
Сопоставление физических свойств элементов приводит к
заключению, что их изменения также носят периодический
характер, но эта периодичность не всегда совпадает с
периодичностью изменения химических свойств. Сравним некоторые
свойства элементов-аналогов 3-го и 4-го периодов:
Элементы 3-го периода Na Mg Al Si P S CI
Т. пл. простых веществ,
°С 97,8 651 660 1413 44,1 119 —102,4
Химические свойства . . Металличность уменьшается >
Валентность ......1 2 3 4 5 6 7
Состав окислов .... Na20 MgO A1203 Si02 P205 S03 CI207
Свойства окислов . . . Кислотные свойства возрастают >
Элементы 4-го периода К Са Ga Ge As Se Br
Т. пл. простых веществ,
°С 63,6 848 29,8 958 817 220 —7,3
Химические свойства . . Металличность уменьшается >•
Валентность 1 2 3 4 5 6 7
Состав окислов .... К20 CaO Ga203 Ge02 As205 Se03 Вг207
Свойства окислов . . . Кислотные свойства возрастают >
Из этих данных видно, что у элементов 3-го и 4-го периодов
закономерно изменяются валентность, химические свойства,
состав и свойства окислов. В изменениях температур плавления
простых веществ по периодам закономерности не наблюдается.
Если же сравнивать температуру плавления простых веществ-
аналогов по вертикали, то в группах Na, Al и Si она снижается,
а в остальных группах аналогов — повышается. •
■ Максимальное значение температуры плавления высших
окислов свойственно элементам 1Упобочной группы, а именно:
двуокисям титана, циркония и гафния (Ti02, ZrC>2, НЮ2). Эти
соединения широко используются в технике для производства
изделий из тугоплавкого фарфора.
* В монографии проф. В. Я. Курбатова (Закон Д. И. Менделеева, НХТИ,
1925) дан обзор исследований, связанных с применением периодического
закона к изучению различных свойств элементов и их соединений.
49
Сопоставление значений плотности (в г/см3) щелочных
металлов, расположенных в I главной группе периодической системы
показывает, что плотность натрия имеет повышенное значение
(она должна быть меньше, чем у калия):
Li Na К Rb Cs
0,534 0,966 0,86 1,52 1,87
Подобные отступления характерны для первых двух
элементов каждой главной группы периодической системы: Д. И.
Менделеев называл эти элементы типическими.
Отклонения в изменениях свойств элементов по периодам и
группам иногда не получают приемлемого обоснования, а в
некоторых случаях объясняются тем, что свойства веществ
изучались в несопоставимых условиях.
ПЕРИОДИЧЕСКИЙ ЗАКОН
И СТРОЕНИЕ АТОМА
КОНЦЕПЦИЯ НЕДЕЛИМОСТИ АТОМА
Как отмечалось выше, до конца XIX столетия большинство
ученых представляло атом как неразложимую и неделимую частицу
элемента — «конечный узел» материи. Интересно следующее
замечание проф. Б. Н. Меншуткина, сделанное им в 1937 г.:
«Сорок пять лет тому назад меня учили, что атом тверд, непроницаем,
•неделим, упруг, абсолютно не меняется в весе».
Однако среди современников Д. И. Менделеева все большее
распространение получали высказывания о возможности
делимости атома. Замечательны в этом отношении работы русского
ученого-революционера Н. А. Морозова*, написанные им
вовремя заключения в Шлиссельбургской крепости и опубликованные
только после его освобождения в 1905 г., в которых он
предсказывал возможность распада атомов. Выдающийся русский химик
А. М. Бутлеров писал (1886 г.), что быть может атомы «не
неделимы по своей природе, а неделимы только доступными нам
ныне средствами...». Д. И. Менделеев также допускал
предположение, «что называемое нами неделимым (атом)—неделимо
только обычными химическими силами...» С другой же стороны,
он отстаивал самобытность и индивидуальность химических
элементов, ограничивая ими пределы превращения веществ:
«Отрицать его ** я не могу, но признавать его еще более для меня
невозможно...»
...«опыт до сих пор отрицательно говорит о превращении элементов друг
е друга...» ***
Ближайший его ученик — проф. Д. П. Коновалов в отзыве на
труды Н. А. Морозова, в которых излагались идеи о сложном
строении атомов и их взаимной превращаемости, писал:
«...вес и непревращаемость элементов сделались основными понятиями
химии. Конечно, никому и теперь не возбраняется предполагать, что элементы
могут превращаться друг в друга, но опыты, беспощадные опыты, показывают,
* Н. А. Морозов за 11 лет до открытия аргона предположил
существование группы инертных газов, безвалентных по водороду и металлам,
теоретически вычислил их атомные веса и определил место этих элементов
в периодической системе.
** Д. И. Менделеев имеет здесь ввиду превращение элементов.
*** Д. И. Менделеев, Основы химии, изд. 13-е, т. II, стр. 392.
51
что во всех случаях, когда дело как будто шло о превращаемости элементов,
была ошибка или обман...»
Действительно, в то время (90-е годы прошлого столетия)
еще не было достоверных опытных данных, подтверждавших
сложность строения атомов, и поэтому как Менделеев, так и
многие другие ученые, не могли признать казавшиеся им чисто
умозрительными предположения о существовании первичной
материи, из которой образуются химические элементы. Вместе
с тем оставался невыясненным главный вопрос, возникавший
при систематике химических элементов, — чем
объясняются причины периодичности изменения их свойств.*
Необходимость дальнейшей разработки периодического
закона отмечалась и самим Д. И. Менделеевым:
«Как одно из недавних, но выдержавших лабораторную проверку
научных обобщений, как инструмент мысли, еще не подвергавшийся до сих пор
никаким видоизменениям, периодический закон ждет не только новых
приложений, но и усовершенствований, подробной разработки и свежих сил».
Более глубокое изучение свойств химических элементов и
поиски ответа на неразрешенные вопросы их размещения в
периодической системе привели к тому, что ученые все чаще стали
пользоваться в своих выводах представлением о первичной
материи и допускать различия в строении атомов. Новые взгляды
в основном сводились к следующим положениям.
1. Химические элементы — это «сложные вещества»,
образовавшиеся путем длительной эволюции «первичных элементов».
2. Периодическая система является отражением процесса
образования атомов уплотнением одной и той же
первоначальной материи.
3. Атомные веса элементов представляют собой лишь
средние значения истинных масс, различающихся у атомов одного
и того же элемента.
4. Атомы элементов дополнительных (побочных) групп
имеют иное внутреннее строение.
Такие выводы первоначально носили гипотетический характер,
так как еще не могли быть ни достаточно обоснованы
теоретически, ни подтверждены экспериментально, а потому и не
находили широкого признания. Сложившееся состояние науки
хорошо характеризуется словами Ф. Энгельса: «...мы можем
познавать только при данных нашей эпохой условиях и лишь
настолько, насколько эти условия позволяют**.
Однако к концу прошлого столетия это положение стало
резко изменяться.
* Такое понимание было достигнуто лишь полвека спустя: оно пришло
с квантовой механикой, которая раскрыла строение атомов и объяснила
периодичность их свойств». И. Е. Т а м м, Сб. «Будущее науки», Изд. «Знание»,
1966, стр. 23.
** Ф. Энгельс, «Диалектика природы», Издательство политической
литературы, 1969, стр. 208.
62
СТРОЕНИЕ АТОМОВ И НОВАЯ КОЛИЧЕСТВЕННАЯ
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ
Современные представления с строении вещества не имеют ни»
чего общего с теми представлениями, которые сложились в
период, предшествовавший открытию периодического закона.
Установление природы катодных и каналовых лучей, фото- и
термоэлектрических эффектов, открытие электрона и
радиоактивного распада говорили о чрезвычайно сложной структуре
атомов. Наука доказала, что атомы, являясь в целом
электронейтральными частицами, состоят из еще более мелких частиц,,
обладающих положительным или отрицательным
электрическим зарядом, что атомы тяжелых элементов относительно
малоустойчивы и самопроизвольно распадаются, превращаясь,
в атомы других элементов (например, при распаде радия
образуются радон и гелий). Таким образом, установившиеся
тысячелетиями представления о материи пережили себя,
человеческое познание углублялось внутрь атома. Концепция неделимости
атома оказалась несостоятельной.
В XX столетии вместе с бурным развитием техники и
промышленности в химию стали внедряться новые физические
методы исследования: спектроскопия, рентгеноскопия, масс-спек-
трография и масс-спектрометрия, электронография,
нейтронография, метод меченых атомов и радиоактивных изотопов,,
парамагнитный и ядерный магнитный резонансы, эффект
Мёссбауэра и др. Широко стали использовать новейшую
аппаратуру: электронный микроскоп, счетчики и ускорители частиц,,
атомные реакторы, хроматографы и др. При помощи этих
разнообразных методов и аппаратуры удалось проникнуть в недра
молекул, атомов и ядер. Изучение строения атома и ядра
помогло приподнять завесу над тайной периодического закона и:
овладеть им.
Штурм атома начался с открытия французским физиком
Беккерелем особого свойства веществ, получившего
впоследствии название радиоактивности. Им было установлено,
что из природной урановой руды (смолки) самопроизвольно-
испускаются лучи, обладающие высокой проницаемостью: они
легко проходят через толщу черной бумаги и вызывают
химические изменения в светочувствительном слое фотопластинки.
Затем было обнаружено, что как сам уран, так и все его
соединения независимо от их состава, обладают тем же
свойством, а следовательно, явление радиоактивности есть свойство-
атомов урана.
Обнаружение радиоактивности урана поставило перед
учеными вопрос, является ли это свойство специфическим только
для урана или присуще и другим элементам. Вскоре было
установлено, что радиоактивностью обладает также и торий.
Открытие радиоактивности удория и урана определило направление
53-
научного поиска, в первую очередь в сторону обнаружения
радиоактивных элементов, сначала среди тяжелых, а затем и
среди других элементов.
Перед учеными встала задача выяснения механизма процесса
радиоактивности. После тщательного изучения было
установлено, что радиоактивность — это самопроизвольный распад ядер
атомов тяжелых элементов, сопровождающийся образованием
ядер атомов других элементов и испусканием альфа-, беТа- и
гамма-лучей (а-, (5-, у-). Самопроизвольный характер
радиоактивного распада подтверждался тем, что изменения внешних
условий (температуры, давления, электромагнитного поля
и др.) не влияли на скорость радиоактивного превращения.
Элементы, образующиеся при радиоактивном распаде атомов
урана или тория, оказались в свою очередь радиоактивными.
Ученые занялись глубоким изучением продуктов распада,
выяснением их химической природы и дальнейшим поиском ранее
неизвестных элементов.
В конце прошлого и начале этого века супруги Мария и
Пьер Кюри, Дебьерн, Резерфорд и Дорн открыли
радиоактивные элементы — радий, полоний, актиний и радон (последний
первоначально назывался эманацией). С течением времени
число известных радиоактивных элементов увеличивалось и
к 1912 г. их насчитывалось 39, причем относительная масса
этих элементов (атомный вес) была равна или больше 209.
Согласно периодическому закону каждому элементу отвечает своя
определенная клетка в периодической системе, и перед
учеными возникла неразрешимая, как тогда казалось, задача
разместить 39 элементов в 10 клетках (от висмута до
урана).
При открытии новых радиоактивных элементов ученые
изучали их радиоактивные характеристики: тип излучения (а-, р-,
у-), энергию испускаемых частиц и период полураспада,
т. е. время, в течение которого распадается половинное
количество радиоактивного элемента. Кроме того, устанавливали и
химическую природу этих элементов, т. е. совокупность свойств:
валентность, тип и состав окисла, хлорида, сульфида,
способность к химическим взаимодействиям и другие характеристики.
Определяли также и самую главную количественную
характеристику элемента — атомный вес. Сопоставляя свойства вновь
открытых элементов со свойствами уже известных, определяли
аналогов и относили, новые элементы к той или иной группе
периодической системы.
Например, для радия было установлено, что при
радиоактивном распаде он испускает а-частицы с энергией 4,79 Мэв*
* Мегаэлектрон-вольт (Мэв) — энергия, которую приобретает электрон
при перемещении в электрическом поле в вакууме между двумя точками
с разностью потенциалов в 1 миллион вольт.
54
и у-частицы с энергией 0,188 Мэв и что его период
полураспада равен 1622 годам. По химическим свойствам он является
аналогом бария, в своих соединениях проявляет максимальную
валентность, равную 2, и должен располагаться во II группе
периодической системы. С другой стороны, было известно, что
атомный вес радия больше атомного веса бария на 88,6
единицы, т. е. как раз на величину (88—90 единиц),
предсказанную Д. И. Менделеевым как разность в атомных весах
элементов 6-го и 5-го периодов. На основании этого радий и был
размещен непосредственно под барием, т. е. в 6-м периоде
II группы периодической системы элементов.
Одновременно ученые занимались изучением природы а-, |3-
и у-лучей. Было установлено, что а-лучи представляют собой
поток частиц — двухзарядных положительных ионов гелия,
обозначаемых Не2+, или 4Не2+ (цифра 4, поставленная слева
вверху символа, обозначает относительную массу частицы),
а р-лучи — это поток электронов, несущих элементарный
отрицательный заряд электричества (—1,602-10"19 к) и обладающих
незначительной массой — примерно в 1840 раз меньше массы
самого легкого атома — водорода. Было установлено также,
что у-лучи—это электромагнитное излучение с очень
короткими длинами волн (1 А и меньше) и что у-лучи могут
проявляться как поток частиц, так называемых у-частиц, несущих
энергию определенными порциями, или квантами, не
обладающих массой покоя и не имеющих электрического заряда.
Все эти данные помогли в изучении механизма
радиоактивного распада. В качестве примера можно рассмотреть
механизм а-распада радия и р-распада радия С — элементов II и
V групп периодической системы (табл. 17).
Таблица 17. Радиоактивный распад Ra и RaC
а-Распад Р-Распад
Номер
группы
Схема
распада
Изменение
массы
0
Rn ч
I
-а2+
1.
222 ■*■ —
1
II
Ra
226
Номер
группы
Схема
распада
Изменение
массы
V
VI
1_
i
1
214 —-> 214
1
Из таблицы видно, что элемент II группы Ra при а-излуче-
нии образует элемент нулевой группы—радон (Rn),
обладающий совершенно отличными от радия химическими свойствами
и являющийся при обычных условиях газообразным веществом,
55
а это характерно для всех элементов нулевой группы. При р-
распаде RaC — элемента V группы — образуется новый элемент
RaC с совершенно иными химическими свойствами,
соответствующими элементам VI группы, но масса его при этом
практически не меняется (излучение электрона изменяет массу
только в четвертом знаке после запятой).
Если рассматривать известные схемы распада
радиоактивных элементов на фоне периодической системы элементов,
можно увидеть, что эти схемы являются как бы «вырезками»
из таблицы периодической системы. Изучая схемы и
рассматривая последние как часть периодической системы, обобщая
все данные о радиоактивном распаде элементов, Содди и
Фаянс сформулировали правило, вошедшее в науку под
названием правила сдвига или смещения.
При альфа-распаде дочерний * элемент приобретает массу,
на 4 единицы меньшую массы материнского элемента, а по
отношению к последнему располагается в периодической системе
на две клетки левее.
При бета-распаде масса атомов практически не меняется,
но дочерний элемент по отношению к материнскому занимает
место на одну клетку правее.
С помощью периодической системы и правила Содди —
Фаянса предстояло выяснить: 1) являются ли радиоактивные
элементы независимыми друг от друга или характеризуются
общностью происхождения (прерывные ступени в непрерывном
развитии вещества); 2) какой элемент является конечным
продуктом радиоактивного превращения.
Сравнивая массы радиоактивных элементов, ученые
установили, что 39 радиоактивных элементов по своему
происхождению не составляют единого ряда, а могут быть разделены
на три радиоактивных семейства, названных по родо-
начальному элементу семейством урана, или семейством (4га +'
+ 2)**, актиноурана (4га+ 3) и тория (4га). Из урана при
последовательном радиоактивном распаде образуется 14
промежуточных радиоактивных элементов (включая уран в семействе
15 элементов), из актиноурана — 12 (в семействе 13), а из
тория—10 (в семействе 11 радиоактивных элементов). Общая
характеристика радиоактивных семейств показана в табл. 18.
Было показано, что конечным продуктом распада всех трех
радиоактивных семейств является один и тот же элемент —
свинец. Однако полученные атомы этого элемента в зависимости
от того, какое семейство их «породило», обладают различной
относительной массой, хотя химические свойства их одинако-
* Исходный радиоактивный элемент принято называть материнским,
а получающийся из него — дочерним.
** При делении значений относительных масс всех элементов данного
семейства на четыре в остатке получается число два, потому его называют
семейством «четыре эн плюс два» (\n-\-2).
56
Таблица 18. Характеристика радиоактивных семейств
Семейство
Урана
Актино-
урана
Тория
Число
радиоактивных
членов
семейства
15
13
11
Число излучателей
а
8
7
6
Р
6
4
4
а, р»
1
2
1
Массовые числа
отдельных
членов семейства
238, 234, 230,
226, 222, 218,
214, 210
235, 231, 227,
223, 219, 215,
211, 207
232, 228, 224,
220, 216, 212,
208
Тип
семейства
4га+ 2
4га+ 3
4га
Конечный
продукт
распада
206рЬ
207РЬ
208РЬ,
* Часть атомов излучает только а-лучи, а другая часть —только Р-лучи.
вы *. Такие разновидности атомов элемента получили название
изотопов. Изотопы данного элемента должны располагаться
в одной клетке периодической системы. Оказалось, что 39
радиоактивных элементов, о которых упоминалось выше,
являются лишь изотопами 10 элементов и теперь не составляло
труда разместить их в 10 клетках периодической системы (от
висмута до урана).
Открытие изотопов показало, что атомный вес является
переменной характеристикой данного элемента и не она
определяет природу элемента. Это подтверждается существованием
и зоб а ров — разновидностей элементов с различными
химическими свойствами, но одинаковыми относительными массами.
В частности, изобары получаются при р-распаде радиоактив^
ных изотопов. Например, RaC и RaC имеют одинаковые
относительные массы, но обладают разными химическими
свойствами, что согласуется с их положением в разных группах
периодической системы.
Новая количественная характеристика элементов,
определяющая их природу, была выявлена в 1913 г. английским
физиком Мозли при исследовании характеристического спектра
рентгеновских лучей. Такой характеристикой оказалась
величина положительного заряда ядра атома. Выяснилось, что
элементы в периодической системе размещаются в порядке
возрастания величины заряда ядра; эту характеристику стали
называть порядковым номером элемента и обозначать Z. Все
изотопы данного элемента независимо от их относительных
* Потребовалось около 30 лет, чтобы доказать высказанную впервые
А. М. Бутлеровым мысль о неравноценности масс атомов одного и того же
элемента.
67
масс имеют один порядковый номер. Например, для изотопов
свинца Z = 82. Принято при символической записи элемента
свинца число, соответствующее порядковому номеру, ставить
слева внизу символа элемента, а число, обозначающее
относительную массу — слева вверху. Последнюю величину стали
называть массовым числом. Тогда изотопы свинца можно
записать следующим образом: ^fjPb, ^Pb, 2gfPb-
Новая характеристика элементов помогла объяснить ряд
вызывавших вопросы и оставшихся неясными положений,
использованных Д. И. Менделеевым при построении его
периодической системы. Так, было подтверждено, что между водородом
(Z=l) и ураном (Z = 92) в системе должно располагаться
только 90 элементов. Получило подтверждение правильное
распределение Д. И. Менделеевым трех пар элементов isAr — юК,
27С0 — 2eNi, 52Te — 5з1, в которых, вопреки первоначальной
формулировке периодического закона, более легкий элемент стоит
за более тяжелым. С другой стороны, стало ясным, что в
противоположность мнению Менделеева, предполагавшего
открытие в будущем легкого галогена с атомным весом 3, между
водородом и гелием не должно быть ни одного элемента, так
как Zh = 1, a Zjie = 2.
Опираясь на новую характеристику элементов, Мозли
указал, что в периодической системе остаются незанятыми клетки
43, 61, 72, 75, 85 и 87, т. е. элементы с этими номерами еще
предстоит открыть, так как ни один из известных в то время
элементов не давал рентгеновские спектры, характерные для
элементов с зарядами ядер, равными этим порядковым
номерам. В связи с введением понятия порядкового номера
элемента была принята новая формулировка периодического закона:
«Химические свойства элементов, а также состав и
свойства соединений, образуемых ими, находятся в
периодической зависимости от порядкового номера элементов».
Однако знание порядкового номера еще не давало
возможность вскрыть причину периодического изменения свойств
элементов, так как порядковый номер, так же как и атомный вес
от первого к последнему элементу изменяется линейно.
ЭЛЕКТРОННАЯ ОБОЛОЧКА АТОМА И СПЕКТРЫ
Впервые идеи о сложной структуре атома были высказаны
русскими учеными М. А. Павловым, Б. Н. Чичериным и
Н. А. Морозовым, но только в 1911 г. английскому физику
Э. Резерфорду удалось разработать планетарную, или ядерную,
модель строения атома. К ядерной модели атома Резерфорд
пришел в результате исследования рассеивания а-лучей,
проникающих сквозь тонкую металлическую фольгу (рис. 2). Для
58
ЭРНЕСТ РЕЗЕРФОРД
(1871—1937)
большинства а-частиц прямолинейная траектория их полета
не менялась. Однако в единичных случаях наблюдалось
изменение траектории полета а-частицы, что можно было
объяснить только сильным электростатическим отталкиванием
положительно заряженной а-частицы от одноименно заряженной
части атома, заряд которой
должен быть сосредоточен Фопьго
в меньшем объеме по
сравнению с объемом всего
атома. Эта часть атома была
названа ядром. Чадвик,
ученик Резерфорда, по
углу отклонения траектории
а-частицы (отклонение на
некоторый угол <р, q/ или
отталкивание почти под
углом 180°) вычислил
величину положительного заряда
ядра атомов ряда
элементов, совпавшую с
величиной, находимой по методу
Мозли из рентгеновских спектров. Было установлено, что
радиус ядра в десятки- тысяч раз меньше радиуса атома в целом.
Именно поэтому Резерфорд образно говорил, что атом в
основном — пустота.
Так как, по мнению Резерфорда, атом является системой
электронейтральной, то естественным оказалось утверждение,
что положительное ядро окружено движущимися электронами,
число которых равно заряду ядра или порядковому номеру.
Совокупность всех электронов, окружающих данное ядро,
получила название электронной оболочки атома.
Рис. 2. Рассеивание а-лучей при
прохождении через металлическую фольгу.
59
НИЛЬС БОР
(1885—1962)
Планетарная модель атома сыграла важную роль в
начальной стадии изучения строения атома. Однако ряд вопро-
•сов оставался нерешенным. Например: Изменяется ли во
времени энергия движущегося вокруг ядра электрона? На каких
расстояниях от ядра движется электрон? Как объяснить
линейный спектр атомов элементов?
Значительный шаг в развитии теории строения атома был
сделан в 1913 г. датским физиком Н. Бором. Используя
квантовые представления о природе излучения, введенные немецким
физиком М. Планком, он высказал ряд постулатов
относительно величины энергии движущегося электрона в атоме
водорода. В обычных условиях единственный электрон в атоме
водорода вращается вокруг ядра на расстоянии от него,
разном 0,53 А *. Энергия электрона при этом не изменяется; такое
состояние атома водорода и называют нормальным или
основным. В этом состоянии энергия связи электрона с
ядром максимальна — 13,6 эв **.
При сообщении атому водорода энергии извне он
поглощает энергию определенными порциями — квантами. Квант
энергии Е = h-v, где h = 6,62517• Ю-27 эрг• сек — постоянная
величина, называемая постоянной Планка, a v — частота
колебаний (сек']). В зависимости от числа поглощенных квантов
энергия электрона увеличивается до Е2, Е3, ..., Еп (где п —
любое целое число) и электрон переходит из нормального
в различные возбужденные состояния. Причем между
состояниями с энергиями Е2 и Е3 или £3 и Е4 не может быть ни
одного промежуточного. Отвечающие этим энергиям уровни были
* Ангстрем (А) — одна стомиллионная доля сантиметра.
** Электрон-вольт (эв) — энергия, которую приобретает электрон при
перемещении в электрическом поле в вакууме с разностью потенциалов
1 вольт.
€0
названы энергетическими или квантовыми уровнями (рис. 3).
Про электрон, находящийся в данном энергетическом
состоянии, стали говорить, что он находится на данном уровне.
Расстояние электрона от ядра в атоме определяется
энергетическим состоянием электрона, т. е. каждому электрону
соответствует свой энергетический уровень. Расстояние электрона от
ядра в атоме водорода можно вычислить по формуле Н. Бора
Гп = 0,53-п2 А (где г„, так „„«
называемые, воровские pa- t^-ofii^^-- -_^
диусы); радиусы относятся
между собой как квадраты
целых простых чисел, т. е.
как I2 : 22 : З2: ... : л2. Чем
дальше электрон отстоит
от ядра, тем он слабее
связан с последним; энергия
связи определяется по
формуле £св = — 13,6/гс2 эв
(знак минус указывает, что
возбуждение электрона
требует затраты энергии).
Следовательно, энергия
электрона в атоме, а
значит и расстояние от ядра
атома, на котором может
находиться электрон,
определяются значением особого г"= я* 3 v"
числа п, названного
главным квантовым
числом, имеющим значение 1,
2, 3, 4 п.
В возбужденном состоянии электрон обычно пребывает лишь
10~8 сек и по истечении этого короткого времени возвращается
в менее возбужденное или нормальное состояние. В этом
случае говорят, что электрон переходит с высокого энергетического
уровня на более низкий (или просто — с высокого уровня на
низкий уровень). Конечно, никаких уровней в атоме нет;
говоря так, понимают лишь энергетическое состояние электрона,
что и определяет его положение в атоме. При переходе
электрона с уровня на уровень разность энергий выделяется в виде
излучения, характеризующегося определенной частотой v или
Длиной волны Я.
Каждому отдельному переходу электрона с уровня на
уровень соответствует определенная линия в оптическом спектре,
^совокупность линий, отвечающая переходу электронов с
любых квантовых уровней на какой-либо один, называется
спектральной серией. Так, при переходе с любого
энергетического уровня на первый возникает серия линий, лежащих
г„'0,53п'А
Рис. 3. Энергия электрона атома
водорода в нормальном и возбужденном
состояниях (по Бору).
61
в коротковолновой части спектра — серия Лаймана. Сери»
линий, лежащих в видимой части спектра—с ерия Бальмера,
возникает при переходе электронов с более дальних
энергетических уровней на второй. При переходе электронов с дальних
энергетических уровней на третий, четвертый и пятый
получаются длинноволновые серии, отвечающие инфракрасной
части спектра. Совокупность всех серий называется
оптическим спектром (рис. 4). В настоящее время для водорода
\ Лашена
Рис. 4. Схема возникновения спектральных серий оптического
спектра водорода.
известны шесть спектральных серий, получивших свои
названия по имени ученых, обнаруживших эти серии
экспериментальными методами.
Зная полную энергию электрона (она равна сумме
кинетической и потенциальной энергий) на дальнем Ея и ближнем
£б квантовых уровнях, можно вычислить частоту излучения по
формуле Бора v = (Ея— Ец)/И'. Длина волны, отвечающая
данной частоте, может быть рассчитана по формуле Я = c/v, где
с — скорость света. Сопоставим значения длин волн,
вычисленных по формуле Н. Бора и найденных экспериментально
(табл. 19). Совпадение данных настолько близко, «...что
истинная природа атомной структуры угадана глубоко и верно»,
как отмечал в одной из своих работ академик С. И. Вавилов.
Теория строения атома Бора позволила не только
качественно, но и количественно расшифровать механизм
возникновения оптического спектра самого простого атома — атома
водорода. Однако попытки использовать теорию Ббра для объ-
62
Таблица 19. Длины некоторых волн
в оптическом спектре водорода
него энергетического
уровня на ближний
2 —* 1
4 —*■ 1
3 —> 2
4 —> 2
4 —► 3
6 —> 3
Длина волны, А
экспериментальная
972
1216
6 564,66
4862,71
10 938
18 751,3
вычисленная
по формуле
Бора
972,5
1 215,68
6 564,70
4 862,80
10 941
18 756
яснения ряда особенностей в строении более сложных атомов
не привели к положительным результатам.
Впоследствии оказалось, что для характеристики электрона
в атоме недостаточно знать только одно главное квантовое
число п. Изучение тонкой структуры спектральных линий,
расщепление их на составные компоненты под влиянием
электрического и магнитного полей и наличие собственного момента
движения электрона или спина (вращение вокруг собственной
оси) показали, что для оценки состояния электрона в атоме
необходимо пользоваться четырьмя квантовыми числами: я, /,
mas.
Для нормальных состояний атомов всех известных
элементов п может иметь значение от 1 до 7, т. е. электроны
электронной оболочки самых сложных атомов располагаются на
семи уровнях (слоях). Максимальное число электронов на п-
уровне можно найти по формуле Хп — 2/г2. Например, на
первых четырех уровнях максимально может разместиться:
..1.2 3 4
. . 2- I2 = 2 2-22 = 8 2 • З2 = 18 2-42 = 32
п .
Из восьми электронов второго уровня два электрона
несколько отличаются по своей энергии от остальных шести. Таким
образом было установлено, что энергетические уровни
расщепляются на подуровни и электроны одного уровня
располагаются на разных подуровнях, число которых равно
номеру уровня, т. е. первый уровень включает один подуровень,
второй — два, третий — три, четвертый — четыре и т. д.
Каждому подуровню отвечает определенное значение
орбитального квантового числа*/ = 0, 1, 2, 3, .... (п.— 1).
Физический смысл этого квантового числа заключается в том, что
движущийся вокруг ядра электрон создает орбитальный
механический момент, возмбжные значения которого и
определяются величинами /.' Обычно вместо числовых значений /
63
применяют буквенные обозначения, а именно: для / = О букву s,
для 1=1—р, для 1 = 2 — d и для 1 = 3— /. Максимальное
число электронов в подуровне (Xi) определяется по формуле
Xt = 2(2l-\- I). Например, 32 электрона в четвертом уровне
(п = 4) распределятся по четырем подуровням следующим
образом:
/ о 1 2 з
Число электронов Хг = 2(21+ 1) . .2 6 10 14
Подуровень s р d f
Максимальная емкость подуровней записывается так: s2pr'dl0fu.
Числа в правом верхнем углу символа, обозначающего
подуровень, равны максимально возможному числу электронов
данного подуровня.
Зная порядковый номер элемента, т. е. заряд ядра его
атома, а следовательно, и число электронов в атоме, можно
проследить распределение этих электронов по энергетическим
уровням и подуровням. Суммарная запись распределения
максимального числа электронов в атоме по уровням 1, 2, 3 и 4
и возможным подуровням имеет вид:
1 s22s2p63s2p6d' °4s2p6d' °f»4
Например, 12 электронов в оболочке атома магния (Z = 12)
следующим образом распределятся по уровням и подуровням:
п 1 2 3
Число е~ в уровнях 2 82
/ . 0 0 1 0 12
Число е~ в подуровнях 2 26 2 —- —
Подуровень s s p s p d
Условно распределение электронов в атоме магния можно
записать: ls22s22/?63s2.
Из схемы и записи распределения видно, что в атоме
магния три энергетических уровня и на внешнем из них
содержится два s-электрона.
Шесть электронов р-подуровня характеризуются также
различным энергетическим состоянием. Подуровни в атоме
подразделяются на энергетические группы, или атомные
орбита л и. Число атомных орбиталей в подуровне равно
максимальному числу электронов в нем, деленному на два. Так, на
s-подуровне — одна атомная орбиталь (2 : 2= 1), р-подуровне —
три (6:2 = 3), d-подуровне — пять (10:2 = 5) и на
/-подуровне семь атомных орбиталей (14:2 = 7). Каждой атомной ор-
битали отвечает определенное значение магнитного
квантового числа т. Это квантовое число позволяет определить
проекции орбитального механического момента на произвольно
выбранное направление. Магнитное квантовое число может
принимать значения от +/ до —/, включая нулевое, где / — орби-
64
тальное квантовое число. Так, при / = 1 (р-подуровень) т
может иметь только три значения:.+1, 0, —1, которые отвечают
трем орбиталям.
На любой атомной орбитали максимально может
находиться два электрона, отличающиеся друг от друга тем, что
вращаются вокруг своей оси в противоположном направлении.
Следовательно, их собственные моменты количества движения,
называемые спинами, также противоположны. Спин харак
теризуют спиновым квантовым числом, которое
определяет величину проекции спина. Спиновое квантовое число s
может иметь два значения: +У2 и —1/2.
Таким образом, каждый электрон атома характеризуется
четырьмя квантовыми числами: п — определяющим
энергетический уровень, / — соответствующим подуровню, т —
отвечающим орбитали и s — говорящим о спине электрона. Электроны
располагаются в атоме в «разрешенном» порядке,
определяемом принципом, или «запретом», Паули:
«В атоме не может быть двух электронов, обладающих
одинаковыми значениями всех четырех квантовых чисел».
Следовательно, каждые два электрона, даже если у них
одинаковые п, I и щ, должны различаться значениями s.
Например, со значениями я = 1, / = 0 и т = 0 может быть
только два электрона, располагающиеся на одной орбитали и,
следовательно, различающиеся спиновым квантовым числом s:
«3
Квантовые числа ... /г /
Электрон 1-й 1 О
Электрон 2-й 1 О
При графическом изображении распределения электронов по
орбиталям орбиталь изображают в виде прямоугольника,
а электроны с разными спинами, находящиеся на орбитали,—
в виде стрелок, направленных в противоположные стороны:
IHI. В атомной орбитали могут находиться:
либо одиночные (или непарные) электроны JTj
либо парные электроны с антипараллельными спинами Щ\
В последнем случае суммарный спин электронов равен нулю
+-jj—у= 0]. Атомные орбитали, подуровни и уровни с
суммарным значением спина, равным нулю, называются
замкнутыми. Суммарный электронный спин атома в целом определяется
лишь наличием одиночных, или непарных, электронов.
апрещенный» порядок
m ' s
О __ „ли +-
О —— или
«Разрешенный»
порядок
1 0 0 -•
1 0 0 +-
3 Зак. 39,
65
Определить однозначно, как распределяются электроны в
атоме, зная все четыре квантовые числа — п, I, m И s — и исходя
из принципа Паули, не всегда возможно. Распределение в
данном подуровне числа электронов, равного или меньшего
половины максимальной емкости подуровня (т. е. для р ^ 3, d =g: 5
или f ^ 7 электронов), теоретически может быть самым
разнообразным. Допустим, например, что по атомным орбиталям
распределяется в р-подуровне три электрона, в d-подуровне —
четыре и в f-подуровне — шесть электронов. В этом случае можно
составить, по крайней мере, по две комбинации распределения
(2 — сумма):
Ж
№2
Р
т
Е*
f
= %
t
fl
t
-
г*='/2
d £s
t t т
nn -
= 4/2
I -
- -
r*=o
t
H
T
t
/
t
t
Is
t
t
=6^
t
t
t -
- -
r*=4/2
Как видно, в комбинации распределения № 1 занято
большее число атомных орбиталей и суммарный спин электронов
(2 s) больше, чем в комбинациях № 2. Возможная комбинация
распределения электронов определяется правилом Гунда:
«В данном подуровне электроны должны занять по
возможности все свободные орбитали, так как при этом
суммарный спин электронов достигает наибольшего значения».
Этому правилу отвечает только комбинация № 1. В качестве
примера рассмотрим строение атомов кислорода и натрия. На
основании всего сказанного возможны только такие схемы
распределения электронов в оболочке:
п ...
е~ . .
/....
е~ ..
m...
s
1
2
0 0
2
2
0 | 0
и
ч
Кислород
2
6
1
4
+ 1
N
0
t
-1
t
п ...
е~..
1 ...
е~..
m ..
s ...
Z-
2
0
2
0
U
= 11
Натрий
2
8
0
2
0
п
1
6
+1
н
0 -1
Н
п
3
1
0
1
0
t
Из схем следует, что в атоме кислорода из шести внешних
электронов одиночными являются два, а в атоме натрия —один
внешний электрон. Электронная оболочка атома кислорода
состоит из двух уровней, а атома натрия — из трех.
66
Таким образом, атомы имеют как бы слоистую структуру, и
аналогичные внутренние уровни у атомов всех элементов
построены одинаково. Однако чем больше Z, тем сложнее
становится закономерность, определяющая последовательность
заполнения электронами энергетических подуровней в атоме. Общим
является только то, что электрон стремится занять подуровень
энергетически более выгодный (наиболее низкий). Именно
поэтому 19-й электрон атома калия располагается не на Зй-под-
уровне, а на 4s. Точно также подуровень 5s заполняется
раньше, чем 4d, а подуровень Ър раньше подуровня 4f. Условно
энергетические подуровни в атоме можно представить по их величине
и порядку заполнения следующим образом:
£У
Is
-*, 2s
->1 3s
2JB
Зр
"*! 4s
-».3cf
-*i 6s
4p
5s I -4d
5p I „4f
—».5d
6p
Наиболее существенную роль в раскрытии тайн строения
атома сыграл метод спектрального анализа. Следует различать
оптические и рентгеновские спектры.
Оптический спектр является отображением всех возможных
«незапрещенных» переходов электрона из возбужденных
состояний в менее возбужденные или в основное состояния (внешний
уровень). Оптические спектры очень сложны. Они состоят из
десятков, сотен и тысяч спектральных линий.
Рентгеновский спектр возникает при переходе электронов на
вакантное место внутренних электронных уровней,
образовавшееся в результате возбуждения атома вследствие соударения с
электроном или фотоном (электронный или фотонный удар) при
рентгеновском облучении. Если электроны перемещаются на
самый близкий к ядру внутренний слой, то возникает серия К
рентгеновского спектра; при переходах на иные внутренние слои
появляются другие серии (рис. 5). Для самых сложных атомов
известны семь серий рентгеновского спектра К, L, M, N, О, Р
и Q, отвечающих семи энергетическим уровням в электронной
оболочке атома.
От оптических спектров рентгеновские спектры отличаются
небольшим числом линий, например, в серии К всего пять линий.
з*
67
Выше отмечалось, что по длинам волн характеристического
рентгеновского излучения можно определить важнейшую
количественную характеристику элементов — порядковый номер.
Расшифровка оптических спектров элементов, атомы которых
имеют сложное строение, представляет собой трудную задачу.
Здесь в упрощенной форме рассматриваются некоторые общие
вопросы расшифровки оптических спектров водородоподобных
атомов. Водородоподобными атомами называются
атомы, состоящие, подобно атому водорода, из ядра и одного
Ионизация электронным ударом
Возбужденные
уровни
Внешний
уровень
Внутренние
уровни
Переход электрона с внешнего
уровня на вакантное место
внутренних уровней
Рис. 5. Схема возникновения рентгеновского спектра калия (Z = 19;
ls22s22pe3s23pe3d°4sI).
электрона. Такими атомами являются ионизированные атомы с
Z ^ 2, потерявшие все электроны, кроме одного. Например,
если от атома лития, имеющего три электрона (Z = 3), оторвать
два электрона, то получим водородоподобный изонизированный
атом лития Li2+. Энергия (в эв) электрона в квантовом уровне
сложного атома определяется по формуле Е = —\3fi(Z*)2/n2.
Здесь Z*—эффективный заряд ядра, равный Z — о, где а —
коэффициент экранирования, характеризующий уменьшение
силы притяжения внешнего электрона к ядру вследствие
отталкивания его остальными электронами; для водородоподобных
атомов о = 0.
В спектроскопии энергию электрона принято выражать
определенным термом (Г), который находят делением энергии (Е),
выраженной в эргах, на скорость света (с) и постоянную
Планка (h), т. е. Т = E/ch.
Одиночному электрону отвечает определенное значение
орбитального квантового числа /. Если в атоме несколько электронов,'
то отдельные орбитальные моменты складываются в суммарный
орбитальный момент L. Каждому значению L отвечает свой
терм. Суммарные орбитальные моменты L обозначаются теми же
68
буквами, что и орбитальный момент электрона, но только не
строчными (s, p, d...), а прописными (S, P, D...), теми же
буквами обозначаются и соответствующие термы. Таким образом,
возможные числовые значения суммарных орбитальных
моментов и принятые обозначения их и их термов следующие:
L О 1 2 3 4 5
Обозначения S P D F G Н
Аналогично рентгеновскому спектру важнейшие линии в
оптическом спектре группируются в серии: главную, резкую,
диффузную и фундаментальную (основную). Спектральные линии
названных серий образуются при следующих переходах электронов:
Серия Переход е~~
Главная р >s
Резкая s >р
Диффузная d >р
Фундаментальная . . . f > d
Термы, отвечающие этим переходам электронов, многообразны.
Терм, соответствующий наименьшей энергии, называется
основным. Например, из схемы возникновения оптического спектра
натрия (рис. 6) следует, что основной терм — 2S, а все другие
термы являются возбужденными. В данной схеме указаны
только наиболее важные спектральные линии, а в
действительности их значительно больше. Так, в главной серии оптического
спектра натрия можно наблюдать не менее 57 спектральных
линий.
С помощью спектроскопов большой разрешающей силы было
обнаружено, что многие спектральные линии состоят из двух,
трех или большего числа тонких линий. Например, в главной
серии оптического спектра натрия наблюдаются двойные
(дублетные) линии с длинами волн 5890 и 5896 А. Этот эффект
вызван тем, что все термы, кроме 5-термов (последние на схеме
обозначены каждый одной горизонтальной линией, отвечающей
состоянию 3s, 4s, 5s или 6s), расщепляются на ряд близких
энергетических состояний (на схеме они обозначены двойными
линиями), или, как говорят, обладают мультиплетностью
(М) *. Мультиплетность может быть меньше и больше двух, т. е.
термы могут быть синглетные (одиночные), дублетные, триплет -
ные, квартетные и более сложные. Мультиплетность терма
обозначается числовым индексом при буквенном обозначении терма.
Например, 25 означает «дублетный терм S». Основное состояние
натрия характеризуется этим термом (см. схему).
Мультиплетность спектра позволяет определить число
непарных электронов в атоме, которое на единицу меньше
* Объем этой книги не позволяет детально анализировать явление муль-
типлетности. Здесь рассматриваются лишь некоторые общие положения.
69
мультиплетности. Так, в атоме натрия должен быть один
непарный электрон, ибо разность М— 1 = 2— 1 = 1. Действительно,
у натрия Z = 11 и формула распределения электронов будет:
ls22s22p63s1, т. е. непарным является один электрон,
расположенный на Зя-подуровне. Для кислорода характерен терм 3Р, чта
свидетельствует о наличии в его атоме двух непарных
электронов (Z = 8; ls22s22/?4; см. схему распределения электронов на
!
3
1
I
I
I
I
высший уровень
i
■
■
Резпая
серия
Ч
to
и
1
25
и
<<
■
■
'
■
Фундаментальная
серия
Диффузная
серия
Основное
состояние
5р
ч
4й
5s
Ьр
36
4s
С;
Эр
Главная
серия
3s
Рис. 6. Схема возникновения оптического спектра натрия.
стр. 66). При терме lS число непарных электронов равно нулю.
Таким термом обладают атомы благородных газов, бериллия и
щелочноземельных металлов, цинка, кадмия, ртути и палладия.
Терм 1S характерен для атома, имеющего шесть непарных
электронов, из которых один s- и пять d-электронов (атом хрома).
По спектроскопическим данным определяются термы элементов
и расшифровывается строение электронных оболочек их атомов.
Мультиплетность терма (М) — чисто физическое свойство
атома — оказалось связанным с основным химическим свойством
элементов — валентностью (В), в ее классическом
представлении. По Льюису — Лондону, валентность определяется
числом непарных электронов в атоме, т. е. валентность на
единицу меньше мультиплетности (В = М — 1). Следовательно,
оптические спектры тесно связаны с конструкцией периодической
системы, в которой номера групп указывают на
характеристичную валентность элементов.
Периодичность в изменении свойств элементов получила
объяснение не только на основе закономерного изменения структуры
электронной оболочки атомов, но и на основе периодического
изменения мультиплетности термов. При движении по периоду
слева направо в системе элементов мультиплетность возрастает
с попеременным чередованием четности (дублет, квартет,
секстет, октет) и нечетности (синглет, триплет, квинтет, септет).
В спектрах испускания, полученных в пламени электрической
дуги (дуговые спектры), для элементов, атомы которых имеют
нечетное число электронов, наблюдается четная
мультиплетность, и наоборот (табл. 20).
Таблица 20. Изменение мультиплетности и характеристичной
валентности у элементов начала четвертого периода
Группа
типлетность
В
I A
К
Дублет *
1
II А
Са
Синглет
Триплет
2
ш в
Sc
Дублет
Квартет
3
IV В
Ti
Триплет
Квинтет
4
VB
V
Квартет
Секстет
5
VI В
Сг
Триплет
Квинтет
Септет
6
VII В
Мп
Секстет
Октет
7
VIII В
Fe
Триплет
Квинтет
Септет
6
* Курсивом набраны термы, которые отвечают характеристичной валентности (В)
элементов.
Для основного состояния атомов элементов 2-го периода в
зависимости от числа эквивалентных s- и /ьэлектронов
(эквивалентными называются электроны с одинаковыми значениями
квантовых чисел п и /) термы обозначаются так:
Элемент Li Be В С N О F Ne
Электроны внешнего
уровня s1 s2 s2pl s2p2 s2p3 s2p* s2p5 в2рЛ
Число непарных
электронов 1 0 1 2 3 2 1 О
Запись термов 2S "S 2P 3/> *S 3P 2P 'S
<MTi+s) • • •• гЧ 's0 %, 'Л, 4Ч v, *р% 's0
Индексами внизу справа отмечаются квантовые числа /,
определяющие полный момент атома в целом / = L + 5 (L —
суммарный орбитальный момент, S — суммарный спиновый
момент).
71
s- и р-элементы одной и той же группы периодической
системы характеризуются одинаковым основным термом. Так, термы
всех щелочных металлов — 2S, а отсюда В = 1, и,
действительно, характеристическая валентность этих элементов равна 1.
Основной терм атомов d-элементов зависит от суммарного
числа эквивалентных s- и d-электронов (2s + 2^)H от числа
s-электронов (/г) во внешнем уровне (sn):
Суммарное число
эквивалентных s- и d-электро-
нов 1 2 3 4 5 6 7 8 9 10 11 12
Терм
при s° 2D SF *F 5D 6S 5£> fF 3F 2D lS — —
при s1 2S SD *F 5F 6D 7S 6D bF *P SD 2S —
при s2 - lS 2D 3F *F 5D 6S 5D 4F 3F 2D lS
Вследствие наблюдающегося «провала» электронов у атомов
d-элементов, являющихся аналогами, термы основного состояния
могут быть различными. Например, у элементов-аналогов VIB-
группы— хрома, молибдена и вольфрама, электронные
конфигурации отличаются и термы в основном состоянии будут
неодинаковые:
Элемент Cr Mo W
Электронная конфигурация d5s' d5sl d4s2
Терм атомов rS 7S 5D
Как отмечалось выше, терм основного состояния бериллия и
щелочноземельных металлов (Mg, Ca, Sr, Ba, Ra) должен быть
45, а следовательно, мультиплетность М = 1 и
характеристическая валентность В = М — 1=0. Но, как известно, эти
элементы в соединениях проявляют валентность, равную 2. Как же это
объяснить? Дело в том, что, помимо основного состояния, за
счет подвода энергии извне, атомы могут быть переведены в
возбужденное состояние при условии, что в подуровнях атомов
имеются незанятые места (орбитали). Например, во внешнем
уровне атома кальция (п = 4) два парных электрона занимают
s-подуровень (конфигурация атома — 4s2). Но на этом же
уровне имеется /7-подуровень с тремя незанятыми орбиталями, на
одну из которых может быть переведен один из электронов
s-подуровня. Атом кальция в возбужденном состоянии
(конфигурация — 4sp) имеет два непарных электрона, характеризуется
мультиплетностью М = 3 и валентностью В = М — 1 = 2.
Действительно, в спектре кальция и других щелочноземельных
металлов (см. табл. 20) обнаруживается как синглет (М = 1), так
и триплет (М = 3).
Если разность между энергиями подуровней невелика, то
возможность возбуждения реально осуществима, что и имеет место.
Увеличение числа непарных электронов приводит к возрастанию
валентности. Например, алюминий может проявлять валент-
72
ность—1 и 3, кремний — 2 и 4, фосфор — 3 и 5, сера — 2, 4 и 6
и т. д. Возбуждению атомов сопутствует явление гибридизации,
о чем будет сказано ниже (см. стр. 103, 124—126).
Причина многообразия валентности элементов объясняется
различной мультиплетностью термов одного и того же элемента.
Так как термы высокой мультиплетности (септеты, октеты,
нонеты) проявляются редко, то и высшая валентность
наблюдается относительно редко.
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ
И СТРУКТУРА ЭЛЕКТРОННОЙ ОБОЛОЧКИ АТОМОВ
Как указывалось выше, элементы в периодической системе
располагаются в последовательности возрастания Z от 1 до 105, но
эта закономерность еще не объясняет природы периодичности.
Современная формулировка периодического закона гласит:
Периодическое изменение свойств элементов зависит от
периодического повторения подобных структур электронной
оболочки атомов.
Следовательно, в основе конструкции периодической системы
лежит структура атомов. Если исходить из положения, что в
атоме электроны стремятся занять наиболее низкие
энергетические уровни и подуровни, то последовательность их заполнения
должна быть такой: уровней—1, 2, 3, 4, 5, 6, 7; подуровней —
s, p, d, f: в целом — is, 2s2p, 3s3p3d, 4s4p4d4f, 5s5p5d5f ...,
bs6p6d ..., Islp ....
Действительно, именно в такой последовательности
заполняются уровни и подуровни в атомах элементов от 1 до 18
включительно, составляющих три первых (коротких) периода в
системе (табл. 21).
Периоды начинаются элементами, в атомах которых на
новом уровне появляется первый s-электрон (водород и щелочные
металлы), а заканчиваются атомами благородных газов,
содержащих на внешнем уровне два s-электрона (Не), два s- и шесть
р-электронов (Ne, Ar). Первый период включает два элемента,
-а второй и третий периоды — по восьми элементов. Если бы все
электронные уровни состояли из двух подуровней (s2p6), то
число элементов в любом периоде должно было быть только
8 = 2 + 6 и это соответствовало бы идеальной восьмиклеточной
таблице периодической системы.
У атома 18-го элемента — аргона все подуровни, кроме 3d-
подуровня, полностью заполнены. У атома следующего за ним
девятнадцатого элемента — калия, казалось бы, должен
заполняться электроном Зй(-подуровень, а в действительности, как мы
уже знаем, заполняется 45-подуровень. Это объясняется тем, что
некоторые подуровни различных уровней имеют близкие энер-
73
гетические характеристики (рис. 7). К таким подуровням
относятся: 4s — 3d, 5s — 4d, 6s — 5d— 4/ и 7s — 6d — 5f. Для
этих подуровней характерна своеобразная энергетическая
«конкуренция», обусловленная притяжением электронов к ядру и
отталкиванием его всеми остальными электронами.
Таблица 21. Распределение электронов в атомах элементов
1-, 2- и 3-го периодов системы
Период
1
2
3
2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
Элемент
н
Не
Li
Be
В
С
N
0
F
Ne
Na
Mg
Al
Si
P
S
CI
Ar
Уровни и подуровни
rt= !
s
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
n~2
s
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
p
1
2
3
4
5
6
6
6
6
6
6
6
6
6
n = 3
s
1
2
2
2
2
2
2
2
P
1
2
3
4
5
6
d
—
Электрону атома калия энергетически выгоднее
расположиться на 45-подуровне. В атоме кальция (Z = 20) два
электрона также помещаются на том же подуровне. Только с атома
21-го элемента — скандия начинает заполняться пропущенный,
ранее Зй-подуровень (табл. 22). Известно, что максимально на
d-подуровне может разместиться 10 электронов, следовательно,,
полностью этот подуровень заполнится лишь у атома цинка
(Z = 30). От 31 до 36-го элементов в атомах идет заполнение
4р-подуровня. В связи с тем, что в 4-м периоде происходит за-
74
Подуровни
"1 d
/
!
—щщ:
ь-
-с
ь-
~с
TD
полнение не только 4s- и 4/?-подуровней, но и Зс?-подуровня, число
элементов в нем возрастает до 18. В 4-м уровне остаются
незаполненными Ы- и 4/-подуровни.
Аналогичное построение имеет 5-й период, содержащий
также 18 элементов от 37 (рубидия) до 54-го (ксенона). У атомов
элементов этого периода первые четыре уровня построены
одинаково (ls22s22p6 3s23dl03p6 4s24p6). Однако у атомов первых двух
элементов этого периода — рубидия и стронция — происходит
заполнение не 4^-подуровня,
а 55-подуровня, затем,
начиная с иттрия, пополняется
пропущенный ранее 4й-под-
уровень и только с индия
начинает заполняться 5^-
подуровень (табл. 23). У
шести элементов данного
периода наблюдается
аномальное заполнение
подуровней в их атомах, а
именно: Nb, Mo, Ru, Rh, Ag
имеют на внешнем уровне
по одному электрону, а у
атома Pd на бя-подуровне
электроны отсутствуют. У
атома этого элемента число
электронных уровней равно
четырем, хотя он находится
в 5-м периоде (единственное
исключение в системе!). У
атомов элементов этого
периода не заполняются
электронами 4/-, bd- и 5/-под-
уровни.
7s.6d.Sfn-
вр ЧГГП—■-.
6s, 5d.«/ П" 2f
* ч-гтп 1
**"Q- rmYi
"Р ЧЩ>"- ~~ -;
«5, «q. nrTTfi
* Угп
2*0
* D
Рис. 7. Энергетические характеристики
подуровней.
В 6-м периоде в атомах 55 и 56-го элементов застраивается
бя-подуровень одним и двумя электронами соответственно.
У следующего 57-го элемента (лантана) один электрон
помещается на 5с?-подуровне (на рис. 7 эта орбиталь отмечена
диагональной чертой), а с 58 до 71-го элемента постепенно
заполняется пропущенный 4/-подуровень (/14), причем 5с?-электрон
сохраняется только в атомах Gd(Z = 64) и Lu(Z = 71). Затем
у атомов с 72-го по 80-й элемент достраивается ^-подуровень с
аномальным заполнением у Pt и Аи, а с 81-го по 86-й — 6/7-под-
уровень. Следовательно, в результате заполнения четырнадцатью
электронами 4/-подуровня в шестом периоде число элементов
увеличивается до 32 (табл. 24).
Седьмой период полностью не завершен, в нем известно пока
только 19 элементов — от 87 до 105-го. Конструктивно этот
период построен аналогично шестому периоду. Для тория еще не
75
Таблица
22. Распределение электронов в атомах элементов
4-го периода
Z
19
20
21
22
23
24
25
26
27
28
29
30
31
32
33
34
35
36
Элемент
К
Са
Sc
Ti
V
Cr**
Мп
Fe
Со
Ni
Си**
Zn
Ga
Ge
As
Se
Br
Kr
s
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
n = 3
P
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
Уровни и подуровни *
d
_
—
1
2
3
5
5
6
7
8
10
10
10
10
10
10
10
10
rt=4
S
1
2
2
2
2
1
2
2
2
2
1
2
2
2
2
2
2
2
p
1
2
3
4
5
6
d
—
—
—
— ■
—
f
—
—
—
—
—
* Уровни п = 1 и п = 2 в таблице не показаны, так как они у всех атомов построены
одинаково (ls2 2s2p6),
** Отмечены случаи аномального заполнения подуровней; во внешнем подуровне не
два, а только один электрон (см. стр. 72).
доказано наличие в его атоме 5/-электронов *: для него принята
электронная конфигурация 6cF7s2. Элементу с Z = 104,
полученному в лаборатории ядерных исследований в г. Дубне,
руководимой академиком Г. Н. Флеровым, предложено название «кур-
чатовий» (Ки) в честь известного советского физика И. В.
Курчатова. Недавно в СССР и в США получен искусственно элемент
с Z = 105. Его предложено назвать «ганий» — На (США) и
«нильсборий» — Ns (СССР); окончательное название еще не
утверждено.
* Американскому ученому Кенингему удалась обнаружить 5/-электрон
в ионе Th3+.
76
Таблица 23. Распределение электронов в атомах элементов
5-го периода
Z
37
38
39
40
41
42
43
44
45
46
47
48
49
50
51
52
53
54
Элемент
Rb
Sr
У
Zr
Nb*
Mo*
Тс
Ru*'
Rh*
Pd*
Ag*
Cd
In.
Sn
Sb
Те
I
Xe
Уровни и подуровни
л-4
s
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
р
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
d
—
1
2
4
5
5
7
8
10
10
10
10
10
10
10
10
10
f
—
—
—
л =5
s
1
2
2
2
1
1
2
1
1
0
1
2
2
2
2
2
2
2
p
1
2
3
4
5
6
d
—
f
—
" Отмечены случаи аномального заполнения электронами подуровней.
Схема последовательности заполнения электронных уровней
и подуровней позволяет составить принципиальную конструкцию
таблицы периодической системы как классификации атомов по
структуре их электронных оболочек (табл. 25).
Так как максимальная емкость периодов соответствует 32
элементам, то естественной формой таблицы периодической
системы должна быть 32-клеточная (табл. 26), включающая
105 элементов.
В таблице, как и в графике на плоскости, следует различать
два направления: горизонтальное (периоды) и вертикальное
(группы).
В периодической системе семь периодов. Номер периода
указывает на число электронных уровней в атомах элементов
(исключение для 46-го элемента отмечено выше). Все периоды,
кроме первого, попарно содержат одинаковое число (X)
77
Таблица 24. Распределение электронов в атомах элементов
6-го периода
Z
55
56
57
58
59
60
61
62
63
64
65
66
67
68
69
70
71
72
73
74
75
76
77
78
79
80
81
82
83
84
85
86
Элемент
Cs
Ва
La
Се
Рг
Nd
Pm
Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Hf
Та
W
Re
Os
Ir
Pt*
Au*
Hg
Tl
Pb
Bi
Po
At
Rn
Уровни и подуровни
га =4
f
—
2
3
4
5
6
7
7
9
10
11
12
13
14
14
14
14
14
14
14
14
14
14
14
14
14
14
14
14
14
га = 5
s
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
Р
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
6
d
1
1
1
2
3
4
5
6
7
9
10
10
10
10
10
10
10
10
f
—
—
—
—
ra-6
s
1
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
2
1
1
2
2
2
2
2
2
2
p
1
2
3
4
5
6
* Отмечены случаи аномального заполнения электронами подуровней.
Таблица 25. Схема конструкции периодической системы
на основе структуры электронных оболочек атомов
Период ■
И
s' s2
(г)
Число элементов
s s2 р' р6
s' s2 р' р6
(8)
(8)
s'
s'
s2
s2
За
а'
а'
i
„Вклинивание"
- и id-подуровней
d2 d'°
d» a10
к
р>...
р'....
...ре
....ре
(18)
(18)
S1
S1
S2
S2
а'
d'
„Вклинивание"
' itf- и Sf-подуровней
fS f!4
f2 fib
a2
d2
if.:..
d'O
p>...
...Pe
(32)
(32)
элементов, которое можно определить по формулам,
предложенным В. М. Клечковским:
Для нечетных периодов
и- 1, 3, 5, 7
^нечетн. пер == 0,5 (п + 1)
Для четных периодов
п - 2, 4, 6
*четн. пер = 0,5 (« + 2)2
В системе четко выделяются четыре типа элементов: $-, /?-,
й- и /-элементы, характеризующиеся не только сходством
свойств элементов, принадлежащих одной группе (сходство по
вертикали), но и рядом специфических свойств, общих для всех
элементов данного типа (сходство по горизонтали). В каждом
периоде первые два элемента относятся к s-типу (их всего 14, в
том числе Ни Не). Во втором — шестом периодах последние
шесть элементов принадлежат к /?-типу (их 30). В четвертом —
седьмом периодах располагаются d-элементы (их 33); в
шестом — седьмом периодах заняли надлежащее место 28
/-элементов (см. табл. 26).
В вертикальном направлении в группах расположены
элементы— аналоги как по химическим свойствам, так и по
структуре электронной оболочки атомов. Так как элементы-аналоги
последующих периодов отстоят от элементов-аналогов
предыдущих периодов на 8, 8, 18, 18 и 32 места, то через столько же
элементов должно происходить периодическое «повторение»
свойств. Например, в группе IV А атомы элементов углерода,
кремния, германия, олова и свинца различаются числом
энергетических уровней, но не различаются по распределению элек-
79
Таблица 26. Периодическая система химических элементов Д. И. Менделеева (длиннопериодный вариант)
ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
период]
1
2
3
4
5
6
7
ГРУППЫ ЭЛЕМЕНТОВ
IA
НА
3
Li
Na
19
К
37
Rb
55
Cs
87
Fr
s'
4
Be
12
Mg-
20
Ca
38
Sr
56
Ba
88
Ra
s*
IIIB
семейства (VBVBVIBVIIB VIIIB
21
Sc
39
Y
57
La
89
Ac
d1
1
.л..
58
Ce
90
T_h
fs
59
Pr
91
Pa
f3
60
Nd
92
и
r*
6t
Pm
93
Np
fs
62
Sm
94
Pu
fs
63
Eu
95
Am
f7
64
Gd
96
Cm
f7d>
65
тъ
97
Bk
fS:
66
Dy
98*
Cf
f'O
,67.
Ho
99
Es
r"
68
Er
100
Fm
fn
69
Tm
101
Md
ft3
70
Yb
102
(No)
r»
22 23
Ti V
40 41
ZrNb
71 72 73
^Lu Hf Та
103 104 105
(Lr)Ku
fV d2 d*
1 1
24 25 26 27 28
CrMnFe CoNi
42 43 44 45 46
Mo Tc Ru Rh £4
74 75 76 77 78
W Re 0s Ir PJ
106 107 108 109 110
d* d5 d6 d7 ds
ГЖ1ТГ
ib iib|iiiaiva|va|v[a
5
В
13
AI
29 30 31
Cu Zn Ga
47 48 49
Aar Cd In
79 80 81
AuHgTl
111 112 113
ds dm p'
6
с
14
Si
32
Ge
50
Sn
82
Pb
114
P!
7
N
15
P
33
As
51
Sb
83
Bi
115
P3
8
0
16
s
34
Se
52
Те
84
Po
116
P"
VI1AVIIIA
i
H
9
F
17
CI
35
Br
53
Г
85
At
117
P5
2
He
10
Ne
18
Ar
36
54
Xe
86
Rn
If8
PS
^Ж1^^Ш
тронов на внешнем уровне, т. е. обладают одинаковой
конфигурацией внешнего электронного уровня, — s2p2. В системе нет
больше ни одного элемента, в атоме которого была бы
указанная конфигурация внешнего электронного уровня.
2s2p2 .
3s2p2
4s2p2 (s*p*\
5s2p2
6s2p2
Группы нумеруются двояко: группы s- и р-элементов
римскими числами с литерой «А», а d-элементов— с литерой «В».
Номер группы соответствует числу внешних или валентных
электронов в атоме. Элементы /-типа — лантаноиды (58—71) и
актиноиды (90—103)—характеризуются переменной
валентностью, первые от двух до четырех, а вторые — от двух до семи
(недавно в СССР получены семивалентные соединения
нептуния и плутония). Они представляют два семейства и не
отнесены к каким-либо группам. Элементы групп кобальта и
никеля, проявляющие валентность от двух до шести, но не выше,
включены условно в VIIIB-группу, хотя для этого нет
убедительных оснований. Их иногда, вместе с элементами группы
железа, называют триадами, так как в каждом периоде (4-, 5- и
6-м) в VIIIB-группу отнесено по три элемента. Для элементов
«нулевой» группы принято обозначение VIIIA, так как за
последние десять лет синтезировано большое число соединений этих
элементов и в некоторых из них валентность достигает значения
восьми. К этой группе относят и гелий, хотя, в отличие от других
благородных газов, он является элементом s-типа.
В атомах d-элементов, как правило, на внешнем уровне
содержится по два электрона за исключением тех элементов, которые
в таблице подчеркнуты одной чертой. У последних наблюдается
энергетически выгодный «провал» одного электрона с внешнего
уровня на d-подуровень внутреннего соседнего уровня, что
происходит при достройке этого подуровня до пяти или десяти
электронов, т. е. до состояния, когда все орбитали заняты
каждая одним (половина максимальной емкости) или когда они
заняты каждая парой электронов (максимальная емкость
подуровня). В атоме палладия (Z = 46) происходит «двойной
провал» электронов — его символ в таблице подчеркнут двумя
чертами. Поэтому у атомов d-элементов — аналогов электронная
структура валентных подуровней не всегда тождественна. Так,
у атомов элементов VIB-группы Cr, Mo, W она различна: 3d4sl,
&Z
AZ=-18
\
Si
AZ=18
У
32
,Ge
\
AZ = 32
/50
\
82
Sn
РЬ
81
4d55sl и 5d46s2, соответственно. Этим различием в строении
электронной оболочки обусловлены некоторые особенности их
химических свойств, но характеристичная валентность, определяемая
суммарным числом электронов s-, d-типа, у всех атомов
одинакова и равна шести.
Структура валентных электронных уровней у атомов
элементов IIB-, ШВ-, IVB- и VIIB-групп одинакова.
Об особенностях структуры электронных оболочек атомов
лантаноидов и актиноидов будет сказано ниже.
Таким образом, становится ясным, что идеальная
последовательность заполнения электронами оболочки атома по
возрастающему значению главного квантового числа п в
действительности распространяется лишь на элементы первых трех
периодов от водорода (Z = 1) до аргона (Z = 18). Эта
последовательность полностью отвечает принципу Паули и получила название
идеальной схемы заполнения.
Начиная с 19-го элемента — калия, несмотря на то что в его
атоме Зс^-подуровень остается вакантным, последний электрон
занимает 45-подуровень. Этот же подуровень заполняется
вторым электроном в атоме кальция (Z = 20). Только с атома 21-го
элемента — скандия — начинает заполняться вакантный Зс?-под-
уровень (табл. 27).
Таблица 27. Заполнение электронами внешних подуровней
атомов элементов с Z, равным 18, 19, 20 и 21
Z
18
19
20
21
Элемент
Аг
К
Са
Sc
Is
2
2
2
2
2s
2
2
2
2
2р
6
6
6
6
3s
2
2
2
2
Зр
6
6
6
6
ы
—
—
1
4s
1
2
2
4р
—
—
ы
—
—
4f
—
—
Реальная схема заполнения электронных оболочек атомов,
начиная с калия, подвергает сомнению доминирующую роль
главного квантового числа п.
Советский ученый В. М. Клечковский предложил
распределять электроны в атоме по сумме главного (п) и орбитального
(/) квантовых чисел, т. е. по (n-f-/), названной им группой
или состоянием.
С увеличением порядкового номера электроны в атоме
заполняют квантовые уровни последовательно, начиная с групп
уровней с меньшим значением суммы (п -f- /) до групп с
большим значением:
Увеличение Z >
п + 1 1 2 3 4 5 6 7 8
Порядок заполнения :—■ >
От меньшего значения (п -f- /) к большему
82
В пределах одной группы (п + /) подуровни заполняются от
меньшего значения п и большего значения / к большему
значению п и меньшему значению /. Например, для группы (п + I) = 5
порядок заполнения электронами подуровней выполняется в
направлении слева направо:
(п + 1) 5
п 3 4 5
/ 2 1 О
Подуровни 3d 4р 5s
Порядок заполнения . . >
В атомах элементов отдельно взятого периода происходит
заполнение s-подуровня со значением (п-\-1), равным номеру
периода, a BcexJостальных подуровней со значением {п-\-1), на
единицу большим номера периода:
п + 1
Заполняемый подуровень
4
Ър
3
4s
1
3d
4
5
Ар
5s
5
На основании этих элементарных правил В. М. Клечковского
определена последовательность заполнения электронами
подуровней в атомах всех элементов:
п + 1 123 4 5 6 7 g
1~И-II II II II II 1 I 1
Подуровни . . Is 2s 2p 3s Зр 4s Ы ip 5s 4d Ър 6s 4f Ы Ър 7s 5f 6d To
l_l I 1 I 1 | 1 I 1 I 1 / _|
Периоды ...12 3 4 5 6 7 .
Учитывая максимальную емкость подуровней s2, p6, rf10, /14,
получим следующие числа элементов в периодах: 2, 8, 8, 18, 18, 32 и
32. Эти числа могут быть найдены и по формулам В. М.
Клечковского, о чем упоминалось раньше.
В. М. Клечковский предложил формулу для определения
порядкового номера элемента Zi, в атоме которого появляется
первый электрон с данным орбитальным квантовым числом /.
Используя ее применительно к двум первым электронам (2>Z;,
заполняющим данный подуровень в атомах, автор по формуле
l2)Zt = Ve (2/ + 1)3+'/б(П-20
установил, что такими элементами являются 2Не, 6С, 22Ti, ssCe.
Действительно, в атомах этих элементов появляются первые два
<s(He), два р(С), два rf(Ti) и два /(Се) электрона. Особенно
важно это для церия, так как этим было подтверждено, что в его
атомах содержатся два /-электрона, а не один, как предполагали
раньше.
Однако нахождение Z; есть лишь частный случай более
общей задачи о связи порядкового номера (Z) с числом электро-
83
нов (Ni), занимающих в невозбужденном атоме уровни с
данным орбитальным квантовым числом. Нахождение начала (ах)
и конца (Ьх) заполнения электронами данного подуровня
сводится к определению координат точек (рис. 8), отвечающих
определенным значениям Z(ax), Z(bx) и Nt, где Ni = (bx) — (ах) —
суммарное число электронов в данном подуровне. Пользуясь
системой из двух уравнений, отдельно для четных и нечетных
значений х(х = 1, 2, ..., 7), Клечковский показал, что можно
легко вычислить значения порядковых номеров тех элементов,
в промежутке между которыми должен заполняться в атоме
подуровень с данным / (/ = 0, 1, 2, 3).
Уравнения для четных х:
Z (ах) = '/. (2/ + x)(2l + x+l)(2l + x + 2)-2(l+ I)2
Z (Ьх) = '/«(И + х) (2 + х + А) (Ш + х + 2) - 2Р
Уравнения для нечетных х:
Z (о,) = Ув [(2/ + xf - (21 + х)) + % (2/ + х + I)2 - 2 (/ + 1 )2
Z (Ьх) = '/в [(2/ + хУ - (21 + х)] + Чг (2/ + х + I)2 - 2/2
Вычисленные по этим формулам и фактические значения Z
вполне удовлетворительно согласуются (табл. 28).
Любая пара соседних чисел показывает границы
комплектования электронами определенного подуровня в атомах.
Например, числа 30 и 36 (они набраны
жирным шрифтом) означают, что первый
/?-электрон появляется в атоме
следующего 31-го элемента — галлия, а
полное заполнение р-подуровня
шестью электронами заканчивается в
атоме 36-го элемента — криптона.
Числа, отмеченные звездочкой,
обнаруживают несоответствие между
вычисленными и фактическими
значениями. Первые /-электроны
появляются в атомах 58 и 91-го элементов, а не
57 и 89-го, непосредственно
следующих за 56 и 88-м. Истинная
последовательность заполнения электронами
подуровней в 6-м уровне такова —
отличается от последовательности
Рис. 8. Координаты начала
и конца заполнения
подуровней электронами.
ввВДЦр&Р-кДО и
6s24/I45d106yO6, найденной В. М. Клечковским.
Кроме того, как было показано выше, известны отступления
от закономерного заполнения электронами подуровней,
вследствие «провала» электронов (см. подчеркнутые символы в
табл. 26).
Если раньше считали, что энергетическое состояние
электрона в многоэлектронном атоме определяется значением глав-
84
Таблица 28. Граничные значения Z при данном /
по В. М. Клечковскому
X
1
2
3
4
5
6
7
s, 1
z(ax)
0
2
10
18
36
54
86
= 0
Z(bx)
2
4
12
20
38
56
88
р, 1
Чах)
4
12
30
48
80
(112)
—
= 1
z(bx)
10
18
36
54
86
(118)
—
d, 1
Ч«х)
20
33
70
(102)
—
—
—
=2
Z(»x)
30
48
80
(112)
—
—
—
f, l
z(ax)
56*
88*
(118)
—
—
—
—
= 3
z(bx)
70
(102)
—
—
—
—
—
ного квантового числа п, то в работах В. М. Клечковского было>
показано:
«...В периферической части электронной оболочки многоэлектронных
атомов вместе с увеличением числа экранирующих электронов зависимость
энергетического уровня от орбитального квантового числа I настолько возрастает,,
что в ряде случаев уровни с большим п, но малым I оказываются
энергетически выгоднее уровней с меньшим значением п, но большим h *.
Правило В. М. Клечковского — правило последовательного'
заполнения электронами (п + /) -групп — является серьезным,
теоретическим обоснованием периодической системы Д. И.
Менделеева.
Важное значение для химии имеет понятие о
конфигурационном индексе {<%w), впервые введенное В. М. Клечковским.
Величина &к — характеризует число электронов, недостающих
до полного заполнения всех начатых заполняться (п+ /)-групп:
в основном состоянии атома. Рассмотрим величину Шк для.
атома бора, имеющего электронную конфигурацию \s22s22pl:
(л + 0 1 2 3
I—I I—I I 1
Подуровни Is 2s 1p 3s
Число возможных электронов . . 2 2 6 2
Фактическое число электронов .2 2 1 —
Число недостающих электронов. 0+ 0+ 5+ 2 = 7(gK)
Среди других элементов периодической системы аналогами бора-
будут те, которые имеют конфигурационный индекс, равный 7.
К таковым относятся: алюминий, галлий, индий и таллий,
которые вместе с бором составляют IIIA-группу элементов.
До сих пор принималось, что химические аналоги являются
в то же время электронными аналогами. Для большинства эле-
* Клечковский В. М, Распределение атомных электронов и
правило последовательного заполнения (п + I) -групп, Атомиздат, 1968, стр. 23.
85-
ментов это утверждение является справедливым, так как у их
атомов электронная конфигурация одинакова (различны только
значения главных квантовых чисел). Однако у р-яда химических
аналогов электронные конфигурации могут различаться. К таким
элементам, как мы уже знаем, относятся хром (ЗйЧя1),
молибден (4d55s') и вольфрам (5d46s2). Несмотря на то что
электронные конфигурации указанных атомов отличаются, они являются
химическими аналогами. Это подтверждается тождественным
значением их конфигурационного индекса — 14.
Из 105 известных элементов В. М. Клечковский отмечает
18 отклонений от его правила, определяющего электронную
конфигурацию атомов и, соответственно, значение
конфигурационного индекса. Например, конфигурационный индекс лантана и
актиния принят равным 31 с учетом того, что в их атомах
имеется по одному f-электрону, а в действительности эти атомы
не содержат электронов данного типа: их электронная
конфигурация — cPs1.
Установление сложной структуры электронной оболочки
атомов позволило выявить новые, ранее неизвестные
характеристики и свойства: например, энергию ионизации, сродство к
электрону, радиус атома и др.
ХИМИЧЕСКИЕ СВОЙСТВА
НЕЙТРАЛЬНЫХ АТОМОВ
ЭЛЕМЕНТЫ - ВОССТАНОВИТЕЛИ
И ЭНЕРГИЯ ИОНИЗАЦИИ
Наиболее характерными химическими свойствами нейтральных
атомов являются окислительно-восстановительные.
Восстановителями называются элементы, атомы которых при
химических реакциях отдают электроны (доноры электронов). На
внешнем уровне этих атомов содержится 1, 2 или 3 электрона.
К типичным восстановителям относятся s-элементы (кроме Н и
Не), d-, f- и четыре ^-элемента из IIIA-группы (алюминий,
галлий, индий и таллий).
При потере электронов атомы-восстановители (обозначим их
условным символом Me) переходят в положительные ионы:
Me — пе~ —> Ме"+
Чтобы оторвать электрон от атома, необходимо затратить
энергию, называемую энергией ионизации. Энергия
ионизации выражается в электрон-вольтах (эв).
Ионизационным потенциалом (/) называется напряжение
электрического поля в вольтах (в), при котором атом превращается в
положительный ион. Ионизационный потенциал численно равен
энергии ионизации. Следует различать первый (/i), второй (/2),
третий (/з), ..., п-ый (/„) ионизационные потенциалы,
отвечающие отрыву первого, второго, третьего, ..., n-го электрона от
атома. Чем легче электрон отрывается от атома, тем меньше
величина ионизационного потенциала.
Следовательно, ионизационный потенциал является одной из
основных количественных характеристик восстановительных
свойств нейтральных атомов.
Сравним величины /i трех элементов, стоящих рядом в
таблице Менделеева, например лития, бериллия и бора (табл. 29).
Как видно, от атома лития относительно легко отрывается один
внешний электрон, от атома бериллия—два и от атома бора —
87
Таблица 29. Ионизационные потенциалы лития, бериллия и борате
Z
3
4
5
Элемент
Li
Be
В
Электронная
конфигурация
ls22s'
\s22s2
\s22s22pl
h
338,5
и
216,6
258,1
h
121,8
153,1
37,75
h
75,26
18,12
25,00
/i
5,39
9,32
8,30
три внешних электрона (см. жирную зигзагообразную
ливню). *
Если построить график зависимости значений h для атомов
всех элементов от их порядкового номера, то как видно (рис. 9),
ионизационные потенциалы меняются периодически, достигая
Не
о
1
/
]
t
1
f*
hi
г'
■V*''
iNe
AT
/
/
Ч
%а
К
Кг
V
Э
'
еа
/
?
Rb
. м
y#j
[П
Хе
1
l/
h
Г
Cs
лГ"
V>5
Gd
Hoi
■/
ь=^-^
Г
1 ''
г\
T1 о
Ка
1 '
i
I I I I I i i i ) i
10 20 30 Ю 50 ВО 70 ВО 90 Z
Рис. 9. Зависимость значений ионизационных потенциалов (It)
элементов от их порядкового номера (Z).
максимального значения через 8, 8, 18, 18 и 32 элемента. В точ-
.ках максимума на кривой расположены благородные газы,
самые слабые восстановители, а в точках минимума — атомы
щелочных металлов, наиболее сильные восстановители. Таким
образом, восстановительные свойства элементов изменяются
периодически. В периодах, от атома щелочного металла к атому
благородного газа, восстановительные свойства элементов
ослабевают, что подтверждается увеличением значений Л. В
пределах каждого периода участок кривой выражается не прямой
* Энергия отрыва электронов каждого следующего внутреннего уровня
-значительно превышает энергию отрыва электронов внешнего уровня, что
служит экспериментальным доказательством «слоистости» структуры
электронной оболочки атомов.
«8
линией, а ломаной, что свидетельствует о сложной зависимости
между Л и Z. Например, во втором периоде ионизационный
потенциал U элементов изменяется следующим образом:
9,32
Л, в . .
Элементы
5,39
L1
Be
8,30
В
11,26
С
Заполнение подуровней
5
t
Р
- - -
s р s р
ц— kit - -
S
р
\Ги т -
/„ в . . .
Элементы
14,53
N
13,61
О
Заполнение подуровней
1*1 р
Mi + t
17,42
F
S p
21,56
Ne
ШШ ШШЗ ЕМВ
Для бора и кислорода величины ионизационных потенциалов
уменьшаются. Это объясняется тем, что отрыв одного непарного
р-злектрона от атома бора происходит легче, чем s-электрона
с заполненного s-подуровня атома бериллия. Точно также
энергия отрыва одного парного р-электрона атома кислорода
меньше энергии отрыва одного электрона с наполовину заполненного
/ьподуровня атома азота. Отрыв электронов с полностью
заполненного подуровня требует значительной энергии. Именно
наличием замкнутых электронных группировок в атомах
S S
f|S* fjj
р
ННН
s*p»
Be Ne
объясняется большая величина их ионизационных потенциалов..
Подобные отклонения от линейной зависимости / —/(Z)
наблюдаются и у элементов других периодов.
Величина ионизационного потенциала зависит не только от
того, как располагаются электроны по уровням и орбиталям, но-
также и от радиуса атома, причем в значительной мере. В
одном и том же периоде атомы элементов имеют одинаковое число
электронных уровней, но с увеличением заряда ядра
увеличиваются силы притяжения и атом как бы сжимается, т. е.
радиусы атомов в периоде уменьшаются, ионизационные потенциалы!
возрастают, а восстановительные свойства ослабевают.
Следует отметить, что, говоря о радиусах атомов, имеют в-
виду кажущиеся атомные радиусы, определяемые из расстояния
между центрами атомов в кристаллах элементарных веществ
(при этом предполагается, что атомы, имеющие шаровую форму,,
соприкасаются своими сферами). Как и следовало ожидать,
кажущиеся радиусы атомов должны изменяться периодически в-
зависимости от порядкового номера (рис. 10). На кривой в
точках максимума расположены атомы щелочных металлов,
отстоящие один от другого на 8, 8, 18, 18 и 32 места. В длинных
89-
периодах изменение величин радиусов атомов характеризуется
сложной кривой; относительно меньшие радиусы отвечают
атомам d-элементов..
Во всех группах с индексом А, в группе ШВ и у f-элементов
радиусы атомов увеличиваются сверху вниз, значения
ионизационных потенциалов уменьшаются,- соответственно возрастают и
90 Z
Рис. 10. Зависимость кажущегося радиуса атома (г) от
порядкового номера элемента (Z).
восстановительные свойства их. Например, для элементов IA-
группы значения г и /t изменяются так:
Элементы .... Li Na К Rb Cs
г, А 1,57 1,86 2,36 2,48 2,62
/i, в 5,39 5,14 4,34 4,18 3,89
Цезий является наиболее сильным восстановителем.
В группах d-элементов, кроме IIIB-группы (например, в
VIB-группе), значения 1\ сверху вниз возрастают: Сг — 6,76;
Мо — 7,10; W — 7,99, соответственно ослабевают и
восстановительные свойства.
Таким образом, величина ионизационного потенциала
зависит от следующих факторов: заряда его ядра, радиуса атома,
строения электронной оболочки (наличия во внешнем уровне
непарных и парных электронов, экранирования внешнего
электрона остальными электронами атома).
ЭЛЕМЕНТЫ-ОКИСЛИТЕЛИ И СРОДСТВО К ЭЛЕКТРОНУ
Элементы, атомы которых при химических реакциях принимают
электроны (акцепторы электронов), называются
окислителями. Они содержат во внешнем уровне от четырех до семи
90
электронов. Принимая электроны, эти атомы переходят в
отрицательное валентное состояние (некоторые — в отрицательные
ионы) по схеме
R + me- —> Rm-
К окислителям относятся все ^-элементы, кроме благородных
газов и четырех элементов IIIA-группы (алюминия, галлия,
индия и таллия). Сюда следует отнести также водород, атом
которого может принять один электрон. В этом отношений водород
аналогичен галогенам; поэтому в периодической таблице (см.
табл. 26) он помещен в VIIA-rpynny.
Присоединение электрона сопровождается выделением
энергии. Количество энергии, выделяющейся при присоединении
электрона к атому, называется сродством к электрону, Е
(ккал/г-атом или эв/атом). Следует отметить, что
экспериментально полученные значения Е несколько различаются, поэтому
ниже приведены средние величины Е (в эв/атом):
Период 1 Н
0,747
» 2 В С N О F
0,33 1,12 0,5 1,47 3,58
» 3 Si Р S С1
1,46 0,77 2,15 3,76
» 4 Вг
3,54
» 5 I
3,29
В закономерном изменении величин Е есть ряд отступлений
'(для N и Р). Однако в общем сродство к электрону возрастает
в периодах слева направо (2 и 3 периоды) и, следовательно, от
элемента к элементу увеличивается окислительная активность.
Из указанных данных следует, что наиболее активным
окислителем является нейтральный атом хлора. Если сравнивать
окислительную активность молекулярного фтора и хлора (F2 и С12),
то первый активнее второго, так как энергия разрыва молекулы
на атомы у фтора меньше, чем у хлора, а энергия образования
связей X—F больше, чем у X—О. Но в отличие от других р-
элементов, фтор является только окислителем, что связано с
высоким значением энергии ионизации, тогда как другие
элементы VIIA-группы могут проявлять не только окислительные,
но и восстановительные свойства. Например, водород и иод
обладают двойственной химической природой:
Н+1е~ = Н~ 1+1е~ = 1~
окислители
Н_1<Г = Н+ 1-1е- = 1+
восстановители
Наличие на кривых зависимости ионизационных потенциалов
и радиусов от порядкового номера максимумов и минимумов
91
объясняется закономерностями построения электронной
оболочки атомов, а также экранированием ядра атома
электронами, т. е. ослаблением его взаимодействия с внешними
электронами. Экранирование зависит от типа электронов: s- и
р-электроны сильно экранируют ядро, а d-электроны — очень
слабо.
ВАЛЕНТНОСТЬ И ВТОРИЧНАЯ ПЕРИОДИЧНОСТЬ
Все известные элементы занимают в периодической системе
элементов свои определенные места в соответствии с зарядом ядра
;их атомов и строением электронной оболочки. Но положение
некоторых элементов в периодической системе пока однозначно
не установлено и по этому вопросу до сих пор еще ведутся
дискуссии. К таким элементам относятся водород, благородные
газы, элементы триад VIII группы, лантаноиды и актиноиды.
Водород
Водород по электронной конфигурации атома (Is1) относится
к s-элементам, а потому до недавнего времени его обычно
включали в первую группу периодической системы. Водород, как и
щелочные металлы, одновалентен и проявляет
восстановительные свойства. Атомы щелочных металлов и водорода, теряя по
•одному электрону, должны переходить в положительные ионы.
Действительно, кристаллические решетки соединений щелочных
металлов относятся к ионному типу, но неизвестно ни одного
соединения ионного типа, содержащего ион Н+ (водород
образует соединения с ковалентными — неполярными или
полярными— типами связи). Обычно указывают на наличие ионов Н+
в кислотах, но растворы последних содержат гидратированные
ионы водорода-—Н+-Н20 или Н30+ (гидроксоний-ион).
Отличает водород от щелочных металлов и его способность
проявлять окислительные свойства.
В гидридах, соединениях водорода с металлами (NaH,
ОаН2), водород находится в виде отрицательного иона Н~, что
«роднит» его с галогенами, образующими с металлами галиды
(Na+Cl", K+F" и др.).
Если сравнить ряд свойств водорода, лития и натрия, фтора
и хлора (табл. 30), то нетрудно видеть, что большинство свойств
водорода ближе к свойствам галогенов, чем к свойствам
щелочных металлов.
К тому же выводу можно прийти, сравнивая энергии
кристаллических решеток фторидов и гидридов щелочных металлов
(рассчитанные М. X. Карапетьянцем), теплоты испарения
водорода и галогенов с теплотами испарения благородных газов,
температуры кипения и теплоты испарения водорода и галоге-
новодородов и др.
92
Таблица 30. Сравнение некоторых свойств водорода, натрия
и лития, фтора и хлора
Свойства
С1
Валентность
отрицательная . . . .
положительная низшая
Ионизационный
потенциал, в
Относительное сродство
к электрону
Электроотрицательность *
Состав молекул в парах .
Тип связи X — X
Тип кристаллической
решетки
Агрегатное состояние ** .
Температура, °С
плавления
кипения
Электропроводность . . .
+ 1
5,14
0,38
0,90
+ 1
5,39
0,40
0,95
—1
+ 1
13,6
1
2,15
-1
17,42
Одноатомные
Металлическая
Металлическая
Твердое Твердое
2,32
3,90
Двухатомные
Ковалентная
-1
+ 1
13,01
1,43
3,10
Молекулярная
97,8
883
179
1370
Газ
-259
—253
Газ
—220
— 188
Газ
-101
-34
Проводят ток
Не проводят тока
* Электроотридательность (ЭО), равная полусумме энергии ионизации и сродства
к электрону, приближенно выражает энергию притяжения данным атомом связующих
электронов. Наибольшее значение ЭО имеет атом фтора.
** Нормальные условия.
Конечно, нельзя считать водород абсолютным аналогом
галогенов, ибо водород обладает рядом специфических свойств,
обусловленных особой структурой электронной оболочки его
атома; у атома водорода нет внутренних электронных уровней.
Химическая природа водорода, в известной мере,
двойственна. И все же более оправдано отнесение его к VIIA-rpynne
периодической системы элементов, что и делается ныне в
большинстве вариантов таблиц периодической системы.
Благородные газы
К благородным газам теперь относят гелий, неон, аргон,
криптон, ксенон и радон, образующие VIHA-группу периодической
системы. Выделены они были позднее, чем Д. И. Менделеев
открыл периодический закон и опубликовал свою систему, т. е. в
конце XIX начале XX веков.
Гелий впервые был обнаружен в 1868 г. спектроскопическим
методом при исследовании протуберанцев Солнца, а
впоследствии он был выделен из ряда радиоактивных минералов при
нагревании последних. Затем Рамзаю со своими учениками
удалось из воздуха получить аргон, неон, криптон и ксенон.
93
Наконец, в 1900 г. стало известно о существовании нового
газообразного элемента — радона. Попытки получения каких-либо
соединений этих газов не дали положительных результатов и их
назвали «инертными газами».
Открытие этих элементов внесло некоторое недоумение и
казалось, на первых порах, наносило жестокий удар по
незыблемости периодического закона. Д. И. Менделеев, абсолютно
уверенный в правильности периодического закона и не находивший
места для новых элементов в своей системе, сначала сомневался
в их индивидуальности. Он писал:
«Но все же пока не будут получены какие-либо их соединения... нельзя
быть совершенно уверенным в точном описании природы описываемых газов».
Отказавшись вначале от внесения этих «элементов» в
систему, он впоследствии, по предложению Рамзая и Эрреры, ввел
в систему «нулевую» группу, поместив в нее все инертные газы.
До конца своих дней Менделеева не покидала уверенность в
том, что инертные газы должны образовывать химические
соединения. Он отмечал:
«•...Я молчал, когда мне не раз выставляли аргоновые элементы (так
Менделеев называл инертные газы. — В. С), как укор периодической системе,
потому что я поджидал, что скоро обратное всем будет видимо».
Пророчество Менделеева сбылось лишь в 1962 году.
Изучение электронной структуры оболочки атомов
подтвердило необыкновенную устойчивость внешнего электронного
уровня у атомов инертных газов, что объясняется замкнутостью
его (суммарный спин электронов равен нулю):
н
ннн
Не Ne,Ar,Kr,Xe.Rn
Отсутствие непарных электронов в атомах инертных газов
объяснило невозможность образования ими соединений с кова-
лентной связью, т. е. неполярных или полярных молекул (кстати,
этим же объясняется одноатомность их молекул). Их атомы
обладают наибольшими значениями ионизационных
потенциалов. Если невозможно при химических реакциях оторвать
электрон от атома фтора (Л = 17,42 в), то это тем более
неосуществимо для следующего за фтором атома неона (Л = 21,56 в).
Отсюда следует, что атомы инертных газов неспособны
образовывать соединения с ионными связями.
Таким образом, восемь электронов внешнего уровня атома
или электронный октет символизировали особую устойчивость
атомных и ионных структур. В 1916 г. Косселем было
высказано положение, что атомы при химических реакциях, отдавая
избыточные или приобретая недостающие электроны, стремятся
94
принять электронную конфигурацию атома ближайшего
инертного газа, другими словами, «имитировать» этот атом.
Например, взаимодействие натрия с фтором сопровождается
переходом электрона от атома натрия к атому фтора, причем
образовавшиеся ионы приобретают электронную конфигурацию атома
неона:
1е"
н и н t+ t —f-u н н н*—н н н +
Na
Ne
Электростатическое взаимодействие противоположно
заряженных ионов Na+ и F~ приводит к образованию ионной молекулы
Na+F'.
«Имитация» атомов инертного газа используется Льюисом
для объяснения механизма образования ковалентной связи.
Атомы хлора, имеющие во внешнем уровне по семь электронов,
соединяются между собой, образуя из непарных электронов
общую (поделенную) пару электронов, характерную для
ковалентной связи; в молекуле хлора каждый атом окружен октетом
электронов («имитация» атома аргона):
:ci. + су. = (ego)
Несмотря на то что электронный октет не всегда соблюдается
при образовании соединений, это положение было возведено
в ранг какого-то «абсолюта». Именно из-за этого химики с
уверенностью считали, что инертные газы не могут образовать
соединений с ковалентными и ионными связями. Валентность их
приравнивалась нулю.
И все же в 1962 г. канадскому ученому Бартлетту удалось
получить первое ионное соединение ксенона Xe+[PtF6]~. Если
сопоставить ионизационные потенциалы атомов инертных газов и
соседних элементов:
С I N О F Ne
11,26 ! 14,53 13,61 17,42 21,56
р
10,48
S
10,36
Se
9,75
С1
13,01
Вг
11,84
I
10,45
Аг
15,76
Кг
14,00
Хе
12,13
Rn
10,75
95
то видно (см. пунктирную линию), что у ксенона /i меньше, чем
у азота, от атома которого можно оторвать один электрон с
образованием одноположительного иона N+. Следовательно, одно-
положительный ион Хе+ получить легче и надо только подобрать
соответствующий сильный окислитель. В качестве такового
Бартлетт избрал гексафторид платины (PtF6).
Впоследствии ученые ряда стран, в том числе и СССР,
приступили к синтезу различных соединений инертных газов,
изучению их строения, установлению природы химической связи
в молекулах и исследованию различных свойств как физических,
так и химических. За истекшие десять лет было получено
большое число соединений криптона, ксенона и радона (табл. 31).
Таблица 31. Состав некоторых полученных соединений Кг, Хе и Rn
Класс соединений
Фториды ....
Оксфториды . . .
Комплексные
соединения . . .
Кг
KrF2, KrF4
KrOF2
H2Kr04
ВаКг04
Kr[SbF4]2
Известные соединения
Хе
XeF2> XeF4, XeFe, XeF8
XeOF2, Xe02F2, XeOF4
Xe03, Xe04
H2Xe04> H4XeOs, H6Xe06) H4Xe04
K2Xe04> Na6XeOe, Ba2Xe05, Na4Xe04
[XeF]J[TiF6]2-, XejtSiFe], Xe[PtF6]
Rn
RnF4
Соединения инертных газов представляют значительный
практический интерес. Они могут быть использованы в качестве
сильных окислителей, фторирующих агентов, а некоторые из
них как взрывчатые вещества (Хе03).
Из всех соединений инертных газов больше всего изучены
фториды. В настоящее время их получают синтезом из фтора и
соответствующего инертного газа, взятых в различных
объемных соотношениях. При проведении синтеза варьируют
температуру и давление. Обменными реакциями фторидов с водой
(гидролиз) можно получить оксфториды, оксиды и кислоты, а
нейтрализацией последних — соли.
По составу продуктов синтеза можно заключить, что
инертные газы образуют соединения с валентностью, равной 2, 4, 6 и
8. До сих пор не получены соединения гелия, неона и аргона.
Состав единственного фторида радона окончательно не
установлен, так как из-за большой радиоактивности радона приходится
работать с микроколичествами вещества.
Как правило, соединения, в которых элементы проявляют
высокую валентность, обладают ковалентным типом связи. Для
того чтобы атомы инертных газов, у которых в основном состоя-
96
нии нет непарных электронов, вступали во взаимодействие,
необходимо возбудить электроны, а это возможно только, если
имеются свободные орбитали и на возбуждение затрачивается
мало энергии. Легче всего возбуждаются атомы радона,
труднее — аргона, а атомы гелия и неона возбудить нельзя, так как
у них нет свободных орбиталей.
Таким образом, «инертность» этих элементов, обусловленная
«необычайной» устойчивостью электронного октета, и нулевая
валентность их (кроме гелия и неона) оказались иллюзорными.
Термин «инертные газы» ныне заменен на термин
«благородные газ ы», «аэрофилы» или «аэрогены» (но не один из этих
терминов нельзя признать удачным). Так как для этих газов
известны соединения с валентностью 8, они должны быть включены
в VIIIA-группу периодической системы на правах полноправных
элементов, обретших свою химическую индивидуальность.
Триады элементов VIII группы
Осенью 1870 г. Д. И. Менделеев, исходя из необходимости
размещения в больших периодах по 17 элементов в семи группах,
ввел в новый вариант системы VIII группу с включением в нее
трех триад элементов: Fe—Со—Ni (4-й период); Ru—Rh—Pd
(5-й период) и Os—Ir—Pt (6-й период). В соответствии с
номером группы эти элементы должны проявлять в соединениях
характеристическую валентность, равную 8, и, в частности,
образовывать с кислородом высший окисел типа R04. В
действительности только для рутения и осмия были получены
соединения Ru04 и Os04, отвечающие характеристической
валентности этих элементов.
Что касается всех других группа
элементов этой группы, то они
в соединениях могут проявлять
любую валентность, но не
выше 6.
Можно было предположить,
что для семи элементов из
девяти соединения с
максимальной валентностью не удавалось
получить. Были предприняты
(в 1926—1931 годах) экспериментальные работы по получению
восьмивалентных соединений железа, кобальта и никеля. По
началу даже казалось, что такие соединения получены, но
вскоре эти результаты были опровергнуты. Невозможность
получения таких соединений была впервые обоснована советским
ученым Б. Ф. Ормонтом.
Первым должен быть решен вопрос: почему железо, в
отличие от рутения и осмия, не образует восьмивалентных
соединений?
Fe
2, 3, в
Ru
2, 3, 4, 5, 6, 8
Os
2, 3, 4, 5, 6, 8
Со
2, 3, 4
Rh
3, 4, 5, 6
lr
2, 3, 4, 5, в
Ni
2. 3, 4
Pd
2, 4
Pt
2, 4, 5, в
4 Зак. 39,
97
Электронная конфигурация валентных подуровней этих
атомов в основном и возбужденном состояниях следующая:
Fe
Основное
состояние
Возбужденное
состояние
t+
и
t
t
3d
t
t
f
t
t
t
4s
И
t
t
4p
Ru
Основное
состояние
Возбужденное
состояние
Os
Основное
состояние
Возбужденное
состояние
И
т
т +
т
4d
т
т
1
т
I
.f
5d
тт
т
t
т
f
1
т
t
1
t
lL
t
4/
5/
1
5s
t
t
6s
H
t
5/,
6p
Jj
У всех этих атомов число валентных электронов равно 8. У
атома железа, как элемента четвертого периода, свободных орбита-
лей в третьем энергетическом уровне нет, поэтому при
возбуждении возможен лишь переход электронов с 45-подуровня на
свободную орбиталь 4/?-подуровня, что приводит к
образованию шести непарных электронов и максимальная валентность
железа достигает значения 6. У атомов рутения и осмия
остаются незаполненными внутренние 4/- и 57-подуровни
соответственно, поэтому для них возможно возбуждение не только
с 5s- и бя-подуровней на подуровни Ър и 6/7, но и с Ad- и Ы-
подуровней на 4/- и 5/-подуровни. Это тем более вероятно
потому, что энергии соответствующих подуровней близки друг
к другу (см. рис. 7). В результате такого двойного
возбуждения в атомах появляется по восемь непарных электронов и
элемент приобретает способность к проявлению валентности 8.
Требует ответа и второй вопрос: можно ли ожидать для
кобальта и никеля соединений с максимальной валентностью?
Из сопоставления электронных конфигураций атомов этих
элементов в основном и возбужденном состояниях
Со,
Основное
состояние
'збужленное
состояние
Ni
Основное
состояние
Возбужденное
состояние
и
н-
н
н
3d
t
t
t
t
+
t
4s
tr
t
t
4p
3d 4s Ар
н
и
U
н
14
Н
t
t
t
t
u
t
-
t
B8
видно, что Со должен давать соединения с максимальной
валентностью 5 (таких соединений в настоящее время
неизвестно), а никель в соединениях может проявлять валентность 4.
Элементы Со — Rh — Ir и Ni— Pd —Pt ни по своей
максимальной валентности, ни по сумме d- и s-электронов, равной
9 и 10, никакого отношения к группе VIIIB не имеют, и поэтому
в последнее время эти элементы в таблицах периодической
системы выносят за контуры восьмой группы (см. табл. 34).
Естественно, что железо, как аналог рутения и осмия,
оставляют в VIIIB-группе, хотя оно и не проявляет в своих
соединениях валентность, отвечающую номеру группы.
Валентность
В классическом представлении числовое значение
максимальной положительной валентности элементов определяется
номером группы и должно изменяться от единицы до восьми.
Если исключить из рассмотрения лантаноиды и актиноиды, то
для 18 из 76 элементов (23%) имеют место отступления
(табл. 32):
Таблица 32. Элементы с максимальной валентностью,
не равной номеру группы
Старая
нумерация
групп
I
V
VI
VII
VIII
0
Элемент
Си
N
О
F
Fe
Со
Ni
Кг
Валентность
максимальная
3
4
2
1
6
4
4
6
Элемент
Ag
Ро
Rh
Pd
Хе
Валентность
максимальная
2
4
-
6
4
8
Элемент
Au
At
Ir
Pt
Rn
Валентность
максимальная
3
5
6
6
4
Новая
нумерация
групп
IB
VA
VIA
VIIA
VIIIB
VIIIA.
К числу исключений прежде относили также бром, для
которого не были известны соединения с валентностью, равной 7,
но в 1968 г. был получен пербромат калия КВг04 (валентность
брома +7) из бромата калия (валентность +5) при действии
сильным окислителем (озоном, дифторидом ксенона).
При рассмотрении ионизационных потенциалов 1\ золота
и ртути, соответственно 9,22 и 10,83 в, — элементов, стоящих
в периодической системе друг за другом (Z = 79 и 80),
обращает внимание резкое повышение значения 1\ для ртути. Это
объясняется образованием ео внешнем уровне атома ртути
замкнутой электронной группировки s2, состоящей из двух
электронов с антипараллельными спинами, получившей название
4*
99
«инертной пары». Наличием «инертной пары» и объясняется
небольшая химическая активность ртути. У атомов
последующих элементов с Z от 81 до 86
«инертная пара» сохраняется. Хотя атомы
элементов от 81 до 83 проявляют
максимальную валентность, отвечающую
суммарному числу электронов на
внешнем уровне, но наиболее
устойчивыми * их соединениями являются те,
в которых валентность на две единицы
меньше, а элементы 84, 85 и 86 не
проявляют в соединениях своей
максимальной валентности.
Действительно, у таллия наиболее
устойчивы соединения с валентностью
+ 1, а у свинца — с валентностью +2;
многообразны и устойчивы соединения трехвалентного висмута.
Наличие инертной пары объясняет максимальную валентность
полония, равную четырем, астата — пяти. По-видимому, для
80 Hg
81 TI
82 РЬ
83 Bi
84 РО
85
86
At
Rn
s
u
н
tl
н
t;
ti
ti
-
t
t
t
ti
ti
ti
p
-
-
f
t
t
ti
ti
—
—
-
t
t
t
ti
(I)
(2)
(3)
(4)
(5)
(6)
4 (
Л,
тнтаноь
ды
1 i
1 1
i
i
i *
58 59 60 61 62 63 6b 65 66 67 68 69 70 71
Се Рг Nd Pm Sm Eu 6d Tb Dy Ho Er Tm Yb Lu
« (
5 -
6 -
7 -
k 1
4
4
4
I—(
4
\
4
»
)—(
•
•
<
1—i
/
/
/
1—\
\—<
Актцноиды
*
•
i—<
>—<
i—
'—9—(
i <
Г"»""»—9~1
>=i
P=*
i
»
90 91 92 93 9b 95 96 97 98 99 100 101 /02 103
Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr
Рис. П. Возможные валентные состояния лантаноидов и
актиноидов (пунктирной линией показано наиболее
устойчивое валентное состояние).
радона возможны лишь шестивалентные соединения, а
соединений с валентностью +8 ожидать трудно.
Отсутствие у азота (2s22/?3), кислорода (2s22/?4) и фтора
(2s22p5) соединений с валентностью, отвечающей номеру группы
* Числа в скобках отвечают наиболее устойчивой валентности в
соединениях.
100
(V, VI и VII), объясняется невозможностью возбуждения
электронов, так как на внешнем уровне атомов этих элементов нет
свободных орбиталей.
Повышенная валентность меди, серебра и золота
свидетельствует о том, что при образовании химической связи у атомов
этих элементов участвуют не только электроны внешнего
уровня, но и электроны d-подуровня уровня, соседнего с внешним.
Валентные состояния лантаноидов и актиноидов крайне
разнообразны (рис. 11). Наиболее общей валентностью для
лантаноидов является валентность, равная трем, хотя для
некоторых из них известны двухвалентные соединения, а для
церия, празеодима и тербия получены соединения с валентностью,
равной четырем. У актиноидов валентность еще более
разнообразна и достигает значений 2, 3, 4, 5, 6 и 7 (как отмечалось
выше, в СССР получены соединения семивалентных нептуния
и плутония), а начиная с 96-го элемента преимущественно
проявляется валентность 3 и реже 4; в связи с этим отнесение их
к какой-либо группе теряет всякий смысл.
Вторичная периодичность
Еще раньше отмечалось, что по смыслу периодического
закона свойства элементов в периодах (слева направо) и в
группах (сверху вниз) должны закономерно и линейно изменяться
(усиление или ослабление). Вместе с тем было показано (см.
рис. 9 и 10), что в пределах каждого периода кривые
ионизационных потенциалов, а также радиусов атомов имеют
отклонения, обусловленные особенностями построения электронных
оболочек атомов. Наиболее существенные отклонения
наблюдаются у соединений элементов некоторых групп, а иногда
у самих элементов, проявляющих свою максимальную
валентность или на две единицы меньше максимальной.
Как установил в 1915 г. русский ученый Е. В. Бирон, в группах:
«...Свойства при последовательном увеличении атомного веса изменяются
не последовательно, а периодически. Эту своеобразную периодичность, как бы
накладывающуюся на основную периодичность, я предлагаю назвать вторичной
периодичностью» (подчеркнуто нами — В. С).
Вторичная периодичность проявляется как в химических,
так и в физических свойствах. Попытка Бирона объяснить
вторичную периодичность, вскрыть ее природу не привела к
существенным результатам.
Работой Бирона в момент ее появления и в .течение
последующих 30 лет никто не интересовался. Около 25 лет тому
назад профессор Ленинградского университета С. А. Щукарев
вместе со своими сотрудниками начал широкое
экспериментальное и теоретическое исследование явления вторичной
периодичности. В настоящее время известно более 50 работ
советских и зарубежных ученых, подтверждающих
закономерность, установленную Бироном.
101
Рассмотрим изменение теплот образования соединений
элементов IVA-группы с кислородом и магнием (рис. 12) и сопо-
а,мол/мола ставим их с кривой изменения
суммарного потенциала ионизации
(Л + h + ^з + /4)- Как видно из
приведенных данных, теплоты
образования (кривые 1 и 3) изменяются
не монотонно, а то возрастают, то
убывают (через один элемент). Так
как кривая 2 меняется также
периодически, то, очевидно,
вторичная периодичность зависит от
структуры электронной оболочки атомов.
В случае изменения свойств в
группе по закономерности вторичной
периодичности нельзя использовать
интерполяцию ■— ошибка здесь
неизбежна. Например, теплота
образования GeC>2 не равна половине
суммы теплот образования Si02 и
Sn02.
Вторичной периодичностью
характеризуется изменение
большинства свойств в группе Си, Ag, Au
(свойства серебра не являются
средними из свойств меди и золота).
Например, температура плавления
серебра, равная 960,5° С, не
вычисляется как среднеарифметическое из температур плавления
меди (1083° С) и золота (1063° С).
Как известно, при предсказании свойств экаалюминия
(галлия), Менделеев отметил, что данный металл должен быть
легкоплавким (это было
подтверждено экспериментом). Однако если
проинтерполировать температуры
плавления элементарных веществ,
окружающих галлий в
периодической системе, по трем возможным
направлениям — горизонтальному,
вертикальному и диагональному, то
его истинная температура плавления
(29,78° С) не предугадывается.
Свойства сложных соединений
могут изменяться линейно или в
соответствии с вторичной периодичностью: это зависит от типа
электронов, участвующих в химической связи между
взаимодействующими атомами при образовании сложного соединения. Как
известно, наиболее общим типом связи между атомами является
Рис. 12. Теплоты
образования (Q) соединений R02 и
Mg2R элементов IVA-группы
и их суммарные
ионизационные потенциалы (/):
/, 3 — теплоты образования R02 и
Mg2R соответственно; 2
—суммарный ионизационный потенциал.
Mg
651°С
Са
848° С
А1
660°С
\1/
—>-Ga-<—
Si
1423°С
Sr
760°С
In
156,4°С
- Ge
958,5°С
Sn
232°С
102
ковалентная связь. Если у данного атома участвуют в
образовании ковалентной связи электроны одного типа, то такие связи
называются чистыми (например, связи, осуществляемые р1-,
р2- и р3-электронами). Если же связь осуществляется
электронами разного типа, то связи называются гибридными
(например, sp2, sp3, sp3d2 и др.).
Рассмотрим ряд примеров. Из распределения электронов по
орбиталям атомов элементов групп VA, VIA и VIIA
(например, азота, кислорода и фтора) следует, что атомы этих
элементов и атомы их аналогов осуществляют связь с помощью
р3-, р2- и р'-электронов, например в таких соединениях, как
NH3, H20 и HF:
Группа
Элемент ......
Внешние
электронные орбитали
атомов
Электроны связи . .
Элементы — аналоги
VA
N
9 р
н
р, J
t
Р
Л
s
Sb,
t
Bi
VIA
О
s p
Till
s,
Se,
t
2
Те,
t
Po
VIIA
F
s p
1ИИ*
с
1, В
p'
r, I
t
At
Водородистые соединения неметаллов групп VA, VIA и
VIIA, в которых связь осуществляется электронами одного
".—:г—
-т т
-•—•-
чу^Кя
-J-.J—j_i_.. m о т •
■Ч" Ч.
Af
Рис. 13. Гибридные уровни в атомах бора и углерода.
типа, характеризуются линейным изменением свойств,
например в ряду HF — НС1 — HBr — HI теплоты образования
соответственно уменьшаются: 64,4; 21,9; 7,3; 1,32 ккал/моль, а
степень термического разложения при 1000° С возрастает и
составляет (в %): 0,0; 0,014; 0,5; 33,0, т. е. устойчивость соединений
уменьшается.
У атомов элементов групп ША и IVA, которым свойственна
максимальная положительная валентность 3 и 4, в основном
состоянии содержится только один или два непарных
электрона. Максимальная валентность может быть достигнута, если
за счет внешней энергии один из электронов пары перейдет на
свободную орбиталь в р-подуровне. В результате происходит
изменение электронной конфигурации s2pl-+slp2 и s2p2—*sxpz.
В возбужденном состоянии у этих атомов имеются соответственно
103
3 или 4 непарных электрона и, следовательно, атом может
осуществлять такое же число ковалентных связей. Однако это
электроны разного типа, что должно привести к неравноценности
связей в молекуле, например в молекулах ВС13 и СН4.
Рассмотрим электронные конфигурации атомов бора н
углерода в основном и возбужденном состояниях:
Группа
Элемент
Электронная конфигурация
внешних орбиталей атомов
в основном состоянии . .
в возбужденном
состоянии
Электроны связи
Гибридные связи
Элементы-аналоги
S
и
S
t
Al,
HIA
IVA
В С
р
t
-
-
згр>
Р
+
t
-
S'p*
<-
Ga
3
, In
, т
s p
\u
t
t
S*p2
s p
t
t
t
sV
Si,
Q
Ge,
4
Sn
-
t
Pb
Изучение структур молекул, например, ВСЬ и СН4
показывает, что все связи равноценны, а это означает, что s- и р-элек-
троны занимают некоторый средний, промежуточный, или
гибридный подуровень q (рис. 13). Так как энергия всех
электронов на гибридном подуровне одинакова, то и связи между
В и С1, С и Н оказываются равноценными.
При изучении свойств таких соединений, в частности
водородных соединений элементов групп IIIА и IVA, в которых
атомы проявляют гибридные связи, было показано, что
свойства их изменяются в соответствии со вторичной
периодичностью. В ряду водородных соединений элементов группы III А,
состав и свойства изменяются через один элемент:
ВгН6
летучее4
,Ga2H6^
летучее
/П2Н6 (?)
неустойчивое
(АШ8)Х
полимерное
твердое
(ШНз)х
полимерное
твердое
Сравнивая свойства водородных соединений элементов IVA-
группы нетрудно установить, что в ряду СН4 (метан), SiH4
(силан), GcH4 (герман) силан окисляется легче, чем метан и
герман, и в отличие от них вступает во взаимодействие с водой.
Свойства ( сложных соединений, в которых связи
осуществляются возбужденными электронами, изменяются в
соответствии с вторичной периодичностью так же, как и свойства
соединений, образованных частично поляризованными связями
(например, теплоты образования сульфидов, оксидов и гали-
104
дов). У элементов-аналогов С! — Вг — I, S — Se — Те, Р — As —
Sb теплоты образования окислов средних элементов меньше,
чем у окислов крайних элементов. В ряду кислот HN03, HPO3,
НАвОз фосфорная кислота в отличие от азотной и
мышьяковой практически не обладает окислительными свойствами.
Наиболее четко вторичная периодичность проявляется в
изменении суммарных ионизационных потенциалов, величины
которых зависят от радиусов атомов: чем больше радиус атома,
тем меньше величина ионизационного потенциала (см.
кривую 2, рис. 12). Это находит объяснение при рассмотрении
структуры электронных уровней. Так, повышение
ионизационного потенциала у германия связано с относительным сжатием
его атома, вызванного заполнением внутреннего уровня
десятью d-электронами, в результате чего сила притяжения
внешних электронов к ядру возрастает. Относительное сжатие
атома наблюдается также у свинца, в котором 4/-подуровень
заполнен четырнадцатью электронами; ионизационный потенциал
у свинца больше, чем у олова.
Таким образом, вторичная периодичность связана
непосредственно с заполнением в атомах d- и /-подуровней, приводящим
к упрочнению связи внешних s- и р-электронов с ядром. Так
как первоначальное заполнение d-подуровня наблюдается
в атомах элементов четвертого периода, а /-подуровня — в
атомах элементов шестого периода, то скачок в изменении свойств
должен быть особенно заметен при переходе от элементов
третьего периода к четвертому и от элементов пятого периода
к элементам шестого периода. В целом вторичная
периодичность обусловлена структурой электронных оболочек атомов и
в скрытой форме отображается в периодической системе
элементов.
ВАРИАНТЫ ТАБЛИЦ
ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Д. И. МЕНДЕЛЕЕВА
Известно свыше 400 вариантов таблиц периодической системы,
различающихся размещением отдельных групп
элементов-аналогов, способом отображения периодического закона. В
некоторых из них группа «инертных» газов размещена в правой
части (этими элементами заканчиваются периоды в системе),
в других — в левой части (ими начинаются периоды), в
третьих — в середине таблицы. Есть таблицы, где элементы
располагаются не в порядке заполнения электронных уровней в
атомах, а в порядке последовательного расположения в левой
части таблицы групп s- и р-элементов, в правой части — всех
групп d-элементов, а затем /-элементов. Известны варианты,
в которых элементы первого периода расположены внизу
таблицы, а над ними элементы последующих периодов, что
символизирует постепенное усложнение электронной оболочки
атомов. Авторы ряда таблиц делят группы элементов на 3 или 4
подгруппы, внося в эти «дополнительные» подгруппы
/-элементы.
Однако большинство этих таблиц, оттеняя периодичность
изменения тех или иных свойств элементов и их соединений,
ничего принципиально нового не вносят в конструкцию
периодической системы. Изменение свойств элементов связано со
строением электронной оболочки атома, точнее, с емкостью
электронных уровней, равной 8, 18 и 32. Отсюда, естественно
вытекает три основных варианта клеточного изображения
системы элементов, расположенных в порядке увеличения заряда
ядра атома или числа электронов в его оболочке. Таблицы
в зависимости от того, какой 8-, 18- или 32-элементный период
положен в основу их построения, делятся на 8-, 18- и 32-кле-
точные.
Тридцатидвухклеточная таблица была нами уже
рассмотрена (см. табл. 26) — это длиннопериодная таблица.
Выше отмечались преимущества этой естественной формы
таблицы. Конечно, эта форма отличается меньшей
компактностью, чем другие формы таблицы, но считать это
недостатком таблицы нет никаких оснований. Небольшое число ученых
106
Таблица 33. Полудлинная таблица периодической системы элементов Д. И. Менделеева
VIIA VIIIA
IA
3
Li
6,940
11
Na
22,997
19
К
39,096
37
Rb
85.48
55
Cs
132.91
87
Fr
223
HA
4
Be
9,02
12
Mg
24,32
20
Ca
40,08
38
Sr
87,63
56
Ba
137,36
88
Ra
226
IIIB
21
Sc
45,10
39
Y
88,92
57
La
138,92
89
Ac
227
IVB
22
Ti
47,90
40
Zr
91,22
72
Hf
178,6
104
Ku
260
VB
23
V
50,95
41
Nb
92,91
73
Та
180,88
105
VIB
24
Cr
52,01
42
Mo
95,95
74
w
183,92
106
VIIB
25
Mn
54,93
43
Tc
75
Re
186,31
26
Fe
55,85
44
Ru
101,7
76
Os
190,2
VIIIB
27
Co
£8,94
45
Rh
102,91
77
Ir
193,1
28
Ni
58,69
- 46
Pd
106,7
78
Pt
195,23
IB
29
Cu
63,57
47
hs
107,880
79
Au
197,2
l
IIB
30
Zn
65,38
48
Cd
112,41
80
He
200,61
IIIA
5
В
10,82
13
Al
26,97
31
Ga
69,72
49
In
114,76
81
Tl
204,39
IVA
6
С
12,010
14
Si
28,06
32
Ge
72,60
50
Sn
118,70
82
Pb
207,21
VA
7
N
14,008
15
P
30,98
33
As
74,91
51
Sb
121,76
83
Bi
209,00
VIA
8
О
16,000
16
S
32,06
34
Se
78,96
52
Те
127,61
84
Po
209
1
H
1,008
9
F
19,00
17
CI
35,457
35
Br
79,916
53
I
126,92
85
At
210
2
He
4,003
10
Ne
20,183
18
Ar
39,944
36
Kr
83,7
54
Xe
131,3
86
Rn
222
1 58
Ce 1
140,13
59
Pr
140,92
60
Nd
144,27
61
Pm
145
62
Sffl
150,43
63
Eu
152,0
64
Gd
156,9
65
Tb
159,2
66
Dy
162,46
67
Ho
163,5
68
Er
167,2
69
Tm
169,4
70
Yb
173,04
71
Lu
174.99
90
Th
232,05
91
Pa
231
92
U
238,03
93
Np
237
94
Pu
244
95
Am
243
96
Cm
247
97
Bk
247
98
Cf
251
99
Es
254
100
Fm
253
101
Md
256
102
No
254
105 1
Lr
257 J
относят к недостаткам этой таблицы то, что «якобы» в ней
разрывается связь между элементами-аналогами главной и
побочной подгруппы. Такое мнение нельзя считать
обоснованным, так как с точки зрения строения атома элементы-аналоги
должны характеризоваться одинаковым значением
конфигурационного индекса, что полностью осуществляется в этом
варианте таблицы (исключениями являются конфигурационные
индексы лантана и актиния, но это будет подробно обсуждено
ниже).
Полудлинная таблица (табл. 33) — восемнадцатикле-
точная. В такой таблице 14 /-элементов шестого периода —
лантаноиды (занимающие места 58—71) и 14 /-элементов
седьмого периода — актиноиды (занимающие места 90—103)
помещены в отдельных строках под таблицей. Этим приемом
авторы хотят придать таблице более компактную форму и
сблизить элементы 11 IB- и IVB-групп. Такая таблица как бы
представляет собой классификацию S-, р- и d-элементов; /-элементы
вынесены из общей таблицы и рассматриваются отдельно
(семейства лантаноидов и актиноидов).
В этой таблице имеются два разрыва в расположении
элементов по порядковым номерам: после 57-го элемента помещен
72, а после 89-го —104 элемент. Об указанном разрыве
следует всегда помнить, так как он не позволяет логически
использовать правило сдвига при рассмотрении процессов
радиоактивного распада, приводящих к взаимному переходу ядер
атомов от 57 к 58, от 71 к 72, от 89 к 90 и от 103 к 104 или
обратно. В химическом аспекте эта таблица неудобна тем, что
в ней трудно проследить причину различия свойств элементов
с номерами 72—80 от свойств элементов 40—48,
расположенных непосредственно друг под другом. При рассмотрении длин-
нопериодной таблицы (см. табл. 26) эти причины становятся
наглядными. Атомы элементов 72—80, стоящие в периодической
системе за лантаноидами, испытывают на себе влияние
лантаноидного сжатия*, следствием которого является
увеличение ионизационных потенциалов, ослабление
восстановительных свойств элементов и резкое возрастание плотности
элементарных веществ. Этим важным обстоятельством,
раскрывающим природу d-элементов, как нам кажется, нельзя
пренебрегать в угоду более компактной форме таблицы.
Восьмиклеточная таблица, короткая форма
периодической системы чаше всего оформляется в следующих трех
вариантах: 1) лантаноиды и актиноиды помещены в нижней части
таблицы, все rf-элементы внесены в группы s- и р-элементов,.
группы разделены на главную и побочную подгруппы (табл. 34);
2) все элементы распределены по 9 группам, включая нулевую,
* Уменьшение радиуса атома за счет усиления притяжения внешних
электронов с ростом заряда ядра, происходящее при застройке внутреннего
/-подуровня.
108
Таблица 34. Восьмиклеточная (короткая) таблица периодической системы элементов Д. И. Менделеева
(Н)
I • 3
L.I т
ЛИТИЙ
Na
НАТРИЙ
II
22.91
ПЕРИОДИЧЕСКАЯ СИСТЕМА
ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА
SJg 9.0122
БЕРИЛЛИЙ
т
МАГНИЙ
12
24.301
III
5
10,01
В
13 Я|
269015 П|
АЛЮМИНИЙ
14
гв,ем
IV
УГЛЕРОД
Si
7
14.00*7
15 п
ЗМ7Э8 |
ФОСФОР
16
32, 00
VI
8 О
КИСЛОРОД
S
СЕРА
VII
1
1.007»
ВОДОРОД
17
35.453
CI
VIII
2 Но
1.0020 ПК
ГЕЛИЙ
».m пе
НЕОН
18
зама
Аг
ПШОДИЧЕСКИИ
ЗАКОН
ОТКРЫТ
ДЛМЕШЕЕМ
1869 году
К
КАЛИЙ
19
39.090
Са
КАЛЬЦИЙ
ъ 2|
ОС 44.054
СКАНДИИ
Ti
ТИТАН
22
47,00
23
50.041
Сг
24
51.991
ВАНАДИЙ
МП Н93М
МАРГАНЕЦ
Fe
ЖЕЛЕЗО
26
55*47
Со
КОБАЛЬТ
27
8419332
Си
МЕДЬ
30
65.38
ЦИНК
60,77
Ga
ГАЛЛИЙ
32 I .
72.50 US
ГЕРМАНИЙ
33 Й<
МЫШЬЯК
28
56.71
34
76.06
Se
СЕЛЕН
35
7Ц908
36
03.00
Кг
Rb
37
•5.4?
СТРОНЦИЙ
39
66.006
Zr о
ЦИРКОНИЙ
Nb
41
92.938
МО 93
МОЛИБДЕН
Тс 43
ТЕХНЕЦИЙ
Ru I-
РУТЕНИЙ
Rh
РОДИЙ
45
W2.905
47
107800
А?
48
11240
Cd
49
114 02
СЕРЕБРО
In
индий
50
118 69
Si
олово
51
12175
Sb
52
127.60
Те
ТЕЛЛУР
53
128904
Pd
ПАЛЛАДИИ
Хе
КСЕНОН
г« 55
1/5 132,905
ЦЕЗИЙ
Ва
56
137,34
57
Ш,Э1
Hf
72
17Bj*9
Та
73
180.948
ГАФНИЙ
W74
юге:
ВОЛоФРАМ
Re
75.
1SS.2
Os
ОСМИЙ
lr
ИРИДИЙ
77
192,2
Pt
78
79
1Н.М7
Au
80
200,50
Hg
81
204.37
Ti
ТАЛЛИИ
82 p»
207.2 ГО
СВИНЕЦ
84
[2»l
At
АСТАТ
86 R.
РАДОН
Обозначение элемента Атомный номер
87
[223]
Ra
■ „ 89
ПС [227]
АКТИНИЙ
104
[284]
КУРЧДТОВИЙ
h
105
ll 3
LI «W.
ЛИТИЙ
; А А
н о и д ы
Атомный вес
6 квадратных скобках приведены классовые числа
наиболее устойчивых изотопов
■. 58
>С 14411!
Pr 2
11 моде»
ПРАЗЕОДИМ
НА 60
ПО 144.24
НЕОДИМ
Рт м
ПРОМЕТИЙ
tm 62
)Ш 150,4
Е, 63
II 151.06
ЕВРОПИЙ
(id I57.25
ГАДОЛИНИЙ
Tli 65
ID 158 02»
ТЕРБИЙ
Dy
ДИСПРОЗИЙ
И
162.50
Но 87
О 164.930
г п
ЭРБИЙ
Тт
ТУЛИЙ
69
188934
Ь
70
173.04
II 71
.11 174,07
•АКТИНОИДЫ
Tii 90
I Л 232.038
ТОРИЙ
Ра ' 91
Id 251,036
ПРОТАКТИНИЙ
II 92
U 230.03
УРАН
Мь 93
ИГ 237.05
НЕПТУНИЙ
Ри
ПЛУТОНИЙ
94
ПИ! 641]
АМЕРИЦИЙ
Cm м
БЕРКЛИЙ
Ct
Ы
Г 99
LS [254]
ЭЙНШТЕЙНИЙ
Cm100
гт tit
♦ЕРМИЙ
Md [258)
МЕНДЕЛЕВИЙ
(No) и Lr
. 103
. [2!J] Ll [2SJ]
[НОБЕЛИЙ) ЛОУРЕНСИЙ
Таблица 35. Девятиклеточная таблица периодической системы элементов Д. И. Менделеева
с внесением лантаноидов в VI период и актиноидов в VII период
Периоды
I
II
III
IV
V
VI
VII
Ряды
1
2
3
4
5
6
7
8
9
10
I
группа
■HI,008
3Li6,9
nNa23
19К39
29Cu63,6
37Rb85,5
47Agl07,9
56Cs 132,9
H
группа
'Be9
I2Mg24,3
20Ca40,l
30Zn65,4
38Sr87,6
48Cdll2,4
56Ba 137,4
III
группа
6B10,8
13A127
2iSc45
31Ga69,7
39Y88,9
49Inll4,8
57Lal 38,9
68EH67,2 69Tul68,9 70Ybl7371Lul75
79Aul97
87Fr
8°Hg200,6
'88Ra226
81T1204,4
S9Ac227
100j 1M 102 103
111 '" —
112
113
IV
группа
6C12
14Si28,l
22Ti47,9
32Ge72,6
40Zr91,2
50Snll8,7
38CeI40,l
72Hfl78,6
82Pb207,2
90Th232
104
114
V
группа
7N14
15P31
23V51
33As74,9
VI
группа
Ю16
I6S32,1
24Cr52
34Se79
41Nb92,9| 42Mo95,9
51Sbl21,8 [52Tel27,6
VII
группа
(H)
9F19
17C135,5
25Mn54,9
35Br79,9
43Tc
53J 126,9
VIII
группа
26Fe55,8 27Co58,9 28Ni58,7
0
■ группа
2He4
">Ne20,2
,8Ar39,9
36Kr83,7
44Rul01,l 46Rhl02,9 45Pdl06,7J
|54Xel31,3
(59Prl40,9 60Ndl44,3) 61Pm 62Sml50,l 63Eul52 64Gdl56,9 65ТЫ58,9 67Dyl62,5 66Hol64,9 1
73Tal80,9
83Bi209
9IPa231
105
115
74W183,9
84Po210
92U238,I
106
lie
75Rel88,3
85At
76OsI90,2 77Irl92,2 78PtI95,2
86Rn222
93Np 94p„ 95Am S6Cm 9?Bk 9SCf 99? j
107 _
117
108 109 110
118
состоящим из двух подгрупп, кроме VIII- и 0-групп (в
последних по одной подгруппе); лантаноиды и актиноиды включены
в VI и VII периоды (табл. 35) и 3) все /-элементы помещены
внутри системы, семейство лантаноидов разделено на два
«подсемейства» по семи элементов в каждом, с некоторым
сдвигом клеток в сторону от основных клеток групп элементов;
триады железа, рутения и осмия помещены в левой части таблицы
без нумерации группы (табл. 36).
Все эти и другие подобные варианты восьмиклеточной
таблицы отличаются компактностью, но в них в одни группы
попадают s- и р-, s- и d-, p- и J-элементы, атомы которых
различаются своей электронной конфигурацией и резко различаются
значениями конфигурационных индексов.
Многоцветный вариант таблицы периодической системы
элементов Д. И. Менделеева, изданной в виде открытки,
издательством «Химия» гораздо более нагляден. В ней s-эле-
менты окрашены в красный цвет, р-элементы— в желтый, &-
элементы — в синий и f-элементы — в черный. В I и II
группах s-элементы образуют главные или А-подгруппы, d-эле-
менты — побочные или В-подгруппы; в III—VIII периодах
главные (А) подгруппы образованы р-элементами, а побочные
(В) подгруппы ^-элементами; f-элементы (лантаноиды и
актиноиды) вынесены вниз таблицы, в отдельные строки. В этом
варианте таблицы учтены все ранее рассмотренные доводы
в пользу расположения отдельных элементов по группам в
соответствии со строением их атомов и свойствами. Так, водород
помещен в VIIA-группу (но поставлен в скобках и в группе
IA, как бы напоминая о своем некотором сходстве с
одновалентными металлами); Fe, Ru и Os размещены в VIIIB-rpynne,
а Со, Ni, Rh, Pd и Ir, Pt выведены из нее; благородные газы
помещены з VIIIA-группу и как бы завершают периоды в
таблице. .
Однако в этой таблице, как вообще во всех восьмиклеточ-
ных таблицах, упор делается на аналогию элементов по
вертикали — сходство элементов по максимальной валентности,
т. е. по свойству, которое, как показано было выше, изменяется
далеко не закономерно. Например, достаточно сравнить все
свойства и физико-химические характеристики хлора и
марганца, чтобы убедиться в резком их различии (единственная
аналогия — образование семивалентных соединений). По
химической природе марганец более сходен со своими соседями по
периоду, т. е. с хромом и железом, чем с хлором, и в этом
случае аналогия по горизонтали доминирует над аналогией по
вертикали.
В заключение можно сказать, что все три формы системы:
длинная, полудлинная и короткая — могут быть использованы
для отображения периодического закона. В каждой из форм
имеются свои преимущества и недостатки. Однако связь при-
111
Таблица 36. Короткая таблица периодической системы элементов Д. И. Менделеева с вынесением триад железа,
рутения и осмия в отдельную группу без нумерации
роды элемента со структурой электронной оболочки атомов
наиболее полно и однозначно раскрывается длинной формой
системы. Изучение периодического изменения свойств элементов
на основе электронных структур атомов принесло химической
науке невиданное развитие, и не случайно академик Л. В. Пи-
саржевский назвал данный этап в развитии химии
электронным этапом.
В настоящее время опубликованы таблицы периодической
системы, включающие «гипотетические» восьмой и девятый
периоды (Сиборг, Таубе, Гольданский), в которых размещено
по 50 элементов, т. е. на 18 элементов больше, чем в шестом
и седьмом периодах. Восьмой период начинается элементом
с порядковым номером 119 — экафранцием и заканчивается
элементом с порядковым номером 168 — д вир а доном. Дви-
радон по своей химической природе должен быть аналогом
благородных газов. В девятом периоде первый элемент — д в и-
франций имеет порядковый номер 169, а последний — т р и-
радон, или эка-экарадон — 218. В последних двух
периодах должны появиться новые типы элементов, относящиеся
к ^-элементам, так как у атомов 18-ти элементов каждого
периода будет застраиваться .^-подуровень (/ = 4),
максимальная емкость которого равна 18[Хг = 2(2-4 -4- 1) = 18]. Новые
5§-элементы, расположенные в 8-ом периоде, В. И.
Гольданский предложил назвать октадеканидами.
Трудно сказать, когда будет осуществлен синтез
неизвестных элементов (Z > 105), и вряд ли многие из них будут
получены, так как ядра этих элементов крайне неустойчивы, но
возможности синтеза 114- и 126-го элементов уже обсуждаются
в литературе (см. ниже).
ПЕРИОДИЧЕСКАЯ СИСТЕМА
И ИЗУЧЕНИЕ ОТДЕЛЬНЫХ ПРОБЛЕМ
В ХИМИИ ЭЛЕМЕНТОВ
Периодический закон, открытый Д. И. Менделеевым в 1869 г.,
и периодическая система химических элементов служили
инструментом познания различных явлений и решения
многочисленных проблем. Ниже будут кратко рассмотрены отдельные из-
этих проблем, при разрешении которых периодический закон:
Менделеева служил руководящей нитью.
МЕТАЛЛЫ, СПЛАВЫ И ИНТЕРМЕТАЛЛИДЫ
Несмотря на то что за последние десятилетия в технике
получили широкое применение такие неметаллические материалы,,
как стекло, пластические массы, каучук и резина, все же по-
прежнему основными конструкционными материалами
являются металлы и их сплавы.
В соответствии со строением атома к металлам относят
элементы s- (кроме Н и Не), d- и f-типов, а из элементов р-типа —
алюминий, галлий, индий и таллий. В химическом отношении
металлы являются только восстановителями и не образуют^
водородом при нормальных условиях газообразных соединений.
Общеизвестно также, что металлы обладают относительно
высокой тепло- и электропроводностью. По этим свойствам к
металлам относят такие элементарные вещества, как олово, свинец и
висмут, отличающиеся от типичных металлов своей
способностью образовывать с водородом газообразные соединения,
а в реакциях наряду с восстановительными свойствами
проявлять и окислительные. Таким образом, металлами можно считать
более 4/5 всех элементов.
Одна из таблиц (табл. 37), в которой проводится разделение
элементов на металлы и неметаллы, была предложена в 1947 г.
Н. В. Агеевым — известным специалистом в области физики и
химии металлов и сплавов. В этой таблице показана
кристаллическая структура элементарных веществ, имеющая важное
значение при изучении сплавов.
Для многих металлов характерно явление
сверхпроводимости, заключающееся в том, что при очень низких температурах
114
Таблица 37. Таблица элементов й Их кристаллическая структура
Неметаллы* -^Металлы
6С
к. а.
г.
14Si
к. а.
32Ge
к. а.
50Sn
к. а.
т. ц.
82РЬ
к. г. ц.
7N
к.
г.
15Р
р-
к.
33As
р. г.
51Sb
р. г.
83Bi
р. г.
80
Р-
р. г.
к.
16S
р.
м.
34Se
Г.
м.
52Те
Г.
84Ро
г.
щ
9F
17С1
т. ц. *
35Вг
р.
531
р.
85-
2Не
г. п. *
lONe
к. г. ц.
18Аг
к. г. ц.
ЗбКг
к. г. ц.
54Хе
к. г. ц.
86Rn
3Li
к. ц.
1Ша
к. ц.
19К
к. ц.
37Rb
к. ц.
55Cs
к. ц.
87-
4Ве
г. п.
12Mg
г. п.
20Са
к. г. п.
г. п.
38Sr
к. г. ц.
56Ва
к. ц.
88Ra
21Sc
г. п. *
39Y
г. п.
57-71
89Ас
к. г. ц. *
22Ti
г. п.
к. П.
40Zr
■г. п.
к. ц.
72Hf
г. п.
90Th
к. г. ц.
23V
к. ц.
41Nb
к. ц.
73Та
к. ц.
91Ра
т. ц. *
24Сг
к. ц.
г. п.
42Мо
к. ц.
74W
к.
к. ц.
92U
К. М. Ц.
к. ц.
25Мп
к. ц.
к.
т. г. ц.
43Тс
г. п. *
75Re
г. п.
26Fe
к. ц.
к. г. ц.
44RU
г. п.
760s
г. п.
27Со
г. п.
к. г. ц.
45Rh
к.
к. г. ц..
771г
к. г. п.
28Ni
г. п.
к. г. ц.
46Pd
к. г. ц.
78Pt
к. г.ц.
29Си
К. Г. Ц,
47Ag
к. г. ц.
79Аи
к. г. ц.
30Zn
г. п.
48Cd
г. п.
80Hg
р. г.
5В
13А1
к. г. ц.
31Ga
р-
491п
к. г. ц.
81Т1
г. п.
к. г. ц.
57La
г. п.
к. г. ц.
58Се
г. п.
к. г, ц.
59Рг
г. п.
60Nd
г. п.
61Рт
62Sm
р. г. *
63Еи
к. ц. *
64Gd
г. п. *
65ТЬ
г. п. *
66Dy
г. п. *
67Но
г. п. *
68Ег
г. п.
69Тт
Г. П. *
70Yb
к. г. ц. *
71Lu
г. п. * I
Примечания. 1. Кристаллическая структура: к. — кубическая, к. ц. — кубическая центрированная, к. г. ц. — кубическая гране-
центрированная, к. а. —кубическая алмазная, г. — гексагональная, г. п. — гексагональная плотная, т. ц. — тетрагональная центрированная,
т. г. ц. — тетрагональная гранецентрированная, р. г. — ромбоэдрическая, р. — ромбическая, м. — моноклинная.
2. Данные, отмеченные в таблице *, приводятся нами (В. С).
металлы не оказывают заметного сопротивления прохождению
электрического тока. Явление сверхпроводимости наблюдали при
температурах ниже 10 °К (—263 °С). Известны 24 металла,
обладающие сверхпроводимостью при температуре от 0,3 °К
(гафний) до 9,22 °К (ниобий). В табл. 38 показана связь
сверхпроводимости металлических элементов с их положением в
периодической системе.
Таблица 38. Сверхпроводимость металлических элементов
Периоды *
1(0)
2(0)
3(1)
4(4)
5(8)
6(9)
7(2)
d"
—
—
La
d2
Ti
Zr
Hf
Th
d*
V
Nb
Та
—
d4
—
Mo
—
1 j **
d5
—
Tc
Re
Подуровни
ds d^ d«
_ _ _
Ru - -
Os - -
d9
—
—
—
dio
Zn
Cd
Hg
pi
Al
Ga
In
Tl
p2
—
—
Sn
Pb
p3
—
' —
—
Bi
* В круглых скобках указано число сверхпроводников в периодах.
** Подуровни атомов Th и U — f2 (?) и /3.
Из таблицы видно, что большинство сверхпроводников
относятся к d-элементам— 15, к /j-элементам относится 7 и к
/-элементам — только 2, среди s-элементов сверхпроводников не
обнаружено *. По сверхпроводниковым свойствам Sn, Pb и Bi
также можно отнести к металлам. Из таблицы видно также, что
с увеличением номера периода увеличивается и число элементов
со сверхпроводниковыми свойствами. Можно считать, что
увеличение числа электронных уровней в атоме благоприятствует
проявлению сверхпроводниковых свойств. По-видимому, в
недалеком будущем должны быть обнаружены новые
сверхпроводники среди металлов 7-го периода, а также у лантаноидов —
элементов 6-го периода.
Не обнаружены сверхпроводники среди элементов, атомы
которых имеют в электронной оболочке 7, 8, 9^-электронов и
свыше трех р-электронов во внешнем уровне. Интересно, что медь,
серебро и золото, проявляющие в обычных условиях среди
металлов максимальную электропроводность, не обладают
сверхпроводимостью. По-видимому, сверхпроводимость мало зависит
от внешних электронов и обусловлена наличием свободных орби-
* При высоком давлении (55 тыс. атм) обнаружены
сверхпроводниковые свойства у бария (при температуре около 1,3 °К).
116
НИКОЛАЙ СЕМЕНОВИЧ
КУРНАКОВ
(1860—1941)
талей на d-, p- и /-подуровнях. Какой-либо закономерной связи
между температурой перехода в сверхпроводящее состояние и
положением элементов в периодической системе пока не
установлено.
Систематические исследования взаимодействия между
металлами— элементами, мало различающимися своими
химическими свойствами, стали проводиться со времени введения
в практику методов физико-химического анализа, в основе
которых лежит исследование изменения свойств системы с
изменением ее состава. Основополагающие теоретические и
экспериментальные работы в этой области принадлежат Н. С. Курна-
кову; он же ввел сам термин «физико-химический анализ».
Наиболее простым объектом изучения являются двухкомпонентные
системы, состоящие из двух различных металлов. Добавляя
к одному металлу переменные количества другого металла, т. е.
изменяя количественный состав системы, изучают изменение
какого-либо физического свойства, например
электропроводности, твердости, температуры плавления или кристаллизации,,
плотности, вязкости. На основании полученных данных строят
диаграмму «состав — свойство» и по виду диаграммы
делают заключение о типе взаимодействия между металлами.
В настоящее время изучено несколько тысяч диаграмм
«состав — свойство» двухкомпонентных систем; на основе
полученных данных сделаны следующие выводы.
1. Два металла могут образовать химическое соединение,
называемое интерметаллидом. Например, титан с
алюминием образует интерметаллид состава Ti3Al, а магний с
кадмием— три интерметаллида: Mg3Cd, MgCd и MgCd3.
2. Два металла могут давать непрерывные твердые
растворы, т. е. неограниченно растворяться друг в друге
при любых количественных соотношениях. Твердые растворы
117
обладают единой кристаллической решеткой, в узлах которой
содержатся атомы (ионы) обоих металлов; соотношение между
числом атомов в решетке будет таким же, как и в исходном
расплаве. Например, если в начальном расплаве содержалось по
50 атомн.% меди и золота (соотношение между числом атомов
50 :50 = 1 :1), то в кристаллической решетке на один атом меди
будет приходиться один атом золота.
3. Два металла могут давать огр аниченные твер д ые
растворы. Примером может служить система из хрома и
иттрия: в интервале температур от 1100 до 1300 °С в иттрии
растворяется 2 атомн.% хрома, а в последнем 1 атомн.% иттрия.
4. Два металла могут образовать эвтектический сплав,
т. е. смесь мельчайших кристалликов обоих металлов, каждый
из которых имеет самостоятельную кристаллическую решетку.
Эвтектические смеси плавятся при более низких температурах,
чем чистые металлы. Например, эвтектический сплав, состоящий
из 24,4 атомн.% свинца (т. пл. 327°С) и 75,6 атомн.% олова
(т. пл. 232 °С), плавится при 181 °С.
5. Два компонента не взаимодействуют друг с другом. В
расплавленном состоянии металлический галлий не смешивается
с жидким свинцом (подобно смеси вазелинового масла с
водой) .
Число возможных двухкомпонентных систем, вероятно, будет
равно числу сочетаний из 75 (число известных металлов) по
два, т. е. оно чрезвычайно велико. Вполне естественно, что
многие из возможных систем еще остаются неизученными.
Взаимодействие какого-нибудь одного металла с другими можно
проследить на примере серебра, (табл. 39), воспользовавшись
данными И. И. Корнилова * для 79 элементов (кроме лантаноидов
и элементов с Z = 95 —- 105).
Из приведенной таблицы следует, что только золото (Аи) и
палладий (Pd) образуют с серебром непрерывные твердые
растворы (для Pd характерно также образование интерметалли-
дов); 28 элементов с серебром дают ограниченные твердые
растворы, а 16 из них одновременно — интерметаллиды (клетки
с диагональной двойной штриховкой); 17 элементов
характеризуются образованием с серебром интерметаллидов; для двух
элементов — кобальта (Со) и кремния (Si) установлены
эвтектические сплавы; 16 элементов не взаимодействуют с серебром,
а системы серебра и 13 различных металлов до сих пор не
изучены.
Различное отношение к серебру рассматриваемых элементов
обусловливается рядом причин: химической природой элемента
(а следовательно, структурой электронной оболочки атома и по-
* И. И. Корнилов, Н. М. Матвеева, Л. И. П р я х и н а, Р. С.
Полякова, Металлохимические свойства элементов периодической системы,
Изд. «Наука», 1966, стр. 272.
118
ложением в периодической системе Д. И. Менделеева);
соотношением между радиусами атомов обоих компонентов;
значениями ионизационных потенциалов, сродства к электрону и элек-
троотрицательностей; типом и размерами кристаллических
решеток компонентов системы и др. Одним из важных факторов
является природа химической связи, возникающей между
компонентами системы.
Таблица 39. Взаимодействие серебра с другими элементами
периодической системы
'□ т т т т *п
1 — элементы, образующие непрерывные твердые растворы; 2 —элементы, образующие
ограниченные твердые растворы; 3 — элементы, образующие соединения; 4 — элементы,
образующие эвтектические сплавы; 5 — элементы невзаимодействующие; 6 —
неизученные элементы.
Чем дальше друг от друга в периодической системе отстоят
элементы, тем больше они отличаются друг от друга
химической природой, радиусами атомов, числом валентных
электронов, величинами ионизационных потенциалов и электроотрица-
тельностей, тем энергичнее они соединяются, образуя ионные
молекулы. Чем ближе расположены элементы друг к другу в
периодической системе, тем менее возможно образование
соединений с ионной связью и тем вероятнее возникновение ковалент-
ной связи, осуществляемой общими парами электронов, или
металлической связи, при которой положительные ионы
удерживаются в узлах кристаллической решетки вследствие
взаимодействия с «коллективом» валентных электронов, равномерно
распределенных в объеме решетки. Естественно, что
металлическая связь проявляется между элементами, расположенными
в металлической области периодической системы (см. табл. 37).
Этот тип связи доминирует при образовании твердых растворов.
119
Если сравнивать соединения одного и того же металла с
элементами какой-либо одной группы, например Mg с элементами
группы IVA:
Mg2C — Mg2Si — Mg2Ge — Mg2Sn — Mg2Pb
то можно проследить, как ковалентный тип связи уступает
образованию металлической связи, явно превалирующей в
соединении Mg2Pb. Это объясняется тем, что по мере перехода от С
к РЬ усиливаются металлические свойства, которые наиболее
выражены у РЬ.
На примере систем серебра с металлами, расположенными
в разных группах, можно установить причины образования
систем металл — металл разного типа. Для этого следует сравнить
характеристики металлов (табл. 40).
Таблица 40. Атомные характеристики и тип кристаллической решетки
систем серебро — металл
Металл
Ag
Au
Сг
Na
Со
V
Группа
IB
IB
VIВ
IA
VIIIB
VB
Число
электронов на двух
последних уровнях
в атоме
(18)1
(18)1
(8+5) I
(3)1
(Й+7)2
(8+3)2
Атомный
радиус
•<
1,44
1,44
1,27
1,89
1,25
1,34
•V
Я
V
я
го
« чр
—
0
11,8
31,2
13,2
7
(О
7,57
9,22
6,76
5,14
7,86
6,74
о
1,93
2,54
1,66
0,93
1,88
1,63
Тип решетки *
К. г. Ц.
К. Г. П.
к. ц.
к.
г. ц.
к. ц.
Система,
образуемая
с серебром
—
Непрерывный
твердый
раствор
Ограниченный
твердый
раствор
Интерметал-
лид
Эвтектика
Не
взаимодействует
* Обозначения типа решетки см. в табл. 37.
Так, характеристики Na и Ag наиболее сильно различаются,
этим и объясняется образование интерметаллида. Образование
непрерывного твердого раствора серебром и золотом
обосновывается положением элементов в одной группе периодической
системы, одинаковой структурой двух последних уровней в
оболочке атомов и аналогичным типом кристаллической решетки.
Различие структур электронных уровней, величин радиусов и
кристаллических решеток кобальта и серебра является
объяснением образования эвтектической смеси.
120
На основе анализа большого числа систем различных
элементов можно сделать выводы об условиях образования систем
того или иного типа.
1. Оптимальными условиями образования непрерывных
твердых растворов между двумя элементами являются: нахождение
элементов в одной группе периодической системы, одинаковый
тип решетки, лишь незначительное различие размеров атомных
радиусов (не более 10%), близость величин ионизационных
потенциалов и электроотрицательностей.
2. Если радиусы атомов различаются на 10—20%, что,
естественно, приводит к большому различию в ионизационных
потенциалах и электроотрицательностях, то происходит
образование ограниченных твердых растворов или интерметаллидов.
3. При различии радиусов атомов более чем на 20%
элементы, как правило, не взаимодействуют друг с другом и нередко
не смешиваются в расплавленном состоянии.
Пользуясь сведениями о свойствах элементов, можно
предугадать возможность того или иного взаимодействия между
металлами. Из табл. 39 видно, что до сих пор не изучены системы
серебра с калием, рубидием и цезием. Если сопоставить радиусы
атомов серебра и указанных элементов и вычислить их
различие (в %): Ag-1,44A; К-2,36А (64%); Rb-2,48A (72%);
Cs — 2,68 А (86%) можно прийти к заключению, что
взаимодействие между ними невозможно.
Теперь становится теоретически объяснимым эмпирическое
правило Таммана:
Элементы одной и той же группы металлов не образуют между собой
химических соединений; если какой-нибудь элемент дает химическое
соединение с одним из элементов какой-либо группы, то он вступает в соединения
со всеми остальными элементами данной группы.
На основе выявленных общих закономерностей стал
возможен научный подход к проблеме получения сплавов с
заданными свойствами, а следовательно, стало возможным
предотвращение ошибок в этой важной отрасли промышленности.
Основной, «диспетчерской» картой металлохимиков является
периодическая система Д. И. Менделеева.
Изменения магнитных свойств элементарных веществ, в том
числе и металлов, также тесно связаны со структурой
электронной оболочки атомов и, следовательно, с положением элементов.
в периодической системе Менделеева. Действительно, магнитная
восприимчивость элементов (х) изменяется с увеличением
порядкового номера (рис. 14).
Все вещества по способности взаимодействовать с внешним
магнитным полем подразделяются на диамагнитные,
парамагнитные и ферромагнитные.
Диамагнитными веществами называются такие, атомы
или молекулы которых не обладают собственным магнитным
121
моментом, но под влиянием внешнего поля приобретают
намагниченность, ориентированную противоположно направлению
внешнего поля. Парамагнитными являются вещества, атомы
или молекулы которых обладают собственным магнитным
моментом, но вещество в целом в отсутствие магнитного поля не
намагничено, так как вследствие хаотичности расположения
частиц их результирующий момент равен нулю. У такого вещества
в магнитном поле происходит преимущественная ориентация
частиц параллельно направлению поля. Ферромагнитными
Х-ю"
з
о
не
-;
О Cr.MaFe.CaNi Pd.Ag Лантаноиды
Рис. 14. Магнитная восприимчивость (%) химических Элементов.
веществами называются такие, атомы или молекулы которых
обладают собственным магнитным моментом в отсутствие
внешнего магнитного поля, причем магнитные моменты отдельных
частиц имеют одинаковое направление, или ориентацию.
Намагниченность, вызванная внешним полем,
пропорциональна его напряженности, а коэффициент пропорциональности,
называемый магнитной восприимчивостью, является
характеристикой данного вещества. Для диамагнитных веществ
она имеет отрицательный знак, для других — положительный
(см. рис. 14).
Следует отметить( что магнитный момент атома в целом
определяется суммарным магнитным моментом протонов,
нейтронов и электронов. Так как собственные магнитные моменты
протона и нейтрона примерно в тысячу раз меньше магнитного
момента электрона, то магнитный момент атома определяется в
основном суммарным значением магнитного момента электронов.
Анализ всех количественных данных по магнитной
восприимчивости позволяет сделать некоторые выводы.
122
У атомов с замкнутой электронной структурой, т. е. не
имеющих непарных электронов, магнитные моменты равны нулю;
соответствующие вещества являются диамагнетиками. Во
всех группах периодической системы диамагнетизм возрастает
с увеличением порядкового номера элементов, особенно" у тех
из них, в чьих атомах заполнены электронами внутренние
уровни (элементы больших периодов).
В атомах элементов d-тяпа, с недостроенными d-подуров-
нями, проявляется пара- или ферромагнетизм. Например, в
четвертом периоде от калия к никелю возрастает парамагнетизм,
а последние три элемента — железо, кобальт и никель — ферро-
магнитны.
Лантаноиды обнаруживают достаточно резко выраженный
парамагнетизм, так как в их атомах застраивается
глубинный 4/-подуровень (по-видимому, такими свойствами
обладают и актиноиды, но о них нет еще достаточно полных
данных).
Магнитные свойства характерны не только для нейтральных
атомов, но и для ионов и молекул; изучение этих свойств
позволяет выявить детали строения частиц, а следовательно, и другие
свойства.
Природа отдельного металла в конечном счете определяется
зарядом ядра атома и структурой его электронной оболочки.
Рассмотреть закономерное изменение всех свойств металлов.
в значительной мере помогает периодическая система элементов
Менделеева. Так, при использовании таблицы Менделеева
удается проследить изменение с увеличением атомного номера
металла сверхпроводимости его, магнитных свойств, плотности,
температур плавления и кипения, электропроводности,
теплопроводности, твердости, изменение взаимодействий в системе
«металл — металл» и др.
ПРОСТЫЕ И КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Элементарной частицей вещества является молекула. Молекула
простого вещества может состоять из одного атома (Не, Хе, Rn)
или нескольких атомов одного элемента (Н2, O2, Р4, h, S8, S&
и др.). Молекула сложного вещества состоит из двух и более
атомов различных элементов (С02) СН4, ВаО, БЮг, NaCl, KI>
SF6 и др.). Разные вещества могут различаться не только
качественным составом молекул, но и количественным ее составом.
Так, известны вещества, молекулы которых состоят из
различного числа одинаковых атомов, например Ог (кислород) и Оз
(озон). Это разные вещества с разными свойствами.
Встречаются вещества, молекулы которых состоят из атомов
одних и тех же элементов, взятых в одинаковом количестве, но
все же сильно различающиеся по свойствам. Формуле С3НвО
12а
соответствуют два вещества — уксусный альдегид (I) и
ацетон (II)
/Н
Н3С—СН2—(Г Н3С—С—СН3
V> II
о
I II
Атомы в их молекулах по-разному расположены относительно
друг друга, т. е. молекулы имеют неодинаковое строение, и
вещества обладают совершенно разными свойствами. Существуют
вещества, молекулы которых включат одинаковое число
атомов одних и тех же элементов, причем порядок соединения
атомов друг с другом одинаков, но в пространстве отдельные
группы атомов расположены по-разному. Такие вещества также
обладают разными свойствами. Наконец, одно и то же вещество
может иметь несколько кристаллических модификаций
(например, алмаз, графит и карбин), различающихся некоторыми
свойствами.
Пространственное строение молекул изучает наука,
называемая стереохимией, кристаллическое строение вещества —
кристаллохимия. Для исследования строения молекул и кристаллов
широко используются методы рентгенографии и
электронографии.
Пространственное строение молекул зависит от природы
химической связи, возникающей между атомами, а следовательно,
структуры их электронной оболочки. Так как в химической связи
могут участвовать электроны s-, p-, d- и /-типа от каждого из
взаимодействующих атомов, то в зависимости от типа и числа
электронов, а также от возможности образования гибридных
связей зависит строение молекул.
Молекулы состава АА и АВ, состоящие из двух атомов
одинаковых или различных элементов, независимо от типа
взаимодействующих электронов s1—s1, р1—р\ s1—р1 и др. имеют всегда
линейную форму, т. е. центры атомов лежат на прямой линии.
Например, Н—Н, О—С1, Н—CI, Na—F, К—Вг и др. Такие
молекулы характерны для элементов IA- и VIIA-rpynn.
Если в молекуле состава АВ2 атом А элемента ПА-группы
имеет в возбужденном состоянии два электрона разного типа
SiPi, то в результате гибридизации образуются две равноценные
связи (гибридизованное состояние электронов — q2), которыми
атом А соединяется с двумя атомами В. Молекула состава АВ2
будет иметь линейную форму В—А—В с углом между связями
180°. В качестве примера можно назвать молекулы следующих
веществ: BeF2, MgCl2, CaH2.
Молекулы состава АВ3, в которых атом А — атом элемента
ША-группы в возбужденном состоянии имеет электронную
конфигурацию s'p2 (или в результате гибридизации — q3), обла-
124
дают формой равностороннего треугольника. В центре его
расположен атом А, а в вершинах — атомы В; углы между
связями составляют 120°. Например, такими веществами будут
ВСЬ, А1Вг3, BF3.
Если в молекуле АВ4 атом А является атомом элемента
IVA-группы с электронной конфигурацией в возбужденном
состоянии slp3, то в результате гибридизации электронов
образуются четыре равноценных гибридных подуровня q4. Такая
молекула имеет тетраэдрическую форму, в центре тетраэдра
находится атом А, а под углом 109° 28' располагаются четыре связи,
направленные к вершинам тетраэдра, с находящимися в них
атомами В. В качестве примера можно указать соединения:
СН4, CF4, CC14, SiH4, SiCl4, GeCl4.
Молекулы состава А3В, в которых В-атом элемента VA-rpyn-
пы, участвует в образовании химической связи /?3-электронами
одного типа, имеют форму пирамиды, в вершине 'которой
находится атом В, а три атома А расположены в углах треугольного
основания. Углы между связями колеблются от 91° 20' до 109°.
К таким соединениям относятся NH3, РН3, PC13, BiCl3, AsH3, PI3
и др.
Молекулы состава А2В, в которых В-атом элемента VIA-rpyn-
пы, участвует в образовании химической связи своими
^-электронами, характеризуются угловой формой*: угол связи
меняется от 90 до 105°, иногда имеет и большие значения, но
меньше чем 180°. К угловым молекулам можно отнести: Н20,
H2S, H2Se, H2Te. '
Таким образом, элементы разных групп периодической
системы, обладая разными электронами связи, способны к
образованию молекул разного типа. Например:
Группы эле
ментов . .
Электроны
связи атома
А (В) . .
Типы молекул
примеры .
Форма моле
кул ....
Угол связи .
IA
АВ
(NaCl)
ПА
sp ->■ 172
АВ2
(ВеС12)
IIIA
IVA
sp2 ->• <73 sp3 -> q*
АВ3
(ВС13)
АВ4
(СН4)
VA
Ръ
А3В
(H3N)
VIA
А2В
(H2S)
VIIA
P^
АВ
(CIF)
линейная линейная треуголь- тетраэл- пирами-
ная рическая дальная
- 180° 120° 109° 28' 108° и
Гибридные связи
меньше
угловая линейная
90° и
больше
При усложненном процессе гибридизации, когда в
химической связи участвуют не только s- и р-электроны, но d- и
/-электроны, образуются молекулы более сложной формы.
* По современным квантовомеханическим представлениям, электронам
каждого типа отвечает электронное облако определенной формы: s-электрон-
ное облако имеет сферическую форму, р-облако — вид гантели, d- и
/-облака— более сложную форму (четырех или шестилопастную). Два р-электрон-
ных облака располагаются перпендикулярно друг к другу в направлении
координат плоскости, чем и обусловливается угловая структура молекул.
125
Рассмотрим процесс образования молекулы SF6. Атом серы
в основном состоянии имеет электронную конфигурацию 3s23p4::
S
р
HtH t
d
Из шести электронов, находящихся на третьем уровне, только
два непарные, они и определяют валентность —2. Для того
чтобы повысить валентность серы до шести, необходимо два
электрона перевести на свободные орбитали d-подуровня:
S
t
р
т t т
d
Т Т
Электронная конфигурация атома серы в возбужденном
состоянии будет svpzd2. При образовании химической связи произойдет
гибридизация, в результате которой электроны связи перейдут
в состояние, соответствующее гибридным подуровням qe. В этом.
(a) sp3d*q}
-,spJd*+q
Jn'-^nS
Рис. 15. Структуры молекул (РС15 и SF6) при гибридных
связях.
случае молекула SF6 должна иметь октаэдрическую форму:
в центре октаэдра находится атом серы, а в шести его углах —
по одному атому фтора (рис. 15).
На том же рисунке показана другая форма (тригональная
бипирамида) молекулы РС15, отвечающая иному типу
гибридизации sp3d. Конечно, указанными формами не исчерпывается,
большое разнообразие возможных форм молекул различных
соединений.
Несмотря на то, что механизм образования связи один и
тот же, возникающие молекулы можно отнести к трем основным
типам:'неполярные, полярные и ионные. Напомним, что для
неполярных молекул характерна ковалентная связь, которая
образуется общей парой электронов, занимающей симметричное
положение между двумя атомами; если эта общая пара смещается:
из симметричного положения к более электроотрицательному
126
атому, то возникает полярная молекула, или диполь. Наконец,
при сильном смещении общей пары к электроотрицательному
атому (это равносильно переходу электрона одного из атомов
в сферу другого) возникает ионная молекула.
Естественно, что молекулы простых веществ (Н2, N2, Cl2, 02
и др.) являются неполярными. Чем дальше в периоде отстоят
элементы друг от друга, тем больше они отличаются значениями
электроотрицательностей и тем резче выражен ионный тип
связи у молекулы, образованной атомами данных элементов
(MgO, CaO, LiF, NaCl, КВг). Обычно симметрично построенная
молекула, в центре которой находится атом элемента в
состоянии высокой валентности, является неполярной (ССЦ, S1F4
и др.).
Таким образом, способность элемента к образованию
молекул различных веществ, характер возникающих связей, вид и
строение изолированной молекулы — все это находится в тесной
связи со строением атома и, главным образом, с конфигурацией
внешней электронной оболочки его, т. е. с положением элемента
в периодической системе элементов. Можно установить
определенные аналогии в этих характеристиках элементов одной
группы. Однако на практике приходится иметь дело не с отдельной
изолированной молекулой, а с большим числом их, с веществом
в целом. Естественно возникает вопрос о взаимодействии
молекул и относительной «силе» этого взаимодействия. Силы,
обусловливающие взаимодействие молекул, называются
межмолекулярными. Они определяются не только строением молекул, но и
агрегатным состоянием вещества, так как при изменении
последнего изменяется и расстояние между молекулами, а
следовательно, и силы взаимодействия между ними: в газообразном
состоянии в веществе действуют наименьшие межмолекулярные
силы, а в твердом — наибольшие. При этом аналогии,
характерные для молекул, могут и не проявляться у данных веществ,
что можно проследить на примере двух соединений С02 и Si02.
Углерод и кремний элементы — аналоги IVA-группы,
расположенные соответственно во 2-м и 3-м периодах. В возбужденном
состоянии атомы этих элементов характеризуются электронными
конфигурациями 2slp3 и 3s1/?3, т. е. имеют по четыре непарных
электрона и могут осуществлять по четыре ковалентные связи;
в атоме углерода нет свободных орбиталей, а в атоме кремния
имеются свободные Зб?-орбитали.
В обычных условиях двуокись углерода — газообразное
вещество. Между непарными электронами атома углерода и двумя
атомами кислорода возникают четыре ковалентные связи.
Молекула С02 обладает линейным строением 0 = С = 0; расстояние
между атомами углерода и кислорода равно 1,13А. Это —
типичная неполярная молекула. При —56,6 °С и давлении 5,28 атм
двуокись углерода сосуществует в трех агрегатных состояниях:
газообразном, жидком и твердом. В твердом состоянии С02
127
характеризуется молекулярной кристаллической решеткой, т. е.
в узлах решетки находятся молекулы С02 с теми же ковалент-
ными связями, но с несколько меньшим расстоянием С—О,
равным 1,05 А.
Структурный тип молекулы С02 при изменении агрегатного
состояния практически не изменяется; число связей отвечает
валентности элементов. Аналогичными свойствами будут обладать
и другие вещества с типично ковалентными связями неполярного
характера с неизменяющимся структурным типом молекулы
в различных агрегатных состояниях (например, СН4, AsH3, SiF4,
NF3 и др.).
Казалось бы, сказанное о двуокиси углерода можно целиком
отнести и к молекуле двуокиси кремния. В действительности
наблюдается другое. В обычных условиях изолированных молекул
Si02 не известно, а существует одна гигантская молекула
(Si02)n, в которой каждый из 2п атомов кислорода связан
с двумя атомами кремния, а каждый атом кремния связан с
четырьмя атомами кислорода:
I I
О О
I I
О—Si—О—Si
I I
О О
I I
О—Si-O-Si
I I
В целом образуется трехмерный каркас с повторяющимися
звеньями. Процесс перехода п Si02 в (Si02)n называется
полимеризацией. Следовательно, двуокись кремния является
неорганическим полимером. Для полимерных соединений
такого типа характерны высокая температура плавления,
относительно большая плотность и твердость. Двуокись кремния
плавится лишь при 1723° С.
В отличие от двуокиси углерода при образовании двуокиси
кремния, помимо ковалентных связей, между непарными
электронами кремния и кислорода возникают «дополнительные»
химические связи за счет свободных Зй?-орбиталей атомов кремния
и неподеленных пар электронов атомов кислорода.
С усложнением строения атома, начиная с третьего периода,
появляются новые подуровни, увеличивается число свободных
орбиталей и возрастает число связей между атомами,
возрастает и возможность образования сложных молекул. К числу'
сложных по составу молекул относятся соединения, названные
комплексными.
При возникновении комплексного соединения один из
компонентов предоставляет неподеленную пару электронов — донор,
а другой — акцептор «пустую», или свободную орбиталь, в ре-
ллл.
А
О О
I I I
-О—Si-O— Si— О—Si —
128
зультате чего осуществляется их взаимодействие. Такой тип
связи получил название донорно-акцепторной или координативной.
Как акцептором, так и донором электронов при образовании
комплексных соединений могут быть атомы, ионы и молекулы.
Наиболее распространенными являются соединения, в которых
акцептором служит положительный ион металла или атом
определенной степени окисления. Такой акцептор принято называть
комплексообразователем. Вокруг него координируются
нейтральные молекулы или отрицательно заряженные ионы,
являющиеся донорами пар электронов и называемые лиганда-
м и. Максимальное число лигандов определяется числом
представляемых комплексообразователем свободных орбиталей.
Число лигандов, окружающих центральный ион, называется
координационным числом.
Практически все элементы могут играть роль комплексооб-
разователя. Однако наибольшее число комплексных соединений
известно для d-элементов 4-, 5- и 6-го периодов системы. В
качестве примера того, что и элементы 2-го периода способны быть
комплексообразователем (лишь бы они могли стать акцепторами
пар электронов), можно рассмотреть образование комплексного
соединения лития. Атом лития имеет электронную
конфигурацию \s22sl2p° и при образовании иона Li+ теряет один электрон.
Следовательно, все четыре орбитали внешнего электронного
уровня (2s/?3) иона лития свободны:
Li
t
Li*
Таким образом, ион Li+ может быть акцептором четырех пар
электронов, т. е. вокруг него может скоординироваться четыре
частицы, являющиеся донорами электронных пар. В качестве
донора могут, например, быть молекулы аммиака, в которых три
атома водорода присоединены ковалентными связями к атому
азота, но у последнего имеется неподеленная пара электронов.
Процесс можно представить так:
□ н
□ и+[] + 4:ы:н=
□ н
NH3
H3N[T|Li[T]NH3
ED
NH3
, сокращенно fLi(NH^4j
Образовавшийся комплексный положительный ион может
сочетаться с любым отрицательным ионом (Х-), в результате чего
получится нейтральная молекула [Li(NH3)4]X. В этом
соединении комплексообразователем является Li+, а лигандами —
молекулы NH3.
5 Зак. 39,
129
Комплексообразователь вместе с лигандами образует
комплексную частицу, которая может нести положительный заряд
(как в разобранном примере), отрицательный заряд или быть
нейтральной. Заряд частицы определяется зарядом комплексо-
образователя и лигандов: если лигандами служат отрицатель-
ные ионы, суммарный заряд которых превышает
положительный заряд центрального иона, то общий заряд комплексной
частицы будет отрицательный, если суммарный заряд лигандов
равен заряду центрального иона, то комплексная частица —
нейтральна. В первом случае, примером которого является
рассмотренное соединение лития, комплексная группа служит ка-,
тионом, во втором — анионом и в третьем она является
молекулой.
В зависимости от заряда комплексной группы комплексные
соединения делят на три типа: положительные, отрицательные
и нейтральные, например:
[Zn (NH,)4]2+ CI" КПСо(М02)6]з- [Pt(NH3)2CI2]°
положительный отрицательный нейтральный
Комплексообразователь вместе с лигандами образуют так
называемую внутреннюю сферу комплекса, ее принято
заключать при написании формулы в квадратные скобки, а заряд
частицы указывать за скобкой, относя его ко всей частице. Ионы,
нейтрализующие заряд комплексной частицы, образуют
внешнюю сферу. Естественно, если комплексная частица нейтральна,
внешней сферы нет. В этом случае вся формула, описывающая
состав комплексной частицы, заключается в квадратные скобки.
Внутренняя сфера состоит из центрального атома, или иона-
комплексообразователя, и координирующихся вокруг него
полярных молекул или отрицательных ионов, называемых лигандами.
Как правило, центральными атомами могут быть
положительные ионы или атомы с положительной степенью окисления,
например: Fe2+, Fe3+, Со3+, Ni2+, Cr3+, Ag+, Au+, Hg2+, Cd2+, Pt2+,
B3+, Si*+ и др. Лигандами могут быть полярные молекулы:
NH3, H20, NO, СО, РН3, N2H4 и др. и отрицательные ионы: С1~,
F-.OH-, NOi, Br-, I", CN-, СОГ, S042~ и др.
Ввиду того что число свободных орбиталей атома комплексо-
образователя может быть самым разным, координационное
число теоретически может принимать значение от 1 до (по крайней
мере) 16. Однако число координируемых лигандов
ограничивается не только числом предоставляемых орбиталей, но и
размерами центрального иона (или атома) и самого лиганда.
Известны комплексы с числом лигандов от 1 до 12, но наиболее
распространены комплексные соединения, в которых
координационное число центрального атома равно 2, 3, 4 и 6. Так как
значение координационного числа зависит от размера и
строения центрального атома, то, следовательно, способность к обра-
130
зованию комплекса и его вид определяются положением
элемента в периодической системе.
Выше было отмечено, что атомы или ионы элементов второго
периода могут иметь предельное координационное число, равное
4, так как в химическую связь могут вовлекаться максимально
4 орбитали. У атомов или ионов элементов третьего периода
в осуществлении координативнои связи помимо одной s- и трех
р-орбиталей могут вовлекаться еще две cf-орбитали, а потому
предельное максимальное координационное число может быть 6.
Это подтверждается составом комплексных ионов элементов
третьего периода: [Mg(H20)6]2+, [AI(OH)6]3-, [SiF6]2" и т. п.
У атомов и ионов элементов последующих периодов (4—7)
координационное число 6 может сохраняться, но может и
возрастать до 7, например у K^TaFy], до 8, например у Na4[W(CN)8],
и до 9, например у [Nd(H20)9]Cl3, если в координативную связь
вовлекаются, соответственно, три, четыре и пять d-орбиталей.
Если же в образовании координативнои связи участвуют
/-орбитали, то координационное число повышается до 12, как,
например, в соединении Ke[Bi (SCN) ю].
На основании рассмотренного можно сделать следующие
выводы.
1. В одной и той же группе периодической системы при
переходе от предыдущего элемента к последующему
координационное число может возрастать, хотя числовая валентность,
определяемая номером группы, у них одинакова.
2. Химическая связь может возникать за счет непарных
электронов, неподеленных пар электронов и свободных орбиталей.
Следовательно, привычное представление о валентности, как
способности присоединять или замещать определенное число
атомов водорода, не вмещает действительной способности атома
элемента образовывать связи с атомами, ионами, радикалами и
даже нейтральными молекулами.
Число комплексных соединений очень велико; их можно
сгруппировать в зависимости от вида координирующихся лиган-
дов. Наиболее изученными типами комплексных соединений
являются: оксокомплексы (лиганд— О), аквакомплексы (лиганд —
Н20), аммины, или аммиакаты (NH3), галокомплексы (F~, Cl~,
Br-, I-), цианокомплексы (CN~), комплексы с лигандами,
содержащими серу [тиомочевина CS(NH2h, тиосульфат-ион ЭгО^- и др.].
Обобщая большое число предшествующих исследований,
академик А. А. Гринберг в 1951 г. попытался выявить
сравнительную способность элементов к комплексообразованию как по
группам, так и по периодам системы, и сформулировать общие
положения, которые с учетом изменившейся систематики
элементов можно свести к следующему.
Наиболее явной способностью к комплексообразованию
обладают атомы и ионы элементов середины больших периодов, т. е.
d-элементы групп железа, кобальта, никеля, меди и цинка.
5*
131
Элементы группы В (cf-элементы) более склонны к комплек-
сообразованию, чем элементы групп A (s- и р-элементы).
Положительные ионы элементов IA-группы и отрицательные ионы
элементов VIIA-группы не обладают склонностью к комплексо-
образованию (кроме иона Li+, обладающего малым радиусом).
Для благородных газов (Хе и Кг) известны некоторые оксоком-
плексы ([Кг04]2-, [XeOi]2- и др.).
В группе элементов-аналогов способность к комплексообразо-
ванию тем выше, чем больше напряжение поля иона,
определяемого отношением заряда иона (е) к квадрату его радиуса,
т. е. е/r2. Например, у В3+ комплексообразующие свойства
выражены сильнее, чем у А13+, так как значения е/r2 отличные и
составляют соответственно 56,7 и 11,5. С увеличением Z у
элементов I- и ПА-групп склонность к комплексообразованию падает,
а в IV—VIA-группах возрастает. У элементов В-групп
вертикальное изменение закономерного ослабления или нарастания
комплексообразующей способности осложняется вследствие
анормального заполнения электронами подуровней («провал»)
у атомов некоторых элементов.
Из индивидуальных особенностей комплексообразования
можно отметить следующие. У катионов элементов одной и той же
группы устойчивость комплексов, содержащих в качестве лиган-
дов ионы CN" и молекулы 1МНз, изменяется по отношению друг
к другу в обратном направлении; специфические свойства иона
ртути предопределяют резко выраженную его способность
к комплексообразованию с содержащими серу лигандами.
Сандерсон в своей книге «Периодичность химических
свойств» сделал попытку представить связь
комплексообразующей способности элемента с его положением в периодической
системе в виде таблицы. Табл. 41 заимствована из книги Сандер-
сона, но несколько дополнена и исправлена в соответствии с
данными, полученными за последние 8 лет (табл. 41).
В этой таблице отмечены элементы, образующие лишь
наиболее устойчивые комплексы. Из нее следует, что d-элементы
резко отличаются от s- и р-элементов по своей склонности к
образованию комплексов. Это является еще одним аргументом
в пользу применения длиннопериодной формы системы по
сравнению с короткой формой (лантаноиды и элементы седьмого
периода в таблицу не включены).
В будущем предстоит колоссальная работа по изучению
связи положения элемента в периодической системе и его
комплексообразующей активности, так как комплексные соединения
с каждым годом все больше и больше используются в технике
и в различных областях науки. Комплексные соединения
применяются для изготовления красок, в гальваностегии и
гальванопластике для получения прочных защитных и декоративных
покрытий на металлах, для разделения ионов редкоземельных
элементов— лантаноидов, умягчения воды, в качестве реагентов
132
Таблица 41. Наиболее устойчивые комплексные соединения
элементов периодической системы Д. И. Менделеева *
s-элементы р-элементы
п
6,
3
4
5
6
IA
Ж
Li
II!!!
IU.li
Na
НА
Hill
Be
Hill
Mg-
llll!
Illll
Ca
Illll
Hill
Sr
Illll
Ba
Ш В
тая
Ш,
Sc
■mir
JffiL
Y
1VB
тая
ш
Ti
тая
ш
Zr
1ГО1ЯН
La
Hf
VB
Illll
Illll
V
тая
Nb
Ш
Та
VIB
tlflt
Cr
Illll
Illll
Mo
Illll
w
VIIB
III If
Illll
Mn
Illll
Illll
Tc
Illll
Re
VIIIВ
Ге
'7///,
Y//7,
Ru
Ш
Os
Co
Rh
Ir
Ni
Pd
Pt
IB
Cu
A?
Ail
11B
Zn
Cd
ША
4x
IVA
В С
Al
Ga
In
*»
не
TI
Si
Ge
Sn
Pb
VA
N
P
As
Sb
Bi
VIA
s
Se
Те
VI1A
CI
Br
I
VI11A
Kr
Xe
/Ш гЩ зШ «GO 5l tig]
i — чаще всего образуют комплексы с донором О; известны также комплексы с F";
тенденция к координации с другими неметаллами возрастает по периоду слева направо;
2 —известны, главным образом, комплексы с донором О; 5 —известны, главным образом,
комплексы с донором N; 4 — образуют устойчивые комплексы с донором S; 5—образуют
устойчивые комплексы, в которых донорами являются: С или Р, редко S, ионы галогенов;
тенденция к координации ионов F- и С1~ и других неметаллов по периоду возрастает
слева направо; 6 — образуют устойчивые комплексы с F~.
* Лантаноиды исключены из таблицы.
в аналитической химии, в качестве антидетонаторов моторного
топлива, как исходные или промежуточные вещества для
получения других веществ и пр. Необходимо отметить, что
гемоглобин и хлорофилл, без которых невозможны жизненные функции
животных и растительных организмов, являются комплексами
железа и магния.
ГЕОХИМИЯ
Геохимия в нашей стране получила развитие благодаря
широким исследованиям академиков В. И. Вернадского и А. Е.
Ферсмана. Они наряду с известными зарубежными учеными
(Кларком, Вашингтоном, Ниггли, Оддо, Гольдшмидтом и Гаркинсом)
являются основоположниками этой науки.
В этой книге будут лишь кратко рассмотрены некоторые ее
положения, которые позволяют связать законы миграции,
рассеяния и накопления элементов с закономерностями,
объединенными великим обобщающим законом Д. И. Менделеева.
Изучение законов образования химических элементов во вселенной.
133
распространение элементов в природе составляют основные
направления исследования геохимиков.
Решая принципиальные проблемы общей химии, Д. И.
Менделеев впервые затронул вопросы геохимии, отметив, что
самыми распространенными в земной коре являются легкие
элементы с атомными весами до 60 единиц (позже было
установлено, что литий, бериллий, бор, скандий, гелий, неон и аргон
являются исключениями).
в » го so вг 12в n
ь I? го гв зб «4 52 во 68 76 вь z
Рис. 16. Кривые кларков, характеризующие связь между
распространенностью химических элементов в природе и порядковым
номером элемента в периодической системе Д. И. Менделеева.
В результате исследований было установлено, что
распространенность элементов есть периодическая функция от
порядкового номера элементов: кривая зависимости кларков* от
величины Z, называемая иначе «кривая кларков», указывает на
уменьшение числа кларков с возрастанием порядкового номера
(рис. 16). Если кривую кларков представить в виде двух
самостоятельных кривых, одной — для четных и другой — для
нечетных (по Z), то станет ясным, что четных элементов в природе
больше, чем нечетных. Исключение составляют благородные
газы, но они в обычных условиях инертны и, по-видимому,
мигрируют в космическое пространство.
Еще до 1935 г. геохимики обнаружили совпадение
периодичности чередования геохимически близких элементов с периодич-
* Кларками (по фамилии американского геохимика Кларка) называют'
числа, выражающие среднее содержание элементов в земной коре в весовых
или атомных процентах. Так как кларки отдельных элементов различаются]
на 13 порядков, то на графиках обычно откладывают логарифмы кларков.
Win
АЛЕКСАНДР ЕВГЕНЬЕВИЧ
ФЕРСМАН
(1883—1945)
ностью элементов, расположенных в длиннопериодной таблице,
в которой число элементов в периодах отвечает числу
электронов: 2, 8, 8, 18, 18, 32. Именно поэтому большинство геохимиков
предлагает длиннопериодную таблицу.
Рассмотрим вариант периодической системы А. Е. Ферсмана
(табл. 42). Таблица состоит из 18 групп, отвечающих 18 рядам
изоморфных элементов В. И. Вернадского (лантаноиды
включены в одну клетку под одним общим символом «TR»; в VIII
группе находятся три триады; ряд устаревших символов заменен
современными). В варианте Ферсмана благородные газы
расположены в середине таблицы и между периодами ЗЬ и 5
проведена двойная черта.
Всю таблицу можно разделить на три геохимических поля.
Верхнее, или обычное, поле над двойной горизонтальной линией
включает первые 28 элементов от Н до Ni, наиболее
распространенных в земной коре— в литосфере (твердая оболочка),
гидросфере (водная оболочка) и атмосфере (газовая оболочка). В
левой части этого поля сосредоточены неметаллические элементы
(кроме алюминия), образующие отрицательные ионы, или
анионы; в правой части — металлические элементы, легко
переходящие в положительные ионы, или катионы.
Нижнее левое поле включает элементы, дающие прочные
соединения с серой (они могут также образовать соединения с
селеном и мышьяком). Так как соединения металлов с серой
называются сульфидами, это поле называют сульфидным,
■а элементы, расположенные в нем, — халькофилами (от
греческого «халькос» — медь, первый элемент этого поля).
Нижнее правое (или кислое)* поле содержит элементы,
встречающиеся, главным образом, в остаточных кислых
* По большому содержанию в породах кислотного окисла БЮг.
135
Таблица 42. Геохимическая система элементов А, Е. Ферсмана
(порядковый номер, символ и атомный вес)
Ряд
1
2Ь
ЗЬ
5
7
9
Группы
I
—
—
29
Си
63,57
47
Ag
107,88
79
Аи
197,2
II
—
—
30
Zn
65,38
48
Cd
112,41
80
Hg
200,61
III
5
В
10,88
13
Al
26,97
31
Ga
69,72
49
In
114,8
81
TI
204,39
IV
6
с
12,00
14
Si
28,06
32
Ge
72,66
50
Sn
118,7
82
Pb
207,81
V
7
N
14,01
15
P
31,02
33
As
74,96
51
Sb
121,76
83
Bi
209,0
VI
8
О
16,00
16
S
32,06
34
Se
79,2
52
Те
127,5
84
Po
(210)
VII
l
H
1,008
9
F
19,00
17
CI
35,46
35
Br
79,92
53
I
126,93
85
At
?
VIII
2
He
10
Ne
20,18
18
Ar
39,94
36
Kr
82,9
54
Xe
130,2
86
Rn
(222)
I
3
Li
6,94
11
Na
23,00
19
К
39,10
37
Rb
85,46
55
Cs
132,81
87
Fr
II
4
Be
9,02
12
Mg
24,32
20
Ca
40,07
38
Sr
87,63
56
Ba
137,36
88
Ra
225,97
III
—
—
21
Sc
45,10
39
Y
83,93
57-71
TR
89
Ac
(227)
IV
—
—
22
Ti
47,90
40
Zr
91,82
72
Hf
178,6
90
Th
232,12
V
—
—
23
V
50,95
41
Nb
93,5
73
Та
181,5
91
Pa
(231)
VI
—
—
24
Cr
52,01
42
Mo
96,0
74
w
184,0
92
U
238,14
VII
—
—
25
Mn
54,93
43
Tc
?
75
Re
186,3
—
VIII
—
—
26 27 28
Fe Co Ni
55,84 58,94 58,69
44 45 46
Ru Rh Pd
101,7 102,9 106,7
76 77 78
Os Ir Pt
190,9 193,1 195,23
—
Ряд
2a
3a
4
6
&
10
57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
Группа TR La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu
138,90 140,13 140,92 144,27 - 150,43 152,8 157,3 159,2 162,16 163,5 167,67 169,4 173,5 175,0
магмах *, стронций и барий — в средних магмах, и платиновые
металлы (44—46 и 76—78) — в ультраосновных магмах.
А. Е. Ферсман отмечал:
«Каждое поле отвечает как бы определенной геохимической ассоциации
элементов, а так как каждое поле занимает определенное место в
Менделеевской системе, то, следовательно, определенные ассоциации отвечают и
тем законам периодичности, которые с ней связаны».
Ферсман рассматривал изменения свойств элементов в
вертикальном, горизонтальном и диагональном направлениях
системы.
В вертикальном направлении в группах элементов
d-типа при различии в строении электронных оболочек атомов
индивидуальные свойства элементов одной и той же группы (и
их соединений) могут отличаться. Например, элементы VIB-
группы — хром и молибден — различаются устойчивым типом
валентности в соединениях, у хрома — нечетная валентность 3,.
а у вольфрама — четная валентность — 6. В природных
минералах содержатся соединения хрома и вольфрама указанных
валентностей. По той же причине различаются свойства
молибдена и вольфрама: трехокись молибдена (МоОз) относительно
легкоплавка, т. пл. 791 °С, и при этой температуре возгоняется,
тогда как трехокись вольфрама (W03) плавится при 1473 °С,_
а возгоняется лишь при 1750 °С. Молибден соединяется с $ерой
легко (MoS2 — основной минерал молибдена), а вольфрам —
трудно (WS2 — чрезвычайно редкий минерал). i
В горизонтальном направлении геохимически сходные
элементы составляют семейства. Геохимики выделяют пять таких
семейств: железа (Z = 22 4-30), молибдена (Z = 42^-46)^
лантаноидов (Z = 57 — 71), рения (Z = 73 -ь 78)-и урана (Z =»
* Изверженная горная порода.
13Г
= 89 4-92). Ферсман считает, что сочетание геохимически
близких элементов определяется скорее их соседством по
горизонтали, чем по вертикали, и что связано это с небольшими
различиями в величинах радиусов ионов, благодаря чему возможен
обмен одних ионов на другие.
Свойство ионов (атомов и молекул) замещать другие ионы
(атомы и молекулы) в кристаллах с сохранением формы
последних называется изоморфизмом. Изоморфизм проявляется
при следующих наиболее благоприятных условиях: замещающие
частицы не должны отличаться радиусами более чем на 15%;
вещества должны иметь одинаковую кристаллическую форму и
один и тот же тип химической связи.
Вследствие происходящего в недрах земли изоморфного
замещения имеет место миграция ионов от одних минералов
к другим, поэтому в природе часто встречаются не
индивидуальные соединения, а соединения или твердые растворы
переменного состава. К ним относятся такие минералы, как
например, биксбиит (Мп, Ре)гОз и пурпурит (Mn, FeJPCu (радиусы
ионов Мп3+ и Fe3+ отличаются всего на 4,1%). Изоморфны
минералы СаСОз, MgC03, FeC03, МпСОз, СоСОз, ZnC03 —соли
двухвалентных металлов, характеризующиеся одинаковой
кристаллической структурой кальцита (СаСОз). Изоморфных
минералов в природе очень много.
В диагональном направлении в таблице Ферсмана
расположены элементы, ионы которых имеют одинаковые или близкие
радиусы, но различный заряд. Наиболее отчетливо намечаются
следующие диагональные ряды ионов (в скобках приведены
радиусы ионов, Л):
Li'+ (0,68) - Mg2+ (0,74) - Sc3+ (0,83) - 2г4+ (0,82)
Na1+(0,98) - Са2+ (1,04) - Y3+ (0,97)
KI+ (1,33) -Sr2+ (1,20)
Rb'+(1,49)-Ba2+(1,38)
Al3+ (0,57) - Ti4+ (0,64) - Nb5+ (0,66)
Эти ионы могут замещать друг друга в кристаллических
решетках минералов. Например, скандий встречается в виде
примени в магниевых и редкоземельных минералах (радиусы ионов
Mg2+ и Sc3+ отличаются на 10,8%).
Изоморфизм характерен и для элементов, расположенных
в одной и той же группе периодической системы, и не случайно
эти группы элементов В. И. Вернадский назвал изоморфными
рядами.
Много внимания геохимики уделяли проблеме возникновения
элементов и их парагенезиса. Несомненно, что количественные
характеристики элементов в масштабе всего космоса — кларки —
не остаются постоянными во времени. В процессе постоянного
синтеза и разложения создаются элементы земли и космоса. От-
138
дельно элемент никогда не возникает, параллельно образуются
спутники — явление, названное парагенезисом. При парагенети-
ческом возникновении элементов один из них получается в
преобладающем количестве. Например, в железных метеоритах (по
данным анализа 360 различных образцов) в среднем содержится
90,57 %" железа, 0,69% кобальта и 8,71% никеля, хотя эти
элементы близки в геохимическом и химическом отношениях,
расположены рядом в периодической системе, имеют близкие
атомные веса и мало отличающиеся температуры плавления.
Для оценки относительного количественного содержания
элементов в земной коре в табл. 43 приведено их распределение по
13 декадам В. И. Вернадского в весовых кларках (вес. %).
Таблица 43. Распределение элементов по декадам В. И. Вернадского
Декады
I
II
III
IV
V
VI
VII
VIII
IX
X
XI
XII
XIII
Кларки, вес. %
10
1-10
10"'-1
10"2-10~'
ю~3-ю~2
10-4_10"3
10"5_Ю"4
10"6-10"5
ю-'-ю"6
10~8-10"7
10"9-10"8
10"'°-10"9
10""-10"'°
Суммарная
масса
элементов,
г
ю18
10"_1018
1016—10х7
1015-Ю16
1014-1015
1013-ю"
1012-Ю13
10"-1012
1010—1011
109-1010
10е—10э
107-108
10е—107
Элементы
О, Si
Al, Fe, Ca, Na, Mg, К, Н
Ti, С, CI, P, S, Mn
F, Ba, N, Sr, Cr, Zr, Ni, Zn, В, Си
Rb, Li, Y, Be, Се, Co, Th, Nd, Pb,
Ga, Mo, Br
U, Yb, Dy, Gd, Sm, Er, La, Sn, Sc,
W, Cs, Cd, As, Pr, Hf, Ac, Lu, Hg,
Tm, Ho, Tb, I, Ge
Se, Sb, Nb, Та, Ей, In, Bi, Tl, Ag
Pd, Pt, Ru, Os, Po, Au, Rh, Ir, Те, Не
Ne, Re, Tc
Kr
Xe
Ra
Pa
От декады к декаде весовой кларк уменьшается в 10 раз (на
один порядок) и соответственно также уменьшается суммарная
масса элементов. Следует отметить резкое различие весовых
кларков самого распространенного элемента кислорода (49,13%)
и наименее распространенного элемента — протактиния (7 X
X 10-11%). Три четверти земной коры состоит из двух
элементов— кислорода и кремния и их соединений. Первые 15
элементов периодической системы составляют 99,61% земной коры,
а на долю остальных приходится лишь 0,39%.
Основоположником биогеохимического направления в науке
является академик В. И. Вернадский. К настоящему времени
установлено, что вещество живых организмов содержит до
139
60 элементов, причем главную массу (около 90%), составляюг
легкие элементы до двадцатого включительно (кроме неона,,
аргона, лития, бериллия, бора и фтора).
Несравненный мастер увлекательных этюдов по геохимии-
А. Е. Ферсман писал:
«Живое вещество в своем среднем составе связано с почвой и строит
свои клетки из элементов по тем же законам, по которым построено вещество-
метеоритов или атмосферы солнца и звезд».
Кратко остановимся на работах академика А. П.
Виноградова, в которых элементарный химический состав рассмотрен
2 в « 20 26 32 38 44 50 56 62 68 7Ь 80 86 92 Z
о Не О Si Ca Fe Ge Sr Ru Sn Ba Sm Er W Hg Rn U
• В Na CI Sc Co Br Nb Ag Cs Pr Tb Lu lr Bi Ac
Рис. 17. Кривые кларков, характеризующие связь между содержанием
химических элементов в живых организмах и порядковым номером
элемента в периодической системе Д. И. Менделеева.
в связи с положением элементов в периодической системе
Менделеева. На основе большого числа анализов был построен
график (рис. 17) зависимости логарифма атомного кларка (lg/()
химических элементов, входящих в состав живых организмов,
от порядкового номера (Z), отдельно для четных (светлые
точки) и нечетных (темные точки) элементов. На основании этих
кривых сделан следующий вывод. Количественный химический
элементарный состав живого вещества есть периодическая
функция порядкового номера элементов. Элементы, расположенные
в минимумах кривой, имеют относительно небольшое значение
для организма; расположенные на восходящих участках —
несколько большее, а находящиеся в максимумах являются
основными элементами в жизнедеятельности организмов.
Общее падение кривых позволяет утверждать, что с
увеличением Z количество тех или иных элементов в живом организме
уменьшается. Положение элементов на кривых распределения пй
на
отдельным отрезкам сходно с положением элементов на кривой
зависимости атомных кларков элементов в неживой природе,
т. е. в земной коре (см. рис. 16).
В геохимическом аспекте периодическая система отображает
естественную взаимосвязь элементов, их генезис и эволюцию,
закономерности образования веществ в неживой и живой природе
в условиях, характерных для поверхности нашей планеты.
А. Е. Ферсман неоднократно указывал, что обычно
периодическая система Менделеева рассматривается вне законов
времени и «...теперь мы должны постигнуть ее новый смысл в
конкретных условиях пространства и времени». Внешнее «одеяние»
атома — электронная оболочка — меняет свою структуру, если
в ультрашироких пределах изменять такие мощные факторы, как
температура (от обычной, характерной для поверхности нашей
планеты, до температуры, измеряемой миллионами градусов) и
давление (от атмосферного до сотен миллионов атмосфер или до
глубокого вакуума).
При ультравысоких температурах, характерных для
раскаленных звезд, атом сбрасывает с себя «внешнее одеяние»
(электронную оболочку) и превращается в «голое» ядро. Мир «голых»
ядер, по мнению Ферсмана, не подчиняется Менделеевскому
закону. При снижении температуры до миллиона градусов
появляются первые электроны вокруг ядра и образуются
положительные ионы с фантастическим, неведомым в наших условиях,
большим зарядом. Так, по данным профессора П. П. Паренаго,
в атмосфере некоторых звезд реально существуют 13-зарядные
ионы железа, тогда как в «земных условиях» мы имеем дело
с 2- и 3-зарядными ионами. При снижении температуры до
нескольких тысяч градусов или до нормальной «земной»
температуры электронное «одеяние» вокруг ядра становится более
«обильным», возникают «нормальные», в нашем понимании,
ионы или атомы, которые дают начало первым химическим
взаимодействиям, подчиняющимся периодическому закону.
Когца говорят о земной коре и ее составе, то имеют в виду
глубину, достигающую 16—20 км, а это составляет всего лишь
около 0,003 радиуса земного шара. Если плотность земной коры
достигает трех единиц, то на глубине она возрастает до 11
единиц, давление на той же глубине составляет 1,5 млн. атм, а
температура колеблется в пределах 2500—3000 °С. Естественно, что
в указанных условиях атомы могут обладать иными
химическими свойствами, но все это пока остается гипотезой, требующей
основательного подтверждения.
Сейчас возникает новая наука — селенохимия, химия лунных
пород. Был проведен химический, спектральный и рентгеновский
анализ состава лунного грунта, доставленного советской
автоматической станцией «Луна-16» и американскими космонавтами
лунных кораблей «Аполлон». Образцы грунтов были взяты из
Разных точек лунной поверхности, удаленных друг от друга на
■ ■
141
расстоянии
различается
Определяемые
компоненты
Si02
Ti02
А1203
FeO
MgO
CaO
Na20
K20
MnO
Cr203
Zr02
2500 км, и
Базальтовая
порода
«Луна — 16»
43,8
4,9
13,65
19,35
7,05
10,4
0,33
0,15
0,2
0,28
0,04
химический состав их (в
Тонкая фракция
«Луна — 16»
41,7
3,39
15,32
16,8
8,73
12,2
0,37
0,10
0,21
0,31
0,015
Базальтовая
порода
«Аполлон — 12»
40
3,7
11,2
21,3
11,7
10,7
0,45
0,065
0,26
0,55
0,023
%)
несколько
Тонкая фракция
«.
Апполон — 12»
42
3,1
14
17
12
10
0,40
0,18
0,25
0,41
0,09
Кроме того, в образцах обнаружены благородные газы. Как
видно из приведенных данных, в одних образцах больше двуокиси
титана и циркония, а другие содержат больше окислов железа
и хрома.
В недалеком будущем будут изучены составы грунтов
далеких спутников Солнца (Венера, Марс). Это позволит расширить
наши знания о космосе в целом.
ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ
В общеизвестной книге «Общая химическая технология»
академик С. И. Вольфкович дает следующее определение:
«Технология изучает методы и процессы переработки сырья в предметы
потребления и средства производства». В химической технологии
эти процессы сопровождаются изменением «...состава и
внутренней структуры вещества, осуществляемые путем химических
реакций».
При решении практических задач химической технологии
исследователь вынужден часто обращаться к периодической
системе элементов Д. И. Менделеева, что особенно важно в случае
синтеза веществ с заданными свойствами. На примере решения
двух вопросов: синтеза хладоносителей и продуктов силикатной
промышленности можно рассмотреть использование
периодической системы.
В связи с широким распространением бытовых холодильников
необходимо было синтезировать хладоносители — вещества,
которые должны обладать большой устойчивостью, не окисляться
и не образовывать с воздухом взрывоопасных смесей, иметь
относительно низкую температуру кипения, не взаимодействовать
с металлами и не обладать ядовитым действием. Иначе говоря,
была поставлена задача подобрать весьма устойчивые в
химическом отношении, легко конденсирующиеся вещества.
142
Такие свойства должны иметь вещества, молекулы которых,
не являются ионными или полярными, т. е. исключаются все-
соли и все вещества с несимметричными молекулами.
Наибольшая симметричность характерна для молекул, образованных
элементами четвертой группы с полностью насыщенными
связями. Естественно было остановиться на соединениях первого-
представителя этой группы — углерода. Действительно,
соединения состава СГ4, где Г — F, CI, Br или I, обладали всеми
заданными свойствами. Однако СВг4 и С14 следовало исключить„так
как эти вещества твердые, относительно менее устойчивы и
дороги. При сравнении свойств других двух соединений — тетра-
фторметана и тетрахлорметана:
CF4 CCI4
Температура плавления, °С . . . —184 —23
Температура кипения, СС . . . . —128 + 77
было установлено, что ССЦ — жидкость при обычных условиях,
a CF4 может сжижаться лишь при очень низких температурах
(—128° и ниже). Следовательно, ни то, ни другое вещество не
может быть использовано в качестве хладоносителя. Если же в
молекуле CF4 заместить два атома фтора на два атома хлора
и получить дифтордихлорметан —: CF2C12, то это вещество по
температурам кипения и плавления должно занимать
промежуточное место; в действительности температура его плавления
равна —155° С, а кипения —30° С. Дифтордихлорметан
относительно легко испаряется при —30° С, а теплота испарения
равна 39,9 ккал/моль. Это вещество нашло широкое применение в
холодильной технике и известно как фреон марки «Ф-12»
(есть фреоны и других марок).
Периодической таблицей широко пользовались при подборе
систем в производстве силикатов, тугоплавких фарфоров и
цементов клинкерного типа.
Еще в 1931 г. проф. М. А. Безбородов выявил роль
отдельных элементов в стекловарении, разделив их на пять типов
(табл. 44).
Было установлено, что к главным стеклообразующим
элементам относятся те, которые характеризуются наибольшей
распространенностью в природе (см. рис. 16).
Красящие (хромофорные) свойства элементов, как
установил чл. корр. АН СССР И. Ф. Пономарев, зависят, в первую
очередь, от типа элементов и размеров молекул силикатов,
образуемых ими. Среди хромофоров основными являются d-элемен-
ты VI, VII, VIII и IB-групп че.твертого периода (хром, марганец,
железо, кобальт, никель и медь).
Однако для производства стекла (и изделий из него)
недостаточно было отыскать стеклообразующие элементы и
элементы, обладающие хромофорными свойствами; надо было еще
подобрать такие системы, эвтектическая смесь которых
из
обладала бы температурой плавления, приемлемой для
стекловарения. Проф. Н. В. Соломину удалось показать, что
температура плавления эвтектик систем «оксид металла — кремнезем»
понижается с увеличением атомного веса металла IA- и ПА-групп,
входящих в состав оксида. Это объясняется усилением
основных свойств оксидов щелочных и щелочноземельных металлов
Таблица 44. Элементы, применяющиеся в стекловарении
(по М. А. Безбородову)
зЦ^Л
'1 — главные стеклообразующие элементы; 2 —прочие стеклообразующие элементы; 3
—красящие и обесцвечивающие элементы; 4 — глушители; 5 —элементы, не применяющиеся в
стекловарении.
с возрастанием атомного веса, вследствие чего происходит
ускорение процесса распада кристаллических агрегатов
кремнезема и образования более легкоплавких эвтектик.
Для производства огнеупорных силикатных материалов не:
обходимо было подобрать состав с наиболее высокой
температурой плавления. Наибольшей температурой плавления должны
обладать соединения с молекулой ионно-ковалентного типа, с
плотной кристаллической упаковкой, а следовательно, с
высокой теплотой образования. Такие окислы могли бы образовать
металлы IVB-группы периодической системы. Действительно,
именно металлы этой группы — Ti, Zr и Hf (электронная
конфигурация d2s2) дают наиболее тугоплавкие окислы (ТЮ2 —
1842°С, Zr02 — 2710°С, НЮ2 — 2811°С). Они-то и нашли при-
144
менение в производстве огнеупоров. Руководствуясь этим,
русский инженер-силикатчик А. А. Литваковский подобрал
наиболее рациональный состав огнеупорных материалов,
отличающихся большой термической устойчивостью.
Эмпирически было найдено, что системы СаО с А1203, Fe203
или Si02 обладают вяжущими свойствами. Они и нашли
применение в производстве цемента. Сопоставляя свойства
элементов и их соединений по группам и рядам периодической системы
и учитывая, что необходимыми условиями проявления вяжущих
свойств должны быть оптимальные радиусы ионов металлов
(больше 1,03 А) и высокая степень основности солей, которыми
и обладают силикаты, ферраты и алюминаты кальция,
В. А. Кинд и В. Ф. Журавлев высказали следующее
предположение. Системы, подобные системам СаО с А1203, Fe203 или
Si02, должны давать ВеО, SrO и ВаО, т. е. оксиды элементов
четных рядов II группы периодической системы, с одной
стороны, и оксиды Сг203, Мп203 и Ge02 — с другой. Вскоре
Журавлев получил ортогерманат и ортостаннат кальция (Ca2Ge204 и
Ga2Sn04), которые действительно обладали вяжущими
свойствами, т. е. доказал правильность ранее выдвинутых
предположений.
Рассматривая вяжущие, цементирующие свойства как
химические, принадлежащие большой группе соединений, сходных
по своему составу и строению, и опираясь на периодическую
систему элементов, Журавлев провел систематику вяжущих
соединений элементов ПА- и ПВ-групп и предугадал наличие или
отсутствие вяжущих свойств у еще не синтезированных
соединений (табл. 45).
Таблица 45. Вяжущие свойства соединений элементов НА- и НВ-групп
(по В. Ф. Журавлеву)
Ряд
периодической
системы
2
3
4
5
6
7
8
Состав
оксида
металла
ВеО
MgO
СаО
ZnO
SrO
CdO
ВаО
Радиус
иона
Ме2+.
А
0,31
0,78
1,06
0,83
1,27
1,03
1,43
Si02
ОС
оо
*
QO
#
СЮ
*
Второй компонент (оксид) '
А12Оз
ОО
оо
*
оо
*
оо
*
Fe203
о
оо
#
оо
*
о
*
Сг2о3
о
о
#
оо
##
о
#
Мп2Оз
о
. Г)
#
О
##
с
#
Ge02
о
о
#
о
##
о
##
Sn02
о
о
#
о
#*
о
*"*
% — установлены вяжущие свойства; -#-•# —предсказаны вяжущие свойства:
ОО-вяжущие свойства отсутствуют; Q—системы не изучены, но предполагается отсутствие
вяжущих свойств.
'/45 Зак. 39.
145
Из таблицы следует, что оксиды металлов нечетных рядов
и второго ряда II группы не образуют с указанными вторыми
компонентами соединений с вяжущими свойствами (радиусы
ионов металлов^ 1,03А). Все изложенное относится к
цементам клинкерного типа, которые получаются обжигом
компонентов при высоких температурах.
Изучая цементы специального типа (зубные цементы),
относящиеся к системам МеО — Р2О5 — Н20, Журавлев пришел к
противоположным выводам. Вяжущие свойства присущи
цементам, изготовленным на основе MgO, ZnO и CdO; у СаО они
проявляются весьма слабо, а у SrO и ВаО полностью
отсутствуют.
ПЕРИОДИЧЕСКИЙ ЗАКОН
И ЯДРА АТОМОВ
«Мысль человека бесконечно углубляется от явления
к сущности, от сущности первого, так сказать, порядка,
к сущности второго порядка и т. д. без конца».*
в. и. ленин
Прошло более ста лет-со времени открытия Д. И. Менделеевым
периодического закона и систематизации на его основе
химических элементов. С тех пор наука о веществе продвинулась
вперед семимильными шагами и глубоко проникла в глубь
атома. И чем больше человек познавал природу атома, тем
становилось очевиднее, что открытие Менделеева является лишь
первым шагом в познании законов эволюции и развития веществ:
«Проблема, поставленная Менделеевым в 1869 году, еще не решена
полностью... А для этого нужно развивать и усиливать атаку на атомное
ядро. В глубине атома мы найдем корни того дерева, которое было посажено
Дмитрием Ивановичем Менделеевым и которое принесет еще немало
плодов» **.
Если Менделееву удалось вкрыть периодическую зависимость
свойств элементов от атомных весов — «сущность первого
порядка» (первый этап), то дальнейшее развитие науки, главным
образом квантовой механики атомов, связало эту зависимость со
структурой электронной оболочки атомов — «сущность второго
порядка» (второй этап). В настоящее время периодичность
нельзя сводить только к изменению структуры электронной
оболочки, необходимо рассматривать оболочку и ядро атома в их
единстве. Раскрывая зависимость периодического изменения
свойств от структуры ядра (третий этап), мы начинаем
овладевать «сущностью третьего порядка».
Несмотря на то что основная масса атома сосредоточена в
ядре и общее число электронов в атоме определяется зарядом
ядра, многие ученые делили атом на две независимые части —
ядро и электронную оболочку, связывая периодически
изменяющиеся свойства элементов лишь с последней. Однако электроны
оболочки и ядро находятся в электромагнитном
взаимодействии, а потому на свойства атомов должно оказывать влияние
и ядро.
* В. И. Л е н и н, Соч. т. 29, стр. 227.
** А. Ф. Иоффе, Периодический закон Д. И. Менделеева и его
философское значение, ОГИЗ, 1947, стр. 98.
'/45*
147
Э. Резерфорд, создавший планетарную модель атома,
представлял ядро как сложный агрегат, состоящий из протонов и
внутриядерных электронов. Планетарная модель Резерфорда
сыграла важную роль в последующем развитии теории атома,
но принятое им строение ядра пришло в противоречие со
спиновыми характеристиками ядерных частиц и ядер в целом.
Ядерная теория стала плодотворно развиваться после того,
как советскими учеными Д. Д. Иваненко и Е. Н. Гапоном .в
1932 г. и независимо от них немецким ученым Гейзенбергом
была предложена протонно-нейтронная модель строения ядра.
Эта модель опиралась на две основные количественные
характеристики ядер: порядковый номер — Z и массовое число — А.
Основное положение ядерной теории можно сформулировать
так: ядра всех атомов, кроме легкого атома водорода, состоят
из протонов и нейтронов (оба вида частиц объединяют общим
названием нуклоны). Протон — частица с зарядом +1 и
относительной массой 1 (точное значение массы 1,007805); эту
частицу обозначают ]р или р. Нейтрон — частица, не
имеющая электрического заряда, относительная масса его равна 1
(точное значение 1,0086654), обозначают его ]0п или п. Эти
частицы обладают одинаковым спином, равным ±'/2-
Зная заряд и округленную массу нуклонов, можно
определить нуклонный состав любого ядра, пользуясь следующими
соотношениями: суммарное число нуклонов в ядре равно его
массовому числу Л; число протонов равно порядковому номеру Z;
число нейтронов в ядре (N) равно разности между массовым
числом и порядковым номером N = А —Z. Например, ядро
атома фосфора 15Р состоит из 15 протонов и 16 нейтронов и его
нуклонный состав можно записать [15/?, 16п].
Взаимодействие протонов и нейтронов в ядре происходит за
счет ядерных сил, природа которых до настоящего времени
148
окончательно не выяснена. Однако, как указывал Д. Д.
Иваненко:
«...Некоторые бесспорные особенности ядерного потенциала... позволяют
сделать уже сейчас ряд обоснованных и, как оказывается, согласных с
опытом выводов относительно строения атомных ядер».
ИЗОТОПЫ И ИЗОБАРЫ
Согласно протонно-нейтронной теории ядер, изотопами
называют разновидности атомов с одинаковым числом протонов
и различным числом нейтронов в ядрах; изобарами —
разновидности атомов с различным числом протонов и нейтронов,
но одинаковым числом нуклонов. (Такие атомы следовало бы,
по предложению С. А. Щукарева, называть изонуклонами,
так как при одинаковом массовом числе истинные массы двух
изобаров не равны друг другу.)
В 1906 г. были открыты первые радиоактивные изотопы
29oTh и 29oTh, в 1919 г. удалось экспериментально доказать
наличие устойчивых изотопов у неона — ioNe и ioNe. С каждым
годом число открытых изотопов возрастало: в 1921 г. их было
известно уже 243, а в настоящее время — свыше 1500 (из
которых только 272 являются устойчивыми или стабильными
изотопами).
В соответствии с числом протонов, входящих в состав ядра,
все элементы можно разделить на четные и нечетные по Z
(2Чет и 2неЧет) • Так как в состав ядер входят также нейтроны, а
число их равно или больше числа протонов, т. е. оно может
быть также четным или нечетным, то, следовательно, и
массовые числа А( = Z -\- N) могут принимать четные и нечетные
значения. Отсюда следует, что возможны четыре варианта ядер
атомов:
Z4er И Лчет: ^чет и Лнечет> ^нечет И ЛЧет> ^нечет И Лнечет
Так возникло представление о четных типах ядер. Оказалось,
что наиболее устойчивыми являются ядра c'Z4eT и особенно те,
для которых Z4eT и Лчет — это так называемые четно-четные
ядра (с четным Z и четным N). Менее прочными являются
ядра с ^нечет- Это четно-нечетные ядра (с четным Z и нечетным
N) и нечетно-четные (с нечетным Z и четным N). Наименьшей
прочностью обладают нечетно-нечетные ядра (с нечетным Z и
нечетным N). Известно всего 4 устойчивых нечетно-нечетных
2гт 6Т . Юг, 14хт
ядра: iH, 3Li, 5В и 7N.
Из 42 нечетных по Z элементов (до 83-го включительно) два
не имеют устойчивых изотопов (43Тс, 6iPm), четырнадцать имеют
по два устойчивых изотопа, а все остальные — только по
одному устойчивому изотопу, причем все устойчивые изотопы
характеризуются нечетным массовым числом, кроме четырех изотопов:
2Н, 6Li, 10B и 14N. Таким образом, нечетные Z элементы являются
1/26 За к. 39,
149
в основном моноизотопными, состоящими из одного
устойчивого изотопа.
Для 41 четного по Z элемента (до 82) известно 213
устойчивых изотопа, причем только один элемент моноизотопен (9Ве),
а все остальные — по л и изотопны и имеют от 2 до 10
изотопов (например, у 5oSn десять устойчивых изотопов с
А = 112-f-124). Элементы с четным А имеют 162 устойчивых
изотопа, с нечетным —51.
Устойчивость изотопов определяется отношением квадрата
порядкового номера к массовому числу Z2\A. Если (Z2//l)>33,
то у элемента нет ни одного устойчивого изотопа. Таковыми
являются элементы с Z = 84-М05; у них все изотопы
радиоактивны. Последний элемент, для которого еще известен устойчивый
изотоп, — это элемент с Z = 83, т. е. висмут — s-jBi.
Для каждого отдельного элемента существует оптимальное
отношение числа нейтронов к числу протонов 2«/2р, при
котором возможно существование устойчивых изотопов: за
пределами этого отношения при избытке протонов и недостатке
нейтронов известны р+-радиоактивные изотопы, а при избытке
нейтронов и недостатке протонов—р~-радиоактивные изотопы.
Например, для кислорода известны семь изотопов:
Изотопы
кислорода . . .
Число р . . .
Число «...
Отношение
2я/2р . . .
Типы изотопов
"6
8
6
0,75
р+-Р
'{О
8
7
0,875
адио-
активные
••о 178о
8 8
8 9
1 1,125
Устойчивые
"О
8
10
1,25
"О 2°0
8 8
11 12
1,375 1,5
Р--Радио-
активные
Природный кислород представляет собой смесь — плеяду
из трех устойчивых изотопов: '|0 (99,759%), 'вО (0,037%) и
'|0 (0,204%), в которой больше всего легкого изотопа,
содержащего в ядре равное число нейтронов и протонов: Е«/2р = 8 : 8= 1.
Это отношение является характерным для наиболее устойчивых
изотопов всех четных по Z элементов до гоСа включительно.
В ядрах изотопов последующих элементов с Z = 21-^83 в
связи с возрастающим числом протонов электростатические силы
отталкивания между ними увеличиваются, и ядра
стабилизируются за счет «вхождения» большего числа нейтронов.
Отношение Еп/2р постепенно растет, доходя у взВ1 до 1,518.
Из диаграммы устойчивости ядер всех изотопов (рис. 18),
составленной в координатах Z—N, видно, что легкие ядра
до гоСа группируются вдоль прямой линии N = Z, отвечающей
отношению Sn/2p = 1. Для последующих ядер это отношение
возрастает вследствие увеличения числа нейтронов, но остается
меньше 2 (прямая N = 2Z). В вертикальном направлении рас-
159
/
f&
о
°i
£*
♦У
/
о *33'
о
•
A-
X
о
Ж—
Областо
»ог- излучателей
Р
К го 28 50 62
в 16 24 4г W 48 56 64 72 80
Z
96 т
Рис. 18. Диаграмма устойчивости ядер изотопов элементов
в координатах Z—N.
Vi6«
положены изотопы элементов: черными кружками обозначены —
устойчивые, белыми кружками — р~- и р+3радиоактивные.
Изотопы нередко являются изобарами различных элементов.
Известны группы, состоящие из двух или трех изобаров,
например:
70/ 70(- 124о |24Т 124у
30z.n, 32ue, 50 an, 52 ie, 54 ле
В настоящее время насчитывается 59 пар и 6 триад изобаров.
В этих группах устойчивых изобаров порядковые номера
отличаются на две единицы. Если встречаются изобары двух
соседних элементов, отличающихся по порядковому номеру на
единицу, то один из изобаров должен быть радиоактивным.
Например, изотоп 44RU — устойчив, а его изобар
«Тс—радиоактивен (у технеция нет устойчивых изотопов).
ЯДЕРНЫЕ УРОВНИ И МАГИЧЕСКИЕ ЧИСЛА
Ядра всех атомов состоят из протонов и нейтронов. Правомерен
вопрос о распределении нуклонов в ядре: является ли оно
хаотичным или подчинено определенным закономерностям?
В конце 40-х годов сформировалась оболочечная теория
строения ядра, утверждающая, что нуклоны в ядре закономерно
распределяются по ядерным уровням и подуровням.
Подобно электрону в оболочке атома каждый нуклон —
протон и нейтрон характеризуется четырьмя квантовыми
числами, и, в соответствии с принципом Паули, эти характеристики
не могут полностью совпадать у любых двух нуклонов:
каждый нуклон имеет свой набор квантовых чисел. Квантовое число
п определяет величину энергии ядерного уровня, а квантовое
число I, отвечающее вращательному, или орбитальному
моменту нуклона, позволяет внести некоторую поправку в величину
энергии нуклона.
В отличие от электронных подуровней, в которых
максимальное число электронов Хх определяется по формуле
Xt — 2(21 + 1), где / = 0, 1, 2, 3, 4, 5, 6, и которые обозначаются
спектроскопическими индексами s, p, d, f, g, h, i, в ядерных
уровнях максимальное число нуклонов Хнукп может быть определено
по формуле:
*„укл = 2-2(2/+1)
где дополнительный коэффициент 2 указывает на два «сорта»
ядерных нуклонов. Ниже приведены числа нуклонов (нейтронов
и протонов) в ядерных уровнях:
Значение / ...
Спектроскопический индекс . .
Число нуклонов
Число протонов
Число нейтронов
0
S
4
2
2
1
Р
12
6
6
2
d
20
10
10
3
f
28
14
14
4
g
36
18
18
5
h
44
22
22
152
Так же как и электроны, протоны и нейтроны обладают
спином (s), имеющим значение -р/г и —'/г- В отличие от
электронов для ядерных частиц характерно сильное спин-орбитальное
магнитное взаимодействие, и полный момент количества
движения / (третье квантовое число нуклона) определится суммой
орбитального и спинового моментов j = l-\-s. Так как
орбитальный и спиновый моменты являются векторами, то в
зависимости от их направления (рис. 19) они складываются
/ = / + 4$ или вычитаются / = / — '/г- В поле ядра происходит
расщепление нуклонных уровней на подуровни с различным
числом нуклонов, а именно: 2/+ 2 (при / = /+'/2) и 2/ (при
/ = / — 7г)- Например, в /-уровне (/ —3) 14 протонов или
нейтронов распределяются по подуровням так: 8 (при / = 3 +
+ '/г == 7/г) и 6 (при / = 3— '/г = 5/г). Энергия связи нуклонов
4
J = l+s
J=l-s
Рис. 19. Значение суммарного момента ядер в
зависимости от направления орбитального и
спинового момента.
на подуровнях неодинакова: при данном значении / она
больше на том подуровне, для которого значение / наибольшее.
Схема расщепления ядерных уровней на подуровни приведена в
табл. 46.
Из таблицы видно, что все ядерные уровни, кроме s-уровней
(/ = 0), расщепляются на два подуровня. Ядерные уровни,
содержащие 2, 8, (14), 20, (28), 50, 82 и 126 нуклонов, являются
полностью укомплектованными (насыщенными). Эти числа
называются магическими (числа 14 и 28 некоторые ученые
относят к субмагическим, в табл. 46 они заключены в скобки).
Ядра, отвечающие магическим числам, называются
магическими ядрами; они заметно отличаются свойствами от
соседних ядер, содержащих большее или меньшее число
нуклонов.
Магические ядра можно разделить на три типа: 1)
магические по числу протонов и нейтронов, или дважды магические;
2) магические по числу протонов; 3) магические по числу
нейтронов. Например, ядро гоСа относится к первому типу (20р,
20п), ядро "oSn — ко второму типу (50/?, 68«) и ядро ЧбВа—
к третьему типу (56р, 82п). Как будет видно из дальнейшего,
153
Таблица 46. Схема ядерных уровней и подуровней
Ядерные уровни
Ядерные подуровни и
значения j
Числор
или п
.' данном
подуровне
зр~-
и j* is/г
2f
1h-
—<
s
■ зр j= 1/2
■ зр J=з/г
■ г Г j=5/2
2f j = 7/2
1h j~9/2
3s
2d <
- 1h j=1l/2
3s J= 1/2
-2d j=3/2
- ig J-t/2
- га j=5/2
fff-
i
4
1g j=9/2
2P Jmf/2
2p <
If*.
2s
\/ If J=5/2
_<' * 2p J=3/2
N If J=7/2
- 1d J=3/2
V
m-
--<
,p
1s
' s 2s j = l/2 —
Id j = 5/2 —
fp 3*1/2 —
1p 3*3/2 —
1s j=l/2 —
1U
2
4
8
8
10
12
2
8
8
10
2
В
4
магические ядра на кривых периодически изменяющихся
свойств ядер занимают особое положение.
Из анализа устойчивости ядер, проведенного в 1965 году,
следует, что ядра с числом протонов 114 и 126 и числом
нейтронов 184, несмотря на их радиоактивность, должны быть
относительно прочны. Эти числа следует также отнести к магическим.
ПЕРИОДИЧЕСКИ ИЗМЕНЯЮЩИЕСЯ СВОЙСТВА ЯДЕР
В кратком изложении невозможно рассмотреть все известные
периодически изменяющиеся свойства ядер. Здесь без
детализации будут обсуждены: распространенность и устойчивость ядер,
моменты ядер и энергия связи нуклонов в ядрах (эти свойства
находятся во взаимосвязи).
Распространенность и устойчивость ядер
Распространенность элементов в земной коре колеблется в
широких пределах. До начала 30-х годов распространенность
элементов геохимики связывали со структурой электронной
оболочки атомов. В настоящее время признано, что
распространенность зависит от устойчивости ядер. Американский геохимик
В. Д. Гаркинс установил, что от первого элемента к последнему
распространенность в целом падает приблизительно обратно
пропорционально седьмой степени порядкового номера. Однако
кривые распространенности носят периодический характер, что
связано с типом ядра по массе, четным или нечетным значением
Z. На кривых распространенности (см. рис. 16) особое место
занимают элементы, ядра которых являются магическими.
К дважды магическим ядрам относятся:
<Не(2); >вО(8); f48Si(14); <°Са (20); 82°8РЬ(126)
(в круглых скобках проставлено число нейтронов). Попытаемся
рассмотреть распространенность этих элементов.
Среди ядер легких элементов ядро 2- Не обладает
наибольшей устойчивостью: энергия связи нуклонов составляет около
28 Мэв. Образование этого ядра путем слияния четырех
протонов сопровождается выделением колоссальных количеств
энергии:
4[|Н] = 24Не + 2е+ + 26 Мэв
Устойчивость ядер гелия послужила отправным пунктом для
гипотезы о гелионном строении ядер, по которой более сложные
ядра состоят из некоторого числа ядер гелия (например, ядро '!0
можно представить в виде «агрегата», состоящего из четырех
альфа-частиц, или гелионов).
155
Интересно, что при альфа-радиоактивном распаде тяжелых
ядер образуется поток альфа-частиц (ядер гелия), не
претерпевающих дальнейшего распада, что является дополнительным
доказательством особой устойчивости гелия.
Ядра !вО и uSi — ядра наиболее распространенных
элементов в земной коре: кислорода — около 50 вес.% (1-е место),
кремния— около 26 вес.% (2-е место). В природной смеси
этих элементов содержится по три устойчивых изотопа, но на
долю дважды магических изотопов приходится основная масса
их, соответственно 99,759 и 92,16%.
Сравним распространенность в природе шести устойчивых
изотопов кальция (общее содержание кальция в земной коре —
3,6 вес.%):
<°Са(20) «Са (22) ^Са (23) s4JCa (24) JJCa (26) «Са (28)
96,97% 0,64% 0,145% 2,06% 0,003% 0,185%
Как видно, наиболее распространенным (96,97%) является
изотоп, обладающий дважды магическим числом.
При радиоактивном распаде изотопа тория 2|oTh образуется
13 промежуточных радиоактивных изотопов других элементов,
но конечным продуктом распада является вгРЬ — устойчивое
ядро, характеризующееся двумя магическими числами.
К магическим ядрам по числу протонов относятся:
23He|^0, '80|«Si, »Si|SCa. JJCa, «Ca, J«Ca, «Ca |
J»Sn-, «J«Sn, »5Sn, »«Sn, '"Sn, »8Sn, »»Sn, «fSn, J»Sn. «Sn | g»Pb. »Pb
Изотоп |Не, в сравнении с |He, должен быть менее
устойчивым (действительно, энергия связи нуклонов в 2,5 раза меньше)
и менее распространенным (его в миллион раз меньше).
Перечисленные изотопы кислорода, кремния и кальция,
характеризующиеся одним магическим числом, распространены в
природе в значительно меньшем количестве, чем их дважды
магические изотопы.
Элементы со средними порядковыми номерами отличаются
большим числом изотопов в природной смеси, но наибольшее
число устойчивых изотопов характерно для олова (в смеси
10 изотопов), обладающего магическим числом 50.
Конечными продуктами распада радиоактивных семейств
урана 92U и актиноурана 92U являются изотопы свинца
(206РЬ и 207 РЬ), отличающиеся устойчивостью и магическим
числом 82.
156
К магическим ядрам по числу нейтронов относятся
следующие устойчивые ядра:
(8«)'5N (14п)^А1*
(20«)»JS "CI ?°Ar JJK
(Б0я)»»Кг JjRb HSr $JY f0Zr JjNb "Mo
(82«)»eXe »'Ba »»La »°Ce JJ'Pr JJ'Nd J^Sm; (126n)^Bi*
Следует особо отметить ядра алюминия и висмута
(отмечены звездочкой). Единственный нечетный элемент с
субмагическим числом 14 — А1 обладает большой распространенностью —
его содержание в земной коре составляет 7,45 вес.%; по
распространенности он занимает третье место, уступая в этом
отношении лишь кислороду и кремнию. Висмуту отвечает
магическое число 126 и, как отмечалось выше, он последний элемент в
периодической системе, для которого известен устойчивый
изотоп. Этот изотоп 8зВ1 является конечным продуктом распада
радиоактивного семейства нептуния — эзИр, все члены
которого по своей массе относятся к типу An + 1.
Элементы Y, Nb, и Рг являются моноизотопными
элементами, имеющими по одному устойчивому изотопу. Большим
содержанием в смеси отличаются изотопы нечетных по Z элементов:
?эК (93,3%) и 'етЬа (99,91%). У четных по заряду ядер
элементов с Z = 40-^82, содержание наиболее распространенного
изотопа в смеси не превышает 35%, за исключением изотопов 138Ва
и 140Се, содержание которых достигает соответственно 71,66 и
88,49%, что, несомненно, связано с их магическим числом,
равным 82. Содержание наиболее легких стабильных изотопов
обычно не превышает 2%, но у изотопов с магическими числами
50 или 82 (90Zr, 92Mo и 144Sm) содержание в смеси повышается
(соответственно до 51,46, 15,86 и 3,16%).
Изотопы серы, хлора, аргона, криптона и ксенона (36S, 37C1,
38Аг, 86Кг и 136Хе), характеризующиеся магическими числами
по п, являются устойчивыми, а изотопы этих элементов,
отличающиеся от указанных массовыми числами (на единицу
меньше или больше), относятся к бета-радиоактивным, т. е. ядра
их неустойчивы.
Пока ничего определенного нельзя сказать о связи
магического числа с распространенностью изотопов азота.
Из всего вышесказанного следует, что наиболее
распространенными являются «четно-четные» ядра, а среди них те,
которым отвечают определенные магические числа. Кривая
распространенности в логарифмической шкале для четных ядер
расположена в среднем на '/г—1 порядок выше, чем для нечетных,
а максимумы приходятся на ядра с магическими числами
(рис. 16).
7 Зак. 38, 157
Радиоактивные изобары соседних элементов в системе в
результате р+- и р_-распада превращаются в наименьший по
массе (т) устойчивый изобар, называемый 2|3-устойчивым.
Например, для изобаров элементов с Z = 32 -4- 36 и массовым числом
77 схема превращения может быть записана так:
_ н+ _ й+
"Р "А _(Г
S6'N* " *~ 35"' "" 34^с "* 33AS 32v
(т) 76,9489 —*■ 76,9458 —► 76,9446 <— 76,9451 ■*—'■ 76,9481
?Кг —■> ПВг ► "Se "As *— "Ge
Эти р+- и ^--превращения протекают самопроизвольно, так как
радиоактивный процесс сопровождается выделением энергии и,
следовательно, уменьшением массы.
Некоторые ученые считают, что проблема устойчивости и
распространенности изотопов в природе должна
рассматриваться не только с учетом магических чисел, но и закономерности
образования 2р-устойчивых изобаров. Это позволяет объяснить
несоответствия в последовательности величин атомных весов
элементов в периодической системе и должна приниматься во
внимание при разработке периодической системы ядер.
Для S-, р- и d-элементов номера групп периодической
системы приобретают новое значение. В четных группах
располагаются элементы с четным Z, а в нечетных группах — с нечетным Z.
Единственным исключением будут нечетные элементы 27С0, 4sRh
и n\f, если их размещать, как еще принято, в VIII группе.
Моменты ядер
Полный момент количества движения ядер / является векторной
суммой орбитальных моментов и спинов всех нуклонов. В
зависимости от числа нуклонов в ядре и направления, или спина,
полный момент количества движения, или ядерный спин, может
иметь целое значение, включая нуль (0,1,2,3,4,5 ...), или
полуцелое значение (V2, 3k, 5k, 7/2 ••■)■
Очевидно, что ядро легкого изотопа водорода iH, состоящее
из одного протона, обладает спином, равным lfa. Измерение
ядерного спина у дейтерия (тяжелого изотопа водорода) iH
приводит к значению /=1, а следовательно, обе частицы —
протон и нейтрон — вращаются в одном и том же направлении
(рис. 20). У первого дважды магического ядра гНе значение
/ = 0, что свидетельствует о том, что по отношению друг к
другу оба протона и оба нейтрона имеют противоположный спин.
Такое ядро обладает наибольшими симметрией и
устойчивостью. Нулевое значение ядерного спина характерно для всех
дважды магических ядер, что и объясняет высокую их
симметрию, особую устойчивость и соответствует предельной
насыщенности ядерных уровней нуклонами.
Можно высказать следующее общее положение: ядерный
спин равен нулю или целому числу для четных ядер, у которых
158
массовое число — четное; спин равен полуцелому числу для
нечетных ядер. Кривая изменения значения спина ядер / в
зависимости от Z имеет периодический характер (рис. 21
—пунктирная линия).
^Н J Не
Рис. 20. Спин ядер дейтерия и гелия.
Если ядро обладает сферической симметрией, то естественно
предположить, что электрически заряженные частицы в нем
Рис. 21. Кривые изменения спина (пунктирная линия)
и магнитного момента ядер (сплошная линия) в
зависимости от значения Z.
должны быть расположены симметрично и оно не имеет
электрического момента. Однако большинство ядер, вследствие
вращения их вокруг своей оси, деформируется (претерпевает
изменение формы), что приводит к сжатию их вдоль оси или
перпендикулярно к ней. В результате электрический заряд ядра
7* 159
распределен асимметрично (рис. 22), что приводит к
возникновению квадрупольного момента (Q). Чем сильнее отклонение
ядра от сферической формы, тем больше квадрупольный момент
ядра, имеющий положительное (в случае вытянутого
эллипсоида) или отрицательное значение (при сплющенном
эллипсоиде). Если ядерный спин равен '/г или нулю, то квадрупольный
Рис. 22. Схема возникновения квадрупольного момента ядер.
момент равен нулю или близок к нулю. К ядрам с нулевым
значением квадрупольного момента относятся дважды магические
ядра.
Зависимость квадрупольного момента от Z (или N) носит
периодический характер (рис. 23). Наибольшими значениями
квадрупольного момента обладают ядра, расположенные
примерно по середине между
ядрами, характеризующимися
магическими числами.
Кроме полного момента
количества движения и
квадрупольного момента, несимметричные
ядра характеризуются
магнитным моментом (ц), зависящим
от магнитных моментов
нуклонов, которые не обладают
сферической симметрией
распределения в ядре и при своем движении порождают появление
электрического тока с каким-то определенным выделенным
направлением. Наиболее полно изучены магнитные моменты для
нечетно-нечетных ядер; для них величины \х колеблются в
пределах от —0,1 до 6 единиц. Кривая зависимости магнитных
моментов от Z носит сложный, но периодический характер; в
точках максимума кривой находятся ядра, характеризующиеся
наибольшим спином от 5/г до 9/г- Образование нового ядерного
уровня совпадает на кривой с резким возрастанием магнитного
момента (см. рис. 22 — сплошная линия).
Периодическое изменение моментов ядер является одним из
лучших доказательств оболочечной структуры и особых свойств
у ядер с магическими числами.
Рис. 23. Кривые изменения
квадрупольного момента (Q) от
значения Z (или N).
160
Энергия связи ядер
Энергией связи ядер называется энергия, выделяющаяся при
образовании ядра из отдельных протонов и нейтронов.
Естественно, что чем больше энергия связи, тем более устойчиво ядро.
Так как экспериментально энергию связи ядер определить
нельзя, то для ее вычисления пользуются известным соотношением
Эйнштейна:
Е = Am • с2
где Am — дефект массы в граммах; с — скорость света в вакууме, равная
3-Ю10 см/сек (точное значение 2,99793-1010 см/сек); Е — энергия связи в эргах.
Энергия связи может быть рассчитана по дефекту массы
Д/л, равному разности между суммарной массой нуклонов,
образующих данное ядро [Z-mp-{- (A — Z)-mn], и истинной массой
(М) ядра, т. е.
Дот = [Z ■ тр + (Л — Z) • от„] — .Vf
где тр — масса протона; а тп — масса нейтрона.
Например, при образовании ядра гелия |Не (М = 4,001506),
состоящего из двух протонов и двух нейтронов, дефект массы
составит:
Am = 2 • 1,007805 + 2 • 1,008665-— 4,001506 = 0,031434
Аналогично могут быть вычислены дефекты масс ядер, для
которых известны их истинные массы.
Обычно энергию связи в ядрах выражают в
мегаэлектронвольтах (Мэв). Для этого дефект массы в граммах,
приходящийся на одно ядро, умножают на Ю-7 (I эрг = Ю-7 джоулей)
и для перевода в Мэв умножают на 6,2-1012 (джоуль = 6,2 X
X 1012Мэв). Для ядра гелия получим
£св = 0,0522 • 10"24 • 9 • 1020 • 10"7 • 6,2 • 1012 = 29,28 Мэв
{0,0522-Ю"24 = 0,031434/6,02-1023, т.е. дефект массы на одно
ядро).
Так как различные ядра состоят из неодинакового числа
нуклонов, то для удобства сравнения величин энергию связи
относят к одному нуклону, называя эту величину удельной
энергией связи, £уд. Св = Есв/А, где А — массовое число, или
число нуклонов в ядре.
Для ядра гелия удельная энергия связи составит 29,28/4 =
7,32 Мэв.
Из графика зависимости удельной энергии связи от
массового числа (рис. 24) следует, что наибольшей энергией связи
(около 8,6 Мэв) обладают ядра элементов с средними
значениями массовых чисел. Становится понятной причина большого
числа устойчивых изотопов у средних по массе элементов. Из
графика видно, что переход от тяжелых ядер к средним
(деление ядер урана и плутония) и от легких к более тяжелым
161
(термоядерный синтез) энергетически выгоден, именно на этом
основана современная и будущая ядерная энергетика.
Энергия связи протонов и нейтронов в ядре определяется
энергией отрыва этой частицы от ядра. Например, если от ядра
%Х оторвать один нейтрон или один протон, то состав
получающихся ядер определится из уравнений: .
я + Л-Х;
(отрыв нейтрона)
А у l„ _l A— iv
ZX=*lP + Z-lY
(отрыв протона)
Энергию связи можно определить по дефекту массы, равной
разности между суммой масс конечных продуктов и массой
_i_
Ю 20 30 40 50 60 70 60 90 100 120
/40
j U
160 180 200, 220
Рис. 24. Кривая зависимости удельной энергии связи (Есв/А) в ядрах от
массового числа (А).
исходного ядра, переведенной в Мэв, умножением на
коэффициент пропорциональности, равный 931,44*:
£св. п = [К+М*')-Л'х]-931,44
есв.р = [К + 'Ик)-Мх]-931-44
Интересно сопоставить энергии отрыва протона и нейтрона от
ядер, примыкающих к ядрам, характеризующимся магическими
числами, что и было сделано С. А. Щукаревым. Были
проанализированы энергии отрыва нуклонов от ядер 24 изотопов
элементов с Z равным 81; 82; 83 и 84, из которых два средних
обладают магическими числами 82 и 126. Сопоставлены также
данные для четных и нечетных изотопов как по числу протонов,
* Коэффициентом 931,44 пользуются для перехода от энергии,
выраженной в эргах, к энергии, выраженной в Мэв (с учетом числа Авогадро —•
6,02- 10м).
162
так и по числу нейтронов (табл. 47); ядра устойчивых
изотопов помещены в кружки — их пять; все остальные изотопы
радиоактивны. (Величины энергии указаны на стрелках.)
Таблица 47. Энергия отрыва протона и нейтрона от ядер 81, 82, 83 и 84
81
82
83
84
т.
125
Отрыв протонов
7Л7 (20врь
3,88 го7т~+-5,ЬО 208ро
-Т-
7,23 7,32
■ 8> 01 ft01 рьУ*- 3'97 208 Bi-
т-
т-
7,08
5,15 говро
Как видно из таблицы, наибольшая энергия связи протона
приходится на ядра изотопов свинца (магическое число 82), а
наибольшая энергия связи нейтрона — на ядра, для которых
N = 126. Таким образом, ядра с магическими числами, у
которых ядерные уровни насыщены нуклонами, имеют
максимальную энергию связи. Ядра, отличающиеся от магических на
один нуклон, обладают энергией на 3—4 Мэв меньше. Из
таблицы следует также, что нечетные по Z и JV ядра обладают
меньшей энергией отрыва нуклона, чем четные.
Если к магическому ядру добавить избыточный нейтрон, он
будет удерживаться в ядре относительно непрочно (подобно
одному внешнему электрону в атомах щелочных металлов).
163
Если построить криву'ю зависимости: энергия отрыва
избыточного нейтрона — заряд ядра (рис. 25), то в ней видны разрывы
непрерывности, приходящиеся на магические ядра.
Е.Мзв
г -
в 1ч го гв so вг z
Рис. 2». Кривые энергии отрыва избыточного нейтрона от ядер.
Вероятность захвата нейтронов магическими ядрами
ничтожна, что обусловливается законченной структурой ядерных
уровней в этих ядрах.
ИСКУССТВЕННОЕ ПОЛУЧЕНИЕ
ТРАНСУРАНОВЫХ ЭЛЕМЕНТОВ
Несмотря на то что Д. И. Менделеев указал на возможность
сущесгвования более тяжелых элементов, чем уран, до 1940 г.
получать их никому не удавалось. За последние 31 год,
благодаря исключительному развитию техники ядерных реакций,
были искусственно получены новые 13 элементов с порядковыми
номерами, от 93 до 105, названные трансурановыми элементами..
Чтобы осуществить ядерную реакцию, ядра исходного
элемента, или «мишени», подвергают бомбардировке различными
«снарядам!» (нейтронами, альфа-частицами, легкими ядрами
и др.), обладающими необходимым запасом энергии.
Превращение однчх ядер в другие сводится к изменению их заряда.
Так как нейтроны не имеют электрического заряда, то их
внедрение в «мишень» приведет к получению изотопа исходного
элемента. Однако новый изотоп, содержащий большее число
нейтронов, может оказаться р -радиоактивным и, излучая электрон,
превратится в изотоп элемента с зарядом ядра на единицу
больше.
В 1940 г. Макмиллану и Эйблсону (в США)
бомбардировкой урана нейтронами удалось получить изотоп нового
элемента— нептуния:
92 U ~ 0™ — 92 U'
-!e + £"Np
В настоящее время известно 12 изотопов нептуния с
массовыми числами от 231 до 241; все они радиоактивны. Наиболее
устойчивый из них —изотоп 237Np с периодом полураспада
164
2,2 -106 лет; в земной коре его практически нет, так как период
полураспада его примерно в две тысячи раз меньше возраста
нашей планеты — Земли. До получения нептуния некоторые
ученые предполагали, что он должен быть химическим аналогом
рения и занимать место в VIIB-группе, но оказалось, что по
совокупности свойств он ближе к урану.
Изотоп нептуния 237Np — родоначальник радиоактивного
семейства, все члены которого по их массовым числам
относятся к типу 4п + 1. Все они характеризуются малыми периодами
полураспада («вымершее семейство»). Конечным продуктом
распада является устойчивый изотоп 8зВ1 с магическим числом
126 (209 — 83= 126).
При |5~-распаде изотопа 93Np получается изотоп следующе-
го элемента — плутония 94Р11, с периодом полураспада
24 400 лет. Этот изотоп можно получить также из изотопа 29<>U,
если добиться увеличения заряда на две единицы, но для этого
в качестве ядерных «снарядов» следует использовать
альфа-частицы:
2Ци + 42а = 1ГР*+Ч1п]
Искусственное получение 94PU в больших количествах имеет
важное техническое значение, так как ядра этого изотопа,
подобно ядрам 92U, при воздействии медленных нейтронов
претерпевают деление с освобождением значительного количества
энергии. Это позволяет использовать плутоний в атомных
реакторах в качестве ядерного горючего.
Ускоренные альфа-частицы с энергией 100 Мэв были
использованы для получения изотопов 96, 97, 98 и 101 элементов. Этим
методом синтезировали изотоп 101-го элемента, получившего
название менделевий (точнее было бы — менделеевий,—
B.C.) в честь творца периодической системы — Д. И. Менделеева:
29fEs + Ja = ^Md + >
Следует отметить, что этот изотоп был получен всего лишь
в количестве 17 (!) ядер. Несмотря на то что период
полураспада ioiMd составляет только 30 мин, его удалось выделить и
изучить свойства. Это свидетельствует о высоком уровне
современного эксперимента. Естественно, что менделевий не может
быть использован в качестве исходной мишени для получения
ядер последующих элементов.
Для получения изотопов 102-, 103 и 104-го элементов
пользовались ядрами плутония 94Ри. Чтобы увеличить заряд
соответственно на 8, 9 и 10 единиц, в качестве «снарядов» были
применены ионы легких изотопов кислорода, фтора и неона,
ускоренные до больших энергий в циклотронах. Например, изотопы
165
102 и 104-го элементов были получены в лаборатории ядерных
исследований в Дубне *, руководимой академиком Г. Н.
Флеровым:
»»Ри + ГО = ™No + 2 [««] Г/Р" + ^Ne = «Ко + 4 ['«]
«Синтез» 104-го элемента представлял значительный
интерес для решения вопроса о структуре 7-го периода, так как
согласно актиноидной гипотезе Сиборга элемент 104 должен быть
аналогом гафния.
Таблица 48. Трансурановые элементы (Z = 93 + 104)
г
93
94
95
96
97
98
99
100
101
102
103
104
Элемент
Np
Pu
Am
Cm
Bk
Cf
Es
Fin
Md
No
Lr
Ku
Название
Нептуний
Плутоний
Америций
Кюрий
Берклий
Калифорний
Эйнштейний
Фермий
Менделевий
Нобелий (?)
Лоуренсий (?)
Курчатовий
Год
получения
1940
1940
1944
1944
1949
1950
1952
1953
1955
1957
1961
1964
Число
изотопов
11
15
10
12
8
11
11
9
2
2
1
1
Наиболее
устойчивый
изотоп
237Np
244рц
243Ат
247Ст
*<?Вк
252Cf
254Es
257Fm
258Md
235No
256Lr
260Ku
Период
полураспада
2,14- 10е лег
8,2 • 107 лет
7460 лет
1,6- 10' лет
1400 лет
2,65 года
270 дней
80 дней
54 дня
3 мин.
35 сек.
0,3 сек.
* Факт получения в 1957—1961 г. 102 и 103-го элементов не подтвердился,
а потому названия «нобелий» и «лоуренсий» оспариваются. Физика
социалистических стран предложила для этих элементов названия «жолий» и «резер-
фордий».
166
Изучение природы 104-го элемента курчатовия было
весьма затруднительно, так как было получено всего лишь 150
ядер изотопа нмКи, отличающегося крайней неустойчивостью
(период полураспада — всего 0,3 сек. (!)). Два года
потребовалось советским и чешским ученым, работающим в
Объединенном институте ядерных исследований в Дубне, для
доказательства, что курчатовий является химическим аналогом гафния,
т. е. относится к d-элементам IVB-группы. Следовательно, 103-м
элементом заканчивается семейство актиноидов, состоящее из
14 /-элементов; актиноидная гипотеза Сиборга получила
блестящее подтверждение. Следует отметить, что большинство
актиноидных элементов было получено в США Сиборгом и его
сотрудниками (табл. 48).
В 1967 г. академику Г. Н. Флерову с сотрудниками впервые
удалось искусственно получить 105-й элемент бомбардировкой
изотопов америция ускоренными ионами неона:
Ц'Am (Ц3Am) + f^Ne = 260105 (21И105) + (3 - 4) ['«]
В начале 1970 г. были проведены дополнительные опыты по
получению 105-го элемента и изучению альфа-активности и
спонтанного распада выделенного изотопа. Установлен период
полураспада, равный около 2 сек, и определена энергия
альфа-излучения 8,9 и 9,1 Мэв. Химически этот элемент был
идентифицирован по относительно легкой летучести его пентахлорида;
он является аналогом тантала с подобной электронной
конфигурацией d3s2 и должен занять место в VB-группе. До 1970 г.
этому элементу не было дано название.
В апреле 1970 г. Гиорсо (США) сообщил, что ему с
сотрудниками удалось получить элемент 105 по ядерной реакции:
2^Cf+'5N = 260105 + 4[^]
Установлено, что изотоп 260105 имеет период полураспада
1,6 + 0,3 сек и распадается с испусканием а-частиц с энергиями
9,06; 9,10 и 9,14 Мэв. Этому новому элементу было предложено
название ганий (символ На) в честь известного немецкого
радиохимика О. Гана. Г. Н. Флеров в печати указал на
поспешность присвоения новому элементу названия, предложенного
американскими учеными, так как приоритет в получении
элемента принадлежит советским ученым, которые предложили
105-й элемент назвать нильсборий или нильсий (символ Ns)
в честь крупнейшего физика Нильса Бора.
Что можно сказать о получении элементов с порядковыми
номерами более 105? В области радиоактивных элементов,
начиная с урана, с возрастанием Z период полураспада (7\/2)
спонтанного деления ядер резко снижается (например, для 2gfU
7\,2 - 2-1016 лет, для 291Ри - 7,2 • 1010 лет, для^Ст - 4- 106лет,
а для 105-го элемента около 2 сек., что связано с уменьшением
167
ГЕОРГИЙ НИКОЛАЕВИЧ
ФЛЕРОВ
(р. 1913)
прочности ядер. По-видимому, для изотопов элементов 106, 107
и последующих периоды полураспада будут еще меньшими и
станут исчисляться долями секунды. Эти ядра должны
характеризоваться большой неустойчивостью и получение и изучение
их свойств вряд ли реально *. Но можно предположить, что в-
«море ядерной неустойчивости» имеются «острова устойчивости»,,
на которых располагаются хотя и радиоактивные, но
относительно устойчивые ядра.
Как уже отмечалось выше, в результате теоретических
расчетов были выявлены новые магические числа 114 и 126 (по Z)
и 184 (по N). Дважды магические ядра 298114 (Z = 114 и N =
= 184) и 310126 (Z = 126 и N = 184) по расчетным данным
должны относиться к сравнительно «устойчивым» с периодами
полураспада до 106—107 лет. Это позволит выделить эти ядра и
изучить их химические и радиоактивные свойства. Не исключена
возможность синтеза ядер с Z = 114 с меньшим или большим
числом нейтронов, чем 184 (N = 174-t-194, а массовые числа
таких ядер будут иметь значения от 288 до 308).
Синтез указанных ядер может быть осуществлен
следующими ядерными реакциями:
2«Ри + <8Са = 288114 + 2 [»«] 2«Pu + ^Ge = 31°126 + 4 [•«]
94*
Возможен и другой путь: слияние двух ускоренных ядер урана
и последующее спонтанное деление образовавшегося сложного
ядра
гЦи + HSU ш. 476184 —> 298114 + ^6Yb + 12 ['«J
Для разработки метода химического отделения 114-го
элемента от мишени и побочных продуктов других ядер необходи-
* В настоящее время в г. Дубне ведутся работы по получению эл«-
мента 106,
168
мо знать природу этого, пока неизвестного, элемента. Здесь на
помощь приходит периодическая система Менделеева. Так как
порядковые номера элементов 7-го периода отличаются на 32
единицы от элементов-аналогов 6-го периода, то по разности
114—32 = 82 находим, что 114 элемент должен являться
аналогом 82-го элемента свинца и его можно предварительно
назвать экасвинцом (ЕРЬ). На основании местоположения
114-го элемента в системе (группа IVA) можно предсказать с
относительной достоверностью все его химические свойства и
электронную конфигурацию атома.
Электронная оболочка атома ЕРЬ должна состоять из семи
уровней, а электронная конфигурация внешнего уровня
отвечать типу s2p2 и, следовательно, максимальная валентность
этого элемента будет равна 4. Соединения четырехвалентного эка-
свинца будут неустойчивы, с сильновыраженными
окислительными свойствами и будут легко переходить в двухвалентные
соединения. Аналогично сульфату свинца PbSO^ сульфат 114-го
элемента EPbSCu должен быть нерастворим в воде и в виде
этого соединения он может быть выделен из раствора.
Малорастворимый иодид экасвинца ЕРЫ2 будет взаимодействовать
с избытком иодида калия, образуя растворимое комплексное
соединение состава K^EPblJ или KJEPbl'e]. Гидроксид экасвинца
ЕРЬ(ОН)г должен обладать слабовыраженными амфотерными
свойствами, но с преобладанием основных свойств и т. п.
Предполагаемая относительно большая «устойчивость» ядер
элемента 114 и ядер, располагающихся в периодической системе
по соседству с ним, подтверждается исследованием космических
лучей. Английским профессором Поуэллу и Фаулеру,
исследовавшим фотоснимки космических лучей, полученные на высоте
40 км над поверхностью земли (фотопластинки поднимались на
эту высоту с помощью шара-зонда), удалось расшифровать
треки (следы) частиц космических лучей, различающиеся своей
толщиной. (Толщина треков пропорциональна массам и
зарядам частиц.) Наряду с треками ядер железа (Z = 26) были
обнаружены следы, толщина которых соответствует ядрам
с зарядом, равным около 108. Не исключена возможность
обнаружения треков, относящихся к изотопам элемента 114. Так
как лучи из далекого космоса достигают района земли через
миллионы лет, то, следовательно, период полураспада ядер
114-го элемента не может быть меньше этого значения, иначе
они бы распались на «пути своего следования».
Естественно поставить вопрос о возможности «приземления»
этих ядер на поверхность нашей планеты. Ядра 114-го элемента
попадают на поверхность земли, но, как показывают расчеты,
*>а каждый 1 кв. км «опускается» в год лишь одно ядро (!).
Всего за год на всю поверхность нашей планеты «осаждается»
^0 микрограммов 114-го элемента. Можно ли «собрать» такие
ничтожные количества? Единственный путь, приводящий
169
к реальному обладанию 114-м элементом, искусственное
получение его ядерными реакциями, указанными выше, или другими
возможными реакциями.
Менее вероятно, но возможно искусственное получение
126-го элемента. Если исходить из ториевой мишени (для тория
Z = 90), то заряд следует увеличить на 36 единиц (90 + 36 =
= 126), а для этого в качестве «снаряда» следует
воспользоваться ускоренными ионами криптона (Z = 36). Ядерная
реакция будет соответствовать следующему уравнению:
2Th 4- 82Kr ■
, 310
' 126
Х + 4[«в|
При этой реакции будет получено «дважды магическое» ядро
126-го элемента с числом нейтронов 184 (310—126=184).
Интерес к этому элементу огромен, так как его атом по
структуре электронной оболочки должен относиться к новому
типу 5^-элементов (напомним, что до сих пор нам были
известны четыре типа элементов s-, p-, й- и f-). Этот элемент не
Таблица 49. Девятипериодная форма системы элементов
Д. И. Менделеева
2s
Li
3
Na
11
Be
4
Mg
12
3s
us за
к
19
Rb
37
Ca
20
Sr
38
Sc
21
Y
39
Ss bit
6s 5a ( if
Cs
55
Fr
87
Ba
56
Ra
88
La
57
Ac
89
Ce
58
Th
90
7s
6U Sf\
H
He
2
Is
гр
В Ne
5 Ю
.Ar
18
3p
за
Ti
22
Zr.
iD
7,n
30
.С.Л
68
*P
Ga Kr
31 36
In Xe
69 56
6d
5p
Pr.,
59
Pa..
91
4/
. I,n
71
. I,r
103
Hf,
72
K«.
106
5d
щ
80
112
6p
Tl Rn
81 86
- -
113 118
Sf
6d
?P
•
8
9
8S
119
/69
120
170
7d
121
171
6f
122
172
123..
sg
...160
161
191..
6f
..153
.203
156
?a
182
8p
213. ....218
9s ea 7f
Sff
7f
8d
9p
имеет в периодической системе вышестоящих аналогов, а
потому предложить ему название с приставкой эка нельзя. Пока,
в соответствии с предложением чл. корр. АН СССР В. И. Голь-
данского, мы можем элемент 126 отнести к семейству «октаде-
канидов» (так названа им группировка из 18 5#-элементов
8-го периода). Поскольку данный элемент будет расположен
в 8-м периоде, то электронная оболочка его атома будет
состоять из восьми уровней. Конфигурация валентных электронов
атома этого элемента будет 5g46/28s2 или 5g56/'8s2 (по
В. И. Гольданскому — 5g68s2). По числу внешних электронов
(8s2) этому элементу будет свойствен явно выраженный
металлический характер. Помимо двух внешних электронов в
химических реакциях будет участвовать один или несколько электронов
из 5g- (или 6/-) подуровня, а потому его наиболее устойчивая
форма валентности достигнет 3 или 4, хотя возможны и высшие
формы валентности.
В будущих 8- и 9-м периодах должно содержаться по 50
элементов (2-52 = 50) и среди них по 18 элементов g-типа.
В настоящее время уже известны таблицы периодической
системы (В. И. Гольданского, М. Таубе, Г. Сиборга),
включающие пока гипотетические 8-й и 9-й периоды. В качестве примера
приведена (табл. 49) 9-периодная форма системы,
разработанная на основе длиннопериодного варианта.
В таблице элементы-аналоги, относящиеся к одному типу,
располагаются друг под другом. Как следует из таблицы, 5g-
элементы не имеют аналогов.
Из сказанного о элементах 114 и 126 видно, сколь мощным
орудием исследования является периодический закон и система
элементов'Д. И. Менделеева в наши дни.
В последние 50 лет * осуществлена мечта Фарадея,
высказанная им еще в 30-х годах прошлого столетия — «Одной из
ближайших задач химии явится трансмутация элементов (т. е.
их взаимное превращение)». О значении решения этой задачи
говорил еще Д. И. Менделеев:
«Мне было бы интересно присутствовать при опытах
превращения элементов, ибо тогда я мог бы надеяться, что будет
понята истинная причина периодического закона».
СИСТЕМА ИЗОТОПОВ ^ЯДЕР>
Как было показано выше, ряд ядерных свойств, например,
моменты ядер, дефект массы и устойчивость ядер,
распространенность в природе, энергия присоединения к ядрам протона
и нейтрона, оказались периодически изменяющимися
свойствами. На кривых этих свойств в зависимости от Z, N или А
имеются резко выраженные максимумы и минимумы. Последние
* Первая ядерная реакция была осуществлена Резерфордом в 1919 г.
171
отвечают ядрам, содержащим определенное число протонов и
нейтронов. Эти числа, названные магическими, получили
объяснение на основе оболочечной модели ядра, вскрывающей
закономерное распределение нуклонов по ядерным уровням. Все это
приводит к мысли, что устойчивые и радиоактивные изотопы
должны быть связаны между собой в единой, периодической
системе.
Естественная систематика изотопов или ядер должна
основываться на количественных характеристиках, именно:
порядковом номере Z и массовом числе А или их производных N =
= А —Z, /d, ZjA и др. (N определяет число нейтронов в ядре).
«■ 15 16 17 18 19 20 21 22 23 Si 25 26 27 26 А
б
Рис. 26. Построение периодической системы изотопов химических
элементов:
с—принцип построения; б —часть системы в координатах Z/A — A для изотопов
кислорода, фтора, неона, натрия и магния.
Ядра, содержащие одинаковое число нейтронов, называют изо-
нейтронами, или, менее удачно, изотонами. Ядра с
одинаковым числом избыточных нейтронов называют изодиффе-
рентами U = А — 2Z (1а определяет число избыточных
нейтронов в ядре). Величина ZjA — удельный заряд ядра, т. е.
заряд, отнесенный к единице массового числа.
Сложность построения периодической системы изотопов
заключается в том, что она должна охватить около 1700
разновидностей атомов, тогда как в периодической системе
элементов всего лишь 105 элементов или видов атомов. Форма
системы изотопов играет решающую роль. Несмотря на то что
предложен ряд вариантов клеточной системы изотопов (О. Мен-
доза, Г. Майтак и др.), ни один из этих вариантов не является
наглядным и легко' воспринимаемым. Более удачны системы
в виде диаграмм, графиков и схем.
172
В зависимости от выбранных двух основных координат
варианты системы могут быть различны по построению.
Принципиальная идея построения сводится к следующему: точке
пересечения линий изотопов, изобаров, изонейтронов и изодиф-
ферентов должно соответствовать определенное ядро (рис. 26, а).
На основе данных табл. 50 составим для изотопов пяти
элементов отрезок системы (рис. 26,6) в координатах «Z/A—Л».
На этом графике устойчивые изотопы изображены черными
квадратами, позитронные излучатели — кружком с плюсом,
электронные излучатели — кружком с минусом и неизвестные
до сих пор изотопы — кружком со знаком вопроса.
Каждый изотоп расположен в месте пересечения
изотопной (Z), изобарной (А), изонейтронной (М) и изодифферент-
ной (h) линий, а так как эти числовые характеристики не
могут быть дробными, то в промежутках не может находиться
никаких изотопов.
Жирная пунктирная линия (см. рис. 26,6), соединяющая
устойчивые изотопы, позволяет проследить последовательный
генезис всех устойчивых изотопов на протяжении всей системы
от 1-го до 83-го элемента. На участке системы для пяти
выбранных элементов видно, что построение устойчивых изотопов
следует закономерности 2п2р:
•«О — "О — !80 — '99F — «jNe —,
8 «В п О п У nJU
2и 2р
22М. J „ 23хг, _ 84.
10
Ne Т "Ne -Г ??Na -* JjMg —* "Mg ~~ ~Mg
2rt 2p 2rt
Эта закономерность приводит к тому, что у четных
элементов должно быть по три устойчивых изотопа, а у нечетных —
по одному, что и соответствует действительности.
Однако помимо последовательности построения ядер по
типу 2п2р, возможна последовательность построения по типу
Ап2р; откуда следует, что четные элементы имеют по пяти
устойчивых изотопов, а нечетные — по одному. На некоторых
участках системы возможно попеременное построение ядер
устойчивых изотопов по типам Ап2р и 2п2р:
■ 4л ■ 2р—■
°Ег -^ >«Ег -? '«Ег у 'ЙТш -у "ЦУЬ
■ 2я . 2р-
Так как группировки нуклонов типа 2р2п и Ап2р
соответствуют ядрам изотопов гелия |Не (2р 2п) и гНе (2р An), такие
группировки называют г ел'и о-группами (альфа-группами, или
173
Таблица 50. Количественные характеристики изотопов кислорода,
фтора, неона, натрия и магния
Z
8
9
10
Изотопы
J5Q
I6Q
,70
»»0
20Q
17р
18р
19р
20р
21р
18Ne
I9Ne
2°Ne
2,Ne
22Ne
23Ne
Z/A
0,570
0,529
0,500
0,470
0,444
0,421
0,400
0,529
0,500
0,474
0,450
0,429
0,555
0,526
0,500
0,476
0,454
0,435
N-A-'Z
6
7
8
9
10
11
12
8
9
10
11
12
8
9
10
11
12
13
,d = A-2Z
-2
-1
0
+ 1
+2
+3
+4
-1
0
+ 1
+2
+3
-2
-1
0
+ 1
+2
+3
Тип
изотопа
P+
P+
Устойчивый
To же
»
P-
P-
P+
P+
Устойчивый
p-
p-
p+
p+
Устойчивый
To же
»
P-
Период
полураспада
76,5 сек.
118,1 сек.
30 сек.
?
72 сек.
107 мин.
12 сек.
?
1,6 сек.
18,2 сек.
40 сек.
Процентное
содержание
изотопа
в смеси
99,76
0,04
0,20
100
90,92
0,26
8,82
2°Na
21Na
22Na
23Na
24Na
25Na
26Na
0,550
0,524
0,500
0,478
0,458
0,440
0,423
9
10
11
12
13
14
15
—2
— 1
0
+ 1
+2
+3
+4
P+
P+
P+
Устойчи
вый
p-
p-
p-
12
22Mg
23Mg
24Mg
25Mg
26Mg
27Mg
28Mg
0,545
0,522
0,500
0,480
0,461
0,444
0,428
10
11
12
13
14
15
16
-2
-1
0
+ 1
+2
+3
+4
P+
P+
Устойчивый
To же
»
P-
P-
?
11,9 сек.
—"
—
—
9,45 мин.
21,2 час.
—
78,6
10,11
11,2»
—
—
174
альфа-структурами), а само построение ядер именуют гелион-
н ы м. При одинаковом значении Id ядра изотопов двух соседних
четных (вО и ioNeJ или нечетных (9F и I'iNaj отличаются друг
от друга на гелио-группу 2Не и, следовательно, учет гелионного
построения ядер, по-видимому, имеет немаловажное значение в
систематике. Нередко отдельные ядра содержат целое число
гелио-групп и числом их можно выразить состав ядра. Напри-
24»»
мер, состав ядра изотопа магния i2Mg можно выразить в виде
б[гНе], или 6а.
Область, лежащая выше жирной пунктирной кривой
(рис. 26,6), занята позитронными, или |3+-излучателями, а
ниже — электронными, или р~-излучателями. Так как места
пересечения всех линий заняты радиоактивными изотопами, то
следует считать, что все устойчивые изотопы данных элементов
открыты и в будущем возможно искусственное получение
только радиоактивных изотопов. В рассматриваемом участке
системы остаются неизвестными изотопы 'gF, 2gF и ?oNe (см.
рис. 26,6). Нетрудно предсказать, что первый из этих изотопов
должен быть р+-, а два последних — р~-радиоактивными;
периоды полураспада их должны быть небольшими и измеряться
секундами или долями их, что следует из величин периодов
полураспада соседних изотопов (см. табл. 50).
Взаимный генезис ядер по любому из четырех направлений
легко прослеживается по данному участку системы. По линии
Z имеет место нейтронный генезис, эта линия связывает
изотопы данного элемента. В этом аспекте элементом следует
называть плеяду изотопов с закономерно изменяющейся массой
ядра определенного заряда.
Перемещению по вертикали, т. е. по линии А, отвечает
изобарный переход, сопровождающийся в верхней части системы
Р+-излучением, а в нижней части — р~-излучением (на рис. 26,6
эти переходы отмечены пунктиром со стрелками).
По изонейтронным линиям (снизу вверх) протекает
протонный генезис: переход к последующему ядру возможен при
присоединении протона.
Каждое последующее ядро возникает из предыдущего,
лежащего на одной изодифференте, при присоединении частицы
?Н (ядро тяжелого изотопа водорода — дейтерия).
Теперь предстоит рассмотреть не участок системы, а всю
систему в целом. Основные координаты можно выбрать любые.
Попытки ряда ученых построить периодическую систему
изотопов на основе периодической системы элементов не
увенчались успехом, так как построение электронной оболочки атомов
и ядерных уровней подчиняется разным закономерностям,
а следовательно, длины периодов и конструкция системы в
целом не могут повторять друг друга.
175
Несомненно, что ядерные периоды в системе изотопов
должны заканчиваться ядрами с магическими числами, и в
первую очередь — дважды магическими числами, отличающимися,
как было показано выше, особыми свойствами. Напомним, что
к этим ядрам относятся:
*Не(2), 40(8), «Si (14), «Са (20), ^Са (28), 2°28РЬ (126)
Однако между ядрами с зарядами 20 и 82 лежит значительный
интервал; между ними расположены ядра изотопов с
магическим числом 50. Дважды магических ядер, отвечающих этому
числу, нет, и поэтому встал вопрос о конструкции периода
с магическим числом 50 либо по числу протонов, либо по числу
нейтронов. Выбор ядра по числу протонов однозначен— это
изотоп олова soSn. К ядрам, магическим по числу нейтронов
(50«), относятся:
6К> 87Ph
Sr 89Y 90Zr 9,Nb и 92Мо
Из данных изотопов следует исключить все нечетные ядра,
которые, как известно, менее устойчивы; останутся четыре
четных изотопа. Неоднозначность выбора изотопов привела к тому,
что в одних системах ядерные периоды заканчиваются
магическими ядрами по числу протонов, в других — магическими
ядрами по числу нейтронов, а в некоторых — обоими типами
ядер. Таким образом, число вариантов периодической системы
изотопов велико. Ниже приведено шесть вариантов
периодической системы изотопов (табл. 51), в которых изотопы
расположены по периодам. Вверху указаны магические числа по /V,
Таблица 51. Шесть вариантов периодической системы изотопов
1
2
3
4
5
6
2
I
I
—I-
J
3 14
20
"1
Са
-О
Са
-И,III—— Са
I Аг
-H-S1
Si
!
i 1
HI—
1
4
2
0
28
50
|
-II-
-IV-
-Fe
Sr
Zr
82
IV—Ba
Ill—Nd
V—Sn
Sr
—IV— Sr
41
2
—HI—Sr
V
Ill Ce
-V-Sn
-IV-Sn
8
5
•VI-Ba
■V-Ce
0
V-
IV
I W
IV-
VI-
126 N
- Ra
—Pb
—
— Pb
8
-
хг
176
а внизу — по Z; римскими цифрами — номера периодов, а
вертикальными линиями — границы периодов.
В вариантах № 1—4 не учитывается число 28, так как
авторы этих систем не считают его, так же как и число 14,
магическим.
Число периодов в различных вариантах, считая последний
период незаконченным, колеблется от 5 до 7, так как
однозначного мнения в отношении конструкции периодической
системы изотопов пока нет. Сдвиги границ периодов от
магических чисел влево или вправо не имеют достаточно
убедительных обоснований.
Однозначное решение вопроса о периодической системе
изотопов затрудняется тем, что периодические свойства ядер
проявляются не так отчетливо, как у атомов. В отличие от куло-
новских сил, действующих в атоме в целом, внутри ядра
действуют ядерные силы, природа которых еще не раскрыта,
и потому внутриядерные свойства не всегда можно
объяснить.
В качестве примера рассмотрим вариант периодической
системы, составленный советским физиком И. П. Селиновым
(табл. 52). Этот вариант был помещен в ряде журналов,
монографий и справочников, а в 1962 г. был издан в виде
настенной таблицы в красках. График системы изотопов построен
в координатах «Z — Id». Устойчивые изотопы изображены
черными квадратами, соединенными прямыми линиями.
Образующаяся в целом зигзагообразная линия характеризует тип
построения ядер (2р2п; 2р4п).
Над жирной линией лежит область р~-, а под ней р+-радио-
активных изотопов. Каждый из этих изотопов изображен
кружком со знаком + или — (в оригинале кружки окрашены в
голубой и розовый цвета с указанием внутри их величин периода
полураспада*). Кружками с вертикальной штриховкой
отмечены радиоактивные изотопы, характеризующиеся ^-захватом
электронов (.Е-захват электрона ядром приводит к
возникновению изобара с зарядом на единицу меньше). Альфа-излучатели
изображены незачерненными квадратами, обрамленными
тонкими линиями. Зигзагообразная линия сверху и снизу
отделена двумя тонкими прямыми линиями, за пределами которых
встречаются 2|3-радиоактивные изотопы, т. е. изотопы,
излучающие по два позитрона или электрона.
Так как после 83-го элемента нет ни одного устойчивого
изотопа, черные квадраты альфа-радиоактивных изотопов
в таблице Селинова заменены белыми. Короткоживущие
альфа-излучатели обозначены кружками с буквой а. Если для
* Используя в оригинале семь различных цветов, И. П. Селинов смог
изобразить изотопы, характеризующиеся смешанным типом излучения,
изомерным переходом, спонтанным распадом и другими свойствами.
17Т
Таблица 52. Периодическая
вводимого в таблицу изотопа тип радиоактивного распада и
период полураспада достоверно не установлены, то в центре
кружка ставится знак вопроса. Устойчивые изотопы,
выходящие за пределы 2р-устойчивых изотопов, обозначены черными
квадратами с белыми просветами. Вертикальные линии,
оканчивающиеся вверху и внизу черными треугольниками, отвечают
изотопам магических ядер по числу протонов.
J 78
система изотопов И. П. Селинова
1 II ■■- '
Период
■•.■'л !Ge|As |Se|Br|Kr |Rb|Sr| Y |Zr |Nt>|Mo|Tc |RulRh|Pd|Aff|Cd, In |Sn|SbfTe[ I |Xe |Cs IBa.LalCe Элемент
ШттштттттттттшттшттттттттРЛШШШШаш
9,
о о8§ЩI
♦ i.x &wj
L
1 в
э © 1
у рч © 0-
ЁгчЭ © G
(*\mtf f ДтЧ^лХ'М") С-
X К V V 8
90000
&Q О В Q
i^t) 49 ^
[ Й © Y e
5 © © 0 §
3 о о п г
к X.«.?£
|ХЛ|ь X 0-ХЛь дж ф Ъ
1 1 ш^№ '—■ ♦ ^^wfr '^^ffV^.
m|il {+^
©©©©©'
f
©ода© ■
r
i ;
aG
© 0Э © i
?зз_
> As:
3 © I
U зь:
ie Br I
р щ ш W
> H у Е
й ы® й
gfflftt
5 © ч
л
S ЗТ38 3<
Сг Rb Sr Y
^КМШШШШШШ (ЩМЙ
нФдИхИхжх!
^ Р w®wwwww*w
О ffl§§®i®vl
© ©
i 40 О 42 43 44
Zr Nb Mo Tc Ru
э © © © s
|Jmmj][ft
fr
(+
0 1
0 0
0 0
0
J 0 I
0 © I
Agg ЙЙЙ
Igggggg JL
'lllllll
' о n о © я о о
r<f о <tt5 *.© ' L4
1 ф*Ф*♦» < >
©
».»
iiW жЧ '
11 [) Q0 (p
5 б © о ® Ф
5 © © v 0 Ф
5 0 w w w w
но Ш # Ш © Щ
5 © © © © ©
45 4£47 4g4
Rh Pa Ae Cd и
3 50
S1 S
?R3
i Sn Sb те I
© W
J4
lie
JS ££
Cs Ba
IV V
|Bi J Po| Ai |Rn|Fr |Ra|Ac|Th|Pa| U |Np|Pu|Am|Cm|BK|Cf | Es|Fm|Md|No|LrlKu
№
ашш|:м™ш№]Ёашенв:зк1е!йШРием№]П!я&П1№1:*»:
П
Й g,
w S
@ 2
И
@ [Г5 К
(с?) (-) C-
@ ЙА £
SNwiKw ь
(одГл к5г> С
3 (a) (a) |OJ fcp С
.: Й § (щ @ £
If (H
0 w ® ©
f:
© © X
@ (a) (a)
(cfi j
(S)
® 1
l si
|§§А
1 1
«ig
- Д \~) (-) w (—) (-) м —)
) tm С Щ
t ® St w
g @n !3 ©
M К"^ M '}i
1 ж si 5k$S§ '
@ @ § Ш (Mi) Ш i
)
@ @ All () О $
@ Id ii
cq4
о ffi (sNO
/Ыо (о) РГя
If ill
mji m|
f ® © @
l Y ©
T
1
t
1
0 i
r
пгакн:ЯРаг^л:¥1К«шишиш^шш^[И1ИС!?;!5Н15:
IBi | PoiAilRnlFrlKalAcl^I'hlPal U |NBlPu|Am|Cm|BK!Cf lEelFmlMdlNolLr |Ki
Период
Элемент
z
j8-PAСПАД
6
5
4
3
2
0
-1
-2
-3
-4
-5
-6
-7
-8
-9
-10
-11
-12
-13
-14
-15
-16
-17
•
Элемент
P А- РАСПАД
1 14
13,
12
11
'9
9
8
7
X 6
Э 5
RH 4
ян з
3 8 2
IM» о
i» "2
3 1 -3
mo -4
5 • -5
i« -6
Э © -7
Hi -8
3 © "9
Э © -10
T Щ _11
57 58
La Се Элемент
He входя в обсуждение данного варианта по существу,
отметим, что это один из многих возможных вариантов
периодической системы изотопов.
Существует несколько формулировок периодического
закона в ядерном аспекте. Приведем одну из них: с увеличением
числа структурных элементов — нуклонов, а также возможно
гелионов (в ядре) и электронов (в атомной оболочке) —
17»
периодически повторяются аналогичные особенности в строении
и свойствах как ядер, так и атомов, причем эти особенности и
периодичность у ядер и атомов имеют различный характер,
хотя и обладают рядом сходных черт.
СООТВЕТСТВИЕ МЕЖДУ ЭЛЕКТРОННОЙ ОБОЛОЧКОЙ
И ЯДРОМ АТОМА
Наиболее устойчивыми ядрами, отвечающими магическим
числам при Z = N = 2, 8, 20, 50, 82 к 126, являются ядра изото-
50 ьо 30 20 10 0-2 ld
Рис. 27. Границы существования р-- и р+-радиоактивных
изотопов.
лов элементов, расположенных в четных группах: олово и
свинец в IVA-группе, кислород в VIA-группе, а атомы остальных
элементов — гелия (VIIIА), кальция, стронция и бария (ПА) —
относятся к s-типу с полностью заполненным электронами s-
подуровнем.
180
Естественно, что зеркального соответствия между ядерными
периодами в системе изотопов и электронными периодами в
системе элементов не может быть. Правда, первый период
заканчивается в обеих системах гелием. За кальцием, стронцием и
барием следуют элементы скандий, иттрий и лантан, атомы
которых относятся к d-типу. Если построить график зависимости
между Z (ось ординат) и Id (ось абсцисс) для всех изотопов
(как устойчивых, так и радиоактивных), то обнаружится
закономерная связь между построением ядер и электронной
оболочки их атомов (рис. 27).
На графике горизонтальными линиями отделены элементы
А- и В-групп, лантаноиды и актиноиды. Устойчивые изотопы
элементов А-групп располагаются на вертикальных отрезках
(Id = const) жирной линии, соединенных наклонными
прямыми, на которых расположены устойчивые изотопы элементов
В-ГруПП (Id послед = Aj предыдущ + 2). ПуНКТИрНЭЯ ЛИНИЯ ДеЛИТ
области р~- (слева) и р+-излучателей (справа). р-Линия и Z-
линия при переходе от А- к В-группам идут вместе, а от В-
к А-группам раздельно, но параллельно друг другу.
р-Линия отклоняется от Z-линии в тех местах, в которых
расположены атомы с наполовину заполненными d- или
/-подуровнями: Мп, Тс, Ей и Am. Вновь сходятся линии в тех
местах, которым отвечают атомы с застроенным наполовину р-
подуровнем: As, Sb и Bi. Изменение вертикального
направления линий к наклонному происходит у атомов с полностью
застроенным s-подуровнем, т. е. у Са, Sr, Ba и Ra. Наклонное
направление р-линии начинается у атомов с заполненным d-
подуровнем: у Си и Ag.
Тонкими волнистыми линиями ограничена область (она
заштрихована) известных в настоящее время изотопов. Эти
линии характеризуются «впадинами», приходящимися на ядра
тех элементов, атомы которых имеют наполовину и полностью
застроенную электронную структуру определенного подуровня.
По данным шведских ученых Асунмаа и Лепсиуса, из 419
Р~-радиоактивных изотопов только семь (около 1,5%) не
вмещается в указанную область на графике. Из 225 изотопов,
характеризующихся f-захватом, только у 8 Id больше на
единицу, чем это следует ожидать по р~-линии. Можно считать,
что свойства р~-радиоактивных ядер закономерно коррели-
руются с типическими химическими свойствами элементов в
периодической системе. Однако для окончательных выводов
потребуются новые дополнительные исследования в этой области.
НЕИСЧЕРПАЕМОСТЬ
ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ
Д. И. МЕНДЕЛЕЕВА
Изучение свойств ядер и разнообразных ядерных реакций
привело к открытию и изучению большого числа «элементарных»
частиц. По этому поводу академик И. Е. Тамм сказал однажды:
«Когда я начинал заниматься физикой, было известно всего два
элементарных кирпича мироздания — электрон и протон, из которых мы считали
построены все тела... С начала 30-х годов стал быстро расти поток открытий
так называемых элементарных частиц. Достаточно сказать, что за
последние пять лет число их выросло с 32 примерно до 200, и, без сомнения, эта
цифра будет быстро увеличиваться».
Итальянский ученый Э. Ферми был прав отмечая, что в
определении «элементарная частица» первое слово больше
относится к нашим знаниям о ней, чем к природе частицы, поэтому
многие ученые считают более правильным пользоваться
термином фундаментальная частица.
Многое в природе фундаментальных частиц остается
неясным, но открытие нейтрона, позитрона, мезонов, античастиц,
гиперонов и др. поставило вопрос о возможности получения
новых атомоподобных систем и атомов нового типа.
Одним из возможных ответвлений периодической системы
в будущем явится система мезоатомов, образованных
обычными ядрами с вращающимися вокруг них отрицательными
мезонами, а не электронами. Другим ответвлением будет
периодическая система антиатомов, т. е. таких «атомных» систем,
ядра которых состоят из антипротонов и антинейтронов с
вращающимися вокруг них позитронами или положительными
мезонами.
Специфичность всех указанных «атомных» систем и
возможность их классификации на «основе боковых ответвлений
периодической системы» были освещены Д. Д. Иваненко.
Всеобщая естественная система фундаментальных частиц,
ядер и атомов — важнейшая тема исследования ближайшего
будущего, к которой должно быть приковано внимание химиков
и физиков.
Со времени открытия закона периодичности свойств
химических элементов в зависимости от их атомного веса наука
пополнилась новыми открытиями, установлены более глубокие
182
обоснования периодичности, изменилась и формулировка
закона:
«...Мы под давлением опытных данных, которых справедливо требовал
Д. И. Менделеев, вынуждены наделить атомы химических элементов
совершенно новыми, в корне отличными, чем это принимал Менделеев, свойствами.
Мы вынуждены принять сложность и делимость атома, способность
превращения элементов, допустить наличие неустойчивых элементов и атомов,
отличающихся по массе для одного и того же элемента. Даже та основа, которая
была принята Дмитрием Ивановичем для характеристики элемента, масса
его атома, оказалась не наиболее важной, ибо не она, а заряд ядра атома
определяет положение элемента в системе» *.
С течением времени отодвигается нижняя граница
периодической системы — открываются новые элементы, намечаются
пути систематики особых «атомных» систем и создания
реальной всеобщей системы фундаментальных частиц, ядер,
элементов и антиэлементов. В основе же всех этих открытий лежит
периодический закон Д. И. Менделеева — один из основных
законов природы, возможности которого неисчерпаемы.
Справедливо отмечает С. А. Щукарев:
«То, что сделано до сих пор с помощью и на основе Системы грандиозно,
но и все эти приобретения малы по сравнению с тем, что осталось совершить»*
* В. Г. Хлопин, Успехи химии, 13, № 3, 201 (1944).
ОБЗОР РАБОТ
ПО ПЕРИОДИЧЕСКОМУ ЗАКОНУ
И ПЕРИОДИЧЕСКОЙ СИСТЕМЕ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
Периодический закон — один из основных законов природы,
закон* эволюции и развития вещества. Это — учение о
материальном единстве мира, реально проявляющемся в химических
элементах, взаимно связанных друг с другом в объективно
существующем единстве и взаимно превращающихся.
Количественное изменение заряда ядра атомов неизбежно приводит к
скачкообразному и качественному изменению свойств элементов.
Последнее, находящееся в периодической зависимости от
порядкового номера, приводит не к тождеству, а к подобию свойств,
закономерно развивающемуся от периода к периоду.
Периодический закон Д. И. Менделеева и периодическая
система химических элементов — могучее орудие познания
многообразных форм материи, позволяющие научно предвидеть
неизвестное.
Величайшее открытие Д. И. Менделеева явилось
естественным объектом обсуждения на химических съездах,
конференциях и совещаниях.
Мы уже упоминали о том, что в 1860 г. Д. И. Менделеев,
вместе, с шестью другими учеными, представлял русскую
химическую науку на международном съезде в Карлсруэ. Его
научная деятельность началась в то время, когда
естествознание «...превратилось из эмпирической науки в теоретическую,
становясь при обобщении полученных результатов системой
материалистического познания природы» *.
Значительный интерес представляют труды десяти
Менделеевских съездов, в которых напечатан ряд фундаментальных
статей о периодическом законе и системе элементов. Особенно
следует отметить X Юбилейный Менделеевский съезд,
посвященный столетию со дня открытия периодического закона,
проходивший 23—26 сентября 1969 г. в Ленинграде. В работе
съезда приняли участие свыше 2000 делегатов из 163 городов
* Ф. Энгельс, Диалектика природы, Издательство политической
литературы, 1969, стр. 167.
184
Советского Союза, а также 80 ученых-химиков из Англии,
Болгарии, Венгрии, ГДР, Дании, Канады, Польши, Румынии,
США, Франции, Чехословакии и Югославии. Столетие,
периодического закона отмечалось во всем мире; специальные
конференции были проведены в Париже, Риме, Минеаополисе,
Хьюстоне и других городах мира.
Развитию, истории и современному состоянию
периодического закона и системы элементов посвящено большое число
трудов.
До 1869 г. было опубликовано 36 работ, посвященных
попыткам нахождения закономерности, лежащей в основе
естественной систематики химических элементов. После открытия
Д. И. Менделеевым периодического закона в 1869 г. и до
наших дней (середина 1971 г.) в разработке идеи периодичности
приняли участие 1249 русских и 1634 иностранных ученых,
опубликовавших 3608 трудов (монографий, книг, статей,
очерков, брошюр и др.).
На первом (химическом) этапе эволюции периодической
системы работы были посвящены исследованиям свойств
элементов в взаимосвязи с их атомным весом — коренной
количественной характеристикой и разработкой различных вариантов
периодической системы. На втором (электронном) этапе
основными направлениями исследования были: строение атомов и
спектры, квантовые числа электронов, уровни, подуровни и ор-
битали, раскрывающие, в конечном счете, тонкую структуру
электронной оболочки атомов — основу периодического
изменения свойств элементов. Принципиальное значение приобретают
квантовомеханические математические обоснования
периодического закона и системы элементов. Ученые предложили ряд
формул, позволяющих определить число элементов в периодах,
число электронов в уровнях и подуровнях, начало и конец
застройки оболочки атомов s-, p-, d- и f-электронами и др.
На третьем (ядерном) этапе основным направлением
научного поиска стало ядро атома и его строение, поскольку
периодические свойства ядер находятся в функциональной
зависимости от их строения.
Большое число работ посвящено открытию, получению и
изучению разнообразных свойств элементов. В последние
тридцать лет (после искусственного получения в 1940 г. первого
трансуранового элемента — нептуния) особенно форсированно
изучалась природа; и свойства актиноидов *, наибольшее
внимание было уделено 94-у элементу системы — плутонию, так
как подобно урану он используется в качестве ядерного
«горючего». В литературе не раз отмечалось, что плутоний в
настоящее время является более изученным элементом, чем железо,
* «Актиниды», Издатинлит, 1955, стр. 701; «Химия трансплутониевых
элементов», Vienna, 1966, стр. 238; Э. Хайд, И. П е р л м а н, Г. Сиборг,
«Трансурановые элементы», Атомиздат, 1967.
185
известное с незапамятных времен. Наконец, семь лет тому
назад началось изучение нового семейства элементов —
трансактиноидов, с порядковыми номерами 104 и больше.
Развитие периодического закона происходит не только
«вглубь», но и «вширь» — от естественной систематики
элементов к систематике соединений. Большое число работ было
проведено в области систематики простых неорганических,
комплексных и органических соединений. Несмотря на ряд
интересных результатов эта сложная проблема пока еще далека or
разрешения.
В связи с открытием позитрония — своеобразного
«атома», состоящего из позитрона и электрона, появилась
возможность получения соединений типа PsX (Ps — символ
позитрония, а X — символ какого-либо элемента). «Позитрониевые»
соединения представят в будущем одну из возможных ветвей
периодической системы.
Периодический закон и система элементов оказали
существенное влияние на развитие аналитической химии, геологии,
геохимии и биогеохимии, кристаллохимии, учения о катализе,,
химической технологии и других областей науки. Необходимо-
отметить, что результаты исследований в этих областях, в свою-
очередь, «укрепляли» периодический закон.
Ни одна химическая кафедра в мире не обходится в
практике преподавания без периодической системы Д. И.
Менделеева. Периодический закон и система элементов — один из
основных разделов учебников и учебных пособий по химии.
Имеется обширная литература по методике преподавания it
изучения периодической системы в высших, средних специальных
учебных заведениях и средних школах.
Ряд научных работ и статей, выполненных, главным
образом, в нашей стране, посвящено мировоззрению Д. И.
Менделеева и философскому значению открытого им периодического-
закона. За последнее время появились статьи на эту тему
также и в журналах, издающихся в ГДР и ЧССР.
Прошло 64 года со дня смерти Д. И. Менделеева, а
открытый им периодический закон глубоко проник в разнообразные
области науки и человеческой деятельности. Сбылось еще одно
предвидение Д. И. Менделеева, отмеченное им в дневнике
10 июля 1905 г.:
«По-видимости, периодическому закону — будущее не гро*
зит разрушением, а только надстройки и развитие обещает...»
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Популярные книги и брошюры
А р и я С. М., Великий закон природы, Детгиз, 1953.
Астахов К. В., Современное состояние периодической системы Д. И.
Менделеева, Изд-во «Знание», 1969.
Вольфкович С. И., Семишин В. И., Дмитрий Иванович Менделеев —
гордость отечественной науки, Изд-во «Знание», 1968.
Кедров Б. М., День одного великого открытия. Об открытии
периодического закона Менделеевым, Соцэкгиз, 1953.
Колесников А. Л., Из чего состоит вселенная. Закон Менделеева, Гос-
техиздат, 1951.
К у р б а т о в В. Я., Д. И. Менделеев, Детгиз, 1954.
Нечаев И., Рассказы об элементах, Детгиз, 1944.
Сб. «Периодический закон Менделеева и его философское значение», Госполит-
издат, 1947.
Степанов Б. И., История великого закона, Изд-во «Молодая гвардия»,
1952.
Ф е р с м а н А.* Е., Занимательная геохимия, Детгиз, 1954.
•Ф и г у р о в с к и й Н. А., Открытие и утверждение периодического закона
Д. И. Менделеева, Изд-во «Знание», 1969.
Сборники и монографии
Менделеев Д. И., Периодический закон, Изд. АН СССР, 1958.
Сб. «Дмитрий Иванович Менделеев», Изд. АН СССР, 1957.
Сб. «100 лет периодического закона химических элементов», Изд-во «Наука»,
т. I, 1969, т. II, 1971.
Рабинович Е., Тило Э., Периодическая система элементов. История и
теория. Гостехиздат, 1933.
С п и ц ы н В. И., Периодическая система и современная неорганическая
химия, Сб. «Глазами ученого», Изд. АН СССР, 1963.
Чу гаев Л. А., Периодическая система химических элементов, СПб,
«Образование», 1913.
Щ у к а р е в С. А., Некоторые аспекты периодической системы в свете
современной химии. Сб. «Лекции семинара по повышению квалификации
преподавателей курса общей химии», Изд-во «Химия», 1966.
Семишин В. И., Литература по периодическому закону Д. И. Менделеева
(1869—1969), Изд-во «Высшая школа», 1969.
СЕМИШИН ВАСИЛИЯ ИВАНОВИЧ
ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА
Издательство «Химия», М., 1972 г.
188 с. УДК 541.9:546
Редакторы А. Л. Банквицер, Н. Ф. Цветкова
Технический редактор Е. Г. Шпак
Художник Е. В. Бекетов
Корректоры Н. А. Козловская, Н. А. Ваничкова
Т-05839. Подписано к печати 29/Ш 1972 г. Формат бумаги бОХЭО'Дб. Печ. л. 11,75.
Уч.-изд. л. 11,24. Тираж 100 000 экз. Типогр. бум. № 1. Цена 39 коп.Тем. план 1972 г., № 118-
Заказ № 39.
Ордена Трудового Красного Знамени
Ленинградская типография № 2 имени Евгении Соколовой Главполиграфпрома
Комитета по печати при Совете Министров СССР, Измайловский проспект, 29.