Автор: Кузнецов С.И. Дубинина Г.А.
Теги: христианство гидробиология водные микроорганизмы водная микробиология физиология бактерий круговорот углерода азота серы
ISBN: 5-02-004020-7
Год: 1989
С. И. КУЗНЕЦОВ Г.А.ДУБИНИНА
Методы изучения
водных
микроорганизмов
'НАУКА
АКАДЕМИЯ НАУК СССР
ИНСТИТУТ МИКРОБИОЛОГИИ
С.И. КУЗНЕЦОВ, Г.А. ДУБИНИНА
Методы изучения
водных
микроорганизмов
Ответственный редактор
доктор биологических наук
Ю.И. СОРОКИН
е
МОСКВА
’’НАУКА”
1989
УДК 27.28.7.11
Методы изучения водных микроорганизмов / С.И. Кузнецов,
Г.А. Дубинина. — М.: Наука, 1989. —288 с.— ISBN 5-02-004020-7
В книге суммированы современные методы изучения водных микроорганизмов и
осуществляемых ими процессов. Наряду с общепринятыми в водной микробиологии
методами приводятся новые, перспективные для оценки численности и активности
микроорганизмов. Дается краткая характеристика основных физиологических и эколого-
трофических групп бактерий, участвующих в круговороте углерода, азота, серы, железа и
марганца.
Для микробиологов, гидробиологов.
Табл. 24. Ил. 33. Библиогр.: 426 назв.
Рецензенты:
академик Е.Н. Мишустин,
доктор биологических наук В.Г. Драбкова
„1905000000-400 м, ол
К---------------524-89, кн. 2
055(02)-89
© С.И. Кузнецов, Г..
1989
ISBN 5-02-004020-7
ПРЕДИСЛОВИЕ
Большинство процессов круговорота вещества в природе происходит
при непосредственном участии микроорганизмов. В последние годы
получены новые экспериментальные данные, существенно расширяющие
и дополняющие наши представления о водных микроорганизмах, сис-
тематике и методах их исследования.
Изучение автохтонных микроорганизмов показало, что они ши-
роко распространены в водоемах и развиваются при минимальных
количествах органического вещества. Однако для своего роста в
большинстве случаев они требуют набор витаминов и микроэле-
ментов. Это заставило существенным образом пересмотреть для мно-
гих групп микроорганизмов рецептуру питательных сред, приведенную
в прежних руководствах [Романенко, Кузнецов, 1974].
Усовершенствование методов анализа показало, что значительная
часть органического вещества, образуемого фитопланктоном и окра-
шенными серобактериями в ходе фотосинтеза, в процессе метабо-
лизма выделяется в воду, что вносит существенную поправку в оценку
первичной продукции в водоеме.
Применение ингибиторного анализа при работе с природными суб-
стратами во многих случаях позволило определить активность отдель-
ных физиологических групп микроорганизмов и оценить их вклад в
образование первичной продукции в водоемах.
Широкие возможности для изучения экологии отдельных видов
микроорганизмов различных таксономических и физиологических
групп открывают методы иммунофлуоресцентного анализа, приведен-
ные в настоящем руководстве.
Успешному изучению экологии метанотрофных бактерий и их
роли в геохимических процессах, связанных с окислением метана, во
многом способствовало введение в практику исследований газохромато-
графического и радиоизотопного методов количественной оценки ско-
ростей образования и окисления метана в природных водах.
Применение масс-спектрометрических методов позволяет получать
ценную информацию о масштабах геохимической деятельности суль-
фатредуцирующих бактерий, метаногенов и метанотрофов в природных
3
экосистемах в геологическом прошлом, о биогенном происхождении
некоторых осадочных пород и руд.
В настоящей книге нами на основе собственных исследований
и литературных данных последнего десятилетия обобщены материалы
в области изучения водных микроорганизмов по систематике, иден-
тификации, методам культивирования, а также по определению интен-
сивности микробиологических процессов, протекающих в континен-
тальных водоемах. Сведения о таксономическом составе многих групп
микроорганизмов пополнены новыми данными, которые пока не отра-
жены в существующих обзорах и руководствах.
Часть I
Методы изучения микроорганизмов прижизненно
и в фиксированных препаратах
Существование микроорганизмов, обитающих в водоеме, в зна-
чительной мере зависит от экологических параметров окружающей
среды. В качестве основных факторов, определяющих их развитие,
можно указать на вертикальное распределение температуры, проник-
новение света, соленость, количество растворенного органического
вещества, сульфатов, сероводорода, железа, марганца, усвояемых форм
азота, растворенного кислорода и др. Все эти показатели окружаю-
щей среды могут сильно колебаться при переходе от одного водоема
к другому [Горленко и др., 1977].
Наиболее четко эти факторы в одном озере отличаются по вер-
тикали в период летней температурной стратификации. В этот пери-
од в димиктическом водоеме наблюдаются следующие экологические
зоны: 1) поверхностный слой с массовым развитием фитопланктона —
эпилимнион; 2) слой температурного скачка, где задерживаются
оседающие частицы отмерших микроорганизмов; 3) нижняя граница
температурного скачка и нижняя граница проникновения кислорода,
где возможно массовое развитие различных физиологических и эко-
Рис. I. Места отбора проб воды
для. анализа по экологическим зо-
нам в евтрофном озере
а — эпилимнион; б — слой
температурного скачка; в — осве-
щенный гиполимнион; г — темно-
вая зона гиполимниона; д — иловые
отложения
О--------------
лого-трофических групп бактерий; здесь наиболее выражена зональ-
ность их вертикального распределения по микрозонам; 4) гиполим-
нион, где распространены анаэробные бактерии и часто встречают-
ся бактерии с газовыми вакуолями; 5) поверхностный слой иловых
отложений (рис. 1). В освещенной зоне гиполимниона возможно про-
текание процесса аноксигенного фотосинтеза.
*В меромиктических озерах со значительным количеством сульфатов
обычно глубинные слои монимолимниона содержат сероводород. При
проникновении света в этой экологической нише наблюдается массо-
вое развитие фотосинтезирующих окрашенных серобактерий.
В зависимости от трофики водоема может меняться и располо-
жение экологических зон в озерах. Об этом сразу можно судить по
вертикальному распределению температуры, растворенного кислорода
и сероводорода. Ориентируясь на эти показатели, отбор проб для
химического н бактериологического анализа производятся с поверх-
ности, в слое температурного скачка — через 0,2—0,5 м в зави-
симости от его мощности, в гиполимнионе — реже, в зависимости
от глубины озера, и из поверхностного слоя ила.
ОТБОР ПРОБ ВОДЫ И ИЛА
Батометр для отбора проб воды с небольших глубин. Пробы
воды для бактериологического анализа, за исключением прямого
счета, необходимо отбирать в стерильную посуду. Для глубин, не
превышающих 10 м, удобнее всего использовать бутыли Мейера.
В гнезде утяжеленной рамы (рис. 2) с помощью зажима (2) укрепляют
стерильную бутыль объемом 0,25—0,5 и закрывают ее обтертой спир-
том резиновой пробкой (5). К пробке подходит трос, на котором
опускают прибор в воду. Металлическая оправа с послаблением при-
вязана к этому же тросу. Бутыль опускают на нужную глубину и рыв-
ком вытягивают резиновую пробку из горлышка бутылки. При этом
вода с нужного горизонта поступает в склянку. Поверхностную воду
сливают, бутыль затыкают стерильной ватной пробкой.
Батометр для отбора глубинных проб воды. Рабочая часть ба-
тометра В.И. Романенко и Т.А. Младовой [1969] представляет собой
баллон (/) шарообразной формы емкостью 100—150 мл с капилляр-
ными отверстиями на концах (рис. 3). Форма баллона способствует
тому, что он не лопается на глубинах свыше 1000 м, как это было
проверено на Байкале. На концевые отростки надевают отрезки ва-
куумного каучука, в которые с одной стороны вставляют сменные
капилляры (2) с отверстием 2—3 мм, а с противоположной сторо-
ны — стеклянную палочку (6). Наличие сменных капилляров позво-
ляет многократно использовать один и тот же баллон. Благодаря
небольшой величине концевых отверстий резина соединительной трубки
не засасывается в баллон при высоком наружном давлении, когда при-
бор находится на большой глубине. После стерилизации баллон
вставляют с помощью кольца (5) в раму (8), которая подвешена к
тросу, с помощью стального стержня (4). При этом конец верхнего
капилляра (2) после удара посыльным грузом отламывается в месте
6
ч
Рис. 2. Батометр для стерильного отбора поверхностных проб воды
1 — гнездо утяжеленной рамы батометра; 2 — зажим для закрепления стериль-
ного сосуда при отборе проб воды; 3 — стерильная бутыль емкостью 0,25—
0,5 л; 4 — рама батометра; 5 — кольцо, к которому прикрепляется трос; 6 — трос для
опускания бутыли; 7 — бечевка, на которой прикрепляется пробка (8) к тросу
Рис. 3. Батометр для стерильного отбора проб воды с большой глубины (объяснения
см, в тексте)
перегиба в стороне от рамы и груза. Рама имеет приспособление
для сбрасывания следующего груза (3) и крепления (7) к тросу.
После отбора пробы воды баллон вынимают из рамы и из него
удаляют верхний разбитый капилляр, а на его место вставляют сте-
рильную трубочку с ватным тампоном.
При отборе проб на глубине свыше 10 м нет необходимости соз-
давать вакуум в баллоне, так как при обломе капилляра вода по-
ступает в баллон за счет гидравлического давления столба воды.
Отбор проб ила. Пробы ила можно отбирать стратометром любой
конструкции диаметром 5—6 см. Проба для посева отбирается в сте-
рильную стеклянную трубочку диаметром около 1 см, которая асепти-
чески вводится в середину монолита ила, при этом можно взять
образец для анализа с любой глубины от поверхности ила. При от-
боре пробы из стратометра монолит ила подвигают поршнем к верх-
нему концу трубки стратометра. В верхний конец стерильной стек-
лянной трубочки вставляют пробку с резиновым шлангом. Противо-
7
Рис. 4. Стерильный отбор образца ила из страто-
метра с ненарушенной структурой (а) и из стеклян-
ной трубки (б)
I — стратометрическая трубка с монолитом ила;
2 — стеклянная трубка, куда асептически отби-
рается колонка ила; 3 — резиновая пробка со
стеклянной трубкой; 4 — резиновая трубка; 5 —
стеклянная палочка; 6 — поршневая пробка; 7 —
монолит ила; 8 — нож; 9 — приемник для ила
положный конец стеклянной трубки постепенно вводят в монолит
ила так, чтобы поверхность его в трубке и монолите оставалась
на одном уровне (рис. 4). Для этого ртом вытягивают воздух из
верхней части стеклянной трубки с помощью каучукового шланга,
насаженного на верхний конец трубки. Таким образом отбирают
асептически образец исследуемого ила ненарушенной структуры. Затем
трубку вынимают из монолита ила и затыкают с обеих сторон
стерильными резиновыми пробками. В таком виде образец ила может
храниться в течение нескольких часов в холодильнике.
При отборе проб для анализа резиновые пробки из стеклянной
трубки вынимают, а с нижней стороны в нее вводят поршневую проб-
ку. Далее весь монолит ила постепенно при помощи стеклянной па-
лочки проталкивают к противоположному открытому концу трубки
(рис. 4).
МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
МЕТОД ФАЗОВЫХ КОНТРАСТОВ
ДЛЯ ИССЛЕДОВАНИЯ ЖИВЫХ ОБЪЕКТОВ
Этот метод позволяет получать контрастное изображение при
наблюдении под микроскопом неокрашенных неконтрастных объектов.
При этом темные и светлые места изображения соответствуют различ-
ной толщине или оптической плотности объектов в препарате.
Основная часть контрастного устройства — специальные фазовые
ахроматические объективы, имеющие на одной из внутренних по-
верхностей линзы фазовое кольцо определенных размеров и револь-
верный диск с кольцевыми диафрагмами, которые устанавливаются
перед конденором. Фазовые объективы используют с обычными
окулярами Гюйгенса. При выключении кольцевых диафрагм фазовые
1
1
2
Рис. 3, Фазово-контрастное устройство
а — фазово-контрастный конденсор: / — окно кожуха конденсора, 2 — цен-
трировочные винты конденсора, 3 — ирисовая диафрагма конденсора; 6 — вспо-
могательный микроскоп: 4 — окуляр вспомогательного микроскопа; в — фазовое
кольцо объектива и светлое кольцо диафрагмы вспомогательного микроскопа: 5 — непра-
вильное совмещение светлого и темного колец, 6 — правильное совмещение свет-
лого и темного колец
объективы могут употребляться как обычные, однако качество изобра-
жения получается хуже вследствие наличия в них фазового кольца.
При работе с фазово-контрастными устройствами соблюдают сле-
дующий порядок работы: 1) выбранные окуляр и фазово-контрастные
объективы вставляют в тубус микроскопа; 2) нормальный конденсор
микроскопа вынимают и в освободившееся гнездо вставляют фазово-
контрастный конденсор, револьвер которого ставится на ”0”; 3) микро-
скопический препарат помещают на столик микроскопа и фокуси-
руют; 4) устанавливают правильное освещение по Келлеру, пользуясь
осветителем ОИ-7 или ОИ-9; диафрагма осветителя должна быть видна в
плоскости препарата, затем центрирована и открыта в соответствии
с полем зрения окуляра; 5) полностью открывают ирисовую диафрагму
конденсора; 6) вынимают из тубуса окуляр Гюйгенса и вместо него
вставляют вспомогательный микроскоп (рис. 5), прилагаемый к фазово-
контрастному устройству, окуляр вспомогательного микроскопа пере-
мещают так, чтобы было резко видно фазовое кольцо объектива, при
этом нельзя трогать ни грубую, ни тонкую подачу тубуса микро-
скопа; 7) вращением револьвера конденсора включают диафрагму,
соответствующую включенному объективу, при этом в окне кожуха
конденсора должна появиться цифра, соответствующая увеличению
объектива; 8) вращая центрировочные винты конденсора, совмещают
видимое во вспомогательный микроскоп светлое кольцо с темным
кольцом; 9) снова заменяют вспомогательный микроскоп окуляром
Гюйгенса.
Для получения большего эффекта рекомендуется пользоваться свето-
фильтрами, входящими в комплект фазового контраста.
При смене объектива или препарата следует проверять центри-
ровку кольцевой диафрагмы конденсора с фазовым кольцом объектива.
Возможные неполадки: 1) поле зрения освещено неравномерно,
появляются темные пятна, что зависит от неправильной установки
освещения по Келлеру; 2) после включения кольцевой диафрагмы
поле зрения становится темным; это зависит от того, что закрыта
9
ирисовая диафрагма; 3) если получается недостаточный контраст,
то необходимо проверить центрировку фазово-контрастного устройст-
ва с пЬмощью вспомогательного микроскопа.
МИКРОСКОПИЯ В ОТРАЖЕННОМ СВЕТЕ
Специфика метода заключается в том, что освещение объекта
осуществляется сверху через специальный эпиобъектив. Метод реко-
мендуется для обнаружения и количественного учета некоторых спе-
цифических групп микроорганизмов в природных водах. Для этого
через мембранные фильтры профильтровывают озерную воду. Фильтры
высушивают и разрезают на две равные части. Одну половину окраши-
вают эритрозином, а другая остается неокрашенной. Обе половины
фильтра просветляют иммерсионным маслом и сверху покрывают по-
кровным стеклом. В окрашенной половине подсчитывают общее число
бактерий. Неокрашенную половину смотрят только в отраженном свете.
Метод дает возможность хорошо отличать окрашенные фотосин-
тезирующие серобактерии от бесцветных форм. В темнопольном от-
раженном свете виды фототрофных бактерий, имеющие зеленую окрас-
ку, светятся голубым светом и легко могут быть определены и под-
считаны. К таковым относятся Chlorobium, Pelodictyon, Prosthecochloris,
консорциум Pelochromatium и др. Виды, имеющие коричневую окраску,
светятся желто-зеленым светом — Chlorobium phaeobacteroides, Pelo-
chromatium roseum.
В светлопольном отраженном свете в клетках отчетливо видны
газовые вакуоли как ярко блестящие включения, а также хорошо
видны включения серы. Кроме фотосинтезирующих бактерий, в отра-
женном свете хорошо видны и другие микроорганизмы, обладающие
газовыми вакуолями.
Серные пурпурные бактерии не выявляются в светлом поле, но
в темном поле имеют розовую окраску.
ИЗГОТОВЛЕНИЕ ОКУЛЯРНОГО СЕТЧАТОГО МИКРОМЕТРА
При учете общего числа бактерий методом А.С. Разумова [1932]
производят подсчет количества бактерий на определенной площади
препарата. Для этого необходимо иметь окулярный сетчатый микро-
метр, который помещают на диафрагму окуляра микроскопа. Диафраг-
му следует поставить так, чтобы при ввинченной верхней линзе деле-
ния сетчатого микрометра были четко видны.
Окулярный сетчатый микрометр можно изготовить кустарным спо-
собом, нанося алмазным или корундовым карандашом тонкие линии
на стеклянные пластинки.
1. Стеклянные пластинки (14X14 мм) нарезают из фотопластинок,
с которых отмыт желатиновый слой, или из предметных стекол.
2. При нанесении тончайших линий на стекло можно взять корун-
довую иглу, которая используется для проигрывания долгоиграющих
пластинок. Иглу в держателе рекомендуется вставить в тонкую метал-
лическую трубочку и закрепить.
10
Рис. 6. Установка для изготовления окулярного сетчатого микрометра
1 — доска, на которой монтируется установка; 2 — вращающаяся на оси
дощечка; 3 — ось вращения (гвоздь); 4 — стеклянная пластинка, на которую нано-
сятся деления; 5 — металлический рычаг; 6 — корундовая игла; 7 — стальная
игла; 8 — металлическая миллиметровая линейка с делениями; 9 — шуруп для
крепления корундовой иглы
3. Нанесение тончайших штрихов на стеклянные пластинки произ-
водят на оптической доске (рис. 6). На одном конце доски (длиной
60 см, шириной 10 см) параллельно ее длине закрепляют металли-
ческую измерительную линейку с делениями, на другом острием вверх
вбивают йебольшой гвоздь или иглу, на которой вращается фанерная
дощечка с наклеенной на нее миллиметровой бумагой. Ось проходит
через центр дощечки.
4. Для нанесения делений на стеклянную пластинку используют
пластмассовый или деревянный стержень длиной около 55 см, в ко-
торый с одной стороны вставляют стальную граммофонную иглу, а с
другой (в отверстие в стержне) — корундовую. Между стальной и
корундовой иглами расстояние должно быть порядка 50 см.
Нанесение делений на стеклянную пластинку производят следую-
щим образом. На центр вращающейся фанерной дощечки кусочком
разогретого воска прикрепляют стеклянную пластинку, на которую
хотят нанести деления. Затем стальную иглу рычага точно ставят
на деление линейки, так, чтобы корундовая игла была на 2,5 мм
дальше центра стеклянной пластинки, и наносят штрих на ее по-
верхность. Далее передвигают стальную иглу на 1 мм и вновь ко-
рундовой иглой делают второй штрих на стекле, который отстоит от
первого точно на 1 мм. Эту процедуру повторяют 6 раз. Далее
фанерную дощечку, не снимая с оси, поворачивают на 90° и всю опе-
рацию повторяют заново. При этом в центре стеклянной пластинки
будет начерчена сетка в 25 мм2, которая и может служить оку-
лярным сетчатым микрометром.
Необходимо, заметить, что нужно предварительно научиться на-
носить четкие линии на стекло. При неправильном повороте корундо-
вой иглы или слишком сильном нажиме стекло по краю линии на-
чинает крошиться и сеточка получается негодной для использова-
ния в качестве окулярного микрометра.
При легком нагревании сеточку снимают с фанерной дощечки,
края ее подшлифовывают на корундовом бруске и после промывки
спиртом помещают в окуляр микроскопа.
Ш-ОБРАЗНАЯ КАМЕРА ПЕШКОВА
Этот тип камеры для прижизненного наблюдения над микроорга-
низмами позволяет применять оптические системы, имеющие рабочую
численную апертуру выше 1. Изготовление камеры производится сле-
дующим образом. Предметное стекло не толще 0,5 мм фламбируют и
устанавливают по уровню строго горизонтально. На поверхность стекла
наливают слой стерильного расплавленного прозрачного агара толщи-
ной не более 0,2 мм (рис. 7, а). Среде дают застыть, стериль-
ным ланцетом делают шесть разрезов в виде буквы Ш. После этого
из получившихся канавок выталкивают ненужные полоски агара
(рис. 7, б). В результате получается Ш-образный слой питатель-
ной среды. Засевают испытуемой культурой лишь среднюю полос-
ку, граничащую справа н слева с воздушными канавками.
а 6 6
Ч Ч 3 2 4 1
Рис. 7. Ш-образная камера по Пешкову
а—в — последовательность операций (см. текст); 1 — слой парафина, закреп-
ляющий покровное стекло на поверхности агара; 2 — место засева агаризованной
питательной среды; 3 — воздушные канавки; 4 — надрезы в слое питательного
агара
Посев производят, нанося каплю бактериальной суспензии стериль-
ным стеклянным капилляром на среднюю полоску. Засеянную камеру
покрывают стерильным тонким покровным стеклом так, чтобы оно
плотно прилегало к слою агара. Слой агара, выступающий за пределы
покровного стекла, обрезают, и покровное стекло по краям гермети-
чески закупоривают расплавленным парафином (рис. 7, в).
Наличие двух канавок с воздухом гарантирует нормальное раз-
витие аэробных бактерий, герметичность камеры предохраняет пре-
парат от подсыхания, а применение агаризированных сред исключает
броуновское движение бактерий и создает оптимальные условия для
фотосъемки.
ИЗУЧЕНИЕ МИКРОФЛОРЫ ПОВЕРХНОСТНОГО СЛОЯ ИЛА
В МИКРОБНОМ ПЕЙЗАЖЕ
Исследования Б.В. Перфильева и Д.Р. Габе [1961] показали большое
разнообразие микроорганизмов в поверхностном слое ила. Наиболее
четкую картину микробных пейзажей указанные авторы получили
12
Рис. 8. Использование плоскопараллельных капилляров Перфильева для изучения
микрофлоры в водной толще и в донных отложениях
а — блок капилляров прямоугольного сечения; б — крепление на предмет-
ном стекле; в — крепление в стеклянном пенале
в образованиях стеклянных поверхностей в период формирования вто-
ричного микрозонального профиля при воспроизведении микрозон
превращения. Именно в это время у иловых микроорганизмов, погре-
бенных при перемешивании ила и оказавшихся в неблагоприятных
условиях, образуются подвижные клетки, перемещающиеся в горизон-
ты ила с оптимальным физико-химическим режимом. Там эти клетки
прикрепляются и начинают размножаться, образуя характерный тип
данного ила микробный пейзаж.
Чтобы эти картины перенести под микроскоп без нарушения,
авторы использовали прибор, названный ими капиллярным пелоско-
пом. Основу прибора (рис. 8) составляет набор из 4—5 капиллярных
ячеек (о) длиной 1—2 см. В каждой капиллярной ячейке 5 капилляров
прямоугольного сечения с просветом 40 X 200 мкм. Капилляры эти
прикрепляются тонким кольцом из нипельной резины к стеклянной
палочке и помещаются в стакан, куда был помещен перемешанный
поверхностный ил из водоема.
Иловый раствор проникает в капилляры, его физико-химические
свойства распределяются аналогично тому, как это имеет место в
иловых капиллярах. Вместе с иловым раствором по соответствующим
микрозонам распределяются и микроорганизмы. После извлечения
капилляров из ила характер и распределение микроорганизмов можно
хорошо контролировать под микроскопом.
Изучение микробного пейзажа ила складывается из следующих
операций.
1. Образец ила и придонной воды отбирают в стеклянный стакан
и тщательно перемешивают. После отстаивания ил должен занимать
примерно 3/4 общего объема.
2. Пачку из 4—5 капиллярных ячеек прикрепляют кольцом из нипель-
ной резины к стеклянной палочке или к специальному держателю
с вмонтированной в него лентой из миллиметровой бумаги.
3. Капиллярные ячейки погружаются вертикально в ил с таким
расчетом, чтобы они пересекли горизонт, в котором формируются
главные микрозоны превращения вторичного диагенетического профиля.
При введении пелоскопов в ил нельзя оставлять в капиллярных
ячейках воздух, так как он препятствует засасыванию илового раст-
13
вора. Поэтому пелоскоп следует опускать в сосуд с илом постепен-
но. В один сосуд одновременно помещают несколько пелоскопов.
4. Сроки пребывания пелоскопических капилляров в иле, необ-
ходимые для получения достаточно четких микробных пейзажей, зави-
сят от скорости формирования физико-химических свойств вторично-
го диагенетического профиля и от быстроты развития соответствую-
щей микрофлоры. Пределы колебания от 2—3 дней до нескольких
месяцев. Срок экспозиции капилляров устанавливается опытным путем.
5. Пелоскоп, вынутый из ила, осторожно обмывают снаружи во-
дой из промывалки, пачку ячеек снимают с держателя и извлекают
из каучукового кольца. Каждую капиллярную ячейку обтирают снару-
жи чистой тряпочкой, укладывают на предметное стекло верхним
концом в одну сторону и немедленно микроскопируют, предохраняя
от высыхания.
6. При изготовлении фиксированных препаратов пелоскопические
капилляры опускают в слабый раствор формалина.
ЭЛЕКТРОННО-МИКРОСКОПИЧЕСКИЕ ИССЛЕДОВАНИЯ
МИКРООРГАНИЗМОВ
Методы световой микроскопии, в том числе фазово-контрастный
и аноптральный основаны на использовании видимой части спектра
с длиной волны около 550 нм. Отсюда максимальная разрешающая
способность, которая может быть получена при помощи светового
микроскопа, не превышает 0,1 мкм. Иными словами, все объекты менее
0,1 мкм в световом микроскопе невидимы.
Электронная микроскопия основана на применении пучка элек-
тронных лучей с длиной волны около 0,005 мкм. Это увеличивает
разрешающую способность микроскопических устройств до 2—5 А.
Применение электронной техники к изучению микрофлоры озер сразу
показало наличие целого мира микроорганизмов, плохо различимых в
световом микроскопе.
Для исследования биологических объектов под электронным ми-
кроскопом обычно используются увеличения в 10000—50000 раз.
Если нужно, дальнейшее увеличение уже производится при фотоувели-
чении с электронных негативов.
ИЗГОТОВЛЕНИЕ ПРЕПАРАТОВ ИЗ ПРОБ ВОДЫ
Объект для исследования наносится на подложку, которая должна
быть прозрачной для пучка электронных лучей. Такие подложки
обычно изготовляются из коллодия или формвара толщиной 10—15 мкм
и помещаются на медные или никелевые сеточки диаметром около
3 мм. Последние преварительно очищают кипячением в 10%-м раст-
воре аммиака и отмывают водой. С целью увеличения сорбционных
свойств коллодиевой пленки и лучшего прикрепления бактерий не-
посредственно перед нанесением исследуемого материала сетки с плен-
кой подвергают ионизации в специальной вакуумной установке. Бла-
годаря этой процедуре пленка приобретает положительный заряд,
14
что способствует сорбции клеток, имеющих, как правило, отрица-
тельный поверхностный заряд.
Методы нанесения материала на сетки. 1. Если хотят исследо-
вать микрофлору воды в целом, то медные сеточки кладут на дно
чашки Петри и заливают дистиллированной водой. На поверхность
воды наносят 1 каплю 1%-го раствора коллодия (предварительно
высушенного в вакуумной установке) в амилацетате. Капля расте-
кается, и на поверхности воды образуется тончайшая пленка колло-
дия. Первую пленку удаляют с целью очистки поверхностного слоя
воды от бактерий, и на поверхность воды наносят вторую каплю
коллодия. На эту пленочку точно над сетками наносят капельки
бактериальной суспензии из концентрата бактерий из природной воды,
полученной путем фильтрования не до конца через мелкопористый
мембранный фильтр. При этом происходит диализ солей из капли через
пленку, который длится от 14 до 17 ч. По окончании диализа воду
из чашки Петри отсасывают пипеткой. Подложка из коллодия оседает
на дно чашки, а капли на подложке попадают как раз на медные
сеточки. После подсыхания капель сеточки вместе с осевшей на них
подложкой осторожно вынимают из чашки Петри и подсушивают.
2. Иной способ изготовления препарата заключается в том, что
предварительно очищенные сетки помещают на предметном стекле на
дно чашки Петри, заливают водой, на поверхность наносят каплю
коллодия. Через 10 мин воду отсасывают и коллодиевая пленка
оседает на сеточки. Последние с чистой подготовленной подложкой
высушиваются. После этого из диализированных капель испытуемой
воды или суспензии бактерий берут небольшие капли и наносят
пастеровской пипеткой на подложки с коллодиевой пленкой.
3. При изготовлении бактериальных препаратов для электрон-
ного микроскопа из воды естественных водоемов методом адсорбции
на сетке используют свойство бактерий адсорбироваться на различ-
ных твердых субстратах [Marshall et al., 1971]. Для этого метал-
лические сетки, покрытые формваровой пленкой, помещают на 1 ч в
воду, взятую в чистую посуду из водоема. Время выдерживания
сеточек в воде для прикрепления бактерий можно варьировать. По
прошествии этого времени сеточки споласкивают дистиллированной во-
дой, фиксируют в 2,5%-м растворе формалина или глутаральдегида,
вновь споласкивают и высушивают. Дальнейшее контрастирование
препарата описано ниже.
Фиксация препаратов. Для фиксации бактерий в процессе диализа на
внутреннюю часть крышки Петри накладывают полоску фильтро-
вальной бумаги, смоченную формалином. Однако предпочтительнее
проводить фиксацию клеток глутаральдегидом, как указано ниже.
Осевшие на пленку бактерии фиксируют путем погружения сето-
чек в 2,5%-й раствор глутаральдегида в 0,05 М фосфатном буфере
при pH 7,0—7,2 на 1 ч при 4°. Для лучшей сохранности поверхност-
ных структур, внеклеточных полимеров и морфологии клеток рекомен-
дуется после фиксации и подсушивания на воздухе провести обезво-
живание материала путем последовательных 10-минутных погружений
сеток сначала в серии этанола возрастающей концентрации (10, 25,
15
50, 75, 100%), а затем путем высушивания при критической точке в
фреоне. Для этого сеточки после обработки спиртом подсушивают
и помещают в смесь фреона 113 и этанола в соотношении 1:1, затем
в 100%-й фреон 113 по 15 мин. Высушивание при критической точке
осуществляется с использованием фреона 13. После этого образцы
напыляют в вакуумном испарителе золотом, как указано ниже, и
просматривают в трансмиссионном микроскопе при ускоряющем на-
пряжении 60—80 кВ [Young, 1978].
Хирш и Панкрац [Hirsch, Pankratz, 1970; Hirsch, 1972] для изучения
естественной микрофлоры использовали метод обрастания бактериями
предметов, погруженных в водоем. С этой целью 4—5 предва-
рительно очищенных медных или никелевых сеточек в 200 меш
помещают в ряд на формваровую или коллодиевую пленку на
поверхности дистиллированной воды в чашке Петри. Затем формваро-
вую пленку вместе с сеточками опрокидывают на чистое предмет-
ное стекло так, чтобы сеточки находились под пленкой. Края вы-
сушенной пленки прикрепляют к стеклу кусочками пластыря, и всю уста-
новку помещают в водоем на срок от 1 до 24 сут или в сосуд с
испытуемой водой.
При извлечении стекол нужно обращать внимание, чтобы на них
не попал нейстон с поверхностной пленки воды из водоема. Не ка-
саясь формваровой пленки на сеточках, стекла быстро высушивают в
вертикальном положении и фиксируют. Перед просмотром под
электронным микроскопом препараты подвергаются напылению под
углом 11—18°. Поверхность предметного стекла с одной стороны
делают матовой. С этой целью на стекло наносят наждачный порошок
и увлажняют его. Слегка прижимая рукой порошок, производят кру-
говые движения, пока поверхность стекла не станет матовой. При
этом пленка, удерживающая сеточки, прочно пристает к матовой
поверхности стекла.
Контрастирование препаратов. При незначительной толщине бакте-
риальных объектов они могут быть слишком прозрачны для пучка
электронов. Поэтому существует ряд методов осаждения тончайшего
слоя металла на поверхности бактериального организма, которые
позволяют сделать его боеле контрастным для пучка электронов.
Остановимся на двух принципиально разных методах оттенения пре-
парата.
1. Метод напыления заключается в том, что препараты
помещают в вакуумный испаритель с разрежением до 10'5 мм рт.ст.
В испарителе имеется вольфрамовая спиральная нить, которая нагре-
вается до 1500°. Внутрь спирали помещают испаряемый металл в
виде порошка или гранул — хром, платина, золото и т.п. Нить
нагревается электрическим током, и при соответствующей темпера-
туре металл испаряется, атомы его разлетаются прямолинейно во все
стороны. Если на их пути поместить на несколько секунд объект
под углом 15—20°, то на его поверхности осядет слой металла
разной толщины.
На поверхность объекта, расположенного перпендикулярно к на-
правлению полета частиц, осаждается наиболее толстый слой ме-
16
талла. В тех местах, где объект экранирует полет пучка частиц
металла, образуются тени. Вследствие того что разные части объекта
по-разному воспринимают пары металла, толщина его осаждения
различна, а это, в свою очередь, повышает контрастность изо-
бражения.
2. Контрастирование препарата солями тяжелых ме-
таллов. Имеются негативный и позитивный способы контрастирова-
ния препаратов с помощью фосфорновольфрамовой кислоты (ФВК).
Негативный способ состоит в том, что на сеточку с подсохшей
каплей воды наносят каплю 1%-го раствора ФВК при pH 7,2. Спустя
1—5 с каплю красителя удаляют фильтровальной бумажкой и сетку
подсушивают. При таком способе контрастирования соли ФВК оседа-
ют на пленку, а выступающие на ней объекты остаются светлыми.
Этим способом особенно удобно оттенять поверхностные структуры
микроорганизмов.
Позитивный способ контрастирования заключается в том, что
при кислом pH, равном 3,4 или 1,7, соли ФВК химически связыва-
ются с белковыми структурами клетки, повышая их контрастность,
фон остается белым. Для этого каплю 1%-го раствора ФВК
при pH 1,7 наносят на 2—4 с на сетку с препаратом и затем
быстро подсушивают, помещая ее пленкой вниз на фильтровальную
бумагу. Фон остается в этом- случае светлым, контрастными вы-
глядят белковые структуры. Поскольку при pH 1,7 ФВК разрушает
некоторые структуры клеток, можно использовать для позитивной
окраски 1%-ю ФВК при pH 7,2, как при негативном способе окраски,
с той разницей, что спустя 5—10 с после нанесения ФВК сетки с
пленкой дважды тщательно отмывают в дистиллированной воде в те-
чение 4—5 с. В этом случае фон остается светлым, а ФВК контрастирует
объекты. В качестве протравы можно использовать уранилацетат,
соли свинца, осмиевую кислоту и т.п. Контрастность бактериаль-
ных препаратов, обработанных таким образом, значительно повы-
шается.
Для контрастирования объектов можно с успехом использовать
раствор молибденовокислого аммония. Для этого готовят 2, 4 или
6%-Й водный раствор при pH 7,0. Контрастирование производят
так же, как при негативной окраске ФВК.
ИЗГОТОВЛЕНИЕ ПРЕПАРАТОВ ИЗ ГРУНТА
Подготовка суспензии ила для изготовления препарата состоит
в следующем. Образец ила в соотношении 1:10 смешивают с 0,0004 N
раствором NaOH и перемешивают 10 мин на магнитной мешалке.
После 5-минутного отстаивания верхний слой жидкости используют
для изготовления электронно-микроскопических препаратов. Суспен-
зию фильтруют через крупнопористый мембранный фильтр, из фильтра-
та готовят препарат, как это было указано выше для проб воды.
2. Зак. 1766
ИЗГОТОВЛЕНИЕ ПРЕПАРАТОВ ИЗ ПРОБ ВОДЫ И ГРУНТА
ДЛЯ СКАНИРУЮЩЕГО МИКРОСКОПА
Преимущества использования сканирующего микроскопа перед
трансмиссионным заключается в следующем: 1) в получении объемного
изображения объекта; 2) в лучшем выявлении поверхностных струк-
тур клеток; 3) в выявлении способов прикрепления к твердому суб-
страту, колонизации поверхностей, 4) в исследовании естественных
ассоциаций в природной среде обитания, в том числе на поверх-
ности объектов, непрозрачных для электронного пучка, — на части-
цах детрита, минералов, на песке и т.д.
Существует несколько способов приготовления препаратов для ска-
нирующего микроскопа/
Наиболее распространен следующий способ: исследуемый мате-
риал из проб воды, бактериальной культуры, обрастаний или из
образца грунта помещают путем фильтрации на ядерные фильтры с
диаметром пор 0,1 мкм. Можно наносить исследуемый материал на
тонкое покровное стекло, оставляя его во влажной камере на не-
сколько часов для прикрепления объектов к стеклу. После удале-
ния влаги со стекла отсасыванием фильтровальной бумагой материал
на фильтре стекла фиксируют в 2%-м глутаральдегиде, приготовлен-
ном на 0,05 М фосфатном буфере при pH 6,8—7,0. Осторожно отмы-
вают фиксатор споласкиванием в дистиллированной воде в течение
10 мин и далее обезвоживают в серии растворов спиртов возрастаю-
щей концентрации (30, 50, 75, 100%-й этанол) по 15 мин. После
этого образцы высушивают при критической точке во фреоне 13 или
в углекислоте и напыляют золотом. Препараты прикрепляют к столи-
ку микроскопа с помощью клея суперцемент.
В другой модификации процедуры приготовления препаратов [Sevioir
et al., 1984] используются специальные сосудики, изготовленные из
стеклянной трубки диаметром 10 мм, нарезанной на отрезки длиной
10 мм. К нижней части каждого отрезка трубки с помощью сили-
конового клея прикрепляется ядерный фильтр с диаметром пор
0,1—0,2 мкм. В приготовленные таким образом сосудики помещается
исследуемый материал, предварительно зафиксированный в смеси
2%-й четырехокиси осмия и насыщенного раствора сулемы в соот-
ношении 6:1, пробы выдерживаются в фиксаторе 12—18 ч при 4°.
После фиксации пробы переносят в сосудики и осторожно промывают
10 мин в воде. Вместо общепринятой процедуры обезвоживания в се-
рии растворов спирта или ацетона производят однократное обезво-
живание в метоксиэтаноле в течение 10 мин и далее в абсолютном
этаноле 10 мин. Промывка материала водой и фиксация осущест-
вляются путем погружения сосудиков в соответствующие жидкости.
Это позволяет полностью сохранить на фильтре пробу и предохра-
няет материал от возможных повреждений. После обезвоживания
пробы в сосудиках высушивают при критической точке в токе угле-
кислоты. Затем фильтры с материалом напыляют золотом и иссле-
дуют в сканирующем микроскопе.
18
ОСНОВНЫЕ МЕТОДЫ ОКРАСКИ БАКТЕРИЙ
Окраска бактерий на фиксированных препаратах. Общее строение
бактерий и других микроорганизмов лучше рассматривать на окра-
шенных препаратах. Процесс окраски заключается в том, что сус-
пензию бактерий располагают на чистом стекле, подсушивают на
воздухе, фиксируют мазок, проводя его 2—3 раза через пламя
спиртовки, и окрашивают одним из способов, описанных ниже. После
окраски мазок промывают проточной водой, высушивают и просмат-
ривают под микроскопом в капле иммерсионного масла. Из красок
наиболее часто используются метиленовая синяя, кристаллвиолет,
фуксин и эритрозин. За исключением эритрозина, основные раство-
ры этих красок готовят на 95°-м этиловом спирте. Перед при-
менением небольшое количество краски фильтруют и разводят по
прописи. Окраску мазка производят 1—3 мин, время от времени
нагревая препарат до появления слабых паров.
Метиленовая синяя по Леффлеру
Насыщенный спиртовой раствор ме- 30 мл
тиленовой синей z
Раствор КОН в дистиллированной 100 мл
воде 1:10000
Карболовый фуксин по Цилю
Насыщенный спиртовой раствор основ- 10 мл
ного фуксина
Карболовая вода, 5%-й водный раствор 100 мл
фенола
Перед окраской бактерий растворы разводят в 10 раз дистилли-
рованной водой.
Окраска эритрозином с докраской фуксином
Эритрозин 3 г
Карболовая вода, 5%-й водный раствор 100 мл
фенола
Фуксин по Цилю 1 капля
Вода дистиллированная 10 мл
Мазок бактерий на предметном стекле после фиксации окраши-
вают эритрозином в течении 3 мин при слабом подогревании. Крас-
ку сливают, и препарат дополнительно окрашивают сильно разве-
денным раствором фуксина 3 мин при слабом нагревании.
Окраска по Граму
1. Кристаллвиолет
Насыщенный спиртовой раствор 10 мл
кристаллвиолета или генцианвиолета
Щавелевокислый аммоний, 1%-й вод- 40 мл
ный раствор
2.Раствор Люголя
Йод 1 г
Йодистый калий 2 г
Вода дистиллированная ‘ 300 мл
3. Сафранин
Насыщенный спиртовой раствор 10 мл
сафранина
Вода дистиллированная 100 мл
19
Одни бактерии после окраски кристаллвиолетом или генциан-
виолетом и обработки йодом легко обесцвечиваются спиртом, в то
время как другие сохраняют свою окраску. Метод заключается в
следующем. Делают тонкий мазок культуры на чистом предметном
стекле, сушат на воздухе и фиксируют на пламени. Окрашивают
1 мин кристаллвиолетом и 1 мин обрабатывают раствором йода.
Обесцвечивают окрашенный препарат 30 с 94%-м спиртом и промы-
вают водой. Дополнительно окрашивают в течение 10 с сафранином.
Промывают и сушат. Если бактерии грамположительны, то они видны
под микроскопом окрашенными в лиловый цвет. Если они грамо-
отрицательны, то в спирту обесцвечиваются и окрашиваются сафра-
нином в красный цвет.
Определение принадлежности к грамположительным или грамотри-
цателъным бактериям без окраски клеток
Надежные результаты определения принадлежности к грамположи-
тельным или грамотрицательным бактериям получают при примене-
нии теста Гендерсона [Buck, 1982].
Каплю 3%-го водного раствора КОН помещают на предметное
стекло. Стерильной петлей переносят небольшое количество бакте-
риальной биомассы с агаровой среды или из осадка после центри-
фугирования в каплю щелочи. Смешивают клетки со щелочью в зоне
около 1,5 см. Если суспензия становится заметно вязкой в пределах
5—60 с — бактерии грамоотрицательные. Если никакой вязкости не
наблюдается — бактерии грамположительные. Наилучший способ выя-
явить вязкость суспензии — поднять петлей каплю на расстояние
около 1 см над стеклом. Наличие слизистого тяжа указывает на
принадлежность к грамоотрицательным бактериям. На одном предмет-
ном стекле можно одновременно проанализировать 6—8 проб.
Окраска спор. 1. М е т о д О же ш к и. Мазок из культуры, содержащей
вегетативные клетки и споры, делают на предметном стекле,
подсушивают на воздухе не фиксируя, заливают 5%-м раствором
соляной кислоты и нагревают 2 мин до появления паров. Затем препарат
промывают водой. Мазок покрывают слоем фильтровальной бумаги и
заливают карболовым фуксином Циля. Окраска производится 5 мин при
легком подогревании препарата, до появления паров. При испарении
краску подливают. Препарат не должен подсыхать. После этого
препарат промывают водой и 2 мин обесцвечивают 1%-м раствором
серной кислоты. Время обесцвечивания может колебаться, него находят
опытным путем. Препарат еще раз промывают водой и докрашивают в
течение 10—15 мин раствором метиленовой синей 1:40. Препарат
промывают водой и высушивают. При правильной окраске бактери-
альные клетки должны быть синими, а споры — красными.
2. Метод Шеффер—Фультона. Препарат-мазок предвари-
тельно просматривается под микроскопом. Необходимо, чтобы были
вегетативные палочки и споры. Мазок высушивается на воздухе и
фиксируется спиртом. После фиксации красят 5%-м водным раствором
малахитового зеленого 60 с, время от времени нагревая до появления
20
слабых паров (3—5 раз). После этого краску смывают током воды.
Мазок осторожно просушивают фильтровальной бумагой, дополни-
тельно 30 с окрашивают 0,5%-м раствором сафранина, вновь промывают
водой и высушивают фильтровальной бумагой. Созревшие споры
окрашиваются в зеленый цвет, вегетативные клетки — в розовый.
Выявление включений в бактериальных клетках. Выявление
гликогена. Суспензию клеток наносят на предметное стекло, до-
бавляют каплю раствора йода в йодистом калии и накрывают покров-
ным стеклом. Зерна гликогена окрашиваются в красновато-коричне-
вый цвет.
Раствор йодистого калия с йодом готовят следующим способом:
2 г йодистого калия растворяют в 5 мл дистиллированной воды, до-
бавляют 0,7 г кристаллического йода и дистиллированной водой до-
водят объем раствора до 30 мл.
Окрашивание волютина методом Омелянского. Во-
лютин, или метахроматические зерна, встречается у ряда микро-
организмов. Известно, что он состоит из фосфолипидных ком-
плексов, но их физиологическая роль пока известна недостаточно.
В клетках дрожжей и грибов они сосредоточены в вакуолях, у бакте-
рий — в цитоплазме. Высушенный на воздухе мазок фиксируют над
пламенем горелки и 30 с окрашивают карболовым фуксином Циля
(см. выше). Промывают стекло водой, обезвоживают 20—30 мин в
1%-м растворе серной кислоты, споласкивают водой и заливают раз-
бавленным (1:40) метиленовым синим. В поле зрения микроскопа
красные зерна волютина резко выделяются на фоне протоплазмы,
окрашенной в синий цвет.
Окрашивание липидов. На предметное стекло наносят каплю
50%-го раствора формалина и суспендируют в нем исследуемый мате-
риал. Через 5 мин добавляют каплю метиленового синего (1:40), а
через 10 мин — каплю Судана III. Цитоплазма клеток окрашива-
ется в синий цвет, а жировые капли — в розовый.
Раствор Судана III готовят путем растворения 0,5 г краски в 100 мл
этанола или концентрированной молочной кислоты.
Выявление капсул. Многие микроорганизмы способны к образова-
нию внеклеточного материала, расположенного поверх жесткой клеточ-
ной стенки, так называемого гликокаликса. Это капсулы и слизистые
зооглейные массы в основном полисахаридного состава. У некоторых
микроорганизмов, например у отдельных видов рода Bacillus, они сос-
тоят из полипептидов.
Капсулы выполняют важные функции во взаимодействии микро-
организмов с окружающей средой: защищают клетки от воздействия
неблагоприятных факторов, например высоких концентраций кисло-
рода; служат барьером для проникновения фаговой инфекции. Важную
роль капсульный материал играет в агрегировании и прикреплении
к субстрату водных бактерий. В некоторых случаях в водоемах бо-
лее 70% клеток в бактериопланктоне имеют капсулы.
1. Негативное окрашивание применяют для выявления
капсул в светооптическом микроскопе. На обезжиренном предметном
стекле смешивают каплю туши с каплей жидкой бактериальной суспен-
21
зии и с помощью покровного стекла готовят тонкий мазок. Его
подсушивают на воздухе и исследуют под микроскопом. На черном
фоне четко выявляются бактериальные клетки и окружающие их
прозрачные капсулы.
2. Метод Гинса. Описанным выше способом готовят негативно
окрашенный тушью препарат, фиксируют либо в течение 2—3 мин
7%-м раствором сулемы, либо 5—10 мин абсолютным метиловым
спиртом или смесью эфира и этилового спирта в соотношении 1:1. Пре-
парат промывают водой и окрашивают разбавленным водой (1:3)
раствором фуксина Циля в течение 3—5 мин. Под микроскопом на
темном фоне видны малиновые клетки, окруженные бесцветными
капсулами.
В некоторых случаях экзополисахаридные фибриллы и капсулы,
окружающие клетки, не выявляются в светооптическом микроскопе,
но при специальной подготовке образцов отчетливо выявляются в
сканирующем (см. выше) или электронном микроскопе.
3. Выявление капсул в электронном микроскопе
с окраской рутением красным [Luft, 1971]. Бактериаль-
ную взвесь из водоема или суспензию бактерий фиксируют добавле-
нием равного объема 0,2 М какодилатного или фосфатного буфера
pH 7,2, содержащего 6% глутаральдегида и 0,3% рутения красного.
Клетки сразу осаждают центрифугированием, осадок ресуспендируют в
0,1 М какодилатном буфере, содержащем 3% того же фиксатора и
0,15% красителя, в течение часа. Бактерии снова осаждают и про-
мывают несколько раз 0,2 М какодилатным буфером, а затем в
течение полутора часов фиксируют в 0,1 М какодилатном буфере
с 1% четырехокиси осмия и 0,15% рутения красного. Осадок дважды
отмывают водой. Далее для приготовления ультратонких срезов
осадок дегидратируют в подкисленном диметоксипропане или в серии
спиртов возрастающей концентрации либо однократно в метоксиэта-
ноле и заливают в эпон или аралдит. Срезы помещают на покры-
тые пленкой сеточки, окрашивают цитратом свинца и уранилаце-
татом и просматривают под электронным микроскопом.
Катионный краситель рутений красный взаимодействует с анион-
ными группировками капсул с образованием Оптически плотного фиб-
риллярного и диффузного материала, выявляя таким образом вне-
клеточные экзополисахариды — микрокапсулы, капсулы, внекапсуль-
ные аморфные слизи.
Определение живых и мертвых бактерий. Для выявления в мазке
мертвых бактерий М.Н. Мейсель и др. [1961] рекомендуют произ-
водить окраску бактерий примулином, этазоловым желтым или брил-
лиантдиониловым зеленым в разведении 1:100000.
На предметное стекло наносят несколько капель красителя, туда же
добавляют бактериальную суспензию и покрывают покровным стек-
лом. Избыток воды удаляют фильтровальной бумагой. Покровное
стекло по краям обмазывают вазелином, чтобы предохранить препа-
рат от высыхания. Через 5—10 мин препарат просматривают в люми-
несцентном микроскопе.
При флуорохромиров&нии этими красителями живые бактерии
22
почти не светятся, а мертвые ярко люминесцируют. Одно и то же
поле зрения сначала просматривают при люминесцентном освещении
и учитывают мертвые клетки, а затем в том же поле зрения при
фазовом контрасте подсчитывают общее количество бактерий.
МИКРОСКОПИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
ЧИСЛЕННОСТИ МИКРООРГАНИЗМОВ
Существует ряд методов определения численности бактерий в при-
родных субстратах с использованием светооптической, люминесцент-
ной и сканирующей микроскопии.
Общепринятым методом определения количества бактерий в воде
служит метод, разработанный А.С. Разумовым [1948]. В его основе
лежит концентрирование микроорганизмов из воды на поверхности
мембранных фильтров и их окраска карболовым эритрозином.
В настоящее время широкое распространение получили методы
окрашивания бактерий на фильтрах флуорохромами с последующим
подсчетом клеток под люминесцентным микроскопом. Преимущества
использования люминесцентных красителей заключаются в том, что
благодаря яркому свечению окрашенных клеток на темном фоне
удается учесть клетки мелких размеров, составляющие иногда значи-
тельную часть общей фракции бактериопланктона. Последнее было
подтверждено при использовании сканирующего микроскопа для ис-
следования и количественного подсчета микроорганизмов на мембран-
ных фильтрах: более 60% бактериопланктона составляют ультра-
микроскопические бактериальные клетки разнообразной формы, кото-
рые не удается учесть в световом микроскопе из-за чрезвычайно
мелких размеров [Overbeck, 1974; Azam, Hodson, 1978; и др.]. Кроме
того, в ряде случаев, особенно при использовании специфических
флуорохромов, с помощью люминесцентной микроскопии удается
более точно дифференцировать на фильтре бактериальные клетки
от мелких частиц небиологической природы.
При использовании указанных выше методов подсчета микроор-
ганизмов необходим правильный подбор типа мембранных фильтров.
Для этих целей применяют фильтры двух типов. Это так называе-
мые глубинные и экранные (которые также называют ядерными или
ситовыми) фильтры. Первые изготовляются из нитроцеллюлозы, аце-
тилцеллюлозы или полихлорвинила. Они построены из переплетен-
ных волокон с неправильной структурой пор. К ним относятся
фильтры отечественного производства Мытищинского завода, марки
Сынпор, изготовляемые фирмой ’’Синтезия” (ЧССР), марки Миллипор,
производимые в США, Канаде, Франции, некоторые типы фильтров
марки Сарториус (ФРГ). При подсчете бактерий в светооптическом
микроскопе хорошие результаты дает использование фильтров типа
Сынпор, имеющих небольшой разброс в размерах пор и высокую
пористость: поры составляют до 80% его площади.
Ситовые, или ядерные, фильтры изготовляют методом облуче-
ния, или следового травления пленок, из поликарбонатных или поли-
эфирных материалов. Поры таких фильтров также однородны по раз-
23
Таблица I
Техническая характеристика мембранных фильтров
Тип, фирма, страна, N фильтра Размер пор, мкм Материал, условия обработки Тип, фирма, страна, N фильтра Размер пор, мкм Материал, условия обработки
г. Мытищи (СССР) 6 5 4 3 2 1 Сынпор (ЧССР) 1 2 3 4 5 6 7 8 9 10 Миллипор (США, Ка- нада) SM SS RA НА GS Глубиннъ 3—5 1,2 0,9 0,7 0,5 0,35 4±1 2,5±0,5 ],5±0,4 0,85±0,15 0,60±0,1 0,40±0,06 0,30±0,04 0,23±0,04 О,17±О,ОЗ 0,12±0,02 5,0 3,0 1,2 0,45 0,22 je Ацетатцеллюлоза, кипячение Ядерные I Нитроцеллюлоза, кипячение, авто- клавирование, ус- тойчива в преде- лах pH 1 — 10 Смесь нитрат* и ацетилцеллюлозы, кипячение, авто- клавирование, ус- тойчива к кисло- там и щелочам VS VM VF ситовые) г. Дубна (СССР) Владипор (СССР) Нуклеопор (США, Ка- нада, Фран- ция) Сарториус (ФРГ) Глубиннъ 0,10 0,05 0,01 0,01—5 0,05—1 0,01 — 12 0,01—8 0,2—1,2 0,2—1,2 0,2—5 е Лавсан, кипячение, автоклавирование, устойчив к слабым кислотам и щело- чам, неустойчив к карболовой кисло- те Ацетилцеллюлоза, автоклавирование (сухой пар, 200°, 40 мин) Поликарбонат, ав- токлавирование, кипячение, неус- тойчив к щелочам Нитроцеллюлоза, автоклавирование, кипячение Ацетилцеллюлоза, автоклавирование, сухой жар Полиамид Тефлон, сухой жар
меру. Высокая пористость определяет высокую скорость фильтра-
ции и их низкие сорбционные свойства. К ним относятся ядерные
фильтры производства Института ядерных исследований в г. Дубне,
типа Владипор (г. Владимир) и типа Нуклеопор (США, Канада,
Франция), Сарториус (ФРГ). Выше приводится краткая характеристи-
ка разных типов мембранных фильтров (табл. 1). Подробное описа-
ние методов ультрафильтрации, в том числе способов стерилизации
растворов и сред для бактериологических исследований, приводится
в монографии Т. Брока [1987].
Для одновременного фильтрования нескольких проб удобна фильтро-
вальная установка, показанная на рис. 9 [Хромов, Семин, 1972]. Она
состоит из 8—10 фильтров Зейтца любого размера, смонтированных
вместе и соединенных через коллектор и бачок с вакуумным насосом.
Манометр позволяет контролировать рабочий вакуум, который не
24
б
Рис. 9. Фильтровальная установка
а — общий вид; б — принципиальная схема установки; 1 — продукционные
склянки; 2 — фильтр Зейтца; 3 — вакуумные краны; 4 — манометр; 5 — уровнеметр;
6 — кран для слива; 7 — бачок для фильтрата; 8 — вакуумный насос
должен превышать 0,1—0,2 атм. Фильтровальная установка может
быть изготовлена из металла, оргстекла или винипласта.
Ниже приводится описание методов подсчета бактерий в воде и
грунтах с использованием мембранных фильтров.
ПОДСЧЕТ БАКТЕРИЙ НА ФИЛЬТРАХ
С ОКРАСКОЙ ЭРИТРОЗИНОМ
1. Пробу воды отбирают в чистую посуду и в случае транспортировки
фиксируют 40%-м раствором формалина (0,5 мл формалина на 100 мл
воды). Формалин предварительно фильтруют через мембранный
фильтр с порами 0,3 мкм для очистки от бактерий.
2. 10—20 мл испытуемой воды фильтруют через предварительно
прокипяченный мембранный фильтр диаметром 2,5 см спорами0,1—0,2
мкм.
3. После фильтрации фильтр сушат на воздухе и на краях шариковой
ручкой маркируют дату, объем профильтрованной воды, но-
мер пробы. Фиксируют в парах формалина. В таком виде фильтры
можно хранить длительное время.
4. Фильтр окрашивают 5%-м раствором эритрозина на 5%-й кар-
боловой воде в течение 3—4 ч при температуре 50—60° в термоста-
те или оставляют на ночь в чашке Петри на фильтровальной бумаге,
пропитанной краской.
По окончании окрашивания окраску отмывают, перекладывая
фильтр несколько раз на влажной фильтровальной бумаге, затем
его высушивают.
5. Подсчет бактерий проводят на фильтре, помещенном на пред-
метное стекло в каплю иммерсионного масла при иммерсионном объек-
тиве (Х90) и окуляре (X 10) с сетчатым микрометром.
6. Подсчет бактерий производится по формуле
5- 10б а
х ----------,
S' п V
25
где х — количество бактерий в 1 мл воды; 5 — площадь фильтра,
мм2; 106 — коэффициент для перевода мм2 в мкм2; а — сумма бак-
терий, подсчитанных в п полях зрения; п — число полей зрения; s —
площадь окулярной сеточки, в которой были просчитаны бактерии,
мкм2; v — объем профильтрованной воды, мл.
Агрегированный бактериопланктон. Численность бактериопланкто-
на, агрегированного в виде микроколоний и на частицах детрита,
можно подсчитать отдельно на тех же фильтрах, но при значительно
большей просматриваемой площади. Для этого на фильтре подсчиты-
вают агрегаты на площади, ограниченной полем зрения микроскопа
при объективе Х90 и шириной от 1 до 5 мм, в зависимости
от частоты встречаемости частиц на фильтре. Расчет численности
агрегированных клеток бактерий проводится по приведенной выше
формуле с учетом просматриваемой площади фильтра [Спнглазов,
1983].
Необходимо указать, что, составляя небольшой процент от чис-
ленности одиночных бактерий, агрегированный бактериопланктон до-
стигает 30% и более по биомассе. Это объясняется относительно
крупными размерами клеток, ассоциированных в агрегатах.
ПОДСЧЕТ БАКТЕРИЙ НА ФИЛЬТРАХ
С ОКРАСКОЙ ФЛУОРЕСЦЕНТНЫМИ КРАСИТЕЛЯМИ
Принципы флуоресцентной микроскопии были разработаны Е. Брум-
бергом [1942]. В дальнейшем они были использованы рядом иссле-
дователей для учета водных бактерий. Для окраски используют сле-
дующие флуорохромы: акридиноранж, флуорескамин, ауроамин О,
флюорит X. Наиболее распространено использование для этих целей
акридиноранжа.
Для устранения собственной флуоресценции фильтров, снижаю-
щей контрастность изображения, ядерные фильтры предварительно об-
рабатывают специальными гасителями, например путем выдерживания
в течение нескольких суток в насыщенном спиртовом растворе Суда-
на черного Б с последующим отмыванием в воде или спирте. Су-
ществуют специально выпускаемые для этих целей черные фильтры
Нуклеопор. Все растворы предварительно фильтруют для устранения
возможности бактериального загрязнения.
Метод В.И. Харламенко [1984] с использованием ядерных фильтров
отечественного производства. Готовят 0,015%-й раствор акридиноранжа
на фосфатном буфере при pH 6,9. Фильтры предварительно окраши-
вают в черный цвет Суданом черным Б. 2—6 мл пробы смешива-
ют с 1—3 мл рабочего раствора-акридиноранжа, инкубируют 1 мин и
фильтруют под слабым вакуумом через ядерный фильтр. По оконча-
нии фильтрации, не допуская высушивания, фильтр помещают на пред-
метное стекло, наносят нефлуоресцирующее масло (вазелиновое) и на-
крывают покровным стеклом. Подсчет светящихся зеленым Цветом кле-
ток проводится под эпифлуоресцентным микроскопом ("Люмам”) с
использованием фильтров ЖС-24, ФС-2, зеленой светоотделительной
пластиной и запирающими светофильтрами ЖС-18 и ЖС-19. Надежные
результаты получаются в тех случаях, если фиксированные пробы
26
воды хранятся не более нескольких суток и фильтры просматрива-
ются во влажном состоянии. Благодаря тому что удается подсчитать
мелкие клетки, неразличимые при окраске обычными красителями,
число бактерий, подсчитанных с окраской фильтра акридиноранжем,
в 1,5—2 раза выше, чем при учете по методу Разумова.
Метод подсчета бактерий с окраской флуорескамином [Поглазо-
ва, Мицкевич, 1985]. Флуорескамин относится к числу специфиче-
ских красителей, взаимодействующих с амино- и иминогруппами бел-
ков, пептидов, аминокислот. Он не обладает собственным свечени-
ем, люминесцируют его комплексы с аминосоединениями. Вследствие
этого исключается окраска мелких минеральных частиц, что имеет
место при использовании адсорбционных флуорохромов.
Флуорескамин отечественного производства выпускается на Олайн-
ском комбинате (ЛатвССР).
Для окрашивания фильтров готовят свежий 0,02%-й раствор флуо-
рескамина на абсолютном ацетоне из расчета 2 мг на 10 мл. Пре-
парат красителя, как и ацетоновый раствор, необходимо хранить в
темноте, избегая попадания влаги для предотвращения его гидро-
лиза.
Пробы воды фильтруют через окрашенные Суданом черным Б
фильтры. После легкого подсушивания фильтров клетки фиксируют,
погружая фильтры на 3—5 с в 96°-й этиловый спирт. В таком
виде фильтры могут храниться длительное время.
Для окрашивания фильтры помещают в бюкс, куда предваритель-
но наливают 3 мл боратного буфера pH 9,0 и 1 мл ацетонового раст-
вора флуорескамина. Длительность окрашивания 30 с. Затем фильтры
отмывают 2—3 порциями дистиллированной воды, высушивают и за-
ключают в вазелиновое масло.
Максимум флуоресценции красителя соответствует 475 нм при
возбуждающем свете с длиной волны 390 нм. Для получения макси-
мальной яркости свечения применяют фильтры ФС-1-4 или ФС-1-6 в
сочетании с теплозащитным фильтром СЗС-24-4, в качестве запираю-
щего фильтра используют направляющую с пластиной "зеленая” Жи-
вые клетки при этом имеют яркую светло-зеленую флуоресценцию на
темном фоне. Мертвые или частично лизированные клетки не окраши-
ваются или обладают очень слабой флуоресценцией. Расчет количест-
ва бактерий производится по приведенной выше формуле.
ПОДСЧЕТ БАКТЕРИЙ В ИЛОВЫХ ОТЛОЖЕНИЯХ
Если ил содержит карбонат кальция, 1 г тщательно перемешан-
ного грунта помещают в воронку на "синий” беззольный фильтр,
промывают 2 N раствором НС1. После этого фильтр протыкают и
ил смывают в колбочку. Если кальций в поглощающем комплексе
грунта отсутствует, то промывание грунта 2 N раствором НС1 исклю-
чают.
Согласно данным А.Н. Дзюбана и А.Ю. Горбенко [1989], точность
подсчета бактерий в пробах грунта существенно зависит от режима
подготовки пробы для анализа. Авторы подобрали условия обработ-
ки пробы, способствующие наиболее полному отмыванию бактериаль-
ных клеток от частиц грунта, с применением ультразвуковой обра-
ботки пробы, а также путем подбора оптимального разведения грунта
безбактериальной водой в соотношении не менее чем 1:500.
I г сырого грунта помещают в бюкс, вносят 19 мл 0,5%-го
раствора K.2SO4, приготовленного на безбактериальной воде. Сус-
пензию гомогенизируют на ультразвуковой установке УЗДН-2Т 2 мин
при силе тока 0,015 А и частоте 22 кГц для отделения адсорбиро-
ванных на частицах ила бактерий.
Отбирают 5 мл гомогената, переносят в чистую колбу на 200 мл
и разводят раствором K2SO4 в 25 раз. 20 мл полученной сус-
пензии центрифугируют 15 мин прн скорости оборотов 750g и при
температуре 4°. Прн скорости центрифугирования ниже 500g не проис-
ходит полного осаждения частиц грунта, что затрудняет выявле-
ние бактериальных клеток. При скорости, большей 1000g, происходит
частичное осаждение и бактериальных клеток. В интервале центри-
фугирования пробы со скоростью от 500 до 1000g в супернатанте
учитывается максимальное количество клеток.
1 мл супернатанта фильтруют через мембранный фильтр. Для
более равномерного распределения бактерий по поверхности фильтра
в воронку предварительно наливают 4 мл безбактериального раство-
ра K2SO4.
Если для подсчета бактерий применяют эпилюминесцентный метод,
ядерные фильтры, предварительно окрашенные раствором Судана Ш,
немедленно после легкого подсушивания на воздухе фильтруют в 96%-м
спиртовом растворе в течение нескольких секунд. Далее их окраску
флуорескамином проводят, как описано выше. Мембранные фильтры
марки Сынпор окрашивают эритрозином, докрашивают метиленовым
синим и подсчитывают количество бактерий, как указано в предыду-
щем разделе. Параллельно проводят контрольное микроскопирование
аналогичного фильтра, через который пропущено 5 мл раствора K2SO4.
Расчет количества бактерий проводят по приведенной выше формуле
с учетом разведения исходной пробы в 500 раз.
ОПРЕДЕЛЕНИЕ БИОМАССЫ БАКТЕРИЙ
1. Учитывают общее количество бактерий в 1 мл по прямому
счету, причем количество палочек и кокков подсчитывают отдельно.
2. Определяют средний объем клеток на основании измерения
длины и ширины с помощью либо окуляр-микрометра на фильтрах,
либо — на микрофотографиях. Необходимо иметь в виду, что на высу-
шенных и фиксированных препаратах объем клеток уменьшается в
1,5—2 раза. Поэтому следует вводить поправочный коэффициент,
равный 1,6 [Локк, 1969; Сажин и др., 1987]. Наиболее точные раз-
меры клеток получают при микроскопировании взвеси во влажных
препаратах в фазово-контрастном микроскопе.
3. Объем клеток рассчитывают: для палочек — по формуле объема
цилиндра (v~l/4nd2h), для кокков — по формуле объема шара
(и = 1 /end2). Далее на основании средних размеров палочек, кок-
28
Таблица 2
Величина объема сырой бактериальной клетки, мкм3
[Родина, 1965]
Параметр Палочки
Длина, мкм 0,3 0,6 1,2 2,0 2,8
Ширина, мкм 0,2 0,3 0,5 0.6 0,7
Объем, мкм3 0,009 0,042 0,236 0,565 1,078
Параметр Кокки
Длина, мкм 0,2 0,6 1,2 2.8
Ширина, мкм Объем, мкм4 0,0004 0,113 0,905 1,078
ков, имея данные их прямого подсчета в 1 мл, переходят к опреде-
лению биомассы. Общая сырая биомасса равна сумме массы клеток
разных морфологических типов.
Кроме того, можно определить средний объем клеток по табл. 2.
Полученные значения умножают на число бактерий в 1 мл, опре-
деленное по прямому счету.
4. Для определения сухой массы от этой величины берется 15%,
принимая, что бактерии содержат 85% воды.
5. Принимается, что углерод составляет 50% по массе от сухой
биомассы. Тогда
= ЛГ-!гОД5- 1,6-0,5,
где Бс — углерод сухой биомассы бактерий; 0,15 — переход от сырой
биомассы к сухой; 0,5 — расчет биомассы на углерод; и — средний
объем сухой клетки; N — число бактерий в 1 мл воды; 1,6 — по-
правочный коэффициент.
Средний объем бактериальных клеток в пресных водоемах, по
многочисленным исследованиям, равняется 0,6 мкм3.
ИММУНОФЛУОРЕСЦЕНТНЫЙ АНАЛИЗ ВИДОВОГО СОСТАВА
И ЧИСЛЕННОСТИ МИКРООРГАНИЗМОВ
В последнее десятилетие с целью идентификации различных организ-
мов как в чистых культурах, так и в природных биоценозах начали
использовать серологические методы иммунофлуоресцентного анализа
с применением специфических антисывороток. В основе этих методов
лежит высокая специфичность реакции образования комплекса ан-
тиген—антитело. Исследуемый вид (штамм) бактерий используется для
приготовления антисыворотки. Готовую антисыворотку метят флуорес-
центным красителем. Если образец с природной популяцией бактерий
обработать такой антисывороткой, специфичной к определенному
29
Рис. 10. Применение прямого (а) и непрямого (б) методов иммунофлуоресцентной
окраски
А, Б — гомологичные организмы; В, Г — негомологичные организмы; I — антитела;
1 2 — флурохром; 3 — меченые антитела; 4 — специфическое антитело из сыворотки
кролика; 5 — меченые антитела (из овечьей сыворотки)
i
виду, то клетки этого вида Окажутся ’’мечеными” в результате
связывания с соответствующими антителами антисыворотки. Если эти
антитела способны к флуоресценции, то меченные ими клетки легко
подсчитать по свечению в люминесцентном микроскопе. Таким обра-
зом, метод иммунофлуоресценции может быть с успехом использован
для экологических исследований: определения численности, динамики,
видового разнообразия определенных групп организмов.
Используют два метода иммунофлуоресценции — прямой и непря-
мой. Различия в способе взаимодействия меченного флуорохромом
антитела с антигеном клеточной стенки микроорганизмов схемати-
чески изображены на рис. 10. При использовании прямого метода
иммунофлуоресценции антиген (клетка) связывается с антителом (спе-
цифической кроличьей сывороткой), предварительно окрашенным флуо-
рохромом. При непрямом методе применяют не окрашенное флуоро-
хромом специфическое антитело, которое затем обрабатывают инди-
каторным антителом к кроличьему глобулину, или маркером. В ка-
честве маркера используют овечью антикроличью сыворотку, пред-
варительно окрашенную флуорохромом. Такие маркеры имеются в про-
даже. В качестве флуорохрома чаще всего применяют изотиоцинат флуо-
ресцеина, обладающий интенсивной флуоресценцией в зеленой области
спектра. Чаще в экологических исследованиях применяют метод
непрямой иммунофлуоресценции, исключающий необходимость прове-
дения трудоемких операций — конъюгации флуорохрома с антисы-
вороткой. Для предотвращения неспецифической окраски при адсорб-
ции меченых антител на взвешенных в воде частицах фильтры для
подсчета бактерий предварительно обрабатывают родамином, при-
витым к желатине и контрастирующим по цвету с аутофлуоресцен-
цией зеленого цвета. После добавления антител комплексы антиген—
антитело флуоресцируют зеленым цветом на красном фоне.
Метод высоко специфичен и обладает высокой чувствительностью.
30
Численность клеток выбранного вида в природных популяциях, опре-
деленная методом иммунофлуоресцентного анализа, в 10—1000 раз
выше, чем определенная методом разведений с использованием элек-
тивных сред.
Этот метод можно комбинировать с индикацией клеточной ак-
тивности, например с окрашиванием солями тетразолия — индикато-
ром электронтранспортной активности [Baker, Misl, 1982].
Применение иммунофлуоресцентной техники в сочетании с радио-
автографией позволяет выявить различия между метаболически актив-
ными и неактивными клетками [Fliermans et al., 1975].
Метод иммунофлуоресцентного анализа с успехом был применен
для подсчета количества клеток многих физиологических групп бак-
терий: Thiobacillus thiooxidans [Apel et al., 1976], Thermoplasma
acidophila [Bochlool, Brock, 1974], Sulfolobus [Bochlool, Brock, 1968a, b,
1974], при изучении метаногенов, метилотрофов [Reed, Dugan, 1978;
Кондратенко и др., 1981], нитрификаторов I и II фазы [Belser,
Schmidt, 1978, 1980], для изучения экологии Chloroflexus [Tayne et al.,
1987].
В качестве примера приводим описание иммунофлуоресцентного
метода количественного определения видов метанотрофных бактерий
[Кондратенко и др., 1981].
1. Получение специфических иммунных сывороток. Культуры раз-
ных видов метанотрофов выращивают на качалках в колбах объемом
2 л с внесением 0,5 л среды. Клетки центрифугируют в конце
экспоненциальной фазы роста, дважды отмывают в 0,15 М растворе
NaCl и ресуспендируют в нем до концентрации 109 кл./мл. Иногда
клетки фиксируют формалином для предотвращения инфицирования
кроликов. Иммунизацию кроликов проводят по определенной схеме,
вводя несколько раз с недельным интервалом по 1 мл суспензии.
На 4—5-й день после окончания иммунизации отбирают кровь и ус-
танавливают титр антител методом объемной агглютинации. Сыво-
ротку неиммунизированных кроликов используют в качестве контроля.
Иммунные сыворотки готовят осаждением эритроцитов из крови,
используют без дальнейшей очистки и хранят в запаянных ампулах
при температуре -20°.
2. Тест на агглютинацию и определение титра сыворотки. В лунках
иммунологической камеры готовят серию двухкратных разведений сыво-
ротки. С этой целью в первую лунку вносят испытуемую сыворотку,
в последующие — по 0,05 мл фосфатно-солевого раствора при pH 7,4
(см. ниже). Далее последовательно переносят по 0,05 мл из первой
лунки во вторую, после перемешивания — из второй — в третью и т.д.
Далее во все лунки, кроме контрольной вводят по 0,05 мл антигена
(суспензию испытуемых клеток). Камеру накрывают и помещают на 2 ч
в термостат при температуре 37°. При отрицательной реакции
антиген—антитело смесь в лунке остается прозрачной или образует-
ся гомогенный слабый осадок, как в контрольной. При положительной
реакции образуется гранулированный осадок или отмечается ’’сверты-
вание” суспензии. Максимальное разведение, при котором отмечается
положительная реакция агглютинации, соответствует титру сыворотки.
31
В качестве рабочего разведения в дальнейшей работе используют 1/2
от максимального разведения сыворотки, при котором еще отмечается
максимальная интенсивность свечения клеток антигена, определяемая
по 4-балльной системе (0, +1, +2, +3, +4).
3. Проверка специфичности иммунных сывороток. Проверка спе-
цифичности имунных сывороток осуществляется в перекрестных реак-
циях агглютинации с различными видами метанотрофов или методом
непрямой иммунофлуоресценции. Она наблюдается при взаимодействии
только с теми видами, против которых была получена, что свидетель-
ствует о ее строгой видовой специфичности. Положительная реакция
иммунофлуоресценции, оцениваемая по 4-балльной системе, прове-
ряется при взаимодействии сывороток с соответствующими штаммами,
к которым они получены.
4. Окраска клеток на фильтрах. Для подсчета отдельных видов
метанотрофов в пробах природного материала используют ядерные
фильтры, окрашенные в черный цвет Суданом. Через фильтры пропу-
скают 10—20 мл природной воды или супернатанта ила. Для более
полного учета бактерий пробы ила предварительно обрабатывают
ультразвуком на низкочастотном диспергаторе типа УЗДН-1 (15 кГц) в
течение 2 мин. Пробы воды или ила фиксируют 2%-м формалином
и хранят в темноте до начала процедуры окраски или сразу промы-
вают фосфатно-солевым раствором.
5. Окраска фильтров флуорохромом. Фильтры помещают в держа-
тель воронки фильтра Зейтца, промывают фосфатно-солевым раствором
(8 г NaCI; 0,2 г КС1; 1,15 г Na2HPO4; 0,2 г К2НРО4 в 1 л дистилли-
рованной воды; pH 7,4).
В других случаях для полевых проб фильтры вынимают из ворон-
ки фильтра Зейтца, помещают на предметное стекло и на его поверх-
ность наливают 0,2 мл гидролизованного с помощью КОН при pH
10,5 раствора желатина для удаления неспецифической адсорбции
меченых антител. Фильтры инкубируют при 50—60° до почти полного
подсыхания. Если исследуют чистые культуры, вместо желатина на
поверхность фильтра, не вынимая его из воронки, приливают 0,2 мл
2%-го альбумина бычьей сыворотки в фосфатно-солевом растворе на
30 мин, а затем промывают тем же раствором.
После промывания отсоединяют вакуумный насос, на поверхность
фильтра наливают небольшое количество этого раствора и наносят
на 30 мин 10 мкл специфической кроличьей сыворотки. В качестве
контроля служат фильтры, окрашенные нормальной кроличьей сыво-
роткой. После последующего промывания 30 мл фосфатно-солевого
буфера, на фильтр наносится 10—15 мкл маркера — овечьей анти-
кроличьей сыворотки, конъюгированной с изотиоцианатфлуоресцеи-
ном. После 30 мин экспозиции следует промывка 30 мл буфера,
затем карбонатным буфером при pH 9,6. Далее фильтры помещают
на предметное стекло, увлажняют смесью глицерина и фосфатно-
солевого буфера (9:1) и просматривают в эпифлуоресцентном микро-
скопе.
зг
Часть II
Описание, культивирование
и количественный учет
основных групп микроорганизмов,
участвующих в круговороте веществ в водоемах
КРУГОВОРОТ УГЛЕРОДА
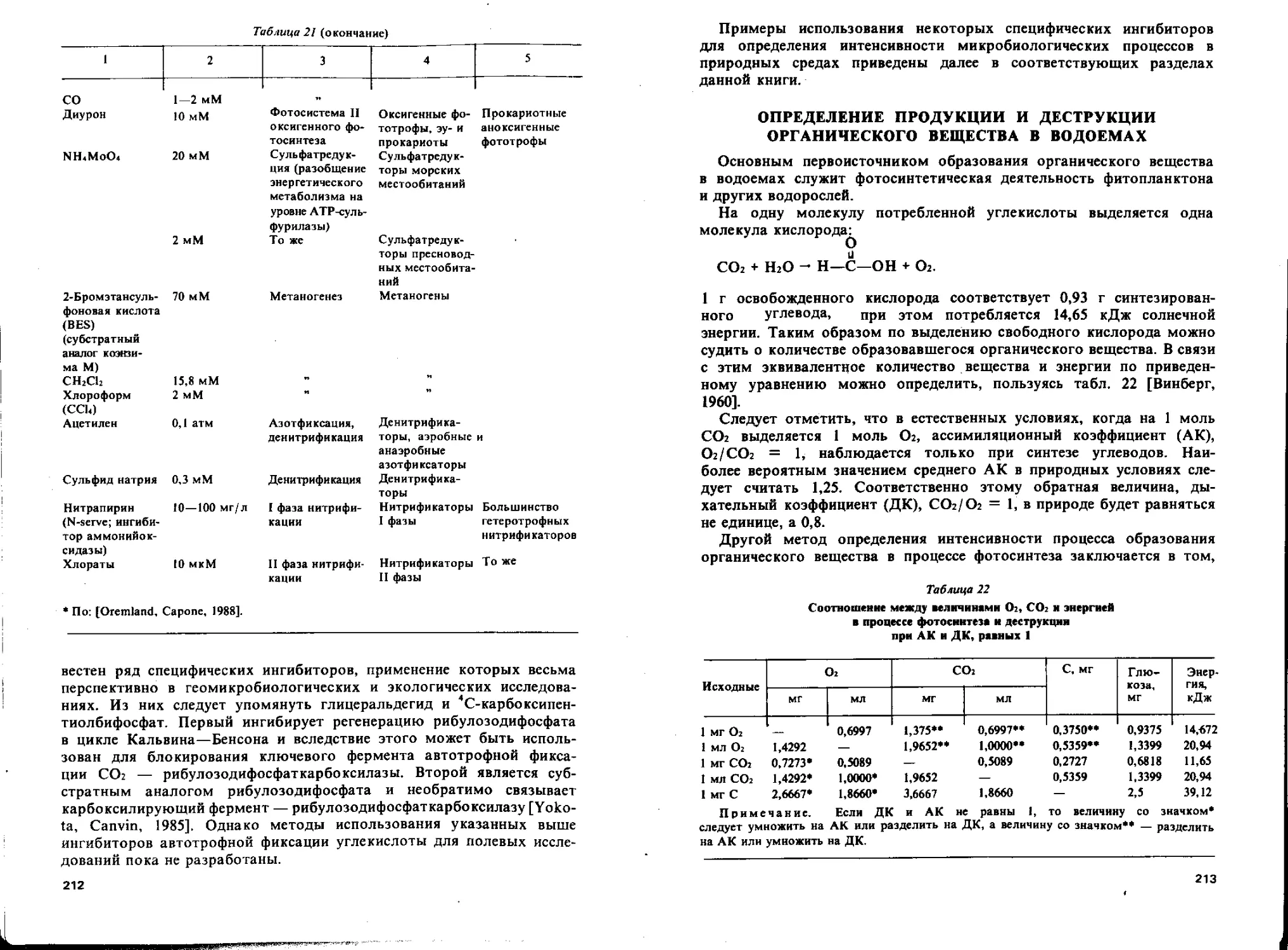
АЭРОБНОЕ РАЗЛОЖЕНИЕ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Основную роль в круговороте углерода играют процессы про-
дукции и деструкции органического вещества. Через эти процессы
осуществляется связь цикла углерода со многими циклами других
элементов, поскольку отдельные элементы, такие, как сера, азот,
железо и др., включаются в органическое вещество при участии от-
дельных видов или целых биоценозов микроорганизмов. Нами приво-
•дится общая схема процессов, участвующих в круговороте углерода,
с учетом степени аэробности отдельных слоев озера в период лет-
ней стратификации (рис. 11).
Пополнение водоема органическим веществом идет за счет по-
верхностного стока с водосборной площади и за счет развития ав-
тохтонной микрофлоры. Сюда относятся фотосинтезирующие организ-
мы, хемосинтетики, использующие энергию окисления восстановлен-
ных соединений азота и серы, и в какой-то мере гетеротрофы,
усваивающие СО: за счет энергии окисления готовых органических
веществ.
Существует достаточно высокий набор методов определения видо-
вого состава и численности микроорганизмов в природных эко-
системах. К ним относятся методы предельных разведений для опре-
деления численности представителей физиологических групп на элек-
тивных питательных средах, иммунофлуоресцентный и радиоавтогра-
фи чес кий анализы. В последнее время для определения качествен-
ного состава природных популяций, представленных ограниченным
числом видов, был развит метод определения последовательностей
5S и I6S рРНК (Расе et al., 1986].
Общие принципы выделения чистых культур
аэробных бактерий
Выделение чистых культур в ряде случаев представляет значи-
тельные затруднения, особенно когда основному виду сопутствуют
другие виды бактерий. Опыт показал, что наилучшие результаты дает
излагаемый ниже метод, предложенный Хуттоном и Зобеллом [Hutton,
Zobell, 1953].
3. Зак, 1766 33
Рис. 11. Круговорот углерода в водоемах
а — аэробная зона; б — микроаэробная эона; в — анаэробная эона; г — донные
отложения; 1 — фотосинтез фитопланктона и высшей водной растительности; 2 — деструк-
ция органического вещества; 3 — осаждение органического вещества; 4 — фотосинтез
окрашенных серобактерий; S — хемосинтез тионовых бактерий; 6 — хемосинтез
нитрификаторов; 7 — анаэробный распад органического вещества; 8 — редукция суль-
фатов; 9 — бродильные процессы; 10 — метаногенез; 11 — окисление метана; 12 — поступ-
ление в водоем аллохтонного органического вещества
1. Испытуемый материал высевают на жидкую элективную сре-
ду и получают культуру накопления данного вида бактерий.
2. Из культуры накопления бактерий делают ряд последователь-
ных разведений и производят высев на агаризованную элективную
питательную среду. В случае, если искомый вид бактерий хорошо
растет на твердой питательной среде, высев можно делать из ряда
последовательных разведений испытуемого материала непосредствен-
но на твердую питательную среду, минуя первую операцию.
3. Из посевов на твердую питательную среду выбирается такой,
34
когда на чашке Петри будет около 30—50 колоний искомого вида
бактерий. Из 50—100 колоний данного вида делают отсевы в про-
бирки с косым агаром, приготовленным на элективной питатель-
ной среде.
4. После соответствующей инкубации через 1—2 нед все посевы
на косой агар контролируют на чистоту. Сначала производят визу-
альный контроль на отсутствие посторонних видов по штриху на
агаре. Грязные культуры отбраковывают. Затем из оставшихся штри-
хов делают микроскопические препараты, окрашивают эритрозином с
докраской фуксином и вновь отбраковывают культуры, содержащие
загрязнения, обнаруживаемые путем микроскопического контроля.
5. Чистые культуры высевают на жидкую элективную питатель-
ную среду и отбраковывают те культуры, которые не дали роста.
6. Чистые культуры, давшие рост на жидкой элективной среде,
высевают на МПА и другие среды для проверки их на чистоту.
7. Вновь производят отбраковку культур, давших рост на тех
средах, где они не должны расти. Если данный вид способен расти
на МПА, то колонии на чашке все должны быть однородны.
Такой прием последовательной отбраковки грязных культур из
первоначального массового посева гораздо быстрее приводит к по-
ложительному результату, чем многократный последовательный пере-
сев из одной колонии на косую агаризированную среду в пробир-
ках и вновь пересев на чашки Петри и т.д. В качестве критерия
служит идентичность клеток под микроскопом, за исключением поли-
морфных культур, посев на специфические среды и идентичность
колоний при посеве с разведениями на питательной среде.
В цикле превращений органических соединений углерода при-
нимают участие микроорганизмы различных физиологических и эко-
лого-трофических групп. Для выделения специализированных физио-
логических групп микроорганизмов используют элективные питатель-
ные среды. Элективность среды достигается либо за счет введения
в ее состав специфического источника углерода, используемого пред-
ставителями конкретной физиологической группы микроорганизмов,
либо созданием наиболее благоприятных физико-химических пара-
метров в среде: концентрации питательного субстрата, pH темпера-
туры, освещенности и др.
Кроме элективных сред, в практике микробиологических иссле-
дований принято использование сред, на которых возможен рост
многих групп гетеротрофных бактерий. К последним относятся сре-
ды для сапрофитных (евтрофных) бактерий, обедненные среды для
сравнительно слабо изученной группы олиготрофных бактерий, ха-
рактеризующиеся низкой концентрацией питательных веществ, близ-
кой к их содержанию в природных водах. Для оценки санитар-
ного состояния водоемов применяют стандартные бактериологиче-
ские методы анализа бактерий группы кишечной палочки. Многие из
указанных выше сред используются в качестве стандартных для
определения микробиологических показателей в гидробиологических
исследованиях.
35
Среды для сапрофитных бактерий
Мясо-пептонный бульон (МПБ)
Мясной экстракт 3 г
Пептон 5 г
Вода водопроводная 1000 мл
Смесь кипятят до тех пор, пока мясной экстракт и пептон не
растворяются. Доводят реакцию до pH 6,8—7,0, используя в качестве
индикатора бромтимоловый синий.
Мясо-пептонный агар (МПА)
Состав питательной среды тот же, что у МПБ, но добавляют на
1 л среды 20 г агар-агара. Равноценен ему выпускаемый промыш-
ленностью сухой питательный агар (СПА).
Мясо-пептонная желатина (МП Ж)
Желатина 100—150 г
Мясной экстракт 3,0 г
Пептон 5 г
Вода водопроводная 1000 мл
В соответствующий сосуд отмеряют 1000 мл МПБ, добавляют
10—15% желатины и оставляют ее набухать 5—10 мин. Нагревают
в водяной бане, пока все не растворится. Доводят реакцию пита-
тельной среды до pH 6,6—7,0, как это указано при приготовле-
нии питательных сред. Желатина имеет кислую реакцию и обладает
большой буферностью, поэтому на ее нейтрализацию идет больше
едкого натра, чем на нейтрализацию бульона или агара. Желатину
можно фильтровать через бумажный или через ватный фильтр.
Среда Горбенко [2962] для учета гетеротрофных бактерий
Сухой питательный 5 г
агар (СПА)
Агар-агар 13,5 г
Вода природная 1000 мл
СПА состоит из триптического гидролизата рыбной муки. Разбав-
ление СПА в 10 раз при учете гетеротрофных бактерий на чашках
Петри способствует росту более олигокарбофильных бактерий, число
колоний при этом увеличивается примерно от 2 до 10 раз по срав-
нению с обычно применяемыми СПА. При этом выявляется большее
разнообразие видов микроорганизмов.
Почвенный агар
Глюкоза 1 г
К2НРОч 0,5 г
Почвенный экстракт 100 мл
Агар-агар 15 г
Вода водопроводная 900 мл
Почвенный экстракт готовят, нагревая в автоклаве 30 мин 1 кг са-
довой почвы, растворенной в 1000 мл водопроводной воды. Добавля-
ют небольшое количество карбоната кальция и все вместе фильтру-
ют через двойной фильтр из фильтровальной бумаги. Если фильтрат
36
будет мутный, то его повторно фильтруют через тот же фильтр
(не заменяя фильтр новым). Растворяют агар в 900 мл воды и нагре-
вают текучим паром в аппарате Коха не меньше 1 ч. Добавляют
100 мл почвенного экстракта. Глюкозу добавляют перед тем, как раз-
ливать агар по пробиркам. Реакцию доводят до pH 6,8.
Среда для дифференцировки видов спорообразующих бактерий
[Мишустин, Перцовская, 1954\
МПА 500 мл
Сусловый агар 500 мл
Сусловый агар готовят на неохмеленном сусле 7° Баллинга и сме-
шивают в горячем состоянии с равным объемом растопленного МПА.
Реакцию среды доводят до pH 7,1—7,2. Среду разливают небольшими
порциями и стерилизуют. На этой среде колонии отдельных видов
спорообразующих бактерий имеют характерный вид.
Сусловый агар
Солодовый экстракт 150 г
(сусло)
Вода водопроводная До 1000 мл
Агар-агар 15 г
Сусло
250 г тонко размолотого солода заливают при помешивании 1 л воды
и нагревают 1 ч при 50°, проверяя полноту осахаривания крах-
мала. Раствор солода отжимают, через 2—3 ч отстаивания фильтруют и
доводят объем до 1 л. Сусло разливают в стерильную посуду и
стерилизуют в автоклаве при 110° или 3 дня в аппарате Коха по
полчаса (в промежутке оставляют на холоде), на 4-й день за несколь-
ко часов до очередной стерилизации жидкость выдерживают при 35—40°.
На 5-й день жидкость не стерилизуют, а выдерживают при 25—30°. По-
следнюю стерилизацию на 6-й день ведут в течение 1 ч.
Картофельный агар
Картофель 200 г
Агар-агар 15 г
Вода водопроводная 1000 мл
Клубни картофеля, моют, чистят, режут мелкими дольками, поме-
щают в холодную воду и варят 30 мин. Жидкость фильтруют через
вату с марлей, добавляют в нее агар-агар и нагревают до тех
пор, пока агар не растворится, pH доводят до 7,0. Стерилизуют
1 ч при 120°.
Анализ бактерий группы кишечной палочки
Наличие фекального загрязнения воды устанавливается наличием
в ней бактерий группы кишечной палочки — Escherichia coli и
Aerobacter aerogenes.
Вся группа показателей фекального загрязнения характеризуется сле-
37
дующими признаками: это короткие грамотрицательные неспоронос-
ные палочки, сбраживающие глюкозу в течение 24 ч при 43—45°
с образованием газа. На среде Эндо бактерии этой группы образуют
красные колонии с золотым блеском или темно-красные и розовые с
темным центром.
Необходимо заметить, что бактерии группы кишечной палочки
способны развиваться за счет органического вещества, переходяще-
го в раствор при распаде водной растительности. Таким образом,
Е. coli нельзя принимать как абсолютный показатель фекального
загрязнения и, проводя анализ, необходимо учитывать общий ха-
рактер водоема.
Совещание руководителей водохозяйственных органов стран —
участниц СЭВ предложило номенклатуру нетаксономических понятий
индикаторов фекального загрязненйя из семейства Enterobacteriaceae.
По разработанной номенклатуре принято выделять: эндобак-
терии — бактерии, вырастающие на среде Эндо при 37° за 24 ч;
энтеробактерии — эндобактерии с отрицательным цитохромокси-
дазным тестом (см. приложение "Определение ферментативной актив-
ности...”); колиформные бактерии — энтеробактерии, сбраживаю-
щие лактозу [Унифицированные методы..., 1977].
Результаты анализа выражаются или в виде коли-иидексов, т.е.
количества бактерий в 1000 мл воды, или в виде коли-титра, т.е.
наименьшего объема воды, содержащего одну кишечную палочку.
Сравнение существующих методов учета бактерий группы кишечной
палочки показало, что их наибольшее число выявляется при исполь-
зовании среды Эндо.
Фуксин-сульфидный агар Эндо
Мясной экстракт 5 г NaCl 10 г
Пептон 10 г Na2SOj-5H2O 5 г
Лактоза 5 г Агар 20 г
Основной фуксин 0,4 г Вода водопроводная 1000 мл
Реакцию агара перед добавлением сульфита доводят до pH 7,5.
Среду готовят следующим образом. МПА разливают перед стерилиза-
цией в колбы по 100 мл. Накануне анализа приготовляют 10%-й
раствор основного фуксина в 90°-м этиловом спирте (например,
1 г краски и 10 мл спирта). Раствор перед употреблением отфиль-
тровывают. Непосредственно перед приготовлением среды в стериль-
ную пробирку вносят 0,5 мл фильтрованного 10%-го раствора фуксина,
к которому прибавляют из пипетки 10%-й раствор безводной соли
сернистокислого натрия (сульфит натрия) или 20%-й раствор его
кристаллической соли до получения ярко-зеленого окрашивания. Затем
0,5 г лактозы растворяют в 2—3 мл стерильной воды и прогревают
в кипящей водяной бане примерно 5 мин. На 100 мл предвари-
тельно расплавленного МПА (pH 7,4—7,6) добавляют сначала раствор
лактозы, а затем все количество фуксина с сульфитом натрия,
тщательно перемешивают и разливают в чашки Петри. Готовый
фуксин-сульфитный агар по застывании в чашке должен иметь кре-
мовую окраску. Сульфитную среду готовят по мере надобности (на
38
текущий день или на 1—2 дня вперед), так как она не выдер-
живает длительного хранения. Остаток неиспользованной готовой
среды можно сохранить в течение 2 дней в прохладном темном поме-
щении. Следует иметь в виду, что при учете кишечной палочки на
мембранных фильтрах эта среда дает лучшие результаты при умень-
шении содержания агара до 1—1,5% [Разумов, 1947].
Среда Эйкмана [Разумов, 1947]
Глюкоза 10 г NaCl 5 г
Пептон 10 г Вода водопроводная 1000 мл
При нагревании растворяют в воде соль и пептон, доводят до
кипения, отфильтровывают, добавляют глюкозу, устанавливают pH в
пределах 7,3—7,6, разливают й пробирки с поплавками и стерили-
зуют дробно текучим паром.
Для чистой воды озер и водохранилищ наилучшие результаты
получают путем ультрафильтрации испытуемой воды и проращивания
мембранных фильтров на среде Эндо. Методика эта была разра-
ботана А.С. Разумовым и К.К. Барсовым [Разумов, 1947].
1. Подготовка к посеву. Фильтровальный аппарат протирают
тампоном, смоченным спиртом, и обжигают. После охлаждения на
площадку фильтровальной воронки кладут свежепрокипяченный мем-
бранный фильтр N 1 или 2 надписью вверх. На фильтр помещают
верхнюю часть прибора (стакан воронки), закрепляют ее. Размер
пор не должен превышать 0,3 мкм.
2. Посев. Через мембранный фильтр с диаметром фильтрующей
поверхности 3 см нужно пропускать такое количество воды, чтобы
после проращивания на фильтре не было более 50 колоний. Если во-
да сильно загрязнена, что определяется опытным путем, то ее сле-
дует предварительно развести в 10 или 100 раз стерильной водой.
В стакан фильтровальной воронки вносят стерильной пипеткой наме-
ченный объем воды. По окончании фильтрования мембранный фильтр
берут обожженным пинцетом, слегка просушивают на воздухе и
помещают в чашки Петри на поверхность застывшей среды Эндо. Необ-
ходимо следить, чтобы под фильтром не осталось пузырьков воздуха.
Сторона фильтра с меткой должна быть обращена вверх. В рабо-
чей тетради записывают номер фильтра, дату, номер пробы, количе-
ство профильтрованной воды. В одну чашку Петри можно положить
несколько фильтров с диаметром фильтрующей поверхности 3 см.
3. Выращивание. Чашки с посевами ставят в термостат, повер-
нув крышками вниз, и инкубируют 24 ч при 37°.
4. Учет результатов анализа. По окончании выращивания резуль-
таты анализа учитывают по схеме (рис. 12). Крышку снимают с чаш-
ки Петри и, пользуясь лупой с увеличением X10 или биноку-
лярным микроскопом, подсчитывают типичные колонии.
Отсутствие в посевах типичных колоний дает окончательный от-
рицательный ответ. При их наличии из некоторых делают мазок и
окрашивают по Граму. Отсутствие грамотрицательных, неспоронос-
ных клеток указывает на то, что фекальных загрязнений нет.
При наличии колоний грамотрицательных бактерий из них дела-
39
Рис. 12. Анализ воды на фекальные загрязнения
1 — фильтрование воды через мембранный фильтр; 2 — проращивание бактерий
на агаре Эндо; 3 — наличие золотистого вида колоний; 3 — отсутствие золотистого
вида колоний; 4 — положительная окраска по Граму; 5 — газообразование на среде
Эйкмана, результаты опытов: знак (—) — окончательный отрицательный результат,
знак (+) — окончательный положительный результат
ют посев в пробирки с поплавками со средой Эйкмана. Посевы выра-
щивают 24 ч при 43—45°. Если не наблюдается газообразования,
то фекальное загрязнение не имеет места.
Наличие газообразования дает положительный и окончательный
ответ во всех случаях анализа воды на фекальное загрязнение.
Среды для олиготрофных бактерий,
близкие по составу к природной воде
Несмотря на то что видовой состав водных микроорганизмов
изучался уже давно, многие из них были описаны только морфоло-
гически. Попытки их культивирования на стандартных бактериоло-
гических богатых средах были малоуспешны. Резкий сдвиг в изуче-
нии автохтонных микроорганизмов наметился, когда авторы перешли
к культивированию бактерий на обедненных средах, по содержанию
органического вещества близких к естественным водам.
Применение новой техники и специальных условий получения
накопительных культур [Hirsch, Muller, 1986] дало возможность
описать новые морфологические типы бактерий, сильно отличающи-
еся от известных и в физиологическом отношении.
Один из методов исследования олиготрофных бактерий, участ-
вующих в разрушении и минерализации органического вещества в во-
де
доемах, заключается в том, что образец естественной воды без
всяких добавок инкубируется длительное время в лаборатории. При
этом вся зимогенная флора в нем отмирает и начинает развиваться
автохтонная олиготрофная микрофлора, которая в дальнейшем высе-
вается на обедненную питательную среду, содержащую небольшие кон-
центрации органических веществ.
Впервые А.С. Разумов [1962] предложил использовать в качест-
ве питательной среды природную воду с добавкой агара для культи-
вирования бактерий, не вырастающих из проб воды на стандартных
бактериологических средах. Это так называемый голодный агар.
Численность мелких колоний, вырастающих на голодном агаре, сопо-
ставима с количеством их клеток, определяемых методом прямого
подсчета в пробе воды.
Голодный агар [Разумов, 1962]
Вода исследуемого водоема 1000 мл
Выщелоченный агар или агар 15 г
Дифко
Выращивание проводят при 20° в течение месяца. Подсчет вы-
росших мелких колоний проводят с использованием бинокулярной
лупы.
В дальнейшем В.И. Романенко [1973, 1974] предложил метод
использования натуральной воды из водоемов в качестве питатель-
ной среды для изучения видового состава и количественного учета
автохтонной микрофлоры. Содержание органических веществ в при-
родных водах пресных водоемов колеблется в пределах 1—15 мг/л.
Метод количественного учета олиготрофных бактерий на при-
родной воде [Романенко, 1974]. Свежеотобранную пробу воды из
водоема предварительно освобождают от детрита и бактериальных
клеток путем фильтрации через мембранный фильтр с диаметром пор
0,3—0,4 мкм, затем разливают по пробиркам и стерилизуют в автоклаве.
После охлаждения выдерживают 3—4 ч в герметизированном шкафу
или в эксикаторе в атмосфере, насыщенной углекислотой, с целью
доведения pH приблизительно до исходной величины. Насыщение
воздуха углекислотой достигается путем добавления к 5—10 г двуугле-
кислого натрия 20%-й серной кислоты в количестве 10—15 мл.
В стерильную воду производят посев из проб воды с десяти-
кратными разведениями. Культивирование проводят при 20° несколько
суток.
О численности жизнеспособных бактерий в исходной пробе су-
дят по наличию развития в предельном разведении, определяя вы-
росшие бактерии прямым подсчетом клеток.
Другой способ регистрации наличия развития бактерий в разве-
дениях состоит в определении радиоуглеродным методом гетеро-
трофной фиксации углекислоты при краткосрочных экспозициях. В про-
бирки вносят стерильный раствор МаН14СОз из расчета 1 мкКи и
на 10 мл, через сутки воду из пробирок отфильтровывают и на
фильтрах определяют радиоактивность бактерий. Контролем служит
крайнее разведение, где рост бактерий отсутствует.
41
В этих условиях развиваются микроорганизмы, обладающие вы-
сокой скоростью рости при низких концентрациях органических ве-
ществ. Численность жизнеспособных бактерий в исходной воде при-
ближается к величинам, учтенным прямым подсчетом клеток, или
бывает на порядок ниже, особенно при посеве из гомогенизированной
пробы [Никифорова, 1975]*
Применение этого метода позволяет подойти к выяснению видо-
вого состава доминирующих видов в исследуемой воде путем выделе-
ния чистых культур бактерий из предельных разведений.
ХАРАКТЕРИСТИКА И КУЛЬТИВИРОВАНИЕ РАЗЛИЧНЫХ ГРУПП
'АЭРОБНЫХ БАКТЕРИЙ
Цианобактерии
Одним из основных факторов пополнения водоема автохтонным
органическим веществом служит развитие фитопланктона. В олиго-
трофных водоемах фитопланктон по преимуществу состоит из диато-
мовых водорослей, в евтрофных и мезотрофных озерах в весенний
период при низких температурах преобладают диатомовые водоросли,
при достаточно быстром прогревании поверхностных слоев начинает-
ся развитие синезеленых водорослей, или цианобактерий. Это фото-
синтезирующие прокариотные микроорганизмы, содержание хлоро-
филл и усваивающие свободную углекислоту за счет использования
солнечной энергии. К наиболее распространенным родам относятся
Anabena, Aphanizomenon, Microcystis и др.
При выделении чистой культуры цианобактерий возникает ряд за-
труднений, связанных с очисткой от сопутствующих бактерий. Осо-
бенные затруднения возникают, если культура цианобактерий разви-
вается длительно в лабораторных условиях и создается стойкая ас-
социация с бактериальными спутниками. В связи с этим при выделе-
нии чистой культуры цианобактерий полезна предварительная проце-
дура отмывания от сопутствующих микроорганизмов либо на круп-
нопористых мембранных или ядерных фильтрах, либо на сеточках,
используемых для электронной микроскопии. Подробнее метод отмы-
вания нитчатых организмов от бактериального загрязнения описан
в разделе "Сульфатредуцирующие бактерии”. Далее чистую культуру
изолируют на твердых средах стандартным клонированием отдельных
колоний.
Другой прием очистки цианобактерий от спутников основан на
их способности к скользящему движению. Сущность его заключается
в том, что свежеотобранный материал, содержащий цианобактерии,
обладающие скользящим движением, после предварительного отмыва-
ния на фильтре или на сеточках помещается на поверхность под-
сушенной агаризованной среды в чашку Петри. После этого под
бинокулярной лупой через каждые 2 ч ведут наблюдения за нитями
цианобактерий: отползшие нити поддевают тонко оттянутым носиком
пастеровской пипетки, переносят в жидкую среду, разлитую по 1—2 мл
в пробирки, и экспонируют на свету.
Важно иметь в виду, что концентрация агара в среде не долж-
42
на превышать 0,8—1,2%. Твердую среду с указанной концентрацией
агара разливают в чашки и подсушивают либо при комнатной темпе-
ратуре двое суток, либо в сушильном шкафу при 65° 4—6 ч.
В качестве минеральной основы для культивирования и выде-
ления используют среду BG-11, приведенную далее. Эта среда под-
держивает прекрасный или умеренный рост всех испытанных (более
300 штаммов) пресноводных цианобактерий [Stanier et al., 1971]. Среду
М используют для культивирования некоторых цианобактерий, выде-
ленных из мест обитания со щелочной реакцией среды.
Для выделения культур и очистки азотфиксирующих цианобактерий
наилучшие результаты получены при использовании среды BG-11, из
которой удален минеральный азот.
При культивировании цианобактерий следует соблюдать следую-
щие физико-химические условия: 1) для целей изоляции и очистки
культур предпочтительно использовать низкую интенсивность света,
не более 500 лк; 2) температурные условия — около 20°, однако
при выделении культур из низкотемпературных источников лучше
вести культивирование при 10°; 3) условия кислотности среды —
нейтральные или щелочные, насыщение среды углекислотой не требу-
ется; 4) в некоторых случаях, особенно при выделении культур из
экстремальных условий (горячие источники, содовые озера, кислые
ручьи и т.д.), рекомендуется добавлять к среде природную воду.
Стандартная минеральная среда для цианобактерий
[Rippka et al., 1979\
ВО-11, г М, г BG-П, г М, г
NaNOj 1,5 0,75 Na2COj 0,02 0,02
К2НРОгЗН2О 0,04 0,02 Раствор микроэле- 1 мл 1 мл
MgSO4-7H2O 0,075 0,038 ментов (см. ниже)
СаС1г2Н2О 0,036 0,018 Вода деиони- 1000 мл 250 мл
Лимонная кислота 0,006 0,003 зированная
Железо аммонийное 0,006 0,003 pH после 7,4 8,3
лимоннокислое стерилизации
ЭДТА 0,001 0,0005
НВО5 2,86 г Na2MoO4*2H2O 0,390 г
МпС12-4Н2О 1,81 г CuSO4-5H2O 0,079 г
ZnSO4-7H2O 0,222 г CoCNOjb-бНгО 0,0494 г
Вода дистиллиро- 1000 мл
ванная
Почкующиеся и простекатные бактерии
Многочисленная группа водных бактерий отличается от обычных
палочковидных бактериальных клеток наличием одного или двух из
следующих признаков: размножение почкованием, наличие простеки
или стебелька. К этой группе тесно примыкают бактерии, обладаю-
щие радиальной симметрией клетки и одним из указанных выше при-
знаков. Все эти морфологически своеобразные бактерии сильно раз-
личаются по характеру потребностей. Большинство из известных ви-
дов относится к хемоорганогетеротрофам, некоторые — к хемотро-
43
LJ
Таблица 3
Характеристика типов питания некоторых почкующихся
я простекатных бактерий
Хемогетеротрофы Фотогетеротрофы Хемотрофы Фотоавтотрофы
Ancalomicrobium Prostheocomicrobium Hyphomicrobium Blastobacter 1 Rhodomicrobium Rhodopseudomonas palustris Rhodopseudomonas Nitrobacter Blastobacter viscosus Methylosinus Methylomonas Ancalochloris Prosthecochloris
фам или фототрофам, образуя параллельные ряды с морфологическими
аналогами гетеротрофных организмов (табл. 3).
В отличие от фототрофных и метилотрофных почкующихся и про-
стекатных бактерий гетеротрофные представители этой группы харак-
теризуются тем, что способны расти за счет низких концентраций
органических веществ и, за отдельными исключениями, относятся к
олиготрофам. В физиологическом отношении большинство из них
сходны. Каждый организм использует ограниченный набор органичес-
ких соединений, главным образом мономерных, включающих моно- и
дисахара, органические кислоты цикла Кребса, аминокислоты, лету-
чие жирные кислоты. Использование мономерных органических соеди-
нений определяет их развитие на последних этапах минерализации
органического вещества. Указанные свойства позволяют относить эти
организмы к микрофлоре рассеяния [Заварзин, 1970], т.е. к организ-
мам, медленно растущим при низкой концентрации легкодоступных
органических веществ, образуемых при участии бактерий, обладаю-
щих мощными гидролитическими ферментными системами. Наличие
простек, способствуя увеличению удельной поверхности клетки, обеспе-
чивает им преимущество в бедных органическим веществом природ-
ных средах. Напротив, избыток органического вещества в среде
ведет к потере морфологического своеобразия — к уменьшению или
полному исчезновению простек, а также радиальной симметрии у
бактерий, имеющих клетки уплощенной формы.
В филогенетическом отношении гетеротрофные простекатные и поч-
кующиеся бактерии очень неоднородны. На основе анализа после-
довательности нуклеотидных оснований 16S рРНК установлено, что
почкующиеся бактерии Hyphomicrobium, Hyphomonas и простекатные
ProBthecomicrobium, Caulobacter близки к фототрофам Rhodomicrobium
vannielli и Rhodobacter (Rhodopseudomonas) sphaeroides, а также к
гетеротрофным и хемолитотрофным бактериям родов Pedomicrobium,
Stella, Nitrobacter. Представители недавно описанного рода Gemmo-
bacter, близкие по фенотипическим характеристикам к Blastobacter,
в филогенетическом отношении гораздо ближе к пурпурным несер-
ным бактериям Rhodobacter capsulatus и даже к бесцветным Paracoccus
denitrificans. Филогенетически изолированную группу, ближе стоящую к
актиномицетноЙ линии, составляют представители родов Pirellula и
44
Planctomyces. Они существенно отличаются по хемотаксономическим
свойствам от других почкующихся бактерий — Blastobacter, Gemmo-
bacter, Gemmata, Isosphaera, Seiiberia. Предполагается, что они состав-
ляют наиболее древнюю ветвь эубактериЙ. Оказалось, в составе
клеточной стенки у них полностью отсутствует пептидогликан, вместо
него присутствует оболочка (слой) белкового состава, устойчивая
к 10% додецилсульфату и к антибиотикам [Stackebrandt et al., 1984;
Kfienig et al., 1984]. По олигонуклеотидному составу 16S pPHK эти
бактерии обнаруживают чрезвычайно низкое сходство как с архе-
бактериями, так и с эубактериями. Необычными свойствами характери-
зуется и липидный состав клеток. Так, полярные липиды сближают
их с эубактериями, а жирные кислоты фосфолипидов имеют состав,
типичный для простейших эукариот. В то же время липиды в сос-
таве липополисахаридов имеют уникальное строение. Относительно
низкое филогенетическое родство существует и между родами Pirellu-
1а и Planctomyces: Sab = 0,3. Тем нем менее, учитывая уникальные
свойства представителей этих двух родов, предлагается выделить
их в семейство Planctomycetaceae в пределах нового порядка Planc-
tomycetales [Schlesner, Stackebrandt, 1986].
Сравнительная морфологическая характеристика хемогетеротроф-
ных почкующихся и простекатных бактерий приведена в табл. 4 и на
рис. 13.
Помимо перечисленных в табл. 4 и на рис. 13, известны строго
анаэробные почкующиеся грамотрицательные или грамвариабельные
бактерии, выделенные из фекалий, — Gemmobacter [Gossling, Moore,
1975]. Они сбраживают углеводы и образуют муравьиную и масляную
кислоты. Их таксономичное положение не выяснено. Описан также
новый род с единственным видом Chamaesiphonsira cymbellicola
(Geitler, 1975] — эпифит некоторых диатомовых водорослей. Это
конические бесцветные нити, прикрепленные к водоросли более
широким основанием. От суженного свободного конца может оттор-
гаться до 30 почек. Морфологически этот организм сходен с циано-
бактериями рода Chamaesyphon. В культуре не выделен.
Ниже приводится ключ для определения до рода гетеротрофных
простекатных и почкующихся бактерий.
Группа I. Простеки отсутствуют. Почки образуются на материнской
клетке. Склонны к формированию агрегатов в виде розеток. Имеют
прикрепительные диски на одном из полюсов клетки
А. Клетки от палочковидных до булавовидных, нередко слегка
изогнутые
а) почки округлой формы ............................ Blastobacter
б) почки мелкие, палочковидные, дорастающие до размеров мате-
ринской Gemmobacter
Б. Клетки палочковидные, спиральноперекрученные........ Seiiberia
В. Клетки сферические, каплевидные или грушевидные
а) имеют стебельки неклеточного строения, которые прикрепляются
к общему прикрепительному диску, формируя po3eTKy.,Planctomyces
б) клетки не имеют стебелька, розетка формируется путем прикрепления
клеток к общему прикрепительному диску.....................Pirellula
45
Таблица 4
Морфологическая характеристика хемогетеротрофных почкующихся
простекатных бактерий
Род Форма вегетативной клетки Способ раз- множения Наличие простеки
Hyphomicrobium Палочковидная, овальная, вибриовд- ная с заостренным концом Почкование +
Pedomicrobium Сферическая, овальная, палочковид- ная +*, **
Hyphomonas Яйцевидная, грушевидная, овальная ** +•
Blastobacter Палочковидная - -
Seliberia Planctomyces Pirellula Палочка спирально перекручена Сферическая, каплевидная, грушевид- ная Каплевидная, грушевидная Деление и - почкование
Stella Звездообразная, шестилучевая +
Angulomicrobium Тетраэдр +
Ancalomicrobium Неправильная с длинными выростами и +
Prosthecomicro- Неправильная с короткими вырос- Бинарное де- +
bhim тами ление
Caulobacter Палочковидная, веретеновидная, вибриоидная То же +
Asticcacaulis Палочковидная » +
Prosthecobacter Палочковидная, изогнутая или прямая +
Isosphaera Сферическая, образуют длинные це- почки из кокковндных клеток Почкование +
Gemmata Сферическая
Labrys Плоский треугольник +
Примечание. + означает наличие признака, - его отсутствие.
* Характерно наличие боковой гифы и ветвление.
’* Продольная ось почки перпендикулярна гифе.
в) сферические клетки формируют длинные цепочки.....Isosphaera
г) сферические крупные клетки не имеют прикрепительного диска,
но выделяют слизистый материал, с помощью которого прикреп-
ляются к субстрату. Розетки не образуют............. Gemmata
Группа II. Простеки выполняют репродуктивную функцию. Почки
образуются на концах простек
А. Простеки образуются с разных сторон клетки, из одной клетки
более одной простеки........................... Pedomicrobium
Б. Простеки образуются только на полюсах клетки
I .He могут расти на Ci-соединениях............. Hyphomonas
2 . Используют Ci-соединения для роста....... Hyphomicrobium
Группа III. Простеки не выполняют репродуктивную функцию. Каждая
клетка имеет две или более простеки.
А. Простеки расположены в разных плоскостях и имеют разную длину
1. Многочисленные конусообразные и относительно короткие
46
Непростекатные выросты Подвиж- ность Образование агрегатов Литературный источник
Не имеют + Розетка Hirsch, 1968
То же + Колониальный (дендроидный) рост Аристовская, 1961; Gebers, Beese, 1988 Pongratz, 1957; Moore et al., 1984
Прикрепительный + То же
ДИСК - Розетка Заварзин, 1961a; Hirsch, Mul- ler, 1985 Rothe et al., 1987
То же + Аристовская, Паринкина, 1963
Прикрепительный диск и стебельки + Gimesi, 1924; Hirsch, Miillcr, 1985a; Bauld, Staley, 1978
Прикрепительный диск + Staley, 1973; Schlesner, Hirsch, 1984
То же — Не образует Васильева, 1972
— То же Васильева и др., 1979
— Staley, 1968
- То же
Прикрепительный ДИСК + Розетка Henrici, Johnson, 1935
•» + Poindexter, 1964, 1972
и — Staley, 1973
Пили Скольжение Не образует Giovannioni et al., 1987 Franzmann, Skerman, 1984
Васильева, 1980
простеки (2 мкм длиной). Размножение поперечным делени-
ем .......................................Prosthecomicrobium
2. Немного длинных (2 мкм) трубчатых простек, размножение почко-
ванием, клетки неподвижны ...................... Ancalomicrobium
Б. Почки не образуют. При делении образуются неэквивалентные
клетки. Одна полярная или две простеки на противоположных
полюсах
1. Дочерняя клетка отделяется после дорастания простеки до размеров
материнской клетки, неподвижны................... Prosthecobacter
2. Деление асимметричное, бинарное. Швермеры образуются
а) одна полярная или субполярная простека. Места прикрепления
и образования простеки совпадают.................... Caulobacter
б) одна или две субполярные простеки. Место прикрепления на
полюсе не совпадает с расположением простек(и)......Asticcacaulis
Группа IV. Клетки плоские, с радиальной симметрией
47
Рис. 13. Представители почкующихся и простекатных бактерий
I — Hyphomicrobium; 2 — Pedomicrobium; 3 — Gemmobacter; 4 — Blastobacter;
5.6 — Planctomyces; 7— Pirellula; 8 — Labrys; 9 — Seiiberia stellata; 10— Ancalomicrobium;
11— Prosthecomicrobium; 12— Caulobacter; 13— Asticcacaulis biprosthecum; 14— Stella;
15— Thiodendron; 16— Hyphomonas; 17— Angulomicrobium
А. Размножение почкованием
а) клетки имеют форму треугольника, с 2—3 простеками на 2 вер-
шинах.................................................... Labrys
б) клетки полигональные, в виде тетраэдра, или ’’грибовид-
ные** ........................................ Angulomicrobium
Б. Размножение бинарным делением
а) клетки звездообразные................................. Stella
Основными таксономическими признаками, характеризующими
группу гетеротрофных простекатных и почкующихся бактерий, яв-
ляются: форма клетки, способ размножения (почкование или деление),
наличие и количество простек, наличие подвижности. Основываясь
на этих признаках, можно условно разделить известных предста-
вителей на несколько групп, объединяющих организмы, близкие по
фенотипическим свойствам, но иногда далеко отстоящие в фило-
генетическом отношении. Ниже приводим из перечень, а также
краткую характеристику тех организмов, которые выделены срав-
нительно недавно и не вошли в известные определители бактерий.
Почкующиеся бактерии, не имеющие простек (группа 1)
К этой группе относятся роды Blastobacter, Pirellula, Gemmobacter,
Planctomyces, Gemata, Isosphaera. Сюда же можно отнести Seiiberia,
хотя эти бактерии наряду с почкованием способны размножаться
путем бинарного деления. Для всех этих организмов характерна
способность к образованию агрегатов в виде розеток.
Blastobacter. В этот род включены аэробные и факульта-
тивно анаэробные бактерии с палочковидной или слегка изогнутой
формой клетки. На одном из полюсов клетки при размножении
48
образуется почка округлой формы, а на противоположном — прикре-
пительный диск. Клетки неподвижные, грамотрицательные [Заварзин,
1961а]. Известно несколько видов: В. aggregatus, В. denitrificans, В. сар-
sulatus [Hirsch, MUller, 1985b; Rothe et al., 1987]. Один из видов —
В. viscosus — факультативно автотрофная метанолиспользующая
бактерия [Логинова, Троценко, 1979].
Gemmobacter. Представители этого рода очень близки к предыдущему
по фенотипическим признакам, но существенно отличаются в генети-
ческом отношении, примыкая ближе к группе Rhodobacter capsulatus
и Paracoccus denitrificans. Клетки палочковидные, с закругленными
концами, иногда овальные, грамотрицательные, неподвижные. От видов
Blastobacter единственный пока вид G. aquatilis отличается тем, что
почки имеют не округлую, а палочковидную форму, иногда они рас-
полагаются латерально. Подобно Р. denitrificans, G. aquatilis способен
к денитрификации, являясь факультативным анаэробом [Rothe et al.,
1987].
‘Pirellula. Под этим названием описаны недавно бактерии, перво-
начально выделенные в чистую культуру Стейли как "Pasteuria га-
mosa” [Staley, 1973]. Последние были впервые описаны И.И. Мечни-
ковым в 1888 г. как паразиты кладоцер, образующие экзоспоры и
существенно отличные от упомянутого выше изолята [Schmidt, Starr,
1978].
У представителей рода Pirellula клетки овальной или грушевидной
формы, размером 0,5Х(1—5)мкм, имеющие прикрепительный диск
на суженном полюсе. С помощью этого диска клетка прикрепляется
к субстрату или к другим клеткам, образуя агрегаты в виде розеток.
На другом, расширенном конце формируется почка, имеющая полярный
или субполярный жгутик. В отличие от всех других почкующихся и
простекатных бактерий клетки окрашиваются по Граму положительно.
G+C в ДНК — 57 мол.%. Известен один вид — Р. staleyi [Schlesner,
Hirsch, 1984].
Planctomyces. Представители этого рода характеризуются, помимо
способности к почкованию, наличием стебельков непростекатной
природы. Функция этих стебельков пока неизвестна. Как и Pirellula,
клетки Planctomyces способны формировать "розетки” путем прикреп-
ления к общему слизистому диску с помощью стебельков, экскрети-
руемых клетками. Клетки имеют форму от сферической до груше-
видной. Размножение происходит путем терминального или лате-
рального почкования зрелых, а иногда более мелких незрелых
клеток, в результате чего образуются цепочки клеток (см. рис. 13).
У некоторых видов стебелек инкрустирован окислами железа и мар-
ганца. Известно несколько видов, различающихся по размерам клеток,
длине стебелька, расположению почек: Р. bekefii, Р. condensatus,
Р. klasmiensis, Р. gracilis и недавно выделенный в чистую культуру
Р. limnophilus [Hirsch, MUller, 1985а], морской штамм — Р. maris
[Bauld, Staley, 1978].
Isosphaera. Описан один вид — I. pallida [Giovannoni et al., 1987].
Необычные нитчатые скользящие почкующиеся бактерии, изолиро-
ванные из термальных горячих источников. Нити состоят из сфери-
4. Зак. 1766
49
ческих клеток размером 2,5—3,0 мкм. Размножение происходит путем
образования интеркулярных почек. Это облигатно аэробные гетерот-
рофные бактерии. Клетки содержат газовые везикулы. Нити обладают
скользящим движением и фототаксисом. Окрашены в бежевый цвет
вследствие высокого содержания каротиноидов. Температурный опти-
мум для роста 55°. Растут при содержании глюкозы или лактата
как источника углерода в среде не выше 0,025%. Ранее этот организм
под названием "Isocystis pallida” был описан как цианобактерии,
позже — как дрожжи. Помимо своеобразия морфологии, эти бактерии
обладают необычными фенотипическими и генетическими свойствами.
Это единственный почкующийся микроорганизм, способный к сколь-
зящему движению и к фототаксису. В клеточной стенке отсутствует
пептидогликан, G+C в ДНК равен 62,2 мол.%. В филогенетическом
отношении по последовательности олигонуклеотидов 5S рРНК и
I6S рРНК I. pallida близок к членам родов Planctomyces и Pirellula
и вместе с ними, вероятно, будет помещен в новое семейство Plancto-
mycetaceae порядка Planctomycetales [Schlesner, Stackebrandt, 1986].
Gemmata. Сферические или грушевидные клеткиразмером 1,4—3 мкм
в диаметре. Размножение происходит почкованием. Швермер подвижен
с помощью перитрихиальных жгутиков. Структура клеточной стенки
типична для грамотрицательных бактерий. Прикрепительный диск не
образуется, но клетки способны прикрепляться к твердой поверхности
с помощью слизистого материала, экскретируемого клеткой.
Бактерии растут на обедненных средах — агаре, приготовленном
на озерной воде, на почвенном агаре или на среде Стейли [Staley, 1973].
Колонии на твердой среде розового цвета. Используют для роста
углеводы: глюкозу, маннозу, галактозу, ксилозу, рибозу, рамнозу,
крахмал. Судя по питательным потребностям, принадлежат к микро-
флоре обрастаний подводной растительности и развиваются за счет
углеводов, экскретируемых в виде слизей на поверхности растений.
Строгие аэробы, оксидазоотрицательны, каталазоположительны.
G+C в ДНК составляет 64,4 мол.%. Описан один вид (и один штамм) —
G. obscuriglobus [Franzmann, Skerman, 1984].
Род Seliberia. Палочковидные спирально закрученные клетки
размером 0,5—0,7 X 1—12 мкм образуют агрегаты в виде розеток
с помощью прикрепительного диска. Размножаются неравномерным
бинарным делением и, вероятно, почкованием. В последнем случае
ширина почек превышает диаметр материнской клетки. Почки могут
обособляться в подвижные клетки — швермеры.
В физиологическом отношении отдельные виды резко различаются
физиологически. Типовой вид рода — S. stellata характеризуется
выраженной олиготрофией и способностью, наряду с окислительным
респираторным метаболизмом, к сбраживанию некоторых органи-
ческих веществ. Этот вид хорошо растет на разбавленном (1:5) карто-
фельном агаре. Два другие вида — строгие аэробы, факульта-
тивные автотрофы. A. hydrogenophila способен расти за счет окисления
молекулярного водорода, a S. carboxydohydrogena, ранее относимая
к роду Pseudomonas, также и за счет окисления окиси углерода.
Несмотря на значительные физиологические и морфологические
50
отличия — слабо выраженную спиральную форму клеток, два последних
вида имеют достаточно высокий уровень гомологии ДНК с S. stellata,
что позволило включить их в состав рода Seliberia [Крюков и др., 1989].
Почкующиеся простекатные бактерии (группа II)
В эту группу объединены микроорганизмы, размножающиеся почко-
ванием и имеющие простеки. Последние выполняют различные функ-
ции у разных представителей.
У Hyphomicrobium, Hyphomonas, Pedomicrobium почка образуется
на конце простеки, или гифы, и дорастает до размеров материнской
клетки. В этом случае простека, или гифа, выполняет репродук-
тивную функцию. Зрелая почка подвижна — имеет полярно или пе-
ритрихиально расположенные жгутики и называется швермером. В даль-
нейшем почка-швермер теряет жгутик, образует простеку и цикл
повторяется. Иногда клетки объединены в розетки слизистым ма-
териалом, выделяемым на полюсе клетки, противоположном гифе.
Клетки имеют палочковидную, каплевидную или бобовидную форму.
Гифы, или простеки, образуются по оси клетки с одного или двух
полюсов. Иногда почки не отрываются от гифы, формируют новые
почки, и тогда образуются дерновинки, или разветвленные кустики.
Особенно наглядно это проявляется у Pedomicrobium, у которого от
клетки отходит несколько гиф. Морфология гифомикробов чрезвы-
чайно вариабельна и сильно зависит от условий культивирования.
В физиологическом отношении гифомикробы различны, многие об-
ладают специализированным обменом.
Подгруппа гифомикробов включает представителей родов Hypho-
microbium, Pedomicrobium, Hyphomonas. Все эти организмы очень
широко распространены в водоемах.
Hyphomicrobium — факультативно метилотрофные бактерии, ис-
пользующие метанол, метиламин и другие Ci-соединения, не содер-
жащие С—С-связи (диметилсульфид, дихлорметан). Многие штаммы,
способные к денитрификации на этих соединениях, восстанавли-
вают нитраты и нитриты как акцепторы электронов. Помимо Ci-
соединений, используют ограниченное число других органических
соединений, главным образом органических кислот [Заварзин, 1961;
Harder, Atwood, 1978].
Один из штаммов, Hyphomicrobium sp. 53-49, способен к ав-
тотрофному росту в атмосфере Нз+Ог+СОг [Uebayasi, Tonomura,
1976]. У некоторых штаммов увеличение биомассы происходит при
росте на среде с метанолом с одновременным окислением тио-
сульфата, что предполагает наличие хемолитометилотрофии [Ve-
denina, 1987].
Таксономия представителей рода Hyphomicrobium разработана
слабо. Описан один вид — Н. vulgare, хотя имеется ряд пресноводных
штаммов, заметно отличающихся от типового, которые не получили
пока видового названия.
Hyphomonas. Морфологически эти бактерии близки Hyphomicrobium,
также имеют сложный цикл развития, но характеризуются чрез-
51
вычайно сильно выраженным полиморфизмом и плеоморфизмом.
Иногда наблюдается почкование без образования гиф. Как правило,
обладают одной полярной гифой. В отличие от представителей рода
Hyphomicrobium размеры и форма вегетативной клетки в культуре
подвержены значительной изменчивости в процессе нормального
жизненного цикла [Moore, 1981, Moore et al., 1984]. Дочерние клетки
имеют субполярно расположенный жгутик. Обладают органотрофным
типом обмена, но не относятся к олиготрофам. Из физиологических
особенностей характерна потребность в наличии в среде NaCl не ме-
нее 0,5%. Для роста предпочтительно используют аминокислоты.
Типовой вид — Н. polymorpha выделен из носовой полости человека.
Другие виды — Н. jannaschiana, Н. hirschiana, Н. oligotropha. Н. nep-
tunium широко распространены в пресных, морских водоемах, а также
в почве. Последний вид, ранее описанный как Hyphomicrobium nep-
tunium, в настоящее время отнесен к роду Hyphomonas.
Pedomicrobium — почкующиеся бактерии, окисляющие железо и
марганец, впервые описаны Т.В. Аристовской [1961] как почвенные
организмы, но впоследствии обнаружены в водоемах разного типа
[Tyler, Massall, 1967; Hirsch, 1964; Hirsch, Conty, 1964; Gebers, Beese, 1988].
Клетки сферические, овальные, тетраэдральные, грушевидные или па-
лочковидные. Из одной клетки вырастает до пяти и более
простек(гиф) диаметром 0,15—0,3 мкм. Характерно латеральное от-
хождение одной из гиф от клетки, другие гифы могут отходить
субполярно или полярно. Размножение происходит почкованием,
причем почка располагается продольной осью перпендикулярно к гифе.
Из материнской клетки может вырастать до трех почек одновременно.
Швермеры подвижны, имеют один жгутик. Гифы склонны к ветвлению
с образованием дендровидных структур. Клетки могут выделять
внеклеточные полимеры, в которых накапливаются окислы железа
или марганца.
По типу обмена — гетеротрофы, аэробы, микроаэрофилы. Исполь-
зуют ацетат, малат, сукцинат, глюконат (некоторые виды — фумарат)
в присутствии органических соединений азота — пептона, казамино-
кислот, дрожжевого экстракта в концентрации не более 0,05%. Могут
расти на дрожжевом экстракте или пептоне. Рост стимулируется
витаминами Biz. G+C в ДНК составляет 63—66 мол.% у разных видов.
Известно несколько видов, различающихся морфологически, главным
образом размером клеток и гиф, а также на основании гомологии ДНК:
Р. ferrugineum, Р. manganicum, Р. americanum, Р. australicum.
Фотосинтезирующим аналогом Hyphomicrobium является фото-
трофная несерная пурпурная бактерия Rhodomicrobium vannielii.
В отличие от перечисленных выше простекобактерий, имеющих
одну или несколько простек, участвующих в репродукции почки, у
представителей другой подгруппы почкующихся простекатных бак-
терий простеки не участвуют в размножении. К таким организмам
относятся Ancalomicrobium [Staley, 1968] и его фотосинтезирующий
аналог — Ancalochloris perfilievii [Горленко, Лебедева, 1971].
Ancalomicrobium. Клетки этого организма неправильной формы
и имеют 2—8 длинных простек, суживающихся к концу. Простеки
52
иногда ветвятся. Почка образуется на участке клетки, не имеющем
простеки. По достижении почкой размера материнской клетки и после
образования простек она отделяется. Клетки неподвижные, не имеют
прикрепительных дисков. Часто в клетках присутствуют газовые
вакуоли. Факультативные анаэробы. Способны в отсутствие кислорода
сбраживать глюкозу по типу гетероферментативного брожения (см.
раздел ’’Ацетогенные бактерии”). Типичные планктонные организмы.
Известен один вид — A. adetum [Staley, 1968].
Простекобактерии с бинарным делением (группа III)
В эту группу входят представители родов Caulobacter, Asticcacaulis,
Prosthecobacter, обладающие одной-двумя простеками, и Prostheco-
microbium с многочисленными простеками — выростами.
Caulobacter. Клетки палочковидные, изогнутые, вибриоидные, имею-
щие одну полярную простеку [Poindexter, 1964]. Длина простеки
может изменяться, увеличиваясь до десятков микрон в олиготрофных
средах. Клетки имеют диморфный жизненный цикл, который включает
последовательное чередование неподвижных клеток с простекой,
или стебельком, и подвижных, обладающих полярным жгутиком
(швермеры). Размножение происходит путем асимметричного деления
перетяжкой только стебельковой клетки. Делящаяся клетка имеет
простеку на одном полюсе и жгутик на другом. После отделения
от материнской, стебельковой клетки швермер теряет жгутик и об-
разует простеку на месте его прикрепления [Красильников, Беляев,
1970; и др.]. На дистальном конце стебелька имеется прикрепи-
тельный диск, с помощью которого происходит прикрепление к по-
верхности, а также формирование розеток.
По типу обмена многочисленные виды Caulobacter органогете-
ротрофны, большинство из них олиготрофны, используют предпоч-
тительно мономерные органические соединения. Выделены из пресных,
морских вод и почв. Все штаммы растут на средах с пептоном и
дрожжевым экстрактом. Типовой вид С. vibrioides.
Asticcacaulis. В отличие от Caulobacter стебельки этих микро-
организмов не служат для прикрепления, и нередко их называют
псевдостебельками. Прикрепительный диск располагается субполярно
или на полюсе клетки [Poindexter, 1972]. Функция простек состоит
только в увеличении удельной поверхности, и так же как у Caulobacter,
они исчезают при росте клеток на обогащенных средах [Larson, Pate,
1975]. Размножение происходит путем резко выраженного асим-
метричного деления (рис. 14). Одна из клеток длиннее и несет один
или два стебелька, вторая имеет жгутик. Швермер со временем теряет
жгутик и переходит в неподвижную вегетативную форму, причем
стебелек вырастает на месте жгутика. У A. excentricus простека
и жгутик образуются субполярно, а прикрепительный диск — полярно.
У другого вида — A. biprosthecum на месте жгутика образуется
прикрепительный диск, а простека формируется позже перпенди-
кулярно к длинной оси клетки.
Prosthecobacter. У этих неподвижных стебельковых бактерий ди-
53
a
Рис. 14. Развитие Caulobacter (а) и Asticcacaulis (б)
морфный цикл отсутствует, хотя деление клеток происходит асим-
метрично. Материнская клетка делится перетяжкой, одна из клеток
имеет простеку, а у другой она формируется одновременно с пере-
городкой клеточной стенки. Разделение клеток происходит только
после того, как дочерняя клетка по форме и размеру становится
неотличимой от материнской. Единственный вид — Р. fusiformis
с клетками веретеновидной формы. Иногда формируют небольшие
агрегаты — розетки [Staley et al., 1976].
Prosthecomicrobium. Клетки этих бактерий имеют много простек
небольшой длины, расходящихся из клетки во всех направлениях.
Простеки конической формы, обычно не более, а чаще менее 2 мкм.
Деление клеток поперечное [Staley, 1968]. В настоящее время известны
три вида — Р. pneumaticum, Р. enhydrum и Р. polyspheroidum. У послед-
него вида простеки не более 0,1 мкм длиной, а клетки имеют вид
початка кукурузы [Васильева, Лафицкая, 1976]. Клетки у разных видов
либо подвижны, либо неподвижны. Все выделенные простекобактерии
этого рода являются хемоорганотрофами, способны использовать
различные органические вещества, но предпочтительно моно- и
дисахара. Как правило, полисахариды, а также спирты и органи-
ческие кислоты они не используют. Многие штаммы нуждаются в вита-
минах.
Морфологическим аналогом этого рода являются фототрофные
зеленые серные бактерии рода Prosthecochiorus [Горленко, 1968;
Пучкова, Горленко, 1976] с видами Р. aestuarii и Р. phaeoasteroidea.
Следующие три рода простекатных и почкующихся бактерий
включают бактерии с радиальной симметрией клеток уплощенной
формы (группа IV). Это делящиеся простекобактерии, представ-
ленные родом Stella, почкующиеся простекобактерии, включающие
род Labrys, и почкующиеся бактерии рода Angulomicrobium. При-
водим их краткое описание.
Stella — впервые описанный прокариотный микроорганизм с ра-
диальной симметрией клетки. По форме плоские клетки напоминают
54
шестилучевую морскую звезду с простеками в виде лучей. При делении
перегородки закладываются между лучами, разделившиеся клетки
восстанавливают число лучей до шести. Клетки неподвижные,
одиночные, размером от 0,7 до 2,0 мкм. Подобная морфология
клеток сохраняется лишь на обедненных средах, но характерная
форма утрачивается при высоких концентрациях питательных веществ,
клетки становятся округлыми. Использует в основном органические
кислоты цикла Кребса [Васильева, 1972].
Labrys. Эти почкующиеся простекобактерии имеют неподвижные
клетки в форме плоского треугольника, на каждой из двух вершин
образуется от двух до трех остроконечных простек длиной до 0,6 мкм.
Почка образуется на вершине треугольника, свободного от простек,
при этом происходит его удлинение, образуются клетки, напо-
минающие гриб. Ранее они были описаны Стейли как "грибовидные”
бактерии. Эти бактерии используют широкий круг органических ве-
ществ, включая углеводы, органические кислоты, пептон, при их низких
концентрациях в среде [Васильева, 1980].
Как видно из приведенных выше описаний, представители почкую-
щихся и простекатных бактерий, обладая своеобразной морфологией
клеток, могут быть идентифицированы в образцах природного ма-
териала в фазово-контрастном или электронном микроскопе. Однако
в определенных микронишах в водоемах численность отдельных
видов может составлять несколько процентов от всей микрофлоры,
как правило, они не могут доминировать в бактериальном биоцено-
зе. Поэтому для обнаружения и выделения этих организмов в чистые
культуры используют ряд приемов, способствующих увеличению их
численности в пробах исследуемой воды или в культурах накопления.
Основные методы изучения почкующихся
и простекатных бактерий
Микроскопические исследования. Известно несколько приемов,
способствующих обнаружению этих бактерий в образцах природного
материала [Hirsch, 1964, 1974; Hirsch, Muller, 1986]. Сравнение при-
меняемых для этих целей методов показало, что наиболее удачным
методом является техника наблюдений, впервые использованная
Генричи и Джонсоном, — метод стекол обрастания с различными
модификациями. С помощью этого метода удается наблюдать боль-
шинство почкующихся и простекатных бактерий, обладающих спо-
собностью прикрепляться к твердому субстрату. Сущность его состоит
в том, что предметные стекла, тщательно вымытые, погружают
в водоем на необходимый горизонт и экспонируют 3—4 сут или более —
в зависимости от типа водоема и сезона года. После экспонирования
в водоеме стекла быстро подсушивают и фиксируют. Перед просмотром
в фазово-контрастном микроскопе их увлажняют стерильной пробой
воды. Перед погружением стекла могут быть покрыты тонким слоем
агаровой питательной среды.
Другой прием наблюдений — так называемый метод чашек Петри.
С его помощью удается обнаружить почкующиеся бактерии, даже если
55
они весьма малочисленны в исходной пробе. С этой целью в чашку
Петри диаметром 20 см помещают слой 2%-го водного агара, затем
вертикально в слой агара погружают в ряд стерильные покровные
стекла и наливают в чашку доверху пробу воды. После нескольких
дней часть стекол вынимают из чашки и микроскопируют. При обна-
ружении интересных форм, выросших на стеклах в виде микроколоний,
обычно на границе агар—вода, оставшиеся в чашке стекла осторожно
вынимают и помещают на слой агаровой среды или размазывают
обрастания по поверхности агаровой среды.
Еще один прием наблюдений — ауксанография. В этом случае
покровные стекла, экспонированные в чашках Петри с водой, как
указано выше, осторожно вынимают из агара и кладут на поверхность
стерильного агара или минеральной среды в другую чашку. Неболь-
шие кристаллики или капельки растворов различных источников
органического углерода наносятся на поверхность агара вблизи края
стекла. После недельной инкубации при 20° стекла вынимают и
просматривают в фазово-контрастном микроскопе, отмечая микроко-
лонии почкующихся или простекатных бактерий, выросших вблизи
внесенных источников углерода.
Необходимо отметить, что в наибольшей степени росту Planctomyces
и Pirellula способствует внесение в среду ацетамида и 2)-рибозы.
Как правило, с помощью указанных выше приемов удается успешно
получить рост отдельных колоний почкующихся и простекатных бак-
терий, обладающих способностью прикрепляться к твердому суб-
страту, — представителей родов Blastobacter, Gemmobacter, Plancto-
myces, Pirellula, Hyphomicrobium, Pedomicrobium, Caulobacter.
Получение накопительных культур. Наиболее успешными являются
следующие два приема.
1. Использование обедненных природных сред. Пробы воды раз-
ливают по 100 мл в колбы и инкубируют длительное время без
внесения каких-либо органических добавок. Как правило, можно
наблюдать интересную сукцессию доминирующих бактериальных
форм. Преобладающие вначале палочковидные или виброидные клетки
через 4—8 нед сменяются почкующимися формами Planctomyces,
Blastobacter и другими — в зависимости от состава взятой пробы
воды. После нескольких месяцев в пробе преобладающей формой
становится Hyphomicrobium.
2. К 100 мл природной воды добавляют пептон из расчета 50—
100 мг/л и инкубируют при 20°. Обычно в этих случаях после 2—3 нед
отмечается массовое развитие Planctomyces, Caulobacter, Stella, An-
calomicrobium, Prosthecomicrobium и др. После обогащения пробы
интересующими организмами обычно приступают к выделению бак-
терий на питательных средах.
Получение культур накопления на средах с гуматами. Культуру
накопления Stella humosa получают следующим образом. 100 г ни-
зинного торфа обрабатывают 1 N раствором КО, пока промывная
вода не перестанет давать осадок с щавелевокислым аммонием, т.е.
до отмывания кальция из поглощающего комплекса торфа. Затем торф
обрабатывают 0,1 N раствором NaOH. При этом происходит гидролиз
56
гумуса и гуматы переходят в раствор. Раствор смывается с осадка
и подкисляется до pH 2. При этом гуматы переходят в осадок. Их
отфильтровывают и растворяют в воде, нейтрализуя ее до pH 7,0,
и доводят объем до 1 л. Для получения отдельных колоний к раство-
ру добавляют 0,8% агара Дифко. Раствор или агаризованную среду
заражают почвой, осадком или водой из водоема.
Вместе со Stella на среде с гуматами растут и другие медленно-
растущие бактерии: Prosthecomicrobium polyspheroideum, Seliberia,
Pedomicrobium.
Рост накопительной культуры Stella можно получить и другим
путем. В испытуемую воду добавляют 0,05% гидролизата казеина или
0,005% дрожжевого экстракта и инкубируют при комнатной темпе-
ратуре. Через несколько недель или месяцев в осадке могут раз-
виться звездообразные клетки. Если в воду добавить смесь витаминов,
то Stella развивается значительно лучше.
Выделение чистых культур. Для выделения большинства известных
видов почкующихся и простекатных бактерий наиболее подходящими
оказались среды, предложенные Стейли [Staley, 1973]. Это пептонно-
дрожжевая глюкозная среда с витаминами (PYGV-среда) и та же среда
без витаминов (PYG-среда).
Среда Стейли для выделения почкующихся бактерий, PYGV-агар
Минеральный раствор Хатнера
(см. ниже)
Пептон Дифко
Дрожжевой экстракт Дифко
20 мл Агар Дифко 15 г
Вода дистиллиро- 965 мл
0,25 г ванная
0,25 г
Среду стерилизуют 20 мин при 121°, охлаждают до 60°, вносят
10 мл 2,5%-го раствора глюкозы, стерилизованного фильтрованием,
5 мл раствора витаминов N 9 двойной концентрации (см. прил.),
pH доводят до 7,5, добавляя на 1 л среды примерно 10 капель 6 N раст-
вора КОН.
Минеральный раствор Хатнера
Нитрилтриу ксусная 10 г FeSO. • 7 Н2О 0,099 г
кислота MgSO< 14,45 г Основной солевой 50 мл
CaCh • 2 Н2О (NH4)tMo,O2. - 4 Н2О 3,335 г 0,00925 г раствор (см. ниже) Вода дистиллированная 950 мл
Основной солевой раствор Хатнера
ЭДТА
ZnSO* 7 НгО
FeSCh • 7 Н2О
MnSO. Н2О
CuSO4 5 H2O
2,5 г
10,95 г
5,0 г
1,54 г
0,392 г
Co(NO3)2 • 6 Н2О 0,248 г
Na2B4O, • 10 Н2О 0,177 г
Вода дистил- 1000 мл
лированная
К основному солевому раствору добавляют несколько капель H2SO4
для предотвращения осаждения металлов. При приготовлении мине-
57
рального раствора нитрилтриуксусную кислоту растворяют в воде
и нейтрализуют, добавляя около 7,3 г КОН. Вносят остальные ком-
поненты и доводят pH до 6,8.
Среда Стейли для выделения и культивирования
Prosthecomicrobium, Ancalomicrobium, Prosthecobacter [Staley, 1968]
Пептон 0,1 г
Основной солевой 20 мл
раствор Хатнера
(см. выше)
Раствор 10 мл
витаминов N 9
Агар Дифко 15 г
Вода дистилли- До 1000 мл
рованная
Просмотр колоний на этой среде проводят через 2 нед под бино-
кулярным микроскопом.
Для культивирования Prosthecomicrobium и Ancalomicrobium и под-
держания культур можно использовать обогащенную агаризированную
среду ММВ [Staley, 1968].
Среда Пойндекстер для Caulobacter [Poindexter, 1964]
Пептон 2 г
Дрожжевой 1 г
экстракт
MgSO4 • 7 Н2О 0,2 г
Агар Дифко 10 г
Вода дистил* 1000 мл
лированная
Среда Беляева для Caulobacter [Красильников, Беляев, 1967]
Пептон 2 г
Дрожжевой 1 мл
экстракт
MgSO4 • 7 Н2О 0.2 мг
Агар
Вода водопро-
водная
15 г
1000 мл
Хороший рост некоторых видов Caulobacter можно получить
путем высева обогащенной культуры с разведениями на МПА, раз-
веденный в 10 раз.
Выделение накопительных и чистых культур Hyphomicrobium.
Как указывалось выше, представители рода Hyphomicrobium спо-
собны использовать в качестве единственного источника углерода
и энергии Ci-соединения, такие, как метанол, метиламин, и могут
расти анаэробно за счет денитрификации. Для создания элективных
условий при выделении этих бактерий используют среду с метанолом.
Среда для Hyphomicrobium [Attwood, Harder, 1972]
KHjPO, 1,74 г
NaH2PO4 • HjO 1,38 г
(NH4)2SO4 о,5 г
MgSO4 • 7 Н2О 0.2 г
СаС12 • 2 Н2О 0,025 г
FeCh • 4 Н2О 3,5 мг
Метанол 5 мл
KNOj 5 г
Раствор микро- 6 мл
элементов
N 9 (см. прил.)
Вода деиони- 1000 мл
зированная
58
Пептон 0,15 г
Дрожжевой экстракт 0,15 г
Глюкоза |,0 г
(NH«)2SO4 0,25 г
Среда для Ancalomicrobium (ММВ)
Раствор витаминов
N 9 (см. прил.)
Агар Дифко
Вода дистиллированная
10 мл
15 г
До 1000 мл
Основной солевой 20 мл
раствор Хатнера
Некоторые штаммы лучше растут на более богатой среде, исполь-
зуемой для культивирования каулобактера [Poindexler, 1964]. Эта
среда содержит 0,2% пептона, 0,1% дрожжевого экстракта, 0,02%
MgSC>4 • 7 НзО и 1,5% агара. Хорошо растет на этой среде Ancalo-
microbium adetum, но в этом случае клетки имеют очень короткие
простеки. Для изучения морфологии клеток культур следует ис-
пользовать электронный микроскоп.
Жидкая среда для Prosthecomicrobium и Ancalomicrobium
(NH4)2SO4
NajHPO*
Солевой раствор
Хатнера
0,25 г Глюкоза 0,25 г
0,0006 г Раствор витаминов 10 мл
20 мл N 9 (см. прил.)
Вода дистиллированная 1000 мл
Доводят pH до 7,0 с помощью NaOH. Метанол вводят после сте-
рилизации. Для приготовления твердой среды вносят 15 г агара Дифко
и исключают KNO3. Для удаления кислорода из жидких сред перед
использованием через них продувают азот. В анаэробных условиях
KNO3 служит акцептором электронов.
Для получения накопительной культуры нестерильную жидкую
среду с метанолом и нитратами разливают доверху в флаконы объемом
100—125 мл, вносят 0,3 мл ила или 5 мл воды и инкубируют при 30°.
Культуру накопления через неделю пересевают еще раз на жидкую
среду, а затем производят рассев на твердую среду и инкубируют
на воздухе.
Среда Хирша для почкующихся бактерий Hyphomicrobium N 337
[Hirsch, Conti, 1964}
КН2РО4 1,36 г MnSO, 7 Н2О 2,5 мг
Na2HPO4 7Н2О 2,13 г Na2MoO4 • 2 Н2О 2,5 мг
(NH4)2SO4 0,5 г Раствор микро- 6,5 мл
MgSO4 • 7 Н2О 0,2 г элементов
CaCh • 2 Н2О 10 г (см. ниже)
FeSCb • 7 Н2О 5 мг Вода дистиллиро- 1000 мл
ванная
Раствор микроэлементов
ZnSO4 • 7 Н2О 50 мг НзВОз 2000 мг
MgCh 4 Н2О 400 мг Na2MoO4 • 2 Н2О 500 мг
СоС12 • 6 Н2О Вода деионизиро- 1000 мл
CuSO4'5H2O 1 мг ванная
0,4 мг
Культуру помещают в сосуд, где создается атмосфера паров ме-
59
танола, для чего в эксикатор ставят открытый стаканчик с мета-
нолом или непосредственно в питательную среду добавляют 4 г/л ме-
танола. Реакцию среды доводят до pH 7,0. В качестве источника
азота вместо сернокислого аммония можно использовать азотно-
кислый натрий, солянокислый метиламин или мочевину в концентра-
ции 100 мМ. На твердой среде колонии мелкие, гранулярные, грязно-
белые, с возрастом приобретают коричневую окраску. Чистые культуры
поддерживают на жидкой среде.
Скользящие бактерии
Микроорганизмы, обладающие скользящим движением, составляют
обширную группу прокариот, относительно слабо изученную. В фило-
генетическом отношении эта группа весьма неоднородна и условно
может быть подразделена на следующие три группы [Reichenbach,
Dvorkin, 1981]. Первую группу составляют цианобактерии, способные
передвигаться скольжением. Вторую группу, сравнительно небольшую
по числу известных представителей, — анаэробные фототрофные
зеленые бактерии, объединенные в семейство Chloroflexaceae. В послед-
ние годы, кроме единственного представителя — Chloroflexus auran-
tiacus, обнаружено еще несколько скользящих нитчатых зеленых
бактерий, которые, вероятно, пополнят состав этого семейства. К ним
относятся роды Chloronema, Oscillochloris, Heliobacterium, Heliothrix.
Подробнее некоторые из них охарактеризованы далее, в разделе "Фото-
синтезирующие бактерии”.
Третья группа, весьма многочисленная, включает одноклеточные
и нитчатые бактерии, объединенные в два порядка и в несколько
Таблица 5
Основные группы нефотосинтезирующих бактерий
со скользящим движением
Признак Цитофаги Миксобактерии Нитчатые скользящие бактерии
Вегетативная струк- Одноклеточные па- Одноклеточные па- Многоклеточные три-
тура лочки и нити лочки хомы
Внеклеточные образо- вания Слизь, чехлы Обильная слизь Чехлы и слизь
Способ размножения Бинарное деление Бинарное деление Фрагментация с об- разованием отдель- ных клеток — гони- дий или отрезков трихома — гормо- гоний
Покоящиеся клетки Отсутствуют* Микроцисты Отсутствуют
Плодовые тела и Образуются
Каротиноидные пиг- менты Имеются Имеются
• Микроцисты образуются лишь у представителей рода Sporocytophaga.
60
Рис. 15. Сопоставление гомологических рядов нитчатых цианобактерий (а) и сколь-
зящих бесцветных бактерий (б)
а. 1 — Oscillatoria; 2 — Lyngbya; 3 — Romeria: 4 — Plectonema; 5 — Spirulina;
6 — Dichothrix; 7 — Anabaena; 8 — Crinalium; 6: 9 —- Beggiatoa; 10 — Flexithrix;
11 — Cytophaga; 12 — Herpetosyphon; 13 — Microscilla; 14 — Saprospira; 15 — Pelonema;
16 — Leucothrix; 17 — Achroonema; 18 — Alysiel la; 19 — Anabaeniolum
самостоятельных семейств и родов, для которых пока трудно уста-
новить систему филогенетических связей (табл. 5). Некоторые из пред-
ставителей скользящих бактерий показаны на рис. 15.
Миксобактерии
Миксобактерии с плодовыми телами — аэробные хемогетеротрофы,
отличающиеся прежде всего необычным циклом развития. Их веге-
тативные клетки размножаются бинарным делением. Они образуют
сомкнутые размазанные колонии, погруженные в слизь. Вегетативные
клетки способны агрегироваться, образуя ярко окрашенные плодовые
тела крупных размеров, внутри которых клетки переходят в по-
коящуюся стадию — микроспоры или микроцисты. Микроцисты и
микроспоры в подходящих условиях прорастают в вегетативные
клетки.
61
Большинство известных миксобактерий — обитатели почв; они рас-
тут на разлагающейся растительности и обладают мощными системами
гидролитических ферментов. Из водных местообитаний выделено
всего несколько видов миксобактерий [Shilo, 1970], и требуются даль-
нейшие исследования в этом направлении.
Как правило, миксобактерий не растут на обычных бактериоло-
гических средах. По пищевым потребностям их можно разделить на
две физиологические группы — бактериолитическую (семейства Му-
хососсасеае, Archangiaceae, Cystobacteriaceae и часть представителей
семейства Polyangiaceae) и целлюлолитическую (некоторые пред-
ставители семейства Polyangiaceae). Бактериолитические миксобактерий
могут обычно расти на агаровых средах, содержащих живые или
убитые клетки бактерий, которые они лизируют.
Большая часть их хорошо растет на агаровых средах с фермента-
тивным гидролизатом белка (казитоном). Ни один из видов этой группы
не обнаруживает способности использовать углеводы как источник
углерода и энергии. Однако полисахариды — гликоген, крахмал,
карбоксиметилцеллюлоза — часто стимулируют рост в тех жидких
средах, которые без этих добавок не поддерживают роста.
Целлюлолитические миксобактерий имеют простые пищевые потреб-
ности и развиваются в неорганических средах при внесении цел-
люлозы или сахаров.
Выделение миксобактерий. 1. Около 5 г образца почвы или ила по-
мещают в пробирку с 5 мл стерильной воды и оставляют на 2—4 дня
при комнатной температуре, а затем взбалтывают и засевают чашки
со средой, содержащей 0,02% триптона или триптиказы и 1% агара.
Чтобы задержать развитие амеб, миксомицетов и диатомовых водо-
рослей, добавляют 100 мг/л актидиона.
Агаровые пластинки просматривают через 3—4 дня и в дальнейшем
в течение 2—3 нед каждые 2—3 дня. Отсев производят из края колоний,
расползающихся или проявляющих какие-либо признаки движения.
Дальнейшие пересевы производят также из края колонии до тех пор,
пока не получат чистую культуру. Живые клетки из края колонии
проверяют в фазово-контрастном микроскопе при увеличении Х900
на способность к скольжению и отсевают на свежую среду.
2. Вследствие литической способности миксобактерий культуры
накопления можно получить, засевая чашки Петри с водным агаром
культурой гриба, дрожжей или газоном бактерий. На поверхность
развившихся бактерий или мицелия гриба помещают образцы ила
или исследуемой воды. Развивающаяся культура накопления мик-
собактерий лизирует мицелий или бактериальный газон. По краям
образующейся зоны просветления могут появиться плодовые тела,
из которых производят высев для получения чистой культу-
ры.
3. Метод основан на характерной способности миксобактерий
к ползанию по поверхности субстрата. Готовится среда Норена с
добавкой 10% агара. На ее поверхности раскладывают посевной
материал в виде комочков ила или концентрата бактерий из воды.
Среда эта имеет настолько плотную и сухую поверхность, что боль-
62
шинство сопутствующих бактерий не способны следовать за миксо-
бактериями, выползающими из посевных очагов.
Выделение чистой культуры. Производят посев на среду Норена,
на картофельный агар или на ломтики картофеля. Выделение куль-
туры производят из края колонии с выползающими' клетками или
спорами, осторожно извлеченными из плодовых тел.
Среда Норена для миксобактерий [Noren, 1955]
Ферментативный
гидролизат казеина
(казнтон)
Аспарагин
К2НРО4
2,5 г
2,5 г
2,0 г
NaCl 1,0 г
MgSO, 7HjO 0,01 г
FeSO4-7H2O 0,003 г
Вода водопроводная 1000 мл
Цитофаги
Цитофаги широко распространены там, где имеется подвергающееся
распаду органическое вещество. Они встречаются в водоемах при
нейтральной реакции в аэробных и микроаэробных условиях в иловых
отложениях и в очистных сооружениях. Встречаются и планктонные
формы, особенно в зоне термо- и хемоклина, где они могут
достигать до 10% общего количества гетеротрофных бактерий.
Большинство представителей порядка Cytophagales обладают актив-
ными гидролитическими ферментами и разрушают в аэробных усло-
виях ряд полимеров: целлюлозу, полисахариды, пектин и др.
Порядок Cytophagales включает следующие роды: Cytophaga, Sporo-
cytophaga, Saprospira, Flexibacter, Microscilla, Herpetosyphon, Sphaerocy-
tophaga, Capnocytophaga. Кроме того, к одноклеточным скользящим
бактериям относится новый род Lysobacter [Christensen, 1977; Christen-
sen, Cook, 1978]. Представители этого порядка, по-видимому, обычны
в пресноводных и морских обитаниях, но их часто упускают во время
выделения из-за применения сред, богатых питательными веществами.
Кроме того, для выявления их прозрачных колоний следует при-
менять микроскопирование чашек с агаровой средой при боковом
освещении.
Культивирование цнтофаг. Большинство бактерий этого семейства
можно культивировать на относительно простой среде. Некоторые
пресноводные виды растут хорошо на двух следующих средах.
Среда для Cytophagales
Пекарские дрожжи 0,5 г Витамин Ви Агар 0,5 мкг 1,5 г
(сырая масса) СаС12-2Н2О Казнтон Дифко 0,1 г 3 г Вода водопро- 100 мл водная Среда для Cytophaga MgSO4-7H2O 0,5 г
Дрожжевой 0,5 г Агар 15 г
экстракт Дифко СаСЬ -2Н2О 0,5 г Вода водопро- водная 1000 мл
63
Перед посевом pH в среде доводят до 7,2.
Выделение чистых культур. При выделении чистых культур исполь-
зуют способность скользящей подвижности Cytophaga, Flexibacter и дру-
гих представителей этой группы.
Разбавленные пробы грунта, воды или водной растительности рас-
севают на поверхность агаровой среды с низкой концентрацией
питательных веществ, например с 0,1% триптона или триптиказы
либо МПА, разбавленного в 10 раз. В другом варианте пробы, пред-
ставляющие собой остатки водных растений, водоросли, грунт, раз-
мазывают в центре чашек Петри по поверхности обедненного агара.
Скользящие бактерии, обладая способностью мигрировать по твер-
дому субстрату, через несколько дней разрастаются за зону нане-
сения исходного материала в виде тонких, почти прозрачных коло-
ний с пальцевидными выступами. Из края этих колоний получают
накопительную культуру и далее — чистую методом предельных раз-
ведений. Для подавления роста других бактерий в агаровую среду
полезно ввести перед посевом пенициллин G (15 ед./мл) и хлорамфеникол
(5 мкг/мл).
Следует указать, что прозрачные колонии цитофаг и других сколь-
зящих бактерий хорошо видны при просмотре агаровых чашек
под бинокулярной лупой в проходящем свете, падающем под опре-
деленным углом зрения, который находят эмпирически.
Для представителей этой группы, использующих целлюлозу как
источник органического вещества, применяют следующую процедуру
их количественного учета и выделения в чистую культуру.
Основная минеральная среда
для целлюлолитических цитофаг
(NH4)jSO4 1 г
или KNO3
К2НРО4 1 г
MgSO4 0,2 г
СаС12 0,1 г
FeCb 0.02 г
Агар 10 г
Вода водо- 1000 мл
проводная
Доводят pH до 7,0—7,5, кипятят и стерилизуют 15 мин при 121°.
На поверхность этой минеральной среды помещают кусочки сте-
рильной фильтровальной бумаги, размещают посевной материал и ин-
кубируют чашки при комнатной температуре. Следят за образова-
нием желтой, розовой или оранжевой окраски вокруг зон лизиса
бумаги. С помощью фазово-контрастного микроскопа можно обнару-
жить небольшие подвижные клетки цитофаги.
Для выделения цитофаг, которые разлагают не только целлюлозу,
культуру рассевают на агар с триптоном (см. выше) штрихом.
Для получения отдельных колоний бактерий, разлагающих только
целлюлозу, на поверхность основного минерального агара разли-
вают тонкий слой той же среды с тонко измельченной фильтроваль-
ной бумагой, при этом лучше видны зоны просветления, образую-
щиеся в результате лизиса целлюлозы вокруг отдельных колоний.
64
Среда Левина для пресноводных культур скользящих бактерий
[Lewin, Lounsbery, 1969]
MgSO«-7H2O 0.1 г Тиамин 1 мг
KNO3 0,1 г Витамин Ви 1 мкг
СаС1г2Н2О 0,1 г Казамино кислоты 1 г
Глицерофосфат 0,1 г Дифко
натрия Глюкоза 1 г
Раствор 1 мл Агар 10 г
микроэлементов Вода дистиллиро- 1000 мл
(см. ниже) ванная
Трис-буфер 1 г
Перед посевом устанавливают в среде pH 7,5.
Раствор микроэлементов по Левину [Lewin, 1969]
Растворимые соли В, Fe и Мп берут по 5 мг, растворимые соли
Со, Си, Мо и Zn — по 0,1 мг в расчете на элемент и растворяют в 10 мл
воды. Таким образом, в этом растворе конечная концентрация пер-
вых трех элементов будет по 0,5 мг, а вторых — по 0,01 мг на 1 мл.
На указанной среде культуры остаются жизнеспособными по крайней
мере 2—3 нед. Для поддержания культур необходимо делать пе-
ресевы каждые 2 нед на свежую среду.
Среда для накопления Saprospira [Lewin, 1969]
Казеинат натрия 750 мг Витамин Ви 5 мкг
Тиамин 100 мкг Вода из водоема 1000 мл
Пиридоксин 10 мкг
В среде перед посевом pH доводят до 6,5—6,7. В твердые среды до-
бавляют 10 г агара. Выросшие колонии скользящих бактерий отсевают
на скошенный агар. Пересев производят не реже чем через 6 дней.
Инкубация при 29—30°. Культура без пересева на жидкой среде остает-
ся жизнеспособной один месяц. Если среда оптимальна, то движе-
ние нитей активное, а нити Saprospira скручены в спирали. При небла-
гоприятных условиях для развития нити прямые, движение замед-
ленное.
Нитчатые, или трихомные, скользящие бактерии
Как указывалось выше (см. табл. 5), эта сборная группа объединяет
скользящие трихомные бесцветные бактерии, не имеющие кароти-
ноидных пигментов. В настоящее время она объединяет представи-
телей семейств Beggiatoaceae, Pelonemataceae и роды с неясным так-
сономическим положением — Leucothrix, Toxothrix, Simonsiella, Alysiel-
la. Последние два рода ранее были объединены в семейство Simon-
siellaceae. Вероятно, к этой же группе трихомных скользящих бактерий
следует отнести недавно описанный род Filibacter с единственным
видом F. limicola [Maiden, Jones, 1984].
Представители этой группы широко распространены в донных от-
ложениях и в водной толще пресных и морских водоемов. Одни при-
способлены к планктонному образу жизни, их клетки содержат га-
зовые вакуоли (Pelonema, Achroonema, Peloploca). Другие ведут при-
s. За к. 1766
65
Таблица 6
Сравнительная характеристика родов семейства Pelonemataceae
Признак Pelonema Achroonema Peloploca Desmanthos
Нити одиночные 1 + +
Нити в пучках — — +
Прикрепительный диск — — — +
Чехлы — ± ± +
Газовые вакуоли + ± ± —
Покоящиеся клетки — ± — —
Число видов 6 13 5 1
крепленный образ жизни и образуют обильные обрастания на дне
водоемов и подводной растительности. К ним относятся Leucothrix,
Thiothrix. Способностью к скольжению у этих организмов обладают
лишь гонидии.
Благодаря крупным размерам и отчетливой морфологии трихом-
ные скользящие бактерии легко различимы в образцах природного
материала. Лишь ограниченное число видов удалось изолировать в
чистые культуры, большинство же известно лишь по морфологи-
ческим описаниям. В поверхностной пленке донных отложений три-
хомные скользящие бактерии составляют значительную часть бакте-
риальной биомассы [JOrgensen, 1977].
Группа весьма неоднородна по физиологическим потребностям.
Некоторые трихомные бактерии используют ограниченный круг пита-
тельных веществ и не обладают гидролитическими ферментами. От-
дельные виды нуждаются в факторах роста (Simonsiella, Alisiella). Пред-
ставители семейства Beggiatoaceae — Beggiatoa, Thioploca, Thiothrix,
способные окислять восстановленные серные соединения, рассматри-
ваются далее, в разделе "Бесцветные серобактерии”. Четвертый
представитель этого семейства — род Vitreoscilla участвует в минера-
лизации аминокислот и не использует углеводы и другие органи-
ческие субстраты, растет лишь на сложных средах.
Методы культивирования этих организмов недостаточно разра-
ботаны. Исследователям удалось получить лишь немногие из из-
вестных организмов данной группы.
В это семейство объединены трихомные бактерии, довольно часто
встречающиеся в планктоне и- поверхностном слое донных отло-
жений. Однако ни одни из них не были получены в чистой куль-
туре.
К семейству Pelonemataceae отнесены представители четырех родов:
Pelonema, Achroonema, Peloploca и Desmanthos. Трихомы бактерий
состоят из цилиндрических клеток, некоторые содержат газовые
вакуоли и имеют чехлы. Трихомы могут быть объединены в пучки
или плоские, ленты. Размножение нитей происходит фрагментацией
на гормогонии, реже — с помощью артроспороподобных покоящихся
клеток.
66
Признаки, служащие для разграничения родов, приведены в табл. 6.
Получение накопительной культуры Pelonema. На дно пробирки
помещают 3—5 мл полужидкого агара, содержащего 0,001—0,005%
сульфида натрия. Сверху его покрывают таким же слоем 1%-го ага-
ра, помещают 2 мл автоклавированного ила и 5—7 мл стерильной
природной воды. Инокулируют среду 1 мл воды или осадка, содер-
жащего трихомы Pelonema, и инкубируют при низкой освещенности
и температуре 14—18°. В пробирке происходит развитие анаэробных
фототрофных бактерий и одновременно скользящих нитей Pelonema.
Однако методы получения чистых культур Pelonema, как и других
представителей этого семейства, не были разработаны.
Выделение Leucothrix. В этот род включены трихомные неподвиж-
ные бактерии. Нити свободноплавающие или прикрепленные. В послед-
нем случае часто образуют розетки с помощью прикрепительных
слизистых дисков. У нитей выражена апикально-базальная дифферен-
циация клеток: к свободной вершине клетки тоньше, у основания —
шире. Размножение происходит гонидиями, отторгаемыми на сво-
бодноплавающем конце нити. Гонидии способны передвигаться сколь-
жением по субстрату. Формирование розеток происходит путем объеди-
нения гонидий с последующим их делением и образованием нитей.
Известен один вид — L. mucor.
Для выделения чистых культур следует использовать свежеотоб-
ранный природный материал и сразу после просмотра под микро-
скопом отдельные ’’кустики” и нити, свободные от сопутствующей
микрофлоры, рассевать на поверхность твердой среды. После су-
точной инкубации при температуре 20—25° чашки исследуют под фазо-
во-контрастным микроскопом при увеличении Х125 и выросшие
микроколонии нитчатых бактерий помещают в 1—2 мл жидкой
среды. Через сутки выросшие культуры переносят в больший
объем среды. Для культивирования используют среду, содержа-
щую 1% глутамата натрия, 0,2% лактата и 0,01% дрожжевого эк-
стракта, pH доводят до 7,6.
Среда для выделения L. mucor [Brock, 1981}
Глутамат натрия 0,5 г
Na2HPO< 0,5 г
Агар Дифко 15 г
Вода деионизированная 1000 мл
Для выделения F. limicola сначала получают накопительную куль-
туру, используя жидкую среду Майдена и Джонса [Maiden, Jones, 1984].
Среда Майдена и Джонса для F. limicola
К2НРО4 28 мг MnSO4-4H2O 8 мг
MgCh 6Н2О 127 мг Цитрат железа 6 мг
KNOj 4 мг Вода дистилли- 1000 мл
(NH,)2SO4 60 мг рованная
После стерилизации добавляют стерильные растворы дрожжевого
экстракта Дифко из расчета 10 мг/л и пептона (Oxoid L-37) — 100 мг/л,
67
устанавливают pH 7,2—7,4. Для приготовления твердой среды добавля-
ют 1% агара (Oxoid L-28).
Чашки с агаровой средой засевают штрихом исследуемым мате-
риалом и инкубируют при 10°. Через 2 нед на некотором расстоянии
от нанесенного материала появляются мелкие прозрачные колонии,
содержащие скользящие трихомы F. limicola. Они состоят из цилиндри-
ческих прямых или изогнутых клеток. Длина нитей 8—150 мкм, раз-
меры клеток 1,1 Х(3—30) мкм.
Чистые культуры хорошо растут на средах, содержащих пептон
в небольшой концентрации.
Спиральные и изогнутые бактерии
В эту группу микроорганизмы объединены по формальному при-
знаку — наличию спиральной или изогнутой формы клеток. Эта груп-
па весьма неоднородна: помимо перечисленных в этом разделе хемо-
трофных (в основном хемогетеротрофных) бактерий, имеются и фото-
и автотрофные бактерии со сходным строением клеток. Они рассмат-
риваются в соответствующих разделах книги, посвященных сероокисля-
ющим, нитрифицирующим и фотосинтезирующим бактериям.
Хемоорганотрофные изогнутые и спиральные бактерии представлены
двумя семействами — Spirillaceae и Spirosomaceae. Первое объединяет
подвижные бактерии спиральной формы. Морфологически к ним близки
подвижные вибрионы рода Bdellovibrio с неясным систематическим
положением, являющиеся паразитами бактерий. Во второе семейство
включены неподвижные изогнутые бактерии.
Семейство Spirillaceae
К этому семейству относятся роды Aquaspirillum, Oceanospirillum,
Spirillum [Hyllemon et al.,1973] и Campylobacter. Первые три рода
характеризуются строго респираторным типом метаболизма и подвиж-
ностью, обусловленной наличием пучков полярно расположенных жгу-
тиков. Некоторые из них способны к анаэробному дыханию (нитрат-
ному, фумаратному). Облигатные микроаэрофилы представлены родом
Spirillum.
В отличие от спирилл представители рода Campylobacter — анаэробы
или строгие микроаэрофилы — имеют по одному полярному жгу-
тику на одном или обоих концах клетки. Многие патогенны, но из-
вестны и непатогенные виды, обладающие серным дыханием [Pfennig,
Biebl, 1976]. Подробнее эти виды характеризуются в разделе ’’Серо-
редуцирующие бактерии”.
Результаты исследования олигонуклеотидной последовательности
16S рРНК и ДНК—ДНК-гибридизации показали значительную фило-
генетическую гетерогенность группы и раннюю эволюционную дивер-
генцию близких по фенотипу видов как пресноводных, так и морских
спирилл [Woese et al., 1984].
Большинство представителей этого семейства имеют сложные пи-
тательные потребности и используют сравнительно небольшое чис-
ло органических веществ, главным образом органические кислоты,
68
спирты, отдельные аминокислоты и сахара. Гидролитические ферменты,
как правило, у них отсутствуют. В водоемах эти бактерии разви-
ваются в изобилии там, где происходит активное разложение све-
жего органического вещества — в зоне температурного скачка и на
поверхности грунта.
Выделение чистых культур Aguaspirillum осуществляют на среде
MPSS, состав которой приводится ниже.
Среда MPSS
Пептон Дифко 5 г
Янтарная кислота 1 г
(NH^SO, 1 г
MgSO4-7H2O 1 г
FeCU-бНгО
MnSO4-H2O
Агар
Вода дистиллированная
0,002 г
0,002 г
15 г или 1 г
1000 мл
Доводят pH до 7,0 с помощью КОН и стерилизуют 15 мин при 12Г.
Для получения культуры накопления полужидкую среду, содер-
жащую 1 г/л агара, разливают в пробирки и заражают пробой воды
или кусочком отмершей водной растительности.
Через 2—5 дней на поверхности среды начинается развитие
бактерий. Спириллы скапливаются непосредственно под пленкой.
Проверку развития спирилл следует проводить путем ежедневного
микроскопирования пробы из зоны развития бактерий в пробирке,
так как из-за быстрой сукцессии они скоро сменяются другими
видами. При наличии обильного развития делают повторный пере-
сев на среду того же состава, а далее — в чашки Петри на твер-
дую среду с разведениями. Развитие колоний наблюдается на 3—5-й день
из 3—4-го разведения. Выросшие колонии с помощью пастеровской
пипетки с тонко оттянутым концом извлекают из агара, микроскопи-
руют. В случае наличия спирилл материал из колонии рассевают на
подготовленные чашки Петри с указанной выше средой для последую-
щего выделения чистой культуры из отдельных колоний. Чистоту
культур проверяют путем микроскопирования и посевом на МПА.
Выделение Spirillum volutans можно осуществить в микроаэробных
условиях путем внесения природного" посевного материала в среду
MPSS, приведенную выше, и культивирования в атмосфере 6% кисло-
рода и 94% азота. Эти гигантские спириллы, толщиной до 2 мкм, очень
чувствительны к избытку кислорода в среде. Однако их можно
культивировать и в аэробных условиях, если к жидкой среде добавить
0,4% агара. Пересевы в этом случае необходимо производить не реже
чем через 3—4 сут.
Добавление к среде стерильных растворов каталазы и супероксид-
дисмутазы около 5—10 ед./мл способствует сохранению устойчи-
вого роста бактерий на жидких и твердых средах.
Выделение культур накопления Bdellovibrio. Это грамотрицательные
подвижные вибрионы длиной менее 1 мкм и шириной не более 0,3 мкм,
которые передвигаются с помощью полярного очехленного жгутика,
обычно монотрихиального. Одни виды могут проявлять специфич-
ность в отношении хозяев, другие — необлигатные паразиты или
независимы от хозяев. Клетки паразитических штаммов прикреп-
ляются к клетке ’’хозяина”, проникают через клеточную стенку и раз-
69
множаются в периплазматическом пространстве с последующим лизи-
сом клетки хозяина.
Виды Bdellovibrio широко распространены в природе. Их выделяли
из почвы, сточных вод, загрязненных рек и из других водных систем.
Виды бделловибрио обладают литической способностью к многим
грамотрицательным бактериям. Численность их в почве и сточной
жидкости колеблется от 10 до 100 клеток в 1 мл и до 200 клеток в 1 л
морской воды.
Для выделения культуры накопления 50 г грунта взбалтывают в
500 мл воды в течение 1 ч. Центрифугируют 5 мин при 2000 об./мин.
Супернатант фильтруют через серию мембранных фильтров с порами
от 3 мкм до 1,2; 0,8; 0,65; 0,45. Последние 2—3 фильтрата помещают в
чашки Петри с двойным слоем агара. На дно чашки диаметром 9 см
наливают 15—20 мл агаровой среды с концентрацией агара 1,5%. Затем
готовят поверхностный слой полутвердого агара(0,6%), который держат
при 42°. В него вносят 0,5 мл суспензии грамотрицательных бактерий
("хозяина”), содержащей около 1О10 клеток, и 0,5 мл разведенной суспен-
зии фильтрата, прошедшего через фильтры с диаметром пор 0,8, 0,65
или 0,45 мкм и содержащего клетки бделловибрио. Полужидкий
агар тщательно перемешивают с внесенными бактериями и выливают
на нижний затвердевший слой. Развитию бделловибрио благоприят-
ствует добавка в агар 0,3% дрожжевого экстракта, 0,06% пептона и
0,05 М трис-буфера. Инкубация 2—4 дня при температуре, благо-
приятной для "хозяина”. Отмечают колонии хозяина и появле-
ние мелких колоний бделловибрио и зоны лизиса бактериальных
колоний хозяина под фазово-контрастным микроскопом. Материал из
зон лизиса суспендируют в трис-буфере, пропускают через ультра-
фильтр с диаметром пор 0,45 мкм, и фильтрат наносят на свежевысеян-
ный газон бактерий-хозяев.
Семейство Spirosomaceae
В это семейство объединены грамотрицательные бактерии с изог-
нутой формой клеток, но в отличие от Spirillaceae не обладающие под-
вижностью. Некоторые из них образуют характерные кольцевидные
структуры или S-образные агрегаты. В водоемах могут иногда дости-
гать заметного развития в определенных условиях.
В это семейство включены роды Microcyclus, Spirosoma, Flectobacil-
lus, Runella, Meniscus, Pelosigma, Brachiarcus. Сравнительная характе-
ристика аэробных представителей семейства приведена в табл. 7.
Выделение Microcyclus. К 100 мл испытуемой воды добавляют сте-
рильный раствор, содержащий 10 мг пептона, и инкубируют в течение
2 нед. Затем 0,1 мл из разведения 1:100 наносят на витаминный
глюкозо-казеиновый агар (GCAV). Через 1 нед после инкубации при
25° на поверхности агара появляются белые колонии. При их микро-
скопировании можно обнаружить неподвижные, похожие на вибрионы
палочки из рода Microcyclus.
Желтые колонии, содержащие изогнутые палочки, относятся к
Spirosoma. Наличие больших блестящих включений в клетках указывает
70
Таблица 7
Сравнительная характеристика аэробных изогнутых бактерий
семейства Spirosomaceae (Larkin, Borral, 1981)
Признак Spirosoma Runella Flectobacillus Microcyclus
Форма клетки
кольца образуют + + ♦ ±
спирали образуют + + + —
Газовые вакуоли — — — +
Пигментация колоний
беловато-кремовая — — — +
желтая — — —
розовая — + + —
Использование метанола —
G + C в ДНК, мол. % 51—53 49—50 34—40 66—69
на присутствие газовых вакуолей. Дальнейшую очистку культуры
следует проводить путем последующих посевов из разведений на среду
того же состава.
Среда GAGV для Microcyclus [Ert van, Staley, 1971]
Казаминовые кислоты (без витаминов) I г
Глюкоза 1 г
Солевой раствор N 3 (см. прил.) 20 мл
Агар 15 г
Раствор витаминов N 9 (см. прил.) 1 мл
Вода дистиллированная 1000 мл
Для выделения Microcyclus используют также среду ДМ. Последняя
подобна приведенной выше среде GAGV во всех отношениях, за исклю-
чением того, что содержит 0,015% сульфата аммония, 0,025% глюкозы,
0,0005 М ЫазНРОд вместо глюкозы и казаминовых кислот.
Для выделения Microcyclus и Spirosoma можно использовать две
среды, приведенные ниже.
Среда MS для выделения Spirosoma [Larkin, Williams, 1977]
Глюкоза
Пептон
Дрожжевой
экстракт
Триптон
Глюкоза
Дрожжевой
экстракт
Агар 15 г
Вода дистил- 1000 мЛ
лированная
Среда для выделения Microcyclus [Raj, 1970]
1 г Агар 15 г
I г Вода дистиллиро- 1000 мл
I г ванная
К семейству Spirosomaceae принадлежат также малоизученные роды
Pelosigma, Brachiarcus и Meniscus. Последний удалось культивировать.
Это строгие бродильщики. Имеют вибрионные или палочковидные
неподвижные клетки с газовыми вакуолями. Pelosigma и Brachiarcus
71
в культуре не получены. Клетки Pelosigma S-образные, расположены
в плоских S-образных группах по 4 клетки, объединены слизистым ве-
ществом, содержат газовые вакуоли. Агрегаты могут передвигаться
с помощью видимого в микроскоп жгутика (или пучка жгутиков).
Brachiarcus имеет клетки, подобные изогнутому луку, с газовыми ва-
куолями и иногда с мелкими капельками серы. Клетки образуют сли-
зистые агрегаты кренделевидной формы. Обычные места обитания этих
организмов — поверхность донных отложений. Методы их культи-
вирования в настоящее время не разработаны.
Спирохеты
Спирохеты широко распространены в природе. Многие из них
существуют как свободноживущие организмы в осадках, илах, боло-
тах, в поверхностных водах прудов, озер, источников, соленых во-
доемов, встречаются даже в районах глубоководных подводных гид-
ротерм. Многие спирохеты, как известно, патогенны для человека
и животных разных таксономических групп — от простейших и тер-
митов до моллюсков и млекопитающих.
Спирохеты объединены в порядок Spirochaetales на основе уни-
кальных морфологических особенностей и химического состава кле-
точных компонентов.
Все спирохеты имеют спирально закрученные клетки, или прото-
плазматический цилиндр, состоящий из цитоплазмы и ядерной зоны,
окруженной мембраной и клеточной стенкой. Спиральная форма клетки
поддерживается пептидогликановым слоем клеточной стенки. Прото-
плазматический цилиндр переплетен с одной или более (до 100)
осевыми фибриллами, которые отходят от субтерминальных прикрепи-
тельных дисков, расположенных на обоих концах спирального ци-
линдра. И протоплазматический цилиндр, и фибриллы заключены в
общую внешнюю оболочку, которая соответствует наружной мембране
других грамотрицательных бактерий. Осевые фибриллы прикреплены
на одном конце спирально изогнутой клетки, другой конец может
выходить за пределы цитоплазматического цилиндра, оставаясь в этом
случае свободным; фибриллы могут создавать впечатление наружных
полярных жгутиков, однако они заключены во внешнюю оболочку.
Спирохеты совершают движение трех типов: быстрое вращение
вокруг длинной оси спирали, изгибание клеток наподобие флексибак-
терий и передвижение штопорообразное по винтовому пути. Осевые
фибриллы структурно и по химическому составу сходны с бакте-
риальными жгутиками, и теперь принято, что фибриллы — орга-
неллы подвижности спирохет. Однако, поскольку они окружены наруж-
ной оболочкой, они не находятся в контакте с внешней средой.
И следовательно, механизм движения спирохет существенно отличается
от движения бактерий с помощью жгутиков.
В физиологическом отношении спирохеты чрезвычайно разнообраз-
ны. Среди них имеются аэробы, факультативные и строгие анаэробы.
Одни получают энергию исключительно за счет сбраживания расти-
тельных полимеров, другие используют только углеводы или длин-
72
ноцепочечные жирные кислоты. Одни виды растут в минеральной
среде с добавкой единственного источника углерода и энергии, дру-
гие обладают очень сложными потребностями в питании и факторах
роста. Многие патогенные виды не удается культивировать.
Группа спирохет гетерогенна и в генетическом отношении. Со-
держание G + С в ДНК варьирует от 25 до 65 мол. %. Филогенети-
ческая неоднородность этой группы подтверждается и исследованиями
олигонуклеотидной последовательности 16S РНК.
Порядок Spirochaetales включает пять родов, различающихся морфо-
логически и физиологически: Spirochaeta, Leptospira, Cristispira, Tre-
ponema и Borrelia. Среди представителей двух первых' многие виды
свободноживущие.
Выделение Spirochaeta. Свободноживущие водные спирохеты встре-
чаются в воде, иловых отложениях, в зоне температурного скач-
ка К известным видам свободноживущих спирохет относятся как
анаэробные, так и факультативно анаэробные. В пробах природного
материала их можно наблюдать при помощи фазового контраста
или темнопольного микроскопа.
Все виды спирохет, которые удалось культивировать, способны
использовать в энергетических и конструктивных целях лишь такие
углеводы, как сахара и крахмал. Как известно, спирохеты не способ-
ны использовать клетчатку, но могут усваивать целлобиозу, которая
образуется при расщеплении клетчатки иными организмами, для ко-
торых уже небольшие концентрации целлобиозы ингибируют их ак-
тивность. Поэтому в присутствии целлюлолитических бактерий спи-
рохеты, используя целлобиозу в очень малых концентрациях, способ-
ны развиваться в анаэробных условиях в иловых отложениях.
Для выделения спирохет в большинстве случаев применяется филь-
трационный метод, основанный на их способности проходить через
мембранные фильтры с размером пор 0,1—0,2 мкм. В качестве
посевного материала используют фильтрат.
Среда для анаэробного роста Spirochaeta stenostrepta
[Canale-Parola, 1981}
Раствор 1 Раствор 3
Глюкоза 9г ЭДТА 0,2 г
Пептон 2 г MgSOr7H2O 0,75
Дрожжевой экстракт 0,3 г СаС1г2Н2О 0,1 г
Вода дистиллированная 875 мл Раствор микро- 5 мл
элементов N 2
Раствор 2 (см. прил.)
К2НРО< 30 г
КН2РО4 70 г
Вода дистиллирован* 100 мл
ная
Для приготовления раствора солей ЭДТА растворяют в 800 мл
воды при нагревании и доводят pH до 7,0 при помощи 2,5% КОН.
Затем вносят в раствор соли, а после того, как раствор солей
будет доведен до 1000 мл, добавляют раствор микроэлементов.
73
Раствор 4
NajS-9HjO 2 г
Вода дистиллиро- 100 мл
ванная
Раствор готовят внесением сульфида в кипящую воду, быстро разли-
вают доверху в флаконы с завинчивающимися крышками и стерилизуют
в автоклаве. Добавляют в среду перед посевом.
Полную среду готовят перед посевом, добавляя к раствору 1 15 мл
раствора 2, 100 мл раствора 3, 10 мл раствора 4 и витамин В12 из расчета
0,1 мг/л среды.
Выделение Leptospira. Члены этого рода — облигатные аэробы. Ха-
рактерной особенностью лептоспир является наличие загнутых в виде
крючков концов спиральной клетки. Свободноживущие виды изоли-
рованы из пресных, морских водоемов и-почв. В физиологическом
отношении это специализированная группа, использующая длинно-
цепочечные жирные кислоты в конструктивном и энергетическом обме-
не, а также для синтеза липидов клетки. В филогенетическом отно-
шении лептоспиры обособлены от других родов порядка Spirochaetales,
составляя раннюю обособленную ветвь в эволюции спирохет.
Для выделения лептоспир используют их устойчивость к краси-
телю бриллиантовой зелени (бриллиант Грюн), который ядовит для
других микроорганизмов.
Среды для их культивирования дополняют либо кроличьей сы-
вороткой (7—20% по объему), либо бычьим альбумином фракции
V и твином 80. Добавление 2—5% нормальной кроличьей сыворотки
в присутствии твина 80 и альбумина ускоряет их развитие в среде. Иногда
в среду вносят куриный желток как источник липидов и факторов
роста.
Для инокуляции среды используют фильтрат пробы, прошедший
через мембранный фильтр с порами 0,1—0,2 мкм.
Среда для выделения лептоспир [Caraway, Krieg, 1972\
Глицерин 0,2 г
Na2HPO4-2H2O 0,53 г
К2НРО4 0,07 г
CaCh-2H2O 0,004 ।
Твин 60 0,02 г
Твин 80 0,05 г
После стерилизации к среде добавляют растворы микроэлементов и
витаминов, простерилизованные ультрафильтрацией. Доводят pH до
7,4—7,6. В качестве микроэлементов добавляют 6 мг (МНд)2 Fe(SO4)2 и
4 мг СиСО3на 1 л среды. Из витаминов добавляют к среде 10 мкг тиами-
на и 3 мкг Ви. За развитием лептоспир наблюдают в темнопольный или
фазово-контрастный микроскоп.
Среда с бриллиантовой зеленью для выделения
и культивирования лептоспир
К2НРО« 183 мг
Na2HPO4-7H2O 650 мг
Бриллиантовая зелень 3 мг
Желток (стерильный) 1 мл
Агар 1 г
Вода дистиллированная 300 мл
Полужидкую среду, разлитую по пробиркам, заражают 0,5—1,5 мл
предварительно профильтрованной пробы, содержащей лептоспиры.
Развитие отмечается по легкому помутнению и по результатам микро-
скопического анализа.
В противоположность патогенным видам сапрофитные лептоспи-
ры размножаются при 18°.
Среди лептоспир вид Leptospira ferrooxidans описан как автотрофный
[Маркосян, 1972], окисляющий двухвалентное железо (см. раздел
’’Окисление железа и марганца микроорганизмами”). Однако морфо-
логически он ближе к спириллам.
Грамположнтельные бактерии актиномицетноЙ линии
К грамположительным бактериям
сятся три группы бактерий.
актиномицетноЙ линии отно-
I группа II группа III группа
Эуактиномицеты 1. Коринеформ- Молочнокислые
Streptomyces ные бактерии бактерии и микро кокки
Corynebacterium Streptococcus
Arthrobacter Leuconostoc
Propionobacterium 2. Проактиномицеты Pediococcus
Biphidobacterium Lactobacillus
Actinomyces Staphilococcus
Mycobacterium Micrococcus
Nocardia Sarcina
Первая включает эуактиномицеты. Во вторую группу входят про-
актиномицеты и коринеформные бактерии. У проактиномицетов ми-
целиальный рост имеет временный характер, они не образуют спор,
размножение происходит путем фрагментации мицелия на короткие
палочки. К этой же группе относятся одноклеточные организмы,
носящие название коринебактерий. Клетки этих бактерий имеют бу-
лавовидную форму, деление бинарное с защелкиванием. К этой группе
относится и артробактер, клетки которого в цикле развития пере-
ходят из кокков в палочки, прорастающие в нити, и вновь распа-
даются на кокки. К третьей группе принадлежат грамположнтельные
одноклеточные бактерии. Это молочнокислые бактерии и мик-
рококки.
Выделение актиномицетов. Эуактиномицеты широко распростра-
нены в природе. Они играют большую роль в минерализации орга-
нического вещества как в почве, так и в водоемах. Для выделения
и количественного учета актиномицетов используют обычно крах-
мало-аммиачный агар.
Разбалтывают растворимый крахмал в небольшом количестве хо-
лодной воды и вливают воду прежде, чем добавляют соли. На поверх-
75
Растворимый 10 г
крахмал
(NILhSO, 2 г
К2НРО4 I г
MgSO4-7H2O 1г
Крахмало-аммиачный агар для актикомицетов
NaCI 1 г
СаСОз 3 г
Агар 15 г
Вода дистиллиро- 1000
ванная
ности среды актиномицеты образуют мелкие колонии, нередко окра-
шенные, с воздушным мицелием.
Выделение коринеформных бактерий. Представители этой группы
бактерий существенно различаются по потребностям в питательных ве-
ществах. Представители коринеформных бактерий используют в ка-
честве источника углерода и энергии широкий круг веществ (угле-
воды, спирты, пектины, лигнин, углеводороды, многие гербициды,
синтетические продукты и т.д.). Встречаются они в самых различ-
ных местах обитания. Облигатно аэробные коринеформные бактерии
в изобилии встречаются в почве и в водоемах разного типа.
К наиболее изученным представителям коринеформных организ-
мов относится Arthrobacter. В водоемах иногда они составляют боль-
шую часть популяций аэробных хемогетеротрофных бактерий и служат
важнейшими агентами, способствующими минерализации органичес-
ких веществ в водоемах и почвах. Наиболее характерная особенность
видов Arthrobacter заключается в последовательном изменении форм
клеток в цикле развития, который свойствен и коринебактериям.
Однако Arthrobacter резко отличаются от группы Corynebacterium—My-
cobacterium—Nocardia по составу клеточной стенки.
Таксономия рода Arthrobacter до недавнего времени была основана
в основном на морфологических и некоторых физиологических кри-
териях. Наиболее важным признаком рода было наличие жизненного
цикла, состоящего из перехода палочковидных клеток в логарифми-
ческой фазе роста в кокковидные в стационарной фазе. Применение
хемотаксономических методов, таких, как исследование состава пепти-
догликанового слоя клеточной стенки, жирных кислот и хинонов в
составе клеток у представителей этого рода, показало гетерогенность
данной группы организмов и привело к пересмотру диагностической
характеристики рода и его видового состава. В настоящее время при-
нято, что род Arthrobacter объединяет облигатно аэробные бактерии,
у которых проявляется сложный жизненный цикл при развитии на
богатых средах, с переходом палочек в кокковидную форму. Непре-
менным условием для отнесения бактерий к данному роду является на-
личие в составе клеточной стенки этих бактерий пептидогликана,
включающего £-лизин [Keddie, Jones, 1981]. Жирные кислоты Arthrobac-
ter должны быть представлены негидроксилированными насыщенными
неразветвленными длинными цепями. Кроме того, клетки истинных
артробактеров богаты гликолипидами и содержат менахиноны в составе
респираторных хинонов. В соответствии с этим ряд видов, ранее
классифицированных как Arthrobacter, в настоящее время отнесены
к другим родам. Так, A. flavescens и A. terregens, содержащие орнитин
76
в составе диаминопимелиновой кислоты клеточной стенки, рекласси-
фицированы как Aureobacterium, a A. simplex и A. tumescens предло-
жено объединить в новый род Pimelobacter [Suzuki, Komagata, 1983].
Представители последнего содержат в составе клеточной стенки L. L-
диаминопимелиновую кислоту.
Систематика, морфология и физиология рода Arthrobacter подробно
рассмотрены Е.И. Квасниковым и Е.И. Писарчук [1980]. Монография
’’Нокардиоподобные и коринеподобные бактерии” [Нестеренко и др.,
1985] обобщает аналогичные сведения в отношении других представи-
телей этой группы.
Из-за отсутствия строго элективной среды и из-за морфологической
изменчивости артробактеров в процессе прохождения жизненного цикла
существуют определенные трудности при их выделении и количествен-
ном учете. Микроскопический анализ выросших колоний обычно про-
водится на 2—3-й день после посева. При этом артробактеры на-
ходятся в колониях в виде кокковидных клеток. Это затрудняет
распознавание и дифференциацию от других кокковидных форм, в част-
ности от микрококков.
С целью определения артробактеров среди первоначально вы-
росших колоний кокковидных бактерий рекомендуется пересевать их
на МПА+ 7% глицерина. На этой среде штаммы артробактера образу-
ют нитевидные клетки, которые постепенно по мере старения фраг-
ментируются до кокковидных в отличие от микрококков, которые
растут в виде кокков [Квасников, Писарчук, 1980].
Существует ряд селективных сред для изолирования и количествен-
ного учета артробактеров. Наивысший процент артробактеров среди
выросших колоний получают, используя среду Хагедорна [Hagedorn,
Holt, 1975].
Среда Хагедорна для количественного учета артробактера
Триптический соевый 4 г Актидион 0,1 г
агар Агар 15 г
Дрожжевой экстракт 2 г Вода дистиллиро- 1000 мл
NaCl 20 г ванная
Метилрот, 0,015%-й 1 мл
раствор
pH устанавливают около 7. Производят рассев воды или грунта
с разведениями на среду указанного состава в чашки Петри.
Комбинация метилрота и актидиона эффективно ингибирует грибы,
актиномицеты, нокардии и грамотрицательные бактерии. На 10-е сутки
колонии из последнего разведения микроскопируют и кокковидные
формы пересевают, проводя в дальнейшем их идентификацию с учетом
цикла развития, свойственного артробактерам. За циклом развития
наблюдают, микроскопируя колонии через 8, 12, 20 ч после их повтор-
ного посева или используя для наблюдений камеру Пешкова. Для
окончательной дифференциации выросших штаммов необходимо при-
менять дополнительные тесты, как указано выше.
Для выделения коринеподобных бактерий полезно применять метод
77
предельных разведений на бедной питательной среде. Проба воды
отбирается в стерильную посуду. В качестве питательной среды ис-
пользуют воду из того же водоема. Ее разливают в пробирки по 9 мл и
стерилизуют в автоклаве [Романенко, 1985]. Посев производится
внесением в первую пробирку 1 мл пробы. Далее по 1 мл переносят
последовательно из первой до восьмой пробирки.
Через 7 дней инкубации пробирок при 20°из каждой пробирки де-
лают высев из ряда десятикратных разведений на МПА: 10. Из выросших
колоний делают посев на скошенный агар МПА:10. Наличие бакте-
рий рода Corynebacterium или Arthrobacter определяют предварительно
по особенностям морфологии клеток. Чистоту культуры проверяют
микроскопически, наблюдая за циклом развития в камере Пешкова
или отбирая пробы через 8—12 ч при росте на агаризованной
среде в чашках Петри. Дальнейшую идентификацию проводят, исполь-
зуя методы хемотаксономии.
Выделение проактиномицетов и нокардий. Но кардии относятся к
проактиномицетам и способны разлагать как свежие растительные
остатки, так и автохтонное органическое вещество гуминового про-
исхождения. Нокардии представлены многими видами. Одни из них
образуют бесцветные колонии, другие — желтые и красные. При разло-
жении растительных остатков на первых этапах наблюдается размно-
жение видов, образующих бесцветные колонии, позднее, когда обра-
зуются перегнойные соединения, начинают размножаться колонии с
красным пигментом.
На обычных питательных средах для сапрофитных бактерий но-
кардии образуют колонии, неотличимые от других бактерий. Их мож-
но, однако, легко выявить на бедных средах, где наблюдается их
мицелиальный рост. Отличительной особенностью проактиномицетов,
относящихся к роду Nocardia, служит их способность в качестве
источников азота использовать нитриты.
Среда для выделения нокардий
NaiCOi 1 г KiHPO< 0,5 г
NaNO2 ! г NaCI 0,5 г
FeSOr7H2O 0,1 г Дрожжевой экстракт 2 г
Агар 20 г Вода дистиллированная 1000 мл
MgSO4-7H2O 0,5 г
Видоизмененный агар Чапека для селективного выделения
нокардийиродококков
NaNOj 2 г Сахароза 30 г
К2НРО4 1 г Дрожжевой экстракт 2 г
MgSO<-7H2O 0,5 г Агар 15 Г
К Cl 0,5 г Вода дистиллированная 1000 мл
FeSO4-7H2O 0,01 г
Среда для селективного выделения нокардий
Куриные яйца 200 г Глицерин 6 мл Малахитовый зеленый, 6 мл 2%-й раствор Среду стерилизуют 1 ч при 90°. 78 Глюконат натрия, 1%-й 100 мл раствор в 1%-м растворе КН2РО4
Бактерии, содержащие газовые вакуоли
Газовые вакуоли [Walsby, 1974] были обнаружены исключительно
у водных бактерий, так как они способствуют плавучести этих орга-
низмов. При помощи газовых вакуолей они могут находить глубину,
наиболее подходящую для их развития. С этой точки зрения газо-
вые вакуоли служат как бы альтернативой жгутиков, позволяя
бактериям двигаться в вертикальном направлении. Для представи-
телей некоторых групп наличие газовых вакуолей используется в ка-
честве диагностического видового признака. Однако следует указать,
что появление газовых вакуолей в клетках иногда зависит от условий
их культивирования [Ert van, Staley, 1971].
Газовые вакуоли встречаются у представителей многих таксономи-
ческих групп бактерий. Кларк и Вальсби [Clark, Walsby, 1979], исследуя
озера Англии, наблюдали, что чаще всего эти бактерии встречаются
в анаэробных условиях в гиполимнионе стратифицированных озер
в летний период. К ним относятся:
1) фототрофные бактерии Chloroflexaceae, Chromatiaceae;
2) консорции фотосинтезирующих и сульфатредуцирующих бактерий
Pelochromatium rosea-viridis, зеленые нитчатые бактерии Chronema
giganteum;
3) скользящие бактерии семейства Pelonemataceae и др.;
4) обладающие чехлом Spirothrix pseudovacuolata;
5) почкующиеся бактерии Prosthecomicrobium;
6) спиральные и изогнутые бактерии семейства Spirosomaceae: Micro-
cyclus, Meniscus, Brachiarcus;
7) грамотрицательные бесцветные бактерии рода Lampropedia;
8) грамотрицательные хемоорганотрофные железоокисляющие бак-
терии Ochrobium tectum;
9) грамотрицательные кокки Lamprococcus;
10) метанообразующие бактерии семейства Methanobacteriaceae и ро-
да Methanosarcina;
11) палочки, образующие эндоспоры Clostridium sp., Desulfotoma-
culum acetooxidans;
12) ряд неидентифицированных бесцветных бактерий, широко рас-
пространенных в гиполимнионе стратифицированных озер.
Очевидно, что для каждого вида этих бактерий пригодны свои
питательные среды. Некоторые из них приведены в соответствующих
разделах настоящей книги.
Водородные бактерии
К водородным бактериям относят прокариоты, способные получать
энергию при окислении газообразного водорода с участием кислорода
в качестве акцептора и фиксировать углекислоту для построения тела,
т.е. расти хемолитоавтотрофно. Помимо получения энергии, газообра-
зный водород используется в конструктивном метаболизме для вос-
становления СО2, при этом на 5 молекул, используемых при дыхании,
1 молекула Н2 затрачивается в биосинтетических целях:
6Н2 + 20г + СО2 - (СН2О) + 5Н2О.
79
Таблица 8
Пути использования Нз
в различных физиологических процессах у бактерий2
Процесс Конечный акцептор электронов Конечный продукт
Восстановительное ассимили- СО2 Вещества клетки
рование углерода Дыхание О2 Н2О
Денитрификация NOj, NOL NO. N2O, NH2OH N2, NO° или NH3
Сульфатное дыхание SOl’, SOP. SjOf H2S
Серное дыхание s° H2S
Фумаратное дыхание Фумарат Сукцинат
Образование метана СОг, CO, HCOOH CH,
Образование ацетата CO2, CO ацетата
Группа водородных бактерий физиологически однородна, хотя вклю-
чает представителей разных таксономических групп. Число бактерий,
растущих хемолитотрофно за счет окисления водорода, велико, в на-
стоящее время они насчитывают представителей более чем 20 родов
грамотрицательных и грамположительных бактерий разной морфоло-
гии, размножающихся делением и почкованием, споровых и неспоро-
образующих. Число их постоянно увеличивается за счет описания
новых родов или обнаружения способности к окислению водорода и
к автотрофии у известных видов бактерий.
Пути использования газообразного водорода представителями раз-
личных физиологических групп суммированы в табл. 8. Для водород-
ных бактерий характерно сочетание первого и второго из перечислен-
ных в таблице процессов при автотрофном росте на водороде.
В группу водородных бактерий не включают микроорганизмы, у
которых способность к энергетическому использованию Нз сочетает-
ся с конструктивным метаболизмом строго гетеротрофного типа (на-
пример, у Azotobacter или Acetobacter) или наблюдается в анаэроб-
ных условиях с использованием иных, чем Оз, акцепторов электронов
(у сульфатредуцирующих, сероредуцирующих, метанообразующих и
других групп).
Все водородные бактерии, за небольшим исключением, — факульта-
тивные хемолитоавтотрофы, способные расти, используя в гетеротроф-
ных условиях самые разнообразные органические соединения. Неко-
торые из них могут использовать и одноуглеродные соединения более
восстановленные, чем СОз. При этом они могут служить одновременно
источниками углерода и энергии. К таким соединениям относятся
метанол, формиат, метиламин, СО.
Большинство из них относится к облигатным аэробам с выраженной
тенденцией к микроаэрофилии. Особенно чувствительны к кислороду
водородные бактерии, растущие хемолитоавтотрофно, что связано с
инактивирующим действием Оз на гидрогеназу — ключевой фермент
80
водородного метаболизма. Некоторые из водородных бактерий спо-
собны расти и в анаэробных условиях, используя вместо О2 в качестве
акцепторов электронов нитраты и нитриты. К ним относится, например,
Paracoccus denitrificans. Подробнее о водородной денитрификации
см. в разделе "Денитрификация и диссимиляционная нитратредукция”.
Имеются данные о возможности роста за счет использования Нг некото-
рых штаммов Thiobacillus denitrificans и Th. versutus, Thiosphaera panto-
tropha. В присутствии Hz и нитратов растут автотрофно также Alcaligenes
eutrophus, A. hydrogenophila, Campylobacter sp., Veillonella alcalescens
(Micrococcus lactilyticus), Pseudomonas pseudoflava, один из штаммов
Hyphomicrobium. К переключению с фотосинтеза на хемосинтез в тем-
ноте в автотрофных условиях способны и пурпурные бактерии Rhodop-
seudomonas capsulata, Rh. acidophila, Rh. sulfidophila, которые можно
также рассматривать как водородные бактерии.
Как правило, водородные бактерии мезофильны, хотя некоторые
относятся к термофилам с оптимумом развития при 50° и выше. К ним
относятся факультативно автотрофные грамположнтельные бактерии
Вас. schlegelii и новый род облигатно автотрофных водородокисляю-
щих термофильных бактерий, выделенных из горячих источников, —
Hydrogenobacter с видом Н. termophilus.
Ниже приводим перечень родов, среди которых обнаружены виды
водородных бактерий. К ним относятся Alcaligenes, Aguaspirillum,
Arthrobacter, Azospirillum, Bacillus, Blastobacter, Campylobacter, Com-
mamonas, Derxia, Escherichia, Flavobacterium, Hyphomicrobium, Micro-
coccus, Microcyclus, Mycobacterium, Nocardia, Paracocccus, Proteus,
Pseudomonas, Rhizobium, Rhodopseudomonas, Thiobacillus, Thiosphaera,
Vibrio, Xantobacter и упомянутые выше термофилы родов Hydrogenobac-
ter и Bacillus. Подробная характеристика водородных бактерий при-
водится в монографии Г.А. Заварзина [1978].
Культивирование водородных бактерий. Для выделения водород-
ных бактерий, как правило, используется минеральная среда Шлегеля
[Schlegel, 1961].
Среда Шлегеля [Schlegel et al., 1961}
Раствор I Раствор 2
NajHPOr 12НгО 9 г Железо аммо- 50 мг
КН2РО4 1.5 г нийно-лимонно-
NH.Cl 1,0 г кислое
MgSO4-7 Н2О 0,2 г СаС12-2НгО 100 мг
Раствор микро- 1 мл Вода дистил- 100 мл
элементов N 2 лированная
(см. прил.) Раствор 3
Вода дистилли- 1000 мл NaHCOj 5 г
рованная Вода дистил- лированная 1000 мл
Чтобы избежать образования осадка, следует готовить три отдельных
раствора, после стерилизации и охлаждения растворы смешивают в
соотношении 1 — 1000 мл,2 — 10 мл и 3 — 10мл,pH доводят до 6,8—7,0.
При изготовлении твердой среды к жидкой добавляют 1,7% очи-
6. Зак. 1766
81
щенного агара. При гетеротрофном росте бактерий в среду вместо
бикарбоната вводят 2 г глутамата натрия.
Выделение водородокисляющнх бактерий из ила на твердой среде.
1 г ила разбалтывают в 10 мл 0,9%-го раствора NaCl. Эту суспензию
или ряд ее разведений смешивают в чашке Петри с 20 мл свеже-
приготовленной агаризированной основной минеральной среды, охлаж-
денной до 45°. После того как агар застынет, чашки помещают в газовую
атмосферу, которая наиболее приспособлена для развития соответствую-
щей группы водородокисляющнх бактерий.
Можно также делать поверхностный посев на агаровую среду в чашке
Петри, внося на ее поверхность 0,02 или 0,1 мл болтушки и разма-
зывая шпателем по ее подсушенной поверхности. Для выделения во-
дородокисляющих бактерий из озерной или прудовой воды от 10 до
500 мл фильтруют через стерильный мембранный фильтр с порами от
0,22 до 0,45 мкм. Фильтры раскладывают на поверхности подсушенной
агаризированной минеральный среды в чашках Петри в эксикаторе
и создают газовую атмосферу в зависимости от того, какой вид
бактерий предполагается выделять. Поверхность агара должна быть
хорошо подсушена.
В этих условиях на поверхности агара вместе с водородными
бактериями могут вырасти и олигокарбофилы. Для того чтобы по
возможности отличить их от загрязнения, следует сделать простую
пробу на наличие гидрогеназы в исследуемых бактерий.
С этой целью после того, как подрастут бактерии, фильтр с агара
переносят на мягкую прокладку из фильтровальной бумаги, пропитан-
ную свежим 0,1-м раствором трифенилтетразолия, и выдерживают
10 мин при комнатной температуре в темноте. Редкие колонии за
этот короткий промежуток времени окрашиваются. Эти колонии могут
иметь поверхностное загрязнение и должны быть отброшены. Если
эти мембранные фильтры в дальнейшем выдерживать 10 мин в атмос-
фере водорода, то все колонии, обладающие гидрогеназой, окраши-
ваются в красный цвет в результате того, что трифенилтетразолий
переходит в формазан при участии гидрогеназы. Такая обработка
фильтра не легальна для бактерий, и окрашенные колонии можно
использовать для выделения чистой культуры.
При автотрофном культивировании водородных бактерий наиболее
благоприятная газовая смесь для большинства известных штаммов
содержит 5% кислорода, что соответсвует его растворимости в воде,
равной 1,8—2,0 мг/л, 10% углекислоты и 85% водорода. Но поскольку
газовая смесь из воздуха и водорода весьма взрывоопасна, то при
работе с водородокисляющими бактериями следует строго соблюдать
правила техники безопасности. Некоторые водородные бактерии хо-
рошо растут при наличии в атмосфере 20% Оз, 4—10% СОз и
65—70% Нз.
Культивирование микроорганизмов в атмосфере водорода и воздуха.
При выявлении в воде или илах аэробных или анаэробных водо-
родокисляющих бактерий можно получать культуры накопления и про-
водить их количественный учет во флаконах объемом 15—25 мл с ре-
зиновыми пробками и металлическими завинчивающимися колпачками.
82
В этих случаях нет необходимости использовать эксикаторы с газовой
смесью. Стерильные флаконы доверху заполняют стерильной минераль-
ной средой, закрывают резиновыми пробками и колпачками. Затем
вставляют в пробку две иглы от шприца, перевертывают флакон
отверстием вниз и через одну иглу вводят под давлением из га-
зометра газовую смесь приведенного выше состава. Через вторую
иглу вытесняют таким способом 2/3 жидкой среды, после чего ее
вынимают и дополнительно вводят смесь газа до создания неболь-
шого избыточного давления. В таком виде флаконы готовы для
введения посевного материала, посев производится шприцем. При раз-
витии бактерий, окисляющих водород, жидкость во флаконах стано-
вится мутной, а на границе с газовой фазой образуется бактериаль-
ная пленка.
При количественном учете водородных бактерий производят серии
разведений пробы и засевают ими подготовленные заранее флаконы,
как указано выше.
Карбоксидобактерии
Группа карбоксидобактерий объединяет аэробные бактерии, спо-
собные к росту за счет использования окиси углерода в качестве
единственного источника углерода и энергии:
24 СО + 11 О2 + Н2О - 23 СО2 + (СНзО),
В ее состав входят представители различных родов грамотрица-
тельных бактерий: Pseudomonas carboxidovorans, Seiiberia carboxidohyd-
rogena, Ps. gazotropha, Ps. carboxidoflava, Comamonas compransoris,
Achromobacter carboxydus.
Карбоксидобактерии могут расти автотрофно, ассимилируя СОг в
цикле Кальвина, или использовать различные органические соединения,
главным образом спирты и органические кислоты, а также метанол,
формиат. Ассимиляция СО в конструктивном обмене происходит после
окисления до СОг с участием особой оксидоредуктазы, находящейся
в растворимой фракции клеток. Электрон, по-видимому, далее передает-
ся на электронтранспортную цепь на уровне хинонов. Все карбо-
ксидобактерии, за исключением A. carboxidus, способны расти в авто-
трофных условиях, используя Нг в качестве донора электронов, поэтому
их рассматривают как особую подгруппу водородных бактерий.
Одним из интересных свойств карбоксидобактерий является их
устойчивостью к окиси углерода, обладающей высокой токсичностью
для других микроорганизмов в результате специфического ингиби-
рования терминальных оксидаз. Для некоторых карбоксидобактерий
показана устойчивость к содержанию в газовой фазе до 90% СО.
Концентрация СО в газовой фазе для выращивания карбоксидобакте-
рий составляет 20—95% для разных видов. В природных водных
средах, где растворимость СО низкая, — поверхностных океанских
водах, озерах — ее содержание очень низкое, примерно 0,1 нмоль по
объему, лишь в сточных промышленных водах содержание ее доходит
до 500 нмоль/л. В приземных слоях атмосферы в среднем содержится
83
около 5 нмоль СО в 1 л воздуха. Несмотря на предельно низкие кон-
центрации, атмосферная СО быстро используется почвенными организ-
мами. Ввиду слабой растворимости и низкой концентрации в природных
водах роль карбоксидобактернй в процессах ее окисления в водоемах
практически не изучалась.
Однако проведенные недавно исследования показали, что в океан-
ской и озерной воде при следовых концентрациях СО, порядка 1 нмоль
происходит ее быстрое потребление олиготрофными бактериями из
природной популяции водных микроорганизмов [Conrad, Seiler, 1982].
Интересно, что олиготрофные бактерии, полученные в накопительных
культурах, обладают очень высоким сродством к этому субстрату:
значения Кт для них оказались предельно низкими — 7—9 нМ СО.
Результаты Конрада и Зейлера показали, что атмосферная окись углеро-
да при концентрациях, не превышающих по объему величины
0,5—200 мкМ, может служить подходящим энергетическим источником
для специфической группы олиготрофных карбоксидобактернй. Мас-
штабы этих процессов в водных средах и их возбудители в настоя-
щее время практически не исследованы. Известно, что некоторые
водоросли, грибы выделяют СО в значительных количествах, ее образо-
вание происходит в целом ряде биологических процессов, например
при распаде порфиринов, серина, флавоноидов и других органических
веществ, сток СО в водоемы осуществляется также при техногенных
загрязнениях из атмосферы. Поэтому исследования интенсивности
микробиологических процессов окисления СО в водоемах и их возбуди-
телей имеют большое значение.
Культивирование карбоксидобактернй. Для изоляции и культивиро-
вания карбоксидобактернй применяется среда Шлегеля, используемая
и для водородных бактерий, но концентрация фосфатного буфера может
быть снижена вдвое.
Состав газовой смеси для карбоксидобактернй содержит варьирую-
щие количества СО — от 80 до 20% и менее, в зависимости от источников
выделения и видовой специфичности. В смесь вводят 20% кислорода,
чистого или в смеси с инертным газом.
Инкубация посевов при 25—30°. О развитии бактерий судя по по-
мутнению среды через 5—30 сут, а также по результатам газохрома-
тографического анализа газов в среде.
Для изоляции чистых культур предварительно очищают культуру
путем ряда последовательных пересевов. Для выделения чистых куль-
тур иногда используют среды с добавлением витаминов группы В (Bi,
Вп).
При работе с СО следует предпринимать особые меры предосторож-
ности. Окись углерода токсична, а в смеси с воздухом и взрывоопасна,
поэтому необходимо строго соблюдать правила техники безопасности,
следить за отсутствием открытого огня.
Окись углерода в баллонах, как правило, загрязнена водородом.
Поэтому ее следует приготовлять в лаборатории. К нагретой до 80°
концентрированной серной кислоте в колбе Вюртца добавляют кон-
центрированную муравьиную кислоту при помощи перистальтического
насоса. Газ пропускают через промывалку с 20% КОН и собирают в
84
газометр, а затем используют для приготовления необходимой газо-
вой смеси и заполнения сосудов для культивирования.
Для получения накопительных культур олиготрофных карбокси-
добактерий из водной природной среды, где концентрация СО низкая,
Конрад и Зейлер рекомендуют следующий прием [Conrad, Seiler,
1982]. В сосуды объемом 300—500 мл к 60 мл пробы озерной
воды добавляют 10 мл минеральной среды Шлегеля. Сосуд вакууми-
руют и через жидкость устанавливают ток газовой смеси, содержащей
0,5—1% СО, со скоростью примерно 3 л/ч. Газовая смесь, прошедшая
через колбы с пробой воды, поступает в приемник и в дальнейшем
анализируется. При работе с СО необходимо соблюдать тщательную
предосторожность, чтобы избежать утечки угарного газа. Контро-
лем служит сосуд, через который пропускают газовую смесь без СО.
О развитии карбоксидобактернй судят по снижению содержания СО в га-
зовой фазе, прошедшей через сосуд, по мере развития бактерий в
культуре накопления.
Метилотрофные бактерии
Многие, микроорганизмы обладают способностью использовать ме-
тан и его окисленные и замещенные производные (Ci-соединения)
в качестве источника углерода и энергии. Все метнлотрофы под-
разделяются на облигатные и факультативные. Облигатные метилотро-
фы способны расти в результате использования только Ci-соединений,
а факультативные — на средах и с другими субстратами.
Особую группу среди метилотрофов составляют метанокисляющие,
или метанотрофы. В свою очередь, их также подразделяют на обли-
гатные и факультативные метанотрофы- Первые способны использо-
вать метан и его одноуглеродные замещенные и окисленные произ-
водные, но не соединения, содержащие С—С-связи. Факультативные
метанотрофы способны окислять как метан, так и полиуглеродные
соединения.
Кроме того, окислять Ci-соединения может ряд других
микроорганизмов из числа хемотрофов и фототрофов. Но их рост
зависит от наличия многоуглеродных органических соединений, кото-
рые используются в конструктивном обмене. К числу факультативно
метилотрофных организмов относятся некоторые метаногены, сульфат-
редуцирующие бактерии, представители родов Citrobacter, Proteus,
Campylobacter, Veillonella, Selcnomonas, Vibrio, а также ряд эукариотных
микроорганизмов. К числу последних принадлежат дрожжи из родов
Candida, Hansenula, Pichia, Torulopsis, Rhodotorula, а также некоторые
мицелиальные грибы — Thichoderma, Glioladium, Penicillum и др.
Метанокисляющие бактерии
В 1970 г. Виттенбари и его сотр. [Whittenbury etal, 1970] разработали
технику получения накопительных и чистых культур метанокисляю-
щих бактерий. Они выделили около 100 штаммов чистых культур, что
дало возможность разработать основную схему их классификации. В
дальнейшем ряд новых видов был выделен В.Ф. Гальченко с соавт.
85
[1975] и украинскими исследователями под руководством Ю.Р. Мала*
шенко [1978]. Все метанокисляющие бактерии облигатно используют
Ct-соедннения, за исключением Methylobacterium organophilum, кото-
рый может использовать и глюкозу.
По Виттенбари, все облигатные метанотрофы обладают перечис-
ленными ниже особенностями.
1. Это палочки, кокки или вибрионы, грамотрицательные аэробы.
2. Обладают активной каталазой и оксидазой, имеют цитохромы
а, с и о или Ь.
3. Чувствительны к кислороду, особенно это относится к видам,
обладающим способностью фиксировать свободный азот.
4. Все используют метан, метанол, метилформиат и формальде-
гид как единственный источник углерода и энергии. Метанол может
быть использован лишь в очень небольших концентрациях, порядка
0,05%.
5. Углекислота, ацетат и соокисляемые субстраты, такие, как этанол
и другие, могут служить дополнительными источниками углерода.
6. Все виды в качестве источника азота используют аммоний, мно-
гие — нитраты, некоторые — мочевину и дрожжевой экстракт.
7. Все восстанавливают нитраты до нитритов, но не могут расти
на метане в анаэробных условиях.
8. Многие соокисляют аммоний, СО, пропан, этанол, пропанол и
другие соединения, но не могут на них расти в отсутствие метана.
9. Все могут образовывать покоящиеся формы —экзоспоры, "липид-
ные* цисты или цисты типа Azotobacter.
10. Обладают сложной системой внутрицитоплазматических мембран
I или П типа.
11. Многие виды пигментированы: колонии окрашены в желтый,
розовый, красный или коричневый цвет. Характер пигментации исполь-
зуют для целей диагностики.
12. Некоторые виды образуют капсулы или покрыты слизью.
В таксономическом отношении все известные облигатные мета-
нотрофы объединены в семейство Methylococcae (табл. 9).
Выделение и подсчет количества метянокисляющих бактерий.
Известные виды метанотрофов растут только при наличии в среде
кислорода, хотя у некоторых видов отмечается тенденция к микро-
аэрофилии. Как правило, они не нуждаются в дополнительных фак-
торах роста или витаминах и растут на простых по составу мине-
ральных средах в атмосфере метана или с добавлением Ci-coe-
динения. В качестве источника азота используют нитраты или аммо-
ний, а некоторые фиксируют азот. Аммоний используется многими
вадами метанотрофов не только в процессах конструктивного обмена,
но и в энергетическом обмене, как у тарификаторов I фазы,
с окислением аммония до гидроксиламина и нитритов.
1. Культивирование метанотрофов обычно осуществляют в газо-
вой смеси, содержащей смесь метана и воздуха в соотношении
30:70, иногда — природный газ, не содержащий примесей этана
и пропана. При использовании газовой смеси с чистым метаном необ-
ходимо добавлять 2% углекислоты.
86
Таблица 9
Облигатные метанотрофные бактерия
Род
Форма клеток
Тип внутрикле-
точных мем-
бран*
Methylosinus
Methylocystis
Methylomonas
Methylobacter
Methylococcus
Палочки с полярно расположенными жгутиками,
грушевидное формы, образуют розетки и экзоспоры
Неподвижные изогнутые палочки, образуют розетки,
экзоспор нет
Палочки с полярно расположенными жгутиками
Палочки с полярно расположенными
жгутами и кокки, образуют цисты
Неподвижные кокки
II
II
I
I
* Мембраны I типа имеют форму пузырьков, мембраны II типа — ламеллярного
строения, располагаются по периферии клетки. Бактерии, имеющие мембраны I типа,
ассимилируют Ci-соединения через рибулозомонофосфатный цикл, а имеющие II тип
мембран — через сериновый цикл.
Виттенбари рекомендует для культивирования две минеральные
среды, отличающиеся по источнику азота: одна содержит аммоний-
ный азот, другая — нитратный.
Среда Виттенбари для метанокислящих бактерий
[IVhittenbury et al., 1970]
Раствор 1
MgSO<-7 НгО 1 г
CaCh 0.2 г
Комплекс солей железа 4 мг
NH.C1 °’5 г
KNO, 1 г
Раствор микро- 5 мл
элементов N 1
(см. прил.)
Вода дистил- 1000 мл
Раствор 2
КНгРОд 15 г
NajHPO* 12Н2О 15 г
Вода дистил- 300 мл
лнрованная
лированная
До автоклавирования pH доводят до 6,8. После того как авто-
клавированный раствор 1 остынет до 60°, в него добавляют 2 мл
стерильного раствора 2.
При приготовлении твердой среды необходимо использовать наи-
более чистый агар, чтобы избавиться от посторонней микрофлоры.
2. Поскольку все метанокисляющие бактерии растут на метано-
ле, А.И. Саралов и др. [1984] рекомендуют для учета метано-
кисляющих бактерий использовать агаризированную среду Виттен-
бари с добавкой 0,5% метанола. Посев производится с десятикрат-
ным разведением в чашки Петри. В последних разведениях, когда
появятся отдельные колонии, их подсчитывают (каждый тип колоний
87
отдельно) и 2—3 колонии каждого типа, преимущественно окрашенные,
отсевают на жидкую среду, помещают в эксикатор с 30% СНд,
3% СОз и 70% воздуха и таким образом проверяют их способ-
ность к окислению метана.
Из колоний тех культур, которые дали рост на смеси метана
и воздуха, делают отсев на агаризированную среду с метанолом.
Получение чистых культур метанотрофов. В склянку на 250 мл
вносят 25 мл питательной среды, заражают ее 1 мл озерного ила
или воды и закрывают резиновый пробкой. Смесь из СНд и 2% СОг
содержат в футбольной камере. Отсюда шприцем берут 20 мл смеси
газа и через резиновую трубку вносят в склянку. В дальнейшем
засеянные склянки инкубируют при соответствующей температуре,
о начале развития судят по появлению пленки или по помутнению
среды. Пересев на стерильную жидкую среду делают последовательно
3—4 раза и затем с разведением высевают на агаризированную
среду. Если пересев сделать из первого посева, то на агаровой
пластинке вырастает больше разных видов бактерий, из последующих
пересевов на агаре развиваются виды, доминирующие в исходной
пробе.
Образование колоний на агаровых пластинках, которые инкубиру-
ются в вакуум-эксикаторе в атмосфере СН< и воздуха в соотно-
шении 1:4, следует контроливать каждые 3—4 дня в течение 3—4 нед.
Постороннее загрязнение колоний следует проверять под микроскопом,
отбирая материал иглой. Заражение может быть Pseudomonas, гри-
бами и простейшими.
В.Ф. Гальченко и др. [1984] исследовали 7 видов (11 штаммов)
метилотрофных бактерий: Methylosinus trichosporium, М. methanicus.
Methylocystis echinoidus, M. minimus, M. pyriformis, Methylobacter
bovis, Methylomonas methanica. Они показали, что изученные штаммы
метанотрофных бактерий хорошо растут на средах при одновременном
присутствии метана и метанола.
Среда для метанотрофных бактерий
[Гальченко и др., 1984]
KNOj
MgSO« 7 Н2О
CaCh
Na2HPO«
.КН2РО4
ЭДТА днна-
триевая соль
FeSOr 7 Н2О
ZnSO*-7 Н2О
1 Г MnCli-4 Н2О
0,2 г СоС1г6 Н2О
0,02 г CuCh-5 HjO
1,5 /т О гио NiCh-б Н2О
0,7 г fib? рЦСЦ NajMoO*
4 мг '~у ' йлпа пигтип.
30 мкг
200 мкг
100 мкг
20 мкг
30 мкг
1000 мл
2 мг
100 мкг
лированная
pH устанавливают до 6,8. Метан в смеси с воздухом (1:4)
стерилизуют через ватный фильтр. Метанол стерилизуют в запаянных
ампулах 1 ч при 121°. В среду добавляют от 0,01 до 4% мета-
нола.
В.Ф. Гальченко с соавт. рекомендуют определять физиологическую
активность исследуемых культур в пенициллиновых флаконах, содержа-
88
щих 5 мл бактериальной суспензии и 10 мл смеси метана с возду-
хом (1:4), по убыли СНд за 0,5—20 ч экспозиции при 30°. Для
анализов отбирают газ из опытных и контрольных (исходных)
склянок шприцем через резиновую пробку и анализируют на га-
зожидкостном хроматографе содержание СН<.
Факультативные метилотрофные бактерии
Круг организмов, использующих для роста Ci-соединения, но не
метан, очень широк. К ним относятся представители многих таксо-
номических групп с разными физиологическими свойствами, как
аэробные, так и факультативные и строгие анаэробы.
К облигатным метилотрофам, использующим только Ci-соединения
(но не метан), относятся представители родов Methylophilus (М. metha-
novorus, М. methylotrophus), Methylobacillus (М. glicogenes, М. methy-
.lophilus), Methylomonas (7 видов).
Среди факультативных метилотрофов к строгим аэробам относятся
представители более чем 20 родов, среди них, например, Pseudo-
monas (15 видов), имеющие розовую окраску колоний, Achromo-
bacter, Alcaligenes, Brevibacterium, Blastobacter, Comamonas, Micro-
cylus, Mycobacterium, Nitrobacter, Nocardia, Streptomyces, Xantobacter,
Vibrio, два вида Thiobacillus (Th. novellus и Th. versutus (Th. A 2)).
Из факультативно анаэробных метилотрофов специализированную
группу составляют представители рода Hyphomicrobium. Сюда же
входят представители родов Alcaligenes, Klebsiella, Paracoccus, не-
которые пурпурные несерные бактерии. Строго анаэробные метилотро-
фы имеются среди видов родов Acetobacterium, Acetogenium, Bu-
tyribacterium, серо- и сульфатредуцирующих бактерий Desulfococcus,
Desulfosarcina, Desulfovibrio и метановых бактерий Methanobacterium
и Methanosarcina.
В отличие от облигатных метанотрофов у метилотрофов отсут-
ствуют развитые системы внутриклеточных мембран. Большинство
из них нуждается в витаминах и других факторах роста.
Из Ci-соединений большинство видов способны использовать мета-
нол *и метилированные амины (метиламин, диметиламин, тримети-
ламин, триметиламмоний, триметилсульфатаммояий, (СНз)з NHx,
(SO4)2 диметилсульфид), реже — формальдегид и формиат. Как
правило, концентрация этих соединений в питательных средах не
превышает 1—5 г/л.
Выделение и культивирование факультативных метилотрофов. Для
получения накопительных и чистых культур микроорганизмов, усваи-
вающих Ci-соединения, используется среда Виттенбари приведенного
выше состава с нитратами в качестве источника азота.
В качестве источника энергии и углерода добавляют 1% мета-
нола, метиламина или формиата, — в зависимости от того, какой
организм хотят выделить. Используют обычную технику выделения:
жидкая культура накопления или непосредственно посев из проб
природного материала на агаризированную среду и далее посев
из выросших отдельных колоний на скошенный агар того же со-
става. „
Методы количественного учета и идентификации метанотрофов
в природных условиях. Для определения численности метанотрофов
в водоемах широко используется метод посевов с разведениями на
жидкие и плотные питательные среды. Для этих целей наиболее
благоприятной является среда Виттенбари, причем необходимо одно-
временно производить высев на среду как с аммонийным, так и с
нитратным азотом. Как и в случае с элективными питательными
средами, использование одной среды не дает возможности выявить
все многообразие метанотрофов в природе. В ряде случаев реко-
мендуется добавлять к стандартной среде 5—10% исследуемой при-
родной воды, простерилизованной путем фильтрации. Как уже указы-
валось, при приготовлении плотных питательных сред рекомендуется
использовать только высокоочищенный агар [Whittenbury et al.,
1970] или кремневый гель [Гальченко и др., 1975]. Способ приготов-
ления кремневого геля см. в приложении.
Другой метод учета метанотрофов состоит в подсчете колоний
микроорганизмов, выросших на поверхности мембранных фильтров,
которые после фильтрации.исследуемой пробы инкубируют на поверх-
ности плотной среды Виттенбари в смеси метана и воздуха.
Углеводородокисляющие бактерии
Первые наиболее обстоятельные работы о бактериальном окислении
углеводородов были опубликованы В.О. Таусоном в 1934 г. Он уста-
новил, что бактериальному окислению подвергаются как алифатиче-
ские, так и циклические углеводороды, и выделил ряд культур,
окисляющих алканы, бензол, нафталин и антрацен.
Дальнейшие исследования ряда авторов показали, что микробио-
логическому воздействию наиболее доступны алифатические углево-
дороды, в их разрушении принимают участие многие грамположитель-
ные и грамотрицательные бактерии, микроскопические грибы и дрож-
жи. Способность к окислению углеводородов обнаружена у предста-
вителей родов Pseudomonas, Achromobacter, Flavobacterium, Cory-
nebacterium, Arthrobacter, Micrococcus, Alcaligenes, Bacillus, Vibrio, Aci-
netobacter, Mycobacterium, Nocardia, Rhodococcus, Mycococcus, Acti-
nomyces, Streptomyces. В значительной мере разрушение углеводоро-
дов осуществляют микроорганизмы, объединенные в группу корине-
формных бактерий.
Алифатические углеводороды, как правило, используются бактери-
ями легче, чем ароматические и циклические. Микроорганизмы,
развивающиеся на ароматических соединениях, принадлежат в основ-
ном к роду Pseudomonas.
Нерастворимые в воде углеводороды, в частности, алканы с дли-
ной цепи Сю и выше, окисляют микроорганизмы родов Согупе-
bacterium, Arthrobacter, Mycobacterium, Nocardia, Rhodococcus, Acine-
tobacter. При росте на нерастворимых углеводородах псевдомонады
выделяют во внешнюю среду поверхностно-активные вещества, спо-
собствующие проникновению углеводородов внутрь клетки, где проис-
ходит их окисление. Бактерии других родов содержат поверхностно-
90
активные вещества в клеточной стенке или в капсуле [Rosenberg,
1986].
Для учета углеводородокисляющих бактерий рекомендуется при-
менять 3 варианта сред: среду с нефтью, где, как правило, выра-
стают псевдомонады, образующие муть и осадок в среде, среду
с гексадеканом, способствующую выявлению представителей других
перечисленных родов, образующих пленку на границе контакта вод-
ной среды и углеводорода, а также среду с летучими углеводо-
родами.
Определение численности нефтеокисляющих микроорганизмов. Для
количественного учета численности нефтеокисляющих бактерий
Е.П. Розанова и Т.Н. Назина [1982] рекомендуют использовать
следующий метод. В пробирки Хангейта или в пенициллиновые фла-
коны объемом на 25 мл вносят 9 мл стерильной минеральной
среды Раймонда.
Среда Раймонда для бактерий, окисляющих нефть
NH4NO3 2 г
MgSO< 7 Н2О 0,2 г
КН2РО. 2 г
NasHPCh 3 г
CaCh-6 Н2О 0,01 г
Na2CO5 0,1г
MnSOrS Н2О, 1%-й раствор 2 мл
FeSOr 7НгО, 1%-й раствор 1 мл
Вода дистиллированная 1000 мл
1%-Й раствор FeSCh в 1%-й HCI и 1%-й раствор МпЗОд готовят
отдельно и добавляют в среду перед посевом. 10% нефти эмульги-
руют в дистиллированной воде с добавлением 0,05% твина 80 на
аппарате УЗДН-1 при силе тока 0,2 А и частоте 44 кГц в течение
5 мин; эмульсию стерилизуют в герметично закрытом флаконе при
0,5 атм.
После приготовления разведений и внесения нефти пенициллиновые
флаконы закрывают резиновой пробкой и закрепляют металлическим
колпачком. Указанного количества кислорода в газовой фазе доста-
точно для выявления наличия аэробных углеводородокислящих бакте-
рий.
Посевы инкубируют при температуре, близкой к естественной, в
течение трех недель (в отсутствие термостата — месяц). Для опреде-
ления количества нефтеокисляющих бактерий в лаборатории ана-
лизируют изменение давления во флаконах, используя манометр на
отрицательное давление, снабженный стерильной иглой от шприца.
Давление ниже 1 атм будет свидетельствовать о потреблении О2
газовой фазы и укажет на развитие углеводородокисляющих- бакте-
рий в разведениях. Этот метод удобен при массовых анализах
углеводородокисляющей микрофлоры. Кроме того, полезно выявить
образование СОг хроматографическим анализом газовой фазы.
Вывод о развитии углеводородокисляющих бактерий подтверждают
визуальными наблюдениями помутнения водной фазы, появления пиг-
ментов, образования осадка, а также по подкислению водной среды.
Визуальные наблюдения за развитием микроорганизмов должны сопро-
вождаться микроскопическим контролем.
91
Определение численности гексадеканокисляющих бактерий. Проце-
дуры посевов и культивирования для определения численности гекса-
деканокисляющих бактерий сходны с процедурами определения нефте-
окисляющих бактерий, за исключением того, что вместо нефти вно-
сят в том же количестве простерилизованный (при 0,5 атм) гекса-
декан. О развитии бактерий судят по потреблению кислорода, а
также визуально по образованию бактериальной пленки на границе
водная фаза — гексадекан, по эмульгированию гексадекана, наличию
клеток, пигментации и подкислению среды.
Для выделения микроорганизмов, использующих летучие углево-
дороды, в частности углеводородокисляющих псевдомонад, исполь-
зуют среду Мюнца в атмосфере пентана или другого летучего
углеводорода.
Как правило, летучие жидкие ароматические углеводороды ток-
сичны в высоких концентрациях для микроорганизмов. Поэтому для
создания газовой фазы, содержащей пары углеводородов, их помещают
в открытом сосуде на дно эксикатора, в котором выдерживают кол-
бочки с накопительными культурами.
Среда Мюнца для бактерий,
окисляющих летучие углеводороды
С,—С? в газовой фазе К?НРО4 0,5 г
NH.C1 1 г MgSO<7 Н?О 0,5 г
КНгРО4 0,5 г Вода водопроводная 1000 мл
Культивирование производится в эксикаторе в атмосфере воз-
духа и паров жидких углеводородов (пентан).
Рост бактерий, использующих жидкие ароматические углеводоро-
ды, регистрируется по мутности или по образованию пленки после
месячной экспозиции. Количественный учет этих бактерий производят
методом посева с десятикратными разведениями на среде Мюнца.
АНАЭРОБНОЕ РАЗЛОЖЕНИЕ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
Значительная часть органического вещества, поступившего в водоем,
подвергается распаду в аэробных условиях. Частично этот процесс
в евтрофных водоемах происходит в анаэробных слоях воды в гипо-
лимнионе при участии анаэробных или факультативно анаэробных
бактерий, многие из которых имеют газовые вакуоли. Основная
масса органического вещества, состоящего из остатков высшей расти-
тельности фитопланктона и зоопланктона, разлагается в иловых
отложениях с образованием метана или сероводорода, если в воде
имеется достаточное количество сульфатов. Схема процессов анаэ-
робного разложения органического вещества приведена на рис. 16.
Анаэробная биодеградация биополимеров происходит в три-четыре
последовательных этапа. Начальной стадией разрушения полиме-
ров является их гидролиз до мономеров — низших кислот и спир-
тов.
Среди микроорганизмов, осуществляющих анаэробное сбраживание
органических веществ, существует несколько специализированных
92
Рис. 16. Процессы анаэробного разложения органического вещества в водоемах
групп бактерий, различающихся главным образом по продуктам
брожения. К ним относятся ацетогенные бактерии, включающие более
узкоспециализированную группу, осуществляющую гомоацетатное бро-
жение, маслянокислые бактерии и метанообразующие бактерии, или
метаногены. За исключением гомоацетатного и метанового брожения,
в других указанных выше процессах в числе продуктов образуется
молекулярный водород. Следует добавить, что образование моле-
кулярного водорода происходит не только в результате сбраживания
органических веществ (углеводородов, белков, аминокислот) типич-
ными ”бродильщиками”. Этот процесс могут осуществлять многие
микроорганизмы не только в анаэробных, но и в микроаэробных
и даже в аэробных условиях. Так, выделение водорода обнаружено
у некоторых сульфатредуцирующих бактерий в отсутствие сульфатов
при сбраживании пирувата или при окислении этанола, лактата,
формиата. Кроме того, оно может происходить у этих бактерий и в
присутствии сульфатов при одновременном протекании процессов
сбраживания и окисления лактата. У многих фототрофных бакте-
рий (пурпурных, зеленых, цианобактерий, а также у некоторых
водорослей) выделение Н2 происходит как в процессе фотосин-
теза, так и в ходе темнового метаболизма. Вопросы, связанные с
образованием и использованием молекулярного водорода, подробно
освещены в монографии Е.Н. Кондратьевой и И.Н. Гоготова
[1981].
На третьей, ацетогенной, или водородной, стадии различные вос-
становленные продукты брожения превращаются в ацетат, водород
93
Таблица 10
Организмы, сбраживающие органические вещества
в анаэробных условиях
Организм Используемый субстрат Продукты брожения
Ацетат образующие бактерии, или цетогены
Clostridium thermocelium Целлюлоза Целлобиоза, глюкоза Глюкоза, этанол,ацетат Н2 и СОг Ацетат, этанол, Нг, СОг^актат
Bacteroidaceae шт. NRG 2248 Acetivibrio cellulolythicus Целлюлоза Восстанавливающие сахара, ацетат, Нг + СОг Этанол, ацетат, Нг, СОг
Cl. pectinofermentans Пектин Нг, ацетат, летучие жирные кислоты
Cl. thermohydrosulfuricum Глюкоза, целлобиоза, кси- лоза Этанол, ацетат, Нг, СОг лактат
Selenomonas ruminantium Углеводы, целлюлоза Лактат, пропионат, ацетат, СОг
Thermoanaerobacter Крахмал, целлобиоза, глю- Этанол, ацетат, лактат, СОг
ethanolicus коза, ксилоза, рибоза Нг
Thermobacteroides Целлобиоза, глюкоза, крах- Этанол, ацетат, Нг, СОг (бу-
acetoethylicus мал тират)
Ancalomicrobium sp. Глюкоза Ацетат, формиат, лактат, эта- нол, Нг, СОг
Ruminoccocus flavefaciens Целлюлоза Сукцинат, ацетат. фор- миат, Нг
R. pasteurii /.-тартрат, цитрат, оксалат, пируват, различные сахара Ацетат, формиат, этанол, СОг
Cl. thermocelium Целлюлоза, целлобиоза Этанол, ацетат, лактат, Нг, СОг
Ci. lentocellum Целлюлоза, гликоген, эску- лин, пируват, ряд сахаров Этанол, ацетат, Нг, СОг * немного лактата
Бактерии, осуществляющие гомоацетатное брожение
Ci. aceticum СОг * Нг Ацетат
Cl. formicoaceticum Cl. thermoautotrophicum Cl. acidiurici Cl. cylindrosporum Acetobacterium woodii Acetogenium kivui Cl. magnum Clostridium 99 Cl. purinolythicum Глюкоза, формиат " H: + СОг сахара и органи- ” ческие кислоты Углеводы ” Нг + СОг, глицерин, глюко- ” за, фруктоза, метанол, фор- миат Ванильная кислота Протокатехиновая кислота + метанол СОг + Нг, глюкоза, манноза. Ацетат фруктоза, пируват, формиат Глюкоза, фруктоза, сахаро- ” за, ксилоза, ацетон, малат, цитрат, ацетоин, 2,3-бутан- диол Метанол, Нг * СОг Нг, СОг, ацетат Восстанавливающие сахара. Ацетат глицерин
94
Таблица 10 (продолжение)
Организм Используемый субстрат । Продукты брожения
Butyribacterium redgerii Sporomusa sphaeroides Углеводы " Нг + СОг, глицерин, лактат, ” пируват, этанол, пропанол, серин, бетаин, диметилгли- цин, метанол, формиат, эти- ленгликоль
S. ovata Нг + СОг, фруктоза, лактат, ” пируват, этанол, пропанол, бутанол, бетаин, диметил- глицин, саркозин, метанол, формиат, пируват
S. acidovorans Нг + СОг, фруктоза, рибоза, ” сукцинат', глицерин, фума- рат, метанол и формиат
B. methylotrophica Глюкоза, сахароза, глице- Ацетат, СОг рин, лактат, пируват * для роста СО, метанол Метанол+ацетат+СОг Ацетат + Н* Нг + СОг Ацетат СО
Acetoanaerobium notaiae Diplococcus glycinophilus Н2 ♦ СОг Углеводы, глицин
Синтрофные ассоциации анаэробных бактерий
Syntrophobacter wolinii Разрушает пропионат, pa- Нг + СОг стет синтрофно с метано- образующими или сульфа- тредуцирующими бактери- ями
Syntrophomonas wolfii Масляная и другие жирные Ацетат + Нг кислоты с нечетным числом атомов углерода
Cl. bryantii синтрофно c Капроновая или другие ки- Ацетат и Нг или СН« слоты от С« до Си
D. vulgaris Маслянокислые бактерии
Cl. butyricum Пектин, крахмал Нг, СОг, метанол, ацетат, эта- нол, бутират Целлюлоза Нг, СОг, ацетат, этанол, бу- тират
Cl. pasteurianum Глюкоза, галактоза, фрук- тоза, сахароза и др. сахара
Cl. kluyveri Cl. cellobioparum Cl. cellulovorans Eubacterium cellulosovens Смесь этанола и ацетата Бутират, капроат, Нг Глюкоза Нг, этанол, лактат, бутират Целлюлоза То же " Глюкоза, Нг, фумарат, бути- рат, лактат
95
Таблица 10 (окончание)
Организм Используемый субстрат Продукты брожения
Bacteroides succinogenes Другие бродильщики Целлюлоза Сукцинат
Eubacterium iimosum Ряд сахаров Н2, СОг
Cl. cellobioparum Anaeroplasma sp., st. London Анаэробные грибы из рубца llybacter tartaricus Целлюлоза Глюкоза Целлюлоза Z.-тартрат, цитрат, пируват, глюкоза, фруктоза, раффи- ноза глицерин СН< Нг, СОг И жирные кислоты Ацетат, этанол, СОг, фор- миат, лактат. Нг Ацетат, этанол, формиат
Термофильные бродилыцики (развиваются при 70—80°)
Thermoanaerobium Ряд сахаров Ацетат, этанол,
Thermoanaerobacter To же СОг, Яг, лактат
Thermobacteroides То же
Thermodesulfobacterium ••
Dictioglomus spp.
Dictfoglomus turgidus J Крахмал, целлюлоза, гли- коген, лигнин, гуминовые кислоты, пептон, гидроли- зат казеина,сахара
и СОг при участии главным образом ацетогенных бактерий, осу-
ществляющих гетероферментативное и гомоацетатное брожение.
На четвертой, последней стадии анаэробной деструкции органи-
ческих веществ ряд продуктов брожения (Нг, ацетат, метанол и др.)
при участии высокоспециализированной группы метанообразующих
бактерий, или метаногенов, расходуются с образованием метана.
Перечень основных групп микроорганизмов, участвующих в процессах
брожения органического вещества, приведен в табл. 10.
Общие правила выделения строгих анаэробов
Многие анаэробы растут только при очень низком окислитель-
но-восстановительном потенциале. Поэтому необходимо защищать
среды и культуры даже от кратковременного контакта с кислородом
воздуха.
При работе с анаэробными микроорганизмами следует соблюдать
ряд правил.
1. Все жидкие и агаризованные среды готовят в анаэробных
боксах в атмосфере, состоящей из 80% азота и. 20% углекислоты.
Следы кислорода удаляют из смеси, пропуская ее через колонку,
заполненную медной стружкой, нагретой до 350°. Медь чернеет
после ее полного окисления. Для регенерации меди ее выдерживают
96
Рис. 17. Посев образцов болтушки ила в анаэробных условиях
1 — плоский флакон; 2 — слой агара; 3 — шпатель из пастеровской пипетки;
4 — инъекционная игла, по которой поступает газ во флаконы; 5 — ватный фильтр,
6 — резиновая пробка; 7 — трубка, по которой подается азот или смесь Н2 + СО1
Рис- 18. Микрогазометр для наполнения флаконов и пробирок газом
1 — зажим Мора; 2 — стеклянная трубка; 3 — игла от подкожного шприца;
4 — подкожный шприц
в атмосфере, содержащей не менее 3% Hi. Можно избавиться
от следов кислорода, пропуская ток газа через специальную склянку
с раствором цитрата титана (III). При обесцвечивании раствора
его сменяют.
2. Восстанавливающие агенты (см. табл. 11) вносят после авто-
клавирования или непосредственно перед посевом в предварительно
прокипяченную и быстро охлажденную в токе бескислородной газо-
вой смеси среду.
3. В жидкие среды вводят 0,5—1 г/л агара, что способствует
уменьшению конвекционных потоков.
4. Среды не следует хранить в холодильнике.
5. Культуры разводят в пробирках или флаконах с ростовой
средой или в свежеавтоклавированном растворе, содержащем вос-
станавливающий агент.
6. Во время разлива среды во флаконы для культивирования
над ее поверхностью пропускают ток бескислородного газа. Следует
предварительно продувать газом пробирки и флаконы перед их за-
полнением.
7. Браун с соавт. предложили удобный способ для выделения
анаэробных бактерий в плоских флаконах [Braun et al., 1979].
Этот метод удобен для изолирования отдельных колоний при вы-
делении культур анаэробов. Можно использовать для выращивания
анаэробов и чашки Петри. В этом случае инокулированную среду
разливают в чашки под током газовой смеси и плотно прижимают
ее перевернутой крышкой, так, чтобы не оставалось пузырьков
газа между агаром и крышкой.
8. Культивирование ведут в специальных плоских флаконах (рис. 17)
или в пенициллиновых флаконах, снабженных завинчивающимися
алюминиевыми колпачками с отверстием для инъекций через рези-
новую пробку.
7. Зак. 1766
97
Таблица 11
Восстанавливающие агенты, применяемые
при культивировании анаэробов
Соединение* 1 Ео, мВ Концентрация в среде, %
Тиогликолат натрия -100 0,05
-200 0,1
Цистеин солянокислый -210 0,025
Дитиотрейтол -330 0,05
Титан(Ш)-цитрат -480 0,5—2**
NajS-9 HiO -570 0,026
Цистеин солянокислый + NajS-9H2O -570 По 0,025
* Основные растворы автоклавируют и хранят в атмосфере, лишенной кислорода.
•• Концентрация дана в мМ.
9. Для заполнения небольших по объему флаконов газовой сме-
сью можно использовать микрогазометр, изображенный на рис. 18.
10. Перед посевом в среду вносят восстанавливающие агенты
(табл. 11).
Для выращивания строгих анаэробов следует использовать вос-
становители, для которых Ею ниже —300 мВ. Готовые растворы
вносят в среду непосредственно перед посевом в необходимой кон-
центрации. За снижением окислительно-восстановительного потенциала
в среде следят, включая в ее состав нетоксичный индикатор. Наибо-
лее употребим для этих целей резазурин в концентраций 0,1—0,2 мг
на 100 мл, а также титан—цитрат, который одновременно служит
восстановителем (см. далее). Восстановленная форма резазурина
бесцветна и имеет Eh, равный от -ПО до -252 мВ. Полностью
окисленная форма — синего цвета. Промежуточный продукт необра-
тимого окисления — резоруфин окрашен в розовый цвет и имеет
Eh, около -50 мВ. Поэтому восстановленная среда всегда бесцветна,
а окисленная имеет розовый оттенок. Если среда окрашивается, ее
кипятят до обесцвечивания и охлаждают перед использованием.
Раствор резазурина
0,2 г резазурина растворяют в 20 мл 0,1 N NaOH и доводят
объем до 500 мл водой. Добавляют к среде перед стерилизацией
из расчета 5 мл/л, конечная концентрация в среде 0,0001%.
Для снижения окислительно-восстановительного потенциала в ереде
и удаления следов кислорода наиболее часто употребляют растворы
сульфида натрия или его смеси с цистеином, а также раствор
титан-цитрата.
Раствор смеси сульфида и цистеина
Растворяют 2,5 г солянокислого цистеина в 50 мл дистиллиро-
ванной воды. Доводят pH 10%-м раствором NaOH до 10,0. Быстро
добавляют 2,5 г Na2S-9 НзО и доводят объем до 200 мл водой.
Кипятят под током азота, разливают и стерилизуют в герметично
закупоренных флаконах. Хранят под азотом. Добавляют 2 мл на
500 мл среды.
98
Раствор сульфида натрия
Готовят 5%-Й раствор в дистиллированной воде, разливают в
ампулы, продувают их азотом, запаивают и стерилизуют. Можно
готовить 1%-й раствор в 5%-м растворе NaHCOs и стерилизовать
в открытой посуде.
Раствор титан(Ш)—цитрата
К 50 мл 0,2 М цитрата натрия добавляют 5 мл 15%-го ра-
створа трихлорида титана и нейтрализуют насыщенным раствором
ИаНСОз. После стерилизации фильтрованием 30 мл этой смеси
вносят на 1 л свежепрокипяченной стерильной среды. Комплекс
титан(1П)—цитрат при восстановлении окрашивается в светло-фиоле-
товый цвет, при окислении — обесцвечивается.
Анаэробное разрушение жирных кислот
в синтрофных культурах
Жирные кислоты с длинной цепочкой представлены в составе жи-
ров и липидов, в то время как кислоты с короткой цепочкой
углеродных атомов служат продуктами анаэробных брожений. В при-
сутствии кислорода жирные кислоты полностью разрушаются по пути
Р-окисления через ацетил-СоА. Образующиеся при этом восстанови-
тельные эквиваленты в анаэробных условиях используются ими для
восстановления неорганических акцепторов электронов, подобных суль-
фатам, или выделяются в виде молекулярного водорода. Так как
образование молекулярного водорода в этом процессе с термоди-
намической стороны неблагоприятно, бактерии, окисляющие кислоты
до ацетата, можно культивировать только в совместной культуре
с бактериями, использующими водород и поддерживающими его
концентрацию при низком парциальном давлении [Thauer et al.,
1977].
Накопление и выделение сиитрофноЙ культуры Clostridium bryantii.
Культуры накопления получают путем заражения питательной среды
5 мл ила из анаэробной зоны. Анализ образовавшегося газа про-
водится через 2—3 нед.
После ряда пересевов в среде появляются палочки и палочко-
видные флуоресцирующие метаногены. В накопительных культурах с
капроатом появляются ацетат и метан как продукты его распада.
Выделение культуры проводится на минеральной среде, содер-
жащей ЮмМ капроата, 20мМ сульфата, 5мМ ацетата, в присутствии
Desulfovibrio sp. Через 3 нед инкубации появляются желтые диско-
образные колонии. После двух последовательных серийных разведе-
ний в агаровых культурах обычно преобладает смешанная культура
из разных штаммов Cl. bryanthii.
Рост культур поддерживается в пробирках при одновременном
внесении синтрофной культуры Methanosphirillum hungatei или De-
sulfovibrio vulgaris в среде с добавлением 10 мМ ацетата и 10 мМ сульфата.
99
Среда для культивирования Cl. bryantii
КН2РО4 0,2 г
NH«C1 0,25 г
КС1 0,5 г
CaCh • 2 Н2О 0,15 г
NaCl 1 г
MgCh • 6 Н2О 4 г
Вода дистил- 1000 мл
лированная
Раствор, содержащий 1 г NaHCOj, раствор микроэлементов N 4 и
витаминов N 8 (см. прил.), добавляют в основной раствор после
автоклавирования и охлаждения, pH среды доводят до 7,2—7,3. Пе-
ред посевом вносят 0,2—0,5 М капроата натрия до конечной кон-
центрации 10 мМ и разливают питательную среду по 50 мл во
флаконы с завинчивающимися крышками объемом 100 мл, предва-
рительно продутые смесью СОг—20% и N2—80%, или во флаконы
объемом 50 мл, которые заливают средой полностью, а под проб-
кой оставляют пузырек газа.
Определение численности капроатокисляющих бактерий. Для опре-
деления численности бактерий, разрушающих капроат в анаэроб-
ных условиях, готовят среду для Cl. bryantii указанного выше сос-
тава и вносят в нее культуру Methanospirillum hungatei в качестве
поглотителя водорода. Среду разливают по 10 мл во флаконы емкостью
15—20 мл, предварительно продутые смесью углекислоты и азота,
как указано выше. Далее во флаконы вносят посевной материал
из серии десятикратных разведений.
Рост бактерий во флаконах отмечается по помутнению среды и
накоплению метана в газовой фазе.
Ацетогенные бактерии
Ацетат представляет собой один из важнейших продуктов анаэроб-
ного разрушения органических веществ, используемых на последней
метаногенной стадии. Кроме того, он служит субстратом для боль-
шой группы сульфатредуцирующих бактерий (см. раздел ”Суль-
фатредуцирующие бактерии”).
Образование ацетата осуществляется в процессе сбраживания самых
разнообразных органических веществ — полимерных соединений, угле-
водов, аминокислот, липидов. Он образуется и как конечный про-
дукт анаэробного окисления органических веществ при сульфатре-
дукции. Кроме того, как указывалось выше, гомоацетатные бак-
терии синтезируют ацетат из СОг (реже из СО или формиата) при
автотрофном росте, используя водород в качестве донора электро-
нов и восстановителя. У гомоацетатных бактерий ацетат является
единственным продуктом при сбраживании ряда субстратов —углево-
дов, органических кислот, аминокислот, этанола.
Бактерии, осуществляющие гомоацетатное брожение
Гомоацетатное брожение углеводов встречается редко. Балч и
др. [Balch et al., 1977] выделили из ила оз. Кристал (США) орга-
низм, который был назван Acetobacterium woodii и осуществлял го-
100
моацетатное брожение в анаэробных условиях, окисляя водород за
счет углекислоты с образованием ацетата:
4Нг+2НСОз + Н+-СНзСООН +4Н2О, AG° = —1063,2 кДж/моль.
Образующие ацетат бактерии встречаются в осадке сточной жид-
кости, в озерных илах, в рубце животных. В настоящее время
описано около 20 видов гомоацетатных бактерий (см. табл. 10).
Ниже приводим описание выделения культур гомоацетатных бак-
терий по методу Балча [Balch et al., 1977].
Получение накопительной и чистой культуры A. woodii. Готовят
серию десятикратных разведений из природного материала и по 1 мл
вносят в среду М-1, предварительно помещенную во флаконы под
газовой смесью Нг + СОг.
Среда для бактерий, образующих ацетат (М-1)
Резазурин, 1%-й 0,1 мл Раствор витаминов N 11 20 мл
раствор (см. прил.)
NH4CI, 10%-й 10 мл Дрожжевой экстрат 2 г
раствор Цистеин солянокислый. 0,5 г
Калий-фосфатный буфер, 5 мл водный
pH 7,0 Na2S-9H2O 0,25 г
MgSO* • 7Н2О, 20%-й 0,5 мл NaHCOj 1 г
раствор Вода дистиллированная 1000 мл
Если среду М-1 инкубируют под давлением в атмосфере смеси
газов Н2 и СОг (67:33), то концентрацию NaHCOj увеличивают до
7 г/л, pH среды 7,8.
Для приготовления разведений культуры используют раствор,
состав которого приводится ниже.
NH<CI I г
MgSO4-7H2O 0,1г
К2НРО4 0,4 г
КН2РО4 0,4 г
Резазурин, 0,1%-й раствор 2 мл
Цистеин-сульфидный восстано- 40 мл
тель (см. с. 98)
После инкубации флаконов при температуре 30° в течение 2—3 нед
приступают к выделению чистых культур на агаризованной среде
М-2. Эту среду получают путем добавления к среде М-1 10 г СаСОз,
2 г дрожжевого экстракта Дифко и 20 г агара Дифко. После
стерилизации среду разливают в чашки Петри в анаэробной камере
и в дальнейшем инкубируют в газовой смеси Н2 и СО2 (67:33) под
давлением 2 атм [Balch, Wolge, 1976].
Для выделения чистой культуры образец из накопительной куль-
туры переносят на среду М-2 в чашку Петри и инкубируют при 30°. Коло-
нии A. woodii, образующие ацетат, отличаются по просветлению
агара за счет растворения СаСОз на среде М-2. Они появляются
на 7—10-й день и достигают 1 мм в диаметре. Старые колонии
слегка пигментированы, имеют желтоватый оттенок. В ультрафиолете
они не флуоресцируют как в анаэробных, так и в аэробных усло-
виях, каталазу не выделяют.
Для того, чтобы отличить метанообразующие бактерии от аце-
101
татных, на поверхность агара наносят 5 мл стерильного 1%-го раст-
вора агара, содержащего индикатор бромкрезол зеленый (см. ниже).
При этом колонии ацетатных бактерий и зона вокруг них окраши-
ваются в желтый цвет, а вокруг колоний метанообразующих бак-
терий остается синей.
Агар, наносимый на поверхность питательного агара
Нобль-агар Дифко 1 г
Бромкрезол зеленый 0,01 г
Вода дистиллированная 100 мл
Для выделения чистой культуры выросшую колонию укалывают
пастеровской пипеткой, разбалтывают в буфере и высевают, как было
указано, во флаконы с агаром. После вторичного пересева отдель-
ные колонии переносят во флаконы с жидкой средой и инкуби-
руют при 30°.
Маслянокислые бактерии
Clostridium pasteurianum и Cl. butyricum — широко распростра-
ненные маслянокислые бактерии. Различия их проявляются главным
образом в сбраживаемых углеводах. Cl. pasteurianum сбраживают
простые углеводы — глюкозу, галактозу, фруктозу, сахарозу и др.
Полисахариды — пектин, крахмал, целлобиозу — этот организм не
использует.
Cl. butyricum в противоположность Cl. pasteurianum обладает вы-
сокой амилолитической способностью и может сбраживать крахмал
и другие сложные углеводы, за исключением пектина и клетчатки.
Cl. cellulovorans, Cl. theimocellum и ряд других видов разрушают
клетчатку.
Ниже для некоторых наиболее распространенных видов приво-
дим методы их накопления и выделения.
Среда Виноградского для Cl. pasteurianum
К2НРО4 1 г FeSO4-7HjO Следы
Mgsa • 7н2о 0,5 г CaCOj 40г
NaCl Следы Глюкоза Юг
MnSOvSHtO Следы Вода дистил- 1000 мл
Нейтральрот 0,004% лированная
Среду стерилизуют при 0,5 атм 20 мин, pH устанавливают 6,5—6,7.
После посева пробирки инкубируют при 24—25°.
После активного сбраживания глюкозы 5 мл осадка из пробир-
ки пастеризуют 15 мин при 80° и делают пересев с пастери-
зацией последовательно 4 раза. Обычно 4-й пересев и служит исход-
ным материалом для выделения чистой культуры.
При выделении чистой культуры к элективной среде Виноград-
ского добавляют 10 г глюкозы, 1 мл раствора микроэлементов
N 7, 1 мл дрожжевого экстракта, 1 г аскорбиновой кислоты,
102
3 г СаСОз. Аскорбиновую кислоту стерилизуют отдельно и добавляют
асептически перед посевом.
Посев производят следующим образом. С помощью стерильной
пипетки в расплавленную агаризованную среду в пробирку вносят
3—5 капель из культуры накопления. Из нее последовательно по 1 мл
переносят в 10 пробирок с расплавленной средой. Одновременно из
пробирок затягивают среду в стерильные стеклянные трубочки и за-
тыкают их ватными пробками. Разрывы агара при росте Cl. pas-
teurianum появляются на 3-И сутки и сопровождаются золотисто-
желтой флуоресценцией среды.
Среда для получения, накопления и количественного учета Cl. butyricum
KHiPOj 0,5 г Раствор микроэлементов 1 мл
К1НРО* 0,5 г (см. прил.) N 7
MgSO. 0,5 г Картофельный крахмал 20г
NaCl 0,5 г Дрожжевой автолизат 0,2 г
FeSO< 0,01 г Вода дистиллированная 100 мл
MnSO, 0,01 г
200 г вареного горячего картофеля растирают в минеральной сре-
де, доводя ее объем до 1000 мл. В приготовленную кашицу вносят
10 г СаСОз и нагревают 30 мин при 120°. pH устанавливают среды
7,4—7,5. Разливают среду по стерильным пробиркам и засевают.
Среда для Cl. butyricum
К солевому составу (среда Виноградского) добавляют:
Картофельный крахмал 20 г
Пептон 5 г
Дрожжевой автолизат 0,2 г
СаСОз 10 г
pH устанавливают 7,4—7,5. Стерилизацию среды проводят при
0,5 атм 30 мин. Инкубация посевов при 30°.
Культивирование Cl. cellulovorans. Хангейт выделил в 1944 г. лизо-
фильную спорообразующую бактерию Cl. lochheadii, которая разлагала
клетчатку- в агаровых трубочках в течение 24 ч инкубации, но куль-
тура была впоследствии утрачена. Слейт с сотр. [Sleat et al., 1984]
выделили из метантенка бактерию, которая лизировала клетчатку
в агаровых культурах через 48 ч. Морфологически этот организм похо-
дил на Cl. lochheadii и был назван Cl. cellulovorans.
Среда для культивирования Cl. cellulovorans
К2НРО< ЗН:О 1 г Клетчатка 330 мл
NaCl 1 г Осветленная жидкость 20 мл
КС1 0,5 г из рубца
MgSO,-2H2O 0,5 г раствор микроэлементов 20 мл
i-Цистенн 0,15 г (см. прил.) N 9
Триптиказа 0,5 г резаэурин 0,001 г
Дрожжевой экстракт Дифко 0,5 г Вода дистиллированная 1000 мл
Для выделения культур используют анаэробную технику по Хан-
юз
гейту. Культивирование осуществляют в плоских флаконах по 100 мл,
в них вносят по 20 мл среды и создают газовую фазу Нг и СОг в соот-
ношении 80:20, благоприятную для роста этих бактерий. На поверхность
застывшего агара вносят 0,1 мл посевного материала из соответ-
ствующего разведения и при помощи шпателя или пастеровской
пипетки распределяют по поверхности агара. При этом во флаконе
проводят постоянный ток газовой смеси из Нг и СОг.
Метанообразующие бактерии
Метанообразуюшие бактерии, или метаногены, являются высокоспе-
циализированной физиологической группой облигатно анаэробных
микроорганизмов. В процессе образования метана разные виды ме-
таногенов получают энергию для роста из ограниченного числа
субстратов: Нг+СОг, формиата, метанола, ацетата, метилированных
аминов, причем большинство видов способны к метаногенезу на Нг +
+ СОг.
Метаногены относятся к архебактериям, их клеточная стенка не
содержит муреина и D-амино кислот и составлена из кислых поли-
сахаридов, белков и псевдомуреина. Из уникальных особенностей
метаногенов следует отметить присутствие в составе клеток хро-
мофорных факторов, что позволило использовать это свойство для
разработки метода их прямого количественного учета с помощью
люминесцентной микроскопии.
В настоящее время метаногены подразделяют на 3 порядка —
Methanobacteriales, Methanomicrobiales и Methanococcales, включающие
5 семейств из 13 родов. Всего известно более 30 видов. Срав-
нительная характеристика метаногенов приведена в табл. 12.
Метанообразующие бактерии осуществляют конечный этап ана-
эробного разрушения органических веществ. Они широко распростра-
нены в анаэробных условиях в водоемах, затопляемых почвах, тер-
мальных источниках, в рубце жвачных животных, в метантенках.
Интенсивность метанообразования определяется наличием субстра-
тов — предшественников метаногенеза и экологической обстановкой
среды.
Выделение метанообразующий бактерий. Метаногены относятся к
строго анаэробным микроорганизмам, и для некоторых видов со-
прикосновение с воздухом вызывает их гибель за несколько минут.
Поэтому все процедуры их учета в естественных средах, полу-
чение культур накопления и чистых культур должны проводиться
с учетом их чувствительности к аэробным условиям. Добавка 0,5—1%
муравьинокислого натрия или метанола и помещение основной пи-
тательной среды (РВМ) в атмосферу 80% водорода и 20% СОг или
50% Нг и 50% СОг создают благоприятные условия для накоп-
ления и роста метаногенов.
Чистые культуры получают путем многократных последователь-
ных пересевов активных накопительных культур. Очищение дости-
гают путем посева на агаризованную среду РВМ во вращающихся
пробирках Хангейта или в плоскостенных флаконах, как было опи-
сано выше (см. рис. 18).
. 104
Таблица 12
Сравнительная характеристика основных групп
метанообразующнх бактерий
Таксон । Морфология Окисляемый субстрат
Methanobactenum М. formicium Meihanobacteriaceae Прямые и изогнутые палочки 1 н3
Methanobrevibacter Короткие палочки Нг, формиат
Mbb. ruminantium Methanothermus Methanolhermaceae Палочки Н2
Mt. fervidus Methanococcus Me. thermolithotrophicus Methanococcaceae Кокки Нг, формиат
Me. mazei Ацетат, метанол, метиламин Метиламин, метанол
Me. halophilus Methanohalobium M. evestigatus Палочки Моно-, ди- и триметиламины
Methanomicrobium Mm. ivanovii Methanomicrobiaceae Палочки Нг* СОг
Methanospirillutn Ms. hungatei Спириллы Нг, формиат
Methanogenium Mg. cariaci Неправильные кокки тоже
Mg. thermophilicum и Я **
Mg. tatii " я
Methanoplanus Mp. limicola Methanoplanaceae Пластинки Нг, формиат
Methanosaicina Ms. barkeri Methanosarcinaceae Кокки, образуют пакеты Ацетат, метанол
Methanococcoides Me. methyluctens Неправильные кокки
Methanolobus Ml. findarius Дольчатые кокки
Methanothrix Mt. sochngenti Палочки, нити •»
Methanoplasma Mp. elizabethii Мелкие почкующиеся кокки, нити Н2, формиат
105
Выросшие колонии пересевают на жидкую среду. Исключение
сульфатов из питательной среды ограничивает рост сульфатредуци-
рующих бактерий, а одновременное исключение органических веществ,
таких, как дрожжевой экстракт и триптиказа, подавляет развитие
гетеротрофных организмов, загрязняющих культуры. Эта процедура
благоприятствует учету метаногенов в природных объектах, таких,
как иловые отложения озер.
Источником питания в культуре накопления метанообразующих
бактерий может служить прокипяченный раствор неорганических со-
лей на водопроводной воде с добавкой простых органических суб-
стратов. Источником азота служат аммонийные соли, сульфаты
исключаются, чтобы не развивались сульфатредуцирующие бакте-
рии. Добавляемый карбонат служит для нейтрализации образующихся
кислот, а также твердым субстратом, на котором предпочтительно
развиваются метаногены. Склянки заполняют средой доверху.
Среда Баркера для накопления метаногенов
NH«C1 0,1% СаСЬ 1—2%
КН:РО«-ЗН1О 0,04% Вода водопроводная 100 мл ,
MgCl2-6H2O 0,01% pH 7,0
Характерно, что бактерии располагаются на осадке, а жидкость
остается прозрачной. Одновременно с заражением для создания ана-
эробных условий в среду добавляют 0,03% NazS’OIbO в 0,15%-м
растворе NazCOj.
Среда Базеи для метаногенов, использующих ацетат
[fiasei, 1978]
NH4CI 0,1г К2НРО4ЗН2О 0,04 г Раствор восстановителя
MgCh-6HjO 0,1г Вода водопроводная . 100 мл
Газовая фаза Н2 Na2S-9H2O, Змл
Ацетат кальция 2 г СаСОз Ю г 0,1%-й раствор Змл NajCOs. 3%-й раствор
Инкубация 30 дней при 37°. При заражении осадком сточной жид-
кости после 30 дней 20% накопительной культуры переносят на све-
жую среду. После нескольких пересевов культуру можно считать
обогащенной.
Среда Зейкуса для метаногенов [Zeikus, Wolfe, 1972]
Минеральный раствор 1 2,5 части Минеральный раствор 2 5 частей Вода дистиллированная 83,5 части NajCOs, 8%-й раствор 2 части Раствор витаминов N 9 1 часть (см. прил.) Раствор микроэлементов 1 часть N 7 (см. прил.) 106 Раствор восстановителя 3 5 частей Минеральный раствор 1 К2НРО4 6 г Вода дистиллированная 1000 мл Минеральный раствор 2 КН2РО4 6 г (NH4)2SO4 6 г NaCI 12 г
Минеральный раствор
MgS04-7H2O
СаС12-2Н2О
Вода дистил*
лированная
2,4 г
1,6 г
1000 мл
Раствор восстано-
вителя 3
NajS- 9Н2О 7.5 г
Вода дистиллере- 100 мл
ванная
Среды стерилизуют в строго анаэробных условиях в атмосфере
Nz и СОг или Нг и СОг (80:20). pH стерильной среды 7,2.
КН2РО« 0,5 г
КгРНОч ЗН2О 1,45 г
NH4CI 0,9 г
MgCl2-H2O 0,2 г
Na2S-9H2O 0,5 г
Среда РМВ для метаногенов [Zeikus, 1977\
Раствор микроэлементов 9 мл
N 7 (см. прил.)
Раствор витаминов N 8 5 мл
(см. прил.)
Резазурин, 0.2%-й раствор 1 мл
Вода дистиллированная 1000 мл
Питательную среду готовят по возможности в анаэробных усло-
виях в атмосфере 95% Nz и 5% СОг. Перед стерилизацией pH сре-
ды доводят до 7,4. В питательную среду вводят донор электронов в
виде Нг, формиата или метанола. Раствор Na2S добавляют после
стерилизации.
Среда для выделения и культивирования Mb. soehngenii
Готовят следующие составные растворы:
1.KH2PO4 27,2 г/л 4. NaHCOj 80 г/л
2. Na2HPO4 28,4 г/л 5. Раствор микро-
3. Раствор мине- ральных солей 8г элементов N 9 (см. прял.)
MgCI26H2O 6. Na2SeOj 0,1 г/л
NH4C1 24г 7. Раствор вита- 240,2 г/л
Na Cl 24 г минов N 8
CaClr2H2O 8,8 г (см. прил.)
Вода дистиллиро- 35 мл 8. Na2S-9H2O
ванная 9. Резазурин 0,5 г/л
Среда имеет следующий состав: 15 мл раствора ”1”, 15 мл раствора
”2”, 1 мл раствора ”9” и необходимое количество CHzCOONa доводят
до 900 мл дистиллированной водой и стерилизуют при 121° при
1 атм в смеси 85% Nz и 15% СОг.
К автоклавированному раствору асептически добавляют отдельно
стерилизованные 1 мл раствора микроэлементов ”5”, 1 мл раство-
ра ”6”, 1 мл раствора витаминов N 8 ”7” и 12,5 мл раствора ”3”.
Среду дегазируют продуванием смеси из 85% Nz и 15% СОг и в нее
тотчас же вносят 40 мл раствора ”8” с pH 7,0. Бактерии культиви-
руют в атмосфере 85% Nz и 15% СОг в склянках емкостью 150 мл,
закрытых пробками из бутиловой резины и завинчивающимися кол-
пачками. Количество среды в каждой склянке 50 мл (в склянки
объемом 35 мл вносят 20 мл среды). Образование метана и исполь-
зование ацетата определяют хроматографически.
107
Среда для Methanospirillum hungatei
К2НРО4 0,23 г Формиат натрия 2 г
КН2РО4 0,23 г Резазурин 0,001 г
(NH4)2SO4 0,23 г Na2CO? 4 г
NaCl 0,46 г Цистеин солянокислый 0,25 г
MgCO}-7H2O 0,09 г Na2S-9H2O 0,25 г
CaClj-2HjO 0,16 г Раствор витаминов N 8 1 мл
Дрожжевой 2г (см. прил.)
экстракт Раствор микроэлементов 1 мл
Триптиказа 2г N 9 (см. прил.)
Перед стерилизацией pH доводят до 7,2, перед посевом — до 7,0.
Для получения твердой среды добавляют 2% агара Дифко.
Количественный учет метанообразующнх бактерий. Определение
общего количества метанообразующих бактерий можно проводить дву-
мя способами.
1. Практически все виды метанообразующих бактерий, за исклю-
чением Methanosarcinaceae, могут развиваться за счет углекислоты
и водорода. В связи с этим С.С. Беляев [1974] разработал способ
учета общей численности метанообразующих бактерий на жидкой
среде методом предельных разведений.
Среда для определения численности метанообразующих бактерий
[Беляев, /974]
NH«CI 0,75 г NaHCOj 0,01 г
КН2РО4 1 г CaCOj 2 г
К2НРО4 2г MgCh-6H2O 0,02 г
СаС12-6Н2О 0,01 г Вода водопро- 100 мл
Вода дистилли- 900 мл водная
рованная
Для удаления следов кислорода и снижения окислительно-восстано-
вительного потенциала среду перед посевом кипятят, продувают
углекислотой н вносят в нее 5 мл 3%-го раствора NazS • 9НгО в 0,5%-м
растворе NazCOj. В качестве органических факторов роста добавляют
2 мл дрожжевого автолизата и 20 мл простерилизованной культураль-
ной жидкости метаносарцины. Значение pH доводят до 7.
Посев природного материала производят из ряда последователь-
ных десятикратных разведений на стерильной воде или питательной
среде, содержащей 10 мг/л HjS. Посев проводят во флаконы
из-под пенициллина объемом 15 мл. В них наливают по 5 мл пита-
тельной среды, продувают СОг, вносят по 1 мл инокулята, еще раз
продувают СОг и закрывают резиновыми пробками. Далее флаконы
помещают в штативы-держатели, пробки закрепляют металлическим
колпачком и при помощи двух игл от шприцев вытесняют угле-
кислоту газовой смесью, состоящей из 80% Нг и 20% СОг. Газовую
смесь готовят в газометре, запорная жидкость которого содержит
20 мг S2"/NazS в 1 л. Время инкубации 1 мес при 28—30°. Пред-
варительный учет численности метанообразующих бактерий проводится
по образованию вакуума в газовой фазе флаконов. Последний изме-
108
ряется по количеству стерильной жидкости, затягиваемой из шприца
во флакон для выравнивания давления газа. А окончательный учет —
по наличию метана путем анализа газовой смеси на хроматографе.
2. Наличие метанообразующих бактерий можно определять по их
флуоресценции в препаратах под люминесцентным микроскопом. Флуо-
ресценция клеток метаногенов в ультрафиолете обусловлена присут-
ствием флуоресцирующих факторов F420 и F430. Первый из них
является переносчиком электронов, коферментом метилкоэнзим-М-ре-
дуктазы — фактором F430. Препараты для подсчета клеток мета-
ногенов готовят путем фильтрования проб воды или болтушки из
ила через окрашенные Суданом черным ядерные фильтры, как и при
определении общей численности бактерий (см. раздел ’’Подсчет бакте-
рий на фильтрах с окраской флуоресцентными красителями”) пре-
парат просматривают под люминесцентным микроскопом с использо-
ванием возбуждающих фильтров ФС-1-4 и ФС-1-2. В этом случае
клетки метаногенов светятся сине-зеленым цветом в области длины
волн 470—500 нм.
Бактерии, восстанавливающие перхлораты и хроматы
Бактериальная природа процессов диссимиляционного восстанов-
ления шестивалентных токсичных соединений хлора и хрома впервые
установлена исследованиями В.И. Романенко и В.Н. Коренькова [Ро-
маненко и др., 1973, 1977]. Они впервые выделили и описали хлор-
восстанавливающие бактерии, названные позднее Vibrio dechloraticans.
Эти бактерии — факультативные анаэробы, растут на жидкой пи-
тательной среде в микроаэробных или строго анаэробных условиях.
На МПА рост отсутствует.
Хромвосстанавливающие бактерии Pseudomonas dechromaticans —
факультативные анаэробы, способные к росту в аэробных условиях
на МПА или в анаэробных на средах, содержащих хромовокислый
калий в качестве единственного акцептора электронов. Шестивалент-
ный хром при развитии восстанавливается до трехвалентной формы.
Близкая морфологически и физиологически культура бактерий,
восстанавливающих шестивалентный хром, позже выделена Н.Н. Ляли-
ковой и Е.В. Лебедевой [1979]. Установлена возможность Proteus
mirabilis использовать в качестве источника электронов С10з при
окислении водорода [Schoenmaker et al., 1978].
В исследованиях А.Ф. Рыльского [1986] показано, что процесс
микробиологического восстановления хрома осуществляют микроорга-
низмы, относящиеся к различным физиологическим и таксономиче-
ским группам. Среди них имеются как культуры, выделенные из
хромсодержащих загрязненных местообитаний, так и не адаптирован-
ные к хрому коллекционные культуры, например: Pseudomonas
aeruginosa, Ps. fluorescens, Ps. putida, Bacillus subtilis, Вас. cereus.
Вас. megatherium, Micrococcus roseus, Achromobacter sp. Из уста-
новки по очистке сточных вод от хрома автором выделены также
термофильные штаммы хромвосстанавливаюших бактерий Вас. coagu-
lans, Вас. stearothermophilus. Вас. circulans.
109
Выделение бактерий, восстанавливающих перхлораты и хроматы.
Среда Романенко и Кузнецова для выделения Vibrio dechloraticans
[Романенко и др., 7973]
К2НРО4 0,1г Витамин Ви 20 мкг
NH«C1 0,05 г
NH'Ck 0,25 г
Ацетат натрия 0,1 г
MgSO4-7H2O 0,01 г
Раствор микроэлементов 1 мл
N 7 (см. прил.)
Вода водопроводная 1000 мл
Микроэлементы, перхлорат, витамин и ацетат стерилизуют отдель-
но и вносят в стерилизованную автоклавированием воду перед по-
севом. Выпавший осадок растворяют доведением pH соляной кисло-
той до 4—5. Затем pH среды доводят осторожно добавлением стериль-
ного раствора NaOH до 7,0—7,3.
После ряда пересевов из обогащенной культуры выделяют чистую
методом предельных разведений на этой же среде. Поддерживают
бактерии на среде, в которую вводят 1,5—2,5 мл этилового спирта,
а содержание ацетата снижают до 0,05 г/л. На МПА бактерии не
растут.
Среда Романенко для выделения Ps. dechromaticans [Романенко, Кореньков, 7977]
NH4CI 0,3 г Ацетат натрия 0.2 г
К2НРО4 0,3 г Раствор микроэлементов 0,5 мл
КН2РО4 0,5 г N 7 (см. прил.)
MgSO4-7H2O 0,1 г Витамин Ви 10 мкг
NaCl 0,1 г Мясо-пептонный бульон 100 мл
СаСОз 0,05 г Вода из водоема, про- 1000 мл
FeCb-6H2O 0,01 г фильтрованная через
K2CrO4 0,1 г бумажный фильтр
Среду стерилизуют в колбах. Растворы ацетата, микроэлементов,
витамин и МПБ стерилизуют отдельно и вносят в колбу перед по-
севом. pH среды устанавливают 7,0—7,2. Бактерии культивируют
в пробирках, доверху заполненных средой, под резиновым пробка-
ми. О потреблении хромата судят по изменению окраски среды с
желтой на бесцветную и по появлению на дне пробирок осадка
Сг(ОН)з. Чистую культуру выделяют на МПА в аэробных условиях.
Колонии Ps. dechromaticans имеют розовую окраску, слегка опалес-
цируют. Культура хорошо сохраняется на мясо-пептонной желатине
(МПЖ).
Среда для выделения термофильных
хромвосстанавливающих бактерий [Рыльский, 19861
К2НРО4 0,3 г Глюкоза 0,5—7 г
КН2РО4 0,2 г Дрожжевой 0,02 г
MgSOx 0,1 г автолизат
СаСОз 0,05 г Витамин В|2 20 мкг
NH4CI 0,2 г Вода водопровод- 1000 мл
FeCh 0,05 г водная
NaCl .0,4 г
100 мг КгСгОд вносят в среду перед посевом; pH устанавливают
около 7,5. Температура культивирования бактерий 55—60°.
110
Для выделения чистых культур первоначальный отбор культур
осуществляют путем посева пробы на плотную среду указанного
выше состава с добавлением 1,5% агара в чашках Петри в аэроб-
ных условиях. Чашки экспонируют в термостате при 60°. Колонии,
вокруг которых среда обесцвечивается в результате восстановле-
ния хроматов, повторно рассевают с разведениями на плотные среды
для очистки. Далее отдельные колонии переносят в жидкую среду.
Культивирование ведут в анаэробных условиях в пробирках, доверху
заполненных средой. В качестве восстановителей используют цистеин—
сульфид или титан—цитрат (см. с. 98).
КРУГОВОРОТ СЕРЫ
Микробиологические процессы, связанные с круговоротом серы
в озерах, можно подразделить на две основные группы — восстанов-
ление окисленных соединений серы до сероводорода и окисление се-
роводорода до ряда промежуточных соединений (элементной серы,
тиосульфата и сульфитов) (рис. 19). Обогащение водоема сульфатами
происходит в основном за счет поверхностного стока и глубинных
вод, если они проходят по пластам, содержащим отложения гипса или
другие сульфатсодержащие породы. Наличие такого подтока вод
может привести к образованию меромиктических водоемов, когда
глубинные воды имеют более высокий удельный вес и не перемеши-
ваются с поверхностными дождевыми водами и растворенный кислород
в них весь исчерпывается. В водной массе монимолимниона, и глав-
ным образом в иловых отложениях, начинаются процессы редукции
сульфатов. На нижней границе проникновения кислорода, на границе
соприкосновения сероводорода с растворенным кислородом развива-
ются тионовые бактерии, особенно если на эту глубину свет не
проникает, и одноклеточные бесцветные серобактерии. Если же свет
проникает до сероводородной зоны, то здесь, в анаэробных условиях,
на свету начинают развиваться фотосинтезирующие серобактерии
(см. рис. 19).
В настоящее время известно шесть микробиологических процес-
сов, при которых в анаэробных условиях образуется HjS как конеч-
ный продукт биохимических реакций.
1. Наиболее важным с экологической точки зрения является
процесс диссимиляторной редукции сульфатов облигатно анаэробны-
ми сульфатредуцирующими бактериями. Акцепторами электронов
для сульфатредуцирующих бактерий являются сульфат, сульфит,
тиосульфат и тетратионат. Элементная сера также может служить
акцептором электронов для этих бактерий.
2. H2S освобождается по мере анаэробного разрушения гнилост-
ными бактериями органических серосодержащих соединений. Масш-
табы этого процесса определяются величиной первичной продукции
органического вещества и наиболее значимы в евтрофированных
водоемах с анаэробными условиями. Вклад этих процессов в обра-
зование сероводорода по сравнению с сульфатредуцирующими бакте-
Рис. 19. Круговорот серы
а — водосборная площадь; б — аэробная зона водоема; в — анаэробная зона;
г — иловые отложения; / — поступление в водоем; 2 — усвоение; 3 — минерали-
зация; 4 — поступление в иловые отложения; 5 — редукция сульфатов; 6 — анаэробный
распад органических соединений серы; 7 — захоронение; 8 — окисление тионовыми
бактериями; 9 — фотосинтез серобактерий
риями, как правило, невелик, хотя в отдельных случаях может быть
сопоставим с интенсивностью сульфатредукции.
3. Диссимиляторную редукцию элементной серы осуществляет
группа облигатно или факультативно анаэробных бактерий. Роль
бактериальной сероредукции в образовании сероводорода в водое-
мах пока не исследована, но показано, что в определенных эко-
системах этот процесс может протекать весьма интенсивно.
4. Образование H2S в результате анаэробного диспропорциониро-
вания неорганических соединений серы — тиосульфата, сульфита,
дитионита. Этот принципиально новый тип энергетического метабо-
лизма, по существу представляющий собой анаэробное брожение не-
органических веществ, обнаружен у некоторых известных и новых
видов сульфатредуцирующих бактерий [Вас, Pfennig, 1986; Вас, Cypion-
ka, 1987]. К ним относятся Desulfovibrio sulfidodismutans, Desulfo-
bacter curvatus. Предполагается, что способность к анаэробному сбра-
живанию неполностью восстановленных неорганических серных соеди-
нений, т.е. к хемолитотрофному брожению, широко распространена
в природе. Значение данного процесса в продуцировании H2S в при-
родных экосистемах пока трудно оценить ввиду отсутствия соответ-
ствующих экспериментальных исследований.
5. Небольшое количество H2S продуцируют зеленые и пурпурные
серобактерии в темноте при анаэробном брожении с использованием
эндогенных запасных веществ.
112
6. H2S может продуцироваться в небольших количествах некоторы-
ми микроорганизмами при анаэробном разложении органических ве-
ществ в процессах брожения.
Последние два процесса не вносят ощутимого вклада в образо-
вание сероводорода. Основными продуцентами его в водоемах явля-
ются сульфатредуцирующие, сероредуцирующие и гнилостные бакте-
рии. Вклад процессов диспропорционирования серных соединений
в образование сероводорода, как упоминалось выше, пока оценить
невозможно.
СУЛЬФАТРЕДУЦИРУЮЩИЕ БАКТЕРИИ
Сульфатредуцирующие бактерии составляют высокоспециализиро-
ванную физиологическую группу облигатно анаэробных бактерий
весьма различных морфологически, которые способны осуществлять
диссимиляционное восстановление сульфатов до сероводорода.
Сульфатредуцирующие бактерии обладают широкими метаболиче-
скими возможностями, что объясняет их широкое распространение
и важную роль в процессах анаэробного разложения органических
веществ в водоемах.
Помимо сульфатов, большинство видов сульфатредуцирующих бак-
терий может использовать в качестве акцепторов электронов ряд
промежуточных серных соединений. К ним относятся тиосульфат,
сульфит, элементная сера; незначительное число видов способно
восстанавливать тетратионат или дитионит. Кроме неорганических
соединений серы, у некоторых видов акцепторами электронов могут
служить иные соединения: нитраты, нитриты, фумарат или СОг.
Однако эти свойства проявляются лишь у немногих известных видов
данной группы. Так, диссимиляционная нитратредукция с образованием
аммония в качестве конечного продукта обнаружена у Desulfobulbus
propionicus, Desulfomonas pigra, Desulfovibrio desulfuricans, способность
к нитритредукции — у некоторых видов Desulfovibrio. При одновремен-
ном наличии в среде сульфатов и нитратов происходит предпочти-
тельное диссимиляционное восстановление последних. Фумарат служит
акцептором электронов у D. gigas, а СО2 в отсутствие сульфатов —
у Dtm. orientis, причем рост в среде с Нг + СОг сопровождается
образованием ацетата по типу гомоацетатного брожения. В отсутствие
доступных акцепторов электронов возможно сбраживание некоторых
органических веществ сульфатредуцирующими бактериями с образова-
нием Н2. К сбраживаемым ими субстратам относятся пируват, малат,
фумарат, реже — спирты: этанол, глицерин, а также холин, серин.
Выделены сахаролитические сульфатредуцирующие бактерии, способ-
ные в отсутствие сульфатов сбраживать многие сахара.
Хотя сульфатредуцирующие бактерии являются строгими анаэро-
бами, некоторые из них проявляют устойчивость к наличию кислоро-
да в среде. Экспериментально показано, что один из штаммов Desul-
fotomaculum способен к образованию H2S при росте в условиях
протока в градиенте H2S—О2 при содержании кислорода около
1 мг/л.
8. Зак. 1766
113
Таблица 13
Диагностические признаки сульфатвосстанавливающих бактерий
[Розанова, Назина, 1989]
Род, вид Форма клеток Расположение жгутиков Наличие спор
Группа А. Неполное окислен Desulfovibrio ue органических субсп гратов (до ацеп ата и СОг)
D. desulfuricans Вибрион м —
D. vulgaris м —
D. gigas Спирилла л —
D. africanus Сигмовидная л —
D. salexigens Вибрион м —
D. sapovorans м —
D. multispirans Н.д. Н.д. Н.д.
D. carbinolicus Искривленная палочка - -
D. sulfidodismutans То же + —
D. fructosovorans D. giganteus Desulfomicrobium Вибрион м
Dmb. baculatus (comb, nov) Палочка м —
Dmb. apsheronum Desulfomonas м -
Dm. pigra Thermodesulfobacterium - -
T. commune — —
T. mobile Desulfobulbus м -
Dbs. propionicus Лимоновидная — —
Dbs. elongatus Desulfotomaculum Палочка м -
Dtm. ruminis п +
Dtm. orientis Крупный вибрион п +
Dtm. nigrificans Палочка п +
Dtm. antarcticum п +
Dtm. guttoideum п +
Группа Б. Полное окисление органических субстратов (до СОг)
Desulfovibrio
D. baarsii Вибрион м —
Desulfobacter Dbr. postgatei Эллипсоидная^
Dbr. hydrogenophilus Овальная — —
Dbr. latus >» м или - —
Dbr. curvatus Desulfobacterium Вибрион м -
Dbm. indolicum Палочка до оваль- ной м -
Dbm. phenolicum Палочка искривлен- Н.д. -
ная
Dbm. autotrophicum Овальная м —
Dmb. catecholicum Овальная до лимо- новидной - -
Dbm. vacuolatum н.д. Н.д. н.д
114
Десульфовири- дин G + С в ДНК, МОЛ.% Основные цитохромы Максимальная температура, °C Автотрофный рост за счет Нз или фор- миата (Ф)
Группа А. Неполное окисление органических субстратов (до ацетата и СОг)
+ 55±1 с 42—45 —
+ 61±1 с 40—45 —
+ 60,2 с 40 —
+ 61,2 с 40 —
+ 46±1 с 42—45 —
— 52,7 38 —
Н.д. Н.Д. Н.д. н.д. н.д.
+ 65,0 с 44 -
+ 64,1 + 45 -
+ 64,1 с 35* -
— 56,8 с, Ъ 41
- 52,0 с, Ь 40 Ф
+ 66±1 с 45 -
34,0 с 85
- 4,05 с 85 —
59,9 с, b 43 —
- 59,0 с, b 40 —
48,5—49,9 Ь 48
— 44,7—45,9 b 42 Н2, Ф
— 48,5 Ъ 70 —
— н.д. Ь 48 —
— 51,6 н.д. 42 —
Группа Б. Полное окисление органических субстратов (до СОг)
- 65,9 + 43 ф
45,9 с, Ъ 37 -
— 45,0 + 35 Из
— 44,0 + 30* —
- 46,0 + 31* -
- 47,4 + н.д. -
- 40,6 + н.д. -
42,6 с, Ь 28* Нз, Ф
- 52,4 + 28* Н2, Ф
1.Д. н.д. н.д. Н.Д. Н.Д.
115
Таблица 13 (продолжение)
Род, вид Форма клеток Расположение жгутиков Наличие спор
Desulfococcus
De. multivorans Сферическая — —
De. niacini Сферическая до овальной м -
Desulfonema
Dn. limicola Палочка, в длинных скользящих нитях - -
Dn. magnum То же - -
Desulfosarcina
Ds. variabilis Неправильная ок- руглая, в пакетах -
Desulfotomaculum
Dun. acetoxidans Палочка п +
Dtm. sapomandens н.д. +
Dtm. kuznetsovii я п +
Dtm. geothermicum Группа В п +
Архебактерия шт. VC-16 Неправильная Группа Г б
Сахаролитические палочки Палочка + -
Обозначения: л — лофотрих; м — монотрих; п — перитрих; б — битрих; н.д. — нет
данных; "+’* — наличие признака; — отсутствие признака; * — температурный
оптимум.
В качестве доноров электронов, помимо различных органических
веществ, ряд видов способен к использованию молекулярного водо-
рода. В этих случаях возможен либо хемолитоавтотрофный рост с
использованием СОг в конструктивном обмене, либо хемолитогетеро-
трофный — с использованием ацетата для биосинтетических целей.
На основании их окислительной и метаболической активности
по отношению к используемым органическим субстратам подавляю-
щее большинство известных видов сульфатредуцирующих бактерий
подразделяется на четыре группы. Первая включает те виды, кото-
рые способны использовать органические соединения с образованием
ацетата в качестве конечного продукта. Она включает роды Desul-
fobulbus, Desulfomonas, Thermodesulfobacterium, отдельных представи-
телей Desulfovibrio Desulfotomaculum. Во вторую группу входят виды,
которые осуществляют полное окисление органических веществ — выс-
ших жирных кислот, лактата, ацетата, бензоата, сукцината, фумара-
та и др. — до СОа. К ним относятся ряд видов рода Desulfovibrio,
Desulfotomaculum, виды Desulfobacter, Desulfobacterium, Desulfococcus,
Desulfonema, Desulfosarcina. Третья группа включает термофильный
штамм VC-16, который относится к архебактериям. Наконец, в четвер-
тую группу входит штамм палочковидных бактерий, способных
осуществлять сульфатредукцию при использовании сахаров.
116
Десульфовири- дин G + С в ДНК, мол.% Основные цитохромы Максимальная температура, °C Автотрофный рост за счет Н2 или фор- миата (Ф)
+ 57,4 с, b 36 Ф
- 45,0 b 30* Н2
+ 34,5 с, b 36 Н2, Ф
- 41,6 с, b 37 -
+ 51,2 н.д. 38 Н2, Ф
37,5 b 36
— 48,0 н.д. 43 Ф
— 49,2 с, b 85 Н2, Ф
— 50,4 С 56 н2
Н.Д. 46,0 н.д. 92 н2, Ф
н.д. н.д. н.д. н.д. -
В настоящее время известно около 50 видов сульфатредуцирующих
бактерий, существенно различающихся по метаболическим возможнос-
тям и по морфологии. Материалы по их систематике и физиолого-
биохимическим свойствам подробно освещены в обзоре Е.П. Розано-
вой и Т.Н. Назиной [1989]. Основные морфологические и физиолого-
биохимические признаки, используемые для диагностических целей,
приведены в табл. 13.
Выделение сульфатредуцирующих бактерий группы А,
окисляющих Сорг до ацетата
Как указывалось выше, представители первой группы способны
окислять используемые органические вещества лишь до ацетата. За
исключением Dt. multispirans, все представители этой группы ис-
пользуют лактат в качестве источника энергии и углерода. Поэто-
му для выделения представителей данной группы бактерий исполь-
зуют, как правило, среды, содержащие лактат.
Получение культур накопления Постгейт [Postgate, 1984] рекомен-
дует осуществлять на питательной среде с осадком, подобной среде
Баарса или среде Постгейта ”В”, так как первоначально развитие
сульфатредуцирующих бактерий наблюдается в осадке.
117
Среда Баарса
NH«C1 1 г (NH4)Fe(SO4)2-6H2O 0,5 г
КН2РО4 0,5 г Лактат натрия 3,5 г
CaSOrZHjO 1 г Вода водопроводная 1000 мл
MgSO4 7H2O 2 г
Соль Мора стерилизуют отдельно в сухом виде в маленькой про-
бирке с ватной пробкой и добавляют перед посевом. Доводят pH
среды до 7,0—7,4. При культивировании D. aestuarii в указанную
среду добавляют 3% NaCl.
Наиболее благоприятна для выделения сульфатвосстанавливающих
бактерий среда, предложенная Постгейтом.
Среда Постгейта пВР [Postgate. 1984]
NaCl 1 г Дрожжевой экстракт 1 г
КН2РО4 0,5 г Аскорбиновая кислота 1 г
NH4CI 1 г Тиогликолевая кислота 1 г
CaSO4-2H2O 1 г FeSO4-7H2O 0,5 г
MgSO4-7H20 2 г Вода водопроводная 1000 мл
Лактат натрия 3,5 г
Аскорбиновую кислоту добавляют перед самым посевом в виде 5%-го
раствора аскорбиновокислого натрия, который отдельно стерили-
зуют в ампулах с выкачанным воздухом. Тиогликолевую кислоту
также добавляют перед посевом в виде 5%-го раствора тиоглико-
лата натрия, который стерилизуют отдельно в ампулах. Сернокис-
лое железо растворяют в 1%-й соляной кислоте и добавляют в ос-
новую среду перед посевом. Реакцию среды доводят до pH 7,5, нейт-
рализуя 5%-м раствором соляной кислоты или углекислого натрия.
Среда сразу должна иметь низкий окислительно-восстановитель-
ный потенциал, который в самом начале создается добавлением
восстановителя, например сульфида натрия в концентрации I мМ.
Другим хорошим восстановителем служит смесь тиогликолата в кон-
центрации 1 мМ и аскорбиновокислого натрия в той же концентра-
ции. Оптимальное значение кислотности - среды pH 7,5. Соленость
среды создается близкой к той, которая имеется в природных усло-
виях, откуда выделяют бактерии.
Культуры накопления лучше всего ставить в склянках на 30—
60 мл со стеклянными пробками, которые смазываются перед авто-
клавированием силиконовой смазкой. Заражение производят 0,1 г
ила или 3—5 мл озерной воды. Склянка наполняется средой так, что-
бы после заражения под пробкой не оставалось пузырьков воз-
духа. Накопление в среде более 30 мг сероводорода оказывает
ингибирующее влияние на развитие процесса сульфатредукции.
Для определенных видов сульфатредуцирующих бактерий Пост-
гейт рекомендует следующие условия постановки культур накопле-
ния.
D. desulfuricans. Используют среду Баарса или Постгента, инку-
бируют при 30°. Окислительно-восстановительный потенциал снижают
добавлением 1 мМ сульфида натрия. 60 мл питательной среды зара-
не
жают 1 г или 1 мл пробы. Среду микроскопируют, когда она почер-
неет в результате образования FeS.
D. aestuarii. Эту разновидность выделяют на той же среде с
добавкой 2,5% NaCl.
Dtm. orientis. Эти бактерии относятся к спорообразующим мезо-
филам. Используют среду Баарса с добавлением тиогли колата до кон-
центрации 1 мМ для снижения окислительно-восстановительного потен-
циала, а посевной материал предварительно прогревают 10 мин при
100°, чтобы избавиться от неспоровых видов. Спорообразующие
виды растут медленнее неспоровых и нуждаются в факторах роста.
Dtm. nigrificans. Используют среду Постгейта с добавкой сульфида
натрия или тиогликолата до концентрации 1 мМ. Инкубируют куль-
туры при 55° С.
D. gigas. Избирательные условия для культуры накопления не
описаны. Поскольку организм более устойчив к растворенному кис-
лороду по сравнению с другими видами, для получения культуры
накопления также используют среду Баарса, но элективность усло-
вий для его развития достигают, создавая более высокий окисли-
тельно-восстановительный потенциал путем добавления более слабо-
го восстановителя в виде 5%-го аскорбиновокислого натрия до кон-
центрации 0,01%. Соль эту стерилизуют отдельно в ампулах, из кото-
рых удален воздух. В случае стерилизации раствора pH снижают
до 4,5, продувают током аргона и стерилизуют в ампулах в атмос-
фере аргона.
Выделение чистой культуры. Прежде чем приступить к выделению
чистой культуры, необходимо активизировать бактерии в культуре
накопления. Для этого нужно создать наиболее благоприятные
условия для искомого вида сульфатредуцирующих бактерий путем
оптимизации питательной среды.
С этой целью варьируют температуру развития, содержание NaCl
или (NH^zSO*, величину окислительно-восстановительного потенци-
ала и т.п. При этом добиваются наибольшего образования H2S за
наиболее короткий промежуток времени. После этого на этой среде
делают 3—4 последовательных пересева из 2-суточной культуры. Для
выделения чистой культуры на твердой среде используют 2-суточную
культуру. 7—8-суточные посевы для выделения чистой культуры не
годятся ввиду массового развития спутников.
Приготавливают среду Постгейта, в которую вносят следующие
добавки: 0,01% аскорбинового натрия, 0,01% тиогликолата натрия,
0,1% дрожжевого автолизата, 1% агар-агара.
Для выделения чистой культуры используется свежая среда. После
автоклавирования устанавливают pH 7,5, расплавленную среду разли-
вают примерно по 10 мл в 6—8 стерильных пробирок (15X1 см), вносят
по 0,5 мл из заранее приготовленной серии разведений накопитель-
ной культуры. Разведения следует готовить в жидкой среде аналогично-
го состава, готовой к употреблению.
Далее используют два приема. 1. После застывания агара пробир-
ки доливают доверху расплавленной средой и плотно закрывают рези-
новыми пробками. 2. После тщательного перемешивания агар засасы-
119
вают из пробирок в стерильные стеклянные трубки диаметром 3—5 мм.
После затвердевания агара концы трубок запаивают или замазывают
менделеевской замазкой. Засеянные пробирки или трубки инкубиру-
ют при 30 или 55°, в зависимости от того, какой вид бактерий
необходимо выделить.
Через 4__5 сут при появлении черных колоний отбирают труб-
ки или пробирки с наименьшим числом выросших колоний, разби-
вают, среду выдавливают в стерильную чашку Петри и под бино-
кулярной лупой находят четко очерченные черные колонии, не загряз-
ненные спутниками. Наличие размытого диффузного края колонии или
светлой зоны указывает на загрязнение колонии сопутствующей ми-
крофлорой. Пастеровской пипеткой с тонко оттянутым носиком коло-
нии переносят в наполненные средой маленькие пробирки, диамет-
ром 6 мм, с суженным нижним концом, что способствует созданию
более благоприятных условий для развития бактерий. Для созда-
ния строго анаэробных условий в среду добавляют дитионит до конеч-
ной концентрации 0,14 мМ.
При выделении спорообразующих бактерий блок агара с черной
колонией предварительно помещают в маленькую пробирку с 1 мл пи-
тательной среды, прогревают на водяной бане при 80° 10 мин и да-
лее колонию пастеровской пипеткой погружают в другую пробирку
с оттянутым острым нижним концом, заполненную средой.
Если не удается избавиться от сопутствующих бактерий, произво-
дят посев культуры на среды с различными добавками NaCl. Мно-
гие штаммы сульфатредуцирующих бактерий приспособлены к широко-
му диапазону солености (от 0,5 до 6%), а спутники этим свойством
не обладают. Для освобождения от аэробных спутников следует ис-
пользовать сильно восстановленную среду, где восстановителем слу-
жит аскорбиновокислый натрий с добавлением тиогликолата или ас-
корбат натрия с сульфидом натрия.
Большие трудности возникают, когда в культуре накопления
одновременно присутствуют два разных вида сульфатредуцирующих
бактерий. В этом случае, как было указано выше, необходимо варьи-
ровать в питательной среде не только соленость, но и температуру
инкубации, степень восстановительности, а для выделения спорооб-
разующих видов производить прогрев посевного материала.
Проверка чистоты культуры. Чтобы проверить культуру на от-
сутствие аэробов, производят посев на глюкозопептонную среду в
аэробных условиях. Для проверки на отсутствие анаэробов поступа-
ют следующим образом. Делают посев на среду, содержащую 0,4% пеп-
тона, 1% глюкозы, 0,2% сернокислого натрия, 0,1% MgSO4*7H2O,
1,5% агар-агара, и добавляют 0,05% стерильного раствора (NH^SCh.
Доводят pH до 7,0—7,6. Среду разливают по пробиркам, охлаждают
до 40°, делают в ряде пробирок разведения, погружая последо-
вательно фламбированную на пламени запаянную пастеровскую пи-
петку из одной пробирки в другую, и дают среде застыть. Эта среда
хороша при выявлении заражения культурами посторонних анаэробов.
Появление разрывов агара и светлых или коричневых (но не черных)
колоний указывает на наличие загрязнения. Отсутствие роста на
120
приведенных выше средах указывает на чистоту сульфатредуцирующих
бактерий. Для накопления максимальной клеточной массы сульфат-
редукторов наиболее благоприятна среда Постгейта ”С” [Postgate,
1984].
Среда Постгейта "О'
КН2РО< 0,5 г Дрожжевой экстракт 1 г
NH«CI 1 г FeSO4'7H2O 0,1 г
Na2SO« 4,5 г Цитрат натрия 0.3 г
CaClr6H2O 0,06 г (добавляют для прозрач-
MgSO,-7H2O 0,06 г ности среды)
Лактат 6г Вода дистиллированная 1000 мл
Сернокислое железо прибавляют в виде раствора в 1%-й НС1. В ка-
честве восстановителей добавляют 1 мМ H2S9H2O или 1 г аскор-
биновокислого натрия в смеси с 0,5 мл 1%-го раствора Na2S-9H2O
в 1%-й двууглекислой соде. Среда должна быть прозрачной. Она мо-
жет мутнеть после автоклавирования, но просветляется при охлаж-
дении. Для галофильных форм по мере надобности вносят хлористый
натрий.
При массовом выделении культур сульфатредуцирующих бактерий
Виддель [Widdel, 1980] рекомендует отдельные ингредиенты минераль-
ной среды готовить в виде миллимолярных растворов в бутылях с
нижним тубусом и при изготовлении среды использовать необходи-
мое количество раствора.
В зависимости от того, из каких экологических условий был
отобран материал для выделения бактерий, количество того или
итого ингредиента можно легко изменять.
Среда Видделя [Widdel, 1980]
Неорганические в е ш с сi в а
Вещество Исследуемые водоемы Масса I мМ, мг
Пресноводные Солоноватоводные Морские
NaCl 20 120 340 58,44
MgCl2 2.0 6,0 15,0 95,21
KCI 4,0 4.0 4,0 74,55
СаСЪ 1,0 1,0 1,0 110,90
NH<C1 5,0 5,0 5.0 54,49
КН2РО« 1.5 1,5 1,5 136,09
Na2SO4 20,0 20.0 20,0 142,04
К стерилизованным средам добавляют перед посевом следующие
стерильные растворы из расчета на 1 л среды: 250 мг NaHCCh; 1 мл
раствора микроэлементов N 1 (см. прил.); 375 мг МагЗ^НгО; растворы
витаминов, каждый по 1 мл. Их готовят растворением каждого из
указанных витаминов в 100 мл воды и стерилизуют ультрафильтраци-
ей: Bn — 10 мг, тиамин — 10 мг, л-аминобензойная кислота — 5 мг,
биотин — 1 мг. Перед посевом в минеральную среду добавляют одно
121
из приведенных ниже органических веществ в указанной концентрации
и pH доводят до 7,2.
Органические вещества
Вещество Концентрация основного ра- створа, М Количество основного раствора на I л среды, мл Конечная кон- центрация, мМ
Формиат 1,0 5—12 5,0—12,0
Ацетат 2,0 5—10 10—20
Пропионат 2,0 4—8 8,0—16,0
и-Бутират 1.0 5—10 5-10
н-Пальмитат 0,1 15 1,5
н-Стеарат 0,1 15 1,5
Лактат 1,0 10 10
Бензоат* 1,0 5 5
Пируват 1,0 10 10
Сукцинат 1,0 5 5
Фумарат 1.0 5 5
D-i-Малат 1,0 5 5
2-Гидроксибензоат 1,0 1—2 1-3
D-Глюкоза 0,5 10 5
* Бензойную кислоту нейтрализуют 4 И раствором NaOH и доводят pH до 8.
Среда Сорокина [JP32] для водородной сулъфатредукции
КН2РО4
Na2HPO« 12Н2О
NaHCOj
(NH«)zSO4
MgSO, 7HjO 1,5 г
CaSO«-2H20 1 г
Вода дистиллиро- 1000 мл
ванная
I
I
Среду стерилизуют 20 мин при 110°. Перед посевом pH доводят
до 7,0. Перед заражением в среду добавляют соль Мора из расчета
1 г/л и NazS-OHzO — 30 мг/л. Растворы соли Мора и сернистого
натрия предварительно разливают в перетянутые пробирки, откачи-
вают из них воздух и запаивают на пламени горелки. Запаянные
ампулы стерилизуют в автоклаве или аппарате Коха. 100 мл среды
наливают в склянку объемом 500 мл, вносят 1—2 мл посевного ма-
териала и закрывают резиновой пробкой с отводной трубкой. После
этого воздух откачивают масляным насосом до 40 мм рт.ст., склян-
ку наполняют водородом, откачку и наполнение повторяют три раза
и закрывают герметически. Культивирование сульфатредуцирующих
бактерий, способных развиваться за счет окисления водорода, мож-
но проводить в пенициллиновых флаконах, заполняя их на 2/3 объ-
ема водородом. Для работы в экспедиционных условиях заранее
готовят флаконы, заполненные средой и водородом. Внесение посевно-
го материала из серии разведений осуществляют с помощью шприца.
Выделение Dbs. propionicus. Подобно ацетату, пропионат является
наиболее важным продуктом при сбраживании органического вещества
естественными популяциями бактерий. Хотя было известно о способ-
ности анаэробных бактерий использовать пропионат для роста [Hvid-
122
Hansen, 1951], однако выделенные ранее культуры были утеряны.
Лишь в 1980 г. Бонне и Бриан описали синтрофную культуру, состоя-
щую из бактерий Synthrophobacter wolinii, разрушающей пропионат,
и Desulfovibrio, использующей Hz. Они разрушали пропионат при
одновременном восстановлении сульфата с образованием ацетата,
СОг и H2S [Boone, Bryant, 1980].
Наконец, Виддель и Пфенниг выделили чистую культуру Dbs.
propionicus, сбраживающую пропионат до ацетата. Пропионат служил
донором электронов, а акцепторами — сульфат, сульфит или тиосуль-
фат:
4CHj—СНг—СООН + 3SOf—4CHjCOO_ + 4СНСОО" H2S + Н*. AG° =
=-151 кДж на реакцию при pH 7.
Среда для выделения Dbs. propionicus
[Widdel, Pfennig, 79S2]
NajSO« 1 г СаС1г2Н2О 0,15 г
КН2РО4 0,2 г MgC)r6H2O 0,4 г
NH4CI 0,3 г NaCl 1 г
KC1 0,5 г Вода дистиллиро- 1000 мл
ванная
К автоклавированной и охлажденной среде добавляют:
Раствор микроэлементов N 1 (см. прил) t мл
NaHCOs, 6%-й раствор 30 мл
Раствор витаминов N 8 (см. прил.) 5 мл
Витамин Biz (5 мг на 100 мл) 1 мл
Пропионат натрия, 10%-й раствор 10 мл
Пропионат добавляют в виде автоклавированного раствора (75 г про-
пионовой кислоты растворяют в 1 л воды и с помощью 4NNaOH дово-
дят pH до 8—9). Раствор NaHCOj автоклавируют и помещают в
атмосферу СОг для насыщения углекислотой.
После заражения питательной среды, разлитой во флаконы с за-
винчивающимися крышками и резиновой прокладкой, вносят пипеткой
от 0,2 до 0,6 мл свежеприготовленного и простерилизованного в
анаэробных условиях раствора дитионита, содержащего 50 г NazSzCh
в 1 л, или стерильным шпателем 10—30 мг кристаллов дитионита для
снижения окислительно-восстановительного потенциала.
Выделение сульфатредуцирующих бактерий группы Б,
окисляющих вещества до СОг
В настоящее время эта группа насчитывает 20 видов бактерий,
принадлежащих к семи родам (см. табл. 13). К ним относятся из-
вестные виды родов Desulfococcus, Desulfosarcina, Desulfonema, Desul-
fobacter, Desulfobacterium, некоторые виды родов Desulfovibrio и
Desulfotomaculum.
Выделение Dtm. acetoxidans осуществляют на среде Видделя и
Пфеннига [Widdel, Pfennig, 1977].
123
Среда Видделя и Пфеннига для Dtm. acetoxidans
2,5 г
0,2 г
Na2SO«
КН:РО«
MgCh'6H2O
NH4CI
После стерилизации
стерильных растворов:
FeCl2-6H2O
Na2Coj- ЮН2О
Na2S9H2O
СаС12-6Н2О
Раствор микроэлементов
N 1 (см. прил.)
Вода дистиллированная
охлаждения к 1 л
0,13 г
10 мл
1000 мл
добавляют в виде
I мг
0,57 г
0,36 г
Раствор витаминов N 1
(см. прил.)
5 мл
20 мкг
и
фосфорной кислотой до 7,1. В качестве органического
Доводят pH
вещества вносят CHjCOONa до концентрации 1,24 г/л либо этанол,
бутанол или бутират.
Среду Видделя с ацетатом разливают во флаконы на 50 мл с
резиновой прокладкой и завинчивающейся крышкой. После заражения
испытуемым материалом в питательную среду добавляют свежеприго-
товленный и простерилизованный через мембранный фильтр раствор
NajSzOj до концентрации 0,14 мМ. Путем подбора оптимальных
условий для развития культуру активизируют, пересевая 2—4 раза,
затем высевают на агаризированную среду того же состава, затя-
гивают в стеклянные трубочки или вносят в пробирки. Появившиеся
колонии извлекают пастеровской пипеткой, повторно пересевают в
трубочки, предварительно встряхивают в пробирке с расплавленной
агаризированной средой, после предварительной пастеризации посев-
ного материала 20 мин при 80°.
Дальнейшее выделение чистой культуры и проверку чистоты про-
водят, как было указано выше (см. начало разд. ’’Сульфатредуцирую-
щие бактерии”). Оптимальная температура культивирования 36°.
Выделение Dbr. postgatei.OroT вид был выделен Видделем из морских
и солоноватоводных водоемов. Штаммы, выделенные из морских
иловых отложений, нуждаются для роста в питательной среде с повы-
шенной концентрацией NaCl и MgSO<.
Основная среда для пресноводных штаммов
Dbr. postgatei [Widdel, Pfennig, 1981}
CaClj-2H2O 0,15 г
MgCl2-6H2O 0,4 г"
NaCl 1 г
Вода дистиллированная 1000 мл
NajSOj
КН2РО4
NH^Cl
КС1
0,2 г
При выделении культур из солоноватых водоемов увеличивают
концентрации MgCh до 1,2 г и NaCl до 7 г, для морских видов — MgCh
до 3 г и NaCl до 20 г. К автоклавированной и охлажденной среде
добавляют:
Раствор микроэлементов N 5 (см. прил.) 1 мл
Раствор NaHCOj, автоклавированный и насыщенный 30 мл
в атмосфере СО2 (5,7 г/л)
Раствор витаминов N 8 (см. прил) 5 мл
124
Среду содержат в специальном пятилитровом сосуде в атмосфере
90% Nz и 10% СОг при повышенном давлении, чтобы избежать
поступления воздуха. Разливают среду во флаконы до резиновой
прокладки и завинчивают крышкой.
Органические вещества добавляют в среду в виде стерильных
растворов до заражения. Если единственным субстратом служит аце-
тат, то 10 мл автоклавированного раствора, содержащего 280 г
СНзСООИа-ЗНгО в 1 л, добавляют в 1 л питательной среды. Тотчас
после заражения в склянку вносят 0,2—0,6 мл свежеприготовленно-
го, простерилизованного в анаэробных условиях раствора дитиони-
та, содержащего в 1 л 50 г NajSzCh, или стерильным шпателем
10—30 мг кристаллов. При внесении дитионита сильно сокращается
лагфаза развития, особенно если посев сделан из старой культу-
ры.
При испытании влияния Н2 склянки заполняют засеянной средой
на 1/3, продувают газом, состоящим на 80% из Нг и на 20% из СО:,
и закрывают бутиловой резиновой пробкой. Инкубируют культуры
при 29°.
Чистую культуру получают при повторном пересеве методом де-
сятикратных разведений путем отсева из предельных разведений
образовавшихся черных колоний (см. выделение чистой культуры
Dtm. acetooxidans). При пересеве культуры в трубки в среду вносят
0,1 мл дитионита.
Выделение нитчатых скользящих сульфатредуцирующих бактерий
рода Desufonema [Widdel, 1983]. Для получения скользящих сульфатре-
дуцирующих бактерий из морских местообитаний для питательной
среды используют морскую воду. Состав среды тот же, что и
при выделении Desulfobacter. После автоклавирования и охлаждения
в нее добавляют в анаэробных условиях необходимые растворы —
КН2РО4, NH4CI, NaHCOj, NaaS и витамины в соответствующих
концентрациях. Благодаря наличию БОГв морской воде Na2SO4 мож-
но не добавлять. Ацетат и бензоат добавляют в виде натриевых
солей так, чтобы конечная концентрация их соответствовала 15 и
14 мН. К готовой среде добавляют 20 мл 0,5%-го раствора дитио-
нита.
Для того чтобы стимулировать рост выделенных нитей, в среду
добавляют 15 мл раствора, сброженного в анаэробных условиях
дрожжевого экстракта. Его готовят в 1 л бессульфатной среды, к
которой добавляют 7,5 г дрожжевого экстракта, 5 г глюкозы, 2,5 г пеп-
тона, заражают эту среду илом из пресного водоема, pH доводят
до 7,2 г и инкубируют 3 нед в анаэробных условиях при 35°. После
этого взвешенные частицы удаляют центрифугированием, а супернатант
используют в качестве стимулятора роста при выделении морских
штаммов Desulfonema.
Сюда же вносят 10-20 мл 0,5%-го раствора дитионита.
Отмывание нитей на сет ке. При развитии нитчатых бактерий
в культуре накопления совместно развиваются и мелкие посторон-
ние бактерии, отделение которых от нитчатых проводится на сетке
для электронно-микроскопических препаратов, которая как сито за-
125
крепляется внутри стеклянной трубки (рис. 20). Трубочку с сеткой
стерилизуют 70%-м спиртом, высушивают продуванием стерильного
воздуха и заполняют стерильной средой. При этом уровни стока и
внесения в трубочку питательной среды поддерживают на 2 см вы-
ше сеточки. 1 мл суспензии нитчатых бактерий, взятый из накопи-
тельной культуры, вносят в трубку. Нитчатые бактерии остаются
на сетке, а мелкие бактерии при пропускании стерильной питатель-
ной среды вымываются. Затем гибкий шланг закрывают и находя-
щиеся на сетке нитчатые сульфатредуцирующие бактерии при помо-
Рис. 20. Отмывка нитчатых бак-
терий от мелких бактериальных
клеток (стрелкой указано место
нахождения медной сеточки)
щи пастеровской пипетки вносят в маленькие трубочки, диаметром
6 см, с агаризованной средой и помещают в анаэробные условия.
Крупные нити, диаметром 6—8 мкм, видны под бинокулярной лу-
пой. Поэтому они могут быть выловлены под бинокулярной лупой
тонкой пастеровской пипеткой и помещены в пробирки диаметром
6 мм, заполненные анаэробной средой. При каждом переносе нити
следует брать свежую пипетку. После интенсивного перемешивания
палочкой длинные нити разрушаются, что увеличивает вероятность
получения колоний из чистых нитей при дальнейшем переносе с
разведениями на полужидкую среду, в которую добавлено 0,7% агара.
СЕРОРЕДУЦИРУЮЩИЕ БАКТЕРИИ
Впервые А.Д. Пельш [1937] обнаружил возможность использования
элементной серы в качестве акцептора электронов при анаэробном
росте бактерий. Выделенные им бактерии росли за счет окисления
водорода в присутствии серы с восстановлением ее до сероводорода
и были названы Hydrogenthiobacteria.
В настоящее время известен широкий круг микроорганизмов, спо-
собных осуществлять ’’серное” дыхание при окислении водорода
или органических веществ. Сведения об этих микроорганизмах на-
коплены за последнее десятилетие и, вероятно, могут быть значи-
тельно пополнены при дальнейших поисках.
Способность к восстановлению серы широко распространена среди
представителей самых различных физиологических и таксономичес-
ких групп бактерий. Однако, как указывалось ранее не всегда этот
процесс способен обеспечивать рост культур. В ряде случаев вос-
126
Таблица 14
Сравнительная характеристика бактерий, осуществляющих «серное» дыхание
Организм Доноры электронов для восстановления серы Акцепторы электронов Литературный источник
Desulfuromonas aceto- xidans Ацетат S0, малат, фумарат Pfennig, Biebl, 1976
D. acetexigens* то же Fowler et al., 1986
D. NZ 27 S° To же
D. succinoxidans* S°, малат, фумарат
Desulfovibrio sp. Этанол, лактат S°, SO, Biebl, Pfennig, 1977
Desulfovibrio carbino- licus Desulfotomaculum sa- pomandens Нг, этанол, лактат, пируват То же s’, so; Nanninga, Gottschal. 1987 Cord-Rudwich, Garsia, 1985
Сахаролитические сульфат восстанавли- вающие бактерии Различные сахара S°, SO, , фумарат Jubert, Britz, 1987
Campylobacter DSM 806 Нг. ацетат, формиат, аминокислоты s", so;, s,o;. o, Laanbrock et al., 1978
Campylobacter DL-1 Нг, сукцинат, лактат s’, so?, s,o;, NOs, диметилсуль- фоксид, O: Zinder, Brock, 1978
Spirillum-5175 Нг, формиат S’, SOi , S,Oi , диметилсульфоксид, O2 Wolfe, Pfennig, 1977
Veillonella alcalescens (Micrococcus lactoli- ticus) Нг S". SjO? . NO,, O, Woolfolk, Whiteley, 1962
Pseudomonas men- docina Нг S°, S2O3 , NO3, Fe3‘, O2 Балашова, 1985
Proteus vulgaris Нг s’, so,, s,o;. o, Балашова, 1985; Woolfolk, Whiteley, 1962; и др.
Acaligenes sp. Н2 S°, SO3 , S2O3,0г To же
Escherichia coli Н2 S°, SO, , S2O2} , фу- марат, малат, NOj, Ог
•Культуры выделены Бекке и Пфеннигом.
становление серы до сероводорода (у некоторых цианобактерий, у пур-
пурных и зеленых фототрофных бактерий в темноте, у некоторых
бродильщиков) служит лишь для ’’поддерживающего” метаболизма.
Микроорганизмы, осуществляющие диссимиляторное восстановле-
ние серы — "серное” дыхание, подразделяются на две большие груп-
пы: в первую объединены в основном мезофильные (за исключением
одного термофильного вида) эубактерии, широко распространенные
в донных отложениях озер, в морских лагунах; во вторую — термо-
фильные и экстремальные термофильные архебактерии (последние —
127
с оптимумов роста при 105°), обитающие в зонах гидротермальной
активности в кислых, реже в слабощелочных высокотемпературных
источниках.
Сравнительная характеристика сероредуцирующих эубактерий при-
ведена в табл. 14. Как видно из таблицы, среди них преобладают
бактерии, осуществляющие наряду с серным дыханием нитратное,
сульфатное, аэробное дыхание, брожение, т.е. используют серу в ка-
честве акцептора при дыхании, и этот процесс не является строго
специфичным.
Наряду с факультативными существуют облигатные сероредуци-
рующие анаэробные бактерии — представители рода Desulfuromonas
(штамм NZ 27) и некоторые архебактерии.
В качестве доноров электронов различные бактерии могут ис-
пользовать разнообразные органические вещества, а также молеку-
лярный водород. В последнем случае микроорганизмы растут как
факультативные хемолитоавтотрофы.
Роль этих бактерий в процессах образования сероводорода в при-
родной обстановке практически не исследовалась, за единичными
исключениями. На основании широкого распространения этих орга-
низмов в различных экологических условиях и их больших метаболи-
ческих возможностей можно полагать, что в ряде случаев они мо-
гут вносить ощутимый вклад в образование сероводорода в водоемах.
Среди термофильных архебактерий, осуществляющих серное дыха-
ние, выделенных из морских и пресноводных гидротерм, также опре-
деляют облигатные сероредукторы: Thermoproteus tenax, Т. neutro-
philum, Thermophilum pendens, T. tenax, Pyrodictium occultum, P. brockii
[Zillig et al., 1981, 1983; Fischer et al., 1983; Stetter et al., 1983]. Ряд обли-
гатно анаэробных архебактерий, помимо серного дыхания, осущест-
вляют либо сбраживание аминокислот (Desulfurococcus mucosus, D. mo-
bilis, Thermococcus celler, WC-C), полисахаридов (D. amylolythicus),
либо метановое брожение [Zillig et al., 1982; Бонч-Осмоловская, и др.,
1989; Stetter, Gaag, 1983]. Ряд видов — факультативные анаэробы и
способны расти, окисляя водород, серу или органические кислоты
кислородом воздуха: Desulfurolobus ambivalens, Acidianus brierley,
Acidotherma infernus [Zillig et al., 1985; Segarer et al., 1985]. Подробная
характеристика сероредуцирующих бактерий приведена в обзоре
Е.А. Бонч-Осмоловской [1989].
Ниже приведены методы выделения и количественного учета на
питательных средах мезофильных сероредуцирующих эубактерий.
Выделение облигатных сероредуцирующих бактерий рода Desulfu-
romonas осуществляют с использованием питательной среды Пфеннига и
Библа [Pfennig, Biebl, 1976].
Среда для выделения и культивирования D. acetoxidans
[Pfennig, Biebl, 1976]
КНгРОц
NHjCI
MgCh-6H2O
CaCl2 2H2O
128
НС!, 2M 4 мл
Вода дистил- 1000 мл
лированная
Раствор 2 СоСЬ 6Н2О 190 мг
FeCh'fHzO 1500 мг СиСк-2НгО 17 мг
ZnCh 70 мг NiCh-бНгО 24 мг
МпС1г-4НгО 100 мг Na2MoO4-2HjO 36 мг
HjBOj 62 мг ЭДТА 5200 мг
Вада дистил- лированная 1000 мл
pH доводят до 6,5
Раствор 3 NaHCOj Раствор 5
10 г Пирндоксамнн 10 мг
Вода дистил- 100 мл солянокислый
лированная Никотиновая 4 мг
Раствор 4 кислота
NajS-9H2O 5 г Тиамин 2 мг
Вода дистил- 100 мл п-АминобензоЙ- 2 мг
лированная ная кислота
Пантотеновая 1 мг
кислота Витамин Bi? 1 мг
Биотин 0,5 мг
Вода дистилли- рованная 200 мл
К 1 л раствора 1 добавляют 1 мл раствора 2, 20 мл раствора 3, 6 мл
раствора 4, простерилизованных автоклавированием, и 5 мл раствора 5,
простерилизоваиного ультрафильтрацией. Доводят pH среды до 7,2.
Среду асептически разливают в предварительно автоклавированные
50-мйллилитровые склянки с завинчивающейся крышкой и силико-
новой прокладкой, под которой оставляется пузырек воздуха, чтобы
предохранить склянку от разрыва при изменении давления. Среду
сохраняют в темноте.
Следующие вещества готовят в виде стерильных 10%-х растворов
на дистиллированной воде: 1) ацетат, малат, 2) источник элементной
серы — серный цвет или полисульфид. Серный цвет растирают в ступке
с дистиллированной водой и автоклавируют 30 мин при температуре
112—115°. Полисульфид готовят путем растворения 10 г NajS ^HzO и
3 г серного цвета в 15 мл дистиллированной воды при нагревании,
стерилизуют автоклавированием.
Для получения культуры накопления на ацетате с элементной серой
кислотность среды доводят стерильным раствором NazCO? до pH 7,8.
В каждую склянку вносят 1 мл посевного материала, около 0,1—0,2 г
элементной серы или 3 капли полисульфида и ацетат до конечной
концентрации 0,05%. Склянки инкубируют 1—3 нед. Увеличение кон-
центрации сульфида до 100—200 мг/л указывает на развитие серо-
бактерий.
Эту культуру используют для выделения чистой культуры. Для чего
3%-й раствор агара разливают по 3 мл в пробирки. После стерилиза-
ции пробирки охлаждают в водяной бане до температуры 55°. Основ-
9. Зак. 1766
129
ную среду в 50-миллилитровом флаконе обогащают 0,05% ацетата
и в качестве источника серы вносят 3 капли автоклавированного
раствора полисульфида. Среда при этом становится мутной от выпа-
дения элементной серы из полисульфида. Среду подогревают до 40° и по
6 мл добавляют в пробирки с 3 мл агара. Пробирки поддерживают
при 40°, и в них производят серию последовательных разведений
(до 6—8) из культуры накопления, внесенной в первую пробирку.
После посевов пробирки погружают в холодную воду для быстрого
застывания агаровой среды, чтобы предотвратить осаждение серы на
дно. Инкубацию посевов ведут в темноте при 28°.
Чистую культуру получают путем повторных пересевов отдель-
ных колоний на тот же агар в пробирках с разведениями. Колонии
бактерий рода Desulfuromonas отличаются характерным красноватым
или охристым цветом. Чистые культуры поддерживают во флаконах
объемом 50 мл, заполненных доверху средой приведенного выше со-
става.
Выделение сероредуцирующих бактерий Campylobacter производят
тем же методом на бессульфатной основной среде, что и для D. aceto-
xidans. В качестве доноров электронов используют формиат, а как
источник углерода в конструктивном обмене — ацетат, так, чтобы
конечная концентрация составляла 0,2% формиата и 0,005 % ацетата.
Как акцептор электронов используют элементную серу или полисуль-
фид. Склянки заражают анаэробным илом и инкубируют при 28°.
Положительный результат отмечается через несколько дней по вы-
сокому содержанию сульфида. При микроскопическом просмотре на-
копительных культур наличие тонких сильно подвижных вибриоидных
или спиральных клеток указывает на наличие Campylobacter. После
двух-трех пересевов на этой же среде выделяют и чистую культуру
методом разведения, используя основную среду с добавкой 0,2%
£-малата или фумарата. Колонии сапрофитных видов Campylobacter
легко отличаются по характерному светло-желтому цвету.
Количественный учет сероредуцирующих бактерий. 1. При коли-
чественном учете в образцах природного материала сероредукторов,
неспособных ^ водородной сероредукции, поступают так же, как при
выделении культур Desulfuromonas, производя посев из серии разве-
дений на стерильную жидкую среду с серой или полисульфидом,
предварительно разлитую по 10 мл во флаконы объемом 15 или 20 мл.
После засева флаконы заполняют газовой фазой из стерильной
углекислоты. О развитии сероредукторов судят по изменению ок-
раски среды от молочно-желтой до серой и по появлению серо-
водорода.
Для идентификации выросших 'бактерий их пересевают в агари-
зованную среду того же состава и далее проводят микроскопи-
ческий просмотр выросших колоний, а в случае необходимости — их
отсев дйя выделения чистых культур и идентификацию с использо-
ванием физиологических тестов.
2. При определении численности сероредуцирующих бактерий на
средах с разным энергетическим субстратом (глюкоза, гидролизат
казеина, лактат, ацетат, этанол, метиламин или Нг) наиболее пред-
130
почтительным из них для выявления максимальной численности бакте-
рий является водород [Бонч-Осмоловская и др., 1988]. Поэтому об-
щий количественный учет представителей этой группы бактерий це-
лесообразно проводить на минеральной среде указанного выше со-
става с серой или на среде Пфеннига и Библа в присутствии мо-
лекулярного водорода как единственного источника энергии. Близкие
результаты получают при использовании в качестве субстрата дрож-
жевого экстракта из расчета 1 г/л. В этих случаях к минераль-
ной среде Пфеннига и Библа прибавляют 10 мл раствора микроэлемен-
тов N 1 (см. прил.) и pH среды доводят до 7,8. Среду разливают по 10 мл
в пенициллиновые флаконы объемом 15 мл, вносят примерно по 100 мг
порошковой серы и стерилизуют. После стерилизации в первые фла-
коны каждой серии вносят исследуемый материал, гомогенизируют
при сильном встряхивании, затем производят рассев с десятикратными
разведениями в серию флаконов. Засеянные флаконы заполняют смесью
Нг + СОг в соотношении 8:2 на 2/3 объема. При использовании вместо
Н2 других доноров электронов (дрожжевого экстракта) создают газо-
вую фазу из углекислоты. О наличии роста сероредуцируюших бакте-
рий судят, как указано выше, по образованию сероводорода и ре-
зультатам микроскопирования.
Следует помнить, что при учете и выделении термофильных се-
роредукторов экспонирование засеянных флаконов при повышенной
температуре приводит к химическому образованию сероводорода в
реакциях химического "диспропорционирования”. Поэтому критерием
наличия микробиологического образования сероводорода из серы
должен быть микроскопический контроль флаконов с посевами, в
которых обнаружено появление H2S.
ГНИЛОСТНЫЕ БАКТЕРИИ, ОБРАЗУЮЩИЕ СЕРОВОДОРОД
Четвертый путь образования сероводорода в водоемах,имеющий
обычно меньшее значение, наблюдается при минерализации орга-
нических веществ в анаэробных условиях: сероводород выделяется за
счет распада сульфгидрильных групп белка. Эти процессы осуществля-
ются при участии неспецифических гетеротрофных бактерий.
Среда Бейеринка для гнилостных бактерий
МПА 1000 мл
Уксуснокислый свинец РЬ(СНзСОО)? I г
К слегка щелочному МПА прибавляют столько растертого угле-
кислого свинца, чтобы получилась равномерно белая, непрозрачная
среда. Посевной материал вносят в чашку Петри, заливают сте-
рильной питательной средой и помещают в анаэробные условия.
Рост происходит лучше, если углекислый свинец заменить окисью
висмута.
При росте колоний, выделяющих H2S, вокруг них замечается по-
бурение или почернение питательной среды.
Можно производить посевы в пробирки, заполненные наполовину
МПБ, а сверху подвешивать к пробке полоску фильтровальной бумаги,
131
смоченную в растворе ацетата свинца и предварительно высушенную.
Выделяющийся сероводород, взаимодействуя с ацетатом свинца,
связывается в виде PbS, в результате чего полоска бумаги темне-
ет или чернеет.
ФОТОСИНТЕЗИРУЮЩИЕ БАКТЕРИИ
К фотосинтезирующим серобактериям относятся прокариотные
пурпурные и зеленые серобактерии, которые осуществляют фотосин-
тез в анаэробных условиях без выделения кислорода. Они обладают
красными или коричневыми каротиноидами и хлорофилльными пигмен-
тами (бактериохлорофиллом a, b, с, d и е), отличающимися от хлоро-
филла зеленых растений и цианобактерий.
Для включения СОг в клеточный материал фототрофам требуют-
ся энергия в виде АТР и восстановленные эквиваленты. У фототроф-
ных серобактерий нет компонентов для функционирования фотосис-
темы II, поэтому они не способны использовать воду в качестве
доноров электронов. В качестве последних они используют H2S, S0,
SzOs , молекулярный водород, некоторые органические вещества.
Суммарную реакцию бактериального фотосинтеза изображают, по Ван
Нилю, следующим образом:
СО2 + 2H2S ——ет-> (СН2О) + 2S° + Н2О, или в общем
виде
2Н2А + СО2 2А + (СН2О)+Н2О.
донор акцептор окисленный восстанов-
водорода водорода донор ленный
водорода акцептор
Фотосинтезирующие бактерии подразделяются на четыре семейства,
как это видно из следующей схемы:
Порядок
Подпорядок
Семейство
Типовой
род
_____________±_
Rhodospirillineae
Rhodospirillaceae | /
Chromatiaceae
Rhodospirillales
Chlorobiineae
Chlorobiaceae |
Chloroflexaceae
Rhodospirillum
Chromatium
Chlorobium
Chloroflexus
Все фототрофные бактерии объединены в порядок Rhodospirilla-
les по способности к анаэробному фотосинтезу и наличию бакте-
риохлорофиллов а, Ь, с, d, е, g.
Большинство фотосинтезирующих бактерий — строгие фототрофы
и анаэробы. Однако как среди пурпурных, так и среди зеленых бак-
132
I
терий есть виды, способные расти гетеротрофно в темноте за счет
дыхания. Пурпурные серобактерии родов Thiocapsa и Amoebacter могут
в темноте в присутствии кислорода расти автотрофно, окисляя сое-
динения серы, подобно тионовым бактериям. Кроме того, для многих
несерных бактерий и некоторых представителей пурпурных серобакте-
рий установлена способность расти в темноте в анаэробных условиях
за счет сбраживания сахаров.
На основании различий в составе пигментов и во внутренней струк-
туре фотосинтезирующего аппарата фототрофные бактерии подраз-
деляются на две основные группы — родобактерии (пурпурные) и хло-
робактерии (зеленые). Родобактерии содержат бактериохлорофиллы
а или b и имеют хроматофоры везикулярного, тубулярного и ламелляр-
ного типов, окруженные двойной мембраной, связанной с цитоплазма-
тической мембраной клетки. Хлоробактерии содержат бактериохлоро-
филлы с, d или е и имеют структуры особого типа — хлоробиумвези-
кулы — овальные тельца, расположенные по периферии клетки и окру-
женные одинарной мембраной, связанной с цитоплазматической мем-
браной.
Подразделение на семейства Rhodospirillaceae и Chromatiaceae,
основанное на различиях в механизме использования Н2 как донора
водорода, недостаточно четкое, и, возможно, в будущем они будут рас-
сматриваться как целостная группа.
Хлоробактерии включают два семейства. Семейство Chlorobiaceae
объединяет строго анаэробные виды, для которых Н2 необходим как
донор водорода при фотосинтезе. Семейство Chloroflexaceae — не-
давно открытая группа нитчатых зеленых бактерий, способных к фо-
тогетеротрофии. Они не нуждаются в Нг при фотосинтезе и могут
развиваться гетеротрофно в темноте в аэробных условиях. Сюда вхо-
дят три рода: Chloroflexus, Chloronema и Oscillochloris. Все предста-
вители последнего семейства — трихомные бактерии, обладающие
скользящим движением.
Кроме того, в последние годы описаны новые роды фотосинтези-
рующих бактерий с необычными свойствами. Их таксономическое
положение в пределах известных семейств и родственные связи пока
недостаточно ясны. Поскольку описание этих новых организмов, об-
ладающих бактериохлорофиллом, отсутствует в известных руководст-
вах и определителях, приводим их краткую характеристику.
Heliothtix oregonensis gen. nov., sp. nov. Под этим названием опи-
саны трихомные скользящие термофильные бактерии, обнаруженные в
микробиальных матах термальных источников с температурой 35—56°
и pH 8,5 в штате Орегон (США). Длинные трихомы шириной около
1,5 мкм сформированы из клеток длиной 10 мкм. От известных
скользящих фототрофных бактерий семейства Chloroflexaceae они отли-
чаются пигментным составом и структурой фотосинтетического аппа-
рата. В отличие от представителей Chloroflexaceae, обладающих бакте-
риохлорофиллом с или d, они содержат в клетках бактериохлорофилл
а, иной состав каротиноидов и, главное, не имеют хлоросом. По типу
обмена бактерии фотогетеротрофы, аэротолерантны [Pierson et al., 1985],
Heliobacterium chlorum gen.nov., sp.nov. — второй представитель
133
Рис. 21. Основные представители фототрофных бактерий
1 — Rhodospirillum; 2 — Rhodomicrobium; 3 — Rhodopseudomonas sphaeroides;
4 — Rh. acidophila; 5 — Rh. palustris и Rh. viridis; 6 — Rhodocyclus; 7 — Ectothiorhodospira;
8 — Thiospirillum; 9 — Chromatium; 10 — Thiocystis; 11 — Thiosarcina; 12 — Thicapsa;
13 — Lamprocystis; 14 — Thiodictyon; 15 — Thiopedia; 16 — Amoebobacter; 17 —
Chlorobium; 18.— C. phaeobacteroides; 19 — C. vibrioforme; 20 — C. chlorvibrioides;
21 — C. phaeovibrioides; 22 — Prosthecochloris aestuarii; 23 — P. phaeoasteroidea; 24 —
Pelodiction lutelolum; 25 — P. phaeum; 26 — P. clathratiforme; 27 — Clathrochloris
sulfurica; 28 — Ancalochloris perfilievii; 29 — Chlorochromatium: 30 — Chloroflexus;
31 — Chloronema gigantea; 32 — Oscillochloris; 33 — Heliothrix oregonensis; 34 —
Heliobacterium chlorum
Рис. 21 (окончание)
недавно выделенных "коричнево-зеленых” фототрофных бактерий
[Gest, Favinger, 1983]. Это палочковидные бактерии размером
1Х(7—10) мкм, изогнутые, обладающие, по-видимому, скользящим
движением. Мезофилы, облигатные анаэробы, очень чувствительны
к кислороду, обладают фотогетеротрофным типом обмена. Бактерио-
хлорофилл с максимумом поглощения при 788 нм отличен от известных
и описан как новый тип бактериохлорофилла — бактериохлорофиллид.
Как и у Heliothrix, в клетках ни хлоросом, ни внутреннего плазмати-
ческого мембранного аппарата не выявлено, и субклеточная локали-
зация фотосинтетических пигментов пока не ясна.
Наконец, большой интерес исследователей привлекли аэробные
гетеротрофные бактерии, обладающие бактериохлорофиллом а. Не-
сколько новых видов объединены в новый род Erythrobacter [Shiba,
Shimidu, 1982]. Хотя, по некоторым данным, у этих морских бакте-
рий не обнаружено светозависимого потребления органических соеди-
нений и стимуляции роста светом, однако их способность к фото-
синтезу остается под вопросом.
В настоящее время установлены основные закономерности распро-
странения фототрофных бактерий в водоемах разного типа. В.М. Гор-
ленко [1982] отмечает, что зеленые формы серобактерий испытывают
сильную конкуренцию со стороны серных пурпурных бактерий. Однако
благодаря светоулавливающим структурам — хлоросомам зеленые
бактерии могут развиваться при крайне низких освещенностях. Таким
образом, бактерии семейства Chlorobiaceae остаются вне конкуренции
со стороны серных пурпурных бактерий в стратифицированных водое-
мах, в которых анаэробная зона располагается на границе про-
никновения света. По универсальности обмена с серными пурпурными
бактериями соперничают несерные пурпурные бактерии семейства
Rhodospirillaceae, наиболее быстро они растут в фотоорганогетеротроф-
ных условиях. Поэтому несерные пурпурные бактерии встречаются
135
в водоемах, где формируется анаэробная зона за счет изобилия легко
разлагающихся органических соединений. Метаболизм скользящих зе-
леных бактерий семейства Chloroflexaceae сходен с таковым у несерных
пурпурных бактерий. Разделение экологических ниш этих двух групп
фототрофных бактерий происходит по отношению к свету. Так, менее
светолюбивые скользящие зеленые бактерии могут занимать нижнюю
экологическую зону.
Отдельные виды фототрофных бактерий хорошо различаются по
морфологическим признакам и составу пигментов. Морфологические
типы фототрофных бактерий приведены на рис. 21. Более детальное
описание фототрофных бактерий и диагностический ключ для их иден-
тификации приведены в монографии В.М. Горленко и др. [1977].
Выделение фототрофных бактерий
В настоящее время разработаны методы культивирования фото-
трофных бактерий, позволившие выделить чистые культуры многих
видов, известных по морфологическим описаниям, а также применить
их для количественного учета на питательных средах. Этому способ-
ствовало введение в состав питательных сред необходимых витаминов
и микроэлементов и создание оптимального режима освещенности
для культивирования различных групп фототрофов. Количественный
учет фототрофных бактерий в образцах природного материала стал
возможным благодаря применению для этих методов микроскопии в
отраженном свете. Ниже приводится несколько прописей сред для
культивирования и количественного учета пурпурных и зеленых фото-
трофных бактерий.
Получение накопительной культуры [Тгйрег, 1970]. Образцы при-
родной воды или ила вносят в склянки, заполненные простерилизован-
ной средой Пфеннига, приведенной ниже, и выдерживают на свету при
20—25°. Для избирательного накопления определенных видов сле-
дует пользоваться светом определенной длины волны. При обычном
дневном свете сначала развиваются Thiorhodaceae, но через некоторое
время их вытесняют Chlorobiaceae. Далее благодаря устойчивости к се-
роводороду в культуре вместе с фотосинтезирующими бактериями
начинают развиваться диатомовые и синезеленые водоросли. Пол-
ностью прекратить развитие водорослей и зеленых фотосинтезирующих
бактерий удается с помощью светофильтра, который пропускает лучи
света с длиной волны больше 800 нм (фильтр N 530, Gottinger Farbfilter
GmbH). Для получения культуры Thiorhodaceae, содержащих бакте-
риохлорофилл Ь, необходимо использовать светофильтр с длиной
волны больше 900 нм (фильтр N 1Р 533, Gottinger Farbfilter GmbH).
Эти фильтры монтируют с одной стороны ящика, внутренняя поверх-
ность которого окрашена в черный цвет, а для охлаждения внутри
поставлен змеевик, через который пропускается холодная вода. Для
освещения снаружи перед светофильтром помещают лампу накали-
вания.
Выделение чистой культуры. 1,3 мл 2,4%-го агара с добавкой 0,1%-го
раствора хлористого кальция на дистиллированной воде вносят в
136
длинную и узкую пробирку, закрывают ватной пробкой и стерили-
зуют в автоклаве. После стерилизации пробирки с расплавленным
агаром помещают в водяную баню при 55°.
2. В склянку, содержащую 120 мл полной стерилизованной среды
Пфеннига, добавляют стерильный раствор аскорбиновокислого нат-
рия до концентрации 0,05% и нагревают в водяной бане до 38°.
3. Затем в каждую пробирку с агаром вносят по 6 мл стериль-
ной нагретой среды Пфеннига, хорошо перемешивают и хранят при
38° в водяной бане.
4. Первую пробирку заражают 1—3 каплями из культуры накопле-
ния фотосинтезирующих бактерий и немедленно тщательно перемеши-
вают.
5. Из этой пробирки 0,5—1 мл вносят во вторую пробирку с агари-
зованной средой Пфеннига и перемешивают, эту процедуру повто-
ряют до 8-го разведения.
6. Каждую пробирку после заражения последующей помещают в во-
дяную баню с температурой 15—20°, чтобы быстрее остудить агар.
7. После застывания агара пробирку заливают расплавленной сте-
рильной смесью (1 часть парафина и 3 части парафинового масла)
слоем в 2,5 см. Пока застывает парафин, пробирки помещают на 1 ч
в темноту, потом для лучшей изоляции от воздуха верхнюю часть
пробирок нагревают повторно.
8. Культуры инкубируют при 20—25° при освещенности прибли-
зительно 500—1000 лк.
9. Как только начнется рост, берут пробирки, в которых не
больше 20 колоний, разрезают алмазом на соответствующем уровне
и одну из колоний фотосинтезирующих бактерий затягивают в пас-
теровскую пипетку, снабженную для удобства резиновой трубкой.
Затем колонию бактерий размешивают в стерильной воде и 3—4 раза
повторяют всю операцию выделения.
10. Чистоту культурыдтроверяют микроскопически, посевом на МПА
и на среду для сульфатредуцирующих бактерий. Отсутствие роста на
этих средах и морфологическая однородность культуры служат кри-
терием чистоты.
Среда Пфеннига для фотосинтезирующих серобактерий
[Pfennig, 1965]
Пропись приводится для 3 л среды и состоит из 4-х растворов.
Раствор 1
СаС1г2Н2О 1,3 г
NaCl (в зависимости от 0,5—105 г
места обитания бактерий)
Вода дистиллированная 2500 мл
500 мл этого раствора стерилизуют в колбе Эрленмейера объемом
2000 мл и разливают по 40 мл в склянки объемом 65 мл. Для куль-
тивирования используют склянки с завинчивающимися тефлоновыми
крышками. После стерилизации в автоклаве склянки охлаждают до
комнатной температуры и плотно завинчивают.
137
Раствор 2
Раствор микроэлементов N 1 30 мл
(см. прил.)
Витамин Ви (2 мг в 100 мл) 3 мл
КН2РО« 1 г
Раствор 3
NaHCOj
Вода дистиллированная
NHiCl
MgCh-бНгО
К Cl
Вода дистиллированная
900 мл
67 мл
Раствор 3 насыщают углекислотой до снижения pH до 6,2. Затем
растворы 2 и 3 смешивают и немедленно стерилизуют ультрафильтра-
цией через фильтр Зейтца, который предварительно промывают
200 мл дистиллированной воды. После стерилизации смесь растворов
2 и 3 вносят асептически по 20 мл в склянки, содержащие по 40 мл
раствора 1.
Раствор 4
Na2S-9H2O 3 г
NaHCO? 2 г
Вода дистиллированная 200 мл
Раствор 4 стерилизуют и при помешивании добавляют по каплям
1,5 мл автоклавированного 2М раствора серной кислоты. Далее этот
раствор по 3 мл вносят в склянки со средой и доливают средой 1 так,
чтобы под пробкой остался небольшой пузырек воздуха. Затем
устанавливают pH продуванием углекислоты или добавлением 2М
серной кислоты в асептических условиях. Для Chlorobiaceae pH доводят
до 6,8; для Thiorhodaceae — до 7,2.
Среда для культивирования зеленых и пурпурных серобактерий
[Biebl, Pfennig, 1978]. 7
Эту среду готовят в двухлитровых колбах Эрле^мейера с отростка-
ми у дна, через которые можно сливать среду.
Трубку из силиконовой резины примерно 30 см длиной соединяют
с колпаком для того, чтобы можно было из колбы разливать асепти-
чески среду по склянкам.
Раствор 1 Ыа282Оэ (раствор 6) 1 мл NH<CI 0,5 г
КНгРО< 1 г MgSO*-7HjO 0.4
Вода дистиллированная 950 мл СаС12-2Н2О 0,05 г
Раствор стерилизуют в двухлитровой колбе с ватной пробкой.
При выделении морских MgSO4-7H2O. форм к среде добавляют 20 г NaCl и 3 г
Раствор 2
ЭДТА динатрие- 5.2 г СаС1г6Н2О 190 мг
вая соль СиС12-2Н2О 17 мг
FeCl2-4H2O 1,5 г NiCI2-6H2O 24 мг
ZnCh 60 мг Na2MoOv2H2O 36 мг
MnCI2-4H2O 100 мг Вода дистилли- 1000 мл
НзВОз 62 мг рованная
138
Соли растворяют в 1 л дистиллированной воды в указанном поряд-
ке, и раствор хранят в холодильнике.
Раствор 3
Витамин Ви
Вода дистил-
лированная
Раствор 4
2 мг NaHCOj 5 г
1000 мл Вода дистил- 100 мл
лированная
Растворы 3 и 4 стерилизуют ультрафильтрацией через мембранный
фильтр.
Раствор 5
Na2S-9H2O
Вода дистиллированная 100 мл
Свежеприготовленный раствор после автоклавирования вносят в сре-
ду для пурпурных серобактерий в количестве 6 мл, для зеленых
серобактерий 12 мл.
Раствор 6
Na2S2O»-5H2O 10 мл
Вода дистиллированная 95 мл
После охлаждения в раствор 1 вливают 1 мл раствора 2; 1 мл раст-
вора 3; 40 мл раствора 4; 6 или 12 мл раствора 5; 5 мл раствора 6. Затем
стерильным раствором соды доводят pH среды до 7,3 для пурпурных или
до 6,8 для зеленых серобактерий. Среду асептически разливают в склян-
ки объемом 50 или 100 мл с металлическими завинчивающимися
затворами, содержащими автоклавированные резиновые прокладки.
Под пробкой оставляется небольшой пузырек воздуха, чтобы пре-
дохранить склянку от разрыва при изменении давления.
Среда для Rhodospirillaceae [Pfennig, 1978\
КН2РО4 0,5 г Цитрат железа, 01%-й 5 мл
MgSO«-7H2O 0,2 г раствор
NaCl 0,4 г Раствор микроэлементов 1 мл
NH*C1 0,4 г N 1 (см. прил.)
СаС12-2НзО 0,05 г Витамин B|2 (I мг 1 мл
Органическая 1 г в 100 мл)
кислота Вода дистиллированная 1000 мл
Дрожжевой экстракт 0,2 г
Соли в среде нужно растворять в том порядке, как указано. Если
в качестве органического вещества вносятся дикарбоновые кислоты,
то pH нужно устанавливать 6,8, если жирные кислоты, то 7,3. Если на-
копительная среда предназначается для Rhodopseudomonas acidophila
или Rhodomicrobium van Mielii, то начальный pH среды нужно уста-
навливать равным 5,3—5,5.
Культивировать лучше всего в склянках на 50 мл с завинчиваю-
щимися крышками с резиновыми прокладками, под которыми оставля-
ют маленький пузырек воздуха. В качестве органического вещества
139
Rhodospirillaceae используют соли жирных кислот: ацетат, пропионат,
бутират и ряд их высших гомологов. Из дикарбоновых кислот при-
годны сукцинат и глютарат. Ацетат и сукцинат рекомендуется для вы-
деления различных видов пурпурных несерных бактерий.
Выделение чистой культуры пурпурных фототрофных бактерий.
В приведенную выше среду Пфеннига [Pfennig, 1978] добавляют 1,5% хо-
рошо отмытого агара и после стерилизации разливают в 10 пробирок,
помещают их в водяную баню при температуре 45°, чтобы агар не остыл.
Первую пробирку заражают 0,1 —1 мл из культуры накопления, готовят
серию десятикратных разведений и из каждой пробирки зараженную
агаризованную среду затягивают в стерильную стеклянную трубочку.
Пробирки и трубочки с зараженной средой выдерживают при ос-
вещении лампой накапливания (50—-75 Вт) с расстояния 40—60 см или
при естественном освещении при 18—25°. Как только появятся мел-
кие колонии, их переносят на жидкую питательную среду с помощью
пастеровской пипетки, разрезая трубочки в месте появления единич-
ных окрашенных колоний. Далее выросшие на жидкой среде культуры
проверяют на чистоту путем микроскопирования и посевом на МПА и
среду для сульфатредуцирующих бактерий.
Выделение и культивирование скользящих зеленых бактерий рода
Chloroflexus. Для получения накопительных и чистых культур скользя-
щих зеленых бактерий рода Chloroflexus используют среду Пирсона и
Кастенхольца [Pierson, Castenholtz, 1974].
Среда D для выделения Chloroflexus
FeCI5-7H2<\ 1 МЛ Нитрилтриуксусная кислота 0,1 г
CaSO4-2H2O 0,06 г Раствор микроэлементов 1 мл
MgSO4-7H2O 0,10 г (см. ниже)
NaCl 0,008 г Глицилглицин 1 г
KNOi 0,103 г Агар Дифко 15 г
NaNOs 0,689 г Вода дистиллированная 1000 мл
NajHPOi 0,111 г
Раствор
микроэлементов
H2SO4, кони. 0,5 мл CuSO4-5H2O 0,025 г
MnSO4 H2O 2,28 г NaiMoOr 2Н2О 0,025 г
ZnSO4-7H2O 0,5 г СоС12-6Н2О 0,045
HBO3 0,5 г Вода дистиллированная 1000 мл
Устанавливают pH 8,2. Раствор FeCb готовят, растворяя 0,2905 г
FeCb в 1 л воды.
При выделении культур используют способность бактериальных
нитей к скольжению. Посевной материал помещают на поверхность
слегка подсушенной агаровой среды, разлитой в чашки Петри, и ин-
кубируют при температуре, близкой к температуре источника выделе-
ния, и при интенсивности освещения около 1000 лк. Под бинокулярной
лупой находят отползающие нити и тонко оттянутой пастеровской
пипеткой переносят их в чашки Петри с агаровой средой того же
состава, в которую добавлено дополнительно 0,05% дрожжевого
экстракта. Выросшие колонии повторно отсевают с разведениями на
агаровую среду в чашки Петри. Чистую культуру изолируют путем
140
перенесения отдельных отползших нитей в свежую порцию жидкой
среды для фотогетеротрофного роста. Последняя отличается от при-
веденной выше тем, что содержит 0,8 г/л глицилглицина и 2 г/л дрож-
жевого экстракта. Культивирование проводят в пробирках или колбах, .
заполненных средой на 3/4 и закрытых ватными пробками в микрй-
аэробных условиях.
Культивирование скользящих зеленых бактерий рода Heliothrix. Для '
получения накопительных культур умеренно термофильных нитчатых
зеленых бактерий рода Heliothrix используют среду IM [Pierson et al.,
1985].
Среда 1М для изолирования нитей Heliothrix
Раствор 1
CaCh-2HjO 320 мг FeCb 0,292 мг
MgSO.-7H2O 400 мг раствор микро- 10 мл
KCl 500 мг элементов (см. сре-
NaCl 1000 мг ду для Chloro-
(NH.)2SO< 500 мг flexus D)
KHjPO, 300 мг Витамин Bn 0,005 мг
Раствор доводят до pH 7,6 с помощью 1 N раствора NaOH. Осадок
удаляют фильтрованием через фильтровальную бумагу.
Раствор 2
NaHCOj 0,6 М раствор в воде
Содовый раствор автоклавируют, затем в течение часа насыщают
стерильно углекислотой.
К 250 мл раствора 1 добавляют 650 мл дистиллированной воды
и 15 г агара. Автоклавируют, охлаждают и прибавляют 100 мл раст-
вора 2.
Развитие Heliothrix обнаружено в альго-бактериальных матах тер-
мальных щелочных источников с температурой 32—56°. При выде-
лении культуры используют способность нитей к скольжению по твер-
дому субстрату. Кусочки бактериального мата, содержащие зеленые
нити, помещают на поверхность агаровой среды в чашки Петри, ко-
торые инкубируют в воздушной среде в присутствии 5% СОг при осве-
щенности 3000 лк и 45° в течение ночи. Отползшие нити вырезают
с блоком агара, помещают в IMC-среду (см. ниже) и культивируют в ука-
занной выше газовой смеси при 37°.
Чистую культуру Heliothrix не удалось получить. Культивирование
этих бактерий осуществлено в лабораторных условиях на среде IMC
в бинарной культуре с аэробными хемогетеротрофными олиготроф-
ными бактериями Isosphaera pallida, выделенными из того же термаль-
ного источника.
Среда IMC для бинарной культуры Heliothrix
Среда IM 1000 мл Раствор витаминов
Глюкоза 0.25 г Никотиновая кислота 2 мг
Казаминокислоты 0,25 г Тиамин солянокислый 1 мг
(без витаминов) л-Аминобензойная 0,2 мг
Раствор витаминов 0,5 мл кислота
(см. ниже) Биотин 0,02 мг
141
Готовую среду стерилизуют автоклавированием. Для приготовления
твердых сред перед стерилизацией добавляют агар 15 г/л.
В чашки с агаровой средой, предварительно инокулированные
I. pallida, вносят блок агара с отдельной нитью Heliothrix. Последующую
инкубацию бинарной культуры осуществляют при 37° при условиях
освещенности и в газовой смеси в микроанаэробных условиях, как
указано выше.
Выделение зеленых бактерий рода Heliobacterium. Палочковидные
"коричнево-зеленые” фототрофные бактерии, обладающие способностью
к скользящему движению, выделяют в строго анаэробных условиях
на среде ЕМ [Gest, Favinger, 1983].
Среда ЕМ для получения накопительной культуры
Среда готовится путем смешивания пяти растворов: 1 — 30 мл; 2 —
0,1 мл; 3 — 0,2 мл, 4 — 0,5 мл, 5 — 0,2 мл.
Раствор 1
Сукцинат натрия 2 г D-Молочная кислота 0,6 г
шестиводный ЭДТА динатриевая 0,005 л
Цитрат натрия 0,8 г соль
двухводный FeSO4-7H2O 0,006 г
D-Яблочная кислота 0,5 г СаС12-2Н2О 0,075 г
Ацетат натрия 0,5 г FeSO4-7H2O 0,006 г
Микроэлементы
HjBOj I 2,8 мг ZnSO* 7Н2О 0,25 мг
MnSO4-H2O 1,6 мг Co(NO3)2-6H2O 60 мкг
Na2MoO4-2H2O / 0,75 мг Cu(NOi)r ЗН2О 40 мкг
pH 6,8
Раствор 2
NH«CI, 3%-й раствор —
Раствор 3
Никотиновая кислота 10 мг Пантотенат кальция I мг
л-Аминобензоат 3 мг Витамин Bt2 20 мкг
Тиамин солянокислый 1 мг Биотин 15 мкг
Раствор 4 Вода дистиллированная 6,6 мл
КН2РО4 2 г Вода дистиллированная 50 мл
К2НРО4 3 г pH 6,8
Раствор 5
Тиогликолат натрия, 6%-й раствор
Растворы 3 и 5 стерилизуют ультрафильтрацией, остальные — авто-
клавированием.
Элективность среды для азотфиксирующего вида Heliobacterium
обеспечивается внесением очень незначительных количеств аммоний-
ного азота, недостаточных для развития бактерий, не обладающих
этой способностью. Культивирование проводят в строго анаэробных
условиях. После внесения посевного материала склянки со средой
выдерживают открытыми 1 ч в анаэростате, закрывают резиновыми
пробками и инкубируют в люминостате. При наличии роста бактерий
в виде темно-зеленого налета или плёнки на дне фототрофные бакте-
рии пересевают еще раз на среду того же состава, а затем рассевают
142
на агаровую среду в чашки Петри, которые также инкубируют в анаэ-
робных условиях на свету. Чистую культуру получают путем рас-
сева колоний зеленого цвета на агаровую среду с повторным микро-
скопическим контролем и отсевом отдельных колоний в жидкую
среду ЕМ.
Определение абсорбционных спектров пигментов фотосинтезирую-
щих бактерий [Тгйрег, Yentsch, 1967]. Культуру бактерий или естест-
венную воду из водоема фильтруют через мембранный фильтр. Послед-
ний просушивают и просветляют кедровым маслом. Затем фильтр
с бактериями вместе с контрольным, просветленным маслом фильтром
монтируют в спектрофотометре на кюветах. В качестве контроль-
ного служит фильтр, через который профильтрован тот же объем во-
ды с горизонтов, не содержащих фотосинтезирующих бактерий. Этот
же фильтр используется в качестве контроля за поглощением света
взвешенными частичками.
Спектры поглощения фотосинтезирующих бактерий снимают обыч-
ным способом и определяют пики поглощения в области видимого света.
Однако таким способом невозможно определить поглощение света
длиной более 750 нм в связи с сильной абсорбцией света самим
веществом мембранных фильтров в области инфракрасных лучей.
В дальнейшем метод был видоизменен Трюпером и Енчем [Trtiper,
Yentsch, 1967] и приспособлен для измерения абсорбционного спектра
в инфракрасной части спектра.
В зависимости от густоты от 5 до 50 мл бактериальной суспен-
зии фильтруют через мелкопористый стеклянный фильтр G-5 диа-
метром 25 мм. Влажный фильтр непосредственно монтируют в специ-
альный держатель, который уже содержит увлажненный контрольный
фильтр. Влажность фильтров должна быть достаточной для того,
чтобы они прилипли обратной стороной к держателю, который поме-
щают в спектрофотометр на место, где обычно ставят кюветы. Спект-
ры снимают в инфракрасном фотометре.
Количественный учет фототрофных бактерий
Использование питательных сред для количественного учета. В за-
висимости от задач исследования используют одну из приведенных
выше питательных сред, вводя соответствующие доноры водорода и соз-
давая необходимый режим освещенности после внесения посевного
материала. Посевной материал образцов воды или грунта вносят с
10-кратными разведениями в заранее подготовленные флаконы с го-
товой средой и экспонируют при выбранном режиме освещенности до
2—3 нед. О развитии судят по появлению розового, коричнево-
зеленого или зеленого цвета (оттенка) среды. С помощью микроскопи-
ческого просмотра и исследования морфологии клеток культур из
предельного разведения определяют принадлежность фототрофных
бактерий к определенному роду. Дополнительные сведения, важные
для диагностических целей, получают путем определения характеристик
абсорбционных спектров пигментов в культуре фототрофов.
. Использование мембранных фильтров для подсчета в отраженном
свете. Отечественные микроскопы МБИ-6 и МБИ-11 приспособлены
143
для микроскопии в отраженном видимом свете как в светлом, так
и в темном поле. Специфика метода заключается в том, что осве-
щение объекта осуществляется сверху через специальный эпиобъек-
тив. В наборе микроскопа МБИ-6 имеются четыре ахроматических
эпиобъектива — 0X0,20; 21X0,40; 40X0,65 и 95X1,0 (масляная
иммерсия). Применение объектива 95X1,0 дает возможность изучать
мелкие формы микроорганизмов.
Для этого через мембранные фильтры профильтровывают озерную
воду. Фильтры высушивают и разрезают на две равные части. Одну
половину фильтра окрашивают эритрозином, другая остается неокра-
шенной. Обе половины фильтра просветляют канадским бальзамом
(иммерсионным маслом) на предметном стекле и сверху покрывают
покровным стеклом. На окрашенной половине фильтра подсчитывают
общую численность микроорганизмов в проходящем или отраженном
свете в темном поле, причем в последнем случае микроорганизмы видны
более рельефно. Неокрашенную половину фильтра просматривают
только в отраженном свете. При этом в светлом поле отчетливо
видны мелкие фотосинтезирующие бактерии семейства Chlorobiaceae.
Виды, имеющие зеленую окраску, светятся голубым светом и легко
могут быть определены и подсчитаны. К таковым относятся Chloro-
bium limicola, Pelodictyon clathratiforme, P. luteolum, Prosthecochloris
aestuarii, Ancalochloris perfilievii, Chloronema, консорциумы Chlorochro-
matium aggregatum и Ch. glebulum.
Виды, имеющие коричневую окраску, светятся желтовато-зеленым
цветом — Chlorobium phaeobacteroides, Ch. phaeovibrioides, Pelodictyon
phaeum и консорциум Pelochromatium roseum. В отраженном свете в
светлом поле в клетках отчетливо видны газовые вакуоли как ярко
блестящие включения.
Серные пурпурные бактерии не выявляются в светлом поле, но
видны в темном поле и имеют розовую окраску. Включения серы хо-
рошо видны и светятся белым светом.
ХЕМОЛИТОТРОФНЫЕ СЕРООКИСЛЯЮЩИЕ БАКТЕРИИ
В окислительных реакциях биологического цикла серы в био-
сфере принимают участие микроорганизмы различных систематических
групп. Среди этих групп микроорганизмов наиболее изучены в физи-
ологическом отношении представители фототрофных серобактерий и
тионовые бактерии. У представителей зеленых и пурпурных серобак-
терий (как и у некоторых аэробных фототрофов, например у циано-
бактерий) восстановленные соединения серы служат донорами элект-
ронов при фотоассимиляции углекислоты. Хемотрофные сероокисляю-
щие бактерии, представители родов Thiobacillus, Thiomicrospira, Sulfo-
lobus и других, используют сероводород и другие восстановленные
соединения серы в качестве источников энергии и обладают хемоли-
тоавтотрофным или хемолитогетеротрофным типом обмена веществ.
Многие представители этих родов достаточно хорошо изучены в физио-
логическом отношении (табл. 15).
В последние годы у целого ряда микроорганизмов была описа-
на способность к росту в автотрофных условиях за счет окисле-
144
ния соединений серы. Среди них имеются не только бактерии, от-
несенные к новым родам, но и ранее известные виды, у которых
обнаружена способность к хемолитоавтотрофному росту за счет
окисления серных соединений. Так, сравнительно недавно описаны
новый род мезофильных сероокисляющих бактерий Thiosphaera [Ro-
bertson, Kuenen, 1983], облигатно ацидофильные термофильные бакте-
рии рода Sulfobacillus [Головачева, Каравайко, 1978] и архебакте-
рии Sulfurococcus [Головачева и др., 1987]. Как упоминалось вы-
ше, способностью к окислению серы наряду с ее восстановлением
до сероводорода в условиях анаэробиоза обладают архебактерии
рода Acidianus (A. infernus, A. brierley) [Segerer et al., 1986], Desul-
furolobus ambivalens [Zillig et al., 1985, 1986]. Бактерий рода Ther-
mothrix [Caldwell et al., 1976], очевидно, идентичны ранее опи-
санным бактериям Thiospirillum pistiense [Czurda, 1935; Кузнецов,
1953]. Из известных ранее микроорганизмов окисление тиосуль-
фата для автотрофного роста обнаружено у представителей некото-
рых водородных бактерий — Aquaspirillum autotrophicum, Paracoccus
denitrificans, Xantobacter autotrophicus, Pseudomonas palleronii и Ps.
pseudoflava [Wiegel et al., 1978; Friedrich, Mitrenga, 1981], у метило-
трофных бактерий рода Hyphomicrobium.
В водоемах при умеренной температуре среды наиболее распро-
странены тионовые бактерии родов Thiobacillus и Thiomicrospira и,
по-видимому, Thiosphaera.
Отдельные виды тионовых бактерий заметно различаются по фи-
зиологическим свойствам (табл. 16). Отличительная особенность
хемолитотрофных сероокисляющих бактерий состоит в том, что эле-
ментная сера, образуемая в процессе окисления серных соединений,
накапливается вне клетки в среде в отличие от бесцветных серо-
бактерий, у которых она накапливается внутриклеточно.
Ранее к тионовым бактериям относили гетеротрофные виды
Th. trautweinii и Th. coproliticus, которые в присутствии органи-
ческих веществ способны окислять тиосульфат до тетратионата.
Как было установлено позднее, окисление тиосульфата не сопро-
вождается использованием энергии для роста. Поэтому в настоящее
время их не относят к роду Thiobacillus. Осуществлять подобную
реакцию способны многие гетеротрофные бактерии за счет переки-
си водорода, образуемой при окислении органических веществ [Дуби-
нина, Грабович, 1981]. Однако в настоящее время вклад хемо-
органогетеротрофных микроорганизмов в процессы окисления серных
соединений в водоемах слабо изучен [Kelly, Kuenen, 1984].
Особую морфолого-физиологическую группу составляют хемоор-
ганогетеротрофные бесцветные серобактерии, способные накапли-
вать элементную серу внутри клеток. Они рассматриваются в следую-
щем разделе книги.
Для выделения и количественного учета сероокисляющих авто-
трофных, литогетеротрофных и миксотрофных бактерий предложен
ряд элективных питательных сред, различающихся главным образом
либо по составу доноров (S2O3 , S°, S2 ) или акцепторов элек-
тронов (О2, NOj) и pH, либо по наличию органических соеди-
10. Зак. 1766 145
Таблица 15
Сравнительная характеристика основных представителей хемолитотрофных
сероокисляющих бактерий
Род Форма клеток Подвижность, наличие жгути- ков Окраска по Граму G + С в ДНК, мол.%
Thiobacillus Палочковидная Полярный жгу- тик - 52—68
Thiomicrospira Спиральная То же - 36—44
SulfoIobus (S. acido- caldarius, S. solfata- ricus) Дольчатая, сфери- ческая Отсутствует - 37—42
Thennothrix (Thios- pirillum pistiense) Вибриоидная, палоч- ковидная, клетки в цепочках Полярный жгутик —
Thiosphaera Кокко- или палочко- Отсутствует - 66
видная, склонны к
образованию цепочек
Sulfobacillus Палочковидная, гру- шевидная, ветвящаяся
Sulfurococcus Кокковидная, иногда с тончайшими вы- ростами и почками
Acidianus (A. brier-
ley, A. infemus)
DesulfuroIobus am-
bivalens
Кокковидная, доль-
чатая, овальная
* Характерно для отдельных видов.
нений. Необходимо, однако, подчеркнуть, что применяемые среды не
являются достаточно элективными и, как правило, росту автотроф-
ных видов бактерий сопутствуют гетеротрофы или миксотрофы: Мор-
фологические и культуральные свойства изолятов достаточны лишь
для разграничения отдельных родов. Поэтому надежная идентифика-
ция выделенных бактерий должна включать детальное изучение их
физиологических и генетических свойств.
Выделение культур рода Thiobacillus
Th. denitrificans (облигатный хемолитоавтотроф). Это факультатив-
но анаэробные бактерии, способные к денитрификации при окислении
соединений серы. В присутствии молекулярного кислорода и нитра-
тов, как правило, эти бактерии осуществляют аэробное дыхание и
146
Отношение к температуре pH (пре- делы роста) Неорганические до- норы электронов Акцепторы электронов Источник СОг в конструктив- ном обмене
Мезофилы 0,5*—10 s2; s", s,o;’, sol; s2oi, s,o;, s.oi, Fe* ог, no;*, no;* СО2, органи- ческие вещест- ва*
5,0—8,5 S-2, s", s.or o2, no;, no? СО2
Термофилы 0,5—7 S2, Si; S", Fe1’ O2, Fe3* СОг или орга- нические ве- щества
Термофилы, 67—77° 6,7—7 s1, s2oi; s", sor Oj, no;, no; (при гетеро- трофном рос- те) СОг, органи- ческие вещества
Мезофилы, 15—42° 6,5—10,5 s2; s2ot, h2 О?, фумарат, no;, no; (при авто- и гетеротроф- ном росте) СОг или орга- нические ве- щества
Умеренные тер- мофилы, 25—58° 1,7— 5,3 S2; S°, Fe2* о2 Органические вещества
Термофилы, 50—87° 1—3 (об- лигатный ацидо- фил) s° Oi СОг или орга- нические ве- щества
Термофилы - S", Fe2; H2 Oi Органические вещества
То же, 80—96° 1,5—6,3 S°, H2 О2 или S° СОг
нитратредуктазу диссимиляционного типа не синтезируют. Чтобы из-
бежать конкуренции со стороны других тионовых бактерий, расту-
щих при pH около 7, получение накопительных и чистых культур
можно проводить избирательно, используя нитраты как конечный
акцептор электроноц.
Анаэробная среда Тейлора [Taylor et al., 1971}
KNO3 2 г
NH,CI 1 г
KH2PO4 2 г
NaHCOa . 2 г
MgSO4-7H2O 0,8 г
NajSjOj-SHjO 5 г
Раствор микроэле- 1 мл
ментов N 1 (см,
прил.)
Вода дистилли- 1000 мл
рованная
147
Таблица 16
Сравнительная характеристика представителей родов
Thiobacillus и Thiomicrospira
Организм G + C в ДНК, мол. % pH Хемолитотрофы Способ- ность к денитри- фикации Окисляемые сое- динения серы
облигат- ные факуль- тативные
Thiobacillus de- 63—67,9 7,0—7,5 + + s!’,s", SiOLs.oi'.
nitrificans Th. neapolitanus 55,1—57 6,2-7,5 + SjOf, CNS’ S2‘, S°, SjOf, s^ot
Th. novellus 66—68 7.0—8,0 - + - S°, S:Of, 8дОГ
Th. thioparus 62—66 6,6—7,5 + - +• S2’. S2O2”, S°, CNS’
Th. intermedius 64,8 5,0—7,0 - + + s,oi\ s"
Th. perometabolis - 5,8—7,0 - + - s2', Sjoi’, s", s,o;’
Th. thiooxidans 52—57,9 2,0—4,0 + - - s2‘, s", ssor
Th. ferrooxidans 53,6—60,1 1,5—4,0 + + - s2\s°, SiOi',S4OT,
Th. acidophilus 2,0—4,0 + - sof s“
Th. organoparus - 2,0-5,0 - + - s°
Th. tepidarius*** - 6,0-7,5 - + + s’. S,or. S,or.
Th. versutus 7.5—9,0 + _»» s<ot s2of %
Th. thermophi- 66,2 2,7—8,0 - + - s’. sot, Sior
lus*** Th. aquaiesuh's*** 65,7 7,0—9,0 + + S4OF SjoF, SjOe, S4O6
Thiomicrospira 43—44 6,0—8,0 + - - s2', s°, s.o?
pelophila Thm. denitrificans 36 7,0—8,0 + + S2 , S", S;Or
* Восстановление нитратов до нитритов.
•* При гетеротрофном росте.
*•* Термофилы с оптимумом 43—45°.
Устанавливают pH 6,8—7,0. При приготовлении аэробной среды
KNO? исключается. Среда содержит, кроме KNO3, и NH4CI, так как
ряд штаммов Th. denitrificans не способны использовать KNO3 в ка-
честве источника азота. pH среды при росте Th. denitrificans не
претерпевает заметных изменений и не требует нейтрализации.
При получении культур накопления вместе с тионовыми бакте-
риями за счет выделяемых или органических веществ могут разви-
ваться гетеротрофные денитрификаторы и восстанавливать нитраты
до нитритов и свободного азота. Очистку обычно проводят, выращи-
вая бактерии аэробно на агаровой среде. После ряда пересевов
Th. denitrificans высевают на анаэробную среду и проверяют спо-
собность к выделению свободного азота.
Th. neapolitanus (облигатный хемолитоавтотроф). Бактерии растут
на минеральной среде с восстановленными соединениями серы. При
148
нейтральных значениях pH Th. neapolitanus может ассимилировать не-
которые органические вещества в конструктивном обмене, но не
может их использовать в энергетическом обмене.
Элективной среды для выделения этого организма не сущест-
вует, но из накопительной культуры он может быть легко выделен
на тиосульфатном агаре.
Среда для выделения Th. neapolitanus
Раствор I Раствор 2
КН?РО< 4 г ЭДТА 50 г
К2НРО, 4 г ZnSO4-7H2O 2.2 г
MgSO4-7H2O 0.8 г СаС12-2Н2О 7,34 г
NH4CI 0.4 г МпС12 4Н2О 2.5 г
KHCOj 0.7 г СоС12-6Н2О 0.5 г
Na2S2Or5H2O I0 г (NH4)eMo7O24'4H2O 0,5 г
Раствор 2 2 мл FeSCh 7Н2О 5 г
Вода дистиллиро- 1000 мл CuSO4-5H2O 0,2 г
ванная NaOH 11 г
Вода дистиллиро- 1000 мл
ванная
Для приготовления раствора 2 растворяют ЭДТА, доводят NaOH до
pH 6,0. Затем растворяют соли одну за другой, поддерживая pH 6,0.
После того как все соли будут внесены и растворятся, подкисля-
ют раствор соляной кислотой до pH 4,0, разливают его по пробир-
кам до пробки или по небольшим склянкам и хранят при 4°. На 1 л
раствора 1 вносят 2 мл раствора 2. Рост бактерий в культураль-
ной среде происходит в пределах pH от 6,2 до 7,0.
Th. thioparus (облигатный хемолитоавтотроф) — типовой вид рода
Thiobacillus. Подобно Th. neapolitanus, он способен ограниченно асси-
милировать углерод органических соединений (ацетат, сукцинат). Его
размножение облигатно зависит от энергии окисления восстановлен-
ных соединений серы. От Th. neapolitanus он отличается: 1) спо-
собностью к анаэробному росту на среде с нитратами, которые
восстанавливаются до нитритов, 2) способностью расти на тиоцианате
и 3) накоплением элементной серы при росте на среде с тиосуль-
фатом. Выделяется из пресных и солоноватых вод.
Накопительную культуру Th. thioparus получают путем зараже-
ния среды Бейеринка для тионовых бактерий при pH 8,5—9 неболь-
шим количеством ила-иЛи воды из меромиктических олиготрофных
озер с наличием сероводорода в хемолимнионе. При наличии тионо-
вых бактерий в посевном материале среда мутнеет через 2—4 дня,
и на ее поверхности появляется пленка элементной серы, которая
образуется при окислении тиосульфата.
Для выделения чистой культуры из обогащенной культуры, полу-
ченной путем нескольких последовательных пересевов пленки в све-
жие порции стерильной среды, производят высев с разведениями
на агаровые пластины. Через 2—3 дня на поверхности агара по-
являются мелкие колонии (1 —1,5 мм в диаметре), белые от отложив-
149
шейся серы. Из выросших на твердой среде колоний делают массо-
вый отсев (в количестве 80—100 шт.) в пробирки со скошенным ага-
ром. В каждую пробирку вносят 2—3 мл стерильной жидкой пита-
тельной среды этого же состава, после того как в пробирках поя-
вится рост по штриху. Появление пленки серы на поверхности жид-
кости в пробирках указывает на хороший рост Th. thioparus. Со-
держимое этих пробирок переносят стерильной пипеткой в колбы
с жидкой средой и сразу же производят проверку на чистоту
культуры (см. ниже). Этот способ дает возможность сразу отбра-
ковать грязные культуры и выбрать активные штаммы.
Проверку чистоты культуры производят путем высева на МПА,
МПБ, СПБ с глюкозой, сусло с мелом, сусло-агар, картофельный
агар, картофельную крошку, ломтики картофеля, на среды Виноград-
ского для нитрификаторов, среду Ваксмана для Th. thiooxidans, среду
Бейеринка без тиосульфата, но с добавкой 1% различных органи-
ческих соединений, таких, как глюкоза, лактат кальция, щавеле-
вокислый, уксуснокислый или муравьинокислый натрий. В случае
чистой культуры Th. thioparus рост на этих средах отсутствует.
При высеве 100 колоний с агаровых пластинок на скошенный агар по
указанному выше методу удается сразу получить 2—3 активные
чистые культуры Th. thioparus.
Чистую культуру следует поддерживать на жидкой питательной
среде, причем необходимо производить пересевы не позднее чем
через 7—10 дней. При таких условиях культивирования Th. thioparus
не теряет своей активности.
Среда Бейеринка для Th. thioparus
Na2S2Oj-5H2O 5 г
NH4C1 0,1 г
NaHCOj 1 г
Na2HP0412H2O 2 г
MgCI2-6H2O 0,1г
FeSO4-7H20 Следы
Вода водопровод- 1000 мл
пая
Тиосульфат и бикарбонат натрия стерилизуют отдельно, растворив
в небольшом количестве воды, и добавляют в стерильный раствор
остальных солей после охлаждения. Следы солей железа также необ-
ходимо добавлять после стерилизации общего раствора. Начальную
кислотность среды устанавливают до pH 9,2—9,4.
Тиосульфатный агар Бейеринка
Na2S2Oj-5H2O 5 г
К2НРО4 0.1 г
NaHCOj 0,2 г
NH4CI 0,1 г
MgCI2-6H2O 0,1 г
Агар-агар 20 г
Вода водопро- (000 мл
водная
Для культивирования Th. thioparus желательно добавлять 3—5 г
СаСОз в среду.
Th. intermedius (факультативный хемолитоавтотроф). На чисто
минеральных средах он растет слабо. Введение глюкозы в среду
с тиосульфатом способствует улучшению роста, тиосульфат при этом
используется как источник энергии, а глюкоза служит основным
источником углерода в конструктивном обмене. В отсутствие соеди-
150
нений серы глюкоза или смесь с другими органическими соеди-
нениями также используется как источник энергии. Хотя многие тио-
бациллы могут расти на среде для Th. intermedins, накопительные
культуры можно легко получить при добавлении 5 г/л дрожжевого
экстракта, который стимулирует развитие Th. intermedius. Более
благоприятные условия для получения культуры накопления имеются,
если pH среды снизить до 4, хотя оптимум развития этого орга-
низма находится около pH 7.
Среда для выделения Th. intermedius
[London, 1963]
Раствор 1 NH«CI 1 г Раствор 2 СаС1г2Н2О 100 мг
MgCl2-6H2O 0,5 г ZnSO«'7H2O 88 г
MgSO* 0,3 г CuSO«-5H2O 40 мг
КН2РО4 0,4 г MnSO# 15 мг
CaCI2-2H2O 0.2 г Na2B<07 10 мг
К2НРО4 0.6 г (ЫН'4)бМо4О24 4H2O 5 мг
FeClr6HjO 0,02 г Вода дистиллиро- 1000 мл
Вода дистиллиро- 1000 мл ванная
ванная Раствор 3 Глюкоза 40 г Раствор 4 Na2S2O3-5H2O 10 г
Вода дистиллиро- 100 мл Вода дистиллиро- 100 мл
ванная ванная
Растворы стерилизуют по отдельности. Перед посевом к раствору 1
добавляют раствор 2, разведенный стерильной водой в соотношении
1:100, в количестве 1 мл и 25 мл раствора 3 для гетеротрофного
роста или 100 мл раствора 4 для автотрофного роста. Микроэле-
менты можно заменить ведением в среду дрожжевого экстракта из
расчета 5 г/л.
Среда Лондона для культивирования Th. intermedius
[London. 1963]
Na2S2Oj-5H2O 10 г MgCl2-6H2O 0.5 г
NH4CI 1 г Дрожжевой экстракт 5 г
КН2РО4 1 г Вода дистиллированная 1000 мл
Реакцию среды доводят до pH 6,8. По мере подкисления ее следует
нейтрализовать путем добавления 10%-го раствора углекислого натрия.
Для получения твердой серы добавляют 1.5% агара. Фосфат, тиосуль-
фат и глюкозу следует стерилизовать по отдельности. При миксо-
трофном росте к среде добавляют 10 г глюкозы. При гетеротроф-
ном росте тиосульфат исключают, но вносят 10 г глюкозы и цистеин
до конечной концентрации 100 мкМ.
Th. perometabolis (хемолитогетеротроф). Окисляет неорганические
соединения серы, используя эту энергию для роста только в присут-
ствии органических соединений, подобных дрожжевому экстракту или
гидролизату казеина.
151
Среда Риттенберга для Th. perometabolis
[London, Rittenberg, 1967]
Тиосульфат, 0,5—1,0 г
тетратионат или
сера
NH4CI I г
КН2РО4 1 г
MgCh-6HjO 0,5 г
Раствор микроэле- 20 мл
ментов N 1 (см.
прил.)
Дрожжевой 0,5—5,0 г
экстракт Дифко
или гидролизован-
ный казеин
Органические сое- 2 г
динения (оксикисло-
ты и спирты)
Вода дистиллиро- 1000 мл
ванная
Органические соединения в виде концентрированных растворов сте-
рилизуют фильтрацией. Для получения твердой среды добавляют 15 г
агара.
Th. versutus (факультативный хемолитоавтотроф). К этому виду
отнесен штамм, ранее известный как Thiobacillus А2 [Taylor, Hoare,
1969], и ряд новых изолятов [Kuenen, Bedeuker, 1982]. Th. versutus
хорошо растет как в автотрофных, так и в миксотрофных и гетеро-
трофных условиях. По своей физиологии он близок к Th. novellas. Этот
организм может расти в пределах pH от 7,5 до 9,0. Выделен из
пресноводных осадков. Отличается способностью к нитратному дыха-
нию при окислении органических веществ, но не соединений серы.
Может расти автотрофно не только на тиосульфате, но также на ми-
неральной среде с формиатом и фиксировать углекислоту в цикле
Кальвина—Бенсона.
Среда для выделения Th. versutus
[Taylor, Hoare, 1969]
KNOs 2 г
KH2PO4 1,5 г
Na2HPO4-7H2O 7,9 г
NH4CI 0,3 г
MgSO4-4H2O 0,1г
Раствор микроэле- 5 мл
ментов N 1 (см.
прил.)
Вода дистиллиро- 1000 мл
ванная
Устанавливают pH 7,6—8,5. При культивировании в аэробных усло-
виях из среды KNO3 исключается. Перед посевом в стерильную
среду вносят в качестве источника энергии один из следующих 10%-х
растворов:
Формиат натрия 6,8 мл
Глюкоза 3.6 мл
Na2S2Oj5H2O 10 мл
Th. novellas (факультативный хемолитоавтотроф). Для выделения и
культивирования этих бактерий предлагается использовать минераль-
ную среду, в которую не вносят микроэлементы [Charles, Cuzuki,
1966]. Установлено, что заметному улучшению роста данных бакте-
рий способствует отсутствие токсических концентраций следов ме-
таллов.
152
Среда MSM для Th. novellus [Charles, Suzuki, 1966]
Na2S2O3-5H2O
КгНРОд
KH2PO<
MgSO«
FeClj
10 г
4 г
0.5 г
0.1 г
0,002 г
СаС12
MnSOi
(NH4)2SO4
Фенолрот, 0,02%-й
водный раствор
Вода дистиллиро-
0.002 г
0.002 г
0.3 г
I мл
1000 мл
ванная
Устанавливают pH 6,8—7,2. Время генерации бактерий на минераль-
ной среде указанного состава составляет не более 2 ч. Добавление
биотина в концентрации 10"5 М к минеральной среде с тиосульфатом
способствует заметному улучшению роста. В чистой культуре хорошо
растет как хемолитотроф при добавлении к среде MSM органи-
ческих соединений (глюкозы, глутамата), а также дрожжевого экстрак-
та (0,03%) в качестве источника биотина.
Th. tepidarius (термофильный облигатный хемолитоавтотроф) выде-
лен сравнительно недавно из горячего источника. Оптимальная тем-
пература для роста составляет 43—45°, хотя рост возможен в пре-
делах 15—48° за счет окисления сульфида, тиосульфата, три-, тетра- и
гексатионата. Оптимум pH 6,0—7,5.
Среда для Th. tepidarius [Wood. Kelly. 1985]
кн2РО< 4 г
К2НРО< 4 г
NH4C1 0,4 г
MgSO4-7H2O 0.8 г
Na2S2O)'5H2O 5 г
Раствор микроэле- 10 мл
ментов N 1
(см. прил.)
Вода дистиллиро- 1000 мл
ванная
Фосфаты, микроэлементы и тиосульфат в виде стерильных раст-
воров вносят в среду после стерилизации, pH среды 6,8—7,0. Куль-
туру инкубируют при 43° на минеральной твердой среде с 1% ага-
ра, заменяя тиосульфат тетратионатом. В среду добавляют 2 мл насы-
щенного водного раствора кислотно-щелочного индикатора бром-
крезола пурпурового.
Th. ferrooxidans (облигатно ацидофильный хемолитоавтотроф). Этот
организм способен использовать энергию окисления закисного железа
или восстановленных неорганических соединений серы, развиваясь в
кислой среде. Чистую культуру Th. ferrooxidans легко получать на
средах, содержащих закисное железо.
Культуру накопления Th. ferrooxidans получают путем зараже-
ния питательной среды Летена железистыми осадками или водами из
кислых ручьев. Начало развития определяют по появлению в среде
осадка окислов железа.
Из обогащенной культуры, полученной путем нескольких после-
довательных пересевов, производят высев с разведениями на агари-
зованную среду того же состава. Для предотвращения гидролиза ага-
ра кислый раствор соли Мора вносят стерильно перед посевом.
Через неделю после посева на агаровых пластинках появляются
153
очень мелкие колонии, окруженные бурым железистым ореолом, ви-
димые лишь под бинокулярной лупой.
Из 80—100 колоний, выросших на твердой среде, делают массо-
вый отсев в небольшие объемы (4—6 мл) жидкой питательной среды
Летена. Через неделю из склянок, где началось развитие, произво-
дят пересев большим объемом жидкости в колбы Эрленмейера с 50 мл
среды Летена или среды 9К и одновременно ведут проверку чистоты
культуры посевом на МПА, сусло- и крахмало-аммиачный агар, так
как культуры чаще всего бывают загрязнены плесневыми грибами.
Среда Летена для Th. ferrooxidans
[Leathen el al., 1951]
(NH«)2SO4 0,15 г
KCI 0,05 г
MgSOv7H2O 0,5 г
Ca(NOj)2-4H20 0,01 г
KH2PO« 0,1 г
После стерилизации к среде добавляют 10 мл 10%-го раствора
FeSC>4-7H2O, подкисленного до pH 3,5 и простерилизованного от-
дельно. Раствор железа стерилизуют нагреванием в водяной бане
в ампулах, из которых удален воздух. Для выделения чистой куль-
туры Th. ferrooxidans к среде Летена добавляют 2% агара. Реакцию
среды до pH 4,0 устанавливают после стерилизации и добавления
раствора сернокислого железа.
Среда Сильвермана и Лундгрена 9К для Th. ferrooxidans
[Silverman, Lundgren, 1959]
Раствор 1 Раствор 2
КС1 0,1 г (NH4hFe(SO4)-6H2O 63 г
КгНРО4 0,5 г Вода дистиллированная 300 мл
MgSO. 7HjO 0.5 г H2SO4, 10 N раствор 1 мл
Ca(NO3)j 0,01 г
Вода дистиллиро- 700 мл
ванная
Стерилизуют раствор 1 при 1 атм, раствор 2 при 0,5 атм. Перед
употреблением оба раствора смешивают и pH доводят до 3,5. Неред-
ко при выделении чистых культур ацидофильных тионовых бактерий
бывает трудно избавиться от сопутствующих гетеротрофных ацидо-
филов. Получению чистых культур способствует добавление к среде
9К сульфата меди в концентрации 1—4 г/л [Johnson, Kelso, 1983].
Th. thiooxidans (облигатно ацидофильный хемолитоавтотроф) с успе-
хом выделяют на элективной среде Ваксмана.
Среда Ваксмана для выделения Th. thiooxidans
К2НРО4 3,5 г FeSO4 • 7НгО 0,018 1
(NH4HO4 0,3 г CaCh 0,25 г
MgSO4-7H2O 0,5 г Серный цвет 5 г
Устанавливают pH 4,5.
Th. acidophilus (Th. organoparus) (факультативный хемолитоавтотроф)
выделен в 1973 г. из сульфидных руд [Маркосян, 1973]. Способен
расти хемолитоавтотрофно, окисляя элементную серу, может переклю-
154
чаться на гетеротрофный рост, используя сахара, аминокислоты, ряд
органических кислот. Оптимум pH ниже 4,5. Позже близкий организм
был выделен из музейной культуры Th. thiooxidans, получившей наз-
вание ”Th. acidophilus” [Guau, Silver, 1975].
При росте Th. acidophilus на жидкой среде 9К с глюкозой сре-
да мутнеет. На агаризованной среде 9К с глюкозой образуются малень-
кие колонии (от 1 до 2 мм в диаметре), круглые, выпуклые, слегка
прозрачные, кремового цвета. Колонии появляются на 6—7-Й день при
инкубации при 25°. После продолжительной инкубации становятся
розовыми.
Способен расти за счет окисления тетратионата серы, тиосульфата
и тритионата как хемоавтотроф, а кроме того — миксотрофно, по-
лучая энергию при окислении и глюкозы и тетратионата, исполь-
зуя углерод из углекислоты или глюкозы.
В настоящее время Th. organoparus рассматривается как штамм
Th. acidophilus [Kelly, Harrison, 1988].
Выделение культур рода Thiomicrospira
Физиология и характер роста Thiomicrospira и Thiobacillus очень
похожи, поэтому среды для получения культур накопления для
Thiomicrospira и Thiobacillus сходны. Кроме известных видов Thm.
pelophila и Thm. denitrificans, недавно описан новый морской штамм 12,
заметно отличающийся от них последовательностью 5S рРНК.
Thm. pelophila (облигатный хемолитоавтотроф) по своей физиологии
аналогичен Th. thioparus и Th. neapolitanus. Эта подвижная морская
спирилла диаметром 0,2—0,3 мкм выдерживает высокие концентра-
ции сульфидов. Большинство штаммов для роста нуждаются в вита-
мине В]2. Элективные условия для роста создают, вводя высокие
концентрации сульфида в агаризованную .среду или в фильтрат
естественных образцов, пропущенных через мембранный фильтр с по-
рами 0,22 мкм. Кроме сульфида, рост бактерий обеспечивают сера,
тиосульфат, тетратионат.
Среда для Thiomicrospira [Киепеп, Veldkamp, 1972]
(для морских штаммов)
NaCl 25 г NajSjOj-SHjO 5-8 г
(NH4)2SO« 1 г Раствор микроэле- 0,2 мл
Mg4-7H2O 1.5 г ментов N 1 (см.
СаСЪ 0.3 г прил.)
KiHPO. 0,5 г Агар Дифко )0г
Витамин Ви 1,5-10’’ г Вода дистиллиро- 1000 мл
ванная
Среду стерилизуют при 118° 20 мин. Фосфаты стерилизуют отдельно
в 1/3 объема среды и добавляют в раствор после охлаждения до 45°.
pH устанавливают равным 7,2—7,5. Оптимум температуры культиви-
рования 28°. В колбу Эрленмейера помещают 10—20 г черного мор-
ского ила и заливают таким же объемом жидкой питательной среды.
Когда из ила перестанет выделяться HiS и на поверхности жидкос-
ти появятся видимые "островки” серы, берут пробу и методом 10-крат-
155
ных разведений производят посев на агаровую среду вплоть до 10-го
разведения или в серию пробирок с жидкой питательной средой.
Затем по 1 мл жидкой среды вносят в 15—20 мл агаризованной
среды, нагретой до 39—40°, и немедленно разливают в чашки Петри.
Thm. denitrificans (облигатный хемолитоавтотроф) — факультатив-
ный анаэроб, по ряду свойств близок к Thm. denitrificans. Хорошо рас-
тет в анаэробных условиях на среде с тиосульфатом или сульфидом
в присутствии нитратов. При окислении соединений серы до серной
кислоты нитраты восстанавливаются до свободного азота. Однако
в аэробных условиях Thm. denitrificans может расти только при низких
концентрациях кислорода, когда рОз не превышает 2%.
Среда для Thm. denitrificans [Timmer-ten, Hoor, 1975]
Раствор 1 Раствор 2
NaCl 20 г Na2S2Or5H20 10 г
(NH^SCh 2 г NaHCOj 3 г
MgCl2-7H2O 1,5 г NaOH 0,05 г
К2НРО< 0.6 г Вода дистиллиро- 1000 мл
КН2РО« 0,4 г ванная
KNO} 4 г
Вода 1000 мл
дистиллированная
Раствор 3
FeSO«-7H2O Юг Раствор микроэле- 2 мл
Вода дистиллиро- 1000 мл ментов
ванная N ! (см. прил.)
После автоклавирования растворы 1 и 2 смешивают в равных
объемах, добавляют 2 мл раствора 3 и 2 мл раствора микроэле-
ментов N 1 (см. прил.). Устанавливают pH 7,0—8,0 разбавленной
соляной кислотой. Оптимум температуры для роста 22°.
В присутствии следов кислорода Thm. denitrificans легко загряз-
няется смешанной популяцией аэробных хемолитотрофных и гетеро-
трофных микроорганизмов, поэтому при культивировании необходимо
соблюдать строго анаэробные условия. Для выделения бактерий ис-
пользуют пенициллиновые флаконы, доверху заполняя их средой.
Выделение Thermothrix thiopara
Выделение термофильных факультативно автотрофных факульта-
тивно анаэробных бактерий Tm. thiopara осуществляют на среде
следующего состава.
Среда для выделения Tm. thiopara
[Caldwell et al., 1978, 1980]
Na2S2Oj-5H2O 3 г MgSO«-7H2O 0,5 г
NaHCOj 2г КНгРО, 2 г
NH*C1 1 г FeSO«-7H20 (хелат ЭДТА) 0,02 г
KNOj 2 г Следы микроэлементов 1 мл
Раствор фосфатов и Fe—ЭДТА-комплекс готовят в виде концен-
трированных растворов и вносят в среду перед посевом, так же как и
микроэлементы. pH-индикатор готовят в 0,lN растворе NaOH, раст-
воряя в 1 л 0,3 г бромтимолового синего и 0,05 г метилового красно-
156
го. Готовый индикатор вносят в среду перед автоклавированием из
расчета 9 мл и доводят pH до 6,8 разбавленной соляной кислотой.
При исследовании литогетеротрофного роста к среде добавляют
0,5 г/л дрожжевого экстракта.
Чистые культуры могут быть получены методом предельных раз-
ведений на жидкой среде, разлитой тонким слоем в колбы. Темпера-
тура инкубации 70°. При ограничении доступа кислорода вслед-
ствие его низкой растворимости при 70° Tm. thiopara образует нит-
чатые формы роста, в условиях аэрации растет в виде подвижных
палочковидных клеток. На агаризованноЙ среде клетки в колониях
Tm. thiopara быстро теряют жизнеспособность при высокой темпе-
ратуре, но остаются жизнеспособными при температуре +4° в течение
недели, а более длительное время — при замораживании в 20%-м гли-
церине при - 50°.
Выделение Thiosphaera pantotropha
Представители рода Thiosphaera способны к автотрофному росту
как в аэробных, так и в анаэробных условиях, используя водород или
ряд восстановленных серных соединений (см. табл. 15). В качестве
акцепторов электронов в анаэробных условиях они используют нитра-
ты, нитриты, окислы азота или фумарат. Они способны также расти
как литогетеротрофы или органогетеротрофы, используя в последнем
случае достаточно широкий круг органических веществ. От предста-
вителей других родов автотрофных сероокисляющих бактерий они от-
личаются и морфологически. Это мелкие кокковидные клетки, раз-
мером не более 1 мкм, часто собранные в длинные цепочки.
Для выделения Thiosphaera Робертсон и Кьюнен [Robertson, Kuenen,
1983, 1986] использовали накопительную культуру, полученную в хемо-
стате в анаэробных условиях на среде с тиосульфатом и ацетатом
следующего состава:
Среда для выделения Tsa. pantotropha [Robertson, Kuenen, 198б\
Nai&OrSHjO 2,5 г
K2HPO4-7H2O 0,8 г
KHjPO* 0,3 г
Ацетат натрия 2,5 г
KNOj 2,5 г
MgSO«-7HjO 0,4 г
Раствор микроэлс- 2 мл
ментов N 8 (см. прил.)
Вода дистиллиро- 1000 мл
ванная
Устанавливают pH 7,6—8,5.
Своеобразная морфология клеток позволяет легко выявлять их под
фазово-контрастным микроскопом в препаратах из накопительных
культур. Для получения чистых культур материал из накопительной
культуры рассевают на твердую среду того же состава с добавле-
нием 2% агара. Чашки инкубируют в анаэробных условиях. Колонии
влажные, полупрозрачные, с белой зернистостью, отчетливо выде-
ляются среди других. Их отсевают на жидкую минеральную среду с
тиосульфатом и нитратом. Чистоту культуры проверяют микроско-
пически.
При культивировании в аэробных условиях из состава среды ис-
ключаются нитраты.
157
БЕСЦВЕТНЫЕ серобактерии
Среди микроорганизмов, участвующих в окислении неорганических
соединений серы, особую группу составляют так называемые бесцвет-
ные серобактерии. Они включают представителей разных физиологи-
ческих и таксономических групп. Единственным общим признаком,
объединяющим их, является способность откладывать внутри клеток
молекулярную, или элементную, серу. Многие бесцветные серобакте-
рии с давнего времени привлекают внимание исследователей бла-
годаря массовому развитию в природе в определенных условиях,
особенностям физиологии, гигантским размерам и своеобразной мор-
фологии клеток. Достаточно вспомнить, что именно с изучением бес-
цветных серобактерий Beggiatoa и Thiothrix в конце прошлого столе-
тия связано создание С.Н. Виноградским [19256] концепции хемоав-
толитототрофии. Однако роль соединений серы в метаболизме бес-
цветных серобактерий до конца не ясна. Изучение энергетического и
конструктивного обмена представителей этой группы тормозится из-за
трудностей их культивирования. Из известных по морфологическим
описаниям более чем 50 видов в настоящее время удалось выделить
чистые культуры всего лишь нескольких видов нитчатых и однокле-
точных серобактерий. Детальное физиологическое исследование выде-
ленных штаммов показало, что представители этой группы сущест-
венно различаются по типу энергетического и конструктивного мета-
болизма и по роли серных соединений в их жизнедеятельности.
На основании имеющихся данных предполагается возможность сле-
дующих путей использования неорганических соединений серы бесцвет-
ными серобактериями в процессах, не связанных с ассимиляцией в
конструктивном обмене.
I. Использование восстановленных форм серы в качестве доноров
электронов либо для фиксации углекислоты у хемолитоавтотрофов
(1), либо для ассимиляции органических веществ при хемолитогете-
ротрофном росте (2).
1. В 1983 г. Нельсон и Яннаш выделили из морской воды факуль-
тативно автотрофный штамм Beggiatoa MS-81-6, растущий в микро-
аэробных условиях в полужидкой минеральной среде в градиенте
Oz—H2S. Доказательством хемоавтотрофного роста в этих усло-
виях служило наличие рибулозодифосфаткарбоксилазы в бесклеточ-
ном экстракте культуры. Накопление до 90% углерода 14COz в бел-
ке клеток и увеличение выхода клеток пропорциональны концент-
рации сульфида в среде. Кроме того, этот штамм может расти и
гетеротрофно, подобно всем другим штаммам Beggiatoa.
2. Хемолитогетеротрофный тип обмена с использованием серы для
получения энергии. Начиная с работ Прингсхейма [Pringsheim, 1967,
1970], впервые выдвинувшего эту идею, и в ряде последующих
исследований установлено, что сульфид, реже тиосульфат, заметно
стимулирует рост нитчатых серобактерий на средах с органическими
веществами [Gude et al., 1981].
Однако концепция литогетеротрофии в отношении бесцветных серо-
бактерий пока не получила убедительного экспериментального обосно-
вания [Kuenen, Bedeuker, 1982]. Более того, показано, что окисле-
158
ние соединений серы в этих условиях у Beggiatoa и одноклеточ-
ние серобактерий не связано с участием специфических оксидаз
серных соединений, а протекает неферментативным путем с участием
перекисного механизма. Тем не менее нельзя полностью исключать
возможность литогетеротрофии у некоторых видов серобактерий.
II. Использование соединений серы для детоксикации продуктов
неполного восстановления кислорода. За исключением одного указан-
ного ранее морского штамма Beggiatoa, все выделенные штаммы нит-
чатых серобактерий из родов Thiothrix, Beggiatoa, как и одноклеточ-
ных из родов Macromonas и Thiospira, по типу обмена относятся
к хемоорганотрофам. Окисление восстановленных соединений серы
у них не связано с энергетическим обменом. Выделенные культуры
серобактерий растут на питательных средах с восстановленными соеди-
нениями серы только при наличии органических веществ, в основном
органических кислот. Рост бактерий в этих условиях сопровождается
окислением серных соединений в результате неспецифических реак-
ций их химического взаимодействия с перекисью водорода, образуе-
мой в клетках. Таким образом, восстановленные соединения серы
используются бактериями для удаления токсического продукта мета-
болизма — перекиси водорода. Последняя образуется в дыхательной
цепи при окислении органических веществ. Накоплению перекиси водо-
рода способствует полное отсутствие каталазы или ее низкая актив-
ность [Dubinina, 1981; Дубинина, Грабович, 1983, 1984]. Как известно,
сульфид служит ингибитором терминальных оксидаз. В его присут-
ствии в среде вместо четырехэлектронного переноса/в дыхатель-
ной цепи протекает двух- и одноэлектронное восстановление Ог, сопро-
вождаемое преимущественным образованием при дыхании не воды,
а Н2О2.
Элементная сера образуется при взаимодействии перекиси водорода
только с сульфидным ионом, а продуктом окисления тиосульфата
перекисью является тетратионат. Поэтому накопление элементной серы
в клетках одноклеточных серобактерий, как правило, происходит
только при росте в средах, содержащих сульфид. В отличие от них
Beggiatoa и некоторые штаммы Thiothrix накапливают внутрикле-
точную серу и в средах с тиосульфатом. Более того, у Beggiatoa
сера накапливается в клетках, даже если единственным источником
ее является сульфат. Оказалось, что в этих случаях происходит пред-
варительное восстановление тиосульфата или сульфата до HzS с учас-
тием специфических редуктаз серных соединений диссимиляционного
типа [Грабович, 1984].
III. Использование соединений серы в качестве акцепторов элек-
тронов при анаэробном дыхании. При исследовании некоторых
штаммов Beggiatoa показано, что наряду с окислением серных соеди-
нений с участием перекисного механизма они способны расти в строго
анаэробных условиях, осуществляя диссимиляционную редукцию серных
соединений (тиосульфата, серы) с использованием их в качестве
акцепторов электронов. Специфическая активность ферментов, участ-
вующих в редукции серных соединений, у бесцветных серобакте-
рий на порядок выше, чем у бактерий, использующих эти соеди-
159
Рис. 22. Бесцветные серобактерии
1 — Beggiatoa; 2 — Thioploca; 3 — Thiothrix; 4 — Thiodendron; 5 — Achromatium;
6 — Thiovulum; 7 — Macromonas; 8 — Thiospira; a — включения оксалата;
б — включения серы; в — прикрепительный диск
160
нения в ассимиляционных целях. Редукция серы и тиосульфата сопро-
вождается синтезом АТР, сопряженным с функционированием электрон-
транспортной цепи [Грабович и др., 1989]. Кроме того, эти штам-
мы растут анаэробно, используя в качестве акцепторов электронов
нитраты или фумарат. Максимальный урожай клеток Beggiatoa при
росте в анаэробных условиях имеет место при фумаратном дыхании
и значительно ниже при нитратном или серном.
Из приведенных данных следует, что некоторые нитчатые серо-
бактерии, в частности Beggiatoa, обладают высокой физиологической
приспособленностью к условиям среды и могут изменять характер
метаболизма в зависимости от окислительно-восстановительных усло-
вий среды обитания. Это важно для существования в неравновесных
условиях среды на нижней границе распространения кислорода в
водоемах.
В связи с этим одна из задач дальнейших экологических ис-
следований заключается в выяснении соотношения аэробного и анаэроб-
ного метаболизма Beggiatoa в природной обстановке и их вклада в
процессы окисления и восстановления серных соединений.
На основании морфологических признаков бесцветные серобакте-
рии подразделяют на две группы — одноклеточные и нитчатые (рис. 22).
Одноклеточные серобактерии
Существующие методы идентификации видов и родов одноклеточ-
ных серобактерий основаны на использовании морфологических приз-
наков — формы и размеров клеток, типа подвижности. В табл. 17 при-
ведена краткая характеристика известных представителей этой группы.
Из пяти родов, объединенных в эту группу, в виде чистых культур изо-
лированы только представители родов Macromonas и ’’Thiospira”. Это
дало возможность получить сведения по физиологии, а также уточнить
таксономическое положение серных спирилл [Дубинина, Грабович, 1983,
1984; La Riviere, Dubinina, 1989].
Выделение культур рода Macromonas
Краткая морфологическая характеристика двух известных видов
этого рода представлена в табл. 17. М. bipunctata получен в чис-
той культуре. Бактерии растут только хемоорганогетеротрофно, окис-
ляя при этом сульфид до серы, тиосульфат до тетратионата с участи-
ем перекиси водорода, образуемой при дыхании. В качестве источни-
ка углерода и энергии используют органические кислоты — ацетат,
сукцинат, малат, фумарат, бензоат, не используют сахара, амино-
кислоты, спирты, полимерные органические соединения. Источником
азота служат аммоний и некоторые аминокислоты, пептон. Нуждаются
для роста в витаминах. Строгие аэробы и аэрофилы. G + С в ДНК сос-
тавляет 67,3—68,2 мол.% у разных штаммов.
Выделение Macromonas. Эти бактерии достаточно широко распро-
странены в пресных водоемах. Зоны развития Macromonas располагают-
ся при одновременном наличии в воде сероводорода и кислорода на
поверхности грунта, в хемоклине некоторых озер, в аэротенках очист-
11. Зак. 1766
161
Таблица 17
Морфологическая характеристика представителей одноклеточных
бесцветных серобактерий
Род, вид Размеры клеток, мкм Форма клеток Наличие капсулы Наличие и тип под- вижности Включения серы и каль- ция
Achromatium Овальная Неоформ- Скольже- Сера и кар-
A. oxaliferum (5—7) X (30—100) нлн сферн- ленная ели- ние бонат каль-
A. volutans 5—40 ческая зистая кап- сула ция
Macromonas От ЦИЛИН- Капсула из Полярный Сера и крис-
М. mobilis (3—9)Х(8—20) дрической концентри- лофотрих таллы, со-
М. bipunetaia (2,2—4)Х(3,3—6,5) до груше- видной веских слоев держащие кальций
Thiovulum Т. majus 5—20 Овальная нлн сфери- ческая Слизистая капсула Перитрих Сера
"Thiospira** Спирально Отсутствует Полярный Сера и крис-
T. winograd- sku* T. bipunctata (2—3,5) X (5—50) (1,7—2,4)Х(б—14) изогнутая лофотрих таллы, со- держащие кальций
Thiobacterium (0,6—1,5) X 2,5 T. bovista "Дополнительно см. текст. Палочко- видная Клетки по- гружены в слизистую массу Непод- вижны Сера
ных сооружений. В этих условиях биоценоз серобактерий, как правило,
составляют различные виды из родов Beggiatoa, Thiospira, а в грунтах —
Thiothrix, иногда Achromatium. Важно подчеркнуть, что упомянутые
выше места обитания серобактерий характеризуются, помимо наличия
H2S, поступлением легкодоступных органических веществ в резуль-
тате разложения отмершей растительности или из сточной жидкости
аэротенков.
Для получения накопительных культур используют образцы природ-
ного материала, в которых Macromonas выявляется при микроско-
пировании по своеобразной морфологии крупных клеток.
Среда для выделения Macromonas
[Дубинина, Грабович, 1984]
Ацетат натрия CaClj 1 г 0,1 г Агар Дифко FeS или CaS 1 г 0,2 г
Кислый гидролизат 0,1 г Вода дистиллиро- 1000 г
казеина ванная
Дрожжевой экстракт 0,1 г
Дифко
Устанавливают pH 7,2—7,4. Суспензию FeS готовят, смешивая
эквимолярные растворы NazS*9H2O и FeSO«, приготовленные в
свежепрокипяченной воде без кислорода, с последующим отмыванием
черного осадка FeS порциями горячей дистиллированной воды.
162
Суспензию быстро разливают в ампулы или во флаконы под током
инертного газа, запаивают или плотно закрывают резиновыми проб-
ками без доступа воздуха и автоклавируют при 0,5 атм. Суспензию
вносят по 0,5 мл на дно пробирок, в которые разлито по 5—7 мл
питательной среды. На 2—3-и сутки после внесения посевного материала
отбирают пастеровской пипеткой тонкий слой среды из верхней зоны
роста. Как правило, Macromonas развивается в верхней пленке
толщиной не более 1 мм. Этот материал, обогащенный клетками
Macromonas, используют для выделения чистой культуры.
Выделение культуры проводят с использованием твердых сред того
же состава с добавлением 10 г/л агара. Мелкие колонии появляются
через сутки после посева. В толще агара они имеют форму
тетраэдра размером 0,3—1 мм и легко отличимы от спутников. На
поверхности агара колонии крупнее, 1—4 мм, слегка опалесцируют и
имеют мелкозернистую структуру. Колонии отбирают пастеровской
пипеткой под бинокулярной лупой в 1—2 мл жидкой среды и повторно
рассевают на твердую среду с последующим выделением чистых
культур на жидкой среде. Чистоту культур легко контролировать под
фазово-констрастным микроскопом, где загрязняющая микрофлора
легко выявляется морфологически.
Среда для культивирования Macromonas
[Дубинина, Грабович, 1984\
(NH^SO* 0,5 г NaiSjOrSHiO 0,5 г
MgSO*-7HzO 0,2 г Каталаза 2 мг
Кислый гидролизат казенка 1 г Раствор витаминов 1 мл
Ацетат натрия (сукцинат или бензоат) 1 г 0,5 г N 10 (см. прил.)
Тиосульфат, каталазу, витамины и источник углерода вносят в виде
стерильных концентрированных растворов перед посевом. Каталазу
стерилизуют ультрафильтрацией через мембранный фильтр фирмы
"Millipore” с диаметром пор 0,1 мкм. Каталазу и тиосульфат (либо
только тиосульфат) вносят для удлинения сроков жизнеспособных
культур между пересевами до 10—15 сут вместо 4—7 сут. Упомяну-
тые компоненты можно заменить введением в среду сульфида каль-
ция.
Для определения видовой принадлежности необходимо проведе-
ние дальнейших исследований физиолого-биохимических и генети-
ческих свойств выделенных культур.
Выделение культур рода "Thiospira”
В этот род объединены бесцветные бактерии со спиральной
формой клеток, накапливающие серу и обладающие полярными или би-
полярными толстыми жгутиками (см. табл. 17). Иногда жгутики видны
в световом микроскопе. Среди серных спирилл, как иногда их назы-
вают, имеются гигантские формы, размером 3X250 мкм.
В природе серные спириллы распространены достаточно широко там,
где имеется H2S. В массовом количестве они встречаются в тех
163
местах, где происходит разложение водной растительности, сопровож-
даемое накоплением HjS.
В существующие руководства, как правило, включены лишь отдель-
ные виды серных спирилл, хотя по морфологическим описаниям
известно их значительное число. Так, в восьмом издании ’’Опреде-
лителя бактерий Берги” приведено описание всего двух видов —
Т. winogradskii и Т. bipunctata, последний из видов не приведен
в "Списках одобренных названий бактерий”.
В настоящее время разработаны методы культивирования предста-
вителей рода Thiospira [Дубинина, Грабович, 1983]. При детальном
исследовании выделенных штаммов серных спирилл было установлено
их близкое сходство по физиолого-биохимическим свойствам, морфо-
логии и составу ДНК с пресноводными гетеротрофными спириллами
рода Aquaspirillum. Свойством расти в присутствии H2S, накапливая
серу внутри клеток, обладают известные виды данного рода, в том
числе типовой вид A. serpens. Применение метода ДНК—ДНК-гибри-
дизации с целью уточнения степени родства серных спирилл с пред-
ставителями рода Aquaspirillum привело к выводам о достаточно
близком генетическом родстве этих организмов. Интересно, что вид
A. autotrophicum DSM 732, обладающий способностью к автотроф-
ному росту при окислении тиосульфата, не накапливает в этих
условиях внутри клеток элементную серу, отличаясь по этому приз-
наку от серных спирилл, а осуществляет окисление до сульфатов
[Friedrich, Mitrenga, 1981]. Этот вид по уровню гомологии ДНК
имеет слабую степень родства с "серными” спириллами.
По итогам проведенных исследований группа гетеротрофных, вклю-
чая новые штаммы "серных”, спирилл оказалась достаточно гетеро-
генной в генетическом отношении, и в дальнейшем она может быть
разбита на несколько независимых родов. Этот вывод согласуется с
результатами недавнего исследования филогенетического родства
группы спирально извитых форм бактерий с использованием метода
изучения олигонуклеотидной последовательности 16S рРНК, показав-
шими высокую степень неоднородности и раннюю эволюционную
дивергенцию близких по типу видов как пресноводных, так и мор-
ских спирилл [Woese et al., 1983, 1984].
Сравнительное исследование серных спирилл, соответствующих мор-
фологическому описанию рода Thiospira, и пресноводных спирилл рода
Aquaspirillum привело к выводу, что существование первого рода в
качестве самостоятельного неправомерно. Выделенные штаммы так
называемых серных спирилл, ранее относимых к роду Thiospira,
в настоящее время могут быть помещены в пределах рода Aqua-
spirillum [Дубинина, 1989].
У серных спирилл, так же как у Macromonas, восстановленные
соединения серы выполняют функцию удаления образуемой при дыха-
нии перекиси водорода. Накопление серы внутри клеток происходит
только при наличии в среде сульфата. Введение в среду тиосуль-
фата, подобно сульфиду, способствует разрушению перекиси, но в виде
продукта реакции накапливается тетратионат [Дубинина, Грабович,
1983].
164
Выделение серных спирилл. Для выделения серных спирилл ис-
пользуют среды, содержащие легкодоступные органические вещества —
дрожжевой экстракт, сукцинат. Градиент концентрации О2 и H2S
создается введением осадка FeS или CaS на дно пробирок с полу-
жидкой средой, содержащей 0,3% агара.
Среда для выделения серных спирилл
[Дубинин, Грабович, 1983}
Ацетат натрия 0,5 г Агар Дифко 0,1г
СаСЬ 0,1 г FeS или CaS 0,2 г
Кислый гидролизат ка- 0,1 г Вода дистиллиро- 1000 мл
зеина ванная
Устанавливают pH 7,4—7,6. Суспензию FeS или CaS готовят от-
дельно, как указано выше (см. начало раздела ’’Одноклеточные
серобактерии”), и вносят по 0,5 мл на дно пробирок с 10 мл полу-
жидкой среды указанного состава.
В отличие от Macromonas серые спириллы — микроаэрофилы.
Зона их роста располагается не на поверхности среды, а на 2—4 см
ниже. Для выделения чистых культур микроскопируют выросшие в по-
лужидкой среде микроорганизмы, отбирая осторожно материал из зоны
роста послойно, через каждый миллиметр. Из слоя, обогащенного
спириллами, содержащими в клетках серу, отбирают посевной мате-
риал в 5—10 мл стерильной воды для дальнейшего выделения чистых
культур. Далее крупные спириллы отмывают от мелких сопутствую-
щих бактериальных клеток путем фильтрации через стерильный ядер-
ный фильтр с размером пор 4—7 мкм. Осадок с фильтра смывают
свежей порцией стерильной воды или среды. Процедуру обогащения
суспензии спириллами повторяют несколько раз, в дальнейшем полу-
ченную суспензию спирилл рассевают на среду того же состава с
добавлением агара 15 г/л и 1 тиосульфата 1 г/л.
Морфологически чистые колонии крупных спирилл, выросшие в
толще агара, отсевают на жидкую среду (см. далее) и проверяют
способность к накоплению в клетках серы при культивировании на
среде с сульфидом. Чистоту культур проверяют путем микроскопи-
рования в фазово-контрастном микроскопе и высевом на мясо-
пептонный и картофельный агары.
Необходимо иметь в виду, что многие виды спирилл относятся
к облигатным микроаэрофилам. Поэтому выделение чистых культур
этих видов следует проводить, инкубируя посевы и питательные сре-
ды при пониженном парциальном давлении кислорода (не более
2—5% Ог в газовой фазе) с одновременным введением в среду в
качестве восстановителей небольшого количества стерильной суспен-
зии CaS или FeS.
Для поддержания культур серных спирилл применяют видоизме-
ненную PSS-среду [Hyllemon et al., 1973].
Среда для культивирования серных спирилл
(NH4)2SO4 1 г
MgSO»-7HiO 1г
Гидролизат казеина 3 г
Дифко
Сукцинат натрия 1 г
Раствор витаминов N 10 I мл
(см. прил.)
NajS2Oj-5H2O 0,5 г
Вода дистиллированная 1000 мл
165
Витамины, тиосульфат и сукцинат вносят перед посевом в виде
стерильных растворов. Устанавливают pH равным 7,4—7,6. Пересевы
проводят не реже одного раза в 15—20 дней.
Попытки получения чистых культур других одноклеточных серо-
бактерий пока не были успешными. Тем не менее ряд сведений о
морфологии и физиологии может быть получен при работе с фрак-
циями природного материала, обогащенного клетками отдельных видов
серобактерий. Ниже описаны методы концентрирования одноклеточ-
ных бесцветных серобактерий из природных образцов.
Род Achromatium
В восьмом издании "Определителя бактерий Берги” приводится
описание двух видов: Achromatium oxaliferum, который встречается
в пресных водах, и A. volutans {синоним Thiophysa macrophysa) —
хорошо известный вид, который встречается только в морском иле.
Клетки его отличаются тем, что заполнены СаСОз и одновременно
более мелкими глобулами S0, диаметр их от 5 до 100 мкм; могут
медленно передвигаться скольжением по твердому субстрату.
Клетки Achromatium обнаруживаются всегда на поверхности грунта,
что, по-видимому, связано с их большим удельным весом и осе-
данием из водной толщи. Часто встречается в прудах, где развива-
ются харовые водоросли, что указывает на значительное коли-
чество растворенного Са(НСОз): и на жесткость воды. Achromatium
предпочтительно развивается в водоемах на глубинах около 40 см с
рыхлым илом, с большим количеством остатков водорослей.
Концентрирование клеток Achromatium из природных сред (метод
Ван-Ниля). Отбирают поверхностный слой ила. Легкие частицы ила
удаляют путем взбалтывания с природной водой и последующей
декантацией. Слой ила (толщиной 0,5 см) из более тяжелых части-
чек помещают в сосуд и подвергают круговому вращению. При этом
происходит дальнейшее фракционирование частичек в зависимости
от их удельного веса, и более тяжелые клетки Achromatium становят-
ся видны в виде тонкой белой полоски, близко прилегающей к
песчаным частичкам. Клетки Achromatium отбирают пипеткой и пере-
носят в сосуд меньшего размера. Эту процедуру повторяют несколь-
ко раз, таким способом получают большую массу Achromatium. Метод
дает положительный результат, если клетки заполнены СаСОз. Как
можно наблюдать под микроскопом, приблизительно 50% клеток
активно передвигаются и, следовательно, сохраняют жизнеспособ-
ность. Материал этот пригоден для электронной микроскопии и ряда
цитохимических и физиологических исследований.
Род Thiovulum
Этот род представлен всего одним видом — Т. majus, который
имеет крупные клетки овальной или сферической формы, размером
5—20 мкм, со жгутиками перитрихиального типа. Он легко выявля-
ется при микроскопировании проб благодаря крупным размерам кле-
ток с активной подвижностью. Thiovulum встречается в морских и
166
пресных водоемах в условиях одновременного присутствия сероводо-
рода и кислорода. Несмотря на неоднократные попытки исследова-
телей, Thiovulum до сих пор не удается культивировать на ис-
кусственных питательных средах.
Детальное изучение зависимости поведения Thiovulum от содер-
жания Оз и HzS в природной среде проведено с применением се-
лективных микроэлементов Юргенсеном и Ревсбахом [Jorgensen,
Revsbach, 1983]. Авторы показали важную роль слизистой взвеси,
образуемой этими бактериями, и хемотаксиса в снабжении клеток
оптимальными концентрациями кислорода и сероводорода. Слизистая
взвесь служит не только твердым субстратом между микроаэроб-
ным и сероводородным микрослоями воды толщиной не более 50 мкм,
но и своего рода "физическим** барьером, препятствующим смешению и
химическому взаимодействию H2S и Оз при микротурбулентном движе-
нии клеток.
Концентрация H2S и Оз в зоне развития бактерий находится в
пределах не более 10 мкм/л. Образование слизи авторы рассматри-
вают как стратегию облигатно микроаэрофильных бактерий для ста-
билизации физико-химических условий в микрозоне их развития.
Род Thiobacterium известен только по первоначальному описа-
нию Молишем в 1912 г. (см. табл. 17) и не был обнаружен дру-
гими исследователями.
Нитчатые бесцветные серобактерии
К нитчатым серобактериям относятся представители родов Thio-
thrix, Beggiatoa, Thioploca. Эти грамотрицательные бактерии имеют
ряд общих черт в строении.
1. Многоклеточные нити, или трихомы, состоят из клеток, от-
деленных друг от друга цитоплазматической мембраной и пептидогли-
кановым слоем клеточной стенки, тогда как другие слои клеточной
стенки тянутся вдоль всего цйлиндрического трихома и не участву-
ют в формировании клеточной перегородки.
2. Накопление серы при наличии H2S в среде происходит в пери-
плазме и инвагинатах цитоплазматической мембраны.
3. Скользящее движение свойственно представителям трех родов,
хотя у Thiothrix подвижностью обладают не нити, а только отдель-
ные клетки — гонидии, а также гормогонии, имеющиеся у отдель-
ных видов.
Выделение культур рода Beggiatoa
В этот род объединены скользящие трихомные бактерии, не имею-
щие чехла. При движении нити оставляют за собой след из слизи
полисахаридного состава. Размножение осуществляется при помощи
гормогониев, образующихся известным у цианобактерий способом:
путем образования некридиальных клеток и освобождения короткого
отрезка нити.
По морфологическим описаниям известно 19 видов, различающих-
ся шириной трихома — от 1 мкм у мелких до 55 мкм у гигантских
форм. Таксономическая ценность морфологических видов сомнительна.
167
В восьмом издании "Определителя бактерий Берги" оставлено
6 видов. В. alba описан как типовой вид рода. Таксономическая
дифференциация на виды в отношении этих бактерий остается важней-
шей проблемой. Морфологический подход, как оказалось, при иссле-
довании чистых культур не может быть приемлемым, поскольку
толщина трихома и размеры клеток варьируют в зависимости от
условий роста [Pringsheim, 1970]. Другой подход к систематике
Beggiatoa, основанный только на сравнительном физиологическом ис-
следовании близких по морфологии щтаммов, также показал беспер-
спективность подобных таксономических исследований [Strohl, Larkin,
1978]. Оказалось, что очень близкие по фонотипическим свойствам
штаммы Beggiatoa имеют различия в содержании нуклеотидов ДНК,
превышающие границы видовых, — от 40—41 до 51,7 мол.% [Mezzino
et al., 1984]. Вероятно, лишь применение современных методов гено-
систематики — анализа нуклеотидного состава в сочетании с гибри-
дизацией молекул ДНК исследуемых штаммов — позволит более четко
выявить границы независимых видов и самого рода.
Первые чистые культуры Beggiatoa были получены с использова-
нием твердых сред с небольшим количеством органического вещества
в виде вываренного сенного отвара [Cataldi, 1940]. Выделенные на
этой среде культуры были способны окислять сульфид или тиосуль-
фат с накоплением в клетках серы. В дальнейшем этот прием
выделения культур Beggiatoa с теми или иными вариациями с успе-
хом был применен рядом исследователей.
Все выделенные к настоящему времени чистые культуры Beggiatoa —
более 70 штаммов, за исключением одного морского штамма, отно-
сятся к хемоорганогетеротрофам. В качестве источников углерода и
энергии могут служить органические кислоты, включая бензойную,
некоторые спирты и отдельные аминокислоты. Важным условием
роста бактерий является наличие в среде низких концентраций ука-
занных соединений — не более 0,2%, а для аминокислот — 0,05—
0,01%. Сахара и полимерные соединения — полисахариды, белки —
не поддерживают рост Beggiatoa.
Один из штаммов, выделенный Нельсоном и Яннашем, — факуль-
тативный автотроф.
При выделении чистых культур используют способность нитей к
скольжению по твердому субстрату. Под бинокулярной лупой отбирают
нити Beggiatoa из природного образца и пастеровской пипеткой с
тонко оттянутым концом переносят в небольшой объем стерильной
среды, налитой в чашку Петри. Процедуру отмывания нитей от кон-
таминантов повторяют 5—7 раз. Отмытые нити помещают на поверх-
ность твердой среды в чашки Петри, предварительно подсушенной в
течение 4—6 ч в термостате при 80° для удаления конденсата. Через
определенные интервалы в 4—6 ч и спустя сутки нити, отползшие от
места инокуляций, осторожно с кусочком агара переносят в неболь-
шой объем жидкой среды. Эти приемы позволяют избавиться от
многочисленных сопутствующих бактериальных клеток, ассоцииро-
ванных со слизью, выделяемой Beggiatoa при скольжении. Следует,
однако, иметь в виду, что последний прием непригоден для изо-
иев
ляции облигатно микроаэрофильных штаммов. Поэтому можно реко-
мендовать отмытые нити сразу помещать в небольшой объем стериль-
ной полужидкой среды в пробирки, в которых установился гра-
диент HjS—Оз.
Среда МР для изоляции нитей Beggiatoa
[Strohl, Larkin, 1978}
CaSO4 2 мг Na2S-9H2O 300 мг
NH*C1 4,5 мг Ацетат натрия 1 мг
КН2РО4 10 мг Агар Дифко Юг
MgSO4-7H20 1 мг Вода дистиллированная 1000 мл
Сульфид натрия вносят перед разливкой сред в чашки, после чего
устанавливают pH 7,2—7,4.
Для культивирования изолированных нитей Beggiatoa можно реко-
мендовать одну из следующих сред в зависимости от источника
выделения.
Среда для культивирования Beggiatoa
NaH2PO4 0,125 г Лактат натрия 0,5 г
NaNOj 0,62 г Раствор витаминов 1 мл
CaCI2-2H2O 0,03 г N 10 (см. прил.)
KCl 0,125 г Раствор микроэле- 1 мл
MgClr7H2O 0,05 г ментов N 7 (см.
Na2SO4 0,5 г прил.)
NaHCOj 0,125 г Na2S20j 5Н2О 0,5 г
Вода дистиллиро- 1000 мл
ванная
Стерильные растворы лактата, витаминов, микроэлементов, тио-
сульфата и бикарбоната натрия добавляют к солевому раствору перед
посевом. Доводят pH 1%-й НС! до 7,5. Лактат может быть заменен
ацетатом из расчета 1 г/л. Лактат и тиосульфат готовят в виде
10%-х растворов, NaHCOj — в виде 5%-го раствора.
Среда для культивирования нитчатых серобактерий
Beggiatoa и Thiothrix [Williams, Unz, 1985]
(NH4bSO4 0,5 г Раствор витаминов N 10 1 мл
MgSO4-7H2O 0,1 г (см. прил.)
CaCh-2H2O 0,05 г Лактат натрия 0,5 г
К2НРО4 0,11 г Na2S2Oj-5H2O 0,5 г
КНгРО* 0,085 г или Na2S-9HiO 0,187 г
FeClj-6H2O 0,002 г HEPES-буфер (Sigma) 0,01 М
ЭДТА ' 0,003 г Вода дистиллированная 1000 мл
Устанавливают pH 7,2—7,5 с помощью NaOH. Тиосульфат, сульфид,
лактат, витамины добавляют в виде стерильных растворов перед
посевом.
Твердые среды (с тиосульфатом или сульфидом) готовят, добав-
ляя к среде приведенного состава 12 г агара Дифко.
169
Среда J для автотрофного роста морских штаммов Beggiatoa
[Nelson, Jannasch, 1983]
Раствор 1 Раствор 2
NH4NOj 1 мМ Раствор витаминов N 10 1 мл
КгНРО« 0,2 мМ Раствор 3
NajSzOs 0,1 мМ Морская или природная вода
NajMoO* 14 мМ Раствор 4
Фенолрот, 0,5%-й водный 1 мл Агар 1,6 г
раствор Вода бидистиллнрованная 200 мл
Вода бидистиллнрованная 50 мл
Перед посевом к 750 мл раствора 3 добавляют 50 мл раствора 1,
1 мл раствора 2, 200 мл'раствора 4 и стерильные растворы NaiS^HjO —
1 мМ, NazSzOj SHzO — 2 мМ, NaHCOj — 2 мМ. В некоторых
случаях добавляют 0,25 мМ ацетата натрия для литогетеротрофного
роста. На дно пробирок помещают 4 мл 1,5%-го стерильного агара,
содержащего 1—8 мМ сульфида, pH доводят до 8. Затем в пробирки вно-
сят 5—7 мл полужидкой среды указанного выше состава. Через 1—2 сут
после создания градиента HzS—Оз в пробирки вносят посевной мате-
риал — отмытые нити Beggiatoa. Пробирки помещают в эксикатор,
который заполняют газовой смесью, содержащей не более 2—5% кисло-
рода. Рост Beggiatoa наблюдается в виде тонкой белой пленки или
белого налета на стенках пробирки в нижней зоне полужидкого
агара.
Выделение культур рода Thiothrix
Этот род объединяет неподвижные нитчатые бактерии, накапли-
вающие серу внутри клеток и обладающие следующими особенностями:
а) наличием у нитей чехла; б) способностью к формированию розеток;
в) размножением с помощью гонидий, образуемых на апикальном кон-
це нитей и способных передвигаться скольжением. На одном из полю-
сов гонидий располагаются многочисленные фимбрии, с участием ко-
торых происходит прикрепление к предметам. Фимбрии участвуют и в
агрегации гонидий в розетки, при этом полюса клеток, имеющие
фимбрии, ориентируются к центру розетки [Larkin, Strohl, 1983]. Некото-
рые штаммы могут размножаться гормогониями, подобно Beggiatoa.
Эти бактерии широко распространены в водах, содержащих серо-
водород, особенно в проточных условиях, и нередко развиваются в мас-
совом количестве, образуя обильные белые обрастания на погружен-
ных в воду твердых субстратах.
По морфологическим описаниям известно 11 видов, различающих-
ся по толщине трихома. Однако таксономическая ценность этого при-
знака, как и для Beggiatoa, недостаточна: размеры клеток (длина и
ширина) подвержены значительной изменчивости, в 2—3 раза даже в
культуре одного возраста. Кроме того, обнаружены существенные
различия фенотипических признаков у морфологически сходных штам-
мов. Типовой вид Т. nivea шт. J2 описан как неотип вида [Larkin,
Shinabarger, 1983]. Другие изоляты не получили видовых названий.
Таксономическое положение Thiothrix не ясно. Морфологически он
близок к Leucothrix и к некоторым цианобактериям семейства
170
Rivulariaceae. В восьмом издании ’’Определителя бактерий Берги”
Thiothrix помещен в семейство Leucothricaceae [Brock, 1981], но позднее
было предложено включить его в состав нового порядка бесцвет-
ных аналогов цианобактерий в пределах нового класса Cyanomorphae
[Rheinchenbach, 1981]. Однако ввиду недостаточности знаний об этих
организмах попытки подобной классификации пока представляются
преждевременными.
В настоящее время предполагается существование штаммов Thiothrix
с различными метаболическими возможностями: наличием облигатной
либо факультативной миксотрофии с использованием соединений вос-
становленной серы в энергетическом обмене и гетеротрофии. Установ-
лена зависимость роста бактерий от наличия в среде восстановлен-
ной серы и каталазной активности у разных штаммов Thiothrix
[Дубинина, 1989]. Как указывалось выше, облигатная зависимость
роста этих бактерий в аэробных условиях от присутствия в среде
восстановленной серы может быть обусловлена отсутствием или низкой
активностью ферментных систем защиты от токсического воздействия
кислорода и продуктов его неполного восстановления.
В конструктивном и энергетическом обмене Thiothrix использует
достаточно широкий круг органических веществ: органические кислоты,
в том числе ароматические (бензоат), спирты, а некоторые штаммы —
сахара. Большинство из них способны осуществлять гидролиз жела-
тины, некоторые — казеина. Аминокислоты, за редким исключением,
не поддерживают рост этих бактерий. Возможности разных штаммов
в отношении использования органических веществ заметно варьируют
[Williams, Unz, 1985].
Для культивирования Thiothrix были успешно применены методы,
используемые при выделении Beggiatoa [Larkin, 1981; Williams, Unz,
1985]. Выделение чистых культур осуществляется путем помещения на
агаровые среды тщательно отмытых от посторонней микрофлоры нитей
и мелких розеток Thiothrix, отобранных из зон их массового роста
в природных условиях. С этой целью используют агаровые среды,
содержащие, помимо минеральных солей, невысокие концентрации
органических кислот (0,01—0,05%) и сульфида либо тиосульфата
(0,03—0,05%). Для выделения и культивирования Thiothrix рекомен-
дуются среда Штроля и Ларкина и среда Вильямса и Унца (см.
начало данного раздела). При выделении из морских местообитаний
в состав среды вводят 75% морской воды.
Выделение культур рода Thioploca
В этот род включены серные бактерии с многоклеточными три-
хомами, обладающими скользящим движением, которые объединены в
пучки параллельных нитей общим чехлом. Нити способны передви-
гаться внутри чехла скольжением, могут выползать за его пределы, и
тогда нити Thioploca морфологически неотличимы от нитей Beggiatoa.
Количество нитей внутри чехла и их толщина варьируют. При обита-
нии в окисленных осадках в чехлах Thioploca могут накапливать-
ся о кислы железа и марганца.
171
Описаны пресноводные и гигантские морские виды. Дифференциа-
ция на виды основана исключительно на ширине трихома. У разных
видов она варьирует от 0,8 до 40 мкм, а толщина чехла — от 30
до 150 мкм. До недавнего времени были известны 4 морфологи-
ческих вида Thioploca: Т. schmidlei — с шириной трихома 5—9 мкм,
Т. ingrica — 2—4 мкм, Т. minima — 0,8—1,5 мкм и Т. mixtra,
у которого внутри чехла заключены нити разной толщины. Лишь один
из видов — Т. schmidei оставлен в ’’Списке одобренных названий
бактерий” и в ’’Определителе бактерий Берги” [Maier, 1981]. Отчет-
ливая морфология другого вида — Т. ingrica, постоянно обитаю-
щего в оз. Констанц (ФРГ), позволила идентифицировать его при
микроскопическом исследовании и составить таксономическое опи-
сание.
Недавно внимание исследователей было привлечено к морским фор-
мам Thioploca, обнаруженным в бентосных сообществах вдоль побе-
режья Перу и Чили на глубинах от 40 до 280 м [Gallardo, 1977;
Morita et al., 1981]. Thioploca оказалась здесь главным компонен-
том донных микробных сообществ. Так, на глубине 60 м био-
масса микроорганизмов, состоящая преимущественно из Thioploca,
достигала 106 г на 0,1 м2. Авторы предполагают важную роль этих
бактерий в трофике донных сообществ.
Морские формы намного крупнее пресноводных, размеры нитей
варьируют у трех морфологических групп в пределах 2,5—5; 15—20 и
30—40 мкм. Последние образуют пучки нитей, покрытые слизистым
чехлом, до нескольких сантиметров в длину. Видового названия
морские формы пока не получили.
Отсутствие чистых культур этих бактерий определяет практиче-
ски полное незнание их физиологии. Природа процессов, приводящих к
отложению серы в клетках, не ясна. Результаты физиологических
исследований природных популяций Thioploca с использованием радио-
автографического метода достаточно противоречивы. На основании
этих исследований наряду с предположениями о литогетеротрофии
за счет окисления H2S высказано предположение о метилотрофии
и побочном процессе накопления серы, не связанном с биологиче-
ским использованием восстановленной серы в энергетическом обмене
[Morita et al., 1981].
Имеется наблюдение о независимости распространения морских
видов Thioploca в донных отложениях от наличия сероводорода.
Их обильное развитие обнаруживается как в сероводородных, так и в
окисленных бурых осадках, где их биомасса была значительно больше.
Решение вопросов о типе обмена веществ и роли серных соеди-
нений невозможно без исследования чистых культур Thioploca.
172
КРУГОВОРОТ АЗОТА
ПРОЦЕССЫ КРУГОВОРОТА АЗОТА В ОЗЕРАХ
Круговорот азота в водоемах представляет собой взаимную цепь
реакций превращения различных форм азота [Кузнецов и др.,
1985]. Ведущая роль в осуществлении этих процессов принадлежит
микроорганизмам (рис. 23). В годичном цикле сюда включаются
следующие процессы: 1 — приток в водоем соединений азота с
водосборной площади и с атмосферными осадками; 2 — фиксация
молекулярного азота микроорганизмами; 3 — ассимиляция минераль-
ных соединений азота при развитии фитопланктона и бактерий;
Рис. 23. Взаимосвязь процессов круговорота азота в водоемах [Кузнецов и др.. 1985]
(объяснения в тексте)
173
4 — усвоение органического азота гидробионтами; 5 — разложение
азотсодержащих органических веществ до аммиака аммонифицирую-
щими бактериями (а) и до нитритов и нитратов при гетеротроф-
ной нитрификации (£); 6 — окисление аммония нитрифицирующими
бактериями до нитритов и нитратов; 7 — восстановление нитритов
и нитратов до свободного азота денитрифицирующими (а) и нит-
ратредуцирующими (б) бактериями; 8 — захоронение соединений
азота в донных отложениях; 9 — вынос аммиачных солей и газо-
образных окислов азота при щелочной реакции воды в атмосферу;
10 — деазотация, т.е. распад соединений азота в анаэробных ус-
ловиях из иловых отложений до газообразного азота в отсутствие
нитратов за счет деятельности анаэробных микроорганизмов.
Химические анализы газа, отобранного из различных анаэроб-
ных экосистем, где накапливается значительное количество органи-
ческого вещества и идет его распад с выделением метана, пока-
зывают, что нередко одновременно выделяется и свободный азот.
Сюда относятся иловые отложения евтрофных озер, метантенки, под-
земные воды месторождений и другие биотопы. Содержание сво-
бодного азота достигает 30% количества выделившегося газа. Путь
образования этого газа до сих пор неизвестен, но биологическая
природа его несомненна и ждет своих исследователей.
АММОНИФИКАЦИЯ
Аммонификации в водоеме подвергаются белки, нуклеотиды и дру-
гие разнообразные азотсодержащие органические вещества расти-
тельного и животного происхождения. В этом процессе, кроме
аммиака, выделяются амины, мочевина и другие азотистые сое-
динения.
Бедки гидролизуются протеолитическими экзоферментами до бо-
лее мелких молекул, которые, в свою очередь, подвергаются даль-
нейшему дезаминированию. Гидролитическое дезаминирование моче-
вины идет при участии Bacillus pasteurii, Вас. freudenreichii, Spo-
rosarcina ureae, Proteus vulgaris и некоторых других организмов в
щелочной среде при участии конститутивных ферментов. У боль-
шинства же бактерий образование уреазы подавляется ионами ам-
мония и стимулируется наличием мочевины.
Обзор работ по процессам круговорота азота в водоемах до-
статочно полно сделан А.И. Сараловым [Кузнецова и др., 1985].
Учет и выделение аммонифицирующих бактерий проводится пу-
тем 10-кратных разведений на мясо-пептонном бульоне (МПБ).
Бульон наливают в 1—2 пробирки, заражают исследуемым мате-
риалом, и выделение аммиака определяют по посинению лакмусовой
бумажки, которую зажимают под ватной пробкой в верхней части
пробирки. Колонии, выросшие в последнем разведении, отсевают на
косяки МПА, из выросших колоний делают отсев на МПБ и про-
веряют выделение аммиака по посинению лакмусовой бумажки.
Удобен для работы в лабораторных и экспедиционных усло-
виях метод количественного учета аммонификаторов, предложенный
174
Г.Н. Олейник [1967]. Посев пробы с разведениями производят в
пептонную воду, содержащую в 1 л 20 мл индикатора, состоящего
из 4 частей 0,1%-го водного раствора бромтимолового синего и
1 части 0,1%-го водного раствора нейтральрота. Индикатор имеет
темно-бурый цвет. При исходном pH среды (МПБ), составляющем
6,8, индикатор имеет буровато-розовую окраску, при pH 7,2 —
сине-зеленую, при pH 7,4 — ярко-синюю. При массовых анализах
этот способ менее трудоемок и более чувствителен, чем метод с
лакмусовой бумажкой. Наличие аммонификаторов регистрируют в
посевах по изменению первоначальной окраски на ярко-синюю на
5—7-е сутки после посева.
Для количественного учета аммонификаторов используют пита-
тельные среды, в состав которых вводят мочевину. Ее разложение
с выделением аммиака свидетельствует о наличии у бактерий ам-
монифицирующих ферментов.
Среда Зенгена
Мочевина зо г
КгНРО< 0,5 г
Цитрат кальция щ г
Вода водопроводная щ00 мл
Устанавливают pH 7,0.
Все среды с мочевиной рекомендуется стерилизовать текучим
паром. Разложение мочевины бактериями приводит к подщелачи-
ванию среды в результате образования аммиака и к выпадению
кристаллов СаСОз в жидких средах на дне колбы или на твердых —
вокруг колоний.
Среда Лениса
Мочевина 50 г
К2НРО4 0.5 г
Почвенный экстракт 100 мл
Вода водопроводная 900 мл
Среда с мочевиной и желатиной
Мочевина 20 г
Желатина 150 г
Мясной бульон 1000 мл
Реакцию среды устанавливают около pH 7,5. Желатина может
быть заменена на 15 г агара.
Хорошие результаты дает внесение в среду индикаторов при уче-
те уробактерий. В результате подщелачивания вокруг колоний из-
меняется окраска среды. В качестве индикаторов в среду вносят
бромтимоловый синий из расчета 1 мл 1,5%-го спиртового раствора
на 1 л среды. Обычно его добавляют асептически в стерильную
среду перед посевом.
175
АЗОТФИКСИРУЮЩИЕ МИКРООРГАНИЗМЫ
В фиксации атмосферного азота в водоемах принимает участие
широкий круг аэробных и анаэробных гетеротрофных бактерий,
авто* и фототрофных бактерий и цианобактерий.
Способность микроорганизмов к ассимиляции молекулярного азо-
та обусловлена действием фермента нитрогеназы, катализирующего
реакцию Nz + бе" + 6Н* + ATP — NH3 + ADP + Р. Помимо этого,
нитрогеназа катализирует энергозависимую реакцию образования
Нг: 2Н+ + 2е + ATP — Hz + ADP + Р. Эта способность к образованию
Н2 свойственна многим азотфиксирующим бактериям.
Ранее наиболее известные свободноживущие азотфиксаторы были
объединены в семейство Azotobacteriaceae. Сюда входили предста-
вители родов Azotobacter, Azomonas, Derxia, Beijerinckia. В даль-
нейшем способность к фиксации азота была обнаружена у пред-
ставителей других физиологических групп аэробов; у метилотрофов
(Methylomonas rubra, Methylococcus capsulatus, M. ucrainicus, M. luteus),
у водородных бактерий Xantobacter autotrophicus, X. flavus, у тио-
новых бактерий Thiobacillus ferrooxidans, у бесцветных нитчатых
серобактерий Beggiatoa, выделенных из морских местообитаний, у
некоторых видов Vibrio, Arthrobacter sp., Alcaligenes faecalis.
Симбиотическую фиксацию азота осуществляют бактерии родов
Rhizobium и Frankia в микроаэробных условиях.
В анаэробных условиях в фиксации азота участвуют, помимо
известных представителей рода Clostridium (Cl. pasterianum, Cl.
butyricum, Cl. felsineum, Cl. kluyverii, Cl. beijerinckii), и другие об-
лигатно и факультативно анаэробные бактерии. К ним относятся
представители рода Azospirillum, сульфатредуцирующие бактерии
Desulfovibrio desulfuricans, D. vulgaris, Desulfotomaculum ruminis, не-
которые виды Bacillus (Вас. macerans, Вас. polymyxa), энтеробактерии
E. coli, Klebsiella pneumonia, Ervinia herbicola. Из пурпурных серных
бактерий такой способностью обладают Amoebobacter roseus, Thio-
cystis violacea, Thiocapsa pfennigii, T. roseopersicina, Ectothiorhodospira
shaposhnikovii, из несерных пурпурных — несколько видов Rhodo-
spirillum, Rhodocyclus purpureus, Rhodomicrobium vannielii, из зеленых
серобактерий — некоторые виды Chlorobium и Pelodyction, очень
многие цианобактерии (Anabaena spp., Aulosira spp., Calothrix, Lyng-
bia, Mastigacladus, Pelonema, Nostoc, Oscillatoria и другие — более
40 видов).
Кроме того, в настоящее время известно, что осуществлять
процесс так называемой ассоциативной азотфиксации способны
очень многие аэробные бактерии, около 50% микроорганизмов,
которые удается выделить на питательных средах. Ассоциативная
азотфиксация осуществляется лишь в определенных условиях: либо
в ’’синтрофных” бинарных культурах микроорганизмов [Калинин-
ская, 1967], либо эпифитной микрофлорой водной растительности
[Одинцов, 1983]. Таким образом, в фиксации азота участвуют
микроорганизмы различных физиологических групп. Поэтому наибо-
лее правильное представление о процессе фиксации атмосферного
азота в водоемах можно получить, определяя интенсивность это-
176
го процесса. Количественный же учет азотфиксирующих бактерий
может показать, какие организмы ответственны за данный про-
цесс, но не дает представления о масштабах фиксации азота. Для
этих целей необходимо определять интенсивность процессов, ис-
пользуя методы, приведенные в III части этой книги.
Аэробные азотфиксирующие бактерии
В эту сборную группу аэробных свободноживущих гетеротроф-
ных бактерий включены бактерии, которые способны усваивать ат-
мосферный азот при развитии на средах с углеродными соедине-
ниями, лишенных азота.
Физиологически однородную группу представляют бактерии, ра-
нее входившие в семейство Azotobacteriaceae. К ним относятся
следующие роды: Azotobacter, Azomonas, Beijerinckia и Derxia. К так-
сономическим признакам, важным для подразделения на роды, от-
носятся форма клеток, подвижность, образование цист, содержа-
ние G + С в ДНК, образование включений поли-р-оксимасляной
кислоты и наличие каталазной активности. Недавно переклассифи-
цированный род Azospirillum, вначале описанный Бейеринком как
Spirillum lipoferum, по-видимому, следует причислить к этой же
группе.
Для представителей всех родов характерны образование капсул,
накопление большого количества слизи (полисахаридов) при росте
на безазотистых средах, высокая активность фиксации молекуляр-
ного азота, по меньшей мере 10 мг атмосферного азота на 1 г потреб-
ленного углевода, при наличии в среде молибдена, бора, железа,
ванадия и марганца.
Azotobacter и Azomonas на искусственных средах определенного
химического состава имеют крупные клетки овальной или сфери-
ческой формы, нередко соединенные парами или в пакеты. Пред-
ставители типового рода Azotobacter образуют цисты, чем отли-
чаются от представителей других родов. Формирование цист у не-
которых штаммов азотобактера происходит только в отсутствие свя-
занного азота.
Derxia отличается от остальных представителей семейства Azoto-
bacteraceae мелкими палочковидными клетками, обладающими од-
ним полярным жгутиком, обилием липидных включений, а также
способностью к активной азотфиксации при автотрофном окисле-
нии Н2 и к росту на синтетической среде, содержащей в качестве
единственного источника углерода и энергии метан, метанол или
формиат.
Выделение культур рода Azotobacter. При выделении и культиви-
ровании азотфиксирующих бактерий следует разливать среду тон-
ким слоем по 10—15 мл в колбы Эрленмейера на 100 мл или по
50 мл в колбы на 250 мл.
Среда для выделения A. chroococcum
Глюкоза 20 г MgSCh 7Н2О 0.5 г
CaCOs 20 г Вода дистиллированная 1000 мл
КН2РО4 1 г
12 Зак. 1766 177
В ряде случаев следует добавить микроэлементы, особенно ЫагМоОд *
•2НгО — 0,005 г на 1 л. При исследовании водных объектов пред-
почтительнее вместо дистиллированной воды использовать воду из ис-
следуемого источника. Через 1—3 дня на поверхности питательной
среды образуется слизистая пленка A. chroococum.
Среда для выделения чистой культуры Л. chroococcum
Глюкоза 20 г
К2НРО4 0,8 г
FeCI3-6H2O 0,1г
Вода дистиллированная 1000 мл
Na2Mo04 • 2Н2О 0,005 г
СаСОз 20 г
Агар 20 г
Устанавливают pH 7,4—7,6.
Колонии, образующие кислоты и растворяющие мел вокруг ко-
лоний, по большей части не относятся к видам азотобактера. СаСОз
забуферивает среду от подкисления, что для азотобактера благоприятно.
Как правило, подкисление среды до pH 6,0 исключает его развитие.
Среда для A. vinelandii
Маннит о,5 г
или этанол 1 г
К2НРО4 0,5 г
Бензоат натрия 1 г
Вода дистиллированная 100 мл
Для выделения из почвы предпочтительнее в качестве источника
углерода вводить в среду этанол, а при выделении из воды — ман-
нит, чтобы исключить развитие Azomonas, который его не исполь-
зует.
Выделение культур рода Azomonas. Вид Azomonas agilis в противо-
положность большинству видов Azotobacter заметно устойчив к на-
личию в среде 1% бензоата, хотя и не может его использовать в
качестве источника углерода.
Среда для Azomonas agilis
Этанол 1 мл
К2НРО4 0,05 г
Бензоат натрия 1 г
Вода речная или озерная 100 мл
Накопительная среда разливается тонким слоем в колбы объемом
100 мл для наилучшей аэрации среды.
Среда для Azomonas insignis
Формиат кальция 0,5 г
Этанол I мл
Вода водопроводная 100мл
Накопительная среда помещается тонким слоем и инкубируется
после заражения при 25—30°. Муравьинокислый кальций добавляется
в среду, чтобы задержать развитие других микроорганизмов, в том
числе и видов Azomonas. A. insignis не использует ни маннит, ни
глюкозу, но хорошо растет в среде с сукцинатом или малатом
кальция.
Чистая культура может хорошо расти на водопроводной воде с
добавкой микроэлементов, 0,05% К2НРО4 и 0,5—1,0% танола. Рост
178
начинается на третий день, среда становится молочно-белой, а в даль-
нейшем принимает фиолетовый оттенок.
Выделение культур рода Beijerinckia. Данные микроорганизмы отли-
чаются своеобразием морфологии: наличием двух полярных телец
внутри клетки, устойчивостью к кислой реакции окружающей среды
при росте и фиксации свободного азота. При росте на жидкой среде
вся среда становится слизистой, а пленка не образуется. Как пра-
вило, культуры накопления получают в чашках Петри с тонким слоем
жидкой среды. После получения культуры накопления на среде с
глюкозой при pH 5 пересев проводят на агаризованную среду.
Среда для выделения культуры Beijerinckia
Глюкоза 20 г FeCh'6H2O 0,025 г
KjHPO* 0,8 г Na2Mo04- 2H2O 0,005 г
KH2PO< 0,2 г Arap 20г
MgSO4 7H2O 0,5 г Вода дистиллированная 1000 мл
Устанавливают pH 6,9. На агаризованной среде образуются колонии
с большим количеством эластичной слизи вокруг колоний. Для
дальшейшей очистки в ту же среду добавляют 1—2% СаСОз, в ре-
зультате чего среда становится слабощелочной. При щелочной реакции
слизи образуется меньше и из колоний можно произвести отсев с
разведениями для последующего выделения чистой культуры из отдель-
ных колоний.
Выделение культур рода Derxia. D. gummosa способна использо-
вать, помимо углеводов, такие субстраты, как метанол и формиат,
которые целесообразно добавлять в элективную среду при выделении
чистой культуры из накопительной. Для получения накопительной
культуры используют среду с крахмалом.
Среда для выделения Derxia gummosa
Крахмал 20 г
К2НРО. 0,05 г
Бромтимо- 5 мл
ловый синий,
0,5%-й спир-
товой раствор
Вода дистил- 1000 мл
лированная
MgSO«-7H2O 0,20 г
СаСЬ 0,002 г
FeCh, Ю%-й 0,1мл
водный
раствор
Na2Mo04'2H20 0,02 г
Агар 20 г
Культуры накопления получают в чашках Петри, раскладывая
частицы ила на поверхность среды. Вырастающие через 5 дней на
частицах ила желтоватые колонии сливаются вместе и образуют ко-
ричневую хрупкую корочку. В дальнейшем чистую культуру получают
из этих колоний методом разведений на твердой среде того же состава.
Анаэробные азотфиксирующие бактерии
Анаэробную фиксацию азота осуществляют различные виды Clost-
ridium: Cl. pasteurianum, Cl. butyricum, Cl. beijerinckii, Cl. multifer-
mentas, Cl. modisonii, CI. acetobutilicum, Cl. kluyverii, Cl. felsine-
179
um, Cl. pectinovorum. К этой же группе можно отнести факуль-
тативно анаэробные бактерии рода Azospirillum.
Наиболее активным фиксатором азота является Cl. pasteurianum.
Для обнаружения и количественного учета этих организмов посевы с
разведениями производят на жидкую безазотистую среду Виноград-
ского в пробирки, заливая их средой доверху, или на агаризован-
ную среду того же состава.
Элективная среда Виноградского для Cl. pasterianum
Глюкоза 20 г
KjHPO* 1 г
MgSO4-7H2O 0,5 г
Вода дистиллированная 1000 мл
NaCl Следы
MnSO4-5H2O
FeSO4-7H2O
CaCOj 40 г
К основной среде добавляют 1 г дрожжевого автолизата и 0,1 г
ЭДТА. При этих условиях подавляется сопутствующая микрофлора и
преимущественно развивается Cl. pasteurianum.
С применением оптимальных сред, обогащенных микроэлементами
и восстановителями, удается определить численность и других видов
анаэробных азотфиксаторов [Мишустин, Емцев, 1974].
Пептонно-дрожжевая среда для количественного учета
CL pasteurianum
СаСОэ Ю г
Вода дистил- 1000 мл
лированная
Глюкоза 20 г
Пептон 5 г
Дрожжевой 0,2 г
автолизат
Среду стерилизуют при 0,5 атм 30 мин. pH устанавливают равным
7. Перед посевом в среду вносят 0,05% тиогликолата для сниже-
ния окислительно-восстановительного потенциала и нейтральрот в
конечной концентрации 0,004%. В присутствии этого окислительно-
восстановительного индикатора (гНз 3,2) колонии Clostridium обладают
золотисто-желтой флуоресценцией.
Количество Cl. pasteurianum подсчитывают методом предельных
разведений. О развитии судят после 2 нед инкубации посевов по
наличию газообразования в результате образования Нг и СОг и по
изменению окраски индикатора — появлению золотисто-желтой флу-
оресценции. Необходимым условием является и микроскопический
анализ выросших бактерий.
Крахмальная среда Емцева для Cl. butyricum
Картофель- 20 г Дрожжевой автолизах 0,2 г
иый крахмал СаСОз 10 г
Пептон 5 г Вода дистиллированная 1000 мл
Перед посевом устанавливают pH 7,4—7,5 и в среду асепти-
чески вносят тиогликолат — 0,05% и нейтральрот — 0,001%. Коли-
чественный учет Cl. butyricum производят так же, как описано для
Cl. pasteurianum.
180
Кукурузный отвар для учета Cl. acetobutylicum
Готовят кукурузный отвар следующим способом. 50 г кукуруз-
ной муки вносят в 1 л холодной воды, быстро нагревают до 90°,
выдерживают 10 мин, затем кипятят 30 мин, устанавливают pH 5,6—
5,7. Приготовленный отвар разливают в пробирки по 2/3 объема и
стерилизуют при 2 атм 60 мин. Перед посевом в среду вносят тио-
гликолат и нейтральрот, как указано выше. О развитии Cl. acte-
tobutilicum судят так же, как описано для Cl. pasteurianum.
Выделение культур рода Azospirillum. A. lipoferum был выделен
Бейеринком под названием "Spirillum lipoferum” из бедной азотом
слабокислой песчаной почвы. В дальнейшем был выделен еще один
вид спирилл, фиксирующих азот в анаэробных условиях, — А. Ьга-
ziliensis.
Среда для культуры накопления Azospirillum
Малат кальция 10 г
К2НРО< 1 г
MgSO«*7HiO 0,5 г
CaCh 0,02 г
Вода дистиллированная 1000 мл
Устанавливают pH 6,5. Если в виде источника углерода ис-
пользуется 2% глюкозы, то вместо СаСЬ добавляют в среду 0,5%
СаСОз. Среду разливают в чашки Петри тонким слоем (2—3 мм) и
заражают 0,5 г ила. При развитии бактерий среда часто подкисляется.
После 14 дней инкубации при 30° культура накопления контро-
лируется на наличие спиральных клеток. Из жидкого слоя делают
пересев на агаризованную среду того же состава. На агаризован-
ной среде A. lipoferum образует круглые красные колонии, сухие —
при использовании малата и влажные — при внесении в питательную
среду глюкозы.
Для Azospirillum характерна спиральная форма клеток длиной
30—40 мкм при развитии на безазотистой среде для азотобактера.
Среда для A. braziliensis [Day. Dobereiner, 7976]
Малат кальция Юг CaClj 0,02 г
или глюкоза 20 г Дрожжевой 0,1 г
КгНРОч 0,1 г экстракт
КН2РО4 0,2 г Агар 15 г
MgSO4-7H2O 0,5 г Вода дистилли- 1000 мл
FeCh-6H2O 0,1 г рованная
Na2MoO4 • 2НгО 0,02 г
Устанавливают pH 6,9.
Ассоциативная азотфиксация
Ассоциативная азотфиксация широко распространена в природе.
Наиболее часто среди микроорганизмов, осуществляющих ассоциатив-
ную азотфиксацию, встречаются азотфиксирующие микобактерии и
факультативные анаэробы наподобие Вас. polymyxa. Роль стимуляторов
в этом процессе выполняют бактерии из родов Pseudomonas, Fla-
181
vobacterium, Achromobacter и др. На стандартных безазотистых средах
эти микроорганизмы, как правило, не выделяются. Для их выделе-
ния необходимо создавать определенные условия.
В качестве среды, пригодной для них выделения, можно рекомен-
довать следующую среду.
Среда Калининской для факультативно
симбиотрофных азотфиксаторов
Глюкоза 10—15 г FeCl}-6HiO 0,01 г
' КЛ4РО, <КН2РО4 1,74 г Дрожжевой автолизат 15 мг
0,91 г Бромтимоловый синий,
MgSO4 7Н2О 0,3 г 0,1 %-й водный раствор 0,01 мл
СаСЬбНгО 0,1 г Раствор микроэлементов 1 мл
NaCl 0,5 г N 1 (см. прил.) Вода дистиллированная 1000 мл
Эту среду засевают илом с разведениями. На этой же среде ведут
количественный учет факультативно симбиотрофных азотфиксаторов.
Наличие азотфиксации определяют по приросту азота в среде по
сравнению с контрольной средой методом Кьельдаля после 2—3 нед
инкубации. Из-за сильного подкисления среды рекомендуется сте-
рильным раствором NaOH ежедневно проводить нейтрализацию среды.
НИТРИФИЦИРУЮЩИЕ БАКТЕРИИ
Биологическое окисление аммиака до нитритов и далее до нитратов
в природе проводится двумя физиологическими группами грамотри-
цательных хемолитотрофных бактерий. Обе группы этих бактерий
фиксируют СО2 в цикле Кальвина в конструктивном обмене и получают
энергию для восстановления СОг от окисления аммиака (аммоний-
окисляющие бактерии) или при окислении нитритов (нитритокис-
ляющие бактерии). За исключением некоторых штаммов Nitrobacter wi-
tknogradsl$ii, которые могут расти хемогетеротрофно, нитрифицирую-
’ щие бактерии — облигатные хемолитоавтотрофы.
В последнее время показана способность отдельных видов к рос-
ту в анаэробных условиях при использовании в качестве акцеп-
тора электронов более окисленных соединений азота: так, Nitro-
somonas europea способен окислять NH3, восстанавливая при этом
NO2 или NO2 до закиси азота или N2 [Poth, 1984]. Nitrobacter
способен восстанавливать NO? до N2 при окислении NO2.
В природе нитрифицирующие бактерии распространены широко,
встречаются в почвах, в компостах аэротенков при очистке сточ-
ной жидкости, в пресных водоемах и в море. Однако в озерах они
распространены преимущественно в поверхностном слое ила, если
растворенный кислород в водной массе доходит до иловых отложе-
ний. В водной массе численность их невелика и заметной величи-
ны может достигать лишь в слое металимниона, если из иловых
отложений сюда поступают заметные количества аммиака.
В природе их развитие определяется такими факторами, как кон-
центрация NH4 или NO2, температура, pH и парциальное давле-
ние кислорода. Как указано выше, развитие отдельных видов воз-
182
Окисляющие NH< до NO2
Окисляющие NO2 до NOj
Таблица 18
Нитрифицирующие бактерии
Вид Место выделения Форма клеток Вид Место выделения Форма клеток
Nitrosomonas europea Вода, почва Палочки Nitrobacter agilis Вода, почва Грушевидная
Nitrosospira briensis Море, почва Спиральная N. winograd- skyi N. hambur- gensis -
Nitrosococeus nitrosus Почва Кокк Nitrospira gracilis Море Тонкая палочка
N. oceanus N. mobilis Море Nitrococcus mobilis Кокк
Nitrosovibrio tenuis Nitrosolobus multiformis Почва Вибрион Дольчатая Nitrospina gracilis Тонкая палочка
можно при окислении NHj и NOj в анаэробных условиях. Опти-
мальные условия для роста большинства штаммов создаются при кон-
центрации субстрата от 1 до 25 мМ, pH от 8,5 до 8 и температуре
25—30°.
Для получения культуры накопления обычно производят посев
в пробирки, которые инкубируют в темноте при 25—30° от одного
до четырех месяцев.
В настоящее время к числу нитрификаторов относятся виды,
перечисленные в табл. 18.
После работ С.Н. Виноградского многие исследователи пытались
разобраться в видовом составе нитрофицирующих бактерий, входящих
в семейство Nitrobacteriaceae. Только в 1971 г. Уотсон [Watson, 1971]
и его сотрудники в Океанографическом институте в Вудс-Холле
получили из разных мест тысячи накопительных культур и из них
выделили 200 чистых культур, провели ревизию систематики и дали
описание новых родов, входящих в семейство Nitrobacteriaceae. Так,
в настоящее время описано 6 родов автотрофных бактерий, окисляю-
щих аммиак до нитратов, и 5 родов, окисляющих нитриты до нитратов
[Лебедева, 1982] (см. табл. 18).
Наиболее благоприятной для получения культур накопления ам-
монййокисляющих бактерий служит среда Сориано и Уокера [So-
riano, Walker,
(NH4)jSO4
КН2РО4
СаС12-2Н2О
MgSO. 7Н2О
1968].
Среда Сориано и Уокера
Цитрат железа
Феноловый красный,
0,05%-й раствор
Вода дистиллированная
0,2 г
0,04 г
0,04 г
0,0005 г
I мл
1000 мл
183
Перед посевом pH сред устанавливают равным 7,5—7,8 внесением
стерильного раствора NaHCOj и добавляют 1 мл раствора микро-
элементов N 1 (см. приложение). Среду разливают в колбы Эрлен-
мейера на 100 мл по 25—30 мл и заражают 10 мл воды или 1—2 мл
ила. При развитии аммонийокисляющих бактерий образуется азоти-
стая кислота, в результате чего присутствующий в среде индикатор
меняет желтую окраску на розовую. Этой средой удобно пользоваться
при количественном учете аммонийокисляющих бактерий. При ис-
пользовании этой среды для культивирования нужно постоянно ре-
гулировать pH прибавлением 0,1%-го стерильного раствора NaHCOj,
так как подкисление среды оказывает неблагоприятное воздействие
на нитрификаторы.
Для культивирования аммонийокисляющих бактерий благоприятна
среда Хармса [Harms et al., 1976]. Наличие в среде СаСОз обеспе-
чивает постоянство pH, а адсорбция на частицах мела бактерий
способствует их длительному выживанию.
Среда Хармса для аммонийокисляющих бактерий
NFbClvj 0,5 г FeSO4-2H2O 0,01 г
MgSO4(2H2O 0,1г CaCOj 2,5 г
КН2РО4 0,02 г Вода дистиллированная 1000 мл
После стерилизации pH устанавливают 7,4—7,8. Перед посевом
в среду вносят 1 мл раствора микроэлементов N 1.
• Среда Уотсона и Менделя [ Watson, Mandel, 1971]
для Nitrosomonas
(NH4)2SO4 1700 мг ZnSO4-7H20 0,1 мг
CaCh-2H2O 20 мг CuSO4- 5H2O 0,02 мг
MgSO4- 7H2O 200 мг Цитрат железа 1 мг
K2HPO4 15 мг NaMoO4-2H2O 10 мкг
Mn Ch -4H2O 0,2 мг Вода дистилли- 1000 мл
CoCI2-6H20 0,002 мг рованная
Устанавливают pH 7,4—7,8 с помощью 0,1%-го раствора NaHCOj.
Для культивирования нитритокисляющих бактерий благоприятна
среда Уотсона и Ватербури [Watson, Waterbury, 1971].
Среда Уотсона и Ватербури для нитритокисляющих бактерий
NaNO: 0.07 г КН2РО4 0,02 г
MgSO4-7H2O 0,1г Вода водопроводная 700 мл
СаС12 -6Н2О 0,006 г Вода дистиллированная 300 мл
После стерилизации устанавливают pH среды около 7,5. Перед
использованием в среду вносят 1 мл раствора микроэлементов N 1.
О развитии аммонийокисляющих бактерий судят по появлению
нитритов, а о развитии нитритокисляющих — по исчезновению
нитритов или появлению нитратов.
Питательные среды для нитрификаторов обладают определенной
селективностью, обеспечивая преимущественное развитие той или
другой группы бактерий. Так, Nitrosospira, Nitrosomonas и Nitroso-
vibrio хорошо растут на среде Сориано и Уокера, a Nitrosolo-
184
bus — только на среде Хармса. На среде Уотсона и Менделя
преимущественно развивается Nitrobacter.
Среда Уотсона и Менделя [Watson, Mendel, 1971] &ля Nitrobacter
NaNOs 6V Na2Mo04-2H20 25 мкг
CaClr 2H2O 5 r MnCI2-4H2O 50 мкг
MgSO.-7H2O 100 мг ZnSO<-7H2O 25 мкг
K2HPO4 3,4 мг CoCI2-6H20 0,6 мкг
Цитрат железа 1 MT CuSOv5H2O 5 мкг
Вода дистилли- 1000 мл
рованная
После стерилизации pH среды доводят до 7,5. Концентрацию
нитритов повышают путем дробного добавления азотистокислого
натрия.
Выделение чистой культуры нитрификаторов. Для выделения
чистой культуры нитрифицирующих бактерий следует применять ме-
тод 10-кратных разведений. При этом необходимо, чтобы нитрифи-
каторы были активны и преобладали в культуре накопления. Нужно
иметь в виду, что использование среды, приготовленной на основе
растворимых солей, обеспечивает более быстрое выделение бакте-
рий, нежели на средах, содержащих твердую фазу.
Для выделения нитрификаторов делают ряд 10-кратных разве-
дений из накопительной культуры. Учитывая повышенную потребность
нитрификаторов в кислороде, в пробирки наливают по 4,5 мл соот-
ветствующей среды и вносят по 0,5 мл суспензии бактерий. Чистые
культуры, как правило, получают в 7—8-кратном разведении. Поэтому
число пробирок с этими разведениями должно быть не менее 10.
Время инкубации аммонийокисляющих бактерий на среде Сориано и
Хармса составляет 30—40 сут при 28°.
Нитритокисляющие бактерии нуждаются в продолжительной лаг-
фазе, поэтому их время инкубирования составляет 120 сут. О раз-
витии нитритокисляющих бактерий судят по образованию нитратов и
исчезновению нитритов.
Nitrobacter может расти и на агаризованной среде Уотсона и
Ватербури, если в среду внести 2% агара Дифко. На поверхности
среды вырастают мелкие прозрачные колонии, видимые под биноку-
лярной лупой.
Проверку чистоты культуры осуществляют посевом на мясо-пептон-
ный и картофельный агар, на разбавленный 1:100 мясо-пептонный
бульон, а также на среду следующего состава: а) дрожжевой экст-
ракт — 0,8%; мясо-пептонный бульон — 0,8%; глюкоза — 0,1%;
вода дистиллированная — 1000 мл; б) минеральная среда для нит-
рифицирующих бактерий: глюкоза —0,1%, дрожжевой экстракт —0,05%;
гидролизат казеина — 0,05%. Кроме того, аммонийокисляющие бакте-
рии высевают на среду для нитритокисляющих, и наоборот. После
7—10 сут инкубации посевы проверяют на присутствие посторон-
ней микрофлоры. Чистоту культур контролируют микроскопиро-
ванием.
185
Количественный учет нитрификаторов. 1. Метод наиболее вероят-
ного числа по Белсеру и Шмидту [Belser, Schmidt, 1978]. Согласно
этому методу, 10 г исследуемого образца помещают в цилиндр,
куда наливают 95 мл деионизированной воды, закрывают резино-
вой пробкой и встряхивают 3 мин. 10-кратные разведения полу-
ченной суспензии готовят на фосфатном буфере (0,1 М, pH 7,2).
Для учета аммонийокисляющих бактерий используют среду Сориано
и Уокера, а для нитритокисляющих — среду Ватсона и Менделя.
В пробирки наливают 4,5 мл соответствующей среды и вносят
последовательно по 0,5 мл суспензии бактерий. Разведения делают
не менее чем в трех повторностях.
2. Применение методов иммунофлуоресцентного анализа для ко-
личественного учета нитрификаторов позволяет выявить в 10—100 раз
большее число отдельных видов по сравнению с общепринятым мето-
дом (см. разд. "Иммунофлуоресцентный анализ...”).
ГЕТЕРОТРОФНАЯ НИТРИФИКАЦИЯ
Наряду с существованием хемоавтотрофных нитрифицирующих бак-
терий известно значительное число гетеротрофных микроорганизмов,
способных осуществлять процессы окисления соединений азота. В
окислительные процессы вовлекаются как неорганические соединения
азота, так и азот органических соединений. Ниже приведен список
эукариотных и прокариотных микроорганизмов, способных окислять
различные соединения азота. Этот процесс получил название гете-
ротрофной нитрификации (табл. 19).
Помимо этого, известны микробиологические процессы окисле-
ния азота аминокислот и амидов до гидроксиламина и далее — до
нитрозо- и нитросоединений, с накоплением в среде свободных нит-
ратов и нитритов.
С экологической точки зрения одним из важных результатов
гетеротрофной нитрификации является накопление в среде промежу-
точных соединений — гидроксамовых кислот, относящихся к биологи-
чески активным соединениям.
При гетеротрофной нитрификации не происходит использования
клетками энергии, освобождающейся в ходе окисления соединения
азота. Предполагается, что оно сопряжено со сбросом избытков
восстановительного эквивалента [Kuenen, Robertson, 1987].
Наиболее выражен процесс окисления аммония до нитратов и
нитритов в кислых почвах, где он протекает при участии микро-
скопических грибов. Некоторые грибы, например Penicillum, осу-
ществляют гетеротрофную нитрификацию интенсивнее при нейтраль-
ных значениях pH. Вклад гетеротрофных микроорганизмов в окисле-
ние соединений азота в почвах может достигать в определенных
условиях 50% автотрофной нитрификации. В водоемах также обна-
ружены многие гетеротрофные микроорганизмы, способные осуще-
ствлять окисление аммонийного и нитритного азота. Так, Годе и
Овербек [Gode. Overbeck, 1972] определили, что в иловых отло-
186
Таблица 19
Микроорганизмы, осуществляющие разные этапы гетеротрофной нитрификации
Вид Субстрат Проду кт
Arthrobacter globiformis Аммоний Гидроксиламин
Arhtrobacter sp. Гидроксиламин, гидрокса- мовая кислота, нитрит и нитрат
Aicaiigenes faecalis Г идроксиламии
Asp. flavus Моногидроксамовая кислота
Streptomyces sp. То же
Mycobacterium phlei Дигидроксамовая кислота
Aerobacter aerogenes Rhodotorula sp. То же
Ustilago sphaerogena Тригидроксамовая кислота
Neurospora crassa То же
Streptomyces griseus Тригидроксамовая кислота
Asp. parasiticus Нитрат
Asp. flavus 3-Нитропропионовая кислота
Chlorella Thiosphaera pantotropha Аммоний, гидроксиламин, Нитрат
мочевина
Proteus sp- Гидроксиламин
Ps. aureofaciens Гидроксиламин, оксим пирувата Нитрит
Ps. fluorescens То же
Ps. stutzeri Aicaiigenes sp. Оксим
Ps. aeruginosa Алифатические нитросоеди- нения, анилин, нитробензол,
карбоксин, оксикарбоксин
Penicillum citrinum Аммоний, пептон, мочевина, цианид, азид Нитрат
Asp, ustus Asp. carneus Caldosporium herbatum То же
Flavobacterium sp. Ароматические нитросоединения
Nocardia sp. То же
Asp. wentil Нитрит
Asp. flavus Алифатические нитросоеди-
нения
Pseudomonas sp. Ароматические нитросоеди-
нения
Penicillum sp. Пептон, карбоксин
жениях численность гетеротрофных бактерий, окисляющих аммиак,
достигает 1 млн клеток в 1 мл.
Прежние представления о незначительном вкладе гетеротрофной
нитрификации в окисление азота в водоемах, основанные на низкой
скорости этого процесса по сравнению с автотрофной нитрифика-
цией, вероятно, нуждаются в пересмотре. Оказалось, что многие
гетеротрофные нитрификаторы одновременно осуществляют процесс
187
денитрификации. В этих случаях накопления нитритов не происхо-
дит или оно незначительно из-за их расходования при денитри-
фикации. Таким образом, реальная интенсивность гетеротрофной
нитрификации может быть значительно выше измеряемой по учету
конечного продукта [Castignetti, Hollocher, 1984; Kuenen, Rober-
tson, 1987].
В настоящее время способность к гетеротрофной нитрификации
обнаружена у многих видов денитрификаторов. К ним относятся
Aicaiigenes faecalis, Chromobacterium violaecus, Flavobacterium sp..
Paracoccus denitrificans, Pseudomonas aeruginosa,’’Pseudomonas” de-
nitrificans, Ps. stutzeri, Ps. fluorescens, Thiosphaera pantotropha и др.
Окисление соединений азота у многих видов может происходить
в присутствии кислорода одновременно с денитрификацией. Было
показано, что при развитии гетеротрофных нитрификаторов окис-
ление азота органических соединений в аэробных условиях
сопровождается одновременно протекающим процессом денитри-
фикации за счет нитритов — продуктов первого процесса.
Накопление конечных продуктов обеих реакций у некоторых орга-
низмов определяется концентрацией кислорода в среде. Так, у
Aicaiigenes продукты нитрификации накапливаются, если содержание
растворенного кислорода не ниже 50% от насыщения, при более
низких величинах происходит их полное восстановление в резуль-
тате преобладания скорости денитрификации. У Ths. pantotropha
максимальная скорость гетеротрофной нитрификации проявляется,
например, в микроаэробных условиях при хемостатном культивиро-
вании. Таким образом, количественные измерения величин гетеро-
трофной нитрификации в водоемах, проведенные без учета одно-
временного потребления продуктов в ходе денитрификации, могут
быть сильно заниженными.
Можно полагать, что гетеротрофная нитрификация может вносить
существенный вклад в баланс образования окисленных форм азота
в водных системах, особенно там, где идет интенсивное разло-
жение органических соединений.
Выделение и количественный учет гетеротрофных ннтрификяторов.
Кьюнен и Робертсон предложили простой метод отбора штаммов,
способных к гетеротрофной нитрификации. С этой целью в суспен-
зии клеток определяют скорость потребления кислорода до и после
введения предполагаемого субстрата гетеротрофной нитрификации.
Увеличение расхода кислорода указывает на способность к гетеро-
трофной нитрификации. Скорость потребления О? в суспензии кле-
ток определяют полярографически [Kuenen, Robertson, 1987].
Среда для выделения и учета гетеротрофных нитрификаторов
Сухой питательный агар 3,5 г
Агар 13,5 г
(NH<)2SO4 0,5 г
Вода дистиллированная 1000 мл
Устанавливают pH 7,0—7,2.
Для учета гетеротрофных нитрификаторов испытуемый материал,
воду или иловые озерные отложения после 10-кратных разделений высе-
188
вают в чашках Петри на приведенную агаризованную среду и
инкубируют при комнатной температуре в течение 5—10 дней. Когда
появятся отдельные бактериальные колонии, на них наносят по
капле реактива Грисса. Покраснение среды указывает на образо-
вание нитритов из аммония, введенного в состав среды.
Для выделения культуры гетеротрофных нитрификаторов среда
разливается по 25 мл в колбы Эрленмейера объемом 100 мл и зара-
жается колонией бактерий, аналогичной той, что дала покрасне-
ние от реактива Грисса. Колбы инкубируют при температуре 28°.
Наличие гетеротрофной нитрификации отмечается по появлению розо-
вой или красной окраски среды при добавлении реактива Грисса.
Среда Годе и Овербека для гетеротрофных нитрификаторов
[Gode. Overbeck, 1972]
Ацетат натрия 2 г
NH4Cl 2 г
NaHCOj 0.4 г
MgSOjVHjO 2,4 г
СаС12 0,4 г
Фосфатный буфер, 1 М рас- 2 мл
твор, pH 7,2
Раствор микроэлементов 0,5 мл
N 2 (см. прил.)
Вода дистиллированная 1000 мл
Раствор микроэлементов и фосфатный буфер добавляют к среде пос-
ле стерилизации.
В некоторых случаях в среду добавляют 1 мл 0,2%-го раство-
ра триптона и 0,2%-го раствора пептона., О развитии гетеротроф-
ных нитрификаторов судят по появлению в среде гидроксиламина,
нитритов или нитратов.
ДЕНИТРИФИКАЦИЯ И ДИССИМИЛЯЦИОННАЯ НИТРАТРЕДУКЦИЯ
Денитрификация представляет собой анаэробный дыхательный
процесс, в результате которого происходит восстановление азота до
N2 или других газообразных продуктов. Восстановление нитрата
при денитрификации протекает в несколько этапов: нитрат (NOj) нит-
рит (NO?) — окись азота (NO) — закись азота (N2O) — свобод-
ный азот (N2).
Принципиально каждая ступень этого пути может способствовать
росту, как это было показано ранее, но известны организмы, кото-
рые не способны использовать всего пути. Микроорганизмы, восста-
навливающие соединения азота в анаэробном дахании при денитри-
фикации, составляют несколько групп.
1. Организмы, способные восстанавливать нитраты только до
нитритов (отсутствуют реакции 2, 3 и 4). К ним относятся многие
гетеротрофные бактерии, а также некоторые автотрофные, например
Т. thioparus. Правильнее этот процесс называть нитритным дыха-
нием.
2. Организмы, способные восстанавливать нитриты до закиси
азота (нет реакции 4) (Achromobacter nephrii, Aquaspirillum iter-
sonii, Halobacterium sp., Pseudomonas spp.).
3. Организмы, способные восстанавливать до свободного азота
нитриты, но не нитраты (отсутствует реакция 1) (Neisseria, Flavo-
rs
bacterium, Alcaligenes odorans, Corynebacterium nephridii (до N2O и NO),
Pseudomonas stutzerii, Alcaligenes faecalis, Achromobacter cycloclastes.
4. Организмы, способные редуцировать закись азота до свобод-
ного азота (отсутствуют реакции 1, 2, 3) (Vibrio succinogenes,
Campylobacter fetus).
5. Организмы, способные осуществлять редукцию нитратов до
газообразного азота. К ним относятся представители очень многих
родов и физиологических групп: представители пурпурных бактерий
Rhodopseudomonas sphaeroides; хемолитотрофные сероокисля!дщие бак-
терии Т. denitrificans, Т. versutus, Thiomicrospira, Thermothrix, Thio-
sphaera; почкующиеся бактерии Hyphomicrobium spp.; грамотрицатель-
ные бактерии родов Alcaligenes, Alteromonas, Aquaspirillum, Acineto-
bacter, Agrobacterium, Bradyrhizobium, Campylobacter, Branhamella,
Chromobacterium, Halobacterium, Gluconobacter, Flavobacterium, Kin-
gella, Neisseria, Paracoccus, Pseudomonas, Rhizobium, Veillonella alca-
lescens; грамположительные бактерии — Bacillus (11 видов), Cl. per-
foringens, Propionibacterium pentosaceum, некоторые виды рода Coryne-
bacterium.
Многие денитрификаторы способны развиваться автотрофно за
счет окисления водорода. Этот процесс получил название водород-
ной денитрификации.
Осуществлять денитрификацию с использованием водорода в ка-
честве донора электронов способен целый ряд факультативно анаэроб-
ных бактерий. К ним относятся Paracoccus denitrificans, Micrococ-
cus lactilyticus (Veillonella alcalescens), отдельные штаммы T. deni-
trificans, A. eutrophus, Proteus mirabilis, P. saccharophyla, E. coli,
V. succinogenes, Campylobacter, штаммы DSM 806 и DL-1, T. ver-
sutus, Tsa. pantotropha, Hyphomicrobium sp.
Метилотрофная денитрификация, т.е. окисление одноуглеродных
соединений, иных, чем формиат (метанол, метиламин, ди-, три-
метиламин), с участием нитратов в качестве акцептора электро-
нов, свойственна представителям рода Hyphomicrobium, а также
Paracoccus denitrificans. Обнаружены другие бактерии, не получив-
шие видового названия [Лебединский, 1984].
Хотя денитрификация, как правило, протекает в анаэробных
условиях у большинства известных видов, некоторые виды способны
осуществлять этот процесс при наличии в среде растворенного кисло-
рода. При этом у Thiosphaera pantotropha зарегистрировано од-
новременное протекание процессов дыхания с потреблением в качест-
ве акцепторов электронов как кислорода, так и нитратов [Kuenen,
Robertson, 1987]. В этих случаях предполагается одновременное функ-
ционирование двух различных ветвей цитохромного участка дыха-
тельной цепи по схеме
денитрификация
NO3 - NO2 - NO - N2O - N2
O2, ATP f
NHa------>NH2OH.
гетеротрофная нитрификация
"Спектр” чувствительности денитрифицирующих бактерий к раство-
190
ренному кислороду в условиях хемостатного культивирования варьи-
рует в широких пределах и составляет 95% от полного насыщения
у Tsa. pantotropha, 55—75% — У A- faecalis, 15% — у Hypho-
microbium X, 0% — у Paracoccus denitrificans [Kuenen, Robertson,
1987].
В свете приведенных данных находит объяснение нередко ранее
наблюдавшийся факт так называемой аэробной денитрификации, т.е.
образования N2 за счет денитрификации в присутствии в среде
значительных количеств кислорода.
Второй путь анаэробного дыхания, с восстановлением нитратов до
аммиака, называется диссимиляционной нитратредукцией. Этот про-
цесс протекает в два этапа и связан с акцептированием сначала
двух, а затем еще шести электронов:
NOJ - NO2 - NH3.
Процесс диссимиляционной нитратредукции осуществляют микро-
организмы различных физиологических и таксономических групп.
Среди них Aerobacter aerogenes, Aquaspirillum itersonii, Campylo-
bacter fetus, C. sputorum, Campylobacter sp., Citrobacter freundii,
Cytophaga, E. coli, Klebsiella pneumoniae, K. aerogenes, Selenomo-
nas ruminantium, Serratia marcescens, Proteus mirabilis, Staphilococcus
aureus, Spirillum, V. succinogenes, B. stearothermophilus, Veillonella
alcalescens, пурпурные бактерии рода Rhodopseudomonas, сульфатре-
дуцирующие бактерии D. propionicus, некоторые штаммы D. desul-
furicans, Dtm. pigra, Dbm. catecholicum. У некоторых видов суль-
фатредукторов нитрат служит предпочтительным акцептором электро-
нов в присутствии сульфатов. Установлена также способность к
редукции нитрита до аммиака при окислении водорода у предста-
вителей рода Desulfovibrio. В этом случае необходимо присутствие
в среде ацетата и СОг для целей конструктивного метаболизма.
Процессы восстановления нитратов до N2 и NH3 могут происхо-
дить одновременно в водоемах. В природных средах процесс дис-
симиляционной нитратредукции преимущественно протекает в усло-
виях, при которых имеется высокое соотношение аммоний: нит-
раты. Этот процесс преобладает над денитрификацией в более
глубоких слоях донных осадков, тогда как в поверхностном слое
отмечено относительное преобладание денитрификации. При наличии
в осадках водоемов нитратов и сульфатов отмечено угнетение суль-
фатредукции в результате преимущественного использования нитра-
тов для дыхания.
Выделение и количественный учет денитрифицирующих бактерий.
Для культивирования денитрифицирующих бактерий можно исполь-
зовать одну из приведенных ниже сред.
Среда для выделения денитрификаторов
Раствор 1
К2НРО4 0,87 г
КН2РО4 0,54 г
KNCh 5 г
(NH4)2SO4 1 г
Источник углерода 4 г
(цитрат натрия)
Вода дистилли- 1000 мл
рованная
191
Раствор 2
MgSO4-7H2O 2 г
Вода дистилли- 100 мл
рованная
Раствор 3
СаСЬНгО 0,2 г
FeSCh 7Н2О 0,1г
MnSO« Н2О 0,01г
Na2Mo04-2H20 0.01 г
CuSO4-5H2O 0,01г
HCI, 0,1 N 100 мл
К стерильному раствору I добавляют асептически по 10 мл
раствора 2 и раствора 3. Если необходимо, добавляют 15 г агара
на 1 л в раствор 1 до его автоклавирования. Если нужно иметь
полужидкую среду, добавляют 3 г агара на 1 л в раствор 1 до
автоклавирования. Посев производят в пробирки, доверху заполняя
их средой, закрывают резиновыми пробками так, чтобы не оставались
пузырьки воздуха. Для количественного учета делают посев мето-
дом предельных разведений.
Среда Гильтая для денитрифицирующих бактерии
Раствор 1
KNO3 1 г
Аспарагин 1 г
Вода дистиллированная 250 мл
Раствор 2
Лимонная кислота 5 г MgS04-7H2O 1 г
или цитрат кальция 8,5 г СаСЪ-бНгО 0,2 г
КН2РО4 1 г MnCh•4Н2О Следы
Вода дистилли- 250 мл
рованная
В случае использования лимонной кислоты ее нейтрализуют 10%-м
раствором КОН в присутствии фенолфталеина как индикатора. Раст-
воры 1 и 2 смешивают, общий объем доводят до 1000 мл сте-
рильной дистиллированной водой. Посев проводят так же, как ука-
зано выше. Наличие процесса денитрификации устанавливают по по-
ложительной реакции на нитриты с реактивом Грисса и по выделению
газообразного азота, который идентифицируют газохроматографи-
ческим методом.
Для получения твердой среды добавляют 1,5% агара. Среду мож-
но употреблять и без аспарагина. Аспарагин служит для более от-
четливого определения нитритного дыхания, когда восстановление
нитратов идет только до нитрита. В присутствии аспарагина в этих
условиях возможно выделение свободного азота за счет химического
взаимодействия аминного азота аспарагина с азотистой кислотой.
Для количественного учета денитрифицирующих бактерий берут
среду Гильтая без аспарагина, добавляют к ней 1,5% агара и нейтра-
лизуют до pH 7,0—7,2. Используемый материал из ряда последова-
тельных 10-кратных разведений вносят в стерильные пробирки
и заливают данной средой до резиновой пробки. Пробирки следует
сразу же поставить в стакан с холодной водой для быстрого
192
застывания агара. О развитии бактерий судят по наличию в стол-
бике разрывов от образования газообразного азота.
Вместо соли лимонной кислоты можно использовать другой ис-
точник углерода. Так, виды Alteromonas лучше растут в среде с
малатом и нитратами (см. раздел ’’Восстановление железа и марган-
ца микроорганизмами”).
Нитратный агар
Мясо-пептонный агар 1000 мл
KNOj 2,5 г
Азотнокислый калий добавляют до стерилизации в расплавлен-
ный агар. Выделение и количественный учет денитрификаторов на
нитратном агаре осуществляют методом предельных разведений в
пробирках, доверху заполненных твердой средой. О развитии судят
по образованию Nz в зоне роста колоний.
Для выделения и культивирования метилотрофных денитрифика-
торов рода Hyphomicrobium Хирш и Конти [Hirsch, Conti, 1964]
использовали среду N 337.
Среда Хирша и Конти N 337
для анаэробного роста Hyphomicrobium
Na2HPO4- 12Н2О 2,85 г MnSO4-4H2O 0,0025 г
КН2РО4 1,36 г Na2MoO4- 2Н2О 0,0025 г
MgSO«-7H2O 0,2 г KNOj 5г
(NH4)2SO4 0,5 г СНзОН 5 мл
СаСе2 2Н2О 0,01 г Вода дистилли- 1000 мл
FeSO4 7Н2О 0,005 г рованная
Растворы CaCh, FeSCh, MgSCh стерилизуют отдельно и вносят в
стерильную среду. Метанол добавляют перед посевом. А.В. Лебедин-
ский [1984] установил, что состав продуктов метилотрофной дени-
трификации зависит от наличия в среде ионов Си2*. В присутст-
вии в среде Си2* промежуточные продукты не накапливаются и
единственным продуктом денитрификации является Nz. Предполагается,
что ион Си2* способствует синтезу медьсодержащей NzO-редуктазы.
Автор рекомендует вносить в среду N-337 раствор CuSOvSHzO в
конечной концентрации 0,1 мг/л, а также следующие микроэлемен-
ты в расчете на 1 л среды: НВО? — 0,25 мг; ZnSCh^HzO —
0,07 мг; СоСЬ-бНзО — 0,025 мг; NiCl3-7H2O — 0,07мг.
Накопительные культуры получают путем внесения посевного
материала во флаконы с жидкой средой, наполовину заполненные
аргоном или азотом без доступа воздуха. Чистые культуры Hypho-
microbium выделяют из накопительных методом предельных разве-
дений с последующим рассевом на чашки с агаризованной (1,6% ага-
ра) средой указанного выше состава и клонированием колоний.
Среда для выделения метилотрофных денитрификаторов [Attwood,
Harder, 1972] приведена в разделе ’’Почкующиеся и простекатные
бактерии. Род Hyphomicrobium”.
13. Зак. 1766
793
Среда Громана для водородной денитрификации
[Verhoenen et al., 1954]
ЫагСОз 0,1 г КНгРО* 0,07 г
MgSO< 0,02 г FeCh Следы
NH<C1 0,1 г KNO, 20 г
NaCl 0,02 г Вода водопроводная 1000 мл
Устанавливают pH 4,2—4,5. Посевной материал вносят в среду,
разлитую в трубки Эльдриджа. Воздух над средой в трубках Эль-
дриджа заменяют примерно на 200 мл смеси 15% СОг и 85% Нг,
сосуд ставят на качалку в термостатной комнате при 30°. Через
2—3 дня начинается сильное снижение давления газовой смеси. Из
культуры накопления переносят посев на свежую среду, к которой
добавлено 0,3% дрожжевого автолизата. При пересеве на минераль-
ный агар, к которому добавлено то же количество дрожжевого ав-
толизата, в атмосфере СОг * Нг вырастает большое количество оди-
наковых колоний. Их отсевают на жидкую среду указанного выше
состава и экспонируют в газовой смеси из СОг и Нг. О развитии
судят по образованию продуктов денитрификации.
КРУГОВОРОТ ЖЕЛЕЗА И МАРГАНЦА
Железо и марганец относятся к металлам с переменной валентнос-
тью, что во многом определяет их огромную роль в геохимических
процессах в водоемах и в жизни.
Марганец более устойчив к химическому окислению кислородом и
более подвижен геохимически. Он относится к I группе подвижных
элементов наряду с К+, Na*, Са* и Mg*, а железо — к IV группе вместе
с А13+ и Ti3*. Согласно термодинамическим расчетам и эксперимен-
тальным исследованиям, окисление Мп2* с заметной скоростью возмож-
но лишь при pH выше 8,5. Железо в ионной форме неустойчиво в
окислительной обстановке при pH выше 4,5. Вследствие этого оно,
как правило, может находиться в растворенной форме в аэробной
толще воды только в виде комплексоорганических веществ, прежде
всего с гуминовыми кислотами.
Железо и марганец поступают в водоемы с водосборной площади
в виде взвесей и в растворенной форме. В результате процессов
химического или биологического окисления нерастворимые окислы
металлов в виде взвеси поступают в донные отложения. Здесь при
участии микроорганизмов происходит их восстановление с образо-
ванием подвижных форм, преимущественно в виде карбонатов. Послед-
ние мигрируют к поверхности грунта или выше, в водную толщу,
вновь подвергаются вторичному окислению при участии микроорга-
низмов, переходя во взвесь.
В зависимости от кислородного режима водоема окисление Fe2*
и Мп2* происходит или - в поверхностном слое грунта в олиго-
трофных водоемах, или в зоне хемоклина.
194
ВОССТАНОВЛЕНИЕ ЖЕЛЕЗА И МАРГАНЦА МИКРООРГАНИЗМАМИ
В восстановлении железа и марганца участвуют анаэробные, фа-
культативно анаэробные и аэробные микроорганизмы. Биохимические
механизмы восстановительных реакций могут быть различными.
Для многих организмов восстановление железа и марганца являет-
ся побочным процессом и обусловлено взаимодействием окислов метал-
лов с восстановленными продуктами метаболизма. К последним
относятся сероводород и вещества, содержащие тиоловые группы,
некоторые аминокислоты и органические кислоты (щавелевая), гидро-
ксиламин, слизи и др. Кроме того, Мп4* легко восстанавливается
до Мп2+ с участием перекиси водорода и в результате обменных
окислитительно-восстановительных реакций Mn4+ + Fe2* — Fe3* + Мп2*.
Неспецифические процессы восстановления железа и марганца легко
протекают в аэробных условиях за счет продуктов аэробного метабо-
лизма — органических веществ при участии очень многих гетеротроф-
ных микроорганизмов: актиномицетов, микроскопических грибов, раз-
личных бактерий.
Следует упомянуть о том, что редукция Мп у железобакте-
рий родов Leptothrix, Metallogenium, Arthrobacter обусловлена дейст-
вием Н2О2, выделяющийся при окислении органических веществ.
Обнаружены ферментативные процессы редукции окислов железа и
марганца с использованием их в качестве акцепторов электронов при
анаэробном дыхании. К редукции железа в анаэробном дыхании спо-
собны как литоавтотрофные, так и органотрофные бактерии. К первым
относятся Т. thiooxidans, Т. ferrooxidans, SulfoIobus acidocaldarius,
водородные бактерии Paracoccus denitrificans, Micrococcus lactilyticus=
Veillonella [Woolfolk, Whiteley, 1962; Jones, Gardner, 1984 и др.].
Из гетеротрофных бактерий функция использования Fe3* в ка-
честве акцепторов электронов обнаружена у многих бактерий: A. aero-
genes, Вас. cereus, Вас. polymyxa,Bac. circulans, Е. coli, Р. herbicola, Р. deni-
trificans, S. marcescens, Staphilococcus,y сульфатредукторов бактерий
D. desulfuricans, Dtm. nigrificans [Балашова, Заварзин, 1979; Jones,
Gardner, 1984; и др.]. Связь процесса восстановления Fe3* с функцио-
нированием электронтранспортной цепи не всегда зависит от наличия
у бактерий нитратредуктазы, как предлагалось ранее, а, вероятно,
связана с наличием специфической ферриредуктазной системы. Во
многих случаях наличие нитратредуктазы не сопровождается способ-
ностью бактерий к восстановлению Fe3* и наоборот проявляется
в отсутствие этого фермента. При использовании Fe3* в качестве
акцептора электронов накопление биомассы бактерий пропорциональ-
но количеству восстановленного железа. Интересно отметить, что
многие бактерии наряду с Fe3* способны восстанавливать при раз-
витии в анаэробных условиях окислы высшей валентности целого
ряда металлов: Cu2+, Мп4*, Pb4*,Sn4*, As4*, U6 , V3 , Mo6 , Cr6 , Se6 .
Подобная способность отмечена не только у органотрофных бактерий,
но и у Veillonella при автотрофном окислении водорода.
Наконец у бродилыциков восстановление железа может проис-
ходить в результате сброса избытка электронов. В этих случаях
восстановление Fe3* не сопровождается увеличением биомассы по
195
сравнению с контролем (в отсутствие железа в ростовой среде).
К восстановлению железа в процессе сбраживания органических ве-
ществ способны Cl. sticklandii, Bacteroides hypermegas, Vibrio sp.
[Jones, Gardner, 1984].
Возможность использования Мп4* в качестве конечного акцептора
электронов в дыхательной цепи убедительно доказано лишь недавно
при изучении Alteromonas putrifaciens, выделенного из озерного ила
[Myers, Nealson, 1988]. Помимо MnOz, эти бактерии способны в анаэроб-
ных условиях использовать в качестве акцепторов электронов и
другие соединения: Fe3*, NO3, S2O3? фумарат. Высокая численность A. putri-
taciens обнаружена автором в верхней части бескислородной зоны
Черного моря. Учитывая данные многих исследователей о широком
распространении способности к восстановлению марганца среди гете-
ротрофных факультативно анаэробных бактерий [Трошанов, 1968;
Castro, Ehrlich, 1970], можно полагать, что во многих случаях у этих
бактерий Мп4* выполняет функцию конечного акцептора электронов
при дыхании. Однако строгие доказательства наличия такой возмож-
ности у названных бактерий не получены. При этом следует иметь
в виду, что Мп4* значительно легче, чем Fe , может подвергаться
химическому восстановлению и даже растворению без изменения
валентности при взаимодействии с экзометаболитами бактерий.
Выделение и количественный учет железо- и марганецвосстанав-
ливякмцих бактерий. Наиболее пригодна для выделения самых разно-
образных микроорганизмов, способных к восстановлению железа и
марганца, среда Бромфильда [Bromfield, 1954]. Другая из приводимых
ниже сред удобна для выделения видов Alteromonas, хотя на ней могут
расти и редуцировать марганец и другие марганецвосстанавливающие
бактерии.
КН2РО« 0,5 г
MgSO«-7H2O 0,2 г
(NthhSCh 1 Г
СаСОз 5 г
Среда Бромфильда
для Fe3*- и Мп* -восстанавливающих бактерий
Дрожжевой экстракт 0,3 г
Сахароза (глюкоза) 10 г
Агар 20 г
Вода дистиллированная 1000 мл
Устанавливают pH 7,0—7,2. Перед посевом вносят окислы железа
в виде FeCb, Ре(ОНз)з или окислы Мп4* в виде MnOz из расчета 1—50 г/л.
В качестве источников окисленных форм железа и марганца можно
вносить в виде порошка некоторые минералы, содержащие Fe3* (лимо-
нит, гетит, гематит, ферригидрит, фероксигит) либо Мп4* (пиролюзит,
вернаднт, тодороккт, бернесснт), а также железо-марганцевые конкре-
ции.
Наличие процесса восстановления окислов металлов обнаружива-
ют либо по изменению цвета среды (обесцвечивание или приобрете-
ние более светлого оттенка), либо, для железа, цитохимически с
1%-й красной кровяной солью (появление синего окрашивания в ре-
зультате образования комплекса с Fe2*). При посеве в аэробных
условиях в чашках Петри вокруг колоний образуются зоны ’’просвет-
ления” вследствие растворения и редукции окислов железа или мар-
ганца.
196
Среда для выделения и количественного учета
Alteromonas [Myers, Nealson, 1988)
Сукцинат натрия или 15 мМ NaHCOj 0,168 г
ацетат натрия 15 мМ Агар 7,5 г
МпОг 0.1 г HEPES-буфер, 10 мм
Бактопептон 0,2 г pH 7,4
Дрожжевой экстракт 0,2 г Вода дистилли- 1000 мл
рованная
ИаНСОз и раствор сукцината стерилизуют отдельно и вносят
в среду перед посевом. Посев производят в пробирки или во флаконы
объемом 15—20 мл, заполняя их доверху средой после внесения
посевного материала из серии десятикратных разведений. После посе-
ва пробирки быстро охлаждают для предотвращения осаждения кол-
лоидной взвеси МпОг. Развитие бактерий, использующих МпОз в ка-
честве терминального акцептора электронов, сопровождается появлени-
ем зон просветления за счет растворения и обесцвечивания МпОг вокруг
отдельных колоний из предельных разведений. На этой среде хорошо
растут факультативно анаэробные бактерии, неспособные к броже-
нию, в частности виды Alteromonas. Последние могут использовать,
помимо Мп4*, другие акцепторы электронов при росте в анаэроб-
ных условиях: Fe5*, NO3, S2O3, фумарат.
ОКИСЛЕНИЕ ЖЕЛЕЗА И МАРГАНЦА МИКРООРГАНИЗМАМИ
Способность окислять двухвалентные соединения железа и марган-
ца присуща многим прокариотным организмам, принадлежащим к раз-
личным таксономическим группам и обладающим разным типом об-
мена веществ.
С.Н. Виноградский впервые применил термин "железобактерии"
для обозначения организмов, использующих окисления железа для
ассимиляции СОг, т.е. способных существовать хемолитоавтотрофно
[Виноградский, 1952в].
Принципиальные различия в функциональной значимости процесса
окисления железа в обмене веществ позволяют четко разделять так
называемые железобактерии на две группы. Первую, сравнительно
немногочисленную по числу видов, составляют облигатно ацидофиль-
ные "истинные” железобактерии, использующие двухвалентное же-
лезо в качестве энергетического материала. Наряду с облигатно
хемолитоавтотрофными в нее входят и литогетеротрофные бактерии
(табл. 20).
Вторую обширную группу составляют микроорганизмы, окисля-
ющие железо и марганец при нейтральной или слабощелочной реак-
ции среды. Представители этой группы широко распространены в во-
доемах, и с их деятельностью связано образование железо-марган-
цевых конкреций в пресноводных и морских водоемах [Dubinina,
1981b].
197
Таблица 20
Облигатно ацидофильные хемолитоавтотрофные и хемолитогетеротротрофные железоокисляющие бактерии
Облигатно ацидофильные железобактерии
Облигатно ацидофильные железобактерии участвуют в окислении
железа в кислых железистых источниках, кислых озерах, встреча-
ющихся в зонах активного вулканизма, но в наибольших масштабах
их деятельность проявляется в рудных месторождениях.
Краткая характеристика ацидофильных железобактерий приведена
в табл. 20.
Оптимальные значения pH для этих организмов находятся ниже
pH 4,5, и составляют, как правило, 2—3. Интересно подчеркнуть,
что, хотя виды Sulfolobus могут развиваться в широких пределах
pH (1—7) при окислении серы, за счет окисления двухвалентного
железа их рост возможен только в кислой среде при pH менее 3,5.
Это связано с особенностями функционирования дыхательной цепи
у видов Sulfolobus при окислении железа.
На примере исследования Т. ferrooxidans установлено, что при окис-
лении железа отсутствует перенос протонов через мембрану, а проис-
ходит только перенос электронов. Градиент Н+ по обе стороны
цитоплазматической мембраны поддерживается как за счет поглоще-
ния протонов из цитоплазмы, так и в результате низкой величины
pH в среде. Синтез АТР происходит за счет движения Н* из внешней
среды в цитоплазму через ATP-синтетазный комплекс. Движущей силой
служит в основном pH. Для синтеза одной молекулы АТР необходимо
окисление по крайней мере двух молекул Fe2+. Образование восста-
новителя у этих бактерий, как известно, происходит в результате
энергозависимого обратного переноса электронов. Активность участка
дыхательной цепи, обеспечивающего обратный перенос электронов,
на порядок ниже активности цитохромного участка, функционирова-
ние которого приводит к получению энергии. Это и определяет низ-
кие биосинтетические возможности и низкий "выход” биомассы. Для
фиксации одной молекулы СОг в цикле Кальвина окисляется более
22 молекул Fe2+.
Из табл. 20 следует, что большинство хемолитоавтотрофных или
хемолитогетеротрофных бактерий, получающих энергию при окислении
железа, обладают способностью наряду с ним использовать и соеди-
нения серы. Исключение составляют лишь Leptospirillum ferrooxi-
dans, узкоспециализированная облигатно хемолитотрофная ацидофиль-
ная железобактерия, и термотолерантные ацидофильные штаммы ТН-1,
ТН-3, не получившие пока видового названия.
Выделение Th. ferrooxidans и L. ferrooxidans. Для выделения и коли-
чественного учета Th. ferrooxidans используют среду Летена [Lean-
then et al., 1951] или среду Сильвермана и Лундгрена 9К.
Среда Летена для Th. ferrooxidans
(NH4)jSO4 0,15 г KHjPO, 0,1г
KC1 0,05 г Ca(NO3)2 0,1г
MgSO4-7HjO 0,5 г Вода дистиллированная 1000 мл
pH 3,5 устанавливают с помощью разбавленной серной кислоты.
К среде добавляют 10 мл 10%-го раствора FeSOr7H2O, подкислен-
199
ного до pH 3, который стерилизуют отдельно в автоклаве при 0,5 атм,
предварительно подкислив его до pH 2,0—2,5.
Выделение Th. ferrooxidans можно проводить на среде Сильвер-
мана и Лундгрена 9К (см. раздел ”Хемолитотрофные сероокисляющие
бактерии”).
Культуру накопления получают путем внесения посевного мате-
риала на среду Летена или 9К. Для выделения чистой культуры Th. fer-
rooxidans из культуры накопления производят посев на агаризован-
ную среду Летена или на гелевые пластинки, пропитанные средой
9К. Мелкие колонии, покрытые окислами железа, пересевают на жид-
кую среду. Проверку чистоты культуры проводят путем микроскопи-
ческого контроля и высевом на среду Летена с добавкой органиче-
ских веществ, на мясо-пептонный бульон и на картофельный агар.
Отсутствие роста указывает на чистоту культуры Th. ferrooxidans.
Рост Th. ferrooxidans и L. ferrooxidans угнетается при использова-
нии неочищенного агара. Для выделения этих организмов рекомен-
дуется использовать марки агара высокой степени очистки, например
фирмы Oxoid, или агарозу. Кроме того, для уменьшения минераль-
ного осадка из состава среды исключают фосфаты.
Среда Харрисона для Th. ferrooxidans [Harrison, 1984]
Раствор 1
(NH«)2SO4 2г MgSO<7H2O 0,25 г
КС! 0,1г Ca(NO3)2 0,01г К2НРО4 0,25 г Вода Ю00 мл дистиллированная pH 2,0—4,0 Раствор 2 Раствор 3 Агароза 8 г FeSO4-H2O 40 г Вода дистилли- 1000 мл Вода дистилли- 1000 мл рованная рованная Готовят смесь расплавленной агарозы и раствора 1 1 в соотно-
шении 1:1, охлаждают до 45°, вносят раствор 3 в конечной концент-
рации 1% FeSO< и разливают среду в чашки Петри, которые хранят
при температуре +10° до посева.
Сверху чашки заливают вторым слоем среды с 0,3% агарозы, в
которую вносят посевной материал. Эту среду готовят непосредствен-
но перед посевом: 60 мг агарозы вносят в 10 мл воды, стерилизу-
ют с 10 мл стерильного раствора 1, вносят 0,5 мл раствора серно-
кислого железа (раствор 3), подогретого до 45°, и 0,1 мл посевного
материала. Далее эту смесь выливают на поверхность приготовленных
предварительно чашек Петри со слоем полутвердой среды (см. выше).
Ярко-оранжевые или желтые колонии появляются после 1—4 нед
и достигают по величине нескольких миллиметров на поверхности
среды, в глубине агара колонии, диаметром 0,1—0,5 мм, — темные
с диффузным краем. Таким способом удается выявить 50—80% общего
количества бактериальных клеток, обнаруживаемых методом прямого
подсчета.
При выделении L. ferrooxidans поступают аналогичным образом,
выявляя микробиологическим путем культуры со спиральной формой
200
клеток. Внесение в среду восстановленной серы в виде цистеина
заметно улучшает рост этих бактерий.
Количественный учет автотрофных железобактерий осуществляют
на тех же средах (9К или Харрисона) методом посева с 10-ными
разведениями.
Более перспективным методом количественного учета служит имму-
нофлуоресцентный анализ с применением специфических иммунных
сывороток (см. раздел "Иммунофлуоресцентный анализ...”).
Методы выделения термофильных ацидофильных железобактерий
описаны в разделе ”Хемолитотрофные сероокисляющие бактерии”
Микроорганизмы, окисляющие железо и марганец
при нейтральной и щелочной реакции среды
Способность к окислению двухвалентных форм железа и марганца с
обложением окислов этих металлов на поверхности клеток широко
распространена среди многих групп прокариотных и эукариотных
микроорганизмов. Наряду с ’’классическими” видами "железобактерий”
из родов Leptothrix, Sphaerotilus, Gallionella, Metallogenium, Ochrobium,
Siderocapsa свойство накопления окислов железа и марганца обнару-
жено у представителей более чем 20 родов грамположительных и
грамотрицательных бактерий. Среди них Seliberia, Spirothrix, Toxothrix,
Hypomicrobium, Pedomicrobium, Siderococcus, Caulococcus, Caulobacter,
Pseudomonas, Aquaspirillum, Proteus, Enterobacter, Aeromonas, Acineto-
bacter, Flavobacterium, Bacillus, Arthrobacter, Nocardia, Streptomyces
и ряд неидентифицированных штаммов Cytophaga. Способность к обра-
зованию ожелезненных чехлов наподобие Leptothrix обнаружена при
росте в микроаэробных условиях у нитчатых фототрофных бактерий
Chloronema, Chloroflexus. Обильное накопление окислов железа проис-
ходит и у одноклеточных фототрофных бактерий Amoebobacter,
Thiocystis. Окисление железа и марганца осуществляется многими вида-
ми цианобактерий и микроскопических водорослей. Из эукариотных
организмов микроскопические грибы многих родов окисляют железо
и марганец. Таким образом, способность к окислению марганца и
железа проявляется у широкого круга гетеротрофных микроорганиз-
мов.
Исследование чистых культур ряда известных железобактерий
привело к пересмотру их таксономического статуса. В настоящее
время установлено, что одна из наиболее многочисленных групп од-
ноклеточных "железобактерий” семейства Siderocapsaceae не пред-
ставляет самостоятельной таксономической ценности. Своеобразные
формы клеток, свойственные представителям рода Siderocapsa и другим
представителям семейства (Siderobacter, Sideronema, Ferribacterium,
Naumanniella), можно наблюдать в культурах разного возрата, у ви-
дов Arthrobacter при определенных условиях культивирования [Du-
binina, Zhdanov, 1975]. В дальнейшем было установлено, что многие
бактерии, имеющие в цикле развития стадию кокковидных клеток
или укороченных палочек, могут имитировать виды Siderocapsa.
К ним относятся Corynebacterium sp., Acinetobacter calcoaceticum,
201
а также Synechocystis ferruginea и ряд неидентифицированных бактерий.
Образование структур, морфологически идентичных различным "видам”
Naumanniella, отмечено в культурах Sphaerotilis natans, Aquaspirillum
metamorphum, A. winogradskii sp. nov., растущих в присутствии в
среде сульфида железа. Накопление окислов железа в чехлах, имити-
рующих Leptothrix ochraceae, свойственно многим бактериям: Spha-
erotilus natans, скользящим фототрофным бактериям Chloronema
gigantea, Chloroflexus, Oscillatoria spp. Приведенных данных достаточ-
но, чтобы показать, с одной стороны, отсутствие таксономической
ценности многих морфбтипов известных железобактерий, а с другой —
чрезвычайно широкое распространение функции окисления марганца
и железа среди микроорганизмов, обладающих разными типами обмена
веществ, что, в свою очередь, предполагает наличие общего неспе-
цифического механизма окислительных реакций.
При исследовании типичных представителей группы железобак-
терий Leptothrix, Metallogemum, Siderocapsa установлено, что окисление
металлов у них не связано с получением энергии.
Механизм накопления окислов металлов у микроорганизмов вклю-
чает процессы как биологической природы (окислительные), так и не-
биологические (сорбционные), которые локализированы в чехлах или
капсулах полисахаридной природы. У мутантов Leptothrix и Sphaero-
tilus, лишенных чехлов, накопления окислов марганца не происходи-
ло. В нейтральной и щелочной среде сорбционные свойства полиа-
нионных компонентов полисахаридного матрикса чехлов и капсул
проявляются наиболее активно. Сама способность микроорганизмов
к биосинтезу внеклеточных капсул полисахаридной природы может
стимулироваться двухвалентными ионами тяжелых металлов, в том
числе марганца и железа. Количество углерода в составе экзопо-
лимеров природной популяции бактерий может быть равным его
содержанию в клетках. Необходимо подчеркнуть важную роль экзо-
полимеров в образовании бактериальных пленок обрастания твердых
субстратов в донных отложениях. Формирование подобных обрастаний
лежит в основе нарастания слоев окислов металлов при образовании
конкреций.
Нижний предел концентраций железа и марганца в природной
воде, при которых возможна их сорбция на поверхности бактериаль-
ных клеток, составляет доли микрограмма на литр, а коэффициент
накопления металлов достигает значений 106—107, что на 2—4 поряд-
ка выше значений, известных для активных химических сорбентов
[Ступакова и др., 1989]. Подробнее вопрос о механизмах сорбцион-
ных и окислительных процессов, приводящих к образованию окислов
железа и марганца микроорганизмами, рассмотрен в обзоре В.В. Ба-
лашовой и Г.А. Дубининой [1989].
В основе биологических процессов окисления сорбированного мар-
ганца и железа лежит перекисный механизм. Он представляет собой
реакции между продуктом метаболизма, Н2О2 и переменно-валентными
^НзОг, каталаза
металлами. Вследствие обратимости реакции Мп у |=±. Мп4+ в
HjOj
202
культурах Leptothrix, Siderocapsa и других наряду с окислением
марганца перекисью при участии каталазы может протекать противо-
положная реакция — восстановления МпОг, т.е. избыток НгОг при-
водит к растворению образовавшихся окислов [Дубинина, 1978а].
В итоге направленность процессов взаимодействия Н2О2 с соедине-
ниями марганца и конечные продукты реакции определяются скоростью
образования Н2О2 при дыхании и активностью каталазы. Эти
факторы контролируются прежде всего концентрацией органического
вещества, а также физиологическим состоянием культуры бактерий.
Поскольку в реакции окисления марганца необходимо участие не-
скольких компонентов (Мп2+, каталазы, Н2О2), оно нередко проявляется
в ассоциациях двух микроорганизмов, один из которых обладает ак-
тивной каталазой, другой продуцирует Н2О2.
Физиологический смысл указанных "выше реакций заключается в
детоксикации вредного продукта метаболизма. Это определяет разви-
тие железо- и марганецокисляющих бактерий в особых экологических
нишах, где присутствуют восстановленные соединения этих металлов.
Вполне очевидно, что участие в окислительных реакциях такого
продукта метаболизма, как Н2О2, образующаяся в целом ряде биоло-
гических реакций, объясняет широкое распространение в различных
биотопах микроорганизмов, способных окислять марганец и железо.
Согласно имеющимся данным, численность этих организмов в водое-
мах может достигать 70—90% общего содержания бактериопланктона
в определенных биологических нишах, в среднем составляя 7—12%
[Горленко и др., 1977; Dubinina, 1981]. Это позволяет понять огром-
ные масштабы их геохимической деятельности в круговороте этих
элементов и в процессах рудообразования в водоемах.
Методы выделения и количественного учета марганец-
и железоокисляющих микроорганизмов
Из приведенных выше данных следует, что железо- и марганец-
окисляющие бактерии не представляют собой специализированную
физиологическую группу. Сам процесс окисления марганца и железа
включает неспецифические, хотя и физиологические значимые реак-
ции взаимодействия ионов переменно-валентных металлов с токсич-
ными продуктами метаболизма. Неспецифичность реакций приводит
к выводу о нецелесообразности изучения конкретного видового сос-
тава' бактерий, участвующих в данных окислительных реакциях в во-
доеме, поскольку их протекание определяется специфичностью эко-
логических условий, а не участием специализированных видов орга-
низмов. Это положение иллюстрируют данные об обратимости реак-
ции окисления марганца в зависимости от концентрации органиче-
ского вещества в среде [Дубинина, 1978], а также о наличии ассоциа-
тивных процессов окисления марганца. Количественные оценки вклада
микроорганизмов в окислительные процессы круговорота марганца
могут быть получены путем прямого микроскопического учета числен-
ности микроорганизмов, осаждающих окислы металлов на поверхности
клеток, с одновременным количественным определением окисленных
203
форм металлов, сконцентрированных на клетках. Анализы показали,
что в водной толще пресных водоемов практически весь окисленный
марганец во взвеси сосредоточен на бактериальных клетках [Dubi-
nina, 1981b].
Другой подход к изучению роли микроорганизмов в окислении
железа и марганца заключается в моделировании природных процес-
сов, протекающих в водоемах, с использованием природных сред
за счет естественных микробиальных сообществ. Для целей разгра-
ничения биологических и химических процессов целесообразно исполь-
зование ингибиторного анализа (см. раздел ’’Применение ингибитор-
ного анализа...”).
Выделение железо- и марганецокисляющих микроорганизмов. Необ-
ходимое условие для выявления способности к окислению марганца
у гетеротрофных микроорганизмов состоит в использовании питатель-
ных сред, содержащих незначительные количества органических ве-
ществ, используемых в энергетическом обмене. Это связано с гем,
что при повышении концентрации веществ преобладают процессы
восстановления образующихся окислов марганца, отчасти железа под
действием продуктов метаболизма, обладающих восстановительными
свойствами в отношении окислов металлов. Второе условие — наличие
небольших концентраций в среде ионных форм железа или марганца.
Это достигается введением в среду либо малорастворимых и ш комп-
лексоорганических соединений металлов, либо небольших ’.оличеств
сернокислого марганца.
Необходимо иметь в виду, что большинство питательных сред,
применяемых для выделения и культивирования многих марганец- и же-
лезоокисляющих организмов, не являются элективными для отдель-
ных ее представителей. Как правило, на одних и тех же средах из
проб природного материала вырастают колонии олиготрофных марга-
нецокисляющих организмов, принадлежащих к различным таксоно-
мическим группам. Вместе с тем для выделения некоторых предста-
вителей этой группы разработаны специальные методы культивирова-
ния с учетом своеобразия их физиологических потребностей. Многие
известные по морфологическим описаниям микроорганизмы, накапли-
вающие на поверхности клеток окислы железа или марганца, до сих
пор не удается культивировать на питательных средах. Среди них —
Ochrobium tectum, Crenothrix polyspora, Siderococcus, Caulococcus,
Toxothrix, Spirothrix и др.
Рост железобактерий на приводимых ниже средах сопровождается
накоплением желто-оранжевых окислов железа или бурых окислов
марганца. Слабое накопление в колониях окислов марганца или же-
леза удается выявить только с помощью их окрашивания растворами
бензидина или желтой кровяной соли соответственно (см. с. 208).
Модифицированная среда Тилера для выделения
Hyphomicrobium [Tyler, Marshall, 7967]
Дрожжевой экстракт Дифко 0,02 г Агар Дифко 15 г
MnSOrSHiO 0,02 г Вода дистиллированная 1000 мл
Лимоннокислое железо 0,002 г
204
Помимо Hyphomicrobium, среда может служить для выделения
и культивирования многих одноклеточных бактерий, окисляющих
марганец, — Arthrobacter, Pseudomonas, Acinetobacter и др.
Среда для выделения и количественного учета
одноклеточных марганецокисляющих бактерий
[Krumbein, 1971]
Пептон 2 г
Дрожжевой экстракт Дифко 0.5 г
MnSO4-4H2O 0,2 г
FeSOr7H2O 0,001 г
Вода дистилли- 1000 мл
рованная
Для выделения фракции марганецокисляющих бактерий из общего
числа выросших на чашках колоний на поверхность среды наносят
тонкий слой подкисленного раствора бербелина голубого или бен-
зидина уксуснокислого. В обоих случаях колонии, содержащие окис-
лы марганца, окрашиваются в синий цвет.
Для количественного учета марганецокисляющих бактерий в со-
лоноватых или морских водоемах дистиллированную воду разбавляют
морской в соотношении 3:1.
Среда для выделения Sphaerotilus natans
[Ambruster, 1969]
Лактат натрия
NaH«CJ
КН2РО<
К2НРО4
Na2HPO4 7НгО
100 мг
1,7 мг
8,5 г
21.5 мг
34,4 мг
MgSO4'7H20
СаСЬ
РеСЬ-бНгО
Вода дистилли-
рованная
22.5 мг
27,5 мг
0,25 мг
1000 мл
Лактат стерилизуют отдельно в виде 10%-го раствора и вносят
в среду перед посевом; pH доводят до 7,2. Накопительные культуры
получают путем заражения среды, разлитой в колбы по 25 мл. Sphaeroti-
lus в виде слизистой пленки на поверхности среды появляется
через 2—5 сут. Выделение чистой культуры проводят на агаровых
средах того же состава.
Среда для выделения Leptothrix
[Савельева, 1965]
Сенной отвар 50 мл
Природная вода 200 мл
Вода водопроводная 750 мл
Агар Дифко 8 или 4 г
Дрожжевой автолизат. 0.1 мл
10%-й раствор
В12 0.002 г
МпСОз, суспензия 1 г
Каждый из компонентов среды стерилизуют по отдельности, смеши-
вая перед посевом с расплавленным агаром
Сенной отвар готовят следующим образом. 5 г сена кипятят
5 мин в 1 л дистиллированной воды, сливают, на ночь заливают
новой порцией воды. На следующий день сливают настой, заливают
снова водой и кипятят 5 мин. После охлаждения pH второго отва-
ра доводят до 7,0—7,5 щелочью и стерилизуют. В чашки наливают
два слоя среды: нижний — с 0,8% агара, верхний — содержащий 0,4%
агара, в который вносят посевной материал. Последний наливают
205
тонким слоем. Рост Leptothrix в виде бурых колоний появляется
через 2—3 сут. Их отсевают на скошенный агар того же состава.
Среда для культивирования Leptothrix-Sphaerotilus
[Van Veen, 1973}
КН2РО4 27 мг Глюкоза 100 мг
KjHPO4 40 мг Bi2 5 мкг
MgSO<7H2O 15 мг Тиамин 50 мкг
CaClr2H2O 50 мг Биотин 10 мкг
FeCh-6H2O 5 мкг МпСОз 1—2 г
Вода дистиллиро- 1000 мл или железо аммо- 100 мг
ванная нийное лимонно-
кислое
За исключением первых трех солей, остальные компоненты вно-
сят по отдельности в виде стерильных растворов перед посевом,
pH устанавливают 7,2.
Культивирование микоплазм, окисляющих железо и марганец.
Интерес к этой группе микроорганизмов определяется не только
широким распространением в природе и важной ролью в биогеохимии
марганца и железа, но и в значительной степени наличием биологи-
ческих особенностей, позволяющих рассматривать их как своеобраз-
ную группу свободноживущих микоплазм.
Эта группа объединяет представителей родов Metallogenium, Gal-
lionella, Siderococcus.
Более полно Metallogenium исследован Б.В. Перфильевым и Д.Р. Га-
бе [1961]. Он обнаружил этот марганецокисляющий организм в Карель-
ских озерах и исследовал сложный цикл его развития в образцах
природного материала при помощи капиллярной техники. Рост в бинар-
ной культуре с несовершенным грибом был получен Г.А. Заварзиным
[19616] на простой по составу питательной среде с ацетатом или
карбонатом марганца.
Применение питательных сред и методов культивирования мико-
плазм для изучения представителей этой группы организмов — Metal-
logenium и Gallionella — привело к обнаружению значительного
сходства их строения с типичными микоплазмами [Дубинина, 1969;
Балашова, 1974]. При дальнейшем изучении стабильной чистой культуры
Metallogenium удалось подтвердить сходство его ультраструктурной
организации с микоплазмами [Балашова, Дубинина, 1989а].
Важной биологической особенностью Metallogenium является его спо-
собность к паразитизму на низших эукариотных и прокариотных
микроорганизмах [Dubinina, 1984]. Степень ингибирующего воздейст-
вия на клетки хозяина определяется условиями культивирования и
наиболее отчетливо проявляется в условиях недостатка питания.
Можно полагать, что при наличии олиготрофных условий в природе
Metallogenium может существовать за счет паразитизма на различ-
ных низших гидробионтах. На вероятность подобного заключения
указывает ряд наблюдений в пресных водоемах [Heat, Unestam,
1974]. В то же время при поступлении достаточных количеств
питательных веществ в природных сообществах развитие Metalloge-
nium возможно без проявления паразитизма.
206
Среда для получения бинарной культуры Metallogenium
[Заварзин, 1961]
Ацетат марганца 0,1 г
Агар Дифко 15 г
Вода водопроводная 1000 мл
На поверхность застывшей среды, разлитой в чашки Петри, поме-
щают каплю посевного материала и размазывают шпателем. На этой
среде рост Metallogenium в виде точечных или диффузных бурых
пятен чаще всего появляется в зонах роста колоний микроскопиче-
ских грибов. При просмотре таких колоний под микроскопом видно,
как мелкие темно-коричневые колонии Metallogenium размером 0,1 —
0,5 мм располагаются между грибными гифами. Эти колонии состоят
из нитевидных структур, или ”паучков”, характерных для Metallo-
genium [Перфильев, Габе, 1961]. Бинарные культуры Metallogenium
с грибом в дальнейшем поддерживают в жидкой среде с карбонатом
марганца.
Среда для культивирования бинарной культуры Metallogenium
[Заварзин, 1961]
Крахмал гидролиэованный 1 г
MnCOj (в суспензии) 1 г
Вода дистиллированная 1000 мл
При развитии Metallogenium жидкая среда приобретает коричневый
цвет вследствие обильного накопления четырехвалентного марган-
ца. Последний может быть представлен как аморфными окислами,
так и марганцевыми минералами вернадитом, бернесситом или мине-
ралами группы асболан—бузерита в зависимости от скорости окисли-
тельных реакций и условий их образования.
Полученную бинарную структуру используют для выделения чистой
культуры Metallogenium.
Среда для выделения чистой культуры
Крахмал гидролизованный 1 г
Дрожжевой экстракт све- 10 мл
жеприготовленный
МпСОз, суспензия 2 г
Фракция сыворотки Дифко I мл
Каталаза 2 мг
Вода дистиллированная 1000 мл
Необходимо указать на трудность поддержания чистой культуры
Metallogenium, что, возможно, связано с низкой концентрацией необ-
ходимых компонентов питания или факторов роста.
Среда для получения культуры накопления Gallionella
NH4CI
К2НРО4
MgSO- 7Н2О
[Kucera, Wolfe, 1957]
1 г CaCh-бНгО 0,1 г
0,5 г FeS, суспензия — в избытке
0,2 г Дистиллированная вода — 1000 мл
Железо добавляют в виде суспензии сернистого железа, которое
разбалтывают в расплавленном 1,5%-м растворе агара и вносят на
дно пробирки. После того как агар застынет, стерильную жидкую
среду наливают слоем 5—7 см поверх агара и через нее пропускают
207
ток углекислоты. Для успешного развития микроорганизма большое
значение имеет продувание среды углекислотой. Последнее приводит
к частичному разложению сульфида железа и к снижению содержания
кислорода в среде. В подготовленную среду вносят железистый оса-
док, в котором микроскопически обнаружена Gallionella. pH доводят до
7,2. Сернистое железо получают, как описано в разделе ’’Бесцвет-
ные серобактерии”.
Рост Gallionella с бактериальным спутником проявляется в виде
охристого налета на стенках пробирки в микроаэробной зоне,
где для них создается оптимальная концентрация железа и кисло-
рода.
Siderococcus, подобно Gallionella, характеризуется способностью
окислять железо, но в отличие от последней относится к микро-
аэрофилам. В средах с сывороткой по характеру роста и морфо-
логии у него появляется большое сходство с Gallionella [Балашова,
1974]. Основные структурные единицы составляют округлые тела и
нитевидные придатки, покрытые окислами железа. Аналогичные мор-
фологические структуры обнаружены в местах его скопления в естест-
венной обстановке.
Методы культивирования Gallionella и Siderococcus на средах для
микоплазм изложены в монографии В.В. Балашовой [1974].
Способность к отложению окислов железа на поверхности цито-
плазматической мембраны свойственна представителям не только сап-
рофитных, но и патогенных микоплазм. Так, коллекционная культура
Acholeplasma laidlawii на среде с двухвалентным железом проявля-
ла способность к окислению железа [Балашова, Заварзин, 1972]. На-
копление окислов происходило на поверхности структур A. laidlawii,
морфологически неотличимых от Siderococcus.
Количественный учет железо- и марганецокисляющих микроорга-
низмов на мембранных фильтрах. Для выявления на фильтрах железо-
окисляющих бактерий используют цитохимические методы окраски
Fe3+ с применением желтой кровяной соли, для марганецокисляющих
микроорганизмов используют бензидиновый тест.
1. Определение численности железоокисляющих микроорганизмов.
1. Пробы воды объемом 5-20 мл фильтруют через мембранные
фильтры фирмы "Синпор” с диаметром пор 0,2 мкм (не ядерные).
2. Фильтры помещают на поверхность 5%-го раствора желтой
кровяной соли (КзРе(СЫ)б) на 2-3 мин.
3. Не промывая, фильтры переносят на 1—2 мин в 1%-й раствор
соляной кислоты.
4. После промывания в дистиллированной воде фильтры окраши-
вают 5%-м эритрозином в 5%-м карболовом растворе. После отмыва-
ния избытка красителя фильтры высушивают и просматривают с мас-
ляной иммерсией.
Клетки железобактерий окрашиваются в красный цвет, капсулы
и чехлы, в которых накапливается окисное железо, — в голубой.
Своеобразие морфологии некоторых видов (Metallogenium, Ochrobium,
нитчатых форм) позволяет далее подсчитать их количество в пробах.
Для количественного определения содержания окислов железа
208
на бактериальных клетках из той же пробы воды в зависимости
от содержания железа отфильтровывают определенный объем воды
(100—1000 мл) через ядерный фильтр с диаметром пор не менее
0,5 мкм. Далее окисное железо определяют количественно общепри-
нятыми в гидрохимии методами. При фильтрации пробы воды фрак-
ция коллоидного железа не задерживается на фильтре и поступает
в фильтрат. Зная численность железобактерий и содержание Fe3+
в пробе, можно рассчитать, сколько железа накапливает в среднем
каждая клетка.
В последнее время появилась возможность определять количест-
венно содержание железа, марганца (и других тяжелых металлов)
на единичных клетках бактерий в пробах природного материала. Для
этих целей используют высокочувствительный микрозондовый рентге-
новский анализатор в сочетании с методами сканирующей микроско-
пии. Применение данного метода позволяет надежно оценить роль
бактериопланктона в накоплении тяжелых металлов во взвеси.
П. Определение численности марганецокисляющих бактерий. Фильтр,
через который пропущен определенный объем воды, сначала окраши-
вают эритрозином. После высушивания его помещают на поверх-
ность фильтровальной бумаги, погруженной в бензол. Вынимают фильтр
из раствора, на невысохшую поверхность быстро приливают раствор
бензидина и через 2—3 с удаляют его фильтровальной бумагой. Капсулы
клеток, содержащие окислы марганца, окрашиваются в синий или
фиолетовый цвет. Раствор бензидина для окрашивания фильтров гото-
вят, растворяя 1 г солянокислого или уксуснокислого бензидина в
10 мл 50%-й уксусной кислоты, и доводят объем до 100 мл дистилли-
рованной водой.
14. Зак. 1766
Часть Ш
Определение интенсивности
микробиологических процессов
ПРИМЕНЕНИЕ ИНГИБИТОРНОГО АНАЛИЗА
ДЛЯ ИЗУЧЕНИЯ ИНТЕНСИВНОСТИ
МИКРОБИОЛОГИЧЕСКИХ ПРОЦЕССОВ
В ПРИРОДНЫХ СРЕДАХ
При проведении полевых исследований нередко трудно или не-
возможно вычленить исследуемый биологический процесс или оценить
его сравнительную активность на фоне процесса химической при-
роды.
Для разграничения процессов различной природы в ряде случа-
ев проводят ингибиторный анализ с применением веществ, обладаю-
щих биоцидным действием или определенной специфичностью в отно-
шении конкретных биологических реакций. Следует иметь в виду,
что эффективность и специфичность действия ингибиторов может
зависеть от многих факторов: видовой специфичности возбудителей
процесса, их метаболической активности, протекания процессов проти-
воположного характера, адсорбции на частицах твердой фазы и
стабильности в среде, взаимодействия с химическими компонентами
среды и т.д. Поэтому при проведении ингибиторного анализа в по-
левых исследованиях следует тщательно учитывать конкретные усло-
вия проведения экспериментов. Так, во многих случаях формальде-
гид или сулема — общие ингибиторы роста и метаболизма — могут
быть использованы для подавления процессов биологической при-
роды. Однако не рекомендуется применять эти вещества при изуче-
нии превращений соединений серы или железа, с которыми они
вступают в химические взаимодействия. Более детально вопросы,
связанные с использованием специфических ингибиторов для изучения
активности ряда микробиологических процессов в природе, обсужда-
ются в обзоре Оремланда и Капоне [Oremland, Capone, 1988).
Перечень наиболее известных ингибиторов микробиологических
процессов приведен в табл. 21. Он включает биоциды и ингиби-
торы широкого спектра действия (тяжелые металлы, дыхатель-
ные яды), общие ингибиторы роста и метаболизма (смесь антибио-
тиков и других ингибиторов), специфические ингибиторы энергети-
ческого метаболизма (разобщители, специфические ингибиторы дыха-
тельных ферментов и др.). Помимо перечисленных в таблице, из-
210
Таблица 21
Биоциды и ингибиторы, используемые геомикробиологическнх
и экологических исследованиях
Ингибирующий фактор Конечная концентрация илн доза Ингибируемый процесс или ха- рактер воздей- ствия Чувствительные микроорга- низмы Устойчивые микроорга- низмы
1 - 2 3 4 5
Би Формальдегид Хлороформ Мертиолат натри» Сулема (HgCh) оциды и бактери 4% 5% 100 мг/л 100 мг/л эстатики широко Биоцидстеркли- эующий эффект Бактериостати- ческий эффект То же Биоцид — связы- вает тиоловые группировки белков и фермен- тов го спектра дейсп Эукариоты и прокариоты То же вия
Прогревание 100°. 3 мин 115°, 0,5 атм избыточного давления Стерилизующий эффе кт Вегетативные клетки Вегетативные клетки и споры Споры
у-Об лучение 0,1 Мрад 0,5 Мрад 1—2 Мрад То же Эукариотные ми кроорган измы Вегетативные клетки , Вегетативные клетки и споры Прокариоты Споры
NaCl 5-10% Бактерицидное и и бактериостати- ческое действие Эукариоты прокариоты Умеренные и экстремальные галофилы
Антибиотики (ингибиторы роста)*
Хлорамфеникол 100 мг/л Частичное или полное ингиби- Бактерии Эукариоты
Ванкомицин 100—200 мг/л рование синтеза бел ка Синтез клеточной и
Пенициллин 1 мг/л стенки То же и
Бензилпенициллин 100 мг/л Клеточное де- •»
Ванкомицин + 200 мг/л ♦ 1 мг/л ление Синтез белка и
пенициллин Циклогексимид 100—200 мг/л клеточной стенки Синтез белка Эукариоты Прокариоты
Колхицин 100 мг/л •*
Колхицин * бен- зилпенициллин 200 мг/л * * 100 мг/л Эукариоты и бактерии
"Специфические" ингибиторы энергетического метаболизма*
KCN 10 мМ Терминальные Прокариоты и
NaNj 10 мМ оксидазы дыха- эукариоты
тельной цепи
211
Таблица 21 (окончание)
1 1 2 3 4 1 5
со 1—2 мМ 1 1
Диурон 10 мМ Фотосистема II Оксигенные фо- Прокариотные
оксигенного фо- тотрофы, эу- и аноксигенные
тосинтеэа прокариоты фототрофы
NHxMoO« 20 мМ Сульфатредук- Сульфатредук-
ция (разобщение торы морских
энергетического метаболизма на местообитаний
уровне АТР-суль- фурилазы)
2 мМ То же Сульфатредук- торы пресновод- ных местообита- ний
2-Бромэтансуль- фоновая кислота (BES) (субстратный 70 мМ Метаногенез Метаногены
аналог коэкзи-
ма М) CH2CI2 15,8 мМ И
Хлороформ (CCh) 2 мМ
Ацетилен 0,1 атм Азотфиксация, Денитрифика-
денитрификация торы, аэробные анаэробные азотфиксаторы и
Сульфид натрия 0,3 мМ Денитрификация Денитрифика- торы
Нитрапирин 10—100 мг/л I фаза нитрифи- Нитрифи каторы Большинство
(N-serve; ингиби- кации I фазы гетеротрофных
тор аммонийок- сидазы) нитрификаторов
Хлораты 10 мкМ II фаза нитрифи- Нитрификаторы То же
кации II фазы
* По: [Oremland, Capone, 1988].
вестей ряд специфических ингибиторов, применение которых весьма
перспективно в геомикробиологических и экологических исследова-
ниях. Из них следует упомянуть глицеральдегид и 4С-карбоксипен-
тиолбифосфат. Первый ингибирует регенерацию рибулозодифосфата
в цикле Кальвина—Бенсона и вследствие этого может быть исполь-
зован для блокирования ключевого фермента автотрофной фикса-
ции СО2 — рибулозодифосфаткарбоксилазы. Второй является суб-
стратным аналогом рибулозодифосфата и необратимо связывает
карбоксилирующий фермент — рибулозодифосфаткарбоксилазу [Yoko-
ta, Canvin, 1985]. Однако методы использования указанных выше
ингибиторов автотрофной фиксации углекислоты для полевых иссле-
дований пока не разработаны.
212
Примеры использования некоторых специфических ингибиторов
для определения интенсивности микробиологических процессов в
природных средах приведены далее в соответствующих разделах
данной книги.
ОПРЕДЕЛЕНИЕ ПРОДУКЦИИ И ДЕСТРУКЦИИ
ОРГАНИЧЕСКОГО ВЕЩЕСТВА В ВОДОЕМАХ
Основным первоисточником образования органического вещества
в водоемах служит фотосинтетическая деятельность фитопланктона
и других водорослей.
На одну молекулу потребленной углекислоты выделяется одна
молекула кислорода:
О
СО2 + Н2О - Н—С—ОН + 02.
1 г освобожденного кислорода соответствует 0,93 г синтезирован-
ного углевода, при этом потребляется 14,65 кДж солнечной
энергии. Таким образом по выделению свободного кислорода можно
судить о количестве образовавшегося органического вещества. В связи
с этим эквивалентное количество вещества и энергии по приведен-
ному уравнению можно определить, пользуясь табл. 22 [Винберг,
1960].
Следует отметить, что в естественных условиях, когда на 1 моль
СОг выделяется 1 моль Ог, ассимиляционный коэффициент (АК),
О2/СО2 = 1, наблюдается только при синтезе углеводов. Наи-
более вероятным значением среднего АК в природных условиях сле-
дует считать 1,25. Соответственно этому обратная величина, ды-
хательный коэффициент (ДК), СО2/О2 = 1, в природе будет равняться
не единице, а 0,8.
Другой метод определения интенсивности процесса образования
органического вещества в процессе фотосинтеза заключается в том,
Таблица 22
Соотношение между величинами Ог, СОг и энергией
в процессе фотосинтеза и деструкции
прн АК и ДК, равных 1
О2 СО2 С, мг Глю- коза, мг Энер- гия, кДж
мг 1 мл мг мл
1 МГ Ог 0,6997 1,375** 0,6997** 0,3750** 0,9375 14,672
1 МЛ Ог 1,4292 1,9652** 1,0000** 0,5359** 1,3399 20,94
1 мг СО2 0,7273* 0,5089 — 0,5089 0,2727 0,6818 11,65
1 МЛ СОг 1,4292* 1,0000* 1,9652 — 0,5359 1,3399 20,94
I мг С 2,6667* 1,8660* 3,6667 1,8660 — 2,5 39,12
Примечание. Если ДК и АК н равны 1, то величину со значком*
следует умножить на АК или разделить на ДК, а величину со значком** — разделить
на АК или умножить на ДК.
213
что в испытуемый образец воды вводят некоторое количество угле-
кислоты, содержащей радиоактивный углерод ”с, тогда в процессе
фотосинтеза образуется радиоактивное органическое вещество, ко-
торое легко обнаруживается при помощи сцинтилляционного счет-
чика.
Радиоизотопный метод более удобен и обладает высокой чувст-
вительностью, что позволяет производить анализы в бедных водое-
мах и на таких глубинах, где первичная продукция органического
вещества слишком мала и не определяется кислородным методом.
Однако он не учитывает органические вещества, выделяющиеся из
клеток при фотосинтезе (внеклеточные продукты фотосинтеза).
ОПРЕДЕЛЕНИЕ ПРОДУКЦИИ И ДЕСТРУКЦИИ
ОРГАНИЧЕСКОГО ВЕЩЕСТВА
КИСЛОРОДНЫМ МЕТОДОМ ВИНБЕРГА
Г.Г. Винберг в 1934—1939 гг. предложил определять скорость
образования и деструкции органического вещества по изменению
содержания кислорода в замкнутом объеме воды, помещенном в ус-
ловия, максимально приближающиеся к естественным.
Разность между содержанием кислорода в исходной воде в мо-
мент заполнения затемненных склянок и его содержанием по истече-
нии суток в склянке соответствует потреблению кислорода на окис-
ление органического вещества и составляет деструкцию.
Разность между содержанием кислорода в светлой и затемнен-
ной склянках после суточной экспозиции в озере служит для
расчета валовой величины фотосинтеза фитопланктона.
Установка со склянками в озере изображена на рис. 24.
Наибольшую ценность для сравнения степени. трофии различных
водоемов имеют данные, получаемые при установке склянок у самой
поверхности, так как на других горизонтах интенсивность фотосин-
теза ограничена проникновением света.
Оборудование. Склянки объемом 120—160 мл обязательно должны
быть из белого стекла с притертыми пробками. Для определения
величины деструкции можно пользоваться такими же склянками,
но обязательно завертывать их в двойной слой черной клеенки.
Укреплять склянки в водоеме можно, подвешивая их к заблаго-
временно прикрепленным в нужных местах троса кольцам, а также
с помощью заранее прикрепленных к склянкам проволочных крюч-
ков. Процедуру подвешивания склянок необходимо вести быстро
и надежно.
Определение содержания растворенного в воде кислорода про-
водят методом Винклера (см. прил.). При указанном объеме склянок
достаточно при фиксации кислорода добавлять по 0,5 мл щелочного
раствора йодистого калия и хлористого марганца. После осаждения
осадка, растворения его кислотой и выделения йода удобно для
титрования гипосульфитом брать не весь объем, а 50 или 100 мл
раствора. При колебании объема склянок от 120 до 140 мл ошибка
титрования из-за разности объемов не превышает 0,25%.
Работа на водоеме. Заранее следует подготовить установку для
214
Рис. 24. Схема постановки опыта для определения интенсивности фотосинтеза фито-
планктона и деструкции органического вещества в водоемах
Рис. 25. Распределение интенсивности фотосинтеза и дыхания по глубине
1 — в затемненных склянках; 2 — в светлых склянках; по оси абсцисс _____ раз-
ность содержания Оз до и после экспозиции склянок, мг/(л сут); по оси ординат —
глубина, м; исходное содержание Оз в момент погружения склянок на графике принято
за ноль
подвешивания светлых и темных склянок в водоеме. Склянки нужно
надписать эмалевой краской. Группы по три склянки, предназна-
ченные для заполнения из одного батометра, должны иметь один
номер. В этой группе одна склянка служит для определения на-
чального содержания кислорода, две другие (светлую и темную)
устанавливают в водоеме. Следует внимательно следить, чтобы
при заполнении склянок водой под пробкой не оставалось пузырь-
ков воздуха.
Последовательность операций приводится ниже.
1. Воду из озера берут батометром Руттнера, из одного бато-
метра заполняют три склянки — две светлые и одну темную. В одну
из светлых склянок добавляют реактивы для фиксации кислорода.
Светлую и темную склянки прикрепляют к тросу для погружения
их в водоем, защищая от прямых солнечных лучей в момент поста-
новки опыта.
2. Первый батометр для заполнения склянок отбирают из по-
верхностного слоя воды. Далее отбор проб воды производят по
вертикали через 0,5 м с различных глубин, начиная от поверх-
ности до глубины утроенной прозрачности воды по диску Секки. и
помещаю! на ту же глубину, с которой была взята вода для анализа.
Если прозрачность по диску более 3 м, то склянки можно ставить
и через I м, а в зоне температурного скачка и на границе
проникновения света — на более близком расстоянии, так как на
215
этих глубинах может сильно увеличиваться деструкция органического
вещества.
3. Когда все склянки заполнены, тросик со склянками подве-
шивают к буйку и оставляют в водоеме на 1 сут.
4. Через 24 ч установку вынимают и тотчас во всех склянках
фиксируют кислород добавлением растворов MnCh и KI.
Вычисление величины продукции и деструкции органического
вещества в водоеме. Предположим, что исходное содержание кисло-
рода в воде было 10,17 мг/л и упало в темной склянке до 9,57 мг/л,
а в светлой поднялось до 14,18 мг/л. Отсюда значение величины
потребления кислорода на дыхание фитопланктона и бактерий, или
деструкция органического вещества, составляет 10,17—9,57 = 0,6 мг/л.
Валовая продукция органического вещества равна 14,18-9,57 = 4,61
мг/л. Следовательно, значение чистой суточной продукции органи-
ческого вещества, выраженное в кислороде, будет равняться 4,61—0,6 =
4,01 мг/л, что, согласно табл. 24, равно 1,5 мг С на 1 л воды.
Подобным образом рассматривается продукция и деструкция для
всех горизонтов {рис. 25). Расстояние между кривыми 1 и 2
соответствует значению суточной интенсивности фотосинтеза на дан-
ной глубине, а площадь, заключенная между ними, соответствует
общей сумме кислорода, выделенного во всем столбе воды (валовая
продукция в миллиграммах Ог). Площадь между кривыми может
быть определена планиметром или путем взвешивания на аналити-
ческих весах площади, вырезанной из графика.
Если содержание кислорода откладывают в г/м3, то продукцию
и деструкцию органического вещества определяют по площади между
кривыми в граммах Ог на I м2 площади водоема за 1 сут.
Чтобы перейти от содержания кислорода к содержанию органи-
ческого вещества, нужно полученное значение умножить на 0,93, а при
переходе на углерод — на 0,37 (см. табл. 22).
Расчет первичной продукции можно производить также расчетным
методом с использованием следующих формул.
1. Валовая продукция Pg, Ог мг/л-ч:
2. Чистая продукция PN, Ог мг/л-ч:
К - V"
р _ к с * т
rN -----------
t
3. Деструкция Р,0г мг/л-ч:
D =
t
Здесь — начальное содержание Ог в склянке перед экспонированием;
Vc — содержание Ог в светлой склянке после экспонирования; И, — со-
держание Ог в темной склянке после экспонирования; г — время
экспонирования склянок, ч.
216
Путем пересчета с использованием табл. 22 величины продукции
и деструкции можно выразить в единицах мг/м3-сут, мг/м’-ч в расчете
на кислород, Сорг и т.д.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ФОТОСИНТЕЗА ФИТОПЛАНКТОНА
РАДИОИЗОТОПНЫМ МЕТОДОМ
При работе с радиоактивными веществами необходимо соблю-
дать ряд правил техники безопасности, краткое описание которых
приведено в приложении.
Сущность данного метода определения интенсивности фотосинтеза
фитопланктона с применением 14С заключается в том, что в пробу
воды из водоема добавляют радиоактивный углерод 14С в составе
ЫаН14СОз и затем ее экспонируют в водоеме или на палубе суд-
на при естественном освещении в течение суток. Водоросли фикси-
руют формалином, пробу профильтровывают через мембранный фильтр
с диаметром пор около 1 мкм. Радиоактивность водорослей на фильт-
ре определяют под торцовым счетчиком Гейгера или под сцинтил-
ляционным счетчиком и по этой величине производят расчет интен-
сивности фотосинтеза в воде [Steeman-Nielsen, 1952].
Для расчета продукции водорослей под 1 м2 водоема необходимо
определить три величины: интенсивность фотосинтеза в поверхно-
стной пробе воды, распределение водорослей в трофогенном слое
воды и изменение интенсивности фотосинтеза в толще воды в зави-
симости от проникновения в нее солнечной радиации.
Приводимая модификация метода для расчета продукции под
1 м2 разработана Ю.И. Сорокиным [1959а] и модифицирована В.И. Ро-
маненко [1971а] и В.И. Романенко и С.И. Кузнецовым [1974].
Приготовление рабочего раствора Na214COj. Фабричный препарат
NaC214Oj или ЫаН14СОз растворяют в 50 мл свежекипяченой охлаж-
денной дистиллированной воды, подщелоченной до pH 8,5—9,0. Полу-
ченный раствор освобождают ог радиоактивных бактериальных тел
и других взвешенных частиц путем фильтрования через прокипячен-
ный мембранный фильтр. Затем этот раствор разбавляют свежеотогнан-
ной дистиллированной водой, в которую в качестве "носителя” было
добавлено 10 мг/л углекислого натрия. Активность 1 мл рабочего
раствора при работе на олиготрофных озерах должна быть равной
под счетчиком (5—10)' 106 имп./мин (5—10 мкКи), для мезотрофных —
(3—5)’10б имп./мин и для евтрофных водоемов — (1—3)-10б имп./мин
(1—3 мкКи).
После определения активности рабочий раствор разливают с по-
мощью шприца в ампулы по 5—10 мл и запаивают. Стерилизацию
раствора производят, нагревая ампулы в водяной бане до 100° 3 дня
подряд по 1 ч. В ампулах из невыщелачивающегося стекла препарат
может храниться несколько лет. Ампулы должны быть изготовлены
из мягкого стекла с толстыми стенками. Количество раствора изо-
топа не должно превышать половины их объема. Радиоактивность
рабочего раствора №г14СОз или МаН|4СОз определяют на сцинтил-
ляционном счетчике после внесения его в специальные флаконы вместе
217
с сцинтилляционной жидкостью и выражают в импульсах в 1 мин.
В работе используются флаконы для сцинтилляционного счета завод-
ского производства, изготовленные из специального боросиликатного
стекла, содержащего минимальные количества естественной актив-
ности и калия, или из полиэтилена.
Определение суточного фотосинтеза
в поверхностной пробе воды
изотопным методом
1. Пробы воды отбирают из поверхностного слоя батометром
Руттнера. В четыре склянки объемом 250 мл из белого стекла вно-
сят по 200 мл воды. В три из них пипеткой со шприцем вносят
по 1 мл радиоактивного карбоната натрия (Na?СОз) в 0,001 N раст-
воре NaOH с удельной радиоактивностью около.. 1 мкКи (или 0,1 —
1-106 имп./(мин-мл, учитываемых под торцовым счетчиком, коэффи-
циент которого около 7). Две из трех склянок инкубируют на свету,
а третью помещают в темный мешок для определения темновой
фиксации углекислоты. Результаты этого контрольного опыта вычи-
тают из данных основного. Летом достаточно одного контроля для
всего водоема. Особое внимание нужно обращать на контроль при
слабом развитии фитопланктона.
В четвертую склянку добавляют 2—3 капли фенолфталеина и воду
подщелачивают до слабо-розовой окраски 0,1 N раствором едкого
натрия, лишенным углекислоты. Эта проба воды служит для опре-
деления в ней общего количества углерода бикарбонатной и свобод-
ной углекислоты.
2. Две склянки с добавкой радиоактивного изотопа инкубиру-
ют в аквариуме на палубе экспедиционного судна в течение одних
суток. Аквариум выдерживают на свету, а воду в нем периоди-
чески сменяют, чтобы температура опыта соответствовала темпера-
туре водоема.
3. По окончании опыта фитопланктон в склянках фиксируют
подщелоченным формалином из расчета 0,5 мл на 250 мл пробы и по
50 мл воды из каждой склянки фильтруют в воронке Зейтца че-
рез мембранный фильтр N 4 (или 5) с величиной пор около 1 мкм.
фильтры с осевшим планктоном подсушивают, нумеруют и сохраняют
до возвращения в лабораторию.
4. В лаборатории фильтры в течение 5 мин обрабатывают раство-
ром слабой соляной кислоты для удаления меченых карбонатов,
для чего в плавучем состоянии их помещают в кювету на поверх-
ность фильтровальной бумаги, смоченной 1%-м раствором НС1, удаля-
ют остатки кислоты с помощью фильтровальной бумаги, смоченной
дистиллированной водой, и высушивают. Радиоактивность органи-
ческого вещества (г), образовавшегося в процессе фотосинтеза фито-
планктона, определяют под сцинтилляционным счетчиком или под
торцовым счетчиком Гейгера—Мюллера.
218
Определение зависимости интенсивности фотосинтеза
от светопроницаемости воды
(нахождение поправочного коэффициента Кс)
1. Зависимость фотосинтеза от светопроницаемости определяют на
станциях следующим путем. В ведро берут пробы воды с какого-
либо среднего горизонта, например с 1 м. Одинаковые порции воды
наливают в серию склянок из светлого стекла и в них добавляют
по 1 мл раствора радиоактивного карбоната с удельной радиоактив-
ностью 1—3 мкКи, или (0,2—1,0)-10* имп./мин под торцовым счетчи-
ком. Затем склянки помещают на тросе в водоем на разные горизонты,
начиная от поверхности и до горизонта нулевого фотосинтеза (утроен-
ная прозрачность по Секки). В самом поверхностном слое водое-
мов, с низкой прозрачностью воды (0,5—2 м), склянки прикрепляют
на расстоянии 0,2 м на глубине от 0 до 0,5 м, а далее через
0,5—1 м (см. рис. 24).
Учитывая высокую чувствительность изотопной методики, этот опыт
лучше всего ставить в следующей последовательности. Склянки с водой
привязывают к тросу и помещают в черные мешочки. Затем во все
склянки добавляют раствор изотопа и опускают в водоем, причем
мешочки снимают с них перед погружением в воду.
Опыт лучше ставить на сутки или с 12 ч дня до ночи (или ночью до 12 ч
следующего дня) с тем, чтобы водоросли могли использовать все
изменения освещенности водной толщи от дневного максимума до ноч-
ного минимума. В конце опыта склянки быстро вынимают из водоема,
водоросли в них фиксируют формалином и сразу отфильтровывают
на мембранных фильтрах. Очевидно, что подобная постановка опыта
при инкубации склянок на разных глубинах будет отражать освещен-
ность воды на разных глубинах.
Определение зависимости
интенсивности фотосинтеза в толще воды
от вертикального распределения фитопланктона
(нахождение поправочного коэффициента Кв)
Как указывалось выше, для того чтобы рассчитать продуктивность
фотосинтеза в толще воды, исходя из величины фотосинтеза в поверх-
ностном слое воды, необходимо учесть, кроме фактора освещенности,
еще и фактор вертикального распределения фитопланктона.
Схема определения вертикального распределения фитопланктона
в водоеме состоит в следующем. Пробы воды отбирают из ряда
горизонтов от поверхности до глубины утроенной прозрачности по
диску Секки. С каждого горизонта равное количество воды наливают
в склянки светлого стекла, добавляют равные объемы раствора
NaHCOj из расчета общей активности (0,4—1,5)* 106 имп./(мин.л) в зави-
симости от интенсивности развития фитопланкона в воде. Склянки
инкубируют в водоеме или в аквариуме в условиях одинаковой осве-
щенности в течение 1—2 ч, после чего водоросли в склянках фикси-
руют. Радиоактивность фильтров в подобном опыте пропорциональна
219
интенсивности фотосинтеза в склянках*. Фактически данная величина
может быть охарактеризована как потенциальная способность к фото-
синтезу при постоянном освещении. Интенсивность фотосинтеза же, в
свою очередь, зависит от исходного количества фитопланктона на со-
ответствующих горизонтах, так как по условиям опыта именно жизне-
способные клетки фитопланктона определяют результат. В то же время
кратковременность опыта гарантирует от искажений исходной картины
распределения фитопланктона, которые могут иметь место вследствие
отмирания фитопланктона в склянках в длительном опыте. Величины
фотосинтеза и, следовательно, величины радиоактивностей фильтров
отражают в этих опытах не только влияние вертикального распре-
деления фитопланктона на фотосинтез, но также и влияние конкретных
факторов среды, ускоряющих или угнетающих этот процесс.
Отношение радиоактивности фильтров с разных глубин к радио-
активности фильтра с поверхностным фитопланктоном обозначается
коэффициентом Кв и служит поправочным коэффициентом к верти-
кальному распределению водорослей. При умножении величины по-
верхностного фотосинтеза на коэффициент Кв, найденный для отдельных
горизонтов, мы получим величины фотосинтеза, которые наблюдались
бы на соответствующих горизонтах в случае равномерной освещен-
ности всех слоев водной толщи.
Определение общей радиоактивности воды после добавления меченой
углекислоты. Радиоактивность испытуемой воды рассчитывается по
количеству и активности внесенного препарата Naj СОз и по объему
воды в склянке. Если есть необходимость, то в конце инкубации
отбирают небольшой объем воды из опытной склянки, добавляют
каплю 10%-го раствора КОН, переносят в пробирку до резиновой пробки
и в лаборатории определяют активность под сцинтилляционным счет-
чиком.
Определение в воде общего количества углекислоты. 1. Определение
общего количества углерода карбонатов с углекислотой (Скарб) пря-
мым титрованием. Пробу воды (100 мл) наливают в коническую колбу
и подщелачивают 0,1 N NaOH до слабо-розовой окраски по фенолфта-
леину. Затем добавляют 1—2 капли соляной кислоты до первого исчез-
новения окраски. При этом все формы углекислоты переходят в бикар-
бонат. Далее бикарбонат оттитровывают 0,05 N соляной кислотой
в присутствии смешанного индикатора — метиленового синего с мети-
леновым оранжевым или метиленовым красным — до ярко-розового
окрашивания. При титровании 0,05 N НС1 1 мл ее соответствует 2,2 мг
СОг или 0,6 мг С.
Таким образом, количество карбонатов в 1 л воды можно рассчи-
тать по следующей формуле:
_<г0,6-1000
Скарб -----------з
Ь
1 В случае разного содержания суммы гидрокарбонатов и углекислоты в пробах с раз-
ных горизонтов прямая пропорциональность между величинами фотосинтеза и радио-
активностью фильтров будут нарушена. В таких случаях необходимо определить содер-
220
где Скарб — количество карбонатов, мг, а — количество 0,05 N НО, мл;
0,6 — эквивалент углерода; 1000 — пересчет результатов титрования
на 1 л; b — объем пробы, мл.
2. Метод титрования углекислоты после отгонки ее в щелочь
более точен и используется при определении гидрокарбонатов в ило-
вых отложениях или загрязненных водах. Пробы фиксируют 1—2 мл
0,1 N КОН. В специальном приборе углекислоту из карбонатов вы-
тесняют НС1 и отгоняют током воздуха в 0,1 N КОН, после чего ее
оттитровывают 0,05 N НС1 и проводят расчет по приведенной выше
формуле.
Расчет продукции органического вещества в процессе фотосинтеза
в пробе воды. Расчет продукции производится по формуле Стимана-
Нильсена [Steeman-Nielsen, 1952]
d> = r ' Скарб
R t ’
где Фп — продукция органического.вещества, мгС/(л-сут); г — радио-
активность водорослей в пробе, имп./мин; Скарб — содержание угле-
рода гидрокарбонатов, мг С/л; R — радиоактивность добавленного
в пробу изотопа, имп./мин; t — время опыта, сут. Для контроля влияния
побочных процессов параллельно опыт ставят в темной склянке, ре-
зультаты которого вычитают из опыта на свету.
Расчет продукции органического вещества фитопланктоном
в процессе фотосинтеза под 1 м2 поверхности водоема
Для того чтобы найти общие поправочные коэффициенты, показы-
вающие степень совместного влияния фактора освещенности и фактора
вертикального распределения фитопланктона на фотосинтез в водной
толще, достаточно перемножить между собой коэффициенты Кс и Кв.
Поправочные коэффициенты, получающиеся при перемножении коэф-
фициентов Кс и Ки для каждого горизонта, обозначаются как суммарные
коэффициенты Кг.
Эти коэффициенты показывают, как меняются величины фотосинтеза
с глубиной на соответствующих горизонтах. Поэтому, умножая зна-
чение величины суточного фотосинтеза в поверхостной пробе (Фп)
на коэффициенты Кг, можно рассчитать величины фотосинтеза для
каждого горизонта и затем построить общую поправочную кривую,
учитывая влияние обоих факторов на фотосинтез (рис. 26).
Далее, найдя путем взвешивания отношение заштрихованной пло-
щади графика, ограниченной кривой /, к общей площади графика до
того горизонта, до которого производились измерения, вычисляют
суммарный поправочный коэффициент К$, дающий возможность рас-
считать фотосинтез во всей водной толще.
жание гидрокарбонатов на разных горизонтах и произвести расчет продукции по фор-
муле (см. ниже).
221
6
Рис. 26. Построение кривых при вычислении суммар-
ного поправочного коэффициента при определении
величины продукции органического вещеста под I м2
изотопным методом
1 — суммарная поправочная кривая коэффициен-
та А\; 2 — кривая коэффициента Кс; 3 — кривая
коэффициента Кл.
Расчет интенсивности фотосинтеза под 1 м2 поверхности водоема
производится по формуле
ф„=ф„кф1,
где Фм — интенсивность фотосинтеза под 1 м2, г С/сут; Фп — интен-
сивность фотосинтеза в поверхностной пробе воды, мг С/(л-сут); Кф —
суммарный поправочный коэффициент; I — глубина трофогенного слоя,
м (расстояние до последней склянки при определении Кс).
ОПРЕДЕЛЕНИЕ ПРОДУКЦИИ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
ФОТОТРОФНЫМИ СЕРОБАКТЕРИЯМИ
Фотосинтезирующие серобактерии распространены в ряде меро-
миктических водоемов там, где формируется анаэробная зона и при
наличии сульфитов идет образование сульфида. В верхних слоях этой
зоны при проникновении сюда света образуется экологическая ниша,
благоприятная для развития фотосинтезирующих серобактерий. Про-
дукция органического вещества идет здесь за счет использования
световой энергии, которая трансформируется в АТР и NAD (Р). Ха-
рактеристика фотосинтеза как фотохимического окислительно-восста-
новительного процесса может быть в общем виде представлена уравне-
нием Ван-Нила
222
2НзА + СО2
донор акцептор
водорода водорода
окислительный
донор
водорода
(СН2О) + Н2О.
восста-
новленный
акцептор '
У фототрофных бактерий нет всех компонентов для осуществления
фотосистемы П, поэтому они не способны использовать воду в качестве
донора электронов, а в качестве таковых используют водород, ряд
восстановленных соединений серы и некоторые органические вещества.
Так, в оз. Вал-де-Сан-Хуан при годовой первичной продукции орга-
нического углерода, равной 450 г С/м2, бактериальная продукция рав-
нялась 3 г С/м2 в год. С другой стороны, в оз. Соларлейк при
продукции водорослей, равной 11 г/м3, годовая продукция бактерий
достигала 48 г С/м2 в год.
Поскольку в процессе фотосинтеза зеленых и пурпурных бактерий
кислород не выделяется, то единственным путем определения его ин-
тенсивности служит использование радиоуглеродного метода. Сущность
метода заключается в том, что воду отбирают батометром Руттнера из
экологической зоны, где наблюдается развитие фотосинтезирующих
серобактерий, со всеми предосторожностями, в нее вносят меченый
бикарбонат натрия (МаН14СОз), разливают в светлую и темную склян-
ки, инкубируют в водоеме на той глубине, с которой была взята
вода для анализа, и определяют радиоактивность биомассы развив-
шихся бактерий.
Последовательность операций приводится ниже.
1. Рабочий раствор из фабричного препарата Na2 СОз или NaHl4CO2
готовят так, как это было описано для определения фотосинтеза
фитопланктона изотопным методом.
2. Из соответствующих горизонтов отбирают пробы воды бато-
метром Руттнера. Каждую из нйх разливают в 4 склянки (2 светлые и
2 темные), вносят по 1 мл раствора Na2 СОз, закрывают стеклянной
пробкой. 2 темные склянки помещают в черный мешок, и все 4 склянки
на тросе опускают на ту глубину, с которой была взята проба для
анализа. Склянки закрепляют через 0,2 м по вертикали по всей
зоне, где идет развитие фотосинтезирующих бактерий.
Вследствие высокой чувствительности изотопного метода сначала
склянки с водой привязывают к тросу и помешают в черные мешочки.
Затем во все склянки добавляют раствор изотопа и опускают в водоем,
причем мешочки с них снимают перед самым погружением в воду.
3. Длительность инкубации светлых и темных склянок в водоеме
одни сутки.
4. По истечении времени инкубации склянки достают из водоема
и тотчас фиксируют £формалином (0,5 мл на 100—200 мл пробы).
5. По возвращении в лабораторию каждую пробу воды фильтруют
через мембранный фильтр. В фильтрате определяют радиоактивность
прижизненных выделений органических веществ, как указано в следую-
щем разделе.
6. Мембранные фильтры с фотосинтезирующими бактериями в во-
ронке промывают озерной или дистиллированной водой 5 раз по 10 мл, и
223
радиоактивность бактерий определяют под сцинтилляционным счетчи-
ком.
7. Черная склянка служит контролем на темновую фиксацию угле-
кислоты; значение радиоактивности фильтров из темных склянок сле-
дует вычесть из значений радиоактивности фильтров бактерий из свет-
лых склянок.
Расчет интенсивности процесса фиксации углекислоты делают по
формуле Стимана-Нельсена
ф = г ' СкаРб *
fT~t ’
где Ф — величина фотосинтеза бактерий, мг С/л в сутки; г — радиоактив-
ность бактерий или прижизненных выделений, имп./мин в пробе;
Скарб — углерод карбонатов в воде, мг/л; R — общая радиоактив-
ность воды, имп./мин в 1 мл; t — время опыта; ч; 24 — пересчет на сутки.
ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ПРОДУКТОВ ФОТОСИНТЕЗА,
ВЫДЕЛЯЕМЫХ В ОКРУЖАЮЩУЮ СРЕДУ КЛЕТКАМИ ФИТОПЛАНКТОНА
ИЛИ ФОТОСИНТЕЗИРУЮЩИМИ БАКТЕРИЯМИ
Как показали Фогг [Fogg, 1971], Ветцель [Wetzel et al., 1972],
В.В. Бульон [1984] и другие, фитопланктон в процессе фотосинтеза
выделяет в окружающую среду растворимые органические вещества.
Количество их зависит от величины освещенности, температуры воды
и иных свойств окружающей среды. Так, в евтрофных водоемах при-
жизненные выделения составляют 10—15% величины продукции фото-
синтеза, а в олиготрофных достигают 60%. Количество этих веществ
определяется в том же опыте, что и величина фотосинтеза фитоплан-
ктона в поверхностной пробе воды изотопным методом.
Последовательность операций.
1. По окончании суточной экспозиции проб воды с добавкой
ЫаГсОз в светлых склянках фитопланктон или фотосинтезирующие
бактерии фиксируют формалином, отфильтровывают на мембранном
фильтре N 5 (или 3) и подвергают дальнейшему анализу.
2. Фильтрат собирают, подкисляют 3%-м раствором фосфорной
кислоты до pH 2 и продувают азотом для удаления свободной меченой
углекислоты.
3. Радиоактивность 1 мл раствора определяют под сцинтилля-
ционным счетчиком. Остаточная радиоактивность раствора обусловле-
на внеклеточными продуктами фотосинтеза фитопланктона.
Расчет внеклеточной продукции производят по формуле Стимана-
Нильсена
_ Г Скарб ЮО
R t а
гдеh — внеклеточная продукция фотосинтеза, мг С/(л-сут); г — радио-
активность внеклеточных выделений, имп./мин; Скарб — содержание
углерода гидрокарбонатов, мг С/л; 1000 — коэффициент пересчета
на 1 л; R — радиоактивность добавленного в пробу Маг4СОз, имп./мин;
t — время опь!та, сут; а — объем пробы, мл.
224
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ТЕМНОВОЙ АССИМИЛЯЦИИ СО2
Темновая фиксация свободной углекислоты микроорганизмами
имеет большое значение в метаболизме. У автотрофных бактерий вся
биомасса строится из СО2 за счет ее усвоения в цикле Кальвина. У ге-
теротрофных организмов фиксация СОг в основном проходит по реак-
ции Вуда—Беркмана и при участии ацетил-СоА поступает в цикл
трикарбоновых кислот. В биомассу гетеротрофных организмов по-
ступает от 1 до 30% и даже до 50% углерода углекислоты, в сред-
нем же около 6%.
Определение интенсивности
темновой ассимиляции СОг в воде
1. Пробу воды с определенного горизонта отбирают батометром
Руттнера.
2. Воду из батометра наливают в склянки с притертыми пробками
емкостью около 60—100 мл. Заполнение склянок ведется так же, как
при отборе проб для определения растворенного кислорода, т.е. через
склянку пропускают 2—3 объема воды.
3. Заполненные водой склянки помещают в черные мешочки и
только после этого в них вносят пипеткой со шприцем по 1 мл раство-
ра радиоактивного карбоната Na; СОз с удельной активностью около
5 мкКи, или 1 • 10б имп./мин. Раствор радиоактивной соды, применяемый
для определения величины темновой фиксации углекислоты, после
приготовления обязательно фильтруют через мембранный фильтр и
хранят в запаянных ампулах по 5—15 мл, в которых его стерилизуют
многократным кипячением на водяной бане. После добавления изо-
топа склянки закрывают притертыми пробками так, чтобы под пробкой
не оставалось пузырьков воздуха.
С каждого горизонта заполняют по 2 параллельные склянки. На
всю серию ставят 1—2 контрольные склянки, куда, кроме радиоактивно-
го карбоната натрия, добавляют по 1 мл 40%-го раствора формалина.
4. Мешочки со склянками плотно завязывают и помещают в во-
доем на 24 ч. Если не представляется возможности инкубировать
склянки в водоеме, то их выдерживают в аквариуме при температуре,
близкой к температуре водоема.
5. По прошествии срока инкубации в склянки добавляют 1—2 мл
формалина, не вынимая их из мешочка. Эта предосторожность
предпринимается во избежание ассимиляции СОг за счет фотосин-
теза водорослями при проникновении света в пробы.
6. По окончании опыта всю воду из склянок или часть ее (40—60 мл)
фильтруют в воронке Зейтца через мембранный фильтр , задер-
живающий бактерии. Фильтры высушивают и в таком виде хранят до
возвращения в лабораторию. Здесь их обрабатывают 1%-Й соляной
кислотой для удаления остатков радиоактивного карбоната так, как
это было описано в методике определения интенсивности фотосинтеза
фитопланктона. Радиоактивность фильтров определяют под сцинтил-
ляционным или торцовым счетчиком Гейгера—Мюллера.
7. Суточную величину темновой ассимиляции СОг рассчитывают по
15. Зак. 1766
225
формуле
' Скарб
R .7
где Ст — величина темновой ассимиляцции СОг, мкг С/(л сут); г — ра-
диоактивность микроорганизмов в пробе воды, имп./мин; CKapg —со-
держание в воде свободной углекислоты и карбонатов, мкг С/л; R —
общее количество изотопа, добавленного в склянку, имп./мин; t —
время инкубации проб, сут.
Метод определения углерода бикарбонатов Скарб и общей радио-
активности пробы R приведен в разделе "Определение интенсивности
фотосинтеза фитопланктона...".
Определение интенсивности темновой ассимиляции СОг
в иловых отложениях
Органическое вещество из водной массы поступает в иловые отло-
жения и подвергается анаэробному распаду. Образующиеся при этом
водород, метан, сероводород и другие продукты анаэробного распада
диффундируют к поверхностным слоям ила и здесь начинают окислять-
ся при непосредственном участии хемосинтезирующих микроорганиз-
мов. Таким образом, процессы хемосинтеза в водоеме, где придонные
слои воды насыщены кислородом, могут достигать наиболее интенсив-
ности именно в поверхностном слое ила.
В то же время в иловых отложениях в громадных количествах
развиваются различные гетеротрофные бактерии в результате поступле-
ния сюда больших количество органического вещества при седи-
ментации, поэтому общая численность бактерий здесь в расчете на
единицу объема на три порядка выше, чем в водной массе.
Методика определения величины хемосинтеза в иловых отложениях
была разработана Ю.И. Сорокиным [1958], однако предложенный
им метод учитывает не только хемосинтез, но и гетеротрофную фик-
сацию СОг.
1. Монолит ила для определения темновой ассимиляции СОг отби-
рают из водоема стратометром. Из определенного слоя ила берут
5 мл и вносят в пенициллиновую склянку, предварительно заполнен-
ную азотом и помещенною в черный мешок. Туда же вводят 1 мл радио-
активного карбоната Naz СОз с удельной активностью от 1 до 4 мкКи,
или (1—2)-106 имп./(мин-мл), под сцинтилляционным счетчиком, и
2—3 мл озерной воды, перемешивают и энергично встряхивают 15 мин.
2. Склянки с плотно закрытой пробкой в черных мешках инкубируют
в водном термостате 4 ч при температуре водоема.
3. По прошествии времени инкубации для отделения бактерий от
частичек грунта ил переносят из баночки в склянку йа 200 мл и создают
вакуум, при этом жидкость вспенивается, после этого быстро восста-
навливают атмосферное давление, пена опадает и бактерии отделяются
от частичек ила. Процесс повторяют несколько раз. В результате
бактерии отделяются от частичек грунта и равномерно распределяются
в жидкости. Затем ил разводят дистиллированной водой до 100 мл и
взбалтывают.
226
9
Рис. 27. Прибор для определения
углекислоты и карбонатов в воде и
донных отложениях
1 — колба для анализируемой
пробы; 2 — пробирка поглоти-
теля; 3 — поглотитель для очистки
воздуха на СОг; 4 — воронка для
кислоты; 5 — поглотитель анали-
зируемой углекислоты; 6 — зажим
входного отверстия; 7 — вакуо-
метр; 8 — кран; 9 — пробка по-
глотителя; 10 — зажим
4. После отстаивания в течение 1—2 мин и после осаждения крупных
частиц 10 мл болтушки фильтруют через мембранный фильтр N 3.
5. Фильтр обрабатывают 3%-м раствором НС1 для удаления радио-
активных карбонатов и высушивают, радиоактивность бактерий опре-
деляют под сцинтилляционным счетчиком.
6. Общее количество минеральных форм углерода, участвующих
в ассимиляции (величина Скарб), определяют путем отгонки углекис-
лоты из ила в специальном приборе (рис. 27). В колбу Кьельдаля (7)
емкостью 50 мл вносят 5—15 г анализируемого ила, 2 мл бутанола и
20 мл воды. В поглотитель (5) наливают 20 мл 0,1 N едкого калия.
В приборе создается вакуум, и через него пропускают слабый ток
воздуха, очищенного от углекислоты крепкой щелочью в поглотителе
(3). Ил в колбе доводят до кипения и кипятят 3—5 мин, после чего ток
воздуха усиливают и углекислоту отгоняют из ила в щелочь в те-
чение Имин. После отгонки количество углекислоты определяют обрат-
ным титрованием едкого калия 0,05 N раствором соляной кислоты в
присутствии хлористого бария. 1 мл 0,05 N соляной кислоты соответ-
ствует 0,3 мг углерода в отгоняемой п^обе. .
7. Радиоактивность раствора Naz СОз (Р), вносимого в опыт,
определяют, как указано выше.
227
8. Суточную величину темновой ассимиляции COz рассчитывают
по формуле
С = Г ‘ Скарб *
Т R • t
где Ст — величина темновой ассимиляции СОг, мкг С/(л сут); г — радио-
активность микроорганизмов за время опыта в расчете на содержимое
склянки, имп./мин; Скарб — количество минеральных форм^углерода,
свободно обменивающихся с радиоактивным углеродом Naz СОз, мкг
С/л; R — радиоактивность раствора Naz СОз, внесенного в опыт,
имп./мин; I — время инкубации пробы, сут.
9. Если для анализа ил берут из слоя толщиной 1 см, то можно про-
извести расчет темновой ассимиляции СО? на 1 м2 ила, умножив резуль-
тат на 10.
БАКТЕРИАЛЬНОЕ УСВОЕНИЕ ОРГАНИЧЕСКОГО ВЕЩЕСТВА,
ИЛИ ГЕТЕРОТРОФНАЯ АКТИВНОСТЬ БАКТЕРИЙ
Хобби [Hobbie, 1964], Хобби и Райт [Hobbie, Wright, 1968; Wright, 1968]
разработали радиоактивный метод прямого определения гетеротрофной
активности водных бактерий. В основу метода положено представле-
ние о бактериальном усвоении органических веществ как активном
транспорте. Для расчета скорости усвоения при определенной кон-
центрации субстрата [S] было использовано уравнение энзимной ки-
нетики Михаэлиса—Ментен
y_r(S0 + S)
R t
где V — максимальная скорость усвоения, мг/(л-ч); г — радиоактив-
ность бактериальных клеток, имп./мин; So — природная концентрация
субстрата, мг/л; S — прибавленное количество субстрата, мг/л; R —
количество изотопа 14С, добавленого в склянки, имп./мин.; t — время
опыта, ч.
После преобразования формула принимает следующее выражение:
R • t = Kt + So + S_
г V V ’
где Kt — транспортная константа, мг/л; V — максимальная скорость
усвоения субстрата, мкг/(л ч) [Фурсенко, 1975].
Необходимо иметь в виду следующее. 1. К„ равно значению [3], при
котором И® Гмакс/2. Усвоение органического вещества у бактерий
связано с транспортными системами, пока [S]< 10АГт, т.е. при внесении
больших доз S опыт проводить нельзя.
Гетеротрофную активность бактериопланктона оценивают по мак-
симальной скорости усвоения меченных по |4С органических соеди-
нений (глюкозы, фенола, протеиногенных аминокислот, ацетата или
228
Рис. 28. Построение графика для опреде-
ления естественного запаса и интенсив-
ности поглощения бактериями опреде-
ленных органических веществ из при-
родной воды
смеси аминокислот). В работе используют растворы изотопов, со-
держащие в 1 мл около 40—60 мкг С, с активностью (0,5—
1,5)- 10б имп./мин.
1. При постановке опыта пробы природной воды с каждого гори-
зонта разливают по 40 мл в 6 склянок объемом 42 мл.
2. В них вносят микропипеткой раствор изотопа из расчета при-
мерно 5, 7, 10, 15, 25 и 50 мкг 14С испытуемого органического вещества
на 1 л пробы. Закрывают резиновой пробкой и инкубируют на нужной
глубине в течение 1 ч в черном мешке.
3. Одну серию в 6 склянок ставят в качестве контроля, фиксируя
воду 0,2 мл 40%-го формалина до внесения 5—50 мкг С/л изотопа.
4. В лаборатории каждую пробу фильтруют через мембранный фильтр
с порами 0,23 мкм, промывают 10 мл физиологического раствора
и отмывают обратную сторону фильтра от адсорбированного изотопа,
затем препарат высушивают.
5. Под счетчиком измеряют радиоактивность бактерий и рассчи-
тывают количество и скорость поглощения НС органических соеди-
нений, внесенных в каждую склянку, по формуле
с =
°рг R t
где Сорг — количество органического вещества, усвоенного бактериями,
мкг/(л-ч); г — радиоактивность бактерий на каждом фильтре,
имп./мин; 5 — прибавленное количество субстрата, мкг/л; R — радио-
активность органического вещества, внесенного в каждую склянку,
имп./мин; t — время опыта, ч.
6. Строят линейный график в двойных обратных координатах
1 /5; 1 / V (график Лайнуивера—Бэрка): для этого на оси абсцисс отклады-
вают обратные величины количества внесенного органического веще-
ства 1/S, а на оси ординат — обратные величины скорости усвоения
органического вещества 1/И (мкг/(л ч)), затем наносят точки, харак-
теризующие время усвоения органического вещества в зависимости от
его концентрации (рис. 28).
7. По графику определяют величину, обратную максимальной ско-
рости усвоения субстрата (1/^тах), равную длине отрезка, отсекае-
мого по оси ординат, а также величину (Кт + So) (субстратная константа
Михаэлиса + природная концентрация субстрата), равную длине
отрезка, отсекаемого по оси абсцисс.
229
ОПРЕДЕЛЕНИЕ ДЕСТРУКЦИИ ОРГАНИЧЕСКОГО ВЕЩЕСТВА
КИСЛОРОДНЫМ МЕТОДОМ
Растворенное и взвешенное органическое вещество в водоемах обра-
зуется за счет автохтонных продуктов фотосинтеза и аллохтонных ве-
ществ, поступивших в водоем с поверхностным стоком. Деструкция
этих веществ в водоемах происходит в основном в аэробных усло-
виях водной толщи и в анаэробных условиях в донных отложениях.
Суммарную величину потребления органического вещества обычно
учитывают кислородным методом одновременно с определением пер-
вичной продукции органического вещества, принимая, что микро-
организмы в процессе метаболизма окисляют органическое вещество
до СОг и воды:
(СН2О)+ Ог - СОг + НгО.
Учитывая, что идет деструкция не только углеводов, но и белков,
вводят дыхательный коэффициент, равный 0,8.
Однако потребление кислорода в водоеме может идти одновре-
менно на окисление аммиака, выделяющегося из донных отложений при
анаэробном распаде белков, до нитратов сероводорода до окисленных
соединений серы, метана до СОг. Иными словами, кислородный метод
определения деструкции органического вещества далеко не универсален
и может применяться лишь при учете экологической обстановки во-
доема, там, где нет указанных выше процессов.
Определение деструкции органического вещества в воде
1. Воду отбирают с поверхности голомиктического водоема или
из ряда глубин стратифицированного водоема, где еще присутствует
растворенный кислород, батометром Руттнера и наливают в 4 оди-
наковые склянки объемом от 65 до 250 мл, в зависимости от интен-
сивности процесса поглощения кислорода, с предосторожностями, как
и при отборе проб на анализ кислорода (см. приложение).
2. В 2 склянках сразу же определяют содержание кислорода ме-
тодом Винклера, а 2 другие помещают в темный мешок и инкубируют
в водоеме на той глубине, откуда была взята вода для анализа.
Время инкубации выбирают, исходя из температуры и визуального
определения наличия органического вещества в воде: в евтрофных
озерах — 6—12 ч, в мезотрофных — от 12 до 24 ч, а в олиготрофных —
более суток.
В евтрофных водоемах можно использовать склянки маленького
объема и титровать выделившийся йод в 50 мл воды, взятой моров-
ской пипеткой. В олиготрофных водоемах следует брать склянки
большего объема и титровать 100—250 мл.
3. Потребление кислорода на деструкционные процессы рассчи-
тывается по формуле
0 _ (Рисх — Окон) '
д t
где Од — величина деструкции Сорп мгОг/(л-сут); Оисх — содержание
230
кислорода в исходной воде, мг/л; Окон — содержание кислорода в конце
инкубации; t — время инкубации, ч.
Для выражения величины деструкции в пересчете на органическое
вещество или на углерод Од умножают на дыхательйый коэффициент,
равный 0,8, а пересчет делают по табл. 22.
Определение деструкции органического вещества
в иловых отложениях
Органическое вещество поступает в водоем извне и образуется в
самом водоеме за счет процессов фотосинтеза. В зависимости от глу-
бины водоема и его кислородного режима примерно от 20 до 80% орга-
нического вещества разрушается в его аэробной зоне. Остальное ор-
ганическое вещество поступает в донные отложения и разрушается
в анаэробных условиях. Суммарную деструкцию органического веще-
ства в иловых отложениях можно определить по выделению углекисло-
ты (аэробная + анаэробная деструкция) с учетом темновой ассимиляции
углекислоты, которая в ходе опыта перешла в биомассу бак-
терий.
1. Ил из водоема извлекается стратометром или дночерпателем
Эйкмана—Берджи. Верхние крышки дночерпателя открывают и в стек-
лянную трубку длиной около 40 см и диаметром 3,5 см осторожно
при слабом отсасывании воздуха затягивают колонку ила длиной
около 5 см с ненарушенной структурой, снизу трубку затыкают ре?
зиновой пробкой.
2. Трубку с илом и такую же трубку без ила (контрольную) за-
полняют при помощи сифона озерной водой, в которой определяют
содержание неорганических форм углерода: СОг + HCOj.
Необходимо обратить внимание на то, чтобы поверхностный слой
ила не взмучивался во время наполнения трубки водой. С этой
целью стеклянный конец сифонной трубки загибают вверх и опускают
вначале до самого ила. Наполнение трубки придонной водой производят
очень медленно и ускоряют, когда слой воды достигнет 3—5 см. Этой
же водой наполняют и контрольную трубку без ила. После этого
трубки закрывают резиновыми пробками, имеющими сливные трубоч-
ки, отверстия которых затыкают стеклянными палочками так, чтобы
под пробками не оставалось пузырьков воздуха.
3. Инкубацию проб производят в течение суток в темных мешках
непосредственно в водоеме или в лабораторных условиях в сосуде
с водой, имеющей температуру придонного слоя воды водоема.
4. При снятии опыта трубки закрепляют в штативе, стеклянную
палочку из сливной трубочки на пробке удаляют и пробку извлекают
из трубки. Столб воды с илом осторожно перемешивают тонким винил-
пластовым прутиком со спиралькой на нижнем конце, так, чтобы ил
не взмучивался, а вода не перемешивалась с воздухом. Эта проце-
дура необходима для выравнивания содержания кислорода во всем
столбе воды, так как содержание СОг в столбе воды над илом
неравномерное, а для расчетов необходимо определить выделение
углекислоты во всем объеме воды. Поскольку перемешивание воды
231
производится как в опытной, так и в контрольной трубке, ошибка ана-
лиза от соприкосновения воды с воздухом не влияет на результаты
определений.
5. Содержание углекислоты, выделившейся за время инкубации
ила за счет аэробной и анаэробной деструкции органического веще-
ства, определяют по разности содержания ее в опытной и контроль-
ной трубках.
6. По истечении срока инкубации трубки помещают в штатив.
Стеклянную палочку из сливной трубочки на пробке удаляют, и проб-
ку извлекают из трубки. Слой воды в трубках не перемешивают, а це-
ликом сливают сифоном. Содержание углекислоты и бикарбонатов
определяют титрованием. Для этого 100 мл воды наливают в колбу
Эрленмейера и подщелачивают 0,1 N раствором КОН до слабо-розовой
окраски по фенолфталеину, затем добавляют 1—2 капли НС1 до
первого исчезновения слабо-розовой окраски. При этом все формы
угольной кислоты переходят в бикарбонат. Далее бикарбонат оттит-
ровывают 0,05 N НС1 в присутствии смешанного индикатора метилового
оранжевого и метиленового синего или метиленового красного до ярко-
розового окрашивания:
КНСОз + НС1 = КС1 + Н2О + СО2.
При титровании один эквивалент НС1 соответствует 1 моль СО2 или
1 моль углерода. При титровании 1 мл 0,5 N НС1 соответствует 2,2 мг
СО2 или 0,6 мг С. Расчет производят на навеску или на взятую страто-
метрическую трубку и пересчитывают на 1 дм3 ила или на 1 м2 ила.
Определение темновой фиксации углекислоты илом производят
по прописи, приведенной в разделе "Определение интенсивности тем-
новой ассимиляции СО2”, и пересчитывают на 1 дм3 или на 1 м2 ила.
Общая деструкция органического вещества иловых отложений равна
сумме темновой ассимиляции С/СО2, аэробной и анаэробной деструк-
ции органического вещества.
ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ЭНЕРГЕТИЧЕСКОГО ОБМЕНА К2
Коэффициент энергетического обмена бактерий Кг показывает, какая
часть потребленной ими энергии израсходована на дыхание и какая
часть аккумулирована в органическом веществе бактериальной клетки.
Коэффициент Кг как показатель жизнедеятельности бактериопланктона
и эффективности его роста в естественных сообществах имеет среднее
значение около 0,32—0,37. Он увеличивается до 0,5—0,7 при высоких
скоростях размножения микрофлоры, снижается до 0,20—0,25 при
значительном вкладе С/СО2 в продукцию бактериальной массы и мо-
жет снижаться до 0,03-0,11 на загрязненных участках водоемов.
Коэффициент Кг рассчитывается по формуле Кг = Р1(Р + К), где
Р — суточная продукция бактерий, измеряемая по времени удвоения
численности или биомассы с помощью метода прямого счета; R — суточ-
ное потребление бактериями растворенного в воде кислорода, изме-
ряемое скляночным методом после удаления зоопланктона. Для приве-
дения Р и R в одну размерность принимается, что энергетическая цен-
232
ность бактерий соответствует 4,18 Дж на 1 мг сырой массы, а окси-
калорийный коэффициент — 14,14 Дж на 1 мг СОг. Бактериальное дыха-
ние составляет в евтрофных озерах в среднем 55% суммарной деструк-
ции, в мезотрофных — 65%, в олиготрофных — 85% [Драбкова, 1981].
Суточная бактериальная продукция определяется по формуле
Pb=(24/g)-50-ln2 = (16,64/g)-.S0,
где Рь — бактериальная продукция, мкг С/(л-сут); g — время генера-
ции бактерий (ч), определяемое как время удвоения биомассы бакте-
риопланктона (g=(rlg2)/(lg£y-lgfy)); bo = \/bo-Во = (bo• 5о)! ;2 _ сред-
нее геометрическое значение биомассы бактериопланктона; Ьо и Во —
исходная и конечная биомасса бактерий в нефильтрованной воде;
bj-nBf — то же, в фильтрованной воде.
Удельная масса бактерий принимается равной 1,06, сухая масса —
.15 % от сырой, содержание углерода в бактериальных клетках 50% от
сухой биомассы, поправочный коэффициент на усыхание клеток, окра-
шенных эритрозином на мембранных фильтрах, изменяется в среднем в
1,5 раза [Локк, 1969; Сажин и др., 1987].
Таким образом, если коэффициент Кг равен 0,33—0,37, то это озна-
чает, что в процессе деструкции органического вещества за счет
деятельности бактерий около 30% энергии используется на конструк-
тивный метаболизм бактерий, а около 70% энергии рассеивается.
Если величины Кг ниже указанной величины, то это означает, что
органическое вещество сжигается впустую и не используется на кон-
структивный обмен, т.е. процесс использования энергии окисления
органического вещества разобщен с процессов продукции бактериаль-
ной биомассы. Иными словами, бактерии работают как мощное очист-
ное сооружение. Если Кг больше 0,33, то это указывает на то, что часть
легкоусвояемых веществ, подобно тем, которые участвуют в цикле
Кребса, включается в этот цикл непосредственно и расходуется на био-
синтез биомассы бактерий.
Таким образом, значение Кг может указывать, происходят ли в во-
доеме отклонения от нормального течения биологических процессов.
Само собой разумеется, что Кг следует рассматривать в совокупности
с общей экологической обстановкой в водоеме.
Суммируя изложенное, следует отметить, что для определения ве-
личины Кг нужно'знать: 1) величину дыхания бактерий, 2) продук-
цию бактериальной биомассы, которая определяется по времени гене-
рации бактерий и по величине биомассы бактерий.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ДЫХАНИЯ БАКТЕРИЙ
1. Отбирают воду из озера с нужной глубины и фильтруют через
планктонный газ N 76, обработанный кипящей водой, для удаления
фито- и зоопланктона.
2. Профильтрованную воду разливают в ряд склянок и определяют
исходное содержание кислорода методом Винклера.
3. Склянки инкубируют в темноте при температуре водоема в те-
чение 12 и 24 ч, в зависимости от содержания в воде органического
вещества.
233
4. По истечении срока инкубации вновь определяют содержание
кислорода в миллиграммах на 1 л.
5. По разности исходного и конечного содержания кислорода в
пробе определяют дыхание бактерий в. миллиграммах Ог на 1 л.
ОПРЕДЕЛЕНИЕ ВРЕМЕНИ УДВОЕНИЯ
ОБЩЕЙ ЧИСЛЕННОСТИ БАКТЕРИЙ
Метод определения времени генерации бактерий, или удвоения
общей численности бактерий в воде, был разработан М.В. Ивановым
[1956].
1. Пробу воды объемом около 0,5 л отбирают из водоема в чис-
тую нестерильную посуду.
2. Из половины объема удаляют зоопланктон путем фильтрова-
ния через мельничный газ N 76; сложенный вдвое, или через мембранный
фильтр с диаметром пор 4—7 мкм.
3. В фильтрате определяют общую численность бактерий.
4. Склянки с фильтрованной водой выдерживают в водоеме или
аквариуме при температуре и освещении, близких к естественным,
после чего анализ численности повторяют.
Время инкубации склянки должно быть равно времени, в течение
которого достоверно улавливается разница между конечной и началь-
ной численностью бактерий в пробе: летом для евтрофных озер от
1 до 6 ч, для мезотрофных от 6 до 18 ч и для олиготрофных
от 24 до 48 ч. При низких температурах, весной и осенью, время
инкубации удлиняется в несколько раз.
5. Расчет времени удвоения бактерий производится по формуле
D = -S2---- .
IgBf - lg*f
где d — время удвоения численности, ч; t — время длительности опыта,
4;Bf — численность бактерий в фильтрате по окончании опыта; bf— ис-
ходная численность бактерий в фильтрате; 2 — коэффициент геометри-
ческой прогрессии, по которой возрастает численность размножающих-
ся бактерий.
Недостатком этого метода, помимо связанного с инкубацией
изолированных проб так называемого скляночного эффекта, являет-
ся тот факт, что время генерации бактерий в результате удаления
фито-, зоопланктона и взвеси может быть иным, чем в природных
условиях.
ОПРЕДЕЛЕНИЕ ВРЕМЕНИ УДВОЕНИЯ БАКТЕРИАЛЬНОЙ МАССЫ
Сущность метода заключается в том, что биомасса бактерий рас-
считывается по численности бактерий, определяемой методом Разумова
в два срока в одной и той же пробе воды, освобожденной фильтро-
ванием от зоопланктона, и по среднему размеру клеток бактерий, изме-
ренному с помощью микрометра. Прирост биомассы рассчитывается
по разности за истекший срок. Расчет времени удвоения бактерий или
234
их биомассы может быть осуществлен по формуле
D =-----LJi?------,
(lgfe0 + Pft) - lgb0
где D — время удвоения биомассы бактерий, ч; t — длительность
опыта, ч; Ьо — исходная биомасса бактерий, мг С/л; Рь — продукция
бактерий за время опыта, которая рассчитывается по приросту числа
бактерийв конце опыта, мг С/л [Иванов, 1956] (см. раздел "Определение
биомассы бактерий...").
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА
ОБРАЗОВАНИЯ МЕТАНА
РАДИОИЗОТОПНЫЙ МЕТОД
Органические вещества в виде отмершего фитопланктона и остат-
ков высшей водной растительности от 80% в мелких водоемах до
20% в глубоких оседают в иловые отложения. Здесь в зависимости
от трофии водоема начинается их распад с образованием метана.
Интенсивность микробиологического образования метана опреде-
ляют радиоизотопным методом по переходу 14С субстрата в метан
[Беляев, Иванов, 1975; Лауринавичус, Беляев, 1978]. Радиоактив-
ный углерод вносят в форме бикарбоната (КаН14СОз) и ацетата
натрия, меченного по метильной группе. Меченые субстраты добав-
ляют с помощью шприца.
Озерной водой или илом заполняют с соответствующими предо-
сторожностями пенициллиновые флаконы объемом по 15 мл. В один из
них сразу же добавляют 0,5 мл формалина. Флаконы герметично
закрывают.
Предварительно исходные меченые субстраты, суммарная радио-
активность которых равна 1мКи, разбавляют в 100 раз. Таким об-
разом, активность рабочих растворов составляет 10 мКи в 1 мл.
Указанные растворы вносят из расчета 0,5 мл на 15 мл озерной
воды.
Затем флакрны помещают в металлический штатив, на тросе
опускают в водоем и инкубируют сутки на той глубине, с которой
образцы были взяты для анализа.
После суточной инкубации флаконы вынимают и фиксируют, до-
бавляя по 0,5 мл насыщенного раствора КОН, который вводят
шприцем через резиновую пробку. Избыток жидкости вытесняется
через вторую иглу. Дальнейшую обработку осуществляют по схеме,
рекомендованной К.С. Лауринавичусом и С.С. Беляевым [1978].
Перед отгонкой метана в пробы вводят по 0,5 мл насыщенного
КОН. Радиоактивный метан, образовавшийся в пробах, отдувают в
течение часа воздухом со скоростью тока 50—60 мл/мин. Время пог-
лощения составляет примерно 1 ч. Далее смесь газов пропускают че-
рез Дрексель, заполненный 0,2 N раствором КОН, что позволя-
ет полностью поглотить следы радиоактивной углекислоты. За дрек-
235
селем помещают стеклянный шарик, содержащий силикагель АСК, ко-
торый, улавливая мелкие капли, служит осушителем газовой фазы.
Радиоактивный метан сжигают до 14СОг при температуре 800—900° в
присутствии окиси кобальта. На конечном этапе образовавшуюся
из метана радиоактивную углекислоту поглощают 2-фенилэтилами-
ном, растворенным в сцинтилляционной жидкости.
В состав сцинтилляционной жидкости входят 4 г РРО, 0,22 г
POPOP, 1 л толуола. Смесь, поглощающая углекислоту, составлена
из следующих компонентов: 400 мл сцинтиллятора, 330 мл 2-фенил-
этиламина, 220 мл метанола и 50 мл бидистиллированной воды.
Радиоактивность измеряют на сцинтилляционном счетчике. Эф-
фективность счета |4С в этих условиях составляет 90%.
Количество метана, образовавшегося в течение суток- за счет
разложения уксуснокислого натрия (в см3/л), рассчитывают по фор-
муле [Беляев и др., 1975]
Л1 - г CCT/Cli3OOONa 24 1,33 1,4
где г — радиоактивность образовавшегося метана, имп./(мин • л);
Сметнл/СНзОО(Жа — количество углерода метильных групп ацетата,
мг/л воды; 24 — коэффициент пересчета на 1 сут; 1,33 — коэффициент
пересчета углерода метана в метан; 1,4 — коэффициент пересчета
1 мг СН< на 1 см3 СН«; R — радиоактивность исходного аце-
тата 14CHjCOONa, имп./(мин л); t — время опыта, ч.
Общее количество метана (в см3/л), образованного микроор-
ганизмами в течение суток за счет восстановления углекислоты во-
дородом, рассчитывают согласно рекомендации С.С. Беляева и
М.В. Иванова [1975]:
М = г-Скарб-24 1,3 1,4/Л • /,
где г — радиоактивность образовавшегося метана, имп./(мин-л);
Скарб — количество углерода СОг и бикарбонатов, содержащихся в
пробе, мг/л; 24 — коэффициент перевода на 1 сут; 1,3 — коэффициент
пересчета углерода метана на метан; 1,4 — коэффициент пересчета
1 мг СН4 — на 1 см3 СН-г, R — радиоактивность исходного
бикарбоната, имп./(мин • л); t — время опыта, ч.
ГАЗОХРОМАТОГРАФИЧЕСКИЙ МЕТОД
Трубкой с делениями отбирают пробу грунта из 0—2 см блоя
колонки пробоотборника и 10 мл помещают в склянку объемом 50 мл,
предварительно продутую инертным газом. Склянку заполняют довер-
ху придонной водой и закрывают пенициллиновой пробкой с воткну-
той в нее инъекционной иглой для выдавливания избытка воды и
предохранения от попадания воздуха. Таким образом заполняют
4 склянки, 2 из которых сразу фиксируют добавлением 0,2 мл насы-
щенного раствора сулемы, остальные инкубируют в темноте при тем-
пературе водоема. Через сутки (летом в богатых илах достаточно
236
12 ч, а зимой необходимо 2 сут) опытные склянки фиксируют суле-
мой. В лаборатории в склянках создают газовую фазу. Для этого в
пробку вкалывают инъекционную иглу, подсоединенную к подушке
с инертным газом, а через другую иглу шприцем отбирают надило-
вую воду в количестве 5—10 мл. После этого склянки энергично
встряхивают 2—3 мин и дают постоять 3—4 ч для выравнивания пар-
циального давления метана в газовой фазе. После этого 0,5 мл
пробы газа анализируют на газовом хроматографе (условия подбира-
ются экспериментально) и рассчитывают содержание метана.
1. Содержание метана (в мкл) в газовой фазе склянки
т = тПроб ' Vi I V,
где тПроб — содержание метана в вводимой пробе газа, мкл; Г1 —
объем газовой фазы; V — объем пробы газа; мл.
2. Концентрация метана в илах (в мл СН4/л ила)
Л/= ИгЮОО/Иг-К
где d — коэффициент растворимости метана в воде при 20°,
равный 0,03; т — содержание метана в газовой фазе, мл; Г] —
объем жидкой фазы в склянке, мл; Иг — объем газовой фазы
в склянке, мл; V — объем пробы ила в склянке, мл; 1000 —
пересчетный коэффициент на 1 л ила.
3. Скорость образования (в мл СН^/л-сут))
ИСН4 = (М2 — М1)-24/ t,
Mi — концентрация метана в опытной склянке после инкубации,
мл/л; М2 — концентрация метана в исходной склянке, мл/л;
24 — коэффициент перевода на 1 сут; t — время инкубации, ч.
Этот метод пригоден для определения скорости образования
метана в анаэробных условиях.
ФРАКЦИОНИРОВАНИЕ ИЗОТОПОВ УГЛЕРОДА
В ПРОЦЕССАХ МЕТАНООБРАЗОВАНИЯ
В процессах метаногенеза при избытке субстратов происходит
фракционирование стабильных изотопов углерода преимущественно с
переходом легкого изотопа в метан. Степень фракционирования выра-
жается величиной о13С°/оо относительно международного стандарта
РДВ [Галимов, 1968].
Основными субстратами биогенного метанообразования в водое-
мах являются ацетат, Н2+ СОг. Ацетат и высшие жирные кислоты воз-
никают как промежуточные продукты разложения органических ве-
ществ. Высшие жирные кислоты при участии анаэробных синтрофных
бактерий разрушаются до ацетата, Нг и СОг, которые улавливаются
метаногенами. Источниками СОг для метаногенеза служат как СОг,
образованный в процессе полного окисления органического вещест-
ва, так и СОг, карбонаты и бикарбонаты неорганического происхож-
дения.
Поэтому при выявлении новообразования метана масс-спектро-
237
метрическими методами определяют изотопный состав (13С) углеро-
да метана, органического вещества и всех форм карбонатов.
Для проведения изотопного анализа углерод исследуемых об-
разцов переводят в форму, удобную для масс-спектрометрических
измерений, — СОг. Схема установки, позволяющей применять единую
методику подготовки проб — твердых, жидких, газообразных, при-
ведена в работе Э.М. Галимова [1968]. Отдельную схему установки
сжигания метана до СОг можно найти также в работе А.М. Зякуна
и др. [1979].
Полученную углекислоту, очищенную от кислорода и паров
воды, собирают в стеклянные ампулы, которые запаивают и исполь-
зуют для масс-спектрометрического анализа. Изотопный анализ
,3С/12С проводят на масс-спектрометре двухлучевым компенсацион-
ным методом, используя СОг в качестве рабочего газа. Ошибка из-
мерений не превышает ±0,2°/<ю.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА ОКИСЛЕНИЯ
МЕТАНА В ВОДЕ
Распад осевшего из водной толщи органического вещества про-
исходит с выделением метана, который поступает в воду и окис-
ляется в слое его соприкосновения с кислородом. В олиготрофных
озерах этот процесс происходит в придонном слое воды, в мезо-
трофяых и евтрофных — в слое хемоклина.
Для определения интенсивности процесса окисления метана при-
меняют высокочувствительный метод газохроматографического ана-
лиза.
Отбирают пробы воды. 4 флакона объемом по 50 мл наполняют
водой из батометра, сменяя трижды объем сливаемой воды, чтобы
избежать обогащения кислородом воздуха, и закрывают силиконо-
выми пробками, укрепляя их завинчивающимися колпачками. В кон-
трольные флаконы шприцем вводят 0,3 мл насыщенного раствора су-
лемы. Опытные и контрольные флаконы инкубируют сутки в водоеме.
По окончании инкубации пробы фиксируют сулемой. В лаборатории в
контрольные и опытные флаконы шприцем вводят по 5 мл инертного
газа, при этом избыток воды вытесняется через вторую инъекци-
онную иглу, вставленную в пробку.
Далее содержание метана определяют хроматографически в га-
зовой фазе, пренебрегая его растворимостью в воде (она равна
0,03%), и производят пересчет на 1 л воды. По разности содер-
жания метана в контрольных и опытных флаконах определяют7 ско-
рость его окисления за сутки.
ФРАКЦИОНИРОВАНИЕ СТАБИЛЬНЫХ ИЗОТОПОВ УГЛЕРОДА
ПРИ ОКИСЛЕНИИ МЕТАНА
Известно, что развитие метанотрофных бактерий сопровожда-
ется фракционированием стабильных изотопов углерода 13С, при этом
происходит обогащение остаточного метана тяжелым изотопом и
образование изотопно-легкой углекислоты. Утяжеление метана прямо
238
пропорционально степени его потребления микроорганизмами. При-
менение масс-спектрометрических методов анализа не только может
дать ценную информацию для оценки интенсивности микробиологи-
ческого окисления метана в природных экосистемах, но и позво-
ляет судить о масштабах их геохимической деятельности. Метод
был разработан А.М. Зякуном с соавт. [1979].
Масс-спектрометрический метод анализа фракционирования ста-
бильных изотопов при окислении метана микроорганизма отличает-
ся от метода, используемого для изучения метаногенеза, тем, что
анализирует соотношение 1ЭС/ПС в остаточном метане после сжи-
гания его до углекислоты. Величину изотопного состава углерода
определяют на масс-спектрометре двухлучевым компенсационным ме-
тодом с использованием COj в качестве рабочего газа [Леин и др.,
1976; Зякун и др., 1979].
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА ФИКСАЦИИ
СВОБОДНОГО АЗОТА
Фиксацию свободного азота может осуществлять широкий круг
свободноживующих микроорганизмов как в аэробных, так и в анаэроб-
ных условиях. Эффективность азотфиксации заметно возрастает при
низкой концентрации органических источников, азота в среде
пониженном парциальном давлении кислорода.
Воду из батометра наливают в склянку емкостью 65 мл, ме-
няя 2—3 раза объем воды. Склянку закрывают пробкой из силиконо-
вой резины и закручивают металлическим колпачком с двумя от-
верстиями, просверленными под инъекционную иглу. В закрытую
склянку шприцем вводят 5 мл ацетилена и 25 мкл этанола, при
этом избыток воды сливается через вторую иглу. Пробы воды
инкубируют в водоеме на соответствующих глубинах в течении 4—
12 ч и фиксируют 0,3 мл насыщенного раствора сулемы. В лабора-
тории каждую пробу воды разделяют на жидкую и газовую фазы.
Для этого склянку перевертывают и шприцем отбирают 10 мл
жидкости, при этом в склянку поступает через вторую иглу воз-
дух. Через несколько часов этилен ^вследствие его малой рас-
творимости почти полностью выделяется в газовую фазу. Коли-
чество его определяют на хроматографе в газовой и жидкой
фазах. Зная объем газовой и водной фаз в склянке, рассчиты-
вают количество образовавшегося этилена во взятом объеме воды
и пересчитывают на 1 л. Для пересчета скорости продуцирования
этилена из ацетилена на скорость фиксации азота используют
теоретическое молярное соотношение N2/C2H4, равное 3%. Зна-
чение величины образовавшегося этилена делят на 3 и принимают
за количество фиксированного азота за время опыта:
N$HKC = л- 24-1000 /6-/-3, ?
где НфИКС — фиксированный азот, ^крУл-сут); а — количество
образовавшегося этилена, мкл; 24 — коэффициент перевода на 1 сут;
1000 — коэффициент перевода на 1 л; b — объем воды, взятой
239
для анализа, мл; t — длительность инкубации пробы, ч; 3 — коэффи-
циент пересчета этилена в азот.
Фиксация свободного азота в поверхностном слое ила (0—2 см)
при наличии свободного кислорода в придонных слоях воды может
идти за счет аэробных и микроаэрофильных бактерий, таких, как
азотобактер, ксантобактер, азоспириллум и др. В этом случае в
склянку объемом 40 мл помещают 10 мл поверхностного ила, вно-
сят 0,4% этанола и создают над илом атмосферу из 5 мл аце-
тилена и воздуха.
Склянку помещают in situ в водоем или в аквариум в темно-
ту при температуре водоема.
Расчет фиксированного азота делают по приведенной выше фор-
муле, учитывая, что один объем фиксированного азота равен трем
объемам образовавшегося этилена. При определении фиксации азота
в более глубоких, анаэробных слоях ила процедура постановки
опыта та же, за исключением того, что атмосфера над илом в
склянке создается из 5 мл ацетилена и аргона, поскольку процесс
идет в анаэробных условиях.
Расчет интенсивности фиксации азота ведут по той же форму-
ле, а количество образовавшегося этилена определяют на хромато-
графе.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА
НИТРИФИКАЦИИ
Чтобы оценить значение биологического процесса, необходимо
количественно измерить его интенсивность in situ. Ранее лока-
лизацию процесса нитрификации в водоеме оценивали путем опреде-
ления "нитрификационной способности”. Для этого в образец воды
или ила вносили NtUMgPO* и через 2—3 нед определяли коли-
чество образовавшихся нитритов или нитратов. Такой подход носит
чисто качественный характер и не дает действительного представ-
ления об интенсивности процесса нитрификации в природе.
В дальнейшем Такахаши и Сайо [Takahashi, Sajio, 1981] для
определения интенсивности процесса нитрификации в оз. Хизаки
применили метод стабильных изотопов, измерив изменение соотно-
шения в изолированной пробе воды 15N/!4N. Этот метод тре-
бует применения сложной аппаратуры.
В последние годы были предложены новые методы измерения
интенсивности процессов нитрификации путем применения ингибито-
ров. Перспективные возможности определения скорости автотрофной
нитрификации открывает радиоуглеродный метод с использованием
специфического ингибитора литотрофного окисления аммония в виде
спиртового раствора N-Serve (коммерческое название нитрапирина).
Впервые этот метод для определения нитрификации в донных
отложениях был предложен Билленом [Billen, 1976] и применен
Сомвиллом [Somville, 1978] для исследования автотрофной нитрифи-
кации в водной массе.
240
Метод был откорректирован А.И. Сараловым [Кузнецов и др.,
1985] и применен на ряде озер для определения интенсивности
процессов нитрификации. Сущность метода состоит в том, что
измеряется убыль интенсивности темновой фиксации СО: в парал-
лельных пробах с добавками 5 мг/л нитрапирина (см. раздел
’’Применение ингибиторного анализа...”) и без него, затем по раз-
ности рассчитывается скорость окисления аммония до нитритов или
нитратов, исходя из весового соотношения:
NoxHcn/CaccMM = 8,3 — при окислении NH4 до NOj;
^окисл/^ассим = Ю — при окислении NH4 ДО NOL
Действие нитрапирина было испытано А.И. Сараловым на куль-
турах бактерий, природных образцах воды и озерного ила. Он при-
шел к заключению, что с помощью этого ингибитора можно оце-
нить порядок величин активности нитрификации в поверхностном
окисленном слое донных отложений и в металимнионе мезотрофных
и евтрофных озер.
Однако для использования этого метода имеется ряд ограни-
чений.
1. Внесение нитрапирина не должно усиливать активность мик-
робного ценоза, т.е. увеличивать темновую ассимиляцию СО: по
сравнению с контролем. Подобное явление иногда наблюдается в ме-
талимнионе мезотрофных озер при содержании в воде от 0,1 до
б мг Ог в 1 л.
2. При внесении в воду или грунт 0,04% этанола ассимиляция
углекислоты по сравнению с контролем не должна увеличиваться
более чем на 25%.
3. Применение метода ограничено в случаях, когда в воде или
иловых отложениях идет восстановление сульфатов или окисление
восстановительных соединений серы хемолитотрофными организмами,
так как на них нитрапирин также оказывает ингибирующее действие.
Следует также иметь в виду, что степень ингибирования про-
цесса нитрификации нитрапирином зависит не только от штамма нит-
рификатора и степени его адсорбции илом, но также и от метаболи-
ческой активности клеток [Powell, Pressor, 1986].
Подробное обсуждение методов, применяемых при изучении про-
цессов нитрификации и денитрификации и экологии участвующих в
них организмов, приведено в обзоре Кьюнена и Робертсон [Kuenen,
Robertson, 1987].
Ход определения интенсивности процесса нитрификации. Пробу
воды из батометра разливают в 3 флакона объемом по 42 мл, внося в
каждый по 24 мл испытуемой воды или ила, и вводят по 1 мл ра-
диоактивного раствора ЫаН|4СОз, имеющего радиоактивность 1 мкКи.
В первый флакон добавок не вносят, во второй добавляют 0,04%
этанола от объема пробы (0,1 мл), в третий добавляют 5 мг/л
препарата нитрапирина в виде 0,04%-го раствора в этаноле.
Пробы инкубируют в черных мешках на соответствующих глуби-
нах в течение 12—14 ч. После экспозиции пробы воды фиксируют
добавлением 0,3 мл 40%-го формалина, а пробы ила — 0,8 мл того
16. Зак. 1766
241
же раствора. Каждую пробу фильтруют через мембранный фильтр
площадью 7,1 см2 с диаметром пор 0,21 мкм. Образец воды
отфильтровывают полностью.
Образец ила разводят до 50 мл, дают отстояться 1,5—2 мин
и отфильтровывают 1 мл. Для быстроты удаления радиоактивных
карбонатов, не включенных в тела бактерий, в воронку с пробой
добавляют НС1 до конечной концентрации О,1 N. Обработка щелочью
для отделения бактерий от частичек ила полностью исключается,
так как она вымывает из бактериальных тел жироподобные вещества.
Помещают фильтры на фильтровальную бумагу, увлажненную 0,3 N
раствором НС1 для удаления иСОг. Далее фильтры отмывают
от изотопа, просушивают и активность проверяют под сцинтилля-
ционным счетчиком.
Разность между активностями ассимиляции СОз с этанолом (А) и
ингибитором (Б), выраженную в углероде, умножают на 10, при-
нимая эту величину за скорость окисления аммонийного азота (И).
Такой расчет производят, если при проведеиии опытов соблюдали
указанные ограничения (1, 2):
М = (А—Б) -24* IO"’- 10/rv,
где М — интенсивность процесса нитрификации, мг N/Orcyr);
А — темновая ассимиляция СОз в пробе с этанолом, мг С/л; Б — тем-
новая ассимиляция СОг гетеротрофной микрофлорой в пробе с нитра-
пнрнном, мг С/л; 24 — коэффициент пересчета на 1 сут; 10э — коэф-
фициент пересчета на 1 л; 10 — коэффициент пересчета на азот;
/ — длительность опыта, ч; v — объем пробы для анализа, мл.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА
ДЕНИТРИФИКАЦИИ
Метод определения скорости денитрификации основан на исполь-
зовании ацетилена в качестве специфического ингибитора N2O-pe-
дуктазы [Yoshinari, Knowles, 1976].
Пробы воды из батометра наливают в склянку емкостью 65 мл,
сменяя 2—3 объема воды. Склянки закрывают пробкой из силиконо-
вой резины, поверх которой накручивают пластмассовый колпачок
с двумя отверстиями под инъекционную иглу.
Шприцем через пробку вводят 5 мл ацетилена. При этом излишек
испытуемой воды выливается из склянки через вторую инъекционную
иглу. Склянки помещают в черный мешок и инкубируют в водо-
еме от 8 до 12 ч на той глубине, с которой была взята вода для
анализа. По истечении инкубации пробы фиксируют 0,3 мл насы-
щенного раствора сулемы. В лаборатории склянки приводят к тем-
пературе 20°, из каждой отбирают 0,5 мл газа и анализируют
содержание NjO на газовом хроматографе.
Производят расчет образовавшейся NzO, учитывая растворимость
ее в объеме воды в пробе, в 5 мл газообразной фазы над водой и
далее производят пересчет на 1 л воды.
242
В случае анализа образования NzO в иловых отложениях доба-
вочно вводят коэффициент абсорбции N2O илом, учитывая объем
введенного ила. Коэффициент абсорбции для торфянистых илов равен
0,9, а для речных песков — 0,41- [Крылова, 1984]. При этом
количество N2O, накопившейся в пробе в течение эксперимента,
эквивалентно количеству N2 + N2O, образовавшихся в результате де-
нитрификации.
Следует заметить, что даже низкие концентрации ацетилена ока-
зывают ингибирующее действие на литотрофные нитрифицирующие
бактерии, окисляющие аммоний до нитритов. Поэтому в методе
ингибирования ацетиленом ЫгО-редуктазы исключено завышение ре-
зультатов денитрификации за счет процесса автотрофной нитрифи-
кации. Однако при низком содержании нитратов или нитритов в
водоеме, при исчерпании пула этих соединений, ингибирование
нитрификации приводит к занижению величин денитрификации.
При использовании этого метода необходимо ограничивать продол-
жительность инкубирования проб ила, так как этилен может восста-
навливаться до этанола в процессе фиксации азота или разрушаться
биологически специфической микрофлорой. Следует иметь в виду,
что ацетилен не ингибирует процесс в присутствии в пробе суль-
фида [Evans et al., 1985].
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ
ПРОЦЕССА РЕДУКЦИИ СУЛЬФАТОВ И СЕРЫ
РАДИОИЗОТОПНЫМ МЕТОДОМ
Метод краткосрочных опытов с изолированными образцами воды
или ила позволяет исследовать деятельность микроорганизмов не в
питательной среде, а в естественных условиях обитания. В течение
всего краткосрочного опыта сульфатредуцирующие бактерии прояв-
ляют свою деятельность в условиях естественного биоценоза при
естественных концентрациях питательных веществ и при тех же
температурных условиях, что и в водоеме. Применение меченого
сульфата позволяет определить наличие процесса сульфатредукции
и учесть его активность, а высокая чувствительности изотопного
метода дает возможность установить ничтожно малые изменения в
соотношении сульфатов и сероводорода, измеряемые сотыми и ты-
сячными долями миллиграмма на 1 л. Метод предложен М.В. Ива-
новым [Иванов, 1956, 1964; Иванов, Теребкова, 1959].
Интенсивность сульфатредукции определяют в изолированных мо-
нолитах грунта в стеклянных трубках, закрытых герметично резино-
выми пробками. В одну из пробок вставляют стеклянную трубочку
с надетым отрезком резинового шланга. В иловые монолиты с
помощью шприца с длинной иглой вводят раствор Nal’SOj с общей
активностью 1—5 мкКи на навеску ила около 40 г.
Пробы ила с радиоактивным сульфатом инкубируют при темпера-
туре, близкой к естественной,в течение!—2 сут. По окончании экспози-
ции сероводород фиксируют 3,5%-м уксуснокислым кадмием в 4%-й
243
3
Рис. 29. Прибор для отгоняя сероводорода кислоторастворимых сульфидов
1 — реакционный сосуд; 2 — поглотитель с шариковым обратным холодиль-
ником; 3 — кран для подсоединения к инертному газу; 4 — капельница для НС1; 5 — кран
или зажим для регуляции скорости продувания газом; 6 — кран для наполнения
раствором поглотителя; 7 — бутыль с раствором уксуснокислого кадмия; 8 — шланг для
подсоединения к вакууму
уксусной кислоте. Образовавшийся сульфид кадмия отгоняют после
подкисления соляной кислотой в 0,05 N раствор перманганата ка-
лия в 0,05 N щелочи. Предварительно взвешиванием определяют
навеску ила. Отгонку ведут в приборе, показанном на рис. 29, после
удаления кислорода продуванием инертным газом.
Если в исходной пробе содержалось мало H2S (нс более 10 мг/л),
в колбу аппарата для отгонки добавляют носитель — примерно
30 мг/л HiS..
Содержимое отгонной колбы доводят до кипения и кипятят
30 мин, при этом образовавшийся сульфид разлагают добавлением
водного раствора НС1 (3:1). С током инертного газа (аргон,
азот и др.) освободившийся сероводород переводят в приемник,
содержащий поглотитель — 10%-й раствор NaOH. Приемник снабжен
дополнительной поглотительной склянкой с раствором уксуснокис-
лого кадмия. Затем, добавляя в поглотитель, 3,5%-й раствор аце-
тата кадмия в уксусной кислоте, получают осадок CdS. Если осадка
мало, его собирают на мембранном фильтре с диаметром пор 0,3 мкм,
который помещают во флакон со сцинтилляционной жидкостью, со-
244
держащей толуол, 4—6 г/л РРО и 0,1—0,5 г/л РОРОР. Сумму этих
компонентов разводят в тритоне Х-100.
Если осадка много, его окисляют перекисью водорода до суль-
фата кадмия. 1 мл раствора помещают в 5 мл жидкости Брея, где
в 1 л диоксана растворено 100—150 г нафталина. Радиоактивность
серы образовавшегося сероводорода подсчитывают на спинтилля-
дионном счетчике. Определяют общую радиоактивность пробы, внося
1 мл надосадочной жидкости из перегонной колбы во флакон с
10 мл сцинтилляционной жидкости. Содержание сульфатов в пробе
иловой или природной воды определяют методом титрования с
ализарином ”S” в качестве индикатора (метод приведен далее в
этом разделе).
Определение суточной интенсивности процесса сульфатредукции
(в мг S / (кг-сут)) производят по формуле
Sh2s = г' Ssoi - 24 / ^soi- * t,
где г — радиоактивность новообразованного сульфида в пробе,
имп./мин; S$ol~ — содержание серы сульфатов в пробе, мг/л; 24 —
пересчет на 1 сут; /?sof — радиоактивность сульфатов, внесенных
в пробу (общая радиоактивность); имп./мин; t — время опыта, ч.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ СУЛЬФАТРЕДУКЦИИ
И ДИАГЕНЕТИЧЕСКОГО ПРЕОБРАЗОВАНИЯ
СЕРОВОДОРОДА
Приведенный выше метод дает возможность определять коли-
чество кислоторастворимых сульфидов, образовавшихся в пробе за
время экспозиции с эОГ. Однако восстановление сульфатов микро-
организмами является лишь начальным звеном биогеохимических реак-
ций, происходящих при диагенезе донных осадков.
Установлено, что даже в краткосрочных опытах значительная
часть образовавшегося сероводорода переходит в другие сернистые
соединения — элементную серу, пирит, серу органических соедине-
ний, причем определяемое приведенным выше методом содержание
фракции кислоторастворимых сульфидов может иногда не превышать
1% сероводорода, новообразованного за время опыта.
Для учета всех форм восстановленной серы, образованной бак-
териями из сульфата, разработан метод прямого определения интен-
сивности диагенетического перераспределения сульфидной серы, об-
разованной прн сульфатредукции [Иванов и др., 19751» Разделение
различных форм серы из пробы после экспозиции с проводят
по схеме, разработанной И.И. Волковым и Н.Н. Жабиной [1975], из-
меняя конечные этапы определения путем перевода соединений серы
в форму, удобную для подсчета радиоактивности.
Работы И.И. Волкова и Н.Н. Жабиной [1975] по совершенство-
ванию методов превращения соединений серы в сероводород поз-
волили значительно упростить определение элементной и особенно
пиритной серы путем применения солей двухвалентного хрома. В
присутствии СгСЪ в солянокислом растворе происходит количест-
245
венное восстановление элементной серы до HzS и количественное
разложение пирита с выделением сероводорода.
Приготовление CrCh. Раствор CrCh получают восстановлением
СгСЬ (ч.д.а.), содержащего 40—50 мг Сг в 1 мл и подкисленного
до 0,5 N НС1, на амальгамированном цинке. Навеску 152,7 г
CrCh растворяют в 1 л 0,01 N НС1 и отфильтровывают. Берут
270 мл приготовленного раствора CrCh, доводят до 300 мл кон-
центрированной НС1 и заливают амальгамированный цинк, через 15—
20 мин трехвалентный хром восстанавливается до двухвалентного и
раствор становится голубым.
Схема определения различных соединений серы при исследова-
нии интенсивности диагенетического преобразования продуктов суль-
фатредукции приведена на рис. 30. Схемы приборов для проведения
анализов изображены на рис. 31, 32.
Разделение различных форм меченой серы. После взвешивания
пробу, экспонированную с NaPsCh и зафиксированную кадмием,
помещают в перегонную колбу, подкисляют и сероводород отго-
няют в приемник с ацетатом кадмия. Осадок CdS из аликво-
ты или всей пробы отфильтровывают на ядерном фильтре, и актив-
ность 3SS/HaS подсчитывают на счетчике, как указано выше.
После отгонки содержимое колбы отмывают от сульфатов на
воронке большим количеством воды, контролируя полноту отмывки
путем подсчета радиоактивности промывных вод. Промывные воды
собирают в мерную посуду и 0,05 мл выпаривают на подложке для
подсчета радиоактивности сульфата.
Элементную серу экстрагируют в аппарате Сосклета (см. рис. 31)
ацетоном, экстракт собирают в мерную колбу, отбирают 0,25—1 мл
раствора, выпаривают на медной подложке и определяют 35S°.
Пиритную, а затем серу органических соединений последовательно
восстанавливают до сульфидной с помощью CrCh и осаждают в
виде CdS. Для этого осадок после экстракции элементной серы
'высушивают для удаления ацетона и помещают в реакционную колбу
аппарата для разложения пирита (см. рис. 32). После удаления
воздуха вводят 50 мл CrCh через капельную воронку и 20 мл
НС1 (d=l,19). Продувают инертный газ в течение 10—15 мин без
подогрева, затем — при кипячении 30 мин, с поглощением образо-
вавшегося HiS в раствор ацетата кадмия. Радиоактивность CdS,
осажденной на фильтре, определяют под счетчиком.
Для определения радиоактивности серы, включенной в состав
органического вещества, ее переводят в сульфаты. С этой целью
остаток после отгонки пиритной серы помещают на фильтр "белая
лента", отмывают от CrCh водой, подкисленной НС1, и высушивают
в сушильном шкафу. К сухому остатку в стакане приливают 20—
30 мл концентрированной HNO3, прибавляют несколько кристал-
лов КМ11О4 и кипятят, упаривая почти досуха, затем высушивают
и операцию повторяют. Затем остаток обрабатывают смесью брома
с четыреххлористым углеродом и азотной кислотой, удаляют из
пробы нитраты многократным упариванием пробы с НС! подсчиты-
вают R сульфатов, как описано выше.
247
Рис. 31. Праборы для определения элементной серы [Волков, Жабина, 1975]
а — экстрактор системы Н.И. Червякова для определения элементной серы (аппарат
Соксклета): 1 — колба, 2 — патрон, 3 — холодильник, 4 — сборник для отгонки
растворителя; б — прибор для определения серы: 1 — реакционная пробирка с подво-
дящей н отводящей трубками, 2 — пробирка с раствором поглотителя, 3 — шарообраз-
ная воронка
Рис. 32. Прибор для определения пиритной серы [Волков, Жабина, 1975]
J —длинногерлая круглодонная колба (объем 150 мл, диаметр горла 22 мм, высота
320 мм); 2 — пробирка (диаметр 24 мм, высота 235 мм); 3 — шариковый обрат-
ный холодильник; 4 — капельная воронка с краном и газопроводящей трубкой,
доходящей почти до дна реакционного сосуда; 5, б — поглотители сероводорода,
заполняемые раствором ацетата кадмия в случае йодометрического окончания титрования
Суммируя величину радиоактивности всех форм серы, опреде-
ляют общую величину интенсивности сульфатредукции.
Количество новообразованной серы в различных формах рассчи-
тывают по формуле
®пир О’' Sso<)/(^' J )>
где Зпир — количество образовавшейся в опыте пиритной серы,
мг/(кг-сут): г — радиоактивность пирита в конце опыта, имп./мин;
R — общая радиоактивность сульфатов, имп./мин; t — время
опыта, сут; Sso4 — содержание серы сульфатов в пробе, мг/л.
Точно так же проводится расчет других форм серы.
Определение сульфатов методом прямого объемного титрования
[Заваров, 1957]. Метод заключается в титровании сульфатов в
30—40%-м растворе спирта или ацетона хлористым барием в присут-
ствии адсорбционного индикатора ализарина красного ”S” Ионы
бария образуют с ним непрочное комплексное соединение красного
цвета. Титрование сульфатов хлористым барием заканчивают при
248
переходе окраски от желтой в розовую при появлении избытка ионов
Ва, осаждающихся на BaSO4. Титрование ведут при низком pH, так
как этот индикатор является также кислотно-основным с переходом
окраски от желтой в кислой среде к розовой в интервале pH 3,7—
5,2. Конец титрования хорошо улавливается только в смеси воды с
ацетоном, метиловым или этиловым спиртом, при оптимальном содер-
жании последних вконце 30—40%. При более высоком содержании
медленно наступает равновесие. Определению мешают Са2+ и Mg2* в
концентрации выше 3000 мг/л. В случае необходимости пробу раз-
водят дистиллированной водой в 10 раз.
Ход анализа. К 25 мл испытуемого раствора, содержащего не
более 0,3—0,5 г солей, добавляют 15 мл ацетона, 5 капель ализа-
рина ”S” и 2 мл бариевой суспензии. Затем вводят концентри-
рованную уксусную кислоту до перехода розовой окраски в жел-
тую с палевым оттенком и добавляют еще 1 мл избытка до перехода
цвета в лимонно-желтый.
Медленно при перемешивании титруют раствором хлористого ба-
рия до появления розового оттенка (на белом фоне).
Из количества хлористого бария, пошедшего на титрование, вычи-
тают индикаторную поправку, находимую холостым титрованием дис-
тиллированной воды вместо пробы.
Расчет производят согласно формуле
Na2SO4 + ВаС12 = BaSO4 + 2NaCl.
1 мл 0,02 N ВаСЪ соответствует 0,32 мг S/SO4 в пробе или
0,96 мг SO2-. Мешающие определению H2S, Na2S2Oj и другие вос-
становленные соединения следует предварительно окислить в той же
пробе титрованием йодом (до тетратионата) в кислой среде.
Необходимые реактивы. Ализарин красный "S” — 0,2%-й водный
раствор, ВаС12 — 0,02 N раствор, ацетон, уксусная кислота ледяная.
Бариевую суспензию готовят путем смешивания 1 л раствора
Na2SO4, содержащего 8,87 г Na2SO4 (безводной соли), и 1 л раствора
ВаС12, содержащего 15,25 г ВаС12. Через сутки отстоявшуюся жид-
кость сливают, взмучивают осадок в 2 л воды, отстаивают и вновь
сливают. К полученной кашице добавляют 2,5 г ацетата магния и
разводят водой до 100 мл. Определяют бариевую поправку в холостом
титровании хлористым барием 2 мл суспензии, добавленной к 25 мл
дистиллированной воды. Конец титрования определяют по переходу
цвета осадка от желтого к бледно-розовому.
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ РЕДУКЦИИ ЭЛЕМЕНТНОЙ СЕРЫ
Интенсивность редукции элемеитной серы до сероводорода в
грунтах определяют с помощью меченой элементной серы 33S°. Схема
опытов аналогична описанной для определения интенсивности суль-
фатредукции, с той разницей, что вместо 33SO4‘ вводят 33S° из расчета
1—5 мкКи на 10—20 г пробы ила.
В опытах по определению сероредукции целесообразно исполь-
зовать свежеосажденную меченую аморфную серу. Ее получают из
раствора меченого тиосульфата Na”SjOj путем подкисления соля-
249
ной кислотой с последующим тщательным отмыванием свежеосажден-
ной серы на фильтре насыщенным раствором NaCl. Отмытую тон-
кодисперсную серу суспендируют в стерильной воде из расчета со-
держания около 0,5 мг/мл с удельной активностью 10—20 мкКи/мл.
В каждую пробу ила вносят по 0,1 мл суспензии тонкодисперсной
серы, что составляет 1—5 мкКи на пробу.
При отгонке H2S из осадка CdS в качестве поглотителя можно
использовать смесь-Р-фенилэтиламин+метанол+ЖС-106 в соотношении
1:1:3. Радиоактивность поглотителя измеряют на жидкостном сцинтил-
ляционном счетчике.
Готовый препарат, меченой серы 35S° можно вводить в образец
грунта в виде полисульфида [Бонч-Осмоловская и др., 1988]. Способ
его приготовления указан в разделе "Сероредуцирующие бактерии”
При использовании полисульфида достигается равномерное распреде-
ление меченой серы в образце. Однако в сильно восстановленной
среде не происходит полного перехода полисульфида в серу, что может
приводить к занижению полученных результатов.
ФРАКЦИОНИРОВАНИЕ СТАБИЛЬНЫХ ИЗОТОПОВ СЕРЫ
ПРИ БАКТЕРИАЛЬНОЙ СУЛЬФАТРЕДУКЦИИ
Известно, что при бактериальном восстановлении сульфатов в
илах происходит обогащение изотопом 34S остаточных сульфатов
иловых вод по сравнению с изотопным составом морской воды. В
восстановленных соединениях серы накапливается изотоп 32S. Поэтому
степень разделения изотопов восстановленных форм серы и исход-
ных сульфатов, выражаемая величиной a34 S, служит индикатором их
микробиологического происхождения.
Для анализов необходимо иметь достаточно большой объем пробы.
Обработку образцов производят немедленно после извлечения осад-
ка. Пробу фиксируют уксуснокислым кадмием, и в дальнейшем в
лаборатории производят выделение различных форм серы. Выделение
сульфата из иловой воды можно осуществлять в виде ВаБОд. С
этой целью твердую фазу пробы отделяют на воронке Бюхнера с
фильтрами "Сынпор” с помощью вакуумного насоса. Фильтрат упа-
ривают, подкисляют НС1 до pH 2—3 и осаждают хлористым барием.
В случае высокого содержания сульфидов в пробе сульфат на
изотопный состав выделяют после предварительной отгонки этих
кислоторастворимых сульфидов.
Твердую фазу осадка высушивают при 60° и используют для
выделения пирита в лаборатории.
Для извлечения пирита применяют метод гравитационного раз-
деления образца в тяжелой жидкости с плотностью 3,33 г/см2 и на
угловой центрифуге Т-23.
Для выделения всех форм серы могут быть использованы и хи-
мические методы, разработанные И.И. Волковым и Н.Н. Жабиной
[1975] (см. раздел ’’Определение интенсивности сульфатредукции...”).
Изотопный состав сульфатов, моносульфидов + сероводорода и пи-
рита определяют масс-спектрометрически [Назина и др., 1988].
250
ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ ПРОЦЕССА ОКИСЛЕНИЯ
ВОССТАНОВЛЕННЫХ СОЕДИНЕНИЙ СЕРЫ
РАДИОИЗОТОПНЫМ МЕТОДОМ
Окисление сероводорода и сульфидов натрия или кальция, ко-
торые чаще всего встречаются в природных водах, может происхо-
дить химически кислородом воздуха, а также биологически за счет
деятельности тионовых бактерий или фотосинтезирующих и бесцвет-
ных серобактерий.
Тионовые бактерии и бесцветные серобактерии ведут окисление
сульфидов как в темноте, так и на свету. Пурпурные и зеленые
серобактерии используют сероводород как донор водорода в про-
цессе аноксигенного фотосинтеза, поэтому процесс этот может идти
только на свету в отсутствие кислорода воздуха.
Заводской препарат сульфида натрия (Nal5S) часто бывает за-
грязнен мечеными сульфатами Naz35SO4, поэтому перед постановкой
опытов его следует очищать перегонкой в щелочь из подкислен-
ного раствора.
Схема проведения опытов была разработана М.В. Ивановым [1959].
В изолированный объем испытуемой воды вводят меченный по сере
сульфид натрия, а в конце опыта (через сутки) определяют коли-
чество образовавшихся меченых сульфатов и молекулярной серы.
С каждым образцом воды ставят три варианта опыта. Схема опреде-
ления интенсивности процессов окисления сульфидов в естествен-
ных водоемах приведена ниже.
Вариант опыта
(.Светлая склянка
без формалина
2. Светлая склянка
с формалином
или хлороформом
3. Темная склянка
без формалина
Процесс, происходящий в склянке
Сероводород окисляется химическим путем, тионо-
выми бактериями, бесцветными и окрашенными серо-
бактериями
Сероводород окисляется только химическим путем,
так как микрофлора убита
Сероводород окисляется химическим путем, тионо-
выми и бесцветными серобактериями. Окрашенные
серобактерии неактивны, так как отсутствует свет
Выполняют следующую последовательность операций (рис. 33).
1. Воду из водоема отбирают с определенной глубины пласт-
массовым батометром Руттнера. Из одного батометра заполняют три
склянки из белого стекла с притертыми пробками объемом 60—150 мл.
В каждую склянку пипеткой со шприцем вносят 1 мл раствора Naz 5S
с удельной радиоактивностью 0,3—0,5 мкКи. В первую склянку одно-
временно с изотопом вносят 1 мл 40%-го раствора формалина, вто-
рую помещают в черный мешочек, третью оставляют на свету.
2. Склянки закрывают притертыми пробками и помещают на соот-
ветственную глубину в водоем на 24 ч. При определении окисления
HzS лишь в темноте (см. выше, вариант 3) пробы инкубируют в
аквариуме в темноте при температуре воды в водоеме.
3. По окончании опыта сразу после извлечения склянок из
водоема остаточные сульфиды во всех склянках фиксируют раствором
251
Рис. 33. Анализ форм серы, образовавшихся при окислении меченого сульфида
уксуснокислого кадмия и в таком виде доставляют в лабораторию.
Анализ серы производят по прилагаемой схеме.
4. Часть воды из каждой склянки фильтруют через мембранный
фильтр и промывают его слабым раствором сернокислого натрия.
Сульфаты проходят через фильтр, а на фильтре остаются меченые
сульфиды, образовавшаяся внеклеточная и внутриклеточная меченая
элементная сера бесцветных сероокисляющих и фотосинтезирующих
серобактерий. Общую их радиоактивность определяют под сцин-
тилляционным счетчиком.
5. Параллельный фильтр с осадком из той же склянки обраба-
тывают бензолом, в результате молекулярная сера растворяется и
активность Cd35S вновь определяется под счетчиком. Количество
образовавшейся молекулярной серы рассчитывают по разности актив-
ности фильтров без обработки и после обработки бензолом.
6. Фильтрат подкисляют соляной кислотой, и сульфаты в нем
осаждают 10%-м раствором хлористого бария. Осадок сернокислого
бария отфильтровывают на мембранном фильтре, и его активность
определяют под счетчиком. При этом через фильтр проходят колло-
идная сера и тиосульфат. Их окисляют перманганатом до SOi".
С этой целью в колбочку с фильтратом вносят 2 мл 5%-го раство-
ра КМпОд, 0,5 мл НС1 (1:2) и 1 мл 10%-го раствора BaClj. Смесь
кипятят и обесцвечивают перекисью водорода. Осадок Ba35SO4 отфиль-
тровывают, определяют его радиоактивность и пересчитывают на сумму
коллоидной серы и тиосульфата.
7. Из второй порции испытуемой воды (см. выше, вариант 2
опыта) после растворения серной кислотой осадка сернистого кад-
252
мия сероводород отгоняют в 0,1 N раствор щелочи или 0,05 N йода.
Общее количество сероводорода в отгоне определяют йодометрически
титрованием и пересчитывают на серу. Отгон из контрольной склян-
ки показывает исходное количество сероводорода, которое подвер-
галось окислению.
Общую радиоактивность сульфида, добавленного в пробу, опре-
деляют в виде Cd3SS после осаждения сульфидов уксуснокислым
кадмием из определенного объема воды контрольной склянки. Радио-
активность Cd’5S определяют под сцинтилляционным счетчиком.
Расчет интенсивности окисления сероводорода до молекулярной
серы или до сульфатов производят по формулам
S° = fS SH;S ' 24 / ^H2S ' t
Ssor = rsof ’ sh2s' 24 / ^HjS ’ 1
где S° — общее количество образовавшейся молекулярной серы,
мг 8/(л сут); — общая радиоактивность молекулярной серы,
образовавшейся за счет окисления сульфидов тионовыми бактериями,
мкКи/мин на всю пробу (или имп./мин); Sh2s — общее коли-
чество сульфидов в пробе, мг S/л; 24 — пересчет на сутки;
t — время инкубации пробы, ч; Ssoi’ — общее количество обра-
зовавшегося сульфата в результате окисления сульфидов, мг 5/(л-сут);
rso«' — общая радиоактивность серы образовавшихся сульфатов,
мкКи на всю пробу (или имп./мин); /?h2S — общая радиоактивность
добавленного сульфида.
ПРИЛОЖЕНИЕ
МИКРОЭЛЕМЕНТЫ И ВИТАМИНЫ,
ВХОДЯЩИЕ В СОСТАВ ПИТАТЕЛЬНЫХ СРЕД
В большинство питательных сред приходится вносить в качест-
ве биостимуляторов растворы микроэлементов или витаминов.
Дрожжевой автолизат
Для приготовления дрожжевого автолизата к 2 кг прессованных
дрожжей добавляют 2 л водопроводной воды, прокипяченной и остужен-
ной до 60°, смешивают в гомогенную массу и нагревают на водя-
ной бане до 49—50°. Далее среду ставят в термостат при 50° на
72 ч, после чего нагревают 30 мин в автоклаве при 105° и фильт-
руют. Прозрачный фильтр содержит 0,9% азота. Затем осадок раз-
водят в 1200 мл воды и снова фильтруют. Обе жидкости сливают
вместе. При этом содержание общего азота равняется 0,6—0,8%.
Жидкость нейтрализуют до pH 6,8, разливают по небольшим колбоч-
кам и стерилизуют 15 мин при 115°.
W 1. Раствор микроэлементов по Пфеннигу [Pfennig. 1969]
ЭДТА 1.5 г
Модифицирован- 6 мл
ный раствор
микроэлементов
Хогланда
(раствор N 2)
FeSO4-7H2O 200 мг
ZnSO4-7H2O 100 мг
МпС12-4Н2О 20 мг
Вода дистилли- 1000 мл
рованная
N 2. Модифицированный раствор микроэлементов по Хогланду
(цит. по'. [Collins. /9(59])
AlCh KI 1 г 0,5 г NiCI2 . CoCh 1 г 1 г
КВг 0,5 г SnCl2-2H2O 0,5 г
LiCl 0,5 г BaCI2-2H2O 0,5 г
МпС12-4Н2О 7 г Na2MoO4 2H2O 0,5 г
Н>ВОз 11 г NaVOj 2H2O 0.1 г
ZnCI2 1 г Вода дистиллиро- 3600 мл
CuCI2 1 г ванная
Каждую соль растворяют отдельно в дистиллированной воде. Перед
смешиванием реакцию каждого раствора устанавливают ниже pH 7.
Общий объем всех растворов доводят до 3600 мл. Конечная реакция
pH всего раствора должна быть около 3—4. Перед употреблением
раствор должен быть тщательно перемешан.
.V 3. Видоизмененный солевой раствор Хатнера
[Cohen-Bazire el al., 1957]
Нитрилтриуксусная 10 г FeSO4-7H2O 90 мг
кислота Раствор металлов 50 мл
MeSO4 -7H20 29,7 г N ”44"
СаС12-2Н2О 3,3 г Вода дистиллиро- 1000 мл
Na2MoO4-2H2O 12.7 мг ванная
Нитрилтриуксусная кислота сначала нейтрализуется раствором
254
КОН. Затем указанные соли добавляются прежде, чем pH будет дове-
дено до 7,2 раствором КОН или H2SO4. Объем доводят до 1000 мл
дистиллированной водой.
N 4. Раствор металлов Н”44”
ЭДТА 250 мг CuSO4-5H2O 39,2 мг
ZnSOvJHzO 1095 мг C0CI2 • 6Н2О 20,3 мг
FeSO4-7H2O 500 мг Na2B4O7 - ЮН2О 17,7 мг
MnSO4 • HjO 154 мг Вода дистиллированная 100 мл
Чтобы предохранить соли от осаждения, в воду добавляют несколько
капель H2SO4 и доводят объем дистиллированной водой до 100 мл.
N 5. Раствор микроэлементов SL7 по Видделю и Пфеннигу
[Widdel, Pfennig, 1982]
HCI, 25%-й 10 мл Н3ВО5 62 мг
раствор Na2MoO4-2H2O 36 мг
FeCh'4H2O 1,5 мг Nia2-6HjO 24 мг
СиОг-бНгО 190 мг СаСЬ-гНгО 17 мг
МпС12-4Н2О 100 мг Вода дистиллированная 1000 мл
ZnCh 70 мг
Сначала хлорид железа растворяют в НС1. Остальные элементы вно-
сят после добавки дистиллированной воды. Стерилизуют раствор и
доводят до pH 7,1 стерильными растворами NazCOa или НС1.
N 7. Набор микроэлементов Хогланда по Пфеннигу и Липперту
[Pfennig, Lippert, 1966]
ЭДТА 500 мг СиСЬ 1 мг
FeSO< 7НгО 200 мг МЮг-ЖО 2 мг
ZnSO4 7Н2О 10 мг Na2MoO.- 2Н2О 2 мг
МпОг' 4 НгО 3 мг или (NH4)2MoO4 1,9 мг
HjBO3 30 мг Вода дистиллиро- 100 мл
СоСгбНгО 20 мг рованная, подкис-
ленная НС1 до
pH 3—4
Стерильный раствор добавляют из расчета 1 мл на 1000 мл среды.
N 8. Раствор микроэлементов Колвелла
[Caldwell et al., /976]
ЭДТА 1000 мг NajMoO.^HiO 0,35 мг
MnSO. • Н2О 22 мг СоСк-бНгО 0,46 мг
ZnSO4 ' 7Н2О 5 мг FeCl3 2,8 мг
HjBOj 5 мг Вода дистиллиро- 1000 мл
C11SO4 0,16 мг ванная
Общие указания по приготовлению растворов витаминов
Ниже приведен ряд прописей комплексов витаминов, используемых
в различных питательных средах. Однако смесь витаминов не может
храниться более одной недели. Для длительного хранения целесо-
образно готовить по крайней мере три раствора, содержащие необхо-
димый комплекс витаминов. Это обусловлено различной устойчивостью
витаминов к кислотности среды. Рекомендуется готовить растворы
витаминов следующим образом.
255
Тиамин и пантотеновую кислоту растворяют в дистиллированной
воде, подкисленной соляной кислотой до pH 3.
Биотин, и-аминобензойную кислоту растворяют в 0,1 N раство-
ре NaOH.
Указанные растворы витаминов не теряют активности в течение
года.
Стерилизацию растворов осуществляют фильтрацией через мем-
бранные фильтры марки Сынпор или Миллипор с диаметром пор не
более 0,1 мкм. Можно стерилизовать растворы текучим паром. В этом
случае растворы разливают в предварительно простерилизованные
ампулы, запаивают их и кипятят по одному часу три дня. Перед
посевом в среду вносят раствор витаминов из расчета 1 мл на
1 л среды.
N 8. Раствор витаминов по Видделю и Пфеннигу
[Widdel, Pfennig, 1982]
Биотин 10 мг Пантотеновая ю мг
Никотиновая 20 мг кислота
кислота Тиамин 20 мг
л -Аминобензой- 10 мг Витамин Ви 1 мг в 50 мл
ная кислота Вода дистиллиро- 1000 мл
ванная
N 9. Раствор витаминов по Стейли
[Staley, 1973]
Витамин Bi: 0,1 мг Пиридоксин соляно- 10 мг
Биотин 2 мг кислый
Пантотеново кислый 5 мг Рибофлавин 5 мг
кальций Тиамин солянокислый 5 мг
Фолиевая кислота 2 мг Вода дистиллированная 1000 мл
Никотинамид 5 мг
N 10. Набор витаминов по Пфеннигу и Липперту
[Pfennig, Lippert, 1966]
Биотин 0,2 г Пантотеновая 0,05 г
Фолиевая кислота 0,02 г кислота
Пиридоксин 0.1 г Тиамин 0,05 г
Рибофлавин 0,1 г в12 0,001 г
Никотиновая кислота 0,05 г п-Аминобензойная 0,05 г
кислота Вода дистиллированная 1000 мл
N 11. Раствор витаминов по Волину
Биотин [Wolin et al., 1963]
2 мг Пантотеновая кислота 5 мг
Фолиевая кислота 2 мг Витамин Bia 0,1 мг
Пиридоксин соляно- 10 мг n-Аминобензойная кислота 5 мг
кислый Тиоктовая кислота 5 мг
Рибофлавин 5 мг Вода дистиллированная 1000 мл
Тиамин 5 мг
Никотиновая кислота 5 мг
256
ПРИГОТОВЛЕНИЕ КРЕМНЕВОГО ГЕЛЯ
Наиболее быстрое застывание кремневого геля происходит, если
после смешивания раствора силиката и соляной кислоты реакция
смеси получается близкой к нейтральной. В связи с этим кремне-
вый гель готовят следующим образом. Берут 25%-й раствор крем-
некислого калия, натрия или растворимого стекла и доводят удельный
вес раствора до 1,06 или лучше до_ 1,2. 5 мл этого раствора
помещают в чашку Петри, добавляют каплю фенолфталеина и из
градуированной пипетки вносят 5%-й раствор соляной кислоты до
исчезновения окраски. Затем кислоту разводят дистиллированной водой
так, чтобы точно 5 мл раствора силиката (или растворимого стекла)
нейтрализовалось 5 мл кислоты. Далее в большую колбу вносят
определенный объем кислоты и добавляют туда эквивалентный объем
силиката. Раствор тщательно перемешивают и тотчас же разливают
по 20—50 мл в чашки Петри, которые оставляют застыть на гори-
зонтальной поверхности. Гель застывает за несколько минут. После
этого чашки помещают в большой сосуд с проточной водой и про-
мывают до исчезновения хлоридов или до тех пор, пока гель в
чашках не будет иметь pH 7 — на это необходимо около суток.
Затем чашки вынимают и помещают в сосуд с кипящей дистил-
лированной водой. Так они остаются некоторое время. После того
как они хорошо промылись, гель в чашках слегка подсушивают и
пропитывают питательной средой. Чашки с гелем завертывают в
бумагу и стерилизуют в стерилизаторе Коха текучим паром или в
автоклаве при 110°.
ПРАВИЛА ТЕХНИКИ БЕЗОПАСНОСТИ
ПРИ РАБОТЕ С ИНДИКАТОРНЫМИ ДОЗАМИ
РАДИОАКТИВНЫХ ИЗОТОПОВ
Радиоактивные изотопы 14С и 35S испускают из ядра слабый
поток электронов p-излучения. При использовании радиоактивности
0,1—1,0 мкКи работать безопасно, если соблюдать приведенные ниже
условия.
1. Растворы радиоактивных изотопов не должны попадать в
рот и на слизистую оболочку глаз. Изотопы поэтому нельзя наса-
сывать в пипетки ртом. Необходимо пользоваться для этой цели
шприцем, шприцем с пипеткой или грушей с пипеткой и другими
приспособлениями.
2. Манипуляции с изотопами следует производить с использо-
ванием эмалированной кюветы или металлической подставки, чтобы
капли не попадали на стол и окружающие предметы. С летучими ме-
чеными веществами необходимо работать под тягой или на открытом
воздухе.
3. После проведения экспериментов рабочее место промывают
водой (кювета, стол), при использовании меченых карбонатов пред-
меты протирают 1%-м раствором соляной кислоты, руки моют 1%-м
раствором той же кислоты и мылом. Помещение проветривают. Хала-
ты стирают чаще обычного. Рабочее место периодически проверяют
17. Зак. 1766
257
на отсутствие радиоактивного загрязнения с помощью переносного
счетчика.
4. Индикаторные дозы отходов следует сбрасывать в канали-
зацию (согласно инструкции работы с изотопами) после значитель-
ного разбавления водой. Твердые отходы надо сжигать в поле или
под тягой. При работе с серой (35S) опасность загрязнения со
временем уменьшается, так как период полураспада ее равен 3 мес.
5. Рабочие растворы изотопов следует хранить в металлическом
ящике или в сейфе в стеклянной посуде с притертыми или резино-
выми пробками. Особо чистые растворы изотопов лучше хранить в
ампулах после дробной стерилизации на водяной бане.
ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО
ПОТЕНЦИАЛА
Величина окислительно-восстановительного потенциала служит по-
казателем напряжения окислительных процессов.
Окислительно-восстановительный потенциал может быть выражен
в вольтах и представляет собой разность потенциалов между нор-
мальным водородным электродом и потенциалом, который принимает
пластинка из индифферентного металла в равновесии с окружающей
средой (Eh). Другая форма выражения окислительно-восстановитель-
ного потенциала — индекс гНг, представляющий собой отрицательный
логарифм концентрации молекулярного водорода, при которой могут
создаваться данные окислительно-восстановительные условия.
Зависимость между этими величинами выражается следующим
образом:
Eh = 0,029(гН2 — 2рН), или гН2 = Eh/0,029 4- 2рН.
Как видно из формулы, величина Eh, представляющая собой
разность потенциалов между индифферентным электродом и нормаль-
ным водородным электродом, зависит как от концентрации молеку-
лярного водорода, так и от концентрации его ионов. Вследствие
этого Eh сам по себе еще не характеризует окислительно-вос-
становительные условия среды. Для получения сравнительных вели-
чин всегда необходимо вести определения при какой-то неизменной
величине pH. В противоположность этому величину гН2 мы можем
всегда получить, определяя одновременно Eh и pH. Значительные
сдвиги в гН2 связаны с переходом к другой степени аэробности,
а зачастую и к другому типу обмена веществ. Колебания эти могут
быть особенно значительными около нейтральной реакции, где
небольшие абсолютные изменения концентрации водородных ионов
сильно сказываются на величине pH и еще более на величине гН2.
Электроды для определения окислительно-восстановительного по-
тенциала готовят из платиновой проволоки диаметром 0,5 мм,
впаивают в стеклянную трубочку так, чтобы свободный конец был
длиной около 1 см.
Электроды очищают последовательно обработкой крепким раство-
ром едкого натрия я горячей азотной кислотой и тщательно промы-
вают дистиллированной водой. Перед употреблением электроды кали-
258
Таблица 1
Поправка на хлорсеребряный и каломельный полуэлектроды
для приведения отсчета
к нормальному водородному электроду
Температура, °C Платиновый полуэлектрод по отношению к Температура, °C Платиновый полуэлектрод по отношению к
хлорсеребря- ному насыщен ному каломельному насыщенному хлорсереб- ряному насыщенному каломельному насыщенному
10 +206 — 30 + 194
20 +200 +250 35 +191 +239
25 +197 +246 40 +191 —
бруют. С этой целью берут стандартный раствор, который имеет
значение Eh = 430 мВ при 25° и состоит из 0,003 М KjFe(CN)6 и
0,003 М K4Fe(CN)s в 0,1 М КС1. Электроды должны показать
правильный окислительно-восстановительный потенциал. К показанию
на шкале прибора прибавляют поправку согласно табл. 1. Например,
для температуры 25° отсчет на приборе будет +184 мВ, поправка
+246 мВ (184+246=+430). Если показания отличаются от теоретических,
то электроды подвергаются повторной очистке. Следует тщательно
проверять, чтобы не было трещин стекла в месте впая платиновой
проволоки.
При определении окислительно-восстановительного потенциала
необходимо следить, чтобы испытуемые образцы воды или ила не
соприкасались с воздухом. С этой целью для определения окислитель-
но-восстановительного потенциала в воде можно рекомендовать сле-
дующую форму сосудика. В стеклянную широкогорлую банку встав-
ляют резиновую пробку с четырьмя отверстиями. В два отверстия
вставляют стеклянные трубки. Одна из трубок каучуковым шлангом
присоединяется к батометру, что дает возможность заполнить сосуд и
пропустить ток воды так, чтобы все пузырьки воздуха были удале-
ны через вторую трубку. В другие два отверстия в резиновой проб-
ке вставляется платиновый электрод и палочковидный каломельный
электрод или соединительный мостик, заполненный 3%-м агаром,
приготовленным на насыщенном хлористом калии, погружаемый в
насыщенный раствор КС1 для контакта с каломельным электродом.
Для определения окислительно-восстановительного потенциала в
иловых отложениях удобно использовать сосуд, состоящий из стек-
лянной трубки диаметром 8—10 мм, с двумя резиновыми пробками.
В одну из пробок вставлена стеклянная трубочка с впаянным
в нее электродом из платиновой проволоки, в другую — стеклянная
трубочка с внутренним просветом в 2—3 мм. При заполнении сосу-
дика пробку с электродом вынимают и ил засасывают в стеклянную
трубку вплоть до пробки, затем вставляют пробку с электродом.
При этом монолит с илом несколько продвигается к противоположно-
259
му концу. После этого пробку вновь вдавливают так, чтобы между
ней и илом не было пузырьков воздуха. Избыток ила выступает
через трубочку, которая и служит для контакта между электродом и
соединительным сосудиком с насыщенным хлористым калием.
Наиболее удобен способ определения окислительно-восстановитель-
ного потенциала в трубчатом стратометре [Романенко, Кузнецов,
1974] с плексигласовой трубкой, на боковой стороне которой
имеется ряд отверстий диаметром 2—3 мм для введения платинового
электрода. Монолит ила отбирают в плексигласовую трубку. После
поднятия стратометра из водоема нижнее отверстие трубки закры-
вают пробкой и плексигласовую трубку отнимают от стабилизатора.
Колонку ила подают с помощью нижней пробки на соответствующую
высоту. Шурупы, которыми закрыты отверстия, вывинчивают, на их
место вставляют платиновые электроды. Каломельный электрод по-
мещают в верхнее отверстие до соприкосновения с илом. Таким
образом удается промерить потенциал на глубину 20—40 см через
небольшие расстояния.
В том случае, когда ил сложен вязкими глинами, его монолит
из трубки выталкивают на эмалированный поднос, верхнюю боковую
сторону зачищают ножом и тонкий платиновый электрод вставляют
непосредственно в монолит ила. Окислительно-восстановительный по-
тенциал может быть промерен в тонких слоях, а разрез монолита позво-
ляет установить, что это за слои.
Отсчет окислительно-восстановительного потенциала (в мВ) пред-
ставляет собой разность потенциалов между каломельным и платино-
вым электродами и выражается через Екалом. Если каломельный
электрод подсоединен к клемме потенциометра ”—”, то Екалом будет
величиной положительной, если каломельный электрод подсоединен
к клемме то величина Екалом будет отрицательной. При этом
Eh=EKajI0M + а, где а — поправка для перехода от показаний
насыщенного каломельного электрода к нормальному водородному
электроду, которая, например, при температуре 18° равна +249 мВ
(см. табл. 1).
ОПРЕДЕЛЕНИЕ РАСТВОРЕННОГО В ВОДЕ КИСЛОРОДА
МЕТОДОМ ВИНКЛЕРА
Сущность метода заключается в том, что гидрат закиси мар-
ганца в щелочном растворе окисляется за счет растворенного кис-
лорода с образованием гидрата окиси марганца:
MnSO< + 2NaOH = Mn(OHh + Na2SO. - Mn(OH)>.
После осаждения Мп(ОН)з растворяют в соляной или серной
кислоте. Гидрат окиси марганца переходит в Мп3*, который в кис-
лой среде реагирует с йодистым калием, окисляя его до свободного
йода и восстанавливаясь до Мп2*:
2Мп(ОН)э + 2KI + 3H2SO4 - 2MnSO< + K2SO4 + 6Н2О + 12.
Следовательно, 2 атома йода эквивалентны одному атому кислоро-
260
да. Выделившийся йод оттитровывают гипосульфитом:
2Na2S3O3 + I2 = Na2S4O6 + 2NaI.
Приготовление реактивов.
1. Раствор хлористого или сернокислого марганца
МпС1г-4Н:0 42,5 г
или MnS04'4H2O 48 г
Вода дистиллированная 100 мл
2. Щелочной раствор йодистого калия
КОН 70 г
или NaOH 59 г
KI 15 г
Вода дистиллированная 100 мл
3. 0,02 N раствор тиосульфата готовят разбавлением 0,2 N
раствора Na2S2O3. Каждый миллилитр 0,02 N раствора Na2S2O3 экви-
валентен 0,16 мг кислорода.
Ход анализа. 1. Воду из водоема отбирают батометром Рут-
тнера. Сливную трубку опускают до дна склянки. 2—3 объема воды
сливают через горлышко склянки так, чтобы через воду не проска-
кивали пузырьки воздуха. Склянки для анализа берут одного объема —
65 или 150 мл.
2. После заполнения склянки водой в нее сразу же вносят
0,5 мл раствора сернокислого марганца и 0,5 мл раствора йоди-
стого калия из расчета на 100 мл воды. Склянку закрывают притер-
той пробкой так, чтобы не осталось пузырьков воздуха, и содер-
жимое склянки тщательно взбалтывают. Дают осадку осесть примерно
в течении 30 мин.
3. Затем вводят 1 мл серной кислоты, разведенной водой 1:1,
или концентрированной соляной кислоты, закрывают склянку пробкой
и тщательно взбалтывают, так, чтобы осадок полностью растворился.
Пипеткой отбирают 50 мл жидкости, вносят в колбу и титруют
0,02 N тиосульфатом до бледно-желтого цвета, после чего вносят
несколько капель крахмала и титруют до обесцвечивания.
4. Расчет количества растворенного в воде кислорода (в мг/л)
определяют по формуле
Ог = (т • 8 1000)/К
где т — количество тиосульфата, пошедшего на титрование 50 мл
пробы, мл; 8 — эквивалент кислорода; N — нормальность тио-
сульфата (около 0,02); 1000 — коэффициент для переведения резуль-
татов на 1 л; И — количество раствора, взятого для титрования, мл.
Расчеты показывают, что если объем склянок, взятых для се-
рийных определений кислорода, колеблется не более чем на 20 мл
(в пределах от 120 до 140 мл), то можно титровать не весь объем
склянки, а, скажем, по 50 или 100 мл. При этом ошибка не превы-
шает 0,25%, а массовые расчеты результатов очень упрощаются и
могут производиться в случае 50 мл титруемой жидкости по форму-
ле, которая после сокращения принимает вид О2 = « (160-N).
261
Когда точно известна нормальность тиосульфата, величина в скоб-
ках превращается в коэффициент K:0i = h K. мг/л. При опреде-
лении деструкции и биохимического потребления кислорода объем
титруемого раствора отмеряют мерной пипеткой на 50 или 100 мл.
БИОХИМИЧЕСКОЕ ПОТРЕБЛЕНИЕ КИСЛОРОДА (БПК)
Природные воды всегда содержат растворенные и взвешенные
органические вещества, в разной степени доступные использованию
микроорганизмами. Под биохимическим потреблением кислорода
(БПК) понимается количество кислорода, которое расходуется на
окисление легкодоступной части этих веществ, находящихся в воде.
Эту величину выражают в миллиграммах на литр кислорода.
При определении химического потребления кислорода (ХПК) по-
становка опыта остается та же, как будет описано ниже для опре-
деления БПК, только в воду вносят несколько капель насыщен-
ного раствора сулемы, чтобы прекратить деятельность бактериаль-
ной флоры.
Путем большого количества анализов удалось установить, что
окислительный процесс во времени идет, как правило, с убываю-
щей скоростью. К нему приложимо уравнение мономолекулярных
реакций
]g(D/(D-Dt)) = Kl,
где D — полное БПК, мг Оз/л; Dt — БПК за t дней, мг Ог/л; К — кон-
станта скорости биохимического потребления кислорода.
Графически поглощение кислорода в процессе окисления растворен-
ных легкоокисляемых веществ может быть представлено логарифми-
ческой кривой. В этом случае можно по формуле вычислить полное
БПК на основании двух наблюдений, сделанных через разные про-
межутки времени.
Однако в ряде случаев, когда в водоем поступают органиче-
ские вещества, не свойственные автохтонной микрофлоре, первые ста-
дии распада этих веществ в опыте по определению БПК могут
задерживаться до тех пор, пока не разовьется соответствующая
микрофлора. Тогда потребление растворенного кислорода уже не
будет идти согласно законам мономолекулярной реакции. В этом
случае полное БПК нельзя вычислить по приведенной выше формуле,
наиболее приближенные величины его могут быть получены при не-
посредственном наблюдении в длительном опыте.
Ход определения. 1. Исследуемую воду из батометра переливают
в колбу и температуру ее доводят до 20°.
2. В случае пониженного содержания кислорода или его отсут-
ствия воду аэрируют, взбалтывая в течение 1—5 мин или продувая
через нее воздух при помощи резиновой груши или насоса, после
чего дают пузырькам воздуха выйти из воды.
3. Воду из колбы разливают в 6 склянок с притертыми проб-
ками так, чтобы в них не осталось пузырьков воздуха.
4. В 2 склянки добавляют реактивы и определяют исходное со-
262
держание растворенного кислорода по Винклеру. На остальные 4
склянки надевают водяные затворы в виде резиновых колпачков,
чтобы предохранить от попадания воздуха во время инкубации.
5. Склянки инкубируют в термостате при 20°.
6. Через 3 дня инкубации в 2 склянках из 4 определяют содер-
жание растворенного Ог, а через 6 дней и в двух остальных. Раз-
ность в содержании кислорода между исходной водой и после трех
дней инкубации обозначается, как ”БПКз”, аналогично после шести
дней — ”БПКби.
7. Разность констант скорости биохимического потребления кислоро-
да и полного БПК вычисляют по формуле
БПКдодн
*..... .к = 1 .ig_^_ ,
2ai — аг t а2 — ^1
где ai — БПК за / сут (в частности, за 3 дня); аг — БПК за 2/ сут
(в частности, за 6 дней).
ОПРЕДЕЛЕНИЕ ФЕРМЕНТАТИВНОЙ АКТИВНОСТИ
В ОБРАЗЦАХ ПРИРОДНОГО МАТЕРИАЛА
ИВ КУЛЬТУРАХ БАКТЕРИЙ
Определение дегидрогеназной активности и количества клеток, обла-
дающих дегндрогеназной активностью. Дегидрогеназы встречаются
только у живых микроорганизмов, поэтому определение дегидро-
геназной активности в субстрате может служить мерой активности
биологических процессов.
Для определения дегндрогеназной активности в иловых отложе-
ниях к 10 г свежеотобранного ила добавляют 100 мг СаСОз, 5 мл
3%-го водного раствора солянокислого 2,3,5-трифенилтетразолия и ин-
кубируют 19 ч при 25°. При этом дегидрогеназа восстанавливает
трифенилтетразолий до красного формазана. Краску экстрагируют
50 мл этилового спирта, раствор фильтруют и его экстинкцию опре-
деляют в спектрофотометре Бекмана в односантиметровой кварцевой
кювете при длине волны 546 нм. Отсчет умножают на 1000, и это
служит мерой определения величины дегидрогеназной активности ила в
условных единицах.
Применение солей тетразолия дает возможность определения числа
клеток, обладающих дегидрогеназной активностью. В таких клетках
формазан откладывается в виде оптически плотных гранул красного
цвета, хорошо различимых в световом микроскопе.
Определение наличия цитохромоксидазы. Колонию бактерий извле-
кают с твердой или жидкой среды стеклянной палочкой или иглой и
помещают на кусочек фильтровальной бумаги площадью 6 см2,
смачивают в чашке Петри 2—3 каплями 1%-го водного раствора
солянокислого тетраметилпарафенилендиамина. При наличии оксидазы
уже через 5—10 с бактериальная масса принимает темно-красный
оттенок [Jurtchuk, McQuitty, 1976].
Определение наличия каталазы. Качественно каталазная активность
263
выявляется путем помещения капли 10%-й перекиси водорода на коло-
нию или штрих микроорганизма от односуточного до недельного
возраста. Выделение пузырьков газа в результате разложения Н2О2
каталазой до НгО и О2 свидетельствует о наличии каталазной актив-
ности культуры бактерий.
Качественная проба на образование перекиси водорода. 1. На поверх-
ность застывшей агаровой среды, содержащей 0,5—1 г/л глюкозы,
наносят тонким слоем 3—5 мл той же среды, в которую внесена
тонкодисперсная взвесь МпОг. Посев делают штрихом. Просвет-
ление коричневого слоя под штрихом в результате восстановления
МпОг свидетельствует об образовании культурой перекиси водорода
2. К охлажденной до 45° агаризованной среде для выращива-
ния добавляют 1% лошадиной сыворотки в качестве источника перо-
ксидазы и стерильную суспензию о-дианизидина в конечной концен-
трации до 0,1%. На поверхность застывшей среды штрихом наносит-
ся посевной материал. Образование темно-красно-коричневого окраши-
вания по штриху свидетельствует об участии образующейся с помощью
пероксидазы перекиси водорода в окислении о-дианизидина [Whitten-
bury, 1964].
Используя о-дианизидин, можно определить численность микроор-
ганизмов, образующих перекись водорода. С этой целью делают посев
с разведениями на агаризованную среду, содержащую 0,5 г/л глюкозы.
Перед посевом в среду вносят 0,1% стерильной суспензии о-дианизидина
и стерильный раствор пероксидазы, около 2 мг/л. Колонии бактерий,
образующих Н2О2, окрашиваются в темно-красно-коричневый цвет.
ОПРЕДЕЛЕНИЕ ВЛИЯНИЯ РАЗЛИЧНЫХ ФАКТОРОВ
НА МИКРООРГАНИЗМЫ
В КРАТКОВРЕМЕННЫХ ОПЫТАХ С W С
Метод основан на том, что двух-трехсуточную культуру бак-
терий, находящихся в стадии логарифмического роста, высевают на
оптимальную питательную среду и варьируют изучаемый фактор. Об
оптимуме развития судят по величине фиксации меченой углекислоты
[Горленко, Кикина, 1979].
Для определения оптимальных условий роста опыт ставят по сле-
дующей схеме: в колбу на 0,5 л вносят 250 мл стерильной жид-
кой среды, содержащей 250 мг/л NaHCOj, 25 мл посевного мате-
риала и 1%-й раствор NaH14COj активностью 1 мкКи в 1 мл.
Например, при изучении влияния NaCl на рост бактерий инкубируют
культуры фотосинтезирующих бактерий при 28° и освещении 1800—
2000 лк. При работе используют герметические стеклянные флаконы, в
которые вносят разные количества NaCl, заливают культурой бактерий
до пробки. Культуры сначала экспонируют 1 ч в темноте, а затем 2 ч на
свету. После этого организмы фиксируют 40%-м формалином из
расчета 0,3 мл на склянку объемом 60—100 мл.
При работе с хемоорганотрофными микроорганизмами колбу с
500 мл среды заражают испытуемой культурой и инкубируют 1—2 дня,
пока культура не перейдет в логарифмическую фазу роста. Затем
в нее вносят NaHl4COj, разливают в равном количестве по склян-
264
кам, в каждую вносят испытуемый ингредиент в разных конентра-
циях и инкубируют 4 ч в темноте при соответствующей температуре.
По истечении времени инкубации из каждой склянки отфильтро-
вывают по 10 мл суспензии бактерий через мембранный фильтр с по-
рами 0,3 мкм. Фильтры обрабатывают 1%-м раствором НС1 для уда-
ления карбонатов, промывают водой и радиоактивность клеток оп-
ределяют под счетчиком.
Расчет проводят по формуле
= г ' <~~каРб
R - tv
где ц — удельная скорость развития, мкг С/(мл-ч); г — радио-
активность клеток на фильтре, имп./мин; Скарб — содержание углерода
карбонатов в среде, мг/л; R — радиоактивность карбонатов в среде,
имп./(мин мл); t — время экспозиции, ч; и — объем пробы, мл.
При работе с культурой аэробных гетеротрофных бактерий склянки
или пробирки заливают средой на 1/3 и плотно закрывают рези-
новой пробкой. Остальные процедуры проводят, как было указано
выше.
ПРИГОТОВЛЕНИЕ РАСТВОРОВ
КИСЛОТНО-ЩЕЛОЧНЫХ ИНДИКАТОРОВ ПО КЛАРКУ
Кларковские индикаторы представляют собой свободные кислоты
и плохо растворяются в воде. Для переведения их в раствор 0,1 г
индикатора растирают в ступке с указанным в табл. 2 количеством
0,05N раствора NaOH до полного растворения и далее разбавляют
Таблица 2
Приготовление индикаторов по Клерку
Индикатор Интервал pH для применения индика- торов Изменение цвета Количество 0,05 N раствора NaOH на 0,1 г индикатора, мл
Тимоловый синий (кис- 1,2—2,8 Красный—желтый 4,3
лый)
Бромфеноловый синий 3,0—4,6 Желтый—голубой 3,0
Метиловый красный 4,4—6,0 Красный—желтый 7,4
Бромкрезоловый пур- 5,2—6,8 Желтый—пурпурный 3,7
пуровый
Бромтимоловый синий 6,0—7,6 Желтый—синий 3,2
Феноловый красный 6,8—8,4 Желтый—красный 5,7
Крезоловый красный 7,2—8,8 То же 5,3
Тимоловый синий ще- 8,0—9,6 Желтый—синий 4,3
лочной
Крезолфталеин 8,2—9,8 Бесцветный—красный 5,3
Метиловый оранжевый 3,1-4,4 Оранжевый—красный 0
фенолфталеин 8,3—10,0 Бесцветный—красный 0
265
дистиллированной водой до 25 мл. Таким образом получают запас-
ной раствор индикатора. Для использования раствор разбавляют
еще в 10 раз.
При определении pH на 10 мл испытуемой жидкости добавляют
5 капель раствора индикатора.
Пределы концентрации водородных ионов, в которых отдельные
индикаторы меняют свою окраску, приведены в табл. 2.
ЛИТЕРАТУРА
Аристовская ТВ. Аккумуляция железа при разложении органо-минеральных комплексов
гумусовых веществ микроорганизмами // Докл. АН СССР. 1961. Т. 136, N 4. С. 954—
957.
Аристовская Т.В., Паринкина О.М. Новый почвенный организм Seliberia stellata nov.
gen. nov. sp. // Изв. АН СССР. Сер. бкол. 1963. N 1. C. 45—56.
Балашова В.В. Об отношении Gallionella к микоплазмам // Докл. -АН СССР. 1969.
Т. 184, N 6. С. 1429—1432.
Балашова В.В. Микоплазмы и железобактерии. М.: Наука, 1974. 65 с.
Балашова В.В. Использование молекулярной серы в качестве окислителя Нг факуль-
тативно анаэробным псевдомонасом // Микробиология. 1985. Т. 54. С. 324—326.
Балашова В.В., Дубинина Г.А. Ультраструхтурная организация Metallogenium в ста-
бильной культуре // Там же. 1989а. Т. 58. С. 75—100.
Балашова В.В., Дубинина Г.А. Микроорганизмы, окисляющие железо и марганец //
Хемосинтез: К 100-летию открытия С.Н. Виноградским / Под ред. М.В. Иванова.
М.: Наука, 19896. С. 101—122.
Балашова В.В., Заварзин Г.А. Окисление железа Mycoplasma laidlawii / / Микробиология.
1972. Т. 41. С. 909—911.
Балашова В.В., Заварзин Г.А. Анаэробное восстановление окисного железа водородной
бактерией / / Микробиология. 1979. Т. 48. С. 773—778.
Беляев С.С. О методах учета и выделения Caulobacter // Там же. 1968. Т. 37. С. 925—929.
Беляев С.С. К учету численности метанобразующих бактерий на среде с молекулярным
водородом // Там же. 1974. Т. 43. С. 349—352.
Беляев С.С.. Иванов М.В. Радиоизотопный метод определения интенсивности бакте-
риального метанобразования // Там же. 1975. Т. 44. С. 166—168.
Беляев С.С., Финкельштейн З.И., Иванов М.В. Интенсивность бактериального метан-
образования в иловых отложениях некоторых озер // Там же. 1975. Т. 44. С. 309—312.
Бердичевская М.В. Экология углеводородокисляющих бактерий нефтяных пластов
Пермского Прикамья: Дис. ... канд. биол. наук. М., 1983. 177 с.
Бонч-Осмоловская Е.А. Сероредуцирующие бактерии и их участие в процессах ана-
эробной деструкции органического вещества // Хемосинтез: К 100-летию открытия
С.Н. Виноградским / Под ред. М.В. Иванова. М.: Наука, 1989. С. 183—198.
Бонч-Осмоловская Е.А.. Заварзин Г.А., Герасименко Л.М.. Венецкая С.Л. Исследование
терминальных процессов анаэробной деструкции нагонных масс кладофоры в оз. Си-
ваш // Микробиология. 1988. Т. 57. С. 312—319.
Бонч-Осмоловская Е.А., Слесарев А.И., Мирошниченко М.Л., Светличная Т.П. Новая
сероокнсляющая бактерия Desulfurococcus amylolythicus sp. nov. // Докл. АН СССР.
1986. Т. 290, N 3. С. 559—563.
Брок Т.Д. Мембранная фильтрация. М.: Мир, 1987. 464 с.
Брумберг Е. Новый метод микроскопии в ультрафиолетовых лучах // Изв. АН СССР.
Сер. физ. 1942. N 1/2. С. 6—9.
Бульон В.В. Гетеротрофная активность бактериопланктона в озерах Монголии // Эко-
логия. 1984. N 2. С. 52—57.
267
Васильева Л.В. Особенности ультраструктуры и цикла развития Stella humosa // Изв.
АН СССР. Сер. бнол. 1972. N 5. С. 782—785.
Васильева Л.В. Морфологическое группирование простекобактерий // Там же. 1980.
N 5. С. 719—731.
Васильева Л.В., Лафицкая Т.Н. Отнесение Agrobacterium polysphaeroideum к роду
Prosthecomicrobium polysphaeroideum comb. nov. // Там же. 1976. N 6. С. 919—923.
Васильева Л.В., Лафицкая Т.Н.. Намсараев Б.Б. Angulomicrobium tetraedrale — новый вид
почкующихся бактерий с радиальной симметрией // Микробиология. 1979. Т. 48.
С. 843—849.
Винберг Г.Г. Первичная продукция водоемов. Минск: Изд-во АН БССР, 1960. 329 с.
Виноградский С.Н. Основы экологической микробиологии // Микробиология почвы
/ Под ред. А.А. Имшенецкого. М.: Изд-во АН СССР, 1952а. С. 781-—789.
Виноградский С.Н. Серобактерии // Там же. 19526. С. 32—47.
Виноградский С.Н. О железобактериях // Там же. 1952». С- 57—60.
Волков И.И., Жабина Н.Н. Методы определения различных соединений серы в морских
осадках // Химический анализ морских осадков. М.: Наука, 1975. С. 5—27.
Галимов ЭМ. Геохимия стабильных изотопов углерода. М.: Недра, 1968.
Гальченко В.Ф., Андреев Л.В., Троценко Ю.А. Таксономия и идентификация облигатных
метанотрофных бактерий. Пущино, 1986. 96 с.
Гальченко В.Ф., Намсараев ББ, Мшанский Ю.Н. н др. Рост метанотрофных бактерий
в присутствии метанола // Микробиология. 1984. Т. 53. С. 724—730.
Гальченко В.Ф.. Шишкина В.Н.. Тюрин В.С.. Троценко Ю.А. Выделение чистых культур
метанотрофов и их свойства // Там же. 1975. Т. 44. С. 884—850.
Головачева Р.С.. Вальехо-Роман К.М-, Троицкий А.В. Suifurococcus mirabiiis gen. nov.
sp. nov. — новая термофильная окисляющая серу архебактерня // Там же. 1987.
Т. 56. С. 95-99.
Головачева Р.С.. Каравайко Г.И. Sulfobacillus — новый род термофильных споро-
образующих бактерий / / Там же. 1978. Т. 47. С. 815—822.
Горбенко Ю.А. О наиболее благоприятном количестве "сухого питательного агара”
в средах для культивирования морских гетеротрофных микроорганизмов // Там же.
1961. Т. 30. С. 168-172.
Горленко В.М. Фотосинтезирующие серные бактерии из водоемов Южного Крыма //
Микробиология. 1968. Т. 37. С. 745—748.
Горленко В.М. Биология фотосинтезирующих серобактерий и их геохимическая дея-
тельность: Автореф. дис. ... д-ра биол. наук. М., 1982. 558 с.
Горленко В.М., Дубинина Г.А.. Кузнецов С.И. Экология микроорганизмов внутренних
водоемов. М.: Наука, 1977. 288 с.
Горленко В.М., Кикина О.Г. Определение оптимальных условий развития микро-
организмов с помощью иС-бикарбоната // Микробиология. 1979. Т. 48. С. 430—433.
Горленко В.М.. Лебедева ЕВ. Новые зеленые серные бактерии с выростами Ц Микро-
биология. 1971. Т. 40. С. 1035—1039.
Готтшалк Г. Метаболизм бактерий. М.: Мир, 1982. 310 с.
Грабович М.Ю. Изучение систематики, физиологии и особенностей серного мета-
болизма бесцветных серобактерий: Автореф. дис. ... канд. биол. наук. М., 1984.
217 с.
Дзюбан А.Н.. Горбенко А.Ю. Оптимизация метода прямого счета бактерий вдонных
отложениях водоемов // Микробиология. 1989. Т. 58, N 5.
Драбкава В.Г. Зональное изменение интенсивности микробиологических процессов
в озерах. Л.: Наука, 1981. 212 с.
Дубинина Г.А. О принадлежности рода Metaliogenium к порядку Mycoplasmatales //
Докл. АН СССР. 1969. Т. 184, N 6. С. 1433—1436.
Дубинина Г.А. Механизм окисления двухвалентного железа и марганца железо-
бактериями, развивающимися при нейтральной кислотности среды / / Микробиология.
1978. Т. 47. С. 591—599.
Дубинина ГА. Бесцветные серобактерии // Хемосинтез: К 100-летию открытия С.Н. Ви-
ноградским / Под ред. М.В. Иванова. М.: Наука, 1989. С. 76—100.
Дубинина Г.А.. Грабович М.Ю. Окисление соединений серы гетеротрофными бакте-
риями / / Круговорот веществ и энгергии в водоемах: Гидрохимия и донные отложения.
Иркутск, 1981. Вып. 5. С. 43—44.
268
Дубинина Г.А., Грабович М. Ю. Выделение чистых культур Thiospira и изучение их серного
метаболизма // Микробиология. 1983. Т. 52. С. 5—12.
Дубинина Г.А., Грабович М.Ю. Выделение, культивирование и характеристика Mac-
romonas bipunctata // Там же. 1984. Т. 53. С. 748—755.
Дубинина Г.А., Стравинская Е.А. Гидрохимические и микробиологические иссле-
дования динамики марганца и железа в озере Красном (Пуннус-Ярви) // Гео-
химическая деятельность микроорганизмов в водоемах и месторождениях полезных
ископаемых. М.: Наука, 1973. С. 249—277.
Заварзин Г-А. Почкующиеся бактерии // Микробиология. 1961а. Т. 30. С. 952—975.
Заварзин Г-А. Симбиотическая культура нового окисляющего марганец организма / /
Там же. 19616. Т. 30. С. 393—395.
Заварзин Г-А. К понятию микрофлоры рассеяния в круговороте углерода // Журн.
общ. биологии. 1970. Т. 3.1. С. 386—393.
Заварзин Г.А. Литотрофные микроорганизмы. М.: Наука, 1972. 323 с-
Заварзин ГА. Принадлежность водородных бактерий и карбоксидобактерий к микро-
' флоре рассеяния // Микробиология. 1976. Т. 45. С. 20—22.
Заварзин Г.А. Водородные бактерии и карбоксидобактерии. М.: Наука, 1978. 207 с.
Заваров В.Т. Улучшенный способ прямого титрования сульфатов с ализариновым
красным // Завод, лаб. 1957. N 5. С. 5—12.
Зякун А.М-. Бондарь В.А.. Намсараев Б.Б. Фракционирование стабильных изотопов
углерода метана при его микробиологическом окислении // Геохимия. 1979.
N 2. С. 291—297.
Иванов М.В. Метод определения продукции бактериальной биомассы в водоеме //
Микробиология. 1955. Т. 24. С. 79—89.
Иванов М. В- Применение изотопов для изучения процесса редукции сульфатов в оз. Бело-
водь // Там же. 1956. Т. 25. С. 305—309.
Иванов М.В. Роль микроорганизмов в образовании серных осадков в Сергиевских серо-
водородных источниках // Там же. 1957. Т. 26. С. 338—345.
Иванов М.В- Изучение интенсивности процессов круговорота серы в озерах с помощью
радиоактивной серы 3SS / / Тр. 6-го совещ. по проблемам биологии внутренних вод
М.; Л.: Изд-во АН СССР, 1956. С. 152—158.
Иванов М.В. Роль микробиологических процессов в генезисе месторождений само-
родной серы. М.: Наука, 1964. 368 с.
Иванов М.В., Леин А.Ю., Кашпаров Е.В. Интенсивность образования и диагенети-
ческого преобразования восстановленных соединений серы в осадках Тихого океана / /
Геохимия диагенеза осадков океана / Под ред. И.И. Волкова. М.: Наука, 1975.
С. 171—178.
Иванов М.В-. Теребкова Л.С. Изучение микробиологических процессов образования
сероводорода в Соленом озере / / Микробиология. 1959. Т. 28. С. 251—256.
Иох Л.В. Электронпереносящие системы, связанные с нитрогеназой // Проблемы фик-
сации азота / Под ред. Р. Харди. М.: Мир, 1982. С. 537—574.
Калининская Т.А. Количественный учет факультативно симбиотрофных азотфикса-
торов // Микробиология. 1967. Т. 36. С. 526—528.
Квасников Е-И., Писарчук ЕН. Артробактер в природе и производстве. Киев: Наук, думка,
1980. 217 с.
Кондратенко Г.П.. Николенко Ю.И., Безрукова Л.В. и др. Идентификация метилот-
рофных бактерий методом иммунофлуоресценции. // Микробиология. 198). Т. 50.
С. 320—329.
Кондратьева Е.Н., Гоготов И.И. Молекулярный водород в метаболизме микро-
организмов. М.: Наука, 1981. 342 с.
Красильников И.А.. Беляев С.С. О распространении Caulobacter в некоторых почвах //
Микробиология. 1967. Т. 36. С. 191—196.
Крылова И.Н- Интенсивность денитрификации в грунтах Рыбинского водохранилища / /
Гидробиол. журн. 1984. Т. 20, N 3. С. 35—41.
Крюков В.Р: Черных И.А., Лысенко А.М. Seiiberia hydrogenophila sp. nov. — новый вид
аэробной водородной бактерии, выделенной из проб морской воды / / Микробиология.
1990. (В печати).
Кузнецов С-И. Микроорганизмы горячих ключей Камчатки // Тр. Ии-та микро-
биологии- 1955. Т. 4. С. 130—154.
269
•Кузнецов С.И., Саралов А.И.. Назина Т.Н. Микробиологические процессы круговорота
углерода и азота в озерах. М.: Наука, 1985. 213 с.
Лауринавичус К.С., Беляев С.С. Определение интенсивности микробиологического
образования метана радиоизотопным методом // Микробиология. 1978. Т. 47.
С. 1115—1120.
Лебедева Б В. Выделение и культивирование нитрифицирующих бактерий // Биология
внутр, вод. 1982. N 56. С. 20—22.
Лебединский А.В. Денитрификация с использованием одноуглеродных соединений:
Дис. канд. биол. наук. М., 1984. 177 с.
Леин А.Ю., Кудрявцева А.И., Матросов А.Г.. Зякун А.М. Изотопный состав соединений
серы в осадках Тихого океана // Геохимия диагенеза осадков океана. М.: Наука,
1976. С. 179-186.
Логинова Н.В., Троценко Ю-.А. Blastobacter viscosus — новая метанолиспользующая
факультативно автотрофная бактерия // Микробиология. 1979. Т. 48. С. 644—651.
Локк С. Изменение микробных клеток при обработке их для прямого счета методом
ультрафильтрации // Гидробиология и рыбное хозяйство внутренних водоемов
Прибалтики. Таллинн, 1969. С. 130—138.
Ляликова Н.Н.. Лебедева Е.В. Восстановление крокоита культурой Pseudomonas chro-
matophila sp. nov. // Микробиология. 1979. T. 48. С. 517—522.
Малашенко Ю.Р., Романовская В.А.. Троценко Ю.А. Метанокисляющие микроорга-
низмы. М.: Наука, 1978. 197 с.
Маркосян Г.Е. Новая железоокисляющая бактерия Leptospirillum ferrooxidans nov.
gen. nov. sp. // Биол. журн. Армении. 1972. T. 25. С. 625—629.
Маркосян Г.Е. Новая миксотрофная тионовая бактерия, развивающаяся в кислой среде
Thiobacillus organoparus sp. nov. // Докл. АН СССР. 1973. Т. 211. N 5. С. 1205—1208.
Мейсель М.Н.. Медведева Г.А., Александрова В.М. О выявлении живых, поврежденных
и мертвых микроорганизмов // Микробиология. 1961. Т. 30. С. 855—859.
Мишустин ЕН.. Емцев В.Т. Почвенные азотфиксирующие бактерии рода Clostridium.
М.: Наука, 1974. 251 с.
Мишустин Е.Н., Перцовская МИ. Микроорганизмы и самоочищение почвы. М.:
Изд-во АН СССР, 1954. 651 с.
Назина Т.Н. Выделение чистых культур сульфатвосстанавливающих бактерий // Био-
логия внутр, вод. 1978. N 37. С. 4—7.
Назина Т.Н., Розанова Е.П., Беляев С.С., Иванов М.В. Химические и микробиологические
методы исследования пластовых жидкостей и кернов нефтяных месторождений.
Пущино, 1988. 25 с.
Нестеренко О.А., Квасников ЕН., Ногина Т.М. Нокардиоподобные и корннеподобные
бактерии. Киев: Наук, думка, 1985. 334 с.
Нестеров А.И., Иванов М.В. Экология метанотрофных бактерий // Успехи микро-
биологии. 1983. Выл. 18. С. 3—18.
Никифорова Е.П. Развитие водных бактерий при натуральных концентрациях орга-
нического вещества: Дис. ... канд. биол. наук. М., 1975. 138 с.
Одинцов В.С. Биологическая фиксация азота в заливе Восток Японского моря: Автореф.
дис. ... канд. бнол. наук. Владивосток, 1983. 22 с.
Олейник Г.Н. К методике количественного определения аммонифицирующих бактерий
в водоемах / / Гидробиоя. жури. 1967. Т. 3. С. 81—83.
Пелъш А.Д. О новых аутотрофных водородсерных бактериях Hydrogenthiobacteria //
Тр. Соляной лаб. 1936. Вып. 5. С. 109—126.
Перфильев Б. В. О новом серожелезком микроорганизме Thiodendron latens и способы
его выращивания в элективных культурах // Изв. АН СССР. Сер. биол. 1969. N 2.
С. 181—198.
Перфильев Б.В.. Габе Д.Р. Капиллярные методы изучения микроорганизмов. М.; Л.:
Изд-во АН СССР, 1961. 534 с.
Перфильев Б.В., Габе Д.Р. Изучение методом микробного пейзажа бактерий, накапли-
вающих марганец и железо в донных отложениях Ц Роль микроорганизмов
в образовании железо-марганцевых озерных руд / Под ред. Б.В. Перфильева. М.;
Л.: Наука, 1964. С. 16—53.
Поглазова М.А., Мицкевич И.Н. Применение флуорескамнна для определения коли-
чества микроорганизмов в морской воде эпифлуоресцентным методом // Микро-
биология. 1984. Т. 53. С. 850—858.
270
Пучкова Н.Н.. Горленко В.М. Новые зеленые серобактерии Chlorobium chloro-
vibrioides nov. sp. // Там же- 1982. T. 51. С. J18—124.
Пучкова Н.Н.. Горленко В.М. Новые коричневые хлоробактерии Prosthecochloris pha-
coasteroides / / Там же. 1976. Т. 45. С. 655—660.
Разумов А.С. Прямой метод учета бактерий в воде: Сравнение его с методом Коха
Там же. 1932. Т. I, N 2. С. 131 — 136.
Разумов АС. Методы микробиологических исследований воды. М.. 1947. 60 с.
Разумов А.С. Взаимоотношения между сапрофитными бактериями и планктоном в
водоемах // Вопросы санитарной бактериологии. М.: Изд-во АМН СССР. 1948.
С. 30—43.
Разумов А.С. Микробиальный планктон воды // Тр. Всесоюз. гидробиол. о-ва. 1962
Т. 12. С. 60—190.
Родина А.Г. Методы водной микробиологии: (Практ. руководство). М.; Л.: Натка.
1965. 363 с.
Розанова Е.П., Назина Т.Н. Углеводородокислящие бактерии и их активность в нефтяных
пластах ) / Микробиология. 1982. Т. 51. С. 324—348.
Розанова Е.П.. Назина Т.Н. Сулъфатвосстанавливающие бактерии (систематика и
метаболизм) // Успехи микробиологии. 1989. Вып. 23. С. 191 - 226.
Романенко В.И. Гетеротрофная ассимиляция СОг бактериальной флорой воды / / Там же.
1964а. Т. 33. С. 679—683.
Романенко В.И. Время генерации и время удвоения ассимиляции СО? гетеротрофными
бактериями Ц Биология внутр, вод. 19646. N 4. С. 8—II.
Романенко В.И. Определение фотосинтеза фитопланктона во внутренних водоемах //
Биология и продуктивность пресноводных водоемов. Л., 1971. С. 234—240. (Тр. Ин-та
биологии внутр, вод АН СССР; Вып. 21(24)).
Романенко В.И. Размножение бактерий на природной воде // Биология внутр, вод.
1973. N 11. С. 5—7.
Романенко В.И. Новый метод определения численности живых бактерий в водоемах
и сравнение его с методом Разумова / / Там же. 1974. N 22. С. 18—21.
Романенко В.И. Микробиологические процессы продукции и деструкции органического
вещества во внутренних водоемах. М.: Наука, 1985. 295 с.
Романенко В.И., Кореньков В.Н. Чистая культура бактерий, использующих хроматы
и бихроматы в качестве акцептора водорода при развитии в анаэробных условиях //
Микробиология. 1977. Т. 46. С. 414—417.
Романенко В.И.. Кузнецов С.И. Экология микроорганизмов пресных водоемов: Ла-
боратор. руководство. М.: Наука, 1974. 194 с.
Романенко В.И.. Кузнецов С-И-. Кореньков В.Н. О новом виде бактерий, разрушающих
NH4CIO4 в анаэробных условиях // Биология внутр, вод. 1973. N 19. С. 6—8.
Романенко В.И.. Младова Т.А. Шарообразные стеклянные баллоны для отбора проб
воды с больших глубин // Там же. 1969. N 4. С. 73—75.
Романенко В.И., Никифорова Е.Н. Развитие бактерий на растворенных органических
веществах пресных водоемов Ц Микробиология. 1974. Т. 43. С. 133—137.
Рыльский А.ф. Бактериальное восстановление хрома VI в связи с очисткой воды: Автореф.
дис. ... канд.' биол. наук. Киев, 1986. 19 с.
Савельева Н.Д. Методы количественного учета окисляющих марганец Leptothrix //
Микробиология. 1965. Т. 34. С. 895—901.
Сажин А.Ф., Мицкевич И.Н.. Поглазова М.Н. Об изменениях размеров бактериальных
клеток при высушивании и фиксации // Океанология. 1987. N 1. С. 142—145.
Саралов А.И., Крылова И.Н., Сараяова Е.Е.. Кузнецов С.И. Распространение и видовой
состав метанокнеляющих бактерий в водах озер // Микробиология. 1984. Т. 53.
С. 837—842.
Сорокин Ю. И. Роль хемосинтеза в продукции органического вещества в водохранилищах:
Изучение хемосинтеза в иловых отложениях с помощью ИС // Там же. 1958. Т. 27.
С. 206—213.
Сорокин Ю.И. Определение продуктивности фотосинтеза фитопланктона в водной
толще с помощью **С // Физиология растений. 1959. Т. 6, вып. 1. С. 118—125.
Сорокин Ю.И. Роль хемосинтеза в продукции органического вещества в водохра-
нилищах // Микробиология. 1961. Т. 30. С. 289—293.
Сорокин Ю.И. Определение поправочных коэффициентов на самопоглощение излу-
271
нения |4С при определении продукции фотосинтеза и хемосинтеза в водоемах //
Там же. 1962. Т. 31. С. 121—128.
Сорокин Ю.И. Вопросы методики отбора проб при изучении морской микрофлоры //
Океанология. 1962. Т. II. С. 808—817.
Спиглазов Л.П. Агрегированный бактериопланктон озера Байкал: Автореф. дне.... канд.
биол. наук. М., 1983. 16 с.
Ступакова Т.П., Дубинина ГА., Демина Л.Л. Роль микроорганизмов в накопления
тяжелых металлов во взвеси океана Ц Микробиология. 1990. (В печати).
Таусон В.О., Веселов И.Я. О бактериальном разложении циклических соединений при
восстановлении сульфатов // Микробиология. 1934. Т. 3.
Трошанов З.П. Микроорганизмы, восстанавливающие железо и марганец в рудоносных
озерах Карельского перешейка // Там же. 1968. Т. 37. С. 934—939.
Унифицированные методы исследования качества вод. Ч. 4: Методы микробиологи-
ческого анализа воя М.: СЭВ, 1977. 114 с.
Фурсенко М.В. Метод определения гетеротрофной активности популяции бактерий
в природных водах // Гидробвол. жури. 1972. Т. 8, N 1. С. 127—133.
Фурсенко М.В. Бактериальное усвоение органического вещества в водах разной степени
загрязненности Ц Микробиология. 1975. Т. 44. С. 505—510.
Харламенко В.И. Определение численности и биомассы водных бактерий эпифлуо-
ресцентным методом с использованием отечественных ядерных микрофильтров Ц
Там же. 1984. Т. 53. С. 165—166.
Хромов В.М., Семин В-A. Методы определения первичной продукции в водоемах.
М.: Изд-во МГУ, 1975. 123 с.
Apel W.A-, Dugan P.R., Filppi J.A., Rheins M.S. Detection of Thiobacillus ferrooxidans in acid
mine by indirect fluorescent antibody staining // Appl. Environ. Microbiology. 1976.
Vol. 32. P. 159—165.
Armbruster E.H. Improved technique for isolation and identification of Sphaerotilus // Appl.
Microbiol. 1969. Vol. 17. P. 320—321.
Aragno M. Enrichment, isolation and preliminary characterization of a thermophilic, en-
dospore-forming hydrogen bacterium // FEMS Microbiol. Lett. 1978. Vol. 3. P. 13—15.
Attwood M.M.. Harder W. A rapid and specific enrichment procedure for Hyphomicrobium
spp. // Antonie van Leeuwenhoek. J. Microbiol, and Serol. 1972. Vol. 38, N 3. P. 369—379.
Azam F., Hodson R.E. Size distribution of marine microheterotrophs // Limnol. and Oceanogr.
1977. Vol. 22. P. 492—500.
Baars J.K. Over sulfaatreduktie door bakterien // Dissertation: W.D. Meinema, N.V. Delft.
Holland, 1930. S. 164.
Bache R., Pfennig ^Selective isolation of Acetobacterium woodii on metoxylated aromatic
acids and determination of growth yields // Arch. Microbiol. 1981. Vol. 130. P. 255—261.
Bak F., Cypionka H.. A novel type of energy metabolism involving fermentation of inorganic
sulfur compounds //'Nature. 1987. Vol. 326. P. 891—892.
Bak F., Pfennig N- Chemuilthotrophic growth of Desulfovibrio sulfodismutans, new species
by disproportionation of inorganic sulfur compounds // Arch. Microbiol. 1987. Vol. 147.
P. 184—189.
Baker K.H., Mils A.L Determination of the number of respiring Thiobacillus fer-
rooxidans cells in water samples by using combined fluorescent-antibody — 2(p-iodophe-
nyl)—3(p-nitrophenyl) — 5 phenyltetrazolium chloride staining//Appl. Environ. Microbiol
1982. Vol. 43. P. 338—344.
Balch W.E., Fox G.E., Magrum L.J. et al. Methanogenesis: reevaluation of a unique biological
group // Microbiol. Rev. 1979. Vol. 43. P. 260—296.
Balch W.E., Schbbert S., Anner R.S., Wolfe R.S. Acetobacterium, a new genus of hydro-
genoxidizing carbon dioxide-reducing anaerobic bacteria // Intern. J. Syst. Bacteriol. 1977.
Vol. 27. P. 355—361.
Balch W.E., Wolfe R.S. A tiey approach to the cultivation of methanogenic bacteria: 2-mer-
captoethanesulfonic acid (HS—CoM)-depended growth of Methanobacterium ruminantium
in a pressurized atmosphere // Appl. Environ. Microbiol. 1976. Vol. 32. P. 781—791.
Barksdale L. The genus Corynebacterium // The prokaryotes. N.Y.: Springer, 1981. Vol. 2.
P. 1827—1837.
Bauld J., Staley J.T Planctomyces mans sp. nov.: a marine isolate of the Planctomyces-
Blastocaulis group of budding bacteria // J. Gen. Microbiol. 1976. Vol. 97. P. 45—55.
272
Belkin S., Jannasch H.W. A new extremely thermophilic sulfur-reducing heterotrophic marine
bacterium // Arch. Microbiol. 1985. Vol. 141. P. 181—186.
Belser L.W., Schmidt E.L. Diversity in the ammonia-oxidizing nitrifier population of a soil //
Appl. Environ. Microbiol. 1978a. Vol. 36. P. 584—588.
Belser L.W., Schmidt E.L. Serological diversity within a terrestrial ammonia-oxidizing po-
pulation // Ibid. 1978b. Vol. 36. P. 584—588.
Biebl И., Pfennig N. Growth of sulfate-reducing bacteria with sulfur as electron acceptor //
Arch. Microbiol. 1977. Vol. 112. P. 115—117.
Biebl H.. Pfennig N.P. Growth yields of green sulfur bacteria in mixed culture with sulfur and
sulfate reducing bacteria // Arch. Microbiol. 1978. Vol. 117. P. 9—16.
Biebl H., Pfennig N. Anaerobic CO: uptake by phototrophic bacteria: A review // Arch.
Hydrobiol. Beih. 1979. N 12. P. 48—58.
Bitten G. A method for evaluation nitrifying activity in sediments by bark (,4C) bicarbonate
incorporation // Water Res. 1976. Vol. 10. P. 5)—57.
Bochlool B.B., Brock E.L. Nonspecific staining: its control in immunofluorescence exami-
nation of soil // Science. 1968. Vol. 162. P. 1012—1014.
Bohlooi B.B., Brock T.D. Population ecology of Sulfolobus acidocaldarius. II Immunoecological
studies // Arch. Microbiol. 1974. Vol. 97. P. 181—194.
Bohlooi B.B., Schmidt E.L. The immunofluorescence approach in microbial ecology // Adv.
Microb. Ecology. 1980. Vol. 4. M. Alexander, ed. New York: Plenum Press. P. 203—242.
Boone D.R., Bryant M.P. Propionate-degrading bacterium Syntrophobacter wolinii sp. nov.,
gen. nov., from methanogenic ecosystems// Appl. Environ. Microbiol. 1980. Vol. 40. P. 626—
632.
Braun M., Schdberth S., Gottschalk G. Enumeration of bacteria forming acetate from Нг and
СОг in anaerobic habitats // Arch. Microbiol. 1979. Vol. 120. P. 201—204.
Brock T.D. The genus Leucothrix // The procaryotes. N.Y.: Springer, 1981. Vol. 1. P. 400—408.
Brock T.D. The poisoned control in biogeochemical investigation // Environmental biogeoche-
mistry and geomicrobiology. 1978. Vol. 3. (Ed. W.E. Krumbein). Ann Arbor, Michigan:
Ann Arbor Sd. Publ., P. 717—725.
Bromfield S.M. Reduction of ferric compounds by soil bacteria // J. Gen. Microbiol. 1954.
Vol. 11. P. 1—6.
BuckJ.D. Nonstaining (KOH) method for determination of Gram reaction of marine bacteria//
Appl. Environ. Microbiol. 1982. Vol. 44. P. 992—993.
Caldwell D.E„ Caldwell S.J., Laycock J.P. Thermothrix thiopara gen. nov., sp. nov., a facul-
tatively anaerobic, facultatively chemolitotroph living at neutral pH and high temperature //
Canad. J. Microbiol. 1976. Vol. 22. P. 1509—1517.
Calge G.D. Critical point drying: rapid method for determinating of bacterial extracellular
polymer and surface structure // Appl. Microbiol. 1974. Vol. 28. P. 312—316.
Campbell L.L. Genus Desulfotomaculum // Bergey’s manual of determinative bacteriology.
8th ed. Baltimore, 1974. P. 572—573.
Canale-Parola E. Free-living anaerobic and facultatively anaerobic spirochaetes the genus
Spirochaeta // The prokaryotes. N.Y.: Springer, 1981. Vol. 1. P. 538—547.
Cappenberg Th.E.. Prins R.A. Interrelations between sulfate-reducting and methane-producing
bacteria in bottom deposit of a freshwater lake, 3. Experiments with ’*C-]abelled substrates //
Antonie van Leeuwenhoek. J. Microbiol, and Serol. 1974. Vol. 40. P. 457—469.
Caraway B.H., Krieg N.R. Uncoordination and recoordination in Spirillum volutans // Canad.
J. Microbiol. 1972. Vol. 18. P. 1749—1759.
Castenhollz R.W. Thermophilic blue-green algae and the thermal environment // Bacteriol.
Rev. 1969. Vol. 33. P. 476—504.
Castignelti D., Hollocher T.C. Heterotrophic nitrification among denitrifiers // Appl. Environ.
Microbiol. 1984. Vol. 47. P. 620—623.
Castro A.F., Ehrlich HL. Reduction of iron oxide minerals by a marine Bacillus // Ant. van
Leeuw., J. Microbiol., Serol. 1970. Vol. 36. P. 317—327.
Cataldi M.S. Aislamiento de Beggiatoa alba en cultivo puro // Rev. Inst, bacteriol. nacl. hig.
1940. Vol. 9. P- 393—423.
Cristensen P.J. The history, biology and taxonomy of the Cytophaga groups // Canad.
J. Microbiol. 1977. Vol. 23. P. 1599—1653.
Clark A.S., Walsby A.E. The occurence of gas vacuolate bacteria in lakes // Arch. Microbiol.
1973. Vol. 118. P. 222—228.
18. Зак. 1766
273
Cohen-Bazire G.W., Sistrom R., Stonier R.Y. Kinetic studues of pigment synthesis by
non-sulfur purple bacteria // J. Cell. Comp. Physiol. 1957. Vol. 49. P. 25—68.
Collins V.G. Isolation, cultivation and maintenance of autotrophs // Methods in micro-
biology. L.: Acad, press, 1969. Vol. ЗВ. P. I—52.
Colmer A.B., Temple K., Hinkle M.E. An tron-oxidizing bacterium from the drainage of
some bitominous cool mines // J. Bacterio!. 1949. Vol. 59. P. 317—329.
Conrad R-. Seiler W. Utilization of trace of carbon monooxide by aerobic oligotrophic
microorganisms in ocean, lake and soils // Arch. Microbiol. 1982. Vol. 132. P. 41—46.
Cypionka H., Widdel F, Pfennig N. Survival of sulfatereducing bacteria after oxygen
stress and growth in sulfate-free oxygen-sulfide gradient // FEMS Microbiol. Ecol.
1985. Vol. 31. P. 39—46.
Czurda К Uber eine neue Autotrophe und Thermophile Schwefelbakterien Gessell-
schaft // Zbl. Bakteriol. 1934. Abt. II. Bd. 92. S. 407—418.
Day J.M., Dobereiner Z. Physiological aspects of Ni-fixation by a Spirillum from Digitari
a roots // Soil. Biol. Biochem. 1976. Vol. 8. P. 45—50.
Dubinina G.A. Die Rolle der heterotrophen Mikroorganisms bei der Oxidation von einiger
anorganischen Verbindungen // III. Intern, hydromicr. Symp. Bratislava: Verl. Slow.
Akad. Wiss., 1981a. S. 413—421.
Dubinina G.A. The role of microorganisms in the formation of the recent iron-manganese
lakustrine ores // Geology and geochemistry of manganese. Budapest: Acad. Kiado,
1981b. Vol. 3. P. 305—326.
Dubinina G.A. Infection of prokariotic and eukariotic microorganisms with metailogenium //
Curr. Microbiol. 1984. Vol. II. P. 349—354.
Dubinina G.A., Zhdanov A. V. Recognition of iron bacteria Siderocapsa as arthrobacter
and description of Arthrobacter sicerocapsulatus sp. nov. // Intern. J. Syst. Bacterio). 1975.
Vol. 25. P. 340—350.
Ert M. van, Staley J.T. Gas-vacuolated strains of Microcyclus aquaticus // J. Bacteriol.
1971. Vol. 108. P. 236—240.
Evans D.G., Beauchamp E., Trevans J. Sulfide alleviation of the acetylene inhibition of
nitrous oxide reduction in soil // Appl. Environ. Microbiol. 1985. Vol. 49. P. 247—249.
Fischer F, Zillig W., Stetter K.O., Schreiber G. Chemolitotrophic metabolism of extremely
thermophilic archaebacteria // Nature. 1983. Vol. 301. P. 5it—513.
Fliermans C.B., Schneider C.P., Schmidt E.L. Direct measurement bacterial stratification in
Minnesota lakes // Arch. Hydrobiol. 1975. Vol. 76. P. 248—255.
Fogg G.E. Nitrogen fixation in lakes // Plant and Soil. 1971. Spec. Vol. P. 393—405.
Fowler V.J., Widdel F., Pfennig N. et al. Phylogenetic relationship of sulfate-reducing
and sulfur-reducing eubacteria // Syst. Appl. Microbiol. 1986. Vol. 8. P. 32—41.
Franzmann P.D., Skerman B.V.D. Gemmata obscuriglobus a new genus and species of
the budding bacteria // Antonie van Leeuwenhoek J. Microbiol, and Serol. 1984. Vol. 50.
P. 261—268.
Friedrich C.G., Mitrenga G. Oxidation of thiosulfate by Paracoccus denitrificans and other
hydrogen bacteria // FEMS Microbiol. Lett. 1981. Vol. 10. P. 209—212.
Gallardo У.А. Large benthic microbial communities in sulfude biota under Peru—Chile
subsurface counter-current // Nature. 1977. Vol. 286. P. 331—332.
Gebers R.. Beese M. Pedomicrobium americanum sp. nov. and Pedomicrobium australicum
sp. nov. from aquatic habitats, Pedomicrobium gen. emend., and Pedomicrobium
ferrugineum sp. emend // Intern. J. Syst. Bacteriol. 1988. Vol. 38. P. 303—315.
Geitler. L. Chamaesiphonosira cymbellicola nov. gen., nov. sp., ein knosphenbildendes
Bakterium und sein specialisierter Epiphytismus // Arch. Microbiol. 1975. Vol. 103.
P. 231—236.
Gest H.. Favinger J.L. Heliobacterium chlorum, an anoxigenic brownish-green photosynthetic
bacterium, containing ’’new" form of bacteriochlorophyll / / Ibid. 1983. Vol. 136. P. 11—16.
Ghiorse W. Biology of iron- and manganese-depositing bacteria // Annu. Rev. Microbiol.
1984. Vol. 38. P. 515—550.
Giovannoni S.J., Schabtach E., Castenholz R.W. Isosphaera pallida, gen and comb, nov., a
glinding, budding eubacterium from hot springs // Arch. Microbiol. 1987. Vol 147.
P. 276—284.
Gimesi N. Planctomyces bekefii Gim nov. gen. et sp. Budapest: Kiadja and Magyar
Ciszterici Rend., 1924.
274
Gode P., Overbeck J. Vntcrsuchungen zur heterotrophen Nitrification in See // Ztschr.
allgem. Mikrobiol. 1972. H. 12. S. 567—574.
Gossling J. Moore W.E. Gemminger formicilis nov. gen., sp., an anaerobic budding bacterium
from intrestines // Intern. J. Syst. Bacteriol. 1975. Vol. 25. P. 202—207.
Gowda T.K.S., Watanabe I. Autoradiographic technique for screening chemolithotrophic
hydrogen-utilizing bacteria // Canad. J. Microbiol. 1983. Vol. 29. P. 1081—1086.
Guay R. Silver M. Thiobacillus acidophilus sp. nov., isolation and some physiological
characteristics // Can. J. Microbiol. 1975- Vol. 21. P. 281—288.
Gude U.. Strohl W.R., Larkin J.M. Mixotrophic and heterotrophic growth of Beggiatoa
alba in continuous culture // Arch. Microbiol. 1981. Vol. 129. P. 357—360.
Hagedorn C., Holt J.G. A nutritional and taxonomic survey of Arthrobacter soil isolates //
Canad. J. Microbiol. 1975. Vol. 21. P. 353—361.
Harder W.. Attwood M.M. Biology, physiology and biochemistry of Hyphomicrobia // Adv.
Micro). Physiol. 1978. Vol. 17. P. 303—359.
Harms H.. Koops HP.. Wehrmann H. An ammonium oxidizing bacterium Nitrosovibrio
tennuis gen. nov., sp. nov. // Ibid. 1976. Vol. 108. P. 105—111.
Harrison A.P. (Jr.). The acidophilic Thiobacillus and other acidophilic bacteria that share their
habitats // Annu. Rev. Microbiol. 1984. Vol. 38. P. 265—292.
Harwood C.S.. Canale-Parole E. Ecology of spirochaetes // Ibid. 1984. Vol. 38. P. 161—192.
Heat I.B., Unestam T. Mycoplasma-like structure in the aquatic fungus Aphanomyces astaci //
Science. 1974. Vol. 183. P. 434—435.
Henrichi A.T. Studies of freshwater bacteria. 1. A direct microscopic technique // J. Bacteriol.
1933. Vol. 25. P. 277—286.
Henrichi A.T., Johnson D.A. Studies of freshwater bacteria. 2. Stalked bacteria, a new order of
Schizomycetes // Ibid. 1935. Vol. 30. P. 61—92.
Hespel P.B.. Canale-Parola E. Carbohydrat metabolism in spirochaeta stenostrepta // Arch.
Microbiol. 1970. Vol. 78. P. 234—236.
Hetter K.O.. Gaag G. Reduction of molecular sulfur by methanogenic bacteria // Nature.
1983. Vol. 305. P. 309—311.
Hirsch P. Biology of budding bacteria // Arch. Microbiol. 1964. Vol. 48. P. 339—357.
Hirsch P. Biology of budding bacteria. 4. Epicellular deposition of iron by aquatic budding
bacteria // Ibid. 1968. Vol. 60. P. 201—216.
Hirsch P. Neue Methoden zur Beobachtung und Izolirung ungewohnlicher oder wenig
bekannter Wasserbakterien // Ztschr. allgem. Mikrobiol. 1972. Bd. 12, N 2. S. 203—212.
Hirsch P. Budding bacteria // Annu. Rev. Microbiol. 1974. Vol. 28. P. 391 — 444.
Hirsch P., Conti S.F. Biology of budding bacteria: Enrichment, isolation and morphology
of Hyphomicrobium sp. // Arch. Microbiol. 1964. Vol. 48. P. 339—357.
Hirsch P. Muller M. Planctomyces limnophilus sp. nov., a stalked and budding bacterium
from fresh water // Syst. Appl. Microbiol. 1985a. Vol. 6. P. 276—280.
Hirsch P„ Muller M. Blastobacter aggregatus sp. nov., Blastobacter capsulatus sp. nov.
and Blastobacter denitrificans sp. nov., a new budding bacteria from freshwater habitats //
Ibid. 1985b. Vol. 6. P. 281—286.
Hirsch P.. Muller M. Methods and sources for the enrichment and isolation of budding,
nonprosthecate bacteria from fresh water // Microbiol. Ecol. 1986. Vol. 12. P. 331—343.
Hirsch P., Pankratz S.H. Study of bacterial populations in natural environments by use of
submerged electron microscopic grids // Ztschr. allgem. Mikrobiol. 1970. Bd. 10. S. 589—605.
Hobbie l.E. Carbon C-14 measurements of primary production in two Arctic Alaska lakes //
Verh. Intern. Vereinig. theor. und angew. Limnol. 1964. Bd. 5. T. 1. S. 360—364.
Hobbie J.E., Wright R.T. A new methods for the study of bacteria in lakes: description and
results // Mitt. Intern. Vereining. Limnol. 1968 Bd. 14. S. 64—71.
Hungate R.E. Hydrogen as an intermediate in the rumen fermentation // Arch. Microbiol.
1967. Vol. 59. P. 158—164.
Hungate R.E. A roll tube method for cultivation of strict anaerobes // Methods in micro-
biology. N.Y.: Acad, press, 1969. Vol. ЗВ. P. 117—132.
Hutton W.E., Zobell C.E. Production of nitrite from ammonia by methane-oxidizing bacteria //
J. Bacteriol. 1953. Vol. 65. P. 216—219.
Hvid-Hansen N. Sulfate-reducing and hydrocarbon-producing bacteria in ground water //
Acta pathol. et microbiol. scand. 1951. Vol. 29. P. 315—335.
Hyllemon P.B.. Wells J.S., Krieg N.R.. Jannasch H. W. Genus Spirillum: A taxonomic study //
Intern. J. Syst. Bacteriol. 1973. Vol. 23. P. 340—380.
275
Johnson D.B., Kelso W.L Detection of heterotrophic contaminants of culture of Thiobacillus
ferrooxidans and their elimination by subculturing in media containing copper sulfate //
J. Gen. Microbiol. 1983. Vol. 129. P. 2969—2972.
Johnson R.C. Aerobic spirochaetes: the genus Leptospira // The prokariotes. N.Y.: Springer,
1981. Vol. I. P. 582—591.
Jones J.G., Gardner D.S. Iron reduction by bacteria: range of organisms involved
and metals reduced. // FEMS Microbiol. Lett. 1984. Vol. 21. P. 133—136.
Jones R.D., Morita R.Y. Carbon monooxide oxidation by chemolithotrophic ammonium
oxidizer // Canad. J. Microbiol. 1983. Vol. 45. P. 401—410.
Jorgensen B. Distribution of colourless sulphur bacteria (Beggiatoa) in a coastal marine sedi-
ments // Mar. Biol. 1977. Vol. 41. P. 19—28.
Jorgensen B., Revsbach N.P. Colourless sulfur bacteria, Beggiatoa sp. and Thiovulumsp., in Ojand
HrS microgradients // Appl. Environ. Microbiol. 1983. Vol. 45. P. 1261 —1270.
Jurtschuk P. (Jr.). McQuitty D.N. Survey of oxidase-positive and negative‘bacteria using a
quantitative covacs oxidase test // Intern. J. Syst. Bacteriol. 1976. Vol. 26. P. 127—135.
Kawasumi T, Igarashi Y.. Komada T, Minoda Y. Hydrogenobacter thermophilus gen. nov.,
sp. nov., an extremely thermophilic, aerobic, hydrogen-utilizing bacterium // Int. J. Syst.
Bacteriol. 1984. Vol. 34. P. 5—10.
Kelly D.P., Kuenen J.G. Ecology of colourless sulphur bacteria // Aspects of microbial
metabolism and ecology / Ed. G.A. Codd. N.Y.: Acad, press, 1984. P. 211—240.
Knovles L The significance of Asymbiotic dinitrogen fixation by bacteria // A Treatise of
dinitrogen Fixation / RWT Hardy, A.H. Gibson, eds/ Sect. 4. 1977. N.Y.: John Wiley, 1977.
P. 33—83.
Klein D.P.. Charles A.M. Media effect on the growth Thiobacilius novellus // Curr. Microbiol.
1987. Vo). 15. P. 107—110.
Konig E.. Schlesner H., Hirsch P. Cell wall studies on budding bacteria of the Planctomyces /
Pasteuria group and on Prosthecotnicrobium sp. // Arch. Microbiol. 1984. Vol. 138.
P. 200—205.
Konig M.. Stetter K.O. Isolation and characterization of Methanolobus tindarius sp. nov., a
coccoid methanogen growing only on methanol and methylamines // Zbl. Bakteriol. Abt: I
Orig. C. 1982. Bd. 3/4. S. 478—490.
Konopka A.E., Moore R.L., Staley J.T. Taxonomy of Microcyclus and other nonmotile
ring-forming bacteria // Intern, J. Syst. Bacteriol. 1976. Vol. 26. P. 505—510.
Konopka A.E., Staley J.T., Lara J.C. Gas vesicle assembly in Microcyclus aquaticus //
J. Bacteriol. 1975. Vol. 122. P. 1301 — 1309.
Kristjansson J.K., Ngason A.. Alfredsson G.A. Isolation of thermophilic obligately autotrophic
hydrogen-utilizing bacteria similar to Hydrogenobacter thermophilus from Islandic hod
springs // Arch. Microbiol. 1985. Vol. 140. P. 391—325.
Krul J.M., Hirsch P.. Staley J.T. Toxothrix trichogenes (Choi) Berger et Bringmann:
The organism and its biology // Antonie van Leeuwenhoek. J. Microbiol, and Seroi 1970
Vol. 36. P. 409—420.
Krumbein W.F. Manganese oxidizing fungi and bacteria in recent shelf sediments of the
bay of Biscay and the North Sea // Naturwissenschaften. 1971. Bd. 58. S. 56—57.
Kucera S.. Wolfe R.S. A selective enrichment method for Gallionella ferruginea // J. Bacteriol.
1957. Vol. 74. P. 344—349.
Kuenen J.G.. Bedeuker R.F. Microbiology of Thiobacilli and other sulphur-oxidizing
autotrophs, mixotrophs and heterotrophs // Philos. Trans. R. Sic. Lond. 1982.
Bd. 298. P. 473—497.
Kuenen J.G., Robertson L.A. Ecology of nitrification and denitrification // The Nitrogen
and Sulfur Cycles / Ed. J.A. Cole, S. Ferguson. Cambridge, 1987. P. 161—218.
Kuenen J.G.. Tuovinen O.H. The genera Thiobacillus and Thiomicrospira // The proka-
ryotes. N.Y.: Springer, 1981. Vol. 2. P. 1023—1036.
Kuenen J.G., Veldkamp R. Thiomicrospira pelophyla nov. gen., nov. sp., a new obligately
chemolnhotrophic colourless sulfur "bacterium // Antonie van Leeuwenhoek. J. Microbiol,
and Seroi. 1972. Vol. 38. P. 241—256.
Laanbrock H.J., Stab L.J., Veldkamp H. Utilizing of hydrogen and formate by Campylobacter
spec, under anaerobic and aerobic conditions // Arch. Microbiol. 1978. Vol. 119.
P. 95—102.
Lackey I.B., Lackey E. W. The habit and description of a new genus of sulfur bacterium //
J. Gen. Microbiol. 1961. Vol. 26. P. 29—39.
276
La Riviere J. H'.M. Cultivation and properties of Thiovulum majus Hinze // Symp. on шаг.
microbiol. Springfield (Ш).: Thomas, 1963. P. 61—72.
La Riviere J. W.M., Dubinina G.A. Genus Macromonas // Bergey’s manual of systematic
bacteriology. 9th ed. N.Y.: Springer, 1989. Vol.,3. P. 1839—1840.
Larkin J.M. Isolation of Thiothrix in pure culture and observation of filamentous
epiphyte on Thiothrix // Cure. Microbiol. 1980. Vol. 4. P. 155—158.
Larkin J.M., Borral R. Spirosomaceae, a new family to contain the genera Spirosoma
Migula 1894. Flectobacillus Larkin et al., 1977, and Runella Larkin and Williams 1978 //
Int. J. Syst. Bacteriol. 1978. Vol. 28. P. 595—596.
Larkin J.M., Shinabarger D.L. Characterization of Thiothrix nivea // Intern. J. Syst. Bacteriol.
1983. Vol. 33. P. 841—846.
Larkin J.M., Strohl W.R. Beggiatoa, Thiothrix and Thioploca // Annu. Rev. Microbiol.
1983. Vol. 37. P. 341—367.
Larkin J.M., Williams P.M. Taxonomy of genus Spirosoma Oerskof // Intern. J. Syst.
Bacteriol. 1977. Vol. 27. P. 147—156.
Larson R.L, Pate J.L. Growth and morphology of Asficcacaulis biprosthecum // Arch. Microbiol.
1975. Vol. 106. P. 147—157.
Leathen W. W., McIntyre S.A., Braley S.A. A medium for the study of the bacterial
oxidation of ferrous iron // Science. 1951. Vol. 114. P. 280.
Lewin R.A., Lounsbery D.M. Isolation, cultivation and characterization of Flexibacteria //
J. Gen. Microbiol. 1969. Vol. 58. P. 145—170.
London J. Thiobacillus intermedius nov. sp. a novel type of facultative autotroph //
Arch. Mikrobiol. 1963. Bd. 46. S. 329—337.
London J., Rittenberg S.C- Thiobacillus perometabolis nov. sp., a non-autotrophic Thiobacillus//
Ibid. 1967. Bd. 59. S. 218—225.
Luft J.N. Ruthenium red and violet. 2. Fine structural localization in animal tissue //
Anat. Rec. 1971. Vol. 171. P. 369—415.
Madigan M.T.. Peterson S.R., Brock T.D. Nutritional studies on Chloroflexus, a filamentous,
photosynthetic, glinding bacterium // Arch. Microbiol. 1984. Vol. 100. P. 97—102.
Maiden M.F.J., Jones J.G. A new filamentous, glinding bacterium, Filibacter limicola
gen. nov., sp. nov. // J. Gen. Microbiol. 1984. Vol. 130. P. 2943—2959.
Maier S. The genus Thioploca // Bergey’s Manual of Determinative Bacteriology / Ed.
R.E. Buchanan, N.E. Gibbons. Baltimore: William and Wilkins, 1974. P. 115—116.
Maier S. Description of Thioploca ingrica sp. nov., nom. rev. // Int. J. System. Bacteriol.
1984. Vol. 34. P. 344—345.
Marschall K. Interface in microbial ecology. Cambridge'. Harvard Univ, press, 1976. 156 p.
Maiden M.F.J.. Jones J.G. A new filamentous, glinding bacterium, Filibacter limicola,
gen. nov., sp. nov. // J. Gen. Microbiol. 1984. Vol. 130. P. 2943—2953.
Mezzino M.J., Strohl W.R.. Larkin J.M. Characterization of Beggiatoa alba // Arch. Microbiol.
1984. Vol. 137. P. 139—144.
Molisch H. Neue farblose Schwefelbakterien // Zbl. Bakteriol. Abt. II. 1912. Bd. 33. S. 55.
Mills A.L., Wassel R.A. Aspects of diversity-measurements for microbial communities //
Appl. Environ. Microbiology. 1980. Vol. 40. P. 578—586.
Moore R.L. The genera Hyphomicrobium, Pedomicrobium and Hyphomonas // The
prokaryotes. B.: Springer, 1981. Vol. 1. P. 926—937.
Moore R.L., Weiner R.M., Gebers R. Genus Hyphomonas Pongartz 1957 mom. rev. emend.,
and Hyphomonas neptunium (Leifson, 1964) comb. nov. emend. (Hyphomicrobium
neptunium) // Int. J. Syst. Bad. 1984. Vol. 34. P. 71—73.
Mulder E.G., Van Veen W.L. Investigation of the Leptothrix—Sphaerotilus group // Antonie
van Leeuwenhoek. J. Microbiol, and Seroi. 1963. Vol. 92. P. 121—153.
Midler L.L. Jack T.G. Rapid chemical dehydratation of samples for eledron microscopic
examination // J. Histocbem. and Cytochem. 1975. Vol. 23. P. 107—110.
Myers C.R., Nealson K.H. Bacterial Mn reduction and growth with MnOj as the sole eledron
acceptor // Science. 1988. Vol. 240, N. 4857, P. 1319—1322.
Nealson K.H. Microbial oxidation and reduction of manganese and iron // Biomineralization
and biological accumulation: 4th Intern, symp. on biomineralization. Dordreht etc.:
Reidel, 1982. P. 459—479.
Nelson D.C., Jannasch H.W. Chemoautotrophic growth of marine Beggiatoa in suffide-
gradient cultures // Arch. Microbiol. 1983. Vol. 136. P. 262—269.
277
з аг §
METHODS OF INVESTIGATIONS OF AQUEOUS MICROORGANISMS
S.I. Kuznetsov, G.A. Dubinina
M.: Nauka, 1989.
Modern methods of investigations of aqueous microorganisms and of
processes carried out by them are summarized in the manual.
Along with the conventional methods of the hydromicrobiology here
the new ones are presented, suitable for the long-term evaluation of
number and activity of microorganisms.
In the first section the methods are given for the study and quantitative
calculation of microorganisms. The immunofluorescent analysis of the
species composition and of quantity of single groups as well as methods
of the cell cycle investigations in alive microorganisms have been described.
One can also find here the description of methods for microorga-
nisms examinations in the natural inhabitance using the peloscopes of
Perfiliev.
In the second section cultivation and quantitative determination of
microorganisms in nature are described. Considering new data available,
a short characteristics of basic physiological and ecologotrophic bacterial
groups participating in the turnover of carbon, nitrogen, sulfur, iron and
manganese is given.
The present day data on the characteristics and cultivation methods
of microorganisms still not appeared in other manuals are described here
in more details.
We mean first of all groups of budding and prosthecate bacteria, sulfur-
oxidizing chemoautotrophic and chemoorganoheterotrophic as well as of
bacteria oxidizing and reducing iron and manganese and then the micro-
organisms carrying out the processes of heterotrophic nitrification.
In the third section — methods of determination of the intensity of
microbiological processes of carbon, nitrogen, sulfur turnover proceeding
in aqueous reservoirs are described. Methods are given for usage of ra-
dioactive and stable isotops and gas chromatography as well as methods
of inhibitory analysis.
In chapter dealing with the study of bacterial hydrogen sulfide gene-
ration besides conventional ones, metgods of sulfur reduction and
diagenetic transformations of hydrogen sulfide in silt deposits are described.
The book includes the detailed list of references to original works.
Кузнецов Сергей Иванович
МЕТОДЫ ИЗУЧЕНИЯ
ВОДНЫХ
МИКРООРГАНИЗМОВ
Институтом микробиологии АН СССР