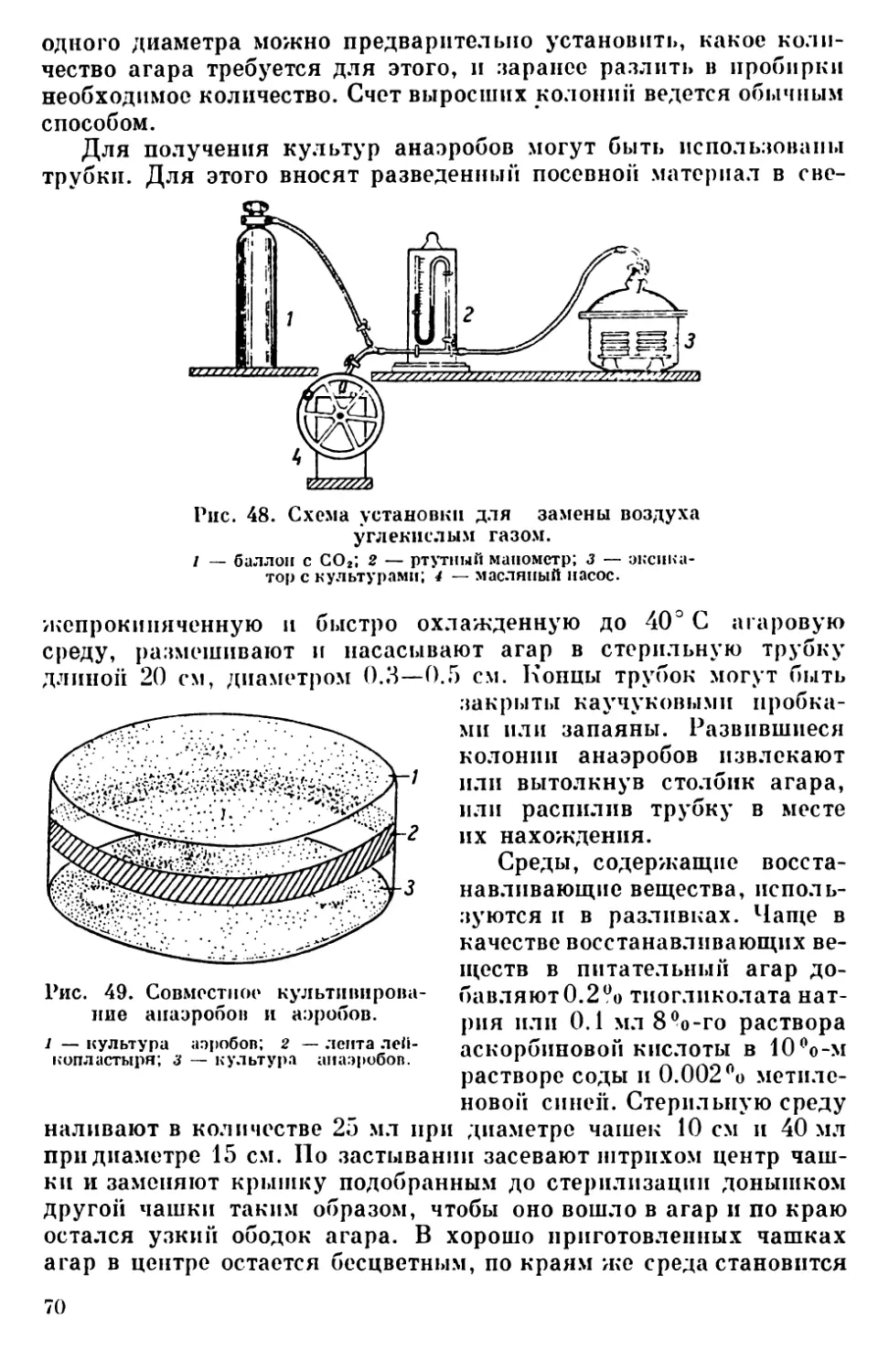
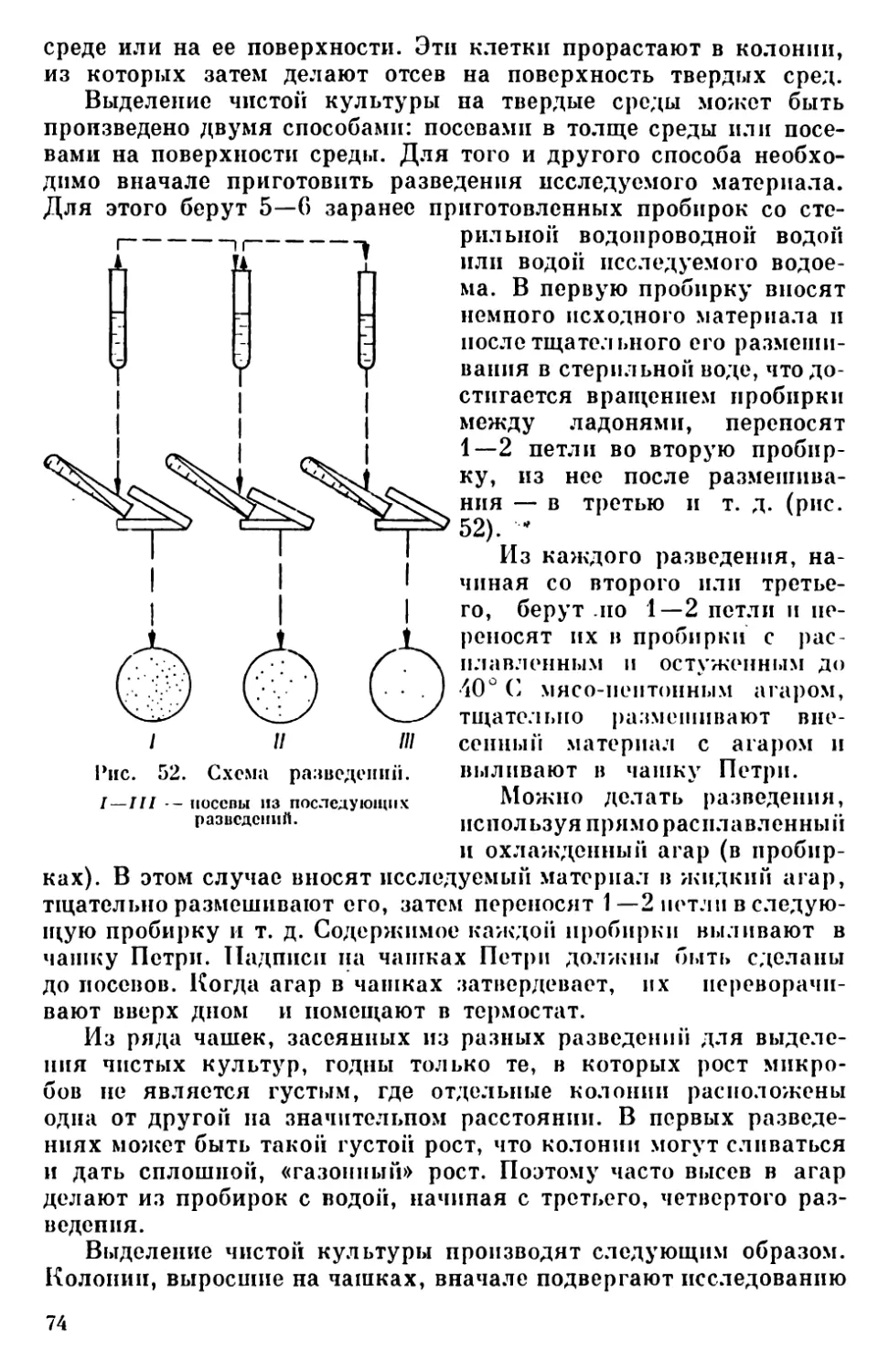
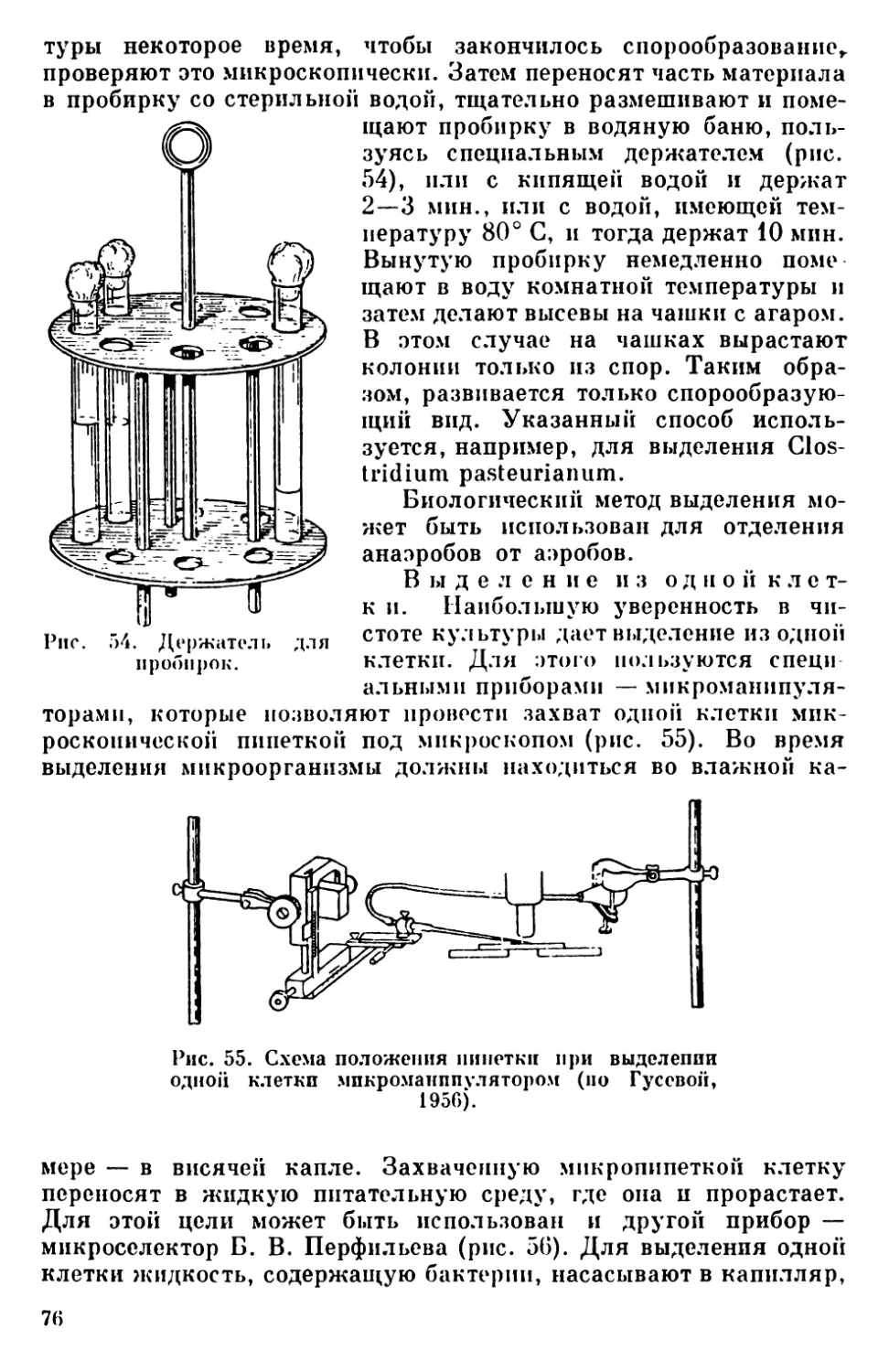
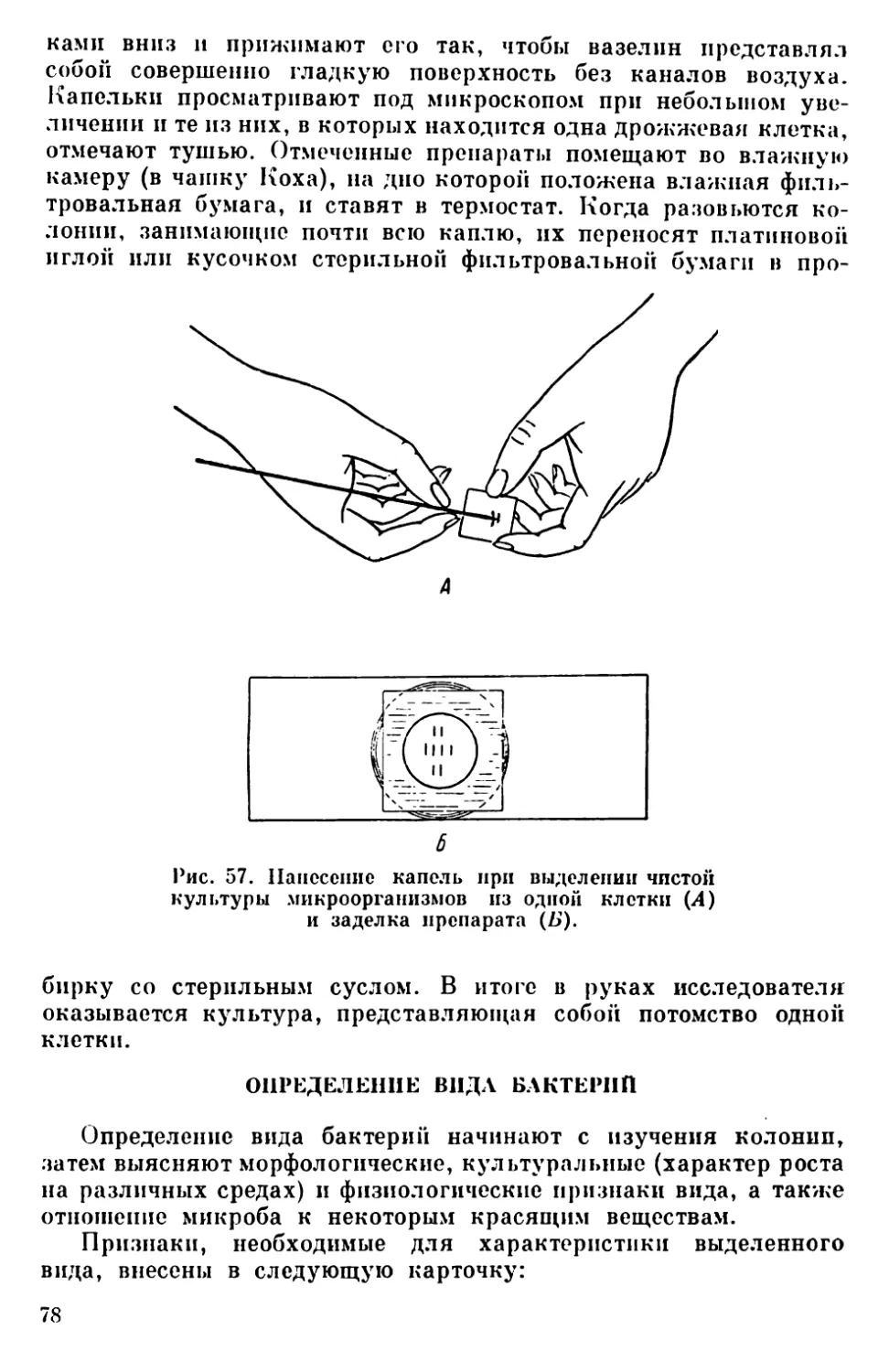
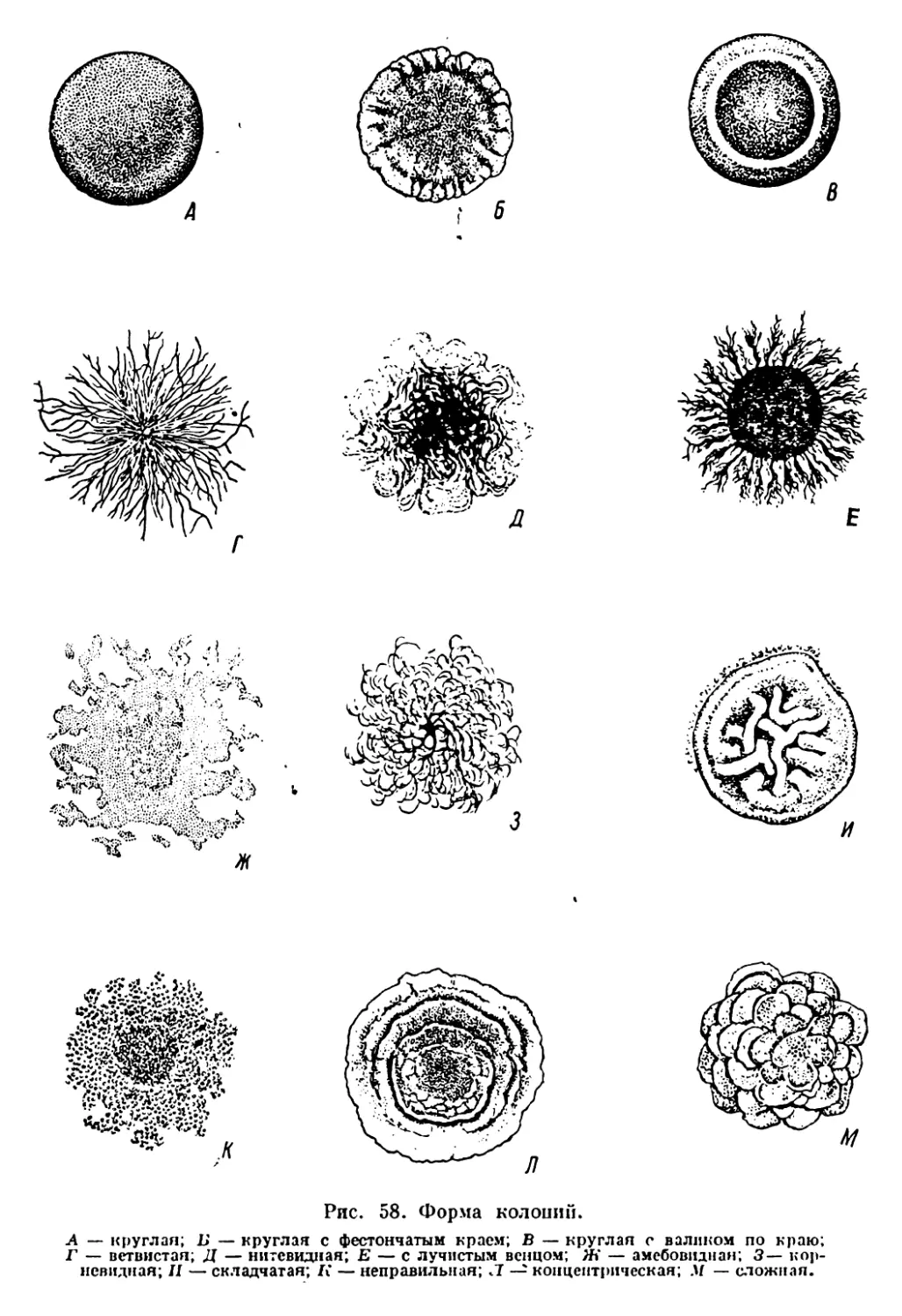
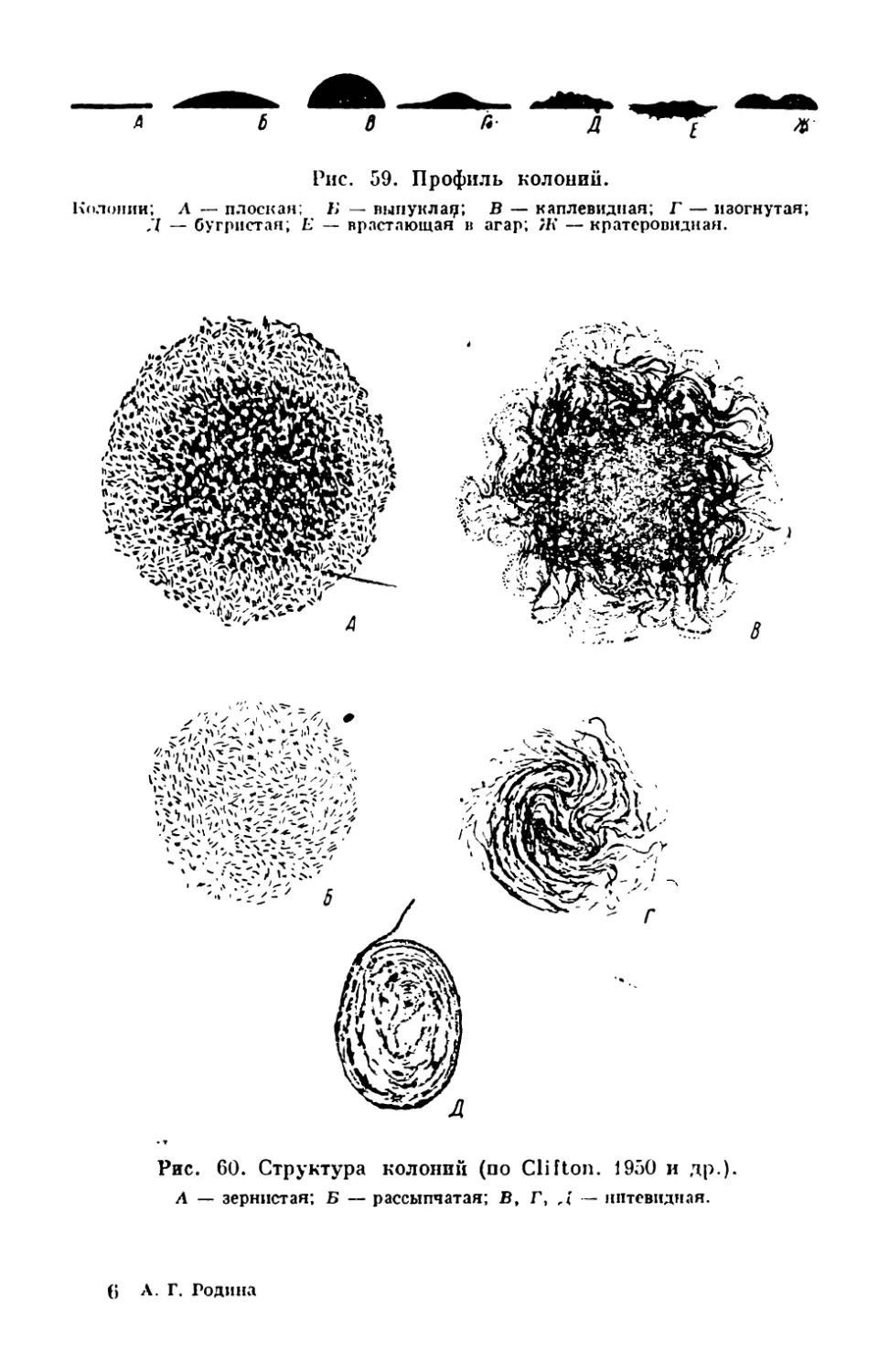
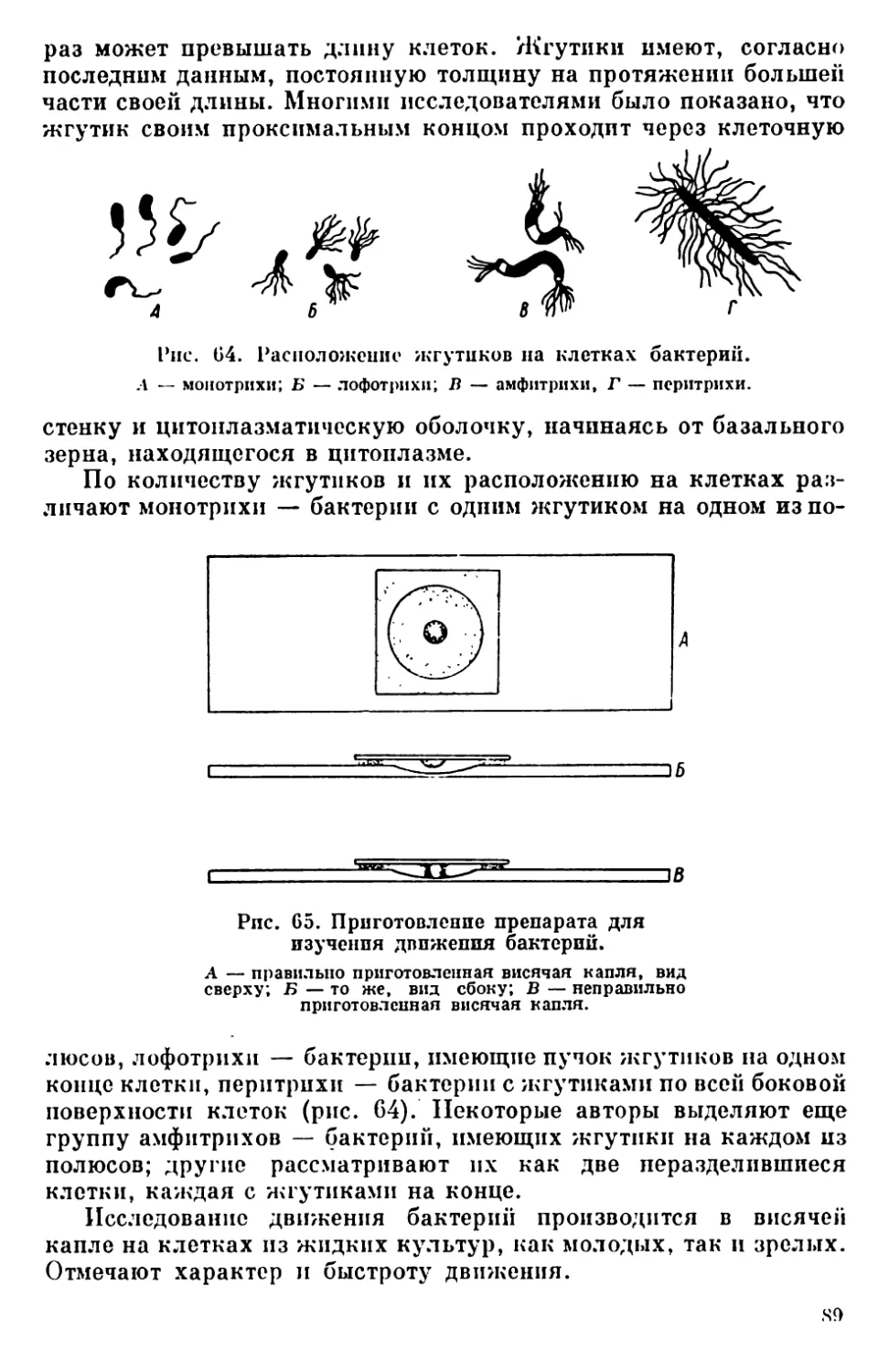
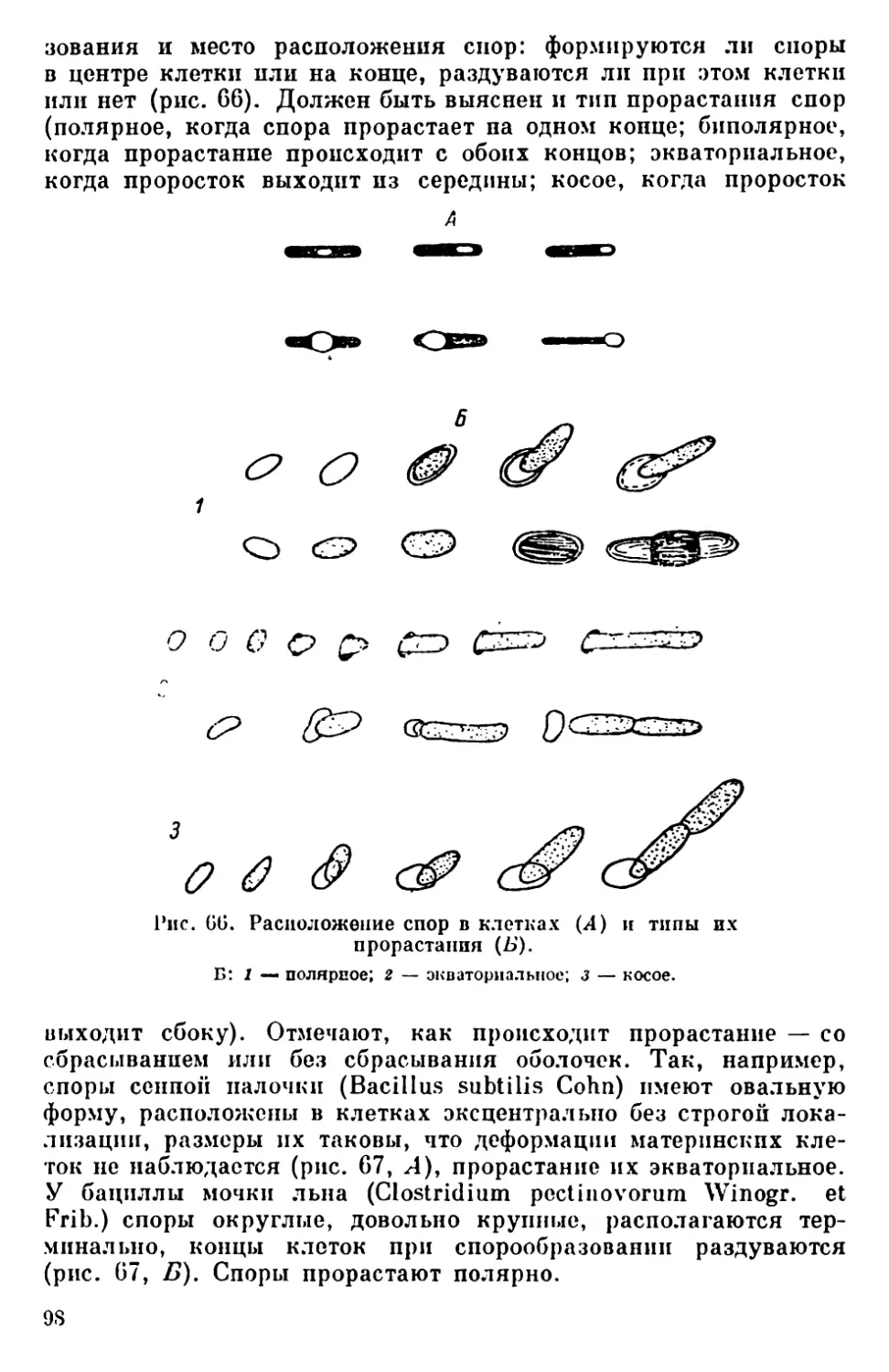
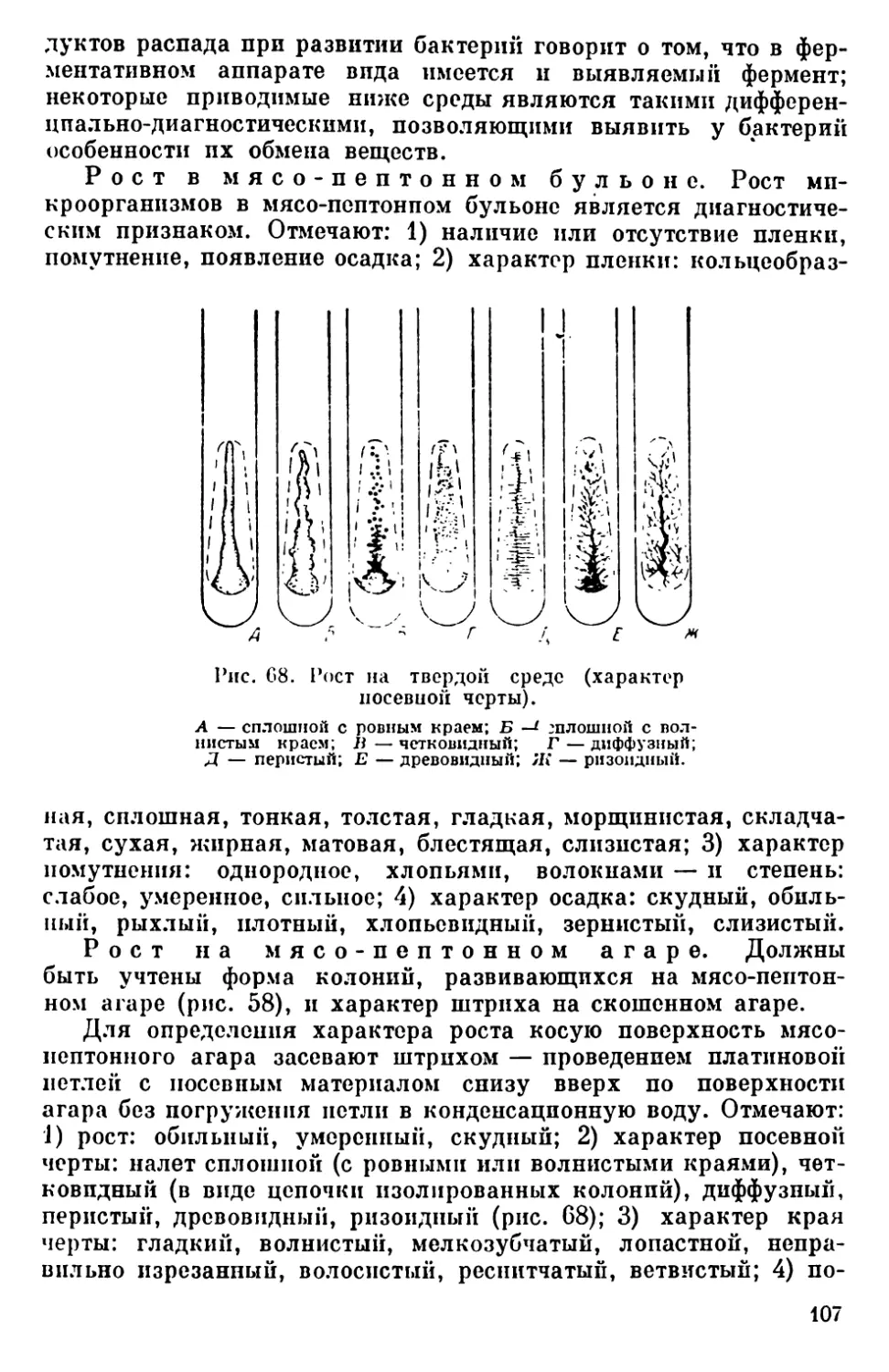
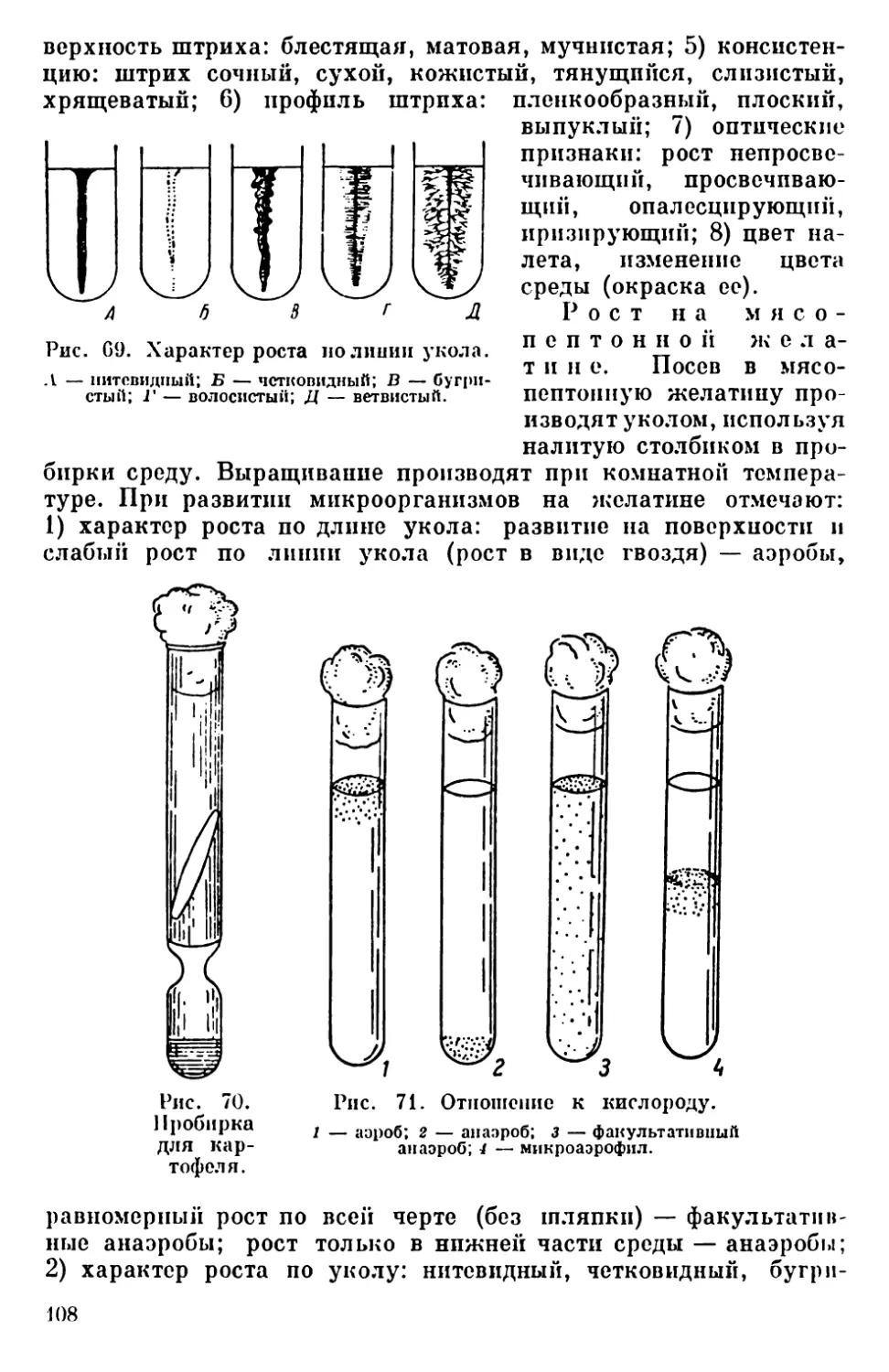
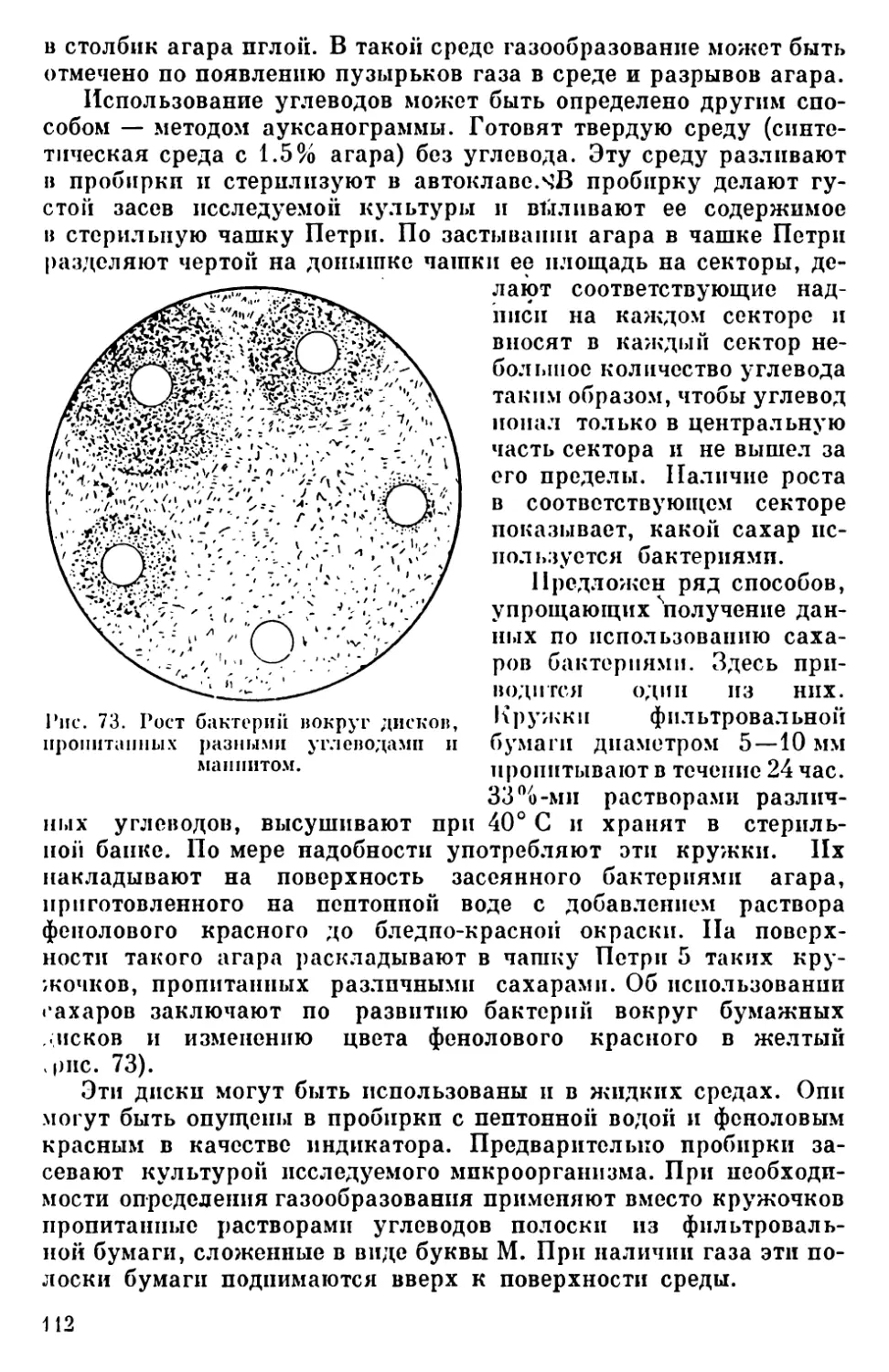
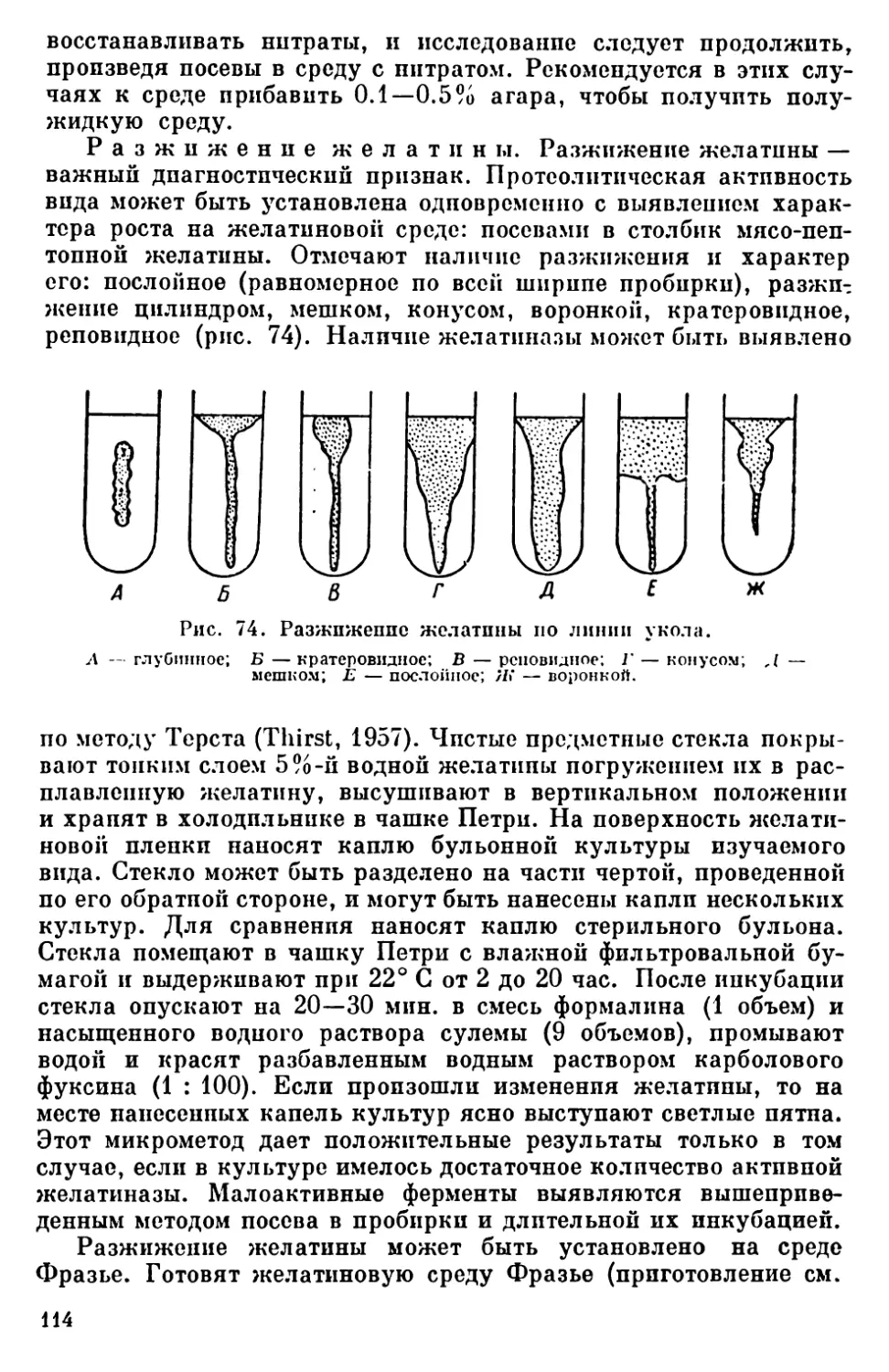
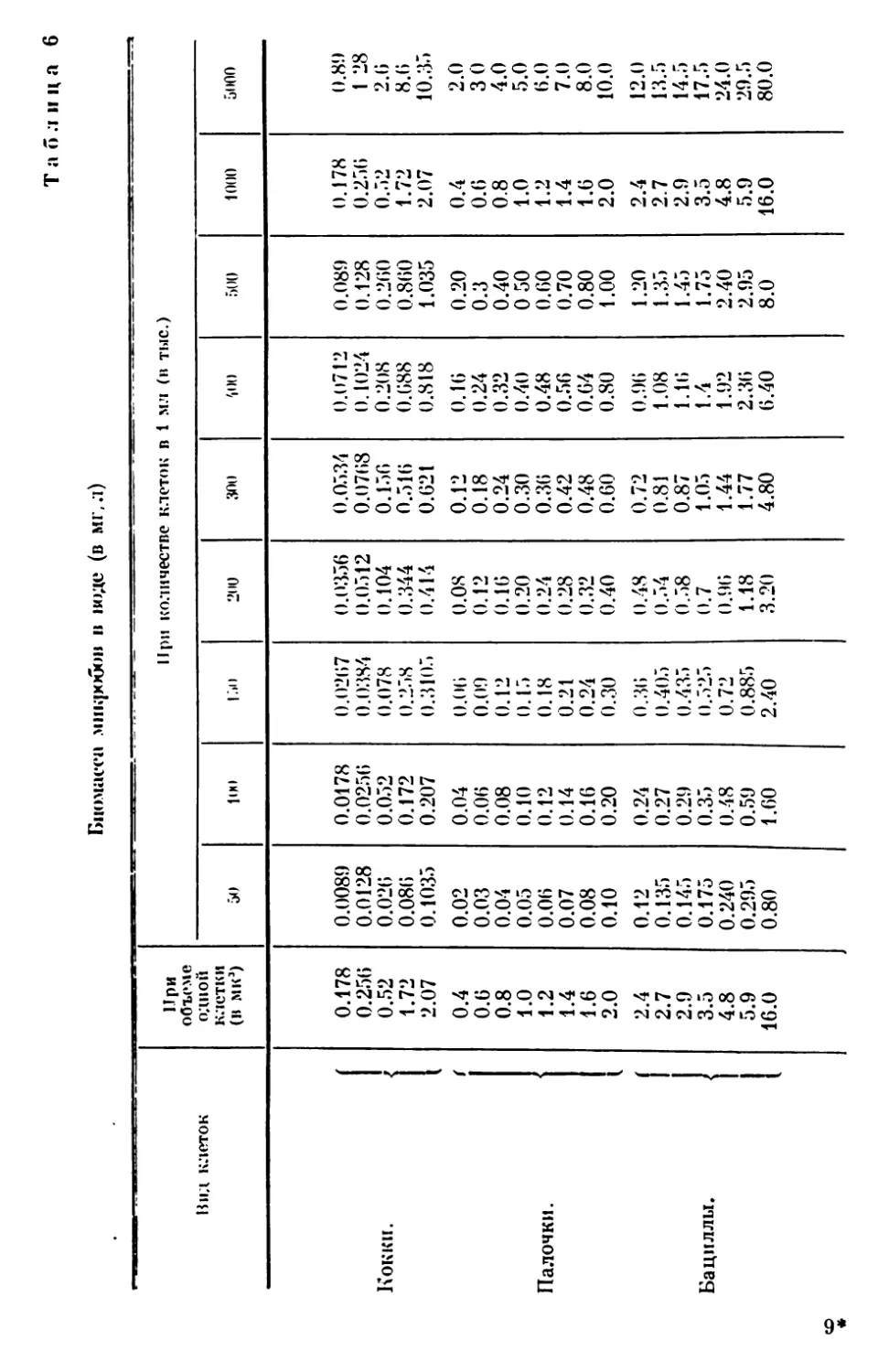
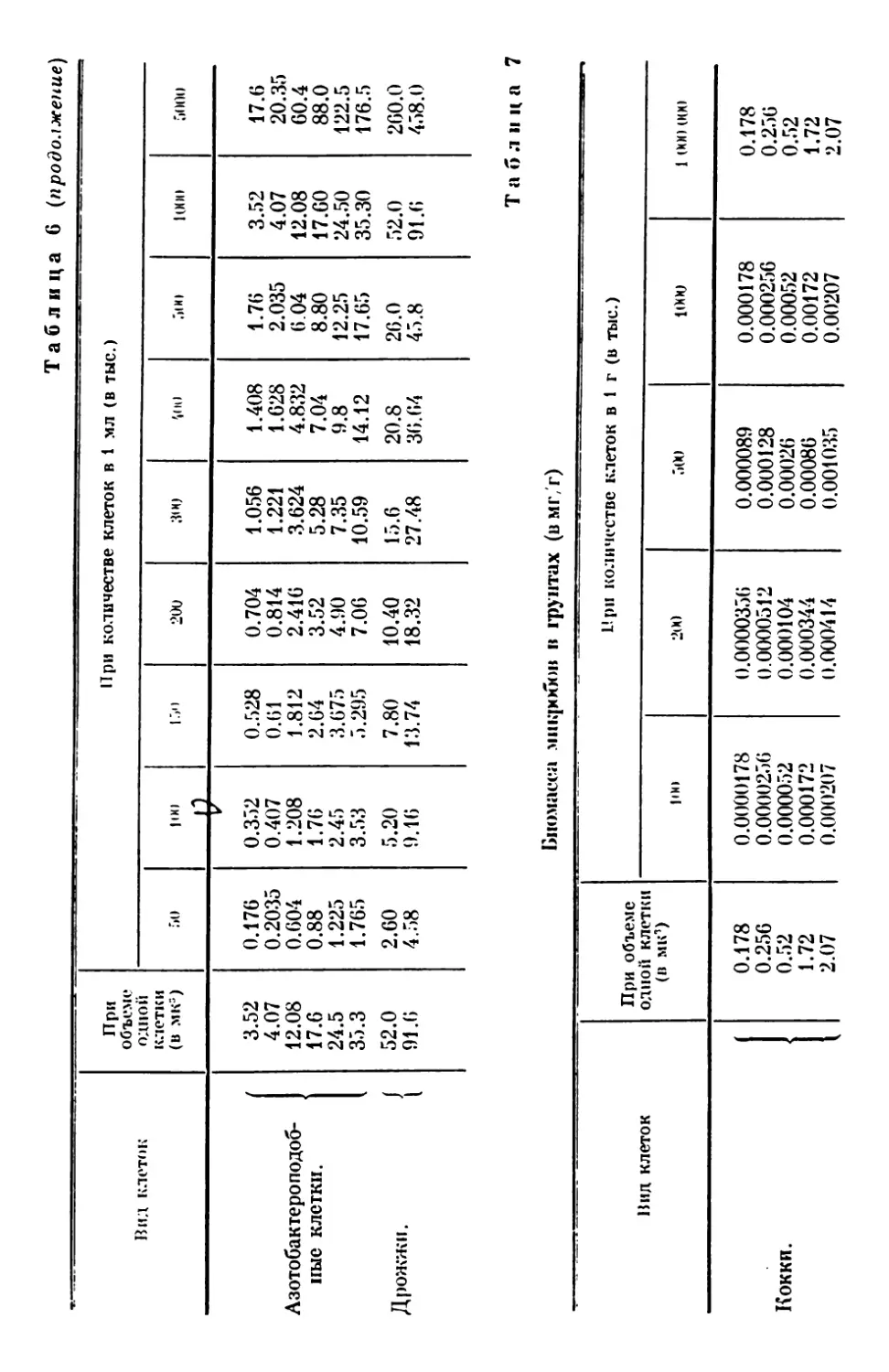
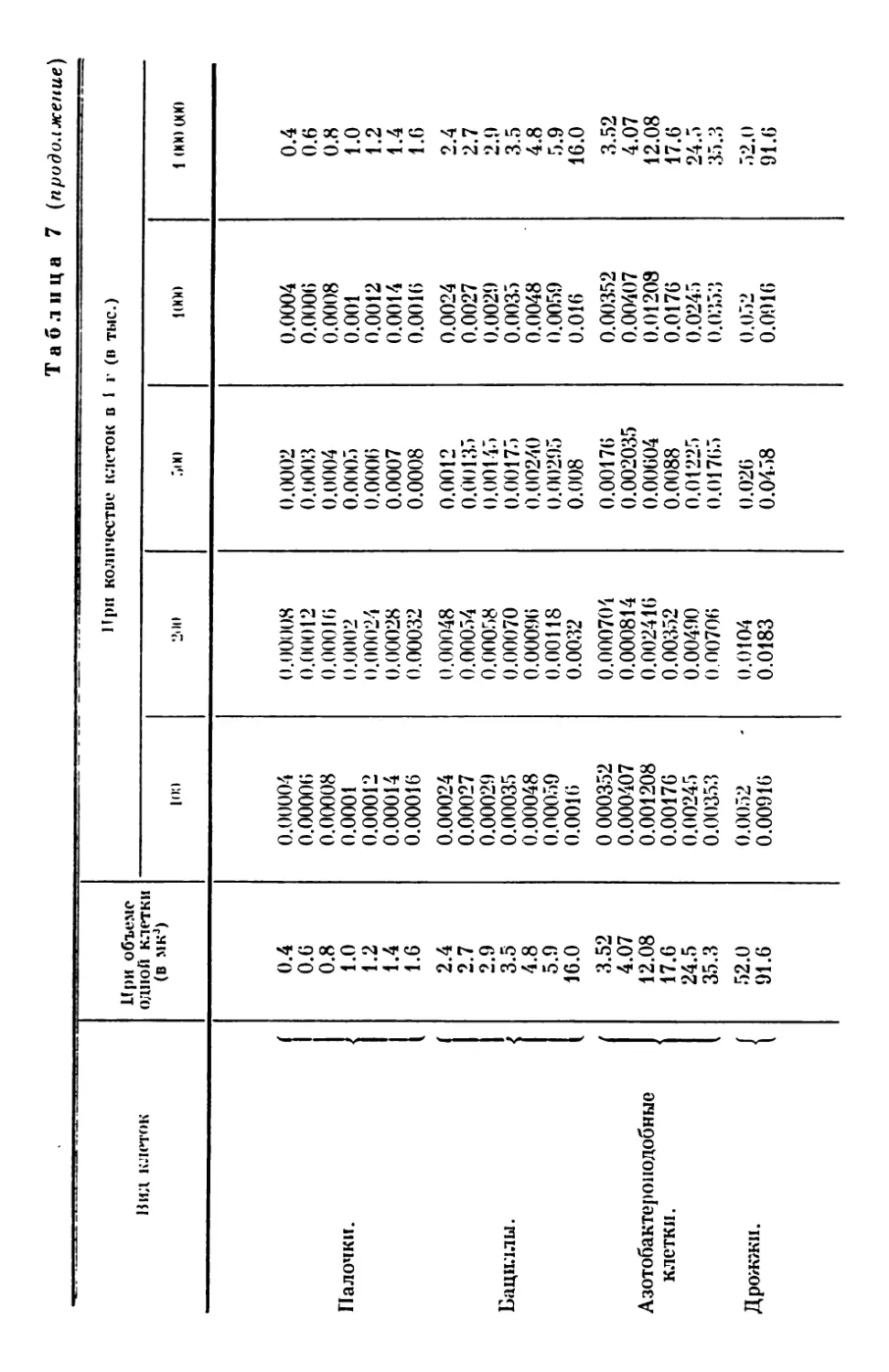
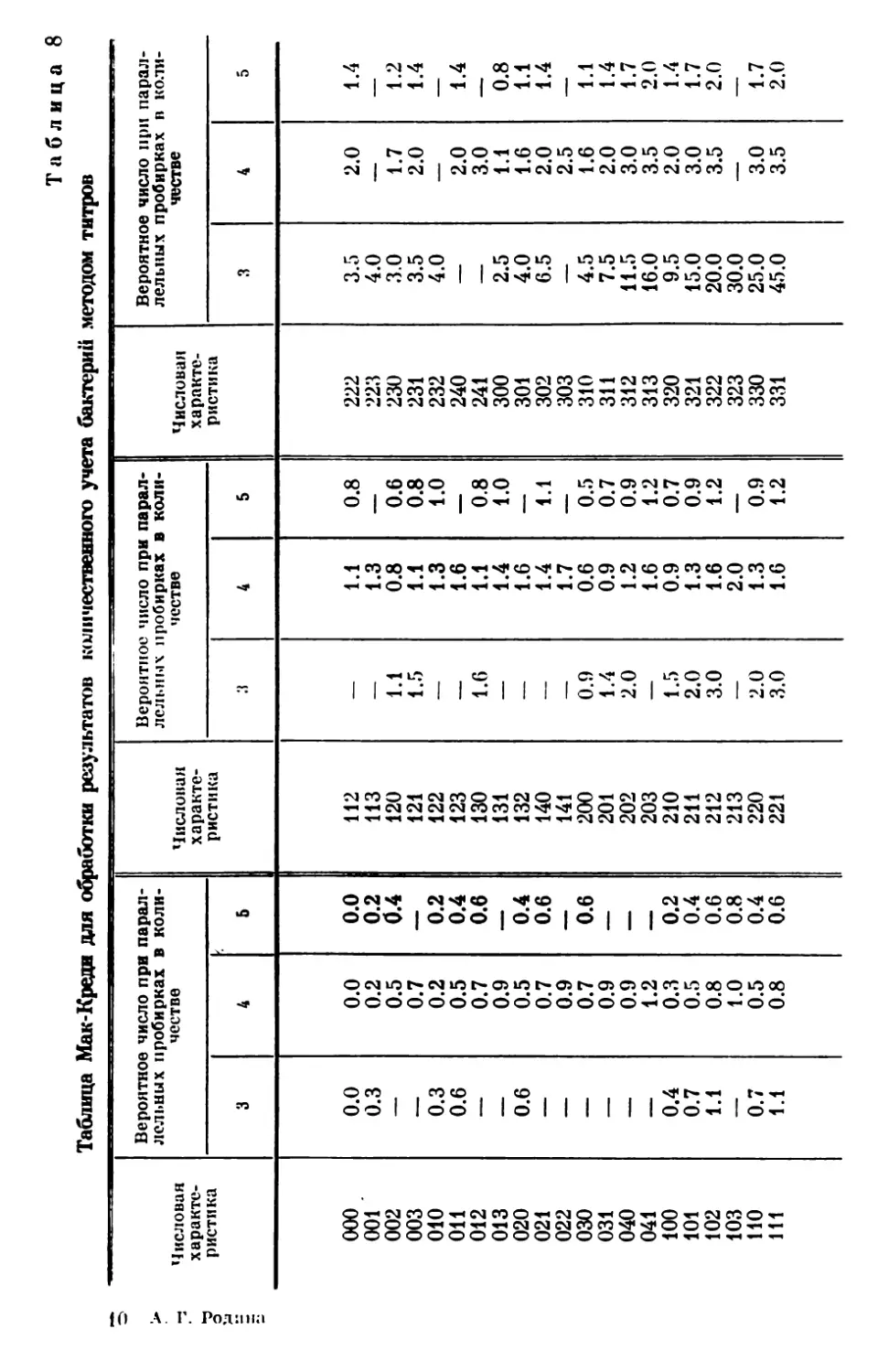
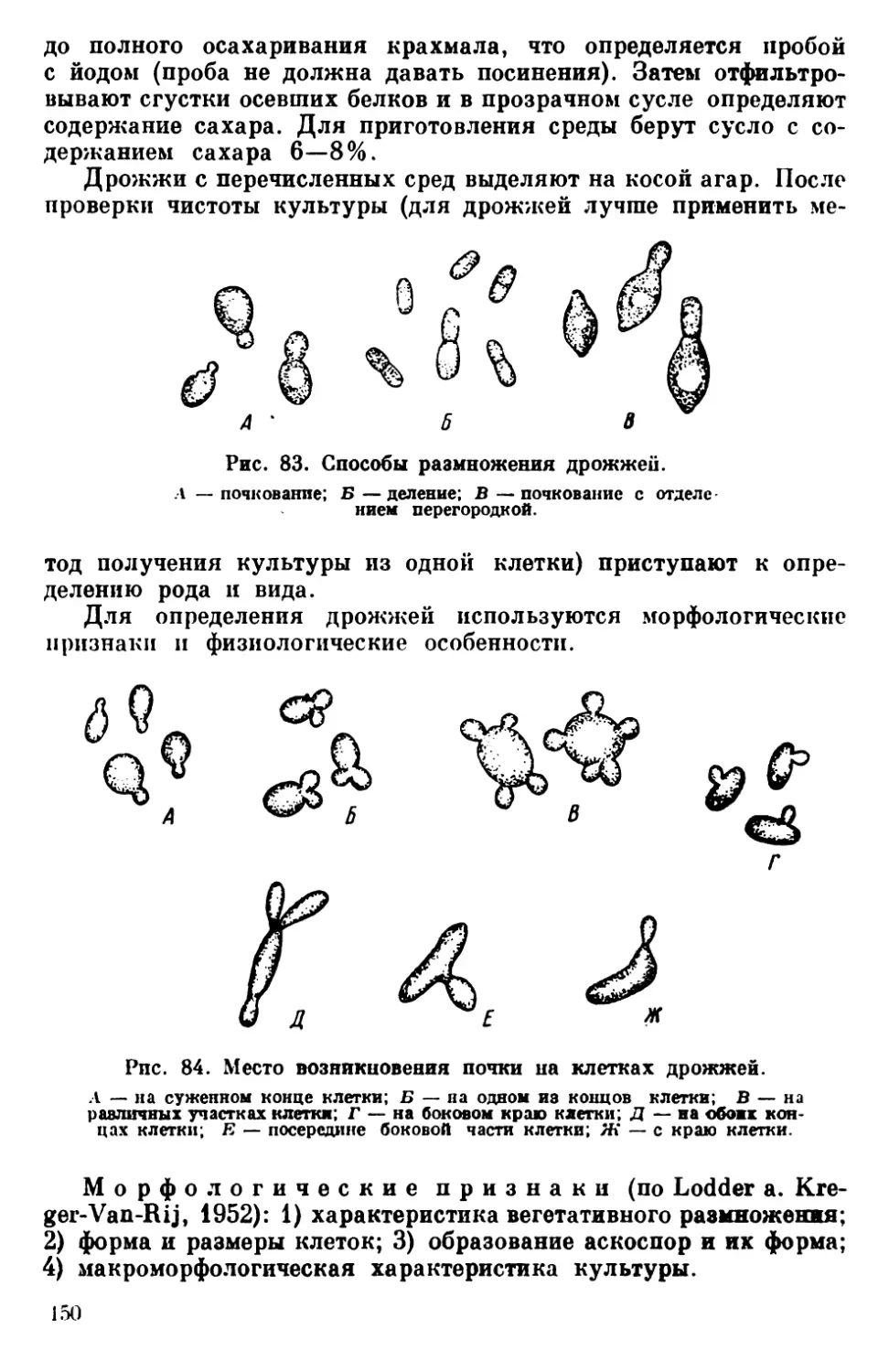
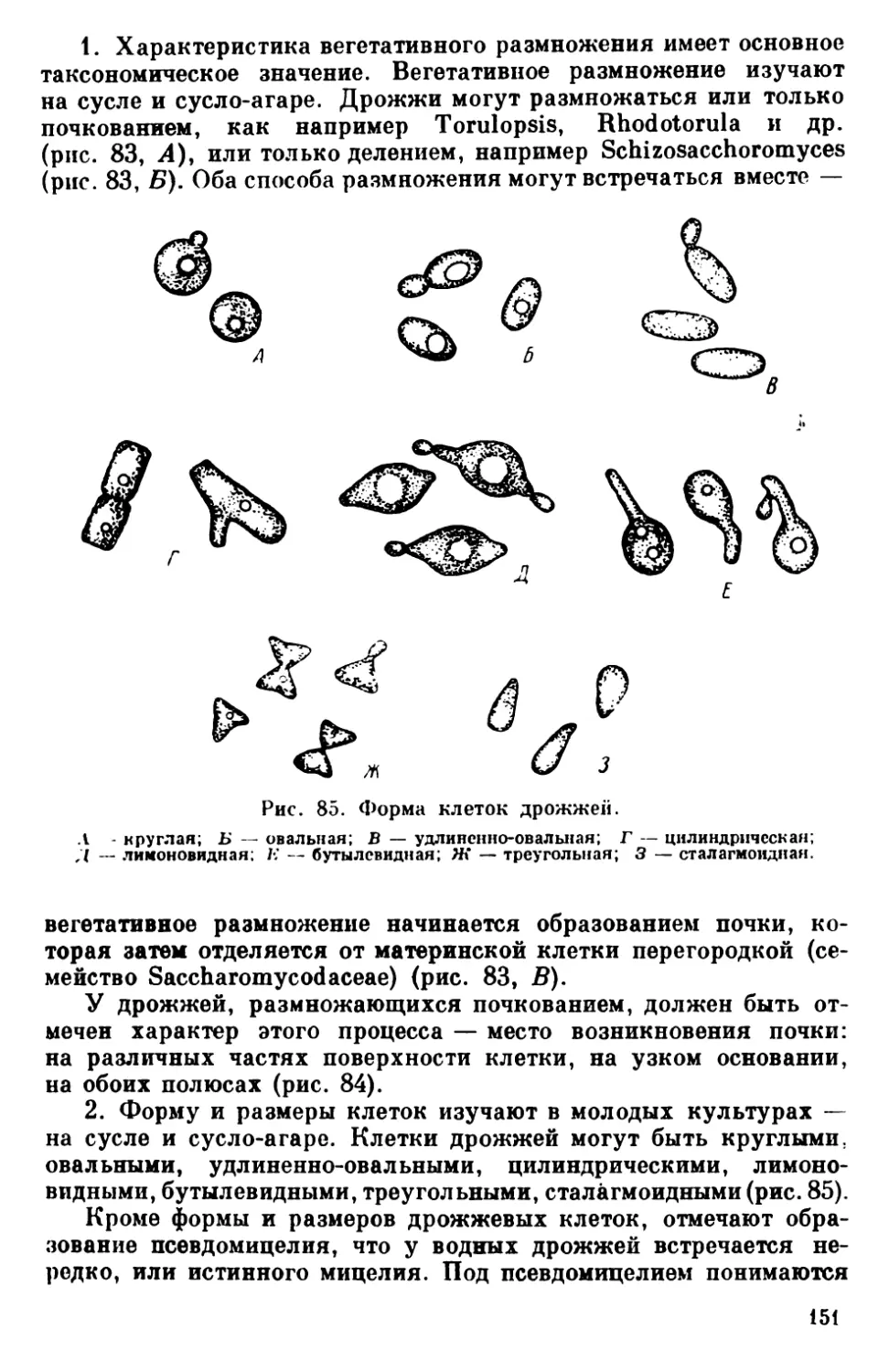
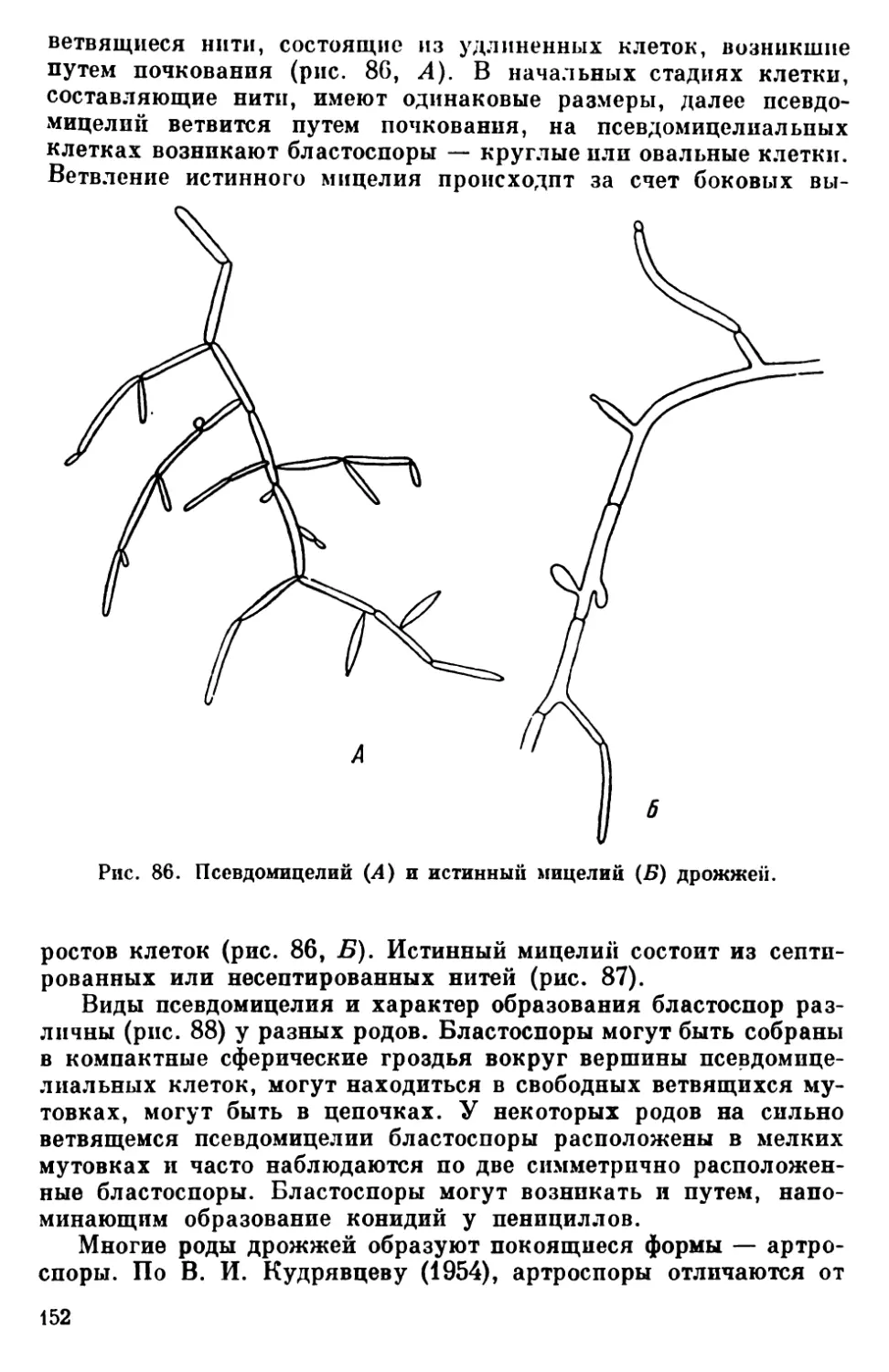
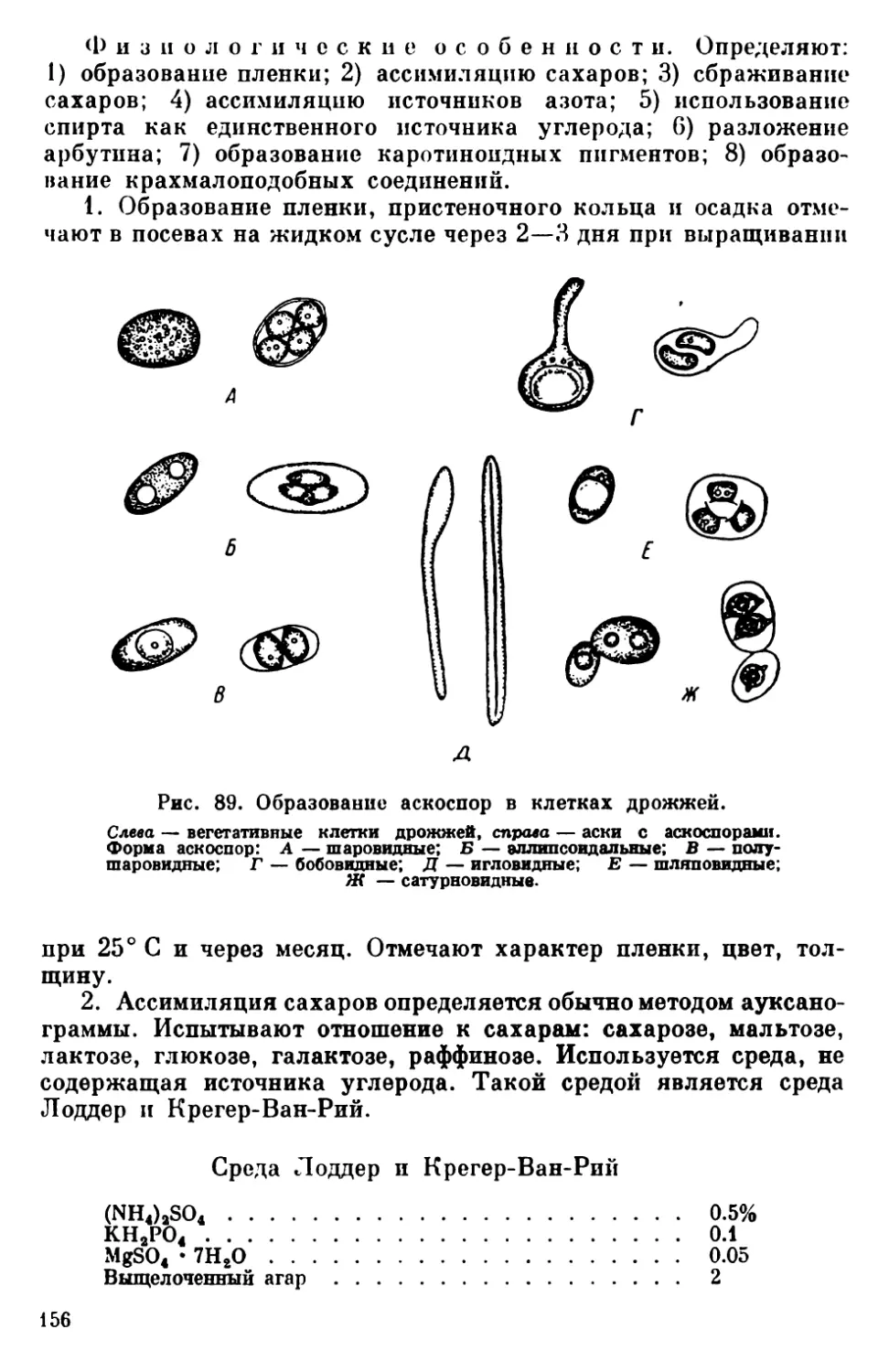
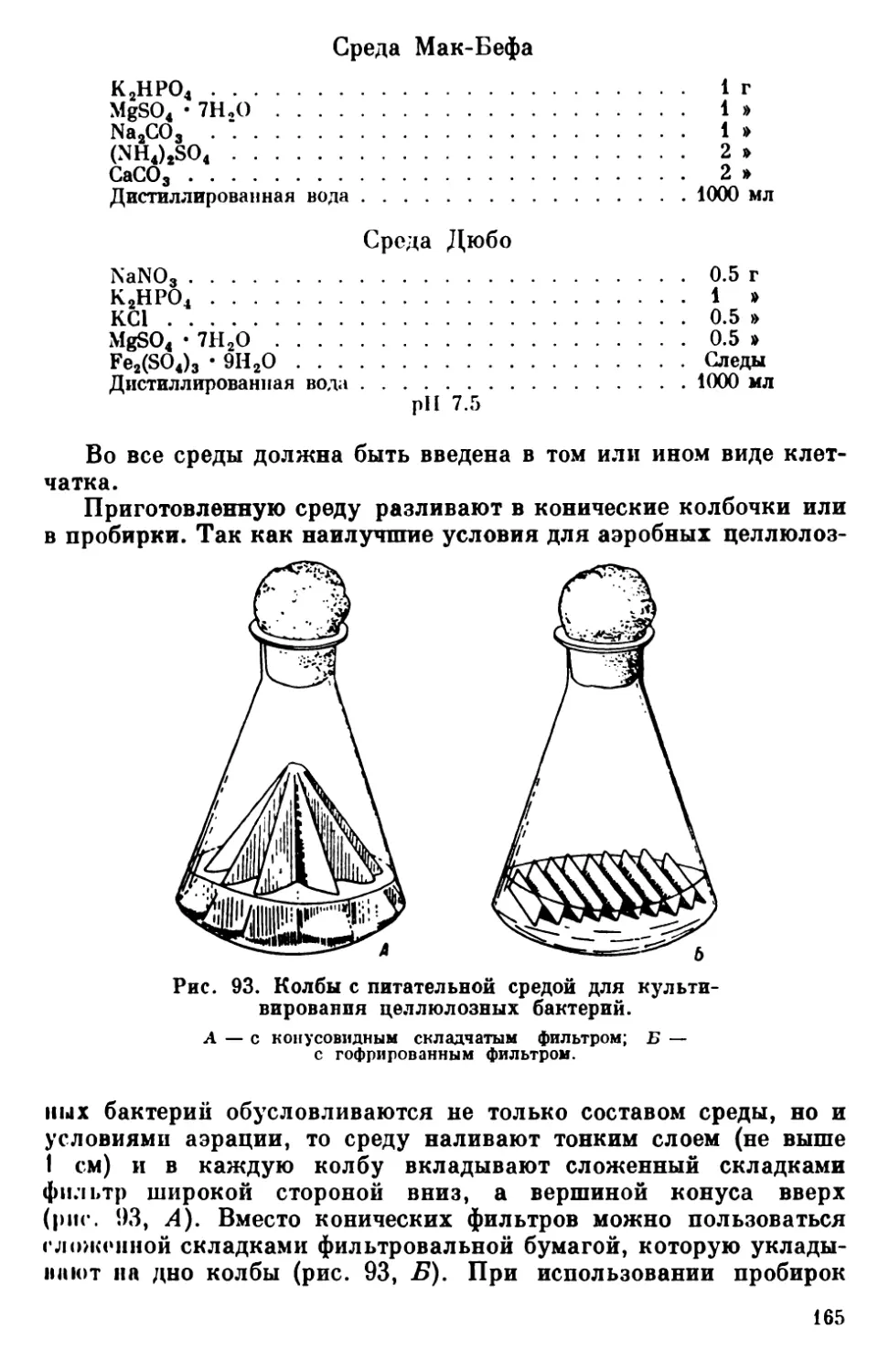
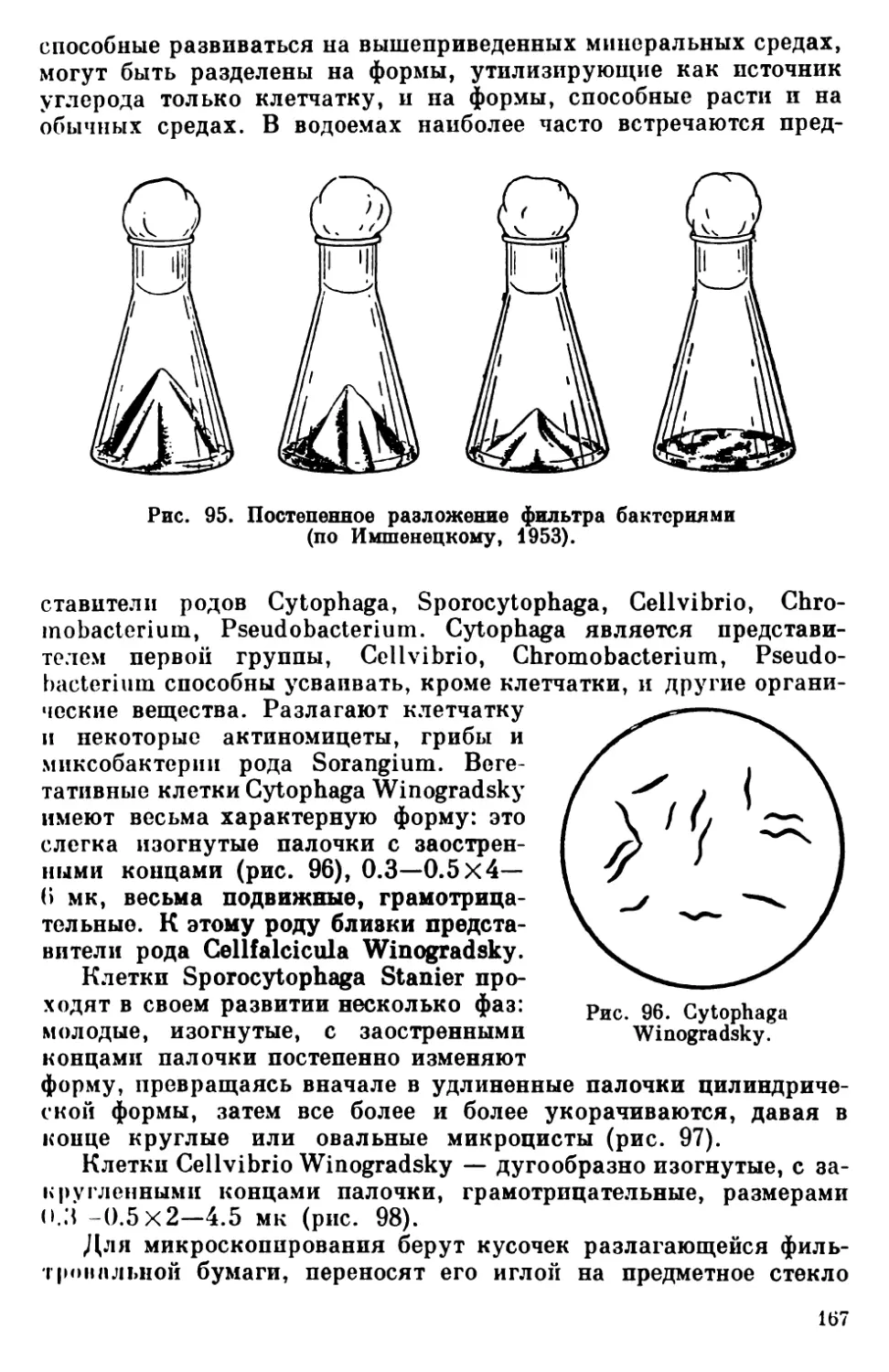
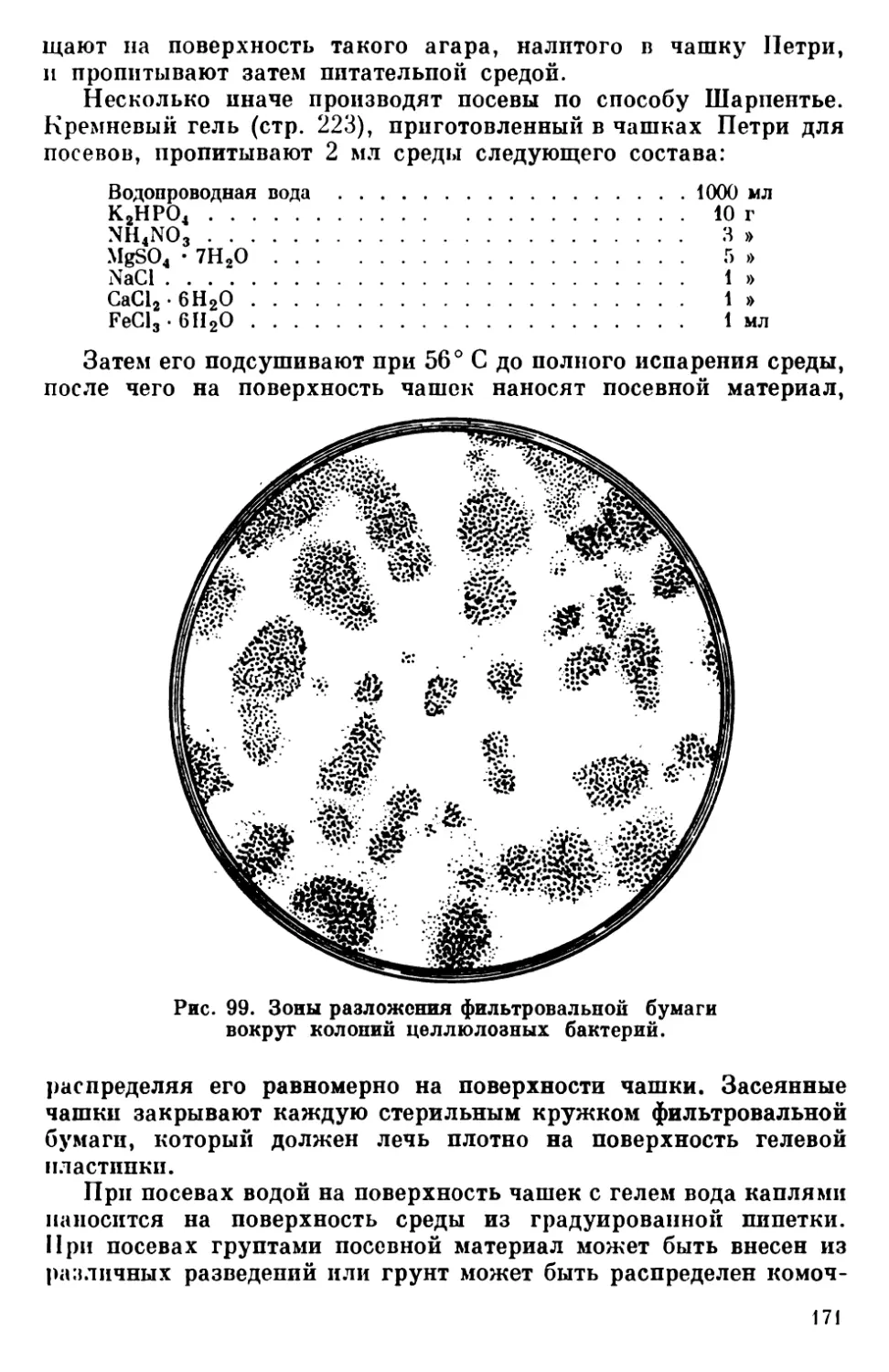
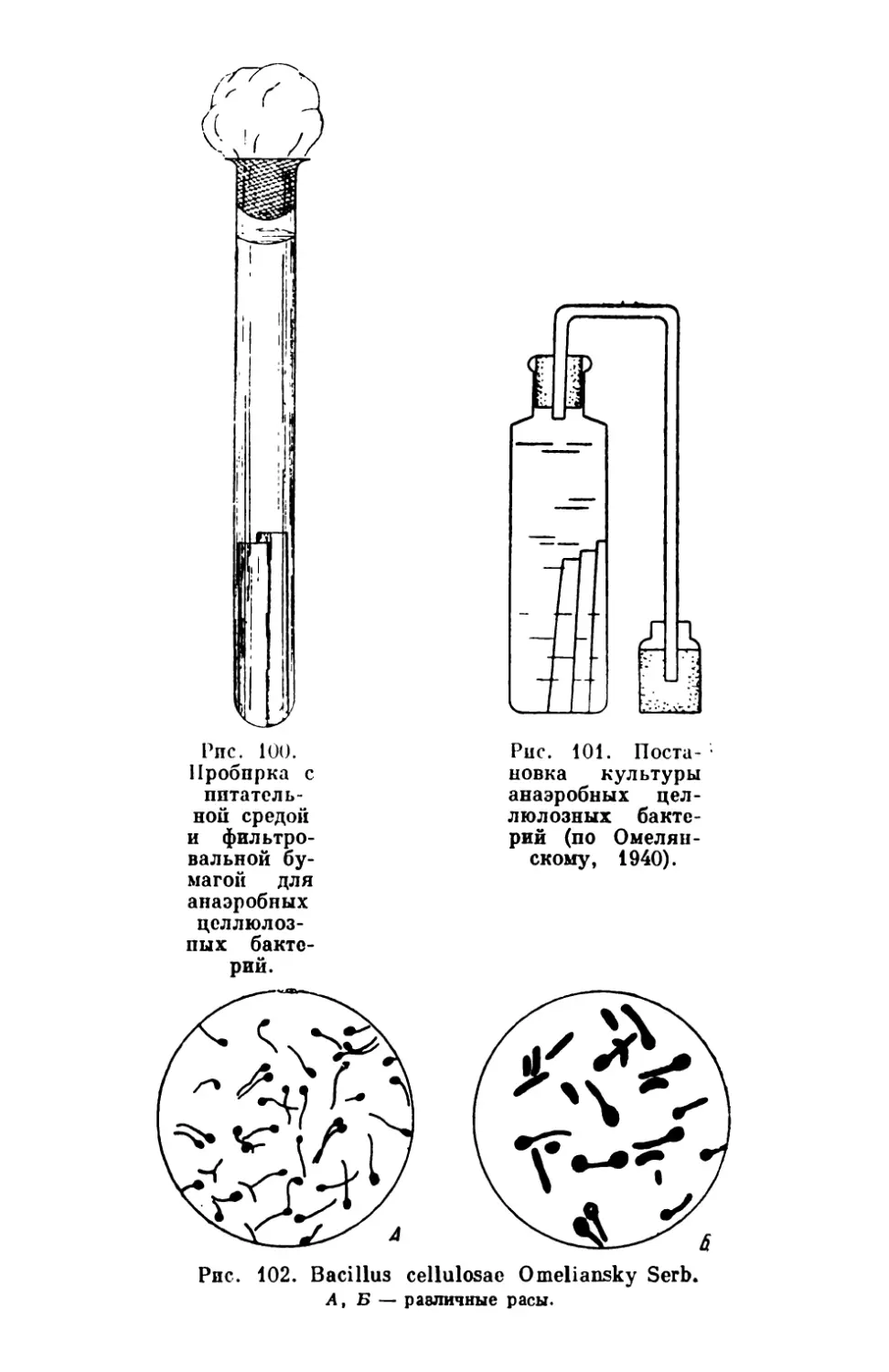
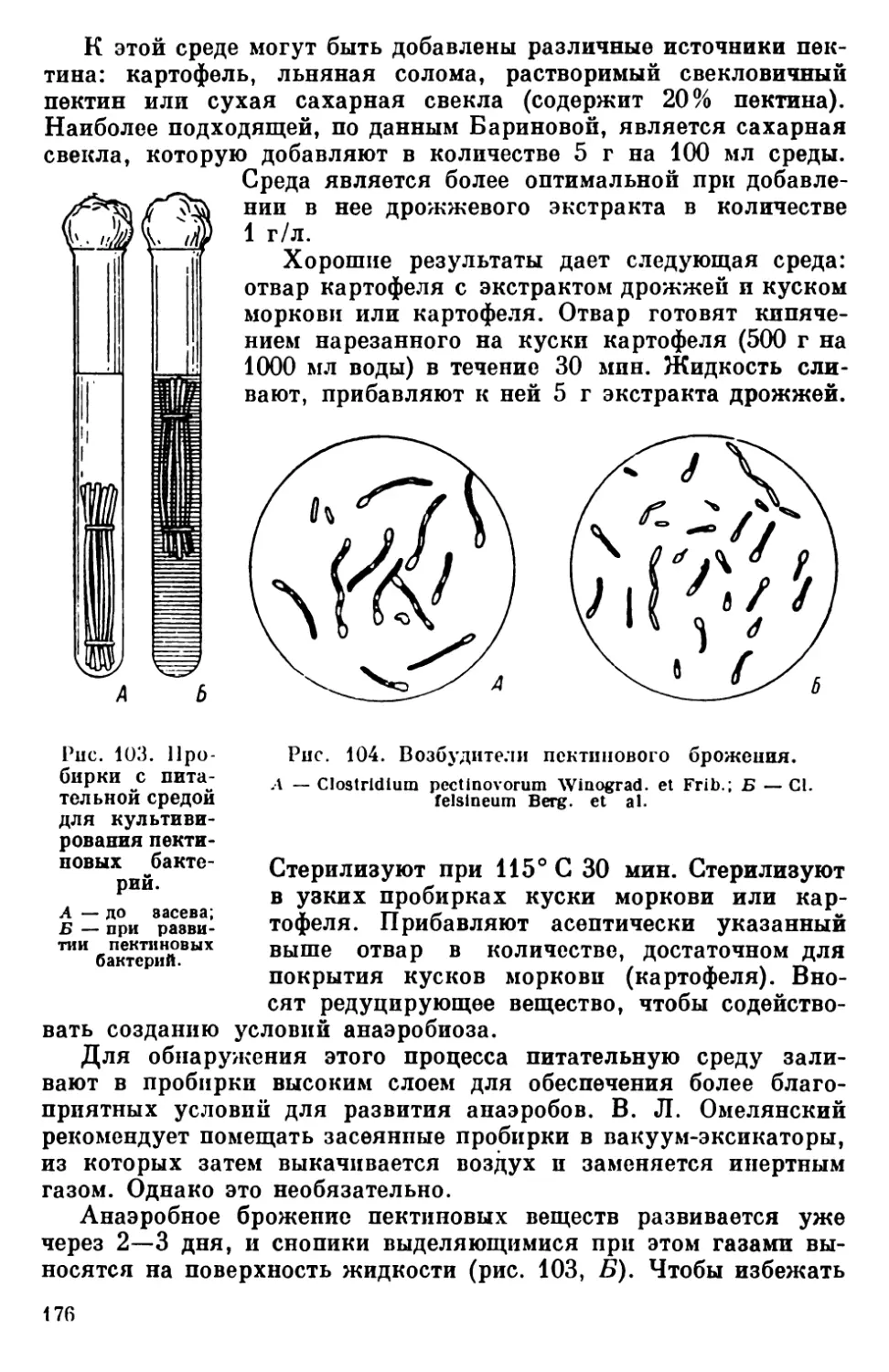
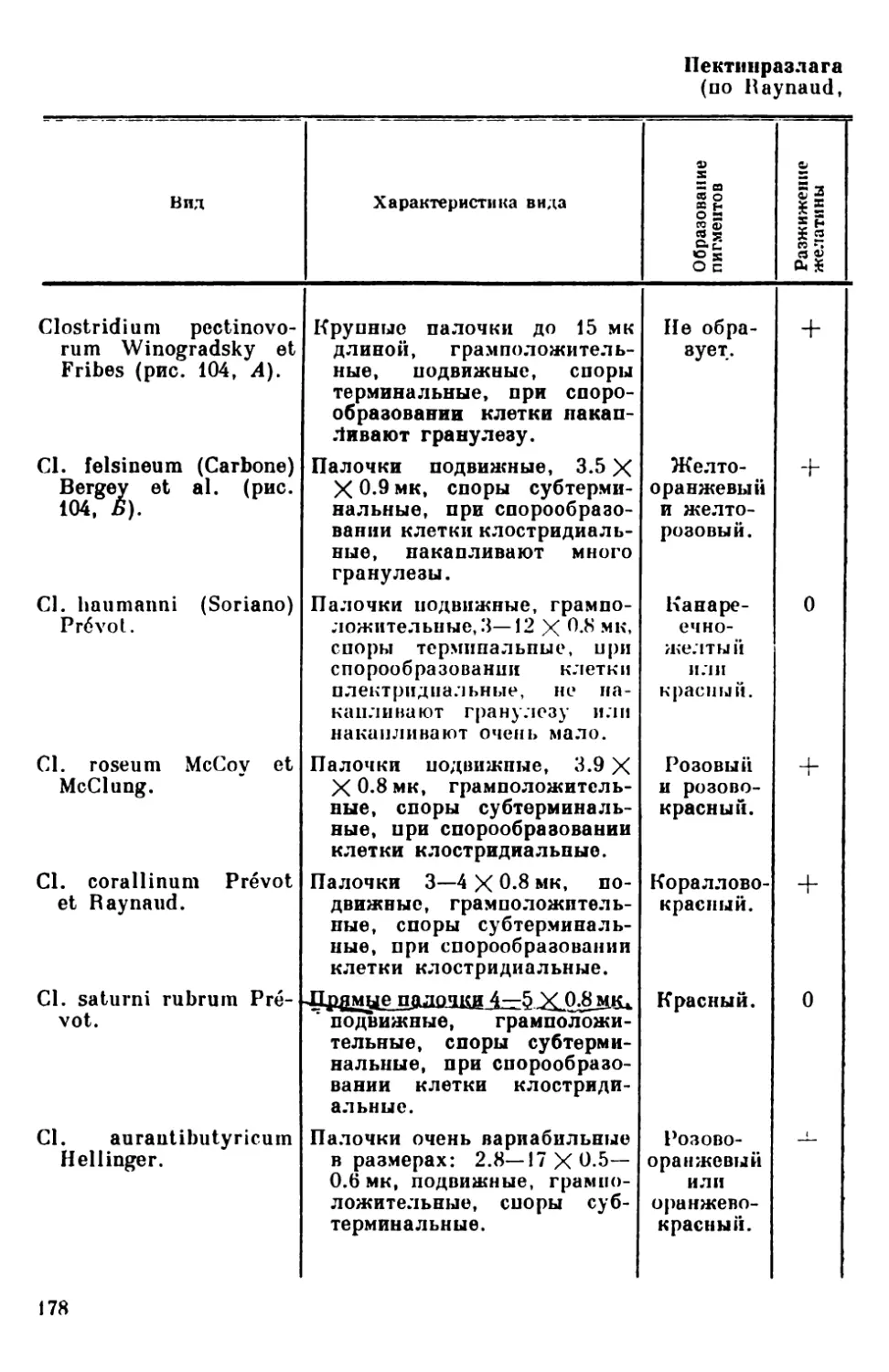
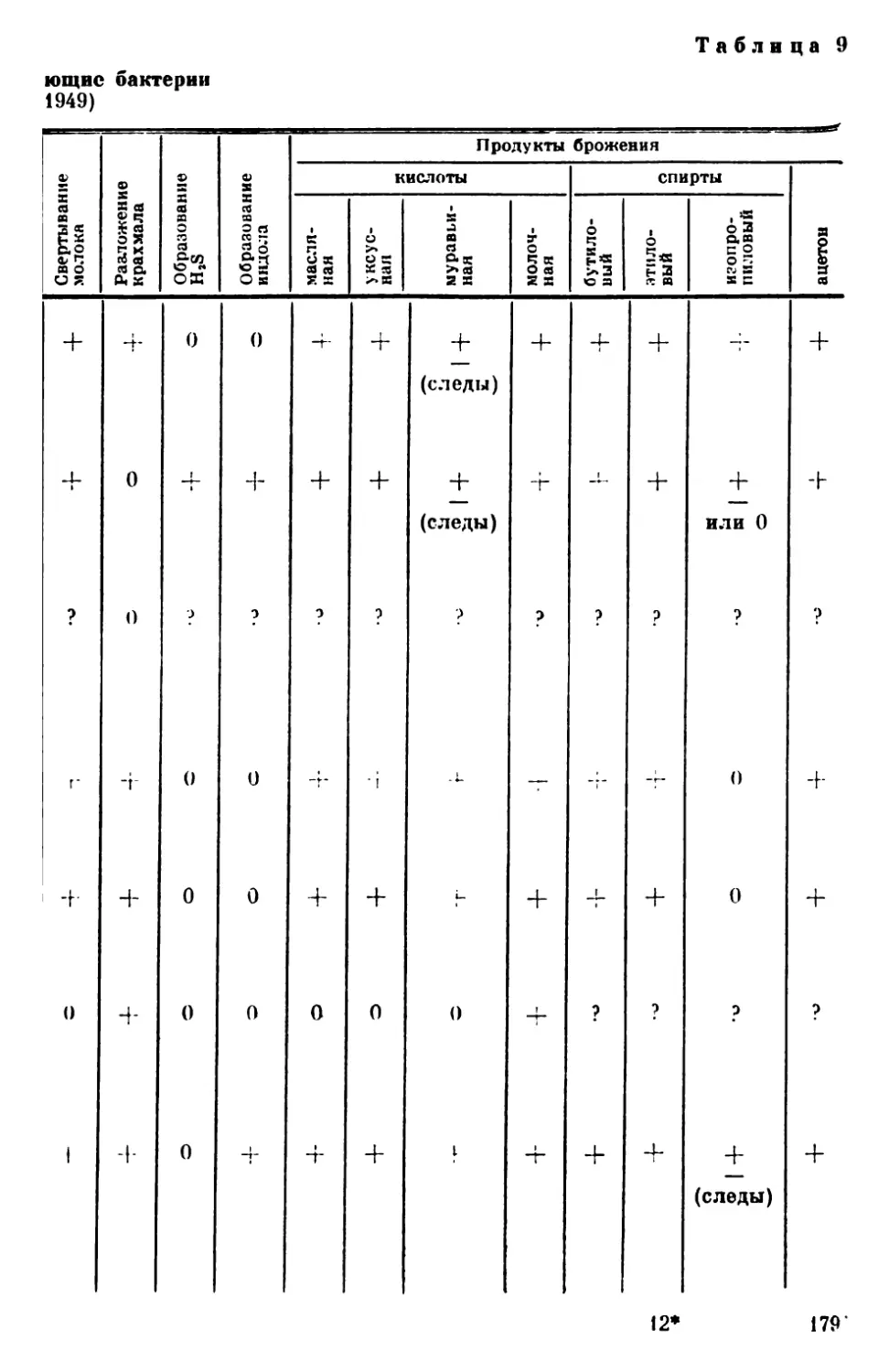
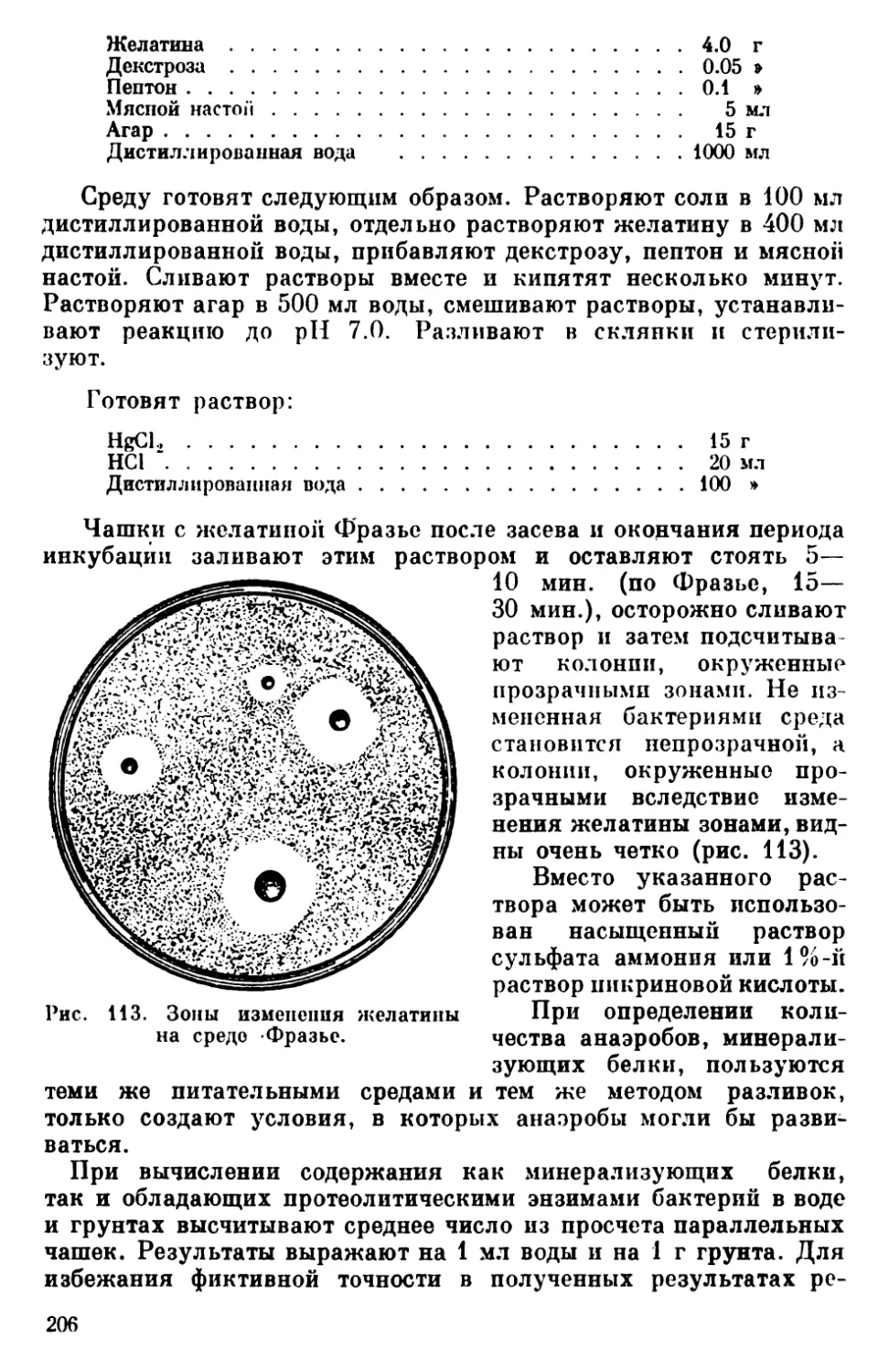
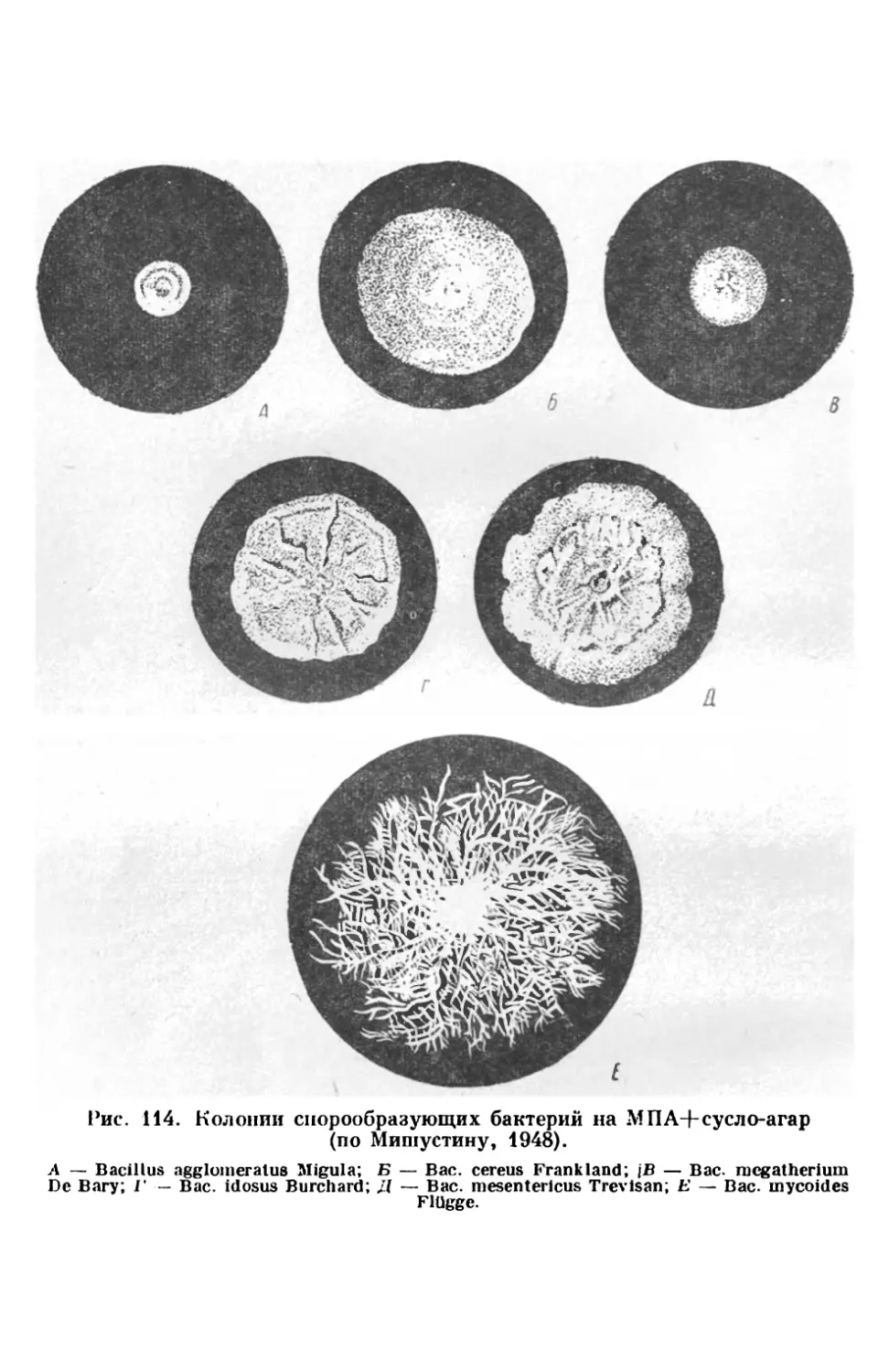
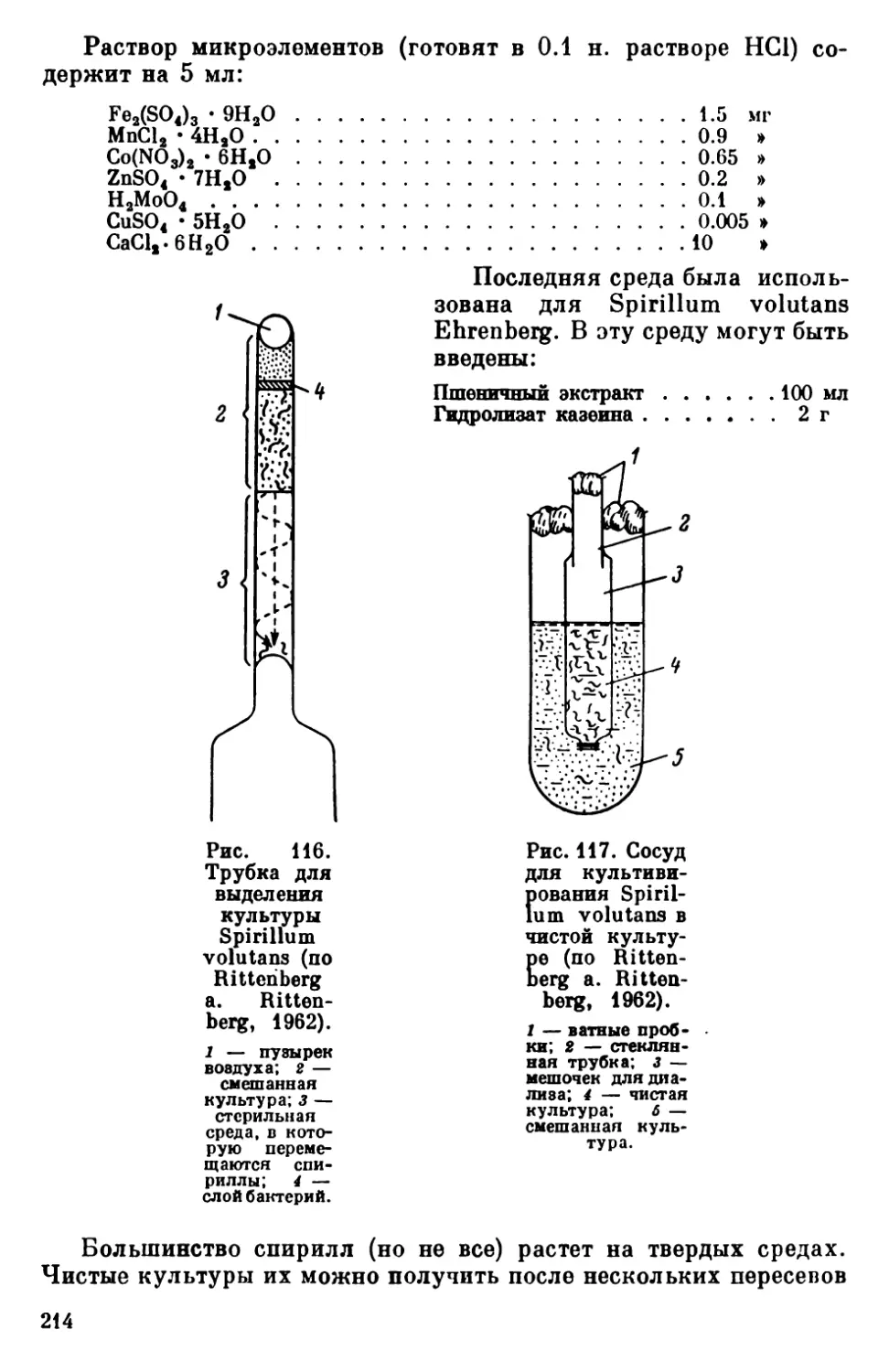
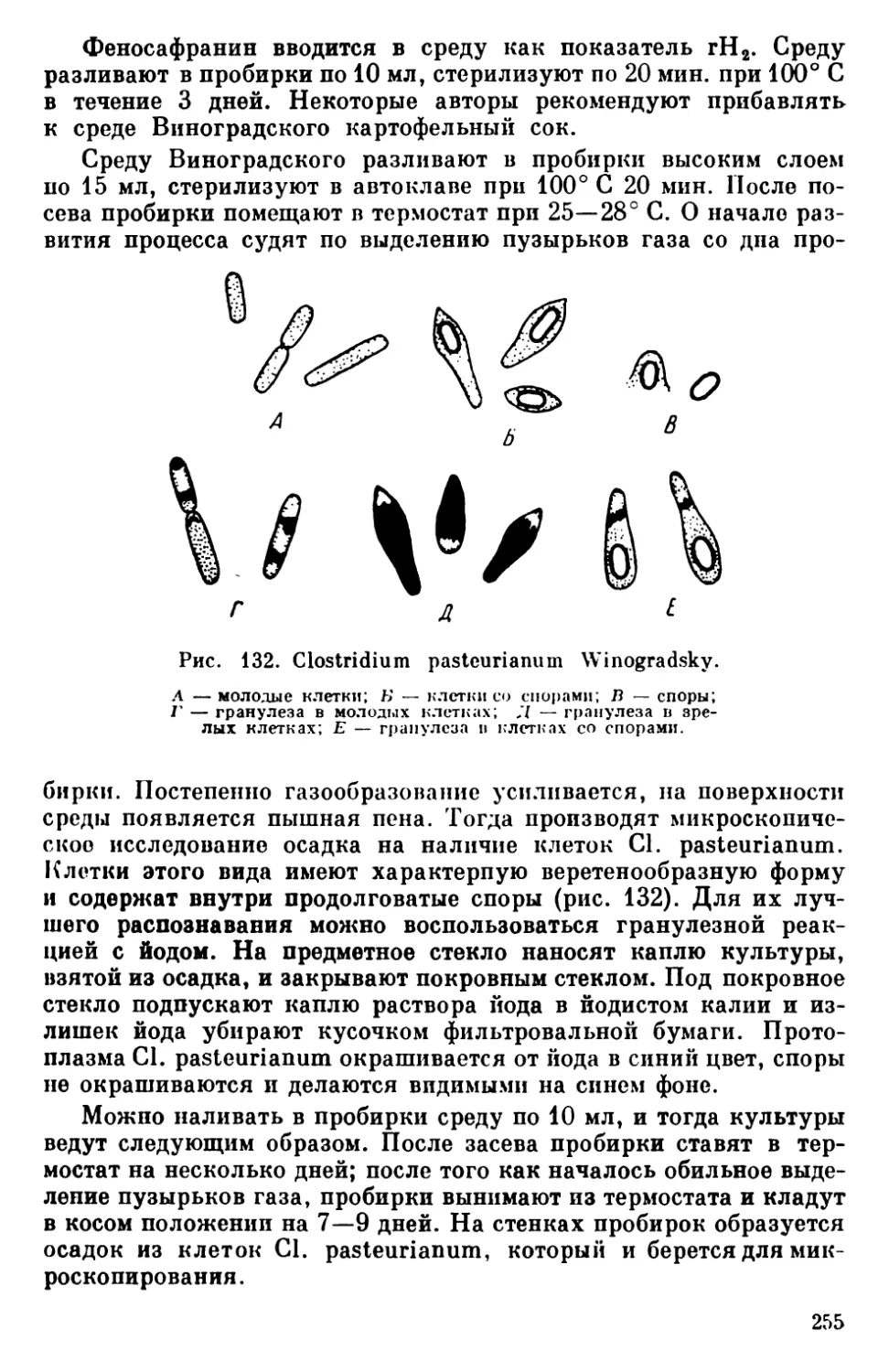
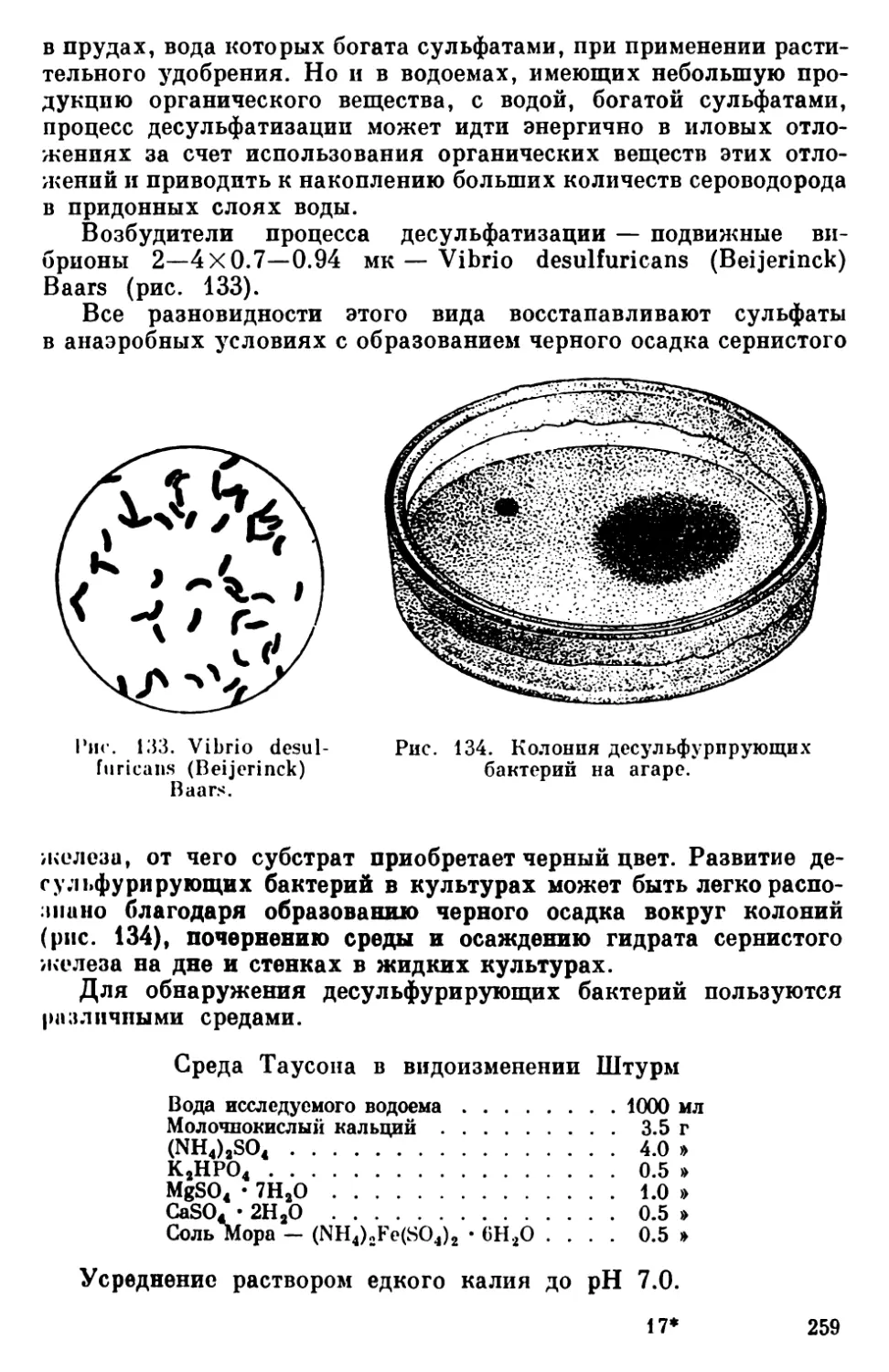
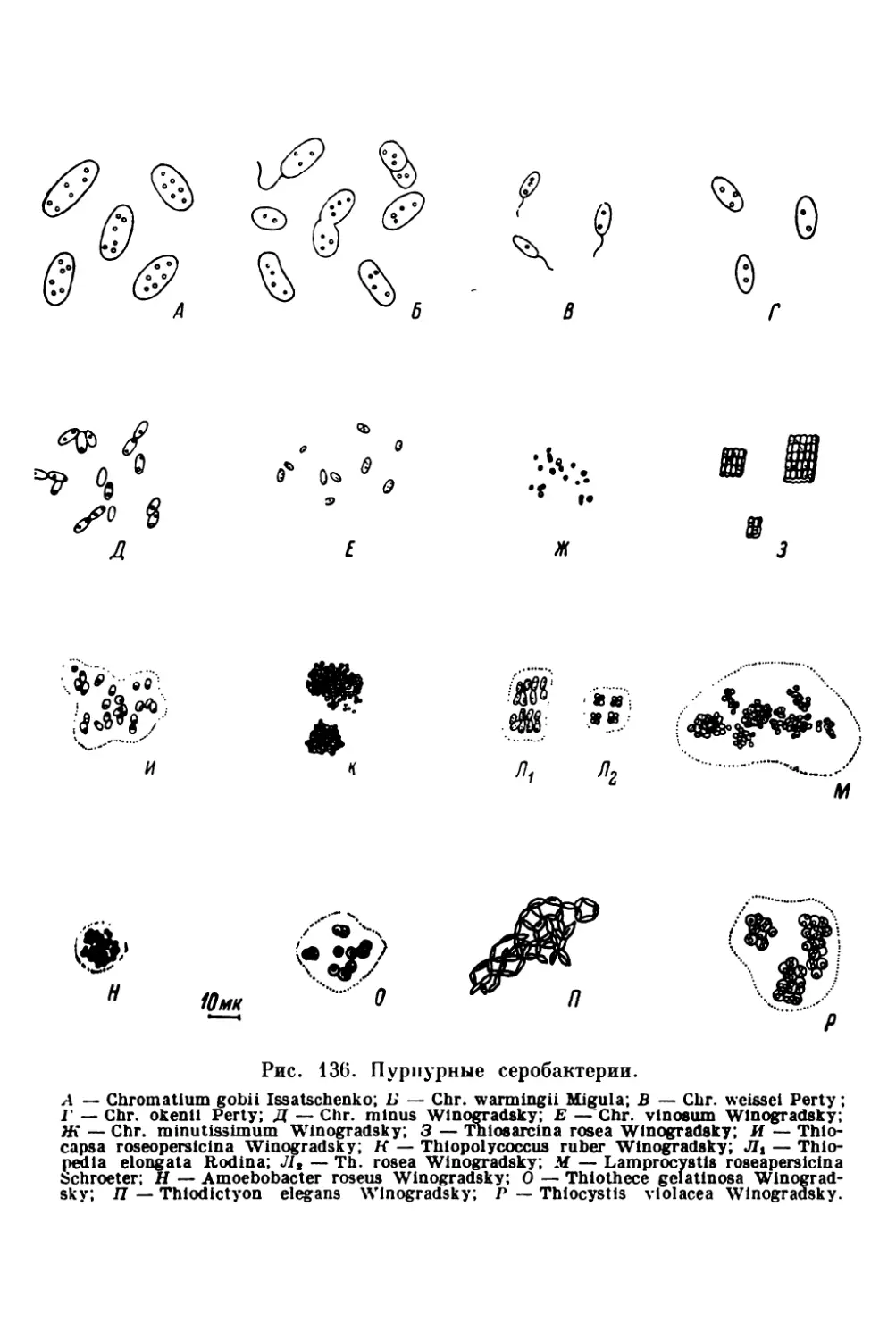
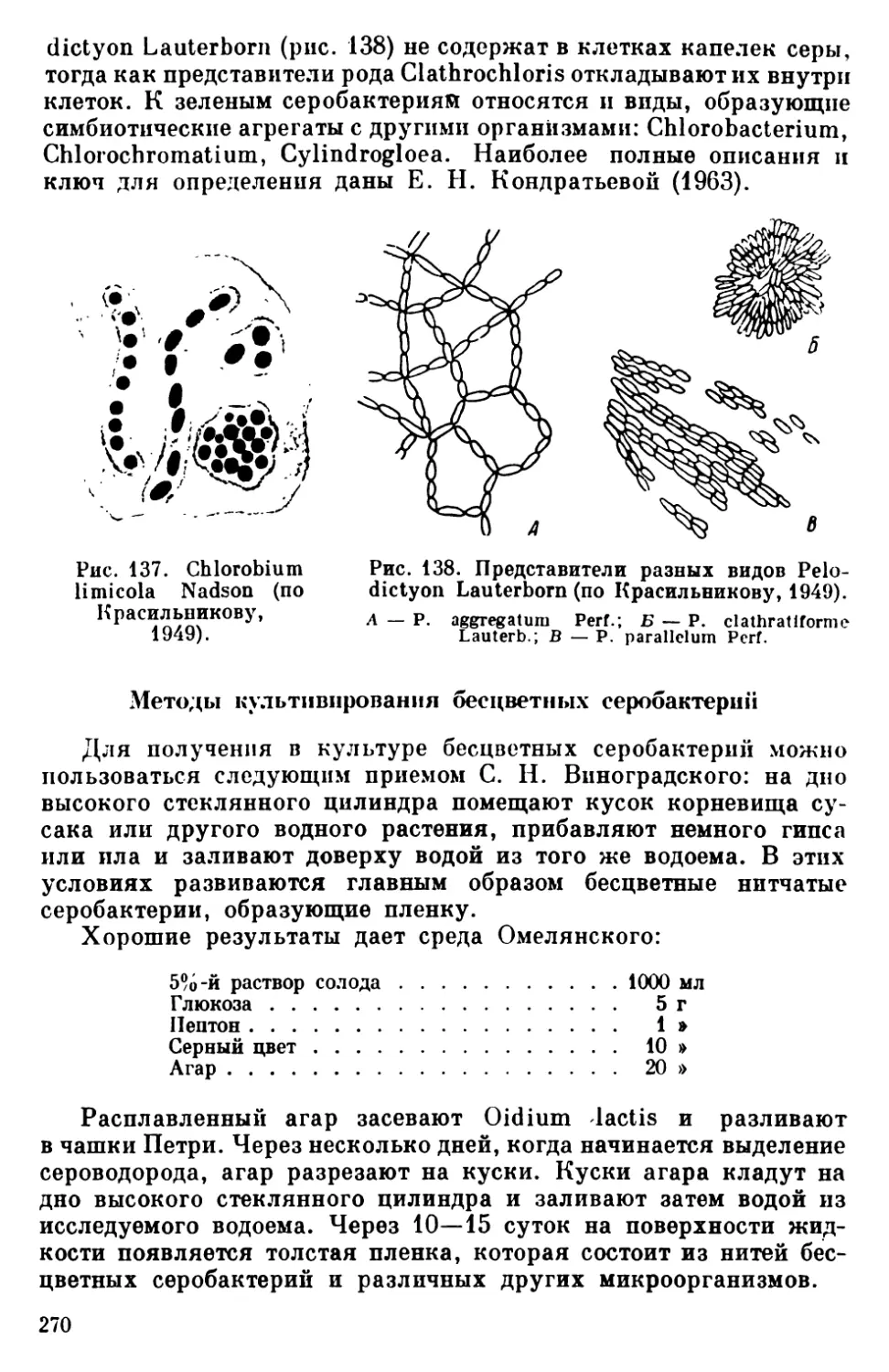
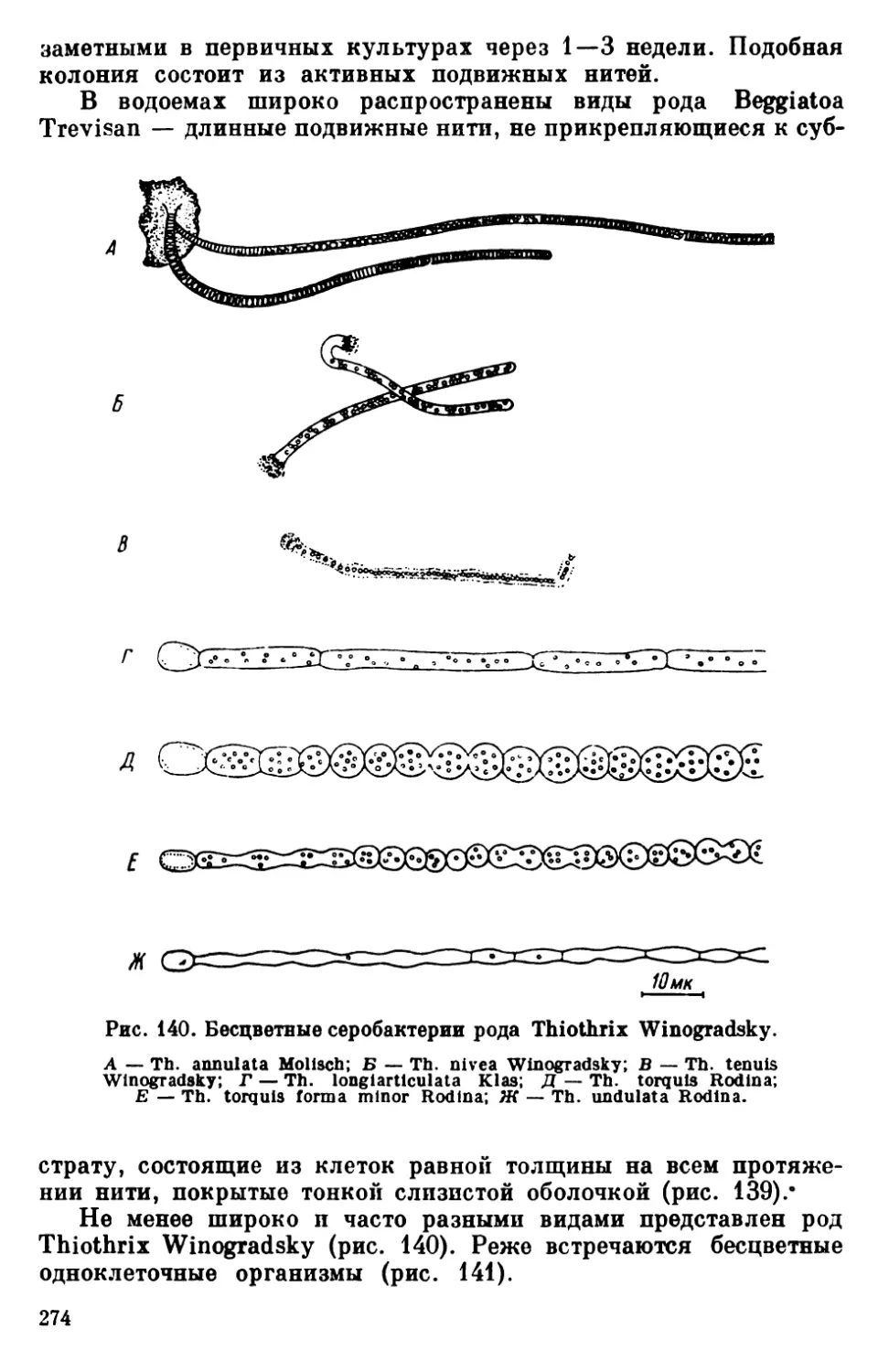
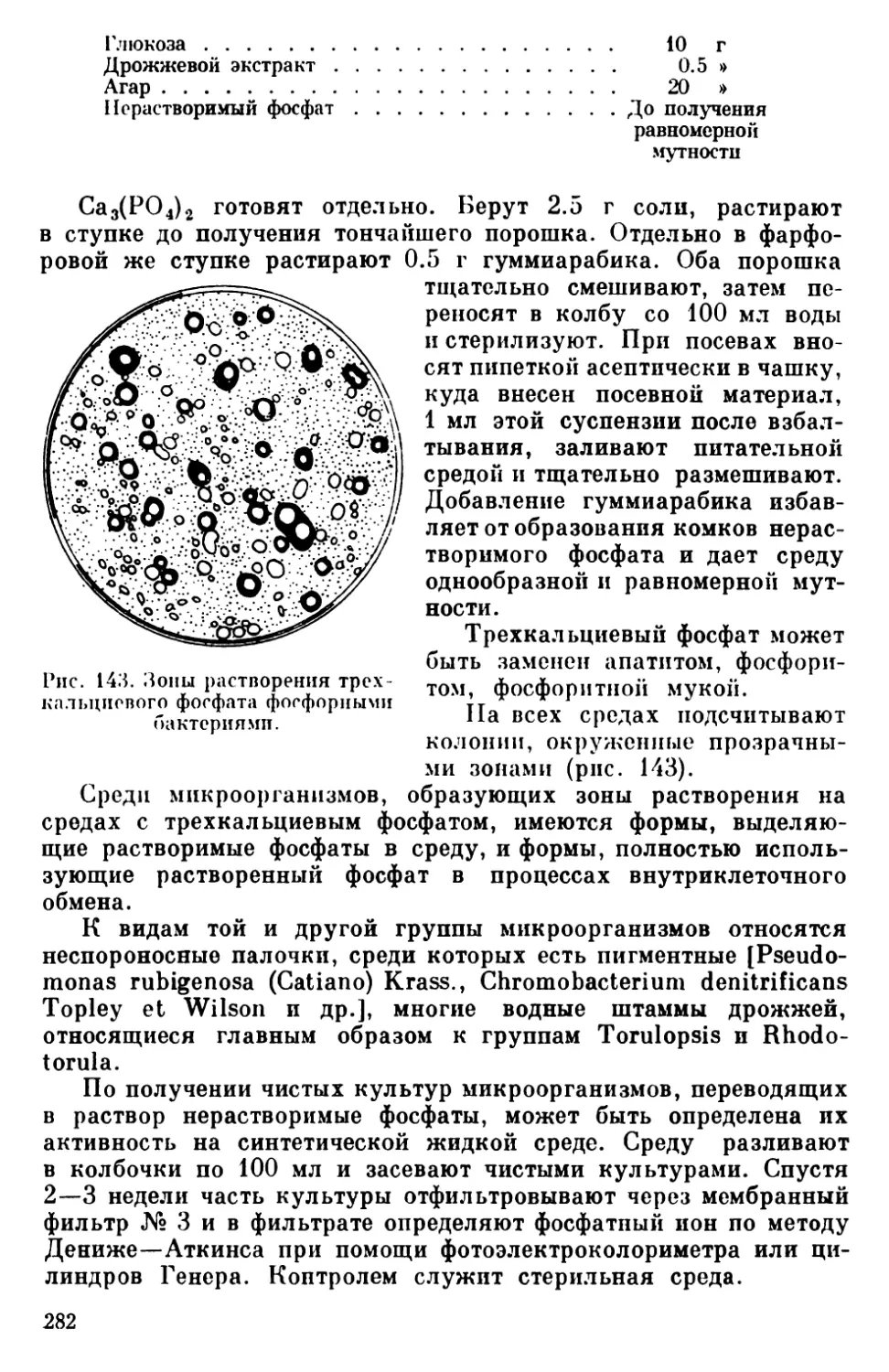
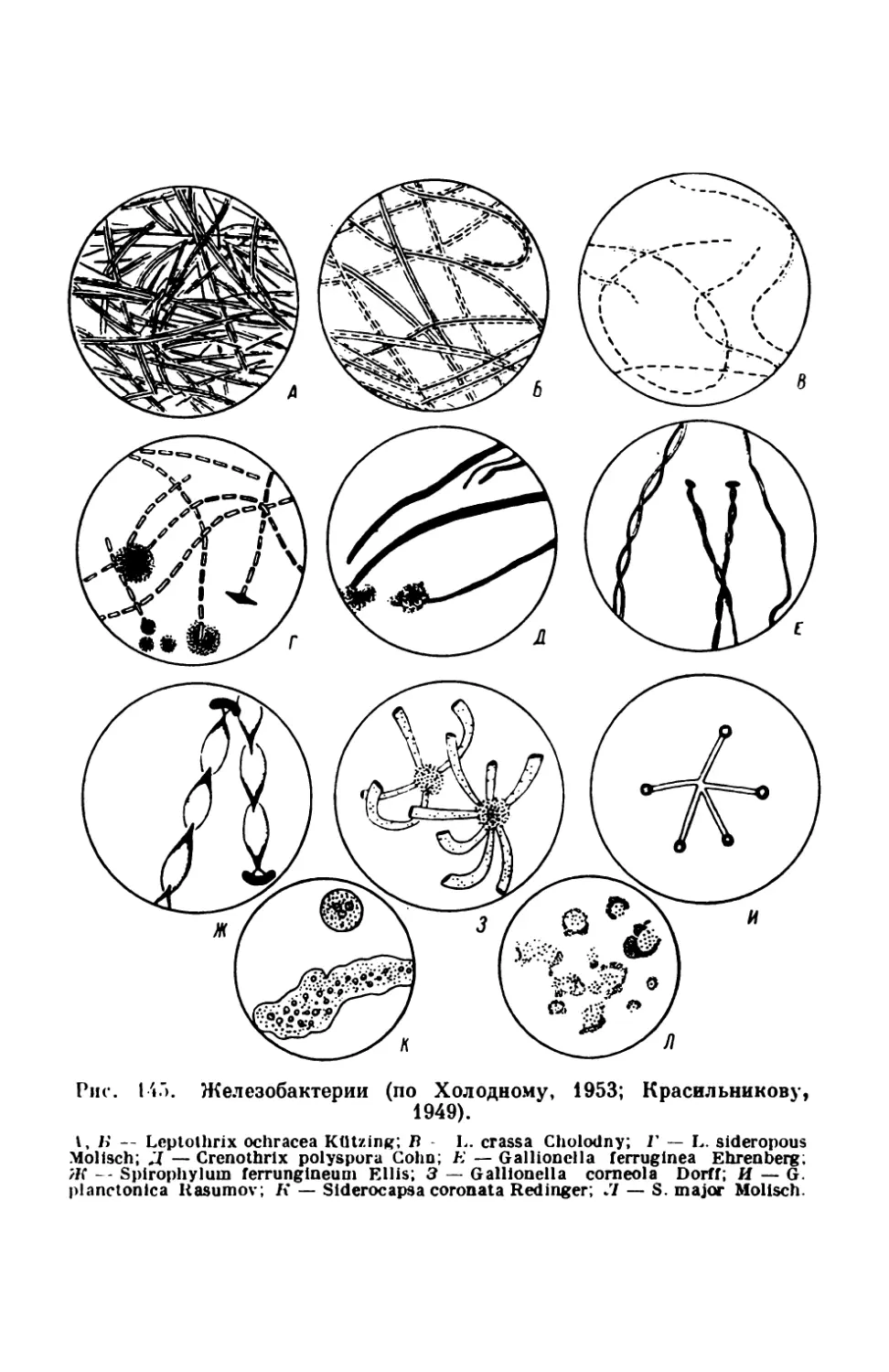
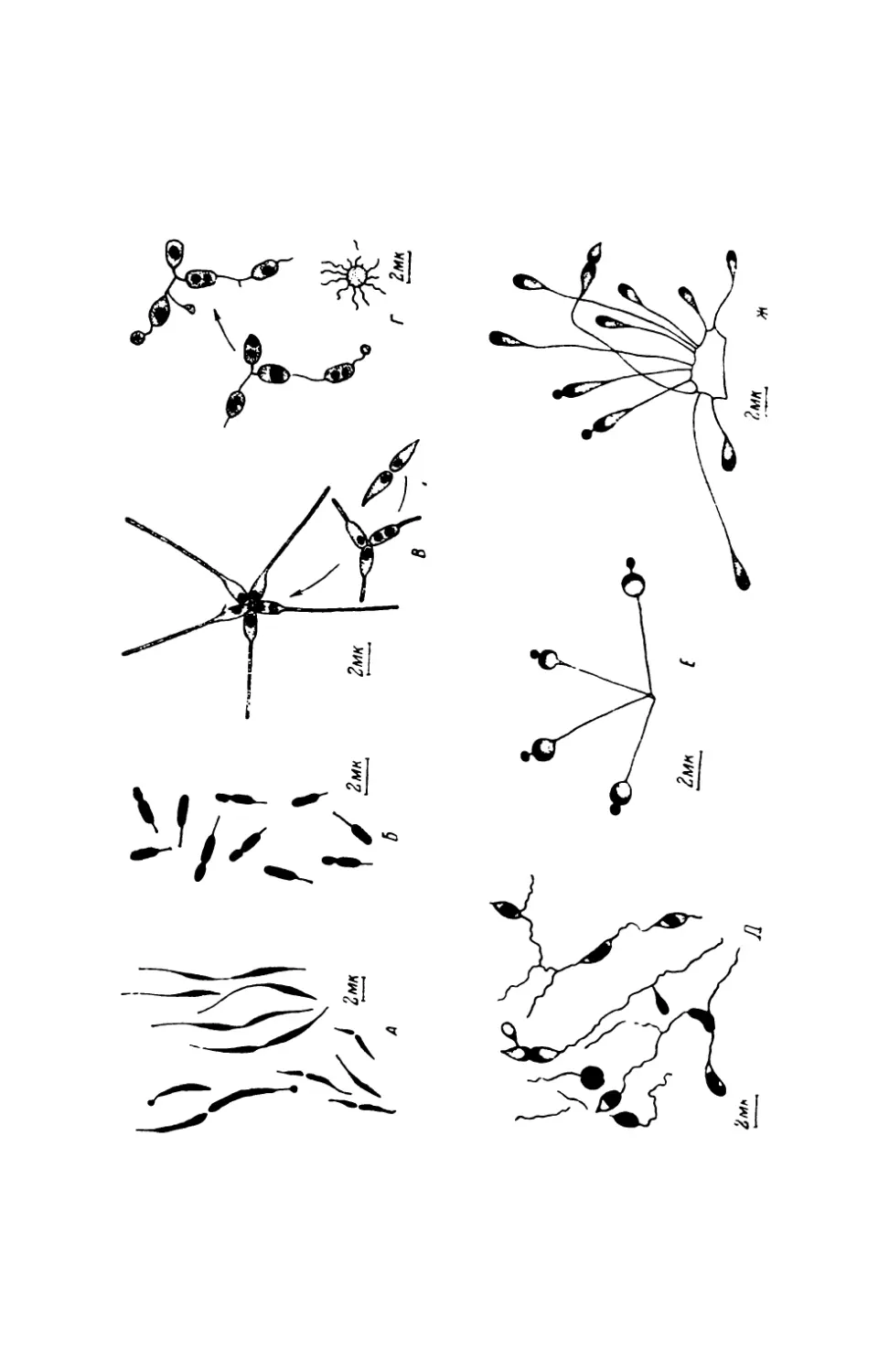
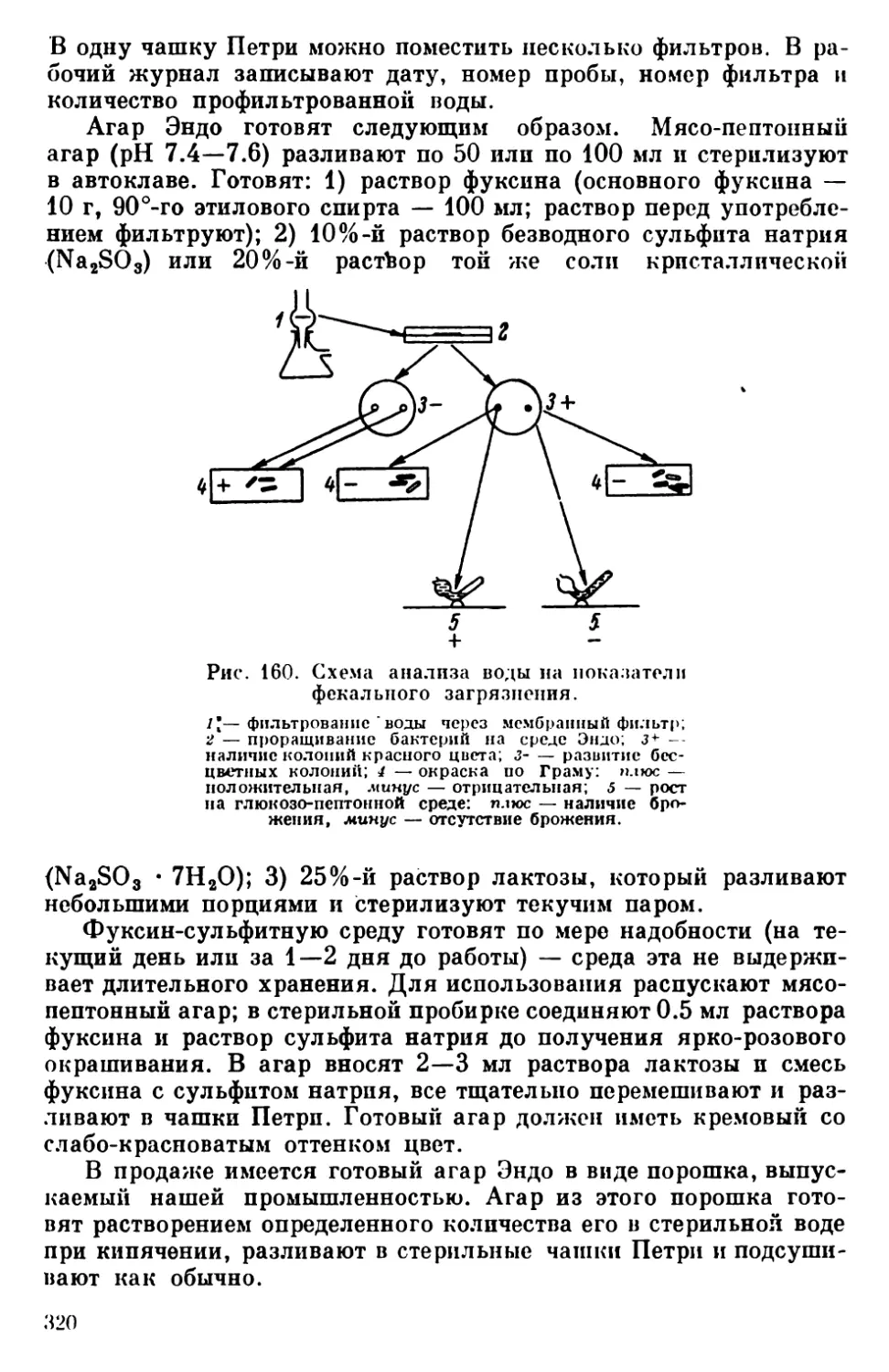
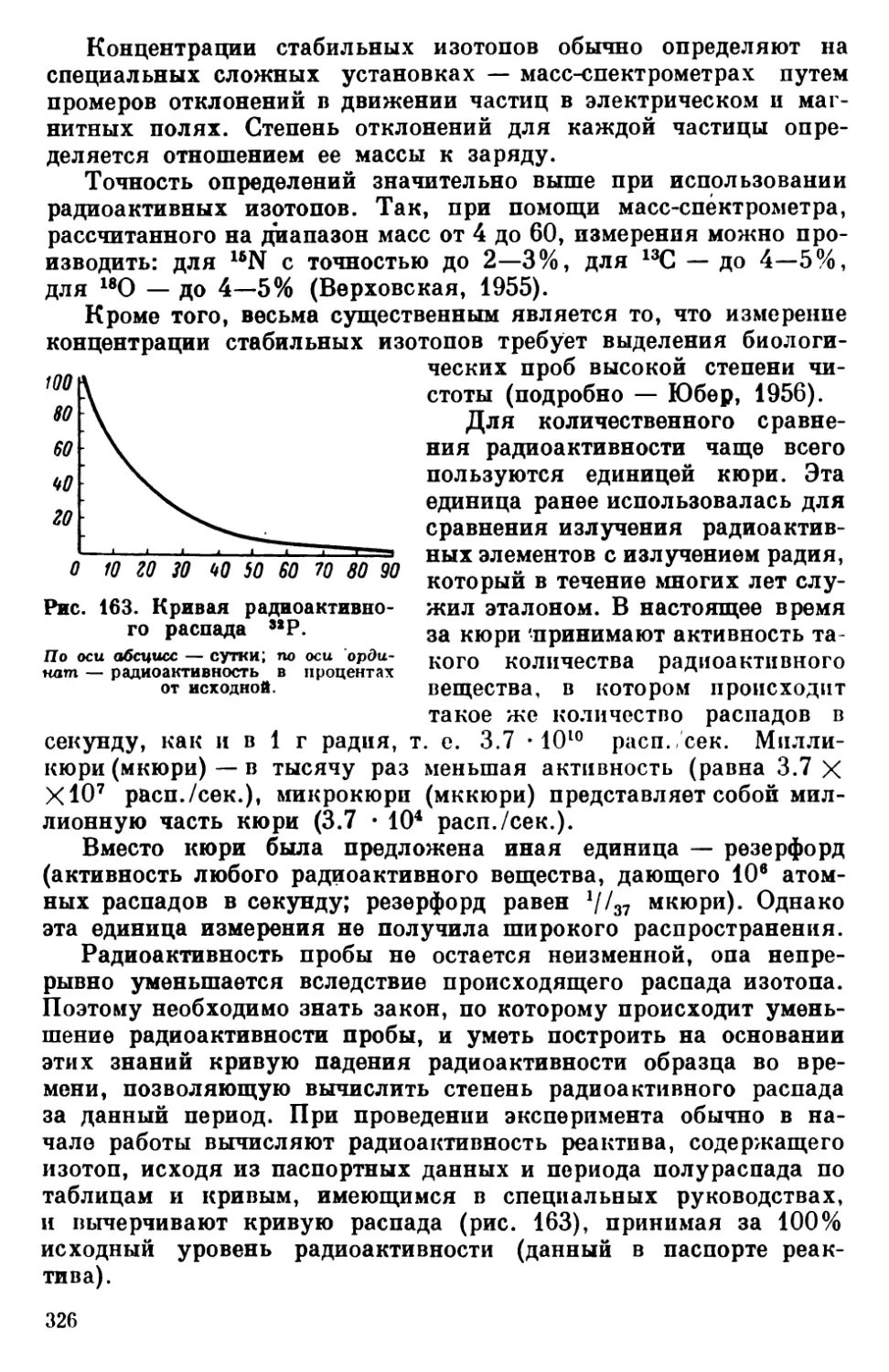
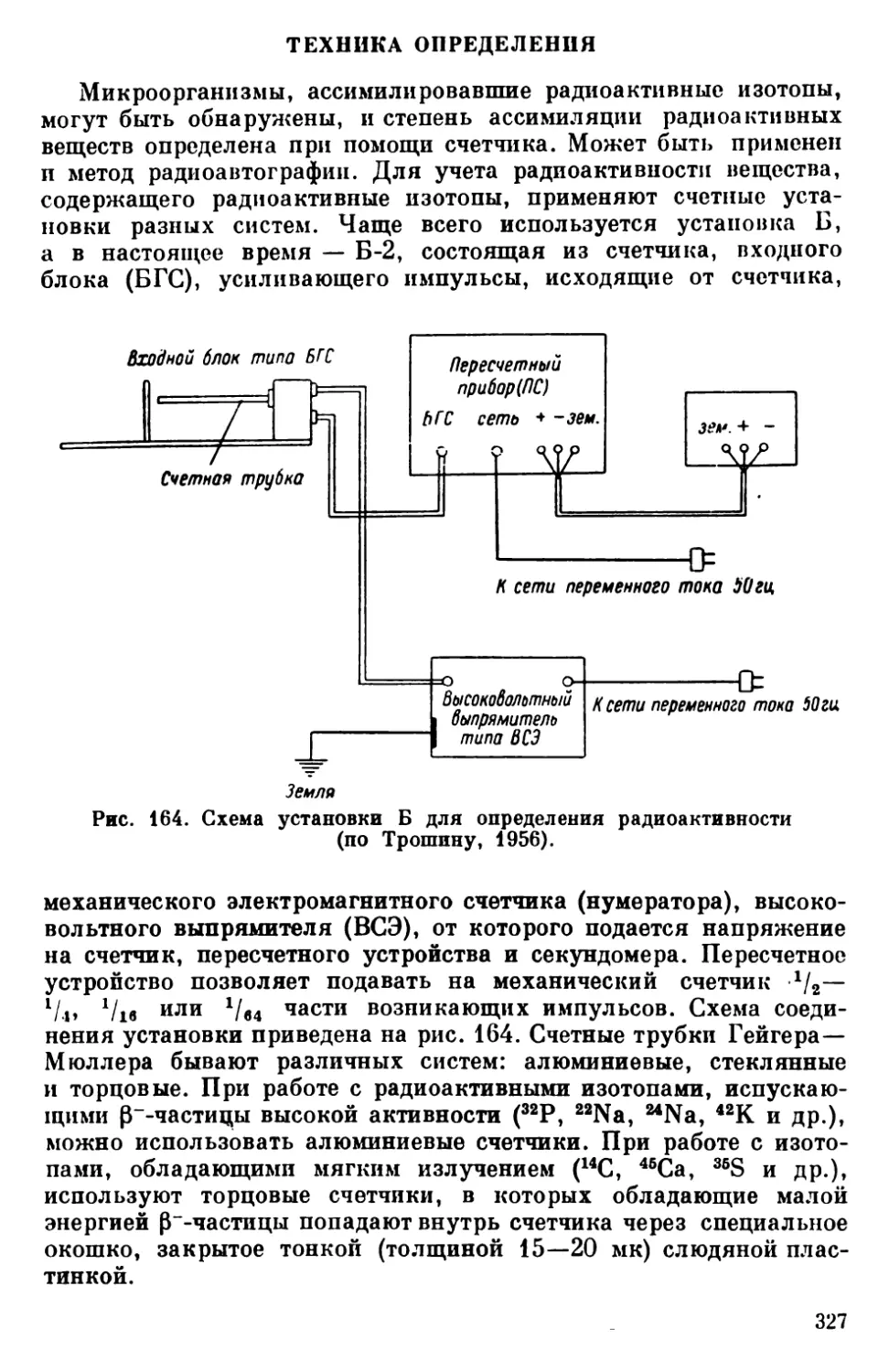
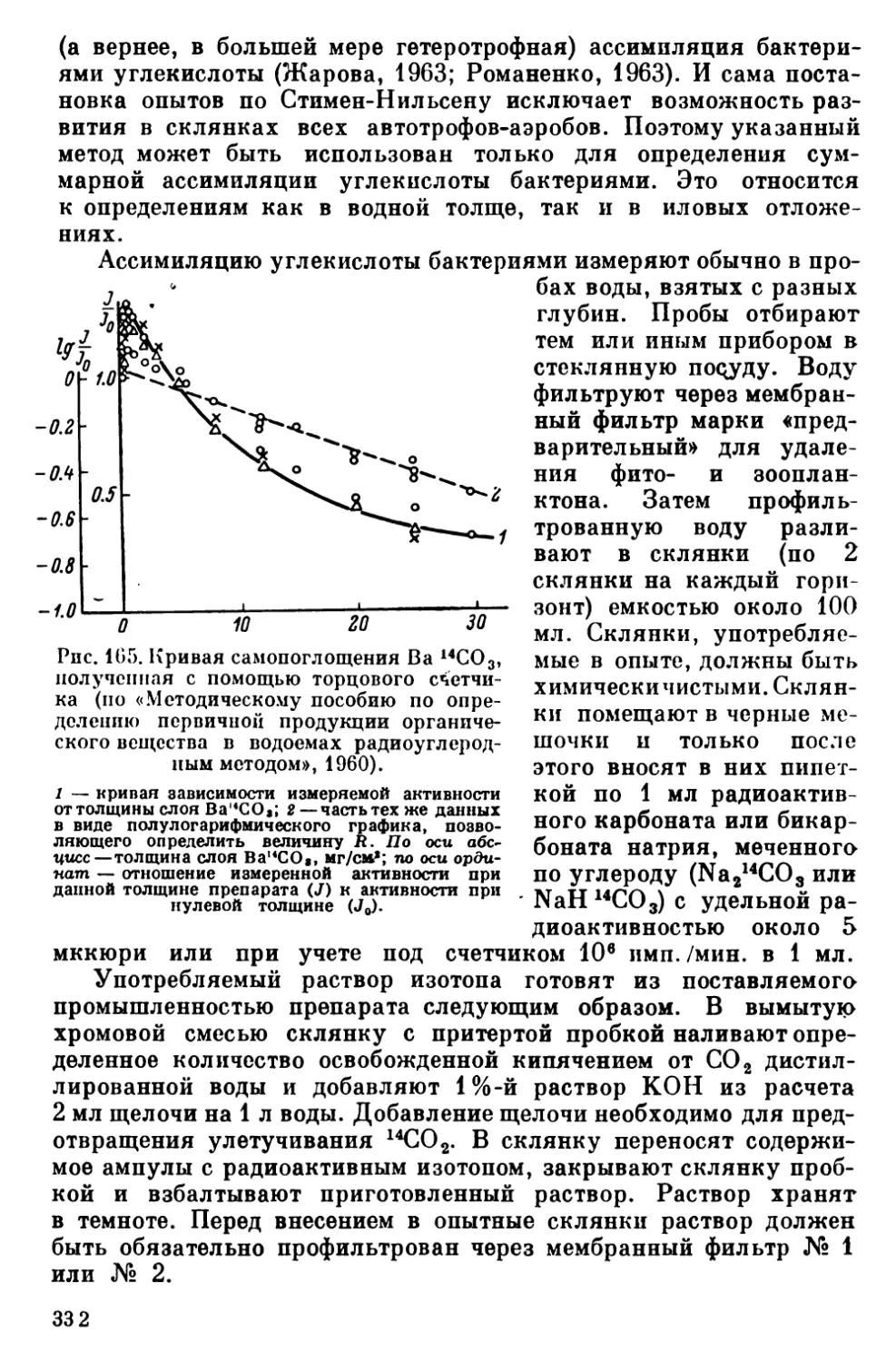
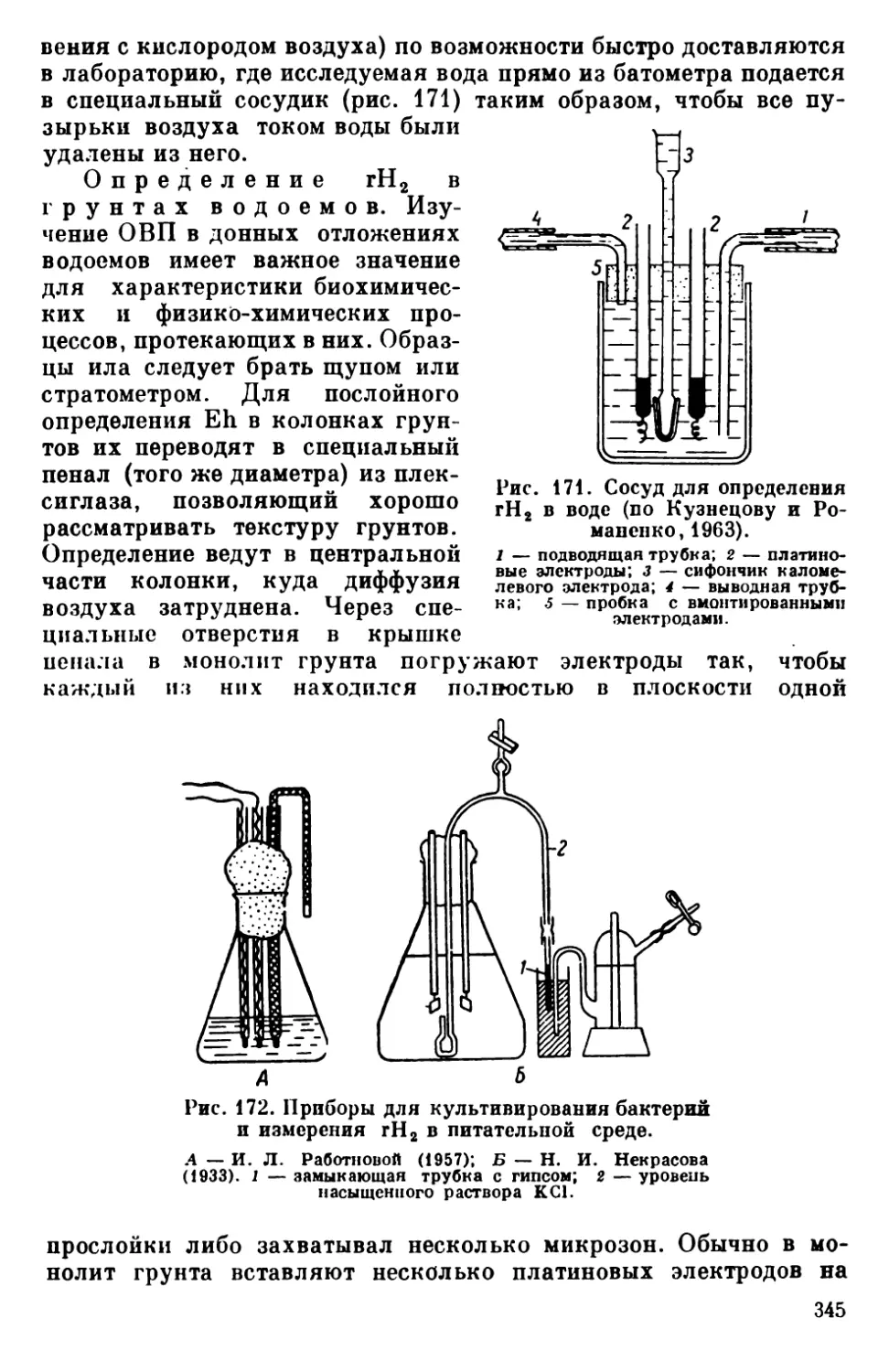
Текст
АКАДЕМИЯ НАУК СССР
ЗООЛОГИЧЕСКИЙ ИНСТИТУТ
Л. Г Р од и нд
Методы водной
микробиологии
ПРАКТИЧЕСКОЕ
руководство
ИЗДАТЕЛЬСТВО „НАУКА"
Москва 1966 Ленинград
АННОТАЦИЯ
Книга является практическим руководством к проведению
полевых и лабораторных исследований, содержит описание как-
широко принятых, так п новых методов культивирования, вы-
деления в чистые культуры и изучения микроорганизмов и про-
цессов, вызываемых ими, рецептуру питательных сред для раз-
личных физиологических групп микроорганизмов и отдельных
видов.
Книга рассчитана на широкий круг биологов, ведущих ис-
следования в области водной и общей микробиологии, а также
иа студентов старших курсов биологических вузов, специали-
зирующихся но микробиологии.
Ответственны й редактор
А. А . СТРЕЛ 1\ О В
ВВЕДЕНИЕ
Использование тех или иных микробиологических методов как
в полевых, так и в лабораторных работах определяется програм-
мой производимых исследований. При изучении загрязнения и
самоочищения водоемов необходимы методы, отличные от исполь-
зуемых при изучении продуктивности водоемов; иными методами
пользуются при выяснении роли микроорганизмов в коррозии
металлов и бетонных сооружений и т. д. Коснемся коротко важней-
ших направлений в работах по водной микробиологии.
Каждому водоему свойственно характерное для него, опреде-
ляемое его конкретными условиями бактериальное население.
Развитие микроорганизмов тесно связано с факторами среды:
содержанием кислорода, минеральных и органических веществ,
активной реакцией, температурой, развитием фито- и зоопланк-
тона. Сообщества микроорганизмов в чистых, пезагрязняемых
водоемах различного типа имеют в каждом из них свои ха-
рактерные черты, связанные с условиями их обитания. Эти со-
общества составляют неотъемлемую часть биоценозов данного
водоема. Но если ценозы животных и растительных организмов
известны и обязательно выясняются при исследованиях, прово-
димых на водоеме, то бактериальные ценозы водоемов продол-
жают оставаться почти неизвестными. Необходимо использование
ряда методов (как прямых микроскопических, так и методов по-
севов), чтобы эти ценозы были выявлены и установлены типичные
сообщества для водоемов разных видов: рек, озер, водохрани-
лищ — и их изменения при загрязнениях.
Характер и интенсивность бактериальных процессов лежат
в основе протекающего в водоемах круговорота веществ. С био-
химической деятельностью микроорганизмов связаны трансфор-
мация и регенерация биогенных элементов, и среди них в первую
очередь азота и фосфора, необходимых для развития первичных
продуцентов водоемов. Образование донных отложений, выделе-
ние газов, меняющих окислительно-восстановительные условия
придонпых слоев воды, — все это связано с деятельностью микро-
организмов и не может быть понято без изучения приводящих
к этому процессов. Еще мало известно о количестве автотрофных
3
микроорганизмов в водоемах и о реальных размерах создаваемого
ими бактериального белка.
Каждый водоем имеет характерные особенности распределения
микроорганизмов как по вертикали, так и по горизонтали.
Скорость размножения микроорганизмов, использование ими
питательных веществ и на основе этого продукция нового органи-
ческого вещества в виде микробных клеток, выедание этих клеток
зоопланктоном существенны для баланса органических веществ
в водоеме. Реки приносят в озера, водохранилища и моря огром-
ные количества живого органического вещества в виде микробных
клеток; произведенные в последнее время работы выявили,
что бактериальный сток в моря выражается сотнями тонн в год.
Этот снос имеет огромное значение для продуктивности эстуариев
рек.
Значительна роль микроорганизмов в коррозии металличе-
ских и бетонных сооружений, в обрастании водоводов и судов.
Знание закономерностей развития и качественного состава бактери-
альных ценозов обрастаний необходимо для разработки эффектив-
ных мер борьбы с этими явлениями.
Существенное значение для развития жизни в водоеме имеют
взаимоотношения между микроорганизмами и растительным планк-
тоном, между гидрофитами и микроорганизмами, между микро-
организмами и животным населением водоемов. Выяснение роли
бактерий в питании водных животных позволило разработать
практические мероприятия по разведению кормовых животных.
Лечебные грязи являются продуктом бактериальной деятель-
ности. Регенерация использованной грязи также происходит
в итоге деятельности микроорганизмов. Знание биологии возбу-
дителей этих процессов необходимо для создания условий, благо-
приятствующих их развитию.
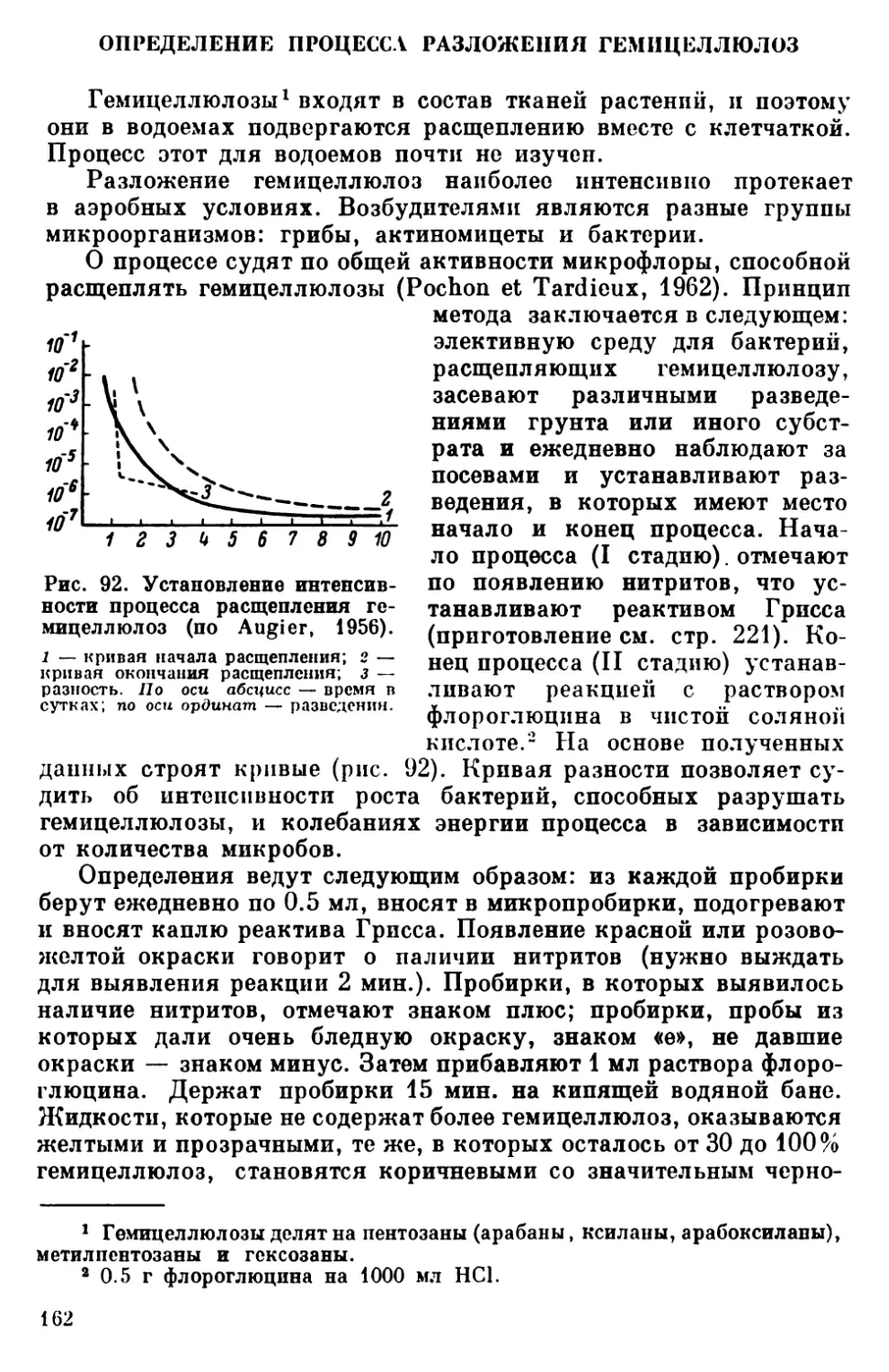
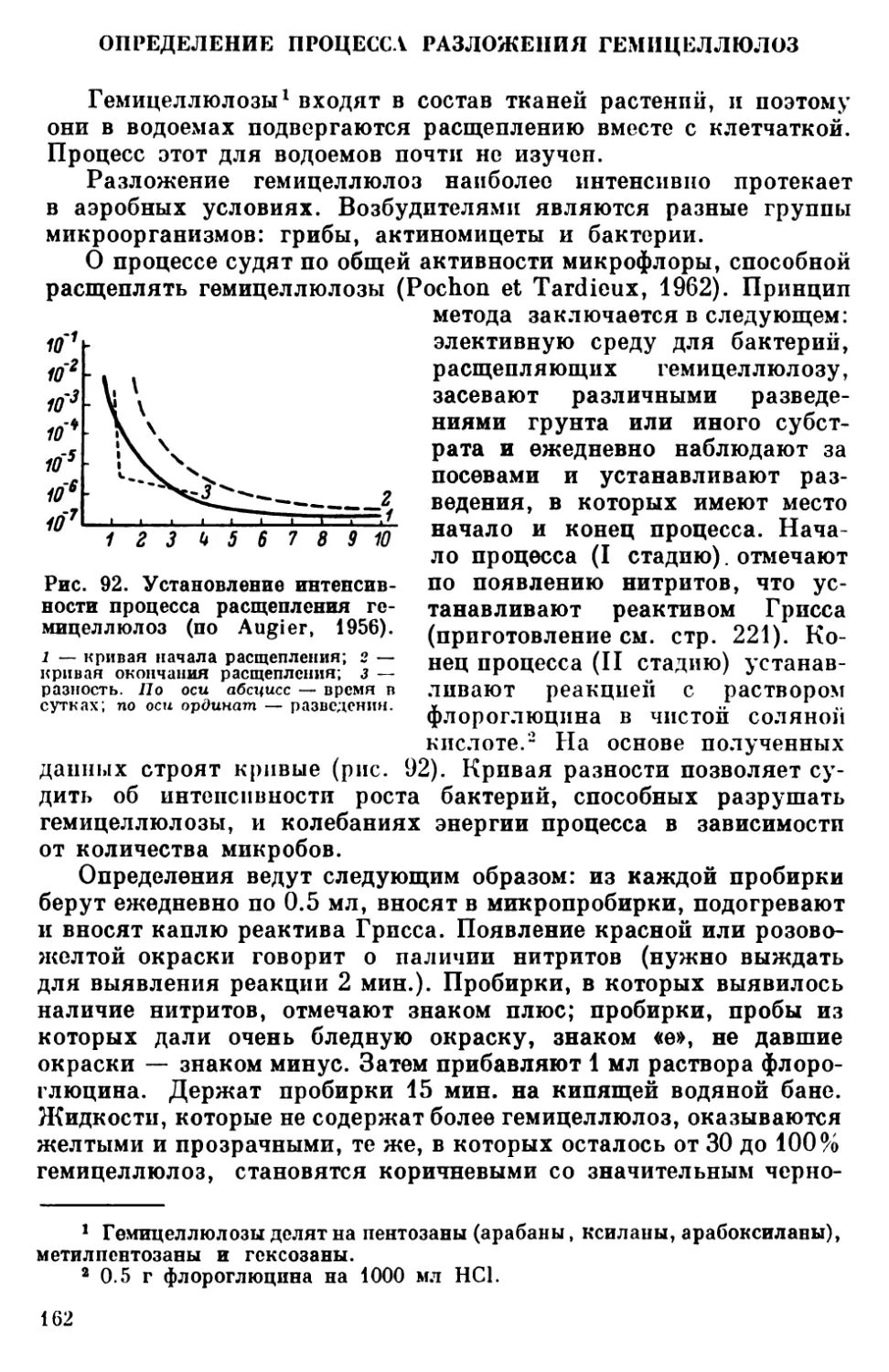
Одним из существенных направлений водной микробиологии
является продукционное. Для понимания основных закономер-
ностей продуктивности водоемов (и рыбопродуктивности в том
числе) необходимо знание воспроизводства всех форм жизни, начи-
ная с микроорганизмов, их экологии и взаимозавпсимостей. По-
этому микробиология органически входит в комплекс гидробиоло-
гических работ, поскольку закономерности развития гидрофауны
могут быть поняты и хозяйственно использованы только исходя
из их взаимосвязи с условиями среды, с развитием бактериаль-
ных и растительных организмов. Микробиологические исследова-
ния здесь должны дать материалы, выявляющие, насколько
концентрации бактерий достаточны для обеспечения пищей беспоз-
воночных, используемых рыбами в пищу, а микробиальные про-
цессы направлены в сторону увеличения продуктивности. Микро-
биологические работы такого направления необходимы в первую
очередь па удобряемых водоемах. В настоящее время сфера приме-
нения удобрений расширяется в связи с падением на ряде водо-
4
смов уловов рыбы — удобрения применяют не только на прудах,
по и на заливах морей, озер, на целых озерах и участках рек.
Микроорганизмы выступают при интенсификационных меро-
приятиях как первое звено, связывающее животный мир с абио-
тической средой, и микробиологические данные в большинстве
случаев даже более ярко, чем химические, показывают все воз-
никающие в среде изменения вследствие того, что микроорга-
низмы являются чувствительнейшими реагентами на эти из-
менения.
В рыбоводных удобряемых прудах микробиологические дан-
ные имеют большое значение для обоснования сроков внесения
удобрении и их количеств. Так, темпы размножения бактерий и
энергия течения вызываемых ими процессов обусловливают сроки
замены растительного удобрения свежим. Количество травы,
которую можно загрузить в пруд единовременно, определяется
размерами развивающейся массы бактерий — потребление кисло-
рода микроорганизмами может привести к дефициту кислорода.
В итоге развития процессов десульфатизацпи при внесении орга-
нических удобрений в прудах с водой, богатой сульфатами, воз-
можны заморы.
Минеральные удобрения в прудах рационально могут быть
применены па основании как данных по степени нуждаемости пру-
дов в тех или иных элементах, необходимых для развития фито-
планктона, так и хода микробиальных процессов трансформации
этих удобрений в корм рыбе. Темны размножения и энергия вы-
зываемых различными группами бактерий процессов определяют
и большой степени использование различных минеральных
удобрений. В условиях различных прудов в разных климатиче-
ских зонах страны эти процессы будут протекать неодинаково,
и только накопление большого по объему материала, собранного
микробиологическими методами, даст научное обоснование под-
бора удобрений, необходимых для прудов каждого типа с водами
различных классов.
Среди физиологических групп микроорганизмов, осуществляю-
щих трансформацию удобрений, выявились имеющие наибольшее
значение. Вактерии, минерализующие органические вещества,
при внесении растительных удобрений и при отмирании водорос-
лей (при смене их форм) достигают огромной численности и отли-
чаются высокой динамичностью этой численности. В периоды мак-
симального своего развития гетеротрофные бактерии составляют
до 50% всей массы микроорганизмов, развивающихся в пруде.
Все они являются для гидрофауны пищевым материалом.
Азотный баланс водоемов тесно связан с деятельностью азот-
фиксирующих организмов. Кроме того, клетки азотобактера
являются предпочитаемым гидробионтами видом бактериального
корма. Имеет значение и выделение клетками этих бактерий ве-
ществ, стимулирующих развитие водорослей.
Процесс, являющийся для удобряемых прудов высоко полез-
ным, — процесс нитрификации — может усиливаться при одном
подборе удобрений и ослабляться при другом.
Показательно значеппе микробиологических работ для выяс-
нения целесообразности и рентабельности внесения азотных удоб-
рений. Исследование хода процесса денитрификации в конкретных
условиях данных прудов может показать, используются ли по
назначению внесенные азотные удобрения.
Другое направление, отличное от разобранных выше, — сани-
тарная бактериология. Бактериологические исследования яв-
ляются обязательной частью работ по водоснабжению насе-
ления, охраны вод от загрязнения, очистки питьевых и
сточпых вод. Программа работ здесь обычно ограничивается
получением данных, необходимых для санитарно-гигиенической
характеристики водоемов. Выработанная для этого методика
ограничивает круг исследований санитарно-показательными
микроорганизмами, характеризующими степень загрязнения
водной среды. Одним из важных моментов исследования яв-
ляется быстрота получения данных о загрязнении. Основными
широко используемыми показателями являются всего два: коли-
чество гетеротрофных микробов, растущих на стандартном мясо-
пептонном агаре при 37э С, и содержание микробов группы кишеч-
ной палочки — показателей фекального загрязнения воды.
Следует отметить необходимость расширения при саиитарно-
гигиеппческих работах числа показателей; это обусловливается
разнообразием состава поступающих в водоемы стоков. В част-
ности, применение прямых микроскопических методов исследо-
вания показывает особенности бактериальных сообществ чистых
вод и резко отличающиеся ценозы участков водоемов, загрязняе-
мых городскими сточными водами, водами предприятий, спускаю-
щих сточные воды с различными органическими веществами п сточ-
ные воды с минеральными примесями. К этим методам следует
отнести: 1) прямой счет микроорганизмов, 2) изучение состава
микроорганизмов воды и грунтов с помощью пластинок обрастания
и 3) изучение этого состава с использованием люминесцентной мик-
роскопии. Прямой счет бактерий в воде и в грунтах дает правильное
представление о численности бактерии, об общем составе бакте-
риальной массы (количестве кокков, палочек, дрожжей, серобак-
терий и др.).
Пластинки обрастания позволяют установить бактериальные
сообщества, в частности формы, не развивающиеся на обычных
питательных средах и часто достигающие массового развития’, и,
следовательно, формы, характерные для условий водоема пли его
отдельного участка. Пластинки обрастания позволяют выявить
взаимоотношения между микроорганизмами в бактериальных
ценозах. Характер загрязнения обусловливает характер сообществ
бактерий. В настоящее время еще нельзя установить ценозы, типич-
6
ные для того или иного вида загрязнения, хотя виды бактерии,
массовое развитие которых связано со степенью сапробности водое-
мов, и установлены.
Весьма существенными показателями загрязнения водоемов
и отдельных их участков являются сообщества микроорганизмов,
развивающиеся в грунтах. Осаждение па дно водоемов различных
загрязняющих веществ (целлюлозы, лигнина, корья, протеинов,
шерстяного волокна, тяжелых металлов и др.), адсорбция грун-
тами различных органических и неорганических соединений
создают там особые условия, которые имеют следствием характер-
ные изменения в составе бактериальных ценозов грунтов. Даже
через длительные сроки эти осевшие на дно водоемов соединения
могут быть, а часто и являются источниками вторичного загряз-
нения. Грунты представляют собой те биотопы, где массового
развития достигают актиномицеты, являющиеся причиной земли-
стых запахов и привкусов воды.
Весьма перспективными в водной микробиологии вообще и
в санитарно-гигиенических исследованиях в частности являются
люминесцентный анализ и использование люминесцентной микро-
скопии. Лишь люминесцентной микроскопией могут быть выявлены
распределение бактерий в грунтах, относительное содержание
в общей их массе свободных, активных, неадсорбированных кле-
ток — агентов самоочищения, и количество малоактивных, ад-
сорбированных грунтами. Изучение природных процессов само-
очищения в водоемах различного характера имеет существенное
значение для характеристики водоема.
Знание качественного состава микроорганизмов и их физио-
логии необходимо для интенсификации процессов биохимической
очистки сточных вод. Состав микроорганизмов активного ила опре-
деляет качество биологической очистки. Выявление форм, являю-
щихся активными агентами очистки, знание их физиологических
особенностей позволяют создать для них оптимальные условия.
Необходимо знать микроорганизмы, являющиеся помехами (на-
пример, бактерии, вызывающие всплывание активного ила),
для выработки эффективных мер борьбы с ними.
Рациональная и правильная загрузка любых очистных соору-
жений возможна лишь при знании и учете деятельности микро-
организмов. Особое значение приобретают сейчас работы по выяс-
нению роли бактерий в переносе по пищевым цепям и ликвидации
радиоактивных и других опасных загрязнений водоемов (загряз-
нения пестицидами, остатками детергентов и др.).
Можно было бы назвать и другие как практические, так и тео-
ретические вопросы, разрешаемые методами водной микробиоло-
гии. Но и приведенный здесь краткий перечень достаточно гово-
рит об их значении и многообразии.
Надо, однако, заметить, что многие поставленные наукой и
практикой вопросы методами водной микробиологии, сложившп-
7
мися к настоящему времени, не могут оыть полностью и точно
разрешены. Поэтому требуются дальнейшие поиски, доработки
и усовершенствования методов водной микробиологии. Такая
работа непрерывно ведется, о чем свидетельствует литература.
В тексте указываются источники, а в конце работы дается список
важнейшей литературы по методике микробиологических иссле-
дований. В водной микробиологии используются и методические
достижения, полученные в других областях микробиологии.
Необходимо коснуться вопросов проведения исследований
солоноватых и солёных вод. Все последующее изложение ве-
дется применительно к проведению анализов в условиях прес-
ных вод, как это обычно делается в пособиях по водной микро-
биологии. Однако при работах даже на континентальных
водоемах приходится встречаться с солёными и солоноватыми
водами, минеральными источниками, лечебными грязями и др.
При работе па этих водоемах используются те же методы вод-
ной микробиологии, что и на пресных, по среды готовят, учи-
тывая минерализацию: или на воде исследуемого водоема без
разведения, или в разведении дистиллированной водой (1:1),
или вводя необходимое количество содержащихся в водоеме
солей.
ГЛАВА 1
ВЗЯТИЕ ПРОБ ДЛЯ МИКРОБИОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЙ
ВЫБОР МЕСТ ВЗЯТИЯ ПРОБ
Выбор в водоеме мест взятия проб представляет собой ответ-
ственную задачу, к решению которой падо подходить со всей вни-
мательностью. Обоснованное решение этого вопроса может быть
принято лишь после получения данных о морфометрических
особенностях водоема: размерах, распределении глубин, геологи-
ческом строении берегов, распределении грунтов, наличии при-
токов, у озер — стока и т. д. При решении вопроса о расположении
станций, на которых будут браться пробы для микробиологиче-
ского анализа, должны быть учтены основные физико-химиче-
ские факторы: распределение в водоеме температуры, кислорода,.
pH и др. Получение данных о вертикальном и горизонтальном рас-
членении водоема должно предшествовать микробиологическому
исследованию.
Наличие больших поселений на берегах открытых водоемовг
наличие промышленных предприятий, нахождение пароходных
пристаней, мест выпаса и водопоя скота — все это следует учиты-
вать при микробиологических исследованиях даже несанитарного
характера, так как все указанные моменты оказывают большое
влияние на содержание бактерий в водоеме и па направление
микробиальных процессов в нем.
У каждого вида водоемов существуют своп особенности, кото-
рые должны быть учитываемы при составлении плана исследова-
ний. В озере паплучшим является расположение пунктов станций
по принципу лимнологических разрезов. Станцией, по принятой
в лимнологии терминологии, называется каждое выполнение работ
в данном мосте и в дапное время. Лимнологический разрез начи-
нается с прибрежной зоны, захватывает область, переходную от
прибрежной к лежащей дальше от берега — глубинной, идет через
глубинную область к другому берегу. В толще воды должны быть
взяты пробы из различных слоев воды — эпилимниона, метали-
мпнона и гиполимниона (эти области в водоеме различаются по
вертикальному распределению температуры) (рис. 1). Число
станций на озере зависит от его величины, распределения глубин.
9-
Количество станций в каждой из областей зависит от условий
этих областей. При тех тесных взаимоотношениях, которые сущест-
вуют между микроорганизмами и условиями среды, численность
и состав бактерий зависят от этих условий.
В прибрежной области наблюдается наибольшее разнообразие
условий среды. Она в большой степени подвержена влиянию
берегов, атмосферы, прибоя волн. В мелкой прибрежной области —
особый температурный режим. Здесь ясно выражены суточные
колебания температуры. Еще более резки сезонные колебания:
зимой небольшой слой воды лежит непосредственно подо льдом
и имеет температуру, близкую к 0°, весной вода в прибрежной зоне
Рис. 1. Различные зоны в озере (схема).
прогревается раньше, чем водная толща открытой части озера.
Летом дневная температура в прибрежной части выше, чем в об-
ласти значительных глубин. Малыми глубинами, действием при-
боя обусловливается значительно большее количество кислорода.
Свет ввиду малой толщины водного слоя проникает до дна, что
позволяет развиваться водным растениям. Заросли макрофитов
создают в прибрежпой области особые условия для развития
микроорганизмов. Наступающее осенью отмирание макрофитов
имеет следствием обогащение среды органическими веществами —
источником питания для многих групп бактерпй. В этой зоне часто
наблюдаются большие скопления отмирающего фитопланктона,
являющегося источником органического материала для бакте-
рий. Разнообразие условии в прибрежной зопе вызывает необ-
ходимость расположения станций на небольшом расстоянии одна
от другой.
Область, переходная между литоралью и глубинной областью,
обладает промежуточным режимом. В пей может начинаться зона
снижения содержания кислорода, в ней — средние между глубин-
ной и прибрежной областью температуры.
Область глубин озера характеризуется по сравнению с при-
брежной большей или меньшей стабильностью условий. Мало
меняющиеся или постоянные низкие температуры, пониженное
содержание органических веществ, отсутствие света, отсутствие
волнений и растительности создают особые условия для жизни
।
10
микроорганизмов и течения вызываемых ими процессов. Дно
глубинной зоны обычно покрыто слоем ила.
Каждая из трех вертикальных зон в озере представляет особые
условия для развития микроорганизмов. Эпилимнион — наиболее
прогреваемая зона, наиболее богатая кислородом, получающая
наибольшее количество света, зона продукции органического
вещества фитопланктоном. Зона мсталимниона часто характери-
зуется резким падением температуры. Гиполимнион является
зоной постепенного равномерного понижения температуры ко
дну озера.
В глубоких озерах в глубинных слоях температура постоянна
в течение года. Во многих озерах вода глубинных слоев переме-
шивается с водой вышележащих лишь в периоды весенней и
осенней циркуляции водных масс. В очень глубоких озерах цир-
куляция может не затрагивать глубинных слоев.
В силу вышеуказанного пробы по вертикали берут в эпилимни-
оне (в поверхностном слое, на горизонтах 5 и 10 м), в металимнионе,
в гиполимнионе (на горизонтах 25, 50, 100 м и далее при больших
глубинах через 100 м и обязательно в придонном слое). Первую
пробу по вертикали обычно берут на глубине 10—15 см от поверх-
ности, придонную — на расстоянии 20—30 см от дна. Таким
образом, в зависимости от распределения глубин количество проб
по вертикали на каждой станции различно.
Заливы озер очень часто отличаются по условиям, причем
иногда очень сильно, от озера в целом и должны быть включаемы
в план исследования.
Во время взятия станции судно или лодка должны стоять
неподвижно. При взятии проб в озере должно быть учтено на-
правление течений, зависящих от направления ветра.
Пруды отличаются незначительной глубиной. Этот основной
фактор обусловливает небольшое вертикальное расчленение,
хорошее прогревание водной толщи, проникновение света до
дна, особый гидрохимический режим, сходность условий в вод-
ной массе. Поэтому число проб в прудах обычно может быть огра-
ничено (если пруды нс имеют очень большой площади и в ппх нет
расчленения на отдельные области). В рыбоводных прудах обычно
берут пробы вблизи места впуска воды, в центре и у водоспуска из
двух горизонтов: поверхностного и придонного, а в очень мелких
прудах можно ограничиться по вертикали и одной пробой —
20—30 см от дна.
Водохранилища в зависимости от того, созданы ли они на ре-
ках пли на озерах, имеют черты, общие с исходным водоемом.
Обычно котловина их асимметрична — наибольшие глубины на-
ходятся перед плотипоп. Они не имеют ясно выраженной сублпто-
рали. Колебания уровня в водохранилищах значительны.
В вертикальном расчленении водной массы имеются свои осо-
бенности, связанные с характером стока воды. При спуске воды
11
через плотину в поверхностных слоях наолюдаются стоковые
течения, в остальной водной массе может иметь место вертикаль-
ная стратификация температуры. Иное — при спуске воды через
придонный водоспуск. В мелких, большой площади водохрани-
лищах ветры вызывают перемешивание воды. Вследствие указан-
ных условий на водохранилищах исследование производят па
продольных и поперечных разрезах.
Река резко отличается по своим условиям от озер, прудов и
водохранилищ. Всякая река имеет верховье, или исток, средин-
ную часть (среднее течение), пижпее течение и устье. Скорость
течения различна в этих частях одной и той же реки и зависит
Рис. 2. Распределение створов на реке (схема).
А — населенный пункт на реке; Б — приток; В — населенный
пункт на притоке.
от уклона русла. Скорости течения, обусловливающие в большой
степени различие условий, неодинаковы по поперечному сечению
реки. У берегов и у дна течение обычно более медленное, чем
в средней части реки. В реке может быть легко отличима лишь
прибрежная полоса (рипаль), где может быть развита водная расти-
тельность, переходная к глубинам зопа обычно выражена слабо.
Речной поток песет обычно воду почти одинаковой температуры
и почти с одинаковой насыщенностью кислородом. Однако могут
быть различия в проходящих отдельных струях, причем па корот-
ком расстоянии в одной и той же реке.
В реке различают русло, которое заполнено водой даже в ме-
жень — в период самого низкого уровня воды в реке, и пойму,,
которая заливается водой лишь во время половодья и паводков.
В некоторых местах в силу изменения рекой ее русла могут сущест-
вовать старицы (отрезки старых русел реки), представляющие
особые условия для развития микроорганизмов. ч
12
В истоке, в среднем и нижнем течении и в устье условия раз-
личны. Реки часто несут взвешенные в воде частицы, обычно бо-
гатые микроорганизмами. Благодаря перемешивающему действию
течения взвешенные частицы переносятся на значительное рас-
стояние, не оседая. В устье благодаря уменьшению скорости тече-
ния оседает большая часть материала.
На количество микроорганизмов в реке, на содержание взве-
шенных частиц и химический состав воды огромное влияние оказы-
вают притоки, которые всегда должны учитываться при исследо-
вании реки. Реки, особенно мощные, редко исследуются на всем
протяжении, чаще псследуются отдельные участки их, находя-
щиеся вблизи городов. В этих случаях пробы должны браться
Рис. 3. Распределение станций взятия проб
на створе (схема).
Буквами над вертикальными линиями показаны
станции на створе.
выше города, против города, ниже его в нескольких местах на
значительном расстоянии (рис. 2), выше и ниже мест выпуска
сточпых вод. Если имеются на исследуемом отрезке реки притоки,
то обязательно выше впадения притока, в его устье (на таком рас-
стоянии, чтобы не могло сказаться влияние реки, принимающей
приток) и ниже его впадения. Взятие проб осуществляется па
заранее установленных створах (рис. 3).
Поступление в реку сточных вод промышленных предприятий
городов, снос частиц почвы с сельскохозяйственных угодий, рас-
положенных на берегах, оказывают огромное влияние на содер-
жание и состав микроорганизмов.
Количество микроорганизмов в реке но остается постоянным
в течение года. Оно зависит сильно от климатических и метео-
рологических условий. Резко повышается содержание микроорга-
низмов в реке во время половодья (самого высокого подъема воды)
и паводков. Факторами, вызывающими подъем численности
микроорганизмов в половодье пли в паводки, являются смыв
дождями загрязнений с окружающей местности, таяние снегов,
также сносящих поверхностные загрязнения, разлив самой реки,
часто затопляющей значительные участки суши, смывающей та-
ким образом и почвенные частицы, насыщенные микроорганиз-
мами, и различные органические остатки. В межень количество
микроорганизмов может снижаться, однако подъемы температуры
воды создают более благоприятные условия для развития микро-
организмов. В зимнее премя подо льдом условия для развития
13
микроорганизмов опять отличны. В силу этого исследование реки
должно производиться в различные сезоны года.
Ключи очень часто являются объектами микробиологического
исследования в силу того, что они используются пли как источ-
ники водоснабжения, или для бальнеологических целей. Вода
ключей отличается постоянством состава, однако по выходе ее
на земную поверхность содержание и состав микроорганизмов
в ней резко меняются в силу изменения условий. Обязателен от-
бор проб в ключах в месте их выхода из земли. Содержание кисло-
рода в воде ключей по выходе их из земли низкое, по оно быстро
увеличивается далее по течению. Меняются и температура воды,
и содержание органических веществ, при движении воды по руслу
она обогащается почвенными бактериями.
При исследовании воды артезианских скважин пробы берут
при откачке воды. Длительность откачки должна быть не мепее
2—3 суток, причем насосное оборудование должно быть предва-
рительно продезинфицировано.
При наличии насосов в колодцах и каптажа ключей произво-
дят перед самой выемкой пробы 10—15-минутную откачку и берут
пробу, подставляя стерильную посуду под вытекающую струю
воды.
Существует ряд общих установок при взятии проб в водоемах
любого типа.
Микробиологические сборы должны сопровождаться опреде-
лением основных факторов среды: температуры, прозрачности,
содержания органических веществ, растворенного кислорода, pH,
общей минерализации, содержания кальция, азота, фосфора;
в реках — скорости течения.
Метеорологические условия могут влиять на получаемые дан-
ные; так, выпадение атмосферных осадков обычно влечет за собой
снос в водоем почвенных частиц, богатых микроорганизмами,
а часто и различных загрязнений. Поэтому взятие проб необхо-
димо производить в различные периоды, и в частности обязательно
в периоды устойчивой погоды.
Выемка проб из-подо льда производится из прорубей с широ-
ким диаметром. Выемку проб из проруби диаметром менее 1 м
и с большой толщиной ледяного покрова (больше 0.5 м) рекомен-
дуется производить прибором с баллонами с эвакуированным воз-
духом. Первую пробу по вертикали берут на глубине 10—15 см
подо льдом.
Пробы нужно брать всегда в одно и то же время дня (обычно
в утренние часы), если, конечно, исследование не имеет целью
выявить суточные изменения в содержании бактерий.
Па небольших водоемах пробы для микробиологических ис-
следований могут быть с успехом взяты с лодки. Вопрос о необхо-
димости установки па лодке лебедки с металлическим тросом ре-
шается в зависимости от используемых приборов. Многие цри-
14
боры могут быть опущены просто руками, будучи укрепленными
на тросе, размеченном на метры и полуметры. Разметка троса
должна вестись с учетом размеров того прибора, с которым пред-
полагается работа.
При работе на больших, глубоких водоемах необходима
установка на том судне, с борта которого будет вестись работа,
лебедки с металлическим тросом и механическим счетчиком.
Способ взятия проб как воды, так и грунтов имеет большое
зпачение при микробиологических работах. Только самое тща-
Рис. 4. Переносный бокс для производства
посевов в экспедиционных условиях.
1 — отверстие для копчика пипетки.
тельное соблюдение всех правил бактериологической техники
гарантирует пробу от загрязнения ее извне, а следовательно, и
точность анализа. Пробы должны быть взяты быстро в предва-
рительно простерплизованную посуду, сохраняемую до самого
момента взятия пробы, тщательно завернутой в ту бумагу, в кото-
рой опа стерилизовалась, все металлические части приборов
должны быть перед взятием пробы обожжены на пламени паяль-
ной горелки илп пламенем спиртового тампопа.
Анализ взятых проб должен быть произведен как можно скорее
после выемки проб, так как чем меньше времени пройдет между
моментом взятия проб и посевами, тем точнее результаты. При
стоянии проб воды происходят быстрые изменения как в коли-
чественном содержании бактерий, так и в соотношении групп и
видов. Эти изменения начинаются в течение первого же часа по
извлечении пробы. Количество бактерий в изолированных пробах
сильно возрастает уже в первые часы по извлечении пробы. Одни
виды размножаются интенсивно и подавляют развитие других,
15
чем и вызываются резкие изменения в групповом и видовом со-
ставе микроорганизмов в пробах.
Чтобы избежать этого и получить точные данные, посевы для
определения численности бактериоплапктона и его видового со-
става проводят па судне или в специально организуемой для этого
микробиологической лаборатории, или — при отсутствии такой
лаборатории — в помещении, пригодном для этой цели, исполь-
зуя специальные переносные боксы. Боксы (рис. 4) могут быть
различных размеров, обычно их делают пз фанеры и органиче-
ского стекла, не боящегося транспортировки. Транспортировка
бокса осуществляется в другом, специально для него сооружаемом,
плотно закрывающемся ящике, предохраняющем бокс от пыли во
время переездов. Внутреннее помещение бокса перед производ-
ством посевов стерилизуют переносной кварцевой лампой пли при
неимении таковой протирают все стенки и дно бокса бактерицидно
действующими растворами.
При необходимости перевозки проб соблюдаются следующие
условия:
1) пробы должны быть доставлены в лабораторию не позд-
нее чем через 1—3 часа после взятия;
2) в жаркое время года пробы должны перевозиться или
в двухстенпом ящике со льдом или с охладительными смесями,
температура внутри которого между пробами нс должна быть выше
4° С, пли в ящике, впутрп которого между пробами должны быть
проложены резиновые аптечные пузырп, наполненные льдом; в зпм-
нес время для предупреждения замерзания воды в ящик кладут
пузыри, наполненные теплой водой;
3) предназначенные к перевозке пробы должны быть пли
в запаянных баллонах, или в склянках с притертыми пробками.
ПРИБОРЫ ДЛЯ ВЗЯТИЯ ПРОБ ВОДЫ И ГРУНТОВ
Приборы для взятия проб воды. Основным
требованием при любом микробиологическом исследовании воды
является асептический отбор проб. Для взятия проб воды могут
быть использованы различные приборы, по следующие правила
являются общими: отбор проб производится в стерильную посуду;
все стекляппые и резиновые части приборов должны быть просте-
рилизованы; склянки, баллоны и другие простерплизоваппые
части приборов должны сохраняться до момента взятия пробы
завернутыми в бумагу, в которой они стерилизовались.
Пород взятием пробы металлические части прибора тщательно
обжигаются пламенем намоченного в спи рте-ректификате ват-
ного тампона (прибор не должен быть мокрым от взятия прсдыду-,
щей пробы). После соединения всех частей прибор обжигается
повторно.
10
Сконструировано и описано большое количество приборов для
взятия проб воды. Одни из них используют механические приспо-
собления для удаления пробки на же-
лаемой глубине и постановки ее на
место после заполнения склянки водой,
другие используют капиллярные труб-
ки, которые отламываются посыльным
грузом на намеченной глубине, и
таким путем осуществляется впуск
воды.
Приборы первого тина при взятии
проб требуют двойных тросов, один из
которых служит для опускания самого
прибора, второй для поднятия и опу-
скания на место пробки, поэтому они
могут быть успешно использованы для
взятия проб воды только в неглубоких
водоемах. Для взятия проб на значи-
тельных глубинах они непригодны,
так как часто перекручиваются тросы
и тогда открыть склянку становится
невозможным. Одни из приборов тако-
го тина изображен на рис. 5. Он состоит
из металлической оправы, в которой
помещается склянка (7) с плоской при-
тертой пробкой. Края пробки охваты-
ваются двумя или тремя крючками
(2). Прибор опускается на тросе (3),
который прикрепляется к дужке при-
бора, и имеет бечевку (4), прикреплен-
ную к трубке (5) с пружиной внутри,
оканчивающейся крючками.
Бечевка при опускании прибора
пускается свободно. Когда прибор опу-
щен на намеченную глубину, тянут за
бечевку и притертая пробка выдерги-
вается из горлышка склянки, давая
возможность воде наполнить склянку.
По наполнении скляпкп бечевка опу-
скается и пробка закрывает склянку
посредством пружины, находящейся
внутри трубки. Массивное металличе-
ское дно (6) поддерживает прибор в вер-
тикальном положении. О взятии пробы
Рис. 5. Прибор со склян-
кой для взятия проб воды.
Объяснения в тексте.
можно судпть по большому количе-
ству пузырьков воздуха, поднимающихся на поверхность
воды.
2 А. Г. Родина
17
На небольших, мелких водоемах, например на прудах, при не-
имении специальных приборов пробы могут быть взяты любой
тяжелой бутылью, снабженной резиновой пробкой с двумя отвер-
стиями, через которые пропущены 2 стеклянные трубочки — одна
короткая, другая длинная. Стеклянные трубкп соединяют не-
большим кусочком рсзпновой трубки (рис. 6). По шейке бутыли
должно быть сделано кольцо, к которому прикреплена петля из
Рис. 6. Склян-
ка, подготов-
ленная для взя-
тия пробы
воды.
металлического троса. К этой петле прикрепляют
веревочным трос. К резиновой трубке прикреп-
ляется тоненький тросик. Перед взятием пробы
бутыль стерилизуется. Опускается опа на веревоч-
ном тросе. При достижении бутылью горизонта,
па котором намечено взятие проб, подергиванием
за топкий тросик выдергивают резиновую трубоч-
ку и вода поступает в склянку через одну из
стеклянных трубочек, через другую выходит вы-
тесняемый водой воздух.
Значительно проще работать с приборами,
имеющими один трос, в которых впуск воды осу-
ществляется открыванием крана или разбиванием
трубки пли копчика баллона посыльным гру-
зом. Недостатком такого рода приборов является
то обстоятельство, что проба воды поднимается с
незакрытой трубкой, через которую осуществлял-
ся впуск воды. Приборов такого рода предло-
жено много.
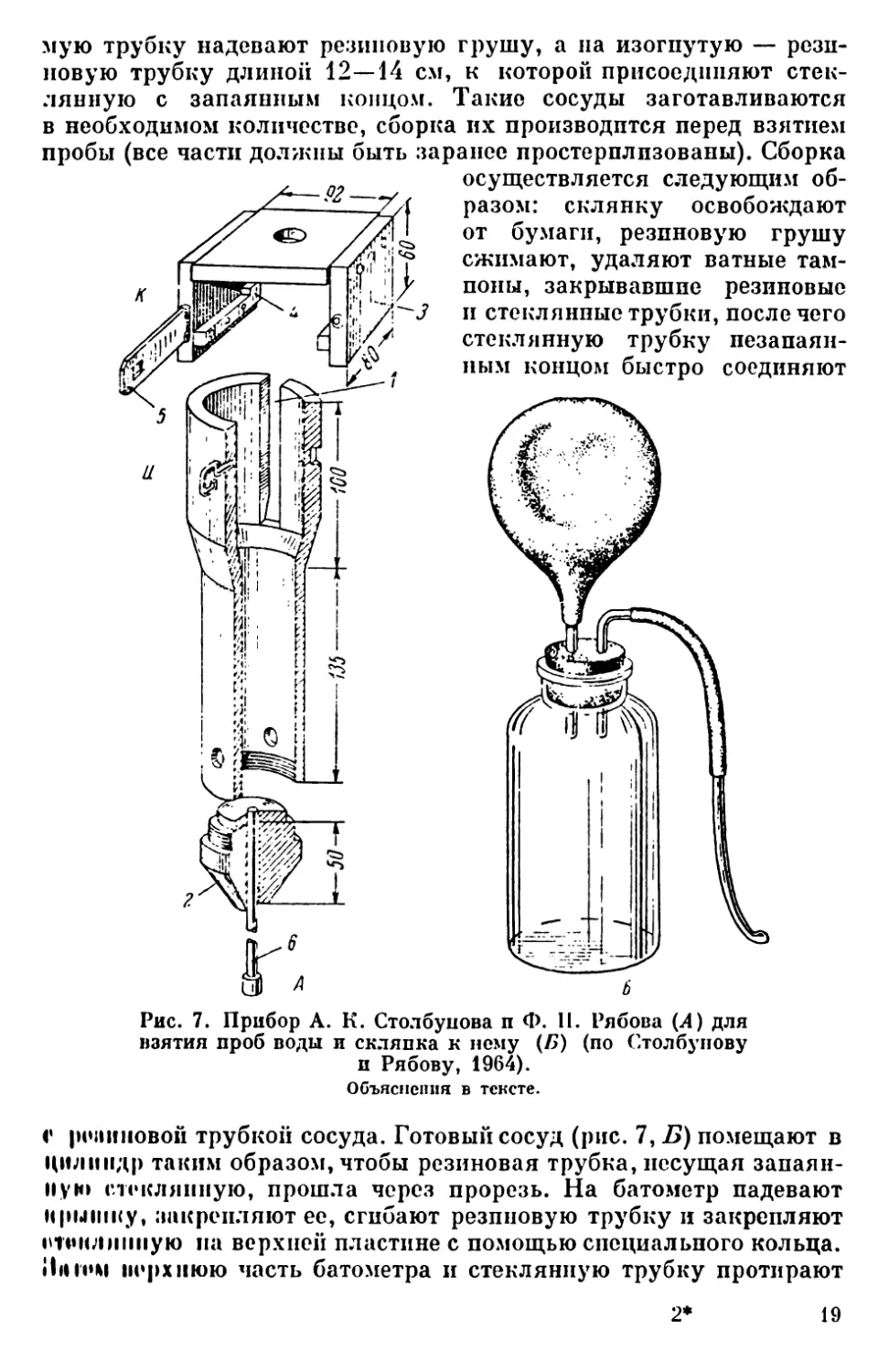
Довольно удобным является прибор (рис. 7, Л),
сконструированный А. К. Столбуновым и Ф. П. Ря-
бовым (1964). Он состоит из тяжелого толстостен-
ного полого цилиндра (Д), суживающегося внизу
и расширяющегося вверху, и крышки (Я). Ци-
линдр снабжен поршпем (б), перемещающимся
внутри цилиндра. В верхней части цилиндра находится прорезь
(7), через которую выводится резиновая трубка сосуда. В ниж-
ней части цилиндра сделаны отверстия для стока воды из при-
бора. Коническая заглушка (2) ввинчивается внутрь цплппдра.
По ее осп проходит направляющий канал поршня, который слу-
жит для извлечения сосуда с пробой из цилиндра. Крышка прибо-
ра состоит из основной пластины и двух щек (3). В центре пла-
стины имеется отверстие с поперечиной, к которой крепится трос.
Щеки через шлицы с выступами (4) и замыкающую щеколду (5)
прикрепляют крышку к цилиндру.
Сосудом для взятия воды в этом приборе служит стандартная
широкогорлая склянка высотой около 10 см и объемом 100—
150 мл. Склянка закрывается плотно пригнанной каучуковой
пробкой, через которую проходят две толстостенные стеклян-
ные трубки, одна из которых согнута под прямым углом. Па пря-
18
мую трубку надевают резиновую грушу, а на изогнутую — рези-
новую трубку длиной 12—14 см, к которой присоединяют стек-
лянную с запаянным концом. Такие сосуды заготавливаются
в необходимом количестве, сборка их производится перед взятием
пробы (все части должны быть заранее простерплпзованы). Сборка
осуществляется следующим об-
разом: склянку освобождают
от бумаги, резиновую грушу
сжимают, удаляют ватные там-
поны, закрывавшие резиновые
п стеклянные трубки, после чего
стеклянную трубку пезапаян-
ным концом быстро соединяют
Рис. 7. Прибор А. К. Столбунова п Ф. II. Рябова (А) для
взятия проб воды и скляпка к нему (А>) (по Столбупову
и Рябову, 1964).
Объяснения в тексте.
с |мч1иновой трубкой сосуда. Готовый сосуд (рис. 7, Б) помещают в
цилиндр таким образом, чтобы резиновая трубка, несущая запаян-
ную стеклянную, прошла через прорезь. На батометр надевают
крышку, закрепляют ее, сгибают резиновую трубку и закрепляют
етоклииную на верхней пластине с помощью специального кольца.
Янгом верхнюю часть батометра и стеклянную трубку протирают
2*
19
спиртом. Собранный прибор опускают на желаемую глубину и
посылают по тросу «почтальон» (нижний, разбивающий конец его
следует обжечь перед употреблением). «Почтальон» разбивает
стеклянную трубку, освободившаяся упругая резиновая трубка
выпрямляется, и на расстоянии 12—14 см от батометра резиновая
груша насасывает пробу воды. По поднятии па поверхность кау-
чуковая пробка должна быть заменена на стерильную (сплошную),
А
В
Рис. 8. Прибор Зибэфа для взятия проб воды
(по Sieburth, 1963).
Л — в разобранном виде; Б — несущий механизм; В — в собранном виде.
при пользовании банками с притертыми пробками — на пробку
от банки.
По этому же принципу построен прибор Зибэфа (рис. 8),
устроенный весьма просто: несущий механизм (рис. 8, Б) пред-
ставляет собой небольшую бронзовую трубку с пружиной и зажи-
мающим винтом. Резиновый баллон опускается в сжатом виде,
с закрепленной у троса стеклянной трубкой. Посыльный груз
разбивает стеклянную трубку, и сам баллон насасывает воду.
Для работы па значительных глубинах удобен прибор, пред-
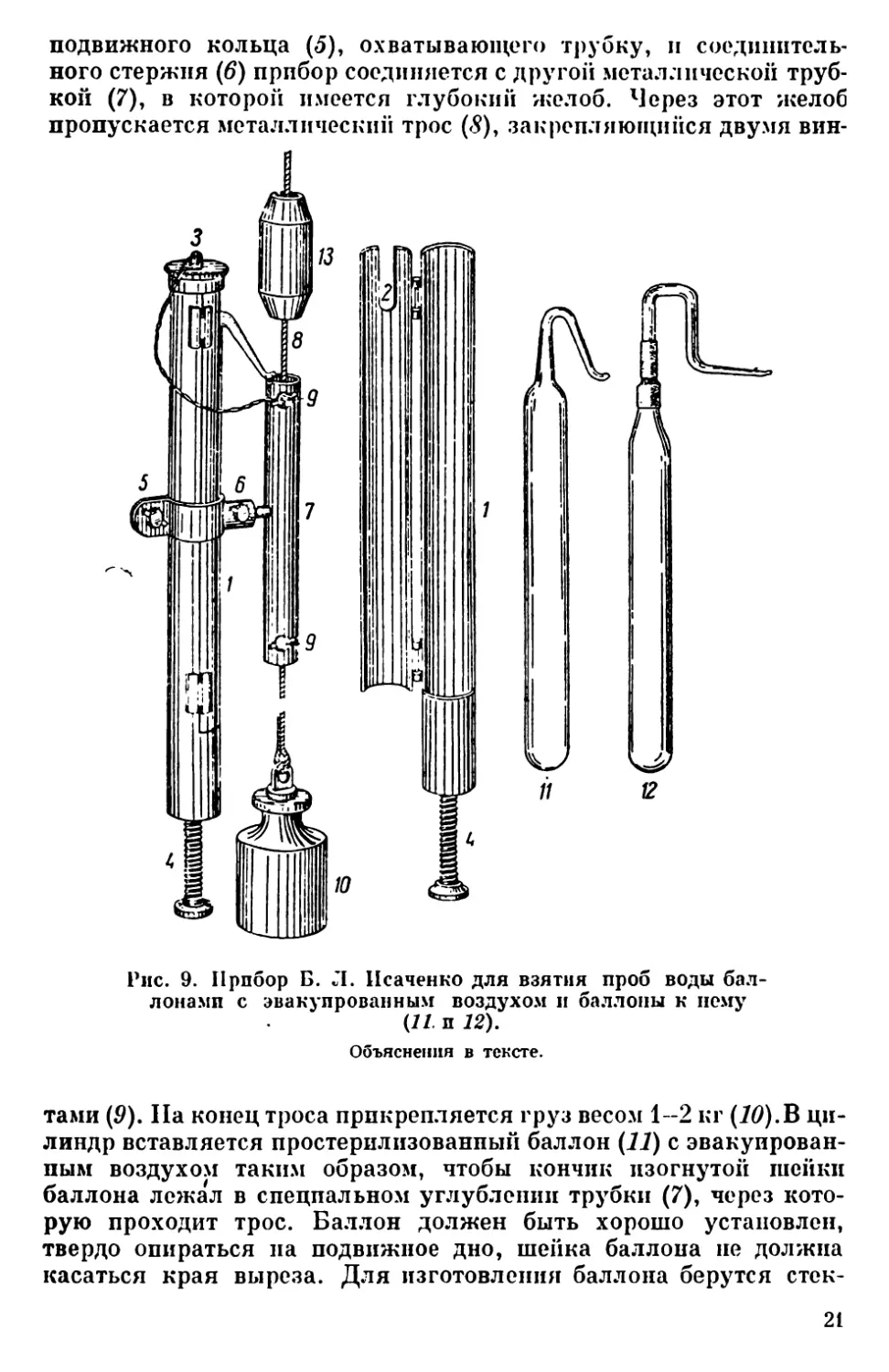
ложенный Б. JI. Исаченко (рис. 9). Прибор состоит из металли-
ческого никелированного цилиндра (7) длиной 30.5 см. Цилиндр
снабжен в верхней части вырезом (2) для шейки баллона и крыш-
кой (3), его закрывающей, а в нижней части вторым дном, которое
с помощью винта (4) может быть поднято и опущено. С помощью
20
подвижного кольца (5), охватывающего трубку, и соединитель-
ного стержня (6) прибор соединяется с другой металлической труб-
кой (7), в которой имеется глубокий желоб. Через этот желоб
пропускается металлический трос (5), закрепляющийся двумя вин-
Рис. 9. Прибор Б. Л. Исаченко для взятия проб воды бал-
лонами с эвакуированным воздухом и баллоны к нему
(11. и 12).
Объяснения в тексте.
тами (9). На конец троса прикрепляется груз весом 1-2 кг (10).В ци-
линдр вставляется простерилизованпый баллон (77) с эвакуирован-
ным воздухом таким образом, чтобы кончик изогнутой шейки
баллона лежал в спецпальном углублении трубки (7), через кото-
рую проходит трос. Баллон должен быть хорошо установлен,
твердо опираться па подвижное дно, шейка баллона не должна
касаться края выреза. Для изготовления баллона берутся стек-
21
Рис. 10. Прибор Зо-
белла для взятия
проб воды (по Zobcll,
1946).
Объяснения в тексте.
ляппые цилиндрические трубки диаметром 26 мм. Длина бал-
лона до шейки 22—27 см, емкость 100—110 мл.
Опустив прибор в воду па желаемую глубину, сверху по
тросу опускают посыльный груз (13) весом около 300 г, который
отбивает кончик оттянутой шейки баллона,
моментально наполняющегося водой. По под-
нятии на поверхность баллон запаивают или
отверстие закрывают стерилизованной ватой.
Каждый такой баллон может быть исполь-
зован ДЛЯ ВЗЯТИЯ ТОЛЬКО ОДНОЙ! пробы. Для
вторичпого употребления баллоны негодны,
так как разбитая трубка баллона не позво-
ляет этого. А. А. Егорова ввела приспо-
собление, позволяющее использовать сами
баллоны много раз. Баллон обрезают в ме-
сте его сужения и к нему присоединяют изо-
гнутую стеклянную трубку с помощью ре-
зиновой трубочки (рис. 9, 12). Выкачивают
воздух и кончик трубки запаивают. В таг
ком виде баллон заворачивают в бумагу
и стерилизуют в автоклаве. После взятия
пробы заменяется только изогнутая трубоч-
ка, кончик которой отбивается посыльным
грузом. Это приспособление значительно
удешевляет взятие проб.
Можно пользоваться большими пробир-
ками, которые закрывают резиновыми проб-
ками с проходящими через них изогнутыми
трубочками, запаянными после выкачивания
воздуха.
k По принципу вышеописанных приборов
построен и прибор Зобелла. Его отличием
является использование не специальных бал-
лонов, а обычных бутылок и склянок (рис.
10). Склянка (1) в этом приборе закрыта
резиновой пробкой (2), снабженной изогну-
той стеклянной трубкой (3), к которой с
помощью резиновой трубки (4) прикреплен
конец (5) стеклянной трубки, запаяппой на
противоположном конце. Склянка, снаря-
женная таким образом, стерилизуется в ав-
токлаве с пробкой, остающейся свободной
па шейке ее. По окончании стерилизации склянка, извлеченная
из автоклава, быстро закрывается пробкой. Автор указывает,
что таким путем достигается удаление воздуха из склянки па
50—90%. Склянка прикрепляется для взятия проб к латунной
раме. Взятие проб осуществляется с помощью посыльного груза.
22
По этому же принципу построен батометр 10. И. Сорокина
(19606). -
Следует иметь в виду, что при работе па больших глубинах
приборы, имеющие баллоны, соединяемые резиновыми трубками
или закрытые резиновыми пробками, непригодны. Под большим
давлением массы воды она просачивается в местах соединения
пли вдавливает резиновые пробки глубоко в баллоны с эвакуи-
рованным воздухом. Поэтому при работе на глубоких горизонтах
должны быть применяемы запаянные стеклянные баллоны с вы-
15 16
Ряс. 11. Прибор Левиса, Макнейла и Саммер-
фельта (по Lewis, McNail a. Summerfelt, 1963).
1 — покрытый резиной электрический кабель; 2 — соле-
ноид; з — пружина; 4 — корковая пробка; 5 — держа-
тель склянки; 6 — склянка; 7 — металлическая рама;
8 — подвижная платформа; 9 — пружина; 10 — утяже-
ленное основание; 11 — реостат сопротивления; 12 —
сигнальная лампа; 13, 14 — батареи (вид сверху),
сцепление проводов; 15, 16 — выключатели.
качанным воздухом. Зобелл предлагает использовать толстостен-
ные резиновые сосуды.
Иной принцип открытия и закрытия склянки предложен Ле-
висом, Макнейлом и Саммерфельтом (Lewis, McNail a. Summer-
felt, 1963). Для этого используется электрический ток от двух
6-вольтовых сухих электрических батарей. Прибор (рис. 11) со-
стоит из каркаса, который держит склянку, и соленоида, смонти-
рованного над нем. Соленоид соединен посредством покрытого
резиной электрического провода с системой выключателей.
Склянка закрывается пробкой и удерживается в определенном
положении снизу пружинящей платформой и сверху воротником.
При опускании на желаемую глубину ток включается, пробка
поднимается, по заполнении склянки ток выключается и склянка
закрывается.
23
Все описанные выше приборы не могут быть использованы для
взятия проб воды в родниках, вытекающих небольшой струей.
Здесь взятие проб может быть осуществлено с помощью стериль-
ной бутыли, закрытой резиновой пробкой с пропущенными через
нее двумя стеклянными трубками (рис. 12). Одна резиновой труб-
кой присоединена к насосу Шинца, с помощью
которого разрежается воздух в бутыли, другая
резиновой трубкой соединена с небольшой стек-
лянной трубочкой, которая вводится в ток воды
ручейка. Весь прибор должен быть простерпли-
зован перед взятием пробы.
На реках с большой скоростью течения взятие
проб не может быть осуществлено обычными прп-
Рис. 13.
Щуп для
взятия проб
грунта.
Рис. 12. Скляпка, подготовленная для взятая пробы
воды из родника.
борами из-за сноса их. В этих случаях при больших глубинах
должны быть использованы специально утяжеленные приборы,
при небольших глубинах самым надежным способом является
прикрепление стерильной бутыли с помощью специальной сетки
к шесту, который при взятии проб упирается в дно. Бутыли при
взятии проб направляются отверстием против течения.
Приборы для взятия проб грунтов. Для
взятия проб грунтов водная микробиология специальными при-
борами до настоящего времени пе располагает. Пробы грунтов
берутся разнообразными приборами, сконструированными для
взятия проб грунтов для иных целей (подсчета донной фауны,
изучения мпкрозонального строения грунта, определения остат-
24
ков животных и т. д.). Поэтому описание указываемых здесь
приборов можно найти в инструкциях по взятию проб грунтов
для изучения бентоса, изучения строения грунта и т. д.
Выбор прибора для микробиологического исследования грун-
тов определяется как задачами исследования, так и глубиной
водоема и характером грунта. Так как местом наиболее интен-
сивно протекающих микробиальных процессов является самый
поверхностный слой грунта, то во всех случаях важно получить
его неизмененным.
Нетвердые грунты в водоемах с малыми глубинами (пруды,
мелководья озер) могут быть взяты прибором типа щупа (рис. 13).
Прибор состоит из металлической трубы диаметром 8—10 см,
длиной 50—70 см, нижний край которой заточен. Па верхнем
конце находится дужка, прикрепленная шарнирами, позволяю-
щими отклонять дужку при выемке пробы из щупа. В верхней
части дужки укрепляется шест нужной длины. Шест позволяет
ввести прибор на желаемую глубину в относительно плотные
грунты. Прибор приносит пробу грунта, в которой можно про-
следить распределение слоев.
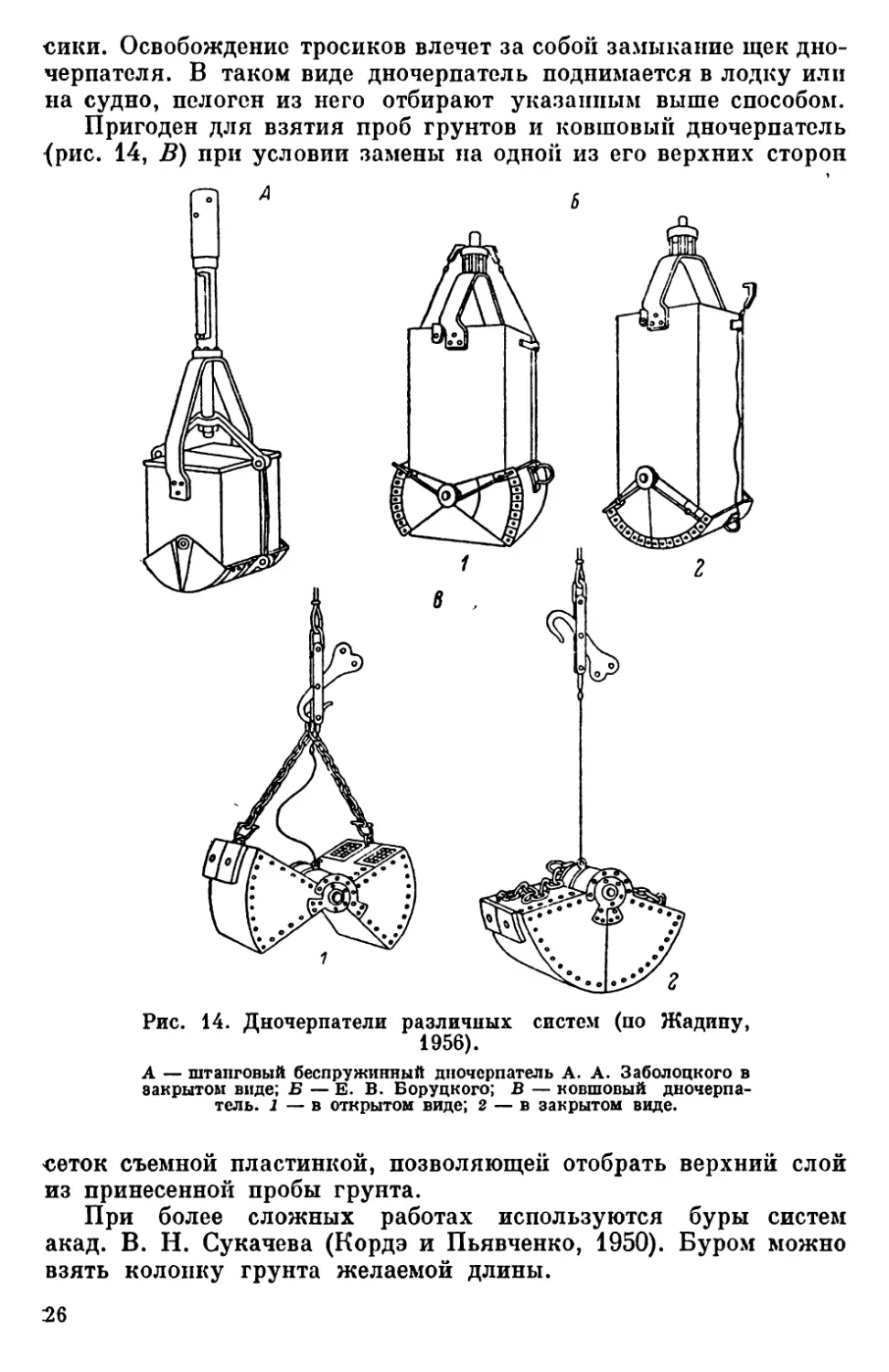
Пробы грунтов можно брать дночерпателем, который пригоден
для работ на любых глубинах и которым можно брать грунты раз-
личных плотностей. В настоящее время существует большое
количество систем дночерпателей. Для микробиологических ис-
следований пригодны только те, которые позволяют открыть
крышки дночерпателя сверху. Для микробиологических иссле-
дований должен быть взят самый верхний — активный слой
грунта, так как исследованиями показано быстрое снижение чн-
сленностп бактерий и разнообразия слагающих их групп с углу-
блением в грунт.
Может быть использован штанговый беспружинный дночер-
патель А. А. Заболоцкого (рис. 14, А), состоящий из корпуса
с открывающимися щеками внизу. В верхней части корпуса
имеются крышки, способные свободно открываться и закрываться.
Дночерпатель опускают с поднятыми щеками. Нажимом на штангу
дночерпатель врезается в дно, затем штанга поворачивается и
новым нажимом на нее щеки закрываются. Закрытый дночерпа-
тель поднимают на поверхность. Крышку дночерпателя открывают
и столовой ложкой, обожженной на пламени смоченного спир-
том ватного тампона, переносят самый поверхностный слой грунта
в стерильную стеклянную банку.
Используется и тросовый дночерпатель (для работ на мягких
грунтах), как например дночерпатель Е. В. Боруцкого (рис. 14, Б).
Дночерпатель опускается в открытом виде (7), для чего щеки
дночерпателя поднимаются вверх, а тросики надеваются на сво-
бодные концы рычажков спускного аппарата. Когда дночерпатель
погрузится в грунт, по тросу посылается посыльный груз, уда-
ряющий по пружине спускного аппарата и освобождающий тро-
25>
сики. Освобождение тросиков влечет за собой замыкание щек дно-
черпателя. В таком виде дночерпатель поднимается в лодку или
на судно, пелоген из него отбирают указанным выше способом.
Пригоден для взятия проб грунтов и ковшовый дночерпатель
{рис. 14, В) при условии замены па одной из его верхних сторон
Рис. 14. Дночерпатели различных систем (по Жадину,
1956).
А — штанговый беспружинный дночерпатель А. А. Заболоцкого в
закрытом виде; Б — Е. В. Боруцкого; В — ковшовый дночерпа-
тель. 1 — в открытом виде; 2 — в закрытом виде.
сеток съемной пластинкой, позволяющей отобрать верхний слой
из принесенной пробы грунта.
При более сложных работах используются буры систем
акад. В. Н. Сукачева (Кордэ и Пьявченко, 1950). Буром можно
взять колонку грунта желаемой длины.
26
Для взятия колонок грунтов мо-
гут быть использованы и стратометры
различных систем. Исследователь мо-
жет получить стратометром колонку
грунта значительной длины (до 1 м),
в которой видны слои донных отло-
жений, которые могут быть исследо-
ваны.
Наиболее широко в СССР приме-
няется стратометр Б. В. Перфильева
(рис. 15, Л). Прибор представляет
собой раму (7), несущую съемные
грузы (2) и трубку (3), служащую для
взятия пробы грунтов. Нагрузку при-
бора грузами можно увеличить или
уменьшить в зависимости от плот-
ности грунта и от желаемой длины
монолита. Прибор снабжен особым
курком (4), соединенным с каучуко-
вой пробкой (5), закрывающей трубку
при опускании курка. После того
как проба ила взята и прибор под-
нимается, трубку надо закрыть с
нижней стороны, пока этот конец
ее находится еще под водой. Для
этого подводят под нижний конец
трубки пробку соответствующего ди-
аметра п закрывают ею трубку. Толь-
ко после этого прибор извлекают из
воды.
Для очень плотных грунтов может
быть использована ударная модель
того же автора.
Трубки стратометров при взятии
проб для микробиологического иссле-
дования должны быть перед самым
взятием проб обожжены пламенем
тампона, намоченного в этиловом
спирте. Для этого надо иметь соот-
ветствующей длины шомпол, на ко-
нец которого и наворачивается ват-
ный тампон. По взятии пробы ее
Рис. 15. Стратометр Б. В. Перфильева (Л)
и шомпол для проталкивания грунта (Б).
Объяснения в тексте.
в
стерильную стеклянную
нельзя оставлять даже на короткое время в металлических трубках.
Немедленно по поднятии на поверхность проба грунта должна быть
переведена тем или иным способом в стеклянную посуду. Для этого
проба может быть просто пережата
трубку того же диаметра и немед-
ленно с обеих сторон закрыта сте-
рильными каучуковыми пробками.
Колонка грунта, находящаяся в сте-
клянной трубке, может быть легко
просматриваема, и в дальнейшем
трубка может быть разрезана па
намеченных горизонтах, и грунтом,
взятым из центральной части наме-
ченного горизонта, могут быть про-
изведены посевы. Надо помппть, что
каким бы образом ни разделять грун-
ты ио горизонтам,
Рис. 17. Прибор
И. В. Баранова п
И. В. Буре для
взятия проб грун-
та и придонной во-
ды (по Баранову,
1956).
Объяснения в тексте.
посевы должны
Рис. 16. Разделе-
ние пробы грунта.
Л — введение сте-
рильной трубки в
пробу; И — трубка с
отделен ной частью
пробы грунта.
производиться обязательно из центральной части колонки, а
не из частей, соприкасавшихся со стенками.
Для проталкивания грунта применяется специальным шом-
пол, деревянный пли металлический, на одном конце которого
прочно укреплена металлическая пластинка соответствующего
28
диаметра, которая и служит для проталкивания грунта. Шомпол
должен быть размечен па сантиметры и миллиметры. Эти разметки
•служат для расчета горизонтов грунта.
Грунт может быть немедленно по взятии расчленен на отдель-
ные части и одновременно переведен в стеклянную посуду (рис. 16).
Для этого стерильная стеклянная трубочка вводится в централь-
ную часть грунта (Л) и вырезает эту часть. Заполненную трубочку
закрывают с обоих концов резиновыми пробками (Б).
Приборы для одновременного взятия
проб грунтов и придонной воды. Для получе-
ния пробы грунта и воды, непосредственно соприкасающейся
с донными отложениями, предложен разными авторами ряд при-
боров. Таким является прибор И. В. Баранова п И. В. Буре (Ба-
ранов, 1956). Основные части прибора (рис. 17): цилиндр из
плексиглаза на 1 л (1) с оправой (2), спускной и закрывающий
механизм (3), крышечка, закрывающая цилиндр (4), муфта (5)
для увеличения веса прибора, насадка для взятия грунта (£),
посыльный груз. Батометр опускается с открытой крышкой, кото-
рая закрывается от удара посыльного грузика. Батометр может
быть использован без нижней части для отбора только проб
воды.
Во всех приборах этого типа отбор проб производится в сте-
клянные цилиндры или в цилиндры из плексиглаза, позволяющие
рассматривать пробы и отделять придонную воду под контролем
глаза.
ГЛАВА 2
МЕТОДЫ МИКРОСКОПИИ
В микробиологических исследованиях весьма важны качество
микроскопа и умение использовать все его возможности.
Современные микроскопы имеют сложную конструкцию; не-
прерывно ведется усовершенствование их, создаются новые, более
совершенные модели. Весьма желательно пользование новейшими
моделями. В настоящее время широко используются в лаборатор-
ной практике отечественные модели биологических микроскопов:
МБИ-3 и МБИ-6.1
ОПТИЧЕСКИЕ МИКРОСКОПЫ
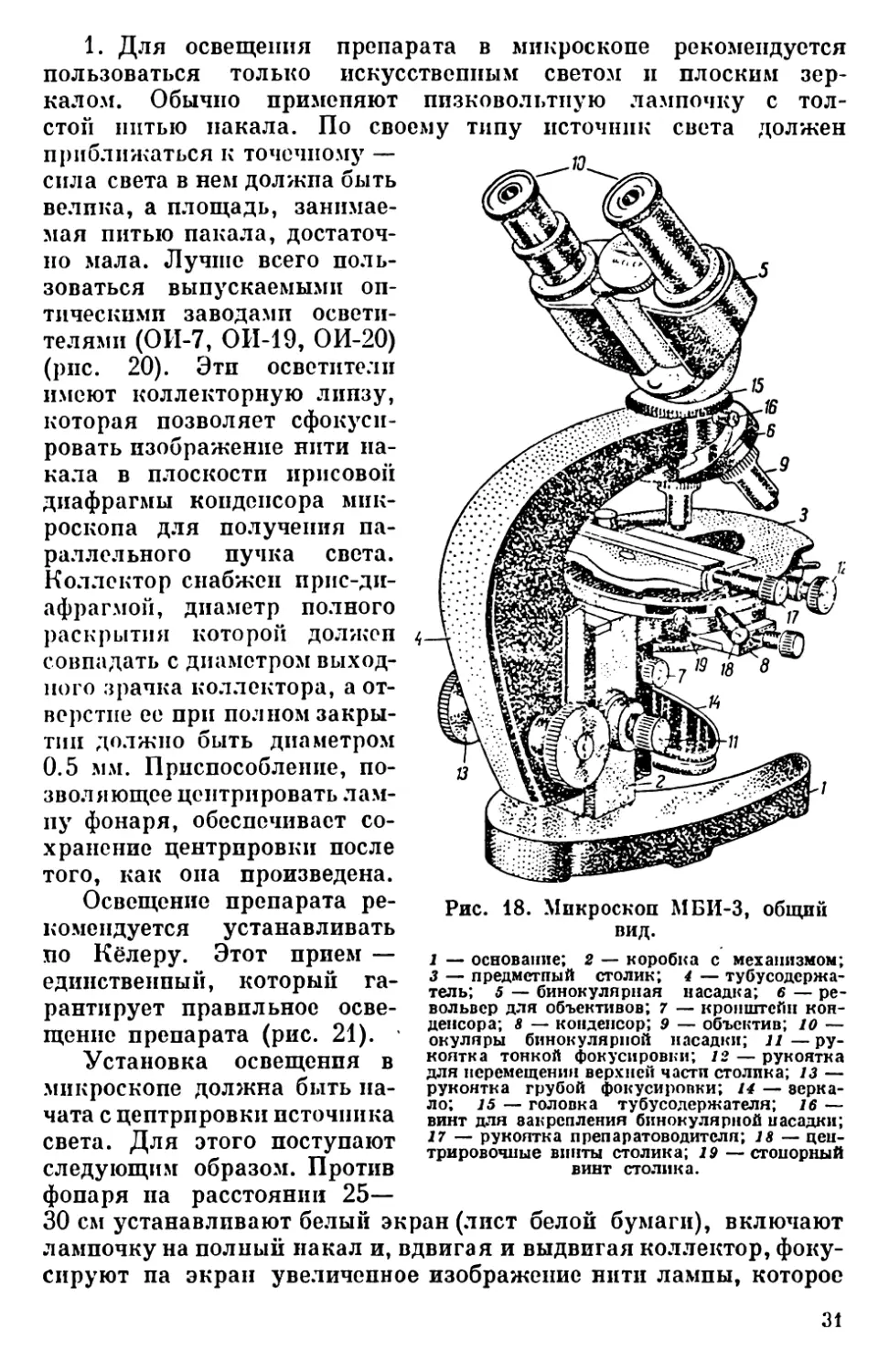
Микроскоп МБИ-3 (рис. 18) представляет собой сложную кон-
струкцию, предназначенную для исследования прозрачных объек-
тов в проходящем свете в светлом поле при прямом и косом осве-
щении. Описание его и инструкция к пользованию прилагаются
к микроскопу и потому здесь не излагаются.
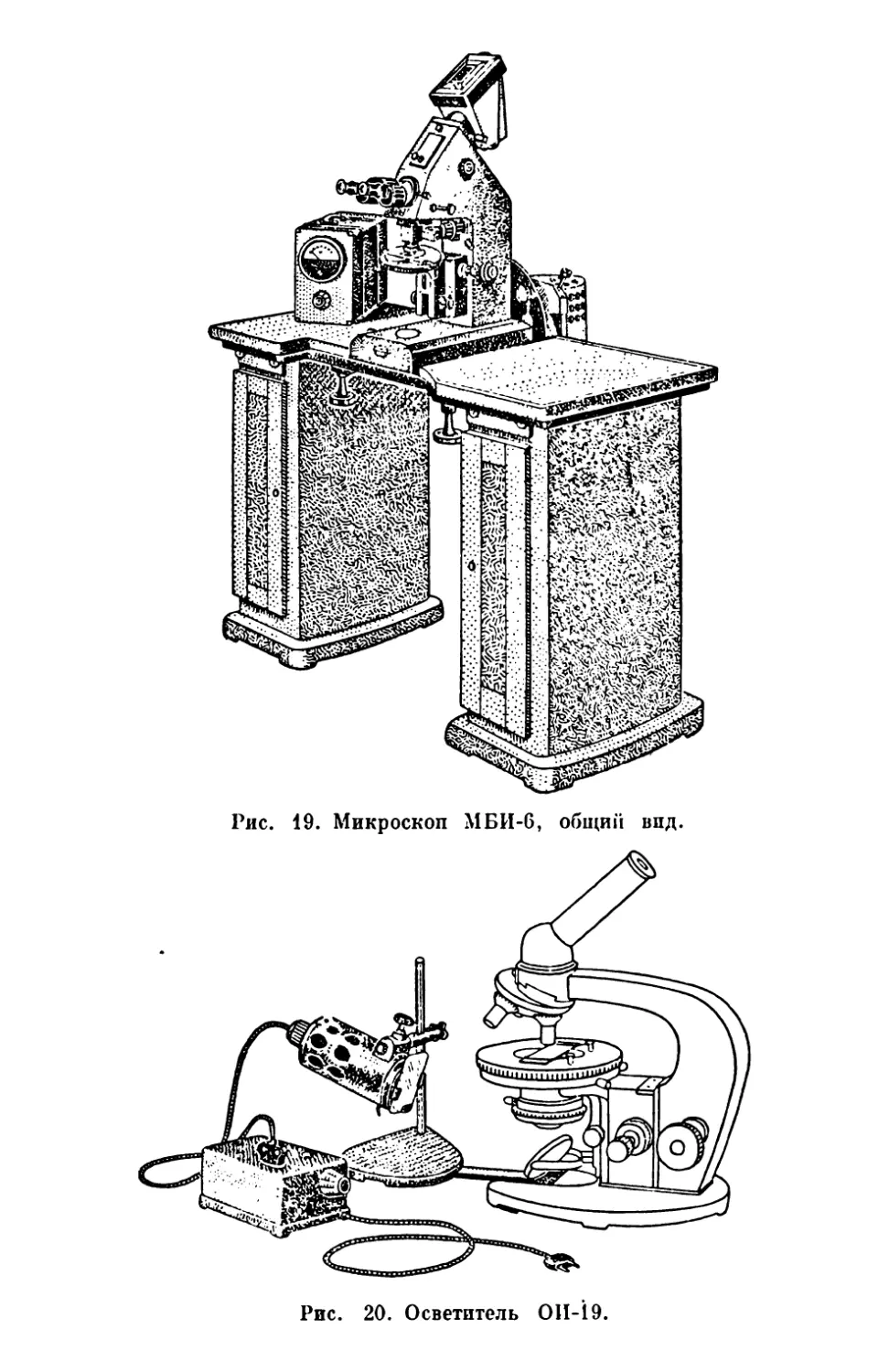
Микроскоп МБП-6 (рис. 19) является универсальным иссле-
довательским микроскопом, позволяющим производить иссле-
дование и фотографирование объектов в проходящем свете в свет-
лом и темном полях и с фазовым контрастом, а также в отражен*
ном свете в светлом и темпом полях. Микроскоп имеет большой
набор оптики. Он установлен на столе, имеющем амортизационное
устройство.
Основные правила работы с оптическими микроскопами
При работе с любым микроскопом весьма существенны следую-
щие условия: 1) правильное освещение препарата; 2) правильный
подбор оптической системы: объектив-окуляр—конденсор;
3) использование топких предметных и покровных стекол (пред-
метных не толще 1.4 мм, покровных 0.15—0.17 мм).
1 Описание общего устройства микроскопа п хода лучей в нем здесь
не приводится, как сведения, которые должны быть хорошо известны иссле-
дователю из курса общей микробиологии.
30
1. Для освещения препарата в микроскопе рекомендуется
пользоваться только искусственным светом п плоским зер-
калом. Обычно применяют низковольтную лампочку с тол-
стой питью накала. По своему типу источник света должен
приолижаться к точечному —
сила света в нем должна быть
велпка, а площадь, занимае-
мая питью пакала, достаточ-
но мала. Лучше всего поль-
зоваться выпускаемыми оп-
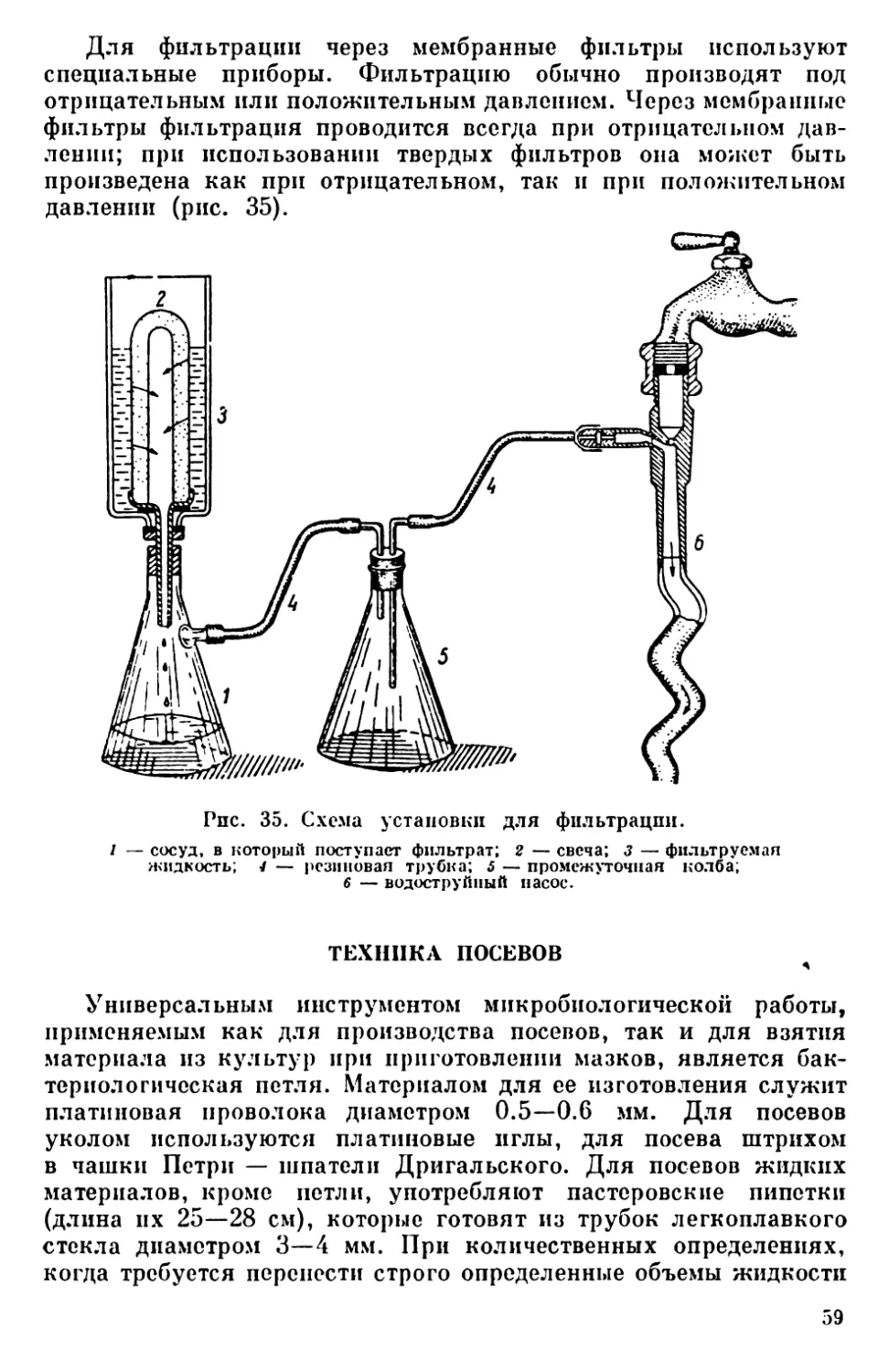
тическими заводами освети-
телями (ОИ-7, ОИ-19, ОИ-20)
(рис. 20). Этп осветители
имеют коллекторную линзу,
которая позволяет сфокуси-
ровать изображение нити на-
кала в плоскости ирисовой
диафрагмы конденсора мик-
роскопа для получения па-
раллельного пучка света.
Коллектор снабжен ирис-ди-
афрагмой, диаметр полного
раскрытия которой должен 4
совпадать с диаметром выход-
ного зрачка коллектора, а от-
верстие ее при полном закры-
тии должно быть диаметром
0.5 мм. Приспособление, по-
зволяющее центрировать лам-
пу фонаря, обеспечивает со-
хранение центрировки после
того, как опа произведена.
Освещение препарата ре-
комендуется устанавливать
по Кёлеру. Этот прием —
единственный, который га-
рантирует правпльное осве-
щение препарата (рис. 21).
Установка освещения в
микроскопе должна быть на-
чата с цептрпровки источника
света. Для этого поступают
следующим образом. Против
фонаря па расстоянии 25—
Рис. 18. Микроскоп МБИ-3, общий
вид.
1 — основание; 2 — коробка с механизмом;
3 — предметный столик; 4 — тубусодсржа-
тель; 5 — бинокулярная насадка; 6 — ре-
вольвер для объективов; 7 — кронштейн кон-
денсора; 8 — конденсор; 9 — объектив; 10 —
окуляры бинокулярной насадки; и — ру-
коятка тонкой фокусировки; 12 — рукоятка
для перемещения верхней части столика; 13 —
рукоятка грубой фокусировки; 14 — зерка-
ло; 15 — головка тубусодержателя; 16 —
винт для закрепления бинокулярной насадки;
27 — рукоятка препаратоводителя; 18 — цен-
трировочные винты столика; 19 — стопорный
винт столика.
30 см устанавливают белый экран (лист белой бумаги), включают
лампочку на полный накал и, вдвигая и выдвигая коллектор, фоку-
сируют па экран увеличенное изображение нити лампы, которое
31
Рис. 19. Микроскоп МБИ-6, общий вид.
Рис. 20. Осветитель ОП-19.
должно быть видно как широкая полоска длиной около 2 см,
окруженная равномерным голубоватым ореолом (вследствие сфе-
рической и хроматической аберрации). Равномерность ширины
ореола вокруг изображения инти является показателем пра-
вильности центрировки фонаря.
Следующим этапом является взаимная центрировка источника
света и осветительного аппарата Аббе. Для этого устанавливают
осветитель перед микроскопом на расстоянии 30—40 см, направ-
ляют пучок света фонаря на плоское зеркало микроскопа, пред-
варительно положив на
него кружок белой бумаги.
Фокусируют в центр бу-
мажного кружка увеличен-
ное изображение накален-
ной спирали лампочки.
Необходимо добиться рез-
кого изображения нити
передвижением патрона
лампы, вдвпжением или
выдвижением коллектора
фонаря.
Далее необходимо по-
лучить изображение ни-
ти накала в плоскости
полностью закрытой ирисовой апертурной диафрагмы микро-
скопа, что весьма важно, так как опа расположена точно
в плоскости переднего главного фокуса конденсора (входной
зрачок микроскопа). Сняв с зеркала кружок бумаги, направляют
с помощью зеркала свет па апертурную диафрагму, находящуюся
Рпс. 21. Схематическое изображение хода
лучей при освещении препарата по методу
Кёлера (по Пешкову, 1962).
1 — нить накала лампы; 2 — коллектор; з —
диафрагма ноли; 1 — изображение нити лампы
в плоскости апертурной диафрагмы; 5 — апертур-
ная диафрагма; б‘ — конденсор; 7 — изображение
краев диафрагмы поля в плоскости препарата.
в закрытом положении, и путем вдвижепия или выдвижения кол-
лектора осветителя добиваются получения на ней изображения
нити накала. При производстве этого для удобства наблюдения
за диафрагмой помещают на правую ножку микроскопа малень-
кое зеркальце под некоторым углом таким образом, чтобы можно
было, глядя на пего сверху, видеть отражение закрытой апертур-
ной диафрагмы.
Правильность установки освещения необходимо проверить.
Для этого открывают апертурную диафрагму (ирис-диафрагму
микроскопа) полностью. Свет лампы уменьшают до красно-жел-
того накала, помещают какой-либо препарат на столик микроскопа
и наставляют па него слабый объектив (10 X) в комбинации со
средним окуляром (10X). Слегка вращая зеркало, ищут в поле
зрения изображение линзы коллектора и находящейся при ней
диафрагмы поля. Так как объектив сфокусирован па препарате,
для фокусировки изображения коллектора в плоскости препарата
нужно или спустить кондепсор, пли слегка приподнять его. Если
освещение налажено правильно, то в поле зрения одновременно
3 А. Г. Родина
33
с препаратом должна быть видна линза коллектора, равномерно
залитая светом (она должна иметь вид равномерно освещенного
круга). Если же линза коллектора освещена лишь частично или
представляется темной, покрытой светящимися точками, то надо
слегка наклонить фонарь вокруг его горизонтальной оси и до-
биться нужного положения. Только в том случае, если глаза ис-
следователя впдят одновременно препарат и изображение поверх-
ности липзы, установка света является правильной. При сужении
диафрагмы поля ее смыкающиеся края должны выглядеть резко
очерченными. При окончательной фокусировке конденсора на
препарате изображенпе суженного отверстия диафрагмы поля
зрения должно быть окружено красной или голубой каймой и
видно достаточно резко. Тогда движением зеркала устанавливают
светящийся кружочек (величина которого ограничена степенью
раскрытия диафрагмы поля) в центр поля зрения. И только тогда
переходят к наблюдению.
М. А. Пешков (1962) при работе с малыми увеличениями реко-
мендует высокоапертурную часть конденсора микроскопа МБП-3
заменять низкоапертурным конденсором типа очкового стекла.
В таком виде конденсор имеет уменьшенную апертуру и удли-
ненный фокус. В этом случае точно совмещают оптически изобра-
жения объекта и отверстия диафрагмы ноля при полностью раскры-
той апертурной диафрагме; смотря в микроскоп, раскрывают
диафрагму поля настолько, чтобы края ее ушли за край диафрагмы
окуляра. Пользование таким конденсором особенно полезно при
микрофотографировании.
Произвольное опускание или поднятие конденсора осветитель-
ного аппарата с целью регулирования силы света является недо-
пустимым и ведет к искажению наблюдаемых в микроскопе картин.
2. Правильное применение объективов и окуляров обусловли-
вает в большой степени качество изображения в микроскопе.
Различные сочетания объективов и окуляров дают различные
увеличения. Для наблюдений над бактериями обычно поль-
зуются сильными объективами (90х) и менее сильными окуляра-
ми (7Х или 10 X). При таком подборе разрешающая способность
микроскопа резко повышена и позволяет рассматривать объекты
величиной до 0.4 мк.
3. Весьма важным условием является толщина применяемых
предметных стекол. Толстое предметное стекло при полном ис-
пользовании численной апертуры системы препятствует правиль-
ной фокусировке конденсора и резко снижает четкость микроско-
пического изображения. Следует пользоваться предметными
стеклами толщиной не более 1.4 мм. Покровпые стекла должны
быть не толще 0.15—0.17 мм, иначе невозможно применять силь-
ный короткофокусный иммерсионный объектив, рабочее расстоя-
ние которого меньше толщины неподходящего покровного стекла.
34
Специальные методы микроскопии
Микроскопия е темном поле
Наблюдения и темпом поле проводят с помощью специального
конденсора (рис. 22). Темпопольный конденсор пропускает только
высокоапертурные (очень косые) краевые лучи. Эти лучи, попа-
Рис. 23. Бумажка для
микроскопии в темпом
поле (по Архангельско-
му, из Тимакова и
Гольдфарба, 1958).
Рис. 22. Внешний вид темнополь-
ного конденсора 011-13. Внизу
справа ключ.
дая на поверхность конденсора, отражаются и концентри-
руются в его фокусе, который должен находиться в плоскости
рассматриваемого объекта. М. А. Пешков (19G2) указывает,
что любой высокоапертурный конденсор Аббе можно превра-
тить в темнопольный, развинтив его и прикрыв его централь-
ную часть (не менее 2/3) кружком черной бумаги. Диаметр бумаж-
ного кружка устанавливается эмпирически. Чтобы кружок за-
нимал между линзами центральное положение, на нем оставляют
4 выступа (рис. 23).
При наблюдении в темпом поле косые лучи, пропускаемые кон-
денсором, проходя через препарат и встречаясь с плотными час-
тицами, напрпмер клетками бактерий, огибают их, благодаря
чему на темпом поле они становятся видны (светятся). Яркость
свечения зависит от источника света и точности наводки.
II здесь лучшие источники света — точечные лампы осветителей
типа 0II-9, 011-19. Свет для темнопольных наблюдений устанав-
ливается по светлому полю. Затем конденсор Аббе заменяют
темнопольным и апертурную диафрагму фонаря раскрывают до
отказа.
3*
35
Наблюдения в темпом поле требуют применения ппзкоапертур-
ных объективов: сухих систем, гомогенной иммерсии 1/7, числен-
ная апертура которой 0.75 (Пешков, 1962).
Наблюдения в темном поле ведут при пммергпрованном кон-
денсоре: на верхнюю линзу его наносят каплю иммерсионного
масла и приподнимают конденсор до тех пор, пока масло не рас-
пространится по предметному стеклу. Далее фокусируют микро-
скоп на препарат.
Весьма важным обстоятельством является толщина препарата.
Чем толще препарат, чем больше в нем светопреломляющего ма-
териала, тем менее контрастным получается изображение.
Фазовоконтрастная микроскопия
Метод фазовых контрастов — один из способов повышения
контрастности изображения в микроскопе прозрачных в види-
мом свете микроскопических объектов, к каким должны быть
отнесены бактерии. Микроорганизмы в большинстве своем про-
зрачны в видимом свете. Пройдя через пих, свет или не ослаб-
ляется совсем, или ослабляется очень мало, и изменения, кото-
рые испытывает свет, пройдя через такие объекты, сводятся лишь
к изменению фазы светового колебания, и объекты выглядят
неконтрастными.
Метод фазовых контрастов, разработанный голландцем Цер-
нике в 1934 г., позволяет обратить эти незначительные смещения
фаз в изменения, обеспечивающие контрастность. Разработанное
устройство получило название фазовокоптрастпого (рис. 24).
Фазовоконтрастное устройство (рис. 25) выпускается нашими
оптическими заводами и состоит из набора фазовых объективов (7),
в каждом из которых имеется кольцеобразная фазовая пластинка,
конденсора с вращающимся диском (2), имеющим соответствую-
щие объективам кольцевые диафрагмы, с центрирующими вин-
тами, совмещающими изображение диафрагмы конденсора с фа-
зовой пластинкой объектива, и вспомогательного микроскопа (3),
с помощью которого контролируется совмещение кольцевой
диафрагмы и фазовой пластинки.
При работе с фазовоконтрастным устройством чрезвычайно
важно хорошее освещепие препарата, поэтому должно быть обра-
щено внимание на установку освещения — оно должно быть осу-
ществлено по Кёлеру.
Порядок работы с фазовоконтрастным устройством сводится
к следующему.
1. В микроскопе заменяют конденсор и объективы на фазо-
вые. Диск конденсора должен находиться в положении 0, что
соответствует обычному светлопольному конденсору.
2. Располагают препарат па столике микроскопа и при малом
увеличении (10 X) устанавливают освещение по Кёлеру.
36
3. Нулевую диафрагму конденсора заменяют диафрагмой
объектива малого увеличения (10 X) (в круглом окошечке кон-
денсора должна появиться цифра 10),
1’ис. 24. Схема
фазово-
контрастного
микроскопа.
1 — окуляр; ? —
плоскость изобра-
жения; з — фазо-
вое кольцо; 4 —
объектив; 5 —
предмет; 6 — кон-
денсор; 7 — диа-
фрагма.
наставляют объектив на препарат и ус-
танавливают фокусировку.
4. Заменяют окуляр вспомогательным
микроскопом. Поднятием тубуса вспомо-
Рис. 25. Устройство для наблюде-
ния методом фазовых контрастов.
Объяснения в тексте.
гательного микроскопа добиваются четкой
фокусировки на выходном зрачке микро-
скопа, представляющемся в виде светлого
круга, внутри которого расположена кон-
цептрично более темная кольцевидная фа-
зовая пластинка.
5. Поворачивают диск конденсора таким образом, чтобы в его
окошечке появилась цифра, соответствующая объективу, при
котором будет проводиться исследование. Устанавливают этот
объектив. С помощью центрировочных винтов совмещают коль-
цевидную диафрагму с фазовой пластинкой так, чтобы последняя
точно вписалась в светлое кольцо диафрагмы.
6. Снимают вспомогательный микроскоп, вставляют окуляр
и ведут микроскопирование.
При каждой смене объектива необходимо поставить соответ-
ствующую кольцевую диафрагму и с помощью вспомогательного
37
микроскопа проверить точность совмещения кольцевой диафрагмы
конденсора с фазовой пластинкой.
Фазовый контраст облегчает проведение прямого счета микро-
организмов благодаря более четкому, выпуклому изображению
микроорганизмов.
Лноптральная микроскопия
Рис. 2G. Совмещение дифракци-
онного кольца объектива с
кольцом диафрагмы.
А — кольца не совмещены: /;
кольца совмещены.
Аноптралыюе устройство, разработанное Вильска (Wilska,
1954), дает более контрастное изображение очень тонких объектов,
чем фазовоконтрастное. При наблюдении с анонтральпым устрой-
ством очертания объектов резкие,
объект приобретает объемность, де-
тали его выявляются во всех оттен-
ках — от светло-коричневого до поч-
ти белого цветов. Чем сильнее от-
личаются но оптической плотности
детали объекта от среды, тем светлее
их изображение.
По существу аноптралыюе (фазо-
вотемнопольное) устройство — разно-
видпость отрицательного фазовокон-
трастного. Отечественной промыш-
ленностью оно выпускается под мар-
кой МФА-2.
Основная часть апоптрального
устройства — специальные ахрома-
тические фазово-темноиольные объективы и специальный кон-
денсор с кольцевыми диафрагмами, установленными на ре-
вольвере. Отличие фазово-темпопольных объективов заключается
в том, что они имеют на одной из поверхностей линз дифракцион-
ное кольцо определенных размеров. При фазово-темпопольных
объективах используются обычные окуляры Гюйгенса.
Для настройки устройства служит вспомогательный микро-
скоп, который для этого вставляют в тубус вместо окуляра.
При сухих объективах 20 X, 45 X фазово-темнопольпое кон-
трастирование производится как при обычном фазовом контрасте.
Весьма важно установить освещение по Кёлеру.
При объективах 70x1.23 и 90x1.25 настройку ведут следую-
щим образом:
1) револьвер конденсора устанавливают на 0;
2) ввинчивают объектив и вводят его в препарат при полностью
закрытой апертурной диафрагме;
3) открывают полностью ирисовую диафрагму конденсора;
4) вставляют вместо окуляра вспомогательный микроскоп;
перемещением окуляра вспомогательного микроскопа фокусируют
38
ого на дифракционное кольцо объектива (при этом нельзя сбивать
фокусировку микроскопа);
5) поворотом револьвера конденсора включают световую диа-
фрагму, соответствующую объективу; во вспомогательном микро-
скопе должно быть видно, помимо дифракционного кольца объек-
тива, светлое кольцо диафрагмы (рпс. 26, Л);
6) центр»ровочнымп винтами конденсора следует совместить
светлое кольцо с темным (рпс. 26, -Б);
7) заменяют вспомогательный микроскоп окуляром.
При работе с объективом 70x1.23 (водпая иммерсия) на фрон-
тальную линзу конденсора следует предварительно нанести
каплю воды, чтобы она покрыла всю линзу, и, подняв конденсор
до соприкосновения с препаратом, нанести каплю воды на фрон-
тальную линзу объектива и сфокусировать микроскоп на резкость
изображения.
При работе с объективом 90x1.25 (масляная иммерсия) на
конденсор и препарат наносят каплю иммерсионного масла.
Люминесцентная микроскопия
Люминесцентная микроскопия — один из весьма перспектив-
ных современных методов исследования. В люминесцентном микро-
скопе многие микроструктуры, неразличимые в обычном микро-
скопе, делаются видимыми и ясно различимыми или благодаря
их природной флуоресценции, пли в итоге воздействия флуоро-
хромов, связывающихся с определенными клеточными компонен-
тами и тем самым сообщающих мм способность люмииесцировать.
Люминесцентная микроскопия позволяет обнаруживать даже
малые количества микроорганизмов в среде благодаря яркому,
контрастному их свечению, выявлять их расположение, а во мно-
гих случаях и их физиологическое состояние.
Люминесценцией принято называть свечение веществ под воз-
действием различных видов энергии. Люминесценция возникает
при преобразовании в свет энергии, поглощенной атомами, моле-
кулами или ионами различных веществ, способных к люминес-
ценции. Частицы люмипесцирующего вещества, поглотив энер-
гию, приходят в особое возбужденное состояние, которое продол-
жается некоторое, обычно незначительное время и заканчивается
переходом к более ппзкому энергетическому уровню. Это возвра-
щение в исходное, нормальное состояние сопровождается отдачей
избытка энергии в виде света — люминесценцией. Необходимую
для возбуждения свечения энергию частицам способного к лю-
минесценции вещества можно сообщить разными путями: потоком
световых лучей, ударами электронов, лучами Рентгена, радио-
активным излучением и др.
Наиболее простым способом возбуждения люминесценции
39
является освещение люминесцирующего вещества ультрафиоле-
товыми лучами определенной длины волны или коротковолновыми
лучами (сине-фиолетовыми видимого света). Ниже приводится
спектральный состав света:
Невидимый свет, ультрафио-
летовый (120—380 ммк).
Видимый свет (380—750 ммк).
Дальний ультрафиолет (120—
200 ммк).
Средний ультрафиолет (200—
300 ммк).
Ближний ультрафиолет (300—
380 ммк).
Фиолетовый (380—430 ммк*).
Синий (430—460 ммк).
Голубой (460—500 ммк).
Зеленый (500—550 ммк).
Желтый (550—600 ммк).
Оранжевый (600—660 ммк).
Красный (660—750 ммк).
Невидимы!! свет, инфракрас-
ный (750—2000 ммк).
В современном люминесцентном микроскопе свечение препарата
возбуждается или ближним ультрафиолетом, или лучами сине-
фиолетовой части спектра (с длиной волны 380—430 ммк).
В зависимости от своей природы освещаемое вещество начинает
испускать видимый свет различного цвета. Обычно при освещении
лучами вещество, поглотившее свет, преобразует получаемое из-
лучение одной длины волны в излучение другой длины волны,
обычно большей.
В зависимости от длительности послесвечения различают
флуоресценцию и фосфоресценцию. Если длительность после-
свечения составляет от 10~° до 10~7 сек., то свечение называют
флуоресценцией, если она больше, то фосфоресценцией.
При люминесцентной микроскопии используется флуоресцен-
ция и один из се видов — фотолюминесценция.
При той краткости послесвечения, какая указана выше, изо-
бражение люминесцирующего препарата в люминесцентном микро-
скопе наблюдается только во время его облучения возбуждающим
светом. С прекращением облучения препарат становится невиди-
мым. Таким путем основными в люминесцентном микроскопе пред-
ставляются явления флуоресценции.
В зависимости от природы возбуждающих люминесценцию
лучей различают: 1) люминесцентную микроскопию в ближнем
ультрафиолете и 2) люминесцентную микроскопию в видимом
свете.
Первый метод люминесцентной микроскопии применяется
преимущественно при изучении естественной, так называемой
первичной флуоресценции биологических объектов.
40
Второй метод — люминесцентная микроскопия в видимом
свете — имеет наиболее широкое применение в микробиологиче-
ских исследованиях и практике. Препарат, облучаемый синими
и фиолетовыми лучами видимой части спектра, излучает свет.
Возбуждающие люминесценцию лучи поглощаются желтым све-
тофильтром, надеваемым па окуляр. В итоге создается темный
фон, на котором ярко люмииесцируют проходящими через желтый
светофильтр лучами изучаемые объекты, что обеспечивает высокую
контрастность изображения.
Люминесцентная микроскопия в видимом свете используется
для наблюдения вторичной, т. е. привнесенной извне люминесцен-
ции препаратов, обработанных флуоресцирующими красителями —
флуорохромами.
Первичным свечением обладают клетки растений и водорослей
благодаря наличию хлорофилла. Живые водоросли люминесцп-
руют ярким кроваво-красным светом. Светятся некоторые мине-
ралы. Многие частицы грунтов обладают хотя и неяркой, но до-
статочно отчетливо выраженной флуоресценцией. Из микроорга-
низмов собственной, отчетливо выраженной люминесценцией
обладают только немногие. Большинство микроорганизмов све-
тится слабо. Предложен метод (Repetigny, Sonea et Frappier,
19G1) установления интенсивности свечения микроорганизмов.
Авторы метода полагают, что различие в свечении — его цвете,
характере и интенсивности — может служить для целей класси-
фикации бактерий и идентификации отдельных видов.
Большое значение при исследовании микроорганизмов имеет
вторичная (или наведенная) люминесценция. Живые структуры,
не обладающие собственной люминесценцией, превращаются
в люминесцирующие при обработке флуорохромами, связывае-
мыми белками и сообщающими им характерную флуоресценцию.
При исследовании люминесценции следует иметь в виду, что
не вся поглощенная энергия излучается в виде энергии люминес-
ценции. Выход люминесценции (отношение энергии излучения
к энергии поглощенного света) зависит как от самого люминес-
цпрующего вещества, так и от различных внешних условий: тем-
пературы, pH растворителя, концентрации вещества и примесей.
Поэтому при люминесцентной микроскопии следует принимать
во внимание все условия.
Аппаратура. Люминесцентная микроскопия осущест-
вляется или с помощью специального микроскопа или установки,
частями которой являются микроскоп, источник света и система
светофильтров, задерживающих лучи с длиной волны, большей,
чем ультрафиолетовые или коротковолновые лучи видимого света.
Так как большинство используемых желтых светофильтров про-
пускает красный свет и инфракрасные лучи, то на пути возбуждаю-
щих лучей ставят дополнительный фильтр, который поглощает
лучи длинных волн. Обычно используются синие стеклянные
фильтры, содержащие медный купорос. Могут быть использованы
и фильтры, содержащие медный купорос в растворе.
На пути излучаемого источником света сильного светового
пучка до фильтров должна быть поставлена кювета, наполненная
дистиллированной водой, для защиты синего светофильтра от
сильного нагревания.
Наиболее удобен для микробиологических исследований вы-
пускаемый отечественной промышленностью люминесцентный
Рис. 27. Люминесцентный микроскоп МЛ-2.
1 — основание микроскопа; 2 — предметный столик; з — рукоятка для переключения
свстодслитслыюй пластинки и кольцевого зеркала; 4 — кронштейн с конденсором; 5 —
диск для переменного увеличения; 6 — рукоятка полевой диафрагмы; 7 — гнездо свето-
фильтра; 8 — винты для центрировки лампы; 9 — рукоятка перемещения коллектора;
20 — рукоятка ирисовой полевой диафрагмы; 11 — светофильтр; 12 — электропульт
ПРЛ-5.
микроскоп — МЛ-2 (рис. 27), предназначенный для изучения
микробиологических и других препаратов в свете люминесценции,
возбуждаемой сине-фиолетовой частью спектра и ультрафиоле-
товыми лучами с длиной волны до 360 ммк. Этот микроскоп поз-
воляет рассматривать препараты при освещении их сверху через
объектив в падающем свете, что дает возможность установить на-
личие микроорганизмов на непрозрачных объектах. Этот способ
освещения создает ряд преимуществ, светофильтры здесь ис-
42
пользуются для защиты от относительно небольшой части возбу-
ждающего излучения. Микроскоп позволяет также вести рас-
смотрение препаратов в проходящем свете, когда возбуждающие
люминесценцию лучи направляются на препарат снизу — через
копденсор микроскопа. При этом может быть использовано и
фазовокоптрастное устройство. Микроскоп снабжен фотоаппара-
том, позволяющим производить фотографирование препаратов.
Люминесцентная микроскопия может проводиться в обычном
микроскопе при использовании опак-иллюминатора ОИ-17
Рис. 28. Опак-иллюмпнатор 011-17.
1 — опак-иллюминатор; 2 — коническая трубка;
з — осветитель.
(рис. 28), позволяющего вести исследование в падающем свете,
и осветителя. Люминесцентный опак-иллюминатор вставляется
в микроскоп между тубусом и револьвером. В микробиологических
исследованиях при использовании опак-иллюминатора необхо-
дим мощный источник невидимого ультрафиолетового и видимого
сипо-фиолетового излучения — лампы ДРШ-250 (выпускаемый
при опак-иллюминаторс осветитель ОИ-18 с лампой СВДШ-120
не дает достаточной для микробиологических исследований све-
товой мощности). Используемые в настоящее время ртутно-квар-
цевые лампы ДРШ-250 представляют собой газово-разрядный
источник света с разрядом в парах ртути. Для их зажигания
необходимо более высокое напряжение, чем для устойчивого
горения. Нормальный режим лампы устанавливается через не-
которое время после ее включения.
В некоторых случаях можно работать с микроскопом при осве-
щении объектов через зеркало микроскопа. Для этого могут
43
быть использованы обычные осветители типа OII-7 или ОП-9
при более сильных источниках света, лучше осветитель ОП-18
с ртутпо-кварцевой лампой. Для выделения сине-фиолетовой части
спектра с длиной волны от 380 до 430 ммк применяют стеклянные
светофильтры, надеваемые на окуляры, и стеклянные синие
светофильтры. При отсутствии стеклянных синих светофильтров
может быть использован жидкий светофильтр, который готовят
по прописи М. Н. Мейселя: к насыщенному раствору химически
чистого медного купороса в дистиллированной воде прибавляют
постепенно раствор крепкого аммиака. При этом выпадает в оса-
док двойная серпоаммонийная соль. Раствор аммиака прибавляют
и дальше до растворения этого осадка. Таким путем получают ос-
новной раствор. Затем раствор разбавляют дистиллированной
водой в зависимости от толщины кюветы, которая будет ис-
пользована. Раствор должен быть совершенно прозрачным. При
совмещении жидкого светофильтре! со стеклянным, желтым, на-
деваемым на окуляр (при помещении синего фильтра против яр-
кого света) должно быть полное или почти полное затемнение.
Подгонка концентрации жидкого светофильтра достигается или
разбавлением его дистиллированной водой, или добавлением ос-
новного раствора.
В люминесцентной микроскопии при всех методах освещения
наиболее целесообразно исиользовать объективы с просветленной
оптикой. Применение объективов с большой апертурой создает
более оптимальные условия для освещенности препарата при на-
блюдении в падающем свете. Окуляры Гюйгеиса имеют преиму-
щество перед компенсационными. Наибольшая яркость изобра-
жения получается при более сильных окулярах в комбинации
с более слабыми объективами. Этой же цели способствует исполь-
зование монокулярного микроскопа с вертикальным тубусом.
Имеющее место недостаточное свечение микроскопических пре-
паратов в целом ряде случаев делает невозможным использование
бинокулярных насадок.
При работе с иммерсионными объективами в люминесцентном
микроскопе должно быть использовано нефлуоресцирующее им-
мерсионное масло.1 Обычно употребляемое масло и его заменители
не годятся ввиду собственной флуоресценции. Предложен ряд
заменителей нефлуореецпрующего масла — анизол (метилфепило-
вый эфир), диметил фталат (днметпловый эфир ортофталиевой
кислоты), минеральное масло СО-ПО (Михайлов и Дьяков, 1961).
Могут быть использованы некоторые сорта очищенного глицерина,,
вазелинового и жидкого парафинового масел. Предложено при-
бавлять гасители флуоресценции в обычное иммерсионное масло.
1 Нсфлуоресцирующее масло, выпускаемое в ГДР, имеет показатели
преломления 1.520 (для просмотра препаратов без покровного стекла) ц
1.515 (для просмотров с покровным стеклом).
44
В качестве гасителя используют нитробензол (от 2 до 10 капель
на 1 г масла).
Ф л у о р о х р о м ы. Предложено большое количество орга-
нических соединений и красящих веществ для флуорохромирова-
ния биологических препаратов. Наиболее широко используются
акридиновая группа (акридин оранжевый, акридин желтый,
корпфосфин, трипофлавин) и тиазоловая группа — примулин.
Флуорохромы применяются в водных растворах (на дистилли-
рованной воде). По их способности диссоциировать в водных рас-
творах они подразделяются на три основные группы:
1) щелочные флуорохромы: акридин оранжевый, аурамип 00,
акридин желтый, корпфосфин, аурофосфпн, берберии-сульфат,
нейтральрот, трипофлавин;
2) нейтральные: родамин В; \
3) кислые: примулин, флуоресцин, уранин, эозин, эритрозин.
Концентрация флуорохрома имеет огромное значение: может
меняться цвет люминесценции в зависимости от концентрации.
Флуорохромы обычно используются в низких концентрациях
(1 : 500-1 : 100 000).
Многие флуорохромы меняют оттенки цвета свечения в за-
висимости от величины pH объекта. Различные компоненты
микробных клеток по-разному связывают и адсорбируют флуоро-
хромы, следствием чего является различие в цвете и яркости
свечения.
Возможна одновременная или последовательная обработка
препарата несколькими флуорохромами.
В тех случаях, когда стремятся получить особо контрастное
изображение отдельных частей клетки, прибегают к использова-
нию специальных тушителей. Такими являются метиленовая си-
няя, анилиновая синяя, фуксин, конго красный, слабые растворы
йода.
Растворы флуорохромов сохраняются в течение многих меся-
цев без изменения при хранении их в темных склянках и про-
хладном месте. Можно прибавлять к растворам флуорохромов
фенол до конечной концентрации 3?о.
Обработка препаратов при флуорохромировапии исследуемого
материала чрезвычайно проста. Небольшое количество жидкости
или грунта, содержащее микроорганизмы, помещают на предмет-
ное стекло в каплю заранее нанесенного флуорохрома. Препарат
накрывают покровным стеклом и через 0.5—1 мин. рассматривают
в микроскоп.
Могут быть обработаны флуорохромами и фиксированные пре-
параты. Фиксация производится различными способами: нагре-
ванием, спиртом, 10°6-м водным раствором формалина, смесью
Никифорова (этиловый спирт и эфир в отношении 1:1) и др.
Не годятся для фиксации растворы, содержащие вещества, туша-
щие флуоресценцию (например, сулема, осмиевая кислота и др.).
45
После фиксации препараты высушивают, наносят каплю флуо-
рохрома и держат 1 — 10 мин. Препарат отмывают дистилли-
рованной водой для удаления избытка флуорохрома, затем
высушивают на воздухе. Фиксированные препараты должны рас-
сматриваться в нелюминесцирующей среде, например в воде,
физиологическом растворе поваренной соли, специальной среде,
имеющей следующий состав: дистиллированная вода — 10 мл,
гуммиарабик — 10 г, глицерин — 5 мл, хлоралгидрат — 1 г.
Люминесцентный а н а л и з. То обстоятельство, что
люминесценция является характерным признаком излучающего
вещества, позволяет определить это ве-
щество ио характеру его излучения. Ис-
следование различных объектов и оп-
ределение состава вещества при изучении
различий в его люминесценции называ-
ется люминесцентным анализом.
Имеется несколько видов люминесцент-
ного анализа. Ценностью его является
весьма высокая чувствительность. Люми-
несцентный анализ может быть использо-
ван для определения наличия и характера
первичного свечения культур. При люми-
несцентном анализе подвергают облуче-
нию возбуждающими лучами небольшие
количества исследуемого вещества.
Возбуждение свечения при люминес-
центном анализе может быть произведено
различными способами. Чаще всего при-
меняют возбуждение ультрафиолетовыми
лучами. Лучи пропускают через свето-
фильтры — стекло Вуда, черное стекло
и др. Светофильтр должен задерживать все видимые лучи и
хорошо пропускать ультрафиолетовые лучи с длиной волны
300—380 ммк.
Для предохранения светофильтра от нагревания между ним
и лампой должен быть помещен тепловой фильтр.
На рис. 29 приведена схема установки для люминесцентного
анализа. Установка состоит из ртутной лампы, находящейся
в кожухе, и светофильтра, расположенного под лампой. Свето-
фильтр пропускает в пижпюю часть прибора только ультрафиоле-
товые лучи, под потоком которых внизу располагается культура
или препарат. Его люминесценция может наблюдаться или не-
посредственно глазом, или через микроскоп. Для анализа приме-
няется и люминесцентный микроскоп.
В гидромикробиологии люминесцентная микроскопия может
быть использована для выяснения количества живых и мертвых
клеток микроорганизмов (стр. 315), выяснения первичной флуо-
46
Рпс. 29. Схема установ-
ки для люминесцентного
анализа (по Левшину,
1956).
/ — ртутная лампа; 2 —
светофильтр; з — исследуе-
мый препарат; 4 — камера.
ресценции микроорганизмов, выяс-
нения спорообразования, для уско-
ренной диагностики кишечной палоч-
ки (стр. 321), выяснения характера
распределения микроорганизмов в
грунтах.1 Люминесцентный метод мо-
жет быть полезен при определении
вида азотобактера, прямого выявле-
ния его в грунтах.
Для выяснения наличия первич-
ной флуоресценции у микроорганиз-
мов может быть использован метод
Репетиньи, Сонеа п Фраппье (Repe-
tigny, Sonea et Frappier, 1961). Вод-
ные суспензии микроорганизмов, от-
мытые от следов среды, центрифуги-
руют, затем разбавляют в 3 раза
водой, 0.05 мл этой суспензии наби-
рают в капилляр длиной 65 мм с внут-
ренним диаметром 1 мм и просматри-
вают под микроскопом при объекти-
ве 10 среднюю часть капилляра. Что-
бы выявить влияние pH на интен-
сивность флуоресценции, вносят в
суспензию каплю буферного раство-
ра М/15 монофосфата калия. Интен-
сивность свечения устанавливают
путем сравнения с интенсивностью
свечения флуорохромов определен-
ной концентрации. Характер люми-
несценции различен у разных видов.
Отличается цвет люминесценции
культур при микроскопическом ис-
следовании.
ЭЛЕКТРОННЫЙ МИКРОСКОП
Электронная микроскопия позво-
ляет получать изображение частиц
с увеличением до 100 000 раз, т. е.
частиц, уже неразличимых в обыч-
ных микроскопах. Осуществляется
это микроскопирование при псполь-
1 Установление типа распределения
микроорганизмов в грунтах производится
при использовании флуорохромов акри-
дина оранжевого п корифосфина.
Рис. 30. Электронный микро-
скоп (схема).
1 — электрон»ан пушка; 2 — кон-
денсорпан линза; з — камера объ-
екта; 4 — люк для смены образцов;
5 — объективная линза; 6 — наблю-
дение промежуточного изображе-
ния; 7 — проекционная линза; 8—
световой микроскоп; 9 — люк для
выемки фотопластинок; 1и — на-
блюдение конечной картины; 11 —
вакуумное распределительное
устройство; 12 — насос.
47
зованип вместо источника света потока движущихся электронов,
излучаемых специальным источником (электронной пушкой). По-
ток электронов (электронный луч) при движении в вакууме
распространяется, как и световой луч, прямолинейно.
Существует несколько типов электронных микроскопов, раз-
личающихся по способу наблюдения объектов (подробно: Спивак,
1954).
При биологических исследованиях наиболее часто приме-
няются микроскопы просвечивающего типа, наблюдение объектов
в которых происходит в проходящем потоке электронов.
В микроскопе этого типа пучок электронов пронизывает
объект. Первое электронное изображение объекта возникает
в объективной электромагнитной линзе, куда после прохождения
объекта попадает сфокусированный копдепсорной линзой пучок
электронов (рпс. 30). Изображение появляется па находящемся
в этой плоскости флуоресцирующем экране в результате его све-
чения под действием электронов. Для уточнения установки пре-
парата промежуточное изображение может быть наблюдаемо через
смотровое стекло. С промежуточного экрана электроны проходят
через проекционную линзу, увеличивающую изображение и
дающую его уже в другой плоскости. В этой плоскости на вто-
ром флуоресцирующем экране возникает конечное изображение,
которое наблюдают через смотровое окно. Дополнительные линзы
позволяют получать еще более высокие увеличения.
Полученное изображение можно фотографировать, для чего
под экраном находится фотокамера, снабженная устройством
для смены пластинок. Снимок, полученный в электронном микро-
скопе, может быть еще увеличен в 4—5 раз обычным, принятым
в фотографии методом. С помощью электронного микроскопа можно
получить точные данные о размерах и форме изучаемого объекта,
выявить мельчайшие детали в его строении.
Электронная микроскопия требует специально приготовленных
препаратов. При исследовании бактерий определяющим успех
условием является чистота препарата, очистка субстратов от
примесей, которые при высушивании препаратов могут искажать
микроскопическую картину. Разработаны методы изготовления
электронномикроскопических препаратов (Кушнир, 1958; Пехов,
1962а, 19626), приготовления подложек и нанесения материала
на них.
Основное требование — толщина объекта вместе с подложкой
не должна превышать 0.25 ммк, так как иначе произойдет заметная
потеря энергии электронов.
В последнее время с помощью электронпого микроскопа
открыт в почвах и грунтах новый мир микроорганизмов свое-
образной формы, размерами менее 1 мк (Воларович и Тропин,
1963).
ГЛАВА 3
МЕТОДЫ КУЛЬТИВИРОВАНИЯ
МИКРООРГАНИЗМОВ
Для изучения микроорганизмов используют методы культи-
вирования на различных питательных средах. Питательные среды
для выращиваемых микроорганизмов не только источник пищи
и энергии, по и среда обитания. Поступление питательных ве-
ществ в клетки представляет собой весьма сложный процесс:
одни вещества (белки, жиры, полисахариды) поступают в клетку
только в водорастворимом состоянии, для чего они предварительно
должны быть воздействием эктоферментов клеток переведены
в такое состояние, другие (например, вещества, растворимые
в липоидах) поступают через липоидную фракцию оболочек и не
нуждаются в предварительном растворении. Поступление мине-
ральных соединений в клетку зависит и от степени диссоциации
их на ионы, и от pH окружающей среды, и от заряда коллоидов
цитоплазматической мембраны, и др. Поэтому состав среды, ее
активная реакция, условия аэрации — окислительно-восстано-
вительный потенциал среды, осмотическое давление и другие
факторы — имеют огромное значение для развития культиви-
руемых микроорганизмов; они определяют возможность этого
развития.
Автотрофные микроорганизмы требуют минеральных сред
строго определенного состава, в которых минеральные соли взяты
в точно установленных количествах. В качестве источника угле-
рода автотрофные бактерии используют только углекислоту. Ге-
теротрофные микроорганизмы нуждаются в органических соеди-
нениях, одни в простых, другие в сложных. В качестве источника
углерода гетеротрофные бактерии используют органические ве-
щества различной химической структуры, но для многих из них
также нужна углекислота для осуществления сложных реакций
обмена.
Различны требования микроорганизмов к источникам азота:
одни могут получать необходимый им для построения белков их
клеток азот только из сложных белковых веществ, другие пз про-
стых минеральных соединений, некоторые могут усваивать моле-
кулярный азот атмосферы.
А. Г. Родина
49
Наряду с органогенами бактериям нужны зольные элементы:
сера, фосфор, калий, магний и др. Для большинства микроорга-
низмов наилучший источник серы — окисленные ее формы:
сернокислые соли; многие микробы используют серу из сложных
органических соединений; имеются группы микроорганизмов,
усваивающие восстановленные соединения серы (серобактерии)
и элементарную серу (тиобактерии). Наилучшим источником
фосфора для большинства микроорганизмов являются окислен-
ные соединения фосфора, а именно солп ортофосфорной кислоты,
некоторые микроорганизмы используют и органические фосфор-
содержащие соединения. В качестве источника калия микроор-
ганизмы лучше всего используют солп фосфорной кислоты (одно-
и двузамещепные), поэтому в большинство синтетических сред
входят эти соли; как источник магния — различные минеральные
соли (главным образом серпокислые).
Кроме основных зольных элементов, для нормального развития
большинству микроорганизмов нужны в очень незначительных
количествах микроэлементы: молибден, бор, цинк, кобальт,
марганец, алюминий, медь и др., которые участвуют в синтезе
белков ферментов; кроме того, микроэлементы играют огромную
роль в активизации ферментных систем. Поэтому введение в среду
в очень малых количествах растворов микроэлементов часто бы-
вает совершенно необходимо.
Многие гетеротрофные организмы не могут самостоятельно
синтезировать некоторые компоненты, входящие в состав прото-
плазмы их клеток,— они должны получать их в готовом виде;
это относится особенно к витаминам и другим дополнительным фак-
торам роста, нужным микробам для синтеза различных ферментов.
Поэтому в многие питательные среды вводят дрожжевые автолп-
заты (дрожжи богаты витаминами) и экстракты или отдельные
витамины, или набор их.
С. II. Виноградским введен в практику микробиологии метод
накопительных, или элективных, сред, которые удовлетворяют
требованиям определенной физиологической группы микроорга-
низмов и непригодны или малопригодны для других. В микро-
биологии разработано и используется большое количество элек-
тивных сред, рецепты которых излагаются при рассмотрении
соответствующей физиологической группы.
Некоторые среды являются широко используемыми, их можно
назвать обычными в микробиологической работе, рецепты их при-
готовления излагаются ниже. К таким относятся мясо-пептонные
среды. Среди обычных сред используется ряд естественных суб-
стратов: картофель, морковь, молоко, белок куриного яйца, ку-
куруза, различные растительные отвары. Чаще используются
искусственные среды, содержащие или только минеральные соли,
или сложные органические соединения в комбинации с минераль-
ными солями.
50
Применяют питательные среды различной консистенции: жид-
кие, плотные (твердые) и полужидкие. Плотные питательные среды
готовят из жидких, добавляя агар-агар в количестве от 1.5 до
2% или желатину в количестве от 10 до 15?6 (реже 20%). Полу-
жидкие среды готовят добавлением агар-агара — 0.1—0.2%. В ка-
честве плотных сред широко используются гелевые пластинки,
введенные в микробиологическую практику С. II. Виноградским.
ПРИГОТОВЛЕНИЕ ОБЫЧНЫХ ЛАБОРАТОРНЫХ
ПИТАТЕЛЬНЫХ СРЕД
Мясо-пептонные среды
Исходным материалом для приготовления мясо-пептонных
сред служит мясная вода, которая готовится следующим образом.
500 г мелко изрубленного или измолотого на мясорубке свежего
мяса, освобожденного от костей, сухожилий и жира, обливают
в эмалированной кастрюле одним литром водопроводной воды,
нагретой до 50—55° С, держат в тепле при 50—55° С 1 час плп при
обычной комнатной температуре 12 час.
Экстракт процеживают через марлю со слоем ваты, которую
йотом отжимают. Полученную жидкость кипятят и затем филь-
труют дважды (первый раз через марлю с ватой, второй — через
фильтровальную бумагу). Фильтрат доливают водой до 1 л,
разливают ио бутылкам, закрывают ватными пробками,горлышки
бутылок с пробками закрывают колпачками из бумаги. Бутылки
с мясной водой стерилизуют при 120° С 20 мин. Такая мясная
вода может быть использована в любой момент для приготовле-
ния сред. Если среды готовятся сразу, то стерилизация излишня.
Мясо может быть заменено мясным экстрактом. Обычно берется
на 1 л среды 5 г мясного экстракта, который распускается в воде.
Мясо-пептонный бульон (МПБ) готовят следующим образом.
К 1 л мясной воды прибавляют 10 г пептона и 3 г поваренной солп
и подогревают до полного растворения пептона, все время поме-
шивая. Сняв с огня, устанавливают реакцию до рП 7.0, прибавляя
по каплям насыщенный раствор NaHCO3, затем кипятят 5 мин.,
еще раз проверяют pH и фильтруют через плотную фильтроваль-
ную бумагу без осветления бульона пли осветлив бульон белком,
что дает значительно более прозрачную среду. Профильтрованный
бульон разливают в пробирки по 5—6 мл и стерилизуют при
120° С 20 мин.
Для осветления белком среду охлаждают до 50° С, свежий
яичный белок взбивают с двойным по объему количеством воды и
смешивают среду с этой пенящейся жидкостью. Смесь кипятят
на несильном огне 10 мин., непрерывно помешивая, и затем филь-
труют. Далее поступают как обычно.
4*
51
Рис. 31. Скошенный агар.
А — пробирка со скошенным агаром; Б —
положение пробирок с расплавленным агаром
дли получении скошенного агара.
Мясо-пептонный агар (МПЛ) готовят на мясо-пептонном буль-
оне, к 1 л которого прибавляют 15 г мелко нарезанного агара.
Нагревают среду до растворения агара, устанавливают pH
насыщенным раствором NaIICO3, фильтруют через марлю
со слоем гигроскопической ваты, разливают в пробирки до раз-
личной высоты в зависимости от назначения: ио 10 мл для раз-
ливок агара в чашки, по 5 мл для получения скошенного агара
и по 7 мл для посева уколом. Пробирки закрывают ватными
пробками и стерилизуют в автоклаве при 120° С 10 мин.
Для получения скошенного агара пробирки сразу после сте-
рилизации раскладывают на столе в наклонном положении таким
образом, чтобы получилась
скошенная поверхность (рис.
31). Пробирки, предназначен-
ные для посевов уколом, ста-
вят в штативы, чтобы полу-
чить ровную поверхность.
При работе на водоемах
вместо мясо-пептонного ага-
ра может быть использован
рыбо-пептонный агар, для
приготовления которого при-
годны мышцы любого вида
рыб, за исключением очень
жирных. При приготовлении
рыбо-пептонного агара преж-
де всего готовят рыбный буль-
он. Для этого берут свежую
рыбу, чистят ее, тщательно
промывают, отделяют мякоть
от костей, разрезают и от-
вешивают необходимое количество. Берут 500 г мякоти на
1 л воды. Отвешенную рыбу заливают водой и нагревают в авто-
клаве при 120° С в течение 20 мин., после чего жидкость оставляют
отстаиваться. Осторожно сливают жидкость с осадка и фильтруют
через бумажный фильтр. К полученному фильтрату доливают
воду, доводя объем до 1 л. Далее с рыбной водой поступают так же,
как с мясной.
Мясо-пептонную желатину (МП7К) готовят из мясо-пептонного
бульона прибавлением к нему белой желатины в количестве
10—15%. Количество желатины, вводимое в среду, зависит от
температуры помещения, где проводится работа. Температура
плавления 10%-й желатины равна 24°, 15%-й — 25°. В теплое
летнее время мясо-пептонную желатину готовят 15%-й. Мелко
нарезанную желатину прибавляют в холодный мясо-пептонный
бульон, оставляют некоторое время стоять, чтобы желатина на-
бухла, затем распускают ее, осторожно подогревая. Когда жела-
52
тина полностью растворится, устанавливают ее реакцию до
pH 7.0—7.2, кипятят в течение 5 мин. и оставляют остыть до
40—50° С. В это же время яичный белок взбивают с небольшим
количеством воды, вливают его в охлажденную желатину, хорошо
взбалтывают и снова нагревают. Свертывающиеся белки про-
светляют желатину. После осветления среду фильтруют, проверяют
реакцию и разливают по пробиркам. Мясо-пептонную желатину
стерилизуют текучим паром 3 дня по 30 мил. Хранить ее реко-
мендуется в прохладном месте.
Дрожжевые автолизаты, экстракты, дрожжевая вода
Д р о ж ж о в ы е авто л и з а т ы. Широко используются
в приготовлении сред. Существует много способов приготовления,
сущность всех их сводится к созданию наиболее благоприятных
условий для автолиза клеток, происходящего под воздействием
находящихся в них протеаз. При автолизе дрожжей большая часть
белков переходит в раствор в виде пептонов и альбумоз. Автолиз
протекает лучше всего при температуре около 45° С и при
pH 6.2. Здесь приводится несколько способов.
' 1. По В. Л. Омел янскому: 1 кг прессованных дрожжей зали-
вают 1 л воды, прокипяченной и остуженной до 60° С. Смешивают
в гомогенную массу и нагревают на водяной бане до 49—50°.
Ставят в термостат на 72 часа при 50е. После этого нагревают
в автоклаве при 105е в течение получаса. Затем несколько раз
фильтруют до получения прозрачной жидкости. Этот фильтрат
содержит около 0.9?о азота. Оставшийся осадок заливают 600 мл
воды, взбалтывают и снова отфильтровывают. Оба фильтрата
смешивают. Средний процент азота получается 0.6—0.8. Жид-
кость нейтрализуют до реакции pH 6.8, разливают по неболь-
шим колбочкам и стерилизуют в течение 15 мин. при 115°.
Если необходимо иметь дрожжевой автолизат с более низким
содержанием азота (0.5 ?6), жидкость, разводят. В этом случае
азот определяют сжиганием ио Кьельдалю.
2. По А. М. Скородумовой: 500 г прессованных дрожжей
заливают 500 мл воды, хорошо размешивают и ставят в термо-
стат при температуре 45° на 2—3 суток. Затем фильтруют, оста-
ток на фильтре промывают 1 л воды. Полученную жидкость до-
ливают водой до 2 л, разливают по колбочкам и стерилизуют
30 мин. при 120°.
3. По А. II. Плотниковой: 100 г прессованных дрожжей зали-
вают 300 мл воды, тщательно перемешивают и помещают в термо-
стат на 48 час. при 53—56°. Время от времени массу перемеши-
вают. Когда автолиз закончен, к массе добавляют 200 мл воды
и фильтруют. Фильтрат стерилизуют 30 мин. при 120°.
4. По рецепту Ленинградского института вакцин и сывороток:
к 1 г прессованных дрожжей добавляют 0.5 л водопроводной воды,
53
нагретой до 45е, смешивают, выдерживают в термостате сутки
при 50°, отфильтровывают. При автолизе этим способом может
быть прибавлено вместе с водой 10 г сахарного песку.
5. По Е. Н. Одинцовой: жидкие прессованные хлебопекарные
или пивные дрожжи хорошо промывают и затем разбавляют
водой jjo консистенции густой сметаны, устанавливают pH 5.6—
6.0 подкислением разбавленной серной кислотой, помещают на
20 час. в термостат при 48°. По окончании автолиза кипятят
в течение 5 мин., отстаивают и фильтруют.
6. По В. И. Кудрявцеву: прессованные дрожжи (400 г на 1 л)
помещают в термостат при 48° на 48 час. Периодически взбалты-
вают. Через 48 час. отфильтровывают.
7 Экстракты дрожжей. Приводим несколько спо-
собов приготовления.
1. По 10. О. Рубинскому: 100 г прессованных дрожжей рас-
тирают в ступке со 100 мл воды, помещают в стеклянном стакане
в коховский кипятильник, где нагревают 30—60 мин. Отфиль-
тровывают через бумажный фильтр трижды. Полученную про-
зрачную желтоватую жидкость стерилизуют в небольших кол-
бочках.
2. По И. С. Левину: 75 г прессованных дрожжей заливают
1 л воды и кипятят на асбестовой прокладке 30 мин. Фильтруют
через бумажный фильтр.
3. По Л. Л. Бычковской: 100 г прессованных дрожжей зали-
вают 200 мл воды и прогревают в автоклаве. После стерилизации
дают отстояться. Берут пипеткой получившуюся после отстаива-
ния прозрачную жидкость.
4. По Л. Калфелду: 100 г пивных дрожжей заливают 400 мл
дистиллированной воды, размешивают и кипятят при помешива-
нии 10 мин. После этого центрифугируют и полученную почти
прозрачную, слегка желтоватую жидкость отсасывают пипеткой
и переливают в колбочки, в которых и стерилизуют 10 мин. те-
кучим паром.
Из этого экстракта может быть изготовлен 5—10°6-й дрожже-
вой бульон.
5. По 10. А. Козлову: к 100 г пивных дрожжей добавляют
400 мл дистиллированной воды, устанавливают реакцию среды
до pH 4.1—4.5 по метил рот, кипятят в течение 10 мин., фильтруют,
разливают, стерилизуют 3 дпя при 100° по 10 мин.
Д р о ж ж е в а я во д а. Может быть приготовлена разными
способами. Укажем два из них.
1. По В. Л. Омеляпскому: 70 г свежих прессованных или 10 г
сухих дрожжей кипятят в течение 30 мин. в 1 л дистиллированной
воды, дают отстояться в высоком стакане, декантируют и жид-
кость фильтруют. К фильтрату прибавляют 1 л воды, еще раз
кипятят в течение 30 мин., фильтруют в стерильные колбы, сте-
рилизуют в течение двух дней по 20 мин.
54
2. По Н. А. Дмитриевской и М. Ф. Чеботаревпч: прессованные
пивные пли хлебопекарные дрожжи помещают в термостат
при 50° для автолиза. Через 24 часа полученную массу разводят
из расчета 6 л воды на 1 кг дрожжей. Кипятят в течение 30 мин.,
устанавливают реакцию pH 7.0—7.2 и стерилизуют при 120°
20 мин., оставляют на сутки для отстаивания, после чего филь-
труют. Дрожжевая вода используется для приготовления жид-
ких сред или при добавлении агара — для твердых.
МЕТОДЫ СТЕРИЛИЗАЦИИ
При любой микробиологической работе: при посевах, выделе-
нии, пересевах, сохранении чистых культур — используются
стерильные среды, стерильная посуда, стерильные инструменты,
чтобы предотвратить возможность попадания посторонней микро-
флоры. Пересевы проводят в особых помещениях—боксах, которые
предварительно обрабатывают ультрафиолетовыми лучами (т. е.
в условиях асептики). В экспедиционных условиях используют
переносные боксы (рис. 4).
Существуют различные приемы стерилизации.
Стерилизация посуды. Для получения стерильно!!
посуды используется стерилизация сухим жаром. Она произ-
водится нагреванием в течение 2 час. при температуре 170° С
(считая с того момента, как температура установилась) в печи
Пастера пли в электросушпльных шкафах (с нагревом до 200е).
В экспедиционных условиях, при отсутствии сушильных шка-
фов, стерилизация посуды может быть произведена в автоклаве
или в духовом шкафу плиты (побурение бумаги показывает до-
статочность нагрева).
Вся посуда перед стерилизацией должна быть тщательно вы-
мыта, высушена и завернута в бумагу. Баллоны, склянки, трубки,
пипетки заворачивают в бумагу поодиночке, и в этой бумаге
они сохраняются до момента использования. Чашки Петри могут
быть завернуты по 2—3 вместе. Пипетки перед стерилизацией
затыкают с широкого конца ватой и заворачивают (закатывают)
в узкие, длинные ленты бумаги, начиная с оттянутого кончика.
При употреблении их легко развернуть с широкого конца, ко-
торый берется в руки.
Пробирки должны быть закрыты ватными пробками или
металлическими, пли пластмассовыми колпачками (рпс. 32),
а склянки и колбочки поверх пробки — колпачками из двух
слоев бумаги, обвязанными тонким шпагатиком вокруг горлышка.
Для заворачивания посуды при стерилизации в сушильном
шкафу лучше пользоваться тонкой бумагой (лимонной или па-
пиросной), при стерилизации в автоклаве — газетной (которая
не размокает). Нельзя стерилизовать посуду, закрытую притер-
тыми пробками. В этих случаях склянки должны быть закрыты
55
ватными пробками, а притертые пробки отдельно завернуты и
привязаны к склянкам
А — латная; Б — металличе-
ская; В — пластмассовая.
или же между горлышком и пробкой
должен быть положен кусочек марли.
Стерилизация питатель-
ных с р е д. Питательные среды
стерилизуют или в автоклаве под дав-
лением, или текучим паром в аппарате
Коха. Стерилизация текучим паром мо-
жет быть произведена и в автоклаве при
иезавпнчеиноп крышке. Текучим паром
стерилизуют среды с сахарами, же-
латиновые среды. Стерилизацию теку-
чим паром проводят три дня в одно
и то же время суток, т. е. чтобы интер-
вал между стерилизациями был 24 ча-
са. Продолжительность каждой — 30
мин., считая от начала энергичного
выхода пара.
Большинство сред стерилизуют на-
сыщенным паром под давлением в авто-
клавах. Повышение давления в авто-
клаве повышает температуру пара, об-
разуемого внутри автоклава, и/следовательно, температуру сте-
рилизации:
Показания манометра (в а гм.) Температура пара (в сС) Показания манометра (в атм.) Температура пара (в СС)
0.0 100.0 1.0 121.0
0.2 105.0 1.2 124.0
0.4 110.0 1.4 126.0
0.5 112.5 1.5 127.0
0.6 114.5 1.8 130.0
0.8 117.0 2.0 132.0
В автоклаве можно стерилизовать п посуду, различные ин-
струменты и приборы. Если при этом бумага, в которую завер-
нута посуда, станет влажной, переносят пакеты в сушильный
шкаф и подсушивают бумагу.
Для получения стерильных игл, петель при производстве по-
севов, взятии материала из культур для приготовления мазков
пользуются стерилизацией прокаливанием па пламени. При этом
иа пламени (спиртовки, газовой горелки) подвергают кратковре-
менному обжиганию горлышки пробирок, колб, пробки и т. д.
Стерилизация холодным способом — метод ультрафильтрации.
Этот метод применяется для освобождения того или иного суб-
страта от находящихся в ном бактерий, для изучения продуктов
обмена нефильтрующихся бактерий, для получения вирусов
и т. д. Следует учитывать, что, по современным представлениям,
56
в фильтрат проходят микоплазмы и субмикроскопические
формы бактерий (Калина, 1962). Для ультрафильтрации исполь-
зуются различные твердые бактериальные фильтры из разных
неорганических материалов, полутвердые фильтры и мембранные
фильтры. При получении освобожденных от бактерий жидкостей
Рпс. -33. Рис. 34. Приборы для фильтрации.
Фильтро-
вальная
свеча. приборы и фильтры должны быть простерили-
зованы в автоклаве при 120° С.
Твердые бактериальные фильтры (фильтровальные свечи —
рис. 33) изготовляются из каолина в смеси с некоторыми другими
веществами (например, инфузорной землей — ископаемые крем-
невые панцири диатомовых водорослей, состоящие в основном
Таблица 1
Размеры пор различных фильтров
(по Калипс, 1962)
Фильтры Ленинград- ского кера- мического института Соответст- вующие марки фильтров Шамбер.тэпа Размер пор (в мк) Фильтры Беркефельда Размер пор (в мк)
<Т>1 Ь1 4.5—7.0 V 5
Ф2 (Л2) L., 2.5—4.5 N 3.5-5
*®з (Л3) кз 1.9-2.5 W 3.5
Ф5р5) к О’) 1.3-1.9
Ф7 (Л7) L7(I!) 0.9-1.3
ФзИЛи) l-л Около 0.8
57
из Si(OH4)). Широко известны фильтры Шамберлэна с порами
различных размеров (Ln L2, L3 и т. д. до L13). Фильтры Ll исполь-
зуют для предварительной фильтрации; для освобождения жид-
кости от бактерий используют свечи Ь5 и L7. Подобные фильтры
выпускает Ленинградский керамический институт. Более зна-
чительный процент инфузорной земли содержат фильтры Бер-
кефельда, выпускаемые крупнопористыми (V), нормальной по-
ристости (N) и мелкопорпстыми (W). Бактерий задерживают
только фильтры марки W. Размер пор различных фильтров при-
веден в табл. 1.
Полутвердые, асбестовые фильтры имеют вид плотных кружков
толщиной 3—5 мм, вкладываемых в специальные фильтроваль-
ные приборы (рис. 34).
Различают 3 марки асбестовых фильтров Зейтца; EKS, EKS1?
EKS2; фильтры марок EKSi и EKS2 задерживают бактерий, но
пропускают вирусы и фильтрующиеся формы. Выпускаемые на-
шей отечественной промышленностью асбестовые фильтры марки
Ф задерживают взвешенные частицы и крупных бактерий, фильтры
марки СФ задерживают бактерий.
Мягкие фильтры готовятся в настоящее время главным обра-
зом из растворов нитроцеллюлозы. Они используются наиболее
широко, значительно шире, чем твердые или асбестовые. Эти
фильтры, называемые мембранными, нашли широкое применение
при прямом счете бактерий воды и грунтов, при санитарно-бак-
териологическом анализе воды. Фабрика мембранных фильтров
в Мытищах выпускает фильтры с порами различных размеров
(табл. 2).
Таблица 2
Характеристика мембранных фильтров
№ фильтра Скорость фильтрации 500 мл воды (в сек.) Средний диаметр пор (В мк)
средина колебании
1 540 360-720 0.35
2 270 180-360 0.50
3 130 90-180 0.70
4 70 45-90 0.90
5 25 20-45 1.20
Кроме приведенных в табл. 2 пяти номеров, выпускается еще
особый сорт их — «предварительные» фильтры (№ 6), которые
могут быть использованы для очистки воды от взвешенных в ней
частиц. Эти фильтры пропускают большую часть бактерий. Они
имеют хорошо заметную при рассмотрении их на свет ячеистую
структуру (диаметр пор у них 3—5 мк).
58
Для фильтрации через мембранные фильтры используют
специальные приборы. Фильтрацию обычно производят под
отрицательным или положительным давлением. Через мембранные
фильтры фильтрация проводится всегда при отрицательном дав-
лении; при использовании твердых фильтров она может быть
произведена как при отрицательном, так и при положительном
давлении (рис. 35).
Рпс. 35. Схема установки для фильтрации.
1 — сосуд, в который поступает фильтрат; 2 — свеча; з — фильтруемая
жидкость; 4 — резиновая трубка; 5 — промежуточная колба;
6 — водоструйный насос.
ТЕХНИКА ПОСЕВОВ
А
Универсальным инструментом микробиологической работы,
применяемым как для производства посевов, так и для взятия
материала из культур при приготовлении мазков, является бак-
териологическая петля. Материалом для ее изготовления служит
платиновая проволока диаметром 0.5—0.6 мм. Для посевов
уколом используются платиновые иглы, для посева штрихом
в чашки Петри — шпатели Дригальского. Для посевов жидких
материалов, кроме петли, употребляют пастеровские пипетки
(длина их 25—28 см), которые готовят из трубок легкоплавкого
стекла диаметром 3—4 мм. При количественных определениях,
когда требуется перенести строго определенные объемы жидкости
59
при производстве разведении, используют градуированные пи-
петки с делениями на 0.1 мл. При производстве посевов водой и
болтушками грунта в различных разведениях требуется большое
количество стерильных градуированных пипеток, поэтому их
необходимо иметь в лаборатории в достаточном количестве и раз-
личных объемов: на 100, 10, 5, 2 и 1 мл.
Посевы в жидкие среды производят или пипетками, опуская
кончик их на 1 мм ниже уровня среды, или петлей, прикасаясь
ею к стенке .пробирки на границе жидкости^ слегка потирая пет-
Рис. 36. Посев уколом.
лей о стенку пробирки, чтобы обес-
печить перенос посевного материала
Рис. 37. Линии
посева на ко-
сом агаре.
А—прямая; Б —
зигзагообразная.
в питательную среду.
Посевы в плотные питательные среды производят на поверх-
ность скошенного агара или уколом в столбик агара (рис. 36).
На дне пробирки с косым агаром должно быть небольшое ко-
личество конденсационной жидкости. Долго хранившиеся сухие
агаровые среды непригодны для работы. Посев производят, про-
водя петлей с посевным материалом от конденсационной воды до
верхней части косяка или широкую прямую, или зигзагообразную
линию (рис. 37).
В чашки Петри посевы могут быть произведены двумя спо-
собами: глубинным посевом или рассевом по поверхности пита-
тельной среды. При первом методе в стерильную чашку Петри
вносят или исследуемую воду, или разведение грунта, или раз-
ведение культуры и заливают расплавленным и охлажденным
G0
до 40—45° С агаром. Лгар выливают из пробирки (немедленно по
обжигании ее краев пламенем спиртовой горелки) в чашку, прямо
на посевной материал (рис. 38). Как при внесении посевного ма-
териала, так и при заливании его агаром крышка чашки Петри
приподнимается как можно меньше.
Немедленно по выливании агар тщательно смешивают с посев-
ным материалом путем легкого вращательного движения чашки
на поверхности стола. Агар должен быть распределен по дну чашки
ровным тонким слоем без пузырьков воздуха и без не залитых
им пространств. Надо следить, чтобы агар не попал па борт чашки,
так как такая чашка для работы не годна. Когда агар в чашках
затвердеет, чашки переворачивают вверх дном и в таком положе-
нии ставят в термостат (перевернуть чашку необходимо, так как
Рис. 39. Посев шпате-
лем на поверхности
агаровой среды.
Рис. 38. Выливание агара в чашку
Петри.
агар отдает конденсационную воду, которая в таких условиях
оседает на крышку чашки).
Прп методе рассева по поверхности плотной среды питатель-
ный агар предварительно разливают в чашки Петри и дают ему
застыть. Застывший в чашках агар затем подсушивают в сушиль-
ном шкафу при температуре около 40° С. На поверхность подсу-
шенного агара наносят стерильной градуированной пипеткой
намеченное количество посевного материала, после чего его рас-
пределяют на поверхности агара стерильным стеклянным шпа-
телем, затем этим, же шпателем втирают засеяппый материал
в агар. Чашку Петри при этом вращают вправо и влево, при-
открывая ее как можно меньше (рис. 39). При посевах на гель
грунт наносят комочками, а воду каплями, равномерно по всей
поверхности, не применяя растирания.
ВЫРАЩИВАНИЕ МИКРООРГАНИЗМОВ
Выращивание бактерий производят в термостатах. Термо-
стат должен иметь постоянную температуру, одинаковую в раз-
личных его частях. Постоянство температуры внутри термостата
обеспечивается терморегулятором. Имеется много систем термо-
регуляторов. Любая система должна обеспечивать автоматическое
размыкание электроцепи и выключение тока при подъеме темпе-
ратуры выше заданной и включение при понижении температуры.
61
Культивирование аэробов
Аэробными организмами называют такие, которым для нор-
мального развития нужен кислород воздуха. Облигатно аэробные
микроорганизмы обычно растут в виде пленок на поверхности
жидких и плотных сред. Однако, по наблюдениям последнего
времени, для развития многих аэробов большая аэрация сред не
является наиболее благоприятной (Работнова, 1957). Имеющиеся
литературные данные свидетельствуют, что аэробы могут сущест-
Рис. 40. Аэраторы различных систем.
А — простейший аэратор: 1 — культуральная жидкость; 2 — пористая плас-
тинка; з — фильтр из ваты. Б — аэратор, позволяющий производить отбор
проб: 1 — распылитель воздуха; 2 — фильтр из ваты; з — трубка, соединяю-
щая с разрежающим насосом; 4 — трубка для отбора пробы. В — аэратор
Любимова: 1 —пористая пластинка; 2—трубка подачи воздуха; 3 — куль-
туральная среда; 4 — трубка для удаления отработанного воздуха; 5 —
трубка для отбора пробы; 6 — трубка для засева среды.
вовать при весьма различных парциальных давлениях кислорода
и оптимальные условия для них определяются составом среды.
Для облигатных аэробов наиболее благоприятные условия
создаются в среде при обеспечении доступа в нее воздуха. Поэтому
среды для выращивания аэробов разливают в конические колбочки,
колбы Виноградского или другие сосуды тонким слоем. Хорошо
растут аэробы на поверхности плотных питательных сред, по-
этому для их выращивания широко используются методы засева
скошенного агара, выращивание на поверхности гелевых пласти-
нок, агаровых и других плотных сред в чашках Петри.
При специальных исследованиях аэробов выращивают в жид-
ких средах, помещаемых на специальные электрические качалки,
чем достигается распределение среды по стенкам колбы тонким
62
слоем. Этот способ постоянно применяется в микробиологической
практике.
Широко используемый способ
пузырьков воздуха через жидкув
компрессором или протягивается
стерилизации до поступления в
культуру он пропускается че-
рез фильтр из ваты. Чем на бо-
лее мелкие пузырьки разбит по-
ступающий воздух, тем лучшие
условия аэрации создаются в
среде. Микроорганизмы при
этом находятся во всей толще
среды в одинаковых условиях,
клетки их непрерывно омыва-
ются аэрируемым питательным
раствором. Чтобы получить мел-
кие пузырьки воздуха, его про-
пускают через мелкопористые
пластинки. Этот способ выра-
щивания микроорганизмов по-
лучил название глубинного. Он
широко применяется в произ-
водственных условиях, где ин-
тенсивность аэрации достигает
значительных размеров. Сущест-
вует ряд конструкций лабо-
раторных аэраторов (рис. 40)
и производственных фермента-
торов. Однако при такой рас-
пылительной аэрации коэффи-
циент полезного действия вду-
ваемого воздуха невелик, кро-
ме того, некоторые среды вспе-
ниваются, что препятствует
диффузии воздуха внутрь их.
Чтобы избежать вспенивания
аэрирования — пропускание
среду. Воздух нагнетается
водоструйным насосом. Для
Рис. 41. Проточные установки
П.Малека (по Малеку, 1956).
А —трехступенчатая установка: 1, з —
трубки, через которые поступает пита-
тельная среда; 2 — трубка для аэрации
культуры. Б — установка с вихревой аэра-
цией: Ci, Са, Сз — сосуды для культивиро-
вания; М — мешалки; П — сосуд с пи-
тательной средой; Т — мотор; Б — ком-
прессор, подающий воздух через фильтры
ф; О — сливной сосуд.
сред, увеличивают размер пузырьков, прибавляют к средам
пеногасители — соевое, касторовое и другие масла, высшие
спирты и др.
Более совершенный способ — вихревая аэрация: применение
быстро вращающихся пропеллерных мешалок. Вся жидкость,
находящаяся в сосуде, проходит за определенный период времени
через вихревую зону и, следовательно, аэрируется. Степень
аэрации в этих приборах регулируется скоростью вращения про-
пеллера. Однако у подобных приборов имеется недостаток —
необходимость пропускания через горло сосуда вращающихся
63
мешалок, что создает затруднения в поддержании в культуре
условий стерильности.
Метод проточных культур. В настоящее время
при исследованиях аэробов все шире применяется метод проточ-
ных культур. Прп этом методе бактерии находятся в непрерывно
обновляемой среде, т. е. в условиях, возможно более близких
к естественным. Даже прп глубинном методе выращивания среда
не обновляется, химический состав ее изменяется в итоге исполь-
зования ее микроорганизмами, накапливаются продукты обмена,
что приводит к старению культуры и отмиранию части клеток.
Проточный субстрат имеет ряд преимуществ. Культура непрерывно
получает свежие питательные вещества, продукты обмена непре-
рывно удаляются, что дает возможность долгое время сохранять
культуру без изменения ее физиологических свойств. Работами
П. Малека (1956) показано, что в проточной среде может быть
получено стократное увеличение микробного населения по срав-
нению с непроточной средой. Малеком и другими авторами
(М. Д. Утенков и др.) сконструированы различные проточные
установки (рпс. 41). Особенностью культивирования в них
является то, что вместе с удаляемой использованной средой
в итоге одностороннего тока субстрата уносится некоторое коли-
чество клеток бактерий.
Сконструированы различные приборы для культивирования
микроорганизмов в целлофановых или коллодионных мешках
(Перфильев и Габе, 1961), омываемых снаружи током питатель-
ного раствора. Через такие полупроницаемые мембраны не про-
ходят клетки бактерий, по поступают питательные вещества и
выводятся продукты обмена.
Культивирование анаэробов
Для учета, выделения и культивирования анаэробов исполь-
зуются особые методы, в основе которых лежит создание усло-
вий, обеспечивающих микроорганизмам изоляцию от доступа
воздуха и удаление кислорода из окружающего их йространства
и питательной среды.
Питательные среды, применяемые для учета и культивирования
анаэробов, обычно те же, что и для аэробных бактерий, и отли-
чаются только условия выращивания. Так, при установлении
в водоеме количества анаэробов, минерализующих белки, поль-
зуются теми же питательными средами п тем же методом разли-
вок, какие использовались для аэробов. Условием, необходимым
для развития анаэробов, является низкий окислительно-восста-
новительный потенциал среды. Особенно важен начальный по-
тенциал (прп засеве), так как им определяется возможность на-
чала роста. В дальнейшем анаэробы, размножаясь, снижают
окислительно-восстановительный потенциал в итоге продуци-
64
рования редуцирующих соединений (возможно, содержащих
SH-rpynny). Если засев производят большим количеством клеток,
то редуцирующие вещества вносятся в достаточном количестве
для снижения окислительно-восстановительного потенциала до
необходимого уровня. Поэтому при культивировании анаэробов
имеет большое значение количество посевного материала.
Благоприятные для развития анаэ-
робов условия в среде могут быть со-
зданы различными способами.
1. Удалением растворенного кисло-
рода посредством кипячения среды.
Анаэробы только тогда быстро разви-
ваются в среде, соприкасающейся с воз-
духом, когда эти среды или свеже-
простерилизованы, или предварительно
прокипячены. Существенным моментом
является быстрое охлаждение среды,
чтобы не дать ей насытиться воздухом,
и быстрый посев.
2. Наслаиванием на среду стериль-
ного жидкого вазелинового или пара-
финового масла. После посева в пред-
варительно прогретую среду на нее
наливают асептически слой масла.
3. Созданием более вязкой среды с
добавлением в нее агара (0.1—О.2°о).
В такой среде диффузия кислорода
затруднена, и несколько ниже поверх-
Рис. 42. Распределение г112
в столбике питательной сре-
ды (по Lambin et German,
1961).
НОСТИ в ней устанавливается ДОВОЛЬНО о - поверхность среды. I-
низкий окислптельно-восстановитель- У,ДСДЫГ,С, гН»=2^ 11 — с
ныи потенциал (г112). После стерилиза- iv — с гн2=э.2; v — с гн2=
ции при соприкосновении с воздухом г112 =8*0, VI ~ с гН2=7 4
у поверхности равен примерно 20 и по-
степенно снижается до 7 (рис. 42). Оптимальная зона гН2 для
анаэробов лежит при значениях от 0 до 12 (по другим данным,
до 14). Практически прибавление 0.2% агара дает возможность
развиться на дне пробирки строгим анаэробам.
4. Добавлением в среду редуцирующих веществ. Добавление
восстановителей дает очень хорошие результаты. Из таких ве-
ществ можно указать глюкозу (1—2?6), муравьинокислый нат-
рий (0.3—0.5%), аскорбиновую кислоту (0.1—0.296), цистеин,
натрий тиогликолевый (0.1 %) и др. Глюкоза является сильно
восстанавливающим веществом (rll2 в растворах глюкозы устанав-
ливается около 6—7). Такими же редуцирующими свойствами
обладают арабиноза, лактоза, галактоза, манноза, ксилоза (но
не сахароза). Сложные органические среды содержат всегда
редуцирующие вещества, например среды с пептоном. Добавле-
5 А. Г. Родина
65
ние аскорбиновой кислоты к пептонным средам дает возможность
развиваться строгим анаэробам на воздухе.
Для изолирования посевов от доступа воздуха и обеспечения
условий анаэробиоза используют различные приборы: ана-
Рис. 43. Простейший кон-
тейнер для анаэробов.
эростаты, контейнеры, эксикаторы и др.
При работе в стационарной лабо-
ратории выращивание анаэробов мо-
жет быть произведено более совершен-
ными способами при использовании
приборов, полнее обеспечивающих ан-
аэробные условия. В экспедиционных
условиях часто приходится ограничи-
ваться более простыми приемами. Одним
из простых способов получения усло-
вий, обеспечивающих ничтожное содер-
жание кислорода в окружающем посе-
вы пространстве, является помещение
посевов в контейнер, в который затем
ставится зажженная свеча (рис. 43).
Контейнер закрывается. Свеча горит до
тех пор, пока кислород поддерживает
горение, затем тухнет.
Обеспечивает условия анаэробиоза
аппарат В. М. Аристовского (рис. 44).
Аппарат этот представляет собой метал-
лический цилиндр с внутренним диаметром, соответствующим диа-
метру чашек Петри, которые должны свободно в пего входить. Высо-
та аппарата может быть различна (у Аристовского она рассчитана
Рис. 44. Аппарат В. М. Аристовского для культивирова-
ния анаэробов.
па 10 чашек). В цилиндр вставляется плотно прилегающее к его
внутренним стенкам металлическое ведерко, одна половина вер-
тикальной стенки которого вырезана. В это ведерко укладываются
одна за другой засеянные чашки Петри. К верхнему краю ведерка
66
прикреплена дужка. Цилиндр снабжен металлической крышкой»
привинчивающейся к прибору наподобие крышки автоклава:
между крышкой и верхним краем цилиндра помещается резиновая
прокладка, уложенная в специальное углубление верхнего края
цилиндра. На нижней поверхности металлической крышки имеется
2 параллельных круговых выступа, которые при привинчивании
крышки к цилиндру вдавливаются в резиновую прокладку.
Для создания анаэробиоза при полной загрузке аппарата
верхнюю и нижнюю чашки заполняют сухой смесью химического
поглотителя кислорода в виде соды и гидросульфита натрия
(Na2S2O4 • 2Н.2О). Гидросульфит должен храниться в гермети-
ческой упаковке. На дно этих чашек насыпают слой соды (около
20 г) и сверху равномерный слой гидросульфита натрия (1.5 г).
Гидросульфит может быть заменен пирогаллолом. Порошок пе-
ремешивают и увлажняют водой из пульверизатора. Ведерко
с посевами и чашками со смесью помещают в цилиндр, герме-
тически его закрывают и помещают в термостат, из которого
через нужные сроки оно вынимается (для счета колоний в чашках,
выделения, наблюдения и т. д.).
Герметичность и определяемая этим полнота удаления кис-
лорода внутри аппарата Аристовского могут быть проверены про-
бой с метиленовой синей. Для этого готовят 3 основных раствора:
I) б мл 0.1 н. NaOll разводят дистиллированной водой до
100 мл;
2) 3 мл 0.5%-го водного раствора метиленовой синей разво-
дят дистиллированной водой до 100 мл;
3) 6 г глюкозы растворяют в 100 мл дистиллированной воды
и добавляют туда маленький кристаллик фенола.
Каждый раз, когда раствор индикатора нужен, смешивают
в пробирке растворы в отношении 1:1:1 и или пропитывают
этой смесью полоску марли, или помещают пробирку со смесью
в кипящую водяную баню и держат там до исчезновения окраски.
Пробирку помещают в анаэробный контейнер перед началом
создания там анаэробных условий. В обескислороженных усло-
виях окрашенная марля обесцвечивается, цвет раствора в про-
бирке не меняется. Сохранение окраски марли, появление синей
окраски в пробирке указывают на неполное удаление кислорода.
Цвет может появиться, но затем с развитием анаэробных условий
он должен исчезнуть (окраска исчезает, когда рО2 снизится
до 0.05 атм.).
Эта проба может быть рекомендована для всех приборов,
которыми пользуются для анаэробных культур.
Полный анаэробиоз обеспечивает и аппарат Верней (рис. 45).
Он состоит из контейнера (7), рамки (2), сетчатой формы (<?),
двух асбестовых дисков (7, 5). В контейнер наливают воду, слой
которой не должен быть выше 2 см. Чашки Петри или пробирки
помещают в рамку (2), на них кладут несколько слоев фильтро-
5*
67
вальной бумаги (6) и сверху асбестовый диск (4). Фарфоровую
чашку ставят на асбест и помещают в нее маленький кусочек
желтого фосфора. Фосфор хранят под водой и берут его только
щипцами. Сетчатую форму (5) перевертывают над чашкой (7),
помещают над ней асбестовый диск, и аппарат быстро закрывают
крышкой (5). Фосфор воспламеняется очень быстро и горит до
тех пор, пока не будет использован кислород. Вода на дне сосуда
Рис. 45. Аппарат Верней.
Объяснения в тексте.
Еще чаще анаэробов
поглощает образующийся при этом
Р2О5. Этот способ удаления кисло-
рода может быть использован и при
отсутствии металлического контей-
нера, вместо которого можно исполь-
зовать цилиндр из жароустойчивого
стекла с крышкой. Способ обеспе-
чивает быстрое получение анаэроби-
оза, однако необходимо соблюдение
мер предосторожности при работе с
фосфором.
В лаборатории наиболее удобно
работать с анаэростатами (рпс. 46).
После загрузки анаэростата крышку
завинчивают. Один из кранов при-
соединяют к вакуумному насосу,
другой закрывают. Воздух откачи-
вают, степень чего устанавливают
по показаниям вакуометра. В на-
стоящее время существуют специ-
альные анаэростаты, в которых под-
держивается постоянная температура
и обеспечивается удаление воздуха.
Может быть использован вакуум-
эксикатор (рис. 47).
культивируют в атмосфере инертного
газа (азот, аргон, гелий). В этом случае в анаэростате оставляют
открытыми оба крана, один из них присоединяют к баллону
с инертным газом и открывают кран баллона. Газ, проходя через
анаэростат, вытесняет воздух. Обычно на это требуется минут
20—30, после чего свободный кран закрывают и сразу же за-
крывают кран, соединяющий анаэростате баллоном, и отъединяют
баллон (рис. 48).
Для удаления кислорода могут быть использованы биологи-
ческие методы, чаще всего совместное культивирование аэробов
с анаэробами. Обычно для этой цели из аэробов используются
Staphylococcus aureus Bergey et al., Serratia marcescens Bergey
et al., Sacchoromyces cerevisiae.
Выращивают предварительно чистые культуры аэробов. Тех-
ника совместного выращивания такова: отбирают 2 чашки Петри
68
с донышками одинаковой величины и стерилизуют их. Питатель-
ный агар выливают на дно одной чашки (чашка 1) и после его
застывания засевают густо штрихом культурой аэробного орга-
низма. В другую чашку (чашка 3) наливают среду для анаэробов
и засевают ее. После застывания удаляют крышки, складывают
донышки краями и соединяют их узкой лентой лейкопластыря
(рис. 49).
Метод очень прост и может быть использован в любой обста-
новке. Недостатком его является возможная недостаточность
анаэробиоза для предотвраще-
ния гибели в посевном мате-
риале вегетативных клеток ан-
аэробов.
Учет анаэробов в экспеди-
ционных условиях можно про-
изводить по методуЛ. Д. Штурм.
Для этого складывают чашки
Рис. 47. Вакуум-эксика-
тор для культуры
анаэробов.
Рис. 46. Анаэростат.
перед стерилизацией не обычным способом, а дно вкладывают в
крышку. Затем чашки заворачивают в бумагу и стерилизуют обыч-
ным способом. Отдельно стерилизуют парафин в небольших склян-
ках пли пробирках. Посевы для определения анаэробов производят
параллельно с посевами для определения аэробных бактерий,
добавив в среду редуцирующие вещества, теми же количествами
воды и грунта. Посевы для учета анаэробов делают в крышки
чашек Петри, заливают их питательным агаром и быстро вкла-
дывают сверху в качестве крышки донышко чашки (рис. 50).
Края чашек заливают стерильным парафином, и в таком виде
чашки помещают в термостат. Вливать агар в крышку чашки
следует так, чтобы донышко плотно вошло в агар, но чтобы он
не был вытеснен на края чашки. При использовании чашек Петри
69
одного диаметра можно предварительно установить, какое коли-
чество агара требуется для этого, и заранее разлить в пробирки
необходимое количество. Счет выросших колоний ведется обычным
способом.
Для получения культур анаэробов могут быть использованы
трубки. Для этого вносят разведенный посевной материал в све-
Рис. 48. Схема установки для замены воздуха
углекислым газом.
1 — баллон с СО2; 2 — ртутный манометр; 3 — эксика-
тор с культурами; 4 — масляный насос.
жепрокиняченную и быстро охлажденную до 40 С агаровую
среду, размешивают и насасывают агар в стерильную трубку
длиной 20 см, диаметром 0.3—0.5 см. Концы трубок могут быть
закрыты каучуковыми пробка-
ми или запаяны. Развившиеся
колонии анаэробов извлекают
или вытолкнув столбик агара,
или распилив трубку в месте
их нахождения.
Среды, содержащие восста-
навливающие вещества, исполь-
зуются и в разливках. Чаще в
качестве восстанавливающих ве-
ществ в питательный агар до-
бавляют 0.2 °о тиогликолата нат-
рия или 0.1 мл 8^o-гo раствора
аскорбиновой кислоты в 10°о-м
растворе соды и 0.002 % метиле-
Рис. 49. Совместное культивирова-
ние анаэробов и аэробов.
1 — культура аэробов; 2 — лента лей-
копластыря; з — культура анаэробов.
новой синей. Стерильную среду
наливают в количестве 25 мл при диаметре чашек 10 см и 40 мл
при диаметре 15 см. По застывании засевают штрихом центр чаш-
ки и заменяют крышку подобранным до стерилизации донышком
другой чашки таким образом, чтобы оно вошло в агар и по краю
остался узкий ободок агара. В хорошо приготовленных чашках
агар в центре остается бесцветным, по краям же среда становится
70
голубой вследствие окисления краски. Предложены и специаль-
ные крышки для культивирования анаэробов таким способом,
например крышка Бревера (рис. 51).
Недостатками этого быстрого и простого способа являются:
1) возможность образования пленки вследствие высокой поверх-
ностной влажности, 2) возможность угнетения некоторых видов
бактерий редуцирующими ве-
ществами.
Этот способ может быть
применен в другом варианте.
Па дно чашки Петри нали-
вают среду, делают посев,
перемешивают все и дают за-
стыть. После застывания на-
ливают слой агара и в него
Рис. 50. Культивирование анаэробов
по методу Л. Д. Штурм.
1 — питательная »среда; 2 — парафин.
кладут стеклянную стериль-
ную пластинку того же диаметра, что и чашка Петри. По засты-
вании наливают слой водного агара, содержащего 0.1 % тио-
Рис. 51. Крышка Бревера.
1 воздух; 2— питательная среда.
юзом (Matthews, 1961). По
гликолата натрия.
Хорошие результаты дает метод Модселя. Культуру анаэробов
засевают в чашку Петри штрихом на поверхность питательной
среды. К крышке прикрепляют конверт из фильтровальной бумаги
размерами 7x4 см, внутри которого
помещается свежеприготовленная
смесь, состоящая из 3 частей пи-
рогаллола, 3 частей К2СО3 и 15 ча-
стей инфузорной земли. Для прикреп-
ления используют парафин, расплав-
ленный при 54—57° С.
Очень простой метод культиви-
рования анаэробов предложен Меть-
этому методу засеянные чашки вме-
сте с индикатором помещают в целлофановый мешочек. Тон-
копористый диск от аппарата Зейца пропитывают 6О?6-м водным
раствором пирогаллола и затем добавляют 1 мл 50%-го водного
раствора Na2CO3 и тоже помещают в мешочек. Мешочек запеча-
тывают и помещают в термостат для выращивания.
Разработаны специальные приборы (Работнова, 1957), позво-
ляющие проводить измерение гН2 в процессе культивирования
анаэробов (рис. 172).
Получение культур анаэробов из водо-
емов. Если работа имеет целью не количественный учет ан-
аэробов, а выявление в водоемах видов анаэробов, то наилучшие
результаты получают путем посевов в жидкие среды с 0.1—0.2%
агара. Могут быть сделаны двойные посевы: одни непрогретым
материалом, вторые — после прогревания исходного материала
0—2 мин. в кипящей водяной бане или 20 мин. при 80° С).
71
Получение чистых культур анаэробов из обогащенной культуры
может быть затруднено из-за наличия в ней аэробов. Наиболее
легко выделение удается из прогретых культур, в которых ан-
аэробы образовали споры. Для этого наиболее подходящими
являются старые культуры на средах, содержащих сахара.
Этот прием непригоден, если в культуре находятся споронос-
ные аэробы, вследствие высокой термоустойчивости спор этих
микроорганизмов. В этом случае рекомендуется прибавлять
к средам раствор кристаллвполета в таком количестве, чтобы
концентрация краски в среде была примерно 1 : 100 000, так как
анаэробы значительно устойчивее к этой краске, чем аэробы.
Краску рекомендуется прибавлять после стерилизации сред.
ГЛАВА 4
ВЫДЕЛЕНИЕ ЧИСТЫХ КУЛЬТУР И ОПРЕДЕЛЕНИЕ
ВИДА БАКТЕРИЙ
В водоемах бактерии находятся не в изолированном состоя-
нии, а в различных биоценозах. Для изучения микроорганизмов
необходимо получить чистые их культуры, т. е. популяции, со-
держащие клетки только одного вида. Только получив чистую
культуру, можно определять морфологические и физиологические
особенности вида.
Определение всех видов микробов, населяющих водоем, про-
изводится весьма редко из-за трудоемкости подобной работы.
Обычно определяют возбудителей тех или иных процессов,
группа же гетеротрофных сапрофитов определяется до вида реже.
При определении вида микробов возникают трудности из-за
большой их пластичности и чрезвычайно быстрой реакции на
изменения во внешней среде. Морфологические и физиологические
признаки связаны с условиями культивирования — температу-
рой выращивания, составом питательной среды, ее реакцией и т. д.
Лишь при определенных условиях развиваются клетки типич-
ной формы и размеров, характерных для данного вида. Вследствие
этого следует пользоваться средами строго определенного состава,
культуру вести при одних и тех же температурах, изучение мор-
фологии микробов проводить на клетках определенного возраста.
Чаще проводят определение лишь преобладающих в исследуе-
мом водоеме видов микробов.
МЕТОДЫ ВЫДЕЛЕНИЯ БАКТЕРИЙ
Выделение чистых культур производят пз колонии, развиваю-
щихся при засеве исходным материалом на поверхности твердой
питательной среды (мясо-пептонного или какого-либо специаль-
ного агара). Методы выделения чистых культур делят на две
основные группы: 1) методы, основанные на принципе механиче-
ского разделения микробов, 2) биологические методы. Обычно
используют первые.
Методы механического разделения ми-
кроорганизмов. В основе этих методов лежит разделение
смеси клеток и их групп на изолированные клетки в питательной
73
среде или на ее поверхности. Эти клетки прорастают в колонии,
из которых затем делают отсев на поверхность твердых сред.
Выделение чистой культуры на твердые среды может быть
произведено двумя способами: посевами в толще среды или посе-
вами на поверхности среды. Для того и другого способа необхо-
димо вначале приготовить разведения исследуемого материала.
Для этого берут 5—6 заранее приготовленных пробирок со сте-
Рис. 52. Схема разведении.
I—III — посевы из последующих
разведений.
рильной водопроводной водой
или водой исследуемого водое-
ма. В первую пробирку вносят
немного исходного материала и
после тщательного его размеши-
вания в стерильной воде, что до-
стигается вращением пробирки
между ладонями, переносят
1—2 петли во вторую пробир-
ку, из нее после размешива-
ния — в третью и т. д. (рис.
52). *
Из каждого разведения, на-
чиная со второго или третье-
го, берут по 1—2 петли п пе-
реносят их в пробирки с рас-
плавленным и остуженным до
40° С мясо-пептонным агаром,
тщательно размешивают вне-
сенный материал с агаром и
выливают в чашку Петри.
Можно делать разведения,
используя прямо расплавленный
и охлажденный агар (в пробир-
ках). В этом случае вносят исследуемый материал в жидкий агар,
тщательно размешивают его, затем переносят 1—2 петли в следую-
щую пробирку и т. д. Содержимое каждой пробирки выливают в
чашку Петри. Падппсп па чашках Петри должны быть сделаны
до посевов. Когда агар в чашках затвердевает, их переворачи-
вают вверх дном и помещают в термостат.
Из ряда чашек, засеянных из разных разведений для выделе-
ния чистых культур, годны только те, в которых рост микро-
бов не является густым, где отдельные колонии расположены
одна от другой на значительном расстоянии. В первых разведе-
ниях может быть такой густой рост, что колонии могут сливаться
и дать сплошной, «газонный» рост. Поэтому часто высев в агар
делают из пробирок с водой, начиная с третьего, четвертого раз-
ведения.
Выделение чистой культуры производят следующим образом.
Колонии, выросшие на чашках, вначале подвергают исследованию
74
и, по застывании агаровой
ионерхпости
— последующие
Рис. 53. Схема посевов
агара.
.А - начало посева; Ь’. В, j
этаны посева.
под лупой, чтобы убедиться в их однородности. Намеченную к вы-
делению колонию отмечают. Осторожно, слегка приоткрыв чашку,
не задевая близлежащие колонии, берут стерильной петлей не-
много материала из этой колонии и переносят в пробирку со ско-
шенным мясо-пептонным агаром. Выделение культур может быть
произведено также методом рассева на поверхности плотной пи-
тательной среды. Для этого питательный агар разливают за-
ранее в стерильные чашки
на поверхность ее (с од-
ного края чашки) вносят
петлей каплю посевного
материала (например, из
второго разведения) и вне-
сенный материал стериль-
ным шпателем размазыва-
ют по всей поверхности
агара. Затем сразу же этим
же шпателем, на поверх-
ности которого остались
отдельные клетки микро-
бов. делают тем же спо-
собом посевы на поверхно-
сти второй, а затем и тре-
тьей чашки. Рассев мате-
риала можно делать также
с помощью петли. В этом
случае единственная петля
посевного материала нано-
сится штрихами на поверх-
ность первой, второй и
третьей чашек без забора
нового материала. Посев делается определенным способом, как
показано на рис. 53. Следует помнить, что здесь особенно тщательно
надо следить за тем, чтобы крышка чашки Петри была приоткрыта
как можно меньше. При этом методе посевов все колонии выра-
стают на поверхности среды, глубинные колонии отсутствуют,
что облегчает рассмотрение колоний под микроскопом и выделение.
Каким бы путем ни были выделены чистые культуры, чистота
их должна быть проверена. IIз каждой полученной культуры
снова делают разведения, убеждаются в однородности развив-
шихся колоний и повторяют выделение.
Б и о л о г и ч е с к и е методы выделения к у л ь-
т у р. Биологические методы выделения чистых культур основаны
на различии свойств микробов и могут быть использованы лишь
в отдельных случаях. Чаще они используются для получения
чистых культур спорообразующих бактерий, находящихся в смеси
с неспорообразующими. Для этого выдерживают смешанные куль-
75
Для
Рис. 54. Держатель
пробирок.
туры некоторое время, чтобы закончилось спорообразование^
проверяют это микроскопически. Затем переносят часть материала
в пробирку со стерильной водой, тщательно размешивают и поме-
щают пробирку в водяную баню, поль-
зуясь специальным держателем (рис.
54), пли с кипящей водой и держат
2—3 мин., или с водой, имеющей тем-
пературу 80° С, и тогда держат 10 мин.
Вынутую пробирку немедленно поме
щают в воду комнатной температуры и
затем делают высевы на чашки с агаром.
В этом случае на чашках вырастают
колонии только из спор. Таким обра-
зом, развивается только спорообразую-
щий вид. Указанный способ исполь-
зуется, например, для выделения Clos-
tridium pasteurianum.
Биологический метод выделения мо-
жет быть использован для отделения
анаэробов от аэробов.
В ы д е л е н и е из о д п о й к л е т-
к и. Наибольшую уверенность в чи-
стоте культуры дает выделение из одной
клетки. Для этого пользуются специ
альнымп приборами — микроманипуля-
торами, которые позволяют провести захват одной клетки мик-
роскопической пипеткой под микроскопом (рис. 55). Во время
выделения микроорганизмы должны находиться во влажной ка-
Рис. 55. Схема положения пипетки при выделепии
одной клетки мпкроманппулятором (по Гусевой,
1956).
мере — в висячей капле. Захваченную микропипеткой клетку
переносят в жидкую питательную среду, где опа и прорастает.
Для этой цели может быть использован и другой прибор —
мпкроселектор Б. В. Перфильева (рис. 5(5). Для выделения одной
клетки жидкость, содержащую бактерии, насасывают в капилляр,
76
имеющий строго прямоугольное сечение. Строгая параллельность
стенок капилляра позволяет просматривать его при больших
увеличениях микроскопа. В капилляре отыскивают участок, где
находится одна клетка, и выламывают его специальным приспо-
соблением. Выломанный кусочек переводят в приемник, а оттуда
в питательную среду.
При выделении микробов, имеющих клетки крупных размеров,
например дрожжей, можно обойтись и без мпкроманипулятора.
Рис. 5G. Мпкроселектор Б. В. Перфильева (ио Перфильеву и Габе,
1961).
А — положение микроселсктора на столике микроскопа; Б — устройство микро-
селектора: 1 — микроселекторный столик, 2 — капилляр приемника, з —
защитная камера, 4 — рукоятка ударника, 5 — наружная трубка приемника,
6 — ушко для установки на микроскопе, 7 — П-образная пружина для
крепления покровного стекла, з — шаровой ввод приемника.
Из выделенной обычным способом культуры дрожжей готовят
последовательные разведенпя в стерильной солодовой жидкой
среде до тех пор, пока в маленькой капельке не будет находиться
одна клетка, что устанавливается под микроскопом. Имея такое
разведение, приступают к процессу выделения. Берут несколько
стерильных покровных стеклышек и последовательно на каждое
из них стерильным (прогретым в пламени) маленьким чертежным
пером наносят ряд капелек (рис. 57). Па предметное стекло с лу-
ночкой, вокруг которой нанесено тонкой кисточкой кольцо сте-
рилизованного вазелина, кладут покровное стеклышко капель-
77
ками вниз и прижимают его так, чтобы вазелин представлял
собой совершенно гладкую поверхность без каналов воздуха.
Капельки просматривают под микроскопом при небольшом уве-
личении и те из них, в которых находится одна дрожжевая клетка,
отмечают тушью. Отмеченные препараты помещают во влажную
камеру (в чашку Коха), на дно которой положена влажная филь-
тровальная бумага, и ставят в термостат. Когда разовьются ко-
лонии, занимающие почти всю каплю, их переносят платиновой
иглой пли кусочком стерильной фильтровальной бумаги в про-
Рис. 57. Нанесение капель при выделении чистой
культуры микроорганизмов из одной клетки (Л)
и заделка препарата (Б).
бирку со стерильным суслом. В итоге в руках исследователя
оказывается культура, представляющая собой потомство одной
клетки.
ОПРЕДЕЛЕНИЕ ВИДА БАКТЕРИИ
Определение вида бактерий начинают с изучения колонии,
затем выясняют морфологические, культуральные (характер роста
на различных средах) и физиологические признаки вида, а также
отношение микроба к некоторым красящим веществам.
Признаки, необходимые для характеристики выделенного
вида, внесены в следующую карточку:
78
Водоем .....................................
Биотоп, откуда выделен вид .................
Дата выделении .............................
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
21
22
23
Колония, Biieiiitinti вид, размеры.......
Вид колонии в профиль ...................
Морфология клетки........................
Размеры клеток ..........................
Цитология клетки: зерна метахромаiина,
включения жира, гликогена ..............
Подвижность..............................
Расположение жгутиков....................
Спорообразование ........................
Образование капсулы......................
Окраска по Граму.........................
Рост на МП В ............................
» » МПА .............................
Образование пигмента ....................
Рост на МП/К.............................
» » молоке ..........................
» » картофеле........................
Отношение к кислороду....................
Образование продуктов обмена:
сероводорода . . .......................
аммиака................................
индола ................................
Восстановление нитратов..................
Разложение жира..........................
» крахмала ..........................
Отиошсппе к температуре..................
Ферментация сахаров (обязательно при оп-
ределении видов группы кишечной па-
лочки) ................................
Использование источников азота...........
Колонии микробов, выросшие на чашках с твердой питатель-
ной средой, исследуют или с помощью бинокулярной лупы, или под
микроскопом с объективами малого увеличения. Отмечают скорость
роста, размеры колоний. Изучают их вид и строение. Эти признаки
являются существенными в определении вида (Красильников,
1949). Однако надо учитывать, что у одного и того же вида бак-
терий колонии могут быть неодинаковыми в различные периоды
роста и при выращивании их в разных условиях и даже при раз-
личной густоте посева.
Рост колоний может быть медленным или быстрым. Колонии,
вырастающие свободно (не в тесном контакте одни с другими),
могут быть крупных размеров (более 4—5 мм), средних (2—4 мм)
и мелких (1—2 мм). У некоторых микробов колонии очень мелки —
не более 1 мм. Их называют точечными. Форма колоний большей
частью характерна для вида микроба. Различают колонии круглые,
79
Рис. 58. Форма колоний.
Л — круглая; Ь’ — круглая с фестончатым краем; В — круглая с валиком по краю;
Г — ветвистая; Д — нитевидная; Е — с лучистым венцом; Ж — амебовидная; 3— кор-
невидная; II — складчатая; К — неправильная; Л — концентрическая; М — сложная.
A
Ь д
д
Рис. 59. Профиль колонии.
Колонии; Л — плоек ан; Б — выпукла?; В — каплевидная; Г — изогнутая;
Д — бугристая; Е — врастающая в агар; Ж — кратсровиднан.
Рис. 60. Структура колоний (по Clifton. 1950 и др.).
А — зернистая; Б — рассыпчатая; В, Г, Л — нитевидная.
6 А. Г. Родина
круглые с фестончатым краем, круглые с валиком по краю, вет-
вистые, нитевидные, амебовидные, корневидные, складчатые, не-
правильной формы, концентрические и сложные (рис. 58).
Поверхность колоний также отличается у разных видов. Она
может быть гладкой, исчерченной радиально, бугристой, морщи-
нистой, блестящей, тусклой, - жирной, шагреневой!, мучнистой.
Отличен профиль колоний у разных видов над поверхностью
плотной питательной среды. Различают колонии плоские, выпук-
лые, каплевидные, слабо изогнутые, круто изогнутые, кратеро-
видные, бугристые, врастающие в агар (рис. 59).
Колонии бактерий имеют характерную для каждого вида
структуру. Внутренняя структура может быть аморфной, мелко-
ь г д
ж
Рис. 61. Край колоний.
Л — гладкий; Г> волнистый; В — зубчатый; Г — лопастной; Д — неправильно изре-
занный; /•; реснитчатый; Я» — нитчатый; 3 — ворсинчатый; II — ветвистый; /Г - -
локонообразный.
зернистой, крупнозернистой, рассыпчатой, нитевидной. Последняя
может быть различной (рис. 60). В связи с 'различием струк-
туры колонии различен их край. Он может быть гладким, волни-
стым, лопастным, зубчатым, неправильно изрезанным, реснит-
чатым, ворсинчатым, нитчатым, ветвистым, локонообразным
(рис. 61).
Детальное изучение строения колоний может быть произведено
с помощью микротомных срезов; например, палочковидные бак-
терии могут располагаться в центре колонии вертикально, па
периферии горизонтально.
Изучение морфологии бактерии
Для определения вида бактерий должны быть изучены форма,
размеры и строение клеток.
Обычно учитывают следующие признаки: 1) форму клеток
(кокк, палочка — прямая, изогнутая, вибрион, спирилла);
2) характер взаимного расположения клеток (одиночные клетки,
соединенные попарно, нити, кубики); 3) размеры клеток (в ми-
кронах); 4) форму концов клеток (закругленные концы, срезанные
под углом, вогнутые); 5) наличие спор, их форму (круглая, эллип-
S2
совидная, продолговатая), размеры, расположение внутри клетки
(центральное, полярное), тип прорастания (экваториальное, косое,
полярное); 6) подвижность и типы жгутикования (один жгутик,
пучок, много жгутиков, расположение их — полярное, биполяр-
ное и по всей поверхности клетки); 7) налично или отсутствие
капсул; 8) цитологию клетки (зерна метахроматина, включения
жира, гликогена).
Изучение формы клеток
Форма клеток бактерий может быть лучше всего изучена ми-
кроскопией их в живом состоянии. Только в живом состоянии не
нарушаются истинная форма и величина микробной клетки. Вы-
Рис. 62. Деформация клетки при высушивании
(по Knausi, 1951).
Б — бактерия в живом состоянии; Бх — в высушен-
ном; С — предметное стекло.
сушпвание, как указывает ряд авторов (Knausi, 1951; Тимаков
и Гольдфарб, 1958), вызывает значительную деформацию бакте-
рий (рис. 02). При изучении формы клетки могут быть подкрашены
слабыми растворами красок (1 : 500. 1 : 5000). Наиболее пригод-
ными для этой цели являются метиленовая синяя и нейтральрот.
Иногда пользуются слабым раствором йода в йодистом калии.
При использовании слабых растворов красителей форма живых
клеток не нарушается.
При приготовлении препаратов надо обращать внимание на
величину капли, из которой готовится препарат. Жидкости должно
быть столько, чтобы она не выступала за пределы покровного
стекла. Чтобы устранить давление покровного стекла на клетки,
на предметное стекло до нанесения капли помещают тонкие во-
локонца ваты таким образом, чтобы края покровного стекла
легли на них.
Более совершенным способом изучения формы клеток является
метод висячей капли (описание приводится ниже). Зарисовка
с помощью рисовального аппарата или микрофотографирование
дают точное изображение формы клеток изучаемой культуры.
Измерение бактерий
Измерение бактерий (диаметра у кокков, длины и толщины
у других форм) производят в культурах определенного возраста
(с возрастом культуры размеры бактерий, а у многих видов и
6*
S3
форма клеток меняются), чаще всего для этого берут культуры
в возрасте 18—20 час. Измерение ведут, пользуясь окулярным
микрометром (рис. 63, Л), значение деления которого должно
быть определено. Для этого сопоставляют шкалу окулярного
микрометра с шкалой объектного микрометра, линеечка ко-
торого равна 1 мм и разделена на 100 частей. Следовательно,
одно деление объектного микрометра равно 0.01 мм, или 10 мк.
Объектный микрометр помещают на столик микроскопа и при
тех же увеличениях, при которых производят измерения микро-
Рис. 63. Окулярные микрометры.
А — обычный; Г> — винтовой: 1 — общий вид, 2 — пластинка
с перекрестием и рисками.
бов, определяют, сколько делений окулярного микрометра при-
дется на одно деление объектного микрометра. Так, если 1 деление
объектного микрометра соответствует 5 делениям окулярного,
то 1 деление окулярного микрометра при данных увеличениях
и установленном положении оптических систем равно 2 мк. Тогда
диаметр клетки, которая занимает 2 деления окулярного микро-
метра, равен 4 мк. По установлении значения деления в дальней-
шем пользуются ужо только окулярным микрометром, но всегда
при одном и том же увеличении микроскопа.
Волее точным инструментом для измерения бактерий является
винтовой окулярный микрометр (рис.‘63, />), имеющий диоптрий-
ную наводку и отсчетный механизм. В окуляре находятся непо-
движная шкала с ценой деления 1 мм и подвижная стеклянная
пластинка с перекрестием и индексом в виде рисок. Пластинка
с сеткой связана с точным микрометрическим винтом и переме-
щается от его вращения, причем целые миллиметры отсчитывают
по неподвижной шкале, а сотые доли миллиметра — по барабану
микрометрического винта. И здесь для определения измерения
линейного увеличения микроскопа используется объект-микро-
метр, и только после этого определения пользуются окуляр-
мпкрометром для измерения объектов.
84
Единицами измерения для микроорганизмов являются: ми-
крон (мк, или |1) = 1 /1000 мм = 10’в м, миллимикрон (ммк, или
тц) =1 юооооо мм=10-# м, ангстрем (A)=*/ю000000 мм=10'10 м.
Методы фиксации и окраски (фиксированных бактерий
Для исследования спорообразования, наличия капсул, жгу-
тиков, распределения в клетках метахроматина и других включе-
ний используются различные методы окраски фиксированных
тем или иным способом бактерий.
Методы фиксации бактерий. Очень часто
в исследованиях бактерий используется фиксация жаром (пре-
парат мазком вверх троекратно проводят через пламя — действие
пламени не должно йродол жаться более 2 сек.). Одпако все
больше накапливается данных о непригодности этого метода,
так как при нем происходит сморщивание клеток, повреждение
жгутиков (их отрыв от клеток), повреждение цитоплазмы. По-
этому следует пользоваться фиксацией химическими веществами.
Для приготовления препаратов пользуются чистыми, заранее
специально обработанными предметными стеклами.
Обработка стекол производится одйим из следующих способов:
1) стекла кипятят в 1?6-м растворе соды, затем промывают
сначала водой, затем слабым раствором соляной кислоты и снова
водой;
2) погружают па несколько суток в хромовую смесь, промывают
водой, затем слабым раствором едкого натра и снова водой; стекла
хранят или в 95с-м спирте в банках с притертыми пробками, или
в сухом виде в банках пли в чашках Коха.
Чистоту стекол можно проверить нанесением на них капли
воды — капля должна равномерно растекаться.
При приготовлении мазка на середину предметного стекла
наносят каплю стерильной водопроводной воды и затем стериль-
ной петлей вносят немного изучаемой культуры. Материал рас-
пределяют равномерно, стараясь, чтобы мазок был нетолстым.
Иногда для лучшего прикрепления бактерий на стекло наносят
тонкий слой смеси яичного белка и глицерина (1:1). Приготов-
ленные препараты высушивают и фиксируют. Применяются раз-
личные способы фиксации.
1. Фиксация этиловым спиртом. На препарат наносят 1 —
2 капли абсолютного спирта и дают им испариться. Может быть
использован и 95°-й спирт. В этом случае фиксация продолжается
15—20 мин.
2. Фиксация смесью Никифорова: этиловый спирт и эфир
(1 : 1). На препарат наносят 1—2 капли смеси и дают ей испа-
риться.
3. Фиксация парами формалина. Препарат помещают в чашку
Коха на подставку, па дно чашки помещают несколько маленьких
85
кусочков ваты, смоченных крепким, неразбавленным формали-
ном. Чашку закрывают и донышко слегка подогревают. На фик-
сацию требуется несколько минут.
4. Фиксация парами осмиевой кислоты. Препарат помещают
на подставку в шпрокогорлую банку с притертой пробкой, на
дно которой налит 1—2?6-й раствор осмиевой кислоты. Держат
препарат 5—10 мин.
5. Фиксация жидкостью Карнуа. Состав: ледяная уксусная
кислота — 10 мл, 96°-й этиловый спирт — 60 мл, хлороформ —
30 мл. Препарат погружают в жидкость на 15 мин.
Окраска фиксированных бактерий. Для
окраски фиксированных бактерий используются различные ани-
линовые краски. Их делят на 2 группы: основные и кислые.
Основные краски
Краевые
Нейтральная краевая
Сафранин 1
Фуксин
Пиронип
Зеленые
Малахитовая зеленая
Метиленовая зеленая
Янус зеленый
Фиолетовые
Генцианвнолет
Кристалл виол ет
Метилвиолет
Гематоксилин
Тионнн
Синие
Метиленовая синяя
Виктория
Толуидиновая синяя
Коричневые
Хризоидин
Везувии
Черные
Ин дул пн
1\ и слые крас к и
Красные и розовые*
Эритрозин
Эозин
Фуксин
Конгорот
Желтые
Аурантия
Пикриновая кислота
Флуоресцин
Черные
Нигрозин
Существует очень простой способ определения кислого или
основного характера краски. Для этого используют водные рас-
творы краски и полоски фильтровальной бумаги. Фильтроваль-
ная бумага всегда имеет отрицательный заряд, и при погружении
полосок в раствор краски красящее вещество будет распростра-
няться по бумаге выше уровня раствора только в том случае, если
оно обладает отрицательным зарядом (т. е. таким же, как и фильтро-
вальная бумага), когда краска кислая. При основной краске только
вода будет подниматься по бумаге выше уровня жидкости, мо-
лекулы красящего вещества окажутся фиксированными проти-
воположно заряженными частицами бумаги в части ее, находя-
щейся в растворе краски.
1 Существует много марок сафранинов, лучшим является сафранин О.
S6
Пэ красок обычно приготавливают вначале насыщенные спир-
товые растворы. Эти растворы не меняют свои свойства при дли-
тельном хранении. Для проведения окрасок готовят разбавленные
спиртовые растворы. Очень часто для приготовления красок
используются растворы фенола.
Наиболее часто в микробиологической практике используются
следующие краски.
Карболовый кристаллвиолет
Готовят 2 раствора:
1. Кристаллвиолет (90%-е содержание краски).......0.4 г
Этиловый спирт (95°-й) ......................... 10 мл
2. Фенол......................................... 1г
Дистиллированная вода...........................100 мл
Для употребления растворы смешивают.
Анилиновый «гепцианвиолст» Эрлиха
Готовят 2 раствора:
1. Кристаллвиолет (90%-с содержание краски)......1.2 г
Этиловый спирт (95°-й)............................12 мл
2. Анилиновая вода ................................. 2 »
Дистиллированная вода.............................98 »
Смешивают анилиновую воду с дистиллированной водой, дают
стоять несколько минут, затем фильтруют. Смешивают растворы
1 и 2.
Анилиновую воду готовят следующим образом: 4 г анилинового
масла (Anilinum purum) вносят в 100 мл дистиллированной воды
до получения гомогенной эмульсии. Фильтруют через смоченный
водой бумажный фильтр. Фильтрат должен быть прозрачным.
Карболовый фуксин Циля
Готовят 2 раствора:
1. Основной фуксин (90%-с содержание краски) .... 0.3 г
Этиловый спирт (95°-й).........................10 мл
2. Фенол.........................................5 г
Дистиллированная вода..........................95 мл
Растворы смешивают.
Щелочная метиленовая синяя Леффлера
Готовят 2 раствора:
1. Метиленовая синяя (90% -е содержание краски)...........0.3 г
Этиловый спирт (95°-й) .............................. 30 мл
2. Раствор КОИ (0.01 % по весу)...........................100 »
Растворы смешивают.
87
Метиленовая синяя в разведенном спирте 1
Метиленовая синяя (90%-е содержание краски) .... 0.3 г
Этиловый спирт (95°-й)..........................30 мл
Дистиллированная вода...........................100 »
Карболовая розовая бенгальская
Розовая бенгальская (90%-о содержание краски) . . 1г
Фенол (5%-й водный раствор)................... 100 мл
CaCL..........................................0.01—0.03 г
Количество хлористого кальция определяет интенсивность
окрашивания.
Карболовая синяя по Кюне
Метиленовая синяя.................................. 2 г
Этиловый спирт (95°-й).............................10 мл
Фенол.............................................. 2 г
Дистиллированная вода.............................100 мл
Приготовление: растирают в фарфоровой ступке краску с фе-
нолом и спиртом. Вливают смесь в банку с притертой пробкой и
оставляют па 24 часа. Через 24 часа доливают 100 мл дистиллиро-
ванной воды, хорошо взбалтывают и фильтруют.
Растворы нейтральном красной
Используются 1 —1.5?6-е водные растворы, для прижизненной
окраски — 0.5 %-й раствор в 0.85?6-м NaCl.
Раствор хризоидина
Хризоидин......................................... 2 г
Кипящая дистиллщюванная вода.................... 300 мл
Растворение краски проводят на бумажном фильтре, куда
насыпают отвешенную краску.
Для окраски надо иметь для растворов красок склянки с пи-
петками и резиновыми баллончиками, ванночки с подставками
для предметных стекол, сосуды для отмывания погружением,
промывалку и специальные пинцеты.
Определение подвижности бактерий и окраска жгутиков
Большое количество видов бактерий, обитающих в водоемах,
способно к самостоятельному движению. Движение бактерий осу-
ществляется главным образом при помощи жгутиков, представляю-
щих собой длинные, нитевидные, волнообразно изогнутые отрост-
ки. Длина жгутпков может быть очень значительна и во много
1 Способ приготовления этой краски и всех предыдущих дается по ру-
ководству Общества американских микробиологов (Manual of microbiologi-
cal methods, 1957).
88
раз может превышать длину клеток. Жгутики имеют, согласно
последним данным, постоянную толщину на протяжении большей
части своей длины. Многими исследователями было показано, что
жгутик своим проксимальным концом проходит через клеточную
Рис. 64. Расположение жгутиков на клетках бактерий.
А — моиотрихи; Б — лофотрихи; В — амфитрихи, Г — псрптрихи.
стенку и цитоплазматическую оболочку, начинаясь от базального
зерна, находящегося в цитоплазме.
По количеству жгутиков и их расположению на клетках раз-
личают моиотрихи — бактерии с одним жгутиком на одном из по-
36
36
Рпс. 65. Приготовление препарата для
изучения движения бактерий.
А — правильно приготовленная висячая капля, вид
сверху; Б — то же, вид сбоку; В — неправильно
приготовленная висячая капля.
люсов, лофотрихи — бактерии, имеющие пучок жгутиков на одном
конце клетки, перитрихи — бактерии с жгутиками по всей боковой
поверхности клеток (рис. G4). Некоторые авторы выделяют еще
группу амфитрихов — бактерий, имеющих жгутики на каждом из
полюсов; другие рассматривают их как две перазделпвшиеся
клетки, каждая с жгутиками на конце.
Исследование движения бактерий производится в висячей
капле на клетках из жидких культур, как молодых, так и зрелых.
Отмечают характер и быстроту движения.
80
На поверхность в центр покровного стеклышка наносят не-
большую плоскую капельку. Предметное стекло с луночкой
(рис. 65) подготовляют заранее, нанося вокруг луночки слой вазе-
лина или смеси вазелина с парафином. По нанесении капельки
покровное стеклышко поворачивают каплей вниз и накладывают
па луночку таким образом, чтобы капля свободно свисала в углуб-
лении, не касаясь пи дна, ни краев его. Стеклышко плотно прижи-
мают к вазелину и заделывают герметически снаружи воском или
коллодием.
Жгутики бактерий могут быть обнаружены и изучены или
в электронном микроскопе, или путем специальной обработки пре-
паратов. Наиболее полное представление о расположении жгути-
ков у бактерий может быть получено при использовании электрон-
ного микроскопа. При изучении жгутиков с помощью обычных
микроскопов используют различные протравы, осаждающиеся на
их поверхности и увеличивающие таким образом их объем, очень
малый — 0.002—0.003 мк в диаметре, в итоге чего они становятся
доступными для рассмотрения при больших увеличениях микро-
скопа.
При приготовлении препаратов для обнаружения жгутиков
необходимо соблюдение следующих условий: 1) все стекла дол-
жны быть абсолютно чисты и тщательно обезжирены, 2) культура
бактерий должна быть в стадии наибольшей подвижности (обычно
в возрасте 15—18 час.), 3) эмульсия должна приготовляться без
механического повреждения жгутиков.
Для приготовления препаратов берут новые стекла, лучше
жароустойчивые, и погружают их на 7—8 суток в свежеприготов-
ленную хромовую смесь, после чего промывают их дистиллирован-
ной водой и высушивают. Ни влажные, ни сухие стекла не берут
руками. Сухие стекла держат в закрытой стеклянной банке. По
Лейфсону (Leifson, 1951), стекла перед употреблением проводят
через бесцветную часть пламени бунзеновской горелки стороной,
которая будет использована, над пламенем.
Посев бактерпй для окраскп жгутиков лучше делать па агаре.
Неумелое приготовление препарата может повести к полпой потере
жгутиков. Материал для препарата берут с агара у конденсацион-
ной воды, т. е. там, где больше влаги, и переносят его в 1 мл сте-
рильной водопроводной воды, не стряхивая его, а осторожно по-
гружая петлю в воду. Процесс перенесения бактерпй повторяют
2—3 раза. Пробирку с бактериями оставляют стоять при комнат-
ной температуре 30—60 мин. На подготовленном стекле восковым
карандашом проводят две черты — одну с края, вторую в сере-
дине— для ограничения мазка. Капиллярной пипеткой берут
каплю культуры из пробирки и наносят ее на конец стекла. На-
клоняют стекло и дают капле медленно стекать к восковой черте.
Обычно наносят так 2 или 3 капли. Мазок высушивают при ком-
натной температуре и другим способом не фиксируют.
90
Способов окраски жгутиков предложено очень много. Здесь
приводятся некоторые из них, наиболее часто дающие хорошие
результаты.
Способы Лейфсона
1-й способ.
Готовят следующий состав:
Насыщенный иодный раствор NH4A1(SO4).2 • 12Но0 или
KA1(SO4)2 • 12Н2О....................". . . . 20 мл
Таллин (20%-й водный раствор).....................10 »
Дистиллированная вода.............................10 »
Этиловый спирт (95э-й)............................15 »
Насыщенный спиртовой раствор основного цлксина . . 3 »
Смешивают компоненты в указанном порядке. Раствор готов
к употреблению через педелю.
2-й способ.
Готовят 3 раствора:
1. Дистиллированная вода.........................100 мл
NaCl...........................................1.5 г
2. Дистиллированная вода.........................100 мл
Тапнип.........................................3.0 г
3. Основной фуксин ..............................1.2 »
Этиловый спирт (95э-й).........................100 мл
Растворы смешивают в равных пропорциях.
Процедура окраски: 1) готовят мазок; 2) наливают краску на
мазок и оставляют стоять 10 мпн. при комнатной температуре;
3) смывают водой и высушивают. Результаты: жгутики окраши-
ваются в красный цвет.
Способ серебрения по Морозову
Готовят 3 раствора:
1. Ледяная уксусная кислота........................ 1 мл
40%-й формалин................................... 2 »
Дистиллированная вода...........................100 »
2. Танпин.......................................... 5 г
Жидкая карболовая кислота........................ 1 мл
Дистиллированная вода . ........................100 »
3. Раствор азотнокислого серебра.
Раствор азотнокислого серебра готовят следующим образом:
1 г кристаллического азотнокислого серебра растворяют в 20 мл
дистиллированной воды. К раствору но каплям осторожно при-
бавляют раствор аммиака до исчезновения осадка и легкой опа-
лесценции раствора. Следует остерегаться введения избыточного
количества аммиака. В этом случае можно приготовить дополни-
тельно небольшое количество раствора азотнокислого серебра и
по каплям добавить его к раствору до слабой опалесценции. Го-
товый раствор разводят дистиллированной водой в 10 раз.
91
Процедура окраски: 1) готовят мазок; 2) наливают на мазок-
раствор 1, держат 1 мин., сливают и промывают мазок водой;
3) наливают на мазок раствор 2 и подогревают до появления пара,
после чего раствор сливают и препарат промывают водой; 4) на-
ливают на мазок раствор 3 и подогревают на слабом пламени в те-
чение 1—2 мин. до появления темно-коричневой окраски, тогда
промывают и высушивают. Результаты: утолщенные азотнокислым
серебром жгутики становятся хорошо видны.
Способ Грея
Готовят 2 раствора:
1. KA1(SO4)2 • 12Н2О (насыщенный водный раствор) . . 5 мл
Танпип (20% -й водный раствор)1...................2 »
HgCl2 (насыщенный водный раствор)...............2 »
2. Основной фуксин (насыщенный спиртовой раствор) . . 0.4 »
Смешивают растворы 1 и 2 за 10—15 час. перед употреблением.
После соединения они быстро портятся.
Процедура окраски: 1) готовят мазок; 2) наливают на мазок
свежепрофильтровапную смесь растворов и оставляют на 8—
10 мип.; 3) промывают дистиллированной водой; 4) наливают па
мазок раствор фуксина и оставляют стоять 5 мин. без нагре-
вания; 5) промывают водой; 6) высушивают и последуют.
Жгутики могут быть обнаружены в люминесцентном микро-
скопе (Bukatsch, 1958) в естественном состоянии. Для этого
в каплю культуры вносят каплю флуорохрома (или водного рас-
твора аурамипа 1 : 1000, илп карболового берберинсульфата
1 : 1000). Карболовый берберписульфат готовят путем добавления
водного раствора берберипсульфата 1 : 1000 к насыщенному рас-
твору фенола. При обработке аурамином клетки и жгутики све-
тятся золотисто-желтым светом, при обработке карболовым бербе-
ринсульфатом — зеленовато-желтоватым.
Подвижность бактерий может быть установлена на полужидких
средах. Среды разливают в пробирки, посев делают тонкой иг-
лой — уколом. У подвижных бактерий рост отмечается в виде
облачка вокруг укола, неподвижные растут только по уколу.
Могут быть использованы различные полужидкие среды.
Пептонный агар
Водопроводная вода .............................. 1000 мл
Пептон............................................. 10 г
Агар................................................ 5 »
Среда должна быть прозрачной, для чего ее фильтруют
дважды через плотный бумажный фильтр.
1 Если раствора ташпша готовят много, то для сохранения его прибав-
ляют несколько капель хлороформа.
92
Мясо-понтонный агар
Дистиллированная вода...............................1000 мл
Пептон...............................................10 г
Мясной экстракт.................................. 1.5 »
NaCl................................................. 2 »
Агар................................................. 5 »
Устанавливают pH 7.2 насыщенным раствором NaIICO3.
Среды разливают в пробирки по 5—7 мл и стерилизуют при
110° С 15 мин.
Мясо-нентопнын агар с желатиной
Готовят 2 раствора:
1. Водопроводная вода.............................. 400 мл
Пепгон............................................ 10 г
Мясной экстракт..................................... 3 »
NaCl............................................... 2 »
Агар............................................... 4 »
2. Водопроводная вода...............................000 мл
Желатина.......................................... 80 г
По растворении ингредиентов растворы сливают вместе, уста-
навливают pH 7.2, среду фильтруют и разливают.
Окраска по Граму
Окраска микробов по Граму — важный диагностический при-
знак. Она связана с наличием в клетках рибонуклеиновой
кислоты — определенной химической! структуры, являющейся
грамположительной субстанцией (Bartholomew, 1962), и таким об-
разом выявляет специфику протоплазматических белков. Все бакте-
рии делятся на грамположптельные и грамотрицательные. Грам-
положптельные отличаются от грамотрицательных целым рядом
свойств (табл. 3). Существуют основной способ окраски по Граму
и различные его модификации. Используются современные моди-
фикации основного метода.
Модификация метода Грама Бартоломью (Bartholomew, 1962)
Необходимые реактивы:
1. Кристаллвиолет Хакера. Готовят смешенном двух растворов:
А. Кристаллвиолет (96%-е содержание краски)..................2 г
Этиловый спирт (95°-й) ...................................20 мл
Б. Щавелевокислый аммоний....................................0.8 г
Дистиллированная вода.....................................80 мл
Смешивают растворы А и Б и дают стоять 48 час. Раствор затем может
сохраняться месяцами.
2. Раствор йода по Бурке. Готовят разведением основного раствора Бурке ди-
стиллированной водой (1:2).
Основной раствор готовят следующим образом: 2 г KJ помещают в фар-
форовую ступку, прибавляют 1 г йода, растирают пестиком 5—10 сек. При-
93
Таблица 3
Свойства грамноложительных и грамотрицательных бактерий
(по Lamanna et Mallcte, 1953; Тимакову ц Гольдфарбу, 1958)
Грамположительпые 1'рамотрн нательные
Изоэлектрическая точ- ка при pH. Отношение к действию протеолитических фер- ментов. Отношение к щелочам. Чувствительность к ос- новным краскам. Спорообразование. pH оптимального роста. Ба ктериос та ти чсское действие йода. Требования к пита- тельным веществам. Проницаемость для кра- сок в живом состоя- нии. Кислотоустойчивое Г!>. Растворимость липидов в растворителях? Чувствительность к ан- тибиотикам. 2-3 Резистентны. Резистентны, не рас- творяются в 1%-м КОН. Очень высокая. Часто образуют споры. Относительно высокое. Рост угнетается йодом. Сложные. Более проницаемы. Более устойчивы. Устойчивы. Чувствительны к гра- мицидину и пени- циллину. Около 4—5. Чувствительны. Нерезистентиы, рас- творимы. Значительно меныпая. Редко образуют споры. При кислотных зна- чениях. Менее чувствительны к действию йода. Относительно более простые, многие ви- ды — автотрофы. Менее проницаемы. Менее устойчивы. Менее устойчивы. Более чувствительны к стрептомицину.
бавляют 1 мл воды и растирают, добавляют 5 мл воды и снова растирают. Под
и йодистый калий должны быть в растворе. Прибавляют 10 мл воды и смеши-
вают. Переносят смесь в склянку для краски, ополаскивают водой пестик и
ступку, сливают эту воду туда же и доводят объем до 100 мл. Этот раствор
устойчив и сохраняется месяцами.
3. Раствор сафранина: 2.5% -й раствор краски в 95° -м этиловом спирте разводится
дистиллированной водой в отношении 1 : 10.
Процедура окраски: 1) готовят тонкий мазок, фиксируют его;
2) па мазок наливают кристаллвиолет (лучше сначала положить
фильтровальную бумагу) и оставляют на 1 мин.; 3) удаляют филь-
тровальную бумагу, смывают излишнюю краску погружением
стекла на 5 сек. в сосуд с 250 мл воды (вода в сосуде должна все
время замещаться текущей со скоростью 30 мл сек. водой); 4) уда-
ляют избыток воды раствором Бурке, затем наливают на мазок
раствор Бурке на 1 мип.; 5) промывают 5 сек. водой, как указано
выше; (i) помещают стекло в сосуд для дифференцирования (лучшие
результаты дифференцирования, по Бартоломью, дает и-пропило-
94
вый спирт; время и необходимые реактивы приведены в табл. 4);
7) промывают 5 сек. водой, как указано выше; 8) удаляют избы-
ток воды 0.25 %-м раствором сафранина, затем наливают на стекло
раствор и красят 1 мин.; 9) промывают 5 сек. водой, высушивают
Таблица \
Рс1хО.менд)е.м<ю время для дифференцирования
в различных жидкостях (по Bartholomew, 1962)
Дифференцирующая жидкость Рекомендуемое дли дифферен- цирования время (в сек.) Пределы требуе- мого для диффе- ренцирования времени (в сек.)
/4-Проппловый спирт 180 30-1800
95°-й н-нропиловый спирт .... 90 15-360
95°-й этиловый спирт 90 15-180
Ацетон 45 5-120
и исследуют. Результаты: грамположительные бактерии синие,,
грамотрицательные — красные.
Процедура дифференцирования производится в 3 вертикаль-
ных сосудах (75 X 25 мм). В каждом сосуде препарат выдерживается
Ч3 общего времени. Рекомендуется слегка двигать стекло, пока
оно находится в сосудах.
Модификация метода Грама Хакера
1 {еобходпмые реактивы:
1. Кристаллвполет Хакера (приготовление см. выше).
2. Раствор Люголя: йод кристаллический — 1г, йодистый калий — 2 гг
вода дистиллированная — 300 мл.
3. Раствор сафранина (приготовление см. выше).
Процедура окраски: 1) тонкий мазок фиксируют на пламени
спиртовки; 2) окрашивают кристаллвиолетом в течение минуты;
3) промывают водопроводной водой не более 2 сек.; 4) погружают
па 1 мин. в раствор йода; 5) промывают водой и удаляют воду
с мазка фильтровальной бумагой; 6) обесцвечивают в 95°-м этиловом
спирте 0.5 мин.,слегка двигая препарат; 7) окрашивают 10 сек.
в растворе сафранина; 8) промывают в водопроводной воде и вы-
сушивают. Результаты: грамположительные бактерии сине-фиоле-
товые, грамотрицательные — красные.
Основной способ окраски по Граму (современная модификация) Д
Необходимые реактивы:
1, Карболовый генцпанвполет: 1 г краски растворяют в 10 мл спирта и по-
лученный раствор выливают в 100 мл 5%-го раствора очищенной карбо-
ловой кислоты.
95
2. Раствор Люголя: йодистый калий — 2 г, йод кристаллический — 1г,
вода дистиллированная — 300 мл.
Так как йод нерастворим в воде, то для приготовления указанного
раствора сначала растворяют 2 г йодистого калия в 5 мл воды, затем в этом
растворе 1 г йода и лишь по растворении его доливают водой до 300 мл.
3. Раствор контрастной краски: разведенный фуксин Циля (1 мл краски на
19 мл дистиллированной воды), или 1%-й водный раствор нейтральрота,
или 0.5—1%-й водный раствор эозина.
Процедура окраски: 1) готовят мазок из суточной культуры,
мазок должен быть тонким, толщина его не должна быть больше
толщины одной клетки; результат окраски может быть иным в за-
висимости от толщины мазка; мазок фиксируют проведением
стекла через пламя горелки; 2) на фиксированный мазок кладут
фильтровальную бумагу и наливают раствор гепцпанвполета
на 1—2 мин.; 3) снимают бумагу, сливают избыток краски и, не
промывая водой, наливают на препарат раствор Люголя, который
держат на препарате 1 мин., затем сливают; 4) опускают препарат
на 0.5—1 мин. в 95°-й этиловый спирт; 5) после обесцвечивания
препарат ополаскивают водой; 6) окрашивают дополнительно мазок
в течение 1—2 мин. сильно разведенным раствором краски — или
фуксина, пли нейтральной красной, или сафранина. Красящиеся по
Граму бактерии сохраняют основную окраску фиолетового цвета
различной интенсивности, а грамотрицательные виды принимают
дополнительную окраску красного цвета.
Для уверенности в правильном проведении окраски В. Л. Оме-
лянский рекомендует следующий прием. На предметное стекло на-
носят рядом 3 мазка: один заведомо красящегося по Граму вида,
другой пекрасящегося, третий исследуемого. В правильности
окраски убеждаются по виду двух контрольных мазков.
Модификация Бурке и Копелева—Бирмана
По Бурке используются следующие растворы:
1. Л. Генциан- или кристаллвиолет.................. 1г
Дистиллированная вода.......................100 мл
Б. NaHCO3....................................... 1г
Дистиллированная вода.......................20 мл
2. Раствор йода: J — 1 г, KJ -- 2 г, дистиллированная
вода — 100 мл.
3. Раствор 2 г сафранина 0 в 100 мл дистиллированной
воды.
По Копелеву и Бирману:
1. Те же 2 основных раствора (А и Б).
2. Раствор йода: J — 2 г, нормальный раствор NaOH (40.01 г/л) — 10 мл. После
растворения йода раствор доводят дистиллированной водой до 100 мл.
3. Смесь эфира с ацетоном (1 : 1 или 1:3).
4. Дополнительная краска: основной фуксин — 0.1 г, дистиллированная
вода — 100 мл.
Процедура окраски: 1) готовят тонкий мазок и высушивают
его на воздухе без подогрева; 2) наливают раствор А, добавляют
96
2—3 капли раствора Б (или более — в зависимости от площади
мазка), смешивают оба раствора на стекле и окрашивают 2—
3 мин.; Копелев и Бирман рекомендуют смешпвать растворы за-
ранее (1.5 мл А и 0.4 мл Б) и окрашивают 5 мпн.; 3) споласкивают
мазок тем или другим раствором йода, наливают этот раствор на
мазок и оставляют стоять 2 мин.; 4) споласкивают водопроводной
водой, удаляют воду с поверхности мазка фильтровальной бума-
гой — без высушивания (на этот момент окраски следует обратить
внимание — клетки не должны стать сухими); 5) быстро обесцве-
чивают в смеси эфира с ацетоном, добавляя на стекло каплю за
каплей, пока практически никакой краски не будет в стекающих
каплях — обычно менее 10 сек. (скорость обесцвечивания зависит
от соотношения эфира и ацетона: чем больше ацетона, тем скорее
идет процесс, для более медленного обесцвечивания употребляют
с^тесь эфира с ацетоном в отношении 1 : 1); 6) мазок высушивают
на воздухе; 7) окрашивают дополнительно 5—10 сек., лучше рас-
твором сафранина; 8) промывают в водопроводной воде и высу-
шивают. Результаты: грамположительные бактерии сине-фиоле-
товые, грамотрицательные — красные.
При окрашивании по Граму неизвестной культуры нельзя
обойтись одним способом окраски. Должны быть использованы
разные способы. Кроме того, культуры могут быть засеяны штри-
хом на чашки с агаром, содержащим или пчелиный яд, или ген-
цианвиолет, что позволит получить дополнительную характери-
стику культур.
Па твердых питательных средах (Ortel, 1957), содержащих
в 1 мл от 0.6 до 1 мкг пчелиного яда, вырастают только грамотрп-
цатсльные бактерии. Внесение в молодую культуру в жидкой!
среде (в возрасте до 20 час.) пчелиного яда в концентрации 6—
10 мкг/мл вызывает, по данным Ортеля, отмирание грамположи-
тельных бактерий, и высев на обычные среды дает рост только грам-
отрицательпых бактерий.
Может быть использована среда с гепцианвиолетом в разведе-
нии 1 : 1 000 000. Грамположительные бактерии не должны
расти на агаре, содержащем краску этой концентрации, а грамот-
рицательные бактерии растут. Но и грамположительные бакте-
рии растут на среде с генциапвиолетом, если концентрация его
ниже 1 : 5 000 000, поэтому надо, чтобы концентрация краски
была не менее 1 : 1 000 000.
Изучение спорообразования и окраска спор
Спорообразование наблюдается почти исключительно у палоч-
ковидных бактерий, из кокковых форм известен лишь один обра-
зующий споры вид — Sarcina ureae Масе.
Для диагностики видов наибольшее значение имеют (по Кра-
сильникову, 1949) форма спор, поперечник клеток, способ обра-
7 А. Г. Родина
97
зования и место расположения спор: формируются ли споры
в центре клетки пли на конце, раздуваются ли при этом клетки
или нет (рис. 66). Должен быть выяснен и тип прорастания спор
(полярное, когда спора прорастает па одном конце; биполярное,
когда прорастание происходит с обоих концов; экваториальное,
когда проросток выходит пз середины; косое, когда проросток
А
О О О о р
Рис. 66. Расположение спор в клетках (Л) и типы их
прорастания (Б).
Б: 1 — полярное; 2 — экваториальное; з — косое.
выходит сбоку). Отмечают, как происходит прорастание — со
сбрасыванием или без сбрасывания оболочек. Так, например,
споры сенпоп палочки (Bacillus subtilis Cohn) имеют овальную
форму, расположены в клетках эксцентрально без строгой лока-
лизации, размеры их таковы, что деформации материнских кле-
ток не наблюдается (рис. 67, Л), прорастание их экваториальное.
У бациллы мочки льна (Clostridium pectiiiovorum Winogr. et
Frib.) споры округлые, довольно крупные, располагаются тер-
минально, концы клеток при спорообразовании раздуваются
(рис. 67, Б). Споры прорастают полярно.
98
Споры имеют толстые оболочки, состоящие из двух слоев:
наружного и внутреннего. Наружный слой оболочки защищает
спору от внешних воздействий, из внутреннего при прорастании
образуется оболочка клетки. Споры отличаются по химическому со-
ставу от бактериальных клеток прежде всего относительно малой
концентрацией воды и высоким содержанием липидов. Благодаря
этому и наличию толстой двуслойной оболочки споры могут сохра-
няться жизнеспособными в течение длительного времени и проти-
востоять воздействию неблагоприятных физических и химиче-
ских факторов. Так, температура 100° С обычно ие убивает спор.
Для этого нужен пар при температуре 120° С.
Рис. G7. Клетки спорообразующпх бактерий со
спорами.
Л — Bacillus subtilis (Ehrenberg) Cohn; Б — Clostridium
pcctinovorum Winogr. et Frib.
Споры прорастают при попадании в оптимальные условия су-
ществования. Процесс прорастания начинается с набухания, био-
химические процессы в споре активизируются. Наружная оболочка
лопается, и из нее выходит проросток. Процесс прорастания
споры протекает несколько часов (4—5).
Толстая оболочка спор является причиной того, что споры
трудно воспринимают окраску и трудно отдают краску обратно.
Споры внутри бактерий можно обнаружить простым исследова-
нием неокрашенного препарата при суженной диафрагме осве-
тителя, благодаря тому что они значительно сильнее преломляют
свет, чем протоплазма клеток. Если же таким путем установить
ясно наличие споры не удается, тогда можно прибегнуть к методу
окраски.
Существует несколько методов дифференциальной окраски
клеток, содержащих споры. Для окраски спор употребляют спль-
иокрасящие растворы и нагревание при окраске. Чаще всего для
этой цели используют карболовый фуксин.
Старый способ приготовления краски
Насыщенный раствор основного фуксппа............10 мл
5%-й раствор карболовой кислоты................100 »
7*
99
Современный способ приготовления краски
Готовят 2 раствора:
1. Основной фуксин.............................0.3 г
Этиловый спирт (95°-й)......................10 мл
2. Фенол.......................................5 г
Дистиллированная вода.......................95 мл
Соединяют растворы.
Процедура окраски: 1) готовят на стекле мазок, подсушивают
его п накрывают кусочком фильтровальной бумаги; 2) наливают
свежепрофильтроваппую краску на фильтровальную бумагу;
3) препарат с краской нагревают до появления пара и держат
так 5—10 мни., по мере испарения доливают краску, не допуская
высыхания препарата; 4) сливают избыток краски и промывают
препарат водой; 5) погружают препарат для обесцвечивания
плазмы в 1—5 %-ю серную кислоту или 33°-й этиловый спирт (время,
необходимое для обесцвечивания, колеблется от секунд до несколь-
ких минут и зависит от особенностей препарата; обесцвечивание
надо прервать в тот момент, когда обесцветилась плазма, но не на-
чалось обесцвечивание спор; срок этот устанавливается в каждом
случае эмпирически); (5) препарат промывают водой; 7) произво-
дят дополнительное окрашивание раствором метиленовой синей
(100 мл дистиллированной воды, 30 мл насыщенного спиртового
раствора краски и 1 мл 1%-го раствора едкого калия), окрашива-
ние продолжается 1—2 мин.; 8) препарат затем промывают и вы-
сушивают. Результаты: споры окрашиваются в красный цвет,
клетки бактерий в синий.
Вторая часть окраски, начиная с пункта 4, может быть произ-
ведена иначе. Для чистоты препарата его погружают на мгнове-
ние в 95°-й этиловый спирт. Промывают препарат водой. Наносят
на мазок каплю насыщенного водного раствора нигрозина (водно-
растворимого нигрозина — 10 г, дистиллированной воды —
100 мл, выдерживают в кипящей водяной бане 30 мин., прибав-
ляют 0.5% формалина и фильтруют дважды через двойной бумаж-
ный фильтр), распределяя краску равномерно. Быстро высуши-
вают при осторожном нагревании без предшествующего промыва-
ния. Результаты: споры красные, вегетативные клетки неокрашен-
ные, фон серый.
Выявление наличия спор путем флуорохромирования —
способ Хагемана
Процедура окраски: 1) готовят мазок, фиксируют его на пла-
мени спиртовки; 2) наливают на мазок на 1—2 мин. водный рас-
твор бриллиантсульфофлавипа (1 : 400), к которому добавлено
0.5 мл жидкой карболовой кислоты; 3) промывают тщательно во-
дой; 4) окрашивают 40 сек. водным раствором корифосфина
(1 : 1000); 5) промывают водой, высушивают на воздухе и иссле-
100
дуют в люминесцентном микроскопе. Результаты: споры флуорес-
цируют зелено-желтым светом, вегетативные клетки — красным.
Окраска капсул
Некоторые виды бактерий образуют вокруг своих клеток кап-
сулы слизистой консистенции, состоящие из сложных полисаха-
ридов и глюкопротеидов. Слизистые капсулы образуются клет-
ками чаще прп большом содержании в среде углеводов п малом со-
держании азотных соединений.
Капсулы бактерий в неокрашенных препаратах обнаружи-
ваются в виде светлой каймы вокруг клеток. Однако прп установ-
лении наличия капсул и окраске их эти бактериальные образова-
ния могут быть более легко спутаны с артефактами, чем другие
структуры. Так, например, при окраске бактерий могут остаться
неокрашенными узкие области вокруг клеток, которые и могут
быть признаны за капсулы. Поэтому лучший метод установления
наличия капсул — дифференциальные окраски, при которых раз-
лично окрашиваются сама клетка и ее капсула.
Способ Антони в модификации Тейлера
Готовят 2 раствора:
1. Кристаллвиолет.............................. 0.1 г
Ледяная уксусная кислота .................... 0.25 мл
Дистиллированная вода........................100 »
2. CuSO, • 5Н2О................................ 20 г
Дистиллированная вода........................100 мл
Процедура окраски: 1) готовят мазок и высушивают его на
воздухе; 2) окрашивают мазок 4—7 мин. раствором 1; 3) промы-
вают раствором 2; 4) подсушивают и исследуют. Результаты: клетки
бактерий темпо-синие, капсулы сине-лиловые.
Способ Оэдлянского
Готовят раствор карболового фуксина:
Насыщенный спиртовой раствор фуксина .......10 мл
5°о-й раствор карболовой кислоты............100 »
Разводят раствор дистиллированной водой в отношении 1:1.
Процедура окраски: 1) наносят на предметное стекло каплю
разбавленного водой карболового фуксина и вносят в псе каплю
культуры; 2) через 2—3 мин. прибавляют немного жидкой туши,
тщательно смешивают и размазывают по стеклу; накрывают по-
кровным стеклом и исследуют. Результаты: клетки бактерий крас-
ного цвета, капсулы бесцветные, четко видны на темном фоне пре-
парата. Вместо жидкой туши может быть использован 10%-й
раствор колларгола.
101
Способ Клетта
Готовят растворы красок:
1. Метиленовая синяя ............................ 1г
Этиловый спирт (95°-й)..........................10 мл
Дистиллированная вода...........................100 »
2. Фуксин........................................ 1г
Этиловый спирт (95°-й)..........................10 мл
Дистиллированная вода............................100»
Процедура окраски: 1) готовят препарат, высушивают его
па воздухе; 2) окрашивают кипящим раствором метиленовой си-
ней 1 мин.; 3) промывают водой; 4) окрашивают в течение 5 сек.
раствором фуксина; 5) споласкивают водой, высушивают и иссле-
дуют. Результаты: клетки бактерий синие, капсулы розовые.
Окраска включений в протоплазме бактерий
Окраска зорен метахроматина. Зерна мета-
хроматина (волютина) находятся в клетках многих бактерий. Пх
образованию содействует наличие в среде фосфорных соединений.
Для выявления наличия в клетках зерен метахроматина предло-
жено много способов.
Метод Леффлера
Готовят раствор краски:
Насыщенный раствор метиленовой синей.....30 мл
Раствор КОН (1 : 10 000)............... 100 »
Процедура окраски: 1) готовят мазок из культуры, имеющей
возраст 18—24 часа; 2) фиксируют жаром; 3) заливают мазок
краской и оставляют стоять 2—3 мин.; 4) промывают водой, вы-
сушивают и исследуют. Результаты: зерна метахроматина окра-
шиваются в синий цвет.
Метод Нейссера
Для окраски по этому методу готовят следующие 2 раствора:
1.А. Метиленовая синяя ......................... 1г
Этиловый спирт (95°-й).................... 20 мл
Ледяная уксусная кислота.................. 50 »
Дистиллированная вода .......................До 1000 »
Г>. Кристаллвиолет............................. 1г
Этиловый спирт (95°-й).................... 10 мл
Дистиллированная вода.......................... . 300 »
Перед употреблением растворы А и Б смешивают в пропор-
ции 2:1.
2. Хризоидин ........................................ 1г
Горячая дистиллированная вода.................. 300 мл
102
Процедура окраски: 1) готовят мазок и фиксируют его жаром;
2) наливают на мазок раствор 1 и оставляют его на 5мин.; 3) сли-
вают раствор 1, промывают водой и высушивают мазок фильтро-
вальной бумагой; 4) наливают на мазок раствор 2 на 1 мин;
5) промывают водой, высушивают и исследуют. Результаты:
зерна метахроматина окрашиваются в черно-сипий цвет, плазма
клеток желтая.
Видоизмененный метод Нейссера
Готовят 2 раствора:
1. Метиленовая синяя ............................ 0.1 г
Абсолютный спирт............................... 2 мл
Ледяная уксусная кислота......................... 5 »
Дистиллированная вода............................95 »
Растворяют краску в- спирту и приливают ее к раствору ук-
сусной кислоты.
2. Хризоидин пли бисмаркбрауп........................ 2 г
Горячая дистиллированная вода.................... 300 мл
Растворяют краску в горячей воде и фильтруют через плот-
ный бумажный фильтр.
Процедура окраски: 1) готовят мазок, высушивают на воздухе
и фиксируют жаром; 2) наливают на мазок раствор 1 па 1 мин.;
3) промывают водой; 4) наливают на мазок раствор 2 на 1 мин.;
5) промывают водой и высушивают. Результаты: зерна мотахро-
матина черно-синие, плазма клеток желто-коричневая.
хМетод Альберта
Гбговят 2 раствора:
1. Толуидиновая синяя.............................0.15 г
Малахитовая зеленая..............................0.2 »
Ледяная уксусная кислота.......................... 1 мл
Этиловый спирт (85°-й)............................ 2 »
Дистиллированная вода............................100 »
2. J................................................ 2 г
KJ................................................ 3 »
Дистиллированная вода........................... 200 мл
Процедура окраски: 1) готовят мазок, фиксируют его жаром;
2) наливают па мазок раствор 1, оставляют на 5 мин.; 3) сливают
краску, но не промывают мазок; 4) держат стекло почти верти-
кально и несколькими каплями раствора 2 промывают мазок,
покрывают мазок раствором 2 и оставляют на 1 мин.; 5) споласки-
вают водой, высушивают и исследуют. Результаты: зерна мета-
хроматина черные, плазма клеток зеленая.
103
Метод Мейера (по Тимакову и Гольдфарбу, 1958)
Готовят растворы:
1. Метиленовая синяя Леффлера.
2. 1%-й раствор серной кислоты.
3. 4%-й водный раствор углекислого калия (К2СО3).
Процедура окраски: 1) готовят два мазка, одпн обозначают
буквой К, второй — буквой Щ, фиксируют жаром; 2) окрашивают
мазки метиленовой синей Леффлера в течение 10 мин.; 3) препа-
рат, обозначенный буквой К, опускают на 5 мин. в раствор серной
кислоты, препарат 1Ц обрабатывают в течение того же времени
в растворе углекислого калия; 4) препараты высушивают без про-
мывания; 5) докрашивают препараты 0.25%-м раствором лихт-
грюна с 2—3 каплями крепкой уксусной кислоты. Результаты:
в препарате К зерна мстахроматпна окрашены в вишнево-красный
цвет, плазма клеток зеленая; в препарате Щ метахроматин обесцве-
чивается и частично растворяется, почему на месте его оказываются
неприкрашенные участки.
Метод Омелянского
Необходимы следующие растворы:
1. Карболовый фуксин Циля (приготовление см. стр. 87).
2. 1%-й раствор серной кислоты.
3. Раствор метиленовой синей (1 мл насыщенного спиртового рас-
твора краски на 40 мл дистиллированной воды).
Процедура окраски: 1) готовят мазок, высушивают его и
фиксируют жаром; 2) наливают на мазок карболовый фуксин
Циля и оставляют на 0.5—1 мин.; 3) промывают водой и обесцве-
чивают в течение 20—30 сек. раствором серной кислоты; 4) про-
мывают водой и окрашивают метиленовой синей 15—20 сек.;
5) промывают водой, высушивают, заделывают в глицерин и ис-
следуют. Результаты: зерна метахроматина красные, плазма кле-
ток синяя.
Окраска гликогена. Гликоген относится к запас-
ным питательным веществам клетки, он близок к крахмалу. Для
гликогена характерна окраска йодом в красно-бурый цвет.
11еобходимые реактивы:
1. Раствор йода в йодистом калии:
J................................................. 7 г
KJ............................................... 20 г
Дистиллированная вода............................100 мл
2. Смесь эфира со спиртом (1 : 1).
Процедура окраски: 1) готовят мазок, 2) обрабатывают рас-
твором 2 5 —10 мни.; 3) наливают раствор йода, накрывают
104
покровным стеклом и исследуют. Результаты: зернышки гли-
когена окрашиваются в красно-бурый цвет. Обработка смесью
спирта с эфиром необходима, так как жпр дает окраску с иодом,
близкую к окраске гликогена.
Окраска жира. Включения жира встречаются в клет-
ках многих бактерии и дрожжей. Они могут быть обнаружены
различными способами.
Метод В. Л. Омел янского (растворение хлоралгидратом)
Готовят 2 раствора:
1. Хлоралгидрат..................................... 5 г
Дистиллированная вода........................... 2 мл
2. Насыщенный спиртовой раствор метиленовой синей. . 1 »
Дистиллированная вода...........................40 »
Процедура окраски: 1) готовят мазок, фиксируют 40%-м
формалином, высушивают; 2) наливают на мазок раствор хлорал-
гидрата и выдерживают его на мазке 3—5 мин.; 3) промывают
водой; 4) окрашивают 1 мин. раствором метиленовой синей;
5) промывают, высушивают и исследуют. Результаты: протоплазма
окрашена в сиппй цвет, неокрашенными остаются места, где были
капельки жира.
Окраска включений жира Суданом III
Готовят раствор:
Судан 111.........................................0.05 г
Концентрированная молочная кислота................10 мл
Процедура окраски: 1) готовят густой мазок; 2) добавляют
каплю формалина (40?о-го) и оставляют стоять 5 мин.;3) добав-
ляют каплю метиленовой синей (1 : 10) и оставляют на 5 мин.;
4) добавляют каплю раствора Судана и оставляют на 5 мин.;
5) накрывают покровным стеклом и исследуют. Результаты: про-
топлазма клеток синяя, капли жира оранжевые.
Окраска черным Суданом
Готовят растворы:
1. Черный Судан В................................0.3 г
Этиловый спирт (70°-и)........................100 мл
2. Сафранин......................................1.5г
Дистиллированная вода.........................50 мл
Сафранин растворяют в кипящей воде и по охлаждении филь-
труют.
Процедура окраски: 1) готовят мазок из культуры в возрасте
1 сутки, фиксируют пламенем спиртовки; 2) наливают краску на
мазок, оставляют стоять при комнатной температуре 10—15 мин.;
3) споласкивают препарат, добавляют каплю раствора сафранина
105
и оставляют на 5 мин.; 4) споласкивают препарат, высушивают и
исследуют. Результаты: протоплазма розовая, капли жира чер-
ные.
Метод Гартмана
Готовят насыщенный раствор краски «черный Судан В» в чи-
стом этиленгликоле (точка кипения 195—197° С).
Процедура окраски: 1) наносят каплю черного Судана на чи-
стое стекло; 2) вносят петлей немного культуры и готовят суспен-
зию; 3) покрывают покровным стеклом и рассматривают. Резуль-
таты: капли жира черные, плазма клеток неокрашенная.
Способ Флемминга
Готовят следующий раствор:
1%-й раствор осмиевой кислоты.....................15 мл
Ледяная уксусная кислота........................ 1 »
2%-й водный раствор хромистой кислоты........... 4 »
Процедура окраски: 1) готовят мазок, фиксируют 40%-м фор-
малином; 2) наносят каплю раствора п оставляют на 5 мин.;
3) накрывают покровным стеклом и исследуют. Результаты:
капли жира коричнево-черные.
Окраска раствором диметиламидоазобензола
Готовят раствор:
Димстиламидоазобспзол................................ 0.2 г
Этиловый спирт (95°-й)..........................50 мл
Процедура окраски: на предметном стекле смешивают каплю
воды и каплю раствора и вносят туда петлю исследуемой куль-
туры. После тщательного смешения накрывают покровным стек-
лом и исследуют. Результаты: плазма клеток бесцветная, капли
жира желтые.
Рост на различных средах
В большинстве случаев при определении вида гетеротрофных
микробов используют обычные лабораторные среды: мясо-пептон-
ный бульон, мясо-пептонпый агар, мясо-пептонпую желатину,
ломтики картофеля.
На этих средах развитие микробов каждого вида имеет свои ха-
рактерные особенности, — таким путем выявляются культураль-
ные свойства вида. Ряд сред используется для выявления физио-
логических свойств вида: наличие у микроорганизмов ферментов,
расщепляющих те или иные вещества, устанавливают путем выра-
щивания микроорганизма па определенной среде. Появление про-
106
дуктов распада при развитии бактерий говорит о том, что в фер-
ментативном аппарате вида имеется и выявляемый фермент;
некоторые приводимые ниже среды являются такими дифферен-
циально-диагностическими, позволяющими выявить у бактерий
особенности их обмена веществ.
Рост в мясо-пептонном бульоне. Рост ми-
кроорганизмов в мясо-пептонпом бульоне является диагностиче-
ским признаком. Отмечают: 1) наличие или отсутствие пленки,
помутнение, появление осадка; 2) характер пленки: кольцеобраз-
Рис. G8. Рост ла твердой среде (характер
посевиой черты).
А — сплошной с ровным краем; Б —L сплошной с вол-
нистым краем; В — четковидный; Г — диффузный;
Д — перистый; Е — древовидный; Ж — ризоидный.
пая, сплошная, тонкая, толстая, гладкая, морщинистая, складча-
тая, сухая, жирная, матовая, блестящая, слизистая; 3) характер
помутнения: однородное, хлопьями, волокнами — и степень:
слабое, умеренное, сильное; 4) характер осадка: скудный, обиль-
ный, рыхлый, плотный, хлопьевидный, зернистый, слизистый.
Рост на мясо-пептонном агаре. Должны
быть учтены форма колоний, развивающихся на мясо-пептон-
ном агаре (рис. 58), и характер штриха на скошенном агаре.
Для определения характера роста косую поверхность мясо-
пептонного агара засевают штрихом — проведением платиновой
петлей с посевным материалом снизу вверх по поверхности
агара без погружения петли в конденсационную воду. Отмечают:
1) рост: обильный, умеренный, скудный; 2) характер посевной
черты: налет сплошной (с ровными или волнистыми краями), чет-
ковпдный (в виде цепочки изолированных колоний), диффузный,
перистый, древовидный, ризоидный (рис. 68); 3) характер края
черты: гладкий, волнистый, мелкозубчатый, лопастной, непра-
вильно изрезанный, волосистый, реснитчатый, ветвистый; 4) по-
107
верхность штриха: блестящая, матовая, мучнистая; 5) консистен-
цию: штрих сочный, сухой, кожистый, тянущийся, слизистый,
хрящеватый; 6) профиль штриха: пленкообразный, плоский,
выпуклый; 7) оптические
А f) В Г Д
Рис. G9. Характер роста полиции укола.
Л — нитевидный; Б — четковидный; В — бугри*
признаки: рост пепросве-
чивающпй, просвечиваю-
щий, опалесцирующий,
иризирующий; 8) цвет на-
лета, изменение цвета
среды (окраска ее).
Рост на м я с о -
пептонной ж е л а-
т и и е. Посев в мясо-
пептонную желатину про-
изводят уколом, используя
налитую столбиком в про-
бирки среду. Выращивание производят при комнатной темпера-
туре. При развитии микроорганизмов на желатине отмечают:
1) характер роста по длине укола: развитие на поверхности и
слабый рост по линии укола (рост в виде гвоздя) — аэробы,
стый; Г — волосистый; Д — ветвистый.
Рис. 70.
Пробирка
для кар-
тофеля.
Рис. 71. Отношение к кислороду.
1 — аэроб; 2 — анаэроб; 3 — факультативный
анаэроб; 1 — микроаэрофил.
равномерный рост по всей черте (без шляпки) — факультатив-
ные анаэробы; рост только в нижней части среды — анаэробы;
2) характер роста по уколу: нитевидный, четковидный, бугри-
108
стый, волосистый, ветвистый (рис. 69); 3) цвет черты п окраши-
вание самой черты. Одновременно отмечают разжижение жела-
тины — наличие желатиназы (стр. 116).
Рост па картофеле. Готовят в пробирках картофель-
ные косяки. Для этого берут невялые клубни картофеля, моют
их щеткой под сильной струей воды для удаления частиц земли.
Снимают кожуру ножом, протертым спиртом, и удаляют «глазки».
Очищенный картофель еще раз промывают водой, срезают затем
верхушки п вырезают с помощью сверла для пробок цилиндры
около 4—5 см длиной, диаметр которых соответствовал бы диа-
метру отобранных для приготовления косяков пробирок. Выре-
занные пз картофеля цилиндры разрезают по диагонали, каждый
на два клина. Клинья ополаскивают водой и погружают в 1 %-й
раствор двууглекислой соды (NaIICO3) па 1 час, так как карто-
фель обладает слегка кислой реакцией. После этого клинья карто-
феля помещают в пробирки, или специальные, с перетяжкой в ниж-
ней части (рис. 70), или при отсутствии их в обычные, положив па
дно пробирки небольшой комочек ваты, смоченный для поддержа-
ния влажности картофеля дистиллированной водой. В пробирки
с перетяжками наливают для той же цели в нижнюю часть воду.
Картофель стерилизуют в автоклаве в течение 20—25 мин.
Посевы производят втиранием посевного материала в скошен-
ный картофель. При развитии культуры на картофеле отмечают
характер роста, поверхность штриха, консистенцию штриха, цвет
штриха и среды.
Методы установления физиологических признаков
Отношение к кислороду. По отношению к ки-
слороду микроорганизмы делятся па следующие группы: 1) стро-
гие аэробы, нуждающиеся для своего развития в свободном кис-
лороде; 2) мпкроаэрофилы, развивающиеся при пониженном пар-
циальном давлении кислорода; 3) факультативные анаэробы,
способные использовать свободный кислород, по растущие и без
него; 4) облигатные анаэробы, не нуждающиеся для своего раз-
вития в свободном кислороде, на которых свободный кислород
действует токсически.
Для определения отношения бактерий к кислороду обычно при
определении вида .ограничиваются простым тестом: делают по-
севы или в жидкую среду, плп в агаризованпую среду с глюкозой.
Среду разливают по 10 мл в пробирки и стерилизуют. Посевы
производят в расплавленную и охлажденную среду, тщательно
размешивают п дают застыть, после чего помещают в термостат
для проращивания.
Строгие аэробы растут на поверхности и в самом верхнем слое
среды, мпкроаэрофилы растут на некотором расстоянии от по-
109
верхности, факультативные анаэробы развиваются во всей среде,
строгие анаэробы — только в глубине среды (рис. 71).
Однако в указанные рамки не укладывается все разнообра-
зие отношений бактерий к кислороду. Так, некоторые строгие
анаэробы требуют для своего развития наличия в среде следов
кислорода. Кроме того, широкая адаптация бактерий к условиям
существования приводит у некоторых микроорганизмов к изме-
нению типа дыхания, что особенно часто имеет место у факульта-
тивных анаэробов, которые могут существовать то аэробно, то
анаэробно в зависимости от условий среды.
Поэтому гораздо полнее отражают направление окислительно-
восстановительных реакций у микроорганизмов условия среды,
характеризуемые окислительно-восстановительным потенциалом
(гН2).
В настоящее время установлено наличие предельных значении
окислительно-восстановительного потенциала для микроорганиз-
мов. Величина окислительно-восстановительного потенциала
имеет низкие значения при обеднении среды кислородом и высо-
кие при насыщении им. Удаление кислорода из среды с помощью
ее нагревания и дальнейшие меры по ограничению его поступления
обеспечивают низкий окислительно-восстановительный потенциал
(и, следовательно, условия для развития анаэробов).
При размножении микроорганизмов в среде наступает быстрое
падение окислительно-восстановительного потенциала.
Изменение окислительно-восстановительного потенциала ме-
няет направление обмена веществ в клетках.
Начальное значение г112 в среде обычно находится в пределах
от 7.4 до 9 (Lambin et German, 1961). Оно зависит от состава среды,
условий анаэробиоза, от отношения свободной поверхности среды
к ее объему. Наличие соединений, обладающих восстановитель-
ными свойствами (цистеин, тимоловая кислота), содействуют сни-
жению г112. После стерилизации агаризировапных сред в авто-
клаве в течение 20 мин. гН2 во всей массе среды равен примерно
7.5. Через 48 час. в итоге проникновения кислорода воздуха через
поверхность среды устанавливается целая гамма значений г112
ио мере углубления в среду (рис. 42).
Использование источников углерода.
Огромное количество бактерий способно расщеплять различные
углеводы и многоатомные спирты. Способность бактерий исполь-
зовать тс плп иные соединения углерода является важным диаг-
ностическим признаком в определении вида. В специальных ис-
следованиях рост выделенного штамма на различных источниках
углерода выясняется прп широком подборе углеводов и сппртов.
В обычной работе выбор ограничивается широко используемыми
и менее дорогостоящими соединениями. Обычно для выявления от-
ношения бактерий к источникам углерода берут: глюкозу, саха-
розу, мальтозу, лактозу, глицерин, маннит и этиловый спирт.
110
Эти соединения прибавляют в количестве 0.5—1% или к пептон-
ной воде, или к синтетической среде с 0.1—0.2% пептона. Часто
используется жидкая среда Лндреде. Применяются следующие
среды для определения использования бактериями углеводов.
Среда Бейерпнка
Водопроводная вода.............................. 1000 мл
NH4H2PO4..........................................1.0 г
КС!...............................................0.2 »
MgSO4 • 7Н2О.................................... 0.2 »
Пептон............................................X-2 »
о ^.Углевод......................................... 20 » ___
pH 7.0 устанавливается 1 н. раствором едкого натра.
Рис. 72. За-
полнение по-
плавков газом.
Среда Лндреде
Среда готовится из двух растворов: 1) инди-
катора и 2) пептонной воды.
1. В стерильную склянку вносят 0.5 г ки-
слого фуксина и 100 мл стерильной дистилли-
рованной воды, добавляют 16.4 мл нормального
раствора едкого натра. Раствор стерилизуют
в автоклаве 5 мин. при 110° С.
2. Па 100 мл водопроводной воды берут 10 г
пептона и 5 г поваренной соли, кипятят, уста-
навливают реакцию pH 7.6, фильтруют, разливают
в колбы по 100 мл и стерилизуют в автоклаве
при 115° С в течение 20 мин. В каждую колбу
прибавляют стерильно по 1 мл индикатора и по
0.5 г необходимого углевода или спирта. В зара-
нее простерилизованные пробирки, содержащие
опрокинутые в них поплавки, разливают стериль-
но среду по 3—5 мл и стерилизуют текучим паром
3 дня по 30 мин. Готовая среда должна иметь свет-
ло-соломенный цвет (без малейшего розового оттенка). Наличие
розоватого оттенка указывает или на перегрев среды, или на не-
подходящее качество фуксина, требующего для обесцвечивания
иного количества едкого натра. Тогда опытным путем устанавли-
вают необходимое количество едкого натра, исходя из того, что
смесь должна иметь соломенно-желтый цвет. kJ
Ферментация сахаров и спиртов устанавливается по изменению
цвета раствора, по заполнению газом и всплыванию поплавков
(рис. 72).
Посевы могут быть произведены в полужидкую среду. Для
этого к одной из указанных сред добавляют 0.3—0.5% агара до
ее стерилизации, распускают агар нагреванием, разливают среду
в пробирки и стерилизуют текучим паром 3 дня. Посев производят
111
в столбик агара иглой. В такой среде газообразование может быть
отмечено по появлению пузырьков газа в среде и разрывов агара.
Использование углеводов может быть определено другим спо-
собом — методом ауксанограммы. Готовят твердую среду (синте-
тическая среда с 1.5% агара) без углевода. Эту среду разливают
в пробирки и стерилизуют в автоклаве.SB пробирку делают гу-
стой засев исследуемой культуры и выливают ее содержимое
в стерильную чашку Петри. По застывании агара в чашке Петри
разделяют чертой на донышке чашки ее площадь на секторы, де-
лают соответствующие над-
писи на каждом секторе и
вносят в каждый сектор не-
большое количество углевода
таким образом, чтобы углевод
попал только в центральную
часть сектора и не вышел за
его пределы. Наличие роста
в соответствующем секторе
показывает, какой сахар ис-
пользуется бактериями.
Предложен ряд способов,
упрощающих 'получение дан-
ных по использованию саха-
ров бактериями. Здесь при-
водится один из них.
Кружки фильтровальной
бумаги диаметром 5—10 мм
пропитывают в течение 24 час.
33 % -ми растворами разлпч-
40° С и хранят в стериль-
но!! банке. По мере надобности употребляют эти кружки. Их
накладывают на поверхность засеянного бактериями агара,
приготовленного на пептоппой воде с добавлением раствора
фенолового красного до бледно-красной окраски. Па поверх-
ности такого агара раскладывают в чашку Петри 5 таких кру-
жочков, пропитанных различными сахарами. Об использовании
сахаров заключают по развитию бактерий вокруг бумажных
-исков и изменению цвета фенолового красного в желтый
.рис. 73).
Эти диски могут быть использованы и в жидких средах. Опи
могут быть опущены в пробирки с пептонной водой и феноловым
красным в качестве индикатора. Предварительно пробирки за-
севают культурой исследуемого микроорганизма. При необходи-
мости определения газообразования применяют вместо кружочков
пропитанные растворами углеводов полоски из фильтроваль-
ной бумаги, сложенные в виде буквы М. При наличии газа эти по-
лоски бумаги поднимаются вверх к поверхности среды.
112
Использование дисков, пропитанных сахарами, создает ряд
преимуществ по сравнению с нанесением углеводов непосред-
ственно на поверхность среды: сахара прп этом на растекаются и
исключена возможность их смешения. Таким путем устраняется
возможность ошибочного вывода.
Отношение к источникам азота. Для уста-
новления способности микроорганизмов использовать различные
источники азота делают ряд посевов в синтетическую среду одного
и того же состава, к которой добавлены различные источники азота
в количестве 0.1—0.2%. Берут обычно пептон, аспарагин, моче-
вину, азотнокалпевую соль и сернокислый аммоний. Может быть
взята среда Бейеринка.
Среда Бейеринка
Водопроводная вода............................... 1000 мл
КН2РО4........................................... 2 г
MgSO4 • 7Н2О..................................... 0.5 »
Са11РО4.......................................... 0.5 »
Глюкоза..........................................20 »
Может быть использован способ ауксанограммы. В этом слу-
чае готовят твердую среду Бейеринка на хорошо выщелоченном
агаре (2%-м), разливают по пробиркам и стерилизуют. Кружочки
фильтровальной бумаги (диаметром 5—10 мм) пропитывают рас-
творами (1—2 %-ми) источников азотного питания погружением
их на 24 часа, высушивают прп 40° С и хранят в банках с притер-
тыми пробками. Пробирки с агаром обильно засевают культурами
исследуемых микроорганизмов, выливают в чашки Петри и по за-
стывании на поверхность агара накладывают эти кружочки. Рост
будет наблюдаться только вокруг тех кружочков, которые про-
питаны используемыми данной культурой источниками азота.
Восстановление нитратов. Способность бак-
терий восстанавливать нитраты является важным диагностиче-
ским признаком в определении вида. Обычно для выяснения этой
способности делают посев в мясо-пентопный бульон с 0.1%
KNO3. Через несколько дней отмечают газообразование и опре-
деляют наличие нитритов реактивом Грисса и наличие аммиака —
реактивом Несслера. Для этого, как обычно, берут каплю куль-
туры и каплю реактива.
Быстрый микрометод определения способности бактерий вос-
станавливать нитраты рекомендован Бру (Brough, 1950). Берут
культуру, росшую 18—24 часа и давшую хороший рост, смывают
налет и из взвеси вносят количество, необходимое для получения
хорошего роста, в маленькую пробирочку, содержащую 1 мл мясо-
пептонного бульона с 0.1 % KNO3. Среда должна быть подогрета
до оптимальной для данного вида температуры. Пробирку инкуби-
руют 15 мин., после чего делают анализ на нитриты. Однако в от-
рицательном случае нельзя считать, что изучаемый вид неспособен
8 А. Г. Родина ИЗ
восстанавливать нитраты, и исследование следует продолжить,
произведя посевы в среду с нитратом. Рекомендуется в этих слу-
чаях к среде прибавить 0.1—0.5% агара, чтобы получить полу-
жидкую среду.
Разжижение желатин ы. Разжижение желатины —
важный диагностический признак. Протеолитическая активность
вида может быть установлена одновременно с выявлением харак-
тера роста на желатиновой среде: посевами в столбик мясо-пеп-
тонной желатины. Отмечают наличие разжижения и характер
его: послойное (равномерное по всей ширине пробирки), разжи-
жение цилиндром, мешком, конусом, воронкой, кратеровидное,
реповидное (рис. 74). Наличие желатиназы может быть выявлено
Рис. 74. Раз/кп/кеппе желатины по линии укола.
Л — глубинное; Б —кратеровидное; В — реповидное; Г — конусом; д —
мешком; Е — послойное; ЯГ — воронкой.
по методу Терста (Thirst, 1957). Чистые предметные стекла покры-
вают тонким слоем 5 ?6-й водной желатины погружением их в рас-
плавленную желатину, высушивают в вертикальном положении
и храпят в холодильнике в чашке Петри. На поверхность желати-
новой пленки наносят каплю бульонной культуры изучаемого
вида. Стекло может быть разделено на части чертой, проведенной
по его обратной стороне, и могут быть нанесены капли нескольких
культур. Для сравнения наносят каплю стерильного бульона.
Стекла помещают в чашку Петри с влажной фильтровальной бу-
магой и выдерживают при 22° С от 2 до 20 час. После инкубации
стекла опускают на 20—30 мин. в смесь формалина (1 объем) и
насыщенного водного раствора сулемы (9 объемов), промывают
водой и красят разбавленным водным раствором карболового
фуксина (1 : 100). Если произошли изменения желатины, то на
месте нанесенных капель культур ясно выступают светлые пятна.
Этот микрометод дает положительные результаты только в том
случае, если в культуре имелось достаточное количество активной
желатиназы. Малоактивные ферменты выявляются вышеприве-
денным методом посева в пробирки и длительной их инкубацией.
Разжижение желатины может быть установлено на среде
Фразье. Готовят желатиновую среду Фразье (приготовление см.
114
стр. 205), разливают по пробиркам и стерилизуют. Готовят рас-
твор: IIgCl2 — 15 г, НС1 — 20 мл, дистиллированной воды —
100 мл, или 1%-й раствор пикриновой кислоты, или насыщенный
раствор сульфата аммония. Разливают желатину Фразье в чашки
Петри и по застывании делят поверхность чашки па 5 секторов,
проводя черту па наружной поверхности донышка чашки. Надпи-
сывают на секторах номера изучаемых культур, затем делают по-
сев штрихом, засевая каждую культуру в отведенном для псе сек-
торе. По окончании периода инкубации чашки заливают выше-
указанным раствором и оставляют стоять на 5—10 мин., затем
осторожно сливают раствор и отмечают результаты. Штрихи раз-
жижающих желатину микроорганизмов окружены прозрачными
зонами вследствие изменения желатины. Неизмененная среда ста-
новится непрозрачной.
j Определение амилолитической- способ-
ности бактерий. Установление наличия у бактерий фер-
мента амилазы, под воздействием которой происходит гидролити-
ческое расщепление крахмала, может быть произведено на жид-
ких и твердых средах, указанных в главе 6 (стр. 159).
Определение способности микроорга-
низмов расщеплять жиры. Стерилизуют в пробир-
ках топленое коровье масло. Отдельно готовят мясо-пептоппый
агар. В расплавленном виде вливают масло на дно чашек Петри и
распределяют его тонким слоем. По застывании масла на его по-
верхность осторожно наливают слой расплавленного и охлаж-
денного мясо-пептонного агара. Застывший в чашках агар делят
па секторы и в каждом секторе делают стерильным скальпелем
бороздку. В каждую бороздку производят обильный посев штри-
хом односуточной агаровой культурой. Через 18—24 часа культи-
вирования развившиеся по штриху посевы заливают насыщенным
раствором медного купороса, через 5—6 мин. купорос осторожно
сливают с агара. Колонии расщепляющих жиры микроорганизмов
окрашиваются в голубой цвет, вокруг них обнаруживается ореол.
При более длительном (3—4 суток) культивировании расщепле-
ние жира может быть установлено по его побелению. Можно до-
полнительно обработать чашки раствором медного купороса.
Свертывание п пептон и заци я молока.
Для культивирования микробов употребляется обычно свежее
обезжиренное (снятое) молоко. Спять жирный слой с молока легче
всего при помощи сифона. Молоко перед снятием должно хорошо
устояться. Снятое молоко разделяют на две части. К одной при-
бавляют бромкрезоловый красный, к другой — бромфеноловый
синий из расчета 1 мл 1.6%-го раствора на 1 л. Молоко хорошо
смешивают с индикаторами, разливают в пробирки по 7—8 мл
и стерилизуют 3 дня текучим паром. Посевы каждой культурой де-
лают в две пробирки с различными индикаторами. Может быть ис-
пользовано сгущенное молоко в разведенном водой виде. Молоко
8*
115
Таблица 5
Степень кислотности молока при развитии в нем микроорганизмов
Окраска молока и его реакции И риблизи- тельнаи ве- личина рП
Кислотность с бромкрезоловым красным с бромфеноловым синим
Очень слабая. Слабая. Средняя. Сильная. Очень сильная. Синяя до серо-зеле- ного. Смягченная серо-зе- леная до зелено- вато-желтой. Желтая; молоко не свернулось. Молоко свернулось. » » । • о Синяя или зеленая. Желтая. Г 6.2-G.8 5.2-G.0 • z45-5.0 * 3.4-4.G 'Ниже 3.4
разводится водой, содержащей индикатор (молока —,1 часть,
воды — 4 части). В культурах на молоке отмечают реакцию, свер-
тывание, иептонизацию. Различают два вида свертывайся: ^кис-
лотное, происходящее от накопления кислот, связанное с изме-
нением реакции среды, при котором сгусток далее но*п вменяется,
и 2) сычужное, при котором реакция молока не изменяется rt за
которым обычно следует пептонизация сгустка. ГТептонпзация
может происходить и без свертывания. В табл. 5 приводится при-
близительная кислотность молока по изменению цвета индика-
тора. л
Отношение к темп е*р а т у р е. На оптимальной
для данного вида бактерий среде устанавливают минимум, опти-
мум и максимум температуры для роста изучаемого вида. Для
этого засевают в ряд пробирок с питательной средой изучаемый
вид и помещают пробирки в термостат при различных температу-
рах. Ведут наблюдения над развитием. У спорообразующих бак-
терий определяют устойчивость спор к высоким температурам:
берут культуру, образовавшую споры, готовят обильную суспен-
зию спор в стерильном физиологическом растворе или в воде, вно-
сят градуированной пипеткой одинаковое количество суспензии
в маленькие пробирочки с 1 мл стерильной среды, помещают их
в держатель (рис. 54) и выдерживают в кипящей водяной бане раз-
личное время. Делают высевы из прогретых пробирок. Отмечают,
какое время нахождения в кипящей воде выдержали споры.
—г
Методы установления продуктов обмена бактерий
Чаще всего определяют следующие продукты обмена бактерий;
аммиак, индол, сероводород.
116
Определение выделения б а к т е р и я я и
а я м и а к а. Огромное количество водных бактерий, исполь-
зующих органические соединения, способно разлагать их до ам-
миака, т. е. они имеют в наборе своих ферментов дезаминирующие.
Количество выделяемого аммиака у различных видов колеблется
в больших пределах. Определение дезаминирующей способности
бактерий обычно проводят на жидких средах, чаще на
мясо-пептоппом бульоне или на пептонной воде, под-
вешивая над средой! сразу после производства посе-
вов индикаторные бумажки, закрывая ватные пробки
резиновыми колпачками или материалами, не пропу-
скающими газ, и в этом случае плотно завязывая про-
бирки (рис. 75). Культуры инкубируют при оптимальной
для них температуре. В качестве индикаторных могут
быть использованы: 1) бумажки, смоченные реактивом
Несслера (приготовление реактива см. на стр. 222)
и высушенные, 2) красные лакмусовые бумажки и
3) бумажки, смоченные реактивом Крупа.
Для приготовления первых из перечисленных бу-
мажек нарезают фильтровальную бумагу полосками
шириной 0.5 см, длиной 8—9 см. Цвет бумажек по их
обработке» реактивом Несслера должен быть равномер-
ным, светло-серым. При выделении культурой аммиака
нижний конец подвешенной! над средой бумажки приоб-
ретает бурый оттенок. При подвешивании красных
лакмусовых бумажек при выделении лулрурой ам-
миака их нижний конец синеет. Для установления вы-
деления аммиака лакмусовыми бумажками доцяйны пс- Рис. 7.3,
пользоватьсяДолько свежеприготовленные, продажные Вроблр-
обычно малочувствительны. Реактив Крупа ифдетав- дпкатор-
ляет собой! смесь, состоящую из 1 части 3%-й|серной пыми бу-
кислоты и 2 частей 1 %-го водного раствора фуксина, мажкамп.
приготовленного из насыщенного спиртового раствора.
Смесь готова к употреблению по приобретении ею бурого от-
тенка. Смочейные' реактивом Крупа полоски фильтровальной
бумаги по высушивании должны быть бесцветными пли слегка
желтоватыми. Хранить их следует в банке с притертой проб-
кой. В присутствии аммиака бумажки приобретают ярко-крас-
ный цвет.
При необходимости более точного.определения дезаминирую-
щей способности культуры может быть произведено количествен-
ное определение выделяемого аммиака. Количественное опреде-
ление производят перегонкой культуральной жидкости с магне-
зией и с последующим титрованием.
Определение образования бактериями
и и д о л а. Образование индола бактериями связано с наличием
у них фермента триптофаиазы, расщепляющей гетероцикличе-
117
скую аминокислоту — триптофан. Поэтому для получения реак-
ции на индол наиболее подходящей является содержащая трип-
тофан среда, например среда с казеином.
Среда с казеином
Дистиллированная вода...........................100;) мл
Казеин.............................................10 г
Глюкоза............................................10 »
КоНР04............................................. 1 »
MgSO4 • 7ILO..................................... 0.5 »
NaCl . . . “..................................... 0.1 »
FeSO4 • 7НоО .....................................Следы
Казеин растворяют в 80 мл 0.1 н. раствора едкого натра,
затем 1 н. раствором соляной кислоты доводят pH до 7.4. Все
остальные ингредиенты растворяют в 920 мл дистиллированной
воды. Смешивают раствор казеина с раствором солей, разливают
в пробирки по 10 мл и стерилизуют текучим паром.
Вводить все компоненты среды необходимо только в том слу-
чае, если изучаемый вид не растет на одном растворе казеина.
Определение индола ведут следующим образом. Культуру вы-
ращивают на мясо-пептонном агаре при оптимальной температуре.
Реакцию па индол проводят через 24 и 48 час. С мясо-пептонного
агара делают густой посев в разлитую в пробирки жидкую среду
с казеином, прогретую до 30—35° С. Посев делают таким количе-
ством, чтобы среда сталд сильно мутной. Пробирки инкубируют
2 часа и ведут определение индола по способу Эрлиха. Заранее
готовят два растворам
1. Парадиметпламинобензальдсгид ................... 1г
Этиловый спирт (95э-й)............................95 мл
Соляная кислота (уд. вес 1.19)....................20 »
2. Насыщенный водный раствор K2S2O3.
К жидкой культуре прибавляют 5 мл первого раствора, затем
5 мл второго и смешивают вращением пробирки в руках. Через
5 мин. при наличии индола появляется красное окрашивание
среды.
Определение индола можно вести и иным способом, используя
раствор 1 и серный эфир. При этом способе определения к куль-
туре прибавляют 5 мл эфира, смешивают содержимое пробирки,
вращая ее между ладонями, затем по стенке пробирки вносят не-
сколько капель раствора 1. В присутствии пндола эфирная вы-
тяжка окрашивается в красный цвет.
Таким путем определяется одновременно наличие индола и
метплипдола (скатола). Эти же реактивы могут быть использованы
для определения наличия только индола. Для этого культуры вы-
ращивают в жидкой среде. Пробки из пробирок с культурами за-
меняют пробками из белой гигроскопической ваты, нижняя по-
118
верхность которых смочена 4—6 каплями раствора 1, затем 4—
6 каплями раствора 2. Пробку вдвигают таким образом, чтобы опа
была на расстоянии 1—1.5 см от поверхности культуры. Ставят
пробирку в держателе (рис. 54) в кипящую водяную баню и дер-
жат 15 мин. Культуральная жидкость не должна приходить в со-
прикосновение с пробкой. Покраснение ваты указывает на нали-
чие индола (метилиндол нелетуч).
Определение индола может быть произведено и другими спо-
собами, например по способу Сальковского илп Морелли.
Способ Сальковского —.
Культуру ведут в мясо-пептонпом бульоне в течение 7 суток.
Семисуточную культуру сначала нагревают с 4 мл 10%-й серной
кислоты, а затем с 0.5—2 мл 0.05%-го раствора азотистопатриевой
соли. Реактивы приливают по стенке пробирки. Появление красно-
фиолетового кольца указывает на наличие индола.
Способ Морелли
При посевах в культуры подвешивают заранее приготовлен-
ные, покрытые кристаллами щавелевой кислоты полоски филь-
тровальной бумаги (эти полоски пропитывают горячим насыщен-
ным раствором щавелевой кислоты и высушивают). В присутст-
вии индола нижняя часть бумажек окрашивается в красноватый
цвет.
Определение образования сероводо-
рода. Образование бактериями H2S при разложении органиче-
ских веществ связано с ферментативным разложением белков илп
пептонов, имеющих в своем составе аминокислоты, содержащие
сору (цистин, цистеин, метионин). Способность образовывать
H2S па белковых средах у бактерий зависит как от вида их, так
и от свойств среды. Поэтому особенно важно здесь использование
строго определенных сред. Обычно посевы делают в пробирки
с мясо-поитопным бульоном, над которым подвешивают полоски
фильтровальной бумаги, пропитанные насыщенным раствором ук-
суснокислого свинца и затем высушенные. Выявление паличия
1I2S основано на реакции образования сульфидов металлов. Вы-
деляющийся H2S реагирует с уксуснокислым свинцом, восстанав-
ливает его, образуется сернистый свинец, и нижний конец бумажки
буреет или чернеет. Вместо подвешивания бумажек можно сма-
чивать в указанном растворе, предварительно простерилизовав
ого, пробки пробирок, покрытые марлей, или ввести в среду 0.5 %-й
раствор виннокислого железа. Почернение марли в первом слу-
чае или почернение питательной жидкости во втором показывают
наличие выделяемого газа.
Выделение II2S может быть установлено п па твердых средах.
Для этого пользуются мясо-пептонным агаром, в который добав-
119
л я ют углекислый свинец, мелко растертый в ступке с гуммиара-
биком (на 2—3 г соли берут 0.5 г гуммиарабика). Почернение
среды вокруг колоний или линии укола указывает на продуциро-
вание бактериями сероводорода.
Предложены следующие специальные среды для определения
выделения сероводорода.
Агар Хоменко
К расплавленному мясо-пептонному агару (pH 7.2—7.4) до-
бавляют уксуснокислый свинец (1%), охлаждают до 45° С, при-
бавляют яичный белок в количестве 2?6, тщательно смешивают
его со средой, разливают по пробиркам и стерилизуют текучим
паром (3 дня по 30 мин.). Посевы производят иглой уколом
в столбик агара. При наличии у изучаемого вида способности об-
разовывать сероводород среда по линии укола чернеет (это может
произойти и за счет меркаптанов).1
Агар Бадера
Водопроводная вода ............................... 1000 мл
Пептон............................................... 20 г
Лактоза.............................................. 10 »
Глюкоза . . . .'.................................... 1 »
Раствор А............................................ 10 мл
Раствор Б............................................ 10 »
Раствор В............................................ 10 »
Индикатор (феноловый красный)........................ 20 »
Агар................................................. 15 г
pH 7.0
Раствор А: в 100 мл дистиллированной воды растворяют на
холоду 2 г сульфата железа (FeSO4 • 7Н2О).
Раствор Б: в 100 мл дистиллированной воды растворяют на
холоду 0.8 г гипосульфита натрия (Na2S2O3 • 5Н2О).
Раствор В: в 100 мл холодной дистиллированной воды рас-
творяют 4 г сульфита натрия (Na2SO3).
Индикатор: 0.1 г фенолового красного растворяют в 10 мл теп-
лого 96°-го спирта и доливают до 100 мл теплой! дистиллированной
водой.
Вначале готовят и распускают в воде пептон и агар, затем уста-
навливают pH 7.0 и вносят сахара, растворы и индикатор. Гото-
вую среду разливают в пробирки по 3 мл и стерилизуют текучим
паром 20 мин. Посев может быть произведен уколом в столбик
агара. Отмечают почернение среды, образование газа, окраску
поверхностного и глубинных слоев.
1 Наличие меркаптанов может быть установлено с помощью изатин-
серной кислоты (наступает позеленение среды).
ГЛАВА 5
КОЛИЧЕСТВЕННЫЙ УЧЕТ МИКРООРГАНИЗМОВ
В ВОДЕ II В ГРУНТАХ
Количественный учет микроорганизмов при исследовании воды
производят как можно скорее после взятия проб во избежание из-
менений в содержании бактерий, неизбежно происходящих при
стоянии проб. Общее количество микроорганизмов определяют
методом прямого счета.
МЕТОД ПРЯМОГО СЧЕТА БАКТЕРИЙ В ВОДЕ
Метод прямого счета дает общее количество бактерий, нахо-
дившихся в воде в момент взятия пробы, им учитываются и от-
мершие клетки, еще не подвергшиеся автолизу; однако, как пока-
зали исследования ряда авторов, число таких клеток невелико.
Существует несколько модификаций способов метода прямого
счета. Все они разработаны и введены в практику советскими уче-
ными. Наиболее широкое применение вследствие его простоты
получил метод ультрафильтрации, предложенный А. С. Разумо-
вым (1932). Метод этот состоит в отфнльтровании при отрицатель-
ном давлении определенного объема исследуемой воды через
мембранный фильтр № 1 или № 2 (характеристика фильтров при-
ведена па стр. 58). Находящиеся в воде микробы более или менее
равномерно распределяются па поверхности мембранного фильтра.
Для фильтрования воды необходимо иметь мембранные фильтры
и прибор (или несколько приборов, если надо фильтровать одно-
временно несколько проб). Чаще для фильтрования воды поль-
зуются различными моделями приборов, сделанных из металла
(рис. 34).
Непосредственно перед фильтрацией металлический столик
прибора и металлическую трубку его стерилизуют обжиганием.
Обжигание производится намоченным в чистом спирте тампоном
ваты, навернутым на металлический стержень. Горящим тампо-
ном прожигают все металлические частп прибора. На стенку ниж-
ней части (воропкп) помещают два вырезанных по диаметру во-
ронки кружка фильтровальной бумаги, а сверху мембранный
фильтр. Перед наложением фильтра на краю его карандашом про-
121
ставляют порядковый помер, в журнале отмечают помер пробы,
фильтруемой через данный фильтр, и количество профильтрован-
ной воды.
Мембранный фильтр прижимают верхней частью прибора,
которая привинчивается к нижней, или обо части соединяют вин-
товыми зажимами. В колбе, в которую вставлена воронка, создают
небольшое разрежение воздуха. Внесенную в воронку воду от-
фильтровывают до конца.
Перед употреблением мембранные фильтры должны быть обра-
ботаны. Фильтры кипятят несколько раз в свежеперегнанной
(еще лучше в свежепрофильтрованной через мембранный фильтр)
дистиллированной воде, сменяя воду 2—3 раза. Кипячение необ-
ходимо как для вытеснения воздуха, заключающегося в порах
фильтров, так и для удаления остатков растворителей, исполь-
зованных при их изготовлении. При кипячении фильтров надо
соблюдать следующие условия, чтобы не испортить фильтры: на-
гревать воду медленно, а когда она закипит, не допускать бур-
ного кипения.
Необходимо каждую партию фильтров, кроме того, предвари-
тельно проверить еще на отсутствие на их поверхности бактериаль-
ного засорения. Для этого несколько фильтров должны быть после
кипячения без фильтрования через них какого-либо материала
высушены, окрашены и просмотрены под микроскопом. Партии
фильтров, загрязненных бактериями, непригодны для целей
подсчета. Кроме того, фильтры (каждый из них в отдельности)
должны быть перед их использованием внимательно просмотрены,
чтобы выявить, нет ли на них каких-либо дефектов (отверстий,
трещин и т. д.).
Количество воды, которое должно быть профильтровано, зави-
сит от типа водоема, от предполагаемого содержания бактерий
в воде и от диаметра используемого фильтра. Рекомендуется брать
при диаметре фильтра 2 см для вод, содержащих очень малые ко-
личества бактерий, как например воды артезпанскпе, 50—100 мл
воды; для чистых озер 5—10 мл (до 25 мл); для прудов 2—3 мл;
для вод, сильно загрязненных, применяют разведение свежепро-
фпльтровапной через ультрафильтр водой (по не дистиллиро-
ванной).
После того как вода профильтрована, ультрафильтр вынимают
из прибора, помещают па фильтровальную бумагу в чашку Петри,
куда предварительно помещен кусочек ваты, смоченной формали-
ном, и высушивают. В таком виде фильтры могут быть сохранены
в течение некоторого времени пли же подвергнуты сразу дальней-
шей обработке. При перевозках фильтры требуют осторожного
обращения с ними, чтобы предотвратить какие бы то ни было
их повреждения, и тщательного охранения их от пыли. Фильтры,
высушенные в парах формалина, лучше всего перевозить в спе-
циальных папках из толстого картона с вырезанными в них круг-
122
лыми отверстиями по диаметру фильтров. Эти папки должны быть
снабжены плотно подогнанной крышкой.
В случае невозможности вести фильтрацию в экспедиционных
условиях можно фиксировать пробы воды формалином, а фильтро-
вать их позднее. Для фиксации проб надо иметь: 1) склянки с хо-
рошо притертыми пробками, которые должны быть соответственно
подготовлены — вымыты хромовой
смесью, прополоснуты дистиллиро-
ванной водой, выдержаны в струе
пара (рис. 76) 10 мин., высушены
сразу же в сушильном шкафу и тща-
тельно закрыты и 2) формалин,
профильтрованный через мембран-
ный фильтр. По взятии пробы воды
определенный ее объем (например,
10 мл) вносят пипеткой в склянку и
к воде добавляют формалин в таком
количестве, чтобы получить 3 %-й рас-
твор его. Склянку после прибавле-
ния формалина закрывают пробкой,
хорошо встряхивают, на нее наклеи-
вают этикетку с указанием даты,
номера пробы, места взятия, объема
внесенной воды. Горлышко и пробку
склянки заливают менделеевской за-
мазкой или парафином, плотно за-
крывают резиновым колпачком и
обвязывают. В таком виде пробы
могут быть доставлены в лаборато-
рию. После фильтрования фиксиро-
ванной воды склянку следует ополос-
нуть водой, профильтрованной через
мембранный фильтр, и эту воду тоже „ -
профильтровать. п£ром
Дальнейшая обработка фильтра
состоит в его окрашивании. Окра-
шивание производят 5%-м раствором эритрозина на 5%-й
карболовой воде следующим образом: в чашку Петри помещают
стопочки фильтровальной бумаги, нарезанной кружками диамет-
ром, несколько большим, чем фильтры, увлажняют их краской.
На эту пропитанную краской бумагу помещают фильтры с осев-
шими на них бактериями (стороной, содержащей взвеси бактерий,
вверх) и закрывают чашку Петри. Окрашивание продолжается
2—3 часа. По окончании окрашивания производят отмывание из-
лишней краски тем же способом: перекладывая фильтр*ы из одной
чашки Петри с фильтровальной бумагой, смоченной дистиллиро-
ванной водой, в другую такую же. Отмывание можно считать за-
123
конченным, когда фильтр будет давать слабую розовую окраску
бумаги. Процесс отмывания имеет большое значение для проведе-
ния счета. Надо остерегаться переотмыть фильтры, прп правильно
законченной отмывке фильтра площадь фильтра сохраняет розо-
вую окраску, бактерии же окрашены в ярко-красный цвет.
Мембранные фильтры могут быть окрашены и способами ком-
бинированной окраски, что, по данным ряда авторов, увеличивает
Рис. 77. Окулярные сетчатые
микрометры.
контрастность изображения.
1. Мембранный фильтр красят
в течение часа карболовым эритро-
зином обычным способом, затем от-
мывают его до слабо розовой ок-
раски. Отмытый фильтр подсушива-
ют в термостате, после чего докра-
шивают свежеприготовленным фук-
сином Пфейфера в течение 1—2 мин.,
затем отмывают избыток краски пу-
тем перекладывания на смоченную
водой фильтровальную бумагу. Для
докраски может быть взят 0.5 %-й
раствор бриллиантовой зелени.
2. Мембранный фильтр красят в
течение 1 часа на фильтровальной
бумаге, смоченной I %-м водным рас-
твором метиленовой синей, затем от-
мывают до голубого цвета переклады-
ванием на смоченную водой фильтро-
вальную бумагу, подсушивают и до-
крашивают или свежеприготовлен-
ным и профильтрованным раствором
фуксина Пфейфера, или 5%-м раство-
ром эритрозина в течение 2—5 мин.
Отмывают и высушивают в парах
формалина.
Непосредственно перед подсчетом
сухую пленку, лучше вырезанную из
нее часть — половину фильтра, поме-
щают на предметное стекло, на кото-
рое предварительно нанесена капля
иммерсионного масла. Сверху пленки наносят еще каплю масла,
препарат покрывают тонким покровным стеклом и ведут счет бакте-
рий, осевших на фильтре. Счет ведут при окуляре 15 и объективе
90, используя анаптральное пли фазовоконтрастное устройство,
дающее высокую контрастность изображения и позволяющее легче
отграничивать бактерии от неорганических частиц. Счет микро-
организмов ведут при помощи окулярного сетчатого микрометра
(рис. 77), просчитывая центральную часть поля зрения. Размеры
J 24
квадратов сетки не должны быть очень мелкими (лучше 1X1 мм) —
тогда в каждом поле зрения’просчитывается 4 центральных квад-
рата. Лучше, когда на микрометре нанесены только эти квадраты.
Количество просчитанных полей зрения не должно быть меньше 30.
Окулярные сетки могут быть изготовлены в мастерских, где
имеются делительные машины, кустарное изготовление их недо-
пустимо, так как при тех больших коэффициентах, которые по-
лучаются при больших увеличениях микроскопа, очень неболь-
шое отклонение в линиях сетки может привести к существенным
ошибкам в итогах счета.
При подсчете бактерий препарат с помощью крестообразного
столика двигают по диагонали. Сосчитывают отдельно палочко-
видные формы, кокки, клетки дрожжей, азотобактероподобные
клетки, железобактерии, серобактерии и др., занося число кле-
ток каждой группы в отдельную рубрику. Подсчет по морфоло-
гическим группам дает возможность, с одной стороны, характери-
зовать микробную флору водоема, а с другой — вычислить в даль-
нейшем па основании полученных данных биомассу микробов.
Определение количества микробов производится по следую-
щей формуле:
SN
X = —77" ,
s V '
где S — фильтрующая площадь прибора (в мк2); s — просчиты-
ваемая площадь поля зрения (в мк2); N — среднее число микроб-
ных клеток, приходящееся па поле зрения; V — объем профиль-
трованной воды.
Площадь поля зреппя, ограниченную определенной частью
сетчатого микрометра, определяют, используя объект-микрометр.
Путем несколько раз проведенных сопоставлений сторон просчи-
тываемой части сетчатого микрометра с делениями объект-мпкро-
метра высчитывают величину стороны квадрата, а затем и площадь
просчитываемой части поля зрения. Фильтрующая площадь при-
бора определяется измерением внутреннего диаметра трубки при-
бора по формуле яг2.
Отношение у при работе с одним п тем же увеличением одного
микроскопа и при использовании одного и того же фильтроваль-
ного аппарата является величиной постоянной. Вычисление этой
величины — коэффициента К позволяет упростить все последую-
щие вычисления, и тогда вышеприведенная формула приобретает
следующий вид:
KN
х~ F •
Во избежание фиктивной точности в выражении результатов
прямого счета полагается округлить полученные числа. Округ-
ляют в следующих пределах:
125
При величинах
» »
» »
» »
» »
» »
от 10001 до 50000 . .
от 50001 до 100000 .
от 100001 до 1000000
от 1000001 до 10000000
> 10000000 ...........
> 1000000000 ....
До ближайших 100
» » 500
» » 1000
» » 10000
» » 50000
» » 100000
Таким образом, если при счете получено число 10889138 на
1 мл, итог надо выразить как 10 900 000 па 1 мл, если получено
10810138, то как 10800000 и т. д.
МЕТОДЫ ПРЯМОГО СЧЕТА БАКТЕРПЙ В ГРУНТАХ
Прямой счет бактерий в грунтах может быть произведен раз-
личными способами, в основу которых положен метод, разработан-
ный С. Н. Виноградским (1952) для почв. Прежде всего прямой
счет бактерий в грунтах может быть осуществлен методом ультра-
фильтрации.
Метод ультрафильтрации. Отвешивают 1 г
грунта в стерильную колбочку, заливают его 25 мл 0.0004 н.
раствора едкого натра, предварптсльпо профильтрованного через
мембранный фильтр, закрывают пробкой и встряхивают 20 мин.,
после чего оставляют болтушку грунта в спокойном состоянии
на 1—2 мин. для осаждения грубых частиц. Затем берут 1—2 мл
суспензии и вносят в воропку фильтровального аппарата, куда
помещен мембранный фильтр № 2. Рекомендуется для более рав-
номерного распределенпя бактерий па фильтре внести предва-
рительно 2—3 мл воды, профильтрованной через мембранный
фильтр. По отфильтровании всего внесенного объема жидкости
мембранный фильтр обрабатывается так, как указано выше при
проведении прямого счета бактерий в воде.
Подсчет бактерий в люминесцентном ми-
кроскопе [видоизмененный метод Пошона и Тардье (Ро-
chon a. Tardieux, 1962)]. Готовят: 0.1 %-й раствор пирофосфата
натрия (Na4P2O7) в профильтрованной через мембранный фильтр
воде и водный раствор акридина оранжевого (0.1 %-й). Отвеши-
вают 1 г грунта в колбочку, наливают 50 мл раствора пирофосфата
натрия и встряхивают его 20 мин. Берут по 10 мл жидкости в три
стерильные пробирки и прибавляют в них раствор акридина оран-
жевого: в первую — 0.5 мл, во вторую — 1.5 мл, в третью — 3 мл.
Из суспензии грунта готовят препараты, нанося определенный
объем, накрывают покровным стеклом, заделывают края препа-
рата вазелином и ведут счет под люминесцентным микроскопом
бактерий, светящихся ярко-зеленым светом.
Размеры просчитываемых полей зренпя могут быть установ-
лены с помощью окулярного микрометра, площадь препарата —
обычпым путем. Расчет количества бактерпй ведут на 1 г сухого
грунта.
26
ОПРЕДЕЛЕНИЕ БИОМАССЫ МИКРОБОВ В ВОДЕ
И В ГРУНТАХ
Прямой счет дает количество микробов в определенном объеме
воды пли в определенном весе грунта. В ряде случаев, и прежде
всего при изучении вопросов, связанных с продуктивностью во-
доемов, существенно определить биомассу бактерий как одну из
частей даваемого водоемом живого вещества, к тому же ту важней-
шую часть, которая обеспечивает круговорот веществ и является
в то же время одним из основных источников питания для планк-
тонных п бентических беспозвоночных.
Биомасса бактерпй может быть вычислена на основании дан-
ных прямого счета отдельных морфологических групп: палочек,
кокков, азотобактероподобных клеток, дрожжей, серобактерий
п др. — в зависимости от формы клеток и их размеров. Биомассу
микробов обычно выражают в весовых единицах па определенный
объем воды и вес грунта (в мг/л, г/л, мг/г).
Для определения объема одной клетки используется формула
объема шара для кокков, объема цилиндра для палочек, объема
эллипсоида для дрожжевых клеток (в водоеме большинство дрож-
жей представлено видами группы Torula, клетки которых в боль-
шинстве своем япцевпдпы) и т. д.
Для определения объема любого впда клеток падо их изме-
рить. При вычислении общей биомассы микробов приходится
брать одни (средние) размеры для всех кокков, находящихся в во-
доеме, для всех палочек и т. д. Но так как в водоеме в зависимости
от факторов среды: температуры, глубипы, содержания кислорода,
содержания питательных веществ и др. — колеблются пе только
численность бактерпй, но и их размеры, то следует прежде вы-
яснить средние размеры находящихся в данном водоеме палочек,
кокков, клеток азотобактера и др.
Для установления средних размеров бактериальных клеток
можно пользоваться следующим приемом: профильтровать через
мембранный фильтр значительное количество воды, пе доводя
фильтрование до копца, а закончив его тогда, когда над плоскостью
фильтра останется около 0.5 мл воды, в которой окажется скон-
центрировано в итого фильтрования большое количество микро-
бов. Отсюда тщательно вымытой хромовой смесью и пропаренной
пипеткой берут небольшое количество воды и наносят ее па поверх-
ность чистого, обезжиренного предметного стекла. Измерение раз-
меров микробов проводят обычным путем, пользуясь окулярной
микрометрической липейкой. Для облегчения измерений бакте-
рпй можно их слегка подкрасить слабым раствором йода или сла-
бым раствором метиленовой синей.1
1 Измерение размеров следует проводить неоднократно в силу их
изменения в зависимости от условии.
127
Для получения средних размеров клеток каждого типа (кокков,
палочек п др.) желательно возможно большее количество измере-
ний. Надо иметь в виду, что вычисления по способу арифметиче-
ской сродней дают приуменьшенные результаты для диаметров
кокков и для толщины палочек, а следовательно, и приуменьше-
ние их объемов. Поэтому для определения среднего диаметра кок-
ков следует использовать кубическую среднюю, а для установле-
ния средней толщипы палочек — квадратическую среднюю ве-
личину. Для облегчения подсчетов можно результаты измерений
сводить в вариационные ряды, а общее число измерений выражать
в процентах или долях к общему числу клеток каждого типа. Для
подсчета средней по интервальным данным пользуются срединами
интервалов. Можно привести примеры подсчета кубической и квад-
ратической средних величин.
Расчет диаметра кокков (D)
Диаметр кокков (в мк) Середина интерпалов D Число случаев п D3 D’n
0.1-0.5 0.3 6 0.027 0.162
0.5-1.1 0.8 34 0.512 17.408
1.1-1.5 1.3 29 2.197 63.713
1.5-1.9 1.7 16 4.913 78.608
1.9-2.5 2.2 9 10.648 95.832
2.5—3.1 2.8 6 21.952 131.712
100 387.435
Следовательно, средний диаметр кокка для
среднего объема выразится так 1
определения
его
3 /Т
лкв=У -
J87.435
100
= </3.87435 = 1.5706 мк,
тогда как при использовании средней арифметической он равен
1.305 мк.
Средний объем кокка
1
V = у • 3.14 • 3.87435 = 2.0276 мк»
(по среднему арифметическому исчислению диаметра объем равен:
у 3.14 • 1.3053 = 1.165 мк3, т. е. приуменьшение составляет
> у объема).
При исчислении объема палочковидных бактерий расчеты
средней квадратической величины толщины палочек (d) произво-
дятся следующим образом:
1 Черточки пад алгебраическими величинами являются знаками сред-
них.
128
Толщина палочек (н мк) Середина интервалов d Число слу- чаев п d- </’н
0.2-0.6 0.4 24 0.916 3.84
0.6-1.0 0.8 46 0.64 29.44
1.0-1.4 1.2 15 1.44 21.60
1.4-1.8 1.6 И 2.56 28.16
1.8-2.2 2.0 4 4.00 16.00
100 99.40
Средний размер толщины палочек
1 Г 99.4
rfKB= У 100 =0-99' мк.
Такой вычисленной величиной и следует пользоваться при
исчислении объема палочек. (Средняя арифметическая по этим
данным 0.9 мк). Если длина палочек 2 мк, то средний объем па-
лочки
к = — . 3.14.0.994 • 2 = 1.56 мк-1
4
(по толщине, вычисленной по средней арифметической, объем
составил бы 1.27 мк3, т. е. имело бы место приуменьшение на Чь).
Средняя длина палочковидных бактерпй в отличие от средней
толщины должна определяться но способу средней арифметиче-
ской.
По получении средних размеров клеток каждой группы можно
перейти к определению биомассы микробов, имея данные прямого
счета. Предположим, что прямой счет дал 200 000 клеток кокков
и 400 000 клеток палочек в 1 мл воды. Определение биомассы бак-
терий сначала проводится для каждой группы отдельно.
Расчет биомассы кокков. Средний диаметр кок-
ков в данном водоеме, например, равен 1 мк, тогда объем 1 клетки
исходя из формулы объема шара Г = -^-~2)3
V = -F • 3.14 • Р = 0.52 мкз.
и
Поскольку объем 1 кокка равен 0.52 мк3, а количество их
в 1 мл воды — 200 000, биомасса кокков в 1 мл составит
0.52 * 200 000= 104 000 мкЗ,
пли
104 000
10003
= 0.(ЬЮ1 мм3.
Биомасса бактерий в 1 л составит 0.1 мм3.
Таким образом, для определения (в мм3) объема биомассы бакте-
рпй, содержащейся в 1 л воды по прямому счету, произведенному
<J A. I'. Родина
129
для 1 мл, прп объеме клетки 0.52 мк3 и содержании их 200 000 кле-
ток/мл производятся следующие действия:
Принимая, что удельный вес бактерий может быть принят
равным удельному весу воды, т. е. равен 1, вес 1 мм3 биомассы
бактерий равен 0.001 г, или 1 мг.
Поэтому для определения выраженной в миллиграммах био-
массы клеток, содержащейся в 1 л воды, надо объем 1 клетки
умножить на число тысяч клеток, обнаруженных прямым счетом
в 1 мл, п полученное произведение разделить на тысячу.
Расчет биомассы палочек. Если в данном во-
доеме средняя толщина палочек равна 1 мк, а средняя длина —
1.78 мк, то объем одной клетки (V), исходя из формулы объема
цилиндра Р=-1к(/2Л, где d —толщина, h — высота, определится
следующим образом:
Г = у • 3.14 • 12 . 1.78 = 1.397 мк-з - 1.4
Если количество палочек в 1 мл воды равно 400 000, то био-
масса их в 1 л выразится
1.4 • 400
-f(W
Расчет биомассы д р о ж ж е в ы х клеток. Для
определения объема 1 дрожжевой клетки (а также любых других
клеток, имеющих овальную форму, например некоторых видов
азотобактера, некоторых видов Chromatium и др.) может быть
использована формула вычисления объема эллипсоида ~KZ)d2,
где D — длина клетки, a d — ширина (но короткой оси).
При длине дрожжевой клетки, равной 7 мк, ширине 5 мк
объем 1 клетки равен • 3.14 • 7 • 52 = 91.58 мк3.
Дальнейшие вычисления биомассы дрожжевых клеток осущест-
вляются на основании данных прямого счета обычным выше-
указанным способом.
Если в исследуемом водоеме дрожжевые клетки имеют различ-
ную форму, то вычисления биомассы их следует вести отдельно
для каждой группы: для круглых клеток по формуле шара, для
яйцевидных по формуле эллипсоида. Общая биомасса микробов
получается суммированием биомасс клеток каждой группы.
Для грунтов биомасса бактерий обычно дается на 1 г, поэтому
для получения величин, выраженных в миллиграммах, при вы-
числении ее следует объем 1 клетки умножить на число клеток,
130
Т а б л и ц а 6
Биомасса микробов в воде (в мг,л)
Вид клеток При объеме одной клетки (н мк3) При количестве клеток в 1 мл (в тыс.)
50 100 1.»п 2<Ю зоо '|00 500 1000 5000
0.178 0.0089 0.0178 0.0267 0.0356 0.0534 0.0712 0.089 0.178 0.89
0.256 0.0128 0.025(5 0.0384 0.0512 0.0768 0.1024 0.128 0.25(5 1 28
Кокки. 1 0.52 0.02(5 0.052 0.078 0.104 0.156 0.208 0.2(50 0.52 2.6
1.72 0.086 0.172 0.258 0.344 0.516 0.(588 0.8(50 1.72 8.6
2.07 0.1035 0.207 0.3105 0.414 0.621 0.818 1.035 2.07 10.35
। ( 0.4 0.02 0.04 0.06 0.08 0.12 0.16 0.20 0.4 2.0
0.6 0.03 0.06 0.09 0.12 0.18 0.24 0.3 0.6 3 0
0.8 0.04 0.08 0.12 0.16 0.24 0.32 0.40 0.8 4.0
1.0 0.05 0.10 0.15 0.20 0.30 0.40 0 50 1.0 5.0
Палочки. 1.2 0.06 0.12 0.18 0.24 0.36 0.48 0.60 1.2 6.0
1.4 0.07 0.14 0.21 0.28 0.42 0.56 0.70 1.4 7.0
1.6 0.08 0.16 0.24 0.32 0.48 0.64 0.80 1.6 8.0
2.0 0.10 0.20 0.30 0.40 0.60 0.80 1.00 2.0 10.0
2.4 0.12 0.24 0.36 0.48 0.72 0.96 1.20 2.4 12.0
2.7 0.135 0.27 0.405 0.54 0.81 1.08 1.35 2.7 13.5
2.9 0.145 0.29 0.435 0.58 0.87 1.1(5 1.45 2.9 14.5
Бациллы. 3.5 0.175 0.35 0.525 0.7 1.05 1.4 1.75 3.5 17.5
4.8 0.240 0.48 0.72 0.9(5 1.44 1.92 2.40 4.8 24.0
5.9 0.295 0.59 0.885 1.18 1.77 2.36 2.95 5.9 29.5
со « 16.0 0.80 1.60 2.40 3.20 4.80 6.40 8.0 16.0 80.0
Таблица 6 (продолжение)
Вид клеток При объеме одной клетки (в мк=) При количестве клеток в 1 мл (в тыс.)
50 11М1 1? 13'1 20U 3<И) 4(н) 500 1000 5000
3.52 0.176 V 0.352 0.528 0.704 1.056 1.408 1.76 3.52 17.6
4.07 0.2035 0.407 0.61 0.814 1.221 1.628 2.035 4.07 20.35
Азотобактере подоб- 12.08 0.604 1.208 1.812 2.416 3.624 4.832 6.04 12.08 60.4
ные клетки. 17.6 0.88 1.76 2.64 3.52 5.28 7.04 8.80 17.60 88.0
24.5 1.225 2.45 3.675 4.90 7.35 9.8 12.25 24.50 122.5
35.3 1.765 3.53 5.295 7.06 10.59 14.12 17.65 35.30 176.5
52.0 2.60 5.20 7.80 10.40 15.6 20.8 26.0 52.0 260.0
Дрожжи. | 91.6 4.58 9.16 13.74 18.32 27.48 36.64 45.8 91.6 458.0
Т а б л и и а 7
Биомасса микробов к грунтах (в мг/г)
Вид клеток При объеме одной клетки (в мк1) Ври количестве клеток в 1 г (в тыс.)
рю 200 500 1000 1 (ММ) ООО
0.178 0.0000178 0.0000356 0.000089 0.000178 0.178
0.256 0.0000256 0.0000512 0.000128 0.000256 0.256
Кокки. 0.52 0.000052 0.000104 0.00026 0.00052 0.52
1.72 0.000172 0.000344 0.00086 0.00172 1.72
2.07 0.000207 0.000414 0.001035 0.00207 2.07
Таблица 7 (продолжение)
Вид клеток При объеме одной клетки (В MKJ) При количестве клеток в 1 г (в тыс.)
КЮ 2<10 .'и И) 1000 1 (ММ) (ХИ)
0.4 0.00004 О.ООООЯ 0.0002 0.0004 0.4
0.6 0.00006 0.0(1012 0.0003 0.0006 0.6
Палочки. 0.8 0.00008 0.00016 0.0004 0.0008 0.8
1.0 0.0001 0.0002 0.0005 0.001 1.0
1.2 0.00012 0.00024 0.0006 0.0012 1.2
1.4 0.00014 0.00028 0.0007 0.0014 1.4
1.6 0.00016 0.00032 0.0008 0.0016 1.6
2.4 0.00024 0.00048 0.0012 0.0024 2.4
2.7 0.00027 0.00054 0.00135 0.0027 2.7
Бациллы. 2.9 0.00029 0.00058 0.00145 0.0029 2.9
г 3.5 0.00035 0.00070 0.00175 0.0035 3.5
4.8 0.00048 0.00096 0.00240 0.0048 4.8
5.9 0.00059 0.00118 0.00295 0.0059 5.9
16.0 0.0016 0.0032 0.008 0.016 16.0
3.52 0 000352 0.000704 0.00176 0.00352 3.52
4.07 0.000407 0.000814 0.002035 0.00407 4.07
Азотобактероподобные 12.08 0.001208 0.002416 0.00604 0.01203 12.08
клетки. 17.6 0.00176 0.00352 0.0088 0.0176 17.6
24.5 0.00245 0.00490 0.01225 0.0245 24.5
35.3 0.00353 0.00706 0.01765 0.0353 35.3
Дрожжи. j 52.0 91.6 0.0052 0.00916 0.0104 0.0183 0.026 0.0458 0.052 0.0916 52.0 91.6
находящихся в 1 г, и полученное произведение разделить на
10003.
В табл. 6 и 7 даны биомассы микробов в 1 л воды (табл. 6) и
в 1 г грунта (табл. 7) при некоторых размерах клеток и различном
их содержании.
ОПРЕДЕЛЕНИЕ ВРЕМЕНИ ГЕНЕРАЦИИ БАКТЕРИИ
II ПРОДУКЦИИ БАКТЕРИАЛЬНОЙ МАССЫ
Количество бактериопланктона, наблюдающееся в водоеме
в любое время, является результирующей величиной скорости
размножения бактерий, их выедания зоопланктоном и отмирания.
Поэтому для выяснения истинной продукции микроорганизмов
в водоеме необходимо определение этих величии.
Показателем скорости размножения бактерий считают время
одной генерации, т. е. период времени удвоения числа клеток.
В практике водной микробиологии пользуются двумя методами
определения времени генерации. Первый метод, предложенный
А. С. Разумовым (1948), — определение времени генерации бакте-
рпй в изолированных пробах воды, лишенной фильтрованием
зоопланктона, погруженных в водоем на определенное время,
второй, разработанный А. Е. Криссом и Е. А. Рукппой (1952), —
учет размножающихся бактерий на стеклах обрастапия.
При расчетах времени генерации исходят из предположения,
что численность размножающихся бактерий возрастает по гео-
метрической прогрессии с коэффициентом прогрессии, равным 2:
т. е. если первоначальное число бактерий Ь было равно 10, то
после первого размножения должно быть 20 клеток, после вто-
рого — 40, после третьего — 80 и т. д.1 Если t — время наблюде-
ния за изменением числа бактерий, g — время одной генерации,
то число генераций (поколений) К — Число бактерий к концу
опыта
В = Ъ2К ~Ъ29 .
После логарифмирования получается
t t Mg 2
lgtf=lg&-|-y lg2; 1g Z? — 1g Ь = у 1g 2; g = .
Эта формула используется при единичном определении вре-
мени генерации в склянке с изолированной пробой. Следует иметь
в виду, что в склянках создаются условия, отличающиеся от при-
родных, вследствие удаления планктона, органических частичек,
отсутствия свободной циркуляции воды, накопления продуктов
1 Ряд авторов берет коэффициент 1.8, всходя из предположения, что
способны к размножению 90% клеток.
134
обмена, явлений антагонизма, прикрепления бактерий к стенкам
склянок и т. д. Поэтому перенесение данных по размножению
бактерий в склянках на весь водоем может быть производимо
с большой осторожностью и с оговорками. В частности, жела-
тельно проведение более кратковременных (чем 8 час.) опытов
(4—6 час.)
Метод учета размножающихся бактерий на стеклах обраста-
ния, разработанный Криссом и Рукпной, состоит в следующем:
стекла устанавливают в водоеме обычпым способом, выдерживают
их одни, двое или трое суток, затем извлекают, подсушивают и
окрашивают раствором эритрозина. Так как размножение бакте-
рий в большой степени зависит от температуры, то во время экспо-
зиции стекол три раза в сутки проводят определение температуры.
Окрашенные стекла просматривают при больших увеличениях
микроскопа и па площади в 4 см2 (по Криссу и Рукипой, на 8 см2)
просматривают все поля зрения одно за другим и сосчитывают
все одиночно лежащие клетки, все микроколонии и количество
клеток в каждой колонии.
По методике выборочного исследования более целесообразно
проводить подсчет на 100 полях зрения через определенные ин-
тервалы препарата, двигая его по диагонали; это подтверждено
и данными наших анализов.
Время генерации в этом случае рассчитывается как среднее
(по размножению различных видов в их микроколопиях). Пред-
полагается, что каждая мпкроколонпя образовалась из одпой
клетки, т. е. 6=1, lg b=0.
Тогда формула для расчета
получает следующий вид:
Mg2 0.30U
1g В - 1g В
— количество
выше. Поэтому вместо 1g В должна быть подстав-
средняя величина, т. е.
Mg2 Mg2
времени генерации упрощается и
(точнее 1g 2 = 0.30103).
клеток в каждой колонии —
Величина В
варьирует от 1 и
лена в формулу
Расчет средней может быть произведен по разным формам
средних: или как средний логарифм В (1g В), пли как логарифм
средней (1g В). Покажем на упрощенном примере эти подсчеты.
Предположим, продолжительность опыта 8 час.
Пиело клеток 1„ О
в колонии Н °
1 0.00000
4 0.60206
5 0.69897
10 1.00000
20 2.30103
135
г - 1+4-U5-- 10 20 ,
Среднее число клеток в колониях В =------------= -7-
4 *
Логарифм среднего числа клеток Ig В = 1g 5 = 0.69897.
Средний логарифм чисел клеток
т 0 4- 0.60206 + 0.69897 + 1.0000 2.30103
Ig D =-----------------------------= —------= 0.37526.
Средняя продолжительность генерации через среднее число клеток
0.30103-8
gl~ 0.69897 ~ 3.4Ь4 часа.
(’родняя продолжительность генерации через средний логарифм числа
клеток
0.30103-8
= 0.57526 =4'186 часа-
Для пояснения смысла каждой из двух вычисленных средних
продолжительностей генерации можно эти средние подставить
в расчетные формулы
£
1 . 2ff = В.
8
Подстановка ^ = 3.4454 дает 1 • 2;М454 = 1 • 22-3222; 2.3222 1g 2 =
= 2.3222 • 0.30103 = 0.69897 = 1g 5 (логарифм среднего числа
клеток). Таким образом, после подсчета средней продолжитель
пости генерации и после ее подстановки получаем то же самое*
среднее число клеток 5, а сумму клеток 20, как было в исход-
ных данных.
Подстановка £2 = 4.186 дает 1 . 2418G=1 • 21-91133; 1.9111 1g 2 =
= 0.57526 (средний логарифм числа клеток).
Если по этому среднему логарифму найти число, которому
он соответствует, то это не 5, а 3.766. Поэтому, видимо,1 для опре-
деления средней продолжительности генерации предпочтитель-
нее первый способ подсчета.
В отличие от приведенного для расчета средней продолжитель-
ности генерации упрощенного численного примера количество
клеток па стеклах обрастания может варьировать в больших пре-
делах и число микроколоний может быть весьма большим. В слу-
чае громоздкости подсчета для его облегчения можно построить
интервальный вариационный ряд и вычисление взвешенной сред-
ней вести по серединам интервалов со взвешиванием по частотам
(по встречаемости) каждой группы. Разумеется, при вычислении
средней g2 (по способу среднего логарифма числа клеток) груп-
пировка и построение вариационных рядов должны произво-
диться по логарифмам чисел клеток в колонии.
1 Вопрос требует дальнейшего анализа.
136
Поясним это па примере:
Число клеток п колонии В . . I 2 3—5 6—10 11 — 15 16—25 26 -50
Число колонии п............ 421 240 125 92 80 183 200
Среднее число клеток в колониях
1 • 421 — 2 • 240 Ч- 4 • 125 4- 8 • 92 + 13 • 80 20.5 • 183 4- 3S • 200
" ~ 421 - 240 4- 125 92 4- 80 4 183 | - 200
14529
______ ,0^34
Число колоний можно выразить в процентах к общему их
числу — принять 1341 за 100, или в долях — принять 1341 за 1.
От этого среднее число клеток в колонии не изменится.
Предположим, опыт продолжался 48 час.; 1g В— 1.03479.
Средняя продолжительность одной генерации составит
0.301 . 48
* I" 10.834
14.448 1QGP
LO3479 = 13ЛЮ ЧаСа-
Для расчета прироста биомассы бактерий в отношении ее
пищевого значения важен абсолютный прирост. Можно считать,
что в водоеме биомасса бактерий поддерживается на определен-
ном уровне более или менее длительное время. Тогда можно пред-
полагать, что прирост идет на питание зоопланктона и на возме-
щение лизиса бактерий. Поэтому представляется возможным
абсолютный прирост массы бактерий предполагать в размере,
не большем, чем масса, учитываемая прямым счетом, т. е. в раз-
мере 100% биомассы в период времени, равный продолжительности
генерации. В таком случае за сутки этот прирост PjB составят
24 часа .. z
п выразится в количестве поколении в сутки (часы со-
кратятся'). В первом нашем примере, при продолжительности
генерации, равной 3.4454 часа за сутки, будет иметь место
з 4454 поколении бактерии. Во втором примере, при про-
должительности генерации 13.96 часа, количество генераций
в сутки оудет равно = 1./2.
При этом способе расчета предполагается, что одна и та же
в среднем масса прироста бактерий повторяется многократно, при
этом достаточно одинаковую массу прироста умножить на количе-
ство генераций. Такое допущение и расчеты возможны только в
условиях водоема, где число бактерий можно принять за устойчивое
в течение более пли менее длительного промежутка времени,
когда повышение или понижение размера биомассы можно не
принимать во внимание. Не такое состояние численности бактерий
имеет место в склянках и на пластинках обрастания (там учиты-
вается изменение численности).
137
Повышение или понижение микробной массы может иметь
место и в любом водоеме, когда эту динамику нельзя не учиты-
вать, например сезонные и суточные изменения. Во всех случаях,
где динамику, темпы размножения нельзя игнорировать, расчет
приростов и убылей должен вестись по формулам геометрической
прогрессии (так как здесь развитие идет на базе уже достигнутого—
приросшие бактерии участвуют вместе с первоначальной массой
в создании нового прироста).
Возможность принимать биомассу бактерий в водоеме устойчи-
вой в течение более или менее длительного периода допускается
в расчетных формулах Н. Д. Иерусалимского (Крисс и Рукина,
1952) и М. В. Иванова (1955). Их формулы различаются по оформле-
нию, а не по существу. Иерусалимский определяет P/В в разах за
сутки. Для расчета абсолютного прироста по формуле Иерусалим-
ского надо биомассу бактерий умножить на P/В. В формуле
Иванова рассчитываются абсолютный прирост и бактериальная
продукция не на 24 часа, а в общем виде на любое число часов.
Умножение на число часов по той и другой формуле предполагает,
что реальная биомасса остается на том же уровне, а прирост
выедается и покрывает убыль за счет лизиса.
Определение времени генерации, прироста, как и биомассы,
должно быть производимо вновь по мере изменения условий раз-
вития бактерий. Неоднократные определения этих показателей
надо, в частности, выполнять для подсчетов месячных, сезонных
и годовых характеристик. Разумеется, для расчета общей массы
водоема придется выяснить особенности отдельных его зон.
ОПРЕДЕЛЕНИЕ ЧИСЛЕННОСТИ ОТДЕЛЬНЫХ
ФИЗИОЛОГИЧЕСКИХ ГРУПП БАКТЕРИИ
Определение общего числа бактерий не дает возможности су-
дить о характере протекающих в водоеме биогенных процессов.
Энергия превращений различных соединений азота, фосфора и
других элементов определяется не общим числом бактерий, а на-
личием бактерий определенных физиологических групп, актив-
ностью этих микробов.
Методика микробиологических исследований небогата прие-
мами установления содержания отдельных групп. Основным ме-
тодом до настоящего времени является метод элективных сред
С. Н. Виноградского. О наличии бактерий той или иной группы
судят по росту их в определенных, наиболее благоприятных для
развития каждой группы средах, по вызываемым ими в этих
средах химическим изменениям.
Количественное содержание бактерий различных групп опре-
деляется или путем посевов строго отмеренных количеств воды
и грунтов в твердые элективные среды и подсчета выросших ко-
лоний — всех или только определенных видов бактерий, или
138
путем посевов различных объемов воды и грунтов в жидкие элек-
тивные среды (метод титров или предельных разведений).
Определение количества бактерий по-
севами в твердые питательные среды. При
этом методе определения количества бактерий той пли иной фи-
зиологической группы могут быть применены два способа посева
при использовании одной и той же твердой питательной среды —
или глубинный, илп поверхностный. При агаровых и желати-
новых питательных средах чаще применяется первый способ,
0.5 мл
0.5 мл
0.5 мл
Рис. 78. Схема разведений воды.
как более простой и менее трудоемкий, при использовании кремне-
кислого геля — второй.
При том и другом способе посева должны быть намечены за-
ранее количества воды и грунта, которыми будут производиться
посевы. В зависимости от намеченной к исследованию физиологи-
ческой группы, характера водоема берут различные количества
посевного материала. Для минерализующих белки бактерий при
посевах водой из незагрязненных водоемов берут от 0.5 до 1.0 мл,
для вод явно загрязненных водоемов — от 0.01 до 0.0001 мл.
Воду загрязненных водоемов разводят стерилизованной в авто-
клаве водой (только не дистиллированной) в простерилизованных
колбочках. Разведения могут быть произведены различными спо-
собами. Одна из схем разведения приведена на рис. 78.
Из каждой пробы воды для посевов должно быть использовано
не менее двух заранее намеченных разведений; из каждого раз-
ведения посевы должны быть произведены не менее чем в 2 чашки.
При разведениях следует соблюдать следующие предосторож-
ности. Пипетка для набирания исследуемой воды вводится в ниж-
ний слой воды. Перед выливанием воды из пипетки в пробирку
со стерилизованной водой края пипетки должны быть обожжены.
139
Если в пробирку должно быть вылито все количество воды, взя-
тое пипеткой, то пипетку выдувают до конца, а последнюю каплю
снимают прикосновением к стенкам пробирки у поверхности воды.
При выливании воды из пипетки в пробирку пипетка должна быть
опущена ниже поверхности воды не более чем на 3 мм (во избежа-
ние смывания бактерий с наружной поверхности пипетки). Про-
бирку в это время надо держать наклонно, чтобы избежать по-
падания в нее бактерий из воздуха. Перед закрыванием про-
бирки ватной пробкой края ее обжигают на пламени спиртовки.
Ватную пробку во время этого процесса следует держать так,
чтобы часть ее, бывшая в пробирке, была обращена вниз и не ка-
салась руки (так всегда полагается держать пробки во время
производства посевов).
Для производства посевов употребляют пипетки на 1 или 2 мл
с делениями на 0.01 мл. Пипетки должны быть заткнуты с широ-
кого конца ватными пробками, тщательно завернуты в бумагу
и простерилизованы. Их разворачивают перед самым посевом и
кончики обжигают над пламенем горелки.
Для каждого разведения берется отдельная пипетка. Как
исключение при недостатке пипеток можно допустить посев одной
пипеткой, но при условии начинать с больших разведений и пере-
ходить к меныпим.
При очень малом содержании микроорганизмов в воде прибе-
гают к следующему приему. 100 мл воды фильтруют через мембран
ный фильтр, последний кладут в чашку Петри па поверхность
питательного агара и проращивают. Бактерии вырастают на по-
верхности фильтра за счет тех минимальных количеств питатель-
ных веществ, которые поднимаются по порам фильтра вверх.
Выросшие на фильтре колонии окрашивают эритрозином и про-
считывают.
При исследовании грунтов ввиду богатства их микроорганиз-
мами посевы производятся из разведений. Существует несколько
приемов разведений. На рис. 79 приводится один из них. Для по-
лучения ряда разведений грунтов необходимо иметь стерильную
посуду: колбочки емкостью 150 мл (лучше плоскодонные), про-
бирки, пипетки на 100, 10 и 1 мл (последние с делениями на 0.1 мл)
и стерильную воду (водопроводную или исследуемого водоема) или
стерильный физиологический раствор.
В стерильную колбочку отвешивают с соблюдением приемов
стерильности 1 г исследуемого грунта. Отвешенный грунт зали-
вают 99 мл стерильной водопроводной воды и тщательно взбалты-
вают 10—20 минут. Так получается основная суспензия. Взбал-
тывание имеет целью, с одной стороны, разбить имеющиеся в грун-
тах скопления микробов, с другой — отделить бактерии от части-
чек грунта. В грунтах, как и в почвах, многие бактерии сильно
адсорбируются частичками донных отложений, и при приготовле-
нии суспензии для производства посевов масса бактерий но отмы-
140
вается от частиц грунта и потому не может быть учтена при по-
севах. Для лучшего отторжения бактерий от иловых частиц
можно прибавлять в колбочку с определенной навеской грунта
стерильные мелкие стеклянные шарики или стеклянные бусы
(по Л. В. Горовиц-Власовой), благодаря которым при встряхи-
вании удается получить большее количество бактерий. Еще
лучше пользоваться особым аппаратом для встряхивания, ко-
торым можно достичь большего однообразия в разбивании скопле-
Рис. 79. Схема разведений грунта.
ний бактерий в различных пробах грунтов путем встряхива-
ния при одном и том же количестве оборотов. При работе с ап-
паратом для встряхивания можно брать большее количество
грунта, а чем больше навеска грунта, тем меньше ошибка в опре-
делении бактерий. При отсутствии аппарата встряхивание про-
изводят рукой в течение 10—20 мин.
Из полученной суспензии надо произвести посевы следующими
количествами: 0.01, 0.001, 0.0001, 0.00001, 0.000001 г и т. д.
грунта, для чего приходится прибегать к дальнейшим разведе-
ниям.
Разведения готовят следующим образом. Берут стерильной
пипеткой 1 мл из среднего слоя основной суспензии и вносят его
в стерильную пробирку с 9 мл стерильной воды (так подготав-
ливается разведение для посевов 0.001 г). Вторично берут той же
пипеткой также 1 мл полученной суспензии и вносят в колбу с 99 мл
стерильной воды (так подготавливается разведение для посевов
0.00001 г). Из колбы после тщательного взбалтывания переносят
по 1 мл в пробирку с 9 мл стерильной воды и в колбу с 99 мл и т. д.
После приготовления разведений приступают к посевам.
Пробирку и колбы с разведениями грунта встряхивают в течение
5—10 мин. и стерильной пипеткой засевают 2 чашки Петри из
каждого разведения. Чашки немедленно заливают агаром, ко-
И1
торый тщательно размешивают с внесенным посевным материалом
и оставляют застывать. Все чашки со всеми посевами после засты-
вания переворачивают дном вверх п ставят в термостат.
Разведения можно производить и другим способом. Грунт
отвешивают в количестве 1 или 10 г и вносят в круглодопную
колбу, содержащую соответственно 991 или 90 мл стерильной
воды. После тщательного встряхивания на специальном аппарате
или рукой (в этом случае 20 мип.) берут из среднего слоя суспен-
зии 1 мл стерильной пипеткой и вносят его во вторую такую же
Рис. 80. Автоматический счетчик
колоний.
Рис. 81. Одноклавишный
счетчик.
1 — клавиша; 2 — рукоятка
гашения.
колбу. Встряхивают 5 мин., берут 1 мл [и переносят в третью
колбу и т. д. Посевы делают так, как изложено выше.
Счет выросших колоний при исследовании различных физио-
логических групп проводится через разное время, которое указы-
вается далее для каждой группы. В случае минерализующих
белки бактерий счет ведут через 48 час.
Наиболее правильный путь определения количества вырос-
ших колоний — прямой подсчет их на всей агаровой пластинке.
Чашку при счете держат дном вверх и счет ведут, пользуясь лу-
пой. Колонии при счете отмечают на дне чашки точками тушью
или восковым карандашом. Счет без лупы или под микроскопом
в микробиологической практике не разрешается. .
Наиболее легкий способ подсчета — использование автомати-
ческого счетчика (рис. 80). В этом случае внимание работающего
сосредоточивается полностью на выросших колониях. При не-
имении автоматического счетчика можно пользоваться однокла-
1 В стерильную колбу наливают стерильной на 100 мл пипеткой 100 мл
стерильной воды, затем отбавляют градуированной пипеткой 1 мл.
впшным счетчиком, выпускаемым киевским заводом медицинской
аппаратуры. Счетчик этот предназначен для подсчета любых
однородных объектов (рис. 81). Прп большом числе выросших
колоний и невозможности непосредственного их счета пользуются
счетными приборами: камерами с делениями на квадраты (рис. 82)
или на секторы.
Вместо не всюду доступных аппаратов для счета колоний
можно использовать более простое приспособление — обычную
прозрачную целлулоидную
в которой вырезается окно
со сторонами в 1 см. На-
кладывая это окно на раз-
личные места чашки и под-
считывая колонии на пло-
щади в 10 см2, определяют
среднее число колоний на
1 см2 и затем пересчитыва-
ют полученное число на
всю площадь чашкп. Из
всех посевов вычисляется
среднее на 1 г влажного
грунта. Окончательный пе-
ресчет числа бактерий дол-
жен быть произведен па 1 г
линейку с сантиметровой шкалой,
Рис. 82. Счетвый прибор Вольфгюгезя.
сухого грунта. Для этого необходимо определить содержание
влаги в грунте. Вымытые хромовой смесью весовые стаканчики
высушивают в сушильном шкафу при 110° С до постоянного веса.
Затем в весовой стаканчик вносят некоторое количество грунта
и взвешивают стаканчики с грунтом. Грунт высушивают при
100° С до постоянного веса и по потере веса определяют содержа-
ние в нем влаги.
Определение количества бактерий ме-
тодом титров. При методе титров элективные среды для
той или другой физиологической группы бактерий засевают раз-
личными количествами воды или грунта. Обычно количество по-
севного материала в каждом последующем посеве берется в 10 раз
большим по сравнению с предыдущим, но в ряде случаев при-
ходится пользоваться и другими соотношениями. Титром в бакте-
риологии называется наименьшее количество посевного мате-
риала (воды или грунта), давшее при засеве питательной среды
рост искомых микроорганизмов. Титр может быть пересчитан на
количество бактерий в определенном объеме воды (1 мл, 1 л).
Наличие искомой группы бактерий определяется наблюдением
над посевами, микроскопическим просмотром и химическими
реакциями.
Выбор среды, ее питательные качества имеют огромное значе-
ние. Среда прп возможно большей электпвности должна обладать
143
и высокими питательными качествами для определенной группы
микробов.
Точность количественных определений бактерий при методе
титров зависит от числа параллельных посевов: она тем выше,
чем больше их сделано. Правильнее делать по 10 параллельных
посевов каждым намеченным количеством воды, но при иссле-
довании нескольких физиологических групп такое количество
посевов очень усложняет работу. Поэтому в ряде случаев прихо-
дится ограничиваться меньшим числом (но не менее 3) параллель-
ных посевов. При исследовании одной группы бактерпй число
посевов уменьшать не рекомендуется.
В первую очередь производятся посевы для определения коли-
чества бактерий, минерализующих белки.
Посевы делают стерильными пипетками возрастающими коли-
чествами посевного материала — различными в зависимости от
Того, какая физиологическая группа бактерий исследуется. На-
пример, при определении титра аммонифицирующих бактерий
в воде посевы производят 0.00001, 0.0001, 0.001, 0.01, и 0.1 мл
воды; для посевов на обнаружение азотобактера в водной толще
лучше брать большие объемы воды: 0.1, 0.5, 1.0, 3.0, 5.0, 10.0 мл
и далее.
Количества воды, начиная с 0.1 мл и выше, засевают без раз-
ведения градуированными пипетками, меньшие количества за-
севают после соответствующих разведений исследуемой воды сте-
рильной.
Посевы грунтами производят из тех разведений, какие при-
готовлены для учета бактерий на мясо-пептонном агаре.
В исследованиях любой группы бактерий при посевах в жид-
кие среды обязательно ставят в термостат контрольные колбы или
пробирки с незасеянной средой, в которых проводят те же хими-
ческие реакции, что и в посевах. Контроль служит для исклю-
чения возможности отнесения биохимических превращений, про-
текающих в посевах, за счет химических реакций.
При получении роста в ряде разведений необходимо вычислить
содержание микроорганизмов исследуемой группы в 1 мл воды,
в 1 г грунта. В крайних разведениях рост исследуемой группы
обнаруживается иногда не во всех параллельных посевах.
В этом случае (при разведении в 10 раз) для вычисления коли-
чества микроорганизмов пользуются таблицами Мак-Креди, со-
ставленными на основе методов математической статистики
(табл. 8).
Для пользования этими таблицами составляют «числовую»
характеристику, которая представляет собой трехзпачное число:
первая цифра — число пробирок, в которых в последнем разве-
дении был обнаружен рост во всех пробирках, вторая и третья
цифры — количество пробирок, в которых наблюдается рост
бактерий в двух следующих разведениях. В том случае, если рост
144
Родина
Таблица 8
Таблица Мак-Креди для обработки результатов количественного учета бактерий методом титров
Числовая характе- ристика Вероятное число при парал- лельных пробирках в коли- честве Числовая характе- ристика "1 Вероятное число при парал- лельных пробирках в коли- | честве Числовая характе- ристика Вероятное число при парал- лельных пробирках в коли- честве
3 4 Ь 3 4 5 3 4 5
ООО 0.0 0.0 0.0 112 1.1 0.8 222 3.5 2.0 1.4
001 0.3 0.2 0.2 ИЗ — 1.3 — 223 4.0 — —
002 — 0.5 0.4 120 1.1 0.8 0.6 230 3.0 1.7 1.2
003 — 0.7 121 1.5 1.1 0.8 231 3.5 2.0 1.4
010 0.3 0.2 0.2 122 — 1.3 1.0 232 4.0 — —
011 0.6 0.5 0.4 123 — 1.6 — 240 — 2.0 1.4
012 — 0.7 0.6 130 1.6 1.1 0.8 241 — 3.0 —
013 — 0.9 — 131 — 1.4 1.0 300 2.5 1.1 0.8
020 0.6 0.5 0.4 132 — 1.6 — 301 4.0 1.6 1.1
021 — 0.7 0.6 140 — 1.4 1.1 302 6.5 2.0 1.4
022 — 0.9 — 141 — 1.7 — 303 — 2.5 —
030 — 0.7 0.6 200 0.9 0.6 0.5 310 4.5 1.6 1.1
031 — 0.9 — 201 1.4 0.9 0.7 311 7.5 2.0 1.4
040 — 0.9 — 202 2.0 1.2 0.9 312 11.5 3.0 1.7
041 — 1.2 203 — 1.6 1.2 313 16.0 3.5 2.0
100 0.4 0.3 0.2 210 1.5 0.9 0.7 320 9.5 2.0 1.4
101 0.7 0.5 0.4 211 2.0 1.3 0.9 321 15.0 3.0 1.7
102 1.1 0.8 0.6 212 3.0 1.6 1.2 322 20.0 3.5 2.0
103 — 1.0 0.8 213 — 2.0 323 30.0 — —
110 0.7 0.5 0.4 220 2.0 1.3 0.9 330 25.0 3.0 1.7
111 1.1 0.8 0.6 221 3.0 1.6 1.2 331 45.0 3.5 2.0
Числовая характе- ристика Вероятное число при парал- лельных пробирках в коли- честве Числовая характе- ристика
3 4 5
332 110 0 4.0 433
333 140.0 5.0 — 434
340 — 3.5 2.0 440
341 — 4.5 2.5 441
350 — — 2.5 442
400 — 2.5 1.3 443
401 — 3.5 1.7 444
402 — 5.0 2.0 450
403 — 7.0 2.5 451
410 — 3.5 1.7 500
411 — 5.5 2.0 501
412 — 8.0 2.5 502
413 — 11.0 — 503
414 — 14.0 — 504
420 — 6.0 2.0 510
421 — 9.5 2.5 511
422 — 13.0 3.0 512
423 — 17.0 — 513
424 — 20.0 — 520
430 — 11.5 2.5 521
431 —- 16.5 3.0 522
432 — 20.0 4.0
Таблица 8 (продолжение)
Вероятное число при парал- лельных пробирках в коли- Числовая характе- Вероятное число при парал- лельных пробирках в коли- честве
честве
3 4 5 ристина 3 4 5
30.0 523 12.0
— 35.0 — 524 — — 15.0
— 25.0 3.5 525 — — 17.5
— 40.0 4.0 530 — — 8.0
— 70.0 — 531 — — 11.0
— 140.0 — 532 — — 14.0
— 160.0 — 533 — — 17.5
— —— 4.0 534 — — 20.0
— — 5.0 535 — — 25.0
— — 2.5 540 — — 13.0
— — 3.0 541 — — 17.0
— — 4.0 542 — — 25.0
— — 6.0 543 — — 30.0
— — 7.5 544 — — 35.0
— — 3.5 545 — — 45.0
— — 4.5 550 — — 25.0
— — 6.0 551 — — 35.0
— — 8.5 552 — — 60.0
— — 5.0 553 — — 90.0
— — 7.0 554 — — 100.0
9.5 555 180.0
был и в последующих больших разведениях, число таких про-
бирок прибавляют к последней цифре.
По определении числовой характеристики находят в таблице
соответствующее ей вероятное число клеток микроорганизмов,
находившихся в 1 мл разведения. После этого делают пересчет
на 1 мл воды или 1 г грунта. Например: засеяно 1—4-м разведе-
ниями по 3 пробирки. Результаты:
Разведение..........1(1:100) 2(1:1000) 3(1:10 000) 4(1:100 000)
Число пробирок, в ко-
торых получен рост.3 2 I 0
Числовая характеристика — 321. Вероятное число по таб-
лице — 15. Следовательно, в 1 мл 1-го разведения было 15 бакте-
рий исследуемой группы, а в 1 мл воды из водоема — 1500.
Г Л А В A 6
МЕТОДЫ ИЗУЧЕНИЯ ПРЕВРАЩЕНИЙ
МИКРООРГАНИЗМАМИ ВЕЗАЗОТИСТЫХ ВЕЩЕСТВ
И ОБНАРУЖЕНИЯ ЭТИХ МИКРООРГАНИЗМОВ
Цикл превращений углерода в водоемах весьма сложен, в нем
участвует ряд физиологических групп микроорганизмов, каждая
из которых осуществляет разложение определенных веществ,
образуя различные соединения в качестве конечных^ и промежу-
точных продуктов распада. Здесь рассматриваются методы об-
наружения дрожжей, бактерий, вызывающих расщепление крах-
мала, гемицеллюлоз, клетчатки, пектиновых веществ, солей орга-
нических кислот, углеводородов и маслянокислое брожение.
Включено рассмотрение окисления водорода по общности методов
его обнаружения с окислением газообразных углеводородов.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ КЛЕТОК ДРОЖЖЕЙ
И ДРОЖЖЕПОДОБНЫХ ГРИБКОВ В ВОДОЕМАХ
Определение содержания клеток дрожжей и дрожжеподобных
грибков при исследовании водоемов, в особенности при определе-
нии биомассы микробов, весьма существенно.
Клетки дрожжей благодаря своим крупным размерам учиты-
ваются отдельно при проведении прямого счета. Кроме того, они
учитываются и методом разливок. Метод разливок обычно дает
заниженные количества дрожжевых клеток, так как дрожжи
в водоемах обычно встречаются в скоплениях, трудно разделяе-
мых при встряхивании па отдельные клетки, и при засеве из скоп-
ления вырастает одна колония.
Посевы производят в чашки Петри. Воду для посевов надо
брать в количестве 0.5—1—2 мл, засевая каждым объемом по
2 чашки Петри. Посевы грунтом производятся из тех же разведе-
ний, которые готовятся для посевов на мясо-пептонном агаре,
теми же количествами. С чашками поступают так же, как при
использовании мясо-пептонного агара: заливают стерильным,
охлажденным до 42° питательным агаром, тщательно смешивают
агар с посевным материалом, дают застыть, переворачивают дном
вверх и ставят прорастать при 22—23° С.
Счет производится первый раз через 5 суток и второй раз
через 10 суток. Все выросшие колонии микроскопируют, колонии
дрожжей отмечают и сосчитывают.
148
Наиболее подходящими средами для учета дрожжей в водоеме
являются следующие.
Среда для дрожжей с суслом и сахарозой
Сл ха роза....................................... 150 г
(NH4)2HPO4......................................... 2 »
КН2РО4............................................. 1 »
MgSO4 • 7Н2О....................................... 1 »
Сусло неохмеленное................................ 10 мл
Пропионовокислый натрий.......................... 0.5 г
Стрептомицин....................................До 10 мг
Водопроводная вода ............................. 1000 мл
Агар.............................................. 20 г
Среда для дрожжей с глюкозой
Глюкоза.........................................(И) г
КН2РО4........................................... 1 »
К2НРО4.......................................... 0.1 »
MgSO4 • 7П2О..................................... 0.7»
NaCl............................................ 0.5 »
Ca(NO3)2........................................ 0.4 »
Отвар дрожжей...................................50 мл
Дрожжевой автолизат................................50 »
Водопроводная вода ............................ 900 »
Агар............................................ 20 г
Отвар дрожжей готовят путем кипячения 200 г прессованных
дрожжей в 1 л водопроводной воды.
Сусло-агар
Исходным материалом для его приготовления является со-
лодовое неохмеленное сусло (можно получать с пивоваренных
заводов или изготовлять в лаборатории из солода). Заводское
неохмеленное сусло содержит обычно 12—16% сахаров и имеет
плотность 16—18° по Баллингу. Для приготовления сред сусло
надо разбавить водой до 8° по Баллингу. Если невозможно сде-
лать это определение, то сусло просто разбавляется в 2 раза. Для
приготовления твердой среды берут дальневосточный или архан-
гельский агар-агар высокого качества (20 г на 1 л), отвешенный
агар распускают в 500 мл воды, соединяют с 500 мл неразбавлен-
ного сусла, хорошо разбалтывают и доводят до кипения. При-
готовленная таким образом среда разливается по пробиркам и
стерилизуется при 110° С 30 мин. В нее должны быть добавлены
асептически стрептомицин и пропионовокислый натрий.
При изготовлении сусла в лаборатории 1 л воды нагревают
до 48—50° Сив нее всыпают, при постоянном помешивании,
250 г молотого солода. Колбу с солодом выдерживают при указан-
ной температуре 30 мин. По истечении этого времени температуру
в колбе поднимают до 55—58° С и поддерживают ее на этом уровне
149
до полного осахаривания крахмала, что определяется пробой
с йодом (проба не должна давать посинения). Затем отфильтро-
вывают сгустки осевших белков и в прозрачном сусле определяют
содержание сахара. Для приготовления среды берут сусло с со-
держанием сахара 6—8%.
Дрожжи с перечисленных сред выделяют на косой агар. После
проверки чистоты культуры (для дрожжей лучше применить ме-
Рис. 83. Способы размножения дрожжей.
А — почкование; Б—деление; В—почкование с отделе
нием перегородкой.
тод получения культуры из одной клетки) приступают к опре-
делению рода и вида.
Для определения дрожжей используются морфологические
признаки и физиологические особенности.
Рпс. 84. Место возникновения почки на клетках дрожжей.
А — на суженном конце клетки; Б — па одном из концов клетки; В — на
различных участках клетки; Г — на боковом краю клетки; Д — на обоих кон-
цах клетки; Е — посередине боковой части клетки; Ж — с краю клетки.
Морфологические признаки (по Lodder a. Kre-
ger-Van-Rij, 1952): 1) характеристика вегетативного размножения;
2) форма и размеры клеток; 3) образование аскоспор и их форма;
4) макроморфологическая характеристика культуры.
150
1. Характеристика вегетативного размножения имеет основное
таксономическое значение. Вегетативное размножение изучают
на сусле и сусло-агаре. Дрожжи могут размножаться или только
почкованием, как например Torulopsis, Rhodotorula и др.
(рис. 83, Л), или только делением, например Schizosacchoromyces
(рис. 83, Б). Оба способа размножения могут встречаться вместе —
Рис. 85. Форма клеток дрожжей.
А - круглая; Б — овальная; В — удлиненно-овальная; Г — цилиндрическая;
Д — лимоновидная; Е — бутылевидная; Ж — треугольная; 3 — сталагмоидная.
вегетативное размножение начинается образованием почки, ко-
торая затем отделяется от материнской клетки перегородкой (се-
мейство Saccharomycodaceae) (рис. 83, В).
У дрожжей, размножающихся почкованием, должен быть от-
мечен характер этого процесса — место возникновения почки:
на различных частях поверхности клетки, на узком основании,
на обоих полюсах (рис. 84).
2. Форму и размеры клеток изучают в молодых культурах —
на сусле и сусло-агаре. Клетки дрожжей могут быть круглыми,
овальными, удлиненно-овальными, цилиндрическими, лимоно-
видными, бутылевидными, треугольными, сталагмоидными (рис. 85).
Кроме формы и размеров дрожжевых клеток, отмечают обра-
зование псевдомицелия, что у водных дрожжей встречается не-
редко, или истинного мицелия. Под псевдомицелием понимаются
151
ветвящиеся нити, состоящие из удлиненных клеток, возникшие
путем почкования (рис. 86, Л). В начальных стадиях клетки,
составляющие нити, имеют одинаковые размеры, далее псевдо-
мицелий ветвится путем почкования, на псевдомицелиальпых
клетках возникают бластоспоры — круглые пли овальные клетки.
Ветвление истинного мицелия происходит за счет боковых вы-
Рис. 86. Псевдомицелий (Л) и истинный мицелий (Б) дрожжей.
ростов клеток (рис. 86, Б). Истинный мицелий состоит из септи-
рованных или несептированных нитей (рис. 87).
Виды псевдомицелия и характер образования бластоспор раз-
личны (рис. 88) у разных родов. Бластоспоры могут быть собраны
в компактные сферические гроздья вокруг вершины псевдомпце-
лиальных клеток, могут находиться в свободных ветвящихся му-
товках, могут быть в цепочках. У некоторых родов на сильно
ветвящемся псевдомицелии бластоспоры расположены в мелких
мутовках и часто наблюдаются по две симметрично расположен-
ные бластоспоры. Бластоспоры могут возникать и путем, напо-
минающим образование конидий у пенициллов.
Многие роды дрожжей образуют покоящиеся формы — артро-
споры. По В. И. Кудрявцеву (1954), артроспоры отличаются от
152
Рис. 87. Септированный (Л) и не-
септированный (Б) мицелий (по
Clifton, 1950).
вегетативных клеток отсутствием вакуолей, утолщенной оболоч-
кой, более резко преломляющей свет плазмой и наличием боль-
шого количества запасных пи-
тательных веществ — гликогена
п жира.
3. Образование аскоспор и
их форма всегда учитываются
при определении вида дрожжей.
Для спорообразования дрожжей
необходимы определенные усло-
вия:
а) сильная культура в ста-
дии активного вегетативного
размножения; б) хорошая упи-
танность засеваемых клеток;
в) резкий переход от обильного
питания к скудному, перенос
дрожжей на такие среды, на
которых вегетативное размно-
жение не может происходить
из-за недостатка питательных веществ; г) благоприятная темпе-
ратура.
Рис. 88. Различное расположение бластоспор на псевдомицелии.
Для соблюдения первого условия делают несколько частых
пересевов (2—3 пересева в течение двух суток) на свежую пита-
153
тельную среду (сусло или другую полноценную среду). При этих
условиях получают культуру, клетки которой богаты запасными
питательными веществами, что необходимо для образования спор
на скудной специальной среде.
Предложены и другие среды для культивирования дрожжей
перед переносом их на среду для спорообразования.
Среда Цетлина
Глюкоза........................................5.0 г
КН2РО4.........................................0.2 »
СаС12 • 6НаО...................................0.05 »
MgSO4 • 7Н2О...................................0.05 »
FeSO4 • 7Н2О ..................................0.001 »
(NH4)2SO4......................................0.5 »
Дистиллированная вода.......................... 1000 мл
Среда Охмана
Экстракт из свекольных листьев.................10 мл
Экстракт из свекольных корней..................20 »
Абрикосовый сок................................35 »
Виноградный сок................................16.5 »
Сухие хлебопекарные дрожжи.....................2 г
Глицерин ......................................2.5 мл
Агар...........................................3 г
Мел............................................1 »
Водопроводная вода ..........................До 100 мл
Выявление способности спорообразования у дрожжей не
всегда удается легко, вследствие того что у некоторых видов этот
процесс выражен слабо, и требует в некоторых случаях исполь-
зования различных сред.
В качестве среды для получения спорообразования могут
быть использованы следующие.
Агар Городковой
Мясной экстракт..................................1.0 г
Пептон...........................................1.0 »
NaCl...........................................0.5 »
Глюкоза........................................0.25 »
Агар...........................................1—2 »
Водопроводная вода.............................100 мл
Агар Городковой в модификации Лоддер и Крегер-Ван-Рий
Глюкоза............................................. 1г
Пептон.......................................... 10 »
NaCl............................................. 5 »
Агар............................................ 30 »
Водопроводная вода ........................... 1000 мл
Гипсовые блоки
Гипсовые блоки готовят смешением 2 частей прокаленного
гипса с 3 частями воды. Полученную массу хорошо размешивают,
переносят в бумажные формочки (без дна) высотой не более 2 см,
154
помещенные на гладкой стеклянной поверхности, и оставляют
застывать. Плотные блоки помещают в чашки Коха гладкой по-
верхностью вверх, наливают воды до половины высоты гипсовых
блоков и стерилизуют при 120° С 30 мин. На гладкую поверх-
ность остывшего блока наносят петлей каплю густой культуры
молодых упитанных дрожжей.
На гипсовых блоках у спорообразующих дрожжей обычно
через 28—30 час. (при температуре около 25°) образуются в клет-
ках споры. Отмечают их количество (количество спор в асках
разных видов различно — от 2 до 8) и форму.
Спорообразование у дрожжей может быть получено на среде,
приготовленной из выщелоченного агара (2?6-го) и дистиллирован-
ной воды. На этой среде споры образуются через несколько дней.
Наиболее благоприятной для спорообразования является темпе-
ратура около 25° С, однако Кудрявцев отмечает, что у дрожжей
рода Nadsonia спорообразование наступает скорее при более
низкой температуре (18°).
Для определения дрожжей весьма важно установление следую-
щих признаков: формы спор, способа их образования и про-
растания.
Аскоспоры могут быть шаровидными, эллипсоидальными,
полушаровиднымп (уплощенные на одной стороне), серповидными,
бобовидными, игловидными, веретеновидными, шляповидными,
сатурновидными (очертаниями напоминающими планету Сатурн)
(рис. 89). Поверхность аскоспор может быть гладкой, бородав-
чатой, с пояском.
Изучение формы аскоспор требует внимательного микроскопи-
рования. Установление способа образования сумок со спорами
производят повторным микроскопированием дрожжей после по-
сева их на среду для спорообразования.
Путь образования спор у разных видов дрожжей различен.
У одних видов споры возникают апогамно — непосредственно из
вегетативных клеток, у других половым путем, в результате про-
цесса копуляции. При копуляции две клетки соединяются между
собой образовавшимися на их поверхности выступами. В месте
соединения выступов оболочка растворяется и содержимое кле-
ток сливается.
Различают копуляцию изогамную—при соединении клеток оди-
накового размера и гетерогамную — при соединении клеток
различных размеров. Сумки, возникшие в итоге процесса копуля-
ции, обычно имеют гантелеобразную форму (две клетки, соеди-
ненные половым каналом) и легко обнаруживаются в препарате
(рис. 90).
4. Макроморфологпческая характеристика культуры дается
описанием штриха на сусло-агаре у молодой культуры и через
1 месяц. Значительно реже приводят описание гигантской колонии
вследствие большой вариабильности этого признака.
15 Г>
Физиологические особенности. Определяют:
1) образование пленки; 2) ассимиляцию сахаров; 3) сбраживание
сахаров; 4) ассимиляцию источников азота; 5) использование
спирта как единственного источника углерода; 6) разложение
арбутина; 7) образование каротиноидных пигментов; 8) образо-
вание крахмалоподобных соединений.
1. Образование пленки, пристеночного кольца и осадка отме-
чают в посевах на жидком сусле через 2—3 дня при выращивании
Рис. 89. Образование аскоспор в клетках дрожжей.
Слева — вегетативные клетки дрожжей, справа — аски с аскоспорами.
Форма аскоспор: А — шаровидные; Б — эллипсоидальные; В — полу-
шаровидные; Г — бобовидные; Д — игловидные; Е — шляповидные;
Ж — сатурновидные.
при 25° С и через месяц. Отмечают характер пленки, цвет, тол-
щину.
2. Ассимиляция сахаров определяется обычно методом ауксано-
граммы. Испытывают отношение к сахарам: сахарозе, мальтозе,
лактозе, глюкозе, галактозе, раффинозе. Используется среда, не
содержащая источника углерода. Такой средой является среда
Лоддер и Крегер-Ван-Рий.
Среда Лоддер и Крегер-Ван-Рий
(NH4)aSO4 ....
КНаРО4..........
MgSO4 • 7НаО . .
Выщелоченный агар
0.5%
0.1
0.05
2
156
Рис. 90. Клетки дрожжей после копуляции.
К среде добавляют 0.05 мл концентрированного в 100 раз
раствора витаминов:
Биотин.............................................. 2 мкг
Кальций пантатеновый.............................. 400 *
Инозит........................................... 2000 *
Ниацин............................................ 400 »
Парааминобензойная кислота........................ 200 »
Солянокислый пиридоксин .......................... 400 »
Тиамин............................................ 400 »
Рибофлавин........................................ 200 »
Водопроводная вода ................................. 10 мл
Раствор витаминов может быть заменен дрожжевой водой
(см. стр. 158).
Стерильная среда распускается на водяной бане, охлаждается
и разливается в чашки Петри, в которые предварительно вносятся
около 2 мл густой суспензии изучаемого вида дрожжей и 1 капля
стерильной дрожжевой воды или раствора витаминов. Агар тща-
тельно смешивается с посевным материалом. После застывания
чашки подсушивают в термостате при 25° С с чуть приподнятой
крышкой для получения сухой поверхности. Затем накладывают
вырезанную из фильтровальной бумаги звезду, каждый луч ко-
торой расширен к краю чашки и смочен в растворе сахара, или
раскладывают на поверхности агара кружки фильтровальной
бумаги, заранее смоченные в растворах сахаров и высушенные,
или же донышко чашки разделяют на секторы линиями, прове-
денными на дне чашки тушью пли восковым карандашом, в каж-
дом секторе отмечают, какой сахар будет внесен, и на поверхность
агара вносят небольшое количество сахара. Рост дрожжей наблю-
дается через 1—2 суток только в тех местах, куда внесен ассими-
лируемый ими сахар.
Использование сахаров может быть определено и на жидких
средах. Вышеуказанная среда готовится в большом количестве,
разливается в ряд колб, в каждую из которых вносится один из
исследуемых сахаров. По растворении сахаров среды разливаются
в пробирки по 5 мл, стерилизуются текучим паром 3 дня. Про-
бирки с различными сахарами засевают одновременно одной сус-
пензией. Наблюдения ведутся через 1 и 2 недели.
Об усвоении того или иного источника углерода судят по массе
развившихся в пробирках дрожжей.
В. И. Кудрявцев (1954) для определения ассимиляции дрож-
жами углеводов рекомендует специальную среду.
Среда Кудрявцева
Исследуемый сахар.............................. 60 г
MgSO4 • 7Н.0................................... 0.7 »
NaCl . . . ”.................................. 0.5 »
Ca(NO3)2....................................... 0.4 »
КН2РО4......................................... 1 »
157
К2НРО4......................................... 0.1 г
Отвар дрожжей................................... 50 мл
Дрожжевой автолиза т............................ 50 »
Водопроводная вода............................ 1000 *
К среде добавляют индикатор бромфеноловый синий в коли-
честве 3 мл 0.04%-го щелочного раствора и 2 г агара на 100 мл
среды. pH среды 5.8—5.9.
3. Сбраживание сахаров дрожжами определяют на дрожжевой
воде с 2% исследуемого сахара. Для приготовления дрожжевой
воды заливают 1 л воды 200 г прессованных дрожжей и стерпли
Рис. 91. Аппараты для установления брожения
(по Carter a. Smith, 1957).
А - Эйнгорна-Смита: 1 — наличие брожении, а — отсут-
ствие брожения; Б — трубка Дунбара.
зуют в автоклаве при 120° С 15 мин. Смесь фильтруют горячей
дважды через складчатый фильтр, к фильтрату добавляют сахар,
разливают в трубки Дунбара или аппараты Эйнгорна-Смита
(рис. 91), стерилизуют текучим паром.
Дрожжи, сбраживающие сахара, выделяют углекислый газ,
который накапливается в закрытом колене трубки. Наблюдения
ведут ежедневно.
4. Ассимиляцию источников азота дрожжами определяют
чаще всего методом ауксанограмм.
Среда для установления ассимиляции дрожжами источников
азота:
Водопроводная вода............................. 1000 мл
Глюкоза...........................................20 г
КН2РО4 ........................................... 1 »
MgSO4 • 7Н2О.................................... 0.5 »
Выщелоченный агар.................................20 »
Стерилизуют 15 мин. при 110° С.
158
На застывший в чашках Петри засеянный агар накладывают
или шаблон из фильтровальной бумаги, каждый луч которого
был заранее пропитан соответствующим источником азота, или
диски из фильтровальной бумаги, пропитанные растворами источ-
ников азота и высушенные. Обычно используют KN()3,
(NII4)2SO4, пептон и аспарагин.
Указанная выше среда может быть использована и в жидком
виде. Приготовленную среду разделяют на части, к одной прибав-
ляют KNO3, ко второй — (NH4)2SO4, к третьей — пептон, к чет-
вертой — аспарагин. Готовые растворы разливают в пробирки
по 5 мл и стерилизуют текучим паром. После стерилизации в каж-
дую пробирку прибавляют асептически по капле смеси витаминов.
5. Использование спирта как единственного источника угле-
рода может быть выявлено на среде Кудрявцева или Лоддер и
Крегер-Ван-Рий, в которые спирт вносится после стерилизации
(до застывания агара) асептически в количестве 1%. Агар разме-
шивается, и пробирка кладется для застывания агара в косом
положении.
6. Разложение арбутина, по Лоддер и Крегер-Ван-Рий, яв-
ляется признаком, имеющим значение при определении дрожжей.1
Для определения его используется агар на дрожжевой воде с
с 0.5% арбутина. В чашки Петри вносится 1 капля раствора
FeCl3, заливается агаром, и после застывания агар засевается по
поверхности. Положительная реакция — появление темно-корич-
невой окраски вокруг колоний в среде — наблюдается через 2, 4
или () суток.
7. Образование каротиноидных пигментов отмечают, выращи-
вая дрожжи на сусло-агаре. Многие водные дрожжи образуют
различные пигменты: розовые, красные, оранжевые и черные.
8. Образование крахмалоподобных соединений является, по
Лоддер и Крегер-Ван-Рий, признаком, необходимым при определе-
нии ряда видов дрожжей. Для определения его используют синте-
тическую среду с 2% агара (стр. 156). В каждую чашку вносят
до засева 1 каплю дрожжевого экстракта или смеси витаминов,
чашку засевают, заливают агаром и выращивают.
Через 1—2 недели определяют наличие крахмалоподобных со-
единений обработкой поверхности агара раствором Люголя.
Появление синего окрашивания показывает образование дрож-
жами крахмалоподобных соединений.
ОПРЕДЕЛЕНИЕ НАЛИЧИЯ АМИЛОЛИТИЧЕСКИХ БАКТЕРИЙ
При отмирании водной растительности в водоемах оказываются
доступные бактериальному разложению крахмалистые вещества.
Крахмал принадлежит к легкоразлагаемым бактериями соедине-
1 Для отграничения рода Hansenula (арбутинположительного) от рода
Pichia (арбутинотрицателыюго).
159
ниям. Очень многие водные бактерии имеют в своем составе амилазу,
под воздействием которой и происходит расщепление крахмала.
Обычно процесс идет в две фазы: сначала происходит гидролиз,
в итоге которого образуется декстрин, далее осахариваемый.
Действие бактерий на крахмал является для них диагности-
ческим признаком.
Для обнаружения амилолитических бактерий обычно поль-
зуются агаром с крахмалом, ведя анализ по методу разливок.
Можно пользоваться и жидкими средами, засевая их по методу
предельных разведений, но первый метод дает более точные данные.
На твердых средах с крахмалом вокруг колоний амилолитиче-
ских бактерий получаются различной ширины, в зависимости от
активности бактерий, зоны гидролиза, не дающие реакции с иодом.
При обработке раствором йода чашек с выросшими на них коло-
ниями среда окрашивается в синий цвет, за исключением зон
гидролиза вокруг колоний амилолитических бактерий, которые
или остаются бесцветными, или получают красновато-бурую
окраску. Цвет зон вокруг колонии зависит от степени гидролиза
крахмала: если крахмал гидролизовав до стадии декстрина, то
зоны красновато-бурые, при более далеко зашедшем процессе
они бесцветны. Колонии, давшие зоны гидролиза, просчитывают.
Могут быть использованы различные крахмальные среды.
Крахмальный агар
Водопроводная пода
КН2РО4..........
К2НРО4 ....
MgSO4 • 7П2О . .
(NII4)2SO4 . . . .
Крахмал.........
Агар............
1000 мл
0.5 г
0.5 »
0.2 »
0.2 »
10 »
15 »
Среда Имшенецкого
20%-й картофельный агар........................ 1000 мл
Пептон............................................ 5 г
Крахмал нерастворимый ........................... 30 »
Мел............................................... 1 »
Для получения этой среды в твердом виде добавляют агар в ко-
личестве 15 г па 1 л.
Агар Пошона
^^Используют стандартный солевой раствор Виноградского,
имеющий следующий состав:
Водопроводная вода ............................ 1000 мл
К2НРО4.......................................... 5.0 г
MgSO4 • 7Н2О.................................... 2.5 »
NaCl............................................ 2.5 »
Fe2(SO4)3 • 9НоО................................ 0.05 »
MnSO4 • 5НоО‘................................... 0.05 »
160
Среду готовят соединением двух растворов:
А. Стандартный раствор Виноградского в разведении
1 : 20 ........................................ 750 мл
NH4NO3............................................ 1г
Агар . . . :.................................... 15 »
Водный раствор фенолового красного (0.02%-и) ... 15 мл
Б. Рисовый крахмал................................. 1.5 г
Водопроводная вода.............................. 250 мл
Смешивают оба раствора. Среда должна быть розоватой.
Первый просчет на этой среде производят через 5 суток: под-
считывают колонии, агар вокруг которых стал желтоватым.
Затем просчитанные чашки обрабатывают раствором Люголя, раз-
веденным в 5 раз, н просчитывают колонии с зонами вокруг них.
Картофельный агар
Картофельный отвар (10%-й)...................... 1000 мл
Мел.............................................. 1г
Агар.............................................. 15 »
Агар на отваре пшеничных отрубей или муки
Отвар пшеничных отрубей или муки (5%-й)......... 1000 мл
Агар............................................... 15 г
Агар Круиффа
Водопроводная вода.............................. 1000 мл
Картофельный крахмал.............................. 0.2 г
Пептон............................................ 0.5 »
К2НРО4..............................................Следы
MgSO4 • 7Н2О.......................................... »
FeCl3 • 6Н2О .................................... »
Агар............................................... 15 г
Агар с мясным экстрактом
Водопроводная вода .............................. 1000 мл
Мясной экстракт..................................... 3 г
Растворимый крахмал................................ 10 »
Агар............................................... 20 »
pH 7.4
Для определения биохимической активности амилолитических
бактерий может быть использована вышеуказанная среда Имше-
нецкого, которую разливают в конические колбочки слоем 1.5—
2. см. После стерилизации производят посевы водой и грунтами по
методу предельных разведений. Засеянные колбочки помещают
в термостат при 23—25° С. Через 24 часа в культурах производят
определения накопленного сахара.
Об активности бактерий в жидких средах судят по исчезно-
вению характерной для крахмала синей окраски после прибавле-
ния йода.
j t А. Г. Родина
161
ОПРЕДЕЛЕНИЕ ПРОЦЕССА РАЗЛОЖЕНИЯ ГЕМИЦЕЛЛЮЛОЗ
Гемицеллюлозы1 входят в состав тканей растений, и поэтому
они в водоемах подвергаются расщеплению вместе с клетчаткой.
Процесс этот для водоемов почти не изучен.
Разложение гемицеллюлоз наиболее интенсивно протекает
в аэробных условиях. Возбудителями являются разные группы
микроорганизмов: грибы, актиномицеты и бактерии.
О процессе судят по общей активности микрофлоры, способной
расщеплять гемицеллюлозы (Pochon et Tardieux, 1962). Принцип
Рис. 92. Установление интенсив-
метода заключается в следующем:
элективную среду для бактерий,
расщепляющих гемицеллюлозу,
засевают различными разведе-
ниями грунта или иного субст-
рата и ежедневно наблюдают за
посевами и устанавливают раз-
ведения, в которых имеют место
начало и конец процесса. Нача-
ло процесса (I стадию). отмечают
но появлению нитритов, что ус-
ности процесса расщепления ге-
мицеллюлоз (по Augier, 1956).
1 — кривая начала расщепления; 2 —
кривая окончания расщепления; з —
разность. По оси абсцисс — время в
сутках; по оси ординат — разведения.
танавливают реактивом Грисса
(приготовление см. стр. 221). Ко-
нец процесса (II стадию) устанав-
ливают реакцией с раствором
флороглюцина в чистой соляной
кислоте.2 На основе полученных
данных строят кривые (рис. 92). Кривая разности позволяет су-
дить об интенсивности роста бактерий, способных разрушать
гемицеллюлозы, и колебаниях энергии процесса в зависимости
от количества микробов.
Определения ведут следующим образом: из каждой пробирки
берут ежедневно по 0.5 мл, вносят в микропробирки, подогревают
и вносят каплю реактива Грисса. Появление красной или розово-
желтой окраски говорит о наличии нитритов (нужно выждать
для выявления реакции 2 мин.). Пробирки, в которых выявилось
наличие нитритов, отмечают знаком плюс; пробирки, пробы из
которых дали очень бледную окраску, знаком «е», не давшие
окраски — знаком минус. Затем прибавляют 1 мл раствора флоро-
глюцина. Держат пробирки 15 мин. на кипящей водяной бане.
Жидкости, которые не содержат более гемицеллюлоз, оказываются
желтыми и прозрачными, те же, в которых осталось от 30 до 100%
гемицеллюлоз, становятся коричневыми со значительным черно-
1 Гемицеллюлозы делят на пентозаны (арабаны, ксиланы, арабоксилапы),
метилпентозаны и гексозаны.
2 0.5 г флороглюцина на 1000 мл НС1.
162
ватым осадком. Отмечают результаты: пробирки с желтой жид-
костью знаком плюс, с черным осадком — знаком минус.
Следует иметь в виду, что нитриты и нитраты дают с флороглю-
цином красную окраску, которая маскирует реакцию на геми-
целлюлозу.
Определение ведут на среде Огье. Элективная среда Огье со-
держит гемицеллюлозы как единственный источник углерода и
нитрат калия как источник азота.
Среда Огье
Стандартный солевой раствор Виноградского (приготов-
ление см. стр. 160) .......................... 50 мл
Почвенная вытяжка ...............................3 »
Раствор микроэлементов ..........................1 »
KNO3.............................................0.3 г
Гемицеллюлоза....................................1 »
СаСО3............................................1 »
Дистиллированная вода..........................До 1000 мл
Среду разливают в пробирки по 5 мл, стерилизуют в автоклаве
20 мин. при 110° С.
Для получения гемицеллюлоз берут 100 г дубовых опилок и
обрабатывают их. Обработка может быть разделена на 4 этапа.
1. Удаление растворимых в воде веществ. Опилки заливают
0.5 л воды, имеющей температуру 70° С, и помещают на 15 мин.
на механическую качалку. Слпвают воду и просушивают опилки
в полотняном мешочке или отфильтровывают на воронке Бюхнера.
< >нерацию повторяют 4 раза. После последнего экстрагирования
опилки высушивают.
2. Экстракция гемицеллюлоз. Заливают опилки раствором
соды (40 г соды на 1 л воды) и оставляют стоять 2 дня, время от
времени встряхивая. Отфильтровывают вначале через полотно,
потом на воронку Бюхнера. Содовый раствор далее используют
для осаждения гемицеллюлоз. Промывают опилки на воронке
150 мл воды.
3. Осаждение гемицеллюлоз. В содовый раствор, соединен-
ный с 150 мл промывной воды, вливают уксусную кислоту до
pH 3.0. Жидкость при этом приобретает красноватую или светло-
коричневую окраску. Затем прибавляют равный объем 95°-го
спирта. Выпадает очень нежный осадок. Осадку дают осесть,
сифоном слпвают жидкость, осадок центрифугируют и собирают
его. Наливают минимальное количество щелочной воды.
4. Очищение гемицеллюлоз. Осадок заливают 50 мл 95°-го
спирта, выливают на воронку Бюхнера, дают стечь и промывают
200 мл абсолютного спирта, затем смесью эфира со спиртом и
наконец эфиром. Снимают осадок, оставшийся на фильтре, сушат
его при 60° С, затем растирают в ступке в тонкий порошок (выход
гемицеллюлоз из 100 г опилок — приблизительно 5 г).
И*
163
ниям. Очень многие водные бактерии имеют в своем составе амилазу,
под воздействием которой и происходит расщепление крахмала.
Обычно процесс идет в две фазы: сначала происходит гидролиз,
в итоге которого образуется декстрин, далее осахариваемый.
Действие бактерий на крахмал является для них диагности-
ческим признаком.
Для обнаружения амилолитических бактерий обычно поль-
зуются агаром с крахмалом, ведя анализ по методу разливок.
Можно пользоваться и жидкими средами, засевая их по методу
предельных разведений, но первый метод дает более точные данные.
На твердых средах с крахмалом вокруг колоний амилолитиче-
ских бактерий получаются различной ширины, в зависимости от
активности бактерий, зоны гидролиза, не дающие реакции с йодом.
При обработке раствором йода чашек с выросшими на них коло-
ниями среда окрашивается в синий цвет, за исключением зон
гидролиза вокруг колоний амилолитических бактерий, которые
или остаются бесцветными, или получают красновато-бурую
окраску. Цвет зон вокруг колонии зависит от степени гидролиза
крахмала: если крахмал гидролизовав до стадии декстрина, то
зоны красновато-бурые, при более далеко зашедшем процессе
они бесцветны. Колонии, давшие зоны гидролиза, просчитывают.
Могут быть использованы различные крахмальные среды.
Крахмальный агар
Водопроводная пода .................
КН2РО4.............................
К2НРО4......................... ...
MgSO4 • 7П2О........................
(NfI4)2SO4..........................
Крахмал.............................
Агар................................
1000 .мл
0.5 г
0.5 »
0.2 »
0.2 »
10 »
15 »
Среда Имшенецкого
20%-й картофельный агар........................ 1000 мл
Пептон............................................. 5 г
Крахмал нерастворимый ............................ 30 »
Мел................................................ 1 »
Для получения этой среды в твердом виде добавляют агар в ко-
личестве 15 г па 1 л.
Агар Пошона
^^Используют стандартный солевой раствор Виноградского,
имеющий следующий состав:
Водопроводная вода ............................. 1000 мл
К2НРО4.......................................... 5.0 г
MgSO4 • 7Н2О.................................... 2.5 »
NaCl............................................ 2.5 »
Fe2(SO4)3 • 9НоО................................ 0.05 »
MnSO4 • 5НоО‘................................... 0.05 »
160
Среду готовят соединением двух растворов:
А. Стандартный раствор Виноградского в разведении
1 : 20 ........................................ 750 мл
NH4NO3........................................... 1г
Агар . . . :.................................... 15 »
Водный раствор фенолового красного (0.02%-и) ... 15 мл
Б. Рисовый крахмал................................. 1.5 г
Водопроводная вода.............................. 250 мл
Смешивают оба раствора. Среда должна быть розоватой.
Первый просчет на этой среде производят через 5 суток: под-
считывают колонии, агар вокруг которых стал желтоватым.
Затем просчитанные чашки обрабатывают раствором Люголя, раз-
веденным в 5 раз, н просчитывают колонии с зонами вокруг них.
Картофельный агар
Картофельный отвар (10%-й)....................... 1000 мл
Мел............................................... 1г
Агар............................................... 15 »
Агар на отваре пшеничных отрубей или муки
Отвар пшеничных отрубей или муки (5%-й)....... 1000 мл
Агар............................................ 15 г
Агар Круиффа
Водопроводная вода.............................. 1000 мл
Картофельный крахмал........................... 0.2 г
Пептон......................................... 0.5 »
К2НРО4.............................................Следы
MgSO4 • 7Н2О..................................... »
FeCl3 • 6Н2О ................................. »
Агар.......................................... 15 г
Агар с мясным экстрактом
Водопроводная вода ................................. 1000 мл
Мясной экстракт..................................... 3 г
Растворимый крахмал................................ 10 »
Агар............................................... 20 »
pH 7.4
Для определения биохимической активности амилолитических
бактерий может быть использована вышеуказанная среда Имше-
нецкого, которую разливают в конические колбочки слоем 1.5—
2. см. После стерилизации производят посевы водой и грунтами по
методу предельных разведений. Засеянные колбочки помещают
в термостат при 23—25° С. Через 24 часа в культурах производят
определения накопленного сахара.
Об активности бактерий в жидких средах судят по исчезно-
вению характерной для крахмала синей окраски после прибавле-
ния йода.
j t А. Г. Родина
161
ОПРЕДЕЛЕНИЕ ПРОЦЕССА РАЗЛОЖЕНИЯ ГЕМИЦЕЛЛЮЛОЗ
Гемицеллюлозы1 входят в состав тканей растений, и поэтому
они в водоемах подвергаются расщеплению вместе с клетчаткой.
Процесс этот для водоемов почти не изучен.
Разложение гемицеллюлоз наиболее интенсивно протекает
в аэробных условиях. Возбудителями являются разные группы
микроорганизмов: грибы, актиномицеты и бактерии.
О процессе судят по общей активности микрофлоры, способной
расщеплять гемицеллюлозы (Pochon et Tardieux, 1962). Принцип
Рис. 92. Установление интенсив-
метода заключается в следующем:
элективную среду для бактерий,
расщепляющих гемицеллюлозу,
засевают различными разведе-
ниями грунта или иного субст-
рата и ежедневно наблюдают за
посевами и устанавливают раз-
ведения, в которых имеют место
начало и конец процесса. Нача-
ло процесса (I стадию). отмечают
но появлению нитритов, что ус-
ности процесса расщепления ге-
мицеллюлоз (по Augier, 1956).
1 — кривая начала расщепления; 2 —
кривая окончания расщепления; з —
разность. По оси абсцисс — время в
сутках; по оси ординат — разведения.
танавливают реактивом Грисса
(приготовление см. стр. 221). Ко-
нец процесса (II стадию) устанав-
ливают реакцией с раствором
флороглюцина в чистой соляной
кислоте.2 На основе полученных
данных строят кривые (рис. 92). Кривая разности позволяет су-
дить об интенсивности роста бактерий, способных разрушать
гемицеллюлозы, и колебаниях энергии процесса в зависимости
от количества микробов.
Определения ведут следующим образом: из каждой пробирки
берут ежедневно по 0.5 мл, вносят в микропробирки, подогревают
и вносят каплю реактива Грисса. Появление красной или розово-
желтой окраски говорит о наличии нитритов (нужно выждать
для выявления реакции 2 мин.). Пробирки, в которых выявилось
наличие нитритов, отмечают знаком плюс; пробирки, пробы из
которых дали очень бледную окраску, знаком «е», не давшие
окраски — знаком минус. Затем прибавляют 1 мл раствора флоро-
глюцина. Держат пробирки 15 мин. на кипящей водяной бане.
Жидкости, которые не содержат более гемицеллюлоз, оказываются
желтыми и прозрачными, те же, в которых осталось от 30 до 100%
гемицеллюлоз, становятся коричневыми со значительным черно-
1 Гемицеллюлозы делят на пентозаны (арабаны, ксиланы, арабоксиланы),
метилпентозаны и гексозаны.
2 0.5 г флороглюцина на 1000 мл НС1.
162
ватым осадком. Отмечают результаты: пробирки с желтой жид-
костью знаком плюс, с черным осадком — знаком минус.
Следует иметь в впду, что нитриты и нитраты дают с флороглю-
цином красную окраску, которая маскирует реакцию на геми-
целлюлозу.
Определение ведут на среде Огье. Элективная среда Огье со-
держит гемицеллюлозы как единственный источник углерода и
нитрат калия как источник азота.
Среда Огье
Стандартный солевой раствор Виноградского (приготов-
ление см. стр. 160) .......................... 50 мл
Почвенная вытяжка ...............................3 »
Раствор микроэлементов ..........................1 »
KNO3.............................................0.3 г
Гемицеллюлоза....................................1 »
СаСО3............................................1 »
Дистиллированная вода..........................До 1000 мл
Среду разливают в пробирки по 5 мл, стерилизуют в автоклаве
20 мин. при 110° С.
Для получения гемицеллюлоз берут 100 г дубовых опилок и
обрабатывают их. Обработка может быть разделена на 4 этапа.
1. Удаление растворимых в воде веществ. Опилки заливают
0.5 л воды, имеющей температуру 70° С, и помещают на 15 мин.
на механическую качалку. Слпвают воду и просушивают опилки
в полотняном мешочке или отфильтровывают на воронке Бюхнера.
< >нерацию повторяют 4 раза. После последнего экстрагирования
опилки высушивают.
2. Экстракция гемицеллюлоз. Заливают опилки раствором
соды (40 г соды на 1 л воды) и оставляют стоять 2 дня, время от
времени встряхивая. Отфильтровывают вначале через полотно,
потом на воронку Бюхнера. Содовый раствор далее используют
для осаждения гемицеллюлоз. Промывают опилки на воронке
150 мл воды.
3. Осаждение гемицеллюлоз. В содовый раствор, соединен-
ный с 150 мл промывной воды, вливают уксусную кислоту до
pH 3.0. Жидкость при этом приобретает красноватую или светло-
коричневую окраску. Затем прибавляют равный объем 95°-го
спирта. Выпадает очень нежный осадок. Осадку дают осесть,
сифоном слпвают жидкость, осадок центрифугируют и собирают
его. Наливают минимальное количество щелочной воды.
4. Очищение гемицеллюлоз. Осадок заливают 50 мл 95°-го
спирта, выливают на воронку Бюхнера, дают стечь и промывают
200 мл абсолютного спирта, затем смесью эфира со спиртом и
наконец эфиром. Снимают осадок, оставшийся на фильтре, сушат
его при 60° С, затем растирают в ступке в тонкий порошок (выход
гемицеллюлоз из 100 г опилок — приблизительно 5 г).
И*
163
ОПРЕДЕЛЕНИЕ ПРОЦЕССОВ РАЗЛОЖЕНИЯ КЛЕТЧАТКИ
При отмирании водной растительности в водоемах подвер-
гается разложению большее или меньшее количество остатков
растений, богатых клетчаткой. Особенно много поступает в воду
клетчатки в осенний период. Разложение клетчатки может про-
исходить в аэробных и анаэробных условиях.
Аэробное разложение клетчатки
Наличие и количество аэробных бактерий, разлагающих клет-
чатку, могут быть определены двумя методами: 1) методом титров
и 2) путем посевов на твердые питательные среды и подсчета вы-
росших колоний.
Для культивирования аэробных целлюлозных бактерий раз-
личными авторами предложено много сред. Здесь приводятся не-
которые из них.
Среда Гетчинсона
К2НРО4.........................................1.0 г
СаС12 . 6Н2О...................................0.1 »
MgSO4 • 7Н2О...................................0.3 »
NaCl...........................................0.1 »
FeCl3 • 6Н2О......................................0.01 »
NaNO3..........................................2.5 »
Дистиллированная вода.........................1000 мл
pH 7.2-7.3
Среда Виноградского
КН2РО4........................................1.0 г
MgSO4 • 7НаО..................................0.5 »
NaCl..........................................0.5 »
MnSO4.........................................0.01 »
Fe3(SO4)3 • 9НаО..............................0.01 >
CaCOa.........................................20 »
KNO3..........................................4 »
Дистиллированная вода......................... 1000 мл
Добавлением 10 %-го раствора углекислого калия pH среды
доводят до 7.2.
Среда Фареуса
(NH4)3PO4..........................................2.5 г
MgSO4 • 7Н2О.....................................0.5 »
FeSO4 • 7Н2О .....................................0.01 »
КС1..............................................0.5 »
СаС12 • 6Н3О......................................0.02 »
MnSO4 • 5Н20 .................................... 0.001 »
Дистиллированная вода............................ 1000 мл
pH раствором NaOH доводится до 7.4.
164
Среда Мак-Бефа
К2НРО4............................................. 1г
MgSO4 • 7Н2О..................................... 1 »
Na2GO3 .......................................... 1 »
(NH4)2SO4........................................ 2 »
GaCO3............................................ 2 »
Дистиллированная вода............................. 1000 мл
Среда Дюбо
NaNO3............................................0.5 г
К2НРО4...........................................1 »
КС1..............................................0.5 »
MgSO4 • 7Н2О.....................................0.5 »
Fe2(SO4)3 • 9Н2О.................................Следы
Дистиллированная вода............................. 1000 мл
pH 7.5
Во все среды должна быть введена в том или ином виде клет-
чатка.
Приготовленную среду разливают в конические колбочки или
в пробирки. Так как наилучшие условия для аэробных целлюлоз-
Рис. 93. Колбы с питательной средой для культи-
вирования целлюлозных бактерий.
А — с конусовидным складчатым фильтром; Б —
с гофрированным фильтром.
пых бактерий обусловливаются не только составом среды, но и
условиями аэрации, то среду наливают тонким слоем (не выше
1 см) и в каждую колбу вкладывают сложенный складками
фильтр широкой стороной вниз, а вершиной конуса вверх
(рис. 93, Л). Вместо конических фильтров можно пользоваться
сложенной складками фильтровальной бумагой, которую уклады-
вают на дно колбы (рис. 93, Б). При использовании пробирок
165
в них наливают немного среды (слоем не выше 2 см) и в каждую
пробирку вкладывают несколько узких полосок фильтровальной
бумаги таким образом, чтобы часть этих полосок была выше среды
4 5
Рис. 94. Пробирки с
фильтровальном бумагой
для аэробных целлюлоз-
ных бактерий.
А — до посева; Б — начало
роста.
(рис. 94, Л). Колбы и пробирки со средами
стерилизуют в автоклаве. Посевы выращи-
вают при температуре около 25° С.
Развитие бактерий, разлагающих клет
чатку, заметно на фильтровальной бумаге
прежде всего на границе среды — там,
где наиболее благоприятны кислородные
условия при обеспечении бактерий пита-
тельной средой (рис. 94, Б). Постепенно
фильтр разлагается бактериями весь и осе-
дает на дно колбы (рис. 95), часто он ос
лизняется. В случае развития разлагающих
клетчатку миксобактерий на фильтре, на
границе среды, появляются влажные сли-
зистые пятна различного цвета. Однако
в ряде случаев при таких условиях аэра-
ции развитие аэробных бактерий происхо-
дит недостаточно быстро. А. А. Имшенец-
кий (1953) рекомендует более совершенные
методы культивирования, обеспечивающие
высокую аэрацию культуры, как культи-
вирование в колбах, помещаемых в ка-
чалки. В круглые колбы наливают такие
количества среды, чтобы на качалке при
раскачивании колбы среда распределялась
тонким слоем по стенкам колбы. Может
быть использовано для улучшения усло-
вий аэрации и продувание воздуха через
среду.
Все перечисленные среды могут быть
использованы и в твердом виде. Тогда в
них добавляют клетчатку (5г/л), обварен-
ную кипятком и растертую на мельчай-
шие волокна, и 1.5% тщательно отмы-
того агара.
По установлении наличия целлюлозных бактерий в водоеме
следует определить возбудителей процесса. Так как разложение
клетчатки может вызываться разнообразными бактериями, необ-
ходимо провести микроскопическое исследование кусочков раз-
лагающейся фильтровальной бумаги. Решение вопроса о виде
возбудителя требует знакомства с формами, вызывающими аэроб-
ное разложение клетчатки. Затруднения возникают еще вслед-
ствие того, что вместе с разлагающими клетчатку бактериями
развиваются и их спутники. Аэробные целлюлозные бактерии,
166
способные развиваться на вышеприведенных минеральных средах,
могут быть разделены на формы, утилизирующие как источник
углерода только клетчатку, и на формы, способные расти и на
обычных средах. В водоемах наиболее часто встречаются пред-
Рис. 95. Постепенное разложение фильтра бактериями
(по Имшенецкому, 1953).
ставители родов Cytophaga, Sporocytophaga, Cellvibrio, Chro-
inobacterium, Pseudobacterium. Cytophaga является представи-
телем первой группы, Cellvibrio, Chromobacterium, Pseudo-
bacterium способны усваивать, кроме клетчатки, и другие органи-
ческие вещества. Разлагают клетчатку
и некоторые актиномицеты, грибы и
мпксобактерии рода Sorangium. Веге-
тативные клетки Cytophaga Winogradsky
имеют весьма характерную форму: это
слегка изогнутые палочки с заострен-
ными концами (рис. 96), 0.3—0.5x4—
6 мк, весьма подвижные, грамотрица-
тельные. К этому роду близки предста-
вители рода Cellfalcicula Winogradsky.
Клетки Sporocytophaga Stanier про-
ходят в своем развитии несколько фаз:
молодые, изогнутые, с заостренными
Рис. 96. Cytophaga
Winogradsky.
концами палочки постепенно изменяют
форму, превращаясь вначале в удлиненные палочки цилиндриче-
ской формы, затем все более и более укорачиваются, давая в
конце круглые или овальные микроцисты (рис. 97).
Клетки Cellvibrio Winogradsky — дугообразно изогнутые, с за-
кру тленными концами палочки, грамотрицательные, размерами
0.3 -0.5x2—4.5 мк (рис. 98).
Для микроскопирования берут кусочек разлагающейся филь-
тровальной бумаги, переносят его иглой на предметное стекло
167
в каплю воды и разрывают иглой на отдельные волоконца. На
волоконцах находятся бактерии. Готовят несколько препаратов;
одни из них просматривают под микроскопом в неокрашенном
виде, другие — после окраски.
Для получения более полного представления о развившихся
бактериях следует приготовить препараты из различных участков
Рис. 97. Цикл развития Sporocytophaga Stanier
(по Имшенецкому, 1953).
Рис. 98. Cellvibrio Wino-
gradsky.
пятна, так как в центре его находятся более старые клетки, а на
периферии более молодые.
А. А. Имшенецкий (1953) указывает, что при выяснении по-
движности аэробных целлюлозных бактерий, помимо метода вися-
чей капли (см. выше, рис. G5), следует при-
менять метод агаровых пленок и кусочков
целлофана, так как движение клеток мик-
собактерий происходит часто только тог-
да, когда они находятся на поверхности
плотного субстрата. Наиболее простым
является использование целлофана. В этом
случае клетки целлюлозных бактерий на-
носят на небольшой четырехугольный ку-
сочек целлофана, который помещают в
центре покровного стекла. На целлофан
наносят небольшую капельку жидкой пи-
тательной среды и немного исследуемого
материала. Затем покровное стекло с цел-
лофаном помещают на предметное стекло с луночкой. Прозрач-
ность целлофана позволяет наблюдать движение клеток и раз-
витие бактерий во всех стадиях.
Для культивирования Cellvibrio более оптимальной является
специальная среда. При выяснении наличия вибрионов следует
сделать пересев на эту среду.
Среда для Cellvibrio
MgSO4 • 7Н2О..................................0.5 г
NaNO3.........................................2.0 »
КС1...........................................0.5 »
168
Fea(SO4)3 • 9H2O..................................0.01 г
KH2PO4...........................................0.14 »
K2HPO4.............................................1.2 »
Дрожжевой экстракт.................................0.5 »
Агар...............................................7.5 »
Дистиллированная вода............................. 1000 мл
Фильтровальная бумага............................ 10 г
Фильтровальная бумага вносится в эту среду в мелко измель-
ченном виде или накладывается на поверхность разлитой в чашки
Петри среды вырезанными по размеру чашек кусками. Фильтро-
вальная бумага в этом случае должна быть заранее простерили-
зована. Для получения же размельченной массы фильтровальная
бумага в мокром виде разделяется с помощью скальпеля илп стек-
лянной палочки на отдельные волоконца. Эту измельченную бу-
магу складывают в ступку, приливают минимальное количество
горячей воды и растирают до получения гомогенной массы.
По Аллену (Allen, 1957), для получения развития, подсчета
и культивирования разлагающих клетчатку бактерий весьма
оптимальной средой является целлюлозно-декстриновый агар
Фуллера и Нормана.
Агар Фуллера и Нормана
NaNO3..............................................1.0 г
К2НРО4.............................................1.0 »
КС1.............................................. 0.5 »
MgCl2 • 6Н2О...................................... 0.5 »
Дрожжевой экстракт (10%-й)......................... 10 мл
Воднонерастворнмый целлюлозный декстрин............ 10 »
Агар............................................... 15 г
Дистиллированная вода............................ 1000 мл
pH 7.0
Воднонерастворимый целлюлозный декстрин готовят следую-
щим образом:
1. Охлаждают в холодильнике или на льду в течение несколь-
ких часов большую фарфоровую ступку и 100 мл 72 %-й серной
кислоты.
2. Холодную ступку окружают мелко раздробленным льдом
с минимальным содержанием в нем воды. Вливают кислоту
в ступку и прибавляют к ней 20 г мелко измельченной фильтро-
вальной бумаги. Смешивают все тщательно. Температура суспен-
зии в это время не должна подниматься выше 10—12° С. Когда
фильтровальная бумага полностью рассыплется (получится водно-
нерастворимый декстрин), смесь оставляют стоять на холоду
1—2 часа.
3. Выливают смесь в G00 мл ледяной воды, содержащей не-
сколько кусочков льда, и оставляют стоять 15—30 мин.
4. Фильтруют декстрин на воронку Бухнера через несколько
рядов тонкой ткани.
169
5. Переносят осадок декстрина с воронки Бюхнера на складча-
тый фильтр из фильтровальной бумаги, промывают его несколько
раз водой, чтобы удалить кислоту, затем нейтрализуют разведенной
щелочью. Снова промывают водой, чтобы удалить из осадка все
растворимые соли. Осадок используется для приготовления среды.
Целлюлозно-декстриновый агар, по Аллену, имеет ряд преиму-
ществ: пригодность его для развития различных видов целлюлоз-
ных бактерий, возможность распознавания активных форм по
образованию ореола, сохранение разлагающими клетчатку бакте-
риями их функций при культивировании на нем в течение дли-
тельного времени.
Для обнаружения целлюлозных бактерий и их выделения мо-
жет быть использован и агар Ривьера.
Агар Ривьера
Целлюлоза в порошке.............................5 г
NaNO3...........................................1 »
Na2HPO4 • 2Н2О..................................1.18 »
КН2РО4..........................................0.9 »
MgSO4 • 7Н2О....................................0.5 »
KG1.............................................0.5 »
Экстракт дрожжей................................0.5 »
Гидролизат казеина..............................0.5 »
Агар............................................10 »
Водопроводная вода ............................. 1000 мл
Целлюлозу в порошке готовят намачиванием в нормальном
растворе соляной кислоты фильтровальной бумаги в течение
12 час. на холоду. Полученную массу переносят на воронку Бюх-
нера п отмывают затем осадок от кислоты. Осадок высушивают.
Среду стерилизуют при 120° С 20 мин. и разливают по чашкам,
стараясь, чтобы целлюлоза равномерно распределилась в среде.
Чашки подсушивают. Посевы производят, нанося на поверхность
среды посевной материал и распределяя его затем по поверх-
ности стерильным шпателем. Инкубация продолжается при 25°
8 суток.
Эта среда подходит для большинства целлюлозных бактерий.
Для выделения в чистые культуры форм Cytophaga и Sporo-
cytophaga Ривьер рекомендует использовать эту среду с добавле-
нием в нее антибиотиков (2.5, 5 и 10 мг/л).
Посевы на твердые среды могут быть произведены на чашки
с гелем, пропитанным одной из вышеуказанных сред. По диа-
метру чашек вырезают кружки фильтровальной бумаги, которые
стерилизуют отдельно сухим жаром. Среду стерилизуют в авто-
клаве. На поверхность кремневого геля, подсушенного с соблю-
дением условий стерильности, помещают кружки фильтровальной
бумаги и наносят на пих 2—2.5 мл среды. Вместо геля можно
пользоваться 1.5—2%-м водным агаром, приготовленным на тща-
тельно промытом агаре. Кружок фильтровальной бумаги поме-
170
щают на поверхность такого агара, налитого в чашку Петри,
и пропитывают затем питательной средой.
Несколько иначе производят посевы по способу Шарпентье.
Кремневый гель (стр. 223), приготовленный в чашках Петри для
посевов, пропитывают 2 мл среды следующего состава:
Водопроводная вода ............................. 1000 мл
К2НРО4............................................ 10 г
NH4NO3............................................. 3 »
MgSO4 • 7Н2О....................................... 5 »
NaCl............................................... 1 »
СаС12 • 6Н2О....................................... 1 »
FeCl3 • 6Н2О....................................... 1 мл
Затем его подсушивают при 56° С до полного испарения среды,
после чего на поверхность чашек наносят посевной материал,
Рис. 99. Зоны разложения фильтровальной бумаги
вокруг колоний целлюлозных бактерий.
распределяя его равномерно на поверхности чашки. Засеянные
чашки закрывают каждую стерильным кружком фильтровальной
бумаги, который должен лечь плотно на поверхность гелевой
пластинки.
При посевах водой на поверхность чашек с гелем вода каплями
наносится на поверхность среды из градуированной пипетки.
При посевах грунтами посевной материал может быть внесен из
различных разведений или грунт может быть распределен комоч-
171
ками таким образом, как это указано для нитрифицирующих
бактерий (стр. 224).
Чашки выдерживают в термостате при 24—25° С. Уже через
4—5 суток может быть отмечено начало развития разлагающих
клетчатку бактерий: на фильтровальной бумаге появляются зоны
разложения клетчатки (рис. 99), часто окрашенные. Окраска ко-
лоний и окраска бумаги являются характерными признаками
развития того или другого вида. Колонии, вокруг которых обра-
зовались такие зоны, просчитывают. Микроскопия зон разруше-
ния клетчатки дает возможность сделать заключение о виде раз-
вившихся целлюлозных бактерий.
Цвет пигмента, образуемого разными видами
целлюлозных бактерий
Cellvibrio ochraceus Winogr. — охряно-желтый
С. flavescens Winogr. — желто-бурый
С. vulgaris Stapp et Bort. — светло-желтый
C. fulvus St. et Bort. — желто-бурый, затем коричневый
C. violaceus Castalli — фиолетовый
Cellfalcicula viridis Winogr. — зеленый
C. mucosa Winogr. — палевый
C. fusca Winogr. — буро-палевый
Sporocytophaga congregate Ful. et Norm. — желтый
S. myxococcoides Stan. — светло-желтый
S. ellipsospora Imschen. et Solntz. — оранжевый
Chromobacterium ferrungineum Rullm. — буро-желтый, коричневый
Ch. rossicum Kell. — ярко-желтый
Ch. biazotcum Kell. — лимонно-желтый
Ch. folium Sanb. — ярко-желтый
Ch. gilvum McBeth — желто-лимонпый
Ch. aurogenes Kell. — ярко-желтый
Cytophaga hutch insonii Winogr. — желтый
C. aurantiaca Winogr. — оранжевый
C. rubra Winogr. — розовый и красный
C. tenuissima Winogr. — оливково-зеленый
C. deprimata Ful. et Norm. — желто-оранжевый
C. lutea Winogr. — ярко-желтый
C. krzemieniewskae Stan. — розоватый или светло-красный
C. defluens Stan. — розовый, затем красный
Pseudobacterium liquatum McBeth et Sc. — желтый
P. flavigenum Kell. — желтый
P. idoneum McBeth — желтый
Bacillus cytaseus McBeth et Sc. — очень бледно-желтый
Ряд видов не образует пигментов.
Анаэробное разложение клетчатки
Для обнаружения в водоемах анаэробных бактерий, разла-
гающих клетчатку, могут быть использованы различные питатель-
ные среды.
Среда Имшенецкого № 1
Водопроводная вода ........................... 1000 мл
NaNH4HPO4 • 4Н2О............................... 1.5 г
КНаРО4......................................... 0.5 »
172
NaCl ........................................... 0.1 г
K2HPO4.......................................... 0.5 »
MgSO4 • 7Н2О.................................... 0.4 »
Пептон.......................................... 5 »
СаСО3........................................... 2 »
MnSCL • 5Н20....................................1 капля
1%-го
раствора
FeSO4 • 7Н2О ...................................1 >
Фильтровальная бумага...........................15 г
pH 7.0-7.4
Среда Имшенецкого № 2
Водопроводная вода................................. 500 мл
Мясо-пептонный бульоп.............................. 500 »
Мел.................................................. 2 г
Фильтровальная бумага............................... 15 »
pH 7.0-7.4
Среда Омелянского
Водопроводная вода
Мясо-пептонный бульон
(NH4)2HPO4..........
К2НРО4..............
MgSO4 • 7Н2О ....
NaCl................
СаСО3 ..............
Фильтровальная бумага
700 мл
300 »
1 г
1 »
0.5 »
Следы
2 г
30 »
Среда Мюллера
Водопроводная вода................................ 900 мл
Дрожжевая вода.....................................100 »
Глюкоза..........................................0.5 г
Пептон..............................................5 »
Целлюлоза...........................................3 »
pH 7.4
Фильтровальную бумагу, нарезанную тонкими полосками,
помещают или в высокие пробирки, или в склянки и заливают
средой (рис. 100). Для обеспечения более полного анаэробиоза
склянки могут быть после засева долиты запасной стерильной
питательной средой доверху и закрыты пробками с газоотводными
трубками, концы которых погружают в жидкий парафин (рис. 101).
Показатели идущего процесса расщепления клетчатки —
распад фильтровальной бумаги и выделение при этом газов.
Возбудителем процесса является Bacillus cellulosae Omeliansky —
длинные, тонкие, иногда искривленные подвижные палочки
с круглой конечной спорой (рис. 102); при спорообразовании
клетки на конце раздуваются и становятся похожи на бара-
банные палочки. Характерный признак—отсутствие в клетках
гранулезы. Вас. cellulosae вызывает гидролиз клетчатки с обра-
17
Рис. 100.
Пробирка с
питатель-
ной средой
и фильтро-
вальной бу-
магой для
анаэробных
цсллюл оз-
пых бакте-
рий.
Рис. 101. Поста-
новка культуры
анаэробных цел-
люлозных бакте-
рий (по Омелян-
скому, 1940).
Рис. 102. Bacillus cellulosae Omeliansky Serb.
А, Б — различные расы.
зованием органических кислот (уксусной, масляной) и газов
(углекислоты и водорода).
Описаны и другие виды, способные разлагать клетчатку:
Вас. methanicus Omeliansky и Вас. cellulososolvens Gowl. et
Rettg.
Форма клеток у всех видов сходная: это палочки с терми-
нальной спорой.
ОПРЕДЕЛЕНИЕ ПРОЦЕССОВ РАЗЛОЖЕНИЯ
ПЕКТИНОВЫХ ВЕЩЕСТВ
Скорость минерализации растительных остатков в водоемах
зависит также и от разрушения пектиновых (межклеточных), не-
растворимых в воде веществ, соединяющих растительные клетки
и содержащихся в значительных количествах в растительных
остатках. Пектиновые вещества являются производными угле-
водов. Химический состав их различен у разных растений.
Бактерии, способные вызывать разрушение пектиновых ве-
ществ, широко распространены в водоемах. Они имеют большое
значение не только в круговороте веществ, но и в народном хо-
зяйстве, так как являются возбудителями мочки лубоволокнистых
растений (льна и др.).
Пектины разрушаются в природных условиях анаэробными
бактериями, аэробными бактериями и грибками.
Для обнаружения анаэробных возбудителей пектинового бро-
жения могут быть использованы различные питательные среды.
Часто применяется элективная среда, содержащая воду и пред-
варительно обработанные снопики льняной соломы (вываренные
несколько раз в воде для удаления из них экстрактивных ве-
ществ).
Эта среда может быть с успехом заменена другой (рецепт
А. Л. Бычковской). Вместо льняной соломки берут снопики из
стеблей крапивы. Крапиву собирают после ее цветения, высу-
шивают. Снопики, приготовленные из такой крапивы, вываривают,
несколько раз сменяя воду, затем опускают в пробирки и зали-
пают водой, к которой прибавлены дрожжевая вода в количестве
5 -10% и мел в осадке. Стерилизация производится в автоклаве
при 120° С.
Может быть использована и минеральная среда, указанная
С. В. Бариновой.
Среда Бариновой
Водопроводная вода ............................... 1000 мл
КаНРО4............................................. 0.5 г
(N1I4)2HPO4........................................ 2.0 »
MgSO4 • 7НоО....................................... 0.1 »
NnCI . . . “....................................... 0.1 »
Мол................................................20.0 »
175
К этой среде могут быть добавлены различные источники пек-
тина: картофель, льняная солома, растворимый свекловичный
пектин или сухая сахарная свекла (содержит 20% пектина).
Наиболее подходящей, по данным Бариновой, является сахарная
свекла, которую добавляют в количестве 5 г на 100 мл среды.
Среда является более оптимальной при добавле-
нии в нее дрожжевого экстракта в количестве
1 г/л.
Хорошие результаты дает следующая среда:
отвар картофеля с экстрактом дрожжей и куском
моркови или картофеля. Отвар готовят кипяче-
нием нарезанного на куски картофеля (500 г на
1000 мл воды) в течение 30 мин. Жидкость сли-
вают, прибавляют к ней 5 г экстракта дрожжей.
Ь
д
Рис. 104. Возбудители пектинового брожения.
А — Clostridium pectinovorum Winograd. et Frib.; Б — Cl.
felsineum Berg, et al.
Рис. 103. Про-
бирки с пита-
тельной средой
для культиви-
рования пекти-
новых бакте-
рий.
А — до засева;
Б — при разви-
тии пектиновых
бактерий.
Стерилизуют при 115° С 30 мин. Стерилизуют
в узких пробирках куски моркови или кар-
тофеля. Прибавляют асептически указанный
выше отвар в количестве, достаточном для
покрытия кусков моркови (картофеля). Вно-
сят редуцирующее вещество, чтобы содейство-
условий анаэробиоза.
вать созданию
Для обнаружения этого процесса питательную среду зали-
вают в пробирки высоким слоем для обеспечения более благо-
приятных условий для развития анаэробов. В. Л. Омелянский
рекомендует помещать засеянные пробирки в вакуум-эксикаторы,
из которых затем выкачивается воздух и заменяется инертным
газом. Однако это необязательно.
Анаэробное брожение пектиновых веществ развивается уже
через 2—3 дня, и снопики выделяющимися при этом газами вы-
носятся на поверхность жидкости (рис. 103, В). Чтобы избежать
176
выноса снопиков вверх внутри снопиков могут быть укреплены
стеклянные трубочки.
Брожение пектиновых веществ сопровождается образованием
уксусной и масляной кислот.
В первые после посева дни развиваются спутники, исполь-
зующие сахаристые вещества внесенных растений. Чтобы от-
сеять постороннюю микрофлору и накопить возбудителей пекти-
нового брожения, производят ряд пересевов. Установление
в тканях пектинразлагающих бактерий производят микроскопи-
ческим путем. Готовят препарат из ткани растения (снимая не-
большой отрезок лубяной ткани скальпелем или бритвой), поме-
щают его в каплю раствора йода в йодистом калии. Пектиновые бак-
терии отчетливо видны благодаря окрашиванию в них гранулезы.
Многие микробы обладают способностью разлагать пектины
и вызывают этот процесс в водоемах. В слабой степени это могут
осуществлять такие банальные формы, как Bacillus mesentericus,
Вас. asterosporus и виды групп fluorescens и coli. Однако суще-
ствует ряд бактерий, обладающих высокой активностью воздей-
ствия на пектиновые вещества, как например ряд видов Clostri-
dium (табл. 9 и рис. 104).
Чистые культуры анаэробных возбудителей пектинового бро-
жения могут быть получены по Омеляпскому. Для этого готовят
агар на морковном отваре. Берут 200 г свежей моркови, измель-
ченной на терке, заливают 1 л водопроводной воды и кипятят
в течение 1 часа, прибавив немного мела для нейтрализации кис-
лот. Полученную жидкость отфильтровывают и на ней готовят
агар.
Может быть использована агаризованная картофельная среда
с дрожжевым экстрактом или среда с пептоном.
Среда с пептоном для пектиновых бактерий
Водопроводная вода ............................. 950 мл
К2НРО4..........................................1 г
MgSO4 • 7Н2О....................................0.25 »
Пептон..........................................2 »
Галактоза.......................................5 »
Дрожжевая вода....................................50 мл
Агар..............................................20 г
Пектин............................................ 8 »
Выделение производится следующим образом. Немного жид-
кости из культуры, в которой прошло спорообразование, пере-
носят в стерильные маленькие пробирочки, подвергают выдержке
ни водяной бане в течение 10 мин. при 80° С. Затем стерильной
пинеткой вносят небольшое количество этой прогретой жидкости
и пробирку с расплавленным агаром, хорошо смешивают ее и
сейчас же набирают в заранее простерилизованные сухим жаром
нпс геройские пипетки, которые после застывания в них агара поме-
щики' в термостат для проращивания.
12 Л Г. Родина 177
Пектинразлага
(по Raynaud,
Впд Характеристика вида Образование пигментов Разжижение желатины
Clostridium pectinovo- rum Winogradsky et Fribes (рис. 104, Л). Крупные палочки до 15 мк длиной, грамположитель- ные, подвижные, споры терминальные, при споро- образовании клетки накап- ливают гранулезу. Не обра- зует. +
Cl. felsineum (Carbone) Bergey et al. (рис. 104, Б). Палочки подвижные, 3.5 X X 0.9 мк, споры субтерми- нальные, при спорообразо- вании клетки клостридиаль- ные, накапливают много гранулезы. Желто- оранжевый и желто- розовый. +
Cl. baumanni (Soriano) PnSvot. Палочки подвижные, грампо- ложительные, 3—12 X 0.8 мк, споры терминальпые, при спорообразовании клетки плектридиальные, не на- капливают гранулезу или накапливают очень мало. Канаре- ечно- желты й или красный. 0
Cl. roseum McCoy et McClung. Палочки подвижные, 3.9 X X 0.8 мк, грамположитель- ные, споры субтерминаль- ные, при спорообразовании клетки клостридиальные. Розовый и розово- красный. +
Cl. corallinum Prevot et Raynaud. Палочки 3—4 X 0.8 мк, по- движные, грамположптель- ные, споры субтерминаль- ные, при спорообразовании клетки клостридиальные. Кораллово- красный. +
Cl. saturni rubrum Pre- vot. ХОдЯмКх " подвижные, грамположи- тельные, споры субтерми- нальные, при спорообразо- вании клетки клостриди- альные. Красный. 0
Cl. aurautibutyricum Hellinger. Палочки очень вариабильные в размерах: 2.8—17 X 0.5— 0.6 мк, подвижные, грамно- ложительные, споры суб- терминальные. Розово- оранжевый или оранжево- красный.
178
62Л
— -т- 4- 4- Свертывание молока ЮЩНС 1949)
-Г U- 4- О 4- Разложение крахмала et 5» 3
о о О о • с 4- Образование H2S о •о S =
-J- о О о •о -J- Образование индола
4’ о 4- 4- •о 4- 4- масля- ная
4- о 4- — 4- 4- уксус- ная я
'Г' г- 1 1 4- Z | 1 4- муравьи- ная S g о а □ •о о
4- 4- 4- 4 •V 4- 4- молоч- ная й ж
4- 4- г + бутило- вый о •о о я
+ 4- 4’ •Х5 4- + ЭТИЛО- ВЫЙ о □ S » S л
(следы) 1 4- V О о я я | + О изопро- пиловый •о ч Е
4- V 4- —V- •V 4- 4" ацетон
Н
59
04
а
я
со
Колонии пектинразлагающих бактерий вырастают на агаре
в капиллярах довольно быстро: их рост может быть отмечен уже
через 1—2 суток. Агар вокруг колоний в результате выделения
газов разрывается. Выделение производится обычным путем —
надпилом п отламыванием капилляра вблизи выросших колоний.
Его обычно повторяют несколько раз. Выделение можно произ-
вести и с поверхности агара, разлитого в чашки Петри, ведя куль-
туру в анаэробных условиях.
Следует иметь в виду, что прибавление пептона или мясной
воды создает менее благоприятные условия для пектиновых бакте-
рий.
Для обнаружения аэробных пектиновых бактерий может
быть использована среда Омелянского.
Среда Омелянского для пектиновых бактерий
Водопроводная вода........................... 1000 мл
(NH4)2SO4................................... 0.5 г
К2НРО4...................................... 0.5 »
Мел...........................................20 »
Эту среду разливают тонким слоем в конические колбочки,
добавляют в каждую какие-либо пектиновые вещества и стерили-
зуют в автоклаве. Засеянные колбочки инкубируют в термостате
при 25° С.
Активность аэробных пектиновых бактерий может быть опре-
делена, по Кайзеру и Шалвиньяку, на специальной среде.
Среда Кайзера и Шалвиньяка
Готовят растворы:
1. Дистиллированная вода.......................... 1000 мл
Агар.............................................. 15 г
СаС12 • 6П2О....................................... 5 »
Приготовленный раствор фильтруют, после фильтрации pH
приводят к 7.3 разбавленным раствором соды, разливают в про-
бирки по 3 мл и стерилизуют 20 мин. при 120° С.
2. Дистиллированная вода.......................... 900 мл
Стандартный раствор Виноградского................ 50 *
Почвенный экстракт............................... 50 »
Раствор NaHCO3 (10%-й)............................ 5 »
NH4NO3............................................ 2 г
Пектин картофеля (готовый препарат)............... 8 »
При введении в среду пектина картофеля следует иметь в виду,
что он плохо смешивается с водой. Пектин или прямо вводят
в солевой раствор, нагретый до 80° С и смешивают с ним до полу-
чения гомогенной смеси, или вносят в абсолютно сухой сосуд,
смешивают с 15 мл 96°-го этилового спирта, затем прибавляют
180
нагретый до 80° солевой раствор и тщательно все смешивают;
pH раствора приводят к 8 введением 5 мл раствора соды.
Разливают по 15 мл. Стерилизуют в автоклаве и останавли-
вают нагревание в момент, как только будет достигнута темпера-
тура 120° С. Таким путем разрушение молекулы пектина сводится
к минимуму; pH после стерилизации снижается до 7.2.
К моменту использования вводят стерильной пипеткой 2 мл
раствора с пектином в каждую пробирку с агаром. Пробирки
засевают. При введении 1 мл разведения грунта пли 1 мл воды
концентрация пектина оказывается 5.33 ?о. Воздействие микро-
организмов на пектин обнаруживается по его разжижению.
Для грибков, вызывающих разложение пектиновых веществ,
С. В. Бариновой предложена специальная среда.
Среда Бариновой для пектинразлагающих грибков
Водопроводная вода.............................. 1000 мл
NH4NO3........................................... 3 г
КН2РО4........................................... 0.6 »
MgSO4 • 7Н2О..................................... 0.3 »
FcCl3 • 6112О.....................................Следы
ZnSO4 • 7Н2О .................................... »
Пектин...........................................10 г
Процесс разложения пектиновых веществ идет под воздейст-
вием ряда ферментов. Первый этап — первоначальная мацера-
ция растительных тканей происходит под воздействием фермента
протопсктиназы, переводящей нерастворимые пектины в раство-
римое состояние. Далее фермент пектаза гидролизует эфирные
связи пектинов. Гидролиз пектиновых веществ доводится до конца
пектиназой или полигалактуронидазой.
Активность пектинразлагающих бактерий может быть опре-
делена по энергии воздействия указанных ферментов: прото-
пектиназы — по мацерации тканей картофеля или моркови (боль-
шей частью определяется по времени обрыва тонкой картофельной
пластинки в строго определенных условиях опыта, см. Большой
практикум по микробиологии, 1962); пектазы — по изменению
цвета среды, содержащей пектин лимона; полигалактуронидазы—
измерением относительной вязкости раствора пектина до и после
воздействия бактерпй (Saissac, Brugiere et Raynaud, 1952).
ОПРЕДЕЛЕНИЕ НАЛИЧИЯ ВОЗБУДИТЕЛЕН
МАСЛЯНОКИСЛОГО БРОЖЕНИЯ
В водной толще и в грунтах водоемов при разложении расти-
тельных и животных остатков идет процесс расщепления раз-
личных углеводов и спиртов (маннита, глицерина и др.) и их со-
единений (глицеридов и др.) с образованием в преобладающем
количестве масляной кислоты. Процесс этот получил название
181
маслянокислого брожения. Вызывается он широко распростра-
ненными в природе, и в том числе и в водоемах, анаэробными
спорообразующими бактериями, сбраживающими указанные со-
единения с обильным газовыделением (Н2 и СО2) и образованием
масляной кислоты и ряда побочных продуктов (кислоты жирного
ряда, спирты, ацетон и др.). Наибольшего развития маслянокис-
лое брожение достигает в тех биотопах, где скапливаются без-
азотистые органические вещества. Систематика этой группы
выяснена еще недостаточно. Возбудители маслянокислого броже-
ния — крупные спорообразующие палочковидные формы, до-
стигающие в длину 10—12 мк; большинство их подвижно. В пе-
риод спорообразования форма клеток меняется, приобретая или
форму веретена (если спора образуется в центральной части),
или барабанной палочки (если спора образуется па конце).
Возбудители маслянокислого брожения накапливают в клет-
ках гранулезу (запасное питательное вещество), вследствие
чего при воздействии йода плазма клеток окрашивается
в синий цвет.
Для обнаружения бактерий, вызывающих маслянокислое
брожение, можно пользоваться различными средами: карто-
фельной средой, пептонной водой с глюкозой, мясо-пептон-
ным бульоном, к которому должны быть добавлены углевод (глю-
коза или сахароза) в количестве 2% и мел для нейтрализации*
образующейся кислоты, различными минеральными средами
с глюкозой. Для выявления маслянокислых бактерий, обладаю-
щих специализированными функциями, например способностью
фиксировать азот; среды указаны в соответствующем разделе.
Сахарсодержащие среды пригодны для развития самых раз-
нообразных микробов; поэтому для получения роста масляно-
кислых бактерий, являющихся строгими анаэробами, культуру
следует вести в условиях, обеспечивающих анаэробиоз, и произ-
водить посевы в горячие среды. При таком способе должны по-
гибнуть бесспоровые виды, спороносные же маслянокислые бакте-
рии должны сохраниться.
Посевы производят в одну из следующих сред.
Картофель с мелом
В широкие и высокие пробирки вносят мелкие кусочки сы-
рого картофеля, наполняя ими х/4 или V2 пробирки, затем до-
бавляют мел (около 0.2 г) и заливают водопроводной водой до
2/3 объема пробирки. Стерилизуют в автоклаве.
Мясо-пептонный бульон с глюкозой
Мясо-пептонный бульон с глюкозой разливают высоким слоем
в пробирки, на дне которых находится небольшое количество
мела. В пробирки вкладывают затем маленькие пробирочки-по-
182
плавки для собирания газа (рис. 105). Среду стерилизуют или
текучим паром, или в автоклаве при 110° С 20 мин. Во время сте-
рилизации маленькие пробирочки полностью за-
полняются средой.
Пептонная вода с глюкозой
Водопроводная вода ....................... 1000 мл
Пептон...................................... 20 г
Глюкоза..................................... 20 »
Мел.........................................В осадке
Среду разливают высоким слоем в пробирки
с маленькими пробирочками на дне и с внесенным
заранее мелом. Стерилизацию производят текучим
паром или в автоклаве при 110° С 20 мин.
Минеральная среда Нероновой
Дистиллированная вода................... 1000 мл
(NH4)2HPO4...............................1 г
К2НРО4...................................0.5 »
MgSO4 • 7Н2О.............................0.01 »
Глюкоза................................... 20 »
Мел (добавляют в каждую пробирку отдельно) . . 10—20 г
А 5
Рис. 105. Про-
бирки для бак-
терий, вызы-
вающих масля-
покислоо бро-
Кристаллический биотин........................0.001 мг
Аскорбиновая кислота .......................... 100 »
Разливают высоким слоем в пробирки, на дпо жспие.
которых внесено небольшое количество мела, а—до засева;
Стерилизуют текучим паром. ь “ Пт"и. разви‘
Среда с этиловым спиртом 1
Дистиллированная вода..........................1СЮ0 мл
Этиловый спирт (96°-й).........................8 »
CH3COONa • ЗН2О................................8 г
КН2РО4—Na2HPO4 забуференный, 1 м., pH 7.0 .... 25 мл
Na2CO8 ........................................0.1 г
(NH4)2SO4......................................0.5 »
MgSO4 • 7Н2О...................................0.2 »
CaSO4 • 2Н2О ...................................10 мг
FeSO4 • 7Н2О ....................................5 »
MnSO4 • 5Н20...................................2.5 »
NaMoO4 • 2Н2О .................................2.5 »
Биотин.........................................3 мкг
Парааминобензойная кислота ....................50 »
Тиогликолат натрия.............................0.5 г
Тиогликолат натрпя может быть заменен 0.2 г Na2S • 9Н2О,
ростовые вещества могут быть заменены 0.5—1 г дрожжевого
экстракта. Спирт вносят асептически в простерилизованную
среду.
1 Manual of microbiological methods, 1957.
183
Среда с мясным экстрактом
Водопроводная вода ................................ 1000 мл
Дрожжевой экстракт..................................10 »
Мяспой экстракт..................................... 5 г
NaCl................................................ 3 »
CH3COONa • ЗН2О..................................... 3 »
Крахмал растворимый ................................ 1 »
Декстроза........................................... 5 »
Цистеин солянокислый............................. 0о5 »
Агар............................................. 0.5 »
pH 7.2
Рис. 106. Возбудитель мас-
лянокислого брожения —
Clostridium butyricum Praz-
mowsky.
На всех средах развитие маслянокислых бактерий может быть
отмечено уже через 1—2 суток; при этом наблюдается помутне-
ние среды, на поверхности среды появляется масса пузырьков
газа, поплавки (если они были в сре-
де) заполняются газом и всплывают,
культуры начинают издавать сильный
запах масляной кислоты.
Перед концом брожения в посевах
производят микроскопический просмотр
развившихся бактерий. Морфологиче-
ски маслянокислые бактерии могут быть
распознаны по вышеизложенным при-
знакам (рпс. 106).
При посевах в бульон с глюкозой для
доказательства того, что в колбах идет
маслянокислое брожение (прп котором
образуются водород и углекислота), а
не спиртовое (при котором образуется
только углекислота), можно пользовать-
ся следующим приемом, рекомендован-
Захватывают длинным пинцетом с изог-
нутыми краями маленький кусочек чистого едкого натра и подво
дят его под опрокинутые поплавки, заполненные выделившимися
газами. Едкий натр поглощает углекислоту, и жидкость входит
в пробирочки. Объем, занятый водородом, не заполняется жид
костью.
Масляная кислота может быть определена путем качествен-
ных реакций. Для качественных реакций используют сброжен-
ную среду.
1. Реакция образования масляноэтилового эфира, имеющего
характерный запах ананасной эссенции. Для этой реакции берут
2—5 мл среды и 1—2 мл крепкой серной кислоты и соединяют
их. Полученную смесь нагревают. В присутствии масляной ки-
слоты появляется характерный запах эфира.
2. Реакция с FeCl3. Берут несколько миллилитров жидкости
из культуры, прибавляют к ним несколько капель крепкого
184
ным В. Л. Омеляпским.
раствора хлористого железа и нагревают. В присутствии ней-
тральных солей масляной кислоты получается коричневое окра-
Рис. 107. Прибор для изучения
маслянокислого брожения
(по Федорову, 1951).
шивание.
Газы, выделяемые бактериями при маслянокислом брожении,
могут быть собраны и определены. Для этого культуру ведут сле-
дующим образом: конические колбы наполняют на 3/j мясо-
пептонным бульоном с сахаром и мелом, подбирают к ним рези-
новые пробки с отверстиями, через которые пропускают изогнутые
стеклянные трубки. Трубки с
магу и стерилизуют отдельно от
пробками, стерилизуют 20 мин.
при 110° С. Перед посевом эти
колбы прогревают, и посевы
производят в горячую среду.
После остывания жидкости кол-
бы доливают доверху стериль-
ной запасной средой, заменяют
ватные пробки резиновыми и
присоединяют концы газоотвод-
ных трубок к резервуарам для
собирания газа (рис. 107).
Для выделения маслянокис-
лых бактерий наилучшими сре-
да ми я вл я юте я ка ртофел ьна я
среда с мелом и смесь равных
частей картофельного и мор-
ковного агаров. Картофельный
агар готовится по одному из
следующих способов.
1. Распускают 7.5 г агара в
варенного картофеля растирают
бавляя все 500 мл, вносят 2.5 г мела, хорошо размешивают и
разливают в пробирки по 10 мл. Стерилизуют в автоклаве.
2. Очищенный от кожуры картофель промывают, нарезают
ломтиками и отваривают в воде (10 г на 100 мл воды). Отвар фильт-
руют, к фильтрату прибавляют 1.5—2% агара. Распускают агар
на водяной бане, если нужно, еще раз фильтруют среду, при-
бавляют мел (2.5 г на 1000 мл) и разливают по пробиркам, не-
прерывно при этом взбалтывая среду. Стерилизуют в автоклаве.
Морковный агар готовят так же, как картофельный.
Выделение чистой культуры ведут следующим образом. Го-
товят несколько разведений из среды, в которой развились ан-
аэробы. В ряд пробирок с расплавленным агаром вносят неболь-
пробками заворачивают в бу-
колб. Колбы, закрытые ватными
500 мл воды, 100 г горячего от-
в теплом агаре, постепенно до-
шое количество посевного материала из каждого разведения,
хорошо его размешивают и оттуда набирают в пастеровские пи-
петки. Затем запаивают кончики пипеток и оставляют стоять
в термостате для проращивания. Колонии маслянокислых бакте-
185
рий развиваются через 1—2 суток. Пипетки в месте нахождения
выбранной для выделения колонии распиливают с соблюдением
условий стерильности и отдельную колонию переносят в жидкую
питательную среду.
Может быть произведено выделение этих бактерий и на лом-
тиках картофеля и моркови, поверхность которых натерта мелом,
после чего их стерилизуют в автоклаве. Посев производят на по-
верхность этих ломтиков из разведений путем растирания нане-
«сенной капли стерильным шпателем. Посевы должны быть по-
мещены в вакуум-эксикаторы или анаэростаты. Через 5—6 су-
ток появляются колонии маслянокислых бактерий, окруженные
пузырьками газа. Их переносят в жидкую среду. Выделение по-
вторяют. Развивающиеся культуры микроскопируют, чтобы убе-
диться в отсутствии других сопутствующих бактерий.
ОПРЕДЕЛЕНИЕ ПРОЦЕССА РАЗЛОЖЕНИЯ ЖИРОВ
Жиры принадлежат к числу веществ, являющихся постоян-
ными компонентами клеток животных и растительных организмов.
При отмирании и тех и других жиры подвергаются разложе-
нию специфическими микроорганизмами. Значительные коли-
чества разнообразных жиров поступают в водоемы, загрязняемые
сточными водами (бытовыми, сточными водами боен, шерсто-
мойных и суконных фабрик, мыловаренных и других заводов).
Разложение жиров постоянно имеет место в различных водоемах.
Определение содержания жирорасщепляющпх бактерий мо-
жет быть произведено путем использования метода разливок
при посевах на твердые среды и путем предельных разведений
при посевах в жидкие среды. Следует указать, что нет общепри-
нятой методики посевов и общепринятых сред. Поэтому здесь
приводятся рецепты различных сред.
Мясо-пептонный агар с жиром
Часто для определения числа жирорасщепляющих бактерий
пользуются следующей методикой. На дно стерильных чашек
Петри наливают предварительно простерилизованное, расплав-
ленное говяжье или свиное сало и тотчас же сливают его обратно.
На дне чашек остается тонкий слой жира. Может быть исполь-
зовано топленое коровье масло. В эти чашки производят посевы.
Посевной материал вносят в чашки обычным способом, затем
наливают мясо-пептонный агар, который должен быть только
чуть теплым, иначе произойдет растворение жира и нарушение
сплошного покрытия им дна чашек, и при осторожном покачи-
вании смешивают его с посевным материалом. Счет колоний жиро-
расщепляющих бактерий проводят через 10 суток. Колонии жиро-
расщепляющих бактерий хорошо заметны, так как под ними жир
186
белеет и становится непрозрачным. Прибавление к среде стериль-
ного раствора краски нильской синей облегчает распознавание
колоний жирорасщепляющих бактерий — в присутствии сво-
бодных жирных кислот среда вокруг колоний синеет; стерильная
среда, содержащая нейтральные жиры, остается розоватой. Мо-
жет быть использован следующий прием (при среде без добавле-
ния нильской синей): по окончании срока выращивания чашки
заливают насыщенным раствором медного купороса, через 5—
6 мин. купорос осторожно сливают с агара; колонии жирорас-
щепляющих бактерий окрашиваются в голубой цвет, вокруг них
отмечаются ореолы.
Среда Селибера
Дистиллированная вода........................... 1000 мл
К2НРО4........................................... 1 г
MgSO4 • 7Н2О.....................................0.3 »
СаС12-6Н2О.......................................0.1 »
(NH4)2HPO4....................................... 2 »
NaCl.............................................0.1 »
Агар.............................................20 »
К среде добавляют 0.5% топленого масла, pH среды должен
быть равен 6.7—7.0. Среду разливают в пробирки по 12—15 мл
в каждую и стерилизуют в автоклаве при 120° С 15 мин. При ее
использовании перед самым посевом в каждую пробирку с рас-
плавленным агаром прибавляют несколько капель спиртового
раствора (0.04 ?6-го) индикатора бромтимолового синего до полу-
чения ярко-зеленой окраски. Этим агаром заливают посевной
материал в чашке Петри. Индикатор меняет цвет вокруг колоний
жирорасщепляющих бактерий вследствие подкисления ими среды,
чем облегчается их распознавание.
При определении содержания жирорасщепляющих микробов
методом титров может быть использована вышеуказанная среда
Селибера (без агара), в которую вместо топленого масла при-
бавляют подсолнечное пли оливковое в количестве 1—2 мл на
50 мл среды.
/ Среда
Дистиллированная вода.......................... 1000 мл
NaNO3..........................................2.0 г
КС1............................................0.5 »
MgSO4 • 7НоО...................................0.5 »
К2НРО4 . “.....................................1.0 »
FeSO4 • 7Н2О ..................................0.001 »
Агар.............................................. 15 »
Среду стерилизуют обычным способом, перед посевами к рас-
плавленной среде прибавляют отдельно простерилизованный
жир (подсолнечное масло) в количестве 2 мл и 1 %-й раствор ниль-
ской синей в количестве 0.2 мл на 100 мл среды.
187
Смесь используется для разливок после продолжительного
встряхивания, которым достигается эмульгирование масла.
Среда Рана
Дистиллированная вода............................ 1000 мл
К2НРО4.............................................. 5 г
(NH4)3PO4........................................... 5 »
MgSO4 • 7Н2О........................................ 1 »
СаС12 . 6Н2О........................................ 1 »
FeCl3 • 6Н2О.......................................Следы
NaCl ............................................. »
Агар............................................... 15 г
Перед посевами к горячему расплавленному агару прибав-
ляют отдельно простерилизованное касторовое масло, или говя-
жий жир, или свиное сало и агар сильно встря-
хивают с маслом в течение 10 мин. Жир при
этом эмульгируется с агаром. Богатый жиром
верхний слой отделяют от нижней части, со-
держащей небольшое количество жира в виде
мельчайших капелек. Только этот нижний слой
агара используют для разливок.
В качестве источника жира могут быть взяты
также подсолнечное масло, бутирин, трио
леин и др.
Жидкая среда Рана с говяжьим или сви
пым жиром может быть использована при ра
боте методом титров. В этом случае поступают
следующим образом. Конические колбочки,
закрытые ватными пробками, стерилизуют
сухим жиром. Готовят жидкую среду и от-
дельно в пробирках жир и стерилизуют в авто-
клаве. Расплавленный стерильный жир выли-
и, наклонив их, дают жиру застыть, затем с
соблюдением условий стерильности в колбочки наливают тонким
слоем жидкую среду (рис. 108) и делают посевы. При разви
тии жирорасщепляющих микробов происходит побеление жира
вследствие образования жирных кислот.
Все среды для определения наличия в водоемах жирорас-
щепляющих бактерий становятся более благоприятными для раз-
вития этих микроорганизмов при добавлении к среде дрожжевого
экстракта (0.5 %).
Среда Стеэра
20%-я эмульсия хлопкового масла ................... 25 мл
0.3%-й раствор синего анилина...................... 50 »
Триптон............................................ 10 г
Дрожжевой экстракт.................................. 5 »
Агар............................................... 30 »
Дистиллированная вода..........................До 1000 мл
188
Раствор анилина готовят растворением в спирту, эмульсию
масла — следующим образом: в 100 мл свежего хлопкового масла
растирают в ступке 10 г мелко измельченного гуммиарабика
при постепенном добавлении 400 мл теплой дистиллированной
воды. После растирания должна быть получена непрозрачная
эмульсия с каплями жира меньше 10 мк в диаметре. Агар, трип-
тон и дрожжевой экстракт растворяют в 900 мл дистиллирован-
ной воды нагреванием в автоклаве в течение нескольких минут.
После растворения этих компонентов прибавляют эмульсию
масла и свежепрофильтрованный раствор анилина. Смесь доводят
до 1 л дистиллированной водой и стерилизуют в автоклаве. Среда
должна храниться на холоду. Колонии жирорасщепляющих
бактерий хорошо видны на агаре благодаря появлению темно-
синей окраски вокруг них.
Анаэробные возбудители разложения жира могут быть опре-
делены на вышеуказанных средах при помещении посевов в усло-
вия анаэробиоза. Может быть использован метод титров, при ко-
тором посевы делают в среды, налитые высоким слоем. После
посевов склянки доливают стерильной средой доверху, закры-
вают каучуковыми пробками, заливают сверху менделеевской
замазкой.
Анаэробное разложение жира — процесс очень медленный,
требующий значительного времени.
Для определения вида возбудителей расщепления жира про-
изводят выделение бактерий из развившихся колоний и ведут их
изучение обычными методами.
ОПРЕДЕЛЕНИЕ ПРОЦЕССА РАЗЛОЖЕНИЯ СОЛЕИ
ОРГАНИЧЕСКИХ КИСЛОТ
В процессах бактериального разложения белков, жиров,
гемицеллюлоз и других соединений образуются соли жирпых и
других органических кислот, которые являются почти постоян-
ными компонентами иловых отложений различных водоемов.
Эти соли подвергаются в водоемах дальнейшему распаду под воз-
действием микроорганизмов, доводящих их распад до конечных
газообразных продуктов — главным образом метана. Метан об-
разуется в больших количествах при разложении органических
веществ в анаэробных условиях как в пресных, так и в морских
водоемах. Брожение солей органических кислот является одним
из источников выделения метана.
Метановое брожение различных соединений углерода вызы-
вается разными видами бактерий. Характеристика изученных
разными авторами видов приведена в табл. 10.
Введение в питательную среду того или иного источника угле-
рода определяет развитие вида бактерий и конечные продукты
брожения.
189
Таблица 10
Метанобразующие микроорганизмы
(по сводке Н. Б. Нечаевой, 1953)
Вид Характеристика вида Использует с образова- нием СН4
Methanobacterium sohn- Клетки палочковидные, Соли кислот: муравьи-
genii Barker. прямые или слабо- изогнутые, непо- движные, неспоро- носные, 5—7x0.3— 0.5 мк, часто соеди- няются в нити зна- чительной длины. Грамотрицательны. Анаэроб. ной, уксусной, масля- ной, капроновой, ка- приловой, каприно- вой. Смесь углекис- лоты и водорода.
К этому виду относятся: Очень тонкие палочки, Соли кислот: муравьи-
а) термофильная мета- длиной от 3 до 6 мк, ной, уксусной, про-
новая бактерия, вы- часто образуют нити. пионовой, масляной,
деленная Коольхас; Анаэроб. изомасляной, щаве- левой, молочной, глюконовой.
б) метановая бакте- рия, выделенная Ви- — Соли уксусной кис- лоты. Ацетон.
кепом.
М. omclianskii Barker. Очень тонкие, доволь- но длинные, 9 — 10X 0.7 мк, слабо изо- гнутые, неподвиж- ные и неспороносные палочки, нити обра- зуют очень редко и очень короткие. Грам- отрицательные. Ан- аэроб. Спирты: этиловый, про- пиловый, изопропи- ловый, бутиловый, изобутпловый, ами- ловый. Смесь угле- кислоты и водорода.
К этому виду относится вторая метановая бактерия, выделен- — Соли муравьиной кис- лоты. Пропиловый спирт.
ная Викеном.
М. formicum Stephenson Короткие, подвижные, В атмосфере водорода:
et Stikland. неспороносные па- лочки. Грамотрица- тельны. Развиваются в аэробных и ан- аэробных условиях. На минеральных сре- дах рост слабее, чем на мясо-пептон- ных, особенно при добавлении к ним различных углеводов. Восстанавливают SO4 до H2S при помощи щ. соль муравьиной кислоты, гексамети- лентетрамин, угле- кислоту, окись уг- лерода. Метиловый спирт.
190
Таблица 10 {продолжение^
Вид Характеристика вида Использует с образова- нном СН4
М. formicum Schellen. — Соли муравьиной кис- лоты. Смесь окиси углерода с водородом, или водой
М. suboxydans Stadtman Тонкие, нежные, слабо Соли кислот: масляной
et Barker. изогнутые палочки различной длины. Клетки часто со- держат зернышки мета хроматина. Грам- положительны, от- ношение к окраске по Граму изменяется с возрастом культу- валериановой, капро- новой, энаптовой.
M. propionicum Stadt- Короткие, относитель- Соли пропионовой кис-
man et Barker. но толстые палочки или коккообразные бактерии. Подвиж- ные. В жидких куль- турах образуют по- мутнение. Грампо- ложительны. лоты (неполное окис- ление).
M. mazei Barker. Клетки мелкие, сфе- рические, одиночные, иногда образуют группы, окруженные слизистой капсулой. Неподвижные, несно- роносные. Окраска по Граму изменчи- вая. Аэроб. Соли уксусной и мас- ляной кислот.
К этому виду относятся: а) кокк, выделенный Гроневеге; — Соли уксусной кисло- ты.
б) кокк, выделенный Внкеном. — Соли масляной кис- лоты. Ацетон.
Methanococcus vannielii Сферические клетки, Соли муравьиной кис-
Stadtman et Barker. диаметром от 0.5 до 4 мк. Кокки очень подвижны, движение по спирали. Анаэроб. лоты. Смесь углекис- лоты и водорода.
Methanosarcina methani- Большие сферические Соли кислот: уксус-
ca (Smit) Kluyver et клетки, неподвижные ной, масляной. Ме-
van Niel. и неспороносные, об- разующие, пакеты ве- личиной 8—10 мк, тетрады, редко в ви- де диплококков. От- ношение к окраске по Граму изменчивое. тиловый спирт.
191
Таблица 10 (продолжение)
Вид Характеристика вида Использует с образова- нием СН4
К этому виду относится сарцина, выделенная Викеном. — Солн кислот: уксус- ной, пропионовой, масляной.
М. barkerii Barker, Ru- ben et Kamen. Крупные коккн, обра- зуют типичные паке- ты клеток. В жидких культурах пакеты представляют собой большие зоогленные массы. Анаэроб. Соли уксусной кисло- ты. Метиловый спирт.
К этому виду относится сарцина, выделенная Шнеллен. Смесь окиси углерода с водородом или ВО- ДОЙ.
Бактерии, разлагающие соли жирных кислот с выделением
метана, могут быть обнаружены на одной из следующих сред
с тем источником углерода, превращения которого намечены
к исследованию.
Среда Омелянского
Вода исследуемого водоема........................... 1000 мл
Пептон................................................. 2 г
Соль органической кислоты ............................ 20 »
Добавление к среде Омелянского дрожжевого экстракта в ко-
личестве 0.5 г/л среды значительно повышает ее качества. Вве-
дение в стерильную среду стерильного раствора сульфида натрия
(0.3 г/л) содействует созданию анаэробных условий в среде.
Для этой же цели пропитывают поглотителем кислорода кусо-
чек ваты, который помещают затем в горлышко сосуда.
Среда Стэдмен и Баркера
Дистиллированная вода........................... 1000 мл
СаС12 • 6ПаО....................................0.01 г
NH4C1...........................................0.5 »
MgCl2 • 4И2О....................................0.01 »
FeCl3 • 6Н2()................................... 0.002 »
MgSO4 • 7Н2О....................................0.001 »
К2НРО4..........................................3.48 »
КН2РО4..........................................2.72 »
NaMoO4 • 2Н2О...................................0.001 »
Феноловый красный .............................. 0.003 »
Метиленовая синяя...............................0.(Х)2 »
После стерилизации к среде прибавляют на каждые 100 мл
от 20 до 40 мг Na2S • 9Н2О, от 200 до 250 мг Na2CO3 и 100—500 мг
192
натриевой соли жирной кислоты. pH среды 10°/о-м раствором
соляной кислоты доводят до 6.8—7.4. Для создания анаэробных
условий вводят в горлышко склянки под пробку кусочек ваты,
смоченный поглотителем кислорода.
Среда Баркера
Дистиллированная вода........................... 1000 мл
NH4C1........................................... 1 г
КН2РО4.......................................... 0.4 »
MgCl2 • 4Н2О.................................... 0.1 »
Кальциевая соль органической кислоты............10 »
Дрожжевой экстракт.............................. 0.3 »
Поглощение кислорода в среде достигается введением в нее
перед посевом на каждые 100 мл среды 3 мл стерильного раствора,
состоящего из Na2S • 9Н2О (1%), Na2CO3 (5%), pH среды 7.0.
Среда Бычковской
Дистиллированная вода........................... 1000 мл
Натриевая или кальциевая соль органической кислоты . 20 г
КН2РО4.......................................... 0.3 »
MgSO4 • 7НоО.................................... 0.1 »
NH4NO3 или (NH4)2HPO4........................... 1 »
Дрожжевой экстракт.............................. 1 »
Среды Викена
Л. Водопроводная вода............................ 1000 мл
NaHCO3 ........................................ 3.5 г
(NII4)2SO4...................................... 0.5 »
MgSO4 • 7Н,0.................................... 0.5 »
КаНРО4.......................................... 1 »
Натриевая соль органической кислоты.............10 »
Отмытый агар....................................15 »
pH 6.8
Б. Водопроводная вода........................... 1000 мл
С2НвОН(96°-й) .................................. 10 »
MgSO4 • 7Н2О...................................0.1 г
(NH4)2SO4.....................................0.5 »
Na2CO3........................................3.5 »
К2НРО4 .......................................1 »
Лгар..........................................3 »
pH 6.8
Спирт вносят асептически перед посевом. После посева вводят
0.8 мг Na2S на 100 мл среды.
Рекомендуется в пробирки при использовании любой из ука-
занных сред вводить до стерилизации небольшое количество
песка, глины пли мелковолокнистого асбеста для обеспечения
брожения и в верхнем, и в глубоком слоях среды.
13 А. Г. Родина
193
Газ, получающийся при разложении солей органических
кислот, может быть собран в специальные сосуды и подвергнут
анализу.
ОПРЕДЕЛЕНИЕ ПРОЦЕССОВ ОКИСЛЕНИЯ
УГЛЕВОДОРОДОВ И ВОДОРОДА
В водоемах могут находиться различные углеводороды как
в чистом виде, так и в виде смесей. Углеводороды благодаря
своему составу не используются в качестве питательных веществ
никакими водными организмами, за исключением бактерий.
Окисление жидких и твердых углеводо-
родов. Для определения численного содержания и актив-
ности бактерий, разлагающих в водоемах нефть и нефтепро-
дукты, могут быть использованы методика и среда, предложенные
В. О. Таусоном (1928), среда А. А. Ворошиловой и Е. В. Дна-
новой или другая минеральная среда. Среда Таусона представ-
ляет собой водный минеральный раствор, включающий все
необходимые для развития микроорганизмов соли и не содержа-
щий никаких органических веществ. К ней после посевов до-
бавляется тот или иной углеводород или нефть.
Таусоп указывает, что среда может быть использована как
с нитратным, так и с аммонийным азотом (одни впды этой группы
лучше растут на аммонийном азоте, другие па нитратном).
В том п другом случае готовят 2 раствора.
Среда Таусона с нитратным азотом
1. Ca(NO3)2.....................................1 г
KNO3.........................................0.25 />
MgSO4 • 7Н2О.................................0.25 »
Fe2(SO4)3 • 9Н2О.............................0.01 »
Дистиллированная вода........................ 800 мл
2. К2НРО4+КН2РО4 (1:1).......................0.25 г
Дистиллированная вода........................ 200 мл
Растворы стерилизуют отдельно и соединяют перед посевами
в отношении 4 : 1; pH среды 6.6.
Среда Таусона с аммиачным азотом
1. (NH4)2SO4....................................1 г
CaSO4........................................0.5 »
MgSO4 • 7Н2О.................................0.3 »
FeSO4 • 7Н2О................................. 0.005 »
Дистиллированная вода........................ 800 мл
2. КН2РО4+К2НРО4 (1:1).......................0.3 г
Дистиллированная вода........................ 200 мл
194
углеводороды (жидкие или твердые) вносят в каждую
отдельно, после
произведены по-
нефть, так и ее
должны быть за-
простерилизованы.
К средам Таусона1 рекомендуется прибавить раствор микро-
элементов по Федорову (стр. 237) в количестве 1 мл на 1 л. Среда
с микроэлементами более благоприятна для углеводородокисляю-
щих бактерий.
Растворы стерилизуют в автоклаве, соединяют перед посе-
вом в отношении 4:1, разливают тонким слоем в простерилизо-
ванные заранее сухим жаром колбы Виноградского. Нефть или
отдельные
колбочку
того как
севы. Как
продукты
ранее
Нефть вносится в таком ко-
личестве, чтобы она образо-
вала топкий, равномерный
слой (не более 1.1 мм тол-
щиной) на поверхности мине-
рального раствора. Твердые
углеводороды наносят на по-
верхность среды в виде от-
дельных кусочков или кри-
сталлов в количестве от 0.1
до 0.6 г на 200 мл среды.
Рис. 109. Схема культуры разлагающих
углеводороды бактерий
(ио Таусону, 1925).
1 — стеклянный треугольник; 2 — чашка
Потри; .7 — углеводород; 4 — минеральным
раствор.
При аэробных культурах
углеводороды не должны покры-
вать всю поверхность среды.
Посевы выдерживают в термостате при 20—25е С.
Развитие бактерпй, разлагающих нефть, может быть отме-
чено уже через несколько дней. Вначале наблюдается помутне-
ние жидкости и слабое желтоватое окрашивание, затем на гра-
нице раздела минерального раствора и нефти появляется бакте-
риальная пленка, вслед за чем могут быть отмечены изменения
и самой нефти, помутнение и образование «окон», в которых
минеральный раствор непосредственно соприкасается с воздухом.
Процесс бактериального окисления нефти требует значитель-
ного времени (полное окисление нефти может продолжаться
до 2 месяцев).
Об активности бактерий, окисляющих нефть, можно судить
по разнице в весе внесенной и оставшейся неокисленной нефти
после определенного промежутка времени (в этом случае надо
вносить нефть по весу). Химическим путем могут быть опреде-
лены продукты разложения (Таусоп и Шапиро, 1934).
При исследовании процессов разложения углеводородов, спо-
собных хотя бы в незначительной степени растворяться в воде,
1 Среды Таусона могут быть использованы для бактерий, разлагающих
фенолы. В этом случае к указанным минеральным растворам прибавляю!
фенол в количестве от 0.1 до 0.5%.
13*
195
может быть использован метод «диффузионного притока», пред-
ложенный В. О. Таусоном. В этом случае углеводород вводят
в питательную среду не на поверхность водного раствора, а под
слой его. Посевы производят в чашки Коха, на дно которых под
слой питательной среды кладут согнутую треугольником стек-
лянную палочку. В чашку Коха помещают стерильную крышку
чашки Петри таким образом, чтобы она стояла краями на стек-
лянном треугольнике и была покрыта слоем питательной среды.
Под эту крышку вводят изогнутой пипеткой 1 или 2 мл жидкого
углеводорода, который остается под крышкой (рпс. 109). Затем
производят посевы и чашки помещают в термостат. Углеводород
в этих условиях растворяется в среде до насыщения. Бактерии
развиваются на поверхности, используя находящийся в растворе
углеводород, на смену которому переходят в раствор новые пор-
ции.
Среда Ворошиловой и Диановой
Дистиллированная вода.......................... 1000 мл
NH4NO3..........................................1.0 г
К2НРО4..........................................1.0 »
КН2РО4..........................................1.0 »
MgSO4 • 7Н2О....................................0.2 »
СаС12.6Н2О.....................................0.02 >
FcC13-6H2O (насыщенный раствор)................2 капли
Углеводород: жидкий........................ . . 1—2 мл
твердый...........................0.5—1 г
Среда для бактерий, разлагающих нефть и ее дериваты
Водопроводная вода ............................ 1000 мл
К2НРО4..........................................0.5 г
NH4C1...........................................0.5 »
Мел...............................................Следы
Среду разливают по колбочкам, стерилизуют и затем при-
бавляют отдельно простерилизованные нефть, бензин, парафино-
вое масло или другие углеводороды. Обнаружение бактерий,
окисляющих жидкие углеводороды: пентан, гексан, гептан и
др. — может быть произведено на среде Ворошиловой и Диа-
новой или на среде следующего состава.
Среда для бактерий, окисляющих жидкие углеводороды
Водопроводная вода ............................ 1000 мл
KNO3...........................................1 г
MgSO4 • 7Н2О...................................0.2 »
NaCl...........................................1 »
КоНР04.........................................1 »
pH 7.0—7.2
Посевы помещают в атмосферу паров углеводородов.
Бактерии, окисляющие жидкие углеводороды, обладают ха-
рактерной люминесценцией (Славнипа, 1947). Интенсивно зе-
196
левым светом флуоресцирует Bacterium aliphaticum Tausz et
Peter., Serratia mogilewskii на ранних стадиях развития светится
серовато-голубым светом.
Выделение окисляющих нефть бактерий может быть произ-
ведено на указанных выше растворах, из которых готовят плот-
ные среды при употреблении выщелоченного агара. Агар берется
в количестве 20 г на литр. Посевы в этом случае производят
обычным путем в чашки Петри, заливают тонким слоем расплав-
ленного п охлажденного агара, затем крышки чашек приоткры-
вают на несколько секунд и на поверхность чашек наносят тон-
чайшим слоем заранее простерилизованный источник углерода
таким образом, чтобы получилось равномерное покрытие. Тау-
сон разработал ряд сложных приемов для нанесения отдельных
углеводородов тончайшим слоем.
Окисление газообразных углеводоро-
дов — метана, пропана и др. Образование метана — про-
цесс, широко распространенный в природе. В больших количествах
метан выделяется со дна водоемов в результате разложения ор-
ганических веществ различными бактериями. В этих биотопах
протекает и другой процесс — окисление этого газа, вызывае-
мый специфическими микроорганизмами. Благодаря деятель-
ности метанокисляющих бактерий значительное количество об-
разующегося в донных отложениях метана окисляется на месте
выделения и не попадает в водную толщу.
Для обнаружения в водоемах бактерий, окисляющих метан
(пропан, этан и др.), применяется минеральная среда. В качестве
единственного источника углерода для метанокисляющих бак-
терий дается метан, для пропанокисляющих — пропан и т. д.
Газ вводится в смеси с воздухом, наличие которого должно обес-
печить аэробные условия культивирования. Для метанокисляю-
щих соотношение газов следующее: 1/3 метана и 2/3 воздуха,
для пропанокисляющих: х/5 пропана и 4/в воздуха.
Для бактерий, окисляющих метан и другие газы, могут быть
использованы различные среды.
Среда Боковой, Кузнецовой и Кузнецова
Водопроводная вода........................... 1000 мл
KNO8...........................................1.0 г
MgSO4 • 7НаО....................................0.2 »
К,НРО4..........................................0.5 »
КНаРО4..........................................0.5 »
..............................................1.0 »
pH 7.2
Среда Казерера
Дистиллированная вода............................ 1000 мл
NH4C1..............................................1.0 г
197
KNO3..........................................2.0 г
KaHPO4........................................0.5 »
MgSO4 • 7Н2О..................................0.2 »
FeCl3 • 6 Н 2О................................Следы
Усредняется раствором NaHCO3 до pH 7.0—7.2.
Среда Омелянского
Дистиллированная вода......................... 1000 мл
NH4MgPO4.........................................1.0 г
К2НРО4...........................................0.5 »
CaSO4 • 2HLO ....................................0.1 »
Среда Громана
Дистиллированная вода
NaaGO
NH4C1
КНаРО4 . .
MgSO4 • 7НаО
NaCl ....
FeCl3.6H2O
1000 мл
1.0 г
1.0 »
0.7 »
0.2 »
0.2 »
Следы
з
Ту или иную среду разливают тонким слоем в конические
колбочки или в стерильные чашки Коха и помещают в анаэростат
или под колокол, шлифованный срез которого притирается
к платформе и смазывается вакуумной замазкой. Сначала из
анаэростата или из-под колокола эвакуируют воздух до остаточ-
ного давления 40 мм рт. ст., а затем заполняют соответствующей
газовой смесью (рис. 110). Анаэростат пли колокол с посевами
помещают в термостат на 14 суток.
Грунты рекомендуется помещать в стерильные стаканчики,
которые заливают затем питательной средой.
Наличие твердой фазы ускоряет развитие микроорганизмов,
поэтому рекомендуется вносить стерильный песок при последую-
щих пересевах.
Метан можно получить нагреванием порошка уксуснокислого
натрия и гидроокиси бария па песчаной бане; выделяющийся
газ промывают бромной водой и едким натром и собирают под
водой в газометр (Омелянский, 1940).
Этап можно получить электролизом уксуснокислого натрия
в кислой среде с последующим очищением его от углекислоты и
примесей пропусканием через 20?6-ю калийную известь и раствор
перманганата калия.
В культурах, где в посевном материале содержится углево-
дородная микрофлора, на поверхности питательной среды по-
является бактериальная пленка или муть. Метан окисляется
различными бактериями (из родов Methanomonas, Pseudomonas,
Mycobacterium). Развитие чистых культур метанокисляющих
198
на агаре, приготовленном
Рис. ПО. Зарядка газовой смесью
колокола с посевами (по Могилев-
скому, 1953).
бактерий возможно, по Дворкину, лишь при добавлении панто-
теновой кислоты.
Чаще на поверхности среды появляется пленка, вначале
тонкая, прозрачная, затем делающаяся плотной, непрозрачной,
пигментированной (коричневатого цвета) и морщинистой. Окис-
ляющие этап бактерии дают пленку белую с розоватым или
красноватым оттенком, для окисляющих пропан характерна
слизистая пленка белого или желтоватого цвета.
Полученные в жидкой культуре бактерии могут быть после
очистки их рядом пересевов выд
на той же жидкой среде. Агар
употребляется хорошо выщело-
ченный.
Окисление водорода.
Водород является газом, выде-
ляющимся в грунтах водоемов
в процессе разложения богатых
углеродом органических ве-
ществ. Наличие в водоеме бакте-
рий, окисляющих водород, име-
ет большое значение для кисло-
родного режима водоема. Окис-
ляющие водород бактерии ши-
роко распространены в водое-
мах, их особенно много в гнию-
щих илах.
Группа окисляющих водород
неспособных развиваться па органических средах (Pseudobac-
terium vitreum Niklewski), и организмы, способные жить как
автотрофно за счет энергии, выделяемой при окислении газо-
образного водорода, так и гетеротрофно (Bacillus pycnoticus
Ruhland et Gromann, Pseudomonas panthothropha Kaserer, Hydro-
gemonas facilis Schatz et Bovell и др). По Лису, ни один из микро-
организмов, окисляющих водород, не является строгим автотро-
фом. В условиях автотрофного роста концентрация кислорода
не должна превышать 30%.
Общепринятых методов для обнаружения окисляющих водо-
род бактерий пока нет. Непременным условием выявления их
является ведение культуры в смеси газов: водорода, кислорода
и углекислоты (6:2:1).
Для культивирования этих микроорганизмов предложен ряд
сред.
бактерий включает автотрофов,
Среда Лебедева
Дистиллированная вода......................... 1000 мл
KNO3............................................2.0 г
KHjPO4..........................................0.5 »
199
MgSO4 • 7H2O.....................................0.2 I-
КеС13«6П2О.................................. ... Следы
Среда Руланда
Дистиллированная вода........................... 1л
NaHCO3........................................ 1.0 г
NH4G1..........................................1.0 »
КН2РО4.........................................0.5 »
MgSO4 • 7Н2О...................................0.1 »
NaCl...........................................0.1 4
pH 7.1-7.2
После стерилизации к среде прибавляют немного стериль-
ного водного раствора FeCO3.
Среда Коэна и Бурриса для
Hydrogemonas facilis
Дистиллированная вода.............................. 1л
NaHCO3..............................................1.0 г
NH4G1...............................................1.0 »
КН2РО4..............................................0.5 »
MgSO4 • 7Н2О........................................0.1 »
NaCl................................................0.1 »
CaCl2*6H2U..........................................0.1 »
Fe(NH4)2(SO4)2 • GH2O ........................... 0.008 »
К среде добавляется смесь микроэлементов:
Н3ВО3 ........................................... 228 мкг
СаС12 • 6Н2О ......................................80 »
CuSO4 • 5Н2О ...................................... 8 »
МпС1а • 4Н2О...................................... 8 »
ZnSO4 • 7НаО .....................................176 »
Na2MoO4 • 2Н2О.....................................50 »
Коэн и Буррис разработали специальную установку, в кото-
рой смесь газа циркулирует через резервуары с газом в сосуд
с культурой (рис. 111); pH среды после установления равновесия
с газом 6.8—7.2; давление в системе поддерживается приблизи-
тельно равным атмосферному. По мере использования газа он
замещается в резервуаре водой. Части системы предварительно
стерилизуют, после стерилизации и охлаждения среды и частей
системы система устанавливается и закрывается резиновыми
пробками.
Рост бактерий заметен по помутнению среды.
Окисляющие водород бактерии растут хорошо на пластинках
кремнекислого геля, пропитанных минеральной средой и по-
мещенных в атмосферу, содержащую кислород, водород и угле-
200
кислоту. Они могут быть легко выделены в чистые культуры.
Упрощенную постановку посевов с окисляющими газы бактериями
предложили С. И. Кузнецов и В. И. Романенко (1963). В обыч-
ную пробирку, наполненную питательной средой, опускается
донышком вверх маленькая пробирочка, которую затем запол-
няют водородом или смесью газов (рис. 112), после чего произ-
водят посев и пробирку закрывают фламбированной на огне
резиновой пробкой.
При погружении пробирочки д б
ее предварительно закрывают
кусочком тонкой бумаги (долж-
на быть простерилизована!),
опускают в большую пробирку
на несколько миллиметров, уда-
Рис. 111. Установка для куль-
тивирования окисляющих водо-
род бактерий (вид сверху) (по
Cohen a. Burris, 1955).
А — насос; Б — склянка с водой для
улавливания масла; В — ватный
фильтр; Г — резервуар с замещающей
водой; Д — резервуары газа; Е — уло-
витель воды; Ж — манометр; 3 — зат-
вор; И — выход воздуха при эвакуа-
ции; К — фильтры; Л — термостатная
баня; М — сосуд с культурой; Н —
трубка для взятия проб; Р — обход-
ный путь. Стрелки показывают на-
правление газа.
Рис. 112. Постановка опыта по
культивированию бактерий в
атмосфере смеси газов (по
Кузнецову и Романенко,
1963).
А — заполнение опрокинутой про-
бирки (1) газом посредством шпри-
ца (2, з); Б — закрытая пробирка.
ляют бумагу, подводят ка
пилляр или иглу от под
кожного шприца, через кото-
рую вводят газ из газометра.
Окисление окиси углерода. В водоемах могут
находиться автотрофные организмы, способные окислять окись
углерода в двуокись. К таким организмам относится Proacti-
nomyces oligocarbophilus (Beijerinck) Krassilnikov, хорошо разви-
вающийся на средах с неорганическими солями. Для их культи-
вирования предложена специальная среда.
20!
Среда .Чанга
Дистиллированная вода.......................... 1000 мл
КаНРО4...........................................0.1 г
NaNOs............................................0.1 »
FeCls*6H2O........................................Следы
MgSO4 • 7НаО..................................... »
Атмосфера над средой должна содержать не 'менее г/3 окиси
углерода.
ГЛАВА 7
МЕТОДЫ ИЗУЧЕНИЯ ПРЕВРАЩЕНИЙ
МИКРООРГАНИЗМАМИ АЗОТИСТЫХ ВЕЩЕСТВ
УСТАНОВЛЕНИЕ НАЛИЧИЯ ПРОЦЕССОВ МИНЕРАЛИЗАЦИИ
БЕЛКОВЫХ ВЕЩЕСТВ
Отмирающие в водоеме растения, умершие животные и орга
нический материал, попавший в водоем извне, подвергаются там
минерализации. Существенное место в минерализации органи-
ческого материала занимают процессы разложения белковых ве-
ществ микроорганизмами. Многие микробы доводят разложение
белковых соединений до конечных продуктов распада (амми-
ака, сероводорода, меркаптанов и др).
Минерализация белковых веществ протекает в водной толще
и в донных отложениях как в аэробных, так и в анаэробных
условиях.
Определение количества бактерий, ми-
нерализующих белковые вещества. Это опре-
деление при исследованиях водоемов проводят во всех случаях.
Количество минерализующих белковые вещества бактерий опре-
деляют методом разливок при использовании в качестве пита
тельной среды чаще всего мясо-пептонного агара (приготовление
см. стр. 52). Нередко при работе на водоемах используется
рыбо-пептонный агар.
В последнее время предложен ряд сред, являющихся более
оптимальными для этой группы, на которых развивается боль-
шее количество видов, чем на обычном мясо-пептонном агаре.
Однако при использовании мясо-пептонного агара создается
преемственность в исследованиях, возможность проведения срав-
нения получаемых данных с данными более ранних исследований.
Поэтому эти среды, рецепты которых приводятся, могут быть
рекомендованы для выявления разнообразия видов минерали-
зующих белки бактерий и их выделения при изучении состава
гетеротрофных микроорганизмов.
Глицерино-мясо-пептопный агар
Водопроводная вода................................ 900 мл
Мясная вода........................................100 »
Пептон............................................ 2.5 г
203
Глицерин..........................................20 i
К2НРО4............................................ 1 *
Nad............................................... 3 *
MgS04 • 7H2O...................................0.25 *
FeS04 • 7HoO...................................0.01 »
CaCO3 . . ‘....................................0.04 •
Arap............................................15
pH 6.9
Агар Торнтона
Водопроводная вода ............................ 1000 мл
Аспарагин........................................0.5 г
Маннит...........................................1.0 »
К2НРО4...........................................1.0 »
MgSO4 • 7Н2О......................................0.2 »
СаС12 • 6Н2О.....................................0.1 »
NaCl.............................................0.1 »
KNO3.............................................0.5 »
FeCl3.6H2O......................................0.002 »
Агар.............................................. 15 *
pH 7.4
Посевы на определение численности разлагающих белковые
вещества бактерий проводят как можно быстрее после взятия
проб, ни в коем случае не позднее 3 час.
Количество воды, которое следует взять для посевов, опре-
деляется содержанием в водоеме органических веществ и свя-
занным с ним количеством бактерий этой группы. Для олиго-
трофных водоемов, бедных органическими веществами, берут
обычно для посевов 1 мл воды, прп исследовании прудов и за-
грязненных участков рек берут для посевов меньшие количества
воды — от 0.1 до 0.0001 мл, прибегая в этих случаях к разведе-
нию посевного материала. Посевы грунтами обычно проводят
из разведений 1 : 100, 1 : 1000, 1 : 10 000 (схемы разведений
приведены на стр. 139). Из каждого разведения делают не меньше
трех параллельных посевов.
Отмеренное стерильной градуированной пипеткой количество
посевного материала вносят в чашку Петри и заливают остужен-
ным агаром. Засеянные чашки выдерживают при температуре
22-23° С.
Счет колоний проводят через 48 час. Если в задачу исследова-
ния входит также учет и медленно растущих микобактерий,
то счет колоний должен быть произведен вторично через 10 суток.
При приготовлении разведений весьма большое значение
имеют используемые для этого жидкости. Не годится дистилли-
рованная вода, в которой вследствие плазмолиза быстро гибнет
большое количество внесенных клеток. Может быть рекомендо-
вана простерилизованная вода того же водоема, из которого
взяты пробы. Хорошие результаты дают слабые растворы амино-
кислот (одной или нескольких) с концентрацией 0.1 %,-с pH
204
раствора 7.0. Такие растворы разливают в пробирки по 10 мл,
стерилизуют в автоклаве и используют при изготовлении разве-
дении.
При очень малом содержании бактерий этой группы в воде
может быть использован метод проращивания микроорганизмов
на мембранных фильтрах. Для этого фильтруют значительные
количества воды из исследуемого водоема через заранее просте-
рилизованные в дистиллированной воде мембранные фильтры
№№ 1 или 2. По окончании фильтрации фильтры помещают
тыльной стороной на поверхность агаровой питательной среды
в чашке Петри для проращивания осевших на фильтре клеток
микроорганизмов. Чашки с фильтрами выдерживают при тем-
пературе 23—25° С 3—5 суток, после чего на фильтрах просчи-
тывают число выросших колоний. Мелкие колонии просчиты-
вают при помощи лупы. Однако следует учитывать, что при
этом методе возможно осаждение одних бактериальных клеток
на другие и, следовательно, некоторое приуменьшение данных.
Если одной из задач исследования является определение
видов бактерий, вызывающих минерализацию белковых веществ,
то те же чашки с посевами (если только рост на них не был очень
густым) могут быть использованы для выделения развившихся
форм. Если же рост в чашках оказался густым, то для выделения
должны быть произведены снова посевы меньшими количествами
посевного материала.
Для определения содержания в водоемах бактерии, обладаю-
щих протеолитическими энзимами, используют мясо-пептонную
желатину. Определение и в этом случае ведут методом разливок.
Счет колоний проводят через 48 час., просчитывают колонии,
вокруг которых имеются зоны разжижения.
Может быть использована и желатиновая среда с пептоном и
дрожжевой водой.
Желатиновая среда с пептоном и дрожжевой водой
Водопроводная вода.............................. 900 мл
Дрожжевая вода...................................100 »
Пептон............................................ 5 г
Желатина.........................................120 »
pH 7.0-7.2
Довольно удобной в работе на водоемах является желати-
новая среда Фразье вследствие наличия в ней агара, позволяю-
щего вести работу и в жаркое время года и не дающего чашки
с полным разжижением всей использованной желатины.
Желатиновая среда Фразье
NaCl........................................3.0 г
КаНРО4......................................1.5 »
КНаРО4......................................0.5 »
205
Желатина.........................................4.0 г
Декстроза........................................0.05 »
Пептон...........................................0.1 »
Мясной настой...................................... 5 мл
Агар.............................................. 15 г
Дистиллированная вода ......................... 1000 мл
Среду готовят следующим образом. Растворяют соли в 100 мл
дистиллированной воды, отдельно растворяют желатину в 400 мл
дистиллированной воды, прибавляют декстрозу, пептон и мясной
настой. Сливают растворы вместе и кипятят несколько минут.
Растворяют агар в 500 мл воды, смешивают растворы, устанавли-
вают реакцию до pH 7.0. Разливают в склянки и стерили-
зуют.
Готовят раствор:
HgCL......................................... 15 г
НС1 ‘.........................................20 мл
Дистиллированная вода..............................100 »
Чашки с желатиной Фразье после засева и окончания периода
инкубации заливают этим раствором и оставляют стоять 5—
Рис. ИЗ. Зоны изменения желатины
на среде Фразье.
10 мин. (по Фразье, 15—
30 мин.), осторожно сливают
раствор и затем подсчитыва-
ют колонии, окруженные
прозрачными зонами. Не из-
мененная бактериями среда
становится непрозрачной, а
колонии, окруженные про-
зрачными вследствие изме-
нения желатины зонами, вид-
ны очень четко (рис. ИЗ).
Вместо указанного рас-
твора может быть использо-
ван насыщенный раствор
сульфата аммония или 1 ?6-й
раствор пикриновой кислоты.
При определении коли-
чества анаэробов, минерали-
зующих белки, пользуются
теми же питательными средами и тем же методом разливок,
только создают условия, в которых анаэробы могли бы разви-
ваться.
При вычислении содержания как минерализующих белки,
так и обладающих протеолитическими энзимами бактерий в воде
и грунтах высчитывают среднее число из просчета параллельных
чашек. Результаты выражают на 1 мл воды и на 1 г грунта. Для
избежания фиктивной точности в полученных результатах ре-
206
комендуется округлять полученные числа. При получении в пе
ресчете на 1 мл воды количества колоний:
от 1 ДО 50 полученные числа приводятся без изменений
» 51 » 100 округляются до ближайших 5
* 101 250 » 10
» 251 » 500 » » 25
» 501 - 1000 » » » 50
» 1001 » 10000 » » » 100
» 10001 » 50000 » » » 500
» 50001 » 100000 » >> » 1000
» 100001 » 500000 » » » 5000
» 500001 » 1000000 » » 10000
Метод разливок, употребляемый для определения численности
в водоемах гетеротрофных бактерий, основан на допущении, что
каждая колония развивается из одной клетки. На самом деле
это не так. Некоторые колонии, а в загрязненных водоемах мно-
гие, развиваются из группы клеток или из цепочки их. =Кроме
того, питательная среда, используемая для разливок, не является
подходящей для всех без исключения гетеротрофных микро-
организмов, находящихся в воде. Для части микроорганизмов
могут оказаться неподходящими условия культивирования, и
онп не разовьются. Так, например, все анаэробы требуют особых
условий культивирования. Адаптированные к низким темпера-
турам холодповодных водоемов микроорганизмы могут или не
выдержать заливки агаром с температурой 40—45° С и погиб-
нуть, или не прорасти при температуре выращивания 22—23° С.
Таким образом, этот метод дает лишь приближенное число ге-
теротрофных бактерий, находящихся в момент исследования
в водоеме в живом состоянии.
Определение количества аммонифици-
рующих бактерий методом титров. Опреде-
ление количества аммонифицирующих бактерий методом титров
производят путем посевов возрастающими количествами воды
в пробирки с мясо-пептонным бульоном или с пептонной водой.
Пептонная вода готовится следующим образом: в 1000 мл во-
допроводной воды (следует избегать избытка железа) вносят
5 г пептона и кипятят 15 мин. В горячую жидкость вносят следую-
щие соли:
К2НРО4.........................................1.0 г
КНаРО4.........................................1.0 »
MgSO4 • 7Н2О...................................0.5 »
NaCl...........................................Следы
По растворении солей раствор тщательно взбалтывают и филь-
труют до полной прозрачности. Среду разливают по пробиркам
и стерилизуют 20 мин. при 1 атм.
207
После посевов над жидкостью подвешивают бумажки для
определения выделения бактериями аммиака: или красную лак-
мусовую бумажку, или реактивную на NH3 по методу Крупа
(приготовление см. стр. 117) и пробирки плотно завязывают
пергаментной бумагой или закрывают целлофановым пли ре-
зиновым колпачком (рис. 75). Выделяющийся в процессе разло-
жения белков аммиак вызывает посинение лакмусовой бумажки
и покраснение реактивной на NH3 полоски бумаги. Следует от-
метить большую чувствительность бумажек, приготовленных по
Крупу.
Аммиак, образованный в культурах, может быть определен
количественно. Для этого выращивание культур ведут в кол-
бах, плотно закрытых для предотвращения улетучивания ам-
миака.
Количество аммиака, образуемого бактериями в среде, кроме
активности бактерий, зависит от характера внесенных белковых
веществ.
Может быть использована среда Пошона и Тардье (Pochon
et Tardieux, 1962).
Среда Пошона и Тардье
Стандартный раствор Виноградского (приготовление см.
стр. 160)......................................... 50 мл
Лспарагпп............................................0.2 г
Раствор микроэлементов (стр. 263).................... 1 мл
Дистиллированная вода............................... 950 »
pH 7.2
Появление аммиака устанавливается реактивом Несслера
.(приготовление см. стр. 222).
I Количественный учет бациллярных
форм. При исследовании водоемов может возникнуть необ-
ходимость выделения при счете бактерий спороносных форм,
являющихся индикаторами на наличие малоподвижных форм
органических соединений, которые не могут уже быть исполь-
зованы неспороноснымп видами.
Для учета спороносных бактерий применяют прогревание
посевного материала при принятой в микробиологической прак-
'тике температуре в течение определенного промежутка времени.
Однако следует учитывать, что таким путем можно получить
приуменьшенные данные, так как при прогревании погибают
все вегетативные клетки спорообразующих бактерий.
Грунты следует, по Е. Н. Мишустину (1948), сначала под-
сушить при комнатной температуре, для того чтобы вегетативные
клетки спороносных бактерий перешли в стадию спор. Опреде-
ленное количество грунта (1 г) подсушивают в стерильных ве-
совых стаканчиках. Затем готовят суспензию (1 : 100 или 10 : 100)
и переносят определенное количество ее (3 — 5 мл) в стерилизо-
208
ванные сухим жаром пробирки малого диаметра, которые и по-
мещают, пользуясь специальным держателем (рис. 54), в водяную
баню с температурой воды 80° С. Пробирки выдерживают при
этой температуре 10 мин.
Посевы из пастеризованной суспензии производят обычным
способом — или методом разливок, или нанося на поверхность
подсушенного агара определенное количество посевного мате-
риала. В качестве среды для выращивания спороносных видов
используют смесь мясо-пептонного агара и сусло-агара, соеди-
ненных в отношении 1:1; pH этой среды должен быть 7.0—7.2.
Спороносные бактерии выращивают при 25—30° в течение
2—3 суток, после чего производят счет выросших колоний.
Различные виды спороносных бактерий дают на вышеуказан-
ной среде характерные колонии, что позволяет уже по форме
колоний установить виды выросших бацилл. Для более легкого
распознавания видов рекомендуется выдержать чашки с посе-
вами после подсчета еще 4—5 суток при комнатной температуре.
Наиболее часто развивающиеся колонии спороносных бакте-
рий (рис. 114) принадлежат к следующим видам: Bacillus mega-
therium De Вагу (гладкие, белые, жирно блестящие колонии,
состоящие из характерных толстых клеток), Вас. mesenteri-
cus Trevisan (тонкие, сухие, морщинистые колонии), Вас. ту-
coides Fliigge (стелющиеся по поверхности, с отходящими от
колонии пучками изгибающихся нитей), Вас. mucosus Zimmer-
mann (слизистые, полупрозрачные, похожие на капли клей-
стера), Вас. subtilis (Ernb.) Cohn (мелкие, морщинистые, срастаю-
щиеся с агаром), Вас. agglomeratus Migula (относительно неболь-
шие, сероватые, иногда с зеленоватым оттенком, газа цз углеводов
не образуют), Вас. brevis Migula (колонии жирно блестящие,
гладкие, выпуклые, образуют газ из углеводов), Вас. cartila-
ginosus Krassilnikov (толстые, округлые колонии, плотные, сни-
маются целиком с агара, газа не дают), Вас. filaris Migula (по-
луслизистые, складчатые, с волнистыми краями, слегка желто-
ватые, газа не образуют), Вас. gracilis Zimmermann (складчатые,
блестящие, выпуклые, желтоватого цвета), Вас. cereus Frank-
land (плоские колонии с ровным центром, слабо волнистыми
краями и как бы мучнистой поверхностью), Вас. idosus Bur-
chard (колонии сухие, матовые, пленчатые, мелкоморщинистые),
Вас. intricatus Migula (широко разрастающиеся беловатые ко-
лонии, плоские, мицелиевидные, врастающие в агар, содержащие
нити с частыми перегородками), Вас. virgulus Duclaux (слизи-
стые, сероватые колонии с бахромчатыми краями).
Для спорообразующих анаэробов предложен ряд сред.
Картофельная среда
Белый картофель............................... 200 г
Глюкоза......................................... 5 »
j zt А Г. Родина
209
Рис. 114. Колонии спорообразующих бактерий на МПА+сусло-агар
(по Мишустину, 1948).
А — Bacillus agglomeratus Migula; Б — Вас. cereus Frank land; iB — Вас. megatherium
De Вагу; Г — Вас. idosus Burchard; Д — Вас. mesentericus Trevisan; E — Вас. mycoides
FlUgge.
(NH4)2SO4......................................... 1г
CaCO3............................................. 3 »
Водопроводная вода .............................До 1000 мл
Картофель очищают от кожуры и добавляют воду. Парят в те-
чение 1 часа или кипятят на медленном огне, пока станет мягким,
п пропускают через мелкое сито. Прибавляют другие ингреди-
енты и доводят объем до 1 л, охлаждают и разливают в пробирки,
постоянно размешивая, чтобы получить равномерное распреде-
ление частиц картофеля.
Среда с этиловым спиртом
Этиловый спирт (96°-й)........................... 8 мл
CH3COONa • ЗН2О.................................. 8 г
КН2РО4—Na2HPO4, забуференный, 1 м., pH 7.0 ... . 25 мл
(NH4)2SO4........................................ 0.5 г
Na2CO3 .......................................... 0.1 »
MgSO4 • 7Н2О..................................... 0.2 »
CaSO4 • 2Н2О ..................................... 10 мг
FeSO4 • 7Н2О .................................... 5 »
MnSO4 • 4Н2О..................................... 2.5 »
NaMoO4 • 2Н2О.................................... 2.5 »
Биотин........................................... 3 мкг
Парааминобензойпая кислота........................ 50 »
Тиоглпколат натрия............................... 0.5 г
Дистиллированная вода........................... 1000 мл
pH 7.0
Тиоглпколат натрия может быть заменен 0.2 г Na2S • 9Н2О,
который добавляют в среду после стерилизации. Ростовые ве-
щества могут быть заменены 0.5—1 г дрожжевого экстракта.
Для выделения чистых культур используют среду этого со-
става с 2% агара, помещая посевы в анаэробные условия.
Методы культивирования спирилл, ис-
пользующих белковые вещества. Спириллы
различной формы (рис. 115) широко распространены в пресных
водоемах и в морях. Эти организмы могут быть легко получены
в обогащенных культурах.
Для получения развития спирилл может быть использован
следующий прием: наполняют водой исследуемого водоема широко-
горлые склянки, добавляют туда водоросли или куски мягких
водных растений из этого же водоема и оставляют стоять при ком-
натной температуре. Через 10—12 суток спириллы появляются
в большом числе. В наибольшем количестве они развиваются
в поверхностном слое.
Вместе со спириллами развиваются всегда в большом коли-
честве другие бактерии. Для получения преобладающего по чис-
ленности развития спирилл весьма полезен следующий простой
прием: часть обогащенной первоначальной культуры смешивают
с водой из того водоема, из которого получена культура, в от-
14*
211
ношении 1 : 1 и стерилизуют в автоклаве. Эту среду используют
без добавления каких-либо питательных веществ. Ее засевают
из первоначальной культуры. В этих условиях спириллы хорошо
развиваются.
Обогащенные культуры могут быть получены заполнением
склянок водой исследуемого водоема при добавлении к ней до
0.5% мясного экстракта, 0.3% пептона и 0.1% дрожжевого авто-
Рис. 115. Спириллы.
А — Spirillum volutans Ehrenberg; Б — Sp. tenuc Ehrenberg; В — Sp. praecla-
rum Collin; Г — Sp. imdula Ehrenberg.
лизата. Развитие спирилл на этой среде обычно наступает через
2—3 суток.
Почвенные вытяжки, пшеничные экстракты, дрожжевые авто-
лизаты являются компонентами многих питательных сред для
спирилл.
Для приготовления почвенной вытяжки 100 г сухой почвы
заливают 100 мл воды, нагревают до кипения и охлаждают.
После осаждения мутную жидкость осветляют или центрифуги-
рованием, или фильтрованием через бумажный фильтр. Фильтрат
должен быть прозрачным. Его стерилизуют при 120° С.
Пшеничный экстракт готовят нагреванием 10 г целых пшенич-
ных зерен в 100 мл воды. После охлаждения фильтруют через
фильтровальную бумагу и стерилизуют в автоклаве.
Дрожжевой автолизат должен быть свежеприготовленным.
Для получения развития спирилл могут быть использованы,
кроме вышеуказанной, следующие среды.
Среда с почвенной вытяжкой
10 мл
Почвенная вытяжка
Пшеничный экстракт.............................10»
Дрожжевой автолизат............................0.5г
Водопроводная вода ............................80 мл
Среда с казеином
Пшеничный экстракт..............................10 мл
Гидролизат казеина..............................2 г
212
Дрожжевой автолизат............................0.5 г
Водопроводная вода.............................90 мл
Среда с лактатом кальция
Вода исследуемого водоема..................... 1000 мл
Мясной экстракт................................... 5 г
Пептон............................................ 3 >
Лактат кальция....................................10 »
MgSO4 • 7НаО.................................... 0.5 »
КаНРО4.......................................... 0.5 »
NaCl............................................ 0.1 »
Дрожжевой экстракт.............................. 0.1 »
Пептоно-глюкозная среда
Водопроводная вода ............................ 1000 мл
КаНРО4.........................................0.5 г
MgCla • 6НаО...................................0.2 »
NaCl...........................................0.2 »
Пептон.........................................1 »
Глюкоза........................................1 »
Дрожжевой экстракт................... .........2 »
Среда на мясной воде
Водопроводная вода ............................ 700 мл
Мясная вода..................................... 300 »
Пептон...........................................0.5 г
Среда с мясным экстрактом и лактатом кальция
Водопроводная вода ............................ 1000 мл
Пептон ........................................... 5 г
Мясной экстракт................................... 3 »
Дрожжевой автолизат............................... 3 »
Лактат кальция.................................... 1 »
Агар.............................................. 2 »
Среда Принсгейма с почвенным настоем
Зерно пшеницы помещают в большую пробирку, покрывают
3—4 см садовой земли, заливают водопроводной водой и остав-
ляют стоять 48 час., после чего стерилизуют текучим паром.
Минеральная среда Б. Риттенберга и С. Риттенберг
Водопроводная вода............................. 1000 мл
КаНРО4......................................... 0.5 г
MgSO4 • 7НаО................................... 0.25 »
Раствор микроэлементов ........................ 5 мл
pH 7.0 устанавливается добавлением раствора NaOH.
213
Раствор микроэлементов (готовят в 0.1 н. растворе НС1) со-
держит на 5 мл:
Fe2(SO4)3 • 9Н2О..................................1.5 мг
МпС12 • 4Н2О......................................0.9 »
Co(NO3)2 • 6HtO...................................0.65 »
ZnSO4 • 7HtO .....................................0.2 »
H2MoO4............................................0.1 »
CuSO4 • 5H2O ..................................... 0.005 »
СаС^.бНгО.........................................10 »
Рис. 116.
Трубка для
выделения
культуры
Spirillum
volutans (по
Ritteriberg
a. Ritten-
berg, 1962).
1 — пузырек
воздуха; 2 —
смешанная
культура; 3 —
стерильная
среда, в кото-
рую переме-
щаются спи-
риллы; 4 —
слой бактерий.
Последняя среда была исполь-
зована для Spirillum volutans
Ehrenberg. В эту среду могут быть
введены:
Пшеничный экстракт...........100 мл
Гидролизат казеина...........2 г
Рис. 117. Сосуд
для культиви-
рования Spiril-
lum volutans в
чистой культу-
ре (по Ritten-
oerg a. Ritten-
berg, 1962).
1 — ватные проб-
ки; 2 — стеклян-
ная трубка; з —
мешочек для диа-
лиза; 4 — чистая
культура; 6 —
смешанная куль-
тура.
Большинство спирилл (но не все) растет на твердых средах.
Чистые культуры их можно получить после нескольких пересевов
214
путем посевов штрихом на твердые среды. Для этого может быть
использовала одна из вышеуказанных сред с добавлением агара.
Для выделения должна быть получена обогащенная культура
(наилучший способ получить ее — использовать в качестве среды
смесь воды и первоначальной культуры, как описано выше).
Для тех видов спирилл, как например Spirillum volutans
Ehrenberg, которые неспособны расти на твердых средах, могут
быть использованы специальные приемы выделения. Такие приемы
разработаны Б. Риттенбергом и С. Риттенберг (Rittenberg а.
Rittenberg, 1962) для Sp. volutans. Выделение чистых культур
спирилл основывается на высокой подвижности их и на длитель-
ном их движении в одном направлении. Авторы указывают, что
выделение чистых культур затруднено, так как есть все основа-
ния полагать, что сопутствующие бактерии выделяют какие-то
факторы роста, необходимые для Sp. volutans.
Для выделения используют плоские капилляры, которые
можно получить сжиманием щипцами размягченного на пламени
горелки капилляра. Капиллярные трубки длиной от 15 до 30 см
стерилизуют и запаивают (с оттянутым концом).
Для изоляции спирилл кончик трубки отламывают стериль-
ным пинцетом и вводят в нее 10—20-сантиметровый слой стериль-
ной жидкости, за ним слой смешанной культуры в 2—4 см. От-
верстие трубки запаивают, оставляя место в несколько милли-
метров для пузырька воздуха (рис. 116). Трубку затем помещают
на столик микроскопа и наблюдают при увеличении 100; когда
количество спирилл в стерильной жидкости будет достаточ-
ным, тогда трубку разламывают и культуру переносят. Для
культивирования чистой культуры этого вида нужны особые
условия — продукты жизнедеятельности спутников. Поэтому
культивируют спирилл в целлюлозном мешочке для диализа,
заполненном стерильной средой, опущенном в смешанную куль-
туру (рис. 117). Внесение чистой культуры производят через 3 су-
ток нахождения мешочка в смешанной культуре.
ОПРЕДЕЛЕНИЕ ПРОЦЕССА АММИАЧНОЙ ФЕРМЕНТАЦИИ
МОЧЕВИНЫ
Разлагающие мочевину бактерии широко распространены
в природе. Находятся они и в водоемах — и в воде, и в грунтах.
Разложение мочевины под воздействием микробов является важ-
нейшим этапом в возвращении в круговорот громадных коли-
честв азота (Омелянский, 1940).
Определение содержания в водоемах этой группы бактерий
может быть произведено путем посевов на твердые среды и под-
счета выросших колоний, которые легко могут быть распознаны,
так как на плотных средах с мочевиной и кальциевыми солями
вокруг колоний уробактерий выпадают кристаллы СаСО3 и
215
СаНРО4 в виде тонкой иризирующей пленочки. Прибавление
к средам индикатора также облегчает распознование колоний
уробактерий вследствие изменения цвета вокруг колоний в итоге
подщелачивания среды бактериями, обладающими уреазой.
Могут быть использованы следующие плотные среды.
Среда Бейеринка
Отвар дрожжей (20%-й) ......................... 1000 мл
Мочевина ....................................... 20—30 г
Желатина........................................100 »
Мясо-пептонная желатина с мочевиной
Мясо-пептонная желатина..........................100 мл
Мочевина ......................................... 2 г
(NH4)aCO3........................................... 0.3 »
Прибавление углеаммонийной соли очень повышает электив-
ные свойства среды.
Среда Рубенчика
Мочевина .........................................50 г
К3РО4............................................. 1 »
NaCl.............................................. 1 »
MgSO4 • 7Н2О.................................... 0.5 »
FeCl3-6H2O......................................Следы
Кальциевая соль органической кислоты (лимонной, мо-
лочной, винной или яблочной).................... 10 г
Агар............................................ 15 »
Дистиллированная вода...........................1000 мл
Среда Зенгена
Мочевина ............................... 20 г
Яблочко- или лимоннокислый кальций ... 5 »
Лимоннокислый аммоний.................. 0.5 *
Агар.................................... 20 »
Водопроводная вода ................. 1000 мл
К этой среде, еще теплой после стерилизации, прибавляют по
каплям отдельно простерилизованный 3%-й раствор КаНРО4
до тех пор, пока не появится слабая опалесценция. При правиль-
ном приготовлении среды пластинки из нее должны быть почти
прозрачны.
Среда Аллена
Мочевина .............................20 г
К2НРО4.................................1 »
СаС12-6Н2О...........................0.1 »
MgSO4 • 7Н2О.........................0.3 »
NaCl . . 0.1 »
216
FeCl3 • 6H2O.............................0.01 г
Мясной экстракт..........................5 »
Водопроводная вода....................... 1000 мл
Агар на почвенном экстракте с мочевиной
Мочевина ............................50 г
КаНРО4............................... 0.5 »
Почвенный экстракт....................100 мл
Водопроводная вода .................. 900 »
Агар...................................15 г
При приготовлении всех сред с мочевиной должно быть со-
блюдено одно правило: мочевина должна быть простерилизована
отдельно или текучим паром, или сухим жаром (при 106° С 30 мин.),
так как при повышении температуры мочевина в жидких раство-
рах частично разлагается. Можно употребить следующий прием
(по Омелянскому, 1940): стерилизовать среды сначала без моче-
вины при 120° С, затем, прибавив мочевину, текучим паром.
Тайдвелл, Хэфер и Меркл (Tidwell, Heather a. Merkle, 1955)
предложили среду, стерилизация которой проводится в автоклаве
вместе с мочевиной.
Среда Тайдвелла, Хэфера и Меркла
Дрожжевой экстракт.............. 0.1 г
КаНРО4................. . 9.1 »
NaH2PO4....................... . 9.5 »
Мочевина.............................20 »
Феноловый красный....................0.01 »
Дистиллированная вода................ 975 мл
Среду стерилизуют в автоклаве 15 мин. Сначала pH среды
низкий — 4.8, стерилизация поднимает pH до 6.8 в итоге частич-
ного разложения мочевины.
Агар с мочевиной и глюкозой
Мясо-пептонный бульон.................100 мл
Мочевина .............................1 г
Агар..................................1.5 »
Глюкоза...............................0.5 »
Бромтимоловый синий (1.5?о-й спиртовой
раствор).............................. 1 мл
Мочевину, глюкозу и бромтимоловый синий добавляют асеп-
тически к стерилизованному, расплавленному и охлажденному
до 50° С агару; pH доводят до 6.8—6.9 и разливают в простерилизо-
ванные сухим жаром пробирки. Стерилизуют текучим паром
10 мин. Среда получается зеленовато-оливкового цвета. При разви-
тии расщепляющих мочевину бактерий цвет среды переходит
в синий.
217
При использовании жидких сред количество уробактерий
определяется методом титров.
Активность уробактерий можно определить в жидких средах
по накоплению аммиака — путем титрования кислотой или коло-
риметрически с реактивом Несслера.
ОПРЕДЕЛЕНИЕ ПРОЦЕССОВ НИТРИФИКАЦИИ
Процесс нитрификации, ведущий к образованию наиболее
хорошо усваиваемых водорослями соединений азота, имеет огром-
ное значение для биологии водоемов. Это следующий за аммони-
фикацией процесс возвращения соединений азота в круговорот —
окисление аммиака в соли азотистой, а затем в соли азотной ки-
слот. Одновременно это процесс создания из минеральных сое-
динений органического вещества в телах микробов.
Количество нитрифицирующих бактерий в воде и в грунтах
водоемов может быть определено методом титров (путем посевов
в жидкие среды различных количеств посевного материала) и
методом подсчета колоний, выросших на кремнекислых пластин-
ках, пропитанных элективной средой.
Анализ ведут отдельно на нитрифицирующих бактерий I фазы,
окисляющих аммиачные соли до азотистой кислоты, и на нитри-
фицирующих бактерий II фазы, окисляющих соли азотистой
кислоты в соли азотпой.
Нитрификация I фазы
Среда Виноградского •
(NH4)2SO4...............1в.........
к2нро4....................
MgSO4 • 7Н2О..........•..........
NaCl..............................
FeSO4 • 7Н2О ......................
Дистиллированная вода..............
Мел................................
Для определения наличия нитрифицирующих бактерий может
быть использована основная среда Виноградского.
2 г ;
1 » !
0.5 »
2 »
0.4 »
. 1000 мл
. В осадке
Мел добавляют в очень небольшом количестве в каждую кол-
бочку отдельно. Среду стерилизуют в автоклаве 10 мин.
При приготовлении сред для нитрифицирующих бактерий
следует обращать большое внимание на химическую чистоту ис-
пользуемых реактивов. До приготовления среды каждый из не-
обходимых реактивов должен быть проверен на отсутствие в нем
примесей нитритов и нитратов. Особенно часто такие примеси
содержит мел. В случае обнаружения примесей реактив должен
быть заменен другим, а в случае невозможности замены тщательно
218
перекристаллизован. Мел освобождается от примесей нитритов
и нитратов многократным кипячением с дистиллированной водой.
Приготовленная среда еще раз проверяется, и только среда, со-
вершенно свободная от нитритов и нитратов, может быть исполь-
зована для посевов.
Среду следует разливать тонким слоем (не более 1.5—2 см
высотой) в колбы Виноградского или при неимении их в кони-
ческие колбочки. Вся посуда должна быть предварительно вымыта
хромовой смесью и тщательно прополоснута дистиллированной
водой.
Е. Л. Рубан (1961) указывает, что среда Виноградского яв-
ляется более оптимальной для развития нитрифицирующих
бактерий при разбавлении ее в 10 раз.
Определение наличия и количественного содержания нитри-
фицирующих бактерий можно производить, взяв воду исследуе-
мого водоема и добавив в нее аммонийномагниевую соль фосфор-
ной кислоты (NH4MgPO4) в количестве от 0.2 до 0.5%.
В последнее время предложен ряд сред для культивирования
нитрифицирующих бактерий I фазы, являющихся по существу
модификациями среды Виноградского, но несодержащих нераство-
римых компонентов, что облегчает наблюдения над развитием
микроорганизмов.
Среда Леви и Прамера
Na2HPO4..............................13.5 г
КН2РО4............................... 0.7 »
MgSO4 • 7Н2О......................... 0.1 »
NaHCO3............................... 0.5 »
(NH4)2SO4............................ 2.5 »
FeCl3.6H2O...........................14.4 мг
СаС12.6Н2О...........................18.4 »
Дистиллированная вода............... 1000 мл
pH 8.0
Среда Энгля и Александера
(NH4)2SO4...............'............3 г
К2НРО4..............................0.5 »
MgSO4 • 7Н2О........................50 мг
СаС12«6Н2О........................... 4 »
Клешневидное железо.................100 мкг
Крезоловый красный..................50 »
Бидистнллированная вода............. 1000 мл
После стерилизации pH среды доводят стерильным раствором
К2СО3 до 8.0 и все время культивирования поддерживают на
этом уровне.
Хорошее развитие Nitrosomonas может быть получено при
использовании модификации среды Виноградского.
219
Модификация среды Виноградского
(NH4)2SO4.............................2 г
К2НРО4................................1 »
NaCl..................................0.5 »
MgSO4 • 7Н2О..........................0.5 »
MnSO4 • 4Н2О..........................Следы
Fe2(SO4)8 • 9Н2О........................ »
Дистиллированная вода................. 1000 мл
pH 8.5
Среду разливают в склянки, стерилизуют в автоклаве. От-
дельно стерилизуют колбы с мелкими кусочками хорошо промы-
того мрамора. Среду наливают в колбы асептически.
Среда Стефенсон
(NH4)aSO4............................. 20 г
КаНРО4.............................. 7.5 »
КН2РО4.............................. 2.5 »
FeSO4 • 7Н2О ....................... 0.1 »
MgSO4 • 7Н2О........................ 0.3 »
СаС12.6Н2О.......................... 0.02 »
Дистиллированная вода.................100 мл
Разводят 1 часть среды в 100 частях дистиллированной воды
для жидких сред и кремнекислого геля.
Среда Майклджона
(NII4)2SO4....................................... 0.66 г
NaCl............................................. 0.3 »
КН2РО4........................................... 0.1 »
MgSO4 • 7Н2О..................................... 0.14 »
FeSO4 • 7НаО .................................... 0.03 >
Дистиллированная,вода........................... 1000 мл
Смесь микроэлементов (следы на 1000 мл дистиллирован-
ной воды: Li2SO4, CuSO4, ZnSO4, Н3РО4, A12(SO4)3,
SnCl2, MnCl2, NiGl2, CoS04, TiCl4, KJ, KBr) .... 1 »
Ha 100 мл среды вводится 1 г CaCO3.
Засеянные колбы ставят в термостат при 25° С. За культурами
необходимо вести следующие наблюдения: производить регулярно
через сутки, начиная с 4-го дня после посева, химические реакции
на наличие аммиака и азотистой кислоты, а через некоторое время,
при положительных реакциях на азотистую кислоту, провести
просмотр развившейся микрофлоры под микроскопом.
Реактивами на азотистую кислоту служат цинк-йод-крахмаль-
ный раствор и реактив Грисса. Можно пользоваться любым из
них.
Цинк-йод-крахмальный раствор готовят следующим образом:
4 г крахмала растирают в фарфоровой ступке с небольшим коли-
чеством воды и приливают эту жидкость при непрерывном поме-
220
шив ан и и к кипящему раствору хлористого цинка в дистиллиро-
ванной воде (20 г хлористого цинка на 100 мл дистиллирован-
ной воды). Смесь кипятят до тех пор, пока жидкость не станет
прозрачной. Испаряющуюся воду рекомендуется доливать.
К прозрачной смеси прибавляют 2 г сухого йодистого цинка,
доливают дистиллированной водой до 1 л и фильтруют. Реактив
следует держать в темноте в склянке с притертой пробкой.
Определение нитритов в культурах с этим реактивом ведут
следующим образом: на белую фарфоровую пластинку в углубле-
ние вначале вносят три капли реактива и одну каплю разба-
вленной серной кислоты, затем каплю исследуемой культуры. При
наличии в среде азотистой кислоты наступает быстрое посинение
жидкости вследствие выделения азотистой кислотой из йодисто-
водородной соли свободного йода, который, вступая во взаимо-
действие с крахмалом, дает синюю окраску. Интенсивность
окраски показывает относительное содержание азотистой кислоты,
и, следовательно, интенсивность процесса.
Реактив Грисса для определения азотистой кислоты в культу-
рах употребляется в сухом виде; в жидком виде он обладает весьма
большой чувствительностью, и, используя его в таком виде,
можно открыть ничтожные примеси нитритов, не имеющие отно-
шения к процессу нитрификации.
Для приготовления сухого реактива Грисса берут 1 г а-нафтил-
амина, 10 г сульфаниловой кислоты, 89 г виннокаменной кислоты,
тщательно перемешивают все, растирая в ступке до получения тон-
кого порошка. Реактив хранят в склянке из темного стекла с при-
тертой пробкой.
Вместо виннокаменной кислоты может быть взята другая (на-
пример, янтарная или щавелевая). Соотношение отдельных ком-
понентов реактива в этОхМ случае несколько иное: 1 г а-нафтил-
амина, 10 г сульфаниловой кислоты и 50 г янтарной (или щавеле-
вой). Наступление реакции при использовании щавелевой ки-
слоты несколько задерживается.
Для реакции берут на скальпеле 7—10 мг сухого реактива,
помещают его в углубление чистой фарфоровой пластинки, при-
ливают туда 4—5 капель культуры (число капель должно быть
всегда одинаковым) и размешивают кончиком стеклянной палочки.
Окраска при значительных количествах нитритов появляется
лразу, при малых — постепенно. Характер окраски меняется
В течение нескольких минут. Наблюдения над изменением окраски
в течение 5 мин. дают возможность определить, конечно весьма
приблизительно, энергию процесса — количество образовавшихся
нитритов.
Точное определение количества образованных в культурах
нитритов может быть произведено с помощью фотоэлектроколо-
риметра. Этот прибор предназначен для определения концентра-
ций окрашенных растворов. При его использовании количество
221
образованных микроорганизмами нитритов может быть опреде-
лено с большой точностью.
Реактив Несслера на аммиак готовят следующим образом: 50 г
йодистого калия растворяют в 50 мл горячей дистиллированной во-
ды и к этому раствору прибавляют горячий концентрированный
раствор сулемы до тех пор, пока не перестанет исчезать образую-
щийся красный осадок. После этого жидкость фильтруют, прибав-
ляют раствор 150 г едкого калия в 400 мл дистиллированной воды и
еще несколько миллилитров раствора сулемы. Когда реактив осты-
нет, к нему прибавляют дистиллированной воды до объема 1 л.
Для реакции берут пипеткой отстоявшуюся прозрачную жидкость.
Этот реактив можно приготовить п другим способом: раство-
ряют 22.5 г йода в 20 мл раствора йодистого калия, содержащего
30 г KJ. К полученному раствору после полного растворения при-
бавляют 30 г металлической ртути и встряхивают до исчезно-
вения цвета от йода. Если раствор не будет давать реакции с крах-
малом на йод, то прибавляют к нему по каплям раствор йода
в йодистом калии до тех пор, пока он не начнет давать эту реак-
цию. Раствор разбавляют дистиллированной водой до 200 мл,
тщательно перемешивают и прибавляют к нему 975 мл 10%-го
раствора едкого натра.
Реактив дает с аммиаком окрашивание желто-оранжевого
цвета различных оттенков в зависимости от концентрации ам-
миака. При малом содержании аммиака окраска желтая, при
значительном — оранжево-желтая, при большом — красно-бурая.
Для получения реакции наносят на белую фарфоровую плас-
тинку несколько капель реактива и с одного края вносят в реак-
тив каплю культуральной жидкости.
Исчезновение аммиака в культурах показывает его окисление
бактериями лишь в том случае, если параллельно с этим появ-
ляется продукт окисления — азотистая кислота, а микроскопия
показывает наличие нитрифицирующих бактерий. Одно исчезно-
вение аммиака не показывает еще, что процесс нитрификации
идет, так как аммиак в щелочном растворе постепенно улетучи-
вается. Поэтому только наличие азотистой кислоты служит на-
дежным доказательством хода процесса. Реакции на наличие ам-
миака, однако, необходимы, так как при полном его исчезновении
его надо прибавить, надо «подкормить» бактерии. Для этого го-
товят 10%-й раствор серноаммонийной соли, переливают его
в колбу, в которую через ватную пробку вставлена градуирован-
ная пипетка, и стерилизуют. В колбы с посевами, в которых весь
аммиак окислен, прибавляют с соблюдением условий стериль-
ности по 2 мл этого раствора. После окисления нескольких пор-
ций аммиака делают пересевы в новую среду.
Необходимо параллельно с культурами в термостат ставить
1—2 контрольные колбы, в которых проводят те же реакции, что
и в посевах.
222
Определения содержания нитрифицирующих бактерий как
в воде, так и в донных отложениях можно вести на гелевых плас-
тинках (по С. Н. Виноградскому). Гелевые пластинки готовят
следующим образом: разбавляют дистиллированной водой хими-
чески чистую соляную кислоту до удельного веса 1.1 (удельный
вес определяют ареометром) и растворимое стекло (лучше брать
кремнекислый натрий) до удельного веса 1.1. Соединяют разве-
денную соляную кислоту и разведенное жидкое стекло в отноше-
нии 1 : 1 следующим образом: к соляной кислоте осторожно при
постоянном помешивании приливают жидкое стекло. Смесь хорошо
перемешивают и разливают в чашки Петри. Через несколько ча-
сов смесь застывает в плотную студнеобразную массу. По Н. М. Ла-
зареву, для избежания появления в толще геля чечевицеобразных
пустот, растворы соляной кислоты и кремнекислого натрия надо
нагреть до кипения и сливать их горячими непосредственно
в чашки Петри.
Приготовленные таким образом гелевые пластинки содержат
в себе большое количество хлоридов, которые должны быть уда-
лены из них промыванием в воде. Кроме того, пластинки имеют
сильнокислую реакцию. Пластинки промывают 2—3 суток. Чашки
Петри открывают, складывают в большие глубокие кристалли-
заторы или тазы и заливают их водой, которую меняют несколько
раз в день, или ставят их под водопроводный кран, устраивая
ток воды таким образом, чтобы вода не била по пластинкам. После
промывки холодной водой чашкп с гелевыми пластинками про-
мывают еще несколько раз горячей дистиллированной водой.
Отмывание можно считать законченным, когда взятый из одной
из чашек кусочек геля при помещении его в каплю раствора
бромтимолового синего покажет зеленое окрашивание, т. е. ней-
тральную реакцию.
Гелевые пластинки могут быть получены и другим способом:
из тетраэтилового эфира ортокремневой кислоты [Si(OC2H5)4J
и этилового спирта, которые соединяют в равных объемах (1п-
gellman a. Laurel1, 1947). В полученную смесь вливают 6 объемов
воды. Воду прибавляют порциями при постоянном помешивании
(чтобы избежать появления пузырьков воздуха рекомендуется
употребление прокипяченной воды). Полученный раствор центри-
фугируют до тех пор, пока он не станет прозрачным, затем его
разливают в чашки Петри. Чашки Петри подвергают затем нагре-
ванию в автоклаве при 120° С в течение 30—40 мин. Пластинки
не должны быть быстро охлаждены во избежание растрескивания.
Их тщательно промывают водой для удаления остатков эфира и
спирта. Дальнейшая обработка гелевых пластинок идет обычным
путем.
Полученные тем или иным способом пластинки стерилизуют
или опуская их в кипящую воду, или в тех случаях, когда тре-
буется автоклавирование, в автоклаве под давлением. Затем их
223
пропитывают или концентрированной в 10 раз средой Виноград*
ского, нанося на каждую чашку по 2 мл, или 0.5%-м раствором
NH4MgPO4, нанося в этом случае 10 мл. И ту и другую среду на-
носят горячей.
В первом случае готовят следующий раствор:
Дистиллированная вода........................... 200 мл
КаНРО4...........................................0.5 г
MgSO4 • 7Н2О.....................................0.3 »
NaCl.............................................0.3 »
FeSO4 • 7Н2О .....................................0.02 »
MnSO4 • 5Н2О......................................0.02 »
Соль цинка, титана, молибдена, алюминия (одна из этих
солей)............................................Следы
Рис. 118. Засев чашки с гелем
комочками грунта.
На пропитанные этим раствором чашки наносят 1 мл стериль-
ного 5 %-го раствора сернокислого аммония и 1 мл взвеси мела, под-
сушивают в термостате, пока поверх-
ность пластинок не станет матовой.
Необходимо остерегаться пересуши-
вать пластинки, так как это влечет за
собой их растрескивание. В случае
пересушивания можно прибавить на
пластинку 1—2 мл стерильной воды.
Посевы на гелевые пластинки
производят тарированной 1 петлей,
нанося ею определенное количество
посевного материала (для воды обыч-
но 1 мл). Посевной материал наносят
правильными линиями на равном рас-
стоянии (капельки воды или ко-
мочки грунта — рис. 118). Чашки Пет-
ри с засеянным гелем помещают во
влажные камеры, так как иначе происходит высыхание и растре-
скивание геля. Выделяющаяся из геля вода удаляется с крышек
чашек Петри стерильными полосками фильтровальной бумаги.
О количестве развившихся колоний можно судить по количеству
так называемых зон просветления, которые получаются вслед-
ствие растворения мела в первой среде или NH4MgPO4 во второй
под действием образующейся азотистой кислоты (рис. 119). Коло-
нии эти вначале бесцветны, затем становятся желтоватыми и
наконец темно-бурыми. Прп микроскопическом просмотре коло-
нии обнаруживают нитрифицирующих бактерий. Гель, взятый
в зоне просветления, показывает положительную реакцию на
азотистую кислоту. Колонии, имеющие зоны просветления, про-
считывают при помощи лупы.
1 Тарированной называется петля, у которой объем или вес взятого ею
материала установлен путем соответствующих измерений.
224
Рис. 119. Зоны растворения мела нитрифици-
рующими бактериями, развившимися вокруг
комочков грунта.
При работе со средой Ви-
ноградского необходимо следить
за исчезновением аммиака, для
чего у края чашки вырезается
платиновой петлей кусочек геля
и помещается в каплю с реак-
тивом на аммиак. Если реакция
на аммиак отрицательная, то
необходимо провести подкарм-
ливание, которое состоит в том,
что в образовавшееся углубле-
ние геля прибавляют 1—2 кап
ли 10/о-го раствора сернокис-
лого аммония. Лучше каждую
пробу (воды или грунта) засе-
вать на 4 чашки Петри с гелем
(2 пропитанные средой Вино-
градского и 2 — раствором
NH4MgPO4), так как различ-
ные виды нитрозных бактерий
требуют среду различной ще-
лочности.
Положительная реакция на
азотистую кислоту, полученная
при наблюдении над культура-
ми 3—4 раза, может служить
показателем идущего процесса
в том случае, если при микро-
скопическом исследовании обна-
ружено наличие бактерий —
возбудителей процесса нитри-
фикации I фазы.
В водоемах часто встреча-
ются различные расы Nitroso-
monas europea Winogradsky, от-
личающиеся размерами и фор-
мой клеток (рис. 120).
Получение чистых культур
Nitrosomonas представляет со-
бой сложную задачу вследст-
вие присутствия в колониях
этого микроорганизма бактерий-
спутников. А. А. Имшенецким и
Е. Л. Рубан (1953) разработаны
специальные методы выделения.
1. Метод глубинны
тельной культуры Nitrosomonas
Рис. 120. Различные расы (Л, Б, В) Nitrosomonas europea Winogradsky (по Виноградскому, 1952).
колоний. 1 мл накопи-
:ят в 10 мл 0.75 %-го стериль-
15 А. Г. Родина
225
ного раствора NaCl и пропускают через жидкость в течение 20 мин.
ток углекислоты, промытой стерильной дистиллированной водой.
Этим достигается растворение мела благодаря переходу его в би-
карбонат кальция и освобождение клеток Nitrosomonas, при-
ставших к твердым частицам.
1 мл взвеси микроорганизмов в 0.75 %-й NaCl после указан-
ного осветления вносят в стерильную чашку Петри, содержа-
щую 1 мл стерильной среды следующего состава (в %): NaCl — 2,
MgSO4 • 7Н2О - 0.5, Na2HPO4 - 12, КН2РО4 - 4, FeSO4 •
7Н2О - 0.01, MnSO4 • 5Н2О - 0.01, NaHCO3 - 1 и 1 мл 5%-го
раствора (NH4)2SO4. В чашку затем вносят 10 мл стерильного
раствора кремневого геля. Пластинки затвердевают через не-
сколько минут.
Кремневый гель готовят заранее как обычно, из смеси кремне-
вой и соляной кислот, смесь сразу же помещают в коллодийный
или целлофановый мешок и промывают в дистиллированной воде
в течение 1—1.5 суток. За это время воду меняют 6—8 раз. Тем-
пература воды в диализаторе не должна превышать 10—12° С,
йначе происходит свертывание геля. После диализа раствор вы-
ливают в колбы и стерилизуют в автоклаве при 120° С 20 мин.
В таком виде смесь сохраняется для работы.
В чашках с прозрачным плотным гелем через 6—9 суток по-
являются микроколонии нитрозпых бактерий, из которых произ-
водят отвивки или тонкой иглой, или волосным капилляром.
2. Капе л ь н ы й м е т о д. Капельный метод основан на
том, что при незначительном количестве клеток в культуральной
среде можно нанести на покровное стекло такие мелкие капельки
жидкости, что некоторые из них будут содержать только одпу
клетку.
Непосредственно перед выделением через накопительную куль-
туру, если среда содержала нерастворимые компоненты, пропус-
кают в течение 20 мин. ток углекислоты, промытой дистилли-
рованной водой. Из такой ставшей прозрачной культуры при
помощи микропипетки Л. И. Комаровой (1949) наносят на пред-
метное стекло капли диаметром 0.2—0.3 мм. После нанесения ка-
пель они возможно скорее должны сниматься со стекла стериль-
ными кусочками фильтровальной бумаги, имеющими клиновид-
ную форму. Эти небольшие кусочки должны быть приготовлены
и предварительно простерилизованы в чашке Петри. После сня-
тия капли кусочек фильтровальной бумаги переносится в колбу
в стерильную Чреду. Для получения чистой культуры должно
быть засеяно таким путем значительное количество колб.
Проверка чистоты культуры производится прежде всего микро-
скопией развившихся микроорганизмов, затем высевами на ряд
сред: МПА, МПБ, картофельный агар, крахмало-аммиачный агар
и др. Отсутствие роста на перечисленных средах, однородность
клеток в культуре показывают ее чистоту.
226
Нитрификация II фазы
Для определения наличия в водоеме нитрифицирующих бак-
терий II фазы делают посевы в среду Виноградского следующего
состава:
Дистиллированная вода............... 1000 мл
NaN02..................................1.0 г
Na2CO3 ................................1.0 »
NaCl...................................0.5 »
К2НРО4.................................0.5 »
MgSO4 • 7НоО...........................0.3 »
FeSO4 • 7Н2О ..........................0.4 »
При изготовлении этой среды должно быть обращено большое
внимание па химическую чистоту используемых реактивов. Осо-
бенно часто содержит примеси нитратов азотистонатриевая соль.
Поэтому прежде чем готовить среду, все реактивы должны быть
проверены, для чего готовят в небольших количествах на дистил-
лированной воде растворы их концентрацией 1 г/л, в которых про-
водят затем реакции на нитраты. В случае обнаружения загряз-
нения нитратами какой-либо соли ее следует перекристаллизо-
вать. Так как чаще всего такую примесь содержит азотистонат-
риевая соль, то здесь приводится способ перекристаллизации этой
соли (по Карякину, 1936). Для очистки продажного (96—97%-го)
продукта растворяют 500 г соли в 750 мл воды при подогре-
вании, фильтруют и, упарив фильтрат до начала выделения кри-
сталлов (пленка па поверхности), охлаждают. Кристаллы чистого
препарата отсасывают на бумажном фильтре в бюхперовской во-
ронке, а маточные растворы последовательно один-два раза выпа-
ривают до начала кристаллизации. Выход чистого (100%-го) пре-
парата равен приблизительно 400 г. При недостаточной очистке
перс кристаллизацию следует повторить. Полученный чистый пре-
парат следует хранить в сухом месте и время от времени повторять
проверку его на наличие нитратов.
Приготовленную питательную среду разливают по 50 мл
в колбы Виноградского или в конические колбочки, предвари-
тельно тщательно вымытые хромовой смесью и хорошо сполосну-
тые дистиллированной водой. Стерилизуют эту среду в автоклаве
при 120° С 15 мин.
Наличие процесса нитрификации II фазы отмечается по исчез-
новению азотистой кислоты, появлению азотной и по наличию
возбудителей. Для обнаружения азотистой кислоты пользуются
указанными выше реактивами, для обнаружения азотной обычно
рекомендуется пользоваться бруцином или дифениламином. Реак-
ция с бруцином производится следующим образом: в каплю кон-
центрированной серной кислоты, помещенной в углубление фар-
форовой пластинки, вносят кристаллик бруцина и затем каплю
15*
227
культуры. В присутствии нитратов наступает в зависимости от
содержания их в среде розовое или вишнево-красное окрашивание.
Бруцин может быть для проведения реакций использован и
в виде 0.02 %-го раствора в серной кислоте, не содержащей ни-
тратов.
Нитраты могут быть обнаружены реакцией с пирогаллолом.
Берут 10 мл культуры, прибавляют к ним 0.2 г пирогаллола, тща-
тельно перемешивают и затем осторожно пипеткой, опустив кон-
чик ее в жидкость, приливают 2 мл крепкой серной кислоты, после
чего прибавляют 0.1 г NaCl. Наступает вскипание на границе этих
слоев и появляется пурпурное кольцо. По интенсивности окраски
и ширине кольца судят о содержании в пробе нитратов.
С дифениламином эта реакция может быть проведена лишь
после разрушения в среде оставшихся неокисленными нитритов,
так как этот реактив дает ту же реакцию и на нитриты. Поэтому
при работе с дифениламином, часто используемым для определе-
ния наличия нитратов в культурах, приходится прибегать к ме-
тоду предварительного разрушения оставшихся неокисленными
нитритов.
Тредвелл и Голл указывают, что нет ни одной вполне надеж-
ной качественной реакции, которая позволяла бы открывать
в водных растворах следы нитратов в присутствии больших коли-
честв нитритов, что может иметь место в начальных стадиях те-
чения процесса нитрификации II фазы в посевах. Поэтому эти ре-
акции лучше осуществлять, когда в среде накопились нитраты.
Для разрушения в культурах нитритов используется взаимо-
действие азотистой кислоты с различными соединениями: азидом
натрия, амидосульфоновой кислотой, мочевиной, метиловым
спиртом.
По первому методу к нейтральному раствору прибавляют из-
быток азида натрия, подкисляют уксусной кислотой и через не-
сколько минут нагревают до кипения, чтобы разрушить избыток
азотистоводородной кислоты. Разрушение азотистой кислоты про-
исходит на холоду по уравнению
2NaN3 4-2HNO2—► 3N2 + 2NO + 2NaOH.
По второму методу смешивают исследуемый раствор с 0.5%-м
раствором ампдосульфоновой кислоты. Реакция проходит на-
столько быстро (даже с концентрированными растворами), что не
приходится опасаться образования каких-либо количеств азот-
ной кислоты за счет окисления азотистой. Разложение азотистой
кислоты проходит согласно уравнению
HNO2+ NH2SO3II —> II2SO44-H2O + No.
Другие способы разрушения нитритов в культурах для даль-
нейшего определения нитратов рассматриваются более подробно.
228
1. Разложение нитритов мочевиной с постановкой реакции
на 16—18 час. (по О. А. Алекину). Готовят ряд пробирок, тща-
тельно вымытых хромовой смесью и высушенных. Их помещают
на обычный штатив и на каждой пробирке отмечают помер куль-
туры, которая будет подвергнута исследованию. В каждую про-
бирку всыпают по 0.1 г мочевины, добавляют по 7 мл дистиллиро-
ванной воды, вносят по 1 мл исследуемой культуральной жид-
кости и самыми последними (лучше если это делать на холоду) —
но 2 мл серной кислоты, разведенной дистиллированной водой
в отношении 1:1. Пробирки с этой смесью оставляют стоять на
16—18 час., обычно до следующего дня. Нитриты за указанное
время полностью разрушаются. На другой день можно проводить
в приготовленных смесях определения нитратов. Для этого берут
по 1 мл смеси, основная среда здесь уже является разведенной
в 10 раз.
2. Разложение нитритов мочевиной в течение 15—20 мин.
(по Бетгеру). Для каждого посева здесь надо заранее приготовить
по 2 вымытые хромовой смесью и хорошо сполоснутые пробирки.
В одну из них наливают 2 мл серной кислоты, разведенной дистил-
лированной водой в отношении 3 : 1, в другую всыпают 1 г моче-
вины, прибавляют 7 мл дистиллированной воды и наконец вносят
1 мл исследуемой культуральной жидкости и размешивают все
чистой стеклянной палочкой до полного растворения мочевины.
Затем приступают к реакции разрушения нитритов, которую про-
водят на холоду. Для этого пробирку с серной кислотой помещают
в стакан с холодной водой, после чего приливают в нее небольшими
порциями содержимое второй пробирки, останавливаясь каждый
раз, когда начнется выделение газа, пережидая его. После добав-
ления последней порции, когда прекратится сильное выделение
газов, разрушение нитритов можно считать законченным. И в этом
случае при разрушении нитритов производится разведение куль-
туральной жидкости в 10 раз, после чего можно перейти к опре-
делению нитратов, взяв для этого 1 мл раствора.
3. Удаление нитритов при помощи метилового спирта (по
Фишеру). В маленькую коническую колбочку на 20—30 мл с мет-
кой, показывающей объем 4 мл, помещают 3 мл исследуемой куль-
туры, добавляют 1 мл 2 н. серной кислоты и затем 2 мл метило-
вого спирта. Смесь тщательно перемешивают и выпаривают до
метки, при этом происходит полное разрушение нитритов. К 1 мл
такого свободного от нитритов раствора добавляют 8.75 мл дис-
тиллированной воды, тщательно перемешивают и 1 мл разведен-
ного раствора испытывают на нитраты.
Так как мочевина часто содержит заметные количества нитра-
тов, то всегда необходимо при разложении нитритов новым, не-
известным с этой стороны реактивом ставить контроль, т. е.,
растворив 1 г мочевины в 10 мл дистиллированной воды, приба-
вить 2—3 капли концентрированной серной кислоты и провести
229
определение нитратов. Вычислив количество нитратов в контроль-
ном реактиве, следует вычесть его из количества нитратов в ис-
следуемом растворе.
Для определения нитратов после разрушения в среде нитри-
тов необходимо иметь 0.017%-й раствор дифениламина в серной
кислоте. Для приготовления реактива (по О. А. Ллекину) берут
чистую концентрированную серную кислоту. Так как продажная
серная кислота часто содержит следы азотной кислоты, то перед
составлением реактива серную кислоту следует очистить от приме-
сей кипячением в течение 15—20 мин. Перед тем как поставить
кислоту кипятиться, в нее нужно добавить КС1 (5 г л), для того
чтобы образовавшаяся в результате кипячения соляная кислота
восстановила азотную кислоту до газообразных окислов азота,
удаляющихся при кипячении.
По получении такой очищенной кислоты приступают к приго-
товлению реактива. На аналитических весах отвешивают и поме-
щают в литровую мерную колбу 170 мг химически чистого кристал-
лического дифениламина, доливают 150 мл дистиллированной
воды, а затем 50—100 мл концентрированной серной кислоты.
После полного растворения дифениламина колбу заполняют до
метки концентрированной серной кислотой.
Готовый реактив должен быть совершенно прозрачным. Реак-
тив необходимо хранить в темной посуде с притертой пробкой,
так как дифениламин под действием света разлагается, в указан-
ных же условиях реактив сохраняется достаточно долго. Чувст-
вительность реактива при использовании его для определения ни-
тратов в среде Виноградского равна 0.001 мг NO3 на 1 л.
По разрушении нитритов при проведении реакции дифенил-
амином можно приблизительно, пользуясь приведенной здесь
табл. 11, определить количество образованных бактериями в среде
нитратов и тем с большей точностью следить за ходом процесса.
В табл. 11 приведены изменения окраски кольца, получающегося
на границе жидкостей, при различном содержании нитратов
в среде.
Ход определения следующий: в пробирку, установленную
па штативе, наливают 1 мл исследуемой культуральной жидкости,
в которой одним из вышеуказанных способов разрушены нитриты;
добавляют одну каплю 20%-го раствора NaCl; затем пипеткой
набирают 2 мл 0.017 %-го раствора дифениламина в серной ки-
слоте и осторожно выливают его по стенке пробирки, не капая на
поверхность раствора и не сотрясая пробирку. В присутствии
нитратов на границе двух жидкостей возникает синее кольцо,
интенсивность окраски которого зависит от содержания нитратов.
Наблюдая на белом фоне в отраженном свете характер измене-
ния окраски кольца, сравнивают его с табличными данными пер-
вого разведения, что позволяет приблизительно определить коли-
чества нитратов в мг л среды.
230
Таблица II
Приблизительные колнмвв нпратов в культурах нитрифицирующих бактерии в среде Виноградского
(при определеви 0.017%-м раствором дифениламина в концентрированной H2SO<)
Разведение Характер окраски кольца Количество нитратов (в мг/л) в культу ре после разрушения нитритов 1
сразу через 1 мин. через 3 мин. через 3 мин. мочеви- ной метиловым спиртом
Нет. Нет. Нет. Едва заметные
следы кольца.
I разведение (1 мл исследуемой куль- Едва заметные следы кольца. Слабо голубое. Голубое. Ярко-голубое. 2 3 8.7
туральной жидко- Голубое. Ярко-голубое. Ярко-голубое. Синее. 8
сти + 9 мл дистил- лированной воды). Ярко-голубое. Синее. Ярко-синее. Темно-синее. 23 24
Синее. Ярко-синее. » » 50 —
Ярко-синее. Черно-синее. Черно-синее. Черно-синее. 75 —
Слабо голубое. Голубое. Ярко-голубое. Синее. 100 —
П разведение (1 мл Ярко-голубое. Синее. Ярко-синее. Темно-синее. 250 —
I разведения + -|-9 мл дистиллиро- ' ('инее. Темно-синее. Черно-синее. Черно-синее. 500 —
ванной воды). Ярко-синее. Черно-синее. » » 750 —
Темно-синее. » /> » 1000 —
Примечание. Приведенные цифры даны в пересчете на содержание NO3 в мг на 1 л среды.
Если сразу появится темно-спнее или черно-синее кольцо,
то определение при этом, первом, разведении вести нельзя, нужно
сделать второе разведение, т. е. в отдельной пробирке к 1 мл пер-
вого разведения добавить 9 мл дистиллированной воды, переме-
шать и в 1 мл разведенного раствора снова повторить определе-
ние содержания нитратов. Полученную картину сравнивают
с данными таблицы для второго разведения.
Можно по разрушении нитритов произвести качественную
реакцию на нитраты другим путем: в углубление фарфоровой
пластинки поместить кристал-
лик дифениламина, па кото-
рый затем нанести каплю кон-
центрированной серной ки-
слоты. По растворении ди-
фениламина осторожно сбоку
наносят каплю культуры
(в которой разрушены ни-
триты). При соединении ка-
пель (избегать размешивания)
появляется при наличии ни-
тратов синее пятно.
Одних химических реак-
ций недостаточно для уста
новления процесса нитрифи-
кации. Обязательны микро-
скопический просмотр куль-
тур и установление наличия
возбудителей процесса. В во-
Рис. 121. Nitrobactcr Winogradsky
Buchanan (по Заварзину, 1958).
доемах широко распростра-
ненным является Nitrobactcr Winogradsky — овальные или слегка
яйцевидные клетки 1.1x0.45 мк.
В культуре (по Заварзину, 1958) находятся одновременно
клетки разных стадий развития, что создает впечатление поли-
формизма клеток. Характерным для культуры является наличие
грушевидных клеток (рис. 121). Особенностью этих клеток яв-
ляется их плохая окрашиваемость. Поэтому для окрашивания
клеток Nitrobactcr рекомендуется применять способы, используе-
мые для окраски спор.
Количественное определение содержания нитратных микробов
может быть произведено, кроме метода титров, и подсчетом вы-
росших колоний на гелевых пластинках. Для этого готовят 2 рас-
твора:
1. Дистиллированная вода......................... 200 мл
К2НРО4..........................................0.5 г
MgSO4 • 7Н2О....................................0.3 »
NaCl............................................0.3 »
FeSOj • 7НоО...................................0.02 »
232
MnSO4 • 5H2O.................................0.02 r
Соль цинка, титана, молибдена или алюминия (одна
из них)......................................Следы
2. Дистиллированная вода........................ 200 мл
KNO2............................................ 6 г
Эти растворы стерилизуют. Отдельно от них стерилизуют хо-
рошо растертый каолин (по 0.5 г). 2 мл первого раствора, 1 мл
второго и 0.5 г каолина соединяют вместе в стерильной колбочке,
хорошо размешивают, нагревают и в горячем виде наносят на по-
верхность геля, приготовленного указанным выше способом. Ка-
олин вносят для получения ровной эмалевой поверхности, на ко-
торой лучше заметно развитие колоний нитратных бактерий.
Вращательными и колебательными движениями достигают равно-
мерного распределения внесенной смеси на поверхности геля.
Чашки Петри затем подсушивают. Посевы производят внесением
тарированной петлей определенных количеств посевного мате-
риала, располагаемого рядами. Подсчитывают мелкие сероватые,
округлые колонии (слегка зернистые), содержащие нитратные бак-
терии, гель вокруг которых дает положительную реакцию на азот-
ную кислоту.
ОПРЕДЕЛЕНИЕ ПРОЦЕССА ДЕНИТРИФИКАЦИИ
Процесс денитрификации — процесс восстановления нитра-
тов в нитриты, в аммиак и далее до молекулярного азота — вы-
зывается различными микроорганизмами, широко распространен-
ными в водоемах. Бактерии этой группы различны по своим морфо-
логическим и биохимическим признакам. При массовом развитии
денитрифицирующих бактерий в водоеме и их энергичной деятель-
ности растворенные в воде и необходимые для развития фитопланк-
тона соли могут быть полностью уничтожены — превращены в не-
доступный для подавляющего большинства водорослей молеку-
лярный азот.
При рассмотрении вопроса о развитии в водоемах денитрифи-
цирующих бактерий должны быть учтены и приняты во внимание
условия, имеющиеся в водоеме. Одно из условий, определяющих
энергичную деятельность депитрификаторов,— пониженное содер-
жание кислорода. Хотя процесс денитрификации может идти при
полном доступе воздуха и для начала его не требуется понижен-
ное содержание кислорода в воде, тем не менее при высоком содер-
жании этого газа в водной толще создаются условия, вызывающие
снижение скорости процесса денитрификации. Непременное ус-
ловие — наличие нитратов. Далее, фактором, определяющим мас-
совое развитие денитрифицирующих бактерий в водоеме, является
наличие органических веществ. Денитрифицирующие бактерии
могут использовать самые различные органические вещества, и
в том числе продукты разложения клетчатки. Однако разные виды
233
и даже штаммы одного вида обладают специфическим избиратель-
ным отношением к тем или иным органическим соединениям. Де-
нитрифицирующие бактерии при отсутствии пригодных для них
органических соединений и при наличии нитратов осуществлять
их восстановление не могут.
Наличие денитрифицирующих бактерий в водоеме может быть
определено или методом титров — посевами в жидкую элективную
среду, или методом разливок — при использовании твердой среды.
Наиболее часто используется для денитрифицирующих бак-
терий среда Гильтая.
Среда Гильтая
Готовят 2 раствора:
1. Дистиллированная вода............. 500 мл
Аспарагин.......................... 0.5 г
Глюкоза..............................10 »
KNO3................................. 2 >
2. Дистиллированная вода............. 500 мл
Лимоннокислый натрий ..............2.5 г
КН2РО4.............................2 »
MgSO4 • 7НоО.......................2 »
СаС12 • 6Н2б ......................0.2 »
FeCl2 • 4Н2О ........................Следы
Растворы сливают вместе, добавлением насыщенного раствора
двууглекислого натрия устанавливают реакцию pH 7.0. Рекомен-
дуется прибавить к среде несколько миллилитров индикатора бром-
тимолового синего, для того чтобы следить за ходом процесса
также и по изменению реакции среды (при развитии денитрифи-
цирующих бактерий pH сильно сдвигается в щелочную сторону).
Среду разливают высоким слоем в пробирки, стерилизацию про-
водят текучим паром 3 дня по 30 мин. Засеянные пробирки ставят
в термостат при 25—30° С.
Может быть использована одна из следующих сред.
Мясо-пептонный бульон с селитрой
Водопроводная вода...................... 1000 мл
Мясной экстракт.........................6 г
Пептон..................................2.5 »
KNO3....................................1 »
pH 7.6
Среда с глюкозой
Дистиллировашхая вода................ 1000 мл
KNO3................................. 1 г
К2НРО4............................... 0.5 »
СаС12 • 6Н2О......................... 0.5 »
Глюкоза..............................10 »
В качестве плотной среды может быть употреблена среда Гиль-
тая с 2% агара или нитрат-сукрозный агар.
234
Нитрат-сукрозный агар
Водопроводная вода .................. 1000 мл
NaNO3................................2 г
К2НРО4...............................1 »
MgSO4 • 7Н2О.........................0.5 »
КС1..................................0.5 »
FeSO4 • 7И2О ........................Следы
Сукроза.............................. 30 г
Агар................................. 15 »
pH 7.0
Наличие процесса денитрификации устанавливают по выделе-
нию газов, образующих на поверхности среды пену различной
высоты (рис. 122), по полному или частичному
исчезновению нитратов, появлению нитритов и
аммиака. Для проведения реакций на нитраты,
нитриты и аммиак пользуются теми же реак-
тивами, что и при процессе нитрификации. Чаш-
ки с нитрат-сукрозным агаром через неделю
инкубации могут быть обработаны одним из
реактивов на нитраты и подсчитаны колонии,
обнаружившие отсутствие или уменьшенное
содержание нитратов вокруг них. Параллель-
ные чашки могут быть обработаны реактивом
Грисса и учтены колонии с зонами, содержав-
шими нитриты.
Микроскопическое исследование осадка или
колоний с зонами на чашках показывает, ка-
кие микроорганизмы — возбудители процесса
развились в посевах. Для установления вида
денитрификаторов необходимо выделение в чи-
стую культуру. Выделение производят на агаре
Гильтая или на нитрат-сукрозном агаре, ведя
культуры в условиях затрудненного доступа
кислорода. Для этого чашки можно поместить
в анаэростат или посев залить слоем стерильного
водного агара. Колонии денитрифицирующих
бактерий могут быть отличены по выделению
ими газов и по положительной реакции с реак-
тивом Грисса кусочков агара, взятых вблизи
колоний.
В водоемах различного типа могут находить
условия для своего существования денитрифи-
Рис. 122. Образо-
вание пены газа в
культуре денитри-
фицирующих бак-
терий.
А — начало процес-
са; Б — развитие
цирующие бактерии, источником энергии для
процесса.
которых является окисление элементарной серы
или тиосульфата. Для обнаружения этих бактерий могут быть ис-
пользованы следующие среды.
235
Среда Бейеринка
Вода исследуемого водоема...... . 1000 мл
Сера (серный цвет)...................10 г
KNO3................................. 0.5 »
К2НРО4............................... 0.2 »
NaHCO3............................... 0.3 »
СаСО3................................10 »
MgCl2 • 6Н2О ........................ 0.1 »
Среда Траутвейна
Дистиллированная вода............... 1000 мл
KNO3..................................1.0 г
Na2HPO4 • 2Н2О........................0.1 »
Na2S2O3 • 5Н2О........................2.0 »
NaHCO3................................0.1 »
MgCl2 • 6Н2О..........................0.1 >
Среда Басрэда
Дистиллированная вода............... 1000 мл
NH4C1.................................0.5 г
MgCl2 • 6Н2О..........................0.5 »
КН2РО4................................2.0 »
Na2S2O3 • 5Н2О........................5.0 »
KNO3 . . .............................2.0 »
NaHCO3 ............................. 1 »
FeSO4 • 7II2О.......................10 мг
pH 7.0
Растворы солей железа, бикарбоната и фосфата стерилизуют
отдельно.
Среда Лиске
Дистиллированная вода............... 1000 мл
Na2S2O3 • 5Н2О......................5 г
KNO3................./1...............5 »
NaHCO3..............................1 »
К2НРО4..............................0.2 »
MgCl2 • 6Н2О........................0.1 »
СаС12 • 6Н2О .......................Следы
FeCl3 • 6Н2О ......................... »
Среду разливают в высокие цилиндры или колбы, наполняя на
2/3. Стерилизацию проводят текучим паром. После производства
посевов доливают запасной питательной средой, которую стери-
лизуют в отдельной посуде, и закрывают каучуковыми пробками
с отводными трубками. При наличии в водоеме возбудителя де-
нитрификации — Sulfomonas denitrificans Tjulpanova-Mosse-
vetsch — через 4—5 суток начинается выделение пузырьков азота
и его окислов. Одновременно с этим могут быть отмечены исчезно-
вение нитратов (реакция с бруцином) и появление сульфатов
(реакция с 1%-м раствором ВаС12 в подкисленной среде). В среде
236
на некотором расстоянии от поверхности появляется опалесци-
рующая зона, содержащая Sulfomonas denitrificans.
ОПРЕДЕЛЕНИЕ ПРОЦЕССОВ ФИКСАЦИИ АЗОТА
Процессы связывания свободного азота микроорганизмами
имеют огромное значение в азотном балансе водоемов. Большая
роль в пополнении соединений азота в водоемах принадлежит
азотфиксирующим бактериям.
Азотфиксация в водоемах осуществляется различными видами
бактерий, относящимися к разным семействам и родам: азотобак-
тером, аэробными палочками, спириллами, серобактериями и
анаэробными бациллами — Clostridium pasteurianum и дрожжами.
В настоящем разделе излагаются методы обнаружения и культи-
вирования первых трех из перечисленных групп и Cl. pasteuria-
num Winogradsky.
Определение содержания азотфиксирующих бактерий про-
изводится методом титров (путем посевов различных количеств
воды или грунта исследуемого водоема в жидкие среды) или путем
подсчета колоний, выращиваемых на кремневых пластинках,
пропитанных соответствующей средой.
Аэробная фиксация азота
Азотфиксирующие аэробы широко распространены в водоемах.
Все они развиваются на одних и тех же средах.
Для культивирования азотобактера предложено много сред.
Приводятся некоторые из них, наиболее оптимальные для об-
наружения и выращивания азотобактера.
Среда Федорова
Дистиллированная вода...........
Маннит .........................
К2НРО4..........................
СаНРО4..........................
MgSO4 • 7Н2О....................
K2SO4...........................
NaCl............................
FeCl3 • 6Н2О....................
СаСО3 ..........................
Смесь микроэлементов ...........
Смесь микроэлементов
1000 мл Л
20 г /
0.3 » /
0.2 »
0.3 » у
0.2 » (
0.5 » \
0.1 » \
5.0 »
1.0 мл J
Дистиллированная вода................. 1000 мл
Н3ВО3...................................5.0 г
(NH4)2MoO4..............................5.0 »
KJ .....................................0.5 »
NaBr ....................................0.5 »
ZnSO4 • 7H2O ...............................0.2 »
A12(SO4)3 • 18H2O...........................0.3 »
237
Смесь микроэлементов готовят отдельно. Концентрированный
раствор микроэлементов стерилизуют в автоклаве и используют
по мере надобности, беря асептически стерильной пипеткой необ-
ходимое количество.
Среда с иловой вытяжкой
Водопроводная вода (лучше вода исследуемого водоема) . . 900 мл
Иловая или почвенная вытяжка.......................100 »
К2НРО4............................................ 0.3 г
Маннит (или другой источник углерода)...............10 *
Мел................................................. 5 »
Прибавление к среде почвенной или иловой вытяжки обеспе-
чивает азотобактер в этой среде микроэлементами. Для приготов-
ления иловой вытяжки берут грунт водоема или почву, отвеши-
вают в большую коническую колбу 1 кг, заливают 1 л воды и ста-
вят в автоклав на 30 мин. при 115° С. Затем фильтруют жидкость
через плотный складчатый фильтр. Фильтрация идет обычно очень
медленно, и фильтрат получается прозрачным. Фильтрат разли-
вают в склянки, стерилизуют в автоклаве и используют для при-
готовления среды по мере надобности.
В указанных средах маннит может быть заменен крахмалом,
декстрином, сахарозой, мальтозой, глюкозой, кальциевыми со-
лями бензойной, уксусной или масляной кислот и некоторыми
другими источниками углерода. Преимущество маннита в средах
для азотобактера заключается в том, что маннит медленнее сбра-
живается другими бактериями, чем создаются некоторые преиму-
щества для азотобактера. Однако в водоемах широко распростра-
нены маннит-негативные расы, наличие которых может быть ус-
тановлено только на средах с иными источниками углерода. Azo-
tobacter insigne Derx не развивается на средах с маннитом, его
наличие может быть выявлено только на средах с этиловым спир-
том или кальциевыми солями органических кислот (кроме муравьи-
ной).
При варьировании источников углерода в средах обычно вы-
является и более высокое содержание клеток азотобактера и боль-
шее разнообразие его видов, чем при применении среды только
с одним маннитом. Может быть использовано введение в среду
смеси источников углерода, состоящей из маннита, глюкозы, са-
харозы, крахмала, декстрина, глицерина и этилового спирта
в суммарном количестве 1.9% и соли бензойной кислоты — 0.1 —
0.15%. Могут быть рекомендованы следующие варианты сред для
обнаружения азотобактера в водоемах при использовании в па-
раллельных посевах: 1) среда с маннитом (1%), 2) среда с ман-
нитом (0.5%) и бензойнокислым натрием (1%), 3) среда с этило-
вым спиртом (1%) и 4) среда с этиловым спиртом (1%) и бензойно-
кислым натрием (1%).
238
Среда Йенсена для Azotobacter macrocytogenes Jensen
Дистиллированная вода............. 1000 мл
Глюкоза............................10 г (или 15 г
сукрозы)
КН2РО4............................ 0.2 г
КЯНРО4............................ 0.8 »
MgSO4 • 7Н2О...................... 0.2 »
NaCl.............................. 0.2 »
СаС12 • 6Н2О ............................ 0.05 »
Fe2(SO4)3 • 9Н2О......................... 0.05 »
Na2MoO4 • 2Н2О........................... 0.05 »
Агар...................................... 20 »
pH 5.5
Среда Норриса для
Azotobacter insigne Derx
Дистиллированная вода................ 1000 мл
Этиловый спирт (96с-й).................10 г
КаНРО4................................. 1 »
MgSO4 • 7Н2О............................ 0.2 »
СаСО,.................................. 1 »
NaCl.................................. 0.2 »
FeSO4 • 7Н2О ......................... 0.1 »
Na2MoO4 • 2H2O . . . ................ 0.005 »
Arap................................... 20 »
Для других видов азотобактера этиловый спирт может быть
замсчкш другим источником углерода. Фред, Бэлдвин и Мак-Кой
рекомендуют вводить в питательную среду для азотобактера 100 мл
дрожжевого настоя (па 900 мл дистиллированной воды).
Среда Проктора и Вильсона для азотфиксирующих бактерий
родов Pseudomonas и Achromobacter
Дистиллированная вода.................. 1000 мл
Сукроза............................. 20 г
Na2HPO4............................. 12.5 »
КН2РО4.................................. 1.5 »
СаС12 • 6Н2О............................ 0.1 »
FeSO4 • 7Н2О ......................... 0.003 »
Na2MoO4 • 2Н2О...................... 0.00015 »
Жидкие среды для азотфиксирующих аэробов разливают в ко-
нические колбочки тонким слоем и стерилизуют 3 дня текучим
паром.
Азотобактер лучше развивается в жидкой среде, если в нее
помещен сложенный конусом фильтр (рис. 124).
Колбы с засеянной средой или держат в термостате при 25° С,
или оставляют при комнатной температуре. Рост азотобактера
может быть установлен наблюдениями над культурами при микро-
скопическом контроле. Начинают наблюдения с 3—4-го дня после
посевов. При наличии азотобактера на поверхности среды разви-
239
вается жирная пленочка, при развитии спирилл среда становится
сильно мутной. Характерные крупные клетки азотобактера
(рис. 123) легко могут быть распознаны под микроскопом.
Определение количественного содержания азотобактера в воде
и грунтах может быть произведено и на кремневых пластинках.
Кремневые пластинки готовят обычным способом (стр. 223), за-
тем пропитывают их концентрированной в 10 раз средой, подсуши-
вают и засевают. Посев водой производят тарированной петлей,
нанося капельки правильными рядами на поверхность кремне-
вой пластинки. Посев грунтом производят следующим образом.
В стерильный весовой стаканчик отвешивают (с соблюдением
условий стерильности) 1 г грунта, в другой стерильный ста-
канчик наливают немного стерильной воды. Стеклянной палочкой
с загнутым на одном конце крючком, смачивая этот кончик
в стерильной воде, берут комочек грунта из стаканчика и перено-
сят на поверхность кремневого студня, располагая посевной мате-
риал рядами, на некотором расстоянии один комочек от другого.
Засеянные чашки помещают во влажные камеры, которые ста-
вят в термостат при 25° С. При наличии азотобактера вокруг
комочков грунта через несколько дней появляются слизистые ко-
лонии, обычно затем буреющие (рис. 126). Микроскопический про-
смотр помогает установить колонии азотобактера, которые отме-
чают и затем сосчитывают.
Азотобактер в водной толще может быть обнаружен на пластин-
ках обрастания путем залива их сразу после выемки тонким слоем
питательного агара и проращиванием в стерильных влажных ка-
мерах.
Азотобактер может быть обнаружен на стеклах и в грунтах.
Для этого берут болтушку из навески почвы в стерильной воде и
наносят каплю взвеси на предметное стекло, туда же наносят*! —
2 капли 1%-й агаризованной среды и смешивают со средой посев-
ной материал. Колонии азотобактера на стеклах развиваются до
значительных размеров.
Получение чистой культуры азотобактера является сложной
задачей, так как используемые питательные среды недостаточно
элективны и вместе с азотобактером развиваются спутники, чаще
других олигонитрофильные микроорганизмы. Кроме того, не-
которые бактерии, используя продукты жизнедеятельности азото-
бактера, находятся в его слизистых капсулах. Иные бактерии мо-
гут просто прилипать к слизистым капсулам и быть перенесенными
в свежую питательную среду.
Одним из способов выделения является следующий. После
ряда пассажей через жидкие среды с менее полноценными источ-
никами углерода — бензойнокислым натрием или уксуснокислым
натрием (если, конечно, азотобактер растет на этих средах) высе-
вают материал на кремневый гель. С геля берут после микроскопии
материал из колонии, переносят его в пробирку со стерильной во-
240
Рис. 123. Виды азотобактера.
А — Azotobacter chroococcum Beijerinck; Б — Az. beijerinckil Lip-
man; В — Az. agile Beijerinck; Г — Az. insigne Derx; Д — Az.
vinelandii Lipman; E — Az. macrocytogenes Jensen.
Рис. 124. Колбы с жидкой средой
и фильтром для культивирова-
ния азотобактера.
А — до посева; П — рост азотобактера
на фильтре на границе среды.
А
Рис. 125. Концентрация нейтральной красной колониями Azotobac-
ter chroococcum (4) и Az. beijerinckii (Б) (no Callao et Hernan-
dez, 1961).
дой и кварцевым песком. Взвесь
помещают в вибрационный ап-
парат, где она встряхивается в
течение 10—15 мин. для получе-
ния отдельных клеток. Затем
делают высев на ряд чашек с
гелем или агаризованной сре-
дой Федорова. Как только по-
явятся мелкие колонии, их ми-
крос копируют, чтобы убедить-
ся, что развился азотобактер.
Берут материал из такпх коло-
ний и снова повторяют всю про-
цедуру. Так поступают до по-
лучения чистой культуры.
При наличии спутников, не
отделяемых указанным путем,
рекомендуют попытаться ис-
пользовать антибиотики. Виды
Рис. 126. Развитие азотобактера па
геле (по Виноградскому, 1952).
азотобактера значительно устойчивее к мицетину, чем многие
другие бактерии. Метод выделения азотобактера с использова-
нием антибиотиков разработан Депу (Depoux, 1953).
Среда Депу
Дистиллированная вода........................ 800 мл
Стандартный раствор Виноградского (стр. 160) . . 200 »
Пнровинограднокислый натрий...................15г (или 5 г
маннита)
Xинозол...................................... 0.15 г
Агар......................................... 20 »
В среду вводится хлорамфеникол в количестве 15 мкг/мл.
Вместо этого антибиотика могут быть введены другие в том же
количестве.
По О. И. Колешко, выделение азотобактера облегчается при
использовании твердых сред, содержащих убитую нагреванием
культуру азотобактера. Для этого предварительно выращивают
культуру азотобактера на косом агаре. Смывают стерильной водой
выросший налет и смывы подвергают нагреванию при 70—80° С
в течение 4 час. При посевах вносят в чашку 2—3 мл такого смыва.
Длительное размножение азотобактера может быть получено
в проточных культурах. И. Малек (1956) и другие исследователи
выращивали азотобактер в трехступенчатой системе сосудов
(рис. 41). Выращивание производится во всех ступенях. В верхний
сосуд поступает питательный раствор и подается очищенный
воздух.
Род Azotobacter объединяет группу свободно живущих, фик-
сирующих азот организмов. Благодаря своим морфологическим
16 А. Г. Родина
241
особенностям клетки азотобактера легко определяются до рода,
однако определение вида является обычно более сложной задачей.
Идентификация вида затрудняется тем обстоятельством, что, по-
мимо четко выраженных видов, в природе существует и выделяется
большое количество вариететов.
Для облегчения идентификации видов азотобактера, кроме
морфологических и культуральных признаков, могут быть допол-
нительно использованы особенности разных видов, как например
различие в свечении культур в ультрафиолетовых лучах, неоди-
наковая чувствительность разных видов к краскам, различия
в использовании источников углерода, различная устойчивость
к некоторым химическим соединениям. Эти сведения, содержа-
щиеся в литературных источниках последнего времени, здесь объ-
единены, и даны краткие описания видов.
Azotobacter chroococcum Beijerinck имеет подвижные клетки
2.3—5.0 X 1.5—2.4 мк, в молодых культурах палочковидные,
в старых кокковидные, соединенные в пары и реже в более круп-
ные группы. Клетки содержат большое количество зерен запасного
питательного вещества; образуют капсулы; выделяют много слизи
(рис. 123, А). Они образуют темно-коричневый пигмент, нераство-
римый в воде, не проникающий в субстрат (встречаются и бесцвет-
ные штаммы). Характерной особенностью вида является способ-
ность использовать крахмал в качестве единственного источника
углерода. Простые углеводы, спирты и жирные кислоты — нап-
лучшие источники углерода для этого вида, но используются им
также и соли бензойной кислоты и сложные углеродсодержащие
соединения. Использует маннит, глюкозу, фруктозу, сахарозу,
мальтозу, галактозу, раффинозу, этиловый спирт, не использует
глицерин, арабинозу, лактозу, лимоннокислый натрий, маннозу,
дульцит, ксилозу (Jensen a. Petersen, 1955). Однако в водоемах
встречаются и маннит-негативные расы Az. chroococcum. Кон-
центрирует в своих колониях краски: нейтральную красную,
метиленовую синюю и метиленовую зеленую (Callao et Hernan-
dez, 1961) при концентрации их в среде 1 : 50000 [вес (в г) к объ-
ему (в мл)] (рис. 125, Л). Растет на твердой питательной среде,
содержащей пиропин в концентрации 1 : 25000, и не растет на
среде с диамандфуксином в концентрации 1 : 50000 (Callao et
Montoya, 1960а). Растет на среде с теллуритом калия при мак-
симальном содержании последнего 1 : 5000—1 : 7000 [вес (в г)
к объему (в мл)] (Callao et Montoya, 1960b). В молодых колониях
наблюдается радиально-концентрическое расположение клеток
(рис. 127, Л) (Колешко, 1960).
Azotobacter beijerinckii Lipman имеет слегка овальные, с за-
кругленными концами клетки более крупных, чем у Az. chro-
ococcum размеров: 3.3—6.6x2—2.8 мк, чаще в парах. В старых
культурах наблюдаются тетрады и короткие цепочки (рис. 123, Б).
Клетки неподвижны, окружены капсулами (Jensen, 1955).
242
Az. beijerinckii растет при более низких, чем Az. chroococcum, зна-
чениях pH (5.1 и даже 4.75). Образует желтоватые до слабо ко-
ричневого пигменты, нерастворимые в воде и не проникающие
в субстрат, или не образует пигмента. Не использует крахмал
в качестве единственного источника углерода. Использует ман-
нит, этиловый спирт, глюкозу, фруктозу, сахарозу и мальтозу.
Не использует маннозу, лактозу, ксилозу, дульцит, лимоннокис-
лый натрий. Концентрирует в колониях при росте на твердых пи-
тательных средах нейтральную красную, метиленовую синюю и
метиленовую зеленую в концентрации их 1 : 50000 [вес (в г)
к объему (в мл)] (рис. 125, Б). Не растет на твердой среде с диа-
мандфукспном в концентрации 1 : 50000 и на среде с пиронином
Рис. 127. Различное расположение клеток в моло-
дых колониях азотобактера (по Колешко. 1960).
А - радиально-концентрическое у Azotobactcr chroococcum;
/; звездчато рассеянное у Az. agile; В — радиальное у
Az. vinelandii.
н концентрации 1 : 25000. Наивысшая концентрация теллурита
калия, при которой возможен рост этого вида, — 1 : 15000—
1 : 25000.
Azotobactcr agile Beijerinck — типично водный вид (рис. 123, В).
Крупные шаровидные или слегка овальные клетки 2.3X3.3 мк,
одиночные или в парах, весьма подвижные (перитрих). Движение
у клеток этого вида устойчивое, ровное, по прямой линии. Клетки
имеют гомогенную протоплазму с крупными зернышками запас-
ного питательного вещества. Окружены очень тонкой капсулой.
Дает обильный рост на питательных средах. Пигментообразование
наблюдается не всегда, пигмент розоватый, желтоватый или зе-
леный. Хорошо растет на средах с этиловым спиртом. Культуры
обладают голубовато-белой флуоресценцией в ультрафиолетовых
лучах. Концентрирует в колониях из среды только нейтральную
красную (при содержании ее 1 : 50000 [вес (в г) к объему
(в мл) ]). Не растет на твердой среде с пиронином (1 : 25000), растет
на среде с диамандфуксином (1 : 50000). Наивысшая концентра-
ция теллурита калия в среде, при которой возможен рост этого
вида, — 1 : 10000—1 : 11000. Не растет на средах с бензойно-
кислым натрием. Молодые колонии характеризуются звездчато
рассеянным расположением клеток (рис. 127, Б).
16*
243
Azotobacter insigne Derx — типично водный вид, аэроб или
микроаэрофил (Derx, 1951). Клетки палочковидные и овальные,
2.5—3.8x1.6—2 мк, часто содержат преломляющие свет зер-
нышки (рис. 123, Г). Клетки весьма подвижны, имеют один или
несколько полярных жгутиков. Большинство штаммов неспособно
использовать как источник углерода ни маннит, ни глюкозу, од-
нако встречаются штаммы, растущие па глюкозе (Jensen, 1955).
Растет хорошо на средах с этиловым спиртом и кальциевыми со-
лями органических кислот (за исключением муравьиной). Не ис-
пользует бензойнокислый натрий. На средах с этиловым спиртом
образует голубовато-серые и лиловатые воднорастворимые пиг-
менты, окрашивающие среду. На твердых средах растет слабо,
его колонии редко достигают 1 мм в диаметре.
Azotobacter vinelandii Lipman имеет в молодых культурах па-
лочковидные клетки 2—3x0.8—1.0 мк, подвижные, с перитри-
хиальными жгутиками. С возрастом клетки укорачиваются
(рис. 123, Д). Образует растворимые в воде пигменты, зеленовато-
коричневые и до темно-красных, обнаруживает зеленую флуорес-
ценцию в ультрафиолетовых лучах. По Йенсену (Jensen, 1961),
этот вид может быть легко отличим от других видов по быстрому
росту (в течение 3—5 суток) в жидкой среде с рамнозой как един-
ственным источником углерода. Az. vinelandii концентрирует
в колониях краски: нейтральную красную, метиленовую синюю
и метиленовую зеленую. Растет на твердой среде с пиронином
(1 : 25000) и дпамандфуксином (1 : 50000). Очень чувствителен
к теллуриту натрия: наивысшая концентрация его, при которой
возможен рост, — 1 : 175000—1 : 200000. В молодых колониях
клетки располагаются радиально (рис. 127, В).
Azotobacter indicum Starkey et De имеет мелкие клетки
1.7—2.7х0.5—1.2 мк, с крупными зернышками жира и большими
слизистыми капсулами. Образует кислоту на глюкознойбезазотистой
среде. Использует маннит, глюкозу, маннозу, фруктозу, галактозу,
сахарозу, соли молочной кислоты, не использует лактозу, маль-
тозу, бензойнокислый натрий, декстрин. Не образует пленок в жид-
ких средах, не растет на белковых средах. По Суто, добавление
к питательной среде небольших количеств азотсодержащих ве-
ществ (солей аммония, пептона, гидролизата казеина) стимули-
рует рост этого микроорганизма. Образует ржаво-красные и ко-
ричнево-красные пигменты.
Azotobacter macrocytogenes Jensen легко отличим от других
видов. Кислотоустойчив, развивается при pH 4.5—5.5. Растет на
глюкозной безазотистой среде в форме сферических клеток 2—
2.5 мк диаметром с гомогенной протоплазмой, соединенных в груп-
пы, окруженные капсулой (рис. 123, Е). В этой стадии роста клетки
неподвижны. Через 3—6 суток капсулы растворяются и бескап-
сульные клетки обнаруживают слабое, медленное движение;
в клетках появляются сильно преломляющие свет включения (зер-
244
нышки запасного питательного материала). Использует в качестве
источника углерода глюкозу, мальтозу, фруктозу, галактозу,
сукрозу, этиловый спирт, маннит, сорбит, соли уксусной, молочной,
масляной и янтарной кислот, не использует ксилозу, арабинозу,
рамнозу, маннозу, лактозу, декстрин, крахмал, инулин, глицерин,
амиловый спирт, дульцит, соли щавелевой, пропионовой, вин-
ной, лимонной и бензойной кислот (последние в концентрации от
0.2 до 0.5%). На агаре с этиловым спиртом образует очень крупные
клетки (до 8 мк в диаметре). Штрих на глюкозной твердой среде
бесцветный или слабо желтого цвета. На жидкой глюкозной среде
Рис. 128. Azotomonas
fhiorcscens Krassilnikov
(по Красильникову,
1949).
Рис. 129. Spirillum
azotocolligens
Rodina.
образует розовый воднорастворимый пигмент. Образует кислоту
на средах с глюкозой и сукрозой.
Последние два вида — Azotobacter insigne и Az. macrocyto-
gonoa — некоторыми авторами объединяются в род Beijerinckia
1)огх, характерными признаками которого считают: большую
кислотоустойчивое», образование кислоты на средах с глюкозой,
отсутствие цист.
Помимо азотобактера, на питательных средах, в которые про-
изведены посевы материалом из водоемов, могут развиваться и дру-
гие азотфиксаторы: разнообразные палочковидные микроорга-
низмы — представители рода Azotomonas Stapp (рис. 128), мел-
кие подвижные палочковидные грамотрицательные клетки, виды
рода Pseudomonas и спириллы — Spirillum azotocolligens Ro-
dina (рис. 129).
Механизм и скорость фиксации азота азотобактером могут
быть определены помещением культур в атмосферу, содержащую
16N (35%), и последующим определением количества фиксиро-
ванного азота в масс-спектрометре. Показано, что в биоло-
гической фиксации азота нет никакого изотопного эффекта; это
25.')
делает метод особенно ценным. Этим методом были установлены
размеры азотфиксации в водной толще самих водоемов (Dug-
dale a. oth., 1959). Описание метода дано Риттенбергом с со-
трудниками (Rittenberg a. oth., 1939), Ниссом, Дагдейлом и др.
(Neess a. oth., 1962).
Определение количества фиксированного бактериями азота
может быть произведено химическим путем одной из модификаций
микрометода Кьельдаля. Для определения фиксированного азота
могут быть использованы как жидкие культуры, так и культуры
на кремневом геле. Жидкие культуры позволяют более точно вы-
разить результаты на 1 г использованного сахара. Культуры ведут
на средах с глюкозой, ввиду того что количественные определения
содержания маннита в среде сложны.
Для определения общего азота в жидких культурах берут точно
отмеренный объем содержимого колб. При определении количе-
ства фиксированного бактериями азота на кремнекислом геле за-
сеянные с выросшими колониями и контрольные пластинки
подкисляют слабой серной кислотой и осторожно высушивают при
60°С. Полученную массу в каждой чашке превращают в порошок,
отвешивают на аналитических весах навеску в длинной пробирке,
из которой материал затем вводится в круглодонную колбу
с длинным горлышком, используемую для сжигания. При пере-
воде сухого материала из пробирки в колбу следят за тем, чтобы
не загрязнять горлышка колбы. После высыпания материала
пробирку снова взвешивают и устанавливают величину на-
вески.
Материал из жидких культур вводят в колбу для сжигания
градуированной пипеткой. При наличии пленкп культура из
колбы переливается в фарфоровую ступку соответствующего раз-
мера и пленка растирается с жидкостью до равномерного ее распре-
деления в среде. Пипетку предварительно промывают анализи-
руемой жидкостью, затем засасывают в нее жидкость. Отмерен-
ную часть жидкости переводят в колбу для сжигания. Для этого
пипетку опускают по возможности глубже внутрь колбы, не ка-
саясь боков стенок, и выдувают из пипетки содержимое. Перед
тем как вынуть пипетку из колбы, кончик ее промывают не-
сколькими каплями воды из промывалки. Чтобы полностью
удалить раствор из пипетки, ее дважды промывают дистил-
лированной водой и также переводят промывные воды в колбу
для сжигания.
Определение общего азота производят сжиганием органиче-
ских веществ крепкой серной кислотой при нагревании. При этом
происходит окисление органических веществ до углекислоты и
воды, а азот освобождается в форме аммиака, который связывается
серной кислотой с образованием аммиачной соли. Полученный при
сжигании аммиак освобождается щелочью и отгоняется в точно от-
меренное количество 0.01 и. раствора серной кислоты.
246
В целях ускорения процесса при сжигании прибавляют ката-
лизатор (соли меди или ртути) и сернокислый калий.
Существует много модификаций микрометода Кьельдаля.
Здесь излагается наиболее широко принятая (Нидерль Д. и
В. Нидерль, 1949; Белозерский и Проскуряков, 1951, и др.).
Необходимые реактивы:
1. Концентрированная серная кислота (уд. вес 1.84).
2. Катализаторы: порошкообразная, не содержащая азота смесь 1 части
сульфата калия и 3 частей сульфата меди, порошкообразный селен, аце-
тат или сульфит ртути.
3. Пергидроль (не содержащая азота перекись водорода, 30%-й раствор).
4. 30%-й раствор едкого натра; этот раствор приготовляют из 240 г хими-
чески чистого едкого натра и 560 мл дистиллированной воды.
5. 0.01 н. раствор едкого натра.
6. 0.01 н. раствор серной кислоты.
7. 0.3%-й раствор индикатора (метилового красного).
8. Смесь 0.1%-х спиртовых растворов метилового красного и метилового
синего (4: 1), разведенная дистиллированной водой (1 : 2).
Раствор индикатора приготовляют, обрабатывая 0.15 г метило-
вого красного 40 мл 0.01 н. раствора едкого натра. Смесь фильтруют
Рис. 130. Прибор для определения общего
азота микрометодом Кьельдаля.
Объяснение в тексте.
и хранят фильтрат в капельнице со стеклянной пробкой. Капилляр
стеклянной пробки должен быть вытянут в виде стеклянной па-
лочки толщиной около 1 мм. Так как применяют только следы ин-
дикатора, то стеклянную палочку просто погружают в раствор
индикатора, а затем прикосновением палочки к внутренней стенке
сосуда переносят в сосуд для титрования. Вращая колбу, сме-
шивают индикатор с титруемым раствором.
247
Для производства анализов наиболее удобной является спе-
циальная аппаратура, показанная на рис. 130, состоящая из паро-
образователя (7), конденсатора для стока отработанной пробы (5),
перегонной колбы (4) и холодильника (5). *
Парообразователем служит литровая круглодонная колба из
стекла пирекс, заполненная на две трети дистиллированной водой.
Для равномерного кипения в воду помещают кусочки карбида
кремния, пористые черепки или следы цинковой пыли. Паро-
образователь соединен с боковой трубкой цилиндрического кон-
денсатора, снабженного у дна спускной трубкой. В верхней части
конденсатора находится стеклянная трубка, согнутая под прямым
углом и соединенная в стык с впаянной вводной трубкой перегон-
ной колбы.
Эта трубка доходит до дна колбы и имеет в верхней части бо-
ковой отвод, к которому при помощи короткой резиновой трубки
с зажимом присоединена небольшая воронка (6) емкостью около
10 мл. Воронка служит для введения в колбу анализируемого ма-
териала. Вся перегонная колба имеет длину 300—350 мм и состоит
из собственно перегонной, или реакционной, части, переходящей
вверху в 2 шарообразных пеноуловителя, и третьего такого же ша-
ра, снабженного согнутой отводной трубкой и припаянного ко вто-
рому. Нижняя часть перегонной колбы окружена стеклянной муф-
той, из которой удален воздух, благодаря чему пет необходимости
нагревать эту часть прибора. Перегонную колбу закрепляют в на-
клонном положении так, чтобы копец вводной трубки был направ-
лен вертикально. Для уменьшения опасности загрязнения дистил-
лята при соприкосновении с резиной отводную трубку верхнего
шара присоединяют в стык к короткому вертикальному колену
трубки холодильника (серебряной, или из кварца, или из особо
тугоплавкого стекла). Для получения возможно более плотного
соединения стеклянной трубки с серебряной (кварцевой) необ-
ходимо, чтобы их внешние диаметры были одинаковы.
Сжигание материала производится следующим образом. Точно
взвешенная навеска исследуемого вещества или точно отмеренное
количество жидкости помещают в большую пробирку или 50-мил-
лилитровую колбу Кьельдаля из тугоплавкого стекла, прибавляют
туда 1 мл концентрированной серной кислоты, около 0.3—0.5 г
смеси из серпокислой меди и сернокислого калия в отношении 1 : 3
и начинают нагревать сначала на слабом огне, потом энергично
до тех пор, пока жидкость не станет совершенно прозрачной и не
приобретет соломенно-желтую или светло-зеленую окраску. Про-
должительность кипячения зависит от характера анализируемого
вещества и обычно может быть ограничена 15—20 мин. Если же
после этого разложение еще не закончится, к разлагаемому веще-
ству прибавляют 2—3 капли пергидроля и продолжают нагревать
еще 5—10 мин. Если вещество разлагается с большим трудом, по-
следнюю операцию можно повторить.
248
Прибор перед отгонкой обычно пропаривается 15—20 мин.,
должна быть пропарена также коническая колба, служащая
приемником.
Жидкость после сожжения сливают с осторожностью через во-
ронку (рис. 130, 6) в перегонную колбу (рис. 130, 4). Ополаски-
вают воронку несколько раз небольшими порциями дистиллирован-
ной воды. В приемник из бюретки точно отмеривают около 3—7 мл
0.01 н. раствора серной кислоты, к которому прибавляют каплю
индикатора (метилового красного). Содержание азота в веществах
различно, поэтому количество кислоты может оказаться недоста-
точным или же избыток кислоты слишком большим, на что укажет
уже первая перегонка. Тогда для следующей перегонки берут
соответственно больше или меньше кислоты, так как во всех слу-
чаях избыток ее должен составлять не менее 1 — 2 мл. Затем
разбавляют охлажденное в колбе для разложения вещество 2 мл
дистиллированной воды и вновь охлаждают под краном. Подни-
мают колбу до тех пор, пока конец холодильника не погрузится
достаточно глубоко в жидкость.
Пипеткой через воронку вводят в перегонную колбу 3—7 мл
30%-го раствора едкого натра. Этого количества достаточно,
чтобы создать нужную щелочность.
Прежде чем начать перегонку, закрывают зажимы у воронки и
конденсатора и усиливают подачу пара через конденсатор в пере-
гонную колбу. Для отгонки аммиака пропускают через сосуд
(рис. 130, 3) пар, поступающий из парообразователя, в котором
вода предварительно доведена до кипения. Подщелоченная жид-
кость быстро нагревается и приходит в состояние кипения.
Продолжительность перегонки равна 5—10 мин., считая
с того момента, когда конденсат достигнет отвода второго шаро-
образного пеноуловителя, находящегося на перегонной колбе.
Поело этого опускают коническую колбу до такого уровня, чтобы
конец трубки холодильника был на 10 мм выше жидкости, и про-
должают перегонку еще 1 мин. Затем опускают коническую колбу
и ополаскивают над колбой кончик трубки холодильника несколь-
KVMH каплями дистиллированной воды. Если розовая окраска
жидкости в конической колбе становится слишком бледной, сле-
дует добавить еще каплю индикатора (метилового красного). Жид-
кость в конической колбе оттитровывают из микробюретки ще-
лочью той же крепости, что и взятая кислота, в присутствии како-
го-либо индикатора до конечной точки. Конечной точкой считают
появление канареечно-желтого окрашивания.
Если же раствор стал во время перегонки желтым, что указы-
вает на переход реакции среды из кислой в щелочную, анализ сле-
дует считать неудавшимся, так как в этом случае отсутствует до-
статочное количество 0.01 н. раствора кислоты, необходимое для
количественного поглощения перегоняемого аммиака. По оконча-
нии перегонки остаток из перегонной колбы автоматически пере-
249
ходит в конденсатор, где после удаления горелки из-под парообра-
зователя, образуется достаточное разрежение. Дальнейшая очистка
перегонной колбы не нужна, и аппарат можно считать гото-
вым для следующего определения. Остаток из конденсатора
сливают, открывая снизу зажим.
Микроопределения должны сопровождаться контрольным сжи-
ганием с последующей отгонкой аммиака для проверки реактивов
на чистоту и установления необходимой поправки.
При одинаковой нормальности титрованных растворов вы-
числение азота производят путем вычитания из числа милли-
литров щелочи, идущих на титрование взятой кислоты, того ко-
личества щелочи, которое потребовалось для окончательного от-
титровывания. Удобным индикатором является смесь раствора
метилового красного и метилового синего.
Расчет: 4 мл 0.1 н. серной кислоты соответствует
1.4 мг азота.
Пример. Было взято 7 мл 0.1 н. серной кислоты, что соответствует 7 мл
0.1 и. едкого натра. После перегонки па титрование пошло 2 мл 0.1 н. NaOH,
следовательно, 7 — 2=5 мл серной кислоты было нейтрализовано аммиаком.
Отсюда 1.4 мгХ5=7 мг N2 было в исследуемой пробе.
Далее следует пересчитать, на какое количество потребленной
бактериями глюкозы было фиксировано полученное количество
азота. Для этого до анализа на азот должны быть проведены ана-
лизы па содержание глюкозы в стерильном растворе и в пробе.
Метод основан на способности редуцирующих сахаров, обла-
дающих свободной карбоксильной группой, восстанавливать в ще-
лочном растворе окисную медь в закисную.
Реакция протекает количественно, образовавшийся осадок за-
киси меди строго соответствует количеству сахара, находящегося
в растворе. Для определения осадок закиси меди растворяют сер-
нокислым окисным железом в присутствии серной кислоты; при
этом закись меди количественно окисляется окисным железом,
восстанавливая его в закисное, а последнее в свою очередь тоже
количественно окисляется марганцовокислым калием.
Необходимые реактивы:
1. Раствор сернокислой меди. 40 г перекристаллизованного
CuSO4-5H2O растворяют в 1 л дистиллированной воды; если раствор полу-
чился мутным, его фильтруют через бумажный фильтр.
2. Раствор сернокислого железа (окисного). 50 г Fe2(SO4)3 растворяют
в дистиллированной воде, затем приливают 200 г (108 мл) концентрированной
серпой кислоты (уд. вес 1.84) и осторожно смешивают. Доводят объем до
1 л дистиллированной водой. Окисление должно быть проведено тщательно.
Чтобы раствор не обладал восстанавливающими свойствами, к нему приба-
вляют по каплям перманганат до появления неисчезающего, по очень сла-
бого розового оттенка.
3. Раствор щелочи. 150 г едкого натра растворяют в 1 л дистиллирован-
ной воды и добавляют 200 г сегнетовой соли (C4H4OeKNa-4HtO).
4. Титрованный раствор марганцовокислого калия. Может быть при-
готовлен из фиксанала или же следующим образом. 5 г марганцовокислого
250
калия растворяют, доливают дистиллированной воды до 1 л, нагревают до
кипения и кипятят 30—40 мин. Сняв с огня, колбу закрывают пробкой с вста-
вленной в нее трубкой, наполненной сухой натронной известью, и дают остыть.
После этого раствор фильтруют через обычный бумажный фильтр прямо
в предназначенную для храпения раствора склянку, закрывают пробкой и
оставляют на несколько дней. Склянка должна быть из темного стекла. При
неимении таковой обычную бесцветную склянку следует обернуть черной
бумагой.
Через 4—5 дней титр устанавливается, и его определяют по щавелево-
кислому натрию или по щавелевой кислоте. Для этого отвешивают несколько
навесок от 0.20 до 0.25 г предварительно высушенного в термостате щавеле-
вокислого натрия прямо в колбы для титрования. Прибавляют в каждую 50 мл
дистиллированной воды и 2—2.5 мл концентрированной серной кислоты, на-
гревают до 70° С и горячую жидкость титруют раствором перманганата до
неисчезающего розового окрашивания.
Вычисление титра производят следующим образом. Окисление идет по
уравнению: 5Na 2С 2О 4+ 2 К М nO 4-f- 8Н 2SO 4= 1 ОСО 2+ К 2SO 4+ 2М nSO 4+
4-5Na2SO4+8H2O.
2 молекулы КМпО4 в подкисленной среде выделяют 5 атомов кислорода.
Таким образом, на окисление 5 молекул щавелевокислого натрия идет 5 ато-
мов кислорода, на одну — один атом кислорода. Отсюда 134 : 16=а : (ЬТ),
где а — навеска Na2CaO4, Ь — количество миллилитров КМпО4,
пошедшее на титрование. Титр КМпО4, выраженный в кислороде,
Т __ *6Д . 20
1 “ 134Ь
Выводят среднее из произведенных проб и берут его как титр. Расхож-
дение между титрами, полученными при титровании различных навесок,
может быть допустимо только в пятом знаке.
Полученный титр перечисляют по меди. Титр, полученный по кислороду,
необходимо выразить по меди, так как в таблицах Бертрана представлены ве-
совые значения меди и соответствующие им весовые эквиваленты сахара. Для
перевода титра исходят из того, что на 2 атома меди идет 1 атом кислорода
CU2O Р*®2(^^4)з H2SO4 = 2CuSO4 -|- 2FeSO4 -j- Н2О,
10FeS04 4- 2KMnO4 + 8II2SO4 = 5Fe2(SO4)3 + K2SO4 -f- 2MnSO4 + 8H2G,
t. e. (63.6X2) : 16 = z : T.
Если титр KMnO4 по кислороду был 0.001155, то
127.2.0.001155 ЛЛЛЛ_
х «-------pj-----=0.00918, или 9.18 мг Си.
Фильтрование жидкости с закисью меди, получающейся при
определении сахара, производят через специальный фильтр из
стеклянной ваты. Готовят его следующим образом: используют
цилиндрическую, суженную на одном конце стеклянную трубку
или стеклянную воронку (рис. 131). На дно трубки или воронки
кладут крест-накрест несколько слоев крупно нарезанной стеклян-
ной ваты, распределяя ее палочкой таким образом, чтобы она за-
крыла все дно. Затем кладут более мелко нарезанную ножницами
стеклянную вату и, наконец, верхнюю часть фильтра заполняют
стеклянной ватой, растертой в фарфоровой ступке.
Последний слой является главной частью фильтра. Его уплот-
няют многократным промыванием фильтра горячей водой. При
таком фильтре фильтрование идет легко, без применения отсасы-
251
вания или с отсасыванием слабым водоструйным насосом. Приме-
нять сильный водоструйный насос или насос Комовского нельзя во
избежание разрушения фильтра и потери части осадка.
Определения сахара ведут следующим образом. В коническую
колбу емкостью 150—200 мл переносят пипеткой 5—20 мл исследуе-
мого раствора в зависимости от ожидаемого содержания сахара. Ко-
личество сахара в пробе должно быть пе менее 10 и не более 100 мг
(предпочтительно 40—60 мг). Определение требует сохранения
определенных соотношении растворов реагирующих веществ, по-
___ этому, если предполагают боль-
Рис. 131. Трубки для отфильтровы-
вания закиси меди при определении
сахаров.
А — общий вид трубки с колбой; Б — ви-
ды трубок и распределение в них стеклин-
пой ваты: 1 — слой мелко растертой ва-
ты, 2 — слой ваты с более крупными ча-
стичками, 3 — крупно нарезанная вата,
4 — стеклянный шарик. Размеры в мм.
шее содержание сахара в иссле-
дуемой пробе, прибегают к раз-
ведению: берут 5—10 мл раство-
ра и добавляют соответственно
5—10 мл дистиллированной во-
ды. Мерным цилиндром прили-
вают в колбу по 20 мл раствора
сернокислой меди и щелочного
раствора, содержащего сегнето-
ву соль (эти реактивы прибав-
ляют в избытке и количества
их не учитывают), осторожно
смешивают, слегка вращая кол-
бу, и помещают на электро-
плитку. Смесь должна кипеть
точно 3 мин. с момента закипа-
ния, после чего дают отстояться
1—2 мин. полученному красно-
му осадку закиси меди. Если рас-
твор, в котором требуется опре-
делить содержание сахара, содержит сахара значительно больше,
чем предполагают, или, наоборот, меньше, то после трехминут-
ного кипячения может оказаться, что осадка закиси меди совсем
не образовалось (мало сахара в растворе) или вся медь восстано-
вилась в закисную и совершенно не осталось окисной формы ее
(видно по исчезновению синей окраски и по большому осадку);
в последнем случае сахара было больше, чем можно учесть в дан-
ных условиях. В обоих случаях (мало или много сахара) анализ
следует переделать, взяв другое количество исследуемого рас-
твора.
Если не образовалось осадка, когда было взято 10 мл раствора,
то надо взять 20 мл его. Воды тогда добавлять не надо, а растворы
сегнетовой соли и медного купороса брать в тех же количествах,
т. е. по 20 мл. Если израсходовала вся сернокислая медь на окис-
ление сахара (исчезла синяя окраска), то уменьшают количество
раствора, например вместо 10 мл берут 5 пли вместо 20 только 10.
Если и этого слишком много, можно взять 10 мл раствора, разба-
252
вить его в мерной колбе дистиллированной водой до 100 мл и из
этого раствора взять 10 или 20 мл.
Следующими этапами анализа являются отфильтровывание и
растворение осадка закиси меди. Жидкость фильтруют через
фильтр из стеклянной ваты, пользуясь водоструйным насосом, по
возможности не перенося осадка на фильтр. Оставшийся в колбе
осадок отмывают в колбе декантацией (не перенося на фильтр
большей части осадка) горячей дистиллированной водой, которую
сливают па фильтр.
Промывание водой проводят до исчезновения щелочной реак-
ции на лакмус, причем тщательно промывают струей воды стенки
колбы и фильтра. Затем воронку с фильтром переносят в другую
колбу Бунзена. Промытый осадок закиси меди растворяют в той же
конической колбе 10—15 мл раствора окисного сернокислого же-
леза и переливают на фильтр. Сразу не отсасывают, чтобы дать пол-
ностью раствориться осадку, находящемуся на фильтре, обычно он
при этом и отфильтровывается без применения отсасывания. Затем
промывают колбу теплой дистиллированной водой 2 раза и сли-
вают все через фильтр.
Когда вся растворенная закись меди будет собрана в отсасы-
вательной колбе, производят немедленно титрование образовав-
шейся закиси железа раствором перманганата, заранее налитым
в бюретку. Титрование ведут до появления розовой окраски. Пе-
реход окраски жидкости из зеленого цвета в розовый очень отчет-
лив. Проводят титрование двух параллельных проб.
Таблица 12
Миллиграммы глюкозы, соответствующие^миллиграммам меди
(по Бертрану)1 >
Глюкоза Медь Глюкоза Медь Глюкоза Медь Глюкоза Медь Глюкоза Медь Глюкоза Медь
10 20.4 26 51.5 41 79.3 57 107.6 71 131.4 87 157.2
11 22.4 27 53.4 42 81.1 58 109.3 72 133.1 88 158.8
12 24.3 28 55.3 43 82.9 59 1Н.1 73 134.7 89 160.4
13 26.3 29 57.2 44 84.7 60 112.8 74 136.3 90 162.0
14 28.3 30 59.1 45 86.4 61 114.5 75 137.9 91 163.6
15 30.2 31 60.9 46 88.2 62 116.2 76 139.6 92 165.2
16 32.2 32 62.8 47 90.0 63 117.9 77 141.2 93 166.7
17 34.2 33 64.6 48 91.8 64 119.6 78 142.8 94 168.3
18 36.2 34 66.5 49 93.6 65 121.3 79 144.5 95 169.9
19 38.1 35 68.3 50 95.4 66 123.0 80 146.1 96 171.5
20 40.1 36 70.1 51 97.1 67 124.7 81 147.7 97 173.1
21 42.0 37 72.0 52 98.9 68 126.4 82 149.3 98 174.6
22 43.9 38 73.8 53 100.6 69 128.1 83 150.9 99 176.2
23 45.8 39 75.7 54 102.3 70 129.8 84 152.5 100 177.8
24 47.7 40 77.5 55 104.1 85 154.0
25 49.6 56 105.8 86 155.6
253
На основании количества пошедшего на титрование перманга-
ната в миллилитрах вычисляют отвечающее ему количество меди
в миллиграммах и по табл. 12 отыскивают соответствующе© со-
держание сахара в миллиграммах во взятой пробе.
Анаэробная фиксация азота
Для обнаружения и установления титра анаэробного фиксатора
азота Clostridium pasteurianum Winogradsky производят посевы
методом титров в жидкую питательную среду. Классической сре-
дой для Cl. pasteurianum является среда Виноградского.
Среда Виноградского
Дистиллированная вода............... 1000 мл
Глюкоза................................20 г
КаНРО4................................. 1 >
MgSO4 • 7НаО......................... 0.5 »
NaCl.................................Следы
MnSO4 • 5Н2О.......................... »
FeSO4 • 7НаО ......................... »
СаСО3................................. 40 г
Для водных форм Cl. pasteurianum эта среда более оптимальна
при добавлении в нее: смеси микроэлементов в количестве 1 мл,
аскорбиновой кислоты — 1 г и дрожжевого автолизата — 1 мл.
Эти ингредиенты могут быть прибавлены асептически в готовую
среду.
Среда Виноградского для получения развития Cl. pasteuria-
num может быть использована в следующем составе:
Основная среда Виноградского....................... 1000 мл
Раствор микроэлементов ............................1 »
Дрожжевой автолизат................................1 »
Трилон Б (этилендиаминтетраацетат натрия)..........0.1 г
В этом составе в среде создаются условия, благоприятствую-
щие развитию Cl. pasteurianum и неблагоприятствующие сопут-
ствующей микрофлоре.
Для обнаружения и выращивания Cl. pasteurianum может
быть использована среда Огье.
Среда Огье
1%-й раствор КНаРО4..................................75 мл
NaHCO3 (0.1 н. раствор)..............................33 »
Почвенный экстракт...................................10 »
Глюкоза..............................................10 г
Раствор микроэлементов .............................. 1 мл
Стандартный раствор Виноградского (стр. 160)........ 50 »
СаСО3..............................................0.05 г
Феносафранин (0.2%-й раствор)...................... 8 мл
Дистиллированная вода...........................До 1000 »
254
Феносафранин вводится в среду как показатель гН2. Среду
разливают в пробирки по 10 мл, стерилизуют по 20 мин. при 100° С
в течение 3 дней. Некоторые авторы рекомендуют прибавлять
к среде Виноградского картофельный сок.
Среду Виноградского разливают в пробирки высоким слоем
по 15 мл, стерилизуют в автоклаве при 100° С 20 мин. После по-
сева пробирки помещают в термостат при 25—28° С. О начало раз-
вития процесса судят по выделению пузырьков газа со дпа про-
Рис. 132. Clostridium pasteurianum Winogradsky.
Л — молодые клетки; Б — клетки со спорами; В — споры;
Г — гранулеза в молодых клетках; Д — гранулеза в зре-
лых клетках; Е — гранулеза и клетках со спорами.
бирки. Постепенно газообразование усиливается, на поверхности
среды появляется пышная пена. Тогда производят микроскопиче-
ское исследование осадка на наличие клеток Cl. pasteurianum.
Клетки этого вида имеют характерную веретенообразную форму
и содержат внутри продолговатые споры (рис. 132). Для их луч-
шего распознавания можно воспользоваться гранулезной реак-
цией с йодом. На предметное стекло наносят каплю культуры,
взятой из осадка, и закрывают покровным стеклом. Под покровное
стекло подпускают каплю раствора йода в йодистом калии и из-
лишек йода убирают кусочком фильтровальной бумаги. Прото-
плазма Cl. pasteurianum окрашивается от йода в синий цвет, споры
не окрашиваются и делаются видимыми на синем фоне.
Можно наливать в пробирки среду по 10 мл, и тогда культуры
ведут следующим образом. После засева пробирки ставят в тер-
мостат на несколько дней; после того как началось обильное выде-
ление пузырьков газа, пробирки вынимают из термостата и кладут
в косом положении на 7—9 дней. На стенках пробирок образуется
осадок из клеток Cl. pasteurianum, который и берется для мик-
роскопирования .
255
Рост анаэробного фиксатора азота может быть получен ина
твердых средах.
Для выделения Cl. pasteurianum в чистую культуру берут оса-
док из накопительной культуры, в которой уже прошло споро-
образование, переносят в пробирку с 1 мл стерильной воды и про-
гревают при 80° С 10 мин. Затем готовят разведения и делают вы-
севы на одну из нижеуказанных твердых сред.
Агар на среде Виноградского
(с микроэлементами, дрожжевым автолизатом
и аскорбиновой кислотой или трилоном Б)
Картофельно-декстрозный агар
Картофельный отвар ................. 1000 мл
Декстроза...............................20 г
К2НРО4............................. 0.2 »
MgSO4 • 7Н2О....................... 0.2 >
Аскорбиновая кислота............... 1 »
Дрожжевой автолизат................ 1 мл
Агар................................. 20 г
СаСО3.............................. 3 »
Берут 20 г очищенного и нарезанного ломтиками картофеля,
наливают 1000 мл воды и кипятят 1 час, затем фильтруют, доли-
вают водой до 1 л, вносят нарезанный агар, кипятят до его рас-
творения, в этот горячий агар вносят соли и декстрозу, дают им
раствориться, хорошо размешивают и разливают по пробиркам.
Стерилизуют при 100° С 20 мин. Паркер указывает, что прибав-
ление к воде для разведений сырого картофельного сока (0.3 мл
на 9 мл воды) приводит к сильному увеличению числа вырастаю-
щих колоний; он рекомендует прибавлять сок и к агару.
Агар на почвенном экстракте
Дистиллированная вода................ 500 мл
Водный почвенный экстракт............ 500 »
Глюкоза................................5 г
К2НРО4.................................1 »
MgS04 • 7Н2О.........................0.5 »
Биотин..............................0.001 мг
Парааминобензойная кислота..........0.1 »
СаСО3................................. 5 г
Агар................................. 20 »
Картофельно-морковный агар Емцева
Картофельный отвар.................. 500 мл
Морковный отвар..................... 500 »
Глюкоза...............................20 г
К2НРО4................................ 1 »
MgSO4 • 7Н2О........................ 0.5 »
NaCl................................Следы
256
FcSO4 • 7H2O ..........................Следы
MnSO4 • 5H2O......................... »
Пептон............................... 5 г
Дрожжевой автолизат (по Омелянскому,
стр. 53) ..................... 0.02 мл
Мел.................................. 40 г
Агар................................. 15 »
Картофельный и морковный отвары готовят следующим обра-
зом: 0.5 кг тщательно промытого корнеплода заливают двойным
количеством дистиллированной воды и кипятят 10 мин., после
чего жидкость декантируют и фильтруют. Фильтрат доводят ди-
стиллированной водой до первоначального объема.
Посевы в чашках Петри должны быть помещены в условия
анаэробиоза — в анаэростаты или эксикаторы, в которых воздух
заменен смесью азота и углекислоты. Инкубация чашек продол-
жается обычно 2—4 суток при 25° С. С успехом может быть исполь-
зован посев в капилляры. Выросшие отдельно колонии переносят
в жидкую среду, по получении развития повторяют выделение.
В. Т. Емцев рекомендует повторять выделение 3—5 раз.
Проверка чистоты выделенной культуры производится высе-
вами на МПА и МПБ (высоким и низким столбиками), на среды
для анаэробов (Вильсон-Блера, Ван-Дельдена и др.).
Содержание азотфиксирующих анаэробов может быть установ-
лено также методом подсчета выросших колоний на кремневых
пластинках. Для этого готовят ранее указанным способом кремне-
вые пластинки, пропитывают их концентрированной в 10 раз сре-
дой Виноградского и после засева определенного количества по-
мещают в эксикаторы, из которых выкачивают воздух и заменяют
его инертным газом с примесью СО2. Через несколько дней начи-
нается брожение, мел вокруг выросших колоний растворяется
(вследствие образования кислот) и получается прозрачный ореол.
Кроме того, на кремневых пластинках около колоний Clostri-
dium pasteurianum появляются маленькие трещинки от образую-
щихся газов. Мазки из этих колоний обнаруживают характерные
клетки.
Количество фиксированного азота определяют на жидкой среде
по микрометоду Кьельдаля.
ГЛАВА 8
МЕТОДЫ ИЗУЧЕНИЯ ПРОЦЕССОВ
КРУГОВОРОТА СЕРЫ
ОБРАЗОВАНИЕ СЕРОВОДОРОДА ИЗ БЕЛКОВЫХ ВЕЩЕСТВ
Бактерии, разлагающие белковые вещества с выделением се-
роводорода, широко распространены в водоемах. Они могут быть
обнаружены и количественно учтены или методом разливок, или
методом титров. В первом случае пользуются мясо-пептонным ага-
ром с добавлением углекислого свинца (стр. 119). При посевах в го-
товый стерильный расплавленный агар прибавляют углекислый
свинец, хорошо размешивая его, чтобы получилась равномерно
мутная среда. Этим агаром заливают посевной материал в чашках
Петри. Засеянные чашки выдерживают при температуре 22—23° С.
При развитии колоний бактерий, выделяющих сероводород, во-
круг них образуются бурые, почти черные зоны вследствие обра-
зования PbS. Эти колонии просчитывают обычно на 6-й день.
Чтобы предотвратить улетучивание сероводорода, можно, после
того как колонии выросли, залить чашки тонким слоем водного
агара.
При методе титров посевы производят из ряда разведении в про-
бирки, содержащие по 10 мл мясо-пептонного бульона, или подве-
шивая индикаторные бумажки, или смачивая пробки в растворе
уксуснокислого свинца (стр. 119).
ОПРЕДЕЛЕНИЕ ПРОЦЕССА ДЕСУЛЬФАТИЗАЦИП
Десульфатизация — восстановление солей серной, сернистой
и серноватистой кислот до сероводорода — биогенный процесс,
в итоге которого в водоемах накапливаются значительные, а иногда
и огромные количества этого газа. Особенно большие количества
сероводорода за счет деятельности десульфурирующих бактерий
скапливаются в водоемах с высоким содержанием сульфатов в воде
и с высокой продукцией органического вещества, так как для
развития десульфурирующих бактерий обязательно наличие суль-
фатов и органического вещества. Значительные количества серо-
водорода в итоге развития десульфурирующих бактерий могут
быть в водохранилищах в первые годы их образования за счет раз-
ложения сульфатов почв, богатых органическим веществом, и
258
в прудах, вода которых богата сульфатами, при применении расти-
тельного удобрения. Но и в водоемах, имеющих небольшую про-
дукцию органического вещества, с водой, богатой сульфатами,
процесс десульфатизации может идти энергично в иловых отло-
жениях за счет использования органических веществ этих отло-
жений и приводить к накоплению больших количеств сероводорода
в придонных слоях воды.
Возбудители процесса десульфатизации — подвижные ви-
брионы 2—4x0.7—0.94 мк — Vibrio desulfuricans (Beijerinck)
Baars (рис. 133).
Все разновидности этого вида восстанавливают сульфаты
в анаэробных условиях с образованием черного осадка сернистого
Рис. 133. Vibrio desul-
furicans (Beijerinck)
Baars.
Рис. 134. Колония десульфурирующих
бактерий на агаре.
железа, от чего субстрат приобретает черный цвет. Развитие де-
сульфурирующих бактерий в культурах может быть легко распо-
знано благодаря образованию черного осадка вокруг колоний
(рис. 134), почернению среды и осаждению гидрата сернистого
железа на дне и стенках в жидких культурах.
Для обнаружения десульфурирующих бактерий пользуются
различными средами.
Среда Таусона в видоизменении Штурм
Вода исследуемого водоема..........
Молочнокислый кальций..............
(NH4)aSO4..........................
КаНРО4.............................
MgSO4 • 7НаО.......................
CaSCL • 2Н2О ......................
Соль Мора — (NH4)2Fe(SO4)2 • 6Н2О . .
1000 мл
3.5 г
4.0 »
0.5 »
1.0 »
0.5 »
0.5 »
Усреднение раствором едкого калия до pH 7.0.
17*
259
Соль Мора стерилизуется отдельно и вводится в среду перед
производством посева.
А. А. Имшенецкий (1949) указывает, что эта среда является
оптимальной для развития десульфурирующих бактерий при
добавлении к ней 5%-й дрожжевой воды в количестве 1°6.
Среда Ван-Дельдена
Вода исследуемого водоема..............1000 мл
Молочнокислый натрий....................5.0 г
Аспарагин...............................1.0 »
MgSO4 • 7Н2О............................1.0 »
КаНРО4.................................0.5 »
FeSO4 • 7Н2О..........................Следы
Среда подщелачивается КОН до pH 7.0.
Среду готовят без железного купороса, его прибавляют во
время посевов, внося в каждую склянку маленький кристаллик,
предварительно обожженный на пламени спиртовки.
Видоизмененная среда Старкея
Вода исследуемого водоема
или водопроводная вода..................1000 мл
Пептон...................................5.0 г
Мясной экстракт..........................3.0 »
Дрожжевой экстракт.......................0.2 »
MgSO4 • 7Н2О.............................1.5 »
Na2SO4...................................1.5 »
Fe(NH4)3(SO4)3 ..........................0.1 »
Глюкоза..................................5.0 »
pH 7.4
Среда с лактатом кальция
Йистиллированная вода.................. 650 мл
ясная вода............................ 350 »
Пептон..................................2.0 г
Экстракт дрожжей........................2.0 »
КаНРО4..................................0.3 »
MgSO4 • 7НаО............................0.3 »
(NH4)aSO4...............................1.0 »
Fe(NH4)s(SO4)3.........................0.15 »
NaaSOs..................................0.6 »
Лактат кальция..........................3.0 »
Аскорбиновая кислота......................0.15»
pH 7.6
Культуры десульфурирующих бактерий можно вести в склян-
ках с притертыми пробками емкостью 100 мл. Склянки наполняют
на 2/3 питательной средой, закрывают ватными пробками и
к горлышку каждой склянки привешивают тщательно заверну-
тую в бумагу стеклянную пробку от нее. Склянки стерилизуют
в автоклаве при 112° С. После посевов склянки доливают до са-
мой пробки запасной стерильной средой того же состава, закры-
260
вают притертыми пробками, сверху заливают или парафином, или
замазкой Менделеева. Надо следить, чтобы в посевах пе осталось
пузырьков воздуха. При неимении склянок с притертыми проб-
ками посевы можно производить в склянки или пробирки, закры-
вая их плотно подогнанными каучуковыми пробками, доливая
таким образом, чтобы под каучуковой пробкой не было пузырьков
воздуха. По Старкею, используются длинные (150 мм) пробирки.
Перед посевами пробирки со средой прогревают при 100° С
10 мин., охлаждают быстро и засевают. Пробирки можно не доли-
вать, а вталкивать ватную пробку возможно ближе к жидкости
(на 1 см от нее), внося затем на пробку 2 кусочка (0.5 мм) пирогал-
ловой кислоты и 8—10 капель крепкого раствора NaOH. Про-
бирки закрывают сверху резиновыми пробками и инкубируют.
_ -'-Ж - ~
Рис. 135. Колонии десульфурирующих бактерий в трубке.
При микроскопировании осадка из таких культур наблюдаются
в большом числе типичные вибрионы (рис. 133).
Количество десульфурирующих бактерий может быть учтено
и другим способом — методом разливок. Вместо жидких сред го-
товят агар соответствующего состава, например на среде Таусона
или Старкея.
Посевы в чашки производят или обычным путем и помещают
их в условия анаэробиоза (в вакуум-эксикаторы или в аппараты
Лристовского), или в чашки, сложенные по методу Штурм
(стр. 71, рис. 50). Развивающиеся черные колонии хорошо видны
(рис. 134).
Определением титра или подсчетом количества десульфури-
рующих бактерий исследование процесса десульфатизации в во-
доемах может быть закончено, однако в случае интенсивно иду-
щего процесса следует определить и энергию его — количество
образуемого бактериями сероводорода. Определение это лучше
проводить, получив чистые или хотя бы хорошо очищенные куль-
туры десульфурирующих бактерий. Для выделения этих микро-
бов может быть использован метод разливок в чашки Петри (при
условии помещения их в атмосферу водорода), или метод разливок
по Штурм, или метод Исаченко — засасывание засеянного и тща-
тельно перемешанного с внесенными бактериями питательного
агара в стерильные трубки (диаметром около 0.3 см). По засты-
вании агара в трубках концы их заливают менделеевской замаз-
кой или запаивают.
Колонии в чашках и трубках появляются обычно через 4—5 су-
ток. Появившиеся черные колонии (рис. 135) извлекают из тру-
261
бок следующим образом: на трубке против колонии делается над-
пил напильником, трубку в этом месте обжигают на пламени
спиртовки и разламывают. Кончиком иглы берут кусочек коло-
нии и переносят в жидкую среду. Выделение обычно приходится
повторить несколько раз.
Для определения количества образованного бактериями серо-
водорода посевы производят в 0.5-литровые склянки, культуры
выдерживают 20—30 суток и затем проводят в них определение
H2S тем или иным способом.
ОКПСЛЕНПЕ СЕРОВОДОРОДА, СЕРЫ
П ТИОСУЛЬФАТОВ
гБактерии, окисляющие сероводород, серу и сернистые соеди-
нения, широко распространены в водоемах различных типов.
В тех водоемах, где в придонных слоях отмечается накопление
сероводорода, на границах слоев, содержащих сероводород, раз-
виваются в массовых количествах или серобактерии, или тпобак-
терии, реже те и другие вместе.
Массовое развитие этих микроорганизмов, окисляющих серо-
водород, является мощным бактериальным фильтром, препятствую-
щим проникновению сероводорода в вышележащие слои воды.
Большие скопления пурпурных серобактерий дают заметную
розовую окраску воды; при массовом развитии зеленых серобак-
терий вода имеет зеленоватый оттенок. Чаще же серобактерии раз-
виваются в водоемах в небольших количествах и могут быть вы-
явлены специальными методами. Серобактерии могут быть обна-
ружены при просмотре мембранных фильтров, через которые
фильтровалась исследуемая вода, в препаратах, приготовленных
из донных отложений или обрастаний, и на пластинках обрастания.
Очень ярко выявляются серобактерии люминесцентной микроско-
пией благодаря их контрастному свечению при воздействии опре-
деленных флуорохромов (например, корифосфина и акридина
оранжевого).
Методы культивирования пурпурных серобактерии
Для получения пурпурных серобактерий в культурах пред-
ложено много сред и способов. Здесь приводятся некоторые
из них.
1. Помещают ил из водоема в высокий цилиндр, заливают во-
дой из того же водоема, прибавляют кристаллик аспарагина или
кусочек сваренного куриного яйца, закрывают цилиндр корковой
пробкой, заливают сверху парафином и ставят в люминостат с тем-
пературой 20—30° С или при неимении его выставляют на окно.
При наличии серобактерий в иле водоема рост наступает через
3—5 недель, так как необходимый им сероводород серобактерии
262
могут получить в итоге развития в среде десульфурирующих бак-
терий, которые необходимые им соединения получат в итоге раз-
вития гнилостных и других микроорганизмов.
Развитие пурпурных серобактерий в среде заметно по появле-
нию розовой окраски различной интенсивности в воде и розово-
красных пятен на поверхности ила и на стенках цилиндра. Для
установления состава развившихся серобактерий берут воду или
часть колонии с поверхности ила и микроскопируют, учитывая
форму и размеры клеток.
2. По Л. Д. Штурм и С. И. Орловой, следующая постановка
культур весьма благоприятствует хорошему росту серобактерий.
Высокие пробирки (около 30 см высотой) заполняют на 3/4 плот-
ной средой, содержащей сульфаты. После стерилизации среду за-
севают активной культурой десульфурирующих бактерий и выдер-
живают в термостате до появления черного осадка сернистого
железа, показывающего накопление сероводорода в среде. Тогда
в пробирки наливают воду исследуемого водоема (если в ней
определяют наличие серобактерий) или воду и грунт (если хотят по-
лучить развитие серобактерий из ила). Пробирки после посева дер-
жат на рассеянном свету. В этих условиях серобактерии хорошо
развиваются.
3. Быстрое развитие пурпурных серобактерий можно полу-
развичить на минеральных средах с Na2S.
Среда Ван-Ниля
Дистиллированная вода................ 1000 мл
NH4C1................................1.0 г
К2НРО4...............................0.5 »
MgCl2 • GHoO.........................0.2 »
NaHCO3 /.............................0.5 »
Na2S • 9Н2О..........................1.0 »
Na2S2O3 • 5Н2О.......................0.2 »
Раствор микроэлементов ..............1 мл
Растворы NaHCO8, NajS • 9НаО, NajS2O8e5HtO стерилизуют
отдельно холодным способом —фильтрацией и прибавляют к среде
непосредственно перед ее использованием.
Раствор микроэлементов (стерилизуется отдельно)
Дистиллированная вода................ 1000 мл
FeCl3 • 6Н2О.........................1.5 г
Н.ВОз................................0.1 »
ZnSO4 • 7Н2О ........................0.01 »
Co(NO3)2 • 6Н2О......................0.05 »
CuSO4 • 5Н2О ........................ 0.005 »
MnCI2 • 4Н2О......................... 0.005 »
pH среды для получения развития пурпурных серобактерий
устанавливают раствором Н3РО4 8.0—8.4.
263
Среду разливают в склянки с притертыми пробками, куда уже
внесен посевной материал, заливают пробки сверху парафином и
ставят в люминостат при 25—30° С. Для быстрого развития пур-
пурных серобактерий, по Е. Н. Кондратьевой (1963), достаточно
круглосуточного освещения лампой накаливания 50—100 вт при
помещении посевов на расстоянии 30—50 см от лампы.
По Постгейту (Postgate, 1959), необходимы несколько более
высокие концентрации отдельных солей: К2НРО4 — 1 г, MgCi2 •
6Н2О - 0.5 г, NaHCO3 - 2 г/л. Ван-Ниль (Van-Niel, 1944) ука-
зывает, что более быстрому развитию пурпурных серобактерий
способствует внесение посевного материала в количестве 1—5?о
(по объему).
При работе с материалом из солоноватоводных бассейнов или
из морей в среду вводят дополнительно соответствующее количе-
ство NaCl.
Среда Гудвина и Лэнда (видоизменение среды Ван-Ниля)
Вода исследуемого водоема.............93 мл
КН2РО4................................0.1 г
NH4C1.................................0.1 »
СаС12-6Н2О ...........................0.01 >
NaCl..................................2.5 »
MgCl2 • 6Н2О..........................0.05 »
К среде добавляют 1 мл раствора микроэлементов вышеуказан-
ного состава. Перед использованием для доведения объема среды
до 100 мл прибавляют заранее простерилизованные растворы:
10%-й раствор Na2S • 9Н2О................... 1 мл
5%-й раствор NaHCO3.........................4 »
10%-й раствор Na2S2O3 • 5Н2О.................1 »
В среду Ван-Ниля, как и ее модификации, могут быть добав-
лены, до установления pH глицерин, маннит, аспарагин, пептон
в конечной концентрации 0.15—0.2% и дрожжевой экстракт в ко-
личестве 0.5%. Для более быстрого роста серобактерий рекомен-
дуется введение 0.1% пептона и 0.5% дрожжевого экстракта.
Среда Макхерея
Дистиллированная вода................ 1000 мл
NaCl....................................5.0 г
NH4C1...................................1.0 »
КН2РО4..................................0.5 »
Na2CO3 .................................6.3 »
Na2S2O3 • 5Н2О........................0.3 »
Трилон Б ...............................0.1 »
pH 8.2
Для ряда пурпурных серобактерий (Chromatium okenii Perty,
Chr. warmingii Migula, Thiospirillum jenense Migula, Amoebo-
264
bacter sp.) Шлегель и Пфенниг (Schlegel u. Pfennig, 1961) указы-
вают как оптимальные следующие среды.
1-я среда Шлегеля и Пфеннига
Дистиллированная вода........................... 3000 мл
CaSO4 • 2Н2О....................................2.0 г
КН2РО4..........................................1.0 »
(NH4),SO4.......................................1.0 »
MgSO4" • 7Н2О...................................0.1 »
КС1.............................................0.5 »
СаСО3...........................................0.15 »
NaHCOs..........................................4.5 »
Na2S • 9H2O.....................................2.25 »
Этилендиаминтетраацетат (титриплекс III)........75 мг
FeSO4 • 7HaO......................................10 »
ZnSO4 • 7H2O...................................... 5 »
MnCl2 • 4H2O...................................... 1 »
Витамин Bl2.......................................30 мкг
Раствор микроэлементов (стр. 263)............... 1.5 мл
pH устанавливается пропусканием СОа для Chromatium okenii
и Thiospirillum jenense 6.6—6.8, для Chromatium warmingii
6.8—7.2. Температура выращивания 18—23° С.
2-я среда Шлегеля и Пфеннига
Дистиллированная вода................ 1000 мл
Раствор витаминов....................10 »
Раствор микроэлементов (стр. 263).... 1.5 »
FeSO4 • 7Н2О.........................10 мг
ZnSO4 • 7Н2О.........................5 »
(NH4)2SO4............................1.0 г
КС1..................................0.5 »
КН2РО4...............................1.0 »
MgSO4 • 7Н2О.........................1.0 »
NaHCOs...............................2.0 »
CaSO4 • 2Н2О.........................0.5 »
СаСО3................................0.05 »
Na.S • 9НаО...................... 0.5 »
pH 6.5
Раствор витаминов:
Дистиллированная вода...................100 мл
Биотин..................................0.1 мг
Кальций пантотеновый....................0.1 »
Парааминобензойная кислота .............1.0 »
Никотиновая кислота.....................2.0 »
Аневрин.................................2.0 »
Для получения обогащенной культуры берут 35 частей среды
и 65 частей воды (или иловой воды). Иловую воду готовят следую-
щим образом. В 10-литровый стеклянный сосуд вносят свежий
ил, землю и CaSO4 в отношении 1:1: 0.5 с пятикратным объемом
265-
дождевой воды и оставляют стоять в темноте на несколько недель.
Отбирают прозрачную, насыщенную сероводородом воду и вводят
в среду. После каждого взятия в сосуд добавляют воду.
Для получения обогащенной однородной культуры делают
несколько последовательных пересевов. Когда такая культура
получена, можно приступать к выделению, для чего производят
посевы на среду того же состава, но содержащую 1.5—2% промы-
того агара. Выделение проводят следующим образом: готовят
несколько разведений из культуры и вносят по нескольку капель
каждого из разведений в стерильные пробирки. Агар расплав-
ляют, охлаждают до 45° С, добавляют в него растворы NaHCO3
и Na2S, доводят pH до необходимой величины и быстро заливают
агарОхМ пробирки с внесенным инокулятом, размешивают среду и
оставляют застывать. По застывании столбики агара заливают
сверху расплавленным стерильным парафином, чтобы не допу-
стить проникновения кислорода в среду.
Колонии серобактерий при круглосуточном освещении по-
являются через 5—7 дней. Пробирку, где колонии отстоят одна
от другой на достаточное расстояние, распиливают, столбик
агара переносят в стерильную чашку Петри, колонии извлекают
и вновь пересевают в агаровую среду. Могут быть исполь-
зованы стеклянные капилляры. После получения роста одну из
развившихся колоний пересевают в жидкую среду. Чистота полу-
ченных культур серобактерий проверяется обычным путем (вы-
севами па МПА, МПБ, на сусло и среду для десульфурирующих
бактерий).
В не содержащей гетеротрофных бактерий культуре пурпур-
ных серобактерий даже при кажущейся однородности клеток
при исследовании под микроскопом может быть не один вид.
Для выяснения этого Е. Н. Кондратьева (1963) рекомендует делать
рассев культуры на среды с различными значениями pH, с раз-
ными концентрациями Na2S и добавлять различные органические
соединения.
Пурпурные серобактерии представлены большим количеством
видов. Виды отличаются по форме клеток, образованию общих
для группы клеток капсул, наличию стадий роения, цвету обра-
зуемых пигментов (рис. 136). Характерной для пурпурных серо-
бактерий является более или менее удлиненная форма клеток,
у ряда видов она сферическая. Размеры клеток и формы обра-
зуемых ими скоплений могут значительно изменяться в зависи-
мости от условий среды.
Все пурпурные серобактерии подвижны и имеют полярно
расположенные жгутики, они грамотрицательны, имеют в клет-
ках бактериохлорофилл п близкие к нему каротиноиды. Дона-
торами водорода для них служат II2S и другие соединения серы
и водорода и органические соединения, источниками углерода —
СО2 и органические соединения.
266
0
Л
О Qo>
3?
Юнк
-Й®
еЖ *®
/7У Л2
'-.......--«.м /
""м
ta S&A;
и
О
О
О
f
в
м
в В
S
з
Р
Рис. 136. Пурпурные серобактерии.
А — Chroma Hum gobii Issatschenko; Б — Chr. wanningii Migula; В — Chr. weissei Perty;
Г — Chr. okenil Perty; Д — Chr. minus Winogradsky; E — Chr. vinosum Winogradsky;
Ж — Chr. minutissimum Winogradsky; 3 — Thiosarcina rosea Winogradsky; И — Thlo-
capsa roseopersicina Winogradsky; К — Thiopolycoccus ruber Winogradsky; JIt — Thio-
pedia elongata Rodina; JIt — Th. rosea Winogradsky; M — Lamprocystis roseapersicina
Schroeter; H — Amoebobacter roseus Winogradsky; О — Thiothece gelatinosa Winograd-
sky; П — Thlodictyon elegans Winogradsky; P — Thiocystis violacea Winogradsky.
Методы культивирования зеленых серобактерии
Основными средами для культивирования зеленых серо-
бактерий являются вышеприведенная среда Ван-Ниля с микро-
элементами, только с иным pH и среда Ларсена. Для зеленых серо-
бактерий более благоприятен pH 7.0—7.3. Постгейт указывает,
что для разных видов зеленых серобактерий благоприятны раз-
личные концентрации сернистого натрия или тиосульфата. Так,
для Chlorobium thiosulfatophilum Larsen в среду вводят 0.2 г л
Na2S • 9Н2О, для Chi. limicola Nadson — 1 г/л, для Chi. thiosul-
fatophilum Na2S2O3 • 5Н2О в количестве 1 г/л.
Среда Ларсена
Дистиллированная вода................. 1000 мл
NH4C1.................................1 г
КНаРО4................................1 »
MgCl2 • 6Н2О..........................0.5 »
NaCl..................................1 »
NaHCO3................................2 »
Na2S2O3 • 5Н2О........................1 »
NaaS • 9НаО...........................1 »
СаС12-6Н2О............................0.1 »
Раствор микроэлементов ...............1 мл
pH 7.0—7.5
Раствор микроэлементов
Этнлендиаминтетраацетат натрия .......50 г
ZnSO4 • 7Н2О .........................22 »
СаС12-6П2О ............................5.54 »
MnCL • 4Н2О............................5.06 »
FeSO4 • 7Н2О ..........................4.99 »
(NH4)eMo7O2 • 4Н2О .....................1.1 »
CaSQ4 • 2НаО .........................1.57 »
СоС12 -6Н2О............................1.61 »
Дистиллированная вода.................. 1000 мл
Na2S и Na2S2O3 стерилизуют отдельно в виде 10%-х растворов
и добавляют к основной части среды перед ее засевом. Культуры
выращивают при круглосуточном освещении лампами накаливания
75-100 вт.
Однако очень часто рост зеленых серобактерий подавляется
пурпурными. В этих случаях рекомендуется ставить накопитель-
ные культуры по Виноградскому. В узкий стеклянный цилиндр
вносят нарезанную фильтровальную бумагу, сульфат кальция и
ил из водоема, доливают водой из водоема и плотно закрывают.
Цилиндр выставляют на свет. В цилиндре протекают сложные
бактериальные процессы. В итоге развития аэробных бактерий
поглощается весь кислород и в цилиндре создаются условия для
развития анаэробов. Начинает идти процесс разложения клет-
чатки с выделением углекислоты и водорода. Развиваются де-
сульфурирующие бактерии, выделяющие сероводород, что соз-
268
дает условия для развития пурпурных и зеленых серобакте-
рий. Колонии зеленых серобактерий появляются на стенках ци-
линдра в виде отдельных пятен, обособленно от пурпурных
серобактерий.
Быстрорастущие колонии принадлежат Chlorobium limicola,
медленно развивающиеся — Chi. thiosulfatophilum. Их снимают
тонкой пипеткой и переносят в среду Ван-Ниля пли Ларсена,
выращивают в анаэробных условиях на свету. Зеленые серобак-
терии — стрдгие анаэробы, поэтому даже малейшие следы кис-
лорода угнетают их рост.
Дальнейшая очистка производится путем высева на агари-
зованную среду, помещенную в анаэробные условия, по методике,
указанной для пурпурных серобактерий.
Для выделения может быть использована одна из вышеуказан-
ных сред с 1.5—2 % агара с pH 7.0—7.3 (что достигается внесением
нескольких капель NaHCO3) или агар Ларсена.
Агар Ларсена
Основной раствор
Дистиллированная вода.............. 1000 мл
NH4C1............................... 1г
MgCl2 • 6Н2О....................... 0.05 »
NaCl..........................От О до 30 »
Агар................................. 20 »
Среду стерилизуют в автоклаве. Отдельно стерилизуют рас-
творы NaHCO3 (2%-й), Na2S • 9Н2О (2%-й) и FeCl3 (1.5%-й),
которые прибавляют асептически перед посевом, чтобы концен-
трация их в среде была: NaHCO3 — 0.2%, Na2S • 9Н2О — от 0.02
до 0.12% и FeCl3 — 50 мкг % Fe. pH доводят до 7.3 прибавлением
нескольких капель разведенного раствора Н3РО4.
Проверка чистоты культуры зеленых серобактерий прово-
дится обычными методами. Кроме того, здесь необходимо уста-
новить отсутствие пурпурных серобактерий, для чего делают
высевы на соответствующие среды с более высокими значе-
ниями pH.
Для поддержания культур Е. Н. Кондратьева (1963) реко-
мендует хранить их при слабом освещении или в темноте при
температуре не выше 19—20° С.
К зеленым серобактериям относятся свободноживущие виды.
Клетки различных видов, обычно небольшие по величине, имеют
форму очень коротких палочек, часто соединенных в цепочки.
Спор не образуют, размножаются путем поперечного деления
клеток, грамотрицательны, содержат бактериовиридин и спе-
цифические каротиноиды. Большинство видов неподвижно, хотя
имеются и подвижные формы. Одни из них не образуют колоний
(Chlorobium — рис. 137), другие объединены в характерные агре-
гаты (Pelodictyon, Clathrochloris). Представители рода Pelo-
269
dictyon Lauterborn (рис. 138) не содержат в клетках капелек серы,
тогда как представители рода Clathrochloris откладывают их внутри
клеток. К зеленым серобактериям относятся и виды, образующие
симбиотические агрегаты с другими организмами: Chlorobacterium,
Chlorochromatium, Cylindrogloea. Наиболее полные описания и
ключ для определения даны Е. Н. Кондратьевой (1963).
Рис. 137. Chlorobium Рис. 138. Представители разных видов Pelo-
limicola Nadson (по dictyon Lauterborn (по Красильникову, 1949).
Красильникову, А — р. aggregatum Perf.; Б — Р. clathratlfornic
1949). Lauterb.; В — Р. parallclum Perf.
Методы культивирования бесцветных серобактерий
Для получения в культуре бесцветных серобактерий можно
пользоваться следующим приемом С. Н. Виноградского: на дно
высокого стеклянного цилиндра помещают кусок корневища су-
сака или другого водного растения, прибавляют немного гипса
или ила и заливают доверху водой из того же водоема. В этих
условиях развиваются главным образом бесцветные нитчатые
серобактерии, образующие пленку.
Хорошие результаты дает среда Омелянского:
5%-й раствор солода.................... 1000 мл
Глюкоза................................... 5 г
Пептон.................................... 1 »
Серный цвет.............................. 10 »
Агар..................................... 20 »
Расплавленный агар засевают Oidium lactis и разливают
в чашки Петри. Через несколько дней, когда начинается выделение
сероводорода, агар разрезают на куски. Куски агара кладут на
дно высокого стеклянного цилиндра и заливают затем водой из
исследуемого водоема. Через 10—15 суток на поверхности жид-
кости появляется толстая пленка, которая состоит из нитей бес-
цветных серобактерий и различных других микроорганизмов.
270
Можно получить хорошее развитие бесцветных серобактерий
при постановке культуры по Боргарду. На дно цилиндра нали-
вают агар следующего состава:
Дистиллированная вода............. 1000 мл
K2S............................... 3 г
КаНРО4............................ 0.2 »
NH4C1............................. 0.1 »
MgCl2 • 6Н2О...................... 0.1 »
Агар..............................30 »
Поверх агара (по его застывании) вносят грунт исследуемого
водоема и заливают агар водой из того же водоема до полного
заполнения цилиндра.
Еще проще получить культуру бесцветных серобактерий по
В. Н. Шапошникову. На дно цилиндра помещают ил, заливают
его водой и в качестве источника сероводорода используют ам-
пулки, наполненные сероводородной водой. Сероводород, посту-
пая постепенно в воду, дает возможность развиваться серобак-
териям.
Для получения накопительных культур Beggiatoa Катальди
(Cataldi, 1940) рекомендует среду с высушенным сеном и 0.05%
Na2S. Среда готовится следующим образом. Сухое сено заливают
значительным объемом воды; экстрагирование производят при
100° С. Воду сменяют 3 раза. Сепо высушивают при 37° и затем
используют для приготовления среды. В эрленмейеровские колбы
объемом 125 мл наливают по 70 мл воды и вносят 0.8% сена. Сте-
рилизуют в автоклаве. Посев производят значительным коли-
чеством ила. Beggiatoa развиваются в виде поверхностных пленок.
Для получения чистых культур часть пленки промывают не-
сколько раз стерильной водопроводной водой и затем нити бак-
терий помещают на поверхность стерильного агара (0.2% мясного
экстракта, 1 % агара). Beggiatoa, развиваясь на поверхности среды,
мигрируют к периферии чашек. Агаровые блоки, содержащие
одну нить, вырезают и переносят в другие чашки на свежий того же
состава агар.
Чистые культуры могут быть выращены на среде Скоттена
и Стоукса (Scotten a. Stokes, 1962).
Среда Скоттена и Стоукса
Водопроводная вода 1 ................. 1000 мл
СаС1а • 6Н2О.........................0.2 г
К2НРО4...............................0.5 »
MgSO4 • 7НаО.........................0.5 »
Дрожжевой автоллзат..................1 »
Мясной экстракт...................... 1 »
Пептон...............................1 »
1 Если для среды берут вместо водопроводной воды дистиллированную,
то необходимо вносить микроэлементы.
271
Авторы указывают на желательность введения витаминов
в количестве 0.4 мл на каждые 100 мл среды. Концентрация ви-
таминов в 1 мл:
Пантотеновая кислота...................
Никотиновая кислота....................
Биотин.................................
Парааминобензойная кислота ............
Рибофлавин.............................
Тиамин ................................
Пиридоксин................'............
Инозит.................................
Фолиевая кислота.......................
pH 7.2—8.2
25 мкг
100 »
0.5 »
10 »
1(Х) »
100 »
100 »
500 »
100 »
1 »
Культуры выращивают при температуре 25—30° С,
Скоттен и Стоукс указывают, что ряд штаммов Beggiatoa
являются аэробами и их рост может быть получен лишь при
аэрировании среды. В этих условиях Beggiatoa дают белую пленку
на поверхности среды. Другие, микроаэрофилы, развиваются
пятнами на дне и стенках сосуда.
Фауст и Вольф (Faust a. Wolfe, 1961) указывают на эффектив-
ность метода Катальди, но дают несколько измененные среды.
Для получения накопительных культур они берут высушенную
придорожную траву, которая подвергалась воздействию погоды
в течение нескольких месяцев, разрезают на мелкие куски и при-
бавляют к кипящей водопроводной воде в количестве 100 г травы
на каждый литр воды. После кипячения в течение около 10 мин.
воду, которая содержит растворимые компоненты травы, сливают.
Наливают свежую воду и повторяют кипячение. После 5-разовой
смены воды экстрагированное сено оставляют в воде на ночь
и на следующий день процедуру повторяют 3 раза. Затем сено
вынимают и высушивают. По 0.5 г вываренного сена и по 60 мл
речной воды вносят в 125-мил лил итровые эрленмейеровские
колбы. Каждую колбу засевают маленьким комком ила, взя-
того из загрязненной реки, и инкубируют при температуре
около 28° С.
По второму способу авторы рекомендуют использовать ко-
черыжку кукурузного початка как для снабжения среды следами
питательных элементов, так и как место прикрепления организ-
мов. В широкогорлые склянки из оранжевого стекла наливают
речную воду, вносят несколько миллилитров ила и несколько
разлагающихся листьев из загрязненной реки. Помещают вы-
ветрившуюся кочерыжку кукурузного початка в склянку таким
образом, чтобы один конец касался дна, другой держался
у вершины склянки. Затем доливают воду таким образом, чтобы
осталось пространство воздуха около 50 мл, и закрывают
склянку пробкой. Инкубируют при комнатной температуре.
272
Техника выделения в чистые культуры представляет собой
модификацию метода Катальди. С помощью капиллярной пипетки
переносят пучок нитей из накопительной культуры в стерильную
воду, чтобы удалить большое количество сопутствующих бакте-
Рис. 139. Бесцветные серобактерии рода Beggiatoa
Trevisan.
А — В. mirabilie Cohn; Б — В. arachnoidea Rabenhorst; В —
В. alba Trevisan; Г —В. 1 ер tom It if orm is Trevisan; Д — в. mi-
nima Winogradsky.
рий. Из стерильной воды пучок нитей помещают на сухую по-
верхность твердой среды, имеющей следующий состав:
Дистиллированная вода...................90 мл
Водопроводная вода......................10 »
Дрожжевой экстракт..................... 0.2 г
Агар................................... 1.5 »
pH 7.0
Среду стерилизуют обычным способом, разливают в чашки
Петри и подсушивают в термостате при 30° С в течение 2 час.,
чуть приоткрыв чашки. Просматривают каждую чашку между
4-м й 6-м часами после засева под микроскопом при увеличении
в 30 раз. Вырезают маленькие агаровые блоки, содержащие хорошо
изолированные нити, и переносят асептически в 2 мл вышеука-
занной среды, но жидкой (без агара). Скопления нитей делаются
18 А. Г. Родина 273
заметными в первичных культурах через 1—3 недели. Подобная
колония состоит из активных подвижных нитей.
В водоемах широко распространены виды рода Beggiatoa
Trevisan — длинные подвижные нити, не прикрепляющиеся к суб-
Рис. 140. Бесцветные серобактерии рода Thiothrix Winogradsky.
А — Th. annulata Molisch; Б — Th. nivea Winogradsky; В — Th. tenuis
Winogradsky; Г — Th. longiartlculata Kias; Д — Th. torquis Rodina;
E — Th. torquis forma minor Rodina; Ж — Th. undulata Rodina.
страту, состоящие из клеток равной толщины на всем протяже-
нии нити, покрытые тонкой слизистой оболочкой (рис. 139).°
Не менее широко и часто разными видами представлен род
Thiothrix Winogradsky (рис. 140). Реже встречаются бесцветные
одноклеточные организмы (рис. 141).
274
Рис. 141. Одноклеточные бесцветные серобактерии.
А — Achromatium oxaliferum Scheviakoff; Б — Achr. mobile Lauterborn;
В — Thiophysa macrophysa Nadson; Г — Thiosphaerella amylifera Nadson;
Д — Thiovolum majus Hinze.
Методы культивирования тиобактерий
Тиобактерии являются энергичными окислителями сероводо-
рода в водоемах. Они широко распространены в природе и имеют
большое значение в процессах самоочищения водоемов при за
грязнении как бытовыми, так и промышленными сточными во-
дами. Тиобактерии участвуют в процессах разрушения бетонных
труб и бетонных сооружений как в пресных, так и в морских
водоемах.
Группа тиобактерий содержит виды, различные по своим фи-
зиологическим свойствам; они отличаются по отношению к орга-
ническим веществам (одни виды способны развиваться в присут-
ствии органических веществ, другие нет) и по отношению к источ-
нику энергии (одни окисляют сероводород и элементарную серу,
другие — только серу, третьи — серу и тиосульфаты, четвертые —
только тиосульфаты, пятые — сульфиды тяжелых металлов, пере-
водя Fe++ в Fe+++). Одни виды, окисляя тиосульфаты, откладывают
элементарную серу вне своих клеток, другие, окисляя элементар-
ную серу, имеют продуктами жизнедеятельности только серную
кислоту. Очень различны у разных представителей этой группы
требования по отношению к pH среды: виды группы Thiobacte-
rium thioparus Beijerinck (рис. 142, Л) развиваются в щелочной
среде (при pH 9.0—9.6), виды группы Thiobacillus thiooxidans
Bergey et al. (рис. 142, Б) — только в очень кислой среде (при
18*
pH 2.0—4.0), некоторые формы, например виды, описанные
А. Г. Салимовской [Родиной| из водоемов Ленинграда, и виды,
описанные Эмото из источников Японии, требуют для своего раз-
вития слабокислой среды (pH 5.4—6.4). Поэтому для обнару-
жения тиобактерий в водоемах надо учитывать особенности ис-
следуемого водоема, чтобы правильно выбрать питательную
среду: в ряде случаев надо делать посевы в несколько сред.
Для получения развития бактерий типа Thiobacterium thio-
parus с большим успехом могут быть использованы следующие
среды:
Среда Бейеринка
Дистиллированная вода............... 1000 мл
NaaS2O3 • 5Н2О......................5 г
NaHCO...............................1 »
Na2HPO4 • 2НоО......................0.2 »
NH4C1...............................0.1 »
MgCl2 • 6Н2О........................0.1 »
Среда Якобсена
Дистиллированная вода.................. 1000 мл
К2НРО4................................. 0.5 г
NH4C1.................................. 0.5 »
MgCl2 • 6Н2О........................... 0.2 »
СаСО3...................................20 »
Сера (порошком).........................10 »
Среда Старкея
Дистиллированная вода . .
(NH4)2SO4................
КН2РО4...................
MgSO4 • 7Н2О.............
СаС12 • 6Н2О.............
Fe2(SO4)3 • 9Н2О.........
Сера (порошком) (пли 5 г
Na2S2O3 • 5Н2О) •........
pH 7.5
1000 мл
0.2—0.4 г
3.0—4.0 »
0.5 »
0.25 »
0.01 »
10 »
Среда Родиной
(для бактерий, требующих более кислой среды)
Дистиллированная вода.................
К3НРО4................................
NH4C1.................................
MgCl2 • 6Н2О..........................
СаС12 • 6Н2О .........................
Na2S2O3 • 5Н2О........................
pH 6.0-6.2
. 1000 мл
3 г
. 2 »
. 0.5 »
. 0.2 »
. 10 »
276
Среду разливают в конические колбочки тонким слоем, при
использовании среды Якобсена на поверхность среды насыпают
небольшое, количество серного цвета, стараясь, чтобы сера легла
на поверхность среды возможно более тонким слоем. Стерили-
зацию проводят при 110° С в течение 30 мин. Рекомендуется при-
бавлять в среды для культивирования бактерий группы Thioba-
cterium thioparus рас-
твор микроэлементов
(стр. 268) в количе-
стве 1 %.
Th. thioparus (рис.
142, Л) является авто-
трофом. Другие виды
этой группы (Th. traut-
weinii Berg et al., Th.
beijerinckii Issatschenko
et Salimovskaja) хоро-
шо растут как на вы-
шеуказанных средах,
так и на органических
средах.
Для бактерий группы Thiobacillus thiooxidans (рис. 142, Б),
представляющих собой очень короткие подвижные палочки, не-
спороносиые, грамотрицательные, являющиеся автотрофами, могут
быть использованы вышеуказанная среда Старкея с pH 3.5 и
среды Ваксмана.
Среды Ваксмана
Рис. 142. Тиобактерии.
А — Thiobacterium thioparus Beijerinck; Б — Thio-
bacillus thiooxidans Bergey et al.
1. Дистиллированная вода..............
(NH4)2SO4...........................
MgSO4 • 7H2O........................
1000 мл
0.2 г
0.5 »
3.0 »
0.25 »
10.0 »
KH.PO4..............................
CaGlj . 6H2O .......................
Сера (порошком).....................
2. Дистиллированная вода............... 1000 мл
MgSO4 • 7Н2О......................... 0.5 г
(NH4)2SO4............................ 0.2 »
КН2РО4............................... 1.0 »
Са3(РО4)2............................ 2.5 »
Сера (порошком)......................10.0 »
В обеих средах молярным раствором фосфорной кислоты уста-
навливается pH 3.0.
Определение содержания бактерий группы Th. thiooxidans
в водоеме может быть произведено на кремневых пластин-
ках, пропитанных средой Ваксмана, на поверхность которых
тончайшим слоем нанесена отдельно простерилизованная сухая
сера порошком. Посев производят капельками воды или комоч-
ками грунта. Колонии тиобактерий хорошо видны на пластин-
277
ках благодаря образованию вокруг них прозрачных зон в итоге
окисления серы в соли серной кислоты.
В жидких культурах тиобактерий может быть произведено
для установления степени их активности количественное опре-
деление образовавшихся сульфатов, сульфитов и политионатов.
Рост на средах с гипосульфитом может быть отмечен по по-
явлению тончайшей пленочки, состоящей из капелек серы и
бактерий, и тонкой равномерной мути. Пленка с течением времени
уплотняется и от выделившейся серы принимает желтоватый
оттенок. По стенкам и на дне появляется желтый осадок. По мере
оседания выделившейся серы среда становится все более про-
зрачной. Наибольшее количество серноватистокислого натрия
окисляется в первые после посева дни, поэтому в первые же дни
развития окисление Na2S2()3 может быть установлено и химиче-
ской реакцией: при прибавлении 1—5%-го раствора ВаС12 к не-
большому количеству среды, взятой в пробирку и подкисленной
несколькими каплями разбавленной азотной или соляной кислоты
(кислота должна быть предварительно проверена на отсутствие
в ней примеси серной), выпадает обильный осадок BaSO4. Для
выделения тиобактерий может быть использована одна из выше-
приведенных сред с прибавлением к ней агара в количестве 1.5%.
Твердая агаризованная среда может быть использована и для
количественного определения содержания тиобактерий в воде
и в грунтах водоемов. Тиобактерпи соответствующей подгруппы
растут на подходящих для них минеральных средах, образуя
мелкие, круглой формы, желтоватые (от выделяющейся серы)
колонии. Под микроскопом они кажутся сине-зелеными, по краям
их видны капельки серы. В колониях развиваются мелкие по-
движные (перитрихи) палочки, откладывающие серу вне своих
клеток.
Thiobacillus ferrooxidans Colmer et Hinkle — короткие па-
лочки 0.8—1x0.4 мк, грамотрицательные, неспороносные, по-
движные, выделены из кислых шахтных вод. Кислотность среды,
наличие сульфидов и соединений закисного железа — необхо-
димые условия для этого микроорганизма. Этот вид способен
окислять закисные соединения железа и восстановленные сое-
динения серы. Его развитие может быть получено на одной из
следующих сред.
Среда Кольмера
Дистиллированная вода.................1000 мл
FeSO4 • 7Н2О ..........................2.0 г
(NH4)2SO4..............................0.1 »
КН2РО4.................................0.1 »
MgSO4 • 7Н2О...........................0.1 »
pH устанавливается серной кислотой до 2.5.
278
Среда Летена, Мак Интайра и Бралея
А. Основной раствор
Дистиллированная иода..................1000 мл
(NH4)2SO4..............................0.15 г
КС1....................................0.05 »
MgSO4 • 7Н2О...........................0.5 »
К2НРО4.................................0.05 »
Ca(NO3)2...............................0.01 »
Б. 10%-й раствор FeSO4 • 7Н2О
На 1000 мл основного раствора вносят асептически 10 мл рас-
твора FeSO4. pH должен быть 3.5.
Выделение Th. ferrooxidans производят на кремневых плас-
тинках, пропитанных средой Летена. Молодые колонии этого
вида имеют неровные края, кремовый до рыжевато-коричневого
цвет; с течением времени колонии приобретают темно-коричневую
окраску.
Th. novellus Starkey может расти как автотрофно, так и как
гетеротроф на среде с бульоном или на синтетической среде с ли-
монной кислотой. Оптимальной для этого вида является синте-
тическая среда с добавлением лимонной или глютаминовой кис-
лоты.
ГЛАВА 9
МЕТОДЫ ИЗУЧЕНИЯ ПРЕВРАЩЕНИЙ
МИКРООРГАНИЗМАМИ СОЕДИНЕНИЙ ФОСФОРА
Круговорот фосфора имеет огромное значение для продуктив-
ности водоемов. Фосфор в водоемах присутствует в виде органи-
ческих (входя в состав фосфопротеинов, нуклеопротеидов, фос-
фатидов и других соединений растительных и животных тканей)
и неорганических соединений.
В виде фосфатного иона фосфор в пресных водоемах нахо-
дится в ничтожных количествах (обычно сотые и тысячные доли
миллиграмма на 1 л воды), так как растворимые соединения фос-
фора в водоемах быстро образуют слабо растворимые и нераство-
римые формы, выпадающие в осадок.
Перевод нерастворимых неорганических соединений фосфора
в растворимое состояние происходит под воздействием особой
группы микроорганизмов, распространенных в водоемах.1
Разложение органических, содержащих фосфор соединений
с освобождением растворимых фосфатов происходит под воздейст-
вием другой группы микроорганизмов и является вторым
источником увеличения в водоемах минеральных растворимых
соединений фосфора.
Несмотря на всю важность вопроса, круговорот фосфора
в водоемах освещен мало, и методы исследования и учета бак-
терий, его осуществляющих, нуждаются в дальнейшей разработке.
РАСТВОРЕНИЕ МИКРООРГАНИЗМАМИ
НЕРАСТВОРИМЫХ СОЕДИНЕНИЙ ФОСФОРА
Определение численности микроорганизмов, способных пе-
реводить нерастворимые фосфаты в растворимое состояние, может
быть произведено методом разливок при использовании той
или иной твердой среды с глюкозой и нерастворимыми фосфатами
[чаще всего для этой цели используется Са3(РО4)2].
1 Перевод нерастворимых фосфатов в растворимое состояние, кроме пря-
мого воздействия специфических микроорганизмов, происходит в итоге
действия на них образованных различными группами бактерий кислот.
280
Среда с почвенной вытяжкой
Водопроводная вода .................... 990 мл
Глюкоза................................10 г
(NH4)2SO
К2НРО4
КН2РО
NaCl
КС1.................................
0.5 »
0.8 »
0.2 »
0.2 »
0.1 »
MgSO4 • 7Н2О............................ 0.3 »
Дрожжевой экстракт...................... 2.5 мл
Почвенная вытяжка .......................10 »
Раствор микроэлементов (стр. 237)....... 1 »
Агар.....................................20 г
Са3(РО4)2............................... 2.5 »
pH 7.0
4
Среда Бента и Ровира
Водопроводная вода................... 750 мл
(NH4)2SO4............................0.5 г
MgSO4 • 7Н2О.........................0.05 »
К2НРО4...............................0.4 »
MgCl2 - 6Н2О.........................0.1 »
FeCl3 • 6Н2О.........................0.01 »
СаС12.6Н2О...........................0.1 »
Пептон...............................1 »
Дрожжевой экстракт...................1 »
Почвенный экстракт................... 250 мл
Глюкоза.................................. 5 г
Са3(РО4)2............................... 25 »
СаСО3................................... 15 »
Среда Новогрудского
Дистиллированная вода................. 1000 мл
(NH4)2SO4............................ 1 г
MgSO4 • 7Н2О......................... 0.5 »
КС1. ................................ 0.5 »
СаС12 • 6Н2О......................... 0.5 »
NaCl ................................ 0.1 »
Фосфоритная мука.....................10 »
Дрожжевой автолизат.................. 1 мл
Среда с иловой вытяжкой
Водопроводная вода..................... 500 мл
Иловая вытяжка......................... 500 »
Глюкоза...............................10 г
Са3(РО4)2............................. 2.5 »
Дрожжевой экстракт.................... 0.5 мл
Агар.................................. 20 г
pH 7.0
Среда Герретсена в модификации Шпербера
Морковный отвар (1 кг моркови на 1 л воды) . . 1000 мл
Аспарагин...................................... 1 г
281
Глюкоза.................................... 10 г
Дрожжевой экстракт......................... 0.5 »
Агар....................................... 20 »
Нерастворимый фосфат........................До получения
равномерной
мутностп
Са3(РО4)2 готовят отдельно. Берут 2.5 г соли, растирают
в ступке до получения тончайшего порошка. Отдельно в фарфо-
ровой же ступке растирают 0.5 г гуммиарабика. Оба порошка
Рис. 143. Зоны растворения трех-
кальцпового фосфата фосфорными
бактериями.
Средн микроорганизмов,
тщательно смешивают, затем пе-
реносят в колбу со 100 мл воды
и стерилизуют. При посевах вно-
сят пипеткой асептически в чашку,
куда внесен посевной материал,
1 мл этой суспензии после взбал-
тывания, заливают питательной
средой и тщательно размешивают.
Добавление гуммиарабика избав-
ляет от образования комков нерас-
творимого фосфата и дает среду
однообразной и равномерной мут-
ности.
Трехкальциевый фосфат может
быть заменен апатитом, фосфори-
том, фосфоритной мукой.
Па всех средах подсчитывают
колонии, окруженные прозрачны-
ми зонами (рис. 143).
бразующих зоны растворения на
средах с трехкальциевым фосфатом, имеются формы, выделяю-
щие растворимые фосфаты в среду, и формы, полностью исполь-
зующие растворенный фосфат в процессах внутриклеточного
обмена.
К видам той и другой группы микроорганизмов относятся
неспороносные палочки, среди которых есть пигментные [Pseudo-
monas rubigenosa (Catiano) Krass., Chromobacterium denitrificans
Topley et Wilson и др.], многие водные штаммы дрожжей,
относящиеся главным образом к группам Torulopsis и Rhodo-
torula.
По получении чистых культур микроорганизмов, переводящих
в раствор нерастворимые фосфаты, может быть определена их
активность на синтетической жидкой среде. Среду разливают
в колбочки по 100 мл и засевают чистыми культурами. Спустя
2—3 недели часть культуры отфильтровывают через мембранный
фильтр № 3 и в фильтрате определяют фосфатный ион по методу
Дениже—Аткинса при помощи фотоэлектроколориметра или ци-
линдров Генера. Контролем служит стерильная среда.
282
ОСВОБОЖДЕНИЕ ФОСФАТОВ ИЗ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Определение наличия бактерий, осуществляющих процесс
освобождения соединений фосфора из органических соединений,
может быть произведено на пластинках из кремнекислого геля,
пропитанных одной из следующих сред.
Среда Менянной
Дистиллированная вода..................1ОСЮ мл
(NH4)2SO4...............................0.5 г
MgSO4 - 7Н2О............................0.3 »
КС1.....................................0.3 »
NaCl....................................0.3 »
MnSO4 • 5Н2О.............................Следы
FeSO4 • 7Н2О ......................... »
Глюкоза ................................10 г
Мел..................................... 5 »
Лецитин.
На каждую пластинку наносят по 3—5 мл этой среды и затем
лецитин или нуклеиновую кислоту из расчета 3—5 мг Р2О6 на
пластинку. Лецитин предварительно должен быть растворен
в 96°-м спирте. Пластинки стерилизуют в автоклаве при х/2—
3/1 атм. 20 мин.
Посев производят путем нанесения комочков ила или капелек
воды.
Может быть использована эта же среда с агаром.
Видоизмененная среда Менкиной
Водопроводная вода
(NH4)2SO4 ....
MgSO4 • 7Н2О . .
К,НРО4.........
КНаРО4.........
NaCl...........
мл
о.5 г
0.25 »
0.8 »
0.2 »
0.1 »
Почвенная вытяжка ....................10 мл
Дрожжевой экстракт....................2.5 »
Раствор микроэлементов (стр. 237).... 1 »
Мел...................................5 г
Лецитин, или натриевая соль нуклеиновой
кислоты, или нуклеиновая кислота.
Источники органического фосфора вносят отдельно в каждую
колбочку из расчета общего фосфора 3—5 мг йа 10 мл среды. Леци-
тин готовят следующим образом: 1 г лецитина растворяют в 2 мл
этилового спирта, затем доливают 18 мл дистиллированной воды.
Усредняют насыщенным раствором двууглекислой соды до pH 7.0,
затем переливают в колбочку градуированной пипеткой и стерили-
зуют текучим паром 40 мин. При производстве посевов вслед за по-
севным материалом вносят в каждую чашку 0.1 мл этого раствора,
283
заливают расплавленным и охлажденным агаром и хорошо пере-
мешивают. Нуклеиновую кислоту вносят из расчета 30—50 мг
на пластинку (содержание общего фосфора 3—5 мг).
Н. С. Одоевской (1961) разработаны для этой группы среды
без дорогостоящих препаратов — нуклеинатов и лецитина.
Картофельный агар
500 г сырого очищенного картофеля кипятят два часа в 1 л
воды,— количество жидкости после кипячения должно состав-
лять 0.5 л. 10 мл простерилизованного отвара доводят добавле-
нием воды до 100 мл, прибавляют 2% агара и 4 мл 1 %-го раствора
фенола.
Картофельно-минеральный агар
Водопроводная вода...................... 900 мл
Указанный выше картофельный отвар . . . 100 »
Глюкоза..................................3.0 г
(NH4)2SO4................................0.2 »
КС1......................................0.1 »
NaCl.....................................0.1 »
MgSO4 • 7Н2О.............................0.1 »
1%-й раствор фенола....................... 4 мл
Мел.....................................В осадке
Агар..................................... 20 г
На этой среде колонии фосфорных бактерий, по Одоевской, легко
отличимы благодаря своему характерному виду. Они крупные,
слизистые, окружены четко выраженными зонами. Автор указы-
вает на значительное снижение численности фосфорных бакте-
рий в итоге прибавления фенола.
Гидролиз фосфорсодержащих органических соединений про-
изводится многими микроорганизмами, обладающими фермен-
тами фосфатазами; предполагается, что существует 15—20 фер-
ментов, принадлежащих к этой группе, отличающихся один от
другого по химической природе гидролизуемого ими субстрата.
Фосфатаза действует на нуклеиновую кислоту и лецитин совместно
с другими ферментами, в конечном итоге происходит отщепле-
ние фосфатов через ряд промежуточных соединений.
Для определения наличия микроорганизмов, обладающих
фосфатазой, может быть применен следующий метод (Красиль-
ников и Котелев, 1957; Котелев, 1958). Высевы производят на
твердую среду (МПА, среду Чапека или крахмально-аммиачную)
в таком разведении, чтобы колонии выросли раздельно одна от
другой; после прорастания колоний чашку с выросшими на ней
колониями заливают слоем агаризованной буферной среды с фе-
нолфталеинфосфатом натрия и помещают в холодильник на 24—
48 час., после чего фосфатазу выявляют заливанием на внутрен-
нюю поверхность крышки чашки 2—3 капель аммиака. Под воз-
284
действием фосфатазы реактив расщепляется на свободный фенол-
фталеин и фосфор. Аммиак, диффундируя в среду, дает с осво-
бодившимся фенолфталеином красное окрашивание колоний,
обладающих фосфатазой, и агара около них.
Среду с феполфталеинфосфатом натрия готовят следующим
образом. К 0.1 н. раствору NH4C1 прибавляют 0.1 % MgSO4 • 7Н2О,
0.05/6 уксуснокислого натрия и 0.7% отмытого белого агара.
Агар растворяют на водяной бане и раствор охлаждают до 45—
50° С, после чего к нему прибавляют 0.1% фенолфталеинфосфата
натрия, предварительно растворенного в небольшом количестве
дистиллированной воды (2—5 мл).
Для определения фосфатазной активности чистых культур
используется вышеуказанная среда с фенолфталеинфосфатом
натрия. Чистые культуры выращивают на питательном агаре
Р. А. Менянной сплошным газоном. Свежеприготовленную среду
с фенолфталеинфосфатом натрия разливают в большие (диаметром
12 см) чашки Петри слоем 2—3 мм. После остывания агара па его по-
верхность наносят блоки из агаровой среды, на которой выращена
исследуемая культура. Блоки вырезают пробкорезом, диаметром
около 8 мм и устанавливают на агар стороной, содержащей налет
бактерий. В чашки с установленными таким образом блоками
наливают для поддержания стерильности несколько капель то-
луола и оставляют их на 2 суток для диффузии бактериальных фос-
фатаз в агар с фенолфталеинфосфатом натрия. Через 2 суток пере-
ворачивают чашки крышками вниз и на внутреннюю часть крышек
наносят несколько капель концентрированного аммиака. Газо-
образный аммиак проникает в агар с фенолфталеинфосфатом нат-
рия, и в местах, где в результате воздействия фосфатаз появился
свободный фенолфталеин, наблюдается красная окраска.
Может быть использован следующий прием (Наумова, 1961).
Культуру выращивают на МПА или на агаре Менкиной в чашках
Петри, смывают бактериальный налет, полученную взвесь раз-
бавляют в 10 раз дистиллированной водой и разливают в пробирки
или колбы. В каждую пробирку наливают по 2 или 1 мл забуфе-
ренного субстрата (0.1% фенолфталеинфосфата натрия в 1 н.
аммиачной буферной смеси с pH 9.8) и по 3 капли хлороформа
в качестве антисептика. Пробирки закрывают пробками и помещают
в термостат при 37—38° С. Через различные промежутки времени
регистрируют цвет жидкости в пробирках. Красное окрашивание
свидетельствует о присутствии фосфатазы.
ГЛАВА 10
МЕТОДЫ КУЛЬТИВИРОВАНИЯ
ЖЕЛЕЗОБАКТЕРИЙ
Железобактерии широко распространены в водоемах различ-
ного типа. Часто они достигают массового развития, окрашивают
в желтоватый цвет воду и покрывают налетом ржавчины дно.
Железобактериям принадлежит основная роль в образовании
в озерах железо-марганцевых конкреций.
Условием, определяющим развитие железобактерий в водоемах,
является наличие соединений железа. Железо в природных во-
дах встречается часто в самых разнообразных неорганических
соединениях, находящихся между собой в динамическом равно-
весии. Помимо этих соединений железа, в природных водах могут
присутствовать органические соединения его, а также сложные
содержащие железо комплексы и взвеси содержащих железо
минералов.
Группа железобактерий включает в себя виды, различно
относящиеся к органическому веществу: одни пз них являются
автотрофами и живут в водоемах с чистой водой, содержащей
растворенное двууглекислое закисное железо, другие являются
миксотрофами, третьи — гетеротрофами, обитающими на поверх-
ности водных растений и водорослей в водах, содержащих зна-
чительные количества органических веществ.
Одни железобактерии требуют для своего развития более
низкого pH, другие, использующие органическую часть гуматов
железа, встречаются в водоемах с более щелочной водой.
Общих методов для культивирования железобактерий нет,
а ряд форм их до сих пор вообще не получен в культурах. Систе-
матика железобактерий требует еще накопления фактического
материала, проведения специальных исследований по отдельным
видам и уточнения их описаний. Поэтому при изучении желе-
зобактерий водоема должен быть использован ряд питатель-
ных сред.
Самым простым способом определения наличия железобакте-
рий в водоемах является микроскопический просмотр пластинок
обрастания и мембранных фильтров, через которые профильтро-
ван определенный объем воды. Препараты обрабатывают 2—5?о-м
раствором желтой кровяной соли в течение 2—3 мин., затем
286
Рис. 144. Поплавок с покров-
ными стеклами для прикреп-
ления железобактерий (по
Холодному, 1953).
5%-й соляной кислотой в течение 1—2 мин. и окрашивают эри-
трозином (5%-й раствор в 5%-й карболовой воде). Это позволяет
рассмотреть клетки железобактерий, окрашивающиеся в красный
цвет, их железистые чехлики и стебельки, окрашивающиеся
в синий цвет. Если эти растворы окажутся крепкими, могут быть
использованы более слабые (2%-е). При микроскопии пластинок
обрастания железобактерии могут быть определены на них до
вида.
Видоизменение этого способа окраски железобактерий пред-
ложено Майерсом (Meyers, 1958). По Майерсу, 10 мл суспензии
железобактерий центрифугируют и каплю центрифугата наносят
на чистое предметное стекло, высушивают на воздухе и фиксируют
погружением на 15 мин. в метиловый спирт. Смешивают равные
объемы 2%-го раствора желтой кро-
вяной соли и 5%-й уксусной кисло-
ты, приготовленные на дистиллиро-
ванной воде, и нагревают до кипе-
ния. Препарат погружают на 2 мин.
в этот горячий раствор. Промывают
водой и затем докрашивают препа-
рат 2%-м водным сафранином. Снова
промывают и высушивают. Клетки
окрашиваются в красный цвет, от-
ложения железа в синий.
Железобактерии могут быть об-
наружены следующими способами.
1. Вода, взятая прибором из ис-
следуемого водоема, помещается в
широкогорлые склянки. При наличии железобактерий уже на
следующий день в банке появляются хлопья, похожие на вату,
в которых, обработав препараты вышеуказанным образом, можно
обнаружить железобактерии.
2. Вода помещается в аквариум (банку) вместе с илом из того же
водоема. Через некоторое время, по оседании ила, над ним в слое
воды появляются ватообразные скопления, а затем и ржавые
пятна. Н. Г. Холодный (1953) рекомендует помещать на поверх-
ность воды в таких аквариумах плоскую корковую пробку,
в нижнюю сторону которой воткнуто несколько покровных сте-
кол (рис. 144). Такую пробку оставляют свободно плавать в аква-
риуме в течение приблизительно 24 час. За это время к поверх-
ности стекол успевает прикрепиться много железобактерий.
Пробку извлекают из воды, с покровных стеклышек осторожно
фильтровальной бумагой удаляют воду, высушивают их на воз-
духе, фиксируют п окрашивают. На дно аквариума помещают
предметные стекла в вертикальном положении.
Для получения культур железобактерий предложен ряд
сред.
287
Среда Виноградского
Дистиллированная вода................ 1000 мл
NH4NO3............................... 0.5 г
NaNO3................................ 0.5 »
К2НРО4............................... 0.5 »
MgSO4 • 7Н2О......................... 0.5 »
СаС12 • 6Н2О......................... 0.2 »
Железоаммонийная соль лимонной кислоты . . 10 »
Эта среда может быть использована в качестве твердой при
добавлении в нее 1.5% агара.
Среда Лиске
В воду исследуемого водоема прибавляют немного ила из него,
железные опилки и немного экстракта из опавших листьев —
столько, чтобы жидкость не приняла желтого цвета. Для получения
обогащенных культур следует сделать несколько пересевов.
Среда с углекислым железом
Дистиллированная вода................ 1000 мл
(NH4)2SO4............................1.0 г
MgSO4 • 7Н2О.........................0.05 »
К2НРО4...............................0.1 »
Ca(NO3)2 • 4Н2О......................0.02 »
FeCO3................................0.05 »
Среда Превэ
Дистиллированная вода.................. 1000 мл
Агар...................................0.25 г
FeSO4 • 7Н2О .......................... 0.005 »
(NH4)2Fe(SO4)2 • 6Н2О.................. 0.005 »
NaHCO3.................................0.03 »
КС1....................................0.03 »
(NH4)2SO4..............................0.03 »
(NH4)2CO3..............................0.03 »
Глюкоза................................0.2 »
Аспарагин..............................0.1 »
К2НРО4.................................Следы
pH 6.0
Культивирование ведут при 13—18° Cf
Среда Мейера
1000 мл
1.5 г
0.05 »
Дистиллированная вода..................
(NH4)2SO4..............................
КС1....................................
MgSO4 • 7Н2О........................0.5 »
К2НРО4..............................0.05 »
Ca(NO3)2 • 4Н,0.....................0.01 »
NaHCO3 . . “........................0.03 »
Раствор микроэлементов (стр. 268) ... 1 мл
288
Среда разливается по 100 мл в конические колбы емкостью
250 мл и стерилизуется в автоклаве, после чего в нее вводится
асептически раствор железа в количестве 10 мл в каждую колбу.
Раствор ионов железа готовится следующим образом:
FeSO4 • 7Н2О ............................10 г
Дистиллированная вода...................100 мл
Раствор стерилизуется фильтрованием через ультрафильтр
(могут быть использованы мембранный фильтр № 1 или № 2,
фильтр Беркефельда или др.). Среда получается слегка опалес-
цирующей и имеющей pH около 6.5.
Агар Лиске
Дистиллированная вода................ 1000 мл
Мн(СН3СОО)2........................... 0.1 г
Агар....................................10 »
Развитие гетеротрофных железобактерий может быть получено
по В. О. Калиненко (1946): 1) на пептонной воде с органическим
железом:
Водопроводная вода ................... 1000 мл
Лимоннокислое железо....................1.0 г
КН2РО4.................................0.05 »
Пептон........<.......................5.0 »
2) на растворах кальцевых солей органических кислот с ни-
тратами и следами К2НРО4;
3) на воде исследуемого водоема при добавлении в нее креп-
кого отвара сена (20 мл на каждый литр) и кремнекислого железа
(20—40 мг/л).
Калиненко указывает, что для получения развития гетеро-
трофных железобактерий лучше использовать твердые среды,
на которых производить посевы свежеполученным из водоема
материалом путем размазывания микроскопических количеств
его по поверхности среды.
Для отдельных видов железобактерий, отличающихся по своим
физиологическим особенностям, разработаны специальные среды
и методы культивирования.
Железобактерии рода Leptothrix (рис. 145, А—Г) легко по-
лучить в культуре по методу Виноградского. На дно стеклянного
цилиндра высотой около 50 см помещают небольшое количество
вываренного в воде сена. Затем туда вносят немного свежеосажден-
ного гидрата окиси железа и цилиндр наполняют водой иссле-
дуемого водоема. В сосуде быстро начинает идти анаэробное
разложение растительных остатков, гидроокись железа подвер-
гается восстановлению, конечным продуктом которого является
растворимый в воде бикарбонат закиси железа. Он диффундирует
19 А. Г. Родина
289
Рис. 145. Железобактерии (по Холодному, 1953; Красильникову,
1949).
I, Ь’ -- Leptothrix ochracea Ktitzing; В L. crass a Cholodny; Г — L. sideropous
Molisch; Д — Crenothrix polyspora Cohn; E — Gallionclla ferruginea Ehrenberg;
Ж — Spirophylum ferrungineum Ellis; 3 — Gallionclla comeola Dorff; И — G.
planctonlca Rasumov; к — Siderocapsa coronata Redinger; JI — S. major Molisch.
вверх, и на границе распространения кислорода в сосуде по-
являются хлопья железобактерий.
Пышное развитие видов рода Leptothrix можно получить по
Гэнтеру и Шварцу на пептоно-марганцевой среде.
Среда Гэнтера и Шварца
Готовят и стерилизуют растворы:
1) 0.025%-й раствор пептона;
2) 0.005 %-й раствор Мп(СН3СОО)2 (уксуснокислый марганец);
3) отвар листьев ивы.
Отвар листьев ивы готовят следующим образом: 12—15 г
высушенных листьев заливают 1 л воды, нагревают в аппарате
Коха 15 мин., фильтруют, разливают по пробиркам и стерилизуют
текучим паром.
Среда должна содержать:
Отвар листьев ивы........................1 мл
Раствор Мп(СН3СОО)2......................1 »
Пептонная вода ..........................1 »
Дистиллированная вода....................8 »
Среда с pH между 5.8 и 6.8 дает оптимальные условия для
развития видов этого рода.
Чистые культуры получают многочисленными пересевами
на указанной среде с 1 % агара.
Развитие Leptothrix может быть получено и на других твердых
средах, в частности на среде с железоаммонийной солью лимон-
ной кислоты.
Среда с железоаммонийной солью лимонной кислоты
Вода исследуемого водоема............... 1000 мл
Мп(СН3СОО)2.............................0.75 г
Железоаммонийная соль лимонной кислоты. . 0.75 »
Пептон..................................0.25 »
Агар..................................... 10 »
Колонии Leptothrix легко распознаются по их коричневой
окраске.
Для получения в культуре автотрофного вида Gallionella
ferruginea (рис. 145, Е) используются специальные среды.
Среда Лиске
Дистиллированная вода................. 1000 мл
(NH4)2SO4.............................1.5 г
КС1...................................0.05 »
MgSO4 • 7Н2О..........................0.05 »
К2НРО4................................0.05 »
Ca(NO3)2 • 4Н2О.......................0.01 »
19*
291
Для приготовления этой среды следует использовать соли
высокой степени чистоты. При культивировании автотрофов ре-
комендуется употреблять вымытую хромовой смесью посуду.
Среду разливают в высокие прямые склянки по 30 мл, после
стерилизации выдерживают для установления газового равнове-
сия с атмосферным воздухом. Перед посевом в каждую склянку
вносят железо в виде железных опилок или плоских кусочков
(3% по весу) или свежеосажденное сернистое железо (FeS).
FeS осаждают Na2S из раствора FeSO4, осадок центрифугируют
со свежепрокипяченной для удаления воздуха дистиллированной
водой.
Итерсон указывает, что культуры Gallionella лучше выращи-
вать в атмосфере, обогащенной углекислотой (до 1 % СО2), хотя
это и не обязательно. Рост Gallionella легче получить при низких
температурах (6° С). Виды Gallionella на неорганической среде,
богатой ионами железа, развиваются хлопьями главным образом
на дне сосуда.
Среда Лиске при добавлении в нее лиственного экстракта
может быть использована и для других видов железобактерий
(Iterson, 1958). Лиственный экстракт готовят нагреванием в авто-
клаве свежих листьев столового салата (Lacthuca sativa) в водо-
проводной воде в течение 20 мин. Жидкость содержит ионы Fe++
и имеет pH около 6.6. pH поднимают до 7.4, цвет жидкости при этом
изменяется в красноватый. Жидкость переливают в бутылки и
снова стерилизуют.
Среда Ван-Пиля
NH4C1................................0.05 г
К2НРО4...............................0.03 »
MgSO4 • 7Н2О.........................0.02 »
Na2CO3 ...............................0.01 »
Дистиллированная вода................ 1000 мл
В качестве источника ионов железа употребляется свежеосаж-
денный FeS. Через приготовленную среду пропускают смесь
газов, состоящую из азота с добавлением 7—15% кислорода и
5% СО2. Это вызывает изменение реакции среды (первоначально
pH 8-9, затем 6—7). Посевы выдерживают при комнатной темпе-
ратуре в контейнерах, содержащих 5% СО2.
К вышеперечисленным средам для создания наиболее опти-
мальных для железобактерий условий рекомендуется прибавлять
растворы витаминов и микроэлементов (по Итерсон).
Раствор витаминов на 1 л среды
Аневрин (витамин В4) .................0.2 мкг
Рибофлавин (витамин В2)...............0.2 »
Кальциевая соль пантотеновой кислоты .0.2 »
Пиридоксин (витамин Вв)...............2.0 »
Парааминобензойная кислота............0.6 »
292
Биотин............................. 0.002 мкг
Никотиновая кислота................0.04 »
Фолиевая кислота...................0.2 »
Витамин В12 .......................Следы
Раствор микроэлементов (прибавляется в среду
в количестве 1%)
ZnSO4 • 7Н2О ..........................4.4 мг
СаС12 • 6Н2О ..........................1.0 »
МоО3...................................3.0 »
ВаСО3.......................................»
Co(NO3)2 • 6Н20........................2.5 »
Н3ВО3..................................56 »
KJ ....................................1.3 »
A12(SO4)3 • 6Н2О....................... 250 »
Кремнекислота..........................Следы
Дистиллированная вода.................. 1000 мл
Среда Кучера и Вульфа
Дистиллированная вода............... 1000 мл
NH4C1...............................1 г
К2НРО4..............................0.5 »
MgSO4 • 7Н20........................0.2 »
СаС12 • 6Н9О........................0.1 »
Наполняют на —1/2 объема стерильной питательной средой
стерильные сосуды.
Затем в течение 1—2 мин. пропускают СО2 и осторожно, не
взмучивая среду, вносят стерильную суспензию FeS в избытке.
Суспензию готовят смешением равных объемов нагретых до кипе-
ния молярных растворов железоаммиачных квасцов и Na2S.
После осаждения сульфид железа промывают декантацией и сте-
рилизуют. Для удобства наблюдения в засеянные сосуды опус-
кают стекла, к которым и прикрепляется Gallionella.
Для сохранения культуры пересевы необходимо делать не
реже одного раза в неделю.
Развитие автотрофного вида Ferrobacillus ferrooxidans (Col-
mer, Temple, Hinkle) можно получить на специальной среде
Сильвермана и Лэнгрюна.
Среда Сильвермана и Лэнгрюна
Дистиллированная вода................. 700 мл
(NH4)2SO4.............................3.0 г
КС1...................................0.1 »
К2НРО4................................0.5 »
MgSO4 • 7Н2О..........................0.5 »
Ca(NO3)2 • 4Н2О.......................0.01 »
0.1 н. раствор H2SO4.................... 1 мл
14.74%-й раствор FeSO4 • 7Н2О......... 300 »
293
Авторы указывают, что Ferrobacillus ferrooxidans лучше раз-
вивается во встряхиваемых культурах.
Методы, сходные с указанными для культивирования железо-
бактерий, используются для бактерий, окисляющих марганец.
Среда для бактерий, окисляющих марганец
Водопроводная вода................... 900 мл
Насыщенный раствор бикарбоната марганца .100 »
NaHCO3..................................0.1 г
(NH4)2SO4...............................0.1 *
К2НРО4..................................Следы
MgSO4 • 7Н2О......................... »
Бикарбонат марганца получают, пропуская ток СО2 через
суспензию МпСО3. Среду стерилизуют текучим паром.
Среда Заварзина для Metallogenium simbioticuni
Среда Лиске без железа (стр. 291) . . . . 1000 мл
Мп(СН3СОО)2............................ 0.1 г
Выщелоченный агар .....................15 »
ГЛАВА 11
КУЛЬТИВИРОВАНИЕ ПИГМЕНТНЫХ И СВЕТЯЩИХСЯ
МИКРООРГАНИЗМОВ.
МЕТОДЫ ПОЛУЧЕНИЯ КУЛЬТУР АКТИНОМИЦЕТОВ
КУЛЬТИВИРОВАНИЕ ПИГМЕНТНЫХ МИКРООРГАНИЗМОВ
Водоемы являются средой обитания многих пигментных микро-
организмов. Пигменты бактерий разнообразны по химическому
составу. Их образование часто связано с составом среды. Для
выявления и культивирования пигментных бактерий рекомен-
дуются среды, в составе которых имеются ионы магния.
Среда для бактерий, образующих красные пигменты
Дистиллированная вода............. 1000 мл
Аспарагин........................... 10 г
Глюкоза ............................ 10 »
NaoC03............................ 0.25 •>
К2НРО4............................... 3 »
MgSO4 • 7Н2О...................... О.4 »
Агар................................ 15 »
Среда Оме л янского
Дистиллированная вода..................
Мясной экстракт.........................
Глицерин ...............................
(NH<)aHPO4
MgSO4 • 7НаО
КНаРО4 . .
Агар ....
1000 мл
1 г
10 »
2 »
0.5 »
1 »
20 »
Среда Салле
Дистиллированная вода................ 1000 мл
Дрожжевой экстракт...................... 5 г
Пептон.................................. 5 »
Глюкоза................................ 10 »
Агар................................... 20 »
Среда Коссовича
Дистиллированная вода................ 1000 мл
Сахароза.............................30 г
КН2РО4...............................2.5 »
(NH4)2HPO4...........................2.5 »
295
MgSO4 • 7H2O...........................2.5 г
NH4C1..................................2.0 »
Ca3(PO4)2..............................0.05 »
Среда для Chromobacterium violaceum Bergonzini
Дистиллированная вода................. 1000 мл
Фибрин..................................10—20 г
КС1...................................0.02 г
Агар..................................20 г
Среда для Pseudomonas aeruginosa Migula
Дистиллированная вода................ 900 мл
Мясо-пептонный бульон.................100 »
Пептон................................. Юг
Глюкоза................................ 5 »
К2НРО4................................. 1 »
MgSO4 • 7НаО........................... 2 »
Среды для Serratia marcescens Berg, et al.
А. Дистиллированная вода.............. 1000 мл
(NH4)2HPO4 ........................5 г
K2HPO4 ..........................5 »
Na2SO4...........................0.5 »
MgSO4 • 7HoO.....................4 »
NaCl . . .“......................4 »
FeSO4 • 7H2O.....................4 »
MnSO4 • 5H2O.....................4 »
pH 7.2
В. Дистиллированная вода............ 1000 мл
Пептон..............................10 г
Аспарагин .......................... 2 »
CH3COONa • ЗН2О..................... 2 »
К2НРО4 ............................. 1 »
MgSO4 • 7НаО......................... 0.5 »
Агар................................20 »
Среду подкисляют 2 каплями молочной кислоты.
Среда Омелянского для Bacillus mesentericus niger Lunt
п его разновидностей
Дистиллированная вода............... 1000 мл
Пептон.................................10 г
Мясной экстракт........................10 »
К2НРО4................................. 1 »
MgSO4 • 7Н2О....................... . 0.5 »
Агар..............................' . . 20 »
Хорошей средой для многих пигментных бактерий являются
ломтики картофеля, слегка натертые мелом.
Кооп (Согре, 1951) предложил следующий прием для обнару-
жения пигментных бактерий в почвах: 5 г грунта помещается в сте-
296
рильную чашку Петри и распределяется стерильным шпателем
равномерным слоем. Стерильные (предварительно сваренные)
зерна риса разбрасываются на поверхность почвы, грунта. Чашки
инкубируются 5 суток. Пигментные бактерии вырастают на зер-
нышках риса. Этот прием может быть использован для обнаруже-
ния пигментных бактерпй только в грунтах. Он оказался малопри-
годным для обнаружения пигментных бактерий в воде.
Среда для Rhodopseudomonas Czurd Maresch
Дистиллированная вода................ 1000 мл
Пептон................................. 2 г
Дрожжевой экстракт..................... 2 »
Молочнокислый кальций.................. 5 »
Лецитин................................ 2 »
pH 7.6
Среда Вуди и Линдстрема для Rhodospirillum rubrum Molisch
Дистиллированная вода................ 1000 мл
Молочнокислый натрий.................5 г
Дрожжевой экстракт...................5 »
К2НРО4...............................5 »
Уксуснокислый калий .................0.4 »
СаС12 • 6Н2О.........................0.02 »
Усредняется КОН до pH 7.2.
Красные пигменты представителей этих двух родов (Rhodo-
pseudomonas и Rhodospirillum), имеющие в составе бактериопур-
пурин и бактериовиридин, образуются лучше в анаэробных усло-
виях, при наличии органических веществ и солей молочной ки-
слоты.
КУЛЬТИВИРОВАНИЕ СВЕТЯЩИХСЯ БАКТЕРИЙ
Выделяются светящиеся бактерии главным образом из мор-
ских субстратов. Одни светящиеся бактерии развиваются на более
простых средах, другие — наболев сложных (Омелянский, 1940).
Поэтому для культивирования их предложен ряд сред.
1. Дистиллированная вода . . 1000 мл
Свежий судак............... 500 г
NaCl.......................30 »
Пептон.....................10 »
Аспарагин.................. 5 »
К2НРО4..................... 1 »
MgSO4 • 7Н2О.............. 0.5 »
Агар.......................20 »
2. Водопроводная вода .... 1000 мл
NaCl ........................ 30 г
Пептон..................... 10 »
Глицерин.................... 5 »
Желатина..............100 г
3. Водопроводная вода . . 1000 мл
Пептон................ 10 г
Глицерин.............. 20 »
NaCl.................. 30 »
4. Отвар из рыбы .... 1000 мл
NaCl ..................30 г
Глицерин................10 »
Пептон..................10 »
Аспарагин............... 5 »
Желатина................ 5 »
297
5. Водопроводная вода . . . 900 мл
Дрожжевая вода............100 »
Декстрин.................. 5 г
Пептон................... 10 »
NaCl..................... 30 »
Агар..................... 18 »
МЕТОДЫ КУЛЬТИВИРОВАНИЯ АКТИНОМИЦЕТОВ
Актиномицеты, или лучистые грибки, являются одной из ши-
роко распространенных в водоемах групп микроорганизмов.
Они могут составлять от 15 до 40% всех развивающихся на мясо-
пептонных средах колоний. Актиномицетов находят как в слабо-
проточных водоемах (таких, как озера и водохранилища), так и
в текучих водах (реках, ручьях и др.). Водная толща содержит
относительно небольшие количества актиномицетов, грунты же
часто бывают богаты ими. Массовое развитие актиномицетов
в грунтах (более 1 млн на 1 г cyxoto ила) бывало причиной воз-
никновения землистых запахов в воде.
Актиномицеты имеют хорошо развитый ветвящийся мицелий
с гифами, не разделенными на клетки (т. е. без поперечных пере-
городок). Гифы актиномицетов обычно топкие (0.6—0.8 мк),
лишь у немногих видов гифы более широкие (до 1.2 мк в попереч-
нике). Длина гифов различна, различают мицелии длинногифные
и короткогифные (рис. 146, А).
Па плотных питательных средах актиномицеты образуют ко-
жистые или хрящеватые врастающие в агар колонии такой плот-
ности, что они снимаются иглой только целиком. Над поверхно-
стью такой колонии образуется воздушный мицелий, благодаря
которому они легко отличимы от колоний микробов — поверх-
ность колоний у актиномицетов мучнистая, пушистая или
бархатистая. На ветвях воздушного мицелия образуются споро-
носцы — нити, несущие споры. Спороносцы у разных видов актп-
номицетов бывают спиральными или прямыми, одиночными или
Собранными в мутовки (рис. 146, Б). На концах спороносцев об-
разуются споры — всегда цепочками.
Обнаружение актиномицетов в воде и грунтах может быть про-
изведено методом разливок — засевом в ту или иную питательную
среду.
Актиномицеты очень различны в своих требованиях к пита-
тельному субстрату. Одни из них растут на сложных органиче-
ских веществах, другие развиваются и на простых соединениях.
Подавляющее большинство актиномицетов может развиваться
не только в условиях, благоприятствующих им, ио и в условиях
неблагоприятных. Актиномицеты разлагают белки, мочевину,
аминокислоты и более простые азотистые вещества. Наилучшими
источниками азота для актиномицетов являются протеины, пеп-
тоны и аминокислоты, но они используют и нитраты, и соли ам-
мония, а некоторые виды — и нитриты. Аммоний сульфатов
298
является для актиномицетов более подходящим источником азота,
чем хлористый аммоний.
Как источник углерода актиномицеты могут использовать
разнообразные углеродистые соединения, как азотистые, так и
безазотистые. Наилучшими источниками углерода для актиноми-
Рис. 146. Мицелий актиномицетов (Л) и снороносцы (Б).
А: 1 — длишюгифкый, ? — короткогпфный: Б. 1 — прямые, ? — спиральные,
3 — мутовчатые.
цетов являются сахара (глюкоза, мальтоза), некоторые органи-
ческие кислоты (такие, как уксусная, яблочная, лимонная),
многоатомные спирты (маннит, глицерин), крахмал и др. Они
могут использовать также и другие спирты, углеводороды арома-
тического ряда, гемицеллюлозы, лигнин, а некоторые виды и клет-
чатку и каучук. Описаны актиномицеты, разлагающие нефтяные
продукты (керосин, бензин, нафталин, парафин) и растительные
воски.
Способность актиномицетов разлагать различные органиче-
ские соединения обусловливает значение их в природе: в водоемах,
почве, компостах и др. В водоемах актиномицеты осуществляют
разложение органических растительных и животных остатков,
освобождение аммиака из сложных протеинов. Многими исследо-
вателями отмечено благоприятное влияние, которое они оказывают
на развитие растений. Актиномицеты образуют различные пиг-
менты: фиолетовый, красный, розовый, черный и бурый, многие
из них окрашивают среду в цвета от темно-бурого до черного.
Имеются данные, что актиномицеты могут вызвать окрашивание
серых илов в черный цвет — процесс этот сопровождается передви-
299
жением кальция и железа в верхние слои ила. Они могут содей-
ствовать осаждению кальция в виде СаСО3.
Наиболее благоприятна для этой группы слабощелочная среда,
но некоторые виды актиномицетов развиваются и при понижен-
ных значениях pH.
Некоторые актиномицеты образуют такие продукты обмена, ко-
торые способны тормозить рост бактерий и других видов актиноми-
цетов. Многие из них способны лизировать клетки бактерий, особен-
но спороносных. Одни виды актиномицетов подавляют развитие
азотобактера, другие усиливают его рост. Массовое развитие ак-
тиномицетов в грунтах имеет огромное значение для развития
других бактерий.
Для определения актиномицетов могут быть использованы сле-
дующие признаки: вид колоний на плотных питательных средах,
образование воздушного мицелия, поднимающегося над колонией;
рост на жидких питательных средах (актиномицеты в жидких
средах никогда не образуют мути, а растут в виде отдельных
хлопьев или колоний, сливающихся затем на поверхности среды
в пленку); характер спороносцев на воздушном мицелии
(рис. 146, Б); положительная окраска по Граму нитей в молодом
возрасте.
Сред для выращивания актиномицетов предложено очень
много.
1. Агар Чапека
Сукроза (глюкоза или глицерин).......30.0 г
NaNO3...................................2.0 »
К2НРО4..................................1.0 »
MgSO4 • 7Н2О............................0.5 »
КС1 ....................................0.5 »
FeSO4 • 7НаО ..........................0.01 »
Агар................................... 15.0 »
Мел.....................................3.0 »
Дистиллированная вода................ 1000 мл
pH 7.0—7.3
2. Глюкозо-аспарагиновый агар
Глюкоза.................................10.0 г
Аспарагин.............................. 0.5 »
К2НРО4................................. 0.5 »
Агар....................................15.0 »
Дистиллированная вода................. 1000 мл
pH 6.8
Может быть добавлен мясной экстракт в количестве 2 г/л.
3. Глицерино-аспарагиновый агар
Глицерин............................... 35 мл
Натриевая соль аспарагиновой кислоты . . 3.5 г
Молочнокислый аммоний.................. 6.5»
300
К2НРО4................................. 2.5 г
СаС12 • 6Н2О........................... 0.1 »
NaCl................................... 1.0 »
MgSO4 • 7Н2О........................... 0.3 »
Агар...................................20.0 »
Дистиллированная вода................ 1000 мл
pH 7.0
4. Тирозиновый агар
Глюкоза................................10.0 г
Тирозин................................ 1.0 »
(NH4)2SO4.............................. 0.5 »
КаНРО4................................. 0.5 »
Агар...................................15.0 »
Дистиллированная вода................ 1000 мл
pH 7.0
5. Мясо-пептонный агар с добавлением 10 г глюкозы
или 15 г глицерина
6. Мясо-пептонная желатина
7. Глюкозо-пептонный агар
Пептон..................................10.0 г
Мясной экстракт......................... 5.0 »
Глюкоза.................................10.0 »
КН2РО4.................................. 1.0 »
MgSO4 • 7Н2О........................... 0.5 »
КС1.................................... 0.5 »
Агар.................................20 »
Дистиллированная вода................ 1000 мл
Чтобы уменьшить образование воздушного мицелия, коли-
чества органических компонентов в среде могут быть взяты
меньшими — от 1/а до указанных количеств.
8. Глюкозо-пептонная желатина
9. Водная желатина
Желатина................................ 100—200 г
Водопроводная вода..................... 1000 мл
pH 7.4
10. Крахмальный агар А
Растворимый картофельный крахмал .... 10.0 г
КаНР04................................ 0.3 »
MgCO3.................................. 1.0 »
NaCl.................................. 0.5 »
NaNO3.................................. 1.0 »
Агар..................................15.0 »
Дистиллированная вода................ 1000 мл
301
11. Крахмальный агар Б
Растворимый картофельный крахмал ... 2.0 г
К2НРО4..............................0.5 »
MgSO4 • 7Н2О........................0.2 »
СаС12-бН2О..........................0.05 »
NaNO3...............................0.05 »
Аспарагин...........................0.05 »
Fe2(SO4)3 • 9НаО....................Следы
Выщелоченный в воде агар............20.0 г
Дистиллированная вода............... 1000 мл
pH 7.4
12. Картофельный агар
Очищенный картофель.................. 500 г
Пептон................................ 10 »
Мясной экстракт....................... 10 »
Агар.................................. 15 »
Водопроводная вода . ............... 1000 мл
pH 7.0
Очищенный и отвешенный картофель нарезают маленькими
кусками, добавляют 350 мл воды и кипятят в течение 45 мин.
Экстракт пропускают через тонкую бумажную ткань.
Д'
13. Картофельно-глюкозный агар
Очищенный картофель.................. 300 г
Глюкоза................................ 5 *
Агар.................................. 20 »
Водопроводная вода .................К ХМ) мл
pH 6.8—7.2
14. Агар с дрожжевым экстрактом
Дрожжевой экстракт.................... 10 г
Глюкоза............................... 10 »
NaCl................................... 1 »
MgSO4 • 7Н2О.........................0.25 »
FeSO4 • 7Н2О .......................0.01. »
Агар.................................. 15 »
Дистиллированная вода............... 1000 мл
15. Соевый агар
Соевая мука........................... 10 г
Глюкоза............................... 10 »
NaCl................................ . 1-5 »
СаСО3............................... 1 »
Агар.................................. 15 »
Дистиллированная вода............... 1000 мл
16. Агар на почвенном экстракте
Мясной экстракт........................ 3 г
Пептон................................. 5 »
302
Почвенный экстракт...................... 1000 мл
pH 7.0
Почвенный экстракт готовят нагреванием 1 кг садовой почвы
с 2.5 л водопроводной воды в течение 1 часа в автоклаве
при 120° С. Фильтруют горячим. —
17. Среда Красильникова I
Речная или водопроводная вода......... 1000 мл
К2НРО4.................................3.0 г
MgCO3..................................0.3 »
NaCl...................................0.2 »
KNO3..................................1.0 »
FeSO4 • 7H2O ..........................0.001 »
CaCO3................................-0.5 ♦
Сахар................................20.0 »
18. Среда Красильникова 11
Дистиллированная вода................ 1000 мл
Глюкоза...............................10.0 г
КН2РО4.................................2.4 »
К2НРО4.................................5.7 »
(NH4)2SO4 . -..........................2.6 »
MgCl2 • 6Н2О...........................1.2 »
ZnSO4 • 7Н2О ..........................0.01 »
FeSO4 • 7Н2О..........................0.01 »
CuSO4 • 5Н2О ..........................О.006 »
МпС12 • 6Н2О......................... 0.008 »
Лактат натрия.........................11.0 •>
19. Среда Красильникова 111
Дистиллированная вода............... 1000 мл
Глюкоза.............................10.0 г
(NH4)2HPO4.............................2.0 »
NaCl...................................2.0 »
' К2НРО4...............................1.0 >
MgSO4 • 7НоО . . . . F.................0.5 »
СаС12 • 6Н2О...........................0.2 »
FeSO4 • 7НаО ........................ 0.002 »
ZnSO4 • 7Н2О .........................0.01 »
20. Среда Красильникова IV
Водопроводная вода.................... 1000 мл
Сахароза...............................20.0 г
KNO3....................................0.1 »
MgSO4 • 7Н2О..........................0.05 »
КС1...................................0.07 »
КН2РО4................................0.1 »
Ca(NO8)2..............................0.25 »
ГЛАВА 12
ИЗУЧЕНИЕ ОБРАСТАНИЙ
ПЛАСТИНКИ ОБРАСТАНИЯ
Метод пластинок обрастания выявляет микробные пейзажи,
дает возможность установить состав бактериальной флоры вод-
ной толщи и грунтов по морфологическим признакам, выявить
микробные биоценозы, взаимоотношения, складывающиеся в этих
биоценозах между отдельными видами. Для поверхностных слоев
грунтов этим методом можно получить как бы отпечаток микро-
бов, находящихся в отложениях, а в воде — отображение актив-
ности водных бактерий, их экологических взаимоотношений,
реакцию микробов на изменения во внешней среде.
Использованием этого метода удается выявить наличие в во-
доемах таких форм бактерии, которые пе выявляются в культурах.
Применяемые в практике исследования питательные среды не
удовлетворяют потребностей многих форм микроорганизмов, и они
не развиваются в них. Применение пластинок обрастания позво-
ляет обнаружить в водоемах огромное число разнообразных форм,
и среди них такие, как виды Gaulobacter, Hyphomicrobium vul-
gare, Hyphomonas polymorpha, Rhodomicrobium vannielli, виды
Pedomicrobium, Blastocaulis, Blastobacter и др. (рис. 147).
Для получения пластинок обрастания предметные стекла,
тщательно обезжиренные, прикрепляют тем или иным* способом
через определенные промежутки на тросе. Трос, несущий стекла,
с грузом на нижнем конце и поплавком на верхнем опускают в во-
доем (рис. 148). На каждом намеченном заранее горизонте при-
крепляют по два стекла с номерами, нанесенными на одном из
их концов алмазом, корундом или победитом. В журнале запи-
сывают, какие номера поставлены на каких горизонтах.
Установка стекол в воде может быть осуществлена различными
способами. По предложенному нами (Салпмовская-Родина, 1936)
способу одновременно используются две каучуковые трубки раз-
личного диаметра (рис. 149). Одна из них, с более широким про-
светом, служит футляром троса, пропущенного через нее; вторая
трубка, с возможно более узким внутренним просветом, служит
для укрепления стекол, для этого в трубке через определенные
интервалы (1 м или более) по ее длине делают по два надреза,
304
предметные стекла вставляют в эти надрезы при растяжении ре-
зины. Вторая трубка прикрепляется к первой резиновыми кольцами
через некоторые интервалы. При такой установке стекла остаются
целыми, даже когда находятся в водоеме в периоды довольно
сильного волнения.
Стекла можно укрепить и другим способом, например в про-
резях резиновых пробок, надетых на трос через определенные
интервалы (рис. 150).
Зобелл и Аллен (Zobell, 1946) предлагают использовать для
погружения стекол особые приспособления из дерева, пласт-
массы или другого материала. Каждое такое приспособление
несет по 6 стекол. Материал, из которого делают эти приспособле-
ния, имеет существенное значение. Наилучшим является пласт-
масса, так как дерево отдает в воду различные вещества и, следо-
вательно, оказывает какое-то влияние на состав развивающейся
в его непосредственной близости микрофлоры.
Для установки стекол в воде и в иле можно пользоваться при-
способлением, предложенным Г. С. Карзинкиным. Оно состоит
из дощечки 20x25 см, толщиной 0.5 см, по длинным краям кото-
рой с верхней и нижней сторон приделываются деревянные бор-
дюры (рис. 151) с прорезями для установки 24 предметных стекол,
из которых 12 вставляются в нижние прорези и предназначаются
для погружения в ил, остальные 12 — в верхние прорези и при
установке прибора в водоем остаются в придонном слое воды.
К верхней части доски прикрепляется груз. Прибор опускается
на тросе, который может быть использован для прикрепления
стекол в воде одним из описанных способов.
Чтобы избежать воздействия дерева, можно рекомендовать
покрытие деревянных частей парафином.
При невозможности установить стекла непосредственно в грунт,
погружают стекла в пробу грунта тотчас же после ее выемки.
Проба должна находиться под слоем воды. Необходимо учиты-
вать, что в этом случае условия, естественно, отличаются от при-
родных.
Установку со стеклами оставляют стоять в водоеме то или
иное время в зависимости от целей исследования. Скорость обра-
стания стекол микробами зависит от температуры воды, содержа-
ния питательных веществ (и в первую очередь органических),
наличия течений, их силы и др. Обрастания развиваются быстро
в летнее время в хорошо прогреваемых водоемах с высоким содер-
жанием органических веществ, медленно в холодноводных олиго-
трофных водоемах. Средний срок выдержки стекол 3—4 суток.
Стекла, находившиеся в водоемах достаточное для развития
обрастаний виемя, извлекают с соблюдением предосторожностей
от смыва слабо прикрепившихся форм и сразу же помещают
в вертикальном положении в коробки для препаратов. В лабора-
тории стекла высушивают, фиксируют илп абсолютным спиртом,
20 А Г. Родина 30")
Рис. 147. Гаулобактсрии (по Заварзипу, 1961).
А—Б — Gaulobacter Henrici et Johnson; В — Hyphoinicrobium vulgare Stutz, et Hartleb; Г — Rho-
domicrobiumi vannielli Duchow et Douglas; JI - Pedomicrobium Aristovskaia; E — Blastocaulis
sphaerica Henrici et Johnson; Hi — Blastocaulis sp. Henrici et Johnson;!^ — Bl. kljasmicnsis Ra-
zumov; Я, К — Blastobacter Zavarzin; JI — Metallogenium personatuni Pcrfilir\. Cmpe.txa.4v по-
казана последовательность фаз развитии.
Рис. 148. Схема по-
становки стекол на
различных горизон-
тах.
или парами формалина. Последнее предпочтительнее, так как
этим избегают повреждения слабо прикрепившихся форм.
Для лучшего рассмотрения бактериальных биоценозов на
стеклах их окрашивают. Обычно для этого используется 5%-й рас-
твор эритрозина на 5%-й карболовой воде. Окраску ведут, погру-
жая стекла в специальные сосуды. Продолжительность окраски
30—40 мин. После окраски стекла отмывают
осторожным проведением их через ряд сосу-
дов с водой. Стекла затем высушивают и про-
сматривают под микроскопом при иммерси-
онном увеличении. Одно из двух стекол,
установленных на каждом горизонте, можно
перед окраской эритрозином обработать 2—
5%-м раствором желтой кровяной соли в те-
чение 2—3 мин, и затем 5%-й соляной ки-
слотой в течение 1—2 мин. — для более лег-
кой дифференциации могущих развиться на
стеклах железобактерий. При обработке ука-
занным способом железобактерии окрасятся
в красный цвет, железистые футляры и от-
ложения — в синий.
С пластинок обрастания могут быть выде-
лены прикрепившиеся к ним формы для их
изучения и определения. Для этого вынутые
из воды пластинки обрастания немедленно
помещают в стерильные влажные камеры и
в таком виде транспортируют в лабораторию,
где стекла заливают тончайшим слоем твер-
дой питательной среды того или иного со-
става. Процедура эта требует навыка, по-
этому полезно сначала попрактиковаться с
любыми стеклами. Залитые средой стекла
помещают во влажных камерах в термостат.
При постановке нескольких стекол на одном
горизонте можно залить их различными сре-
дами. Элективность сред обеспечивает раз-
витие желаемых групп. Так, при залитии агаром Федорова на
пластинках обрастания вырастают колонии азотобактера. Раз-
витие колоний показывает, что наблюдающиеся на пластинках
обрастания скопления азотобактероподобных клеток действи-
тельно являются скоплениями азотобактера, и свидетельствует
об активном состоянии этого микроорганизма в водной толще
или в грунте. Залитие стекол агаром для дрожжей дает возмож-
ность выявить эти микроорганизмы и т. д.
В случаях, когда стекла должны быть опущены через особенно
обогащенную бактериями поверхностную пленку и слой воды
около судна, загрязненный отбросами, может быть использован
308
специальный прибор, сконструированный 10. И. Сорокиным (1963)
(рис. 152), с помощью которого стекло опускается на нужную
глубину в закрытом сосуде. Обыч-
Рис. 149. Ус-
тановка стекол
в воде (по Са-
лимовской-Ро-
диной, 1936).
но эти предосторожности не нуж-
ны.
Методика пластинок обраста-
ния может быть применена и в
видоизмененном виде. Целью этих
видоизменений является возмож-
ность изучения бактериального
перифитона в ненарушенном жи-
вом виде. К. А. Воскресенский
Рис. 150. Установка стекол
в воде на пробках.
(1947) предложил заменить пред-
метные стекла покровными. По-
кровные стекла вставляются в паз
стеклянной рамки и опускаются в водоем (рис. 153). Для изго-
товления рамки на сильно нагретый прямоугольник из тон-
Рис. 151. Установка стекол в грунтах (по Карзинкину, 1934).
кого стекла наносится полоска состава для подклейки покровных
стекол. Затем нагретая полоска покровного стекла шириной
309
около 5 мм накладывается на полоску склеивающего состава.
Покровные стекла должны плотно прилегать к стеклу рамки,
чтобы обрастания могли развиваться с
Рис. 152. При
бор Сорокина
для погруже-
ния стекол.
1 — сосуд, в ко-
тором опускается
стекло; 2 — стек-
ло; з — пружи-
на; 7 — защелка.
одной стороны.
Для сохранения бактерий обрастаний
в жизнеспособном состоянии Воскресен-
ский рекомендует помещать покровные
стекла в маленький кристаллизатор с во-
дой, дно которого, за исключением сред-
ней части, должно быть предварительно
залито слоем парафина для крепления
стеклянных трубочек, поддерживающих
покровные стекла. Рассмотрение бак-
Рис. 153. Установка покров-
ных стекол (по Воскресен-
скому, 1947).
терий осуществляется при водной им-
мерсии. Обросшая сторона стекла на-
правлена вниз и погружена в воду.
КАПИЛЛЯРНЫЙ МЕТОД ИЗУЧЕНИЯ ОБРАСТАНИЙ
Б. В. ПЕРФИЛЬЕВА
Б. В. Перфильевым разработан капиллярным метод изучения
водного перифитона. Для этого используются плоскопараллель-
ные капилляры, чем создается защита молодых бактериальных
обрастаний от механических повреждений и высыхания. Однако
надо заметить, что внутри капилляров возникают особые условия,
благоприятные для развития одних форм и неблагоприятные
для развития ряда других видов бактерий.
Прибор Б. В. Перфильева назван им капиллярным перифитоно-
метром (рис. 154, Л). Основной частью прибора является ловчая
стеклянная пластина, состоящая из предметного стекла разме-
ром 25.0x75.0x1.0—1.4 мм, на поверхности которой укреплены
(спеканием или с помощью полимеризующегося клея) две стеклян-
310
ные крепежные фигурные планки со щелевыми пазами, обращен-
ные навстречу одна другой. Расстояние между крепежными план-
ками строго определенное: оно соответствует длине (64 мм) смен-
ной части ловчих стеклянных
лент прямоугольного сечения
(2.0x0.5 мм) (рис. 154, Б). На
Рис. 154. Перифито-
нометр (по Перфилье-
ву и Габе, 1961).
А — общий вид: 1 — ко-
нец шнура, закрываю-
щего кассеты: 2 — конец
шнура, открывающего
кассеты; з — трубка, на
которой закреплены кас-
сеты; 4 — защитные
створки; 5 — петля для
подвешивания груза.
Б —ловчая пластина пе-
ри фитонометр а.
Рис. 155. Пелоскоп Пер-
фильева и Габе (по Пер-
фильеву и Габе, 1961).
каждую из ловчих лент насажи-
вается свободно скользящий по
ней отрезок прямоугольного сте-
клянного капилляра длиной 30 мм,
позволяющий применять для ми-
чения микроскопа, включая
кроскопирования начальных ста-
дий обрастаний сильные увели-
иммерсию. На каждой ловчей
стеклянной пластине перифитонометра помещаются четыре снаб-
женные капиллярами ловчие ленты. Для того чтобы ленты не
зи
соприкасались, используются разделители. Разделитель пред-
ставляет собой короткий отрезок (длиной 3 мм) фигурного капил-
ляра, имеющего в сечении С-образную форму. Ловчие пластины
помещают в алюминиевые кассеты, состоящие из двух створок —
одной поворотной, в пазы которой вдвигается стеклянная лов-
чая пластина, и второй — имеющей вид плоской алюминиевой
коробки, защищающей капиллярную часть ловчей пластины от
поломок во время опускания прибора в воду и извлечения его.
Поворотная створка служит для открывания и закрывания кассет.
Перифитонометр снабжается грузом. Прибор опускается в за-
крытом виде, после чего поднятием тросика открывается. По
окончании срока экспозиции кассеты закрываются и в таком виде
прибор извлекается из воды.
Для изучения микрофлоры пелогена иловых отложений
Б. В. Перфильевым сконструирован пелоскоп (рпс. 155). Основу
прибора составляет набор из 4—5 капилляров одинаковой длины
(1—2 см). Такая пачка ячеек скрепляется каучуковым кольцом
и погружается вертикально в ил таким образом, чтобы капилляр-
ные ячейки пересекали горизонт, в котором формируются глав-
ные микрозоны превращения ила. Для обеспечения этого пачку
ячеек закрепляют на стеклянном держателе длиной 65—70 мм.
Сроки выдержки могут быть различными.
Второй вариант прибора — щелевой пелоскоп. Он представ-
ляет собой две стеклянные прямоугольные пластины, соединен-
ные каучуковыми кольцами. Между ними должна быть щель,
которую создают помещением двух тонких стеклянных прокла-
док у верхнего и нижнего концов.
Если задачей исследования является не только изучение мик-
робного пейзажа, но и получение культур путем переноса в пита-
тельную среду, то одна из стеклянных пластин должна быть тон-
кой (толщиной не более 0.16—0.17 мм) и длина и ширина ее должны
соответствовать размерам проточных камер или культуральных
сосудов.
При плотных грунтах Б. В. Перфильев рекомендует нижний
конец опорной пластины заострять как клин для того, чтобы пред-
отвратить поломку пластины при установке.
УСТАНОВЛЕНИЕ БАКТЕРИАЛЬНЫХ ЦЕНОЗОВ
В ВОДОЕМАХ
Выявление состава бактериальных ценозов в водоемах весьма
существенно, так как в любом водоеме, в каждом его биотопе,
развиваются своеобразные сообщества бактерий, способные су-
ществовать в имеющихся условиях. Для установления бактериаль-
ных ценозов наиболее результативно использование прямых
микроскопических методов в их комплексе: сюда должны быть
отнесены микроскопирование в обычном световом микроскопе
312
Рис. 156. Бактериальный ценоз загрязненной воды
(р. Славянка, ниже Павловска).
Рис. 157. Бактериальный ценоз загрязненного грунта
(устье Москва-реки).
мембранных фильтров, используемых для прямого счета, и пла-
стинок обрастания, микроскопирование в сине-фиолетовых лу-
чах живых микроорганизмов при использовании флуорохро-
мов тотчас же после взятия пробы.
При микроскопировании мембранных фильтров могут быть
использованы два приема: 1) зарисовка с рисовальным аппаратом
всех микроорганизмов, находящихся в поле зрения, при рас-
смотрении не менее 30 полей зрения, 2) микрофотография не менее
30 полей зрения и затем учет находящихся в каждом поле зрения
микроорганизмов. Таким путем выявляются преобладающие
формы микроорганизмов, формы, не растущие на используемых
в микробиологической практике средах. Подсчеты количества
различных форм позволяют установить соотношение отдельных
групп микробов в тех или иных ценозах.
Микроскопирование пластинок обрастания в добавление к полу-
ченным данным подтверждает преобладание различных видов,
позволяет выяснить характер их развития и их взаимоотношения
в ценозе. Своеобразие сообществ бактерий воды и грунтов, уста-
новленное указанными выше методами, показывают рис. 156 и 157.
Люминесцентная микроскопия позволяет не только выявить
природные сообщества бактерий, но и наблюдать их при этом в их
естественном состоянии, позволяет судить о природных группи-
ровках бактерий в микробных ценозах того или другого биотопа.
В грунтах этим методом возможно установить не только природ-
ные ценозы, но и распределение микроорганизмов между жидкой
и твердой фазами (рис. 158), что никакими иными методами вы-
явить невозможно. Для выявления микробных ценозов в грунтах
достаточно непосредственного рассмотрения небольшого коли-
чества грунта в люминесцентном микроскопе (в падающем свете)
при добавлении к нему флуорохрома и тушителя. Для выявления
микробных ценозов в воде необходимо предварительное концент-
рирование пробы ультрафильтрацией. Этот прием позволяет
наблюдать и точно воспроизвести размеры и форму клеток в естест-
венных условиях их существования.
Выявление живых и мертвых клеток
в ценозах бактерий. В очень многих случаях при
исследовании бактериальных ценозов возникает необходимость
выяснения состояния микроорганизмов в том или ином их сооб-
ществе. Для выявления живых и мертвых клеток могут быть ис-
пользованы как методы дифференциальных окрасок, так и метод
люминесцентной микроскопии.
Предложено несколько способов окраски.
Способ Пешкова
Необходимые реактивы:
1. Фиксатор: этиловый спирт (96°-ii) .... 60 мл
ледяная уксусная кислота . . 30 »
хлороформ.........................10 »
314
Рпс. 158. Распределение микроорганизмов между
жидкой и твердой фазами грунта (люминесцентный
микроскоп, препарат с корпфосфин ом).
Рис. 159. Зоны отсутствия
роста вокруг колечка, окра-
шенного токсической краской.
Рис. 161. Колонии бактерий группы coli
на мембранном фильтре.
2. Краска Гимза: Азур 11,1: 1000
эозин, 1 : 1000
3. Водный 0.25%-й раствор краски лихт-
грюн.
Процедура окраски: 1) обрабатывают мазок или пластинку
обрастания фиксатором в течение 20 мин.; 2) подсушивают на
воздухе в течение 1 часа; 3) погружают в краску Гимза на 4 часа
при 37° С или на 24 часа при комнатной температуре; 4) промы-
вают нейтральной (pH 7.1) дистиллированной водой; 5) докраши-
вают в течение 20 сек. 0.25 %-м водным раствором лихтгрюна;
6) споласкивают дистиллированной водой и подсушивают препа-
рат. Результаты: микроорганизмы, б^шие до фиксации живыми,
окрашиваются в фиолетовый цвет, отмершие еще до фиксации —
в зеленый.
Способ Дроботько
Необходимые реактивы:
1. 3%-й водный раствор конгорота 100 мл
Насыщенный раствор сулемы ... 4 »
2. Этиловый спирт (96-й)........... 100 »
Соляная кислота.................... 3 »
Кислый фуксин..................До насыщения
Процедура окраски: 1) готовят мазок и высушивают на воз-
духе; 2) наносят раствор конгорота и держат несколько минут;
3) сливают краску, длительно промывают; 4) наносят на мазок
раствор фуксина и держат несколько минут; 5) промывают и
высушивают. Результаты: микроорганизмы, бывшие до фиксации
живыми, окрашиваются в красный цвет, отмершие еще до фикса-
ции — в черный.
Люминесцентный метод
Для того чтобы в поле зрения люминесцентного микроскопа
можно было выявить одновременно как живые, так и мертвые
клетки микроорганизмов, М. Н. Мейсель, Г. А. Медведева и
В. М. Алексеева рекомендуют применять флуорохромирование
смесью примулина (1 : 20—1 : 40000) и сильно разведенного ак-
ридина оранжевого (1 : 100000). В этом случае живые клетки све-
тятся зеленым, а мертвые — желтым.
Для выявления мертвых бактерий, по данным названных авто-
ров, наилучшими флуорохромами являются: примулин, тиазоловый
желтый и бриллиант-дианиловый зеленый (все в разведении
1:100000). При флуорохромировании этими красителями (в указан-
ном разведении) живые бактерии почти не светятся, мертвые ярко
люминесцируют. Для учета в одном и том же поле зрения живых и
мертвых клеток бактерий Мейсель с соавторами рекомендуют сле-
дующие приемы: поле зрения препарата с флуорохромом просмат-
315
ривают сначала при люминесцентном освещении и регистрируют
светящиеся мертвые клетки, затем то же поле просматривают при
фазовом контрасте, учитывая уже все бактерии: и живые и мерт-
вые. Для проведения этого счета удобнее всего пользоваться ми-
кроскопом, снабженным опак-пллюминатором (011-17).
МЕТОДИКА БИОКОНТРОЛЯ НЕОБРАСТАЮЩИХ
ПОКРЫТИИ С ИСПОЛЬЗОВАНИЕМ МИКРООРГАНИЗМОВ
Любое сооружение независимо от материала, из которого оно
выполнено, при нахождении его в воде и суда, плавающие как
в океанах и морях, так и в ^нтинентальных водоемах, с различной
быстротой обрастают бактериями, растениями и животными.
Трубы водоводов могут так зарасти указанными организмами,
что их внутренний просвет может быть совершенно закрыт. Обра-
стание судов влечет за собой снижение скорости их хода, обраста-
ние буев может вызвать их погружение в воду и т. д.
Процесс обрастания судов и портовых сооружений начинается
с прикрепления к поверхности микроорганизмов и их развития.
За бактериями, образующими сплошную пленку, поселяются
водоросли, а в дальнейшем животные. С обрастаниями судов в на-
стоящее время успешно борются пропусканием электрического
тока. Но в целом ряде случаев этот прием применен быть не мо-
жет и используются специальные краски, в состав которых вхо-
дят различные токсические вещества. Технология изготовления
необрастающих красок различна. Различен и их состав. Одни из
них могут освобождать большое количество токсинов сразу, за-
тем следует постепенное падение отдачи, другие отдают токсины
постепенно с равномерной скоростью.
При испытании степени токсичности этих покрытий ими обыч-
но покрывают металлические пластинки, которые опускают за-
тем в водоем на желаемую глубину на определенное время. Нали-
чие микроорганизмов на них может быть обнаружено обычным ми-
кробиологическим анализом: 1) посевом налета, взятого стериль-
ным тампоном с определенной площади поверхности пластинки,
2) люминесцентной микроскопией (взятием кусочка покрытия,
обработкой его флуорохромом и рассмотрением в люминесцентном
микроскопе в- падающем свете). j
Испытаниям в природе обычно предшествует лабораторный
контроль. Для определения токсичности необрастающих красок
очень удобно использовать бактерии. Этот метод был разработан
нами в 1947 г. и успешно применялся специальными лаборатори-
ями. Он состоит в следующем. В чашку Петри вносят густо за-
сеянный бактериями агар (обычно мясо-пептонный или рыбо-
пептонный). По застывании его помещают в чашку 5—6 стеклян-
ных колечек, имеющих высоту около 1 см, окрашенных заранее
снаружи испытываемыми красками.
316
Чашку помещают в термостат для проращивания. Вследствие
токсичности покрытия и диффузии его ионов в агар бактерии во-
круг колечка развиваться не могут, получается зона отсутствия
роста, которая может быть измерена (рис. 159). Обязательным
условием для получения сравнимых результатов является оди-
наковая толщина покрытия. Наиболее правильно использование
смешанной ассоциации микробов обрастания, развивающейся
в естественных условиях в водоеме, что установлено нами экс-
периментальным путем. Ассоциация водных бактерий значите-
льно устойчивее к ядовитым покрытиям, чем чистые культуры
каких-либо обычных музейных штаммов. Однако для получения
представления об относительной силе воздействия того или иного
соединения на микроорганизмы могут быть использованы и чис-
тые культуры водных бактерий. Необходима предварительная
работа по выявлению более устойчивых штаммов, с которыми
должна вестись дальнейшая работа.
ГЛАВА 13
МЕТОДЫ САНИТАРНО-БАКТЕРИОЛОГИЧЕСКОГО
АНАЛИЗА ВОДЫ
В санитарно-бактериологических определениях качества воды
используется обычно всего два показателя: 1) количество гетеро-
трофных микроорганизмов, вырастающих за 24 часа на стандарт-
ном мясо-пептонном агаре при 37° С; 2) наличие бактерий — по-
казателей фекального загрязнения воды.
Для определения количества гетеротрофных бактерий про-
изводят посевы обычным способом (описание см. стр. 204). Пробу
перед посевом тщательно взбалтывают и стерильной пипеткой
вносят в чашки Петри намеченные к посеву количества воды, при-
бегая или не прибегая к разведениям в зависимости от ожидаемых
результатов. Каждым намеченным объемом воды и из каждого
разведения рекомендуется засевать не менее 2 чашек. Посевы
помещают в термостат, установленный на 37° С.
Счет ведут через 24 часа. Количество колоний, вырастающи х
через 24 часа при 37 , всегда меньше количества колоний, кото-
рые развиваются при 22° и учитываются через 48 час.
В обзоре принятых европейских методов для установления сте-
пени загрязнения воды Бик (Bick, 1963) указывает на метод Буг-
стега и Тиля (Bucksteeg u. Thiele, 1959) как облегчающий
счет бактерий в воде. Определения основаны на восстано-
влении ТТС (2-3-5-трифенилтетразолиум хлорид) в красный
формазан редуктазами живых бактерий. Раствор ТТС прибавляют
к загрязненной воде. Под воздействием живых активных бактерий
этот реактив восстанавливается в красный формазан, красная
краска экстрагируется спиртом. Интенсивность окраски измеряют
в фотометре и затем сравнивают со стандартной суспензией бак-
терий, содержащей определенное количество клеток. Бик указы-
вает, что эти определения легче и быстрее позволяют установить
количество бактерий, чем метод разливок. В то же время точность
метода выше, чем метода счета на пластинках питательного агара,
и, кроме того, метод позволяет получить истинную картину био-
логической активности загрязненной воды или ила.
Фекальное загрязнение воды устанавливается по наличию
в ней бактерий группы кишечной палочки с входящими в нее под-
группами Bacterium paracoli и Bact. aerogenes.
318
Показательные для фекального загрязнения организмы ха-
рактеризуются следующими признаками: это аэробные, слабо под-
вижные, грамотрицательные, неспороносные палочки, не разжи-
жающие желатину, образующие индол, свертывающие молоко,
сбраживающие с образованием газов (водорода и углекислоты)
глюкозу, лактозу, мальтозу, левулезу, арабинозу и маннит и не
сбраживающие сахарозу. На среде Эндо эти бактерии образуют
характерные красные с золотистым металлическим блеском коло-
нии, темно-красные и розовые с темным центром.
Методика проведения выделенного в чистой культуре штамма
из группы кишечной палочки через ряд сред, составляющих так
называемый пестрый ряд, является очень громоздкой и требует
значительной затраты времени. Поэтому в настоящее время ис-
пользуется несколько сокращенный анализ.
Технически наиболее прост и позволяет получить ответ наи-
более быстро метод выращивания на мембранных фильтрах. Он
дает более точные результаты, так как счет вырастающих колоний
всегда более точен, чем расчет, производимый из данных метода
титров. Однако вполне допустим и метод постановки бродильных
проб.
Результаты анализов при том и другом методе выражаются
количеством клеток показательных организмов на 1 л воды (ко-
лп-индекс) или наименьшим объемом воды, содержащим 1 клетку
кишечной палочки (коли-титр).
Анализ воды по методу мембранных фильтров (Разумов, 1953)
состоит из двух этапов: 1) выращивания сконцентрированных па
мембранном фильтре бактерий на фуксин-сульфитной среде Эндо
в течение 24 час. при 37° С; 2) выращивания при 43° С в течение
24 час. в сосудах с пептон-глюкозпой средой бактерий из колоний,
выросших на фильтрах, и регистрации образования газа в этих
условиях. Схема анализа дана на рис. 160.
Первый этап анализа проводится следующим образом. Фильтро-
вальный аппарат — воронку и площадку с фильтровальной плас-
тинкой — стерилизуют фламбированием после обтирания ват-
ным тампоном, смоченным этиловым спиртом. По охлаждении на
фильтровальную пластинку накладывают фламбированным пин-
цетом стерильный мембранный фильтр (№ 1 или № 2) меткой или
надписью вверх и собирают прибор. Затем в воронку фильтроваль-
ного аппарата вносят стерильной пипеткой намеченный объем
воды, в приемном сосуде создают вакуум и фильтруют воду.
Мембранный фильтр с осевшими на нем бактериями осторожно
снимают пинцетом и накладывают в чашку Петри на поверхность
агара Эндо, заранее налитого и остуженного. Необходимо следить,
чтобы фильтр плотно лег на поверхность агара, для чего следует
опускать его постепенно (не должно быть пузырьков воздуха
между фильтром и агаровой средой). Сторона фильтра с номером
и осевшими микроорганизмами должна быть обращена вверх.
319
В одну чашку Петри можно поместить несколько фильтров. В ра-
бочий журнал записывают дату, номер пробы, номер фильтра и
количество профильтрованной воды.
Агар Эндо готовят следующим образом. Мясо-пептонный
агар (pH 7.4—7.6) разливают по 50 или по 100 мл и стерилизуют
в автоклаве. Готовят: 1) раствор фуксина (основного фуксина —
10 г, 90°-го этилового спирта — 100 мл; раствор перед употребле-
нием фильтруют); 2) 10%-й раствор безводного сульфита натрия
(Na2SO3) или 20%-й раствор той же солп кристаллической
Рис. 160. Схема анализа воды на показатели
фекального загрязнения.
/’— фильтрование воды через мембранный фильтр;
2 — проращивание бактерий на среде Эндо; з + —
наличие колоний красного цвета; з-развитие бес-
цветных колоний; 4 — окраска по Граму: плюс —
положительная, минус — отрицательная; 5 — рост
на глюкозо-пептонной среде: плюс — наличие бро-
жения, минус — отсутствие брожения.
(Na2SO3 • 7Н2О); 3) 25%-й раствор лактозы, который разливают
небольшими порциями и стерилизуют текучим паром.
Фуксин-сульфитную среду готовят по мере надобности (на те-
кущий день или за 1—2 дня до работы) — среда эта не выдержи-
вает длительного хранения. Для использования распускают мясо-
пептонный агар; в стерильной пробирке соединяют 0.5 мл раствора
фуксина и раствор сульфита натрия до получения ярко-розового
окрашивания. В агар вносят 2—3 мл раствора лактозы и смесь
фуксина с сульфитом натрия, все тщательно перемешивают и раз-
ливают в чашки Петрп. Готовый агар должен иметь кремовый со
слабо-красповатым оттенком цвет.
В продаже имеется готовый агар Эндо в виде порошка, выпус-
каемый нашей промышленностью. Агар из этого порошка гото-
вят растворением определенного количества его в стерильной воде
при кипячении, разливают в стерильные чашки Петри и подсуши-
вают как обычно.
320
Счет колоний, выросших на фильтре на среде Эндо, производят
через 24 часа. Считают только колонии, имеющие характерную
окраску (рис. 161). Если на фильтре развились только бесцветные
колонии, то из двух-трех из них делают мазки и окрашивают по
Граму. Отсутствие в мазках грамотрицательных неспороносных
палочек дает окончательный отрицательный ответ (—) на наличие
бактерий группы кишечной палочки в данном объеме воды. При
наличии грамотрицательных палочек переходят ко второму
этапу. При наличии окрашенных колоний из нескольких из них
делают мазки, окрашивают по Граму и переходят ко второму этапу.
При очень густом росте, слиянии колоний и наличии смешан-
ной культуры производят вторичные высевы на агар Эндо для по-
лучения изолированных колоний, повторяют микроскопическое
исследование и переходят к второму этапу.
На втором этапе анализа производят высевы в пептон-глюкоз-
ную среду, налитую в пробирки с поплавками или в трубки Дун-
бара (рис. 91) из колоний, развившихся на фильтре (и из тех, из
которых делались мазки). Посевы помещают на 24 часа в термо-
стат, установленный на 43° С. Газообразование в посевах считают
положительным (+) и окончательным ответом на присутствие
бактерий группы кишечной палочки. Отсутствие газообразования
принимается как отрицательный ответ (—).
Пептон-глюкозная среда
Водопроводная вода .................1(ХХ) мл
Пентон................................ 10 г
Хлористый натрий....................... 5 »
Глюкоза................................ 5 »
pH 7.4—7.6
Анализ воды на наличие в ней бактерий группы кишечной
палочки может быть ускорен путем использования люминесцент-
ного метода. Методика разработана М. Н. Мейселем и В. А. Стра-
ховой (1955). Первый этап анализа начинается с фильтрования
воды и проводится обычным образом. Рекомендуется мембранные
фильтры до подготовки их к фильтрации проштамповать специаль-
ным резиновым штампом с тем, чтобы разделить линиями площадь
фильтра на 8 одинаковых секторов для облегчения количествен-
ного учета развивающихся микроколоний.
Фильтры, через которые отфильтрована исследуемая вода, на-
кладывают обычным образом на элективные среды в чашки Петри
и помещают чашки в термостат при температуре 40—41 ° С на
5.5 час. Среды при этом рекомендуется применять специальные,
предназначенные для ускоренного выращивания. После проращи-
вания колоний на мембранных фильтрах их снимают с агара и под-
вергают флуорохромированию. Для этого готовят основной рас-
твор флуорохрома концентрацией 1 : 1000, перед употреблением
основной раствор разводят в 2—3 раза физиологическим раство-
21 А. Г. Родина 321
ром. Флуорохромирование осуществляется следующим образом:
на дно стерильной чашки Петри накапывают небольшое коли-
чество флуорохрома и на поверхность этой жидкости помещают
фильтр тыльной стороной.вниз (фильтры должны как бы плавать
на поверхности флуорохрома). Прокрашивание продолжается
5—10 мин., после чего фильтры снимают с раствора флуорохрома,
помещают в сухую чашку Петри и производят подсчет выросших
микроколоний под лупой-микроскопом путем освещения мембран-
ного фильтра сверху я]йсим
• 4
! ।
шм светом осветителя, возбуждаю-
щим люминесценцию. Яркий пучок
света от источника должен падать
на фильтр (рис. 162). Перед источ-
ником света помещают стеклянный
синий светофильтр, задерживаю-
щий тепловые лучи, или ставят
кювету с раствором двойной сер-
ноаммонийной соли. На окуляры
лупы надевают желтые светофиль-
тры. Наиболее целесообразно поль-
зоваться стереоскопической лупой
МБС-1 с увеличением в 25 раз.
В зависимости от используе-
мого флуорохрома микроколонии
Рис. 162. Схема установки и хода
лучей при люминесцентном иссле-
довании мембранных фильтров
(по Мейселю и Страховой, 1955).
Сплошные линии — лучи синего света;
прерывистые — люминесцентное свече-
ние. В окулярах лупы — желтые стек-
лянные светофильтры.
кишечной палочки дают свечение
различного цвета. При акридине
оранжевом они дают зеленовато-
желтое свечение при влажном
фильтре и оранжевое в высушен-
ном состоянии.
Обработка мембранного филь-
тра флуорохромами не повреж-
дает существенно колоний. Большинство бактерий при этом ос-
тается живыми, и поэтому может быть произведен второй этап ис-
следования. Микроколонии снимают с фильтра под контролем
лупы капиллярной пипеткой (пастеровская пипетка с тонко от-
тянутым кончиком), часть микроколоний переносят на предметное
стекло для приготовления мазка и последующей окраски его по
Граму, часть переносят в микропробирку с пептон-глюкозной
средой и плавающим в среде маленьким ватным тампоном. Микро-
пробирки помещают в термостат при 43° С на 2—4 часа. Колонии,
относящиеся к типичной кишечной палочке, дают отрицательную
окраску по Граму и вызывают брожение среды, обнаруживаемое
по большому количеству мелких пузырьков газа, плавающих под
ватным тампоном и даже пронизывающих его.
Для ускоренного выращивания кишечной палочки исполь-
зуется питательная среда с пониженной плотностью агара, при-
готовленная из мясного и дрожжевого лизатов с добавлением
322
настоя ячменных ростков, разработанная Рублевской водопро-
водной станцией (РВС). Для подавления самосвечения' мембран-
ных фильтров в среду добавляют парафуксин.
Среда РВС
Водопроводная вода ............................До 1000 мл
Ячменные ростки............................... 20 г
Мясной лизат.................................. 20 »
Дрожжевой автолизат из пивных дрожжей......... 45 мл
Агар.......................................... 6—7 г
Сульфит натрия (безводный) ................... 600 мг
Лактоза....................................... 15 г
Витамин Bj.................................... 40 мг
Насыщенный спиртовой раствор парафуксина ... 4 мл
В случае отсутствия пивных дрожжей дрожжевой автолизат
может быть заменен дрожжевым лизатом из хлебопекарных дрож-
жей в количестве 20 г.
ГЛАВА 14
МЕТОД РАДИОАКТИВНЫХ ИНДИКАТОРОВ
Биологическое использование радиоактивных изотопов в ка-
честве меченых атомов основано на допущении, что живые орга-
низмы не ощущают различий между изотопами одного4 и того же
химического элемента, вследствие чего радиоактивные элементы
могут участвовать во всех химических реакциях наравне со ста-
бильными изотопами.1 * Это подтверждено больным количеством
работ в отношении многих элементов, хотя имеются отдельные на-
блюдения о не вполне идентичном поведении радиоактивных и ста-
бильных изотопов — о так называемом изотопном эффекте (изо-
топный эффект обусловливается различием масс атомов — их
массовых чисел). Как пример могут быт^ приведены данные о не-
одинаковой относительной скорости ассимиляции 12СО2 и 13СО2
(скорость выше у стабильного изотопа), о различии степени на-
копления 12С и 14С при усвоении СО2 (12С накапливается па 3 —
6% больше).
Радиоактивные изотопы характеризуются испусканием иони-
зирующего излучения, которое может быть зарегистрировано и
измерено соответствующей специальной аппаратурой. Ядра ра-
диоактивных изотопов неустойчивы, и в них совершается реакция
распада. Радиоактивные изотопы в большинстве случаев полу-
чают искусственно при бомбардировке стабильных изотопов мощ-
ными потоками нейтронов, протонов и пр., производимой на спе-
циальных установках. Каждый элемент может иметь как стабиль-
ные, так и радиоактивные изотопы, например (по Соколову и
Сердобольскому, 1954):
Стабильные — {Н, |Н, ^С, J3C, J4N, ^N, ^0 и т. д.
Радиоактивные — ^Н, J°C, J4C, ]3N, X?N, J40, J50, и т. д.
При распаде радиоактивных элементов наблюдаются следую-
щие типы излучения: а, 0 и у. а-Лучи представляют собой поток
положительно заряженных ядер гелия. Проникающая способ-
ность а-лучей очень мала, даже быстрая а-частица проходит
1 Стабильными изотопами являются такие, в ядрах атомов которых ни-
каких превращений не происходит и структура ядер остается постоянной.
324
слой воздуха не более И см или слой воды не более 0.15 мм.
р-Лучи представляют собой поток электронов (0“), или пози-
тронов (Р+), или тех и других вместе. Проникающая их
способность значительно выше, чем у а-лучей. P-Лучи способны
пройти слой воздуха в несколько метров и слой алюминия толщи-
ной около 5 мм. у-Лучи по своей природе сходны с лучами Рент-
гена. у-Л учи проникают значительно глубже Р-частиц, их дейст-
вие не локализовано вблизи источника излучения.
Одни радиоактивные элементы испускают а-, р+, 7-лучи (на-
пример, радий), другие — р-лучи (например, фосфор — ^Р),
третьи — а-лучи (литий, бериллий). При радиоактивном распаде
некоторые радиоизотопы испускают позитроны (Р+), чаще же про-
исходит испускание электронов (Р-) — излучение, наиболее удоб-
ное для учета меченых атомов.
Скорость радиоактивного распада различна у разных элемен-
тов. Распад ядер одних атомов совершается в ничтожно малые про-
межутки времени, других — в очень большие. Теоретически пол-
ный распад всех ядер изотопа с p-излучением (с большим временем
распада) заканчивается только через бесконечно большой проме-
жуток времени. Поэтому это время учесть весьма сложно. Легко
определяемым является время полураспада, т. е. время, за кото-
рое распадается 50% наличного числа атомов изотопа. Это время,
за которое интенсивность P-излучения уменьшиться вдвое.
Для экспериментальных работ непригодны радиоактивные изо-
топы с очень малым периодом полураспада. Так, например, один
из важнейших в жизни организмов элементов — азот — имеет
четыре радиоактивных изотопа: 12N, 13N, leN, 17N, по они имеют
очень малый период полураспада (несколько секунд) и поэтому
для экспериментальной работы не могут быть использованы. Вме-
сто них для индикации используют стабильный тяжелый изотоп
16N. Вместо радиоактивных используются также тяжелые стабиль-
ные изотопы водорода: 2Н и кислорода: 18О. Следует отметить,
что работа со стабильными изотопами значительно более сложна.
Для ряда важных в обмене веществ организма элементов могут
быть использованы в качестве индикаторов как радиоактивные,
так и стабильные изотопы. К числу таких элементов относятся:
углерод, сера и некоторые другие.
Прп решении вопроса о применении индикатора: какой изотоп
следует применять в данном эксперименте — прежде всего сле-
дует учитывать фактор разведения, затем доступность измеритель-
ного оборудования, продолжительность эксперимента, возмож-
ность воздействия радиоактивного излучения.
Несомненным преимуществом радиоактивных изотопов яв-
ляется возможность использования больших разведений: 10-в
и даже 10"9. Допустимый предел разведений для стабильных изо-
топов значительно ниже: 10-4. Но стабильные изотопы устойчивы,
что является их положительным качеством.
325
Концентрации стабильных изотопов обычно определяют на
специальных сложных установках — масс-спектрометрах путем
промеров отклонений в движении частиц в электрическом и маг-
нитных полях. Степень отклонений для каждой частицы опре-
деляется отношением ее массы к заряду.
Точность определений значительно выше при использовании
радиоактивных изотопов. Так, при помощи масс-спектрометра,
рассчитанного на диапазон масс от 4 до 60, измерения можно про-
изводить: для 16N с точностью до 2—3%, для 13С — до 4—5%,
для 18О — до 4—5% (Верховская, 1955).
Кроме того, весьма существенным является то, что измерение
концентрации стабильных изотопов требует выделения биологи-
Рис. 163. Кривая радиоактивно-
го распада 32Р.
По оси абсцисс — сутки; по оси орди-
нат — радиоактивность в процентах
от исходной.
ческих проб высокой степени чи-
стоты (подробно — Юбер, 1956).
Для количественного сравне-
ния радиоактивности чаще всего
пользуются единицей кюри. Эта
единица ранее использовалась для
сравнения излучения радиоактив-
ных элементов с излучением радия,
который в течение многих лет слу-
жил эталоном. В настоящее время
за кюри принимают активность та-
кого количества радиоактивного
вещества, в котором происходит
такое же количество распадов в
секунду, как и в 1 г радия, т. е. 3.7 • 1010 расп./сек. Милли-
кюри (мкюри)— в тысячу раз меньшая активность (равна 3.7 X
Х107 расп./сек.), микрокюри (мккюри) представляет собой мил-
лионную часть кюри (3.7 • 104 расп./сек.).
Вместо кюри была предложена иная единица — резерфорд
(активность любого радиоактивного вещества, дающего 10е атом-
ных распадов в секунду; резерфорд равен 1//37 мкюри). Однако
эта единица измерения не получила широкого распространения.
Радиоактивность пробы не остается неизменной, опа непре-
рывно уменьшается вследствие происходящего распада изотопа.
Поэтому необходимо знать закон, по которому происходит умень-
шение радиоактивности пробы, и уметь построить на основании
этих знаний кривую падения радиоактивности образца во вре-
мени, позволяющую вычислить степень радиоактивного распада
за данный период. При проведении эксперимента обычно в на-
чале работы вычисляют радиоактивность реактива, содержащего
изотоп, исходя из паспортных данных и периода полураспада по
таблицам и кривым, имеющимся в специальных руководствах,
и вычерчивают кривую распада (рис. 163), принимая за 100%
исходный уровень радиоактивности (данный в паспорте реак-
тива).
326
ТЕХНИКА ОПРЕДЕЛЕНИЯ
Микроорганизмы, ассимилировавшие радиоактивные изотопы,
могут быть обнаружены, и степень ассимиляции радиоактивных
веществ определена при помощи счетчика. Может быть применен
п метод радиоавтографии. Для учета радиоактивности вещества,
содержащего радиоактивные изотопы, применяют счетные уста-
новки разных систем. Чаще всего используется установка Б,
а в настоящее время — Б-2, состоящая из счетчика, входного
блока (БГС), усиливающего импульсы, исходящие от счетчика,
Земля
Рис. 164. Схема установки Б для определения радиоактивности
(по Трошину, 1956).
механического электромагнитного счетчика (нумератора), высоко-
вольтного выпрямителя (ВСЭ), от которого подается напряжение
на счетчик, пересчетного устройства и секундомера. Пересчетное
устройство позволяет подавать на механический счетчик д/2—
1/ь Vie или х/в4 части возникающих импульсов. Схема соеди-
нения установки приведена на рис. 164. Счетные трубки Гейгера-
Мюллера бывают различных систем: алюминиевые, стеклянные
и торцовые. При работе с радиоактивными изотопами, испускаю-
щими р~-частицы высокой активности (32Р, 22Na, MNa, 42К и др.),
можно использовать алюминиевые счетчики. При работе с изото-
пами, обладающими мягким излучением (14С, 4бСа, 36S и др.),
используют торцовые счетчики, в которых обладающие малой
энергией ^“-частицы попадают внутрь счетчика через специальное
окошко, закрытое тонкой (толщиной 15—20 мк) слюдяной плас-
тинкой.
327
Алюминиевый счетчик Гейгера—Мюллера представляет собой
тонкостенную алюминиевую трубку, по оси которой натянута тон-
кая вольфрамовая нить, изолированная от корпуса счетчика.
Воздух в трубке заменен смесью аргона и паров спирта. К воль-
фрамовой нити подводится высокое стабилизированное напряже-
ние в 700—1000 в, в итоге между нитью и стенкой счетчика соз-
дается больщая разность потенциалов. Стенка счетчика является
катодом, нить — анодом. 0-частица, проникшая через стенку счет-
чика, вызывает ионизацию молекул газа. Отрицательно заряжен-
ные частицы двигаются к аноду, положительно заряженные —
к катоду. Количество отрицательно заряженных частиц на
пути к нити увеличивается возрастающими темпами, и, достигнув
нити, они вызывают возникновение электрического ч импульса.
Импульсы тока, возникающие в счетчике, обладают недостаточной
мощностью, чтобы привести в действие электромагнитный счет-
чик. Поэтому их предварительно усиливают в ламповом усили-
теле, и установленный на выходе усилителя электромагнитный
механический счетчик отсчитывает их.
Обычно радиоактивность проб из анализируемого материала
определяют путем сравнения отсчета импульсов этих проб в еди-
ницу времени с отсчетом импульсов исходного радиоактивного ве-
щества, использованного в опыте, радиоактивность которого из-
вестна. При определениях соблюдают следующие условия.
1. Радиоактивность опытных и стандартных проб должна на-
ходиться в пределах возможности учета их счетчиком (не должна
быть высокой).
2. Форма опытных и стандартных проб должна быть одинако-
вой, с подложкой из одного и того же материала, одной толщины.
Для этого пробы помещают в одинаковые формы, обычно малень-
кие тарелочки, которые штампуют из листочков меди, латуни или
алюминия толщиной около 1 мм, диаметром в 2 раза меньше диа-
метра цилиндрического счетчика или немного меньше окошка тор-
цового счетчика. При работе с жидкостями пробу выпаривают,
осторожно нагревая ее и никоим образом не доводя до кипения.
Тарелочки заворачивают в алюминиевую фольгу толщиной около
0.001 мм или заклеивают фольгой.
3. Измерение радиоактивности бактерий производят часто
на мембранных фильтрах, через которые фильтруют содержащие
бактерии жидкости (воду, среды и др.), или концентрируют бак-
терии фильтрацией через фильтр, доводя до определенного объ-
ема, отмеривают пипеткой то или иное количество сконцентриро-
ванной взвеси, вносят на латунную тарелочку, в которой и выпа-
ривают.
Фильтрование пробы следует производить через воронку с мень-
шей фильтрующей площадью, чем площадь окошка торцового
счетчика, используемого при определении радиоактивности филь-
тров. По окончании фильтрации фильтры высушивают и в слу-
328
чае использования радиоактивного карбоната обрабатывают
для удаления минеральных частиц, содержащих радиоактив-
ный изотоп, могущих оказаться на фильтре. Эти частицы удаляют
с помощью соляной кислоты. Обработку фильтров соляной кис-
лотой проводят после фильтрования пробы одним из трех спо-
собов:
а) через фильтр пропускают 1 мл 2 %-го раствора соляной
кислоты;
б) фильтры переносят на фильтровальную бумагу и смачи-
вают несколькими каплями 2%-й соляной кислоты;
в) фильтр нижней стороной кладут на поверхность 0.1 н. рас-
твора соляной кислоты, налитого в чашку Петри, и оставляют пла-
вать на поверхности кислоты в течение 2—3 мин.
Затем фильтры для удаления остатков соляной кислоты про-
мывают дистиллированной водой, помещая их на кружки филь-
тровальной бумаги, смоченной дистиллированной водой. После
промывки фильтры высушивают вначале на воздухе, для чего кла-
дут их на фильтровальную бумагу в чашку Петри, и затем в эк-
сикаторе над хлористым кальцием или натронной известью.
Активность таких фильтров измеряют при помопщ торцового
счетчика. Фильтры при сушке часто свертываются. Во избежа-
ние этого рекомендуется применять специальные держатели,
так как сохранение горизонтальной поверхности весьма сущест-
венно для точности счета.
4. Измерение активности проб для получения сравнимых ре-
зультатов по всем пробам следует проводить в одинаковых гео-
метрических условиях. Центр пробы должен находиться под цент-
ром окошка торцового счетчика, расстояние от поверхности пробы
до стенки счетчика всегда должно быть одинаково.
5. Все образцы опытных и стандартных проб должны содер-
жать радиоактивное вещество в одной химической форме и быть
одинакового веса. Для выполнения этих условий надо брать мини-
мальное количество вещества и количество импульсов вычислять
на единицу веса или объема. Для получения точных резуль-
татов вносят поправку на поглощение р-частиц в веществе
пробы.
6. Обязательно определение так называемого естественного
фона, т. е. количества импульсов на единицу времени, даваемого
счетчиком без исследуемой пробы. Эта величина должна быть вы-
чтена из полученных импульсов пробы. Естественный фон оп-
ределяют каждый раз ввиду его непостоянства. Если работа
ведется с веществами малой активности, тогда для уменьшения ес-
тественного фона счетчик помещают в свинцовый домик — тол-
стостенную (5—7 см) свинцовую коробку, предохраняющую счет-
чик от посторонних излучений.
Время проведения измерений должно быть достаточным для
получения достоверных данных.
329
Вероятную ошибку измерений находят по формуле
£„ = 0.67 V/V,
где N — число сосчитанных импульсов.
Вероятную ошибку можно вычислить в процентах по формуле
67V/V
£о/о = —Не-
вероятная ошибка измерений (по Хевегпи, 1950)
Ошибка (в %) 1 2 5 10 20 Количество сосчитанных импульсов 4445 1114 177 45 И
Другой метод учета радиоактивности — радиоавтография.
Метод радиоавтографии основан на действии излучений радио-
активных веществ на фоточу ветвите л ьную эмульсию, аналогич-
ном действию лучей света. С помощью радиоавтографов может
быть выяснено распределение радиоактивных элементов в орга-
низме и в клетке.
Для получения радиоавтографов объект, содержащий радио-
активное вещество, помещают па фоточувствительную пластинку,
плотно прижимают его к ней и тщательно заворачивают в черную
бумагу. В таком виде материал оставляется обычно на несколько
суток в темноте в сухом месте, после чего пластинка проявляется.
Длительность выдержки определяют эмпирически. Она зависит
и от фоточувствительности пластинки, и от количества радиоактив-
ного вещества, и от природы излучения изотопа. Обычно для из-
готовления радиоавтографов употребляют высокочувствитель-
ную рентгеновскую пленку.
Материал, который предполагают использовать для получе-
ния радиоавтографов, должен быть подготовлен; он должен быть
сухим и расположенным в одной плоскости. Чем более радиоак-
тивна бактериальная клетка, тем более четкий след оставляет
она на эмульсии высокочувствительной фотопленки.
Метод радиоавтографии позволяет изучить радиоактивность
отдельных клеток, выявить участки скопления меченого ве-
щества внутри клеток.
Включение радиоактивных элементов в клетки микроорганиз-
мов происходит главным образом в результате вовлечения их в об-
мен веществ в процессах питания и роста (некоторое значение
могут иметь процессы адсорбции и диффузии). Вступившие
в клетку меченые соединения претерпевают те же изменения, что
и немеченые. Перемещения меченых соединений в клетках могут
быть учтены указанным выше способом. При выяснении сложных
330
вопросов — например, при необходимости определения путей
связывания поступившего в клетку изотопа — сочетают изотоп-
ный метод с химическими и физическими методами разделения и
определения клеточных структур (разделения при помощи хро-
матографии, применения ионообменных смол, определения био-
логически активных веществ и др.).
Высокая точность метода меченых атомов позволяет с его по-
мощью решать различные вопросы биологии и экологии микро-
организмов и превращения веществ с их участием в водоеме.
М. Н. Мейсель (1955) указывает следующий круг вопросов микро-
биологии, для решения которых может быть применен изотопный
метод: 1) выяснение путей и скоростей обмена и обновления
в клетке микробов отдельных элементов и их соединений; 2) вы-
явление путей проникновения, включения в клетку и перемеще-
ния в клетке различных элементов; 3) выявление путей и меха-
низмов биосинтеза микробами различных веществ (белков, амино-
кислот, углеводов, витаминов, антибиотиков, липидов и др.);
4) установление способов расщепления и образования различ-
ных веществ в итоге ферментативной деятельности микробов;
5) выяснение механизмов действия на микроорганизмы биотиче-
ских и антибиотических веществ и различных физических аген-
тов; 6) изучение характера взаимоотношений между отдельными
видами микробов, между микробами и растительными и живот-
ными организмами.
В водной микробиологии метод меченых атомов использовался
для определения коэффициентов накопления микроорганизмами
и другими компонентами водоемов различных изотопов, попадаю-
щих в воду или могущих в нее попасть, для выяснения путей про-
никновения радиоактивных изотопов в организм водных живот-
ных, пищевого значения бактерий и растворенных органических
веществ, для решения вопроса о выборности пищи у водных жи-
вотных, путей распределения изотопов в водоеме, величины ас-
симиляции углекислоты бактериями, значения микроорганизмов
в удалении из воды радиоактивных элементов.
МЕТОДИКА ОПРЕДЕЛЕНИЯ АССИМИЛЯЦИИ
УГЛЕКИСЛОТЫ БАКТЕРИЯМИ
Для выяснения величины ассимиляции бактериями углекис-
лоты применяется специальный метод — метод Стимен-Нильсена
для определения величины фотосинтеза в водоеме (Steemann-
Nielsen, 1952). Итоги определений рассматривались некоторыми
производившими такие работы авторами как величины хемосин-
теза (Кузнецов, 1955; Сорокин, 1955, 1957, 1958, 1960а; Кузне-
цов и Романенко, 1963). Работы последнего времени по проверке
пригодности этого метода для определения хемосинтеза в водое-
мах показывают, что по этому способу определяется суммарная
331
-0.8
f ~ ___________—I-----------1 ....J
о 10 20 30
Рпс. 165. Кривая самопоглощения Ва 14СО3,
полученная с помощью торцового счетчи-
ка (но «Методическому пособию по опре-
делению первичной продукции органиче-
ского вещества в водоемах радиоуглерод-
ным методом», 1960).
1 — кривая зависимости измеряемой активности
от толщины слоя Ba,4COs; 2—часть тех же данных
в виде полулогарифмического графика, позво-
ляющего определить величину R. По оси абс-
цисс—толщина слоя Ва’*СОв, мг/см’; по оси орди-
нат — отношение измеренной активности при
данной толщине препарата (J) к активности при
нулевой толщине (Jo).
(а вернее, в большей мере гетеротрофная) ассимиляция бактери-
ями углекислоты (Жарова, 1963; Романенко, 1963). И сама поста-
новка опытов по Стимен-Нильсену исключает возможность раз-
вития в склянках всех автотрофов-аэробов. Поэтому указанный
метод может быть использован только для определения сум-
марной ассимиляции углекислоты бактериями. Это относится
к определениям как в водной толще, так и в иловых отложе-
ниях.
Ассимиляцию углекислоты бактериями измеряют обычно в про-
бах воды, взятых с разных
глубин. Пробы отбирают
тем или иным прибором в
стеклянную поцуду. Воду
фильтруют через мембран-
ный фильтр марки «пред-
варительный» для удале-
ния фито- и зооплан-
ктона. Затем профиль-
трованную воду разли-
вают в склянки (по 2
склянки на каждый гори-
зонт) емкостью около 100
мл. Склянки, употребляе-
мые в опыте, должны быть
химическичистыми. Склян-
ки помещают в черные ме-
шочки и только после
этого вносят в них пипет-
кой по 1 мл радиоактив-
ного карбоната или бикар-
боната натрия, меченного
по углероду (Na214CO3 или
' NaH14CO3) с удельной ра-
диоактивностью около 5
мккюри или при учете под счетчиком 10е имп./мин. в 1 мл.
Употребляемый раствор изотопа готовят из поставляемого
промышленностью препарата следующим образом. В вымытую
хромовой смесью склянку с притертой пробкой наливают опре-
деленное количество освобожденной кипячением от СО2 дистил-
лированной воды и добавляют 1%-й раствор КОН из расчета
2 мл щелочи на 1 л воды. Добавление щелочи необходимо для пред-
отвращения улетучивания 14СО2. В склянку переносят содержи-
мое ампулы с радиоактивным изотопом, закрывают склянку проб-
кой и взбалтывают приготовленный раствор. Раствор хранят
в темноте. Перед внесением в опытные склянки раствор должен
быть обязательно профильтрован через мембранный фильтр № 1
или № 2.
33 2
Опытные склянки после прибавления изотопа закрывают при-
тертыми пробками таким образом, чтобы под пробками не остава-
лось пузырьков воздуха. Мешочки со склянками плотно завязы-
вают, опускают в водоем
горизонт) и выдерживают
ставят 1—2 контрольные,
ляют по 1 мл 40?6-го
•формалина.
По извлечении скля-
нок содержимое их фик-
сируют формалином и
находящиеся в воде бак-
терии отфильтровывают
на мембранный фильтр
№ 1 или № 2. Обыч-
но профильтровывают
значительное количе-
ство воды (40—60 мл).
Фильтры высушивают,
обрабатывают указан-
ным выше способом и
определяют их радио-
активность.
Величину суточной
ассимиляции углекисло-
ты бактериями рассчи-
тывают по формуле,
предложенной Стимен-
Нильсеном для опреде-
ления величины фото-
синтеза,
г гСкаРб
Ч»— Rt ,
где Св — количество ас-
(каждую склянку на соответствующий
там 24 часа. На каждую серию склянок
в которые, кроме радиоизотопа, добав-
Шкала активности
I I I I I I I I I I I 1 I 'J
,1 10 100 1 10 100 1
мккюри мкюри кюри
Рис. 166. Уровни токсичности некоторых ра-
диоактивных изотопов (по Войту, 1956).
I — мало опасных (24Na, 42К, 64Cu, 52Mn, 7вАа, 77As,
•’Кг, ,27Hg); II — умеренно опасных (3Н, 32Р. 22Na,
35S, ЖС1, 64Mn, ”Fe, “Со, R*Sr, MNb, l03Ru, loeRu,
,27Te, ”*Te, 131 J, l37Cs, l43Pr, ,47Nd, ,wAu, ,wAu. 203Hg,
205Hg, ,40Ba, ,40La, ,4lCe); III — крайне опасных (|4С,
45Ca, ”Fe, “Sr, *‘Y, “Zr, *44Ce, 2l0Bi).
симилированной углекислоты (в мг С/л);Скорб — количество уг-
лерода свободной углекислоты и карбонатов в воде; R — ра-
диоактивность воды в склянке после добавления в нее изотопа
{вимп./мин. на 1 л); г — радиоактивность бактерий на фильтре
{в имп./мин. на 1 л профильтрованной воды);£ — время экспо-
зиции (в сутках). Должна учитываться также поправка на
замедление скорости ассимиляции 14С по сравнению с 12С (5—6%
от величины ассимиляции). Отношение показывает, какая
доля добавленного количества 14С к концу экспозиции склянок
оказалась заключенной в клетках бактерий.
Определение исходной радиоактивности воды (Я) ведут
333
в тех же условиях, что и определение активности опытных фильт-
ров, т. е. применяют тот же фильтрационный аппарат, тот же
счетчик и т. д. Для этого определения прибавляют хлористый
барий для связывания 14С и выпавший углекислый барий отфиль-
тровывают на фильтр. Слой осадка на фильтре должен быть тон-
ким. При толстом слое осадка происходит самопоглощение час-
тиц и число измеряемых импульсов снижается. Однако может
происходить и противоположный процесс саморассеяния, что
приводит к увеличению числа отсчитываемых импульсов. В этих
случаях возникает необходимость внесения поправок. Поль-
зуются или уже опубликованными кривыми самопоглощения
(рис. 465), или полученными поправочными кривыми для данных
условий работы.
Меры предосторожности. Работа с радиоактив-
ными изотопами требует строгого соблюдения правил техники без-
опасности для предохранения от облучения дозой выше предельно
допустимой. Уровни токсичности некоторых радиоактивных изо-
топов приведены на рис. 166. Следует брать для индикации воз-
можно малые количества радиоактивного изотопа. Работа с изо-
топом должна вестись в отдельном, специально оборудованном
помещении с вытяжной вентиляцией. Работу проводят в спец-
одежде. Всегда необходимо пользоваться специальными пинце-
тами и пипетками с приспособленными к ним шприцами или гру-
шами. При работе с сильно активными пробами следует ставить
между пимп и лицом, ведущим эксперимент, экран из толстого
листа плексиглаза. Необходима периодическая проверка воздуха
на концентрацию в нем изотопов.
Радиоактивные отходы следует собирать в специальные кон-
тейнеры и уничтожать затем согласно правилам, выработанным
органами здравоохранения.
Посуду следует мыть сначала какой-либо специальной смесью:
или раствором соды, или раствором, весьма часто используемым,
следующего состава (смесью Полянского): вода — 10 л, азотная
кислота (концентрированная) — 675 мл, насыщенный раствор
щавелевой кислоты — 1л, NaCl — 200 г, затем обычным способом.
При работе с 14С посуду следует мыть раствором соды.
ГЛАВА 15
ОПРЕДЕЛЕНИЕ АКТИВНОЙ РЕАКЦИИ СРЕДЫ
И ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО
ПОТЕНЦИАЛА
ОПРЕДЕЛЕНИЕ АКТИВНОЙ РЕАКЦИИ СРЕДЫ (pH)
Развитие микроорганизмов происходит в определенных ин*
тервалах активной реакции среды. Поэтому установление актив-
ной реакции обязательно в питательных средах, как и опреде-
ление ее в водоеме.
Реакция водного раствора любых соединений определяется
соотношением между концентрацией водородных ионов (Н+),
обусловливающих кислые свойства, и концентрацией гидроксиль-
ных (щелочных) ионов (ОН“). Реакцию водного раствора считают
нейтральной, когда концентрация водородных ионов равна кон-
центрации гидроксильных ионов.
Для установления реакции водного раствора каких-либо сое-
динений измеряют концентрацию водородных ионов, так как кон-
центрация гидроксильных связана с концентрацией первых: при
увеличении содержания одних ионов происходит строго соответ-
ствующее уменьшение других. Реакция среды выражается не
в абсолютном значении концентрации водородных ионов, а в виде
водородного показателя, обозначаемого символом pH.
pH является отрицательным логарифмом концентрации водо-
родных ионов (С)
pH = —lg Сн+ = 1g ;
г!"г
например, в дистиллированной воде концентрация водородных
ионов равна 7.
pH = -1g 10-7 = lg = lg 1 - 1g ю-7 = о - (-7) = 7.
Значения pH выше 7 имеют место в щелочных растворах,
ниже 7 — в кислых. Изменение pH на единицу соответствует из-
менению концентрации водородных ионов в 10 раз в силу того,
что водородный показатель есть степень 10, взятая с обратным
знаком. Таким образом, при pH 6 концентрация водородных ио-
335
нов в 10 раз больше, чем при pH 7.0; при pH 8 она в 10 раз
меньше, чем в нейтральной среде.
Определение pH производят двумя методами: колориметри-
ческим и электрометрическим.
Колориметрическое определение pH.
Колориметрическое определение pH основано на свойстве неко-
торых органических веществ изменять свою окраску в зависи-
мости от реакции среды. Эти красители получили название ин-
дикаторов.
Индикаторы являются или слабыми кислотами, или слабыми
основаниями, у которых недиссоциированные молекулы имеют
один цвет, а ионы — другой. Если, например, индикатор является
слабой кислотой, то он будет находиться в виде недиссоциирован-
ных молекул в кислой среде и в виде ионов в щелочной.
В практике используется два набора индикаторов: двухцвет-
ные индикаторы Кларка и Лэбса и одноцветные Михаэлиса. Наи-
более пригодны первые (табл. 13).
Таблица 13
Двухцветные индикаторы (Кларка и Лэбса)
Индикатор Изменение цвета Интервал pH 1 /то н. раствора NaOH (мл на 0.1 г индика- тора)
Тимолблау. К расны й—желтый. 1.2—2.8 4.3
Бромфенолблау. Желтый—синий. 3.0—4.6 3.0
Метил рот. Красный—желтый. 4.4—6.0 7.4
Бромкрезолпуриур. Желтый—пурпурный. 5.2—6.8 3.7
Бромтимолблау. Желтый—сипни. 6.0—7.6 3.2
Фополрот. Желтый—красный. 6.8—8.4 5.7
Крезолрот. Тимолблау. » » Желтый—синий. 7.2—8.8 8.0-9.6 5.3 4.3
Наиболее стойки водно-щелочные растворы индикаторов*
0.1 г индикатора отвешивают на аналитических весах, растирают
в агатовой ступке с н.) раствором едкого натра. Количество
едкого натра различно в зависимости от растворенного индика-
тора и указано в таблице. Для получения 0.04 %-го раствора ин-
дикатора к полученному щелочному раствору приливают дистил-
лированную воду — до 250 мл, а для 0.02%-го — до 500 мл. Рас-
творы хранят в склянках с притертыми пробкамп в прохлад-
ном месте.
Колориметрическое определение pH основано на сравнении
окраски индикатора в воде или исследуемом растворе с заранее
приготовленной шкалой с гаммой переходных тонов этого инди-
катора в ряде стандартных растворов, соответствующих по своему
336
pH интервалу индикатора. Для стандартных растворов приме-
няют так называемые буферные смеси. Характерной особенностью
буферных смесей является их способность противостоять сме-
щению pH. Концентрация водородных ионов в этих смесях не
меняется при разбавлении водой (некоторое смещение происхо-
дит при разбавлении в 1000 раз и более). По приготовлении стан-
дартных растворов, используемых для определения pH, его про-
веряют в них электрометрически (потенциометрически).
Изготовление шкалы является делом весьма ответственным,
для этого требуется проверка потенциометрическим способом.
Шкалы для измерения pH
готовят по заказам в
БРИСе Государственного
гидрологического институ-
та (Ленинград, В. О., 2-я
линия, д. 23).
Определение ведут пу-
тем сравнения оттенков
исследуемой жидкости с
цветом индикатора в бу-
ферных растворах следую-
щим образом. В пробирку,
прилагаемую к шкале (она
должна быть из того же
стекла, что и пробирки
Рис. 167. Схема потенциометра.
1 — элементы, питающие цепи сопротивлений:
— измерительного, Ру — установочного, Рр —
регулировочного; 2 — измеряемое напряжение;
з — нормальный элемент; 4 — переключатель
(А и Б — различные положения переключателя:
А — при установке рабочего тока, Б — при из-
мерении); 5 — гальванометр; 6 — подвижной
контакт.
шкалы, и одного с ними
диаметра), после троекрат-
ного споласкивания иссле-
дуемой жидкостью нали-
вают эту жидкость до мот-
ки, т. е. тот объем, кото-
рый налит в пробирки шка-
лы (обычно 10 мл). Без
промедления наливают в пробирку индикатор, закрывают проб-
кой, перемешивают содержимое пробирки и затем сравнивают
окраску с окраской раствора в пробирках того интервала pH,
который отграничивает прибавленный индикатор. Если окраска
в пробирке выходит за границы действия индикатора, процедуру
повторяют с другим, следующим индикатором. При совпадении
окрасок pH исследуемой воды считают равным pH пробирки той
же окраски.
В случае окрашенных вод определение pH производят с по-
мощью компаратора, где можно компенсировать эту окраску по-
мещением перед пробиркой шкалы пробирок с исследуемой водой
без добавления в нее индикатора.
При работе с растворами в результат определения вводят
«солевую» поправку. При проведении измерений при температуре
1/422 А. Г. Родина
337
выше 18° С, на которую обычно рассчитывают шкалы, вводят тем-
пературную поправку.
При установлении pH сред (особенно мутных и имеющих боль-
шую цветность агаровых сред) можно пользоваться индикатор-
ными бумажками, позволяющими производить быстрое, хотя и
не с высокой степенью точности, определение. Могут быть исполь-
зованы как реактивные бумажки РИФ АН, вы-
<5— — пускаемые нашей отечественной промышленно-
5 стью, так и бумажки Phan, выпускаемые про-
п п мышленностью Чехословакии.
Рис. 168. Стеклян-
ные электроды (по
Алехину, 1959).
А — электрод с буль-
бой; Б — электрод с
запаянным концом.
1 — тончайшая стек-
лянная пленка, при-
паянная па конце
трубки; 2 — хлор-се-
ребряный электрод;
3 — 0.1 н. раствор
НС1; 4 — столбик
ртути для контакта;
5 — медная проволо-
ка.
Электрометрическое опре-
деление pH. Для электрометрического
определения pH пользуются ламповыми по-
тенциометрами (например, ЛП-5 или ЛП-58,
рис. 167). Описание потенциометра и инструк-
ция к пользованию прилагаются к потенцио-
метру. Наиболее простым и совершенным спо-
собом является измерение с помощью стек-
лянного электрода.
Стеклянный электрод (рис. 168) представ-
ляет собой тонкую мембрану (с толщиной сте-
нок 0.03—0.05 мм) из специального электрод-
ного стекла (Крюков, 1955; Алекин, 1959, и
др.). Использование стеклянного электрода
основано на возникновении па границе фаз
между мембраной и растворами разности по-
тенциалов.
Техника измерения при наличии прокали-
брованного стеклянного электрода проста. В
стаканчик наливают исследуемую воду, в нее
опускают дважды ополоснутый этой водой стек-
лянный электрод и с помощью сифона, содер-
жащего насыщенный раствор КС1, стаканчик соединяют с ка-
ломелевым электродом. После этого с помощью потенцио-
метра производят определение электродвижущей силы.
ОПРЕДЕЛЕНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОГО
ПОТЕНЦИАЛА
Развитие жизни в водоемах тесно связано с окислительно-вос-
становительными условиями в них. Эти условия, зависящие от хода
окислительно-восстановительных реакций, не могут быть характе-
ризованы только содержанием кислорода. По современным воз-
зрениям, окисление и восстановление — это потеря или присое-
динение электронов. Вещество, теряющее отрицательные заряды,
окисляется, получающее их — восстанавливается. Таким обра-
зом, существуют и такие окислительные и восстановительные
338
процессы, которые протекают без участия как кислорода, так и
водорода, хотя в природе окислителем обычно является кислород,
а восстановителем — водород. Наличие окислителя и восста-
новителя в среде создает окислительно-восстановительную (ОВ)
систему. Таких О В систем в естественной среде может быть не-
сколько или даже много: например, в водной среде всегда имеются
окисленные и восстановленные ионы железа Fe+++ и Fe++, одно-
временно с ними могут быть окисленные и восстановленные ионы
марганца Мп++++ и Мп++ и др. В ОВ системе перенос электронов
будет продолжаться до тех пор, пока не установится одинако-
вая концентрация окисленной и восстановленной форм или, дру-
гими словами, не выравняется окислительно-восстановительный
потенциал (ОВП).
Окислительно-восстановительный потенциал характеризует
окислительно-восстановительное состояние среды: чем выше в нем
концентрация окислителя, тем больше потенциал. Окислительно-
восстановительный потенциал указывает, в каком направлении
пойдет реакция окисления, если раствор будет смешан с другим
раствором; так, при смешении раствора с более высоким потенциа-
лом с раствором’с более низким потенциалом первый будет окис-
лять второй, сам же будет при этом восстанавливаться. Процесс
этот будет продолжаться до тех пор, пока находящиеся в растворе
окислители и восстановители не придут в состояние химического
равновесия. При определении окислительно-восстановительного
потенциала в сложной смеси достаточно определить потенциал
какой-нибудь одной пары: окислитель—восстановитель. Так как
во всяком водном растворе обязательно имеются ионы Н+ и ОН-,
(тогда как другие могут отсутствовать), то наиболее удобно для
определения окислительно-восстановительного потенциала брать
водород в окисленном (Н+) и восстановленном (Н2) состоянии,
т. е. определять систему Н+5;Н2.
Связь между величиной потенциала и концентрацией окисли-
теля и восстановителя установлена Нернстом. Им дана следую-
щая общая формула:
п RT f окислитель RT t Ох
E = Eo+^in восстановитель ’ или Е = 111 R^d ’
где Eq — потенциал при равных концентрациях окислителя и
восстановителя; 2? — газовая постоянная; Т — абсолютная тем-
пература; F — количество продуцируемых одним грамм-экви-
валентом вещества зарядов (равно 96 500 кулонов); п — число
переносимых электронов в соответствии с формулой реакции;
Ох — концентрация окисленной формы реагирующего вещества,
a Red — концентрация редуцированной его формы.
Окислительно-восстановительный потенциал по отношению
к водороду обозначают Eh. При измерении Eh устанавливают раз-
V2 22 а. Г. Родина
339
ность потенциалов между двумя электродами: одним — исполь-
зуемым как электрод сравнения, другим — испытываемым. Да-
лее Eh вычисляют по отношению к нормальному водородному
электроду, потенциал которого принимают за нуль. Это пред-
ставление исходит из того, что когда электрод погружен в 1 н.
раствор водородных ионов при давлении газообразного водорода,
равном 1 атм., концентрация как окисленной формы водорода,
так и восстановленной равна 1.
Тогда уравнение Нернста выражается следующим образом:
ГН+1
Eh = 0.029 IgTfTT »
I ri2J
так как при 20° С и переводе натуральных логарифмов в деся-
тичные ^г=0.029.
Эта величина меняется в зависимости от температуры:
15 э . . . 0.0285 19е . . . 0.0289 23° . . . 0.0293
16 . . . 0.0286 20 . . . 0.0290 24 . . . 0.0294
17 . . . 0.0287 21 . . . 0.0291 25 . . . 0.0295
18 . . . 0.0288 22 . . . 0.0292
Так как многие О В реакции идут с участием водорода, то ве-
личина Eh в этих системах зависит не только от отношения окис-
лителя к восстановителю, но и от значения pH. Поэтому при из-
мерениях Eh всегда необходимо определить pH и указать, при
каком pH был установлен Eh.
Для получения сравнимых данных по окислительно-восстано-
вительным условиям в растворах, имеющих разное значение pH.
Кларком был предложен иной показатель — гН2, имеющий рас-
четный характер, значение которого может быть вычислено легко
из формулы
гН2= 0^)29 4~2рН (ври выражении Eh в вольтах).
По Кларку, гН2=—lgH2, т. е. показатель гН2 есть отрицатель-
ный логарифм количества молекулярного водорода, содержащегося
в растворе. Из равенства —lgH2=rH2 вытекает, что при гН2=0
величина Н2=1, т. е. значение гН2=0 будет иметь место в ука-
занном выше случае — в растворе, насыщенном водородом при
атмосферном давлении, равном 1. В растворе, насыщенном ки-
слородом, т. е. в условиях, когда ОВП выше указанного на 1230 мв,
величина г112 будет равна ^^=41. Следовательно, значения,
равные 0 и 41, являются крайними пределами. Они указывают на
полное насыщение раствора или водородом (восстановительная
среда), или кислородом (окислительная среда). Однако следует
заметить, что при указанных крайних значениях гН2физический
340
смысл этого показателя теряется. Например, при гН2—41 или
—lgH2=41 вычисленное давление Н2 будет выражаться чис-
лом 10-41, что лишено реального значения. В аэробных условиях
при гН2, равном 25—30 и выше, никакого реального водорода нет
(Работнова, 1957). В этом случае имеются другие ОВ-системы,
имеющие реальные концентрации. Принимается, что гН2 в пре-
делах от 0 до 41 характеризует все степени насыщения раствора
водородом и кислородом. Чем меньше гН2, тем ярче выражены
восстановительные условия в растворе.
Следует указать, что все изложенное относится к ничем не
осложненным (простейшим) окислительно-восстановительным про-
цессам. Отличительными их признаками являются следующие
свойства: 1) они обратимы, 2) протекают быстро.
Биологу обычно приходится сталкиваться с необратимыми си-
стемами, когда вещество, влияющее на Eh раствора, будучи окис-
лено или восстановлено, не может быть возвращено в первона-
чальное состояние. К таким веществам относятся сахара, органи-
ческие кислоты и др. В этих случаях указанная выше формула
RT . Ох
-Eh — Ео + пр In Red
не представляется полностью соответствующей действительному
положению ОВ систем. Однако рядом авторов показано, что ОВП
необратимой системы может быть характеризован через потенциал,
аналогичный Eh обратимой системы. Таким потенциалом является
Eh самого слабого восстановителя, который может восстанавли-
вать данную необратимую систему. Так же как Eh обратимых
систем, Eh необратимых изменяется в зависимости от pH.
Существуют две методики определения окислительно-восста-
новительного потенциала — колориметрическая и электрометри-
ческая.
Колориметрическое определение ОВП. На-
бор индикаторов, меняющих свой цвет при изменении окисли-
тельно-восстановительных условий, охватывающих большую
часть шкалы гН2, был впервые предложен Кларком. Эти индика-
торы в восстановленном состоянии большей частью бесцветны,
в окисленном состоянии — окрашены. Однако каждый индикатор
охватывает весьма ограниченную зону Eh (две единицы гН2).
Вследствие этого оказалось необходимым подобрать очень боль-
шое число таких индикаторов, каждый из которых имеет ограни-
ченную сферу применения. Индикаторы, которые можно было бы
использовать для определения различия степени аэробности при
значениях гП2 выше 23.1, вообще до сих пор не установлены.
В силу вышеуказанных особенностей индикаторов и невозмож-
ности вести с ними работу при соприкосновении с воздухом, когда
от этого растворы окисляются и ОВП их меняется, индикаторы
22*
341
могут быть использованы для определения гН2 лишь в некоторых
определенных случаях.
Так, использование индикаторов может быть полезно при опре-
делении гН2 в культурах анаэробов. В этих случаях рекомендуется
пользоваться агаровыми средами, налитыми в высокие, узкие
пробирки, доступ кислорода в которых затруднен уже в подпо-
верхностный слой. Достаточно добавления 0.2 ?о агара, чтобы
анаэробы смогли развиться в столбике агара, отступя от поверх-
ности на несколько миллиметров. Стерильные растворы индикато-
ров прибавляют к питательной среде непосредственно перед по-
севом. Для установления пределов, до которых исследуемый мик-
________===ввя_в, Р°б снижает гН2, необходимо ис
пользовать несколько индикато-
» ров в ряде параллельных'посевов.
Перечень таких индикаторов дан
И. Л. Работновой (1957).
—Электрометрическое
’ определение ОВП. Элек-
Рис. 169. Гладкие платиновые трометрическое определение ОВП
электроды. в своей основе просто и не отли-
чается по технике от такого же
способа измерения pH. Для этих
измерений лучше всего пользоваться теми же ламповыми
потенциометрами (Л П-5, Л П-58), какими пользуются для опре-
деления pH. В анализируемую жидкость, находящуюся в спе-
циальном сосуде, опускают платиновый электрод. Ламповые по-
тенциометры сделали возможным использование гладких плати-
новых электродов, так как в этих приборах полностью устранено
явление поляризации электродов, имеющее место в электрометри-
ческих установках иного типа.
Гладкий платиновый электрод (рис. 169) представляет собой
стеклянную трубку диаметром 3—5 мм произвольной длины,
в один из концов которой впаяна платиновая проволока диаметром
лучше всего 0.5 мм, либо проволока с приклепанной к ней пла-
тиновой пластинкой размером около 5x15 мм. Для подключения
электрода к потенциометру в его стеклянную трубку наливают
небольшое количество чистой ртути, куда вставляется медная про-
волока. Перед употреблением платиновые электроды необходимо
протарировать (промерить по каломелевому электроду, с кото-
рым будут производиться измерения). Для этого готовят буфер-
ную смесь: в 1 л дистиллированной воды растворяют 1/300 М крас-
ной кровяной соли, 1/300 М желтой кровяной соли и 1/lt) М КС1. Та-
кой раствор имеет значение Eh — +430 мв при 25° С. Электроды
считаются пригодными тогда, когда при измерении такой буфер-
ной смеси по каломелевому электроду каждый из них показы-
вает на приборе 430 мв. После измерения буферной смеси электроды
промывают дистиллированной водой. Платиновые электроды не-
342
обходимо периодически выдерживать 30—60 мин. в хромовой
смеси, после чего их промывают вначале водопроводной, а затем
дистиллированной водой. Платиновые электроды сле-
дует хранить в дистиллированной воде (которую пе-
риодически рекомендуется заменять свежеперегнан-
ной) и проверять герметичность впая платиновой про-
волоки в стеклянную трубочку.
При определении ОВП определяют разность
потенциалов между двумя электродами. Платино-
вый электрод опускается в исследуемую жидкость
и затем Измеряется разность потенциалов (или, как
иначе называют, электродвижущая сила) между ним
и другим каким-либо электродом, называемым элек-
тродом сравнения, также вводимом в жидкость.
Обычно в качестве стандартных электродов или элек-
тродов сравнения употребляют каломелевые элек-
троды. В этих электродах металлом служит ртуть,
а электролитом — насыщенный раствор каломели
с определенной концентрацией КС1. Так как кон-
центрация КС1 в каломелевых электродах посто-
янна, то и значение потенциала этих электро-
дов также постоянно, что и дает возможность
использовать их в качестве электродов сравнения.
При изготовлении каломелевых электродов
применяются: очищенная ртуть, каломель и насы-
щенный раствор хлористого калия (рис. 170).
Кал омел евая паста приготовляется путем тща-
тельного растирания в ступке химически чистой ка-
ломели с небольшим количеством (1—2 капли) рту-
ти и насыщенным раствором хлористого калия. При
растирании раствор хлористого калия время от вре-
мени сливают и заменяют свежим (декантация) с
целью удаления из каломели возможных приме-
сей, например двухвалентной ртути.
Для приготовления насыщенного раствора КС1
применяют дважды перекристаллизованный хлорис-
тый калий.
б
Рис. 170.
Каломеле-
вый элек-
трод (по
Крюкову,
1955).
1 — медная
проволока;
2 — замазка;
з — платино-
После определения разности потенциалов между
платиновым и каломелевым электродами вычисляют,
какова разность потенциалов между используемым
платиновым электродом в испытываемой жидкости и
так называемым нормальным водородным электродом.
Полученная величина и является ОВП раствора или
Eh его.
вая проволо-
ка; 4 — кало-
м ел ев ан паста;
5 — вата, про-
питанная на-
сыщенным
раствором
КС!; 6 — во-
локно асбеста.
Измерение электродвижущей силы (э. д. с.) или разности потен-
циалов между платиновым и каломелевым электродами производят
ламповым потенциометром обычным компенсационным методом.
:из
Величину электродвижущей силы отсчитывают по реохорду
прибора в момент компенсации, отсчет производят в милливоль-
тах. Техника измерения подробно излагается в инструкциях,
прилагаемых к приборам. После измерения вычисляют Eh по
формуле
Eh = Ex Ес,
где Ех — величина потенциала, полученная непосредственно при
измерении, т. е. это потенциал испытываемого электрода по срав-
нению с каломелевым электродом. Но так как Eh — потенциал
электрода по сравнению с потенциалом нормального водородного
электрода при определенной температуре, при которой велось
измерение, то необходимо ввести поправку на разницу между ка-
ломелевым и водородным электродами (Ес). Так как калюмелевый
электрод отличается от водородного при 20° на 4-250 мв, то сле-
дует к величине, полученной при измерении (независимо от знака
потенциала) прибавить 250 мв.
В гидромикробиологии измерения окислительно-восстанови-
тельного потенциала производят в воде и грунтах водоемов и
в культурах микроорганизмов.
Определение гН2 в воде. Определение гН2 в водоемах
весьма сложно из-за ряда методических трудностей, среди кото-
рых должны быть указаны следующие: необходимость проведения
электрометрических определений на месте, длительность сроков
выравнивания величины потенциала между электродом и измеряе-
мой средой, поэтому данные по величине ОВП в водоемах скудны.
При определении ОВП в воде следует тщательно следить, чтобы
проба воды не соприкасалась с воздухом во избежание изменений
окислительно-восстановительных условий. Лучше всего поль-
зоваться прибором, который позволяет производить определение
гН2 непосредственно на водоеме, на различных глубинах, как
поступал ряд исследователей (Нехотенова, 1938, и др.). Из ре-
зультатов опытов, проведенных на водоеме, Нехотенова устано-
вила, что потенциал устанавливается через 15—30 мин. Несколько
дольше устанавливается потенциал при первом определении не-
зависимо от того, находится электрод на поверхности или на глу-
бине. Это и понятно, так как необходимо время для установления
определенной физико-химической системы. При втором измерении
потенциал устанавливается быстрее. Поэтому при измерении по-
тенциала на различных глубинах не надо вынимать прибор с элек-
тродами на воздух после каждого измерения, а надо прямо опус-
кать или поднимать его на ту глубину, на которой нужно изме-
рить потенциал (Нехотенова, 1938).
Для определения Eh воды в лаборатории отбор проб должен
производиться приборами типа батометра, исключающими сопри-
косновение отбираемой пробы с воздухом. При этом пробы воды
в батометрах с перекрытыми трубками (во избежание соприкосно-
344
171. Сосуд для определения
вения с кислородом воздуха) по возможности быстро доставляются
в лабораторию, где исследуемая вода прямо из батометра подается
в специальный сосудик (рис. 171) таким образом, чтобы все пу-
зырьки воздуха током воды были
удалены из него.
Определение гН2 в
грунтах водоемов. Изу-
чение ОВП в донных отложениях
водоемов имеет важное значение
для характеристики биохимичес-
ких и физико-химических про-
цессов, протекающих в них. Образ-
цы ила следует брать щупом или
стратометром. Для послойного
определения Eh в колонках грун-
тов их переводят в специальный
пенал (того же диаметра) из плек-
сиглаза, позволяющий хорошо
рассматривать текстуру грунтов.
Определение ведут в центральной
части колонки, куда диффузия
воздуха затруднена. Через спе-
циальные отверстия в крышке
ненала в монолит грунта погружают электроды так,
Рис.
гН2 в воде (по Кузнецову и Ро-
маненко, 1963).
1 — подводящая трубка; 2 — платино-
вые электроды; з — сифончик каломе-
левого электрода; 4 — выводная труб-
ка; 5 — пробка с вмонтированными
электродами.
чтобы
каждый из них находился полностью в плоскости одной
Рис. 172. Приборы для культивирования бактерий
и измерения гН2 в питательной среде.
А — И. Л. Работновой (1957); Б — Н. И. Некрасова
(1933). 1 — замыкающая трубка с гипсом; 2 — уровень
насыщенного раствора КС1.
прослойки либо захватывал несколько микрозон. Обычно в мо-
нолит грунта вставляют несколько платиновых электродов на
345
Рис. 173. Сосуд для измерения гН2
в культуральной жидкости в атмо-
сфере азота (по Raynaud et Viscon-
tini, 1945).
1 — место запайки трубки после напол-
нения сосуда азотом; 2 — платиновый
электрод; з — мостик; 4 — агар с насы-
щенным раствором KG1.
определенном расстоянии друг от друга и один каломелевый
электрод. Для определения Eh в грунтах каломелевый электрод
со шлифом следует заменить палочковидным каломелевым элек-
тродом, предложенным П. А. Крюковым (1955), так как поры
шлифа каломелевого электрода забиваются частицами грунта.
В электроде, предложенном Крюковым, контакт с испытываемой
средой осуществляется через тонкое волокно асбеста на конце
электрода, что вполне гарантирует электрод от загрязнения и
вместе с тем обеспечивает хо-
рошую проводимость.
Все электроды следует вы-
держать в исследуемом образце
ила не менее 15 мин. до начала
измерений. По истечении ука-
занного времени подключают
первый платиновый и каломе-
левый электроды к ламповому
потенциометру и снимают пока-
зания прибора, затем то же са-
мое проделывают со вторым,
третьим и т. д. платиновыми
электродами, каждый из кото-
рых находится на определенной
глубине монолита. Повторные
измерения следует произвести
через 1.5 часа и через 2 часа.
Устойчивого значения потенци-
ал достигает обычно через 2
часа с момента погружения
электрода в монолит. Считают,
что потенциал достиг стабиль-
ного значения, если он изменя-
ется не более чем на 2 мв в
5 мин. Для вычисления Eh не-
обходимо измерить температуру
грунта.
Измерение pH производится стеклянным электродом, который
опускается непосредственно в грунт.
Величина потенциалов двух электродов, погруженных в грунт
на небольшом расстоянии один от другого может быть несколько
различной даже на однородных по составу грунтах. Небольшие
различия во влажности, в аэрации, наличие или отсутствие раз-
лагающихся органических веществ, различная интенсивность
развития микроорганизмов и другие условия могут создавать
местные, очаговые изменения величины ОВП. В однородных
грунтах очаговые изменения ОВП обычно не превышают 20-—
30 мв.
346
Определение ОВП в культурах микро-
организмов. Использование электрометрического метода
позволяет вести непрерывные наблюдения за изменениями ОВ ус-
ловии в течение развития культуры. Этот метод дает возможность
получить кривую изменения Eh во времени, не вмешиваясь в ход
биохимических процессов. Для этого в прибор для культивиро-
вания должен быть вмонтирован стеклянный электрод для изме-
рения pH. И. Л. Работнова (1957) указывает, что отбор пробы из
культуры неизбежно ведет к перемешиванию среды, активации
микроорганизмов и как следствие этого к смещению гН2. Работ-
нова рекомендует измерять Eh в культурах, где развитие уже
закончилось и субстрат исчерпан, пли предварительно убить
культуры прибавлением за 18—20 час. до производства опреде-
лений тимола, который сам не оказывает никакого действия ни
на Eh, ни на pH жидкости. Вследствие изложенного наиболее
правильным является измерение Eh непосредственно в культуре,
когда электрод погружен в культуральную жидкость на все время
культивирования. При этом рекомендуется использовать не ме-
нее 2 (лучше 3) электродов, чтобы можно было взять среднее из
их показаний.
Для измерений Eh в культурах микроорганизмов разработаны
специальные приборы (рис. 172). Некоторые авторы рекомендуют,
для того чтобы избежать влияния кислорода воздуха при опре-
делениях Eh, дезаэрпровать растворы. Лучшим способом дез-
аэрацпп, по Работповоп, является продуванпе через исследуемую
среду азота, полностью очищенного от следов кислорода. Райно
и Висконтини (Raynaud et Vjscontini, 1945) сконструировали
для таких определений специальный прибор (рис. 173). Хорошие
результаты дают измерения в вакууме (Работнова, 1957).
ЛИТЕРАТУРА
А л е к и н О. А. 1959. Методы исследования физических свойств и химиче-
ского состава воды. «Жизнь пресных вод, т. IV, ч. 2, Изд. АН СССР,
М.—Л. : 213—300.
Баранов И. В. 1956. Комбинированный батометр ВНИОРХ для отбора
проб воды и грунта. Научно-техн. бюлл. ВНИОРХ, № 1—2 : 67—69.
Белозерский Л. Н. и Н. И. Проскуряков. 1951. Практиче-
ское руководство по биохимии растений. Изд. «Сов. наука», М. :
1-388.
Большой практикум по микробиологии. 1962. Под ред. Г. Л. Селибера.
Изд. «Высшая школа», М. : 1—490.
Верховская И. Н. 1955. О некоторых особенностях метода изотопных
индикаторов. Сб. «Изотопы в микробиологии», Изд. АН СССР, М. :
227-233.
Виноградский С. Н. 1952. Микробиология почвы. Проблемы и ме-
тоды. Изд. АН СССР, М. : 1 — 792.
Войт А. 1956. Радиоактивные изотопы. Сб. «Биофизические методы иссле-
дования», Изд. иностр, лит., М. : 364—397.
В о л а р о в-и ч М. 11. и В. П. Т р о п и н. 1963. Изучение микрофлоры
торфов методом электронной микроскопии. Микробиология, т. 32,
в. 2:281 —287.
Воскресенский К. А. 1947. Новые приемы изучения микроценозов.
Бюлл. Моск. общ. испытат. природы, т. 52 : 35—43.
Гусева К. А. 1956. Методы эколого-физиологического исследования во-
дорослей. Жизнь пресных вод, т. IV, ч. 1, Изд. АН СССР, М.—Л. :
122—159.
Драчев С. М., А. С. Разумов, С. В. Бруевич, Б. А. Ско-
пинцев, М. Т. Голубева. 1953. Методы химического и бак-
териологического анализа воды. Медгиз, М. : 1—279.
Жадин В. И. 1956. Методика изучения донной фауны водоемов и эколо-
гии донных беспозвоночных. Жизнь пресных вод, т. IV, ч. 1, Изд.
АН СССР, М.-Л. : 279-382.
Жарова Т. В. 1963. Ассимиляция углекислоты гетеротрофными бакте-
риями и ее значение при определении хемосинтеза в водоемах. Микро-
биология, т. 32, в. 5 : 843—849.
Заварзин Г. А. 1958. О возбудителе второй фазы питрификации. Мор-
фология возбудителя второй фазы питрификации. Микробиология,
т. 27, в. 6 : 679—686.
Заварзин Г. А. 1961. Почкующиеся бактерии. Микробиология, т. 30,
в. 5 : 952—975.
Иванов М. В. 1955. Метод определения продукции бактериальной био-
массы в водоеме. Микробиология, т. 24, в. 1 : 79—89.
Имшенецкий А. А. 1949. Оптимальные питательные среды для десуль-
фурирующих бактерий. Микробиология, т. 18, в. 4 : 324—331.
348
Имшенецкий А. А. 1953. Микробиология целлюлозы. Изд. АН СССР,
М. : 1—439.
Имшенецкий А. А. иЕ. Л. Рубап. 1953. Получение чистых куль-
тур Nitrosomonas. Микробиология, т. 22, в. 4 : 376—384.
Калина Г. П. 1962. Ультрафильтрация в микробиологии. Методы и ап-
паратура. Общая микробиология, т. II. Многотомное руководство
по микробиол., клинике и эпидемиол. инфекц. болезней. Медгиз, М. :
400—416.
Карзинкин Г. С. 1934. К изучению бактериального перифитона. Тр.
Лимнология, ст. в Косине, в. 17 : 21—45.
Карякин Ю. В. 1936. Чистые химические реактивы. Химтеоретиздат,
Л. : 1—617.
Колешко О. И. 1960. Строение юных колоний азотобактера. Микробио-
логия, т. 29, в. 2 : 293—295.
Комарова Л. 1949. Пипетка для выделения культур из одной клетки.
Микробиология, т. 18, в. 4 : 370.
Кондратьева Е. Н. 1963. Фотосинтезирующие бактерии. Изд. АН
СССР, М. : 1—314.
Кордэ Н. В. иН. И. Пьявченко. 1950. Приборы для взятия проб
озерных отложений. Тр. сапропел. лабор. АН СССР, в. IV : 115—
119.
Котелев В. В. 1958. К методике выделения из почвы микроорганизмов,
разлагающих органофосфаты. Докл. Всес. акад. с.-х. наук им. Ленина,
в. 9 : 17—18.
Красильников Н.А. 1949. Определитель бактерий и актиномицетов.
Изд. АН СССР, М.—Л. : 1—829.
Красильников Н. А. иВ. И. Котелев. 1957. Качественное
определение фосфатазной активности некоторых групп почвенных ми-
кроорганизмов. ДАН СССР, т. 117, № 5 : 894—895.
Крисс А.Е.иЕ.А. Рукина. 1952. Биомасса микроорганизмов и ско-
рость их размножения в океанических глубинах. Журн. общ. биол.,
т. 13, № 6-7 : 346—362.
Крюков П.А. 1955. Измерение величины pH со стеклянным электродом.
Сб. «Современные методы химического анализа природной воды»,
Изд. АН СССР, М. : 7—13.
Кудрявцев В. И. 1954. Систематика дрожжей. Изд. АН СССР, М. :
1—426.
Кузнецов С. И. 1955. Использование радиоактивной углекислоты С14
для определения сравнительной величины фотосинтеза и хемосинтеза
в ряде озер различных типов. Сб. «Изотопы в микробиологии», Изд.
АН СССР. М. : 126-135.
Кузнецов С. И. и В. И. Романенко. 1963. Микробиологическое
изучение внутренних водоемов. Лабораторное руководство. Изд.
АН СССР, М.-Л. : 1—129.
К у ш н и р Ю. М. 1958. Советские электронные микроскопы. Приборы и
техника эксперимента. Изд. «Знание», М. : 1—31.
Левшин В. Л. 1956. Люминесценция и ее техническое применение. Изд.
АН СССР, М. : 1—47.
Малек И. 1956. Проточный метод размножения микробов. Микробиоло-
гия, т. 25, в. 6 : 659—667.
Мейсель М. Н. 1955. Применение изотопов в микробиологии. Сб. «Изо-
топы в микробиологии», Изд. АН СССР, М. : 5—18.
Мейсель М.Н.иВ.А. Страхова. 1955. Ускоренный люминесцент-
ный метод обнаружения бактерий (обнаружение и количественный
учет кишечной палочки). Изд. АН СССР, М. : 1—48.
Методическое пособие по определению первичной продукции орга-
нического вещества в водоемах радиоуглеродным методом. 1960. Изд.
Белорусск. гос. у нив., Минск : 1—26.
23 А. Г. Ронина
349
Михайлов И. Ф. и С. И. Дьяков. 1961. Люминесцентная микроско-
пия. Медгиз, М. : 1—221.
Мишустин Е. Н. 1948. О роли спороносных бактерий в почвенных про-
цессах. Микробиология, т. 17, в. 3 : 201—207.
Могилевский Г. А. 1953. Микробиологический метод поисков газов
и нефтяных залежей., Гостоптехиздат, М.—Л. : 1—56.
Наумова А. Н. 1961. Минерализация фосфорорганических соединений
ризосферными и почвенными бактериями. Тр. Инет, микробиол.,
в. XI : 222—232.
Некрасов Н. И. 1933. Окислительно-восстановительный потенциал
в биологии. Успехи биол. химии, в. 10 : 72—118.
Нехотенова Н. И. 1938. Электрометрическое определение окисли-
тельно-восстановительного потенциала в водоемах. Микробиология,
т. 7, в. 2 : 186-197.
Нечаева Н. Б. 1953. Образование метана микроорганизмами. Микробио-
логия, т. 22, в. 4 : 456—471.
Нидерль Д. иВ. Нидерль. 1949. Микрометоды количественного
органического анализа. Госхимиздат, М.—Л. : 1—276.
Одоевская II. С. 1961. Новые среды для Вас. mega terium var. phos-
phaticum в почве. Бюлл. научно-техн, информации по с.-х. микро-
биол., в. 10 : 30—32.
Омелянский В. Л. 1940. Практическое руководство по микробиоло-
гии. Изд. АН СССР, М.—Л. : 1—427.
Перфильев Б. В. и Д. Р. Габе. 1961. Капиллярные методы изу-
чения микроорганизмов. Изд. АН СССР, М.—Л. : 1—534.
П е х о в А. П. 1962а. Электронная микроскопия микроорганизмов. Общая
микробиология, т. П\ Многотомное руководство по микробиол., кли-
нике и эпидемиол. инфекц. болезней. Медгиз, М. : 73—108.
Пехов А. П. 19626. Электронпомикроскопическое исследование бактерий
и фагов. Медгиз, М. : 1—224.
Пегаков М. А. 1962. Световой микроскоп и его разновидности. Общая
микробиология, т. II. Многотомное руководство по микробиол., кли-
нике и эпидемиол. инфекц. болезней. Медгиз, М. : 11—72.
Р а б о т п о в а II. Л. 1957. Роль физико-химических условий (pH и гН2)
в жизнедеятельности микроорганизмов. Изд. АН СССР, М. : 1—274.
Разумов А. С. 1932. Прямой метод учета бактерий в воде. Микробиоло-
гия, т. 1, в. 2 : 131—146.
Разумов А. С. 1953. Методы санитарно-бактериологических исследова-
ний. В кн.: Драчев С. М., А. С. Разумов, С. В. Бруе-
вич, Б. А. Скопинцев, М. Т. Голубева. Методы хими-
ческого и бактериологического анализа воды. Медгиз, М. : 226—
271.
Родина А. Г. 1956. Методы микробиологического исследования водое-
мов. Жизнь пресных вод, т. IV, ч. 1, Изд. АН СССР, М.—Л. : 7—121.
Романенко В. И. 1963. Потенциальная способность микрофлоры воды
к гетеротрофной ассимиляции углекислоты и к хемосинтезу. Микро-
биология, т. 32, в. 4 : 668—674.
Рубан Е. Л. 1961. Физиология и биохимия нитрифицирующих микро-
организмов. Изд. АН СССР, М. : 1—173.
Салимовская-Родипа А. Г. 1936. Опыт применения метода пла-
стинок обрастания к изучению бактериальной флоры воды. Микробио-
логия, т. 5, в. 4 : 487—493.
Славнина Г. П. 1947. Разработка люминесцентного метода обнаруже-
ния бактерий, окисляющих углеводороды. Изв. Гл. упр. геол, фондов,
в. 3 : 80—81.
Современные методы и техника морфологических исследований.
1955. Под ред. Д. А. Жданова. Медгиз, Л. : 1—269.
Соколов А. В. и Н. П. Сердобольский. 1954. Методика приме-
нения «меченых атомов» при агрохимических исследованиях. Сб.
350
♦Агрохимические методы исследования почв», Изд. АН СССР, М. :
318-340.
Сорокин Ю. И. 1955. О бактериальном хемосинтезе в иловых отложе-
ниях. Микробиология, т. 24, в. 4 : 393—399.
Сорокин Ю. И. 1957. Роль хемосинтеза в продукции органического ве-
щества в водоемах. Подледный хемосинтез в водной толще Рыбинского
водохранилища. Микробиология, т. 26, в. 6 : 736—744.
Сорокин Ю. И. 1958. Роль хемосинтеза в продукции органического ве-
щества в водоемах. Изучение хемосинтеза в иловых отложениях с по-
мощью С14. Микробиология, т. 27, в. 2 : 206—213.
Сорокин Ю. И. 1960а. Определение изотопического эффекта при усвое-
нии меченой углекислоты в процессе фотосинтеза и хемосинтеза. Ми-
кробиология, т. 29, в. 2 : 204—208.
Сорокин Ю. И. 19606. Батометр для отбора проб воды на бактериоло-
гический анализ. Бюлл. Инет. биол. водохр., № 5 : 48—50.
Сорокин Ю. И. 1963. Об истинной природе нового класса микроорга-
низмов Krassilnikovia (Крисс). Микробиология, т. 32, в. 3 : 425-433.
Спивак Г. В. 1954. Некоторые общие свойства электронномикроскопи-
ческих устройств. В кн.: Электронная микроскопия. Гос. изд. технико-
теорет. лит., М. : 11—24. г
Столбунов А. К. иФ. П. Рябов. 1965. Новая модель бактериоло-
гического батометра. Вопросы гидробиол., М. : 400.
Сушкин Н. Г. 1949. Электронный микроскоп. Гос. изд. технико-теорет.
лит., М. : 1—276.
Тарусой Б. Н. 1954. Основы биологического действия радиоактивных
излучений. Мсдгиз, М. : 1—140.
Таусон В.О. 1925. К вопросу об усвоении парафина микроорганизмами.
Журн. Русск. бот. общ., т. 9 : 161—176.
Т a v с о II В. О. 1928. О бактериальном окислении нефтей. Нефт. хоз.,
т. XIV, № 2 : 220—230.
Таусон В. О. и С. А. Шапиро. 1934. Общее направление окисления
нефти бактериями. Микробиология, т. 3, в. 1 : 79—85.
Тимаков В. Д. и Д. М. Г о л ь д ф арб. 1958. Основы эксперименталь-
ной медицинской бактериологии. Медгиз, М. : 1—347.
Трошин А. С. 1956. Метод радиоактивных индикаторов и его примене-
ние в гидробиологии. Жизнь пресных вод, т. IV, ч. 1, Изд. АН СССР,
М.-Л. : 414-437.
Федоров М. В. 1951. Руководство к практическим занятиям по микро-
биологии. Изд. с.-х. лит., М. : 231.
Хевешн Г. 1950. Радиоактивные излучатели. Изд. иностр, лит., М. :
1-539.
Холодный Н. Г. 1953. Железобактерии. Ияд. АН СССР, М. : 1—222.
Юбер Ф. 1956. Применение стабильных изотопов в качестве меченых ато-
мов. Сб. ♦ Биофизические методы исследования», Изд. иностр, лит.,
М. : 340-363.
Allen О. N. 1957. Experiments in soil bacteriology. Ill. ed. Burgess publ.
Co, Minneapolis : 1—117.
Angier J. 1956. Recherches sur la mesure de I’activite hemicelluloly-
tique des sols. Ann. Inst. Pasteur, t. 90, 2:161—170.
Bartholomew J. W. 1962. Variables influencing results, and the pre-
cise definition of steps in Gram staining as a means of standardizing the
results obtained. Stain Technol., v. 37, № 3 : 139—155.
В i c k H. 1963. A review of central european methods for the biological es-
timation of water pollution levels. Bull. Org. mond. Sante, v. 29 : 401 —
413.
Brough F. K. 1950. A rapid microtechnique for the determination of nit-
rate reduction by microorganisms. J. Bacter., v. 60, № 3 : 365—366.
Bucksteeg W. und H. Thiele. 1959. Die Beurteilung von Abwas-
23*
351
ser und Sohlamm mittes TTC (2-3-5-Triphenyltetrazoliumchlorid).
Gas u. Wasserfach, Bd. 100, H. 36 : 916—920.
Bukatsch F. 1958. Versuche zur Sichtbarmachung von GeiBelaggrega-
ten der Bakterien im Fluorescenzmicroskop. Arch. Mikrobiol., Bd. 31,
№ 1 : 11—15.
Callao V. et E. Hernandez. 1961. Differenciacion de especies del
genero Azotobacter por la concentracion de colorantes en sus colonias.
Microbiol. Espanola, v. 14, № 4 : 247—252.
Callao V. et E. Montoya. 1960a. The use of dyes to distinguish
species of Azotobacter. J. Gen. Microbiol., v. 22, № 3 : 657—661.
Callao V. et E. Montoya. 1960b. Effectos producidos por el telu-
rito potasico sobre el desarrollo de los Azotobacter en medios de cultivo
solidos. Microbiol. Espanola, v. 13, № 4 : 351—360.
Carter С. T. and A. L. Smith. 1957. Principles of microbiology. 3 ed.,
Mosby, St. Louis : 1—665.
C a t a 1 d i M.S. 1940. Aisamiento de Beggiatoa alba en cultivo puro. Rev.
inst. bacteriol. dept. nacl. hig. (Buenos Aires), v. 9, № 4 : 393—423.
Clifton С. E. 1950. Introduction to the bacteria. Mg Graw-Hill, N. Y. :
1-528.
Cohen J. S. and R. H. Burris. 1955. A method for the culture of hyd-
rogen bacteria. J. Bacter., v. 69, № 3 : 316—319.
С о r p e W. A. 1951. A study of the wide spread distribution of Chromobac-
terium species in soil by a simple tecnnique. J. Bacter., v. 62, № 4 :
515-517.
Depoux R. 1953. Sur 1’utilisation des antibiotiques pour l”isolement en
culture pure des azotobacter & partir de la terre. Ann. Inst. Pasteur,
t. 84, № 3 : 645-647.
D e r x H. G. 1951. Azotobacter insigne sp. n. fixateur d'azote a flagellation
polar. Proc. Konink. Nederl. Akao. Wetenschappen, v. LIV, № 4 :
342-350.
D u g d a 1 e R., V. D u g d a 1 e, J. Nees and J. Goering. 1959.
Nitrogen fixation in Lakes. Science, v. 130, № 3379 : 859.
Faust L. and R. S. Wolf e. 1961. Enrichment and cultivation of Beg-
giatoa alba. J. Bacter., v. 81, № 1 : 99—106.
Ingellman B. and H. L a u r e 1 1. 1947. The preparation of silicic acid
gellies for the cultivation of microorganisms. J. Bacter., v. 53, № 3 :
364-365.
Iterson W. van. 1958. Gallionella ferrunginea Ehrenberg in a different
ligth. Verhandl. Konink. Nederl. Akad. Wetenschappen, AFD. Natu-
urkunde, Tweede Reeks, LI I, № 2 : 1—185.
Jensen H. L. 1955. Azotobacter macrocytogenes n. sp., a nitrogenfixing
bacterium resistant to acid reaction. Acta agricult. Scandin., v. 5, № 2 :
280—294.
Jensen V. 1961. Rhamnose for detection and isolation of Azotobacter
vinelandii Lipman. Nature, v. 190, № 4778 : 832—833.
Jensen V. and E. J. Petersen. 1955. Taxonomic studies on Azoto-
bacter chroococcum Beij. and Az. beijerinckii Lip. Roy. Vet. and Agr.
Coll., Copenhagen. Yearbook 1955 : 107—126.
Knausi G. 1951. Elements of bacterial cytology. 2d ed., Ithaca. N. Y.,
Comstock : 1—375.
Lamanna P. D. and M. F. M a 1 1 e t t e. 1953. Basic bacteriology. Wil-
liams a. V^ilkins. Baltimore : 1—677.
Lambin S. et A. German. 1961. Precis de microbiologie, t. 1. Masson,
Paris : 1—458.
Lei f son E. 1951. Staining, shape and arrangement of bacterial flagella.
J. Bacter., v. 62, № 4 : 377-389.
Lewis N. M., O. D. M c N a i 1 a. R. C. S u m m e r f e 1 t. 1963. A de-
vice for taking water samples in sterile bottles at various depths. Eco-
logy, v. 44, № 1 : 171-173.
352
L о d d е г J. and N. J. W. К rege r-V a n - R i j. 1952. The yeasts. A taxo
nomic study. North-Holland, publ. Co, Amsterdam : 1—713.
Manual of microbiological methods. 1957. N. Y., London : 1—315.
Matthews A. D. 1961. A simple method for the cultivation of anaerobes.
Canad. J. Med. Technol., v. 23, № 4 : 145-151.
Meyers G. E. 1958. Staining iron bacteria. Stain Technol., v. 33, № 6
283-285.
N e e s s J. C., R. C. D u g d a 1 e, V. D u g d a 1 e and J. J. G о e r i n g.
1962. Nitrogen metabolism in lakes. 1. Measurement of nitrogen fixa-
tion with N15. Limnology a. Oceanography, v. 7, № 2 : 163—169.
О r t e 1 S. 1957. Bienengift nahrboden zur Trennung grampositives und
gramnegatives Rakterien. Rontgen Laboratoriumpraxis, v. 10, № 12 :
341-342.
Pochon J.etP. Tardieux. 1962. Techniques d'analyse en microbio-
logie du sol. Ed. de la Tourelle, S. Mande : 1 — 111.
Postgate J. R. 1959. Differential media for sulphur bacteria. J. Science,
Food a. Agriculture, v. 10, № 12 : 669—674.
Raynaud M. 1949. Les bacteries anaerobies pectinolytiquds. Ann. Inst.
Pasteur, t. 77, № 4 : 434—470.
Raynaud M. et M. Viscontini. 1945. Le potentiel d’oxydoreduc-
tion au cours de la regdneretion des milieux employes pour la culture
des anadrobies. Ann. Inst. Pasteur, t. 71, №4-2 : 172—187.
Reperigny J. and S. S о n e a. 1958. Detection microscopique de la
fluorescence primaire chez les bacteries. Canad. J. Microbiol., v. 4,
№ 1 : 17—23.
Repetigny J., S. So nea etA. Frappier. 1961. Etudes micro-
fluorometrique des nicroorganismes. La fluorescence primaire. Ann.
Inst. Pasteur, t. 101, № 3:353—366.
R i t ten berg D., A. S. Keston, F. Roseburg and R. Scho-
en h e i m e r. 1939. The determination of nitrogen isotopes in organic
compounds. J. Riol. Chem., v. 127 : 291—299.
Rittenberg В. T. and S. C. R i t t e n b e r g. 1962. The growth of
Spirillum volutans Ehrenberg in mixed and pure cultures. Arch. Mikro-
biol., Bd. 42, № 2 : 138—153/
S a i s s a c R., L. M. В r u g i e r e et M. Raynaud. 1952. Activite
pectinolvtique de quelques bacteries anaerobies. Ann. Inst. Pasteur,
t. 82, № 3 : 356—361.
Schlegel H. G. und N. Pfennig. 1961. Die Anreicherungskultur
einiger Schwefelpurpurbakterien. Arch. Mikrobiol., Bd. 38, № 1 : 1—39.
Scotten H. L. and J. L. Stokes. 1962. Isolation and properties of
Beggiatoa. Arch. Mikrobiol., Bd. 42, № 4 : 353—368.
Sieburth J. Me. N. 1963. A simple form of the Zobell bacteriological samp-
ler for shallow water. Limnology a. Oceanography, v. 8, № 4 : 489—
492.
Silverman M. P. and D. G. Lungren. 1959. Studies on the chemo-
autotrophic iron bacterium Ferrobacillus ferrooxidans. An improved
medium and a harvesting procedure for securing high cell yields. J. Вас-
ter., v. 77, № 5 : 642—647.
Stadman T. C. and H. A. Barker. 1951. Studies on the methane fer-
mentation. J. Bacter., v. 61, № 1 : 67—71.
Stapp C. 1940. Azotomonas ins о lit a ein neuer aerober Stickstofflbinden-
der Mikroorganismus. Centr. Bakt., II Abt., Bd. 102, H. 1/3 : 1—19.
Steemann-Nielsen E. 1952. The use of radio-active carbon (Cu) for
measuring organic production in the sea. J. Conseil, v. 18 : 117—140.
Thirst M. 1957. Gelatin liquefaction. J. Gen. Microbiol., v. 7, № 2 : 396—
400.
Tidwell L.,C. D. Heather and C. Merkle. 1955. An autoclave-
sterilized medium for the detection of urease activity. J. Bacter., v. 69,
№ 6 : 701—702.
353
Van-Niel С. В. 1944. The culture, general physiology, morphology and
classification of non sulfur-purple and brown bacteria. Bact. Rev., v. 8 :
1-118.
Williams О. B. 1955. Laboratory manual for general bacteriology. Ill
ed., Austin, Texas, Hemphills : 1—114.
W i 1 s к a A. 1954. Observations with the anoptral microscope. Microscopie,
v. 9, H. 1—4 : 1—80.
W i к в n T. 1940. Untersuchungen fiber Methangarung und die dabei wirk-
samen Bakterien. Arch. Microbiol., Bd. 11, № 3 : 312—315.
Z ob all С. E. 1946. Marine Microbiology. Mass, Chronica botanica, N. Y. :
1-240.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Автолпзаты дрожжей 53
Агар Бадера 120
— глицерино-аспарагиповый 300
— глицерино-мясо-пептонный 203
— глюкозо-аспарагиновый 300
— глюкозо-пептонный 301
— Городковой 154
— для учета дрожжей 149
— картофельный для бактерий 161
— — — актиномицетов 302
— — — фосфорных бактерий 284
— картофельно-глюкозный 302
— картофельно-декстрозный 256
— картофельно-минеральный для
фосфорных бактерий 284
— картофельно-морковный Емцева
256
— крахмальный для актиномицетов
301
— — — амилолитических бактерий
160
— Круиффа для амилолитических
бактерий 161
— Ларсена для зеленых серобак-
терий 269
— Лиске для железобактерий 289
— мясо-пептонный 52
— мясо-пептонный с жиром 186
— на почвенном экстракте с мочеви-
ной 217
— на почвенном экстракте для
актиномицетов 302
— нитрат-сукрозный 235
— Пошона для амилолитических
бактерий 160
— Ривьера для целлюлозных бакте-
рий 170
— скошенный 52
— соевый для актиномицетов 302
— с мочевиной и глюкозой 217
— с дрожжевым экстрактом для
актиномицетов 302
— с иловой вытяжкой для фосфор-
ных бактерий 281
— с почвенной вытяжкой для фос-
форных бактерий 281
— с фенолфталеинфосфатом натрия
для фосфорных бактерий 285
— тирозиновый для актиномицетов
301
— Торнтона для минерализующих
белковые вещества бактерий
204
— Фуллера и Нормана для целлю-
лозпых бактерий 169
— Хоменко 120
— Чапека для актиномицетов 300
— Эндо 320
Азотобактер, методы культивиро-
вания 237
— методы выделения 240
— описание видов 242
Азотфиксирующие бактерии 237
Активная реакция среды, метод опре-
деления 335
Актиномицеты 298
— признаки для определения 298
Аммиак, выделение бактериями 117
— обнаружение в культурах 222
Аммиачная ферментация мочевины
215
Аммонифицирующие бактерии, оп-
ределение методом титров 207
Анализ воды, санитарно-бактери-
ологический 318
Анаэробы, культивирование 64
Ангстрем 85
Аноптральпое устройство 38
Аппарат Аристовского 66
— Вернея 67
Артроспоры 152
Аскоспоры 155
Ассимиляция бактериями углекис-
лоты, метод определения 331
355
Аэробы, культивирование 62
Аэраторы 62
Бактерии азотфиксирующие 237
— амилолитические 159
— аммонифицирующие 207
— грамотрицательные 94, 97
— грамположительные 94, 97
— денитрифкйщрующие 233
— — окисляющие серу 235
— десульфурирующие 258
— маслянокислые 181
— метанобразующие 189
— минерализующие белковые ве-
щества 203
— нитрифицирующие 218
— окисляющие водород 199
— • — сульфиды и соединения за-
киси железа 278
— — углеводороды 197
— пектинразлагающие 175—178
— пигментные 295
— разлагающие гемицеллюлозы 162
— — жир 186
— — соли органических кислот 189
— светящиеся 297
— фосфорные 280
Бациллы, количественный учет 208
— среды для культивирования 209
Биомасса бактерпй 127
Бластоспоры 152
Бокс переносный, для посевов 15
Бруцин, раствор 228
Бульон мясо-пептонный 51
— — с селитрой 234
Буферные растворы 337
Вакуум-эксикатор 69
Висячая капля, приготовление 89
Включения в клетках бактерий 102
Вода дрожжевая 54
— пептонная 207
— — с глюкозой 183
Волютин 102
Восстановление нитратов ИЗ
Время генерации бактерий, опреде-
ление 134
Выбор мест взятия проб в водоеме 9
Выделение бактерий, методы 73
— из одной клетки 76
Выращивание бактерий 61
Гаулобактерии 306
Гелевые пластинки по Виноградскому
223
— — по Ингельману и Лауреллю
223
Гипсовые блоки 154
356
Гликоген, окраска 104
Гранулеза 255
Движение бактерпй, установление 89
Декстрин целлюлозный, приготовлен
ние 169
Денитрификация 233
Держатель для пробирок 76
Деформация клеток при высушива-
нии 83
Дифениламин 230
Дночерпатели 25
Дрожжи 148
— ассимиляция сахаров 156
— использование источников азота
158
— — спирта 159
— мицелий 152
— морфология 150
— образование пигментов 159
— псевдомицелий 152
— разложение арбутина 159
— способы размножения 150
— форма клеток 151
Жгутики 88
— окраска 91
Желатина водная 301
— глюкозо-пептопная 301
— мясо-пептонная 52
— мясо-пептонная с мочевипой 216
Желатиновая среда с пептоном и
дрожжевой водой 205
— — Фразье 205
Железобактерии 286
Жир, включения 105
Зоны растворения мела нитрозными
бактериями 224
— разложения фильтровальной бу-
маги 171
Измерение бактерпй 83
— площади поля зрения 125
— радиоактивности бактерий 328
Изотопы радиоактивные 324
— стабильные 324
Иловая вытяжка 238
Индикаторы для определения pH
336
Индол, образование бактериями 117
Использование источников углерода
НО
— азота 112
— спирта дрожжами 159
Капсулы бактерий 101
Клетка, форма 83
Количественный учет бациллярных
форм 208
Конденсор темнопольный 35
Краска, анилиновый «генцианви-
олет> Эрлиха 87
— карболовая розовая бенгальская
88
— карболовая синяя по Кюпе 88
— карболовый генциапвиолет 95
— — кристаллвполет 87
— — фуксин Циля 87
— кристаллвполет Хакера 93
— нейтральная красная 88
— сафранин 94
— Судан 105
— хризоидин 88
Краски 86
Крышка Бревера 71
Культуры чистые 73
Кюри 326
Лампа ртутно-кварцевая 43
Люминесцентная микроскопия 39
Люминесцентный анализ 46
— метод выявления живых и мерт-
вых клеток бактерий 314
— — подсчета колоний группы ки-
шечной палочки 321
Люминесценция окисляющих угле-
водороды бактерпй 196
Мазок, приготовление 85
Мембранные фильтры, характери-
стика 58
Меры предосторожности в работе
с изотопами 334
Метахроматин, окраска 102
Метод Виноградского элективных
сред 50
— капиллярный Перфильева изу-
чения обрастаний 310
— пластинок обрастания 304
— прямого счета бактерий в воде
121
— радиоактивных индикаторов 324
— титров 143
Методика биоконтроля необрастаю-
щих покрытий 316
— определения ассимиляции угле-
кислоты бактериями 331
Методы культивирования микроорга-
низмов 49
— — спирилл 211
— микроскопии 30
— прямого счета бактерий в грун-
тах 126
— фиксации бактерий 85
Мнкроманипулятор 76
Микрометр окулярный сетчатый 124г
Микрон 85
Микроселектор Перфильева 77
Микроскоп люминесцентный 42
— электронный 47
Микроскопия апоптральная 38
— в темном поле 35
— люминесцентная 39
— фазовоконтрастная 36
Минерализация белковых веществ
203
Мицелий актиномицетов 299
— дрожжей 152
Молоко, свертывапие 115
— степень кислотности 116
Морфология бактерий 82
Мочевина, аммиачная ферментация
215
Окулярмикрометр 84
Опак-иллюминатор 43
Определение азота в культуре 246-
— биомассы бактерий в воде и
в грунтах 127
— вида бактерий 78
— количества аммонифицирующих
бактерий 207
— — бактерий на фильтре 125
— — глюкозы в культуре 250
— фосфатазпой активности фосфор-
ных бактерий 285
— pH 335
— гН2 338
Осветитель 31, 32
Освещение препарата по Кёлеру 31
Отвар картофельный 257
— морковный 257
Отношение бактерий к кислороду 109
— к температуре 116
Пелоскоп Перфильева и Габе 312
Перифитонометр » 310
Пластинки обрастания 304
— — окраска 308
Посев глубинный 60
— на поверхности агара 75
Посевы, техника 59
Прибор Сорокина для погружения
стекол 310
Приборы для взятия проб воды 16—
24
— — — — грунтов 24—29
— — — — грунтов и придонной
воды 29
— для культивирования бактерий
и измерения гН2 345
— для фильтрации 57
357
Признаки для определения вида 79
Проточные установки 63
Радиоактивные индикаторы 324
Разведения посевного материала 74,
139, 141
Разложение нитратов 229 '
— - арбутина 159
Размеры пор различных фильтров 57
— колоний 79
Распределение станций взятия проб
на створе 13
Раствор витаминов 157, 265, 272, 292
— йода по Бурке 93
— — Люголя 95
— микроэлементов 200, 214, 237,
263, 268, 293
— сулемы 206
— флороглюцина 162
— цинк-йод-крахмальный 220
Растворение бактериями нераствори-
мых в воде фосфатов 280
Расчет биомассы дрожжевых клеток
130
— — кокков 129
— — палочек 130
— диаметра кокков 128
Реактив Грисса 221
— Несслера па аммиак 222
— Крупа 117
Реакции на аммиак 222
— нитраты 227
— нитриты 221
Редуцирующие вещества 65
Рост бактерий в МП Б 107
---на МПА 107
— — на картофеле 109
— — в молоке 115
Свойства грамположительных и
грамотрицательных бактерий 94
Серобактерии 262
— бесцветные 270
— — выделение по Катальдп 271
— — постановка культур по Бор-
гарду 271
— — — — по Шапошникову 271
— зеленые, методы культивирова-
ния 268
— пурпурные, получение накопи-
тельных культур 262
Сероводород, определение образова-
ния бактериями 119
Смесь Никифорова 85
Совместное выращивание аэробов
с анаэробами 68
Спириллы, методы культивирования
211
— азотфиксирующие 245
Споры, форма 82
— прорастание 98
— окраска 100
Спорообразование у дрожжей 153
Среда Аллена 216
— Андреде для определения исполь-
зования углеводов 111
— Бариновой для пектиновых бак-
терий 175
— —- для пектинразлагающпх гриб-
ков 181
— Баркера для бактерий, разла-
гающих соли органических кис-
лот 193
— Басрэда 236
— Бейеринка для определения
использования углеводов 111
— — для бактерий, разлагающих
мочевину 216
— — для Sulfomonas denitrificans
236
— — для тиобактерий 276
— Бента и Ровира для фосфорных
бактерий 281
— Боковой, Кузнецовой и Кузне-
цова для окисляющих метан бак-
терий 197
— Бычковской для бактерий, раз-
лагающих соли органических
кислот 193
— Ваксмана для Thiobacillus thio-
oxidans 277
— Ван-Дельдепа для десульфури-
рующих бактерий 260
— Ван-Ниля для пурпурных серо-
бактерий 263
— — для Gallionella 292
— Викена для бактерий, разлагаю-
щих соли органических кислот
193
— Виноградского для Nitrosomonas
218
— — для Nitrobacter 227
— — для Clostridium pasteurianum
254
— — для целлюлозных бактерий
164
— — для железобактерий 288
— Ворошиловой и Диановой для
бактерий, окисляющих углеводо-
роды 196
— Вуди и Линдстрема для Rhodo-
spirillum rubrum 297
— Гентера п Шварца для железо-
бактерий 291
— Герретсена для фосфорных бак-
терий 281
358
— Гетчинсона для целлюлозных бак-
терий 164
— Гильтая для денитрифицирующих
бактерий 234
— Грохана для окисляющих метан
198
— Гудвина и Лэнда для пурпурных
серобактерий 264
— Дену для азотобактера 241
— для дрожжей с глюкозой 149
— — — с суслом и сахарозой 149
— для маслянокислых бактерий 184
— для окисляющих жидкие углево-
дороды бактерий 196
— — — марганец бактерий 294
— для разлагающих пефть бактерий
196
— для светящихся бактерий 297
— для установления ассимиляции
дрожжами источников азота 158
— - для фосфорных бактерий 281
— для целлюлозных бактерий 171
— для Cell vibrio 168
— - для Chromobacterium violaceum
296
— для Pseudomonas aeruginosa 296
— для Rhodopseudomonas 297
— для Serratia marcescens 296
— Дюбо для аэробных целлюлоз-
ных бактерий 165
— Заварзина для Metallogenium
simbioticum 294
— Зон ген а с мочевиной 216
— Йенсена для Azotobacter шасго-
cytogenes 239
— Имшенецкого для амилолитиче-
ских бактерий 160
— — для целлюлозных бактерий
173
— Кайзера и Шалвиньяка для пек-
тиновых бактерий 180
— Казерера для окисляющих метан
бактерий 197
— Калинепко для железобактерий
289
— картофельная для спороносных
бактерий 209
— Кольмера для Thiobacillus fer-
rooxidans 278
— Коссовича для пигментных бак-
терий 295
— Коэна и Бурриса для Hydroge-
monas facilis 200
— Кудрявцева для дрожжей 157
— Кучера и Вульфа для Gallionella
293
— Ланга для бактерий, окисляющих
окись углерода 202
— Ларсена для зеленых серобакте-
рий 268
— Лебедева для бактерий, окисляю-
щих водород 199
— Леви и Прамера для нитрифици-
рующих бактерий 219
— Летена и др. для Thiobacillus fer-
rooxidans 279
— Лиске для железобактерий 288
— — для Sulfomonas denitrificans
236
— Майк л джона для нитрифицирую-
щих бактерий 220
— Мак-Бефа для целлюлозных бак-
терпй 165
— Макхерея для пурпурных серо-
бактерий 264
— Менкиной для фосфорных бакте-
рпй 283
— Мюллера для целлюлозных бак-
терий 173
— на мясной воде для спирилл
213
— Нероновой для маслянокислых
бактерий 183
— Новогрудского для фосфорных
бактерий 281
— Норриса для Azotobacter insigne
239
— Огье для Clostridium pasteuria-
num 254
— — для бактерий, разлагающих
гемицеллюлозы 163
— Омелянского для бесцветных серо-
бактерий 270
— — для бактерпй, окисляющих ме-
тан 198
— — для бактерий, разлагающих
соли органических кислот 192
— — для пектиновых бактерий 180
— — для пигментных бактерпй 295
— - — для целлюлозных бактерий 173
— — для Bacillus mesentericus
296
— Охмана для дрожжей 154
— пептон-глюкозпая 321
— пептоп-глюкозпая для спирилл
213
— полужидкая для определения
подвижности бактерий 92
— Пошона и Тардье для аммони-
фицирующих бактерий 208
— Превэ для железобактерий 288
— Принсгейма для спирилл 213
— Проктора и Вильсона для азот-
фиксирующих бактерий 239
— Рана для жирорасщепляющих
бактерий 188
359
Среда Риттенберга и Риттенберг для
спирилл 213
— Родиной для тиобактсрий 276
— Рубенчика с мочевиной 216
— Руланда для бактерий, окисляю-
щих водород 200
— с глюкозой для денитрифицирую-
щих бактерий 234
— с иловой вытяжкой для азотобак-
тера 238
— с казеином для спирилл 212
— с картофелем для бацилл 209
— с лактатом кальция для спирилл
213
— — — для десульфурирующих
бактерий 260
— с мясным экстрактом для масля-
нокислых бактерий 184
— с почвенной вытяжкой для спи-
рилл 212
— для фосфорных бактерий 281
— с фенолфталеинфосфатом натрия
285
— с углекислым железом для желе-
зобактерий 288
— с этиловым спиртом для масляно-
кислых бактерий 183
— Салле для пигментных бактерпй
295
— Селпбера для жирорасщепляю-
щих бактерий 187
— Сильвермана и Лэпдгрюпа для
Ferrobacillus ferrooxidans 293
— Скоттена и Стоукса для бесцвет-
ных серобактерий 271
— Старкея для десульфурирующих
бактерий 260
— для тиобактерий 276
— Стефепсоп для нитрифицирую-
щих бактерий 220
— Стэдмен и Баркера для жирорас-
щепляющих бактерий 192
— Тайдвелла, Хэфера и Меркла
для бактерий, разлагающих мо-
чевипу 217
— Таусопа для десульфурирую-
щих бактерий 259
— — для жирорасщепляющих бак-
терий 187
— — для бактерий, окисляющих
— углеводороды 194
— Траутвейна для Sulfomonas de-
nitrificans 236
— Фареуса для целлюлозных бак-
терий 164
— Федорова для азотобактера 237
— Шлегеля и Пфеннига для пур-
пурных серобактерий 265
— Цетлпна для дрожжей 154
— Энгля и Александера для нитри-
фицирующих бактерпй 219
— - Якобсена для тиобактерий 276
Среды Красильникова для актино
мицетов 303
— »мясо-пептоппые 51
Стратометр Перфильева 27
Схема установки Б 327
Счетчик колоний автоматический 142
— — одноклавишный 142
Таблица Бертрана для установления
количества глюкозы 253
— для определения биомассы бак-
терий 131—133
— Мак-Креди 145
Темнопольный конденсор 35
Температура стерилизации 56
Техника посевов 59
Толщина предметного стекла 34
— покровного стекла 34
Установка для пластинок обрастания
309
— покровных стекол по Воскресен-
скому 309
Установление бактериальных цено-
зов 312
Устройство анонтральное 38
— фазовокоптрастное 37
Учет бактерпй методом титров 143
Фекальное загрязнение воды, пока-
затели 318
Ферментация сахаров 111
Физиологические группы бактерий,
определение численности 138
Физиологические признаки 109
Фиксация азота 237
— бактерий, методы 85
Фильтровальные свечи 57
Фильтры асбестовые 58
— мембранные 58
— размеры пор 57
Флуоресценция первичная 41
— вторичная 41
Флуорохромы 45
Форма клеток бактерий 83
— колоний 80
Цвет пигмента, образуемого целлю-
лозными бактериями 172
Ценозы бактерий в воде 312
Экстракт почвенный 303
Экстракты дрожжей 54
ОГЛАВЛЕНИЕ
Стр.
Введение ....................................................... 3
Глава 1. Взятие проб для микробиологических исследований 9
Выбор мест взятия проб.................................... 9
Приборы для взятия проб воды и грунтов................... 16
Глава 2. Методы микроскопии ................................... 30
Оптические микроскопы.................................... 30
Основные правила работы с оптическими микроскопами 30
Специальные методы микроскопии ........................ 35
Микроскопия в темном поле........................... 35
Фазовокоптрастная микроскопия....................... 36
Аноптральная микроскопия ........................... 38
Люминесцентная микроскопия.......................... 39
Электронный микроскоп.................................... 47
Глава 3. Методы культивирования микроорганизмов................ 49
Приготовление обычных лабораторных питательных сред . ... 51
Мясо-пептонные среды................................... 51
Дрожжевые автолизаты, экстракты, дрожжевая вода .... 53
Методы стерилизации...................................... 55
Техника посевов ......................................... 59
Выращивание микроорганизмов ............................. 61
Культивирование аэробов ............................... 62
Культивирование анаэробов ............................. 64
Глава 4. Выделение чистых культур и определение вида бактерий. 73
Методы выделения бактерий................................ 73
Определение вида бактерий................................ 78
Изучение морфологии бактерий........................... 82
Изучение формы клеток............................... 83
Измерение бактерий.................................. 83
Методы фиксации и окраски фиксированных бактерий . . 85
Определение подвижности бактерий и окраска жгутиков 88
Окраска по Граму ................................... 93
Изучение спорообразования и окраска спор............ 97
Окраска капсул..................................... 101
Окраска включений в протоплазме бактерий........... 102
Рост на различных средах........................... 106
361
Стр-
Методы установления физиологически? признаков .... 109
Методы установления продуктов обмена бактерий .... 116
Глава 5. Количественный учет микроорганизмов в воде и в грунтах 121
Метод прямого счета бактерий в воде...................... 121
Методы прямого счета бактерий в грунтах.................. 126
Определепие биомассы микробов в воде и в грунтах......... 127
Определение времени генерации бактерий и продукции бактери-
альной массы........................................ 134
Определение численности отдельных физиологических групп
бактерий............................................ 138
Глава 6. Методы изучения превращений микроорганизмами безазо-
тистых веществ и обнаружения этих микроорганизмов........ 148
Определение содержания клеток дрожжей и дрожжеподобных
грибков в водоемах ................................. 148
Определение наличия амилолитических бактерий............. 159
Определение процесса разложения гемицеллюлоз............. 162
Определение процессов разложения клетчатки . ............ 164
Аэробное разложение клетчатки ........................ 164
Анаэробное разложение клетчатки ...................... 172
Определение процессов разложения пектиновых веществ .... 176
Определение наличия возбудителей маслянокислого брожения 181
Определение процесса разложения жиров.................... 186
Определение процесса разложения солей органических кислот . 189
Определение процессов окисления углеводородов и водорода 194
Глава 7. Методы изучения превращений микрооргапизмами азо-
тистых веществ .......................................... 203
Установление наличия процессов минерализации белковых
веществ ............................................ 203
Определепие процесса аммиачной ферментации мочевины . . . . 215
Определение процессов нитрификации.................. 218
Нитрификация I фазы................................... 218
Нитрификация II фазы.................................. 227
Определение процесса денитрификации ..................... 233
Определение процессов фиксации азота..................... 237
Аэробпая фиксация азота .............................. 237
Анаэробная фиксация азота ............................ 254
Глава 8. Методы изучения процессов круговорота серы...... 258
Образование сероводорода из белковых веществ............. 258
Определение процесса десульфатизации .................... 258
Окисление сероводорода, серы и тиосульфатов.............. 262
Методы культивирования пурпурных серобактерий .... 262
Методы культивирования зеленых серобактерий........... 268
Методы культивирования бесцветных серобактерий .... 270*
Методы культивирования тиобактерий.................... 275
Глава 9. Методы изучения превращений микроорганизмами со-
единений фосфора......................................... 280
Растворение микроорганизмами нерастворимых соединений фос-
фора ............................................... 280
Освобождение фосфатов из органических соединений......... 283
Глава 10. Методы культивирования железобактерий............... 286
Глава И. Культивирование пигментных и светящихся микроорга-
низмов. Методы получения культур актиномицетов .... 295
362
Стр.
Культивирование пигментных микроорганизмов............... 295-
Культивирование светящихся бактерий....................... 297
Методы культивирования актиномицетов...................... 298
Г Л 1 в а 12. Изучение обрастаний............................... 304
Пластинки обрастания ..................................... 304
Капиллярный метод изучения обрастаний Б. В. Перфильева 310
Установление бактериальных ценозов в водоемах............ 312
Методика биоконтроля необрастающих покрытий с использо-
ванием микроорганизмов............................ 31 &
Гл а в а 13. Методы санитарно-бактериологического анализа воды 318
а в а 14. Метод радиоактивных индикаторов................... 324
Техника определения ...................................... 327
Методика определения ассимиляции углекислоты бактериями 331
л а в а 15. Определение активной реакции среды и окислительно-
восстановительного потенциала............................ 335
Определение активной реакции среды (pH)................... 335
Определение окислительно-восстановительного потенциала . . 338
ература..................................................... 348
Гре сметный указатель........................................... 355
Антонина Гавриловна Родина
МЕТОДЫ
ВОДНОЙ МИКРОБИОЛОГИИ
Утверждено к печати
Зоологическим институтом
Академии наук СССР
Редактор издательства Л. Ф. Пухальская
Художник Д. А. Андреев
Технический редактор Н. Ф. Виноградова
Корректор Н. М. Шилова
Сдано в набор 7/1 1965 г. Подписано к печати
30/IV 1965 г. РИСО АН СССР № 10-110 В. Фор-
мат бумаги 60 х 90*/1в. Бум. л. 113в. Печ. л.
223/4 = 22.75. Усл. печ. л.+4 вкл. Уч.-изд. л.
22.6 -|- 4 вкл. (0.22). Изд. № 2508. Тип. зак. № 6.
М-29714. Тираж 2000. ТП 1965 г. № 725.
Цена 1 р. 82 к.
Ленинградское отделение издательства «Наука»
Ленинград, В-164, Менделеевская лин., д. 1
1-я тип. издательства «Наука». Ленинград, В-34,
9 линия, д. 12