Текст
А. А. КУЗНЕЦОВ, E. H. СУДАКОВ
РАСЧЕТЫ
ОСНОВНЫХ ПРОЦЕССОВ
И АППАРАТОВ
ПЕРЕРАБОТКИ
УГЛЕВОДОРОДНЫХ
ГАЗОВ
Справочное пособие
МОСКВА, ХИМИЯ, 1983
6П7.43
К 891
УДК 665.632 : 66.011
Кузнецов А. А., Судаков Е. Н.
Расчеты основных процессов и аппаратов перера-
ботки углеводородных газов: Справочное пособие.—
М.: Химия, 1983.— 224 с., ил.
В справочном пособии даны расчеты основных процессов и
аппаратов технологических установок газо- и нефтеперерабаты-
вающих заводов по очистке, осушке и разделению углеводород-
ных газов (нефтяных и природных). Приведенные примеры и
справочный аппарат соответствуют требованиям проектных и
поверочных расчетов процессов и аппаратов.
Пособие предназначено для инженерно-технических работни-
ков газо- и нефтеперерабатывающих заводов и соответствующих
проектных организаций. В качестве пособия по курсовому и
дипломному проектированию оно может быть полезно студентам
нефтяных вузов и факультетов.
224 с., 115 табл., 56 рис., 63 литературных ссылок.
Рецезент —докт. техн, наук, проф. МОЛОКАНОВ Ю. К.
2801010000-044
К 050(01)-83 4483
<§) Издательство «Химия», 1983 г.
СОДЕРЖАНИЕ
Предисловие ......................................... *
Глава 1. Процессы и аппараты очистки газов от H2S и СО2 5-
Абсорбер для очистки углеводородного .газа от кислых
компонентов ............................................ 6
Десорбер для регенерации раствора моноэтаноламина 31
Теплообменник для нагревания насыщенного водного рас-
твора моноэтаноламина.................................49
Глава 2. Процессы и аппараты осушки газов ......................55
Абсорбер для осушки углеводородной газовой смеси рас-
твором диэтиленгликоля................................57
Десорбер для регенерации раствора диэтиленгликоля . 71
Глава 3. Процессы и аппараты разделения углеводородных газов
абсорбцией ............................................. 83
Абсорбционно-отпарная колонна для разделения углеводо-
родных газов.............................................84
Холодильник абсорбента установки низкотемпературной
абсорбции.............................................105
Глава 4. Процессы и аппараты разделения легких углеводородов
ректификацией ............................................. . . 112
Этановая колонна установки низкотемпературной ректи-
фикации газожидкостной смеси углеводородов . . . ИЗ
Этановая колонна установки низкотемпературной ректифи-
кации углеводородного конденсата ...................... 127
Пропановый холодильник-конденсатор газа установки низ-
котемпературной ректификации углеводородного конден-
сата ................................................. 144
Бутановая колонна-стабилизатор газофракционирующей
установки...............................................152
Изопентановая колонна газофракционирующей установки 167
Конденсатор-холодильник изопентановой колонны газо-
фракционирующей установки...............................176
Литература .................................. 185
Приложения..................................187
П.1. Соотношение единиц СИ с другими единицами измерения................. 188
П.2. Коэффициенты для вычисления изобарной теплоемкости некоторых веществ
в состоянии идеального газа........................................ 188
П.З. Состав природных газов газовых и газоконденсатных месторождений СССР 192
П.4. Состав попутных газов нефтяных месторождений СССР......................... 192
П.5. Выходы газов и содержание в них этилена н пропилена при различных про-
цессах переработки нефти.................................................. 193
П.6. Состав продуктов разделения природных газов, % (мол.).................... 194
П.7. Формулы, используемые при расчетах аппаратуры............................ 195
П.8. Основные термодинамические характеристики некоторых газов .... 198
П.9. Давление паров этаноламннов, Па..................................... 200
П.10. Растворимость а некоторых газов в воде................................ 200
П.11. Совместная растворимость СО2 и H2S в растворах этаноламина .... 201
П.12. Основные термодинамические характеристики углеводородов............... 202
ПЛЗ. Фактор ацентричностн некоторых газов................................... 210
П.14. Значения коэффициентов Л и В в уравнении влагосодержания газа . . 210
П.15. Физические параметры воды при температуре кипения..................... 211
П.16. Характеристика насыщенного водяного пара.............................. 212
П.17. Энтальпия и теплоемкость перегретого водяного пара.................... 213
П.18. Энтальпия нефтяных жидкостей, кДж/кг................................. 214
П.19. Энтальпия нефтяных паров, кДж/кг...................................... 216
П.20. Показатели тарельчатых абсорберов..................................... 218
Предметны йуказатель........................................................ 220
ПРЕДИСЛОВИЕ
Основными направлениями экономического и социального развития СССР
на 1981—1985 годы и на период до 1990 года предусмотрено увеличение
мощности по комплексной переработке нефтяного и природного газов с по-
лучением из них этана, серы и других сопутствующих компонентов.
За последние полтора десятилетия переработка углеводородных газов
(нефтяных и природных) развивалась быстрыми темпами. В настоящее
время она оказывает значительное влияние на многие важнейшие отрасли
народного хозяйства и является большим комплексом материального про-
изводства.
Современное развитие газоперерабатывающих предприятий характеризует-
ся значительными объемами переработки газа, большими единичными мощ-
ностями установок, высокими рабочими давлениями и степенями извлечения
целевых компонентов из газа.
Основными источниками углеводородного сырья для крупномасштабного
химического производства являются нефть, природный и нефтяной газы. При
этом наибольший объем переработки приходится на природный газ, а наи-
меньший— на углеводородные газы нефтеперерабатывающих заводов (НПЗ).
Объем переработки попутного нефтяного газа занимает промежуточное по-
ложение.
Попутный нефтяной и природный газы в основном используются как
энергетическое и бытовое топливо, которое должно без потерь транспорти-
роваться по трубопроводам на большие расстояния; при этом не должны
образовываться кристаллогидраты. Извлеченные из этих газов ценные ком-
поненты и газовый конденсат после соответствующей переработки служат
сырьем для нефтехимических процессов и источником так называемого газо-
вого бензина, серы и гелия.
Углеводородные газы НПЗ, наоборот, в основном являются сырьем для
нефтехимических процессов и в меньшей степени служат энергетическим топ-
ливом, в основном для нужд НПЗ.
В настоящее время повышенный спрос на нефтяные фракции увеличивает
ценность углеводородов, содержащихся в природном газе. Этим объясняется
развитие промышленности переработки природного газа, для которой имеет-
ся мощная сырьевая база.
Роль тех или иных установок в системе газопереработки, их удельный
вес и единичные мощности различны. Однако основополагающие физико-хи-
мические, кинетические, термодинамические и гидродинамические законы
остаются общими для установок одинакового технологического назначения,
независимо от их местонахождения на промысле, газо- или нефтеперераба-
тывающем заводе.
В предлагаемом справочном пособии даются достаточно подробные рас-
четы основных процессов и.аппаратов для очистки, осушки газов и их раз-
деления на узкие фракции или практически чистые компоненты.
Расчеты выполнены в международной системе единиц физических величин
(см. Приложение, табл. П.1). Все количественные величины даны в расчете
на 1 ч. Расчеты для определения теплофизических и других величин выпол-
нены различными методами.
Главы 1, 2 написаны Е. Н. Судаковым, главы 3, 4 — А. А. Кузнецовым и
Е. Н. Судаковым.
Авторы выражают глубокую признательность рецензенту книги профес-
сору, докт. техн, наук Ю. К. Молоканову за ценные замечания, способствую-
щие улучшению содержания рукописи.
Авторы будут весьма признательны всем читателям за отзывы и крити-
ческие замечания о книге.
ГЛАВА 1
ПРОЦЕССЫ И АППАРАТЫ ОЧИСТКИ ГАЗОВ
ОТ H2S И СО2
Общие сведения
Углеводородные нефтяные и природные газы могут содержать в качестве
примесей нежелательные кислые компоненты — диоксид углерода (СО2), се-
роводород (H2S), а так же сероорганические соединения — серооксид угле-
рода (COS), сероуглерод (CS2), меркаптаны (RSH), тиофены.
Диоксид углерода, сероводород и меркаптаны создают условия для кор-
розии металлов, отравляют катализаторы, снижая эффективность каталити-
ческих процессов, в которых используются углеводородные газы.
Сероводород, меркаптаны, серооксид углерода — высокотоксичиые веще-
ства.
Диоксид углерода, присутствующий в газообразном топливе, уменьшает
теплоты сгорания топлива.
Однако кислые компоненты, извлеченные при очистке углеводородных
газов, могут использоваться в качестве сырья при производстве, например,
серы и серной кислоты.
Для очистки нефтяных и природных газов от сероводорода, диоксида уг-
лерода и других серо- и кислородсодержащих соединений применяют абсорб-
ционные процессы, которые в зависимости от взаимодействия этих соедине-
ний с растворителями (абсорбентами) подразделяются на «частные» процес-
сы физической и химической абсорбции.
Выбор способа очистки сводится к выбору растворителя, поскольку от его
специфических свойств зависит технологическая схема и технико-экономиче-
ские показатели процесса.
При физической абсорбции очистка газов от нежелательных соединений
происходит в результате контакта газов с жидкими растворителями неорга-
ническими (вода) или органическими (пропиленкарбонат, диметиловый эфир
полиэтиленгликоля, N-метилпирролидон и др.), а также поглощения нежела-
тельных компонентов названными растворителями.
Основные недостатки процессов физической абсорбции состоят в следую-
щем: применяемые растворители относительно хорошо поглощают углеводо-
роды; тонкая очистка газов обеспечивается после дополнительной доочистки
алканоламиновыми растворителями.
При химической абсорбции очистка газов от нежелательных соединений
происходит в результате контакта газов с растворителями, представляющими
собой водные растворы алканоламинов: моноэтаноламина (МЭА), диэтанол-
амина (ДЭА), диизопропаноламин (ДИПА), дигликольамина (ДГА) и др.
При контакте нежелательных компонентов с названными растворителями-ре-
агентами происходят химические реакции.
Каждый из названных растворителей обладает определенными физико-хи-
мическими свойствами, влияющими на процесс очистки. Выбор растворителя
зависит от требуемой степени очистки газа, начального содержания приме-
сей, а также необходимых технико-экономических показателей процесса (рас-
ход растворителя, тепла и энергии на процесс очистки).
Аминовые процессы обеспечивают тонкую очистку газов от сероводорода
и диоксида углерода при незначительном поглощении углеводородов.
К основным недостаткам процессов химической абсорбции следует отне-
сти следующее: не достигается комплексная очистка газов от H2S, СО2, RSH,
COS и CS2; с некоторыми растворителями образуются нерегенерируемые
химические соединения; кратность циркуляции абсорбента высока.
При низких и средних парциальных давлениях кислых газов поглотитель-
ная способность абсорбентов на основе водных растворов- алканоламинов
5
возрастает по отношению к сероводороду и диоксиду углерода. Происходит
комбинированная физическая и химическая абсорбция кислых компонентов.
Ниже приведены основные физико-химические свойства некоторых алка-
ноламиновых растворителей:
Параметр МЭА ДЭА ДИПА ДГА
Молекулярная масса . 61 105,1 133,2 105,1
Плотность, кг/м2 Температура кипения, °C при давлении, Па 1018 1090 989 1055
110 171 248,7 221
660 100 187 167 —.
1320 69 150 133 —
Давление насыщенных паров при 20 °C, Па 48 1,33 1,33 1,33
Температура замерзания, 10,5 28 42 9,5
Абсолютная вязкость, 0,241 0,38 0,198 0,026
Па-с (при 20 °C) (при 30 °C) (при 45 °C) (при 24 °C)
Растворимость в воде при 20 °C, % (масс.) Полная 96,4 87 Полная
Теплота парообразования при 1 • 105 Па, Дж/кг 1486,4 1205,9 722,5 917,4
Содержание МЭА в водном растворе не превышает, как правило, 15—
20% (об.). При насыщении кислыми компонентами более концентрированных,
растворов увеличивается скорость коррозии металлов (чистый алканолами-
новый раствор не обладает коррозионной активностью). Однако в связи с
разработкой ингибиторов коррозии появилась возможность увеличить кон-
центрацию МЭА в растворе до 30% (об.), что делает процесс МЭА-очистки
более рентабельным и перспективным. Объясняется это высокой поглоти-
тельной способностью и стабильностью растворов МЭА, его низкой стои-
мостью и доступностью. Однако применение МЭА практически ограничивается
очисткой природного и попутного нефтяного газов, не содержащих примеси
сероксида углерода, сероуглерода и меркаптанов, которые необратимо реаги-
руют с моноэтаноламином.
Если есть опасность разложения раствора МЭА вследствие присутствия
в исходном газе значительных количеств COS, CS2 и RSH, то вместо моно-
этаноламинового раствора применяют растворы диэтаноламина (ДЭА), ко-
торые стабильны в присутствии указанных соединений.
Ниже приводятся рекомендации и порядок расчета абсорбера для очист-
ки углеводородного газа от кислых компонентов, десорбера для регенера-
ции раствора моноэтаноламина и теплообменника для нагревания насыщен-
ного водного раствора моноэтаноламина на установке одновременной очист-
ки углеводородной газовой смеси от сероводорода и диоксида углерода.
Изложенная методика позволяет рассчитать указанную аппаратуру и в
случаях раздельной очистки углеводородных газов от H2S или СО2.
АБСОРБЕР ДЛЯ ОЧИСТКИ УГЛЕВОДОРОДНОГО ГАЗА
ОТ КИСЛЫХ КОМПОНЕНТОВ
Исходные данные
Рассчитать абсорбер для очистки углеводородного газа от кислых компо-
нентов (сероводорода и диоксида углерода) регенерированным водным рас-
створом моноэтаноламина (МЭА). Состав газа приведен в табл. 1.1. Темпе-
ратура газового сырья при вводе в аппарат /с=42°С. Температура регене-
рированного водного раствора МЭА равна ta = 44°C. Давление в аппарате
6
Таблица 1.1. Состав газового сырья абсорбера
Компонент Содержание в сырье % (об.) Количество vci. MS/Ч Компонент Содержание в сырье u'i, % (Об.) Количество Vc£, мЗ/ч
сн4 С2н6 с3н8 С4Н,о 73,4 9,8 7,5 8,3 234880 31360 24000 26560 H2S со2 S 0,8 0,2 100,0 2560 640 320000
Таблица 1.2. Состав регенерированного водного раствора моноэтаноламина
Компонент Молекулярная масса М Содержание Ср масс, доли । Компонент Молекулярная масса М Содержание с., масс. доли
Н2О 18,0 0,8498 со2 44,0 0,0001
МЭА' 61,1 0,1500 — 1,0000
H2S 34,0 0,0001 Г
л=3,92 МПа. Количество газа при нормальных условиях* Ve = 320 000 м*/ч.
Состав регенерированного раствора МЭА дан в табл. 1.2.
Содержание диоксида углерода в очищенном газе не должно превышать
0,007 об. долей, а содержание сероводорода должно быть не более 0,0015 об.
долей.
При очистке газов от кислых компонентов использо-
вать процесс хемосорбции 15%-ным водным раствором
моноэтаноламина [1], получивший наибольшее про-
мышленное применение. Схема материальных потоков
аппарата показана на рис. 1.1.
В нижнюю часть аппарата подается газовое сырье
Vc, а очищенный газ V выводится из верхней части
аппарата. Водный раствор моноэтаноламина Ар по-
дается на верх аппарата, а насыщенный кислыми
компонентами раствор моноэтаноламина АИ покидает
абсорбер снизу.
V
А/
х'
Рис. 1.1. Схема для
баланса
"р
расчета материального
абсорбера.
* Здесь и далее нормальное давление составляет 0,1 МПа, нормальная
температура равна 0°С.
7
Рис. 1.2. Зависимость количества циркулирующего моноэтаноламина от ко
личества неочищенного газа и содержания кислых компонентов.
Поглощение в абсорбере кислых компонентов раствором МЭА описывает-
ся следующими стехиометрическими уравнениями химических реакций
2RNH2 + СО2 + Н2О ^=fc (RNH3)2CO3 (1.)
(RNH3)2CO3 + СО2 + Н2О 2RNH3HCO3 (2)
2RNH2 + H2S (RNH^S (3)
(RNH3)2S + H2S 2RNH3HS (4)
где R — группа OHCH2CH2—.
Кислые компоненты и легкие углеводороды (метан и этан) частично рас-
творяются в водном растворе МЭА.
Расчет
1. Материальный баланс абсорбера. Количество раствора моноэтанолами-
на, циркулирующего в системе абсорбер — десорбер в единицу времени, оп-
ределяется в зависимости от расхода сырья Ус = 320 000 м3/ч и суммарного
содержания кислых компонентов:
У'к = £/'h2s + У'со2 = 0,8 + 0,2 = 1
где у'н. s и y'coz — содержание кислых компонентов в газовом сырье,
% (об.).2
Количество раствора МЭА в единицу времени найдем из графика
(рис. 1.2) [2, с. 77] равным цр=173 м3/ч, тогда
Ар = ОрРр = 173-998-= 172 660 кг/ч
при этом рр — плотность 15%-ного водного раствора МЭА при температуре
входа в аппарат /Р=44°С [3, с. 29].
Расчет мольного состава регенерированного раствора МЭА дан в
табл. 1.3.
Расчет количества неочищенного газа приведен в табл. 1.4.
Метан и этак (относительно пропана и бутана) могут в заметных коли-
чествах растворяться в воде , содержащейся в водном растворе моноэтанол-
8
Таблица 1.3. Расчет мольного состава регенерированного
раствора моноэтаноламина
Компонент Мольная масса мг Количество Содержание М.с"1 1 i
кг/ч л — g‘ i Л1. ’ кмоль/ч 1 масс, доли ni ci ~ 2п. ’ мольн. доли
Н2О 18,0 146720 8151 0,8498 0,9504 17,11
МЭА 61,1 25900 424 0,1500 • 0,0495 3,02
H2S • 34,0 20 0,6 0,0001 0,000069 0,00
со2 44,0 20 0,4 0,0001 0,000046 0,00
2 — 172660 8576 1,0000 1,000015- «1,0000 20,13*я= «20,1*
• В данном случае Л1р .
амина. Количество метана и этана, растворившихся в единицу времени, рав-
ны, м3/ч:
273
Vch4 = аснЛн2о /+273
273
^с2нб = «c2h8Vh2o t+273
где асн4и ас 2нв— растворимость метана и этана в воде при температуре t
и нормальном давлении [4], м3/м3;Ун4о= 146,72 м3/ч— объемный расход во-
ды в водном растворе моноэтаноламина (см. табл. 1.3, учитывая, что
рн2о=1000 кг/м3); t — температура, при которой происходит растворение,
°C.
Примем температуру, при которой происходит растворение углеводородов,
равной 1 = 42 °C, тогда:
Усн4 = 0,02369-146,72- 42^327з- = 3 м3/ч
273
Vc2H6 = 0,02915 -146,72—42 + =3,7 м»/ч = 4 м«/ч
Таблица 1.4. Расчет состава неочищенного газа
Компонент Мольная масса М1 Количество vci- м3/ч Содержание Vei Уа svc- ’ МОЛЬН. доли М-у'. г ci Количество г V^Mi “cl 22,4 ’ кг/ч Содержание -WjS'ci Ус; = С‘ масс, доли
сн4 16 234880 0,734 11,74 167770 0,5072
с2н6 30 31360 0,098 2,94 42000 0,1270
СзН8 44 24000 0,075 3,30 47143 0,1426
58 26560 0,083 4,82 68771 0,2078
H2S 34 2560 0,008 0,272 3886 0,0117
со2 44 640 0,002 0,088 1257 0,0037
2 — 320000 1,000 23,16= «23,2 330827 1,0000
9
Таблица 1.5. Расчет состава очищенного газа
Компонент Мольная масса м. Количество vi- мЗ/ч Содержание vi yi~ • мольн. долм Мр'. Количество viMi G. = —— * 22,4 ’ кг/ч Содержание . - Miy'i = масс, доли
сн4 16 234877 0,7414 11,86 167760 0,5151
с2н6 30 31356 0,0990 2,97 41995 0,1289
с3н8 44 24000 0,0758 3,34 47143 0,1448
с4н10 58 26560 0,0838 4,86 68771 0,2112
H2S 34 4 0,0000126 0,00 6 0,0000184
со2 44 5 0,0000113 0,00 10 0,0000307
2 — 316802 1,0000239» »1,0000 23,03 »23 325685 1,0000491» ;= 1,0000
Расходы метана, этана, двуокиси углерода и сероводорода в очищенном
газе равны, м3/ч:
V°CH4 = Гссн4 - ^СН4 = 234 880 - 3 = 234 877 м3/ч
У°с2нв = УсС2нв - Vc2h„ = 31 360 - 4 = 31 556 м3/ч
У°со2 = Уссо2’У'со2 = 640-0,007 = 4,48 м3/ч я= 5 м3/ч
V°H2s = Усн28-У'н25 = 2560-0,0015 = 3,84 м3/ч « 4 м3/ч
где у'со2,=0,007 и j/'h2s= 0,0015 — содержание диоксида углерода и серово-
дорода в очищенном газе, об. доли; индекс «о» относится к очищенному
газу, «с» — к сырому.
Расчет состава очищенного газа дан в табл. 1.5.
Расход газов, поглощенных раствором МЭА, равен, кг/ч:
Ог = 330 827 — 325 685 = 5142
Расход насыщенного кислыми компонентами водного раствора МЭА ра-
вен, кг/ч:
А„ = Ар 4- GK = 172 660 + 5142= 177802
Материальный баланс абсорбера представлен в табл. 1.6.
2. Тепловой баланс абсорбера. Тепловой баланс абсорбера составляется
для определения температуры, при которой насыщенный раствор МЭА выво-
дится из аппарата. Уравнение теплового баланса абсорбера имеет вид:
Qvc + Q?ip + Qa — Си + Qah
где Q — количество тепла соответствующего материального потока, кВт;
Qa — количество тепла, выделяемого при абсорбции компонентов, кВт.
Таблица 1.6. Материальный баланс абсорбера
Поток, поступающий в абсор- бер (см. рис. 1.1) Количество, кг/ч Поток, выводимый из абсорбе- ра, (см. рис. 1.1) Количество, кг/ч
Неочищенный газ Ус 330827 Очищенный газ V 325685
Регенерированный рас- твор моноэтаноламина Ар 172660 Насыщенный раствор моноэтаноламина АИ 177802
2 503487 2 503487
10
Количество тепла, вносимого в аппарат газовым сырьем при температуре
/с=42 °C, равно:
где НГ1 с — энтальпия газа при температуре поступления в аппарат, кДж/кг.
Энтальпия газовой смеси рассчитывается по формуле [5]:
Яг»0 = Ясм<о)-ДНсм
где — энтальпия идеальной газовой смеси, кДж/кг; ДЯсм— поправка
на давление, кДж/кг.
Энтальпия Я<0)см вычисляется по формуле:
N
Ясм(0) = 2
1=1
в которой yi — содержание i-ro компонента, масс, доли; Н<°>,— энтальпия
идеального газа, кДж/кг.
Энтальпию идеального газа рассчитаем по формуле, кДж/кг:
т /ту / Т ,3 100
И1М = А 100 + 100 ) + С( 100 ) +° т
где А, В, С, D — коэффициенты [6, с. 529]; Т — температура, К.
Расчет энтальпии Я<°’См идеального газа представлен в табл. 1.7.
Поправка на давление рассчитывается по формуле:
АНсм = ~%П'КР + Шсмдд(И)
•исм
где /?= 8,315 кДж/(кмоль-К)—универсальная газовая постоянная; Tn. кр —
псевдокритическая температура, К; .Мем=23,2— средняя мольная масса га-
за, поступающего в аппарат; ДН<°) и ДЯ<*>— поправки на давление для эн-
тальпии [6, с. 530]; Шсм — фактор ацентричности смеси.
Поправки ДЯ<°> и Д//(1> на давление определяются в зависимости от при-
веденных давления РПр и температуры ТПр, вычисляемых по формулам
л Т
^ПП -- Р ТПр = д,
'п.кр 1 п.кр
где Рп. кр — псевдокритическое давление, Па; Тп. кр — псевдокритическая тем-
пература, К.
Таблица 1.7. Расчет энтальпии НСмт для неочищенного газа
Компонент Содержа- ние масс, доли Коэффициенты в формуле для расчета энтальпии идеального газа* Энтальпия, кДж/кг
А в с D я/°> 1
сн4 0,5070 154,15 15,12 0,0519 56,62 652,9 331,0
0,1270 58,65 23,63 0,4139 56,15 424,2 53,8
с3н8 0,1426 33,65 26,31 0,5380 35,58 361,5 51,5
0,2078 34,72 26,08 0,5455 39,22 363,6 75,5
H2S 0,0117 87,27 2,54 0,0128 25,12 307,7 3,6
со2 0,0037 58,62 5,05 0,0119 —11,08 230,9 1,0
2 1,0000 — — — — 553,9 516,4
* Числовые значения взяты из работы [6, с. 529] с округлением.
11
Таблица 1.8. Расчет псевдокритических параметров
и фактора ацентричности для неочищенного газа
Компонент мольн. доли р 'кпГ Мпа т крр К ai Ркр1УсГ МПа TKpjyci’ К Ылу’. 1 Cl
сн4 0,734 4,605 190,55 0,0104 3,3830 143,60 0,0076
Санв 0,098 4,875 305,43 0,0986 0,4774 29,92 0,0097
С3Н8 0,075 4,248 369,82 0,1524 0,3185 27,72 0,0114
С4Н,о 0,083 3,795 425,16 0,2010 0,3150 35,28 0,0167
H2S 0,008 9,000 373,60 0,1000 0,0720 2,98 0,0008
со2 0,002 7,375 304,20 0,2310 0,01475 0,61 0,00046
S 1,000 — — — 4,58065» =4,58 240,11 0,04666
Псевдокритические величины давления и температуры рассчитываются так:
^п.кр = Т'п.кр = i/i'^Kpi
при этом Ркр, и Ткр i — критические давления (Па) и температура (К) для
i-ro компонента.
Фактор ацентричности смеси равен:
шсм = Уг шг
где <0i — фактор ацентричности t-го компонента [6, с. 157].
Расчет псевдокритических параметров и фактора ацентричности для га-
зовой смеси при входе в аппарат приведен в табл. 1.8.
Величины приведенных давления и температуры для газа при вводе в
аппарат равны:
3,92 315
^*пр = 4 58 = 0 ’ 856 ~ 0 > 86 . ТПр = 24Q । ] =1,31
Величины поправок ДЯ<°> и ДЯ<‘> определяются интерполированием чис-
ловых значений, приведенных в работе [6, с. 530]; они равны
ДД(<» = 2,515 Д//(1) = 0,628
Подставив в формулы числовые значения величин, получим:
8,315-240,11
ДЯСМ = 23 2 2,515 4- 0,04666-0,628 = 218 ,9 кДж/кг
Hrtc=42 = 553,9 — 218,9 = 335 кДж/кг
Аналогично рассчитана энтальпия газа, покидающего абсорбер; ее вели-
чина будет дана в табл. 1.10.
Приход тепла с регенерированным водным раствором МЭА равен:
где H>Kta — энтальпия раствора МЭА при температуре /а=44°С, кДж/кг.
Поскольку остаточное H2S и СО2 содержатся в незначительных количест-
вах (см. табл. 1.2) без ущерба для точности расчета теплового баланса ап-
парата энтальпию регенерированного раствора МЭА можно принять равной
12
Рис. 1.3. Зависимость теплоемкости растворов МЭА от температуры:
/ — чистая вода; 2—15% (масс.) МЭА; 3 — 30% (масс.) МЭА; 4 — 50% (масс.) МЭА.
энтальпии 15%-ного водного раствора МЭА. Энтальпия в этом случае рас-
считывается по формуле:
= da
где с — теплоемкость водного раствора МЭА, кДж/(кг-°С).
Величину теплоемкости раствора МЭА в зависимости от содержания МЭА
и температуры /а = 44°С найдем по графику (рис. 1.3) равной
с=3,97 кДж/(кг-°С)
Тогда Нж13 =3,97-44= 174,7 кДж/кг.
Количество тепла, выделяемого в единицу времени при абсорбции СО2 и
H2S в 15%-ном водном растворе МЭА (если пренебрегать теплом, выделяе-
мым при абсорбции незначительных количеств СН< и С2На), рассчитывается
по формуле:
Qa = ^к7а
где <?а — теплота хемосорбции СО2 и H2S, кДж/кг.
Теплота хемосорбции рассчитывается так: '
1=2
?а = TiXi
i=l
где г, — теплота хемосорбции i-ro кислого компонента, кДж/кг; Xi— доля
компонента в смеси кислых компонентов.
Теплота хемосорбции кислых компонентов [7, с. 35] принимается равной
'‘со j = 1918 кДж/кг; гн2в= 1905 кДж/кг.
Результат расчета величины qa дан в табл. 1.9.
Таблица 1.9. Расчет теплоты хемосорбции H2S и СО2
Компонент Поглощенное количество Ср кг/ч Содержание Gi Xi = 2G7’ масс, доли Теплота хемосорбции, кДж/кг
г. rixi
H2S 3880 0,7567 1905 1442
со2 1247 0,2433 1918 467
S 5127 1,0000 — 1909*
* В данном случае qa.
13
Таблица 1.10. Тепловой баланс абсорбера
Обозначение потока Количество, кг/ч Температура, °C Энтальпия, кДж/кг Количество тепла, кВт
Приход
Qvc 330827 42 335,0 30785
Qa 172660 44 174,7 8379
5127 — 1909,0 2718
s — — — 41882
Расход
Q v 325685 42 350,6 31718
177802 //* Злн
2 — — 41882
Расход тепла QA с насыщенным абсорбентом вычисляется на основе теп-
лового баланса абсорбера (табл. 1.10).
Из табл. 1.10 получим:
= 41 882 — 31 718 = 10 164 кВт
Тогда
3600<2Л 3600-10 164
"%= Тн = 177 802 = 205,8 кДж/кг
Температуру насыщенного абсорбента найдем из уравнения:
Яж*н = с/ч’ откУДа Zh = Hxta!c
Перепад температур раствора МЭА в промышленных абсорберах амин-
ной очистки газов в зависимости от содержания кислых компонентов в сырье
и степени очистки может достигать 70 градусов [7, с. 35]. Для учета зави-
симости теплоемкости насыщенного абсорбента от температуры, примем, что
температура насыщенного абсорбента на 8 градусов выше температуры реге-
нерированного раствора:
t„' = 44 + 8 = 52 °C
Из графика (см. рис. 1.3) при температуре <'Н=52°С найдем, что
с= 4,0 кДж/(кг-°С).
Тогда
205,8
'Н = ^- = 51,45«52°С
Найденная величина /Ы = 52°С не отличается от принятой температуры
/'„=52 °C.
3. Химический состав насыщенного абсорбента. Для расчета регенерации
поглотителя в десорбере необходимо знать химический состав насыщенного
абсорбента.
Водный раствор МЭА содержит СО2 и H2S в растворенном и химически
связанном состояниях.
Следует найти количества кислых компонентов, которые взаимодействуют
с моноэтаноламином по реакциям (1) — (4); константы химического равнове-
14
сия в форме, принятой в литературе [8, с. 246], имеют вид:
[RNHJ2 [СО,] [Н2О]
1 ~ [(RNH3)2CO3]
|(RNH3)2CO3] [СО2] [Н,О]
2 “ [RNH3HCO3]2
[RNHa]2 [H,S] . [(RNH8)2S] [H2S]
- 1(RNH3)2S] “ [RNH3HS]2
Здесь в квадратные скобки заключены количества молей веществ.
С учетом давления в аппарате и протекания реакций в растворе констан-
ты равновесия можно записать так [9, с. 265]:
[RNHJ2 [СО2] [Н2О] / 10,2л \Д«1
[(RNH3)2CO31 (у пг1 I
[(RNH3)2CO3] [СО2] [Н2О] /10,2л \Д«2
2~ [RNH3HCO3]2 (2пг21
[RNH2]2 [H2S] / ю,2л \Д«з
*з- [(RNH3)2S] (2^)
[(RNH8)2SJ [H2S] / 10,2л \Д«4
[RNH3HS]2 у
I Л. пг4 I
где л — давление в аппарате, МПа; S/i; — общее число молей реагирующей
смеси; Дл — разность чисел молей продуктов и исходных реагентов в реакци-
ях (1)—(4).
Константа химического равновесия связана с изменением стандартного
изобарного потенциала [10, с. 230]:
2.3RT
где ДО, — изменение стандартного изобарного потенциала для /-ой реакции
(/=1, 2, 3, 4), кДж/моль; R=8,315 кДж/(моль-К)—газовая постоянная;
Т — температура реакции, К.
Расчеты констант химического равновесия осуществляются при темпера-
туре насыщенного абсорбента Т= Гн=325 К и давлении л =3,92 МПа.
Изменение изобарного потенциала реакции рассчитывается по уравнению
[10, с. 232]: '
ДС; = ДД/> — TkS°
где ДД° — изменение энтальпии образования, кДж/моль; Д$° — изменение
энтропии реакции, кДж/(моль-К).
Изменение изобарного потенциала для реакции (1) равно:
— TASf
При этом
ДД)° = W(RNH3)2CO3 — 2//rnh2 — #со2 — #н2о
ASj° = S(rnh3)2co3 — 2Srnh2 — SCo2 — Sh2o
где Я(нннз)2соз, Янмн2, —> Янго — энтальпии образования веществ, кДж/моль;
5(нннз)2соз, Shnh2, Sh2o — энтропии веществ, кДж/(моль-°C).
15
Таблица 1.11. Стандартные энтальпии Н° образования
и энтропии 5° при температуре t-25cC [/<?]
Элемент, сое- динение, ион н°, кДж/моль 5°. Дж/(моль-К) Элемент, сое- динение, ион H°, кДж/моль s°, кДж/(моль-К)
со2 —393,768 213,777 N Нз —46,221’ 192,630’”
со?- —676,696 —53,171 С2Н4 —51,036 219,592
Н2О 286,023 69,985 нсо3 —676,696” 12,167”
он 42,118 183,746 rnh2 —55,139” 595,968”
H2S —20,160 205,776 (RNH3)2CO3 —504,045” 1138,765”
HS- —17,668 —61,126 RNH3HCO3 —731,835” 608,135”
S 2,805 22,190 (RNH3)2S —52,334” 1214,126”
NH3 46,221 192,630 RNH3HS —72,807” 534,843”
’ "nh2 * «nh3-
** Расчетные значения.
* * * с О с®
~ ’ЧЧНз*
Числовые значения энтальпии образования и энтропии веществ для реак-
ций (1) — (4) приведены в табл. 1.11. При этом энтальпии и энтропии для
соединений, содержащих радикал R, рассчитаны суммированием стандартных
энтальпий Н° и энтропий S° для элементов, входящих в состав соединений.
Тогда
= 504,046 — 2 (—55,139) — (—393,768) — (-286,023) = 286 кДж/моль
Д51° = 1138,765-2-595,968— 192,63 — 69,985 =
= —315,768 Дж/моль ж —0,316 кДж/моль
Аналогично рассчитаны числовые значения величин ДЯ°2=
= —279,8 кДж/моль; Д//°3=78,1 кДж/моль; ДЯ°4=73,1 кДж/моль; Д-5°2=
=—0,206 кДж/(моль-К); Д5°3=—0,184 кДж/(моль-К); ДХ°4 =
=—0,35 кДж/(моль-К).
Подстановка числовых значений величин в уравнение для расчета изме-
нения изобарного потенциала дает, кДж/моль:
Ml = MIS — TbSf = 286 — 325 (—0,316) = 388,7
ДС2 = ДЯ2° — Т’Д52° = 279,8 — 325 (-0,206) = 346,8
ДСЭ = ДЯЭ° — 7'Д53° = 78,1 —325 (-0,184) = 137,9
ДО4 = ДЯ4° — ТД54° = 73,1 —325 (—0,35)= 186,9
Тогда
Дб. 388,7
lg^ = — = 2,3-8,315-325 =~ °>0625 ^=0,864
Аналогично получены числовые значения &2=1,082; Л3=0,95; /г4=0,933.
Число киломолей (RNH3)2CO3, полученных по реакции (1), следует обо-
значить через Х| и для расчета равновесного превращения пользоваться сле-
дующей .схемой (в дальнейшем ее запись опускается):
Реакция 2RNH2+CO2 + H2O= (RNH3)2CO3
Число киломолей в исходной смеси 4
в равновесной смеси (2—2xi), (1—Xi), (1— Xi) Xi
всего в равновесной смеси S/iii = 4—Эх,
Разность чисел киломолей дЛи=1-4=—3
16
Тогда в соответствии с найденным уравнением для константы химическо-
го равновесия kt можно записать:
(2 —Xj)2 (1 — хх)2 / 10,2л Vs
kl=---------*--------=0.864
0 864 = (2-2х1)2(9-х1)2 М-З^У
’ * 1 40 /
*1
Значение х, определяется методом подбора; Xi=0,0045 кмоль/ч. Уравне-
ния для расчета х2, Хз и х4 имеют вид:
(1 — *2)3 / Ю,2л V1
2 “ (2х^ \ 3 - х2 )
1~х%) \ « — Х2 I
1,082
4х22 I 40 )
откуда
х2=0,1087 кмоль/ч;
(2-х3)2(1-х3)
к3
-2
3 — 2х3 J
(2-2х3)2(1-х3)(3-2х3)2
и,Уо =------------------------
10,2.3,92-Хз
откуда
откуда
Для
х3=0,022 кмоль/ч;
(1-х4)2
~ 4х42
х4= 0,341 кмоль/ч.
получения (RNH3)2CO3 в количестве х, кмоль/ч по реакции (1)
2x4RNH2 + х4СО2 + Х]Н2О = x1(RNHs)2CO3
необходимо знать количество прореагировавших веществ.
Количество исходного диоксида углерода равно:
°СО2 1247
Л/Со2 = М(=о = —44— = 28,3409 кмоль/ч
По реакции (1) прореагировали вещества в количествах:
<Зр1СО2 = = 0,0045-28,3409-44 = 5,6 кг/ч
Gp2RNH2 = 2xiWCO2^rnh2 = 2-0,0045-28,3409-61'1 = 15,6 кг/ч
Ср1Н2О = *Л»/<н2О = 0,0045-28,3409-18 = 2,3 кг/ч
Получено по реакции (1):
Gpl(RNH3)2co3 = ti^co2/W(RNH3)2co3 = 0,0045-28,3409-184,2 = 23,5 кг/ч
или
23 5
A\rnh3)2co3 = 184,2 = °’1276 кмоль/ч
После реакции (1) в насыщенном абсорбенте остаются непрореагировав-
шими:
GH1CO2 = <?со2 ~Ср1со2 = 1247-5,6 = 1241,4 кг/ч
°h1RNH2 = Grnh — <3plRNH = 25 900 - 15,6 = 25884,4 кг/ч
0н1н2о = Gh2o -Ор1н2о = 146 720 - 2,3 = 146717,7 кг/ч
2—640
17
Для получения RNH3HCO3 в количестве 2х2 кмоль/ч по реакции (2)
x2(RNH3)2CO3 + х2СО2 + х2Н2О = 2x2RNH3HCO3
необходимо рассчитать количества исходных реагентов.
По реакции (2) прореагировали вещества в количествах:
G₽2(RNHa)2coa = *2^(RNHa)2coajW(RNHa)2coa = °> 1087-0,1276-184,2 = 2,5 кг/ч
Gp2co2 = ^^(RNHajjCO^COj =0,1087-0,1276-44 = 0,6 кг/ч
Gp2H2O = x2W(RNh3)2CO<Mh2o = 0,1087-0,1276-18 — 0,3 кг/ч
Получено по реакции (2):
<3p2RNHaHCOa = 2xaW(RNH8)2COajM(RNHa)2HCOa =
= 2-0,1087-0,1276-123,1 =3,4 кг/ч
В насыщенном абсорбенте остается непрореагировавшим диоксид угле-
рода:
<Jh2CO2 = Gh1co2 - Gp2co2 --= 1241,4 - 0,6 = 1240,8 кг/ч
С учетом содержания остаточного диоксида углерода в поступающем в
аппарат абсорбенте (см. табл. 1.3) количество СО2, растворенное в насыщен-
ном абсорбенте составляет:
(Qh«)' = GH2 + 20 = 1240,8 + 20 = 1260,8 кг/ч
После реакции (2) остались непрореагировавшими:
<Jh2(RNH3)2co3 = Gpl(RNH3)2co3 — Gp2(RNH3)2CO3 = 23,5 — 2,5 = 21 кг/ч
GH2H2O = Gh1h2O - Gp2H2O = 146717,7 - 0,3 = 146717,4 кг/ч
Последовательность расчетов превращений по реакциям (3) и (4) соот-
ветствует расчетам превращений по реакциям (1) и (2).
Gh2s 3880
Wh2s= =—34—= H4.I176 кмоль/ч
• 2x3RNH2 + x3H2S = x8(RNH3)2S
Gp3h2s = X3A1h2sMh2s = 0,022 114,1176 34 = 85,4 кг/ч
G₽3rnh2 = 2x3JVH2sAfRNH2 = 2.0,022-114,1176-61,1 = 306,8 кг/ч
Gp3(RNH3)2s = x31vh2s^W(RNH3)2s = 0,022-114,1176-1562,2 = 392,2 кг/ч
Gh3h2s = Gh2s - Gp3h2s = 3880 - 85,4 = 3794,6 кг/ч
Gh3rnh2 = Gh1rnh2 - Gp3RNH2 = 25884,4 —.306,8 = 25577,6 кг/ч
x4(RNH3)2S + x4H2S = 2x4RNH3HS
W(RNH3bs = aZh/)’? = “Sr = 2’5109 кмоль/ч
G₽4(Rnh3)2s = -*4^(RNh3)2sA4(Rnh8)2s = 0,341-2,5109-156,2 = 133,7 кг/ч
Gp4h2s = x4A'(RNH3)2s-'4h2s = 0,341-2,5109-34 = 29,1 кг/ч
G^4rnh3hs = 2*4A\rnh3)2sMrnh2hs = 2-0,341-2,5109-95,1 = 162,8 кг/ч
Gp4(RNH3)2s = Gp3(RNH3)2s - Gp4(RNH3)2s = 392,2 - 133,7 = 258,5 кг/ч
GH4h2s = GH3h2s - Gp4h2s = 3794,6 - 29,1 = 3765,5 кг/ч
С учетом содержания остаточного сероводорода в поступающем в аппа-
рат абсорбенте (см. табл. 1.3) количество H2S, растворенное в насыщенном
абсорбенте, равно
(G44h2s)' = GH4h2s + 20 = 3765,5 + 20 = 3785,5 кг/ч
18
Таблица 1.12. Расчет состава насыщенного абсорбента
Компонент Мольная масса Mi Количество Содержание M.c. i i
кг/ч „ - Si ni~ M.‘ кмоль/ч с = • масс, доли f ni 4 ’ МОЛЬН. ДОЛН
RNH2 (МЭА) 61,1 25577,6 418,6187 0,143854 0,048040 2,94
Н2О 18,0 146717,4 8150,9666 0,824173 0,935400 16,84
со2 44,0 1260,8 28,6545 0,007091 0,003288 0,14
(RNH3)2CO3 184,2 21,0 0,1140 0,000118 0,000013 0,00
RNH3HCO3 123,1 3,4 0,0276 0,000019 0,000003 0,00
H2S 34,0 3785,5 111,3382 0,021291 0,012777 0,43
(RNH3)2S 156,2 258,5 1,6549 0,001454 0,000190 0,03
RNH3HS 95,1 162,8 1,7119 0,000916 0,000196 0,02
CH4 16,0 10,0 0,6250 0,000056 0,000072 0,00
C2H6 30,0 5,0 0,1667 0,000028 0,000036 0,00
2 — 177802,0 8713,8781 1,000000 1,000015a 20,4*
a 1,0000
* В данном случае М.
Расчет состава насыщенного абсорбента, выводимого из аппарата, дан в
табл. 1.12.
4. Диаметр абсорбера. Диаметр абсорбера в наиболее нагруженном ниж-
нем его сечении рассчитаем по формуле [6, с. 265]:
Da
1800/.
Рж
(К£ + 35)
3600G
Р Рп (Рж — Рп)
А0С + 35
где L — расход насыщенного абсорбента из аппарата, кг/с; рж — плотность
насыщенного абсорбента, кг/м3; д0=0,3 — коэффициент для клапанных та-
релок; С=480— коэффициент для абсорберов при расстоянии между тарел-
ками, равном 0,6 м [6, с. 264]; G — расход газового сырья в аппарат, кг/с;
рп — плотность газового сырья, кг/м3.
Расход насыщенного абсорбента:
177 802
L = .ЧКПП = 49-4 КГ'?С
Плотность насыщенного водного раствора моноэтаноламина при темпе-
ратуре /Н=52°С найдем по содержанию в нем моноэтаноламина (см.
табл. 1.12):
25577,6-100
Хн“ 177 802 ~ 14>4%
Тогда [3, с. 29] имеем рж = 989 кг/м3.
Расход газового сырья в аппарат:
330 827
G =-
Плотность газового сырья
л=3,92 МПа равна
Л4273л
Рп“ 22,4 (/с 4-273) л0 ~ 22,4(42 4-273)0,1 “
3600
при температуре /с = 42°С и давлении
23,2-273-3,92
2'
19
3600-91,9
/35 989 - 35
--------------= 3,68 м
Диаметр абсорбера равен:
1800-49,4
989 +
Da'=---------------
Числовое значение диаметра абсорбера принимается равным Da=3,8 м.
Правильность принятия числового значения диаметра аппарата должна под-
твердиться расчетом работоспособности тарелок.
5. Расчет работоспособности клапанных тарелок. Работоспособность наи-
более нагруженной по газу и жидкости нижней тарелки абсорбера опреде-
ляется необходимыми значениями следующих показателей:
сопротивление тарелки потоку газа;
скорость газа в отверстиях тарелки;
отсутствие провала жидкости;
унос жидкости;
высота слоя пены на тарелке;
градиент уровня жидкости на тарелке;
отсутствие захлебывания.
5./. Сопротивление тарелки потоку газа. Сопротивление (Па) клапанной
тарелки потоку газа рассчитаем по формуле [6, с. 281]:
АР =-f-[(S + °>5) ^2£-+9.81Рж(й' + Л") + 0,5АР<1
где £ — коэффициент сопротивления сухой тарелки; wOr — скорость газа в от-
верстии под клапаном, м/с; К' — высота сливной перегородки, м; h" — подпор
жидкости над сливной перегородкой, м; ДРО—сопротивление, связанное с
действием сил поверхностного натяжения, Па.
При полностью открытых клапанах коэффициент сопротивления сухой
тарелки равен £=3,63 [6, с. 277].
Скорость газа в отверстиях тарелки рассчитывается по формуле:
G
Wor ~ Pnf
где / — площадь сечения отверстий в тарелке, м2.
Размеры клапанных тарелок регламентированы ОСТ 26-02-1401—76 и
ОСТ 26-02-1402—76, откуда для двухпоточной клапанной тарелки типа Б
диаметром £>т = 3,8 м при доле живого сечения тарелки 7^ = 0,149 м2/м2
найдем f= 1,49 м2.
Тогда
91,9 , е
Шог — 35-1,49 176 м7с
Высота сливной перегородки у клапанных тарелок может быть 0,03—
0,04 м. Принимаем /i'=0,04 м.
Подпор жидкости над сливной перегородкой определяется по формуле:
h" = 0,0029 (G/Bf/з
где 5=5,14 м — периметр слива.
Тогда
h" = 0,0029 (91,9/5, 14)2/з = 0,02 м
Сопротивление, связанное с действием сил поверхностного натяжения
жидкости
АРа = 4<т/г/э
где о — поверхностное натяжение жидкости а= 0,054 Н/м; d, — эквивалент-
ный гидравлический диаметр щели под клапаном, м.
20
Для клапанных тарелок
d3 = 2hK =2-0,01 =0,02 м
где +=0,01 м — высота поднятия клапана.
Следовательно
4-0,054
АЛт =—g-Q2— = I®18 Па
Подставив в формулу для расчета сопротивления тарелки числовые зна-
чения величин, получим:
2 Г 35-1,762
др = _ (3,63+0,5)--------g----
+ 9,81-989 (0,04 + 0,02) + 0,5-10,8 = 554 Па
Сопротивление клапанных тарелок находится в пределах 450—800 Па.
5.2. Скорость газа в отверстиях тарелки. Рассмотрим условие открытия
клапана на орошаемой жидкостью тарелке
> “>ог
где wa — скорость газа (в м/с), определяемая по формуле:
,3/2g(GK-^)
W° ~ V /клРп
где g=9,81 м/с2—ускорение свободного падения; GK=0,035 — масса сталь-
ного клапана, кг; Ож — масса цилиндрического столбика жидкости над кла-
паном, кг; {ХЛ — площадь клапана, на которую действует давление газа, м2.
Массу цилиндрического столбика жидкости над клапаном можно подсчи-
тать по формуле:
&ж — 4 (Л Й") рж
где dK„ =0,045 м — диаметр клапана.
Тогда
3,14 0,0452
Ож =-------------(0,04 + 0,02) 989 = 0,097 кг
Для упрощения принимаем, что площадь клапана, на которую действует
давление газа, равна площади отверстия под клапаном:
л+2
/кл — 4
3,14-0,042
4
= 0,00126 м2
Тогда
^3/2-9,81 (0,035 + 0,097)
wo=y 0,00126-35 = 3’9 м/с
Такую скорость должен иметь поток газа в отверстии под клапаном, что-
бы поднять клапан и столбик жидкости над ним. После поднятия клапана!
в отверстии установится скорость шОг=1,76 м/с. Условие t®o>Wor выпол-
няется.
5.3. Отсутствие провала жидкости. У клапанных тарелок возможна утеч-
ка жидкости на нижележащие тарелки через отверстия под клапанами.
Утечка жидкости (провал) снижает разделительную эффективность и поэтому
необходимо рассчитать в отверстиях тарелки минимальную скорость газа,
2Г
при которой его кинетическая энергия частично расходуется для обеспечения
отсутствия провала жидкости. Для нормальной работы каждой тарелки аб-
сорбера необходимо, чтобы фактическая скорость газа в отверстиях тарелки
шог превышала минимальную скорость ш0 мин-
Минимальная допустимая скорость газа в отверстиях клапанной тарелки
рассчитывается по формуле:
1 / Рж
^omhh = (0,00253Lv + Q) I/
Г Рп
тде Lv—удельная жидкостная нагрузка, м3/(м-ч); Q — коэффициент, зави-
сящий от длины пути жидкости.
3600Z, Зб00<49,4 _ в ,
Lv~ Ржв 989-5,14 — 35 м/(м-ч)
Величина Q зависит от длины £т пути жидкости по тарелке:
< 1,5 1,5—2,5 2.5
<2 0,16 0,19 0,22
При диаметре тарелки DT = 3,8 м и по ОСТ 26-02-1402—76 имеем £т = 1,15.
Тогда
1/"989~
tfloмин = (0,00253-35+ 0,16) у -35-= 1,35 м/с
Для нормальной работы тарелки необходимо, чтобы w0P^b>0 мив- В дан-
ном случае это условие выполняется (1,76> 1,32 м/с).
5.4. Унос жидкости. Допустимая величина межтарельчатого уноса жид-
кости определяется по уравнению [6, с. 287]:
L
ецоп = (0,1 = 0,3)
Для расчета допустимой величины межтарельчатого уноса в кг жидкости
на кг газа принимается меньшее числовое значение:
49,4
едоп = 0,1 д[ 9-0 3 — 0,179 кг/кг
Величину уноса жидкости с наиболее нагруженных нижних тарелок ап-
парата рассчитаем по формуле [11, с. 193]:
_ 4(0,052Ао —1,172) / w X 3>’
ЛтРф2 \ еафт J
где А и р — величины, учитывающие влияние межтарельчатого расстояния
на унос жидкости; he— глубина барботажа, мм; ф — доля зеркала барбота-
жа; еЭф — относительная эффективная рабочая площадь тарелки, м’/м2,
m — коэффициент, учитывающий влияние физических свойств газа и жидко-
сти на унос.
Величины Дир равны [6, с. 289]:
прийт<[0,4м Д=9,48-10’ р = 4,36
при + + 0,4 м 4 = 0,159 р=0,95
22
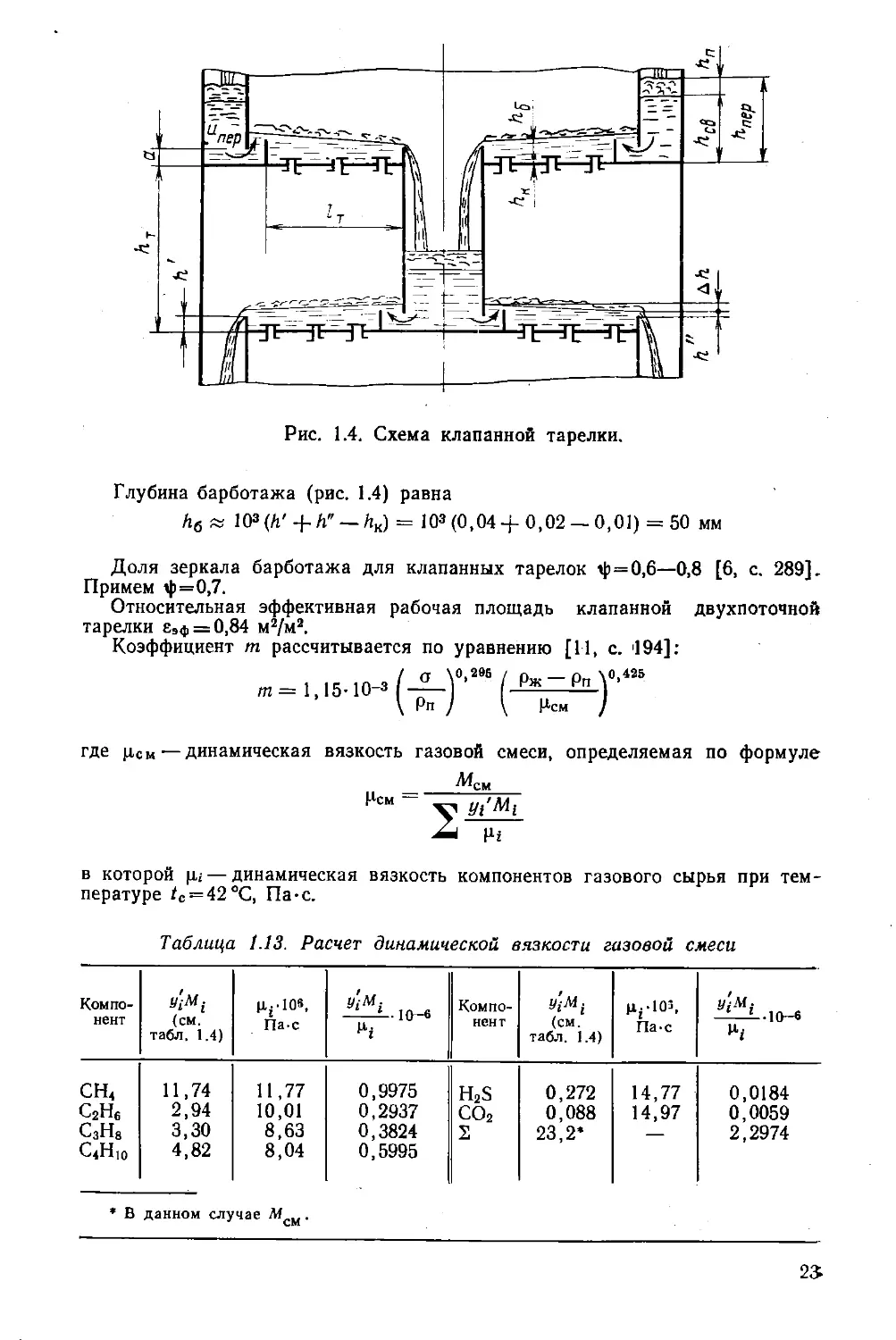
Глубина барботажа (рис. 1.4) равна
Лб» 1О3(/1' + Л" — /гк) = 103(0,04+ 0,02 —0,01) = 50 мм
Доля зеркала барботажа для клапанных тарелок ф=0,6—0,8 [6, с. 289].
Примем ф=0,7.
Относительная эффективная рабочая площадь клапанной двухпоточной
тарелки еЭф = 0,84 м2/м2.
Коэффициент т рассчитывается по уравнению [11, с. 194]:
где рем—динамическая вязкость газовой смеси, определяемая по формуле
___________________________________Мсм
Исм~ у yj'Mj
в которой |1; — динамическая вязкость компонентов газового сырья при тем-
пературе tc = 42°C, Па-с.
Таблица 1.13. Расчет динамической вязкости газовой смеси
Компо- нент «X (см. табл. 1.4) UflO*. Пас !/£'л4. —10-е Hi Компо- нент y’iMi (см. табл. 1.4) ц; ю-=, Па-с У,-Л4. -L_L.10-6 М-,-
сн< 11,74 11,77 0,9975 H2S 0,272 14,77 0,0184
СгН6 2,94 10,01 0,2937 со2 0,088 14,97 0,0059
С3НЯ 3,30 8,63 0,3824 2 23,2* 2,2974
с4н10 4,82 8,04 0,5995
* В данном случае Мсм.
23
Расчет динамической вязкости газовой смеси представлен в табл. 1.13, из
которой имеем:
23 2
Рем = 2,2974-106 = Па-с
Подставив в формулы числовые значения величин, получим:
/ 0,054 \°,293 / 989 — 35 \°>423 „ ,,Jt_
т= 1,15-10-3 35 J ( 10,098-10-’} —0,4145
0,159 [(0,052-50)— 1,72]
600°>96-0,72
( 0,35
\ 0,84-0,4145
3,7
= 0,0008 кг/кг
Унос жидкости е=0,0008 кг/кг не превышает допустимой величины
£ДОП=0,179 кг/кг и потому работоспособность тарелок абсорбера обеспечи-
вается.
5.5. Высота слоя пены на тарелке. Высота слоя пены ha над слоем свет-
лой жидкости ho рассчитывается по формуле:
Лп = h0/k
где k — относительная плотность пены (по отношению к плотности чистой
жидкости).
Величину k найдем по формуле [12, с. 447]:
1 + уТг
где Fr=tt>2np/(g/io) — критерий Фруда, рассчитываемый по приведенной ско-
рости газа.
Приведенная скорость газа (скорость, отнесенная к рабочей площади
/'рае тарелки):
О 91,9
“Jnp= Рп^раб = 35-8,93 -°>29 м/с
Примем h0 «Лои = 0,04 м, тогда
0,292
Fr = 9,81-0,04 = °>22
k =------7=^ = 0,68
14-/0,22
0,04
q gg — 0,059 м
Полученная высота пены ha=0,059 м является допустимой.
5.6. Градиент уровня жидкости на тарелке. На клапанных тарелках с пе-
рекрестным током вследствие гидравлического сопротивления при течении
жидкости в сторону переливного порога уровень жидкости на стороне ее
вход^ будет больше на величину гидравлического градиента (м), рассчиты-
ваемого по формуле [12, с. 450]:
/т
д/1 = £-а—
°экв
ц2усл
2g
где g — коэффициент сопротивления для клапанных тарелок; 1т — длина пу-
ти жидкости на тарелке (см. рис. 1.4), м; d9KB— эквивалентный диаметр по-
тока вспененной жидкости, м; пусл — условная скорость пены на тарелке, м/с;
£=9,81 м/с2 — ускорение свободного падения.
•24
Для клапанных тарелок коэффициент сопротивления рассчитаем по фор-
муле для колпачковых тарелок [12, с. 450]:
/ hK \2/з
|=3'105 (“Л?) (Re*)’1-18
где =0,01 — высота поднятия клапана, м; йв —высота барботажа, м;
Re>K — критерий Рейнольдса.
р _____ цусл^экв
ж “ V»
где уж — кинематическая вязкость жидкости с нижней тарелки, м2/с.
Условная скорость пены на тарелке:
,,________Здср
“уСЛ -- I, I
ft,W Г
где <?ср — средняя линейная плотность орошения, м2/с.
Величину <?Ср рассчитаем по формуле:
£ 49,4
9ср “ Рж^гр — 994-3,88 ~ 0,0128м/с
где Лор — средняя ширина потока при движении жидкости по тарелке, рав-
ная
Л _ Л>аб_________8,93 __
°СР - 1тп ~ 1,15-2 “3’88м
где ZT = 1,15 м; п=2 — число потоков жидкости на тарелке.
Тогда
3-0,0128
“усл = 0,04 4-0,02 = 0>62 м/с
Эквивалентный диаметр потока вспененной жидкости:
46срЛп 4-3,88-0,059
ftcp _]_ 2йп ~ 3,88 4-2-0,059 “ 0,23 М
Кинематическая вязкость насыщенного раствора моноэтаноламина при содер-
жании МЭА, равном 14,4% (масс.), составляет:
где |Лж = 0,94-10-3 Па-с — динамическая вязкость насыщенного раствора мо-
ноэтаноламина [3, с. 103].
Тогда
0,62-0,23 , „ „
Rcjk — 0 9-10-6 — 400
/ 0,01 Лз
g = 3 • Ю8 ( 0 052 ) 158 400-i.w = 0,073
1,15 0,622
hh = 0.073--Q 2/9 81~ = 0,007 м
Полученное числовое значение Дй=6,007 м для длины пути жидкости
/т= 1,15 м следует считать допустимым. •
25
5.7. Отсутствие захлебывания. В результате переполнения переточного
устройства тарелка может захлебнуться и нормальный переток жидкости с
тарелки на тарелку будет нарушен.
Отсутствие захлебывания определяется выполнением условия (см. рис. 1.4)
Лпер < 4* h'
ГД6 Лпер — высота уровня вспененной жидкости в сливном устройстве, рав-
ная
^пер = ^св 4~
при этом йсв — высота светлой жидкости в сливном устройстве, м; hn— вы-
сота слоя пены в сливном устройстве, м.
Высота светлой жидкости рассчитывается по уравнению:
где ДР=554 Па — общее сопротивление нижней клапанной тарелки аппара-
та; ДРпер — потеря давления жидкости при ее протекании через слитное
устройство, Па.
Величину ДРпер найдем по формуле
Д^пер = &Ржи2пер/2
где |=3,25 — коэффициент сопротивления; un«p — скорость жидкости в сече-
нии между нижним обрезом сливной перегородки и тарелкой (см. рис. 1.4),
м/с.
Скорость жидкости иПер равна:
L 49,4
“пер = рж«пеРп = 989-0,1352-2 = °’18 м/с
где Snep — площадь сечения между нижним обрезом сливной перегородки и
тарелкой, рассчитанная по формуле:
snep = ЬСЛа = 1,69 0,08 = 0,1352 ма
При этом бел — длина линии слива, м; а — зазор под сливной перегородкой,
м.
Тогда
989-0,182
ДРпер = 3,25-----2---- = 16 Па
554 -4- 16
Лса = 9 81.98д‘ + 0,04 4-0,007 = 0,106 м
Высоту пены в сливном устройстве примем равной высоте пены на тарел-
ке йп=0,059 м. В этом случае
Лпер = 0,106 4-0,059 = 0,165 м
При
йт 4- hw = 0,6 + 0,04 = 0,64 м
выполняется условие
^пер 4~ Л
В результате расчета работоспособности наиболее нагруженной по газу
и жидкости нижней тарелки абсорбера подтверждается правильность приня-
тия диаметра аппарата равным Z)a=3,8 м.
6. Высота абсорбера. Одновременная абсорбция двух компонентов газа
широко применяется в промышленности, однако расчет высоты аппаратов
26
Рис. 1.5. Схема для расчета высоты абсорбера
очистки газов раствором МЭА.
для хемосорбции компонентов является проблема-
тичным, особенно в случае одновременной хемосорб-
ции нескольких компонентов.
Относительно хорошо изучена кинетика хемо-
сорбции СО2 и H2S водным раствором МЭА в на-
садочных аппаратах. Расчеты высоты насадочных
аппаратов с числовыми примерами хемосорбции од-
ного компонента даны в работе [12].
Рабочая высота абсорбера (рис. 1.5) равна, м:
//р = Aj -f- Нт + h2
где hi — высота верхней камеры; Нт — высота, ча-
сти аппарата, занятой тарелками; h2 — высота ниж-
ней камеры.
Высоты верхней и нижней камер аппарата при-
мем равными Л1 = й2=1,5 м.
Высота части аппарата, занятой тарелками, рас-
считывается по формуле:
Нт = (Ар - 1) hT
где АР — число рабочих тарелок; Лт — расстояние между тарелками, м.
Число рабочих тарелок равно:
Ар=Ат/т]
где Ат—число теоретических тарелок; т] — коэффициент полезного действия
тарелки.
Число теоретических тарелок Ат, необходимое для обеспечения заданного
коэффициента извлечения одного компонента в абсорбере при постоянном
среднем коэффициенте его извлечения на каждой тарелке, можно рассчитать
по уравнению [1, с. 161]:
где <ра — коэффициент извлечения компонента в абсорбере; ф — средний ко-
эффициент извлечения компонента на тарелках.
Кислые компоненты СО2 и H2S извлекаются в абсорбере одновременно,
но не одинаково. Если рассчитать необходимое число теоретических тарелок
Ат для компонента, который извлекается труднее, то этого числа теорети-
ческих тарелок вполне хватит и для извлечения другого компонента.
Из двух компонентов труднее будет извлекаться тот, для которого кон-
станта фазового равновесия при условиях, например на нижней тарелке ап-
парата, окажется больше.
Константы фазового равновесия для СО2 и H2S рассчитаем по формуле:
Мж
mi = mpt рж/?Т
где mPi — константа фазового равновесия для водных растворов газов, кПа;
Мж и рж — средняя мольная масса и плотность абсорбента в нижней части
аппарата; 2? = 8,315 кДж/(кмоль-К)—универсальная газовая постоянная;
7=52+273=325 К — температура газа.
Константы фазового равновесия для водных растворов СО2 и H2S при
температуре /Я=52°С равны [12, с. 25]:
/прсо2 = 2986-102 Kpja "ZpH2s — 925- Ю2 кПа
Расчет средней мольной массы жидкого поглотителя на нижней тарелке
абсорбера дан в табл. 1.12.
27
Подставив в формулу для расчета mt числовые значения величин, полу-
чим:
2986-102-20,4 п по
тСО2 = 989-8,315-325 — 2,28
925-102-20,4
mH2s = '989-8,315-325 ~°>71
Поглощение СО2 в водном растворе МЭА будет происходить труднее, чем
поглощение H2S, так как /псог>отн2з. В этой связи число теоретических та-
релок Л\ следует рассчитать применительно к поглощению СО2.
Коэффициент извлечения СО2 в абсорбере
(GcO2)bx — (GcO2)bmx
4,3 ~ (<3со2)вх
где (Gco^bx, (Gco2) вых —расходы СО2 при вводе газового сырья в аппарат
и выводе из аппарата очищенного газа (см. табл. 1.4 и 1.5), кг/ч.
Подставив числовые значения величин в формулу для расчета коэффи-
диента <ра, получим
Фа = 1251257 1-0 = 0 ’9920445
Средний коэффициент извлечения на тарелках рассчитаем по формуле:
~Krahn
где Кг — коэффициент массопередачи при хемосорбции, м/ч; а — удельная
поверхность контакта фаз, м2/м3; ha — высота газожидкостного слоя, м;
wnp — приведенная скорость газа при рабочих условиях в нижней части ап-
парата, м/с.
Коэффициент массопередачи при хемосорбции рассчитывается через коэф-
фициенты массоотдачи при физической абсорбции по формуле
1
= 1 /nx
Рг I- Рж
где и Рж — коэффициенты массоотдачи в газовой и жидкой фазах, м/ч;
mi — константа фазового равновесия для физической абсорбции с поправкой
на ионную силу раствора, полученного в результате хемосорбции.
Коэффициент массоотдачи в газовой фазе:
Рг = PrsFp
где prs — коэффициент массоотдачи в газовой фазе, отнесенный к единице
рабочей площади Гр(м2) тарелки, м/(ч-м2).
Для клапанной тарелки коэффициент 0Гх находят по эмпирической фор-
муле Ц2, с. 499]:
Рг« = ArnmnPV
где А = 41700, т=1, п=0,5 — коэффициенты; h0 л/г"=0,04 м.
Подставив числовые значения величин в формулу, получим:
prs = 41 700-0,29-0,040,6 = 2419 м/(ч м2)
Рабочая площадь клапанной двухпоточной тарелки диаметром От = 3,8 м
равна Гр=7,68 м2 [13, с. 243].
28
Тогда
0r = 2419-7,68 = 18 578 м/ч
Коэффициент массоотдачи в жидкой фазе равен:
Рж = р
где Ря<5 — коэффициент массоотдачи в жидкой фазе, отнесенный к единице
рабочей площади (м2) тарелки, м/(ч-м2).
Для клапанной тарелки коэффициент pms найдем по эмпирической фор-
муле [12, с. 504]:
PKS = Ла^пр^о = 240 • 0,29°.35 • 0,04°.68 = 24,1 м/(ч • м2)
где Л=240, т = 0,35, п=0,58 — коэффициенты; /io~/i"=0,04 м.
Коэффициент рж равен:
₽ж =Ржв^р = 24,1-7,68 = 185 м/ч
Константу фазового равновесия с поправкой на ионную силу водного
раствора моноэтаноламина найдем по эмпирической формуле:
1—(я/+2 Kz' + 2 z) с°’75
где К'г, К+, К~ — поправочные коэффициенты на присутствие растворенного
газа, положительных и отрицательных ионов соответственно; Z+ и Z~ — ко-
личества положительных и отрицательных ионов; С — концентрация абсор-
бента, кмоль/м3.
В водном растворе моноэтаноламина в результате хемосорбции СОг со-
держатся следующие положительные и отрицательные ионы:
RNH2 + СО2 7—>- RNHCOO" + №
СО2 + Н2О нсо3- + Н+
2RNH2 + 2№ <—> 2RNH3+
RNH2 + НСО3- <—> RNH3+ + СО32-
Значения поправочных коэффициентов К'г, К~ и К+ можно определить
для большинства ионов по данным [12, с. 27]. Для ионов, данные по кото-
рым отсутствуют в работе [12, с. 27], значения поправочных коэффициентов
принимаются по аналогам.
Количества положительных и отрицательных ионов определены на основе
стехиометрических уравнений и приведены в табл. 1.14, где также указаны
принятые аналоги и значения поправочных коэффициентов К'г, К~ и К+.
Концентрация абсорбента равна:
СмэаРн2О 25 900-1000
Ммэа£н2О — 61,1-146 720
= 2,89 кмоль/м3
Таблица 1.14. Поправочные коэффициенты
Ион, молекула Ион-аналог Число ионов Поправочный коэффициент
Z- Z + к- к+
RNHCOO- НСОз- 1 0,05
RNH3+ NH4+ 3 — — — 0,07
СОз2- СОз2- — 1 — 0,17 —
со2 — — — 0 ,03 .— ' —
29
Подставив в формулу для расчета константы фазового равновесия mt
числовые значения величин, получим:
2,28
= 1 —(-0,03 + 0,05-1 4-0,07-3 + 0,17-1)2,89°,’в ~ 20,14
Коэффициент массопередачи равен:
Кг = j 20,14 = 9’18
18 578 + 185
Удельную поверхность контакта для клапанных тарелок найдем на осно-
ве уравнения [12, с. 490]:
0,64 / цж \
а = —j— Fr».2We°.°<pr°>3 )
, па \ го» /
где Fr=0,22; We — критерий Вебера; <рг — газосодержание; Цж =
= 0,94-10~3 Па-с и pw=0,55-10-3 Па-с —вязкость водного раствора МЭА и
воды при температуре /К=52°С.
Критерий Вебера [12, с. 489]:
а 0,054
We = gPx^o ‘ 9,81-989-0,042 = °’0035
Газосодержание рассчитаем по формуле [12, с. 447]:
/FF /0^2
<рг =-------=- =--------, =0,319
1 + /Fr 14-/0,22
Подставив в формулу для расчета удельной поверхности контакта число-
вые значения величин, получим:
0,64 / 0,94-IO-3 \
а = -q4q4~ 0,22°,2-0,0035°.°-0,319°.3 ~0 55.10-3 1 = 0,482 м2/м3
Тогда
— 9,18-0,482-0,059
<р=1 — е °’29 = 0,5934960
1 —0,9920445
ЛГт = 1 — 0,5934960 = 5,4~6
Применим в абсорбере клапанные тарелки, к. п. д. которых при хемосорб-
ции СО2 и H2S находятся в пределах 10—40% [1, с. 124; 14, с. 139]. Приняв
среднее числовое значение г] = 25%, найдем число рабочих тарелок:
6
0,25 =24
Выеота части аппарата, занятой тарелками, при йт=0,6 м равна:
Ут = (24—1)0,6= 13,8 м
Рабочая высота абсорбера равна:
Яр= 1,5+ 13,8+ 1,5= 16,8 м
Диаметры штуцеров аппарата рассчитываются по обычным формулам
гидравлики [15, с. 97].
30
ДЕСОРБЕР ДЛЯ РЕГЕНЕРАЦИИ РАСТВОРА МОНОЭТАНОЛАМИНА
Исходные данные
Рассчитать отгонную колонну (десорбер) для регенерации насыщенного
кислыми компонентами (сероводород и диоксид углерода) водного раствора
моноэтаноламина (МЭА). Состав раствора приведен в табл. 1.12. Температу-
ра насыщенного раствора МЭА при его вводе в аппарат /=90°С. Количест-
во серосодержащих компонентов в регенерированном растворе не должно
превышать 0,0025 кмоль на моль МЭА, а углекислых компонентов —
0,0009 кмоль на кмоль МЭА.
Насыщенный кислыми компонентами водный раствор МЭА регенерирует-
ся при нагревании. Схема материальных потоков аппарата показана на
рис. 1.6.
Сырьем десорбера 1 является водный раствор МЭА, нагреваемый в теп-
лообменнике 6 до температуры t и подаваемый в верхнюю часть тарельчато-
го аппарата в количестве Gc.
При нагревании насыщенного кислыми компонентами раствора МЭА дав-
ление паров этих компонентов быстро растет. Химические соединения, обра-
зовавшиеся при химической абсорбции, разлагаются с выделением кислых
компонентов. Процесс разложения химических соединений описывается сле-
дующими стехиометрическими уравнениями
2RNH3HCO3 ч=±: (RNH3)2CO3 + СО2 + Н2О (5)
(RNH3)2CO3 =f=t 2RNH2 + СО2 + Н2О (6)
2RNH3HS sj—>- (RNH3)2S + H2S (7)
(RNH3)2S 2RNH2 + H2S (8)
где R — группа OHCH2CH2—.
Насыщенный раствор МЭА при вводе в аппарат однократно испаряется.
Образовавшаяся при однократном испарении жидкая фаза GM раствора
МЭА из нижней части десорбера поступает в межтрубное пространство испа-
рителя 2, где нагревается и вновь частично испаряется за счет тепла кон-
денсации водяного пара. Нагретый и регенерированный раствор Ар выводится
из нижней части десорбера.
Поток G'n кислых газов, водяного пара и жидкий остаток G'M из испари-
теля 2 возвращается в десорбер 1.
Кислые газы и водяной пар в количестве Gn. г. с выводятся из верхней
части десорбера, охлаждаются в конденсаторе-холодильнике 4 и поступают
в емкость орошения 3. Вода Go из емкости орошения насосом 5 возвращает-
ся в верхнюю часть десорбера в каче-
стве орошения. Кислые газы GK вы-
водятся из системы.
Расчет
1. Состав сырья. Для расчета реге-
нерации поглотителя в десорбере необ-
ходимо знать химический состав насы-
щенного абсорбента при температуре
Рис. 1.6. Схема материальных потоков
десорбера:
1 — десорбер; 2 — испаритель; 3 — сепаратор;
4 — конденсатор-холодильник; 5 — насос; 6 —
теплообменники; / — насыщенный абсорбент
из абсорбера; II — регенерированный абсор-
бент в абсорбер.
31
/=90°С и давлении в теплообменнике 6 (см. рис. 1.6). Принимаем давление
в трубном пространстве теплообменника равным лт =0,196 МПа.
Водный раствор МЭА содержит СО2 и HiS в растворенном и химически
связанном состояниях (см. табл. 1.12).
Найдем количества кислых компонентов, которые образуются при раз-
ложении химических соединений по реакциям (5)—(8).
Константы химического равновесия для реакций (5)—(8) запишем в фор-
ме, принятой в литературе [8, с. 246]:
[RNH3HCO3]2 [(RNH3)2CO3]
5 ~ {(RNH3)aCO3] [COJ [Н2О] - [RNHJ2 [СО2] [Н2О]
_ [RNH3HS]2 _ KRNH3)2S]
- [(RNHaJjS] [HjS] ** - [RNH2]2 [H2S]
где в квадратных скобках — количества молей веществ.
С учетом давления и протекания реакций в растворе константы равнове-
сия запишем так [9, с. 265]:
[RNH3HCO3]2
5 - [(RNH3)aCO3] [СОа] [Н2О]
10,2лт \дл3
[(RNH3)2CO3] 6 - [RNH]2 [СОа] [Н2О] / 10,2лг \ (2^ /
[RNH3HS]2 7 - [(RNH3)2S[ [H2S] 1 / 10,2лт \ Дл7 [ 2^’ /
_ [(RNH3)2S] / 8 - [RNHa]2 [H2S] 10,2лт \д«в 2 n‘s)
где Sa; — общее число молей в реагирующей смеси; Ди—разность чисел
молей продуктов и исходных реагентов в реакциях (5) — (8).
Константа химического равновесия связана с изменением стандартного
изобарного потенциала [10, с. 230]:
tab - ^Gj
igRy-— 23/?г
где AGj — изменение стандартного изобарного потенциала /-ой реакции
(/=5, 6, 7, 8), кДж/моль; R=8,315 кДж/(моль-К)—газовая постоянная;
Т — температура реакции, К.
Изменение изобарного потенциала реакции рассчитывается по уравнению
[10, с. 232]:
\Gj = bHf — TAS°j
где ДЯ°2 — изменение энтальпии образования, кДж/моль; AS0 — изменение
энтропии реакции, кДж/(моль-К).
Рассчитаем изменение изобарного потенциала для реакции (5):
ДС6 = ДЯ5О-ТД.<?8°
при этом
ДЯ5° =*-Д(ймн3)гсо3 + Нсо2 + Нн2о — 2wrnh3hco3
Д$5° = S(rnh3)2co3 + 5со2 + 5н,о — 2Srnh3hco3
32
где HiwSi —энтальпии образования и энтропии веществ (см. табл. 1.11).
Подставив в формулы числовые значения величин, получим:
ДЯ5° = - 504,046 — 393,768 — 286,023 — 2 (—731,835) =279,8 к Дж/модь
ДД5" = 1138,765 + 213,777+ 286,023 — 2-608,135 =
= 206 Дж/(моль-К) = 0,26 кДж/(моль-К)
Д65 = 279,8 — 363-0,206 = 204,3 кДж/моль
204,3
1g ^з = — 2,3-8,315-363 =~0,029
откуда й5=0,935.
Аналогичным образом получены числовые значения +=0,874, kj= 1,018,
£s= 1,049.
Обозначим число киломолей каждого вещества, полученного по реакции
(5), через *5. Тогда для расчета равновесного превращения воспользуемся
схемой (в дальнейшем ее запись опускается):
Реакция
2RNH3HCO,3= (RNH3)2CO3 + CO2+ Н2О
Число киломолей в исходной смеси 2 0 0 0
То же, в равновесной смеси 2—2х3 х5 х5 хл
Всего киломолей в равновесной смеси 2 + х3
Разность чисел киломолей 2л/5 = 3—2=1
Тогда в соответствии с найденным уравнением для константы химическо-
го равновесия k$ запишем
(2 —2х5)2 / 10,2-0,196 V
0,935= (-2+^-)
Методом подбора определяем х$= 0,6836 кмоль.
Уравнения для расчета хе, х?, х3: 1 — хя 0,874 - 4х/ 1,018= х72 1 —Хя 1 1,049 ~ 4х/ ( / 10,2-0,196 з \ 1 ~~Н j / 10,2-0,196 .° \ 2 ) ' 10,2-0,196 \2 , 1 + 2хй )
откуда х6 = 0,5116 кмоль/ч; Хт = 0,6647 кмоль/ч; Ха=0,4952 кмоль/ч.
Для разложения (кмоль/ч) вещества, записанного в левой части стехио-
метрического уравнения (5)
x5RNH3HCO3 — 0,5х3 (RNH3)2CO3 + 0,5х5СО2 + 0,5х5Н2О
надо знать исходное количество сырья для этой реакции (см. табл. 1.12). Оно
равно Mrnh3нсо3—0,0276 кмоль/ч.
По реакции (5) разлагается
Gp6Rnh3hco3 = x5^rnh3hco++kh3hco3 '-= 0,6836-0,0276-123,1 = 2,3 кг/ч
или
2 3
'V₽5Rnh.,hco3 = 123 1 =0'0187 кмоль/ч
3—640
33
Получено по реакции (5):
Gp5(RNH3)2CO3 = O.SW^RNHaHCo/^RNHjj.jCO;) = 0,5-0,0187-184,2 = 1,7 кг/ч
Gp5co2 = 0,5,Vp5rnh3co3^co2 = 0,5-0,0187-44 = 0,4 кг/ч
Gp5h2o = 0,5Wp5rnh3hco3'Wh2o = 0,5-0,0187-18 = 0,2 кг/ч
После реакции (5) в насыщенном абсорбенте остается непрореагировав-
шим сырье в количестве
G05rnh3hco3 = Grnh3hco3 — G®rnh3hco3 = 3,4 — 2,3 = 1,1 кг/ч
Для разложения х6 (кмоль/ч) вещества, записанного в левой части сте-
хиометрического уравнения (6)
х6 (RNH3)2CO3 = 2x6RNH2 х8СО2 + х8Н2О
имеем исходное количество сырья (см. табл. 1.12)
1,7
J^(RNH3)2CO3 = 0,1140 Ц-—j-gTj—2~ = 0,1232 кмоль/ч
По реакции (6) разлагается:
Gp2(RNH3)2CO3 =*eW(RNH3)2CO3M(RNH3)2CO3 = 0,5116-0,1232-184,2 = 11,6 кг/ч
или
11,6
Wpe(RNH3),CO3 = 184,2 = 0,063 кмоль/ч
Получено по реакции (6):
Gp6rnh2 — 2№6(RnH3)2CO3-'Wrnh2 = 2-0,063-61,1 = 7,7 кг/ч
Gp6CO2 = Alpe(RNH3)2CO3MCo2 = 0,063-44 = 2,8 кг/ч
Gp6H2o = 7/p0(rnh3)2co334h2o = 0,063-18 = 1,1 кг,'ч
В насыщенном абсорбенте остается непрореагировавшим сырье в количе-
стве
GH6(RNH3)2CO3 = G(RNH3)2CO3 + Gh5(rn-h3)2co3 - GP6(rnh3)2CO3 =
= 21 -f- 1,7 — 11,6 = 11,1 кг/ч
Для разложения х? (кмоль/ч) вещества, записанного в левой части стехио-
метрического уравнения (7)
x7RNH3HS = 0,5х7 (RNH3)2S + 0,5x7H2S
имеем исходное количество сырья (ем. табл. 1.12)
/Vrnh3HS = 1,7119 кмоль/ч
По реакции (7) разлагается
G₽7rnh3HS = x7A,RNHaHS^RNH3HS = 0,6647-1,7119-95,1 = 108,2 кг/ч
или
• 108,2
A,p7RNH3HS = 95 1 = 1,1377 кмоль/ч
Получено по реакции (7)
GP7(rnh3)2s = 0,5/VP7rnh3hs'W(RNh3)2s = 0,5-1,1377-156,2 = 88,9 кг/ч
Gp7H2s - 0,5.VP7rNh.1hs-Wh2s = 0,5-1,1377-34= 19,3 кг/ч
34
Количество непрореагировавшего сырья
Gh’rnh3hs = Grnh3hs — Gp’rnh3hs — 162,8 — 108,2 = 54,6 кг/ч
Для разложения х3 (кмоль/ч) вещества, записанного в левой части сте-
хиометрического уравнения (8)
хй (RNH3)2S = 2xeRNH2 4- x8H2S
имеем исходное количество сырья (см. табл. 1.12)
88,9
W(RNH3)2s = 1.6549 -|- ~]56-g- = 2,2240 кмоль/ч
По реакции (8) разлагается:
Gp8(RNH3)2s = *8W(RNh3)2sA4(rnh3)2s = 0,4952-2,2240-156,2 = 172 кг/ч
или
172
Afp8(RNH3)aS = 156>2 = 1.1012 кмоль/ч
Получено по реакции (8):
Gp8rnh2 = 2jVp8(RNh3)2s^4rnh2 = 2-1,1012-61,1 = 134,6 кг/ч
Gp8H2s = №’8(RNH3)2sjWh2s = 1 -1012-34 = 37,4 кг/ч
Количество непрореагировавшего сырья:
Gh8(RNH3)2S = G(RNH3)2s+ Gp’(RNH3)2S — Gp8(RNH3)2S =
= 258,54-88,9 —172 = 175,4 кг/ч
В результате нагревания в теплообменнике состав сырья десорбера, най-
денный при расчете абсорбера (см. табл. 1.12), изменится. При вводе сырья
в десорбер имеем:
Gbrnh2 = Grnh2 + Gp6rnh2 + Gp8RNH2 = 25577,6 4- 7,7 4- 134,6 = 25719,9 кг/ч
Gbh2o = Gh2o + Gp5H,o + Gp6h2o = 146717,4 4- 0,2 4- 1,1 = 146718,7 кг/ч
Gbco2 = GCo2 4- Gp6co2 + Gp6co2 = 1260,84- 0,4 4-2,8 = 1264 кг/ч
Gbh2s = Gh2s + Gp7h2s + Gp6h2s = 3785,5 4- 19,3 4-37,4 = 3842,2 кг/ч
Расчет состава насыщенного абсорбента при его вводе в десорбер дан в
табл. 1.15.
Средняя мольная масса сырья десорбера из табл. 1.15
Мс = ^AW = 20,4
2. Температура и давление в аппарате. Температура в верхней части де-
сорбера должна быть такой, чтобы унос раствора МЭА из аппарата был
минимальным. Этому условию соответствует температура
= ^кип — №
где Д/ — разность температуры кипения tKsn раствора МЭА и температуры
/в в верхней части аппарата, °C.
Величина Д/ выбирается так, чтобы соблюдалось неравенство температур
-\ -кип
Температура кипения насыщенного раствора при с «0,07 кмоль СО2/кмоль
МЭА определяется из графика (рис. 1.7); /кип = 119 °C.
3 • 35
Таблица 1.15. Расчет состава насыщенного абсорбента
при его вводе в десорбер
Компонент Мольная масса Mi Количество ‘Содержание М.с' г i
кг/ч — g* г Af.’ кмоль/ч 1 ’ масс, доли ni ci ” ’ МОЛЬН. доли
RNH„ (МЭА) 61,1 25719,9 420,9476 0,0144655 0,048294 2,95
Н2О 18,0 146718,7 8151,0388 0,935151 0,935151 16,83
СО2 44,0 1264,0 28,7272 0,003296 0,003296 0,14
(RNH3)2CO3 184,2 11,1 0,0603 0,000007 0,000007 0,00
RNH3HCO3 123,1 1,1 0,0089 0,000001 0,000001 0,00
H2S 34,0 3842,2 113,0059 0,012965 0,012965 0,44
(RNH3)2S 156,2 175,4 1,1229 0,000129 0,000129 0,02
RNH3HS 95,1 54,6 0,5741 0,000066 0,000066 0,01
CH4 16,0 10,0 0,6250 0,000072 0,000072 0,00
c2H6 30,0 5,0 0,1667 0,000019 0,000019 0,00
s — 177802,0 8716,2774» »8716,3 1,000000 1,000000 20,39* 20,4
* В данном случае М с.
Приняв Д/ = 8°С, получим
1В= 119 — 8 = 111 °C
Указанное выше неравенство температур выполняется:
90 °C < 111 °C < 119 °C
Для обеспечения движущей силы процесса регенерации раствора МЭА
необходимо создать разность температур Д^ между нижней и верхней частя-
ми десорбера. При проектировании установок аминной очистки газов от
кислых компонентов числовое значение AZj принимают равным 10—20 °C.
Принятие больших числовых значений Д^ приведет к увеличению тепло-
вой нагрузки испарителя 2 (см. рис. 1.6), обеспечивающего теплом нижнюю
часть десорбера. Одновременно увеличится тепловая нагрузка конденсатора-
холодильника, обеспечивающего поддержание температуры /В=П1 °C. С уче-
Рис. 1.7. Зависимость температуры кипения 15%-кого раствора МЭА от
содержания СО2 в растворе при давлении в верхней части колонны
л = 0,12 МПа.
36
том названных обстоятельств примем АЛ=10°С. Тогда температура в ниж-
ней части аппарата равна
=zb+ = Hl + 10 = 121 °C
С учетом термической стойкости раствора МЭА и для предотвращения
коррозии оборудования давление в аппарате должно быть не выше
л = 0,167 МПа [14, с. 139]. Принимаем давление по высоте аппарата одина-
ковым и равным л=0,12 МПа; это не окажет существенного влияния на ре-
зультаты дальнейших расчетов, так как перепад давления в десорбере зави-
сит от числа и типа тарелок.
3. Доля отгона и состав жидкой и паровой фаз сырья. При нагревании
насыщенного водного раствора МЭА химические соединения, образовавшие-
ся вследствие поглощения кислых компонентов в абсорбере, разлагаются с
выделением СОз и H2S (см. с. 31). При подаче сырья в десорбер (г = 90°С
и л=0,12 МПа) происходит однократное испарение с образованием жидкой
и паровой фаз.
Мольная доля отгона е' исходного сырья и составы фаз при температуре
/=90°С и давлении л=0,12 МПа рассчитываются аналитическим методом
Трегубова путем подбора такого значения е', при котором удовлетворяются
равенства:
п п ,
= (9)
•! * ь \‘ I ч1I
I 1
И
п П Р
2^'=^ ^гХг', = 1 * * * (10)
1 1
где п — число компонентов в исходном сырье; y't— содержание г'-го ком-
понента в жидкой и паровой фазах, образовавшихся при однократном ис-
парении сырья, мольн. доли; л= 120 000 Па — давление в аппарате; с',— со-
держание г-го компонента в сырье (см. табл, 1.15), мольн. доли; Р; — давле-
ние насыщенного пара г-го компонента, Па.
Давления насыщенных паров компонентов при температуре <=90°С опре-
делены по следующим источникам:
Ссылка
Для МЭА (RNH2) [3, с. 46]
Для воды [3, с. 42]
Для сероводорода и диоксида угле- [5, с. 9]
рода Для метана и этана [6, с. 115]
Ввиду отсутствия надежных данных давления насыщенных паров хими-
ческих соединений кислых компонентов приняты равными нулю.
Значение мольной доли отгона, которое удовлетворяет равенствам (9) и
(10) определено методом постепенного приближения и равно е'=0,0242. Ре-
зультаты расчетов составов жидкой и паровой фаз сырья, образовавшихся
при однократном испарении, даны в табл. 1.16.
Зависимость между массовой и мольной долями отгона имеет вид:
еМс = е'Му
где е — массовая доля отгона; Му — мольная (средняя) масса паровой фа-
зы, образовавшейся при однократном испарении.
Расчет средних мольных масс жидкой и паровой фаз, образовавшихся при
однократном испарении сырья дан в табл. 1.17, где значения Si/; и SV;
приведены точно к единице путем распределения по компонентам невязок
+0,000007 и —0,0000406 (табл. 1.16).
37
Таблица 1.16. Расчет мольной доли отгона сырья при подаче его в десорбер (t=90°C, л = 120000 Па)
« Компонент Состав сырья, c'l ЛСр Па Pi, Па л-|-е' (Ppit) (е'=0,0242), Па , лс. л 1 мольн. доли
1 л-j-e' (Р*—л) мольн. доли
RNH2 (МЭА) 0,048294 5795 6268 117248 0,049425 0,002580
Н2О 0,935151 112218 70118 118793 0,944652 0,551976
СО2 0,003296 396 27865174 791433 0,000500 0,116105
(RNH3)2CO3 0,000007 1 0‘ 117096 0,000007 0
RNH3HCO3 0,000001 0 0* 117096 0,000001 0
H2S 0,012965 1556 7530232 299328 0,005198 0,326184
(RNH3)2S 0,000129 15 0* 117096 0,000128 0
RNH3HS 0,000066 8 0‘ 117096 0,000068 0
CH4 0,000072 9 14233158 461538 0,000020 0,002372
C2H6 0,000019 2 5658158 254023 0,000008 0,000377
s 1,000000 — — — 1,000007х 1,00000 0,999594 «1,000
* Числовое значение принято равным нулю.
Таблица 1.17. Расчет средних мольных масс потоков,
образовавшихся в результате однократного испарения сырья
Компонент Мольная масса М- х- Л12.У;-
RNH2 (МЭА) 61,1 0,002630 0,049424 0,16 3,0198
Н2О 18,0 0,552332 0,944646 9,94 17,0036
СО2 44,0 0,116105 0,000500 5,11 0,0220
(RNH3)2CO3 184,2 0 0,000007 0,00 0,0013
RNH3HCO3 123,1 0 0,000001 0,00 0,0001
H2S 34,0 0,326184 0,005198 11,09 0,1767
(RNH3)2S 156,2 0 0,000128 0,00 0,0200
RNH3HS 95,1 0 0,000068 0,00 0,0065
сн4 16,0 0,002372 0,000020 0,04 0,0003
c2H6 30,0 0,000377 0,000008 0,01 0,0002
2 1,000000 1,000000 26,35«26,4* 20,25»
^20,3’»
* В данном случае Af .
** В данном случае М'х.
Массовая доля отгона равна:
М,, 26,4
е --= е’ = 0,0242 -9П =0,0313
1 F 1£ у *
Количество паровой и жидкой фаз, образовавшихся при однократном ис-
парении сырья:
Gn = eGc = 0,0313-177 802 = 5565 кг/ч
6Ж = Gc — Gn = 177 802 — 5565 = 172 237 кг/ч
4. Расчет разложения химических соединений в испарителе. В результате
однократного испарения сырья в жидком потоке GM содержание кислых ком-
понентов уменьшилось (табл. 1.18).
Однако в абсорбере осталось еще много кислых компонентов в растворен-
ном и химически связанном состоянии. Для дальнейшего разложения хими-
ческих соединений кислых компонентов с абсорбентом его необходимо на-
греть до температуры /В=121°С, что обеспечивается подогреванием абсор-
бента в испарителе. Для расчета разложения химических соединений в ис-
парителе необходимо принять величину давления в межтрубном пространст-
ве. Принимаем величину давления в испарителе лн=0,12 МПа.
Расчеты химических разложений в испарителе (tB= 121 °C, л=0,12 МПа)
подобны расчетам разложений химических соединений в теплообменнике
(^=90 °C, л = 0,196 МПа) и потому их подробности опущены; результаты
представлены в табл. 1.19. Сравнение составов абсорбента после однократ-
ного испарения (см. табл. 1.18) и нагретого до температуры /Н = 121°С
(табл. 1.19) показывает незначительное его изменение.
Объясняется это незначительным содержанием химических соединений в по-
догреваемом сырье и недостаточным его нагревом. Известно, что при тем-
пературе выше 125 °C моноэтаноламин разлагается. Поэтому регенерацию
водного раствора МЭА при температуре выше 125 °C не проводят. Подогрев
абсорбента до температуры 125 °C, как показывают расчеты, которые здесь
опущены, не меняет заметно содержания (RNH3)2CO3, RNH3HCO3,
(RNH3)2S и RNH3HS в абсорбенте. Поэтому в последующих расчетах
процесса регенерации используют состав абсорбента, приведенный в табл. 1.19.
5. Материальный баланс регенерации раствора МЭА. Для составления
39
Таблица 1.18. Расчет состава жидкой и паровой фаз сырья
Компонент i ‘ Mx y^,Ji^ аж1 = °жхи Kr/4 Gni = Gn-Vi’ кг/ц nxi~ M. ’ 2 КМОЛЬ/Ч „ • = G,li , П1 Al. ’ кмоль/ч
RNH2 (МЭА) 0,149124 0,006072 25686,1 33,8 420,3944 0,5532
Н2О 0,839665 0,377230 144620,2 2098,5 8034,4555 116,5833
СО2 0,001086 0,193928 184,8 1079,2 4,2000 24,5273
(RNH3)2CO3 0,000064 0 H,1 0 0,0603 0
RNH3HCO3 0,000001 0 1,1 0 0,0089 0
H2S 0,008726 0,420873 1500,0 2342,2 44,1176 68,8882
(RNH3)2S 0,000988 0 175,4 0 1,1229 0
RNH3HS 0,000321 0 54,6 0 0,5741 0
CH4 0,000015 0,001518 1,6 8,4 0,1000 0,5250
c2H6 0,000010 0,000379 2,1 2,9 0,0700 0,0967
s 1,000000 1,000000 172237,0 5565,0 8505,1037 st 8505,1 211,1737 = 211,1
Таблица 1.19. Расчет состава абсорбента при температуре
te = 121 °C
Компонент Моль- ная масса Количество Содержание
8г- кг/ч ni ~ Mt' кмоль/ч c. = -lL, масс, доли f ni мольн. доли
RNH2 (МЭА) 61,1 25753,7 421,5008 0,149525 0,049552 3,02
Н2О 18,0 144620,7 8034,4833 0,839662 0,944540 17,00
СО2 44,0 186,0 4,2273 0,001080 0,000497 0,02
(RNH3)2CO3 184,2 7,2 0,0391 0,000042 0,000005 0,00
RNH3HCG3 123,1 0,4 0,0032 0,000002 0,000000 0,00
H2S 34,0 1524,5 44,8382 0,008851 0,005271 0,17
(RNH3)2S 156,2 122,5 0,7843 0,000711 0,000092 0,01
RNH3HS 95,1 18,3 0,1924 0,000106 0,000023 0,00
сн4 16,0 1,6 0 1000 0,000009 0,000012 0,00
c2H6 30,0 2,1 0,0700 0,000012 0,000008 0,00
2 — 172237,0 8506,2386« «8506,2 1,000000 1,000000 20,22« «20,2
материального баланса процесса регенерации раствора МЭА необходимо знать
количества десорбированных кислых газов и регенерированного водного
раствора МЭА.
Принимаем, что химические соединения (RNH3)2CO3, RNH3HCO3,
(RNH3)2S и RNH3HS, неразложившиеся после нагревания абсорбента до тем-
пературы /Н=121°С, остаются в регенерированном растворе в расчете на
один кмоль МЭА (табл. 1.19):
«(RNH3),co3 0,0391 кмоль
G'(RNH3)2CO3 = = 421,5008 = °-000092 кмоль
' nRNH3HCO3 0,0032 кмоль
G RNH3HCO3 = = 421,5008 = °"0000082 кмоль
Суммарное количество неразложившихся углекислых химических соеди-
нений в регенерированном абсорбенте:
кмоль
G со3 = G'(rnh3)2co3+ G'RNh3hco3 = 0,000092 + 0,000008 = 0,0001
В соответствии с заданием содержание углекислых компонентов в реге-
нерированном растворе не должно превышать 0,0009 кмоль на кмоль МЭА.
При этом остаточное количество диоксида углерода в регенерированном аб-
сорбенте (см. табл. 1.19) составит:
G'co2 = (0,0009 — 0,0001) Мсо, = 0,0008 25™’7 -44 = 14,8 кг/ч
Количество десорбированного диоксида углерода (см. табл. 1.19) равно:
G’co2 = 186,0— 14,8= 171,2 кг/ч
Количество серосодержащих химических соединений в регенерированном
растворе в расчете на один кмоль МЭА (см. табл. 1.19):
«(RNH3;2s 0,7843 кмоль
G (rnh3)2s = nRNH2 = 421,5008 = °’001861 кмоль
«Rnh3hs 0,1924 кмоль_
G RNH3HS = „RNHa = 421 5008 = 0,000456 кмоль
41
Суммарное количество неразложившихся серосодержащих химических
соединений в регенерированном абсорбенте:
кмоль
G's = G'(RNH3)2s + G'rnh3HCO3 = 0,001861 + 0,000456 = 0,002317^^
Количество серосодержащих компонентов в регенерированном растворе не
должно превышать 0,0014 кмоль на кмоль МЭА. При этом остаточное коли-
чество сероводорода в регенерированном абсорбенте (см. табл. 1.19) соста-
вит:
GM,, 25753,7
G'H s= (0,0025 —0,002317) ту— AfH,s = °-000183 - /, .— 34 = 2,6 кг/ч
2" -™мэа 2 01,1
Количество десорбированного сероводорода равно:
G«H2S= 1524,5 — 2,6 = 1521,9 кг/ч
Количество кислых газовых компонентов, десорбированных из раствора
МЭА и выводимых из верхней части аппарата, равно:
екг = Спсо2 + <J3co2 + <JnH2s + Одн2з =
= 1079,2 + 171,2 4- 2342,2 + 1521,9 = 5114,5 кг/ч
Количество испарившейся воды Одн2о при концентрировании раствора
моноэтаноламина найдем по формуле
0,15 — 0,149525
G5h2o — q, 15
= 172 237
0,15 — 0,149525
0,15
= 1006 кг/ч
где в числителе представлена разность содержания МЭА в регенерированном
растворе и содержания МЭА в жидкости, масс, доли (см. табл. 1.19).
Количество воды в регенерированном растворе составляет (см. табл. 1.19):
0н2о = 144620,7— 1006 = 143614,7 кг/ч
Количество десорбированной парогазовой смеси равно:
G’n.r.C = 2 °П1 + °дсо2 + <J’h2S + СДН2О =
= 5565 + 171,2+ 1521,9+ 1006 = 8264,1 кг/ч
Количество парогазовой смеси, выводимой из аппарата, рассчитывается
по формуле [1, с. 50];
^П.Г.С = G3n г СФ
где Ф — флегмовое число.
В промышленных условиях числовое значение флегмового числа находит-
ся в пределах от 0,4 до 8 [1, с. 177]. .
Приняв Ф=2, получим:
Gn г с =8264, Г-2 = 16528,2 кг/ч
Количество орошения равно:
Go = Gn г с G п.г.с
где G'n. г. с — количество десорбированной парогазовой смеси без паров мо-
ноэтаноламина, кг/ч.
Моноэтаноламин в количестве 33,8 кг/ч (см. табл. 1.18) будет возвращен
в десорбер вместе с орошением, поэтому
G'n г с = Gan r c — 33,8 = 8264,1 — 33,8 = 8230,3 кг/ч
42
Таблица 1.20. Расчет состава регенерированного раствора МЭА
Компонент Моль- ная масса, Mi Количество Содержание Ai.cJ
gp кг/ч „ _ *i I • кмоль/ч c. = 1 Sgf масс, доли nt ci ~ T.ni 1 МОЛЬВ, доли
rnh2 61,1 25787,5 422,0540 0,152075 0,050231 3,07
Н2О 18,0 143614,7 7978,5944 0,846928 0,949578 17,09
со2 44,0 14,8 0,3364 0,000087 0,000040 0,00
(RNH3)2CO3 184,2 7,2 0,0991 0,000042 0,000005 0,00
RNH3HCO3 123,1 0,4 0,0032 0,000002 0,000000 0,00
H2S 34,0 2,6 0,0765 0,000015 0,000009 0,00
(RNH3)2S 156,2 122,5 0,7843 0,000722 0,000044 0,01
RNH3HS 95,1 18,3 0,1924 0,000108 0,000023 0,00
CH4 16,0 1,6 0,1000 0,000009 0,000012 0,00
C2H6 30,0 2,1 0,0700 0,000012 0,000008 0,00
2 — 169571,7 8402,2503® «8402,3 1,000000 1,000000 20,17» »20,2
Тогда
Go = 16528,2— 8230,3 = 8297,9 кг/ч
Количество раствора, выводимого из аппарата равно:
G* = 172 237 + 33,8 = 172270,8 кг/ч
Количество десорбированной в испарителе смеси, вводимой в десорбер
составляет:
Gn' = 0дсо2 + G*h2s + <3’н2О = 171,2 + 1521,9+ 1006 = 2699,1 кг/ч
Количество регенерированного раствора равно:
Ар = Ож — Ghco2 — <34h2s — Одн2о =
= 172270,8— 171,2— 151,9 — 1006 = 169571,7 кг/ч
Расчет состава регенерированного абсорбента дан в табл. 1.20
Материальный баланс регенерации раствора МЭА представлен в табл. 1.21.
6. Тепловой баланс десорбера. Количество тепла <2Д, которое подводится
в десорбер для отгона сероводорода и двуокиси углерода из насыщенного
раствора МЭА, определяется из уравнения теплового баланса десорбера
(рис. 1.8):
Qgc + Qg0 + + <2д = Q<?n.r.c + + Qn
Таблица 1.21. Материальный баланс регенерации раствора МЭА
Поток, поступающий в десорбер (см. рис. 1.6) Количество, кг/ч Поток, выводимый из десорбера, (см. рис. 1.6) Количество, кг/ч
Насыщенный раствор Gc 177802,0 Парогазовая смесь Оп.г.с 16528,2
Орошение Go Десорбированная смесь 8297,9 2699,1 Раствор из десорбера в испаритель Gx 172270,8
из испарителя G'n S 188799,0 S 188799,0
43
Энтальпия водяного
Рис. 1.8. Схема для расчета теплового баланса
колонны.
Левая часть уравнения соответствует приходу
тепла (в кВт): Qac — с насыщенным раствором
МЭА; Qao — с жидким орошением; Qa-K—с де-
сорбированной смесью из испарителя; Qa — на
десорбцию кислых компонентов и образование
парового орошения.
Правая часть уравнения отвечает расходу
тепла (в кВт): Qcn г с—в парогазовой смеси;
—с раствором, направляемым в десорбер;
Qn — тепловые потери, составляющие 1 % обще-
го расхода тепла.
Тепло потока фд сообщается суммарным ма-
териальным потоком &.G = G1K + Gn.
Энтальпия насыщенного раствора МЭА при
температуре 1=90 °C равна
ht = Cpt = 4,14-90 = 372,6 кДж/кг
где ср=4,14 кДж/(кг-°С)—теплоемкость раство-
ра (см. рис. 1.3).
орошения при температуре /о=30°С равна:
hto = cBto = 4,187-30 = 125,6 кДж/кг
где св= 4,187 кДж/(кг-°С) —теплоемкость воды.
Энтальпию парогазовой смеси без ущерба для точности расчетов можно
принять равной энтальпии водяного пара. При необходимости производят
расчет энтальпии парогазовой смеси (см. с. 11).
Энтальпия водяного пара при температуре верха колонны /в=111°С рав-
на Я<в = 2700 кДж/кг [16, с. 102].
Ввиду низкого давления в аппарате энтальпию сероводорода и диоксида
углерода следует рассчитать по формуле [5]:
Т f т X. / Т \з / 100 \
Н = А Что- + в ("Too") + с уЧоо") + D ( т )
где А, В, С, D — коэффициенты, числовые значения которых для H2S и СО2
берутся из работы [6, с. 529].
Расчет состава и энтальпии десорбированной в испарителе парогазовой
смеси дан в табл. 1.22.
Таблица 1.22. Состав и энтальпия парогазовой смеси из испарителя
Компонент <• Количество кг/ч Содержание - &г ’ масс, доли Энтальпия / = 121 °C
Н-, кДж/кг кДж/кг
H2S 1521,9 0,5639 391,3 220,7
со2 171,2 0,0634 310,1 19,7
Н2О 1006,0 0,3727 2750,0 1025,0
S 2699,1 1,0000 — 1265,4
44
Таблица 1.23. Тепловой баланс десорбера
Обозначение пото- ка (см. рис. 1.6) Количество, кг/ч Темпера- тура, °C Энтальпия, кДж/кг Обозначение теплового потока Количество тепла, кВт
Приход
Gc 177802,0 90 372,6 Ч 18403
Go 8297,9 30 125,6 Qg0 290
G'x 2699,1 121 1265,4 Зс'ж 249
AG = G/JK—G'n — — — <?д 11120
S 188799,0 — — 30792
Расход
Gn.r.c 16528,2 Ill 2700 ^П.Г.С 12396
Gx 172270,8 90 378 18088
Потери тепла — — — Qn 308
2 188799,0 — — — 30792
Ввиду незначительного содержания кислых компонентов энтальпия рас-
твора МЭА, направляемого из десорбера в испаритель, равна
htc — Cptz = 4,2-90 = 378 кДж/кг
где ср = 4,2 кДж/(кг-°С)—теплоемкость раствора (см. рис. 1.3); /о=90°С—
принятая температура, при которой раствор выводится из десорбера.
Расчет теплового баланса представлен в табл. 1.23, при этом количество
теплопотерь составляет величину
0,01 0,01
Qn = “оЖ (%т.с + %<) = W(12 396 + 18 088) = 308 кВт
Количество водяного пара в нижней части десорбера рассчитывается по
уравнению
ЗбООРд — rH;,sG’H2s — гсо2Оцсо2 —'HjoG’h,©
п2^
3600-11 120- 1905-1521,9— 1918-171,2 — 2227-1006
=------------------------2227-----------------------= 15 520 кг/4
где /-h2s=1905 [7, с. 35]; гсо2=1918 [7, с. 35]; гн.2о=2227 [16, с. 94] — удель-
ные теплоты десорбции сероводорода, диоксида углерода и испарения воды,
кДж/кг.
7. Число теоретических и рабочих тарелок. Извлечение СО2 и H2S из вод-
ных растворов моноэтаноламина является одним из трудных процессов де-
сорбции, вследствие относительной стойкости соединений, образуемых моно-
этаноламином [7, с. 46]. Расчет разложения химических соединений при
температуре £Н=121°С и сравнение составов абсорбента до разложения и
после него (см. табл. 1.18 и 1.19) подтверждают это обстоятельство. Основ-
ная масса кислых компонентов выделяется из раствора при однократном
испарении (см. табл. 1.15 и 1.18). По этой причине необходимое число тео-
ретических тарелок предпочитают устанавливать, исходя из опытных данных;
оно составляет 2—4 тарелки.
Число рабочих тарелок равно:
Мр = Мт/П
где Ат — число теоретических тарелок; г] — к. п. д. тарелки.
45
С учетом повышенных требований к чистоте абсорбента принимаем
NT = 4.
Материальный баланс десорбции (табл. 1.21) показывает, что аппарат
имеет высокую нагрузку по жидкости, наряду с высокой нагрузкой по паро-
газовой смеси. Поэтому принимаем решение установить в аппарате тарелки
из S-образных элементов с прямоточными клапанами [6, с. 262].
В десорберах известные конструкции тарелок имеют низкие к. п. д. (в пре-
делах от 0,1 до 0,2). Принимая j]=0,15, получим
NP = 0,15 = 27
Для извлечения испарившегося амина в верхней части аппарата (выше
ввода насыщенного раствора) устанавливают от 2 до 6 рабочих тарелок.
Для установления в верхней части аппарата следует принять Л'в=6 рабочих
тарелок.
8. Диаметр десорбера. Диаметр аппарата рассчитывается по формуле, м:
где V — объемный расход парогазовой смеси в наиболее нагруженном сече-
нии аппарата, м3/с; w —- максимальная допустимая скорость смеси, м/с.
Наиболее нагруженным является сечение аппарата под нижней тарелкой;
объемный расход парогазовой смеси в этом сечении равен
у_____^н-
k - 3600рп
где Спи — количество парогазовой смеси под нижней тарелкой десорбера,
кг/ч; рп — плотность парогазовой смеси, кг/м3.
Величина Gn.H равна:
Gu.h = G'h2o + G'n = 15 520 + 2699,1 = 18219,1 кг/ч
Плотность парогазовой смеси при давлении в аппарате близком к атмо-
сферному рассчитывается по формуле:
Л4смл273
Рп = 22,4 (/н+ 273) 98 067
в которой Л1см — средняя мольная масса парогазовой смеси, равная
м________________________Gntt__________________
см ~ с'н2о бдсо2 <Здн2? Сдн2о —
Мн2о NfCo2 Мщд + Л4н2о
18219,1
= 15 520 , 171,2 , 1521,9 , 1006 - 17,8
18 + 44 + 34 + 18
Подставив в формулу для расчета плотности числовые значения величин,
получим
17,8-0,12-273 п л
Рп = 22,4(121 + 273)0,1 — 0,674 кг/,м
Объемный расход парогазовой смеси составит:
18219,1 г ,
V = 3600-0,674 — 7>5м/с
46
цу длины слива.
Значение коэффициента С определяется по формуле:
С = 8,47-10-» - С2 (А, - 35)]
в которой коэффициенты, стоящие в правой части, зависят от типа тарелки.
Для тарелок из S-образных элементов Ki = l. Для десорберов рекоменду-
ется числовое значение коэффициента Ki = 1,13.
Величина коэффициента Ci определяется в зависимости от расстояния
между тарелками, которое принимается равным Лт = 0,6 м. Тогда числовое
значение коэффициента Ci найдем из графика, приведенного на рис. 1.9,
С[ = 465.
Для тарелок из S-образных элементов с прямоточными клапанами С2=4.
Коэффициент А принимают в зависимости от £ — расхода жидкости на
единицу длины сливной планки тарелки:
L, мЗ/(м -ч) 1
<10 10
>65 65
Расход жидкости на единицу длины сливной планки вычислим так:
Рж^-сл
где — расход жидкости, кг/ч; £сл—длина сливной планки, равная (0,75ч-
4-0,8) Dnr.
Плотность жидкости в нижней части аппарата принимается равной плот-
ности регенерированного раствора МЭА рж=980 кг/м3.
Примем £Сл=0,8 £>Пр=0,8-2,8=2,24 м, где £>Пр=2,8 м — предварительно
принимаемый диаметр регенератора раствора МЭА.
Числовое значение расхода жидкости £ равно:
172270,8
— 980-2 24~ = м3/(м’ч)
При £^65 м’/(м-ч) величина А=65.
Числовое значение коэффициента С равно:
С = 8,47-10~5 [1 • 1,13 -465 — 4 (65 — 35)] = 343-10'8
47
Подставив числовые значения величин в формулу для расчета скорости
ш, получим:
1 / 980 —0,674
а; = 3434-10~5 у ---0~~674---= 1 >3 м/с
Диаметр аппарата:
-1/ 4-7,5 „ „
В = У 3,14-1,3 -2’8м
В соответствии с принятым в нефтеперерабатывающей промышленности
нормальным рядом диаметров колонн принимаем Ов = 2,8 м.
Тогда скорость парогазовой смеси в свободном сечении аппарата будет
равна
w = V/FCB
где FCB — площадь свободного сечения аппарата в межтарелочном отделе-
нии, которая на 10—15% меньше поперечного сечения аппарата.
Тогда
4V 4-7,5
w= 0,9лОв2 = 0,9-3,14-2,82 - 1’35 м/с
Далее следует проверить полученный диаметр колонны по жидкостной на-
грузке сливного устройства. При этом для предотвращения захлебывания
тарелки необходимо, чтобы высота уровня вспененной жидкости в сливном
устройстве не превышала примерно половины расстояния между тарелками.
Расчет высоты уровня вспененной жидкости в сливном устройстве подроб-
но изложен в [17, с. 48; 18, с. 212].
9. Высота десорбера. Рабочая высота аппарата ffp (м) равна (рис. 1.10):
а2 + Л3 4- 4- ^5
где Л1 — высота нижней части десорбера; Л2 — высота нижней части десорбе-
ра, занятой тарелками; /г3 — высота секции питания десорбера; — высота
Рис. 1.10. Схема для расчета рабочей высоты десорбера.
Рис. 1.11. Схема нижней части десорбера.
48
верхней части десорбера, занятой тарелками; + — высота аппарата над его
верхней тарелкой.
Высота нижней части десорбера hi (м) равна (рис. 1.11):
hi = Л6 + /г,
при этом he, — высота уровня жидкости внизу десорбера; /17 = 1,2 + 2,0 м —
высота над уровнем жидкости внизу десорбера.
Высоту hi нижней части десорбера можно рассчитать, исходя из пятими-
нутного запаса жидкости при h7 = 1,6 м:
бж5-4 172270,8-5-4
= 60ржл£>62 = 60-980-3,14-2,82 + *’6 = 4м.
Высота h2 равна:
h2 = (Л/р — 1)йг = (27 - 1)0,6 = 15,6 м
Высоту секции питания десорбера примем разной Лз = 1,2 м.
Высота ht равна:
й4 = (Л/в — 1) hT = (6 — 1) 0,6 = 3 м
На основе практических данных высоту над верхней тарелкой примем
равной /i5 = l,0 м.
Тогда рабочая высота колонны будет равна:
Нр = 4+ 15,6 4- 1,2 + 3-р 1 = 24,8 м
Диаметры основных штуцеров колонны рассчитываются по обычным фор-
мулам гидравлики с последующим принятием их согласно существующим
нормалям.
ТЕПЛООБМЕННИК ДЛЯ НАГРЕВАНИЯ НАСЫЩЕННОГО
ВОДНОГО РАСТВОРА МОНОЭТАНОЛАМИНА
Исходные данные
Рассчитать поверхность теплообмена и определить число кожухотрубча-
тых теплообменных аппаратов с плавающей головкой (по ГОСТ 14246—79)
для нагревания насыщенного кислыми компонентами водного раствора мо-
ноэтаноламина (МЭА) регенерированным раствором МЭА при следующих
исходных данных: количество горячего теплоносителя (регенерированный
раствор МЭА) Gt= 170000 кг/ч; количество нагреваемого теплоносителя (на-
сыщенный раствор МЭА) б2= 178000 кг/ч; начальная температура горячего
теплоносителя // = 121 °C; насыщенный раствор нагревается от температуры
/2' = 52°С до температуры /2,/ = 90°С; состав насыщенного и регенерированно-
го раствора дан в табл. 1.15 и 1.20.
Расчетная схема теплообменника пока-
зана на рис. 1.12.
Насыщенный кислыми компонентами H2S
и СО2 раствор МЭА направляется в труб-
ное пространство, а регенерированный рас-
твор МЭА — в межтрубное пространство
теплообменного аппарата (см. рис. 1.6).
Рис. 1.12. Расчетная схема теплообменника.
4—640
49
Расчет
1. Конечная температура горячего теплоносителя. Конечную температуру
горячего теплоносителя — регенерированного раствора МЭА — рассчитаем по
формуле:
где htl"—энтальпия жидкого горячего теплоносителя при • температуре //',
кДж/кг; ct — теплоемкость горячего теплоносителя при температуре
i”, кДж/(кг-°C).
Энтальпия горячего теплоносителя рассчитывается так:
3600Q,
"Ч" - — g1T)
где энтальпия жидкого горячего теплоносителя при температуре
1/, кДж/кг; Qi—количество тепла, воспринимаемого насыщенным раство-
ром МЭА, кВт; 1] — коэффициент использования тепла, равный 0,97—0,99
(для данного расчета принято значение 0,98).
Энтальпия жидкого горячего теплоносителя при температуре //=121 °C
равна:
= с^Л/
где Ct ' — теплоемкость горячего теплоносителя при температуре //=121 °C.
Ввиду незначительного содержания кислых компонентов теплоемкость рас-
твора МЭА при температуре //=121СС (см. рис. 1.3) равна ctl' =
= 4,24 кДж/(кг-°С).
Тогда
, = 4,24-121 = 513 кДж/кг
Количество тепла, воспринимаемого насыщенным раствором:
G2 178 000
~ 3600 ^h') = 3600 ^72 ~ 208) = ЗЮ® к®т
где й«2"и ht2' —соответственно энтальпия насыщенного раствора МЭА при
температурах /2"=90°С и /2'=52°С, кДж/кг.
Подставив числовые значения величин в формулу для расчета энтальпии
ht ", получим:
3600-8109
АД" = 513— 170 000-0,98 = 338 кДж/кг
Предварительно примем температуру /"i = 82°C и по графику, приведен-
ному на рис. 1.3, найдем с82 = 4,1 кДж/(кг-°С).
Числовое значение конечной температуры //' равно:
338
= 82,4°С я 82°C
1 4,1
Разницей (0,4 °C) с предварительно принятой температурой /// = 82°С
пренебрегаем.
2. Выбор типоразмера теплообменного аппарата. Типоразмер кожухотруб-
чатого теплообменного аппарата с плавающей головкой следует выбирать
по скорости движения теплоносителей в трубном и межтрубном простран-
стве.
Средняя скорость движения (в м/с) насыщенного раствора в трубном
пространстве и регенерированного раствора в межтрубном пространстве рас-
50
Рис. 1.13. Зависимость плотности растворов моноэтаноламина от темпера-
туры:
1 — вода; 2 — 15%-ный водный раствор МЭА; 3 — 30%-ный водный раствор МЭА; 4 —
50%-ный водный раствор МЭА; 5 — насыщенный 30%-ный раствор МЭА, мольное отноше-
ние СОа: МЭА—0,1; 6 — то же, 0,15.
считывается по формулам:
__________________________________G1
- 3600Pf2cpfTp - 3600Р/1ср/МТр
где pt icp и pi2cp— соответственно плотность регенерированного и насыщен-
ного раствора МЭА при средней температуре Лер и Лер кг/м3; /тр и /итр—
соответственно площадь сечения трубного и межтрубного пространства для
прохождения теплоносителей, м2.
Средняя температура равна:
t' + Л' 52 + 90
/ _ А 1 _ L __ *7 1 оЛ*
Лер — 2 ~ 2 ~ '
f — 11 +
icp — 2
121 + 82
101,5°С а 102°C
2
Плотности регенерированного и насыщенного водного раствора моноэта-
ноламина при средней температуре определяются из графика (рис. 1.13):
pilcp=960 кг/м3; р(2ср =980 кг/м3.
Числовые значения величин /тр для теплообменников с длиной труб /гр=
= 6 м, диаметром d„=25 мм и размещением труб по вершинам треугольни-
ков даны в табл. 1.24; в этой же таблице даны числовые значения /мтр в
вырезе перегородки.
Предварительные расчеты скоростей теплоносителей показывают, чго в
трубном пространстве будут высокие значения скоростей (3,2—12,3 м/с) при
движении холодного теплоносителя через один ряд теплообменников. По-
этому принимается схема движения теплоносителей (см. рис. 1.16), при ко-
торой количество насыщенного раствора МЭА разделяется пополам и на-
правляется в 2 параллельных ряда теплообменников.
Результаты расчетов числовых значений скоростей движения теплоноси-
телей в трубном и межтрубном пространствах теплообменных аппаратов
стандартных типоразмеров представлены в табл. 1.24.
4
51
Таблица 1.24. Характеристика теплообменников с плавающей головкой*
Внутренний диа- метр корпуса теплообменник а £>в, мм Поверхность теплообменника F1, м2 Число ходов теплоносителя в трубном простран- стве Плотаць се- чения, 103 м2 Средняя скорость движения, м/с
^•лтр ^тр tl’2
600 105 2 4,0 37 6,1 1 ,4
800 196 2 6,8 69 3,6 0,7
800 178 4 6,8 24 3,6 2,1
1000 325 2 11,2 1 19 2,2 0,4
1000 301 4 11,2 51 2,2 1 ,о
1200 409 2 11.3 179 2,2 0,3
1200 460 4 11 ,3 86 2,2 0,6
1400 375 2 15,3 247 1,6 0,2
1400 642 4 15,3 110 1,6 0,5
* ГОСТ 14246—69. Теплообменники кожухотрубчатые с плавающей головкой. М., Гос-
стандартгнз, 1970.
Оптимальные числовые значения скоростей движения теплоносителей в
кожухотрубчатых теплообменных аппаратах находятся в пределах 0,3—
2,5 м/с [6, с. 442].
Подходящим типоразмером теплообменника для рассматриваемого слу-
чая является аппарат, внутренний диаметр корпуса которого DB равен
1000 м, а число ходов теплоносителя в трубном пространстве равно четы-
рем.
3. Физические параметры теплоносителей. Физические параметры регене-
рированного и насыщенного кислыми компонентами водного раствора моно-
этаноламина при их средних температурах (рис. 1.14, рис. 1.15) даны
в табл. 1.25.
4. Коэффициент теплоотдачи. Для расчета коэффициента теплоотдачи от
регенерированного водного раствора моноэтаноламина к наружной поверх-
ности трубного пучка необходимо определить режим движения теплоносите-
ля по числовому значению критерия Рейнольдса:
ш,спйл 2,2-0,025
Relcp=-g^ = 0:з4.ЙГ-в--^1800
где йл = (/„=0,025 м — линейный определяющий размер, в качестве которого
при расчете межтрубного пространства кожухотрубчатых теплообменных
аппаратов принимается наружный диаметр трубы.
Таблица 1.25. Физические параметры раствора МЭА
Наименование теплоносителя Средняя температура / °C ср’ Плотность (см. рис. 1.13) рср. КГ/мЗ Коэффициент теплопровод- ности (см. рис. 1.14) Лср, Вт/(м-°С) Теплоемкость (см. рис. 1.3) сср’ кДж/(кг-°С) Кинематичес- кая вязкость (см. рис. 1.15), vcp'10S’ м2/с
Регенериро- ванный рас- твор 102 960 0,59 4,18 0,34
Насыщенный раствор 71 980 0,56 4,04 0,55
52
Рис. 1.14. Зависимость коэффициента теплопроводности раствора МЭА от
температуры.
Рис. 1.15. Зависимость вязкости растворов моноэтаноламина от температуры:
/ — вода; 2 —20%-ный раствор МЭА; 3 — 30%-ный раствор МЭА; 4 — 50%-ный раствор
МЭА.
При числовом значении Reicp = 117650> 104 режим движения теплоноси-
теля является турбулентным и коэффициент теплоотдачи а, можно рассчи-
тать по формуле М. А. Михеева [19, с. 89]:
1 / Рг \0 25
“1 = 0,021 Jr RW-^cp0’" (р^)
где Рг1ср — критерий Прандтля, равный
D vlcpClcpPlcp 0,34.10-8-4,18-1СЗ.960
Г1ср" Х1ср 0,59 ’
Предварительный расчет показывает, что отношение
(РЧср/РГют)».25 * 1
Тогда
0 59
“1 = 0,021 '0 025 '161 8°00’3-2,3о,« = Ю200 Вт/(м2-°С)
Для расчета коэффициента теплоотдачи от внутренней поверхности труб-
ного пучка к насыщенному кислыми компонентами водному раствору моно-
этаноламина рассчитаем критерий Рейнольдса
Ш2Ср//л
*хеаср — v
V2Cp
1,0-0,021
0,55- IO-6
= 38 200
где d.4 = dB = 0,021 м — линейный определяющий размер, в качестве которого
при расчете трубного пространства кожухотрубчатых теплообменников при-
нимается внутренний диаметр трубы.
Режим движения теплоносителя в трубном пространстве является турбу-
лентным, поэтому коэффициент теплоотдачи 0.2 следует рассчитать по той
же формуле, что и коэффициент ар
1
а2 = 0,021-—4^- Re2Cpo,«Pr2Cp°.« (Рг2ср/Рг2СТ)о,2»
ал
53
где Ргзср — критерий Прандтля, равный
n V2cPC2cpP2gp 0,55-10~в-4,04-103-980
Рг^Р~ Х2Ср “ 0,56
Приняв по-прежнему (Рг2ср/Рг2ст)с'25 ~ 1, найдем
0,56
а2 = 0,021 0 021~'38 200°.8-3,9°143 = 4670 Вт/(м2-°С)
5. Коэффициент теплопередачи. Коэффициент теплопередачи рассчитаем
по формуле:
1
К = 1 61 6СТ 62 _1_
+ /.J Аст + Х2 а2
где д|/7ч, 62Д2 — соответственно тепловое сопротивление загрязнений со сто-
роны регенерированного и насыщенного водного раствора моноэтаноламина,
(ма-°С)/Вт; бст/Хст — тепловое сопротивление стенки стальной трубы
(м2-°С)/Вт.
Тепловое сопротивление загрязнений со стороны регенерированного и на-
сыщенного водного раствора моноэтаноламина принимается так же, как и
для оборотной подготовленной воды [13, с. 269]:
6, 6,
-=- = 1^- = 0,0005 (м2°С)/Вт
Aj Ag
Тепловое сопротивление стенки стальной трубы равно:
6СТ 0,002
= 16 = 0,000125 Вт/(м2-°С)
при этом Кст=16 Вт/(м-°С)—коэффициент теплопроводности для легиро-
ванных стальных труб.
Тогда
+ =------j-------------------------------------j— = 700 Вт/(м2-°С)
Д02ДО- + 0,0005 + 0,000125 + 0,0005 + ^579-
6. Средний температурный напор. Расчет средней разности температур
по формуле:
теплоносителей (среднего температурного напора) выполним
л / Аймаке — А/Мин
где А/макс, А/мин — большая и меньшая разность температур,
по формулам:
Аймаке = G' - V = 121 - 90 = 31 °C
Д/„„„ = = 82 —52 = 30 °C
определяемая
Тогда
. 31 — 30
Д/ср =---------др = 30,5 °C
2,31g -39-
При расчете среднего температурного напора необходимо учитывать схе-
му движения теплоносителей, однако методика такого расчета громоздка
[18, с. 561]. В нашем случае различие между большей и меньшей разностя-
ми температур незначительно, поэтому средний температурный напор рас-
54
Рис. 1.16. Схема соединения теплооб-
менников.
считан как среднелогарифмическое
значение большей и меньшей темпе-
ратурных разностей.
7. Поверхность теплообмена. По-
верхность теплообмена рассчитывает- нагыщенцый.
ся по уравнению: раствор МЭЯ
Q 8109-10» ~
F~ NKAicp = 2-700-30,5 = 200 м2 2
где Q — тепловая нагрузка теплооб-
менников, Вт.
Необходимое число теплообмен-
ных аппаратов в одном ряду:
F 200
ZP- Fj ~ 301 =0’7
С запасом принимается Zp=l.
Общее число теплообменников равно:
регенерирова нный
раствор МЭЯ
- Яг/2
Насыщенный
оаствоо МЭЯ
! 1
Регенерированный
раствор МЗЯ
вг/2
Z = У2р = 2-1 = 2
Схема соединения теплообменников показана на рис. 1.16.
ГЛАВА 2
ПРОЦЕССЫ И АППАРАТЫ ОСУШКИ ГАЗОВ
Общие сведения
Нефтяные и природные газы, добываемые из недр, а также углеводород-
ные газы, содержащие кислые (нежелательные) компоненты и подвергае-
мые очистке водными растворами активных веществ, насыщены водяным
паром. Их влагосодержание зависит от давления, температуры и химиче-
ского состава газа.
Влагосодержание, соответствующее полному насыщению газа водяным
паром, называется равновесным.
Влажность газа может быть абсолютной и относительной. Абсолютная
влажность газа есть масса водяного пара, находящегося в единице объема
или в единице массы газа (она выражается в г/м3 или г/кг газа). Относи-
тельная влажность газа есть отношение массы водяного пара, содержащего-
ся в газовой смеси, к минимальной массе водяного пара, которая могла бы
находиться в данном объеме газа при условиях насыщения (выражается в
процентах или долях единицы).
Температура, при которой водяной пар, содержащийся в газе, конден-
сируется, называется точкой росы газа при данном давлении.
55
Содержание водяного пара в газах регламентируется, так как при кон-
денсации он создает в технологических системах условия для образования
гидратов, закупоривающих трубопроводы и трансферные линии аппаратов.
При содержании в газах водяного пара и сернистых соединений создаются
условия, благоприятствующие коррозии металлов.
Газ осушают для того, чтобы температура его точки росы по воде стала
ниже минимальной температуры в системах транспортирования или пере-
работки газа.
В промышленности получили применение следующие методы осушки газа:
абсорбция влаги гигроскопическими жидкостями, адсорбция влаги активи-
рованными твердыми осушителями, конденсация влаги за счет сжатия или
охлаждения газа.
В технологии газопереработки абсорбционная осушка газа концентриро-
ванными водными растворами ди- или триэтиленгликоля является основ-
ным методом. При этом остаточная влажность (точка росы) газа на выходе
из гликолевой колонны (абсорбер) зависит от влагосодержания гликоля,
поступающего в аппарат.
Осушка газа гликолями основана на разности парциальных давлений во-
дяных паров в газе и абсорбенте. Количество влаги, которое можно извлечь
из газа с помощью абсорбента, определяется гигроскопическим свойством
осушителя, температурой и давлением, эффективностью контакта газа и
абсорбента, массой циркулирующего в системе осушителя и его вязкостью.
В задачу осушки не входит удаление из газов всех водяных паров; до-
статочно оставить в газе такое количество влаги, при котором его последу-
ющая переработка, транспортирование и использование при соответствую-
щих давлениях и температурах будут застрахованы от конденсации паров
или образования гидратов.
Теплофизическпе свойства диэтиленгликоля (ДЭГ) и триэтиленгликоля
(ТЭГ) как осушителей приведены ниже:
Свойство
Мольная масса
Плотность при 20 °C, кг/м3
Температура, °C
кипения при давлении 101,3 кПа
замерзания
разложения
регенерации
снижения точки росы
Давление насыщенного пара при 20 °C, Па
Вязкость при 20 °C, МПа с
Теплота парообразования, кДж/кг
при 1,3 кПа
при 101,3 кПа
ДЭГ
106,12
1116,1
245
—8
164,4
148,9—162,8
44—55
<1,3
35,7
648,9
ТЭГ
150,18
1124,3
287,4
—7,2
206,7
176,7—196,1
58—58,6
<1,3
47,8
416,8
Степень осушки, достигаемая при применении растворов гликоля, опре-
деляется полнотой удаления воды из раствора в регенераторе. Для сни-
жения до минимума содержания воды в концентрированном растворе гли-
коля без применения чрезмерно высоких температур регенерацию проводят
под вакуумом. Другим методом регенерации осушающего раствора является
его нагрев с отдувкой паров инертным газом.
Процесс осушки газа абсорбционным способом рассчитывают либо гра-
фоаналитическим методом с использованием графиков для определения рав-
новесного влагосодержания углеводородных газов, либо — на основе уравне-
ния Кремсера для расчета коэффициента извлечения воды.
Десорбер можно рассчитать также по уравнению Кремсера или как рек-
тификационную отгонную колонну.
Ниже приведены методика и рекомендации по расчету абсорбера и де-
сорбера для осушки углеводородного газа раствором диэтиленгликоля.
56
АБСОРБЕР ДЛЯ ОСУШКИ УГЛЕВОДОРОДНОЙ ГАЗОВОЙ СМЕСИ
РАСТВОРОМ ДИЭТИЛЕНГЛИКОЛЯ
Исходные данные
Рассчитать абсорбер для осушки углеводородной газовой смеси диэтилен-
гликолем при следующих исходных данных: количество газовой смеси при
нормальных условиях (состав см. табл. 1.5): 14=316802 м3/ч, давление в
аппарате л=1,47 МПа, точка росы осушенной газовой смеси 4 =—10 °C. Со-
держание диэтиленгликоля в свежем растворе Xi = 0,98 масс, долей.
Принципиальная технологическая схема установки осушки газа диэтилен-
гликолем приведена на рис. 2.1.
Влажный газ / поступает в абсорбер 1, где при повышенном давлении
производится осушка газа. В качестве абсорбента в верхнюю часть аппарата
подается диэтиленгликоль (ДЭГ). Отводимый снизу абсорбера отработанный
раствор III (насыщенный абсорбент) подогревается в теплообменнике 2 и
вводится в десорбер 3, работающий при давлении, близком к атмосферному.
Тепло, необходимое для испарения влаги, подводится в десорбер с помощью
испарителя 7.
Осушенный газ II из верхней части абсорбера направляется на техноло-
гические нужды. Выводимый сверху десорбера водяной пар попадает в кон-
денсатор и емкость орошения. Для уменьшения потерь гликоля часть водЬ:
V возвращается в десорбер в качестве орошения, а остальное ее количество
VI сбрасывается в канализацию. Несконденсированная смесь VII направля-
ется в топливную сеть.
Расчет
1. Влагосодержание газа. В случае насыщения газа водяным паром, вла-
госодержание определяется по графику (рис. 2.2), в зависимости от темпе-
ратуры и давления в системе [7, с. 249].
Температура контакта влажного газа (или температура, при которой сле-
дует подавать газовую смесь в аппарат) определяется в зависимости от со-
держания диэтиленгликоля х, = 0,98 масс, долей из графика, приведенного
на рис. 2.3 [14, с. 37]; она равна 4 = 27 °C.
Рис. 2.1. Принципиальная технологическая схема установки абсорбционной
осушки газа:
I — абсорбер; 2 — теплообменник; 3 — десорбер; 4 — конденсатор; 5 — емкость орошения;
6 — насосы; 7 — испаритель; I — сырой газ; ll — осушенный газ; HI — насыщенный рас-
твор ДЭГ; /V — регенерированный раствор ДЭГ; V — орошение; VI— сточная вода; VII—
несконденсированная смесь.
57
Рис. 2.2. Зависимость содержания водяного пара в смеси углеводородных
газов от температуры и давления.
Точка росы влажного газа до контакта с диэтиленгликолем:
/р' = /р + А/ = —10 + 16 = 6:С
где А1=16°С— понижение точки росы, определяемое в зависимости от тем-
пературы контакта (рис. 2.4) [20, с. 39].
Начальное влагосодержание углеводородного газа (см. рис. 2.2) при
температуре /с = 27 °C и давлении л=1,4/ МПа равно С„=250- 10-а' кг/м3,
конечное — при температуре 7Р=—10 °C и давлении л=1,47 МПа равно Ск =
= 23-10-5 кг/м3.
Температура диэтиленгликоля при вводе в аппарат принимается равной
/ГЛ = 27°С.
2. Количество раствора диэтиленгликоля. Количество свежего раствора
(кг/ч), подаваемого в поглотительную абсорбционную колонну, рассчитыва-
ется по формуле [21, с. 176]:
г -Г *2
• и г Л — ивл.п Y у
Л1 л2
где бал л — количество поглощаемой влаги, кг/ч; X) и х2— концентрация
ДЭГ в свежем и насыщенном растворе, масс. доли. Количество поглощае-
мой влаги рассчитывается по формуле:
Свл.п = (6-н Ск) V
где V — объемное количество углеводородного сырья, м3/ч.
.58
Таблица 2.1. Расчет псевдокритических параметров
газового сырья абсорбера (без влаги)
Компонент Содержание мольн. доли Критические парамет- ры Псевдокритические параметры
темпера- тура Т 'кр.р К давление якр.£’ МПа температура Т — и'-Т 'пс.кр *1 кр’ К давление япс.кр = у<якр’ МПа
сн4 0,7414 190,55 4,604 141,3 3,413
с2н6 0,0990 305,43 4,880 30,2 0,483
0,0758 369,82 4,249 28,0 0,322
с4н10 0,0838 425,16 3,796 35,6 0,318
H2S 0,0000126 373,60 9,007 0,0 0,0
со2 0,0000113 . 304,20 7,382 0,0 0,0
2 1,0000239» «1,0000 — — 235,1» 235 4,536»4,5
Объемное количество углеводородного сырья находят по формуле:
22,46 (?с + 273) 0,1 • 106г
V - Мг273л
где 6 = 325685 кг/ч — количество газа (см. табл. 1.5); z — коэффициент сжи-
маемости газовой смеси.
Для смеси газов коэффициент сжимаемости определяется в зависимости
от приведенных температуры и давления:
Т 300 л 1,47
Тпр = Тпс.кр = 235,1 = Ь28 Л"Р= лпс.кр = T5F=0-32
где Тпс.кр, К и Ппс.кр, МПа — псевдокритические параметры компонентов,
рассчитанные в табл. 2.1. Коэффициент сжимаемости при тпр=1,27 и лпр =
= 0,32 равен z=0,95 [22, с. 17].
Тогда
22,4-325685 (27+273) 0,1 • 106-0,951
V~ 23-273-1,47-106
= 22 530 м3/ч
6ВЛ.П = (250—23) 10-^-22530=51,1 кг/ч
Концентрация гликоля в насы-
щенном растворе принимается рав-
ной х2=0,97; правильность принято-
го числового значения подтверждает-
ся дальнейшим расчетом.
Рис. 2.3. Зависимость точки росы га-
за при осушке растворами ДЭГ от
температуры контакта.
Цифры на линиях соответствуют содержа-
нию ДЭГ в растворе, % (масс.); штрих-
пунктирной линией ограничена зона отло-
жения твердых гидратов.
Температура контакта
59
Понижение точна оось/ At,
Рис. 2.4. График, иллюстрирую-
щий степень осушки газа диэти-
ленгликолем.
Цифры на линиях соответствуют содер-
жанию ДЗГ, % (масс.).
Количество свежего раствора
равно:
°,97
G„ = 51,l c, g8_o;97
= 4947 кг/ч
Объемное количество свежего
раствора равно:
С-,„ 4957
'/гл= р = 1]50 =4,3 n?/4
где р — плотность раствора гликоля при температуре ,с=27°С (рис. 2.5).
Количество циркулирующего гликоля зависят, главным образом, от про-
изводительности установки осушки по газовому сырью, его влагосодержания
и степени осушки; в промышленных системах она составляет 1 —10 м3/ч
[20, с. 59].
3. Материальный баланс аппарата. Уравнение материального баланса аб-
сорбера (рис. 2.6) имеет вид:
Gy + GrJ1 — Go -f~ <?гл.н
Его левая часть отвечает вводимым в аппарат материальным потокам (кг/ч):
Gy — с увлажненным газовым сырьем; 6Гл — с раствором гликоля; правая—
выводимым из аппарата материальным потокам (в кг/ч): Ga— с осушенным
газовым сырьем; Gra.K— с насыщенным раствором гликоля.
Количество увлажненного газового сырья равно:
Gy = G + G„V = 325 685 + 250 • 10-з • 22 530 = 325 741 кг/ч
Количество осушенного газового сырья составит:
Gq ~ Gy — GBji п Gp y
Рис. 2.5. Зависимость плотности растворов диэтиленгликоля от температуры.
60
Рис. 2.6. Расчетная схема абсорбера для осушки
углеводородной газовой смеси.
где Gp. у — количество углеводородных компо-
нентов, растворимых в диэтиленгликоле, кг/ч.
Количество углеводородных компонентов, по-
глощаемых диэтиленгликолем в результате рас-
творения, равно:
Gp у = Ур.уРр.у^гл
где Vp. у — растворимость углеводородных газов
в диэтиленгликоле, м3/м3; рр. у — плотность рас-
творяемой газовой смеси, кг/м3.
Растворимость углеводородных газов в диэти-
ленгликоле при давлении л=1,47 МПа и приня-
той средней температуре в аппарате / = 33°С (оп-
ределяется по графику рис. 2.7) [20], откуда
Рр. у=2,5 м3/м3.
Плотность растворяемой газовой смеси, или
плотность сырья равна:
Мгл273
рР-У = 22,4 (/ + 273) 0,12 =
23-1,47-273 , ,
= 22,4(33 + 273)0,1-0,95 ~14-2кг/м
Тогда
Gp у = 2,5-14,2-4,3 = 153,7 кг/ч
Количество г-го углеводорода, растворяющегося в диэтиленгликоле, равно
Si = ^р.у+
где Xt — массовая доля 1-го углеводорода, растворившегося в диэтиленгли-
коле.
Массовая доля t-ro углеводорода, растворившегося в диэтиленгликоле,
находится из предположения об одновременном растворении углеводородов
пропорционально их коэффициентам диффузии в растворителе.
Коэффициенты диффузии углеводородов в диэтиленгликоле при средней
температуре абсорбции / = 33 °C рассчитываются по приближенной формуле
[23, с. 264]:
Of = P20 [! + &(/-20)]
где Dio — коэффициент диффузии углеводорода в диэтиленгликоле при тем-
пературе 20 °C, м2/с; Ь — коэффициент, учитывающий влияние температуры
на диффузию вещества.
Коэффициент Д2о рассчитывается по формуле [23, с. 278]:
____________1-ю-6________ / г~ ~г~
20 ~ АВ Ф+(1/л1/з + ^3)2 |/ МА + Мв
где А и В — коэффициенты, зависящие от свойств растворенного вещества
и растворителя (для газов А = 1; для гликоля В=2); р=25 МПа-с — динами-
ческий коэффициент вязкости [20, с. 31]; V a, VB — мольные объемы рас-
творенного вещества и диэтиленгликоля; МА и Мв — мольные массы газа
и гликоля.
61
Рис. 2.7. Зависимость растворимости углеводородных газов в диэтиленглико-
ле от давления при разных температурах.
Мольные объемы углеводородов и гликоля, определяемые как сумма
атомных объемов элементов, входящих в состав газа и гликоля, рассчитаны
по данным [23, с. 264], результаты приведены в табл. 2.2; там же даны
числовые значения коэффициентов диффузии газов при температуре /=33°С,
рассчитанные по приведенной формуле, и расчет массовых долей углеводо-
родов, растворенных в диэтиленгликоле.
Равновесные потери гликоля при его испарении и уносе из колонны с
выводимым осушенным газом определяются по диаграмме (рис. 2.8) в за-
висимости от температуры контакта /с=27°С и давления в аппарате л=
= 1,47 МПа; они равны z\g=5,8-10~3 кг/(м3-103).
Количество теряемого диэтиленгликоля равно
V 22 530
Вгл==&ё- 1000 = 5,8-IO-3 [00Q «0,1 кг/ч
Количество осушенного газа равно:
Pq Ру --- Рвл.п Рр.У 4" &ГЛ —
= 325 741 —51,1 — 153,7 + 0,1 =325536,3 кг/ч
Количество насыщенного раствора гликоля равно:
Ргл.н — Ргл + Рцл.п + Рр.у ~ йгл= 4957+ 51,1 + 153,7 — 0,1 = 5161,7 кг/ч
Материальный баланс процесса осушки углеводородного сырья представ-
лен в табл. 2.3
Таблица 2.2. Расчет состава углеводородов,
растворенных в диэтиленгликоле
Компонент • Мольная масса Мг Мольный объем vi Коэффициент диффузии М2/2 Dt Y v 1 ’ масс, доли
сн4 16 29,6 8,19 0,3848
с2н6 30 51,8 5,39 0,2532
с3н8 44 74,8 4,20 0,1973
58 96,2 3,50 0,1647
V ’ — — 21,3 1,0000
62
Таблица 2.3. Материальный баланс осушки углеводородного сырья
Поток, поступающий в аппарат (см. рис. 2.6) Количество, кг/ч Поток, выводимый из аппарата (см. рис. 2.6) Количество, кг/ч
Увлажненная парогазо- вая смесь Gy 325741 Осушенная газовая смесь Go 325536,3
Свежий раствор гликоля Огл 4957 Насыщенный раствор ГЛИКОЛЯ Огл н 5161,7
2 330698 S 330698,0
Содержание ДЭГ в насыщенном растворе составляет:
Х2Р —-«1 сглн — 0,98 5161 7 —0,94
Расчеты показывают, что увеличение х3 приведет к заметному росту ко-
Массовая доля Температура контакта, °C
Рис. 2.8. Номограмма для определения потерь диэтиленгликоля в газовой
фазе.
63
ки и регенерацию. Поэтому расхождение числовых значений х2 = 0,97 и
х2р = 0,94, равное 3%, следует считать допустимым и пересчетов не делать.
4. Тепловой баланс аппарата. В рассчитываемом абсорбере осушка газа
должна протекать при изотермических условиях, что практически незначи-
тельно повлияет на температуру диэтиленгликоля.
Уравнение теплового баланса абсорбера имеет вид:
<2су + Ссгл 4- Qk + Qp = Qa0 + Чсгли
Его левая часть отвечает приходу тепла (кВт): QGy—с газовым сырь-
ем; QcrJI—со свежим раствором ДЭГ; QK — от выделения тепла при кон-
денсации водяного пара и растворения конденсата в гликоле; Q? — от час-
тичного растворения углеводородов в гликоле; правая — расходу тепла
(кВт): Qgq—с осушенным газом; <3сгл н — с насыщенным раствором гликоля.
Количество тепла, вносимое в аппарат влажным газовым сырьем, равно:
*2бу = ^уСр^с
где ср — теплоемкость газового сырья, кДж/(кг-°C).
Теплоемкость газового сырья рассчитывается по формуле [5, с. 54]:
Ср = Ср() Дер
где ср° — изобарная теплоемкость газовой смеси в расчете на идеальный газ,
кДж/(кг-°С); Дср — поправка на давление, кДж/(кг-°С).
Теплоемкость ср° вычисляется по формуле:
сПр = f/ie°pi
где у,—содержание i-ro компонента в смеси, масс, доли; сор,— теплоем-
кость 1-го компонента в расчете на идеальный газ, кДж/(кг-°C).
Теплоемкость компонентов газового сырья как идеальных газов рассчи-
тывается по формуле [5, с. 49]:
/ Т \ „ / Т * / Т \з / ЮО \
c°pi = ~г 100 ) + . 100 j +ЯЦ 100 J ( т у
где Et, Fi, Gt, Hi, Nt, кДж/(кг-°С)—коэффициенты, значения которых для
ряда часто встречающихся в расчетах веществ приведены в Приложении
(табл. П.2).
Расчет изобарной теплоемкости сырья как идеального газа дан в
табл. 2.4.
! аб.ища 2.4. Расчет изобарной теплоемкости газового сырья абсорбера
(как идеального газа) (1с = 27°С)
Компонент Количество кг/ч Содержание у., масс. доли Теплоемкость Cipi, кДж/(кг-°С) <Тс°рг кДж/(кг-°С)
сн4 167760 0,515010 2,23 1,15
с2н6 41995 0,128921 1 1,76 0,23
с3н8 . 47143 0,144726 1,68 0,24
С4Н)о 68771 0,211122 1,69 0,36
H2S 6 0,000018 0,98 0 ,00
со2 10‘ 0,000031 2,75 , 0,00
Н2О 56 0,000172 j 9,78 0,00
S 325741 1,000000 1 1,98*
* В данном случае с°р
64
Таблица 2.5. Расчет фактора ацентричности для газового сырья абсорбера
Компонент Мольная масса Mi Количество Содержание У‘ Ъп.' 1 МОЛЬН. доли 15]
кг/ч _£i_ кмоль/ч
сн4 16 167760 10485,0 0,741230 0,0104 0,0077
С2н6 30 41995 1399,8 0,098958 0,0986 0,0098
с3на 44 47143 1071,4 0,075742 0,1524 0,0115
с4н10 58 68771 1185,7 0,083823 0,2010 0,0168
H2S 34 6 0,2 0,000014 0,1000 0,0000
со2 44 10 0,2 0,000014 0,2310 0,0000
Н2О 18 56 3,1 0,000219 0,3480 0,0000
S — 325741 14145,4 1,000000 — 0,0458*
* В данном случае <о.
Поправка теплоемкости на давление в аппарате рассчитывается по фор-
муле [5, с. 50]:
R
Дср = ~М <Лср° + “Лср )
где 7?=8,315 кДж/(кмоль-°C)—универсальная газовая постоянная; св —
фактор ацентричности (безразмерная величина); Дс°р, Дс'р — функция, учи-
тывающая влияние давления (безразмерная величина).
Величина Дс°р и Дс'р определяются из графиков, приведенных в Приложе-
нии (см. рис. П-1 и П-2), в зависимости от тПр=1-28 и лПр=0,32; они равны
Дс% = —0,25; Aczp = —0,29.
Числовое значение со=0,0458 рассчитано в табл. 2.5.
Величина ДсР равна:
8,315
Дср =—23- [—0,25+ 0,0458 (—0,29)] = —0,1 кДж/(кг-°С)
Тогда
Ср =4,98 -(—0,1) = 2,08 кДж/(кг-°С)
QGy = 325 741-2,08-27 = 18 294 000 кДж/ч = 5082 кВт
Количество тепла, которое вносится в аппарат с раствором диэтиленгли-
коля, составляет
Q<Jrj] — ^глСгл^гл
где сгл — средняя массовая теплоемкость 98%-ного раствора диэтиленглико-
ля при температуре ^,-л=27°С, кДж/(кг-°C).
Величину теплоемкости ДЭГ находят из графика (рис. 2.9); сгл =
=2,38 кДж/(кг-°С).
Тогда
Qcrji = 4957-2,38-27 = 318 500 кДж/ч = 88,5 кВт
Количество тепла, которое выделяется при конденсации водяного пара
и растворении конденсата и диэтиленгликоля, равно:
QK = Q' + Q"
где Q' — количество тепла, выделяемое при конденсации водяного пара,
кВт; Q" — количество тепла, выделяемое при растворении конденсата, кВт.
5—640
65
Рис. 2.9. Диаграмма для определения теплоемкости водных растворов ди-
этиленгликоля.
Цифры на кривых соответствуют содержанию гликоля в водном растворе, % (масс.);
штрих-пунктирной линией ограничена зона образования твердых гидратов.
Количество тепла, выделяемое при конденсации водяного пара, равно:
Q' = GM n/-H2o = 51.1-2424 = 123 900 = 34,4 кВт
где Гн 2о = 2424 кДж/кг — теплота конденсации водяного пара при темпера-
туре tc=27 °C.
Количество тепла, выделяемого при растворении воды в диэтиленгликоле,
равно:
Q" = бвл пГр = 51,1-135,2 = 6909 кДж/ч = 1,9 кВт
где гр= 135,2 кДж/кг — теплота растворения воды в диэтиленгликоле.
Тогда
QK = 34,4 -)-1,9 = 36,3 кВт
Количество тепла, которое выделяется при частичном растворении угле-
водородов в диэтиленгликоле, рассчитывается по формуле:
Qp = 2 Sifi
Таблица 2.6. Расчет количества тепла, выделяемого
при растворении углеводородов в ДЭГ
Компонент Состав растворен- ных углеводородов х^, масс, доли Количество растворенно- го углеводорода Spi = Gp.y*i = 153'7xi’ кг/ч Теплота растворе- ния углеводорода г., кДж/кг Siri 3600 ’ кВт
сн4 0,3848 59,1 419 6,9
с2н6 0,2532 38,9 364 3,9
с3н8 0,1973 30,3 289 2,4
с4н10 0,1647 25,4 239 1,7
2 1,0000 153,7 — 14,9*
* В данном случае Qp
66
Таблица 2.7. Тепловой баланс абсорбера
Наименование теплового потока Температура, °C Количества тепла, кВт
Приход
Газовое сырье Qgv 27 5082,0
Свежий раствор <2сгл 27 88,5
Тепло конденсации и растворения воды QK — 36,3
Тепло растворения углеводородов Qp — 14,9
2 Расход — 5221,7
Осушенный газ Qa0 27 5078,4
Насыщенный раствор <2сгл н 143,3*
2 — 5221,7
* По разности с приходом.
где gi — количество ;-го углеводорода, растворившегося в диэтиленгликоле,
кг/ч; г, — теплота растворения i-ro углеводорода в диэтиленгликоле, кДж/кг.
Расчет количества тепла, которое выделяется при частичном растворении
углеводородов в гликоле, представлен в табл. 2.6.
При этом теплота растворения г; углеводородов принята равной теплоте их
парообразования (рис. 2.10) [21, с. 212].
Количество тепла, которое выводится из аппарата осушенным газом,
равно:
Qg0 = GoCpto = 325536,3-2,08-27 = 18 282 000 кДж/ч = 5078,4 кВт
при этом ср=2,08 кДж/(кг-°С)— теплоемкость осушенного газа при темпе-
ратуре /с=27°С, принятая равной теплоемкости газового сырья. Тепловой
баланс аппарата представлен в табл. 2.7.
Температура насыщенного абсорбента, выводимого из аппарата, рассчи-
тывается по уравнению:
36ОО(^Л.Й.
^гл.нсн
3600-143,3
5161,7-2,3
= 35 °C
Тогда средняя температура
в абсорбере будет равна:
А: +
1 ~ 2
27 + 43
= 2
Расхождение с принятым
в условиях разделения сред-
ним значением температуры
в аппарате ?=33°С состав-
ляет приемлемую величину
5,7%.
Рис. 2.10. Зависимость
скрытой теплоты парообра-
зования углеводородных га-
зов (Ci — С5) от давления
(по Максвеллу).
5
67
5. Число теоретических тарелок. При проектировании промышленных про-
цессов осушки принято графическое определение числа теоретических тарелок
[7, с. 258].
Координаты крайних точек оперативной линии рассчитываются так.
На входе раствора и выходе осушенного газа
1—х, Мгл 1 — 0,98 106,12
Xl’~" хг ‘“«Г = 0,98 18 = 0,1203
кмоль воды на один кмоль ДЭГ при его вводе в аппарат
кмоль
На
кмоль
22,4СК
У* = Ма
22,4-23-Ю-з
18
= 0,00029
воды на один кмоль газа на его выводе из
выходе раствора и входе газа
^ГЛ.Н
, _ 1 — *2Р
Х2 —
Х2р
воды
на
один кмоль
воды
1 — 0,94
0,94
аппарата.
92,7
-^— = 0,3287
ДЭГ
, 22,4Сн
У1 = Ма
один кмоль газа
при его выводе из аппарата
22,4-250- Ю-з
= 0,00311
18
кмоль
сыщенного
Оперативная линия АВ,
y'i), показана на рис. 2.11.
Расчет координат линии равновесия дан в табл. 2.9; при этом задан ряд
числовых значений концентрации воды в растворе х, (масс, доли) и из диа-
граммы (рис. 2.12) определены числовые значения парциальных давлений
воды в растворе ДЭГ.
Мольная концентрация воды в растворе рассчитывается по формуле
на
раствора диэтиленгликоля Л1гл
построенная
при его вводе в аппарат; мольная масса на-
= 92,7 рассчитана в табл. 2.8.
по координатам A(x'j, у'%) и
- A4Cpi д/в
Мср/— средняя мольная масса раствора ДЭГ.
Таблица 2.8. Расчет средней мольной массы насыщенного раствора ДЭГ
Компонент Мольная масса М. i Количество Содержание
^z’ кг/ч — g* "i “ Af кмоль/ч х - S‘ ‘ -Si ’ масс. доли х'-=Л- нг Sn. ’ мольн. доли
ДЭГ 106,1 4956,9 46,72 0,9603 0,8389 89,00
Н2О 18 51,1 2,84 0,0099 0,0510 0,92
сн4 16 59,1 3,70 0,0114 0,664 1,06
С2Н6 • 30 38,9 1,30 0,0075 0,0233 0,70
с3н8 44 30,3 0,69 0,0059 0,0124 0,55
58 25,4 0,44 0,0050 0,0080 0,46
2 — 5161,7 55,69 1,0000 1,0000 92,7*
* В данном случае -Мгл н
68
Рис. 2.11. График для опре-
деления числа теоретических
тарелок в абсорбере.
Числовые значения средней
мольной массы растворов ДЭГ
рассчитаны по формуле:
1
Mcpi = х. 1
м? + мгл
и представлены в табл. 2.9
Кривая равновесия CD изо-
бражена на рис. 2.11.
Построением ступенчатой
линии от точки входа газа в
аппарат и выхода раствора из
аппарата (точка В) до точки
выхода газа и входа раствора
(точка А) определяется (с не-
которым запасом) число тео-
ретических тарелок NT=2.
6. Диаметр аппарата. Диаметр абсорбера в наиболее нагруженном ниж-
нем его сечении (под нижней тарелкой) рассчитывается по формуле [6,
с. 265]:
D.
1800С'гл,н
Ргл.н
(^C-f-35)
Г Рр.у (Ргл.н Рр.у)
К0С 4- 35
где С'гл.н — расход насыщенного абсорбента из аппарата, кг/с; рглн =
= 1105 кг/м3 — плотность раствора гликоля при температуре /Н=43ОС (см.
рис. 2.5); Ко=О,25 — коэффициент для тарелок, состоящих из S-образных
элементов (приняты согласно рекомендациям) [14, с. 46]; С=480— коэффи-
циент для абсорберов при расстоянии между тарелками /гт = 0,6 м [6, с. 264];
Таблица 2.9. Расчет координат линии равновесия
Концентрация воды в раство- ре Х-, масс, доли Мольная масса раствора Мср- Давление водяных паров в растворе (см. рис. 2.11) Па Мольная концен- трация воды в растворе xi X'i — Я1~’ 1 CP‘ AfB кмоль/кмоль Равновесная моль- ная концентрация водяных паров в газе ^4- кмоль/кмоль
0,01 101,1 70 0,0561 0,000047
0,02 96,6 190 0,1073 0,000129
0,03 92,5 400 0,1541 0,000272
0,05 85,3 640 0,2363 0,000435
0,10 71,2 1050 0,3952 0,000714
69
G?—расход газового сырья в аппарат, кг/ч; рр.у= 14,2 кг/м3 — плотность газо-
вого сырья (см. с. 61).
Расход насыщенного абсорбента составляет:
с/гл.н— 3600 — 3600 — ьад кг/с
Диаметр абсорбера равен:
1800-1,43
1105
Da' =----------
325741
(0.25-480 + 35) v==(iio5_i4;-
0,25-480 4-35
= 4,12м
Числовое значение диаметра абсорбера принимается равным ближайшему
большему стандартному Da=4,5 м. Приемлемость принятого значения диа-
метра абсорбера должна быть проверена расчетом работоспособности таре-
лок. Последовательность такого расчета изложена на с. 20—30 и более под-
робно в работе [6].
7. Высота аппарата. Рабочая высота аппарата (рис. 2.13) равна, м:
Ир —
где ft, —высота нижней камеры аппарата; й2 — высота части аппарата, за-
нятой тарелками; h3 — высота верхней камеры аппарата.
Высота hi нижней камеры колонны принимается равной 1,5 м.
Высота h2 равна:
Л2 = (^Р- ’Мт
давление р, Па
где — число рабочих тарелок в колонне.
Число рабочих тарелок в
аппарате определяется по фор-
муле:
где т)т — к. п. д. тарелок из
S-образных элементов.
Обычно к. п. д. тарелок в
промышленных абсорберах
гликолевой осушки лежит в
пределах Т)т—О,25—0,4 [7,
с. 258]. С целью максимальной
осушки газа принимается г)т=
=0,25.
Тогда
2
jVp= 0,25 ~8
Л2 = (8 — 1)-0,5 = 3,5 м
Рис. 2.12. Зависимость парци-
ального давления воды в рас-
творе диэтиленгликоля от тем-
пературы:
1 — вода; 2 — 25% (масс.) воды; 3 —
20% (масс.) воды; 4 —15% (масс.)
воды; 5—10% (масс.) воды; 5 —
5% (масс.) воды; 7 — 3,8% (масс.)
воды; 5 — 3% (масс.) воды; 9 —
2% (масс.) воды; /0—1% (масс.)
воды; II — диэтиленгликоль.
70
Рис. 2.14. Схема материальных потоков десорбера для регенерации раствора
диэтиленгликоля.
Высота верхней части /t3 принимается равной 1,5 м. Тогда
Яр= 1,54-3,5+1,5 = 6,5 м
Диаметры штуцеров рассчитывают по обычным формулам гидравлики.
ДЕСОРБЕР ДЛЯ РЕГЕНЕРАЦИИ РАСТВОРА ДИЭТИЛЕНГЛИКОЛЯ
Исходные данные
Рассчитать десорбер для регенерации насыщенного раствора диэтилен-
гликоля, состав которого дан в табл. 2.8, при следующих исходных данных:
количество раствора диэтиленгликоля <?гл.н=5160 кг/ч; давление в аппарате
л=0,12 МПа.
Содержание диэтиленгликоля в регенерированном растворе не менее *1 =
= 0,987 масс, долей.
Температура раствора диэтиленгликоля при его выводе из аппарата Л =
= 154 °C.
Описание принципиальной технологической схемы работы десорбера было
дано ранее (см. «Исходные данные» и рис. 2.1); схема материальных потоков
приведена на рис. 2.14.
Расчет
1. Температура в аппарате. По данным работы десорберов нескольких про-
мышленных установок осушки газа раствором диэтиленгликоля температура
ввода сырья в аппарат находится в пределах 52—109 °C [20, с. 51]. С целью
71
исследования влияния предварительного нагрева на степень регенерации рас-
твора диэтиленгликоля принимается повышенное значение температуры ввода
сырья в аппарат 12 = 105°С.
Температура парогазовой смеси, выводимой из аппарата, принимается рав-
ной /п=100°С. Температура воды, подаваемой для орошения верха аппара-
та, принимается равной /й=97°С.
Температура раствора диэтиленгликоля после обмена теплом с более на-
гретой парогазовой смесью определяется из теплового баланса аппарата.
2. Материальный баланс десорбера. Уравнение материального баланса де-
сорбера, схема материальных потоков которого показана на рис. 2.14, имеет
вид:
^ГЛ.Н 4~ G/ + Go + 0ж = Оп.г.С + Сж + Ож' + Со
Левая часть уравнения отвечает приходу материальных потоков (кг/ч):
бгл.н — насыщенного раствора диэтиленгликоля, подаваемого на регенерацию;
G'r — отдувочного газа; Go — воды, подаваемой на верх аппарата в качестве
орошения для уменьшения потерь гликоля; G,; — жидкости из испарителя;
правая—расходу материальны^ потоков (кг/ч): Gnr.c — парогазовой смеси;
G>k — жидкости в испаритель; О'ж — регенерированного раствора диэтиленгли-
коля; G„ — испарившегося орошения.
Для регенерации раствора гликоля до концентрации 99% (масс.) и более
применяется отдувочный или отпарной газ, подаваемый под первую тарелку
десорбера. Отдувочный газ уменьшает парциальное давление водяного пара
и способствует переходу воды из жидкой фазы в паровую.
Количество отдувочного газа рассчитывается по формуле [20, с. 66]:
NT' = ЛГглЗ/йС
где А" г.-г — количество диэтиленгликоля в насыщенном растворе, кмоль/ч; S —
фактор десорбции воды; К — константа равновесия воды в системе ДЭГ —
вода.
Количество диэтиленгликоля в насыщенном растворе равно:
G„ цХ2 5160-0,9603
Ю6,12 ” = 46'69 КМ0ЛЬ'4
Фактор десорбции воды можно определить по диаграмме Кремсера [24,
с. 32]; для этого принимается число теоретических тарелок A\ = 3. Расчетная
степень отпарки парогазовой смеси в аппарате равна:
х2 (1 - Xj) 0,9603 (1 —0,987)
Ч5- 1— xt(l -х2) “ 1 ~ 0,987 (1 — 0,9603) ~ U’W
Тогда, при ср=0,63 и Мт = 3 из графика Кремсера находим 5 = 0,75 (см.
Приложение, рис. П.З).
Температура отдувочного газа принимается равной /г= 154 °C. Тогда кон-
станта фазового равновесия для воды при этой температуре и давлении л =
= 0,12 МПа определяется из графика (рис. 2.15); она равна Д=3,85.
Тогда
46,69-0,75
У/ =------g-gg----= 9,1 кмоль/ч
СЛтав принятого в данном случае отдувочного газа дан в табл. 2.10.
Расход отдувочного газа составляет:
„ , О/ 153
Gr' = Nr'Mr' = 9,1 • 16,82 = 153 кг/ч или Vr = = -р 57 = 268 м3/ч
При этом плотность газа равна:
Л4гл273 16,82-0,12-108.273
Рг = 22,4(^+ 273)0,1-108 - 22,4 (154 + 273) 0,1 • 10® - °-57 «г/м3
72
Рис. 2.15. Зависимость константы равновесия воды в системе ДЭГ — вода от
температуры и давления.
Удельный расход отдувочного газа равен:
№ — Ур ]Угл.н
где Угл.н — объемное количество насыщенного влагой диэтиленгликоля, м3/ч.
Величина Г'гл.н рассчитывается по формуле:
6ГЛн 5160
= = П055-= 419 м3/Ч
где ргл.н — плотность раствора гликоля при температуре f5 = 105°C (см.
рис. 2.5).
Тогда
268
w = g = 55 м3/м3
Удельный расход отдувочного газа в промышленных регенераторах глико-
лей находится в пределах ш=10—100 мэ/м3 [24, с. 31].
Для определения количества парогазовой смеси, выводимой из аппарата,
рассчитываются количества парогазовой смеси, образованные при однократ-
ном испарении насыщенного раствора диэтиленгликоля. Однократному испа-
73
Таблица 2.10. Состав отдувочного газа
Компонент Мольная масса Afi Содержание у., мольн, доли Mi«’i Содержание масс, доли
сн4 16 0,970 15,52 0,9227
с2н6 30 0,009 0,27 0,0160
с3н8 44 0,013 0,57 0,0338
С4Н,0 58 0,008 0,46 0,0275
2 — 1,000 16,82* 1,0000
• В данном случае М г.
рению раствор ДЭГ подвергается дважды: первый раз — при вводе сырья
Gr-л.н в аппарат и второй — при вводе нагретого в испарителе жидкого остат-
ка Ож, полученного после однократного испарения сырья (см. рис. 2.14). При
этом допускается, что при контакте с отдувочным газом состав насыщенного
гликоля после первого однократного испарения не меняется. Такое допуще-
ние обеспечивает резерв разделительной возможности аппарата.
Мольная доля отгона е' рассчитывается по методу А. М. Трегубова [22,
с. 72], путем подбора такого значения е', при котором удовлетворяются ра-
венства:
2 X'ui = 1 + е' (Аг — 1) = 1 2г/ иг' = KiX'ni = 1
где х'В1, у'— содержание г'-го компонента в жидкой и паровой фазах, обра-
зовавшихся при однократном испарении насыщенного диэтиленгликоля,
мольн. доли; Ki— константа фазового равновесия t-го компонента.
Однократное испарение насыщенного раствора Огл.я происходит при тем-
пературе /2 = 105°С и давлении л=0,12 МПа. Однократное испарение жидкого
потока Gx — при температуре /1=154 °C и давлении л=0,12 МПа.
При этих условиях константы фазового равновесия для метана, этана, про-
пана и бутана могут быть найдены из номограммы [25, с. 18]; константа фа-
зового равновесия для раствора диэтилепгликоля рассчитывается по формуле
Адэг = Рдэг/л
где Рдэг — давление насыщенного пара диэтиленгликоля, Па.
Давление насыщенного пара диэтиленгликоля (Па) в интервале темпера-
тур от 80 до 165 °C можно вычислить по уравнению [26, с. 120]:
1йРдэг= 10,2775-—2 —
где Т — температура, К.
Ниже приведены подобранные значения мольных долей отгона:
при однократном испарении насыщенного раствора ДЭГ е'=0,106;
при вторичном однократном испарении ДЭГ е'=0,0032.
Расчеты составов парогазовой и жидкой фаз, образовавшихся при одно-
кратном испарении абсорбента, даны в табл. 2.11 и 2.12. При этом допусти-
мые невязки величин 2х'( и 2у\ распределены по компонентам.
Содержание диэтиленгликоля в растворе после однократного испарения
при температуре /=105 °C и давлении л=0,12 МПа составляет 0,9864 масс,
долей. Для подачи в абсорбер осушки газа (см. «Исходные данные») требу-
ется раствор, содержащий 0,98 масс, долей диэтиленгликоля, так что для это-
го аппарата условие регенерации выполняется.
74
Таблица 2.11. Расчет дали отгона при t=105°C и л=0,12 МПа
Компонент м. 1 Содержание мольн. доли К1 Kix'i Mix'i Mly'i Mix'i Xi° SM.x't yi
(е' = 0,106)
ДЭГ 106,12 0,8389 0,0115 0,9371 0,0108 99,4451 1,1461 0,9864 0,0470
Н2О 18 0,0510 1,2 0,0509 0,0519 0,9162 0,9342 0,0091 0,0383
сн4 16 0,0664 210,0 0,0029 0,6020 0,0464 9,6320 0,0005 0,3947
с2н6 30 0,0233 68,0 0,0029 0,1955 0,0870 5,8650 0,0009 0,2403
с3н8 44 0,0124 30,0 0,0030 0,0914 0,1320 4,0216 0,0013 0,1647
58 0,0080 15,0 0,0032 0,0484 0,1856 2,8072 0,0018 0,1150
s' — 1,0000 — 1,0000 1,0000 100,8123» »100,8* 24,4061» »24,4*‘ 1,0000 1,0000
* В данном случае Л1*
** В данном случае Л1^>
Таблица 2.12. Расчет доли отгона при t=154°C и л—0,12 МПа
Компонент Mi Содержание мольн. доли / С'1 y'i “ Kix'l Mtx'i MiX't i “I SMjS'j
‘ 1+е'(К.-1) (<•' = 0,0032)
ДЭГ 106,12 0,9371 0,0648 0,9399 0,0606 99,7422 6,4309 0,9875 0,2123
H2O 18,0 0,0509 3,85 0,0504 0,1919 0,9072 3,4488 0,0090 0,1139
сн4 16,0 0,0029 230,0 0,0017 0,3858 0,0272 6,1728 0,0002 0,2038
с2н6 30,0 0,0029 82,0 0,0023 0,1862 0,0690 5,5860 0,0006 0,1843
С3Н8 44,0 0,0030 41,0 0,0027 0,1101 0,1188 4,8444 0,0011 0,1599
С4Н,о 58,0 0,0032 22,0 0,0030 0,0657 0,1740 3,8106 0,0016 0,1258
S — 1,0000 1— 1,0000 1,0000 101,0384» ^101,0* 30,2935» «30,3** 1,0000 1,0000
* В данном случае Мх-
•• В данном случае Му.
Содержание диэтиленгликоля в растворе после второго однократного ис-
парения при температуре /=154 °C и давлении л=0,12 МПа составляет
0,9875 масс, долей, причем оно удовлетворяет условиям регенерации в рас-
считываемом аппарате.
Массовые доли отгона равны:
при /=105 °C
Му 24,4
^ = ^'^7=0,106^ = 0,0279
при /= 154 °C
Л4„ 30,3
е2 = ег' = 0,0032 "Joo 8~ = °.00096
где Л4В=24,4 (см. табл. 2.11), 4451=30,3 (см. табл. 2.12), 44rn.H=92,7 (см.
табл. 2.8), Мх— 100,8 (см. табл. 2.11).
После первого однократного испарения имеем:
количество парогазовой смеси
Gn = е^гл.н = 0,0279-5160 = 144 кг/ч
количество жидкости
Gx = G„ н - Gn = 5160 — 144 = 5016 кг/ч
После второго однократного испарения имеем:
количество парогазовой смеси
G'n = е2Ож = 0,00096-5016 = 5 кг/ч
количество жидкости
G'X = GX— G'„ = 5016 — 5 = 5011 кг/ч
В результате второго однократного испарения отгон равен 5 кг/ч; по срав-
нению с отгоном, полученным при первом однократном испарении и равным
144 кг/ч, он является малой величиной. При этом потребовался нагрев аб-
сорбента от 105 °C до 154 °C.
Таблица 2.13. Расчет количества и состава парогазовой смеси,
выводимой из верхней части десорбера
Компонент Мольная масса л/г. Поток <?п = 144 кг/ч Поток G'n — 5 кг/ч Отдувочный газ G'r = 153 кг/ч
содержа- ние у., масс, доли (см. табл. 2.11) количество Спг = = слуг., КГ/Ч содержа- ние у., масс, доли (см. табл. 2.12) количество = = GiA'- кг/ч содержа- ние у., масс, доли (см. табл. 2.10) количество с'г/ = = С'Л- кг/ч
ДЭГ 106,12 0,0470 6,8 0,2123 1,1
Н2О 18 0,0383 5,5 0,1139 °,6 —
сн4 16 0,3947 56,8 0,2038 1,0 0,9227 142
С2н6 * 30 0,2403 34,6 0,1843 °,9 0,0160 2
С3Н8 44 0,1647 23,7 0,1599 0,8 0,0338 5
C4H1Q 58 0,1150 16,6 0,1258 0,6 0,0275 4
2 — 1,0000 144,0 1,0000 5,0 1,0000 153
Парогазовая смесь, образовавшаяся в результате однократных испарений
раствора диэтиленгликоля, вместе с отдувочным газом выводится из верхней
части аппарата. Расчет количества и состава этой смеси дан в табл. 2.13.
76
Продолжение табл. 2.13
Поток °п.г.с = °п + с'п + С'г
количество содержание
Компонент Si- кг/ч Si ni М. * i yi “ Ъц ’ масс, доли y'i = "Ёй-’ мольн. доли
ДЭГ 7,9 0,0744 0,0262 0,0049
Н2О 6,1 0,3389 0,0202 0,0223
сн4 199,8 12,4875 0,6616 0,8222
С2н6 37,5 1,2500 0,1242 0,0823
с3на 29,5 0,6705 0,0976 0,0442
С4Н|о 21,2 0,3655 0,0702 0,0241
2 302,0 15,1868^15,2* 1,0000 1,0000
* В данном случае ЛГП
Материальный баланс десорбера для регенерации раствора диэтиленглико-
ля дан в табл. 2.14.
3. Тепловой баланс десорбера. Уравнение теплового баланса десорбера в
общем виде (см. рис. 2.14) имеет вид:
^сгл н + ®в'г + ^°ж + ®ао = ^'вж + ®аи г ^с'ж "Ь ®ао
Левая часть уравнения отвечает приходу тепла (кВт): QorjI —с насыщен-
ным раствором диэтиленгликоля, подаваемым в аппарат на регенерацию;
Q'ar—с отдувочным газом; Qox—-с нагретым в испарителе жидким остат-
ком после однократного испарения потока Огл.н; Qcp — с орошением верха
аппарата; правая — расходу тепла (кВт): Q'ox—с жидким остатком первого
однократного испарения сырья, направляемым в испаритель; Qcn г с — с па-
рогазовой смесью и отдувочным газом; Qox'—с регенерированным раство-
ром диэтиленгликоля; Qgo —с испаряющимся водяным орошением.
Количество тепла, вносимое в аппарат насыщенным раствором диэтилен-
гликоля, рассчитывается по уравнению:
<2с?гл.н = + hti (1 — ej]
где Ht2—энтальпия парогазовой смеси Gn, образовавшейся при однократном
испарении сырья при температуре t2= 105 °C, кДж/кг; ht2 — энтальпия жид-
Таблица 2.14. Материальный баланс десорбера
Поток, поступающий в десорбер (см. рис. 2.14) Количество, кг/ч Поток, выводимый из десорбера (см. рис. 2. 14) Количество, кг/ч
Насыщенный раствор Огл.н 5160 Парогазовая смесь Gn.r.c 302
Жидкость из испарителя бж 5016 Жидкость в испаритель бж 5016
Отдувочный газ G'r 153 Регенерированный рас- твор б'ж 5011
Орошение Go — Орошение Go —
2 10329 4- Go 2 10329 + Go
77
кости Gm, образовавшейся при однократном испарении сырья при той же
температуре, кДж/кг.
Энтальпия парогазовой смеси Gn рассчитывается по формуле:
Ht2 = Сп^2
где сп — теплоемкость парогазовой смеси, кДж/(кг-°C).
Расчет теплоемкости парогазовой смеси при известном ее составе (см.
табл. 2.11) производится в последовательности, изложенной на с. 64. Пред-
варительно определяется теплоемкость пара раствора диэтиленглйколя по
формуле:
СДЭГ =
где ЯдЭГ—энтальпия пара диэтиленгликоля при температуре 12 =
= 105 °C, кДж/кг.
Энтальпия пара диэтиленгликоля рассчитывается по формуле:
77 дэг = Л дэг + г
где h дэг—энтальпия жидкого диэтиленгликоля при температуре i2 = 105°C,
кДж/кг; г — теплота испарения диэтиленгликоля при той же температуре,
кДж/кг.
Энтальпия жидкого диэтиленгликоля равна:
Лдэг = с/2 = 2,5-105 = 262,5 кДж/кг
где с=2,5 кДж/(кг-°С) —теплоемкость диэтиленгликоля при температуре /2 =
= 105 °C (см. рис. 2.9).
Теплота испарения диэтиленгликоля при температуре /2=105°С, равная
г=860 кДж/кг, определяется из графика (рис. 2.16) [26, с. 119].
Тогда
Ядэг = 262,5 + 860 = 1122,5 кДж/кг
1122,5
сдэг = —Где— =Ю,7 кДж/(кг-°С)
Теплоемкость парогазовой смеси при температуре 73 = 105°С рассчитана
в табл. 2.15.
Тогда
Hf2 = 2,63-105 = 276 кДж/кг
Энтальпия раствора диэтиленгликоля равна
= сж<2 = 2,68-105 = 281,4 кДж/кг
Температура t, °C
Рис. 2.16. Зависимость теплоты испарения диэтиленгликоля (7) и триэтилен-
гликоля (2) от температуры.
78
Таблица 2.15. Теплоемкость парогазовой смеси при температуре t2=105aC
Компонент Содержание у^, масс, доли (см. табл. 2.11) Теплоемкость с°_., кДж/(кг-°С)Р Ц.С* УГ Р* л кДж/(кг«°С)
ДЭГ 0,0470 10,70 0,50
Н2О 0,0383 1,86 0,07
сн4 0,3947 2,47 0,97
с2н6 0,2403 2,11 • 0,51
С3н8 0,1647 2,05 0,34
С4Н10 0,1150 2,05 0,24
2 1,0000 — сп=2,63
Тогда
<2огл н = 5160 [ЗТ'б-0,°279 + 281,4 (1 —0,0279)] = 1 451 000 кДж/ч = 403,1 кВт
Количество тепла, которое вносится в аппарат отдувочным газом, рассчи-
тывается по уравнению:
<?С'г=<'г'Ср<
где ср — теплоемкость отдувочного газа при температуре /=154 °C, кДж/(кг-
°C).
Расчет теплоемкости отдувочного газа при известном его составе (см.
табл. 2.10) производится в последовательности, изложенной в разделе «4. Теп-
ловой баланс аппарата». Величина ср=2,62 кДж/(кг-°С).
Тогда
Qc,r= 153-2,62-154 = 61 700 кДж/ч = 17,1 кВт
Количество тепла, которое вносится в аппарат раствором ДЭГ при темпе-
ратуре /1=154 °C, рассчитывается по уравнению:
<Эож = Ож [Н(1е2 4- h.tl (1 — е2)]
где Ht1—энтальпия парогазовой смеси, образовавшейся при однократном ис-
парении потока Ож при температуре /1 = 154°C, кДж/кг; hi±—энтальпия жид-
кого потока G'x, образовавшегося при однократном испарении потока Сж,
кДж/кг.
Энтальпия парогазовой смеси, образовавшейся при однократном испарении
раствора диэтиленгликоля при температуре Л = 154 °C, рассчитывается по фор-
муле:
Htl — cntt = 3,53-154 = 544 кДж/кг
где сп = 3,53 кДж/(кг-°С)—теплоемкость парогазовой смеси, образовавшейся
при втором однократном испарении раствора диэтиленгликоля (см. табл. 2.12).
Расчет теплоемкости сп=3,53 кДж/(кг-°С) подобен расчету теплоемкости
сп = 2,63 кДж/(кг-°C) и потому опущен.
Энтальпия раствора диэтиленгликоля при температуре /1 = 154 °C равна
htl — сж11 = 2,8-154 = 431,2 кДж/кг
где сж=2,8 кДж/(кг-°С)—теплоемкость раствора, содержащего х=
= 0,9875 масс, долей диэтиленгликоля, при температуре /1 = 154 °C (ем. рис. 2.9).
Тогда
QCjk = 5016 [544-0,00046-431,2 (1 — 0,00096)] = 2 163 000 кДж/г = 600,9 кВт
79
Таблица 2.16. Тепловой баланс десорбера
Наименование теплового потока (см, рис. 2.14) Температура, °C Количество тепла, кВт
Приход
Насыщенный раствор <2егл н 105 403,1
Отдувочный газ QG'r 154 17,1
Жидкость из испарителя Qax 154 600,9
Орошение Qg 97 0go
2 — 1021,1 +QGo
Расход
Жидкость в испаритель Q'c ж 105 392,1
Парогазовая смесь Qcn г с Регенерированный ДЭГ <2с'ж 100 21,5
154 600,2
Испаренное орошение Q'а 100 Q'g0
2 ° — 1013,8+Q'Go
Количество тепла, которое выносится из десорбера жидким остатком пер-
вого однократного испарения сырья при температуре Z2 = 105°C, равно
Q'Gjk = GKht2 = 5016-281,4= 1 412 000 кДж/ч = 392,1 кВт
Количество тепла, которое выносит из десорбера парогазовая смесь при
температуре Zn = 100°C, равно:
QGn.r.c = Gn.r.ccn.r.czn = 302-2,56-100 = 77 300 кДж/ч = 21,5 кВт
Количество тепла, которое выносит из аппарата регенерированный раствор
диэтиленгликоля при температуре tt = 154 °C, составляет:
Оа,ж = G'^htl = 5011 -431,2 = 2 161 000 кДж/ч = 600,2 кВт
Тепловой баланс аппарата представлен в табл. 2.16.
Из теплового баланса десорбера имеем:
1021,1 +QCo= 1013,8 +<Э'йо
или
Q'g0 — Qg0“7,3 кВт
Решая последнее уравнение относительно количества оросительной воды,
получим:
3600-7,3 3600-7,3
G° = //100 —= 2677 - 406 = 12 кг/ч
при этом //то — энтальпия водяного пара при температуре ta = 100 °C, кДж/кг;
/г97 — энтальпия воды при температуре /с=97°С, кДж/кг.
4. Диаметр десорбера. Диаметр аппарата в его наиболее нагруженном
нижнем сечении (под нижней тарелкой) рассчитывается по формуле [6,
с. 265]:
1800О'ж / Gn.r
—о------+ 1 / (^oG + 35)
Рж У Рп (Рж Рп)
= КаС + 35
80
Рис. 2.17. Схема для расчета рабочей высоты де-
сорбера.
где G+ — расход регенерированного раствора ди-
этиленгликоля с нижней тарелки десорбера, кг/с;
Рж = 1018 кг/м3 — плотность раствора гликоля при
температуре fi = 154°C (см. рис. 2.5); К0=0,25— ко-
эффициент для тарелок с капсульными колпачками;
С = 550 — коэффициент для десорберов при расстоя-
нии между тарелками Лт=0,6 м [6, с. 264]; Gn. г. о—
расход парогазовой смеси, поступающей под ниж-
нюю тарелку десорбера, кг/ч; рп — плотность парога-
зовой смеси, кг/м3.
Расход регенерированного диэтиленгликоля равен:
5011
6 ж,— 350Q —1,39 кг/с
Количество парогазовой смеси под нижней та-
релкой, а также состав и средняя мольная масса
рассчитаны в табл. 2.17.
Плотность этой парогазовой смеси составляет:
Л4Пг сл273 17-0,12-273
Рп — 22,4(^ + 273)0,1 — 22,4(154 + 273)0,1 = 0,58 К1/‘"3
Диаметр десорбера равен:
1800-1,39 , Г 158
—Г7ГГя + 1 / (0,25-550 + 35) г —
1018 у > }/0,58 (1018 — 0,58)
Da = 0,25-550+ 35 = 0,21 м
С учетом наименьшего диаметра тарелок с капсульными колпачками типа
ТСК-1 (по ОСТ 26-01-282—71) принимается диаметр десорбера Од=0,4 м.
Приемлемость принятого значения диаметра аппарата должна быть провере-
Таблица 2.17. Расчет состава парогазовой смеси под нижней
тарелкой десорбера
Компонент Мольная масса ЛТ. Лоток On.r.c = G'n.r.c + G'r
количество содержание / ni yi - *7’ мольн. доли
кг/ч кмоль! ч
ДЭГ 106,12 1,1 0,0104 0,0011 0,12
Н2О 18 0,6 0,0333 0,0036 0,06
сн4 16 143.0 8,9375 0,9622 15,39
С2Н6 30 2,9 0,0967 0,0104 0,31
СзН8 44 5,8 0,1318 0,0142 0,62
С4Ню 58 4,6 0,0793 0,0085 0,50
2 — 158,0 9,2890^9,3 1,0000 17,0*
* В данном случае ЛГП
6—640
81
на гидравлическим расчетом тарелок. Последовательность такого расчета из-
ложена на с. 20—26 более подробно она рассматривается в работе [6].
5. Высота десорбера. Рабочая высота аппарата (рис. 2.17) равна, м:
Яр = + Л2 + Л3 + Л4 + Л6
где hi — высота верхней камеры колонны; hi — высота верхней секции колон-
ны (занятой тарелками); — высота секции питания; + — высота нижней
секции колонны (занятой тарелками); h3 — высота нижней камеры колонны.
На основании практических данных принимается следующее: /г( = 1,0 м;
+ = 1,2 м; /г3=2,5 м.
Высота верхней секции равна:
ла = (Яв -1) Лт
где Яв— число рабочих тарелок в верхней секции аппарата.
Обычно число рабочих тарелок в верхней секции аппарата составляет:
Лгв=2—4. Примем NB=3. Тогда
/12 = (3 — 1)0,6= 1,2 м
Высота нижней секции равна:
Л4 = (Яв-1)Лт
где NH — число рабочих тарелок в нижней секции аппарата.
Выше, при определении фактора десорбции воды, было принято число тео-
ретических тарелок Я7 = 3. Известно, что число рабочих тарелок равно
Ян = JVт/г]
где т] — к. п. д. тарелок с круглыми колпачками, равный 0,1—0,3.
Принимается среднее значение т] = 0,15. Тогда
3
Л'н= 0,15 =20
Число рабочих тарелок в десорберах промышленных осушительных уста-
новок изменяется в пределах 10—20 [7, с. 260]. Некоторый избыток числа
тарелок необходим для уменьшения потерь диэтиленгликоля с отгоняющимся
водяным паром.
Высота нижней секции равна:
= (20 — 1)0,6= 11,4 м
Тогда рабочая высота колонны составит:
Нр = 1,0+ 1,2+ 1,2+ 11,4 + 2,5 = 17,3 м
Диаметры основных штуцеров аппарата рассчитываются по обычным фор-
мулам гидравлики с последующим принятием значений, соответствующих су-
ществующим нормалям.
ГЛАВА 3
ПРОЦЕССЫ И АППАРАТЫ РАЗДЕЛЕНИЯ
УГЛЕВОДОРОДНЫХ ГАЗОВ АБСОРБЦИЕЙ
Общие сведения
Абсорбция и десорбция — массообменные процессы, составляющие основу
абсорбционного разделения нефтяных и природных газов. Абсорбционный ме-
тод разделения углеводородных газов применяется в промышленности для
извлечения газового бензина и жидких газов (пропан-бутановая смесь).
Физическая сущность абсорбции и десорбции заключается в достижении
равновесия между взаимодействующими потоками газа и жидкости. Достиже-
ние состояния равновесия в системе «газ — жидкость» зависит от диффузии
(переноса) вещества из одной фазы в другую. Движущая сила диффузии
определяется разностью парциальных давлений извлекаемого компонента в
газовой и жидкой фазах. Если парциальное давление компонента в газовой
фазе выше, чем в жидкой, то происходит процесс абсорбции (поглощение
газа жидкостью) и наоборот, если парциальное давление извлекаемого ком-
понента в газовой фазе ниже, чем в жидкой, то происходит десорбция (вы-
деление газа из жидкости).
При десорбции многокомпонентных смесей жидкость и газ в аппарате (по
крайней мере на теоретической тарелке) находятся в состоянии фазового рав-
новесия — в том смысле, что жидкость кипит, а пар является насыщенным.
При этом температура жидкости на каждой тарелке или в каждой точке ап-
парата определяется давлением и составом.
При абсорбции этого нет: температура от давления не зависит и может
быть выбрана в некоторых пределах.
На газоперерабатывающих заводах абсорбцию и десорбцию проводят в
аппаратах тарельчатого и насадочного типов. При наличии технологического
контура «абсорбер — десорбер» поглощение из газа соответствующих компо-
нентов происходит в абсорбере, а выделение их — в десорбере. Извлеченные
из насыщенного абсорбента углеводороды получают из верхней части десор-
бера, а регенерированный абсорбент отводят из его нижней части и подают
в абсорбер для повторного использования.
Процесс абсорбции углеводородных газов сопровождается выделением теп-
ла, поэтому температура в нижней части абсорбера несколько выше, чем в
верхней. При абсорбции природного газа (с содержанием Метана 85—95%)
разница между температурами верха и низа абсорбера составляет 5—8 °C.
При абсорбции заводских газов эта разница увеличивается в несколько раз.
Регенерация абсорбента в десорбере сопровождается подводом тепла в
аппарат, поэтому разница между температурой верха и низа десорбера со-
ставляет несколько десятков градусов.
Известно несколько методов расчета физической абсорбции многокомпо-
нентных углеводородных газов.
Метод Крейсера — Брауна применяется для расчетов абсорбции и десорб-
ции малорастворимых газов в условиях давления й температуры, при кото-
рых уменьшение газовой фазы, а также увеличение жидкой фазы относитель-
но невелики. При этом соотношение между количеством жидкости и газа ос-
тается, по существу, постоянным по высоте абсорбера. Расчет ведется при
средней арифметической температуре процесса.
Льюис и Шервуд при расчете абсорбции исходят из того, что линии рав-
новесия для индивидуальных углеводородов газовой смеси являются прямы-
ми, и предлагают графический покомпонентный расчет абсорбции.
Хортон и Франклин, приняв за основу предположение Льюиса и Шер-
вуда о том, что абсорбция в тарельчатой колонне происходит неравномерно
(на верхних тарелках аппарата интенсивно поглощаются легкие компоненты,
а на нижних — относительно тяжелые компоненты) предложили рассчитывать
абсорбцию покомпонентно, ориентируясь на коэффициент поглощения, для
интервалов колонны, в которых располагается наибольшее число тарелок,
связанных с поглощением данного компонента, или где происходит в основ-
6* 83
ном абсорбция данного компонента. Для определения интервалов колонны, в
которых в основном происходит абсорбция данного компонента, предвари-
тельно осуществляется ориентировочный расчет по методу Кремсера — Брауна-
Эдмистер предложил метод расчета абсорбции «жирных» углеводородных
газов на основе использования эффективного фактора абсорбции, как функ-
ции коэффициента конечного поглощения, и с учетом изменения материальных
потоков и температуры по высоте аппарата.
Метод Ферро, как и метод Эдмистера, основан на концепции коэффициен-
та конечного поглощения, но для определения коэффициентов поглощения
использует графическое решение алгебраических прогрессий.
Метод Харберта основан на прямом вычислении составов жидкости и га-
за, уходящих с каждой тарелки, по предполагаемым соотношениям между
жидкостью и газом и температурам на всех тарелках колонны. Проверка
предположительно принимаемых температур осуществляется составлением ма-
териального и теплового балансов по каждой тарелке.
Расчет абсорбции углеводородных газов по методу Мак-Нисса ведется на
электронно-вычислительных машинах путем составления материального и теп-
лового балансов по тарелкам. Для легких компонентов расчет ведется сверху
вниз, а для тяжелых — снизу вверх по аппарату. Так поступают, чтобы как-то
учесть неравномерность поглощения компонентов по высоте аппарата.
В методе Аткинса и Франклина предлагается графический способ опре-
деления числа теоретических тарелок. Необходимые равновесные соотноше-
ния определяются по эмпирическим формулам.
Предложены и другие комбинированные методы расчета абсорбции угле-
водородных газов, использующие в качестве ориентировочных заданий пока-
затели, получаемые по методу Кремсера — Брауна или по другим эмпириче-
ским допущениям (методы Ландеса и Белла, Донела и Дрепера, Парека,
Шелтона, Трейбелла и Мэддокса).
Разработаны и отечественные методы расчета многокомпонентной углево-
дородной абсорбции. Уместно назвать методы Пономарева, Платонова и Бер-
го, Марушкина, Судакова и Кузнецова и др.
Ниже приведены методика и рекомендации по расчету абсорбционно-де-
сорбционной (абсорбционно-отпарной) колонны для разделения углеводород-
ных газов; методика и рекомендации по расчету холодильника абсорбента ус-
тановки низкотемпературной абсорбции.
АБСОРБЦИОННО-ОТПАРНАЯ КОЛОННА ДЛЯ РАЗДЕЛЕНИЯ
УГЛЕВОДОРОДНЫХ ГАЗОВ
Исходные данные
Рассчитать абсорбционно-отпарную колонну (АОК) абсорбционной уста-
новки, работающей по схеме «Абсорбер — АОК — Десорбер». Состав питания
АОК (насыщенный абсорбент из абсорбера) приведен в табл. 3.1. Произво-
дительность аппарата по сырью 6 = 87000 кг/ч.
Таблица 3.1. Состав питания АОК
Углеводород Содержание с'., мольн. доли Углеводород Содержание мольн. доли
сн4 0,2567 С6Н14 0,0254
с2н6 0,2400 с7н16 0,0431
с3н8 0,1184 с8н!8 0,0543
U-C4HI0 0,0289 С9Н2С 0,0843
H-C4HLG 0,0344 С[оН22 0,0844
a-CsH[2 0,0178 —
Н-С5Н12 0,0123 2 1,0000
84
Рис. 3.1. Расчетная схема АОК.
Схема материальных потоков абсорбци-
онно-отпарной колонны показана на рис.
3.1.
Углеводородное сырье в количестве G
поступает в АОК для выделения метан-
этановой фракции.
Аппарат состоит из верхней абсорбци-
онной и нижней отпарной (десорбционной)
частей.
В абсорбционной части из газовой фазы,
выделенной из сырья жидким поглотите- } <
лем, подаваемым в верхнюю часть аппара-
та в количестве La, абсорбируются преиму-
щественно углеводороды С3Н3 и более тя-
желые, а также некоторое количество лег-
ких углеводородов.
В отпарной части из жидкой фазы (за
счет подачи в низ аппарата нагретого де-
сорбента в количестве IT) выпариваются
преимущественно легкие углеводороды СН<
и С2На, а также некоторое количество тя-
желых углеводородов.
Обе части АОК работают сопряженно,
чтобы из верха аппарата получить метан-
этановую фракцию в количестве Vi, а из
его низа — абсорбент £а, насыщенный про-
паном и более тяжелыми углеводородами
в количестве S/m,.
Расчет
1. Принятые условия разделения. На основании промышленной практики
принимаются следующие исходные данные: коэффициент извлечения пропана
по аппарату <роз=О,9; давление в аппарате л=2,45 МПа; температура сырья
по его подаче в АОК t/=5 °C; температура тощего абсорбента, подаваемого
в верхнюю часть АОК 10°С; число теоретических тарелок: в абсорб-
ционной части АОК А7а = 8. в десорбционной части Мд=10.
2. Составы и количества жидкой и газовой фаз сырья при его подаче в
АОК. Если питание поступает в АОК в газожидком состоянии, то фазовое
состояние должно описываться неравенствами
12 12 ,
2^->‘ 2тг>’
I 1
в которых Ki — константы фазового равновесия компонентов, определяемые
по номограмме [27, с. 159].
Расчет, приведенный в табл. 3.2, подтверждает двухфазное газожидкостное
состояние питания АОК-
При известных температуре и давлении доля газовой фазы питания нахо-
дится расчетом мольной степени (доли) отгона по уравнению:
12 12 ,
2 Х'^ = 2 1+е'(Аг— 1) = 1
1 1
где х'ц — мольная доля i-го компонента в жидкой фазе сырья; е’ — мольная
доля отгона сырья.
Расчет, выполненный методом последовательного приближения, показы-
вает, что е'=0,235.
85
Таблица 3.2. Расчет фазового состояния потоков АО К
Компонент Kj при t, = 5 °C л = 2,45 МПа Kic'i »' (К,-1) = = 0,235х X 1)
сн4 5,8 0,2567 1,49 0,045 1,13
С2н6 1,05 0,2400 0,252 0,228 0,0118
СзН8 0,29 0,1184 0,034 0,412 —0,1660
U-C4H10 0,13 0,0289 0,004 0,222 —0,2040
Н-С4Н10 0,085 0,0344 0,003 0,405 —0,2140
М-С5Н12 0,046 0,0179 0,0008 0,390 —0,2250
Н-С5Н12 0,025 0,0123 0,0003 0 495 —0,2380
С6н14 0,0088 0,0254 0,0002 2,900 —0,2330
С7н16 0,0032 0,0431 0,0001 13,500 —0,2350
С8Н18 0,0015 0,0543 0,00008 36,300 —0,2350
С9Н20 0,4-108 0,0843 0,032-10-в 0,2110-е —0,2350
С]0Н22 0 0,0844 0 СО —0,2350
2 — 1,0000 >1 >1 —
П родолжение
Компонент I + е' X X (К;-1) = = 1 + 0,235 X X (Лг—1) xfi = c'i y'fi = = 1500c-p кмоль/ч =1147,5x^-, кмоль/ч v!i = =325,51/ fi, кмоль/ч
1+235(Лг--1)
сн4 2,13 0,1210 0,702 385 138,9 246,1
С2н6 1,012 0,2380 0,250 360 272,0 88,0
0,834 0,1420 0,041 177,4 162,9 14,5
W-C4H10 0,796 0,0364 0,005 43,3 41,5 1,8
Я-С4Н10 0,786 0,0438 0,004 51,6 50,1 1,5
Z/-C5H12 0,775 0,0231 0,001 26,8 26,4 0,4
Н-СйН12 0,762 0,0161 0,0004 18,5 18,4 0,1
С6Н,4 0,767 0,0331 0,0003 38,1 38,0 0,1
С7Н|6 0,765 0,0563 0,0002 64,6 64,6 0
с8н18 0,765 0,0710 0,0001 81,7 81,7 0
С9Н20 0,765 0,1100 0 126,4 126,4 0
С10Н22 0,765 0,1008 0 126,6 126,6 0
2 — 1,0016» 1 1,004»! 1500,0 1147,5 -352,5
Количества каждого компонента в сырье и еп? жидкой и газовой фазах
определяются по формулам:
hi + vft =G'ct' lfi = 0 —e')G'x’fi _vfi =e'G'y'fi
где G' — количество питания, кмоль/ч.
G' = G/M.
(At— мольная масса сырья)
12
M. = '^Mici’ = 16 0,2567 + 30-0,24 + 44-0,1184 + 58-0,0344 +
1
+ 72-0,0179 + 72-0,0123 + 86-0,0254+ 100-0,0431 +
+ 114-0,0543+ 128-0,0843+ 142-0,0844 = 58
86
Подстановка в формулы известных числовых значений величин дает сле-
дующие результаты:
87 000
G = —gg— = 1500 кмоль/ч
lfi + Vfi = 1500с/
lfi =(1 —0,235) 1500х'м = 1147,5х'/г
vfi = 0,235 • 1500ц'fi = 352,5y'fi
Расчет количеств каждого компонента (см. табл. 3.2).
3. Материальный баланс абсорбции и десорбции. Коэффициент извлечения
пропана при абсорбции <р'з=0,95 принимается на основе практических дан-
ных. Так как общий коэффициент извлечения пропана по аппарату задан и
равен фоз=0,9, то коэффициент извлечения пропана при десорбции рассчиты-
вается по преобразованной формуле [28, с. 30]:
„ __ Фоз (Ifa + Щз) — Uft + г7зФз') _
Фаз (^/з + vfs) Фз (//з "/зФз )
0,9(162,9+ 14,5) —(162,9+ 14,5-0,95)
~ 0,9(162,9+ 14,5)0,95 —(162,9+ 14,5-0,95) ~ 0,68
Средняя температура в абсорбционной части АОК принимается равной
/а—Ю °C.
Знание коэффициента извлечения пропана при абсорбции и числа теорети-
ческих тарелок в абсорбере Аа = 8 позволяет определить по диаграмме Крем-
сера (см. Приложение, рис. П.З), фактор абсорбции для пропана Аз=1,2.
Значения факторов абсорбции для остальных углеводородов питания АОК
находятся из соотношения
+ = A3KaIKt
При этом значения констант фазового равновесия определяются по но-
мограмме [27, с. 159] при температуре /а=10°С и давлении л=2,45 МПа.
По диаграмме Кремсера при Аа = 8 и найденных значениях А, определя-
ются коэффициенты извлечения всех углеводородов питания АОК, кроме
принятого ранее ф'з=0,95. Все расчеты сведены в табл. 3.3, из которой вид-
Таблица 3.3. Расчет коэффициентов извлечения
Компонент Абсорбция при / = 10 °C и л = 2,45 МПа Десорбция при /д = 140 °C и л = 2,45 МПа
Кг А. i f’i S. 1 (₽z
сн4 6 0,066 0,066 10,1 3,13 1
СгНб 1,12 0,35 0,35 4,6 1,42 0,99
с3н8 0,33 1,2 0,95 2,2 0,68 0,68
W-C4H10 0,15 2,63 1,00 1,4 0,43 0,43
Н-С4Н10 0,10 3,96 1,00 1,1 0,34 0,34
W-CgH(2 - 0,04 9,9 1,00 0,62 0,19 0,19
К-С5Н12 0,031 12,8 1,00 0,58 0,18 0,18
С6н,4 0,011 35,9 1,00 0,31 0,096 0,096
С?н16 0,004 99 1,00 0,17 0,053 0,053
С8Н,8 0,0019 208 1,00 0,10 0,031 0,031
С9Н20 0,0007 565 1,00 0,05 0,016 0,016
+0Н22 0 1,00 0,026 0,008 0,008
87
но, что компоненты питания АОК, которые тяжелее пропана, полностью изв-
лекаются при абсорбции.
Знание коэффициента извлечения пропана при десорбции <р"=0,68 и чис-
ла теоретических тарелок в десорбере Ад=10 позволяет определить по диа-
грамме Кремсера фактор десорбции пропана 5з=0,68. Значения факторов де-
сорбции для остальных углеводородов питания АОК определяются из соот-
ношения:
S, = S3Ki' !К3'
Принимается средняя температура в десорбционной части аппарата /д =
= 140 °C. При этой температуре и давлении л=2,45 МПа по номограмме
[27, с. 159] определяются константы фазового равновесия углеводородов.
По диаграмме Кремсера при Л’д=10 и найденных значениях S, определя-
ются коэффициенты извлечения <р", всех углеводородов, кроме пропана, для
которого ф"3=0,68. Все величины см. в табл. 3.3. Количества каждого ком-
понента в соответствующих потоках определяются из следующих уравнений,
полученных подобно тому, как это было
см. на рис. 3.1):
_ frti 4~ 0 — Ф/)
~ 1 _ф;'фг"
(Ifi + VfiVi') Vi’
Vci 1—фг'фг"
сделано в работе [28] (схему АОК
Ifni = Ifi 4" Vfi t'li
lei ~ vci 4~ Imi
vbi — v/i 4" vci lbi — vbi vii lei Ifi
Суммирование соответствующих количеств компонентов позволяет полу-
чить величины потоков АОК, приведенные в табл. 3.4.
Коэффициент извлечения этана по аппарату равен:
4,02 = If^ + vfi = 272 + 88 0,0125
а количество извлеченного этана в долях от количества пропана составляет:
4,5-100
159,7 ~2,8%
что меньше допустимого числового значения. Если эту величину желательно
уменьшить, следует задаться большим коэффициентом извлечения пропана
<р'з при абсорбции, что повысит коэффициенты извлечения пропана <р"3 п эта-
на <р"2 при десорбции.
Между абсорбционной и десорбционной частями аппарата рециркулиру-
ют при установившемся режиме потоки компонентов в жидкой R"i и паровой
R'i фазах [29]. Расчет этих потоков дан в табл. 3.4. Следует указать на не-
обходимость выбора такого режима работы АОК, при котором рециркули-
рующие потоки будут оптимальными и соответствующими минимальным ка-
питальным и эксплуатационным расходам на АОК.
Расчеты составов потоков сделаны на основе данных, приведенных в
табл. 3.4, и представлены в табл. 3.5.
Мольные массы потоков рассчитаны по известному правилу аддитивности
и приведены в табл. 3.6.
Количество тощего абсорбента рассчитывается по формуле-.
з
Аа* = Ухг-
где А3 — фактор абсорбции пропана (см. табл. 3.3); Кз — константа фазового
равновесия пропана при средней температуре абсорбции /а=10°С (см.
з
табл. 3.3); — количество сухого газа, кмоль/ч (см. табл. 3.4).
88
Таблица 3.4. Количества потоков АОК
Компонент кмоль/ч Vfi’. кмоль/ч фг- 1-<р- 1-ф" / п 1—<Рг-Ф; , п кмоль/ч кмоль/ч = !fi +
сн4 138,9 246,1 0,066 1 0,934 0 0,066 0,934 138,9 16,2 155,1
С2н6 272,0 88,0 0,35 0,99 0,65 0,01 0,347 0,653 270 30,8 302,8
с3н8 162,9 14,5 0,95 0,68 0,05 0,32 0,646 0,354 110,8 13,8 176,7
U-C4H10 41,5 1,8 1 0,43 0 0,57 0,43 0,57 17,8 1,8 43,3
Н-С4Н10 50,1 1,5 1 0,34 0 0,66 0,34 0,66 17,0 1,5 51,6
W-C5H12 26,4 0,4 1 0,19 0 0,81 0,19 0,81 5,0 0,4 26,8
н-С5Н12 18,4 0,1 1 0,18 0 0,82 0,18 0,82 3,3 0,1 18,5
С6Н14 38,0 0,1 1 0,096 0 0,904 0,096 0,904 3,65 0,1 38,1
с7н16 64,6 0 1 0,053 0 0,947 0,053 0,947 3,40 0 64,6
с8н|8 81,7 0 1 0,031 0 0,969 0,031 0,969 2,53 0 81,7
С9Н20 126,4 0 1 0,016 0 0,984 0,016 0,984 2,03 0 126,4
С10Н22 126,6 0 1 0,008 0 0,992 0,008 0,992 1,02 0 126,6
S 1147,5 352,5 — — — — — — 575,43 64,7 1212,2
<О
О
Компонент Fa = vfi + + ‘fi'f'i' кмоль/ч vii = . Fa (-<₽/) 1 = Z/i + + vti~vii> кмоль/ч vei = Fn'f'i
/ и ’ !— 4'1%' кмоль/ч кмоль/ч
сн4 385 385 0 166
с2н6 358 355,5 4,5 457,2
с3н8 125,3 17,7 159,7 339,5
U-C4H10 19,6 0 43,3 32,6
Н-С4Н10 18,5 0 51,6 26,5
и-С5Н12 5,4 0 26,8 6,3
k-CsHi2 3,4 0 18,5 4,06
с6н14 3,75 0 38,1 4,04
С7Н15 3,40 0 64,6 3,61
с8н,8 2,53 0 81,7 2,61
С9Н20 2,03 0 126,4 2,06
СюН22 1,02 0 126,6 1,02
2 927,93 758,2 741,8 1045,50
Продолжение табл. 3.4
hi ~vci~rhni> кмоль/ч vbi = КМОЛЬ/ч 1ы = -vbi~vii, кмоль/ч R; — . ' " » 1 кмоль/ч ,, _ (‘ft+VfiVi) Wi КМОЛЬ/Ч
166 412,1 27,1 27,1 11
461,7 545,2 189,7 190,0 160,5
499,2 354,0 336,3 228,7 322,5
75,9 34,4 34,4 14,7 32,5
78,1 28,0 28,0 9,5 26,5
33,1 6,7 6,7 1,26 6,3
22,56 4,16 4,16 0,75 4,1
42,14 4,14 4,14 0,40 4,03
68,21 3,61 3,61 0,19 3,60
84,31 2,61 2,61 0,081 2,60
128,46 2,06 2,06 0,033 2,05
127,62 1,02 1,02 0,008 1,02
1787,30 1398,00 639,80 472,70 576,7
Таблица 3.5. Расчет состава потоков АО К
Компонент хп (см. табл. 3.2) «Н (см. табл. 3.2) yfi 2о1г *mi ~ *mi
сн« 0,1210 0,7020 0,507 0
с2н6 0,2370 0,2500 0,469 0,006
С3Н8 0,1420 0,0410 0,024 0,215
0,0364 0,0050 0 0,059
0,0438 0,0040 0 0,069
0,0231 0,0010 0 0,036
0,0161 0,0004 0 0,025
С6Н,4 0,0331 0,0003 0 0,052
С7Н1б 0,0563 0,0002 0 0,087
CgHia 0,0710 0,0001 0 0,110
С9Н20 0,1100 0 0 0,170
С10Н22 0,1108 0 0 0,171
S 1,0006-1 1,004^1 1,0 1,0
Продолжение
Компонент ' vbi Уы- Svbi ' ‘bi ХЫ- Xlbi ' V cl ycl - £vci Xci- 2Zci
сн4 0,2940 0,0422 0,1590 0,0930
с2н6 0,3900 0,2960 0,4360 0,2580
с3н8 0,2530 0,5260 0,3250 0,2800
0,0245 0,0538 0,0311 0,0425
W-C4H10 0,0200 0,0438 0,0253 0,0436
U-C5HI2 0,0048 0,0105 0,0060 0,0185
Н-С5Н12 0,0030 0,0065 0,0040 0,0126
С6Н14 0,0029 0,0065 0,0040 0,0236
с7н16 0,0026 0,0056 0,0035 0,0382
CjFhe 0,0019 0,0041 0,0025 0,0473
C9H2Q 0,0015 0,0032 0,0020 0,0720
С|оН22 0,0007 0,0016 0,0010 0,0712
S 1,0 1,0 1,0 1,0
Подстановка числовых значений дает:
ЬЛ1 = 1,2-0,33-758,2 — 300 кмоль/ч
Таблица 3.6. Мольные массы потоков
Поток StF. . b 1 *bi *>Ci *cl
Мольная масса 69,3 21,2 23,3 93,2 31,9 41,9 35-,3 59,2
91
При расчете принимается абсорбент следующего состава, % (мольн.):
Свнм С;Н16 С.0н22
8,8 14,8 18,7 . 28,8 28,9
Мольная масса абсорбента равна:
5
Л1а Mix'll =86-0,088+ 100-0, 148+ 114-0,187 +
1
+ 128-0,288 + 142-0,289 = 122
Количество абсорбента, подаваемого на верх АОК:
Ga = LaM., = 300-122 = 36600 кг/ч
Удельный расход абсорбента (в кг на кг газа) рассчитывается по формуле:
vbi
1
12
где^п*,— суммарное питание абсорбционной части (см. табл. 3.4); М„ъ —
1
мольная масса суммарного питания (см. табл. 3.6).
Удельный расход абсорбента равен:
36 600
6 = 31,9-1398 = 0,82 КГ/,КГ
4. Температурный режим десорбционной части. Температура верха десорб-
ционной части рассчитывается при помоши уравнения изотермы паровой фа-
зы, покидающей верхнюю десорбционную тарелку
12
У ci __ .
Kt
1
Значения у'а см. в табл. 3.5.
После нескольких попыток эта температура принимается равной /ВД = 85°С.
Результат расчета температуры верха десорбционной части аппарата по урав-
нению изотермы представлен в табл. 3.7
Температура +д низа десорбционной части находится по уравнению изо-
термы жидкой фазы потока, уходящего из низа АОК:
12
y^lX'Ll = 1
2
где х'Li — мольная доля компонента в потоке (La+21mi) определена в
табл. 3.8.
92
Таблица 3.7. Расчет температуры верха десорбционной части
Компонент при ‘в. Д=«5°с- л=2,45 МПа Ki
сн4 0,1590 9,50 0,0167
С2н6 0,4360 3,35 0,1300
СзН8 0,3250 1,40 0,2320
11-С4Н10 0,0311 0,73 0,0423
/<-С4Н10 0,0253 0,58 0,0436
»-CsHi2 0,0060 0,26 0,0230
rt-CsHi2 0,0040 0,25 0,0160
СбН14 0,0040 0,13 0,0307
С?Н16 0,0035 0,055 0,0638
CgHis 0,0025 0,030 0,0835
С9Н20 0,0020 0,013 0,1530
С10Н22 0,0010 0,0048 0,2080
1,0000 — 1,04® 1
Знание количества абсорбента и его состава (см. с. 92) позволяет найти
часовое количество каждого компонента в абсорбере:
Л'св = 300-0,088 = 26,4 кмоль/ч
L'c7 = 300-0,148 = 44,4 кмоль/ч
L'ca = 300-0,187 = 56,1 кмоль/ч
L'c9 = 300-0,288 = 86,4 кмоль/ч
£'с1;) = 300 0,289 = 86,7 кмоль/ч
Мольная масса потока (La+S/mi-) рассчитана в табл. 3.8.
После предварительных попыток принимается температура /;1Д=200оС.
Расчет температуры низа десорбционной части аппарата по уравнению изо-
термы жидкой фазы приведен в табл. 3.8. Состав пара (десорбента) из
кипятильника АОК и его мольная масса также рассчитаны в табл. 3 8.
Теперь проверяется ранее принятая средняя температура в десорбционной
части. Так как согласно сделанным выше расчетам температура верха этой
части АОК ^в.д=85°С,
равна:
/д -
Расхождение с принятой температурой /д=140°С находится в допустимых
пределах.
5. Тепловой баланс абсорбционной части АОК. По принятой средней тем-
пературе абсорбции /а = 10°С и температуре тощего абсорбента, подаваемого
на верх абсорбера <ьа =—10°C, определяется температура /на насыщенного
абсорбента, стекающего с нижней тарелки абсорбера-.
а ^La + Ач.а
— 2
откуда
*я.а = 2*а - *La = 2-10 - (-10) = 30°C
а низа /н.д = 200 С, то средняя расчетная
температура
tB д + t„ д 85 4- 200
ДТ -Д- =--------я----- = 142,5 °C
Определяется избыточное тепло абсорбции, которое должно быть отведено
из абсорбера для поддержания в его нижней части температуры /н.а=30°С.
Таблица 3.8. Расчет температуры, низа десорбционной части
Компонент кмоль/ч (см. табл. 3.4) 4 кмоль/ч Li+lmi’ кмоль/ч Х‘Г ‘i^mi *Li при /„.д-аооое, л^2,45 МПа =A'i xLi Alf y'u
сн4 0 0 0 0 16 0 13 0 0
С2н6 4,5 0 4,5 0,0044 30 0,132 6,2 0,0273 0,82
СзН8 159,7 0 159,7 0,1536 44 6,750 3,6 0,5530 24,40
w-C$H io 43,3 0 43,3 0,0416 58 2,400 2,4 0,0998 5,79
Я-С4Н10 51,6 0 51,6 0,0497 58 2,860 . 2,0 0,0994 5,77
U-C5H12 26,8 0 26,8 0,0257 72 1,860 1,2 0,0308 2,22
Н-С5Н12 18,5 0 18,5 0,0178 72 1,280 1,1 0,0196 1,42
С6Нц 38,1 26,4 64,5 0,0620 86 5,330 0,7 0,0434 3,73
С7Н,6 64,6 44,4 109,0 0,1050 100 10,500 0,42 0,0441 4,41
С8Н18 81,7 56,1 137,8 0,1324 114 15,100 0,28 0,0371 4,23
С9Н20 126,4 86,4 212,8 0,2050 128 26,200 0,15 0,0308 3,96
С10Н22 126,6 86,7 213,3 0,2060 142 29,200 0,10 0,0206 2,93
2 741,8 300,0 1041,8 1,003^1 — 101,6 — 1,0059s! 59,7*
* В данном случае
Рис. 3.3. Схема для расчета теплового баланса десорбера.
2^
«7
теплового баланса абсорбера.
Для этого используется уравнение теплового баланса абсорбера (рис. 3.2):
Qvf + Q.vc + Q' ia = Qoi + Qib + Q'j-a + Qo
где Qo — избыточное тепло абсорбции, кВт.
Количество тепла Q (кВт) соответствующего потока рассчитывается по
формуле:
Q = G///3600
где G — расход, кг/ч; Н — энтальпия, кДж/кг.
Энтальпия потоков определяется по графику [30, с. 11].
Расчет теплового баланса АОК дан в табл. 3.9; избыточное тепло абсорб-
ции QO=2541 кВт должно отводиться из аппарата за счет промежуточного
охлаждения абсорбента.
6. Тепловой баланс десорбционной части АОК. Для отгонки от абсорбента
легких углеводородов (в основном метана и этана), поглощенных им в аб-
сорбционной части, в низ десорбера необходимо подать тепло Q.,, количест-
во которого определится из уравнения теплового баланса (рис. 3.3):
Qif + Qib + Q'ia + <Эд = Qvc + Qz.a
где Qa — тепло десорбции, кВт.
Как видно из данных, приведенных в табл. 3.10, в низ десорбера необхо-
димо подавать тепло Qu—18486 кВт. Это тепло вносится в десорбер парами
(десорбентом), которые выделяются из нижнего продукта десорбера при его
частичном испарении (/„.я=200°С) в кипятильнике АОК. Состав и мольная
масса этих паров рассчитаны в табл. 3.8. Без большой ошибки можно при-
нять, что пары эти будут соответствовать бутану, а их количество опреде-
лится так:
3600Qa 3600-18357,5
#200—^00 = 985 — 737,4 = 266 000 кг/4 = 266 т/ч
где //2оо = 985 кДж/кг — энтальпия паров бутана при /нд=200сС и л=
= 2,45 МПа; /г2(М=737,4 кДж/кг — энтальпия нижнего продукта АОК при
/к.д=200°С (см. табл 3.10).
95
Таблица 3.9. Тепловой баланс абсорбционной части АОК
Обозначение материального потока (см. рис. 3.2) Коли- чество G', кмоль/ч (см. табл. 3.4) Мольная масса A1i (см. табл. 3.7) Коли- чество G, кг/ч Темпе- ратура 1, °C Энтальпия “г- кДж/кг Обозна- чение теплового потока (см. рис. 3.2) Коли- чество тепла Q. кВт
Приход 352,5 21,2 7473 5 402 Qvf 835
'LVc 1045,5 35,3 36906 85 595 Qvc 6100
300,0 122,0 36600 —10 250 2550
у 1698,0 — 80979 — — 9485
Расход
Sfi 758,2 23,3 17666 —5* 418 2050
2/ь 639,8 41,7 26680 30* 201 1494
Да 300,0 122,0 36600 30* 335 Q'La 3400
Всего — — — — — 6944
— — — — — — 2541**
2 1698,0 — 80946 — — — 9485
* Принято.
** Поток, вычисляемый по разности с приходом.
Таблица 3.10. Тепловой баланс десорбционной части АОК
Обозначение материального потока (см. рис. 3.3) Коли- чество, кмоль/ч (см. табл. 3.4) Мольная масса (см. табл. 3.5) Коли- чество, кг/ч Тем- пера- тура t. °C Энталь- пия, кДж/кг Обозна- чение теплового потока (см. рис. 3.3) Коли- чество тепла, кВт
Приход 2Л 1147,5 69,3 79522 5 200 4400
639,8 41,7 26680 30 201 % 1494
и 300,0 122,0 36600 30 335 Q' La 3400
Всего 2087,3 — 142802 — —- — 9294
— — — — — <2д 18486*
S 2087,3 — 142802 — — — 27780
Расход 1045,5 35,3 36906 85 595 6100
1041,8 101,6 105847 200 737 21680
S 2087,3 — 142753 — — — 27780
* Поток, вычисляемый по разности с расходом.
Из анализа предыдущих расчетов следует, что такой сравнительно боль-
шой расход паров десорбента объясняется:
низкой средней температурой в абсорбере;
большим перепадом температур по высоте десорбера (115 °C);
высокой степенью извлечения при абсорбции самых легких углеводородов;
большими потоками рециркулятов (см. табл. 3.4).
Разумеется, указанные факторы взаимосвязаны.
7.Число рабочих тарелок АОК. Для АОК принимаются решетчатые тарел-
ки провального типа. При этом число рабочих тарелок находится по формуле
Ар = Ат/т|т
где Ат — число теоретических тарелок; т;т — к. и. д. (коэффициент эффектив-
ности) рабочей тарелки.
Ввиду отсутствия надежных методов расчета эффективности тарелок абсор-
беров и десорберов и с учетом данных, приведенных в работе [31, с. 217],
для тарелок абсорбционной части принимается г], а = 0,3, а для тарелок де-
сорбционной (отгонной) части г]т.л=0,4.
Тогда число рабочих тарелок составит:
для абсорбера
8
^Р-а ~ 0,3 = 27
для десорбера
10
Ард — од —25
8. Промежуточное охлаждение абсорбента. Так как температурный ре-
жим абсорбции был принят, необходимо определить температуру насыщенно-
го абсорбента в нижней части абсорбера при условии, что найденное раньше
избыточное тепло из него отводиться не будет. Для этого записывается урав-
нение теплового баланса:
Qo = 4- 1ь) а (htK
где hi к—энтальпия насыщенного абсорбента при искомой температуре /к,
когда избыточное тепло Qo не будет отводиться, кДж/кг; /г3о — то же, при
температуре низа абсорбера /н.а = 30°С, кДж/кг; А4н.а — мольная масса насы-
щенного абсорбента в нижней части абсорбера, определяемая по формуле:
L
Ми., = Ма -------+ Mt ------------^5— =
La + ^lb b La + ^lb
300 ,, „ 639,8
-= 122 300 + 639,8 + 41 ’7 300 + 639,8 ~ 67
Тогда
. , Qo 2541-3600
= 30 + "(z.a + 2zfe) = + <30’° + 639-8)'67 = 400 кДж/кг
Этой энтальпии соответствует температура fK=95°C. При расчете промежу-
точного охлаждения абсорбента в любом расчетном объеме абсорбера долж-
на быть выдержана ранее принятая средняя температура абсорбции. Для
этого расчётом определяются те тарелки, на которых температура превышает
Ли=30°С, вследствие чего требуется охладить абсорбент
Методика такого графоаналитического расчета приведена в работе [17,
с. 65]. Однако ниже дается менее трудоемкий аналитический расчет ,
7—640
Количество газа (в кмоль/ч), уходящего с любой Л'-й тарелки абсорбера,
легко определить по следующей формуле, которая получается из уравнения
Хортона — Франклина [32, с. 166] путем несложного преобразования: t
2 v-- = гл-1
где Гс= (Sni/Sti6)1/Jvp.a —коэффициент сокращения количества газа по высо-
те абсорбера.
Имеем
/ 758,2 \i,2’ Л
ГС=(П398-) =0-977
Тогда
V _ 758,2
2^VN~ 0,977'v—1
Температура на любой тарелке абсорбера определяется из уравнения
[32, с. 166]:
tK-tN
откуда
1 — Гс^Р-3-
tN = tk — (tK — ZLa) ] _ г Л-р a
После подстановки числовых значений:
1 — 0,97727_n „ 1 —0,97727~'v
/дг = 95 [95 — ( 10)] J____ 0,97727 —0,464
Теперь определяется номер тарелки (считая от верха аппарата), на кото-
рой насыщаемый абсорбент будет иметь заданную температуру:
1g
Гс^Р-а_____
(1-гМ
tK-tLa U Гс 7
1g Гс
Для дальнейших расчетов необходимо знать мольную массу насыщаемого
абсорбента на любой тарелке абсорбера. Она определяется по формуле:
L. 2'»
Afy - Л1а + М1Ь у .
• + Zj W
где М/в=41,7 — мольная масса поглощенных углеводородов (см. табл. 3.6);
в целях упрощения расчетов она принимается постоянной по всей высоте аб-
сорбера; S/n=Son+i—— количество поглощенных углеводородов, поки-
дающих N-io тарелку аппарата.
8.1. Расчет первого промежуточного охлаждения абсорбента. Определяется
номер тарелки абсорбера, на которой температура насыщенного абсорбента
98
будет равна максимально допустимой /н.а=30°С.
0.97727
95 — 30
[1-95^-(-П0)-(<-0.97727)
Следовательно, с 14-й тарелки абсорбент необходимо выводить на охлаж-
дение. При этом температура его /и равна:
1___ 0.97727-14
/14 = 95 105 ]____о,97727 = 3^
Определяется мольная масса Л414 насыщаемого абсорбента, выводимого с
14-й тарелки абсорбера:
14
01 ~ Гс14
t'l =
758,2
= Q 97714 — 758,2 = 292 кмоль/ч
300 292
Л114 — 122 зоо_^ 292 + 41,7 300 + 292 ~82
Количество насыщенного абсорбента, выводимого с 14-й тарелки:
Z.J4 = /14 + La = 292 + 300 = 592 кмоль/ч
Количество тепла, снимаемого в первом промежуточном холодильнике при
охлаждении абсорбента от температуры /14 = 34 °C до его начальной темпе-
ратуры /'14=—10 °C:
Qi = LltM 14 (/гз4 — Л-ю) = 592 82 (286 — 188) = 4 800 000 кДж/ч = 1340 кВт
В результате отвода найденного количества тепла от абсорбента на 14-й
тарелке температура в нижней части абсорбера будет равна /К1.
Температура /К1 рассчитывается через ht^.
Qo — Q, „ (2541 — 1340) 3600
- V ib\ м ~254 + (30° + 639 >8) 67 = 322 кЦж'кг
— Л30 +
По графику [30, с. 11] найдем /К1=65°С.
Поскольку эта температура превышает расчетную /Яа=30°С, необходимо
рассчитать второе промежуточное охлаждение абсорбента.
8.2. Расчет второго промежуточного охлаждения абсорбента. Аналогично
расчету первого промежуточного охлаждения абсорбента получаем:
0,97727
65 — 303
1-+5^263-(1-0'97727)
1g 0,977
1g
N =
= 17
Следовательно, температура на 18-й тарелке будет выше, чем /я.а=30°С,
и равна:
1___о 97727-и
/18 = 65 - [65 (-10)] • } _ о 977-27- = 35 °C
7*
99
Количество насыщенного абсорбента, выводимого с 18-й тарелки, и его
мольная масса равны:
2 zie=2 °19=2Vi = _ Di =
758,2
= Q — 758,2 = 392 кмоль/ч
300 392
71418 = 300+ 392 ‘122+ 300+ 392 ‘41,7 = 77
Количество абсорбента составляет:
Lle = ^1в + £а = 392 + 300 = 692 кмоль/ч
Количество тепла, снимаемого во. втором холодильнике, равно:
Qn = L]8Al18(/i35—й_10) =692-77(272— 188) = 4 400 000 кДж/ч = 1210 кВт
Температура низа абсорбера равна:
, , Qo — Qi — Qu
+к-«зо+ -Г V / \ лл "
hj ^н.а
(2541 — 1340 — 1210) 3600
= 254 + (300 + 639,8) 67 = 259 кДж/кг
По графику [30, с. И] определяется /к2=30,5°С. Эта температура мало
отличается от ранее установленной +а = 30°С. Следовательно, двухступенча-
тое промежуточное охлаждение абсорбента позволяет поддерживать необхо-
димую температуру в нижней части абсорбера.
9. Диаметр абсорбционной части АОК. Диаметр колонны определяется по
формуле: ____
1/4И
D^~ У лш
где V — количество газа под нижней тарелкой абсорбера, м3/с; w— расчетная
скорость газа в колонне, м/с.
Для расчета секундного объема газа надо знать его температуру. Так как
этот поток газа складывается из газового питания Sv/ = 352,5 кмоль/ч (см.
табл. 3.4) с температурой 1/ = 5°С и газов отпарки 2пс = 1045,5 кмоль/ч (см.
табл. 3.4) с температурой +Д=85°С (см. табл. 3.7), то искомая температу-
ра без большой ошибки определяется так:
2 "S р^в.д vf 7в-д 2 Vc
= 2»,+2- " “
5-352,5 + 85-1045,5 „
=----------1398-------= 65 °С
где 2t>6=1398 кмоль/ч — количество газа, поступающего на абсорбцию (см.
табл. 3.4).
Объем газа равен:
^^-22,4(+й + 273)-0,1 1398-22,4(65_Н-273) 0,1 з
V = 3600-273-л = 3600-273-2,45 =0,435 м3/с
100
Расчетная скорость газа для колонны с решетчатыми тарелками находит-
ся по уравнению [31, с. 206]:
у = 20 ехр (—4х)
где
_ w* Рп / Нж У116
У №^э<Рса ‘ Рж \ Ив /
/ £ Х8.28 / Рп \0'125
* “Д С ) Рж )
При этом К — коэффициент, представляющий отношение рабочей скорости
газа к скорости захлебывания, принят равным 0,8 [31, с. 206]; da — эквива-
лентный диаметр щелн тарелки
2аЬ 2-0,1-0,006
= a-f-b ~ 0,1 +0,006 =0-0113 м
причем а=0,1 м — длина, а 6=0,006 м— ширина щели (принимаются); <рс=
= 0,2 — свободное сечение тарелки, м2/м2; рж — плотность жидкости (насы-
щенного абсорбента) в расчетном сечении, имеющей мольную массу Л4на =
= 67,8; с целью упрощения расчета принимается, равной плотности пентана
при температуре /я.а=30°С, т. е. составляет 616,3 кг/м3 [33, с. 202]; рп —
плотность газа в расчетном сечении при температуре /Ой=65°С:
MVb 273л 31,9-273-2,45
Рп 22,4 (tVb + 273) 0,1 = 22,4 (65 + 273) = 28,6 кг/м’-
— вязкость жидкости (насыщенного абсорбента) в расчетном сечении при
температуре +а=30°С, принимаемая (как для пентана) равной цж=2,2-
•10-4 Па-с [33, с. 204]; — вязкость воды при 20°С, равная цв=
= 110-3 Па-с [33, с. 55];
£ = ^£а + V ib] Ми а = (300 + 639,8) 67,5 = 63 300 кг/ч
G = MVb vb = 31,9-1398 = 44 500 кг/ч
L 63 300
"7Г = ~4450(Г = *’42 кг/кг
Подстановка этих данных в расчетные уравнения дает следующие ре-
зультаты:
/ 28,6 \0,12Б
х = l,42°,28l -g-16y- =0,74 у = 20ехр(-4-0,74) =1,025
w1 28,6 / 2,2-10-4 18
1,025 = 0,82-9,81-0,0113-0,22‘ 616,3 1-Ю-3 ) = 12,8
откуда и = 0,285 м/с.
Диаметр абсорбционной части АОК равен;
т/ 4-0,435
Da - V 3,14-0,285 — 1 >4 м
Полученное числовое значение величины Da соответствует принятому в
промышленности нормальному ряду диаметров.
10. Гидравлическое сопротивление абсорбционной тарелки. Этот показа-
тель работы тарелки рассчитывается при работе колонны в режиме захле-
J01
бывания по уравнению [И]:
AD_______________________5Рп^2_________,, ft., ,
~ 2<рс2 (1 -Р)(1 -т)3№ 11 — т(| “ Р'1 ' 6(1 - 0)
в котором неизвестные величины определяются так:
коэффициент сопротивления сухой тарелки, толщина которой принимается
равной 6 = 0,004 м
/ b \°.2 i 0,006 ХМ
* = 1,75(1-Фс)2(-^ = 1,75(1 -0,2)0,3 =1,21
доля сечения тарелки, занятая стекающей жидкостью, при коэффициенте
истечения ее е=0,62 равна:
V / L \а р~
|/ \ G J рже£
1 + ]/ М "рЭг)
2 28>6
11422'616,3-0,62-1,21
1,422‘616,3-0,62-1,21
= 0,344
м2/м2
коэффициент, характеризующий вспениваемость жидкости
/ Рп \°-118 / 28,6 \°-118
=1’11 (-6Т673-) =0’765
поверхностное натяжение жидкости (насыщенный абсорбент) при /н.а =
= 30 °C принимается как для пентана: <т=0,01495 Н/м [33, с. 204];
коэффициент 1\, учитывающий скорость газа в режиме захлебывания, ра-
вен 0,8.
Сопротивление тарелки равно:
1,21-28,6 0,2852 [1 —0,344(1 -0,765)]
ЛР= 2-0,22(1 —0,765) (1 —0,344)3-0,82 +
2-9,8-0,01495
+ 0,006 (1 —0,765) = 400 Па
Гидравлическое сопротивление решетчатой (провальной) тарелки можно
рассчитать, пользуясь и другими зависимостями, см. например [34, с. 277].
11. Расстояние между тарелками абсорбера. Высота колонного аппарата
зависит от расстояния между тарелками, которое определяется так:
Лт -5 Нп + Яс
где /?п — высота слоя пены на тарелке, м; Нс — высота сепарационного про-
странства, м.
Высота слоя пены рассчитывается по уравнению [31, с. 206]:
, п ьРп^2захл
2(1 —т)2
в котором неизвестные величины определяются следующим образом:
102
относительная плотность пены
/ 28,6 \°,18 / 2,2-10~4 \о,озб2
= 0,43.1,42».3«(-6T6TJ (п.б-Ю-3) =°-31
при этом Цп= 11,5-10-8 Па-с — вязкость газа в расчетном сечении аппарата
при /„Ь = 65°С, принятая как для этана [33, с. 161];
скорость газа при работе аппарата в режиме захлебывания
w 0,285
^захл = Д' — q g ~ 0,356 М/с
Подстановка известных числовых величин в исходное уравнение дает сле-
дующее числовое значение высоты слоя пены:
1,21-28,6-0,3562
400— 2(1 —0,344)2
Нп= 9,81-0,31-616,3 = 0,210 м
Нс = 2,42-Ю^захл
Высота сепарационного пространства находится по формуле [18, с. 215]:
1п_\<”43 / рп \°.285 / 0,14 у,39
а / ( Рж — Рп ) (е-ю2 ) =
/ 11,5-10-е \«,« / 28,6 \о.23б
= 2,42-102• 0,356 ( о,01495) (б16,3— 28,б) х
/ 0,014 \»,39
х ( о ОК. 102 ) = 0,172 м
где е=0,05 кг/кг — величина межтарелочного уноса жидкости, принятая со-
гласно данным [11, с. 197].
Расчетное расстояние между тарелками равно:
йт = 0,210+ 0,172 = 0,382 м = 382 мм
С учетом рекомендаций [35, с. 132] принимается /гт=450 мм.
12. Диаметр десорбционной части АОК. Из предыдущих расчетов нетруд-
но видеть, что наиболее нагруженным по парам сечением десорбера будет се-
чение под его нижней тарелкой. Диаметр десорбера в этом сечении определя-
ется по формуле:
D«~y лш
где V—секундный объем паров (десорбента), м3/с, рассчитываемый по урав-
нению:
07.22,4 (/н д + 273) 0,1 266 000-22,4 (200 + 273) 0,1
И= ML-3600-273л = 59,7-3600-273-2,45 = 1,92 м3/с
w — рабочая скорость пара в свободном (полном) сечении колонны, опреде-
ляемая из уравнений:
у = 20 ехр (— 4х)
W* / Рп \ ( Рж \°’18
У №^э<Рс2 \ Рж ) \ Ив /
/ L' \«,28 / рп \°.12|>
jc=(“g7'; (^г)
103
при этом рж — плотность жидкости (нижний продукт АОК), мольная масса
которой ЛГНД= 101,6 (см. табл. 3.8), принимаемой за гептан в целях упро-
щения расчета, т. е. равной 495,2 кг/м3 [33, с. 220]; рп — плотность паров при
температуре /к.д=200°С, определяемая так:
/ЙГ.273Л 59,7-273.2,45
Рп“ 22,4 (/н.д + 273) 0,1 - 22,4(200-]- 273)0,1
цж — вязкость нижнего продукта АОК при температуре 200 °C, принимаемая
(как для гептана) равной 85,1 -10—6 Па-с; р.в— вязкость воды при 20°C, рав-
ная 1 • 10-3 Па-с;
L' = ^а + ^/т)л1н.д = (300 + 741,8) 101,6= 105 847 кг/ч
G' = W = 266 000 кг/ч
L' 105 847
~G!~= 266 000-= 0,397 кг/кг
Подстановка этих данных в расчетные уравнения дает следующие резуль-
таты:
/ 38,5 о,125
* = 0,397°,25 (-49572-) =0.578
</ = 20ехр (-4-0,578) = 2
0) 0,0776 / 85,1 -10-е у,2’ 2
2== 0,82-9,8-0,0113-0,22 1-Ю"3 ) = 18,4 ю2
откуда
w = 0,328 м/с
Диаметр десорбера равен:
°Д~ У 3,14-0,328 - 2-73 м
Согласно нормальному ряду диаметров принимается Од=2,8 м.
13. Гидравлическое сопротивление десорбционной тарелки. Расчет ведется
так же, как для тарелки абсорбера.
Исходными величинами являются следующие: 6=1,21—коэффициент
сопротивления сухой тарелки; е=0,62— коэффициент истечения жидкости;
|/ 0,3972 495,2.0,62-1,21
38,5
1+У 0.3972 495,2.0,62-1,21
= 0,203 м2/м2
0 = 1,11
38,5 \0,и8
495,2 ) = 0,82
1,21-38,5-0,3282
’ &‘Р== 2-0,22 (1 —0,82) (1 — 0,203)3 0,82 U — °.203 0 — °-82)1+
2-9,8-0,00407
+ 0,006 (1 —0,82) = 1040 Па
14. Расстояние между тарелками десорбера.-Расстояние между тарелками
десорбера определяется так же, -как и для абсорбера. Здесь этот расчет
опускается. Согласно указанным . выше рекомендациям принимается йт =
= 450 мм.
104
Рис. 3.4. Схема для расчета рабочей высоты
АОК.
15. Высота абсорбционно-отпарной колон-
ны. Полезная высота аппарата (рис. 3.4):
Нп = + h3 4- Л4 + h6
где hi — высота аппарата над верхней абсорб-
ционной тарелкой с учетом расположения от-
бойного устройства, принимаемая равной
3ftT = 3- 0,45 = 1,35 м
h3 — высота части аппарата, занятой абсорб-
ционными тарелками, определяемая по фор-
муле:
Л2 = (^р.а- 1)Лт = (27— 1) 0,45 = 11,7 м
Лз — расстояние между нижней тарелкой аб-
сорбера и верхней тарелкой десорбера, прини-
маемое равным /i3=2 м; +— высота части ап-
парата, занятой десорбционными тарелками,
определяемая по формуле:
/Ч = (Ар.д~ 1) Лт = (25—1)0,45= 10,8 м
hs — высота нижней части десорбера, принимаемая равной 3,5 м, чтобы обес-
печить внизу аппарата такой объем нижнего продукта, который соответству-
ет его пятиминутному запасу.
Полезная высота аппарата равна:
Яп= 1,35 +11,7 4-2 + 10,8 + 3,5 = 29,35 м
Диаметры штуцеров рассчитываются по обычным формулам гидравлики;
расчет здесь не приводится.
ХОЛОДИЛЬНИК АБСОРБЕНТА УСТАНОВКИ НИЗКОТЕМПЕРАТУРНОЙ
АБСОРБЦИИ
Исходные данные
Рассчитать пропановый холодильник тощего (регенерированного) абсор-
бента абсорбциойно-отпарной колонны при следующих исходных данных: ко-
личество абсорбента Gi = 90000 кг/ч; начальная температура абсорбента fi =
= 30 °C, конечная его температура t'\=—10 °C. Состав абсорбента (мольн.
доли):
С3н14 С-Н16 CeHie CgH20 C10H22
0,088 0,148 0,187 0,288 0,289
Аппарат предназначен для охлаждения регенерированного абсорбента пе-
ред подачей его на верх колонны (см. с. 85). Хладоагентом служит испаря-
ющийся пропан.
105
Рис. 3.5. Схема пропанового испарителя-холодильника (ИКТН):
/ — корпус; 2 — распределительная камера; 3 — трубки.
В промышленности для охлаждения абсорбента применяют кожухотрубча-
тые испарители.
Схема подачи теплоносителей в аппарат показана на рис. 3.5.
Регенерированный абсорбент поступает в трубное пространство испарите-
ля в количестве Gi при температуре 1\, а выводится при температуре t"i.
Пропан подается в межтрубное пространство в количестве G2 при темпе-
ратуре tf2 и выводится при температуре 1"2.
Расчет
1. Тепловая нагрузка холодильника. Количество тепла, отнимаемого в хо-
лодильнике у абсорбента испаряющимся пропаном, находится из уравнения:
1 Qi — ^1
где hi ' и hj «— энтальпии абсорбента соответственно на входе (температура
/"1=30 °C) и выходе (температура t"i =—10 °C) из аппарата, кДж/кг.
Для определения энтальпии абсорбента [30, с. 10] необходимо знать
мольную массу абсорбента; в данном случае она равна Л4а=122 (см. с. 92):
Величина Qi равна:
Qi = 90 000 (335,2 — 251,4) = 7,75- 10е кДж/ч = 2,15• 103 кВт
2. Расход пропана. Абсорбент охлаждается испаряющимся пропаном, рас-
ход которого находится по формуле
где г — скрытая теплота испарения жидкого пропана; цт — коэффициент ис-
пользования тепла, принимаемый равным 0,95.
Принимается, что жидкий пропан подается в межтрубное пространство
кожухЬтрубчатого холодильника под давлением л=0,15 МПа [36, с. 127—
128]. Тогда, согласно графику [25, с. 19], температура кипения пропана бу-
дет равна ts = —30 °C, а его скрытая теплота испарения г=413,3 кДж/кг [33,
с. 175].
Количество испаряющегося пропана равно:
7,75-10» „ „
G2 — 413,3-0,95 — 19750 К17ч
106
3. Выбор типа аппарата. Для выбора типоразмера аппарата ориентировоч-
но определяется поверхность теплообмена пропанового холодильника абсор-
бента; для этого по данным [37, с. 31] принимается величина ее теплонапря-
жения (теплового потока) <?=7500 Вт/м2.
Тогда
Q, 2,15 ЮМО3
F~~q~ 7500 - =286 м2
По отраслевому стандарту ОСТ-26-02-434—72 принимается испаритель ко-
жухотрубчатый типа ИКТН (испаритель кожухотрубчатый с неподвижными
трубными решетками и жестким кожухом), имеющий следующую техническую
характеристику:
Диаметр корпуса Диаметр распределительной камеры трубного пучка Длина трубок Диаметр трубок Шаг трубок Число ходов по трубкам 1200 мм 800 мм 4000 мм 20x2 мм 26 мм 2
По этим данным достаточно точно рассчитывается поверхность теплооб-
мена аппарата.
При размещении трубок по вершинам и сторонам правильных шестиуголь-
ников диаметр распределительной камеры трубного пучка равен:
£>к = 4dH
где D' — диаметр окружности, описанной около наибольшего шестиугольника,
м; 4=0,02 м — наружный диаметр трубки.
Тогда
D' = DK —44 = 0,8 —4-0,02 = 0,72 м
Число трубок, размещаемых на диагонали наибольшего шестиугольника,
находится из формулы:
D' = s (6 — 1)
где s = 0,026 м — шаг трубок.
Тогда
D' 0,72
& = s + 1 = 0026 + 1 = 29
Число шестиугольников, на которых размещены трубки равно:
Ь — 1 29—1
х = —2-----=-----2----= 14
Общее число трубок в пучке при одном ходе равно A'i=721.
В двухходовом пучке — трубок будет меньше на столько, сколько их сле-
дует убрать с диагонали наибольшего шестиугольника, по которой располо-
жится перегородка в распределительной камере. Тогда
N = А/! _ Ь = 721 — 29 = 692
Следовательно, число трубок в одном ходу пучка равно:
107
Поверхность теплообмена аппарата составит:
F, = Mnd,,/= 692-3,14-0,02-4 = 174 м2
Для обеспечения необходимой поверхности теплообмена следует устано-
вить:
п =
7 286
— = )74~ « 2 аппарата
Т 1
При последующем расчете величины F и п будут уточнены.
4. Коэффициент теплоотдачи а2 со стороны кипящего пропана. Сжижен-
ный пропан, вследствие снижения его давления до 0,15 МПа непосредствен-
но перед холодильником (испарителем), испаряется в корпусе аппарата при
температуре ts = —30 °C. При этом он отнимает тепло у охлаждаемого абсор-
бента, проходящего в трубном пучке.
Коэффициент теплоотдачи от кипящего пропана к поверхности горизонталь-
ных трубок пучка рассчитывается по следующей зависимости [38, с. 119] :
М \1/3 2,
voTs ) q
«2
где Ь — коэффициент, равный
6 = 0,075
Рп
Рж — Рп
% — коэффициент теплопроводности пропана при температуре ts = —30 °C,
Вт/(м-С); v — коэффициент кинематической вязкости пропана при той же
температуре, м2/с; а — поверхностное натяжение жидкого пропана на грани-
це с равновесным ему паром при той же температуре, Н/м; рв, рж — плот-
ность пропана в парообразном и жидком состояниях при температуре ts =
=—30 °C, кг/м3.
Плотность пропана в парообразном и жидком состояниях берут из спра-
вочника [33, с. 175]: рж=568 кг/м3 и рп=4,02 кг/м3.
Таким же образом [33, с. 191] экстраполяцией определяют поверхностное
натяжение
а= 13,8 10-а Н/м
Коэффициент динамической вязкости q жидкого пропана находят по гра-
фику [39, с. 474] в зависимости от приведенной температуры
Ts 243
Т'пр = у = оса о =0,65
1 кр ЗоУ,8
Он равен
г] = 0,15-10~3 Па-с
Тогда кинематическая вязкость пропана определится так:
г] 0,15-10-3
V = —1- = ,-со---= 0,265-10-6 м2/с
Рж 568
Коэффициент теплопроводности пропана при температуре Т, = 30 °C опре-
деляют по формуле [40, с. 126].
Л = 13,3- Ю^СрРж
где ср=2,28 кДж/(кг-°С) —теплоемкость жидкого пропана, найденная экстра-
поляцией по данным справочника [33, с. 175].
108
Коэффициент теплопроводности пропана равен:
Х= 13,3 10-6-2,28 568 I/ -77-= 0,062 Вт/(м-°С)
Коэффициент теплоотдачи определится после предварительного расчета
коэффициента b
Г г 4,02 \%1
b = 0,075^1 + 10 (-568 _4,orj ] = 0,102
Тогда
( 0 0622 \х/з
13,8-10-2-0,265-10-6-243 / <?/з = 1 -66? /з Вт/(м2 - °C)
Коэффициент теплоотдачи со стороны испаряющегося пропана, как функ-
ция теплонапряжения поверхности теплообмена испарителя определяется по
формуле (Вт/(м2-°С):
а2 = 1,66<//з
5. Коэффициент теплоотдачи ai со стороны охлаждающегося абсорбента.
Для выбора расчетного уравнения сначала определяется режим движения
абсорбента в трубном пучке аппарата, характеризуемый критерием Рей-
нольдса:
Re = wdg/vcp
где w— скорость абсорбента в трубках, м/с; dB=0,016 м — внутренний диа-
метр трубки; vcp — кинематическая вязкость абсорбента при его средней тем-
пературе, м2/с.
Предварительные расчеты показывают, что без большой ошибки абсорбент
(М= 1202) можно принять за нонан (С9Н20, Af=128). Это значительно сокра-
щает объем вычислений.
Средняя температура абсорбента в трубном пучке равна:
Из справочника [33, с. 229] определяются:
теплопроводность абсорбента (нонан при температуре ?ср=10°С) ХсР=
=0,132 Вт/(м-°С);
теплоемкость (при той же температуре) сср=2,15 кДж/(кг-°С);
динамическая вязкость т]ср=0,827-Ю-3 Па-с;
плотность рсР=725 кг/м'1.
Кинематическую вязкость вычисляют так:
пгО 0,827-IO-3
Vcp = Тер" 725 = 1-14-10 6 м2/с
Секундный объем абсорбента равен:
6, 90 000
Усек= Зб00рСр = 3600-725 = 0,035 м /с
Площадь поперечного сечения одного хода трубного пространства состав-
ляет:
nd 2
f1 = Nt —^- = 346-0,785-0,0162 = 0,07 м2
Скорость абсорбента в трубках пучка равна:
Усек 0,035
щ = = 0 07 = 0,5 м/с
109
Критерий Рейнольдса равен;
0,5-0,016
Recp ~ ]14. 10-е — 7000
Следовательно, режим движения переходный (2-103<Re<104).
Коэффициент теплоотдачи cti от абсорбента к внутренней стенке трубки
рассчитывается по формуле М. А. Михеева для турбулентного движения с по-
правкой на переходный режим [37, с. 22—23]:
= O,O21Recpo,8PrCp0.43 ezen
где PrCp — критерий Прандтля при средней температуре /Ср=Ю9°С; Ргс—
критерий Прандтля при температуре стенки трубки; ez — коэффициент, зави-
сящий от отношения длины трубки к ее внутреннему диаметру (в нашем
случае Z/dB = 4/0,016=250>50, поэтому 6=1); еп — поправочный коэффици-
ент на переходный режим, в нашем случае равный 8п=0,92.
Для определения критерия Ргс задается температура стенки трубки 1С =
=—16 °C и при этой температуре по справочнику [33, с. 229] находятся сле-
дующие параметры абсорбента (нонан):
плотность р = 746 кг/м3;
теплоемкость с=2,08 кДж/(кг-°C);
вязкость динамическая г)= 1,271 10~3 Па-с;
теплопроводность л=0,134 Вт/(м-°С).
Кинематическая вязкость равна:
п 1,271-10—3
V=T=----------74^— = 1,71-Ю- м/с
Критерий Прандтля равен:
D vcpccpPcp 1,14-10— • 2,15 • 10~3 • 725
НГср - лср 0,132 - ид
v-c-o 1,71-10--2,08-10-3-746
РГс = = 0,134 = 2°
Коэффициент теплоотдачи равен:
0,132 / 13,4 \°,25
а, =0,021-a 70000-8-13,4°,43 [ ’ 0,92 = 530 Вт/(м2-°С)
1 0,01о \ 2U / '' '
6. Коэффициент теплопередачи. Коэффициент теплопередачи с учетом теп-
ловых сопротивлений стенки трубки и загрязнений ее обеих поверхностей рас-
считывается по уравнению:
_______________1
1 , бет . бв 6,, , 1
Cti Хе;- Хв Хн CCg
где 6ст=0,002 м — толщина стенки трубки; Хст = 46,5 Вт/(м-°С)—коэффици-
ент теплопроводности стали; ев/Хв = 0,0006 (м2-сС)/Вт— тепловое сопротив-
ление загрязнения со стороны абсорбента [17, с. 336]; 6н/Хн=0,000172 (м2-
°C)/Вт — тепловое сопротивление со стороны пропана [17, с. 336].
Тогда
А ~ 1 0,002 1 ~ 1
530-+-46Т“ + 0-0006 + 0’00()172+^- °’0027+^-
Так как коэффициент теплоотдачи а2 является функцией теплонапряжения
поверхности теплообмена q, величина которого неизвестна, то вычисление К
110
Рис. 3.6. График зависимо-
сти Д/ор=/(<7).
ведется методом последова-
тельного приближения. За-
даются различные числовые
значения q и для каждого
из них определяются а2, К
и Д/ср. Результаты расчетов
даны в таблице 3.11.
По данным таблицы 3.11
построен график зависимо-
сти q от Д/ср (рис. 3.6), на-
зываемый нагрузочной ха-
рактеристикой испарителя.
Величина среднего температурного напора в аппарате определяется по
формуле:
Д^ср —
Д^макс — Д^мин
2,31g
Д^макс
Д^мин
где Ломакс и Д/мин — максимальная и минимальная разность температур.
Так как в процессе теплообмена температура испаряющегося пропана ос-
тается постоянной 1t'2= t"2——30 °C, максимальная разность температур
равна:
Л'макс = - t3 = 30 - (-30) = 60 °C
а минимальная
Д<мин = V -л = - 10 - (-£0) = 20 °C
Тогда
Д'ср = 6°~2б°0 =36,5 °C
2'31g~66"
По известному числовому значению среднего температурного напора Д?ср=
= 36,5 °C и графику (см. рис. 3.6) определяется соответствующее теплонапря-
Таблица 3.11. Расчет коэффициентов теплоотдачи и теплопередачи
Параметр, единица измерения Результаты расчетов по четырем приближениям
1 2 3 4
q, Вт/м2 (принимается) 7500 8000 8500 9500
а,, Вт/(м2-°С) 530 530 530 530
«2= 1,66^2/3, Вт/(м2-°С) 644 664 690 750
К = ! -, Вт/(м2-°С) 235 237 239 250
0,0027+ —
Л f i-. ©Г 32 34 36 38
111
жение поверхности теплообмена </=8650 Вт/м2. Тогда коэффициент теплопе-
редачи в испарителе будет равен:
к______Я_
* ~ А'ср :
7. Поверхность теплообмена
мена равна:
8650
= 36 5 = ^7 Вт/(м2-°С)
испарителя. Расчетная поверхность теплооб-
2,15-1С3 1С3
8650 = 250 м2
FP~ q
Расчетное число аппаратов ранее выбранного типа:
А
_ гр
Р- Fi
250
174
= 1,43
Из расчета следует, что для заданных условий теплообмена необходимо
установить последовательно (по ходу абсорбента) два испарителя-холодиль-
ника типа ИКТИ, обеспечивая резерв поверхности теплообмена примерно
в 40%.
8. Проверка температуры на внутренней поверхности трубки. Эта тем-
пература определяется по уравнению:
/с=/«+Ц’<+х') =
= -зо + 8650 (--—1 —,7- + 0,000172^ = —16,2°С
\ 1,66-86502% )
Расхождение с ранее принятым значением /с=16сС является незначи-
тельным.
ГЛАВА 4
ПРОЦЕССЫ И АППАРАТЫ РАЗДЕЛЕНИЯ ЛЕГКИХ
УГЛЕВОДОРОДОВ ректификацией
Общие сведения
Ректификация — массообменный процесс, применяемый для разделения
жидких и паро- или газообразных смесей, компоненты которых различаются
по температурам кипения.
Процесс ректификации осуществляется при контактировании потоков пара
или газа и жидкости, которые имеют разные составы и температуры: пар
(газ) имеет более высокую температуру, чем вступающая с ним в контакт
жидкость. Движущими силами процесса ректификации являются разности
составов и температур контактирующих потоков пара или газа и жидкости.
При достаточной продолжительности контакта пар и жидкость могут достичь
состояния равновесия, при котором температуры потоков станут одинаковы-
ми; при этом их составы будут связаны уравнениями равновесия. Составы
встречных (но не вступивших в контакт) потоков пара и жидкости связаны
уравнениями рабочих линий. Такой схеме контактирования потоков пара
и жидкости соответствует понятие «теоретической тарелки», или «теоретиче-
ской ступени контакта».
ПроцЛс ректификации осуществляется в ректификационных тарельчатых
или насадочных аппаратах колонного типа. Для создания разности темпера-
тур потоков в нижнюю часть колонны подводят тепло, а из ее верхней части
тепло отводят.
В реальных условиях ректификационной колонны равновесие уходящих из
контактной зоны потоков пара и жидкости может не достигаться, в связи
с чем эти потоки будут иметь разные температуры, а их составы определять-
ся не только уравнениями равновесия, но и более сложными зависимостями.
112
Верхняя часть колонны, служащая для выделения низкокипящих ком-
понентов, называется концентрационной или укрепляющей, а нижняя часть,
в которой выделяются высококипящие компоненты, называется исчерпываю-
щей, или отгонной. Между этими частями колонны находится место ввода
сырья (секция питания или эвапорационное пространство).
Основными рабочими параметрами процесса ректификации являются дав-
ление и температура в системе, соотношение потоков жидкости и пара (флег-
мовое число), число контактных ступеней. При соответствующем выборе
этих параметров обеспечивается разделение исходной смеси на компоненты
(фракции), удовлетворяющие определенным требованиям.
Для получения заданной степени разделения исходной смеси требуется
определенное число теоретических тарелок.
Углеводородные смеси, как правило, являются многокомпонентными, при
их ректификации применяются следующие методы расчетов числа теоретиче-
ских тарелок.
Метод расчета «от тарелки к тарелке» предполагает последовательное оп-
ределение составов паров и жидкости на тарелках колонны с использовани-
ем уравнений равновесия, рабочей линии и теплового баланса для каждого
сечения колонны. Однако вследствие того, что для многокомпонентных сме-
сей нельзя заранее полностью задать составы продуктов колонны, возника-
ет необходимость корректировки составов продуктов колонны и потоков в не-
которых сечениях (например, при вводе сырья, выводе боковых продуктов).
Вследствие этого точное решение задачи требует применения метода после-
довательных приближений.
При аналитическом методе расчета ректификации многокомпонентных сме-
сей, характеризуемых небольшим изменением относительной летучести компо-
нентов в пределах температурного режима колонны, используются уравнения
Андервуда или Фенске.
Известны также приближенные методы расчета многокомпонентной рек-
тификации, в которых вводят различные упрощающие допущения относитель-
но распределения компонентов, температур в колонне, флегмовых чисел.
Ниже приведены необходимые данные для расчета, его последователь-
ность и порядок проведения для следующих объектов:
этановые колонны установки низкотемпературной ректификации газожид-
костной смеси углеводородов и установки низкотемпературной ректификации
углеводородного конденсата;
пропановый холодильник-конденсатор газа установки низкотемпературной
ректификации углеводородного конденсата;
бутановая колонна-стабилизатор и изопентановая колонна газофракциони-
рующей установки;
конденсатор-холодильник изопентановой колонны газофракционирующей
установки.
ЭТАНОВАЯ КОЛОННА УСТАНОВКИ НИЗКОТЕМПЕРАТУРНОЙ
РЕКТИФИКАЦИИ ГАЗОЖИДКОСТНОЙ СМЕСИ УГЛЕВОДОРОДОВ
Исходные данные
Рассчитать этановую ректификационную колонну для отбензинивания по-
путного нефтяного газа при следующих исходных данных: производительность
аппарата по сырью Gc = 34000 кг/ч; на установке используется пропановое
охлаждение. Состав попутного газа-сырья, подвергающегося отбензиниванию
(мольн. доли):
сн4 с2нв с3н8 u-C4HJ0 /t-C4Hio U-C5H12 «-С5Н12
0,432 0,154 0,196 0,056 0,094 0,025 0,043
8-640
113
Рис. 4.1. Схема установки низкотемпературной ректификации:
/ — теплообменник; 2 — колонна; 3 — пропановый холодильник; 4— подогреватель; 5 — ем-
кость орошения; 6 — насос; / — сырье; // — дистиллят; /// — нестабильный бензин*, /V —
хладоагснт.
Рис. 4.2. Схема материальных потоков этановой колонны.
Степень извлечения компонентов от их потенциала в исходном сырье в
нестабильный бензин (в мольн. долях) равна: для этана <р,2=0>015, для про-
пана ср'з=0,9.
Процесс отбензинивания попутного нефтяного газа подробно описан в ли-
тературе [25, 36, 41, 42]. Схема установки низкотемпературной ректификации
попутного газа для его отбензинивания показана на рис. 4.1. Целью этого
процесса является получение нестабильного бензина, стабилизация которого
осуществляется в пропановой ректификационной колонне.
Схема материальных потоков этановой тарельчатой ректификационной ко-
лонны показана на рис. 4.2.
Сырье подается в аппарат в количестве Fc прп температуре //. Необходимое
для ректификации жидкое орошение в количестве g0 и при температуре tD
подается на верх колонны. Под нижнюю тарелку аппарата подается паровое
орошение в количестве Ид.
Сверху колонны выводятся при температуре h в паровой фазе дистиллят
и орошение в количестве D и g0, которые после конденсации и охлаждения
в конденсаторе-холодильнике поступают в емкость орошения.
Дистиллят, практически состоящий из метана и этана (более 96%), из ем-
кости орошения направляется в газосборную сеть, а конденсат — на ороше-
ние верха колонны.
Снизу колонны жидкий поток при температуре tR в количестве
поступает в кипятильник, из которого поток паров в количестве VR возвра-
щается в аппарат для парового орошения низа колонны. Нестабильный бен-
зин в количестве 7? направляется для последующей стабилизации в пропа-
новую колонну газофракционирующей установки.
Расчет
1. Материальный баланс аппарата. Производительность аппарата, кмоль/ч:
F = GrjMQ
114
Таблица 4.1. Расчет материального баланса этановой колонны
Углево- дород Данные по сырью Данные по остатку Данные по дистилляту
содер- жание мольн. доли коли- чество F^FCi = = 1000 cit кмоль/ч степень извле- чения <Р1. мольн. доли коли- чество R.= = Fi <₽!• кмоль/ч содер- жание ч= Rf коли- чество °i= =V-Rf, кмоль/ч содержа- ние yD^ Di
мольн. доли мольн. доли
сн4 0,432 432 0 0 0 432,0 0,717
С2н6 0,154 154 0,015 2,3 0,006 151,7 0,251
С3н8 0,196 196 0,900 176,4 0,444 19,6 0,032
И-С4Н10 0,056 56 1,000 56,0 0,141 0 0
н-СчНю 0,094 94 1,000 94,0 0,237 0 0
Й-С5Н12 0,025 25 1,000 25,0 0,064 0 0
Н-С5Н12 0,043 43 1,000 43,0 0,108 0 0
2 1,000 1000 — 396,7* 1,000 603,3** 1,000
* В данном случае R.
** В данном случае D.
где Мс — средняя мольная масса сырья, равная
Мс = Mici' = 16-0,432 + 30-0,154 + 44-0,196 +
4- 58 (0,056 + 0,094) + 72 (0,025 + 0,043) = 34'
Тогда
34 000
F = —34— = 1000 кмоль/ч
Расчет материального баланса колонны с учетом заданных условий раз-
деления приведен в табл. 4.1.
2. Температура и давление в аппарате. При пропановом охлаждении тем-
пература верхнего продукта колонны на выходе из конденсатора может
быть принята равной /0=—25 °C и выше. Более низкая температура достига-
ется в случае применения аммиачной, фреоновой или этановой холодильной
установки.
Принимается температура на выходе из конденсатора-холодильника to=
= —18°С. Если принять давление в емкости орошения равным давлению на
выходе из конденсатора, то его величина найдется по уравнению изотермы
паровой фазы дистиллята путем последовательного приближения-.
** Ki
Константы фазового равновесия определяются из графика [25, с. 19]. Ре-
зультаты расчета даны в табл. 4.2.
Итак, давление в емкости орошения Ло = 3,73 МПа.
Как видно из табл. 4.2 конденсат наполовину состоит из этана.
Составы орошения и дистиллята различны (см. табл. 4.2), поэтому пары
Vi, уходящие с верха колонны, будут представлять паровую смесь дистилля-
та и орошения. Чтобы рассчитать состав паров Vb необходимо знать коли-
чество орошения g0, подаваемого на верх колонны. Его можно определить,
8* 115
Таблица 4.2. Расчет давления в емкости орошения этановой колонны
Углеводород мольн. доли К, при tD= -18 °C, Лд=3,73 МПа *о£= - yD t
Ki
СН4 0,717 3,20 0,224
С2Н6 0,251 0,49 0,512
С3На 0,032 0,12 0,265
S 1,000 — 1,001 5 1,00
зная флегмовое число колонны. Ниже рассмотрен вопрос об определении флег-
мового числа по уравнению Андервуда:
_ у, фУ'р,. _
'’мин — а. — ф
1
в котором значение параметра <р рассчитывается по формуле
у _2?£lL = ez
at — <р
1
где а, — относительная летучесть компонента при средней температуре в ко-
лонне.
Давление на верху колонны п, с учетом перепада давления в конденсато-
ре принимается на 0,04 МПа выше давления в емкости орошения:
л1 = лд+ 0,04 = 3,73 4-0,04 = 3,77 МПа
Давление в секции питания с учетом сопротивления укрепляющих таре-
лок принимается на 0,02 МПа выше давления на верху колонны:
Л/ = nj 4-0,02 = 3,77 4-0,02 = 3,79 МПа
Температура сырья, подаваемого в колонну, на основе промышленных дан-
ных [36] принимается равной //=20 °C.
Расчет степени конденсации сырья при этой температуре и давлении л/ =
=3,79 МПа ведется по уравнению
2 X'f i = 2 1 4- е' (Ki - 1)
1 1
методом последовательного приближения, заданием нескольких числовых зна-
чений степени отгона е'. Результаты расчета даны в табл. 4.3.
При температуре 4 = 20 °C и давлении л,=3,79 МПа половина сырья
будет в паровой фазе, а половина — в конденсате. Заметим, что состав па-
ровой фазы сырья сравнительно близок к составу дистиллята, поэтому от
укрепляющей части колонны не требуется большой разделительной мощности.
Принимается, что давление нижней части колонны (или в кипятильнике)
на 0,04 МПа больше, чем в секции питания. Тогда
’ лл=Л/4-0,04 = 3,79 4-0,04 = 3,83 МПа
Температура в нижней части колонны (в кипятильнике) при найденном
давлении определяется последовательным приближением по уравнению изо-
термы жидкой фазы остатка:
7
2***4 =1
1
116
Таблица 4.3. Расчет доли отгона сырья этановой колонны
Угле- водород c'i К. при ^=20 °C, лг =3,79 МПа УС-1 e'UCf—1) при е'=0,5 l-H'(X.-l) Х!Г С‘ II ' й'“ "S' 11
H-e'CKj-l)
сн4 0,432 4,400 3,400 1,7 2,700 0,160 0,704
С2н6 0,154 1,000 0 0 1,000 0,154 0,154
с3на 0,196 0,340 —0,660 —0,330 0,670 0,293 0,100
u-C4Hl0 0,056 0,140 —0,860 —0,430 0,570 0,098 0,014
Н-С4Н10 0,094 0,100 —0,900 —0,450 0,550 0,171 0,017
u-C5H[2 0,025 0,045 —0,955 —0,478 0,522 0,048 0,002
w-C5H12 0,043 0,038 —0,962 -0,481 0,519 0,083 0,004
s 1,000 — — — — 1,007» 1,00 0,995» «1,00
Расчет температуры ip дан в табл. 4.4.
Итак, температура в кипятильнике колонны (низ колонны) равна (/в=
= 118 °C.
Предварительные расчеты показывают, что температура наверху колонны
/1 = 12°C ( в дальнейшем эта температура уточняется). Поэтому средняя тем-
пература в колонне равна:
, _ /j + fy + *R 12 + 20 4- 118
*ср — 2 — 3 —
При этой температуре и среднем давлении в колонне лср=3,78 МПа нахо-
дятся константы равновесия компонентов сырья и относительные летучести
их, при принятии за эталонный компонент нормального пентана (табл. 4.5).
Методом последовательного приближения по уравнению Андервуда най-
дется числовое значение параметра <р. Его величина лежит между значениями
относительных летучестей распределенных компонентов, т. е. этана и пропана.
Весь расчет приведен в табл. 4.5.
Итак, параметр в уравнении Андервуда ср =10,2.
После подстановки значения <р в уравнение Андервуда для расчета гМВИ,
получается:
10,2-0,717 10,2 0,251 10,2-0,032
'мин—а._ ф = 58 — 10,2 + 16,6 — 10,2 + 6,6— 10,2 = 0,461
1
Таблица 4.4. Расчет температуры tR
Углеводород *Ri мольн. доли при /^=118 °C, ^=$33 МПа vR=Ki xRt
с2нв 0,006 2,9 0,0174
с3н8 0,444 1,45 0,6438
U-C4H10 0,141 0,83 0,1199
Н-С4Н10 0,237 0,67 0,1588
u-CsH]2 0,064 0,37 0,0237
K-CgHi2 0,108 0,34 0,0367
2 1,000 — 1,0003» 1
117
Таблица 4.5. Расчет параметра <р
Угле- водород Кг- при а =3,78 МПа, ,ср=50°С II + мольн. доли “i С1 а.—ф при ф=10,2 аг с.
аг-<р
си4 5,20 58,0 0,432 25,000 +47,8 +0,524
СзНе 1,50 16,6 0,154 2,550 +6,4 +0,400
С3Н8 0,59 6,6 0,196 1,290 —3,6 —0,358
U-C4H10 0,29 3,2 0,056 0,180 —7,0 —0,026
Н-С4Н10 0,21 2,3 0,094 0,216 —7,9 —0,027
U-C5H12 0,10 1,1 0,025 0,028 —9,1 —0,003
Н-СдН]2 0,09 1,0 0,043 0,043 —9,2 —0,005
2 — — 1,000 — — е'=0,505« «0,5
Коэффициент избытка орошения найдется по соотношению [31, с. 68]:
г 0,35 0,35
а = ----= -------+1,35 =-0^4-1,35 = 2, И
'мин 'мин 0,101
Рабочее флегмовое число равно:
г = агмин = 2,11 0,461 =0,97
По всей высоте укрепляющей части колонны флегмовое число принимает-
ся постоянным.
Количество горячего орошения или флегмы, находящейся при температуре
начала кипения, определится так:
g = rD = 0,97 • 603,3 = 585,2 кмоль/ч
Количество паров, проходящих любое сечение в диаметральной плоскости
укрепляющей части колонны найдется по уравнению материального баланса:
p=g+D=D(r+l) =603,3(0,97+ 1) = 1188,5 кмоль/ч
Состав паров, уходящих с первой (верхней) тарелки колонны определяет-
ся по уравнению концентраций укрепляющей части:
(go + D) у'и = gox'oi + Dy'Dl
где go=g=585,2 кмоль/ч — количество орошения, поступающего на первую
тарелку; у'ц — мольная доля компонента в парах, поднимающихся с первой
тарелки; x'Oi — мольная доля компонента в орошении, подаваемом на верх
колонны (см. табл. 4.2).
Из этого уравнения получается:
, g° ' Dy'Di
У11~ £о + D Xoi~‘ g0+D ~
585,2 603,3i/£>.
= 585,2 + 603,3 x'oi + 585,2 + 603,3 = °-492x'oi + 0,508y'D.
Расчет состава паров с первой тарелки дан в табл. 4.6.
Температура верха колонны ti определяется последовательным приближе-
нием по уравнению изотермы паровой фазы, уходящей с верхней тарелки
колонны
з ,
1
118
Таблица 4.6. Расчет состава паров с первой тарелки этановой колонны
Угле- водород х'ы 0.492 xoi UDi 0,508 yD. Уц = 0,492 л014- -j-0,508 у_
сн4 0,224 0,110 0,717 0,364 0,474
с2н6 0,512 0,252 0,251 0,127 0,379
СзН8 0,265 0,130 0,032 0,016 0,146
S 1,001» 1,00 — 1,000 — 0,999» 1
Таблица 4.7. Расчет температуры верха этановой колонны
Углеводород «и Л- при /1=13°C, Я!=3,77 МПа ’ _ уи
сн4 0,474 4,20 0,112
С2Н6 0,379 0,95 0,400
СзН8 0,146 0,30 0,487
S 0,999» 1,00 — 0,999» 1,00
Расчет температуры верха колонны дан в табл. 4.7
Итак, температура верха колонны Л = 13 °C. Перепад температуры в ук-
репляющей части невелик и составляет
t} — tj =20— 13 = 7°С
3. Материальные потоки секции питания. При расчете секции питания не-
обходимо показать, что количества проходящих через нее потоков удовлетво-
ряют уравнениям материального баланса для укрепляющей и отгонной ча-
стей аппарата.
Материальные потоки секции питания колонны схематически изображены
на рис. 4.3.
Количество парового орошения над верх-
ней отгонной тарелкой рассчитывается по
формуле:
V0=sR
где з — паровое число над верхней отгонной
тарелкой.
Паровое число наверху (над верхней та-
релкой) отгонной части определяется из урав-
нения материального баланса секции питания
[22, с. 381]:
rD + F(l -е') -7?
s ~ R ~
0,97-603,3-1- Ю00 (1—0,5)—396,7
= 396,7 — 1.74
Рис. 4.3. Схема секции питания колонны.
11»
Тогда имеем:
количество парового орошения наверху отгонной части
Vo = 1,74-396,7 =688,5 кмоль/ч
количество флегмы с нижней укрепляющей тарелки
gn = rD =0,97- 603,3 = 585,2 кмоль/ч
количество паров, поступающих под нижнюю тарелку укрепляющей части
V т = gn + D = 585,2 -f- 603,3 = 1188,5 кмоль/ч
количество паровой фазы сырья
Vc = e'F =0,5-1000 = 500 кмоль/ч
количество жидкой фазы сырья
gz = F (1 — е') = 1000 (1 — 0,5) = 500 кмоль/ч
количество флегмы, стекающей на верхнюю отгонную тарелку
= gn + gc = 585,2 + 590 = 1085,2 кмоль/ч
количество паров, поднимающихся с верхней отгонной тарелки
Ио = gm —R = 1085,2 — 396,7 = 688,5 кмоль/ч
Для проверки вычисляется количество паров, поступающих в укрепляю-
-щую часть:
Vm = V'c+ Vo = 500+ 688,5 = 1188,5 кмоль/ч
4. Число тарелок в колонне. Минимальное число теоретических тарелок
в колонне определяется по уравнению Фенске — Андервуда [22, с. 357]’.
, У'd2‘ x'r3
g и'
__ У Рз' х Rj’
«ИНН - „
lg^~
:где индекс 2 относится к этану, 3 — к пропану — ключевым компонентам.
Тогда
0,251-0,444
lg 0,032-0,006
Л/мин— 1б>6 —7
lg ~6ДГ
Для определения числа теоретических тарелок в колонне используется
уравнение [31, с. 68]:
М 0,70 0,70
v---= 77------+ 1,70 = —у-+ 1,70 = 1,8
МИН IV мин '
Откуда
M = oJV/V„„H = 1,8-7= 12,6® 13
Соотношение числа теоретических тарелок Nr в укрепляющей и Ns — в от-
гонной частях колонны определяется по уравнению Керкбрайда (22, с. 412]:
120
Откуда
Nr = 0,485b',
Поскольку
Nr 4- Ns = W = 13
решение двух последних уравнений дает jVs = 8,8 и Nr = 4,2.
В соответствии с имеющимися рекомендациями для колонны принимается
клапанная тарелка.
Ввиду отсутствия надежного метода расчета среднего к.п.д. тарелки для
колонн, разделяющих многокомпонентные смеси, этот параметр в первом:
приближении рассчитывается (в %) по уравнению [31, с. 218]:
1gПер = 0,85+0,3 1g (ф- ) — 0,251g (И/<х) Ч- О.ЗЛг
\ /ср
где (g'/VQcp — среднее мольное отношение встречных на одном уровне жид-
кого и парового потоков; ц, — вязкость жидкого сырья при средней темпе-
ратуре в колонне /ср = 5О°С, Па-с; а — коэффициент относительной летучести
для ключевых компонентов, равный (см. табл. 4.5):
а = = р’q =2,55
• х 2 U оУ
hL — глубина погружения центра тяжести прорези колпачка, м.
Сырье принимается за этан (Л+=34), тогда по данным [33, с. 161] =
= 51,5-IO-6 Па-с.
Далее определяется среднее мольное отношение потоков жидкости и пара:
4-) =°-5
> /ср
Г е*
[ ёк' + D' +
gm' ] _ п Л 585,2
Vo’ J ’ [ 585,2 + 603,3
1085,2 ]
688,5 = 1,0+
Поскольку гидравлический расчет тарелки не делается, пренебрежение по-
следним слагаемым правой части уравнения приводит к получению несколько
заниженного результата:
1g-г)ср = 0,85 + 0,30 1g 1,04 -0,25 1g(51,5-10-» 2,55) = 1,8257
Тогда цСр = 67%.
Число рабочих тарелок в колонне рассчитывается по формуле:
Np = (V/rjcp
Следовательно число тарелок равно:
в укрепляющей части
Nr 4,2
Nrp~ Пер ~ 0,67 ~7
в отгонной части
JVS 8,8
NSD = —— = -n ёТ = 13
sp Пер 0.67
всего в колонне
Np = Nrp + Nsp = 7+ 13 = 20
Данные о числе тарелок в подобных колоннах приводятся в литературе
[41, 43]; они очень близки к полученным выше.
5. Тепловая нагрузка конденсатора колонны. Из предыдущего изложения
следует, что дистиллят колонны D получается из емкости орошения в парах
121
при температуре tD=—18 °C. Следовательно, в конденсаторе колонны проис-
ходит частичная конденсация паров, поступающих в него из верхней части
колонны. Образующийся из этих паров конденсат подается на орошение ко-
лонны. Тепловая нагрузка конденсатора для этого случая найдется по урав-
нению [22, с. 175]:
Qk = go (Hi - ho) + D (H1 - HD)
где g0=g—rD=585,2 кмоль/ч — количество орошения; Hi — энтальпия паров,
уходящих с верха колонны при температуре Л = 13°С и давлении Л1 =
= 3,77 МПа, кДж/моль; h0 — энтальпия орошения, подаваемого на верх ко-
лонны при температуре tD =—18 °C, кДж/кмоль; HD — энтальпия паров дис-
тиллята при температуре tD=—18 °C и давлении лр = 3,73 МПа, кДж/кмоль.
Мольные массы потоков рассчитываются на основе данных, приведенных
в табл. 4.6.
Дальнейший расчет дает следующие данные:
пары, поднимающиеся с верхней тарелки колонны
MV1 = 16-0,474 + 30-0,379 + 44-0,146 = 25,4
пары дистиллята
= 16-0,717 + 30-0,251 + 44-0,032 = 20,4
орошение
= 16-0,224 + 30-0,512 + 44-0,265 = 30,6
энтальпии потоков (кДж/кмоль) находятся по графику [30, с. 10]:
Hi =406,1-25,4 = 10 300 h0 = 58,6-30,6 = 1800
HD = 334,9-20,4 = 6800
Тепло конденсатора равно:
<2К = 585,2 (10 300 — 1800) + 603,3 (10 300—6800) = 7,1- 10в кДж/ч = 1980 кВт
Это тепло снимается в конденсаторе с помощью пропанового охлаждения,
так как должна быть достигнута температура /р =—18 °C.
6. Тепловая нагрузка кипятильника колонны. Перепад температур по вы-
соте отгонной части составляет
tR tf = 118 — 20 = 98 °C
поэтому количества парового орошения внизу и наверху отгонной части бу-
дут значительно отличаться одно от другого.
Количество паров внизу отгонной части может быть найдено, если извест-
но тепло кипятильника Qp. Это тепло определяется из уравнения теплового
баланса колонны [22, с. 158]:
FQf + Qp = DHd + + QK
где Q; — энтальпия сырья, подаваемого в колонну при температуре /, = 20 °C,
кДж/кмоль; hR — энтальпия остатка колонны при температуре /Л=118°С,
кДж/кмоль.
Энтальпия сырья рассчитывается по формуле:
, Qf =е'Нус-\-(I—е') hgc
где е'— мольная доля отгона сырья; Hv<.—энтальпия паровой фазы сырья,
кДж/кмоль; hgz — энтальпия жидкой фазы сырья, кДж/кмоль.
Вначале находят необходимые исходные данные:
средняя молекулярная масса паровой и жидкой фаз сырья (см. табл.43)
MVc = 16-0,704+ 30-0,154 + 44-0,100+ 58-0,031 + 72-0,006 = 22,6
А4йс = 16-0,160 + 30-0,154 + 44-0,293 + 58-0,269 + 72-0,131 =45,1
122
средняя молекулярная масса остатка колонны (см. табл. 4.1)
MR = 30-0,006 + 44-0,444 + 58-0,378 + 72-0,172 = 53
энтальпия потоков (по графику [30, с. 10]), кДж/моль:
HV(.= 418,7-22,6 = 9440 hgc = 171,7 45,1 =7740
= 0,5-9440 +0,5 7740 =8590 hR = 439,6-53 = 23 300
Далее вычисляется тепло кипятильника:
Qp = 603,3-6800 + 396,7-23 300 + 7 100 000 — 1000-8590 =
= 11,8-10® кДж/ч = 3280 кВт
Масса парового орошения 1+, подаваемого из кипятильника под нижнюю
отгонную тарелку колонны, без большой ошибки может быть найдена из
уравнения:
<?p = ^R (HVR~ hVR)
где (HVR——теплота испарения орошения, равная разности его энталь-
пии в паровой и жидкой фазах при температуре /«=118 °C и давлении nj.=
3,83 МПа, кДж/кмоль.
Для этого предварительно вычисляются:
средняя молекулярная масса паров орошения (см. табл. 4.4)
MVa = 30-0,0174 + 44-0,6438 + 58-0,2787 + 72-0,0604 = 49,4
К
энтальпии, кДж/кмоль
Яу = 653,1-49,4 = 32 200 hVn = 435,4-49,4 = 21 400
К к
количество парового орошения, кмоль/ч
Qp 11,810е
Vli ~ HVo — hVa ~ 32 200 — 21 400 ~ 1093
• X К
Паровое число внизу колонны равно:
У« 1093
SR = "7Г = 396,7 = 2,74
7. Диаметр колонны. Диаметр колонны рассчитывается по формуле:
д _ -1
Г Л&>
где Усек — секундный объемный расход паров наверху колонны, м3/с; w —
допустимая скорость паров в свободном поперечном сечении над верхней
тарелкой колонны, м/с.
Объем паров наверху (над верхней укрепляющей тарелкой) колонны оп-
ределяется по известной формуле:
(D + go) 22,4 (^ + 273)0,1
‘'сек - 3600-273-Hj 2
где 2 — коэффициент сжимаемости паров, определяемый по графику [22,
с. 15] в зависимости от приведенных температуры 7пр и давления Рар.
1 23
Знание состава паров (см. табл. 4.7) и критических констант компонен-
тов [33] (метан, этан и пропан) позволяет рассчитать критические константы
для смеси:
Тир = ТКр1у1 + Ткр2г/2 + Ткрзу3
= 190,5-0,474 + 305,3-0,379+ 369,8-0,146 = 260 К
Ркр ~ Ркр1У1 4* РкръУъ “Ь РкрзУз' =
= 4,49-0,474 + 4,71-0,379 + 4,13-0,146 = 4,5 МПа
Приведенные параметры равны:
„ Л 286 л, 3,77
Гпр~ Т’кр - 260 = 1,1 Рпр~ Ркр = 4,5 ~0'84
По графику [22, с. 15] находится z (0,84; 1,1) =0,75
Объем паров составляет:
_ (603,3 + 585,2) 22,4(13 + 273) 0,1-0,75
исек — 3600-273-3,77 —0,152 м/с
Максимально допустимая скорость паров в свободном сечении над верх-
ней тарелкой колонны рассчитывается по формуле:
r I f Рж--Рп
W = CV Рп '
где С — коэффициент, определяемый из выражения
С = 0,09ЛтС'
при этом йт=0,5 м — принятое расстояние между тарелками; С' — коэффици-
ент, зависящий от поверхностного натяжения на границе «пар — жидкость» на
верхней тарелке колонны, определяемый из графика, приведенного на
рис. 4.4.
Величина поверхностного натяжения находится по формуле Этвиша:
а =
21,2 10-*
/ у/з
\ Рж I
(Ткр-Л-7)
где Mgl—мольная масса орошения, стекающего с верхней тарелки, равная
(см. табл. 4.7)
Mgl = 16-0,112+ 30-0,4 + 44-0,487 = 35,2
рж — плотность этого оро-
шения при температуре
/1= 13°С на верхней тарел-
ке (по графику [39, с. 106]
рж = 430 кг/м3); ТКр —кри-
тическая температура оро-
шения, К.
Знание состава орошения
(см. табл. 4.7) и критиче-
ских температур его.
Рис. 4.4. График зависимо-
сти С'=[(а), используемый
при определении скорости
паров в колоннах для раз-
деления углеводородных
газов.
124
компонентов позволяет рассчитать критическую температуру орошения:
Ткр = 190,5-0,112 4-305,2-0,4+ 369,8-0,487 = 323 К
Подстановка найденных величин в формулу дает:
21,2-10-е
а = — 2 (323 —286 — 7) = 3,41 10-3 Н/м
( 430 )
Отложив на оси абсцисс (см. рис. 4.4) числовое значение 0=3,41-
•10-3 Н/м, найдем С'=0,78.
Тогда
С = 0,09-0,5-0,78 = 0,035
Плотность паров, уходящих с верхней тарелки, равна:
Л4у1л1273 25,4-3,77-273 з
Pn~ 22,4(^ + 273) л0 = 22,4(13+ 273)0,1 ~4,Ькг/м
Максимально допустимая скорость паров наверху колонны составляет:
-1 Г 430 — 41,6
и> = 0,035 |/ ---g------=0,115 м/с
Диаметр колонны в ее верхнем поперечном сечении равен:
1 [ 4-0,152
D~ V 3,14-0,115 = 1,3м
В соответствии с нормальным рядом диаметров по ГОСТ 9617—61 при-
нимается диаметр колонны 0=1,4 м.
Объем паров под нижней отгонной тарелкой рассчитывается по формуле:
Ур 22,4 fa+ 273) 0,1
г сек— 3600-2732
где 2 — коэффициент сжимаемости паров при температуре +=118 °C и дав-
лении л» = 3,83 МПа.
Критические параметры равны:
Т’кр ~ Т1кргУ'я2 + ТкрзУ'к3 + • + Т’кр7у+7 =
= 305,2-0,0174 + 369,8-0,6438 + 408-0,1199 + 425 0,1588 +
+ 461-0,0237+ 470-0,0367 = 396 К
ркр = РкргУ'к2 + РкрзУ'к3 4“ ' ’ ’ Ч" РкрчУ r~ —
= 4,71-0,0174 + 4,13 0,6438 + 3,53-0,1199 + 3,68-0,1588 +
+ 3,24-0,0237 + 3,27 0,0367 = 3,93 МПа
Тогда
Тр 391 „ пр 3,83
Гпр~ Ткр ~ 396 '-°’99 рпр- ркр - 3,93 —0,975
Из графика [22, с. 15[ z (0,975; 0,99) =0,4.
Объем паров равен:
1093-22,4 (118 + 273) 0,1-0,4
VceK= 3600-273-3,83 “°’ М'С
125
Для определения максимально допустимой скорости паров под нижней оч
тонной тарелкой следует подготовить необходимые данные.
Поверхностное натяжение на границе «пар — жидкость» вычисляется пс
формуле Этвиша:
21,2-10~6
/ М/г \2/з
\ Рж )
(Л<р Т’а — 7 )
где рж — плотность остатка при температуре /«=118 °C, кг/м3; Ткр—крити-
ческая температура остатка, равная
7
Ткр = TKPix'R. = 305,3 • 0,006 + 369,8 • 0,444 + 425 • 0,237 +
2
+ 408 0,141 + 460,8 0,064+ 469,6-0,108 = 421 К
Плотность остатка по графику [39, с. 106] равна рж = 515 кг/м3.
Тогда
21,2-10-6
а = ----+----г— (421 - 391 — 7) = 2,22 10"3 Н/м
/ 53 'з
\~515"/
Из графика (рис. 4.4) найдем С'=0,67.
Следовательно
С = 0,09-0,5-0,67 = 0,03
Плотность паров орошения на выходе из кипятильника равна:
Л4у_яЛ273 49,4-3,83-273
Р"= 22? 4 (+ + 273) < = 22,4-391-0,1 = 60 кг/м3
Тогда
„ т/ 515 — 60
щ = 0,03 у ------go----= 0,083 м/с
Диаметр низа колонны составляет:
1/ 4-U.1
D = V 3,14-0,083 = 1 >24 м
Расчетные диаметры колонны в ее верхнем и нижнем поперечных сечениях
мало отличаются один от другого. Поэтому принимается диаметр колонны
D— 1,4 м.
8. Высота колонны. На основании практических данных принимается:
расстояние между верхним днищем колонны и ее верхней укрепляющей
тарелкой hi= 1,0 м;
высота секции питания (расстояние между нижней укрепляющей и верх-
ней отгонной тарелками) hs= 1,5 м;
расстояние между нижним днищем и нижней отгонной тарелкой йа=
= 2,0 м.
Тогда рабочая высота колонны будет равна (см. рис. 4.5):
Яр = йг + (Ялр - 1) йт + й3 + (Мф - 1) Лг + Л5 =
= 1 + (7_1) 0,5+ 1,5+(13 —1)0,5+ 2= 13,5 м
Рис. 4.5. Схема для расчета рабочей высоты ко-
лонны.
где h2= —1)Лт — высота, занятая укрепляющими
тарелками, м; Л4= (Nsv—l)/iT — то же, отгонными.
Диаметры основных штуцеров колонны рассчиты-
ваются по обычным формулам гидравлики с после-
дующими принятиями их по существующим норма-
лям.
Гидравлический расчет тарелки рассматривается
в ряде литературных источников [6, 18, 31, 40, 44,
45], поэтому здесь он опускается.
ЭТАНОВАЯ КОЛОННА УСТАНОВКИ НИЗКОТЕМПЕРАТУРНОЙ
РЕКТИФИКАЦИИ УГЛЕВОДОРОДНОГО КОНДЕНСАТА
Исходные данные
Рассчитать этановую колонну установки низкотемпературной ректифика-
ции углеводородного конденсата при следующих исходных данных: состав
попутного нефтяного газа — сырья, подвергающегося отбензиниванию
(мольн. доли):
сн4 С2Нв сзНв W-C4H10 H-C4H10 U-C5H12
0,432 0,154 0,196 0,056 0,094 0,025 0,043
степень извлечения в нестабильный бензин (мольн. доли): пропана <р'з — 0,9,
этана q/2— 0,015 от их содержания в углеводородном конденсате; произво-
дительность установки по газу Gc = 34000 кг/ч.
Расчет этановой ректификационной колонны для отбензинивания попутно-
го нефтяного газа по схеме низкотемпературной ректификации без предвари-
тельной сепарации газового сырья рассмотрен ранее (см. с. 114—127).
Для сравнения предлагается вариант работы этановой колонны на уста-
новке низкотемпературной ректификации углеводородного конденсата
(рис. 4.6). Особенностью рассматриваемого варианта работы ректификацион-
ной колонны является предварительная (перед ректификацией) сепарация
одинакового газового сырья.
Обозначения основных материальных потоков см. на рис. 4.2.
Расчет
1. Выбор температуры и давления конденсации сырого газа. Заданный
для разделения газ содержит более 40% (мол.) углеводородов, более тяже-
лых, чем этан, поэтому относится к жирным газам. Условия разделения сы-
127
Рис. 4.6. Схема установки низкотемпературной ректификации углеводород-
ного конденсата:
/ — теплообменник; 2 — пропановые холодильники; 3 — сепаратор; 4 — этановая колонна;
•5 — подогреватель; 6 — емкость орошения; 7 — насосы; / — сырой газ; // — сухой газ;
/// — нестабильный бензин; /V — хладоагент.
рого газа диктуют необходимость высокой степени извлечения [90% (мол.)]
пропана, поэтому потери его с сухим газом, уходящим из сепаратора, долж-
ны быть минимальными, а потери углеводородов, более тяжелых чем пропан,
совершенно незначительными. Исходя из этих предпосылок и руководствуясь
рекомендациями [25, с. 172; 36, с. 123; 41, с. 49; 42, с. 269], рассмотрим че-
тыре варианта режимных показателей конденсации сырого газа:
1) температура /=10°С, давление л=1,96 МПа; 2) /=10°С, л = 3,92 МПа;
3) / =—10°С; л=1,96 МПа; 4) /=—10°С, л=3,92 МПа.
Для каждого варианта сделан расчет процесса однократной конденсации,
протекающего в сепараторе установки; при этом были использованы следую-
щие уравнения:
1 + е'(К,-— 1) = 1 ^У1' = 2Кг*г' = 1
11 11
где x'i, у', — мольные доли компонента в равновесных жидкой и паровой фа-
зах при однократной конденсации; c't — мольная доля компонента в исходном
газе; е' — мольная доля паров в равновесной парожидкостной системе; К —
константа фазового равновесия компонента, определяемая по графику [25,
с. 19].
Результаты расчета на 100 кмолей сырого газа приведены в табл. 4.8.
Анализ данных, полученных в табл. 4.8, позволяет сделать следующие
выводы.
При первом режимном варианте наибольшее количество метана и этана
(49,68 кмоль из 58,60) и значительное количество более тяжелых углеводоро-
дов,^ том числе более трети пропана (7, 44 кмоль из 19,6) уходит с сухим
газом из сепаратора; такая потеря тяжелых углеводородов нежелательна.
Во втором и третьем режимных вариантах в сухой газ тоже уходит много
метана и этана, а потери с сухим газом тяжелых углеводородов, в том числе
пропана (соответственно 14,8% и 18,2% от их потенциала в сырье)—очень
велики и не позволяют достичь требуемого извлечения пропана [90% (мол.)].
В четвертом режимном варианте потери тяжелых углеводородов с сухим
газом невелики (около Г,7% (мол.), считая на сырье, или 4% (мол.) от их
потенциала в сырье], а степень извлечения пропана в конденсат составляет
128
Таблица 4.8. Расчет процесса однократной конденсации
Угле- водород XL v't 100Х КМОЛЬ = 100-e'^j-, КМОЛЬ «1 x'i y'i gz=100x X(l —e')X£ t кмоль V^~ = 100-e'z/^, кмоль
сн4 7,000 Z=10°C 0,093 Вариант , л=1,96 ДО 0,659 1: Па, е'=0,6 3,72 39,54 3,800 f=10°C, 0,201 В a p и а н т = 3,92 МП 0,769 т 2: a, e' = 0,41 11,85 31,50
С2Н6 1,300 0,130 0,169 5,20 10,14 0,800 0,167 0,136 9,75 5,52
с3н8 0,400 0,305 0,124 12,20 7,44 0,250 0,282 0,071 16,68 2,93
0,150 0,113 0,017 4,52 1,02 0,100 0,088 0,009 5,23 0,39
Н-С4Н10 0,110 0,201 0,022 8,04 1,32 0,070 0,151 0,011 8,85 0,47
0,046 0,058 0,003 2,32 0,18 0,031 0,041 0,0013 2,41 0,054
0,037 0,101 0,004 4,04 0,24 0,025 0,072 0,002 4,27 0,083
2 — 1,001 «1,00 0,998® 1,00 40,04 «40 59,88«60 1,002® 1,00 0,9993® 59,04«59 40,947®41
СН4 6,000 t= —1( 0,126 В а р и а н 1 ГС; л =1,96 0,755 3: МПа, е' = 0,4 6,4 9 36,900 3,350 <=10 °C 0,250 «1,00 В a p и а н „ л = 3,92 A 0,838 т 4: Ша, e' = 0,49 17,00 26,70
с2н6 0,940 0,159 0,148 8,10 7,180 0,590 0,178 0,105 12,10 3,36
с3н8 0,250 0,310 0,078 15,80 3,810 0,160 0,268 0,043 18,20 1,38
0,088 0,101 0,009 5,13 0,440 0,062 0,070 0,0044 4,74 0,141
0,054 0,175 0,0095 8,90 0,465 0,040 0,135 0,0054 9,17 0,173
0,021 0,048 0,001 2,44 0,049 0,014 0,037 0,0005 2,52 0,016
0,017 0,083 0,001 4,23 0,050 0,012 0,063 0,0008 4,27 0,026
2 — 1,002-1,00 1,002® 1,0 51,0 48,904® 49 — 1,001 «1,00 0,997® 1,0 68,0 31,796® 32
более 93% (мол.), однако, в конденсате остается примерно половина всего
метана и этана.
Чтобы обеспечить степень извлечения пропана из сырого газа, составляю-
щую не менее 90% (мол.) от потенциала, следует принять четвертый вари-
ант, при котором в сепараторе поддерживаются температура t——10 °C и дав-
ление л=3,92МПа.
В условиях четвертого варианта доля сырья в парах будет равна е'=
= 0,32, и следовательно, из 100 кмоль сырого газа получится 63 кмоль кон-
денсата. Это количество конденсата, состав которого дан в табл. 4.8, и явля-
ется сырьем для этановой ректификационной колонны.
2. Материальный баланс колонны. Мольная масса сырого газа, подавае-
мого на установку, равна:
7
Л4С' = = 16-0,432+ 30-0,154 4- 44-0,196 +
1
+ 58-0,150 + 72-0,068 = 34
Производительность установки составляет:
Gc 34 000
F' = , = —кт— = 1000 кмоль/ч
/Wq О*
Количество сырья, поступающего в колонну, равно:
Fj = F (1 — е') = 100 (1 — 0,32) — 68 кмоль/100 кмоль сырья
или
F, 68
F/ = F' — .qq • 1000 = 680 кмоль/ч
Расчет материального баланса колонны приведен в табл. 4.9.
При этом нестабильный бензин, полученный в данной колонне, можно срав-
нить с нестабильным бензином, получаемым в колонне, рассчитанной ранее
(см. с. 115).
Таблица 4.9. Материальный баланс этановой колонны
Углево- дород Данные по сырью Данные по остатку Данные по дистилляту
содер- жание c'v мольн. доли количество Fi= -F’r-'i- =680 c'v кмоль/ч степень извлечения 4>'i’ мольн. доли количество «г кмоль/ч содержа- ние х.' Ril мольн. доли количество °i= =Fi~Rp кмоль/ч содержа- ние y'D = Di ‘
мольн. доли
сн4 0,250 170,0 0 0 0 170,0 0,553
С2Н6 0,178 121,0 0,015 1,8 0,005 119,2 0,388
с3н8 0,268 182,0 0,900 163,8 0,438 18,2 0,059
и-с4н10. 0,069 47,4 1,000 47,4 0,127 0 0
Н-С4Н10 0,135 91,7 1,000 91,7 0,247 0 0
U-C5H42 0,037 25,2 1,000 25,2 0,068 0 0
Н-С5Н12 0,063 42,7 1,000 42,7 0,115 0 0
2 1,000 680,0 — 372,6* 1,000 307,4** 1,000
* В данном случае R.
*• В данном случае D.
130
3. Давление в колонне и ее температурный режим. Поскольку конденсат
из нижней части сепаратора, где давление л=3,92 МПа, перед поступлением
в колонну проходит рекуперативный теплообменник, в котором охлаждается
сырой газ, давление в секции питания колонны должно быть на 0,04 МПа
ниже, чем в сепараторе, т. е.
Я/= л—0,04 = 3,92—0,04 = 3,88 МПа
Давление в верхней части колонны с учетом тарелок укрепляющей части
должно быть на 0,02 МПа ниже, чем в секции питания:
л± = л/ — 0,02 = 3,88 — 0,02 = 3,86 МПа
Давление в емкости орошения, с учетом сопротивления конденсатора и
трубопровода «колонна — емкость орошения», должно быть на 0,04 МПа
ниже, чем в верхней части колонны:
лд=Я1 —0,04 = 3,86 — 0,04 = 3,82 МПа
Давление внизу колонны (в кипятильнике) с учетом сопротивления та-
релок отгонной части должно быть на 0,04 МПа выше, чем в секции пита-
ния:
лд = Л) 4-0,04 = 3,88 + 0,04 = 3,92 МПа
Особенностью работы рассчитываемой колонны является получение из ем-
кости орошения дистиллята в паровой фазе. Дистиллят преимущественно
состоит из метана и этана (см. табл. 4.9). Поэтому в конденсаторе колонны
конденсируется только часть паров, представляющая собой орошение колон-
ны. Так как в конденсаторе протекает, а в емкости орошения завершается
процесс однократной конденсации с образованием двух равновесных фаз —
паровой (дистиллят) и жидкой (орошение) — то при известных составе дис-
тиллята и давлении в емкости орошения, температура в емкости орошения
колонны может быть найдена методом последовательного приближения по
уравнению изотермы паровой фазы:
Соответствующий расчет приведен в табл. 4.10.
Искомая температура в емкости орошения равна /р =—2 °C.
Температура остатка (температура в кипятильнике) определяется по урав-
нению изотермы жидкой фазы:
7 7
1 1
Таблица 4.10. Расчет температуры в емкости орошения этановой колонны
Углево- дород м. 2 lJ'Di при /д=-2°С. Л=3,82 МПа X- .=2А_ OI Ki
сн4 16 0,553 8,85 3,70 0,150 2,40
с2нб 30 0,388 11,64 0,69 0,562 16,86
СзН8 44 0,059 2,60 0,20 0,295 12,98
S — 1,000 23,1* — 1,007^1,00 32,2**
* В данном случае М&.
** В данном случае М а .
ьо
9*
131
Таблица 4.11. Расчет температуры низа этановой колонны
Углево- дород л/. при /д=121 °C л^=3,92 МПа "'ll h л' Miy'Ri
С2н6 30 0,065 0,150 2,9 0,015 0,45
с3н8 44 0,438 19,27 1,5 0,657 28,91
и-С4Н10 58 0,127 7,37 0,83 0,106 6,15
Н-С4Н10 58 0,247 14,33 0,66 0,163 9,45
U-C5H12 72 0,068 4,90 0,37 0,025 1,80
H-CsH]2 72 0,115 8,28 0,34 0,039 2,81
2 — 1,000 54,3* — 1,005^1,0 49,6**
* В данном случае Mr.
** В данном случае
методом последовательного приближения. Одновременно находится состав па-
ров орошения, поступающих из кипятильника под нижнюю отгонную тарелку
колонны. Расчет приведен в табл. 4.11; искомая температура в нижней части
колонны (в кипятильнике) равна /Л=121 °C.
Температуру сырья при его подаче в колонну нерационально оставлять
равной температуре конденсата в сепараторе t=—10 °C, так как при этом
тепловые нагрузки кипятильника и конденсатора будут высокими. Поэтому
сырье нагревают и частично испаряют за счет охлаждения сырого газа, по-
даваемого в сепаратор.
После предварительных расчетов (см. с 136), температура сырья при его
подаче в колонну принимается равной // = 30 °C.
Степень отгона сырья при давлении секции питания л,=3,88 МПа рассчи-
тывается методом последовательного приближения по уравнениям:
7 7 ,
2 X'>i = 1 + е' (Kt — П = 1 y'fi = KiX'ii
1 1
Расчет доли отгона дан в табл. 4.12.
Для определения температуры верха колонны необходимо знать состав
паров, покидающих верхнюю укрепляющую тарелку колонны. Состав этих па-
ров определяется по уравнению концентраций укрепляющей части:
г , y'oi
У'и = г 1 x'oi + г_|_ 1
где у'и — мольная доля i-ro компонента в парах, поднимающихся с верхней
тарелки колонны; г — флегмовое число; x’oi — мольная доля компонента в
орошении, подаваемом на верх колонны (см. табл. 4.10); у’в^ — мольная доля
компонента в дистилляте (см. табл. 4.10).
Флегмовое число определяется по методике Винкла и Тоддта (46, с. 136].
Средняя температура в колонне (имея в виду, что температура ее верха
должна.быть примерно равна /1=17 °C) равна:
'cp = 4“<zi + z/+z*) = ir (17 + 30+ 12]) =56°C
Если в результате расчета будет получено несколько иное значение, это
практически не отразится на точности дальнейших расчетов, так как коэффи-
циенты относительной летучести компонентов незначительно зависят от тем-
132
Таблица 4.12. Расчет доли отгона в этановой колонне
Углеводороды С.'. 1 Л';- при 6=30 “С, Лр=3,88 МПа «г-> е'(Кг-1) г'=0,23
сн4 16 0,250 4,400 3,400 0,782
с2н6 30 0,178 1,100 0,100 0,023
С3н8 44 0,268 0,400 —0,600 —0,138
И-С4Н10 58 0,069 0,190 —0,810 —0,186
H-C4HIQ 58 0,135 0,130 —0,870 —0,200
и-С5Н12 72 0,037 0,056 —0,944 —0,212
Н-С5Н12 72 0,063 0,050 —0,950 —0,218
3 — 1,000 — — —
Продолжение
Углеводороды С1 y’trKiX’ti c'i
1+е'(К2-1)
сн4 1 ,782 0,141 0,621 4,00 2,25 9,90
С2Н6 1,023 0,174 0,192 5,34 5,22 5,76
СзН8 0,832 0,312 0,125 11,80 13,70 5,50
И-С4Н10 0,814 0,085 0,016 4,00 4,92 0,93
Н-С4Н10 0,800 0,169 0,022 7,83 9,80 1,26
И-С5Н12 0,788 0,047- 0,003 2,66 3,38 0,22
н-С5Н12 0,782 0,080 0,004 4,54 5,76 0,29
2 — 1,008^1,00 0,983 s: 1,0 40,2* 45** 23,9***
* В данном
*• В данном
*** В данном
случае
случае
случае
Мс'.
'V
пературы. Коэффициенты относительной летучести компонентов дистиллята,
необходимые для расчета, приведены в табл. 4.13.
За эталонный тяжелый ключевой компонент принимается пропан, а лег-
ким ключевым компонентом будет этан.
Минимальное флегмовое число рассчитывается по уравнению Андервуда:
О
г । ! V a*Di
'мин-Ь 1 а._0
Таблица 4.13. Коэффициенты летучести
Углеводород К1 при /ср=56 °C, лср=3,88 МПа а.= -^- кс3
сн4 5,30 8,80
с2н6 1,52 2,55
С3н8 0,60 1,00
133
Параметр 5
Рис. 4.7. График для определения па-
раметра 6 в уравнении Андервуда.
где 0 — параметр уравнения, определяе-
мый по графику (рис. 4.7) в зависимо-
сти от соотношений с'л/с'т и ал/ат, при
этом с'п и с'т — мольные доли легкого и
тяжелого ключевого компонента в сырье;
ал и ат — коэффициенты относительной
летучести легкого и тяжелого ключево-
го компонента.
В нашем случае
п Лсз' а2 \ 7 0,178 2,55
И-Цс3' ’ а3 0,268 * 1 J~
= /(0,66; 2,55)
Тогда 0=1,6.
Подстановка в уравнение найденных числовых значений величин дает:
8,8-0,553 , 2,55-0,388 _ 1 0,059
'мин + 1 = 8>8_ 1>6 + 2,55—1,6 + 1 — 1,6 =1>57
откуда г„цИ = 0,57.
Рабочее флегмовое число определяется из следующей зависимости:
г ( Г / у'рл \ / х'/?т \ / сл' Х0-55осл I «л )
гмин Ilk У'DT ) \ х'1?л )\Ст) ] ’ ат J
правая часть которой определяется по графику (рис. 4.8).
В нашем случае
Г f Г/г/'р2 \ / х'#3 \ ( с2’ \°’55а21 а2 I
f Г/ 0,388 \ / 0,438 \ / 0,178 \°,55 2.55
= f (lg 0,059 ) 0,005 ) 0,268 J
= /(2,51; 2,55)
Тогда из графика (см. рис. 4.8) можно найти отношение (г/г„„и) = 1,23.
Следовательно
г= 1,23гмин= 1,23-0,57 = 0,7
и уравнение концентраций укрепляющей части колонны принимает вид:
0,7 У'О;
У' 1/ — 0 7 | f~ x'°i "Ь 0,7 -f- 1 = 6,412х ог- -f- 0,588г/ р.
Расчет по этому уравнению приведен в табл. 4.14.
По. известному составу паров, с верхней тарелки и давлению верха ко-
лонны, воспользовавшись уравнением изотермы паровой фазы
зз,
1 I
и применив последовательное приближение, вычисляем температуру верха
колонны /1 = 24°C (см. табл. 4.14).
1 34
Таблица 4.14. Расчет концентраций укрепляющей части этановой колонны
Углеводород x'oi (см. табл. 4.10) y,Dt (см. табл. 4.10) 0,412 x’oi 0,588 у'и- = 0,412 х’о + + 0,588 U’D; Л’. при /1=24 °C. л1=3.86 МПа у'ц х и „ Лг М1 м1«’и
сн4 0,150 0,553 0,062 0,325 0,387 4,15 0,094 16 6,2
с2н6 0,562 0,388 0,232 0,228 0,460 1,05 0,437 30 13,8
с3н8 0,295 0,059 0,122 0,035 0,157 0,33 0,476 44 6,9
2 1,007^1,00 1,000 — — 1,004^1,00 — 1,007^1,00 — 26,9*
В данном случае Му •
Таблица 4.15. Расчет псевдокритических параметров этановой колонны
Углеводород Гкр’ К Ркр, МПа Низ колонны Верх колонны
y'Ri (см. табл. 4.11) Л,..!/ D.’ кр Hi МПа уп’ (см. табл. 4.14) V1,- к Ркру'11’ МПа
СН4
С2Н6
С3Н8
U-C4H10
Я-С4Н10
U-C5H12
-CsH12
«и
190,5 4,50 0,387 74 1,74
305,3 4,70 0,015 4,57 0,06 0,460 140 2,15
369,8 4,13 0,657 242,00 2,71 0,157 58 0,65
408,0 3,53 0,106 43,10 0,38 — — —
425,0 3,67 0,163 69,00 0,60 — —
461,0 3,24 0,025 11,40 0,08 — —
469,6 3,26 0,039 18,20 0,13 — — —
— — 1,005 а: 1,00 388,3* 3,96** 1,004»1,00 272* 4,53**
* В данном случае Т П кр.
•• В данном случае Рп< кр.
Рис. 4.8. График для оп-
ределения рабочего флегмо-
вого числа.
Средняя температура в
колонне равна:
1
*ср= з X
Х(24+ S0+ 121) = 58 °C
Рассчитанная средняя
температура всего на 2К
выше ранее принятой, по-
этому пересчет не делается.
4. Проверка возможно-
сти нагрева сырья до тем-
пературы ввода в колонну.
Подтвердим возможность
нагрева сырья колонны
(конденсат сепаратора) от
/=—10 °C до /, = 30°С и
его частичного испарения (см. табл. 4.12) за счет охлаждения и частичной
конденсации сырого газа, поступающего в сепаратор. Принимается, что из
100 кмоль сырого газа 80 кмоль пройдет через теплообменник конденсата
(количество конденсата равно 68 кмоль на 100 кмоль сырого газа) и
20 кмоль — через теплообменник сухого газа из сепаратора (количество сухо-
го газа равно 32 кмоль на 100 кмоль сырого газа).
Если принять, что сырой газ охлаждается от температуры 35 °C, с которой
он подается на установку [36, с. 127], до температуры 10 °C и частично кон-
денсируется (е' = 0,4<1, см. табл. 4.8), то количество тепла, выделяемого при
этом, будет равно:
Qi — 0.8F [//35 0 — е ) ^н)1
где Ягз — энтальпия сырого газа при температуре 35 °C, давлении 3,92 МПа
и мольной массе Мс = 34 кДж/моль; Н10 — энтальпия паровой фазы сырья
при температуре 10 °C, давлении 3,92 МПа и мольной массе Мп = 21 кДж/
/кмоль (рассчитана по данным табл. 4.8); А1о — энтальпия жидкой фазы
сырья при температуре 10 °C и мольной массе Мж=42,5 кДж/кмоль (рассчи-
тана по данным табл. 4.8).
Из графика [30, с. 10] определяются числовые значения энтальпий,
кДж/кмоль:
Л35 = 448-34 = 15 2 50 Я10 = 385,2-21 = 8100
/г10 = 146,5-42,5 = 6200
Тогда
Qx = 0,8-100 [15250-0,41-8100 — 0,59-6200] =
• = 663 200 кДж/100 кмоль сырья
Количество тепла, необходимого для нагревания конденсата от —10°С до
4-30°С и его частичного испарения (е' = 0,23, см. табл. 4.12) перед подачей
в колонну, равно:
Q2 = Fi [е'Нзо + (1 — е') А3о — h-ia)
где н3о — энтальпия паров при температуре /;=30°С, давлении л/=
= 3,88 МПа и мольной массе Мис=23,9 (см. табл. 4.1Й), кДж/кмоль; й30 —
136
энтальпия жидкой фазы сырья при температуре //=30 °C и мольной массе
Л4г<;=45 (см. табл. 4.12), кДж/кмоль; h-la — энтальпия конденсата при тем-
пературе —10°С и мольной массе А4с=40,2 (см. табл. 4.12), кДж/кмоль.
Из графика [30, с. 10} найдем значения энтальпий, кДж/кмоль:
//30 = 439,6-23,9= 10 515 Л30 = 217,7-45 = 9770
й_10 = 104,7-40,2 = 4210
Тогда
Q2 = 68 [0,23-10 515 + 0,77-9770 — 4210] = 388 000 кДж/100 кмоль сырья
Так как количество тепла, необходимого для нагревания и частичного ис-
парения конденсата, подаваемого в колонну, меньше количества тепла, отда-
ваемого сырым газом при его охлаждении и частичной конденсации (при при-
нятом количестве сырого газа и его конечной температуре), то подогрев и
частичное испарение конденсата вполне возможны. При этом потребуется
меньше 80 кмоль сырого газа, если он будет охлаждаться до 10 °C; если же
его количество будет равно 80 кмоль, то охлаждать газ необходимо до тем-
пературы более высокой, чем 10 °C.
5. Число тарелок в колонне. Число теоретических тарелок в колонне опре-
деляется по графику (рис. 4.9), построенному по формуле:
N
У'Яг \1
х'ял
«л 1
«т /
где N — число теоретических тарелок; ММИв— то же, минимальное.
Минимальное число теоретических тарелок в колонне находится по гра-
фику (рис. 4.10) [46, с. 136], построенному по формуле:
Рис. 4.9. График для определения числа теоретических тарелок в колонне.
137
В данном случае
1g Л/мин — f
( Г/ 0,388 \/ 0,438
f jlg I 0,059 )( 0,005
/<2 ' J о /
2,55 1
—j—> = f (2,762; 2,55)
Тогда
lgArMKH = 0,8 или A\mH = 6,3
Отношение числа теоретических тарелок к минимальному^ числу равно:
N _ f Uy'D* 1 (x'Rs Я -М =
N МИН I аз J
( I / 0,388 \ / 0,438 \] 2,55 ) Л „
~ Vs 1д 0,059 /( 0,005 /1’ 1 I ~^2,762: 2’55)
Тогда (см. рис. 4.9) .¥/Лгиин=2,24, откуда Л’=2,24-Ммин=2,24-6,3= 14.
Оптимальное соотношение чисел теоретических тарелок Ny в укрепляющей
и No в отгонной частях колонны найдется по уравнению [22, с. 412]:
Тогда
-— = 0,412 или Л'у = 0,412^
Так как (Vy+Af0=A’=14, то Ny=4, Л'о= 10.
Число реальных (рабочих) тарелок найдется по формуле
Л/р — Л//г]Ср
где т]ср — средний к.п.д. барботажных тарелок.
Эксплуатация ректификаци-
онных колонн с барботажны-
ми тарелками различных кон-
струкций показывает, что при
работе тарелок в оптимальных
режимах их к. п. д. близки друг
другу. Разными авторами пред-
ложены опытные корреляции
среднего к. п. д. [22, с. 208;
35, с. 90; 47, с. 206].
Для ректификационных ко-
лонн, работающих под давле-
нием, целесообразно использо-
вать клапанные тарелки [47,
с. 207].
Предварительным расчетом
по рекомендациям [47, с. 206]
найдено числовое значение
к. п. д. клапанной тарелки
т] ср=0,67.
Рис. 4.10. График для опреде-
ления минимального числа тео-
ретических тарелок.
138
Число рабочих тарелок равно:
в укрепляющей части
N _ Ny__________^__6
— °-67
в отгонной части
„ _JV___________io__.,
Nop~ Лер - 0,67 7 * * * * * * * 15
всего в колонне
tf = 6+ 15=21
6. Секция питания колонны. При расчете секции питания колонны необхо-
димо показать, что количества проходящих через нее потоков удовлетворяют
уравнениям материального баланса для верхнего и нижнего уровней сечений
этой секции.
Схема секции питания и все обозначения паровых и жидких потоков
приведены на рис. 4.3. Последовательно рассчитываются:
количество флегмы, стекающей с нижней укрепляющей тарелки
gn = rD = 0,7-307,4 = 215,2 кмоль/ч
количество паров, поступающих под нижнюю укрепляющую тарелку
Vm = gn + D = 215,2 4- 307,4 = 522,6 кмоль/ч
количество паровой фазы сырья
Vc — e'Fj1 = 0,23-680 = 156,4 кмоль/ч
количество жидкой фазы сырья
gc = (1 — е') Fi = (1 - 0,23) 680 = 523,6 кмоль/ч
количество флегмы, стекающей на верхнюю отгонную тарелку
gm = gn 4- gc =215,2 + 523,6 = 738,8 кмоль/ч
количество парового орошения с верхней отгонной тарелки
Vo = gm — R = 738,8—372,6 = 366,2 кмоль/ч
Для проверки определяют количество паров, поступающих на нижнюю
укрепляющую тарелку:
Vm = Vc+ Vo = 156,4+ 366,2 = 522,6 кмоль/ч
Паровое число наверху отгонной части (в секции питания):
Уо _ 366,2
«п— = 372|6 —0,98
7. Тепловая нагрузка конденсатора колонны. Тепловая нагрузка конденса-
тора определяется по уравнению [22, с. 175]:
Qk = go (Я1 - h0) + D (Н1 - HD)
где g0=gn=215,2 кмоль/ч — количество орошения; Hi — энтальпия паров,
уходящих с верха колонны при температуре /1=24 °C, давлении iti—
= 3,86 МПа и мольной массе AfV1=26,9 кДж/кмоль; h0 — энтальпия ороше-
ния, подаваемого на верх колонны при температуре /о =—2 °C и мольной
массе Afgo = 32,2, кДж/кмоль; HD — энтальпия паров дистиллята при темпе-
ратуре/о=—2 °C, давлении ло=3,83 МПа и мольной массе Мо =
= 23,1 кДж/моль.
139
Из графика [30, с. 10] определяются числовые значения энтальпий,
кДж/кмоль:
= 418,7-26,9 = 11 250 HD = 376,8 23,1 = 8700
/г0 = 96,3-32,2 = 3100
Тогда
QK = 215,2 (11 250 — 3100) + 307,4 (11 250 — 8700) =
= 2,5-106 кДж/ч = 694,4 кВт
Это количество тепла снимается в конденсаторе с помощью пропанового
охлаждения.
8. Тепловая нагрузка кипятильника колонны. Тепловая нагрузка кипя-
тильника определяется из уравнения теплового баланса колонны [22, с. 158]:
Fi'Qf + Qp ~ DHp + RhR + QK
откуда
Qp = DHd + RhR + QK F/Qf
где hR— энтальпия остатка колонны при температуре /«=121 °C и мольной
массе М«=54,3 (см. табл. 4.11), кКж/кмоль; Qf — энтальпия сырья колонны
(кДж/кмоль), определяемая по уравнению
Qf = e’HVc + (1 — е') hSc
где Hvo—энтальпия паровой фазы сырья при температуре /, = 30 °C, давле-
нии л/=3,88 МПа и мольной массе A4yf = 23,9 (см. табл. 4.12), кДж/кмоль;
hg с —энтальпия жидкой фазы сырья при температуре /,=30 °C и мольной мас-
се A/gc = 45 (см. табл. 4.12), кДж/кмоль.
Из графика [30, с. 10] определяются значения энтальпий, кДж/кмоль:
hR = 452,2-54,3 = 24 600 Яус = 439,6-23,9 = 10 550
he = 201-45= 9045
sc
Тогда
Qf = 0,23-10550 + (1 —0,23)9045 = 9395 кДж/моль,
Qp = 307,4 8700 + 372,6 • 24 600 + 2,5 • 10е — 680 • 9395 =
= 8,1 • 106 кДж/ч = 2250 кВт
Количество парового орошения из кипятильника, поступающего под ниж-
нюю отгонную тарелку колонны, найдется по формуле:
И Qp
F HVr HVr
где HyR—hvR— теплота испарения орошения, равная разности энтальпий его
в паровой и жидкой фазах при температуре /«=121 °C, давлении л«=
= 3,92 МПа и мольной массе Му д=49,6 (см. табл. 4.11), кДж/кмоль.
Ив графика [30, с. 10] определим значения энтальпии, кДж/кмоль:
HVr = 640,6-49,6 = 31 750
hVa = 439,6-49,6 = 21 750
r\
Тогда
8,1 -106
— 31 750 — 21 750 ~ 810 кмоль/4
140
Следовательно, паровое число в нижнем сечении отгонной части аппарата
равно:
VR 810
Sli~ R = 372,6 = 2,2
Как видно, количество парового орошения изменяется по высоте отгон-
ной части более, чем в два раза:
sr 2,2
~^ = Х9Г = 2’24
9. Диаметр колонны. Диаметр колонны определяется по формуле:
где Усек — секундный объем паров в расчетном сечении колонны, м3/с; w —
допустимая скорость паров в расчетном сечении, м/с.
Секундный объем паров определяется по формуле:
У-22,4 (/+ 273) 0,1
г сек- 3600-273л 2
где V — количество паров, проходящих через рассматриваемое сечение ко-
лонны, кмоль/ч; t — температура паров, °C; л — давление паров, МПа; z—
коэффициент сжимаемости паров, являющийся функцией приведенных тем-
пературы и давления смеси z—f (Тар, лПр).
Приведенные температура и давление равны:
для условий верха колонны
Л! 3,86 п ог_
Ппр = ~Р^ = "ХбЗ- = 0,85
для условий низа колонны
То 394
Тпр== Гп.кр = 388,3 = 1,01
nR 3,92
Лпр= Л1.кр “ 3,96
Числовые значения Та.кр и Рп.кр для паров верха и низа колонны рас-
считаны в табл. 4.15.
По графику [22, с. 17] получаем:
для верха колонны z(0,85; И) =0,76;
для низа колонны z(0,99; 1,01) =0,45.
Объемы паров равны:
вверху колонны
(307,4 4- 215,2) 22,4 (24 + 273) 0,1 -0,76
Гсек =-------------3600-273-3,86--------------- °’С68
внизу колонны
810-22,4(121 + 273)0,1.0,45
=--------3600.273-3,92----------= °’С83 М /С
141
Допустимая скорость паров в свободном сечении колонны определяется по
уравнению [31, с. 204]:
0,305С j Г рж — рп
w ~ 3600 \ рп
где С — коэффициент скорости, учитывающий поверхностное натяжение и
расстояние между тарелками; рж и рп — соответственно плотность жидкой и
паровой фаз, кг/м3.
Коэффициент скорости рассчитывается по формуле:
С = 2,6702Смакс у о
в которой Смакс — максимальное значение коэффициента скорости; а — поверх-
ностное натяжение жидкости на границе с паром, Н/м.
Максимальное значение коэффициента скорости для клапанных тарелок
рассчитывается по уравнению:
Смаке = 2950/iT — 460
где hT — расстояние между тарелками, принимаемое равным 0,4 м.
Тогда
Смаке = 2950-0,4 — 460 = 720
Поверхностное натяжение флегмы на границе с паром рассчитывается по
уравнению [31, с. 14]:
I Рж — Рп \0'667
о = 21,2-10-« (7’п.кр- Т) )
где Тп.кр — псевдокритическая температура флегмы, К; Т— температура
флегмы, К; М — средняя мольная масса флегмы.
Псевдокритическая температура флегмы равна:
п
^п.кр = ^КР iXl'
1=1
при этом Ткр I — критическая температура (см. табл. 4.15), К; x’i — содержа-
ние компонента во флегме (см. табл. 4.11 и 4.14).
Числовые значения псевдокритической температуры для флегмы на верх-
ней укрепляющей тарелке и для жидкого остатка равны соответственно
328 К и 406 К.
Средняя мольная масса флегмы на верхней укрепляющей тарелке равна
(см. табл. 4.14):
з
16-0,094 4- 30-0,437+ 44-0,476= 35,6
1
Плотность этой флегмы при температуре /1 = 24 °C находится по графику
[39, с. 106], она равна рж=420 кг/м3.
По величине средней мольной массы остатка Л4Я = 54,3 (см. табл. 4.11)
его плотность при температуре t%= 121 °C находится по графику [39, с. 106J,
она равна рж=380 кг/м3.
Плотность паров, покидающих верхнюю тарелку колонны, рассчитывается
по формуле:
MVj273n 26,9-273-3,86 3
Рл = 22,4 (*! + 273) л0 = 22,4 ( 24 + 273 ) 0,1 ~ 43 кг/м
Плотность паров орошения, выводимых из кипятильника, равна:
Муд273ля 49,6-273-3,92
Рп~ 22,4 (/₽ + 273) л„ ~ 22,4 (121+273) 0,1 ~Ь1’5 кг/м
142
Поверхностное натяжение флегмы на границе с паром при температурах
74=297 К и Г(г=394К равно:
/ 420 — 43 \о.«в7
аТ1 = 21,2 10-е (328 - 297) I--gg-g— I = 3,15 • Ю-з Н/м
/ 380 — 61,5 \°.бб7
аг= 21,2 IO-6 (406 —394) --------л = 0,77-10-3 Н/м
А 1 D х , О г
Подстановка числовых значений величин в формулу для расчета коэффи-
циента скорости дает:
для верха колонны
С = 2,6702-720 ^/3,1510-з = 455
для низа колонны
С = 2,6702-720 у<0,77-IO-3 = 320
Скорость паров равна:
для верха колонны
0,305-455 1/ 420—43
w~~ 3600 V 43 — о, 116 м/с
для низа колонны
0,305-320 -1/ 380 — 61,5 „ „„„
w~ 3600 V 61,5 —0,062 м/с
Диаметр колонны равен:
для верха колонны
1/ 4-0,068
Db~ V 3,14-0,116 —°>87м
для низа колонны
1/ 4-0,083
D4—f 3,14 0,062 ~ 1,31 м
Согласно нормальному ряду диаметров принимается следующее: для верх-
ней части колонны DB=1 м, для нижней DB= 1,4 м.
10. Высота аппарата. Рабочая высота аппарата определится так (см.
рис. 4.5):
Яр = й, + й2 + й3 + й4 +
где ht — расстояние между верхним днищем колонны и ее верхней тарелкой,
принимаемое равным fti=l м; й2— высота укрепляющей части (занятой та-
релками), равная
й2 = (А/у р — 1) йт = (6 — 1) 0,4 = 2 м
h.i — высота секции питания, принимаемая равной й3=1,5 м; /и — высота от-
гонной части колонны (занятой тарелками), равная
Й4= (Яо.р—1)йт= (15—1)0,4=5,6 м, й5 = 2,0 м — принимается из необходи-
мого запаса жидкости. Тогда
Нр= 1 + 2 + l,5 + 5,6-f-2 = 12,1 м
Диаметры основных штуцеров колонны рассчитываются по обычным фор-
мулам гидравлики с последующим принятием их числовых значений по су-
ществующим нормалям.
Сравнивая два варианта этановой колонны (см. рис. 4.1 и 4.6) нетрудно
убедиться в том, что при заданных составе сырья и условиях разделения
143
экономически более целесообразен второй вариант (см. рис. 4.6), обеспечи-
вающий меньшие эксплуатационные расходы. Объясняется это уменьшением
количества орошения, подаваемого на верх колонны, в силу чего сильно
снижаются тепловые нагрузки конденсатора-холодильника и кипятильника.
Более подробно сравнение двух вариантов работы этановой колонны да-
ется в литературе [36, с. 123—128; 41, с. 49—52].
ПРОПАНОВЫЙ ХОЛОДИЛЬНИК-КОНДЕНСАТОР ГАЗА УСТАНОВКИ
НИЗКОТЕМПЕРАТУРНОЙ РЕКТИФИКАЦИИ УГЛЕВОДОРОДНОГО
КОНДЕНСАТА
Исходные данные
Рассчитать пропановый холодильник-конденсатор газа установки низкотем-
пературной ректификации углеводородного конденсата при следующих ис-
ходных данных: состав сырого газа (мольн. доли):
сн4 С2Нб с3н8 И-С4Н10 H-C4H10 И-С5Н12 н-С5Н12
0,432 0,154 0,196 0,056 0,094 0,025 0,043
начальная температура углеводородной смеси /'1=25°С, конечная ее темпе-
ратура ti"=—10°С; давление газа Л1 = 3,92 МПа; количество газа Gi =
=34000 кг/ч; давление пропана на входе в аппарат л2=0,15 МПа.
Схема материальных потоков аппарата показана на рис. 4.6 и 4.11.
Горячий теплоноситель — газ в количестве Gt при температуре t'i пода-
ется в трубное пространство холодильника-конденсатора и выводится из него
при температуре t" (см. рис. 4.11). Холодный теплоносптель — жидкий про-
пан в количестве G2 при температуре /'а подается в межтрубное пространст-
во аппарата и выводится из него при температуре ta".
Расчет
Рис. 4.11. Схема кожухотрубчатого холодильника-конденсатора (испарителя):
1 — корпус аппарата; 2 — распределительная камера; 3 — трубчатый пучок.
144
где Qi — количество тепла, отнимаемого в холодильнике у конденсирующего-
ся газа (тепловая нагрузка), Вт; К — коэффициент теплопередачи в конден-
саторе-испарителе, Вт/(м2-°С); Д/ср — средний температурный напор, °C; q —
теплонапряжение поверхности теплообмена, Вт/м2.
Для определения количества тепла, отдаваемого углеводородной смесью
в холодильнике, необходимо знать ее фазовое состояние в долях газа и кон-
денсата на входе и выходе из аппарата. Для этого надо рассчитать процесс
однократной конденсации углеводородной смеси по уравнениям:
7 7,
2 = 2 1+е' (Кг - 1) = 1
1 1
7 7
2^'=2КгХг'= I
11
где Xi, у/ — мольные доли компонента в равновесных жидкой и паровой фа-
зах (определяются для температур /'i = 25°C и ti" =—10°C); с' — мольная до-
ля компонента в сыром газе; е' — мольная доля паров в равновесной газожид-
костной смеси (определяется при //1=25°С и t"=—10 °C); К — константа
фазового равновесия компонента, определяемая по графику [25, с. 19] при
указанных температурах и давлении ?ti = 3,92 МПа.
Результаты расчета, который ведется методом последовательного прибли-
жения, даны в табл. 4.16.
Количество тепла, отнимаемого в аппарате от газа, находится по уравне-
нию:
Qi = G1 [енЯ(1 вн) htj, — екН^„ (1 ек)
где ен и ек — начальная и конечная массовая доля паров; — эн-
тальпия паровой фазы (М,=21,9) при температуре f'i = 25oC, кДж/кг;
/г/1=Й25 — энтальпия жидкой фазы конденсата (ЛК=44,6) при /'i=25°C,
кДж/кг; Н/'1 = Д_1о — энтальпия паровой фазы (Л4£/=19) при температуре
ti"=—10°C, кДж/кг; hi"1-=h-io — энтальпия жидкой фазы (ЛК=40) при
//'=—10°С, кДж/кг.
Массовые доли паров находятся по соотношению:
где Му и Мс — средняя мольная масса паровой фазы и сырого газа (см.
табл. 4.16).
Тогда
на входе в аппарат
Мя 21,9
ен = ен =0,5 34 = 0,322
на выходе из аппарата
бк = б/4^=0,32-^-=0,179
Мс o'*
Из графика [30, с. 10] определяются числовые значения энтальпий:
Я25 = 431,6 кДж/кг; Н_10 = 335,2 кДж/кг;
й25 = 188,6 кДж/кг; h_10 = 96,4 кДж/кг
Подстановка числовых значений величин в уравнение для расчета коли-
чества тепла дает:
Qj = 34 000 [0,322 431,6 + (1 — 0,322) 188,6-0,176-335,2 —
— (1 —0,179)96,4] =4,34-10,6 кДж/ч = 1210 кВт
10—640
145
Таблица 4.16. Расчет конденсации углеводородной смеси в этановой колонне
У г.’ езо дород ЛЬ 2 c'i Mic'i /'1=25 °C; iti=3,92 МПа! «’„=0.5
Ki Х'Г
сн4 16 0,432 6,90 4,20 0,166 0,697
с2н6 30 0,154 4,62 1,05 0,150 0,158
с3н8 44 0,196 8,60 0,35 0,290 0,102
W-C4H10 58 0,056 3,25 0,17 0,096 0,017
я-С^Ню 58 0,094 5,45 0,12 0,168 0,020
W-C5H12 72 0,025 1,80 0,05 0,048 0,002
rt-CsHi2 72 0,043 3,10 0,04 0,083 0,003
2 — 1,000 34* — 1,001 «1,00 0,999^1,0
Продолжение
<’1=25 °C; л1=3,92 МПа >'н=0,5 t\=—10 °C; П1=3,92 МПа; е'к=0,32
Углеводо- род 7 - + д 'я II ч "Ь;
й 3= к н 5
сн4 2,56 11,20 3,35 0,250 0,838 4,00 13,40
с2н6 4,50 4,75 0,59 0,178 0,105 5,34 3,15
СзН8 12,80 4,50 0,16 0,268 0,043 11,80 1,45
U-C4H10 5,56 0,99 0,062 0,070 0,0044 4,06 0,25
Н-С4Н10 9,70 0,116 0,040 0,135 0,0054 7,83 0,31
W-C5HI2 3,45 0,144 0,014 0,037 0,0005 2,66 0,04
Н-С5Н12 5,98 0,216 0,012 0,063 0,0008 4,54 0,06
2 44,6** 21,9“* — 1,001« «1,00 0,997« «1,0 40“ 19“’
* В данном случае Л1С.
♦* В данном случае Л1х.
*** В данном случае Л1 .
2. Материальный баланс аппарата. Количество газа и конденсата на входе
в аппаоат равно:
VH = е^ = 0,322 34 000 = 10 948 кг/ч
. gH= (1—еи)Ог = (1 —0,322)34 000 = 23 052 кг/ч
Количество газа и конденсата на выходе из аппарата равно:
Кк = eKG1 = 0,179 -34 000 = 6086 кг/ч
gK = (1 — ек) G1 = (1 — 0,179) 34 000 = 27 914 кг/ч
В качестве холодного теплоносителя используется пропан. Согласно зада-
нию, жидкий пропан подается в межтрубное пространство аппарата под дав-
146
лением лг=0,Г5 МПа. При этом температура кипения пропана будет равна
is=—30 °C, а его скрытая теплота испарения г=413,3 кДж/кг [33, с. 175].
Необходимое количество испаряющегося пропана определяется по фор-
муле:
где Т]т — коэффициент использования тепла в аппарате, принимаемый рав-
ным 0,95.
Подстановка числовых значений величин в формулу для расчета количе-
ства испаряющегося пропана дает:
„ 4,34-10*
°п— 413,3-0,95 — 11 100 кг^4
Необходимое количество жидкого пропана составляет
бп 11 100
^2= о,8 = 0,8 =13 875 кг/ч
где 0,8 — принятая на базе практических данных доля испаряемого жидкого
пропана.
3. Выбор типа аппарата. Для нахождения стандартного типоразмера ап-
парата необходимо определить ориентировочную поверхность теплообмена
пропанового холодильника с учетом того, что в нем идет процесс частичной
конденсации углеводородной смеси.
Ориентировочная поверхность теплообмена рассчитывается по формуле:
F______<к—
где Ко — ориентировочный коэффициент теплопередачи, Вт/(м2-°С).
Согласно рекомендации [18, с. 557] коэффициенты теплопередачи в кон-
денсаторах-испарителях практически находятся в пределах 230—580 Вт/(м2-
•°C). Для данного случая принимается, что коэффициент теплопередачи Ка=
= 400 Вт/(м2-°С).
Средний температурный напор в аппарате равен:
., _ Аймаке А/мин
а‘ср — м
2,31g
где Аймаке и Д/мин — максимальная и минимальная разность температур, °C.
Со стороны пропана, кипящего в межтрубном пространстве холодильника-
конденсатора, температура остается постоянной и равной —tt=—ЗО°С.
Поэтому максимальная разность температур равна:
Аймаке = G' - is = 25 - (-30) = 55 °C
а минимальная
А^мин = ii - is = - Ю - (-30) = 20 °C
Подстановка числовых значений величин в формулу для расчета среднего
температурного напора дает:
д/ср з4?5оС
2,31g^o-
Ориентировочная поверхность теплообмена равна:
1210-Ю3 „ „
F~ 400-34,5 ~88м
10’
147
По отраслевому стандарту ОСТ-26-02-434—72 принимается испаритель ко-
жухотрубчатый непосредственного охлаждения технологических сред типа
ИКТУ (испаритель кожухотрубчатый с П-образными трубами и жестким
кожухом). Техническая характеристика этого аппарата приведена ниже:
Диаметр корпуса, мм Диаметр распределительной камеры трубного 1000 600
пучка, м.м Длина трубок, мм 6000
Диаметр трубок, мм 25X2,5
Шаг трубок, мм 32
Число трубок в пучке 241
Число ходов по трубкам 2
По этим данным можно достаточно точно рассчитать поверхность тепло-
обмена аппарата.
При размещении трубок по вершинам и сторонам правильных шестиуголь-
ников диаметр распределительной камеры трубного пучка равен:
DK = D' + 4dH
где D' — диаметр окружности, описанной около наибольшего шестиугольни-
ка: м; 4 = 0,025 м — наружный диаметр трубки.
Тогда
D' = Da — 4dH = 0,6 — 4-0,025 = 0,5 м
Число трубок, размещаемых по диагонали наибольшего шестиугольника,
находится из формулы:
D' = s (b — 1)
где s = 0,032 м — шаг трубок; Ь — число трубок.
Тогда
D' 0,5
Ь = —+ 1= 0032 + 1 ~ 17
Число шестиугольников, на которых размещены трубки:
Ь-1 17-1 ,
х- 2 — 2 -8
Так как пучок из ДЛобразных трубок является двухходовым, то число его
трубок будет меньшим на «столько трубок, сколько их имеется на наибольшей
диагонали одноходового пучка, т. е.
ЛГ = /ут _ b = 241 — 17 = 224
Следовательно, можно подсчитать число трубок в пучке для одного хода
теплоносителя
N 224
=-2’ — 2 = 112
Поверхность теплообмена аппарата равна:
/\ = ЛГл4/ = 224-3,14-0,025-6= 106 м2
Поэтому, для обеспечения необходимой поверхности теплообмена, рас-
считанной выше, следует установить следующее число аппаратов:
F 88
"= Fl = 106 ~ 1
148
В последующих расчетах поверхность теплообмена и число аппаратов бу-
дут уточнены.
4. Коэффициент теплопередачи. Коэффициент теплопередачи с учетом теп-
ловых сопротивлений стенки и загрязнений внутренней и наружной ее по-
верхности рассчитывается по уравнению:
1
К ~ 1 , 6ст 6В 6Н 1
«г + Хет + + + Хн + а2
где ai — коэффициент теплоотдачи со стороны конденсирующегося газа,
Вт/(м2-°С); 6ст=0,0025 м — толщина стенки трубы; ХСт=45,3 Вт/(м-°С) —
коэффициент теплопроводности материала стенки трубы (сталь); 6В/ХВ=
= 0,000172 (м2-°С)/Вт— тепловое сопротивление слоя загрязнения внутрен-
ней поверхности труб [17, с. 336]; 6Н/ХН=0,000172 (м2-°С)/Вт— тепловое
сопротивление слоя загрязнения наружной поверхности труб [17, с. 336]; аг —
коэффициент теплоотдачи со стороны кипящего пропана, Вт/(м2-°С).
Расчет показывает (см. табл. 4.16), что в трубном пучке холодильника-
конденсатора идет процесс частичной конденсации исходного газа, причем
паросодержание двухфазного потока (или массовая доля пара) изменяется от
е„=0,322 до ек = 0,179. В этом случае средний коэффициент теплоотдачи (со
стороны конденсирующегося газа) в трубном пространстве рассчитывается по
формуле [38, с. 145]:
где а0 — коэффициент теплоотдачи при турбулентном движении потока в
трубном пучке. Вт/(м2-°С); (рв/рсм)i — отношение плотности конденсата к
плотности парожидкой смеси при температуре потока на входе в трубный
пучок fi=25°C; (рк/рсм)2 — то же, при температуре выхода потока из труб-
ного пучка ti"=—10 °C.
- Коэффициент теплоотдачи а0 для турбулентного потока в трубках рассчи-
тывается по уравнению [38, с. 84];
\ / Рг \0,25
«о = 0,021 — Reo.sPr^-p;—) е/
где % — коэффициент теплопроводности жидкости при средней температуре
потока в трубном пучке, Вт/(м-°С); dB=0,02 м — внутренний диаметр трубки;
Re — критерий Рейнольдса для жидкого потока при его средней температуре;
Рг, Ргст — критерии Прандтля для этого же потока при средней температуре
и температуре стенки трубы; щ — коэффициент, учитывающий изменение
среднего коэффициента теплоотдачи по длине трубы (в данном случае при
//+=6/0,02=300 >50 и ег=1 [38, с. 84]).
Средняя температура жидкости в трубном пучке:
*ср.1 = 0,5 (// + //) = 0,5 (25+ (—10)) = 7,5 °C
Температура стенки трубы принимается (с последующей проверкой) рав-
ной /с = —5 °C.
Так как исходный газ имеет мольную массу Л/с = 34, близкую к мольной
массе этана, то необходимые для расчета коэффициента теплоотдачи а0 теп-
лофизические свойства жидкости берутся как для этана. Предварительные
расчеты показывают, что это не приводит к значительной ошибке:
коэффициент теплопроводности [33, с. 173]
Х7 5 = 0,096 Вт/(м °С) 2._5 = О,1О4 Вт/(м-°С)
коэффициент теплоемкости [33, с. 172]
с7 5 = 3,55 кДж/(кг-°С) с_5 = 3,47 кДж/(кг °С)
149
плотность [38, с. 106]
р7 5 = 445 кг/м3
вязкость динамическая [33, с. 161]
т]7>5 = 60-10-6 Па с
вязкость кинематическая
р_5 = 457 кг/м3
т]-5 = 67,1 Ю-® Па с
117,5 60 -10-е
v7.5 = — = = 0,135-10-® м2/с
п_5 67,1-IO-6
V-5 = = -^457------= 0,147- IO-® м2/с
Критерий Рейнольдса определяется по формуле:
Re =
*ср.1
в трубках пучка, м/с; Vi3p j — коэффи-
где w—линейная скорость жидкости
циент кинематической вязкости, м2/с.
Линейная скорость жидкости в трубах пучка равна:
w ~ Vсек/fl
где Усек — секундный объем конденсата, пропускаемого по трубкам
м3/с; fi — площадь проходного сечения для одного хода теплоносителя
ке, м2.
Секундный объем конденсата равен:
G, 34 000 .
3600р7>5 = 3600-445 = °>022 м/с
^сек —
Площадь проходного
равна:
сечения для одного хода теплоносителя в
= 112-
3,14-0,022 „
= 0,035 м2
пучка,
в пуч-
пучке
Л = ЛЛ
4
4
Тогда
0,022 .
ш = ’0^35" = 0-63 м/с
0,63-0,02
Re ~ 0,135-10~6 — 93000
формуле:
Критерии Прандтля определяются по
0,135-10-«.3,55-103-445 _ 2 22
Рг =
РгСт
I _ 0,096
7,5
\ 0,147-10~6-3,47-103-457 _ 2 23
-5
0,104
По^становка полученных значений физических величин в уравнение для
коэффициента теплоотдачи а<> дает:
0,096
а0 = 0,021 -q Q2Q 93 000°.82,22М3
( 2 22 Л0.2®
-2^23~) * 1 = 1330 Вт/(м2-°С)
Плотность конденсата (кг/м3) находится из графика [39, с. 106]:
(Рж)г5=495;
(рж) -ю = 515.
при
при
// = 25 °C и ЛК=44,6
/," =—10°С и Мх=40
150
Плотность паровой фазы (кг/м3) рассчитывается по известной формуле:
МлТ0
Рп = 22,4 (/ +273) л0
при Z'i=25 °C и Afs=21,9
21,9-3,92-273
(Рп)а5 — 22,4 (25 + 273) 0,1 ~ 35,6
при t’i =—10 °C и Л!и=19
19-3,92-273
(Рп)-ю= 22,4 (—10+ 273)0,1 — 35
Плотность парожидкостной смеси (кг/м3) определяется по формуле:
1
Рем = е 1 _ е
Рп Рж
при //=25 °C
(рсм)з5 = I _ еч = 0,322 1 — 0,322 ='93
(рп)з5 (Рж)25 35,6 495
при t"=—10 °C
1 1
(Рсм)-ю— ек 1—ек ~ 0,179 1 —0,179 ~150
(Рп)-ю (Рж)-ю 35 515
где е — массовая доля пара в парожидкостной смеси.
Коэффициент теплоотдачи eti [Вт/(м2-°С)] равен:
1330 Гт/"495“ т/ 515 1
“1 ~ 2 [И 93 + Г 150 J “2750
Коэффициент теплоотдачи со стороны кипящего пропана зависит от теп-
лонапряжения поверхности теплообмена аппарата (с. 109):
а2 = 1,66<у2/ з
где q — теплонапряжение поверхности теплообмена, Вт/м2.
Подстановка числовых значений в уравнение для расчета коэффициента
теплопередачи дает:
1 1
К = 1 0,0025 1 ~ 1
-2750" + "TS/T" + °'000172 + °'000172 + °'°0076 +
Так как коэффициент а2 является функцией теплонапряжения поверхности
теплообмена <?, величина которого неизвестна, коэффициент теплопередачи
рассчитывается методом последовательного приближения. Для этого задают-
ся несколькими значениями ?к и находят а2, К, Д/р- Результаты расчетов
приведены в табл. 4.17.
Теплонапряжение поверхности теплообмена (см. с. 111) можно определить,
построив нагрузочную характеристику аппарата Д/ср=/(?)- Однако, зная
средний температурный напор в рассчитываемом аппарате Д/ср=34,5°С,
теплонапряжение его поверхности теплообмена легко определить интерполя-
151
Таблица 4.17. Расчет коэффициента а2
Параметр, единица измерения Результаты четырех расчетов
1 2 3 4
q, Вт/м2 (принимается) 10000 15000 20000 25000
ab Вт/(м2-°C) 2750 2750 2750 2750
«2=1,66 <72-3, Вт/(м2-°С) 770 1010 1220 1410
К, Вт/(м2-°С) 484 570 633 682
Д^ср= 'с л 20,6 26,2 31,6 36,6
цией данных, приведенных в табл. 4.17:
25 000— 20 000
q = 25 000 — 3(. 6_ 31 6 (36,6 — 34,5)= 22 900 Вт/м2
Тогда, коэффициент теплопередачи в холодильнике-конденсаторе будет
равен:
Q, 22 900
к= дЙГ = ^4Х = С60 Вт/(м2-ос>
Поверхность теплообмена холодильника-конденсатора составляет:
Qi 1210-103
FP= q = 22 900 =53 м2
5. Проверка температуры стенки трубы. Средняя температура стенки тру-
бы рассчитывается по уравнению:
/ 1 6В \
zct = 4p.i — q =
/ 1 \
= 7,5 — 22 900 О7с7г + 0,000172 1 = —4,8°С
\ z/oU /
Ранее температура стенки принималась равной —5°C (с. 149). Как видно,
разница с полученной величиной находится в допустимых пределах.
6. Число теплообменных аппаратов. Расчетное число теплообменных ап-
паратов ранее выбранного типоразмера составляет
Кр 53
ЛГр— — 106 —0,5
Из расчета следует, что для заданных условий необходимо установить
один холодильник-конденсатор типа ИКТУ, при этом будет обеспечен ре-
зерв поверхности теплообмена.
БУТАНОВАЯ КОЛОННА-СТАБИЛИЗАТОР ГАЗОФРАКЦИОНИРУЮЩЕЙ
• УСТАНОВКИ
Исходные данные
Рассчитать бутановую ректификационную колонну для стабилизации не-
стабильного бензина при следующих исходных данных: нестабильный бензин
имеет следующий состав (масс, доли):
152
С3н8 w-СдНю н-СдНю С5Н12 и выше
0,006 0,171 0,415 0,408
Нормальный бутан в дистилляте должен содержаться в количестве <р0 =
= 0,98 масс, доли; содержание всего пентана и более тяжелых углеводородов
в стабильном бензине должно составлять <рЛ = 0,99 (масс, доли); начальная
температура охлаждающей воды /в=20°С; сырье в колонну подается в виде
кипящей жидкости; производительность аппарата по сырью Gc =30000 кг/ч.
Обозначения основных материальных потоков бутановой колонны соответ-
ствуют рис. 4.2.
Особенности работы и показатели технологического режима газофракцио-
нирующих установок с различными режимами давления описаны в литерату-
ре [36, с. 41, 45].
Расчет
1. Материальный баланс колонны, соответствующий условиям разделения
приведен в табл. 4.18.
2. Давление в колонне. Принимается, что температура дистиллята в емко-
сти орошения на 15 °C превышает начальную температуру охлаждающей
воды:
/о = ^ + 15 = 20+ 15 = 35 °C
По уравнению изотермы жидкой фазы для дистиллята
4
1
методом подбора находим давление по в емкости орошения.
Величины констант фазового равновесия определяются по номограмме
[25, с. 19}. Весь расчет приведен в табл. 4.19; давление в емкости орошения
ло = О,38 МПа; давление на верху колонны, учитывая гидравлическое сопро-
тивление между колонной и емкостью орошения, принимается на 0,04 МПа
больше, чем в емкости орошения.
Тогда
Лд = ло + 0,04 = 0,38 + 0,04 = 0,42 МПа
За счет сопротивления тарелок давление внизу колонны должно быть на
0,03 МПа выше, чем наверху, поэтому
л^ = Лд + 0,03 = 0,42 + 0,03 = 0,45 МПа
Давление в секции питания принимается средним между по и л^:
я; =0,5 (яд + яд) = 0,5 (0,42 + 0,45) = 0,435 МПа
3. Температурный режим в колонне. Температура tD наверху колонны
определяется методом последовательного приближения по уравнению изотер-
мы паровой фазы для дистиллята
Расчет приведен в табл. 4.20; температура верха колонны Zz)=41 °C.
153
Таблица 4.18. Материальный баланс бутановой коЛоннЫ
Компонент М1 Данные по сырью Данные по дистилляту
содержание xfC масс, доли количество содержание степень извлечения 4>р.. масс, доли количество
xtr — 30000 Xf , кг/ч ‘ м. 1 кмоль/ч • .= мольн. доли Di=h кг/ч nD.^. и1 Л1. кмоль/ч
с3н8 44 0,006 180 4,1 0,008 0,352 1,00 180 4,1
U-C4HIO 58 0,171 5130 98,4 0,202 11,716 1,00 5130 98,4
Н-С4Н10 58 ' 0,415 12450 215,0 0,442 25,636 0,98 12200 210,7
с5н12+ 72 0,408 12240 170,0 0,348 25,056 0,01* 147 2,04
2 — 1,000 30000 487,5 1,000 447=62,8 — 17657 315,24
Продолжение
Компо- нент Данные по дистилляту Данные по остатку
содержание Mix'Di степень извлечения масс, доли количество содержание Mlx'Ri
г масс, доли Х'°Г = "Д; , мольн. доли Ч'^. кг/ч R Mi кмоль/ч масс, доли Х' - 'lRi Ri~Sn ’ мольн. доли
с3н8 0,0102 0,013 0,572 0 0 0 0 0 0
U-C4HI0 0,2910 0,311 18,038 0 0 0 0 0 0
Н-С4Н10 0,6900 0,670 38,860 0,02“ 250 4,30 0,0204 0,025 1,45
0,99 12093 167,96 0,9800 0,975 70,20
С5Н12+ 0,0083 0,006 0,432
2 0,9995® 1,000 Л4д=57,9 — 12343 172,26 1,0004® 1,000 44^=71,7
®1,000 «1,000
• фо =1- ф „ «1-0,99=0,01.
<р 6 = i-m п6 = 1-0,98=0,02.
Таблица 4.19. Расчет давления в емкости орошения
Компонент К- при яо=0.38 МПа. /О=35 °C X'Di (см. табл. 4.18) Kix'Di
С3Н8 ' 2,60 0,013 0,034
iz-C4HI0 1,25 0,311 0,389
»-с4н10 0,86 0,670 0,576
С5Н12+ 0,29 0,006 0,002
2 — 1,000 1,001х1
Таблица 4.20. Расчет температуры верха бутановой колонны
Компонент К, при Лд=0,42 МПа, /р=41 «С y'DrX'Di y,Dj *1
с3на 2,80 0,0130 0,0046
м-С4Н]0 1,31 0,3110 0,2381
Я-С4Н10 0,91 0,6700 0,7370
С5Н12+ 0,31 0,0060 0,0194
2 — 1,0000 0,9991 al
Таблица 4.21. Расчет температуры сырья бутановой колонны
Компонент при Лл= 0,435 МПа, ^=51 °C x’h y'f-rKix'h
С3Н8 3,26 0,0080 0,0260
м-С4Ню 1,68 0,2020 0,3390
к-С4Ню 1,13 0,4420 0,5000
^sHt2 + 0,40 0,3480 0,1390
2 — 1,0000 1,0040а 1
Температура tf сырья, при его подаче в колонну, определяется по урав-
нению изотермы жидкой фазы
4
2К^=1
1
тем же методом. Расчет дан в табл. 4.21. Температура сырья // = 51 °C.
Температура tR внизу колонны определяется по уравнению изотермы жид-
кой фазы для остатка
4
2 =1
1
тем же методом. Расчет дан в табл. 4.22. Температура внизу колонны /«=
=90 С.
155
Таблица 4.22. Расчет температуры низа бутановой колонны
Компонент при л^=0,45 МПа, /^=90 °C y,R~Kix'R-L
Я-С4Н10 2,40 0,0250 0,0600
С5н12+ 0,97 0,9750 0,9400
2 — 1,0000 1,0000
4. Минимальное количество орошения. Минимальное флегмовое число под
нижней тарелкой укрепляющей части находится по уравнению Андервуда
4
V aix Di
Г“ИН + 1 = аг — е
где а,- — коэффициент относительной летучести компонента при температуре
/, = 51 °C и давлении л/ = 0,435 МПа (табл. 4.23); 0 — параметр, определяе-
мый из другого уравнения Андервуда
4
е а‘~е
методом подбора, имея в виду, что в нашем случае е' = 0 (сырье — кипящая
жидкость). Расчет значения параметра 0 дан в табл. 4.23.
При этом за эталонный компонент принят пентан. Параметр 0=1,31 соот-
ветствует мс\ту, располагающемуся между значениями а, распределяющихся
компонентов: а„.с4=3,83 и ас7> — I.
Минимальное флегмовое число равно:
8,15-0,013 , 4,2-0,311 2,83-0,670 г 10,006
гМин+ > = 8;15 _ 1>31 + 4,2 — 1,31 + 2,83— 1,31 + 1—1,31 =
-=1,69 или гмин = 0,69
5. Рабочие флегмовое и паровое числа. Коэффициент избытка флегмы на-
ходится по уравнению [31, с. 68]:
/-опт 0,35 0,35
гопт = ~ ~ 4-1,35= Q eg 4- 1,35 = 1,86
'МИН 'МИН и =
Тогда рабочее флегмовое число равно:
гопт = 1,86тми„ = 1,86-0,69 = 1,28
Таблица 4.23. Расчет параметра 0 для бутановой колонны
Компо- нент (см. табл. 4.21) Ki rR = х'п (см. табл. 4.18) 1 fi r4-9 при e=i ,.3i
a.— 0
С3Н8 3,26 8,15 0,008 0,065 6,84 0,0095
U-C4H10 1,68 4,20 0,202 0,848 2,89 0,2930
H-C4H1Q 1,13 2,83 0,442 1,251 1,52 0,8230
с5н12+ 0,40 1,00 0,348 0,348 —0,31 —1,1230
2 — — 1,000 — — 4-0,0025=0
156
Рабочее паровое число равно:
______грптО' 4~ Е' (1 — е ) —R' _
$опт = ' —
1,28-315,24 + 487,5(1 —0)— 172,26
= 172,26 —4.17
6. Количество материальных потоков, проходящих секцию питания колон-
ны. Схема секции питания колонны приведена на рис. 4.3. Расчет проводится
в такой последовательности:
количество орошения, стекающего с нижней укрепляющей тарелки
gK' — ronTD' = 1,28-315,24 = 403,5 кмоль/ч
количество паровой фазы сырья
Vc' = e'F' = 0-487,5 = 0
количество жидкой фазы сырья
gc' = F’ — Vcr = 487,5 — 0 = 487,5 кмоль/ч
количество жидкости, стекающей на верхнюю отгонную тарелку
gm' = gK' + gc' = 403,5 + 487,5 = 891 кмоль/ч
количество парового орошения, стекающего с верхней отгонной тарелки
Vo' = gm' — R' — 891 — 172,26 = 718,74 кмоль/ч
количество паров, поступающих под нижнюю укрепляющую тарелку
Vm' = Vo' + Vc' = 718,74 + 0 = 718,74 кмоль/ч
или
Vт’ = gR' + D' = 403,5 + 315,24 = 718,74 кмоль/ч
7. Тепловая нагрузка конденсатора-холодильника и количество холодного
орошения колонны. Тепловая нагрузка конденсатора-холодильника с доста-
точной точностью может быть найдена по уравнению
QK = g'(^D-M + °'(^D-4)
где g'=g'K=392,l кмоль/ч — количество горячего орошения наверху колон-
ны, принимаемое равным количеству орошения внизу укрепляющей части;
И, D—энтальпия паров дистиллята при температуре + = 41 °C и давлении
Ло=0,42 МПа, кДж/кмоль; htD—энтальпия конденсата дистиллята при тем-
пературе +=41 °C, кДж/кмоль; hiQ — энтальпия конденсата дистиллята при
температуре +=35 °C, кДж/кмоль.
Числовые значения энтальпий определяются по графику [30, с. 10]. Тогда
QK = 403,5 (34 000 — 14 500) + 315,24 (34 000 — 13 600) =
= 14,3-10е кДж/ч = 3970 кВт
Количество холодного орошения, подаваемого наверх колонны, находится
по формуле:
, , HtD—htD 34 000— 14 500
So ~g HtD—hto —403,5 34 000— 13 600 ~386 кмоль/4
или
go = go'MD = 386-57,9 = 22 350 кг/ч
8. Тепловая нагрузка кипятильника и количество парового орошения внизу
колонны. Если считать количество парового орошения величиной переменной
157
по высоте отгонной части, то тепловую нагрузку кипятильника можно опре-
делить из уравнения теплового баланса всей колонны [22, с. 158]:
F'htf = D'qB + R'qB
где Л^— энтальпия сырья, подаваемого в колонну в виде кипящей жидкости
при температуре Zf = 51 °C, кДж/кмоль; qB и qB — верхний и нижний тепло-
вые параметры колонны, кДж/кмоль.
Энтальпия сырья определяется по графику [30, с. 10].
Верхний тепловой параметр колонны определяется по формуле [22,
с. 148]:
386 (34 000- 13 600)
= 34 000 4-------3Т5 24-------- '= 58 990 кДж/кмоль
нижний — по формуле [22, с. 135]:
~ htR R’
где hi R—энтальпия остатка колонны при температуре <д=90°С, кДж/кмоль;
<2р — тепловая нагрузка кипятильника, кДж/ч.
Подстановка значения qB в уравнение теплового баланса колонны дает:
Qp = К'?1!# — (F В ?в) =
= 172,26-28 680 -(487,5-17 000 — 315,24-58 990) =
= 15,3 -10е кДж/ч = 4250 кВт
Количество парового орошения внизу колонны находится по формуле:
,, , _ Qp Qp
R ~ ^R ~
где Xr=Hir—ht^—скрытая теплота испарения флегмы, поступающей из ко-
лонны в кипятильник, равная разности энтальпий паров орошения, идущих
из кипятильника в колонну, и остатка, покидающего кипятильник,
кДж/кмоль (при рабочих условиях колонны с кипятильником, имеющим па-
ровое пространство).
Тогда
15,3-10е
= 49 600 - 28 680 “ 732 кмоль/ч
Сравнение полученного значения У'д с ранее найденной величиной У'о=
= 718,74 кмоль/ч показывает, что количество парового орошения несколько
возрастает к низу отгонной части.
Если количество парового орошения считать постоянным по высоте отгон-
ной части, то V'r= V'o = 718,74 кмоль/ч. Тогда тепловая нагрузка кипятиль-
ника определится так:
« Qp = = VR (HtR - htR) =
= 718,74 (49 600 — 28 680) = 15,1- 10е =- 4200 кВт
Как видно, эта величина мало отличается от той, которая была рассчи-
тана выше.
9. Число теоретических тарелок колонны и ее частей. Минимальное число
теоретических тарелок в колонне определяется по уравнению Фенске — Ан-
дервуда в расчете на то, что легким ключевым компонентом по условиям
158
разделения является нормальный бутан («-С4Н10), а тяжелым ключевым —
пентан (CsHia):
(x'd3 x'Ri \ / 0,670 0,975 А
lg U'n, ‘ x'r, ) lg 0,006 ‘ 0,025 /
Л/мин =---------5?---— =--------------ГЙ----------= 7,9 « 8
Число теоретических тарелок в колонне находится по формуле [31, с. 68]:
Ыопт 0,7 0,7
Оопт =^- = V—+1.7 =-i~+1.7 =1.788
О'мин '’мин °
Тогда
МОпт = 1,788Л/МИН = 1,788-8 = 14,3
Принимается следующее число теоретических тарелок в колонне /+=15.
Оптимальное соотношение числа тарелок N, в укрепляющей и Ns в отгон-
ной частях колонны вычисляется по уравнению [22, с. 412]:
N, Г /?' / x'f \ / x'r
1^ = 0’20614^«)(рБГ
Г 172,26 7 0,348 \ / 0,025 \2
= 0,206 lg 315>24 I 0 >442 I I 0>006 I
= 0,18
откуда
-^-=1.5!5
Так как Mr+Ms=15, то числа теоретических тарелок равны Ns=6, Nr=9.
Для сравнения рассчитывается число теоретических тарелок в колонне по
методике Тиле и Геддеса, основы которой изложены в литературе [22, с. 406;
48, с. 389]. В качестве исходных данных для расчета по этой методике ис-
пользуется материал, полученный в предыдущей части настоящего расчета.
Расчетные уравнения для укрепляющей части:
x'ni _ I _ у'п1 I __ g/ / x'ni _ Л . !
X D} Кщ X D-t х D} Vm у X р. J
То же, для отгонной части:
У m: X ГП:
____z __ г/ г
X Ri____1 X #i
X (m+1) I Vn' / ifm.: \
———— = V —T-2- —11+1
x’Ri gm’ x'R. I
где n — номер укрепляющей тарелки, считая сверху; т — номер отгонной
тарелки, считая снизу; i—номер компонента согласно табл. 4.18 (i=l, 2, 3,
4); х'о .— мольная доля i-го компонента в дистилляте (при л=1, y'ni=x't>i)
x'r. — то же, в остатке (для кипятильника щ=0, x'Ol =x'^.); К — константа
фазового равновесия компонента при давлении л=0,435 МПа и температуре
на данной тарелке.
При выбранном профиле изменения температуры по тарелкам укрепляю-
щей части, пользуясь первой парой уравнений, можно для каждой тарелки
(начиная с первой сверху) рассчитать значения x'n./x'Diu у’п./X'ог не распо-
159
Таблица 4.24. Расчет числа тарелок по Тиле и Геддесу
для укрепляющей части колонны
Углеводороды к *'i _ 1 x'd к D'x'. = L D'x’D x'd x'd
1-я тарелка сверху (i=l) Л = 41°С
C3H8 2,750 0,365 1,497 0,645
U-C4H10 1,315 0,760 74,632 0,867
H-C4H10 0,885 1,130 237,752 1,072
0,300 3,330 1,865 2,300
2 — — 315,75 —
2-я тарелка сверху (1=2) /2=42°С
C3H3 2,82 0,230 0,94 0,570
U-C4H10 1,37 0,633 62,16 0,794
Й-С4Н10 0,91 1,180 248,17 1,100
C5Hi2+ 0,31 7,420 4,15 4,590
2 — — 315,52 —
3-я тарелка сверху (1=3) /3=42,5°С
C3H8 2,840 0,201 0,824 0,555
ZZ-C4H[O 1,400 0,569 55,880 0,761
Н-С4Н10 0,925 1,190 250,380 1,110
C5H12 + 0,315 14,600 8,150 8,600
2 — — 315,23 —
4-я тар елка свер xy (1=4) /4 = 43,5 °C
C3H8 2,910 0,192 0,785 0,550
U-C4H10 1,450 0,526 51,650 0,736
Л-С4Н10 0,940 1,180 248,270 1,100
С5Ы12+ 0,325 26,500 14,840 15,200
2 — — 315,55 —
5-я таре лка сверху (i=5) Г.=45,6°C
с3н8 2,960 0,186 0,762 0,545
U-C4H10 1,510 0,487 47,820 0,713
Н-С4Н10 0,960 1,145 240,910 1,081
csHJ2+ 0,332 45,900 25,700 26,000
2 — — 315,19 —
6-я тарелка сверху (1=6) /6=47,5°С
с3н8 3,030 0,180 0,74 0,543
U-C4H[0 1,560 0,457 44,88 0,697
Н-С4Н10 0,995 1,090 229,34 1,050
С5Н12 + 0,355 73,000 40,890 41,300
2 — — 315,85 —
160
Продолжение
Углеводороды К X'. 1 Ж'. Dfx'.——— D'x'D x'd y'i+i x'd
7-я тарелка сверху (1=7) 6 = 48,6°C
С3на 3,100 0,175 0,718 0,544
1,610 0,432 42,400 0,682
1,050 1,000 210,400 1,000
С5Н12+° 0,372 111,000 61,600 62,600
2 — — 315,12 —
8-я тарелка сверху ((=8) /g-50,7oC
C3H8 3,250 0,168 0,688 0,539
U-C4H10 1,670 0,408 40,070 0,668
Я-С4Н10 1,125 0,889 187,050 0,938
C5H12+ 0,400 156,500 87,640 88,000
2 — — 315,45 —
9-я тарелка сверху (i=9) 6=54 °C
C3H8 3,440 0,157 0,645 0,530
U-C4H10 1,750 0,382 37,510 0,655
H-C4H10 1,200 0,780 164,110 0,877
С5Н12+ 0,435 202,300 113,290 113,730
s — — 315,56 —
в табл. 4.24. В качестве примера, дается
лагая величиной х'п-- Расчет сведен
расчет для второй тарелки:
Х 21______у'21
x>Dl — x'D1
0,645
2,82 — 0,230
У 31____________У к
Я £>£ V'm
403,5
1 = 718+4 (°.23— О + 1 =
= 0,56 (0,23— 1)+ 1 =0,570
= 0,56 (0,633 - 1) + 1 = 0,794
^2
Л11-= 0,56 (1,18-1) + 1 = 1,10
х 22 __ У 22
x'd2 ~ Кх'р2
х'гз________У
x'd3 ~ Кх'г>3
0,867
1,37
= 0,633
1,072
0,91
= 1,18
х 24_____У 24___2,30 ____
x'd4 " Kx'd4 — 0,31 — ’
у'и
Л^- = 0,56 (7,42— 1)+ 1 = 4,59
Л
Аналогичным образом, пользуясь второй парой уравнений, можно для
каждой тарелки, отгонной части (начиная с кипятильника) рассчитать число-
вые значения y'mi/x'Я1 и х'т;/х>. не располагая величиной x'Rj,Расчет сде-
11—640
161
Таблица 4.25. Расчет числа тарелок по Тиле и Геддесу
для отгонной части колонны
Углеводород к R'i xi+l
х R х R х R
Кипятильник (1= 0) А)=88,6°С
С3Н8 5,55 5,55 0 4,65
U-C4HI0 3,04 3,04 0,608 2,53
Н-С4Н10 2,34 2,34 10,760 2,07
С5н12+ 0,95 0,95 160,970 0,96
2 — — 172,34 —
1-я тарелка снизу (1=1) Г, = 85,5 °C
С3Н8 5,190 24,130 0 19,62
U-C4HI0 2,930 7,410 1,48 6,14
Н-С4Н10 2,240 4,640 21,34 3,91
С5Н12+ 0,919 0,882 149,45 0,906
S — — 172,27 —
2-я тарелка снизу (1=2) 12 = 81,8°С
с3н8 5,03 98,73 0 79,380
и-С4Н10 2,77 17,01 3,40 13,840
Н-С4Н10 2,07 8,09 37,21 6,690
С5Н12+ 0,86 0,78 132,16 0,824
S — — 172,77 —
3-я таре/ к а снизу (1=3) 13 = 76°С
С8Н8 4,84 384,200 0 308,320
Ц-С4Н10 2,54 35,150 7,03 28,390
Н-С4Н10 1,88 12,580 57,87 10,290
С5Н12+ 0,77 0,634 107,42 0,706
S — — 172,32 —
4-я тарелка снизу (i=4) Z4=69°C
с3н8 4,540 1399,77 0 1120,00
U-C4H10 2,270 64,45 12,89 51,80
H-C4HL0 1,670 17,18 79,03 13,95
С5Н12+ 0,675 0,476 80,65 0,58
S — — 172,57 —
5-я тарелка снизу (1=5) /5 = 61,8°С
С3Н8 4,06 4547,00 0 3631,00
U-C4H10 2,04 105,67 21,13 84,95
Н-С4Н10 1,48 20,64 94,94 15,75
csH,2+ 0,57 0,331 56,08 0,464
S — — 172,15 —
6-я тарелка снизу (1=6) 16 = 60,5°С
С3Н8 3,78 13720,20 0 10951,000
U-C4H10 1,93 163,95 32,79 131,000
Н-С4НЮ 1,39 21,90 100,74 17,700
с5н12+ 0,50 0,232 39,31 0,387
S — — 172,84 —
лан в табл. 4.25. В качестве примера, ниже дается расчет для первой та-
релки отгонной части:
-М1- = К А11-= 5,19-4,65 = 24,13
X К, X R,
х'ц______У'о / у'и
x’ra g'm \ x’r-l
(24,13-1)4-1 =
= 0,805 (24,13 — 1)4- 1 = 19,62 Д12- = К = 2,93-2,53 = 7,41
1 XR2 X r2
-^- = 0,805 (7,41 - 1)4- 1 =6,14
Л32- = 0,805 (4,64 — 1) 4- 1 = 3,91
X R.
А^- = 2,07-2,24 = 4,64
XR3
= 0,96-0,919 = 0,882
х r4
^- = 0,805 (0,882— 1)4- 1 = 0,906
Для определения значении x'd t и x'r f необходимо рассчитать количества
каждого компонента сырья в дистилляте и остатке по уравнениям [22,
с. 408]:
F'x'f.
R'x'Ki = D'x'd-
, F'x'ii
D'x о. - R,x,
1 + D’x'd.
или
D'x'd- = F’x’f. —R’x’r.
Содержание компонентов в концевых продуктах колонны определится по
формулам:
X D- X R. — « . ~
%DxOi ' ^xRi
Однако такой расчет может быть произведен, если известно отношение
x’d-Ix’r. или обратное ему.
Для случая питания колонны сырьем в виде кипящей жидкости состав па-
ров, поднимающихся с верхней отгонной тарелки, совпадает с составом па-
ров, поступающих под нижнюю укрепляющую тарелку, т. е. у'(п+1)1=у'т^
или в нашем случае у'ми=у'б1.
Поэтому
x'Pf У'т{/х'ц. y'vjlx'R.
x'Rt ~ y'inHfi/X'Di = y'TOilx'Di
Последнее отношение для каждого компонента рассчитывается на основе
результатов потарелочных определений в отгонной (числитель) и укрепляю-
щей (знаменатель) частях колонны.
Количества и составы дистиллята и остатка рассчитаны в табл. 4.26.
Сравнение материальных балансов колонны по данным
Н’ 163
Таблица 4.26. Расчет составов дистиллята и остатка бутановой колонны
Углеводород У'10 х' D (см. табл. 4,24) х'н (см. табл. 4,25) 11 1 с е н н £ е>' "S' И 1 ь' Л II D'x' D _ R'x' R 315,24 x'D 172,26 x'D К п =1,84 —— x'r
с3н, 0,530 13720,000 25800 47400
U-C4H10 0,655 163,95 260 460
Н-С4НЮ 0,877 21,90 25,0 46
С5н12+ 113,73 0,232 0,0021 0,00386
2 — — — —
П родолжение
Углеводород и н л' е>' + R £ f D х jrj—F,xr/?'х'
+ а;
кмоль/ч мольн. доли кмоль/ч мольн. доли
СзН8 47401 0,000087 0 4,100 0,0131
461 0,214 0,00123 98,186 0,3134
Я-С4Н10 47 4,58 0,0264 210,42 0,6716
1,0039 169,44 0,9723 0,56 0,0018
2 — 174,23 0,9999« «1,000 313,27 0,9999« «1,000
табл. 4.18 и 4.26 сделано в табл. 4.27. Оно показывает, что в обоих случаях
количества и составы продуктов колонны мало отличаются одни от других,
поэтому последующие расчеты при новых температурах на тарелках колонны
не проводятся.
Графы в табл. 4.24 и 4.25, дающие значения D'x'n и Р'у'т (при п=1,
2....9 и /71=1, 2,..., 6), дополняются после того, как сделаны все расче-
ты, сведенные в табл. 4.26.
Следует заметить, что верхняя отгонная тарелка является тарелкой пита-
ния, и, как нетрудно убедиться, для нее соблюдается соотношение [22, с. 411]:
х вз
Х'в4
X’f:<
X'f4
Х 93
х'»4
где левая дробь относится к тарелке питания (верхняя отгонная), средняя —
к сырью, подаваемому в колонну, а правая — к нижней (девятой) укреп-
ляющей тарелке. Индексы «3» и «4» соответствуют ключевым компонентам —
нормальному бутану и пентану.
10. Число рабочих тарелок в колонне. Для колонны принимаются клапан-
ные тарелки. Вследствие отсутствия надежных данных для расчета среднего
к.п.д. тарелки (к.п.д. колонны) его величина принимается равной г]т=0,45.
Тогда число рабочих тарелок будет равно:
164
Таблица 4.27. Сравнение материальных балансов бутановой колонны
Углеводород Данные по дистилляту Данные по остатку
количество, кмоль/ч содержание, мольн. доли количество, кмоль/ч содержание, мольн. доли
по табл. 4.18 по табл. L4.26 по табл. 4.18 по табл, 4.26 по табл, 4.18 по табл. 4.26 по табл. 4.18 по табл. 4.26
с3н8 4,10 4,10 0,013 0,0131
U-C4H10 98,40 98,186 0,311 0,3134 — 0,214 0,00123
Н-С4Н10 210,70 210,42 0,670 0,6716 4,3 4,58 0,025 0,0264
csH12+ 2,04 0,56 0,006 0,0018 167,96 169,44 0,975 0,9723
S 315,24 313,27 1,000 0,9999» «1,000 172,26 174,23 1,000 1,0010» »1,00
в укрепляющей части
Nr 9
Nr?= г]т = 0,45 =20
в отгонной части
Ns 6
Ns?= Г)т = 0,45 = 14
всего в колонне
W = A% + 2Vep = 2O+ 14 = 34
11. Диаметр колонны. Наиболее нагруженным по пару сечением колонны
будет сечение под ее нижней отгонной тарелкой, оно принимается за расчет-
ное.
Диаметр колонны рассчитывается по формуле
Т nw
где Vces — секундный объем паров в расчетном поперечном сечении аппарата,
м3/с; w — допустимая скорость газа в расчетном сечении, м/с.
Секундный объем паров в расчетном сечении при температуре /r=90°C и
давлении л>=0,45 МПа определяется по формуле;
_ Ук' 22,4(^4-273)0,1 _ 732-22,4 (90 4-273) 0,1
Iх сек- 3600-273-Ля 3600-273-0,45 - 1,^м«>/с
Ввиду того, что давление в аппарате невелико, коэффициент сжимаемости
газа принят равным единице.
Допустимую скорость газа в расчетном сечении находят по формуле:
1 / Рж — Рп
w==c V
где рж, рп — плотности жидкости (флегмы) и газа в расчетном сечении,
Коэффициент С' определяется по уравнению:
С' = ftftC
где fi = 0,65 и /з=1—принимаемые числовые значения величин, а С=0,12 —
определяется по графику (рис. 4.12) при расстоянии между тарелками Лт=
=0,5 м.
с
Рис. 4.12. График С=/(рп), используемый при определении допустимой ско-
рости пара в колонне с клапанными тарелками.
Тогда
С = 0,65-1-0,12 = 0,078
Скорость газа равна:
а) = 0,078 у -----’ 12 gg --= 0,51 м/с
Диаметр колонны равен:
•./ 4-1,32
D = V 3,14-0,51 = 1,81 м
Согласно нормальному ряду диаметров по ГОСТ 9617—61 принимается
диаметр колонны 0=1,8 м.
Для сравнения определяется диаметр колонны по ее сечению над верхней
укрепляющей тарелкой. Дистиллят имеет мольную массу Л4О=57,9 и поэтому
принимается за бутан.
Расчет ведется аналогично уже изложенному определению диаметра ко-
лонны в наиболее нагруженном поперечном сечении колонны:
количество паров наверху колонны
VD' = g0' 4- D1 = 387,5 + 315,24 = 702,74 кмоль/ч
плотность жидкости (бутан) при температуре /о=41 °C равна рж =
= 555,2 кг/м3 [33, с. 194];
плотность паров
Л4л273ло 57,9-273-0,42
Рп= 22,4 (/D 4- 273) 0,1 — 22,4 (41 -f-273) 0,1 “ У кг/м
допустимая скорость паров
т/ 555,2 — 9,5 п
w = 0,078 ]/ ------------= 0,583 м/с
г У । о
секундный объем паров
702,74-22,4-3140,1
Усек= 3600-273-0,42 = 1,2 м/с
166
диаметр колонны в ее верхнем поперечном сечении
Dli~ V 3,14-0,583 -*-64 м
Диаметр колонны окончательно принимается по нижнему сечению аппа-
рата; он равен DK=1,8 м.
12. Высота колонны. Схема для расчета высоты колонны дана на рис. 4.5.
На основе практических данных расстояние между верхним днищем ко-
лонны и ее верхней укрепляющей тарелкой принимается следующее: ht =
= 1,2 м; высота секции питания h3= 1,3 м; расстояние между нижним днищем
и нижней отгонной тарелкой h3=3 м (для обеспечения трех-четырехминутного
запаса флегмы внизу колонны). Высота колонны равна:
для укрепляющей части
h2 = (Ny— 1)йт = (20— 1)0,5 = 9,5 м
для отгонной части
Й4 = (АО—1)ЛТ = (14—1)0,5 = 6,5 м
рабочая
Яр = hr + Л2 + Л3 + ft4 + Л5 = 1,2+ 9,5+ 1,3 + 6,5 + 3 = 21,5 м
Диаметры основных штуцеров колонны рассчитываются по обычным фор-
мулам гидравлики с последующим принятием их размеров согласно сущест-
вующим нормалям.
Гидравлический расчет тарелки здесь не приводится, он рассмотрен в ра-
боте [17, с. 73].
ИЗОПЕНТАНОВАЯ КОЛОННА ГАЗОФРАКЦИОНИРУЮЩЕЙ УСТАНОВКИ
Исходные данные
Рассчитать изопентановую колонну газофракционирующей установки при
следующих исходных данных: производительность колонны по сырью Gc =
= 10000 кг/ч; сырье подается в аппарат в виде насыщенной жидкости; тем-
пература охлаждающей воды /В = 25°С.
Состав питания колонны (мольн. доли):
u-C4Hj0 Н-С4Н10 и-С5Н]2 И-С5Н12 свн]4 с,н1в
0,0004 0,0040 0,4232 0,5610 0,0092 0,0022
В дистилляте должно содержаться не менее 98,5% (мольн.) изопентана;
в остатке его содержание не должно превышать 1% (мольн.).
Обозначения основных материальных потоков изопентановой колонны
см. на рис. 4.2.
Подлежащая расчету колонна входит в современную систему фракцио-
нирования на газобензиновых заводах [42].
Расчет
1. Количество и составы дистиллята и остатка. Расчет (до определения
тепловых нагрузок конденсатора-холодильника и кипятильника колонны) ве-
дется на 100 кмоль исходного сырья.
167
Таблица 4.28. Материальный баланс изопентановой колонны
Компо- нент Данные по сырью Данные по дистилляту
F', кмоль x'ff МОЛЬН. ДОЛИ Mix'fi Г’ъ кмоль/ч D', кмоль у'оз- МОЛЬН. доли
58 0,04 0,0004 0,023 0,06 0,04 0,0009
58 0,40 0,0040 0,232 0,56 0,40 0,0090
72 42,32 0,4232 30,470 58,69 41,74 0,9850
72 56,10 0,5610 40,392 77,79 0,20 0,0045
с6н14 86 0,92 0,0092 0,791 1,28 0 0
с7н16 100 0,22 0,0022 0,220 0,32 0 0
S — 100,00 1,0000 138,70 42,38 0,9994®
=72,13 ® 1,000
Продолжение
Компо- нент Данные по дистилляту Данные по остатку
D, кмоль/ч Rr, КМОЛЬ x'rI' мольн. ДОЛИ R, кмоль/ч
U-C4H10 0,052 0,06 0 0 0 0
К-С4Н10 0,522 0,56 - 0 0 0 0
U-CrHi2 70,920 57,80 0,58 0,0100 0,720 0,89
Н-С5Н12 0,384 0,35 55,90 0,9702 69,854 77,44
СбН14 0 0 0,92 0,0159 1,367 1,28
с7н16 0 0 0,22 0,0038 0,380 0,32
,88 58,77 57,62 0,9999® ® 1,000 4^=72,32 79,93
В сырье, дистилляте и остатке заданы содержания изопентана, поэтому
из уравнения материального баланса колонны по этому компоненту рассчи-
тывается (кмоль) количество дистиллята:
D' =
У’оа — х'яа
F' =
0,4232 —0,01
0,985 — 0,01
• 100 = 42,38
R' = F' - D' = 100 —42,38 = 57,62
Материальные балансы колонны в расчете на 100 кмоль сырья и на ее ча-
совую производительность, соответствующие заданным условиям разделения
и приведенному выше расчету, даны в табл. 4.28.
Знание мольной массы сырья, рассчитанной в табл. 4.28, позволяет найти
часовую производительность колонны по сырью:
Gc 10 000
F,' = —гт- — ,о =138,7 кмоль/ч
1 /VI f /-ь, 1о
2. Давление в колонне и ее температурный режим. Давление л0 в емко-
сти орошения определяется по уравнению изотермы жидкой фазы дистиллята:
2 K‘x'°t=1
168
Таблица 4.29. Расчет давления в емкости орошения изопентановой колонны
Компонент Д. при /О=37 °C, ло=0,134 МПа x’Di~u'Dl (см. табл. 4.28) kix'd1
И-С4Н10 3,35 0,0009 0,0030
н-С4Н10 2,50 0,0090 0,0225
W-C5H12 0,97 0,9850 0,9555
И-С5Н12 0,76 0,0045 0,0034
2 — 0,9994» 1,0 0,9844» 1,0
где —мольная доля компонента в дистилляте (см. табл. 4.28);
Kt=f(to, по) —константа фазового равновесия компонента при температуре
t0 и давлении л0 в емкости орошения.
Принимаемая температура /0 на 12 ЧС выше заданной температуры tB ох-
лаждающей воды:
to = ta -J- 12 = 25 4- 12 = 37 °C
Давление .определяется методом подбора. Константы фазового равнове-
сия компонентов находятся по номограмме [27, с. 459]. Расчет дан в
табл. 4.29. Давление в емкости орошения ло=0,135 МПа.
С учетом сопротивлений на участке между колонной и емкостью ороше-
ния принимаемое давление наверху колонны на 0,065 МПа превышает давле-
ние л0:
Лд = ло+ 0,045 = 0,135 + 0,065 = 0,2 МПа
С учетом сопротивления тарелок принимаемое давление внизу колонны
должно быть на 0,1 МПа больше давления по:
лЛ = лп 4-0,1 =0,24-0,1 =0,3 МПа
Давление в секции питания принимается равным среднему значению дав-
лений наверху и внизу колонны:
л^ = 0,5 (л£> 4-лд) = 0,5 (0,2 + 0,3) = 0,25 МПа
Расчет температур верха, низа и секции питания колонны проводится ана-
логично расчету температурного режима бутановой колонны. Результаты вы-
числения этих температур приведены в табл. 4.30.
3. Минимальное флегмовое число. Этот показатель работы колонны на-
ходится по уравнению Андервуда:
'’мин + 1 = а _ g
1 ’
где at — коэффициент относительной летучести компонента, определяемый при
температуре /,=62°С (мало отличающейся от средней температуры в колон-
не) и давлении Л/=0,25 МПа; 0 — параметр, определяемый из другого урав-
нения Андервуда:
6 ,
е -21 af-0
I
в котором е'=0 — мольная доля отгона сырья при его подаче в колонну в
виде насыщенной жидкости.
169
Таблица 4.30. Расчет температур верха, низа и секции питания
изопентановой колонны
Компонент Данные для верха колонны Данные для низа колонны
К. при +=40 “С. Лд=0,2 МПа y>Di (см. табл. 4.28) y,Di А'; при iR=75 °C, л^=0,3 МПа
U-C4H10 3,20 0,0009 0,00028 0
Н-С4Н10 2,41 0,0090 0,00374 0
м-С5Н12 1,00 0,9850 0,98500 1,25
Н-С5Н12 0,80 0,0045 0,00560 1,00
с6н14 0 0 0 0,44
С7Н16 0 0 0 0,19
S — 1,0000 0,9946 и 1,00 —
Продолжение
Компонент Данные для низа колонны Данные для секции питания
х'Ri (см. табл. 4.28) 4'Ri=Kix'Ri Kj при t,=62°C Лу=0,25 МПа xfi (см. табл. 4.28) y'fi=Kix'fi
М-С4Н10 0 0 3,40 0,0004 0,00136
Н-С4Н10 0 0 2,60 0,0040 0,01040
W-C5H12 0,0100 0,0125 1,13 0,4232 0,47820
Н-С5Н12 0,9702 0,9702 0,90 0,5610 0,50490
с6н14 0,0159 0,0070 0,35 0,0092 0,00322
С7Н16 0,0038 0,0007 0,15 0,0022 0,00033
S 1,0000 0,9904^1,0 — 1,0000 0,9977^1,0
За эталонный компонент принимается гептан (C?Hie). Расчет параметра 0,
проводимый по методу последовательного приближения, приведен в табл. 4.31.
Подстановка найденного значения параметра 0=6,82 в первое уравнение
дает:
22,7-0,0009 17,4 0,009 7,6 0,985 6-0,0045
гмин+ 1 = 22,7 —6,82 + 17,4 — 6,82 + 7,6 — 6,82 + 6 —6,82 = 9,6
Тогда Гмкв = 8,6.
Минимальное паровое число находится по уравнению Андервуда:
6
2ajXRj _
а, —0 ~
1
7,6-0,01 6-0,9702 2,4-0,0159 1-0,0038
= 7,6 — 6,82 + 6 — 6,82 + 2,4 — 6,82 + 1 —6,82 = ~7,03
Тогда Smhh = 7,O3.
Этот же показатель может быть найден по формуле:
_ rmmD' + F'(l-e')-R' _ 8,6-42,38+ 100 (1 -0)-57,62 _
«мин— Я' — 57,62 —/,ио
170
Таблица 4.31. Расчет параметра 0 для изопентанной колонны
Компо- нент Лг. (см. табл. 4.30) “i= Кв (см. табл. 4.30) V'fi а^—0 0=6,82 06. “г-0
U-C4H1Q 3,40 22,7 0,0004 0,00908 15,88 °.00057
«-С4Н10 2,60 17,4 0,0040 0,06960 10,58 °.00658
U-CsHja 1,13 7,6 0,4232 3,2163 0,78 4,13000
Н-С5Н12 0,90 6,0 0,5610 3,3660 —0,82 —4,12000
С6н14 0,35 2,4 0,0092 0,0221 —4,42 —°>00500
С7н16 0,15 1,0 0,0022 0,0022 —5,82 —0.00040
2 — — 1,0000 — — • °,012^0
4. Рабочие флегмовое и паровое число. Коэффициент избытка флегмы на-
ходится по уравнению [31, с. 68]:
Оопт =-^ =-^-+1,35 = -^- + 1,35= 1,39
Гмин г«ин 8,6
Тогда рабочее флегмовое число будет равно:
г ОПТ — СТоПтГ МИН = 1 > 39 • 8,6 = 12,0
Эта величина близка к кратности орошения аналогичных колонн промыш-
ленных установок [41].
Рабочее паровое число отгонной части находится по формуле:
Гопт^' + ^'О —e') — R' 12,0-42,38 4-100(1 —0)—57,62
«опт- — 57,62 = 9,5 3
5. Количества материальных потоков, проходящих секцию питания. Схема
потоков жидкости и пара представлена на рис. 4.3. Расчет проводят в такой
последовательности:
количество флегмы, стекающей с нижней укрепляющей тарелки, кмоль
ёк = гОптО' = 12-42,38 = 508,56
количество флегмы, стекающей на верхнюю отгонную тарелку, кмоль
gm = g*' + gc = g* 4- F' (1 -e') = 508,56 4- 100 (1 - 0) = 608,56
количество пара, подымающегося с верхней отгонной тарелки, кмоль
Ио' = gm' —R' = 608,56 — 57,62 = 550,94
количество пара, поступающего на нижнюю укрепляющую тарелку, кмоль
Vm' = Vo' 4- Vc = V'o4- F'e' = 550,94 4- 100-0 = 550,94
Проводим проверку (см. выше)
Sk' = Vm' — D' = 550,94 —42,38 = 508,56
6. Число теоретических тарелок колонны и ее частей. Минимальное число
теоретических тарелок колонны находится по уравнению Фенске — АндерВуда
S X'DiX'R3
Л'МИН —
0,985-0,9702
lg 0,0045-0,01
1,13 ~43
lg 0,9
1.А.
lg Ki
171
Это, определение сделано на основе концентраций распределяющихся
компонентов — изопентан и нормальный пентан в дистилляте и остатке (см.
табл. 4.28) и их констант фазового равновесия (см. табл. 4.30).
Число теоретических тарелок в колонне определяется эмпирическим мето-
дом Брауна — Мартина [22, с. 412]. Для этого подготавливаются необходи-
мые данные:
для укрепляющей части
Глпт 12 8.6
т = ^7+Т = -12 + Г = °-023 -- = = 0.895
для отгонной части
9^53+1 , , змин+1 7,03+1 f 1Л
т~ s - 9,53 -1’1 тмнн- ^ин - 7103 -1.14
Тогда на основе полученных данных имеем:
^мин
^мин
0,2
0,27 =0-74
Из корреляционного графика Брауна — Мартина [22, с. 412] находим
откуда
М= 1,84Л'МИН = 1,74-43 = 75
Числа теоретических тарелок в укрепляющей и отгонной частях колонны
определяются также на основе эмпирической формулы Керкбрайда [22,
с. 412]:
1g -^- = 0,206 1g
я'^л.к \2
X Rt.k /
где Nr и Ns — число теоретических тарелок в укрепляющей и отгонной ча-
стях колонны; x'f t.K=x'fi—мольная доля тяжелого ключевого компонента
(нормальный пентан) в сырье; x't л.к=х'м—мольная доля легкого ключевого
компонента (изопентан) в сырье; х'ял.к=х'яз — мольная доля легкого клю-
чевого компонента в остатке; х'кт.к=.*'я4 — мольная доля тяжелого клю-
чевого компонента в остатке.
Подстановка в формулу необходимых данных (см. табл. 4.28) дает
Nr [ 57,62 / 0,5610 \ / 0,01 «]
lg = 0,206 lg [ 42,38 \ 0,4232 )( 0,0045 ) J=°.194
^ткуда
Nr= 1,565MS
Так как из проведенного выше расчета Nr+Ns = 75, решение двух послед-
них уравнений дает
Nr = 4& N„ = 29
7. Тепловая нагрузка конденсатора-холодильника и количество холодного
орошения. Если принять флегмовое число постоянным по высоте укрепляю-
172
щей части колонны, то тепловую нагрузку конденсатора-холодильника можно
найти по уравнению:
Qk = g' (Hd - fiD) + D' (HD - ho)
где g' — количество горячего орошения наверху колонны, равное g=r0WtD'=
= 12-58,77 = 705,2 кмоль/ч; HD — энтальпия паров дистиллята при темпера-
туре /д=50°С и давлении ло=0,2 МПа, кДж/кмоль; hD, ho — энтальпии кон-
денсата дистиллята при температурах гЪ=50°С и /О=37°С, кДж/кмоль.
Числовые значения энтальпий определяются из графика [30, с. 10].
Подстановка необходимых данных в уравнение дает:
QK =705,2 (45 300 — 20 100) + 58,77 (45 300 — 19 400) =
= 19,32- 10е кДж/ч = 5366 кВт
Количество холодного орошения, подаваемого наверх колонны, равно:
, g'(HD-hD) 705,2 (45 300 - 20 100)
~ HD — ho ~ 45 300—19 400 - 687 кмоль/ч
8. Тепловая нагрузка кипятильника и количество парового орошения вни-
зу отгонной части колонны. Тепловая нагрузка кипятильника определяется
из уравнения теплового баланса всей колонны [22, с. 158]:
F'hf + Qp = QK + D'ho + R'h^
где £'=138,7 кмоль/ч — количество сырья; D'=58,77 кмоль/ч — количество
дистиллята; R' = 79,93 кмоль/ч — количество остатка (см. табл. 4.28); hf —
энтальпия сырья (кипящая жидкость) при температуре /,=62°С, кДж/
/кмоль; hR— энтальпия остатка при температуре tR=75 “С, кДж/кмоль.
Решая уравнение теплового баланса относительно величины Qp и под-
ставляя в него необходимые данные, получим:
Qp = 19,32-10’+ 58,77-19400+ 79,93-23 700— 138,7-21 700 =
= 19,34-10’ кДж/ч = 5372 кВт
Количество парового орошения внизу отгонной части определяется по
формуле
V Qp
к h#
где HR — энтальпия паров орошения, поступающих из кипятильника под
нижнюю отгонную тарелку, определяется как для пентана, из которого прак-
тически состоит этот поток (см. табл. 4.30), кДж/кмоль.
Подстановка числовых значений в формулу дает:
, 19,34-10’
V R~ 48 200 — 23 700 — 790 кмоль/4
Количество парового орошения на 100 киломолей сырья составит:
790-100
V % — —у— = 570 кмоль
что больше количества паров над верхней отгонной тарелкой.
Тепловой баланс колонны приведен в табл. 4.32.
9. Диаметр колонны. Диаметр колонны определяется по ее верхнему (над
верхней тарелкой) и нижнему (под нижней отгонной тарелкой) сечениям.
Количество паров наверху колонны равно:
Vd = go' + D' = 687 + 58,77 = 745,77 кмоль/ч
173
Таблица 4.32. Тепловой баланс изопентановой колонны
Количество теплоноси- теля, кмоль/ч Температура, °C Энтальпия, кДж/кмоль Количество тепла, кДж/ч (кВт)
Приход
С сырьем (е' = 0) 138,7 62 21700 3,01 10« (836)
Из кипятильника — —• — 19,34-106 (5372)
S Расход 138,7 — — 22,35-106 (6208)
С дистиллятом 58,77 37 19400 1,14-106 (317)
С остатком 79,93 75 23700 1,89-106 (525)
В конденсаторе- — — — 19,32-106 (5366)
холодильнике
2 138,7 — — 22,35-106 (6208)
Секундный объем паров составляет:
tz 22,4 (Q) + 273) 0,1 745,77 22,4 ( 46 Н-273) 0,1
VceK~ 300-273-nD “ 3600-273-0,18 — 3,01 м3/с
Плотность паров при температуре верха колонны равна:
Л1Д-273ЛД 71,88-273-0,18
рП«- 22,4 (tD + 273) 0,1 = 22,4 (46 + 273) 0,1 ~ 4,95
Так как дистиллят содержит 98,5% (мол.) изопентана, то без большой
ошибки его конденсат можно принять за изопентан, плотность которого
рж4б = 592 кг/м3 [33, с. 206].
Количество паров внизу колонны составит l/'s=790 кмоль/ч.
Секундный объем паров равен:
22,4 Рл +273) 0,1 790-22,4 (65 + 273) 0,1
- 3600 273-л^ ~ 3600-273-0,22 “2,/&м/с
Плотность паров при температуре низа колонны равна:
MR273nR 72-273-0,22
рПб5~ 22,4 (iR + 273) 0,1 “ 22,4 (65 + 273) 0,1 ~5’7 кг/м
Так как пары орошения на 98,94% (мол.) состоят из нормального пентана
(см. табл. 4.30), их мольная масса принята равной Л1«=72.
Остаток также может быть принят за нормальный пентан, тогда его плот-
ность при температуре /«=65 °C будет равна (ржб5=579 кг/м3 [33, с. 202].
Для колонны принимаются колпачковые тарелки с капсульными колпач-
ками [6, с. 256]. Предварительные расчеты показывают, что диаметр колонны
будет более 2,5 м, поэтому в соответствии с существующими рекомендация-
ми [11] принимаем расстояние между тарелками Лт=600 мм.
Скорость паров в свободном поперечном сечении аппарата определяется
по формуле [45, с. 172]:
для верха колонны
1/ о,б
а, = 1,74 у Х95“ = 0’6 М/С
174
для низа колонны
Л Г 0,6
w = 1,74 у g у = 0,565 м/с
Эти числовые значения скоростей незначительно отличаются от тех, кото-
рые получаются по другим уравнениям [31].
Диаметр колонны находится по формуле:
1/ 4Усек
DK= I/ -----
к г ЯШ
для верха колонны
Dk~ V 3,14-0,6 —2’53 м
для низа колонны
1/ 4-2,75 л _
йк—у 3,14-0,565 - 2-48 м
В соответствии с нормальным рядом диаметром по ГОСТ 9617—61 при-
нимается диаметр колонны £)к=2,6 м.
10. Высота колонны. Рабочая высота колонны (см. рис. 4.5) равна
77 р = + ^4 + ^5
где /п —высота аппарата над верхней укрепляющей тарелкой, м; h2— высо-
та, занятая укрепляющими рабочими тарелками, м; йз — высота секции пи-
тания, м; hi — высота отгонной части, м; йз— высота кубовой части аппа-
рата, м.
На основании практических данных принимается:
ht = 1,2 м; й2 = 1,3 м; ft5 = 1,4 м
Высота колонны, занятая рабочими тарелками, рассчитывается по фор-
мулам:
= (А% - 1) йт й4 = №р-1)йт
где NrV и Alsp—числа рабочих тарелок в укрепляющей и отгонной частях
колонны, рассчитываемые по формулам:
^Р-Т]ср ^Р-Т1ср
где т]Ср — средний к.п.д. контактных тарелок.
Вполне надежных методов расчета средней эффективности ректификаци-
онных тарелок колонн, разделяющих многокомпонентные углеводородные сме-
си, пока не существует. Поэтому для ориентировочной оценки к.п.д. колпач-
ковой тарелки используется корреляция [22, с. 208]
Igricp = 0,85+ 0,3 1g МЙ - 0,25 1g (И/а) + Зй/
\ /ср
где (g/V)ср — среднее мольное отношение встречных (на одном уровне) жид-
ких и паровых потоков; ц, — вязкость жидкого сырья при средней темпера-
туре в колонне, Па-с; а — коэффициент относительной летучести; hi — глу-
бина погружения центра тяжести прорези колпачка, м.
Необходимые данные для вышеприведенного уравнения:
для верха колонны
I д' \ дк' 508,56
I, V' /в ” ёк' + О' - 508,56 + 42,38 ~
175
для низа колонны
( g' \ V'r + R' 570 4-57,62
\ /н ~ V'K ~ 570
среднее значение
0,92-f- 1,1
----£^-=1.01
Имея в виду, что сырье практически состоит из пентана и изопентана,
и пренебрегая весьма небольшой разницей их вязкостей, найдем [33, с. 204],
что при средней температуре в колонне 55 °C динамическая вязкость равна
р./=0,17-10-3 Па-с; относительная летучесть при средней температуре 55°C
(см. табл. 4.30).
а =
*4
1,13
0,9
= 1,2
Слагаемым hi следует пренебречь (так как гидравлический расчет тарелки
не делался); это несколько уменьшит расчетное значение к.п.д. тарелки.
.Тогда
1gПср = 0,85 4- 0,31g 1,01 —0,25 1g (0,17-1,25-10~3) = 1,78
откуда qср = 60%.
Эта величина близка к показателям, приводимым в литературе [31, 50].
Число рабочих тарелок равно:
в укрепляющей части
Nr 46
Nrp~ Лер ~ 0,6 ~77
в отгонной части
Общее число тарелок в аппарате равно-.
Ар = 77 4- 50 = 127
Высота укрепляющей части колонны (занятой тарелками) равна:
й2 = (А% - 1) Лт = (77 - 1) 0,6 = 45,6
То же, для отгонной части
h4 = (Nsp— 1)йт = (50 — 1)0,6 = 29,4 м
Рабочая высота колонны составляет:
Нр = 1,24- 45,64- 1,34- 29,44-1,4 = 78,9 м
Диаметры штуцеров колонны рассчитываются по обычным формулам гид-
равлики с последующим принятием величин согласно существующим норма-
лям. Гидравлический расчет тарелки с капсульными колпачками здесь не при-
водится ввиду того, что он подробно рассматривается в ряде литературных
источников [И, 31, 44, 45, 49].
КОНДЕНСАТОР-ХОЛОДИЛЬНИК ИЗОПЕНТАНОВОЙ колонны
ГАЗОФРАКЦИОНИРУЮЩЕЙ УСТАНОВКИ
Исходные данные
Рассчитать конденсатор-холодильник изопентановой колонны при следую-
щих исходных данных: состав горячего теплоносителя (дистиллят и орошение
изопентановой колонны), мольн. доли:
176
«-С4Н10 Н-С4Н10 ы-С5Н12 H-CjHjj
0,001 0,009 0,985 0,005
количество теплоносителя Gi =745,77 кмоль/ч; температура поступающих в
аппарат паров /о=50°С; давление на входе лр=0,2 ЛШа; температура кон-
денсата, поступающего в емкость орошения 10=37°q. давление в емкости
орошения ло = 0,135 МПа; температура охлаждающей веды на входе в аппа_
рат /В=25°С.
Схема материальных потоков аппарата показана на рис 433
Горячий теплоноситель — дистиллят и орошение изопентановой колонны
(см. с. 167) в количестве Gi при температуре t'। вводцтся в межтрубное про-
странство аппарата, а выводится при температуре ti
Холодный теплоноситель (вода) поступает в трубное пространство аппа-
рата в количестве Gj при температуре t'z и покидает конденсатор-холодиль-
ник при температуре 1г' •
Такое распределение теплоносителей в аппарате вызывается удобством
технического обслуживания (сравнительно частая очистка поверхностей труб
от внутренних отложений).
Расчет
Горячий теплоноситель на 98,5% (мол.) состоит д3 ИЗоПентана поэтому
без большой ошибки его теплофизические свойства можно определять как
для чистого изопентана. v
1. Тепловая нагрузка конденсатора-холодильника. для определения теп-
ловой нагрузки аппарата, необходимо найти температуру конденсации горя-
чего теплоносителя — изопентана. За расчетное давление в аппарате по ходу
горячего теплоносителя, принимается среднее давление-. И /
я = 0,5 (nD + яо) = 0,5 (0,2 4- 0,135) =0,167 МПа
Тогда температура конденсации изопентана при этом давдении может
быть найдена по справочнику [33, с. 205]; она раана /к=43°с (получена
интерполяцией). 1
Рис. 4.13. Схема конденсатора-холодя^лщ^.
/ — передняя распределительная камера; 2 - трубный пучсц, а— задняя распредели-
тельная камера. v
12—640
177
Рис. 4.14. График распределения температур в конденсаторе-холодильнике.
Таким образом, в аппарате имеются две расчетные зоны: зона конденса-
ции насыщенного пара и зона охлаждения конденсата (рис. 4.14).
Падение температуры вдоль зоны конденсации теплоносителя связано
с конденсацией многокомпонентной смеси н падением давления вследствие
гидравлического сопротивления по ходу потока.
Тепловая нагрузка конденсатора-холодильника определяется по следующей
формуле:
Q = G1(WfD-A<K) + G1(/l(K-/lto)
где Gi = 745,77 кмоль/ч — количество горячего теплоносителя; /7jd=
= 45300 кДж/кмоль — энтальпия паров горячего теплоносителя при to = 50 °C
и давлении ло=0,2 МПа; htK = 19800 кДж/кмоль — энтальпия конденсата го-
рячего теплоносителя при температуре /К=43°С; /ij0= 19400 кДж/кмоль —
энтальпия конденсата при температуре /О=37°С.
Все числовые значения энтальпий найдены по графику [30, с. 10].
Подстановка в формулу числовых значений величин дает:
Q = 745,77 (45 300 — 19800) + 745,77 (19 800 — 19 400) =
= 19,3- 10е кДж/ч = 5360 кВт
Первое слагаемое в приведенном выражении есть тепловая нагрузка зоны
конденсации, второе — тепловая нагрузка — зоны охлаждения конденсата:
Qj = 745,77 (45 300 — 19 800) = 19-106 кДж/ч = 5277 кВт
Q2 = 745,77 (19 800 — 19 400) = 0,3-106 кДж/ч = 83 кВт
2. Расход воды в конденсаторе-холодильнике. Расход воды определяется
из уравнения теплового баланса конденсатора-холодильника без учета потерь
тепла в окружающую среду; температура охлаждающей воды на выходе из
аппарата принимается равной /2//=42°С:
Q = G2cB(/2"-/2')
откуда
г Q
СВ (//-//)
где G2 — расход воды, кг/ч; Q = 19,3- 10е кДж/ч — тепловая нагрузка аппара-
та; св=4,187 кДж/(кг-°С)—теплоемкость воды; = 25 °C — начальная тем-
пература воды.
178
Тогда
19,3-10е
G2 = 4,187 (42 — 25) = 271 000 кг/4
Промежуточная температура воды т в конце первой или вначале второй
зоны (см. рис. 4.14) определяется по уравнению теплового баланса любой из
зон.
Тепловой баланс первой зоны имеет вид:
Q1=<W~T)Cb
откуда
Q, 19-106
G2cb —42— 270000-4, 187 = 25,3°С
Из сделанных расчетов следует, что в данном конденсаторе-холодильнике
вторая зона (зона охлаждения конденсата) невелика по своей тепловой на-
грузке и по изменению температуры воды (всего на 0,3°C).
3. Выбор типа конденсатора-холодильника. Для ориентировочного выбора
типа конденсатора-холодильника рассчитывается поверхность теплообмена:
Q
F~ КМср
где К — коэффициент теплопередачи, Вт/(м2-°С); Д< — средний температур-
ный напор, °C.
На основании практических данных fl8, с. 557] для водяного конденсато-
ра-холодильника принимается коэффициент теплопередачи К=350 Вт/(м2-°С).
Средний температурный напор в аппарате определяется по 'формуле
Грасгофа:
где Д/Макс == 37-25 = 12 °C; Д1МИН =//- f/= 50-42 = 8°С.
Тогда поверхность теплообмена будет равна:
Q 5360-103
F== КЫср = 35010 = 1540 м
По полученному числовому значению поверхности теплообмена выбирает-
ся конденсатор с неподвижными трубными решетками, горизонтальный, ус-
ловное обозначение по ГОСТ 15121—69
1400КНГ -6 —М10
20Г6 — 6
Ниже приведена краткая техническая характеристика аппарата:
Диаметр кожуха внутренний, мм 1400
Давление в кожухе, условное, МПа 0,588
Диаметр гладких труб наружный, мм 20
Толщина стенки трубы, мм 2
Длина трубы, мм 6000
Число ходов теплоносителя по трубам 6
Площадь сечения труб для одного хода тепло- 0,064
носителя, м2
Поверхность теплообмена по наружному диамет- 818
ру труб, м2
12*
179
Горячий теплоноситель направляется в межтрубное пространство аппара-
та, а холодный (вода) — по трубам.
Следует установить два аппарата выбранного типа. Последующим расче-
том величина поверхности теплообмена и число необходимых аппаратов бу-
дут уточнены.
4. Средние температурные напоры по зонам аппарата. Горячий и холодный
теплоносители движутся в аппарате перекрестным током, поэтому, без боль-
шой ошибки, средний температурный напор для каждой из зон можно найти
по формуле Грасгофа для случая чистого противотока:
для первой зоны (см. рис. 4.14)
A'cpi - / т - 2.31g * t„ *1 — Ч для второй зоны (<К~Т)-(+'-//) ЛГсР2 — t — Т 2-318 (43-25,3)-(50-42) _ ~ о 43-25,3 — 12,3 С 2,3 lg 50 — 42 _ (43-25,3)-(37-25) ,. . _ - 43 — 25,3 — 14,0 G 2,31g 37_25
5. Коэффициент теплопередачи по зонам конденсатора-холодильника. Для
первой зоны коэффициент теплопередачи от конденсирующихся паров к на-
ружной поверхности горизонтальной трубки аппарата рассчитывается по фор-
муле [23, с. 160]:
4/ тр2Х3
где г — теплота конденсации углеводородных паров (изопентан), Дж/кг; р—
плотность конденсата, кг/мэ; X — коэффициент теплопроводности конденсата,
Вт/(м-°С); ц— динамическая вязкость конденсата, Па-с; Д/— разность тем-
ператур конденсирующегося пара и стенки трубы, °C; dH=0,02 м — наружный
диаметр трубок аппарата.
Значения р, X, р, берутся при средней температуре пограничного слоя кон-
денсата /т1 с учетом средней температуры конденсации Gi.
Согласно графику, приведенному на рис. 4.12.
/в1 = 0,5 (// + /к) = 0,5 (50+ 43) = 46,5°C = 47°C
Принимается (с последующей проверкой) температура стенки трубы со
стороны горячего теплоносителя /a»i = 35 °C. Тогда средняя температура погра-
ничного слоя конденсата будет равна:
tmi = 0,5 (tal + twl) = 0,5 (47 + 35) = 41 °C
Из таблиц [33, с. 204—206] находим
р41 = 598 кг/м3; г4, = 330 кДж/кг;
Х41 = 0,11 Вт/(м-°С); р41 = 0,198-10~3 Па-с
Величина Д/ равна:
М = tal — twl = 47 — 35 = 12 °C
Тогда
• 4/330-103-5982-0,113
“1' = 1,28 у 0,198-10-3-12-0,02 = 1730 Вт/(м2-’С)
В соответствии с конструкцией аппарата среднее число труб, расположен-
ных в одном вертикальном ряду пучка, равно п=33. Поэтому коэффициент
теплоотдачи cii от конденсирующегося пара к поверхности пучка горизон-
тальных труб можно найти по формуле
а = епа/
180
где еп — усредненный поправочный коэффициент при различном размещении
труб в пучке, определяемый по графику (15, с. 305] и равный еп=0,5.
Тогда
а, = 0,5-1730 = 865 Вт/(м2-°С)
Теперь можно определить коэффициент теплоотдачи а2 со стороны воды в
первой зоне.
Средняя температура воды (см. рис. 4.14):
тср1 = 0,5 (т + 4") = 0,5 (25,3 + 42) = 34 °C
Физические параметры воды при этой температуре находятся из таблицы
[38, с. 299]:
рз4 = 994,3 кг/м3; v34 = 0,747-10-3 м2/с;
Хз4 =0,618 Вт/(м-°С); Рг = 5,014
Скорость воды в трубах аппарата находится по формуле:
w - 3600p34/j .
где [1=0,064 ма — площадь сечения труб для одного хода теплоносителя.
Тогда
271 000
w~ 3600-994,3-0,064 ~ 1,18 м/с
Критерий Рейнольдса равен:
wdB 1,18-0,016 „„
Res4— Va4 - 0,747-10-“ -25 400
Режим движения турбулентный, поэтому коэффициент теплоотдачи со сто-
роны воды определяется по уравнению [38, с. 84]:
1 , / Рг , \0,25
а2 = 0,021Рез4«.3Ргз4«,33 (-р^1
“В \ = 35 J
Полагая Ргз4«Ргз5, получим:
0,618
а2 = 0,021 o’016-'25 4000.8-5,014i>,43 =5400 Вт/(м2-°С)
Коэффициент теплопередачи в первой зоне (с учетом тепловых сопротивле-
ний загрязнений труб) равен:
K1 = 1 6Н бет 1' =
Хц Лет ХВ
= j Q 002 j =550 Вт/(м2*°С)
”865" + ° ’000086 + ТЬ- + ° 00035 + ^400~
где 6ц/Лв=0,000086 (м2-°С)/Вт — тепловое сопротивление загрязнений наруж-
ной поверхности стенок труб (17, с. 336]; 6в/Лв=0,00035 (м3-°С)/Вт — тепло-
вое сопротивление отложений на внутренней поверхности труб [17, с. 336];
?ьст=46,5 Вт/(м-оС) —коэффициент теплопроводности стали.
Проверка ранее принятой температуры стенки трубы дает следующий ре-
зультат:
18Е
Расхождение с принятым значением /ии = 35°С считается допустимым, по-
этому пересчет не делается.
Во второй зоне происходит охлаждение конденсата (практически состоя-
щего из изопентана) от температуры конца конденсации /К=43°С до темпе-
ратуры //'=37 °C (см. рис. 4.14).
Теплоотдача от конденсата к наружной поверхности трубного пучка про-
исходит при поперечном омывании труб. Выбор формулы для подсчета коэф-
фициента теплоотдачи ai от горячего теплоносителя к наружной поверхности
пучка труб тоже зависит от величины критерия Рейнольдса при средней
температуре конденсата в этой зоне. Средняя температура конденсата со-
ставляет:
*ср2 = 0,5 (/Л + //) = 0,5 (43 + 37) = 40 °C
Теплофизические параметры конденсата (изопентан) при этой температуре
[33, с. 204—206] таковы: теплоемкость с4о = 2,36 кДж/(кг-°С); теплопровод-
ность 7,40 = 0,109 Вт/(м-°С); плотность р4о = 599 кг/м3; динамическая вяз-
кость Ц4о=О,2-1О-3 Па с. Остальные параметры вычисления:
кинематическая вязкость
1140
критерий Прандтля
г, 'v40c40p40
нг4о =
л40
0,2-IO-3
—™— = 0,335-10-6 м2/с
099
0,335-10-в-2,36-599-103
0,109 =4,35
скорость конденсата в узком (сжатом) сечении пучка труб
= VK/fc
тде /к — секундный объем конденсата при температуре /ср2=40°С, м3/с;
Лс—площадь сжатого сечения пучка труб, м2.
Секундный объем конденсата:
G±M 745,77-77 „ лг_ „
Vk= 3600р40 ~ 3600-599 -°-025 м/с
Площадь сжатого сечения пучка труб находится по формуле:
/с = ([(«с — О si 4” 3dH] ncdH] lT
где nc = 47— число труб в среднем ряду пучка; s1=0,025 м — шаг труб;
3dH=0,06 м — сумма расстояний от центров крайних труб до стенки корпуса
-аппарата; /т = 6 м — длина трубы.
Тогда
/с= {[(47— 1)0,025 + 0,06] -47-0,02)6 = 1,62 м2
Скорость конденсата составляет:
0,025
। g2 ~ 0<0154 м/с
Критерий Рейнольдса равен:
0,0154-0,02
^» = ^Г = 0,335-IO'6 =920
Полученное числовое значение критерия Рейнольдса указывает на лами-
нарный режим движения теплоносителя и на необходимость расчета коэффи-
циента теплоотдачи от конденсата к наружной поверхности пучка по урав-
нению [38, с. 100]:
<4 = 0,56Re400>6Pr40°>36 (^-Y’
“Н \ /
1S2
Предварительный расчет показывает, что последний множитель в данном
уравнении может быть принят равным единице, поэтому
“1 = 0156 ~о’~б^о~'9200,5 4’350,36 = 158 Вт/(м2-°с)
Для определения коэффициента теплоотдачи аг со стороны воды во вто-
рой зоне, рассчитаем среднюю температуру охлаждающей воды:
tcpa=S+V=^+^=25il5oC«25oC
Физические параметры воды при этой температуре [38, с. 299] таковы:
р25 = 997 кг/м3; Х25 = 0,605 Вт/(м-°С);
v2S = 0,906- 10-в м2/с; с28 = 4,178 кДж/(кг-°С)
Pr3S = 6,24
Секундный расход воды в трубах в этой зоне практически остается преж-
ним, поэтому и ее скорость останется равной ai=l,18 м/с.
Критерий Рейнольдса равен:
„ Ыв 1,18-0,016
Re2-i- ~ 0,906-10-е -20 800
Режим движения теплоносителя — турбулентный, поэтому коэффициент
теплоотдачи со стороны воды находится по уравнению:
1 / Рг . \ о
а = 0 021 —— Re °.6 * 8Рг с0.43 I 25 1
а2 u.uzi ке25 . нг25 . рГда2 j
Имея в виду, что Рг25«РгИ2, получим:
0,605
а, = 0,021 -ь nic- 20 800°.8 6,24е,43 ~= 4960 Вт/(м2-°С)
4 0,016
Коэффициент теплопередачи во второй зоне с учетом тепловых сопротив-
лений загрязнений труб:
1
^2 - 1 5 5 6 1 -
= ----------------------67Й6-----------------Г- =143 ВтЛм2,°с)
-158- + 0,000172 + -да- + 0,00035 +
6. Поверхность теплообмена конденсатора-холодильника получают расче-
том:
для первой зоны
Qi 5277-103 о
- KiA^cpi = 550-12,3 ~ 783 м
для второй зоны
<?2 83-103
F*~ К2Д/СР2 - 143-14,6 “ 397 м
общая
F = + F2 = 783 + 397 = 1180 м2
18S
Средний коэффициент теплопередачи для конденсатора-холодильника ра-
вен:
5360 103
^ср = 1180*10 = 455 Вт/(м2-°С)
Полученное значение среднего коэффициента теплопередачи для конденса-
тора-холодильника соответствует эксплуатационным данным по коэффициен-
там теплопередачи [6, с. 454].
Необходимое число аппаратов выбранного типа составляет:
1180
818 “ 1,45
Из расчета следует, что для заданных условий необходимо установить
последовательно два конденсатора ранее выбранного типа, обеспечивая ре-
зерв поверхности теплообмена.
ЛИТЕРАТУРА
1. Семенова Т. А. и др. Очистка технологических газов. М., Химия, 1977.
488 с.
2. Rosen W. D. — Oil a. Gas J., 1968, v. 66, N 12, p. 75—85.
3. Чернышев А. K-, Поплавский К. Л., Заичко Н. Д. Сборник номограмм
для химико-технологических расчетов. Л., Химия, 1969. 279 с.
4. Справочник по разделению газовых смесей методом глубокого охлажде-
ния/Под ред. Н. И. Гельперина. 2-е изд., перераб. М., Госхимиздат, 1963,
512 с.
5. Всесоюзное объединение НЕФТЕХИМ. Методы расчета теплофизических
свойств газов и жидкостей. М., Химия, 1974. 248 с.
6. Рабинович Г. Г. и др. Расчеты основных процессов и аппаратов нефтепе-
реработки. Справочник/Под ред. Е. Н. Судакова. 3-е изд. М., Химия,
1979. 568 с.
7. Коуль А. Л., Ризенфельд Ф. С. Очистка газа. М., Недра, 1968. 392 с.
8. Данкверте П. В. Газожидкостные реакции. Пер. с англ. И. А. Гильден-
блата. М., Химия, 1973. 296 с.
9. Карапетьянц М. X. Примеры и задачи по химической термодинамике. Ро-
стов, Росвузиздат, 1963. 326 с.
10. Даниэльс Ф., Альберти Р. Физическая химия, М., Высшая школа, 1967.
780 с.
11. Александров И. А. Ректификационные и абсорбционные аппараты. М.,
Химия, 1978. 277 с.
12. Рамм В. М. Абсорбция газов. 2-е изд. М., Химия, 1976. 655 с.
13. Рудин М. Г., Драбкин А. Е. Краткий справочник нефтепереработчика. Л.,
Химия, 1980. 328 с.
14. Бекиров Т. М. Промысловая и заводская обработка природных и нефтя-
ных газов. М., Недра, 1980. 293 с.
15. Касаткин А. Г. Основные процессы и аппараты химической технологии.
9-е изд., перераб. М., Химия, 1973. 784 с.
16. Вукалович М. П. Теплофизические свойства воды и водяного пара. М.,
Машиностроение, 1967. 160 с.
17. Кузнецов А. А., Кагерманов С. М., Судаков Е. Н. Расчеты процессов и
аппаратов нефтеперерабатывающей промышленности. Л., Химия, 1974.
342 с.
18. Скобло А. И., Трегубова И. А., Егоров Н. Н. Процессы и аппараты неф-
теперерабатывающей и нефтехимической промышленности. М., Гостоптех-
издат, 1962. 652 с.
19. Михеев М. А. Основы теплопередачи. М., Госэнергоиздат, 1962. 392 с.
20. Жданова Н. В., Халиф А. Л. Осушка природных и попутных газов. М„
Недра, 1975. 158 с.
21. Смирнов А. С. Сбор и подготовка нефтяного газа на промысле. М., Нед-
ра, 1971. 255 с.
22. Багатуров С. А. Основы теории перегонки и ректификации. М., Химия,
1974. 439 с.
23. Павлов К. Ф-, Романков П. Г., Носков А. А. Примеры и задачи по кур-
су процессов и аппаратов химической технологии. 9-е изд. Л., Химия,
1981. 560 с.
185
24. Бекиров Т. М. и др. Науч.-техн, обзор. Технический прогресс в техноло-
гии осушки природного газа. М., ВНИИЭгазпром, 1975. 55 с.
25. Саркисьянц Г. А. и др. Переработка и использование газа. М., Гостоп-
техиздат, 1962. 218 с.
26. Дымент О. И. и др. Гликоли и другие производные окисей этилена и
пропилена. М., Химия, 1976. 373 с.
27. Фазовые равновесия легких углеводородов. Сборник переводов статей
из иностранных журналов. М., Гостоптехиздат, 1962. 262 с.
28. Glen.den.ing A. S., Sanderson С. F. — Petrol. Process., 1949, v. 4, N 1, p. 27—
30.
29. Кузнецов А. А., Голубенко T. B. — Газовая пром., 1975, № 7, с. 60—65.
30. Клименко А. П. Получение этилена из нефти и газа. М., Гостоптехиздат,
1962. 236 с.
31. Молоканов Ю. К. и др. Разделение смесей кремнийорганических соеди-
нений. М., Химия, 1974. 295 с.
32. Эмирджанов Р. Т. Основы расчета нефтезаводских процессов и аппара-
тов. Баку, Азнефтеиздат, 1956. 423 с.
33. Варгафтик Н. Б. Справочник по теплофизическим свойствам газов и жид-
костей. М., Физматгиз, 1963. 708 с.
34. Романков П. Г., Курочкина М. И. Гидромеханические процессы химиче-
ской технологии. Л., Химия, 1974. 288 с.
35. Берлин М. А., Коробко В. Д. Основное технологическое оборудование
зарубежных газоперерабатывающих заводов. М., Химия, 1977. 248 с.
36. Чуракаев А. М. Газоперерабатывающие заводы. М., Химия, 1971. 235 с.
37. Данилова Г. Н. Теплообменные аппараты холодильных установок. Л.,
Машиностроение, 1973. 328 с.
38. Михеев М. А., Михеева И. М. Основы теплопередачи. М., Энергия, 1973.
320 с.
39. Рид Р., Шервуд Т. Свойство газов и жидкостей. Определение и корреля-
ция. Л., Химия, 1971. 704 с.
40. Флореа О„ Смигельский О. Расчеты по процессам и аппаратам химиче-
ской технологии. М., Химия, 1971. 448 с.
41. Халиф А. Л., Кельцев Н. В. Отбензинивание попутных нефтяных газов.
М., Гостоптехиздат, 1955. 147 с.
42. Клименко А. П. Сжиженные углеводородные газы. М., Недра, 1974. 368 с.
43. Платонов В. М., Берго Б. Г. Разделение многокомпонентных смесей. М.,
Химия, 1965. 368 с.
44 Ставников В. В. Ректификационные аппараты. М., Машиностроение, 1965.
356 с.
45. Каспарьянц К. С. Промысловая подготовка нефти и газа. М., Недра, 1973.
376 с.
46. WiKkle М. V., lodd W. G. — Chem. Eng., 1971, v. 42, N 9, p. 136—140.
47. Каспарьянц К. С., Кузин В. И., Григорян Л. Г. Процессы и аппараты для
объектов промысловой подготовки нефти и газа. М., Недра, 1977. 254 с.
48. Рейхсфельд В. О., Еркова Л. И. Оборудование производств основного ор-
ганического синтеза и синтетических каучуков. Л., Химия, 1974. 440 с.
49. Кафаров В. В. Основы массопередачи. М., Высшая школа, 1962. 655 с.
50. Лукьянов П. И., Басистов А. Г. Пиролиз нефтяного сырья. Ресурсы неф-
техимии. М., Гостоптехиздат, 1962. 274 с.
186
51. Клименко А. П. Разделение природных углеводородных газов. Киев, Тех-
ника, 1964. 379 с.
52. Свидченко А. И., Григорьев Б. А. — В научн.-техн. сб. ВНИИОЭНГ. Сер.
Транспорт и хранение нефти н нефтепродуктов. М., 1978, № 8, с. 20—21,
53. Ван-Нес К-, Ван-Вестен X. Состав масляных фракций нефти и их анализ.
Пер. с англ. М., Издатинлит, 1954. 463 с.
54. Григорьев Б. А. и др. — В кн.: Тез. докл. Всесоюз. совещания по теории
и практике ректификации нефтяных смесей, Уфа, Башкир, научн.-исслед.
ин-т по переработке нефти. 1975, с. 128.
55. Андопенко Р. А., Свидченко А. И., Григорьев Б. А. — В кн.: Науч, тр,
«Электрификация и автоматизация объектов нефтяной промышленности».
Грозный, Чеч.-Инг. гос. ун-т. 1980, с. 237.
56. Григорьев Б. А., Свидченко Л. И. — Химия и технол. топлив и масел,
1980, № 2, с. 46—48.
57. Гриценко А. И. и др. Физические методы переработки и использование
газа. М., Недра, 1981. 224 с.
58. Technical Data Book—Petroleum Refining. 2nd ed., Washington, API, 1970.
Ch. 6.
59. Теплотехнический справочник Под ред. В. Н. Юренева и П. Д. Лебедева.
2-е перераб. изд. М., Энергия, 1976. Т. 2, 896 с.
60. Сарданашвили А. Г., Львова А. И. Примеры и задачи по технологии пе-
реработки нефти и газа. 2-е изд., перераб. и доп. М., Химия, 1980. 256 с.
61. Берлин М. А., Гореченков В. Г., Волков Н. П. Переработка нефтяного и
природного газа. М., Химия, 1981. 472 с.
62. Аэров М. Э. и др. — Газовая пром., 1961, № 11, с. 27.
63. Harris I. /. — Brit. Chem. Eng., 1965, v. 10, № 6, p. 47.
ПРИЛОЖЕНИЯ
Таблица П./. Соотношение единиц СИ с другими единицами измерения
Величина Единица измерения в СИ Перевод в СИ единиц измерения другой системы
Сила н 1 кгс=9,81 Н
Давление Па (Н/м2) 1 кгс/см2=98067 Па 1 м вод. ст.=9807 Па 1 мм рт. ст. = 133,3 Па
Вязкость динамическая Пас 1 (кг-с)/м2 = 9,81 Па-с 1 сП=1 -10-3 Па-с
Вязкость кинематическая м2/с 1 сСт= 1 • 10~6 м2/с 1 Ст= 1 • 10-4 м2/с
Поверхностное натяже- ние Н/м 1 дин/см= 1 • 10“3 Н/м
Количество тепла Дж 1 ккал = 4,187 кДж
Энтальпия, теплоты фа- зовых превращений, теп- лоты реакций кДж/кг 1 ккал/кг=4,187 кДж/кг
Теплоемкость массовая кДж/(кг-°C) 1 ккал/(кг-К) =4,187 кДж/(кг-°С)
Т еплопроводность Вт/(м-°С) 1 ккал/(м-ч-К) = = 1,163 Вт/(м-°С)
Коэффициент теплопере- Вт/(м2-°С) 1 ккал/(м2-ч-К) = 1,163
дачи, коэффициент теп- лоотдачи Вт/(м2-°С)
Теплонапряжение Вт/(м2-°С) 1 ккал/(м2-ч) = 1,163 Вт/м2
Таблица П.2. Коэффициенты для вычисления изобарной теплоемкости
некоторых веществ в состоянии идеального газа [5, с. 233]
Коэффициенты в кДж/(кг-°С)
Вещество £ | К-102 1 —G-I03 | Я-103 | N-10
Н2 0 329,83 294,05 940,12 200,39
о2 0 21,62 16,46 45,44 12,05
N2 0 21,74 16,13 45,18 15,43
СО 0 22,07 16,19 44,59 15,20
со2 0 25,75 19,43 53,59 6,92
С12 0,55 0,23 0,42 1,99 —2,22
so2 0 19,10 15,48 43,24 5,11
NH3 0 53,77 30,80 77,65 21,20
н2о 0 40,15 27,80 79,22 26,41
H2S 0 24,41 16,68 45,82 11,68
сн4 0 58,43 15,19 —2,94 18,55
с2н6 0 62,46 25,62 , 35,94 3,34
С2Н4 ’ 0 58,31 31,71 68,49 2,36
с3н8 0 66,22 32,71 62,19 —0,78
С3Н6 0 57,38 28,87 56,17 1,54
0 65,71 33,13 64,19 0
с4н8 0 61,06 33,12 70,58 —0,50
С5Н|2 0 65,66 33,76 66.84 —6,11
С5Н10 0 61,65 33,33 70,27 0,10
С6НМ -1,21 66,06 34,77 70,91 —0,46
С6Н12 0 62,39 34,00 72,18 —0,10
188
Рис. П.1. График для определения поправочной величины Дс%.
Рис. П.2. График для определения поправочной величины Дс'р.
Рис. П.З. График зависимости <р (или <р') от А (или S), используемый при
расчете процессов абсорбции и десорбции углеводородных газов.
Таблица П.З. Состав природных газов газовых и газоконденсаторных
месторождения СССР [14]
Месторождение Компонент, % (об.)
сн4 | с2нв I CgHe | С4Н10 [ С5Н12 | со2 Na+R*
Аккумское 81,55 8,16 3,22 1,89 1,92 1,42 1,8
Березанское 87,58 5,66 1,13 0,44 0,6 3,39 1,2
Березовское 96,1 1,1 0,3 0,07 0,03 0,4 3,0
Битковское 93,56 2,95 0,95 0,55 1,17 0,26 0,56
Вуктыпьское 81,19 9,11 2,44 1,27 — 0,18 5,81
Газлинское 92,7 3,2 0,9 0,47 0,13 0,1 2,5
Гугуртли 94,4 3,6 0,7 0,3 0,5 0,1 0,4
Заполярное 98,6 0,07 0,02 0,13 0,01 0,18 1,1
Кандымское 94,42 2,91 0,6 0,21 0,56 1,0 0,3
Каневское 89,2 4,6 1,8 0,7 0,2 0,6 2,9
Карадагское 93,2 2,1 1,2 1,0 1,2 0,8 0,5
Крестищенское 91,44 3,87 1,07 0,38 1,39 0,22 1,59
Кызыл-Кумское 92,2 2,8 2,1 1,0 1,9
Ленинградское 86,9 6,0 1,6 1,0 0,5 1,2 2,8
Майкопское 88,04 6,32 1,2 0,52 0,84 1,99 1,06
Марковское 80,4 7,0 2,9 1,3 4,5 0,6 3,3
Медвежье-Надынское 98,05 0,1 0,1 0,02 — 0,2 1,53
Нибельское 84,8 3,6 1,0 0,5 0,05 0,05 10,0
Оренбургское (скважина 105)** 87,0 3,74 1,53 0,7 0,34 0,59 4,15
Оренбургское (скважина 85,91 3,03 1,36 0,85 0,81 0,63 4,41
17)***
Средне-Вилюйское 90,6 4,9 1,7 0,6 1,4 0,3 0,5
Тимофеевское 81,30 5,54 2,54 2,44 6,33 1,03 1,82
Уренгойское (сеноманская 97,8 0,10 0,03 0,002 0,01 0,3 1,7
залежь)
Уренгойское (пласты валан-
жинской залежи):
БУ.-з 89,0 5,15 2,33 1,08 1,44 0,19 0,81
БУа 86,33 5,33 2,42 1,12 4,1 0,21 0,49
бу9 88,49 4,64 2,23 0,91 3,18 0,46 0,09
Усть-Вилюйское 92,5 2,8 1,8 0,9 0,4 0,02 1,4
Шебелинское 92,0 4,0 1,1 0,52 0,26 0,12 2,0
* R —радикал, общая формула । СН1)П •• Содер жание H2S в газе 1,95е 0. •** Т о же, 3,0%.
Таблица П.4. Состав попутных газов нефтяных месторождений СССР [14]
Месторождение Компонент, % (об.)
сн4 с2на СзНв CiHjo С&+- со2 H2s N +R*
Ромашкинское 39,0 20,0 18,5 6,2 4,7 0,1 11,5
Бавлинское 35,0 22,0 19,0 7,4 4,6 12,0
Туймазинское 42,0 21,0 18,4 6,8 4,6 0,1 7,1
Сызранское 31,9 23,9 5,9 2,7 0,8 1,6 1,7 31,5
Жирное 82,0 5,0 3,0 3,5 1,0 5,0 1,7 1,5
Ишимбайское 42,4 12,0 20,5 7,2 3,1 1,0 2,8 п,о
Андижанское 66,4 16,6 9,4 3,1 — 0,2 0,05 4,17
Небит-Дагское 85,7 4,0 3,5 2,0 1,4 2,1 1,3
Калиновское 76,8 4,4 1,7 0,8 0,6 0,2 1,0 14,5
Мухановское 30,1 20,2 23,6 10,6 4,8 1,5 2,4 6,8
Шкаповское 44,0 12,1 21,2 8,5 4,2 —
Зольный овраг 36,0 23,5 23,0 9,3 3,5 0,2 4,5
Кинельское 71,94 4,12 3,08 1,54 1,42 0,64 1,06 16,2
Новодмитровское 74,7 7,1 6,2 8,6 3,4 1,0 — —
* R — радикал, общая формула (СН3)„,
192
Таблица П.5. Выходы, газов и содержание в них этилена и пропилена
при различных процессах переработки нефти [50]
Процесс и сырье Выход газа, % (масс.) на сырье Относительное содержа- ние в газе этилена и пропилена, % (масс.)
на сырье на газ
С2н4 с3Н6 С2н4 с3нв
Первичная переработка несернистых нефтей Термический крекинг: 0,12 0,024 0,036 0,2 0,3
мазута 7,5 0,14 0,99 1,86 13,2
гудрона Каталитический крекинг: 4,7 0,10 0,50 2,20 10,7
вакуумного дистиллята, фракции 350—500 °C керосино-газойлевой фракции несер- нистой нефти: 17,7 0,30 2,0 1,75 11,3
I ступень — крекинг 16,4 0,23 1,15 1,4 7,0
II ступень — очистка 18,8 0,23 1,45 1,5 7,7
Коксование гудрона Пиролиз при 750 °C: 14,61 0,87 0,95 6,0 6,5
керосина, р420 = 0,8 3 23 54,5 16,5 10,9 30,3 20,0
газойля, р420 = 0,8704 47,4 13,6 9,2 28,7 19,4
крекинг-полимеров, р420 = 0,83 69 48,7 12,6 12,0 25,9 24,6
мазута при 700 °C 46,3 15,7 8,67 33,9 18,7
гудрона бакинского при 680 °C 49,2 16,0 7,7 32,5 15,7
гудрона рсмашкинского при 750 °C 37,0 И,1 6,65 30,0 18,0
13—640
Таблица П.6. Состав продуктов разделения природных газов (в % мол.) [5/]
Продукт, насыщенный Н2О СН4 С2Н8 СзН8 U-C4HI0
Метан для производства ацетилена >85 Не ограни- чивается <0,5 <0,3
То же, для хлорпроиз- водных >99,5 <0,3 <0,3 <0,3
Этан для получения эти- лена методом пиролиза <3 >95 <2 <2
Пропан для пиролиза — <з >90 <5
н-Бутан для получения бутилена дегидрировани- ем — <2 <2 2
u-Бутан для производст- ва бутилена дегидриро- ванием — •<^1 >96
u-Пентан технический — — <1 1
Фракция для моющих средств* — — — —
Сероводород технический — — — —
Гелий технический, чис- тотой >99,99**
Продукт, насыщенный Н2О «С4НЮ а-СзНю с5+ H2S со2 n2
Метан для производства ацетилена <0,3 <0,3 <0,3 <0,03 Не огра- ничивает- ся Не огра- ничивает- ся
То же, для хлорпроиз- водных <0,3 <0,3 <0,3 <0,005 — —
Этан для получения эти- лена методом пиролиза 2 <2 <2 <0,03 То же То же
Пропан для пиролиза 5 — <1 <0,03 »
н-Бутан для получения бутилена дегидрировани- ем 96 <1 <0,01 <0,1 »
ц-Бутан для производст- ва бутилена дегидриро- ванием 2 — <0,01 <0,1 >
u-Пентан технический 1 — <2 <0,01 <0,1
Фракция для моющих средств* — — — 0,01 <0,1
Сероводород технический 1 — — >95 <2 —
Гелий технический, чи- стотой >99,99** 4 <0,0001 <0,00015
* Разгоняется на следующие фракции по температурам выкипания:
50—160 °C...<2% (мол.)
160—200...<8% (мол.)
>200 °C...>90% (мол.)
** В том числе Нг<0.0008% (мол.), Ne<0,0005% (мол.).
194
Таблица П.7. Формулы, используемые при расчетах аппаратуры
Название формулы Вид формулы и условия ее применения Номер биб- лиографи- ческой ссылки
Расчет средней моль- ной массы нефтяных фракций М= (Ппа— p/°)exp(&o+bi/f.iin) где паа =a04-ai(p4!'<))!; nDto — показатель преломления при температуре /о;рл*° — от- носительная плотность; /кип — среднеобъем- ная температура кипения, °C; коэффициен- ты ао, а.}, Ьо и 61 принимаются в зависимо- сти от 13 — температуры застывания и t0 — температуры определения основных харак- теристических факторов нефтепродуктов: При /3<20°С, t0 = 20 °C ao=l,218; <14=0,358; 60=4,5687; 61=0,00453 При /3 Дэ20 °C, t0 = 70 °C 00=1,232; ai=0,332; 60=4,7115; 61 = =0,00396. [521
Пересчет относитель- ной плотности ре неф- тепродуктов с одной температуры на дру- гую Р1 = Ро—у(/—/о) где ро — плотность при температуре to (при t0 = 20 °C, ро=Р420); у — температурная по- правка плотности нефтяных фракций: 10-3
1,706-_^115 mre
где М — мольная масса; Re — удельная ре- фракция по Эйкману (п/?)2-1 1 [53]
«До+ 0,4 p4to
Расчет приведенной плотности рпр нефтя- ных фракций рПр= 1,2979—0,54957т—0,09247+ где рПр=Рт/ро; т=Т/Го'; рт — плотность неф- тяной фракции при температуре Т, К\ р0, Та — параметры приведения. [54]
Расчет температурной
зависимости изобар-
ной теплоемкости неф-
тяных фракций
Cp,t = Cp,t0 [7+а(/—/„)]
где cp,t — теплоемкость при температуре
/°C, кДж/(кг-К); ср, /(1 — теплоемкость при
температуре t Q, кДж/(кг-К); а — темпе-
ратурный коэффициент теплоемкости, К-1.
Фиксированная температура to равна:
Для фракций с температурой застывания
С <20 °C...20 °C
Для фракций с температурой застывания
/3>20 °С...7О °C
Для узких и широких нефтяных фракций,
фракций продуктов вторичной переработки
нефтей, стабильных газовых конденсатов и
их фракций при наличии данных о показа-
теле преломления Пр?а, относительной плот-
ности р/° и средней мольной массе М ве-
личины Cp't п и а могут определяться по
13
195
Продолжение табл. П.7.
Название формулы Вид формулы и условия ее применения Номер биб- лиографи- ческой ссылки
формулам
со,/, = А, + Ауу' 1g Л4 + А2 . _|_ Р? + [55]
a-W = B0+BlM+B2(p^)3+B3\gnD‘a При этом: если 13<20°С, то Aj=20°C, ср,(() = ср,20; Ло = 2,35О4; Л1 = 4,6588; Л2 =—1,3406; А3 = = —5,344; В0 = 15,730; В, = 0,6114-10~4; В,= = 8,645; В3 = —114,24; если /3>20°С, то /о = 7О°С, ср,(() =ср,70; Л0 = 2,897; ^ = 0,2991; Л2 = 0,1611; Л3 = = — 1,7524; В0 = 7,8392; В, = —0,5233-10-3; В2 = 5,0285; В3 = —54,32. Для нефтяных фракций, стабильных газо- вых конденсатов и их фракций при наличии данных об относительной плотности р</(1 и среднеобъемной температуре кипения Дип: [55]
' Cp,t 0 —(р4^°) 3 [55]
а -103 = Bq+B.t. VAiВ2 (Р4^°)3 При этом: если <20 °C, то /о = 2О°С; cP,io = cP,2o; Ло = 2,45О5; Л 1= 1,0892-10-3; Л2=—1,3977; В0 = 2,2378; В,= —1,659-10~3; В2 = 0,09206; если 5 >20 °C, то /о = 7О°С; Cp,to = cP,7o; Л0 = 2,6331; Л, = 0,1054 -10-3; Л2 = —0,9752; В0 = 1,446; В, = —0,9147-10-3; В2 = 0,9227. [55]
Расчет температурной Xf = Xf()[l-a(t-f»)]
зависимости теплопро- где —коэффициент теплопроводности
водности жидких неф- при температуре to °C, Вг/(м-К); а — тем-
тепродуктов пературный коэффициент теплопроводности, К"1; Р430, р*а — относительная плотность при температуре 20 °C и фиксированном значении температуры to', nota — показатель преломления при фиксированной темпера- туре to', Л4— мольная масса. Для нефтяных фракций:
[56]
4 При этом если /3<20°С, то /о=20°С и при М< <400, (пс20—р4-°) >0,595 [56]
196
Продолжение табл. П.7.
Название формулы Вид формулы и условия ее применения Номер биб- лиографи- ческой ссылки
Расчет влагосодержа- ния газа W, кг/м3 Ао=—0,2269; Д,=0,163-10-3; А2 = 0,308; Аз = 2,977; Ве = —0,02159; В, = 0,02517; В2 = = 0,00442; при Ж400, (лсм—р420) <0,595 Ао = —0,1127; А, = 0,402-10~3; А2 = 0,475- -10-3; А3 = 0,729; Во = —0,02159; В.= = 0,02517; В2 = 0,00442. А W--=~ + B где А — коэффициент, равный влагосодер- жанию идеального газа; В — коэффициент, зависящий от состава газа; р — давление газа, Па. Значения коэффициентов А и В даны в табл. П.14. [57]
Таблица П.5. Основные термодинамические
Название, химическая фор- мула вещества, масса 1 кмоль ГКИП’ с <кр. °с Ркр. МПа Плотность жидко- сти, кг/м3
Темпера- тура, °C плотность р-10-3
Азот N2, Л! = 28,01 —195,8 — 147,13 3,288 — 196 0,808
Оксид азота NO, Л4=30,00 — 151,8 —94,00 6,378 —89 1,226
Диоксид азота NO2, Л4=46,0 4-21,2 4-158,2 9,807 — —
Аммиак NH3, Л4= 17,03 —33,35 4-132,4 10,938 —39 0,683
Аргон Аг, М=39,95 —185,7 — 122,0 4,710 —185 1,402
Ацетилен С2Н2, М=26,04 —83,6 4-36,0 6,054 —23,5 0,520
Водород Н2, М=2,02 —252,7 —239,9 1,258 —252 0,071
Водяной пар НгО, М= 18,02 4-1С0.0 +374,00 21,843 +4 1,000
Воздух, .44 = 28,95 -195,0 — 140,7 3,651 — 192 0,830
Гелин Не, М=4,00 —268,9 —267,9 0,225 —269 0,125
Кислород Оз, М = 32,00 — 182,97 — 118,82 4,878 — 183 1,140
Криптон Кг, М=83,80 — 153,2 — 62,60 5,322 —146 2,16
Ксенон Хе, М= 131,3 — 109,1 + 16,6 5,711 —108 3,06
Диоксид серы SO2, М= = 64,06 — 10,02 + 157,2 7,623 — 10,1 1,46
Сероводород H2S, Л4=34,08 —60,2 + 100,4 8,721 -60 0,96
Диоксид углерода СО2, Л1 = =44,01 —78,2 +31,1 7,162 —50 1,155
Оксид углерода СО, М= = 28,0Г — 191,47 — 140,2 3,390 —191 0,814
Хлор С12, М=70,91 —33,8 + 144,0 7,466 0 1,469
* При температуре 36 °C.
** При температуре 16 °C.
198
характеристики некоторых газов [4]
Теплоемкость изобарная, кДж/(кг*°С) Теплота ис- парения при температуре <кип, кДж/кг Вязкость дина- мическая (при 0 °C и 101 325 Па) ц*10в
при 20 °C при 100 °C
1,0509 1,0646 199,2 16,677
0,9755 0,9755 416,3 17,266
— — 712,0 —
2,2441 2,2254 1369,5 9,007
0,5233 — 157,4 20,503
1,6831 — 829,0 9,172
14,2683 14,5337 454,3 8,260
2,0096 1,9700 2257,0 —
1,0090 1,0120 205,1 16,971
5,2962 — 23,1 18,443
0,9127 0,9156 215,6 18,835
0,2512 — 107,6 22,759
0,1591 — 96,3 21,170
0,6448 0,6415 393,5 11,478
1,0257 1,0504 548,5 11,438
0,8373 0,9338 573,6 13,440
1,0467 1,0460 211,4 16,285
0,5192 0,5133 259,6* 12,655**
1°9
Таблица П.9. Давление паров этаноламинов, Па [/]
Концентрация этаноламинов, % ((масс.) Температура, °C МЭА ДЭА ТЭА
25 30 4 0,4 0,4
50 13,33 1,333 1,333
75 53,4 5,72 5,2
100 168 20 17,3
50 30 9,33 1,333 0,666
50 30,7 4,93 2,54
75 121,5 21,3 10,4
100 400 73,2 36
75 30 30,7 3,33 1,86
50 106,7 13,33 6,66
75 384 64 26,6
100 1275 243 92
100 30 108 11,6 6,52
50 441 48 22,6
75 1840 221 93,6
100 6680 842 322
Таблица П.10. Растворимость а некоторых газов в воде* [4]
Темпера- тура, °C н, а-102 О2 а-102 H2S а NO а-102 СО а-102 со2 а сн4 а-102 С2Н« а-102 С2Н4 а-10 а
0 2,148 4,889 4,670 7,381 3.537 1 ,713 5,563 9,874 2,26 1,73
5 2,044 4,287 3,977 6,461 3,149 1,424 4,805 8,033 1,91 1,49
10 1,955 3,802 3,399 5,709 2,816 1,194 4,177 6,561 1,62 1,31
15 1,883 3,415 2,945 5,147 2,543 1,019 3,690 5,504 1,39 1,15
20 1,819 3,103 2,582 4,706 2,319 0,878 3,308 4,724 1,22 1,03
25 1,754 2,831 2,282 4,323 2,142 0,759 3,006 4,104 1,08 0,95
30 1,699 2,608 2,037 4,004 1,998 0,665 2,762 3,624 0,98 0,84
35 1,666 2,440 1,831 3,734 1 ,877 0,592 2,546 3,230 — —
40 1,644 2,306 1,660 3,507 1,775 0,530 2,369 2,915 — —
45 1 ,624 2,187 1,516 3,311 1,690. 0,479 2,238 2,660 — —
50 1,608 2,090 1,392 3, 152 1,615 0,436 2,134 2,459 .— —
60 1,600 1,946 1,190 2,954 1,488 0,359 1,954 2,177 — —
70 1,600 1,833 1,022 2,810 1,440 — 1,825 1,948 — —
80. 1,600 1,761 0,917 2,700 1,430 — 1,770 1,826 — .—
90 1,600 1,761 0,840 2,650 1,420J 1,735 1,760 — —
100 1,600 1,700 0,810 2,630 1,410 — 1 1,700 1,720 — —
» а _ коэффициент растворимости, соответствующий объему газа (в см3 при
760 мм рт. ст. и О °C), растворяющегося в объемной единице воды при данной темпера-
туре и парциальном давлении газа 760 мм рт. ст.
200
Таблица П.11. Совместная растворимость С02 и H2S
в растворах этаноламина [/]
Содержание в растворе моль/моль амина Парциальное давление при равновесии, Па
H2S I со2 H2S | СО2
Для 2,5 н. раствора МЭА
0,265 0,025 245 0
0,265 0,092 370 0
0,270 0,155 546 0
0,268 0,255 953 34,6
0,262 0,311 2692 236
0,262 0,385 9380 9990
0,145 0,029 92 0
0,145 0,216 277 0
0,145 0,300 482 34,6
Для 2 н. раствора ДЭА
0,126 0,016 229 0
0,126 0,198 684 166
0,128 0,342 2490 1650
0,123 0,406 3140 3330
0,027 0,186 102 —
0,149 0,186 800 106
0,302 0,186 3060 347
0,425 0,189 8990 720
0,517 0,195 12200 1600
0,556 0,203 18700 2460
0,017 0,363 173 600
0,067 0,363 813 906
0,206 0,355 4930 1910
0,277 0,363 8130 3270
0,404 0,324 11300 7460
0,491 0,270 31900 10600
201
202
Таблица П.12. Основные термодинамические характеристики углеводородов [58]
Название, химическая фор- мула вещества, мольная масса ^кин’ 'кр- ^кр' Плотность жидкости Рж-10-3, кг/м3 Поверхност- ное натя- жение жид- кости при 25 °C (1-103, Н/м Кинемати- ческая вяз- кость жидко- сти v-Ю6, м-/с Изобарная теплоем- кость при 25 °C. кДжДкг-ЧЗ) Теплота ис- парения, кДж/кг
°C “С МПа при 15 °C при 20 °C при 25 °C при 37,8 °C при 98,9 °C идеаль- ного- зовая жидко- сти при атм. дав- лении при 25 °C при тем- пературе кипения
Предельные углеводороды
1 Метан СН4> 51=16,04 —161,49 —82,60 4,604 0,2600 - . 1,4737 — — 510,2
2 Этан С2Н6, 31 = 30,07 — 88,63 32,28 4,880 0,3580 0,3399 0,3165 — 1,7517 5,1622 129,4 489,7
3 Пропан С3Н8, 44=44,09 —42,07 96,67 4,250 0,5076 0,5005 0,4928 — — 1,6684 2,5078 133,0 426,0
4 Бутан С4Н|0, 34 = 58,12 —0,50 152,01 3,797 0,5847 0,5788 0,5730 — 1,6592 2,4115 153,4 385,6
5 2-Метилпропан (4-й бу- — 11,72 134,99 3,648 0,5633 0,5572 0,5510 — — — 1,6667 2,4434 329,2 366,7
тан) 366,5 357,5
6 Пентан С5Н12, 31 = 72,15 +36,06 196,50 3,369 0,6309 0,6262 0,6214 15,48 0,33 — 1,6671 2,3253
7 2-Метилбутан 27,84 187,28 3,381 0,6246 0,6196 0,6146 14,45 — — 1,6475 2,2910 344,5 342,4
8 2,2-Диметилнропан 9,50 160,63 3,199 0,5967 0,5910 0,5851 — — — 1,6646 2,6209 303,1 315,6
9 Гексан С6Н14, 31 = 86,18 68,73 234,30 3,012 0,6638 0,6594 0,6548 17,90 0,4137 — 1,6617 2,2695 385,6 335,1
10 2-Метилпентан 60,26 224,35 3,010 0,6577 0,6531 0,6524 16,87 — — 1,6642 2,2449 346,8 322,8
11 З-Метилпентан 63,27 231,30 3,124 0,6688 0,6643 0,6597 — — — 1,6408 2,2005 351,6 326,1
12 2,2-Диметилбутан 49,73 215,63 3,080 0,6539 0,6491 0,6444 — — 1,6412 2,2064 321,5 305,5
13 2,3-Димегнлбутан 57,98 226,83 3,127 0,6662 0,6616 0,6570 — — 1,6320 2,1913 338,2 316,7
14 Гептан С7Н16, 31=100,2 98,43 267,10 2,736 0,6880 0,6837 0,6795 19,80 0,5024 0,3425 1,6613 2,3550 368,0 316,6
15 2-Мстилгексап 90,05 257,22 2,734 0,6829 0,6786 0,6744 18,83 — — 1,6537 2,2261 347,6 336,3
16 З-Метилгексап 91,85 262,10 2,814 0,6915 0,6871 0,6829 19,30 — 1,6537 2,1850 347,5 307,5
17 З-Этнлпентан 93,47 267,49 2,891 0,7026 0,6981 0,6939 19,94 — 1,6537 2,1926 351,9 309,1
18 2,2-Дпметилпеитан 79,19 247,35 2,773 0,6781 0,6738 0,6695 17,55 — — 1,6747 2,2081 323,9 291,2
1,6575 2,1725 342,0 303,5
19 2,3-Диметилпептан 89,78 264,20 2,908 0,6994 0,6951 0,6909 19,47 — — 1,6454 2,2390 328,4 294,6
20 2,4-Диметилпентан 80,49 246,64 2,737 0,6771 0,6727 0,6683 17,66 — — 1,6747 2,1474 329,8 296,1
21 3,3-Диметилпеитан 86,06 263,25 2,851 0,6974 0,6933 0,6891 19,10 — 1,6311 2,1327 320,0 289,1
22 2,2,3-Триметилбутан 80,88 258,02 2,859 0,6944 0,6901 0,6859 19,26 0,6476 0,4082 1,6613 2,2256 363,4 301,5
23 Октаи, Cgllia, Л! —
= 114,23
24 2-Метилгептан
25 З-Метилгептан
26 4-Метилгептан
27 З-Этилгексан
28 2,2-Диметилгексан
29 2,3-Диметилгексан
30 2,4-Диметнлгсксап
31 2,5-Диметилгексан
32 3,3-Диметилгсксап
33 3,4-Диметилгексап
34 2-Метил-3-этплпепта11
35 З-Метил-З-этнлпснтан
36 2,2,3-Триметплпсптан
37 2,2,4-Трнмстилпепта11
38 2,3,3-Трпметилпептан
39 2,3,4-Тримстилпентап
40 2,2,3,3-Тетраметилбутап
41 Нонан С9Н20, Л1= 128,26
42 2-Метилоктап
43 З-Метилоктан
44 4-Метилоктан
45 З-Этилгептан
46 4-Этилгептан
47 2,2-Диметилгептан
48 2,3-Димстилгептан
49 2,4-Димстилгептан
50 2,5-Диметнлгептан
51 2,6-Диметилгептан
52 3,3-Диметилгептап
53 3,4-Диметилгептан
54 3,’5-Диметилгептан
55 4,4-Диметилгептан
56 2-Метил-З-этилгексан
57 2-Метил-4-этилгексан
58 З-Метил-З-этилгексан
59 З-Метил-4-этилгексан
8
125,67 295,68 2,407 0,7065 0,7025 0,6985 21,26 — — 1,6537 2,2039 347,6 296,0
117,65 286,49 2,407 0,7019 0,6979 0,6939 20,14 — 1,6328 2,1867 349,0 296,8
118,93 290,52 2,464 0,7099 0,7058 0,7017 20,70 — — 1,6328 2,1997 347,6 296,9
117,72 288,59 2,461 0,7088 0,7046 0,7005 20,54 — — 1,6487 2,1771 347,3 294,5
118,54 292,34 2,524 0,7176 0,7136 0,7095 21,04 — — 1,6747 2,2106 326,7 282,6
106,54 276,72 2,448 0,6995 0,6953 0,6911 19,14 — .— 1,6433 2,1771 339,8 290,9
115,61 290,34 2,544 0,7163 0,7121 0,7081 23,53 — — 1,5909 2,2190 330,9 285,5
109,43 280,37 2,474 0,7045 0,7003 0,6962 19,59 286,0
109,10 276,91 2,407 0,6977 0,6935 0,6893 19,28 — -— 1,5909 2,1913 331,7
111,97 288,87 2,568 0,7141 0,7100 0,7059 20,18 — - 1,6328 2,1603 328,9 284,7
117,73 295,70 2,606 0,7234 0,7192 0,7151 21,18 — * 1,6307 2,1352 341,5 291,5
115,65 293,94 2,613 0,7234 0,7193 0,7152 21,05 — — 1,6320 2,1352 337,5 288,8
118,26 303,43 2,717 0,7312 0,7274 0,7235 21,53 — — 1,6270 2,0934 332,8 287,3
109,84 290,35 2,642 0,7200 0,7160 0,7121 20,22 — — 1,6747 2,1352 323,4 280,5
99,24 .270,81 2,485 0,6960 0,6919 0,6878 18,32 — — 1,6215 2,0900 307,8 271,6
114,76 300,41 2,729 0,7300 0,7262 0,7223 21,10 — —. 1,6328 2,1930 326,1 283,4
113,47 293,26 2,642 0,7230 0,7190 0,7150 20,68 — * 1,6684 2,2185 330,4 281,6
106,47 294,80 2,775 . — —. -— 1,6872 — 375,1 275,1
150,82 321,49 2,216 0,7214 0,7176 0,7138 22,44 0,8087 0,4766 1,6517 2,2185 362,4 288,0
143,28 313,60 2,216 0,7173 0,7134 0,7095 21,41 — " 1 1,6747 2,2064 350,3 286,0
144,23 317,00 2,265 0,7242 0,7205 0,7168 21,87 — 1,6747 2,1771 350,0 286,8
142,44 314,50 2,265 0,7242 0,7202 0,7163 21,87 — — 1,6747 2,1771 347,0 285,5
143,00 317,40 2,324 0,7306 0,7265 0,7225 21,34 — — 1,6328 2,1352 347,0 286,8
141,20 314,80 2,314 0,7322 0,7281 0,7241 22,34 — 1 — 2,1352 349,6 285,0
132,70 304,60 2,246 0,7144 0,7105 0,7066 20,34 — — 1,7165 2,1603 330,0 271,3
140,50 316,50 2,324 0,7299 0,7260 0,7221 21,87 — —— 2,1352 340,2 281,8
132,90 303,70 2,265 0,7192 0,7153 0,7115 20,84 .— — 2,1771 334,9 275,9
136,00 308,00 2,275 0,7208 0,7167 0,7127 20,84 — — — 2,1771 337,5 278,0
135,22 304,80 2,226 0,7130 0,7089 0,7049 20,38 — — 1,6328 2,2190 337,9 277,2
137,02 315,40 2,354 0,7296 0,7256 0,7216 21,55 I» — — 2,1478 332,3 275,5
140,60 318,80 2,383 0,7353 0,7314 0,7275 22,34 — — — 2,1352 340,2 283,9
136,00 310,10 2,324 0,7262 0,7225 0,7186 21,31 — — — 2,1771 337,5 278,0
135 20 312,30 2,354 0,7296 0,7256 0,7216 21,53 — — » — 2,1352 329,4 275,9
138,00 315,10 2,373 0,7375 0,7335 0,7295 22,34 • — — — 2,1352 337,2 280,9
133,80 307,00 2,324 0,7276 0,7235 0,7195 21,31 — — — 2,1771 334,6 278,0
140,60 324,40 2,471 0,7451 0,7411 0,7371 22,76 — — — 2,0934 334,6 278,8
140,40 320,70 2,432 0,7437 0,7400 0,7363 22,80 — 2,0934 339,8 283,9
« Название, химическая фор- мула вещества, мольная масса ^КИН’ °C ZKp’ °C Ркр’ МПа
60 2,2,3-Триметилгексаи 133,61 314,90 2,412
61 2,2,4-Триметилгексап 126,55 300,50 2,305
62 2,2,5-Триметилгексаи 124,09 294,90 2,256
63 2,3,3-Триметилгексан 137,69 323,00 2,471
64 2,3,4-Триметилгексаи 139,06 321,40 2,442
65 2,3,5-Триметилгексан 131,35 306,10 2,324
66 2,4,4-Триметилгексан 130,66 308,50 2,354
67 3,3,3-Триметилгексап 140,48 329,20 2,540
68 3,3-Диэтилпентан 146,19 336,90 2,589
69 2,2-Диметил-З-этилпен-
тан 133,84 317,40 2,471
70 2,3-Диметил-3-этилпен-
тан 144,70 333,7 2,599
71 2,4-Диметил-З-этилпен-
тан 136,70 318,1 2,442
72 2,2,3,3-Тетраметилпен-
тан 140,29 337,7 2,648
73 2,2,3,4-Тетраметилпен-
тан 133,03 319,0 2,481
74 2,2,4,4-Тетраметнлпен-
таи 122,29 298,2 2,285
75 2,3,3,4-Тетраметилпентан 141,57 335,9 2,609
76 Декан С10Н22, Af- 142,29 174,15 344,5 2,030
77 2-Метилнонан 167,03 337,2 2,030
78 З-Метилнонан 167,80 340,4 2,069
79 4-Метилнонан 165,70 337,4 2,069
Продолжение табл. И. 12
Плотность жидкости 1 loncpx- иосгное натяжение Кинемати- ческая вяз- Изобарная теплоем- кость при 25 °C, кДж/(к г-ЛС) Теплота нс* парения, кДж/кг
Р-Л • 10-л, кг/м3 кость СТИ V • жид ко- 106, м7с
жидкости при 25 °C жидкое-
при 15 °C при 20 °C при 25 С 0103, Н/м при 47,8 °C при 98,9 °C и де а ль- нога- зовая ти при атм. дав- лении при 25 °C пературе кипения
0,7333 0,7295 0,7257 21,41 2,1352 325,5 271,3
0,7193 0,7156 0,7118 20,09 — 1,6328 2,1771 317,6 265,4
0,7192 0,7072 0,7032 19,60 — — 1,6328 2,2190 313,5 263,3
0,7414 0,7375 0,7345 21,95 — — 1,6328 2,1352 328,1 273,0
0,7430 0,7392 0,7354 22,34 — — — 2,1352 333,3 278,4
0,7260 0,7219 0,7179 20,82 — — 1,5909 2,1771 323,2 271 ,7
0,7275 0,7238 0,7200 20,75 — — 1,6328 2,1771 320,2 267,5
0,7495 0,7454 0,7414 22,79 — 1,6328 2,0934 330,7 274,2
0,7571 0,7536 0,7500 22,29 — — 1,5909 2,0515 339,8 280,9
0,7348 0,7348 0,7310 21,92 — — 1,6328 2,1352 325,2 271 ,7
0,7588 0,7548 0,7508 22,40 — — — 2,0515 333,0 275,5
0,7418 0,7379 0,7341 22,34 — — 1,5909 2,1352 330,4 276,3
0,7603 0,7566 0,7530 22,93 — — 1,6747 2,0513 321,2 275,1
0,7427 0,7389 0,7352 21,54 — — 1,6328 2,1352 318,6 267,5
0,7233 0,7195 0,7156 19,92 1,6747 2,1771 297,7 256,2
0,7584 0,7547 0,7511 22,88 — — 1,6328 2,0513 326,4 272,6
0,7339 0,7300 0,7262 23.37 1,0040 0,5591 1,6500 2,2118 361,2 276,2
0,7304 0,7264 0,7225 — — 1,7165 2,1938 358,8 275,9
0,7373 0,7334 0,7296 — — — 1,7165 2,1771 355,9 275,1
0,7362 0,7322 0,7283 — — — 1,7165 2,2022 352,9 273,0
80 5-Метилнонан 165,10 336,6 2,069 0,7365 0,7326 0,7288 1,7165 2,1855 350,0 272,1
81 З-Этилоктан 166,50 340,6 2,119 0 7438 0,7399 0,7359 — — — 2,1352 350,0 272,1
82 4-Этплоктан 163,67 336,6 2,108 0,7419 0,7381 0,7343 — — — 2,1352 344,1 269,2
83 2,2-Диметилоктан 156,90 328,9 2,059 0 7281 0,7245 0,7208 — — 2,1520 338,3 265,0
84 2,3-Диметилоктан 164,34 340,1 2,119 0,7418 0,7379 0,7341 — — — — 2,1352 344,1 268,8
85 2,4-Диметилоктан 155,90 326,3 2,079 0,7302 0,7264 0,7226 — — — — 2,1771 338,3 265,9
86 2,5-Диметилоктан 158,50 330,0 2,079 0,7341 0,7302 0,7264 —— — — — 2,1771 341 ,2 265,9
87 2,6-Диметилоктан 160,41 330,0 2,079 0 7317 0,7276 0,7236 — — — 2,1771 344,1 268,8
88 2,7-Диметилоктан 159,89 329,9 2,030 0 7282 0,7242 0,7202 —- — I,6747 2,1645 347,1 268,8
89 3,3-Диметилоктаи 161,20 339,1 2,148 О’7429 0,7390 0,7351 — — — 2,1436 335,4 264,6
90 3,4-Диметилоктан 163,40 340,9 2,167 0,7487 0,7448 0,7410 — — — 2,1352 341,2 267,5
91 3,5-Диметилоктан 159,40 333,2 2,118 0,7405 0,7367 0,7329 . — — — 2,1352 338,3 265,4
92 3,6-Диметилоктан 160,80 335,2 2,118 0,7402 0,7363 0,7324 — — —, 2,1352 341,2 267,9
93 4,4-Диметилоктан 157,50 333,8 2,138 0,7382 0,7347 0,7312 — — -— 2,1771 332,4 262,1
94 4,5-Диметилоктаи 162,15 339,1 2,167 0 7507 0,7470 0,7432 — — — 2,1352 338,3 266,2
95 4-н-Пропилгептан 157,50 328,1 2,108 0,7397 0,7359 0,7321 — — — 2,1771 345,4 267,9
96 4-и-пропилгептан 158,90 324,6 2,157 0,7430 0,7392 0,7354 — — — 2,1352 332,4 263,3
97 2-Метил-З-этилгептан 161,20 337,1 2,157 0,7474 0,7436 0,7398 — — 2,1352 338,3 265,4
98 2-Метил-4-этилгептан 156,20 328,7 2,118 0,7398 0,7360 0,7322 — — 2,1771 332,4 262,9
99 2-Метил-5-этилгептан 159,70 328,7 2,118 0 7393 0-7356 0,7318 — —• — 2,1771 337,0 265,4
100 З-Метил-З-этилгептап 163,80 346,90 2,236 0,7539 0,7501 0,7463 — — — — 2,1352 335,4 263,8
101 З-Метил-4-этилгептан 162,2 341,3 2,207 0,7543 0,7504 0,7466 — — — — 2,1352 335,4 265,0
102 З-Метил-5-этилгептаи 158,20 333,1 2,157 0,7445 0,7406 0,7368 . — — 2,1352 335,4 265,0
103 4-Метил-З-этилгептан 163,00 342,2 2,207 0,7544 0,7506 0,7468 — — — — 2,1352 338,3 265,4
104 4-Метил-4-этилгептап 160,80 342,7 2,236 0,7548 0,7510 0,7472 — — — — 2,1352 329,5 262,5
105 2,2,3-Триметилгептан 157,60 338,7 2,226 0,7423 0,7423 0,7385 — — — — 2,1352 329,5 260,8
106 2,2,4-Триметилгептан 148,30 321,4 2,099 0,7313 0-7275 0,7237 — — — — 2,1771 320,7 255,8
107 2,2,5-ТрПМетилгептан 150,80 331 ,9 2,099 0,7320 0,7281 0,7243 —. — — 2,1771 323,6 257,9
108 2,2,6-Тримстилгептан 149,00 320,3 2,059 0,7277 0,7238 0,7200 — — — 1,5909 2,2190 326,6 258,3
109 2,3,3-Триметилгептан 160,20 344,1 2,246 0,7527 0,7488 0,7450 — — — —. 2,1352 329,5 261,7
110 2,3,4-Триметилгептан 159,90 340,7 2,216 0,7523 0,7485 0,7447 — — — 2,0934 332,4 262,5
111 2,3,5-Триметилгептан 160,70 339,7 2,167 0,7490 0,7451 0,7413 — — — 2,1352 332,4 261,3
112 2,3,6-Триметилгептап 156,00 331,1 2,118 0,7385 0,7347 0,7309 — — — 2,1771 332,4 262,5
ИЗ 2,4,4-ТрИметилгептан 151,00 327,2 2,148 0,7384 0,7346 0,7308 — — — 2,1771 317,8 255,8
114 2,4,5-Триметилгептан 156,50 333,1 2,167 0,7450 0,7411 0,7373 — — — — 2,1352 329,5 260,8
115 2,4,6-Триметилгептан 147,60 337,2 2,079 0,7265 0,7228 0,7190 —
g 116 2,5,5-Триметилгептан 152.82 320,1 2,148 0,7438 0,7400 0,7362 — — — — 2,2190 326,6 259,6
206
• Название, химическая фор- ^КИП’ °C ркр’ МПа
мул а вещества, мольная масса
117 3,3,4-Триметилгептан 161,90 340,1 2,295
1 18 3,3,5-Триметилгептан 155,70 335,1 2,187
119 3,4,4-Триметилгептан 161,10 347,1 2,295
120 3,4,5-Триметнл гептан 162,50 346,3 2,265
121 2'Метил-З‘Изопропил- гексан 166,70 330,1 2,216
122 3,3-Диэтилгексап 166,30 354,3 2,334
123 3,4-Диэтилгексаи 163,90 345,9 2,256
124 2,2-Диметил-З-этилгек- сап 156,10 336,6 2,236
125 2,2-Диметил-4-этилгек- сан 147,00 321,6 2,148
126 2,3-Диметил-З-этилгек- сан 163,70 352,10 2,344
127 2,3-Димстил-4-этилгек- сан 160,90 346,2 2,265
128 2,4’Диметил-З-этилгск- сап 160,10 343,1 2,265
129 2,4-Димстил-4-этилгек- сап 161,10 347,9 2,295
130 2,5-Диметил-З-этилгск- сан 154,10 330,4 2,167
131 3,3-Диметил-4-этилгек- сан 162,90 352,6 2,344
132 3,4-Димети л-З-этил гек- сан 162,10 351,5 2,344
Продолжение табл. П.12
Плотность жидкости Поверх- ностное натяжение Кинемати- ческая вяз- Изобарная теплоем- кость при 25 °C, кДж/(кг-°C) Теплота ис- парения, кДж/кг
рж •10—кг/м3 кость СТИ V' жидко- 10е, м2/с
при 15 °C при 20 °C при 25 °C жидкости при 25 °C о-103, Н/м при 37,8 °C При 98,9 СС идеаль- нога- эовая жидкос- ти при атм. дав- лении при 25 е С при тем- пературе кипения
0,7604 0,7565 0,7527 2,1352 323,6 258,7
0,7466 0,7428 0,7390 — — — — 2,0934 329,5 261,7
0,7612 0,7573 0,7535 — — — — 2,1352 323,6 257,9
0,7596 0,7557 0,7519 — — — — 2,0934 326,6 260,8
0,7512 0,7474 0,7436 __ 2,0934 328,2 263,3
0,7652 0,7613 0,7575 — — — — 2,1352 326,6 257,5
0,7548 0,7510 0,7472 — — — — 2,0934 332,4 264,6
0,7523 0,7485 0,7447 — — — — 2,1352 335,4 265,0
0,7377 0,7340 0,7302 — — — 2,1352 323,6 257,9
0,7676 0,7637 0,7599 — — — — 2,1771 317,8 255,0
0,7592 0,7554 0,7516 — — — — 2,0515 329,5 261,7
0,7591 0,7552 0,7514 — — — 2,0934 329,5 262,1
0,7600 0,7563 0,7525 — — — — 2,0934 329,5 261,3
0,7445 0,7406 0,7368 —- — — — 2,0934 326,6 260,4
0,7674 0,7636 0,7598 — — — 2,1352 326,6 259,2
0,7673 0,7634 0,7596 — — — — 2,0514 326,6 260,8
133 134 135 2,2,3,3-Тетрамети л гек- сан 2,2,3,4-Тетрамстилгск- сан 2,2,3,5-Тетраметилгек- саи 160,34 158,80 148,40 355,1 347,3 338,2 2,383 2,295 2,226 0,7680 0,7589 0,7420 0,7644 0,7551 0,7378 0,7609 0,7513 0,7336 — — — — 2,0514 2,0514 2,0934 326,6 317,8 320,7 260,0 255,8 255,8
136 2,2,4,4-Тетраметнлгек- сан 153,80 337,1 2,177 0,7499 0,7462 0,7424 — — 2,1771 317,8 255,0
137 2,2,4,5-Тстраметилгек- сан 147,90 327,4 2,148 0,7393 0,7354 0,7316 — — 2,1352 309,8 246,6
138 2,2,5,5-Тетраметплгек- сан 137,47 328,4 2,079 0,7227 0,7187 0,7148 — —. 2,1771 311,9 252,0
139 2,3,3,4-Тстраметплгек- сан 164,62 358,1 2,403 0,7731 0,7694 0,7656 — — 2,2190 309,8 248,3
140 2,3,3,5-Тетраметилгек- сан 153,10 337,1 2,246 0,7525 0,7487 0,7449 — — — 2,0514 326,6 260,0
141 2,3,4,4-Тетраметилгек- сап 161,60 353,3 2,344 0,7663 0,7624 0,7586 — —. 2,1352 317,8 255,0
142 2,3,4,5-Тетраметплгск- сан 156,20 348,2 2,265 0,7531 0,7494 0,7456 — .— — 2,0934 323,6 257,9
143 3,3,4,4-Тетраметилгек- сан 170,00 371,7 2,491 0,7859 0,7824 0,7789 — — 2,1352 323,6 257,9
144 2,4-Диметпл-З-изопро- пилпентаи 157,06 341,4 2,265 0,7621 0,7583 0,7546 — — —. 2,0096 2,0934 297,3 320,7 246,2 255,8
145 2-Метил-3,3-диэтилпеп- тан 169,70 366,1 2,452 0,7831 0,7793 0,7755 — —. 2,0514 332,4 263,8
146 2,2,3-Триметил 3-этил- пентан 169,50 370,1 2,491 0,7857 0,7818 0,7780 — — — 2,0096 323,6 256,6
147 2,2,4-Трнметил-З-этил- пентан 155,3 342,3 2,295 0,7612 0,7571 0,7531 — —. 2,0934 314,8 254,1
148 2,3,4-Триметил-3-этил- пентан 169,47 361 ,3 2,550 0,7812 0,7773 0,7735 — — — 2,0514 326,6 260,4
149 2,2,3,3,4-Пентаметил- пентан 166,08 371,3 2,501 0,7834 0,7801 0,7767 — — —. — 2,0096 317,8 255,8
150 2,2,3,4,4-Пентаметил- пентан 159,31 354,2 2,324 0,7704 0,7670 0,7635 — — — — 2,0514 309,8 248,3
Продолжение табл. П.12
208
А Название, химическая фор- мула вещества, мольная масса ^КИП’ °C *кр' °C п ь кр’ МПа Плотность жидкости Рж-10-э> кг/м3 Поверхно- стное натя- жение жид- кости при 25 °C (Т-103, Н/м Кинемати- ческая вяз- кость жидко- сти v-108, м2/с Изобарная теплоем- кость при 25 °C кДж/(кг’°С) Теплота ис- парения, кДж/кг
при 15 °C при 20 °C При 25 °C при 37,8 °C при 98,9 °C идеаль- нога- зовая жидко- сти при атм. дав- лении при 25 °C при тем- пературе кипения
Непредельные углеводороды
151 Этен С2Н4, /И — 28,05 — 103,71 6,2 4,870 — — — — — — 1,5537 — — 382,7
152 Пропен С3Н6, М = 42,08 —47,70 91,6 4,462 0,5226 0,5139 0,5053 — — — 1,5194 2,5581 — —
153 Бутен-1 С4Н8, Л1=56,10 —6,26 146,4 3,893 0,6014 0,5951 0,5888 — — — 1,5277 2,2985 358,9 345,2
154 рис-Бутен-2 3,72 162,4 4,070 0,6271 0,6213 0,6154 . — — — 1,4076 2,2499 394,8 416,4
155 транс-Бутен-2 0,88 155,46 3,972 0,6100 0,6042 0,5884 — — —. 1,5662 2,2755 388,3 402,1
156 2-Метилпропен —6,90 144,73 3,872 0,6005 0,5942 0,5879 — — — 1,5893 2,3362 367,2 —
157 Пентен-1 С5Н|о, М=
= 70,14 29,97 191,59 3,923 0,6456 0,6405 0,6353 15,45 — — 1,5633 2,2160 355,1 —
158 цис-Пентен-2 36,93 203,00 3,530 0,6607 0,6556 0,6504 16,80 — — 1,4519 2,1645 382,7 372,6
159 транс-Пентен-2 36,34 202,00 3,530 0,6534 0,6482 0,6431 16,42 — — 1,5474 2,2399 381,0 —
160 2-Метилбутен-1 31,16 192,00 3,334 0,6556 0,6504 0,6451 15,90 — — 1,5935 2,2428 369,0 —
161 З-Метилбутен-1 20,06 177,00 3,432 0,6320 0,6272 0,6219 13,80 — — 1,6923 2,2269 340,4 —
162 2-Метилбутен-2 38,57 197,00 3,334 0,6676 0,6623 0,6570 17,14 — — 1,4984 2,1377 386,1 —
163 Гексен-1 СаН12, М=
= 84,16 63,49 230,83 3,040 0,6778 0,6732 0,6685 17,80 0,34 — 1,5733 2,1796 364,0 344,1
164 цис-Гексен-2 68,89 244,00 3,177 0,6919 0,6872 0,6825 — — — 1,4946 2,1352 374,3 346,2
165 транс-Гексен-2 67,88 243,00 3,164 0,6826 0,6779 0,6732 — — — 1,5742 2,2148 375,1 343,7
14—640
166 ffuc-Гексеп-З £6,45 244,00 3,177 0,6845 0,6799 0,6752 1,4700 2 1771 371,8 340,4
167 транс-Гексен-3 67,09 244,00 3,177 0,6820 0,6771 0,6723 — — — 1,5796 2 1771 375,1 344,1
168 2-Метнлпентен-2 67,30 244,00 3,177 0,6911 0,6865 0,6819 — — — 1,5055 2 1352 375,5 344,6
169 З-Метил-цпс-пентен-2 67,69 244,00 3,177 0,6978 0,6932 0,6866 — — — 1,5055 2 1352 381,6 344,1
170 З-Метил-транс-пентен-2 70,43 248,00 3,187 0,7021 0,6976 0,6930 — — — 1,5880 2 2148 368,8 340,4
171 2,3-Диметилбутен-1 55,61 228,00 3,138 0,6829 0,6781 0,6732 — — — 1,7061 2 1352 346,7 325,7
172 3,3-Диметилбутен-1 41,24 217,00 3,050 0,6583 0,6531 0,6479 — — — 1,5039 2 2441 316,5 304,8
173 2,3-Диметилбутен-2 73,20 251,00 3,256 0,7127 0,7081 0,7035 — — — 1,5164 2 0770 386,9 352,4
174 Гептен-l С7Ы14, М= = 98,19 93,64 264,08 2,746 0,7013 0,6970 0,6927 19,30 0,44 — 1,5822 2 1193 368,4 316,9
175 4,4-Димети.ипелтен-1 72,52 253,00 2,858 0,6957 0,6825 0,6780 — — — 1,5909 2 2190 317,8 287,6
176 2,3-Диметилпеитен-2 97,40 283,00 3,029 0,7321 0,7277 0,7234 — — — 1,6328 2 0933 362,6 315,7
177 2,3,3-Триметилбутен-1 77,89 259,00 2,898 0,7289 0,7046 0,7002 — — — 1,6747 2 1352 327,4 294,3
178 Октсн-1 С3Н16, М= = 112,22 121,29 293,50 2,550 0,7190 0,7149 0,7108 21,26 0,557 0,364 1,5880 2 1511 361,7 301,0
179 г(ис-Октен-2 125,64 308,00 2,687 0,7285 0,7243 0,7201 — — — 1,6328 2 1352 358,4 307,3
180 транс-Октси-2 125,00 307,00 2,697 0,7240 0,7199 0,7157 — — — 1,6747 2 1771 358,4 306,9
181 транс-Октеп-З 123,30 305,00 2,658 0,7194 0,7152 0,7110 — — — 1,6328 2 1771 358,4 306,0
182 цис-Октен-4 122,50 304,00 2,648 0,7252 0,7212 0,7170 — — — 1,5909 2 1352 354,6 305,6
183 тра«с-Октен-4 122,26 304,00 2,648 0,7183 0,7141 0,7099 — — — 1,6328 2 1771 354,6 305,6
184 2-Метилгептен-1 119,30 300,00 2,628 0,7245 0,7206 0,7164 — — — 1,6747 2 1603 350,8 302,7
185 2,3-Диметилгексен-2 121,76 304,00 2,648 0,7450 0,7406 0,7366 — — — 1,7165 2 0934 354,6 303,1
186 2,3,3-Триметилпентен-1 108,31 296,00 2,686 0,7396 0,7352 0,7308 — — — 1,5909 2 1352 343,3 296,8
187 2,4,4-Трнметилпептен-1 101,00 287,00 2,645 0,7230 0,7190 0,7150 — — — 1,5909 2 1268 317,4 288,0
188 2,4,4-Триметилпентен-2 104,91 290,00 2,655 0,7259 0,7218 0,7176 — — — 1,5909 2 1394 332,0 290,6
189 Нонен-1 C9Hia, А4 = = 126,24 146,87 319,00 2,330 0,7331 0,7292 0,7253 22,56 — — 1,6265 2 1436 360,8 288,0
190 Децен-1 С10Н20, М= = 140,27 170,57 342,00 2,229 0,7447 0,7397 0,7360 23,54 — — 1,6261 2 1427 360,0 275,9
Таблица П.13. Фактор ацентричности некоторых газов [5/]
Вещество Фактор ацен- тричности Вещество Фактор ацен- тричности
Водород 0,000 Кислород +0,0213
Аргон —0,002 Оксид углерода 0,041
Криптон —0,002 Ацетилен 0,1858
Ксенон 4-0,002 Пропилен 0,1427
Метан 0.013 и-Бутаи 0,1918
Азот 0,040 «-Бутилен 0,2007
Сероводород 0,100 Бутен-1 0,2027
Этан 0,105 1{«с-Бутен-2 0,2725
Пропан 0,152 трсшс-Бутен-2 0,2336
Неопентан 0,195 Толуол 0,2518
«-Бутан 0,201 и-Пентан 0,2060 -
Бензол 0,215 Гексан 0,2899
Диоксид углерода 0,225 Циклопентан 0,1925
и-Пентан 0,252 Метилциклопентан 0,2343
Диоксид серы 0,246 Циклогексан 0,1858
Вода 0,348 Метанол 0,5560
«-Гептан 0,352
Таблица П.14. Значения коэффициентов А и В
в уравнении влагосодержания газа [57]
Темпера- тура, °C А В Темпера- тура, СС А В Темпера- тура, °C А В
—40 0,145 0,00347 8 8,200 0,0630 56 126,0 0,487
—38 0,178 0,00402 10 9,390 0,0696 58 138,0 0,521
—36 0,219 0,00465 12 10,72 0,7670 60 152,0 0,562
—34 0,267 0,00538 14 12,39 0,0855 62 166,5 0,599
—32 0,323 0,00623 16 13,94 0,0930 64 183,3 0,645
—30 0,393 0,00710 18 15,75 0,1020 66 200,5 0,691
—28 0,471 0,00806 20 17,87 0,1120 68 219,0 0,741
—26 0,566 0,00921 22 20,15 0,1227 70 238,5 0,793
—24 0,677 0,01043 24 22,80 0,1343 72 260,0 0,841
—22 0,809 0,01168 26 25,50 0,1453 74 283,0 0,902
—20 0,960 0,01340 28 28,70 0,1595 76 306,0 0,965
— 18 1,144 0,01510 30 32,30 0,1740 78 335,0 1,023
— 16 Г, 350 0,01705 32 36,1 0,189 80 363,0 1,083
— 14 1 ,590 0,01927 34 40,5 0,207 82 394,0 1,148
— 12 1,868 0,02115 36 45,2 0,224 । 84 427,0 1,205
—18 2,188 0,02290 38 50,8 0,242 86 462,0 1,250
—8 2,550 0,02710 40 56,2 0,263 88 501,0 1,290
-6 2,990 0,30350 42 62,7 0,285 90 537,5 1,327
—4 3,480 0,03380 44 69,2 0,310 92 582,5 1,327
—2 4,030 0,03770 46 76,7 0,335 94 624,0 1,405
0 4,670 0,04180 48 85,3 0,363 96 672,0 1,445
2 5,400 0,04640 50 94,0 0,391 98 725,0 1,487
4 6,225 0,0515 52 103,0 0,422 | 100 776,0 1,530
6 7,150 0,0571 54 114,0 0,454 ПО 1093,0 2,620
210
Таблица П..15. Физические параметры воды при температуре кипения [40]
Температу- ра, °C Плотность, кг/м3 Энтальпия, кДж/кг Теплопро- водность, Вт/(м-°С) Кинемати- ческая вяз- кость-106. м2/с Поверхност- ное натяже- ние-104, Н/м
0 999,8 0 0,551 1,790 756
10 999,6 46,22 0,574 1,300 742
20 998,2 83 ,'90 0,599 1,000 727
30 995,6 125,7 0,618 0,805 712
40 992,2 167,5 0,634 0,659 696
50 988,0 209,3 0,648 0,556 678
60 983,2 251,1 0,659 0,479 662
70 977,7 293,0 0,668 0,415 643
80 971,8 334,9 0,675 0,366 626
90 965,3 377,0 0,680 0,326 607
100 958,3 461,0 0,683 0,295 589
ПО 951,0 461,3 0,685 0,268 569
120 943,1 503,7 0,686 0,244 548
130 934,8 546,4 0,686 0,226 529
140 926,1 589,1 0,685 0,212 507
150 916,9 632,2 0,684 0,202 487
160 907,4 675,3 0,683 0,191 466
170 897,3 719,3 0,679 0,181 443
180 886,9 763,3 0,675 0,173 423
190 876,0 876,0 0,670 0,166 400
200 864,7 852,4 0,663 0,160 377
210 852,8 897,6 0,655 0,154 354
220 840,3 943,7 0,645 0,149 332
230 827,3 990,2 0,637 0,145 310
240 813,6 1037 0,628 0,141 285
250 799,2 1086 0,618 0,137 262
260 784,0 1135 0,605 0,135 237
270 767,9 1185 0,590 0,133 215
280 750,7 1237 0,575 0,131 191
290 732,3 1290 0,558 0,129 169
300 712,5 1345 0,540 0,128 144
14
211
Таблица П.16. Характеристика насыщенного водяного пара [55]
Температу- ра, °C Давление, МПа Плотность, кг/мэ Энтальпия, кДж/кг Теплота па- рообразова- ния, кДж/кг
жидкости пара
0 0,000508 0,00484 0 2491, 14 2491,14
10 0,001225 0,00940 41,87 2510,40 2468 ,53
20 0,002334 0,01729 83,73 2530,06 2446,34
30 0,004246 0,03036 125,80 2549,34 2423,73
40 0,007375 0,05114 157,43 2568,60 2401,12
50 0,012535 0,0830 209,34 2587,44 2378,10
60 0,01992 0,1301 251,20 2606,28 2355,07
70 0,03115 0,1979 293,07 2624,28 2331,21
80 0,04737 0,2929 334,94 2642,28 2307,75
90 0,07012 0,4229 376,81 2659,87 2283,06
100 0,10130 0,5970 418,68 2677,03 2258 ,35
110 0,1433 0,8254 460,96 2693,36 2231,98
120 0,1986 1,1199 503,67 2708,85 2205,18
130 0,2702 1 ,494 546,37 2723,93 2177,55
140 0,3514 I ,962 589,08 2734,74 2148,66
150 0,4761 2,543 632,20 2750,72 2118,52
160 0,6181 3,252 653,97 2752,86 2С87,11
170 0,7924 4,113 719,29 2773,33 2054,04
180 1 ,003 5,145 753,25 2782,54 2019,29
190 1,225 6,338 807,63 2790,08 1982,44
200 1,554 7,840 852,01 2795,52 1943,50
210 1,917 9,567 897,23 2799,29 1902,48
220 2,320 11,600 942,44 2800,90 1858,52
230 2,798 13,98 988,50 2800,13 1811,62
240 3,347 16,76 1034,55 2796,78 1761,80
250 3,977 20,01 1081,45 2790,08 1708,63
260 4,692 23,82 1128,76 2780,87 1651 ,69
270 5,503 28,27 1175,90 2758,31 1591,40
280 6,416 33,47 1225,47 2751,98 1525,50
290 7,441 39,50 1274,46 2732,30 1457 ,42
300 8,591 46,93 1325,54 2708,02 1382,48
310 9,875 55,59 1378,71 2679,97 1301,25
320 11,297 65,95 1436,07 2648,15 1212,07
330 12,833 78,53 I496,78 2610,46 1113,68
340 14,812 93,28 1562,93 2568,60 1005,66
350 16,534 113,20 1636,20 2515,58 880 ,48
212
213
Таблица П.17. Энтальпия и теплоемкость перегретого водяного пара [60]
Давление, 10-5-Па Температура кипения, °C Энтальпия, кДж/кг Средняя теплоемкость. кДж/(кг-°С)
насыщенного пара при 100 °C при 200 °C при 300 °C до 100 °C до 200 °C до 300 °C
0,05 32,55 2562 2690,0 2881,8 3078,8 1,9060 1,9148 1,9693
0,10 45,45 2588 2689,9 2881,4 3078,7 1,9199 1,9149 1,9734
0,20 59,67 2610 2688,7 2881,0 3078,6 1,9831 1,9232 1,9776
0,30 68,68 2626 2687,4 2880,6 3078,3 1,9625 1,9315 1,9777
0,40 75,42 2638 2686,2 2880,2 3078,3 1,9734 1,9399 1,9818
0,50 80,86 2643 2684,9 2879,3 3077,9 2,0153 1,9441 1,9860
0,60 85,45 2654 2683,2 2878,9 3077,6 2,0320 1,9567 1,9861
0,70 89,45 2661 2682,4 2878,5 3077,5 2,0321 1,9609 1,9902
0,80 92,99 2666 2681,1 2878,1 3077,1 2,0900 1,9693 1,9903
0,90 96,18 2671 2679,5 2877,2 3076,7 2,0901 1,9776 1,9944
1,00 99,09 2676 — 2876,9 3076,6 2,0905 1,9860 1,9986
1,50 110,79 2694 — 2874,3 3075,0 — 2,0112 2,0070
2,00 119,62 2708 — 2871,8 3074,2 — 2,0237 2,0237
2,50 126,79 2718 — 2869,3 3072,5 — 2,0656 2,0321
3,00 132,88 2726 — 2866,7 3071,2 — 2,1033 2,0447
4,00 142,92 2739 — 2862,6 3068,7 — 2,1494 2,0614
5,00 151,11 2749 — 2856,3 3066,2 — 2,1788 2,1369
6,00 158,08 2758 — 2851,7 3063,7 — 2,2332 2,1201
7,00 164,17 2765 — 2847,1 3060,7 — 2,2877 2,1369
8,00 169,61 2770 — 2841,6 3058,2 — 2,3464 2,1662
9,00 174,53 2775 — 2835,7 3055,7 — 2,3841 2,1997
10,00 179,04 2779 — 2879,9 3052,8 — 2,4218 2,2290
Габлица П./8. Энтальпия нефтяных жидкостей (кДж/кг) [6]
Темпе- ратура, СС Относительная плотность при температуре 15СС
0,65 0,70 0,75 0,80 0,85 0,90 0,95 1,00
0 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00
2 4,23 4,06 3,89 3,77 3,68 3,56 3,48 3,38
4 8,42 8,08 7,83 7,58 7,37 7,16 6,95. 6,77
6 12,64 12,18 11,76 11,39 11,05 10,76 10,47 10,19
8 16,87 16,24 15,70 15,20 14,74 14,36 13,98 13,61
10 21,14 20,39 19,68 19,05 18,51 17,96 17,50 17,04
12 25,41 24,49 23,66 22,90 22,23 21,27 21,02 20,49
14 29,73 28,64 27,63 26,80 26,00 25,20 24,58 23,95
16 34,04 32,78 31,69 30,69 29,77 28,93 28,14 27,43
18 38,35 36,97 35,71 34,58 33,58 32,57 31,74 30,92
20 42,66 41,16 39,77 38,48 37,35 36,30 35,30 34,42
22 47,06 45,34 43,79 42,41 41,16 39,98 38,94 37,94
24 51,46 49,57 47,90 46,35 44,97 43,71 42,54 41,47
26 55,85 53,80 52,00 50,33 48,82 47,44 46,18 45,02
28 60,25 58,03 56,10 54,30 52,88 51,20 49,82 48,58
•?0 64,67 62,34 60,21 58,28 56,56 54,93 53,51 52,15
32 69,12 66,65 64,35 62,30 60,46 58,74 57,23 55,73
34 73,60 70,92 68,50 66,36 64,39 62,55 60,88 59,33
36 78,08 75,24 72,68 70,38 68,29 66,36 64,56 62,94
38 82,56 79,63 76,87 74,44 72,18 70,21 68,29 66,57
40 87.09 83,90 81,06 78.50 76,16 74,02 72,01 70,20
42 91,61 88,26 85,29 82,56 80,09 77,83 75,78 73,86
44 96,17 92,65 89,51 86,67 84,07 81 ,73 79,55 77,52
46 100,73 97,05 93,78 90,77 88,09 85,58 83,32 81,22
48 105,30 101,49 98,01 94,92 92,07 89,47 87,13 84,90
50 109,90 105,93 102,33 99,06 96,09 93,41 90,81 88,61
52 114,51 110,36 106,60 103,20 100,15 97,34 94,71 92,32
54 119,11 114,80 110,91 107,39 104,21 101,28 98,56 96,06
56 123,80 119,28 115,26 111,58 108,27 105,21 102,41 99,81
58 128,45 123,80 119,58 115,81 112,33 109,19 106,26 103,57
60 133,14 128,28 123,97 119,99 116,44 113,17 110,11 107,34
62 137,83 132,85 128,33 124,26 120,54 117,19 114,01 111,13
64 142,52 137,37 132,72 128,49 124,64 121,17 117,90 114,93
66 147,25 141,93 137,12 132,76 128,79 125,19 121,84 118,75
68 152,02 146,50 141,56 137,03 132,97 129,25 125,77 122,58
70 156.80 151,10 145,99 141,35 137,12 133,27 129,67 126,42
72 161,57 155,71 150,43 145,66 141,31 137,33 133,64 130,28
74 166,38 160,35 154,91 150,01 145,49 141,43 137,62 134,15
76 171,20 165,00 159,43 154,33 149,72 145,49 141,60 138,03
78 176,01 169,65 163,96 158,68 153,95 149,59 145,62 141,92
80 180,91 174,30 168,52 163,12 158,18 153,78 149,68 145,84
82 185,77 179,03 173,08 167,43 162,45 157,84 153,66 149,76
84 190,63 183,72 177,60 171,83 166,72 162,03 157,68 153,70
86 195,52 188,45 182,13 176,26 170,99 166,22 161,74 157,65
88. 200,46 193,18 186,65 180,70 175,30 170,36 165,80 161,61
90 205,36 197,95 191,21 185,14 179,57 174,59 169,94 165,59
92 210,35 202,68 195,78 189,58 183,93 178,78 174,00 169,58
94 215,29 207,50 200,38 194,10 188,23 183,01 178,11 173,59
96 220,27 212,27 205,07 198,58 192,64 187,23 182,21 177,60
98 225,29 217,09 209,72 203,02 196,99 191,50 186,36 181,62
100 230,32 221,94 214,41 207,58 201,43 195,69 190,50 185,69
102 235,34 226,80 219,10 212,15 205,78 200,05 194,69 , 189,75
104 240,36 231,66 223,83 216,67 210,22 204,32 198,87 192,82
214
Продолжение табл. П.18.
Относительная плотность при температуре 15 °C
ратура, °C 0,65 0,70 0,75 0,80 0,85 0,90 0,95 1,00
106 245,47 236,55 228,52 221,27 214,66 208,63 203,06 197,90
108 250,54 241,41 233,25 225,84 219,14 212,94 207,25 201,96
НО 255,66 246,35 237,98 230,48 233,53 217,25 111,43 206,95
112 260,84 251,33 242,75 235,09 228,01 221,61 215,66 210,24
114 265,90 256,23 247,52 239,65 232,49 215,96 219,93 214,39
116 271,05 261,17 252,34 244,30 237,02 230,40 224,20 218,54
118 276,25 266,16 257,11 248,11 241,54 234,75 228,47 222,71
120 281,40 271,18 261,97 253,64 246,06 239,15 232,74 226,89
122 286,63 276,20 266,83 258.37 250,66 243,59 237,10 231,09
124 291,86 281,23 271,68 263,06 255,23 247,98 241,41 235,29
126 297,10 286,29 276,58 267,75 259,79 252.46 245,72 239,52
128 302,33 291,26 281,48 272,52 264,40 256,94 250,08 243,76
130 307,60 296,43 286,38 277,29 269,00 261,42 254,43 248,01
132 312,92 301,53 291,28 282,28 273,61 265,90 258,83 252,27
134 318,62 306,64 296,22 286,84 278,26 270,43 263,22 256,54
136 323,51 311,75 301,20 291,61 282,90 274,95 267,62 260,83
138 328,87 316,90 306,14 296,43 287,59 279,47 272,02 265,13
140 334,23 322,05 311,12 301,24 292,28 284,03 276,45 269,44
142 339,59 327,20 316,15 306,10 296,97 288,55 280,89 273,78
144 345,24 332,68 321,17 310,95 301,66 293,41 285,37 278,13
146 350,39 337,62 326,19 315,81 306,39 297,77 289,81 282,49
148 355,84 342,86 331,22 320,71 311,08 302,37 294,29 286,86
150 358,81 348,09 336,28 325,61 315,89 307,02 298,81 291,25
152 366,72 353,37 341,39 330,55 320,67 311,62 303,33 295,64
154 372,16 358,64 346,46 335,49 325,44 316,27 307,86 300,06
156 377,65 363,92 351,61 340,43 330,26 320,96 312,38 304,48
158 383,18 369,28 356,46 345,37 335,07 325,65 316,94 308,92
160 388,70 374,55 361,87 350,35 339,88 330,34 321,50 313,35
162 392,55 379,91 367,02 355,38 344,78 335,03 326,11 317,84
164 399,80 385,23 372,21 360,36 349,64 339,76 330,67 322,32
166 405,37 390,63 377,40 365,38 354,50 344,49 335,32 326,81
168 410,98 395,99 382,51 370,41 359,35 349,26 339,93 331,32
170 416,59 401,43 387,82 375,51 364,29 353,99 344,57 335,84
172 422,07 406,83 393,02 380,54 369,19 358,73 349,22 340,38
174 427,85 412,27 398,29 385,65 374,13 363,58 353,87 344,93
176 433,50 417,76 404,40 390,59 379,07 368,40 358,56 349,49
178 439,15 423,20 408,84 395,86 384,06 373,21 363,25 354,06
180 444,85 428.69 414,12 401,01 389,00 378,03 367,98 358,65
182 450,58 434,21 419,48 406,12 394,02 382,88 372,67 363,25
184 456,32 439,74 424,79 411,31 399,04 387,78 377,44 367.87
186 462,10 445,27 430,15 416,46 404,07 392,64 382,17 372,50
188 467,79 450,79 437,98 421,65 409,09 397,54 386,94 377,14
190 473,57 456,36 440,87 426,89 414,16 402,44 391,72 381,80
192 479,39 461,97 446,27 432,08 419,22 407,38 396,53 386,47
194 485,17 467,54 451,67 437,31 424,29 412,32 401,31 391,15
196 490,99 473,19 457,12 442,59 429,52 417,26 406,12 395,85
198 496,85 478,80 462,56 447,86 434,51 422,24 410,98 400,56
200 502,71 484,41 467,96 453,14 439,61 427,26 415,79 405,28
215
Таблица П./9. Энтальпия нефтяных ларов, кДж!кг [6]
Темпе- ратура, °C Относительная плотность при температуре 15 °C
0,65 0,70 0,75 0,80 0,85 0,90 0,95 1,00
50 476,00 464,23 452,47 440,70 428,85 417,26 405,49 393,77
52 479,39 467,25 455,82 443,97 432,12 420,36 408,63 396,83
54 482,86 471,06 459,17 447,28 435,39 423,70 411,77 399,92
56 486,34 472,94 462,56 450,63 438,65 426,64 414,95 403,06
58 489,81 477,88 465,95 453,51 441,92 429,98 418,09 406,20
60 493,33 481,36 469,34 457,32 445,22 433,33 ' 421,32 409,34
62 496,85 484,83 472,73 460,55 448,53 436,27 424,54 412,48
64 500,41 488,18 476,17 464,19 451,88 439,61 427 ,89 415 ,67
66 503,97 491,82 479,64 467,46 455,23 442,96 430,82 418,89
68 507,52 495,34 483,12 470,85 458,46 446,31 434 ,17 422 ,03
70 511,13 498,86 486,59 474,28 461,80 449,66 437,52 424 ,96
72 514,31 502,42 490,07 477,71 465,15 453,01 440,87 428,31
74 518,37 505,98 493,58 481,19 468 ,92 456,36 444 ,22 431 ,66
76 522,01 509,99 497,14 484,66 472,27 459,71 447,57 435,01
78 525,65 513,18 500,66 488,14 475,62 463,06 450 ,50 438 ,36
80 529,34 516,78 504,22 491,66 478,97 466,41 453,85 441,71
82 532,98 520,42 507,82 495,59 482,32 470,18 457,20 444 ,64
84 536,71 523,69 511,38 498,73 486,09 473,52 460,97 447,99
86 540,10 527,70 514,98 502,25 489,44 476,88 463,90 451,34
88 544,16 531,39 518,62 505,81 491,79 480,23 467,67 454,69
90 547,89 535,07 522,26 509,49 496,56 483,99 471,02 458,04
92 551,65 538,80 525,90 513,01 499,90 487,34 474 ,36 461,39
94 555,42 542,53 529,55 516,61 503,67 490,69 477,71 464,74
96 559,23 546,25 533,23 520,21 507,02 494,46 481,06 468,08
98 563,04 550,02 536,96 523,39 510,79 497,81 484,83 471,85
100 566,85 553,79 540,64 527,54 514,14 501,16 488,18 475,20
102 570,70 557,53 544,37 531,18 517,91 504,93 491,95 478,55
104 574,56 561,32 548,09 534,86 521,68 508,28 495,30 481,90
106 578,45 565,18 551,86 538,59 525,03 512,06 498,65 485,25
108 582,59 568,99 555,63 542,27 528,79 515,40 502,00 489,02
НО 586,24 572,84 559,44 546,00 532,56 519,16 505,77 492,37
112 590,13 576,73 563,25 549,77 536,33 522,93 509,12 496,14
114 594,07 580,58 567,06 553,54 539,68 526,28 512 ,88 499 ,49
116 598,04 584,48 570,87 557,31 543,45 530,05 516,65 502,84
118 601,98 588,37 574,72 561,07 547,22 533,82 520,00 505 ,77
120 606,00 592,35 578,57 564,88 550;98 537,59 523,77 510,79
216
_____________________________________________Продолжение табл. П.19
Темпе- Относительная плотность при температуре 15СС
ратура, °C 0,65 0,70 0,75 0,80 0,85 0,90 0,95 1,00
122 609,98 596,24 582,43 568,69 554.88 541,35 527,54 513,72
124 613,91 600,22 586,32 572,50 558,18 544,28 530,89 517,07
126 618,01 604,16 590,26 576.40 562,41 548,47 534,65 520,84
128 622,03 608,18 594,19 580,25 566,22 552,24 538,42 524,61
130 626,14 612,15 598,13 584,14 570,03 556,01 542,19 527,96
132 630,20 616,17 602,27 588,04 573,89 559,78 545,96 531,72
134 634,30 620,19 606,04 591,93 577,74 563,54 549,73 535,49
136 638,40 624,29 610,06 595,87 581,59 567,31 553,50 539,26
138 642,51 628,31 614,04 599,80 585,36 571,50 556,84 543,04
140 646,65 632,37 618,06 603,74 589,33 575,27 560,61 546,38
142 650,80 636,48 622,08 607,71 593,27 578,62 564,38 550,15
144 654,98 640,58 626,14 611,65 597,16 582,80 568,57 533,91
146 659,17 644,73 630,20 615,71 601,10 586,57 572,34 557,68
148 663,36 648,87 634,26 619,69 605,08 590,76 576,10 561,45
150 667,59 653,02 638,36 623,75 609,01 594,53 579,87 565,22
152 671,81 657,16 642,47 627,77 612,99 598,29 583,64 568,99
154 676,09 661,35 646,57 631,83 617,01 602,48 588,25 572,75
156 680,36 665,58 650,71 635,89 621,03 606,25 591,60 576,52
158 684,63 669,80 654,86 639,99 625,05 610,01 595,36 580,29
160 688,90 674,03 659,04 644,10 629,07 614,20 599,13 584 ,48
162 693,21 678,26 663.23 648,20 633,13 617,97 603,32 583,24
164 697,56 682,53 667,42 652,34 637,15 622,16 607,09 592,01
166 701,92 686,80 671,65 656,49 641,29 626,35 611,27 596,20
168 707,15 691,12 675,83 660,68 645,35 630,11 615,04 599,97
170 710,58 695,43 680,10 664,86 649,50 634,30 618,81 603,74
172 715,02 699,74 684,37 669,05 653,60 638,49 623,00 607,92
174 719,42 704,05 688,65 673,24 657,75 642,67 627,18 611,17
176 723,86 708,45 692,92 677,47 661,89 .646,87 630,53 615,46
178 728,29 712,80 697,23 681,70 666,08 652,72 634,72 619,23
180 732,73 717,20 701,54 685,92 670,27 654,81 639,32 623,42
182 737,21 721,60 705,90 690,24 674,45 659,00 643,09 627,60
184 741,69 725,99 710,25 694,51 678,68 663,19 647,28 631,79
186 746,17 730,43 714,60 698,82 682,91 667,25 651,47 635,56
188 750,69 734,87 718,96 703,13 687,18 671,44 655,65 639,74
190 755,15 739,35 723,35 707,44 691,41 675,62 659,84 643,93
192 759,78 743,83 727,79 711,80 695,68 679,81 663,61 647 ,70
194 764,34 748,31 732,19 716,15 700,00 684,04 667,80 651,89
196 768,91 752,83 736,67 720,51 704,30 688,27 671,98 656,07
198 773,51 757,35 741,10 724,90 708,62 692,54 676,17 660,26
200 778,12 761,91 745,58 729,30 712,93 696,81 680,35 664,45
217
Таблица П.2(7. Показатели
Тип аппарата Технологический процесс
Колонна с клапанными тарелками Низкотемпературная адсорбция угле-
для разделения углеводородного газа водородных газов
Колонна с клапанными тарелками Низкотемпературная адсорбция и де-
для разделения газов и отпарки жид- кости (АОК) сорбция углеводородов
Колонна с колпачковыми тарелками для очистки газа Абсорбция аммиака водой
Колонна с желобчатыми тарелками Абсорбция углеводородных газов
Колонна с колпачковыми тарелками »
Колонна с ситчатыми провальными тарелками
Колонна тарельчатая Осушка природного газа
Колонна с колпачковыми тарелками Адсорбция углеводородных газов
То же Абсорбер аминной очистки от диокси- да углерода
Колонна с ситчатыми тарелками
То же »
Колонна с решетчатыми тарелками »
Колонца с провальными тарелками
-218
тарельчатых адсорберов
Температура, °C Давле- ние, МПа Число таре- лок Диаметр, мм Сопротив- ление, Па Номер литера- турной ссылки
газа на входе газа на выходе абсорбен- та на входе абсорбен- та на выходе
—23 —15 —23 —10,5 3,4 30 2600 — [61]
30 — —23 136 1,8 40 1400/2400 — [61]
— — — — — 1 457 127,3 [491
— — — — — 33 3000 54,6 [49]
— — — — — 33 3000 78,8 [49]
— — — — — 20 570 38,9 [49]
34 34 35 — 6,0 5 — — [14]
— — — — — 30 1800 — [62]
— — — — 1,18 16 1200 — [1]
— — — — — — 1600 — [63]
— — -- 55 1,67 10 2080 — [1]
— — — — — 30 1800 — [62]
1,81 28 2100 [1]
219
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсорбент
насыщенный 14 сл.
охлаждение промежуточное 97
холодильник 105 сл.
Абсорбер
для осушки газа 57 сл.
баланс материальный 60 сл.
— тепловой 64 сл.
высота 70, 71
диаметр 69, 70
число тарелок рабочих 70
----теоретических 68, 69
для очистки газа 6 сл.
баланс материальный 8, 9
— тепловой 20 сл.
высота 26 сл.
диаметр 19, 20
число тарелок 27
расстояние между тарелками
102 сл.
Абсорбционно-отпарная колонна 84 сл.
баланс материальный 87 сл.
части абсорбционной 93, 94
— десорбционной 92, 93
высота 105
диаметр абсорбционной части 100,
101
— десорбционной части 103, 104
температурный режим десорбцион-
ной части 92, 93
холодильник 105 сл.
число тарелок рабочих 97
Абсорбция 83
низкотемпературная 105 сл.
физическая 5
химическая 5, 6
Алканоламины о, 6
Баланс
материальный см. Материальный
баланс
тепловой см. Тепловой баланс
Бутановая колонна
баланс материальный 153, 154
высота 167
давление 153, 155
диаметр 165 сл.
кипятильник 157, 158
орошение
минимальное 156
паровое 157, 158
холодное 156
секция питания 157
температурный режим 153, 155
тепловая нагрузка
кипятильника 157, 158
конденсатора-холодильника 157
Бутановая колонна
число тарелок
теоретических 158 сл.
рабочих 164, 165
Влагосодержание газа 55, 57, 58
Влажность газа 55
Высота
абсорбера 26 сл., 70, 71
десорбера 48, 49, 82
колонны
абсорбционно-огпарной 105
бутановой 167
изопентановой 175, 176
этановой 126, 127, 143, 144
Вязкость газовой смеси 23
Газ/ы/
влагосодержание 55, 57, 58
нефтяные 5
осушка 55 сл.
очистка 6 сл.
отдувочный 72 сл.
попутный 5
природный' 5
сырой 127 сл.
Градиент уровня жидкости на тарел-
ке 24 сл.
Давление
а десорбере 35 сл.
в колонне
бутановой 153, 155
изопентановой 168, 169
этановой 115 сл., 131
конденсации 127 сл.
Десорбер
расстояние между тарелками 104
для регенерации диэтиленглико-
ля 71 сл.
баланс материальный 72 сл.
— тепловой 77 ел.
высота 82
диаметр 80, 81
доля отгона 75
температура 71, 72
число тарелок 82
----моноэтаноламина 31 сл.
баланс материальный 39 сл.
— тепловой 43 сл.
высота 48, 49
давление 35 сл.
диаметр 46 сл.
доля отгона 37
1220
Десорбер
состав сырья 31 сл.
температура и давление 35 сл.
число тарелок 45, 46
Десорбция 83
Диаметр
абсорбера 19, 20, 69, 70
десорбера 46 сл., 80, 81
колонны абсорбционно-отпарной
абсорбционной части 100, 101
десорбционной части 103, 104
— бутановой 165 сл.
— изопентановой 173 сл.
— этановой 123 сл., 141 сл.
Дигликольамин 5, 6
Диизопропаноламин 5, 6
Диэтаноламин 5, 6
Диэтиленгликоль 56, 58, 71 сл.
Доля отгона
в десорбере для регенерации
диэтиленгликоля 75
моноэтаноламина 37
в колонне этановой 117, 133
Захлебывание тарелки 26
Изопентановая колонна
высота 175, 176
давление 168, 169
диаметр 173 сл.
дистиллят и остаток 167, 168
конденсатор-холодильник 176 сл.
орошение паровое 173
— холодное 172, 173
температурный режим 169
тепловая нагрузка
конденсатора-холодильника 172,
173
кипятильника 173
число паровое 171
— тарелок 171, 172
— флегмовое
минимальное 169
рабочее 171
Испаритель 39
поверхность теплообмена 112
Испаритель-холодильник пропановый
106
Кипятильник колонны
бутановой 157, 158
изопентановой 173
этановой 122, 123, 140, 141
Клапанная тарелка
градиент уровня 24 сл.
высота слоя пены 24
захлебывание 26
провал жидкости 21, 22
работоспособность 20 сл.
Клапанная тарелка
скорость газа в отверстиях 21
унос жидкости 22 сл.
Колонна
абсорбционно-отпарная см. Аб-
сорбционно-отпарная колонна
бутановая см. Бутановая колонна
изопентановая см. Изопентановая
колонна
ректификационная 112, ИЗ
этановая см. Этановая колонна
Конденсатор колонны
бутановой 157
этановой 121, 122, 139, 140
Конденсатор-холодильник колонны
бутановой 157
изопентановой 176 сл.
коэффициент теплопередачи 180
поверхность теплообмена 183,
184
расход воды 178
температурный напор 180
тепловая нагрузка 172, 173
типы 179, 180
Конденсация
газа сырого 127 сл.
однократная 129
температура и давление 127 сл.
Коррозия 6
Коэффициент
извлечения 87, 88
летучести 133
теплоотдачи 52 сл., 108 сл.
теплопередачи 54, 55, 110, 111,
149 сл., 180 сл.
теплопроводности 53
Материальный баланс
абсорбера 8 сл., 60 сл.
десорбера 39 сл., 72 сл.
колонны
абсорбционно-отпарной 87 сл.
бутановой 153, 154
этановой 114, 115, 130
холодильника-конденсатора
пропанового 146 сл.
Моноэтаноламин 5 сл.
регенерация раствора 31 сл.
теплообменник для нагрева 49 сл.
Нагрузка тепловая
кипятильника 122, 123, 140, 141,
157, 158, 173
конденсатора 121, 122, 139, 140,
157
конденсатора-холодильника 172,
173
Напор температурный 54, 55, 180
221
Однократная конденсация 129
Однократное испарение (ОИ) 39, 74,
75
Орошение колонны
бутановой
минимальное 156
паровое 157, 158
холодное 157
изопентановой
паровое 173
холодное 172, 173
Осушка газа 55 сл.
Очистка газа 6 сл.
Параметры псевдокритическпе 12, 59,
135
Поверхность теплообмена 55, 112,
144, 183, 184
Провал жидкости 21, 22
Работоспособность тарелки клапан-
ной 20 сл.
Рабочая тарелка
абсорбера 27, 70 i
колонны
абсорбционно-отпарной 97
бутановой 164, 165
Растворители 5
алканоламиновые 5, 6
Регенерация раствора
диэтиленглпколя 71 сл.
моноэтаноламина 31 сл.
Режим температурный см. Темпера-
турный режим
Ректификация 112 сл.
Секция питания колонны
бутановой 157
этановой 119, 139
Сопротивление гидравлическое та-
релки
абсорбционной 101, 102
десорбционной 104
Степень осушки 56
Тарелка(и)
в колонне абсорбционно-отпар-
ной 97
-----бутановой 158 сл.
----- изопентановой 171, 172
-----этановой 120, 121, 137 сл.
Температура
в десорбере 35 сл., 71, 72
в колонне 115 сл.
конденсации 127 сл.
стенки трубы холодильника-кон-
денсатора 152
теплоносителя горячего конечная
50
Температурный режим
колонны
абсорбционно-отпарной 92, 93
бутановой 153, 155
изопентановой 169
этановой 131 сл.
Теоретическая тарелка 68, 69, 112,
158 сл.
Тепловой баланс
абсорбера 10 сл., 64 сл.
десорбера 43 сл., 77 сл.
колонны
абсорбционно-отпарной 92 сл.
Теплоемкость 64 сл.
Теплоноситель 50, 52
Теплообменник
для нагрева моноэтаноламина
49 сл.
поверхность теплообмена 55
температурный напор средний
54, 55
теплоносители 52
типоразмеры 50 сл.
число 152
Точка росы 55, 56, 59
Триэтиленгликоль 56
Унос жидкости 22 сл.
Уровень жидкости на тарелке 24 сл.
Фактор ацентричности 12, 65
Тарелка/и/
захлебывание 26
клапанная см. Клапанная тарелка
рабючая см. Рабочая тарелка
расстояние межтарельчатое 102 сл.
сопротивление гидравлическое 101.
102, 104
теоретическая 68, 69, 112, 158 сл.
уровень 24 сл.
число
в абсорбере 27, 68 сл.
в десорбенте 45, 46, 82
Хемосорбция 7, 13
Холодильник абсорбента 105 сл.
Холодильник-конденсатор пропановый
144 сл.
материальный баланс 146 сл.
поверхность теплообмена 144
температура стенки 152
Число
паровое 156, 157, 171
тарелок
222
Число
в абсорбере 27, 68 сл.
в десорбере 45, 46, 82
в колонне абсорбционно-отпар-
ной 97
---- бутановой 158 сл.
---- изопентановой 171, 172
----этановой 120, 121, 137 сл.
теплообменников 152
флегмовое 134, 156, 157, 169, 171
Энтальпия стандартная 16
Энтропия стандартная 16
Этановая колонна
для газожидкостной смеси 113 сл.
баланс материальный 114, 115
высота 126, 127
давление 115 сл.
диаметр 123 сл.
доля отгона 117
секция питания 119
Этановая колонка
температура и давление 115 сл.
тепловая нагрузка кипятильни-
ка 122, 123
----- конденсатора 121, 122
число тарелок 120, 121
для углеводородного конденсата
127 сл.
баланс материальный 130
высота 143, 144
давление 131
диаметр 141 сл.
доля отгона 117, 133
режим температурный 131 сл.
секция питания 139
температура и давление кон-
денсации 127 сл.
тепловая нагрузка кипятильни-
ка 140, 141
----- конденсатора 139, 140
число тарелок 137 сл.
— флегмовое 134
АЛЕКСЕЙ АЛЕКСЕЕВИЧ КУЗНЕЦОВ
ЕВГЕНИИ НИКОЛАЕВИЧ СУДАКОВ
РАСЧЕТЫ
ОСНОВНЫХ ПРОЦЕССОВ
И АППАРАТОВ
ПЕРЕРАБОТКИ
УГЛЕВОДОРОДНЫХ
ГАЗОВ
Редактор Степанова Р. М.
Художник Бекетов Е. В.
Художественный редактор Носов Н. В.
Технический редактор Цыганок Е. В.
Корректор Иванова Н. А.
ИБ № 1567
Сдано в наб. 20.10.82. Подп. в печ, 24.05.83. Т. 10286.
Формат бумаги 60X90'/i6. Бумага тип. № 2. Гарн. литератур».
Печать высокая. Усл. печ. л. 14. Усл. кр.-отт. 14.
Уч.-изд. л. 16,41- Тираж 6400. Заказ 640. Цена 1 р. 10 к.
Изд. № 2516
Ордена «Знак Почета» издательство «Химия».
107076. Москва, ул. Стромынка, д. 13
Московская типография № 11 Союзполиграфпрома
ри Государственном комитете СССР по делам издательств,
полиграфии н книжной торговли.
Москва, 113105, Нагатинская ул., д. I