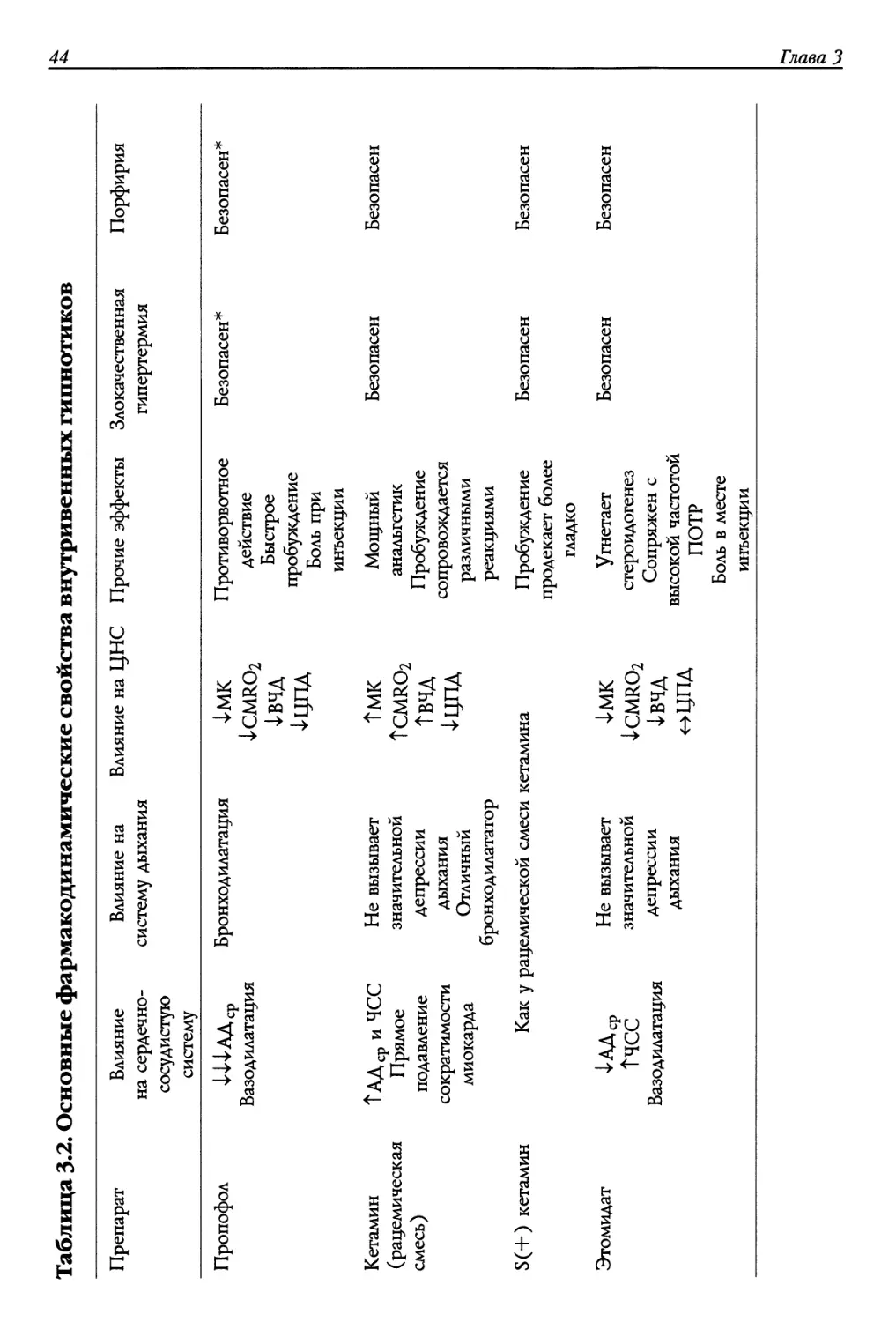
Текст
Йен Смит
Пол Уайт
ТОТАЛЬНАЯ
ВНУТРИВЕННАЯ
АНЕСТЕЗИЯ
Клиническое руководство
R.A.S.Lab OCR
raslab.info
Данная книга представлена исключительно в
ознакомительных целях. Любое коммерческое
или иное использование кроме предварительного
ознакомления запрещено. Публикация данного
документа не преследует никакой коммерческой
выгоды. Но такие документы способствуют
быстрейшему профессиональному и духовному
росту читателей и являются рекламой бумажных
изданий таких документов.
Все авторские права сохраняются за
правообладателем.
ТОТАЛЬНАЯ
ВНУТРИВЕННАЯ
АНЕСТЕЗИЯ
Principles and Practice
Series
TOTAL INTRAVENOUS ANAESTHESIA
IAN SMITH BSc, MBBS, FRCA
Senior Lecturer in Anaesthesia,
Keele University, North Staffordshire Hospital,
Stoke-on-Trent, Staffordshire, UK
PAUL F WHITE PhD, MD, FANZCA
Professor and McDermott Chair of Anesthesiology,
University of Texas Southwestern Medical Center,
Dallas, Texas, USA
Principles and Practice in Anaesthesia Series edited by
CEWHAHN
University Lecturer in Anaesthetics,
Oxford University and Consultant in Clinical Measurement,
Oxford Radcliffe Hospital
and
APADAMS
Professor of Anaesthetics, University of London,
United Medical and Dental Schools of Guy's and St Thomas' Hospitals
and Honorary Consultant Anaesthetist, Guy's,
King's and St Thomas' Hospitals, London
BMT
Books %J
Йен Смит
Пол Уайт
ТОТАЛЬНАЯ
ВНУТРИВЕННАЯ
АНЕСТЕЗИЯ
Клиническое руководство
Перевод с англ. под редакцией
докт. мед. ндук А.Ю. ЛубнинА,
канд. мед. НАукА.М. Цейтлина
Издательство БИНОМ
Москва
2006
lv*-\
УДК 616-089.5
ББК 54.5
С50
Перевод с английского А.С. Добродеева, И.В. Ништенковой
Смит Й., Уайт П.
Тотальная внутривенная анестезия. Пер. с англ. М.: Издательство БИНОМ,
2006. - 176 с: ил.
Книга посвящена внутривенной анестезии — методике, имеющей стратегическое
значение для российской анестезиологии. Достаточно полно и в то же время лаконично
описаны теоретические и практические аспекты проблемы.
Книга предназначена для анестезиологов-реаниматологов.
© The original English language work has
been published by BMJ Books, London 1999
© БИНОМ-Пресс, 2006
ISBN 5-7989-0300-1 (БИНОМ)
ISBN 0-7279-1191-0 (англ)
Научное издание
Йен Смит, Пол Уайт
ТОТАЛЬНАЯ ВНУТРИВЕННАЯ АНЕСТЕЗИЯ
Зав. редакцией к.б.н. Е.Ь. Мосткова
Оформление К.А. Свиридова
Компьютерная верстка СВ. Аычашпа
Корректор И.Е. Чуняева
Подписано в печать 05.05.2006. Формат 70 х 100/16. Печ. л. 11
Бумага офсетная. Печать офсетная. Тираж 2000 экз. Заказ 3017
ООО "Издательство БИНОМ", 2006 г.
103473, Москва, ул. Краснопролетарская 16
При участии ООО ПФ «Сашко»
Отпечатано в ОАО «ИПК «Ульяновский Дом печати»
432980, г. Ульяновск, ул. Гончарова, 14
От редакторов перевода
Уважаемые коллеги!
Настало время поздравить всех интересующихся одной из ключевых проблем
современной анестезиологии, каковой является внутривенная анестезия, с
изданием на русском языке той великолепной книги, которую вы держите в руках.
Выход в свет этой книги за рубежом, а теперь и в России, — сам по себе
достаточно интересный феномен, свидетельствующий о возрастающем интересе к
внутривенным методикам анестезии. Сейчас вряд ли можно найти хотя бы одного
практикующего анестезиолога, не использующего в своей повседневной работе
внутривенные анестетики. Кроме того, появилось много приверженцев тотальной
внутривенной анестезии, которые вообще отказались от ингаляционных препаратов.
Об авторах. Авторы этой книги — бесспорно, эксперты мирового уровня,-
опубликовавшие многие основополагающие работы и обладающие
колоссальным клиническим опытом в области внутривенной анестезии.
О книге. На наш взгляд, она очень удачна. В ней освещены все необходимые
аспекты темы, даже такие, которые, на первый взгляд, не имеют отношения к
внутривенной анестезии. Весь материал представлен убедительно, достаточно
полно и в то же время лаконично. Особенно хотелось бы отметить прекрасный
простой язык книги, которым излагаются достаточно сложные вещи.
Желаем приятного и полезного чтения.
А. Ю. Аубнин
А. М. Цейтлин
Содержание
Предисловие авторов к изданию на русском языке 7
Список сокращений 10
Глава 1. История и научные основы внутривенной анестезии 11
Глава 2. Методики внутривенной анестезии 28
Глава 3. Фармакокинетика и фармакодинамика препаратов,
применяемых при тотальной внутривенной анестезии 39
Глава 4. Проведение внутривенной анестезии в отдельных группах больных. . 95
Глава 5. Обеспечение внутривенной анестезии:
доставка анестетиков и мониторинг адекватности анестезии .... 114
Глава 6. Преимущества и недостатки внутривенной анестезии . . , 146
Глава 7. Будущее внутривенной анестезии 161
Предметный указатель 164
Предисловие авторов к изданию
на русском языке
История внутривенной (в/в) анестезии начинается с 1656 г., когда
Кристофер Рен (Christopher Wren) использовал птичье перо для инъекции настойки
опия в вену собаки. Хотя изобретение шприца и полой иглы в 1853 г.
значительно облегчило введение анестетиков и других препаратов внутривенно, на Западе
в/в анестезия стала популярной только в последние 20 лет, когда были
разработаны новые в/в анестетики и удобные системы их доставки. Одним из
пионеров в/в анестезии, значительно опередившим свое время, был профессор Джон
Данди (John Dundee) из Белфаста, Северная Ирландия. В/в анестетики стали
широко применяться в рамках тотальной внутривенной анестезии (ТВВА), а
также в сочетании с местными анестетиками.
В настоящее время многие препараты, применяемые а^ в/в анестезии,
характеризуются быстрым началом и короткой продолжительностью действия.
В их число входят препараты седативно-гипнотического действия (пропофол),
анальгетики (фентанил и его новые аналоги), миорелаксанты (мивакурий, ро-
куроний, рапакуроний). Кроме того, имеются различные в/в вспомогательные
препараты (Р-адреноблокаторы, (Х2-адреномиметики, кеторолак). Весь этот
медикаментозный арсенал позволяет анестезиологу точнее управлять
соматическими и вегетативными реакциями больного на ноцицептивные стимулы.
Быстрая элиминация анестетиков обеспечивает быстрое пробуждение с ясным
сознанием без побочных эффектов.
Появились технологии, позволяющие проводить мониторинг глубины
анестезии (например, биспектральный индекс, сжатый спектральный ряд,
акустические вызванные потенциалы), благодаря чему анестезиолог может точнее
дозировать в/в анестетики и анальгетики. Наконец, в клинике начали
применяться удобные компьютеризированные системы доставки в/в анестетиков
(например, Диприфьюзор), позволяющие дозировать их таким же образом, как
испаритель дозирует ингаляционные анестетики. Благодаря этим
усовершенствованиям ТВВА становится серьезной альтернативой ингаляционной анестезии.
Это очень серьезный прогресс, если учитывать, что в странах Запада многие
десятилетия господствующей методикой общей анестезии была именно
ингаляционная. Фармакологические и биотехнологические достижения в будущем
сделают ТВВА еще безопаснее, удобнее и экономичнее. Чтобы ТВВА получила
еще более широкое распространение, необходимы исследования,
доказывающие ее преимущество над ингаляционной анестезией в отношении скорости
пробуждения, побочных эффектов и прочих важных ^ля больного параметров
(например, быстроты возвращения на работу).
8
Предисловия
Мы надеемся, что это руководство поможет российским анестезиологам
усовершенствовать способы применения в/в анестетиков для достижения
оптимальной седации и анестезии. Может быть, это руководство даст толчок к
проведению в России исследований, сравнивающих тотальную внутривенную
анестезию с ингаляционной и регионарной.
Пол Уайт (Paul F. White), Ph.D., M.D. FANZCA
Professor and Holder of the Margaret Milam McDermott Distinguished Chair
of Anesthesiology at the University of Texas Southwestern Medical Center in
Dallas, Texas
President of the White Mountain Institute, Los Altos, California
При создании «Тотальной внутривенной анестезии» авторы ставили своей
целью не описание мельчайших нюансов фармакологии и клинического
применения препаратов, но подробное освещение ключевых аспектов в/в анестезии,
представленное в ясном и удобном ^^ля читателя виде. Планировалось, что
«Тотальная внутривенная анестезия» будет практическим руководством для
анестезиологов Европы и Северной Америки. Для нас стало приятным сюрпризом и
большим удовольствием узнать, что теперь книга стала доступной и мя
русскоязычного читателя.
В/в анестезия чрезвычайно важна для России, где ингаляционная анестезия
пока не может получить широкого распространения из-за нехватки
современных анестетиков и низкопоточных наркозных препаратов. В/в анестезия имеет
долгую историю, и в разные промежутки времени были популярны сочетания
опиоидов и дроперидола, кетамина и бензодиазепинов. Эти методики, хорошо
знакомые российским анестезиологам, не стали менее эффективными, но в
настоящее время утрачивают свое значение и уступают место схемам на основе
современных в/в анестетиков. На протяжении всей книги авторы
подчеркивают важность применения в/в анестетиков короткого действия. В/в анестетики
короткого действия не только ускоряют пробркдение и делают его более
гладким, но и облегчают управление анестезией, что предотвращает передозировку
и сводит к минимуму риск побочных эффектов. Такой подход значительно
уменьшает вероятность осложнений в ближайшем послеоперационном
периоде, что особенно важно в условиях дефицита палат пробркдения и нехватки
в них квалифицированного сестринского и врачебного персонала.
Нельзя переоценить важность правильного дозирования и титрования
анестетиков в ходе операции. Для этого необходимо хорошо разбираться в
принципах фармакокинетики и фармакодинамики, а также в частной фармакологии
применяемого анестетика, что достаточно подробно освещено в руководстве.
При ТВВА могут возникнуть межлекарственные взаимодействия.
Благоприятные взаимодействия необходимо использовать, неблагоприятных следует
избегать. В книге описаны некоторые новые технологии и приборы а^я доставки
анестетиков (например, инфузия, управляемая по целевой концентрации),
Предисловия Э_
а также АЛ^ мониторинга глубины анестезии (биспектральный индекс,
акустические вызванные потенциалы). Пока еще нельзя окончательно сказать,
насколько полезны эти разработки для клинической практики. Мы надеемся, что
руководство поможет российским анестезиологам усовершенствовать свои
знания и навыки в области в/в анестезии.
Йен Смит (Ian Smith), BSc, MD, FRCA,
Senior Lecturer in Anesthesia,
Stoke-on-Trent
Сентябрь 2001 года.
Список сокращений
АД — артериальное давление
в/в — внутривенно, внутривенная, внутривенный
ИИС — инфузия с изменяющейся скоростью
ИПС — инфузия с постоянной скоростью
ИУЦК — инфузия, управляемая по целевой концентрации
МАК — минимальная альвеолярная концентрация
МК — мозговой кровоток
НЛА — нейролептанальгезия
НПВП — нестероидные противовоспалительные препараты
ПОТР — послеоперационная тошнота и рвота
ПСВ — периодическое струйное введение
ТВВА — тотальная внутривенная инфузия
УБА — управляемая больным анальгезия
УБС — управляемая больным седация
ЧСС — частота сердечных сокращений
цАМФ — циклоаденозинмонофосфат
ЦНС — центральная нервная система
ЦПД — церебральное перфузионное давление
ЦСЖ — цереброспинальная жидкость
ЭЭГ — электроэнцефалограмма
BIS — биспектральный индекс
ЕС50 — концентрация препарата, вызывающая эффект, составляющий 50% от
максимального
ED50 — доза лекарственного препарата, вызывающая эффект, составляющий 50% от
максимального, или вызывающая эффект у 50% больных
ED90 — Доза лекарственного препарата, вызывающая эффект, составляющий 90% от
максимального, или вызывающая эффект у 90% больных
ED95 — доза лекарственного препарата, вызывающая эффект, составляющий 95% от
максимального, или вызывающая эффект у 95% больных
Етах — концентрация препарата, вызывающая максимальный эффект
EMLA — эутектическая смесь местных анестетиков (от англ. eutextic mixture of local
anesthetics). Состоящий из смеси прилокаина и лидокаина крем для
поверхностной анестезии кожи
C(t) — концентрация препарата в момент времени t
со — начальная концентрация препарата
С1 — клиренс
CMRO2 — потребление кислорода мозгом
от — целевая концентрация
F1O2 — фракционная концентрация кислорода во вдыхаемой смеси
ррт — частей на миллион (выражение концентрации газа в газовой смеси)
SpC>2 — насыщение гемоглобина кислородом
Vd — объем распределения
Vdss, Vss — объем распределения в равновесном состоянии
Vpeak effect — объем распределения в момент пикового эффекта
Глава 1
История и научные основы
внутривенной анестезии
Введение
В настоящее время невозможно представить хирургию в отрыве от
анестезиологии — относительно молодой науки, существующей чуть более 150 лет. На
заре своего возникновения анестезия достигалась исключительно ингаляцией
препаратов, представляющих собой газ или испаряемую жидкость. И в наши
дни художники-карикатуристы, чтобы читатель легко понял, о ком идет речь,
изображают анестезиолога держащим в руках мяску и шланги из черной
резины. На самом деле в настоящее время ведущая роль в модернизации
анестезиологии принадлежит препаратам ^ля внутривенного введения.
Настоящая книга представляет собой практическое руководство по
внутривенной анестезии, включающее в себя описание основополагающих научных
принципов, а таюке рассматривающее возможности и реальные преимущества
(и недостатки) внутривенной анестезии по сравнению с ингаляционной. В
руководстве описаны различные методики внутривенной анестезии, их
применение среди отдельных групп больных, фармакокинетика и фармакодинамика
внутривенных анестетиков, анальгетиков, миорелаксантов и вспомогательных
средств. Основное внимание уделено наиболее распространенным и давно
применяемым в клинике препаратам, но представлена информация и о некоторых
новых средствах, которые станут доступными в ближайшем будущем.
В наши планы не входило сделать эту книгу всеобъемлющей. Также не
предусматривалось, чтобы каждое утверждение подтверждалось публикациями в
литературе, хотя весь представленный материал основан на достоверных
научных фактах. Ссылки на источник указаны только для некоторых наиболее
важных и клинически значимых исследований, а таюке аая ключевых обзоров,
описывающих обсуждаемую тему особенно глубоко. Остальной материал
суммирован на основании многих источников (включая личный опыт авторов книги).
Многие наиболее современные сведения были позаимствованы из нового
обширного руководства по внутривенной анестезии [1], к которому мы с
удовольствием отсылаем читателей, желающих получить более подробную
информацию относительно той или иной проблемы.
12
Глава 1
История тотальной внутривенной анестезии
В XVII-м веке, вскоре после открытия Гарвеем системы кровообращения,
были выполнены первые в/в инъекции лекарственных веществ. Интересно, что
при этом в качестве шприца использовали пузырь, а вместо иглы — ствол
птичьего пера; и шприц, и полая игла были изобретены позже. Одним из
первых введенных в/в веществ был опиум, который до этого многие столетия
принимали иными способами. Отметим, что идея введения опиума для лечения
боли в периоперационном периоде возникла намного позже. Датой рождения
современной анестезиологии считают 16 октября 1846 года, когда в Бостоне с
успехом прошла публичная демонстрация эфирной анестезии. Еще до этого
немногочисленным исследователям тоже удавалось вызвать состояние анестезии
другими ингаляционными анестетиками. Эфирная анестезия стала основной
методикой и быстро получила широкое распространение по всему миру. Как
только была разработана концепция анестезии, неудовлетворенность
некоторыми аспектами действия эфира (особенно медленной и неприятной индукцией
анестезии) подтолкнула исследователей к поиску других анестетиков.
Большинство препаратов, разработанных в то время, также были ингаляционными,
исследование в/в препаратов началось несколькими годами позже. В начале 70-х годов
XIX века были предприняты первые попытки проведения внутривенной
анестезии с помощью хлоралгидрата, но по причине высокой летальности от методики
отказались. Токсичность доступных в то время препаратов остановила
дальнейшее развитие внутривенной анестезии до следующего века, и господство
ингаляционных анестетиков на тот момент было неоспоримым.
Энтузиазм в отношении внутривенной анестезии возродился в 1909 году,
когда был успешно применен гедонал [2]. Этот препарат, представляющий собой
производное уретана, до применения в анестезиологии использовали аая лечения
бессонницы. Гедонал оказался в некоторой степени безопаснее, чем
предшествующие ему в/в анестетики. Недостатки гедонала: относительно плохая
растворимость в воде, затрудняющая введение; медленное начало действия и медленное
пробуждение. В 1921 г. в клинической анестезиологии начал применяться
первый барбитурат — сомнифен. После этого было синтезировано много различных
барбитуратов, появились многочисленные работы, посвященные зависимости их
активности от структуры. В 1932 г. был синтезирован первый барбитурат
короткого действия (гексобарбитал), а в 1934 г. в клинике начал применяться
тиопентал, который в меньшей степени вызывал возбркдение. Тиопентал широко
применяют и в настоящее время, хотя его популярность несколько снизилась с
появлением пропофола. Тем не менее тиопентал является «золотым стандартом», с
которым следует сравнивать любой новый в/в анестетик.
Барбитураты, хотя имели значительное преимущество перед
предшествующими в/в анестетиками, тем не менее вызывали определенные побочные
эффекты. Например, введение многих барбитуратов служило причиной
выраженного возбркдения и даже судорог, что не позволяло их использовать. Не
вызывавшие такого эффекта барбитураты молено было применять в клинике, но при
использовании в большой дозе или при многократном введении {аая
поддержания анестезии) продолжительность их действия значительно увеличивалась.
История и научные основы внутривенной анестезии 13_
Основные этапы развития внутривенной анестезии
Дата
III век до н.э.
XVI век
XVII век
1803
1845
1846
1853
1872
1909
1910
1921
1934
1939
1941
1942
1950
1954
1955
1957
1959
1960
1965
1967
1969
1972
1974
1976
1979
1980
1984
1996
Событие
Опиум используют для обезболивания и развлечения
В качестве яда для стрел применяют кураре
Выполнены первые в/в инъекции лекарственных веществ
Из опия выделен морфий
Изобретена полая игла
Проведена публичная демонстрация эфирной анестезии
Изобретен шприц
Хлоралгидрат введен в/в
Для внутривенной анестезии применено производное уретана
Разработана концепция сбалансированной анестезии
В клинике начал применяться первый барбитуровый анестетик
В клинике начал применяться тиопентал
Синтезирован петидин (первый синтетический опиоид)
Трагические события в Перл-Харборе; внутривенная анестезия
названа «идеальным методом эвтаназии»
Открыты анестетические свойства стероидов
В клинике начали применяться препараты кураре
В анестезиологии начали применяться принципы фармакокинетики
Искусственная гибернация
Синтезирован первый бензодиазепин
Первый стероидный анестетик (гидроксидион)
В клинике начал применяться метогекситал
Описана методика нейролептанальгезии
В клинике начал применяться диазепам
В клинике начал применяться кетамин и пропанидид
В клинике начал применяться фентанил
Предложена методика высокодозной опиоидной анестезии
В клинике начал применяться альтезин
В клинике начал применяться этомидат
Синтезирован суфентанил
Синтезирован альфентанил
В клинике начал применяться мидазолам и минаксалон
Синтезирован флумазенил
Запрещено применение минаксалона
В клинике начал применяться пропофол
Запрещено применение альтезина и пропанидида
В клинике начал применяться ремифентанил
В клинике начал применяться пропофол с помощью прибора для
инфузии, управляемой по целевой концентрации
14
Глава 1
Барбитураты вызывали выраженное угнетение кровообращения, особенно при
использовании в высокой дозе (например, моноанестезия тиопенталом без
закиси азота и других анестетиков) или на фоне гиповолемии. Массовые потери
американской стороны при налете японской авиации на главную
военно-морскую базу США в Перл-Харборе 8 декабря 1941 г. практически совпали с пиком
увлечения моноанестезией барбитуратами. Внутривенная анестезия казалась
идеальной в условиях войны или катастрофы. В/в анестетики было легко
транспортировать, они легко и компактно упаковывались, не нуждались в особенно
строгих условиях хранения. Кроме того, в отличие от эфира и циклопропана
они были неогнеопасны и невзрывоопасны. После налета на Перл-Харбор
многие тяжелораненые погибли из-за того, что неадекватная инфузионная терапия
сочеталась с чрезмерно высокими дозами тиопентала и других барбитуратов,
назначенных плохо обученным персоналом. В одном из сообщений того
времени внутривенную анестезию назвали «идеальным способом эвтаназии» [3].
Хотя во многих случаях задействованость тиопентала в генезе летальных исходов
представлялась неубедительной, события при Перл-Харборе тем не менее
замедлили развитие внутривенной анестезии.
Спустя некоторое время были разработаны многие анестетики небарбиту-
ратного ряда. В 1955 году появился первый стероидный анестетик — гидрокси-
дион. В отличие от многих других стероидных анестетиков, гидроксидион был
относительно стабилен в водном растворе. С другой стороны, эффект гидрокси-
диона развивался медленно и продолжался слишком долго, что в сочетании с
неприемлемо высокой частотой тромбофлебитов быстро заставило отказаться от
препарата. Исследовали и некоторые другие стероидные анестетики, наиболее
удачным из которых был альтезин, применявшийся в клинике с 1972 г. и
представляющий собой смесь двух препаратов — альфаксалона и альфадолона [3].
Альтезин был самым популярным в клинической практике стероидным
анестетиком и обладал такими свойствами, что мог бы составить конкуренцию пропо-
фолу, появившемуся лишь 12 лет спустя. В состав альтезина входил растворитель
кремофор EL, вызывавший тяжелые анафилактоидные реакции. Из-за того же
растворителя сходные проблемы возникали при использовании другого небар-
битуратного анестетика — пропанидида. Вследствие этого в 1984 г.
использование альтезина и пропанидида было запрещено.
В том же 1984 г. в Великобритании начал применяться пропофол.
Продолжительность действия пропофола была предсказуемо короткой, что облегчало
управление анестезией и позволяло быстро пробудить больного после
окончания операции. Кроме того, побочные эффекты пропофола не превышали
допустимого уровня. Благодаря сочетанию этих качеств пропофол стал основой
внутривенной анестезии (глава 3). Интересно отметить, что пропофол едва не
постигла печальная участь альтезина и пропанидида, посколысу вначале в состав
препарата входил кремофор EL. К счастью, проблемы, связанные с этим
растворителем, были своевременно распознаны, и еще до начала применения в
клинике пропись пропофола была изменена на жировую эмульсию. Попытки
подобным образом изменить пропись более ранних анестетиков были не столь
успешными.
Исторические и научные истоки внутривенной анестезии 75
В 1950—1970-ые гг. появились другие внутривенные анестетики, которые
продолжают применяться и в наши дни. В 1957 г. появился метогекситал,
который стали широко использовать в качестве короткодействующей альтернативы
тиопенталу — до тех пор, пока не появились альтезин и, впоследствии, пропо-
фол, продолжительность эффекта которых была еще меньше. Благодаря
предсказуемому влиянию на продолжительность судорог метогекситал все еще
применяют во время электросудорожной терапии, но мало используют где-либо
еще. В 1965 г. появился кетамин. Кетамин вне сочетания с другими
препаратами вызывал галлюцинации и делирий при пробуждении, что значительно
ограничило его применение. Хотя эти побочные реакции в значительной степени
молено предотвратить одновременным назначением бензодиазепинов, в
Северной Америке и Западной Европе кетамин так и не обрел широкой
популярности, оставшись лекарственным препаратом, применяемым в исключительных
случаях. Этомидат доступен в клинической практике рке более 20 лет. Он
оказывает менее выраженное кардиодепрессивное действие, чем большинство
других в/в анестетиков, но, к сожалению, вызывает другие осложнения —
тромбофлебит, тошноту и рвоту, подавление синтеза стероидных гормонов в
надпочечниках, каждое из которых ограничивает его применение (глава 3). Недавно
пропись этомидата была преобразована в жировую эмульсию, что, как
предполагается, позволит устранить некоторые из этих побочных эффектов или
уменьшить их выраженность до приемлемого уровня. Если результаты испытаний
подтвердят эти предположения, то, возможно, этомидат вновь обретет
широкую популярность.
Первый из миорелаксантов, кураре, начал использоваться в анестезиологии в
1942 г. В течение нескольких лет перед этим его применяли при
электросудорожной терапии в психиатрии ^\я предотвращения переломов. На самом деле
первое сообщение о применении кураре в хирургии было опубликовано в
немецком журнале еще в 1912 г., но тогда никто не обратил внимания на эту
работу. Интересно, что миорелаксанты при общей анестезии начали
использоваться на несколько лет раньше, чем началось широкое применение ИВЛ под
положительным давлением. Первые миорелаксанты были относительно
неспецифичными и обладали массой побочных эффектов. Несмотря на большое
количество разработанных миорелаксантов, векуроний (синтезированный в 1980 г.)
оказался первым относительно специфичным недеполяризующим миорелак-
сантом, не вызывающим значительных побочцых эффектов. Впоследствии
появился целый ряд миорелаксантов с различной продолжительностью действия и
скоростью наступления эффекта (глава 3). Миорелаксанты необходимы не для
всех операций, но во многих обстоятельствах они оказываются полезными.
В настоящее время можно выбрать из нескольких миорелаксантов один,
наиболее подходящий аля той или иной ситуации. Вместе с тем, применение
миорелаксантов сопряжено с определенными проблемами: например, они маскируют
признаки неадекватной анестезии и увеличивают риск непреднамеренного ин-
траоперационного восстановления сознания (глава 5).
С момента возникновения анестезиологии подразумевалось, что состояния
анестезии следует достигать с помощью единственного анестетика
(моноанестезия). При этом подходе доза анестетика должна была быть достаточно вели-
16
Глава 1
ка, чтобы обеспечить все желаемые эффекты. Подобная тактика была широко
распространена как при становлении ингаляционной анестезии, так и при
появлении барбитуратов. Вне зависимости от применяемых препаратов,
моноанестезия часто вызывала тяжелые осложнения и смерть вследствие угнетения
дыхания и кровообращения. Очевидная неудовлетворенность этими результатами
привела к разработке концепции сбалансированной анестезии, впервые
предложенной в 1910 г. в виде сочетания местной инфильтрационной анестезии с
неглубокой общей анестезией. В 1920-х гг. концепция была расширена, она
теперь включала сочетание премедикации с регионарной и общей анестезией.
В 1940—1950-е гг. получила развитие более современная методика, включавшая
сочетание закиси азота, опиоидного анальгетика и препарата с гипнотическим
эффектом. В конце 1960-х гг. наметился возврат назад — м^ применения в
кардиохирургии была предложена методика высокодозной опиоидной
анестезии. Но и этот вариант моноанестезии привел к плачевным результатам из-за
высокой частоты мышечной ригидности и интраоперационного восстановления
сознания. В настоящее время большинство анестезиологов применяет методику
сбалансированной анестезии, используя как минимум два препарата —
анальгетик и гипнотик, часто в сочетании с закисью азота. Другой вариант
сбалансированной анестезии представлен нейролептанестезией (глава 2), возникшей
в 1950-е гг. и получившей дальнейшее развитие в конце 1960-х гг. с появлением
фентанила и дроперидола. Хотя в свое время нейролептанестезия с точки зрения
безопасности имела значительные преимущества по сравнению с другими
методиками, ее применение сопряжено с высокой частотой послеоперационного
психологического дискомфорта и других нежелательных побочных эффектов, и в
развитых странах она постепенно была вытеснена более современными методами.
Основы фармакокинетики и фармакодинамики
Чтобы введение лекарственного препарата в/в позволило обеспечить
необходимый клинический эффект в оптимальный момент времени, необходимо знать
основы фармакокинетики и фармакодинамики. Фармакокинетика изучает
взаимоотношение между введенной дозой препарата и его концентрацией в
плазме, т. е. «что организм делает с лекарством». Фармакодинамика описывает
взаимоотношение между концентрацией препарата в плазме и клиническим
эффектом, т. е. «что лекарство делает с организмом».
Основы фармакокинетики
Фундаментальным понятием фармакокинетики является объем
распределения. Если вводят известную дозу препарата, после чего измеряют его
концентрацию в плазме, то объем, в котором препарат растворился (известный как объем
распределения), легко вычислить путем деления дозы препарата на его
концентрацию в плазме. Математически это расчитывается следующим образом:
Объем распределения (Vd, от англ. volume of distribution) =
количество введенного препарата/концентрация препарата в плазме
История и научные основы внутривенной анестезии 77
Объем распределения вовсе не отражает истинный объем плазмы или других
тканей и жидкостных пространств организма, а представляет собой
отвлеченное математическое понятие. По этой причине его часто еще называют
кажущимся объемом распределения. Хотя расчет предполагает равное
распределение, на практике это не имеет значения. Например, два препарата вводят
в одинаковой дозе. Пусть первый препарат интенсивно связывается с тканями
организма, в то время как второй по большей части остается в плазме. Тогда
концентрация первого препарата в плазме будет значительно ниже, а объем
распределения, наоборот, значительно больше, чем у второго.
Другим важным понятием является «клиренс», а именно способность
организма удалять лекарственный препарат из крови или плазмы. Клиренс может
осуществляться путем почечной экскреции, метаболизма в печени, а также
другими способами. Как правило, удобно рассматривать общий клиренс
организма, включающий в себя все его разновидности. Поскольку клиренс представляет
собой часть объема распределения, из которой препарат полностью удаляется за
определенный промежуток времени, измеряется он в единицах потока, а
именно объем/время. Математически это можно выразить следующим образом:
Клиренс (С1, от англ. clearance) =
скорость удаления препарата/концентрация препарата в плазме
Отсюда следует, что скорость удаления препарата зависит от его
концентрации в плазме. Так, если клиренс препарата составляет 1 л/мин, то за 1 минуту
будет удален 1 мг препарата, при условии, что его концентрация в плазме равна
1 мг/л, и 50 мг препарата, если его концентрация будет 50 мг/л.
Эти подходы могут быть наглядно представлены с помощью гидравлической
модели, состоящей из заполненного водой сосуда, из дна которого выходит
трубка (рис. 1.1). В этой модели объем воды соответствует количеству
препарата, площадь поперечного сечения сосуда представляет собой объем
распределения, высота столба — это концентрация препарата в плазме, а размер трубки
равен клиренсу. При одинаковом количестве воды уровень ее тем ниже, чем
больше площадь поперечного сечения сосуда. С помощью данной простой
модели становится очевидным, что чем выше уровень воды, тем быстрее она течет
через трубку благодаря высокому давлению водяного столба. «Клиренс» воды
(препарата) является процессом первого порядка, поскольку прямо
пропорционален давлению (концентрации). В процессе первого порядка
концентрация препарата снижается в соответствии со следующим уравнением:
C(t)=Q) х е-** ,
где C(t) — концентрация в момент t, Cq — начальная концентрация препарата,
t — время с момента введения препарата, е — основание натурального
логарифма и к — константа скорости элиминации (k^Cl/Vd). Константа скорости
элиминации к измеряется в единицах времени""1, а период полусуществования
данного процесса составляет 0,693/к. Если концентрацию отобразить в
логарифмической системе координат, то наклон прямой линии будет определяться
величиной к, а сама прямая пересечет ось Y в точке Cq, равной начальной
концентрации препарата.
2 Тотальная внутривенная анестезия
18
Глава 1
Рис. 1.1. Простая гидравлическая модель, представляющая распределение препарата в
плазме. Площадь поперечного сечения емкости соответствует объему распределения,
объем воды соответствует количеству препарата, а высота водяного столба соответствует
концентрации препарата в плазме. Клиренс определяется размером дренажной трубки
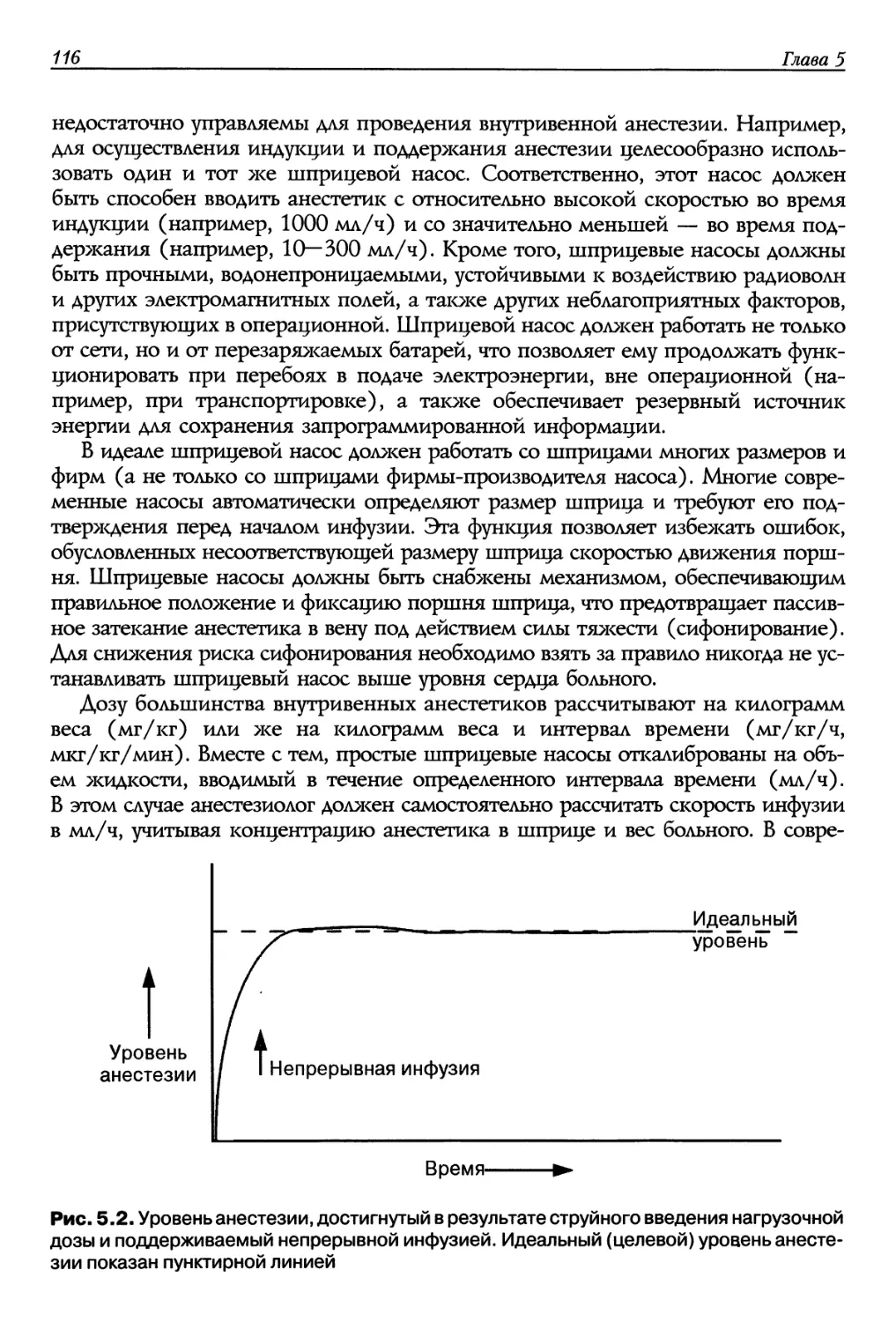
При постоянной инфузии препарата его концентрация в плазме постепенно
нарастает до того момента, пока не установится равновесие между скоростью
введения препарата и скоростью его элиминации. С этого момента
концентрация препарата остается постоянной. Если препарат вводят только путем
инфузии, то его концентрация в плазме зависит от продолжительности инфузии
относительно периода полувыведения. Когда продолжительность инфузии
составляет один период полувыведения, то концентрация препарата достигает 50% от
возможной, по истечении двух периодов полувыведения — 75%, после трех
периодов — 87,5%.
После пяти периодов полувыведения концентрация препарата будет составлять
97% от возможной, что уже молено считать равновесным состоянием. В
равновесном состоянии скорость удаления препарата из организма (клиренс) равна
скорости введения препарата (т. е. скорости инфузии). Достижение желаемой (или
целевой) концентрации (Cj) путем постоянной инфузии потребует слишком много
времени, если только период полувыведения препарата не очень короток. Чтобы
это произошло быстрее, необходимо ввести препарат сгруйно в дозе, необходимой
для достижения целевой концентрации, после чего перейти на инфузию со
скоростью, необходимой для поддержания концентрации на требуемом уровне.
Нагрузочная доза для струйного введения равна частному от деления целевой
концентрации на объем распределения (Ст/Vd), в то время как скорость инфузии равна
произведению целевой концентрации и клиренса (Ст х С1). Вообще стратегия
сочетания нагрузочной дозы с последующим переходом на поддерживающую дозу
используется для большого количества лекарственных препаратов.
Трехкамерная модель
До сих пор обсуждение принципов фармакокинетики проходило в рамках
однокамерной модели. В соответствии с этой моделью, препараты вводятся в
единственную камеру, распределяются в ней и элиминируются из нее. Вместе
История и научные основы внутривенной анестезии
19
с тем фармакокинетику большинства препаратов, используемых в анестезии,
целесообразнее описывать с помощью двух- и трехкамерной моделей. В трехка-
мерной модели препарат вводится и элиминируется из «центральной камеры»,
соединенной с двумя «периферическими камерами» (рис. 1.2). Вначале
препарат присутствует только в центральной камере, затем он распределяется в обе
периферические. Периферическая камера, с которой плазма уравновешивается
быстрее, получила логичное название «быстрый периферический объем», иногда
математически обозначаемый как V2 (поскольку Vi — это центральная
камера). Камеру, с которой плазма уравновешивается медленнее, называют
«медленный периферический объем» или V3. Сумма объемов этих камер составляет
объем распределения в равновесном состоянии, Vss (от англ. steady state —
равновесное состояние). Удаление препарата из центральной камеры обозначают
термином «центральный клиренс» (синонимы: метаболический клиренс,
клиренс элиминации). Распределение препарата из центральной камеры в
периферические представляет собой «межкамерный» клиренс (синоним: «клиренс
распределения»). Он подразделяется на «быстрый межкамерный клиренс» и
«медленный межкамерный клиренс».
Медленная
периферическая камера
v3
Центральная
камера
V,
Быстрая
периферическая камера
v2
Межкамерные
клиренсы
Рис. 1.2. Гидравлическая имитация трехкамерной модели. Центральный сосуд
представляет собой центральную камеру (V1, которая быстро уравновешивается (соединительная
трубка большого диаметра) с быстрой периферической камерой (V2) и медленнее
(соединительная трубка малого диаметра) с медленной периферической камерой (V3). Обратите
внимание, что элиминация (центральный клиренс) происходит только из центральной
камеры. Показаны также константы микроскоростей (к) для межкамерных клиренсов
20
Глава 1
Объемы, описываемые трехкамерной моделью, не соответствуют каким-либо
анатомическим областям, а представляют собой математические константы,
выведенные из уравнений, описывающих динамику концентрации препарата
в плазме в зависимости от времени. Центральный объем представляет собой
пространство, в котором препарат изначально растворяется. Сюда относятся кровь и
некоторые другие ткани с очень высоким кровотоком. Центральный клиренс
возможно измерить с определенной степенью точности, поскольку он представляет
собой сумму всех процессов, которые удаляют препарат из организма (т. е.
почечная экскреция, печеночный метаболизм, ферментный метаболизм). На
межкамерные клиренсы влияют кровоток и проницаемость капилляров, но их
можно рассчитать из математических уравнений, описывающих изменения
концентрации в плазме в зависимости от времени. В трехкамерной модели изменение
плазменной концентрации препарата во времени подразделяют на три фазы.
«Фаза быстрого распределения» начинается сразу же после струйного введения
нагрузочной дозы, она обусловлена перемещением препарата из плазмы в быстро
уравновешиваемые ткани. Далее следует «фаза медленною распределения»,
обусловленная перемещением препарата из плазмы в медленно уравновешиваемые
ткани, а также возвратом препарата из наиболее быстро уравновешиваемых
тканей в плазму. «Терминальная фаза» (представляющая собой почти прямую
линию на полулогарифмическом графике) отражает элиминацию препарата из
организма, а также возвращение препарата из обоих объемов распределения в
плазму. Возвращение препарата уменьшает скорость падения его концентрации в
плазме. Хотя терминальную фазу часто называют «фазой элиминации», это не
совсем верно, поскольку элиминация происходит в течение всех трех фаз.
Перемещение препарата между камерами может быть описано с помощью
целого ряда «констант микроскорости», обозначенных как к. Например, 1¾
определяет скорость перехода препарата из камеры 1 в камеру 2, в то время как
lc2i характеризует процесс, протекающий в обратном направлении. Хля
полного описания трехкамерной модели необходимо 5 констант скоростей: одна для
перемещения препарата из центральной камеры в быструю периферическую
камеру, другая аая перемещения в обратном направлении, вторая пара
констант управляет движением между центральной и медленной периферической
камерами, и пятая константа описывает элиминацию (рис. 1.2). Хотя
дифференциальные уравнения на основе данных констант слишком сложны ^ля
практического применения при назначении в/в анестетиков, они могут быть
использованы аля разработки компьютерных программ, которые моделируют
фармакокинетику препаратов или управляют работой устройств,
обеспечивающих относительно постоянную концентрацию препарата в плазме (глава 5).
Трехкамерная модель может быть описана на основе трех периодов
полувыведения, два из которых являются периодами полувыведения в фазах
распределения, а третий является терминальным периодом полувыведения (синоним:
«период полувыведения в фазе элиминации»). В литературе, описывающей тот
или иной лекарственный препарат, часто ссылаются на период полувыведения;
как правило, при этом речь идет о терминальном периоде полувыведения.
Поскольку терминальный период полувыведения относится только к финальной
фазе кривой концентрация-время, то он слабо отражает снижение плазменной
История и научные основы внутривенной анестезии 21
концентрации препарата после струйного введения нагрузочной дозы или при
постоянной инфузии и, следовательно, не позволяет прогнозировать
продолжительность эффекта [4]. Терминальный период полувыведения всегда больше
реального времени, необходимого АА^ снижения концентрации препарата в
плазме на 50% после окончания его введения. Более того, время, в течение которого
концентрация препарата в плазме снизится на 50%, в значительной степени
зависит от длительности предшествующей инфузии препарата, поскольку по
сравнению со струйным введением концентрация препарата в крови после
длительной инфузии снижается медленнее (иногда значительно медленнее).
Прогнозирование снижения концентрации препарата в плазме
Скорость снижения концентрации препарата в плазме (ив мозге) важна,
поскольку она, например, определяет быстроту пробуждения после
прекращения инфузии анестетика. Так как терминальный период полувыведения плохо
отражает скорость снижения концентрации аая препаратов, описываемых с
помощью многокамерной фармакокинетики, а взаимодействия разных
клиренсов, объемов, констант диффузий слишком сложны, то необходим простой
параметр, позволяющий прогнозировать прекращение эффекта в/в анестетиков.
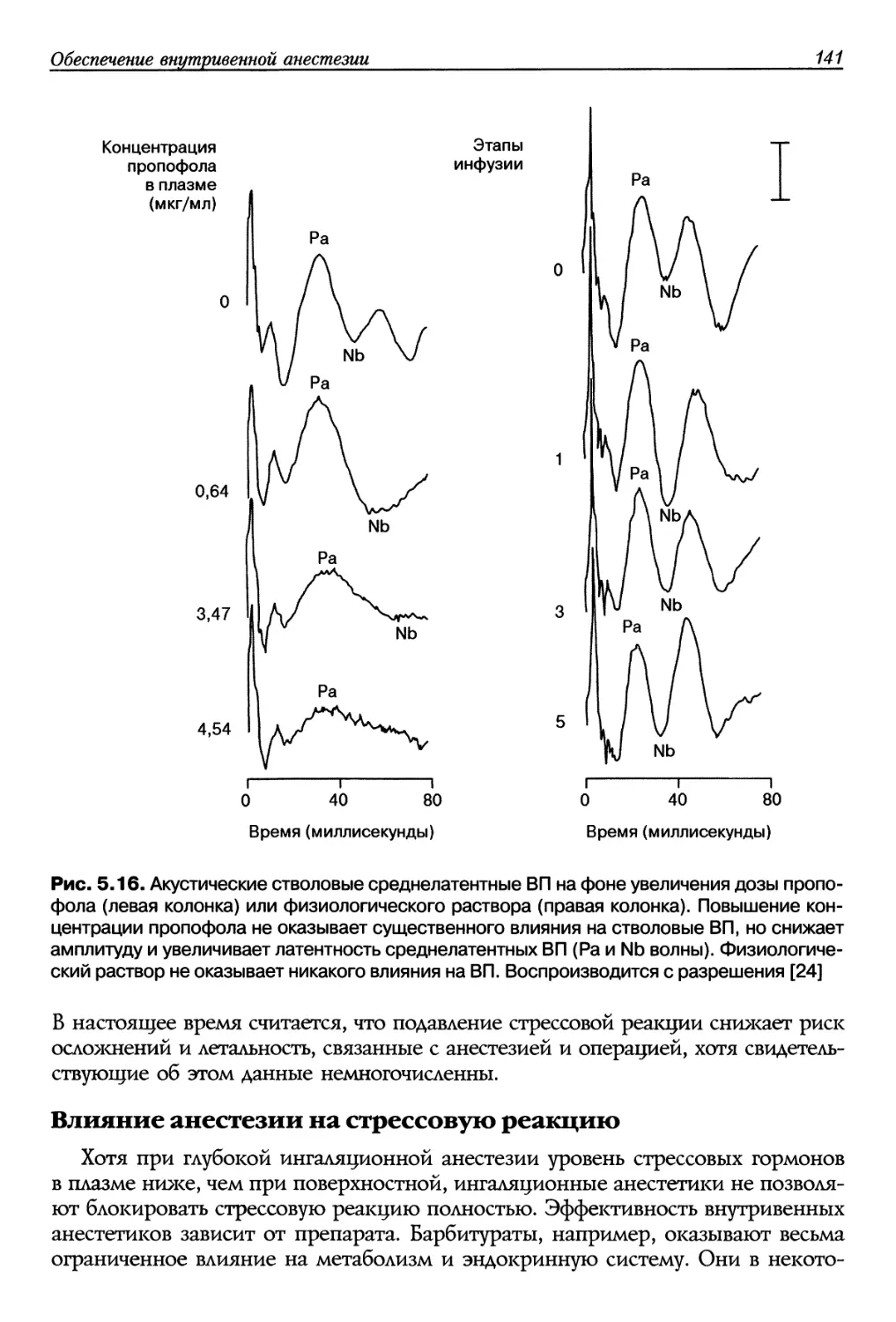
В 1992 году Hughes и соавт. ввели термин «контекст-чувствительный период
полувыведения» [5]. Под «периодом полувыведения» подразумевают время
после прекращения инфузии, необходимое аля снижения концентрации
препарата в плазме на 50%, а «контекст» представляет собой длительность
предшествовавшей инфузии, во время которой поддерживалась равновесная концентрация
препарата. По определению контекст-чувствительный период полувыведения
не является неизменной величиной. Лучше всего этот параметр может быть
представлен в виде кривой зависимости периода полувыведения от
продолжительности инфузии. Для иллюстрации на рис. 1.3 изображены кривые
контекст-чувствительного периода полувыведения опиоидных анальгетиков.
Подход, альтернативный графическому отображению, заключается в перечислении
периодов полувыведения аая струйного введения, а также АА^ инфузии малой,
средней и большой продолжительности.
Основы фармакодинамики
Фармакодинамика рассматривает зависимость между концентрацией
препарата и эффектом. Для большинства лекарственных препаратов эту зависимость
можно отобразить графически в форме сигмовидной кривой (рис. 1.4).
Отметим, что, строго говоря, подразумевается концентрации препарата в месте
воздействия (например, АА^ анестетика это нейроны головного мозга, АА^ миорелак-
санта — нервно-мышечный синапс). Если концентрация равна нулю, то эффект
отсутствует. Концентрацию, вызывающую максимальный эффект, обозначают
как Ещах. Как только Етах достигнута, дальнейшее повышение концентрации не
усиливает эффект (возможно, это обусловлено тем, что все места связывания на
рецепторах заняты). Концентрацию, соответствующую 50% от максимального
эффекта, называют ЕС5о- ЕС50 используют для сравнения мощности препаратов
сходного действия. Для достижения одного и того же эффекта концентрация
слабого препарата должна быть выше, чем более сильного. Необходимо заметить,
22
Глава 1
Продолжительность инфузии (мин)
Рис. 1.3. Время после прекращения инфузии, необходимое для снижения концентрации
препарата в плазме на 50% (контекст-чувствительный период полужизни).
Представлены данные для фентанила, альфентанила, суфентанила и ремифентанила [6]
что мощность отражает зависимость между концентрацией и эффектом, в то
время как на взаимозависимость доза-эффект влияют фармакокинетические
параметры. Мощность — это не синоним эффективности. Мерой эффективности
препарата является Ещах. Увеличив дозу препарата меньшей мощности, можно
достичь такого же Ещ^, как и с помощью более сильного. Напротив, вне
зависимости от своей концентрации препарат с низкой Е,^ всегда менее эффективен, чем
препарат с высокой Ещ^.
Описанная выше зависимость сигмовидной формы позволяет определить
выраженность реакции на препарат у среднего индивидуума. В этом случае наклон
сигмовидной кривой отражает легкость титрования препарата в диапазоне от
нулевого до максимального эффекта (рис. 1.5).
Кроме того, реакцию на некоторые воздействия оценивают по принципу
«все или ничего». Например, при различных хирургических стимулах
(интубация, кожный разрез, швы на кожу) больной либо двигается, либо не двигается.
Вероятность возникновения такой реакции при некоторой концентрации
препарата в плазме тоже описывается зависимостью сигмовидной формы. В этом
случае ЕС50 — это концентрация анестетика, необходимая рф^ подавления
двигательной реакции на различные стимулы у 50% больных. Наклон кривой
указывает на вариабельность реакции на препарат в популяции больных.
Чем круче наклон кривой, тем (а) меньше диапазон между концентрацией,
которая не вызывает никакого эффекта, и концентрацией, которая вызывает
максимальный эффект, или (б) ниже вариабельность реакции на препарат в
популяции больных. Эти взаимоотношения позволяют определить, какая
концентрация соответствует терапевтическому действию, а какая — токсическому
эффекту (т.е. терапевтическую широту). Данная информация помогает подоб-
История и научные основы внутривенной анестезии 23
Логарифм концентрации препарата
Рис. 1.4. Эффект препарата при различных возрастающих дозах. Етах представляет
собой максимально достижимый эффект, а ЕС50 — концентрацию препарата, при которой
развивается эффект, составляющий 50% от Етах
рать начальную концентрацию препарата и определить верхнюю границу
диапазона терапевтической концентрации.
Не менее важным аспектом является диффузия препарата из плазмы к месту
действия. Хотя концентрация препарата в плазме достигает своего пика почти
мгновенно после в/в инъекции, плазма не представляет собой места действия
препарата, а лишь обеспечивает транспорт к нему. Биологическое действие
препарата развивается в «биофазе» (синонимы: «эффекторная камера»,
ткань-мишень, место действия), под которой понимают различные биологические
структуры, в том числе мембраны и рецепторы. Биофаза мала и недоступна для
измерений, поэтому концентрацию препарата в ней определить невозможно.
Если существует метод, позволяющий хотя бы приблизительна дать
количественную оценку эффекту препарата (например, мониторинг нервно-мышечной
проводимости, электроэнцефалография), то можно определить начало и
продолжительность действия препарата, т. е. следовательно, скорость его
поступления в биофазу и элиминации из нее. Может быть определена константа
микроскорости, описывающая перемещение препарата из центральной камеры в
биофазу и обратно. Константу обозначают как 1¾) (хотя логичнее было бы
обозначить ее kei)- Это позволяет включить в состав фармакокинетической модели
эффекторную камеру, что дает возможность точнее описать начало действия
препарата (рис. 1.6). Эффекторная камера настолько мала, что не оказывает
какого-либо влияния на остальные фармакокинетические параметры.
24
Глава 1
Логарифм концентрации препарата
Рис. 1.5. Препараты А и В, характеризующиеся одинаковым максимальным эффектом
(Етах) и одинаковой ЕС50- Наклон кривой концентрация-эффект круче для препарата А, чем
для препарата В. Соответственно, у препарата А меньше диапазон между концентрацией,
которая не вызывает никакого эффекта, и концентрацией, которая вызывает
максимальный эффект (иными словами, уже терапевтическая широта). Следовательно, препарат А
труднее дозировать для достижения желаемого клинического эффекта, чем препарат В
Время, необходимое для достижения пиковой концентрации (и, следовательно,
пикового эффекта) в ткани-мишени после введения препарата в/в струйно,
зависит как от фармакокинетических факторов, так и от 1¾). Если после введения
препарата в/в струйно его концентрация в плазме быстро снижается, то
концентрация препарата в ткани-мишени быстро достигает пикового значения вне
зависимости от величины 1¾. Наоборот, если после введения препарата в/в струйно его
концентрация в плазме снижается медленно, скорость достижения пикового
значения концентрации препарата в ткани-мишени зависит в первую очередь от 1¾).
Константа 1¾) имеет высокое значение для тиопентала, пропофола и альфентанила,
среднее — для фентанила, суфентанила и большинства миорелаксантов, и
низкое — АА^ морфина и кеторолака.
В то время как ткань-мишень уравновешивается с плазмой, концентрация
препарата в плазме продолжает снижаться, в основном за счет
перераспределения препарата. Поскольку препараты диффундируют по градиенту
концентрации, то у медленно уравновешивающегося препарата пиковая концентрация в
ткани-мишени будет ниже, чем у быстро распределяющегося. Поэтому, чтобы
достичь того же пикового эффекта, потребуется более высокая доза медленно
уравновешивающегося препарата, нежели быстро уравновешивающегося. По-
История и научные основы внутривенной анестезии 25_
V3 Эффекторная v, V2
камера
Рис. 1.6. Гидравлическая имитация трехкамерной модели с добавлением эффекторной
камеры. Обратите внимание на малый размер эффекторной камеры и константу
микроскорости (^) описывающую перемещение препарата из центральной камеры в эффекторную и
обратно
вышение дозы влечет за собой увеличение количества препарата, достигающего
периферических тканей, что удлиняет продолжительность действия препарата и
повышает риск побочных эффектов.
В рамках однокамерной модели легко было рассчитать дозу препарата,
необходимую для достижения желаемой концентрации в плазме, используя
следующую формулу: доза = Cj x Vd. В рамках трехкамерной модели с эффекторной
камерой применение этой формулы некорректно, посколысу неизвестно, какой
объем использовать в качестве Vd. Если использовать объем центральной
камеры (Vj), то рассчитанная доза окажется слишком малой, посколысу некоторые
препараты перераспределяются или элиминируются, не успев достигнуть
ткани-мишени. Если применять объем распределения в равновесном состоянии
(Vdss), то доза, наоборот, будет слишком большой, посколысу достижение
равновесного распределения препарата между камерами обычно занимает
несколько часов. Существует другой подход: если известно соотношение между
исходной концентрацией препарата в плазме и концентрацией в момент
пикового эффекта, то возможно рассчитать тот объем, в котором предстоит
распределиться болюсной (т. е. введенной в/в струйно) дозе препарата в момент
достижения пикового эффекта. Этот расчетный объем называют «объем
распределения в момент пикового эффекта» и обозначают Vp^ effect- ^^eak effect носит сугубо
теоретический характер, посколысу разница мелсду начальной концентрацией и
концентрацией в момент пикового эффекта обусловлена процессами
перераспределения и элиминации. Тем не менее, понятие Vpeak effect вполне применимо аая
расчета необходимой болюсной дозы.
Для трехкамерной модели поддержание постоянной концентрации
препарата в плазме в силу сложности процесса не может быть описано простой
формулой О х Ст, справедливой аая однокамерной модели. Для поддержания посто-
26
Глава 1
янной концентрации препарата в ткани-мишени инфузию необходимо начать
сразу же после достижения пикового эффекта. В момент пикового эффекта
исчезает градиент концентрации между плазмой и тканью-мишенью, поэтому,
если поддерживать постоянную концентрацию препарата в плазме, то и в
ткани-мишени концентрация будет постоянной. Для обеспечения постоянной
концентрации необходимо, чтобы при инфузии препарат поступал со
скоростью, покрывающей (а) перемещение препарата из центральной камеры в
быструю периферическую камеру (V2), (б) перемещение препарата из
центральной камеры в медленную периферическую камеру (V3), (в) элиминацию
препарата из организма. Эти расчеты слишком сложны при введении препаратов
вручную или при использовании обычных инфузионных насосов, но с легкостью
могут быть выполнены компьютером. Управляемую компьютером инфузию
препарата можно использовать для достижения относительно постоянной
концентрации препарата в плазме (или в ткани-мишени), а таюке для
увеличения/уменьшения концентрации в ткани-мишени в зависимости от реакции
больного. Недавно в клинической практике начал применяться шприцевой
насос для пропофола, основанный на принципах фармакокинетики (Diprifusor).
Весьма вероятно, что в ближайшие годы появятся подобные насосы,
предназначенные для многих других анестетиков (глава 5).
Заключение
Хотя история анестезиологии насчитывает рке больше 150 лет, многие
значительные открытия были сделаны в последние годы. Большинство
используемых в настоящее время препаратов появилось в течение прошедших 20 лет,
а многие из них и того позже. С расширением нашего понимания зависимости
активности от структуры появилась возможность синтезировать препараты с
заданными свойствами. В этом отношении многого удалось достигнуть для бензо-
диазепинов, опиоидов, миорелаксантов. По мере того, как появляется все
больше информации о механизмах действия в/в гипнотиков, молено ожидать
появления новых препаратов этого класса.
Углубленное понимание принципов фармакокинетики позволило точнее
предсказывать концентрацию препарата в плазме (и соответствующий клинический
эффект) после его в/в введения. Дополнительная информация дала возможность
детальнее относиться к выбору препарата, а таюке использовать препараты более
рационально, чтобы быстро достигнуть требуемою эффекта и поддерживать его
на выбранном уровне так долго, как это будет необходимо. Оптимизация
введения лекарственного препарата позволяет избежать передозировки, уменьшая
риск побочных эффектов и обеспечивая максимально быстрое прекращение
действия препарата по окончании его введения. Понимание важности фармакоки-
нетических параметров дает возможность более точно предсказывать поведение
новых препаратов в различных обстоятельствах.
Следует помнить, что фармакокинетические параметры, на основе которых
рассчитывают болюсную дозу и скорость инфузии препарата, были определены
у здоровых взрослых индивидуумов среднего веса и телосложения.
Значительные отклонения от этих усредненных антропометрических факторов, а также
История и научные основы внутривенной анестезии
27
сопутствующие заболевания влияют на фармакокинетику и фармакодинамику
препарата. Соответственно, при дозировании препарата необходимо учитывать
индивидуальные особенности. Пока еще невозмолаю математически учитывать
варианты нормы и патологии, что позволило бы использовать
модифицированные формулы. Оптимального эффекта удается достичь, наблюдая за
клиническим эффектом (и побочными эффектами) и соответствующим образом
корректируя дозу.
В настоящее время аая введения в/в анестетиков начинают применяться
компьютерные программы, разработанные на основе фармакокинетических данных.
Эти новые приборы представляются перспективными. К сегодняшнему дню
достигнут большой прогресс, но еще многое предстоит сделать.
Список литературы
1. White PF, ed. Intravenous anesthesia. Baltimore: Williams and Wilkins, 1997.
2. Kissin I, Wright AG. The introduction of hedonal: a Russian contribution to intravenous
anesthesia. Anesthesiology 1988;69:242-245.
3.Halford FJ. A critique of intravenous anesthesia in war surgery. Anesthesiology 1943;4:67-69.
4. Shafer SL, Varvel JR. Pharmacokinetics, pharmacodynamics, and rational opioid selection.
Anesthesiology 1991;74:53-63.
5. Hughes MA, Glass PSA, Jacobs JR. Context-sensitive half-time in multicompartment
pharmacokinetic models for intravenous anesthetic drugs. Anesthesiology 1992; 76:334-341.
6. Egan TD, Lemmens HJM, Fiset P, et al. The pharmacokinetics of the new short-acting opioid re-
mifentanil (G187084B) in healthy adult male volunteers. Anesthesiology 1993;79:881-892.
Глава 2
Методики внутривенной анестезии
Введение
В 1990 г. Мэллон и Эделист [1] предсказывали: «Нет сомнения в том, что
время тотальной внутривенной анестезии (ТВВА) наступило...». К сожалению,
сейчас, одиннадцать лет спустя, аая большинства анестезиологов это время все еще
не пришло. Хотя ТВВА приобрела популярность в кардио- и нейрохирургии,
чаще всего общую анестезию проводят, сочетая в/в анестетики с
ингаляционными. В этой главе будет описано применение в/в анестетиков в рамках
различных методик общей анестезии.
Сбалансированная анестезия
На заре развития анестезиологии большинству больных проводили
анестезию одним препаратом (например, эфиром, закисью азота или хлороформом).
Для поверхностных хирургических вмешательств было достаточно относительно
небольшой дозы анестетика, но если требовалась мощная анальгезия или
глубокая миорелаксация, то /^ая достижения эффективной «глубокой» анестезии
приходилось применять высокую дозу препарата. В современной клинической
практике существует иной подход: одновременно вводят несколько препаратов
различного действия, что позволяет относительно независимо друг от друга
управлять такими компонентами анестезии как устранение сознания,
анальгезия, миорелаксация и стабильность вегетативной нервной системы. Если этой
цели достигают сочетанием внутривенных и ингаляционных анестетиков, то
методику называют «сбалансированной анестезией».
Возможно, впервые концепция сочетания различных препаратов была
предложена Джорджем Вашингтоном Крайлом из Кливленда (штат Огайо, США),
который пропагандировал сочетание поверхностной общей анестезии
(позволяющей блокировать только лишь слуховые, зрительные и обонятельные
стимулы), с местной анестезией, предотвращающей боль. Термин «сбалансированная
анестезия» впервые был использован Джоном Ланди в 1926 г. Под ним
подразумевали применение нескольких препаратов в малых дозах, что позволяло
избежать побочных эффектов, обусловленных высокой дозой одного анестетика.
Эта методика была безопаснее а^я больного и более управляема, чем
моноанестезия. С целью выключения сознания и анальгезии Ланди в рамках своей
«сбалансированной» методики сочетал премедикацию, регионарную и общую
анестезию. Обеспечение анестезии с помощью нескольких препаратов может быть
безопаснее, чем применение одного или двух. Безопасность сбалансированного
Методики внутривенной анестезии 29
подхода была доказана при анализе 100 000 анестезий, который показал, что
в случаях применения одного или двух препаратов для анестезии
относительный риск летального исхода в течение семи дней после операции в 2,9 раза
выше, чем при использовании трех и более препаратов [2].
Когда тиопентал только появился в клинической практике, его применяли в
качестве единственного анестетика. К 1938 г. его начали сочетать с закисью
азота, что позволило уменьшить дозу барбитурата и улучшить качество анестезии.
Благодаря уменьшению дозы барбитурата пробуждение больного после
применения сбалансированной методики было значительно быстрее, чем после
моноанестезии тиопенталом в отсутствии закиси азота. И по сей день закись азота
применяется в качестве анальгетического компонента большинства методик
анестезии, вне зависимости от того, является ли основной анестетик
внутривенным или ингаляционным.
Методика сбалансированной анестезии значительно усовершенствовалась,
когда в 1942 г. Гриффит и Джонсон начали применять в клинике миорелаксант
кураре [3]. Благодаря этому анестезиологи смогли добиться адекватной миоре-
даксации без использования больших доз общих анестетиков. В 1952 г. Грейс и
Рис предложили концепцию «анестезиологической триады». Под этим они
понимали три основных компонента анестезии — наркоз (устранение сознания),
анальгезию и миорелаксацию [4]. В 1957 г. Вудбридж добавил четвертый
необходимый компонент — блокаду вегетативных рефлексов, превратив триаду в
тетраду [5]. Анальгезия, обеспечиваемая закисью азота, чаще всего оказывалась
недостаточно сильна аая надежной блокады симпатической стимуляции во
время операции. Поэтому аая того, чтобы полноценно обеспечить анальгетический
компонент «сбалансированной анестезии», к сочетанию тиопентала, d-тубоку-
рарина и закиси азота был добавлен опиоид петидин (синоним: меперидин).
Впоследствии были синтезированы и внедрены в методику сбалансированной
анестезии многие наркотические анальгетики, препараты гипнотического
действия и миорелаксанты. Были разработаны вспомогательные препараты,
предназначенные аая управления вегетативными реакциями, возникшими в ходе
операции. Несмотря на усовершенствование каждого компонента тетрады
анестезии, наиболее эффективным остался именно сбалансированный подход.
Например, после появления мощных наркотических анальгетиков (фентанил, су-
фентанил, и альфентанил) было предложено проводить анестезию в
кардиохирургии высокими дозами опиоидов в сочетании с кислородом и миорелаксанта-
ли. Этот вариант моноанестезии оказался сопряжен с высокой частотой таких
осложнений, как ригидность грудной клетки, интраоперационное
восстановление сознание и длительная послеоперационная депрессия дыхания, требующая
продленной ИВЛ в отделении интенсивной терапии. Хотя у больных в
критическом состоянии для анестезии все еще применяют умеренно высокие дозы
опиоидов с целью стабилизации гемодинамики, более сбалансированный
подход обеспечивает отличные интраоперационные условия и обеспечивает
быстрое пробуждение.
30
Глава 2
Нейролептанестезия и диссоциативная анестезия
Нейролептанестезия возникла в противовес применению тиопентала,
сопряженному с высоким риском летального исхода у больных с тяжелой гиповоле-
мией, для которых доза анестетика была неадекватно высока. Хирург
французского военного флота Анри Лабори наблюдал у своих больных после операции
состояние, описанное им как «постагрессивная болезнь». Оценив это состояние
как ответную реакцию на стресс, он попробовал ослабить его применением
препарата фенергана, чтобы уменьшить симпатическую гиперактивность «ней-
ровегетативной» системы. Фенерган обладает антиадренергическим, антигиста-
минным и противорвотным действием, но не обеспечивает ни выключения
сознания, ни анальгезии. Для обеспечения анальгезии к фенергану добавили пети-
дин (меперидин), ^ая выключения сознания — нейролептик хлорпромазин.
Получившуюся смесь препаратов Лабори назвал «литическим коктейлем».
Со времени появления первой прописи литического коктейля были
разработаны и применяются в клинике в различных сочетаниях многие нейролептики
(производные фенотиазина, бутирофеноны, бензамиды и тиоксантены). Хотя в
начале внедрения нейролептиков в практику анестезиологии отмечались
серьезные осложнения в результате неправильного употребления или ошибок в
дозировании, в течение первых десяти лет применения они не были причиной ни
одной смерти, что резко контрастировало с достаточно высокой частотой
летальных исходов при ингаляционной анестезии того времени. В дальнейшем
исходная методика нейролептанестезии была дополнена гипотермией &ая
обеспечения «искусственной гибернации», которая благодаря снижению температуры
тела и метаболизма обеспечивала некоторую клеточную защиту. Ранние
достижения кардиоторакальной хирургии и нейрохирургии были во многом
обусловлены именно этими методиками.
Петидин, входящий в состав первой прописи литического коктейля, не
обладал мощным анальгетическим действием. Когда был синтезирован фентанил,
имевший значительно более высокую анальгетическую мощность и большую
терапевтическую широту, его стали сочетать с нейролептиками галоперидолом
или дроперидолом, назвав эту методику «нейролептанальгезией» (НЛА). Под
маркой Инновар (Innovar) в клинической практике начали применять
препарат, в 1 мл которого содержалось 50 мкг фентанила и 2,5 мг дроперидола.
Добавление диазепама к Инновару во время индукции анестезии позволило
снизить дозу последнего и обеспечить стабильность гемодинамики. Эта методика
известна под названием нейролептанестезии.
Нейролептические препараты (нейролептики)
Состояние нейролепсии впервые наблюдали после назначения галоперидола.
Этот синдром подразумевает подавление всего разнообразия вегетативных,
психических и двигательных функций. Нейролептики в умеренных дозах предотвращают
рвоту, в то время как более высокие дозы вызывают каталепсию. Хотя по
сравнению со многими другими нейролептиками дроперидол обладает менее
выраженными побочными эффектами, тем не менее и он может вызывать дискинезию,
беспокойство, гиперактивность, озноб и дрожь, дисфорию с внутренней тревогой,
Методики внутривенной анестезии
31
галлюцинации и нарушение схемы тела. Применение других бутирофенонов
сопряжено с еще более высоким риском этих побочных эффектов. Фенотиазины
вызывают ортосгатическую гипотонию, гипотермию и симпатолитическое действие. Сейчас
нейролептанальгезия и нейролептанесгезия утратили былую популярность в первую
очередь из-за этих частых и неприятных для больного побочных эффектов.
Фармакокинетика
Продолжительность действия дроперидола составляет 3—6 ч, период
полувыведения около 100 мин, общий клиренс 14 мл/кг/мин, достоверный объем
распределения 2 л/кг. Дроперидол хорошо растворяется в жирах и поэтому
интенсивно поглощается различными тканями организма. По сравнению с фентани-
аом действие дроперидола развивается медленнее и продолжается дольше.
Следовательно, фентанил и дроперидол целесообразнее примененять раздельно, а
не использовать в фиксированном сочетании, как в Инноваре. В идеале сначала
следует назначить нагрузочную дозу дроперидола, после чего вводить
фентанил — либо дробными дозами по 25—50 мкг, либо в виде постоянной инфузии.
Вместо фентанила можно использовать какой-либо новый синтетический опио-
ид (например, альфентанил, суфентанил, ремифентанил).
Практические аспекты
Традиционная нейролептанальгезия сочетанием фентанил-дроперидол (Инно-
вар) все еще применяется во многих странах мира. Тем не менее в США,
Великобритании, других странах Западной Европы эта методика стала менее
распространенной. Причиной этого является фиксированное соотношение фентанила и
дроперидола в Инноваре. Дисфория, развивающаяся в результате применения
смеси, имеет двоякое действие: с одной стороны, она препятствует нелегальному
применению наркотического анальгетика, с другой — представляет
значительный недостаток /^я больных. Относительный избыток дроперидола в рамках
этой фиксированной комбинации приводит ко многим побочным гемодинамиче-
ским и психологическим эффектам.
НЛА все еще используют немногочисленные энтузиасты, причем не с
помощью Инновара, а применяя фентанил и дроперидол по отдельности (например,
в Университете Техасского Юго-Западного Медицинского Центра в Далласе).
Вместе с тем следует признать, что эта методика почти совершенно вытеснена
новыми в/в и ингаляционными анестетиками. Дроперидол продолжают
достаточно часто применять в малых дозах (1,25 мг) для профилактики
послеоперационной тошноты и рвоты (ПОТР), но даже столь низкие дозы могут вызвать
послеоперационную дисфорию [6]. Сторонники НЛА утверждают, что ее
основным преимуществом является отсутствие ПОТР, и поэтому НЛА наиболее
показана при тех операциях, после которых это осложнение особенно
нежелательно (глазная хирургия, ЛОР-хирургия). Этот аргумент в значительной
степени утратил свой вес после появления пропофола с его выраженными противо-
рвотными свойствами, а также в связи с повышением популярности неопиоид-
ных анальгетиков (нестероидные противовоспалительные препараты, местные
анестетики). Кроме того, в тех случаях, когда необходима профилактика ПОТР,
32
Глава 2
наиболее эффективны антагонисты 5НТз-рецепторов, не вызывающие
серьезных побочных эффектов. Кардиоанестезиологи ценят НЛА за быструю
индукцию анестезии на фоне стабильной гемодинамики, умеренную альфа-адренер-
гическую блокаду, хорошую периоперационную анальгезию и минимальное
подавление рефлексов с дыхательных путей. В свое время НЛА значительно
снизила частоту артериальной гипо- и гипертонии по сравнению с употреблявшейся
до того методикой тиопентал-галотан-закись азота и явилась значительным
прогрессом в кардиоанестезиологии. В настоящее время методика практически
полностью вытеснена сочетанием средних или высоких доз опиоидов с пропо-
фолом (или даже с низкими дозами новых ингаляционных анестетиков).
Кетамин вызывает необычную форму каталепсии, называемую
«диссоциативной анестезией». Из-за побочных эффектов кетамин (глава 3) очень скоро
стали сочетать с диазепамом (так называемая атаральгезия). Сочетание кетами-
на и бензодиазепинов использовали также в кардиоанестезиологии, где оно
обеспечивало гемодинамические условия как минимум не хуже тех, которые
достигались применением других доступных в то время анестетиков.
Тотальная внутривенная анестезия (ТВВА)
Как следует из названия, тотальная внутривенная анестезия подразумевает
использование аая индукции и поддержания анестезии только в/в препаратов.
Каждый компонент анестезии (выключение сознания, анальгезия, амнезия,
стабильность вегетативной нервной системы, миорелаксация) обеспечивается и
управляется селективно действующим в/в препаратом. От сбалансированной
анестезии ТВВА отличается тем, что не предполагает применения закиси азота.
ТВВА, как и сбалансированная анестезия, свободна от осложнений,
обусловленных ингаляционными анестетиками (таблица 2.1). Кроме того, ТВВА
целесообразно применять при тех сопутствующих заболеваниях и операциях, при
которых закись азота противопоказана или ее использование затруднено.
Отсутствие закиси азота позволяет назначить более высокую фракционную
концентрацию кислорода в дыхательной смеси (Fi02), что особенно ценно при одно-
легочной ИВА, а также у больных с высоким риском гипоксемии и ишемии.
Существуют и другие клинические ситуации (например, бронхоскопия,
высокочастотная ИВА), когда ТВВА, позволяя проводить вентиляцию кислородом
или воздушно-кислородной смесью, помогает обеспечить адекватную оксигена-
цию. ТВВА позволяет снизить частоту ПОТР — в первую очередь за счет
отсутствия закиси азота. С другой стороны, отсутствие закиси азота необходимо
компенсировать другими препаратами, обычно наркотическими анальгетиками,
которые сами индуцируют ПОТР. По сравнению со сбалансированной
методикой, при ТВВА требуются более высокие дозы в/в гипнотических препаратов,
что может замедлять пробркдение, если только не применять препараты
ультракороткого действия и тщательно не корректировать их дозу. Необходимость
увеличения доз в/в препаратов увеличивает прямые расходы на ТВВА, но они
компенсируются за счет ускорения пробуждения, укорочения пребывания в
послеоперационной палате, а также уменьшения затрат на лечение ПОТР и
прочих побочных эффектов.
Методики внутривенной анестезии 33
Таблица 2.1. Осложнения, сопряженные с применением
ингаляционных анестетиков
Сердечно-сосудистая система
Угнетение кровообращения (энфлюран>изофлюран>галотан)
Стимуляция кровообращения (десфлюран)
Синдром обкрадывания коронарного кровотока (изофлюран; клиническая значимость
синдрома не определена)
ЦНС
Дилатация сосудов головного мозга
Провокация судорожных припадков (энфлюран)
Система дыхания
Раздражение дыхательных путей (десфлюран>изофлюран>энфлюран)
Устранение гипоксической легочной вазоконстрикции
Токсическое действие
Гепатотоксичность ( галотан> энфлюран> изофлюран> десфлюран)
Нефротоксичность (метоксифлюран; возможно, энфлюран)
Злокачественная гипертермия
Загрязнение воздуха операционной
Адекватная анестезия недостижима без правильного режима доставки
анестетика в кровоток, что детально будет обсуждено ниже (глава 5). Если
анестетик вводят дробными дозами в/в струйно через определенные промежутки
времени, то кривая концентрации препарата в плазме выглядит как чередование
пиков и провалов. Пики проявляются чрезмерной глубиной анестезии и
побочными эффектами анестетика, провалы — слишком поверхностной анестезией,
сопряженной с риском восстановления сознания. Если анестетик вводить
слишком часто, то он может кумулировать, что замедляет пробуждение. Более
точного управления глубиной анестезии можно достичь постоянной инфузией
короткодействующего препарата [7]. Используются достаточно сложные режимы
в/в введения препарата. Например, вначале вводят нагрузочную дозу препарата
(струйно или в виде инфузии), чтобы быстро достичь адекватной концентрации
препарата в крови. После введения нагрузочной дозы переходят на
поддерживающую инфузию, скорость которой постепенно уменьшают до достижения
определенного уровня. Такой режим введения, компенсируя
перераспределение, позволяет обеспечить эффективную концентрацию препарата в месте его
действия. Помимо особенностей режима введения, обусловленных фармакоки-
нетическими свойствами препарата, необходимо регулировать скорость
инфузии в зависимости от интенсивности хирургической стимуляции.
5 Тотальная внутривенная анестезия
34
Глава 2
Таблица 2.2. Осложнения, сопряженные с применением
закиси азота
Сердечно-сосудистая система
Угнетение кровообращения
Желудочно-кишечный тракт
Возможное увеличение риска послеоперационной тошноты и рвоты
Феномены, обусловленные высокой растворимостью закиси азота
Увеличение объема воздушного эмбола (включая микроэмболы после искусственного
кровообращения )
Повышение давления в полости среднего уха при отологических вмешательствах
Усугубление вздутия кишечника при кишечной непроходимости и длительных
операциях на кишечнике
Усугубление пневмоцефалии после нейрохирургических операций
Токсическое действие
Диффузионная гипоксия
Дисфункция костного мозга при длительном воздействии
Возможны аномалии плода при вдыхании следовых количеств (актуально для
женского персонала операционных)
Прочее
Поддержка горения (актуально, например, при лазерной хирургии дыхательных
путей)
Невозможность назначения дыхательной смеси с высоким содержанием кислорода
Проблемы снабжения (например, в местности с жарким климатом, в полевых
условиях)
При ТВВА необходимо вводить два препарата — гипнотик и анальгетик,
поэтому существует много стратегий инфузии. Например, аая большинства
операций целесообразно скорость инфузии гипнотика поддерживать на постоянном
уровне, а анальгетика —изменять в зависимости от интенсивности
хирургической стимуляции и реакции больного. Альтернативная методика предполагает
постоянную скорость инфузии анальгетика и меняющуюся — гипнотика.
Наконец, можно изменять скорость инфузии обоих препаратов независимо друг
от друга.
Некоторые специалисты предпочитают установить постоянную инфузию
опиоида на уровне, обеспечивающем адекватную анальгетическую
концентрацию в месте действия, в то время как скорость инфузии гипнотика изменять по
необходимости. Но интенсивность ноцицептивной (хирургической)
стимуляции изменяется во времени, поэтому инфузия анальгетика в дозе, эффективно
подавляющей наиболее интенсивное болевое раздражение, может привести
Методики внутривенной анестезии 35_
к относительной передозировке опиоида и замедлить восстановление
самостоятельного дыхания в конце операции. В отличие от анальгезии, необходимый
уровень угнетения сознания в ходе операции не изменяется, поэтому периоды
«неадекватной анестезии» лучше всего устранять увеличением концентрации
анальгетика в плазме. Монк и соавт. [8], исследовавшие ТВВА альфента-
нил-пропофол, обнаружили, что острый подъем АД значительно быстрее
устраняется увеличением скорости инфузии альфентанила (в течение 6 мин), нежели
пропофола (в течение 10 мин). Режим введения, когда скорость инфузии гип-
нотика постоянна, а анальгетика —изменяется, обеспечивает наиболее быстрое
пробуждение больного по окончании операции [8]. При решении вопроса о
стратегии инфузии следует принимать во внимание фармакокинетику
препаратов. Логично изменять скорость инфузии препарата с более быстрым началом и
короткой продолжительностью действия, в то время как препарат более
длительного действия следует вводить с постоянной скоростью, обеспечивающей
равновесную концентрацию, чуть превышающую минимально эффективный
уровень. Появление ремифентанила, ультракороткий контекст-чувствительный
период полувыведения которого составляет 3 мин, значительно облегчит
управление анальгетическим компонентом ТВВА.
Иногда применяют подход, когда изменяется скорость инфузии обоих
препаратов. В этом случае скорость введения опиоида следует изменять в
зависимости от симпатической активности и/или предполагаемой интенсивности
хирургической стимуляции, а скорость инфузии гипнотика — в зависимости от
двигательной реакции больного или появления других симптомов неадекватности
анестезии. Применение больших доз миорелаксантов маскирует эти симптомы,
делая такой подход малопродуктивным. Сообщалось о случаях
непреднамеренного интраоперационного восстановления сознания на фоне ТВВА, что может быть
одной из причин недостаточно быстрого роста популярности этой методики.
В настоящее время не существует общепринятого и достоверного метода
мониторинга «глубины анестезии». Анестезиолог вынужден полагаться на
клинические симптомы адекватности анестезии, наиболее информативными из которых
считаются изменения мышечного тонуса и характера дыхания [9]. Миорелак-
санты и принудительная ИВА устраняют эти симптомы, что делает
необходимым поиск иных критериев. При использовании в/в анестетиков изменения
АД являются менее достоверным показателем глубины анестезии, чем при
ингаляционной анестезии [10]. Активность вегетативной нервной системы
оказывается неинформативной при использовании опиоидов и адреноблокаторов.
Более того, многие применяемые во время анестезии препараты, независимо от
механизма действия, изменяют активность вегетативной системы.
Для предотвращения интраоперационного восстановления сознания
необходимо назначать опиоиды в дозе, соответствующей уровню ноцицептивной
стимуляции, и поддерживать адекватную концентрацию гипнотика в крови. Риск
пробуждения наиболее высок, когда концентрации анальгетика и гипнотика
изменяются в широких пределах. К сожалению, аая большинства в/в анестетиков
неизвестна взаимозависимость между дозой и эффектом (где критерием
эффекта является сознание/отсутствие сознания). Вместе с тем определено, что
концентрация пропофола в плазме от 3,3 до 5,4 мкг/мл обеспечивает амнезию.
36
Глава 2
Если появились признаки поверхностной анестезии, ее можно быстро углубить
струйным введением пропофола. До того момента, когда интраоперационное
восстановление сознания достигнет уровня, достаточного для сохранения
воспоминаний о происходящем в операционной, обычно требуется несколько минут
неадекватной анестезии. Этого времени вполне достаточно, чтобы бдительный
анестезиолог углубил анестезию, предотвратив нежелательные а^я больного
(и себя самого) воспоминания. Кроме того, с целью индукции амнезии можно
использовать бензодиазепины, которые нарушают эксплицитную и
имплицитную память [11].
Фармакодинамика препаратов, применяемых при ТВВА
ЦНС
За исключением кетамина, все в/в анестетики вызывают вазоконстрикцию
сосудов головного мозга. В/в гипнотики угнетают метаболизм мозга, не оказывают
значительного влияния на ауторегуляцию мозгового кровообращения и реакцию
сосудов головного мозга на 0(¾. В результате этого в/в гипнотики снижают
внутричерепное давление или, по крайней мере, не изменяют его, уменьшают
выраженность отека мозга, обеспечивают хорошие условия для манипуляций
нейрохирурга. ТВВА обеспечивает высокое соотношение доставки кислорода к его
потреблению, что особенно важно при черепно-мозговой травме и ишемии мозга.
Сердечно-сосудистая система
ТВВА обеспечивает оптимальное управление гемодинамикой. Вместе с тем,
отдельные препараты /^ая ТВВА оказывают специфическое дозозависимое
действие на кровообращение. Взаимодействие этих препаратов может привести
к аддитивному и синергистическому эффекту. Из в/в анестетиков слабее всех
угнетают кровообращение этомидат и опиоиды. Бензодиазепины вызывают
незначительное уменьшение общего периферического сосудистого сопротивления
(ОПСС). Барбитураты вызывают существенное снижение АД, ударного объема
и ОПСС. Пропофол угнетает кровообращение даже сильнее, чем барбитураты,
из-за сочетания вазодилатации с отрицательным инотропным эффектом.
Несмотря на столь очевидное неблагоприятное влияние на кровообращение, ТВВА
обеспечивает лучшее соотношение доставки кислорода к его потреблению
в миокарде, чем ингаляционные анестетики, благодаря чему ТВВА сопряжена
с меньшим риском ишемии миокарда и является методикой выбора у больных
с ИБС и артериальной гипертонией.
Дыхание
Большинство в/в анестетиков вызывает дозозависимые изменения дыхательного
объема, частоты дыхания и минутного объема дыхания. В отличие от ингаляционных
анестетиков, некоторые в/в анальгетики и гипнотики подавляют легочную гипокси-
ческую вазоконстрикцию — компенсаторную реакцию, оптимизирующую
газообмен при нарушении вентиляционно-перфузионных отношений. Особенно
эффективна ТВВА при необходимости подачи смеси с высокой FiOj (одно-легочная ИВА,
тяжелые заболевания легких) или при технической невозможности подачи
ингаляционных анестетиков и закиси азота (высокочастотная ИВА).
Методики внутривенной анестезии 37
Прочие органы
На фоне действия в/в анестетиков печеночный и почечный кровоток
сохраняется на адекватном уровне. Не существует доказательств гепатотоксичности и
нефротоксичности в/в анестетиков. Отметим, что многие ингаляционные
анестетики гепатотоксичны (га/ютан, энфлюран, изофлюран и десфлюран) и неф-
ротоксичны (метоксифлюран и, возможно, энфлюран). Ни один из в/в
анестетиков не вызывает злокачественную гипертермию. Некоторые в/в анестетики
можно безопасно применять при порфирии.
Заключение
В широком смысле термин «сбалансированная анестезия» означает
применение различных препаратов для обеспечения каждого компонента
анестезиологической тетрады. В этом контексте термин включает в себя и методики на
основе нейролептиков, и ТВВА. В более узком и наиболее распространенном
смысле под сбалансированной анестезией понимают сочетание в/в анестетиков
с закисью азота, в то время как ТВВА исключает применение закиси азота.
Современные концепции сбалансированной анестезии и ТВВА происходят
из ранних вариантов НЛА. В начале своего клинического применения НЛА
представляла собой значительный шаг вперед по сравнению с другими
методиками анестезии. Вместе с тем, нейролептанестезия и диссоциативная анестезия
всегда сочетались с высокой частотой периоперационных побочных эффектов.
В свое время эти побочные эффекты были более чем приемлемой альтернативой
в сравнении с высокой летальностью, сопряженной с предшествующей
методикой — моноанестезией барбитуратами. Прогресс не стоит на месте, и по мере
разработки новых анестетиков и методов их доставки, а также в связи с
увеличением запросов больных именно побочные эффекты стали причиной резкого
снижения популярности НЛА.
Дроперидол все еще занимает свое место в профилактике ПОТР, но
применяется в значительно меньших дозах, чем при НЛА. Даже низкие дозы дропе-
ридола сопряжены с риском побочных эффектов, поэтому его начинают вытеснять
новые противорвотные препараты. Появление кетамина и диссоциативной
анестезии добавило еще один модифицированный вариант НЛА, который в
развитых странах изредка применяется по сей день. Использование кетамина, тем не
менее, сводится к нескольким неординарным ситуациям, в которых
уникальные свойства этого препарата обеспечивают ему преимущества перед другими
доступными методиками. В тех странах, где труднодоступны современные
анестетики или не хватает квалифицированных анестезиологов, НЛА (и особенно
диссоциативная анестезия), несмотря на побочные эффекты, может все еще
играть большую роль в силу своей относительной безопасности ^ая жизни
больного.
ТВВА позволяет избежать целого ряда осложнений, обусловленных
применением ингаляционных анестетиков и закиси азота. Используя препараты
селективного действия, ТВВА обеспечивает все компоненты анестезии. В отличие от
ингаляционной анестезии, ТВВА не создает никаких препятствий для оксигена-
ции и удаления СС>2, что может быть важным при многих обстоятельствах (на-
38
Глава 2
пример, однолегочная ИВЛ, высокочастотная ИВЛ, бронхоскопия, тяжелые
сопутствующие заболевания легких). Как правило, в/в анестетики действуют
более селективно, чем ингаляционные, поэтому компонентами анестезии
(угнетение сознания, анальгезия, миорелаксация и стабильность вегетативной нервной
системы) можно управлять по отдельности в зависимости от реакции больного,
что снижает риск побочных эффектов. Необходимость одновременного
применения нескольких препаратов дает толчок к исследованию
межлекарственных взаимодействий. Чтобы анестезия была безопасной, нужно изучать
поведение препаратов при изолированном назначении и в сочетании друг с другом.
Поскольку продолжительность действия в/в анестетиков зависит от
перераспределения и метаболизма, для оптимального выбора препарата и режима
дозирования необходимо глубоко разбираться в принципах фармакокинетики.
Фармакокинетические модели оказались чрезвычайно полезными мя
понимания того, как снижается концентрация препарата в плазме после инфузии
различной продолжительности. Прогресс в области фармакологии привел к
появлению препаратов со значительно укороченной продолжительностью действия
(например, ремифентанил), что значительно облегчает подбор дозы,
необходимой аля достижения желаемого эффекта, а также уменьшает риск продленного
действия в послеоперационном периоде. Предполагают, что в будущем
появятся в/в анестетики и анальгетики еще более селективного и короткого действия,
в результате чего популярность ТВВА возрастет.
Список литературы
l.MallonJS, Edelist G. Total intravenous anesthesia (editorial). Can] Anaesth 1990; 37:279-281.
2. Cohen MM, Duncan PG, Tate RB. Does anesthesia contribute to operative mortality? JAMA
1988;260:2859-2863.
3. Griffith HR, Johnson GE. The use of curare in general anesthesia. Anesthesiology 1942;3:418-420.
4. Gray TC, Rees GJ. The role of apnoea in general anesthesia. Br ] Anaesth 1952; 2:891-892.
5.Woodbridge PD. Changing concepts concerning depth of anesthesia. Anesthesiology 1957; 18:
536-550.
6. Melnick B, Sawyer R, Karambelkar D, Phitayakprn P, Uy NT. Delayed side effects of droperidol
after general anesthesia. Anesth Analg 1989;69:748-751.
7. White PF. Clinical uses of intravenous anesthetic and analgesic infusions. Anesth Analg
1989;68:161-171.
8. Monk TG, Ding Y, White PF. Total intravenous anesthesia: Effects of opioid versus hypnotic
supplementation on autonomic responses and recovery. Anesth Analg 1992; 75:798-804.
9. Chang T, Dworsky WA, White PF. Continuous electromyography for monitoring depth of anest-
hesia.JAnesth Analg 1988;67:521-525.
10. White PF, Boyle WA. Relationship between hemodynamic and electroencephalographic changes
during general anesthesia. Anesth Analg 1989;68:177-181.
11. De Roode A, Jelicic M, Bonke B, Bovill JG. The effect of midazolam premedication on implicit
memory activation during alfentanil-nitrous oxide anaesthesia. Anaesthesia 1995;50:191-194.
Глава 3
Фармакокинетика
и фармакодинамика препаратов,
применяемых при тотальной
внутривенной анестезии
Введение
Появление быстро- и короткодействующих в/в анестетиков, анальгетиков и
миорелаксантов значительно облегчило проведение внутривенной анестезии.
В будущем возможности внутривенной анестезии возрастут благодаря
появлению еще более управляемых и селективно действующих препаратов. В этой
главе рассматривается фармакокинетика и фармакодинамика используемых при
внутривенной анестезии препаратов седативно-гипнотического действия, опио-
идных и неопиоидных анальгетиков, миорелаксантов и вспомогательных
лекарственных средств.
Препараты седативно-гипнотического действия
Пропофол
В клинике пропофол начали использовать с конца 1980-х гг. С тех пор он
стал наиболее распространенным гипнотическим компонентом внутривенной
анестезии. Вначале пропофол применяли лишь в амбулаторной анестезиологии,
но сейчас его часто используют в кардио- и нейрохирургии, при анестезии у
детей, аая седации при сохраненном сознании и седации в отделении
интенсивной терапии. Пропофол обеспечивает гладкую и быструю индукцию анестезии,
не сопровождающуюся тяжелыми побочными явлениями. Продолжительность
действия препарата настолько мала, что позволяет быстро пробудить больного
сразу по окончании операции, а также облегчает управление глубиной
анестезии в период поддержания.
Проведенные исследования молекулярных механизмов действия пропофола
позволяют предположить, что пропофол, как и другие депрессанты ЦНС
(барбитураты, этомидат), активирует комплекс ГАМКд-рецептора с хлоридным
ионным каналом. В клинически применяемых концентрациях пропофол
увеличивает проницаемость каналов для хлора. В более высоких концентрациях
пропофол, наоборот, вызывает десенситизацию ГАМК^-рецепторов, что угнетает
ингибиторную систему.
40
Глава 3
Фармакокинетика
Основные фармакокинетические параметры пропофола в сравнении с
другими внутривенными гипнотиками представлены в табл. 3.1. Пропофол в
значительной степени (до 98%) связывается с белками плазмы. Фармакокинетика
пропофола представлена типичной трехкамерной моделью. Объем центральной
камеры составляет 0,1—0,4 л/кг, a Vdss колеблется в пределах от 2 до 12 л/кг.
Короткая продолжительность клинического действия пропофола обусловлена
как его перераспределением, так и быстрым метаболическим клиренсом.
Концентрация препарата в плазме после струйного введения быстро снижается
в основном за счет перераспределения пропофола из мозга и других хорошо вас-
куляризованных тканей в органы с менее интенсивным кровоснабжением
(например, в скелетные мышцы). Хотя клиренс начального распределения
пропофола достаточно высок (3—4 л/кг/мин), он не превышает клиренса тиопента-
ла. Напротив, последующий метаболический клиренс пропофола
приблизительно в десять раз выше по сравнению с тиопенталом и даже превышает скорость
печеночного кровотока, что позволяет сделать предположение о существовании
внепеченочного метаболизма пропофола. Это предположение было
подтверждено обнаружением метаболитов пропофола в крови в ангепатическую фазу
ортотопической трансплантации печени.
Таблица 3.1. Основные фармакокинетические параметры
в/в гипнотиков
Препарат
Пропофол
Кетамин
(рацемический)
S(+) кетамин
Этомидат
Тиопентал
Метогекситал
Мидазолам
Связывание
с белком (%)
98
12
—
65
83
73
96
(л/кг)
ОД-0,4
0,3-1,4
0,4
0,15
0,5
0,35
0,17
Vdss
(л/кг)
2-12
1,4-6,0
—
2,5-4,5
2,5
2,2
1,1
Клиренс
(мл/кг/мин)
20-28
14-20
30
18
3,4
10,9
6-10
Vc — объем центральной камеры; Vdss — объем распределения в равновесном состоянии
Несмотря на длительный период полувыведения (Ti/2y), пробуждение
наступает быстро даже после продолжительной инфузии пропофола. Причина
подобного противоречия заключается в большом объеме распределения
пропофола в равновесном состоянии: он интенсивно перераспределяется в мышцы, жир
и другие плохо васкуляризованные ткани. Эти места связывания пропофола
обладают колоссальной емкостью и в то же время крайне медленно
уравновешиваются с центральной камерой. В результате даже в конце длительной инфузии
концентрация пропофола в центральной камере будет значительно больше, чем
в периферических камерах, так что перераспределение будет продолжаться
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 41_
и после прекращения введения препарата. После прекращения инфузии
концентрация пропофола в центральной камере будет быстро уменьшаться — как
за счет метаболизма (элиминации), так и за счет продолжающегося
перераспределения, — пока не окажется ниже уровня, необходимого аая анестезии
(или глубокой седации), что обеспечивает быстрое пробуждение. Как только
концентрация в центральной камере станет ниже, чем в высоколипофильной
ткани (жир), пропофол начнет перемещаться обратно в центральную камеру.
Это перемещение происходит очень медленно, и концентрация пропофола
в центральной камере остается субклинической. Таким образом, полная
элиминация пропофола из организма может занимать несколько часов или даже дней
(на что указывает длительный Ti/2y), но это не оказывает ощутимого влияния
на скорость пробуждения. Контекст-чувствительный период полркизни
пропофола составляет менее 25 мин при инфузии продолжительностью до 3 ч и около
50 мин — после более длительной инфузии. Если скорость инфузии пропофола
тщательно дозируют в зависимости от клинического эффекта, то мя
пробуждения оказывается достаточно снижения его концентрации в плазме на 10—20%,
что происходит после окончания введения очень быстро.
С возрастом объем центральной камеры и клиренс снижаются, поэтому у
пожилых дозу пропофола (так же, как, например, и барбитуратов) необходимо
снизить. Наоборот, у детей в пересчете на кг веса объем центральной камеры и
клиренс больше, чем у взрослых. Поэтому доза пропофола аля индукции и
поддержания анестезии у детей в пересчете на кг веса выше, чем у взрослых.
Ожирение, умеренная дисфункция печени и почек не оказывают
значительного влияния на продолжительность действия пропофола. Почечная
недостаточность не замедляет пробуждение после инфузии пропофола, несмотря на
кумуляцию его метаболитов. Это дает основание предположить, что метаболиты
пропофола не обладают клинически значимым эффектом. Существует значительная
индивидуальная вариабельность относительно эффекта пропофола, причем она
наблюдается и в отсутствие сопутствующих заболеваний, и у тяжелобольных.
Если скорость инфузии пропофола тщательно регулируется в зависимости от
наблюдаемого эффекта, то снижается частота побочных эффектов (например,
артериальной гипотонии) и ускоряется пробуждение по окончании анестезии.
Полезной отправной точкой аая больных с массой тела 60—90 кг является режим
инфузии «стандартной» дозы. Адекватная скорость инфузии пропофола для
сбалансированной анестезии и ТВВА составляет 75—300 мкг/кг/мин, а^я
седации — 25—100 мкг/кг/мин (рис. 3.1). В настоящее время известно, что целевая
концентрация пропофола в плазме составляет 2—6 мкг/мл ^\я анестезии и
0,5—1,5 мкг/мл для седации (рис. 3.2). На значение целевой концентрации
влияют сопутствующие анестетики (опиоиды, закись азота), а также степень
травматичности операции.
Фармакодинамика
В табл. 3.2 представлены основные фармакодинамические характеристики
пропофола в сравнении с другими в/в гипнотиками.
42
Глава 3
Седация ТВВА: ТВВА: Пропофол/М20 Пропофол/М20
только пропофол/ при малых при больших
пропофол опиоид операциях операциях
Рис. 3.1. Режимы инфузии пропофола (рекомендованное изменение скорости во
времени) в зависимости от методики, сопутствующего анестетика и травматичности
операции: седация, ТВВА (только пропофол), ТВВА (пропофол с опиоидом), сбалансированная
анестезия (пропофол с закисью азота) при мало- и высокотравматичных
вмешательствах. Воспроизведено с разрешения из [62]
Рис. 3.2. Целевая концентрация пропофола в плазме в зависимости от методики,
сопутствующего анестетика и травматичности операции. Воспроизведено с разрешения
из [62]
Фармакокинетика и фармакодинамика препаратов при ТВВА 43
Центральная нервная система
Пропофол приобрел широкую популярность аая поддержания анестезии
в нейрохирургии, поскольку обеспечивает быстрое пробуждение и позволяет
провести неврологическое обследование сразу после окончания операции.
Пропофол является реальной альтернативой ингаляционным анестетикам, которые
вызывают вазодилатацию мозговых сосудов и, следовательно, повышают
внутричерепное давление (ВЧД). Пропофол, наоборот, вызывает вазоконстрикцию
мозговых сосудов, уменьшая мозговой кровоток (МК) и снижая
метаболические потребности мозга в кислороде (CMRO2). Хотя индукция анестезии про-
пофолом вызывает уменьшение ВЧД, сопутствующее снижение среднего
артериального давления (АДср) обычно приводит к уменьшению церебрального
перфузионного давления (ЦПД). Пропофол не нарушает ауторегуляцию
мозгового кровообращения и реакцию сосудов мозга на 0¾.
Хотя имеются сообщения о возникновении непроизвольных движений, или
«конвульсий», после введения пропофола, в нескольких работах показано, что
они не сопровождаются судорожной или эпилептиформной активностью на
ЭЭГ. Вероятнее всего эти непроизвольные движения обусловлены
преимущественной депрессией подкорковых структур, устраняющей ингибирующие
влияния на кору. Пропофол не вызывает судорожной активности на ЭЭГ даже при
сложной парциальной эпилепсии и успешно применяется а^ лечения
эпилептического статуса [1]. Доказано, что пропофол вызывает феномены
возбуждения (миоклонию, тремор, дистонию) реже, чем этомидат, тиопентал и мето-
гекситал [2].
Сердечно-сосудистая система
При индукции анестезии пропофол снижает АД сильнее, чем другие в/в гип-
нотики [3]. Гипотензивный эффект обусловлен в первую очередь
периферической вазодилатацией. В отсутствие сопутствующих заболеваний возникающая
артериальная гипотония не имеет особого клинического значения. Чтобы
уменьшить выраженность артериальной гипотонии, (1) пропофол следует
вводить медленно и внимательно, ориентируясь на реакцию больного, (2)
необходимо провести адекватную инфузию жидкости до начала индукции. При
сопутствующих сердечно-сосудистых заболеваниях пропофол следует вводить с
особой осторожностью.
В кардиоанестезиологии добавление пропофола к высокодозной опиоидной
анестезии позволило улучшить гемодинамическую стабильность, снизить
частоту интраоперационного восстановления сознания и ускорить пробуждение
после операции. Индукция анестезии пропофолом (даже в малых дозах —
0,5мг/кг) в сочетании с алъфентанилом (50 мкг/кг) вызывает артериальную
гипотонию [4]. Артериальная гипотония возникает и при индукции анестезии
пропофолом (1 мг/кг) в сочетании с фентанилом (6 мкг/кг), хотя на
протяжении всего периода снижения АД на ЭКГ не было зарегистрировано никаких
признаков ишемии миокарда [5]. По сравнению с другими в/в гипнотиками
пропофол в большей степени снижает венозную емкость и ОПСС, что и
объясняет его более выраженный гипотензивный эффект. Добавление опиоидов
к пропофолу потенциирует артериальную гипотонию.
46
Глава 3
В кардиоанестезиологии необходимо предотвратить артериальную гипотонию
при индукции анестезии и обеспечить стабильность гемодинамики во время
ларингоскопии, интубации трахеи и стернотомии. Для этого было решено
применять пропофол только аля поддержания анестезии, используя для индукции
другие препараты. Двухступенчатая инфузия пропофола после опиоидной индукции
характеризуется сходными гемодинамическими изменениями и снижением
потребности в вазодилататорах, аналогичными энфлюрановой анестезии [6].
У больных с дисфункцией левого желудочка методику анестезии суфентанил-про-
пофол (индукция суфентанилом, 5 мкг/кг; поддержание пропофолом,
меняющаяся скорость инфузии, 50—200 мкг/кг/мин) изучали в сравнении с
методикой суфентанил-энфлюран. Оказалось, что методика суфентанил-пропофол
позволяет успешно управлять гемодинамикой, а по сравнению с методикой
суфентанил-энфлюран снижает потребность в вазопрессорах и сопровождается менее
выраженными биохимическими признаками ишемии миокарда [7]. Было
показано, что сочетание пропофола с опиоидами вызывает артериальную гипотонию
чаще, а гипертонию, наоборот, реже, чем сочетание пропофола с мидазоламом,
причем между двумя схемами анестезии не было различий в частоте периопера-
ционной ишемии и нарушений со1фатимости миокарда.
В кардиохирургии поддержание анестезии пропофолом по сравнению с вы-
сокодозной фентаниловой анестезией характеризуется более быстрым
пробуждением после операции и более ранней экстубацией, что сокращает
продолжительность пребывания больного в отделении интенсивной терапии. Например,
поддержание анестезии пропофолом в дозе 67—100 мкг/кг/мин позволяет
перевести гемодинамически стабильных больных на самостоятельное дыхание
сразу же после восстановления сознания. Медиана времени до экстубации при
пропофоловой анестезии составила 2 ч, и только 2,5% больных потребовали
продленной ИВЛ в течение 24 ч. Для сравнения: при высокодозной
фентаниловой анестезии медиана времени до экстубации составила 7 ч [8].
Прочие эффекты
Пропофол является прямым бронходилататором, влияя на гладкие мышцы
бронхов аналогично действию на гладкие мышцы сосудов. Пропофол подавляет
синтез стероидов в надпочечниках в 1500 раз слабее, чем этомидат [9]. Не
получено клинически значимых признаков нарушения стероидогенеза под
воздействием пропофола [10]. Во время электросудорожной терапии (ЭСТ)
продолжительность судорог при пропофоловой анестезии меньше, чем при использовании
тиопентала и метогекситала. При использовании пропофола и метогекситала
эффективность ЭСТ оказалась одинаковой, несмотря на меньшую
продолжительность судорог в группе пропофола. Кроме того, пропофол эффективнее
метогекситала подавлял подъем АД и ЧСС немедленно после сеанса ЭСТ, что может
обеспечить защиту от инфаркта миокарда — относительно частого осложнения
ЭСТ. Пробуждение после ЭСТ в большей степени зависит от длительности
судорог, чем от вида вводимого гипнотика; после применения пропофола больные
пробркдались ненамного быстрее, чем после метогекситала [11].
Пропофол безопасен при использовании у больных с высоким риском
злокачественной гипертермии, а таюке при биопсии мышцы у больных с подозрением
Фармакокинетика и фармакодинамика препаратов при ТВВА £7
на это заболевание. Пропофол не влияет на чувствительность контрактурного
теста in vitro [12]. Пропофол также безопасен при острой перемежающейся
порфирии в анамнезе.
Большим преимуществом пропофола оказалось его прямое противорвотное
действие [13], которое может быть опосредовано через антагонизм
дофаминовых 02-рецепторов [14]. По сравнению с ингаляционными анестетиками,
применение пропофола при общей анестезии сопряжено с меньшей частотой
ПОТР и/или сниженной потребностью в противорвотных средствах [15].
Помимо того, противорвотное действие пропофола сильнее, чем у других в/в
препаратов /^ая индукции или поддержания анестезии. Противорвотные свойства
пропофола подтверждаются его способностью устранять тошноту и рвоту при
инфузии в субгипнотических дозах. В палате пробуждения введение 10—20 мг
пропофола позволило устранить ПОТР в 81% случаев, в то время как жировая
эмульсия — только в 35% [16]. Вместе с тем, противорвотный эффект
пропофола непродолжителен, у 6 больных из 21 ПОТР возобновилась через 30 мин
после введения пропофола.
Субгипнотическая доза пропофола (10 мг) позволяет устранить зуд после
интратекального введения опиоидов не менее эффективно, чем налоксон в дозе
2 мкг/кг. В этой ситуации применение пропофола сопряжено с меньшей
частотой послеоперационной боли.
Существенным недостатком при использовании пропофола является боль во
время инъекции, возникающая у 28—90% больных. Хотя механизм вызванной
пропофолом боли по ходу вены остается неизвестным, предполагается, что он
может быть обусловлен активацией кининового каскада. Боль обусловлена
самим пропофолом, а не содержащимися в препарате неактивными
компонентами [17]. Боль можно ослабить использованием крупной вены, охлаждением
пропофола, разведением пропофола раствором 5% глюкозы или 10% интрали-
пида, но наиболее эффективным средством является добавление местных
анестетиков (например, 1—2% лидокаина). Степень ослабления боли зависит от
дозы добавленного к пропофолу лидокаина; может потребоваться до 40 мг
лидокаина. Лидокаин одинаково эффективен как при смешивании с пропофолом,
так и при предварительном введении. Смесь необходимо использовать в течение
30 мин после смешивания, иначе значительная доля лидокаина переходит в ли-
пидную фазу, что снижает концентрацию его свободной фракции. Хотя
пропофол часто вызывает боль в месте инъекции, но, в отличие от диазепама и этоми-
дата, он не служит причиной флебитов. Относительно безвредно
непреднамеренное внутриартериальное или внесосудистое введение пропофола.
Резюме
Пропофол стал распространенным в/в гипнотиком благодаря короткой
продолжительности действия и относительно благоприятному профилю побочных
эффектов. Короткая продолжительность действия облегчает титрование дозы по
эффекту и обеспечивает быстрое пробркдение после седации и анестезии даже
при длительных вмешательствах. Значительным преимуществом является
противорвотное действие пропофола. Препарат стал полезным «универсальным»
анестетиком, который молено применять у «проблемных больных» (например,
48
Глава 3
при злокачественной гипертермии, порфирии). Хотя пропофол вызывает
артериальную гипотонию, последняя редко оказывается опасной при условии
осторожного медленного введения препарата. Другой существенный недостаток
пропофола — боль в месте инъекции — может быть значительно ослаблен с
помощью лидокаина. На сегодняшний день пропофол обладает наилучшим
сочетанием клинических свойств среди всех в/в гипнотиков. Хотя при
определенных обстоятельствах другие препараты могут иметь отдельные преимущества
перед пропофолом, в большинстве случаев они ему уступают.
Кетамин и его изомеры
Кетамин, производное фенциклидина, был синтезирован в 1963 г. и впервые
применен в клинике в 1965 г. Кетамин вызывает уникальную «диссоциативную
анестезию» [18], при которой больные пребывают в состоянии
каталептического транса (часто с открытыми глазами), отчужденные от всего
окружающего. Кроме того, кетамин является мощным анальгетиком.
Кетамина гидрохлорид представляет собой водорастворимую белую
кристаллическую соль. Используемый в клинике препарат кетамина является
прозрачным бесцветным раствором, стабильным при комнатной температуре и
имеющим рН от 3,5 до 5,5. Следует отметить, что кетамин — это рацемическая смесь
двух оптически активных изомеров, S(+) кетамина и R(—) кетамина [19].
Фармакокинетика
Основные фармакокинетические параметры кетамина в сравнении с
другими внутривенными гипнотиками представлены в табл. 3.1. Связь кетамина
с белками плазмы невелика. Кетамин обладает высокой жирорастворимостью и
поэтому интенсивно поглощается тканями организма, а объем распределения
составляет 100—400 л. Кетамин характеризуется большим объемом
центральной камеры (20—100 л), а общий клиренс составляет 1000—1600 мл/мин.
Период полувыведения (Т1/2Р) составляет 2,5—3 ч. По сравнению с взрослыми,
у детей выше клиренсы, меньше объемы распределения и короче период
полувыведения в фазе элиминации. Биодоступность кетамина при приеме внутрь
из-за эффекта первого прохождения невелика (< 20%), в то время как при
в/м введении составляет 93% [20]. Концентрация препарата в плазме
достигает пикового уровня в течение 5 мин после в/м инъекции. При введении в/в
струйно в дозе 2 мг/кг утрата сознания наступает через 20—60 сек,
пробуждение — через 10—15 мин. Как и при использовании других в/в гипнотиков,
пробуждение после кетаминовой индукции обусловлено в основном
перераспределением препарата из мозга в хуже васкуляризованные ткани.
Под воздействием печеночных микросомальных ферментов кетамин
разлагается на ряд метаболитов, из которых наибольшую клиническую значимость
имеет норкетамин (N-деметилированный кетамин). Норкетамин
определяется в плазме уже через 2—3 мин после введения кетамина, а пикового уровня
достигает через 30 мин. Норкетамин фармакологически активен, его
гипнотическая и анальгетическая мощность в 3—10 раз слабее, чем у кетамина. После
дальнейших превращений большинство метаболитов кетамина выводится с
мочой. Сочетанное применение кетамина с бензодиазепинами может увеличивать
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 4Э_
его период полувыведения в фазе элиминации, поскольку диазепам снижает
печеночный клиренс кетамина, конкурентно ингибируя процесс N-деметилирова-
ния. Барбитураты оказывают аналогичное действие.
Фармакодинамика
В табл. 3.2 представлены основные фармакодинамические характеристики
кетамина в сравнении с другими в/в гипнотиками.
Центральная нервная система
Действие кетамина на ЭЭГ можно подразделить на несколько фаз, которые
сменяют друг друга по мере увеличения концентрации препарата в крови (и,
соответственно, в мозге). Вначале под действием кетамина исчезает
альфа-активность, амплитуда волн снижается, частота может изменяться по-разному. Затем
эта картина сменяется постоянной ритмической тета-активностью (4—6 Гц)
повышенной амплитуды. Наконец, появляется перемежающаяся
высокоамплитудная полиморфная дельта-активность с частотой 0,5—2,0 Гц [21].
Кетамин угнетает отдельные области в неокортексе и подкорковых
структурах (таламус), одновременно активируя другие отделы лимбической системы
(гиппокамп). Этот механизм действия отличает его от других в/в анестетиков,
вызывающих более распространенную депрессию ЦНС. Благодаря такому
воздействию кетамин вызывает функциональную диссоциацию (т.е. разобщение)
лимбической и таламокортикальной системы. В дозах, вызывающих анестезию,
кетамин снижает амплитуду зрительных вызванных потенциалов, а также в
некоторой степени угнетает акустические вызванные потенциалы.
Кетамин повышает ВЧД, причем сильнее при введении в/в, чем в/м. При
внутричерепной патологии индукция анестезии кетамином вызывает
преходящее повышение ВЧД на 1—60 мм рт. ст. Менее выраженное увеличение ВЧД
наблюдается и у здоровых исследуемых. Повышение ВЧД может быть
ослаблено предварительным назначением седативных препаратов и не имеет особой
клинической значимости у больных без сопутствующих заболеваний головного
мозга. Повышение ВЧД обусловлено увеличением мозгового кровотока.
Поскольку ВЧД увеличивается в большей степени, чем АД, то ЦПД снижается,
поэтому следует избегать применения кетамина при внутричерепной
патологии и нарушениях мозгового кровообращения.
Имеются противоречивые данные о эпилептогенных свойствах кетамина.
Вместе с тем показано, что у больных с генерализованной и парциальной
эпилепсией кетамин провоцирует эпилептическую активность слабее, чем
естественный сон. Кроме того, кетамин оказывает мощное противосудорожное
действие при генерализованных тонико-клонических судорогах у животных.
Сердечно-сосудистая система
В отличие от других в/в гипнотиков, кетамин вызывает значительное
увеличение ЧСС, АДср и концентрации катехоламинов в плазме. Эти эффекты
обусловлены вызываемой кетамином центральной симпатической
стимуляцией [22] и носят благоприятный характер при гиповолемии и массивном
кровотечении. Кетамин оказывает прямое депрессивное воздействие на
миокард при введении в/в струйно в большой дозе (> 1,5 мг/кг) или слишком
4 Тотальная внутривенная анестезия
50
Глава 3
быстро (< 30 с). В большинстве случаев депрессия миокарда более чем
компенсируется за счет симпатической стимуляции, но может иметь клиническую
значимость у больных в критическом состоянии. Опосредованная
симпатической системой вазоконстрикция компенсируется прямым влиянием кетамина
на сосуды (вазодилатация), в результате чего ОПСС практически не
изменяется. Кетамин увеличивает коронарный кровоток, хотя этого может оказаться
недостаточно вследствие возрастания метаболических потребностей миокарда
из-за тахикардии и артериальной гипертонии. Кетамин повышает легочное
сосудистое сопротивление (ЛСС), давление в легочной артерии и сократимость
правого желудочка, поэтому он противопоказан при сниженном резерве
правого желудочка. При однолегочной ИВЛ кетамин не угнетает благоприятную а^
больного гипоксическую легочную вазоконстрикцию.
Система дыхания
Стандартная индукционная доза кетамина не вызывает клинически
значимой депрессии дыхания. Тем не менее, депрессия дыхания может возникнуть
при быстром в/в введении большой дозы (> 2 мг/кг). Кроме того, депрессию
дыхания потенциирует премедикация бензодиазепинами. В сравнении с
другими в/в анестетиками, кетамин в наибольшей степени поддерживает
нормальную функциональную остаточную емкость, минутный объем дыхания,
дыхательный объем и участие межреберных мышц в акте дыхания. Благодаря
прямому действию на гладкие мышцы бронхов кетамин вызывает бронходилата-
цию у больных с бронхиальной астмой.
Кетамин увеличивает секрецию слюнных и трахеобронхиальных желез,
в связи с чем следует его вводить в сочетании с холиноблокатором (например,
гликопирролат, 0,1—0,2 мг; атропин 0,01—0,02 мг/кг). Кетамин не обычно не
угнетает глоточные и гортанные рефлексы, что обеспечивает проходимость
дыхательных путей и сохраняет способность к глотанию. Хотя кетамин влечет
меньший риск аспирации, чем другие анестетики, он не устраняет его
полностью, и поэтому у больных группы риска следует принять меры по защите
дыхательных путей.
Прочие эффекты
В дозе, вызывающей анестезию (1—2 мг/кг в/в), кетамин повышает тонус
матки и интенсивность маточных сокращений, но в анальгетической дозе
(0,2—0,4 мг/кг в/в) не оказывает на матку заметного эффекта. Кетамин
можно использовать j^l индукции анестезии при акушерских кровотечениях,
поскольку он поддерживает АД и тонус матки, а также позволяет проводить
ингаляцию 100% кислорода.
Кетамин безопасен при острой порфирии, миопатии и злокачественной
гипертермии.
Феномены, возникающие при пробуждении
после кетаминовой анестезии
Если кетамин применяется без сочетания с другими анестетиками, то
пробуждение сопровождается сновидениями (приятными и неприятными),
нарушениями зрения, галлюцинациями, иллюзиями, «сверхъестественными пережива-
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 51
ниями», ощущением опьянения, изменением настроения и делирием. Эти
реакции при пробуждении (особенно галлюцинации) возникают у 90% больных.
Факторы риска включают женский пол и психологические расстройства в
анамнезе. В ряде случаев на протяжении нескольких недель после кетаминовой
анестезии эти феномены могут возникать повторно. Закрывание глаз или
помещение больного на период пробуждения в затемненную и изолированную от шума
палату не позволяет устранить эти побочные эффекты. Атропин и другие холи-
ноблокаторы центрального действия увеличивают риск психомиметических
побочных реакций. Дроперидол уменьшает кардиостимулирующее действие кета-
мина, но не влияет на психомиметические реакции [23]. Психомиметическое
действие кетамина может быть ослаблено многими седативными препаратами.
В настоящее время признано, что аая профилактики побочных
сердечно-сосудистых и психомиметических эффектов кетамина целесообразнее всего
использовать бензодиазепины.
Применение в клинике
Использование кетамина в клинической практике ограничено
сердечно-сосудистыми и психомиметическими побочными эффектами, которые в
некоторой степени сохраняются даже при сочетании его с другими препаратами седа-
тивно-гипнотического действия (мидазолам, пропофол). Вместе с тем, в
некоторых клинических ситуациях кетамин может быть весьма полезен (табл. 3.3).
Кетамин идеален аая использования в военно-полевых условиях и при массовых
катастрофах среди гражданского населения. Возможность внутримышечного
введения в сочетании с отсутствием угнетающего действия на гортанные и
глоточные рефлексы делает кетамин препаратом выбора в случаях, когда нет
доступа ко всему телу больного (например, при сдавлении фрагментом здания в
случае землетрясения). Благодаря мощному анальгетическому действию кетамин
целесообразно использовать при коротких болезненных вмешательствах
(перевязка при ожогах, трепанобиопсия, люмбальная пункция, удаление
торакальных дренажей у детей).
При сопутствующих сердечно-сосудистых заболеваниях кетамин
нецелесообразно применять как единственный анестетик (в силу его кардиостимули-
рующего действия), но можно использовать в сочетании с бензодиазепинами.
Кетамин успешно использовали при операциях на сердце в сочетании с
высокими дозами диазепама {ал^ предотвращения увеличения АД и ЧСС), благодаря
чему адекватная глубина анестезии сочеталась со стабильной
гемодинамикой [24]. У больных с тяжелой кардиомиопатией при пересадке сердца
кетамин по сравнению с суфентанилом обеспечивал более стабильный сердечный
выброс и ЧСС, но увеличивал напряжение стенки левого желудочка [25].
Индукция анестезии сочетанием кетамина и фентанила угнетает кровообращение
в меньшей степени, чем индукция другими в/в анестетиками (тиопентал, это-
мидат). В торакальной хирургии кетамин по сравнению с фентанилом
обеспечивает более продолжительную послеоперационную анальгезию.
Так как кетамин поддерживает активность симпатической нервной системы,
он признан препаратом выбора при тампонаде сердца и констриктивном
перикардите. Следует, правда, иметь в виду, что кетамин способен повысить легочное
52
Глава 3
Таблица 3.3. Показания к применению кетамина в анестезиологии
Индукция и поддержание анестезии у больных из группы высокого риска
Шок или гемодинамическая нестабильность
Тяжелая дегидратация
Бронхоспазм
Выраженная анемия
Однолегочная ИВЛ
Акушерство
Индукция анестезии у больных из группы высокого риска
Анальгезия при инструментальном ведении родов или наложении швов
Для сочетания с регионарной анестезией при кесаревом сечении
Сочетание с инфильтрационной и регионарной анестезией
Седация/анальгезия во время проведения блокады
Дополнительная анальгезия в случае неадекватной блокады
Амбулаторная анестезия
Непродолжительные диагностические и лечебные вмешательства
Дополнение к инфильтрационной и регионарной анестезии
Педиатрия
Болезненные манипуляции (удаление дренажей, люмбальная пункция)
Перевязки
Седация во время рентгенологических исследований, КТ, МРТ, ангиографии
Пероральная премедикация
Применение вне операционной
Ожоговые отделения (обработка ожоговой раны, перевязки)
Приемные отделения, травматологические пункты (вправление вывихов)
Отделения интенсивной терапии (седация, болезненные манипуляции)
Палаты пробуждения (послеоперационная седация и анальгезия)
Применение в полевых условиях (отсутствие доступа ко всему телу больного,
использование на поле боя)
Фармакокинетика и фармакодинамика препаратов при ТВВЛ
53
сосудистое сопротивление, в результате чего гемодинамическая реакция на него у
больных с заболеваниями перикарда может оказаться непредсказуемой.
Существуют противоречия относительно применения кетамина у больных с гиповолеми-
ческим шоком. Хотя кетамин значительно увеличивает АД при нормоволемии, на
фоне тяжелой гиповолемии он может, наоборот, вызывать артериальную
гипотонию. Возможно, что у больных в критическом состоянии кетамин не вызывает
активации симпатической системы, в результате чего проявляется его прямое
действие на кровообращение, состоящее в угнетении сократимости миокарда и
вазодилатации.
Обусловленная кетамином бронходилатация носит благоприятный характер
при гиперреактивности дыхательных путей, а также у больных, получающих
бронходилататоры парентерально. Кетамин целесообразно использовать аая
поддержания анестезии на фоне однолегочной ИВЛ у больных с тяжелыми
заболеваниями легких и выраженным нарушением газообмена. При
однолегочной ИВЛ кетамин улучшает оксигенацию благодаря тому, что не нарушает ги-
поксическую легочную вазоконстрикцию и, соответственно, снижает фракцию
легочного шунта (синоним: венозная примесь). Кроме того, кетамин,
обеспечивая анестезию и анальгезию, позволяет использовать дыхательную смесь с
высокой F1O2.
У детей введение кетамина в/м в дозе 4—8 мг/кг позволяет провести
индукцию анестезии. Более того, эта доза может оказаться достаточной для
обеспечения анестезии на всем протяжении диагностической процедуры или малой
хирургической операции. Для обеспечения седации детям иногда назначают
кетамин внутрь. При назначении его в дозе 6 мг/кг внутрь адекватная седация
развивается через 20—25 мин без выраженных побочных эффектов.
Изомеры кетамина
Используемые в настоящее время препараты кетамина представляют собой
рацемическую смесь, состоящую из равных количеств S(+) и R(— ) изомеров.
У животных S(+) изомер кетамина вызывал более продолжительное угнетение
сознания, более глубокую анальгезию и менее выраженное послеоперационное
возбркдение по сравнению с R(— ) изомером и рацемической смесью [26, 27].
У людей S(+) изомер кетамина обеспечивал более эффективную анестезию и
меньшую выраженность психомиметических реакций и возбуждения при
пробуждении, чем R(—) изомер и рацемическая смесь [19]. Кроме того, S(+)
изомер кетамина более эффективно устранял послеоперационную боль [19].
Исследования показали, что по сравнению с рацемической смесью S(+)
изомер кетамина обеспечивает большую управляемость анестезии в результате
более высокого клиренса и менее крутого наклона кривой
концентрация-эффект. Благодаря этому S (+ ) кетамин титровать по клиническому эффекту
легче, чем рацемическую смесь. Кроме того, между двумя оптическими изомерами
кетамина происходит взаимодействие, в результате чего клиренс S(+)
кетамина снижается в присутствие R(—) кетамина. Это взаимодействие может
объяснить, почему при использовании S(+) кетамина пробуждение наступает
быстрее, чем при применении рацемической смеси. Время покажет, станет ли S(+)
изомер кетамина широко доступным p^sl клинического применения.
54
Глава 3
Резюме
Кетамин представляет собой многоцелевой препарат, полезный в некоторых
клинических ситуациях. Его широкое применение ограничено отсроченным про-
бркдением, сопряженным с различными психомиметическими реакциями, а
также стимулирующим действием, приводящим к увеличению АД, ВЧД и
внутриглазного давления. Предварительное назначение бензодиазепинов позволяет смягчить
или даже предотвратить некоторые — но не все — побочные эффекты кетамина.
Уже давно известно, что кетамин представляет собой рацемическую смесь,
в которой более полезными свойствами обладает S(+) оптический изомер.
Сейчас стало относительно легче производить большое количество отдельных
оптических изомеров, в силу чего может увеличиться интерес к S(+) кетамину.
Хотя этот компонент полезнее, чем рацемическая смесь, пока еще неясно,
достаточно ли этих преимуществ fi^si начала сложной процедуры внедрения его
в широкую клиническую практику.
Этомидат
Этомидат, производное имидазола, представляет собой мощный анестетик
короткого действия. Хотя этомидат является рацемической смесью, активным
анестетиком является лишь R(+)-изомер. Этомидат нерастворим в воде, и
в начале клинического применения в пропись препарата входил растворитель
кремофор EL. Когда стало известно, что кремофор EL является причиной
неприемлемых побочных эффектов, в качестве растворителя с 1977 г. стали
использовать 35% раствор пропиленгликоля. Низкий рН (5,6) и высокая осмолярность
(4600 мосм/л) пропиленгликоля повлекли за собой ряд осложнений, включая
боль в месте инъекции и тромбофлебиты. Это осложнение удалось устранить,
отказавшись от пропиленгликоля и растворив этомидат в жировой эмульсии.
Этомидат, растворенный в жировой эмульсии, в настоящее время разрешен
к применению в некоторых европейских странах. Этомидат мощнее метогек-
ситала в 6 раз и тиопентала — в 25 раз. При исследовании у крыс было
обнаружено, что этомидат значительно безопаснее барбитуратов, поскольку его
терапевтический индекс ЛД50/ЭД50)1 составляет 26 по сравнению с 9,5 у метогек-
ситала и 4,6 у тиопентала.
Фармакокииетика
Основные фармакокинетические параметры кетамина в сравнении с другими
внутривенными гипнотиками представлены в табл. 3.1. Этомидат
приблизительно на 65% связывается с белками плазмы, преимущественно с альбумином.
Объем распределения в равновесном состоянии составляет 2,5—4,5 л/кг. Период
полувыведения в фазе быстрого распределения составляет 2,8 мин, в фазе
медленного распределения — около 28 мин, и в фазе элиминации — 2,9—5,3 ч
[28]. Новая пропись этомидата, растворенная в жировой эмульсии, обладает
схожими фармакокинетическими параметрами.
1 Терапевтическим индексом называют отношение медианы летальной дозы к медиане
эффективной дозы (ЛД5о/ЭД5о)- Медиана эффективной дозы (ЭД50) — это доза препарата,
которая вызывает ожидаемый эффект у 50% популяции. Медиана летальной дозы (ЛД50) — это
доза препарата, которая приводит к смерти у 50% популяции.
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 55
Этомидат быстро проникает через гематоэнцефалический барьер, достигая
пикового уровня в месте действия в течение 1 мин от начала введения, что
соответствует быстроте выключения сознания. В печени этомидат подвергается
быстрому эфирному гидролизу, в результате которого образуется его
фармакологически неактивный метаболит (производное карбоновой кислоты). После в/в
введения 75% препарата в течение первых 24 ч выделяется с мочой (в виде
метаболита), и около 13% — с калом.
Фармакодинамика
В табл. 3.2 представлены основные фармакодинамические характеристики
этомидата в сравнении с другими в/в гипнотиками.
Центральная нервная система
Этомидат влияет на ЭЭГ аналогично тиопенталу и метогекситалу. Главное
место воздействия — неокортекс. Главный механизм действия — подавление
ГАМК-эргической системы. Индукция анестезии этомидатом в отсутствие пре-
медикации сопряжена с высокой частотой миоклонии. Возможно, этомидат
устраняет ингибирующие влияния на экстрапирамидную систему, отвечающую
за непроизвольные движения. Эту миоклоническую активность можно в
некоторой степени уменьшить предварительным введением опиоидов и/или бензо-
диазепинов. Миоклонию ни в коем случае не следует путать с истинными
эпилептическими припадками1. Тем не менее, недостаточно обоснованные выводы,
сделанные на основании сообщений о случаях из практики, привели (как и
в случае с пропофолом) к предположению, что этомидат является «эпилепто-
генным».
Если бы препарат на самом деле обладал эпилептогенной активностью, то во
время анестезии этомидатом эпилептические приступы должны были бы
возникать намного чаще, чем это происходит в реальности. У больных без эпилепсии
в анамнезе при введении этомидата не наблюдалось никаких ЭЭГ-признаков
эпилепсии. Даже у больных эпилепсией во время анестезии этомидатом не
было отмечено отчетливых ЭЭГ признаков судорожной активности. Наоборот,
исследования на животных показали даже, что этомидат обладает противосудо-
рожными свойствами.
Этомидат пригоден рфя индукции анестезии при внутричерепной гипертен-
зии. Препарат снижает мозговой кровоток (МК) и потребление кислорода
мозгом (CMRO2). Важно отметить, что CMRO2 уменьшается на 45%, в то
время как МК — только на 36%, что обеспечивает хорошую перфузию мозга [29].
1 Миоклония — это быстрые неритмичные непроизвольные подергивания мышцы или группы
мышц, сменяющиеся расслаблением. Миоклония достаточно часто возникает при введении
индукционной дозы многих в/в анестетиков. Исследования показали, что в этой ситуации
она, как правило, не имеет ничего общего с истинными эпилептическими припадками
(т. е. не сопровождается появлением характерной для эпилепсии картины на ЭЭГ), а
обусловлена индуцируемым анестетиком устранением тормозящего влияния коры на
экстрапирамидную систему. Таким образом, миоклония является относительно доброкачественным
проявлением действия в/в анестетиков (Прим. ред.)
56
Глава 3
Сердечно-сосудистая система
В отсутствие значимых сопутствующих заболеваний этомидат не оказывает
существенного влияния на сердечно-сосудистую систему. При введении
обычной индукционной дозы этомидата весьма незначительно — всего лишь на
10% — снижается АДср (преимущественно вследствие уменьшения ОПСС),
на 10% увеличивается ЧСС и сердечный выброс, в то время как ударный объем,
конечно-диастолическое давление левого желудочка и сократимость миокарда
практически не изменяются. Даже если имеется умеренное нарушение
функции сердца, этомидат в дозе 0,3 мг/кг не оказывает заметного влияния на
кровообращение, снижая сердечный выброс всего лишь на 8—10%.
Повышая ЧСС, этомидат вызывает небольшое увеличение потребления
кислорода миокардом. Это явление более чем компенсируется за счет снижения
коронарного сосудистого сопротивления и увеличения коронарного кровотока
на 20%, что приводит к уменьшению экстракции кислорода в миокарде и
поддерживает отношение доставки кислорода к его потреблению. Этомидат
угнетает сократимость миокарда слабее, чем другие в/в анестетики, что делает его
препаратом выбора аля индукции анестезии при сопутствующих
сердечно-сосудистых заболеваниях.
Система дыхания
Этомидат лишь в незначительной степени угнетает дыхание. Он вызывает
апноэ реже, чем тиопентал, метогекситал. и пропофол. Этомидат может даже
увеличивать минутный объем дыхания, что нехарактерно аая в/в анестетиков.
Надпочечники
В 1983 г. был опубликован отчет, в котором отмечалось значительное
увеличение летальности в группе больных, которым проводили седацию этомидатом
в отделении интенсивной терапии [30]. Было обнаружено снижение
концентрации кортизола в плазме у погибших больных, что позволило сделать
предположение о способности этомидата подавлять синтез этого гормона в
надпочечниках. Впоследствии оказалось, что этомидат является мощным ингибитором
11-Р-гидроксилазы коры надпочечников, причем синтез кортизола угнетается
даже после однократного введения препарата при индукции анестезии. Вместе
с тем, этот эффект относительно непродолжителен (6—8 ч) и скорее всего не
имеет особой клинической значимости. Пока еще не вполне ясно, как этомидат
влияет на стрессорную реакцию, возникающую в ответ на хирургическое
вмешательство, а также на общий исход лечения. В настоящее время достигнут
консенсус, что этомидат безопасен j^jl индукции, а также для поддержания
анестезии в составе ТВВА, даже если состояние больного критическое. Более
того, следует помнить, что и другие распространенные препараты (например,
опиоиды) также могут снижать концентрацию кортизола в плазме.
Прочие эффекты
Этомидат не оказывает очевидного эффекта на функцию почек и печени.
Внутриглазное давление после введения индукционной дозы уменьшается на
60%. Этомидат успешно применяли у беременных, сообщений о побочных
эффектах не было.
Фармакокинетика и фармакодинамика препаратов при ТВВА 57_
Введение этомидата часто вызывает боль. Как и при использовании пропофо-
ла, частота этого осложнения зависит от калибра и месторасположения вены и
может быть снижена предварительным введением фентанила или лидокаина.
Помимо боли, этомидат может вызывать тромбофлебит, продолжающийся
несколько дней. Он появляется через 3—4 дня после введения препарата и
протекает в виде весьма болезненного уплотнения вены проксимальнее места
инъекции. Интересно, что появление тромбофлебита никак не связано с
интенсивностью боли в момент введения препарата. Осложнения, вызванные
раздражением стенки вены, обусловлены пропиленгликолем — растворителем, входящим
в пропись препарата этомидата. Замена пропиленгликоля на другой
растворитель позволяет решить проблему. Боль в месте инъекции значительно слабее при
использовании этиленгликоля, но, к сожалению, он не обеспечивает
достаточной стабильности. Боль уменьшается, но не исчезает совсем при использовании
гидроксипропил- -циклодекстрина [32]. В качестве растворителя таюке была
предложена жировая эмульсия, которая позволила устранить все побочные
реакции со стороны вен и одновременно обеспечила достаточную стабильность.
Было проведено сравнительное исследование двух прописей этомидата [33].
Там, где в пропись входил пропиленгликоль, 36% из 47 больных пожаловались
на боль при введении; на первый день после операции у троих больных развился
тромбофлебит и еще у девяти отмечалось уплотнение вены при пальпации; на
седьмой день после операции тромбоз развился у 9 больных. Наоборот, в
группе, где в пропись этомидата входила жировая эмульсия, ни один больной не
пожаловался на боль при введении и ни в одном случае не было признаков
тромбофлебита [33]. Применение жировой эмульсии в качестве растворителя не
повлияло на биодоступность этомидата и стабильность кровообращения [33].
Интересно, что смена пропиленгликоля на жировую эмульсию позволила
снизить частоту миоклонической активности до 10% [34]. Этомидат,
растворенный в жировой эмульсии, в настоящее время разрешен к клиническому
применению в некоторых странах Европы.
Распространенным побочным эффектом этомидата является ПОТР, частота
которой составляет 30—40%. ПОТР является главным фактором,
ограничивающим применение этомидата в амбулаторной анестезиологии. Смена
пропиленгликоля на жировую эмульсию снизило частоту ПОТР.
Инъекция этомидата на основе пропиленгликоля вызывает преходящий
гемолиз в связи с высокой осмолярностью растворителя (4965 мосм/л). В
отсутствие заболеваний почек и сопутствующего повреждения эритроцитов этот
гемолиз не приводит к значимому нарушению функции почек. Напротив, если
имеется сопутствующее заболевание почек, либо проводится интраоперацион-
ная аутотрансфузия, либо параллельно применяются другие способные
разрушать эритроциты лекарственные средства, то может развиться выраженный
гемолиз и гемоглобинурия, чреватая повреждением почек. Замена
пропиленгликоля на жировую эмульсию приводит к более чем десятикратному снижению
осмолярности (с 4965 мосм/л до 400 мосм/л), что устраняет вероятность
гемолиза.
58
Глава 3
Резюме
Изменение прописи этомидата с заменой растворителя пропиленгликоля на
жировую эмульсию позволило устранить его некоторые нежелательные
побочные эффекты или уменьшить их выраженность, сохранив благоприятное
влияние на кровообращение. Это усовершенствование сделало этомидат более
привлекательным в/в гипнотиком. Весьма вероятно, что в будущем его
популярность увеличится.
Барбитураты
Раньше в качестве в/в анестетиков использовали несколько барбитуратов,
в то время как в настоящее время широко применяются только тиопентал и
метогекситал. Благодаря быстрому перераспределению действие этих
препаратов после однократного введения продолжается недолго, поэтому тиопентал и
метогекситал получили название барбитуратов ультракороткого действия.
Напротив, при повторном введении тиопентал и метогекситал быстро кумулиру-
ют, что обусловлено относительно небольшим объемом центральной камеры и
длительным периодом полувыведения в фазе элиминации (несколько часов).
Кумуляция значительно ограничивает применение тиопентала и метогекситала
в клинике.
Физико-химические свойства
Тиопентал и метогекситал представляют собой производные
фармакологически инертной барбитуровой кислоты. Замещение различными радикалами в
положениях Ni и С2 в молекуле барбитуровой кислоты приводит к образованию
ряда веществ, обладающих свойствами анестетика. И у тиопентала, и у
метогекситала в положении Ni атом водорода замещен радикалом. Метогекситал
является оксибарбитуратом, поскольку атом углерода в положении С2 связан с
атомом кислорода. Тиопентал представляет собой тиобарбитурат, поскольку атом
углерода в положении С2 связан с атомом серы.
В качестве препарата мя индукции анестезии тиопентал начал
использоваться в клинике с 1934 г. и в настоящее время является старейшим из
применяемых в/в анестетиков. Метогекситал появился в 1957 г. Благодаря быстрому
наступлению действия оба препарата применяют /^ля индукции анестезии. Они
хорошо растворимы в жирах, показатели рКа слабощелочные (7,6 для
тиопентала и 7,9 для метогекситала), что обеспечивает быстрое проникновение через
гематоэнцефалический барьер. Оба препарата представляют собой слабые
кислоты, практически нерастворимые в воде. Их натриевые соли водорастворимы,
но водные растворы имеют выраженную щелочную реакцию (рН > 10). В
результате растворы тиопентала и метогекситала могут вызывать значительное
повреждение тканей при подкожном или внутриартериальном введении, а также
выпадают в осадок (вызывая окклюзию системы аая внутривенного введения
препаратов) при смешивании с большинством других препаратов, включая сук-
цинилхолин. Высокое рН обеспечивает лишь одно преимущество — бактерио-
статическую активность, позволяющую хранить растворы барбитуратов до двух
недель.
Фармакокинетика и фармакодинамика препаратов при ТВВА 59
Механизм действия
Механизм действия барбитуратов, как и всех остальных анестетиков, пока не
вполне понятен. Барбитураты влияют на многие нейротрансмиттерные
системы, хотя их действие на ГАМК^-рецепторы носит стереоспецифический
характер и коррелирует с анестетической мощностью. Наиболее вероятно, что
анестетические свойства барбитуратов обусловлены воздействием на ГАМКд-ре-
цепторы, модулирующим проницаемость потенциал-зависимых натриевых
каналов.
Фармакокинетика
Основные фармжокинетические параметры барбитуратов в сравнении с другими
в/в гипнотиками представлены в табл. 3.1. Тиопентал и метогекситал в высокой
степени связываются альбумином плазмы. Клиренс тиопентала находится в
прямой зависимости от уровня свободной фракции препарата и поэтому на него
влияет уровень альбумина, а также препараты, вытесняющие тиопентал из связи
с альбумином. Вместе с тем, /^я индукции анестезии тиопенталом изменение
скорости его элиминации не имеет особого клинического значения. У взрослых
объем распределения центральной камеры (Vc) ААЯ тиопентала составляет
8—26 л. Быстрое начало действия тиопентала, возможно, обусловлено тем, что
мозг является частью того малого объема, который быстро уравновешивается
с кровью центральной камеры по концентрации тиопентала. Константа скорости
в месте действия (1¾)) АЛ% тиопентала составляет 0,3/мин, а для метогексита-
ла — 0,6/мин. Объем распределения в равновесном состоянии (Vd$s) АЛ&
тиопентала и метогекситала составляет 2,5 и 2,2 л/кг соответственно.
Элиминация тиопентала и метогекситала происходит в основном в печени,
почки практически не задействованы в этом процессе. Клиренс элиминации
(Cle) для тиопентала составляет 250 мл/мин, для метогекситала — 690 мл/мин.
Печеночная экстракция метогекситала (50—87%) значительно больше, чем у
тиопентала (10—20%). В результате период полувыведения в фазе элиминации
для метогекситала (3,9 ч) меньше, чем для тиопентала (11,6 ч). Кроме того,
элиминация метогекситала в большей степени зависит от печеночного
кровотока (и поэтому более вариабельна) по сравнению с тиопенталом.
Кратковременность клинического эффекта метогекситала и тиопентала обусловлена прежде
всего процессом перераспределения. При высокой концентрации тиопентала
в крови его элиминация зависит только от емкости печеночного фермента Р450
(так называемая кинетика нулевого порядка: в единицу времени подвергается
метаболизму одинаковое количество препарата вне зависимости от его
концентрации в крови).
Из вышеприведенного следует, что тиопентал не подходит аая поддержания
анестезии методом продолжительной инфузии. Для иллюстрации этого
положения представим себе, что в течение 2-х часов проводили инфузию тиопентала
в режиме, позволяющем обеспечить его постоянную концентрацию в плазме.
В этом случае время, необходимое аая снижения его концентрации на 25%,
будет лишь немногим больше 15 мин. Напротив, время, необходимое для
снижения концентрации на 50% (контекст-чувствительный период полувыведения),
превысит 1 ч, на 75% — превысит уже 2 ч. В результате более быстрой печеночной
во
Глава 3
элиминации контекст-чувствительный период полувыведения метогекситала
составляет < 20 мин. Поэтому метогекситал больше подходит /^ля поддержания
анестезии методом длительной инфузии, чем тиопентал, хотя в настоящее
время вытеснен из этой клинической ниши пропофолом.
Фармакодинамика
В табл. 3.2 представлены основные фармакодинамические характеристики
пропофола в сравнении с другими в/в гипнотиками.
Центральная нервная система
Барбитураты угнетают биоэлектрическую активность и метаболизм мозга.
Тиопентал вызывает дозозависимое угнетение потребления кислорода мозгом
(CMRO2) до 55% от уровня бодрствования. Снижение CMRO2 вызывает вазо-
констрикцию сосудов мозга, что влечет за собой уменьшение мозгового
кровотока и ВЧД. Поскольку ВЧД снижается в большей степени, чем АДср, то ЦПД
остается нормальным или слегка увеличивается. Тиопентал подавляет нейро-
нальную активность, вызывая дозозависимую депрессию ЭЭГ. Амплитуда ЭЭГ
увеличивается, а частота уменьшается. По мере нарастания концентрации
препарата в крови возникает ЭЭГ-картина «вспышка-подавление» (вспышки
биоэлектрической активности перемежаются периодами изоэлектрического
молчания). Максимальное подавление CMRO2 соответствует появлению изолинии на
ЭЭГ. Тиопентал является мощным противосудорожным препаратом, в то время
как метогекситал обладает проконвульсивными свойствами и при недиагности-
рованной ранее эпилепсии может вызвать припадки.
Сердечно-сосудистая система
Воздействие тиопентала на сосуды проявляется главным образом венодилата-
цией, что обуславливает скопление крови в венозных депо. В отсутствие
сопутствующих заболеваний введение стандартной индукционной дозы не вызывает
значимых изменений ОПСС и АД. В высокой дозе тиопентал оказывает прямое
угнетающее влияние на сократимость миокарда. Как тиопентал, так и
метогекситал вызывают опосредованное через барорецепторный рефлекс увеличение
ЧСС. Метогекситал повышает ЧСС на 40%, а тиопентал — только на 25%. При
гиповолемическом шоке и сердечной недостаточности, когда кровообращение
поддерживается за счет значительно увеличенного симпатического тонуса,
индукция анестезии барбитуратами (как, впрочем, и другими в/в анестетиками)
должна проводиться с особой осторожностью. При сопутствующей ИБС
следует ожидать выраженных изменений гемодинамики (снижение постнагрузки,
ударного объема, коронарного кровотока, потребления кислорода миокардом).
Система дыхания
Тиопентал и метогекситал вызывают дозозависимую депрессию дыхания, и у
большинства больных после введения индукционной дозы обычно развивается
апноэ. Подавляются также реакции на гипоксемию и гиперкапнию, а также
защитные рефлексы дыхательных путей, хотя и недостаточно глубоко /^ля
интубации трахеи или установки ларингеальной маски.
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 61_
Печень и почки
Введение обычной индукционной дозы не оказывает значительного влияния
на функцию печени даже при сопутствующем заболевании печени. Тиопентал
может снижать почечный кровоток и диурез, хотя клинически значимое
уменьшение на фоне адекватной инфузионной терапии маловероятно. Цирроз
печени, уремия и программный гемодиализ вызывают гипоальбуминемию, что
сопряжено с уменьшение фракции тиопентала, связанного с белком плазмы.
Чтобы предотвратить чрезмерное увеличение концентрации несвязанного с
белком тиопентала, индукционную дозу следует вводить медленнее. Чем больше доля
свободного препарата, доступного печеночному метаболизму, тем меньше
продолжительность действия тиопентала (при условии сохранной функции печени).
Прочие эффекты
Тиобарбитураты (но не оксибарбитураты) вызывают дозозависимое
высвобождение гистамина. При этом клинически значимые изменения со стороны
кровообращения и дыхания наблюдаются редко, хотя иногда тиопентал может
вызывать анафилаксию. Тиопентал снижает концентрацию кортизола в плазме,
но не блокирует стрессорную реакцию на хирургическое вмешательство. Боль
в месте инъекции обычно наблюдается при введении метогекситала, но не
тиопентала, если, конечно, препарат не введен экстравазально. Подкожное или
внутриартериальное введение тиопентала вызывает боль, отек, эритему и
реакции в диапазоне от ощущения дискомфорта до некроза тканей и гангрены,
особенно при введении концентрированных растворов. Экстравазальное введение
метогекситала не вызывает таких тяжелых реакций.
Непроизвольные мышечные сокращения, кашель и икота часто возникают
после индукции анестезии метогекситалом и значительно реже появляются
после введения тиопентала. Барбитураты могут спровоцировать приступ острой
перемежающейся порфирии или смешанной порфирии у восприимчивых
больных, поскольку они индуцируют выработку синтетазы 8-аминолевуленовой
кислоты — катализатора ключевого этапа синтеза порфиринов. У больных с пор-
фирией назначение барбитуратов вызывает ряд проявлений, включая паралич,
боль в животе и фоточувствительность.
Резюме
Тиопентал применяют для индукции анестезии в тех случаях, когда нет
необходимости в быстром пробуждении. Метогекситал популярен для проведения
анестезии при электросудорожной терапии, поскольку хорошо известно его
влияние на продолжительность судорог. Для поддержания анестезии
барбитураты в настоящее время не применяют из-за очень медленного пробуждения,
особенно при использовании тиопентала.
Бензодиазепины
Бензодиазепины оказывают противосудоролсный, ашссиолитический (т. е.
устраняющий тревожность) и гипнотический эффект, а также вызывают амнезию.
Основные показания к применению бензодиазепинов в анестезиологии: премеди-
кация, уменьшение риска интраоперационного восстановления сознания, седация
62
Глава 3
при сохраненном сознании. Бензодиазепины взаимодействуют с ГАМК-бензодиа-
зепиновыми рецепторами, облегчая ингибиторное воздействие ГАМК на передачу
нервного импульса. Воздействие на ГАМК-рецепторы обеспечивает анксиолитиче-
ское, противосудорожное и миорелаксирующее свойство бензодиазепинов, но их
гипнотический эффект, возможно, опосредуется каким-то другим механизмом.
Диазепам и лоразепам используют аая премедикации с целью устранения
тревожности. Продолжительность действия обоих препаратов достаточно
велика, так что они могут значительно замедлить пробуждение. Диазепам
используют аая индукции анестезии, хотя медленное начало действия, замедленное
пробуждение и высокая частота венозных тромбозов ограничили его применение.
Важным шагом вперед оказался синтез мидазолама — водорастворимого бензо-
диазепина короткого действия, в 2—3 раза более мощного по сравнению с диа-
зепамом.
Фармакокинетика
Основные фармакокинетические параметры мидазолама в сравнении с
другими в/в гипнотиками представлены в табл. 3.1. Мидазолам водорастворим,
рКа составляет 6,15, в значительной степени (96%) связывается с альбумином
плазмы. Период полувыведения в фазе распределения составляет 5—10 мин,
в фазе элиминации — 2—4 ч. Клиренс мидазолама выше, чем у диазепама и ло-
разепама, и составляет 6—10 мл/кг/мин. Продолжительность действия
мидазолама относительно невелика при введении в/в струйно или при
непродолжительной инфузии, но значительно увеличивается при более длительной инфузии.
В отличие от других бензодиазепинов, метаболиты мидазолама не обладают
значимой фармакологической активностью. Биодоступность мидазолама при
приеме внутрь составляет 50%. Назначение мидазолама внутрь мя премедикации
приобретает все большую популярность (особенно у детей).
Фартакодинамика
В табл. 3.2 представлены основные фармакодинамические характеристики
мидазолама в сравнении с другими в/в гипнотиками.
Центральная нервная система
Мидазолам вызывает дозозависимое снижение метаболизма мозга и мозгового
кровотока, поэтому его можно применять ^ая индукции анестезии при
внутричерепной гипертензии. Следует отметить, что утрата сознания при индукции
происходит относительно медленно, что несколько увеличивает риск гипоксии и гипер-
капнии. Мидазолам, как и другие бензодиазепршы, в некоторой степени повышает
порог судорожной готовности (иными словами, уменьшает риск припадков).
Сердечно-сосудистая система
При индукции анестезии мидазолам оказывает относительно слабый и
преходящий гипотензивный эффект, выраженный, впрочем, сильнее, чем у
диазепама. Несмотря на это, мидазолам в дозе 0,2 мг/кг можно безопасно
применять при тяжелом аортальном стенозе. Гипотензивное действие мидазолама
усиливается на фоне тяжелой гиповолемии, а также при сочетании с опиоидами
(вследствие угнетения симпатического тонуса и выброса катехоламинов).
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 63
Система дыхания
Мидазолам вызывает относительно слабую депрессию дыхания. Депрессия
дыхания усиливается при сопутствующем хроническом обструктивном
заболевании легких, а также при сочетанном введении с опиоидами (глава 5).
Клиническое применение
В клинике мидазолам часто применяют аая премедикации перед анестезией.
После в/в введения он начинает действовать быстро (через 2—3 мин) и
обеспечивает глубокую амнезию продолжительностью 20— 30 мин. Мидазолам
значительно уменьшает дозу других в/в анестетиков для индукции анестезии, и в
последнее время стала популярной концепция сочетанной индукции. Для
премедикации до пункции периферической вены мидазолам может быть введен в/м
или внутрь. В настоящее время ^^ приема внутрь применяют раствор аая в/в
введения, который обычно смешивают с фруктовым сиропом, позволяющий
приглушить горький вкус препарата. С этой целью часто используют сироп ибу-
профена, обеспечивающий и сладкий вкус, и упреждающую анальгезию. К
сожалению, сейчас не существует готового к применению препарата мидазолама
мя приема внутрь.
Доза мидазолама АА^ индукции анестезии в отсутствие премедикации
составляет 0,2—0,3 мг/кт в/в. При введении этой дозы в течение 30—60 с утрата
сознания наступает быстрее, чем через 2 мин, но медленнее, чем при
использовании большинства других в/в анестетиков. При многократном введении или
продолжительной инфузии мидазолам может кумулировать, что замедляет про-
бркдение. Отсроченное восстановление сознания может создавать
значительные затруднения, когда мидазолам используют ^ая поддержания анестезии или
седации при сохраненном сознании, и особенно при проведении седации в
отделении интенсивной терапии.
Стероидные анестетики
В ходе исследований обнаружилось, что некоторые стероиды естественного
происхождения из групп прегнана и андростана обладают свойствами
анестетиков. Оказалось, что гипнотические (анестетические) свойства стероидов не
зависят от гормональных. Например, стероид с наиболее мощным
гипнотическим (анестетическим) эффектом, прегнан-3,20-диол (прегнандион), вовсе
лишен эндокринной активности.
Поскольку многие стероидные анестетики естественного происхождения
(а также первые из синтезированных) были нерастворимы в воде, то аая
применения в клинике необходимо было синтезировать водорастворимые
препараты. Первым потенциально приемлемым стероидным анестетиком оказался
гидроксидион. Он был получен из прегнандиона и приобрел водорастворимость
благодаря этерификации в позиции Сц. Гидроксидион обеспечивал медленную,
но гладкую индукцию анестезии с минимальными изменениями
кровообращения и дыхания, хорошую миорелаксацию и легкое пробуждение [35]. К
сожалению, гидроксидион часто вызывал боль при введении и тяжелые
тромбофлебиты, поэтому его использование в клинике было запрещено. Опыт
применения гидроксидиона послужил толчком к поиску новых стероидных анестетиков.
64
Глава 3
Было синтезировано множество перспективных препаратов с быстрым началом
действия и высоким терапевтическим индексом, но их применение
сопровождалось такими побочными эффектами, как парестезии и судороги.
В 1972 г. в клинике начал применяться другой стероидный анестетик — аль-
тезин. Он представлял собой смесь двух стероидов, альфаксалона и альфадолона,
обладавших анестетической активностью, но нерастворимых в воде. Из двух
стероидов наиболее мощным был альфаксолон, а альфадолон присутствовал
преимущественно /^ая увеличения растворимости альфаксолона в кремофоре EL.
Предполагается, что альтезин, как и другие стероиды, оказывает свой эффект,
активируя комплекс ГАМКд-рецептора с хлоридным ионным каналом. Бензо-
диазепины и барбитураты также воздействуют на эти структуры. Альтезин
обладал быстрым началом и короткой продолжительностью действия. Препарат
имел высокий терапевтический индекс, а угнетение кровообращения было
незначительным, даже если индукционная доза равнялась двум ED50 После
индукции анестезии альтезин вызывал непродолжительный период
гипервентиляции, а также благоприятное снижение ВЧД. Препарат обладал рядом других
преимуществ, включая отсутствие значительного влияния на функцию почек и
печени, безопасность применения при высоком риске злокачественной
гипертермии (но не порфирии), снижение внутриглазного давления и релаксирую-
щее действие на мышцы гортани. Основное преимущество альтезина
заключалось в более быстром пробуждении по сравнению с барбитуратами.
К сожалению, альтезин обладал способностью высвобождать гистамин из
тучных клеток, что вызывало периферическую вазодилатацию и различные
кожные проявления — покраснение, отек и волдыри. Повторное введение
альтезина в некоторых случаях приводило к тяжелому сердечно-сосудистому коллапсу,
обусловленному активацией классического механизма системы комплемента.
Выявление антител IgG против кремофора EL позволяет предположить, что эти
реакции вызывает именно растворитель, а не отдельные стероиды [36]. Частота
побочных реакций при введении альтезина колеблется от 1 : 1000 до 1 : 18 000,
но при повторном применении может составлять 1 : 14. В результате этих
побочных реакций альтезин никогда не поставлялся на рынок США, и в 1984 г.
был изъят из клинического применения в Великобритании. До настоящего
времени все попытки найти приемлемый растворитель аая альфаксалона не
увенчались успехом.
Последние разработки в области стероидных анестетиков
Прогестерон и 5-а-прегнандион обладают анестетической активностью. Оба
препарата метаболизируются до прегнанолона (3-а-ОН, 5~а-прегнан-20-она), и
именно этот метаболит является активным анестетиком. Прегнанолон,
растворенный в жировой эмульсии (эльтанолон), интенсивно исследовался в качестве
внутривенного анестетика. Индукция анестезии эльтанолоном не оказывает
значительного влияния на кровообращение и дыхание. По сравнению с пропофолом,
эльтанолон вызывает менее выраженную боль в месте инъекции [37].
Пробуждение после эльтанолона наступает медленнее, чем после пропофола [38], в связи
с чем эльтанолон не оказался подходящим альтернативным препаратом для
амбулаторной анестезиологии. В 1996 г. клинические исследования эльтанолона были
Фармакокинетика и фармакодинамика препаратов при ТВВЛ
65
прекращены из-за отсутствия ясных клинических преимуществ и относительно
высокой частоты аллергических реакций (зуд, крапивница).
Проводились исследования целого ряда водорастворимых стероидных
анестетиков. Минаксолон, изучаемый в 1970-е гг., в отношении некоторых свойств
напоминал альтезин, но индукция и пробуждение оказались медленнее. После
выявления высокой частоты возбуждения во время индукции анестезии
препарат был запрещен. ORG 20599, еще один стероид, способен индуцировать
непродолжительный гипнотический эффект, а его терапевтический индекс
равен 13. Относительная нестабильность этого препарата в водном растворе
помешала его клиническим испытаниям. После этого были проведены исследования
ORG 21465 — другого водорастворимого аминостероида, замещенного во 2
позиции. Препарат имеет высокий терапевтический индекс, но его введение часто
сопровождается возбуждением. В настоящее время будущее ORG 21465
остается неясным. В реальности, несмотря на возможность разработки препарата
с высоким терапевтическим индексом, мягкой индукцией и коротким
действием, перспективы стероидной анестезии пока что представляются достаточно
безрадостными.
Опиоидные и неопиоидные анальгетики
Опиоидные анальгетики
Из препаратов, применяемых в современной анестезиологии, дольше всех
человечеству знакомы опиоиды. Первые письменные свидетельства об опиуме
датируются третьим веком до нашей эры. Опиум, добываемый из восточного
мака (Papaver somniferum), содержит более 20 различных алкалоидов, главным
из которых является морфин. Из опиума удалось выделить несколько
алкалоидов, в том числе морфин (по имени греческого бога сновидений — Морфея),
кодеин и папаверин. Эти производные опиума называются опиатами, в то время
как термин опиоид относится к синтетическим препаратам с морфиноподобны-
ми свойствами. Термин наркотик иногда используют как синоним термина
опиоид, хотя он означает седацию и сон, обусловленные действием любого
препарата, а не только опиоида. Термин наркотик произошел от греческого слова
narkosis, обозначающего ступор, оцепенение, отсутствие чувствительности.
Опиоиды применяли для обеспечения периоперационной анальгезии
значительно раньше, чем возникла общая анестезия. После появления первых
ингаляционных анестетиков морфин стали использовать а^я премедикации и
обнаружили, что он снижал потребность в хлороформе. После этого проводились
попытки применять большие дозы морфина в сочетании со скополамином а^
обеспечения анестезии без ингаляционных препаратов. Эта методика позволила
уменьшить выраженность возбуждения во время индукции анестезии и при
пробуждении, но сопровождалась непроизвольными движениями и тяжелой
депрессией дыхания [39]. Соответственно, на ранних этапах опиоиды были не
самостоятельными анестетиками, а использовались при ингаляционной и
регионарной анестезии в качестве вспомогательных препаратов.
5 Тотальная внутривенная анестезия
66
Глава 3
Первым синтетическим опиоидом стал петидин (меперидин),
синтезированный в 1939 г. К 1947 г. петидин уже применяли в составе сбалансированной
методики в сочетании с закисью азота, кураре и барбитуратами. В
кардиохирургии применяли высокие дозы морфина или меперидина в сочетании с
кислородом. Хотя эта методика позволяла обеспечить определенную стабильность
гемодинамики у больных с дисфункцией сердечно-сосудистой системы,
артериальную гипертонию удавалось предотвратить не всегда, и достаточно частым
осложнением было интраоперационное восстановление сознания. Кроме того,
морфин вызывал опосредованную высвобождением гистамина артериальную
гипотонию, а петидин — тахикардию и угнетение сократительной способности
миокарда.
В 1953 г. Пауль Янссен начал поиск более мощных опиоидов, основываясь на
том, что большая мощность позволит усилить специфичность, снизить риск
побочных эффектов и осложнений. В 1960 г. он синтезировал фентанил, который
оказался в 1 ОСЬ-300 раз мощнее морфина, обладал более высоким
терапевтическим индексом и имел менее выраженные побочные эффекты. Очень скоро
фентанил ста/ш применять в сочетании с дроперидолом и с закисью азота
(глава 2). Кроме того, фентанил широко использовали в кардиоанестезиологии.
При моноанестезии фентанил был более эффективен, чем морфин и петидин,
хотя достаточно часто отмечались интраоперационное восстановление сознания
и замедленное пробркдение после операции, поэтому в настоящее время
фентанил чаще всего используют в составе сбалансированной методики анестезии.
В середине 1970-х гг появился суфентанил, оказавшийся в 10 раз мощнее фен-
танила и обладавший меньшей продолжительностью действия. В конце 1970-х гг.
был синтезирован альфентанил. По сравнению с фентанилом альфентанил в 5 раз
слабее, но действие его развивается быстрее и длится значительно меньше времени.
Последней разработкой стал, ремифентанил, который по мощности
приблизительно равен фентанилу. Ремифентанил имеет уникальную эфирную структуру и
поэтому очень быстро расщепляется неспецифическими эстеразами крови и тканей,
что обеспечивает ультракороткую продолжительность действия.
Опиоиды взаимодействуют со стереоселективными трансмембранными опи-
атными рецепторами. Лигандами этих рецепторов являются эндогенные опио-
идные пептиды, модулирующие ряд функций организма. Идентифицировано
три подтипа рецепторов — jli (мю),к (каппа) и 5 (дельта). Существуют также
8-(эпсилон) и а-(сигма) рецепторы, взаимодействующие как с опиоидами, так
и с веществами неопиоидного происхождения (кетамин). Большинство
клинических эффектов (желательных и нежелательных) опосредованы
ц-рецепторами. Выделено две субпопуляции ц-рецепторов: \х\-рецепторы опосредуют
состояние анальгезии, в то время как ц2 — депрессию дыхания [40]. Из этого
проистекает возможность (пока еще теоретическая) разработки селективного
агониста jliI -рецепторов, способного обеспечить анальгезию без угнетения
дыхания, к-рецепторы сконцентрированы в тех участках спинного и головного
мозга, которые модулируют афферентные ноцицептивные импульсы. Селективные
агонисты к-рецепторов можно использовать в клинической практике,
поскольку они не вызывают депрессии дыхания и чаще обуславливают дисфорию, чем
Фармакокинетика и фармакодинамика препаратов при ТВВЛ
67
Таблица 3.4. Основные фармакокинетические характеристики
агонистов и антагонистов опиатных рецепторов
Препарат
Морфин
Петидин
(мепередин)
Кодеин
Фентанил
Суфентанил
Альфентанил
Ремифентанил
Налоксон
Налтрексон
Налмефен
Связывание с
белками (%)
23-26
70
7-25
80
93
90
70
40
20
—
Vc
(а/кг)
—
1-2
—
0,5-1,0
0,2
0,1-0,3
0,1-0,2
—
—
—
Vdss
(л/кг)
3-5
3-5
2,5-3,5
3-5
2,5-3,0
0,4-1,0
0,3-0,4
2,6-3,0
16
2,3
Клиренс
(мл/кг/мин)
15-20
8-18
10-15
10-20
10-15
4-9
40-60
20-30
20
14
Vc — объем центральной камеры; Vd^ — объем распределения в равновесном состоянии
эйфорию, что значительно снижает риск их злоупотребления. Следует отметить,
что агонисты к-рецепторов оказывают седативный эффект и угнетают
высвобождение антидиуретического гормона (АДГ). Возможно, что частичные
агонисты опиатных рецепторов (например, налорфин, пентазоцин, буторфанол, нал-
буфин, дезоцин), вызывают анальгезию, воздействуя именно на к-рецепторы.
Кроме того, эти препараты могут быть и частичными агонистами \х-рецепторов,
что объясняет их способность вызывать депрессию дыхания. 6-рецепторы,
расположенные в спинном и головном мозге, взаимодействуют с энкефалинами.
Активация 5-рецепторов может углубить анальгезию путем модуляции
активности ц-рецепторов.
Фармакокинетика
Основные фармакокинетические параметры опиоидных анальгетиков
приведены в табл. 3.4. При приеме внутрь всасывание происходит медленно, весьма
значителен эффект первого прохождения через печень. Биодоступность
морфина составляет 20%, кодеина — чуть больше 60%. После в/м введения
концентрация морфина в плазме достигает пиковых значений через 7—20 мин, мепе-
редина — через 30 мин. Значения пиковой концентрации морфина и кодеина
в плазме после в/м введения могут значительно различаться у разных больных.
Степень связывания морфина с белками плазмы относительно мала
(около 25%). После в/в введения концентрация морфина в плазме быстро
снижается; кинетика этого процесса описывается двух- или трехэкспоненциальной
убывающей функцией. Морфин относительно гидрофилен и поэтому проникает
68
Глава 3
через гематоэнцефалический барьер достаточно медленно. Соответственно,
изменение концентрации морфина в ЦНС значительно запаздывает относительно
изменения его концентрации в плазме. Так, концентрация морфина в ЦСЖ
достигает пикового значения лишь через 15—30 мин после в/в введения, что
затрудняет подбор дозы морфина, позволяющей обеспечить адекватную
анальгезию без седативного эффекта и депрессии дыхания. Кроме того, морфин
достаточно медленно покидает ЦСЖ, потому что в ее относительно кислой среде
увеличивается ионизированная фракция препарата. Благодаря вышеприведенным
обстоятельствам, продолжительность действия морфина значительно выше, чем
молено было бы предположить на основании кинетики его концентрации
в плазме. Несоответствие между концентрацией препарата в плазме и
клиническим эффектом значительно сильнее проявляется при использовании морфина,
нежели других опиоидов, которые более липофильны. Метаболизм морфина
происходит в основном в печени, клиренс составляет 15—23 мл/кг/мин.
Морфин очень быстро подвергается метаболизму с образованием морфин-3-глюку-
ронида и морфин-6-глюкуронида. Последний метаболит обладает высокой
активностью и элиминируется из ЦСЖ даже медленнее, чем сам морфин. При
продолжительном введении морфина анальгезия и депрессия дыхания в
значительной степени обусловлены морфин-6-глюкуронидом.
Фентанил, суфентанил, альфентанил и ремифентанил являются более
мощными анальгетиками, чем морфин. Между собой они отличаются по мощности,
скорости достижения максимального эффекта и продолжительности действия.
Соответственно, при переходе от одного опиоида к другому необходимо менять
относительные дозы и режим введения.
Фентанил связывается с белками плазмы на 80% и обладает высокой жирорас-
творимостью. Этот факт обуславливает большой объем распределения (3—6 л/кг).
По сравнению с морфином, после в/в введения концентрация фентанила
в ЦСЖ достигает эффективного уровня значительно быстрее: ее изменения
запаздывают относительно изменения концентрации в плазме только на 5 мин.
Благодаря значительной жирорастворимости и большому объему
распределения, у разных больных после в/в введения могут значительно различаться
значения пиковой концентрации, а также другие фармакокинетические параметры.
Фентанил характеризуется высоким клиренсом (10—20 мл/кг/мин).
Метаболизм фентанила происходит в основном в печени (путем N-дезалкилирования и
гидроксилирования) с образованием норфентанила и других относительно
неактивных метаболитов.
По сравнению с фентанилом, суфентанил в 10 раз мощнее и в 2 раза лучше
растворяется в жирах. Суфентанил в значительной степени связывается с
белками плазмы (93%). Фармакокинетика суфентанила описывается трехкамерной
моделью. Объем распределения в равновесном состоянии составляет около
3 л/кг, печеночный клиренс — 3 мл/кг/мин. В печени суфентанил
превращается в неактивные метаболиты. Продолжительность действия меньше, чем у
фентанила, и при длительности инфузии менее 6—8 ч приблизительно
соответствует продолжительности действия альфентанила. Возможно, что короткая
продолжительность действия обусловлена значительным связыванием с белками
плазмы и низким объемом распределения.
Фармакокинетика и фармакодинамика препаратов при ТВВА 69
Альфентанил, как и другие синтетические опиоиды, в высокой степени
связывается с белками плазмы (90%), преимущественно с а-1 гликопротеином.
Альфентанил проникает в ЦНС быстрее, чем фентанил, несмотря на меньшую жирорас-
творимость. Меньшая жирорастворимость предотвращает чрезмерное
поступление альфентанила в ЦНС, обеспечивая короткую продолжительность действия
препарата. Клиренс альфентанила (4—9 мл/кг/мин) по сравнению с клиренсом
фентанила ниже, но это нивелируется меньшим объемом распределения
(0,4— 1,0 л/кг), что ограничивает распределение и накопление препарата в
тканях. Альфентанил метаболизируется аналогично суфентанилу, с образованием
нескольких неактивных метаболитов.
Ремифентанил является новым мощным синтетическим опиоидом с очень
быстрым началом действия. Ремифентанил уникален тем, что его молекула
содержит эфирную связь, которая быстро подвергается внепеченочному
гидролизу под воздействием неспецифических эстераз крови и тканей. Гидролиз
эфирной связи трансформирует ремифентанил в производное карбоновой кислоты
(GI90291). Этот метаболит в 300—1000 раз слабее ремифентанила. Объем
распределения ремифентанила в равновесном состоянии (22 л) близок к объему
распределения альфентанила (38 л). Кинетика элиминации ремифентанила
может быть описана с помощью трехкамерной модели с поразительно высоким
клиренсом (4,1—5,0 л/мин). Короткая продолжительность действия
обусловлена именно высоким клиренсом, и лишь в весьма незначительной степени
перераспределением. Главный метаболит ремифентанила не подвергается
внепеченочному гидролизу и клиренс его поэтому меньше. В равновесном состоянии
концентрация метаболита в плазме в 12 раз выше, чем самого
ремифентанила [41]. Этот феномен не имеет большой клинической значимости, поскольку
метаболит по меньшей мере в 300 раз слабее ремифентанила. Четко
установлено, что при почечной недостаточности клинически значимой кумуляции
метаболита не происходит. В отношении клиренса ремифентанила удивительнее
всего то, что гидролиз эфирной связи оказался полностью независимым от дозы,
возраста, функции печени и почек, продолжительности инфузии и даже от
генетической изменчивости. Вне зависимости от продолжительности инфузии
ремифентанила, после ее прекращения концентрация препарата в плазме
уменьшается на 50% в течение 3 мин. Прекращение действия ремифентанила оказалось
относительно независимым от введенной дозы. Так, оценивали пробуждение и
восстановление самостоятельного дыхания после трехчасовой анестезии реми-
фентанилом и закисью азота в нескольких группах больных, которые отличались
одна от другой скоростью инфузии ремифентанила. Оказалось, что между
исследуемыми группами практически не было различий в быстроте восстановления
сознания и самостоятельного дыхания, хотя скорость инфузии ремифентанила
могла отличаться в 80 раз [42].
Продолжительность действия опиоидов после завершения инфузии
различной продолжительности зависит от таких параметров, как объем
распределения, клиренс и элиминация, и лучше всего охарактеризовывается
контекст-чувствительным периодом полувыведения (рис. 1.3). Для всех опиоидов, за
исключением ремифентанила, быстрота прекращения эффекта зависит главным
образом от продолжительности инфузии.
70
Глава 3
Заболевания печени влияют на чувствительность к опиоидам, а также на их
распределение и элиминацию. При умеренной дисфункции печени, если
отсутствует энцефалопатия, обычно не возникает надобности снизить начальную дозу
опиоида. Больным, злоупотребляющим алкоголем, наоборот, может
потребоваться увеличение дозы опиоида. При заболеваниях печени продолжительность
действия опиоидных анальгетиков может увеличиваться, поэтому их
поддерживающую дозу следует уменьшить. Благодаря своему уникальному метаболизму,
не зависящему от функции печени, ремифентанил является опиоидом выбора
при тяжелом заболевании печени.
Метаболиты опиоидов кумулируют пропорционально степени дисфункции
почек. Если при дисфункции почек применяются опиоиды, чьи метаболиты
фармакологически активны (морфин, петидин), то может увеличиваться
продолжительность действия и возрастать токсичность. Заболевания почек
относительно слабо влияют на фармакокинетику фентанила и суфентанила, но
усугубляют изменчивость их действия. Дисфункция почек может усиливать действие
альфентанила вследствие уменьшения объема распределения и увеличения
свободной фракции препарата. Посколысу дисфункция почек не влияет на клиренс
альфентанила, то пробуждение после инфузии альфентанила не замедляется. Фар-
макокинетика ремифентанила при почечной недостаточности практически не
изменяется, его клиренсы у больных, зависимых от гемодиализа (36 мл/кг/мин),
и у здоровых добровольцев (34 мл/кг/мин) практически идентичны [44]. При
почечной недостаточности может накапливаться метаболит ремифентанила, но
его кумуляция не вызывает ни увеличения продолжительности действия, ни
токсических эффектов.
Фармакодинамика
Опиоиды обладают широким спектром полезных и побочных эффектов. Их
назначают для устранения боли, уменьшения «стрессовой» реакции на ноци-
цептивные стимулы и обеспечения стабильности сердечно-сосудистой системы.
Опиоиды сокращают потребность в других анестетиках (например, они
снижают минимальную альвеолярную концентрацию ингаляционных анестетиков).
Центральная нервная система
Опиоиды обеспечивают дозозависимую седацию, устранение тревожности,
подавление кашля и выключение сознания. Опиоиды способны обеспечить
анестезию, но не столь наделаю, как при использовании других в/в анестетиков.
Кроме того, опиоидная анестезия сопряжена с высоким риском интраопераци-
онного восстановления сознания и сохранения воспоминаний об этом
(глава 4). Малые дозы опиоидов практически не оказывают влияния на
биоэлектрическую активность мозга, при введении высоких доз на ЭЭГ появляются
высокоамплитудные медленные дельта-волны (коррелирующие с состоянием,
общей анестезии). Опиоиды оказывают весьма незначительное воздействие на
метаболизм мозга и мозговой кровоток. По некоторым данным, при
черепно-мозговой травме большие дозы опиоидов могут вызвать увеличение ВЧД.
Этот эффект менее вероятен при использовании малых доз опиоидов. Следует
подчеркнуть, что прямое действие препарата на внутричерепное давление
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 71_
следует отличать от опосредованного, обусловленного гиперкапнией,
развившейся вследствие депрессии дыхания.
Сердечно-сосудистая система
Морфин вызывает выраженное высвобождение гистамина, что приводит
к вазодилатации и артериальной гипотонии. Применение синтетических опио-
дов, наоборот, характеризуется исключительной стабильностью гемодинамики,
что значительно отличает эту группу препаратов от других в/в анестетиков.
Опиатные рецепторы расположены в центральных и периферических центрах
регуляции кровообращения и симпатической нервной системы. Единственным
клинически значимым эффектом синтетических опиоидов в отношении
кровообращения является заметное снижение ЧСС. Этот эффект обычно не
сопровождается нарушением стабильности сердечно-сосудистой системы. Как и при
использовании всех других анестетиков, индукция анестезии опиоидами при
сопутствующей артериальной гипотонии и вазоконстрикции может привести
к снижению АД. Артериальная гипертония свидетельствует о неадекватной
анестезии/анальгезии.
Система дыхания
Опиоиды оказывают мощное угнетающее действие на дыхательный центр,
а также на рефлексы с верхних дыхательных путей и трахеи. Это свойство
оказывается очень выигрышным во время анестезии (ив отделении интенсивной
терапии), помогая больным переносить эндотрахеальную трубку без кашля и
сопротивления. Установленная эндотрахеальная трубка является мощным
раздражителем, способным вызвать артериальную гипертонию, повышением ВЧД
вследствие кашля, а также нарушение газообмена. Опиоидные анальгетики
подавляют кашель и уменьшают сопротивление больного во время пробуждения
после общей анестезии, не замедляя восстановление сознания [45].
Определенные трудности может создавать свойство опиоидов вызывать выраженную
депрессию дыхания. Прямое угнетающее действие опиоидов на дыхательный
центр в продолговатом мозге приводит к уменьшению его чувствительности
к СС>2, увеличению РаСС>2 и повышению порога апноэ. (Порог апноэ — это
максимальное РаСС>2> при котором больной еще не начинает дышать
самостоятельно. — Прим. ред.) Появляется нерегулярное и периодическое дыхание,
дыхательная аритмия прогрессирует до наступления апноэ. Апноэ возникает до
выключения сознания, поэтому больные могут дышать по команде. Факторы,
потенциирующие угнетающее действие опиоидов на дыхание: отсутствие
болевой или какой-либо другой стимуляции, нормальный сон, сочетанное
применение других анестетиков и седативных препаратов (например, мидазолам).
Депрессия дыхания может иметь клиническую значимость в послеоперационном
периоде после анестезии, основу которой составляли опиоиды, а также при
лечении опиоидами послеоперационной боли. Неадекватно леченая боль тоже
может приводить к гиповентиляции, поэтому следует обеспечить полноценную
анальгезию, не сопровождающуюся побочными эффектами. Чтобы добиться
баланса мелсду эффективностью и безопасностью, следует тщательно подбирать
дозу по эффекту, с тем чтобы ввести минимальную анальгетическую дозу
препарата.
72
Глава 3
Опиоиды способны снижать тонус гладкомышечной мускулатуры бронхов,
что носит благоприятный характер при сопутствующей бронхиальной астме и
гиперреактивности дыхательных путей. Опиоиды не вызывают заметного
угнетения гипоксической легочной вазоконстрикции и поэтому могут быть
использованы при однолегочной ИВЛ [46].
Прочие эффекты
Мощные, быстродействующие опиоиды могут вызывать мышечную
ригидность. Этот эффект носит дозозависимый характер и возникает при введении
относительно высоких доз препаратов (суфентанил, 0,3 мкг/кг; фентанил,
3 мкг/кг; альфентанил, 30 мкг/кг), а также при быстром струйном введении.
Мышечная ригидность неприятна аа^ больного, а также может препятствовать
ручной вентиляции с помощью дыхательного мешка и лицевой маски. Если не
считать применения низких доз опиоидов, единственным эффективным
методом профилактики этого осложнения является одновременное введение миоре-
лаксантов, что полностью блокирует мышечную ригидность.
ПОТР представляет собой наиболее значимое проявление действия опиоидов
на желудочно-кишечный тракт. После сбалансированной методики анестезии,
содержащей опиоиды, ПОТР развивается в 15—60%. Частота ПОТР одинакова
при применении любого из доступных опиоидов. Хотя ПОТР является частым
осложнением опиоидной анальгезии, сама боль тоже может спровоцировать это
осложнение. Эффективным способом предотвращения ПОТР является
профилактическое применение противорвотных средств, а также альтернативные
стратегии анальгезии, позволяющее уменьшить дозу опиоидов. Помимо
прямого действия на хеморецепторную триггерную зону, опиоиды увеличивают
желудочную секрецию, подавляют моторику желудка и кишечника, замедляют
эвакуацию содержимого желудка и снижают тонус нижнего пищеводного
сфинктера. Все эти факторы способствуют ПОТР. Опиоиды пролонгируют
послеоперационный илеус и потенциируют запоры. Все опиоиды повышают давление
в желчных путях, повышая тонус сфинктера Одди. Это может вызывать спазм
желчных протоков, способствующий ПОТР.
Опиоиды снижают стрессовую гормональную реакцию, хотя клиническое
значение этого феномена остается неясным (глава 4). Опиоиды часто вызывают
зуд, особенно при длительном применении; в лечении этого осложнения
эффективны антигистаминные препараты. Опиоиды не оказывают заметного влияния
на функцию печени и почек. Иногда опиоиды вызывают задержку мочи,
особенно при использовании аля спинномозговой или эпидуральной анальгезии.
Нестероидные противовоспалительные препараты (НПВП)
НПВП применяются достаточно давно. В 1829 г. был идентифицирован
активный компонент коры ивы — салицин, а в 1899 г. Байер синтезировал
ацетилсалициловую кислоту (аспирин). В последнее время было разработано
множество НПВП ^ля приема внутрь и парентерального назначения. С ростом
популярности амбулаторной хирургии возник интерес к интраоперационному
применению НПВП, поскольку они лишены многих нежелательных побочных
эффектов, присущих опиоидным анальгетикам (угнетение дыхания, тошнота,
рвота, задержка мочи, привыкание, зависимость, возможность злоупотребления).
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 73
Следует учитывать, что максимальная эффективность НПВП ниже, чем у опио-
идных анальгетиков, и они могут вызывать побочные эффекты (кровотечения
из ЖКТ, бронхоспазм, почечная недостаточность). НПВП эффективно
устраняют боль средней тяжести, а также играют важную роль в качестве компонента
сбалансированной анальгезии.
Механизм действия
В течение долгого времени считалось, что НПВП оказывают анальгетическое
действие исключительно путем подавления синтеза простагландинов в
периферических тканях. (Травма является стимулом к синтезу простагландинов,
которые вызывают воспаление и сенситизацию ноцицепторов, снижая болевой
порог.) Большинство побочных эффектов НПВП тоже обусловлено угнетением
синтеза простагландинов. Последние данные позволяют предположить, что
НПВП могут модулировать боль на уровне ЦНС. Некоторые НПВП
эффективны при интратекальном введении. При парентеральном введении скорость
проникновения НПВП в ЦНС невелика, поэтому их эффекты на уровне ЦНС не
имеют особой клинической значимости.
Фармакокинетика
Некоторые НПВП назначают внутрь (например, ибупрофен, напроксен,
диклофенак). При назначении внутрь в рамках премедикации НПВП
обеспечивают эффективную и длительную послеоперационную анальгезию.
Применение давно известных НПВП (например, ибупрофен) может обеспечивать
адекватную анальгезию и в то же время вызывать меньше побочных эффектов, чем
некоторые новые препараты для парентерального применения (например, ке-
торолак). Ниже в контексте внутривенной анестезии будут рассмотрены лишь
НПВП /^я парентерального применения.
Кеторолак
Кеторолака триметамин был первым парентеральным НПВП, разрешенным
j^iSi послеоперационного обезболивания, что произошло в 1990 г. Мощнее
аспирина в 800 раз, кеторолак является наиболее мощным НПВП. Кеторолак
быстро всасывается, эффект первого прохождения через печень выражен
незначительно. Он может быть назначен внутрь или в/м, после чего концентрация
в плазме достигает пика через 30—45 мин. При в/в введении максимальный
эффект развивается через 20 мин. Как и другие НПВП, кеторолак в высокой
степени связывается с белками плазмы (99%) и обладает малым объемом
распределения. Кеторолак конкурирует за связывание с белками с
антикоагулянтами, дигоксином и метотрексатом, и вытеснение этих препаратов из связи
может значительно усилить их токсическое действие. Клиренс составляет
0,02—0,04 л/кг/ч. Кеторолак преимущественно выводится почками (60%
неизмененного препарата, 40% коньюгированного или гидроксилированного
препарата; метаболизм осуществляется в основном в почках, а не в печени).
Период полувыведения составляет 5,4 ч, но вследствие уменьшения клиренса
увеличивается у пожилых и при дисфункции почек. Кеторолак проникает через
плаценту и выделяется с грудным молоком, но в обоих случаях концентрация
препарата значительно меньше, чем в организме матери.
74
Глава 3
Диклофенак
Диклофенак представляет собой фенилуксусную кислоту, анальгетическая
мощность его в 100 раз выше, чем у аспирина. Он плохо растворим в воде,
поэтому в качестве растворителя применяют пропиленгликоль. Введение в/м
может осложниться асептическим абсцессом, а введение в/в без разведения у
60—80% больных вызывает тромбоз вены. В настоящее время диклофенак
разрешен к в/в применению лишь при условии, что его растворяют не менее чем
в 100 мл инфузионного раствора и вводят дозу не быстрее чем за 30 мин. Хотя
этот способ введения предотвращает повреждение вен, но он неудобен, и при
необходимости в/в введения чаще применяют кеторолак. Диклофенак можно
назначать внутрь, хотя его биодоступность составляет только 60% ввиду
эффекта первого прохождения через печень. Ректальный путь введения позволяет
избежать эффекта первого прохождения, что обеспечивает эффективную и
длительную анальгезию. В Европе диклофенак до последнего времени часто
назначали ректально, но в последнее время необходимость получения согласия
больного уменьшила популярность этого способа введения.
Как и кеторолак, диклофенак в значительной степени связывается с белками
плазмы (99,5%), и обладает малым объемом распределения (0,12 л/кг). Он
выделяется преимущественно через почки, почти полностью в коньюгирован-
ной форме.
Другие НПВП
К другим парентеральным НПВП относятся кетопрофен и теноксикам.
Преимуществами теноксикама являются относительно малый клиренс и
предположительно большая продолжительность действия. Пока проведено мало
клинических исследований, где бы сравнивались эффективность, продолжительность
анальгезии и побочные эффекты этих и некоторых других НПВП в периопера-
ционном периоде.
Фармакодинамика
В отличие от опиоидных анальгетиков, периоперационное использование
НПВП не уменьшает потребность в ингаляционных анестетиках [47]. Когда
^ая интраоперационной анальгезии применяли только НПВП, то частота
целенаправленных движений в ответ на хирургическую стимуляцию была
неприемлемо высока [48]. По сравнению с опиоидами, НПВП слабее влияют на
кровообращение и дыхание, вызывают более длительную послеоперационную
анальгезию, а также обеспечивают более быстрое пробуждение с меньшей частотой
ПОТР. Целесообразно сочетать НПВП с низкими дозами опиоидов и местных
анестетиков, что значительно улучшает послеоперационную анальгезию и
сводит к минимуму риск побочного действия опиоидов. Если послеоперационная
боль слабая или среднеинтенсивная, то может оказаться эффективным
изолированное применение НПВП (± местные анестетики), что позволяет полностью
избежать побочных эффектов опиоидов.
Побочные эффекты
В периоперационном периоде НПВП могут оказать серьезное побочное
действие на почки, желудочно-кишечный тракт и гемостаз. Хотя в медицинской
Фармакокинетика и фармакодинамика препаратов при ТВВА 75_
литературе встречаются единичные сообщения об обусловленных НПВП
летальных исходах вследствие острой почечной недостаточности или
кровотечения, их частота чрезвычайно мала. Обычно чем мощнее препарат, тем слабее его
побочное действие (поскольку аая достижения определенного эффекта
достаточно меньшей дозы, чем при использовании слабого препарата), но на НПВП эта
закономерность не распространяется, потому что подавление синтеза простаг-
.\андинов обуславливает как лечебное, так и побочное воздействие.
В большинстве случаев токсическое действие НПВП на почки в
послеоперационном периоде развивалось на фоне исходной дисфункции почек или на фоне
других состояний, сопряженных с повышенным риском острой почечной
недостаточности (гиповолемия, сепсис, сердечная недостаточность, цирроз). Со-
четанное применение НПВП с нефротоксичными препаратами (например, ан-
тибиотики-аминогликозиды) также предрасполагает к осложнениям со
стороны почек. Простагландины не оказывают особого влияния на кровообращение
в почках, если эффективный ОЦК нормален, но играют важную роль в
регуляции почечного кровотока при гиповолемии и сердечной недостаточности. Риск
нефротоксичных реакций выше при длительном лечении НПВП [49].
НПВП угнетают функцию тромбоцитов, поскольку подавляют активность
содержащейся в них циклооксигеназы. У разных НПВП выраженность этого
эффекта отличается [50]. Единичные сообщения о клинически значимых пе-
риоперационных кровотечениях чаще касаются кеторолака и индометацина,
реже — ибупрофена. Вообще, эти побочные реакции обычно осложняют
длительное лечение заболеваний суставов высокими дозами НПВП. При
непродолжительном применении в периоперационном периоде клинически значимые
осложнения со стороны ЖКТ возникают редко, даже при назначении натощак.
НПВП могут провоцировать бронхоспазм при бронхиальной астме, и это
заболевание часто считают противопоказанием к применению НПВП. На
практике, только у небольшой части больных бронхиальной астмой назначение
НПВП приводит к ухудшению состояния. Как правило, практически все
больные бронхиальной астмой хотя бы раз принимали такие распространенные
препараты, как НПВП, и осведомлены об их действии на свой организм.
Отсутствие осложнений при приеме НПВП в анамнезе предполагает безопасность
периоперационного применения НПВП у больных бронхиальной астмой.
Следует оговориться, что при тяжелой бронхиальной астме требуется особая
осторожность, особенно если неизвестна последняя реакция на применение НПВП.
Резюме
Накоплен некоторый опыт применения НПВП в периоперационном
периоде. НПВП целесообразно применять при амбулаторных вмешательствах, а
также в качестве дополнения к опиоидным анальгетикам после больших операций.
Было отмечено более эффективное устранение болевого синдрома при
одновременном сокращении потребности в опиоидах. В то время как преимущества
полного отказа от опиоидов очевидны (особенно в амбулаторной хирургии),
преимущества от снижения дозы опиоидов менее очевидны. Например,
снижение дозы опиоидов практически не снижает частоту ПОТР.
76
Глава 3
Хотя мощность разных НПВП значительно отличается, проведено пока еще
очень мало сравнительных исследований эффективности различных препаратов
в эквипотентных дозах. На основе клинических впечатлений можно
предположить, что более мощные препараты (например, кеторолак) не всегда
обеспечивают более эффективную анальгезию, в то время как риск побочных эффектов при их
применении выше. Существует явная потребность в проведении исследований,
посвященных применению различных НПВП в периоперационном периоде. На
настоящий момент можно констатировать, что ибупрофен и диклофенак (которые
можно назначать внутрь или ректально), эффективны и относительно безопасны.
Местные анестетики
Местные анестетики вызывают преходящую предсказуемую блокаду
проведения нервного импульса по аксону. Местные анестетики связываются с инак-
тивированными натриевыми каналами, предотвращая их активацию и
поступление натрия в клетку. В результате замедляется процесс деполяризации и
блокируется передача нервного импульса по аксону [51]. Местные анестетики
также связываются с ионными каналами других возбудимых тканей, что может
быть причиной их токсического действия.
Молекула местного анестетика состоит из третичного амина, бензольного
кольца и соединяющей их цепочки эфирной или амидной структуры.
Классификация местных анестетиков на эфиры и амиды (в зависимости от структуры
соединяющей цепочки) важна прежде всего с точки зрения метаболизма
препаратов. Местные анестетики эфирного типа (кокаин, прокаин, тетракаин, хлоропро-
каин) подвергаются гидролизу (особенно активно под действием псевдохолинэ-
стеразы), в то время, как препараты амидного типа (лидокаин, мепивакаин,
прилокаин, бупивакаин, этидокаин, ропивакаин) подвергаются метаболической
деградации в микросомах печени.
Местные анестетики представляют собой слабые основания, поэтому их
производят в виде соли сильной кислоты (например, соляной). В водном растворе
часть препарата существует в ионизированной форме, часть — в неионизиро-
ванной. Между ионизированной и неионизированной фракцией препарата
существует динамическое равновесие. Неионизированная форма местного
анестетика лучше растворяется в жирах, и поэтому она проникает через липидную
мембрану и достигает ионного канала в месте действия быстрее, чем
ионизированная форма. Соответственно, чем ниже рКа препарата, чем выше рН
раствора, чем больше жирорастворимость, тем быстрее начинает действовать местный
анестетик. Ощелачивание раствора местного анестетика увеличивает долю
свободного основания и ускоряет начало действия препарата. Поскольку
свободно-щелочная форма менее растворима, то увеличение рН некоторых местных
анестетиков (бупивакаин) может привести к выпадению осадка.
Местные анестетики применяют в сочетании с внутривенными или
ингаляционными анестетиками во время хирургического вмешательства (они
значительно уменьшают потребность в системных анальгетиках и анестетиках), а
также для лечения послеоперационного болевого синдрома. Местные
анестетики используют для инфильтрации тканей, блокады периферических нервов и
нервных стволов, а также аля спинномозговой и эпидуральной блокады. Для
Фармакокинетика и фармакодинамика препаратов при ТВВА 77
продолжительных операций предпочтительнее применять бупивакаин, если же
важно достичь эффекта быстро, препаратом выбора является лидокаин.
Существуют показания и для внутривенного введения местных анестетиков (см. ниже).
Внутривенная регионарная анестезия (блокада по Виру)
Существует методика внутривенной регионарной анестезии конечности. Для
этого вначале вытесняют кровь из вен конечности (наложением эластичного
бинта), затем раздувают манжетку проксимально наложенного
пневматического турникета, после чего через катетер вводят местный анестетик в/в. Впервые
эта методика была описана в 1908 г. Августом Биром и известна под названием
блокада по Виру. На самом деле Вир не обескровливал конечность с помощью
эластичного бинта, а просто вводил прокаин в/в между двумя наложенными
турникетами. Методика не была особенно популярной до 1963 г., когда Макки-
нон Холмс ввел лидокаин в обескровленную руку, используя пневматический
турникет с одной манжеткой [52]. Местный анестетик достаточно быстро
достигает окончаний кожных нервов и мелких нервных веточек, и поэтому так же
быстро (спустя 5—10 мин) развивается анестезия [53]. Молекулы местных
анестетиков проникают и в сосуды, питающие крупные нервные стволы, что
обеспечивает более глубокую анальгезию. Диффузия местного анестетика за
пределы изолирующего турникета (вследствие неисправности или
неправильного применения оборудования, или же из-за слишком энергичного введения
препарата), а также распространение его по сосудам, не сдавленным
турникетом (расположенным внутри костей и между ними), может привести к
опасному увеличению концентрации анестетика в крови выше токсического уровня.
В Великобритании препаратом выбора ^я внутривенной регионарной
анестезии является прилокаин, потому что он обладает относительно высоким
терапевтическим индексом. Бупивакаин, напротив, непригоден ^ля этой методики
из-за относительно высокой сердечно-сосудистой токсичности.
Системное действие местных анестетиков
Местные анестетики повышают болевой порог и могут устранять
хроническую и ишемическую боль при в/в применении [54]. Местные анестетики в/в
вводят также в качестве дополнения к общей анестезии. Наиболее
распространенным показанием к в/в применению местных анестетиков являются
желудочковые аритмии. Препаратом выбора для этой цели стал лидокаин, который
не подавляет сократимость миокарда и не влияет на функцию синусового и ат-
риовентрикулярного узлов. Лидокаин преимущественно уменьшает наклон
фазы 4 деполяризации волокон проводящей системы сердца, повышая таким
образом порог фибрилляции желудочков, но не влияя на мембранный
потенциал покоя. Другие местные анестетики также действуют на ионные каналы
миокарда, хотя из-за особенностей кинетики их взаимодействия с натриевыми
каналами миокарда соотношение благоприятных и токсических эффектов может
быть самым различным.
Лидокаин диссоциирует из связи с натриевыми каналами миокарда в
течение 200 мс, что позволяет натриевым каналам восстановить свою конформацию
во время диастолы даже на фоне выраженной такхикардии. Бупивакаин диссо-
78
Глава 3
циирует из связи с натриевыми каналами значительно дольше — в течение
1400—2000 мс. В результате, лидокаин вызывает фазовую блокаду, замедляя
проводимость и действуя как антиаритмическое средство, в то время как бупи-
вакаин вызывает тоническую блокаду, способствуя возникновению аритмий по
альтернативным проводящим путям. Лидокаин блокирует натриевые каналы
преимущественно в тканях с длительным потенциалом действия (например,
волокна Пуркинье), и поэтому он эффективнее при желудочковых аритмиях,
нежели при предсердных (в проводящей системе на уровне предсердий
продолжительность потенциала действия короче).
Токсическое действие местных анестетиков
При увеличении концентрации местных анестетиков в крови выше
определенного уровня (вследствие в/в инъекции либо поступления из периферических
тканей в кровоток) проявляется их токсическое действие. Скорость
поступления местного анестетика в кровь из периферических тканей (системная
абсорбция) зависит от абсолютного количества введенного препарата и интенсивности
кровотока в месте введения. Так, абсорбция мала при подкожном введении и
велика при межреберной блокаде. Абсорбция из области плечевого сплетения и
из эпидурального пространства по величине стоит между вышеуказанными
крайностями. Вазоконстрикторы уменьшают системную абсорбцию, хотя их
действие зависит от интенсивности кровотока в месте инъекции и в некоторой
степени от применяемого местного анестетика. Лидокаин и прилокаин
абсорбируются быстрее, чем бупивакаин. Очевидно, что непреднамеренное внутри-
сосудистое введение препарата оказывает наибольшее влияние на системную
абсорбцию, что диктует необходимость проведения аспирационной пробы
перед каждым введением местного анестетика.
Наиболее отчетливо токсическое действие местных анестетиков
проявляется в отношении ЦНС. Лидокаин в малых дозах (концентрация в плазме
1—5 мкг/мл), применяемых с антиаритмической целью, обладает противосудо-
рожной активностью, в то время как в более высоких (концентрация в плазме
4,5—7 мкг/мл), наоборот, вызывает раздражение коры и судороги. Подобные
эффекты наблюдаются и при использовании других местных анестетиков. У
местных анестетиков низкая терапевтическая широта между лечебным и токсическим
действием, поэтому аая лечения эпилептических припадков их не применяют.
К ранним симптомам нейротоксичности относятся возбуждение, странность
поведения, головокружение, околоротовые парестезии, нарушения зрения и
слуха, дизартрия, спутанность сознания и мышечная дрожь. При более высокой
концентрации препарата в крови могут возникать тонико-клонические
судороги. Этот спектр осложнений со стороны ЦНС обусловлен блокадой ингибитор-
ных нейронов, сопровождающейся разблокированием возбуждающих
нейронов. На риск нейротоксичности влияют оксигенация, кислотно-основное
состояние, а также сочетанное применение других препаратов, влияющих на
судорожную готовность. Эффективным способом уменьшения нейротоксичности
является гипервентиляция, поскольку она увеличивает оксигенацию мозга,
уменьшает стимулирующее влияние СО2, а также снижает мозговой кровоток,
уменьшая таким образом доставку местного анестетика к мозгу. Барбитураты,
Фармакокинетика и фармакодинамика препаратов при ТВВА 79
пропофол и бензодиазепины эффективно устраняют припадки,
индуцированные местными анестетиками.
Местные анестетики также способны оказывать токсическое действие на
сердечно-сосудистую систему, но для этого концентрация препарата в крови должна
быть выше, чем, например, достаточная для индукции нейротоксичности.
Соответственно, токсические реакции со стороны сердечно-сосудистой системы обычно
возникают либо при непреднамеренном быстром введении большой дозы
местного анестетика в/в, либо когда предшествующая кардиотоксичности клиническая
картина нейротоксичности маскирована состоянием общей анестезии.
Проявления токсичности могут быть различными, в том числе желудочковые аритмии, бра-
дикардия, артериальная гипотония и сердечно-сосудистый коллапс.
По сравнению с другими местными анестетиками, бупивакаин и, в меньшей
степени, этидокаин сопряжены с более высоким риском сердечно-сосудистых
осложнений, и при непреднамеренном в/в введении могут вызывать желудочковые
аритмии и фибрилляции желудочков. Возможно, это связано с большим
временем диссоциации из связи с натриевыми каналами в миокарде, что вызывает
тоническую блокаду проведения. Гиперкапния, ацидоз и гипоксемия потенцииру-
ют токсическое действие бупивакаина на сердечно-сосудистую систему.
Натриевые каналы миокарда стереоспецифичны. Бупивакаин представляет
собой рацемическую смесь двух энантиомеров — R(+) и S(—). Было доказано,
что аритмогенность R(+) бупивакаина в несколько раз больше, чем его энан-
тиомера. Этот факт позволяет объяснить малую кардиотоксичность ропивакаи-
на по сравнению с бупивакаином, поскольку ропивакаин существует лишь
в виде чистого S(—) энантиомера. Существует также интерес к разработке
чистого S(—) бупивакаина.
Резюме
В/в применение местных анестетиков в основном ограничено лечением
аритмий и проведением внутривенной регионарной анестезии. Вместе с тем,
в современной анестезиологии топическая, инфильтрационная и регионарная
анестезия местными анестетиками занимает важное место, поскольку
органично вписывается в стратегию сбалансированной анестезии (позволяет снизить
дозу опиоидов и других анестетиков) и обеспечивает продолжительную
послеоперационную анальгезию. Благодаря системной абсорбции концентрация
местного анестетика в крови может достигать значительного уровня и при внесо-
судистой инъекции, поэтому анестезиолог должен знать о системном и
токсическом действии местных анестетиков.
Вспомогательные препараты, применяемые для лечения
боли
а2- адреномиметики
а2-адреномиметики достаточно давно используются в ветеринарной
анестезиологии, в то время как их применение у людей в США и странах Западной
Европы все еще считается экспериментальным. Активация а,2-адренорецепто-
ров приводит к угнетению аденилатциклазы, уменьшает количество цАМФ
80
Глава 3
и протеинкиназы, и модифицирует регуляторные белки таким образом, что
уменьшается нейрональная импульсация и угнетается выброс нейротрансмит-
теров. У людей наиболее хорошо исследованы два препарата — клонидин и
дексмедетомидин.
Клонидин представляет собой частичный агонист а2-адренорецепторов.
После приема внутрь он быстро всасывается, пиковая концентрация в крови
достигается через 60—90 мин. Его можно назначать и чрескожно, хотя при этом
АЛЯ достижения пиковой концентрации может потребоваться до двух суток.
Клонидин является относительно длительно действующим препаратом, его
элиминация почти в равной пропорции обусловлена метаболизмом в печени и
почечной экскрецией.
Дексмедетомидин является полным агонистом а2-адренорецепторов, он
действует мощнее и селективнее клонидина.
Применение а2-адреномиметиков в анестезиологии
Одним из показаний к применению а2-адреномиметиков является премеди-
кация. Клонидин (0,3 мг) обеспечивает седацию и анксиолитический эффект,
сравнимый с действием бензодиазепинов. Вне зависимости от того, был назначен
препарат внутрь или сублингвально, действие его развивается относительно
быстро, что позволяет применять его в различных клинических ситуациях. а2-адрено-
миметики подавляют секрецию слюнных желез. Хотя раньше в отношении
препарата для премедикации это свойство считалось желательным, в настоящее
время большинство анестезиологов расценивает его как необязательное, а
большинство больных находит неприятным. а2-адреномиметики значительно снижают
потребность во в/в и ингаляционных анестетиках. В наибольшей степени этот
эффект выражен, когда клонидрш назначают до операции. Клонидин снижает
МАК галотана на 50%, позволяет уменьшить индукционную дозу в/в анестетика,
снижает потребность в опиоидах на 40—45%. Дексмедетомидин еще более
эффективен: в экспериментах на животных он снижал МАК галотана на 95% [55].
Хотя эти препараты эффективно снижают потребность в других анестетиках у
человека, их изолированное применение неспособно индуцировать состояния
анестезии.
а2-адреномиметики обладают мощным симпатолитическим действием, что
имеет особенно благоприятный характер у больных с ИБС и артериальной
гипертонией. К сожалению, то же симпатолитическое действие достаточно часто
является причиной выраженной брадикардии и артериальной гипотонии. Бра-
дикардию можно предотвратить или устранить холиноблокаторами (атропин,
гликопирролат), их применение в свою очередь сопряжено с нестабильной и
непредсказуемой ЧСС, что особенно нежелательно при сопутствующих
сердечно-сосудистых заболеваниях. В настоящее время не существует достоверных
данных, позволяющих сделать четкий вывод об улучшении (или, наоборот,
ухудшении) исхода при периоперационном применении а2-адреномиметиков
у больных с сопутствующими тяжелыми сердечно-сосудистыми заболеваниями.
а2-адреномиметики позволяют обеспечить послеоперационную анальгезию.
В большинстве случаев а2-адреномиметики оказались не особенно
эффективными анальгетиками вне сочетания с другими препаратами. Вместе с тем, они
Фармакокинетика и фармакодинамика препаратов при ТВВА
81
пролонгируют анальгезию и сокращают потребность в опиоидах, что
значительно снижает частоту и выраженность побочных эффектов опиоидов (особенно
депрессии дыхания). а2-адреномиметики могут замедлять пробуждение,
поскольку обладают мощным седативным действием. Нежелательной
представляется возникающая брадикардия. Появление в клинической практике
специфического (Х2-адреноблокатора (например, атипамезола) позволит ускорить
пробуждение и своевременно устранить побочные эффекты а2-адреномиметиков.
<Х2-адреномиметики оказывают мощное седативное, анксиолитическое и
анальгетическое действие, значительно снижают потребность в ингаляционных
и в/в анестетиках, стабилизируют сердечно-сосудистую систему. Их
целесообразно применять для премедикации, особенно при сопутствующих
сердечно-сосудистых заболеваниях. Определенную проблему представляет побочное
действие а2-адреномиметиков. Остаточная седация замедляет восстановление
сознания. Иногда возникает выраженная брадикардия, требующая экстренных
мер. Существует настоятельная необходимость в проведении дальнейших
исследований, предназначенных для определения оптимальной точки приложения
этих интересных препаратов, для изучения отношения между затратами и
эффективностью, а также АА^ определения влияния на клинические исходы.
/З-адреноблокапюры
Р-адреноблокаторы позволяют предотвратить острые сердечно-сосудистые и
другие соматические проявления ноцицептивной стимуляции,
р-адреноблокаторы не вызывают анальгезии. Во время артроскопических операций в условиях
пропофоловой анестезии короткодействующий р-адреноблокатор эсмолол
ослаблял реакцию кровообращения на хирургическую стимуляцию аналогично
альфентанилу [56]. р-адреноблокаторы снижают выраженность реакции
кровообращения на болевую стимуляцию, но не обеспечивают анальгезию, хотя
позволяют предотвратить серьезные сердечно-сосудистые нарушения у больных
с сопутствующей артериальной гипертонией. Особое внимание следует
обратить на то, чтобы р-адреноблокаторы не маскировали симптомы неадекватной
анестезии, иначе сильная боль может привести к интраоперационному
восстановлению сознания.
Антагонисты кальция
Хотя антагонисты кальция не являются рутинным компонентом ТВВА, они
позволяют быстро устранить интраоперационный подъем АД. Кроме того,
применение антагонистов кальция оказывает благоприятное воздействие при
острой ишемии миокарда. Эти препараты можно вводить внутривенно; кроме
того, они быстро всасываются при приеме под язык.
Миорелаксанты
Впервые о миорелаксантах стало известно в XVI веке, когда европейцы
наблюдали действие яда, которым индейцы Амазонии смазывали наконечники стрел.
Как выяснилось позже, активным ингредиентом яда был кураре. В 1850 г. было
установлено, что icypape действует на нервно-мышечный синапс, не влияя на
6 Тотальная внутривенная анестезия
82
Глава 3
сами мышцы и нервы. Считают, что впервые кураре во время анестезии
применил Гриффит и Джонсон в 1942 г. [57], хотя на самом деле первое сообщение об
использовании кураре в хирургии было опубликовано в немецком журнале еще
в 1912 г. На этапе внедрения в практику миорелаксанты применяли в больших
дозах в сочетании с кислородом, закисью азота и на фоне гипервентиляции (так
называемая «ливерпульская методика»), что сопровождалось высокой частотой
интраоперационного восстановления сознания. В настоящее время используют
намного меньшие дозы миорелаксантов, необходимые только ^ая облегчения
хирургического доступа и ИВЛ, в то время как анальгезия и устранение сознания
обеспечиваются ингаляционными или внутривенными анестетиками. Тем не
менее и при таком подходе использование миорелаксантов увеличивает риск
интраоперационного восстановления сознания (глава 5).
В настоящее время применяют ряд миорелаксантов. Эти препараты
отличаются быстротой наступления эффекта, продолжительностью действия и
побочными реакциями (табл. 3.5). Миорелаксанты подразделяют на
деполяризующие (которые действуют подобно ацетилхолину, вызывая возбуждение мышцы
до наступления релаксации) и недеполяризующие (конкурентные антагонисты
ацетилхолина). Применение деполяризующих миорелаксантов сопряжено со
многими побочными эффектами, и в практике остался только суксаметоний,
обладающий такими полезными свойствами, которых лишены
недеполяризующие препараты.
Суксаметоний
(синонимы: сукцинияхолин, диацетилхолин)
Суксаметоний состоит из двух молекул ацетилхолина, соединенных между
собой через ацетильные группы. В результате взаимодействия суксаметония
с холинорецептором открываются ионные каналы, и возникает деполяризация.
В отличие от ацетилхолина, суксаметоний находится в связи с
холинорецептором достаточно долгое время, обеспечивая таким образом релаксацию.
Большинство побочных эффектов суксаметония обусловлено деполяризацией холи-
норецепторов нервно-мышечного синапса (фасцикуляции, высвобождение
калия) или м-холинорецепторов (брадикардия). Небольшая продолжительность
действия суксаметония объясняется его быстрым метаболизмом под действием
холинэстеразы плазмы (бутирилхолинэстераза) до сукцинилмонохолина,
который в свою очередь разлагается на янтарную кислоту и холин. Нарушение
активности холинэстеразы плазмы увеличивает продолжительность действия
суксаметония. При приобретенном дефиците холинэстеразы плазмы (заболевания
печени, плазмаферез) продолжительность действия суксаметония увеличивается
умеренно, в то время как при врожденном дефиците (частота 1 на 20 000
населения) нервно-мышечная блокада может длиться несколько часов. Главным
преимуществом суксаметония является быстрое наступление глубокой миорелакса-
ции, что делает его препаратом выбора АА^ интубации трахеи в экстренных
случаях с полным желудком. Вторым преимуществом является его предсказуемо
короткая продолжительность действия (в отсутствие дефицита холинэстеразы),
что гарантирует быстрое восстановление самостоятельного дыхания (весьма
желательное в некоторых клинических ситуациях), а также обеспечивает опре-
84
Глава 3
деленную степень безопасности в случае неудавшейся интубации. Поскольку
суксаметоний вызывает достаточно много нежелательных побочных эффектов
(табл. 3.6), в настоящее время его применение ограничено теми ситуациями,
в которых он имеет отчетливое преимущество перед недеполяризующими мио-
релаксантами.
Таблица 3.6. Побочные эффекты суксаметония
Фасцикуляции
Боль в мышцах
Увеличение внутричерепного, внутриглазного и внутрижелудочного давления
Высвобождение калия
Вызывает аритмии и/или остановку кровообращения
Особенно высока клиническая значимость при ожогах, денервапии, (например,
тетра- и параплегия), нервно-мышечных заболеваниях, почечной недостаточности
Сердечно-сосудистая система
Брадикардия и/или асистолия (особенно при повторном введении)
Заболевания мышц
Мощный провоцирующий фактор злокачественной гипертермии
При некоторых миопатиях вызывает выраженный выброс калия
Пролонгированное действие
Врожденные дефекты холинэстеразы
Приобретенный дефицит холинэстеразы
Блокада II типа при продолжительном введении препарата
Недепояяризующие миорелаксанты
По структуре недеполяризующие миорелаксанты подразделяют на бензилизо-
хинолины и стероиды. Бензилизохинолинам свойственно вызывать
высвобождение гистамина, что сопряжено с риском сердечно-сосудистых побочных реакций.
Для оценки миорелаксантов необходимо охарактеризовать ряд параметров.
Мощность определяется параметром ED95, который представляет собой
среднюю дозу миорелаксанта, необходимую аая угнетения вызванного ответа
приводящей мышцы большого пальца кисти на 95%. Стандартная доза АА^ интубации
трахеи составляет две 2 х ED95, хотя мя некоторых препаратов с медленным
развитием действия она обычно достигает 3 х ED95- Начало действия изменяется от
момента введения препарата до пикового эффекта, хотя интубация трахеи
возможна рке чуть раньше достижения этого пика. Если повысить дозу препарата,
то эффект будет достигнут быстрее, но продолжительность действия в этом случае
тоже увеличивается. Среди миорелаксантов наблюдается обратная зависимость
между мощностью и быстротой действия: чем быстрее действует препарат, тем
Фармакокинетика и фармакодинамика препаратов при ТВВЛ 85
ниже его мощность. Продолжительность действия миорелаксантов обычно
определяется как время от начала действия до восстановления амплитуды вызванного
мышечного ответа на 25%. Этот период приблизительно соответствует времени,
по прошествии которого необходимо ввести дополнительную дозу препарата для
обеспечения хирургической релаксации.
Клиренс большинства современных недеполяризующих миорелаксантов
достаточно высок, они не кумулируют. Это означает, что при повторном введении
продолжительность эффекта будет такая же, как и при первом. При
использовании некоторых давно разработанных миорелаксантов, а также при
сопутствующих заболеваниях почек и печени продолжительность действия может
увеличиваться. Метаболизм и элиминация атракурия и цис-атракурия лишь
незначительно зависят от печени и почек, они спонтанно разлагаются в плазме в ходе
неферментативного процесса, получившего название элиминации Хоффмана.
Соответственно, дисфункция печени или почек не оказывает особого влияния
на продолжительность действия атракурия и цис-атракурия. Мониторинг
нервно-мышечной блокады обеспечивает точную оценку продолжительности
действия препарата и полноценности восстановления нервно-мышечного
проведения, что, например, дает точный ориентир для повторного введения препарата.
При использовании миорелаксантов короткого действия спонтанное
восстановление мышечного ответа до TOF-отношения > 70% считают критерием,
позволяющим безопасно удалить эндотрахеальную трубку. При использовании
большинства недеполяризующих миорелаксантов спонтанное восстановление
нервно-мышечной проводимости происходит слишком медленно, и для устранения
их действия часто назначают ингибиторы ацетилхолинэстеразы (см. ниже
в этой главе).
В табл. 3.5 отражены ключевые фармакокинетические и фармакодинамиче-
ские параметры недеполяризующих миорелаксантов. Ниже представлена
дополнительная информация.
Атракурий и цис-атракурий
Атракурий в некоторой степени подвергается метаболизму печенью и
выводится почками, но в основном его метаболическая деградация до неактивных
компонентов происходит в ходе спонтанного процесса, называемого
элиминацией Хоффмана. Этот процесс протекает при физиологических значениях рН и
температуры тела, что делает атракурий относительно стабильным в кислом
растворе при низкой температуре. Элиминация Хоффмана обеспечивает
метаболическую деградацию атракурия даже в отсутствие функции печени и почек.
Основным недостатком атракурия является индукция выброса гистамина. Один
из десяти оптических изомеров атракурия — цис-атракурий, напротив, не
высвобождает гистамин и поэтому не влияет на сердечно-сосудистую систему.
Цис-атракурий мощнее атракурия и поэтому начинает действовать медленнее.
Начало действия молено несколько ускорить увеличением индукционной дозы
до трех ED95, хотя это чревато удлинением действия. Цис-атракурий тоже
подвергается элиминации Хоффмана.
86
Глава 3
Мивакурий
Мивакурий обладает самым непродолжительным действием среди всех неде-
поляризующих миорелаксантов. Подобно суксаметонию, мивакурий гидролизу-
ется холинэстеразой плазмы, и при снижении уровня этого фермента
продолжительность действия препарата возрастает. Мивакурий вызывает значительное
высвобождение, что сопряжено с риском артериальной гипотонии и
тахикардии. Снижение дозы и медленное введение препарата позволяют уменьшить
выраженность этой гемодинамической реакции, но значительно замедлит
начало действия и уменьшит его продолжительность.
Панкуроний
Панкуроний является первым синтетическим миорелаксантом стероидной
структуры. Он обладает некоторым ваголитическим действием, приводящим
к тахикардии, повышению АД и сердечного выброса. Его элиминация в
большой степени зависит от почечной экскреции, поэтому при почечной
недостаточности препарат может кумулировать. В связи с большой
продолжительностью действия и побочным действием на кровообращение препарат используют
достаточно редко. Иногда панкуроний применяют в кардиоанестезиологии, где
его ваголитическое действие может компенсировать брадикардию, часто
развивающуюся в результате действия высоких доз опиоидов.
Векуроний
По структуре векуроний близок к панкуронию, но не оказывает влияния на
кровообращение и характеризуется средней продолжительностью действия.
Поскольку элиминация векурония определяется метаболизмом в печени и
почечной экскрецией, он относительно независим от дисфункции этих органов,
хотя и не в такой степени, как атракурий.
Рокуроний
Рокуроний очень напоминает векуроний, за исключением более быстрого
начала действия. Отличные условия аля интубации трахеи обеспечиваются уже
через 1 мин после введения рокурония — практически так же быстро, как при
использовании суксаметония [58]. В высоких дозах рокуроний вызывает
легкую тахикардию (хотя не столь выраженную, как под действием панкурония),
а при печеночной недостаточности кумулирует больше, чем векуроний.
Доксакурий и пипекуроний
Продолжительность действия обоих этих препаратов очень высока
(приблизительно как у панкурония). Они не оказывают неблагоприятного действия на
кровообращение. В настоящее время существует тенденция к многократному
введению (или инфузии) миорелаксантов короткого действия, поэтому в США
популярность доксакурия и пипекурония невысока. В Великобритании
доксакурий и пипекуроний недоступны.
Фармакокинетика и фармакодинамика препаратов при ТВВА #7
Перспективы развития
Давно уже существовало желание создать недеполяризующий миорелаксант,
обладающий быстрым началом и малой продолжительностью действия,
сравнимый по этим параметрам с суксаметонием. К настоящему времени были
достигнуты быстрое начало действия (рокуроний) и относительно небольшая
продолжительность действия (мивакурий), но по отдельности, а не в составе
одного препарата. В поисках «недеполяризующей замены суксаметония» было
выполнено большое количество исследований на животных и ранних фаз
клинических испытаний. В настоящее время наиболее многообещающим
представляется испытываемый препарат ORG9487. Он обладает малой мощностью,
связанной с быстрым началом действия, ED90 составляет 1,15 мг/кг. Среднее время
начала действия после введения в дозе 1,5 мг/кг составляет 83 с, что лишь
немногим дольше по сравнению с суксаметонием (67 с). Через 1 мин после
начала введения условия для интубации трахеи были почти такие же, как через
1 мин после введения суксаметония [59]. Время спонтанного восстановления
нервно-мышечной проводимости до TOF-отношения > 70% составляет 24
мин, но при условии применения неостигмина не позже чем через 2 мин после
введения миорелаксанта может быть уменьшено до 11,6 мин [59]. Эта
необычная тактика может быть оправданной в случае «неудавшейся» интубации. В
отличие от суксаметония и мивакурия, восстановление нервно-мышечной
проводимости после введения ORG9487 не зависит от активности холинэстеразы
плазмы. Тем не менее, продолжительность действия препарата дольше, чем у
суксаметония. Остается еще выяснить, приведет ли увеличение дозы
(обусловленное малой мощностью) к чрезмерному удорожанию препарата или
выраженным побочным эффектам.
Резюме
Миорелаксанты стали важным компонентом современной
сбалансированной анестезии и ТВВА. Большинство современных миорелаксантов не вызывает
значительных побочных эффектов (особенно векуроний и цис-атракурий).
С применением миорелаксантов сопряжены некоторые сложности, в том числе
колебания продолжительности действия, кумуляция при определенных
заболеваниях, неадекватное прекращение действия. Некоторые миорелаксанты
вызывают побочные эффекты (высвобождение гистамина), выраженность которых
меньше у более новых препаратов. Миорелаксанты уникальны в том
отношении, что возможен прямой и точный мониторинг их действия, поэтому
удивляет недостаточно широкая распространенность мониторинга нервно-мышечной
проводимости. В заключение необходимо напомнить, что применение
миорелаксантов маскирует важные симптомы неадекватности анестезии и
увеличивает частоту интраоперационного восстановления сознания. Поэтому
миорелаксанты следует использовать только в тех случаях, когда они действительно
необходимы, и ограничиваться минимально эффективными дозами.
88
Глава 3
Антагонисты препаратов, применяемых
для внутривенной анестезии
Антагонисты опиоидов
Специфическим антагонистом опиоидов является налоксон, устраняющий
все эффекты опиоидов — как лечебные, так и побочные. Он начинает
действовать через 1—2 мин после в/в введения, обладает небольшой
продолжительностью действия. Продолжительность действия налоксона обычно меньше, чем у
введенного ранее опиоида. Следовательно, спустя какое-то время действие
опиоида может возобновиться, и тогда следует ввести налоксон повторно.
Поскольку налоксон устраняет все эффекты опиоидов, его следует вводить очень
медленно и только до того момента, пока не исчезнут потребовавшие его
назначения побочные эффекты. При таком подходе после применения налоксона
сохраняется определенная степень анальгезии. Альтернативная тактика
предполагает применение дыхательных стимуляторов (например, доксапрам), которые
быстро устраняют обусловленную опиоидами депрессию дыхания, не снижая
уровень анальгезии. Тщательное дробное введение опиоидов до достижения
желаемой анальгезии снижает риск передозировки и потребность в антагонистах.
Недавно появился еще один антагонист опиоидов — налмефен. Его
продолжительность действия значительно больше, чем у налоксона, что снижает риск
рецидива побочных эффектов опиоидов («ренаркотизацию»). Налмефен вводят
в разовой дозе 0,25 мкг/кг, которую можно повторять каждые 2—3 мин до
достижения эффекта. Как и налоксон, налмефен устраняет как анальгетическое,
так и побочное действие опиоидов. Другим длительно действующим
антагонистом опиоидов является налтрексон. Его можно назначать не только
парентерально, но и внутрь. При приеме внутрь налтрексон устраняет зуд,
обусловленный эпидуральным введением опиоидов. Некоторые фармакокинетические
параметры антагонистов опиоидов приведены в табл. 3.4.
Антагонисты бензодиазепинов
Флумазенил является конкурентным антагонистом бензодиазепиновых
рецепторов. Флумазенил устраняет все поведенческие, неврологические и
электрофизиологические эффекты бензодиазепинов. Растворим в водных растворах
с низким рН. Подобно бензодиазепинам, он в высокой степени связывается
с белками плазмы. Вследствие интенсивного метаболизма в печени клиренс флу-
мазенила высок (5—20 мл/кг/мин). Остальные фармакокинетические
параметры: Т1/2Р 0,7—1,3 ч, Vdss 0,6—1,6 л/кг.
Сам по себе флумазенил не оказывает действия на ЦНС,
сердечно-сосудистую систему и систему дыхания. Флумазенил устраняет эффекты
бензодиазепинов: в дозе 0,1—0,2 мг частично, а в дозе 0,4—1,0 мг — полностью (при
условии, что применялись стандартные дозы бензодиазепинов). Флумазенил можно
использовать аая выявления причины длительного угнетения сознания в
отделении интенсивной терапии. Он может ускорить пробркдение после бензодиазе-
пиновой седации. Поскольку плазменный клиренс флумазенила выше, чем ми-
дазолама (и, тем более, других бензодиазепинов), то существует риск возобнов-
Фармакокинетика и фармакодинамика препаратов при ТВВА
89
ления седации при однократном введении флумазенила, если до того ввели
большую дозу мидазолама или проводили его инфузию [60]. Возобновление
седации маловероятно, если начальная доза мидазолама была минимально
эффективной (рис. 3.3).
Рис. 3.3. Взаимодействие между мидазоламом и флумазенилом в различных
клинических ситуациях. И — Больной, находящийся в отделении интенсивной терапии; А —
Анестетическая доза мидазолама, назначенная больному со сниженной элиминацией
(верхняя линия) или нормальной элиминацией (нижняя линия); С — Седативная доза
мидазолама. Пунктирная линия обозначает уровень седации в отсутствие флумазенила.
BZ — бензодиазепин. Воспроизведено с разрешения [61]
Антагонисты миорелаксантов
Медикаментозное устранение действия недеполяризующих миорелаксантов
является распространенной практикой. Это обусловлено тем, что хотя
хирургическая миорелаксация регрессирует достаточно быстро, j^sl полного
восстановления нервно-мышечной проводимости требуется значительно больше времени.
Это кажущееся противоречие объясняется значительным резервом холиноре-
цепторов, расположенных на нервно-мышечных синапсах нормальных
скелетных мышц. Мышечная сила, достаточная аля движения и даже аля вентиляции,
может быть достигнута даже на фоне умеренной нервно-мышечной блокады.
Способность поддерживать тетаническое сокращение (необходимое для
большинства физиологических движений) или вызывать кашель АА^ защиты
дыхательных путей требует намного большей силы и возможна лишь при
нормальном функционировании большинства нервно-мышечных синапсов. Поэтому
антагонисты миорелаксантов назначают практически во всех случаях
применения недеполяризующих миорелаксантов. Исключения составляют ситуации,
90
Глава 3
когда применяются короткодействующие миорелаксанты (мивакурий) или со
времени последнего введения миорелаксанта прошло достаточно много
времени, так что больной способен поддерживать физиологический тетанус (т. е.
может приподнять голову над подушкой не менее чем на 5 с) или его TOF-otho-
шение > 70%.
Антагонистами миорелаксантов являются ингибиторы ацетилхолинэстеразы,
подавляющие гидролиз ацетилхолина (во всех холинергичесих синапсах). В
результате их воздействия ацетилхолин дольше присутствует в синаптической
щели, что позволяет ему более успешно конкурировать с миорелаксантами за
холинорецепторы в нервно-мышечных синапсах. Поскольку ингибиторы
ацетилхолинэстеразы действуют на все холинергические синапсы, то они также
усиливают действие ацетилхолина в синапсах вегетативной нервной системы.
Ввиду этого ингибиторы ацетилхолинэстеразы обычно назначают в сочетании
с холиноблокаторами — атропином или гликопирролатом, которые действуют
на все холинергические синапсы, за исключением нервно-мышечных. В клинике
применяют ингибиторы ацетилхолинэстеразы обратимого действия,
продолжительность их эффекта приблизительно такая же (или даже чуть дольше), как и у
миорелаксантов. Наиболее распространенными ингибиторами ацетихолинэсте-
разы являются неостигмин (в России известен под названием прозерин —
прим. пер.) и эдрофоний. Неостигмин назначают в дозе 35 мкг/кг (в сочетании
с атропином 10—20 мкг/кг), при этом максимальный эффект достигается
через 5—7 мин — при условии, что к моменту введения препарата
нервно-мышечная проводимость в некоторой степени восстановилась. При более глубокой
блокаде потребуется большая доза препарата, и нервно-мышечная
проводимость будет восстанавливаться медленнее. По сравнению с неостигмином,
эдрофоний (0,5—1,0 мг/кг) действует быстрее и менее продолжительно, поэтому
его целесообразно применять для устранения эффекта миорелаксантов средней
продолжительности действия. Если применялись миорелаксанты длительного
действия, то введение эдрофония иногда устраняет их эффект только на
какое-то время, после чего миорелаксация рецидивирует.
Избыточные дозы ингибиторов ацетилхолинэстеразы могут вызывать
аналогичный деполяризующему нервно-мышечный блок, хотя это осложнение
возникает значительно реже, чем неполное устранение действия недеполяризующих
миорелаксантов. Имеются доказательства, что ингибиторы ацетилхолинэстеразы
увеличивают частоту ПОТР. Кроме того, применение ингибиторов
ацетилхолинэстеразы сопряжено с повышением частоты несостоятельности кишечных
анастомозов. Поэтому представляется логичным по возможности избегать назначения
ингибиторов ацетилхолинэстеразы, что наилучшим образом достигается
применением очень малых доз миорелаксантов короткого действия и мониторингом
нервно-мышечной проводимости.
Фармакокинетика и фармакодинамика препаратов при ТВВА
91
Заключение
За прошедшие годы в клинической практике появилось много внутривенных
анестетиков с гипнотическим эффектом, другие препараты, наоборот, вышли из
употребления. В настоящее время наиболее популярным из внутривенных гип-
нотиков стал пропофол. Возможно, увенчаются успехом разработки и
продвижение в практику растворенного в жировой эмульсии этомидата и S(+) кета-
мина. Успех пропофола объясняется короткой продолжительностью действия,
что облегчает управление глубиной анестезии и дает возможность быстро
пробудить больного по окончании операции. Доза пропофола аая поддержания
сбалансированной анестезии составляет 75—200 мкг/кг/мин (что
соответствует «целевой» концентрации в плазме 3—7 мкг/мл), при изолированном
применении — 100—300 мкг/кг/мин («целевая» концентрация 6—10 мкг/мл).
В дозе 25—75 мкг/кг/мин («целевая» концентрация 0,5—1,0 мкг/мл)
пропофол позволяет обеспечить качественную седацию.
Как правило, в/в анестетики сочетают с опиоидными анальгетиками. До
недавнего времени наиболее распространенными опиоидами на Западе были аль-
фентанил и суфентанил. Альфентанил обычно назначают в виде инфузии,
поскольку продолжительность его действия невелика. В сочетании с пропофолом
нагрузочная доза альфентанила составляет 25— 50 мкг/кг, после чего переходят
на поддерживающую инфузию в дозе 0,5—2,0 мкг/кг/мин (что соответствует
концентрации в плазме 100—200 нг/мл). Вскоре опиоидом выбора ^А^
сочетания с пропофолом может стать ремифентанил. Для большинства операций
поддерживающая доза ремифентанила составляет 0,25—0,5 мкг/кг/мин, хотя ее
можно легко увеличить, не вызвав замедления пробуждения. При острой
необходимости углубления анальгезии (например, аая подавления прессорной
реакции на интубацию трахеи) ремифентанил можно ввести в нагрузочной дозе
0,25—0,5 мкг/кг. Адекватная анальгезия достигается в течение нескольких
минут от начала инфузии. Ремифентанил можно применять для седации в
сохраненном сознании, особенно когда интраоперационная боль выражена
умеренно. Доза ремифентанила аая седации при сохраненном сознании составляет
0,1 мкг/кг/мин, при этом значимой депрессии дыхания не возникает. В перио-
перационном периоде по мере возможности следует применять НПВП и
местные анестетики, что снижает потребность в опиоидах (и частоту сопряженных
с их применением побочных эффектов), а также улучшает качество анальгезии.
Важным компонентом ТВВА и сбалансированной внутривенной анестезии
являются миорелаксанты. В настоящее время существует широкий выбор мио-
релаксантов, и препараты последнего поколения практически лишены
побочных эффектов и не кумулируют даже при тяжелой дисфункции печени или
почек. Выбор миорелаксанта в первую очередь определяется необходимой
продолжительностью действия. Новые миорелаксанты характеризуются либо быстрым
началом, либо короткой продолжительностью действия. Сохраняется
необходимость в препарате, объединяющем в себе оба эти свойства.
Несмотря на существование антагонистов бензодиазепинов, опиоидов и
миорелаксантов, в анестезиологии достаточно часто применяют лишь
препараты последней группы — ингибиторы ацетилхолинэстеразы. В первую очередь
92
Глава 3
это обусловлено тем, что продолжительность действия антагонистов, как
правило, меньше, чем самих бензодиазепинов и опиоидов. Следовательно, устранение
антагонистами избыточной седации или депрессии дыхания может быть
временным. Особенную опасность представляет то, что действие опиоидов или
бензодиазепинов часто возобновляется достаточно отсроченно, когда больной
находится уже вне пристального наблюдения. Кроме того, сами антагонисты не
лишены побочных эффектов. По мере появления препаратов короткого
действия (мивакурий, ремифентанил) антагонисты будут использовать еще реже.
Список литературы
1. Borgeat A, Wilder-Smith OHG, Jallon P, Suter PM. Propofol in the management of refractory
status epilepticus: a case report. Intens Care Med 1994;20:148-149.
2. Reddy RV, Moorthy SS, Dierdorf SF, Deitch RD Jr, Link L. Excitatory effects and electroencepha-
lographic correlation of etomidate, thiopental, methohexital, and propofol. Anesth Analg
1993;77:1008-1011.
3. Grounds RM, Twigley AJ, Carli F, Whitwam JG, Morgan M. The haemodynamic effects of
intravenous induction. Comparison of the effects of thiopentone and propofol. Anaesthesia
1985;40:735-740.
4. Roberts FL, Dixon J, Lewis GTR, Tackley RM, Prys-Roberts C. Induction and maintenance of
propofol anaesthesia. A manual infusion scheme. Anaesthesia 1988;43 (supplement) :14-17.
5. Haessler R, Madler C, Klasing S, Schwender D, Peter K. Propofol/fentanyl versus etomidate fen-
tanyl for the induction of anesthesia in patients with aortic insufficiency and coronary artery
disease. ] Cardiothorac Vase Anesth 1992;6:173-180.
6. Underwood SM, Davies SW, Feneck RO, Walesby RK. Anaesthesia for myocardial
revascularisation: a comparison of fentanyl/propofol with fentanyl/enflurane. Anaesthesia 1992; 47:939-945.
7. Hall RI, Murphy JT, Landymore R, et at Myocardial metabolic changes during propofol
anesthesia for cardiac surgery in patients with reduced ventricular function. Anesth Analg
1993;77:680-689.
8. Chong JL, Grebenik C, Sinclair M, et at The effect of a cardiac surgical recovery area on the
timing of extubation. J Cardiothorac Vase Anesth 1993;7:137-141.
9. Robertson WR, Reader SCJ, Davison B, et at On the biopotency and site of action of drugs
affecting endocrine tissue with special reference to the anti-steroidogenic effect of anaesthesic agents.
Postgrad Med J 1985;61 (supplement 3):145-151.
10. Aitkenhead AR, Pepperman ML, Willatts SM, et al. Comparison of propofol and midazolam for
sedation in critically ill patients. Lancet 1989;ii:704-709.
11. Fredman B, d EtienneJ, Smith I, Husain MM, White PF. Anesthesia for electroconvulsive therapy:
effects of propofol and methohexital on seizure activity and recovery. Anesth Analg 1994;
79:75-79.
12. McKenzie AJ, Couchman KG, Pollock N. Propofol is a safe anaesthetic agent in malignant
hyperthermia susceptible patients. Anaesth Intens Care 1992;20:165-168.
13. Borgeat A, Wilder-Smith OHG, Suter PM. The nonhypnotic therapeutic applications of propofol.
Anesthesiology 1994;80:642-656.
14.DiFlorio T. Is propofol a dopamine antagonist? (letter). Anesth Analg 1993;77:200-201.
15. Smith I, White PF, Nathanson M, Gouldson R, Propofol: an update on its clinical use.
Anesthesiology 1994;81:1005-1043.
16. Borgeat A, Wilder-Smith OHG, Saiah M, Rifat K. Subhypnotic doses of propofol possess direct
antiemetic properties. Anesth Analg 1992;74:539-541.
17. Klement W, Arndt JO. Pain on injection of propofol: effects of concentration and diluent. Br ]
Anaesth 1991;67:281-284.
Фармакокинетика и фармакодинамика препаратов при ТВВЛ
93
18.Corssen G, Domino EF. Dissociative anesthesia: farther pharmacologic studies and first clinical
experience with the phencyclidine derivative CI-581. Anesth Analg 1966;42:29-40.
19. White PF, Ham J, Way WL, Trevor AJ. Pharmacology of ketamine isomers in surgical patients.
Anesthesiology 1980;52:231-239.
20. Clements JA, Nimmo WS. The pharmacokinetics and analgesic effect of ketamine in man. Br ]
Anaesth 1981;53:27-30.
21. White PF, Schuttler J, Shafer A, et at Comparative pharmacology of the ketamine isomers. Studies
in volunteers. Br J Anaesth 1985;57:197-203.
22.Chodoff P. Evidence for central adrenergic action of ketamine. Anesth Analg 1972;51:247-250.
23.Coppel DL, Bovill JG, Dundee JW. The taming of ketamine. Anaesthesia 1973;28:293-296.
24. Hatano S, Keane DM, Boggs RE, El-Naggar MA, Sadove MS. Diazepam-ketamine anaesthesia for
open heart surgery. A "micro-mini" drip administration technique. Can Anaesth Soc J 1976;
23:648-655.
25. Gutzke GE, Shah K, Glisson SN, Griesemer R, Rao TLK. Sufentanil or ketamine: Induction in
cardiomyopathy patients. Anesthesiology 1987;67:A64.
26. Marietta MP, Way WL, Castagnoli N, Trevor AJ. On the pharmacology of the ketamine enantio-
morphs in the rat. ] Pharmacol Exp Ther 1977;202:157-165.
27. Ryder S, Way WL. Comparative pharmacology of the optical isomers of ketamine in mice. Eur ]
Pharmacol 1978;49:15-23.
28. van Hamme MJ, Ghonheim MM, Ambre JJ. Pharmacokinetics of etomidate, a new intravenous
anesthetic. Anesthesiology 1978;49:274.
29. Renou AM, Vernhiet J, Macrez P, et at Cerebral blood flow and metabolism during etomidate
anaesthesia in man. Br ] Anaesth 1978;50:1047.
30. Ledingham IM, Watt I. Influence of sedation on mortality in critically ill multiple trauma patients
(letter). Lancet 1983;1:1270.
31. Wagner RL, White PF, Kan PB, Rosenthal MH, Feldman D. Inhibition of adrenal steroidogenesis
by the anesthetic etomidate. NEJM 1984;310:1415-1421.
32. Doenicke A, Roizen MF, Nebauer AE, et at A comparison of two formulations for etomidate,
2-hydroxypropyl-P-cyclodextrin (HPCD) and propylene glycol. Anesth Analg 1994;79:933-939.
33. Doenicke A, Kugler A, Vollmann N, Suttmann H, Taeger K. Etomidate with a new solubilizer.
Clinical and experimental investigations on venous tolerance and bioavailability. Anaesthetist
1990;39:475-480.
34. Doenicke A, Kugler A, Vollmann N. Venous tolerance to etomidate in lipid emulsion or
propylene glycol (hypnomidate). Can] Anaesth 1990;37:823-824.
35. Montmorency FA, Chen A, Rudel H, Glas WW, Lee LE. Evaluation of cardiovascular and general
pharmacologic properties of hydroxydione. Anesthesiology 1958;19:450-456.
36. Moneret-Vautrin DA, Laxenaire MC, Viry-Babel F. Anaphylaxis caused by anti-Cremophor EL
IgG STS antibodies in a case of reaction to Althesin. Br J Anaesth 1983;55:469-471.
37. Van Hemelrijck J, Muller P, Van Aken H, White PF. Relative potency of eltanolone, propofol,
and thiopental for induction of anesthesia. Anesthesiology 1994;80:36-41.
38. Kallela H, Haasio J, Korttila K. Comparison of eltanolone and propofol in anesthesia for
termination of pregnancy. Anesth Analg 1994;79:512-516.
39. Bailey P, Gerbode F, Garlington L. An anesthetic technique for cardiac surgery which utilizes
100% oxygen as the only inhalant. Arch Surg 1958;76:437-443.
40. Ling GSF, Spiegel K, Lockhart SH, Pasternak GW. Separation of opioid analgesia from respiratory
depression: evidence for different receptor mechanisms. J Pharmacol Exp Ther 1985;232:149-155.
41. Westmoreland CL, Hoke JF, Sebel PS, Hug CC, Muir KT. Pharmacokinetics of remifentanil
(G187084B) and its major metabolite (Gl 90291) in patients undergoing elective inpatient
surgery. Anesthesiology 1993;79:893-903.
94
Глава 3
42. Dershwitz M, Randel GI, Rosow СЕ, et al. Initial clinical experience with remifentanil, a new
opioid metabolized by esterases. Anesth Analg 1995;81:619-623.
43. Chauvin M, Lebrault C, Levron JC, Duvaldestin P. Pharmacokinetics of alfentanil in chronic
renal failure. Anesth Analg 1987;66:53-56.
44. Hoke JF, Muir KT, Glass PSA, et al. Pharmacokinetics of remifentanil and its metabolite
(Gl90291) in subjects with renal disease (abstract), Clin Pharmacol Ther 1995;57:PI55.
45. Mendel P, Fredman B, White PF. Alfentanil suppresses coughing and agitation during emergence
from isoflurane anesthesia. J Clin Anesth 1995;7:114-118.
46. Bjertraes LJ. Hypoxia-induced vasoconstriction in isolated perfused lungs exposed to injectable or
inhalation anesthetics. Acta Anaesthesiol Scand 1977;21:133-147.
47. Rich GF, Schacterle R, Moscicki JC, DiFazio CA. Ketorolac does not decrease the MAC of halotha-
ne or depress ventilation in rats. Anesth Analg 1992;75:99-102.
48. Ding Y, Fredman B, White PF. Use of ketorolac and fentanyl during outpatient gynecologic
surgery. Anesth Analg 1993;77:205-210.
49. Kenny GNC. Ketorolac trometamol — a new non-opioid analgesic. Er J Anaesth 1990;65:
445-447.
50. Dordoni PL, Delia Ventura M, Stefanelli A, et al. Effect of ketorolac, ketoprofen and nefopam on
platelet function. Anaesthesia 1994;49:1046-1049.
51. Butterworth JF, Strichartz GR. Molecular mechanisms of local anesthesia: a review. Anesthesiology
1990;72:711-734.
52. Calverley RK. Anesthesia as a specialty: past, present, and future. In: Barash PG, Cullen BF, Stoel-
ting RK, eds, Clinical Anesthesia. Philadelphia: J. B. Lippincott, 1989:3-33.
53. Raj PP, Garcia CE, Burleson JW, Jenkins MT. The site of action of intravenous regional anesthesia.
Anesth Analg 1972;51:776-786.
54. Kastrup J, Angelo H, Petersen P, Dejgarda A, Hilstead J. Treatment of chronic painful diabetic
neuropathy with intravenous lidocaine infusion. Br Med ] 1986;292:173.
55. Segal IS, Vickery RG, Walton JK, Doze VA, Maze M. Dexmedetomidine diminishes halothane
anesthetic requirements in rats through a postsynaptic alpha2 adrenergic receptors.
Anesthesiology 1988; 69:818-823.
56. Smith I, van Hemelrijck J, White PF. Efficacy of esmolol versus alfentanil as a supplement to pro-
pofol-N20 anesthesia. Anesth Analg 1991;73:540-546.
57. Griffith HR, Johnson GE. The use of curare in general anesthesia. Anesthesiology 1942;3:418-420.
58. Puhringer FK, Khueni-Brady KS, Koller J, Mitterschiffthaler G. Evaluation of the endotracheal
intubating conditions of rocuronium (ORG 9426) and succinylcholine in outpatient surgery.
Anesth Analg 1992;75:37-40.
59. Wierda JMKH, van den Broek L, Proost JH, Verbaan BW, Hennis PJ. Time course of action and
endotracheal intubating conditions of Org 9487; a new short-acting steroidal muscle relaxant: a
comparison with succinylcholine. Anesth Analg 1993;77:579-584.
60.Ghouri AF, Ramirez Ruiz MA, White PF. Effect of flumazenil on recovery after midazolam and
propofol sedation. Anesthesiology 1994;81:333-339.
61. Whitwam JG. Midazolam-flumazenil: an update. Min Invas Ther 1995;4(supplement 2):31-38.
62.Shafer SL. Advances in propofol pharmacokinetics and pharmacodynamics. ] Clin Anesth
1993;5(supplement 1):14S-21S.
Глава 4
Проведение внутривенной анестезии
в отдельных группах больных
Введение
Различные методики внутривенной анестезии можно использовать
практически у всех категорий больных и при всех видах операций. Вместе с тем, не
существует одинаковых больных и одинаковых операций, поэтому в каждом случае
методику анестезии необходимо видоизменять, чтобы лучше соответствовать
индивидуальным особенностям. Существуют определенные группы больных,
характеризующиеся схожим набором проблем. Поэтому особенности
внутривенной анестезии удобно обсуждать по отдельности в рамках каждой группы.
При амбулаторных вмешательствах, где здоровье пациентов обычно хорошее
(за исключением хирургической патологии), особое внимание уделяется
быстрому пробркдению в ясном сознании, а также отсутствию побочных эффектов,
включая те, которые в других областях анестезиологии расценивают как
«незначительные». В силу физиологических различий, у детей по сравнению с
взрослыми дозы препаратов мя индукции и поддержания анестезии выше (в пересчете
на килограмм веса). Характер хирургических и сопутствующих заболеваний у
детей тоже иной, чем у взрослых. Пожилые реагируют на анестетики иначе,
чем больные среднего возраста. Кроме того, они часто страдают тяжелыми
сопутствующими заболеваниями, влияющими на действие анестетиков и ход
операции. Больные, находящиеся в критическом состоянии, представляют собой
группу высокого риска, что обусловлено острыми тяжелыми физиологическими
нарушениями, часто накладывающимися на хроническое заболевание.
Настоящая глава посвящена некоторым важным особенностям внутривенной
анестезии у этих четырех групп больных.
Внутривенная анестезия при амбулаторных
вмешательствах
Из-за необходимости выписки в день поступления анестетик АА^
амбулаторной анестезиологии должен обеспечивать не только гладкую индукцию и
оптимальные интраоперационные условия, но и быстрое пробркдение при
минимальных побочных эффектах. На заре амбулаторной анестезиологии популярным
внутривенным анестетиком был метогекситал, пробркдение после которого
наступало значительно быстрее по сравнению с тиопенталом. После появления
новых анестетиков метогекситал стали применять реже. На непродолжительное
96
Глава 4
время популярность обрел этомидат. Пробуждение после анестезии этомидата
было приемлемо быстрым, но часто возникала ПОТР (главный недостаток
препарата при использовании в амбулаторной анестезиологии) и другие побочные
эффекты. Кетамин тоже не лишен ряда побочных эффектов. Даже если его
галлюцинаторные свойства ослаблены (чаще всего сочетанием с бензодиазепина-
ми), кетамин по сравнению с другими препаратами начинает действовать
медленнее, и действует дольше, поэтому его редко применяют АА^ индукции и
поддержания анестезии в амбулаторной хирургии. Пропофол быстро стал
анестетиком выбора аля амбулаторных вмешательств, поскольку по сравнению с другими
в/в препаратами наиболее полно соответствовал необходимым критериям.
Пропофол
Пропофол обладает значительными преимуществами перед другими
внутривенными препаратами для индукции анестезии благодаря гладкости и быстроте
наступления эффекта, короткой продолжительности действия, а также
приемлемым побочным эффектам [1]. Короткая продолжительность действия и
быстрое пробркдение обусловлены ранним перераспределением и высоким
метаболическим клиренсом пропофола.
Проводились сравнительные исследования, в которых сравнивали индукцию
анестезии пропофолом и другими в/в анестетиками при амбулаторных
вмешательствах (поддержание обеспечивалось ингаляционными анестетиками; табл. 4.1).
Оказалось, что по сравнению с тиопенталом пропофоловая индукция
обеспечивает более быстрое восстановление сознания после операции, улучшает
результаты психомоторных тестов в раннем периоде после пробуждения у детей и
взрослых, и даже позволяет быстрее выписать больных домой после
амбулаторных вмешательств. По сравнению с метогекситалом, пропофоловая индукция
обеспечивает более быстрое пробуждение, ускоряет время выбора реакции и
характеризуется более коротким периодом послеоперационной атаксии.
Быстрота восстановления психомоторной функции после введения индукционных
доз пропофола и этомидата оказалась одинаковой. По сравнению с этомидатом
и метогекситалом, пропофол вызывает меньше побочных эффектов в
послеоперационном периоде.
Пропофол обладает значительными преимуществами перед другими
внутривенными препаратами и для поддержания анестезии при амбулаторных
вмешательствах (табл. 4.2). Как правило, пробуждение после пропофола наступает
значительно быстрее, чем после поддержания анестезии другими в/в
анестетиками. Чем продолжительнее операция, тем отчетливее становится
преимущество пропофола относительно быстроты пробуждения. По сравнению с
барбитуратами, в течение 24 ч после пропофоловой анестезии показатели
психомоторной функции лучше. Пропофол не только ускоряет пробуждение и
восстановление психомоторных функций, но и обеспечивает более высокое качество
анестезии. По сравнению с этомидатом, пропофоловая анестезия более
стабильна и управляема. Пропофол обеспечивает лучшую миорелаксацию и реже
вызывает икоту, чем тиопентал и метогекситал, что облегчает работу хирурга.
Применение пропофола а^я индукции и поддержания анестезии сопряжено с
меньшей частотой ПОТР, чем использование других в/в анестетиков. В амбулатор-
100
Глава 4
ной хирургии ПОТР особенно нежелательна, потому что не только представляет
дискомфорт для больного, но и может значительно отсрочить выписку домой
или даже потребовать повторной госпитализации. В настоящее время
накапливается все больше данных за то, что пропофол обладает отчетливым противо-
рвотным действием [2].
Пропофол не полностью лишен нежелательных побочных эффектов. Он
вызывает более глубокую артериальную гипотонию, чем другие внутривенные
анестетики (вследствие периферической вазодилатации), хотя этот феномен не
особенно опасен у относительно здоровых пациентов, подвергающихся
амбулаторным вмешательствам. Боль при введении является весьма нежелательным
явлением, но она может быть значительно ослаблена профилактическим
применением лидокаина. Пропофол может улучшать настроение больных в
послеоперационном периоде, обеспечивая комфортное, эйфориеподобное состояние.
Как сравнить пропофол в рамках ТВВА или сбалансированной методики
с ингаляционной анестезией? Такие исследования трудно провести, посколысу
очень сложно обеспечить одинаковую глубину внутривенной и ингаляционной
анестезии, что необходимо для корректного сравнения. Пока не будет
разработан объективный и не зависящий от вида анестетика монитор глубины
анестезии, практическим врачам остается полагаться лишь на клинические симптомы.
К сожалению, взаимоотношение между глубиной анестезии и гемодинамикой
для внутривенных анестетиков менее четкое и достоверное, чем для
ингаляционных (глава 5).
В ряде исследований показано, что индукция и поддержание анестезии про-
пофолом обеспечивает более быстрое пробуждение и восстановление
психомоторных функций, чем сочетание тиопенталовой индукции с поддержанием
ингаляционными анестетиками. Следует оговориться, что этот вид исследований
не позволяет отделить влияния индукционного анестетика (пропофол против
тиопентала) от эффекта анестетика АА^ поддержания анестезии (пропофол
против ингаляционного анестетика). Когда в обеих группах для индукции
применяют пропофол, а для поддержания используют пропофол или
ингаляционный анестетик, то пробркдение обычно медленнее после ингаляционной
анестезии. Хотя пропофоловая анестезия обеспечивает более раннее пробркдение,
по сравнению с ингаляционными анестетиками она не ускоряет более поздние
параметры восстановления психомоторной функции (вплоть до готовности
к выписке).
Возможно, это обусловлено тем, что некоторые из сравнительных
исследований выполнялись при неодинаковой глубине анестезии, поскольку
использовались «стандартизированные» режимы инфузий или постоянные концентрации
ингаляционных анестетиков.
Более того, применение других препаратов (например, фентанила или мида-
золама) практически стирает небольшие различия между методиками. Кроме
того, строгие протоколы, которых придерживается персонал палат пробркде-
ния и отделений амбулаторной хирургии, могут препятствовать выписке
больных, даже если методика анестезии реально обеспечила эту возможность.
Можно резюмировать, что различия в восстановлении психомоторных функций не
имеют особой клинической значимости. Замена ингаляционных анестетиков
Проведение внутривенной анестезии в отдельных группах больных 101
пропофолом снижает риск ПОТР, даже если пропофол применяют только для
индукции перед ингаляционной анестезией.
Преимущества поддержания анестезии пропофолом особенно отчетливо
проявляются при длительных амбулаторных вмешательствах, когда пропофол
значительно ускоряет пробуждение, восстановление психомоторных функций и
выписку домой по сравнению с изофлюраном. При сравнении с новейшими
ингаляционными анестетиками это достоинство пропофола может быть менее
выраженным.
Опиоиды и другие препараты,
применяемые для лечения боли
Поскольку пропофол не обладает анальгетическим действием, его
необходимо сочетать с опиоидами. Так как опиоидные анальгетики вызывают седацию и
влияют на психику, при амбулаторных вмешательствах применяют препараты
короткого действия — фентанил и альфентанил. Опиоды короткого действия
подавляют нежелательную двигательную активность больного, не вызывая
значительного замедления пробркдения. Инфузия альфентанила сокращает
потребность в дополнительном струйном введении пропофола, необходимого мя
устранения симптомов неадекватной анестезии [3]. Хотя опиоиды являются
установленной причиной ПОТР, их добавление к гипнотику не обязательно
приводит к значительному увеличению частоты ПОТР [3]. Применение опио-
идных анальгетиков при операциях, сопряженных с высокой частотой ПОТР,
может замедлить выписку домой из-за необходимости лечения этого
осложнения [4]. В скором будущем появление ремифентанила — опиоида
ультракороткого действия — позволит более эффективно устранять боль. Считают, что
исключительно короткий контекст-чувствительный период полувыведения этого
нового опиоида ускорит восстановление психомоторных функций и уменьшит
тяжесть и продолжительность неблагоприятных послеоперационных побочных
эффектов. С другой стороны, применение ремифентанила не обеспечивает
эффективной послеоперационной анальгезии.
В связи с серьезностью проблемы ПОТР при амбулаторных вмешательствах
существует большой интерес к неопиоидным анальгетикам. Если интраопера-
ционная боль характеризуется средней интенсивностью, то для ее устранения
подходят НПВП. Если интраоперационная боль выраженная, то НПВП
малоэффективны и не могут полностью заменить опиоидные анальгетики. Если
НПВП используют аля снижения дозы опиоидов, то частота и тяжесть ПОТР
уменьшаются не всегда [5]. Тем не менее, НПВП могут обеспечить более
длительную анальгезию, чем такой распространенный анальгетик, как фентанил.
а2-адреномиметики тоже обладают анальгетическими свойствами. Их
применение в амбулаторных условиях ограничено высокой частотой артериальной
гипотонии, брадикардии и остаточной седации. Для поддержания анестезии в
амбулаторной хирургии можно использовать опиоидные анальгетики короткого
действия (в сочетании с закисью азота). Преимущество этой методики
заключается в более быстром пробркдении по сравнению с ингаляционными
анестетиками (хотя того же молено достичь и с помощью пропофола). Применение
опиоидных анальгетиков мя поддержания анестезии сопровождается неприем-
102
Глава 4
лемо высокой частотой интраоперационного апноэ, ПОТР, самопроизвольных
движений, а также сопряжено с риском интраоперационного восстановления
сознания. В настоящее время опиоиды используют в сочетании с пропофолом и
очень редко применяют в качестве основного анестетика.
Резюме
При амбулаторных вмешательствах пробуждение после внутривенной
анестезии наступает как минимум не медленнее, чем после ингаляционной
анестезии. Хотя в амбулаторной хирургии быстрое пробуждение ценится очень
высоко, не менее важным представляется отсутствие побочных эффектов, особенно
тех, которые задерживают выписку домой. Свойства пропофола делают его
анестетиком, особенно хорошо подходящим аая амбулаторных вмешательств.
Пропофол обеспечивает гладкую и эффективную анестезию, быстрое
пробуждение, характеризуется приемлемыми побочными эффектами. Пропофол
обладает противорвотными свойствами и значительно снижает частоту ПОТР.
Разработка новых внутривенных анестетиков ведется, но адекватной замены пропо-
фолу при амбулаторных вмешательствах не найдено. Сохраняется потребность
в мощном анальгетике, лишенном присущих опиоидам побочных эффектов.
Прогрессивным шагом стало появление ремифентанила, побочные эффекты
которого сохраняются, но их продолжительность весьма невелика. В настоящее
время наиболее выигрышным с точки зрения уменьшения побочных эффектов
считают сочетание малых доз нескольких препаратов.
Внутривенная анестезия у детей
ТВВА долго завоевывала популярность в детской анестезиологии, что можно
объяснить несколькими причинами. Во-первых, все дети очень не любят уколы,
поэтому у них издавна применяли ингаляционную индукцию, логично
переходящую в поддержание анестезии ингаляционными анестетиками. Во-вторых,
операции у детей в большинстве случаев непродолжительные, а используемые
до относительно недавнего прошлого барбитураты значительно замедляли
пробуждение по сравнению с ингаляционными анестетиками. Наконец, в-третьих,
дети не страдают сопутствующими заболеваниями взрослых, и особенно не
свойственны им сердечно-сосудистые заболевания (за исключением
врожденных пороков сердца). Соответственно, относительная стабильность
сердечно-сосудистой системы, характерная j^l этомидата и опиоидов, у детей
оказалась не столь уж необходимой.
Появление крема EMLA и аметокаинового геля, которые делают укол
безболезненным, способствовало более широкому применению внутривенной
индукции анестезии у детей. Рост популярности внутривенной индукции послужил
толчком к более широкому использованию внутривенных препаратов и *&ая
поддержания анестезии, особенно после появления пропофола и новейших
опиоидов. В этом разделе будут рассмотрены особенности внутривенной
анестезии и фармакологии в/в анестетиков у детей.
Проведение внутривенной анестезии в отдельных группах больных 103
Гипнотики
Пропофол
Пропофол — это самый распространенный в детской анестезиологии в/в
гипнотик, поскольку короткая продолжительность его действия хорошо
соответствует небольшой продолжительности типичных операций в детской
хирургии. По сравнению со взрослыми, объем распределения в центральной камере у
детей больше (340 мл/кг против 230 мл/кг у взрослых) и клиренс выше
(32—57 мл/кг/мин против 27 мг/кг/мин у взрослых). В результате этого ^ля
достижения и поддержания одной и той же концентрации пропофола в крови
детям необходимы более высокие дозы, чем взрослым (разумеется, в пересчете
на килограмм веса). Могут также иметь место и фармакодинамические
различия, поскольку целевая концентрация для достижения и поддержания
адекватной анестезии у детей оказалась выше, чем у взрослых. Для предотвращения
двигательной активности в ответ на хирургическую стимуляцию необходимая
концентрация составляет 6,6 мкг/мл против 5—6 мкг/мл у взрослых. Тем не
менее, результаты фармакокинетических исследований у детей следует
трактовать с осторожностью. Для получения точных данных необходимо часто брать
образцы относительно больших объемов крови, что невозможно у маленьких
детей. Отсюда проистекает необходимость модифицировать протоколы
фармакокинетических исследований, порождающая ошибки. На практике доза
пропофола аая индукции анестезии составляет 2,5—3,5 мг/кг, аая поддержания —
100—300 мкг/кг/мин.
Истинная ТВВА применяется у детей очень редко: когда пропофол
используют ,/^ая поддержания анестезии, его почти всегда сочетают с закисью азота
в рамках сбалансированной методики. Пропофоловая индукция анестезии у
детей вызывает уменьшение ЧСС и АД на 10—20%. Эти гемодинамические
изменения выражены слабее, чем у взрослых, и в общем клинически приемлемы.
Отсутствие заболеваний периферических сосудов у детей делает артериальную
гипотонию более приемлемой, чем у взрослых. У детей более серьезным
побочным эффектом пропофола является брадикардия, особенно если его сочетают
с а^ьфентанилом или суксаметонием.
Хирургическая коррекция косоглазия, являющаяся распространенной
операцией у детей, характеризуется высокой частотой ПОТР. Если аля поддержания
анестезии применяют галотан, то частота ПОТР составляет 60—80%, если
вместо галотана используют пропофол, то частота ПОТР значительно снижается и
составляет 16—20%. Пропофол уменьшает частоту ПОТР и после других
амбулаторных операций у детей. Как и у взрослых, еще более сократить частоту
ПОТР позволяет отказ от закиси азота и опиоидов. Противорвотный эффект
пропофола, как и его седативное действие, весьма непродолжительны, и в тех
случаях, когда основной причиной ПОТР является сама операция (например,
та же коррекция косоглазия), частота рвоты после выписки домой при
использовании пропофола может быть такой же, как и при применении другого
анестетика.
104
Глава 4
У детей пропофол обладает некоторыми дополнительными преимуществами.
Он не провоцирует злокачественную гипертермию и широко используется при
высоком риске этого осложнения. Пропофол применяют при
микроларингоскопии, когда не может быть установлена эндотрахеальная трубка и требуется
быстрое пробуждение больного для защиты его дыхательных путей. Катетер,
введенный в дыхательные пути, применяют аая инсуффляции кислорода, в то время как
анестезию поддерживают инфузией пропофола. Использование пропофола
позволяет отказаться от закиси азота, что бывает очень ценно в ряде ситуаций. Так,
закись азота поддерживает горение, поэтому ее не следует применять при
коагуляции лазером или термокоагуляции. Пропофол значительно ослабляет рефлексы
с верхних дыхательных путей, что дает возможность интубировать трахею при
миастении и других нервно-мышечных заболеваниях без миорелаксантов.
Некоторые специалисты считают, что пропофол можно использовать для интубации
трахеи без суксаметония, который у детей вызывает тяжелые аритмии (и даже
остановку сердца) значительно чаще, чем у взрослых. В субнаркотических дозах
пропофол применяют аля седации при рентгенологических процедурах, КТ и
МРТ, лучевой терапии и катетеризации сердца. Инфузия пропофола очень удобна
в тех случаях, когда больного в состоянии анестезии необходимо
транспортировать из одного помещения в другое.
Кетамии
У детей кетамин используют достаточно часто. Особенно он ценен у
неуправляемых детей (как крайняя мера), поскольку может быть введен в/м.
Выявлены также новые показания и разработаны новые пути введения препарата.
В качестве премедикации перед операцией кетамин может быть назначен
внутрь или интраназально. Кетамин полезен при многократных болезненных
манипуляциях (например, перевязки при ожогах, хирургическая обработка
раны). Поскольку кетамин не вызывает значительного угнетения
кровообращения и дыхания, его можно использовать при катетеризации сердца. Следует
учитывать, что кетамин повышает легочное сосудистое сопротивление и
давление в легочной артерии, что необходимо принимать во внимание при
измерении параметров центральной гемодинамики, проводимом на фоне применения
кетамина. Во всех случаях использования кетамина нужно быть готовым к
обеспечению проходимости дыхательных путей, что требует наличия
соответствующего оборудования и присутствия обученного персонала.
Бензодиазепины
Одним из основных показаний к применению бензодиазепинов у детей
является назначение внутрь для премедикации. Наиболее эффективным является
мидазолам. Поскольку не существует официнальной жидкой формы мидазола-
ма для приема внутрь, то с этой целью используют раствор ^я парентерального
введения. Мидазолам смешивают с сиропом ибупрофена, чтобы устранить
горький вкус и обеспечить некоторую степень послеоперационного обезболивания.
Из-за относительно малой биодоступности необходимая доза мидазолама мя
приема внутрь достаточно велика и составляет 0,5—0,75 мг/кг. С целью
седации мидазолам также назначают внутривенно. Поскольку мидазолам слабо
влияет на электрофизиологические процессы в сердце, его используют при элек-
Проведение внутривенной анестезии в отдельных группах больных 105
трофизиологических исследованиях аритмий типа reentry. Мидазолам широко
применяют для седации детей в отделении интенсивной терапии.
У новорожденных клиренс мидазолама ниже, чем у более старших детей.
Соответственно, у новорожденных доза мидазолама в пересчете на килограмм
веса должна быть ниже. Фармакокинетические данные, полученные при
исследованиях у детей, использовали аая разработки управляемой компьютером ин-
фузии мидазолама. Эту компьютеризованную инфузию мидазолама
использовали для кардиохирургии в сочетании с опиоидами в качестве приемлемой
альтернативы ингаляционным анестетикам.
Опиоиды
У детей опиоиды в качестве основного препарата аая поддержания анестезии
применяются в основном при хирургической коррекции врожденных пороков
сердца. Несколько лет назад было показано, что при глубокой высокодозной
опиоидной анестезии выраженность маркеров физиологической стрессовой
реакции (гипергликемия, лактат-ацидоз, повышенная концентрация ацетоацетата
в крови) была значительно ниже, чем при поверхностной анестезии галотаном и
морфином [6]. Кроме того, опиодная анестезия была сочетана с меньшим
риском таких тяжелых осложнений и исходов, как сепсис, метаболический ацидоз,
ДВС-синдром и смерть. Добавление к опиоидам бензодиазепинов способствует
еще большей гемодинамической стабильности и уменьшает стрессовую реакцию
во время кардиохирургических операций у детей. Опиоиды можно использовать
А^я седации детей с врожденными пороками сердца во время катетеризации
сердца. Интересно, что у детей с цианотическими пороками сердца необходимые
дозы опиоидов меньше, чем при пороках в отсутствие цианоза.
Другой областью, где у детей целесообразно применять опиоиды в качестве
основного препарата для поддержания анестезии, является хирургическая
коррекция сколиоза [7]. Альфентанил с закисью азота обеспечивают адекватную
анальгезию, не угнетают вызванные корковые соматосенсорные потенциалы,
облегчают интраоперационное пробркдение (необходимое АА^ тестирования
состояния спинного мозга).
По сравнению со взрослыми, объем распределения опиоидов у детей больше
на 50%, а клиренс — почти вдвое. Из этого следует, что детям необходимы
более высокие индукционные и поддерживающие дозы опиоидов (в пересчете на
килограмм веса), чем у взрослых. Если фармакокинетические параметры
выражать в пересчете на площадь поверхности тела, то различия между детьми и
взрослыми будут менее выраженными.
Резюме
У детей до последнего времени внутривенную анестезию применяли реже,
чем у взрослых, пока появление новых препаратов не привело к значительному
росту ее популярности. Некоторые операции, проводимые маленьким детям,
очень удобно проводить на фоне внутривенной анестезии. Дозы большинства
анестетиков у детей выше, чем у взрослых (в пересчете на килограмм веса).
Следует подчеркнуть, что внимательное наблюдение за больным и оценка
эффекта препарата позволяют оптимизировать его дозу.
106
Глава 4
Внутривенная анестезия у пожилых
В структуре населения постоянно увеличивается доля пожилых. По
сравнению с людьми среднего возраста, они чаще болеют и, соответственно, чаще
нуждаются в хирургическом вмешательстве и анестезии. У пожилых выше
чувствительность к влиянию в/в анестетиков на ЦНС, а также больше риск
побочных эффектов, что требует уменьшения дозы. Сопутствующие заболевания
играют более важную роль, чем хронологический возраст. Старение оказывает
влияние на такие параметры, как концентрация белков плазмы, содержание
воды в организме, перфузия тканей и функция экскреторных органов. На белки
плазмы оказывает влияние не возраст сам по себе, но сопутствующие
заболевания печени, почек и соединительной ткани. По мере старения снижается
содержание воды в организме, уменьшается безжировая масса тела и, наоборот,
увеличивается содержание жира. Эти изменения вызывают уменьшение объема
распределения водорастворимых препаратов, но оказывают противоположное
действие в отношении жирорастворимых. У пожилых а\я расчета дозы
препарата лучше использовать безжировую массу тела, а не реальный вес.
С возрастом уменьшается раннее диастолическое наполнение левого
желудочка, что снижает перфузию тканей. Снижение перфузии тканей, в свою очередь,
удлиняет интервал времени от введения препарата до развития максимального
эффекта, а также ухудшает печеночный клиренс. Старение приводит к
уменьшению массы печени и печеночного кровотока, что также влечет за собой снижение
печеночного клиренса. По мере старения снижается клубочковая фильтрация и
почечный кровоток, хотя между больными одного возраста существуют большие
различия относительно этого снижения. Возрастные изменения почечного и
печеночного клиренса могут потребовать уменьшения дозы и/или увеличения
частоты введения препаратов (или же уменьшения скорости инфузии).
Возрастные изменения фармакодинамики включают снижение количества и
активности рецепторов в ЦНС, а также уменьшение их сродства к молекулам
нейротрансмиттеров. Концентрация катехоламинов в крови, наоборот,
повышается, но органы-мишени реагируют на катехоламины слабее. В настоящее
время изучается влияние этих и некоторых других факторов на действие
наиболее распространенных внутривенных анестетиков.
Гипнотики
Индукционная доза барбитуратов у пожилых ниже, чем у больных среднего
возраста. Этот феномен в большей степени обусловлен фармакокинетикой,
нежели фармакодинамикой. Было показано, что взаимозависимость между
равновесной концентрацией тиопентала в плазме и ЭЭГ-картиной у пожилых и более
молодых больных не отличается. Фармакокинетика тиопентала в значительной
степени зависит от веса и функции сердца, которые с возрастом изменяются.
Эти изменения и объясняют большинство особенностей действия тиопентала у
пожилых. По сравнению с больными среднего возраста, реакция пожилых на
индукционную дозу тиопентала более вариабельна, что требует особого
внимания при введении.
Проведение внутривенной анестезии в отдельных группах больных 107_
У пожилых продолжительность действия барбитуратов увеличивается, что
обусловлено изменением перераспределения и снижением метаболического
клиренса. У пожилых повышена чувствительность к этомидату, опять же
больше в силу фармакокинетических, нежели фармакодинамических особенностей.
Относительная гемодинамическая стабильность этомидата у пожилых весьма
желательна, но следует учесть, что на фоне сопутствующих сердечно-сосудистых
заболеваний препарат может оказывать значительное отрицательное инотроп-
ное действие.
После введения одной и той же дозы пропофола концентрация препарата
в плазме у пожилых несколько выше, чем у больных среднего возраста. Кроме
того, с возрастом фармакодинамическое действие пропофола возрастает. В
результате этого, пропофоловая индукция анестезии у пожилых сопряжена с
особенно высоким риском артериальной гипотонии. По мере старения снижается
общий клиренс пропофола, что удлиняет пробуждение.
У пожилых с сопутствующей ИБС может быть нежелательным кардиости-
мулирующее действие кетамина. Индуцированные кетамином галлюцинации у
пожилых носят более дезориентирующий характер. Пробуждение после кета-
миновой анестезии с возрастом практически не изменяется, если не считать
случаев выраженного снижения печеночного кровотока или метаболизма.
Бензодиазепины
По сравнению с больными среднего возраста, пожилые более чувствительны
к угнетающему действию бензодиазепинов на ЦНС. В отличие от других
внутривенных анестетиков, эта возрастная особенность обусловлена главным
образом фармакодинамическими изменениями. Вероятно, что повышенная
чувствительность пожилых к бензодиазепинам объясняется изменением занятости бен-
зодиазепиновых рецепторов, хотя не было показано каких-либо возрастных
изменений количества или сродства этих рецепторов. С возрастом клиренс
бензодиазепинов снижается, что сопровождается удлинением их действия,
особенно на фоне дисфункции печени. Как и у более молодых больных, наиболее
короткой продолжительностью действия и быстрым пробуждением среди
бензодиазепинов характеризуется мидазолам. Диазепам и лоразепам действуют
значительно дольше, особенно при сопутствующих заболеваниях печени,
поскольку в ходе их деградации образуются активные метаболиты.
Опиоиды
У пожилых повышена чувствительность ко всем опиоидным анальгетикам,
что обусловлено фармакокинетическими и фармакодинамическими
возрастными особенностями. По сравнению с больными среднего возраста, у пожилых
индуцированная опиоидами депрессия дыхания часто бывает более глубокой и
продолжительной.
Пока еще накоплено мало опыта в применении у пожилых нового опиоид-
ного анальгетика ремифентанила. По предварительным данным, у пожилых ре-
мифентанил вызывает гипотонию и депрессию дыхания так же, как и другие
опиоиды. Деградация ремифентанила неспецифическими эстразами не
изменяется с возрастом, поэтому у пожилых ремифентанил действует так же непро-
108
Глава 4
должительно, как и у более молодых. Соответственно, непродолжительны и
побочные реакции ремифентанила.
Миорелаксанты и их антагонисты
С возрастом продолжительность действия большинства миорелаксантов
увеличивается, особенно при сопутствующей тяжелой дисфункции почек и печени.
Исключением является суксаметоний. Хотя концентрация псевдохолинэстера-
зы с возрастом снижается, клинически это не оказывает ощутимого влияния на
продолжительность действия суксаметония. Продолжительность действия атра-
курия и цис-атракурия (подвергающихся деградации Хоффманна) тоже не
претерпевает особых изменений, хотя может возрастать при уменьшении
объема распределения. Эффект рокурония может развиваться медленнее из-за
сниженного сердечного выброса. Чувствительность к миорелаксантам у пожилых
может значительно колебаться. В этой возрастной группе особенно показан
мониторинг нервно-мышечной проводимости, позволяющий подобрать дозу и
определить, когда следует ввести препарат повторно.
Поскольку с возрастом продолжительность действия большинства
миорелаксантов возрастает, у пожилых часто возникает необходимость в применении
ингибиторов ацетилхолинэстеразы. Неостигмин действует значительно дольше,
чем эдрофоний. Теоретически сочетание холиноблокаторов и ингибиторов ан-
тихолинэстеразы не должно влиять на ЧСС и ритм сердца. На практике,
однако, часто возникают аритмии. Гликопирролат вызывает аритмии реже, чем
атропин. По продолжительности действия гликопирролат лучше соответствует
неостигмину, чем атропин. В отличие от атропина, гликопирролат не проникает
в ЦНС и не способен вызывать спутанности сознания, иногда возникающей у
пожилых при развитии центрального антихолинергического синдрома. В силу
всех этих обстоятельств у пожилых холиноблокатором выбора является
гликопирролат.
Резюме
Старение оказывает различное и часто непредсказуемое влияние на эффекты
и продолжительность действия многих препаратов, применяемых при в/в
анестезии. Эти изменения вызываются или потенциируются дисфункцией печени,
почек, сердечно-сосудистой системы. У пожилых в/в анестетики имеют
преимущества перед ингаляционными, но назначать их следует с осторожностью,
применяя малые дозы и следя за эффектом.
Внутривенная анестезия у больных,
находящихся в критическом состоянии
Проведение анестезии у больных в критическом состоянии осложняется
влиянием многих фагсгоров. Некоторые важные аспекты, на которые следует обратить
внимание: влияние анестетиков на органы и системы, находящиеся в состоянии
тяжелой дисфункции; влияние физиологических расстройств на распределение
анестетиков и реакцию органов-мишеней на анестетики; влияние дисфункции
печени и почек на элиминацию анестетика и, соответственно, продолжительность его
Проведение внутривенной анестезии в отдельных группах больных 109
действия. В наибольшей степени подвержена действию в/в анестетиков
сердечно-сосудистая система, а ее состояние, в свою очередь, оказывает значительное
влияние на действие этих препаратов. Ниже будут рассмотрены некоторые
особенности сердечно-сосудистой системы в критических состояниях.
Критическое состояние, как правило, сопровождается гиповолемией. При
гиповолемии развиваются компенсаторные реакции, в том числе
высвобождение катехоламинов и симпатическая стимуляция, что помогает поддерживать
АД посредством тахикардии и вазоконстрикции. Помимо прямого
угнетающего воздействия на сократимость миокарда и ОПСС, в/в анестетики подавляют
высвобождение катехоламинов и барорецепторный рефлекс, что
противодействует эффектам вышеуказанных компенсаторных механизмов. В результате ги-
поволемия может значительно усиливать гипотензивное действие внутривенных
анестетиков.
Среди в/в анестетиков сильнее всех угнетает кровообращение пропофол,
промежуточное положение занимают тиопентал и мидазолам, наименее
выраженную депрессию вызывает этомидат. Тем не менее, при тяжелой
гиповолемии даже этомидат может привести к значительному снижению АД. Вместе
с тем, в/в анестетики подавляют барорецепторный рефлекс слабее, чем
некоторые ингаляционные. Несомненно, что перед индукцией анестезии необходимо
как можно лучше восполнить ОЦК. Кетамин отличается от других в/в
анестетиков тем, что может увеличивать ЧСС, АД и сердечный выброс у больных,
находящихся в критическом состоянии [8]. Кетамин блокирует обратный захват
моноаминов (например, норадреналина) в симпатических нервных
окончаниях, что усиливает симпатическую активность. При длительной симпатической
стимуляции (например, при проведении инотропной терапии) запасы
катехоламинов могут истощаться, что устраняет симпатомиметические эффекты кета-
мина, проявляя при этом его прямое отрицательное инотропное и вазодилати-
рующее действие. Следовательно, у некоторых больных в критическом
состоянии кетамин может вызывать угнетение сердечно-сосудистой системы.
Высокодозная опиоидная анестезия представляет собой альтернативную
методику, позволяющую свести к минимуму угнетение кровообращения. Вместе
с тем, чистая опиодная анестезия без сочетания с другими анестетиками
сопряжена с такими побочными эффектами, как длительная депрессия дыхания,
замедленное пробркдение, высокий риск интраоперационного восстановления
сознания. Отсюда понятна тенденция сочетать в/в анестетики, что позволяет
обеспечить адекватную анестезию, но уменьшить выраженность побочных эффектов
за счет снижения дозы каждого препарата. В отличие от ингаляционных
анестетиков, введенный в/в анестетик не может быть удален иначе, чем за счет
перераспределения и элиминации. Отсюда легко понять, насколько важно не
допустить передозировки при внутривенной анестезии. Для этого начальная доза
должна быть минимально эффективной, а повторно вводить препарат следует
только после того, как пройдет достаточно времени для развития максимального
эффекта. Следовательно, при внутривенной анестезии легче применять
препараты, концентрация которых быстро уравновешивается между кровью и местом
действия, поскольку их максимальный эффект развивается быстро. Отметим, что
измененное состояние кровообращения и перераспределение кровотока могут
замедлять скорость достижения пикового эффекта некоторых препаратов.
110
Глава 4
Избегая артериальной гипотонии при индукции анестезии, не менее важно
не допустить или уменьшить подъем АД на интубацию трахеи (так называемую
прессорную реакцию). Для этого к в/в гипнотику добавляют опиоид. К
сожалению, сопутствующее введение опиоидов может потенциировать снижение
АД при индукции анестезии. Важно также учитывать фактор времени:
препараты следует вводить с таким расчетом, чтобы интубация трахеи приходилась на
момент пикового эффекта и внутривенного гипнотика, и опиоида.
Оптимальный эффект достигается введением умеренной дозы опиоида и низкой дозы
гипнотика, а не высокой дозой гипнотика и низкой дозой опиоида, как это
часто бывает. Из опиоидов /^ля подавления прессорной реакции целесообразно
применять альфентанил, эффект которого развивается быстро и продолжается
недолго, что обеспечивает достаточно быстрое (и в некоторых ситуациях весьма
желательное) восстановление спонтанного дыхания.
Хотя пропофол вызывает артериальную гипотонию при индукции анестезии,
его вторичное вазодилатирующее действие может оказывать благотворное
влияние при высоком давлении наполнения в камерах сердца, обусловленном
дисфункцией левого желудочка. Быстрое пробуждение после пропофоловой
анестезии позволяет рано экстубировать больного.
У больных в критическом состоянии очень важно обеспечить адекватную
ЧСС. Особенно нежелательна брадикардия, поскольку она снижает сердечный
выброс. Следует избегать и тахикардии, которая сокращает время коронарной
перфузии, снижает доставку кислорода к миокарду, а потребление кислорода
миокардом, наоборот, повышает. Брадикардия возникает при высокодозной
опиоидной анстезии, особенно при сопутствующем применении р-адренобло-
каторов и антагонистов кальция. Благоприятным может быть применение мио-
релаксантов панкурония или рокурония, поскольку их ваголитические свойства
противодействуют индуцированной опиоидами стимуляции блуждающего
нерва, не вызывая в то же время выраженной тахикардии. При тяжелой брадикар-
дии могут потребоваться холиноблокаторы. Следует отметить, что иногда эти
препараты могут вызывать рикошетную тахикардию. Альтернативным
подходом может быть пищеводная электрокардиостимуляция, которая позволяет
устранить брадикардию быстрее атропина и гликопирролата и обеспечивает
поддержание выбранной ЧСС [9].
Ингибиторы ацетилхолинэстеразы следует применять с осторожностью,
поскольку они непредсказуемо влияют на ЧСС. Наиболее безопасным решением
является ожидание спонтанного восстановления мышечного тонуса, даже если
требуется продленная послеоперационная ИВА.
При особо тяжелых нарушениях гемодинамики дозы в/в гипнотиков
должны быть очень низкими, а иногда от них вовсе отказываются. Вместо
полноценной в/в анестезии иногда ограничиваются сочетанием опиоида с низкой дозой
бензодиазепина, что обеспечивает утрату сознания и амнезию. На фоне
тяжелой артериальной гипотонии или остановки кровообращения анестезия часто
бывает очень поверхностной, и тогда больные, пережившие критическое
состояние, впоследствии могут восстановить в памяти происходившие события.
Чтобы этого не произошло, следует ввести небольшую дозу бензодиазепина,
обеспечивающего амнезию. При улучшении состояния больного может быть
Проведение внутривенной анестезии в отдельных группах больных 111
введена дополнительная доза бензодиазепина или малая доза любого в/в гипно-
тика. Следует помнить, что при сочетании бензодиазепинов и опиоидов
возникает синергизм в отношении угнетения сознания и дыхания.
У больных в критическом состоянии важно поддерживать адекватное
церебральное перфузионное давление. Этого можно достичь, предотвращая
снижение АД и повышение ВЧД.
В отличие от ингаляционных анестетиков, все в/в анестетики (за
исключением кетамина) вызывают церебральную вазоконстрикцию и уменьшают
потребление кислорода мозгом [10]. Ингаляционные анестетики нарушают ауто-
регуляцию мозгового кровообращения, а также нарушают сопряжение между
мозговым кровотоком и метаболизмом. Так как в/в анестетики угнетают
кровообращение, они могут снизить церебральное перфузионное давление,
особенно при сопутствующей дисфункции сердечно-сосудистой системы. Для
индукции анестезии при сопутствующем заболевании сердечно-сосудистой системы
целесообразно использовать опиоиды в сочетании с низкими дозами гипноти-
ков, что сводит к минимуму артериальную гипотонию при введении гипнотика
и ослабляет прессорную реакцию (и повышение ВЧД) на интубацию трахеи.
Если использовать пропофол осторожно, избегая снижения АД, то он является
идеальным анестетиком при ЧМТ, поскольку улучшает мозговой кровоток и
обеспечивает быстрое пробркдение.
Необходимо учитывать влияние физиологических нарушений на
фармакокинетику. При тяжелых заболеваниях изменяется тканевой кровоток, объемы
жидкостных пространств организма, концентрация белков плазмы, а также
метаболическая функция органов-мишеней. Эти изменения могут изменить
фармакокинетику препаратов. Помимо того, на фармакокинетику анестетиков
влияет сопутствующее применение инотропных препаратов или вазодилатато-
ров. Ишемия может вызывать метаболический ацидоз, в результате чего
изменяется ионизация препаратов и степень их связывания с белками плазмы. При
низком сердечном выбросе кровоток перераспределяется в пользу жизненно
важных органов (например, в ЦНС), что может приводить к попаданию в мозг
большей доли индукционной дозы и усиливать центральное угнетающее
действие препарата.
Уменьшение печеночного кровотока или дисфункция печени могут
замедлять пробркдение после применения мидазолама и пропофола.
Продолжительность действия векурония при дисфункции печени или почек возрастает. При
дисфункции печени и почек миорелаксантами выбора являются атракурий и
цис-атракурий, деградация которых происходит путем элиминации Хоффмана.
Из этих двух препаратов цис-атракурий в меньшей степени высвобождает гис-
тамин и, соответственно, вызывает менее выраженное угнетение
кровообращения.
Для быстрой последовательной индукции анестезии можно использовать
суксаметоний. Отметим, что он может вызывать выраженную гиперкалиемию
(например, при ожогах или денервации), а также многие другие побочные
эффекты. По быстроте наступления эффекта конкуренцию суксаметонию
составляет рокуронии, хотя продолжительность его действия увеличивается, как и у
векурония, при дисфункции печени или почек.
112
Глава 4
Резюме
При критических состояниях изменяется регионарный кровоток, связывание
препаратов с белками плазмы, нарушаются объемы распределения и клиренсы, а
таюке повышается чувствительность к препаратам седативно-гипнотического
действия, что значительно затрудняет прогнозирование эффекта препарата у
больного. Вариабельность реакции на анестетики и анальгетики при критических
состояниях выше обычной. Оптимального результата позволяет добиться
медленное введение низких доз тщательно отобранных анестетиков в проверенных
сочетаниях, внимательная оценка эффекта, а также при необходимости изменение
интервала между введениями.
Заключение
Выше были обсркдены особенности внутривенной анестезии у четырех групп
больных. На методику анестезии очень сильно влияют особенности больного и
тип операции, но вместе с тем полезно будет указать некоторые
распространенные схемы и типичные дозы. Следует обязательно подчеркнуть, что во многих
случаях могут потребоваться значительные отклонения от этих схем и доз.
Для амбулаторных вмешательств у взрослых индукцию анестезии проводят
с помощью мидазолама 1—3 мг, после чего вводят пропофол в дозе 1,5—2,5 мг/кг.
Для поддержания применяют инфузию пропофола в дозе 75—200 мкг/кг/мин,
сочетаемую с инфузией альфентанила (0,5—1,0 мкг/кг/мин) или ремифента-
нила (0,1—0,2 мкг/кг/мин). Анестезия при операциях у детей: идеальной пре-
медикацией является назначение мидазолама внутрь в дозе 0,5—0,75 мг/кг. Для
индукции применяют пропофол в дозе 2,5—3,5 мг/кг, для поддержания тоже
пропофол (100—300 мкг/кг/мин) в сочетании с закисью азота. Анестезия у
пожилых: для индукции вводят 1—2 мг мидазолама (главным образом для снижения
дозы пропофола, чтобы уменьшить его гипотензивное действие), после чего
применяют пропофол (0,5—1,5 мг/кг) или этомидат (0,1—0,2 мг/кг). Для
поддержания применяют пропофол (50—100 мкг/кг/мин) в сочетании с альфентанилом
(0,25—0,75 мкг/кг/мин) или ремифентанилом (0,05—0,15 мкг/кг/мин). У
пожилых АА^ расчета дозы анестетиков целесообразно применять безжировую
массу тела, а не реальный вес, что позволяет снизить риск побочных эффектов.
У больных в критическом состоянии индукции анестезии должно
предшествовать адекватное восполнение ОЦК. Д/^ индукции анестезии применяют мида-
золам 1—2 мг и альфентанил 10—20 мкг/кг (с целью амнезии и гемодинамиче-
ской стабильности); если позволяет состояние сердечно-сосудистой системы,
к этим двум препаратам добавляют этомидат (0,1—0,2 мг/кг) или кетамин
(1—2 мг/кг). А^ поддержания анестезии анальгетики и анестетики следует
титровать в зависимости от клинической реакции и состояния больного.
Необходимо подчеркнуть, что диапазоны доз для этих четырех групп
больных носят только ориентировочный характер и должны быть адаптированы
к клинической ситуации.
Проведение внутривенной анестезии в отдельных группах больных
113
Список литературы
1. Smith I, White PF, Nathanson M, Gouldson R. Propofol: an update on its clinical use.
Anesthesiology 1994;81:1005-1043.
2. Borgeat A, Wilder-Smith OHG, Suter PM. The nonhypnotic therapeutic applications of propofol.
Anesthesiology 1994;80:642-656.
3. Smith I, Van Hemelrijck J, White PF. Efficacy of esmolol versus alfentanil as a supplement to pro-
pofol-N20 anesthesia. Anesth Analg 1991;73:540-546.
4. Sukhani R, Vazquez J, Pappas AL, et at Recovery after propofol with and without intraoperative
fentanyl in patients undergoing ambulatory gynecologic laparoscopy. Anesth Analg 1996;83:
975-981.
5. Smith I, White PF. New anaesthetics, analgesics and muscle relaxants for ambulatory surgery.
Curr Opin Anesthesiol 1995;8:298-303.
6.Anand KJ, Hickey PR. Halothane-morphine compared with high-dose sufentanil for anesthesia
and postoperative analgesia in neonatal cardiac surgery. NEJM 1992;362:1-9.
7 Van Beem H, van Koopman GA, Kruls H, Notermans SL. Spinal monitoring during vertebral
column surgery under continuous alfentanil infusion. Eur ] Anaesthesiol 1992;9:287-291.
8. Lippman M, Appel PL, Mok MS, Shoemaker WC. Sequential cardiorespiratory patterns of
anesthesia induction with ketamine in critically ill patients. Crit Care Med 1983;11:730-734.
9. Smith I, Monk TG, White PF. Comparison of transesophageal atrial pacing with anticholinergic
drugs for the treatment of intraoperative bradycardia. Anesth Analg 1994;78:245-252.
10. Ravussin P, de Tribolet N, Wilder-Smith OHG. Total intravenous anesthesia is best for
neurologic surgery. ] Neurosurg Anesth 1994;6:285-289.
8 Тотальная внутривенная анестезия
Глава 5
Обеспечение внутривенной
анестезии: доставка
анестетиков и мониторинг
адекватности анестезии
Введение
Для доставки ингаляционных анестетиков применяют калиброванный
испаритель, позволяющий регулировать глубину ингаляционной анестезии. Чтобы
обеспечить адекватную внутривенную анестезию, тоже требуются специальные
системы АА^ доставки анестетиков. Ниже описаны различные системы доставки
внутривенных анестетиков — от самых простых до весьма сложных.
Необходимо знать критерии, на основании которых следует изменять дозу
анестетика. Ниже будут рассмотрены различные критерии, мониторинг
которых помогает обеспечить адекватность анестезии.
Операция и ближайший послеоперационный период сопровождается
выбросом гормонов — так называемой стрессовой реакцией. В этой главе будут
обсуждены важные аспекты стрессовой реакции, в том числе ее влияние на
исходы и стратегии управления ею.
Доставка внутривенных анестетиков
Основное оборудование аая внутривенного введения анестетиков — шприц
и полая игла — появилось в середине XVIII века. В наше время препарат мя
индукции анестезии чаще всего вводят в/в струйно вручную, наблюдая за его
действием и останавливая введение по достижении желаемого эффекта
(например, после утраты сознания). Диффузия анестетика из кровотока к месту его
непосредственного действия занимает определенное время. Так как анестетик
продолжает поступать к месту действия уже после прекращения его введения,
возникают предпосылки для относительной передозировки, сопряженной
с риском побочных эффектов (например, артериальной гипотонии).
Вероятность этой передозировки можно несколько уменьшить, если (1) вводить
препарат медленно, что дает дополнительное время ^ля достижения равновесия
между концентрацией анестетика в плазме и в месте его действия; (2)
использовать препараты, которые быстро достигают места действия (например, аль-
фентанил предпочтительнее фентанила). После того как эффект начальной
(индукционной) дозы анестетика в результате перераспределения проходит, необ-
Обеспечение внутривенной анестезии
115
ходимо продолжить введение анестетика для дальнейшего поддержания
анестезии. Существуют различные способы поддержания анестезии, каждый из
которых имеет свои преимущества и недостатки (табл. 5.1).
Периодическое струйное введение является технически самым простым
способом, но сопровождается значительными колебаниями концентрации
анестетика в плазме — от «пиков» относительной передозировки до «провалов» слишком
поверхностной анестезии (рис. 5.1). Пики концентрации могут проявляться
такими побочными эффектами, как артериальная гипотония и апноэ. Апноэ весьма
нежелательно, если изначально предполагалось сохранить спонтанное дыхание
больного. Провалы концентрации могут стать причиной слишком поверхностной
анестезии, не соответствующей уровню хирургической стимуляции.
Непрерывная в/в инфузия позволяет поддерживать относительно постоянную
концентрацию препарата в плазме, что обеспечивает более стабильное течение анестезии
(см. рис. 5.2). По сравнению с периодическим струйным введением,
непрерывная инфузия, во-первых, сглаживает все пики и провалы концентрации, что
снижает риск побочных эффектов, а во-вторых, уменьшает общую дозу анестетика,
что способствует более быстрому пробуждению больного после операции [1].
В то время как для периодического струйного введения анестетика достаточно
шприца с иглой, АА^ непрерывной инфузии требуется дополнительное
оборудование. Существуют относительно простые регуляторы инфузии, но они слишком
неточны и не позволяют должным образом управлять скоростью введения таких
сильнодействующих препаратов, как анестетики. С большей уверенностью
простые регуляторы инфузии можно использовать, если раствор анестетика
разбавить до слабой концентрации, но в этом случае возникает опасность перегрузки
жидкостью.
Шприцевые насосы, используемые в отделениях интенсивной терапии, могут
применяться и для внутривенного введения анестетиков. Эти приборы
приводят в движение поршень фиксированного шприца, что позволяет обеспечить
необходимую скорость введения препарата (рис. 5.3). Вместе с тем, эти насосы
Рис- 5.1. Уровень анестезии, достигнутый в результате струйного введения нагрузочной
дозы и поддерживаемый периодическим струйным введением меньших доз. Идеальный
(целевой) уровень анестезии показан пунктирной линией
116
Глава 5
недостаточно управляемы аая проведения внутривенной анестезии. Например,
Аая осуществления индукции и поддержания анестезии целесообразно
использовать один и тот же шприцевой насос. Соответственно, этот насос должен
быть способен вводить анестетик с относительно высокой скоростью во время
индукции (например, 1000 мл/ч) и со значительно меньшей — во время
поддержания (например, 10—300 мл/ч). Кроме того, шприцевые насосы должны
быть прочными, водонепроницаемыми, устойчивыми к воздействию радиоволн
и других электромагнитных полей, а также других неблагоприятных факторов,
присутствующих в операционной. Шприцевой насос должен работать не только
от сети, но и от перезаряжаемых батарей, что позволяет ему продолжать
функционировать при перебоях в подаче электроэнергии, вне операционной
(например, при транспортировке), а также обеспечивает резервный источник
энергии для сохранения запрограммированной информации.
В идеале шприцевой насос должен работать со шприцами многих размеров и
фирм (а не только со шприцами фирмы-производителя насоса). Многие
современные насосы автоматически определяют размер шприца и требуют его
подтверждения перед началом инфузии. Эта функция позволяет избежать ошибок,
обусловленных несоответствующей размеру шприца скоростью движения
поршня. Шприцевые насосы должны быть снабжены механизмом, обеспечивающим
правильное положение и фиксацию поршня шприца, что предотвращает
пассивное затекание анестетика в вену под действием силы тяжести (сифонирование).
Для снижения риска сифонирования необходимо взять за правило никогда не
устанавливать шприцевый насос выше уровня сердца больного.
Дозу большинства внутривенных анестетиков рассчитывают на килограмм
веса (мг/кг) или же на килограмм веса и интервал времени (мг/кг/ч,
мкг/кг/мин). Вместе с тем, простые шприцевые насосы откалиброваны на
объем жидкости, вводимый в течение определенною интервала времени (мл/ч).
В этом случае анестезиолог должен самостоятельно рассчитать скорость инфузии
в мл/ч, учитывая концентрацию анестетика в шприце и вес больного. В совре-
Рис. 5.2. Уровень анестезии, достигнутый в результате струйного введения нагрузочной
дозы и поддерживаемый непрерывной инфузией. Идеальный (целевой) уровень
анестезии показан пунктирной линией
Обеспечение внутривенной анестезии
117
Таблица 5.1. Преимущества и недостатки различных методов
доставки внутривенных анестетиков
Способ
Преимущества
Недостатки
Периодическое
струйное
введение
Инфузия с
постоянной
скоростью
(ИПС)
Инфузия с
изменяющейся
скоростью
(ИИС)
Ступенчатая
инфузия
Простота
Не требуется никакого
специального оборудования
Вероятно, более гладкое течение
анестезии
Более гладкое течение анестезии
Низкая общая доза анестетика
Более быстрое пробркдение после
анестезии (по сравнению
с периодическим струйным
введением)
Практически достигается
равновесная концентрация
анестетика в плазме
Не требуется применения
компьютера
Инфузия, Практически достигается
управляемая по равновесная концентрация
целевой анестетика в плазме
концентрации дегко изменять скорость инфузии
анестетика
<* v.ww.ai4<* в зависимости от клинического
(ИУЦК)
Инфузия,
управляемая по
принципу
отрицательной
обратной связи
эффекта
Не имеют значения
фармакокинетические и
фармакодинамические различия
между анестетиками
Низкое качество анестезии
(«пики» и «ггровалы»
концентрации )
Высокая общая доза анестетика
Медленное пробуждение после
анестезии
Анестезия со временем
«углубляется»
Возможно интраоперационное
восстановление сознания или,
наоборот, появление побочных
эффектов (в зависимости от
выбранной скорости инфузии)
Необходимо часто изменять
скорость инфузии
Могут возникнуть затруднения в
дозировании (из-за отсутствия
достоверных клинических
критериев)
Жесткая схема, не
предусматривающая
индивидуальных особенностей
Трудно изменять скорость инфузии
в зависимости от клинического
эффекта
В сходных ситуациях у разных
больных может потребоваться
установка различной целевой
концентрации
Высокая стоимость
Целесообразно проведение
дополнительных исследований
Отсутствие достоверных
клинических критериев
адекватности анестезии
Не разработано систем, пригодных
Аля практической работы
118
Глава 5
Рис. 5.3. Простой шприцевый насос. Прибор позволяет установить скорость инфузии в
мл/ч. Необходимую скорость выставляют кнопками с изображением стрелок,
направленных вверх и вниз. Менять скорость инфузии можно только после выключения насоса
менных программируемых насосах можно выставить концентрацию анестетика
в шприце, вес больного и желаемую скорость инфузии мг/кг/ч или мкг/кг/мин
(рис. 5.4). После этого встроенный микропроцессор выполнит необходимые
расчеты и на дисплее появится реальная скорость в мл/ч, после чего можно
начинать инфузию. В большинстве моделей инфузионных насосов для ввода этой ин-
Обеспечение внутривенной анестезии 119
Рис. 5.4. Программируемый шприцевый насос. Вес больного, концентрацию препарата
в шприце и скорость инфузии в мкг/кг/мин выставляют с помощью клавиатуры, после
чего встроенный микропроцессор рассчитывает скорость инфузии в мл/кг
формации предусмотрена цифровая клавиатура. Однако существуют и другие
системы, в которых а&я программирования концентрации анестетика
используются магнитные смарт-карты, а вес больного и желаемая скорость инфузии
выставляются на круговом циферблате с помощью рукояток (рис. 5.5). Хотя с
помощью круговых циферблатов молено выставить не любой вес и скорость
инфузии, а только с некоторым шагом (например, 60, 65 и 70 кг; 100, 120 и
120
Рис. 5-5. Программируемый шприцевой насос со сменными магнитными
смарт-картами, в которых закодирована информация о концентрации препарата в шприце, дозе для
струйного введения и скорости инфузии. С помощью рукояток на трех верхних круговых
циферблатах выставляют соответственно скорость инфузии, вес больного и дозу для
струйного введения. Поворотом рукоятки на нижнем циферблате включают и выключают
насос, а также вводят препарат струйно. Дозы легко изменить простым поворотом
рукояток, не выключая насос
Обеспечение внутривенной анестезии 121_
140 мкг/кг/мин), в практической работе такой неточностью молено пренебречь
без особого ущерба. Кроме того, поворотом рукоятки на круговом циферблате
значительно легче изменить скорость инфузии, чем нажатием нескольких кнопок
в определенной последовательности. Эта легкость имеет и отрицательную
сторону: при применении насоса с круговым циферблатом достаточно высок риск
непреднамеренного изменения скорости инфузии. Существуют и другие инфузион-
ные насосы, на дисплее которых высвечивается «меню» из нескольких
анестетиков в стандартных концентрациях.
Осложнения, обусловленные использованием
програмируемых шприцевых насосов
Инфузионные насосы с встроенными микропроцессорами избавляют
анестезиолога от необходимости рассчитывать скорость инфузии. Эта
автоматизация значительно облегчает работу врача, но сопряжена с риском ошибок. Так,
в некоторых насосах скорость инфузии можно установить в режимах мг/кг/ч,
мкг/кг/мин и мл/ч. По ошибке можно ввести с клавиатуры число, имея в виду
один режим скорости, хотя на самом деле установлен другой. Например, желая
проводить инфузию со скоростью 160 мкг/кг/мин (около 10 мг/кг/ч), врач
вводит с клавиатуры «160»; если шприцевой насос по ошибке работает в
режиме мг/кг/ч, то доза будет превышена в 16 раз. Подобные случаи не редкость,
если на один дисплей выводится большое количество информации. Интересно,
что аналогичные проблемы возникают и в авиации: относительно недавно
авиакатастрофа произошла из-за того, что пилот заходил на посадку под слишком
крутым углом, хотя прибор на первый взгляд показывал правильные параметры.
Подобных катастроф можно избежать, если на одно поле дисплея выводить
только один вид информации или же придавать каждому режиму явные
визуальные отличия. Важное значение имеет правильное обучение пользованию
насосами и повышенная настороженность врача в отношении таких осложнений.
Режимы инфузии
Чтобы проводить внутривенную анестезию, необходимо знать, какая
скорость инфузии необходима p^si достижения желаемого эффекта, и как ее надо
изменять, чтобы поддержать этот эффект на должном уровне. Для препаратов,
фармакокинетика которых описывается трехкамерной моделью (например,
пропофол и мощные опиоиды), струйное введение с последующим переходом
на инфузию с постоянной скоростью (ИПС) не позволяет достичь равновесной
концентрации в месте действия (глава 1). Вначале скорость инфузии
анестетика должна быть высокой, чтобы компенсировать быстрое перераспределение,
но потом, когда перераспределение замедляется и достигается равновесная
концентрация препарата в плазме, скорость инфузии следует снизить. Если бы
существовала реальная возможность проводить мониторинг концентрации
внутривенных анестетиков в плазме (аналогично тому, как измеряется
концентрация ингаляционных анестетиков в конце выдоха), было бы значительно легче
изменять скорость инфузии. В этом случае мя достижения желаемого уровня
анестезии требовалось бы просто увеличить или уменьшить скорость инфузии.
122
Глава 5
К сожалению, концентрацию внутривенных анестетиков в плазме в режиме
реального времени определять невозможно. Тем не менее, можно брать пробы
крови (предпочтительнее артериальной) через определенные интервалы
времени после струйного введения или короткой инфузии и измерять в них
концентрацию анестетика с помощью газовой хроматографии. При таком подходе
можно изучить, как изменяется концентрация анестетика в плазме при
различных режимах введения. Полученные данные можно включить в фармакокине-
тические уравнения, что позволяет вычислить константы скорости,
определяющие перемещение анестетиков в организме между условными
пространствами — камерами (глава 1). В свою очередь, эти константы молено использовать
Аая создании математической модели режима инфузии, позволяющего
поддерживать постоянную концентрацию анестетика в крови. Следует отметить, что
эти модели разрабатывались на относительно небольшом количестве
индивидуумов, поэтому переход к их широкому практическому применению сопряжен
с объяснимой статистической вариабельностью.
Инфузия, управляемая вручную
Основываясь на фармакокинетических принципах, был разработан режим,
где после струйного введения анестетика переходили на ступенчатую инфузию,
управляемую вручную. Оказалось, что количество ступеней (т.е. изменений
скорости инфузии) на протяжении всей анестезии молено сократить до одной или
двух. Ручное управление скоростью инфузии позволяет использовать любой
(даже самый простой) шприцевой насос. Такой режим инфузии описан для
пропофоловой анестезии [2]. Индукция анестезии осуществляется струйным
введением пропофола в дозе 1 мг/кг. Скорость поддерживающей инфузии в
течение первых 10 мин составляет 10 мг/кг/ч, следующих 10 мин — 8 мг/кг/ч,
затем 6 мг/кг/ч до окончания анестезии. Хотя этот режим позволяет достичь
постоянной концентрации пропофола в плазме (3 мкг/мл) и поддерживать ее,
он недостаточно управляем и молеет потребовать применения других
анестетиков и анальгетиков. Так, при поверхностных операциях на колее и подкожной
клетчатке на фоне сохраненного дыхания проводили анестезию пропофолом
(инфузия в описанном выше режиме 10-8-6) и 70% N2O на фоне опиоидной
премедикации; каждому четвертому больному потребовалось подключение
ингаляционного анестетика [3]. Другим недостатком управляемой вручную
инфузии является необходимость менять скорость инфузии через четко
определенные интервалы времени. Если анестезиолог отвлекается на другие аспекты
ведения больного и забывает снизить скорость инфузии, то возмолена
передозировка. Кроме того, этот релеим предназначен аая обеспечения постоянной
концентрации анестетика в плазме. Потребность в анестетике зависит от выра-
леенности хирургической стимуляции и индивидуальной чувствительности
больного к препарату, поэтому не существует единой концентрации анестетика
в плазме, которая позволила бы обеспечить адекватную анестезию при всех
уровнях хирургической стимуляции у всех больных. Инфузия, управляемая
вручную, представляет собой весьма жесткую схему, в рамках которой очень
трудно с необходимой быстротой изменять концентрацию препарата в плазме
в зависимости от клинического эффекта.
Обеспечение внутривенной анестезии
123
Инфузия, управляемая с помощью компьютера
Рассчитать кинетику распределения анестетика и его диффузии в место
действия достаточно просто. Напротив, предсказать концентрацию анестетика
в месте действия в произвольный момент времени очень сложно. Чтобы это
сделать, необходимо использовать специальные компьютерные программы. При
создании этих компьютерных программ были использованы фармакокинетиче-
ские параметры, измеренные в ходе исследований, проводимых у различных
групп больных. Компьютерная программа позволяет автоматически изменять
скорость инфузии анестетика (рис. 5.6). Компьютеризированные системы,
управляющие скоростью инфузии, позволяют обеспечить расчетную
концентрацию анестетика в плазме, которую еще называют целевой концентрацией.
Соответственно, эта методика доставки анестетика получила название инфузии,
управляемой по целевой концентрации (ИУЦК). Здесь целесообразно
привести и англоязычное наименование, часто встречающееся в литературе —
target controlled infusion (TCI). Используемый ранее термин «управляемая
компьютером постоянная инфузия» вышел из употребления.
Несколько исследовательских групп разрабатывали системы ^М ИУЦК
пропофола и альфентанила. К концу 1996 г. появилась первая разрешенная к
применению в клинике система для введения пропофола по методике ИУЦК, получившая
название Diprifusor (рис. 5.7). Она была разработана в результате исследовательской
работы профессора Гевина Кении из Глазго, Великобритания. При ИУЦК
анестезиолог должен ввести с клавиатуры не только вес, но и возраст больного, поскольку
Рис. 5.6. Ранний прототип шприцевого насоса для инфузии, управляемой по целевой
концентрации. Справа внизу располагается компьютер с фармакокинетической
программой. Вес и возраст больного вводятся с помощью дискового регулятора
(располагается на левой стороне). По соединяющему кабелю компьютер посылает команды
шприцевому насосу (слева вверху)
124
Глава 5
Рис. 5.7. Djpnfusor — шприцевой насос для ИУЦК пропофола. Шприцевой насос
снабжен компьютером с фармакокинетической программой для пропофола. В специальный
готовый к употреблению шприц встроена магнитная метка, подтверждающая наличие
1 % пропофола и обеспечивающая работу шприцевого насоса в режиме ИУЦК. Если
вместо шприца с магнитной меткой установить стандартный шприц, то прибор будет
работать как обычный шприцевый насос
он тоже влияет на фармакокинетические параметры. Затем вводится желаемая
начальная целевая концентрация пропофола в плазме. После того, как заданы все
вышеперечисленные параметры, компьютерная программа сообщает шприцевому
насосу скорость инфузии, позволяющую быстро достичь целевой концентрации
(рис. 5.8). После достижения целевой концентрации скорость инфузии
уменьшается и в дальнейшем постоянно изменяется. Изменения скорости инфузии,
диктуемые компьютерной программой, позволяют поддерживать целевую
концентрацию пропофола в плазме. Если возникают симптомы неадекватности анестезии, то
в любой момент времени можно задать новую целевую концентрацию. Если новая
целевая концентрация должна быть выше предшествующей, то к насосу поступит
команда увеличить скорость инфузии. Если, наоборот, концентрацию нужно
уменьшить, то инфузия будет остановлена до тех пор, пока концентрация
пропофола в плазме не снизится до нового целевого значения. Когда это произойдет,
инфузия возобновится со скоростью, необходимой для поддержания новой целевой
концентрации. Итак, системы для ИУЦК применяют для обеспечения постоянной
концентрации анестетика в плазме, которую затем регулируют в зависимости от
полученного клинического эффекта. Аналогичным образом калиброванный
испаритель позволяет обеспечить постоянную концентрацию ингаляционного
анестетика во вдыхаемой смеси, которую тоже регулируют в соответствии с клиническим
эффектом. По сравнению с инфузией, управляемой вручную, системы для ИУЦК
пропофола обеспечивают более высокую гемодинамическую стабильность и значитель-
Обеспечение внутривенной анестезии
125
Ввод информации
Рис. 5.8. Принципиальная схема системы для ИУЦК. С клавиатуры врач вводит в систему
информацию о возрасте и весе больного и целевой концентрации пропофола.
Микропроцессор (расположен внутри шприцевого насоса или как отдельная приставка)
рассчитывает концентрацию анестетика в плазме на каждый момент времени, а также
разницу между ней и целевой концентрацией. Затем микропроцессор определяет, в
какую сторону (увеличения или уменьшения) нужно изменить скорость инфузии, чтобы
достичь целевой концентрации, и сообщает соответствующую скорость поршню.
Реальная скорость движения поршня постоянно измеряется и сравнивается с заданной
скоростью
но удобнее в применении [4]. Системы для ИУЦК можно использовать не только
для анестезии, но и для седации, если задавать более низкую целевую концентрацию
пропофола. Системы для ИУЦК применяются мя седации, например, при
эндоскопических вмешательствах, в сочетании с местной и регионарной анестезией, а
также в отделении интенсивной терапии.
Чтобы оценить эффективность системы ^ая ИУЦК, необходимо измерить
концентрацию анестетика в пробах крови и сравнить ее с целевой
концентрацией, заданной на моменты взятия проб на анализ. Факторы, влияющие на
эффективность системы м^ ИУЦК: способность шприцевого насоса вводить препарат
именно с той скоростью, которую рассчитывает компьютерная программа;
ошибки фармакокинетической модели (неадекватная методология, дефекты
сбора данных); индивидуальные особенности больных. Возможно, последний фактор
играет наиболее важную роль, поскольку отдельные индивидуумы могут
существенно отличаться по фармакокинетическим параметрам, даже если фармакоки-
нетическая модель была разработана на людях приблизительно такого же веса и
возраста.
На рис. 5.9 проиллюстрированы различия между измеренной (реальной) и
расчетной концентрацией пропофола в рамках различных фармакокинетиче-
ских моделей. Очень важно понять, что фармакокинетическая модель должна
соответствовать особенностям той группы больных, в которой она будет
применяться. Например, в педиатрии эффективность ИУЦК выше, когда в
фармакокинетической программе используют данные, полученные в ходе исследований
именно у детей, а не у взрослых.
126
Глава 5
Рис. 5-9- Соотношение между измеренной и расчетной концентрацией пропофола в
плазме. Каждый из трех графиков соответствует отдельной фармакокинетическои
модели. Система координат полулогарифмическая [5]
Обеспечение внутривенной анестезии 127_
Еще одним источником ошибок являются индивидуальные особенности,
обуславливающие фармакодинамическую вариабельность. Даже если бы
существовала возможность измерять концентрацию внутривенного анестетика в плазме
в режиме реального времени, все равно концентрация препарата, позволяющая
предотвратить реакцию на один и тот же ноцицептивный стимул, у разных
больных может значительно отличаться [6]. Следовательно, при ИУЦК нужно
поддерживать постоянную концентрацию анестетика в плазме и изменять ее в
зависимости от наблюдаемого эффекта. Напротив, совсем не нужно жестко
придерживаться избранной целевой концентрации на протяжении всей анестезии у всех
больных. Важно знать, насколько эффективна ИУЦК по сравнению с другими
методами доставки внутривенных анестетиков (табл. 5.1).
После премедикации темазепамом сравнивали индукцию анестезии пропо-
фолом, проводимую методом ИУЦК или обычным струйным введением. При
ИУЦК с целевой концентрацией пропофола 5 мкг/мл утрата сознания у 90%
больных наступила через 3 мин после начала инфузии [4]. По сравнению со
струйным введением, не так сильно снижалось АДср, реже возникали апноэ и
боль от инъекции. По результатам этого исследования можно заключить, что по
сравнению со струйным введением при ИУЦК индукция анестезии протекала
более «гладко», но ценой значительного увеличения времени, необходимого аая
устранения сознания.
ИУЦК также применялась аля введения фентанила и альфентанила, что
характеризовалось более высокой гемодинамической стабильностью по сравнению
с инфузией этих препаратов, управляемой вручную. Системы мя ИУЦК
относительно просты в обучении и использовании, позволяют уверенно работать
анестезиологам, не имеющим большого опыта в проведении ТВВА. Хотя системы для
ИУЦК описываются как аналоги испарителя, на момент написания книги было
проведено только одно сравнительное исследование ингаляционной анестезии и
пропофоловой ИУЦК [7]. Это рандомизированное исследование показало, что у
детей пробркдение наступало практически через одно и то же время после
операции независимо от вида анестезии (табл. 5.2). При этом в качестве
ингаляционного анестетика был выбран галотан, АА^ которого характерно замедленное
пробркдение. Чтобы окончательно выяснить, какое место займет ИУЦК в
анестезиологии, необходимы дополнительные сравнительные исследования.
Сравнивать ингаляционные и внутривенные анестетики достаточно сложно,
потому что неясно, что принимать за эквивалентные дозы. Мощность
ингаляционных анестетиков определяется по их минимальной альвеолярной
концентрации (МАК). Под МАК понимают концентрацию ингаляционного анестетика
во вдыхаемой смеси, которая позволяет предотвратить произвольные движения
у 50% больных при разрезе кожи. Была также установлена эффективная
концентрация пропофола в плазме, которая тоже позволяет предотвратить
произвольные движения у 50% больных при разрезе кожи (ЕС50) [8] • При
моноанестезии пропофолом АА^ предотвращения движений у половины больных
достаточно концентрации 6 мкг/мл, в то время как концентрация 6,2 мкг/мл
предотвращает движения у 95% больных (ЕС95). Аналогично тому, как N2O
снижает МАК ингаляционных анестетиков, присутствие во вдыхаемой смеси
67% N2O уменьшает ЕС50 пропофола до 4,5 мкг/мл, а ЕС95 до 4,7 мкг/мл.
128
Глава 5
Таблица 5.2. Сравнение пропофоловой ИУЦК со стандартной
методикой пропофол/галотан у детей [7]
Пропофол-галотан Пропофоловая ИУЦК
Количество больных (п) 20 20
Возраст (мес) 67,6 (16-154) 66 (13-141)
Продолжительность анестезии (мин) 30,6 (9—52) 33,3 (11—60)
Адекватность анестезии (%) 100 100
Пробуждение (мин.) 10,5 (3-32) 13,5 (4-36)
Числа представляют собой средние значения, в скобках представлен диапазон значений
Инфузия, управляемая по принципу отрицательной обратной связи
Процесс доставки анестетиков мог бы осуществляться автоматически по
принципу отрицательной обратной связи, если бы существовали достоверные
критерии оценки эффекта этих препаратов (рис. 5.10). В отношении
анальгезии таким критерием является отсутствие боли, что дало возможность
разработать системы аая управляемой больным анальгезии (УБА). УБА, которая на
Западе широко используется в клинике, представляет собой пример системы с
отрицательной обратной связью. Аналогичные системы были разработаны аая
введения препаратов гипнотического действия с целью обеспечения седации
при сохраненном сознании. Эта методика получила название управляемой
больным седации (УБС). УБС приобрела широкую популярность и успешно
конкурирует с традиционными методиками. Недавно была описана модификация
методики ИУЦК, где больной самостоятельно регулирует целевую
концентрацию пропофола. Больной управляет седацией с помощью одной кнопки,
нажатие на которую увеличивает целевую концентрацию пропофола. Напротив,
в отсутствие регулярных сигналов от больного концентрация пропофола в
плазме будет постепенно снижаться [9]. Таким образом, в случае слишком
глубокой седации больной не сможет нажимать на кнопку и поэтому начнет
постепенно просыпаться.
Чтобы управлять внутривенной анестезией по принципу отрицательной
обратной связи, необходимы достоверные критерии адекватности анестезии. Для
мониторинга адекватности анестезии применялись многие методики (см.
ниже), которые в большинстве своем представляют различные модификации
ЭЭГ, обработанной с помощью компьютера. Имеется несколько прототипов
системы отрицательной обратной связи, основанные на ЭЭГ либо акустических
вызванных потенциалах, но они применяются пока только в эксперименте и их
скорое появление в клинике маловероятно. Существует возможность
объективного мониторинга миорелаксации, и поэтому в течение некоторого времени
при введении миорелаксантов применяли систему отрицательной обратной
связи. Сейчас эту методику используют редко —может быть, из-за того, что
обычные схемы применения миорелаксантов не менее эффективны.
Обеспечение внутривенной анестезии
129
Монитор адекватности анестезии
Рис. 5.10. Простая система отрицательной обратной связи включает в себя монитор
адекватности анестезии и содержит информацию о целевой глубине анестезии.
Микропроцессор определяет необходимость увеличения или уменьшения скорости введения
анестетика, чтобы фактический уровень анестезии был бы как можно ближе к целевому
Мониторинг адекватности анестезии
Мониторинг адекватности анестезии сложен, поскольку сама анестезия тоже
является сложным феноменом. Анестезия представляет собой тетраду
компонентов: анальгезию, отсутствие сознания, вегетативную блокаду и миорелакса-
цию. Мониторинг ЧСС, АД и миорелаксации, по которым можно судить о
некоторых компонентах анестезии, несложен. Напротив, уровень сознания
измерить очень трудно, а он является наиболее важным параметром для оценки
адекватности анестезии. Явными признаками неадекватной анестезии являются
все движения больного (как непроизвольные, так и целенаправленные), мелкие
подергивания конечностей, изменение частоты и характера дыхания.
Применение миорелаксантов устраняет мышечную активность, так что о
вышеупомянутых признаках судить будет нельзя. Следовательно, применение
миорелаксантов сопряжено с повышенным риском интраоперационного восстановления
сознания, причем больной будет лишен возможности сообщить об этом. Хотя
миорелаксанты не устраняют гемодинамические и другие вегетативные
проявления поверхностной анестезии, эти проявления неспецифичны и могут
изменяться в зависимости от инфузионной терапии и воздействия других
лекарственных препаратов (например, холиноблокаторы, а- и Р-адреномиметики, а-
и р-адреноблокаторы, опиоиды). Единственным точным критерием
адекватности анестезии является отсутствие воспоминаний об интраоперационных
событиях. Конечно же, этот критерий имеет отчетливый ретроспективный
130
Глава 5
характер и неприменим в ходе операции. Кроме того, воспоминания
субъективны, и существуют доказательства того, что не во всех случаях интраопераци-
онного восстановления сознания больные могут вспомнить об этом. С другой
стороны, опрос больных в послеоперационном периоде («расскажите, что вы
запомнили о дне операции») и сопоставление ответов с методикой и течением
анестезии способствует росту мастерства анестезиолога.
В 1937 г. Гведел описал клинические симптомы адекватности эфирной
анестезии. Хотя это описание явилось существенным достижением аая своего
времени, многие симптомы не отражают применение современных анестетиков, а
о некоторых из них нельзя судить при использовании миорелаксантов.
Применение различных сочетаний препаратов еще более осложняет ситуацию.
Многие препараты, не оказывающие никакого влияния на уровень сознания,
позволяют управлять АД и ЧСС. Миорелаксанты часто применяются при движениях
или натуживании, которые мешают хирургу работать. Следует подчеркнуть, что
с точки зрения больного «адекватная» анестезия означает отсутствие сознания.
Интраоперационное восстановление сознания
Точно неизвестно, насколько часто в клинической практике случается
интраоперационное восстановление сознания, поскольку о многих случаях не
сообщается. В одной работе были опубликованы результаты опроса 63 000 больных,
перенесших анестезию. Оказалось, что частота интраоперационного восстановления
сознания составляет 12,4 на 10 000 анестезий [10]. В прошлом многие больные
считали, что не могут прийти в сознание во время анестезии и приписывали свои
ощущения сновидениям или воображению. После того как общество осознало
это проблему, частота сообщений об интраоперационном восстановлении
сознания возросла [11], как и вероятность юридических последствий. В 1989—1990 гг.
интраоперационное восстановление сознания послужило причиной 12,2%
юридических исков против анестезиологов, причем серьезность обвинений
потребовала опубликования экспертного медицинского обзора [11]. К сожалению, в
Великобритании иски больных, лечившихся в учреждениях Национальной Службы
Здравоохранения, рассматриваются на местах, поэтому статистика
интраоперационного восстановления сознания в масштабе всей страны отсутствует. Вместе
с тем имеется статистика по сектору частного здравоохранения, где претензии по
поводу интраоперационного восстановления сознания составляют 15% всех
исков, связанных с анестезий, если не считать незначительные повреждения зубов
(данные Союза Защиты медицинских работников).
В большинстве случаев интраоперационное восстановление сознания
происходит на фоне миорелаксантов. В отсутствие миорелаксантов при неадекватной
анестезии больной начинает двигаться, что позволяет предпринять
необходимые меры еще до восстановления сознания. Интраоперационное
восстановление сознания часто случается при высокодозной опиоидной анестезии, а также
в экстренной хирургии, особенно на фоне нестабильной гемодинамики. В
прошлом при кесаревом сечении было принято проводить относительно
«поверхностную» анестезию. Это было связано с ошибочным представлением, что
«глубокая» анестезия оказывает неблагоприятное воздействие на ребенка.
В результате интраоперационное восстановление сознания и воспоминания об
Обеспечение внутривенной анестезии 131_
интраоперационных событиях после кесарева сечения были чрезвычайно
частыми. В настоящее время появилось больше информации о физиологии плода и
матери и стало ясно, что стресс, возникший из-за неадекватности анестезии
в организме матери, передается еще не родившемуся ребенку и оказывает
вредное воздействие на обоих.
Невозможно сказать, какая методика анестезии сопряжена с более высоким
риском интраоперационного восстановления сознания — внутривенная или
ингаляционная. Это связано с тем, что достоверно неизвестны ни частота
интраоперационного восстановления сознания, ни общее число и доля
внутривенной и ингаляционной анестезии. В одной работе сообщалось, что при 1727
анестезиях (методика ТВВА) было 5 случаев интраоперационного восстановления
сознания [12]. Все инциденты были обусловлены сочетанием технических и
врачебных ошибок. Эксперты признали, что во всех пяти случаях
восстановления сознания можно было избежать. По мнению некоторых авторов, «интрао-
перационное восстановление сознания является главной опасностью тотальной
внутривенной анестезии» [13]. Ниже перечислены причины, которые
позволили авторам сделать такой вывод: сложная зависимость между скоростью инфу-
зии и концентрацией анестетика в плазме; риск неисправности шприцевого
насоса и ошибок его программирования; паравазальное введение анестетиков;
заброс анестетиков в параллельную инфузионную линию (рис. 5.11).
Рис. 5.11. На рисунке показано, каким образом во время инфузии анестетика под
высоким давлением может произойти его заброс в сообщающуюся инфузионную линию.
В результате в кровоток поступает меньшее количество анестетика, что сопряжено с
риском интраоперационного восстановления сознания. Для предотвращения заброса
анестетика в точке V можно установить направляющий клапан, или же вводить растворы
и внутривенные анестетики через отдельные катетеры
132
Глава 5
Некоторые из этих проблем можно предотвратить, аля чего необходимо
лучше понимать принципы фармакокинетики и использовать
усовершенствованное оборудование для инфузий.
Воспоминания об интраоперационных событиях заключаются в том, что
больной осознавал окружающую действительность во время операции и
вспомнил это впоследствии. Возможен и такой вариант, когда больной осознавал
происходящее и выполнял команды во время операции, но впоследствии об этом
не помнил. Этот феномен изучался с помощью методики изолированного
предплечья. При этом на одну руку больного накладывали турникет, так что миоре-
лаксанты не могли туда попасть. Если анестезия была неадекватной, больные
могли двигать этой рукой. Когда для анестезии использовали только закись
азота, то 40% больных двигали по команде рукой, хотя только 4—8% из них
помнили об этом впоследствии [14]. Больные во время анестезии могут также
демонстрировать научение или «имплицитную память» в отсутствие интраопера-
ционного восстановления сознания и воспоминаний. Это выражается в том, что
больные (после подсказки) «вспоминают» ключевые слова или эпизоды
рассказа, который им читали во время анестезии. Имеются определенные
доказательства того, что позитивные, ободряющие высказывания во время анестезии
снижают потребность в анальгетиках в послеоперационном периоде и
способствуют спокойному и быстрому пробуждению. Есть данные и за то, что негативные
реплики и обсркдение неблагоприятного прогноза сопряжены с повышенным
риском психоза и расстройств сна в послеоперационном периоде. Отметим, что
эти данные не вполне однозначны и не получили четкого подтверждения при
дальнейших исследованиях. Тем не менее, представляется разумным оградить
больного от возможности «слышать» негативные комментарии во время
анестезии. Вероятно, не будет никакого вреда, если больной будет «слушать» музыку
или позитивную информацию через наушники.
Критерии адекватности анестезии
Существует ряд методов мониторинга адекватности анестезии (табл. 5.3).
Явными признаками неадекватности анестезии являются целенаправленные
движения больного во время операции. Возникновение движений в ответ на
разрез кожи используется аая определения мощности ингаляционных
анестетиков. Как рке было сказано выше, мерой этой мощности является так
называемая минимальная альвеолярная концентрация (МАК) ингаляционного
анестетика, которая предотвращает движения в ответ на разрез кожи у 50% больных.
Впоследствии были измерены концентрации ингаляционных анестетиков,
необходимые, например, для того, чтобы у 50% больных предотвратить гемодина-
мическую реакцию при ноцицептивной стимуляции (эта концентрация выше,
чем МАК) или устранить сознание (эта концентрация ниже, чем МАК).
Интересно, что важную роль в предотвращении движений во время анестезии
может играть спинной мозг. Опыты на животных показали, что при
изолированной перфузии головного мозга (т.е. когда влияния спинного мозга
отсутствовали) для предотвращения движений при ноцицептивной стимуляции
требовалась более высокая концентрация анестетика в плазме, чем при общей
перфузии (когда влияния спинного мозга сохранялись). Отсюда следует вывод,
Обеспечение внутривенной анестезии 135
что во время анестезии спинной мозг может подавлять движения при ноцицеп-
тивной стимуляции. Этим можно объяснить те отдельные случаи интраопера-
ционного восстановления сознания, когда при неадекватной анестезии больные
не двигались, хотя миорелаксанты им не вводили.
В отсутствие целенаправленных движений адекватность анестезии пытаются
оценить с помощью других клинических показателей и симптомов. Эти
показатели и симптомы включают АД и ЧСС, частоту и характер дыхания, мышечный
тонус, размер и реакцию зрачков, слезотечение и потоотделение. Чтобы
повысить вероятность выявления неадекватности анестезии, необходимо оценивать
сразу несколько клинических показателей и симптомов. Так, в ходе анестезии
(альфентанил + закись азота) проводили мониторинг АД, ЧСС,
целенаправленных движений, глотательных движений, кашля, гримасничания, открывания
глаз, слезотечения, гиперемии лица и потоотделения. По отдельности ни один
из этих показателей и симптомов не позволял судить об адекватности
анестезии [15]. Изменения ЧСС и АД очень неспецифичны и недостоверны. Кроме
того, их трудно интерпретировать, потому что анестетики, анальгетики и
вспомогательные препараты значительно различаются между собой по способности
вызывать тахикардию, брадикардию и артериальную гипотонию. Слезотечение
и потоотделение тоже не позволяют достоверно судить об адекватности
анестезии. В ряде случаев они не возникают даже на фоне гемодинамических и
двигательных проявлений неадекватности анестезии, а также при последующих
воспоминаниях об интраоперационных событиях. Потоотделение очень зависит от
колебаний температуры, особенно при операциях на сердце с применением
активного согревания и охлаждения. На размер и реакцию зрачков влияют опио-
иды, атропин, глазные капли. Зрачки нельзя оценивать в ходе
офтальмологических операций. Итак, с помощью клинических показателей и симптомов
оценить адекватность анестезии достаточно сложно. Осознание этого дало толчок
к поиску более достоверных, специфичных и универсальных критериев
адекватности анестезии.
Одним из критериев адекватности анестезии является активность мышц, не
подверженных действию миорелаксантов. Относительно устойчивы к миоре-
лаксантам мимические мышцы. С помощью электромиографии и накожных
электродов можно оценить активность лобной мышцы, мышцы,
нахмуривающей бровь, скуловой мышцы и круговой мышцы глаза. Было высказано
предположение, что характер мышечного напряжения (гримаса или улыбка) может
быть критерием адекватности анестезии, однако для подтверждения этого
необходимы дальнейшие исследования. Для оценки адекватности анестезии
пытались использовать сократимость нижнего отдела пищевода [16]. К сожалению,
сократимость нижнего отдела пищевода по-разному изменяется под действием
ингаляционных и внутривенных анестетиков. Кроме того, на нее оказывают
влияние холиноблокаторы. Эти серьезные недостатки говорят о том, что
сократимость нижнего отдела пищевода вряд ли может служить достоверным
критерием адекватности анестезии.
Электроэнцефалография (ЭЭГ) позволила разработать многие подходы к
мониторингу адекватности анестезии. Использование ЭЭГ аля этих целей было
совершенно логичным в силу абсолютной непреложности того факта, что главным
136
Глава 5
местом воздействия общих анестетиков является головной мозг. Для
мониторинга адекватности анестезии использовали как стандартную методику ЭЭГ
(так называемый необработанный сигнал), так и прошедшую определенную
обработку. Стандартная ЭЭГ применяется очень ограниченно, потому что
необработанный сигнал представляет собой очень сложную картину, которую
может интерпретировать только квалифицированный нейрофизиолог. Кроме того,
разные анестетики влияют на необработанный сигнал ЭЭГ по-разному, что не
позволяет считать его универсальным монитором адекватности анестезии.
Компьютеризированная обработка ЭЭГ начинается с преобразования
коротких отрезков ЭЭГ (называемых эпохами) из аналоговой формы в цифровую.
Затем оцифрованная ЭЭГ математически трансформируется в результате
процесса, называемого анализом Фурье. В результате этой трансформации сложная
волна (которую являет собой необработанный сигнал ЭЭГ) разлагается на
несколько синусоид различной амплитуды [17]. Рассчитав относительную
амплитуду (т.е. удельный вес) каждого частотного диапазона, молено получить спектр
мощности (рис. 5.12). Для каждой эпохи (т.е. обработанного сегмента ЭЭГ)
спектр мощности молено отобразить графически. Молено получить больше
информации, если эпохи распололеить друг над другом (снизу вверх от более
ранних к более поздним) и скомпоновать. При этом образуется так называемый
слеатый спектральный ряд, имеющий характерный вид «холмов и долин»
(рис. 5.12). «Холмы» соответствуют частотам ЭЭГ наибольшей амплитуды (или
мощности). Существует и другой способ предоставления данных обработанной
ЭЭГ: определяется частота, нилее которой находится 95% общей мощности. Ее
называют частотой спектрального края [18]. Главное достоинство частоты
спектрального края заключается в том, что этот простой параметр, выралеае-
мый одним числом, коррелирует, как считали долгое время, с адекватностью
анестезии. Следует отметить, что дополнительные исследования дали
противоречивые результаты: частота спектрального края могла коррелировать, а могла и
не коррелировать с такими критериями адекватности анестезии, как гемодина-
мические параметры и целенаправленные движения.
Описанный выше рутинный анализ спектра мощности не позволяет оценить
фазовые взаимоотношения меледу различными компонентами ЭЭГ. Другим
методом обработки ЭЭГ является биспектральный анализ. Здесь целесообразно
привести и англоязычную аббревиатуру этого метода, часто встречающуюся
в литературе — BIS (от bispectral analysis). Биспектральный анализ позволяет
исследовать взаимодействие меледу фазами различных частот [19] и лучше, чем
вышеописанные методы, представить содерлеащуюся в первичной ЭЭГ
информацию (рис. 5.13). Биспектральный анализ позволяет предсказать, будет ли
больной двигаться при разрезе колеи. Эта его прогностическая ценность
продемонстрирована при анестезии изофлюраном [19], а также при сочетании про-
пофола с альфентанилом и изофлюрана с альфентанилом [20]. Вместе с тем
нельзя сказать, что биспектральный анализ абсолютно не зависит от методики
анестезии: в случае, когда в качестве основного анестетика применяли гипно-
тик, были получены одни результаты, когда лее с этой целью использовали
анальгетик — другие [20]. Этот феномен молеет оказаться потенциальным
недостатком биспектрального анализа или лее просто отражать тот факт, что гип-
Обеспечение внутривенной анестезии
137
Рис. 5.12. На рисунке изображена принципиальная схема исследования спектра
мощности ЭЭГ. Необработанный сигнал (вверху слева) преобразуется из аналоговой формы в
цифровую и разбивается на отрезки продолжительностью в одну секунду каждый. Такой
отрезок называют эпохой. Эпоху подвергают анализу Фурье, что позволяет расчитать
относительную амплитуду каждого частотного дипазона. После этого на гистограмме можно
отобразить спектр мощности. Затем эпохи располагают друг над другом (снизу вверх от
более ранних к более поздним) и скомпоновывают, так что образуется характерная
картина «холмов и долин». Воспроизведено с разрешения [17]
Обеспечение внутривенной анестезии
139
нотики и анальгетики оказывают различные клинические эффекты. В то время
как целенаправленные движения представляют собой непосредственную
реакцию на ноцицептивный стимул, биспектральный анализ может отражать иной
аспект функционального состояния мозга, а именно характеризующий интра-
операционное восстановление сознания. Вследствие этого были предприняты
попытки выявить корреляцию между результатами биспектрального анализа и
уровнем седации. Особенно интересен тот уровень седации, когда наступает
утрата сознания. Исследования на добровольцах показали, что при седации про-
пофолом, мидазоламом и изофлюраном результаты биспектрального анализа
хорошо коррелируют со способностью выполнять устные команды [21]. Следует
отметить, что результаты биспектрального анализа несколько отличались в
зависимости от применяемого препарата (рис. 5.14).
Рис. 5.14. Взаимосвязь между биспектральным индексом и вероятностью выполнения
устной команды при седации пропофолом, мидазоламом и изофлюраном. Обратите
внимание, что при использовании пропофола биспектральный индекс, соответствующий
50% вероятности выполнения устной команды, ниже (около 62), чем при применении
изофлюрана и мидазолама (около 70). Воспроизводится с разрешения [21]
Альтернативой ЭЭГ является мониторинг вызванных потенциалов (ВП).
Поскольку из всех систем ЦНС наименее чувствительна к воздействию общих
анестетиков слуховая система, большинство попыток было сконцентрировано
на исследовании акустических ВП. Сразу после подачи простого звукового
раздражителя (например, «щелчок» через наушники) с различных анатомических
зон записывается ЭЭГ. Существует определенная последовательность появления
ВП. Вначале возникают ВП со ствола мозга, затем среднелатентные ВП из тала-
муса и слуховой коры, и последними регистрируются длительнолатентные ВП
из коры лобной доли (рис. 5.15).
140
Глава 5
1 10 100 1000
Миллисекунды
Рис. 5.15- Акустические ВП, вызванные подачей звукового раздражителя. Короткола-
тентные ВП (с I по VII) происходят из ствола мозга, среднелатентные — из таламуса и
слуховой коры, а длительнолатентные — из других участков коры. Воспроизводится с
разрешения [23]
Анестетики и анальгетики практически не влияют на стволовые ВП, но
оказывают дозозависимое действие на среднелатентные ВП (рис. 5.16). Не
выявлено особых отличий во влиянии различных анестетиков на среднелатентные ВП.
Интересно, что высокодозная опиоидная анестезия не влияет на
среднелатентные ВП и в то же время сопряжена с высоким риском интраоперационного
восстановления сознания. Возможно, что в будущем акустические ВП будут
использоваться аля оценки адекватности анестезии.
Управление стрессовой реакцией
Хирургическое вмешательство вызывает сложную стрессовую реакцию,
которая проявляется многочисленными эндокринными, гемодинамическими,
метаболическими и воспалительными изменениями. Вначале происходит выброс катехо-
ламинов, которые стимулируют глюконеогенез, способствуют распаду лсиров и
белков, вызывают задержку натрия и воды. После этого происходит выброс
стероидных и пептидных гормонов, вызывающих устойчивую катаболическую
реакцию, после чего для восстановления исходного метаболического состояния может
потребоваться несколько дней и даже недель. Стрессовая реакция повышает риск
периоперационных сердечно-сосудистых, легочных и желудочно-кишечных
осложнений и летальности. Изучалась способность ингаляционных, внутривенных и
регионарных анестетиков угнетать стрессовую реакцию; а некоторые работы
были посвящены тому, как эта способность влияет на клинические исходы.
Обеспечение внутривенной анестезии
141
Концентрация
пропофола
в плазме
(м кг/мл)
Этапы
инфузии
Время (миллисекунды)
Время (миллисекунды)
Рис. 5.16. Акустические стволовые среднелатентные ВП на фоне увеличения дозы
пропофола (левая колонка) или физиологического раствора (правая колонка). Повышение
концентрации пропофола не оказывает существенного влияния на стволовые ВП, но снижает
амплитуду и увеличивает латентность среднелатентных ВП (Ра и Nb волны).
Физиологический раствор не оказывает никакого влияния на ВП. Воспроизводится с разрешения [24]
В настоящее время считается, что подавление стрессовой реакции снижает риск
осложнений и летальность, связанные с анестезией и операцией, хотя
свидетельствующие об этом данные немногочисленны.
Влияние анестезии на стрессовую реакцию
Хотя при глубокой ингаляционной анестезии уровень стрессовых гормонов
в плазме ниже, чем при поверхностной, ингаляционные анестетики не
позволяют блокировать стрессовую реакцию полностью. Эффективность внутривенных
анестетиков зависит от препарата. Барбитураты, например, оказывают весьма
ограниченное влияние на метаболизм и эндокринную систему. Они в некото-
142
Глава 5
рой степени уменьшают выраженность гипергликемии, но практически не
влияют на активность коры надпочечников.
Этомидат подавляет реакцию коры надпочечников на стресс, но не влияет на
выброс катехоламинов. Влияние этомидата на кору надпочечников обусловлено
не антиноцицептивным действием, а угнетением фермента (lip-гидроксила-
зы), необходимого аая синтеза кортизола. Есть данные, что угнетение синтеза
кортизола этомидатом повышает (а не понижает) летальность. Этот
неблагоприятный эффект был обнаружен, когда этомидат применяли аая седации в
отделении интенсивной терапии (глава 3).
По сравнению с тиопенталом пропофол сильнее угнетает секрецию АКТГ и
кортизола. По некоторым данным, пропофол подавляет острые гемодинамиче-
ские и гормональные реакции, по крайней мере, не менее эффективно, чем
опиоиды [22].
Мидазолам и другие бензодиазепины уменьшают реакцию адреналовой
системы на хирургический стресс за счет угнетения секреции АКТГ, а также влияя
на выработку нескольких цитокинов.
Хотя кетамин обеспечивает глубокую анальгезию, его применение
сопровождается артериальной гипертонией и существенным повышением секреции АКТГ,
кортизола и пролактина. Подобный эффект кетамина объясняется
непосредственной стимуляцией симпатической нервной системы, угнетением обратного
захвата катехоламинов, а также воздействием на ось гипофиз-надпочечники,
приводящим к выбросу АКТГ и альдостерона. Добавление к кетамину мидазолама
может предотвратить повышение уровня катехоламинов, но в отношении других
стрессовых гормонов действует слабее. Более благоприятное действие на
стрессовую реакцию оказывает добавление к кетамину других препаратов
гипнотического действия (например, пропофола). Изомеры кетамина влияют на стрессовую
реакцию так же, как рацемическая смесь.
Чаще всего м^ ослабления стрессовой реакции применяют опиоиды.
Высокие дозы опиоидов (например, фентанил, 50—100 мкг/кг) оказывают
выраженное угнетающее влияние на выброс адреналина, норадреналина, дофамина,
кортизола, гормона роста, альдостерона, эндорфинов и вазопрессина. Менее
высокие дозы опиоидов тоже ослабляют стрессовую реакцию, особенно в
сочетании с другими анестетиками. В этих менее высоких дозах опиоиды практически
так же снижают выброс стрессовых гормонов, но реже вызывают побочные
эффекты (например, продолжительную депрессию дыхания, мышечную
ригидность). Следует отметить, что при сбалансированной анестезии эффективность
добавления опиоидов и гипнотиков в устранении гипертензивных реакций
одинакова [22].
Каким образом опиоиды уменьшают выраженность стрессовой реакции?
Отчасти они снижают ноцицептивную стимуляцию высших нервных центров,
воздействуя на восходящие и нисходящие пути проведения боли, а также,
возможно, оказывают анальгетический эффект на периферии. Кроме того,
опиоиды влияют на различные нейрогуморальные системы за счет взаимодействия
с естественными эндорфинами. Стрессовую реакцию можно снизить и другими
препаратами, воздействующими на ноцицептивную импульсацию, например,
(Х2-адреномиметиками (глава 3). Например, периоперационное назначение
Обеспечение внутривенной анестезии
143
клонидина значительно снизило уровень катехоламинов в плазме во время
вмешательств на сердце и крупных сосудах. Хотя НПВП являются мощными
анальгетиками и антипиретиками (считается, что повышенная температура усиливает
активность системы гипоталамус-гипофиз-надпочечники), их периоперационное
применение не оказывает существенного влияния на стрессовую реакцию.1
Заключение
Хотя для введения в/в анестетиков достаточно минимума оборудования, более
управляемая и надежная анестезия достигается с помощью длительной инфузии.
Инфузия с постоянной скоростью позволяет достичь относительно постоянной
концентрации анестетика в плазме посредством выполнения немногочисленных
заранее заданных инструкций и не требует сложного оборудования. Инфузия
с изменяющейся скоростью позволяет управлять глубиной анестезии в
зависимости от выраженности хирургической стимуляции и ответной реакции. ИУЦК
сочетает достоинства обоих методов инфузии. ИУЦК позволяет достичь стабильной
концентрации анестетика в плазме, которую затем можно увеличить или
уменьшить в зависимости от реакции и вновь стабилизировать уже на другом уровне.
В настоящее время системы для ИУЦК пока что не способны обеспечить
стабильную концентрацию анестетика в плазме у всех категорий больных.
Положение может улучшиться за счет дальнейшего усовершенствования фармакокинети-
ческих моделей, разработанных для многих категорий больных, а также
благодаря разработке новых препаратов. Следует продолжить изучение ИУЦК, чтобы
точнее понять ее преимущества относительно более простых методов доставки
в/в анестетиков. Независимо от способа введения анестетиков (вручную,
полуавтоматически или автоматически) их доставка будет более точной при
использовании надежного и универсального монитора глубины анестезии.
К сожалению, несмотря на многочисленные интересные разработки в
области ЭЭГ, пока еще не существует простого, неинвазивного, достоверного и
удобного аая применения монитора адекватности анестезии, обеспечивающего
прогностическую информацию в режиме реального времени независимо от вида
анестетика и методики анестезии. В настоящее время анестезиолог должен
полагаться на собственный опыт в оценке эффективности анестезии.
Помощниками в этом слркат многочисленные клинические реакции, возникающие в ответ
на различные хирургические стимулы. В настоящее время появились новые
методы оценки адекватности анестезии с помощью прошедшей определенную
обработку ЭЭГ, но они пока еще не могут заменить клинические показатели и
симптомы.
Мониторинг гемодинамики проводят в рамках стандартного интраопераци-
онного мониторинга. Вместе с тем изменения гемодинамики представляют
собой только одно из проявлений стрессовой реакции, неизбежно
сопровождающей хирургическое вмешательство. Очевидно, что многочисленные в/в гипно-
тики, анальгетики и вспомогательные препараты (в том числе барбитураты,
1 Одним из препаратов, оказывающих выраженное угнетающее действие на стрессовую
реакцию, является нейролептик дроперидол. — Прим. ред.
144
Глава 5
этомидат, пропофол, бензодиазепины, опиоиды и (Х2-адреномиметики) могут
ослабить стрессовую реакцию на операцию. Вместе с тем в настоящее время
едва ли существуют анестетики или методики анестезии, которые могли бы
полностью предотвратить стрессовую реакцию. Кроме того, нет достаточных
доказательств существенного преимущества одного анестетика (или вида
анестетиков) перед другими. Также нет доказательств, что уменьшение стрессовой
реакции оказывает какой-либо положительный эффект на исход анестезии.
Отсутствуют доказательства каких-либо различий между сбалансированной
анестезией и ТВВА относительно влияния на исход операции. Эти вопросы будут
рассматриваться в следующей главе.
Список литературы
1. White PF. Clinical uses of intravenous anesthetic and analgesic infusions. Anesth Analg
1989;68:161-171.
2. Roberts FL, Dixon J, Lewis GTR, Tackley RM, Prys-Roberts С Induction and maintenance of pro-
pofol anaesthesia. A manual infusion scheme. Anaesthesia 1988;43 (Supplement) :14-17.
3. Tackley RM, Lewis GT, Prys Roberts C, et at Computer controlled infusion of propofol. BrJAna-
esth 1989;62:46-53.
4.Chaudhri S, White M, Kenny GN. Induction of anaesthesia with propofol using a
target-controlled infusion system. Anaesthesia 1992;47:551-553.
5. Coetzee JF, Glen JB, Wium CA, Boshoff L. Pharmacokinetic model selection for target controlled
infusions of propofol. Assessment of three parameter sets. Anesthesiology 1995;82:1328-1345.
6.Shafer SL. Advances in propofol pharmacokinetics and pharmacodynamics. J Clin Anesth
1993;5(supplement 1):14S-21S.
7. Doyle E, McFadzean W, Morton NS. I.V. anaesthesia with propofol using a target-controlled
infusion system: comparison with inhalation anaesthesia for general surgical procedures in children.
BrJAnaesth 1993;70:542-545.
8. Davidson JA, McLeod AD, Howie JC, White M, Kenny GN. Effective concentration 50 for
propofol with and without 67% nitrous oxide. Acta Anaesthesiol Scand 1993;37:458-464.
9. Irwin MG, Thompson N, Kenny GNC. Patient-maintained propofol sedation. Assessment of a
target-controlled infusion system. Anaesthesia 1997;52:525-530.
10. Cohen MM, Duncan PG, Pope WDB, Wolkenstein C. A survey of 112,000 anaesthetics at one
teaching hospital (1975-83). Can Anaesth Soc J 1986;33:22-31.
11. Aitkenhead AR. Risk management in anaesthesia. J Med Defense Union 1991;4:86-90.
12. Sandin R, Nordstrom O. Awareness during total i.v. anaesthesia. Br J Anaesth 1993;71:782-787.
13.Mallon JS, Edelist G. Total intravenous anesthesia (editorial). Can ] Anaesth 1990;37:279-281.
14. Russell IF. Balanced anesthesia: does it anesthetize? Anesth Analg 1985;64:941-942.
15. Ausems ME, Hug CC Jr, Stanski DR, Burm AGL. Plasma concentrations of alfentanil required to
supplement nitrous oxide anesthesia for general surgery. Anesthesiology 1986;65:362-373.
16. Watcha ME, White PF. Failure of lower esophageal contractility to predict patient movement in
children anesthetized with halothane and nitrous oxide. Anesthesiology 1989;71:664-668.
17. Levy WJ, Shapiro HM, Maruchak G, Meathe E. Automated EEG processing for intraoperative
monitoring: a comparison of techniques. Anesthesiology 1980;53:223-236.
18. Rampil IJ, Holzer J A, Quest DO, Rosenbaum SH, Correll JW. Prognostic value of computerized
EEG analysis during carotid endarterectomy. Anesth Analg 1983;62:186-192.
19. Sebel PS, Bowles SM, Saini V, Chamoun N. EEG bispectrum predicts movement during thiopen-
tal/isoflurane anesthesia. ] Clin Monit 1995;11:83-91.
Обеспечение внутривенной анестезии
145
20. Vernon JM, Lang E, Sebel PS, Manberg P. Prediction of movement using bispectral electroencep-
halographic analysis during propofol/alfentanil or isoflurane/alfentanil anesthesia. Anesth Analg
1995;80:780-785.
21. Glass PSA, Bloom M, Kearse L, et al. Bispectral analysis measures sedation and memory effects of
propofol, midazolam, isoflurane, and alfentanil in healthy volunteers. Anesthesiology 1997;86:
836-847.
22. Monk TG, Ding Y, White PF. Total intravenous anesthesia: effects of opioid versus hypnotic
supplementation on autonomic responses and recovery. Anesth Analg 1992;75:798-804.
23.Ghoneim MM, Block RI. Learning and consciousness during general anaesthesia. Anesthesiology
1992;76:279-305.
24. Thornton C, Konieczko KM, Knight AB, et al. Effect of propofol on the auditory evoked response
and oesophageal contractility. Br J Anaesth 1989;63:411-417.
10 Тотальная внутривенная анестезия
Глава 6
Преимущества и недостатки
внутривенной анестезии
Введение
В настоящей главе рассмотрены преимущества и недостатки различных
методик внутривенной и ингаляционной анестезии. Будет обсуждено токсическое
воздействие анестетиков на органы и ткани, а также влияние различных
методик анестезии на некоторые формализованные исходы.
Внутривенную анестезию обычно проводят сочетанием нескольких
препаратов, что порождает проблему взаимодействия между ними. Взаимодействие
между анестетиками может носить как благоприятный, так и неблагоприятный
характер. Ниже будут рассмотрены механизмы этого феномена и приведены
примеры клинически значимого взаимодействия.
Токсическое воздействие на органы и ткани
Современные внутривенные и ингаляционные анестетики редко оказывают
прямое токсическое воздействие. Вместе с тем, ингаляционные анестетики
вызывают некоторые побочные эффекты, которые никогда не возникают при
использовании внутривенных анестетиков.
Злокачественная гипертермия
Злокачественная гипертермия возникает у людей с наследственной аномалией
сарколеммы саркоплазматического ретикулума при воздействии
провоцирующего фактора. Для злокачественной гипертермии характерен гиперметаболизм,
повышенное потребление кислорода и повышенная выработка углекислого газа, что
вызывает ацидоз, мышечные сокращения и быстрое повышение температуры
тела. В отсутствие лечения злокачественная гипертермия обычно приводит
к смерти. Своевременное распознавание, устранение провоцирующего фактора и
лечение дантроленом позволяют вывести больного из этого состояния. Частота
злокачественной гипертермии составляет 1 : 6000—1 :200 000. Важно
подчеркнуть, что все ингаляционные анестетики являются провоцирующими
факторами злокачественной гипертермии. Внутривенные гипнотики и опиоиды не
провоцируют злокачественную гипертермию и могут быть использованы у больных
с высоким риском этого осложнения. Мощным провоцирующим фактором
злокачественной гипертермии является сукцинилхолин, но не недеполяризующие
миорелаксанты.
Преимущества и недостатки внутривенной анестезии 147
«Галотановый» гепатит
Иногда после применения галотана развивается молниеносный некроз
печени. В период с 1978 по 1985 гг. Комитетом по Безопасности Лекарственных
Средств (Committee on Safety of Medicines) было получено 84 сообщения о
тяжелых повреждениях печени, сопряженных с применением галотана. При
анализе этих сообщений установили, что для тех случаев, когда применение
галотана было установлено с абсолютной достоверностью, летальность составила 40%.
Если повреждение печени возникало после многократных галотановых
анестезий, то летальность была еще выше. В настоящее время известно, что более 20%
попавшего в организм галотана подвергается биотрансформации, в результате
чего образуется трифторуксусная кислота. В свою очередь, трифторуксусная
кислота взаимодействует с белками печени, образуя конъюгаты. Эти конъюгаты
представляют собой антиген, который у некоторых больных запускает
иммунную реакцию. Повторная экспозиция к галотану или другим ингаляционным
анестетикам, тоже способным образовывать конъюгаты с белками печени (эн-
флюран, изофлюран, десфлюран), может привести к опосредованному
иммунными механизмами некрозу печени. Степень биотрансформации галотана
значительно выше, чем у других ингаляционных анестетиков, поэтому он наиболее
гепатотоксичен. Тем не менее, в ходе метаболизма изофлюрана и десфлюрана
образуется небольшое количество трифторуксусной кислоты. В ходе
метаболизма энфлюрана образуется вещество, тоже способное образовывать иммуноген-
ные конъюгаты с белками печени (рис. 6.1). Вероятность повреждения печени
прямо пропорциональна степени метаболизма анестетиков. Так,
биотрансформации подвергаются 2% энфлюрана, 0,2% изофлюрана и 0,02% десфлюрана.
Новейшие ингаляционные анестетики не подвергаются биотрансформации в
степени, достаточной для инициации выработки антител, хотя они могут
спровоцировать гепатит у ранее сенсибилизированных больных. Действительно, описаны
случаи печеночного некроза после применения энфлюрана, изофлюрана и
десфлюрана. Хотя внутривенные анестетики подвергаются интенсивному
метаболизму, ни один из продуктов их метаболизма не образует перекрестно
реагирующих коньюгатов с белками или каких-либо других антигенов. Это объясняет, почему
внутривенные анестетики не вызывают гепатита. Севофлюран тоже не вызывает
гепатит, поскольку по структуре значительно отличается от других галогенизированных
эфиров (рис. 6.1) и не образует коньюгатов с печеночными белками, хотя в
умеренной степени (около 7%) подвергается биотрансформации.
Токсическое действие ионов фтора
В ходе метаболизма ингаляционного анестетика метоксифлюрана образуется
большое количество ионов фтора, что приводит к повреждению почек, а именно
к полиурической почечной недостаточности. Раньше считали, что повреждение
почек может возникнуть при концентрации ионов фтора в плазме > 50 мкмоль/л.
В настоящее время ясно, что нефротоксичность в значительной степени зависит
еще и от продолжительности применения ингаляционного анестетика, при
биотрансформации которого образуются ионы фтора. Метоксифлюран рке
давно не применяют в клинике. При метаболизме энфлюрана и севофлюрана тоже
148
Глава 6
Рис. 6.1- Метаболизм ингаляционных анестетиков. Галотан, изофлюран и десфлюран
окисляются до трифторуксусной кислоты, образующей конъюгаты с белками. Энфлюран
окисляется до производного трифторуксусной кислоты, также образующего конъюгаты с
белками. Севофлюран окисляется до гексафторизопропанола
образуются ионы фтора. По сравнению с метоксифлюраном и севофлюраном,
при метаболизме энфлюрана образуется намного меньше ионов фтора. Тем не
менее, длительная ингаляция энфлюрана может вызвать определяемую
лабораторными методами (но субклиническую) дисфункцию почек. Энфлюран
нецелесообразно использовать при длительных операциях, а также при исходной
почечной недостаточности. По сравнению с энфлюраном, при биотрансформации се-
вофлюрана образуется больше ионов фтора. Несмотря на это, не было описано
ни одного случая опосредованной севофлюраном нефротоксичности, даже у
больных с исходной дисфункцией почек [1]. Возможно, это обусловлено тем, что,
во-первых, в ходе метаболизма севофлюрана дефторирование происходит
преимущественно в печени, а не в почках, и, во-вторых, севофлюран очень быстро
элиминируется. Тем не менее, следует проявлять осторожность, поскольку опыт
использования севофлюрана меньше, чем энфлюрана. В ходе биотрансформации
внутривенных анестетиков и анальгетиков ионов фтора не образуется.
Преимущества и недостатки внутривенной анестезии 149^
Токсические эффекты, обусловленные взаимодействием
анестетиков с натронной известью
Расход ингаляционных анестетиков зависит преимущественно от потока
свежего газа, поэтому большую популярность получила низкопоточная анестезия,
требующая применения сорбентов 0(¾. Многие ингаляционные анестетики
взаимодействуют с натронной известью (и другими сорбентами СО2), в
результате чего могут образовываться токсические вещества. При некоторых
обстоятельствах натронная известь высыхает — например, если через адсорбер
в течение нескольких часов пропускают смесь с очень высоким содержанием
кислорода. Чем суше натронная известь, тем выше ее способность
адсорбировать ингаляционные анестетики и вступать с ними в химические реакции. При
взаимодействии сухой натронной извести с энфлюраном, изофлюраном и дес-
флюраном может образовываться угарный газ. При этом, если натронная
известь абсолютно сухая, то концентрация угарного газа в дыхательной смеси
может достигать нескольких тысяч ррт (ррт, от английского parts per million —
«частей на миллион» — выражение концентрации газа в газовой смеси). При
взаимодействии натронной извести с галотаном и севофлюраном угарный газ не
образуется. На практике полного высыхания натронной извести обычно не
происходит и отравления угарным газом не возникает.
Галотан активно взаимодействует с натронной известью. Одним из
продуктов этого взаимодействия является 2-бром-2-хлор-1,1-дифторэтилен, который
в концентрации 250 ррт оказывает токсическое действие у мышей. У людей
токсическое действие 2-бром-2-хлор-1,1-дифторэтилена не исследовалось, но
известно, что в ходе обычной галотановой анестезии его концентрация не
превышает 5 ррт (в 50 раз ниже токсического уровня, установленного ^я
животных) . При взаимодействии севофлюрана с натронной известью образуется оле-
фин (синоним: соединение А). У крыс летальная концентрация соединения А
составляет 1000 ррт. В клинических условиях у людей при севофлюрановой
анестезии концентрация соединения А значительно ниже — 20—30 ррт.
С другой стороны, поражение почек у крыс может возникнуть при
концентрации соединения А около 50 ррт. Хотя этот уровень близок к концентрации,
которая может быть достигнута в ходе анестезии, пока что не поступало
сообщений о повреждении почек после применения севофлюрана [1].
Внутривенные анестетики не взаимодействуют с натронной известью. Более
того, при внутривенной анестезии нет необходимости в применении низкого
потока свежего газа. Для умеренного нагревания и увлажнения дыхательной
смеси существуют иные способы, помимо применения натронной извести.
Отказ от ингаляционных анестетиков позволяет избежать значительных затрат, а
также устраняет проблему загрязнения атмосферы. Следовательно,
внутривенную анестезию вполне можно проводить без натронной извести.
Прочие токсические эффекты
Внутривенные анестетики редко оказывают токсическое действие.
Барбитураты, бензодиазепины и стероидные анестетики провоцируют обострение
некоторых форм порфирии. Порфирия не является противопоказанием к приме-
150
Глава 6
нению пропофола, этомидата, кетамина и ингаляционных анестетиков.
Повреждение печени и почек может быть обусловлено снижением кровотока в этих
органах. В нормальных условиях большинство внутривенных анестетиков
вызывает лишь незначительное снижение регионарного кровотока, которое, однако,
может стать значительным при сопутствующих заболеваниях и гиповолемии.
Крупномасштабные ретроспективные исследования не выявили значимых
различий между ингаляционными и внутривенными анестетиками относительно
общей токсичности и повреждения- органов.
Взаимодействие между анестетиками
Как уже было отмечено (глава 2), имеются четыре основных компонента
анестезии — устранение сознания, анальгезия, вегетативная блокада и миоре-
лаксация. Ингаляционные анестетики адекватно устраняют и боль, и сознание.
В отличие от них, внутривенные анестетики действуют более избирательно,
обеспечивая какой-либо один компонент анестезии. Соответственно,
адекватная внутривенная анестезия требует применения нескольких анестетиков, что
делает актуальным проблему их взаимодействия друг с другом. Взаимодействие
между двумя ингаляционными анестетиками носит аддитивный характер:
например, сочетание двух анестетиков, одного в дозе 60% МАК, другого в
дозе 40% МАК оказывает тот же эффект, что и любой из этих двух препаратов
в дозе 1 МАК. Взаимодействие мелсду внутривенными анестетиками (или
мелсду ингаляционными и внутривенными) значительно слолснее, потому что
в/в гипнотики, анальгетики, анксиолитики и адреноблокаторы воздействуют на
различные рецепторы и обладают различными механизмами действия.
Существуют три вида взаимодействия лекарственных препаратов. Во-первых, аддитивное
взаимодействие, когда эффект от сочетания препаратов такой лее, как от суммы
их компонентов (как описано выше для двух ингаляционных анестетиков).
Во-вторых, синергизм, о котором говорят в том случае, когда эффект от сочетания
препаратов больше, чем от суммы их компонентов. В-третьих, антагонизм, когда
эффект от сочетания препаратов меньше, чем от суммы компонентов.
Взаимодействие благоприятно, если оно увеличивает лселательный эффект (или
уменьшает нелселательный), и неблагоприятно, если возникает обратное.
Механизмы взаимодействия между лекарственными
препаратами
Существует ряд механизмов мелслекарственного взаимодействия.
1. Физико-химическое взаимодействие: два препарата несовместимы при
смешивании друг с другом, например, из-за различия рН. Вследствие этого
взаимодействия некоторые препараты нельзя смешивать в одном шприце. Если
несовместимые препараты не смешивать в одном шприце, а последовательно
вводить через катетер в/в, то проблемы возникают очень редко.
Промывание катетера после калсдого введения препарата или введение препарата на
фоне быстрой инфузии еще более снижает риск физико-химического
взаимодействия.
Преимущества и недостатки внутривенной анестезии
151
2. Фармакокинетическое взаимодействие: один препарат изменяет
распределение или метаболизм другого препарата, или же влияет на его связь с
белками плазмы, изменяя его активную несвязанную фракцию. Например,
уменьшение сердечного выброса, обусловленное одним препаратом, может
уменьшить перераспределение другого препарата, увеличивая, таким образом, его
концентрацию в плазме.
3. Фармакодинамическое взаимодействие: (а) чувствительность рецепторов
к препарату может изменяться под влиянием другого препарата; (б)
комплементарное (или антагонистическое) действие одного препарата на
рецепторы второго в тех участках связывания, с которыми этот второй
препарат не взаимодействует; (в) другие механизмы.
Оценка взаимодействия лекарственных препаратов
Эффект сочетания двух препаратов можно выразить графически. Вначале для
каждого препарата рассчитывается кривая доза-эффект. После этого с
помощью изоболографического анализа изучается эффект сочетания препаратов [2].
На графике откладывают ED50 одного препарата на оси X, ED50 второго — на
оси Y (ED50 — доза препарата, при которой развивается эффект,
составляющий 50% от максимального). Эти две точки соединяют прямой. Если новая
точка, представляющая собой ED50 сочетания препаратов, находится на этой
прямой, то взаимодействие носит аддитивный характер. Если эта точка
располагается ниже (левее) прямой, то речь идет о синергизме, если выше
(правее) — то об антагонизме (рис. 6.2).
Рис. 6.2. Простая изоболограмма. На графике откладывают ED50 препарата А на оси Y,
ED50 препарата В — на оси X. Полученные точки соединяют прямой линией. После этого
определяют ED50 для сочетания А и В, и отмечают ее в виде точки на графике. Если новая
точка находится на прямой, то взаимодействие носит аддитивный характер. Если эта
точка располагается ниже (левее) прямой, то речь идет о синергизме, если выше
(правее) — то об антагонизме
152
Глава 6
Клинически значимые взаимодействия между анестетиками
Взаимодействие мидазолама с барбитуратами, пропофолом и опиоидами
характеризуется выраженным синергизмом. Малые дозы мидазолама потенцииру-
ют действие барбитуратов, пропофола и опиоидов. В свою очередь, малые дозы
барбитуратов, пропофола и опиоидов потенциируют действие мидазолама. Про-
пофол и барбитураты влияют на связывание бензодиазепинов с бензодиазепино-
выми рецепторами. Мидазолам в дозе 0,02 мг/кг (очень низкая доза,
составляющая 10% от ED50) уменьшает ED50 тиопентала вдвое, a ED50 альфентанила —
почти на 80%. Значительным преимуществом этого взаимодействия является
снижение доз анестетиков, что сокращает затраты. Кроме того, премедикация
мидазоламом значительно снижает вариабельность реакции на анестетики,
используемые в ходе индукции анестезии, что позволяет точнее рассчитать дозу
этих анестетиков, избежать передозировки и снизить расходы.
Синергизм может носить и неблагоприятный характер. Например,
сочетание опиоидов и мидазолама характеризуется выраженным синергизмом в
отношении депрессии дыхания. Так, фентанил в дозе 2 мкг/кг в/в не вызывает
апноэ, но у 50% исследуемых добровольцев приводит к снижению Sa02 ^ 90%.
Мидазолам в дозе 0,05 мг/кг в/в не оказывает практически никакого влияния
на дыхание. Сочетание фентанила с мидазоламом в вышеуказанных дозах
вызывает апноэ (отсутствие попытки вдоха в течение > 15 сек) у 50% добровольцев,
а снижение SaC>2 — у 95% [3]. Это взаимодействие было причиной
смертельных исходов при использовании сочетания опиоида с бензодиазепином для се-
дации (например, в ходе эндоскопии). Кроме того, сочетание бензодиазепина
с опиоидом вызывает более глубокую артериальную гипотонию, чем каждый
препарат по отдельности.
Многие межлекарственные взаимодействия носят аддитивный характер.
Примерами являются взаимодействие ингаляционных анестетиков между
собой, взаимодействие ингаляционных анестетиков с закисью азота,
взаимодействие кетамина с тиопенталом, пропофолом и мидазоламом, а также
взаимодействие пропофола с опиоидами.
Взаимодействовать между собой могут не только два, но и три препарата.
Например, мидазолам, опиоиды и барбитураты действуют синергично, что
уменьшает их индукционные дозы. Пропофол оказывает аддитивное действие
на сочетание опиоида с бензодиазепином, которое, в свою очередь, носит си-
нергистичный характер. Индукция анестезии сочетанием препаратов позволяет
использовать низкие дозы анестетиков, ускоряет наступление анестезии,
обеспечивает более стабильную гемодинамику и сильнее угнетает подъем
внутриглазного и внутричерепного давления при интубации трахеи.
Иногда при взаимодействии лекарственных препаратов наблюдается
предельный эффект. Так, при индукции анестезии малые дозы опиоидов уменьшает
потребность в пропофоле. Когда концентрация опиоидов в плазме превышает
определенный уровень (3—4 нг/мл аая фентанила и 100—150 нг/мл аая
альфентанила), то дальнейшее увеличение их дозы рке не снижает потребность
в пропофоле, но увеличивает риск побочных эффектов.
Преимущества и недостатки внутривенной анестезии
153
Анализ исходов анестезии
Исход после общей анестезии может подразумевать несколько понятий.
Очевидно, что главным, ключевым критерием является летальность. На заре
внутривенной анестезии (например, в бытность событий при Перл-Харборе)
чрезмерно высокие дозы некоторых анестетиков на фоне неадекватной инфузи-
онной терапии обусловили высокую летальность. Причину этой летальности
в то время ошибочно нашли в самой методике анестезии [4]. Позднее
внутривенная анестезия была «повторно» изобретена как нейролептанестезия,
сопровождающаяся уже значительно меньшей летальностью, чем другие доступные
в то время методики анестезии. Обусловленная анестезией летальность
уменьшилась с 1 : 1000 в 1944 г. до 1 : 250 000 в 1986 г. [5]. Все современные
методики анестезии оказались весьма безопасными, и в настоящее время
невозможно выявить даже небольшие различия между ними в отношении летальности.
Отсроченное влияние анестезии на такие синтетические параметры, как
отдаленная реакция организма на операцию и общее самочувствие, оценить
трудно. При длительном наблюдении в послеоперационном периоде на общий
исход влияют многие факторы. Чтобы устранить действие этих факторов,
необходимо провести строго организованное и контролируемое исследование у
большого количества больных, что на сегодняшний день практически невозможно
сделать. В настоящее время не существует достоверных данных,
свидетельствующих о более благоприятном отдаленном исходе после внутривенной
анестезии по сравнению с ингаляционной. Не имеется достоверных данных и за
противоположный вывод.
Существуют другие важные исходы. В раннем послеоперационном периоде
больные с большим удовлетворением воспринимают быстрое и полноценное
восстановление сознания после анестезии. При амбулаторных вмешательствах
больные хотят иметь возможность быстрее вернуться домой. Больные не
желают испытывать боль и другие побочные эффекты, особенно ПОТР.
Окончательным исходом являются суммарные затраты для общества. Общество хочет,
чтобы здравоохранение было экономически эффективным. Иными словами, оно
желает либо лучшего здравоохранения за те же средства, либо поддержания
определенных стандартов здравоохранения при меньших затратах.
При анализе экономической эффективности анестезии необходимо
принимать во внимание все прямые затраты на лекарственные препараты и
аппаратуру, а также непрямые затраты, необходимые АА^ функционирования палаты
пробуждения, пребывания больного в больнице, а таюке аая лечения побочных
реакций. Кроме того, необходимо учитывать убытки общества от
нетрудоспособности и инвалидности.
Пробуждение и ближайший послеоперационный период
Пробуждение и восстановление психомоторных функций после анестезии
представляют собой достаточно удобные критерии /^ оценки исходов.
Предполагается (хотя и в отсутствие строгих доказательств), что раннее
пробуждение сопровождается более ранним восстановлением защитных
рефлексов и поэтому безопаснее, чем отсроченное. С другой стороны, если в палате
154
Глава 6
пробуждения хватает опытного персонала, и у больного раньше времени не
удаляют интубационную трубку или ларингеальную Macicy, то особой опасности
в отсроченном восстановлении защитных рефлексов нет. Предполагается
также, что быстрое пробркдение позволяет эффективнее использовать
операционную, давая возможность быстрее начать следующую операцию. Это верно
только в том случае, когда отсутствует палата пробуждения и больного необходимо
пробудить на операционном столе. Быстрое восстановление психомоторных
функций может сократить расходы, если оно укорачивает время, проведенное
в палате пробркдения, или позволяет раньше выписать больного после
амбулаторного вмешательства. Экономия средств в значительной степени зависит от
того, каким образом рассчитывается и оплачивается время работы палаты
пробуждения. В конечном счете, финансовая выгода появляется только за счет
больших изменений в кадровой политике (иными словами, если методика
анестезии позволяет быстро пробудить подавляющее большинство больных, то можно
значительно сократить персонал палаты пробуждения). На практике между
различными современными методиками анестезии не выявляется выраженных
различий в отношении пробуждения после операции.
Ранние исследования, в которых сравнивали ТВВА на основе пропофола
(который применяли как для индукции, так и ^.ая поддержания) с
«традиционными» методиками анестезии (индукция тиопенталом и поддержание
ингаляционными препаратами), логично демонстрировали более быстрое пробркдение
и более раннюю выписку при пропофоловой анестезии (табл. 6.1). Если для
индукции анестезии в обеих группах применяли пропофол (сейчас это широко
распространено при амбулаторных вмешательствах), то различия значительно
уменьшались (табл. 6.2). Замена «старых» ингаляционных анестетиков (галота-
на, энфлюрана и изофлюрана) «новыми» (севофлюраном и десфлюраном)
значительно ускорила пробуждение, особенно если для индукции тоже применяли
ингаляционный анестетик [6, 7]. Чем больше времени проходит после
операции, тем меньше становятся различия между методиками анестезии. Поэтому
неудивительно, что так мало работ посвящено влиянию различных методик
анестезии на события отсроченного послеоперационного периода (например,
возвращение к работе после операции). После биопсии молочной железы
женщины, получившие пропофоловую анестезию, выписывались раньше и приступали
к работе на полдня раньше (1,5+0,1 против 2,0+0,1 дней) тех, кому
проводили анестезию по схеме тиопентал-изофлюран [8]. Напротив, когда всем
больным проводили индукцию пропофолом, а для поддержания применяли либо
пропофол, либо энфлюран, то через 4 ч после стоматологической операции
между группами не было выявлено различий в восстановлении психомоторных
функций [9].
Не выявлено различий между методиками пропофол-фентанил и изофлю-
ран-фентанил относительно продолжительности госпитализации после больших
операций на брюшной полости, хотя через семь дней после хирургического
вмешательства субъективные ощущения и социальная адаптация оказались лучше
в группе ТВВА [10]. Неоспоримое преимущество ТВВА (по крайней мере, на
основе пропофола) состоит в значительном снижении риска
послеоперационной тошноты и рвоты (ПОТР). На риск ПОТР, помимо методики анестезии,
Преимущества и недостатки внутривенной анестезии 157
влияют многие факторы, на которые нельзя повлиять — пол, анамнез, вид
операции. Тем не менее, после применения пропофола частота ПОТР всегда ниже,
чем после использования других анестетиков. Противорвотный эффект
развивается, даже если пропофол применяли только для индукции, но становится
наиболее выраженным при поддержании анестезии пропофолом. Например,
частота требующей лечения тошноты после изофлюрановой анестезии составляет
44% против 19% после поддержания анестезии пропофолом [11]. Отметим,
что после севофлюрановой анестезии частота ПОТР приближается к
наблюдаемой после применения пропофола [6].
По сравнению с изофлюрановой анестезией, пропофоловая сопряжена с
более быстрым пробуждением и меньшей частотой ПОТР в течение первых 2 ч
после больших операций на брюшной полости [12]. Тем не менее, эти
очевидные преимущества пропофола в отношении раннего послеоперационного
периода не сопровождались ни уменьшением частоты эпизодов снижения Sa02
в первые три ночи после операции, ни более ранним восстановлением функции
ЖКТ, ни более быстрой активизацией, ни уменьшением продолжительности
госпитализации [12]. Благодаря снижению частоты ПОТР, пропофол может
ускорять выписку после амбулаторных вмешательств. При амбулаторных
вмешательствах после изофлюрановой анестезии больных выписывали через 235+90 мин,
после пропофоловой — через 197+55 мин [12]. ПОТР значительно замедляет
выписку: если ПОТР развивалась, то больных выписывали в среднем через
267+95 мин после операции, если не развивалась — через 185+47 мин.
Помимо более длительного пребывания в больнице, ПОТР требует дополнительного
медицинского ухода и времени, а также применения лекарственных
препаратов и расходных средств. Средние расходы на одного больного, страдающего
ПОТР, были оценены в 15 долларов США. Как правило, больные очень
негативно относятся к ПОТР и даже предпочитают испытывать боль, а не тошноту.
Помимо неприятных субъективных ощущений и увеличения продолжительности
пребывания в больнице, ПОТР может вызвать такие осложнения, как
аспирация желудочного содержимого, повышение внутриглазного и внутричерепного
давления, а также расхождение швов и кровотечение из операционной раны.
Применение этомидата и опиоидов сопровождается высокой частотой
ПОТР. Значительная частота ПОТР при использовании опиоидов повысила
интерес к альтернативным методам обезболивания, включая вспомогательную
местную анестезию и НПВП. Тем не менее, существует потребность в мощном
анальгетике, не вызывающем тошноты.
Прочие исходы
Существуют значительные противоречия относительно влияния методики
анестезии на различные исходы. Выше уже упоминалось, что оценивать
отсроченные исходы трудно, поэтому большинство работ посвящено влиянию
анестезии на ключевые системы органов.
Сопутствующие сердечно-сосудистые заболевания достаточно широко
распространены и сопряжены с высоким риском периоперационных осложнений
и летальности. При оценке частоты послеоперационных сердечно-сосудистых
158
Глава в
осложнений необходимо установить, насколько велика была вероятность
возникновения этих осложнений в отсутствие операции. Достаточно трудно
оценить роль операции и анестезии в генезе сердечно-сосудистых осложнений
отдельно от факторов риска (например, от курения).
Многие работы, сравнивающие в/в и ингаляционные анестетики при
сопутствующих сердечно-сосудистых заболеваниях, не выявили различий относительно
влияния на частоту периоперационных сердечно-сосудистых осложнений. Пе-
риоперационная ишемия миокарда, скорее всего, является наиболее важным
фактором, определяющим долгосрочный прогноз состояния сердечно-сосудистой
системы. В отделении интенсивной терапии после аортокоронарного
шунтирования частота и тяжесть эпизодов ишемии миокарда была ниже, если в ходе
операции проводили адекватную интенсивную анальгезию суфентанилом
(1 мкг/кг/час), а не периодическое струйное введение морфина [13]. Эти
различия сохранялись только на период поддержания интенсивной анальгезии, но не
влияли на частоту повторных инфарктов [13]. Другие авторы тоже показали, что
эффективная интраоперационная анальгезия уменьшает риск
послеоперационной ишемии миокарда, но ее влияние на отсроченные исходы неизвестно.
Опиоидные анальгетики значительно ухудшают функцию внешнего дыхания
в послеоперационном периоде, что обусловлено их угнетающим действием на
дыхательный центр. Ингаляционные анестетики и в/в гипнотики не имеют
особых различий относительно влияния на систему дыхания.
После кардио- и нейрохирургических вмешательств относительно часто
развивается послеоперационный неврологический дефицит. Пока не существует
четких доказательств, что какая-либо методика анестезии достоверно снижает
риск неврологических осложнений. На многих экспериментальных моделях у
животных доказано, что барбитураты защищают мозг от очаговой ишемии.
Пока не существует единого мнения касательно нейропротективного действия
барбитуратов у человека.
Исследования на животных и in vitro показали, что ингаляционные
анестетики угнетают иммунную систему сильнее, чем внутривенные. Хотя теоретически
это может повысить частоту послеоперационных инфекционных осложнений и
способствовать опухолевому росту, на практике не было найдено значимых
различий в этом отношении между больными, получавшими внутривенную и
ингаляционную анестезию.
Заключение
Внутривенной анестезии присущи как преимущества, так и недостатки.
Адекватная внутривенная анестезия требует применения нескольких анестетиков, что
делает актуальной проблему их взаимодействия друг с другом. Взаимодействия
между анестетиками могут носить благоприятный характер в том случае, если
позволяют добиться более сильного или стойкого эффекта, а также снижают
расход препаратов. Взаимодействия могут усиливать желаемый эффект,
одновременно снижая выраженность побочных эффектов, возникающих при использовании
высокой дозы одного препарата. Взаимодействия иногда могут усиливать
токсическое действие, и анестезиолог всегда должен иметь это в виду, когда при
введении нескольких препаратов возникают какие-то необычные эффекты.
Преимущества и недостатки внутривенной анестезии
159
Любой лекарственный препарат может оказывать токсическое действие.
Существует несколько редких, но хорошо известных форм токсического действия
ингаляционных анестетиков. К ним относятся злокачественная гипертермия и
«галотановый» гепатит. Можно избежать этих осложнений, отказавшись от
ингаляционной анестезии в пользу внутривенной. Токсические эффекты
ингаляционных анестетиков на практике развиваются очень редко. Общие исходы после
внутривенной и ингаляционной анестезии практически не различаются.
Сопутствующие заболевания могут влиять на выбор методики анестезии (например,
при порфирии нельзя применять барбитураты и бензодиазепины).
Трудно оценить отсроченное действие анестезии на отдаленные исходы.
Достаточно легко продемонстрировать некоторые отличия между различными
методиками анестезии относительно влияния на пробуждение и
восстановление психомоторных функций в ближайшем послеоперационном периоде.
Вместе с тем и эти различия становятся все менее различимым по мере
усовершенствования внутривенных и ингаляционных анестетиков. Существует мнение,
что более быстрое пробуждение снизит затраты и улучшит самочувствие
больных. На самом деле, затраты зависят от многих факторов, а влияние анестезии
на долгосрочные исходы определить трудно. ТВВА снижает риск ПОТР, но
только при использовании пропофола. Более того, риск ПОТР зависит от
многих факторов; в частности, он значительно увеличивается при использовании
опиоидов. Влияние анестезии на другие исходы исследовали редко. Анестезия
становится все более безопасной с благоприятным послеоперационным
исходом. Тщательно проведенная, хорошо управляемая анестезия, позволяющая
избежать периоперационной ишемии миокарда, в большей степени гарантирует
благоприятный исход, нежели применение какого-то особенного анальгетика
или анестетика.
Список литературы
1. Smith I, Nathanson M, White PF. Sevoflurane — a long-awaited volatile anaesthetic. BrJAnaesth
1996;76:435-445.
2. Loewe S, Aldou RA, Fox SR, Johnson DG, Perkins W. Isobols of dose-effect relations in the
combination of trimethadione and pentylenetetrazole. ] Pharmacol Exp Ther 1955;113:475-480.
3. Bailey PL, Pace NL, Ashburn MA, et at. Frequent hypoxemia and apnea after sedation with
midazolam and fentanyl. Anesthesiology 1990;73:826-830.
4.Halford FJ. A critique of intravenous anesthesia in war surgery. Anesthesiology 1943;4:67-69.
5. Cohen MM, Duncan PG, Pope WDB, Wolkenstein C. A survey of 112,000 anaesthetics at one
teaching hospital (1975-83). Can Anaesth Soc J 1986;33:22-31.
6.Jellish WS, Lien CA, Fontenot HJ, Hall R. The comparative effects of sevoflurane versus propofol
in the inductions and maintenance of anesthesia in adult patients. Anesth Analg 1996;82:479-485.
7. Van Hemelrijck J, Smith I, White PF. Use of desflurane for outpatient anesthesia: a comparison
with propofol and nitrous oxide. Anesthesiology 1991;75:197-203.
8. Sung YF, Reiss N, Tillette T. The differential cost of anesthesia and recovery with propofol-nitro-
us oxide anesthesia versus thiopental sodium-nitrous oxide anesthesia. ] Clin Anesth
1991;3:391-394.
9. Pollard BJ, Bryan A, Bennett D, et al. Recovery after oral surgery with halothane, enflurane, isof-
lurane or propofol anaesthesia. Br ] Anaesth 1994;72:559-566.
160
Глава 6
10. Kalman SH, Jensen AG, Ekberg K, Eintrei C. Early and late recovery after major abdominal
surgery. Comparison between propofol anaesthesia with and without nitrous oxide and isoflurane
anaesthesia. Acta Anaesthesiol Scand 1993;37:730-736.
11. Green G, Jonsson L. Nausea: the most important factor determining length of stay after
ambulatory anaesthesia. A comparative study of isoflurane and/or propofol techniques. Acta Anaesthesiol
Scand 1993;37:742-746.
12. Phillips AS, Mirakhur RK, Glen JB, Hunter SC. Total intravenous anaesthesia with propofol or
inhalational anaesthesia with isoflurane for major abdominal surgery. Anaesthesia 1996;51:
1055-1059.
13. Mangano DT. Postoperative myocardial ischemia. Therapeutic trials using intensive analgesia
following surgery. Anesthesiology 1992;76:342-353.
14. Smith I, White PF, Nathanson M, Gouldson R. Propofol: an update on its clinical use.
Anesthesiology 1994;81:1005-1043.
Глава 7
Будущее внутривенной анестезии
С момента своего возникновения внутривенная анестезия значительно
усовершенствовалась. Явный прогресс наблюдался в последние годы, когда были
разработаны селективные препараты короткого действия, не вызывающие
серьезных побочных эффектов. Возросло понимание фармакокинетики
внутривенных анестетиков, что позволило точнее предсказывать реакцию организма на
них, а также облегчило расчет их продолжительности действия и быстроты
пробуждения. В будущем наши познания в фармакокинетике будут углубляться,
что позволит более дифференцированно назначать анестетики с учетом
особенностей конституции больного и сопутствующих заболеваний.
Хотя механизм действия анестетиков все еще неясен, в будущем мы
ожидаем появления гипнотиков еще более селективного действия и лишенных
побочных эффектов. Существует насущная потребность во внутривенных гипнотиках,
не угнетающих кровообращение и дыхание. Механизмы действия опиоидов и
миорелаксантов достаточно хорошо изучены, что облегчает разработку новых
поколений этих препаратов с заданными свойствами. В настоящее время
имеется большой выбор различных миорелаксантов с различными свойствами, но
пока еще не появилось мощного анальгетика, не вызывающего угнетения
дыхания, тошноты, рвоты и других побочных реакций со стороны ЖКТ.
Продолжительность действия внутривенных анестетиков должна быть
короткой, что облегчает управление анестезией, а также обеспечивает быстрое
пробуждение даже после длительной операции. Препараты, подвергающиеся
метаболизму неспецифическими эстеразами крови (эсмолол, ремифентанил)
обладают сверхкороткой продолжительностью действия, на которую не влияют
ни длительность введения, ни функция печени и почек, ни сопутствующие
заболевания. Может быть, в будущем будут разработаны гипнотики и миорелаксан-
ты, расщепляющиеся неспецифическими эстеразами крови, что даст
возможность проводить ТВВА только препаратами сверхкороткого действия. При
разработке препаратов, подвергающихся интенсивной и быстрой
биотрансформации, необходимо удостовериться в том, что их метаболиты фармакологически
неактивны, нетоксичны и безвредны.
К сожалению, затраты на производство новых препаратов беспрестанно
возрастают, в то время как рост затрат на здравоохранение, наоборот, всячески
сдерживается правительственными органами. В силу этого представляется, что
разработка истинно новых внутривенных анестетиков будет происходить
медленнее, чем в прошлом. С другой стороны, популярной может стать
модификация уже существующих препаратов, приводящая к уменьшению побочных
11 Тотальная внутривенная анестезия
162
Глава 7
эффектов и приобретению более благоприятных свойств. Многие
распространенные внутривенные анестетики существуют в виде рацемических смесей
(тиопентал, кетамин, атракурий), в то время как желаемый эффект оказывает
лишь один из оптических изомеров. В этом случае целесообразно применять
только чистый оптический изомер, что может снизить риск побочных
эффектов. Хотя «оптически чистым» препаратам еще предстоит пройти суровые
клинические испытания, чтобы удостовериться в их эффективности и безопасности,
эта процедура все же дешевле, чем создание абсолютно новых лекарственных
средств с нуля.
Прогресс может касаться и способов доставки внутривенных анестетиков.
Некоторые внутривенные анестетики можно вводить с помощью ингалятора,
применять трансназально, чрескожно и трансбуккально (защечно), а также
принимать под язык, после чего они поступают в кровь посредством пассивной
диффузии или ионофореза. Альтернативные способы доставки анестетиков (которые
в этом случае нельзя считать «внутривенными» в строгом смысле слова) позволяют
сохранить многие благоприятные свойства препаратов, снижая риск побочных
эффектов. Эти неинвазивные способы доставки анестетиков могут оказаться
особенно полезными аля премедикации и послеоперационной анальгезии.
Разработаны различные системы доставки анестетиков, управляемые больным. В
некоторых странах в клинической практике применяются фентаниловый «леденец»,
система для чрескожного введения фентанила, а также управляемый больным
дозированный назальный аэрозоль с опиоидом, снабженный системой блокировки.
На различных этапах разработки находятся и другие системы.
Прицельная доставка мощного препарата к органу-мишени может
уменьшить долю препарата, поступающего в периферические ткани, что снижает
риск побочных эффектов. Методы прицельной доставки препарата к
органу-мишени включают применение внешних физических сил, оптимизирующих
распределение препарата внутри организма; инкапсулирование препарата в
микросферы; присоединение молекул внутривенных анестетиков к моноклональ-
ным антителам, направленным против определенных рецепторов.
Когда появится возможность измерять концентрацию внутривенного
анестетика в плазме в режиме реального времени, можно будет оперативно
изменять скорость введения препарата АА^ поддержания избранной постоянной
концентрации. Это не решит проблему управляемости анестезии: одна и та же
концентрация анестетика в плазме у разных больных может оказывать разное
действие. Возможно, это связано с тем, что концентрация препарата в плазме
не вполне точно отражает концентрацию в месте действия (органе-мишени).
Если бы существовал достоверный критерий глубины анестезии, то по нему
можно было ориентироваться, чтобы должным образом изменять скорость
введения анестетика. Разработка мониторинга глубины анестезии даст
возможность автоматически управлять введением анестетика по механизму
отрицательной обратной связи. За последние годы в этой области были достигнуты
впечатляющие успехи: наиболее достоверными критериями действия
анестетиков признан биспектральный анализ ЭЭГ [1,2] и акустические вызванные
потенциалы [3].
Будущее внутривенной анестезии 163
Внутривенная анестезия имеет ряд преимуществ перед ингаляционной. В
будущем разработка высокоселективных внутривенных анестетиков
ультракороткого действия без значимых побочных эффектов еще более усилит эти
преимущества. В настоящее время во всех сферах деятельности первостепенную
значимость приобретают экологические соображения. Ингаляционные анестетики
разрушают озоновый слой, и со временем этот их эффект будет встречать все
большее неприятие со стороны общественности. Внутривенные анестетики не
вызывают подобного загрязнения окружающей среды, хотя не следует
сбрасывать со счетов отходы заводов, производящих препараты, а также проблему
утилизации пластиковых шприцов, капельниц и удлинительных трубок.
Большое влияние на анестезиологическую практику оказывает прогресс
хирургии. Например, в последнее время большую популярность получила
амбулаторная хирургия и малоинвазивные оперативные вмешательства. Дальнейшее
развитие хирургических методик может сократить потребность в общей
анестезии и увеличить число вмешательств, выполняемых в условиях седации.
Идеальными седативными препаратами являются внутривенные гипнотики и
анальгетики. Если будут разработаны более эффективные и высокоселективные
анальгетики, то появится возможность проводить сложные операции у больных в
полном сознании или в состоянии неглубокой седации.
Резюме
Первые эффективные внутривенные анестетики стали доступными меньше
ста лет тому назад. Многие популярные внутривенные анестетики (пропофол,
мидазолам, альфентанил) и методики (ТВВА, седоаналгезия, управляемая
больным седация) появились на протяжении последних двадцати лет. Совсем
недавно появились другие значительные достижения: инфузия, управляемая по
целевой концентрации; биспектральный анализ ЭЭГ; ремифентанил, мивакурий; ро-
куроний. Сейчас, в начале XXI века, перед внутривенной анестезией
открываются реальные и захватывающие перспективы.
Список литературы
1. Glass PSA, Bloom M, Kearse L, et ей. Bispectral analysis measures sedation and memory effects of
propofol, midazolam, isoflurane, and alfentanil in healthy volunteers. Anesthesiology 1997;86:
836-847.
2. Sebel PS, Bowles SM, Saini V, Chamoun N. EEG bispectrum predicts movement during
thiopental/isoflurane anesthesia. ] Clin Monit 1995;11:83-91.
3. Thornton C, Konieczko KM, Knight AB, et al. Effect of propofol on the auditory evoked response
and oesophageal contractility. Br J Anaesth 1989;63:411-417.
Предметный указатель
А
Аддитивное взаимодействие
лекарственных препаратов 150-152
Акустические вызванные потенциалы
139-140, 141, 162
Альтезин 13, 14, 64
Альфентанил 66
взаимодействие с другими
лекарственными препаратами 152
инфузия, управляемая с помощью
компьютера 123, 127
у больных, находящихся в
критическом состоянии 110
при амбулаторных вмешательствах
101
при тотальной внутривенной
анестезии 35
фармакокинетика 68-69
Амбулаторные вмешательства 95-112,
153
и опиоиды (а также другие
препараты, применяемые для лечения
боли) 101-102, 105
и пропофол 96-101, 103-104
Анальгезия, управляемая больным 162
Анальгетики 34-35, 65-76, 162 см.
также нестероидные
противовоспалительные препараты, опиоиды
Анестезия на поле боя 14, 51
Анестетики ингаляционные, см.
ингаляционные анестетики
Антагонизм при взаимодействии
лекарственных препаратов 150-152
Антагонисты опиоидов 67, 88
Антагонисты препаратов,
применяемых для внутривенной анестезии
88-90
Антихолинергические препараты см.
холиноблокаторы
Артериальное давление 133, 135
Аспирин 72
Астма бронхиальная 71, 75 см. также
тонус гладких мышц бронхов
Атаралгезия 32
Атракурий 83, 85
у больных, находящихся в
критическом состоянии 111
у пожилых 108
Атропин 90, 108, 110
Ацетилсалициловая кислота 72
Ацетилхолинэстеразы ингибиторы
89-90, 108
Б
Барбитураты 58-61 см. также мето-
гекситал, тиопентал
взаимодействие с лекарственными
препаратами 152
влияние на стрессовую реакцию
141-142
история 12, 13, 14
механизм действия 59
у пожилых 106-107
фармакодинамика 44, 60-61
фармакокинетика 40, 59-60,
физико-химические свойства 58
Бензодиазепины 61-63 см. также ми-
дазолам
антагонисты 88-89
взаимодействие с лекарственными
препаратами 152
влияние на стрессовую реакцию 142
профилактика воспоминаний об ин-
траоперационных событиях 36
сочетание с кетамином 51
у больных, находящихся в критичес-
Предметный указатель
165
ком состоянии 110-111
у детей 104-105
у пожилых 107
Биофаза 23
Бир, блокада 77
Биспектральный анализ (BIS) 134,
136, 138-139
Брадикардия 103, 110
Болезненные манипуляции 51, 104
Боль во время инъекции 47, 57, 100
Больным управляемая анальгезия 162
Больным управляемая седация 128
Больного предпочтения 153
Бупивакаин 76, 77
Бутирилхолинэстераза (псевдохолинэ-
стераза) 82, 108
Бутирофеноны 30, 31
В
Вегетативные показатели и симптомы
133-134
Векуроний 15, 83, 86
Взаимодействие между анестетиками
150-152
оценка 151
клинически важные взаимодействия
152
механизмы 150-151
Внутривенная регионарная анестезия
77
Внутривенных анестетиков
антагонисты 88-90
Внутривенных анестетиков системы
доставки 114-129, 162
Внутриглазное давление 56
Внутричерепное давление (ВЧД) 36
и лекарственные препараты 49, 55,
60
Воспоминания об интраоперацион-
ных событиях 36, 129-130
Восстановление сознания, интраопе-
рационное 35-36, 82, 130-132
Вспомогательные лекарственные
препараты 29, 79-81
при амбулаторных вмешательствах
101
Вызванные потенциалы 134, 139-140,
141, 162
Выписка после амбулаторных
вмешательств 153, 154, 157
Г
Галоперидол 30
Галотан 147,148
и гепатит 142
и взаимодействие с натронной
известью 149
ГАМК-бензодиазепиновые рецепторы
62
ГАМКл-рецептор, комплекс с хлорид-
ным ионным каналом 39, 59, 64
Гедонал 12
Гемолиз, индуцированный этомида-
том 57
Гепатит, галотановый 147,148
Гепатотоксичность 37, 61, 147, 150
Гидроксидион 14, 63
Гидроксипропил-Р-циклодекстрин 57
Гипертермия злокачественная 37, 146
и препараты, которые можно
применять при этом заболевании 44-45,
46, 104
Гипертония артериальная 36, 110
Гипнотические препараты 39-65, 163
взаимодействие с другими
препаратами 152
и стрессовая реакция 142
у детей 41, 103-105
у пожилых 41, 106-107
скорость инфузии 34
фармакодинамика 41
фармакокинетика 40-41
Гиповолемия/гиповолемический шок
53, 109
Гипотермия 30
Гипотония артериальная
и мидазолам 62
и опиоиды 71
и пропофол 43-46, 100, 103
у больных, находящихся в
критическом состоянии 109-110
Гистамина высвобождение 61, 71
Гликопирролат 90, 108, 110
166
Предметный указатель
Глубина анестезии
неадекватная см. восстановление
сознания, интраоперационное
измерение 132-140
мониторинг 35, 128, 129-140
А
Движения, целенаправленные 132,
133, 135
Дексмедетомидин 80
Десфлюран 147, 148
Дети 95, 102-105
и кетамин 48, 51-53, 104
и пропофол 41, 103-104
и опиоиды 105
Диазепам 62
Диклофенак 74
Диприфьюзор 26, 123-124
Диссоциативная анестезия 32, 48
Дисфория, послеоперационная 30, 31
Доксакурий 83, 86
Доксапрам 88
Доставка внутривенных анестетиков
114-129, 162
Дроперидол 30, 31, 51
Дыхания система 36, 44-45
и барбитураты 60
и взаимодействие лекарственных
препаратов 152
и кетамин 50
и мидазолам 63
и опиоиды 71
в послеоперационном периоде 158
и пропофол 44
и этомидат 56
3
Загрязнение окружающей среды 163
Задержка мочи 72
Закись азота (N20) 29, 103
осложнения 32-33
Злокачественная гипертермия, см.
гипертермия злокачественная
Зрачки, размер и реакция 135
Зуд 47, 72
И
Изоболограммы 151
Изолированного предплечья метод
132
Изомеры, оптические 162
Изофлюран 147, 148
Иммуннитет 158
Ингаляционная анестезия 12, 114
и интраоперационное
восстановление сознания 131
и пробуждение 154
и стрессовая реакция 141
Ингаляционные анестетики
взаимодействие с другими
анестетиками 150-152
недостатки 163
осложнения 32-33
сравнительная мощность 127
токсичность 147-150
Инновар 30, 31
Интубация трахеи
и прессорная реакция 110
быстрая последовательная
интубация трахеиШ
Инфузия, непрерывная 18, 26, 115
и системы доставки 114-129
режимы 121-129
с изменяющейся скоростью 117
с постоянной скоростью 117
скорости 18, 26, 34, 121
ступенчатая 117
управляемая вручную 122
управляемая по принципу
отрицательной обратной связи 117,
128-129, 162
управляемая по целевой
концентрации (ИУЦК) 117, 123-127
управляемая с помощью
компьютера 26, 123-128
Исходы анестезии, анализ 153-158
Ишемическая болезнь сердца 36
Ишемия головного мозга 36
К
Кальция антагонисты 81
Камера
быстрая периферическая (У2) 19
медленная периферическая (V3) 19
Предметный указатель
167
центральная (У\) 19
эффекторная (Ve) 25
Кардиохирургия 32, 46, 51, 105
Катастрофы 14, 51
Катехоламины 142, 143
Кесарево сечение 130-131
Кетамин 48-54
взаимодействие с другими
анестетиками 152
влияние на стрессовую реакцию 142
изомеры 53
история препарата 15
клиническое применение 51-53
при амбулаторных вмешательствах
96
у больных, находящихся в
критическом состоянии 109
у детей 104
у пожилых 107
фармакодинамика 44, 49-50
фармакокинетика 40, 48-49
феномены, возникающие при
пробуждении 50-51
Кетопрофен 74
Кеторолак 73
Кислорода высокая фракционная
концентрация во вдыхаемой смеси 36
Клиренс 17-18
межкамерный (клиренс
распределения) 19
общий 17
центральный (метаболический,
клиренс элиминации) 19
Клонидин 80, 143
Кодеин 67
Компонент А 149
Константы микроскорости (к) 19,
20, 23-24
Концентрация в месте действия
препарата пиковая 24
Концентрация в плазме
и эффект 21-26
измерение в режиме реального
времени 122, 162
поддержание постоянной
концентрации 25-26
прогнозирование снижения 21
целевая (ct) 18
Кора надпочечников, реакция на
стресс 142-143
Кортизол, в плазме 56, 142
Косоглазия хирургическое лечение
103
Крайл, Джордж Вашингтон 28
Кремофор EL 14, 54, 64
Критические состояния 95, 108-112
Курареподобные препараты 15, 29,
81
Л
Лабори, Анри 30
Легочные заболевания, тяжелые 36,
158
Летальность 153, 158
Ливерпульская методика 82
Лидокаин 47, 78
Литическая смесь 30
Лоразепам 62
М
Манипуляции болезненные 51, 104
Меперидин 29, 30, 66-67
Местные анестетики 47, 76-79
системное действие 77
токсическое действие 78-79
Метогекситал 58-61
история препарата 15
механизм действия 59
при амбулаторных вмешательствах
95, 96
фармакодинамика 45, 60-61
фармакокинетика 40, 59-60
физико-химические свойства 58
Метоксифлюран 147-148
Мивакурий 83, 86
Мидазолам 62-63
взаимодействие с другими
анестетиками 152
влияние на стрессовую реакцию 142
и флумазенил 88-89
клиническое применение 63
у больных, находящихся в
критическом состоянии 109, 111, 112
у детей 104
168
Предметный указатель
фармакодинамика 45, 62
фармакокинетика 40, 62
Микроскорости константы (1с) 19-20,
23-24
Минаксолон 65
Минимальная альвеолярная
концентрация (МАК) 127, 132
Мимические мышцы 134, 135
электромиография 135
Миокарда ишемия,
послеоперационная 158
Миоклония 55, 57
Миорелаксанты 81-87
деполяризующие 82
и ингибиторы ацетилхолинэстеразы
89-90, 108, 110
и интраоперационное
восстановление сознания 130
и мониторинг глубины анестезии
130
и мониторинг нервно-мышечного
блока 85
история препаратов 15, 29
недеполяризующие 82, 84
у больных, находящихся в
критическом состоянии 110
у пожилых 108
фармакокинетика/фармакодинами-
ка 83
Мониторинга системы 114, 129-140
Морфин 65-68
Мощность анестетиков 21-22
Мышечная ригидность 72
Н
Налмефен 67, 88
Налоксон 67, 88
Налтрексон 67, 88
Наркотические анальгетики см. опио-
иды
Насыщающая инфузия 33
Натриевые (Na+) каналы 76, 78, 79
Натронная известь, взаимодействие
с ингаляционными анестетиками
149
Научение, интраоперационное 132
Неврологические осложнения,
послеоперационные 158
Нейролепсия 30
Нейролептанальгезия (НЛА) 30-32
Неостигмин 90, 108
Нестероидные
противовоспалительные препараты (НПВП) 72-76, 143
механизм действия 73
недостатки 72-73
при амбулаторных операциях 101
фармакодинамика 74-75
фармакокинетика 73-74
Норкетамин 48
НПВП, см. нестероидные
противовоспалительные препараты
О
Объем распределения (Vd) 16-17, 25
в момент пикового эффекта
(Vpeak effect) 25
в равновесном состоянии (Vss) 19,
25
Однокамерная модель распределения
18
Однолегочная ИВЛ 36, 50, 72
Опиатные рецепторы 66у 71
Опиаты 65
Опиоиды 65-72, 157
взаимодействие с другими
анестетиками 152
влияние на стрессовую реакцию 142
высокодозная методика 16, 29, 109,
130
и нейролептанальгезия 32, 66
и сбалансированная анестезия 29
при амбулаторных вмешательствах
101-102
ТВВА 34
у больных, находящихся в
критическом состоянии 109
у детей 105
у пожилых 107-108
фармакодинамика 70-72
фармакокинетика 67-70
Опиум 12, 65
Предметный указатель
169
П
Память, на интраоперационные
события 132
Панкуроний 83, 86
у больных, находящихся в
критическом состоянии 110
Педиатрия, см. дети
Перикардит, констриктивный 51
Петидин, см меперидин 29, 30, 66-67
Печени болезни 69-70, 111
Пипекуроний 83, 86
Плазменная концентрация см.
концентрация в плазме
Пожилые 95, 106-108
и гипнотики 41, 106-107
и миорелаксанты/ингибиторы аце-
тилхолинэстеразы 108
и опиоиды 107-108
Полиэтиленгликоль 57
Полувыведения период
в фазе распределения 20
в фазе элиминации (терминальный)
20
контекст-чувствительный 21, 22
Порфирия 37, 149-150
и безопасные препараты 44-45
и небезопасные препараты 44-45,
61
Потоотделение 135
ПОТР, см. тошнота и рвота
послеоперационная
Почек дисфункция
индуцированная лекарственными
препаратами 37, 61, 75, 147-148
сопутствующая 41, 70
Прегнандион 63, 64
Прегнанолон 64
Предпочтения больного 153
Прилокаин 76, 78
Прицельная доставка лекарственных
препаратов 162
Пробркдение после анестезии
оценка 153-157
феномены, возникающие после ке-
таминовой анестезии 50-51
Прогестерон 64
Продолжительность действия 161
Пропанидид 14
Пропиленгликоль 54, 57
Пропофол 39-48
взаимодействие с другими
анестетиками 152
влияние на стрессовую реакцию 142
зависимость реакции от дозы 35-36
инфузионные системы 26, 122-125,
126, 128
и пробуждение 154
и ТВВА 35
и управляемая больным инфузия
128
история препарата 14
при амбулаторных вмешательствах
96-101, 103-104
противорвотное действие 47, 100
у больных, находящихся в
критическом состоянии 109, 111, 112
у детей 41, 103-104
у пожилых 41, 107
фармакодинамика 41-48
фармакокинетика 40-41
Простагландины 73, 75
Противорвотные препараты
пропофол, противорвотное действие
47, 96, 100-102
профилатическое применение 31-32
Псевдохолинэстераза (холинэстераза
плазмы) 82
Пути введения анестетиков 162
Р
Равновесное состояние 18
Распределения (быстрого,
медленного) фаза 20
Рвота в послеоперационном периоде,
см. тошнота и рвота
послеоперационные
Реакция «все или ничего» 23
Регионарная анестезия, внутривенная
77
Ремифентанил 35, 66, 61
при амбулаторных вмешательствах
101
170
Предметный указатель
у пожилых 107
фармакокинетика 67, 68, 69
Рокуроний 83, 86
у больных, находящихся в
критическом состоянии 111
у пожилых 108
Ропивакаин 79
С
Сбалансированная анестезия 16,
28-29
Севофлюран 147, 148
Седативно-гипнотического действия
препараты, см. также гипнотики
39-65
Седация
и биспектральный анализ 139
управляемая больным 128
Сердечно-сосудистая система 36,
44-45
и барбитураты 60
и больные, находящиеся в
критическом состоянии 108-110
и кетамин 49-50
и местные анестетики 79
и мидазолам 62
и миорелаксанты
и опиоиды 71
и пропофол 43, 46
и послеоперационный период
157-158
и этомидат 56
и (Х2-адреномиметики 80-81
Сжатый спектральный ряд 136
Симпатическая нервная система
и анестетики 142
и больные, находящиеся
в критическом состоянии 111
и кетамин 49, 51
и а2-адреномиметики 79-81
Синергизм при взаимодействии
лекарственных препаратов 151, 152
Синтез кортикостероидов в
надпочечниках, угнетение 46, 56, 142
Системы доставки для инфузии,
управляемой по целевой
концентрации 117, 123-127
Сколиоз, хирургическое лечение 105
Слезотечение 135
Сократимость нижнего отдела
пищевода 134, 135
Спинальная хирургия 105
Стероидные анестетики 14, 63-65
Стероидогенеза угнетение 46, 56
Стрессовая реакция 114, 140-143
и препараты, ее ослабляющие 56,
72
и анестетики 141-143
Струйное введение 33, 114
периодическое 33, 115
Суксаметоний 82-84
у детей 104
у больных, находящихся в
критическом состоянии 111
у пожилых 108
Суфентанил 66, 67, 68
Т
Тампонада сердца 51
Тахикардия 110
ТВВА, история 12-16
ТВВА см. тотальная внутривенная
анестезия
Теноксикам 74
Терминальная фаза 20
Тиопентал 58-61
взаимодействие с другими
анестетиками 152
и пропофол, сравнительная
характеристика 100
история препарата 12-13, 29
механизм действия 59
у больных, находящихся в
критическом состоянии 109
у пожилых 106
фармакодинамика 45, 60
фармакокинетика 40, 59-60
физико-химические свойства 58
Токсичность анестетиков 146-150
Тонус гладких мышц бронхов
и нестероидные
противовоспалительные препараты (НПВП) 75
и опиоиды 71-72
Предметный указатель
171
и препараты седативно-гипнотиче-
ского действия 46, 50, 52, 53
Тонус матки 50
Тотальная внутривенная анестезия 28,
32-36
препараты 39-92
фармакодинамика 36-37
Тошнота и рвота послеоперационная
(ПОТР) 154, 157
и нейролептанальгезия 30
и опиоиды 72
и пропофол 47, 96-101, 103
и ТВВА 34
и этомидат 57
Трехкамерная модель распределения
18-21
с эффекторной камерой 23
Триада анестезии 29
Трифторуксусная кислота 147, 148
Тромбофлебит 57
Тромбоцитов функция 75
у
Угарный газ 149
Ф
Фармакодинамика 21-26
определение 16
и взаимодействие лекарственных
препаратов 151
и препараты, применяемые для
ТВВА 39-92
Фармакокинетика 16-21
и больные, находящиеся в
критическом состоянии 111
определение 16
и взаимодействие лекарственных
препаратов 151
и препараты, применяемые для
ТВВА 39-92
Фенерган 30
Фенотиазины 30, 31
Фентанил 66, 67, 68
альтернативные способы введения
162
взаимодействие с другими
анестетиками 152
влияние на стрессовую реакцию 142
инфузия, управляемая с помощью
компьютера 127
и кетамин 51
и нейролептаналгезия 30, 31, 66
при амбулаторных вмешательствах
101
фармакокинетика 67-68
Флумазенил 88, 89
Фтора ионы, токсическое действие
147-148
X
Хлоралгидрат 12
Хлорпромазин 30
Холинергические средства 110
Холиноблокаторы 90
Холинэстераза плазмы 82, 108
Хоффмана элиминация
ц
Цис-атракурий 83, 85
у больных, находящихся в
критическом состоянии 111
у пожилых 108
Центральная нервная система 36,
44-45, 158
и барбитураты 60
и больные, находящиеся в
критическом состоянии 111-112
и кетамин 49
и местные анестетики 78-79
и мидазолам 62
и опиоиды 70
и пропофол 43
и этомидат 55
Церебральное перфузионное давление
(ЦПД) 43, 60, 111
ч
Частота и характер дыхания 133
Частота сердечных сокращений 110,
133, 135
Частота спектрального края 136
Черепно-мозговая травма 36, 70, 111
Чреспищеводная
электрокардиостимуляция 110
Ш
Шприцевые насосы 115-121
программируемые 118-121
172
Предметный указатель
Эдрофоний 90, 108
Экономической эффективности
анализ 153
Электрокардиостимуляция чреспище-
водная 110
Электросудорожная терапия 15, 46,
61
Элиминации фаза (терминальная) 20
Эльтанолон 64
Эмульсия жировая 54, 57
Эндотрахеальные трубки 71
Энфлюран 147, 148
Эпилептогенная активность 43, 49, 55
Эсмолол 81
Этидокаин 79
Этомидат 54-58, 150
история препарата 15
ослабление стрессовой реакции 142
при амбулаторных вмешательствах
96
у больных, находящихся в
критическом состоянии 109
фармакодинамика 44, 55-58
фармакокинетика 40, 54-55
Эфир 12, 130
Эффект максимальный (Еmах) 21-24
Эффективность 22
Эффекторная камера 23
ЭЭГ
биспектральный анализ (BIS)
136-139
и анестетики 55, 70
мониторинг адекватности анестезии
133, 135-139, 162
спектр мощности 136, 137
Ю
Юридические последствия интраопе-
рационного восстановления
сознания 130
(Х2-адреноблокаторы 81
(Х2-адреномиметики 79-81, 101, 142
Diprifusor 26, 123-124
ЕС50 21-22, 127
ЕС95 127
ED95 83
к (константы микроскорости) 19-20,
23-24
R.A.S.Lab OCR
raslab.info
Данная книга представлена исключительно в
ознакомительных целях. Любое коммерческое
или иное использование кроме предварительного
ознакомления запрещено. Публикация данного
документа не преследует никакой коммерческой
выгоды. Но такие документы способствуют
быстрейшему профессиональному и духовному
росту читателей и являются рекламой бумажных
изданий таких документов.
Все авторские права сохраняются за
правообладателем.