Автор: Морозов Е.И. Тарасевич Е.И. Анохина В.С.
Теги: общая генетика общая цитогенетика иммуногенетика эволюционное учение видообразование филогенез биология генетика
ISBN: 5-7855-0203-8
Год: 1989
Е. И МОРОЗОВ
Е. И. ТАРАСЕВИЧ
В С АНОХИНА
ГЕНЕТИКА
В ВОПРОСАХ
И ОТВЕТАХ
Е. И. МОРОЗОВ
Е. И. ТАРАСЕВИЧ
В С. АНОХИНА
ГЕНЕТИКА
В ВОПРОСАХ
И ОТВЕТАХ
Издание второе, переработанное
и дополненное
МИНСК
„УНИВЕРСИТЕТСКОЕ”
1989
ББК 28.04я73
М 80
УДК 575(075.8)
Рецензент доктор биологических наук И. Б, Моссэ
Морозов Е. И. и др.
М80 Генетика в вопросах и ответах/Е. И. Морозов,
Е. И. Тарасевич, В. С. Анохина.— 2-е изд., перераб.
и доп.— Мн.: Университетское, 1989.— 288 с.
ISBN 5-7855-0203-8.
В пособии в форме вопросов и ответов излагаются современные представ-
ления о молекулярной и общей генетике, генетике человека и микроорганизмов,
генетике популяций и селекции и т. д., приводится словарь генетических тер-
минов.
Для студентов биологических специальностей вузов, широкого круга лиц,
интересующихся вопросами генетики.
1903020000 —060 ББК 28.04я73
М-----------------37-89
М317(03)—89
Учебное издание
Морозов Евгений Иванович
Тарасевич Евгения Иосифовна
Анохина Вера Степановна
генетика в вопросах и ответах
Зав. редакцией Л. Г. Лепило. Редактор Р. В. Михновец. Мл.
редактор Л. Р. Г а б а с о в а. Обложка В. В. 3 и к е е в а. Художественный
редактор Р. В. К о н д р а д. Технические редакторы Г. М. Романчук,
Т. К. Романович. Корректоры М. В. М и л ю х и н а, Л. С. Ма-
нул е н к о, Л. С. 3 и з а.
ИБ № 1317
Сдано в набор 05.08.88. Подписано в печать 15.06.89. АТ 06289. Формат 84Х108’/зг*
Бумага книжно-журнальная. Гарнитура литературная. Высокая печать. Усл. печ. л. 15,12.
Усл. кр.-отт, 15,12. Уч.-изд. л. 16,77. Тираж 28 800 экз. Заказ 1740. Цена 1 р. 20 к.
Издательство «Университетское» Госкомиздата БССР. 220048, Минск, просдект Ма-
шерова, 11.
Минский ордена Трудового Красного Знамени полиграфкомбинат МППО им. Я. Коласа.
220005, Минск, ул. Красная, 23.
ISBN 5-7855-0203-8
© Издательство «Университетское», 1989
ПРЕДИСЛОВИЕ
Генетика — наука о наследственности и изменчи-
вости живых организмов и методах управления ими. В ее
основу легли закономерности наследственности, обнару-
женные Г. Менделем при скрещивании различных сортов
гороха, а также мутационная теория X. Де Фриза. Рожде-
ние генетики принято относить к 1900 г., когда X. Де Фриз,
К. Корренс и Э. Чермак вторично открыли законы
Г. Менделя.
В начале 80-х гг. XIX в. В. Ру, О. Гертвиг, Э. Страс-
бургер, а также А. Вейсман сформулировали ядерную ги-
потезу наследственности, которая в начале XX в. перерос-
ла в хромосомную теорию наследственности. Т. Морганом
были заложены и основы теории гена, получившей раз-
витие в трудах советских ученых школы А. С. Серебров-
ского, сформулировавших в 1929—1931 гг. представления
о сложной структуре гена. Эти представления были раз-
виты и конкретизированы в исследованиях по биохими-
ческой и молекулярной генетике, приведших после созда-
ния Дж. Уотсоном и Ф. Криком модели ДНК к расшиф-
ровке генетического кода, определяющего синтез белка.
Значительную роль в развитии генетики сыграло открытие
факторов мутагенеза — ионизирующих излучений
(Г. А. Надсон и Г. С. Филиппов, Г. Мёллер) и химических
мутагенов (В. В. Сахаров, М. Е. Лобашев). Использова-
ние индуцированного мутагенеза способствовало увели-
чению разрешающей способности генетического анализа
и представило селекционерам метод расширения наслед-
ственной изменчивости исходного материала. Важное
значение для разработки генетических основ селекции
имели работы Н. И. Вавилова. Сформулированный им
закон гомологических рядов в наследственной измен-
чивости позволил установить центры происхождения куль-
з
турных растений, в которых сосредоточено наибольшее
разнообразие наследственных форм. Работами С. Райта,
Дж. Б. С. Холдейна и Р. Фишера были заложены основы
генетико-математических методов изучения процессов,
происходящих в популяциях. Фундаментальный вклад
в генетику популяций внес С. С. Четвериков, объединив-
ший в единой концепции закономерности менделизма
и дарвинизма.
Идеи и методы генетики находят применение во всех
областях человеческой деятельности, связанной с живыми
организмами. Они имеют важное значение для решения
проблем медицины, сельского хозяйства, микробиологи-
ческой промышленности и др.
Предлагаемая читателю книга написана в форме
вопросов и ответов по основным разделам вузовской про-
граммы по генетике. Целью такой формы изложения
является не только облегчить усвоение материала, но и
ориентировать читателя на самостоятельную работу.
В ответах в краткой, сжатой форме изложены основные
положения современной генетики по таким проблемам, как
независимое наследование, взаимодействие генов, опреде-
ление пола и наследование признаков, сцепленных с
полом, изменчивость и др. Даются также ответы на не-
которые вопросы молекулярной генетики, генетики
популяций и человека. На вопросы, которые не вклю-
чены в книгу, в какой-то мере можно найти ответ в сло-
варе генетических терминов.
Авторы стремились ограничить изложение мате-
риала только наиболее существенными сведениями по
тем вопросам, которые, по их мнению, являются затрудни-
тельными для студентов на экзамене, не претендуя на
полноту освещения всех проблем генетики.
Авторы выражают благодарность рецензенту И.Б.Мос-
сэ, сделавшей ряд полезных замечаний и предложений,
большинство которых было учтено при доработке книги.
4
Глава - НЕЗАВИСИМОЕ НАСЛЕДОВАНИЕ
ПРИЗНАКОВ. ЗАКОНЫ Г. МЕНДЕЛЯ
1. КАКОВЫ ОСНОВНЫЕ ЗАДАЧИ ГЕНЕТИКИ!
Изучение закономерностей наследственности и измен-
чивости, а также разработка методов практического
использования этих закономерностей являются основны-
ми задачами генетики, которые связаны между собой.
Поскольку генетика занимается изучением наслед-
ственности и изменчивости, в качестве основных проблем,
стоящих перед ней, можно выделить следующие: 1) хране-
ние генетической информации (изучение материальных
структур, ответственных за ее хранение); 2) передача
генетической информации (механизм и закономерности)
от поколения к поколению; 3) реализация генетической
информации (механизм) в конкретные свойства и приз-
наки организма; 4) изменение генетической информации
(причины и механизм) на разных этапах развития орга-
низма.
Данные проблемы можно решать на различных уров-
нях: молекулярном, клеточном, организменном и над-
организменном, т. е. популяционном. Степень изученности
проблемы того или иного объекта определяет возмож-
ность практического использования теоретических поло-
жений генетики.
Важными практическими задачами генетики являют-
ся: выбор оптимальной системы скрещивания в селекцион-
ной работе и наиболее эффективного метода отбора,
управление развитием наследственных признаков, исполь-
зование мутагенеза в селекции. В медицине использова-
ние генетических знаний способствует разработке меро-
приятий по защите наследственности человека от мута-
генного действия факторов окружающей среды.
2. КАКОЙ МЕТОД ИСПОЛЬЗОВАЛ Г. МЕНДЕЛЬ
В ОПЫТАХ ПО ИЗУЧЕНИЮ НАСЛЕДСТВЕННОСТИ!
Предшественники Г. Менделя, изучавшие наслед-
ственность, пытались учитывать наследование одновре-
менно многих признаков. Однако, не зная способов переда-
чи признаков потомству, трудно выявить какую-либо зако-
5
номерность при их совместном наследовании. Поэтому
Г. Мендель в каждом опыте изучал наследование только
двух или очень немногих признаков, которыми различа-
лись родители. Им были выбраны растения, отличающие-
ся следующими парами контрастирующих признаков: се-
мена — гладкие или морщинистые; окраска семядолей —
желтая или зеленая; окраска цветов — красная или белая
и т. д. Исходными для опытов были так называемые
чистые линии, т. е. сорта, проявлявшие в течение несколь-
ких поколений одну из форм контрастирующих призна-
ков. Естественной что скрещиваемые растения помимо
изучаемых отличаются и многими другими признаками, на
которые не обращается внимание исследователей. Скре-
щивание, в котором родители отличаются одной парой
контрастирующих признаков, называется моногибридным,
скрещивание с участием родителей, различающихся дву-
мя парами признаков, называется дигибридным и т. д.
Особенностью метода исследования Г. Менделя был точ-
ный подсчет результатов каждого опыта, что и позволило
установить количественный характер расщепления и сфор-
мулировать законы наследственности. Г. Мендель в ка-
честве объекта своей работы использовал садовый горох
Pisum sativum, который является самоопылителем, что
обеспечивало чистоту экспериментов и в большинстве слу-
чаев не требовало специальных изоляторов для цветков
в процессе работы (для предотвращения нежелательных
скрещиваний посторонней пыльцой). Успех опытов Г. Мен-
деля объяснялся тем, что изучаемые им признаки контро-
лировались несцепленными генами, т. е. генами, располо-
женными в разных парах хромосом, что, естественно, об-
легчало интерпретацию получаемых результатов.
3. КАКИЕ ОСНОВНЫЕ ЗАКОНЫ НАСЛЕДСТВЕННОСТИ УСТАНОВИЛ
Г. МЕНДЕЛЬ!
Г. Мендель представлял «вещество наследственности»
как совокупность множества независимых и постоянных
факторов, которые передаются от одного поколения к
другому, могут перегруппировываться и создавать так
называемую комбинативную изменчивость. К такому
выводу Г. Мендель пришел после анализа результатов
скрещивания различных сортов гороха. Он обнаружил,
что свойства гибридов по анализируемому признаку не
являются промежуточными между родительскими форма-
6
ми, а в большинстве случаев соответствуют одному из
родителей. Признак одного из родителей, который про-
являлся у гибридов первого поколения Fft был назван
доминантным, а признак второго родителя, который по-
давлялся,— рецессивным. Описанное явление получило
название первого закона Менделя, или закона доминиро-
вания, или закона единообразия гибридов первого по-
коления.
Во втором поколении F%, полученном в результате
самоопыления растений F\, наблюдалось расщепление
потомства по анализируемому признаку, а именно: в сред-
нем 3/4 растений обладали доминантным, а 1/4 — рецес-
сивным признаками.
В чем же причина такого расщепления? Г. Мендель
предположил, что гибриды образуют два типа половых
клеток: 50 % — с аллельным фактором, полученным от
матери (например, Л), и 50 % —с аллельным фактором,
полученным, от отца (а). При оплодотворении равнове-
роятна встреча клеток обоих типов (рис. 1). Таким обра-
зом, из четырех комбинаций аллелей 1/4 АА, 2/4 Аа и 1/4
аа при полном доминировании получается расщепление
по фенотипу 3:1. Это второй закон Менделя, или закон
расщепления (см. рис. 1).
Предположение Менделя об образовании гибридом
Аа двух типов гамет (приблизительно в равном количест-
ве) было проверено и при так называемом анализирующем
скрещивании (рис. 2).
В результате такого скрещивания в потомстве на-
блюдалось расщепление по анализируемому признаку
1 /2:1 /2 ил и, что то же самое, 1:1. Расщепление 1:1 служит
доказательством того, что гибрид Аа образует два типа
гамет, в которых генетические факторы сохраняются в том
виде, в каком они попали в зиготу при скрещивании гомо-
зиготных родителей.
Как известно, скрещиваемые организмы отличаются
многими признаками. Г. Мендель, проанализировав на-
следование двух и более признаков, установил, что каж-
дый из признаков наследовался как бы независимо от
других.
Согласно теории вероятности возможность совмеще-
ния двух признаков в одном организме должна соответ-
* F — потомство, родители (от лат. filil); Р — родители (от лат.
parenta).
7
Р:
Гаметы:
Гаметы:
ч
гаметы $
1/2 А 1/2 а
1/2 А 1/tfAA 1/4 Аа
1/2 а 1/kAa 1/4 аа
1/i/AA
1/tf аа
Рис. 1. Моногибридное скрещивание
ствовать произведению вероятностей появления каждого
из них в отдельности. Если по окраске семян в моногибрид-
ном скрещивании во втором поколении наблюдается
расщепление 3/4 желтых и 1/4 морщинистых, то в дигиб-
ридном скрещивании во втором поколении должно быть
9/16 желтых гладких, 3/16 желтых морщинистых, 3/16
зеленых гладких и 1/16 зеленых морщинистых, так как
Аа х аа
Гаметы: 1/2 (R\f/2(a
1/2 аа
Ц2 Аа
Рис. 2. Анализирующее скрещивание
8
произведение двух многочленов (3/4 Л-:1/4 аа) (3/4
В--Л/4ЬЬ) дает 9/16 Л-В-, 3/16 Л-66, 3/16 ааВ-9 1/16 aabb,
что и подтверждено опытами. Таким образом, третий
закон Менделя, или закон независимого распределения,
гласит: расщепление по каждой паре признаков идет
независимо от других пар признаков.
Рассмотренные законы Г. Менделя правильнее считать
законами наследования. Вытекающие же из его работ
законы наследственности таковы: 1) закон дискретной
(генной) наследственной детерминации признаков; 2) за-
кон относительного постоянства наследственной единицы
и 3) закон аллельного состояния гена.
4. ЧТО ОЗНАЧАЕТ ЧИСТОТА ГАМЕТ!
Помимо случаев наследования признаков с полным
доминированием одного признака над другим были от-
крыты случаи неполного доминирования или отсутствия
доминирования, когда гетерозигота имеет промежуточный
по сравнению с обеими родительскими формами фенотип
или совмещает одновременно оба признака родителей.
В подобных случаях можно было бы ожидать, что
гетерозиготы, имеющие промежуточный по сравнению
со своими гомозиготными родителями фенотип, образуют
и гаметы промежуточные. Например, гетерозигота от
скрещивания красно цветкового растения АА с белоцвет-
ковым растением аа должна дать гаметы с генами, об-
условливающими розовую окраску. Однако опыты пока-
зали, что подобные гетерозиготы образуют чистые гаметы,
в которых изучаемые аллели совершенно не изменяются.
Поведение аллелей в гетерозиготе напоминает поведение
атомов, образующих молекулы и сохраняющих свои
свойства при их распаде.
При рассмотрении микроспорогенеза у растений мож-
но заметить, что в результате двух мейотических делений
материнской клетки пыльцы образуется клеточная тетрада
из четырех микроспор. Если эти четыре микроспоры
образовались действительно из одной клетки с генотипом
Аа, то в тетраде микроспор должно наблюдаться расщеп-
ление по данным генам в отношении 2А:2а. Но у покры-
тосеменных состав тетрады учесть невозможно, так как
зрелые пыльцевые зерна (микроспоры) из одной тетрады
расходятся. У таких растений расщепление можно учесть
лишь по совокупности всех пыльцевых зерен. У кукурузы,
9
например, имеется пара аллелей W и ш, действие которых
проявляется уже в пальцевых зернах. Доминантный
аллель W вызывает в пыльцевом зерне образование крах-
мала, а рецессивный аллель ш — эритродекстрина. Эри-
тродекстрин в отличие от крахмала окрашивается иодом
не в синий, а в красноватый цвет. После обработки пыльцы
гетерозиготных растений иодом половина пыльцевых зерен
окрашивается в синий цвет, а половина — в красный.
Таким образом, расщепление соответствует теоретически
ожидаемому 1:1.
Благодаря чистоте гамет возможно расщепление и
проявление какого-либо признака предка при сохране-
нии рецессивного аллеля в гетерознготе и его переход в
гомозиготное состояние при определенном скрещивании,
S. ВСЕГДА ЛИ ПРИЗНАКИ ПОДЧИНЯЮТСЯ ЗАКОНАМ МЕНДЕЛЯ!
Установленные Г. Менделем закономерности расщеп-
ления проявляются при следующих условиях: равная ве-
роятность образования гамет всех типов, их одинаковая
жизнеспособность, отсутствие избирательности оплодо-
творения, одинаковая жизнеспособность зигот. Нарушение
хотя бы одного из этих условий вызывает закономерные
отклонения от ожидаемого расщепления в потомстве
гибридов.
У растений-перекрестников, например, существуют
серии множественных аллелей самостерильности (Si—
S2—S3 и т. д.). Если в геноме микроспоры присутствует
такой же аллель, как и в геноме ткани пестика, микроспора
не прорастет, а, значит, гомозиготные особи (например,
Si*Si) не появятся, что определяет избирательность
оплодотворения, предотвращает возможность самоопы-
ления, приводящего к ослаблению потомства, и изменяет
теоретически ожидаемое расщепление в следующем по-
колении.
В потомстве платиновых лисиц наблюдалось не
обычное расщепление 3:1, а 2:1 (2 платиновые к 1 черно-
бурой) . Это объясняется тем, что все платиновые лисицы
гетерозиготны, поскольку скрещивание их с черно-бурыми
всегда давало расщепление 1:1 (результат анализирую-
щего скрещивания). Отсутствие форм, гомозиготных по
гену платиновой окраски, можно было объяснить их
гибелью в период эмбриогенеза. Действительно, вскры-
тие самок подтвердило это предположение. Очевидно, ген,
10
обусловливающий платиновую окраску, одновременно
обладает рецессивным летальным действием и в случае
гомозиготности (А1 А1) приводит к недоразвитию и гибели
зародыша. Такой же летальный эффект в гомозиготном
состоянии вызывает ген, определяющий серую окраску
шерсти у овец (установлено, что ягнята ширази гибнут
от недоразвития желудочно-кишечного тракта), ген жел-
той окраски у домашних мышей, ген, определяющий раз-
витие чешуи у линейных карпов, и др. Гибель гомозигот-
ных доминантных по окраске форм вызывает отклонения
от классического менделевского расщепления, но рас-
крытие механизма этого явления лишь подтверждает
закономерности, установленные Г. Менделем.
Что касается третьего закона Г. Менделя, то он спра-
ведлив только для признаков, гены которых локализованы
в разных парах хромосом, т. е. для несцепленных при-
знаков.
6. ЕСЛИ ПОЛУЧЕННЫЕ РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА
ОТЛИЧАЮТСЯ ОТ ТЕОРЕТИЧЕСКИ ОЖИДАЕМЫХ,
ТО КАК МОЖНО УСТАНОВИТЬ, ЧТО ПОЛУЧЕННОЕ
ОТКЛОНЕНИЕ СЛУЧАЙНО!
Расщепление потомства в Гг, обычно не совпадает
с теоретически ожидаемым, так как в любом эксперименте
анализируется не идеальная популяция, а лишь большая
или меньшая выборка, в которой неизбежны случайные
отклонения (ошибки выборки). Какие расхождения меж-
ду фактически полученными и теоретически ожидаемыми
результатами можно допустить, чтобы они не были след-
ствием действия каких-либо факторов, нарушающих
расщепление, а были случайными и обусловливались,
например, недостаточной величиной выборки? В ста-
тистике принято считать, что если отклонение встречается
чаще, чем одно на 20 проб = 0,05^, то оно не случайно.
Для статистической оценки отклонения применяют метод
%2 (хи-квадрат), который позволяет определить вероят-
ность совпадения полученных результатов с теоретически
ожидаемыми (табл. 1):
где d2— квадрат отклонения полученных результатов от
ожидаемых; g — ожидаемые величины.
11
Таблица /. Таблица значений %2 при разных степенях свободы
(по Фишеру, с сокращениями)
df Вероятность Р
0,99 0,95 0.1 0,05 0,01
1 0,0001 0,039 2,71 3,84 6,63
2 0,101 0,103 4,61 5,99 9,21
3 0,115 0,352 6,25 7,81 11,34
Например, при моногибридном скрещивании получено
потомство из 400 особей. Ожидаемое расщепление
должно быть 3/4 Л-: 1 /4 аа, т. е. 300 особей одного фено-
типа и 100 особей другого. В опыте наблюдалось 285 осо-
бей одного и 115 особей другого фенотипа (табл. 2). Для
Таблица 2. Моногибридное скрещивание
Данные Классы
А аа
Ожидаемая численность q 300 100
Наблюдаемая численность 285 115
Отклонения:
d 15 15
d2 225 225
d2/q 0,75 2,25
того чтобы определить, случайно ли полученное отклоне-
ние, найдем Л2:Л2= 0,75+2,25= 3,0. Согласно правилам
статистики число степеней свободы (d, f) на единицу
меньше, чем число классов (п — 1), т. е. в нашем примере
d, / = 1 (см. табл. 1). В строке таблицы, соответствующей
числу степени свободы, равной 1, найдем значение Z2,
равное 3,84, что соответствует вероятности Р^0,05.
Таким образом, полученное в данном опыте отклонение
от ожидаемого расщепления можно считать случайным.
12
7. В ЧЕМ РАЗЛИЧИЕ ИСПОЛЬЗУЕМЫХ В ГЕНЕТИКЕ ПОНЯТИЙ
«НАСЛЕДСТВЕННОСТЬ», «НАСЛЕДОВАНИЕ», «НАСЛЕДУЕМОСТЬ»!
Наследственность в широком смысле слова — это
свойство организма воспроизводить себе подобное; преем-
ственность в поколениях. В узком же смысле слова наслед-
ственность означает свойство генов детерминировать
построение специфической белковой молекулы и контро-
лировать развитие отдельного признака и целого
организма.
Наследование отражает наличие процесса передачи
генетической информаций от одного клеточного или
организменного поколения к другому, т. е. передачи
системы контроля развития признаков организма.
Наследуемость — генотипическая обусловленность
изменчивости признака для популяции или группы орга-
низмов. Степень наследуемости определяют количественно
с помощью коэффициента й2. Коэффициент изменчивости
выражает, какая часть общей наблюдаемой изменчивости
определяется генотипической изменчивостью и вычисляет-
ся по формуле
А О
™ гг2 I гг2 *
°Р “Г аЕ
9 «
где ое — показатель изменчивости под воздействием
окружающей среды.
Значения коэффициентов наследуемости (в процентах)
различных хозяйственно полезных признаков сельско-
хозяйственных животных следующие:
Крупный рогатый скот (молочный)
Удой молока 0—67
Плодовитость 0— 18
Крупный рогатый скот (мясной)
Привес при откормке 7—40
Убойная масса 69—73
Качество мяса 16—73
Куры
Яйценоскость 11—35
Масса яйца 30—70
13
Глава X. ВЗАИМОДЕЙСТВИЕ ГЕНОВ
8. ЧТО ОЗНАЧАЕТ ПОЛИГЕННОСТЬ ПРИЗНАКА!
КАКИЕ ПРИМЕРЫ МОГУТ ПРОИЛЛЮСТРИРОВАТЬ ЭТОТ ФАКТ!
Полигенность признака — это обусловленность при-
знака многими генами. По-видимому, большинство
признаков контролируется многими неаллельными генами,
которые взаимодействуют между собой. Простейшими
случаями неаллельного взаимодействия являются случаи,
когда признак контролируется двумя парами аллелей.
Рассмотрим некоторые типы такого взаимодействия.
Комплементарное взаимодействие. Для такого взаимо-
действия характерно то, что в потомстве от скрещивания
двух форм появляется признак, которого не было ни у
одного из родителей. Родительские геномы как бы допол-
няют друг друга и формируют новый признак. Этот
тип взаимодействия генов широко распространен и имеет
большое значение при изучении комбинативной и мута-
ционной изменчивости.
Например, при скрещивании двух белоцветковых форм
душистого горошка потомство оказалось пурпурным,
а в F% шло расщепление: 9/16 пурпурных и 7/16 белых,
что соответствовало, результатам диаллельного скрещи-
вания. Подобное расщепление является следствием того,
что синтез пигмента — сложный процесс, имеющий ряд
промежуточных ступеней. Каждый этап этого процесса
контролируется определенными ферментами, которые в
свою очередь находятся под контролем генов:
субстрат->Д->В->...^-пурпурный пигмент
t t
ЭНЗИМл ЭНЗИМд
t t
ген А+ ген
Мутация любого гена блокирует синтез необходимого
энзима, и пурпурный пигмент не образуется. Если
скрестить две формы, у которых мутация произошла
в разных генах, то у гибрида будут синтезироваться все
необходимые энзимы, в результате чего образуется
пурпурный пигмейт:
iyi b
белоцветковые растения
14
Ftt a b X a b
пурпурноцветковые растения
Л: 9/16 33
пурпурн<*чветковые
растения
зле ±A
белоцветковые
растения
3/16i±
белоцветковые
растения
1/16— А
а b
белоцветковые
растения
Расщепление по фенотипу 9:7. В Г2 формы с блоком
одного или двух энзимов белоцветковые.
Такой вид взаимодействия факторов наблюдается
и при образовании алкалоидного потомства от скрещи-
вания двух безалкалоидных сортов люпина. Очевидно,
у разных сортов безалкалоидного люпина мутация произо-
шла в разных локусах: Fi от скрещивания неаллельных
мутантов оказывается алкалоидным, а в Г2 наблюдается
расщепление 9/16 алкалоидных и 7/16 безалкалоидных.
Зная генетическую природу этого явления, его можно
предотвратить. Для этого следует проверять сорта люпина,
высеваемые в хозяйстве, на совместимость, т. е. на
способность образовывать алкалоидные семена при скре-
щивании.
Новообразование (кооперация). Скрещивание кур
породы с розовидным гребнем (виандоты) и кур породы
с гороховидным гребнем (брамы) дало в Fi птиц с новой
формой гребня — ореховидной, характерной для малай-
ской породы (рис. 3). В Гг наблюдалось такое расщепле-
ние: 9/16 — с ореховидным, 3/16 — с розовидным, 3/16 —
с гороховидным и 1/16 — с простым (леггорны) гребнями.
Р и с* 3. Формы гребней у петухов:
а — простой; б — гороховидный; в — розовидный; г — ореховидный
Итак, в Fi и Fz появляются особи с формой гребня,
нехарактерной для пород, использованных в данном скре-
щивании. Это диаллельное расщепление, при котором
простой гребень является результатом взаимодействия
15
двух рецессивов, а ореховидный — двух доминантов (по
одному от каждого родителя).
Если /? — фактор розовидного гребня, а Р — горохо-
видного, то получаются следующие формы гребня:
P:RRpp х
/розовидный гребень
F\'.RrPp X
ореховидный гребень
ггРР
гороховидный гребень
RrPp
f2: 9/16Я-Р- 3/16 R-pp 3/16 ггР- 1/16 ггРР
ореховидный розовидный гороховидный простой
гребень гребень гребень гребень
Таким образом, каждая пара аллелей /?- —г и Р—р на
следуется независимо друг от друга, но воздействует на
один и тот же признак — форму гребня. Конечный
фенотипический эффект зависит от того, какие аллели этих
пар присутствуют в генотипе.
У дрозофилы рецессивный ген st-scarlet в гомозигот-
ном состоянии определяет ярко-красную окраску глаз,
а рецессивный ген bw-brown — коричневую. Скрещивание
этих двух форм дает в F\ нормальных красноглазых мух.
В F2 наблюдается расщепление: 9/16 — с красными
глазами, 3/16 — с коричневыми, 3/16 — с ярко-красными
и 1/16 — с белыми глазами. Окраска глаз зависит от
взаимодействия двух независимых пар аллелей:
+ bw
+ bw
ярко-красные
глаза
коричневые
глаза
st bw
st bw
красные глаза
F2: 9/16±± з/16±-^- 3/16 4 — 1/16 4 4^-
— — — bw st — st bw
красные
глаза
коричневые
глаза
ярко-красные
глаза
белые глаза
Если ген st блокирует в гомозиготном состоянии син-
тез коричневого пигмента, a bw — синтез красного
и желтого пигментов, то белая окраска глаз является
16
результатом блокирования синтеза всех пигментов. У форм
i— синтез пигмента идет нормально, что приводит к появ-
лению мух дикого типа по данному признаку.
9. ЧТО ПОКАЗЫВАЕТ ТЕСТ НА КОМПЛЕМЕНТАРНОСТЫ
С помощью теста на комплементарность можно пока-
зать, являются ли две данные мутации аллельными,
т. е. находятся в одном гене, или неаллельными, т. е. лока-
лизованными в разных сегментах или даже в разных
хромосомах, и затрагивают ли они различные гены, а зна-
чит, и этапы формирования данного признака.
Рассмотрим пример с наследованием окраски глаз
у дрозофилы, контролируемой аллелями сцепленного
с полом локуса W (white). Красно-коричневая окраска
глаз, свойственная дикому типу а также белая (ш),
абрикосовая (wa). эозиновая (ше), вишневая (wch) могут
рассматриваться как выражение разной степени количе-
ственного изменения одного и того же процесса, а именно
определенного этапа в синтезе глазного пигмента. Дока-
зательством аллельности указанных мутаций является
отсутствие комплементации (восстановления дикого
признака) по данному признаку у гетерозиготных самок
(самцы, естественно, не могут быть гетерозиготными по
Х-хромосоме). Гетерозиготные самки с генотипом W+/w
или W+/wa, полученные от скрещивания особей дикого
типа W+ с белоглазой особью w или особью с абрикосовы-
ми глазами wa, имеют красно-коричневые глаза, так как
доминантен. Гетерозиготы от скрещивания белоглазой
линии с линией, имеющей абрикосовые глаза, получают
светло-абрикосовую окраску, т. е. аллели w и wa дейст-
вуют более или менее аддитивно, следовательно, обе
эти линии дефектны по одному и тому же метаболическому
процессу, поэтому дикий признак у таких гетерозигот не
восстанавливается.
Совершенно иные результаты получаются при скрещи-
вании мутантов, у которых окраска глаз контроли-
руется генами, локализованными в разных хромосомах.
Так, например, самки, полученные от скрещивания линий
white (Х-хромосома) X scarlet (Ш-хромосома), имеют
окраску глаз, свойственную дикому типу. Другими
словами, эти мутации комплементарны. Это понятно,
так кАк в данном случае каждая самка получает от
родителя white нормальную Ш-хромосому, несущую ген
17
St+, а от родителя scarlet — нормальную Х-хромосому,
несущую ген W+t и, следовательно, она имеет генотип
W+/wSt/st.
С помощью такого же теста на комплементарность
обнаруживается и функциональная независимость генов,
находящихся в двух разных локусах одной хромосомы.
Ген bw, обусловливающий коричневую окраску глаз
(отсутствие красного компонента, свойственного дикому
типу), и ген сп, обусловливающий киноварную окраску
(отсутствие коричневого компонента), локализованы в
П-хромосоме на расстоянии 43 % кроссинговера. У гете-
розиготы Сп+/сп bw/Bw+ глаза дикого типа. Это показы-
вает, что обе мутации нарушают разные процессы в син-
тезе глазного пигмента, т. е. мутации затронули различные
гены, что определяет возможность комплементации.
10. ЧТО ТАКОЕ ЭПИСТАЗ И КРИПТОМЕРИЯ!
При неаллельном взаимодействии одна пара аллелей
может подавлять проявление другой. Такой тип взаимо-
действия называется эпистазом, а ген, оказывающий инги-
бирующее действие,— ингибитором, супрессором или
подавителем.
Так, скрещивание лука с красными и белыми лукови-
цами дает в Fi растения только с белыми луковицами,
а в F%—расщепление: 12/16—с белыми, 3/16—с крас-
ными и 1/16 — с желтыми луковицами.
Обозначив ген, определяющий красный цвет луковиц,
через Y, ген, определяющий желтый цвет,— через у, ген-
ингибитор — через /, его рецессивный аллеломорф, не
оказывающий подавляющего действия,— через i, прове-
дем скрещивание:^.
Р: UYY X Иуу
красные Fi: луковицы ПУу X белые луковицы liYy
белые луковицы
Г2:
9/16 I- Y- 3/lGI-yy 3/16 «У- 1/16 iiyy
белые белые красные желтые
луковицы луковицы луковицы луковицы
Расщепление по фенотипу 12:3:1.
Таким образом, формы, в генотипе которых присут-
18
ствовал ген-ингибитор, оказывались с белыми луковицами
(доминантный эпистаз / подавляет как У, так и у). Нужно
отметить, что гетерозиготы по 1-1 паре имеют слабую
окраску вокруг шейки луковицы, в то время как формы II
совершенно белые.
Несколько иной характер наследований наблюдается
при скрещивании растений лука, если рецессивный ген
с (colorless — бесцветный) в гомозиготном состоянии
определяет образование белых луковиц, а доминантный
С — окрашенных. Рецессивный эпистаз сс подавляет как
Y, так и у:
Р-. CCYY X ссуу
красные луковицы белые луковицы
Л: CcYy X CcYy
красные луковицы
9/16 С- Y-
красные
луковицы
3/16 С-уу
желтые
луковицы
3/16 ccY-
белые
луковицы
1/16 ссуд
белые
луковицы
Расщепление по фенотипу 9:3:4.
Этот случай интересен в практическом отношении.
Дело в том, что окрашенные луковицы устойчивы к пят-
нистости (болезнь лука), которая является результатом
присутствия определенных веществ, связанных с образо-
ванием пигмента. Рецессивные белые формы ссуу, лишен-
ные пигмента, подвержены болезни, а белые формы
с генотипом ccY- устойчивы к ней.
Скрещивание некоторых белых пород кур давало
в Fi только белых птиц, а в F2 наряду с белыми появлялись
и окрашенные (в отношении 13:3). Очевидно, одна из
скрещиваемых форм потенциально способна синтезиро-
вать пигмент, но его синтез блокируется наличием в гено-
типе гена-ингибитора. Генотип такой формы можно
представить как /-С- (С- определяет наличие предшест-
венника пигмента; / — ингибитор):
Р: НСС х ice
белые леггорны белые плимутроки
Fi: НСс X ИСс
белые куры
19
Fit 9/16 I-C- 3/16 1-cc 3/16 UC- 1/16 iicc
белые куры белые куры окрашенные куры белые куры
Расщепление по фенотипу 13:3.
В ряде случаев отдельные гены не проявляют своего
действия фенотипически, если не взаимодействуют с дру-
гими неаллельными им генами. Такой тип взаимодействия
называется криптомерией, а ген, присутствие которого
в генотипе необходимо для фенотипического проявления
признака, можно назвать геном-проявителем. Так, у льна
В — ген, определяющий голубую окраску цветков, b —
розовую. Однако для проявления окраски необходимо
наличие в генотипе доминантного гена (проявителя) А.
Его отсутствие в генотипе определяет белую окраску
цветков:
Pt AAbb X ааВВ
разноцветковые белоцветковые
растения растения
Ft: AaBb X АаВЬ
голубоцветковые растения
F2i Ъ/\ЬА-В- 3/16 A-bb 3/16 ааВ- \/\Qaabb
голубоцветковые розовоцветковые белоцветковые белоцветковые
растения растения растения растения
Расщепление по фенотипу 9:3:4.
У грызунов (кроликов, белок, морских свинок, мышей
и др.) окраска дикого типа — агути зависит от действия
двух генов: гена, определяющего ее развитие (С), и гена,
отвечающего за распределение пигмента по длине волоса
(А — зональное распределение пигмента; а — равномер-
ное его распределение).
При скрещивании черных мышей с белыми (альбино-
сами) все гибриды в первом поколении оказываются
агути, а в наблюдается расщепление (9/16 составляют
агути, 3/16 — черные и 4/16 — белые мыши):
Pi ааСС X ААсс
черные мыши белые мыши
F\ АаСсX АаСс
агути
F2i $/\6А-С- 3/16 А-сс 3/16 ааС- 1/16 аасс
агути белые мыши черные мыши белые мыши
20
Расщепления в примерах на первый взгляд кажутся
несовпадающими с менделевским расщеплением, но при
более глубоком анализе выявляется их общая основа.
Для знания того, к какому типу наследования принадле-
жит каждый конкретный случай, необходимо выяснить
биохимическую основу данного признака. Незнание этой
биохимической основы приводит к положению, при кото-
ром один и тот же случай может быть отнесен к различным
типам взаимодействия генов (в частности, пример с насле-
дованием окраски у мышей может рассматриваться как
обычное комплементарное наследование).
11. ЧТО ТАКОЕ ПОЛИМЕРИЯ!
Ряд признаков и свойств организма может опреде-
ляться действием нескольких генов с одинаковым фено-
типическим выражением. При этом может наблюдаться
усиление проявления признака с увеличением количества
таких генов в генотипе, или кумулятивный эффект. Мно-
жественные гены с однозначным действием (полигены)
могут наследственно определять и качественные (альтер-
нативные) и количественные признаки. Такое неаллельное
взаимодействие называется полимерией.
Скрещивание, например, растений пастушьей сумки
с треугольными и овальными стручками дает в F\ все
растения с треугольными стручками, а в F2 наблюдается
расщепление: 15/16 — с треугольными и 1/16 — с оваль-
ными стручками. Очевидно, что признак обусловлен
двумя парами однозначных генов, наследующихся незави-
симо. В F2 1/16 потомства (с овальными плодами) —
это гомозиготная рецессивная форма. Растения с треуголь-
ной формой стручка имеют в генотипе хотя бы один
доминант:
Р: AiAiA2A2 X ai&iaza?
треугольная форма овальная форма
Fi: AiaiA2a2 X AiaiA2a2
треугольная форма
F2: 9/16Д1-Л2- 3/16Л1-а2Л2 3/16aiai42- l/16aiaia2a2
I--------треугольная форма----1 овальная форма
Расщепление по фенотипу 15:1.
21
12. КАК НАСЛЕДУЮТСЯ КОЛИЧЕСТВЕННЫЕ ПРИЗНАКИ!
Количественные признаки — это все мерные признаки:
рост (в сантиметрах), удой молока (в литрах), жирность
молока (в процентах) и т. п. Анализ наследования коли-
чественных признаков значительно затруднен. Первое,
с чем сталкивается генетик,— это непрерывный характер
изменчивости.
Уже при анализе наследования окраски зерна у пше-
ницы, обусловленной полимерными генами, Н. Г. Нильсон-
Эле установил непрерывный ряд изменчивости окраски
зёрна растений в Fz от белой до интенсивно-красной.
Число гетерозиготных локусов, отвечающих за данный
признак, можно было установить по количеству появив-
шихся рецессивных потомков: 1/16 белозерных — расщеп-
ление идет по двум локусам, 1/64 — по трем, 1/256 —
по четырем, 1/1024 — по пяти и т. д., т. е. 1/4". Таким
образом можно выявить только число локусов, по которым
родители различаются. »
Число пар факторов п, отвечающих за исследуемый
признак, вычисляется ио формуле
D2
п=— ---—,
(1)
где D — разница между средними арифметическими
признаков у родителей; — фенотипическая
изменчивость F\ и Fz соответственно.
Наследование количественных признаков подчиняется
менделевским законам расщепления: чем больше пар
аллелей влияет на признак, тем больше варьирование по
данному признаку. Гибриды в F\ в отношении количествен-
ных признаков оказываются промежуточными между
родительскими формами, в F2 наблюдается варьирование
признака от наименьшего значения одного родителя до
наибольшего значения другого.
В Fz количество генотипов равно Зп, но генетических
значений меньше, так как они зависят только от количест-
ва доминантных аллелей, а не от их локализации. Напри-
мер, если признак контролируется двумя парами факторов,
в Fz будет 32 = 9 генотипов. Однако формы AiAia2az,
aiatA2Az и AiaiA2a2 имеют одинаковое генетическое зна-
чение, так как включают по две доминанты. Это касается
и форм с одной и тремя доминантами. В нашем примере
22
генетических значений пять: 4А, ЗА, 2А, 1Л, ОЛ, т. е. 2п 4-1.
Распределение потомства соответствует биномиальной
кривой, а коэффициенты генетических значений — по-
казателям степени членов разложения бинома Нью-
тона:
где Рх— вероятность числа особей определенного генети-
ческого значения; 2п — число аллелей, контролирующих
исследуемый признак; х — число доминантных аллелей
определенного генетического значения; р — вероятность
доминантного аллеля в популяции; q — вероятность
рецессивного аллеля в популяции; ! — факториал (произ-
ведение натурального ряда чисел от большего до самого
малого, например 5! равно 5 • 4 • 3 • 2 • 1).
Если х=0 или х=2/г, формула (2) упрощается:
^0=(1-рЛр2п=р2\ (3)
Практически вычисления можно сократить: частота
особей определенного генетического значения равна
частному от деления произведения частоты предыдущего
члена и его генетического значения на число предшествую-
щих членов:
число доминантных генов
в генотипе: 4А ЗА 2А 1А ОА
частота генотипов: 1/16 4/16 6/16 4/16 1/16
Имеются и другие способы подсчета расщепления по
количественным признакам.
Кроме генетических свойств организма существует
ряд внешних по отношению к нему воздействий, которые
могут сглаживать наследственные различия и еще более
способствовать непрерывному характеру изменчивости
этих признаков. Общая фенотипическая изменчивость
о2 слагается из двух факторов: генотипической изменчи-
вости og и изменчивости под влиянием окружающей
среды Of*.
<yJ=aG + orj. (4)
Значение Ос найдем следующим образом. Изменчи-
вость в F\ определяется лишь условиями окружающей
среды, так как особи в F\ по генотипу однородны, т. е.
23
== Се; изменчивость в Fi определяется двумя фактора-
ми, т. е. оД = со + се. Подставляя вместо се его значение
в формулу (4), найдем
0 9 2
Величину о! можно найти с помощью метода идентич-
ных однояйцевых близнецов. Все наблюдаемые у них
различия определяются влиянием условий окружающей
среды, т. е. Ор=о|.
13. МОЖЕТ ЛИ ПРИЗНАК В ПОТОМСТВЕ БЫТЬ ВЫРАЖЕН СИЛЬНЕЕ
ИЛИ СЛАБЕЕ, ЧЕМ У РОДИТЕЛЕЙ! ,
Признак в потомстве может быть выражен сильнее
или слабее, чем у родителей. И причин этому несколько.
Появление в потомстве форм, у которых признак выражен
сильнее или слабее, чом у родителей, может быть
следствием положительной или отрицательной трансгрес-
сии, что обусловлено полигенностью признаков. Это
происходит в тех случаях, когда у родительских форм
доминантные гены, отвечающие за данный признак,
находятся в разных локусах:
Р: 4i4ia2a2 X 0101/12/12
/ч: Л1Q1A2CI2 X Л
Г2: 4А ЗА 2Л 1Л ол
1/16 4/16 6/16 4/16 1/16
* особи с поло- особи, особи с отри-
жительной сходные цательной
трансгрессией с родителями трансгрессией
В нашем примере у форм с числом доминантов боль-
шим, чем у родителей (4Л, ЗЛ), признак будет выражен
сильнее. Таким же образом можно объяснить, почему
у родителей среднего роста могут быть дети высокого
и низкого роста. Если формы с 4Л (Л iA 1Л2Л2) гомозиготны
и потому константны, то формы с ЗЛ гетерозиготны
и в потомстве будут давать расщепление. Это в равной
мере относится и к формам с отрицательной трансгрес-
сией.
Признак в потомстве может быть выражен сильнее
или слабее, чем у родителей, вследствие его разной
степени выраженности, т. е. экспрессивности. Варьирова-
ние фенотипического проявления гена возможно при
изменении условий окружающей среды. Оно имеет место
24
в реализации многих признаков у всех организмов.
Например, число фасеток в глазах у потомства мутантных
«безглазых» мух может варьировать в больших пределах
и достигать половины нормального числа фасеток.
14. МОЖЕТ ЛИ ОДИН ГЕН ВЛИЯТЬ ОДНОВРЕМЕННО НА НЕСКОЛЬКО
ПРИЗНАКОВ ОРГАНИЗМА!
Обусловленность признака многими генами — полиген-
ностъ признака — тесно связана с плейотропным (мно-
жественным) действием гена. Так, у дрозофилы фактор,
обусловливающий белую окраску глаз, вызывает снижение
плодовитости, уменьшает продолжительность жизни и т. д.
У человека синдром Марфана (длинное и худое тело,
смещение хрусталика глаза, врожденный порок сердца)
зависит от действия одного гена. Для другого синдрома,
обусловленного также одним геном, характерна ломкость
костей в молодом возрасте, голубая склера, ранняя
глухота и т. д.
Примером плейотропизма может служить также ген
серповидно-клеточной анемии, широко распространенный
среди жителей Средиземноморья. Этот ген кодирует
р-цепь молекулы гемоглобина и от нормальной аллели
отличается заменой всего лишь одного триплета, значит,
в мутантном белке изменена только одна аминокислота.
На клеточном уровне это приводит к тому, что эритроциты
гомозигот по мутантному гену приобретают форму серпа
и не способны выполнять свою основную функцию по
транспорту кислорода из легких в ткани.
Кроме этого, в организме наблюдаются и другие
нарушения: увеличение селезенки, поражения кожи, серд-
ца. У гетерозигот по данному гену наблюдается склон-
ность к слипанию эритроцитов. Слипаясь, они закупо-
ривают кровеносные сосуды, вызывая нарушение функций
многих органов. Другими словами, наблюдается иерархия
причин множественного эффекта этого гена: измененный
мутантный ген, определяемый им ненормальный гемогло-
бин, обусловленная гемоглобином серповидность эритро-
цитов, слипание и разрушение эритроцитов, которые
вызывают органические дефекты и анемию.
Любой организм представляет собой сложную систему,
в которой различные процессы находятся во взаимо-
связи, и нарушение даже одного из них может привести
к серьезным нарушениям в обмене веществ и изменению
25
многих морфолого-физиологических характеристик. При-
чем один и тот же ген может^ оказывать различное
влияние на проявление признаков: усиливать (гены-
модификаторы) или ослаблять (гены-ингибиторы) дейст-
вие основного гена, отвечающего за данный признак.
Влияние гена на свойства и признаки тем большее, чем
раньше проявляется его активность в период эмбриональ-
ного развития организма.
Глава ОПРЕДЕЛЕНИЕ ПОЛА. НАСЛЕДОВАНИЕ
ПРИЗНАКОВ, СЦЕПЛЕННЫХ С ПОЛОМ
15. КАК И КЕМ БЫЛА НАЙДЕНА СВЯЗЬ МЕЖДУ ГЕНАМИ
И ХРОМОСОМАМИ!
Ко времени опубликования результатов работы Г. Мен-
деля методы окрашивания и микроскопирования клетки
были разработаны слабо. Однако, несмотря на то, что
способы деления клетки — митоз и мейоз были открыты
еще в 1870—1880 гг., вплоть до вторичного открытия
законов Менделя никто не предполагал, что между процес-
сами, происходящими в мейозе, и передачей наследствен-
ных свойств существует связь. Впервые эту связь между
законами Менделя и процессами, сопровождающими
деление клеток, установил У. Сеттон.
Рассуждения У. Сеттона сводились к следующему:
биологический «мостик», соединяющий поколения, состоит
из двух небольших клеток — сперматозоида и яйцеклетки.
Поскольку гены переходят от одного поколения к другому,
они должны локализоваться где-то в этих половых
клетках. Далее У. Сеттон сделал вывод, что, несмотря на
различия в размерах сперматозоида и яйцеклетки, они
вносят одинаковый генетический вклад в создание нового
организма. Это заключение подтверждалось и работами
Г. Менделя, когда результат скрещивания (при наследо-
вании форм семян гороха) не зависел от направления
скрещивания: Р — АА X аа, Ft — Аа; Р — аа% АА, Fi —Аа.
Рассуждая об одинаковом генетическом вкладе поло-
вых клеток, У. Сеттон предположил, что гены в обеих
гаметах должны располагаться в одном и том же месте.
В каком же именно? Спермин — мужская гамета — пред-
ставляет собой ядро, окруженное небольшим количеством
цитоплазмы. Ядро яйцеклетки похоже на ядро спермия,
26
хотя объем ее цитоплазмы во много раз больше объема
цитоплазмы спермия. Отсюда было сделано заключение
о локализации генов в ядрах гамет. Заметив параллелизм
в распределении хромосом при гаметогенезе и наследо-
вании генов (а следовательно, и признаков) в чередую-
щихся поколениях, У. Сеттон выдвинул следующую гипоте-
зу: гены представляют собой определенные физические
единицы, локализованные на хромосомах. Каждый из
аллелей данного гена может быть расположен на одной
из пары гомологичных хромосом. Только при таком усло-
вии будет сохраняться параллелизм в поведении хромосом
и генов. Таким образом, именно У. Сеттон первым
объяснил цитологический механизм расщепления.
16. ПОЧЕМУ РОЖДАЕТСЯ ПРИМЕРНО ОДИНАКОВОЕ КОЛИЧЕСТВО
ОСОБЕЙ МУЖСКОГО И ЖЕНСКОГО ПОЛА!
Особей мужского и женского пола рождается примерно
поровну. Так, например, у лошадей процент самцов при
рождении равен 52, у людей — 51, у мышей и голубей —
50, у кур — 49. Примерно такие же соотношения между
полами у растений и насекомых. х
Причины этого явления кроются в самих механизмах
наследования пола, первый из которых был открыт у клопа
Protenor. Подсчет количества хромосом в ядрах его кле-
ток после первого мейотического деления показал, что
их число различно: в одних ядрах наблюдалось 11 хромо-
сом, в других — 10. При проверке числа хромосом в клет-
ках мужских и женских особей оказалось, что самцы
содержат по 21 хромосоме, а самки — по 22. Поэтому все
яйцеклетки имели одинаковые (11), а сперматозоиды —
различное (10, 11) число хромосом. Непарная 11-я хромо-
сома была названа Х-хромосомой, или половой хромосо-
мой. При слиянии мужской гаметы с 11 хромосомами
и яйцеклетки образуется зигота женского пола, а при
слиянии сперматозоида с 10 хромосомами и яйцеклетки —
зигота мужского пола. Поскольку сперматозоиды с 10
и 11 хромосомами образуются в одинаковом количестве,
то соотношение мужских и женских особей в потомстве
будет одинаковым.
При изучении клопа Ligaus было выявлено, что число
хромосом всех его половых клеток (и сперматозоидов,
и яйцеклеток) одинаково. Но у половины сперматозоидов
одна хромосома резко отличалась от других по размеру,
27
Р и с. 4. Определение пола у дрозофилы
(2л=8):
а — хромосомный набор родителей; б—гаметы;
в — хромосомный набор потомков
она была короче других
хромосом. Эта хромо-
сома получила назва-
ние Y-хромосомы. Клет-
ки самцов содержат по
одной X- и Y-хромосо-
ме, а ядра клеток са-
мок — по две Х-хромо-
сомы. При оплодотворе-
нии яйцеклетки, имею-
щей обязательно Х-хро-
мосому, сперматозои-
дом с Х-хромосомой по-
лучается женская зиго-
та, сперматозоидом с Y-
хромосомой — мужская
зигота. Тех и других
сперматозоидов обра-
зуется поровну, а зна-
чит, и число мужских
особей в потомстве бу-
дет равно числу жен-
ских.
Рассмотренные два
типа определения пола
характерны в основном для животных и двудомных расте-
ний. Тип Protenor обнаруживается у большинства насе-
комых и части червей, тип Ligaus — у млекопитающих,
рыб, насекомых, например у дрозофилы (рис. 4). Насле-
дование пола у птиц осуществляется так же, как и у мле-
копитающих, хотя самки имеют набор хромосом XY,
а самцы — XX. Но механизм определения пола остается
в принципе таким же.
Таким образом, в основе различия между полами
лежат различия в наборе X- и Y-хромосом. Равномерное
распределение половых хромосом при гаметогенезе обу-
словливает равновероятное образование мужских и жен-
ских особей при оплодотворении.
17, ЧТО ТАКОЕ БАЛАНСОВАЯ ТЕОРИЯ ОПРЕДЕЛЕНИЯ ПОЛА!
В природе и эксперименте встречаются факты, которые
свидетельствуют о том, что роль половых хромосом
в определении пола не абсолютна: их функция может
изменяться в зависимости от общего генного баланса.
28
Иногда среди раздельнополых животных появляются
особи, имеющие признаки того и другого пола, это так
называемые интерсексы, или особи с усиленным развитием
половых признаков,— сверхсамки и сверхсамцы, причем
последние обычно бесплодны. Цитологический анализ
таких необычных особей у дрозофилы показал, что для их
кариотипа характерно и необычное соотношение половых
хромосом (X) и аутосом (А). Для нормальных самок
соотношение Х:А равно 1:1, т. е. двум Х-хромосомам
соответствует двойной набор аутосом; для нормальных
самцов Х:А=1:2, т. е. у самцов две аутосомы и одна
половая хромосома.
Нарушая путем воздействия рентгеновскими лучами
нормальное расхождение хромосом при гаметогенезе,
К. Б. Бриджес получил различные сочетания Х:А в карио-
типе потомства. Оказалось, что относительное повышение
доли аутосом по отношению к Х-хромосомам приводит
к усилению мужских признаков (табл. 3).
Таблица 3. Половые типы дрозофилы в зависимости от соотношения
половых хромосом и аутосом
Число Х-хромосом Число наборов аутосом (А) Отношение Х:А У Пол особи
3 2 1,5 сверхсамка
2 2 1 нормальная дипло-
идная самка
2 3 0,67 интерсекс
1 2 0,5 нормальный дипло-
идный самец
1 3 0,33 сверхсамец
Согласно данным табл. 3 фенотипическое определение
пола у дрозофилы зависит от того, какая из двух потенций
в общем балансе генов окажется сильнее. Увеличение
числа Х-хромосом, в которых локализованы гены
женского пола, определяет усиленное развитие признаков
самки, а увеличение числа аутосом, несущих гены
мужского пола,— усиленное развитие признаков самца.
У человека, мыши, а возможно, и у других видов
млекопитающих распределение генов, влияющих на пол,
иное, чем у дрозофилы: в аутосомах находятся гены как
мужского, так и женского пола. На определение пола могут
оказывать влияние и факторы цитоплазмы.
29
18. МОЖНО ЛИ ИСКУССТВЕННО ИЗМЕНИТЬ СООТНОШЕНИЕ ПОЛОВ
В ПОТОМСТВЕ!
Для животных, у которых гетерогаметны самцы,
возможна дифференциация сперматозоидов на две фрак-
ции — с X- или Y-хромосомой, что позволяет отобрать
желаемый тип сперматозоидов: с Х-хромосомой, если
нужны самки, или с Y-хромосомой, если нужны самцы,
и получить зиготы преимущественно с набором хромосом
заданного пола.
Идея разделения спермы на две фракции с целью
направленного изменения соотношений полов у животных
впервые была сформулирована Н. К. Кольцовым и В. Н.
Шредером в 1933 г. Пропуская через разбавленный
специальным электролитом эякулят кролика, барана,
быка, хряка и других животных электрический ток,
В. Н. Шредер смог разделить сперму на две фракции.
От «анодной» фракции (предположительно с Х-спермато-
зоидами) при искусственном осеменении были получены
в основном самки, а от «катодной» (предположительно
с Y-сперматозоидами) — большей частью самцы. Особей
предполагаемого пола получалось примерно до 75 %, что
было существенным сдвигом по сравнению с обычным
соотношением полов.
Подлинный успех в регулировании пола достигнут
только у чешуекрылых благодаря исследованиям Б. Л.
Астаурова, который работал с тутовым шелкопрядом. Как
известно, у тутового шелкопряда гетерогаметен женский
пол ZW, мужской пол го мо га метен ZZ. (Z и W — половые
хромосомы при женской гетерогаметности, когда самка
образует два типа гамет, различающихся по набору
половых хромосом, в отличие от X- и Y-хромосом при
мужской гетерогаметности.) Если не прошедшие мейоз
и неоплодотворенные яйца самок нагреть до 46 °C, то
мейоз не происходит, и яйца остаются диплоидными.
Такие яйца развиваются партеногенетически, без опло-
дотворения, и все потомство состоит только из дочерей.
Имеются данные о возможности изменения пола обработ-
кой молодых особей половыми гормонами.
19. КАКОВЫ МЕТОДЫ РАННЕЙ ДИАГНОСТИКИ ПОЛА!
Кроме приемов, способствующих численному увеличе-
нию особей одного пола, важное практическое значение
имеет разработка генетических методов, позволяющих
30
у некоторых видов животных проводить раннюю диаг-
ностику и отбраковку особей нежелательного пола.
Как известно, у зародыша некоторых видов животных
пол невозможно распознать не только по вторичным, но
и по первичным половым признакам, а ,поздняя отбраковка
животных иногда экономически невыгодна. Так, у туто-
вого шелкопряда пол важно распознать или на ранних
личиночных стадиях, или на стадии зиготы, чтобы не тра-
тить корм на выращивание гусениц-самок, которые поеда-
ют много листовой массы шелковицы и дают шелка при за-
вивке кокона на 25—30 % меньше, чем гусеницы-самцы.
Чтобы можно было распознавать пол на ранних
личиночных стадиях, японский исследователь В. Тадзима
вывел такую породу тутового шелкопряда, у которой
гусеницы-самки имеют покров с характерным рисунком
(«маской»), отсутствующим у гусениц-самцов. Это уда-
лось осуществить путем перенесения на W-хромосому,
участвующую в образовании гусениц женского пола,
фрагмента второй аутосомы с задатками пигментации.
Такая необычная хромосома стабильно передается потом-
ству по прямой женской линии. Таким образом, у новой
породы тутового шелкопряда гусеницы-самки, подлежа-
щие отбраковке, легко отличимы от гусениц-самцов,
оставляемых на завивку коконов.
По той же методике В. Тадзима . вывел другую
породу, у которой гусеницы женского пола имеют черную,
а мужского — обычную светлую окраску.
Над созданием аналогичной породы тутового шелко-
пряда в нашей стране работали В. А. Струнников
и Л. М. Гуламова. Им удалось придать яичкам
с мужскими и женскими зародышами разную окраску:
темные яички — будущие самки, светлые — самцы. Благо-
даря тому что у таких линий и пород шелкопряда на
мужских и женских яичках есть четкие метки, их легко
рассортировать с помощью машины-фотоэлемента. От-
сортированную «на самок» темную грену выбраковывают,
сохраняя необходимое для размножения количество,
а светлую — «на самцов» — оставляют на выкормку.
20. ЧТО ТАКОЕ ПОЛОВОЙ ХРОМАТИН!
В конце 40-х гг. нашего века М. Барр обнаружил
половые различия в строении интерфазных ядер сомати-
ческих клеток кошек. В ядрах соматических клеток нор-
31
мальной самки было обнаружено тельце, получившее
название половой хроматин или тельце Барра. В ядрах
клеток нормального самца таких телец не было. Благо-
даря этому открытию и изучению половых аномалий
возникли современные представления о механизме опре-
деления пола у человека и других млекопитающих.
Тельце Барра можно обнаружить у женщин в клетках
всех соматических тканей. Кроме того, ядра полиморфно-
ядерных лейкоцитов у женщин иногда имеют своеобраз-
ные придатки типа «барабанных палочек» (рис. 5).
Редко
Рис. 5. Образование полового хроматина в клетках с различным
содержанием Х-хромосом:
I — хромосомы женщины и мужчины; II — половой хроматин; III — «барабанные па-
лочки»
Самый простой метод определения состояния полового
хроматина (генетического определения пола) —это иссле-
дование эпителиальных клеток в соскобе слизистой щеки.
32
Присутствие телец Барра и «барабанных палочек» объяс-
няется наличием в женских соматических клетках двух
Х-хромосом, из которых активна только одна. Поэтому
в клетках нормальной женщины имеется тельце Барра,
а в мужских клетках его нет. В клетке с тремя X-хромосо-
мами имеются два тельца Барра, с четырьмя Х-хромосо-
мами — три. Это отмечено для женских и для мужских
аномальных клеток и используется для ранней диагности-
ки пола и аномалий полового развития у человека.
21. СУЩЕСТВУЕТ ЛИ ПОЛ У РАСТЕНИЙ!
Среди споровых и цветковых растений широко распро-
странено явление двудомности, т. е. наличие отдельных
мужских и женских растений в популяции.
Гомо- и гетерогаметность у растений впервые была
установлена К. Э. Корренсом на Bryonica dioica. Скрещи-
вание между мужскими и женскими растениями этого вида
дает в среднем одинаковое число мужских и женских
растений.
Сведения о механизме наследования пола у растений
были получены также и при изучении гибридов от скрещи-
вания двудомной В. dioica и однодомной В. alba. При
опылении растений В. alba пыльцой мужских растений
В. dioica все потомство оказывается двудомным и состоит
из равного числа мужских и женских растений. При
реципрокном скрещивании получается лишь чисто женское
потомство. На основании этих опытов можно сделать
вывод, что мужские растения В. dioica гетерогаметны,
а женские — гомогаметны. Внутри вида В. dioica в потом-
стве постоянно образуется одинаковое количество муж-
ских и женских растений. В. alba имеет генотип mm, так
же как женское растение В, dioica.
У двудомных растений, как и у животных, обнару-
жены половые хромосомы. Так, например, у мха-печеноч-
ника Sphaerocarpus само растение (гаметофит) гаплоид-
но, тогда как спорофит, т. е. спорангий и его ножка,
диплоиден. Было обнаружено, что мужской гаметофит
имеет семь обычных хромосом и одну маленькую Y-xpo-
мосому. Хромосомный набор женского растения состоит
из тех же семи обычных хромосом и одной длинной
Х-хромосомы. При оплодотворении эти два хромосомных
набора соединяются и спорофит имеет набор 2A + X + Y.
В мейозе образуются семь пар аутосом и одна пара X—Y
2-1740
зз
Значит, одна половина спор получит набор 7А + Х,
а вторая — 7A4-Y. Из этих спор развиваются соответст-
венно женские и мужские растения.
Половые хромосомы были обнаружены и у некоторых
двудомных цветковых растений. Так, например, у Melan-
driutn album женские растения имеют набор 22А + ХХ,
а мужские — 22A4-XY, т. е. наследование пола у растений
в принципе не отличается от наследования пола у
животных.
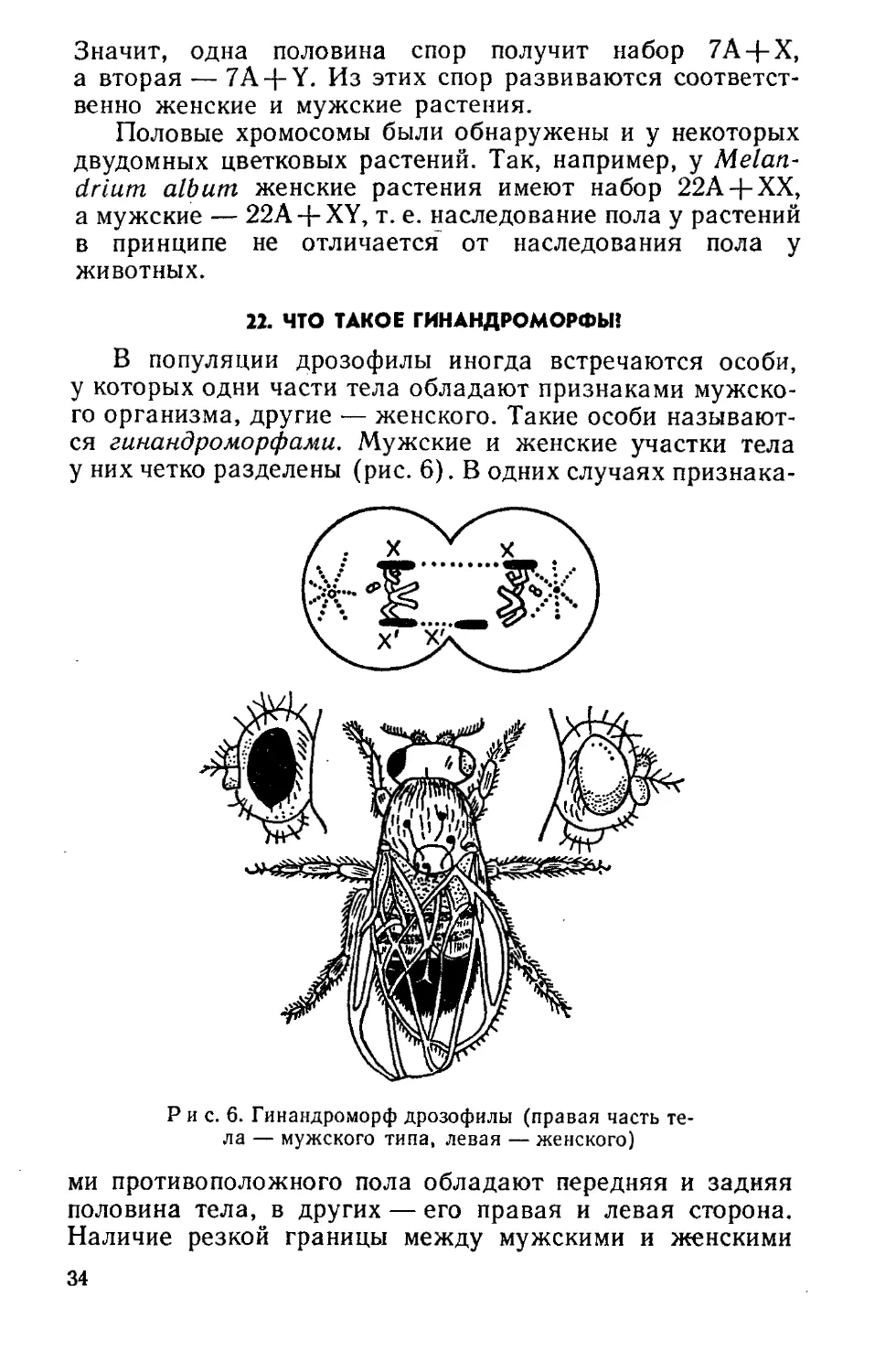
22. ЧТО ТАКОЕ ГИНАНДРОМОРФЫ!
В популяции дрозофилы иногда встречаются особи,
у которых одни части тела обладают признаками мужско-
го организма, другие — женского. Такие особи называют-
ся гинандроморфами. Мужские и женские участки тела
у них четко разделены (рис. 6). В одних случаях признака-
Р и с. 6. Гинандроморф дрозофилы (правая часть те-
ла — мужского типа, левая — женского)
ми противоположного пола обладают передняя и задняя
половина тела, в других — его правая и левая сторона.
Наличие резкой границы между мужскими и женскими
34
участками у гинандроморфных насекомых объясняется
тем, что в процессе дифференциации гормоны играют
у них относительно малую роль и каждая часть тела
формируется исключительно в соответствии со своим
генотипом.
Гинандроморфы могут возникать следующим образом:
будущая гинандроморфная особь начинает свое развитие
из зиготы 2А + ХХ (два набора аутосом и две X-хромосо-
мы), т. е. как женская. Однако первое митотическое деле-
ние зиготы происходит ненормально. Дочернее ядро со-
держит после деления 2А + ХХ, а второе дефектно
и содержит 2А + Х, так как одна Х-хромосома по каким-
либо причинам была утеряна. Затем следует нормальное
деление ядер. Клетки, имеющие две Х-хромосомы, дают
ткани женского типа, а клетки с одной Х-хромосомой —
мужского. В этом случае у гинандроморфа одна половина
тела имеет признаки мужского пола, а вторая — женского.
Если же Х-хромосома была потеряна при более позднем
делении зиготы, то участок тела с мужскими признаками
будет меньше. Этим можно объяснить существование
гинандроморфов, у которых одна четверть или еще мень-
шая часть тела принадлежит мужскому типу, а осталь-
ная — женскому.
Гинандроморфы часто встречаются и среди бабочек.
Мужские особи обычно имеют более яркую окраску
крыльев, а у самки крылья меньших размеров и невзрач-
ной окраски. Были обнаружены гинандроморфы, у которых
крылья на одной стороне тела такие же, как и у самцов,
а на другой — как у самок. Объяснение подобных случаев
аналогично гинандроморфизму у дрозофилы, однако у ба-
бочек гинандроморфы начинают развиваться как муж-
ские особи из зиготы с генотипом XX
Некоторые гинандроморфы возникают другим путем.
Иногда после мейоза появляется ненормальная яйцеклет-
ка, содержащая два гаплоидных ядра. Поскольку у неко-
торых насекомых встречаются случаи полиспермии, т. е.
проникновения в яйцеклетку нескольких сперматозоидов,
то одно из двух гаплоидных ядер такой необычной яйце-
клетки может оплодотвориться сперматозоидом, несущим
Х-хромосому, второе — сперматозоидом с Y-хромосомои.
Образовавшиеся при этом особи будут гинандроморфами.
35
23. КАКИЕ ПРИЗНАКИ НАЗЫВАЮТСЯ СЦЕПЛЕННЫМИ
С ПОЛОМ!
Признаки, гены которых локализованы в половых
хромосомах, называются сцепленными с полом. Генети-
ческий анализ выявил некоторые особенности наследова-
ния таких признаков, как 1) различие в результатах
прямых и реципрокных скрещиваний; 2) наследование
крест-накрест (крисс-кросс), т. е. признак от матери
наследуется сыновьями, от отца — дочерьми. Эти особен-
ности наследования связаны с тем, что Y-хромосома
гетерогаметного пола у разных организмов в большей
или меньшей степени генетически инертна, поэтому
факторы, локализованные в Х-хромосоме, находятся
в гемизиготном состоянии. Свою единственную Х-хромо-
сому сыновья получают от матери, поэтому их генотипы
зависят от генотипа матери: если мать гомозиготна, все
сыновья имеют одинаковый генотип; если мать гетерози-
готна, среди сыновей наблюдается расщепление 1:1 в отно-
шении исследуемого признака.
У дрозофилы известно около двухсот признаков,
которые наследуются сцепленно с полом. В качестве
примера рассмотрим наследование окраски глаз. У мух
дикого типа — красные глаза; белые глаза определяются
рецессивным мутантным геном (w), локализованным
в Х-хромосоме. При обычном менделевском наследовании
для расщепления в F\ и F^ не имеет значения, кем вносятся
гены, контролирующие признак, матерью или отцом, а в
данном случае результаты эксперимента зависят от пола
родителя, имеющего мутантный ген (рис. 7).
У человека ряд признаков, в том числе гемофилия^
атрофия зрительного нерва, дальтонизм, сцеплены с Х-хро-
мосомой и наследуются так же, как и окраска глаз у дрозо-
филы. Но если у самцов дрозофилы между X- и Y-хромо-
сомами не бывает кроссинговера и, следовательно,
обмена генами, то у человека в Y-хромосоме есть участки,
гомологичные Х-хромосоме, поэтому возможны частичная
конъюгация, кроссинговер и обмен участками, что вносит
некоторые отклонения от типичного наследования крисс-
кросс.
Признаки, гены которых локализованы в участках
Y-хромосомы, негомологичных ни одному из участков
Х-хромосомы, передаются только от отца сыновьям
(голандрические признаки), так как дочери никогда не
получают Y-хромосому. Примером может служить насле-
36
Рис. 7. Различия в реципрокных скрещиваниях по признакам, сцеплен-
ным с полом (дрозофила):
а — самка красноглазая, самец белоглазый; б — самка белоглазая, самец красноглазый
Рис. 8. Наследование окраски оперения кур (признак сцепления с
полом) в реципрокных скрещиваниях:
а — темный петух, рябая курица; б — рябой петух, темная курица
37
дование такой безвредной аномалии, как наличие перепон-
ки между пальцами ног у человека. Она передается только
от отца сыновьям.
У птиц, некоторых рыб и бабочек также обнаружен
ряд сцепленных с полом признаков. В этих случаях гены,
контролирующие признак, тоже находятся в Х-хромосоме,
но в схеме наследования самцы и самки меняются местами,
так как гетерогаметным полом здесь являются самки
(рис. 8).
24. КАКИЕ ПРИЗНАКИ НАЗЫВАЮТСЯ ОГРАНИЧЕННЫМИ ПОЛОМ
И ЗАВИСИМЫМИ ОТ ПОЛА!
Существуют признаки, которые проявляются только
у одного пола, несмотря на то что гены, определяющие
эти признаки, имеются у обоих полов как в аутосомах,
так и в половых хромосомах. Такие признаки называются
признаками, ограниченными полом. К ним относятся
признаки, характеризующие продуктивность животных,
например молочность и жирность молока у крупного
рогатого скота. Быки имеют гены, определяющие молоч-
ность их «дочерей», но эти гены своего действия,
естественно, не проявляют. Петухи также имеют в своих
хромосомах гены яйценоскости и размера яиц, которые
будут нести их «дочери», но у самих петухов действие
данных генов подавлено.
Отмечено существование признаков, характер домини-
рования которых зависит от пола. Такие признаки
называются признаками, зависимыми от пола. Например,
у крупного рогатого скота развитие рогов определяется
доминантным геном, а их отсутствие — рецессивным. Од-
нако доминирует данный ген только у самцов, у самок он
рецессивен. Поэтому гетерозиготные самцы оказываются
рогатыми, а гетерозиготные самки — безрогими. Лишь в
гомозиготном состоянии и доминантные и рецессивные
гены у обоих полов проявляются одинаково.
Таким же образом наследуется «лысость» у человека.
У мужчин ген «лысости» доминирует, а у женщин он
рецессивен. Следовательно, у мужчин для облысения
достаточно одного доминантного аллеля, тогда как у жен-
щин для получения того же эффекта необходима гомози-
готность по доминантному гену, поэтому лысых мужчин
гораздо больше, чем лысых женщин.
Проявление зависимых от пола признаков определяет-
38
ся соотношением мужских и женских гормонов в крови.
Гены, определяющие вторичные половые признаки, имеют-
ся у обоих полов, но их проявление контролируется
также гормонами.
25. КАК НАСЛЕДУЮТСЯ ПРИЗНАКИ ПРИ БЕСПОЛОМ РАЗМНОЖЕНИИ!
При бесполом размножении начало новому организму
дает одна клетка или же группа клеток материнского
организма, т. е. в отличие от полового размножения
потомство происходит от одного родителя. Бесполое
размножение широко распространено у растений, бактерий
и вирусов. У более высокоорганизованных животных
оно наблюдается лишь у видов, способных к партеногенезу
или регенерации.
При вегетативном размножении, используемом обычно
в плодоводстве, декоративном садоводстве и картофеле-
водстве, начало новому организму дают побег, почка,
луковица, клубень и т. д., другими словами, группа
соматических клеток. Эти клетки формируются на мате-
ринском растении путем митоза (процесс прямого деления
ядра), имеют одно и то же число хромосом, а следователь-
но, и наследственность, свойственную материнскому
организму. Развиваясь, такая группа дает начало новому
самостоятельному растению. Дальнейшее его развитие
происходит также путем митотического деления клетки.
Поэтому у такого растения сохраняется прежнее строение
ядра и исходные сортовые особенности даже в тех случаях,
когда материнский организм получен в результате
скрещивания разных сортов и даже разных видов. Однако
если от таких вегетативно размножающихся растений
получить семена, то потомство, выращенное из них, не-
медленно обнаружит гетерозиготную природу материн-
ского организма и будет отличаться высокой изменчи-
востью. При этом особенности материнского сорта в ре-
зультате расщепления теряются. Иногда повышенную
изменчивость семенного потомства вегетативно размно-
жающихся растений используют для выведения новых
сортов, так как при этом могут быть получены ценные
экземпляры, качество которых можно легко сохранить
путем вегетативного размножения.
Будучи, как правило, гетерозиготными, вегетативно
размножающиеся растения при скрещивании их с предста-
вителями других сортов, также размножающихся вегета-
39
тивно, дают в первом поколении большое разнообразие
форм. Поэтому И. В. Мичурин был прав, указывая, что
плодовые растения не подчиняются законам Г. Менделя.
Однако данная особенность есть следствие их гетерозигот-
ности, а не особого типа наследования признаков.
Группу растений и животных, происшедших от
одной особи путем вегетативного размножения, называют
клоном, а группу микроорганизмов (бактерий и вирусов),
происшедшую таким же путем,— штаммом. Входящие в
состав клона или штамма особи характеризуются одина-
ковым генотипом, повторяющим генотип материнского
организма или клетки, от которой они произошли.
26. В ЧЕМ ЗАКЛЮЧАЕТСЯ БИОЛОГИЧЕСКАЯ РОЛЬ ПОЛОВОГО
РАЗМНОЖЕНИЯ!
Одним из факторов эволюции является изменчивость.
Организмы, обладающие большей изменчивостью, лучше
приспособлены к условиям окружающей среды. Если бы
размножение всегда происходило бесполым путем, то все
равно Земля была бы заселена генетически различаю-
щимися организмами — каждый вариант возникал бы в
результате мутации в предыдущей особи, которая в свою
очередь произошла из непрерывного ряда поколений.
В этом случае эволюционный процесс шел бы очень
медленно, поскольку для возникновения нового варианта,
характеризующегося большей приспособленностью, необ-
ходимо появление новых мутаций, которые, как известно,
являются редким событием.
Половой процесс имеет огромные генетические пре-
имущества по сравнению с бесполым и вегетативным
размножением. При половом размножении возможны ге-
нетические рекомбинации, ускоряющие процесс эволюции,
т. е. процесс создания более приспособленных организмов.
Более приспособленные генотипы могут возникнуть в ре-
зультате объединения генов, принадлежавших до этого
различным родителям, причем родители могли быть и пло-
хо приспособлены к окружающим условиям. Поскольку
рекомбинация происходит в каждом поколении, то адап-
тивные комбинации генов возникают гораздо чаще за счет
относительно редких мутаций.
40
27. КАКОВЫ ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ОПРЕДЕЛЕНИЯ ПОЛА У
ОДНОКЛЕТОЧНЫХ ОРГАНИЗМОВ!
Рассмотрим в качестве примера определение пола
у дрожжей. Половой процесс у них заключается в слиянии
двух гаплоидных клеток разного полового типа. Различают
гетероталлические штаммы, состоящие из клеток одного
полового типа, и гомоталлические, включающие в себя
клетки различных половых типов. Внутри гомоталлических
штаммов клетки при митозе могут менять пол. У некоторых
пивных дрожжей пол «плюс» или «минус» определяется
тем, что на хромосоме между генами М и Р, которые
определяют пол, есть участок ДНК, играющий роль
своего рода переключателя. При одной ориентации
переключателя транскрибируется, например, ген Af, а при
обратной ориентации —> ген Р, и клетка имеет соответст-
венно тот или иной половой тип (знак). У хлебопекарных
дрожжей половой тип а и а зависит от того, что на хромо-
соме, несущей «молчащие гены» 1 и 2, определяющие
половой тип, между этими генами существует участок —
«локус пола» PTL, включающий в свой состав копию
гена 1 или 2. И в зависимости от того, копия какого гена
имеется в локусе пола, клетка относится к половому типу
а или а. Таким образом, пол в данном случае регулируется
не изменением ориентации транскрипции, а транспозицией
структурных генов.
Глава 4. СЦЕПЛЕНИЕ И КРОССИНГОВЕР.
КАРТЫ ХРОМОСОМ
28. КАКИЕ ПРИЗНАКИ НАЗЫВАЮТСЯ СЦЕПЛЕННЫМИ!
КАК ОНИ НАСЛЕДУЮТСЯ!
Любой организм обладает многообразием морфологи-
ческих, физиологических, биохимических и прочих призна-
ков и свойств, причем каждый признак или свойство
контролируется одним либо несколькими генами, локали-
зованными в хромосомах. Однако если число генов орга-
низма огромно и может измеряться десятками тысяч, то
число хромосом сравнительно невелико (табл. 4). В связи
с этим в каждой паре хромосом локализованы сотни и
тысячи аллелей, образующих группы сцепления. Установ-
лено полное соответствие между числом групп сцепления
и числом пар хромосом. У кукурузы, например, число
41
Таблица 4. Диплоидное число хромосом у некоторых
растений и животных
Растения Число хромосом Животные Число хромосом
Бобы конские 12 Лягушка зеленая 26
Рожь 14 Кошка домашняя 38
Пшеница 14—42 Мышь домашняя 40
Свекла, редис, капуста 18 Кролик 44
Кукуруза 20 Шимпанзе 48
Сосна, ель, дуб, бук 24 Лошадь, осел 66
Картофель 24—72 Куры домашние 78
пар хромосом составляет 2л = 20 и 10 групп сцепления,
а у дрозофилы 2п = 8 и 4 группы сцепления.
Гены, локализованные в одной хромосоме, передаются
совместно, и способ их наследования отличается от насле-
дования генов, локализованных в разных парах гомологи-
чных хромосом. Так, если при независимом распределении
А В
дигибрид ~ образует четыре типа гамет АВ, АЬ,
аВ, ab в равных количествах, то такой же дигибрид
уу- при условии полного сцепления факторов Ап В (анЬ)
образует только два типа гамет: АВ и ab. Отклонения от
независимого менделевского расщепления как результат
сцепления генов впервые установили У. Бэтсон и Р. К.
Пеннет (1906 г.). Однако разработка этой проблемы
принадлежит школе Т. X. Моргана. Для определения
типа наследования двух пар генов (сцепленное или
независимое) необходимо провести анализирующее скре-
щивание:
при полном сцеплении
АВ ab
ab ab
гаметы: ДД abab;
ab ab
при неполном сцеплении
АВ ab-
ab х ab
гаметы: АВ ab Ab аВ ab
Р t АВ Ab аВ ab
а ’ ab ab ab ab
42
Рис. 9. Схема кроссинговера между различными хрома-
тидами
Значит, сцепленные гены могут наследоваться в по-
томстве как пара аллельных генов. Это справедливо лишь
для полного сцепления, когда гены локализуются в хро-
мосоме близко друг к другу. При анализирующем скре-
щивании в потомстве при неполном сцеплении появляются
четыре фенотипа, два из них имеют новое сочетание
генов: Aabb и ааВЬ. Появление подобных форм свидетель-
ствует о том, что дигибрид с гаметами АВ и ab образует
гаметы-рекомбинанты АЬ и аВ. Появление таких гамет
возможно только в результате обмена участками гомо-
логичных хромосом, т. е. в процессе кроссинговера, и коли-
чество их значительно меньше, чем некроссоверных (не
рекомбинантных, родительского типа).
Кроссинговер происходит в профазе I мейоза, во вре-
мя конъюгации гомологичных хромосом. Удвоение хромо-
сом к этому времени завершается, и каждая пара их
представлена четырьмя хроматидами. В пахинеме проис-
ходит их тесное переплетение, при этом возможны разрыв
и объединение хроматид в новые комбинации.
Нужно отметить, что единого мнения относительно
механизма обмена гомологичными участками нет: одни
исследователи считают, что обмен происходит в момент
разрыва хиазм, другие — что хиазмы — это результат
43
уже прошедшего обмена. Однако при отсутствии хиазм
кроссинговер обычно не наблюдается.
Так как обмен происходит между участками хрома-
тид, количество кроссоверных гамет не превышает 50 %.
В редких случаях обмен наблюдается между всеми че-
тырьмя хроматидами, приводя к образованию четырех
рекомбинантных хромосом (рис. 9).
29. КАК ОПРЕДЕЛИТЬ СИЛУ СЦЕПЛЕНИЯ ГЕ НО ВI
Если перекрест между двумя генами происходит редко,
то их сцепление считается сильным и, напротив, если
перекрест происходит часто, сцепление слабое. Для изме-
рения силы сцепления растение или животное, гетерози-
готное по сцепленным генам, скрещивается с двойным
рецессивом, и в потомстве от такого скрещивания под-
считывается число особей, у которых оба гена находятся
в первоначальных комбинациях (некроссоверы), и число
особей с новой комбинацией (кроссоверы). Выраженная
в процентах от общего числа потомков частота появления
кроссоверов и характеризует силу сцепления анализируе-
мых генов.
У кукурузы, например, ген С определяет наличие
окраски алейрона в зерне, с — отсутствие окраски, S —
гладкую поверхность зерна, s — морщинистую. Скрещи-
вание двух гомозиготных линий’ CS/CS и cs/cs дало в
Fi гетерозиготы (CS/cs) по исследуемым признакам.
При анализирующем скрещивании (CS/cs X cs/cs)
были получены следующие результаты:
фенотип число зерен
окрашенные гладкие 4032
окрашенные морщинистые 149
неокрашенные гладкие 152
неокрашенные морщини- 4035
стые
Всего: 8368
Окрашенные гладкие и неокрашенные морщинистые
зерна сохранили родительские комбинации генов — это
некроссоверы; окрашенные морщинистые и неокрашен-
ные гладкие зерна с новыми комбинациями генов (крос-
соверы) составляют 301 (149+ 152), или 3,6 % от общего
числа потомков. Таким образом, гены окраски и*формы
поверхности сцеплены с показателем перекреста 3,6 %.
Учитывая, что максимальная величина перекреста дости-
гает примерно 50 %, можно считать, что в нашем при-
мере сила сцепления генов значительна.
44
30. КАК УЧИТЫВАЕТСЯ КРОССИНГОВЕР У ГАПЛОИДНЫХ
ОРГАНИЗМОВ! МОЖНО ЛИ ПРЕДСКАЗАТЬ РЕЗУЛЬТАТЫ
СКРЕЩИВАНИЯ, ЕСЛИ ИЗВЕСТНА ЧАСТОТА КРОССИНГОВЕРА!
Если во время мейотического деления произошел крос-
синговер, то его последствия можно наблюдать и учи-
тывать по продуктам мейоза (тетрадный анализ). Для
этого наиболее удобно использовать плесневый гриб
Neurospora crassa. У гетерозигот Аа в результате мейоза
и следующего за ним митоза в каждом аске образуется
по восемь спор, различающихся по окраске: четыре окра-
шенные зрелые споры А и четыре неокрашенные незрелые
споры а. Если в профазе
мейоза не произошло крос-
синговера, расположение
спор будет ААААаааа или
ааааАААА. Если же крос-
синговер произошел, рас-
положение спор окажется
измененным в разнообраз-
ных вариантах: ААааАА
аа, ааААааАА, ААааааАА
ааААААаа, зависящих от
расхождения хроматид в
первом и втором делении
мейоза (рис. 10).
У гаплоидных организ-
мов число кроссоверных
генотипов точно соответст-
вует числу кроссоверных
спор или гамет, поэтому и
у диплоидов вполне право-
мерно судить о частоте
кроссинговера по числу
рекомбинантов в потом-
стве.
Если известны частота
кроссинговера между дву-
мя генами и какие гаметы
и в каком отношении обра-
зует гетерозигота по двум
сцепленным генам, то
можно предсказать ре-
зультаты скрещивания.
Например, установлено,
/7
а
в
8+
Рис. 10. Схема образования
аскоспор у нейроспоры:
а — сумка; б — стадия четырех нитей;
в — кроссинговер
45
что гены А и В сцеплены с показателем перекреста 20 %.
Скрещивание гомозиготных линий АВ/АВ и ab/ab в Fi
даст гетерозиготы АВ/аЬ^ которые образуют четыре типа
гамет:
АВ
гаметы родительского типа (некроссоверы) 80 %
АВ
гаметы-рекомбинанты (кроссоверы) 20 %
Составив решетку Пеннета с учетом частоты гамет
каждого типа, можно подсчитать расщепление в Fi
(табл. 5).
Таблица 5. Расщепление в F2 при наличии кроссинговера
9 Гаметы Гаметы
0,4.АВ (40 %) 0,4а6 (40 %) 0,1АЬ (10 %) 0,laB (10 %)
0,4 А В 0,16ЛВ/ЛВ 0,16АВ/аЬ 0,04AB/Ab 0fl4AB/aB
Q,4ab 0,16ЛВ/а& 0,16ab/ab 0,04ab/Ab $$4ab/aB
QAAb 0,04ЛВ/Л6 0,04Ab/ab 0,01Ab/Ab 0,0lAb/aB
Ъ,\аВ 0,04ЛВ/аВ 0,04aB/ab OfllaB/Ab 0,01 aB/aB
При суммировании фенотипически одинаковых особей
в Fz окажется 66 % Л-В-, 9 % A-bb, 9 % ааВ- и 16 % aabb.
Если гены локализованы в участках, значительно уда-
ленных друг от друга, возможны двойные и даже мно-
жественные перекресты (рис. 11). Если известна вели-
А 6 С
I //////Z/Z/Z w:
Рис. 11. Схема двойного кроссинговера
чина одиночных пере-
крестов между точка-
ми АВ и ВС, можно тео-
ретически рассчитать
частоту двойного пере-
креста, т. е. частоту од-
новременного разрыва
и обмена в обоих участ-
ках. Эта частота равна
произведению частот
одиночных перекрестов.
Однако теоретически
найденная величина
обычно выше действи-
тельной, так как разрыв
в одном участке хромо-
сомы препятствует раз-
рыву в соседних из-за
46
интерференции. Влияние интерференции падает с увели-
чением расстояния от места первого перекреста. Коэф-
фициент интерференции — это отношение действительной
частоты двойных перекрестов к теоретически ожидаемой.
Силу интерференции выражают коэффициентом коинци-
денции, или коэффициентом совпадения. Значительное
влияние на частоту кроссинговера оказывают: I) структу-
ра хромосом (в гетерохроматиновых участках, вблизи
центромера и на концах хромосом перекрест происходит
редко); 2) функциональное состояние организма; 3) фак-
торы внешней среды (температура, облучение и др.), при-
чем одни и те же агенты могут увеличивать частоту пере-
креста в участках вблизи центромера и уменьшать ее на
концах хромосом.
31. ЧТО ТАКОЕ МНОЖЕСТВЕННЫЙ КРОССИНГОВЕР!
Явление множественного кроссинговера заключается
в том, что при достаточном расстоянии между изучаемыми
генами перекрест и разрыв хромосом может происходить
несколько раз. Наличие множественного кроссинговера
затрудняет составление генетической карты хромосомы
вследствие кажущегося уменьшения расстояния между
генами.
Возьмем три сцепленных гена АВС. Частота реком-
бинаций между генами АВ и генами ВС равна 20 %. Если
на отрезке АС может происходить только один кроссин-
говер, то частота рекомбинации между локусами А и С
равна 40 %, т. е. кроссинговер на этом отрезке происхо-
дит вдвое чаще, чем на отрезках АВ и ВС. Одновременно
кроссинговер на обоих отрезках может осуществляться
с частотой, равной произведению вероятностей кроссин-
говеров на каждом из отдельных отрезков: 20/100Х
X20/100—4 %. При этом получаются гаметы АЬС и
аВс. В отношении локусов А и С данные гаметы не отли-
чаются от родительских и, следовательно, не могут быть
отобраны как рекомбинанты при непосредственном опре-
делении частоты кроссинговера между ними. Наблюдае-
мая частота кроссинговера окажется равной не 40 %,
а на 4 % меньше, т. е. 36 %.
Таким образом, частота рекомбинации между далеко
расположенными генами всегда меньше суммы проме-
жуточных частот. При непосредственном определении
частота кроссинговера между крайними генами в хромо-
соме не может превышать 50 %. Это происходит потому,
47
что одиночный кроссинговер ведет к рекомбинации, а
двойной восстанавливает родительское сочетание генов,
расположенных по обе стороны от места, где произошел
перекрест. Если происходит третий кроссинговер, то он
опять приводит к рекомбинации между внешними генами.
Четвертый кроссинговер вновь восстанавливает родитель-
ское сочетание генов. Другими словами, нечетное число
кроссинговеров приводит, а четное не приводит к реком-
бинации генов, удаленных друг от друга на расстояние,
в пределах которого возможен множественный кроссин-
говер. Такое чередование означает, что вероятность
рекомбинации между далеко стоящими генами равна
0,5, и потому частота рекомбинации не превышает 50 %.
Но если определить это расстояние по сумме частот реком-
бинации между промежуточными генами, оно может
оказаться больше 50 % и даже превышать 100 %. Так,
например, длина хромосомы бактериофага составляет
800 %, а £. coll — 2000 %.
32. КАК ОПРЕДЕЛЯЕТСЯ РАССТОЯНИЕ МЕЖДУ ГЕНОМ
И ЦЕНТРОМЕРОЙ!
Генетическим способом это можно осуществить только
на объектах с нерасходящимися продуктами мейоза.
Например, у сумчатых грибов (нейроспора, Sordaria,
Podospora) споры в аске располагаются в линейном по-
рядке и по их расположению легко определить аски, яв-
ляющиеся результатом мейоза без кроссинговера, и аски,
образовавшиеся в результате кроссинговера между
изучаемым геном и центромерой. Это так называемые
прередукционные и постредукционные аски.
У большинства аскомицетов вслед за мейозом сле-
дует дополнительное митотическое деление и образуется
Рис. 12. Образование спор без кроссинговера (прередукция):
а — скрещивание; б — зигота; s — тетрада хроматид; г — мейоз 1;
д— мейоз II; е —аск с линейным расположением спор
48
Рис. 13. Образование спор с кроссинговером между центромерой
и геном (постредукция):
а — тетрада хроматид; б—кроссинговер; в — мейоз I; г—мейоз II; д — аски
аск с 8 спорами. У гриба подоспора дополнительного де-
ления не происходит, и в аске имеются 4 споры. Случай
образования аска без кроссинговера между геном и цент-
ромерой — прередукции, т. е. редукции типов аллелей в
мейозе I, приведен на рис. 12. На рис. 13 видно располо-
жение спор в том случае, если между данным геном и
центромерой происходит кроссинговер. В зависимости
от того, между какими хроматидами происходит кроссин-
говер, могут быть получены 6 типов асков:
Лос/предущим/ше Продукционные
о • О • • О
• о • о • О
о ф • о О •
• о О • О •
2 J * 6
Процент постредукции (аски 1-4) от общего числа
жжуь есть показатель частоты кроссинговера между
центромерой и геном, а следовательно, и расстояния меж-
ду ними. Поскольку в случае постредукции кроссинговер
происходит только между 2 хроматидами из 4 (вероят-
ность кроссинговера 0,5), для определения расстояния
между геном и центромерой количество постредукцион-
ных асков умножают на 0,5. Так как возможно образо-
вание 6 типов асков (из них 4 постредукционные), мак-
симальная вероятность постредукции равна
1ООУ<±~66 %.
Ген и центромера могут считаться генетически сцеплен-
ными при расстоянии между ними менее 66X0,5=33 %.
49
33. КАК РАССЧИТАТЬ РАСЩЕПЛЕНИЕ
ОТ СКРЕЩИВАНИЯ ДИГЕТЕРОЗИГОТ ПРИ СЦЕПЛЕНИИ ГЕНОВ!
АВ
Гетерозиготадает 4 типа гамет, частота которых за-
висит от вероятности рекомбинации р между обоими ло-
кусами. Родительские (некроссоверные) гаметы обра-
о м | — п
зуются с одинаковой вероятностью, равной —т. е.
АВ = --I"—; ab= - ~р . Кроссоверные гаметы имеют
частоту, равную р/2, т. е. АЬ — р/2 и аВ — р/2.
АВ
Пример 1. В каком отношении дигибрид —& образует гаметы раз-
личных типов, если сила сцепления между генами А и В равна 40 %?
Если вероятность кроссинговера р = 0,4, то дигибрид дает следую-
щие гаметы
ЛЯ;±=£-_±^1_0,3;
аЬ:-Ц^ = ДДЫ=0,3;
ЛЬ: ^- = -^-=0,2;
аЬ:£ = Д± = 0,2.
При скрещивании двух гетерозигот —— X—г- с двумя сцеплен-
ао ао
ными генами получается расщепление:
(аЬ)=Д^-; (аВ)=
(Л&)=_^Р)г ..
Пример 2. Каким окажется расщепление в F\ от скрещивания
двух гетерозигот при расстоянии между генами А и В, равном 40 ед.
рекомбинации?
При полном доминировании в каждой паре аллелей в Fi получа
ется 4 фенотипических класса (ЛВ), (Л&), (аВ), (ab) в следующих со-
отношениях:
50
AB AB
ab X ab
9 сГ
лв-!— Сэ ег » 1 1 о* ю 1 Си КЗ I о
-1-у£ АВ & (1-р)2 АВ 4 АВ (1 — р)2 ab 4 АВ (1 — р)р АЬ 4 АВ (1— р)р аВ 4 АВ
<3 ей 1 р (1-Р)2 АВ 4 ab (1-Р)2 ab 4 ab {\—р)р АЬ 4 ab (1—Р)Р аВ 4 ab
4 Аь £ (1 -Р)Р АВ 4 АЬ (1~Р)Р ab 4 АЬ р2 _АЬ_ 4 АЬ р2 ab Т "лГ
(1~Р)Р АВ 4 аВ (1—Р)Р ab 4 аВ р2 АЬ ~4 р2 аВ 4 аВ
Значит, расщепление по фенотипу окажется сле-
дующим:
ЛВ:2 + (14~р)2 =0,59; (1)
=0,09; (2)
Л6: !~(14~р)2 =0,16; (3)
аВ:±т(14-р>2_=0,16. (4)
Ав АЬ
В случае гетерозигот -^g-X -^g-ддя вычисления соот-
ношения получаемых фенотипов выражение 1 — р в фор-
мулах (1) — (4) необходимо заменить на р. Тогда частота
фенотипов будет следующей:
АВ-.^-- АЬ:±=Р--,
а6:-£; аВ:±=±.
4 4
Для определения силы сцепления по полученному рас-
щеплению необходимо решить уравнения (1) —(4).
51
34. КОНТРОЛИРУЕТСЯ ЛИ РЕКОМБИНАЦИЯ ГЕНЕТИЧЕСКИ!
У бактерий и фагов открыт ряд генов, ответственных
за осуществление рекомбинации. У Е. colt мутации в двух
сцепленных генах гес В и rec С приводят к снижению
частоты рекомбинации примерно в 100 раз и подавлению
активности экзонуклеазы V или АТФ-зависимой ДНКазы,
хотя эти гены не контролируют ее структуру. В то же
время мутанты более чувствительны к УФ и X лучам.
При изучении реверсии генов гес В и rec С обнаружены
два гена-супрессора (sbc), мутации которых восстанав-
ливают способность клеток к рекомбинации через актива-
цию нового пути рекомбинации, так называемого пути
rec Е, и к активации экзонуклеазы VIII (ген sbc Л).
Мутации гена sbc В инактивируют экзонуклеазу I и акти-
вируют другой путь рекомбинации — rec F.
Мутации в гене sbc А у Е. coll приводят к полному
подавлению рекомбинации даже при наличии нормально
функционирующих генов гес В и rec С. Таким образом,
в клетке Е. colt существует несколько путей рекомбинации
бактериальной хромосомы.
Бактериофаги имеют собственные ферментные си-
стемы рекомбинации. У фага А выявлены гены группы
Red (гены ехо и bet, контролирующие экзонуклеазу X и бе-
лок / соответственно). Экзонуклеаза X расщепляет двой-
ную спираль ДНК, создавая моноспиральные участки.
Белок / подавляет экзонуклеазу клетки-хозяина, превра-
щая ее фенотипически в Rec ВС~~. Это важно для раз-
вития фага, так как ДНК фага X проникает в клетку fe
виде линейных молекул, а экзонуклеаза V разрушает
незамкнутые линейные молекулы ДНК.
Имеются данные о том, что на частоту рекомбинации
определенных мутаций влияет нуклеотидный состав неко-
торых участков гена. Это явление названо влиянием кон-
текста на рекомбинацию.
35. ЧТО ТАКОЕ НЕРАВНЫЙ И МИТОТИЧЕСКИЙ КРОССИНГОВЕР!
Обычно при кроссинговере происходит комплемен-
тарный обмен строго идентичными участками хроматид
гомологичных хромосом. Однако у дрозофилы, а затем
и у кукурузы был установлен факт обмена неравными
участками, т. е. неравный кроссинговер, вследствие чего
в одной из гомологичных хромосом происходила дупли-
52
кация, а в другой
локусу:
А
В А
С В
С
наблюдалась нехватка
по данному
А
А
В
А
с
Так, ген Ваг у дрозофилы, определяющий полоско-
видные глаза (с уменьшенным числом фасеток), пред-
ставляет собой дупликацию локуса гена дикого типа,
а форма ультра-Ваг представляет собой утроение дан-
ного локуса.
Кроссинговер — процесс, характерный для мейотиче-
ского деления. Однако он может встречаться и в мито-
тических делениях соматической ткани. Такой кроссин-
говер называется митотическим. Митотический кроссин-
говер может происходить между двумя несестринскими
хроматидами на стадии четырех хроматид (рис. 14).
а в
Рис. 14. Схема митотического кроссинговера:
а — без кроссинговера; б — с кроссинговером
з
В результате обмена участками хромосом генотипы обра-
зовавшихся клеток оказываются измененными: рецессивы
переходят в гомозиготное состояние и обусловлива-
ют появление участков тканей с рецессивными призна-
ками.
Так, у дрозофилы в результате митотического крос-
синговера гетерозигот ysn+/у+sn (у — ген желтой окрас-
ки тела, sn — ген опаленных щетинок, y+usn+—их
нормальные аллели) на теле особей нормального фено-
типа были обнаружены пятна желтого цвета и опален-
ных щетинок, обусловленные действием рецессивных
генов, которые перешли в гомозиготное состояние:
ysn+/ysn+ и y+sn/y+sn.
У людей радужная оболочка одного глаза может быть
темная, а другого — светлая или на темной радужной
оболочке могут быть светлые секторы. Это результат
митотического кроссинговера. Подобным образом возник-
шие пятна на зернах по окраске алейронового слоя были
обнаружены у кукурузы. Митотический кроссинговер
возможен и в половых хромосомах и в аутосомах.
36. КАК СОСТАВЛЯЮТСЯ ГЕНЕТИЧЕСКИЕ КАРТЫ ХРОМОСОМ!
Под генетическим картированием обычно понимают
определение положения какого-либо гена по отношению
к другим генам. По частоте кроссинговера находится
расстояние между сцепленными генами, что позволяет
составлять генетические карты хромосом, на которых
указаны порядок расположения генов в хромосоме и отно-
сительные расстояния их друг от друга. Возможность
подобного картирования основана на постоянстве про-
цента кроссинговера между определенными генами. Рас-
стояние между генами выражается в единицах, соответ-
ствующих 1 % кроссинговера, которые называют морга-
нидами (в честь Моргана). Если известно взаимное
расположение генов на хромосоме (их порядок и рас-
стояния между ними), то его можно изобразить схема-
тически в том или ином масштабе. При картировании
вначале необходимо определить, в какой хромосоме лока-
лизован интересующий нас в данный момент ген, т. е.
установить группу сцепления. Если у изучаемого вида
исследуется большое количество генов, то постепенно
они разбиваются на группы сцепления. Число групп сцеп-
ления соответствует гаплоидному набору хромосом.
Затем определяются взаимные расстояния между генами
54
в группе сцепления. Предположим, что изучаемый нами
мутантный ген сцеплен с полом. Для проверки этого
предположения проводятся реципрокные скрещивания
мутантной особи с нормальной. Если данный ген сцеплен
с полом, в первом поколении появятся мутантные самцы
и самки (в случае доминантной мутации) или мутант-
ными окажутся только самцы (в случае рецессивной
мутации). Подобные результаты получаются при гетеро-
гаметности мужского пола.
Обычно группы сцепления последовательно нумеру-
ются по мере их обнаружения. Так, у дрозофилы груп-
па сцепления генов Х-хромосомы определена как пер-
вая.
Для установления групп сцепления аутосом необхо-
димо иметь хотя бы по одному гену-маркеру в каждой
группе сцепления. С геном, аллельным гену-маркеру той
группы сцепления, в которой мутантный ген локализован,
будет наблюдаться полное или частичное сцепление.
С генами-маркерами остальных групп сцепления мутант-
ный ген даст независимое наследование. Если окажется,
что мутантный ген не относится ни к одной из уже извест-
ных групп сцепления, его можно отнести к новой группе,
где он будет служить уже маркером. Таким образом,
при определении групп сцепления необходимо для каж-
дого объекта получить линии с хромосомами, маркиро-
ванными известными генами.
После того, как группа сцепления будет установлена,
следует найти место локализации исследуемого гена в
хромосоме. Для этого проводится скрещивание мутант-
ной формы с нормальной и учитываются результаты
кроссинговера с другими генами, локализация которых
известна. Очевидно, частота кроссинговера будет выше
для генов, расположенных на большом расстоянии друг
от друга (так как увеличивается вероятность разрыва),
чем для генов, расположенных близко.
Так, если установлено, что между сцепленными генами
А и В частота кроссинговера 10 %, а между генами В и
С 20 %, то очевидно, что расстояние ВС в 2 раза больше,
чем АВ,
На основании данных о частоте кроссинговера и со-
ставляются генетические карты хромосом. Для чего они
составляются? Благодаря системам скрещиваний можно
создавать определенные генотипы с замещенными хромо-
сомами, несущими желательные гены, и конструиро-
55
вать новые формы организмов. Данное направление наи-
более перспективно в селекции, и ему принадлежит
будущее.
37. ЧТО ТАКОЕ ЦИТОЛОГИЧЕСКИЕ КАРТЫ ХРОМОСОМ
И КАК ОНИ СОСТАВЛЯЮТСЯ!
Если определить локализацию генов какого-либо орга-
низма непосредственно на хромосоме, то тем самым будет
создана цитологическая карта данной хромосомы. Цито-
логическая карта хромосомы, в которой можно наблю-
дать истинное расположение генов, впервые создана для
дрозофилы и кукурузы. Метод создания цитологических
карт заключается в следующем: с помощью мутагенов
индуцируют различные хромосомные перестройки —
делении, транслокации или инверсии, которые приводят
к изменению силы сцепления генов, что выявляется при
генетическом анализе. Некоторые из этих перестроек
можно определить с помощью микроскопа и установить
корреляцию между генетическими и цитологическими
данными.
Так, если определенное количество генов, принадле-
жащих к одной группе сцепления, в результате трансло-
кации окажется в другой, то можно измерить величину
транслоцированного фрагмента в световом микроскопе
и составить его цитологическую карту. В мейозе при
конъюгации с хромосомой, несущей делецию, нормальная
хромосома образует петлю напротив того места, где в
гомологичной хромосоме произошла делеция, что дает
возможность определить локализацию выпавшего фраг-
мента геном В. Фенотипически такое изменение может
проявиться в «ложном доминировании» Л CD/abcd при-
знака, обусловленного рецессивным геном Ь. После со-
поставления цитологических и генетических данных можно
сделать вывод, что ген В локализован в выпавшем фраг-
менте, положение которого в хромосоме установлено.
При составлении цитологических карт учитываются
также некоторые особенности слюнных желез личинок
насекомых. Слюнные железы насекомых достигают боль-
ших размеров без какого бы то ни было деления клеток
или ядер. При этом хромосомы клеток слюнных желез
раскручиваются и становятся длиннее хромосомы обыч-
ных клеток. Затем хромосомы многократно удваиваются,
но дочерние хромосомы не расходятся. Такое явление
называется эндомитозом. В результате образуются длин-
56
ные лентовидные хромосомы с хорошо заметными попе-
речными полосами по всей длине, т. е. политенные хромо-
сомы (рис. 15).
Полосы или дис-
ки хорошо окраши-
ваются. Поперечная
исчерченность для
каждой хромосомы
имеет характерный
вид. Число и поло-
жение дисков специ-
фично для каждой
хромосомы. Диски
служат маркерами.
С их помощью мож-
но установить харак-
тер и размеры хро-
мосомных перест-
роек, а также поло-
жение генов, сущест-
вование которых ус-
тановлено по данным
рекомбинационного
анализа. Например,
делецию, величина
которой найдена при
помощи генетическо-
Р и с. 15. Политенные хромосомы дрозо-
филы
Цифрами указаны группы сцепления
го анализа, можно
связать с исчезновением определенной полосы или группы
полос на такой гигантской хромосоме. Когда цитологи-
ческую карту сравнивают с соответствующей генетиче-
ской картой, линейный порядок расположения генов пол-
ностью совпадает, однако могут иметь место расхождения
в относительном положении (расстоянии) генов. Так,
например, вблизи центромеры гены, которые на генети-
ческой карте кажутся тесно сцепленными, на самом деле
расположены значительно дальше друг от друга. Это
несовпадение генетических и цитологических карт объяс-
няется неравномерной частотой перекреста по длине хро-
мосомы при 'кроссинговере.
Сопоставление генетических и цитологических карт
дало возможность подтвердить следующие положения
хромосомной теории наследственности:
1) хромосомы по своей длине наследственно дискретны;
57
2) каждый ген имеет определенное место (локус) в
хромосоме;
3) гены расположены в хромосоме в определенной
линейной последовательности;
4) частота кроссинговера между генами зависит от
расстояния между ними.
38. ИЗМЕНЯЕТСЯ ЛИ ДЕЙСТВИЕ ГЕНА В ЗАВИСИМОСТИ
ОТ ЕГО ПОЛОЖЕНИЯ В ХРОМОСОМЕ!
ЧТО ТАКОЕ ЭФФЕКТ ПОЛОЖЕНИЯ ГЕНА!
Проявление активности гена может зависеть от его ло-
кализации в хромосоме. Так, изменение доминантности
гена может произойти вследствие изменения располо-
жения соседних генов.
Рассмотрим пример. У дрозофилы в IV-хромосоме
имеется рецессивный ген, влияющий на жилкование
крыльев. У гомозиготы одна из жилок крыла прерыва-
ется по данному гену. В результате перекреста хромо-
сом в IV-хромосому можно внедрить небольшой участок
III-хромосомы (опыт Н. П. Дубинина) таким образом,
что он окажется расположенным по соседству с этим ре-
цессивным геном. Дрозофила, взятая для эксперимента,
несла нормальный доминантный ген и должна была иметь
нормальные, со всеми жилками крылья. Однако как только
произошел подобный обмен участками хромосом, начал
проявляться рецессивный ген и одна из жилок оказалась
прерванной. Генетический анализ показал, что никакого
изменения в самом гене не произошло. Наблюдаемое
нарушение крыла было вызвано только изменением в
окружении гена. Это явление и было названо эффектом
положения гена.
Другим характерным примером является наличие в
Ш-хромосоме дрозофилы гена Хэйри. Он рецессивен и в
гомозиготном состоянии вызывает появление дополни-
тельных щетинок. Гетерозиготы по этому гену дополни-
тельных щетинок не имеют. Если к Ш-хромосоме при-
соединяется фрагмент IV-хромосомы, ген Хэйри начинает
активно образовывать щетинки, несмотря на свою рецес-
сивность. Если с помощью кроссинговера перенести
рецессивный ген Хэйри из полученной гибридной хромо-
сомы в нормальную, он снова становится рецессивным.
Классическим примером эффекта положения гена
служит анализ наследования доминантного гена Ваг.
Этот ген, расположенный в Х-хромосоме, вызывает обра-
58
зование полосковидных глаз вместо круглых. Гомозигот-
ная самка Ваг с двумя генами Ваг имеет более узкие глаза,
чем самец, единственная Х-хромосома которого имеет
один ген Ваг. Изучение хромосом слюнных желез дрозо-
филы показало, что ген Ваг возникает в результате удвое-
ния небольшого участка хромосомы, содержащего четыре
диска. В хромосомах, несущих ген Ваг, этот участок
представлен дважды. В потомстве таких гомозиготных
самок могут возникать хромосомы, содержащие три гена
Ваг. Такие хромосомы обеспечивают появление признака
ультра-Ваг, и у дрозофилы глаза становятся гораздо уже,
чем глаза у гомозиготных самок. Гетерозиготная самка
ультра-Ваг с одной нормальной хромосомой и одной хро-
мосомой ультра-Ваг имеет столько же участков Ваг,
сколько гомозиготная самка с полосковидными глазами.
Однако у гетерозиготы глаза значительно меньше, чем
у гомозиготы. Таким образом, данный пример хорошо
иллюстрирует зависимость активности гена от его поло-
жения.
Эффект положения может быть следствием структур-
ных перестроек хромосом. По характеру проявления он
бывает доминантным, рецессивным, летальным, в неко-
торых случаях может изменять проявление количествен-
ных признаков или действовать как модификатор доми-
нантности и пенетрантности других генов. Для объяснения
эффекта положения выдвинуты две гипотезы: 1) кинети-
ческая, объясняющая данное явление нарушением локаль-
ного взаимодействия между генами и генными продук-
тами, и 2) структурная, рассматривающая эффект поло-
жения как результат физического изменения локуса,
которое приводит к изменению структуры нуклеопро-
теида.
Глава 5 . МОЛЕКУЛЯРНАЯ ГЕНЕТИКА
39. ЧТО СЛУЖИТ ДОКАЗАТЕЛЬСТВОМ ГЕНЕТИЧЕСКОЙ РОЛИ
НУКЛЕИНОВЫХ КИСЛОТ!
1. Все изученные вирусы, являющиеся авторепроду-
цирующимися системами, состоят из дезоксирибонуклео-
протеинов или рибонуклеопротеинов.
2. Чистая ДНК пневмококков штамма 7? (без капсулы)
может трансформировать штамм S (капсульный) в £
(трансформации у бактерий).
59
3. При заражении бактериальной клетки бактерио-
фагом Т2 в нее входит фаговая ДНК, а фаговый белок
останется снаружи (Херши и Чейз).
4. Инфекционным началом вируса табачной мозаики
(ВТМ) является РНК. При заражении листьев табака
смесью РНК и белка разных штаммов тип получаемого
потомства определяет РНК.
40. КАКОВ МЕХАНИЗМ РЕПЛИКАЦИИ ДНК!
Биосинтез ДНК катализируется несколькими ДНК-
полимеразами. В естественных условиях необходимы
также экзонуклеазы и ДНК-лигаза.
ДНК-по ламе раза I участвует в полимеризации дез-
оксирибонуклеозид-5-трифосфатов (фермент был открыт
в 1958 г. А. Корнбергом у Е. colt) и контролируется ге-
ном ро! А:
ДНК
tt\d АТФ d АМФ П1
n{d ТТФ днкб/ТМФ ni+2(«i+n2)p—
n2d ГТФ ГМФ п2
n2d ЦТФ Mgr d ЦМФ п2
In vivo реакция необратима, так как освобождающая-
ся пирофосфатная группа гидролизуется клеточной пиро-
фосфатазой. Для реакции необходимо присутствие четы-
рех дезоксирибонуклеозид-5'-трифосфатов и ионов Mg2+
и небольшого количества ДНК в качестве затравки.
ДНК-полимераза I катализирует присоединение отдель-
ных мононуклеотидов к З'-ОН концу цепи ДНК. Синтез
осуществляется в направлении 5'-->3':
А Ц A U,
ДНК-затравка должна иметь двойную денатурирован-
ную цепь с разрывом одной из диэфирных связей. Эта
затравка выполняет две функции — функцию затравки,
к З'-ОН концу которой присоединяются мононуклеотиды
(разорванная цепь), и матричную функцию для синтеза
комплементарной цепи (интактная цепь).
60
Наравне с ДНК-полимеразной активностью ДНК-по-
лимераза I Е, coli обладает двумя экзонуклеазными актив-
ностями: 3'->5' и 5'->3'. Различные характеристики
ДНК-полимеразы I предполагают наличие в ней сайтов:
прикрепления матрицы, прикрепления затравки, при-
крепления З'-гидроксила затравки, прикрепления дезокси-
рибонуклеотидов и, наконец, сайт 5z->3' экзонуклеазной
активности. ДНК-полимераза I не может использовать
в качестве затравки нативную ДНК. Тем не менее мутанты,
лишенные ДНК-полимеразы I, способны синтезировать
ДНК.
ДII К-no ламе раза II обладает экзонуклеазной актив-
ностью 3'->5', контролируется геном pol В. Полимераз-
ная активность
ДНД-полимераза III контролируется геном dna Е.
(Другое название этого фермента Pol III.) Активной фор-
мой ДНК-полимеразы III является димер (Pol III*). Для
активации фермента необходимо присутствие белкового
фактора — кополимеразы III (Copol III*). ДНК-полиме-
раза III обладает двумя экзонуклеазными активностями
и полимеразной активностью 5'->3'.
ДНК-лигаза катализирует фосфодиэфирную связь
между З'-ОН одной цепи ДНК и 5'-монофосфатом другой
цепи при условии, что обе эти цепи соединены с интакт-
ной комплементарной цепью. ДНК-лигаза служит для
образования кольцевой ДНК, репарации цепи ДНК,
имеющей разрыв, рекомбинации генов и репликации
ДНК.
41. КАКИЕ ФЕРМЕНТЫ КРОМЕ ПОЛИМЕРАЗЫ
И ЛИГАЗЫ УЧАСТВУЮТ В РЕПЛИКАЦИИ ДНК!
Для репликации ДНК необходимо разъединение и
раскручивание двух ее цепей ДНК. Эту роль выполняет
дерулаза, которая, двигаясь по молекуле ДНК, обеспе-
чивает продвижение вилки репликации. Освобожденные
однонитчатые зоны стабилизируются особым факто-
ром — ДНК протеин В, который защищает их от действия
дезоксирибонуклеаз. Закручивание однонитчатых участ-
ков предотвращается ферментом гиразой.
Синтезу ДНК предшествует образование праймера —
короткого участка РНК, комплементарного одной из
цепей ДНК (50—100 нуклеотидов) и служащего затрав-
кой, так как ни одна из известных ДНК-полимераз не
может синтезировать ДНК в отсутствие затравки. Этот
61
участок РНК синтезируется под контролем примазы. Ее
действие аналогично действию ДНК-зависимой РНК-по-
лимеразы. Новая цепь ДНК обычно синтезируется на-
чиная с З'-ОН конца затравки (рис. 16). Добавление
дезоксирибонуклеотидов к затравке РНК катализируется
комплексом Pol III* — Copol III*. После начала инициа-
ции Copol III* покидает комплекс и репликацию продол-
жает Pol III*. Обе цепи ДНК синтезируются в направ-
лении б'-^З' (т. е. в противоположном направлении),
Рис. 16. Схема синтеза ДНК:
а — интактная молекула ДНК; б, в — продвижение вилки репли-
кации вдоль молекулы ДНК
и на одной из цепей образуются небольшие фрагменты
от 1000 до 2000 нуклеотидов (фрагменты Оказаки). Эли-
минация РНК-затравок на 5'-концах фрагментов Оказаки
осуществляется экзонуклеазной активностью 5'->3' ДНК-
полимеразы L Место, освобожденное РНК-затравкой,
заполняется комплементарными нуклеотидами под конт-
ролем ДНК-полимеразы I.
42. ЧТО ПРОИСХОДИТ В РЕПЛИКАЦИОННОИ ВИЛКЕ!
Нити ДНК перекручены одна вокруг другой. Для обес-
печения полуконсервативной репликации обеих нитей
их необходимо раскрутить. Это раскручивание осущест-
вляется АТФазой, носящей название геликаза (кодируе-
мой геном rep Е. coll). Раскручивание нитей ДНК вызы-
вает напряжения в молекуле, что приводит к перекручи-
ванию всей молекулы вокруг оси и появлению супервитков.
Эти супервитки элиминируются белками, названными
топоизомеразами, которые способны вызывать переходя-
щие и обратимые разрывы фосфодиэфирных связей. Раз-
личают два типа топоизомераз: топоизомераза I, лишен-
62
ная АТФазной активности и вызывающая обратимые
разрывы одиночных цепей (протеин (о у £. coli)\ топо-
изомераза II, обладающая АТФазной активностью и
вызывающая разрывы двойной цепи. Примером служит
фермент топоизомеразы II, гиразы, состоящей из двух
субъединиц, одна из которых кодируется геном gyr А и
чувствительна к действию налидиксовой кислоты, а другая,
кодируемая геном gyr В,— к новобиомицину. Репликация
ДНК бактерий ингибируется обоими агентами, кроме
штаммов, получивших в результате мутации гиразу, устой-
чивую к налидиксовой кислоте и новобиомицину. Раскру-
чивание обеих цепей ДНК приводит к образованию одно-
нитчатых зон. Эти зоны должны быть стабилизированы
(предотвращение спаривания и восстановления двойной
спирали) и защищены от действия ДНКазы. Эти функции
выполняются протеином, названным DNA binding pro-
tein (ДНК-связывающий белок), который специфически
связывается с одиночными цепями ДНК. Этот комплекс
(ДНК +ДНК-связывающий белок), по-видимому, явля-
ется субстратом для ДНК-полимеразы III.
Все известные ДНК-полимеразы могут синтезировать
ДНК только в присутствии затравки, а при ее отсутствии
они не могут инициировать синтез. Синтез затравки осу-
ществляется белком-инициатором, названным примазой,
который необходим для репликации бактериальной хро-
мосомы. Имеются мутанты, термочувствительные по этому
белку (dna Gts Е, coli}. In vitro белок-инициатор катали-
зирует полирибонуклеотидную затравку, начиная с рибо-
нуклеозидтрифосфата, т. е. его активность аналогична
активности РНК-полимеразы, но отличается от нее неко-
торыми физико-химическими свойствами. Например, этот
белок нечувствителен к рифампицину (специфический
ингибитор бактериальной РНК-полимеразы). Значит,
первый рибонуклеотид неподвластен корректирующему
действию экзонуклеазы 3'->5', осуществляемой ДНК-по-
лимеразой, хотя впоследствии он все же элиминируется.
ДНК-полимераза может перемещать инициаторный белок
и использовать рибонуклеотидную затравку для синтеза
фрагмента ДНК (фрагмент Оказаки). Таким образом,
взаимное действие белка-инициатора и ДНК-полимеразы
III ведет к образованию цепи ДНК 5'->3', содержащей
на 5'-конце фрагмент РНК и ДНК, соединенную с этим
фрагментом на З'-конце ковалентной связью. Для полу-
чения готовой ДНК, во-первых, необходимо удалить рибо-
63
нуклеотидную затравку и, во-вторых, репарировать в
этом месте цепь, полимеризуя дезоксирибонуклеотидтри-
фосфаты. Удаление затравки — функция ДНК-полиме-
разы I, как и заполнение бреши в цепи путем замены
рибонуклеотидов на дезоксирибонуклеотиды. Итак, одна
цепь ДНК реплицируется непрерывно в направлении дви-
жения вилки. Синтез второй цепи осуществляется путем
образования фрагментов. Сшивка фрагментов обеспечи-
вается полинуклеотидлигазой, которая образует связь
между З'-ОН и 5'-монофосфатом (рис. 17).
----- I
m н
4---- Ш
Рис. 17. Схема репликационной вилки:
! — геликаза; 2 — топоизомераза; 3 — белок, стабилизирующий однонитчатую ДНК;
4 — ДНК-полимераза III; 5 — примаза; 6 — ДНК-полимераза I; 7 — лигаза; I - матричная
цепь; II — РНК, синтезируемая под контролем белка-инициатора; III — ДНК, синтезируе-
мая ДНК-полимеразой III; IV — ДНК, синтезируемая ДНК-полимеразой I
43. КАКОВА РОЛЬ ДНК-ПОЛИМЕРАЗЫ I В КЛЕТКЕ
ПРИ РЕПАРАЦИИ УФ ПОВРЕЖДЕНИИ!
Рис. 18. Вырезание диме-
ров тимина с помощью
ДНК-полимеразы
ДНК-полимераза I катализи-
рует удлинение полидезоксирибо-
нуклеотидных цепей в направле-
нии Субстратом служат
все четыре дезоксирибонуклеотид-
5'-трифосфаты. Мутанты Pol А Е.
сolit лишенные активности полиме-
разы I, более чувствительны к ле-
тальному действию УФ лучей, чем
дикий тип. Под действием ультра-
фиолетовых лучей ближайшие ти-
мины на одной цепи могут обра-
зовывать димеры, вызывая дефор-
мацию ДНК- Специальные
ДНКазы могут узнавать эти де-
формации и вызывать разрывы на
цепи-носителе димеров тимина
(рис. 18). На рисунке показаны
последовательные этапы выреза-
ния димеров тимина и воссоеди-
нение нитей ДНК (рис. 18, а, б):
под действием эндонуклеазы про-
64
исходит вырезание димера (рис. 18, в, г, д)\ ДНК-поли-
мераза I заполняет образовавшуюся брешь в нити
ДНК, которая сшивается с помощью лигазы (рис. 18, г,
д,е). Таким образом, ДНК-полимераза I играет важную
роль в репарации, контролируя репаративный синтез.
В случае неправильного спаривания (ошибки) этот
участок вырезается благодаря экзонуклеазной активности
3'->5', т. е. ДНК-полимераза I выполняет роль корректора
в синтезе ДНК*
44. ЧТО ОБОЗНАЧАЕТ ТЕРМИН «РЕПЛИКОН»
И ЧЕМ ОТЛИЧАЕТСЯ РЕПЛИКОН ОТ ОБЫЧНОЙ МОЛЕКУЛЫ ДНК!
Термин «репликон» введен Ф. Жакобом и С. Бреннером
для обозначения молекулы ДНК, способной к самовос-
произведению и содержащей необходимые для этого эле-
менты регуляции.
В основе представлений о репликоне лежат следующие
данные:
1) репликация ДНК не начинается в отсутствие син-
теза белка, но уже начавшаяся репликация может завер-
шиться и в его отсутствие. Следовательно, для инициа-
ции репликации необходим определенный белок, назван-
ный инициаторным;
2) фрагменты ДНК, попадающие в клетку при конъ-
югации или трансформации, не способны к автономной
репликации. Следовательно, репликон должен иметь в
своей структуре особый элемент, названный оператором
редупликации или редупликатором и опознаваемый
белком-инициатором;
3) регуляция репликации основана на позитивном
контроле, т. е. инициатор в связи с оператором редупли-
кации инициирует (дает сигнал к началу) репликацию.
45. НА ЧЕМ ОСНОВАНЬГпРЕДСТАВЛЕНИЯ О ДВУНАПРАВЛЕННОСТИ
РЕПЛИКАЦИИ БАКТЕРИАЛЬНОЙ ХРОМОСОМЫ!
У £. coll точка начала редупликации размещается
около 85 мин в районе гена ilv (изолейцин — валин). Две
вилки редупликации инициируются одновременно и дви-
гаются в противоположных направлениях, пока не встре-
тятся в точке, расположенной на 180° от точки инициации
на кольцевой хромосоме, что соответствует району около
25 мин карты. Подобный способ репликации установлен
в экспериментах, в которых бактериальные клетки лиго-
3—1740
65
генизировали одновременно двумя
бактериофагами: Л, который вклю-
чается между генами gal и Ыоу и
Ми* не имеющего конкретного сай-
та прикрепления. Определение от-
носительного количества ДНК фа-
гов Л и Afu в различные моменты
репликации бактериальной хромо-
сомы методом гибридизации
ДНК — ДНК показало, что отно-
шение ДНК Afrz/ДНК Л оказы-
вается максимальным, если про-
фаг Ми локализован слева или
справа вблизи гена ilv> и снижает-
ся в тех штаммах, в которых точка
локализации Ми сдвинута ближе к точке, расположенной
на 180° от ilv. Следовательно, в Е. coll первым удваивается
участок ДНК, включающий маркер ilv, рядом с которым
расположена точка начала редупликации, и репликация
хромосомы идет в двух противоположных направлениях
(рис. 19). Двунаправленность редупликации хромосомы
характерна для большинства организмов — бактерий,
бактериофагов, эукариотов.
46. КАКОВА РОЛЬ ФЕРМЕНТОВ РЕСТРИКЦИИ — МОДИФИКАЦИИ!
Рестрикция чувствительных молекул ДНК (не моди-
фицированных) происходит в момент их проникновения
в непермиссивные клетки. В клетках, способных к рестрик-
ции, существуют эндонуклеазы, специфичные к опреде-
ленным нуклеотидным последовательностям. Ферменты
модификации защищают собственную ДНК от действия
эндонуклеаз рестрикции. Следовательно, система рестрик-
ция — модификация служит своеобразным барьером,
охраняющим клетку от включения в ее геном чужерод-
ной ДНК-
47. ВСЕГДА ЛИ ДНК В КЛЕТКЕ СИНТЕЗИРУЕТСЯ
ПОЛУКОНСЕРВАТИВНЫМ СПОСОБОМ!
Нет, не всегда. В клетках бактерий, поврежденных
УФ лучами, происходит так называемый репаративный
синтез ДНК. Механизм этого синтеза называется полу-
консервативным. Репарация УФ повреждений имеет и
другое название — эксцизионная репарация, так как
66
связана с удалением (эксцизией) димеров тимина и заме-
щением поврежденного участка новой ДНК. Эксцизионная
репарация — многоэтапный процесс, который включает
узнавание димера; надрезание моноспирали ДНК вблизи
димера (инцизии); вырезание поврежденного участка
(эксцизии); ресинтез ДНК; восстановление непрерывно-
сти цепи ДНК- Узнавание димера тимина осуществляется
УФ-эндонуклеазой. Она же производит и инцизию одной
спирали ДНК около димера с 5'-конца поврежденной
цепи.
Вырезание димера производит УФ-экзонуклеаза, при
этом удаляется не только димер, но и несколько сосед-
них оснований. Затем происходит репаративный синтез
днк» заполняющий образовавшуюся брешь. Мутанты
Pol Л, ехг Л, rec At гее В характеризуются уменьшением
способности к репаративному синтезу. Репаративный
синтез осуществляется ДНК-полимеразой I, кодируемой
геном ро! А. и происходит в 99 % на коротких участках —
до 1500 нуклеотидов и контролируется ДНК-полиме-
разой II.
Восстановление непрерывности цепи ДНК контроли-
руется нуклеотидлигазой, кодируемой геном lig.
Система репарации УФ повреждений найдена не толь-
ко у Е. coll, но и у фага Т4, у простейших и в культуре
клеток млекопитающих.
48. ВСЕГДА ЛИ ПРИ БИОСИНТЕЗЕ БЕЛКА
МЕЖДУ НУКЛЕИНОВОЙ КИСЛОТОЙ, ХРАНИЛИЩЕМ ГЕНЕТИЧЕСКОЙ
ИНФОРМАЦИИ, И ПРОДУКТОМ-БЕЛКОМ НАБЛЮДАЕТСЯ
ТРАНСКРИПЦИЯ И ТРАНСЛЯЦИЯ!
Нет, не всегда. Бактериофаги fi и ФХ174 содержат
кольцевую одноцепочную молекулу ДНК, так называемую
«плюс»-цепь. После проникновения «плюс»-цепи ДНК во-
внутрь клетки-хозяина она превращается в двухцепоч-
ную репликативную форму в результате образования
комплементарной «минус»-цепи. Образовавшаяся репли- ‘
кативная форма служит матрицей как для транскрипции
информационных РНК, так и для репликации, в ходе
которой образуются дополнительные молекулы реплика-
тивной формы и дочерние «плюс»-цепи.
В случае РНК содержащих фагов, например /г, отсут-
ствует стадия транскрипции вообще и их генетический
материал непосредственно используется в качестве мат-
рицы для трансляции генетической информации
67
49. В ЧЕМ СУЩНОСТЬ КАТАБОЛИТНОЙ РЕПРЕССИИ!
При выращивании кишечной палочки на среде, содер-
жащей в качестве источника энергии и углерода глюкозу,
бактерии не реагируют на добавление индукторов 0-галак-
тозидазы и не образуют ферментов сбраживания лактозы.
Это явление было названо эффектом глюкозы. Экспери-
менты с мутантами, у которых прерван гликолитический
цикл (разложение глюкозы), показали, что сама по себе
глюкоза не является ингибитором, поскольку в этих экс-
периментах она оставалась в среде не тронутой. Значит,
ингибитором, ответственным за эффект глюкозы, может
быть один из продуктов расщепления, т. е. катаболит
глюкозы. Это явление получило название катаболитной
репрессии,
В клетках всех организмов обнаружен необычный
тип аденозинмонофосфата (АМФ), а именно цикличе-
ский 3'-5'-АМФ. Он образуется из АТФ под действием
аденилциклазы. Оказалось, что цАМФ играет роль вто-
рого посредника при гормональном контроле биохими-
ческих реакций в клетках эукариотов. Гормоны, секре-
тируемые эндокринными железами, являющимися первым
посредником, вызывают изменение в содержании цАМФ
путем изменения активности аденилатциклазы. Колебания
в содержании цАМФ в свою очередь вызывают измене-
ния скорости того или иного клеточного процесса. Уста-
новлено, что цАМФ может участвовать в процессах, в
которых гормоны не играют никакой роли. Клетки Е, coll
при росте на глюкозе содержат цАМФ низкой концентра-
ции, которая увеличивается при росте этих клеток на
бедных средах. Следовательно, продукт катаболизма
глюкозы подавляет образование лактозных ферментов,
снижая концентрацию цАМФ, угнетая активность аде-
нилатциклазы. Кроме того, выяснилось, что цАМФ может
обусловливать синтез катаболитных ферментов только
в комплексе с особым белком-активатором катаболизма
(БАК, англ. Сар). Чтобы РНК-полимераза смогла при-
соединиться к своему участку связывания на промоторе,
необходимо соединение комплекса БАК — цАМФ с участ-
ком связывания БАК на том же промоторе. По-видимому,
этот комплекс расплетает нити ДНК, обнажая ее матрич-
ную нить, к которой в дальнейшем прикрепляется РНК-
полимераза. Поэтому в отсутствие цАМФ (при росте на
глюкозе) РНК-полимераза не может присоединиться к
68
своему участку на промоторе и инициировать транскрип-
цию адаптивных ферментов даже в присутствии индук-
торов.
50. НАБЛЮДАЕТСЯ ЛИ СОГЛАСОВАНИЕ В РЕГУЛЯЦИИ
АКТИВНОСТИ РАЗЛИЧНЫХ ГЕНОВ У ВИРУСОВ
И БАКТЕРИЙ!
Несмотря на простую организацию прокариотов, они
имеют определенные генетические программы, благо-
даря которым в жизненном цикле происходит переклю-
чение транскрипции с одних структурных генов на другие,
например наблюдается каскадная регуляция оперонов у
фагов. В зависимости от того, какие белки необходимы
для развития фага, синтез соответствующих иРНК про-
текает сначала на «предранних» генах, затем на «ранних»
и, наконец, на «поздних» генах. Как только фаг (Т4)
«впрыснет» в клетку свою ДНК, в ней начинают синте-
зироваться ферменты, разрушающие ее собственную
ДНК, затем происходит синтез ферментов, контролирую-
щих образование фаговой ДНК, за которым следует син-
тез белков головки фага, его отростка и нитей отростка.
Последними синтезируются белки, обеспечивающие сборку
зрелых фаговых частиц, и, наконец, лизоцим, разрушаю-
щий оболочку бактерии, что обеспечивает выход наружу
фаговых частиц. При переключении транскрипции с одних
оперонов на другие определенную роль играют «анти-
репрессоры», инактивирующие репрессорные белки, бло-
кировавшие до этого транскрипцию следующего оперона.
Последовательное включение оперонов может осу-
ществляться и при транскрибировании первого из них бак-
териальной РНК-полимеразой, а последующих — РНК-
полимеразой, закодированной в предыдущем опероне.
51. КАК ИЗУЧАЮТ ЦЕПИ МЕТАБОЛИЗМА
И ИХ ГЕНЕТИЧЕСКИЕ ДЕФЕКТЫ!
При изучении метаболизма и их генетических дефек-
тов определяются 1) дефектные ферменты; 2) накапли-
вающиеся продукты метаболизма, предшествующие де-
фектному этапу; 3) метаболиты, компенсирующие дефект
метаболизма, и проводится тест на синтрофизм («сов-
местное питание»), т. е. изучается способность одних
мутантов компенсировать метаболические дефекты и сти-
мулировать размножение других мутантов в общей
69
питательной среде путем диффузии накапливающихся
метаболитов. Представим цепь метаболических реакций:
Л------> д----> с-----> D дикий тип
А------^В----->С| D мутант 3
I
накапливается С
А------С D мутант 2
I
накапливается В
Л | В С D мутант 1
4
накапливается А
При высеве мутантов 1—3 на обедненную среду в раз-
личных комбинациях можно наблюдать усиление роста
определенных мутантов (рис. 20). Следовательно, стадии
1 и 2 предшествуют стадии 3, т. е. устанавливается после-
довательность стадий: 1->2->3 Чем раньше в цепи мета-
болизма произошла мутация, тем большее количество
добавок способствует росту данного мутанта. Очевидно,
что если дефектен фермент 2, то превращение В в С бло-
кировано и метаболит В накапливается. Рост мутанта 2
может восстановиться при добавлении в среду метабо-
литов С и D, мутанта 1 — при введении метаболитов
Z), С, В.
Пример определения последовательности этапов син-
теза триптофана у сальмонеллы:
цистрон блокированный этап
накапливающийся
метаболит
антраниловая кисло-
та
антраниловая кисло-
та, индол-глицерофо-
сфат
индол-глицерофо-
сфат, индол
индол-триптофан
антраниловая
слота
ки-
индол-глицерофо-
сфат
индол и индол-гли-
церофосфат
8
С
с
компенсирующий
метаболит
антраниловая кис-
лота, индол-глице-
рофосфат, индол,
триптофан
индол-глицеро-
фосфат, индол,
триптофан
индол, триптофан
триптофан
C=DJ ,
А
В
D
а
г
DJ
Рис. 20. Тест на синтрофизм:
а мутант 3 способствует росту мутантов / н 2\ б —
мутант 3 способствует росту мутанта 2, а мутант 2 —
росту мутанта /; в — мутанты 2, 3 способствуют росту
мутанта 1
Заштрихованные участки означают рост культуры
70
Значит, последовательность этапов в синтезе трипто-
фана у сальмонеллы может выглядеть так: антраниловая
кислота индол-глицерофосфат -> индол триптофан.
52. КАКУЮ РОЛЬ ИГРАЮТ ИЗОФЕРМЕНТЫ
В РЕГУЛЯЦИИ БИОСИНТЕЗА!
У Е. colt в цепи биосинтеза лизина, треонина, метио-
нина и изолейцина один из его этапов контролируется
одновременно тремя изоферментами — аспартаткиназы
I, П, Ш (AKI, АКП, AKHI). В этой же цепи синтеза при-
нимают участие две гомосериндегидрогеназы (ГСДП,
ГСДГП). Различные конечные продукты этой развет-
вленной цепи биосинтеза контролируют активность ука-
занных ферментов путем репрессии, ретроингибирова-
ния или обоими способами:
^лизин_
х изолейцин
Аспартат Ml
MU',
метионин
-------ретроинзидйро/ание
-------репрессия
Таким образом, из приведенной схемы следует, что в раз-
ветвленной цепи биосинтеза блокирование синтеза одной
аминокислоты при увеличении ее концентрации и ретро-
ингибировании соответствующего изофермента не отра-
жается на интенсивности синтеза других аминокислот.
Некоторые организмы, например род Bacillus, имеют
только одну аспартаткиназу, и она может ретроингиби-
роваться только благодаря увеличению концентрации
лизина и треонина одновременно. Однако ретроингиби-
рование в данном случае не является общим и не затра-
гивает синтез метионина.
S3. КАКОВЫ РАЗЛИЧИЯ РЕГУЛЯЦИИ ПО ТИПУ .РЕТРОИНГИБИРОВАНИЯ
И РЕПРЕССИИ!
По типу ретроингибирования или ретроконтроля регу- •
лируются цепи анаболизма, т. е. приводящие к синтезу
тех или иных малых молекул, например аминокислот.
Конечный продукт (аминокислота) обладает способ-
71
ностью аллостерически соединяться с каким-либо фер-
ментом, контролирующим один из первых этапов цепи
синтеза данной аминокислоты. Это приводит к инакти-
вации фермента и мгновенной остановке синтеза. Напри-
мер, регуляция синтеза валина будет выглядеть следую-
щим образом:
пировиноградная кислота —валин ——
ретроингибирование
I
трансляция
I
иРНК
4
транскрипция
репрессия
оперон
В процессе репрессии синтез конечного продукта пре-
кращается при взаимодействии с геном-оператором (при
посредстве белка-репрессора), что приводит к остановке
транскрипции и трансляции, в результате чего аминокис-
лота не синтезируется. Таким образом, ретроингибиро-
вание обеспечивает более тонкий и быстрый адаптивный
ответ на изменение среды, чем репрессия.
54. КАКОВЫ ОСОБЕННОСТИ РЕГУЛЯЦИИ АКТИВНОСТИ ОПЕРОНОВ
У ЭУКАРИОТОВ!
Одной из особенностей регуляции активности оперонов
у эукариотов является то, что в них наряду с механизмами
регуляции существует и другой способ регуляции актив-
ности генов, в частности подавление в ядре, отдельной
хромосоме или в ее части многих генов. Такая групповая
репрессия осуществляется гистонами — основными бел-
ками хромосомы. Вторая особенность заключается в
том, что структурные гены эукариотов можно разделить
на три группы: 1) гены, функционирующие во всех клетках
организма (гены, контролирующие энергетический обмен
и синтез важнейших макромолекул); 2) гены, функцио-
нирующие только в тканях одного типа (синтез миозина
в мышцах); 3) гены, активные в узкоспециализирован-
ных клетках (контролирующие синтез гемоглобина в
эритроцитах, гормонов — в эндокринных железах, фиб-
роина шелка, кератина волос и др.). Третьей особенностью
является то, что в отличие от прокариотов многие иРНК
эукариотов могут длительно сохраняться и впоследствии
использоваться для трансляции.
72
55. КАКИЕ ГЕНЫ ВХОДЯТ В СОСТАВ ОПЕРОНА!
В состав оперона входят структурные гены, представ-
ляющие собой последовательность нуклеотидов, коди-
рующих структуру синтезируемых клеткой макромолекул
(полипептидов, рРНК, тРНК). Кроме этих генов, сущест-
вуют последовательности нуклеотидов, не имеющие коди-
рующих функций, но управляющие работой структурных
генов с помощью присоединения к себе различных фак-
торов. Это так называемые акцепторные или регулятор-
ные гены (промотор, оператор, аттенюатор).
56. ОТЛИЧАЮТСЯ ЛИ ОПЕРОНЫ ПРОКАРИОТИЧЕСКИХ
И ЭУКАРИОТИЧЕСКИХ ОРГАНИЗМОВ!
Принцип построения оперонов у обеих групп орга-
низмов одинаков. Однако у эукариотов иная организация
оперона. Он содержит, как правило, только один структур-
ный ген в отличие от бактерий, у которых их до десятка.
Поэтому у эукариотов широко распространена согласо-
ванная регуляция генов, принадлежащих разным оперо-
нам, пространственно разобщенным или даже находя-
щимся в разных хромосомах, примером чего является
прекращение транскрипции всех генов при сперматоге-
незе у животных. Находящиеся в ядре сперматозоида
гены совершенно неактивны. Групповое выключение одной
хромосомы наблюдается в онтогенезе самок, у которых
гены обеих Х-хромосом активны лишь на ранних стадиях
эмбриогенеза, когда решается вопрос, по какому пути
пойдет развитие — по женскому или мужскому. Дальней-
шее развитие первичных и вторичных половых признаков
регулируется половыми гормонами.
57. КАКИЕ СУЩЕСТВУЮТ ТИПЫ РЕГУЛЯЦИИ АКТИВНОСТИ
ГЕНОВ!
1. Позитивная индукция. Белок-регулятор не запре-
щает, а активирует транскрипцию. Регуляция катаболи-
ческого оперона, контролирующего синтез ферментов
арабинозы (ara-оперон), осуществляется белком-регуля-
тором, производимым геном-регулятором. Этот белок
прикрепляется к оператору и запрещает транскрипцию
структурных генов. Эффектором служит арабиноза, кото-
рая, соединяясь с регуляторным белком, лишает его
активности и способности связываться с оператором
73
(происходит индукция). Более того» комплекс регуля-
тор — арабиноза приобретает сродство к промоторной
области оперона, прикрепляется к ней и активирует струк-
турные гены. Из репрессора белок-регулятор становится
активатором. В мальтозном опероне белковый активатор,
синтезируемый геном-регулятором, активируется маль-
тозой и в этом состоянии реагирует с сайтом инициации,
что ведет к транскрипции структурных генов.
2. Позитивная репрессия. Белок-регулятор, в норме
активирующий работу оперона, может быть инактиви-
рован эффектором.
3. Негативная индукция. Белок-регулятор запрещает
транскрипцию. Например, регуляция работы структур-
ных генов /^-области осуществляется прикреплением
к оператору белка-репрессора, запрещающего его транс-
крипцию, в результате чего ингибируется инициация
транскрипции вследствие блокирования места прикреп-
ления РНК-полимеразы. Индукция вызывается тем, что
белок-репрессор, соединившись с индуктором-лактозой,
изменяет свою структуру и не может прикрепиться к
оператору (аллостерический эффект).
4. Негативная репрессия. В основе негативной репрес-
сии лежит прикрепление к оператору белка, запрещаю-
щего транскрипцию, однако если при негативной индук-
ции эффектор лишает репрессор способности прикреп-
ляться к оператору, то при негативной репрессии эффектор
передает ее неактивному репрессору. В триптофановом
опероне £. coli ген-регулятор контролирует синтез неактив-
ного репрессора, который при соединении с избытком
триптофана становится активным и прекращает синтез
триптофана.
5. Одновременный контроль транскрипции многих опе-
ронов. Этот тип контроля наблюдается у бактерий, когда
опероны, относящиеся к различным путям метаболизма;
регулируются одним белком. Например, в случае ката-
болитной репрессии наблюдается ингибирование сразу
многих катаболитных оперонов (оперонов, контролирую-
щих усвоение различных сахаров).
6. Каскадная регуляция. Наблюдается у бактерио-
фагов, когда происходит переключение транскрипции
с одних структурных генов на другие в течение жизнен-
ного цикла (предранние, затем ранние и поздние гены).
Каскадная регуляция осуществляется антирепрессорами,
активирующими транскрипцию следующего оперона.
74
58. КАКОВЫ ОСОБЕННОСТИ РЕГУЛЯЦИИ СИНТЕЗА рРНК!
Клетка обычно содержит много* рибосом, для созда-
ния которых необходимо большое количество рибосомаль-
ной РНК, что обеспечивается многократным повторе-
нием генов рРНК. Число таких повторов может состав-
лять несколько сот и даже тысяч, которые разделяются
небольшими нетранскрибируемыми участками — спенсе-
рами. Продуктом транскрипции такого гена является
крупная молекула — предшественник рРНК, которая
«одевается» белком, распадается на две неравные части,
выходящие через ядерные поры в цитоплазму, где они
участвуют в образовании большой или малой субъеди-
ницы рибосом. В ооцитах земноводных, насекомых, дву-
створчатых моллюсков, в регенерирующих тканях жи-
вотных, в выстилающем слое пыльника растений, т. е.
там, где необходимо особенно большое количество рибо-
сом, наблюдается явление амплификации генов рРНК.
При репликации генов рРНК часть их выходит из хромо-
сомы в ядерный сок и продолжает там реплицироваться
автономно по типу катящегося кольца, что приводит к
многократному увеличению этих генов. Затем в сотнях
сформированных таким образом добавочных ядрышках
происходит транскрипция и большое число молекул
рРНК выходит в цитоплазму, где используется для по-
строения рибосом. Иногда, например у дрозофилы, наблю-
дается встраивание таких автономно реплицированных
генов в хромосому и передача их следующим поколениям.
Такое явление получило название магнификации.
59. ВСЕГДА ЛИ СОБЛЮДАЕТСЯ ПРИНЦИП «ОДИН ЦИСТРОН —
ОДНА ПОЛИПЕПТИДНАЯ ЦЕПЬ»!
Нет, не всегда. При изучении генетического контроля
синтеза иммуноглобулинов у млекопитающих было вы-
яснено, что легкие и тяжелые цепи иммуноглобулинов
(L и Н) содержат постоянную (С) й вариабельную (V)
части, каждая из которых наследуется как монофактор-
ный признак. Были найдены случаи, когда у одного инди-
видуума определенная V часть находилась в комбинации
с различными С частями. Предполагается, что С и V —
участки иммуноглобулинов кодируются разными цистро-
нами, т. е. два цистрона — одна цепь иммуноглобулина.
Таким образом, указанные цистроны могут объединяться
в разных комбинациях для синтеза соответствующего
белка.
75
60. РЕПРЕССИЯ — ЭТО МЕХАНИЗМ РЕГУЛИРОВАНИЯ
НА УРОВНЕ ТРАНСКРИПЦИИ, А ВОЗМОЖНА ЛИ РЕГУЛЯЦИЯ
НА УРОВНЕ ТРАНСЛЯЦИИ!
Регуляция на уровне трансляции связана с наличием
так называемых изоакцепторных тРНК. Эти тРНК пере-
носят одну и ту же аминокислоту на рибосомы, но опо-
знают различные кодоны на иРНК, так как сами имеют
различные антикодоны. Например, две изоакцепторные
изолейциновые тРНК печени кролика включают лейцин
в различные места синтезируемой полипептидной цепи,
поскольку одна из них опознает кодон ЦУЦ, а другая
ЦУУ. Синтез аминокислоты регулируется соотношением
этих тРНК в клетке. При заражении кишечной палочки
фагом Т4 ДНК фага контролирует синтез особой нуклеазы,
разрушающей одну из лейциновых тРНК, ту, что опознает
кодон ЦУГ. Так как этот триплет практически отсутствует
В иРНК фага, синтез фаговых белков происходит нор-
мально, а синтез бактериальных белков тормозится. Опре-
деленную роль в регуляции могут играть так называемые
супрессорные тРНК, т. е. такие тРНК, которые в резуль-
тате мутации приобрели способность узнавать нонсенс-
кодоны. При наличии подобных тРНК синтез белка даже
при возникновении нонсенс-мутации происходит нор-
мально.
61. ЧТО ПОЛОЖЕНО В ОСНОВУ ПОДСЧЕТА ЧИСЛА БЕЛКОВ,
ЗАКОДИРОВАННЫХ В ГЕНОМЕ!
Подсчет числа белков основывается на сопоставлении
количества ДНК в данном геноме со средним содержа-
нием аминокислотных остатков в белке. В ядерной ДНК
Е. coli насчитывается примерно 4Х Ю6 нуклеотидных
пар или 4000 kb (килобаз, где 1 kb равен 1000 оснований
или пар оснований). Принято считать, что среднее число
аминокислот в белке составляет 330. Значит, при триплет-
ном коде для кодирования среднего по размеру белка
необходимо ЗХ 330 ~ 1000 нуклеотидов в цепи ДНК или
1000 пар нуклеотидов в двух цепях ДНК. Значит, число
различных белков, кодируемых клеткой кишечной палоч-
ки, не превышает (4Х 106): 1000= 4000.
76
62. МОГУТ ЛИ тРНК ВСТРАИВАТЬ В ПОЛИПЕПТИДНУЮ ЦЕПЬ
НЕСВОЙСТВЕННУЮ ИМ АМИНОКИСЛОТУ}
МОГУТ ЛИ тРНК «ОШИБАТЬСЯ»!
Связь тРНК с аминокислотами осуществляется под
действием аминоацил-тРНК-синтетаз, обладающих двумя
сайтами специфичности: один — узнающий аминокисло-
ту, другой — узнающий соответствующую тРНК. От спе-
цифичности зависит правильность трансляции генети-
ческой информации, так как ошибка, допущенная в период
активации аминокислоты, не может быть исправлена при
росте полипептидной цепи. Это можно наблюдать в экспе-
рименте по трансформации цистеина в аланин и последую-
щей вставке аланина на место цистеина в полипептидной
цепи. Цистеин в составе цистеинил-тРНК может быть
трансформирован реактивом никель Ранен (никель, насы-
щенный водородом) в аланин, который остается при-
соединенным к цистеиновой тРНК (tPHK“*c) и бла-
годаря комплементации антикодона тРНКцис с кодоном
на иРНК встраивается вместо цистеина:
NH2
________, I
АТФ + тРНК"*' + H2S—СН2|-СН—
цистеинил-тРНК-синтетаза [77*7—7"тт'1
—С ООН------------------------** [Н20—СН21 —
nh2
—СН—СО—тРНК^+АМФ+Р-Р,—•—Р-а-н-—-сНз —
nh2
I
—СН—СО—тРНКц"с
аланил-тРНКцис
Аланил-тРНКцис внедряется в полипептидную цепь
вместо цистеина.
63. ЧТО ТАКОЕ НЕОДНОЗНАЧНОСТЬ ТРАНСЛЯЦИИ!
Под неоднозначностью трансляции понимают, с одной
стороны, случаи, когда различные тРНК, переносящие
одну и ту же аминокислоту, встраивают ее в места на
иРНК, не соответствующие ей, т. е. каждая из этих тРНК
может узнавать более чем один триплет. С другой сто-
роны, антибиотик стрептомицин, связываясь с субчасти-
цей 30S, может вызывать ошибки трансляции. Например,
некоторые мутанты Е. coli, ауксотрофные по аргинину,
77
несущие нонсенс-мутации гена орнитинтранскарбами-
лазы, могут расти на среде без аргинина, но со стрепто-
мицином. По предположению Крика, эти случаи объясня-
ются тем, что при взаимодействии между и РНК и тРНК
на рибосоме только первые два основания обязательно
должны образовывать комплементарные пары оснований
кодона и антикодона. Третий же нуклеотид кодона может
образовать пару с более чем одним основанием анти-
кодона, что приводит к появлению необычных пар нуклео-
тидов (Г — У, И — У, И — А, где И — инозиновая кис-
лота).
На неоднозначность трансляции влияет состояние
белков S2 и S4, входящих в состав 30S рибосом. Мутации
устойчивости к стрептомицину могут нейтрализовать
неоднозначность трансляции.
М. КАКОВЫ ОСОБЕННОСТИ ГЕНОМА МИТОХОНДРИЙ!
Геном митохондрий клеток человека представлен коль-
цевой двухцепочечной ДНК, содержащей 16 569 пар осно-
ваний. Геном митохондрий дрожжевых клеток в 5 раз
длиннее и содержит 78 000 пар оснований. В геноме мито-
хондрий человека содержится информация для синтеза
двух рРНК длиной 1559 и 954 нуклеотидов соответственно
(в митохондриях дрожжей — две рРНК по 8200 и
1660 нуклеотидов), а также для синтеза 228-тРНК
(255-тРНК у дрожжей). Отмечено, что тРНКтре мито-
хондрий человека необычно коротка и имеет только 3 нук-
леотида в Т'Р петле вместо 7. Некоторые тРНК, имеющие
У в первом положении антикодона, могут считывать
4 кодона, различающиеся только третьим основанием.
Найдены 8 белков, синтезируемых митохондриями. Гены
митохондрий человека не разделены межцистронными
последовательностями, и пунктуация осуществляется
генами тРНК, а иРНК не содержит ни инициирующей
последовательности (лидера), ни какой-либо специальной
последовательности на конце. Многие из иРНК сразу
после транскрипции не имеют терминирующих кодонов,
и они появляются только в результате последующего
добавления одного или двух аденинов к УА или к У. На
каждую цепь ДНК митохондрий человека приходится
всего один промотор, и длинный предшественник иРНК
впоследствии разрывается в местах, соответствующих
тРНК- В генах митохондрий человека нет интронов, а у
дрожжей есть.
78
65. РАЗЛИЧАЮТСЯ ЛИ ПЕРИОДЫ ПОЛУЖИЗНИ иРНК
РАЗЛИЧНЫХ ОРГАНИЗМОВ!
У прокариотов период полужизни иРНК колеблется
в течение нескольких минут, а длительность существо-
вания данной иРНК не превышает нескольких десятков
минут. У эукариотов молекулы иРНК находятся в комп-
лексе с белками (рибонуклеопротеид, РНК). Продолжи-
тельность их жизни колеблется от нескольких минут до
нескольких дней, а иногда, например в покоящихся семе-
нах или спорах, она составляет месяцы и даже годы.
66. ВСЕГДА ЛИ С РИБОСОМ СХОДИТ ГОТОВЫЙ
К ДЕЙСТВИЮ БЕЛОК!
Белок, образующийся на рибосоме, часто остается
недостроенным и становится активным только в резуль-
тате так называемых посттрансляционных модификаций.
При этом отщепляется N-концевой ф-Мет или Мет; сек-
реторные белки теряют сигнальную последовательность
и получают покров из углеводов. Многие ферменты (трип-
син, химотрипсин, пепсин, инсулин) образуются в виде
неактивных более длинных предшественников, что явля-
ется самозащитой клеток от активности этих белков.
Активность других (аллостерических) белков изменяется
путем обратимого связывания с субстратом или эффек-
тором. К посттрансляционным модификациям относится
также образование конечной третичной и четвертичной
структуры белковой молекулы (образование дисульфид-
ных мостиков).
67. ЧТО ИМЕЮТ В ВИДУ. КОГДА ГОВОРЯТ О НЕМЕНДЕЛЕВСКИХ ГЕНАХ
И НЕМЕНДЕЛЕВСКОЙ НАСЛЕДСТВЕННОСТИ!
Среди систем регуляции активности оперонов найде-
ны системы, способные иметь несколько альтернативных
функциональных состояний, работающих по принципу
триггера и получивших название эпигенов. Подобный
триггер, имеющий два устойчивых альтернативных состоя-
ния, обнаружен в системе управления репликацией фага
Л, и установлено, что каждое из состояний (литическое
или лизогенное) поддерживается наличием репрессора
того или иного оперона. Переход между альтернативными
состояниями (например, выход из лизогенного состояния)
определяется или случайными событиями, или воздейст-
вием внешних факторов, активирующих или связываю-
79
щих молекулы репрессора. В случае индукции профага
к таким фактором оказывается ультрафиолет, который
стимулирует синтез протеазы гес Л, уничтожающей ре-
прессор CL Два функциональных состояния эпигена
схожи с аллелями менделевского гена с таким диагно-
стическим для эпигена различием, что он изменяет свою
функцию под действием внешних факторов или при обра-
зовании эпигетерозиготы, когда в клетку входят две ко-
пии триггера в разных состояниях. Обе копии триггера
вследствие общего пула репрессоров унифицируют свои
состояния, теряя при этом второе состояние. Таким
образом, при скрещивании эпигенов не соблюдается
важнейшее требование менделевской генетики — несме-
шиваемость наследственных факторов, и поэтому эпигены
считаются неменделевскими системами, состоящими из
менделевских генов (оперонов).
68. ЧТО ОЗНАЧАВ! «СПАСЕНИЕ ГЕНЕТИЧЕСКИХ МАРКЕРОВ»!
Спасение генетических маркеров заключается в про-
явлении активности генетических маркеров (генов) одного
из родителей в рекомбинантном потомстве, если в роди-
тельском геноме их активность не проявлялась. Например,
ts мутации в гене С1 фага X не проявляются при возвра-
щении лизогенного по такому мутанту штамма бактерий
в пермиссивные условия после его кратковременного
пребывания при рестриктивной температуре. При этом
иммунитет к суперинфекции нормальным фагом к не
восстанавливается. Создается впечатление, что пребы-
вание бактерий при рестриктивной температуре «изле-
чило» их от профага. Однако, суперинфицируя такие
штаммы генетически маркированным фагом, можно по-
казать, что дефектный фаг в них не потерян, и его гены,
в том числе Cl ts, появляются среди фагового потомства
и «спасены» при генетической рекомбинации.
69. МОЖЕТ ЛИ ОРГАНИЗМ ИЗВЛЕКАТЬ РАЗЛИЧНУЮ ИНФОРМАЦИЮ
ИЗ ОДНОГО И ТОГО ЖЕ УЧАСТКА ХРОМОСОМЫ!
У вирусов и бактериофагов открыты участки на хромо-
соме, где происходит перекрывание генов и даже отмечено
наличие гена в гене. Так, например, у фага ФХ174 ген Е на-
ходится на гене D, но считывание заключенной в них ин-
формации начинается с двух разных точек со сдвигом на
80
один нуклеотид. Опухолевый вирус SV40 имеет геном,
представленный двухцепочечной ДНК. Он использует не-
однократно информацию, содержащуюся в одной нуклео-
тидной последовательности. иРНК вируса SV40 может
подвергаться процессингу: одни и те же последователь-
ности могут входить или в интрон (не значащую часть),
или в экзон, т. е. нести смысловую нагрузку. Таким обра-
зом, при одном типе созревания про-иРНК синтез белка
на ранней иРНК терминируется в одном районе, при другом
из иРНК вырезается участок, близкий к терминирующе-
му триплету, и синтезируется белок Т, имеющий длину
в 3 раза большую, чем обычная, аминотерминальный уча-
сток которого совпадает с белком t Интроны для белка
Т частично являются экзоном для белка t. Возможно,
что в ходе онтогенеза разные режимы сплайсинга могут
чередоваться. Следовательно, имеется гибкая система,
способная извлекать разную информацию из одного и того
же участка генетического материала.
70. ЧТО ТАКОЕ СПЛАЙСИНГ И КАК ПОКАЗАТЬ ЕГО НАЛИЧИЕ!
Сплайсинг (от англ, сращивание) — это разорван-
ность в пространстве одного гена, явление, заключающее-
ся в том, что некоторые гены существуют не в виде целого
отрезка, а в виде фрагментов, распределенных вдоль ге-
нома. Сплайсинг наблюдается у аденовируса, вируса
SV40, в гемоглобиновом и овальбуминовом генах, в генах
тРНК и иРНК эукариотов. Наличие сплайсинга подтверж-
дается экспериментами по гибридизации иРНК указан-
ных генов с соответствующей ДНК. иРНК гибридизирует-
ся с участками, разбросанными вдоль всей молекулы
ДНК, тогда как расположенные между ними последова-
тельности образуют петли. Таким образом, при транскрип-
ции образуется предшественник иРНК (про-иРНК), ко-
торый затем подвергается процессингу, при этом часть
иРНК расщепляется, происходит вырезание интронов из
середины молекулы, затем присоединение к З'-концу иРНК
около 200 остатков аденина, а к 5'-концу присоединяется
особая группировка м7Г (5')M6ApN, что также характерно
и для иРНК эукариотов. Таким образом, информация
о структуре генопродукта закодирована во многих фраг-
ментах полинуклеотидной последовательности (эксонах),
разделенных вставками (интронами), которые не содер-
жат информации о его структуре. Эксон — интронная
81
структура обнаружена у подавляющего большинства
генов эукариотов и у вирусов, их поражающих. Интронов
в генах прокариотов нет. Длина интронов варьируется
в широких пределах и может быть больше длины аксонов
(например, в гене а-жоллагена белоккодирующая часть
разбита интронами на 52 эксона; ген кональбумина со-
держит 17 эксонов).
71. ЧТО ТАКОЕ ПРОЦЕССИНГ!
Клеточная РНК всегда возникает как первичный про-
дукт транскрипции, т. е. информация для ее образования
считывается с ДНК. После транскрипции РНК подверга-
ется процессингу, при котором молекула ее дробится на
короткие фрагменты, отдельные основания модифициру-
ются с помощью ферментов, а к 3'- и 5'-концам при-
соединятся дополнительные нуклеотиды. Продукт тран-
скрипции, гетерогенный по длине, называется гя-РНК
(гетерогенная ядерная, или про-РНК). Только небольшая
часть этой фракции РНК покидает ядро и связывается
в цитоплазме с полисомами, как и иРНК. Роль гя-РНК
не выяснена, возможно она служит резервуаром нуклео-
тидных последовательностей. Граница между интронами
и эксонами проходит по определенному сочетанию ну-
клеотидов (ГТ с одного конца и АГ — с другого). По-ви-
димому, эти последовательности служат сигналом для
ферментов, выкраивающих из нуклеотидных последова-
тельностей предшественника — зрелую РНК, лишенную
интронных участков.
Однако представление об интронах как об абсолютно
нефункциональной части гена неверно. Например, изуче-
ние структуры гена цитохрома в митохондрии показало,
что его интроны кодируют другие белки, работающие в
процессе созревания цитохрома Ь. Наличие интронов в ге-
не способствует нейтрализации вредных мутаций, увели-
чивает возможность рекомбинации и уменьшает вероят-
ность возникновения при рекомбинации опасных мутаций
вследствие неверной стыковки эксонов, так называемых
мутаций сдвига рамки считывания.
72. КАК ОРГАНИЗОВАН ГЕНОМ!
Геном — это совокупность генов, характерных для
гаплоидного набора хромосом данного вида организмов.
Представления о структуре генома формировались под
82
влиянием данных многочисленных экспериментов и изме-
нялись со временем. Так, в результате исследований Бидла
и Татума появилась гипотеза «один ген — один фермент».
Однако правильнее сказать «один ген — один белок или
одна полипептидная цепь», хотя и это высказывание не
полностью отражает положение, поскольку существуют
белки, которые кодируются участками, распределенными
вдоль всего генома. Молекула ДНК выполняет различные
функции. В ней имеются нуклеотидные последователь-
ности, несущие генетическую информацию о структуре бел-
ка, инициирующие и терминирующие кодоны, участки,
которые контролируют экспрессию (выражение) генов
и репликацию. Поэтому разные участки ДНК имеют раз-
личное название. Так, последовательности, несущие ин-
формацию о структуре белков, называются структурны-
ми генами. Каждый из них имеет инициирующий и тер-
минирующий кодон. К структурным генам присоединены
промотор, связывающий ДНК-зависимую РНК-полимера-
зу, и оператор, соединяющий регуляторные молекулы.
Между промотором и структурными генами найдены ко-
роткие последовательности, называемые спейсерами (раз-
деляющие последовательности). Несколько структурных
генов присоединяются к промоторно-операторной области
и образуют генетическую единицу — оперон, экспрессия
которого включается и выключается как единое целое.
Регуляторные белки — результат действия регулятор-
ных генов. В один оперон включаются гены для белков,
используемых в одном биосинтетическом цикле. Из этого
правила могут быть исключения, и гены одной биосинте-
тической цепи могут быть разбросаны по всему геному
(рис. 21).
У вирусов нуклеиновая кислота состоит почти целиком
из структурных генов. Хромосома спутника некроза табака
длиной 1200 нуклеотидов содержит только 1 структурный
ген (белок оболочки). Геном других вирусов может со-
Овласть узнавания______ирнк_______________ терминатор
полимеразы 1
в
Промотор Оператор
Структурные гены
. 21. Модель оперона
место связы-
вания фактора
Пвласть узнавания
активатора
(6АК-САМ<Р)
Р и
Промотор заканчивается стартовой точкой транскрипции, кодирующей 5'-концевое
основание (почти всегда пурин)
83
держать до 200 тысяч пар нуклеотидов и до сотни генов.
Если у самых простых вирусов транскрипция происходит
на всех генах одновременно, то у наиболее сложных
имеются определенные механизмы регуляции транскрип-
ции (гены предранние, ранние, поздние).
У бактерий ДНК, состоящая из миллионов пар нуклео-
тидов, содержит сотни генов и каждый ген представлен
в единственном числе (кроме генов рРНК и тРНК, они
представлены несколькими копиями). Геном эукариотов
организован гораздо сложнее, чем у бактерий, что объ-
ясняется как увеличением количества ДНК и числа генов,
так и возрастанием сложности системы контроля актив-
ности генов во времени и пространстве, связанной с диф-
ференциацией клеток и тканей в онтогенезе. При общем
увеличивании содержания ДНК в геноме организмов раз-
ных филогенетических рядов наблюдаются случаи откло-
нения от этого правила. Например, содержание ДНК
в геноме рыб колеблется от 14 до 35 000 по отношению
к геному человека.
Особенностью генома высших организмов является
высокая избыточность ДНК, т. е. наличие нетранскриби-
руемых участков. Это объясняется многократным повто-
рением генов, наличием большого числа регуляторных
генов и тем, что часть ДНК вообще не содержит генов.
Гены рРНК повторены многократно. Гены 28S и 18S рРНК
располагаются всегда рядом друг с другом; таких пар в
геноме животных до нескольких тысяч. Они собраны в
блоки или кластеры и находятся в прицентромерных
участках хромосом. Кроме того, в геноме эукариотов
установлена категория повторов, характеризующихся
очень высокой многократностью. Это так называемая
сателлитная ДНК, состоящая из кластеров, образованных
повторенной до 300 раз короткой последовательностью
нуклеотидных пар (5 пар у дрожжей, 6 пар у мышей).
Число таких повторов может достигать миллиона. Отсюда
доля сателлитной ДНК довольно значительна (у человека
до 10, у мыши — 12 %). Сателлитная ДНК не транскри-
бируется.
73. МОГУТ ЛИ ГЕНЫ ПЕРЕКРЫВАТЬСЯ!
В геноме фага ФХ174 ген В расположен внутри гена
Д, а Е — внутри £>. Считывание информации генов Е и D
осуществляется двумя рамками различных точек со сдви-
гом на один нуклеотид (рис. 22). Считывание гена I на-
84
чинается до того, как закончится
Считывание генов D и £, при этом
используется третья рамка считыва-
ния. У опухолевого вируса SV40
считывание информации происхо-
дит с перекрыванием генов, причем
используются обе комплементарные
цепи одновременно. Считывание пе-
рекрывающихся генов начинается
либо из одной, либо из разных точек
со сдвигом на один нуклеотид. По-
добный способ записи генетической
Рис. 22. Генетическая
карта бактериофага
ФХ174
информации имеет преимущества в силу своей эконо-
мичности. Однако подобное использование генома имеет
и недостатки. При многократном считывании нуклеотид-
ных последовательностей ошибка, возникающая при му-
тации, проявится в двух или трех белках. Как известно,
в силу вырожденности генетического кода в большинстве
случаев замена третьего основания не приводит к замет-
ным фенотипическим изменениям. При использовании же
одной нуклеотидной последовательности в разных рамках
считывания вырожденность как защитный механизм пере-
стает действовать, так как третий нуклеотид для первого
триплета является вторым нуклеотидом для второго три-
плета.
74. ИМЕЮТСЯ ЛИ ПРЯМЫЕ ДОКАЗАТЕЛЬСТВА КОЛИНЕАРНОСТИ
ГЕНА И КОДИРУЕМОГО ИМ БЕЛКА!
Порядок чередования оснований в гене обусловлива-
ет последовательность чередования аминокислотных
остатков в молекуле белка, кодируемого этим геном. Та-
кая колинеарность структуры гена и структуры контроли-
руемого им белка доказана при проведении серии скре-
щиваний, в результате которых была составлена карта
мутаций в гене 23, детерминирующем первичную струк-
туру основного белка головки фага Т4. Исследование
первичной структуры этого белка показало, что он пред-
ставляет собой простую полипептидную цепь, которая
при обработке трипсином и химотрипсином распадается
на восемь фрагментов, выделяемых с помощью электро-
фореза. В эксперименте использовались так называемые
амбер-мутанты, у которых в мутантном сайте появился
кодон АТЦ, при транскрипции превращавшийся в кодон
УАГ в молекуле иРНК. Амбер-мутации являются стоп-
сигналом (терминирующим кодоном) при синтезе белка.
85
Из бактерий, зараженных тем или иным мутантом фага,
выделялся фаговый белок (в клетки добавлялась ^-ами-
нокислота после заражения фагом так, что весь фаговый
белок, образующийся в клетке, был радиоактивным и его
было легко отделить от клеточного белка). Различные
мутанты образовывали белок, распадающийся на меньшее
число фрагментов, чем белок дикого типа. Следовательно,
чем меньше число, обычных пептидных фрагментов вы-
является у мутанта, тем короче полипептидная цепь,
образуемая им, из-за наличия терминирующего кодона.
Поскольку порядок этих нонсенс-кодонов отражается на
размерах полипептидных цепей, образующихся у соответ-
ствующего мутанта, можно сделать вывод, что порядок
кодонов и порядок аминокислот колинеарны. Наиболее
наглядно колинеарность гена и белка продемонстрирована
при сравнении локализации УФ-мутаций гена А трипто-
фансинтетазы кишечной палочки и соответствующих замен
аминокислотных остатков в ферменте. Было показано,
что расстояния между изменившимися нуклеотидами в
гене (в процессах рекомбинации) согласуются с расстоя-
ниями между изменившимися аминокислотами в поли-
пептидной цепи.
75. ЧТО ПРОИСХОДИТ С ДНК ФАГА ПРИ ЛИЗОГЕНИЗАЦИИ КЛЕТКИ!
При лизогенизации клетки происходит интеграция хро-
мосомы бактериофага с хромосомой бактерии и бактерио-
фаг переходит в состояние профага. Рассмотрим пове-
дение фага X при лизогенизации £. coll. Сайт 62 фага X
участвует в генетическом обмене с хромосомой Е. coli
в участке между генами gal и bio, названном сайтом при-
крепления фага А или сайтом atth. При этом кольцевая
вегетативная хромосома фага X разрывается между ге-
нами I и N внутри сайта интеграции и в виде линейной
структуры включается в геном бактерии. При интеграции
профага с бактериальной хромосомой происходят цикли-
ческие перестановки карты вегетативного фага Л: если на
карте вегетативного фага гены А и 7? находятся на про-
тивоположных концах карты, то на карте профага Л они
оказываются рядом. Интеграция профага с хромосомой
A h — att сШ cl сП R
t— +—Г —I 4—— 4
Рис. 23. Генетическая карта фага Л
86
c R A h
-ш—I I i i
gaP bio
Рис. 24. Последовательные ста-
дии включения профага в хромо-
сому бактерии (7—2)
бактерии сопровождается так называемой «сайт-специфи-
ческой рекомбинацией» и контролируется особым «белком
интеграции» (рис. 23, 24). Однако при лизогенизации не
все фаги интегрируются с хромосомой бактерии, например
фаг Pl £. coll остается в цитоплазме бактерии.
76. ЧЕМ ОТЛИЧАЮТСЯ ЛИЗОГЕННЫЕ КЛЕТКИ,
ОБРАЗУЮЩИЕ ОБЫЧНЫЙ ТРАНСДУЦИРУЮЩИИ ФАГ,
ОТ КЛЕТОК, ОБРАЗУЮЩИХ HFT-ЛИЗАТ!
1. Клетки, образующие трансдуцирующие частицы фа-
га X, имеют следующий состав в области прикрепления
фага:
С R A h
-----1--1---1--1--М-
gat у просраг } в io
а
При формировании 0а/+ трансдуцирующего фага К gal
происходит выщепление дефектных частиц фага X, несу-
щих бактериальный ген gal, но потерявших часть своего
генома вследствие разрыва образующейся при этом петли
в различных местах (1—4):
87
2. Клетки, образующие HFT-лизат, заражены двумя
фагами: дефектным трансдуцирующим X gal и нормаль-
ным X (фаг-помощник).
Последовательные этапы трансдукции нелизогенной
клетки Gal~ с помощью Gal+ фага X gal (1—3)-.
Образование клетки, способной дать HFT-лизат
(/-2):
Индукция двойного лизогенного штамма УФ приводит
к образованию HFT-лизата.
77. МОГУТ ЛИ ОРГАНИЗМЫ ВОСПОЛЬЗОВАТЬСЯ ЧУЖЕРОДНОЙ
ГЕНЕТИЧЕСКОЙ ИНФОРМАЦИЕЙ
ДЛЯ СИНТЕЗА ЖИЗНЕННО ВАЖНЫХ СОЕДИНЕНИЙ!
Репликация РНК-содержащих фагов (fz, MSz, 7, QP)
в бактериальной клетке контролируется РНК-репликазой,
состоящей из нескольких субъединиц, часть из которых
88
синтезируется клеткой-хозяином, а часть закодирована
в геноме фага. В случае фага Q0 РНК-репликаза содер-
жит четыре субъединицы (полипептидные цепи), три из
них закодированы в геноме Е. coli, а четвертая кодиру-
ется фаговой РНК.
78. ИЗВЕСТНО, ЧТО ИНИЦИАЦИЯ ТРАНСКРИПЦИИ ОСУЩЕСТВЛЯЕТСЯ
ПРИСОЕДИНЕНИЕМ КОМПЛЕКСА БАК — цАМФ К ПРОМОТОРУ.
ВСЕГДА ЛИ ДЛЯ ИНИЦИАЦИИ НЕОБХОДИМ ЭТОТ КОМПЛЕКС!
Нет, не всегда. В условиях азотного голодания глю-
коза не подавляет функции /шЛоперонов (опероны для
утилизации (катаболизма) гистидина), так как гистидин
служит для клетки не только источником энергии, но и
источником азота. Имеются данные, что неаденилирован-
ная форма глутамат-синтетазы может заменить комплекс
БАК — цАМФ при стимулировании транскрипции hut-
оперонов in vitro. Таким образом, белком позитивного
контроля при регулировании ftuZ-оперонов служит не спе-
циальный регуляторный белок, а фермент, участвующий
в азотном обмене клетки.
79. ЧТО ТАКОЕ АТТЕНЮАЦИЯ!
Помимо репрессии и индукции регуляция некоторых
бактериальных оперонов, участвующих в биосинтезе ами-
нокислот триптофана, гистидина, лейцина, фениланина,
осуществляется с помощью аттенюации. В этом случае
аминокислота, синтез которой контролируется ферментами
данного оперона, может регулировать свой собственный
синтез, модулируя эффективность (частоту) преждевре-
менной терминации транскрипции на уровне сигнала, рас-
положенного между промотором и первым структурным ге-
ном оперона. Терминация транскрипции происходит (в
случае триптофанового оперона) в 141-м нуклеотиде от
точки инициации frp-иРНК, в конце последовательности,
богатой гуаниловыми и цитидиловыми остатками, за кото-
рыми следует блок уридиловых остатков. Участок длиной в
30 нуклеотидов называется аттенюатором. Терминация в
аттенюаторе контролируется концентрацией триптофана в
клетке. Это установлено на фоне полной генетической дере-
прессии в культуре trpR~. При росте такой культуры
(конститутивный мутант) в избытке триптофана из 10 мо-
лекул полимеразы, начинающих транскрипцию, только
одна проходит аттенюатор и транскрибирует структурные
89
гены. При умеренном голодании по триптофану аттенюа-
тор проходит уже 25 % молекул РНК-полимеразы, т. е.
механизм аттенюации контролирует верхний предел тран-
скрипции, который может быть повышен на порядок в
условиях голодания по триптофану.
80. ЧТО ПРЕДСТАВЛЯЕТ СОБОЙ КОМПЕНСАЦИЯ ДОЗ ГЕНОВ!
У гомогаметного и гетерогаметного пола в клетке на-
блюдается различное содержание Х-хромосом, различное
количество генов, локализованных в Х-хромосоме. Такое
различие доз генов компенсируется у млекопитающих тем,
что на определенной стадии развития гомогаметных осо-
бей в их соматических клетках одна из Х-хромосом гете-
рохроматизируется и ее гены перестают транскри-
бироваться. Следовательно, у гомогаметного пола прояв-
ляется только один набор сцепленных с полом признаков и
в этом отношении оба пола оказываются в одинаковом
положении. У дрозофилы уравнение активности локализо-
ванных в Х-хромосомах самцов и самок генов достигается
иначе. Активность генов Х-хромосомы у самцов вдвое вы-
ше, чем у самок. Это явление получило название компен-
сации доз генов. При дозовой компенсации у дрозофилы
активность Х-хромосомных генов контролируется генами,
лежащими в аутосомах, причем активирующий фактор
влияет на работу всех генов Х-хромосомы. Если в резуль-
тате транслокации Х-хромосомный ген перемещен в
аутосому, он, как и прежде, остается под контролем
этого активирующего фактора у самцов, но аутосомные
гены, перенесенные в Х-хромосому, не приобретают способ-
ности к такой активации.
81. КАК МОЖНО ОБЪЯСНИТЬ СЛУЧАИ ВНУТРИГЕННОЙ
КОМПЛЕМЕНТАЦИИ!
При картировании ts (температурочувствительных) и
амбер-мутаций фага Т4 было обнаружено, что некоторые
^-мутации в зависимости от их положения на генетиче-
ской карте и результатов функционального цис-транс-
теста с тесно сцепленными амбер-мутациями должны отно-
ситься к одному и тому же гену, но тем не менее в цис-
транс-тесте они дают комплементацию. Такие же случаи
внутригенной комплементации были обнаружены в гено-
мах бактерий и других организмов. Внутригенную компле-.
90
ментацию можно объяснить на основе представлений о
четвертичной структуре белка. Многие белки выполняют
свою функцию только тогда, когда они организованы в
виде четвертичной структуры, т. е. состоят из нескольких
полипептидных цепей. Например, фермент р-галактозида-
за представляет собой агрегат из четырех идентичных
полипептидных цепей. Рассмотрим /5-мутацию гена, детер-
минирующего подобный белок. Мутантный фенотип is мо-
жет быть следствием замены аминокислоты в полипеп-
тидной цепи. В результате замены интервал температур,
в котором данный белок может принимать активную чет-
вертичную структуру, оказывается суженным, т. е. при
пермиссивной температуре 25 °С такой белок сохраняет
свою активность, а при 42 °C он денатурируется. Пред-
положим, что в одной клетке присутствуют две копии гена,
детерминирующего данный белок. Как и в цис-транс-тесте,
эти копии несут разные /5-мутации. Тогда должны возни-
кнуть гибридные агрегаты мутантного белка, часть поли-
пептидных цепей которого синтезирована под контролем
одного гена, а часть — под контролем другого /5-мутант -
ного гена. В результате температурный интервал, в ко-
тором образуется физиологически активная структура, мо-
жет быть шире. Значит, две мутации одного гена могут
быть взаимно скомпенсированы.
82. КАК ОСУЩЕСТВЛЯЕТСЯ ГЕТЕРОДУПЛЕКСНОЕ КАРТИРОВАНИЕ!
Два образца ДНК (два разных, но близких генома)
смешивают, расплавляют, а затем проводят ренатура-
цию образовавшейся одноцепочечной ДНК. Среди ренату-
рированных молекул ДНК могут оказаться и такие струк-
туры, в которых отдельные участки ДНК не будут связаны
с комплементарными им цепями. Такие участки под элек-
тронным микроскопом имеют вид одноцепочечных петель.
Можно измерить и установить их длину и положение по
отношению к остальному геному. Гетеродуплексное кар-
тирование может проводиться и при добавлении к ДНК
соответствующей иРНК. Гибриды ДНК/РНК часто
оказываются даже стабильнее, чем гибриды ДНК/ДНК.
Картирование ведется также по локализации одноце-
почечных петель.
91
83. ВОЗМОЖНО ЛИ КАРТИРОВАНИЕ ТОНКОЙ СТРУКТУРЫ ГЕНА У
ВЫСШИХ ЭУКАРИОТОВ!
Картирование тонкой структуры гена у высших эука-
риотов выполнялось на дрозофиле, вследствие легкости
культивирования мух и малой продолжительности их гене-
рации. Детально исследован цистрон rosy (ту) — структур-
ный ген, ответственный за синтез ксантиндегидрогеназы
(КДГ). Мухи, не имеющие этого фермента в активной
форме (нуль-активные мутанты), легко определяются по
красновато-коричневому цвету глаз, возникающему из-за
отсутствия пигмента изоксантоптерина. Личинки, у кото-
рых отсутствует КДГ, чувствительны к действию пурина,
добавляемого в корм. Таким образом, использование
корма с пурином может служить методом выделения
редких рекомбинантов дикого типа при скрещивании
носителей различных КДГ нуль-гетероаллелей. Самки,
гетерозиготные по двум гетероаллелям rosy (ryx/ryy),
скрещиваются с самцами, гетерозиготными по двум дру-
гим гетероаллелям этого гена {rtf /rtf*). Поскольку у
самцов дрозофилы рекомбинация не наблюдается, то ге-
терозиготы дикого типа могут появляться в потомст-
ве лишь вследствие рекомбинации между гух и гуу и
обладать одним из двух возможных генотипов: гу+/гуА
или гу+ /гув, активность КДГ которых обеспечивает их
устойчивость к пурину. Часть потомства, гетерозиготная
по гетероаллелям rosy, погибает от пурина. Подсчитывая
частоту возникающих гетерозигот дикого фенотипа,
устойчивых к пурину, можно установить частоту реком-
бинаций и определить взаимное положение мутаций
внутри гена. Разрешающая способность генетического
анализа на основе описанного эксперимента сравнима с
достижимой разрешающей способностью в генетике фа-
гов и микроорганизмов.
84. ЧТО ТАКОЕ ПАЛИНДРОМ!
Палиндром, или палиндромная последовательность,
представляет собой обращенный повтор, т. е. нуклеотид-
ные последовательности замыкаются сами на себе и обра-
зуют структуры, похожие на шпильки. Они обладают
вращательной симметрией второго порядка и потому в
обоих направлениях читаются одинаково. Широко рас-
пространены короткие палиндромы, представляющие со-
бой области узнавания для рестриктаз и многих регулятор-
ных белков.
92
85. ИЗВЕСТНЫ ВЕЩЕСТВА — ИНДУКТОРЫ И РЕПРЕССОРЫ
АКТИВНОСТИ ГЕНОВ, А МОЖЕТ ЛИ ОДИН И ТОТ ЖЕ ПРОДУКТ БЫТЬ
ОДНОВРЕМЕННО И ИНДУКТОРОМ, И РЕПРЕССОРОМ!
Интересен в этом отношении репрессор фага X, детер-
минируемый геном С19 обусловливающий возможность
поддержания лизогенного состояния бактерии и ее имму-
нитет к экзогенному суперинфицирующему фагу. Моле-
кулы репрессора имеют сродство к промоторно-оператор-
ной области фага PrOr, состоящей из трех тандемно
повторяющихся участков связывания репрессора. При
ограниченном количестве репрессора фага А он соединяет-
ся только с крайним правым участком связывания и ана-
логично комплексу БАК — цАМФ в области 1асР стимули-
рует транскрипцию. Однако когда на каждую молекулу
профага количество молекул репрессора достигает трех и
больше, он начинает связываться со всеми тремя участка-
ми связывания и в крайнем левом участке связывания
действие репрессора фага А напоминает действие 1ас-
репрессора в локусе 1асО — он подавляет транскрипцию.
Такая двойственная функция репрессора А позволяет
ему индуцировать свой собственный синтез, когда его
концентрация мала, и подавлять собственный синтез, ко-
гда его концентрация высока.
86. ЧТО ТАКОЕ СУПРЕССОРНЫЕ тРНК!
Супрессорные тРНК — тРНК, антикодон которых в
результате мутации получил возможность узнавать тот или
иной нонсенс-кодон на иРНК и считывать его как знача-
щий. Иногда в супрессорной тРНК антикодон остается без
изменений. Например, в супрессорной тРНК45" антикодон
(АЦЦ) не изменен, но имеется замена нуклеотида в
положении 24, удаленном от антикодона на 1 нм. Очевид-
но, в результате этой замены четвертичная структура
тРНК так изменилась, что антикодон способен узнавать не
только кодон УГГ (триптофан), но и терминирующий ко-
дон У ГА.
87. ОПЕРОНЫ ЧАСТО ОТЛИЧАЮТСЯ ЧИСЛОМ СТРУКТУРНЫХ ГЕНОВ.
А МОГУТ ЛИ ОНИ ОТЛИЧАТЬСЯ ЧИСЛОМ ОПЕРАТОРОВ!
Да, могут. У дрожжей синтез фермента мелезитазы
индуцируется пятью сахарами — мелезитозой, мальтозой,
сахарозой, туранозой и метил-/)-глюкопиранозидом, кото-
93
рые служат субстратами для этого фермента. Оперон, кон-
тролирующий синтез мелезитазы, имеет сложный опера-
тор, состоящий из пяти сегментов, каждый из которых
взаимодействует со специфическим для него регулятор-
ным белком. Регуляторные белки, связываясь с сахарами,
действуют в данном случае по типу позитивной индукции.
Мутации различных операторов этого оперона, приводя-
щие к полной или частичной утрате способности к индук-
ции синтеза, бывают пяти типов. Они делают невозмож-
ной индукцию мелезитазы 1) мелезитозой; 2) мелезитозой
и метил-Д-глюкопиранозидом; 3) мелезитозой, метил-£>-
глюкопиранозидом, сахарозой; 4) мелезитозой, метил-О-
глюкопиранозидом, сахарозой и мальтозой; 5) всеми
пятью сахарами.
88. ИМЕЕТ ЛИ ПРИНЦИПИАЛЬНОЕ ЗНАЧЕНИЕ ТОТ ФАКТ,
ЧТО НАЧАЛО РЕПЛИКАЦИИ ХРОМОСОМЫ Е. coli ПРОИСХОДИТ
СО СТРОГО ОПРЕДЕЛЕННОЙ ТОЧКИ (САЙТА ИНИЦИАЦИИ
РЕПЛИКАЦИИ), А НЕ С ЛЮБОЙ ТОЧКИ ХРОМОСОМЫ!
Бактериальные клетки, растущие в различных средах,
где в качестве источника углерода и энергии использует-
ся какое-либо соединение углерода (глюкоза, глицерин,
пролин), имеют различный период генерации (время де-
ления клетки). Чем богаче и питательнее среда, тем
короче время генерации и тем больше белка на один
геном содержит клетка. Исследования показывают, что
скорость, с которой происходит транскрипция и трансля-
ция рибосомных РНК и рибосомных белков, изменяется
обратно пропорционально квадрату времени генерации.
Например, при росте в питательном бульоне рибосомные
гены выражаются в 122= 144 раза быстрее, чем при росте в
пролиновой синтетической среде, где время генерации
больше в 12 раз. Поскольку скорость роста полипептид-
ной цепи в клетке равна примерно 15 аминокислотным
остаткам в секунду в любой среде, значит, в более бога-
той питательной среде клетка содержит больше рибосом,
чем в бедных средах. Наращивание относительно боль-
шого числа рибосом достигается тем, что весь набор
генов, кодирующих 32 белка 50S субчастиц рибосом (ге-
ны rpl) и 21 белок 30S субчастицы (гены rps), располо-
жен на хромосоме £. coll между 72 и 88 мин по обе сто-
роны от сайта начала репликации, расположенного около
83 мин. При быстро следующих друг за другом клеточ-
ных делениях, когда новая репликация хромосомы на-
94
чинается до окончания предыдущей репликации, в клетке
наблюдается увеличение числа проксимальных генов, к ко-
торым относятся и рибосомные гены.
89. ВСЕГДА ЛИ ПОСТОЯННО ЧИСЛО ГЕНОВ У ВЫСШИХ ОРГАНИЗМОВ
МОГУТ ЛИ ОТДЕЛЬНЫЕ ГЕНЫ В КЛЕТКАХ ВЫСШИХ ОРГАНИЗМОВ
РЕПЛИЦИРОВАТЬСЯ НЕЗАВИСИМО ОТ ОСТАЛЬНОГО ГЕНОМА!
При репликации у высших организмов наблюдаются
случаи избирательного умножения отдельных частей гено-
ма. Подобный тип репликации генов рРНК, когда часть
их выходит из хромосомы в ядерный сок, располагается
вблизи ядерной мембраны и автономно там реплицируется.
Это явление получило название амплификации генов.
После транскрипции большое количество молекул рРНК
поступает в цитоплазму и используется при образовании
рибосом. Амплификация наблюдается в ооцитах земно-
водных, насекомых, моллюсков, в выстилающем слое
пыльника растений.
У дрозофилы открыто явление автономной реплика-
ции рРНК генов с последующим встраиванием их копий
в хромосому, которое называется магнификацией.
90. КАКИМ ОБРАЗОМ РАСШИФРОВЫВАЮТСЯ КОДОНЫ
С ПОМОЩЬЮ ИСКУССТВЕННОЙ иРНК!
Расшифровка кодонов, состоящих из одинаковых ну-
клеотидов, не представляет трудностей, так как на основе
подобных гомополимеров можно синтезировать только со-
ответствующие белковые гомополимеры:
УУУУУУУУУ ---------> полифенилаланин
полиурацил
ААААААААА----------> полилизин
„ полиаденин
ГГГГГГГГГ ---------> полиглутаминовая кислота
полигуанин
цццццщщц----------—> полипролин
полицитозин
Если полимер, служащий в качестве иРНК, состоит из
нескольких различных нуклеотидов, то расшифровка
усложняется. Для расшифровки кодонов в первую очередь
необходимо знать точное соотношение нуклеотидов в по-
лимере, например А/У—3/2; Ц/Г=1/4 и т. д. Зная
относительную частоту различных нуклеотидов, можно вы-
числить вероятность того или иного триплета в такой
95
искусственной синтезированной иРНК- Например, соотно-
шение У и Ц в иРНК 2:1. Значит, вероятность образования
триплета УУЦ равна 2/3X2/3X1/3=4/27. Такова ве-
роятность образования и двух других триплетов, содер-
жащих 2У + 1Ц (УЦУ, ЦУУ). Следовательно, вероят-
ность образования всех возможных триплетов в реакцион-
ной смеси, содержащей 2У+1Ц, равна:
2У1Ц УУЦ УЦУ ЦУУ (2/3 X 2/3 X1/3) X 3 = 4/27 ХЗ = 12/27
2Ц1У ЦЦУ ЦУЦ УЦЦ (1/ЗХ1/ЗХ2/3)ХЗ=2/27ХЗ=6/27
ЗУ УУУ (2/3 X 2/3 X 2/3) X 1 = 8/27 X 1 = 8/27
зц ццц (1/3 X 1/3 X 1/3) X 1 = 1/27 X 1 = 1/27
Сравнение относительной частоты триплетов различ-
ного состава с частотой аминокислот, включаемых в по-
лимер под контролем этого полинуклеотида, позволяет
расшифровать триплеты по совпадению частот.
91. В ЧЕМ СУЩНОСТЬ ДОМИНИРОВАНИЯ И РЕЦЕССИВНОСТИ!
Для проявления доминирования одного аллеля над
другим необходимы следующие условия: доминантный ал-
лель должен обеспечивать в достаточных количествах
синтез молекул, определяющих специфичность действия
гена, а рецессивный аллель — синтез молекул, неактив-
ных относительно данной функции и не вступающих в
конкурентные отношения с активными молекулами ни в
одной из реакций, в которой те участвуют. Эти условия
часто реализуются в биохимических мутантах. Боль-
шинство мутаций, затрагивающих структурные гены, фер-
ментов метаболизма приводят к появлению аллелей,
полностью лишенных активности. Они контролируют син-
тез полипептидов с измененной структурой и неактив-
ных полипептидов таким образом, что их присутствие
в клетке не влияет на функционирование нормальных
ферментов.
Доминантный аллель — это чаще всего наиболее рас-
пространенный аллель среди особей данного вида в естест-
венных условиях (дикий тип). Рецессивный аллель — про-
дукт более или менее недавней мутации. Как правило,
он элиминируется естественным отбором и может сохра-
няться только в искусственных популяциях. Например, у
96
дрозофилы сотни мутантных аллелей поддерживаются в
генетических лабораториях. Подавляющее большинство
их полностью рецессивны по отношению к дикому ал-
лелю. Очень часто у высших организмов рецессивные
аллели в гомозиготном состоянии детальны, а в присут-
ствии одного доминантного аллеля в гетерозиготе обеспе-
чивают нормальное развитие организма. Однако необходи-
мо отметить, что доминирование редко бывает абсолют-
ным. Гетерозигота может быть внешне похожа на йикий
тип, но при тщательном анализе удается выявить и не-
значительные различия. Например, гладкие гетерозигот-
ные семена гороха, сходные по фенотипу с гомозиготны-
ми, имеют микроскопические различия в структуре зерен
крахмала. В данном случае у гетерозигот концентрация
фермента, осуществляющего полимеризацию мальтозы,
слишком мала, чтобы обеспечить образование правильных
зерен крахмала.
92. ЧТО ТАКОЕ ГЕНЕТИЧЕСКАЯ ИНЖЕНЕРИЯ!
Общепринятого определения генетической инженерии
не существует. Понятия «генная» и «генетическая» ин-
женерия часто используются как синонимы, хотя послед-
нее является более широким понятием и включает опери-
рование не только генами, но и более крупными частями
генома. Генетическая инженерия в отличие от ранее
применявшихся методов изменения генотипа позволяет
конструировать функционально активные генетические
структуры in vitro без классического скрещивания. Генети-
ческая инженерия появилась в начале 70-х годов, ког-
да Бергом была получена in vitro первая рекомби-
нантная молекула ДНК путем объединения линейных
фрагментов ДНК с помощью искусственных «липких»
концов. В этих экспериментах был объединен генети-
ческий материал из трех источников: генома онкоген-
ного вируса обезьян SV40, части генома бактериофага
к и генов галактозного оперона кишечной палочки. С по-
мощью методов генетической инженерии удалось заста-
вить бактериальную клетку производить животный гормон
соматостатин. В клетках кишечной палочки осуществлен
синтез ряда белков и гормонов человека — инсулина, ин-
терферонов, гормона роста, альбумина и т. д. В СССР в
лабораториях Ю. А. Овчинникова, А. А. Баева, М. Н. Ко-
лосова, Е. Д. Свердлова осуществлена экспрессия таких
4—1740
97
генов человека, как лейцин-экефалин, лейкоцитарный ин-
терферон, брадикинин, соматотропин. Бактериальные
штаммы, продуцирующие вещества, активные в организме
человека, могут использоваться для промышленного
производства лекарственных препаратов.
Генетическая инженерия открыла путь для производст-
ва продуктов белковой природы путем введения в клетки
микроорганизмов искусственно синтезированных коди-
рующих их генов, где они могут экспрессироваться в сос-
таве гибридных молекул. Метод химического синтеза
генов обеспечил возможность получения штаммов бакте-
рий — продуцентов инсулина человека. Ген инсулина син-
тезировался в виде более 40 шестичленных олигонуклеоти-
дов, которые затем объединялись в единую структуру с
помощью ДНК-лигазы. Полученные двухцепочечные поли-
нуклеотиды были встроены в плазмидные векторы вместе
с регуляторными участками ДНК, обеспечивающими экс-
прессию гибридных молекул. Клонированные гены кодиро-
вали синтез проинсулина, который легко химически пре-
вратить в активный инсулин, включающий две цепи А и В
из 21 и 30 аминокислотных остатков.
В генетической инженерии используется также способ
искусственного получения генов, основанный на их фер-
ментативном синтезе с помощью механизма обратной
транскрипции. Для этого применяется РНК-зависимая
ДНК-полимераза или обратная транскриптаза — фер-
мент, обнаруженный при исследовании репликации РНК
онкогенных вирусов. Этот фермент способен строить ДНК-
копии на различных матрицах РНК, включая и искус-
ственно синтезированные. Другими словами, с помощью
обратной транскриптазы, или ревертазы, можно синтези-
ровать любой ген при наличии соответствующих иРНК-
Этот принцип использовался для получения и клонирова-
ния генов интерферона человека в бактериях. Выде-
ленный из клеток бактерий интерферон очень близок
интерферону, находящемуся в крови доноров. За счет вве-
дения в векторную плазмиду сигнальных последователь-
ностей, инициирующих синтез иРНК и белка, удалось
получить бактерии, синтезирующие до 5 мг интерферона
на 1 л суспензии бактерий. Это в 5000 раз больше, чем
в 1 л крови донора.
С помощью генетической инженерии можно исследо-
вать строение различных геномов, отдельных генов и коди-
руемых ими продуктов. Она позволила раскрыть экзон-
98
интронную организацию эукариотических генов, выяснить
роль мигрирующих генетических элементов, открыла но-
вые возможности для изучения молекулярных основ онто-
генеза, наследственных заболеваний, эволюционного
происхождения различных организмов. Огромные воз-
можности перед генетической инженерией открываются в
связи с созданием банков генов. Получение банков ге-
нов заключается в выделении ДНК данного организма,
фрагментации ее с помощью рестриктаз, присоединении
фрагментов к векторным молекулам (плазмидам или фа-
гам) и введении рекомбинантных ДНК в реципиентные
бактерии. Это позволяет иметь набор клонов бактерий
или фагов, различающихся по включенным фрагментам
ДНК- В случае необходимости с помощью специально
разработанных методов исследователь может выбрать
нужный ген из такого банка. Создан банк генов дрозо-
филы в клетках кишечной палочки. Создается банк ге-
нов человека, что откроет перспективы для генотерапии
наследственных заболеваний человека.
93. ЧТО ТАКОЕ БИОТЕХНОЛОГИЯ!
Биотехнология — промышленное получение важных в
народном хозяйстве продуктов с помощью микроорганиз-
мов и клеток животных и растений.
Термин «биотехнология» получил распространение в
середине 70-х годов XX в., хотя такие отрасли биотех-
нологии, как хлебопечение, виноделие, пивоварение, сыро-
варение, основанные на применении микроорганизмов, из-
вестны с незапамятных времен. Последние достижения
биологии, и в частности генетики, создали огромные до-
полнительные возможности для развития биотехнологии.
На основе деятельности микроорганизмов начали при-
меняться новые способы получения белка из парафинов
нефти, метилового и этилового спирта из природного га-
за, липидов, используемых в мыловарении, что позволяет
сохранять липиды животного происхождения. Развитие
генетической и клеточной инженерии позволяет получать
ранее недоступные препараты, применяемые в медицине:
интерферон, инсулин, некоторые антибиотики и орга-
нические кислоты.
Культура клеток и тканей пока еще используется не-
достаточно, но и здесь есть определенные достижения.
Так, продукты, получаемые из культуры клеток женьшеня,
99
применяются в парфюмерной промышленности: в произ-
водстве кремов, лосьонов, шампуней.
Разработана технология производства пищевых лиза-
тов — высококачественных пищевых продуктов для
вскармливания молодняка животных, прудовой рыбы. Гид-
ролиз лактозы молочной сыворотки делает возмож-
ным ее усвоение пекарскими дрожжами, благодаря чему
в хлебобулочном производстве достигается значительная
экономия сахара.
К достижениям новейшей биотехнологии можно от-
нести применение иммобилизованных ферментов, получе-
ние синтетических вакцин, использование клеточной тех-
нологии в племенном деле на животноводческих комплек-
сах и др., Широкое распространение получили гибридомы и
продуцируемые ими моноклональные антитела, используе-
мые в качестве уникальных реагентов, диагностических и
лечебных препаратов.
Таким образом, биотехнология тесно связана с наукой,
техникой, сельским хозяйством, медициной и вносит опре-
деленный вклад в их развитие.
94. КАКОВЫ ОБЩИЕ СВОЙСТВА ГЕНЕТИЧЕСКОГО МАТЕРИАЛА!
Генетический материал обладает следующими уни-
версальными свойствами: дискретностью, непрерыв-
ностью, линейностью и относительной стабильностью.
Дискретность — это существование гена того или иного
признака и аллелей этого гена, множества генов, соответ-
ствующих группе сцепления (хромосоме), и множества
групп сцепления, соответствующих геному.
Непрерывность проявляется в существовании мно-
жества генов, сцепленных между собой, различных типах
эффекта положения гена при хромосомных перестрой-
ках, а также в существовании полярных и регуляторных
мутаций в оперонах.
Линейность проявляется в определенной последова-
тельности генов в группе сцепления.
Относительная стабильность — это способность гене-
тического материала к конвариантной редупликации.
95. КАК ПРОИСХОДИЛА ЭВОЛЮЦИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА!
Первые примитивные клеткоподобные организмы по-
явились три миллиарда лет назад; два миллиарда лет
назад появились бактерии, синезеленые водоросли; древ-
100
нейшие эукариоты (зеленые водоросли и примитивные
грибы) возникли примерно полтора миллиарда лет назад,
а многоклеточные — около миллиарда лет назад. В тече-
ние этих громадных промежутков времени эволюция гене-
тического материала шла по пути развития более эко-
номного способа передачи генетической информации и точ-
ного ее копирования. Химическая эволюция заключалась
в передаче функции хранения и переноса информации от
одноцепочечной РНК к двухцепочечной ДНК и затем к
ДНП (дезоксирибонуклеопротеидам), что повышало на-
дежность, стабильность генетической системы, обеспе-
чивало наиболее экономный способ регуляции. На уровне
хромосом большое значение получили в эволюции хромо-
сомные перестройки (транслокации, инверсии и дуплика-
ции) и так называемые робертсоновские слияния и дис-
социации, когда, например, две акроцентрические хромо-
сомы давали одну метацентрическую или наоборот. Эти и
другие типы мутаций наряду с гибридизацией привели к
появлению новых кариотипов. Существует мнение,
что эволюция канализована, т. е. это не случайный, а
оптимизированный процесс. Общей закономерностью эво-
люции генетического материала можно считать следую-
щие явления: уменьшение числа хромосом (до оптималь-
ного уровня плоидности), уменьшение числа акроцентри-
ческих и увеличение числа метацентрических хромосом,
увеличение количества повторов в ДНК, появление зна-
чительного количества участков, не несущих генетической
информации (гетерохроматина).
96. КАКИЕ ВОПРОСЫ РЕШАЕТ БИОХИМИЧЕСКАЯ ГЕНЕТИКА!
Основное внимание уделяется механизмам наследо-
вания и проявления функции гена, связям между после-
довательностью нуклеотидов в ДНК и соответствующей
последовательностью аминокислот в белке; образованию и
свойствам нормальных и анормальных ферментов и их
влиянию на организм. Например, установлено, что фенил-
кетонурия у человека является результатом потери способ-
ности к синтезу фермента, превращающего фенилаланин,
который в норме непрерывно образуется при распаде тка-
невых белков и при переваривании пищи, в тирозин.
Фенилаланин накапливается в организме и вызывает раз-
личные вторичные биохимические нарушения. Пути обме-
на фенилаланина изучены достаточно хорошо. У больных
101
фенилкетонурией обычно встречается резко выраженная
умственная отсталость. Лечение фенилкетонурии сводится
главным образом к ограничению фенилаланина в рационе.
Диета должна начинаться как можно раньше, так как
наиболее серьезные поражения мозга происходят, по-ви-
димому, в первые несколько месяцев после рождения.
Выявить заболевание легко по анализу мочи новорожден-
ных. Установлено, что большинство врожденных наруше-
ний обмена веществ наследуется по рецессивному типу,
поэтому индивидуумы с типичными метаболическими и
клиническими проявлениями заболевания обычно гомо-
зиготны по аномальному гену. Гетерозиготы, у которых
есть один нормальный и один измененный аллель, обычно
вполне здоровы, хотя средний уровень ферментативной
активности у них ниже, чем у гомозигот по нормаль-
ному гену, причем всегда имеют место значительные
отклонения в обе стороны от средней величины.
Исследование путей метаболизма, генетики многих
болезней позволяет разрабатывать методы лечения и
предотвращения этих недугов.
97. ЧТО ОЗНАЧАЮТ РАЗЛИЧНЫЕ НАЗВАНИЯ ГЕНОВ — ПСЕВДОГЕНЫ,
УНИКАЛЬНЫЕ, ПОВТОРЯЮЩИЕСЯ, ПРЫГАЮЩИЕ И Г. Д.!
Псевдогены — это участки ДНК, которые структурно
сходны с функционирующими генами, но из-за мутацион-
ных изменений утратили способность производить
активный продукт. Их наличие создает условия для на-
капливания мутаций.
Уникальные гены — это гены, которые встречаются в
клетке два или несколько раз (до 10—20). Большинство
исследователей считает, что у многоклеточных общее чис-
ло генов в среднем равно сто тысяч и подавляющее их чис-
ло — это уникальные гены. Характерная черта генов эука-
риотов — мозаичное экзон-интронное строение. Интроны,
не несущие генетической информации, вырезаются (сплай-
синг) . Число и размер интронов у разных видов
варьируется. Присутствие их в гене приводит к значитель-
ному увеличению размеров гена. Интроны стабилизируют
экзоны, однако существует представление, что
интрон — это так называемая «эгоистическая» ДНК, не
дающая организму никаких эволюционных преимуществ.
Экзоны контролируют синтез белков: 1 экзон — 1 домен.
К повторяющимся генам относятся прежде всего гены
102
больших и малых рРНК и гистонов. Число их сильно
варьирует и может достигать более 2000. Гены боль-
ших рРНК организованы в блоки, в которых последова-
тельно идут гены 18S рРНК, 5,8S рРНК и 28S рРНК.
Между ними имеются промежутки, различающиеся по
длине у разных организмов. Межгенные участки имеют
повторы разных типов, с необычной последовательностью,
богатых парами ГЦ. Гены низкомолекулярных ядерных
РНК блоков не образуют. Гены гистонов повторяются в
геноме десятки (у млекопитающих), и сотни (у дрозо-
филы), и тысячи (у аксолотля) раз. Причем не удается
уловить связи между этим показателем и положением
организма на эволюционной лестнице.
Перестраивающиеся, или рекомбинирующие, гены —
это гены, кодирующие легкие и тяжелые цепи белков им-
муноглобулинов, выполняющих функции антител. Гены
этих белков состоят из двух типов генов для легких и
пяти типов — для тяжелых цепей. Легкие цепи кодируют-
ся тремя отдельными генетическими элементами, тяже-
лые — четырьмя. Перестройки генома приводят к соедине-
нию разных участков и в итоге — к образованию им-
муноглобулинов разных классов.
Прыгающие гены, или транспозоны, — мобильные ге-
нетические элементы. Являясь нормальным компонентом
генома, они составляют его значительную часть (у дро-
зофилы — 7 % генома), могут быть представлены мно-
гими копиями, рассеянными по геному, и имеют варьи-
рующую локализацию. Структура разных классов
мигрирующих элементов (МЭ) варьирует, но для всех их
характерно наличие на концах обращенных повторов.
В середине МЭ могут иметь уникальные последователь-
ности. МЭ проявляют высокую локусную специфичность,
так как могут встраиваться в определенную последо-
вательность на хромосоме.
98. ЧТО ТАКОЕ ПЛАЗМИДЫ!
Плазмиды — это внехромосомные факторы наслед-
ственности, генетические элементы, способные стабильно
существовать в клетке в автономном не связанном с
хромосомами состоянии.
Нуклеиновая природа плазмид была показана в 1961 г.
путем определения их чувствительности к распаду 32Р.
Разработан метод избирательного выведения ДНК плаз-
103
мид в результате центрифугирования в градиенте
плотности CsCl. Метод основан на способности бромида
этидия внедряться исключительно в хромосомную ДНК,
что позволяет разделять хромосомы и плазмиды по их
плотности. Подобное же разделение можно произвести и
с помощью электрофореза в геле. ДНК плазмид (F-фак-
тор, Col-фактор, R-фактор) представляет двухцепочечную
кольцевую структуру, часто закрученную в суперспира-
ли. Молекулярные массы плазмид составляют от 1,5* 106
до 600- 10\
Плазмиды бывают трех типов: половой фактор бакте-
рий, факторы стойкости бактерий к лекарствам и колици-
ногены. Половой фактор кишечной палочки имеет моле-
кулярную массу 65* 106, длину 31 нм и содержит 100 000
пар нуклеотидов. По способности передаваться от одной
бактерии к другой различают конъюгативные (трансмис-
сивные) и неконъюгативные (нетрансмиссивные) плазми-
ды. Некоторые плазмиды, подобно F-фактору, являются
факторами половой дифференциации бактерий, придавая
им свойства донора или реципиента. Таким свойством
обладают некоторые R-факторы, имеющие гены устой-
чивости к определенным антибиотикам и сульфамидным
препаратам, Col-плазмиды, контролирующие синтез коли-
цинов (в общем виде — бактериоцинов) веществ, убиваю-
щие тот же вид бактерий, что и продуцент колицина.
Некоторые плазмиды играют важную роль в патогенности
бактерий.
К неконъюгативным плазмидам относятся Col El, Col
Е2 и некоторые R-факторы. Они могут передаваться от
клетки к клетке путем трансдукции, трансформации или
совместное конъюгативными плазмидами. Многие плазми-
ды используются в качестве векторов в генетической
инженерии. Функциональное разнообразие плазмид очень
велико. Например, бактерии рода псевдомонас несут
плазмиды биодеградации, определяющие способности
этих бактерий утилизировать в качестве источника углеро-
да нафталин, толуол, камфору.
Плазмиды определяют способность ряда почвенных
бактерий вступать в симбиоз с бобовыми растениями,
обеспечивая образование корневых клубеньков, необходи-
мых для усвоения азота. Некоторые плазмиды придают
бактериям способность индуцировать добавочные корни у
двудольных растений, что может иметь практическое
значение в условиях низкой увлажненности. Конъюга-
104
тивность некоторых R-плазмид обеспечивает возможность
быстрого распространения устойчивости ко многим анти-
биотикам, что представляет серьезную проблему для ме-
дицины и ветеринарии.
99. ЧТО ТАКОЕ ГЕНЕТИЧЕСКАЯ ТРАНСФОРМАЦИЯ!
Трансформация — это изменение наследственных
свойств клетки в результате проникновения в нее чужерод-
ной ДНК, один из способов обмена генетическим
материалом у прокариот. Впервые обнаружена Ф. Гриф-
фитом (1928 г.), который показал, что некоторые клетки
невирулентных штаммов бактерий приобретают патоген-
ные свойства при заражении ими мышей совместно с
клетками вирулентных штаммов, убитыми нагреванием.
Это открытие легло в основу более поздних работ,
показавших, что наследственным веществом является
ДНК.
Вирулентность пневмококков для животного организ-
ма зависит от наличия полисахаридной капсулы, покры-
вающей бактериальную клетку. Капсульные пневмококки
образуют гладкие блестящие колонии S-формы.
Многие типы пневмококков отличаются друг от друга
по химическому составу капсулы. Определить их можно
методами серологии. Иногда возникают мутантные штам-
мы пневмококков, утратившие способность к образова-
нию полисахаридной капсулы. Такие штаммы авирулент-
ны и образуют колонии с шероховатой поверхностью.
Они названы колониями R типа. Ф. Гриффит обнаружил,
что при введении культуры живых бескапсульных
пневмококков типа II-/? или суспензии убитых нагрева-
нием капсульных штаммов типа I-S ни одно из животных
не погибло от инфекции. Однако при введении смеси
убитых клеток типа I-S и живых клеток типа П-7? мыши
заболевали. Из крови этих мышей были выделены
чистые культуры пневмококков капсульного S-типа. По-
скольку пневмококки /? типа не дают мутаций в S-тип,
можно предположить, что какое-то вещество, присут-
ствующее в суспензии убитых S клеток, может сооб-
щать наследственную способность образовывать капсулы
типа S бактериям типа /?, которые не могут продуци-
ровать свой собственный полисахарид.
В 1944 г. О. Т. Эйвери показал, что при обра-
ботке трансформирующего фактора протеолитическими
105
ферментами или РНКазой биологическая активность его
не меняется, а при обработке ДНКазой она резко падает.
Это указывает на связь трансформирующего фактора
с ДНК.
С помощью трансформации можно передавать такие
признаки, как свойства капсулы, устойчивость к различ-
ным антибиотикам, способность к синтезу некоторых фер-
ментов.
Трансформация обычно происходит между различны-
ми штаммами одного и того же вида. Однако она может
осуществляться и между разными видами бактерий, но
частота переноса генов при межвидовой трансформации
гораздо ниже, чем при внутривидовой. Примером меж-
видовой трансформации может служить трансформация
между Н. parainfluenzae и Н. influenzae.
Явление трансформации может быть использовано при
генетическом анализе для определения сцепления генов,
точного картирования хромосом. При трансформации два
гена считаются сцепленными, если они трансформируются
вместе на одной молекуле ДНК- Определить это можно по
частоте совместной передачи изучаемых генов. Если гены
А и В не сцеплены, а реципиенты ab, обработанные
ДНК, из доноров АВ дают трансформанты АЬ и аВ с
частотой 1 %, то ожидаемая частота двойных трансфор-
мантов АВ должна быть равной 0,01 % (один трансфор-
мант на 10 тыс. клеток). Вероятность одновременного
включения двух генов, находящихся на разных молекулах
ДНК, равна произведению вероятностей включения каж-
дого из этих генов. И если в эксперименте получены
данные, говорящие о повышенной частоте передачи двух
генов, можно сделать вывод об их сцеплении.
100. ВОЗМОЖНА ЛИ ТРАНСФОРМАЦИЯ У ВЫСШИХ ОРГАНИЗМОВ!
Трансформация — один из наиболее распространенных
способов обмена генетическим материалом между различ-
ными штаммами микроорганизмов. Возможны трансфор-
мации и между клетками высших организмов, для иссле-
дования которых были проведены опыты с культурой
клеток костного мозга человека линии Д98. В этой линии
получена мутация, при которой клетки не способны исполь-
зовать гипоксантин для синтеза пуринов. В качестве
реципиентов были выбраны клетки данного клона, а в ка-
честве доноров — клетки двух других линий (клонов), спо-
106
собных использовать гипоксантин. Клетки реципиента
высевались на среду, содержащую в качестве источника
пуринов гипоксантин, так как на ней могли существо-
вать и размножаться только те клетки, которые его
используют. ДНК, извлеченная из клеток двух других
линий, вносилась в чашки Петри, в которых выращи-
вались клетки-реципиенты. При отсутствии донорных мо-
лекул ДНК все клетки клона-реципиента погибали; при
внесении же ДНК доноров часть клеток сохранялась и
давала колонии клеток, способных усваивать гипоксантин,
т. е. с признаком донора.
Существование трансформации подтверждено не толь-
ко для бактерий, но и для клеточных культур человека.
Однако выяснить, сохранилась ли такая способность в
клетках целого организма, еще не удалось. Возмож-
ность трансформации установлена и у высших растений.
Показано, что ДНК бактерий проникает в ядро клетки
и там происходит интеграция ДНК бактерий и хромосом
растений, гибридная ДНК реплицируется и способна к
транскрипции бактериальных генов.
В опытах, например, с петунией воздействие на про-
ростки белоцветковой линии ДНК растений красноцветко-
вой линии вызвало синтез пигмента у 27 % обработан-
ных растений. Способность синтезировать пигмент насле-
довалась у этих растений и проявлялась в Л и
Внедрение чужеродной ДНК в клетку и ее интегра-
ция с геномом реципиента или даже сохранение в автоном-
ном состоянии (плазмиды или эписомное наследование)
создают возможность молекулярной реконструкции
клеток.
101. ЧТО ТАКОЕ ТРАНСДУКЦИЯ!
Явление трансдукции заключается в том, что некоторые
бактериофаги, лизируя клетку-хозяина, захватывают
часть бактериальной хромосомы и переносят ее в другие
бактериальные клетки, которые вследствие этого генети-
чески изменяются. Если выращивать умеренный фаг (Z,
Р22) на бактериях дикого типа, а затем высевать его
потомство на мутантных бактериях, отличающихся от
дикого типа такими признаками, как потребность в росто-
вых веществах, способность сбраживать те или иные
углеводы или устойчивость к различным лекарственным
препаратам, то в потомстве этих штаммов можно ото-
брать клетки дикого типа. В среднем на 1 млн фаго-
107
вых частиц, заражающих бактериальные клетки, возни-
кает одна такая колония. Роль фага в трансдукции
заключается в том, что при литическом цикле фрагменты
хромосомы-хозяина случайно включаются в дочерние
частицы фага, которые становятся переносчиками этих
фрагментов в другие бактерии.
Трансдукция осуществляется у различных видов
микроорганизмов (£. coll, Salmonella). При трансдукции
может быть перенесен фрагмент хромосомы бактерии,
равный около 1/100 ее длины и соответствующий не-
скольким генам. Некоторые фаги, например %, могут
переносить лишь определенный фрагмент хромосомы
(галактозную область). Такая трансдукция называется
специфической. При неспецифической трансдукции раз-
личные гены могут переноситься с одинаковой частотой.
При специфической трансдукции переносимый фрагмент
прикрепляется к гомологичному участку хромосомы ре-
ципиента. Следовательно, трансдуктанты (клетки, под-
вергнутые трансдукции) оказываются диплоидными по
определенным генам. Такие частичные диплоиды назы-
ваются гетерогенотами. Генотип подобных гетерогенот
нестабилен. При делении клетки происходит расщепле-
ние и клетки могут потерять приобретенный фрагмент,
а следовательно, и данный признак. При неспецифи-
ческой трансдукции перенесенный ген донора обычно
включается в хромосому реципиента, что приводит к созда-
нию нерасщепляющихся рекомбинантов.
Трансдукция может быть использована для карти-
рования небольших областей бактериальной хромосомы,
что позволяет уточнить относительную локализацию сцеп-
ленных генов.
102. КАК В КЛЕТКЕ ЗАКОДИРОВАНА НАСЛЕДСТВЕННАЯ
ИНФОРМАЦИЯ!
В полинуклеотидных цепях ДНК и РНК каждые
три следующих друг за другом основания составляют
триплет.
Триплет — это не случайная группировка из трех
нуклеотидов, а такая, при которой каждый триплет управ-
ляет включением в молекулу белка совершенно определен-
ной аминокислоты. Количество возможных комбинаций
азотистых оснований, образующих триплет, невелико и
составляет 43=64. С помощью триплетов кодируется по-
следовательность 20 аминокислот в белковой молекуле, и
108
Таблица 6. Таблица генетического кода
Первый нуклео- тид Второй нуклеотид Третий нуклео- ТИД
У Н А г
У Фен Сер Тир Цис У
Фен Сер Тир Цис Ц
Лей Сер Охра Опал А
Лей Сер Амбер • Три Г
ц Лей Про Гис Apr У
Лей Про Гис Apr ц
Лей Про Глн Apr А
Лей Про Глн Apr Г
А Илей Тре Асн Сер У
Илей Тре Асн Сер ц
Илей Тре Лиз Apr А
Мет Тре Лиз Apr Г
Г Вал Ала Асн Гл и У
Вал Ала Асп Гли ц
Вал Ала Глу Гли А
Вал Ала Глу Гли Г
для кодирования всех аминокислот достаточно образую-
щихся 64 триплетов.
В качестве примера можно привести несколько трипле-
тов: ГЦУ кодирует аланин, ЦЦУ — пролин, УУУ — фе-
нилаланин. Таким образом, последовательность из трипле-
тов ГЦУ, ЦЦУ, УУУ соответствует участку полипеп-
тида, содержащего аланин, пролин, фенилаланин. Други-
ми словами, последовательность оснований в ДНК несет в
себе информацию о последовательности аминокислот в
белковой молекуле. Триплет представляет собой инфор-
мационную единицу — кодон.
Генетический код является триплетным — три основа-
, ния кодируют одну аминокислоту; неперекрывающимся —
основания, составляющие один триплет, не входят в сос-
тав соседних триплетов; вырожденным — одна амино-
кислота может кодироваться несколькими триплетами, на-
пример:
аланин — ЦУГ, ЦАГ, ЦЦГ
лейцин — УАУ, УУЦ, УГУ
пролин — ЦЦЦ, ЦАЦ.
109
Данные по расшифровке генетического кода пред-
ставлены в табл. 6.
Аминокислоты в белке располагаются в той же после-
довательности, в какой кодоны располагаются в гене.
Это положение получило название колинеарности, т. е.
линейного соответствия аминокислот в белке и кодирую-
щих их триплетов на определенном отрезке ДНК.
103. МОЖНО ЛИ ГЕНЕТИЧЕСКИМИ МЕТОДАМИ ПРОВЕРЯТЬ
ГЕНЕТИЧЕСКИЙ КОД!
Генетическими методами можно проверить лишь неко-
торые характеристики генетического кода. В основе совре-
менных представлений о генетическом коде лежит положе-
ние, согласно которому чередование оснований в участке
ДНК, составляющем ген, определяет последовательность
аминокислот в соответствующей полипептидной цепи. Зна-
чит, если найти положение нескольких мутаций в преде-
лах гена и одновременно установить положение амино-
кислотных замен, вызываемых каждой мутацией, то после-
довательность расположения мутаций будет совпадать с
последовательностью соответствующих аминокислотных
замен в полипептиде. Для проведения опыта выбирают
низкомолекулярный белок, который легко очистить и в
котором можно установить расположение аминокислот, а
также организм, поддающийся генетическому анализу с
высокой разрешающей способностью. Таким организмом
может быть кишечная палочка или бактериофаг. Опреде-
ляя положение замененных аминокислот в мутантном бел-
ке, можно показать неперекрываемость кода. Если бы код
был перекрывающимся, то мутация {замена одной, бук-
вы — основания) должна была бы привести к замене не
одной, а нескольких аминокислот в молекуле белка. Одна-
ко известны мутантные белки (гемоглобин, белок ВТМ,
триптофансинтетаза), в молекуле которых мутация при-
водит к замене только одной аминокислоты, что под-
тверждает положение о неперекрываемости кода.
Вырожденность генетического кода может быть прове-
рена с помощью мутаций, индуцированных азотистой
кислотой или аналогами оснований. Эти мутагены произ-
водят мутации типа транзиций, т. е. замен оснований,
а не делеций или вставок. Поскольку большая часть подоб-
ных замен не приводит к остановке синтеза белка,
а выражается лишь в изменении синтезируемой молекулы,
НО
можно утверждать, что вновь получаемые триплеты при
мутации не являются бессмысленными. Они кодируют
ту или иную аминокислоту, следовательно, код вырожден-
ный. В противном же случае большая часть му-
таций (замен оснований) привела бы к появлению
бессмысленных кодонов и прекращению синтеза белка.
Триплетность генетического кода может быть доказана
с помощью мутаций, индуцированных акридиновыми му-
тагенами.
104. КАКОВЫ ДОКАЗАТЕЛЬСТВА ТРИПЛЕТНОСТИ ГЕНЕТИЧЕСКОГО
КОДА!
Доказательства триплетности генетического кода
были получены в опытах с мутантами rll бактериофага
Т4 (опыты Ф. Крика). Известно, что акридиновые краси-
тели вызывают делении или вставки оснований в молеку-
лах ДНК. Предположим, что прямая индуцированная»
профлавином мутация возникла вследствие дополни-
тельной пары оснований в ДНК, а обратная обусловлена
компенсирующей нехваткой пары оснований в других
близких к ней участках хромосомы. Прямая мутация обо-
значается знаком —, а обратная, т. е. супрессорная,—
знаком 4-. Прямая и обратная мутации имеют проти-
воположный знак.
При скрещивании мутантных фагов rll, несущих деле-
нию ( — ) или вставку (+), могут возникнуть различ-
ные комбинации мутаций у рекомбинантов. Можно ожи-
дать, что комбинации + + или----будут давать мутант-
ный фенотип, так как при этом добавятся или удалятся
две пары оснований в ДНК и правильность считыва-
ния информации будет нарушена. Однако если кодовое
отношение равно трем, т. е. код триплетен, то добав-
ление или удаление трех оснований не должно нарушать
правильности считывания информации. Третья мутация
того же знака, как и две предыдущие, восстановит дикий
фенотип фага и приведет к так называемому псевдодикому
типу, поскольку часть генетической информации в про-
межутке между мутациями будет нарушена. Если указан-
ные мутации не затрагивают активный центр белковой
молекулы, такой тройной мутант будет похож на фаг дико-
го типа.
Рассмотрим пример. Предположим, что в гене сущест-
вует такая последовательность оснований: АВС АВС АВС
Ш
ABC ABC. Добавление трех оснований (XYZ) изменит
эту последовательность на
АВС ХАВ УСА BZC АВС АВС,
t____ t _______f
1--вставки---1
а их выпадение даст последовательность
АВС ВСА СВС АВС АВС.
i________________ f t
J--делеции- 1
В том и другом случае за пределами крайней нехват-
ки или вставки триплеты будут считываться правильно,
следовательно, генетический код триплетен.
105. КАКОВЫ ДОКАЗАТЕЛЬСТВА НЕПЕРЕКРЫВАЕМОСТИ
ГЕНЕТИЧЕСКОГО КОДА!
Рассмотрим так называемый перекрывающийся код,
т. е. код, в котором часть букв в подряд идущих
словах совпадает. Например, в последовательности трип-
летов АВСАВСАВС первое слова АВС, второе — ВСА,
третье — САВ и т. д. Код такого типа должен налагать
некоторые ограничения на последовательность слов: вто-
рое слово в нашем примере обязательно должно начинать-
ся с В, третье — с С. Действительно ли существуют такие
ограничения, можно проверить двумя способами. Первый
способ основан на изучении известной последовательности
аминокислотных остатков, например, в таких белках, как
инсулин, тироксин, РНКаза, в которых должны были бы
выявиться определенные группировки аминокислот. Одна-
ко такие группы не обнаружены. Второй способ осно-
ван на том, что при перекрывающемся коде изменение
только одной буквы (основания) в результате мутации
привело бы к изменению не одного, а нескольких слов
(триплетов), а следовательно, и к изменению нескольких
аминокислот в полипептиде. В последовательности
АВСАВСАВС замена С в первом триплете на D приведет
к изменению первых трех триплетов на ABD, BDA, DAB.
Однако на примере молекулы гемоглобина, белка ВТМ и
триптофансинтетазы Е. coll можно видеть, что единичная
мутация, как правило, приводит к замене только одной
«' аминокислоты.
При различных заболеваниях крови в молекуле
гемоглобина один остаток глутаминовой кислоты заме-
щается или валином, или лизином. Каждое из этих замеще-
ний обусловлено одной мутацией, затрагивающей только
112
одно основание в молекуле ДНК- Появление валина или
лизина вместо глутаминовой кислоты можно объяснить
заменой в каждом случае лишь одного основания:
।------>ГУГ
ГАГ
1------> ААГ,
что и подтверждает неперекрываемость генетического
кода.
106. ДЕЙСТВИТЕЛЬНО ЛИ ГЕНЕТИЧЕСКИЙ КОД УНИВЕРСАЛЕН!
У всех исследованных организмов кодирование генети-
ческой информации осуществляется по одному принципу,
с использованием одних и тех же кодовых слов. Различ-
ные виды РНК (рРНК, тРНК) и рибосомы различных
организмов взаимозаменяемы. Искусственно синтезируе-
мый полиурацил регулирует включение фенилаланина во
всех изученных бесклеточных системах, полученных из
кишечной палочки, сальмонелл, дрожжей, некоторых зеле-
ных водорослей, морского ежа, дрозофилы, крысы, кро-
лика и, наконец, человека. Так же обстоит дело и со сме-
шанными полимерами, т. е. полимерами, включающими все
четыре типа нуклеотидов.
Еще более поразительны результаты, полученные в
экспериментах с природной РНК. Выделенная из Е. coll
транспортная РНК (тРНК), переносящая лейцин, делает
то же самое в бесклеточной системе ретикулоцитов
кролика. Ретикулоциты — это клетки звездчатой формы,
содержащиеся в селезенке и костном мозге и способ-
ные вырабатывать гемоглобин, специфичный для каждого
вида. Если выделить из кроличьих ретикулоцитов рибосо-
мы и иРНК и добавить к ним тРНК из Е. colt, то в ново-
образованном гемоглобине кролика обнаруживается мече-
ный лейцин. Это означает, что антикодоны транспортной
РНК бактерии соответствуют кодонам иРНК кролика. Код
вирусов оказывается сходным с кодом бактерий. Отсюда
можно сделать вывод об универсальности генетического
кода по крайней мере у всех изученных организмов, за
небольшим исключением. Так, генетический код, исполь-
зуемый митохондриями, отличается от общеизвестного ко-
да, например триплет УГА — кодон триптофана, а не
нонсенс-кодон; АУА — кодон метионина, а не изолейцина;
АГА и АГГ могут использоваться как терминирующие
из
кодоны, а не кодоны аргинина; АУА, АУУ — как иниции-
рующие кодоны, а не кодоны изолейцина; кодон ЦУА узна-
ется треониловой тРНК, а не лейцйновой тРНК.
107. КАК ОСУЩЕСТВЛЯЕТСЯ БИОСИНТЕЗ БЕЛКА!
В процессе биосинтеза белка следует различать два
последовательных процесса: транскрипцию и транс-
ляцию.
При транскрипции генетическая информация, за-
ключенная в молекуле ДНК, переписывается благодаря
действию транскриптазы в информационную РНК
(иРНК). В цитоплазме на рибосомах иРНК определяет
порядок соединения аминокислот, осуществляя таким
образом синтез специфического белка. Этот процесс назы-
вается трансляцией, в нем можно выделить несколько
последовательных этапов: активацию аминокислот, обра-
зование аминоацил-тРНК и присоединение аминокислот.
Активация аминокислот и образование аминоацил-
тРНК включает собственно активацию аминокислоты и
перенос активированного аминоацильного остатка на
молекулы тРНК с образованием аминоацил-тРНК. Обе
реакции катализируются аминоацил-тРНК-синтетазой
или ферментом активации, специфичным для каждой
аминокислоты.
Аминокислота активируется с помощью АТФ путем
ее присоединения к карбоксильной группе остатка АМФ
от АТФ. Полученный аденилат аминокислоты соединяет-
ся с ферментом активации:
АКЧ~АТФ-|-тРНК->аминоацил-тРНК+АМФ-|~Р — Р,;
ЧНг //° фермент
r- с - с + атф активации*
н Чон Р-Р£
аминокислота nupopoctpam
С С А
С С А
л и, ° №
аденин/иЛаа^Р^о-с-с-е фермент
. A J
мю*<рермент I
аминоацил-тРНК
тРНК
114
При образовании аминоацил-тРНК аденилат амино-
кислоты присоединяется к специфической тРНК с после-
дующим отщеплением фермента и АМР. Полученная
аминоацил-тРНК затем участвует в образовании поли-
пептидной цепи.
Аминоацил-тРНК-синтетаза обладает двумя сайтами
специфичности: один — узнающий аминокислоту, дру-
гой — узцающий определенную тРНК. От специфичности
фермента зависит правильность трансляции генетической
информации. Поскольку имеется множество тРНК (даже
для одной и той же аминокислоты), несущих различные
антикодоны, способные узнавать различные кодоны (изо-
акцепторные тРНК), существует и множество амино-
ацил-тРНК-синтетаз, обладающих очень строгой спе-
цифичностью, так как ошибка, допущенная в период
активации, уже не может быть исправлена при росте
полипептидной цепи. Это может быть установлено в
процессе эксперимента по трансформации цистеина в ала-
нин и последующей вставки аланина на место цистеина
в пептидной цепи (см. вопр. 62).
Эксперименты с импульсной меткой растущей цепи
полипептида (гемоглобин а и £ в ретикулоцитах кро-
лика) показали, что полипептидная цепь растет в направ-
лении от У-конца к С-концу. (В ретикулоцитах ско-
рость роста цепи достигает 1 аминокислотного остатка в
секунду; у бактерий — 20 остатков в секунду.)
Трансляция включает три этапа: инициацию, элонга-
цию, терминацию полипептидной цепи.
1. Инициация. У бактерий синтез полипептида начи-
нается всегда с установки первой аминокислоты — N-фор-
милметионина, кодируемой кодонами АУГ и ГУГ. Суще-
ствует две метиониновых тРНК: тРНК£ет и тРНК^ет, но
только метионин, прикрепившийся к тРНК£ет, может быть
формилирован, превращаясь в N-формилметио-
нил-тРНКР67. Формилирование Мет-тРНКГт катализи-
руется трансформилазой при участии Nio-формилтетра-
гидрофолата (фбрмил-Мю-ТГФ) как донора формиль-
ной (СНО)-группы:
транс-
Н О форми-
I i| мет лаза
Н3с —S — сн2 - С - С - О - тРНК р + формил* Ы 10 = ТГФ -*-
NH2
метионин
115
н о
трансформил^ HjC s CHj _ СН2 ... • _. н _ 0 ... ^мет *
Ын
I____
I С-0 I
I 1
1_н____I
Мет-тРНК₽ет включает метионин в начале цепи при
наличии кодона ГУГ и АУГ, в то время как Мет-
тРНКрет содержит метионин внутри пептидной цепи при
наличии кодона АУГ.
Поскольку существуют два типа метиониновых тРНК,
имеется и средство распознавания инициирующего трипле-
та единственным типом тРНК — тРНК£ет. Это средство
включает наличие вблизи инициирующего кодона специ-
фической последовательности богатой пуриновыми осно-
ваниями и комплементарной 16S РНК рибосомы 30S.
2. Образование комплекса инициации. При синтезе
белка наблюдается непрерывное образование и распадение
70S рибосом (у £. coli), поскольку тРНК и инициаторная
аминоацил-тРНК не могут фиксироваться непосредст-
венно на 70S рибосомах. А такие антибиотики, как стреп^
томицин и неомицин, блокирующие диссоциацию рибосом,
ингибируют инициацию белкового синтеза.
В процессе инициации участвуют три фактора: IFi, IF2,
IF3. Фактор инициации IF3, соединяясь с рибосомой 30S,
предотвращает объединение рибосомальных субъединиц,
что обеспечивает в свою очередь фиксацию иРНК на
субъединице 30S. В присутствии факторов IFi, IF2 и ГТФ
N-формилметионил-тРНК образует комплекс инициации.
М-Формилметионил-тРНК£ет обладает структурой, позво-
ляющей ей фиксироваться на пептидильном центре субъ-
единицы 50S. К этому комплексу присоединяется 50S субъ-
единица, образуя функциональную рибосому 70S. При-
соединение 50S субъединицы сопровождается освобожде-
нием факторов инициации и гидролизом ГТФ на пепти-
дильном центре субъединицы 50S (сайт Р), оставляя сво-
бодным аминоацильный центр (сайт А), к которому
присоединяется аминоацил-тРНК с последующим образо-
ванием пептидной связи:
АУГ иРНК АУГ
in jit in .in . in- iil. <рМет- тРНК
[ J05 ) [ 305 ] * +IF1+IF2*IFj+n<p-»
116
фМет
рибосома 70S
3. Элонгация включает фиксацию аминоацил-тРНК,
образование пептидной связи и транслокацию.
В процессе фиксации аминоацил-тРНК, приносящая в
полипептидную цепь аминокислоту № 2, прикрепляется
к аминоацильному центру (А) рибосомы и встраивается на
свое место благодаря антикодону и комплементарному ко-
дону на тРНК. Для фиксации необходимо присутствие
ГТФ и специфического белка — фактора элонгации
EF — Т, который состоит из двух субъединиц, различаю-
щихся по своей термочувствительности (EF — Ts — устой-
чивая — stable и EF — Ти — неустойчивая — unstable).
Комплекс EF — Ти — ГТФ, соединяясь с аминоацил-
тРНК, позволяет ей занять аминоацильный центр.
Одновременно происходит гидролиз ГТФ, и освобож-
дающийся ГДФ покидает рибосому в виде комплекса
EF — Ти — ГДФ. Необходимо отметить, что фактор
EF — Ти не способен соединяться с N-формилметио-
нил-тРНК?ет. Следовательно, инициаторная тРНК не мо-
жет присоединяться к кодону АУГ, кодирующему метионин
внутри полипептидной цепи.
Между М-формилметионин-тРНК£ет и аминоацил-
тРНК, находящимися в пептидильном (Р) и амино-
ацильном (А) центрах соответственно, образуется пептид-
ная связь (аминогруппа аминоацил-тРНК и карбоксиль-
ная группа N-формилметионил-тРНК). Эта реакция кон-
тролируется пептидилтрансферазой — ферментом, лока-
лизованным в 50S частице. Она приводит к образованию
дипептидил-тРНК- тРНК, освободившись от N-формил-
метионина, остается прикрепленной к пептидильному (Р)
центру. Описанный процесс повторяется в каждом цикле"
элонгации:
EF-Tu-ГТФ^Р-*
Н7
FF“6 EF-S
ГТФ ГДФ+Р
При транслокации после образования пептидной связи
пептидил-тРНК фиксируется на аминоацильном центре
(А). Присоединение следующей аминокислоты будет воз-
можно только после перехода этой пептидил-тРНК в
пептидильный центр (Р). Этот процесс транслокации
требует присутствия фактора элонгации EF — G и ГТФ,
который, гидролизуясь до ГДФ и Р/, и обеспечивает вы-
деление энергии для передвижения рибосом вдоль иРНК.
При каждом акте транслокации освобождается амино-
ацильный центр, что позволяет присоединить следующую
аминокислоту.
Прекращение трансляции (роста полипептидной цепи)
обеспечивается наличием сигналов терминации. Сигнал
терминации представляет собой особый нонсенс-кодон, так
как не существует ни одного антикодона, который бы к не-
му присоединился (УАГ, УАА, УГА). Для терминации
обычно используются несколько нонсенс-кодонов, разде-
ленных обычными кодонами. Это предотвращает действие
мутаций, так как один терминирующий кодон может легко
мутировать в смысловой кодон, что привело бы к синтезу
двух различных соединенных пептидных цепей. В термина-
ции участвуют факторы «освобождения» (RF от англ,
releasing factors): RFi, RF2, RF3. После фиксации фак-
тора освобождения на рибосоме полипептидил-тРНК пере-
ходит из аминоацильного центра А в пептидильный Р.
Затем происходит гидролиз связи на С-конце полипептида,
соединявшей его с последней тРНК. Этот гидролиз ката-
лизируется пептидилтрансферазой, чья специфичность
модифицируется в присутствии фактора освобождения.
Когда полипептидная цепь освобождается, тРНК покидает
рибосому.
Механизм инициации потерь может начать новый цикл
синтеза полипептидной цепи:
<рМет-(АК)я
р| м
уаг нонсенс-кодон
in ill ш in
I-------------)
фМет-(АК)/?
освобождение
полипеогпиднии
цепи
118
Освобождение .
полил^ипионои
<РМвТ-(АК)„-АКСООН +
I J ТРНК+ИРНК+®
Освобожденная полипептидная цепь претерпевает
опрёделенные модификации и приобретает активную кон-
фигурацию: 1) формильная группа на N-конце отсоеди-
няется под действием деформилазы. Многие белки впо-
следствии теряют на N-конце ряд аминокислот под дей-
ствием аминопептидаз; 2) между остатками цистеина
образуются дисульфидные мостики; 3) некоторые амино-
кислоты модифицируются, например в коллагене часть
остатков пролина или лизина подвергаются гидроксили-
рованию.
Особенностью белкового синтеза эукариот является то,
что у них в качестве инициаторной тРНК служит особая
метионил-тРНК (Мет-тРНКг). Остаток метионила нико-
гда не формилируется. Имеется также тРНК, включающая
метионин внутри цепи (Мет-тРНКм)- На малой субъеди-
нице рибосомы первой прикрепляется инициаторная амй-
ноацил-тРНК» а не иРНК. В момент инициации участ-
вует метил-7-гуанозин, расположенный на 5'-конце иРНК
и узнающий фактор инициации IF3. Вместо трех факторов
освобождения известен только один.
108. НАСКОЛЬКО ОПРАВДАНО ВЫРАЖЕНИЕ «ОДИН ГЕН — ОДНА
ПОЛИПЕПТИДНАЯ ЦЕПЬ»!
Известно, что все ферменты являются белками и ката-
литическая активность фермента определяется его белко-
вой частью и добавочными кофакторами. Белки, состоя-
щие из аминокислот, которые соединяются между собой
аминным и карбоксильным концами, называются поли-
пептидами. Каталитическая активность фермента зависит
от количества и типа входящих в него аминокислот,
порядка их расположения по цепи, количества цепей и
характера их взаимного расположения.
Бактерии £*. coli имеют фермент триптофансинтетазу,
который можно разложить на две полипептидные цепи.
Ни одна из этих цепей в ' отдельности не обладает
ферментативной активностью. Однако при восстановле-
нии целостности белковой молекулы ферментативная
активность восстанавливается, т. е. основа катализирую-
щей способности фермента заложена в самой природе
Н9
полипептидных цепей, которые, соединяясь, образуют дан-
ный фермент. Следовательно, каждая из цепей может
быть результатом первичного действия различных генов.
Это предположение было проверено на мутантах, утра-
тивших активность триптофансинтетазы. Одни мутанты
были дефектны по одной полипептидной цепи, другие — по
другой. Генетические исследования показали, что все му-
тации, приводящие к дефекту одной цепи, при реком-
бинации могут отделяться от мутаций, приводящих к
дефекту другой цепи. Значит, существуют два гена,
каждый из которых определяет структуру одной из двух
полипептидных цепей. Впоследствии они могут соединять-
ся, образуя активный фермент. И поскольку каждая поли-
пептидная цепь контролируется своим собственным геном,
а на целый фермент в данном случае необходимо взаимо-
действие двух генов, гипотеза «один ген — одна полипеп-
тидная цепь», по-видимому, наиболее правильно отражает
существующие связи между генами и ферментами. Таким
образом» первым решающим шагом от генов к признакам
является синтез специфических белков-ферментов.
109. ЧТО ТАКОЕ ЦИСТРОН)
Согласно классическим представлениям ген обозначает
единицу генетического материала, которая передается от
родителей потомству и может (шть обнаружена по ее спо-
собности мутировать в различные состояния, рекомбиниро-
вать с такими же единицами и функционировать, т. е. опре-
делять тот или иной фенотип организма. Такие пред-
ставления о гене просуществовали вплоть до середины
50-х гг. XX в., до тех пор, пока не была изучена
структура гена. Эксперименты С. Бензера показали, что
классического гена не существует, поскольку единицей му-
тации и рекомбинации может служить одна пара нуклеоти-
дов в ДНК- Оставался открытым вопрос о единице
функции, и необходимо было выяснить, изменяет ли
мутация гена его функцию как единого целого. Для выяс-
нения этого вопроса надо было найти метод, позволяющий
определять мутации в различных функциональных еди-
ницах.
Чтобы определить, принадлежат ли обе мутации к
одному или разным генам, С. Бензер применил цис-
транс-тест, или тест на комплементарностъ (рис. 25). Тест
на комплементарность основывается на том, что при зара-
120
жении штамма Е. coli К дву-
мя бактериофагами — мута-
нтным (неспособным расти
на газоне штамма К) и диким
фагом — оба штамма
развиваются нормально.
Знамит, нормальный ген ди-
коре типа способен обеспе-
чить функцию, необходимую
для размножения на штамме
К не только дикого фага, но
и ril-мутанта.
Было замечено, что в не-
которых случаях не только
дикий штамм фага способст-
вует росту мутанта на Е. coll
К, но и два мутанта могут
Р я с. 25. Тест на комплементар-
ность у бактериофага Т4:
а, б, в — мутации в цистронах А, В и
в разных цистронах соответственно; 1 —
размножение не происходит; 2 — нор-
мальное размножение
помогать друг другу расти
на этом штамме, на котором
ни один из них в одиночку не
способен размножаться. Для
выделения таких комплемен-
тарных пар мутантов клетки
штамма К заражаются одно-
временно двумя ril-мутантами,
чтобы выяснить, смогут
ли они при совместном посеве помогать друг другу и
давать потомство. Если два мутанта способны к такому
совместному размножению, то можно считать, что обе му-
тации комплементарны и локализованы в различных функ-
циональных участках фагового генома. Если же два мутан-
та некомплементарны, значит, они затронули одну и ту же
функциональную часть генома. Неспособность одного му-
танта расти на штамме К свидетельствует о том, что он
не может осуществлять какую-то определенную функцию
или синтезировать какой-либо белок, необходимый для
размножения фага в клетке. В отличие от первого у
второго комплементарного мутанта мутация затрагивает
другую функцию. Значит, два таких мутанта могут раз-
множаться при совместном посеве. При совмещении
двух мутантных геномов в одной бактериальной клетке в
ней будут осуществляться все реакции, необходимые для
размножения, так как функции, осуществляемые одним
мутантом, будут использованы другим.
С помощью теста на комплементарность С. Бензер
121
показал, что мутанты rll разделяются на два класса
А и В. Все мутанты одного класса комплементарны
любому мутанту другого класса и не комплементарны
мутантам того класса, к которому они сами принадлежат.
Наличие двух классов мутантов свидетельствует о сущест-
вовании двух функциональных единиц в пределах области
rll генома фага Т4. Каждая функциональная единица
связана, по-видимому, с синтезом специфического поли-
пептида, необходимого для роста на штамме К. Генети-
ческую единицу функции, выявленную с помощью цис-
транс-теста, С. Бензер назвал цистроном. Термины «ген» и
«цистрон» следует употреблять как синонимы.
Путем рекомбинационного анализа можно вычислить
длину цистронов А и В в области rll фага Т4. Оказа-
лось, что расстояние между наиболее удаленными точками
цистрона А равно примерно пяти единицам карты, а
соответствующее расстояние для цистрона В — трем еди-
ницам карты. Таким образом, общая длина области rll
равна 8 % рекомбинации. Исходя из общей длины карты
фага Т4 (общая длина карты равна 1500 единицам
рекомбинации, 2- 105 парам нуклеотидов), можно рассчи-
тать, что цистрон А составляет (5/1500) • 2 • 105 700, а
цистрон В — (3/1500) • 2 • 105 = 400 пар нуклеотидов.
НО. ЧТО ТАКОЕ ОПЕРОН!
Клетка любого организма содержит полную генети-
ческую информацию, полный набор генов независимо от ее
специализации. В каждый период жизни клетки исполь-
зуется лишь часть информации, т. е. реализация генети-
ческой информации регулируется в процессе роста и раз-
вития организма. Подобная регуляция является необходи-
мым условием нормальной жизнедеятельности клетки.
Допустим, что клетка по какой-то причине перестает
синтезировать белок. Тогда аминокислоты остались бы без
применения, и если их синтез не прекращается, то они
накапливаются ненужным балластом. Та клетка, которая
в этих условиях прекращает синтез аминокислот, рабо-
тает экономичнее, чем клетка без такого «тормоза».
Рассмотрим, как происходит подобное торможение на
примере аминокислоты аргинина. Синтез аргинина из
предшественников протекает в четыре этапа, следова-
тельно, для него требуется четыре фермента, образование
которых контролируют четыре гена. Фермент 1 преобразу-
122
ет исходное вещество А в вещество В, фермент 2 из В про-
изводит С, фермент 3 из С продуцирует D и, наконец,
фермент 4 превращает D в конечный продукт Е, представ-
ляющий в данном случае аргинин. Когда потребность в
аргинине отпадает, ферменты оказываются лишними и их
синтез прекращается. Причем эксперименты показали, что
синтез, всех четырех ферментов прекращается одновре-
менно. Кроме того, оказалось, что гены, контролирующие
их синтез, на генетической карте расположены рядом. Ге-
ны, ответственные за синтез определенных ферментов, на-
зываются структурными, поскольку они определяют струк-
туру ферментов. На одном из концов цепи этих генов
находится ген-оператор (О), определяющий, будут ли гены
неактивными. Участок генетического материала, транс-
формация которого осуществляется на одну молекулу
информационной РНК (иРНК) под контролем белка-реп-
рессора, получил название оперона (рис. 26). Этот термин
принадлежит Ф. Жакобу и Ж. Моно.
Рис. 26. Схема регуляции транскрипции:
1 — апорепрессор (неактивен); 2 — корепрессор; 3 —
голорепрессор (активен)
Помимо гена О существует еще ген-регулятор /?,
контролирующий деятельность оперона. Наличие двух пус-
ковых регулирующих генов подтверждается в опытах по
локализации мутаций с нарушениями регуляции синтеза
аминокислот. Было установлено, что ген R располагает-
ся на некотором расстоянии от гена О. Оператор воз-
действует непосредственно на соседние структурные гены,
тогда как действие регулятора осуществляется через
вещество, выделяемое им в цитоплазму. Это вещество при
соединении с низкомолекулярным веществом, например с
аргинином, становится активным и выключает оператор.
123
Рис. 27. Схема индукции синтеза ферментов, участвующих в
усвоении лактозы (Ф1—Ф4):
/ —- апорепрессор; 2 — индуктор (в даннокгслуяяв Лйктпва); 3 — апорепрессор (бло-
кирован); 4 — распад лактозы; 5 — трансляция на рибосомах
Его выключение приводит к прекращению считывания ин-
формации, а следовательно, к прекращению синтеза фер-
мента. Такое явление получило название репрессии. Ре-
гуляторный белок, подавляющий транскрипцию генов
регулируемого им оперона, называется репрессором. Реп-
рессор состоит из апорепрессора, продуцируемого геном
/?, и из соединенного с ним корепрессора — аргинина. Ген
R производит апорепрессор, неэффективный сам по себе,
который поступает в цитоплазму. Накапливающийся ко-
репрессор соединяется с апорепрессором, образуя голо-
репрессор, последний подавляет ген О и тем самым весь
оперон, контролирующий синтез аргинина. Апорепрессоры
и корепрессоры строго специфичны: аргинин не тормозит
синтеза других аминокислот.
Кроме рассмотренной системы отрицательного контро-
ля, когда функционирование данного биосинтетического
пути выключалось при избытке конечного продукта био-
синтеза, имеются случаи противоположного характера:
синтез фермента может происходить только в присут-
ствии его субстрата. Это явление называется индук-
цией синтеза ферментов. Примером таких ферментов
могут служить р-галактозидаза, пенициллиназа и фермен-
ты, принимающие участие при усвоении галактозы у Е. coll.
Рассмотрим систему регуляции ферментов, сбражи-
вающих лактозу (рис. 27). Репрессор, производимый ге-
124
ном /?, блокирует ген О до тех пор, пока в среде нет
лактозы. При появлении лактозы репрессор соединяется с
ней и дает неактивный голорепрессор. Наступает дерепрес-
сия оперона. Это состояние продолжается до тех пор,
пока концентрация индуктора не снизится до определен-
ного минимума.
111. КАКОВЫ ФУНКЦИИ ГЕНА-ОПЕРАТОРА!
Оператор выполняет две функции: с него начинается
синтез иРНК вдоль одной цепи молекулы ДНК и он (или
его продукт) взаимодействует со специфической молеку-
лой репрессора. Можно ожидать, что мутации оператора
будут затрагивать одну или обе эти функции.
Мутации оператора, приводящие к прекращению или
резкому снижению синтеза иРНК, называются негативны-
ми мутациями оператора (О0). Такие мутации в области
оператора могут обусловливать либо утрату способности
взаимодействовать с РНК-полимеразой, например при
делеции оператора, либо увеличение сродства оператора
(или его продукта) со специфической молекулой репрес-
сора, либо возникновение сродства с молекулой репрессо-
ра, не обладающей (или незначительно обладающей) спо-
собностью взаимодействовать с оператором дикого типа
или его продуктом, либо изменение последовательности
нуклеотидов, влияющих на процесс трансляции.
Мутации оператора, вызывающие более интенсивный
или даже конститутивный синтез ферментов, называются
Репрессор }
f —I-
Репрессор
Репрессор
I I
R
0* Рена
- ।
/ велона отсутствует
Велона отсутствует
о* Гена
+
гена
к
Велон а
Велон а отсутствует
—А---------1—
Гена
Ри с. 28. Схема, иллюстрирующая различие в механизме действия нор-
мального и мутантного гена-регулятора (а) и гена-оператора (б)
125
конститутивными мутациями оператора (0е). По-видимо-
му, такие мутации приводят к уменьшению или полной
утрате оператором или его продуктом сродства к спе-
цифической молекуле репрессора (рис. 28).
Мутации О0 и 0е влияют только на гены, занимающие
цис-положение по отношению к мутантному оператору
(т. е. только на гены, расположенные в той же молекуле
ДНК). Неспособность мутаций оператора функциониро-
вать в транс-положении рассматривается как свидетельст-
во того, что оператор служит рецепторным участком и
его действие не связано с образованием независимого
цитоплазматического продукта. В клетке, несущей (/-му-
тацию в одной хромосоме и нормальный оператор, чувстви-
тельный к репрессору в гомологичной хромосоме, происхо-
дит конститутивный синтез белка.
112. ЧТО ТАКОЕ РЕПРЕССОР И КАК ДЕЙСТВУЕТ ГЕН-РЕГУЛЯТОР!
Репрессор — регуляторный белок, подавляющий тран-
скрипцию генов регулируемого им оперона в результа-
те связывания с оператором.
Молекула репрессора, согласно современным представ-
лениям, может существовать в двух альтернативных и спе-
цифических формах — активной и неактивной. По-видимо-
му, конформация в большей степени обусловлена первич-
ной структурой репрессора. Поскольку первичная структу-
ра молекулы репрессора изменяется в результате мутаций
гена /?, доля активного репрессора в клетке находится
под контролем этого гена.
Некоторые метаболиты с небольшой молекулярной мас-
сой способны изменять относительное содержание двух
форм репрессора в клетке, образуя комплекс с одной из
них. Метаболиты, способствующие увеличению содержа-
ния активного репрессора и тем самым усиливающие ре-
прессию фермента, называются корепрессорами. Специфи-
ческие низкомолекулярные вещества, способствующие
образованию активного репрессора, называются индукто-
рами.
Одни мутации гена /?, особенно его деления, вы-
ражаются в полном прекращении синтеза репрессора, дру-
гие приводят к конститутивному синтезу фермента и могут
вызывать образование репрессора с резко уменьшенной
способностью принимать активную конфигурацию, необ-
ходимую для взаимодействия с оператором. Изменен-
126
ный в результате мутации репрессор может утратить спо-
собность быстро связываться с корепрессором или после
связи с ним претерпевать конформационное превращение.
Наконец, мутации гена /? могут привести к гиперрепрес-
сии, если уровень синтеза фермента геном а будет ниже
нормального. Было высказано предположение, что такие
мутации, ведущие к гиперрепрессивному синтезу фермен-
та, вызывают образование активного репрессора, обла-
дающего высоким сродством с оператором. Репрессор при
этом с большей легкостью принимает активную конфигу-
рацию в присутствии метаболитов клетки.
Важным генетическим признаком активного гена /?
является его доминантность. Ген R функционирует в транс-
конфигурации (см. рис. 28). Это указывает на то, что
белок-репрессор существует вне хромосомы. Ген R опре-
деляет структуру белка, способного специфически взаимо-
действовать с определенным участком оператора или его
продуктом. По-видимому, продукт гена /? влияет на синтез
иРНК.
113. КАКИЕ ОСОБЕННОСТИ РЕГУЛЯЦИИ ДИФФЕРЕНЦИАЛЬНОЙ
АКТИВНОСТИ ГЕНОВ У ЭУКАРИОТОВ!
У эукариотов размер генома в сотни, а у млекопитаю-
щих в тысячу раз больше, чем у прокариотов, поэтому
регулировать такую систему довольно сложно. У большин-
ства эукариотов регуляция активности генов осущест-
вляется на стадии транскрипции (рис. 29). Для них харак-
терны долгоживущие матрицы иРНК.
Хотя у эукариотов после введения субстрата синтез
определенных ферментов усиливается, однако это усиление
не столь велико, как у микроорганизмов, потому что
осуществляется на фоне уже работающего гена.
Если у микроорганизмов идет координированная
регуляция синтеза ферментов (оперонная система регу-
ляции), то у животных гены, которые бы имели единую
регуляторную зону, не установлены. Каждый их ген регу-
лируется отдельно, и наблюдается последовательность в
синтезе ферментов, так называемая «каскадная» регуля-
ция. Под влиянием эффекторов многие гены могут ре-
гулироваться одновременно и включать целые группы
дифференцировки. В качестве эффекторов могут исполь-
зоваться низкомолекулярные вещества и белки. Гормоны,
например, действуют лишь на отдельные клетки — клет-
ки-мишени, которые, очевидно, содержат рецепторы,
127
т
Р^а2Оз On On
s'-------1-----14—T------j'npo -PHK
V V
ИРНК
Рис. 29. Схема регуляции транскрипции
у эукариотов:
Г — транскриптон; р — промотор; а< — ап— акцептор-
ная зона; п—г„ — регуляторные белки; S„ — структур-
ный ген; 1—транскрипция; 2— транспорт иРНК
в цитоплазму; 3 — распад неинформативной части
про-иРНК
способные присоединять гормоны, образуя с ними комп-
лексы.
При включении определенной генетической системы
происходит дифференцировка клеток, после чего действие
эффектора может быть устранено, но клетка продолжает
работать. Это так называемое эпигенетическое наследо-
вание — один из важнейших факторов развития и диф-
ференцировки организмов, система самоподдержания
включенных программ.
Сравнение матричной активности хроматина с актив-
ностью очищенной ДНК показало более высокую актив-
ность последней в 10 раз. Исследованиями установлено,
что основные белки хроматина (в частности, гистоны)
ограничивают транскрипцию, блокируя гены. В отличие
от многих эффекторов гистоны нельзя рассматри-
вать как специфические регуляторы генной активности,
так как они сходны в разных тканях и организмах. Оче-
видно, они необходимы для структурирования молекул.
Специфичность же хроматина определяют кислые белки.
Хроматин эукариотов в зависимости от его функцио-
нального состояния может существовать либо в гетерохро-
матиновой, либо в эухроматиновой форме (взаимообрати-
мые физические состояния хроматина).
Гетерохроматин остается компактным и, следователь-
но, неактивным на протяжении интерфазы клеточного цик-
ла. Поэтому молекулярные механизмы, лежащие в основе
128
гетерохроматинизации, контролируют степень конденса
ции или спирализации хромосом, делая нити ДНК недо-
ступными для транскрипции РНК.
При активизации участков хроматина со многими пов-
торами синтезируется гигантский предшественник (про-
иРНК), включающий в функциональном отношении ин-
формативную (структурные гены) и неинформативную
(акцепторную) зоны. Происходит распад псевдо-иРНК, а
иРНК (с небольшими избытками на концах цепи) служит
матрицей для синтеза специфических белков.
114. КАКОВЫ ФОРМЫ ИЗМЕНЧИВОСТИ!
Различают ненаследственную (модификационную) и
наследственную (генотипическую) изменчивость. Наслед-
ственная изменчивость может быть комбинативной, обу-
словленной перекомбинацией генов в мейозе, и мутацион-
ной.
Ненаследственная изменчивость представляет собой
эволюционно закрепленные адаптивные реакции организ-
ма на изменение условий внешней среды без измене-
ния генотипа. Характерными особенностями модификаций
являются массовое проявление возникающих изменений,
адекватность изменений воздействиям среды и в большин-
стве случаев кратковременность их существования. Моди-
фикации не передаются даже следующему поколению и
исчезают после прекращения воздействия, вызвавшего их.
Однако у организмов, размножающихся вегетативно или
партеногенетически, известны так называемые длительные
модификации, сохраняющиеся в течение нескольких по-
колений. Сохранение длительных модификаций объясняет-
ся тем, что диапазон изменений признака определяется
нормой реакции, зависящей от функциональных особен-
ностей продуктов определенных генов, формирующих те
или иные признаки. Можно сказать, что организмы
наследуют не признаки, а норму реакции, и в силу различ-
ной пластичности признаков их проявление сильно зависит
от внешней среды.
Классическим примером модификационной изменчи-
вости у животных является изменение окраски у горно-
стаевых кроликов, у которых интенсивность окраски за-
висит от температуры. Естественно, необходимо знать, что
температура выступает здесь не более чем средовым фак-
5—1740
129
тором, но степень изменчивости определяется генотипом
организма
Большинство модификаций имеют приспособительное
значение и способствуют адаптации организма к измене-
ниям окружающей среды. Некоторые модификации, вы-
званные необычными или экстремальными для вида
факторами, например мутагенами, резко изменяют фено-
тип организма вплоть до появления «уродства». Такие
модификации называются морфозами. Некоторые мо-
дификации напоминают то или иное аллельное состояние
гена и получили название фенокопий.
Наследственная изменчивость может быть результатом
мутаций, рекомбинаций и переноса внехромосомных генов.
Термином «мутации» обозначают внезапные наследуемые
изменения генетического материала, которые могут воз-
никнуть без видимых причин (спонтанно) или быть инду-
цированы внешним* воздействием на организм. Процесс
возникновения мутаций называется мутагенезом. Орга-
низм, измененный в результате мутации, называется
мутантом.
По происхождению все мутации можно разделить на
две группы: спонтанные и индуцированные. Это деление
условно, поскольку спонтанные мутации не являются бес-
причинными, могут иметь эндогенное происхождение, не
связанное с внешними воздействиями на организм.
По месту происхождения мутации подразделяются на
генеративные, возникающие в половых клетках и пере-
дающиеся по наследству, и соматические, образующи-
еся в клетках тела, не участвующих в размножении.
Соматические мутации иногда ведут к появлению гене-
тических мозаик, у которых изменена только часть орга-
низма, развившаяся из мутантной клетки.
В зависимости от того, где возникла мутация — в гене-
тическом материале, клетке-ядре, нуклеоиде (у прокариот)
или цитоплазме, — различают ядерные (хромосомные) или
цитоплазматические мутации, которые являются резуль-
татом изменения ДНК хлоропластов, митохондрий, плаз
МИД.
По характеру изменений фенотипа можно условно
выделить видимые морфологические, физиологические и
биохимические мутации, так как проявление любого
признака определяется деятельностью того или иного
фермента или группы ферментов. К физиологическим
относят мутации, влияющие на жизнедеятельность орга-
130
низма и ведущие к нарушению таких процессов, как дыха
ние, кровообращение и т. д.
Биохимические мутации включают все случаи измене-
ния активности ферментов от их полного выключения до
включения в норме неактивных метаболических путей.
Например, мутации к ауксотрофности у микроорганизмов,
т. е. к потере способности синтезировать необходимые
для жизнедеятельности вещества (витамины, аминокисло-
ты). К биохимическим относят мутации, нарушающие
синтез ферментов, которые участвуют в репликации нукле-
иновых кислот, репарации повреждений ДНК, транскрип-
ции и трансляции генетического материала.
Геномные мутации способны изменять число хромосом.
Увеличение числа хромосом кратно гаплоидному и при-
водит к появлению полиплоидов. В основе возникновения
полиплоидии лежат репродукции хромосом в неделящих-
ся клетках, слияние соматических клеток или их ядер и
нарушение процесса мейоза, приводящее к образованию
гамет с нередуцированным числом хромосом.
Определения мутаций зависят от особенностей самой
мутации, а также от организма, с которым проводится
эксперимент. Не представляет особого труда выделение
мутаций в чистых линиях растений, животных и дрожжей
При рецессивной мутации (А->а) в спорах или половых
клетках (генеративные мутации) соединение гаметы, не-
сущей мутантный ген, с нормальной гаметой (Д) дает
гетерозиготное растение Аа, у которого мутация не про-
явится (так как А доминирует над а). Однако в следующем
поколении оно даст типичное моногибридное расщепление
Таким образом, выщепление 1/4 аа в самоопыленной
линии АА указывает на возникшую в дедовском поколении
мутацию. Если же мутация доминантна (а-^А)ч мутант-
ный признак проявляется уже у гетерозигот (Да), переда-
ющих его 3/4 своего потомства.
При возникновении рецессивной мутации в сомати-
ческих клетках (соматические мутации) у самой мути-
ровавшей особи изменение признака не проявится. Если
мутировавший побег даст семена, в потомстве появятся
растения аа, что указывает на возникшую в предыдущем
поколении мутацию. Чем раньше в онтогенезе возникает
соматическая мутация, тем больше участок ткани, несущей
данную мутацию. Если мутация имеет доминантный ха-
рактер или она рецессивна, но находится в геми- или
гомозиготном состоянии, появляется мозаик (химера)
131
Рис. 30. Мутантные формы дрозофилы
Так, у самцов дрозофилы часто встречаются мозаики по
окраске глаз: часть фасеток красных и часть белых. Эти
формы возникают в результате рецессивной мутации
нормального гена, который находится у самцов в гемизи-
готном состоянии.
Соматические мутации имеют большое практическое
значение у вегетативно размножающихся форм, так как в
этом случае любая мутация может быть закреплена.
Например, известный сорт яблок, выведенный И. В. Мичу-
риным, антоновка «шестисотграммовая», был получен из
«почковой» мутации. У организмов, размножающихся
только половым путем с ранним обособлением зачатко-
вого, соматические мутации не имеют никакого значения
для селекции.
Интенсивные исследования соматических мутаций
связаны с предположением, что ряд злокачественных
опухолей возникает по типу соматических мутаций. Вы-
яснение причин их возникновения имеет значение для
132
проблемы канцерогенеза у человека, т. е. процесса
возникновения и развития злокачественной опухоли.
Мутации подразделяются на прямые (нормальный ген
Л->мутантный ген а) и обратные (мутантный ген а-+
-анормальный ген Л). Эти процессы протекают в природе
с разной скоростью, и их соотношение определяет накопле-
ние в популяции нормальных или мутантных генов. Обрат-
ные мутации легко учитываются у нейроспоры и других
микроорганизмов. Важной характеристикой мутаций
является разнонаправленность возникающих изменений
(рис. 30).
Таким образом, изменения организма могут быть
обусловлены изменением как самих наследственных
факторов, так и внешних условий, в которых реализуется
генотип и происходит развитие организма.
115. ЧТО ТАКОЕ ЛЕТАЛЬНЫЕ ГЕНЫ!
В ряде случаев нарушения в развитии организма при
мутации бывают настолько сильными, что организм поги-
бает. Гены, вызывающие такое нарушение, называются
летальными (от лат. letaeis — смертельный). При наличии
разных летальных генов организмы гибнут на различных
стадиях развития. Как правило, летальное действие таких
генов рецессивно, т. е. проявляется лишь тогда, когда они
находятся в гомозиготном состоянии. При возникновении
мутаций с доминирующим летальным действием организм
погибает, не давая потомства.
Однако отмечены случаи, когда летальные гены,
вызывая в гетерозиготном состоянии видимые изменения,
становятся даже полезными с хозяйственной точки зрения.
Так, среди овец каракульской породы встречаются живот-
ные с красивой серебристо-серой окраской шкурки, оцени-
ваемой дороже, чем обычный черный каракуль. При скре-
щивании серых овец с серыми баранами оказалось, что
они всегда гетерозиготны. При изучении причин этого
явления было установлено, что среди полученных в ре-
зультате такого скрещивания серых ягнят примерно г/з,
или около 25 % всего приплода, заболевала хрони-
ческим тимпанитом и погибала. Причиной заболевания
служили нарушения в деятельности парасимпатической
нервной системы. Когда же скрещивали серых баранов
с черными овцами или серых овец с черными баранами,
в потомстве рождалось 50 % серых и 50 % черных ягнят,
133
причем серые ягнята не заболевали. Оказалось, что в
гомозиготном состоянии ген, вызывавший развитие серой
окраски, обладал рецессивным летальным действием.
У лисиц встречается ценная окраска меха — плати-
новая, обусловленная доминантным геном, вызывающим
в гомозиготном состоянии гибель зародышей на ранней
стадии развития. В таких случаях соотношение фенотипов
во втором поколении меняется, так как из трех доминант-
ных форм одна (гомозиготная по летальному гену) по-
гибает, в результате чего соотношение фенотипов стано-
вится 2:1.
Аналогичное расщепление отмечено и у зеркального
карпа, у которого наблюдалось наследование недоразви-
тия чешуи: она сохранилась только на средней линии
тела, остальная часть его голая, поэтому его называют
линейным. При скрещивании между собой линейных
карпов потомство всегда расщепляется в соотношении
2 линейных : 1 с нормальной чешуей, так как зародыши,
гомозиготные по гену, вызывающему недоразвитие чешуи,
погибают на ранних стадиях развития.
116. В ЧЕМ СУТЬ ЗАКОНА ГОМОЛОГИЧЕСКИХ РЯДОВ
В НАСЛЕДСТВЕННОЙ ИЗМЕНЧИВОСТИ!
Спонтанный мутационный процесс у генетически близ-
ких родов и видов протекает параллельно, в результате
чего у разных форм возникают сходные мутации (гомо-
логические ряды):
gi(ai + &i+cj +...),
§2(02 + 62 + ^2 +
gsfflt + &з + Сз + ...),
где gi, g2, gs— виды; а, &, с — различные варьирующие
признаки.
Закон был сформулирован Н. И. Вавиловым в 1920 г.
Изучая изменчивость признаков у видов и родов злаков
и других семейств, Н. И. Вавилов обнаружил, что все виды
и роды генетически близки между собой и характеризуются
тождественными рядами наследственной изменчивости.
Зная ряд форм для одного вида, можно предвидеть на-
хождение форм у других видов и родов. Он пришел к вы-
воду, что целые семейства растений характеризуются
определенным циклом изменчивости, проходящей через все
роды, составляющие семейство.
134
Хотя закон касался изменчивости у растений, Н. И. Ва-
вилов указывал на его применимость и к животным.
Теоретической основой гомологии рядов фенотипической
изменчивости у близких таксономических групп является
представление о единстве их происхождения путем дивер-
генции под действием естественного отбора. Поскольку
общие предки имели определенный, специфический набор
генов, то и их потомки должны обладать таким же набором
за небольшим исключением. Учитывая, что каждый ген
может мутировать в разных направлениях (множествен-
ный аллелизм) и что мутационный процесс носит не-
направленный характер, можно предположить, что спектр
изменений одинаковых генов у особей близких видов
будет сходным. Следовательно, в основе закона гомо-
логических рядов лежит параллелизм генотипической
изменчивости у особей со сходным набором генов. Являясь
теоретической основой сравнительной генетики, закон
объясняет полиморфность видов.
Закон гомологических рядов, отражая общую законо-
мерность мутационного процесса и формообразования
организмов, является биологической основой методов
целенаправленного получения нужных наследственных
изменений. Он дает возможность селекционерам прово-
дить искусственный отбор различными методами: от на-
хождения нужных форм в природе или выявлении их при
инбридинге до получения этих форм с использованием
мутагенов. Биохимические механизмы закона гомологи-
ческих рядов изучаются на разных объектах — от измене-
ний метаболизма бактерий в процессах микробиологи-
ческого синтеза до наследственных заболеваний человека.
117. ЧТО ПРОИСХОДИТ С ГЕНЕТИЧЕСКИМ МАТЕРИАЛОМ ПРИ
ВОЗНИКНОВЕНИИ МУТАЦИИ!
К мутациям относятся изменения отдельных генов,
хромосомные перестройки, а также изменения числа
хромосом.
Наиболее часто встречаются генные, или точковые,
мутации. Они представляют собой вставки или выпадения,
а также изменения (транзиции и трансверсии) пары
нуклеотидов ДНК (РНК). Точковые мутации могут изме-
нять функцию отдельных генов одного оперона в случае
полярного эффекта, т. е. выключения всех генов, распо-
ложенных дистально от оператора по отношению к воз-
никшей мутации.
135
Хромосомные перестройки возникают в основном, по-
видимому, за счет «незаконной» рекомбинации, т. е. реком-
бинации негомологичных участков генетического мате-
риала. К ним относятся перемещения участков генети-
ческого материала, соизмеримых по длине с геном, между
хромосомами или в пределах одной хромосомы. Измене-
ния числа хромосом в клетках организма могут быть
кратными гаплоидному набору, а также не кратными
гаплоидному набору.
Особенностью ДНК, которая выполняет роль хра-
нилища генетической информации, является неограничен-
но варьирующая последовательность азотистых оснований
вдоль каждой ее цепи. Отсюда следует, что наиболее
вероятным механизмом мутации является замена одного
основания другим, т. е. изменение последовательности
оснований.
Мутация может возникнуть вследствие таутомерного
сдвига в положении атома водорода, принадлежащего,
например, аденину. Этот сдвиг приводит к неправиль-
ному спариванию аденина с цитозином вместо тимина,
с которым он обычно спаривается. При следующей репли-
кации ДНК цитозин, как правило, соединяется с гуанином
таким образом, что в определенной точке ДНК пара
оснований А — Т заменяется на пару Г — Ц.
Многочисленные типы замен оснований можно клас-
сифицировать следующим образом:
А^г А^Ц
t t
т^ц г
транзиции трансверсии
Замена пуринового основания на пуриновое или пири-
мидинового на пиримидиновое называется простой или
транзицией. Замена пуринового основания на пиримиди-
новое и наоборот называется сложной или трансверсией.
Различные мутагены обладают специфической способ-
ностью вызывать или транзиции, или трансверсии. На-
пример, включение аналогов оснований в ДНК (5-бром-
урацил, 2-аминопурин) приводит к транзиции; воздействие
на ДНК алкилирующих соединений (иприта, этиленими-
на) вызывает изменения оснований, которые способствуют
появлению трансверсий в результате нарушения спарива-
ния при репликации ДНК.
При обработке ДНК дезаминирующими агентами по-
являются необычные (минорные) основания, которые на-
136
рушают правильность спаривания при репликации. При
этом аденин превращается в гипоксантин, гуанин — в
ксантин, цитозин — в урацил. Гипоксантин и урацил спа-
риваются соответственно с цитозином и аденином. Это
приводит к мутациям типа транзиций. В качестве при-
мера дезаминирующего агента можно назвать азотистую
кислоту.
Интересной группой мутагенов являются так называ-
емые акридиновые красители (профлавин, акридин). Они
обладают свойством внедряться в молекулу ДНК при ее
репликации, однако вследствие слабой связи их с соседни-
ми основаниями при следующих репликациях они могут
выпасть из молекулы ДНК, что приведет к выпадению
основания в комплементарной цепи. Такая мутация назы-
вается выпаданием или делецией. Мутации, вызываемые
акридиновыми красителями, называются вставками, по-
скольку при спаривании внедрившегося акридинового кра-
сителя с любым основанием при репликации ДНК про-
исходит добавление основания в комплементарную цепь.
Когда ДНК выдерживается при pH ниже 4, некоторые
основания приобретают положительный заряд. Это при-
водит к расхождению цепей ДНК и в конце концов к
депуринизации, т. е. полному удалению А и Г.
При действии на ДНК ионизирующих излучений
могут наблюдаться разнообразные эффекты, такие как
разрывы ДНК или изменения некоторых оснований.
Причем излучения могут действовать на ДНК как не-
посредственно, так и косвенно, поскольку вдоль трека каж-
дой частицы возникает много ионов или радикалов, спо-
собных инициировать цепь химических реакций.
Одним из эффектов облучения ДНК УФ лучами являет-
ся димеризация тимина вследствие поляризации двойных
связей. Нарушение репликации из-за появления димера
приводит или к летальному исходу, или к мутации. Другим
эффектом, наблюдаемым при УФ излучении, можно счи^
тать появление нестойких аналогов оснований после
облучения пиримидинов. Эти аналоги оснований, несмотря
на кратковременность их существования, могут служить
причиной мутаций.
118. РАЗЛИЧАЮТСЯ ЛИ МУТАЦИИ ПО СВОЕМУ ДЕЙСТВИЮ НА
ОРГАНИЗМ!
В зависимости от действия на организм мутации
бывают летальные, полулетальные, нейтральные и полез-
ные. В большинстве случаев мутанты менее жизнеспо?
137
собны, чем исходные формы. Это закономерно, так как
наследственность организма и сам организм — хорошо
сбалансированная система и нарушение в любом ее звене в
большинстве случаев может вредно сказываться на разви-
тии организма.
Многие рецессивные мутации, не оказывая влияния
на организм в гетерозиготном состоянии, вызывают
гибель особей, гомозиготных по мутантному гену (напри-
мер, хлорофилловые мутации у растений, серповиднокле-
точная анемия у человека). Доминантные мутации также
часто детальны в гомозиготном состоянии, но и в гетеро-
зиготе мутантный ген вызывает значительные отклоне-
ния от нормы.
При полулегальной мутации рецессивные гомозиготы
какое-то время могут жить, но затем погибают из-за
резко сниженной жизнеспособности (например, гемофилия
и пигментная ксеродерма у человека, отсутствие оперения
у кур и др.).
Оценивая значение мутаций, нужно учитывать отно-
сительную целесообразность организмов. При изменении
условий окружающей среды нейтральные и даже вредные
мутации могут оказаться полезными. Появление мутан-
тов на границах ареала определенного вида может рас-
ширить его распространение за счет освоения новых
областей с неблагоприятными для исходных форм условия-
ми окружающей среды. Нужно учитывать и то, что дейст-
вие мутантных генов может изменяться в результате
рекомбинаций при скрещивании и благодаря естествен-
ному и искусственному отбору.
119. КАК ЭКСПЕРИМЕНТАЛЬНО ИНДУЦИРОВАТЬ МУТАЦИИ!
. Широкое использование разнообразных физических
и химических факторов для экспериментального получе-
ния мутаций было начато после того, как Г. А. Надсон,
С. Г. Филиппов и Г. Мёллер доказали мутагенное действие
рентгеновских лучей, а В. В. Сахаров открыл химический
мутагенез.
Для получения мутаций используются УФ лучи,
различные виды ионизирующих излучений (рентгеновские
лучи, у-лучи, быстрые и медленные нейтроны) и химиче-
ские вещества.
В результате воздействия ионизирующей частицы на
атомы облучаемого вещества происходит ионизация. При-
138
чем результаты воздействия разных видов ионизирующих
излучений различаются по плотности ионизации (т. е. по
числу пар ионов, образующихся на единицу объема) и
распределению ионизации в облученном веществе: чем
больше заряд частицы, тем выше плотность ионизации.
Причиной появления новых мутаций считалось прямое
воздействие ионизирующей частицы на молекулярную
структуру хромосом («теория мишени»). Однако облуче-
ние только питательной среды приводило к увеличению
частоты мутаций высеянных на нее бактерий и нейро-
споры, что и позволило выявить косвенное воздействие
облучения через химические изменения субстрата. Дейст-
вительно, энергия излучения поглощается не только в
хромосомах, но и в ядре и цитоплазме. Образующиеся
при этом ионы вызывают цепь физико-химических про-
цессов, растянутых во времени, в результате которых
могут возникать генные мутации или структурные хромо-
сомные перестройки. Важную роль в непрямом воздейст-
вии ионизирующего излучения играют свободные ради-
калы, возникающие при радиационном разложении во-
ды — основной составной части всех живых организмов.
Обладая высокой реакционной способностью,-эти радика-
лы расщепляют органические вещества, в том числе и
нуклеиновые кислоты.
Факторы, способствующие образованию свободных ра-
дикалов, усиливают мутагенный эффект. Так, повышение
концентрации кислорода во время облучения значительно
повышает частоту мутаций («кислородный эффект»). Изу-
чение влияния различных доз ионизирующей радиации
(рентгеновских лучей, у-лучей и др.) на частоту генных
мутаций выявляет прямую пропорциональную зависимость
частоты мутаций от дозы облучения. Причем не имеет зна-
чения, получит ли объект дозу за более короткое время —
при большей интенсивности облучения или за более про-
должительное время — при меньшей интенсивности облу-
чения.
Генные мутации могут быть вызваны воздействием
УФ лучей. Частота мутаций зависит от дозы облучения,
но до определенного предела, выше которого она не только
не увеличивается, но и снижается. Наибольшим мутаген-
ным действием обладают УФ лучи с длиной волны 250—
280 нм, что соответствует спектру поглощения ДНК.
Для экспериментального получения мутаций исполь-
зуются разнообразные химические соединения (этилен-
139
имин, N-нитрозоэтилмочевина и др.). Химическое воз-
действие вызывает определенные молекулярные изменения
в ДНК и влияет на фенотипическое выражение генов.
Очевидно, именно наличие мутагенного действия ряда
химических соединений, которые накапливаются в орга-
низме в результате обмена, позволяет объяснить увели-
чение частоты мутаций у людей пожилого возраста. Хи-
мические мутагены могут оказывать не только прямое,
но и косвенное действие на организм, подавляя или
уничтожая его естественные антимутагейы*.
Структурные перестройки хромосом, как и генные мута-
ции, возникают спонтанно и могут быть индуцированы
разнообразными физическими и химическими фактора-
ми. Однако зависимость частоты хромосомных перестроек
от дозы облучения в данном случае не прямолинейная,
так как конечный результат определяется разрывом хро-
мосом и соединением образовавшихся фрагментов. Если
разрыв одиночный, образовавшийся при воссоединении
фрагмент может занять только свое прежнее положение**.
Неправильные соединения фрагментов возможны лишь
при одновременном разрыве в двух местах. Вероятность
же одновременного двойного разрыва равна произведению
вероятностей одиночных разрывов, так как это независи-
мые события.
Так, если облучение при дозе 50 рентген вызывает
одиночные разрывы с частотой 1/100, т. е. 1 %, то вероят-
ность двух одновременных разрывов 1/100-1/100 =
= 1/10 000. При удвоении дозы облучения удвоится и
частота одиночных разрывов, а вероятность одновремен-
ного разрыва в двух местах будет равна 2/100 «2/100 =
= 4/10 000, т. е. увеличится в 4 раза. Таким образом,
наблюдается, квадратичная зависимость между дозой
облучения и частотой двух одновременных разрывов. По-
этому большие дозы облучения вызывают обычно много-
численные хромосомные перестройки. В данном случае
имеет значение, дается ли вся доза облучения однократно
или в несколько приемов. При однократном быстром облу-
чении большой дозой разрывы образуются одновременно
* Имеются данные о наличии у организмов соединений, кото-
рые предупреждают или противодействуют мутагенному эффекту ряда
веществ. Таким антимутагеном является, например, фермент каталаза,
который немедленно прекращает мутагенное действие пероксида
водорода.
** Концевые части хромосомы — теломеры не могут присое-
динять фрагменты хромосом.
140
во многих точках и увеличивается вероятность непра-
вильных воссоединений фрагментов. При многократном
или продолжительном облучении малыми дозами возника-
ющие одиночные разрывы могут восстанавливаться почти
полностью.
Эффект облучения могут значительно изменять различ-
ные дополнительные факторы, такие, например, как нали-
чие или отсутствие кислорода, ультразвук, видимый свет
и др. Эффект облучения зависит и от состояния хромосом
в период облучения: хромосомы сильнее повреждаются
в период деления, особенно в профазе и метафазе мейоза.
Причем облучение клеток в предсинтетический период
(Gi—удвоение хромосомных нитей еще не произошло)
приводит к хромосомным аберрациям, т. е. к фрагмента-
ции хромосом, а облучение в постсинтетический период
(G2) и на ранних стадиях деления — к хроматидным
аберрациям, т. е. к относительно независимому образо-
ванию и соединению фрагментов отдельных хрома-
тид. Благодаря свойству саморепродукции возникшие
структурные перестройки могут сохраняться в ряду по-
следующих клеточных делений. В мейозе можно наблю-
дать своеобразную конъюгацию хромосом, образование
хромосомных и хроматидных мостов, микроядер, трансло-
кацию и другие нарушения, приводящие к снижению
плодовитости облученных форм.
Жизнеспособность и другие признаки потомства опре-
деляются степенью нарушения генетической системы хро-
мосом. В результате разрывов и неправильных соединений
фрагментов возникают внутрихромосомные (делеции,
дефишенси, дупликации, инверсии) и межхромосомные
(транслокации) перестройки.
120. МОЖНО ЛИ ОПРЕДЕЛИТЬ ЧАСТОТУ МУТАЦИЯ!
Учесть все мутации, возникающие в организме, практи-
чески невозможно, особенно у высокоорганизованных
многоклеточных организмов. Частоту же мутирования
отдельных генов, контролирующих хорошо изученные в
генетическом отношении признаки и свойства организма,
можно учесть достаточно точно.
У микроорганизмов, например, легко определяется
частота обратных мутаций. Ауксотрофные мутанты (А-+а)
утрачивают способность синтезировать определенное ве-
щество, необходимое для нормального роста, и на пита-
тельной среде, лишенной этого вещества, культура не
14!
растет. Значит, если на такой
среде появляются растущие
Рис. 31. Определение частоты
мутаций методом С1В:
У — самец погибает; 2 — самец погибает
колонии, то у них восстанав-
ливается способность синте-
зировать данное вещество в
результате обратной мута-
ции. Число таких колоний
относительно общего числа
высеянных бактерий говорит
о частоте мутирования опре-
деленного гена. Если, напри-
мер, посеяно 108 живых бак-
терий, а выросло на селектив-
ной среде 25 колоний, то ча-
стота мутаций равна —=
= 2,5- 10"? 10
У дрозофилы частота ви-
димых мутаций определяется
методом сцепленных ХХ-хро-
мосом, рецессивных и сце-
пленных с полом леталь-
ных — методом С1В (рис. 31)
и Мёллер-5 аутосомных ле-
тальных — методом сбалан-
при наличии летали сированных деталей. На
основании использования этих методов было установлено,
что частота спонтанных летальных мутаций прибли-
зительно 1,2 %, а летальные мутации составляют 20—
25 % всех мутаций. Таким образом, общая частота
мутаций около 5 %, т. е. одна гамета из двадцати несет
мутацию. Принято считать, что средняя частота мутаций
гена 10“5—10~7.
Учет мутаций у человека проводится двумя метода-
ми — прямым и непрямым. Прямой метод применим в
основном к доминантным мутациям. Он сводится к реги-
страции частоты детей с ярко выраженными доминантны-
ми признаками, которые родились от родителей, не имев-
ших этих признаков. Правда, прежде необходимо убе-
диться, что 1) пенетрантность, т. е. частота проявления
аллеля определенного гена у разных особей родственной
группы организмов данного гена, полная*; 2) данный
* При полной пенетрантности мутантный ген проявляет свое дей-
ствие у каждой особи, обладающей им.
142
Таблица 7. Частота встречаемости некоторых доминантных
аутосомных мутаций у человека
Признак Вызываемая аномалия Количество му- тантных генов на 100 тыс. гамет
Ретинобластома опухоль на сетчатке глаза 0,4
Синдром Ваарден- бурга Мышечная дистрофия аномалия в развитии и пигментировании глаза, глухо- та и др. мышечная дистрофия 0,4 0,8
Эпилойя мозговая опухоль 0,8—1,2
Хондродистрофия Синдром Марфана хондродистрофические кар- лики удлинение скелета, ненор- v мальное расположение хруста- лика, порок сердца 1—1,4 0,5
признак никогда не возникает под действием рецессивных
аллелей; 3) признак не порождается ненаследственными
факторами; 4) признак обусловлен доминантным геном
только одного локуса. Если хотя бы одно из перечислен-
ных условий не подтверждено, результаты подсчета часто-
ты мутирования гена окажутся неточными.
Частоту мутаций правильнее выражать не числом
родившихся мутантных особей, а числом мутантных алле-
лей. Так, если мутантный организм появляется с частотой
1 особь на 12 тыс., то частота мутантного аллеля (один
на 24 тыс.) равна 4 • 10-5.
Непрямой метод основан на генетико-популяционных
расчетах.
Применение прямого и непрямого методов дало воз-
можность установить частоту мутирования нормальных
аллелей в доминантные патологические для более чем
десятка различных генов (табл. 7).
121. МОГУТ ЛИ ИЗНАЧАЛЬНО ВРЕДНЫЕ МУТАЦИИ СТАТЬ
ПОЛЕЗНЫМИ!
С подобным вопросом мы можем столкнуться, если
задумаемся, почему вообще существуют и сохраняются
вредные мутации, почему они не исчезают. В некоторых
случаях наличие патологии объясняется мутациями нор-
мального гена (например, гемофилия). Однако сущест-
вуют наследственные заболевания, большую частоту ко-
торых нельзя объяснить появлением новых спонтанных
143
мутаций. Должны существовать какие-то другие факторы,
поддерживающие существование «нежелательных» генов.
Одно из таких заболеваний — серповидноклеточная ане-
мия. У людей, страдающих этим заболеванием, гемоглобин
значительной части эритроциты плохо функционируют.
Однако эти люди более устойчивы к малярии, значит^
вредные мутации в определенных условиях становятся
полезными.
122. ОТ ЧЕГО ЗАВИСИТ ЧАСТОТА МУТИРОВАНИЯ!
Частота мутирования определяется генетической
структурой организма. Известны штаммы кишечной па-
лочки с необычайно высокой частотой спонтанных мута-
ций. У этих штаммов частота мутирования самых различ-
ных генов может превышать частоту мутирования генов
у обычных штаммов на 2—3 порядка. В некоторых случаях
удалось установить генетическую природу такого явления.
Генетический анализ показал, что признак высокой
мутабильности контролируется особыми генами. Для
микроорганизмов установлено, что спонтанные мутации,
ведущие к ауксотрофности по гистидину, т. е. потере
способности синтезировать гистидин, очень похожи на
мутации, индуцированные аналогами оснований. В вы-
сокомутабильных штаммах были обнаружены необычные
для нормальных штаммов азотистые основания — ана-
логи гуанина. Значит, мутация, приводящая к высокой
мутабильности, может быть следствием появления генов,
определяющих синтез необычных аналогов оснований.
Эффективность ионизирующих излучений определяется
как их физической природой, так и свойствами облу-
чаемого организма. Необходимо иметь в виду, что каждый
организм на определенных этапах онтогенеза имеет
различные адаптационные механизмы, способные контро-
лировать действие внешних факторов. Генотип контро-
лирует эффективность ионизирующих излучений. Очевид-
но, зависимость мутагенного эффекта ионизирующей ра-
диации от генотипа контролируется генами, которые
определяют состав ядра клетки, количество воды и кисло-
рода в ней, коллоидное состояние содержимого ядра и т. д.
Определяемые генами различия в облучаемом субстрате
обусловливают выход радиохимических веществ, ответ-
ственных за мутагенный эффект ионизирующих излучений.
Генотип определяет характер вторичных процессов в облу-
144
ченном организме, ведущих к реализации первичных нару-
шений, вызванных непосредственно облучением.
Таким образом, можно утверждать, что генотип дейст-
вительно определяет ту или иную степень мутабильности
организма.
Необходимо отметить неодинаковую чувствительность
к мутагенам разных участков хромосомы. Более того,
С. Бензер обнаружил неравномерное распределение мута-
ции по длине гена. Исследуя мутанты бактериофага Т4,
он установил, что 40 % спонтанных мутаций возникало
всего в двух сайтах исследуемых цистронов. Эти точки
преимущественного мутирования были названы «горячими
точками». Возможно, что на мутационную реакцию сайта
влияет конформация и стабильность спирали ДНК*
123. в какой степени мутационный процесс находится
ПОД ГЕНЕТИЧЕСКИМ КОНТРОЛЕМ!
В изучении генетического контроля мутабильности сло-
жилось два направления — определение автономной не-
стабильности генов, их аллелей и определение генов-
мутаторов. Нестабильные аллели, ревертирующие с повы-
шенной частотой, были описаны у кукурузы, нейроспоры,
фага Т4. Природа такой нестабильности объясняется
неустойчивостью определенной нуклеотидной последова-
тельности. Кроме того, открыты гены-мутаторы, которые
определяют общую мутабильность клетки. Ген mutT изме-
няет спонтанную частоту мутаций в 1000 раз, mutD — в
100 000 раз. Мутаторы не только стимулируют спонтан-
ную мутабильность, но и увеличивают частоту индуциро-
ванных мутаций. У бактериофагов имеется три типа генов,
контролирующих мутабильность: гены-мутаторы, измене-
ния в которых увеличивают частоту мутаций (hm); гены-
антимутаторы, уменьшающие частоту мутаций (рх), и
гены, обладающие обоими этими качествами, например
ген 43, контролирующий структуру репликативной ДНК-
полимеразы фага Т4.
124. ВСЕГДА ЛИ НАРУШЕНИЕ СТРУКТУРЫ ДНК ПРИВОДИТ
К ПОЯВЛЕНИЮ МУТАЦИИ!
Нет, не всегда. Большинство индуцированных физи-
ческими и химическими агентами нарушений ДНК исправ-
ляется с помощью нескольких механизмов репарации,
145
направленных на восстановление целостности молекулы
ДНК. Наиболее полно репарация ДНК изучена в УФ
облученных клетках. В процессе репарации УФ повреж-
дений различают фотореактивацию и темновую репа-
рацию.
Различают три типа репарации ДНК. Первый тип —
дорепликативная, или внерепликативная, репарация
включает фотореактивацию и различные формы темновой
эксцизионной репарации, направленной на вырезание
(эксцизию) участков ДНК с повреждениями. Второй
тип — пострепликативная, или внутрирепликативная, ре-
парация производится с помощью механизмов, участ-
вующих в процессах рекомбинации и репликации ДНК,
и обеспечивает восстановление участков, не удаленных
в ходе репарации первого типа. Оба типа репарации устра-
няют основную часть предмутационных повреждений.
Третий тип репарации — индуцируемая репарация, за-
висящая у бактерий от генов гес А и lex А. Характерной
чертой этого типа репарации является неточность вос-
становления структуры ДНК, поэтому она называется
репарацией, «склонной к ошибкам», в отличие от отно-
сительно безошибочной эксцизионной репарации.
Кроме данных типов репарации, у £*. coll действует
еще один тип репарации ДНК, называемый адаптивным
ответом на действие алкилирующих агентов. Адаптивный
ответ наблюдается в случае, если клетка до обработки
большой дозой алкилирующих агентов подвергается
воздействию очень низких нелетальных доз тех же аген-
тов. Подобная предварительная обработка вызывает
индукцию ферментов репарации, специфично действующих
на алкилирование ДНК. Один из этих ферментов
индуцируемая О6-метил-гуанин-ДНК-метилтрансфера-
за — переносит метильную группу с О6-метилгуанина
(основного предмутационного повреждения в алкилиро-
ванной ДНК) на остаток цистеина, входящий в состав
самого фермента, и тем самым непосредственно исправ-
ляет повреждение ДНК.
Другой фермент — индуцируемая ДНК-гликолиаза —
удаляет ряд потенциально летальных повреждений в ДНК,
включая 3-метиладенин, 3-метилгуанин и др.
Системы индуцируемой репарации обнаружены также
и у эукариот. Так, гены, функционально близкие к генам,
контролирующим индуцируемую репарацию у бактерий,
обнаружены у дрожжей и крыс.
146
125. ЗАВИСИТ ЛИ ЧАСТОТА МУТАЦИЙ ОТ ПОЛА И ВОЗРАСТА!
Установлено, что частоты рецессивных, сцепленных с
полом летальных мутаций у дрозофилы выше для
спермиев, чем для яйцеклеток. У растений в хранившейся
пыльце увеличивается число мутантных аллелей.
У человека получены доказательства повышения часто-
ты рождения мутантов у родителей пожилого возраста.
Установлено также, что частота рецессивных, сцепленных
с полом мутаций в мужских гаметах выше, чем в женских
(гемофилия).
Таблица 8. Относительная Частота болезни Дауна
у детей в зависимости от возраста матери
Возраст матери Сравнительная частота болезни, если первую группу принять за единицу
15—19 20—24 25—29 30—34 35—39 40—44 45 и старше 1 1,3 1,3 3,7 11,0 41,3 104,0
Характерным примером, иллюстрирующим зависи-
мость частоты мутации от возраста матери, является
болезнь Дауна (табл. 8). У женщин, родивших в более
позднем возрасте, дети с болезнью Дауна составляют
несколько процентов, тогда как у молодых матерей —
доли процента, так как с возрастом увеличивается часто-
та нерасхождения хромосом в мейозе (при образовании
половых клеток).
126. КАК ДЕЙСТВУЮТ ГЕНЫ-МУТАТОРЫ!
Полной противоположностью неравнозначному мути-
рованию отдельных сайтов ДНК является сбалансирован-
ное увеличение частоты спонтанного мутирования сразу
всех генов, иногда внезапно возникающее у высших
(дрозофила, кукуруза) и низших организмов. Например,
выделена так называемая «гарвардская линия» £. coll,
характеризующаяся повышенной частотой спонтанных
мутаций. Мутантный ген ast (нестабильный) оказал
влияние на ряд биохимических процессов. Известны и
147
другие примеры мутаторных генов, способствующих уве-
личению частоты возникновения всех точковых мутаций.
Действие гена-мутатора проявляется не только в дан-
ной клетке, но и в любой другой, куда его удастся пере-
нести. Так, передача гена-мутатора ast линии £. coli
К при помощи конъюгации другому хозяину привела к
повышению частоты спонтанных мутаций в 1000 раз.
Было установлено, что все мутации по гистидину,
спонтанно возникающие у сальмонелл (один из высоко-
мутабильных штаммов), очень похожи на мутации, инду-
цированные аналогами оснований. При хроматографи-
ческом анализе оснований этого штамма было обнаружено
помимо обычных оснований аденина, тимина, гуанина,
цитозина необычное основание, которого нет у нормаль-
ных в генетическом отношении штаммов,— аналог гуани-
на. Эти данные свидетельствуют о том, что мутация,
приводящая к высокой мутабильности, может детермини-
ровать синтез мутагенного аналога какого-либо осно-
вания.
127. МОЖЕТ ЛИ ВОССТАНАВЛИВАТЬСЯ ДИКИЙ ФЕНОТИП
У МУТАНТНЫХ ФОРМ?
Если мутация гена А приводит к его превращению
в рецессивный аллель, это прямая мутация, т. е. А~^а.
Возможны мутации в противоположном направлении —
проявление мутации приводит к полному или частичному
восстановлению дикого типа, т. е. Такие мутации
называются обратными или реверсиями. Для изучения
обратных мутаций удобно использовать микроорганизмы.
Многие мутанты микроорганизмов характеризуются тем,
что они утратили способность синтезировать то или иное
вещество, иначе говоря, ростовой фактор (аминокислота,
витамин, азотистое основание и т. д.). На питательной
среде, лишенной данного вещества, мутантная культура
не растет. Однако отдельные колонии, которые растут и без
добавки ростового фактора, все же удается обнаружить.
Эти колонии являются результатом обратной мутации
некоторых клеток а~+А: клетки восстанавливают спо-
собность синтезировать данный ростовой фактор само-
стоятельно.
При индукции обратной мутации часто неясен вопрос,
идентичен ли аллель, возникший в результате обратной
мутации, исходному или нет. Если ген А мутирует в
состояние а, а затем происходит обратная мутация, то,
148
как правило, возникает новый аллель А\ не вполне иден-
тичный аллелю А и обладающий несколько измененной
активностью. Такая мутация, в результате которой про-
исходит частичное или полное восстановление признака,
измененного при первичной мутации, называется супрес-
сорной, а гены, изменение которых приводит к восстановле-
нию прежнего фенотипа,— генами-супрессорами.
Наличие супрессорной мутации определяется генети-
ческими методами. Согласно определению при супрессор-
ной мутации локус, претерпевший прямую мутацию,
остается не затронутым, и поэтому среди потомства от
скрещивания между диким типом и ревертантом можно
обнаружить мутантные формы.
Мутации со сдвигом порядка считывания так же, как
и нонсенс-мутации, затронувшие любую пару оснований
в цистроне, приводят к тому, что аллель дикого типа
перестает функционировать (нуль-аллель). Чтобы не-
функционирующий аллель ревертировал к дикому типу,
необходимо восстановление именно той пары оснований,
которая была бы изменена в результате мутации. Поэтому
истинные обратные мутации крайне редки.
Примером обратных мутаций у человека могут служить
изредка наблюдаемые атавизмы.
128. В ЧЕМ СУЩНОСТЬ МНОЖЕСТВЕННОГО АЛЛЕЛИЗМА!
МЕНЯЕТСЯ ЛИ СООТНОШЕНИЕ ФЕНОТИПОВ
В ГИБРИДНОМ ПОТОМСТВЕ ПРИ МНОЖЕСТВЕННОМ АЛЛЕЛИЗМЕ!
В рассмотренных примерах мы сталкивались лишь с
двумя аллельными состояниями локуса, например А — а,
W — w. В результате взаимодействия этих аллелей наблю-
далось полное или неполное доминирование определенного
признака. В ряде случаев локус может иметь несколько
состояний, т. е. множественный аллелизм. Множественный
аллелизм для генов, контролирующих системы несовмести-
мости, выступает как фактор отбора, препятствующий
образованию зигот и организмов определенных зигот.
Примером множественного аллелизма является серия
множественных аллелей si, S2, s3, ...» srt, обеспечивающих
самостерильность многих растений; двенадцать различ-
ных состояний одного локуса у дрозофилы, обусловливаю-
щих разнообразие окраски глаз (w — белые, we — эозино-
вые, wa — абрикосовые, wch — вишневые, шт — пятнистые
и т. д.); серия множественных аллелей окраски шерсти
у кроликов («сплошная», гималайская, альбинос и т. д.);
149
аллели /А, /в, /°, определяющие группы крови у человека,
и т. д. Серия множественных аллелей — результат мути-
рования одного гена.
Обусловленность признака серий множественных алле-
лей не меняет соотношения фенотипов в гибридном по-
томстве. Во всех случаях в генотипе присутствует только
одна пара аллелей, их взаимодействие и определяет разви-
тие признака.
129. ЧТО ТАКОЕ АНТИМУТАГЕНЕЗ!
В начале 50-х годов XX в. была установлена возмож-
ность контроля спонтанного и индуцированного мутаге-
неза: было показано, что пуриновые рибонуклеозиды
тормозят возникновение мутаций у £. colt. По аналогии
с мутагенами эти вещества были названы антимутагенами,
а снижение уровня спонтанного и индуцированного мути-
рования — антимутагенезом, или «защитой».
При предварительном введении (перед облучением) в
организм некоторых химических соединений — протекто-
ров возможно ослабление эффекта от ионизирующего
облучения. «Защитное» действие при использовании иони-
зирующих излучений и химических мутагенов выявили
сульфаниламидные препараты, антибиотики, кофеин,
цистамин, алкиламинотиофосфаты и др.
Механизмы модификации эффекта воздействия мутаге-
нов по химическому строению веществ разнообразны,
например повышение активности систем естественной за-
щиты клеток и организмов и пострадиационного вос-
становления и др.
Антимутагенный эффект зависит от концентрации
вещества — протектора, являющегося специфичным для
разных видов растений и животных.
130. НАСЛЕДУЮТСЯ ЛИ ПРИОБРЕТЕННЫЕ ПРИЗНАКИ!
Приобретенным называют признак, изменившийся под
непосредственным влиянием среды, упражнения или не-
упражнения органов. Например, при содержании живот-
ных в холодных помещениях у них усиливается развитие
шерстного покрова: шерсть становится длиннее, гуще, уве-
личивается количество пуха в подшерстке. Особенностью
этих признаков является приспособление к определенным
150
условиям среды, поэтому их называли благоприоб-
ретенными.
Вопрос о наследовании приобретенных признаков
долгое время не вызывал сомнений. Только в XX в. после
появления хромосомной теории наследственности он был
подвергнут критике. Споры велись вокруг вопроса, может
ли изменение условий вызвать адекватное (приспособи-
тельное) изменение наследственного материала.
Благодаря открытию механизмов наследственности и
законов наследования признаков стало ясно, что гено-
тип организма — это сложная система генов и признак
развивается под влиянием всего генотипа как целого,
Поэтому очевидно, что признание возможности адекват-
ного изменения признака и генотипа организма не соот-
ветствует действительности. Современная генетика дает
строгий ответ на поставленный вопрос: приобретенные
признаки не наследуются, так как при их возникновении
генотип организма не изменяется.
Несмотря на то, что модификационная изменчивость
является ненаследственной, все же способность к таким
изменениям, ограниченная нормой реакции генотипа орга-
низма, имеет важное эволюционное значение. Если моди-
фикационные изменения приспособительного значения
возникают при постоянно действующих в ряду поколений
факторах среды, которые способны вызывать мутации,
определяющие такие же изменения, может создаться
впечатление наследственного закрепления модификаций.
131. ИГРАЮТ ЛИ МУТАЦИИ КАКУЮ-ЛИБО РОЛЬ В ЭВОЛЮЦИИ!
Так как мутации, являясь нарушением готового гене-
тического материала, в той или иной степени прошедшего
проверку естественным отбором, должны давать резкие
отклонения от нормы, то можно предположить, что они не
в состоянии обеспечить ход прогрессивной эволюции. При
определении эволюционной значимости мутаций необходи-
мо иметь в виду, что их приспособительная ценность может
меняться со временем. Вредные прежде мутации могут
оказаться полезными в новых условиях и спасти вид от
исчезновения. В этом и заключается огромное преимущест-
во диплоидности, позволяющее рецессивным мутациям
сохраняться в гетерозиготном состоянии до момента, когда
они смогут проявиться. Ч. Дарвин приводил данные о
преобладании среди насекомых, обитающих на океани-
ческих островах, где постоянно дуют сильные ветры,
151
особей с рудиментарными крыльями, поскольку в таких
условиях крылья не нужны и преимущество имеют бескры-
лые насекомые, которые в меньшей степени уносятся
ветром в море. Следовательно, в таких условиях отбирать-
ся будут бескрылые мутанты. Значит, вредная в норме
мутация в данном случае оказалась полезной.
Мнение, будто мутации — это редкие отклонения от
нормы, не совсем верно. Резко выраженные мутации
определить легко. Тщательный анализ популяций показы-
вает, что слабо выраженные мутации также широко
распространены. Кроме того, организмы в процессе эволю-
ции выработали своеобразные приспособления против
мутаций, представляющих собой резкое отклонение от
нормы,— появились так называемые гены-модификаторы,
которые изменяют степень проявления мутаций.
Таким образом, можно сделать вывод, что встречаемые
в природных условиях мутации представляют собой резерв
наследственной изменчивости. Поскольку мутации — это
ненаправленный тип изменчивости, в популяции в гетеро-
зиготном состоянии мутации сохраняются «на все случаи
жизни» и вид не будет застигнут врасплох резким изме-
нением условий существования.
Мутации являются основным материалом эволюции,
так как отбор мутаций, оказавшихся в тех или иных
условиях приспособительными, формирует новые разно-
видности и виды организмов.
132. ВЛИЯЕТ ЛИ ОКРУЖАЮЩАЯ СРЕДА НА ПРОЯВЛЕНИЕ ГЕНОТИПА!
Когда биологи заинтересовались проблемами наследст-
венности, были начаты поиски признаков, передающихся
по наследству. Было замечено, что многие аспекты жизни
имеют наследственную основу и многие признаки могут
проявляться в различных формах. Например, люди отли-
чаются друг от друга цветов волос, окраской глаз, окрас-
кой кожи, группой крови и т. д. Одни из этих признаков
более важны, другие — менее, но все они наследственны.
Изучение наследственности основано на выявлении
сходства и различий между родителями и потомством.
При изучении наследования того или иного признака
необходимо помнить, что изучаемый признак находится
в окружении других признаков, которые могут влиять на
его проявление. Кроме того, все организмы всегда испы-
тывают воздействия внешних факторов, которые могут
изменить степень проявления того или иного признака.
152
25 °C
16’0
Рис. 32. Влияние
температуры на формирование фенотипа
у дрозофилы
Только при строгом соблюдении постоянства условий
можно быть уверенным в том, что наблюдаемые различия
являются генетическими.
Наследственность определяет, каким организм может
быть, но не каким он будет. Например, у дрозофилы
имеется ген, определяющий форму крыльев. При выращи-
вании мух с данным геном при 25 °C они имеют крылья,
153
сильно загнутые вверх, а при 16 °C нормальные. Однако
при понижении температуры данный ген не исчезает, он
вновь может проявиться, если следующее поколение выра-
щивается при 25 °C (рис. 32). С подобным явлением мы
сталкиваемся при изучении кукурузы. У некоторых сортов
кукурузы зерна остаются желтыми, если на них не падает
солнечный свет, но после освещения солнечным светом
на початках появляются пурпурные зерна.
Имеются, однако, признаки, на которые окружающая
среда мало влияет. Например, полидактилия у человека
(появление дополнительных пальцев) совершенно не за-
висит от окружающих условий. К признакам такого типа
относятся и цветовая слепота, «лысость», типы крови,
окраска кожи и глаз, способность ощущать вкус некоторых
веществ и др.
Выяснение роли генов и среды в развитии фенотипа
является ведущей проблемой генетики развития, которая
включает вопросы, связанные с изучением действия гена
в онтогенезе, регуляцией этого действия, фенотипической
реализацией генетической информации. Генетика развития
смыкается с молекулярной биологией, экспериментальной
эмбриологией, цитогенетикой и иммунологией.
133. МОЖЕТ ЛИ ИЗМЕНЯТЬСЯ ЧИСЛО ХРОМОСОМ У ОРГАНИЗМА!
Число и форма хромосом является систематическим
признаком для каждого вида. Однако если речь идет о
постоянстве числа хромосом, то следует иметь в виду и
относительное постоянство, так как число хромосом в клет-
ках соматических тканей может меняться в онтогенезе.
Явление кратного увеличения числа хромосом в клетке
называется полиплоидией. Полиплоидные клетки могут
возникать при 1) эндомитозе и нарушении митоза в
клетках соматических тканей; 2) нарушениях мейоза,
приводящих к неправильному расхождению хромосом и
образованию диплоидных нередуцированных гамет, слия-
ние которых дает начало полиплоидному организму, и
3) действии мутагенов. Таким образом, могут возникать
полиплоидные ткани* и организмы. Помимо этого, может
наблюдаться некратное изменение числа хромосом, приво-
дящее к образованию гетероплоидов.
Полиплоиды по сравнению с исходными диплоидными
* Организмы, имеющие генетически различающиеся участки
тела, называются химерами.
154
организмами могут иметь большую вегетативную массу,
более крупные цветки и семена (рис. 33, 34). Подобное
явление чаще всего наблюдается у перекрестноопыля-
ющихся растений. Наиболее общим свойством поли-
плоидов является увеличение размеров клеток и пыльце-
вых зерен. С увеличением размеров клеток иногда наблю-
дается уменьшение их числа. С изменением объема клеток
связано изменение некоторых их физиологических свойств:
относительное увеличение количества воды в клетке,
уменьшение осмотического давления, изменение содержа-
ния различных веществ — белков, хлорофилла, витами-
нов. Полиплоидные растения более устойчивы к воздейст-
вию неблагоприятных факторов внешней среды, поскольку
'вероятность проявления у них вредных мутаций меньше,
чем у диплоидных растений. У полиплоидов рецессивные
мутации чаще остаются в гетерозиготном состоянии.
Рис. 33. Цветки тюльпана (I) и нарцисса (II):
а — диплоидные; б — тетра плоидные
Рис. 34. Семена диплоидной (а) и тетраплоидной (б) ржи
155
Интересно отметить, что «живые ископаемые» расте-
ния — представители древних растительных групп —
часто оказываются полиплоидами. Так, среди псилофитов
имеются виды, содержащие от 100 до 400 хромосом.
Известно, что у папоротника число хромосом может
достигать 500. Полиплоидия явилась приспособительным
механизмом сохранения этих древних форм.
Рис. 35. Колосья пшенично-ржаного амфидиплоида (а) и исход-
ных видов — пшеницы (б) и ржи (в)
Полиплоиды (эуплоиды) могут классифицироваться по
характеру изменений в числе хромосом. При увеличении
числа хромосом за счет одного и того же гаплоидного
набора получаются автополиплоиды (триплоиды, тетра-
плоиды, пентаплоиды и т. д.). В случае увеличения числа
хромосом у гибридных форм получаются аллополиплоиды.
Аллополиплоиды 2rti+2/i2 иначе называются амфиди-
плоида ми (рис. 35). Если изменение числа хромосом не
кратно гаплоидному, это гетерополиплоиды.
Все типы полиплоидии могут иметь определенное зна-
чение для селекционной работы.
156
134. КАКОВЫ ОСОБЕННОСТИ И ЗНАЧЕНИЕ ГАПЛОЦДИИ!
Гаплоидия — это уменьшение числа хромосом до оди-
ночного набора, т. е. все хромосомы представлены в
единственном числе. Такое уменьшение обычно происходит
при редукционном делении. В жизненном цикле боль-
шинства организмов гаплоидная фаза непродолжительна,
исключение составляют низшие растения. Крайне редуци-
рована она у животных: гаплоидны только гаметы.
В результате партеногенеза или андрогенеза могут
возникать гаплоидные организмы и у растений, и у живот-
ных. Гаплоидные организмы всегда меньше диплоидных,
характеризуются низкой жизнеспособностью и обычно
бесплодные. Из-за отсутствия гомологичных хромосом в
мейозе нет конъюгации, расхождение хромосом к полю-
сам беспорядочное и образующиеся клетки нежизнеспо-
собны. Вероятность же отхождения всех хромосом к одно-
му полюсу и образования гаплоидной клетки мала. Гапло-
иды представляют интерес, поскольку их фенотип
полностью совпадает с генотипом, так как проявляются
все рецессивные гены.
Гаплоиды имеют практическое значение: если у гапло-
ида удвоить число хромосом, то в течение одного поколе-
ния получится организм, гомозиготный по всем генам.
Создание же гомозигот путем скрещивания организмов,
имеющих общих предков, т. е. инбридинга,— длительный
процесс, требующий смены нескольких поколений.
Гаплоиды можно получить, искусственно вызывая
партеногенез или андрогенез. С определенной частотой
для каждого вида гаплоиды появляются в посевах спон-
танно. Широкое распространение получают методы созда-
ния гаплоидов из культур пыльников.
135. ЧТО ТАКОЕ ГЕТЕРОПЛОЦДИЯ! КАКОВО ЕЕ ЗНАЧЕНИЕ!
Гетероплоидия (анеуплоидия) —явление, при котором
клетки организма содержат измененное число хромосом,
не кратное гаплоидному набору. Формы, имеющие допол-
нительные хромосомы, называются полисомиками. Форма
2п +1 — трисомик, так как одна хромосома повторена
трижды. Форма 2п — 1 — моносомик, так как одна хро-
мосома представлена в единственном числе. Форма 2м —
— 2 — асомик (нуллисомик), так как отсутствует пара
гомологичных хромосом.
Добавление и утрата одной хромосомы могут быть
157
JEST—р 3CTOWi«
Нормальная
7^j Z/EESB-lg
Рис. 36. Варьирование, формы и размеров коробочки у трисомиков
дурмана.
Цифрами обозначены пары хромосом
/Л^^/ЯдащППДО 17Ш^18
IS Я&^102№К=У2 2ЯНШМ/
одновременно в двух и более парах: 2п+1 + 1 —двойной
трисомик, 2п —1 —1 —двойной моносомик и т. д.
Гетероплоидные клетки могут появляться в результа-
те нарушений мейоза или митоза. Например, нерасхожде-
ние пары хромосом (АА) в мейозе приводит к образова-
нию гамет п-^А и п—А. При участии таких гамет в опло-
дотворении появятся гетероплоидные формы 2п-\-А и
2п—А. Добавление или утрата одной хромосомы вызывает
значительные изменения фенотипа, благодаря которым
можно установить влияние отдельных хромосом и генов, в
них локализованных, на проявление определенных свойств
и признаков организма (рис. 36). Анеуплоиды встречаются
как у растений и животных, так и у человека. Анеу-
плоидные растения обладают низкой жизнеспособностью
и плодовитостью. Однако анеуплоидные формы, в част-
ности моносомики, имеют практическое значение, так как
используются в генетической инженерии для направлен-
ного «конструирования» определенных генотипов путем
введения желательных генов, а также в селекции при
158
замещении Х-хромосом для улучшения сорта растений.
Путем замещения отдельных хромосом получены новые
формы пшеницы, устойчивые к ржавчине и другим заболе-
ваниям.
У человека также встречаются случаи гетероплоидии,
которые вызывают хромосомные болезни.
136. ЧТО ТАКОЕ ПОЛИПЛОИДНЫЙ РЯД!
При изучении хромосомных наборов различных расте-
ний была обнаружена любопытная закономерность. Ока-
зывается, что виды одного рода можно расположить в ряд
по степени увеличения числа хромосом. Так, например,
род Triticum (пшеница) имеет много видов. Пшеница
однозернянка в ядрах клеток содержит 14 хромосом,
твердая, польская, ветвистая — 28, мягкая — 42 хромосо-
мы. Изменяется число хромосом — изменяются и свойства
растения. Так, пшеница однозернянка является диплоид-
ной (2/?), пшеница твердая, польская и ветвистая —
тетраплоидной (4л), а пшеница мягкая — гексаплоидной
(6л). Указанные виды пшениц составляют полиплоидный
ряд.
Таким образом, группа родственных видов, у которых
наборы хромосом составляют ряд возрастающего увели-
чения основного числа хромосом, называется полиплоид-
ным рядом.
Подобные полиплоидные ряды определены и у других
родов растений. Род паслен характеризуется следующим
полиплоидным рядом: 12, 24, 36, 48, 60, 72, 96, 108, 144
хромосомы. Род роза представляет ряд, члены которого
имеют 14, 28, 42, 56 хромосом. Полиплоидные ряды не
обязательно содержат только автополиплоидные расте-
ния? В роде крепис, например, наблюдается четко выра-
женная гетероплоидия. Разные виды имеют 6, 8, 10, 12,
16, 18, 24, 40, 42 хромосомы. Есть род и с двумя полиплоид-
ными рядами, например у рода вика виды одного ряда
имеют 12 и 24 хромосомы (основное число х~6), а виды
другого— 14 и 28 хромосом (основное число х=7).
137. КАК ЭКСПЕРИМЕНТАЛЬНО ПОЛУЧИТЬ ПОЛИПЛОИДЫ!
Впервые полиплоидные клетки экспериментально были
получены И. И. Герасимовым (1889 г.) у водоросли спиро-
гиры при воздействии на нее низких температур в период
159
деления. Охлаждение приостанавливает деление, в резуль-
тате чего появляются двуядерные клетки или клетки с
тетра плоидными ядрами.
У растений, способных к регенерации, полиплоиды
можно получить методом декапитации, т. е. удалением
верхушки побегов и подавлением развития боковых по-
бегов. При этом на поверхности среза развивается каллюс
(наплыв), из которого начинают дифференцироваться по-
беги, часто тетраплоидные. Появление тетраплоидных кле-
ток — результат слияния митотических веретен одновре-
менно делящихся двуядерных клеток, образуемых в
большом количестве в зоне роста декапитированного по-
бега.
Долгое время главным источником экспериментального
получения полиплоидных форм были отдаленные скрещи-
вания. Возникающие в потомстве межвидовых и межро-
довых гибридов полиплоиды были результатом слияния
нередуцированных гамет.
Наиболее эффективным методом получения полиплои-
дов оказался метод воздействия на ход митоза и мейоза
разнообразными химическими веществами.
Так, в 1896 г. И. И. Герасимов обнаружил, что при
действии на делящиеся клетки спирогиры хлороформа,
эфира или хлоралгидрата в них увеличивается число
хромосом.
Для изменения числа хромосом в клетке применяются
разнообразные химические соединения. Наибольший вы-
ход полиплоидных растений дало использование алкало-
ида колхицина* (А. Ф. Блексли, О. Т. Эйвери, 1937 г.).
Колхицин подавляет образование митотического веретена
в клетках, приступивших к делению, в результате чего
удвоенные хромосомы не расходятся и клетка оказывается
тетраплоидной. Следует, однако, отметить, что продолжи-
тельное воздействие колхицина может привести к высокой
степени плоидности.
Если воздействию подвергаются соматические клетки,
то полиплоидными они становятся не все и растение
приобретает химерное строение. Если же воздействию
подвергаются генеративные клетки, возникают нередуци-
рованные гаметы, дающие начало полностью полиплоид-
ным растениям.
* Колхицин добывают из растения Colchicum (семейство лилейных)
и синтезируют искусственно.
160
138. ЕСЛИ ПОЛИПЛОИДНЫЕ ФОРМЫ ЛУЧШЕ ДИПЛОИДНЫХ,
ТО ПОЧЕМУ НЕ ВСЕ ФОРМЫ РАСТЕНИИ, ИСПОЛЬЗУЕМЫЕ
В СЕЛЬСКОХОЗЯЙСТВЕННОМ ПРОИЗВОДСТВЕ, ПЕРЕВЕДЕНЫ
НА ПОЛИПЛОИДНЫЙ УРОВЕНЬ!
Увеличение числа хромосом не всегда дает положитель-
ный результат. Для каждого вида организмов характерен
оптимальный уровень полиплоидизации, зависящий от
особенностей организма, которые определяются историей
создания данного вида или сорта, его генотипом и условия-
ми окружающей среды.
Невысокая степень полиплоидизации, как правило,
сопровождается увеличением вегетативной массы, разме-
ров цветков, плодов и семян, -что является ценным для
большинства культурных растений. При высокой же степе-
ни полиплоидизации замедляется рост растений и падает
их продуктивность. Поэтому для получения полиплоидов
перспективны только формы с небольшим числом хро-
мосом и формы, у которых используются вегетативные
части.
У автополиплоидов в профазе мейоза наряду с бива-
лентами образуются поливаленты (из-за конъюгации не-
скольких гомологичных хромосом). Расхождение полива-
лентов в анафазе I мейоза случайное и приводит к образо-
ванию анеуплоидных клеток, бесплодию и понижению
жизнеспособности растений. Причем если число наборов
хромосом четное, например у тетраплоидов, мейоз может
проходить и без нарушений, с образованием диплоидных
гамет. Если же число наборов хромосом нечетное, на-
пример у триплоидов, нарушения мейоза неизбежны, так
как образуются либо триваленты, либо биваленты и уни-
валенты, и расхождение хромосом при делении окажется
неупорядоченным, что приведет к образованию маложиз-
неспособных анеуплоидных клеток. По этой причине для
получения триплоидных семян необходимо постоянно про-
водить скрещивания тетраплоидных и диплоидных форм.
Увеличение числа хромосом не всегда сопровождается
увеличением размеров различных органов и частей расте-
ния. Разные виды по-разному реагируют на удвоение
числа хромосом. Например, автотетраплоидная рожь зна-
чительно превосходит диплоидную по развитию вегета-
тивных органов и размерам семян, а перевод 42-хромосом-
ной пшеницы на 84-хромосомный уровень вызывает де-
прессию в росте и развитии. Следовательно, существуют
определенные пределы в увеличении числа хромосом и
6—1740
161
наиболее оптимальные уровни плоидности. К лучшим
сортам пшеницы относятся виды, имеющие 28 и 42 хро-
мосомы, овса — 42, дикие виды риса имеют 12, а куль-
турный вид (полиплоид) — 24 хромосомы. У хлопчатника
наиболее ценные сорта относятся к 52-хромосомным ви-
дам, в то время как сорта с 26 хромосомами имеют огра-
ниченное распространение.
139. ПОЧЕМУ ПОЛИПЛОИДИЯ У ЖИВОТНЫХ ВСТРЕЧАЕТСЯ РЕДКО!
Полиплоидия у животных встречается значительно
реже, чем у растений. Это связано с тем, что большинство
животных двуполые. Полиплоидия, вызывая изменение
соотношения половых хромосом и аутосом, затрудняет
определение пола, в результате чего такие формы ока-
зываются маложизнеспособными и бесплодными. Это
предположение подтверждается тем, что среди гермафро-
дитных организмов, особенно размножающихся партено-
генетически, полиплоидия — явление нередкое (например,
триплоидная раса Trichoniscus elisabetae и тетраплоидная
раса Artemia salina).
Триплоиды и тетраплоиды могут образовываться как
результат полиспермии и соматического удвоения хро-
мосом.
Если у земноводных и пресмыкающихся (лягушки,
тритоны, саламандры, ящерицы) в потомстве появляются
триплоидные и тетраплоидные личинки, то у млекопи-
тающих (в частности, у мышей) триплоидные эмбрионы
не доживают до рождения. Очевидно, это связано с боль-
шими нарушениями в развитии эмбрионов.
В то же время у млекопитающих, как и у других много-
клеточных животных, в соматических клетках ряда тка-
ней полиплоидия распространена довольно широко (воз-
никает в результате эндомитозов).
В эволюции животного мира полиплоидия, очевидно,
не сыграла большой роли.
140. В ЧЕМ ЗАКЛЮЧАЕТСЯ ЯВЛЕНИЕ ПОЛЯРНОСТИ МУТАЦИИ!
Полярные мутации инактивируют не только гены,
в которых они возникли, но и влияют на активность сле-
дующих генов в опероне. К такому эффекту приводят
вставки чужеродной ДНК в оперон. Например, при внедре-
нии в оперон элемента IS2 в одной из двух возможных
162
ориентаций он прерывает транскрипцию последующих
генов оперона, так как именно в этой ориентации он со-
держит p-зависимый терминатор транскрипции. Мутации,
обладающие полярностью, т. е. заменой оснований, приво-
дят к возникновению нонсенс-триплетов. При этом чем
больше расстояние от возникшего нонсенс-триплета до
начала следующего гена, тем выше полярность. Сущест-
вуют две гипотезы для объяснения подобной зависимо-
сти. Одна предполагает, что при трансляции рибосома,
встретившая нонсенс-кодон, покидает иРНК и между этим
кодоном и началом следующего гена матрица становится
свободной и доступной мишенью для эндонуклеазы. При-
чем чем больше мишень, тем больше вероятность ее
поражения. По другой гипотезе прерывание транскрипции
объясняется тем, что РНК-полимераза с большим тру-
дом продвигается по участку иРНК, свободному от
рибосом.
141. МОГУТ ЛИ ФАГИ БЫТЬ ПРИЧИНОЙ МУТАЦИЙ!
Местом прикрепления профага X к бактериальной
хромосоме является участок attk Установлено, что в случае
делении этого локуса частота лизогенизации клеток сни-
жается в 200 раз. При этом 1 % лизогенизированных
клеток оказываются ауксотрофными по тому гену, где
прикрепился профаг. Следовательно, внедрение профага
в некоторые гены изменяет их, приводя к возникновению
мутации. Чаще всего профаг X и мутация локализуются
в генах ргоВ, ргоА. Мутации могут быть вызваны и внедре-
нием фага (фаг Ми), не имеющего определенной точки
прикрепления на бактериальной хромосоме, например при
возникновении мутации chlD (ген нитрат-хлоратредукта-
зы) под влиянием фага Ми наблюдается увеличение рас-
стояния между £Ц/-опероном и attK. В результате этого
фаг X теряет характерную для него способность трансдуци-
ровать гены gaZ-оперона. Из таких штаммов были выделены
трансдуцирующие частицы фага %, которые несли участки
генома профага Ми. Как и в случае с фагом X, реверсии
мутаций, возникших под влиянием фага Afu, сопровожда-
лись потерей лизогенного состояния. Характерным свой-
ством Mu-инсерций является их полярный эффект в оперо-
нах, т. е. подавление функции генов, расположенных
дистально от точки внедрения Ми по отношению к опе-
ратору.
163
142. КАКИМ ОБРАЗОМ КЛЕТКА ИЗЛЕЧИВАЕТСЯ ОТ ПОВРЕЖДЕНИЙ,
ВЫЗВАННЫХ УФ ИЗЛУЧЕНИЕМ!
При УФ излучении в клетках происходит локальная
денатурация ДНК в результате образования димеров ти-
мина, расположенных на одной и той же нити. Объектом
действия большинства репарационных систем являются
именно эти нарушения структуры ДНК. Выделены три
основных механизма репарации ДНК: фотореактивация,
эксцизионная и пострепликативная репарация. Последние
два типа относятся к так называемой темновой репа-
рации.
Фотореактивация заключается в уменьшении повреж-
дающего действия УФ излучения на живые клетки при
последующем воздействии на них ярким видимым све-
том. При этом наблюдается мономеризация димеров ти-
мина.
Фотореактивация осуществляется ферментом дезокси-
рибопиримидинфотолиазой, которая в темноте образует
комплекс с димером, а на свету этот комплекс распадает-
ся и происходит мономеризация димеров. Репарировать-
ся по типу фотореактивации могут до 90 % УФ-повреж-
дений.
Эксцизионная репарация связана с удалением повреж-
денного участка ДНК и представляет собой многоэтап-
ный процесс, состоящий из узнавания димера, надрезания
моноспирали ДНК вблизи димера, удаления димера
(эксцизии), ресинтеза ДНК, восстановления непрерывно-
сти репарируемой цепи. За узнавание димера и инцизию
ответственна особая УФ-эндонуклеаза. Эксцизия контро-
лируется УФ-экзонуклеазой. Ресинтез ДНК контролирует-
ся ДНК-полимеразой I и ДНК-полимеразой II. Репа-
ративный синтез осуществляется по неполуконсервативно-
му способу. Последний этап репарации — восстановление
цепи контролируется лигазой.
Нарушения процессов репарации ДНК обнаружены,
в частности, у человека. Известна такая болезнь, как
пигментная ксеродерма, характеризующаяся повышенной
чувствительностью к солнечному свету, приводящая к раз-
витию рака кожи. Повышение чувствительности кожи свя-
зано с отсутствием активности УФ-эндонуклеазы. Постреп-
ликативная репарация наблюдается в случае, если орга-
низм не способен выщеплять димеры. В таких мутантных
клетках редупликация ДНК происходит медленно, ДНК
синтезируется с однонитевыми разрывами, равными по
164
длине димерам. Впоследствии эти бреши заполняются.
Однако при наличии rec-мутации этого не происходит,
в таком случае пострепликативная репарация называет-
ся рекомбинационной.
143. ИМЕЮТСЯ ЛИ МУТАЦИИ, ЗАТРАГИВАЮЩИЕ
РЕТРОИНГИБИРОВАНИЕ!
Да. При концентрации 5-метилтриптофана 10 мкг/мл
бактерии Е. coll дикого типа не могут расти, поскольку он
вызывает токсическое действие. Оно заключается в том,
что 5-метилтриптофан подавляет антранилатсинтазу —
первый фермент заключительного этапа синтеза триптофа-
на по типу ложного ретроингибирования. В норме по-
давление активности фермента обусловлено соединением
триптофана с аллостерическим центром молекулы белка
По своей структуре 5-метилтриптофан имеет почти та
кую же структуру, как и триптофан, и способен соеди-
няться с аллостерическим центром антранилатсинтазы.
Так как 5-метилтриптофан не может заменить триптофан,
то в его присутствии синтез триптофана прекращается
и клетки не могут расти на минимальной среде. Однако
в результате мутации в гене, контролирующем струк-
туру антранилатсинтазы, появляются клетки, устойчивые
к 5-метилтриптофану, частота появления которых со-
ставляет 10“|0. У этих мутантов структура активного
центра, контролирующего реакцию между глутамином
и хоризмовой кислотой, не изменена, но конформация
аллостерического центра нарушается таким образом, что
он утрачивает способность соединяться как с триптофа-
ном, так и с 5-метилтриптофаном.
144. С ОДИНАКОВОЙ ЛИ ЧАСТОТОЙ ПРОИСХОДЯТ МУТАЦИИ
ИЗМЕНЕНИЯ ФУНКЦИИ И ПОТЕРИ ФУНКЦИИ!
Рассмотрим мутации Strs-+Strr у бактерий, возникшие
с низкой частотой. Гены, при мутировании которых воз-
никает фенотип Strr, контролируют образование клеточных
компонентов, обеспечивающих синтез белков, а следова
тельно, и «незаменимую» функцию. Такая мутация, при-
водящая к потере «незаменимой» функции, будет леталь-
ной. Поэтому, чтобы клетка приобрела устойчивость Strr,
должна произойти не потеря, а изменение функции белка,
контролируемого геном, затронутым мутацией. Это изме-
нение должно не только сохранить незаменимую функцию,
165
но и сделать ее нечувствительной к воздействию стрепто-
мицина. Изменения третичной и четвертичной структур,
которые удовлетворяют такому жесткому требованию,
очень редки, поэтому и мутации, изменяющие функцию,
происходят реже, чем мутации, приводящие к потере
функции.
145. РАЗЛИЧАЮТСЯ ЛИ МЕХАНИЗМЫ УСТОЙЧИВОСТИ БАКТЕРИИ
К РАЗЛИЧНЫМ АНТИБИОТИКАМ!
Да, различаются. Различия эти кроются в неодина-
ковом количестве генов устойчивости к тому или иному
антибиотику в генотипе данного организма или в ме-
ханизме действия этих генов. Для выявления этих разли-
чий сравним особенности возникновения устойчивости
к пенициллину и стрептомицину у Е. colt. Устойчивость
к пенициллину (признак Репг) возрастает ступенчато. Для
получения высокорезистентных штаммов вначале прово-
дят последовательный отбор клеток, устойчивых к повы-
шенной концентрации пенициллина, чем достигается
устойчивость первой ступени. Затем среди этих устойчивых
клеток на фоне более высоких концентраций пенициллина
отбирают клетки Репг второй ступени устойчивости и т. д.
Возрастание устойчивости к пенициллину объясняется
наличием в клетке нескольких генов амр (ампициллин —
один из производных пенициллина) с однозначным и
аддитивным действием. Мутации к устойчивости в этих
генах возникают независимо, и вероятность одновременно-
го мутирования нескольких генов, что привело бы к скачко-
образному повышению устойчивости к высоким концентра-
циям пенициллина, очень низка.
Процесс возникновения устойчивости к стрептомицину
несколько иной, чем к пенициллину. Среди выживших
клеток на фоне высокой концентрации стрептомицина
можно выделить клетки трех типов: клетки, устойчивые
к стрептомицину с концентрацией 100 мкг/мл, с концен-
трацией 500 и с концентрацией более чем 500 мкг/мл.
В клетках Е, coll имеются три гена устойчивости к стреп-
томицину, мутирующих независимо, не обладающих
аддитивным действием, т. е. мутации каждого из них
определяют устойчивость к определенным концентрациям
стрептомицина.
166
<46. НА ЧЕМ ОСНОВАНО ИСПОЛЬЗОВАНИЕ АНАЛОГОВ ОСНОВАНИИ
В МЕДИЦИНЕ!
Аналоги оснований могут быть естественного или ис-
кусственного происхождения и имеют химическую структу-
ру строения, близкую к структуре обычных нуклеотидов,
входящих в состав нуклеиновых кислот. Это сходство
в отроении позволяет аналогам вступать в конкурентные
отношения с обычными основаниями при построении
соответствующей молекулы нуклеиновой кислоты, входить
в ее состав, приводя к потере ее функциональной актив-
ности. Таким действием обладает 5-иодурацилдезокси-
рибозид.
Молекула арабинозидцитозина отличается от цитидина
или дезоксицитидина положением гидроксильной группы
С-2' в молекуле пентозы, которая в данном случае являет-
ся арабинозой вместо рибозы или дезоксирибозы. Араби-
нозидцитозин может замещать естественные субстраты
ферментов фосфорилирования до стадии образования
нуклеозидтрифосфата, на которой реакция прерывается,
так как цитозинарабинозидтрифосфат (фффЦА) является
ингибитором ферментов полимеризации и блокирует син-
тез ДНК.
Глава 6 • ЦИТОПЛАЗМАТИЧЕСКАЯ
НАСЛЕДСТВЕ ННОСТЬ
147. КАКОВЫ ДОКАЗАТЕЛЬСТВА ЦИТОПЛАЗМАТИЧЕСКОЙ
НАСЛЕДСТВЕННОСТИ!
Наряду с фактами, подтверждавшими хромосомную
теорию наследственности, в процессе формирования ге-
нетики как науки стали накапливаться факты о наследова-
нии, не подчиняющемся установленным закономерностям:
наследование только по материнской линии, отклонение
от менделевских числовых отношений, не обусловленное
взаимодействием генов, локализованных в Х-хромосомах,
и др. Эти случаи можно было объяснить лишь локализа-
цией детерминантов, определяющих данный признак, в ци-
топлазме.
Цитоплазматическую наследственность можно выявить
путем сравнения результатов реципрокных скрещиваний.
У большинства организмов мужские половые клетки
167
практически лишены цитоплазмы и основная ее масса
вносится в зиготу яйцеклеткой. Поэтому различия, наблю-
даемые в потомстве реципрокных скрещиваний, опреде-
ляются только цитоплазмой, так как в отношении хромо-
сомного набора потомство в обоих случаях одинаково,
за исключением наследования, сцепленного с геном.
Неодинаковые результаты реципрокных скрещиваний
лучше выявляются у межвидовых и межродовых гибридов,
потому что цитоплазма таких форм различается в большей
степени, чем у форм одного вида. Исследования межвидо-
вых скрещиваний кипрея показали, что даже после 25 по-
колений «насыщающих» скрещиваний, в результате кото-
рых хромосомный набор гибрида практически не отличал-
ся от отцовской формы, сохранились различия в зависимо-
сти от направления скрещивания.
Случаи неменделевского наследования отмечались
К. Э. Корренсом по признаку пестролистности. Было уста-
новлено, что окраска листьев, зависящая от типа пластид,
у ряда культур наследуется только по материнской ли-
нии. Это связано с тем, что пластиды передаются цито-
плазмой яйцеклеток, т. е. пластиды — органоиды клетки,
которые несут генетическую информацию. Данной функ-
цией обладают и митохондрии, что было установлено
при изучении дыхательной недостаточности у некоторых
грибов и цитоплазматической мужской стерильности у рас-
тений.
Ядерная и цитоплазматическая наследственность сосу-
ществуют и не противопоставляются друг другу. Струк-
туры клетки определяются генотипом, однако, обладая
саморепродукцией и преемственностью в поколениях, они
могут иметь функцию наследственности. Совокупность
факторов, локализованных в цитоплазме и ее органоидах,
плазмогенов составляет «плазмотип», или «цитотип»,
организма.
148. ЧТО ТАКОЕ ЦИТОПЛАЗМАТИЧЕСКАЯ МУЖСКАЯ СТЕРИЛЬНОСТЬ!
Одним из самых ярких примеров цитоплазматической
наследственности можно считать цитоплазматическую
мужскую стерильность (ЦМС), обнаруженную у многих
растений — кукурузы, лука, свеклы, льна.
Рассмотрим ЦМС на примере кукурузы. Кукуруза —
однодомное растение, женские цветки которого собраны
в початок, а мужские — в метелку. Иногда в метелке
могут быть недоразвитые пыльники со стерильной пыль-
168
цой. Стерильность пыльцы определяется некоторыми
особенностями цитоплазмы. Опыление растений с ЦМС
пыльцой, взятой от других растений, дает в потомстве
формы также со стерильной пыльцой. Следовательно,
признак мужской стерильности передается по материн-
ской линии. Даже когда все 10 пар хромосом стерильного
по пыльце растения замещены хромосомами растений
с нормальной пыльцой, мужская стерильность сохраня-
ется. Цитоплазму, обусловливающую мужскую стериль-
ность, можно обозначить через ци'Г, а нормальную цито-
плазму—через цит^. Генетический анализ показал, что
генотип растения также влияет на стерильность пыльцы.
Цитоплазма цит5 обусловливает стерильность только при
наличии в генотипе рецессивных генов rfrf в гомозиготном
состоянии — цит5 rfrf, При цит5 RfRfnm цит5 Rfrf растения
имеют нормальную фертильную пыльцу. Значит, ген Rf спо-
собен восстанавливать фертильность пыльцы. Подобные
отношения между цитоплазмой и генотипом позволили
разработать методику и составить схему получения меж-
линейных гибридов кукурузы с использованием ЦМС
(рис. 37):
линии: А
цит5 rfrf
цмс
В
UHTN rfrf
фертильная
(«закрепитель»)
С
цит5 rfrf
цмс
D
циты RfRf
фертильная
(«восстановитель»)
Р: скрещивание линий:
А X В С X D
цит5 rfrf uhtn rfrf цит5 rfrf цнт*RfRf
Ff. (Я X В) X (С X D)
ЦМС фертильный («восстановитель»)
цит5 rfrf цит5 RfRf
Л: двойной гибрид: (ЛХ#)Х(£Х£)
цит Rfrf
фертильный
Используемые линии кукурузы относятся к так назы-
ваемым «закрепителям» стерильности и «восстановите-
лям» фертильности. Фертильные линии и сорта, сохраняю-
щие при скрещивании со стерильной формой стерильность
у потомства, называются «закрепителями» стерильности,
а линии и сорта, восстанавливающие плодовитость потом-
ства растений с ЦМС,—«восстановителями» фертильно-
сти. У кукурузы известно два типа мужской стериль-
ности. Изучение образования пыльцы у стерильных форм
кукурузы показало, что видимые нарушения спорогенеза
169
материнская
линия (А лания)
Опылитель
(R-линия)
Восстановитель
фертильности (8-линия)
Восстановленные
В-линия А-линия
Фертильный Восстановленная
гиВрид /7 R-линия
Рис. 37. Схема производства гибридных семян на основе
цитоплазматической мужской стерильности
происходят на различных этапах: у одних дегенерация
завершается на стадии одноядерной пыльцы, у других —
двуядерной. Большое влияние на проявление стерильности
оказывают внешние условия: температура, влажность
почвы и воздуха, а также продолжительность дня. Сорта
кукурузы с тем или иным типом ЦМС имеют различную
чувствительность к факторам внешней среды. У растений
с молдавским типом ЦМС метелки образуют пыльники,
которые не раскрываются, пыльца в них нежизнеспособ-
ная, хотя при определенных условиях может образоваться
и жизнеспособная. У растений с техасским типом ЦМС
проявление стерильности в меньшей степени подвержено
влиянию внешних воздействий, а признак выражен значи-
тельно: пыльники сильно дегенерированы и никогда
не раскрываются. В селекции используются оба типа
ЦМС.
Кроме того, имеются данные о возможности исполь-
зования ЦМС и у пшеницы. Получены стерильные формы
от скрещивания двух видов растений — эгилопса и пшени-
цы, ведутся работы по подбору других компонентов для
скрещивания, обеспечивающих максимальный гетерозис.
Удалось выявить пары скрещиваний, которые дают при-
бавку урожая на 40—50 %.
170
149. КАКОВО БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ ЦИТОПЛАЗМАТИЧЕСКОЙ
НАСЛЕДСТВЕННОСТИ!
Причины существования цитоплазматической наслед-
ственности кроются, по-видймому, в необходимости
обеспечения большей гибкости в процессе развития клетки.
Репликация хромосом тесно связана с циклом клеточного
деления, тогда как органоиды, в том числе хлоропласты
и митохондрии, развиваются до некоторой степени неза-
висимо от клеточного деления, непосредственно реагируя
на воздействия окружающей среды. Это может быть
справедливо и для других цитоплазматических систем.
В таком случае желательно, чтобы часть генетической
информации, контролирующей развитие организма, могла
претерпевать репликацию неодновременно с ДНК хромо-
сом. Внехромосомные генетические системы имели бы то-
гда огромное значение для быстрой реакции организма
на меняющиеся условия среды.
Глава 7. ГЕНЕТИЧЕСКИЕ ПРОЦЕССЫ В ПОПУЛЯЦИИ
150. КАК ОПРЕДЕЛЯЕТСЯ ГЕНЕТИЧЕСКИЙ СОСТАВ ПОПУЛЯЦИЙ!
Под популяцией понимается совокупность особей
определенного вида, в течение длительного времени (боль-
шое число поколений) населяющих определенный ареал,
внутри которого практически осуществляется та или иная
степень панмиксии (свободного скрещивания между всеми
особями). Популяция отделена от соседних таких же
совокупностей особей данного вида той или иной степенью
давления различных форм изоляции. Структура популяции
может рассматриваться как оптимально сложившийся ва-
риант взаимоотношения вида и конкретной среды оби-
тания.
Для определения генетического состава популяции
необходимо прежде всего установить наличие тех или иных
генотипов с указанием числа особей — носителей этих
генотипов. Предположим, нас интересует какой-либо ген,
локализованный в аутосоме (т. е. не сцепленный с полом),
например ген Д, имеющий два аллеля — А и а. В попу-
ляции встречаются три возможных генотипа: АА, Аа, аа.
Генетический состав этой популяции описывается частотой
171
встречаемости всех трех генотипов. Если мы найдем, что
четверть особей данной группы имеет генотип аа, то
частота генотипа аа будет равна 0,25, или 25 %. Естествен-
но, что сумма частот всех генотипов должна быть равной
1,0, или 100 %. В генетическую характеристику популяции
входит не только частота генотипов (в малых популяциях
это величина переменная и зависит от характера передачи
генов от поколения к поколению), но и частота генов
или частота аллелей (более или менее постоянная ве-
личина). Частота аллелей может быть определена по
частоте генотипов.
Пример 1. Рассчитать частоты аллелей в популяции, состоящей .из
100 особей трех разных генотипов— АА, Аа, аа:
генотип АА Аа аа сумма
число особей 40 50 10 100
число аллелей А 80 50 0 130
число аллелей а 0 50 20 70
итого 200
Так как каждый организм имеет два гена или два аллеля, то 100 особей
имеют 200 аллелей, особи генотипа А А — 2 аллеля А, особи Аа — 1
аллель А и 1 аллель а, что в сумме дает 130 А и 70 а. Следовательно,
частота аллеля А равна 0,65>или 65 %, а аллеля а — 0,35, или 35 %.
Зависимость частоты генов (аллелей) и генотипов может быть пред-
ставлена в следующем виде:
гены генотипы
А а АА Аа аа
частоты р q Р Н Q
Частоту аллеля А можно рассчитать по формуле
л = (1)
а зависимость частоты аллелей от частоты генотипов может быть вы-
ражена следующим образом:
р =/>+1/2/7, (2)
q=Q+1/2Л. (3)
Подставив числовые значения в формулы (2), (3), получим
р=0,4 + 1 /2 (0,50) = 0,65Л;
<7=0,1 + 1 /2 (0,50)=0,35а.
Харди и Вайнбергом было выведено уравнение (закон Харди —
Вайнберга), показывающее зависимость частот генов и генотипов в
большой панмиктической популяции:
р2АА -\-2pqAa-\- q2aa~ 1. (4)
Согласно уравнению (4) частота гамет А в популяции равна РА- 1/2Н.
Зная частоты аллелей в популяции, легко подсчитать соотношение
генотипов в потомстве при свободном скрещивании особей, образующих
популяцию
172
9 Л(р) a(q)
Л(р) a(q) ЯД(р2) Aa(pq) aa(q )
Следует отметить, что согласно уравнению (4) частоты аллелей
в следующем поколении остаются прежними:
Р2 + 2р?/2=р(р + р)=р.
Из уравнения (4) следует, что генетический состав популяции можно
определить, если известны частоты рецессивных или доминантных го-
мозигот.
Пример 2. Рассчитать состав популяции, если частота генотипа аа
составляет 1 особь на 400. Так как частота аа
q2 = 1/400,
то частота а равна корню квадратному из этой величины:
q = /17400=1/20.
Согласно формуле (4) популяция принимает следую-
щий вид:
р2ЛЛ 2pqAa q2aa
361 38 1
400 400 400 *
151. КАК ОПРЕДЕЛИТЬ ВЕРОЯТНОСТЬ КАКОЙ-ЛИБО КОМБИНАЦИИ
СКРЕЩИВАНИЯ В ПАНМИКТИЧЕСКОЙ ПОПУЛЯЦИИ!
Для определения вероятности той или иной комбинации
скрещивания обозначим вероятность аллелей и генотипов
в популяции следующим образом:
аллели генотипы
А а АА Аа аа
частота р q Р Н Q
В популяции возможны 9 комбинаций скрещивания:
Генотип и частота (самки) Генотип м частота (самцы)
АА (Р) Аа(Н) aa(Q)
ЛЛ(Р) Р2 PH PQ
Аа(Н) PH н2 HQ
aa(Q) PQ HQ Q2
Частота тех или иных генотипов в потомстве в резуль-
тате различных комбинаций скрещивания будет сле-
дующей:
Тип скрещивания Частота Генотипы и их частота в потомстве
АА Аа аа
ААХАА Р2 р2 - -
ААХ Аа 2РН PH PH —
ААХ аа 2PQ — 2PQ —
АаХАа Н2 1/4//2 1/2Н2 1/4//2
АаХаа 2HQ — HQ HQ
ааХаа Q2 (Р+Х/2Н)\ или р 2(Р+1/2Я)(<Э+ + 1/2Я), или 2pq О2 (0+1/2Я)2, или qz
152. КАК ПРОВОДИТСЯ ГЕНЕТИЧЕСКИ» АНАЛИЗ ПОПУЛЯЦИИ В
СЛУЧАЕ МНОЖЕСТВЕННОГО АЛЛЕЛИЗМА!
Для упрощения анализа популяции в случае множест-
венного аллелизма рассчитывается частота только одного
аллеля, а все остальные сводятся в одну группу, т. е. счи-
тываются как бы одним аллелем. Если же определяется
частота другого аллеля, то операция повторяется, но
с иной группировкой остальных аллелей.
Пример. Группы крови человека АВО представляют собой случай
множественного аллелизма. Обозначим частоту аллелей А, В и 0 через
р, q и г, где р + q + г = 1.
Тогда частоту генотипов можно выразить следующим образом:
генотипы
АА АО ВВ ВО 00 АВ
группы крови А В 0 АВ
частота Р2 + 2рг q2 + 2qr г2 2р<?
Частота аллелей равна корню квадратному из частоты группы
крови 0. Сумма частот групп 0 и В равна q2-\-2qr Ц-г2— (^ + г)2 —
— (1 — р)2, т. е. р — 1 — д/В -р 0, где В и 0 — частоты групп В и 0.
Таким же способом найдем частоту аллелей: q— 1— j/A’+TT,
и r= Если известны частоты генотипов, частота аллелей может
быть выражена формулами
А = АА+ 1/2АВ+ 1/2А0;
В = ВВ+1/2АВ+1/2В0;
0=00+1/2А0+ 1/2В0.
174
153. КАК РАССЧИТАТЬ ГЕНЕТИЧЕСКИЙ СОСТАВ ПОПУЛЯЦИИ
ДЛЯ ПРИЗНАКОВ, СЦЕПЛЕННЫХ С ПОЛОМ!
Частота аллелей и генотипов среди особей гомогамет-
ного пола такая же, как и для аутосомных генов. Однако
гетерогаметный пол содержит только два генотипа и каж-
дая особь обладает только одним аллелем данного гена.
Следовательно, 2/3 генов, сцепленных с полом, находятся
среди особей гомогаметного пола и лишь 1/3 принадле-
жит гетерогаметному полу. Обозначим частоты аллелей
Айа через р и q, а частоты генотипов
самки самцы
АА Аа аа А а
частота Р Н Q R D
Частота аллеля А среди самок определяется по формуле
р,=Р+1/2/7, (1)
а частота этого аллеля среди самцов по формуле
Р. =# (2)
Формула расчета частоты аллеля А в популяции имеет вид
р = 2/Зр? + 1 /3ptf = 1 /3(2р9 + pj= 1 /3(2Р + Я + /?). (3)
Если частоты аллелей среди самок и самцов неодина-
ковы, то популяция не будет находиться в равновесии.
В целом в популяции частота аллелей не меняется от по-
коления к поколению, но их распределение между полами
колеблется и приближается к равновесию постепенно.
Причину таких колебаний можно объяснить тем, что
самец получает свои гены, сцепленные с полом только от
матери, следовательно, prf равно р9 предыдущего поко-
ления. Самки получают свои сцепленные с полом гены от
обоих родителей. Значит, р9 равно l/2(prf 4“Рг) предыду-
щего поколения, или р^=р$, где р9'— частота аллеля
в предыдущем поколении.
Частота аллеля у самок определяется по формуле
я = 1/2(р'+р;).
Частоты аллелей среди самцов и самок неодинаковы,
и разница в частоте аллелей обоих полов составит
р, - ра=1 /2(р,'+₽;) -р,'=-1 /2(р; - р'а),
т. е. половину разницы частот аллелей предыдущего
поколения.
175
Рис. 38. Приближение популяции к равновесию по признаку,
сцепленному с полом:
/ — самки; 2 — самцы
Подобная динамика частот цллелей обоих полов в итоге
приводит популяцию к состоянию равновесия, хотя это
и происходит не за одно поколение, как в случае признаков,
не сцепленных с полом (рис. 38),
154. КАК РАССЧИТАТЬ СОСТАВ ПОПУЛЯЦИИ
ПРИ САМООПЫЛЕНИИ!
Если популяция происходит от одного гетерозиготного
родителя Xa(Fo), то соотношение генотипов в поколении
Fn может быть определено по следующей формуле:
(2П —1)ЛЛ :2Да:(2п“ 1)аа,
где п — номер поколения.
При расчете динамики популяции, имеющей начальное
определенное соотношение генотипов, используется фор-
мула
[2\21^А+КАа)-КАа]АА-.[2ЫАа-.[2я(2Каа +
+ Ллй) — Кла]аа,
где п — номер поколения; К а а, К.а<ъ Каа — коэффициенты,
показывающие исходное соотношение генотипов в Fo- По-
лучаемые на основании этой формулы результаты отра-
жают общую тенденцию в изменении популяции, когда
относительное количество гетерозигот уменьшается в каж-
дом поколении вдвое, т. е. происходит гомоготизация
популяции.
176
155. В ЧЕМ ЗАКЛЮЧАЕТСЯ ЯВЛЕНИЕ ПОЛИМОРФИЗМА
И КАКИЕ ТИПЫ ПОЛИМОРФИЗМА ВСТРЕЧАЮТСЯ
В ЕСТЕСТВЕННЫХ ПОПУЛЯЦИЯХ!
Полиморфизм — это наличие двух и более форм особей
в пределах одного вида. Случаи полиморфизма наблюда-
ются в популяции человека, например различная окраска
волос или глаз (морфологический полиморфизм). Клас-
сическим примером полиморфизма может быть наличие
в популяциях божьей коровки Adalia bipunctata наряду
с особями красного цвета с черными точками особей
черных с красными точками.
При полиморфизме каждая форма (раса) существует
в популяции в достаточно большом, хотя и не постоянном
количестве.
Кроме морфологического полиморфизма встречается
полиморфизм, когда генетические различия между фор-
мами, не изменяя внешней морфологии организма, влияют
на структуру определенных макромолекул (полисахари-
дов, белков). Такой полиморфизм может быть назван
биохимическим и выявляться биохимическими или им-
мунологическими методами. Одной из наиболее извест-
ных форм подобного полиморфизма является существо-
вание различных групп крови в популяции человека.
Подобное же явление обнаружено и среди многих млеко-
питающих и птиц.
Методами хроматографии и электрофореза установ-
лено, что одна и та же биохимическая' функция у раз-
личных организмов контролируется ферментами, имеющи-
ми определенные изменения в молекуле (аллофермента-
ми). Значит, диплоидный организм может содержать по
крайней мере два аллофермента. Такое явление называет-
ся полиморфизмом ферментов. Генетически это явление
объясняется наличием двух или многих аллелей одного
гена, контролирующих синтез практически одинаковых по
активности ферментов, но обладающих, например, различ-
ной подвижностью в электрическом поле вследствие
аминокислотных замен в полипептидной цепи.
К более редкому типу полиморфизма может быть
отнесен случай сосуществования в популяции тех или
иных хромосомных перестроек (инверсий, транслокаций).
Например, у двух близких видов Drosophila pseudoobscura
и Drosophila persimilis в естественных популяциях часто
встречаются структурные перестройки третьей хромосо-
мы. Значительную часть популяции данных видов
177
составляют гетерозиготы по структурным перестройкам, и
на хромосомах их слюнных желез хорошо видны ин-
версионные петли.
К полиморфизму относятся и случаи существования
в популяции особей, различающихся по количественным
признакам, проявление которых определяется как факто-
рами внешней среды, так и генотипом, т. е. наличием в нем
того или иного соотношения доминантных и рецессивных
количественных генов.
156. КАК МОЖЕТ НАРУШАТЬСЯ ГЕНЕТИЧЕСКОЕ РАВНОВЕСИЕ В
ПОПУЛЯЦИИ!
Генетическое равновесие в популяции нарушается дав-
лением мутаций, которое создается в результате спонтан-
ного мутирования, происходящего с определенной часто-
той в каждом поколении. Исключение (элиминация),
сохранение или увеличение частоты новых мутантных
генов в популяции зависит от того, в какой степени им
благоприятствует или, наоборот, противодействует есте-
ственный отбор. Прослеживая судьбу мутации в той или
иной популяции, можно говорить об их адаптивной форме,
которая равна 1, если отбор не исключает ее и не проти-
водействует распространению. В большинстве случаев
показатель адаптивной ценности мутаций меньше 1 и
может быть равен нулю, если мутанты совершенно не
способны размножаться, т. е. мутантный ген не пере-
дается следующему поколению.
Когда адаптивная ценность мутации меньше 1, от-
бор рано или поздно устраняет ее из популяции. Однако
благодаря спонтанному мутированию один и тот же
мутантный ген может возникать неоднократно, что ком-
пенсирует его элиминацию, производимую отбором. В ре-
зультате может быть достигнуто равновесие, когда появле-
ние и исчезновение мутантного гена сбалансировано.
Сбалансированное состояние доминантных и рецессивных
генов достигается различными путями. Предположим, что
адаптивная ценность доминантной мутации равна 0,5,
т. е. дикий тип размножается вдвое быстрее, чем мутант,
и частота мутаций равна а. Тогда можно вычислить
число мутантов, равное в каждом поколении F2, F3,
F4, F$ а, а/2, а/4, а/8, а/16, п/32 соответственно. Сумма
подобных показателей приближается к 2. Поскольку в
178
каждом поколении половина мутантных генов элимини-
руется, то за каждое поколение приток мутантов 2а/2 = п,
т. е. равновесие популяции поддерживается на уровне
спонтанной частоты мутаций.
Несколько иная картина наблюдается при рецессивных
мутациях, которые не проявляются в гетерозиготном
состоянии. Они могут накапливаться до более высокого
уровня, чем вредные доминантные мутации. Так как общее
количество генов в любом организме велико, то и коли-
чество вредных рецессивных мутаций может достигать
больших величин и оказаться значительным генетическим
грузом, обременяющим популяцию.
При рецессивных мутациях эффективность отбора
уменьшается, при этом снижается частота встречаемости
данных мутаций. Отсюда следует, что ‘ полностью исклю-
чить рецессивный ген, редко встречающийся в популяции,
путем отбора почти невозможно. Это касается только
панмиктических популяций. Если скрещивание в популя-
ции не случайно, т. е. определенные группы особей скрещи-
ваются между собой чаще, чем другие, нарушается сбалан-
сированность генов. Тот или иной вид селективных скре-
щиваний часто наблюдается у человека, в основе чего
лежат социальные, физиологические и психологические
факторы. Сбалансированность генов нарушается также
и при сокращении размеров популяции, что приво-
дит к уменьшению панмиксий и возникновению инбри-
динга.
157. КАК ИЗМЕНЯЕТСЯ СООТНОШЕНИЕ ГЕНОТИПОВ
В ПОТОМСТВЕ ПРИ ИНБРИДИНГЕ!
Снижение жизнеспособности при инбридинге зависит
прежде всего от повышения гомозиготности по многим
вредным генам. Если при отборе гомозиготность повы-
шается лишь по части генотипа, то при инбридинге —
по всем генам независимо от направления отбора, а также
вредности или полезности новых свойств для организма,
т. е. затрагивает любую часть генотипа. Если генотип
гетерозиготного организма был АаВЬСс, то через п поколе-
ний инбридинга в его потомстве будут особи с генотипами
ААВВСС, ААВВсс, ААЬЬСС и т. д.
Возрастание гомозиготности представлено на следую-
щей схеме:
179
Р: .-------А а------1 X А а------1
v t । i
Fi, А А Аа*---------------------1 аа
25%------50%--
I
АА Аа аа
25% 12,5% 25% 12,5%
Соотношение гетерозигот и гомозигот в n-м поколении
при инбридинге вычисляется по формуле
(2п — 1 )Л А + 2Л а + (2Л - 1 )аа.
158. НТО ПОДРАЗУМЕВАЕТСЯ ПОД ПОНЯТИЕМ
«ГЕНЕТИЧЕСКАЯ СМЕРТЬ»!
Генетическая смерть — это один из способов элимина-
ции гена из популяции. Гены могут исключаться из популя-
ций не только в результате гибели особи, но и неспособ-
ности организма, несущего мутацию, передать ее потом-
ству. Следовательно, все. гены такой особи обречены
на генетическую смерть. Так как мутации — явление ред-
кое, а гены довольно стабильны, то они исчезают из по-
пуляции не столько вследствие гибели самой особи, сколь-
ко в результате генетической смерти.
Человек, имеющий доминантную деталь, например
ретинобластому (злокачественная опухоль глаза), генети-
чески умирает, и этот мутантный ген исчезает из популяции
в том же поколении, в котором он появился. Период его
существования равен одной генерации. Если проследить
за доминантной вредной мутацией с коэффициентом отбо-
ра 0,2, то время ее существования вплоть до генетической
смерти будет равно в среднем пяти поколениям, т. е. в
каждом поколении организм, несущий мутацию, может по-
гибнуть с вероятностью 0,2.
Глава 8. ГЕНЕТИКА ЧЕЛОВЕКА
159. ПОЧЕМУ СРЕДИ МИЛЛИАРДОВ ЧЕЛОВЕК, НАСЕЛЯЮЩИХ
НАШУ ЗЕМЛЮ, НЕТ АБСОЛЮТНО ПОХОЖИХ!
Для ответа на поставленный вопрос необходимо под-
считать число комбинаций хромосом и генов в гаметах,
образуемых гетерозиготными особями, а также число
180
комбинаций генов в зиготах при скрещивании двух орга-
низмов.
При различии по одной паре генов (моногибридное
скрещивание) две гетерозиготы дают три типа потомков:
Р: Аа X Аа
F: АА Аа аа
При полигибридном скрещивании количество генети-
чески различающихся потомков увеличивается значитель-
но и может рассчитываться по формуле N=3n, где п —
число пар генов, участвующих в скрещивании.
Учитывая, что человек имеет 23 пары хромосом и что
в каждой хромосоме могут располагаться тысячи генов,
можно подсчитать, что число вероятных комбинаций всех
генов превысит число электронов в видимой части Все-
ленной.
Будет ли ребенок иметь голубые или карие глаза,
темные или светлые волосы, сможет ли он прожить 19
или 90 лет — эти и тысячи других признаков предопреде-
лятся уже в момент оплодотворения.
Учитывая сложность строения организма, длитель-
ность его развития, в течение которого организм испыты-
вает влияние факторов внешней среды, можно сделать
вывод, что вероятность появления двух совершенно одина-
ковых человек равна нулю*.
160. КАКИЕ ПРИЗНАКИ У ЧЕЛОВЕКА НАСЛЕДУЮТСЯ ПО
МОНОГИБРИДНОМУ ТИПУ!
Доминантные Рецессивные
Кожа, волосы, зубы,
Пятнистая кожа
Седая прядь
Темные волосы (несколько ге-
нов)
Не рыжие волосы
Веснушки
Курчавые волосы (у гетерози-
готы — волнистые)
Норма
Раннее облысение
Норма
Норма
Светлые волосы
Рыжие волосы
Норма
Прямые волосы
Гипотрихоз
Норма
* Исключение составляют однояйцевые, или идентичные, близнецы,
развивающиеся из одной яйцеклетки, которая после ее оплодотворе-
ния делится на два бластомера, дающих начало двум эмбрионам.
181
Глаза
Карие Голубые или серые
Пигментированный ирис Альбинизм
Глаукома Норма
Астигматизм Норма
Катаракта Норма
Скелет
Карликовость Норма
Полидактилия Норма
Брахидактилия Норма
Сросшиеся пальцы Норма
Заячья губа и волчья пасть Норма
Кровеносная и дыхательная системы
Гемолитическая желтуха Норма
Норма Аллергия
Эндокринная система
Норма Сахарный диабет
Разные болезни
Норма Пигментная ксеро-
дерма
Ритинобластома Норма
Норма Врожденная глухота
Ощущение вкуса фенилтиомо- Отсутствие ощуще-
чевины ния
Норма Мускульная атрофия
Норма Спинальная атаксия
Хорея Хантингтона Норма
161. ОТ ЧЕГО ЗАВИСИТ И КАК НАСЛЕДУЕТСЯ ЦВЕТ ГЛАЗ ЧЕЛОВЕКА!
Необходимо отметить, что многообразие оттенков цвета
глаз не определяется соответствующим разнообразием
пигментов в глазу. Голубые глаза, например, не имеют
никакого голубого пигмента. Широкое разнообразие
окраски глаз у человека от черной до светло-голубой
есть результат действия генов, производящих и распреде-
ляющих меланин. Когда мы говорим, что различные гены
182
обусловливают различную окраску, это значит, что они
принимают участие в производстве различных количеств
или типов веществ, которые дают различный цветовой
эффект.
Пигменты, определяющие цвет глаз, расположены на
радужной оболочке, состоящей из двух частей, которые
могут как бы расходиться и вновь сходиться вместе.
Следовательно, можно говорить о передней и задней
(внутренней) частях радужной оболочки. И в зависи-
мости от расположения пигмента на обеих сторонах обо-
лочки или только на одной стороне глаз может иметь
различную окраску. При голубых глазах передняя часть
оболочки не содержит или содержит очень мало пиг-
мента. Это хорошо видно, если посмотреть на голубогла-
зого человека сбоку. Весь пигмент сосредоточен у него
на внутренней стороне радужной оболочки. Следует, одна-
ко, помнить, что это не голубой пигмент, а просто рас-
сеивание света коричневатыми частичками меланина,
производящее впечатление голубой окраски.
Другому цвету глаз соответствует добавление пигмен-
та в передней части радужной оболочки. Альбинотические
глаза не являются результатом действия гена окраски
глаз. Альбинизм — результат дефекта какого-то общего
гена, контролирующего все процессы пигментации. Таким
образом, настоящий альбинос совсем не имеет пигмента.
Розовая окраска глаз альбиносов — следствие просве-
чивания капилляров, расположенных позади бесцветной
радужной оболочки.
Способность образовывать пигмент в глазу опреде-
ляется доминантным геном. Следовательно, если ребенок
получил ген темных глаз от одного родителя, то незави-
симо от того, каким окажется ген, полученный от второго
родителя, ребенок будет иметь темные глаза.
162. ЧЕМ ОПАСНЫ БЛИЗКОРОДСТВЕННЫЕ БРАКИ!
По статистическим данным, в Европе по крайней мере
в 15 % случаев амовротического слабоумия детей роди-
тели были двоюродными братом и сестрой, а еще в 12 %
случаев родители находились в меньшей степени родства.
Необычайно высокая частота браков между двоюродными
братом и сестрой наблюдается среди родителей, дети
которых страдают другими редкими рецессивными бо-
лезнями. В европейской же популяции в целом браки
между двоюродными составляют меньше 1 %.
183
Каждый человек является носителем хотя бы несколь-
ких вредных рецессивных мутаций. Но поскольку они лока-
лизованы в негомологичных участках хромосом, вероят-
ность перехода их в гомозиготное состояние очень мала.
Различные люди могут быть носителями неаллельных
вредных мутаций. Браки между родственниками значи-
тельно повышают вероятность того, что оба партнера
гетерозиготны по одному и тому же вредному гену и что
они произведут на свет дефективных детей. Близкородст-
венные браки более характерны для малонаселенных (так
называемых изолятов), чем для густонаселенных райо-
нов. Если в такой малой популяции появляется вредная
мутация, инбридинг приведет к необычайно высокой
встречаемости наследственных дефектов. Таким образом,
вероятность здоровых детей выше при браках неродст-
венных между собой людей, чем при браках между
родственниками. Конечно, и браки между родственниками
могут оказаться удачными во всех отношениях, но в
среднем опасность для потомков появления наследствен-
ных дефектов больше от таких браков, чем для потомков
от браков между неродственниками.
Частота рождения младенцев, пораженных, например,
фенилкетонурией, в свободных скрещиваниях 1:1000.
В браках между родственниками частота заболевания
повышается до 7 (6 из них — следствие близкородственно-
го брака).
Появление большого количества наследственных забо-
леваний и быстрое физическое и умственное вырожде-
ние династий аристократических семей, в которых си-
стематически практиковались браки между родственни-
ками (в некоторых династиях египетских фараонов),
зафиксировано и в исторических документах.
Причиной наследственных заболеваний являются спон-
танные мутации. При этом доминантные мутации прояв-
ляются в первом поколении. Рецессивные мутации ничем
не выражаются и остаются скрытыми до тех пор, пока
они не перейдут в гомозиготное состояние. Так как боль-
шинство наследственных заболеваний снижает жиз-
неспособность и плодовитость, то доминантные мутанты
редко оставляют жизнеспособное потомство и частота
встречаемости доминантных мутаций определяется спон-
танной частотой их возникновения. Рецессивные же
мутации в силу своей природы могут длительно переда-
ваться из поколения в поколение, причем концентрация
184
их постепенно увеличивается вследствие накопления
повторных мутаций.
На частоту спонтанных мутаций влияют факторы
внешней среды. Особенно отрицательно сказывается фон
ионизирующей радиации нашей планеты. Небольшое
повышение естественного фона радиации (на */з)» напри-
мер в результате испытаний ядерного оружия, может
привести к появлению в каждом поколении дополни-
тельно 20 млн человек с тяжелыми наследственными
нарушениями.
163. ЧТО ТАКОЕ РЕЗУС-ФАКТОР И КАК ОН НАСЛЕДУЕТСЯ!
Резус-фактор — это антиген, который содержится в
эритроцитах человека и макаки-резуса. Обнаружен
К. Ландштейнером и др. в 1940 г. в крови людей с помощью
сывороток животных, иммунизированных эритроцитами
макаки-резуса. По химической природе — липопротеид.
Передается по наследству и не изменяется в течение
жизни. Частота встречаемости резус-фактора у евро-
пейцев — 85 %, у монголоидов — 99 %. По наличию или
отсутствию резус-фактора выделяются резус-положитель-
ные (их генотип — RhRh или Rhrh) и резус-отрипательные
организмы (rhrh).
Открытие резус-фактора позволило объяснить тяжелое
заболевание — гемолитическую желтуху новорожденных.
Это заболевание может поражать детей в одной и той же
семье. Первый ребенок заболевает чрезвычайно редко,
если же родительская пара произвела на свет гемоли-
тического ребенка, большая часть последующих - детей
будет страдать тем же недугом. Данный факт был объяс-
нен, когда установили, что во всех случаях гемолити-
ческой желтухи мать была резус-отрицательной, а отец —
резус-положительным. Это указывает на то, что жен-
щина с отрицательным резусом реагирует на резус-поло-
жительный плод так, как если бы ей перелили резус-
положительную кровь. Она вырабатывает антитела
против резус-антигена. Первый ребенок редко страдает
гемолитической болезнью потому, что за время первой
беременности уровень антител в крови матери не успевает
подняться достаточно высоко. Однако когда резус-отри-
цательная женщина беременна вторым резус-положи-
тельным ребенком, ее антитела могут попасть в кровенос-
ную систему ребенка и разрушить клетки его крови. Когда
185
резус-отрицательная женщина носит резус-положитель-
ного ребенка, плод должен получить /?й-ген от отца. Отец
может быть либо гомозиготным (RhRh), либо гетерози-
готным (Rhrh) по резус-гену. В первом случае все дети
оказываются резус-положительными, во втором — по-
ловина детей наследует r/i-ген и от отца, и от матери и
будет иметь генотип rhrh (резус-отрицательные). Такие
дети не подвергаются опасности со стороны антител
матери. Не имеет значения также разница в резус-фак-
торе, когда отец резус-отрицательный, а мать резус-поло-
жительная. Поскольку гй-ген не вызывает образования
антител, плод матери любого генотипа не будет под-
вержен заболеванию.
164. ЧЕМ ОПРЕДЕЛЯЮТСЯ НАСЛЕДСТВЕННЫЕ
БОЛЕЗНИ ЧЕЛОВЕКА!
Наследственное заболевание может быть результатом
мутации определенного гена. Мутация гена, контроли-
рующего синтез того или иного фермента, может приво-
дить к нарушению соответствующего этапа в цепи мета-
болических реакций. Такие изменения называются врож-
денными нарушениями метаболизма. К настоящему
времени открыто более 2000 наследственных болезней
человека. Часть этих заболеваний определяется генами,
проявление которых не зависит от действия внешней
среды, например фенилкетонурия, гемофилия. Другие
болезни обусловлены генами, действие которых в той
или иной степени зависит от неблагоприятного действия
внешней среды, например подагра (в случае неправиль-
ного питания). Многие болезни имеют мультифактори-
альную природу и относятся к болезням, к которым
человек может иметь наследственную предрасположен-
ность (язвенная болезнь желудка, многие формы зло-
качественных опухолей).
Рассмотрим несколько примеров наследственных бо-
лезней человека.
Алкаптонурия обусловлена недостаточностью фермен-
та оксидазы гомогентизиновой кислоты. Гомогентизино-
вая кислота в большом количестве выводится с мочой,
которая на свету или при добавлении щелочи чернеет.
Черные пятна на пеленках новорожденного сразу бро-
саются в глаза. Накапливающаяся в организме гомоген-
тизиновая кислота связывается с коллагеном хряща,
что может привести к артриту. Алкаптонурия — примор
186
генетического нарушения, при котором фенотипические
признаки обусловлены накоплением некоторых продуктов
в избытке.
При некоторых генетических нарушениях фенотипи-
ческое проявление мутации связано с отсутствием
нормального продукта реакции на этапе, следующем
за блоком.
При других врожденных нарушениях метаболизма
фенотипическое проявление связано с избыточным накоп-
лением продукта реакции, представляющей собой в нор-
ме второстепенный путь обмена.
Фенилкетонурия, как и алкаптонурия и альбинизм,
также связана с генетически обусловленным нарушением
метаболизма одной из ароматических аминокислот —
превращением фенилаланина в тирозин. Из-за недостатка
пигмента волосы и кожа таких больных обычно светлые,
но не в такой степени, как при альбинизме, поскольку
тирозин поступает в организм с пищей. Один из наиболее
ярких симптомов этого заболевания — резкая задержка
умственного развития, что, по-видимому, обусловлено
влияние^ продуктов фенилаланина на мозг. Некоторые
из продуктов обмена, в частности фенилпировиноград-
ная кислота, выводятся с мочой, что позволяет поставить
диагноз.
Заболевание галактоземия обусловлено недостаточной
активностью галактозо-1-фосфатуридилтрансферазы. Ак-
тивность фермента у больных не превышает 10 % нормы,
а иногда и полностью отсутствует. Болезнь проявляется
только в гомозиготном состоянии. У гетерозигот актив-
ность указанного фермента достигает 50 % нормы. За-
болевание связано с нарушением процесса превращения
галактозы в глюкозу в кишечнике человека. Так как
галактоза входит в состав материнского молока, то при
галактоземии наблюдается отравление организма галак-
тозой, что в свою очередь ведет к гипогликемии и нару-
шению аминокислотного обмена. У больного галактозе-
мией ребенка наблюдаются желтуха, диспептические
расстройства, поражение печени и селезенки, а главное —
умственная отсталость. Частота заболеваемости состав-
ляет 1 на 50 тыс. новорожденных. Диета, не содержа-
щая молочного сахара, предотвращает развитие указан-
ных симптомов. Болезнь наследуется по рецессивному
типу.
Сахарный диабет связан с дефицитом гормона инсу-
187
лина. Лечение заключается во введении в организм
недостающего гормона, получаемого обычно из подже-
лудочной железы крупного рогатого скота. Имеются
сведения о получении инсулина из бактерий, в которые
введен инсулиновый ген человека. Получаемый таким
образом инсулин имеет антигенные характеристики,
полностью соответствующие человеческому гормону,
что предотвращает нежелательные аллергические реак-
ции, возникающие иногда при использовании инсулина
от крупного рогатого скота.
Синдром Дауна относится к так называемым хромо-
сомным болезням, которые, как правило, не наследуются
из-за нарушения числа хромосом, происходящего в
гаметогенезе родителей. Поскольку эти заболевания
являются патологией генетического аппарата, их тоже
относят к наследственным заболеваниям. При синдроме
Дауна наблюдается трисомия по 21-й хромосоме. Частота
заболевания составляет 1 на 750 новорожденных. Глав-
ными морфологическими признаками болезни Дауна счи-
таются монголоидный тип лица, умственная отсталость,
проявляющаяся в широком диапазоне от идиотии до
легких степеней дебильности. При синдроме Дауна
встречаются пороки сердца, нарушение крупных сосудов,
органов пищеварительного тракта, снижение продолжи-
тельности жизни, высокая частота злокачественных опу-
холей. Предполагается, что болезнь есть результат дис-
баланса продуктов структурных и регуляторных генов,
возникающего при трисомии.
Как правило, врожденные нарушения обмена насле-
дуются по рецессивному типу, и только у гомозигот на-
блюдается клиническая картина болезни, но иногда
и гетерозиготных носителей можно обнаружить специ-
альными методами. Один из методов состоит в усилении
нагрузки на определенный ферментативный процесс. Так,
если гетерозиготным носителям гена фенилкетонурии
ввести определенную дозу фенилаланина, уровень его
в крови будет выше и остается повышенным дольше,
чем у контрольных здоровых людей.
165. НАСЛЕДУЕТСЯ ЛИ РАК У ЧЕЛОВЕКА!
Прежде всего необходимо отметить, что термин «рак»
включает различные формы новообразований и лейкозов.
Раковые заболевания являются результатом сложных
взаимодействий наследственных факторов и факторов
188
среды, относительное значение которых в этиологии
опухолей различно. В одних случаях ведущее значение
имеют генетические факторы, обусловливающие наслед-
ственное предрасположение организма к опухоли, в дру-
гих — негенетические. Причем на протяжении жизни
человека в разных условиях внешней среды соотношение
этих факторов может меняться.
Воздействие на организм человека неблагоприятных
факторов вызывает появление генеративных и сомати-
ческих мутаций, в результате чего нормальные клетки
могут превращаться в злокачественные и при размноже-
нии передают это свойство дочерним клеткам. В случае
генеративной мутации наследственное предрасположение
передается от родителей детям.
При генетическом анализе родословных выявлен как
аутосомно-доминантный и рецессивный моногибридный
характер наследования многих форм опухолей человека
(полипоз кишечника, обычно переходящий в рак, синдром
Гарднера с сильной тенденцией к малигнизации, карци-
нома щитовидной железы, тайлоз, фиброкистоз почек
и др.), так и полигенные формы новообразований (рак
желудка, легких, матки, кишечника и др.), не обнаружи-
вающие простого менделевского наследования.
При наследственной форме рака потомству переда-
ются лишь патологические мутантные гены, которые
и обусловливают предрасположенность к развитию опу-
холи, часто выражающуюся в повышенной чувствительно-
сти к определенным воздействиям среды. У таких индиви-
дов может- быть патологически повышена чувствитель-
ность даже к обычным безвредным для большинства
людей воздействиям.
Восприимчивость к опухолеродным вирусам и вирусо-
подобным образованиям также контролируется геноти-
пом организма.
Судить о роли генетических факторов в возникновении
новообразований можно по частоте исследуемого вида
опухоли среди близких родственников больного (про-
банда), численным соотношениям больных родственников
различной степени родства с пробандом, изучению
«онкологических» близнецов и так называемых «раковых
семей» (семей, в которых наблюдается высокая концент-
рация раковых заболеваний) и др.
Установлено, что существует не общая генетически
обусловленная предрасположенность к любой форме
189
опухоли, а предрасположенность к опухоли определенного
вида и органа, поэтому могут быть больные или семьи
с двумя (и более) видами опухоли.
Наличие у индивида генов, обусловливающих наслед-
ственное предрасположение к какому-то виду опухоли,
не обязательно приводит к ее возникновению, так как
болезнь может быть с неполной пенетрантностью и слабо
экспрессивной. Например, у больных пигментной ксеро-
дермой (гомозиготы по рецессивным аллелям), характе-
ризующихся патологически повышенной чувствитель-
ностью кожи к солнечному свету (ультрафиолетовым
лучам), конечной стадией болезни является развитие
раковых опухолей. При профилактической защите инди-
видов с таким генотипом от ультрафиолетовых лучей
удается предотвратить развитие рака.
Изучение опухолей у однояйцевых близнецов выявило
сравнительно невысокую конкордантность по всем видам
опухолей (в среднем 12 %), что может свидетельствовать
о значительном влиянии негенетических факторов в опу-
холевом росте. Принято считать, что опухоль не разви-
вается в здоровом органе. Возникновению опухоли пред-
шествует длительное вяло текущее заболевание. Такие
заболевания называют предопухолевыми. Например,
к предопухолевым заболеваниям желудка относятся
полипы, длительно существующие язвы, хронический
гастрит с пониженной кислотностью желудочного сока.
Предопухолевые заболевания опасны тем, что могут не
вызывать заметных расстройств здоровья и больные не
стремятся к их излечению, а на фоне таких заболеваний
развивается рак.
В связи с этой проблемой первостепенной важностью
является профилактика рака, его ранняя диагностика,
воздействие различными противоопухолевыми агентами
на течение болезни.
На вопрос, можно ли заразиться раком, учитывая,
что некоторые его формы вызываются вирусами, с полной
уверенностью можно ответить, что опухоли у человека
незаразны.
166. КАКОВЫ ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ КАНЦЕРОГЕНЕЗА!
Около 40 лет назад советским вирусологом Л. А. Зиль-
бером была выдвинута вирусо-генетическая теория рака,
согласно которой генетический материал онкогенных
190
вирусов встраивается в хромосому клетки, что приводит
к нарушению структурной целостности отдельных локусов.
Такое нарушение генома изменяет биохимический меха-
низм клеток, которые приобретают автономность, т. е.
становятся менее чувствительными к регуляционным
влияниям организма и размножаются бесконтрольно.
В начале 70-х годов теория Л. А. Зильбера была допол-
нена концепцией онкогенов, предложенной Р. Хюбнером
и Дж. Тодаро. Онкогены — это участки хромосом нор-
мальных клеток, которые под действием повреждающих
ДНК-факторов активируются и продуцируют белки,
вызывающие злокачественную опухоль. В норме онко-
гены находятся в неактивном состоянии, и их активация
обусловлена дестабилизацией генома мутагенами и дру-
гими агентами. Установлено, что клетки позвоночных
животных содержат в своих хромосомах встроенные
геномы ДНК-содержащих опухолеродных вирусов, кото-
рые в норме репрессированы. Нарушение структуры
регуляторных зон, прилегающих к онкогену, в результате
дестабилизирующих влияний на геном, в частности
эффекта хромосомных перестроек, может привести к зло-
качественной трансформации.
167. ИМЕЮТСЯ ЛИ У ЧЕЛОВЕКА ПРИЗНАКИ, СЦЕПЛЕННЫЕ С ПОЛОМ!
Поскольку человек имеет две половые хромосомы,
аналогичные половым хромосомам других организмов,
он обладает рядом признаков, сцепленных с полом. К ним
относятся такие признаки, как цветовая слепота и гемо-
филия.
Цветовая слепота (дальтонизм) заключается в неспо-
собности различать некоторые цвета (большей частью
красный и зеленый). Это довольно распространенный
признак. Дальтонизм может быть определен с помощью
специальных, таблиц, на которых окрашенные точки
распределены таким образом, что лица, не различающие
цвета, видят иной рисунок или слово, чем лица с нор-
мальным зрением.
Дальтонизм чаще встречается у мужчин, чем у жен-
щин. Причину этого нетрудно объяснить. Если мужчина
получает от матери Х-хромосому, несущую ген цветовой
слепоты, он будет дальтоником, потому что в Y-хромосоме
отсутствует доминантный аллель нормального зрения,
который мог бы подавить проявление рецессивного гена
цветовой слепоты. Женщина может быть дальтоником
191
только при наличии 2 Х-хромосом с рецессивным геном
цветовой слепоты в каждой из них: одну — от матери,
другую — от отца. Если в популяции одна Х-хромосома
из 10 несет ген цветовой слепоты, то один мужчина из
10 будет дальтоником. Для расчета вероятности появле-
ния женщины-дальтоника используется закон умножения
вероятностей, согласно которому вероятность одновре-
менного происхождения двух независимых событий равна
произведению вероятностей каждого из них. Следова-
тельно, вероятность для женщины получить 2 Х-хромо-
сомы, каждая из которых несла бы данный ген, равна
0,1-0,1—0,01, т. е. вероятность появления женщины-
дальтоника в 10 раз меньше, чем мужчины.
В различных популяциях частота мужчин-дальтоников
колеблется от 5 до 9 %, а женщин составляет доли
процента. Мужчины-дальтоники не передают этот дефект
сыновьям, так как те получают свою единственную Х-хро-
мосому от матери. Однако дочери могут оказаться носи-
телями Х-хромосомы с рецессивным геном дальтонизма
и передавать ее своим сыновьям.
Гемофилия — другой пример сцепленного с полом
признака у человека. Причиной гемофилии служит ген,
определяющий прекращение выработки одного из фак-
торов, необходимого для нормального свертывания крови.
Малейшее нарушение целостности кровеносных сосудов
у таких больных приводит к длительному кровотечению.
Ген гемофилии рецессивен, поэтому у большинства
гетерозиготных женщин он не проявляется, хотя у них
отмечается некоторое увеличение времени свертывания
крови. Именно по этому признаку можно отличить носи-
телей данного гена от здоровых людей.
Гемофилия была распространена среди представите-
лей королевских семей Европы. Впервые ген гемофилии
возник, по-видимому, в результате мутации у королевы
Виктории. Она была гетерозиготной носительницей этого
гена и передала его сыну и двум дочерям. Потомки
королевы Виктории распространили этот признак по мно-
гим королевским семьям.
Если какая-либо аномалия определяется сцепленным
с полом доминантным геном, то она будет встречаться
у женщин вдвое чаще, чем у мужчин. Например, один
из сцепленных с полом доминантных генов вызывает
нарушение зубной эмали. Такие нарушения у девочек
встречаются чаще, чем у мальчиков.
192
168. КАК СОСТАВЛЯЮТСЯ ЦИТОГЕНЕТИЧЕСКИЕ КАРТЫ ХРОМОСОМ
ЧЕЛОВЕКА!
Карты хромосом человека составляются главным
образом путем накопления сведений об отдельных семьях
и их родословных, т. е. о характере распределения на-
следственных признаков в этих семьях. Анализ родослов-
ных позволяет проследить менделевское расщепление
и независимое распределение признаков, получить сведе-
ния по аллелизму и сцеплению отдельных признаков.
В определении групп сцепления большую помощь оказы-
вают методы цитогенетики.
Общие принципы составления цитогенетических карт
хромосом человека следующие:
1) делеция части хромосом позволяет демаскировать
рецессивный аллель на гомологичной хромосоме;
2) анализ распределения признаков-маркеров в семьях
позволяет связать определенные локусы с конкретной
хромосомой (например, если отец ребенка с трисомией
имеет группу крови 00, а мать и ребенок — АВ, то локус
АВО должен находиться в «трисомичной» хромосоме,
потому что оба аллеля ребенок унаследовал от матери);
3) эффект дозы может служить для локализации
определенного гена в конкретной хромосоме. Известно,
что активность фермента щелочной фосфатазы лейкоци-
тов при болезни Дауна (трисомия по 21-й хромосоме)
повышается, а при хроническом миелоидном лейкозе
(частичная деления длинного плеча 21-й хромосомы)
снижается. Это позволяет предположить, что локус щелоч-
ной фосфатазы лейкоцитов находится в длинном плече
21-й хромосомы;
4) особенности хромосом, например необычно крупные
спутники или своеобразный вид транслокационной хро-
мосомы, могут использоваться при анализе сцепления
данного локуса с другими локусами-маркерами (если
обнаружено сцепление гигантского спутника на 15-й
хромосоме с определенной системой групп крови, то
можно сделать вывод, что локус данной группы крови
находится на коротком плече 15-й хромосомы).
Рассмотрим пример картирования хромосом человека
с использованием культуры клеток. Расположенные по
соседству клетки могут сливаться. Такое явление наблю-
дается у дифференцированных клеток в организме и у кле-
ток в культуре. Частоту слияния клеток можно значи-
71740
193
тельно повысить, если к культуре добавить инактиви-
рованный вирус Сендай или полиэтиленгликоль. При
этом могут сливаться клетки разных видов и получаться
гетерокарионы, содержащие различные геномы, например
человек — мышь, человек — табак, курица — мышь. Ге-
терокарионы способны к делению, и при этом фенотипи-
чески выражаются оба генома. Для определения актив-
ности генов и идентификации продуктов человеческих
генов, отличающихся зарядом от аналогичных продуктов
другого вида, используется гель-электрофорез.
Наряду с определением активности генов исследуются
и кариотипы. При делении клетки происходит постепенная
потеря хромосом. Сопоставляя изменения в активности
фермента с изменениями кариотипа, можно заключить,
что локус генов данного фермента находится в данной
(утерянной) хромосоме. По скорости утраты участков
хромосом благодаря происходящим транслокациям можно
судить об их расположении относительно друг друга
(сцепленные участки чаще исчезают вместе).
169. ИМЕЮТСЯ ЛИ ВРЕДНЫЕ МУТАЦИИ У ЧЕЛОВЕКА!
КАКОВА ГЕНЕТИЧЕСКАЯ ОТЯГОЩЕННОСТЬ ЧЕЛОВЕКА!
Поскольку большинство мутаций вредно в гомозигот-
ном состоянии, генетическую отягощенность человека
можно оценить, сравнивая ущерб, причиняемый гомози-
готной части популяции (инбредной, полученной от близ-
кородственных браков), с ущербом от мутаций в осталь-
ной части популяций. Такая оценка проводилась по
переписям сельского населения Франции за 100 лет, где
перечислены спонтанные аборты и случаи смерти детей.
Частота гибели потомства у неродственных родителей
сравнивалась с частотой гибели потомства от браков
между родственниками. Частота гибели потомства нерод-
ственных родителей составляла 0,12, тогда как родствен-
ных— 0,25. Избыточная смертность (13 %) имеет гене-
тическую природу и вызвана гомозиготностью, возникаю-
щей при браке между родственниками. Полное количество
рецессивных деталей, находящихся в популяции в гете-
розиготном состоянии, можно подсчитать, если допустить,
что в потомстве от браков между двоюродными братьями
и сестрами становится гомозиготным 1/16 всех генов.
Браки между особями, имеющими одного общего роди-
теля, называются браками полусибсов. В этом случае
194
вероятность, с которой данный аллель общего родителя
переходит к сыну, равна 1/2 и вероятность, с которой
потомство сына получит этот аллель, также равна 1/2.
Поэтому вероятность, что оба эти события произойдут,
равна 1/4. Вероятность же того, что такие события про-
изойдут и с дочерью данного человека, тоже равна 1/4,
и поэтому вероятность перехода этого гена при браке
полусибсов будет равна 1/16. Так как с вероятностью
1/16 и другой аллель общего родителя переходит в гомо-
зиготное состояние, то полная добавочная вероятность
гомозиготности при браках полусибсов равна 1/8. Иными
словами, в результате инбридинга такого типа 1/8 генов,
бывших в гетерозиготном состоянии, переходит в гомози-
готное состояние.
Аналогичным образом можно показать, что в браке
между двоюродными братьями и сестрами вероятность
перехода в гомозиготное состояние любого гена равна
1/16. В нашем примере половина от 1/16, т. е. 1/32 всех
особей, должна стать гомозиготной по нормальным ге-
нам, а другая половина — гомозиготной по вредным
ненормальным аллелям. Математическая обработка часто-
ты всевозможных наследственных заболеваний показы-
вает, что у каждого человека имеется четыре летальных
гена, способных привести к гибели потомство при пере-
ходе в гомозиготное состояние.
170. ЧТО ТАКОЕ ИММУНОГЕНЕТИКА И КАКОВА ЕЕ РОЛЬ В ГЕНЕТИКЕ
ЧЕЛОВЕКА!
Начало иммуногенетике положили работы Э. Дунгерна
и Л. Хиршфельда, открывших наследственность групповых
антигенов крови.
Иммуногенетика изучает закономерности антигенной
специфичности и роль генетических механизмов в осуще-
ствлении иммунных реакций. Иммуногенетика способна
решать важные современные проблемы: 1) генетический
контроль иммунного ответа; 2) генетика несовместимости
при пересадке тканей и 3) генетический гомеостаз внут-
ренней среды человека.
Факты неодинаковой восприимчивости различных ин-
дивидуумов к одним и тем же возбудителям инфекцион-
ных заболеваний были известны давно, например не-
возможно заразить животных. возбудителем холеры
человека или человека — возбудителем чумы собак. Им-
195
муногенетика изучает чувствительность генетически раз-
личающихся особей одного и того же вида. Известны
резистентные и чувствительные породы крупного рогатого
скота, свиней, кур к сальмонеллезу и вирусным инфек-
циям.
Как показал близнецовый метод, у людей монозигот-
ные близнецы гораздо чаще болеют одной и той же инфек-
ционной болезнью, чем дизиготные.
Иммуногенетика изучает также наследование груп-
повых факторов крови (изоантигенов). Открыто более
70 антигенов человеческих эритроцитов (А, В, М, N, резус
и т. д.), около 30 лейкоцитарных изоантигенов, десятки
аллотипов сывороточных глобулинов и др.
Наследование антигенов характеризуется неполным
доминированием, его отсутствием или кодоминированием.
Поэтому антигенный фенотип организма повторяет его
генотип. Существует правило: «один ген — один антиген».
Изучение изоантигенов привело к появлению трансплан-
тационной иммуногенетики, основным вопросом которой
стал вопрос о механизмах взаимодействия генетически
различающихся тканей донора и реципиента.
Достижения иммуногенетики позволяют разрабаты-
вать новые подходы к изготовлению вакцин и преодолению
несовместимости тканей. Один из таких подходов состоит
в том, чтобы создать дифференцированные вакцины с уче-
том генотипов больных. При этом необходимо выполнять
следующее условие: вакцинируемый должен получать
препарат, содержащий минимум антигенов, общих с его
собственными, и максимум антигенов, отличающихся от
изоантигенов индивидуума. Дело в том, что некоторые
бактерии и вирусы содержат в своем составе антигены,
общие с тканевыми антигенами человека. Совершенно
очевидно, что с увеличением количества антигенов, общих
е тканевыми, эффективность иммунизации снижается.
И наоборот, с уменьшением общих антигенов эффектив-
ность иммунизирующих препаратов должна увеличивать-
ся. Повышение иммуногенности вакцин помимо эффектив-
ного предупреждения заболеваний может оказаться важ-
ным и для предупреждения возможных иммунопатологий,
вызываемых многократным введением антигенов.
Таким образом, можно сделать вывод, что иммуноге-
нетика имеет самое непосредственное отношение к ряду
важнейших медико-биологических проблем, одной из ко-
торых является изучение механизмов возникновения имму-
196
нитетов. Иммунитет — это способность организма защи-
тить собственную целостность при воздействии факторов,
имеющих признаки генетически чужеродной информации.
Иммунитет обеспечивает сохранение индивидуальных при-
знаков на протяжении жизни каждого индивидуума, тогда
как наследственность обеспечивает сохранение признаков
от поколения к поколению.
Глава Т - ГЕНЕТИКА И СЕЛЕКЦИЯ
171. ЧТО ТАКОЕ СЕЛЕКЦИЯ!
Селекция — наука о методах создания сортов расте-
ний, пород животных и штаммов микроорганизмов с
нужными человеку признаками. Наиболее значительных
успехов она достигла при активном использовании дости-
жений генетики, которая явилась теоретической основой
селекции. В селекционном процессе, как правило, выделя-
ют несколько этапов: обоснование цели и задач селекции,
создание и подбор исходного материала, разработка схе-
мы селекции, селекционный процесс (включая разнообраз-
ные методы селекции) и сортоиспытание.
Возникновение научной селекции связано с эволюцион-
ным учением Ч. Дарвина, экспериментальными исследо-
ваниями Г. Менделя, В. Иогансена, Н. Г. Нильсона-Эле,
селекционеров И. В. Мичурина, Л. Бербанка, работы ко-
торых послужили основой для разработки теории селек-
ции. В*свою очередь открытия в генетике способствовали
ускоренному созданию исходного материала, разработке
методов селекционного процесса и повышению эффектив-
ности отбора, ведущего метода селекции. Так, например,
открытие законов Менделя позволило целенаправленно
вести подбор пар для скрещивания, а установление
Н. И. Вавиловым первичных центров происхождения куль-
турных растений и обоснование закона гомологических
рядов наследственной изменчивости дали возможность
селекционерам разрабатывать методы эффективного по-
иска исходного материала. Изучение характера наследо-
вания хозяйственно ценных признаков способствовало
созданию целой системы скрещиваний и позволило ком-
бинировать различные свойства растений. В селекции
успешно использовались как простые, так и сложные
скрещивания (ступенчатая гибридизация, конвергентные
197
скрещивания и др.), которые обеспечивали создание таких
сортов, как яровая пшеница Саратовская 29, озимая
пшеница Безостая-1, ячмень Московский-121.
Чтобы культивируемым растениям придать устойчи-
вость к болезням и экстремальным экологическим факто-
рам, их необходимо скрещивать с дикими формами, об-
ладающими этим признаком. Однако при скрещивании
разных видов часто наблюдается стерильность гибридов.
Преодолеть несовместимость родительских компонентов
при отдаленной гибридизации позволила аллополиплои-
дия, благодаря которой получены плодовитые пшенично-
пырейные гибриды, сорта тритикале (гибрид пшеницы
и ржи).
Повышению продуктивности сортов способствовала
и автополиплоидия, на основе которой были получены
тетраплоидная рожь (Белта, Пуховчанка, Крыжачок),
сахарная свекла, гречиха (сорта Искра, Минчанка), ле-
карственные и другие культуры.
Резкий скачок в повышении продуктивности многих
культур был достигнут благодаря использованию явления
гетерозиса. Перспективным методом в практической се-
лекции оказался и экспериментальный мутагенез. Его
использование в сочетании с другими методами позволило
значительно расширить спектр изменчивости хозяйственно
ценных признаков, получить новый исходный материал и
создать ценные сорта разных культур (более 500 сортов).
Использование различных методов в селекционном*
процессе привело к созданию нового направления —
синтетической селекции. Она основана на применении
исходного материала, создаваемого путем гибридизации
(синтеза) различных сортов и форм. Основа синтетиче-
ской селекции — перекомбинация и трансгрессия. При
комбинационной синтетической селекции в одном гибрид-
ном растении сочетаются признаки и свойства двух или
более родительских форм. Задача селекционера — ото-
брать и генетически стабилизировать гибридные расте-
ния, сочетающие эти признаки и свойства наиболее удачно.
Трансгрессивная синтетическая селекция основана на от-
боре в расщепляющихся после гибридизации поколений
особей с трансгрессиями, т. е. с положительными призна-
ками, выраженными в большей степени, чем у родителей.
Успех трансгрессивной синтетической селекции зависит
от правильного определения родительских пар, способных
при скрещивании давать трансгрессии.
198
172. ЧТО ТАКОЕ СОРТ!
Любой сорт (sort, sorte, varietee, variety, cultivar),
как правило, относится к установленной ботанической
разновидности определенного вида, например Triticum
aestivum subspecies vulgare lutescens или erythrosper,
или multurum и т. д. Между тем сорт не является и не мо-
жет быть ботанической систематической единицей, по-
скольку к одной и той же разновидности может принад-
лежать очень много сортов. Сорт — это больше агроно-
мическая, чем ботаническая категория.
Согласно Государственному стандарту СССР сорт —
это совокупность культурных растений, созданная путем
селекции и обладающая определенными наследственными,
морфологическими, биологическими и хозяйственными
признаками и свойствами.
Поскольку сорт существует в определенных условиях
окружающей среды, между ним и средой необходимо
установить такие отношения, которые бы способствовали
развитию его потенциальных возможностей. Эти отноше-
ния должны находить свое выражение в адаптивной
ценности отдельных генотипов сорта (или сорта как еди-
ного целого) и исходить из его генетического состава,
т. е. из генетической структуры образующих его генотипов.
В соответствии с генетическим составом сорта различают
чистые линии, чистые и мультилинейные сорта, сортовые
смеси, сорта-популяции, синтетические, гибридные и поли-
плоидные сорта, а также сорта-клоны.
Выбор селекционером любой из этих генетических
структур для будущего сорта зависит от того, с каким
растением — самоопылителем или перекрестником ведется
работа, для каких агроэкологических условий создается
сорт и каковы потребности производства.
Сорта могут быть получены разными путями, что по-
рой находит отражение и в их названии. Так, под назва-
нием местный сорт понимают сорт народной селекции,
продолжительное время возделываемый в данной мест-
ности. С методами выведения сорта связаны и такие на-
звания сортов, как гибридный, линейный, сорт-популяция.
173. КАКИЕ СУЩЕСТВУЮТ ТИПЫ СОРТОВ!
Различаются сорта по их значимости, новизне и цен-
ности для производства и классифицируются согласно
методике их получения.
199
Стандартный сорт (стандарт) — лучший райониро-
ванный в данной зоне сорт той или иной культуры, ко-
торый включается во все виды сортоиспытания или в опы-
ты в качестве эталона. С ним сравниваются другие испы-
тываемые сорта и дается их оценка.
Перспективный сорт — ценный, проходящий государ-
ственное сортоиспытание и размножаемый, но еще не
районированный сорт.
Дефицитный сорт — новый районированный ценный
сорт, по которому испытывается недостаток семян. Де-
фицитный сорт имеет ряд преимуществ перед старыми
сортами и подлежит быстрейшему размножению и вне-
дрению в производство по плану сортосмены.
Сорт интенсивного типа — селекционный сорт, создан-
ный для возделывания в условиях интенсивной культуры
земледелия: высокопродуктивен, устойчив к заболеваниям,
неполегающий, способен давать большие прибавки уро-
жая на высоком агрофоне, в том числе на поливе.
Сорт-клон — это сорт, полученный путем отбора у ве-
гетативно размножающейся культуры и являющийся раз-
множенным потомством одного клона. Поэтому сорт-клон
отличается высокой степенью выравненное™, нарушаю-
щейся только под действием естественного мутагенеза.
Линейный сорт — сорт самоопыляющейся культуры,
выведенный методом индивидуального отбора из есте-
ственной популяции и являющийся размноженным по-
томством одного элитного растения. Линейный сорт
отличается высокой выравненностью по всем признакам
и свойствам в силу его более однородной генетической
природы.
Местный сорт — сорт, созданный в результате дли-
тельного естественного отбора и простейших приемов
искусственного (народная селекция) при возделывании
той или иной культуры в определенной местности.
Многолинейный сорт — сорт, состоящий из смеси ли-
ний, одинаковых по морфологическим и хозяйственно
полезным признакам, но различающихся по устойчивости
к различным расам патогена. Эти линии создаются мето-
дом возвратных насыщающих скрещиваний районирован-
ного сорта с набором форм (доноры), устойчивых к раз-
ным расам паразита. Многолинейный сорт может быть
также продуктом смешения нескольких сортов, мало раз-
личающихся по комплексу хозяйственно-биологических
признаков, но обладающих дифференциальной иммун-
200
ностью. В обоих случаях при появлении любой расы
возбудителя преобладающая часть растений в посеве
сорта будет устойчивой к нему.
Сорт-популяция — сорт перекрестноопыляющейся или
самоопыляющейся культуры, полученной путем массового
отбора и представляющей совокупность наследственно
неоднородных растений.
Селекционный сорт — районированный или принятый
в государственное сортоиспытание сорт, выведенный в
научно-исследовательском учреждении на основе научных
методов селекции. В отличие от местных сортов селек-
ционный сорт характеризуется большой выравненностью
по морфологическим признакам и хозяйственно-биологи-
ческим свойствам.
Синтетический сорт — выращиваемая в производстве
сложная гибридная популяция перекрестноопыляющего-
ся растения. Синтетический сорт обычно представляет
собой потомство многолинейного гибрида, получаемого
на основе 4—10 и более простых гибридов. Урожаи син-
тетического сорта ниже, чем у исходного многолинейного
гибрида или двойных гибридов, но выше, чем у обычных
сортов. Сорт характеризуется высокой урожайностью
в течение нескольких лет. Широко известен синтетический
сорт кукурузы Краснодарская 1/49 (потомство смеси
семян четырех межлинейных гибридов).
174. ПОЧЕМУ СТАРЕЮТ СОРТА!
Существуют разные причины вырождения сортов и их
засорения, которые приводят к падению продуктивности
растений и бесперспективности их использования для
производства. Различают биологическое и механическое
засорение сорта.
Биологическое засорение сорта — это его засорение
другими формами, которое может быть следствием есте-
ственного переопыления и спонтанных мутаций или рас-
щепления при гетерозиготности сорта по тому или иному
признаку (в основном полимерному). Биологическое за-
сорение сорта особо опасно для перекрестноопыляющихся
культур, при семеноводстве которых строго соблюдаются
нормы пространственной изоляции. В свою очередь засо-
ренные сорта могут быть источником биологического
засорения других форм.
Механическое засорение сорта — это его засорение
201
семенами других сортов и культур во время посева, обмо-
лота и очистки семян. Оно особенно опасно, если засори-
тель обладает большим коэффициентом размножения,
чем засоряемый сорт.
175. ЧТО ТАКОЕ СОРТОСМЕНА)
При вырождении используемого в производстве сорта
возникает необходимость либо его замены, либо улуч-
шения.
Сортосмена — это замена старых, возделываемых в
производстве сортов новыми районированными сортами,
более урожайными и ценными по техническим качествам.
Быстрая сортосмена на всех производственных площадях
при районировании одного сорта — основная задача се-
меноводства, которая может быть решена за счет уско-
ренного размножения перспективных сортов в объеме
семян, достаточном для районирования. Приемы уско-
ренного размножения (пониженная норма высева, широ-
корядный или ленточный посев, высокая агротехника)
направлены на максимальное увеличение коэффициента
размножения семян.
176. КАКИЕ БЫВАЮТ ТИПЫ СОРТОИСПЫТАНИЯ)
Полученные новые сорта и гибриды проходят различ-
ные типы сортоиспытаний перед их рекомендацией для
внедрения в производство.
Сортоиспытание — это сравнение урожайности и дру-
гих биологических и хозяйственных признаков и свойств
данного сорта (гибрида) с соответствующими показате-
лями стандартного сорта (гибрида) по определенной ме-
тодике.
Предварительное сортоиспытание (первоначальное)
осуществляется в селекционно-опытном учреждении. Оце-
ниваются лучшие селекционные номера (потенциальные
сорта), выделенные после испытания в контрольном пи-
томнике.
Конкурсное сортоиспытание (большое) проводится в
селекционно-опытном учреждении. Выделенные в предва-
рительном сортоиспытании сорта проходят конкурс между
собой, сравниваются со стандартом и лучшими сортами
других селекционных учреждений. После конкурсного сор-
тоиспытания сорта получают окончательную оценку и луч-
202
Питомники исходного материала
коллекционный гидридный мутанты и гетераплоиды
Селекционный питомник
Контрольныйпитомник
Предварительное сортоиспытание
v
Предварительное
размножение
Конкурсное
сортоиспытание
Зональное
(межстанционное
сортоиспытание)
Питомники
первичного
семеноводства
Государственное Производственное
сортоиспытание сортоиспытание
Рис. 39. Примерная схема селекционного процесса
шие из них, превосходящие стандартный сорт по комплек-
су признаков, передаются в государственное сортоиспы-
тание. Конкурсное сортоиспытание проводится по мето-
дике государственного сортоиспытания.
Производственное сортоиспытание осуществляется
селекционно-опытным учреждением или государственным
сортоучастком в производственных условиях. Производ-
ственное испытание организуется для одного-двух луч-
ших сортов из конкурсного стационарного сортоиспыта-
ния или перспективных сортов из конкурсного стационар-
ного сортоиспытания.
Динамическое сортоиспытание осуществляет оценку
сортов по динамике накопления урожая в течение веге-
тации. Оно применяется для культур, у которых важен
не только общий (итоговый) урожай, но и его величина
203
в отдельные периоды вегетаций: картофель, овощные,
кукуруза на силос, кормовые корнеплоды и т. д.
Межстанционное сортоиспытание (зональное, экологи-
ческое) проводится в различных экологических условиях
для всесторонней и быстрой оценки новых сортов, пере-
даваемых одним селекционно-опытным учреждением дру-
гому.
Специальное сортоиспытание — динамическое и зо-
нальное сортоиспытание, а также сортоиспытание, прово-
димое на различных агрофонах (разные виды и дозы удоб-
рений, нормы высева, сроки посева, полив и т. д.) с целью
установления характера реакции новых сортов на варьи-
рование факторов агрофона.
Государственное сортоиспытание проводится на госу-
дарственных сортоучастках Государственной комиссией
по сортоиспытанию сельскохозяйственных культур. Оно
организуется в строгом соответствии с утвержденными
методиками. По результатам государственного сортоиспы-
тания проводится районирование новых сортов и гибридов.
Примерная схема селекционного процесса и разных
типов сортоиспытания представлена на рис. 39.
177. ЧТО ТАКОЕ ГЕТЕРОЗИС!
При скрещивании разных пород животных и сортов
растений, а также инбредных линий гибриды в F\ по ряду
признаков превосходят исходные родительские формы.
Такое явление называется гетерозисом. Скрещивание
гибридов между собой ведет к снижению гетерозиса в
последующих поколениях.
Существуют три основные гипотезы, объясняющие
гетерозис.
Признаки, проявляющиеся в первом поколении гибри-
дов (доминантные), благоприятны для развития организ-
ма, а признаки, подавляемые при скрещивании (рецес-
сивные), чаще всего имеют неблагоприятный эффект.
Такие различия связаны с тем, что вредные доминантные
мутации исключались естественным отбором, а неблаго-
приятные рецессивные мутаций могли накапливаться, так
как они не проявлялись в гетерозиготном состоянии. Это
гипотеза доминантности. Вредные последствия инбридинга
объяснялись переходом неблагоприятных рецессивных ге-
нов в гомозиготное состояние, а гибридная сила при
скрещивании — подавлением вредных рецессивных генов
204
благоприятными (в гетерозиготе). Однако было доказано
превосходство гетерозигот над обеими (доминантными и
рецессивными) гомозиготами и гетерозиготность стала
рассматриваться как причина гетерозиса. Это гипотеза
сверхдоминирования.
В связи с накоплением новых фактов появилась гипо-
теза генетического баланса. Сторонники данной гипотезы
фенотипический эффект гетерозиса связывали с представ-
лением о благоприятном балансе генов и генных продук-
тов у гибридов (гипотеза биохимического обогащения).
Гетерозис обычно выражается в повышении устойчи-
вости к неблагоприятным условиям среды, усилении роста
и увеличении плодовитости. В силу этого различают ге-
терозис адаптивный, соматический и репродуктивный.
В зависимости от форм, участвующих в скрещивании,
эффект гетерозиса может быть большим или меньшим.
Поэтому проводится предварительная оценка партнеров
на комбинационную способность.
Снижение гетерозиса во втором и последующих по-
колениях связано с расщеплением гибридного потомства.
В развитии растений и животных могут наблюдаться
эффекты, напоминающие по проявлению гетерозис, но
вызванные не генетическими причинами (не вследствие
скрещивания), а влиянием некоторых внешних воздей-
ствий. Это так называемый физиологический гетерозис.
Например, для растений установлены случаи снятия вред-
ных последствий самоопыления при резком изменении
условий выращивания. Природа таких эффектов пока не-
достаточно ясна.
178. КАК ЗАКРЕПИТЬ ГЕТЕРОЗИС!
Гетерозис наиболее ощутимо проявляется только в
первом поколении, постепенно снижаясь в последующих
генерациях, что, безусловно, уменьшает экономическую
эффективность мероприятий по его получению. Вопросы
закрепления гетерозиса представляют определенный
интерес для селекции. Проблема гетерозисного закрепле-
ния решается сравнительно просто только у вегетативно
размножающихся растений, у которых гетерозис гибридов
в Fi сохраняется при дальнейшем их вегетативном раз-
множении. Для растений, размножающихся семенами,
эта проблема находится в стадии теоретических изысканий
или в начальной стадии экспериментальной разработки.
205
Наиболее эффективными способами гетерозисного закреп-
ления считаются переведение гетерозисных гибридов на
путь устойчивого апомиктического размножения и поли-
плоидизация гетерозисных гибридов, вследствие чего
скорость гомозиготизации в поколениях снижается и по-
является возможность получения эффекта гетерозиса на
протяжении пяти-шести поколений.
179. ДОСТАТОЧНО ЛИ ВЕЛИК ГЕТЕРОЗИСНЫЙ ЭФФЕКТ И
РЕНТАБЕЛЬНО ЛИ ПРОИЗВОДСТВО ГИБРИДНЫХ РАСТЕНИЯ
В СЕЛЬСКОМ ХОЗЯЙСТВЕ!
Методы разведения, создающие гетерозисный эффект,
широко используются в селекции растений и животных,
играющих важную роль в экономике. Прибавка урожая
у гибридных сортов компенсирует все затраты на выведе-
ние чистых линий, необходимых для получения гетерозис-
ного эффекта. Например, обычные сорта кукурузы непо-
стоянны и дают расщепление в потомстве. Инбридинг
(создание чистых линий) уменьшает это непостоянство.
Однако он приводит к снижению жизнеспособности и утра-
те многих других желательных качеств. Разрешить эти
противоречия можно путем получения гомозиготных ин-
бредных линий с желательными доминантными призна-
ками и последующего скрещивания разных инбредных ли-
ний друг с другом. Первое поколение от такого скрещи-
вания будет гетерозисным и более жизнеспособным, чем
любая из родительских линий. Однако следует учитывать,
что, хотя растения первого поколения сильны и однородны,
все же они получены от маломощных инбредных линий
и поэтому гибридные семена немногочисленны. Следова-
тельно, получение таких растений нерентабельно. Чтобы
выведение растений было рентабельным, на практике
скрещивают четыре инбредных линии между собой по
две, затем полученные гибриды скрещивают опять между
собой, т. е. получают сдвоенные межлинейные гибриды.
Будучи образованы на мощном гибридном растении от
первого скрещивания, семена при таком двойном скрещи-
вании появляются в большом количестве.
180. В ЧЕМ ТРУДНОСТИ ОТДАЛЕННОЙ ГИБРИДИЗАЦИИ!
ПОЧЕМУ БЕСПЛОДНЫ ОТДАЛЕННЫЕ ГИБРИДЫ!
Отдаленная гибридизация — это скрещивание форм,
относящихся к разным видам и родам. Такие скрещива-
ния проводят с целью совмещения у гибридов полезных
206
для человека признаков и свойств в тех случаях, когда
внутривидовая гибридизация оказывается неэффективной.
Например, при гибридизации сортов культурных видов
с дикими предками потомство неприхотливо к условиям
выращивания и устойчивым к болезням и вредителям.
При отдаленной гибридизации в зиготу объединяются
гаметы, которые могут различаться и по генетической
конструкции хромосом, и по их числу. Поэтому и в есте-
ственных условиях, и в эксперименте возможность отда-
ленной гибридизации ограничивается рядом факторов:
1) географическая изоляция видов; 2) препятствия к опы-
лению, обусловленные несовпадением циклов размноже-
ния, различием в строении половых аппаратов, несо-
вместимостью пыльцевых трубок и тканей пестика;
3) препятствия к оплодотворению, вызванные генетиче-
ской несовместимостью сливающихся гамет или физиоло-
гической несовместимостью ядра и цитоплазмы; 4) нежиз-
неспособность зиготы, погибающей на ранних стадиях
развития; 5) полная или приближающаяся к таковой
стерильность гибридов Ft.
Первым исследователем проблемы отдаленной гибри-
дизации был Й. Г. Кёльрёйтер, получивший в 1760 г.
первый гибрид от скрещивания махорки и табака. В даль-
нейшем эту проблему продолжали развивать такие из-
вестные гибридизаторы, как О. Сажрэ, Ш. Нодэн, Г. Мен-
дель, И. В. Мичурин, Н. В. Цицин и др. Так, И. В. Мичу-
рин разработал методы преодоления нескрещиваемости
форм при отдаленной гибридизации: опыление смесью
пыльцы, метод посредника предварительного вегетатив-
ного сближения, и получил отдаленные гибриды у плодово-
ягодных культур.
Межвидовые и межродовые гибриды, как правило,
имеют пониженную плодовитость или совершенно бес-
плодны. Одной из причин их бесплодия в одних случаях
можно считать неправильное развитие генеративных орга-
нов. У растений это отражается на пыльниках, которые
остаются недоразвитыми и не раскрываются. В других
случаях затруднения возникают на более поздних стадиях
и выражаются в нарушениях мейоза. Эти нарушения
прежде всего состоят в том, что хромосомы разных видов
плохо конъюгируют или же конъюгация между ними про-
текает неправильно. Часто разные виды различаются
неодинаковым числом хромосом, что затрудняет нормаль-
ную конъюгацию хромосом у гибрида.
207
Например, Drosophila pseudoobscura и Dr. miranda
внешне очень похожи, число хромосом у обоих видов
одинаково, их форма и величина тоже совпадают. Однако
изучение хромосом слюнных желез показало, что хромо-
сомные комплексы обоих видов сильно различаются. Эти
различия вызваны главным образом структурными изме-
нениями хромосом — инверсией и транслокацией. Вслед-
ствие нарушения гомологии хромосом у гибридов нару-
шается их конъюгация во время мейоза, что приводит
к невозможности образования нормальных половых
клеток.
Нарушения мейоза — часто результат того, что у скре-
щиваемых видов разное число хромосом. Если вид А имеет
14 хромосом, а вид В — 28, то у гибрида будет 21 хромо-
сома (7 — от вида А и 14 — от вида В). Таким образом,
у 7 хромосом В нет гомологов для конъюгации. Это при-
ведет к беспорядочному распределению хромосом при
мейозе и образованию несбалансированных нежизнеспо-
собных гамет. Бесплодие у отдельных гибридов может
быть преодолено путем перевода этих форм на полиплоид-
ный уровень. Впервые такая работа была осуществлена
Г. Д. Карпеченко (1924 г.), получившим плодовитый гиб-
рид между редькой и капустой (рафанобрассика). Опре-
деленных успехов добились ученые в повышении продук-
тивности амфидиплоидов тритикале и т. д.
Отдаленная гибридизация зерновых, кормовых, техни-
ческих, плодово-ягодных и других культур проводится
в широких масштабах.
181. ЧТО ТАКОЕ КОМБИНАЦИОННАЯ СПОСОБНОСТЬ!
В ЧЕМ ОТЛИЧИЕ ОБЩЕЙ ОТ СПЕЦИФИЧЕСКОЙ КОМБИНАЦИОННОЙ
СПОСОБНОСТИ!
Комбинационная способность — способность линии
или сорта при сочетании их в гибридных комбинациях
давать потомство в Fh отличающееся от условно приня-
того за норму выражения того или иного признака или
свойства. Если гибрид окажется лучше по определенным
показателям обоих родителей, то это свидетельствует об
их высокой комбинационной способности. Определение
комбинационной способности линий и сортов является
важным этапом в селекции на гетерозис у многих сель-
скохозяйственных растений. Знание характеристики сор-
тов по их комбинационной способности позволяет успешно
208
вести подбор пар при скрещивании. Различают общую
и специфическую комбинационную способность.
Общая комбинационная способность (ОКС) — это
способность самоопыленных линий или сортов, определяе-
мая средней величиной гетерозиса во всех исследован-
ных гибридных комбинациях с участием этих форм. ОКС
оценивается на основе полных или неполных диаллель-
ных скрещиваний, методами топкросс, поликросс или сво-
бодного опыления.
Специфическая комбинационная способность
(СКС) — это способность самоопыленной линии или сор-
та, определяемая величиной гетерозиса в какой-нибудь
конкретной комбинации. СКС обычно устанавливается
после предварительной упрощенной оценки материала
по общей комбинационной способности. Если величина
гетерозиса в гибридной комбинации линии с данной фор-
мой значительно выше, чем это можно было ожидать,
говорят о высокой СКС. СКС определяется на основе
диаллельных скрещиваний. Если нужно подобрать компо-
нент в гибридную комбинацию с ценной в том или ином
отношении формой, то по результатам топкросса с исполь-
зованием этой формы в качестве тестера можно опреде-
лить СКС привлеченных в комбинации линий и сортов.
182. КАКИЕ ТИПЫ ОТБОРА ИСПОЛЬЗУЮТСЯ В СЕЛЕКЦИИ!
Все типы отбора могут быть разбиты на две большие
группы — отбор индивидуальный и массовый.
Индивидуальный отбор основан на оценке по потом-
ству отобранных и индивидуально размножаемых лучших
растений. У самоопылителей индивидуальный отбор чаще
бывает однократным, у перекрестников — только много-
кратным и непрерывным. Метод однократного индиви-
дуального отбора в селекции самоопыляющихся растений
по сути сводится к проведению через все звенья селек-
ционного процесса однажды отобранных элитных растений
(рис. 40). Различия в применении однократного индиви-
дуального отбора заключаются только во времени про-
ведения этого отбора в F2, F3, F± или в более поздних
поколениях. Например, П. П. Лукьяненко применял
следующие этапы селекционного процесса на основе ин-
дивидуального отбора в гибридных популяциях озимой
пшеницы: 1) браковка в Fi всех гибридов, пораженных
ржавчиной; 2) отбор в F% элитных растений, устойчивых
209
IV
з-й год
4-й год
5-й год
Питомник
исходного
материала
1-й год
I
г-й год
II
Госсортсеть
Семеноводческая
работа. Испытание
на сортоучастках
Посев семей от
слитных рас-
тений
Отбор элитных
растений
Испытание
лучших семей,
браковка
Посев лучших
семей,
браковка
Испытание на
станции и вгоне.
Размножение.
Передача на сорто-
участки •
PWI
КС
Ш
Рис. 40. Схема однократного индивидуального отбора у само-
опыляющихся растений:
I, II — селекционный (СП), селекционный и контрольный (КП) питомники;
III — предварительное (ПС) и конкурсное (КС) сортоиспытание в конт-
рольном питомнике; IV—конкурсное и зональное (ЗС) сортоиспытание с пред-
варительным размножением (ПР); V — семенной питомник (СП); VI - пред-
варительное размножение в семенном питомнике
к ржавчине; 3) проведение в малом сортоиспытании и
предварительном размножении перспективных номеров
отбора элитных растений для закладки семеноводческого
питомника испытания потомств первого года.
Индивидуальный отбор в селекции самоопылителей
может быть, как и в селекции перекрестников, однократ-
ным и многократным. В обоих случаях он является основой
метода педигри. Для селекции и семеноводства перекрест-
210
ников характерны свои,
вытекающие из специ-
фики опыления этих
растений модификации
метода индивидуально-
го отбора: индивиду-
ально-семейный, семей-
но-групповой и инди-
видуальный непрерыв-
ный отбор, метод ре-
зервов.
При массовом отбо-
ре из исходной популя-
ции извлекается боль-
шое число сходных по
комплексу признаков
лучших растений. По-
сле лабораторной бра-
ковки урожай этих ра-
стений объединяется и
высевается на следую-
щий год на одной де-
лянке. Разновидностью
массового отбора явля-
ется однократный мас-
совый отбор, который
может быть эффектив-
ным только у самоопы-
лителей. Для достиже-
ния целей селекции у
перекрестноопыляющих-
ся растений применяют
многократный массо-
вый отбор (рис. 41).
Если для поддержания
определенных характе-
ристик сорта массовый
отбор применяют на
Рис. 41. Схема многократного массо-
вого отбора:
I — испытание первого отбора и сравнение его
результатов с исходным и стандартным сортами;
II — испытание второго отбора на станции и на
сортоучастках с предварительным размноже-
нием; III, IV, V — первый, второй и третий
отборы элитных растений из исходного сорта
и из первого и второго отборов соответственно
протяжении всего времени производственного использо-
вания сорта, то многократный массовый отбор переходит
в непрерывный. В ряде случаев, в частности в семеноводст-
ве, от общей массы типичных для селекционной формы
или сорта растений необходимо удалить незначительное
число нетипичных растений или примесь. Массовый отбор
в этом случае называется негативным.
211
Массовый отбор наряду с достоинствами (техниче-
ская простота и высокая экономичность в случае четко
выраженной немноготипной гетерогенности исходной по-
пуляции) имеет и существенные недостатки — невозмож-
ность индивидуальной оценки по потомству и вследствие
этого потерю крайних лучших генотипов.
183- ЧТО ТАКОЕ СИНТЕТИЧЕСКАЯ СЕЛЕКЦИЯ!
Синтетическая селекция — это селекция, основанная
на использовании для отбора исходного материала, созда-
ваемого путем гибридизации (синтеза) различных сортов
и форм. Синтетическая селекция осуществляется путем
перекомбинации и трансгрессии. При комбинационной
синтетической селекции в одном гибридном растении со-
четаются признаки и свойства двух или более родитель-
ских форм. Задача селекционера — отобрать и генети-
чески стабилизировать гибридные растения, наиболее
полно сочетающие эти признаки и свойства. Трансгрессив-
ная синтетическая селекция основана на отборе в рас-
щепляющихся после гибридизации поколений особей с
трансгрессией, т. е. с положительными признаками, вы-
раженными в большей степени, чем у лучшего родителя.
При трансгрессивной синтетической селекции успех рабо-
ты зависит от отыскания родительских форм, способных
при скрещивании давать трансгрессии.
На основе синтетической селекции и создано большин-
ство новых сортов.
184. ЧТО ТАКОЕ ДИАЛЛЕЛЬКОЕ СКРЕЩИВАНИЕ!
Скрещивание, при котором испытываемые линии или
сорта объединяются между собой во всевозможные ком-
бинации (полные диаллельные скрещивания) или только
в части комбинаций (неполные диаллельные скрещива-
ния), называется диаллельным. Оно применяется для
оценки специфической комбинационной способности не-
большого числа линий после предварительной оценки их
общей комбинационной способности в скрещиваниях по
системе топкросс. Если в полных диаллельных скрещи-
ваниях п-го числа линий используются реципрокные ком-
бинации, то число возможных комбинаций будет равно
п(п — 1). Для сокращения объема работ применяются не-
полные диаллельные скрещивания, когда материнская
212
форма скрещивается только с частью отцовских, при
этом разные отцовские формы участвуют в скрещиваниях
с разными материнскими.
185. ЧТО ТАКОЕ СТУПЕНЧАТАЯ ГИБРИДИЗАЦИЯ!
Ступенчатая гибридизация — это разновидность слож-
ного скрещивания, когда в гибридизацию последовательно
(ступенчато) вовлекаются несколько родительских форм.
Схема ступенчатой гибридизации может иметь различные
модификации, например [(АХБ)ХС], [(АХВ)Х(СХ
XD)]XE и т. д.
Полученные по приведенным схемам гибриды в по-
следующих поколениях могут ступенчато скрещиваться
с другими привлекаемыми в комбинацию формами. Таким
образом, ступенчатая гибридизация может продолжаться
до желаемого совмещения в одном гибриде комплекса
положительных признаков, свойственных многим формам,
каждая из которых в отдельности страдает теми или ины-
ми недостатками. Ступенчатая гибридизация имеет зна-
чительные преимущества по сравнению с простыми скре-
щиваниями и является основным методом селекции многих
сельскохозяйственных растений.
186. ЧТО ТАКОЕ КОНВЕРГЕНТНЫЕ СКРЕЩИВАНИЯ!
Конвергентное скрещивание — это разновидность на-
сыщающих скрещиваний, в которых гибриды первого
поколения скрещиваются в двух направлениях: одни с
отцовской формой, другие с материнской. Конвергентные
скрещивания можно представить в виде следующей схемы:
исходное скрещивание: АХ В-
беккросс 1-й: АВХАВВХВ;
» 2-й: АВАХААВВХВ;
» 3-й: АВААХААВВВХВ;
» 4-й: АВАААХАХАВВВВХВ.
В беккроссах, где насыщение осуществляется формой
А, отбираются лучшие признаки, свойственные форме
В, а в беккроссах с насыщением гибрида ядерным веще-
ством В — наоборот. В результате получаются две сбли-
женные (конвергентные) линии, которые скрещиваются
между собой.
213
187. КАК ПОЛУЧАЮТ НОВЫЕ ВИДЫ!
Экспериментальное воссоздание видов, существующих
в естественных условиях, возможно на основе рекомбина-
ции геномов других видов. Процесс видового ресинтеза
сводится к скрещиванию возможных для данного алло-
полиплоида исходных форм и последующему естествен-
ному или индуцированному удвоению числа хромосом
у полученного гибрида (амфиполиплоидия). Таким же
образом были ресинтезированы несколько видов растений.
Наиболее ярким примером видового ресинтеза является
воссоздание мягкой пшеницы путем скрещиваний с уча-
стием Triticum thaoudar (АА, 2п = 14, дикая двуостая
однозернянка), Aegilops speltoides (ВВ, 2н = 14) и Aegi-
lops squarrosa (DD, 2n —14) по следующей схеме:
ААХВВ
I
AB
Удвоение числа хромосом ААВВ (2п == 28, дикая дву-
зернянка) X (2n = 42, Triticum aestivum).
Полученный аллогексаплоид идентичен подвиду гек-
саплоидной пшеницы spelta, легко скрещивается с его
сортами и с обычными сортами мягкой пшеницы. Воз-
никает вопрос, можно ли получить формы растений, не
существующих в естественных условиях, эксперименталь-
но. Видовой синтез обычно является следствием сочетания
отдаленной гибридизации с полиплоидией (амфидиплои-
дией), когда удвоение хромосомного набора в Fi отдален-
ного гибрида сообщает ему относительно стабильную
фертильность. К видам, синтезированным в эксперименте,
относятся тритикале, гибрид редьки и капусты (Raphano-
brassica), полученный Г. Д. Карпеченко, 56-хромосомные
промежуточные пшенично-пырейные гибриды, октоплоид-
ный амфидиплоид Triticum soveticum А. Р. Жебрака и не-
которые другие формы.
188. КАКОВЫ ПРИМЕРЫ ИСПОЛЬЗОВАНИЯ ГЕНЕТИКИ В СЕЛЕКЦИИ
МИКРООРГАНИЗМОВ!
Бактерии и актиномицеты давно используются в ми-
кробиологической промышленности для получения хозяй-
ственно полезных продуктов. С помощью генетических
методов удается значительно повысить эффективность
микробного синтеза. В качестве примера рассмотрим
214
синтез триптофана, используемого в животноводстве для
обогащения кормов. Известно, что триптофан синтезиру-
ется в организме из хоризмовой кислоты с помощью
генов, объединенных в один оперон и регулируемых конеч-
ным продуктом. Генетическими методами удалось вывести
штамм кишечной палочки, вырабатывающий около 80 мг
триптофана на 1 г сухой массы бактерий. Для этого в
локус гена-репрессора или в оператор вначале вводились
мутации, снижающие скорость ингибирования конечным
продуктом. Затем в этот же штамм добавлялись мутации,
блокирующие образование из хоризмовой кислоты других
аминокислот — фенилаланина и тирозина, что увеличило
процент использования хоризмовой кислоты на образо-
вание триптофана. На конечном этапе работы в аттенюа-
тор были введены мутации, обеспечивающие транскрип-
цию всех инициированных информационных РНК, что еще
более повысило продуктивность данного штамма. На этом
примере хорошо видны широкие возможности использо-
вания генетических методов в селекции бактериальных
штаммов. Путем постепенного отбора были получены
штаммы актиномицетов — продуцентов пенициллина,
стрептомицина и других антибиотиков. Однако использо-
вание классических методов селекции в микробиологии
наталкивается на значительные затраты труда, так как
мутагенез не носит сайт-специфичного характера.
Иногда удается получить штаммы-продуценты методом
гибридизации клеток через слияние протопластов. Метод
заключается в обработке клеток ферментами, разрушаю-
щими их оболочку, что обеспечивает возможность по-
следующего слияния образовавшихся протопластов. С по-
мощью генно-инженерных методов создаются ценные для
промышленности штаммы бактерий, вырабатывающих ви-
тамины (В2, В12), гормоны, интерферон. Бактериальный
синтез всех этих веществ сравнительно дешевый и позво-
ляет получать их в достаточно больших количествах.
189. КАКИЕ СОРТА КУЛЬТУРНЫХ РАСТЕНИЙ СОЗДАНЫ
БЕЛОРУССКИМИ СЕЛЕКЦИОНЕРАМИ!
Озимая рожь
Белта — сорт выведен методом гибридизации сорта
Петкусская с тетраплоидным образцом из ПНР с исполь-
зованием индивидуально-семейного отбора. Районирован
в БССР (1969 г.) и некоторых областях РСФСР, Украин-
215
ской и Молдавской ССР. Урожайность выше 50 ц/га. Зер-
но имеет хорошие мукомольные и хлебопекарные качества.
Зимостойкость и степень устойчивости к поражению
снежной плесенью средние. Экологически пластичен.
Засухоустойчив. Устойчивость к полеганию выше
средней.
Пуховчанка — сорт выведен методом гибридизации
тетраплоидных сортов Белта и Карстен и последующим
индивидуально-семейным отбором. Районирован в БССР
(1985 г.). Максимальная урожайность 68 ц/га. Зимостой-
кость выше средней. Устойчивость к поражению снежной
плесенью удовлетворительная.
Крыжачок — тетраплоидный сорт, представляет собой
сложную популяцию. Родительские формы — Белта, Жо-
динская, Калужская-45, Вятка тетра, ЕМ-1 и др. Райони-
рован в Минской обл. (1985 г.). Максимальная урожай-
ность 64 ц/га. Среднеспелый. Зимостойкий, устойчивый
к осенним и весенним заморозкам, обладает хорошей
регенерационной способностью. Слабо поражается снеж-
ной плесенью. Поражение мучнистой росой и бурой
ржавчиной среднее. Сорт практически не полегает.
Озимая пшеница
Березина — сорт выведен методом индивидуального
отбора из гибридной популяции Мироновская-808Х Без-
остая-1. Районирован в БССР (1985 г.). Максимальный
урожай 74 ц/га. Имеет высокие мукомольно-хлебопекар-
ные качества, вышесреднюю зимостойкость. Степень пора-
жения бурой ржавчиной нижесредняя, мучнистой росой
и корневыми гнилями — средняя. Обладает хорошей эко-
логической пластичностью, полевой устойчивостью к бо-
лезням и полеганию, засухоустойчив.
Надзея — сорт выведен методом индивидуального от-
бора из гибридной популяции Мироновская-808Х Аврора.
Районирован в Минской и Витебской обл. (1987 г.).
Максимальная урожайность 79,4 ц/га. Относится к сортам
зернофуражного использования. Зимостойкость на уровне
стандарта. Сорт слабо поражается твердой головней,
септориозом и снежной плесенью, устойчив к полега-
нию. Имеет хорошую экологическую пластичность.
Пригоден для возделывания по интенсивной техно-
логии.
216
Яровой ячмень
Зазерский-85 — сорт выведен методом индивидуально-
го двукратного отбора из гибридной популяции НЕ 481-
128X49214/69. Районирован в республике (1985 г.).
Максимальная урожайность 72,3 ц/га. Степень поражения
пыльной головней и сетчатым гельминтоспориозом сред-
няя. Устойчив к полеганию.
Жодинский-5 — сорт получен методом индивидуаль-
ного отбора из гибридной популяции МазуркаХ Км-1192.
Районирован в БССР (1986 г.). Максимальная урожай-
ность 69 ц/га. Устойчив к сетчатому гельминтоспориозу
и мучнистой росе. Лучший сорт для почв легкого механи-
ческого состава и поздних сроков сева, отличается
быстрым первоначальным ростом, повышенной засухо-
устойчивостью, высокой стабильностью урожая. Сорт
полуинтенсивного типа.
Овес
Буг — сорт получен методом отбора из гибридной
популяции МН 61645Х Грунди. Районирован в БССР.
Максимальная урожайность 78 ц/га. Сорт высокоурожай-
ный. Обладает высокой устойчивостью к поражению
корончатой ржавчиной. Пригоден для возделывания на
разных по механическому составу и уровню плодородия
почвах. Устойчив к болезням и полеганию. Сорт интен-
сивного типа.
Яровая пшеница
Белорусская-12 — сорт выведен методом индиви-
дуально-семейного отбора из гибридной популяции от
скрещивания Опал X Минская. Районирован в 1980 г.
в Мордовской АССР, Калужской, Владимирской, Черни-
говской, Житомирской, Львовской, Винницкой, Терно-
польской, Черновицкой, Ивано-Франковской обл. Макси-
мальная урожайность 80,2 ц/га. Среднеспелый. Сорт
высокоурожайный. Хлебопекарные качества хорошие.
Слабо поражается бурой и стеблевой ржавчиной, муч-
нистой росой, средне — пылевой и твердой головней. По
устойчивости к полеганию значительно превосходит
стандартные сорта. Сорт отзывчив на внесение азотных
удобрений и хорошо приспособлен к возделыванию по
интенсивной технологии.
Белорусская-80 — сорт выведен методом многократно-
217
го индивидуального отбора из гибридной популяции от
скрещивания ярового сорта Опал с озимым сортом
Кавказ. Районирован в республике (1983 г.). Максималь-
ная урожайность 62,7 ц/га. Среднеспелый, период
вегетации 95—105 дней. Хлебопекарные качества хорошие.
Имеет равномерное созревание. Высокоустойчив к полега-
нию. Слабо поражается бурой и стеблевой ржавчиной,
средне — пыльной головней, а твердой головней значи-
тельно слабее, чем сорт Ленинградка.
Люпин желтый
Нарочанский — сорт выведен методом многократного
отбора из польского образца Р-6025. Районирован в
БССР, Владимирской и Брянской обл. Максимальная
урожайность зерна 27, зеленой массы 536 ц/га. По уро-
жайности зерна и зеленой массы сорт Нарочанский близок
к стандарту Академический. Содержание белка в зерне
45,8 %. Сорт высокоустойчив к фузариозному увяданию.
Кормовой горох (пелюшка)
Устянская — сорт выведен методом многократного
массового отбора из образца местной популяции. Райони-
рован в Витебской и Минской обл. (1967 г.), в БССР
(1982 г.). Урожайность семян 25—30, зеленой массы до
400 ц/га. Среднеспелый, вегетационный период 90—
100 дней. Сорт высокоурожайный по семенам и зелёной
массе. Устойчив к поражению аскохитозом и мучнистой
росой. Плодожоркой практически не поражается.
Гречиха
Искра — сорт создан методом индивидуально-семей-
ного отбора и семейно-группового отбора высокопродук-
тивных потомств из переведенного на тетраплоидный
уровень диплоидного гибрида Юбилейная-2 X Жиздрин-
ская и направленного переопыления высокопродуктивной
части их семей в условиях высокого агрофона. Тетрапло-
идный сорт. Районирован в БССР (1979 г.). Средняя
урожайность на сортоучастках 12,8—21,5, максимальная
24,5 ц/га. По качеству крупы отнесен к ценным сортам.
Устойчив к болезням и полеганию.
Черноплодная — сорт выведен методами инбридинга,
мутагенеза и отбора микромутаций из сорта Юбилейная-2.
218
Районирован в БССР (1980 г.), Мордовской АССР
(1982 г.), Тульской обл. (1985 г.}. Диплоидный сорт.
В опытах средняя урожайность за 1980—1984 гг. состави-
ла 21, максимальная — 34,5 ц/га. Устойчив к болезням.
Минчанка — сорт создан методом многократного от-
бора высокопродуктивных растений и их потомств из
генофонда сорта Искра. Районирован в БССР (1985 г.).
Тетраплоидный сорт. Максимальная урожайность
27,6 ц/га. Сорт среднеспелый, вегетационный период
78—90 дней, растения ветвистые, хорошо облиственные,
цветки и зерно крупные, масса 1000 зерен 35—36 г. Сорт
высоких технологических качеств зерна и устойчив к
болезням.
Сахарная свекла
Гибрид ганусовский-8 — межсортовой гибрид, уро-
жайно-сахаристого направления, позднеспелый, однорост-
йовость гибрида 65—80 %, всхожесть семян 75—82 %.
Районирован во всех свеклосеющих областях БССР.
Урожайность корнеплодов 480 ц/га. Сорт высокопродук-
тивный. Содержание сахара в корнях 16,8 %, сбор сахара
достигает 80,9 ц/га. Устойчив к пероноспорозу и корнееду.
Ганусовская односемянная-55 — популяция урожайно-
сахаристого направления. Одноростковый диплоид.
Районирован (1986 г.) во всех свеклосеющих районах
БССР. Высокопродуктивный сорт. Урожайность корнепло-
дов 490 ц/га, сахаристость 16,9 %, сбор сахара 82,9 ц/га.
Сорт малоцветущий. Относительно устойчив к церкоспоро-
зу и корнееду.
Полигибрид Белорусский-31 — сорт выведен в Инсти-
туте генетики и цитологии АН БССР в содружестве
с Ганусовской опытно-селекционной станцией методом
скрещивания тетраплоидных и диплоидных форм сахарной
свеклы. Малоростковый триплоид. Районирован в Брест-
ской обл. (1978 г.). Средний урожай корней составил
410—623 ц/га, содержание сахара 15,3—19,5 %, сбор са-
хара 56,3—99,1 ц/га. Лежкость корнеплодов удовлетво-
рительная. Нецветущий, малоростковый сорт, устойчив
к повреждению корнеедом и поражению церкоспорозом.
Технология возделывания общепринятая.
Кормовая свекла
Белорусская красная — сорт гибридного происхожде-
ния, получен в результате скрещивания кормовой свеклы
219
Сибирская оранжевая с сахарной свеклой Б-9151 и после-
дующим отбором. Районирован в БССР на торфяно-
болотных (1975 г.), а в Могилевской обл. на минеральных
почвах (1981 г.). Урожай корнеплодов 600—800 ц/га.
Смолевичская — сорт получен на основании гибриди-
зации из тетраплоидной формы сорта Эккендорфская
желтая. Районирован в БССР (1984 г.). Урожайность
корнеплодов составила 647—1326, сбор сухого вещест-
ва — 95,0—142,7 ц/га. Сорт тетраплоидный. Корнеплод
крупный, мешковидно-цилиндрической формы, со слабо
выраженным перехватом посередине. По внешнему виду
схож с видом Эккендорфская желтая. Содержание сухого
вещества в корнеплодах 12,5—14,0 %.
Клевер луговой
Цудоуны — сорт создан путем свободного переопыле-
ния 28 лучших местных популяций в сочетании с негатив-
ным отбором. Районирован в БССР с 1969 г. на минераль-
ных почвах. Максимальная урожайность зеленой массы
750 ц/га, семян 4,5 ц/га. Сорт хорошо зимует, облиствен-
ность составляет 35—56 %. Сено высокого качества,
содержание сырого протеина в сене составляет 15—
17,8 %. Пригоден для механизированной уборки. Пораже-
ние пятнистостью и клеверным раком среднее. Высоко-
урожайный многолетний сорт, слабо снижает продуктив-
ность во втором году пользования.
Клевер ползучий
Волат — сорт создан методом гибридизации сорта
Гигант со шведским сортом Киви и последующим систе-
матическим негативным отбором. Районирован в Смолен-
ской обл. (1979 г.) и в БССР (1982 г.). За три укоса уро-
жайность зеленой массы достигает 641—782 и сена
90,9—106,4 ц/га. Сорт позднеспелый, крупнолистный,
многоотавный, рано отрастающий весной и после укосов.
Ветвистость и облиственность хорошие. Соцветие крупное,
довольно плотное.
Клевер гибридный
Красавок — сорт выведен путем отбора из шведского
образца. Районирован в БССР (1983 г.) для минеральных
почв на сенокосное использование. Урожайность зеленой
массы достигает 550—570, сена — 100—110, семян —
220
5 ц/га. Сорт тетраплоидный, позднеспелый, медленно
отрастает после укосов. Влаголюбив. Менее требователен
к почвенным условиям, чем клевер луговой. Сохраняется
в травостое при использовании на сено до 5, на пастбищах
до 8 лет. Содержание протеина в сухом веществе достигает
16 %. Среднеустойчив к мучнистой росе. Зимостоек.
Люцерна
Белорусская *— сорт выведен методом биотипического
отбора растений, обладающих хорошей зимостойкостью,
засухоустойчивостью, семенной продуктивностью. Райони-
рован в БССР (1979 г.). Урожайность зеленой массы
в конкурсном сортоиспытании в первом году пользования
достигла 468—629 ц/га, во втором — 410—757, в треть-
ем—501—602 ц/га, сена— 116—140, 104—167,7, 116—
137 ц/га соответственно. Устойчив к различным листовым
болезням. В благоприятные годы может давать три
полноценных укоса. Устойчив к неблагоприятным услови-
ям в период перезимовки и вегетации, раньше отрастает
весной и после скашивания, более долголетен при
интенсивном использовании.
Глава
10
РЕШЕНИЕ ЗАДАЧ ПО ГЕНЕТИКЕ
190. КАК РЕШАТЬ ЗАДАЧИ ПО ГЕНЕТИКЕ!
Решение задач по генетике способствует усвоению
теории и ее практическому применению. Обычно при
решении задач проводится генетический или гибридоло-
гический анализ. Цели анализа могут быть различными:
определение числа генов, контролирующих изучаемый
признак, установление характера наследования, определе-
ние генотипов и фенотипов потомства или родительских
форм и т. д.
Рассмотрим некоторые примеры решения задач на
моно-, ди- и полигибридное скрещивание, сцепленное
наследование, наследование, сцепленное с полом, неал-
лельное взаимодействие генов и генетический анализ
популяций.
221
Моногибридное скрещивание
Задача 1. Определить генотипы родительских форм,
если при скрещивании желтосемянных растений в Fi, F% и
F3 были только желтосемянные. Установлено, что при-
знак — окраска семян гороха контролируется одной
парой аллелей, локализованных в паре аутосом.
Решение. Поскольку в течение трех поколений не
наблюдалось расщепления, исходные формы гомозиготны.
Задача 2. Определить генотипы родительских форм,
если при скрещивании желтосемянного и зеленосемянного
растений первое поколение было желтосемянным, а во
втором поколении наблюдалось расщепление на.3/4 жел-
то- и 1/4 зеленосемянных.
Решение. Fi было единообразным, значит, родители —
гомозиготы. При скрещивании двух различных гомозигот
в Fi все потомки должны быть гетерозиготными. Они
желтосемянные, значит, этот признак доминирует. Обо-
значим аллели, определяющие желтую окраску семян,
через 4, а зеленую — через а. Тогда
Р: ААх^а
гаметы: А а
Fr. Аа
гибрид
Для получения второго поколения скрещиваем гиб-
риды Fr.
АаХАа
гаметы: АаАа
9 сГ А а
А АА Аа
а Аа аа
Расщепление по генотипу в F$> 1/4 44+2/4 4п+1 /4 аа
или по фенотипу 3/4 желтосемянных и 1/4 зелено-
семянных.
Задача 3. Какое потомство следует ожидать в анали-
зирующем скрещивании желтосемянных растений их Fi?
222
Решение. Скрещиваем желтосемянное растение
с зеленосемянным:
Р: Аа%аа
G: 1/2 4 а
1/2 а
F: 1/2 4а + 1/2 аа
желтое зеленое
растение растение
В анализирующем скрещивании получим расщепление
1:1, что является результатом образования двух типов
гамет гетерозиготой Аа.
Ди-Г полигибридные скрещивания
Если изучается передача двух или более пар признаков,
необходимо учитывать, что гены, контролирующие их,
могут наследоваться независимо или быть сцепленными.
Независимое наследование
Поскольку каждый признак контролируется одной па-
рой аллелей, локализованных в разных парах хромосом,
анализ каждого признака при решении задач должен
проводиться отдельно.
Задача 4. Какое потомство следует ожидать от
скрещивания гомозиготного желтосемянного растения с
зеленосемянным морщинистым, если окраска и поверх-
ность семян гороха наследуются независимо? Желтая
окраска доминирует над зеленой, гладкая поверхность
семян — над морщинистой.
Решение. Обозначим через Лиа аллели желтой и зеле-
ной окраски, а через В и b — аллели гладкой и морщи-
нистой поверхности семян соответственно.
В первом поколении все потомство будет гетерозигот-
ным АаВЬ с желтыми гладкими семенами, во втором
наблюдается расщепление по каждому признаку в отно-
шении 3/4:1/4. Анализируя совместно оба признака,
получим 3/4А- + 1 /4аа) (3/4В- 4- 1 /Abb}:
9/16 4-В-+3/16 4-6& + 3/16 ааВ + 1/16 aabb
желтые желтые зеленые зеленые
гладкие морщинистые гладкие морщинистые
Сцепленное наследование
Если признаки определяются генами, локализованными
в одной паре гомологичных хромосом, то они наследуются
223
сцепленно. При полном сцеплении гены всегда насле-
дуются вместе. Благодаря процессу кроссинговера могут
возникать кроссоверные гаметы (или гаметы-рекомби-
нанты), частота которых, зависит от расстояния между
генами: чем больше расстояние, тем больше вероятность
разрывов и обменов и тем больше кроссоверных гамет.
Частота кроссоверных и некроссоверных гамет определяет
число потомков родительского типа и рекомбинантов,
сочетающих признаки матери и отца.
Задача 5. Определить частоту кроссинговера между
генами, если при скрещивании серых длиннокрылых мух
(дикий тип) с черными короткокрылыми в Fi все мухи
были длиннокрылыми, а в анализирующем скрещивании
самок Fi с черными короткокрылыми самцами получили
расщепление: 722 серых длиннокрылых, 139 серых корот-
кокрылых, 161 черных длиннокрылых и 778 черных
короткокрылых. У дрозофилы гены окраски тела сцеплены
с генами, определяющими длину крыла. Доминантные
аллели серого тела и длинных крыльев обозначим
знаком +, черного тела — 6, а зачаточные крылья — vg.
Решение. При независимом наследовании в анали-
зирующем скрещивании было бы расщепление 1:1:1:1,
т. е. при общем количестве потомков 1800 было бы
расщепление 450 серых длиннокрылых, 450 серых коротко-
крылых, 450 черных длиннокрылых и 450 черных корот-
кокрылых. Но поскольку гены сцеплены, потомство
родительского типа значительно превышает число реком-
бинантов. Общее число рекомбинантов достигает 300, что
составляет 16,7 % от общего числа особей в потомстве.
Это и есть величина кроссинговера, характеризующая
силу сцепления, а значит, и расстояние между генами.
Задача 6. Какое потомство следует ожидать от скрещи-
вания нормальных (серых длиннокрылых) гетерозиготных
самок с черными короткокрылыми самцами, если кроссин-
говер между генами b и vg составляет 16,7 %?
+ +
Решение. Гетерозиготные самки = = дадут 16,7 %
b vg
рекомбинантных гамет (151 + ug и 151 Ь) и 83,3 % гамет
родительского типа (749 + +, 749 bvg). В задаче были
получены другие результаты: 720++, 139 + vg, + 161
& + и 778 Разница между теоретически ожидаемыми
результатами и результатами, полученными в эксперимен-
те, может быть случайной, т. е. следствием ошибки
224
выборки, неточности данных, заключенных в условии
задачи.
Для выяснения причины установленных отклонений
полученные данные необходимо обработать по методу х2
Составим таблицу:
Результат Классы
+ 4- ь+
Ожидаемый ре- зультат q Наблюдаемый ре- зультат Отклонение d d2/q 749 722 27 729/749 0,9 151 139 12 144/151 0,9 151 161 10 100/151 0,6 749 778 29 841/743 1,1
По полученным результатам найдем х2;Х2 = ^d2/q = 3,5.
Число степеней свободы при четырех фенотипических
классах равно 3. По таблице Фишера найдем 0,2>Р<0,5
(см. табл. 1). Значит, отклонение случайное и является
результатом ошибки выборки.
Наследование, сцепленное с полом
Задача 7. Допустим, что женский пол гомогаметен
(XX), а мужской — гетерогаметен (XY). Например, у дро-
зофилы окраска глаз — признак, сцепленный с полом,
аллель красной окраски обозначен знаком +, аллель
белой окраски — w. Какое потомство можно получить от
скрещивания белоглазой самки с красноглазым самцом?
Решение. Самка имеет две Х-хромосомы, значит,
и два аллёля окраски глаз, самец — одну Х-хромосому,
а значит, и один аллель окраски глаз, поскольку Y-хромо-
сома может считаться генетически инертной и не несет
аллеля окраски глаз:
ау
Р: 2 = X
w
белоглазая
G: w
Ft: 99 =
W
красноглазые
+
a =5
красноглазый
белоглазые
8—1740
225
Если один признак сцеплен с полом, а другой не
сцеплен, анализ несколько усложняется.
Задача 8. Какое потомство в Fj и можно получить
от скрещивания белоглазой длиннокрылой самки/: красно-
глазым короткокрылым самцом, если у дрозофилы окраска
глаз сцеплена с полом, а длина крыльев не сцеплена?
Решение. Обозначим аллель красной окраски глаз
через +, белой — до, длинных крыльев — через + и ко-
ротких крыльев — через vg. Тогда
9 = = X
G: tv-Ь +vg
красноглазые
длиннокрылые
ш ч-
92= =
+ vg
+ Vg
~~7 Vg
—7 Vg
W +
cfcf— ==
“^Vg-
белоглазые
длиннокрылые
G: w-f~ к>4-
J-vg tvvg
W Vg -------7 +
+ + Vg
p . 3 + + 3 4- -h
t2. 99 == = красноглазые длиннокрылые o'o' -g—— —
3 w &
------- белоглазые длиннокрылые
8 w —
•g- “ “ красноглазые короткокрылые
1 w vg
~w ~vg оелоглазые короткокрылые
3 w 4-
8
1 + vg
8 —7 vg
1 w vg
8 —7 Vg '
Задача 9, Определить порядок генов, расстояние
между ними и генотип гетерозиготного родителя, если
в анализирующем скрещивании получено:
cv+ cP v — 73
cv+ cP v+— 2
cv+ ct v+ — 759
cv+ ct v — 140
cv cP v — 766
cv ct v+ — 80
cv сГр— 158
cv ct v — 2
Обозначения генов: — красная окраска глаз; и — кино-
варная; ct+ — нормальные крылья; ct — вырезки на
крыльях; cv + — жилка отсутствует.
Решение. Поскольку полученные результаты явно
отличаются от ожидаемых, в случае, если бы гены наследо-
226
вались независимо, делаем вывод, что наследуемые
признаки, а значит, и гены, контролирующие их, по-види-
мому, сцеплены. Для решения задачи необходимо опре-
делить силу сцепления между всеми тремя генами.
Выбираем любую пару аллелей, например cv+ ct+, и ком-
плементарную ей cvct и подсчитываем количество особей
с избранной комбинацией признаков (73+, 2+, 2+, 80 =
= 157). Оставшиеся комбинации этих же аллелей
cv + ct и cv ct+ в сумме дают 759+ 140 + 766+ 158= 1823,
что гораздо больше числа предыдущих комбинаций,
которые являются рекомбинантными или кроссоверными.
Доля кроссоверных особей от общего числа потомков
составляет 7,9 %. Значит, расстояние между генами будет
равно 7,9 единиц рекомбинации, а их расположение на
хромосоме окажется таким: cv+ ct или cv ct+.
Аналогичным образом определяется расстояние между
следующей парой генов — ct и у. В этом случае сумма
ct+v и ctv + = 73 + 766 + 759 + 80 = 1678, а сумма ct+v +
и ctv = 2+140+158 + 2 = 202. Значит, расстояние меж-
ду ct cv равно 10,2 % и аллели ct+v расположены на
одной хромосоме. Таким же образом определяем расстоя-
ние между генами cv и v\ [(си+у + су v+)] = 73 + 140 +
+ 80 + 158 = 451, что составляет 27,7 %. Значит, порядок
генов на хромосоме следующий:
ггг+ 7,д ct ir*
I_____1------i-----1-----1----1
Неаллельное взаимодействие генов
Генетический анализ усложняется, если один признак
контролируется не одной, а двумя и более парами аллелей.
В таких случаях необходимо установить тип неаллельного
взаимодействия и число пар генов (пар аллелей), контро-
лирующих признак.
Задача 10. При скрещивании двух безалкалоидных
растений люпина в F\ все потомство оказалось алкалоид-
ным, а в Г2 наблюдалось расщепление: 9/16 алкалоидных
к 7/16безалкалоидньЬс. Установить генотипы исследуемых
форм.
Решение, Родительские безалкалоидные формы генети-
чески отличаются, иначе в F% они не дали бы расщепления.
Они были гомозиготами, так как Fi было единообразным.
Наблюдаемое в F% расщепление свидетельствует о наличии
двух пар аллелей (двух генов). Следовательно, формула
227
расщепления у дигибридов 9:3:3:1 в данном случае
трансформировалась в 9:7 за счет объединения трех
последних классов в один фенотип: 3+34-1 = 7. Такое
расщепление возможно, если для проявления алкалоид-
ности необходимо наличие в генотипе доминантов по
обоим генам (ЛВ), все же остальные генотипы (Л-6, ааВ-,
aabb) фенотипически будут безалкалоидными:
Р: A Abb х ааВВ
безалкалоидные
АаВЬ X АаВЬ
алкалоидные
Г2: 9/16 А-В- 3/16 А-ЬЬ 3/16 ааВ- 1/16 aabb
алкалоидные безалкалоидные
В анализирующем скрещивании алкалоидной гетеро-
зиготы с безалкалоидным рецессивом будет непривычное
расщепление 3:1:
АаВЬ X aabb
G: АВ Ab аВ ab ab
F: 1/4 АаВЬ \/4Aabb 1/4 ааВЬ \/4 aabb
алкалоидные безалкалоидные
Следовательно, полученное расщепление по фенотипу
составит 3/4 безалкалоидных и 1/4 алкалоидных.
Генетический анализ популяций
Решение задач по генетике популяций предполагает
выяснение следующих вопросов: какие гены и генотипы
представлены в популяции, какова их частота и какой
будет популяция в последующих поколениях.
Задача 11. В изоляции оказалась группа особей
в соотношении ЗДЛ :6Ла: 1 \аа. Какими будут первое
и последующие поколения, если будут сохраняться условия
генетического гомеостаза: будут исключены такие факто-
ры, как отбор, мутационный процесс и миграция, и соблю-
дена равновероятность образования гамет всех типов
и панмиксия?
Решение, Определим соотношение аллелей А и а, кото-
рое будет соответствовать частоте гамет А и а. Доминант-
ные гомозиготы дадут только гаметы А (3 из 20); гомозиго-
ты аа — только гаметы а (11 из 20); гетерозиготы —
ЗЛ и За. Значит, частота гамет А окажется равной
3/20 + 3/20=6/20=0,3; а частота гамет а—11/20 +
+ 3/20= 14/20=0,7.
223
Составим решетку Пеннета для определения первого
поколения:
2 сГ 0,ЗЛ 0,7а
о,зл 0,09ЛЛ 0,21Ла
0,7а 0,21Ла 0,49аа
Л:9 % АА, 42 % Аа, 49 % аа.
Для определения, каким будет Г2, подсчитаем число
типов гамет А и а в F\\ 9/100 + 21/100=30/100=0,3 А;
49/100 + 21/100=70/100=0,7 а.
Составим решетку Пеннета для определения второго
поколения:
9 ст 0,ЗЛ 0,7а
0,ЗЛ 0.094Д 0,21 Л а
0,7а 0,21 Л а 0,49аа
F2:9 % АА, 42 % Аа, 49 % аа.
Результаты исследований показали, что генетическое
равновесие, установленное в первом поколении, сохра-
няется и в последующих.
Задача 12. Частота людей с группой крови NN в попу-
ляции составляет 16 %. Найти соотношение групп крови
ММ, MN и NN и частоту аллелей М и N.
Решение. Учитывая, что частота гомозигот (NN) со-
ставляет 16 % (0,16), найдем частоту аллеля N в популя-
ции: д/о,16 = 0,4. Тогда частота аллеля М составит 1 —
— 0,4 = 0,6. Определим число гомозигот ММ: 0,62= 0,36 и
число гетерозигот MN: 2 X 0,6 X 0,4 = 0,48 (48 %).
Задача 13. Уши кроликов породы баран имеют длину
30 см, других пород — 10 см. Предположим, что различия
в длине ушей зависят от двух пар генов с однозначным
действием. Генотип баранов — L1L1L2L2, обычных кроли-
ков — /1Л/2/2. Определить длину ушей кроликов в Fi и всех
возможных генотипов в F2.
Решение. Длина ушей кроликов относится к количест-
229
венным признакам, что затрудняет разбивку потомства
на четкие фенотипические классы. Генотипы с различным
количеством доминантных генов, определяющих длину
ушей, будут различными по фенотипу вследствие сум-
мирующего действия указанных генов. Запишем генотип
особей F\ и F%:
Р:
Fi: LylxLih-
В F% получим большое разнообразие генотипов с раз-
личным количеством доминантных генов (от 0 до 4):
F2: OF IL 2L 3L 4L.
Частота каждого генотипа соответствует коэффициен-
там разложения бинома Ньютона: 1 (0£), 4(1£), 6(2£),
4(3L), 1(4L) или 1/16, 4/16, 6/16, 4/16, 1/16 соответ-
ственно.
Для определения фенотипического выражения каждого
генотипа, т. е. длины ушей кроликов различных геноти-
пов, полученных в F2, найдем вклад одного доминантного
гена в фенотип: различие между крайними формами (на-
пример, у родителей) составляет 20 см при разнице до-
минантных генов 4. Значит, вклад одного доминантного
гена равен 5 см и длина ушей окажется равной 0L — 10 см,
1L — 15, 2L — 20, 3L — 25, 4L — 30 см. Формы с двумя
доминантными генами (гибриды F\) имеют среднее выра-
жение признака.
Задача 14. В популяции частота дальтонизма (т. е.
неспособность различать красный и зеленый цвета) со-
ставляет среди мужчин 0,08. Этот дефект обусловлен
сцепленным с полом рецессивным аллелем. Каковы ожи-
даемые частоты трех генотипов у женщин?
Решение. Так как дальтонизм — сцепленный с полом
признак, то частота встречаемости этой аномалии зрения
у мужчин совпадает с частотой обусловливающего даль-
тонизм гена q. Следовательно, 4 = 0,08 и р-1—0,08 =
= 0,92. Тогда ожидаемые частоты различных генотипов
среди женщин будут соответственно равны (0,92)2=0,846;
2 • 0,92 • 0,08 = 0,147; (0,08)2= 0,006.
Задача 15. В исходный момент популяция обладает
следующей генетической структурой по сцепленному с
полом локусу:
самцы: 400 А 600 а
самки: 640 А А, 320 Аа, 40 аа
230
Считая скрещивания случайными, рассчитайте равно-
весные частоты всех генотипов.
Решение, Частоты аллелей в целом по популяции
равны:
А [400/1000 + (640.2 + 320; /20001/2 = 0,6,
«[600/1000 + (320 4- 40 • 2)/2000]/2 = 0,4.
Значит, равновесные частоты генотипов будут сле-
дующими:
’ для самцов: А ~ 0,6; а — 0,4;
для самок: АА ~ 0,36; Ла = 0,48; аа = 0,16.
Задача 16. Если частота прямой мутации определен-
ного гена равна 10-5, а частота обратной мутации этого
же гена 10“6, то может ли наступить в данной популя-
ции равновесие по этим аллелям и какова будет равно-
весная частота аллелей?
Решение. Предположим, что частота прямой мутации
Ai-+A2 = и, а обратная мутация А2—А{ происходит с
частотой v. Если исходные частоты аллелей равны ро и 7о,
то в следующем поколении частота аллеля Л1 будет равна
Pi=Po“ upn + vqQ.
Так как доля иро аллелей Л1 превращается в А2, то и
доля vqo аллелей А2 превращается в А\. С учетом этого
изменение частоты аллеля А\ за одно поколение обозна-
чим Ар и получим формулу Ap — pt—р0, в которую
подставим значение рь Др = (р0 — цр0 + ир0)— ро =
~vqQ — иро. Когда Ар~0, наступает равновесие между
прямыми и обратными мутациями. Обозначим равно-
весные частоты аллелей через р и $ и, приняв, что Ар = 0,
получим up = vp.
При равновесии число различных аллелей, превращаю-
щихся друг в друга, равно. Если р + q = 1 или q = 1 — р,
то для равновесной частоты аллеля Ai имеем:
«р = и(1—р),
up 4- vp = V,
* V
р~ « + <?
Так как р 4- q = 1, то Q -------
г 1 и 4- v
Подставив истинные значения частот прямых и обрат-
ных мутаций и=10“5 и и = 10-6, получим следующие
результаты:
231
10~6
"- ~io‘~5‘+ io— - ТГ-"да; т0-^'+10-. - 1т ’ °'8'-
Естественно, что равновесие наступит только при условии
отсутствия других возмущающих факторов (миграции,
естественного отбора и т. д.).
Задача 17. У кишечной палочки частота мутаций,
обусловливающих превращение штамма из не нуждаю-
щегося в гистидине в растущий только в присутствии
гистидина, и частота обратных мутаций оцениваются
следующими величинами: his+-+his~ = 2 • 10-6; his~ -+
-+/iis г = 4 • 10-8. Предположив, что никаких иных
процессов в популяции не происходит, рассчитать равно-
весные частоты обоих аллелей.
Решение. Частоты his+ и his~ равны соответственно:
~ у _ 4* 10~8 _
2 . Ю“6 4-4 • 10~8 ~~ ’ ’
q=\— р —0,98.
Задача 18. Предположим, что частота мутаций А^а
равна 10“6, причем обратные мутации отсутствуют. Ка-
кой будет частота аллеля А через 10, 1000, 100 000 поко-
лений?
Решение. Частота pt по прошествии t поколений вы-
числяется по формуле pt = ро(1 — Если считать, что
начальная частота ро = 1,00, то
р10^(1 - Ю-6)10 — 0,99999;
Piooo = (1 - i0-6)I000 = 0,999;
рюо ооо = (I - IO’6)'00 000 == 0,905.
Молекулярная генетика
Задача 19. Искусственно синтезированная информа-
ционная РНК (молирибонуклеотид) может служить мат-
рицей при синтезе полипептида. В нескольких экспери-
ментах получены следующие результаты.
Эксперимент I. Поли (А) ведет к образованию поли-
лизина.
Эксперимент II. Поли (АГ) ведет к образованию поли-
пептида, состоящего из чередующихся глутаминовой
кислоты и аргинина.
Можно ли по результатам этих экспериментов утвер-
ждать, что 1) кодон состоит из 3 оснований; 2) код явля-
232
ется перекрывающимся; 3) зная, что код триплетен и не-
перекрывающийся, какие кодоны кодируют аргинин и
глутаминовую кислоту.
Эксперимент III. Поли(ААГ) образует смесь из трех
полипептидов: полилизин, полиаргинин, полиглутами-
новая кислота.
1. Что можно сказать на основании этого экспери-
мента об инициации трансляции?
2. Какие уточнения полученных ранее выводов можно
извлечь из результатов этого эксперимента?
Эксперимент IV. Поли(АААГ) образует полипептид
со следующим чередованием аминокислот: глутаминовая
кислота, аргинин, лизин, лизин.
1. Можно ли на основании результатов этого экспери-
мента говорить о вырожденности генетического кода?
Решение. Результаты эксперимента I могут быть интер-
претированы следующим образом:
1. Код моноплетен А — лизин
2. Код биплетен АА — лизин
3. Код триплетен ААА — лизин
На основании эксперимента II можно предположить,
что генетический код может быть
1) моноплетным:
А — аминокислота 1
Г — аминокислота 2
2) биплетным и перекрывающимся:
АГ — аминокислота 1
ГА — аминокислота 2
АГ — аминокислота 1
3) триплетным и неперекрывающимся:
АГА — аминокислота 1
ГАГ — аминокислота 2
АГА — аминокислота 1
Следовательно, результаты экспериментов I, II не
позволяют определить, является ли генетический код трип-
летным и неперекрывающимся. Если код триплетен и
неперекрывающийся, можно предположить, что амино-
кислоты — глутаминовая и аргинин кодируются двумя
триплетами АГА и ГАГ без уточнения, какой именно
233
триплет соответствует той или иной аминокислоте.
Результаты эксперимента III, в котором на поли (ААГ)
синтезируются три разных полипептида (полилизин, поли-
аргинин и полиглутаминовая кислота), показывают, что
инициация синтеза полипептида на такой искусственно
синтезированной матрице может начаться с любой точки,
т. е. из поли (ААГ) можно получить следующие полинук-
леотиды: поли (ААГ), поли (АГА), поли (ГАА), каждый из
которых даст начало той или иной полипептидной цепи.
Следует подчеркнуть, что такой способ синтеза полипеп-
тида может быть только in vitro.
Если бы код был моноплетным, то полученный поли-
пептид включал бы только две аминокислоты, одна из
которых была бы представлена в два раза чаще другой:
XXYXXYXXY, так как полинуклеотид был бы разбит на
кодоны: А[А|Г|А|А|Г|А|А|Г.
Если бы код был биплетным, неперекрывающимся в
составе полинуклеотида, были бы выделены следующие
биплеты: АА|ГА|АГ|АА|ГА, т. е. был бы получен один
полипептид, состоящий из трех аминокислот, чередую-
щихся в такой последовательности: XYZXYZXYZ; если бы
код был биплетным, перекрывающимся, мы бы имели
следующие рамки считывания: АА ГА АГ|АА, ГА, АГ|,
т. е. был бы синтезирован полипептид, состоящий из трех
чередующихся аминокислот: XYZXYZXYZ.
Если бы код был триплетным, перекрывающимся
на один нуклеотид, мы бы имели следующие рамки счи-
тывания: ААГААГААГ (ААГ, ГАА, АГА) был бы синте-
зирован один полипептид с тремя чередующимися ами-
нокислотами XYZXYZXYZ.
Если бы код был триплетным, перекрывающимся на
два нуклеотида ААГААГААГЦААГ, АГА, ГДА), то был
бы получен один полипептид с тремя аминокислотами.
Другими словами, если бы код был моноплетным, биплет-
ным, перекрывающимся или неперекрывающимся, три-
плетным, перекрывающимся, мы получили бы один, а не
три разных полипептида.
Если код триплетен, неперекрывающийся со случай-
ной точкой инициации считывания, он ведет к синтезу
трех полипептидов, или,точнее, к трем гомополипептидам.
В эксперименте IV было установлено, что поли(АААГ)
служит матрицей для синтеза полипептида, состоящего
из глутаминовой кислоты, аргинина, лизина, лизина.
С учетом полученной из предыдущих экспериментов ин-
234
формации разбивка на триплеты может быть следующей:
ААА ГАА АГА ААГ и т. д. с точкой инициации в любом
триплете. Исходя из результатов эксперимента, можно
предположить расшифровку кодонов в виде
ААА — глутаминовая кислота
ГАА — аргинин
АГА — лизин
ААГ — лизин.
Однако эксперименты показали, что между кодонами и
аминокислотами существует следующая связь:
ААА лизин (эксперимент I)
АГА <
РдР аргинин, глутаминовая кислота (эксперимент II)
1 AI
ААГ
Ард лизин, аргинин, глутаминовая кислота (эксперимент III)
ГАГ
Следовательно, АГА может кодировать аргинин или глу-
таминовую кислоту. Тогда кодоны ААГ и ГАА будут соот-
ветствовать лизину. Итак, лизин кодируется тремя кодо-
нами: ААА, ААГ, ГАА.
В данном случае проявляется вырожденность гене-
тического кода, заключающаяся в том, что одной амино-
кислоте соответствуют несколько триплетов.
Задача 20. Количество ДНК в ядре клетки человека
равно приблизительно 6* 10“12 г. Известно, что участок
двойной спирали ДНК длиной в 0,1 нм имеет массу, рав-
ную массе 190 атомов водорода. На основании этих дан-
ных определить а) общую длину ДНК в ядре; б) среднюю
массу ДНК одной хромосомы и в) длину ДНК одной хро-
мосомы, если допустить, что все хромосомы одинаковы по
длине. Сравнить длину ДНК хромосомы и размеры мета-
фазных хромосом.
Решение. Масса ДНК длиной в 0,1 нм в 190 раз больше
массы атома водорода. Масса одного атома водорода
(в граммах) равна 1/6- 1023. Следовательно, масса 0,1 нм
ДНК равна 190/6* 1023 г. Тогда общая длина ядерной
ДНК будет равна:
6-ю-12
190/6 - 1023
= 1,9 • 109 нм = 1,9 м.
235
Количество ДНК (в граммах) в одной хромосоме равно:
6И0“12
46 “
1,3 ИО” “
Длина ДНК одной хромосомы
-L - — - =4,75 ИО7 нм1=4;75 см.
46
Следовательно, длина хромосомы в интерфазе (длина
ДНК) более чем в 40 000 раз превышает длину метафаз-
ной хромосомы.
Задача 21. Культуру клеток Е. coli равномерно ме-
тили 15N, выращивая клетки в течение 14 поколений на
среде с 15NH4C1. Затем эту среду заменяли средой, содер-
жащей I4NH4C1. При центрифугировании в градиенте
плотности ДНК, выделенной из клеток перед пересевом
на среду с 14NH4C1, обнаруживался гомогенный пик ДНК,
седиментирующий отдельно от обычной ДНК, которую
добавляли в качестве контроля. Этот пик соответство-
вал ДНК, полностью меченой 15N. После переноса на
среду с I4N брали пробы клеток, выделяли в них ДНК
и анализировали ее в градиенте плотности. При этом
обнаруживали три пика ДНК с различной плотностью.
Один соответствовал максимально меченой ДНК, вто-
рой — немеченой, а третий являлся промежуточным между
первым и вторым. Относительное содержание этих трех
ДНК изменялось в зависимости от времени, прошед-
шего после переноса клеток на среду с 44N:
время, мин легкая фракция промежуточная фракция, %, общей ДНК тяжелая фракция
0 0 0 100
13 0 31 69
20 0 48 52
28 0 70 30
44 2 98 0
61 27 73 0
80 50 50 0
100 61 38 0
120 78 23 0
160 88 12 0
Среднее время генерации клеток было равно 40 мин.
Выполнить анализ полученных результатов.
Решение. В течение первого поколения промежуточный
236
пик увеличивается до 100 %, одновременно тяжелый пик
уменьшается до 0 %. Поскольку это происходит за одно
поколение, масса клеток должна удвоиться так же, как и
число клеток и количество молекул ДНК- Следовательно,
каждая молекула ДНК содержит тяжелый и легкий мате-
риал в отношении 1:1. Можно считать, что каждая моле-
кула ДНК содержит одну нить старой ДНК и одну —
новой.
В течение следующего поколения количество моле-
кул ДНК вновь удваивается, однако плотность промежу-
точного пика не уменьшается. Это означает, что в тех моле-
кулах ДНК, в которых после деления содержится тяже-
лый материал, легкий и тяжелый материал вновь нахо-
дится в отношении 1:1. Подобный характер распреде-
ления материала после деления соответствует тому, что
нити ДНК эквивалентны половине молекулы. Если каждая
нить в каждом поколении копируется и соединяется со
своей копией, то появление легкого пика, образовавше-
гося во втором поколении, объясняется тем, что легкая
нить, синтезированная в первом поколении, соединяется
со своей копией, образованной во втором поколении, т. е.
ДНК реплицируется по полуконсервативному типу.
СЛОВАРЬ ГЕНЕТИЧЕСКИХ ТЕРМИНОВ
Автолиз — самопереваривание тканей, клеток или их частей под
действием их собственных ферментов у животных, растений и микро-
организмов.
Автосиндез — конъюгация между собой хромосом одной родитель-
ской формы у отдаленного гибрида,
Адаптивные (индуцированные) ферменты — ферменты, скорость
синтеза которых изменяется в зависимости от условий существования.
Регуляция синтеза происходит на генетическом уровне под действием
индукторов, которыми могут быть соответствующие субстраты и мета-
болиты, а также гормоны (ферменты /ас-области Е. coli, р-галактозидаза,
пермеаза, ацетилаза; субстратом для них может служить галактоза,
индуктором — изопропил-p-D-тиогалактозид, ИПТГ).
Адаптор — молекула транспортной РНК (тРНК), подносящая ами-
нокислоты к информационной РНК (иРНК) при трансляции.
Аддитивные гены — полимерные гены, одинаково влияющие на
фенотип, но обладающие суммирующим действием.
Азотистые основания — основания, входящие в состав нуклеино-
вых кислот. Бывают двух основных типов — пиримидиновые (урацил,
тимин, цитозин) и пуриновые (аденин, гуанин).
Н
2-о -дигидроксипиримидцн
(урацил)
Н
Н-С
н-с
N
пиридин
$-метилурацил (тимин}
В основе пиримидиновых нуклеотидов лежат пиримидиновые коль-
ца:
238
Активация аминокислоты — образование аминоацил-тРНК. Этот
процесс включает собственно активацию аминокислоты и перенос акти-
вированного аминоацильного остатка на молекулу тРНК с образова-
нием аминоацил-тРНК. Обе реакции катализируются аминоацил-
тРНК-синтетазой (или ферментом активации), специфичной для каж-
дой аминокислоты. Аминокислота активируется с помощью АТФ путем
присоединения к ее карбоксильной группе остатка АМФ. Полученный
аденилат аминокислоты остается соединенным с ферментом активации:
АК 4- АТФ + тРНК-> аминоацил-тРНК + АМФ + р-р.
Акридины (акридиновые красители) — акридин оранжевый, акри-
флавин, профлавин, а также алкилированные акридины (ICR-170, ICR-
191) обладают мощным мутагенным действием, индуцируя смещение
рамки считывания.
Активный центр фермента — специфический участок на поверх-
ности, благодаря которому фермент проявляет специфичность в отноше-
нии субстрата. Ферменты, состоящие из одной полипептидной цепи,
обладают одним активным центром. Молекула р-галактозидазы имеет
четыре активных центра — по одному на каждую из четырех идентич-
ных полипептидных цепей, участвующих в образовании ее структуры.
Наличие активного центра — следствие трехмерной конформации
фермента, так как аминокислотные остатки, его образующие, располо-
жены в разных частях полипептидной цепи.
Алкилирующие агенты — мутагены (этилметансульфонат, нитрозо-
метилмочевина и др.), способные изменять азотистые основания путем
введения в них остатков углеводорода — этила н метила.
Аллель — одно из возможных состояний гена. Любое изменение
структуры гена в результате мутаций или за счет внутренних рекомбина-
ций у гетерозигот по двум мутантным аллелям приводит к появлению
новых аллелей этого гена. Пару генов, определяющих альтернативные
признаки, называют аллеломорфной парой, а само явление парности —
аллеломорфизмом или аллелизмом. Различают гомоаллели и гетеро-
аллели. Томоаллели (изоаллели) — аллели, различия между которыми
касаются только одного сайта. Гетероаллели — аллели, различающиеся
разным сайтам и способные давать рекомбинации вследствие внутри-
генного кроссинговера.
Аллели множественные — для многих генов известно не два, а
несколько и даже много аллельных состояний. При множественном
239
аллелизме в гамете или споре всегда присутствует только один аллель
данного гена, а в клетках диплоидных организмов — по два (одинако-
вых или разных) аллеля этого гена. Расщепление по множественным
аллелям при этом всегда остается моногибридным.
Аллельная специфичность мутагенов — способность мутагена вы-
зывать реверсии мутантов, несущих аллельные изменения.
Аллополиплоид. См. Мутация, Амфидиплоид.
Ал л осин дез — конъюгация хромосом разных родительских форм
у отдаленного гибрида.
Аллостерический эффект — явление, при котором конфигурация
и биологическая активность фермента или регуляторного белка изме-
няется прикреплением к нему низкомолекулярного вещества — эффекто-
ра (белок-репрессор и лактоза).
Аллофенные организмы — химерные организмы, развивающиеся
из сочетания бластомеров генетически различающихся зародышей.
Аллоферменты (аллотипы) — ферменты, кодируемые различными
аллелями одного локуса (гена). У дрозофилы известны два аллотипа
алькогольдегидрогеназы, различающиеся по специфичности к суб-
страту,— A-форма и В-форма. A-форма лучше, чем В-форма, перера-
батывает этанол, изопропанол и циклогексанол. При повышенной
температуре В-форма стабильнее и активнее, чем A-форма, и по сравне-
нию с ней имеет некоторые селективные преимущества. Наличие алло-
ферментов увеличивает полиморфизм популяций, повышающий ее жиз-
неспособность. См. Изоферменты.
Амбер-супрессоры — мутантные гены, кодирующие тРНК и способ-
ные узнавать (считывать как значащие) амбер-кодоны (УАГ).
Амбивалентность (амбивалентные фаги) — явление, заключаю-
щееся в том, что некоторые rll мутанты фага Т4 на одних К-штаммах
бактерий не могут расти, а на других могут. Амбивалентные мутанты
содержат в гене rllA нонсенс-мутацию, из-за чего трансляция области
гПВ, находящейся справа от нее, не происходит. Пермиссивные штам-
мы К содержат нонсенс-супрессоры (супрессоры нонсенс-мутаций), в ре-
зультате чего нонсенс-кодон считывается как смысловой и трансляция
протекает нормально.
Аминоацильный центр рибосомы — участок 50S рибосомы, к кото-
рому присоединяется тРНК, несущая аминокислоту (аминоацил-тРНК),
если антикодон этой тРНК соответствует тому кодону иРНК, который
в данный момент находится в аминоацильном центре.
Амниоцентез — извлечение с помощью пункции небольшого коли-
чества околоплодной жидкости, в которой плавают клетки эмбриона.
Клетки культивируются на искусственных питательных средах и иссле-
дуются цитогенетически и биохимически. Используется для раннего
распознавания мутаций и пола эмбриона.
Амплификация генов — избирательное умножение отдельных частей
генома. Особый тип репликации генов рРНК, когда часть их выходит
из хромосомы в ядерный сок, располагается вблизи ядерной мембраны
и продолжает там автономно реплицироваться. После транскрипции
большое количество молекул рРНК поступает в цитоплазму и исполь-
зуется при образовании рибосом. Наблюдается в ооцитах земноводных,
насекомых, некоторых моллюсков, в выстилающем слое пыльников
растений.
Амфидиплоид — организм, возникающий на основе межвидовой
гибридизации и имеющий два диплоидных набора хромосом. Многие
межвидовые гибриды растений бесплодны из-за того, что хромосомы,
полученные ими от разных родителей, не конъюгируют при мейозе,
240
распределяются беспорядочно и поэтому продукты мейоза нежизнеспо-
собны. Но при удвоении числа хромосом у такого гибрида мейоз про-
текает нормально, так как такой тетраплоидный гибрид имеет по два
набора хромосом обоих родительских видов; при мейозе хромосомы
конъюгируют со своими гомологами и правильно расходятся в обра-
зующиеся гаметы. Получение амфидиплоидов есть метод восстановле-
ния плодовитости отдаленных гибридов.
Амфимиксис — способ полового размножения растений и животных,
при котором новый организм образуется путем слияния отцовской и
материнской гамет.
Анализ частоты ближайших соседей — Используется для доказа-
тельства идентичности последовательности оснований во вновь синте-
зируемой комплементарной цепи ДНК.
В нуклеиновой кислоте четыре типа оснований. Следовательно, воз-
можны 16 комбинаций динуклеотидов. А. Корнберг предложил метод
определения частоты, с которой каждая из этих 16 комбинаций встре-
чается в изучаемой ДНК. Для этого берется четыре дезоксирибонукле-
озид-5'-трифосфата. Один из них, например связанный с углеродом 5'
в пентозе, мечен 32Р в положении а:
А
Стрелка указывает место разрыва после полимеризации.
После полимеризации образованная ДНК подвергается гидролизу
ферментами, специфически разрешающими фосфодиэфирные связи меж-
ду 5'-С дезоксирибозы и фосфатом, что приводит к образованию
дезоксирибонуклеозид-З'-монофосфатов:
X А
Метка 32Р, первоначально принадлежащая аАТФ, будет расположе-
на в форме ссХМФ, т. е. в нуклеозид-З'-монофосфате, который был рядом
с адениловым нуклеотидом в полимере.
В полученных четырех дезоксирибонуклеозид-З'-монофосфатах опре-
деляют их радиоактивность и подсчитывают частоту, с которой каждое
основание в полимере занимает место рядом с аденином, т. е. частоту
четырех динуклеотидных последовательностей ТфА, ЦфА, ГфА, АфА.
241
Аналогичный эксперимент проводится и с другим меченым нуклеотидом,
например дГТФ (32Р2), и после гидролиза определяется частота четырых
других нуклеотидных, последовательностей ТфГ, ЦфГ, АфГ, ГфГ, а затем
с остальными трифосфатами — дЦТФ, дТТФ (32Р). Анализ позволяет
сделать следующие выводы.
1. В ДНК существуют все 16 динуклеотидных последователь-
ностей, а их частоты есть характеристика ДНК.
2. Частота ближайших соседей в ДНК, включенной в реакцию, и
вновь синтезированной ДНК одинакова, т. е. первая ДНК действи-
тельно служит матрицей в синтезе:
ТфА(0,012) = ТфА (0,012);
АфГ (0,045) = ЦфТ (0,045);
ГфА (0,065) = ТфЦ (0,065).
Цепи антипараллельны.
ТфА (0,012) должно быть равно
АфТ (0,031);
АфГ (0,045) должно быть равно
ТфЦ (0,061);
ГфА (0,065) должно быть равно
СфТ (0,045).
Молекула ДНК имела бы та-
кой вид, если бы цепи были
параллельны.
3. Две вновь образованные цепи ДНК антипараллельны, так как
теоретические динуклеотидные частоты совпадают с эксперименталь-
ными данными:
242
Анализирующее скрещивание — скрещивание доминантного по фе-
нотипу организма, генотип которого неизвестен, с рецессивным орга-
низмом. В зависимости от наличия или отсутствия расщепления разли-
чают следующие генотипы доминантного организма — гетерозиготу и
гомозиготу. Расщепление на два фенотипических класса 1(4) 4*1 (а)
служит доказательством наличия одного гена, контролирующего при-
знак. Расщепление на четыре фенотипических класса — доказательство
дигибридности скрещиваемых форм.
Аналоги оснований — пурины и пиримидины, которые отличаются
от обычных азотистых оснований нуклеиновых кислот. Они могут вклю-
чаться в нуклеиновые кислоты и приводить к индукции мутаций.
Андрогенез — форма размножения организмов, при которой в раз-
витии зародыша участвует мужское ядро, привнесенное в яйцо сперма-
тозоидом, а женское не участвует.
Антиген — антитело реакция — специфическое связывание антиге-
на с соответствующим антителом, приводящее к образованию иммун-
ного комплекса.
Антигены — вещества, которые воспринимаются организмом как
чужеродные и вызывают специфичный иммунный эффект, способный
взаимодействовать с продуктами этого ответа — антителами (иммуно-
глобулинами) и иммуноцнтами как in vivo, так и in vitro. Антигенными
свойствами обладают макромолекулярные компоненты всех живых
организмов.
Антикодон — участок молекулы тРНК, состоящий из трех нуклеоти-
дов и узнающий соответствующий ему участок из трех нуклеотидов (ко-
дон), который кодирует соответствующую аминокислоту в матричной
(информационной) РНК. В процессе трансляции данный кодон узнается
только специфической тРНК благодаря комплементарности кодона и
антикодона и тем самым обеспечиваются строгая очередность и порядок
включения аминокислот в растущую полипептидную цепь.
Антимутагены — факторы, снижающие частоту мутаций. К их числу
относятся разнообразные по своей химической природе соединения —
цистеамин, хинакрин, некоторые сульфаниламиды, производные пропио-
новой и галловой кислот.
Антитерминация — термин, употребляемый при описании взаимо-
действия триптофана и аттенюатора триптофанового оперона. Наличие
триптофана в среде приводит к терминации транскрипции лидерной по-
следовательности р-мРНК, отсутствие триптофана определяет транскрип-
цию всего триптофанового оперона, т. е. антитерминацию. См. Атте-
нюатор.
Апогамия — одна из форм апомиксиса у растений. См. Апомиксис.
Апомиксис — размножение организма, не сопровождающееся поло-
вым процессом. В более узком смысле вторично бесполое размножение,
при котором зародыш развивается без оплодотворения вследствие нару-
шения предшествующих этапов размножения. В зависимости от того,
дает ли начало новому организму половая (яйцевая) или вегетативная
клетка, различают две основные формы апомиксиса — партеногенез
и апогамия.
Апоспория — выпадение из жизненного цикла растений процес-
са спорообразования и, следовательно, гаплоидной формы.
Аттенюатор — участок в frp-опероне между локусом О и началом
гена trp Е, который участвует в регуляции синтеза триптофана.
Аргинин — аминокислота, входящая в состав белков, особенно про-
таминов (до 85 %) и гистонов.
Ауксотрофная мутация — мутация, которая приводит к потере
243
способности синтезировать то или иное сложное органическое вещество,
необходимое для жизнедеятельности организма. Например, бактериаль-
ный мутант будет образовывать колонии только на полноценной пита-
тельной среде и не будет расти на минимальной среде.
Аутбрйдипг — скрещивание или система скрещиваний неродствен-
ных форм одного вида. При этом могут скрещиваться организмы, при-
надлежащие как к одной и той же породе или сорту (внутр и породное
или внутрисортовое скрещивание), так и к разным (межпородные или
межсортовые скрещивания). При скрещивании неродственных особей
вредные рецессивные мутации переходят в гетерозиготное состояние и
гибриды первого поколения часто оказываются более жизнеспо-
собными и устойчивыми к заболеваниям, чем родители, и имеют повы-
шенную плодовитость. С помощью аутбридинга комбинируют различ-
ные ценные признаки при создании новой породы животных или сорта
растений. Поскольку при аутбридинге в результате комбинативной из-
менчивости появляются гибриды, которые могут иметь как лучшие, так
и худшие сочетания признаков, за скрещиванием всегда должен сле-
довать отбор нужных форм.
Аутоиммунные исключения — подавление репликации автономных
изогенных плазмид в присутствии одноименной плазмиды, уже попав-
шей под строгий контроль репликации. У умеренных фагов это имму-
нитет к суперинфекции, осуществляемый посредством репрессии, у
F-фактора — поверхностное исключение.
Аутокаталитическая функция ДНК — способность ДНК контроли-
ровать собственную репликацию благодаря наличию в ней генетической
информации, обеспечивающей осуществление всех необходимых про-
цессов и механизмов для синтеза комплементарной молекулы:
ДНК-полимераза
ДНК----------------> ДНК
дупликация ДНК
Аутосомы — все хромосомы в клетках раздельнополых животных,
растений и грибов, за исключением половых хромосом. Обозначаются
буквой А. Хромосомная формула самки дрозофилы: 6А + ХХ; самца —
6A + XY.
Бактериофаги — вирусы, размножающиеся в бактериях.
Бактериоцины — специфические белки, вырабатываемые некоторы-
ми бактериями и подавляющие жизнедеятельность клеток других штам-
мов того же вида или родственных видов бактерий. Бактериоцины, про-
дуцируемые Е, coli, называют колицинами. Наиболее изучены плазмиды
Col El, Col Е2 и Col ЕЗ, встречающиеся у 20 % природных популяций
энтеробактерий. Все колицины узнаются специальными рецепторами на
поверхности бактериальных клеток: одни из них проникают в клетку,
другие действуют через модификации клеточной мембраны. Так, Col El
ингибирует клеточное фосфорилирование, Col Е2 является ДНК-эндо-
нуклеазой, Col ЕЗ прерывает биосинтез белка, вызывая изменение
рибосомной 30S субчастицы (наблюдается частичная деградация
16S-pPHK).
Бекросс. См. Возвратное скрещивание.
Близнецовый метод — один из способов выяснения относительной
роли наследственности и среды в изменчивости признаков с помощью
сравнительного анализа близнецов. Для генетических исследований
близнецов необходимо определить их тип, используя следующие Крите-
244
рии: 1) однояйцевые близнецы обязательно должны быть одного пола;
2) однояйцевые близнецы должны характеризоваться конкордантностью
(сходством), разнояйцевые — дискордантностью (несходством) по мно-
гим признакам, в том числе и по группам крови; 3) реципрокная транс-
плантация тканей у однояйцевых близнецов, как и аутотранспланта-
ция, не должна заканчиваться отторжением. У разнояйцевых близне-
цов она невозможна в силу иммунологической несовместимости. Пара
однояйцевых близнецов имеет тождественный генотип, что дает возмож-
ность выяснить роль среды в формировании признаков (например,
воспитание близнецов в разных условиях). Сравнение обоих типов
близнецов в одной среде позволяет выявить роль наследственности
в развитии признака. При этом надо иметь в виду, что средой для чело-
века являются не только физические факторы, но и социальные усло-
вия. Близнецовый метод дает возможность выяснить наследственную
предрасположенность к ряду таких заболеваний, как шизофрения,
туберкулез, рахит.
Блуждающие гены. См. Транспозоны.
Вектор — автономно реплицирующаяся генетическая структура,
с помощью которой можно передать включенный в нее ген в надлежащий
изменению геном. Вектором служат кольцевые бактериальные плазмиды
(R-плазмиды, геном фага X с делецией части генома, F-фактор). Для
переноса генов в клетки млекопитающих используется онкогенный
вирус SV40, иногда превращающийся в псевдовирион, в котором внутри
вирусного белкового капсида (оболочки) находится не вирусная ДНК,
а фрагмент ДНК-клетки, в которой реплицировался вирус.
Взаимодействие генов — влияние многих генов на один признак.
Поскольку любой белок состоит из аминокислот, то в синтезе белка
участвует не только ген, контролирующий его первичную структуру, но
и гены, обеспечивающие синтез самих аминокислот.
У дрозофилы описаны мутации свыше 50 генов, влияющих на
окраску глаз. Сложные признаки организма, например жизнеспособ-
ность и плодовитость, также зависят от большого количества генов.
Взаимодействие генов может быть продемонстрировано на примере так
называемого генного баланса, т. е. влияния соотношения половых хро-
мосом и аутосом на половые признаки раздельнополых организмов. Гены,
направляющие развитие в женскую сторону (у дрозофилы), локализо-
ваны в основном в Х-хромосоме, а направляющие развитие в мужскую
сторону—в различных местах аутосом (вторая и третья хромосомы).
Взаимодействие генов проявляется на всех этапах реализации генети-
ческой информации. Условно можно выделить следующие формы
взаимодействия генов: 1) влияние первичного продукта (полипептида)
одного гена на транскрипцию другого гена; 2) реакции между про-
дуктами транскрипции разных генов; 3) перекрещивание разных цепей
онтогенетических процессов, в детерминации которых участвовали эти
гены.
На фенотипическом уровне можно выделить следующие типы взаимо-
действия генов: 1) комплементация, 2) новообразование, 3) эпистаз,
4) криптомерия^ 5) полимерия.
Влияние контекста на рекомбинации — зависимость частоты реком-
бинации в определенном участке гена от нуклеотидного состава, при-
водящая к нарушению линейности при построении рекомбинационных
карт на основании двухсайтовых скрещиваний.
Внеплановый синтез — синтез ДНК, индуцированный ее поврежде-
нием.
Внутригенная специфичность мутагенов — это способность мутаге-
245
нов индуцировать прямые мутации, различающиеся локализацией или
характером проявления (с четким или нечетким проявлением) и спо-
собностью к межаллельной комплементации или супрессируемости.
Отражает сродство мутагена с определенным участком гена. Специ-
фичность мутагенов обнаруживается по проявлению «горячих точек».
Внутренние супрессоры. См. Супрессоры сдвига считывания.
Возвратное скрещивание — скрещивание гибрида первого поколе-
ния одной из родительских форм или аналогичной по генотипу формой.
Вращательная симметрия — нуклеотидные последовательности, про-
читываемые одинаково при переворачивании их на 180° (инверсии).
Подобные участки отмечены lac О, где они служат местом прикрепле-
ния репрессора и образуют участок присоединения БАК в промоторе
лактозного оперона.
Гаплоидность — наличие в клетке одного набора хромосом соб-
ственного вида.
Геликазы (хеликазы) — расплетающие белки (дестабилизирую-
щие спираль ДНК-хеликс) и удерживающие одноцепочечные фрагменты
от воссоединения. В репликационной вилке встречается до 200 геликаз,
причем каждая молекула образует комплекс с 8—10 нуклеотидами.
Связывание носит неспецифический характер по отношению к основа-
ниям. Геликазы выделены из фагов и бактерий (фаг fd — белок 5, фаг
Т4 — белок гена 32).
Гемизиготность — состояние, когда особь имеет только одну дозу
определенных генов и, следовательно, не может быть ни гомо-, ни
гетерозиготной. Гемизиготными по некоторым генам, локализованным
в Х-хромосоме, являются самцы двукрылых насекомых, млекопитаю-
щих, самки птиц.
Ген — структурная единица наследственной информации; функцио-
нально неделимая единица генетического материала. Ген представляет
собой участок молекулы ДНК (у некоторых вирусов РНК), кодирующий
первичную структуру полипептида, молекулы транспортной или рибо-
сомальной РНК или взаимодействующий с регуляторным белком.
Различают структурные гены, кодирующие синтезируемые в клетке
полипептиды, определяющие строение рРНК, тРНК, и акцепторные
гены, служащие местами специфического присоединения определенных
ферментов, участвующих в репликации, транскрипции и регуляции
активности генов.
Генеалогический анализ — анализ закономерностей наследования
тех или иных признаков на основе сопоставления родословной (генеало-
гии). Анализ проводится в том случае, если известны прямые родо-
словные — предки обладателя наследственного признака (пробанда)
по материнской и отцовской линиям в ряду поколений или потомки
пробанда в нескольких поколениях. Генеалогический метод применя-
ется в медико-генетических консультациях.
Генетический анализ — совокупность методов исследования наслед-
ственных свойств организма. К основным методам генетического анализа
относятся селекционный, гибридологический, цитогенетический, популя-
ционный, молекулярно-генетический, мутационный и близнецовый.
Генетический, или популяционный, гомеостаз — способность пан-
миктической популяции поддерживать относительную стабильность
и целостность генотипической структуры в изменяющихся условиях
среды. К механизмам гомеостаза относятся поддержание равновесного
состояния популяции по генетическим частотам согласно формуле
246
Харди — Вайнберга, поддержание гетерозиготности и полиморфизма,
поддержание определенного темпа и направления мутационного про-
цесса.
Генетический груз — часть наследственной изменчивости популя-
ции, ‘которая определяет появление менее приспособленных особей,
подвергающихся избирательной гибели в процессе естественного от-
бора. Генетический груз, снижающий приспособленность популяции,
складывается из двух компонентов: спонтанный мутационный процесс,
имеющий чаще всего неблагоприятные последствия, и появление но-
вых, менее приспособленных генотипов в результате расщепления и
комбинирования генов. Однако поскольку мутагенез и рекомбинации
генов являются источником полезных изменений генотипа, представ-
ляющих мобилизационный резерв изменчивости, генетический груз вы-
ступает в качестве «платы» за возможность дальнейшего совершен-
ствования вида.
Генетический код — свойственная живым организмам единая систе-
ма записи наследственной информации в молекулах нуклеиновых
кислот в виде последовательности нуклеотидов. Основными свойствами
генетического кода являются 1) триплетность — каждая аминокислота
кодируется тремя нуклеотидами (УУУ — фенилаланин, ЦЦЦ — пролин,
ЦАУ— гистидин); 2) непрекрываемость— нуклеотиды, принадлежа-
щие одному триплету (кодону), не входят в состав соседних триплетов
и 3) вырожденность — одна аминокислота может кодироваться несколь-
кими триплетами (пролин—ЦЦЦ, ЦЦА, ЦЦУ, ЦЦГ), называемыми
эквивалентными. Группа бивалентных кодонов называется кодовой
серией. Метионин и триптофан имеют по одному кодирующему трипле-
ту — АУГ, УГГ соответственно. Остальным аминокислотам соответству-
ют несколько триплетов, например пролину, гистидину — четыре, арги-
нину, лейцину, серину — шесть триплетов. Триплеты УАА, УАГ, УГА слу-
жат терминирующими кодонами (нонсенс-кодоны), обозначающими
конец трансляции.
Различают систематическую и несистематическую вырожденность.
Систематической называют такую вырожденность, когда в эквивалент-
ных парах кодоны различаются либо пуринами (А и Г), либо пирими-
динами (У и Ц) в З'-концевом положении, остальные случаи являются
примером несистематической вырожденности.
Генетический материал — компоненты клетки, структурно-фун-
кциональное свойство которых обеспечивает хранение, реализацию и
передачу наследственной информации при вегетативном и половом раз-
множении. Генетический материал обладает универсальными для всего
живого свойствами: дискретностью, непрерывностью, линейностью и от-
носительной стабильностью. Дискретность — это существование гена,
хромосом и генома. Проявляется дискретность в виде множества
аллелей данных генов, соответствующих группе сцепления — хромосоме;
множества групп сцепления, соответствующих геному. Непрерыв-
ность — физическая целостность хромосомы, проявляется в виде сцеп-
ления множества генов между собой в различных типах эффекта
положения, обнаруживаемых в результате хромосомных перестроек,
а также в полярных и регуляторных мутациях в опероне. Линейность —
одномерность записи генетической информации, выявляется в определен-
ной последовательности генов в пределах группы сцепления или сан св
в пределах гена. Относительная стабильность — возникновение и со-
хранение вариантов в ходе воспроизведения генетического материала,
проявляется в виде мутационной изменчивости. Способность к конва-
риантной редупликации — это воспроизведение и изменение генетиче-
ского материала с последующим воспроизведением измененных ва-
риантов.
Генная специфичность мутагенов — характеристика мутагена, по-
казывающая его способность вызвать изменения в каком-либо опреде-
ленном гене.
Генный баланс. См. Взаимодействие генов.
Геном — совокупность всех генов, характерных для гаплоид-
ного набора хромосом данного вида организмов; основной гаплоидный
набор хромосом.
Генотип — генетическая (наследственная) конституция организма,
совокупность всех наследственных задатков данной клетки или орга-
низма, включая аллели генов, характер их физического сцепления
в хромосомах и наличие хромосомных перестроек. Различают гомози-
готы, имеющие одинаковые аллели в обеих гомологичных хромосомах
в гомологичных локусах (АА, аа) и образующие одинаковые гаметы
с различными аллелями данного гена.
Генотрофы — организмы, претерпевшее изменения в результате
смены питания. В основе образования генотрофов может лежать
амплификация различных участков хромосом.
Гены-мутаторы — гены, контролирующие уровень мутабильности
генома.
Гены-супрессоры — Сены, способные подавлять фенотипическое
проявление других генов.
Гетероаллели. См. Аллель.
Гетерогаметный пол — пол, образующий два типа гамет, разли-
чающихся по половым хромосомам. В системах XX—XY и XX—ХО
гетерогаметен мужской, а в системах ZZ—ZW и ZZ—Z0 — женский
пол. Определение пола по типу XX—XY встречается у большинства
организмов — млекопитающих, двукрылых насекомых, рыб; XX—ХО —
у некоторых клопов. Система ZZ—ZW и ее производная ZZ—Z0 распро-
странена меньше. Гетерогаметность женского пола обнаружена у ру-
чейников, бабочек, некоторых рыб, амфибий и почти у всех птиц, среди
растений — у клубники.
Гетерогенота. См. Мерозигота.
Гетеродуплексная модель. См. Гетерозигота внутренняя.
Гетерозигота внутренняя — наличие в вегетативном фонде Т-четных
фагов молекул ДНК с ограниченной гетерозиготной областью вслед-
ствие образования ковалентных связей между нуклеотидами:
Эта гетерозигота при полуконсервативной репликации будет рас-
щепляться на гомозиготные Йг2+г7 + и рекомбинантные hr2rl+ моле-
кулы ДНК.
Гетерозигота комплексная — наличие у некоторых видов растений,
например у Oenothera lamarckiana, двух разных геномов. Благодаря
особому цитологическому механизму, обусловленному перестройками
хромосом в пределах каждого гаплоидного набора хромосом, все
хромосомы связаны друг с другом так, что при мейозе они не переком-
бинируются, а в каждую гамету попадает один из двух хромосомных
248
наборов — или gaudens, или velans. Постоянство такой гетерозигот-
ности поддерживается сбалансированными деталями, подавляемыми
В гетерозиготном состоянии нормальными аллелями других генов.
Гетерозиготность в популяции — насыщенность популяций мута-
циями, составляющая резерв их наследственной изменчивости, кото-
рая позволяет ей приспособиться к условиям за счет изменения своей
генетической структуры. Гетерозиготное состояние особей популяции
обеспечивает ее приспособительную пластичность. Кроме того, гетерози-
готы имеют более высокую жизнеспособность, чем гомозиготы, у них
шире норма реакции, т. е. больший диапазон приспособительных
возможностей, чем у гомозигот, что и дает им селективное преиму-
щество.
Гетерозис — повышенная жизненная мощность, плодовитость у
гибридов первого поколения при неродственном скрещивании.
Гетерой ммунные фаги — фаги 434 и Л, гетеройммунные по отноше-
нию друг к другу, так как каждый из них растет на бактериях, лизоген-
ных по второму фагу, т. е. каждый из них нечувствителен на действие
репрессора другого фага.
Гетерокаталическая функция ДНК — способность ДНК контроли-
ровать синтез всех жизненно важных органических молекул.— амино-
кислот, полипептидов, витаминов и т. д. благодаря заключенной в ней
генетической информации:
РНК-полимераза ДНК-зависимая
ДНК ------------------------иРНК;
»РШГ рибосомы тРНК
ирнк --------—;белки.
аминокислоты
Гетероморфизм хромосом — явление, когда гомологичные хромосо-
мы морфологически отличаются друг от друга (например в результате
мутаций).
Гетерохроматин. См. Хроматин.
Гетероталлические клоны — половой процесс у дрожжей, заключаю-
щийся в слиянии двух гаплоидных клеток, принадлежащий к двум
половым типам. Существуют гетероталлические и гомоталлические кло-
ны. В первом случае клетки принадлежат к какому-либо одному поло-
вому типу, во втором — клетки представляют собой смесь обоих половых
типов. У хлебопекарных дрожжей контроль за образованием клеток того
или иного полового типа (а и а) осуществляется следующим образом: в
одной из хромосом локализованы два «молчащих» гена I и 2. Между
ними находится «локус пола» PTL, в котором присутствует или копия
гена 1 (половой тип а), или копия гена 2 (половой тип а), т. е. регуляция
пола в данном случае осуществляется транспозицией структурных генов.
В реализации такой транспозиции участвует ген НО, определяющий
гомоталлизм. При его делении штамм дрожжей становится гетеротал-
лическим, т. е. закрепляется тот или иной половой тип.
Гетеротрофы — организмы, использующие в качестве источника
углерода экзогенные органические вещества.
Гетерофиллия — различия в форме, размерах и структуре листьев
на одном и том же растении.
Гибрид — организм, полученный в результате объединения генети-
ческого материала генотипически разных организмов (клеток), т. е.
гибридизации.
Гибридизация соматических клеток — система приемов, позволяю-
щая добиться слияния культивируемых в искусственных средах клеток
249
различных организмов (мыши и крысы, мыши и человека, человека и
курицы, курицы и дрожжей). В таких гибридных клетках можно
наблюдать взаимодействие генов, которые другими способами совме-
стить невозможно. Поскольку при делении могут теряться отдельные
хромосомы, можно выявить их действие на фенотип клетки или на
синтез ферментов. С помощью гибридизации соматических клеток была
определена локализация многих генов в хромосомах человека.
Гибридологический анализ — это анализ характера наследования
признаков с помощью системы скрещиваний. Он заключается в полу-
чении гибридов и дальнейшем их сравнительном анализе в ряду по-
колений.
Гидролиз нуклеиновых кислот. См. Определение последователь-
ности нуклеотидов в нуклеиновых кислотах.
Гинандроморфы — особи, часть тела которых имеет женское,
часть — мужское строение. У дрозофилы гинандроморфы образуются
обыкновенно вследствие того, что на разных стадиях деления оплодо-
творенного яйца XX один из бластомеров получает обе Х-хромосомы
(женская часть тела), другой — одну Х~хромосому (мужская часть). На
каждой из частей тела могут проявляться признаки в соответствии с на-
бором генов в Х-хромосоме. Гинандроморфизм может возникнуть в
результате наличия в неоплодотворенном яйце двух гаплоидных ядер, и
благодаря полиспермии (частой у насекомых) оплодотворенные ядра
могут иметь разный набор половых хромосом.
Гипотеза неоднозначного соответствия (от англ, wooble hypothesis),
или гипотеза качаний. Согласно этой гипотезе при взаимодействии
между иРНК и тРНК на рибосоме только первые два основания кодона
непременно образуют стандартные комплементарные пары с соответ-
ствующими нуклеотидами антикодона. При взаимодействии третий ну-
клеотид кодона может образовывать пары с различными основаниями
антикодона. Неоднозначное соответствие в третьем положении до-
пускает образование пары Г—У, А—И (инозиновая кислота, в антико-
доне содержащая пуриновое основание — гипоксантин). Третий нукле-
отид в антикодоне тРНК может узнавать определенный спектр основа-
ний в кодонах иРНК. Примером неоднозначного соответствия кодона
и антикодона служит аланиновая тРНК дрожжей, антикодон которой
ЦГИ реагирует на три аланиновых кодона — ГЦУ, ГЦЦ и ГЦА. Однако
для узнавания четвертого аланинового кодона ГЦГ имеется вторая
аланиновая тРНК с антикодоном ЦГУ или ЦГЦ.
Гипотеза последовательности. Согласно этой теории последователь-
ность элементов гена определяет последовательность аминокислотных
остатков в полипептидной цепи.
Гиразы (жиразы) — топоизомеразы II, вызывающие негативную
сверхспирализацию в кольцевых молекулах ДНК путем разрыва одиноч-
ной связи, вращения и замещения связи. У В. coli, например, гиразы
контролируются генами gyr А и gyr В.
Гистоны — белки, содержащиеся в ядрах клеток растений и
животных. Они богаты остатками аргинина и лизина, определяющими
их щелочные свойства. Молекулярная масса 11200—21 000. Присут-
ствуют в ядрах в виде комплекса с ДНК» играя важную роль в ее упа-
ковке. В хроматине гистоны составляют 25—40 % сухой массы. Гистоны
стабилизируют организацию хроматина, служат одним из звеньев в
регуляции синтеза нуклеиновых кислот, значительно повышают прони-
цаемость клеточных мембран для высокомолекулярных соединений.
Видовая специфичность гистонов выражена слабо. Реконструкция
диссоциированных нуклеосом может быть произведена с уча-
250
стием гистонов, взятых из различных организмов. См. Нуклеосома.
Голандрнческие признаки — признаки, наследуемые только по
мужской линии вследствие локализации контролирующих их генов
в Y-хромосоме, например наличие кожной перепонки между пальцами
ног, волосатость ушей у человека.
Гомеозисные мутации — мутации, при которых вместо одного орга-
на развивается другой, в частности у дрозофилы из зачатков усиков
могут образоваться конечности.
Гомеостаз — способность биологических систем противостоять из-
менениям н сохранять динамическое относительное постоянство состава
н свойств.
Гомоаллели. См. Аллели.
Гомогаметный пол — пол, который формирует гаметы, одинаковые
в отношении половых хромосом. См. Гетерогаметный пол.
Гомологичные хромосомы — хромосомы, принадлежащие одной
паре. У диплоидных организмов столько пар хромосом, сколько разных
хромосом имеется в соответствующем гаплоидном наборе.
Гомология — соответствие органов у организмов разных видов,
обусловленное их филогенетическим родством.
Гомоталлические клоны. См. Гетероталлические клоны.
«Горячие точки» мутирования — это сайты с повышенной часто-
той мутирования (у фага Т4 сегмент А — 300 мутаций, В — 500 мута-
ций). Характер распределения «горячих точек» может меняться в зави-
симости от используемого мутагена.
Группа сцепления — совокупность генов, лежащих в одной хромо-
соме и потому наследующихся сцепленно. Гены, находящиеся в разных
хромосомах, т. е. принадлежащие к разным группам сцепления, насле-
дуются независимо друг от друга. Число групп сцепления равно гаплоид-
ному числу хромосом.
Давление мутационное — изменение соотношения частот аллелей в
популяции вследствие разной вероятности прямых и обратных мутаций
какого-либо гена. В результате увеличивается частота того аллеля, в
сторону которого мутации происходят с большей частотой. При равно-
вероятности прямых и обратных мутаций мутационное давление исчезает
и в популяции наступает равновесное состояние.
Делеция — тип хромосомной перестройки, в результате которой
выпадает внутренний участок гена хромосомы. См. Мутация.
Дефектные фаги — фаги из HFT-лизатов, способные к трансдук-
ции (например, фаг X gal), у которых до 30 % их генома замещено
областью gal бактерий. В результате у дефектных фагов Л gal отсутствует
часть жизненно важных генов в области h генома X. Поэтому недефектные
или активно лизогенные трансдуктанты Gal+ можно получить только
в том случае, если нелизогенные бактерии Gal~ заражаются фагом из
HFT-лизата. HFT-лизат образуется при индукции ультрафиолетом
профага X в культуре лизогенных гетерозигот Gal+/Gal~ с высокой
множественностью заражения, чтобы клетка, зараженная трансдуци-
рующим фагом X gal, была одновременно инфицирована и нормальной,
нетрансдуцирующей частицей.
Димеризация тимина — связывание двух соседних остатков тимина,
находящихся на поли нуклеотидной цепи, в результате поглощения одним
из них кванта ультрафиолета. Димеризация приводит к локальному
нарушению вторичной структуры двойной спирали ДНК и подавлению
функции гена, в котором она произошла.
251
Диминуция хроматина — исключение части генома у эукариотов
в эмбриогенезе или при созревании макронуклеуса у простейших.
Диплоидность — наличие в клетке двух наборов хромосом, свой-
ственных виду.
Дискордантность — несходство признака у близнецов. См. Близне-
цовый метод.
Дискретность. См. Генетический материал.
Дистальные гены — гены, расположенные далеко друг от друга на
хромосоме.
Длительные модификации — модификации, затрагивающие не-
сколько поколений при вегетативном или партеногенетическом раз-
множении.
Дифференциация пола — процесс становления половых признаков
в онтогенезе. Зачаточные индифферентные в половом отношении
гонады у эмбрионов животных имеют двойственную природу. Они
включают внешний слой — кортекс, из которого в процессе дифферен-
циации развиваются женские половые клетки, и внутренний слой —
медуллы, из которой развиваются мужские гаметы. В ходе дифферен-
циации один из слоев гонады развивается и подавляется другим. Про-
цесс дифференциации пола у животных обусловлен термонами, вы-
деляемыми соответствующими слоями полового зачатка, а впоследствии
и половыми железами. На дифференциацию пола у высших растений
влияют растительные гормоны — ауксины.
Дифференциальная активность генов — все клетки многоклеточ-
ного организма содержат идентичные наборы генов, ио в разное время
в разных тканях функционируют разные гены, благодаря чему осу-
ществляется дифференциация. Регуляция активности генов может
осуществляться на различных уровнях: репликации, транскрипции,
трансляции. Регуляция на уровне репликации осуществляется за счет
увеличения или уменьшения числа копий генов, ненужных в данный
момент. См. Амплификация генов.
ДНК-пол и меразы— высокомолекулярный полимер, катализирую-
щий добавление нуклеотидов к З'-ОН концу цепи ДНК.
Добавочные хромосомы (В-хромосомы) — мелкие, сплошь гетеро-
хроматиновые хромосомы, не входящие в стандартный набор, характер-
ный для данного вида (рожь, кукуруза, полевки, ящерицы, насекомые).
Встречаются они не у всех особей и являются случайной добавкой к
хромосомному набору. Влияние на фенотипы незначительно. Множество
В-хромосом отрицательно сказывается на жизнеспособности и плодови-
тости.
Доза гена — количество копий данного гена в геноме.
Домены — полуавтономные единицы образования третичной струк-
туры белка. Обнаружены в ряде белков методом рентгеноструктурного
анализа. Показана возможность наследственного закрепления различ-
ных сочетаний доменов (триптофансинтетаза Е. coll, N. crassa). Коопера-
ция доменов может служить причиной межаллельной комплементации.
Доминирование (доминантная аллель, мутация, признак) — пре-
обладание у гибрида первого поколения признака одного из родителей.
Для проявления доминирования одного аллеля над другим доминант-
ная аллель должна обеспечивать в достаточном количестве синтез
молекул, определяющих специфичность действия гена, а рецессив-
ная — синтез молекул, неактивных относительно данной функции и не
вступающих в конкурентные отношения с активными молекулами.
Дрейф генов — изменение частот генов (аллелей) в малочислен-
252
ных популяциях вследствие случайного сочетания пар при размно-
жении. Характерная особенность динамики генотипической структуры
популяции вследствие дрейфа генов состоит в усилении гомозиготи-
зации, которая нарастает с уменьшением численности популяции. Рас-
смотрим поведение гипотетической популяции, в которой генотипы
согласно формуле Харди — Вайнберга представлены в соотношении
1АА + 2Аа + 1аа. Если в скрещивании участвуют только две особи
этой популяции, то вероятность сочетания родителей того или иного
генотипа в паре будет следующей:
1АА 2Аа \аа
1АА 1(ААХ^) 2(ААХАа) 1 (АА Хаа)
2Аа 2(АаХАА) 4(Л«ХЛа) 2(АаХа^)
1аа 1 (ааХЛЛ) 2(ааХЛа) 1 (ааХаа)
Из таблицы следует, что вероятность перехода в гомозиготное
состояние этой гипотетической популяции равна: ААХАА —1/16;
ааХаа— 1/16, что в результате даст 1/16 4-1/16 = 2/16=1/8. Зна-
чит, вероятность случайной утраты какого-либо аллеля за 1 поколение
равна 1/8, т. е. в среднем за 8 поколений популяция станет либо АА, либо
аа. Роль дрейфа генов в изменении генотипа популяции быстро па-
дает с ростом ее эффективной численности.
При численности популяции в 50 особей частота гетерозигот за
поколение из-за дрейфа генов может снизиться на 0,01, а при численно-
сти 500 особей — на 0,001, т. е. на 0,1 %. Частота геторозигот в попу-
ляции уменьшается за поколение вследствие дрейфа генов на вели-
чину, выражаемую формулой К — 1 /2м, где К — доля, на которую
уменьшается частота гетерозигот, а п •— эффективная численность
популяции.
Дупликация — удвоение гена или участка гена. См. Мутация,
Кроссинговер.
Евгеника — учение о наследственном здоровье человека и путях
его улучшения.
Зигота — клетка, образующаяся в результате слияния гамет раз-
ного пола; оплодотворенное яйцо.
Зиготена — одна из стадий профазы I деления.
Зиготенная ДНК — часть ДНК эукариотов, участвующая в образо-
вании гетеродуплекса, т. е. гибридной двойной спирали, нити кото-
рой принадлежат разным хромосомам во время мейоза, что задержи-
вает ее репликацию до возникновения синаптонемального комплекса
в зиготене.
Зиготная индукция — это индукция фага, вызываемая проникно-
вением в нелизогенную реципиентную клетку фрагмента хромосомы
лизогенной бактерии донора, несущей профаг, например А, который
индуцируется н переходит в вегетативное состояние, что приводит к
253
лизису зиготы. В результате при таких скрещиваниях [Hfr(X) X F ]
у рекомбинантов могут проявляться только те маркеры, которые пере-
даются раньше профага.
И диограм ма — схематическое обобщение кариотипа с соблюдением
усредненных количественных отношений между отдельными хромо-
сомами и их частями.
Изоакцепторные тРНК — различные тРНК» переносящие одну и
ту же аминокислоту при синтезе белка, узнающие различные кодоны
на иРНК и, следовательно, имеющие различные антикодоны. Напри-
мер, две изоакцепторные лейциновые тРНК из печени кролика вклю-
чают лейцин в различные места синтезируемой полипептидной цепи,
так как одна из них опознает на иР.НК триплет ЦУЦ, а другая —
триплет ЦУУ. От соотношения этих тРНК зависит ход синтеза белка.
Изолейцин — незаменимая аминокислота, которая входит в состав
почти всех белков.
Изоляция — исключение или затруднение свободного скрещивания
между особями одного вида, ведущее к обособлению внутривидовых
групп и новых видов.
Изомеразы — класс ферментов, катализирующих внутримолекуляр-
ные реакции перестройки органических соединений, в том числе взаимо-
превращения изомеров.
Изоферменты — ферменты с одинаковой или сходной функцией,
которые кодируются разными локусами (генами) одного и того же хро-
мосомного набора (гаплоидного). Такие локусы возникают в резуль-
тате дупликации и последующих изменений. Так, у одной особи может
синтезироваться несколько вариантов одного фермента. Изоферменты
обнаружены в тканях животных, растений, а также у микроорганизмов.
Играют важную роль в регуляции ферментативной активности, а
также в процессах развития. Набор изоферментов возникает в ре-
зультате генетически обусловленных различий (в количественном и ка-
чественном отношении) для разных тканей и. организмов животных и
растений и часто строго специфичен. Наличие или отсутствие опре-
деленного изофермента широко используется как генетический маркер
для определения принадлежности особи к определенной группе, а ана-
лиз частот изофермента одного белка — для определения границ
популяций.
Иммобилизованные ферменты — искусственно получаемые препа-
раты ферментов, молекулы которых ковалентно связаны с полимер-
ным носителем, в результате чего значительно повышается их устой-
чивость к денатурирующим воздействиям.
Иммуногенетика — раздел медицинской генетики, изучающий гене-
тическую детерминацию иммунологических систем человека, групп крови.
Иммуноглобулины — сложные белки (гликопротеиды), которые спе-
цифически связываются с чужеродными веществами — антигенами.
Инбридинг — скрещивание особей, имеющих близкую степень
родства.
Инверсия — тип хромосомной перестройки, заключающийся в пере-
вороте участка генетического материала на 180°.
Ингибиторы — вещества различной химической природы, подав-
ляющие каталитическую активность отдельных ферментов или,фермент-
ных систем.
Индикаторный штамм — используемый для идентификации (выде-
ления) других штаммов бактерий или бактериофагов.
254
Индукция — способность клеток бактерий и дрожжей синтезиро-
вать определенные ферменты лишь при наличии соответствующих суб-
стратов в среде, переключение транскрипции в результате взаимодей-
ствия индуктора с белком-регулятором; вырезание профага из генома
клетки-хозяина вследствие инактивации белка-репрессора, ведущее к
началу литического цикла развития.
Индуцируемые ферменты — ферменты, скорость синтеза которых
изменяется в зависимости от условий существования организма.
Инициация синтеза бедка. См. Трансляция.
Инициирующий кодон — синтез большинства или всех полипеп-
тидных цепей у кишечной палочки, который начинается с включения
в аминоконец формилметионина благодаря наличию инициирующего
кодона ДУГ, узнаваемого Мет-тРНКмет. См. Трансляция.
Инсерционные сегменты. См. IS-элементы.
Инсерция — вставка перемещающегося генетического элемента в
какое-то новое место на хромосоме или плазмиде; часто ведет к обра-
зованию инсерционных генных мутаций.
Интеркинез — период между первым и вторым делениями мейоза.
Интерсексы — особи с промежуточным проявлением половых
признаков.
Интерсперсия — чередование нуклеотидных последовательностей
различной степени повторяемости в хромосомной ДНК эукариот.
Интерфаза — отрезок мейотического цикла между окончанием
одного мейоза и началом следующего. Состоит из трех стадий: пред-
синтетической, синтеза ДНК и постсинтетической.
Интерференция. См. Кроссинговер.
Интрон — вставка определенной нуклеотидной последовательно-
сти внутри гена, не несущая генетической информации. Обнаружен
в генах эукариотов. Длина интронов колеблется в широких пределах.
Нередко их суммарная длина больше длины остальной части гена,
несущей информацию (экзона). Граница между интронами и экзонами
проходит по определенному сочетанию нуклеотидов (ТТ — с одного кон-
ца, ГЦ — с другого). Появление зрелой молекулы иРНК есть ре-
зультат сшивки отдельных ее участков после удаления интронов. Этот
процесс получил название сплайсинг. Имеются данные о том, что интро-
ны не являются нефункциональной частью гена. Так, например, у дрож-
жей в гене, контролирующем цитохром митохондрий, интроны коди-
руют другие белки, работающие в процессе созревания иРНК цитохро-
мов (работа на «самообслуживание»). Наличие интронов важно для
процессов генетической рекомбинации, которая может привести к ней-
трализации вредных мутаций и образованию новых генов.
Искусственный отбор — выбор человеком наиболее ценных в хозяй-
ственном отношении особей животных и растений данного вида, породы
или сорта для получения от них потомства с желательными свойствами.
IS-элементы — транспозирующие элементы (ТЭ), имеющие разме-
ры 200—5Х Ю3 пар нуклеотидов и содержащие только гены, свя-
занные с транспозицией. Встраиваясь в различные места хромосомы,
IS-элементы не только могут инактивировать близлежащие гены, что
фенотипически может выражаться как видимые или летальные мута-
ции, но и играть роль переключателей, прекращая или разрешая тран-
скрипцию этих генов в зависимости от того, совпадает или нет на-
правление транскрипции самого IS-элемента и оперона бактерий.
182-элемент может регулировать таким образом работу галактозного
оперона.
255
Кариотип — совокупность признаков хромосомного набора (число,
размер, форма), характерных для того или иного вида хромосом.
Карта комплементации — изображение в виде линейных или кру-
говых неперекрывающихся (в случае отсутствия комплементации) от-
резков отношений между аллельными мутациями, отражающих взаимо-
действие полипептидных цепей, уложенных в третичную структуру. Спо-
соб генетического анализа третичной и четвертичной структуры белка
основан на изучении межаллельной комплементации. Тест на межал-
лельную комплементацию может быть использован для изучения эво-
люционной дивергенции белков. Например, щелочные фосфатазы Е, coll
и Serratia marcescens осуществляют одинаковые реакции, но имеют
различный аминокислотный состав. Между ними существует компле-
ментация, что указывает на эволюционную консервативность центров
взаимодействия между субъединицами щелочной фосфатазы обоих
видов. Подобным образом может быть получена активная трипто-
фансинтетаза из гетерологичных аир субъединиц Е. coll и других
представителей энтеробактерий.
Картирование — определение локализации (порядка и взаимного
расстояния) между генами на хромосоме (мутациями внутри гена).
Различают гетеродуплексное и рестрикционное картирование. Гетеро-
дуплексное картирование — картирование с помощью гибридизации
двух отрезков ДНК различных, но близких геномов. Среди ренатури-
рованных молекул ДНК могут оказаться такие структуры, в которых
отдельные участки ДНК не связаны в двухцепочечную молекулу из-за
отсутствия комплементарности. Эти участки определяются под электрон-
ным микроскопом. Можно установить их протяженность и положение
по отношению к остальному геному. Гетеродуплексное картирование
может быть проведено и при гибридизации ДНК с соответствующей
иРНК. Картирование ведется по локализации одноцепочечных петель.
Рестрикционное картирование — геномы некоторых организмов (гено-
мы вирусов, митохондрий, хлоропластов, части более крупных геномов)
могут расщепляться ферментативно на отдельные фрагменты. При
сравнений мелких фрагментов можно установить последовательность
компонентов всего генома.
Каскадная регуляция оперонов — переключение транскрипции с
одних структурных генов на другие в течение жизненного цикла виру-
сов и прокариотов.
Катаболизм — совокупность ферментативных реакций в живом
организме, направленных на расщепление сложных органических ве-
ществ — белков, нуклеиновых кислот, жиров, углеводов, поступающих
с пищей или запасенных в организме.
Катаболитная репрессия — угнетение синтеза адаптивных фермен-
тов в бактериальных культурах в присутствии глюкозы, так называе-
мого глюкозного эффекта. Ингибитор, ответственный за этот эффект,
является продуктом расщепления, т. е. катаболизма глюкозы. В отсут-
ствие глюкозы под действием фермента аденилатциклазы из АТФ обра-
зуется циклический 3'-5'-АМФ или цАМФ, который в комплексе с
белком БАК присоединяется к промотору и дает возможность РНК-поли-
меразе начать транскрипцию. В присутствии глюкозы подавляется ак-
тивность аденилатциклазы, что приводит к уменьшению концентрации
цАМФ и предотвращает транскрипцию адаптивных ферментов. Глюкоз-
ный эффект наблюдается также в средах, содержащих лактозу, маль-
тозу, арабинозу, ксилозу, галактозу. Не наблюдается на фруктозе и
маннозе.
Катенаны — структуры нуклеиновых кислот, имеющих форму це-
256
пей. Например, кольцевые молекулы ДНК ряда вирусов (SV40, ФХ 174)
и митохондрий связаны друг с другом как звенья одной цепи.
Кластер — расположенные в ряд функционально связанные гены.
Клеточная инженерия — метод конструирования клеток нового
типа на основе их культивирования, гибридизации и реконструкции.
Клон — совокупность клеток или особей, происшедших от общего
предка путем бесполого размножения.
Клонирование молекулярное — метод обнаружения молекул реком-
бинантных ДНК путем рассева и. выращивания на питательном агаре
клеток, в которые такая ДНК была введена путем трансформации.
В случае бактерий каждая клетка образует колонию, представляющую
собой клон, все клетки которого содержат идентичные молекулы реком-
бинантной ДНК.
Кодоминирование — участие обоих аллелей в определении призна-
ка у геторозиготной особи (классический пример — взаимодействие ал-
лелей определенной группы крови ММ, MN, NN).
Кодон — триплет; дискретная единица генетического кода; участок
информационной РНК, состоящий из трех последовательностей.
Коинциденция — отношение числа наблюдаемых кроссинговеров
(перекрестов) к теоретически ожидаемому. См. Кроссинговер.
Колинеарность гена и кодируемого им белка — обусловленность
порядка расположения аминокислотных остатков в белке чередованием
нуклеотидов ДНК
Колицины. См. Бактериоцины.
Комбинативная изменчивость — изменчивость, в основе которой
лежит образование рекомбинаций, т. е. таких комбинаций генов, которых
не было у родителей.
Компаунд — два мутантных аллеля из серии множественных ал-
лелей в гетерозиготе образуют компаунд (wa/wch).
Компенсация доз генов — регуляция активности группы генов,
находящихся в Х-хромосоме. В онтогенезе самок млекопитающих ге-
ны обоих Х-хромосом активны только на ранних стадиях эмбриогенеза,
когда решается, что последующая дифференциация организма пойдет
в сторону женского, а не. мужского пола. В дальнейшем у самок одна
из Х-хромосом гетерохроматизируется и локализованные в ней гены
перестают транскрибироваться. Вследствие этого у гомогаметного пола,
как и у гетерогаметного, фенотипически проявляется только один на-
бор лежащих в Х-хромосоме генов. Последующее развитие первичных
и вторичных половых признаков определяется половыми гормонами.
Активность двух Х-хромосом привела бы к возникновению больших
различий не только по половым, но и по другим жизненно важным при-
знакам. Следует отметить, что по отношению к Х-хромосоме гетеро-
гаметные особи являются моносомиками. Этим достигается одинаковое
развитие у обоих полов признаков, независимых от половых гормонов.
У дрозофилы уравнение активности локализованных в Х-хромосоме
генов самцов и самок достигается тем, что у самцов активность генов
Х-хромосомы вдвое выше. Активизация генов Х-хромосомы самцов
осуществляется благодаря наличию активирующего фактора (вероятно,
белковой природы).
Компетентные клетки — клетки, способные к трансформации. См.
Трансформация.
Комплекс инициации. См. Трансляция.
Комплементарность — наличие дополняющих друг друга генов,
которые при совместном действии определяют появление какого-либо
нового (дикого) признака. Расщепление при комплементарном взаимо-
9—1740
257
действии может быть 9:7, 9:3*4, 9:3:3:1. Примером взаимодействия
генов на уровне их первичных продуктов может служить комплемента-
ция, проявляющаяся при синтезе некоторых белков, имеющих четвер-
тичную структуру, т. е. состоящих из нескольких одинаковых или
разных полипептидных цепей (щелочная фосфатаза имеет 2 одинаковых
цепи, гемоглобин — 4 цепи двух типов). Гибрид двух мутантных роди-
телей по разным генам оказывается способным к синтезу нормального
функционирующего белка (AAbb X ааВВ^-АаВЬ). Комплементировать
могут не только разные гены, но и разные аллели одного гена. Такая
межаллельная комплементация встречается, когда аллельные мутации
гена различным образом изменяют порядок аминокислот в полипептид-
ной цепи, что искажает ее вторичную и третичную структуры, лишая
фермент активности. У гетерозигот, имеющих в своем геноме разные
аллели гена, может наблюдаться нормализация пространственной кон-
фигурации измененных цепей и гибридная молекула, состоящая из
нескольких субъединиц, может обладать полной или частичной актив-
ностью. См. Карта комплементации.
Комплементарные гены — два или более неаллельных гена, фено-
типическое проявление которых необходимо для выражения одного
признака организма.
Комплементарные ДНК (кДНК) — синтезируемые in vitro с по-
мощью обратной транскриптазы (или ДНК-полимеразы) копии иРНК,
соответствующие определенному гену без интронов.
Комплементация — восстановление дикого или близкого к нему фе-
нотипа при объединении в одной клетке двух рецессивных мутаций
с различным или сходным фенотипическим проявлением.
Конвергенция — независимое развитие сходных признаков у разных
групп организмов к сходным условиям среды.
Конверсия генов — кроссинговер, происшедший в гетерозиготе
вблизи гена, при расщеплении аллелей которого имеет место наруше-
ние реципрокности. При конверсии гена у нейроспоры в аске наблю-
дается расщепление 64 ; 2а, 2А : 6а, 5а : За вместо нормального 4А ; 4а.
Конкордантность — проявление изучаемого признака у обоих близ-
нецов пары.
Конститутивный синтез — синтез ферментов в отсутствие индуктора.
При мутации в Zac-опероне, ведущей к конститутивному синтезу,
измененный регуляторный белок не связывается с оператором, а при
мутации Ос нормальный регуляторный белок (репрессор) не присоеди-
няется к мутантному оператору. В таких случаях структурные гены
становятся доступными РНК-полимеразе и транскрибируются. Фермен-
ты, синтезируемые клеткой постоянно, вне зависимости от наличия в
среде субстрата или индуктора, называются конститутивными.
Конъюгация бактерий — один из способов обмена генетическим
материалом, при котором происходит его однонаправленный перенос
от донора («мужской» клетки) к реципиенту («женской» клетке).
Конъюгация хромосом — попарное временное сближение гомоло-
гичных хромосом, при котором возможен обмен их гомологичными
участками — кроссинговер.
Концевая избыточность — наличие повторяющихся последователь-
ностей оснований или генов на концах хромосомы. Наблюдается у фагов.
Координированная репрессия ферментов — прекращение синтеза
фермента в присутствии продукта реакции, которую он катализирует.
Было установлено, что синтез триптофансинтазы Е. coll, фермента,
детерминируемого генами trp А и trp В, подавляется в присутствии
триптофана. Биологический смысл этого явления очевиден: для клетки
258
было бы неэкономно синтезировать ферменты, обеспечивающие синтез
триптофана, так как в среде эта аминокислота содержится в доста-
точном количестве. Триптофан координированно регулирует активность
всех пяти смежных генов trp Д, В, С, D, Е. Это означает, что внутри-
клеточное содержание триптофансинтетазы (trp Л, trp В), ИГФ-син-
тетазы (trp D) фосфорибозилантранилаттрансферазы (trp С) и антрани-
латсинтазы (trp Е) в одинаковой степени изменяется с изменением
концентрации триптофана. В случае репрессибельного оперона репрес-
сор находится в неактивном состоянии в отсутствие триптофана и
переходит в активную форму, в которой он может соединяться с опе-
ратором в присутствии триптофана.
Коферменты — органические соединения небелковой природы, вхо-
дящие в состав активного центра некоторых ферментов.
Коэволюция — эволюционные взаимодействия организмов разных
видов, не обменивающихся генетической информацией, но тесно связан-
ных биологически.
Коэффициент наследуемости. См. Наследуемость.
Крест-накрест (крисс-кросс) наследование — тип передачи призна-
ков, сцепленных с полом, от отца к дочерям и от матери к сыновьям.
Криптический мутант—мутант lac Z Y+, у которого отсутствует
галактозидпермеаза и вследствие этого он не синтезирует р-галакто-
зидазу. Способность к гидролизу лактозы обнаруживается у этого му-
танта только в клеточных экстрактах.
Криптические фаги (скрытые фаги) — часть генома профага, остав-
шаяся в бактериальной хромосоме после образования дефектного
трансдуцирующего фага. Криптические фаги способны к рекомбинации
с другими мутантными гомологичными фагами.
Криптомерия — один из видов взаимодействия генов (рецессивный
эпистаз).
Кроссинговер — перекрест, взаимный обмен участками гомологич-
ных хромосом во время мейоза, приводящий к появлению новых комби-
наций генов и впоследствии рекомбинантных особей, зависит от расстоя-
ния между генами и служив мерой картирования хромосом.
Неравный кроссинговер — нарушение адекватности обмена при
кроссинговере приводит к обмену различными по длине участками
хромосом, что является причиной появления дупликаций.
Левый оператор. См. Оператор.
Лиазы •— класс ферментов, катализирующих реакции негидроли-
тического отщепления от субстратов определенных групп атомов с
образованием двойных связей, а также реакции присоединения атомов
и групп атомов по двойным связям.
Лектины — растительные белки, агглютирирующие клетки млеко-
питающих в результате избирательного связывания с углеводными
компонентами клеточной поверхности.
Лигазы — класс ферментов, катализирующих реакции присоеди-
нения друг к другу двух различных молекул за счет энергии сопря-
женной реакции гидролиза нуклеозидтрифосфатов. Используются при
репарации, репликации и рекомбинации ДНК. Катализируют синтез
фосфодиэфирных связей между соседними З'-гидроксильным и 5'-фос-
фатным концами двухцепочечной ДНК. Например, в клетке кишечной
палочки содержится до 400 молекул лигазы. ДНК-лигазы выделяют
также из клеток эукариотов. В клетках млекопитающих встречаются
два типа лигаз, серологически отличающихся друг от друга: лигаза I
259
локализована преимущественно в цитоплазме, а лигаза II — в ядре и
митохондриях.
Лидерная последовательность — нетранслирующийся участок на
5'-конце иРНК, предшествующий инициирующему кодону.
Лидерная РНК—часть РНК (90 %), инициация транскрипции
которой терминируется в области аттенюатора (например, в Zrp-опероне)
при быстрых колебаниях концентрации триптофана. В условиях глу-
бокого голодания по триптофану доля терминаций в аттенюаторе па-
дает до нуля и начатые транскрипции проходят в зону структурных
цистронов, обеспечивая тем самым синтез триптофана. См. Аттенюатор.
Лидирующая цепь ДНК (leading) — вновь синтезируемая цепь
ДНК, направление которой (5Z—3') совпадает с направлением дви-
жения репликационной вилки. Вторая, вновь синтезируемая цепь, комп-
лементарная первой цепи, называется запаздывающей (lagging).
Лизат HFT—лизат, полученный в результате индукции ультра-
фиолетовым светом дважды лизогенных бактерий, содержащих X gal-
дефектный и Л-интактный профаги. Обладает высокой трансдуцирую-
щей способностью.
Лизогения — состояние бактериальной клетки, при котором в ее
хромосоме находится один или несколько бактериофагов.
Лизогенная конверсия — приобретение новых признаков (свойств)
бактериальной клеткой при лизогенизации. Лизогенная клетка стано-
вится устойчивой к гомологичному фагу; лизогенные штаммы К12 (X)
не способны поддерживать рост rll мутантов Т-четных фагов; лизо-
генные по фагу PI клетки модифицируют ДНК фага Л. Эти модифика-
ции защищают ДНК фага X от разрушения под действием рестрикти-
рующей нуклеазы PI, разрушающей обычную немодифицированную
ДНК фага %. Потомки редких выживших в лизогенной по фагу PI клетке
частиц X с модифицированной ДНК уже не рестриктируются лизогенными
штаммами KPI и размножаются на них. См. Модификации, контро-
лируемые хозяином.
Лизоцим — фермент класса гидролаз; катализирует гидролиз р-
1,4-гликозидных связей между остатками аминосахаров. N-ацетил-
глюкозамина и N-ацетилмурамовой кислоты в полисахаридных цепях
муреинов, что ведет к разрушению оболочки бактериальной клетки.
Линкеры. См. Липкие концы.
Линии чистые — совокупность генотипически однородных организ-
мов, возникающих в результате самоопыления у растений или дли-
тельного близкородственного скрещивания у животных.
Липкие концы — это перекрывающиеся концевые участки, ответст-
венные за превращение линейной хромосомы фага А в кольцевую. Дли-
на липких концов достигает 12 нуклеотидов. Образуются за счет дейст-
вия фагоспецифической нуклеазы (эндонуклеазы), закодированной в
гене А фага X и образующейся в клетке-хозяине только при вегетатив-
ном размножении фага. В генетической инженерии используются
так называемые линкеры — короткие синтетические олигонуклеотиды.
В векторы часто вставляют полилинкеры, являющиеся участками
узнавания для нескольких эндонуклеаз рестрикции.
Локус — местоположение определенной мутации на генетической
или цитологической карте хромосомы. Это понятие относительное, и
две мутации считаются расположенными в одном локусе до тех пор,
пока между ними не будет установлена возможность кроссинговера.
Чаще используется для обозначения больших районов хромосомы,
включающих целый ген.
260
Магнификация генов — выщепление из хромосомы генов рРНК
в виде кольцевых молекул, репликация их с последующим встраива-
нием в хромосому. Наблюдается в ооцитах, клетках зародыша на ран-
них стадиях развития. Увеличенное число генов передается через га-
меты следующим поколениям. Это способ компенсаторного увеличения
числа генов рРНК в ответ на потерю их в результате неравного крос-
синговера. Наблюдается у дрозофилы.
Материнское наследование — наследование, контролируемое вне-
хромосомными (цитоплазматическими) факторами и приводящее к
фенотипическим различиям между индивидуумами с идентичным
генотипом.
Межлинейные гибриды — гибриды, полученные от скрещивания
инбредных линий. Межлинейные гибриды, например кукурузы, оцени-
вают в первом поколении по эффекту гетерозиса, отбирают линии, да-
ющие лучшие комбинации, и затем размножают их в больших масшта-
бах для производства гибридных семян. При получении гибридных
семян исходные линии высевают рядами, чередуя материнские и от-
цовские формы. Для обеспечения опыления между ними используется
цитоплазматическая мужская стерильность (ЦМС). Широко использу-
ются двойные межлинейные гибриды. Их получают путем скрещива-
ния двух простых гибридов, проявляющих гетерозис. Такой двойной
гибрид часто проявляет гетерозис, и его получение основано на исполь-
зовании четырех инбредных линий от четырех разных сортов: (А X В) X
X (С X D).
Мейоз — особый способ деления клетки, в результате которого
происходит редукция (уменьшение) числа хромосом и переход клеток
из диплоидного состояния в гаплоидное. У растений мейоз происходит
в спорофите с образованием микро- и макроспор, у животных — во
время так называемых делений созревания в ооцитах у самок и сперма-
тоцитах у самцов. По соотношению диплоидной и гаплоидной фаз в
жизненном цикле организма выделяют три типа мейоза: 1) начальный,
или зиготный (происходит сразу после оплодотворения с первыми де-
лениями зиготы, у водорослей и простейших); 2) промежуточный, или
споровый (протекает в период спорообразования между стадиями спо-
рофита и гаметофита, у большинства растений); 3) конечный, или
гаметный (характерен для всех многоклеточных животных, некоторых
простейших и низших растений, например бурых водорослей).
Меланины — черные, коричневые или желтые пигменты. Молекулы
меланинов представляют собой сложные комплексы, образованные
полимерами производных тирозина и белками.
Менделизм — учение о закономерностях наследования признаков
организма.
- Меродиплоид — частичный диплоид.
Мерозигота — частичная зигота, возникающая у бактерий при
трансформации, трансдукции и сексдукции, когда в клетку-реципиент
внедряется только фрагмент ДНК клетки-донора, включающий один
или несколько генов. Если внесенный участок, конъюгирующий с
хромосомой (экзогенота), отличается по аллельному составу от соответ-
ствующего участка хромосомы бактерии (эндогенота), то образуется
частичная гетерозигота, называемая также гетерогенотой.
Мигрирующие, или мобильные, генетические элементы (МГЭ) —
участки генетического материала, способные к перемещению в преде-
лах генома внутри одной клетки. С перемещениями МГЭ различного
происхождения (IS-элементов и транспозонов у бактерий, мобильных
диспергированных генов у разных животных, элементов типа актива-
261
тора и диссоциатора у растений) связано возникновение мутаций и
вариаций. Вариации выражаются, например, в том, что отдельные
особи в природных популяциях дрозофилы различаются по располо-
жению и количеству МГЭ. Со вставками МГЭ типа вирусов, в частности
вируса «сигма», детерминирующего чувствительность к СО2 у дрозо-
филы, связан феномен синхронных «вспышек» одних и тех же мута-
ций в организмах одного вида, обитающих в разных географических
ареалах.
Микросомы — субклеточная фракция, получающаяся при диффе-
ренциальном центрифугировании клеточных гомогенатов.
Мини-клетки — мутанты Е. coli, дефектные по способности к раз-
множению, не содержащие ДНК и не способные делиться. Имеют
примерно 10 % объема от нормальной клеткн.
Минорные основания. См. Редкие основания.
Минус-цепь. См. Плюс-минус-цепь.
Митоз (непрямое деление) — основной способ деления эукариотных
клеток. Биологическое значение митоза состоит в строго одинаковом
распределении редуплицированных хромосом между дочерними клетка-
ми, что обеспечивает образование генетически равноценных клеток и
сохраняет преемственность в ряду клеточных поколений.
Множественное действие гена. См. Плейотропное действие гена.
Множественность заражения — количество фаговых частиц, ад-
сорбированных на одной бактериальной клетке.
Мобильные гены — структурно и генетически дискретные фраг-
менты ДНК, способные перемещаться по геному клеток.
Модификации — изменения признаков организма, вызванные вли-
янием факторов внешней среды, но не затрагивающие его генотип.
Модификации представляют однозначные реакции организма на воз-
действие среды. Они не наследуются и сохраняются на протяжении
жизни организма. Изменения признака колеблются в определенных
пределах, которые зависят от генотипа и называются нормой реакции.
Для разных признаков норма реакции различна.
Изучение модификаций необходимо для выяснения относительной
роли и характера взаимодействия генотипа и среды, понимания законо-
мерностей эволюции, так как естественный отбор действует на уровне
фенотипа, т. е. оперирует как мутациями, так и модификациями. В ка-
честве примеров модификаций можно назвать увеличение количества
зерен хлорофилла при удалении части листьев в ассимилирующих тка-
нях стебля и черенках листьев, изменение цвета лепестков льна, китай-
ской примулы и бабочек в зависимости от температуры, растений
в загущенных и редких посевах. Модификации бывают адаптивными
(адекватными), когда они вызываются обычными изменениями среды,
действию которых особи данного вида подвергались на протяжении
его прошлой эволюционной истории. Если же организм попадает в
необычные обстоятельства, с которыми не приходилось сталкиваться
данному виду, то могут возникнуть модификации, лишенные приспо-
собительного значения (например, развивающиеся при недостаточном
освещении воздушные листья стрелолиста имеют такую же лентовид-
ную форму, как и подводные). Различают также вредные модифика-
ции, называемые морфозами,— ненаследственные изменения, вызван-
ные экстремальными или необычными для вида факторами внешней
среды, в частности излишки бора, ведут к хлорозу у некоторых расте-
ний, у мальков рыб, развивающихся в присутствии хлорида лития,
образуется лишь один глаз (циклопизм). Некоторые морфозы могут
напоминать фенотипический эффект каких-либо генов. Они называются
262
фенокопиями» например под влиянием температурного шока из куколок
дрозофилы получаются мухи с закрученными вверх и растопыренными
крыльями, с увеличенными крыльями у линии vg.
Модификации, контролируемые хозяином.— Большинство частиц
фага X, выращенного на Е. coli К-12 (назовем их X К), не способны раз-
множаться на лизогенной бактерии Е, coll К-12 (PI), несущей профаг
PI. Потомки же тех редких частиц X, которые размножились на К-12
(PI) (назовем их % PI), могут расти на обоих штаммах, т. е. они не рест-
риктируются, их ДНК не подвергается распаду под действием рестрик-
тазы PI. Подобная устойчивость есть следствие модификации ДНК
фага, т. е. появления в ней минорных оснований 5-метилцитозина и
6-метиламинопурина в результате метилирования цитозина и аденина
под действием бактериальных метилтрансфераз, переносящих метиль-
ную группу S-аденозилметионина на два обычных основания (аденин
и цитозин). См. Лизогенная конверсия.
Модификации посттрансляционные.— Белок, образующийся на ри-
босоме, часто остается недостроенным и подвергается последующей
ферментативной модификации. Отщепляется N-концевой фМет или Мет,
секреторные белки теряют «сигнальную последовательность» и полу-
чают покров из углеводов. Некоторые ферменты (пепсин, зимотрипсин,
трипсин, инсулин) образуются в виде более длинных предшественни-
ков, чем готовый продукт, что является самозащитой клетки от актив-
ности этих ферментов. Активность аллостерических белков изменяется
путем присоединения к ним субстрата (эффектора). Происходит фор-
мирование конечной третичной и четвертичной структур с образова-
нием дисульфидных мостиков, а иногда и образованием редких ами-
нокислот, не имеющих своего кодона (гидроксипролин из про-
лина).
Мозаики — организмы, состоящие из клеток с различным гено-
типом; возникают вследствие мутаций или соматического кроссин-
говера.
Молчащие мутации — мутации, не проявляющиеся фенотипически
и приводящие к видимому уменьшению частоты мутаций Тон5— Тонг
(чувствительность — устойчивость к фагу TI). В основе их лежат из-
менения белка, определяющего структуру рецепторов для фага TI, ко-
торых недостаточно, чтобы обусловить фенотип Тон'.
Мутаген — физический или химический агент, увеличивающий
частоту возникновения мутаций.
Мутагенез — процесс возникновения мутаций.
Мутант — клетка или отдельный организм, характеризующийся
изменением, вызванным мутацией.
Мутация — генетическое изменение, приводящее к качественно
новому проявлению основных свойств генетического материала.
Мутация генеративная — мутация, возникающая в генеративных
клетках и передающаяся по наследству.
Мутация генная — мутация, в которой происходят перестройки
структуры отдельных генов.
Мутация геномная. См. Полиплоидия.
Мутация-миссенс — нарушение нуклеотидного состава кодонов, при
котором измененный код определяет включение в синтезируемый
белок неверной аминокислоты.
Мутация-нонсенс — это такое изменение кодона, при котором но-
вый кодон вообще не определяет включение какой-либо аминокислоты.
Нонсенс-мутации являются терминирующими и приводят к появлению
следующих кодонов: УАГ — амбер, УАА — охра, УГА —опал.
263
Мутация обратная, или реверсия,— мутация, приводящая к вос-
становлению дикого фенотипа.
Мутация сдвига рамки считывания — вставки (инсерции) или вы-
падения (делении), приводящие к искажению транскрипции и соот-
ветственно строения синтезируемых полипептидов.
Мутации соматические — мутации, происходящие в соматических
клетках и не передающиеся по наследству.
Ми-мутагенез — мутагенез под действием бактериофага Ми.
Наследование — процесс передачи задатков наследственно детер-
минированных признаков и свойств организма в процессе размножения.
Наследственность— свойство структур клетки и организма обеспе-
чивать материальную и функциональную преемственность между по-
колениями.
Наследственные болезни — патологические состояния, связанные с
мутацией гена и передающиеся из поколения в поколение.
Наследуемость — степень, в какой определенный признак контроли-
руется генетически, т. е. отношение генетической изменчивости к фено-
типической.
Негативная индукция синтеза — индукция, заключающаяся в том,
что регуляторный белок (репрессор) в присутствии индуктора (суб-
страта) не прикрепляется к оператору (вследствие аллостерического
эффекта), разрешая таким образом транскрипцию структурных генов
для /ас-области £. coli (субстрат — галактоза, индуктор — ИПТГ).
См. Позитивная индукция.
Негативная репрессия — репрессия структурных генов, при кото-
рой эффектор придает регуляторному белку способность прикрепляться
к оператору, предотвращая транскрипцию.
Неоднозначная трансляция. См. Супрессия на уровне рибосомы.
Неправильное спаривание нуклеотидов — спаривание редких форм
нуклеотидов с нормальными: Ах — С, Г* — Т, где Ах и Г* — пурины в
редкой имииоформе, и Г V, А — Сх, где Тх и Сх — пиримидины
в редкой энольной форме.
Несовместимость — неспособность родственных плазмид, при-
надлежащих к одной группе несовместимости, существовать одно-
временно в одной бактериальной клетке.
Нонсенс-кодоны — кодоны, которые не соответствуют ни одной из
аминокислот и выполняют роль терминирующих кодонов при транс-
ляции (УАГ — амбер, УАА — охра, УГА — опал).
Норма реакции. См. Модификации.
Нуклеоид — эквивалент эукариотического ядра у бактерий, стер-
жень РНК-содержащих инковирусов, состоящий из РНК и окружающей
ее белковой оболочки.
Нуклеопротеиды — сложные комплексы нуклеиновых кислот с
белками.
Нуклеосома — структурный элемент хромосомы у эукариотов, обе-
спечивающий ее стабильность. Состоит из четырех классов гистонов,
образующих шаровидное тельце. Сердцевина нуклеосомы представляет
собой тетрамер из двух молекул гистона Н4; снаружи расположены
по две молекулы гистона Н2А и гистона Н2В (всего 8 молекул). Диа-
метр нуклеосомы 10 нм. Вокруг этой структуры уложен отрезок дву-
спиральной ДНК длиной до 230 пар нуклеотидов, образующий почти
два оборота вокруг нуклеосомы. Соседние нуклеосомы соединены друг
с другом короткими отрезками ДНК.
264
Обратная транскриптаза. См. Ревертаза.
Ограниченная транскрипция — случай неполного считывания ге-
нома при нарушении генов, продукты которых необходимы для прояв-
ления активности других генов. Например, при индукции лизогенного
штамма, несущего профаг X, мутантный по гену N, в соответствующие
иРНК транскрибируется только сам ген N (инициация иа промо-
торе PR).
В экспериментах in vitro при добавлении в смесь продукта гена
N наблюдается более обширная транскрипция (считываются гены сШ,
red, xis, int, cl I, О),
Ограниченные полом признаки — признаки, которые проявляются
только у одного пола или выражение которых различно у различных
полов. Они могут определяться как аутосомными генами, так и гена-
ми, лежащими в половых хромосомах. У овец, например, рогатость
определяется геном Н, комолость — геном н. При этом у баранов
Н>н, а у ярок, наоборот, н>Н. Доминирование Н определяется на-
личием мужских половых гормонов, поэтому у гетерозиготных самок
не имеет места.
Однозначные гены — неаллельные гены, проявляющиеся фенотипи-
чески одинаково.
Онкогены — гены, кодирующие белки, способные вызвать злока-
чественную трансформацию клеток эукариот.
Онтогенез — индивидуальное развитие особи, вся совокупность ее
преобразований от зарождения (оплодотворение яйцеклетки, начало
самостоятельной жизни органа вегетативного размножения или деле-
ние материнской одноклеточной особи) до конца жизни.
Онтогенетическая адаптация — свойство организма приспосабли-
ваться в индивидуальном развитии к меняющимся условиям окружа-
ющей среды. Условно подразделяется на тканевую (клеточную) и орга-
низменную.
Онтогенетика (феногенетика) — раздел генетики, изучающий на-
следственные основы онтогенеза.
Онтогенетический метод — комплекс приемов для изучения носи-
телей наследственного заболевания как в гомозиготной, так и в гетеро-
зиготной форме. Включает методы определения гетерозиготных носи-
телей аномалий. Например, гетерозиготный носитель гена фенилкетону-
рии может быть определен путем введения в кровь фенилаланина,
уровень которого определяется в плазме крови.
Оператор — участок ДНК, «узнаваемый» специфическими белками-
репрессорами и регулирующий транскрипцию оперонов или отдельных
генов. В системе lac — это место прикрепления репрессора и начала
синтеза иРНК- Оперон может находиться в двух состояниях — от-
крытом и закрытом. Оператор открыт, если он свободен от репрессора,
и закрыт, если к нему присоединен репрессор. Закрытие оператора пред-
отвращает транскрипцию всех структурных генов данного оперона.
Бактериофаг X обладает двумя операторами, расположенными слева
и справа от гена cl, получившими название левых и правых опера-
торов (OL,OR).
Оперон — система координированной генетической регуляции, со-
стоящая из одного или нескольких структурных генов и сцепленных
с ними соответствующих акцепторных генов (регуляторных). У Е. colt
/ас-оперон начинается с промотора Р, включающего участок, к которому
присоединяется белок-активатор катаболитных генов, и участок взаимо-
действия с РНК-полимеразой. За промотором следует оператор О, с ко-
торым связывается репрессор, затем следуют структурные гены. Закан-
265
чивается /яс-оперон терминатором, участком, содержащим нонсенс-
кодоны:
eac еаср eacQ гас Z ВасЧ СасЬ
_______________1--1-------1-------1--------
Определение последовательности аминокислот в белке. Использует-
ся реакция 2-4-динитрофторбензола (ДНФБ) со свободной a-амино-
группой кислоты, расположенной на аминоконце или /V-конце. Реак-
ция с ДНФБ дает сильно окрашенное динитрофенильное производное
W-концевой аминокислоты (ДНФ):
ДНФБ
АГ-конец полипептида
ДНФ
После этого полипептид подвергается полному кислотному гидро-
лизу и распадается на отдельные аминокислоты. Полипептид можно
подвергнуть неполному гидролизу, при котором получаются фрагмен-
ты различной длины. В обоих случаях с помощью хроматографии
можно легко выделить ДНФ-производные AJ-концевой аминокислоты.
Затем эти фрагменты подвергаются полному гидролизу и в них опреде-
ляется аминокислотный состав. Для получения перекрывающихся олиго-
меров, содержащих несколько аминокислотных остатков, используются
ферменты, разрывающие полипептидную цепь в определенных местах.
Например, трипсин разрывает связи аргинина и лизина со следующим
аминокислотным остатком со стороны С-конца:
химотрипсин — связи ароматических аминокислот; лейцин-аминопепти-
даза — первую пептидную связь на JV-конце; карбоксил-пептидаза —
первую связь от С-конца. Используя оба последних фермента и после-
довательно разрывая связи с обоих концов молекулы белка, можно
определить, какой из аминокислотных остатков оказывается свобод-
ным на каждом из этапов исследования.
Определение последовательности нуклеотидов в нуклеиновых кис-
лотах. Для этого применяется селективный множественный гидролиз
с последующим анализом полученных фрагментов. Гидролиз панкреа-
тической рибонуклеазой.— Панкреатическая рибонуклеаза относится к
эндонуклеазам и разрывает фосфодиэфирные связи внутри молекулы
РНК в том месте, где со стороны З'-С находится пиримидиновый
нуклеотид (Ц, У, Т). Таким образом, она разрывает 6-связи (X —аРь —
— X). В результате гидролиза освобождаются нуклеозид- (и олигонук-
леозид)-трифосфаты:
266
Гидролиз с помощью рибонуклеазы TI (такадиастазы). Эта эндо-
нуклеаза разрывает &-связи между фосфором и 5'С, если в положении
3' находится гуанин:
Гидролиз фосфодиэстеразой змеиного яда — эта экзонуклеаза
разрывает молекулы РНК и ДНК между фосфатной группой и З'С
предыдущего нуклеотида. Она освобождает 5'-нуклеотиды по одному,
начиная с З'-конца (разрывает a-связи):
Гидролиз с помощью фосфодиэстеразы селезенки быка. Эта экзо-
нуклеаза освобождает нуклеозид-3-монофосфаты в молекулах РНК и
ДНК, начиная с б'-конца (разрывает а-связи):
Ориджин (ori) — локус, в котором начинается репликация ДНК
или ее перенос.
Ослабленные мутации — мутанты £. coll с повреждениями в гене
relA (от англ, relaxed — ослабленный контроль синтеза РНК), осво-
бождающие клетки от строгого контроля синтеза рРНК и тРНК при
аминокислотном голодании. В норме продукт гена relAt названный
фактором строгого контроля, при аминокислотном голодании катали-
зирует образование необычного нуклеотида гуанозин-З-дифосфат-5-ди-
267
фосфата (ррГрр) из ГДФ (ррГ) и АТФ (рррА). Нормальные штаммы
обладают «строгим» (stringent) контролем синтеза рРНК и тРНК. Му-
танты с ослабленным контролем лишены активного фактора строгого
контроля и поэтому не накапливают ррГрр при аминокислотном голо-
дании, Фактор строгого контроля активен только в комплексе с 70S рибо-
сомами, несущими в своем аминоацильном центре деацилированную
тРНК, соответствующую очередному кодону. Возможно, что накопление
ррГрр вызывает выключение синтеза обоих типов РНК, препятствуя
инициации, например, полинуклеотидных цепей в тех ппомпторах, где
в норме инициируется транскрипция рРНК и тРНК-
Отбор — дифференциальная вероятность оставления потомства
разными особями или группами особей. Вероятность дать потомство
определяется многими свойствами организма: жизнеспособностью, быст-
ротой достижения репродуктивного возраста, продолжительностью ре-
продуктивного периода, способностью к скрещиванию и плодовитостью.
Совокупность этих свойств называется приспособленностью особи к
условиям среды и определяется генотипом. Из нескольких сравнива-
емых групп приспособленность той, которая выше, принимается за 1,
приспособленность других — за доли единицы. При вероятности оста-
вить потомство особями аа на 10 % меньше, чем особями АА и Аа,
приспособленность А А и Аа (w) равна 1, в этом случае w для аа равно
0,9. Критерием интенсивности отбора служит разность приспособлен-
ности сравниваемых групп, называемая коэффициентом отбора S. Для
данного примера S = — wAa — 1 — 0,9 = 0,1.
Отдаленная гибридизация — гибридизация, в которой скрещива-
ются разные виды и роды с использованием комбинаций отдельных
генов и хромосом разных видов, а иногда, например при получении
аллоплоидных гибридов, и комбинаций целых геномов, что позволяет
у них совмещать свойства форм, далеких в систематическом и биоло-
гическом отношениях. Проводить отдаленную гибридизацию достаточно
трудно по различным причинам: несовместимости пыльцевых трубок и
тканей пестика у растений, несовпадении в строении половых органов и
циклов размножения и т. д. Разработаны методы преодоления нескре-
щиваемости, например предварительные прививки в целях вегетативно-
го сближения тканей, опыления смесью пыльцы. Перспективным мето-
дом преодоления стерильности отдаленных гибридов является получение
амфидиплоидов.
Открытая рамка считывания — последовательность нуклеотидов, со-
стоящая из ряда триплетов, кодирующих аминокислоты, и не содер-
жащая кодонов, терминирующих трансляцию. Такая последователь-
ность потенциально может транслироваться в белок.
Ошибки репарации — первичные мутационные повреждения, воз-
никающие в результате ошибок ферментов в системе репарации и
связанных с ними систем репликации и рекомбинации. Ошибки со-
ставляют значительную долю спонтанных мутаций.
Палиндром (палиндромная последовательность) — участок ДНК,
в котором полностью или почти идентичные последовательности осно-
ваний «прочитываются» одинаково в обоих направлениях от одного
центра симметрии: АВССВА
АВССВА
Панмиксия — свободное скрещивание разнополых особей с разны-
ми генотипами в популяции перекрестно оплодотворяющихся организмов.
Партеногенез — одна из форм полового размножения организмов,
268
при которой женские половые клетки развиваются без оплодотворения.
Пахитенная ДНК — ДНК эукариотов, синтез которой обнаружи-
вается в пахитене мейоза, что приводит к замене некоторых уже имею-
щихся участков ДНК, и протекает по типу репаративного синтеза.
Синтез пахитенной ДНК происходит в разбросанных по хромосомной
ДНК участках (часто многократно повторенных) с одинаковой по-
следовательностью оснований. Эти участки составляют 0,1 генома. Син-
тез пахитенной ДНК осуществляется обычными репарирующими и
реплицирующими ферментами. Исключение составляет специальная
эндонуклеаза (никаза), появляющаяся только на пахитенной стадии.
Пенетрантность — частота проявления аллеля определенного гена
у разных особей родственной группы организмов.
Пептидазы — протеолитические ферменты, отщепляющие концевые
аминокислотные остатки от молекул белков и пептидов.
Пептидилтрансфераза — фермент, катализирующий образование
пептидной связи и располагающийся в 60S рибосоме. Образование
пептидной связи происходит между формилметионин-тРНКфЁТ и ами-
ноацил-тРНК, находящимися в пептидильном и аминоацильном цент-
рах рибосомы соответственно, и способствует образованию дипептидил-
тРНК. См. Трансляция.
Пептидильный центр — участок 50S рибосомы, в который передви-
гается тРНК из аминоацильного центра при подходе к нему следующей
аминоацил-тРНК. См. Трансляция.
Пептидная связь — вид амидной связи, которая возникает в ре-
зультате взаимодействия а-аминогруппы ( —NH2) одной аминокисло-
ты с а-карбоксильной группой (— СООН) другой аминокислоты.
Пептиды — органические вещества, состоящие из остатков оди-
наковых или различных аминокислот, соединенных пептидной связью.
Первичная перетяжка — сужение хромосомы, делящее ее на два
плеча. В области первичной перетяжки находится центромера. В за-
висимости от положения центромеры хромосомы бывают метацентри-
ческими (равноплечие), субметацентрическими (неравноплечие) и акро-
центрическими (палочковидные).
Первичная структура белка — порядок расположения аминокис-
лотных остатков в полипептиде. См- Определение последовательности
аминокислот в белке.
Перетекание генов — изменение частоты генов (аллелей), связанное
с миграцией особей из популяции в популяцию.
Перлиазы — белки-переносчики, участвующие в активном транс-
порте веществ через мембраны.
Пермутация — циклические перестановки общего порядка локу-
сов, например абвгдежзикл.....орпжзикл...
Плазмагены — наследственные факторы, локализованные в цито-
плазме, способные к авторепродукции и передаче наследственной
информации.
Плазмиды (эписомы) — добавочные кольцевые хромосомы бакте-
рий, реплицирующиеся, как правило, автономно и присутствие кото-
рых необязательно для выживаемости клетки. Некоторые плазмиды
могут встраиваться в бактериальную хромосому (F-фактор). Длина
плазмид составляет от 0,05 до 1 % бактериальной хромосомы. Кроме
F-фактора различают R-факторы, факторы устойчивости к лекарствен-
ным препаратам (стрептомицин, хлорамфеникол, сульфаниламиды),
Col-факторы, или колициногенные факторы (у шигелл, сальмонелл,
кишечной палочки), содержащие гены, вызывающие продуцирование
269
колицинов, особых белковых веществ, способных убивать бактерии
того же вида, не имеющих данного бактерноцина. Как правило, все
плазмиды придают клетке донорные свойства.
Плазмон (плазмотип) — совокупность наследственных факторов,
локализованных в цитоплазме и ее органоидах.
Пластидом — совокупность пластид клетки как структур, передаю-
щих наследственную информацию.
Плейотропия — множественное действие гена, способность гена
воздействовать на несколько признаков.
Плейотропное действие гена — влияние одного гена на различные
признаки. Объясняется тем, что продукт транскрипции отдельного гена
используется в нескольких переплетающихся друг с другом процессах
роста и развития. Плейотропность гена выявляется путем изучения
фенотипических изменений, вызываемых его мутациями. У человека
плейотропное действие гена обнаруживается при изучении синдромов
(комплексов патологических изменений фенотипа), характерных для
многих генных мутаций. У лиц, страдающих арахнодактилией, вызы-
ваемой доминантной мутацией, удлинены пальцы рук и ног, наблю-
даются врожденные пороки сердца. Редкое наследственное заболева-
ние галактоземия ведет к слабоумию, циррозу печени, слепоте. Такое
сочетание симптомов — следствие рецессивной мутации гена, кодирую-
щего галактозо-1-фосфатуридилтрансферазу — один из ферментов,
необходимых для усвоения галактозы (молочного сахара). У растений
плейотропное действие генов может быть проиллюстрировано на при-
мере генных мутаций, затрагивающих синтез хлорофилла. Такие
мутации помимо ослабления зеленой окраски затрагивают рост расте-
ния, число и размеры листьев и цветков, семенную продуктивность.
Плоидность — число наборов хромосом, содержащихся в клетке
или во всех клетках многоклеточного организма.
Плюс-минус-цепь — одноцепочечные фаги (ФХ 174) содержат ДНК,
получившую название плюс-цепь. При попадании в клетку-хозяина
ДНК фага (плюс-цепь) на ней начинает строиться комплементарная
цепь, служащая матрицей для образования новой фаговой ДНК,
которая называется минус-цепью. Таким образом, генетическая инфор-
мация заключена в плюс-цепи. РНК-содержащие фаги (вирусы) в за-
висимости от их типа содержат либо плюс-цепь (вирус полиомиелита),
либо минус-цепь (вирус гриппа). После того, как плюс-цепь попа-
дает в клетку, она сразу же начинает играть роль иРНК. На минус-
цепи должна сначала синтезироваться плюс-цепь, прежде чем заклю-
ченная в ней генетическая информация может быть использована.
Повышающие мутации. См. Понижающие мутации.
Позитивная индукция — тип регуляции, при которой белковый
продукт гена-регулятора не запрещает, а активирует синтез. Наблюда-
ется в катаболическом опероне кишечной палочки, кодирующем фер-
менты усвоения арабинозы (ага — оперон). Комплекс «регуляторный
белок — арабиноза» приобретает сродство с промоторной частью опе-
рона, прикрепляется к ней и активирует структурный ген.
Позитивная репрессия — тип регуляции, при которой регуля-
торный белок, активирующий работу оперона, инактивируется эффек-
тором.
Пол — совокупность признаков и свойств организма, обеспечиваю-
щих его участие в воспроизводстве потомства и передаче наследствен-
ной информации следующему поколению за счет образования гамет.
Полимеразы — ферменты, катализирующие образование макро-
молекул из низкомолекулярных веществ.
270
Полимеризация органов — процесс увеличения в филогенезе числа
равноценных гомологичных образований в организме.
Полимерия — генетическая детерминация количественного при-
знака несколькими генами с однозначным действием. Такие гены на-
званы полимерными и обозначаются одной буквой с указанием номера
разных генов (Аь А2, Аз). Различают два типа полимерии: кумуля-
тивную, при которой проявление признака зависит от числа доминантных
генов в генотипе и усиливается при их накоплении, и некумулятивную
(например, наследование оперенности ног у кур, формы стручка у пас-
тушьей сумки), при которой гены с «однозначным действием» опреде-
ляют качественный признак. В обоих случаях присутствие любого из
доминантных генов обусловливает доминантный признак, а форма аааа
имеет рецессивный фенотип. Поскольку при кумулятивной полимерии
признак зависит от числа доминантных генов, то и расщепление под-
считывается по частоте генотипических классов, имеющих определен-
ное число доминантных генов.
Полимерные гены — неаллельные гены с одинаковым или почти
одинаковым действием на признак (чаще количественный), обладающие
аддитивным действием. См. Полимерия.
Полиморфизм в популяции — существование в ней ряда генети-
чески различных форм, воспроизводящихся при размножении. За
счет существования гетерозигот в популяции поддерживается опреде-
ленное соотношение классов особей, различающихся генетически и фено-
типически, что получило название балансированного полиморфизма,
например разделение функций между различными формами у общест-
венных насекомых: пчел, муравьев, термитов. Полиморфизм является
механизмом поддержания популяции как единой системы. Полимор-
физм может проявляться и на биохимическом уровне. См. Изофер-
менты, Генетический груз.
Полинуклеотидфосфорилаза — фермент, осуществляющий поли-
меризацию рибонуклеозиддифосфатов. Не нуждается в ДНК-ма-
трице.
Полипептиды — полимеры, построенные из остатков аминокислот
(от 6—10 до нескольких десятков).
Политения — множественная репликация молекул ДНК без после-
дующей цитотомии (деления клетки), благодаря чему образуются
гигантские хромосомы (например, в клетках слюнных желез личинок
насекомых).
Полифилия — происхождение данной группы организмов от не-
скольких предковых групп, не связанных близким родством.
Половой хроматин — участки хроматина, определяющие различие
интерфазных ядер у особей разных полов, связанные с особенностями
структуры или функционирования половых хромосом. Встречается у
70 % ядер особей женского пола и у 5—6 % особей мужского пола.
Наличие и число половых хроматинов зависит от числа Х-хромосом.
Число половых хроматинов на единицу меньше числа Х-хромосом в
клетке. Образуется вследствие того, что все Х-хромосомы, кроме од-
ной, спирализуются и после окрашивания проявляются в виде поло-
вого хроматина. Определение полового хроматина используется в
медицинской практике при установлении пола индивида, что позволяет
установить пол при интерсексуальности у плода н у новорожденного.
Для исследования используются клетки лейкоцитов, базального слоя
эпидермиса и клетки из мазка слизистой рта.
Половые хромосомы — хромосомы, по которым особи разного пола
отличаются друг от друга. У дрозофилы меланогастер 8 хромосом обра-
271
зуют 4 пары. Три пары хромосом одинаковы морфологически, а чет-
вертая — гетероморфна. Одна из хромосом этой пары изогнута и
субметацентрична (Y-хромосома), другая (Х-хромосома) —акроцент-
рична. У самок набор половых хромосом — XX, у самцов — XY. См.
Гетерогаметный пол, Гомогаметный пол.
Полярные мутации — нонсенс-мутации, которые могут снижать
синтетическую активность всех позже считываемых генов того же one-,
рона. Активность генов, лежащих между оператором и мутантным
геном, т. е. считываемых раньше его, при этом не затрагивается. По-
лярный эффект нонсенс-мутации объясняется тем, что в норме рибосомы
закрывают всю молекулу иРНК и свободными остаются небольшие
участки между терминирующими кодонами одного гена и начальными
кодонами другого. В случае же преждевременного окончания тран-
скрипции вследствие нонсенс-мутации свободными от рибосом ока-
зываются более значительные участки иРНК, они более подвергаются
действию нуклеаз и при этом, естественно, теряется часть генетиче-
ской информации.
Понижающие мутации — мутации локуса /асР в участке связыва-
ния комплекса БАК — цАМФ, снижающие максимальную скорость
транскрипции /ас-генов (уменьшается способность ДНК, содержащей
/ас-оперон, связывать указанный комплекс, что приводит к снижению
вероятности инициации транскрипции). Повышающие мутации имеют
противоположный эффект.
Популяционный метод — метод, позволяющий изучать распростра-
нение отдельных генов или хромосомных аномалий в человеческих
популяциях. Исследование частоты распространения генов имеет важ-
ное значение для анализа наследственных болезней человека, для
оценки последствий родственных браков, которые часты в изолирован-
ных популяциях, и для выяснения генетической истории человеческой
популяции.
Популяция — совокупность особей одного вида, обладающих об-
щим генофондом и занимающих определенную территорию.
Порода-сорт — популяция организмов, искусственно созданная че-
ловеком и имеющая конкретные наследственные особенности. Все особи
внутри породы и сорта имеют сходные наследственно закрепленные
свойства: продуктивность, собственный комплекс физиологических и
морфологических свойств, однотипную реакцию на факторы внешней
среды. Свойства породы и сорта проявляются в наиболее типичной
форме только в определенных природных условиях.
Постредукция. См. Прередукция.
Правый оператор. См. Оператор.
Праймер —- небольшой фрагмент РНК (50—200 нуклеотидов), ко-
торым начинается вновь синтезирующийся участок ДНК. РНК-прай-
меры инициируются «мобильным промотором». У Е. coll эту функцию
выполняет В-белок, кодируемый геном dna В. Он последовательно
связывается со специфическим участком матрицы запаздывающей
цепи и обозначает место инициации праймеров примазой (инициаль-
ная РНК-полимераза), осуществляющей синтез праймеров. Примаза
Е. coll кодируется геном dna G. Дальнейшая элонгация у Е. coll
производится голоэнзимом ДНК-полимеразы III (гены pol С и dna Е,
dna Z). Удаляется праймер с помощью ДНК-полимеразы I (ген pol А).
Предетерминация цитоплазмы — случаи наследования признаков,
связанного с особенностями цитоплазмы, которые возникают в про-
цессе индивидуального развития под влиянием факторов среды. Разли-
чают онтогенетическую и генетическую предетерминацию. Онтогенети-
272
ческая предетерминация — это изменения, вызванные средой в цито-
плазме, которые не стойки и исчезают через несколько поколений.
Например, воздействие повышенной температуры на яйца самок наезд-
ника Hctbrobracon до оплодотворения приводит к изменению окраски
тела у их потомства. Через несколько поколений при нормальной
температуре этот эффект исчезает. Подобные изменения, затухающие
в ряду поколений при возвращении в исходные условия, называют
длительными модификациями. Генотипическая предетерминация опре-
деляется генотипом материнского организма. Примером может служить
наследование направления закручивания раковины у моллюска Limnea,
когда фенотип потомков зависит от генотипа матери, а не от гено-
типа зигот, из которых они развиваются. При этом менделевское рас-
щепление 3:1 проявляется не во втором, а в третьем поколении.
Прередукция — расхождение несестринских хроматид в первом
мейотическом делении. Расхождение во втором мейотическом делении на-
зывается постредукцией и является результатом кроссинговера между
каким-либо геном и центромерой.
Принцип дробовика (shot gun experiments) — метод клонирова-
ния отдельных генов путем фрагментации ДНК генома какого-либо ор-
ганизма и введения этих фрагментов в бактериальные клеткй в составе
тех или иных векторов. При наличии достаточного числа бактериаль-
ных клонов, несущих случайные фрагменты исследуемой ДНК, в одном
из клонов может быть найден интересущий исследователя ген, который
необходимо идентифицировать.
Приспособленность. См. Отбор.
Пробанд — первичный пациент. См. Генеалогический метод.
Прогамное определение пола — определение пола до оплодотворе-
ния, при котором пол будущей особи зависит от того, что самки про-
изводят яйца двух сортов — крупные, богатые цитоплазмой, и мелкие,
бедные цитоплазмой. После оплодотворения первые развиваются в самок,
вторые — в самцов, например у некоторых червей, коловраток.
Прокариоты — одноклеточные организмы, не имещие обособленного
ядра (главным образом бактерии).
Проксимальные гены — гены, сцепленные и близко расположенные
на хромосоме или к О-концу хромосомы бактерии.
Промежуточное наследование — случаи отсутствия доминирования,
когда признак у гибридной особи занимает как бы промежуточное
положение между соответствующими признаками родителей.
Промотор — один из акцепторных генов, имеющий последователь-
ность нуклеотидных пар, опознаваемую РНК-полимеразой, которая при-
крепляется к нему и затем продвигается вдоль оперона, транскриби-
руя его.
Протопласты — клетки растений с разрушенными пектиназой и цел-
люлазой клеточными стенками. Используются для гибридизации со-
матических клеток.
Прототрофы — бактерии, способные синтезировать необходимые им
сложные органические вещества из простых, например минеральных
солей, и расти на минимальной среде.
Процессинг — совокупность реакций, ведущих к превращению пер-
вичных продуктов транскрипции и трансляции в функционирующие
молекулы.
Прыгающие гены. См. Транспозоны.
Псевдогены — сегменты глобиновых скриптонов ('Fpl, Чгр2, Чга1),
имеющие по 80 % гомологии с цистронами определенных цепей гемо-
глобинов. Они не образуют белковых продуктов, так как несут много
дефектов, нарушающих фазу трансляции.
Псевдополиплоидия — увеличение числа хромосом без увеличения
количества генетического материала. Различают фрагментационную
псевдополиплоидию (в соматических клетках имеется большое коли-
чество мелких хромосом, а в клетках зародышевого пути — лишь не-
сколько крупных хромосом, например у лошадиной аскариды); агма-
топсевдополиплоидию (появление диффузных центромер, например у
спирогиры, некоторых грибов и многих насекомых); псевдополиплоидия,
возникшая в результате слияния мелких хромосом. Последняя разно-
видность псевдополиплоидии приводит к появлению крупных хромосом
в различном числе у разных особей, что может быть принято за поли-
плоидный ряд, например у сапрогиры. У некоторых растений отмечено
появление так называемых В-хромосом, являющихся результатом фраг-
ментации обычно А-хромосом. Роль В-хромосом не установлена.
Разветвление биохимических реакций — образование различных
конечных продуктов независимыми путями из одного предшественника:
антраниловая кислота — L .-триптофан
хоризмовая кислота СТ
префеновая кислота — L -фенилаланин
Расплетающие белки. См. Геликазы.
Расщепление — появление в потомстве гибрида особей (клеток)
разного генотипа или обусловленное генотипически различие потомков
по проявлению признака.
Реверсия. См. Мутация.
Ревертаза (обратная транскриптаза) — фермент онкогенных РНК-
содержащих вирусов, осуществляющий так называемую обратную тран-
скрипцию, т. е. синтез ДНК провирусов на матрице вирусной РНК- В ходе
синтеза образуется гибрид РНК-ДНК, затем цепь ДНК реплицируется
под действием ДНК-зависимой ДНК-полимеразы и возникшая двойная
цепь ДНК подвергается дальнейшей репликации. Синтезированная при
помощи ревертазы вирусная ДНК включается в геном инфицированной
клетки.
Регулятор — ген, кодирующий структуру репрессора, функцией
которого является контроль транскрипции оперона.
Редкие нуклеотиды (минорные) — нуклеотиды, имеющие необычные
основания, такие как инозиновая (И), 1-метилгуаниловая (Гм), 1-метил -
инозиновая (Им) и диметил гуаниловая кислоты. Наличие метильных
групп препятствует образованию каких бы то ни было комплементарных
пар. К редким основаниям относятся также псевдоуридиловая (Ч’’), у
которой пиримидиновое кольцо урацила присоединено к рибозе не
через связь в положении 1, а через углерод в положении 5, риботимиди-
ловая кислота (Т), имеющая основание, родственное урацилу н со-
держащее метильную группу в положении 5'С.
Реинициация — способность клеток прокариотов возобновлять бел-
ковый синтез, прерванный возникшей нонсенс-мутацией. Сигналом реини-
циации может служить не только кодон АУГ (Мет), но и другие кодо-
ны. У эукариотов реинициации не обнаружено.
Рекомбинация незаконная (или неправильная) — рекомбинация,
включающая негомологичные обмены (транслокации, инверсии и случаи
неравного кроссинговера), например рекомбинация между фаговой и
бактериальной ДНК при отсутствии гомологии. Результатом такой не-
законной рекомбинации могут быть интеграция и исключение профа-
274
га %, которые приводят к появлению дефектных трансдуцирующих фагов
с различным содержанием фаговой ДНК-
Рекомбинация сайт-специфическая — рекомбинация, вызываемая
белком интеграции, закодированным в гене int фага X. Этот белок спе-
цифически связывается со специальным сайтом интеграции, располо-
женным в области Ь2 генома фага 1, и вызывает кроссинговер между
бактериальной и фаговой хромосомами только в этом сайте.
Репликаза — РНК-зависимая РНК-полимераза.
Репликон — единица процесса репликации участка генома, который
находится под контролем одной точки инициации.
Реплисома — комплекс белков, формирующийся в репликационной
вилке и осуществляющий нормальное прохождение всех этапов репли-
кации ДНК. Компонентом реплисомы может быть ДНК-полимераза
I, II, III, ДНК-зависимая РНК-полимераза, РНК, участвующая в обра-
зовании фрагментов Оказаки, полинуклеотидлигаза, соединяющая эти
фрагменты; ферменты, названные’ топоизомеразами, функцией которых
является изменение степени суперспирализации ДНК; ферменты, пла-
вящие ДНК, т. е. разделяющие комплементарные цепи, обеспечиваю-
щие раскручивание ДНК; разделение ее цепей; синтез затравочного
фрагмента РНК (праймера) с последующим образованием фрагментов
Оказаки; удаление РНК-затравки; заполнение образовавшейся односпн-
ральной бреши и ковалентное соединение фрагментов Оказаки.
Репрессия — подавление активности гена, чаще всего путем бло-
кирования его транскрипции.
Репрессор — белок, подавляющий транскрипцию одного или не-
скольких генов, тесно сцепленных между собой в составе оперона либо
разбросанных на хромосоме.
Рестрикция — неспособность бактериальных штаммов, нормально
чувствительных к определенному фагу, поддерживать его рост. Рест-
риктируемый фаг обладает, следовательно, ограниченным кругом хозяев.
См. Модификации, вызываемые хозяином.
Ретровирусы — семейство РНК-содержащих вирусов (ВТМ, НТ LV1
и 2, LAV/HTLV3).
Ретроингибирование — ингибирование конечным продуктом, имею-
щим, как правило, небольшую молекулярную массу (аминокислота),
первого фермента данной метаболической цепи. В случае разветвления
биохимических путей и отсутствия изоферментов может наблюдаться
так называемое координированное ретроингибнрование. Например, в
отличие от Е. coli у рода Baccilus в синтезе лизина, треонина, изолей-
цина участвует только одна вместо трех аспартаткиназа и ее ретроин-
гибирование происходит только при одновременном избытке всех трех
аминокислот. См. Изоферменты.
Рецессивность — отсутствие фенотипического проявления одного
аллеля у гетерозиготной особи.
Реципрокные скрещивания — пара скрещиваний, в которых орга-
низмы с доминантными и рецессивными признаками используются
н как материнские, и как отцовские.
Рибонуклеаза панкреатическая. См. Определение последовательно-
сти нуклеотидов в нуклеиновых кислотах.
Рибосома — цитоплазматическая структура, на которой синтези-
руются полипептиды.
РНК-полимераза ДНК-зависимая — фермент, катализирующий
транскрипцию (синтез РНК). Он использует в качестве матрицы одно-
цепочечную или денатурированную ДНК, синтезируя на ней РНК. За-
травки при этом не требуется. Фермент нуждается во всех четырех
275
5'-трифосфатрибонуклеозидах и содержит субъединицы п'яти типов:
а, ₽, а, <о. Структура называется «кор-ферментом» или «ми-
нимальным ферментом». Комплекс осарЗ'оэсг представляет собой голо-
фермент. Кор-фермент катализирует неспецифический синтез РНК, ко-
торый может начаться в любом месте ДНК-матрицы. Добавление сг-фак-
тора приводит к избирательной транскрипции. Она начинается только
в области промотора. См. Синтез РНК.
РНК-полимераза РНК-зависимая — репликаза.
Сайт — местоположение точковой мутации на рекомбинационной
карте гена, на картах фагов используется иногда и для обозначения
целой области хромосомы, например Ь2 фага к сайт int, т. е. сайта ин-
теграции. Если две аллельные мутации рекомбинируют между собой,
то они локализованы в разных сайтах.
Сателлитная ДНК— часть ДНК эукариотов, состоящая из класте-
ров, образованных повторенной 150—300 раз краткой последователь-
ностью нескольких нуклеотидов. Сателлитная ДНК составляет значи-
тельную часть ДНК эукариотов: у дрозофилы 4—12 %, у человека —
до 15 % Локализована в основном в центромерном гетерохроматине
и теломерных участках.
Сбалансированные летали — гены, имеющие рецессивный леталь-
ный эффект. Их наличие в генотипе популяции поддерживается естест-
венным отбором, так как в силу плейотропности действия генов эти
аллели в гетерозиготном состоянии могут обусловить определенный
положительный эффект в тех или иных условиях. Линии, в которых
автоматически поддерживается гетерозиготность по рецессивным де-
талям, называются системами сбалансированных леталей.
Сбалансированный полиморфизм. См. Генетический гомеостаз.
Сведберга единица (S) — единица седиментации, определяемая по
формуле
5 = X/^xdx/dt,
где о2 — угловое ускорение; dx/dt — перемещение частицы в единицу
времени; <о2х — характеристика поля гравитации, в котором перемеща-
ется частица при ультрацентрофугировании. Иногда она может заме-
няться на g — ускорение свободного падения.
Сверхдоминирование — более сильное проявление признака у зи-
готной особи, чем у любой из гомозигот (АА и аа) данной пары ал-
лелей.
Секвенирование (от англ, sequence — последовательность) —
определение нуклеотидной последовательности РНК или ДНК-
Сексдукция — процесс переноса генов из одной бактериальной
клетки в другую с помощью автономного полового фактора (F'=/ac).
Сибсы — потомки одних и тех же родителей.
Сингамное определение пола.— Пол будущей особи определяется
генотипом зиготы и не зависит от окружающих условий. Встречается
у большинства раздельнополых организмов.
Синдром кошачьего крика — наследственное заболевание, опреде-
ляемое делецией короткого плеча пятой хромосомы человека.
Синкарион — продукт слияния двух претерпевших мейоз гаплоид-
ных микронуклеусов у инфузорий.
Спасение генетических маркеров — проявление генетических мар-
керов одного из родителей в рекомбинантном потомстве, если в роди-
тельском геноме они были подавлены.
Спейсеры — короткие разделяющие нуклеотидные последовательно-
276
сти между промотором и структурным геном. У Е. coll насчитывается
37 пар нуклеотидов. В виде нетранскрибированных участков они встре-
чаются между рРНК-генами в случае их многократного повторения.
В генах эукариотов спейсеры — это участки, разделяющие транскриби-
руемые части гена — скриптоны.
Специфическая комбинационная способность — повышенная цен-
ность самоопыленной линии в какой-либо одной конкретной комбина-
ции скрещивания. Может быть определена путем скрещивания между
собой многих линий.
Соматические клетки — клетки тканей многоклеточных организмов,
не являющиеся половыми.
Сплайсинг. См. Интрон.
Спорофит — бесполое диплоидное поколение в жизненном цикле
растений. Начинается с оплодотворенной яйцеклетки и заканчивается
образованием спор.
Сорт. См. Порода.
Строгий контроль синтеза РНК — прекращение синтеза рРНК и
тРНК при аминокислотном голодании. Контролируется геном г el А
(Е. coll). См. Ослабленные мутанты.
Суперинфекция — дополнительное заражение бактериальной клет-
ки, инфицированной ранее новыми фаговыми частицами.
Супрессия на уровне рибосомы — присутствие стрептомицина вызы-
вает неправильное считывание некоторых кодонов, приводя к включе-
нию, например, лейцина, тирозина, серина в ответ на фенилаланиловый
кодон.
Супрессорная мутация — мутация, обусловливающая полное или
частичное восстановление функции, утраченной в результате первичной
мутации.
Супрессорные тРНК— тРНК, антикодон которых в результате
мутации получил возможность узнавать тот или иной нонсенс-кодон
на иРНК и считывать его как значащий. Иногда в супрессорной тРНК
антикодон остается без изменений. Например, в супрессорной тРНК1₽п
антикодон (АЦЦ) не изменен, но имеется замена нуклеотида в поло-
жении 24, удаленном от антикодона на 1 нм. Очевидно, в результате
этой замены четвертичная структура тРНК так изменилась, что анти-
кодон ее узнает не только кодон УГГ (триптофан), но и терминирующий
кодон У ГА (опал).
Супрессоры сдвига считывания — супрессирующие индуцированные
акридиновыми красителями мутации сдвига рамки (делении, вставки).
Различают внутри- и межгенные супрессоры. Действие внутригенных
супрессоров заключается в том, что недалеко от сайта исходной мута-
ции сдвига рамки (делении, вставки) происходит вставка, деления
(мутация обратного знака), что приводит к восстановлению нормаль-
ной рамки считывания во всем цистроне, за исключением района между
этими мутациями. Межгенные супрессоры — это супрессорные мутации,
локализованные в далеко отстоящем от исходной мутации локусе. Не-
которые из этих супрессоров возникают в тРНК бактерии. Такая супрес-
сорная тРНК восстанавливает рамку считывания в случае, если синтези-
руемый полипептид прошел место мутации сдвига рамки (например,
вставленное основание) и мутантная тРНК продвигается не на 3, а на
4 нуклеотида.
Сцепление генов — явление, заключающееся в совместной пере-
даче генов группами при их локализации в одной хромосоме. Сцепление
может быть полным и неполным. Мерой сцепления является вероят-
ность кроссинговера.
277
Сцепление с полом — наследование признаков, гены которых лока-
лизованы в половых хромосомах. Признаки, сцепленные с полом, вы-
являются по различному расщеплению у обоих полов в реципрокных
скрещиваниях. Расщепление по полу 1:1 объясняется образованием
двух типов гамет по набору половых хромосом гетерогаметным полом
у одного типа гамет гомогаметным полом.
Теломеры — концевые участки хромосомы.
Теория замороженного случая — согласно этой теории структура
генетического кода сформировалась в результате случайных событий,
но после установления смысла кодонов в исходной клетке, являющейся
общим предком всех ныне живущих организмов, дальнейшая эволю-
ционная дивергенция кода стала невозможной, поскольку любая му-
тация, изменяющая установленное соответствие кодона и аминокислоты,
может оказаться летальной.
Терминатор (терминирующий кодон) — участок ДНК, служащий
стоп-сигналом, прекращающим продвижение РНК-полимеразы, тран-
скрипцию оперона. Обычно состоит из нескольких повторяющихся нон-
сенс-кодонов.
Тест на синтрофизм — изучение способности одних мутантов ком-
пенсировать метаболические дефекты и стимулировать размножение
других мутантов в общей питательной среде путем диффузии избы-
точных накапливающихся метаболитов. Может использоваться при
установлении последовательности этапов метаболических путей.
Тетрадный анализ — метод, позволяющий доказать, что/менделев-
ское расщепление обусловливается механизмом мейоза и что оно пред-
ставляет не статистическую, а биологическую закономерность. У хле-
бопекарных дрожжей имеются красные и белые колонии.' Эти альтерна-
тивные признаки определяются парой аллелей: А — белый, а — красный
цвет колонии. При слиянии гамет образуется диплоидная зигота Аа.
Она вскоре приступает к мейозу, в результате чего в аске образуется
тетрада гаплоидных спор. Для определения расщепления каждую спору
из аска высевают на питательную среду отдельно. Из образующихся
четырех колоний две белые и две красные, т. е. наблюдается расщеп-
ление 1А:1а. Подобный результат получается при изучении любых
двух других признаков. Такое расщепление является результатом мей-
оти чес кого деления.
Транзнцня — мутация, в результате которой пуриновое основание
заменяется пуриновым, а пиримидиновое — пиримидиновым (А—Т->
Трансверсия — мутация, в результате которой пуриновое основание
заменяется пиримидиновым, а пиримидиновое — пуриновым (А—Т->
->Т —А).
Трансгеиоз — один из методов генетической инженерии. Представ-
ляет собой экспериментальный перенос выделенных из одного генома
или искусственно синтезированных генов в другой геном. Состоит из
трех последовательных операций: выделение, или синтез, гена, вклю-
чение его в вектор и введение вектора с включенным в него геном в
клетку.
Трансгрессия — суммирующее действие генов, вызывающих увели-
чение или уменьшение какого-либо признака.
Тралсдетермннация — внезапное изменение направления развития
зачатка органа вследствие гормональных нарушений. Причиной транс-
детерминации могут быть как гомеозисные мутации, так и трансплан-
тации зачатков дисков у насекомых.
278
Трансдукция — перенос фрагмента ДНК клетки-донора в клетку-
реципиент с помощью вируса (умеренного фага). Различают общую
и специфическую трансдукции. Общая (неспецифическая) трансдук-
ция — это такая трансдукция, при которой фаг, размножающийся в
бактерии, способен захватить любой участок бактериальной ДНК и пе-
ренести ее в другую восприимчивую для данного фага бактерию. Обычно
переносятся 1—3 гена. В трансдуцирующей фаговой частице часть ее
генома замещена фрагментом донорной бактериальной ДНК и такая
частица не размножается, не разрушает клетку и не делает ее лизо-
генной. Специфическая (ограниченная) трансдукция — трансдукция,
при которой переносится определенный район хромосомы донора вслед-
ствие крепления генома профага в определенном локусе. Например,
место прикрепления фага Л около /ас-оперона и образующиеся при
выщеплении так называемые дефектные фаги kdg, имеющие ~30 %
своего генома, переносят гены gal (фаг ф 80 переносит гены try). Иногда
геном трансдуцирующего фага остается невстроенным в хромосому-
хозяина, сохраняется в цитоплазме клетки и при ее делении попадает
только в одну из двух дочерних клеток. Такое явление называется обор-
тивной трансдукцией.
Транскрипция — процесс переписывания генетической информации
с молекулы ДНК на молекулу РНК, т. е. синтез и РНК.
Транслокация — перемещение гена или участка хромосомы из одно-
го локуса в геноме в другой.
Трансляция — перевод генетической информации с языка нуклеи-
новых оснований в иРНК на язык аминокислот в белке, т. е. синтез
белка.
Транспозиция — перемещение фрагмента генетического материала
между негомологичными участками генома клетки.
Транспозоны (транспозирующие элементы) — небольшие фрагмен-
ты ДНК, способные встраиваться в хромосому, перемещаться вдоль
нее и со дерущие помимо системы транспозиции также гены другого
функционального назначения (устойчивость к антибиотикам, гены,
контролируют не метаболические процессы).
Трансфекция — заражение бактериальных клеток при обработке
их очищенными препаратами ДНК, выделенной из ДНК-содержащих
вирусов, в результате чего в клетке образуется новое поколение ви-
рионов, как если бы они были заражены полноценным вирусом.
Трехфакторное скрещивание — генетические скрещивания с исполь-
зованием трех различных генетических маркеров (например +/a + /e-f-
+ /сХ а/а в/в с/с).
Трисомия — изменение кариотипа, при котором одна или несколько
хромосом в диплоидном наборе представлены тремя экземплярами.
Трансформация — перенос генов между клетками с помощью ДНК-
донора. Клетки-реципиенты трансформируются только в определенный
период жизненного цикла, когда они восприимчивы к трансформирующей
ДНК, так называемые компетентные клетки. Фрагмент донорной
ДНК, проникший в клетку-реципиент, включается в ее хромосому по-
средством двойного кроссинговера, замещая там соответствующие гены.
Различают внутривидовую и межвидовую трансформацию.
Умеренный фаг — фаг, способный лизогенизировать бактериальную
клетку, переходя в состояние профага, внедряясь в ДНК-хозяина (фаг X)
или оставаясь в цитоплазме (фаг PI).
Условно-летальные мутации — мутации, летальные в определенных
279
условиях: ауксотрофные — в отсутствие необходимых факторов роста;
температурочувствительные — при повышенных температурах.
Фаг-помощник — нормальные фаговые частицы (геномы), способ-
ствующие развитию дефектных трансдуцирующих фагов (геномов).
Фактор строгого контроля — фермент, контролируемый геном г el А:и
Е. colt. Контролирует синтез рРНК и тРНК, прекращая его при амино-'
кислотном голодании. См. Ослабленные мутации.
Факторы элонгации — факторы элонгации EF — Tu, EF — Ts и
EF — G, необходимые для сборки аминокислот в полипептидную цепь.
Они не являются структурными компонентами рибосом и присоединяются ‘
к ним только на определенном этапе сборки белка.
Феногенетика. См. Онтогенетика.
Фенотип — совокупность всех признаков и свойств организма,
формирующихся в процессе взаимодействия ее генетической структуры
(генотипа) и внешней по отношению к ней среды. В фенотипе никогда
не реализуются все генетические возможности, т. е. фенотип каждой
особи есть лишь частный случай проявления ее генотипа в определен-
ных условиях развития.
Фенотипический радикал — та часть генотипа организма, которая
определяет его фенотип. Для генотипов ААВВ> АаВВ, АаВЬ, ААВЬ,
АаВЬ фенотипическим радикалом будет Л-В-.
Флуктуационный тест — метод доказательства генетической (му-
тантной) природы изменений бактериальных клеток путем сравнения
частоты встречаемости (флуктуаций) данных признаков в независимых
культурах (различия должны быть статистически достоверны).
Фрагменты Оказаки — во время репликации вновь синтезированная
ДНК на одной так называемой запаздывающей цепи состоит из большого
числа небольших фрагментов, содержащих около 1000 (у эукариотов
около 200) нуклеотидов.
Фримартины — у млекопитающих при развитии разнополых близне-
цов иногда происходит изменение пола одного из них в эмбриогенезе.
Так, у разнополых двоен крупного рогатого скота бычки развиваются
нормально, а телочки оказываются интерсексами. Такие животные на-
званы фримартинами. Они, как правило, бесплодны. Подобные изме-
нения вызываются тем, что семенники начинают выделять мужские
гормоны в кровь раньше, чем яичники.
Хиазма — Х-образная структура, возникающая вследствие кроссин-
говера после начала расхождения гомологичных хромосом в профазе
I мейоза.
Хроматин — комплекс ДНК с белками, представляющий собой де-
компактизованные в интерфазном ядре хромосомы.
Хромосомы — нуклепротеиновые нитевидные структуры клеточного
ядра, имеющие сродство с основным красителем. Наблюдаются и иден-
тифицируются во время митоза и мейоза. Основной осевой компонент
хромосом — гигантская непрерывная молекула ДНК, которая в линей-
ном порядке содержит гены и генетические регуляторные последова-
тельности.
Цис-транс-тест — метод генетического анализа, позволяющий опре-
делить принадлежность двух рецессивных мутаций, имеющих сходное
фенотипическое проявление, к одному или разным генам. В основе цис-
280
транс-теста лежат представления о гене как единице функции. В двойной
гетерозиготе типа а + /-\-Ь две мутации в одном гене приводят к мута-
генному фенотипу, если они расположены в транс-конфигурации, и к
дикому типу — если расположены в цис-конфигурации.
Цистрон — единица функции в ДНК, определяемая по цис-транс-
тесту. Термин используется как синоним гена для определения после-
довательности ДНК, координирующей один полипептид.
Штамм — клоповая (из одной клетки) по происхождению культура
микроорганизмов, генетическая специфичность которой поддерживается
отбором.
Экзоны — кодирующие последовательности в структурных генах
эукариот; представлены в зрелой ДНК.
Экспрессивность — степень выражения генетрантного гена.
Экспрессия гена — реализация генетической информации, закоди-
рованной в ДНК, путем ее транскрипции и трансляции иРНК.
Эндогенота — часть бактериальной хромосомы, гомологичная фраг-
менту генома (экзогеноте), передаваемому от донора к реципиенту
при формировании.
Эписома — плазмида, способная интегрировать в хромосомную
ДНК бактерий.
Эпистаз — подавление экспрессии одного гена другим, неаллельным
геном.
Эукариоты — организмы, клетки которых имеют четко выраженное
деление на ядро и цитоплазму. Эукариоты могут быть как одноклеточ-
ными, так и многоклеточными.
Эффект положения — изменение проявления гена в результате его
певемещения в необычное место при хромосомных перестройках.
ЛИТЕРАТУРА
Айала Ф., Кайгер Дж. Современная генетика.— М.,
1987.— Т. 1.— 295 с.; 1988.— Т. 2.— 368 с.
Алиханян С. И., Акифьев А. П., Чернин Л. С. Общая
генетика.— М., 1985.— 448 с.
Бороевич С. Принципы и методы селекции растений.—
М., 1984.—444 с.
Гершензон С. М. Основы современной генетики.—
Киев, 1979.— 508 с.
Гуляев Г. В., Мельченко В. В. Словарь терминов по
генетике, цитологии, селекции, семеноводству и семенове-
дению.— М., 1975.— 240 с.
Зенгбуш П. Молекулярная и клеточная биология.—
М„ 1982.—Т. 1.—366 с.; 1982.—Т. 2.—438 с.
Инге-Вечтомов С. Г. Введение в молекулярную ге-
нетику.— М., 1983.— 343 с.
Ратнер В. А. Молекулярная генетика: принципы и
механизмы.— Новосибирск, 1983.— 256 с.
ОГЛАВЛЕНИЕ
Предисловие................................................3
Глава 1. Независимое наследование признаков. Законы
Г. Менделя....................................................5
1. Каковы основные задачи генетики?.......................5
2. Какой метод использовал Г. Мендель в опытах по изучению
наследственности?..............................................5
3. Какие основные законы наследственности установил Г. Мен-
дель? .........................................................6
4. Что означает чистота гамет? ......................... 9
5. Всегда ли признаки подчиняются законам Менделя? . ... 10
6. Если полученные результаты эксперимента отличаются от
теоретически ожидаемых, то как можно установить, что полученное
отклонение случайно? ........................................ 11
7. В чем различие используемых в генетике понятий «наслед-
ственность», «наследование», «наследуемость»?.................13
Глава 2. Взаимодействие генов.............................14
8. Что означает полигенность признака? Какие примеры могут
проиллюстрировать этот факт?..................................14
9. Что показывает тест на комплементарность?.............17
10. Что такое эпистаз и криптомерия?......................18
11. Что такое полимерия?..................................21
12. Как наследуются количественные признаки?..............22
13. Может ли признак в потомстве быть выражен сильнее или
слабее, чем у родителей? .....................................24
14. Может ли один ген влиять одновременно на несколько при-
знаков организма?........................................... 25
Глава 3. Определение пола. Наследование признаков, сцеп-
ленных с полом.............................................. 26
15. Как и кем была найдена связь между генами и хромосомами? 26
16. Почему рождается примерно одинаковое количество особей
мужского и женского пола?.....................................27
17. Что такое балансовая теория определения пола? .... 28
18. Можно ли искусственно изменить соотношение полов в по-
томстве? .....................................................30
19. Каковы методы ранней диагностики пола?................30
20. Что такое половой хроматин? ........................ 31
21. Существует ли пол у растений?........................33
22. Что такое гинандроморфы?.............................34
283
23. Какие признаки называются сцепленными с полом? ... 36
24. Какие признаки называются ограниченными полом и зависи-
мыми от пола?.................................................38
25. Как наследуются признаки при бесполом размножении? . . 39
26. В чем заключается биологическая роль полового размно-
жения? 40
27. Каковы генетические механизмы определения пола у одно-
клеточных организмов?.......................................я4*1
Глава 4. Сцепление и кроссинговер. Карты хромосом ... 41
28. Какие признаки называются сцепленными? Как они насле-
дуются? ......................................................41
29. Как .определить силу сцепления генов? . . .... . . . 44
30. Как учитывается кроссинговер у гаплоидных организмов?
Можно ли предсказать результаты скрещивания, если известна
частота кроссинговера? ...................................... 45
31. Что такое множественный кроссинговер?.................47
32. Как определяется расстояние между геном и центромерой? 48
33. Как рассчитать расщепление от скрещивания дигетерозигот
при сцеплении генов? ........................................ 50
34. Контролируется ли рекомбинация генетически? .... 52
35. Что такое неравный и митотический кроссинговер? ... 52
36. Как составляются генетические карты хромосом? .... 54
37. Что такое цитологические карты хромосом и как они со-
ставляются? ..................................................56
38. Изменяется ли действие гена в зависимости от его положе-
ния в хромосоме? Что такое эффект положения гена?.............58
Глава 5. Молекулярная генетика................................59
39. Что служит доказательством генетической роли нуклеино-
вых кислот?................................................. 59
40. Каков механизм репликации ДНК?.......................60
41. Какие ферменты кроме полимеразы и лигазы участвуют
в репликации ДНК?.............................................61
42. Что происходит в репликационной вилке?................62
43. Какова роль ДНК-полимеразы I в клетке при репарации
УФ повреждений?...............................................64
44. Что обозначает термин «реплнкон» и чем отличается репли-
кон от обычной молекулы ДНК?..................................65
45. На чем основаны представления о двунаправленности ре-
пликации бактериальной хромосомы?.............................65
46. Какова роль ферментов рестрикции — модификации? . . 66
47. Всегда ли ДНК в клетке синтезируется полуконсерватив-
ным способом?.................................................66
48. Всегда ли при биосинтезе белка между нуклеиновой кис-
лотой, хранилищем генетической информации, и продуктом-белком
наблюдаются транскрипция и трансляция?........................67
49. В чем сущность катаболитной репрессии?...............68
50. Наблюдается ли согласование в регуляции активности раз-
личных генов у вирусов и бактерий?............................69
51. Как изучают цепи метаболизма и их генетические де-
фекты? 69
284
52. Какую роль играют изоферменты в регуляции биосинтеза? 71
53. Каковы различия регуляции по типу ретроингибирования
и репрессии? ................................................71
54. Каковы особенности регуляции активности оперонов у эука-
риотов? .......................................................72
55. Какие гены входят в состав оперона?...................73
56. Отличаются ли опероны прокариотических и эукариоти-
ческих организмов?.............................................73
57. Какие существуют типы регуляции активности генов? . . 73
58. Каковы особенности регуляции синтеза рРНК? .... 75
59. Всегда ли соблюдается принцип «один цистрон — одна
полипептидная цепь»?...........................................75
60. Репрессия — это механизм регулирования на уровне транс-
крипции, а возможна ли регуляция на уровне трансляции? ... 76
61. Что положено в основу подсчета числа белков, закодиро-
ванных в геноме?.......................................... . 76
62. Могут ли тРНК встраивать в полипептидную цепь несвой-
ственную им аминокислоту? Могут ли тРНК «ошибаться»? ... 77
63. Что такое неоднозначность трансляции?................77
64. Каковы особенности генома митохондрий?...............78
65. Различаются ли периоды полужизни иРНК различных орга-
низмов? .......................................................79
66. Всегда ли с рибосом сходит готовый к действию белок? 79
67. Что имеют в виду, когда говорят о неменделевских генах
и неменделевской наследственности?...........................79
68. Что означает «спасение генетических маркеров»? .... 80
69. Может ли организм извлекать различную информацию из
одного и того же участка хромосомы?..........................80
70. Что такое сплайсинг и как показать его наличие? .... 81
71. Что такое процессинг?.................................82
72. Как организован геном?..............................82
73. Могут ли гены перекрываться?.........................84-
74. Имеются ли прямые доказательства колинеарности гена и
кодируемого им белка?.......................................85
75. Что происходит с ДНК фага при лизогенизации клетки? . . 86
76. Чем отличаются лизогенные клетки, образующие обычный
трансдуцирующий фаг, от клеток, образующих HFT-лизат? ... 87
77. Могут ли организмы воспользоваться чужеродной генети-
ческой информацией для синтеза жизненно важных соединений? . 88
78. Известно, что инициация транскрипции осуществляется
присоединением комплекса БАК — цАМФ к промотору. Всегда ли
для инициации необходим этот комплекс?.......................89
79. Что такое аттенюация?...............................89
80. Что представляет собой компенсация доз генов? .... 90
81. Как можно объяснить случаи внутригенной компле-
ментации? ...................................................90
82. Как осуществляется гетеродуплексное картирование? . . 91
83. Возможно ли картирование тонкой структуры гена у высших
эукариотов?..................................................92
84. Что такое палиндром?.................................92
85. Известны вещества — индукторы и репрессоры активности
генов, а может ли один и тот же продукт быть одновременно и ин-
дуктором, и репрессором?.....................................93
86. Что такое супрессорные тРНК? ........................93
87. Опероны часто отличаются числом структурных генов.
285
А могут ли они отличаться числом операторов?..................93
88. Имеет ли принципиальное значение тот факт, что начало
репликации хромосомы Е. coli происходит со строго определенной
точки (сайта инициации репликации), а не с любой точки хромосомы? 94
89. Всегда ли постоянно число генов у высших организмов?
Могут ли отдельные гены в клетках высших организмов репли-
цироваться независимо от остального генома?...................95
90. Каким образом расшифровываются кодоны с помощью
искусственной иРНК?...........................................95
91. В чем сущность доминирования и рецессивности? .... 96
92. Что такое генетическая инженерия?....................97
93. Что такое биотехнология?.............................99
94. Каковы общие свойства генетического материала? . . .100
95. Как происходила эволюция генетического материала? . .100
96. Какие вопросы решает биохимическая генетика? . . . .101
97. Что означают различные названия генов — псевдогены,
уникальные, повторяющиеся, прыгающие и т. д.?................102
98. Что такое плазмиды?..................................103
99. Что такое генетическая трансформация?................105
100. Возможна ли трансформация у высших организмов? . .106
101. Что такое трансдукция?..............................107
102. Как в клетке закодирована наследственная информация? 108
103. Можно ли генетическими методами проверять генетиче-
ский код?.....................................................ПО
104. Каковы доказательства триплетности генетического кода? 111
105. Каковы доказательства неперекрываемости генетического
кода? 112
106. Действительно ли генетический код универсален? . . .113
107. Как осуществляется биосинтез белка?................114
108. Насколько оправдано выражение «один ген — одна поли-
пептидная цепь»?.............................................119
109. Что такое цистрон?..................................120
110. Что такое оперон? . ..........................122
111. Каковы функции гена-оператора?......................125
112. Что такое репрессор и как действует ген-регулятор? . . 126
113. Какие особенности регуляции дифференциальной актив-
ности генов у эукариотов?....................................127
114. Каковы формы изменчивости?..........................129
115. Что такое летальные гены?.........................133
116. В чем суть закона гомологических рядов в наследствен-
ной изменчивости? .......................................... 134
117. Что происходит с генетическим материалом при возник-
новении мутации?.............................................135
118. Различаются ли мутации по своему действию на организм? 137
119. Как экспериментально индуцировать мутации?..........138
120. Можно ли определить частоту мутаций? ...............141
121. Могут ли изначально вредные мутации стать полезными? . 143
122. От чего зависит частота мутирования?................144
123. В какой степени мутационный процесс находится под ге-
нетическим контролем?........................................145
124. Всегда ли нарушение структуры ДНК приводит к появле-
нию мутации?.................................................145
125. Зависит ли частота мутаций от пола и возраста? .... 147
126. Как действуют гены-мутаторы?........................147
127. Может ли восстанавливаться дикий фенотип у мутантных
286
форм?........................................................148
128. В чем сущность множественного аллелизма? Меняется ли
соотношение фенотипов в гибридном потомстве при множествен-
ном аллелизме? ..............................................149
129. Что такое антимутагенез?............................150
130. Наследуются ли приобретенные признаки?.............150
131. Играют ли мутации какую-либо роль в эволюции? . . . 151
132. Влияет ли окружающая среда на проявление генотипа? . .152
133. Может ли изменяться число хромосом у организма? . . .154
134. Каковы особенности и значение гаплоидии? ..... 157
135. Что такое гетероплоидия? Каково ее значение? . . . .157
136. Что такое полиплоидный ряд?.........................159
137. Как экспериментально получить полиплоиды?...........159
138. Если полиплоидные формы лучше диплоидных, то почему
не все формы растений используемые в сельскохозяйственном про-
изводстве, переведены на полиплоидный уровень?...............161
139. Почему полиплоидия у животных встречается редко? . .162
140. В чем заключается явление полярности мутаций? . . ,162
141. Могут ли фаги быть причиной мутаций?...............163
142. Каким образом клетка излечивается от повреждений, вы-
званных УФ излучением?.......................................164
143. Имеются ли мутации, затрагивающие ретроингибирование? 165
144. С одинаковой ли частотой происходят мутации изменения
функции и потери функции?....................................165
145. Различаются ли механизмы устойчивости бактерий к раз-
личным антибиотикам? ....................................... 166
146. На чем основано использование аналогов оснований
в медицине? ... 167
Глава 6. Цитоплазматическая наследственность.................167
147. Каковы доказательства цитоплазматической наследст-
венности? ...................................................167
148. Что такое цитоплазматическая мужская стерильность? . . 168
149. Каково биологическое значение цитоплазматической на-
следственности? .............................................171
Глава 7. Генетические процессы в популяции...................171
150. Как определяется генетический состав популяций? . . .171
151. Как определить вероятность какой-либо комбинации скре-
щивания в панмиктической популяции?..........................173
152. Как проводится генетический анализ популяции в случае
множественного аллелизма?..........................*. ... 174
153. Как рассчитать генетический состав популяции для при-
знаков, сцепленных с полом?..................................175
154. Как рассчитать состав популяции при самоопылении? . .176
155. В чем заключается явление полиморфизма и какие типы
полиморфизма встречаются в естественных популяциях? . . . .177
156. Как может нарушаться генетическое равновесие в попу-
ляции? 178
157. Как изменяется соотношение генотипов в потомстве при
инбридинге?..................................................179
158. Что подразумевается под понятием «генетическая смерть»? 180
287
Глава 8. Генетика человека....................................180
159. Почему среди миллиардов человек, населяющих нашу
Землю, нет абсолютно похожих?.................................180
160. Какие признаки у человека наследуются по моногибрид*
ному типу?....................................................181
161. От чего зависит и как наследуется цвет глаз человека? . .182
162. Чем опасны близкородственные браки?..............183
163. Что такое резус-фактор и как он наследуется?.....185
164. Чем определяются наследственные болезни человека? . .186
165. Наследуется ли рак у человека?...................188
166. Каковы генетические механизмы канцерогенеза? . . . .190
167. Имеются ли у человека признаки, сцепленные с полом? . .191
168. Как составляются цитогенетические карты хромосом
человека?.....................................................193
169. Имеются ли вредные мутации у человека? Какова генети-
ческая отягощенность человека?................................194
170. Что такое иммуногенетика и какова ее роль в генети-
ке человека? .................................................195
Глава 9. Генетика и селекция..................................197
171. Что такое селекция?..............................197
172. Что такое сорт?..................................199
173. Какие существуют типы сортов?.............. . . .199
174. Почему стареют сорта?............................201
175. Что такое сортосмена?............................202
176. Какие бывают типы сортоиспытания?................202
177. Что такое гетерозис?............................ 204
178. Как закрепить гетерозис?.........................205
179. Достаточно ли велик гетерозисный эффект и рентабельно
ли производство гибридных растений в сельском хозяйстве? . . . 206
180. В чем трудности отдаленной гибридизации? Почему бес-
плодны отдаленные гибриды?....................................206
181. Что такое комбинационная способность? В чем отличие
общей от специфической комбинационной способности? ..... -208
182. Какие типы отбора используются в селекции?.......209
183. Что такое синтетическая селекция?..............212
184. Что такое диаллельное скрещивание?.............212
185. Что такое ступенчатая гибридизация?............213
186. Что такое конвергентные скрещивания?...........213
187. Как получают новые виды?.........................214
188. Каковы примеры использования генетики в селекции мик-
роорганизмов? ............................................ ... 214
189. Какие сорта культурных растений созданы белорусскими
селекционерами?...............................................215
Глава 10. Решение задач по генетике...........................221
190. Как решать задачи по генетике?...................221
Словарь генетических терминов.................................238
Литература....................................................282