Автор: Лысов В.Ф. Ипполитова Т.В. Максимов В.И. Шевелев Н.С.
Теги: общее животноводство разведение млекопитающих животных и птиц скотоводство домашние животные и их разведение физиология животных биологические основы животноводства физиология зоология
ISBN: 978-5-9532-0770-6
Год: 2010
АССОЦИАЦИЯ «АГРООБРАЗОВАНИЕ»
О
В. Ф. ЛЫСОВ, Т. В. ИППОЛИТОВА, В. И. МАКСИМОВ,
Н. С. ШЕВЕЛЕВ
ПРАКТИКУМ ПО ФИЗИОЛОГИИ
и этологии животных
Под редакцией профессора В. И. Максимова
2-е издание, переработанное и дополненное
Допущено Министерством сельского хозяйства Российской
Федерации в качестве учебного пособия для студентов высших
аграрных учебных заведений, обучающихся по направлениям
111200 «Ветеринария» и 110400 «Зоотехния»
МОСКВА «КолосС» 2010
УДК 636:591.1/.5(075.8)
ББК 45.2я73
Л88
Редактор канд. биол. наук Д. Р. Архипова
Рецензенты: заслуженный деятель науки Российской Федерации, почетный
работник высшего профессионального образования Российской Федерации,
доктор биологических наук, профессор кафедры физиологии и фармакологии
животных Белгородской государственной сельскохозяйственной академии Г. И.
Горшков; заслуженный работник высшей школы России, доктор биологических наук,
профессор кафедры физиологии животных Уральской государственной академии
ветеринарной медицины А. И. Кузнецов
Лысов В. Ф., Ипполитова Т. В., Максимов В. И., Шевелев Н. С.
Л88 Практикум по физиологии и этологии животных / Под ред.
проф. В. И. Максимова. — 2-е изд., перераб. и доп. — М.: Ко-
лосС, 2010. — 303 с, [2] л. ил.: ил. — (Учебники и учеб.
пособия для студентов высш. учеб. заведений).
ISBN 978-5-9532-0770-6
Второе издание «Практикума по физиологии и этологии животных»
отражает современный уровень развития физиологии как науки с учетом
требований производственного процесса, а также последних достижений в
области биохимии, биофизики и биотехнологии.
В практикуме (соответствует программе по физиологии и этологии
животных, утвержденной Министерством образования и науки РФ)
изложены на современном методическом уровне в систематизированном виде
формы и методики выполнения лабораторных и практических работ по
физиологии и этологии животных в соответствии с закономерностями
деятельности систем организма, а также принципы работы, возможности и
правила использования приборов.
Описаны методы исследования, методические приемы для оценки
физиологических функций, поведения и адаптации животных.
Предназначен для студентов высших учебных заведений по
направлениям подготовки и специальностям «Ветеринария» и «Зоотехния», других
биологических специальностей, слушателей ФПК — преподавателей
высших учебных заведений.
УДК 636:591.1/.5(075.8)
ББК 45.2я73
Оригинал-макет книги является собственностью издательства «КолосС»,
и его воспроизведение в любом виде, включая электронный,
без согласия издателя запрещено.
ISBN 978—5—9532—0770—6 © Издательство «КолосС», 2010
1. ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К ПРОВЕДЕНИЮ ЛАБОРАТОРНЫХ ЗАНЯТИЙ
Цель лабораторного курса физиологии сельскохозяйственных
животных — ознакомить студентов с проявлениями
физиологических процессов и функций, их закономерностями, а также с
механизмами регуляции физиологических процессов в
организме.
Знание существа и механизмов регуляции физиологических
процессов и функций необходимо в практической деятельности
ветеринарного врача, зооинженера и ветврача-биолога. Оно
способствует формированию врачебного и зооинженерного
мышления.
На первом занятии студенты должны изучить и освоить
правила безопасности при проведении экспериментов и исследований
на сельскохозяйственных животных.
Каждый раздел лабораторного курса физиологии включает
такой перечень тем, целей и задач, благодаря которому можно в
логической последовательности изучить сущность и закономерности
деятельности всех органов и систем организма.
Лабораторный курс предусматривает познание физиологии
органов и систем организма путем проведения наблюдений и
экспериментов (опытов).
Метод наблюдения заключается в установлении и
описании проявлений процесса жизнедеятельности или функции
органа, метод эксперимента —в определении характера
и степени изменений процесса жизнедеятельности и функции
после устранения или усиления действия того или иного фактора,
участвующего в обеспечении этого процесса или функции. По
характеру и степени изменений физиологического процесса или
функции делается заключение о роли данного фактора (факторов)
в обеспечении процесса или функции. В итоге определения роли
всех факторов делается вывод, почему и как осуществляется этот
процесс или эта функция органа.
Методы наблюдения и эксперимента предусматривают
использование подготовительных оперативных вмешательств (таких, как
3
наложение фистул, вживление электродов и др.), а также простых
и сложных приборов. Студенты должны гуманно обращаться с
животными.
Четкая организация лабораторных занятий и активная работа
студентов обусловлены обязательным выполнением следующих
требований:
1. Знание календарного плана и содержания лабораторных и
практических занятий, включая контрольные вопросы.
2. Подготовка к текущему занятию; степень знаний проверяют
путем систематического опроса или программированного
контроля в течение 10... 15 мин.
3. Самостоятельное выполнение работы каждым студентом
(или группой из 2...3 чел.) после ознакомления с содержанием
при консультации преподавателя. Демонстрации опытов на
практических занятиях проходят при активном участии
студентов.
4. Ведение краткого протокола и зарисовка опытов с
основными выводами в тетради для лабораторных и практических занятий.
5. Отработка пропущенных занятий в установленные сроки
индивидуально или с группой.
6. Проведение итогового контрольного занятия по каждому из
основных разделов курса. Итоговую контрольную работу
учитывают во время зачета и экзамена.
1.1. ПРОГРАММИРОВАННОЕ ОБУЧЕНИЕ
Программированное обучение — один из путей
совершенствования учебного процесса, которое строится на обучающих
программах.
Обучающая программа включает короткие последовательные,
логически связанные между собой этапы («кадры», «шаги»),
содержащие определенное количество информации с обратной
связью деятельности учащихся.
Для проверки усвоения и закрепления материала после
каждого «шага» учащемуся задают контрольный вопрос. Ответы
немедленно корректируют сообщением результата. При правильном
ответе происходит подача новой порции информации, т. е. новый
«шаг» вперед. Благодаря тому, что программа составлена логично,
в порядке нарастающей трудности, число неправильных ответов
сводится к минимуму и учащийся последовательно приближается
к ответу, который является конечной целью данного этапа
обучения.
Согласно классификации, основанной на принципе
продвижения учащегося по программе (Никандров, 1970), различают три
4
основных типа программ: линейные, внутреннеуправляемые и
внешнеуправляемые.
Линейные программы. Деятельность учащегося сводится к
введению конструктивных (т. е. самостоятельно сформулированных)
ответов; частным случаем ответов является заполнение пропусков
в «кадрах» минимального размера. Неправильный ответ не влияет
на последовательность «кадров» и лишь служит поводом для
возвращения к вопросу ошибочно понятого раздела.
Линейные программы можно предъявлять учащимся как в виде
безмашинных программированных пособий, так и с помощью
машин разной степени сложности, но основанных на одном
принципе: подача учебной информации, ответ на контрольный вопрос
появляются после введения учащимся своего собственного ответа.
Внутреннеуправляемые программы. При работе каждый
последующий «шаг» учащегося определяется в зависимости от ответа на
конкретный вопрос предшествующего «кадра», причем
возможные пути продвижения (число разветвлений) предусмотрены
программой.
Во всех случаях после поступления информации предлагаются
контрольный вопрос и несколько готовых закодированных
ответов, из которых надо выбрать правильный (метод выборочных
ответов). При правильном ответе учащийся переходит к следующему
«кадру», а при неправильном отсылается на коррективную ветвь —
к серии «кадров» низшей программы, которые в
информационном отношении равноценны одному неусвоенному «кадру»
заданной программы.
Внешнеуправляемые программы. Особенность данных программ
заключается в наличии внешнего устройства (обычно ЭВМ), которое
принимает решение о каждом «шаге» обучаемого по многим
факторам, но, как минимум, в зависимости от всей предыстории ответов.
Наиболее простая форма программирования — это
использование элементов программирования только для контроля знаний
учащегося (включая самоконтроль), что также заметно повышает
качество учебного процесса и эффективность преподавания.
Систематический контроль за усвоением знаний способствует
повышению заинтересованности студентов на лекциях, активизации
их самостоятельной работы над учебником, а следовательно, и
повышению успеваемости.
Программированный контроль знаний можно осуществлять с
помощью контролирующих машин (приспособлений) или без
них — безмашинным способом. Как правило, машинный и
безмашинный методы контроля основаны на принципе линейного
программирования.
Безмашинный программированный контроль. Сущность
безмашинного программированного контроля при групповом обучении
5
заключается в подаче учащимся серии вопросов, на которые
они должны дать правильные ответы. Содержание вопросов к
предстоящему занятию должно быть известно студентам
заранее. Правильность ответов оценивают тотчас после окончания
работы.
Студент должен быть подготовлен к занятию, проработав
соответствующие разделы учебника, лекционного курса и
практикума.
Ответы на заданные вопросы могут быть в конструктивной
произвольно составленной форме {метод конструктивных
ответов) либо путем выбора одного ответа из серии предложенных
{метод выборочных ответов). Метод конструктивных ответов
требует самостоятельного творчества, а при методе выборочных
ответов деятельность учащегося в известной мере пассивна.
Безмашинный контроль с конструктивными ответами. Чтобы
обеспечить подготовку по всем вопросам, заданным к
предстоящему занятию, а также избежать подсказок во время работы,
необходимо дать студентам возможность случайного выбора билетов
с вопросами или (при ограниченном наборе вопросов) соблюдать
определенную систему распределения вариантов билетов по
закрепленным за студентами рабочим местам.
При работе с подгруппой студентов (12...16 рабочих мест)
минимальными являются 4 варианта билетов по 5 вопросов в каждом
(всего 20 вопросов к занятию).
Безмашинный контроль с выборочными ответами. При этой
форме контроля студент получает билет (опросную карту) с
4...5 вопросами. На каждый из вопросов дается 4...5 ответов, один
из которых верен. Возможен вариант с отсутствием правильного
ответа.
Некоторые вопросы задаются в виде схем, рисунков, кривых и
т. д. Задача учащегося состоит в выборе правильного ответа или
указании на отсутствие правильного решения.
Используя метод выборочных ответов, можно осуществлять и
групповой безмашинный контроль знаний. Это рекомендуется
делать на завершающих занятиях по определенному этапу курса.
В этом случае всей группе студентов выдаются бланки с одними и
теми же вопросами (10... 17). Варианты различаются
расположением правильных ответов в некоторых (или во всех) вопросах,
последовательностью и нумерацией вопросов или (что проще)
нумерацией ответов. Правильные ответы на вопросы при этом
обозначены цифрами в соответствии с составленным кодом,
который меняется.
Машинный метод контроля. С помощью контролирующих
машин (устройств), работающих в режиме «экзаменатор» или
«самоконтроль», осуществляется проверка знаний, приобретенных уча-
6
щимся обычным ^программированным путем. Информации для
усвоения данные машины в своей конструкции не содержат.
Простейшие устройства подобного типа (первый вариант) позволяют
формировать самостоятельные конструктивные ответы на
заложенные ранее вопросы и сравнивать их с правильными. Оценки
эти устройства не выдают.
Второй вариант устройства позволяет путем включения
соответствующих тумблеров на панели выбрать из числа
предложенных ответов на заданные вопросы предполагаемый правильный
ответ. Вопросы при этом задаются обычным путем, как и при
безмашинном программированном контроле с выборочными
ответами. Этот вариант устройства является наиболее простым и
удобным для осуществления регулярного кратковременного контроля
за подготовкой студентов к текущим занятиям.
Третий вариант машин позволяет автоматически и
последовательно предоставлять учащемуся предварительно заложенные в
них билеты с вопросами и выборочными ответами. Ответ
учащегося вводится в машину нажатием кнопки или клавиши,
включением тумблеров и т. п. Машина оценивает правильность ответов и
выводит итоговую оценку.
В режиме «самоконтроль» машина может быть использована
для контроля при самообучении, а при введении дополнительных
материалов — как «репетитор».
Разработаны и более сложные машины, в которые возможен
ввод специально построенных конструктивных ответов с их
последующей автоматической оценкой.
Для обучения и проверки знаний учащихся по специально
запрограммированным материалам разработаны автоматизированные
классы программированного обучения группового использования.
Основанные на одном принципе (система выборочных
ответов), эти классы отличаются деталями конструкции, числом и
устройством индивидуальных пультов, количеством задаваемых
вопросов и ответов, способом ввода материала в машину («прямой»
или с помощью перфокарт), способом сигнализации
правильности ответов, наличием или отсутствием печатающего устройства
и т. д.
К системам такого типа предъявляются следующие общие
требования: 1) большая «кодовая память» и возможность быстрой
смены кодов; 2) быстрота оценки действий учащегося; 3)
возможность автоматического регулирования выдержки времени в
зависимости от сложности вопроса; 4) простота управления,
надежность и безопасность.
При выполнении этих требований система обеспечивает: 1)
активный контроль за усвоением материала для
программированного обучения; 2) самоконтроль учащихся при подготовке к заня-
7
тию, коллоквиуму, зачету; 3) проведение кратковременного
текущего контроля за подготовкой к занятию; 4) проведение зачета
или экзамена.
Конструкция классов (с «прямым» вводом материала)
позволяет преподавателю задавать устные вопросы и анализировать с
группой сложные по содержанию ответы, а также проводить
разбор наиболее важных письменных ответов, составленных на
итоговых занятиях по принципу свободного конструирования.
1.2. МЕТОДИЧЕСКИЕ ПРИЕМЫ
В учебном процессе широко применяются экранные и
звуковые п о с о б и я — кинофильмы, радио и телевидение.
Систематическое и планомерное использование этих средств
способствует усвоению материала студентами, улучшает качество
обучения, облегчает труд педагога и повышает его
производительность. Они позволяют облегчить восприятие студентами сложных
физиологических процессов, происходящих в организме,
особенно на клеточном и молекулярном уровнях.
При всем этом очевидна целесообразность первоочередного
использования в учебном процессе доски, мела, настенных таблиц
и рисунков, а также лабораторных экспериментов.
Накопленный опыт указывает на нецелесообразность создания
на кафедрах специальных кабинетов технических средств
обучения. Для применения экранных и звуковых пособий разумнее
приспособить те учебные лаборатории, где обычно проводятся
лабораторные занятия или читаются лекции. В этих аудиториях
должны быть предусмотрены быстрые способы затемнения,
оборудованы столики для проекционной аппаратуры, подвешены
свертывающиеся экраны, сделаны вводы радиотрансляционной сети и
телевизионной антенны.
Важную роль в учебном процессе играют статические
экранные пособия —диапозитивы, диафильмы, а также
непрозрачные репродукции, демонстрируемые с помощью
эпидиаскопов, кодоскопов и др., мультимедиапроекторы.
Новые усовершенствованные модели диапроекторов
существенно расширили возможность использования этого вида
экранных пособий, цветных и черно-белых диапозитивов
(слайдов). Большое применение нашли широкоформатные
диапозитивы, изготовленные на прозрачной пленке и проецируемые на
экран с помощью обычных эпидиаскопов или специальных
приборов — кодоскопов. В настоящее время выпускают большое
количество черно-белых и цветных учебных диафильмов,
позволяющих показать процесс в динамике.
8
Для проецирования на экран прозрачных и непрозрачных
объектов предназначены эпидиаскопы, для демонстрации
диапозитивов — диапроекторы, диафильмов — диапроекторы. Весьма
перспективны для использования в учебной работе, особенно в
лекционном курсе, кодоскопы. Они имеют световую оптику и
мощные проекционные лампы, позволяющие проецировать на
экран изображение с крупноразмерных пленочных диапозитивов.
Кодоскопы работают как в отраженном, так и в проходящем свете.
На экран могут проецироваться либо изображения с
широкоформатных диапозитивов, либо записи и рисунки преподавателя в
процессе объяснения учебного материала (метод «световой
доски»). Запись или зарисовки во время лекции производятся
обычным пером чернилами или тушью на целлофановой ленте.
Прибор можно использовать и для проецирования на экран обычных
диапозитивов.
Для демонстрации на просвечивающем экране специально
изготовленных транспарантов предназначены диапроекторы
автоматические с экраном, для демонстрации микропрепаратов —
микропроекторы.
Применяют мультимедиапроекторы, которые снабжены
устройствами, считывающими цифровые способы проекции
цифровых видеосигналов, проекторы, подключенные к компьютеру
(проводной или беспороводной связью), или без него. С помощью
мультимедиа обеспечивается комплексное электронное
представление информации, включающее несколько ее видов: текст,
изображение, анимацию, аудио- и видеофрагменты.
Для воспроизведения различных звуковых эффектов,
связанных с физиологическими процессами и функциями (тоны
сердца и др.), используются грамзапись и магнитная
запись.
В учебном процессе курса физиологии широко применяют
кинофильмы, видеофильмы, которые дают возможность
показать изучаемые процессы в динамике. Кроме того, они
обладают временным и пространственным масштабами, позволяют
вводить мультипликации, использовать документальные
материалы и др. Перечень рекомендуемых учебных кино- и видеофильмов
по физиологии животных приведен в учебной программе.
Значительны масштабы применения телевидения в
учебных целях. Для консервации и последующего воспроизводства
учебных телепередач широко используют видеомагнитофоны. Во
многих вузах созданы кафедральные библиотеки учебных теле- и
видеозаписей.
Средством повышения эффективности обучения является
использование в учебном процессе электрифицированных и
радиофицированных установок — стендов. Электрорадиофицирован-
9
ные модели-стенды имитируют некоторые физиологические
функции (кровообращение, мочеобразование, молокообразование и мо-
локовыделение). С их помощью можно изучать направление
движения крови и причины, его обусловливающие, происхождение
сердечных тонов, скорость кругооборота крови, а в сочетании с
электро- и векторкардиографией — процесс возникновения и
распространения возбуждения в сердечной мышце. Наглядны
электрифицированные модели взаимодействия возбуждения и
торможения в коре головного мозга, механизм образования условных
рефлексов, нервно-гуморальная регуляция функции пищеварительных
желез, механизмы дыхания, мочеиспускания, нервно-гуморальная
регуляция молокоотдачи и т. д.
2. ОСНОВНЫЕ ВИДЫ АКТИВНЫХ МЕТОДОВ
ОБУЧЕНИЯ И ЦЕЛЕВЫЕ УСТАНОВКИ
К ИХ ПРИМЕНЕНИЮ
Повышение качества подготовки будущего ветеринарного
врача, зооинженера, ветврача-биолога по физиологии требует
интенсификации и оптимизации учебного процесса.
Интенсификация и оптимизация учебного процесса связаны с
использованием активных методов обучения на основе обратной
связи с использованием ЭВМ как средства информационного и
технического обеспечения занятий. Активизация и
компьютеризация учебного процесса создают предпосылки для усиления
элемента самостоятельности во всех звеньях системы обучения.
Применение активных методов обучения обязательно для каждого занятия,
вопросы использования ЭВМ должны решаться, исходя из
реальных потребностей. Каждый активный метод обучения должен быть
направлен на достижение определенных целей.
Учение есть процесс познания, включающий подготовку к
познанию, познание и проверку знаний.
1. Подготовка к познанию. Она предусматривает актуализацию
прежних знаний, повторение пройденного, проверку готовности
к усвоению новых знаний, обеспечение эмоционального
настроя, интереса, показ актуальности темы, создание проблемной
ситуации.
2. Познание. Это процесс формирования новых понятий,
приемов, умений, навыков. Пути достижения этой цели — активные
методы обучения, включая приемы и способы проведения лекций
и лабораторных занятий:
полемические дискуссионные лекции развивающего характера,
предполагающие обратную связь, откровенный обмен мнениями
между лектором и аудиторией;
метод анализа конкретного процесса, функции, механизма
регуляции, заключающийся в изучении, анализе и оформлении
конкретного вывода по вопросу;
решение практических физиологических задач — упражняясь,
студент активно усваивает принципы, закономерности, навыки,
способы решения задач (проблем);
11
индивидуальный практикум — это решение задач,
направленное на обработку различных навыков, закрепление навыков,
умений;
метод «мозговой атаки» — способ коллективного
продуцирования новых идей для решения проблемы, не поддающейся
решению традиционными способами;
встречи студентов и преподавателей за «круглым столом» для
обсуждения проблем.
Учебный материал подразделяют на части, после изучения
каждой из которых необходимо получить обратную информацию
о степени усвоения студентом материала.
Познание связано с организацией работы студента по
добыванию знаний, самостоятельной работы — что делать, как делать, о
чем сделать вывод. Наиболее широко применяют такие методы
активизации познания, как анализ и решение задач, проблем,
деловые игры, студенческие олимпиады. Метод анализа, решение
задач, проблем учит логично излагать свои мысли,
аргументировать и отстаивать принятые решения.
Пример лабораторного занятия. Тема: Анализ механизма
возбуждения и регуляции секреторной деятельности желудочных
желез.
Перед студентом поставлена цель— изучить механизм
возбуждения и регуляции деятельности желудочных желез — и
предлагаются вопросы: выяснить, осуществляется секреторная
деятельность желудочных желез непрерывно или периодически
в связи с приемом корма и желудочным пищеварением;
определить характер секреторной реакции желудочных желез на
принятый пищевой раздражитель; выяснить механизм
возбуждения и регуляции секреторной деятельности желудочных
желез на принятый корм. Обсуждается все многообразие
вариантов решения вопросов.
Дается задание — сделать вывод о механизме возбуждения и
регуляции желудочных желез, нарисовать схему этого механизма.
Здесь важны процесс поиска, обсуждения всего многообразия
вариантов, принятие решения, выделение основных факторов,
необходимых для оформления выводов.
Можно использовать и такой путь активизации познавательного
процесса: преподаватель дает исходные данные и проводит
промежуточное и конечное подведение итогов, а студенты методом
самообучения выбирают решения, добывают факты, оформляют
выводы, защищают их. Главное назначение данного метода —
выработка у студентов практических навыков принятия решения,
оценки фактов, оформления заключения.
Деловые игры. Это наиболее обобщающий вид активных
методов обучения. Их целью являются развитие творческого мышле-
12
ния, формирование практических умений и навыков,
стимулирование, концентрация внимания и повышение интереса к знаниям,
создание условий для активизации учебного процесса.
Деловые игры проводят по разработанной методике.
Необходимую для игр информацию студенты получают при реализации
учебного плана репродуктивными и активными методами, а
недостающую часть информации — самостоятельно. Средствами
обеспечения деловых игр служат подготовленные заранее студентами
(участниками) графики, таблицы, номограммы, слайды,
диафильмы, кинофильмы, модели и др.
Формой деловой игры может быть ролевая игра, свободная
игра без предварительного распределения ролей и др. Арбитраж
состоит из различных по квалификации и уровню знаний
студентов и преподавателя.
Игра есть процесс смыслопорождения, вырабатывания своего
горизонта видения вопроса через соотнесение, перекрещивание
различных позиций. Строится не просто ситуация, а логика
действий и переживаний в ситуации. Логика игровой ситуации
должна быть драматичной, т. е. конфликтной.
Игра состоит из трех этапов.
I этап. Организация игры:
1. Выбор темы (любая тема по физиологии).
2. Выбор участников.
3. Выбор формы (преподаватель определяет, в какой форме
будет проводить занятие).
4. Выбор и организация игрового места.
5. Выбор и определение игровых задач (участники игры
должны четко уяснить задачи).
II этап. Проведение игры:
1. Завязка. «Провоцирование» студентов в форме постановки
проблемы, распределение студентов по игровым группам,
создание между ними конфликтной ситуации.
2. Кульминация. Осознание того, что преподаватель
спровоцировал ситуацию. Смена ролей. Студенты отстаивают свои
позиции.
3. Развязка. Преподаватель со студентами анализируют
результат занятия, делают выводы, фиксируют их в схемах, записях,
ставят новую проблему на следующее занятие.
III этап. Исследование игры. Устанавливают соответствие,
какие игровые задачи ставились и что на самом деле получилось.
Главное — уметь представлять себе общий «каркас» игры, ее
форму и логику, исходные принципы, научиться исследовать сам
процесс проигрывания ситуации.
Студенческая олимпиада. Участие в творческом соревновании,
как известно, воспитывает у студентов стремление расширить
13
свой кругозор, развивает у них навыки самостоятельной работы,
повышает интерес к углубленному изучению дисциплины, служит
«генеральной репетицией» перед экзаменами и эффективным
средством пропаганды званий «студент-отличник», «активист
СНО». Важно, чтобы олимпиада имела профессиональную
направленность.
Для достижения наибольшей эффективности олимпиады
используют тематические домашние задания, кинофильмы, ТСО,
ЭВМ и т. д. Современные информационные и обучающие
программы позволяют осуществлять новый подход к использованию
компьютеров в качестве технических средств обучения. Так,
диалоговые программы с режимом «доброжелательного собеседника»
являются действительно обучающими, т. е. позволяют получать
новую информацию, помогают ориентироваться в ней.
Обучающие программы. Студенту необходимо изучить
определенную тему. После набора на терминале названия темы на
дисплей будет выведен перечень вопросов, на которые нужно дать
ответы. При необходимости студент может запросить и получить
дополнительную информацию по данной теме. В таком диалоговом
режиме студенту предоставляется возможность задавать
компьютеру вопросы по любой интересующей его информации.
Достаточно свободный по форме вопрос основан на ранее заданной
совокупности ключевых слов, и это позволяет получить нужную
информацию для оформления ответов на вопросы, для
самостоятельного изучения темы.
Для введения в компьютер программы изучения темы не
требуется построения специальной математической модели, поскольку
блок-схема программы изучения темы описывает простой
информационный массив и совместима со структурой
поисково-библиографической программы (открытая программа, которую можно
расширить за счет введения новых ключевых слов-операторов
дополнительной информации и целевых программ, разработана
Международным центром научной и технической информации в
1979 г.).
3. Проверка знаний. Проверку знаний (усвоения материала)
студента можно осуществлять путем опроса-собеседования,
устных ответов на вопросы билета. Широко практикуют
безмашинный программированный контроль и с использованием
контролирующих машин. По каждой теме оформляют программу для
контроля, содержащую отправные сведения, вопросы и ответы. При
безмашинном программированном контроле студентам выдают
отправные сведения по теме, необходимые для правильного
представления материала, и ставят вопросы для ответа. Ответы
студента на заданные вопросы можно давать в произвольно
составленной форме.
14
Вопросы по теме и ответы на них должны быть оформлены так,
чтобы в определенной логической последовательности было
раскрыто существо темы. Все варианты ответов на вопросы должны
быть правильными, но один из них полным, другие — неполными
или полными, но не родственные вопросы.
Для программированного контроля знаний с конструктивными
ответами студент заводит отдельную тетрадь, где записывает тему,
номер билета, вопросы и письменные ответы на каждый из них.
Тетрадь сдает преподавателю, получает лист с правильными
ответами на все вопросы, проверяет свои ответы.
При контроле с выборочными ответами студент получает билет
с 5 вопросами. На каждый из вопросов дают 3...5 ответов, один из
которых полный. Вместе с вопросниками студент получает
контрольную карту с номерами вопросов и ответов. На ней нужно
зачеркнуть номера тех ответов, которые он считает правильными.
Преподаватель проверяет правильность ответов с помощью
трафарета. Отверстия трафарета соответствуют расположению
правильных ответов в данном варианте программы.
При программированном контроле с использованием
контролирующих машин, работающих в режиме «экзаменатор» или
«самоконтроль», студенту выдают вопросы, как и при безмашинном
программированном контроле, с выборочными ответами. Номера
правильных ответов кодируются. Ответ студента вводится в
машину нажатием клавиши. Машина оценивает правильность ответов и
выводит итоговую оценку.
Примеры вопросов и ответов из программы
I. У животных, имеющих нервную систему, развился особый тип ответных
реакций на раздражение — рефлекторный.
Вопрос. Какие ответные реакции называют рефлексом?
Ответы.
1. Реакция целостного организма на раздражение.
2. Реакция организма на раздражение, происходящая при обязательном
участии нервной системы.
3. Ответная реакция организма или органа на раздражение рецепторов,
осуществляемая при обязательном участии центральной нервной системы.
И. Простые рефлексы и различные акты поведения животных осуществляются
благодаря информации, доставляемой с рецепторов.
Вопрос. Что называют рецепторами?
Ответы.
1. Воспринимающие раздражения нервные окончания или
специализированные клетки, реагирующие на определенные изменения в окружающей
среде.
2. Совокупность нейронов, участвующих в восприятии раздражений и
проведении возбуждений, а также сенсорные клетки коры больших
полушарий мозга.
3. Объединение структур и процессов, обеспечивающее
приспособительный эффект.
15
III. Необходимым условием нормальной мышечной деятельности является
поступление информации в ЦНС о состоянии мышц и суставов. Эта информация
поступает в центральную нервную систему от мышечно-суставных рецепторов
(проприорецепторов).
Вопрос. Какие образования относят к проприорецепторам?
Ответы.
1. Мышечные веретена.
2. Тельца Гольджи и Пачиниевы тельца.
3. Мышечные веретена, тельца Гольджи и Пачиниевы тельца.
IV. Орган зрительной рецепции — глаз — включает в себя рецепторный
аппарат и оптическую систему.
Вопрос. Какова роль оптической системы глаза?
Ответы.
1. Регулирует приток света в глаз.
2. Фокусирует световые лучи и обеспечивает четкое изображение
предметов на сетчатке в уменьшенном и перевернутом виде.
3. Воспринимает зрительные раздражители.
3. ПОДОПЫТНЫЕ ЖИВОТНЫЕ
о
Для экспериментальной работы студентов на лабораторных
занятиях используют разные виды лабораторных — собаки,
кролики, кошки, морские свинки, мыши, лягушки — и
сельскохозяйственных животных (интактных или предварительно
оперированных) — лошади, крупный рогатый скот, свиньи, овцы, птицы.
Целесообразно наличие физиологического скотного двора,
некоторого количества прооперированных животных специально для
учебных целей, учебного манежа.
Лабораторных и мелких сельскохозяйственных животных
содержат и разводят в специально оборудованных помещениях —
вивариях.
Фиксация животных. При проведении физиологических
экспериментов часто необходимо фиксировать сельскохозяйственных и
лабораторных животных (рис. 1). Для экспериментов желательно
использовать спокойных животных.
Лошадей при исследовании держат в поводу или
привязывают к столбу (коновязи). При исследовании задних участков
туловища поднимают переднюю конечность, сгибая ее в
запястном суставе, или одевают на конечности так называемую
«случную шлею».
При некоторых исследованиях, а также операциях,
проводимых в стоячем положении, лошадей помещают в стационарные
или разные фиксирующие станки. При манипуляциях, связанных
с болевыми воздействиями, часто пользуются как надежным
отвлекающим средством накладыванием на верхнюю губу
животного веревочной или металлической закрутки. Для той же цели
можно использовать носовой зажим системы Кумсиева. При сложных
хирургических вмешательствах лошадей (и других крупных
животных) после общей анестезии фиксируют на специальных
операционных столах.
Крупный рогатый скот исследуют в стойлах или
привязывают за рога к столбу. Удобными для проведения занятой
являются стационарный станок из срарных труб и разбррный фикса-
! >vV: iV-4V>:.-:. ' 17
ционный станок Виноградова (см. рис. 1). При необходимости
прибегают к помощи отвлекающих средств — сдавливанию носо-
губного зеркальца пальцами, носовым зажимом Кумсиева или
носовыми щипцами.
При проведении хирургических операций и опытов животное
фиксируют в стоячем положении, прижимая к стене манежа же-
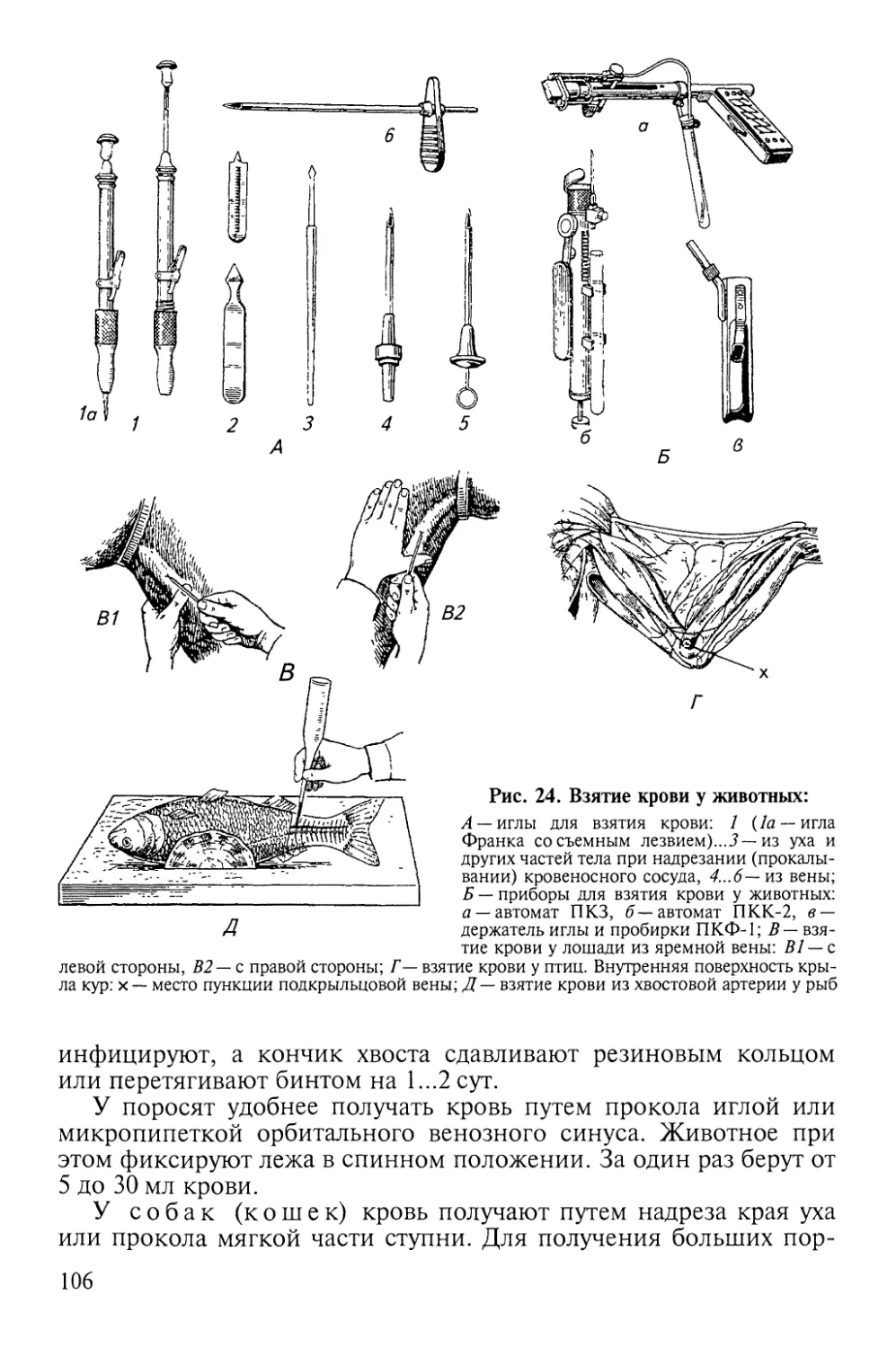
Рис 1. Методы фиксации:
Л — крупного рогатого скота: 1, а, б, в — с помощью петли (телят), 2-е помощью пальцев,
3— с помощью носовых щипцов, 4— с помощью зажима, 5— в станке; Б — собак: 6— в
станке, 7— с помощью намордника; В — лошадей: 8— наложением закрутки, 9— поднятием
передней конечности, 10 — наложением на конечности «случной шлеи»; Г— свиней наложением
закрутки; Д— кролика на столике; Е— птиц в станке
18
лезной трубой, специально смонтированной на подвижной муфте.
При сложных полостных операциях крупный рогатый скот
фиксируют на операционных столах.
Для проведения опытов на овцах и козах используют
станки, предназначенные для фиксации собак.
Свиней (особенно поросят) фиксируют на время опытов в
станках, предназначенных для фиксации собак. При бесстаночной
фиксации свиней в стоячем положении используют веревку, закрутку с
длинной ручкой или разные конструкции щипцов (см. рис. 1). При
операциях и острых опытах свиней фиксируют на операционных столах
для мелких сельскохозяйственных животных или в деревянных
станках, сделанных в виде корытец и козел.
Собак фиксируют в станках лямками из тесьмы, продетыми
сквозь резиновые трубки. К станку приучают постепенно. Во
избежание укусов собакам надевают намордники или завязывают
челюсти бинтом. При проведении операций и острых опытов
используют специальные операционные столы или столы для
мелких животных. Голову фиксируют головодержателем.
Кошкам при фиксации без анестезии на конечности
надевают петли из фланелевого бинта; один студент захватывает руками
кожную складку на шее и передние конечности, а другой —
задние. Кошку переворачивают спиной вниз и привязывают к
столику. Голову фиксируют головодержателем.
Кролика и морскую свинку при острых опытах и
операциях фиксируют в спинном или брюшном положении на
деревянных операционных столиках (см. рис. 1). Морских свинок
фиксируют на металлических столиках для препарирования
мелких животных.
Крыс и мышей захватывают пинцетом или корнцангом.
Для острых опытов и операций применяют специальные
операционные столики.
Птиц удерживают двумя руками, захватывают за крылья и
конечности или завертывают в полотенце. При острых опытах и
операциях птиц фиксируют бинтом на операционных столиках,
предназначенных для кроликов, или на специальном столике в
виде корытца, используя особые модели станков в зависимости от
цели опыта.
Лягушек в экспериментах анестезируют и фиксируют на
пробковых пластинках или пропитанных воском поролоновых
пластинках на твердой подложке, или на деревянных дощечках. К
дощечкам приклеивают куски больших плоских пробок или
просверливают отверстия в местах фиксации и вставляют в них куски
пробки, покрытые расплавленным парафином.
В демонстрационных опытах лягушек фиксируют на
специальных операционных столиках.
19
Рыб фиксируют в спинном или брюшном положении с
помощью специального станка: в деревянную подставку вбивают две
пары пружинящих металлических полос, которые охватывают
туловище. Движению вперед препятствует кольцо или стеклянная
воронка. При проведении опыта на воздухе в рот рыбе заводят
трубку, подающую аэрированную воду.
Обездвиживание, обезболивание. Для успокоения и
анестезии животных применяют миорелаксанты (вещества,
вызывающие расслабление скелетных мышц) и нейроплегики
(вещества, обладающие транквилизирующим, или
успокаивающим, действием). Они не обладают ни анестезирующими, ни
наркотическими свойствами и сами по себе не обеспечивают
полного обезболивания, т. е. наркоза, и не снимают полностью
болевых ощущений. Эти препараты применяют для успокоения
животных.
Для общего обезболивания (ингаляционного и
неингаляционного, внутривенного, внутримышечного, орального,
подкожного и внутрибрюшинного) используют средства для
анестезии. Средствами для ингаляционной анестезии являются эфир,
фторотан и другие, которые применяют самостоятельно или в
смеси, а также галотан, циклопропан, закись азота. Для
неингаляционной анестезии употребляют хлоралгидрат, тиопентал-натрий,
гексенал и др. Растворы этих веществ готовят асептически на
физиологическом растворе. Довольно широкое применение имеет
также этиловый алкоголь (этанол).
Чаще на животных используют комбинированный и
потенцированный виды анестезии. При комбинированной анестезии два
или три средства вводят в организм последовательно, но разными
путями. При потенцированной анестезии в процессе ее подготовки
или во время анестезии проводят премедикацию, т. е.
фармакологическую обработку животных нейроплегиками, миорелаксантами
или анальгетиками.
Анестезия лошадей. Перед анестезией лошадь выдерживают на
голодной диете 12 ч. Премедикацию проводят ацепромазином.
Обычно применяют чистую или потенцированную хлоралгид-
ратную анестезию. Хлоралгидрат можно вводить внутривенно,
орально, через прямую кишку. За 20 мин до анестезии
внутримышечно вводят 5 мл 1%-ного раствора атропина. Для внутривенной
анестезии применяют 10%-ный раствор хлоралгидрата с
добавлением глюкозы (10... 15 г глюкозы на 100 мл раствора). С целью
исключения побочных токсических явлений с помощью
хлоралгидрата вызывают лишь состояние неполной (поверхностной)
анестезии. Доза хлоралгидрата составляет 8... 12 г (0,1 г чистого
хлоралгидрата на 1 кг массы тела животного); длительность анестезии
30...60 мин. Хлоралгидрат готовят ex tempore без стерилизации.
20
При операциях на животном в стоячем положении
внутривенно вводят рампун из расчета 3...5 мл на 100 кг массы тела, с
повалом — 4 мл рампуна и 8 г хлоралгидрата на 100 кг массы тела или
5 мл рампуна и 6...8 мг/кг тиопентал-натрия.
Для внутренней анестезии вводят 4...5%-ный раствор
хлоралгидрата в слизистом отваре через носопищеводныи зонд или в
прямую кишку (0,1 г чистого хлоралгидрата на 1 кг массы тела
животного).
Анестезия крупного рогатого скота. Животное за 12 ч до
анестезии выдерживают на голодной и безводной диете. Премедикация:
за 10 мин до анестезии животному вводят под кожу 5... 10 мл 1 %-ного
раствора атропина, вслед за этим внутривенно или
внутримышечно 2,5%-ный раствор аминазина (2 мл на 100 кг массы тела).
Внутривенная тиопентал-натриевая анестезия: после премеди-
кации внутривенно медленно вводят 5%-ный раствор тиопентал-
натрия из расчета 15 мг на 1 кг массы тела животного. Анестезия
наступает через несколько минут.
Этиловый алкоголь (33%-ный) вводят внутривенно медленно в
изотоническом растворе NaCl с добавлением 5 % глюкозы из
расчета 120... 140 мл на 100 кг массы тела животного.
Для оральной анестезии заливают в ротовую полость из
резиновой бутылки или вводят непосредственно в желудок с помощью
носопищеводного зонда водку в количестве 250...300 мл на 100 кг
массы тела животного.
Анестезия овец и коз. Неполную («оглушающую») анестезию у
овец и коз вызывают введением алкоголя. Чистая алкогольная
анестезия: 33%-ный этиловый алкоголь с добавлением 5%-ной
глюкозы вводят внутривенно в дозе 7... 10 мл на 1 кг массы тела.
Потенцированная пентотал(тиопентал)-натриевая анестезия:
после премедикации атропином и аминазином внутривенно
вводят 5%-ный раствор тиопентал-натрия в 5%-ной глюкозе из
расчета 15 мг на 1 кг массы тела в подкожную вену. Анестезия длится
20 мин. Для продления вводят еще третью часть дозы.
Анестезия свиней. Премедикация: за 15 мин до анестезии для
успокоения животного вводят внутримышечно азаперон (1 мл на
10 кг массы тела).
Внутривенная пентотал(тиопентал)-натриевая анестезия:
используют 5%-ный раствор из расчета 15 мг на 1 кг массы тела
животного. Сначала вводят половину дозы, а после успокоения
животного медленно — оставшуюся часть. Продолжительность
анестезии около 20 мин. Для продления анестезии дополнительно
вводят еще третью часть дозы.
Анестезия птиц. При несложных операциях и манипуляциях,
связанных с небольшой травмой, птицам задают легкий эфирный
наркоз с помощью маски. При полостных операциях или острых
21
опытах применяют смесь из хлоралгидрата (10 мл) и воды
дистиллированной (100 мл); доза—1,0...1,5 мл раствора на 1кг массы
тела в грудную мышцу.
У кур поддерживающую анестезию осуществляют
внутримышечной инъекцией фенобарбитала натрия (50 мг/кг) с добавкой
при необходимости с помощью маски диэтилового эфира.
Анестезия собак и кошек. Собаке за 15...20 мин до анестезии
подкожно или внутримышечно вводят 0,5...5 мл 0,1%-ного
раствора атропина, а затем 2,5%-ный раствор аминазина (1,5 мл на 10 кг
массы тела) или рампун (0,5... 1 мл).
Вводная анестезия: внутривенно вводят 5%-ный раствор тио-
пентал-натрия (20 мг/кг); сначала вводят половину дозы.
Основная анестезия: эфирная (1...2 капли в 1 с на маску).
Кошке внутримышечно или подкожно вводят аминазин в дозе
0,5 мг/кг (0,2 мл 2,5%-ного раствора) и атропин (0,5...1 мл 0,1%-ного
раствора). Вместо аминазина можно вводить рампун (0,15 мл/кг).
Затем задают эфирную анестезию.
Пентотал(тиопентал)-натриевая анестезия: после премедика-
ции внутрибрюшинно сбоку от белой линии вводят 50...60 мл
10%-ного раствора пентотал(тиопентал)-натрия.
Анестезия кроликов. Легкая анестезия кроликов наступает при
ингаляции малых доз эфира. Хлоралгидрат применяют в виде
10%-ного раствора внутривенно (0,4...0,5 г на 1 кг массы тела)
или ректально (0,7 мг/кг в слизистом отваре). Длительность
анестезии — несколько часов. Кратковременную анестезию у
кроликов вызывают внутривенным введением 5...10%-ного
раствора гексенала (40...50 мг/кг), тиопентал-натрия (30...35 мг/кг).
Растворы указанных веществ готовят ex tempore и вводят в вену
медленно (1 мл/мин).
Анестезия морских свинок. Легкая анестезия наступает при
ингаляции эфира. Для глубокой анестезии используют смеси,
предназначенные для кроликов, в тех же дозах.
Анестезия крыс и мышей. Чтобы вызвать легкую анестезию,
животное помещают в банку, куда кладут вату, смоченную фторота-
ном. Последующая анестезия после фиксации поддерживается
ингаляцией эфира. Глубокую кратковременную анестезию можно
вызвать введением гексенала (70 мг/кг массы тела в виде 0,25%-ного
раствора внутрибрюшинно).
Анестезия лягушек. Используют эфир или алкоголь. В первом
случае лягушек помещают под колпак (воронку), где находится
вата, смоченная эфиром. Во втором случае лягушек помещают в
смесь абсолютного спирта и воды (1 : 9). Анестезия наступает
через 8... 10 мин и длится до 45 мин.
Обезболивающие средства. Алкан. Собакам массой 5...15 кг —
1 сахарный кубик в день, 15...30 кг — 1,5 сахарного кубика, 30 кг и
22
больше — 2,0 сахарных кубика в день; кошкам — 0,5 сахарного
кубика в день.
Ветбутал (жидкость). Применяют внутривенно или внутри-
брюшинно для анестезии (контролировать дыхание, пульс,
проявление рефлексов). Доза для полной анестезии на 1 кг массы тела
животного: крупный рогатый скот —0,08...0,25 мл (5...15 мг
активного вещества); телята —4...5мг; овцы и козы—10...20мг
(0,17...0,33 мл ветбутала); свиньи — 8...15 мг (0,13...0,33 мл ветбута-
ла); собаки — 15...30 мг (0,5 мл ветбутала); кошки — 15...25 мг;
кролики — 25...35 мг.
Ветранквил (гранулят). Оказывает успокаивающее действие на
центральную нервную систему, снижает нервное и мышечное
напряжение, используют при юпщическом исследовании. Действие
развивается в течение 1...2ч, продолжается 8...10 ч. Доза: лошади,
крупный рогатый скот—1...5 мерных ложек на животное;
свиньи — 2 мерные ложки; собаки, кошки — 0,5 мерной ложки на
10 кг массы тела.
Ветранквил (жидкость). Используют при клиническом осмотре
животного. Доза: лошади, крупный рогатый скот, свиньи —
внутривенно 0,5...1,0 мл и внутримышечно 1...2мл на 100 кг массы
тела; мелкие жвачные, собаки — внутривенно 0,5 мл и
внутримышечно 0,5... 1,0 мл на 10 кг массы; кошки — внутримышечно 0,1 мл
на 1 кг массы тела.
Имальжен 1000 (раствор кетамина). Прозрачный раствор, в
1 мл содержится 100 мг кетамина; выпускают в 10%-ном
разведении. Блокирует нервные импульсы на уровне коры больших
полушарий. Вводят внутримышечно или внутривенно. Эффект
наступает через 6...10 мин продолжительностью 10...30 мин. Доза:
кошки — внутривенно 5...8 мг и внутримышечно 10...20 мг на 1 кг
массы тела; собаки — внутривенно 5...8 мг, внутримышечно 10...20 мг
на 1 кг массы; кролики — внутривенно 15...20 мг и
внутримышечно 20...25 мг на 1 кг массы; лошади — внутривенно 1...2,5 мг,
внутримышечно 8... 12 мг на 1 кг массы; крупный рогатый скот —
внутривенно 5 мг, внутримышечно 15 мг на 1 кг массы; овцы —
внутривенно 2...5 мг и внутримышечно 10...20 мг на 1 кг массы;
свиньи — внутривенно 5 мг и внутримышечно 20 мг на 1 кг массы
тела.
Калипсовет. В 1 мл содержится 50 мг кетамина; используют
при кратковременных операциях. Доза: крупный рогатый скот —
внутривенно 2...5 мг и внутримышечно 11 мг на 1 кг массы тела;
лошади — внутривенно 2,2 мг на 1 кг массы; свиньи — 10... 11 мг/кг;
овцы — 2,2 мг/кг; собаки, кошки — 20...30 мг на 1 кг массы;
птицы — 25 мг на 1 кг массы тела внутримышечно.
Кастран (раствор ацепромазина малеата, 15 мг в 1 мл). Вводят
внутривенно и внутримышечно. Действие наступает через 20 мин,
23
продолжается 6...12 ч. Доза: лошади, крупный рогатый скот,
свиньи—для успокоения 0,5 мл на 100 кг массы тела, внутривенно
1 мл; собаки, кошки — 0,25 мл на 100 кг массы, для сильного
успокоения 0,5 мл на 100 кг массы тела.
Кетамин (водный раствор). Используют (инъекции) для
обезболивания (в 1 мл — 115,14 мг). Доза: собаки — 11... 12 мг/кг массы
тела; кошки — 10...20 мг/кг массы тела.
Комбелен. Используют для успокоения перед общей анестезией.
Действие наступает через 5...15 мин после внутривенного
введения и через 15...40 мин после внутримышечного. Доза: лошади —
внутривенно и внутримышечно 0,5...1,0 мл на 100 кг массы тела;
крупный рогатый скот — внутривенно и внутримышечно 1...2мл
на 100 кг массы, подкожно 2...5 мл на 100 кг массы; свиньи —
внутривенно 0,2...0,3 мл, внутримышечно 0,3...0,5, подкожно 0,5...2,0 мл
на 10 кг массы; овцы — внутримышечно 1 мл и подкожно 1 мл на
10 кг массы; собаки — внутривенно 0,3 мл на 1 кг массы,
внутримышечно 0,05 мл на 1 кг массы; кошки — внутримышечно 0,2 мл на
1 кг массы тела.
Ксила. Применяют для седативного эффекта и при мелких
операциях. Доза: крупный рогатый скот — 0,25... 1 мл на 100 кг массы
тела, при мелких операциях 0,5 мл на 100 кг массы; лошади —
внутривенно 1...4мл на 100 кг массы и внутримышечно 10 мл на
100 кг массы; овцы — внутримышечно 0,15 мл на 10 кг массы;
собаки—внутривенно и внутримышечно 0,15 мл/кг, с кетамином
0,1 мл и 6... 10 мг кетамина на 1 кг массы; кошки —
внутримышечно и подкожно 0,15 мл на 1 кг массы тела.
Ксила «Интерхеми». Раствор ксилазина гидрохлорида — 20 мг в
1 мл; используют для успокоения животного. Доза: крупный
рогатый скот — внутримышечно 0,25 мл на 100 кг массы тела, для
хирургических вмешательств 1 мл на 100 кг массы; лошади
—внутривенно 4 мл и внутримышечно 10 мл на 100 кг массы; овцы —
внутримышечно 0,15 мл на 10 кг массы; собаки — внутривенно и
внутримышечно 0,15 мл на 1 кг массы, в комбинации с кетамином
0,1 мл и 6... 10 мг кетамина на 1 кг массы; кошки —
внутримышечно 0,15 мл/кг, в комбинации с кетамином 0,1 мл и 6... 10 мг
кетамина на 1 кг массы тела.
Ксилавет. Ксилазин (ксилазина хлорид) и наполнитель (в 1 мл
20 мг ксилазина хлорида); используют для успокоения и
обезболивания. Доза: лошади — 2...5 мл на 100 кг массы тела при
внутривенном введении (0,4...1,0мг ксилазина на 1 кг массы);
крупный рогатый скот —0,25...1,5 мл на 100 кг массы; собаки —
внутримышечно 0,05...0,1 мл (1...2 мг ксилазина) на 1 кг массы
или 0,1 мл с 6... 10 мг кетамина на 1 кг массы; кошки —
внутримышечно 0,05...0,15 мл/кг (1...3 мг ксилазина на 1 кг массы) или
0,1 мл с 5... 15 мг кетамина на 1 кг массы тела.
24
Лидокаин (1%-ный и 2%-ный растворы). Используют для
местной анестезии.
Метаприн. Анальгетик спазмолитического действия;
используют для инъекций (внутривенно или внутримышечно). Доза:
лошади— 20...40 мл; овцы, козы —2...8; свиньи — 5...20; собаки —
1...5 мл.
Наркамон. Раствор содержит 50 мг кетамина гидрохлорида в
1 мл, вводят внутривенно или внутримышечно, лучше с ромета-
ром. Доза: собаки— 20...30 мг/кг, с рометаром 8...10мг/кг;
кошки — 20...30 мг/кг, с рометаром 15 мг/кг; телята и овцы — с
рометаром 10 мг/кг; лошади — внутривенно с рометаром 2,2 мг/кг.
Пирагин (50%-ный раствор новалгина). Используют для
инъекций (внутривенно или внутримышечно), обезболивания. Доза:
лошади, крупный рогатый скот —20...50мл, свиньи— 3...15,
собаки — 1...5 мл.
Плацивет (раствор ацепромазина). В 1 мл содержится 20 мг
ацепромазина. Используют для хирургического вмешательства и
как успокаивающее. Доза: крупный рогатый скот, лошади,
свиньи—внутривенно 0,5 мл и внутримышечно 0,5...1мл на 100 кг
массы тела; телята, овцы, козы — внутривенно 0,1 мл или
внутримышечно 0,15...0,25 мл на 10 кг массы; собаки, кошки — внутривенно
0,25 мл или внутримышечно 0,25...0,50 мл на 10 кг массы тела.
Рометар. Инъекционное успокаивающее средство с
болеутоляющим и миорелаксационным действием (20 мг в 1мл). Доза:
крупный рогатый скот — внутримышечно 0,25 мл или
внутривенно 0,08...0,12 мл на 100 кг массы тела для успокоения, при малых
хирургических вмешательствах внутримышечно 0,5 мл или
внутривенно 0,17...0,25 мл на 100 кг массы, при больших
хирургических вмешательствах 1 мл (внутримышечно) или 0,33...0,5 мл
(внутривенно) на 100 кг массы; лошади — внутривенно З...5мл или
внутримышечно 10... 15 мл на 100 кг массы; овцы, козы —
внутримышечно 0,15...0,25 мл на 1 кг массы; собаки, кошки —
внутримышечно 0,1...0,2 мл на 1 кг массы тела.
Рампун. В 1 мл раствора содержится 2 мг ксилазина и 1 мг метил-
4-гидроксибензоата: седативное, обезболивающее, анестезирующее
действие и мышечный релаксант. Доза: крупный рогатый скот —
внутримышечно 0,25...1 мл или внутривенно 0,08...0,5 мл на 100 кг
массы тела; лошади — внутривенно З...5мл на 100 кг массы;
собаки — 0,5...1,5 мл на 10 кг массы; кошки — 0,1 мл на 1 кг массы тела.
Седазин (2%-ный раствор ксилазина). Доза: крупный рогатый
скот — внутримышечно 0,25...1,5 мл на 100 кг массы тела;
лошади — внутривенно 3,5 мл или внутримышечно 7,5... 15 мл на 100 кг
массы; овцы — внутримышечно 0,15 мл на 10 кг массы; собаки —
внутримышечно 0,15 мл на 1 кг массы; кошки — 0,15 мл
(внутримышечно) на 1 кг массы тела.
25
Седак. В 1 мл содержится 20 мг ксилазина гидрохлорида. Доза:
крупный рогатый скот — внутримышечно 0,25... 1 мл на 100 кг
массы тела; лошади —4 мл (внутривенно) или 10 мл
(внутримышечно) на 100 кг массы; собаки — 0,15 мл (внутривенно) на 1 кг
массы; кошки — 0,15 мл (внутримышечно) на 1 кг массы тела.
Домитор (1%-ный раствор медетомиана). Оказывает седуктив-
ное и анестезирующее действие. Седакция: доза для собак —
Ю...18мкг/кг(0,1...0,8млна 10 кг массы тела); кошек — 50... 150 мкг/кг
(0,05...0,15 мл на 1кг массы тела). Анестезия: доза для собак —
внутримышечно 20...60 мкг/кг (0,2...0,6 мл на 10 кг массы тела) +
+ 4 мкг кетамина на 1 кг массы тела (0,8 мл на 10 кг массы);
кошек— 80... 100 мкг/кг (0,3...0,4 мл на 5 кг массы) + + 5...7,5 мкг
кетамина на 1 кг массы тела (0,4...0,75 мл на 5 кг массы тела),
внутримышечно или внутривенно.
Транквилин. Оказывает успокаивающее действие. Доза:
лошади — 1 мл на 100 кг массы тела; крупный рогатый скот — 1 мл на
50 кг массы; свиньи — 1 мл на 50 кг массы; собаки — 0,5 мл на
5...50 кг массы тела.
Убой экспериментальных животных. Животных, подвергнутых
острым опытам, а также фистульных животных по окончании
экспериментальной работы приходится убивать (усыплять).
Умерщвление собак, кошек и других лабораторных животных
проводят в состоянии анестезии и с применением дитилина из
расчета 1...1,25мгна 1 кг массы тела в форме 0,5... 1%-ного
раствора на дистиллированной воде.
4. ОСНОВНАЯ АППАРАТУРА,
МЕТОДЫ СТИМУЛЯЦИИ И РЕГИСТРАЦИИ
ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ
о
Наблюдение и эксперимент — основные приемы исследований
в физиологии. Они предусматривают использование простой и
сложной современной аппаратуры, приборов и устройств,
которые по назначению можно разделить на две основные группы:
1) для воздействия на объект, т. е. для раздражения органов,
тканей и клеточных образований; 2) для регистрации различных
проявлений жизнедеятельности, т. е. для регистрации
физиологических функций (или их отдельных процессов), эффектов,
вызванных раздражением.
4.1. ПРИБОРЫ, ПРЕДНАЗНАЧЕННЫЕ
ДЛЯ ВОЗДЕЙСТВИЯ НА ОБЪЕКТ
Раздражение органов и тканей может быть вызвано
воздействием любого вида энергии: механической, химической,
электрической, излучением и др.
Электрический ток— наиболее универсальный и
удобный раздражитель, при оптимальных напряжениях и силе он не
вызывает повреждающего эффекта, может быть применен
неоднократно, точно дозируется как по времени воздействия, так и по
интенсивности. Раздражающее действие тока проявляется уже при
очень малой силе тока, что приближает его к адекватным
раздражителям.
Наиболее совершенные исследовательские приборы для
раздражения тканей электрическим током (постоянным,
индукционным, импульсным)— электронные стимуляторы. Для
раздражения медленно реагирующих объектов (гладких мышц,
желез) и для изучения электротонических явлений в нерве в
качестве раздражителя используют постоянный ток. Постоянный ток
служит также источником питания для индукционной катушки.
Простой гальванический элемент, которым можно
вызвать раздражение, — гальванический пинцет, состоящий из двух
27
пластинок (обычно цинковой и медной), одним концом спаянных
между собой. Если таким гальваническим пинцетом дотронуться
до нервно-мышечного препарата, то между пластинками
возникает гальванический ток, вызывающий раздражение нерва и
сокращение мышцы.
Для питания электрических приборов и раздражения
возбудимых систем током с небольшим напряжением могут быть
использованы сухие гальванические элементы. Из этих элементов
составляют батареи нужного напряжения.
Однако чаще в качестве источника постоянного тока
применяют аккумуляторы. Аккумуляторы позволяют получать более
сильные разрядные токи, чем элементы, и при своевременной зарядке
могут служить продолжительное время. Для физиологических
экспериментов более предпочтительны не кислотные, а щелочные
аккумуляторы, так как они значительно легче кислотных, не
портятся при полной разрядке и перезарядке и, главное, не
чувствительны к короткому замыканию. Щелочной аккумулятор состоит
из сосуда с раствором гидроксида (едкого) калия, в который
опущены электроды; анодом служит гидроксид никеля, а катодом —
железо и кадмий.
Для выпрямления переменного тока применяют
разнообразные выпрямители. В сочетании с трансформаторами и реостатами
выпрямители дают возможность получать постоянный ток
нужного напряжения.
Для питания индукционных аппаратов постоянным током или
получения дозированного переменного тока удобно пользоваться
электрораспределительным щитом, сделав подводку тока к
лабораторным столам. Этот щит позволяет получать переменный ток
напряжением от 5 до 240 В и постоянный (пульсирующий) ток от 5
до 80 В при максимальной силе тока 8 А с изменением
напряжения от 5 В до максимума через 1,5...2 В.
Для изменения напряжения переменного тока обычно
применяют трансформаторы различной конструкции. Для плавного
изменения напряжения постоянного тока используют
реохорд-потенциометр с малым сопротивлением. Он состоит из линейки с
делениями, на которой натянута проволока длиной 1 м из кон-
стантана, никелина или нихрома. По проволоке скользит
контакт, позволяющий включать в цепь больший или меньший ее
отрезок.
Для превращения постоянного тока низкого напряжения в
импульсный ток высокого напряжения служит
индукционный аппарат (рис. 2). Действие прибора основано на
принципе электромагнитной индукции. Индукционный аппарат
состоит из двух катушек: неподвижной — первичной с небольшим
числом (до 250) витков толстой проволоки и подвижной — вто-
28
Рис 2. Индукционные аппараты:
А — общий вид индукционного аппарата*
1 — прерыватель; 2 — первичная катушка;
3— вторичная катушка; Б —
индукционный аппарат с вращающейся катушкой
ричной с большим числом
витков (5...10 000) тонкой
проволоки. Если через первичную
катушку пропустить постоянный
ток, например от аккумулятора,
то в момент замыкания и размыкания тока вокруг нее возникает
магнитное поле, вызывающее образование наведенного, или
индукционного, тока во вторичной катушке. В промежутке между
замыканием и размыканием, когда ток течет по первичной катушке,
не изменяясь по силе и направлению, индукционный ток во
вторичной катушке отсутствует. Для усиления магнитного поля первичной
катушки в нее вставлен сердечник (иногда подвижной) из пучка
мягкой железной проволоки.
Так как напряжение индукционного тока во вторичной
катушке зависит от количества магнитных силовых линий,
воздействующих на нее, то, приближая или удаляя вторичную
катушку от первичной, можно менять это напряжение в широких
пределах. Тот же эффект достигается перемещением
подвижного сердечника первичной катушки. Силу раздражения объекта
током индукционного аппарата выражают условно в
сантиметрах (см) расстояния вторичной катушки от первичной (для
данного аппарата при данной силе тока в первичной цепи).
Для ритмического раздражения тканей в первичную цепь
индукционного аппарата вводят автоматический прерыватель тока.
Индукционные аппараты обычно снабжены электромагнитным
прерывателем тока. Он состоит из электромагнита, подвижной
железной пластинки, контактного винта и металлической стойки
с пружиной. Прерыватель включается последовательно в
первичную цепь индукционного аппарата.
В момент прохождения постоянного тока через прерыватель
сердечник электромагнита намагничивается и притягивает
железную пластинку, тем самым размыкая контакт между пластинкой и
29
контактным винтом. Электромагнит размагничивается, а
пластинка под действием пружины возвращается в исходное положение и
снова замыкает контакт, после чего все повторяется вновь.
Увеличивая или уменьшая зазор между контактным винтом и
пластинкой, можно в известных пределах регулировать частоту
прерывания тока. Электромагнитные прерыватели варьируют
частоту индукционных ударов от 30 до 80 раз в 1 с. Для получения
более частых или более редких перерывов используют другие
прерыватели.
Для получения большого и строго определенного числа
прерываний электрического тока порядка 100, 200, 500 колебаний в 1 с
применяют электромагнитные камертоны. Камертон состоит из
ножек, электромагнита, поддерживающего их колебания, и
пружинящей проволочки, которая одним концом припаяна к ножке
камертона, а другим соприкасается во время колебаний с
контактным винтом. Камертон включается в цепь первичной обмотки
индукционного аппарата. При использовании камертона в качестве
отметчика времени к одной из его ножек прикрепляют перышко,
отмечающее интервалы времени.
В тех случаях, когда необходимо получить редкие перерывы
тока, используют метроном с ртутными контактами. Он состоит из
часового механизма, поддерживающего качание маятника,
который связан с коромыслом. Проволочки, находящиеся на концах
коромысла, опускаясь в чашечки с ртутью, равномерно замыкают
и размыкают ток.
Для замыкания и размыкания первичной цепи индукционного
аппарата в нее вводят ключ-рубильник. Во вторичную цепь
аппарата обязательно вводится ключ Дюбуа—Реймона или Гельмгольца для
создания короткой цепи сопротивления. Это необходимо для
отведения тока из цепи электродов при регулировании первичной
катушки и для предотвращения разрядки индукционных ударов
через обмотку при незамкнутых контактах вторичной спирали
(когда электроды не приложены к тканям).
Ключ Дюбуа—Реймона состоит из эбонитового или
пластмассового основания, на котором укреплены две металлические
пластинки. Каждая пластинка снабжена двумя зажимами для
проводников. Пластинки соединяются между собой подвижным
металлическим мостиком с рукояткой. К клеммам металлических
пластинок подходят 4 провода: 2 от вторичной обмотки катушки и 2 от
электродов. При поднятом мостике ток от вторичной катушки
идет к электродам. При опущенном мостике образуется короткое
замыкание: индукционный ток не доходит до электродов и
объекта, а благодаря ничтожно малому сопротивлению мостика
возвращается через него в катушку индукционного аппарата.
Ключ Гельмгольца используют для короткого замыкания
30
вторичной цепи; одновременно он позволяет графически
регистрировать на кимографе момент нанесения раздражения
на объект.
Для переключения тока с одной цепи на другую, а также для
перемены направления постоянного тока предназначены
коммутаторы. Коммутатор ртутный состоит из деревянной или
эбонитовой пластинки с шестью ртутными контактами и съемной
перекидной «качалки», разделенной изолятором на две половины.
Электрический ток от аккумулятора подводится к средним
контактам и с помощью «качалки» посылается в одну или другую
цепь. Если необходимо менять направление тока в одной и той же
цепи, контакты соединяют перекрестно проволочным мостиком.
Расположение полюсов и направление тока в цепи будет меняться
в зависимости от поворота «качалки» вправо или влево.
Коммутатор с металлическими контактами состоит из
пластинки эбонита или пластмассы, на которой укреплены 4 контакта для
двух цепей и 2 ползунка, связанные между собой. Ползунки с
помощью контактов соединяются с источником электрического тока
и передают его на одну из двух пар контактов, включая одну или
другую цепь. Парное соединение контактов (2—3 и 1—4) приводит
к изменению направления тока.
Для раздражения живых тканей наиболее удобными
современными приборами являются электронные стимуляторы (рис. 3).
Они заменяют аккумулятор, индукционный аппарат,
прерыватель, реохорд, ключ и другие приборы, используемые для
электрической стимуляции.
Электронный стимулятор дает возможность точно
регулировать силу импульсов (как по току, так и по напряжению), время
действия, скорость нарастания и спада, периодичность
импульсов.
Для раздражения мышц, нервов и других тканей током от
индукционного аппарата или импульсатора используют
стимулирующие электроды из двух медных (желательно посеребренных
или луженых) проволок толщиной 0,2...0,5 мм, лежащих в оправе из
эбонита, плексигласа или другого
изолирующего материала. Для
длительного раздражения тканей
предназначены электроды из
благородных металлов или нержавеющей
стали, никеля, нихрома, так как
они при импульсном или
переменном токе не реагируют с
электролитами тканей объекта и не выде-
ляют ионов, изменяющих его
состояние. Рис. 3. Электронный стимулятор
W
ЧАСТОТА ГЦ АМПЛИТУДА В
УЭС-1М 20 30 50
"" -200 з-
^300
>С0 1 6
0,(М|
б{??*зФЛЛЬ-ЛППЛРЛЛ
ВЫХОД
_1_ _А_
31
Для однократных раздражений отсепарированных нервов
холоднокровных и теплокровных животных используют переносные
электроды. Для раздражения объекта, находящегося в глубине ткани,
применяют так называемые погружные электроды. Они состоят из
эбонитовой пластинки, один конец которой загнут крючком; в
специальных углублениях эбонитовой пластинки помещены
металлические (обычно платиновые) электроды, заканчивающиеся
на загнутом конце. На другом конце пластинки находятся зажимы
для присоединения проводников от источника электрического
тока.
Металлические электроды можно применять для раздражения
тканей импульсным или переменным током. При использовании
же постоянного тока на границе металл — электролиты тканей
возникают поляризационные явления. Отрицательно
заряженные ионы тканевой среды концентрируются в месте приложения
анода, а положительно заряженные — в месте приложения
катода. На катоде при этом выделяется водород, газовая пленка
которого ослабляет раздражающий ток вплоть до его прекращения.
Выделение гидроксильных ионов на аноде вызывает, в свою
очередь, химические процессы, создающие дополнительную
разность потенциалов. Эта собственная электродвижущая сила
поляризации имеет направление, обратное раздражающему току,
и искажает результаты опыта. Поэтому во всех случаях
раздражения тканей постоянным током, а также при отведении
медленно изменяющихся или постоянных потенциалов организма
применяют так называемые неполяризующиеся электроды, в
которых продукты электролиза связываются и не мешают
прохождению тока.
4.2. ПРИБОРЫ ДЛЯ РЕГИСТРАЦИИ
ФИЗИОЛОГИЧЕСКИХ ФУНКЦИЙ
(РАЗЛИЧНЫХ ПРОЯВЛЕНИЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ
ОБЪЕКТА)
Для регистрации физиологических функций используют
разнообразную аппаратуру — от простых механических
приспособлений до сложных электронных приборов, обладающих высокой
точностью. В зависимости от принципа, лежащего в основе их
действия, все регистрирующие системы условно делят на три
группы: 1) система регистрации с помощью только механических
устройств; 2) система регистрации, основанная на преобразовании
механических процессов в электрические; 3) система регистрации
только с помощью электрических приборов (применяют при
отведении биопотенциалов сердца, мозга, желудка и др.).
32
1. Механическая система регистрации
Воспринимающие
устройства (баллоны,
манжеты, капсулы и др.)
Передающие приборы
(воздушная, водно-воздушная,
рычажковая системы)
Приборы для
регистрации: пишущие
приспособления,
кимографы, отмет-
чики времени
2. Система преобразования неэлектрических процессов в электрические
Объект
Датчик
(первичный
[преобразователь)
"4ZZ
Вторичный
преобразователь
Усилитель
Т
Регистрирующие приборы
общего
назначения
3. Система отведения и регистрации биопотенциалов
Электроды,
отводящие
биотоки
Усилитель
Регистратор
(гальванометр, осциллограф,
лентопротяжный
механизм)
Любая из этих систем включает приборы: ^воспринимающие
определенный физиологический эффект; 2) промежуточные,
трансформирующие или проводящие воспринятые импульсы;
^непосредственно осуществляющие регистрацию (графическая запись,
отклонение стрелки измерительного прибора и т. д.).
Для механической регистрации движений,
связанных с проявлением физиологических функций (дыхания,
сердечно-сосудистой деятельности, моторики пищеварительного тракта,
сокращения мышц и др.), используют следующие устройства: для
записи дыхательных движений пневмограф — это резиновая
манжета или гофрированная трубка; для записи сердечного толчка
кардиограф — металлическая, обтянутая резиной капсула, и
прибор для записи сокращений рубца руменограф — цилиндр с
поршнем или наполненный водой баллон; приборы для записи
сокращений мышц полых органов (желудка, кишечника, матки) —
тонкостенные резиновые баллончики и др.
Проводящая и записывающая часть всех этих приборов обычно
состоит из резиновой трубки и капсулы Марея с рычажком и пис-
чиком. В воздушно-водную систему передани дополнительно
монтируют водяной манометр; недостаток — инертность водной
массы, заполняющей манометр.
33
Рис. 4. Капсула Марея:
А — внешний вид; Б— схема капсулы Марея:
1 - капсула; 2 - резиновая мембрана; 3—
регистрирующий рычажок
Объективное и точное
отражение сократительных
движений обеспечивает воздушная
система передачи с
использованием так называемого гласс-баллона. Система состоит из двух
резиновых баллончиков и регистрирующей капсулы,
соединенных между собой с помощью толстостенных резиновых трубок,
двух тройников с зажимами и широкогорлой склянки
вместимостью 100...200 мл.
Капсула Марея (рис. 4) представляет собой круглую
металлическую чашечку диаметром З...6см и глубиной 0,5...0,8 см,
обтянутую сверху тонкой резиновой мембраной. Капсула крепится на
штативе с помощью муфты. На патрубок, отходящий от капсулы,
надевается каучуковая трубка, соединяющая капсулу через
манометр (гласс-баллон) с воспринимающей частью прибора. К
середине мембраны приклеена металлическая пластинка, на
которой располагается легкий рычажок с пишущим пером. Всякое
изменение давления в системе вызывает колебания мембраны, а
вместе с ней рычажка. На капсуле есть приспособление,
позволяющее передвигать рычажок в вертикальной плоскости.
Для чернильной записи наиболее подходящим является
металлический рычажок, на конце которого укрепляется специальный
чернильный писчик. Для записи на закопченной поверхности в
качестве рычажка лучше всего использовать соломину, в
расщепленный конец которой вставляется перо из плотной пергаментной
бумаги или кинопленки.
Вместо мембраны можно надевать на металлическую чашечку
меха цилиндрической формы, сделанные из очень тонкой резины.
Внутрь резинового цилиндра вставляют металлические кольца,
диаметр которых равен диаметру чашечки. Цилиндр закрывают
картонным диском.
В ряде физиологических экспериментов (регистрация
деятельности изолированных скелетных мышц, сердца, кишечника и др.)
используют непосредственную рычажную передачу движения.
Работающий орган соединяется при этом с помощью нити
непосредственно с одним плечом рычажка и при сокращении
поднимает рычаг, а при расслаблении опускает его. Рычажки,
укрепленные на штативе вместе с держателем и предназначенные
34
для регистрации изолированных или отпрепарированных мышц,
носят название миографов.
Для кимографической записи чаще используют чернильные
писчики (рис. 5). В качестве резервуара для чернил служит
стеклянный цилиндр вместимостью 10 или 20 мл. Резервуар
укрепляют в зажимах универсального штатива. Подачу чернил регулируют
высотой расположения резервуара и уровнем находящихся в нем
чернил. Чернила из резервуара подаются по тонким резиновым
или хлорвиниловым трубочкам к писчикам. Писчики изготовляют
из инъекционных игл, концы которых загибают под углом
100...110° и шлифуют. Писчики напаивают на концы
металлических рычажков мареевской капсулы. Для записи используют
специальные чернила.
При кратковременных опытах эффективнее стеклянные
чернильные писчики. Стеклянный писчик представляет собой
тонкостенную трубочку (внутренний диаметр Змм, длина 4...5 см),
конец которой оттянут под углом, изогнут и оплавлен, писчик
укрепляют с помощью резиновой трубочки на конце рычажка
миографа или электроотметчика. Заполняют писчик чернилами
с помощью обычного пера (через «носик»), глазной пипетки или
резинового баллончика с трубкой.
Запись быстрых или слабых движений проводят на
закопченной движущейся поверхности цилиндра — кимографе с помощью
упругих перьев, присоединенных к рычажкам. Кимограф с
часовым механизмом (рис. 6) состоит из вращающегося цилиндра,
надетого на ось, снабженную металлическим диском, и штатива с
укрепленным на нем часовым механизмом. Движение цилиндра
происходит вследствие трения муфты, насаженной на основную
Рис. 5. Писчики:
Л — графическая запись с помощью чернильных писчиков; Б— образцы чернильных писчи-
ков
35
ось, о поверхность диска. Запись производится на бумажной
ленте. Пуск и остановку часового механизма осуществляют с
помощью особого рычажка. Изменение скорости движения
кимографа достигается перемещением муфты по оси: скорость
возрастает при передвижении к центру диска. Для увеличения
сопротивления движения служит регулятор вращения в виде
насадки — флюгера. При снятии насадки или уменьшении ее
площади скорость вращения кимографа возрастает. С помощью
верхнего и нижнего винтов, фиксирующих ось цилиндра, последний
можно отсоединить от часового механизма и передвигать рукой.
Кимограф может быть использован для записи как в
вертикальном, так и в горизонтальном положении.
В последнее время широко используют электрические
кимографы (см. рис. 6). В комплект прибора входят: собственно
кимограф, универсальный штатив, укрепленный на стойке, и штатив-
удлинитель с барабаном. Ведущий барабан приводится в движение
механизмом, состоящим из синхронного электродвигателя (127 и
220 В), редуктора и двойной фрикционной передачи.
Ленты для кимографа обычно вырезают из плотной белой
глянцевой бумаги в виде полос, ширина которых равна высоте
барабана, а длина несколько больше его окружности. Вырезанную
ленту туго обертывают вокруг барабана, а края ее склеивают. При
работе на кимографе с удлинителем длина ленты достигает
1,5...2 м.
Для крепления регистрирующей аппаратуры с помощью стоек,
держателей, подставок и другого подсобного оборудования служит
универсальный штатив.
Рис. 6. Кимографы:
А — кимограф с часовым механизмом; Б — электрокимограф; 1 — барабан, 2— электродвигатель;
3— механический двигатель; 4— универсальный штатив
36
Для регистрации физиологических функций используют
механические и электрические отметчики времени
(хронограф ы). У механических отметчиков имеется часовой механизм,
на оси которого установлено кулачковое приспособление,
вызывающее периодические смещения металлического плечика.
Прибор позволяет получать на ленте отметки времени
продолжительностью 0,2 или 1 с. Установка для электрической отметки времени
(электромагнитные хронометры) состоит из электромагнитного
отметчика и введенного в цепь прерывателя тока (генератора
частот), посылающего импульсы через равные промежутки времени.
Для преобразования неэлектрических процессов в
электрические существует система электронных приборов —
преобразователей различных физических величин в эквивалентные
электрические сигналы. В опытах с графической регистрацией секреторной
деятельности тех или иных органов (слюнных желез, желудка,
почек, молочной железы) используют каплеписцы. Принцип
действия их основан на замыкании цепи электромагнитного
отметчика падающей каплей секрета. Запись кривых происходит,
как при воздушной регистрации, на движущемся барабане.
В электрические сигналы могут быть преобразованы
механические, термические, звуковые, световые, физико-химические и
другие эффекты. Наиболее распространены в физиологии механо-
электрические датчики, преобразующие механические величины
(давление, смещение) в электрические сигналы через
пьезоэлектрический эффект.
В индуктивном датчике механические перемещения
трансформируются в изменения индуктивности. С помощью этих датчиков
можно регистрировать как малые, так и большие (до нескольких
сантиметров) перемещения.
Емкостные (конденсаторные) датчики преобразуют
перемещения в изменения емкости плоского конденсатора, состоящего из
двух или нескольких пластин. Изменения емкости датчика
вызывают изменения частоты, которые с помощью частотного
дискриминатора превращаются в изменения амплитуды тока,
поступающего на вход регистрирующего прибора.
Преобразованный датчиком сигнал претерпевает дальнейшие
преобразования с участием электронных схем. При
использовании генераторных (пьезоэлектрических или фотоэлектрических)
датчиков их можно подключить непосредственно к специальным
или универсальным регистрирующим приборам:
электрокардиографу, осциллографу, чернилопишущему регистратору с
транзисторными усилителями, оксигемографу и др.
Все эти устройства вместе с измерительной схемой
смонтированы в приборах — вторичных преобразователях общего назначения,
позволяющих регистрировать различные физиологические процес-
37
сы с помощью датчиков разной чувствительности. Приборами
такого рода являются электронный измеритель давлений и
регистратор механических перемещений.
Регистрирующие приборы трансформируют электрические
сигналы, поступающие к ним от преобразователей и усилителей, в
видимые или слышимые сигналы — отклонение стрелки,
движение луча на экране, графическая или числовая регистрация на
бумаге и др. В зависимости от характера выходных регистрирующих
устройств эти приборы делят на 3 типа: электромеханические
(шлейфные или чернилопишущие), электронно-ламповые
(катодные осциллографы), магнитоэлектрические (магнитные
самописцы).
Более удобны приборы с непосредственной чернильной
записью, в которых использованы мощные перьевые гальванометры.
Они нашли применение в качестве выходных пишущих устройств
в чернилопишущих электрокардиографах, электрогастрографах,
электроэнцефалографах, а также в приборах общего назначения —
чернилопишущих регистраторах.
Для отведения и регистрации биопотенциалов
предназначена система приборов, состоящая из отводящих
электродов, усилителя и регистрирующего прибора.
Отводящие электроды не имеют принципиального отличия от
стимулирующих электродов.
Для регистрации собственной электрической активности
объектов, которая характеризуется очень малыми значениями
измеряемых величин (мкА, мкВ), используют усилители с большим
коэффициентом усиления (несколько миллионов).
Для регистрации отведенных и усиленных биопотенциалов
используют либо шлейфные и катодные осциллографы (для
потенциалов нейронов, нервного ствола и др.), либо специальные
приборы — электрокардиографы, электрогастрографы,
электроэнцефалографы (для биопотенциалов сердца, желудка, мозга,
отводимых с поверхности тела).
5. ЛАБОРАТОРНО-ПРАКТИЧЕСКИЕ ЗАНЯТИЯ
о
5.1. ВВОДНЫЕ ЗАНЯТИЯ
I. Правила безопасности и охрана труда, правила личной гигиены
на лабораторно-практических занятиях.
Студенты проходят инструктаж и обучение по технике
безопасности и охране труда, правилам личной гигиены на лабораторно-
практических занятиях на кафедре физиологии животных.
Основные правила следующие: 1) присутствие на занятиях в халатах;
2) при работе с кроликами, особенно в момент их фиксации на
столе и при взвешивании на весах, животное следует брать за кожу
спины и шеи, опасаясь удара задних лап, что может привести к
сильным травмам (удары, ушибы, раны и др.); 3) после работы с
животными (лягушки, мыши, кролики, собаки) тщательно мыть руки
с мылом; 4) проверить заземление электроприборов перед
включением в сеть переменного тока, убедиться в исправности соединения
сетевого шнура и штепселя; 5) при работе с электроприборами
избегать попадания растворов на электропровода; 6) при работе с
растворами серной кислоты соблюдать осторожность: не погружать
лапки лягушки в кислоту, чтобы предотвратить разбрызгивание
серной кислоты и попадание ее в глаза; 7) при работе с пипетками
следить, чтобы в момент взятия растворы кислот или щелочей не
попали на кожу и слизистые оболочки; 8) при работе с режущими
инструментами избегать травм (не наносить ранений себе или
соседям), не размахивать ножницами, скальпелями, иглами и др.;
9) при кипячении растворов на спиртовке конец пробирки
направлять в сторону от себя и работающих рядом; 10) при использовании
химических веществ (кислоты, щелочи, спирт, аммиак и т. д.)
запрещается пробовать их на язык и вдыхать их пары из флаконов;
11) после окончания занятий привести в порядок рабочее место.
Перед началом занятий староста группы назначает дежурного,
который несет полную ответственность за рабочее состояние
оборудования и инструментов во время занятий, порядок в
аудитории. В обязанности дежурного входит:
1) получение у лаборантов инструментов, оборудования,
лабораторных животных;
39
2) после окончания занятия сдать инструменты и оборудование
в исправном и чистом виде.
II. Общие указания о порядке проведения лабораторно-практичес-
ких занятий и подготовке к ним студентов.
III. Требования к ведению тетрадей для домашних заданий и
записям на лабораторно-практических занятиях.
При протоколировании следует указать: дату занятия, его тему;
номер и наименование работы; ход работы; результаты работы,
опыта; выводы.
Занятие 1. Предмет физиологии. Задачи практикума.
Методы и методические приемы физиологических
исследований. Физиологическая аппаратура и современные
методы регистрации параметров деятельности
функциональных систем организма
Цель занятия. Уяснить основные понятия — физиология,
объект и задачи физиологии, задачи практикума, методы и
методические приемы физиологических исследований; познакомиться
с устройством, назначением и правилами пользования основной
физиологической аппаратурой и правилами ведения протоколов
исследований.
Объект исследования, материалы и оборудование. 1. Корова,
лошадь, овца, коза, собака, лягушки. 2. Рисунки и схемы по теме.
3. Кимографы, штативы с держателями; регистрирующие
рычажки—рычажки Энгельмана; регистрирующие капсулы — капсулы
Марея; серфины, манжеты и резиновые баллоны; препаровальные
наборы; лигатуры (нитки); станки для фиксации животных. 4.
Физиологические приборы общего и специального назначения: элек-
троимпульсатор, индукционная катушка, миограф,
электрокардиограф, сфигмоманометр, фотоэлектроколориметр, пневмограф,
спирометр, оксигемометр и т. д.
Выполнение работы. На первом занятии студенты решают
поставленные задачи совместно с преподавателем, используя
учебники, учебные пособия, конспекты лекций по физиологии,
рисунки и схемы по теме.
I. Основные задачи практикума по физиологии животных.
Методы и методические приемы физиологических исследований и сущность
каждого метода, приема.
При разборе задачи студент должен уяснить, проявив
максимум самостоятельности, понятия — физиология, общая
физиология сельскохозяйственных животных, задачи физиологии, задачи
практикума по физиологии, конечная задача (цель) физиологии;
методы и методические приемы физиологических исследований.
Законспектировать их в тетради.
40
И. Проведение наблюдения за дыхательными движениями грудной
стенки у животного (корова, лошадь, овца, коза или собака) и
графическая регистрация этих движений. Определение, кто в этом
исследовании является объектом, как называется метод и каковы его
особенности.
Исследования проводят на корове, лошади, овце или собаке.
Животное фиксируют в станке. Вначале визуально наблюдают за
дыхательными движениями грудной стенки и записывают
результат. Затем графически регистрируют эти движения с помощью
манжета, наложенного на грудную стенку животного,
регистрирующей капсулы и кимографа.
III. Проведение наблюдения за сокращениями сердца и
графическая регистрация сокращений сердца в обычных условиях и после
отделения лигатурой венозного синуса от предсердий. Определение, что в
этом опыте является объектом исследования.
Используют любое лабораторное животное, удобнее лягушку.
Лягушку после анестезии кладут на препаровальную пластину
брюшком кверху. Затем обнажают сердце у лягушки и проводят
наблюдения за сокращениями сердца и графическую регистрацию
сокращений сердца с помощью серфина, регистрирующего
рычажка (рычажок Энгельмана) и кимографа в обычных условиях и
после отделения лигатурой венозного синуса от предсердий.
IV. Разбор: а) принципов, лежащих в основе конструкции и
работы основных простых и электронных приборов, предназначенных для
регистрации проявлений жизнедеятельности; б) принципов, лежащих
в основе конструкции и работы основных простых и электронных
приборов, предназначенных для воздействия на объект; в) общей
схемы систем для воздействия на объект и для регистрации различных
проявлений жизнедеятельности.
V. Просмотр в действии имеющейся на кафедре электронной и
другой физиологической аппаратуры и инструментов.
При решении четвертой и пятой задач используют практикум
по физиологии, инструкции по приборам, рисунки и схемы
приборов, приборы.
Физиология — наука экспериментальная. Эксперимент
является основной формой исследования, он сочетается с
использованием различного рода технических приспособлений, устройств,
инструментов.
Знакомство с аппаратурой студент должен строить таким
образом, чтобы познать: 1) принципы, лежащие в основе конструкции
и работы основных типов простых и электронных приборов;
2) важнейшие характеристики и правила техники безопасности
при работе с ними, и уметь: 1) пользоваться специальными
приборами, создавать из них в случае необходимости комплексные
схемы; 2) обрабатывать и читать зарегистрированные кривые (или
41
оценивать показания приборов), знать, какие пределы колебаний
при этом характеризуют норму.
По своему назначению все приборы, используемые в
физиологии, составляют две группы: I — приборы, входящие в системы,
предназначенные для воздействия на объект; II — приборы,
входящие в системы, предназначенные для регистрации различных
проявлений жизнедеятельности.
Основой электрической схемы I группы приборов, создаваемых
для воздействия на объект, служат электрические генераторы
(электростимуляторы).
Приборы II группы предназначены для регистрации различных
физиологических функций и процессов. Момент регистрации
(графическая запись, отклонение луча осциллографа или стрелки
измерительного прибора) является заключительным этапом. Ему
предшествует ряд промежуточных операций, выполняемых
различными приборами и устройствами. Существует много способов
превращения различных функциональных проявлений в
электрические сигналы.
Предложена общая схема систем для воздействия на объект
(организм, орган, ткань) и для регистрации различных
проявлений жизнедеятельности.
А. Система для воздействия на объект (электрическая схема)
ЭЛЕКТРИЧЕСКИЙ ГЕНЕРАТОР
I
ЭЛЕКТРОСТИМУЛЯТОР
I
ЭЛЕКТРОДЫ СТИМУЛИРУЮЩИЕ
I
ОБЪЕКТ
I
Б. Система приборов для регистрации различных проявлений жизнедеятельности
(электрическая схема)
ЭЛЕКТРОДЫ ОТВОДЯЩИЕ
I
УСИЛИТЕЛЬ
I
РЕГИСТРАТОР
Знание этой аппаратуры дает возможность понять принцип
работы любого специального прибора и быстро овладеть правилами
его эксплуатации.
42
VI. Разбор схемы составления протокола исследований.
Протокол исследования
Число, месяц, год
Цель исследования
Задачи исследования
Метод исследования
Схема исследования
Результаты исследования
Выводы (и при необходимости обоснование их)
При решении задач на протяжении всего курса физиологии
студент обязан проявить максимум инициативы и
самостоятельности, записывать полученные результаты и формулировать в
виде вывода то, что доказывает проведенный опыт, давать
письменные ответы на поставленные вопросы.
5.2. ВОЗБУДИМЫЕ ТКАНИ
Особое место в физиологии отводится возбудимым тканям,
которые в процессе эволюции выработали свойство быстро
«отвечать» на действие раздражителя. Ткани и клетки организма,
специально приспособленные к осуществлению быстрых ответных
реакций на действие раздражителя, называют возбудимыми
тканями. К ним относят нервную, железистую и мышечную ткани.
Возбудимые ткани обладают рядом специфических свойств:
возбудимостью, проводимостью.
Возбудимость —это способность возбудимой ткани
отвечать изменением структуры и деятельности на действие
раздражителя, т. е. отвечать особой биологической реакцией, называемой
возбуждением. Возбуждение — ответная реакция возбудимой
ткани на действие возбудителя (раздражителя), проявляющаяся в
совокупности физических, физико-химических, химических,
метаболических процессов и изменений деятельности.
Возбуждение — волнообразный процесс, который внешне проявляется в
разных возбудимых тканях специфическим образом: в
мышечной — сокращением, в железистой — образованием и выделением
секрета, в нервной — возникновением и проведением нервного
импульса.
Обязательным и общим признаком возбуждения возбудимых
тканей является возникновение биологического тока действия, т. е.
43
биоэлектрических явлений. Проводимость — это свойство
возбудимой ткани активно проводить волну возбуждения.
Итак, для возникновения возбуждения необходимо
раздражение — процесс воздействия раздражителя на возбудимые
структуры. Под раздражителем понимают любое изменение
условий внешней и внутренней среды, если оно возникает
внезапно, имеет достаточную силу, удерживается определенное
время, вызывает обратимые изменения структуры и деятельности
живых тканей и клеток.
Различают три группы раздражителей: физические
(термические, механические, электрические, световые, звуковые), физико-
химические (изменение осмотического давления, реакции среды,
электролитного состава) и химические (вещества пищи, гормоны,
продукты обмена, яды, лекарственные вещества, кислоты,
щелочи); особо выделяют как раздражитель нервный импульс.
По физиологическому значению все раздражители
подразделяют на адекватные и неадекватные. Адекватные —это
раздражители, которые действуют на организм и его структуры в
естественных условиях, и структуры организма приспособлены к
восприятию этого раздражителя (например, свет адекватен для
структур глаза). Неадекватные — это раздражители, которые
в естественных условиях не действуют на организм, и структуры
организма не приспособлены к их восприятию; такие
раздражители чаще всего вызывают нарушение функций организма.
5.2.1. ОБЩАЯ ФИЗИОЛОГИЯ ВОЗБУДИМЫХ ТКАНЕЙ
Занятие 2. Общие свойства возбудимых тканей. Законы
раздражения. Биоэлектрические явления
Цель занятия. Изучить общие свойства возбудимых тканей;
уяснить такие понятия, как раздражитель, раздражение,
раздражимость, биологическая реакция, возбудитель, возбуждение,
возбудимость, биологические токи, а также суть законов раздражения;
убедиться в наличии биологических токов и ознакомиться с методами
их отведения; уяснить, что биоэлектрические явления отдельных
органов на регистрируемой электрограмме выражены волнами
различного вольтажа и частот, специфичными для каждого органа и
состояния.
Объект исследования, материалы и оборудование. 1. Лягушки,
овца или корова. 2. Рисунки и схемы по теме. 3. Препаровальный
набор (рис. 7), раствор Рингера, физиологический раствор, 10%-
ный раствор хлорида натрия, пипетка, индукционная катушка с
электродами, ключ для замыкания, источник тока, электронный
стимулятор, усилитель постоянного тока с катодным повторите-
44
8 Ю
Рис. 7. Препаровальный набор для физиологических опытов на лягушке:
/—ножницы большие; 2 — ножницы малые; 3— скальпель; 4— игла; 5 —тонкий крючок; 6—
лигатурный крючок; 7—стеклянный крючок; б1—пинцет анатомический; 9—зажим Пеана;
10— зажим Диффенбаха
лем, катодный осциллограф, миограф, хронаксиметр,
гальваническая вилка.
Выполнение работы.
I. Исследование общих физиологических свойств возбудимых
тканей организма. Приготовление нервно-мышечного препарата из
седалищного нерва и икроножной мышцы лягушки.
Физиологические опыты по изучению свойств возбудимых
тканей (нервной и мышечной) проводят чаще всего на
нервно-мышечном препарате (цв. рис. I). Нервно-мышечный препарат
представляет собой выделенные из организма лягушки и соединенные
между собой нерв и мышцу. Чаще для этой цели используют
седалищный нерв и икроножную мышцу — классический препарат,
реже — полусухожильную и полуперепончатую. Для сохранения
физиологических свойств тканей препарата его постоянно
увлажняют раствором Рингера для холоднокровных.
Лягушку под общей анестезией эфиром или алкоголем
фиксируют марлевой салфеткой. Затем браншу больших ножниц вводят в
ротовую полость и рассечением позади глаз удаляют верхнюю че-
45
люсть (при этом удаляют часть центральной нервной системы —
головной мозг), затем разрушают спинной мозг посредством
введения металлического стержня (зонда) в позвоночный канал
(цв. рис. I, 7).
Лягушку берут в левую руку за задние лапки, завернутые в
марлевую салфетку, приподнимают. При этом туловище сгибается под
прямым углом и видны маклоки тазовых костей. Ножницами
делают поперечный разрез позвоночного столба на 0,5... 1 см выше тазо-
во-грудного сочленения (впереди маклоков). После этого
подрезают кожу и удаляют переднюю часть туловища вместе с грудными и
брюшными внутренними органами (цв. рис. I, 2). Удерживая в
левой руке оставшуюся часть позвоночного столба, правой рукой с
помощью марлевой салфетки захватывают кожу по краю разреза и
быстрым движением снимают ее с задних лапок (цв. рис. I, 3),
которые кладут на тарелку, смоченную раствором Рингера, спинной
поверхностью книзу, и удаляют остатки внутренних органов.
Задние лапки покрывают марлей, осторожно берут рукой
так, чтобы ясно выступала на поверхности копчиковая кость, и
удаляют ее (цв. рис. I, 4). Затем через образовавшееся окошечко
делают продольный разрез остатка позвоночного столба и по
лобковому сочленению тазовых костей разъединяют лапки, не
затрагивая нервов (цв. рис. I, 5).
Из лапок готовят нервно-мышечные препараты. При этом
нужно соблюдать крайнюю осторожность, стараясь не повредить
седалищный нерв. Одну из лапок покрывают ватой, смоченной
раствором Рингера для холоднокровных. Вторую лапку
подвергают дальнейшей обработке: придерживая лапку за кусочки
оставшихся позвонков, подводят браншу ножниц под седалищный
нерв, удаляют тазовую кость и отпрепаровывают нерв до
тазобедренного сочленения (цв. рис. I, 6). Препарат перевертывают на
брюшную сторону, осторожно поднимают седалищный нерв за
кусочки позвоночника, чтобы отчетливо был виден ход
седалищного нерва до коленного сустава, между двуглавой и
полуперепончатой мышцами. Фасцию между этими мышцами разрывают
тонкой иглой, а мышцы раздвигают пинцетом, после чего
седалищный нерв остается свободным (параллельно с ним идет
бедренная артерия) (цв. рис. I, 7).
Нерв стеклянным крючком приподнимают, а мышечные ткани
и отходящие к мышцам бедра нервные веточки подрезают
ножницами (цв. рис. I, 8). Отпрепарованный нерв перебрасывают на
голень. Мягкие ткани бедра удаляют; маленькими ножницами
вылущивают головку бедренной кости в тазобедренном сочленении
(цв. рис. I, 9). Приготовленный препарат называют реоскопической
лапкой. Он состоит из нерва, бедренной кости и нижней части
конечности (голень, лапка).
46
Рис. 8. Нервно-мышечный препарат Рис. 9. Упрощенная установка для записи
во влажной камере сокращения мышцы
Для приготовления нервно-мышечного препарата из реоскопи-
ческой лапки проводят следующие манипуляции (цв. рис. I, 10, 11):
ахиллово сухожилие захватывают пинцетом и подрезают
ножницами на пяточном бугре; икроножную мышцу отпрепаровывают
от всех тканей голени; затем удаляют голень и стопу, перерезая
большими ножницами голенную кость ниже коленного сустава, и
препарат готов. Для лучшего его закрепления в штативе оставляют
бедренную кость.
Для проведения опытов нервно-мышечный препарат надо
поместить в такие условия, чтобы он не подсыхал и его легко можно
было раздражать и записывать сокращения мышцы. Для этих
целей лучше всего поместить нервно-мышечный препарат во
влажную камеру, где условия наиболее благоприятны (рис. 8). При
отсутствии влажной камеры применяют упрощенную установку для
записи сокращения мышцы (рис. 9).
На приготовленном нервно-мышечном препарате проводят
решение задач.
II. Наблюдение за проявлением реакции нервно-мышечного
препарата на раздражение нерва или мышцы и оформление заключения,
какой раздражитель является естественным, адекватным для
мышцы, нерва, какая ткань является более возбудимой.
В качестве раздражителя используют индукционный ток или
импульсы электронного стимулятора. Перед началом
раздражения возбудимой ткани вторичную катушку индукционного сан-
47
ного аппарата следует отодвинуть от первичной катушки на
заведомо большое расстояние (25...30 см). Сближение производят
постепенно.
Опыт 1. Электроды индукционной катушки или электронного
стимулятора, накладывают на седалищный нерв и наносят
одиночное раздражение током, используя ключ для замыкания цепи.
Наблюдают мгновенное сокращение мышцы.
Опыт 2. Электроды индукционной катушки или электронного
стимулятора, накладывают непосредственно на икроножную
мышцу и наносят одиночное раздражение током. Наблюдают
мгновенное сокращение мышцы.
Опыт 3. Раздражитель — разность потенциалов гальванической
вилки. На нерв накладывают пластинки гальванической вилки. В
момент соприкосновения вилки с нервом наблюдают сокращение
мышцы.
Опыт 4. Раздражитель механический. Нерв сдавливают
пинцетом. Мышца отвечает сокращением.
Опыт 5. Раздражитель химический. На нерв накладывают
кристаллик поваренной соли. Через некоторое время мышца начинает
быстро сокращаться. Сокращения мышцы будут продолжаться
даже после удаления кристаллика соли.
III. Определение проявления реакции мышцы на очень слабые
кратковременные и более длительные умеренные электрические
раздражения ее и оформление заключения о значении силы и времени
действия раздражителя для возникновения ответной реакции ткани
(возбуждения).
Делают нервно-мышечный препарат или препарат реоскопи-
ческой лапки. В качестве раздражителя используют минимальный
электрический ток. Электроды накладывают на мышцу и,
применяя одиночные индукционные разряды, наносят на мышцу
слабые кратковременные и более длительные умеренные
электрические раздражения.
IV. Исследование проявления закона действия постоянного тока.
Определение, на каком полюсе возникает возбуждение при
замыкании и размыкании постоянного тока (полярный закон
раздражения).
Делают нервно-мышечный препарат или препарат реоскопи-
ческой лапки. Реоскопическую лапку или нервно-мышечный
препарат фиксируют в штативе. Нерв накладывают на неполяризую-
щиеся электроды. Находят пороговую силу тока. Силу тока
увеличивают до тех пор, пока мышца не ответит сокращением при
замыкании и размыкании (ток средней силы). В период
прохождения тока по замкнутой цепи сокращений мышцы не
наблюдают. В опыте используют коммутатор, который служит для
смены полюсов постоянного тока. Коммутатор устанавливают в
48
таком положении, чтобы положительный электрод (анод) был
ближе к мышце.
Для того чтобы доказать, что возбуждение при замыкании
возникает на катоде, а при размыкании — на аноде (закон Дюбуа—
Раймона), нарушают физиологическую проводимость нерва. Для
этого наносят на нерв между неполяризующимися электродами
каплю крепкого раствора аммиака. Участок нерва между
электродами убивают, и он становится неспособным проводить
возбуждение. Теперь при замыкании цепи сокращения мышцы не
произойдет, так как возбуждение, возникающее на катоде в момент
замыкания, не может пройти через мертвый участок нерва. Цепь
размыкают и наблюдают сокращение мышцы, потому что
возбуждение, возникающее на аноде, распространяется по
неповрежденному нерву на мышцу.
С помощью коммутатора сменяют полюса так, чтобы ближе к
мышце оказался катод, а за поврежденным участком нерва —
анод. При таком положении электродов сокращение мышцы
будет только при замыкании. Следовательно, возбуждение при
замыкании возникает на катоде, при размыкании — на аноде.
V. Определение наименьшей силы раздражителя, которая
необходима для возникновения возбуждения мышцы при раздражении нерва
и непосредственно мышцы.
1. Электроды индукционной катушки накладывают на
седалищный нерв и наносят одиночные индукционные удары, увеличивая
силу тока, пока мышца не ответит на раздражение минимальным
сокращением.
2. Электроды индукционной катушки накладывают
непосредственно на мышцу. Далее, как и в первом случае.
VI. Определение реобазы и хронаксии двуглавой мышцы плеча у
овцы или коровы.
Реобазу и хронаксию измеряют с помощью хронаксиметра.
Прибор представляет довольно сложную электрическую систему,
включающую в себя кенотрон, набор трансформаторов и
конденсаторов, вольтметр, реостаты, шкалу управления с тумблером,
сигнальной лампочкой, ключом и рычажком управления. Время
действия раздражителя определяют посредством набора
конденсаторов различной емкости. Для определения реобазы и
двигательной хронаксии с двигательной точки нерва или мышцы
используют униполярное раздражение.
Овцу или корову фиксируют в станке, выстригают шерсть на
передней конечности в области двуглавой мышцы плеча и на
средней части позвоночника (или живота). Индифферентный
электрод, покрытый смоченной в физиологическом растворе
марлевой салфеткой, накладывают на спину (или живот) и
фиксируют тесемками. Активный электрод также смачивают физиологи-
49
ческим раствором и прикладывают в различных точках, отыскивая
такую точку, где на меньшую силу тока мышца отвечает
сокращением. Замыкание ключа осуществляют с интервалом до 10 ударов
в 1 с, чтобы избежать суммации подпороговых раздражений. При
3-кратном получении одинакового результата фиксируют
показания на шкале вольтметра (это реобаза). Ключ прибора переводят в
положение «хронаксия». Реостатами удваивают пороговую силу
тока. Затем подбирают конденсатор. Емкость конденсатора, при
которой будет минимальное сокращение мышцы, покажет
наименьшее время, или хронаксию.
VII. Определение наличия тока покоя в возбудимой ткани:
возникает ли сокращение мышцы нервно-мышечного препарата при
набрасывании нерва на другую рассеченную в поперечном направлении
мышцу. Если сокращение мышцы возникает, пояснить причину ее
возбуждения.
Делают нервно-мышечные препараты (рис. 10, А).
Гальванической вилкой проверяют физиологическую целостность нерва.
Рассекают мышцу бедра в поперечном направлении и тотчас
набрасывают на нее нерв нервно-мышечного препарата таким
образом, чтобы он одновременно коснулся поврежденного и
неповрежденного участков мышцы первого препарата (используют
стеклянные крючки). Проводят наблюдение за состоянием
мышцы нервно-мышечного препарата.
VIII. Исследование генерации тока действия: можно ли вызвать
сокращение мышцы нервно-мышечного препарата, набрасывая его
нерв на сокращающуюся мышцу другого препарата. Если
сокращение мышцы возникает, пояснить причину ее возбуждения.
Делают два препарата реос-
копической лапки (рис. 10, Б).
Гальванической вилкой
проверяют физиологическую целост-
Рис. 10. Биоэлектрические явления
в мышцах (опыты Гальвани и Маттеучи):
А — второй опыт Гальвани (без металла): 1 —
стеклянные крючки; 2 —седалищный нерв;
3— икроножная мышца; 4—надрезанный
участок мышцы; Б— опыт Маттеучи: / — ре-
оскопические лапки; 2— седалищные нервы;
3 — электроды от электростимулятора
Рис. 11. Схема постановки опыта для
определения наличия мембранного
потенциала:
/—гальванометр; 2— ключ Дюбуа—Реймо-
на; 3 — отводящий электрод, помещенный
на поврежденный участок мышцы; 4—
отводящий электрод, помещенный на
неповрежденный участок мышцы; 5— шкала
гальванометра; 6 — лампа
ность нерва обоих препаратов.
Далее нерв одного препарата
реоскопической лапки помещают на электроды, нерв другого
накладывают вдоль икроножной мышцы первого. Вызывая
ритмическими раздражениями нерва тетаническое сокращение мышц
первого препарата, проводят наблюдение за состоянием мышцы
второго.
IX. Определение наличия мембранного потенциала мышечного
волокна скелетной мышцы с помощью усилителя постоянного тока.
Подготавливают нервно-мышечный препарат (рис. 11).
Включают усилитель постоянного тока (он должен прогреться).
Индифферентный неполяризующийся электрод накладывают на
поверхность препарата. Отрывистым движением погружают другой
электрод в ткань мышцы. На экране осциллографа должен быть виден
скачок потенциала.
Контрольные вопросы и задания. 1. Что понимают под раздражимостью? 2. Что
понимают под биологической реакцией? 3. Что понимают под раздражителем?
4. Какие воздействия могут быть раздражителями? 5. Какими преимуществами
обладает электрический ток как раздражитель? 6. Какие ткани (перечислите)
относят к числу возбудимых тканей? 7. Чем нервно-мышечный препарат удобен для
изучения свойств возбудимых тканей? 8. Назовите свойства возбудимых тканей.
9. Что такое возбудимость ткани? 10. Что понимают под возбуждением? 11. В
совокупности каких процессов проявляется возбуждение? 12. Какими изменениями
живой клетки характеризуется возбуждение? 13. Какое изменение живой клетки,
характеризующее возбуждение, имеет особо важное значение? 14. Что называют
потенциалом покоя? 15. Что определяет величину потенциала покоя клетки?
16. За счет чего создается и поддерживается разность потенциалов между
наружной и внутренней поверхностью мембраны клетки? 17. Концентрация какого
иона преобладает в протоплазме мышечных и нервных клеток по сравнению с
окружающей клетку средой? 18.3а счет чего поддерживается ионная асимметрия
внутри и вне клетки? 19. Как называют механизм, осуществляющий активный
перенос через мембрану ионов натрия и калия против их градиента концентрации?
20. Изменится ли (и если да, то как) величина потенциала покоя, если
искусственно снизить на 30 % концентрацию ионов калия внутри клетки? 21. Как
изменится амплитуда потенциала действия одиночного нервного волокна, если
снизить на 20 % наружную концентрацию ионов натрия? 22. Что называют
потенциалом действия? 23. Опишите механизм возникновения потенциала действия.
24. В чем состоит ионный механизм возникновения потенциала действия? 25. Ка-
51
кими методами можно доказать наличие биоэлектрических явлений в возбудимых
тканях? 26. Назовите приборы для регистрации биоэлектрических явлений.
27. Как отводятся биологические токи?
5.2.2. ФИЗИОЛОГИЯ МЫШЦ
У животных различают три вида мышц: скелетные
поперечнополосатые, сердечная поперечно-полосатая и гладкие, которые
отличаются по строению и физиологическим свойствам.
Скелетные поперечно-полосатые мышцы вместе со скелетом составляют
опорно-двигательную систему организма, которая обеспечивает
поддержание позы и перемещение отдельных частей тела и всего
тела в пространстве. Наряду с этим скелетные мышцы и скелет
выполняют также защитную функцию, предохраняя внутренние
органы от повреждений. Согласно структурной организации и
физиологической роли мышцы бывают динамические и статоди-
намические.
Поперечно-полосатым скелетным мышцам присущи основные
свойства возбудимых тканей: возбудимость, проводимость и в
определенной степени упругость, растяжимость, эластичность,
пластичность. Возбуждение мышцы внешне проявляется
сокращением. В ответ на одиночное раздражение мышца отвечает
одиночным сокращением. Оно осуществляется очень быстро
(0,09...0,1 с), в нем различают три фазы: скрытую, укорочения и
расслабления. В естественных условиях к мышце поступает, как
правило, не один импульс, а серия импульсов, на которые она
отвечает длительным сокращением, которое называют
тетанус. Различают гладкий тетанус, который возникает при частых
ритмах раздражения (когда каждый очередной импульс застает
мышцу в фазе укорочения), и зубчатый тетанус, возникающий
при редких ритмах раздражения (когда каждый очередной
импульс застает мышцу в фазе расслабления), а также изотоническое
(без изменения тонуса) и изометрическое (без изменения длины)
сокращения.
Занятие 3. Специфические физиологические
свойства скелетных мышц. Работа мышц.
Свойства гладких мышц
Цель занятия. Изучить особенности сокращения мышц в
зависимости от силы и частоты поступающих к ним импульсов и
величины нагрузки.
Объект исследования, материалы и оборудование. 1. Лягушки,
овца, корова, лошадь. 2. Рисунки и схемы по теме. 3. Миограф с
52
ограничителем, кимограф, стимулятор (индукционная катушка
или электроимпульсатор); электроды, электрокамертон (отметчик
времени); препаровальный набор, универсальный штатив;
пипетка, вата, лигатура, набор разновесов (10, 20, 50, 100, 200 г),
линейка; раствор Рингера.
Выполнение работы.
Собирают и проверяют установки для записи сокращений
мышц и для раздражения нервно-мышечного препарата (рис. 12).
Быстро и аккуратно делают нервно-мышечный препарат,
укрепляют его в миографе. Под мышцей к рычажку подвешивают
небольшой груз (способствует лучшей записи). Подбирают силу
тока, при которой происходит отчетливое сокращение мышцы.
Нерв на электроды следует положить только на время
раздражения, в промежутках между опытами нерв снимают с электродов и
кладут на мышцу, периодически орошая раствором Рингера.
I. Запись кривой мышечного сокращения при раздражении нерва
мышцы одиночным ударом электроимпулъсатора (одиночного
сокращения) и анализ ее.
Одиночное сокращение мышц записывают при быстром
вращении барабана кимографа (ветряк снять). Седалищный нерв
нервно-мышечного препарата раздражают редкими одиночными
импульсами. При анализе кривой одиночного мышечного
сокращения обращают внимание на отрезок ее от начала раздражения
до сокращения мышцы, на отрезок ее от начала сокращения до
конца расслабления.
Поясните, имеет ли место одиночное сокращение мышц в
организме.
II. Запись кривой мышечного сокращения при раздражении нерва
мышцы частыми (в начале каждой фазы расслабления мышцы)
одиночными ударами электроимпулъсатора и анализ ее.
Определите вид (тип) сокращения. Поясните его механизм, и
имеет ли место такое сокращение в организме.
III. Запись кривой мышечного сокращения при частом
раздражении нерва (в каждую фазу укорочения от предыдущего сокращения) и
ее анализ.
Рис. 12. Сокращение скелетной мышцы при разной частоте раздражения:
А — миограмма икроножной мышцы лягушки: 7 —одиночные сокращения; 2...4— зубчатый
тетанус; 5— гладкий тетанус; Б— отметки времени
53
Определите вид сокращения. Поясните, каков его механизм и
имеет ли место такое сокращение в организме.
Тетанические (длительные) сокращения мышц записывают
при медленном вращении барабана кимографа. Вначале
седалищный нерв нервно-мышечного препарата раздражают импульсами
частотой 5 Гц, затем — 10, 15, 20, 25, 30 Гц и более.
Продолжительность каждого раздражения должна быть приблизительно
одинакова — около 5 с, а интервалы между раздражениями —
около 1 мин (в промежутках между раздражениями барабан
кимографа останавливают). Под каждой миограммой отмечают частоту
раздражений. При анализе кривой длительных (тетанических)
сокращений обращают внимание на высоту начальных и последних
волн (что отражает такая кривая).
Определите вид сокращения. Поясните его механизм, и имеет
ли место такое сокращение в организме.
IV. Исследование состояния мышцы (степени напряжения и
укорочения) при раздражении ее в условиях, когда фиксирован в
штативе только один конец ее, а другой конец свободен и когда оба конца
фиксированы к неподвижной основе.
1. В штативе зафиксирован только один конец мышцы, а
другой свободен. Седалищный нерв нервно-мышечного препарата
раздражают импульсами в течение 5 с, наблюдая за состоянием
мышцы (обращают внимание на степень напряжения и
укорочения ее). При анализе описывают состояние мышцы, определяют
вид сокращения, поясняют, имеет ли место такое сокращение в
организме.
2. В штативе зафиксированы оба конца мышцы к неподвижной
основе. Седалищный нерв нервно-мышечного препарата
раздражают импульсами в течение 5 с, наблюдая за состоянием мышцы
(обращают внимание на степень напряжения и укорочения ее). При
анализе состояния мышцы описывают его, определяют вид
сокращения, поясняют, имеет ли место такое сокращение в организме.
V. Определение зависимости работы мышцы от величины
поднимаемого груза (малый, средний, большой).
При определении силы и работы мышц необходимо
ограничить опускание рычажка ниже горизонтального положения
(мышца не растягивается грузом). Запись ведут на неподвижном
барабане, немного поворачивая его после очередного сокращения
мышцы рукой.
Записывают тетаническое сокращение мышцы без нагрузки,
раздражая ее в течение 2...3 с (рис. 13). Затем подвешивают на
рычажок миографа непосредственно под мышцей гирьку массой 10 г,
чтобы истинная нагрузка на мышцу соответствовала величине
груза, и вновь раздражают нерв и записывают высоту сокращения
мышцы, подвешивают гирьку в 20 г, раздражают нерв и записыва-
54
Рис. 13. Схема миографа для
определения силы мышц:
/— мышца; 2— миограф; 3—
ограничитель движения рычага; 4 — чашка для груза
с
1
Щ
ют высоту сокращения мышцы. Опыт
повторяют, последовательно
увеличивая массу гирек. Находят предельный
груз, который мышца в состоянии
поднять. Эта максимальная величина груза
и будет силой мышцы (силу мышц
измеряют по максимальному грузу, который мышца в состоянии
поднять, либо по максимальному напряжению, которое она может
развить в условиях изометрического сокращения). Для
вычисления работы мышцы при разных нагрузках измеряют высоту
сокращения мышцы. Поскольку рычажок миографа записывает
сокращение мышцы в увеличенном виде, для вычисления ее работы
находят истинную высоту сокращения мышцы. Для этого измеряют
длину рычажка миографа (L) от оси вращения до конца писчика и
длину (/) от оси вращения до места прикрепления мышцы.
Истинная высота сокращения мышцы, мм
и Ш
где Я—высота сокращения мышцы (записанная на кимографе), мм.
Определив высоту истинного сокращения мышцы для каждого
груза, динамическую работу мышцы вычисляют по формуле
W=Ph,
где W— работа мышцы, г/мм; Р— масса груза, г.
Результаты записывают в таблицу со следующими графами:
1) высота мышечных сокращений, мм; 2) истинная высота
сокращений мышцы, мм; 3) масса груза, г; 4) работа мышцы, г/мм.
Определяют, при каких нагрузках мышца выполняет максимальную
работу.
55
VI. Определение порога возбудимости и времени протекания
одиночного сокращения гладких мышц.
Гладкие мышцы в организме находятся в полых внутренних
органах (желудок, кишечник и др.), которые обеспечивают
пищеварение, в кровеносных сосудах, коже и т. д. Они имеют те же
основные свойства, что и поперечно-полосатые скелетные
мышцы: возбудимость, проведение возбуждения, сократимость и др.,
но им присущи и особые свойства: автоматия, т. е. способность
сокращаться и расслабляться без внешних раздражений, а за счет
возбуждений, возникающих в них самих; высокая
чувствительность к химическим раздражителям; выраженная пластичность
(свойство сохранять приданное растяжением состояние);
отвечать сокращением на быстрое растяжение. Одиночное
сокращение протекает продолжительно.
Из желудка лягушки (из средней более широкой части)
вырезают мышечное кольцо шириной 0,5 см и удаляют слизистую
оболочку. Мышечное кольцо увлажняют раствором Рингера и
фиксируют в миографе. Подводят электроды
электростимулятора и наносят на мышцу с интервалом не менее Юс одиночные
раздражения возрастающей силы до получения ответной
реакции (рис. 14). Записывают кривую одиночного сокращения
мышцы на медленновращающемся барабане кимографа,
устанавливая время латентного периода, укорочения и расслабления
мышцы.
Сделайте заключение об особенностях свойств гладких
мышц.
Время, 10 с
Рис. 14. Регистрация
сокращений гладкой
мышцы:
Л — схема установки:
7 — кимограф; 2 — пис-
чик; 3 — рычажок миографа; 4—мышечное
кольцо; 5— изоляторы; 6— провода от
электростимулятора; 7—штатив; Б— миограмма: 7 —момент
раздражения; 2—кривая сокращения, 3— отметка
времени Юс
56
Контрольные вопросы и задания. 1. Какие виды мышц различают в организме у
сельскохозяйственных животных? 2. Опишите строение скелетных мышц. 3.
Назовите основные свойства мышц. 4. Как проявляется сокращение мышц? 5. На
какие фазы подразделяют одиночное сокращение мышцы? 6. От каких факторов
зависит сокращение мышцы? 7. Чем объяснить тот факт, что с увеличением силы
раздражения увеличивается величина сокращения мышцы? 8. Какие сокращения
мышцы называют тетаническими и какова их природа? 9. Какое состояние
мышцы называют тонусом? 10. Какие виды сокращения мышц различают? 11. Какой
вид сокращений преимущественно имеет место в естественных условиях?
12. Опишите механизм укорочения мышц при сокращении. 13. Чем определяют
силу мышцы? 14.0т каких факторов зависит сила мышцы? 15. Как определяют
работу мышцы? 16. При каких условиях мышца производит наибольшую работу?
17. Каковы возбудимость и проводимость мышц? 18. Какова особенность
сокращений гладких мышц? 19. Какое раздражение адекватно для гладких мышц?
20. Каким не присущим скелетным мышцам свойством обладают гладкие
мышцы?
5.2.3. ФИЗИОЛОГИЯ НЕРВОВ
Нерв — это сложное образование, состоящее из большого
числа нервных волокон, заключенных в общую соединительнотканную
оболочку. Нервное волокно представляет собой отросток
нервной клетки (нейрона) — дендрит или аксон. Все нервные
волокна по строению делят на миелиновые и безмиелиновые, а по
физиологическому значению (структурным особенностям и
скорости проведения возбуждения) — на тип А (Аа, Л(3, Ay, A8) [толстые
миелиновые, быстропроводящие афферентные и эфферентные],
тип В [вегетативные преганглионарные мякотные] и тип С [безмя-
котные, тонкие, медленнопроводящие, симпатические].
Основные свойства нерва — возбудимость и проводимость.
Возбуждение проводится в виде потенциалов действия, от
рецепторов в центральную нервную систему — афферентные волокна,
от центральной нервной системы к периферическим
исполнительным органам — эфферентные нервные волокна. Возбуждение
по нервному волокну проводится при физиологической
целостности его, изолированно.
Передача возбуждения с одного нервного волокна на другое,
нервную клетку, железистую клетку, мышечное волокно
осуществляется через особое структурно-физиологическое
образование — синапс ив результате выделения из нервного
окончания химического посредника —медиатора. Роль медиатора в
нервных волокнах соматических нервов и в преганглионарных
вегетативных играет ацетилхолин, в постганглионарных
симпатических — норадреналин. Синапсы животных состоят из трех основных
элементов: пресинаптической мембраны, постсинаптической
мембраны и синаптической щели. Медиатор через пресинапти-
ческую мембрану выделяется в синаптическую щель,
взаимодействует с белками-рецепторами постсинаптической мембраны,
вызывает генерацию мембранного потенциала.
57
Занятие 4. Специфические физиологические свойства
нервных волокон, нерва, афферентных
и эфферентных проводников и синапсов
Цель занятия. Уяснить особенности строения нервного
волокна, синапса; специфические свойства нерва и синапсов.
Объект исследования, материалы и оборудование. 1. Лягушки,
лошадь, корова или овца, кролик. 2. Рисунки и схемы по теме.
3. Электроимпульсатор, поверхностные стимулирующие
электроды, набор препаровальных инструментов, стеклянные крючки для
препаровки нервов; раствор Рингера, пипетка, вата; установка для
записи развернутой кривой одиночного мышечного сокращения,
кимограф, миограф, универсальный штатив; набор гирек, 0,1%-ный
раствор новокаина, 30%-ный раствор спирта.
Выполнение работы. Собирают и проверяют установку для
записи сокращений мышц и для раздражения нервно-мышечного
препарата. Быстро и аккуратно делают нервно-мышечный
препарат, укрепляют его в миографе. Под мышцей к рычажку
подвешивают небольшой груз (способствует лучшей записи).
Подбирают силу тока, при которой происходит отчетливое
сокращение мышцы. Нерв на электроды кладут только во время
раздражения. В промежутках между опытами нерв следует снимать
с электродов и класть на мышцу, периодически орошая
раствором Рингера.
I. Определение свойств нервных волокон.
Раздражают участок седалищного нерва нервно-мышечного
препарата, удаленного от мышцы, наблюдают за состоянием
мышцы. Если сокращение мышцы происходит, то это доказывает
наличие у нерва свойств возбудимости и проводимости.
И. Определение скорости проведения возбуждения по нерву.
Подбирают такую силу стимула, чтобы при размыкании
контакта мышца развивала достаточно сильное сокращение. Запись
кривых одиночного сокращения мышцы осуществляют на быстровра-
щающемся барабане кимографа при раздражении участка нерва,
расположенного вдали от мышцы, а затем в тех же условиях при
раздражении нерва у места вхождения его в мышцу. Измерив
расстояние между участками раздражения и время, затраченное на
прохождение волны возбуждения по этому участку нерва (оно равно
разности латентных периодов сокращения мышцы), рассчитывают
скорость проведения возбуждения по нерву.
III. Определение влияния физиологической целостности нерва на
его свойство проводить возбуждение.
Для создания альтерированного (измененного) участка на нерв
между электродами и мышцей накладывают кусочек ваты,
смоченный альтерирующим веществом: новокаином (0,1%-ный),
58
спиртом (30%-ный), КС1 (0,8%-ный). Каждые 1...2 мин, начиная с
момента нанесения на нерв раствора и на протяжении всего
исследования, наносят одиночные раздражения на нерв и следят за
реакцией мышцы. Сокращения мышцы записывают на медлен-
новращающемся барабане кимографа. Если возбуждение
(сокращение) мышцы не возникает, то этот факт служит
доказательством свойства мышцы проводить возбуждение только при
условии физиологической целостности. Кусочек ваты с раствором
удаляют с нерва и его несколько раз промывают физиологическим
раствором; нерв вновь раздражают и определяют,
восстанавливается ли исходная величина сокращения мышцы.
IV. Определение свойства синапса проводить возбуждение только
в одном направлении — с нерва на орган.
Седалищный нерв нервно-мышечного препарата располагают
вдоль икроножной мышцы другого препарата. Вызывая
ритмическими раздражениями сокращения мышцы первого препарата,
проследить за состоянием мышцы второго. Если мышца второго
препарата в этих условиях не сокращается, то этот факт может
быть объясним только тем, что синапс не проводит импульсы с
органа на нерв, т. е. обладает только свойством одностороннего
проведения возбуждения.
V. Определение свойства синапса — утомление.
Используют установку, включающую в себя две пары
электродов и переключатель, позволяющий в ходе работы мгновенно
переключать ток с нерва на мышцу. Находят порог возбудимости
нерва и порог возбудимости мышцы (при прямом ее раздражении).
Исследование начинают с записи сокращений мышцы при
раздражении нерва. Для этого переключатель ставят в положение на
«нерв». Установив ключ электронного импульсатора на частоту
60 импульсов в 1 мин, записывают сокращения мышцы. Когда
сила сокращения мышцы резко уменьшится или же сокращения
ее прекратятся, переводят переключатель в положение на
«мышцу» и записывают ее. Если мышца в ответ на раздражение
осуществляет сильные сокращения, то это свидетельствует о том, что
мышца не утомлена, а причиной прекращения сокращений
мышцы в ответ на раздражение нерва является утомление синапса.
Контрольные вопросы и задания. 1. Какова структура нервных волокон? 2.
Какова физиологическая роль структурных элементов нервного волокна? 3. Каковы
законы проведения возбуждения в нервах? 4. Назовите особенности проведения
возбуждения в безмякотных и мякотных нервных волокнах. 5. Как
классифицируют нервные волокна по скорости проведения возбуждения и строению? 6.
Опишите характерные особенности волокон типа Аа, А$, Ау, АЬ. 7. Опишите
характерные особенности волокон типа В. 8. Опишите характерные особенности волокон
типа С. 9. Что называют синапсом? 10. Какова структура синапса? 11. Каковы
свойства синапсов? 12. Каков механизм передачи возбуждения с нерва на орган?
13. Какова роль холинэстеразы в процессах нервно-мышечной передачи? 14. Как
59
меняются свойства нерва при альтерации (парабиоз Введенского)? 15. Какая из
возбудимых структур характеризуется наибольшей лабильностью? 16. Что
приводит к интенсивному выбросу ацетилхолина из синаптической бляшки в синапти-
ческую щель? 17. Что понимают под утомлением? 18. Каков механизм развития
утомления?
5.3. НЕРВНАЯ СИСТЕМА
Нервная система связывает в организме рецепторы, ткани и
органы в рефлекторные дуги. Через рефлекторные дуги
осуществляются приспособительные реакции— рефлексы; рефлекторная
регуляция — приспособление состояния и деятельности тканей,
органов и организма в целом к условиям внутренней и внешней
среды. Нервная система образована нейронами и клетками нейро-
глии.
Нервную систему подразделяют на центральную и
периферическую. Центральная нервная система (ЦНС) включает головной
и спинной мозг, а периферическая — нервы, отходящие от
центральной нервной системы к органам.
Структурно-физиологической единицей нервной системы служит нейрон. Клетки нейро-
глии выполняют опорную, защитную и трофическую роли.
5.3.1. ПРИНЦИПЫ РЕГУЛЯЦИИ ДЕЯТЕЛЬНОСТИ ОРГАНОВ
И СИСТЕМ ОРГАНИЗМА
Приспособление процессов жизнедеятельности организма, его
органов, тканей и систем к меняющимся условиям среды
называют регуляцией. Регуляцию, обеспечиваемую нервной и
гормональной системами, называют нервно-гормональной. Нервная система,
организм осуществляют свою деятельность по принципу
рефлекса. Рефлекс — это закономерная ответная реакция организма на
раздражение рецепторов, осуществляемая с участием центральной
нервной системы.
Рефлекс осуществляется через специальное структурное
образование нервной системы, которое называют рефлекторной дугой.
В образовании рефлекторной дуги участвуют три вида нейронов:
чувствительные (рецепторные), контактные (промежуточные,
интернейроны), двигательные (эффекторные). Рецепторные
нейроны расположены вне центральной нервной системы, контактные
(вставочные) и двигательные — в ЦНС. Рефлекторная дуга может
быть образована разным числом нейронов (от трех до нескольких
сотен) всех трех видов. В свою очередь, в рефлекторной дуге
различают 5 звеньев: рецептор, афферентный (или центростреми-
60
тельный) путь, нервный центр, эфферентный (или
центробежный) путь и рабочий орган (или эффектор).
В последние годы учение о рефлекторной деятельности
организма дополнено новыми моментами, представлением об
обратной связи периферических исполнительных органов с
центральной нервной системой. Это привело к созданию П. К. Анохиным
новой концепции о работе ЦНС. Согласно этой концепции
центральная нервная система осуществляет свою деятельность по
принципу функциональных систем. Звено пусковой афферента-
ции (рецепторы и афферентные проводники) воспринимает
изменение среды и передает информацию в нервный центр, который
осуществляет анализ и синтез этой информации, определяет цель
к действию, решение и формирует программу действия, передает
ее на эфферентное звено и в акцептор действия. Программа
действия по эфферентному звену поступает к периферическим
исполнительным органам, которые осуществляют ответную реакцию
на действие программы. Ответная реакция характеризуется
определенным результатом действия, параметрами (объем, количество,
качество и др.). Параметры ответной реакции воспринимаются
звеном обратной афферентации (рецепторами звена) и
передаются в акцептор действия. В акцепторе действия осуществляется
сопоставление параметров действия с программой действия. Если
они совпадают, тогда программа действия становится
санкционирующей (обязательной). Если они не совпадают, то тогда
программа действия в центральном звене разрушается и формируется
новая программа действия. При формировании новой программы
действия используется дополнительная информация.
Занятие 5. Общие принципы деятельности организма.
Нервно-гуморальные механизмы регуляции деятельности
организма. Нейрон, его деятельность.
Рефлекс. Функциональная система
Цель занятия. Изучить общие принципы деятельности
организма, лежащие в основе ее нервно-гуморальные механизмы
регуляции; уяснить особенности строения нейрона, рефлекторный
принцип деятельности организма и деятельности органов и организма
животного по принципу функциональных систем (функций).
Объект исследования, материалы и оборудование. 1. Лягушки,
овца, овца с предварительно наложенной фистулой. 2. Рисунки и
схемы по теме. 3. Препаровальный набор, раствор Рингера,
пипетка, штатив с зажимом и пробковой пластинкой; 0,25, 0,5, 1%-ный
растворы серной кислоты, стаканы для воды и растворов серной
кислоты; кусочки фильтровальной бумаги в виде квадратиков
61
0,5... 1 см2, 1%-ный раствор новокаина; электрокимограф со
штативом и регистрирующим сокращения рубца приспособлением
(регистрирующая капсула, резиновая трубка, баллон, стеклянный
тройник, нагнетательный резиновый баллон).
Выполнение работы.
I. Исследование рефлекторной деятельности нервной системы.
Рефлекторные реакции удобно изучать на примере простейших
спинномозговых рефлексов лягушки (на спинальной лягушке,
т. е. лягушке с сохраненным спинным мозгом). Опыт начинают
через 10... 15 мин после удаления верхней челюсти у лягушки со
всеми отделами головного мозга (в первые минуты у лягушки
шоковое состояние). Лягушку за нижнюю челюсть свободно
подвешивают в штативе.
Раздражение рецепторов кожи вызывают пощипыванием кожи
пинцетом или путем накладывания на кожу небольшого кусочка
фильтровальной бумаги, смоченной 0,25, 0,5, 1,0%-ным
растворами серной кислоты. После каждого раздражения кислотой и
ответной реакции этот участок кожи промывают водой. Ответная
реакция проявляется в движениях с целью устранения действия
раздражителя или отстранения от раздражителя.
Если ответная реакция происходит, то этот факт свидетельствует
о рефлекторном механизме этой приспособительной реакции.
И. Исследование рефлекторной деятельности нервной системы
путем раздражения рецепторов кишечника пощипыванием или
легкими ударами пинцета (опыт Гольца).
Лягушку (спинальную) фиксируют на пробковой дощечке,
обнажают сердце и кишечник. Проводят наблюдение за реакцией
сердца (отмечают изменения числа сокращений в единицу
времени) при раздражении рецепторов кишечника пощипыванием или
легкими ударами.
Если ответная реакция происходит, то она свидетельствует о
рефлекторном механизме этой приспособительной реакции,
рефлекторном принципе регуляции деятельности внутренних
органов.
III. Исследование физиологической роли звеньев рефлекторной
дуги в осуществлении рефлекса.
Исследование роли отдельных звеньев рефлекторной дуги
проводят чаще на спинальной лягушке в определенной
последовательности.
Сначала наблюдают за проявлением рефлекса на раздражение
кожи голени путем наложения на нее кусочка фильтровальной
бумаги, смоченный 0,25...1%-ным раствором серной кислоты. После
этого лапку лягушки ополаскивают в стакане с водой.
С голени срезают кожу (удаляют рецепторы) и к обнаженной
мышце прикладывают фильтровальную бумагу, смоченную сер-
62
ной кислотой той же концентрации, что и в первом случае. Если
при этом ответная реакция не проявляется, то этот факт дает
основание для заключения, что роль рецепторов состоит в
восприятии действия раздражителя.
На другой лапке отпрепаровывают седалищный нерв (в составе
которого находятся афферентные и эфферентные волокна
рефлекторной дуги) и перерезают его. На кожу голени после
перерезки нерва накладывают фильтровальную бумагу, смоченную
серной кислотой. Если в этих условиях при действующих рецепторах
ответная реакция не проявляется, то этот факт дает основание для
заключения, что роль афферентного звена состоит в проведении
информации с рецепторов в нервный центр.
Центр рефлекторной дуги двигательного рефлекса сгибания
и разгибания конечностей располагается в спинном мозге. Для
определения его роли используют метод удаления
(разрушения). В этих целях в спинномозговой канал лягушки вводят
тупую иглу и разрушают спинной мозг. Затем раздражают
рецепторы кожи: фильтровальную бумагу, смоченную серной кислотой,
кладут на кожу спины или передних лапок и ведут наблюдение за
поведением лягушки. Если ответная реакция в этих условиях при
сохраненных рецепторах, афферентных и эфферентных
проводниках и исполнительных органах не проявится, то этот факт дает
основание для заключения, что роль нервного центра состоит в
восприятии информации с рецепторов и формировании
программы действия. Программа действия передается на
эфферентное звено, эффектор.
Ответьте на вопрос: как образуется рефлекторная дуга?
Нарисуйте схему рефлекторной дуги.
IV. Изучение влияния изменений условий внешней и внутренней
сред, вызывающих раздражение тех или иных рецепторных полей, на
некоторые системы и органы организма: желудок (мышцы) овцы на
раздражение рецепторов ротовой полости кормом или самой стенки
желудка баллоном (имитация наполнения желудка кормом).
Овце для раздражения рецепторов ротовой полости дают
жевать в течение 2...3 мин жгут из травы или сена. С целью
раздражения рецепторов стенки желудка в него вводят баллон и
заполняют 1...1,5 л воздуха. О реакции желудка судят по изменению его
сокращений. Сокращения записывают на кимографе с помощью
баллона, введенного в желудок, заполненного воздухом и
соединенного с регистрирующей капсулой: в течение 10 мин до
раздражения рецепторов и 30 мин после раздражения рецепторов.
Обратите внимание на амплитуду и частоту сокращений.
В чем проявляются эти реакции и как их называют? Каков их
биологический характер и смысл, механизм? Выражением чего
они являются?
63
5.3.2. ЦЕНТРАЛЬНАЯ НЕРВНАЯ СИСТЕМА. ФИЗИОЛОГИЧЕСКАЯ
РОЛЬ ЧАСТНЫХ ОБРАЗОВАНИЙ ЦЕНТРАЛЬНОЙ НЕРВНОЙ
СИСТЕМЫ
Центральная нервная система — это головной и спинной мозг.
Головной мозг включает задний мозг, или продолговатый мозг и
варолиев мост, средний мозг, ретикулярную формацию,
мозжечок, промежуточный мозг, лимбическую систему, подкорковые
ядра, кору больших полушарий.
Занятие 6. Физиология центральных звеньев функциональных
систем, нервных центров. Свойства нервного центра.
Координация нервных центров
Особенности рефлекторной деятельности нервной системы в
значительной степени обусловлены свойствами нервных центров
(одностороннее проведение возбуждения, замедленное
проведение возбуждения, суммация, трансформация, окклюзия,
последействие, утомление, тонус, посттетаническая потенция,
торможение), их координацией — взаимодействием нервных центров,
обеспечивающим согласованную деятельность (конвергенция,
иррадиация, сопряженная иннервация, индукция, «отдача», цепные
рефлексы, обратная связь, общий конечный путь, доминанта,
пластичность).
Цель занятия. Уяснить особенности деятельности (свойства)
нервных центров и сущность явления координации.
Объект исследования, материалы и оборудование. 1. Лягушки,
лошадь, овца, кролик, морская свинка, крупная лягушка. 2.
Рисунки и схемы по теме. 3. Кимограф с приспособлением для
графической регистрации сокращений рубца, индукционная
катушка, телеграфный ключ, простой ключ, переключатель, провода,
две пары вилочных электродов, электроды для раздражения
конечности животного; механический стержень с рукояткой,
манометром и секундомером; установка для раздражения одиночными
ударами индукционного тока; бинокулярная лупа; пробковая
дощечка; 0,25...0,5%-ный раствор серной кислоты, стерильный
шприц с иглами, 2%-ный раствор новокаина, звуковой генератор;
резиновый баллон с резиновой трубкой, манометром и
нагнетательным баллоном; перкуссионный молоточек, секундомер,
марля, вата, тонкая кисточка, игла; набор препаровальных
инструментов, штатив с пробкой, булавки, скальпель глазной;
кристаллики хлорида натрия, раствор Рингера, стакан с водой, 10%-ный
этиловый спирт.
64
Выполнение работы.
I. Определение свойства нервного центра — одностороннее
проведение возбуждения с афферентного звена на эфферентное звено
рефлекторной дуги.
От нервного центра аксоны от нейронов направляются на
периферию к исполнительным органам. От центров,
расположенных в спинном мозге, они проходят в составе вентральных
корешков. К нервному центру подходят аксоны рецепторных нейронов,
расположенных в ганглиях; дендриты этих нейронов
направляются к периферическим исполнительным органам, рецепторным
полям. Аксоны рецепторных нейронов проходят в составе
дорсальных корешков спинного мозга. Аксоны нейронов нервного центра
являются эфферентным звеном рефлекторной дуги, аксоны и
дендриты рецепторных нейронов — афферентным звеном
рефлекторной дуги.
Для определения свойства нервного центра — одностороннего
проведения возбуждения с афферентного звена на эфферентное
звено рефлекторной дуги — берут крупную лягушку, подвергают
ее общей анестезии, фиксируют на пробковой пластинке спинкой
вверх (рис. 15). Разрезают кожу по средней линии спины и отпре-
паровывают мышцы по обеим сторонам позвоночника. Края
разреза расширяют специальными широкими пластинками. Ватными
тампонами убирают кровь. Надрезают связку между копчиком и
последним поясничным позвонком. В спинномозговой канал
осторожно вводят браншу малых ножниц, перерезают с обеих сто-
Рис. 15. Перерезка спинномозговых корешков
у лягушки:
а — после операции (края разреза расширены
металлическими пластинками); #—препаровка корешков
(увеличено); в — схема к опыту (стрелками указаны
перерезанные корешки), г —общий вид
оперированной лягушки (слева перерезаны двигательные
корешки, справа — соответствующие чувствительные)
65
рон дужки последних четырех позвонков и удаляют их. При этом
обнажается спинной мозг. Используя бинокулярную лупу для
увеличения объекта исследования, стеклянными крючками
приподнимают 7, 8 и 9-й правые дорсальные корешки. На них хорошо
видны спинномозговые узлы. Корешки перерезают ножницами.
На левой стороне дорсальные корешки отодвигают в сторону,
приподнимают и перерезают вентральные корешки.
Слабым индукционным током раздражают центральный конец
перерезанного вентрального корешка и наблюдают за состоянием
мышц задней лапки: реакция отсутствует. Раздражают
центральный конец перерезанного дорсального корешка и наблюдают за
состоянием мышц лапки: сокращаются мышцы.
Отмеченные факты дают основание для заключения, что нервный
центр проводит возбуждение только в одну сторону — с
афферентного звена на эфферентное звено.
II. Определение свойств нервного центра — суммации,
последействия, явления координации — иррадиации.
Определяют особенности двигательной реакции животного в
ответ на слабое одиночное и ритмическое сильное электрическое,
механическое или химическое раздражение рецепторов кожи
конечности.
Исследовать свойства нервного центра — суммацию и
последействие — можно на крупных животных и на таламической лягушке.
Крупное животное (корова, лошадь, овца) предварительно
фиксируют в станке и прикрывают ему глаза. Конечность в
области венчика раздражают надавливанием специальным
механическим стержнем с рукояткой, манометром и секундомером или с
помощью установки для раздражения одиночными ударами
индукционного тока. Нельзя наносить бесцельные раздражения.
Определяют пороговую величину механического или электрического
раздражителя, вызывающего рефлекторное сгибание конечности.
Затем силу раздражителя уменьшают до такой величины, при
которой одиночное раздражение не вызывает рефлекторного
сгибания конечности. Затем конечность раздражают раздражителем
такой силы часто (60 раздражений в 1 мин). Отмечают время начала
раздражения и время появления ответной реакции. Появление
ответной реакции является свидетельством суммации раздражений
подпороговой силой раздражителя (в основе ее лежит повышение
возбудимости нервного центра после каждого раздражения, в
результате какой-то очередной подпороговый раздражитель
становится пороговым).
При проведении исследований на таламической лягушке
(срезают лягушке верхнюю челюсть позади глаз) можно
определить временную и пространственную суммации. Лягушку
подвешивают на штативе. На одной из задних лапок закрепляют
66
электроды от вторичной индукционной катушки или от
стимулятора. Действуют на лапку 2...3 раза редкими одиночными
раздражениями подпороговой силы и наблюдают за реакцией
лягушки. Одиночное действие раздражителя подпороговой силы не
вызывает ответной реакции. Затем действуют на лапку частыми
одиночными раздражителями и наблюдают за реакцией. Если
последует ответная реакция (сгибание конечности), то этот факт
дает основание считать, что нервный центр обладает свойством
суммации.
Для исследования свойства последействия на лапку лягушки
или на конечность крупного животного действуют сильным
сверхпороговым раздражителем и наблюдают за ответной реакцией.
Одиночное действие раздражителя пороговой силы вызывает
сгибание и вслед за ним разгибание конечности. При действии
раздражителя сверхпороговой силы сгибание и разгибание
конечности осуществляются несколько раз после прекращения действия
раздражителя. Этот факт свидетельствует о сохранении
возбуждения нервного центра какое-то время и после прекращения
действия раздражителя на животное (двигательный центр), т. е. о
явлении последействия. В этом опыте часто в ответную реакцию
включаются все конечности. Такая реакция является следствием
распространения возбуждения на другие отделы нервного центра
и свидетельствует о явлении иррадиации во взаимодействии
нервных центров — координации.
Чем обусловлены различные реакции на слабое и сильное
раздражения? Какие свойства нервных центров характеризуют
отмеченные особенности реакций?
При решении задачи дополнительное раздражение наносят
путем наложения закрутки на губу (у лошади) или ухо (у овцы),
сжатия носовой перегородки (у коровы), наложения зажима на
переднюю конечность (у лягушки).
С чем связано изменение времени рефлекса в этих условиях?
Какое явление координации характеризует отмеченное изменение
времени рефлекса?
III. Определение свойства нервного центра — тонуса.
Все нервные центры постоянно находятся в состоянии
некоторого возбуждения — тонуса. Тонус нервного центра можно
определить путем отведения от него биологических токов. Тонус
нервного центра проявляется и в некотором возбуждении
периферических исполнительных органов, с которыми он связан
(двигательного центра — некоторое сокращение мышц — тонус
мышц, пищевого центра — небольшое отделение пищеварительных
соков). Определяют, как изменится положение задней конечности
у животного после подавления функции седалищного нерва.
Исследование можно провести на кролике, морской свинке
67
или предварительно дакапитированной лягушке. Обращают
внимание на положение задних конечностей у животных в обычных
условиях и при условии, когда оно приподнято и задние
конечности не касаются поверхности. Затем с помощью шприца с
раствором новокаина делают блокаду седалищного нерва (в седалищном
нерве находятся нервные волокна, связывающие двигательный
нервный центр с мышцами задних конечностей) с внутренней
стороны бедра одной конечности. Через 10... 15 мин сравнивают
положение нормальной и блокированной конечностей. После
блокады седалищного нерва прекращается поток импульсов от
центра к мышцам, мышцы удлиняются, конечность
выпрямляется.
Исследование тонуса нервного центра можно провести на тала-
мической лягушке. Лягушку подвешивают на штативе.
Наблюдают за расположением отделов конечностей. Отмечают, что обе
лапки слегка полусогнуты в коленном и скакательном суставах,
пальцы обеих лапок находятся на одинаковом уровне. Затем на
одной из лапок отпрепаровывают седалищный нерв и перерезают
его. Отмечают, какие изменения произошли в расположении
отделов лапки после перерезки нерва. Исчезновение тонуса мышц
сопровождается расслаблением мышц, удлинением лапки.
С чем связано изменение положения конечности в этих
условиях? Какое свойство нервного центра характеризует отмеченное
изменение положения конечности?
IV. Определение свойства нервного центра — торможения.
Наряду с возбуждением нервному центру свойственны
торможение, ослабление или прекращение деятельности, активный
процесс задержки возбуждения. Открытие процесса торможения в
ЦНС (центральное торможение — результат действия тормозных
нейронов или синапсов, которые продуцируют тормозные
медиаторы) принадлежит И.М.Сеченову (1862). Первичное
торможение в ЦНС обеспечивается специальными тормозными
нейронами. Вторичное торможение развивается в тех же нейронах, что и
возбуждение, в результате изменения свойств мембран. Оно
может быть пессимальным (при неоптимальной силе и частоте
поступающих импульсов) и торможением вслед за возбуждением в
результате сильной следовой гиперполяризации. Первичное
торможение, возникающее на пресинаптической мембране,
называют пресинаптинеским, возникающее на постсинаптической
мембране — постсинаптическим.
Исследование проводят на лягушке. Выясняют, как изменится
время рефлекса сгибания задней конечности у лягушки при
условии раздражения ее раствором серной кислоты после
предварительного раздражения промежуточного мозга кристалликом
поваренной соли (центральное торможение по И. М. Сеченову) (рис. 16).
68
а б в г д
Рис. 16. Схема опыта И. М. Сеченова для демонстрации явлений внутрицентрального
торможения [с раздражением зрительных бугров (таламуса) у лягушки]:
а — фиксация лягушки и начало операции; б— вскрытый головной мозг; в — головной мозг
лягушки: 7 —линия разреза на уровне зрительных бугров (таламуса) — сеченовский разрез; г —
до наложения на зрительные бугры кристаллика соли (NaCl) и д — после наложения
Лягушку анестезируют 10%-ным раствором этилового спирта,
завертывают ее в марлевую салфетку так, чтобы голова оставалась
свободной. Берут ее в левую руку и одновременно поддерживают
указательным пальцем той же руки голову снизу. Малыми
остроконечными ножницами делают поперечный разрез кожи,
отступив несколько назад от носовых отверстий. После этого надрезают
кожу спереди назад вначале над одной, а затем над другой боковой
поверхностью головы до места соединения головы с туловищем.
Откидывают кожный лоскут назад и отрезают его поперечным
разрезом. Ватой протирают обнаженные кости черепа и
рассматривают просвечивающие через них отделы головного мозга.
Ножницами делают поперечный разрез черепной коробки позади
носовых отверстий по переднему краю разреза кожи. Конец бранши
малых остроконечных ножниц осторожно вводят во вскрытую
поперечным разрезом полость черепа над мозгом, прижимая острие
бранши ножниц изнутри к боковой поверхности крышки черепа.
Разрезают кости черепа до заднего конца полости черепа сначала с
одной, а затем с другой верхнебоковых поверхностей. Пинцетом
захватывают передний свободный край костной пластинки,
приподнимают ее вверх и отрезают по заднему краю. Посредством
69
этой операции, не повреждая головного мозга, обнажают
поверхность больших полушарий, промежуточный и частично средний
мозг. Поверхность мозга осушают маленькими ватными
шариками, рассматривают отделы мозга. Глазным острым скальпелем
перерезают мозг поперек по заднему краю больших полушарий на
уровне промежуточного мозга. Удаляют из полости черепа
большие полушария головного мозга. Лягушку подвешивают на
штативе, прикрепляя ее булавками за обе челюсти к пробке, и
оставляют висеть, пока не кончится действие наркоза и
восстановятся рефлексы.
Опыт проводят в следующей последовательности:
к коже задней лапки прикладывают кусочек фильтровальной
бумаги, смоченной 0,25...0,5%-ным раствором серной кислоты, и
определяют время рефлекса. После ответной реакции лапку
тщательно ополаскивают водой;
поверхность разреза мозга и черепную полость тщательно
осушают ватными шариками и на поверхность разреза мозга, на
зрительные бугры, кладут кристаллик труднорастворимого хлорида
натрия (каменной соли). Через 1 мин к коже задней лапки вновь
прикладывают кусочек фильтровальной бумаги, смоченной
0,25...0,5%-ным раствором серной кислоты, и определяют время
рефлекса. После ответной реакции ополаскивают лапку водой,
удаляют кристаллик хлорида натрия и несколько раз поверхность
мозга обмывают раствором Рингера;
спустя 5... 10... 15 мин после удаления раздражителя опыт
повторяют, раздражая заднюю лапку лягушки 0,25...0,5%-ным
раствором серной кислоты; в каждом случае определяют время рефлекса
и убеждаются, что оно соответствует норме.
V. Определение явления координации — индукции.
Сильное возбуждение одного нервного центра наводит на
соседние центры процесс торможения (отрицательная индукция), а
торможение нервного центра наводит на соседние центры
процесс возбуждения (положительная индукция).
Выясните, изменяются ли и как характер и интенсивность
сокращений (двигательной функции) рубца у жвачных,
обусловленных рефлекторными влияниями содержимого предже-
лудков, при более сильном возбуждении других нервных
центров (при сильных звуковых раздражениях, раздражении других
висцерорецепторов, вызывающих специфические
рефлекторные акты).
Исследование можно провести на овце с предварительно
наложенной фистулой рубца. Открывают фистулу рубца, вставляют в
рубец баллон, соединяют его с регистрирующей капсулой рубца и
заполняют воздухом. В течение 10 мин записывают сокращения
рубца в обычных условиях. Затем, не прекращая записи и наблю-
70
дений, наносят сильное звуковое раздражение, используя
звуковой генератор, или производят раздражение рецепторов прямой
кишки путем нагнетания воздуха в баллон, предварительно
вставленный в прямую кишку (давление не должно превышать
2,6...3,9кПа).
Если реакция рубца (количество и амплитуда сокращений)
изменится, то объясните, каков механизм (причина) этих явлений и
выражением чего они являются.
Исследование явления индукции можно провести и на тала-
мической лягушке. Лягушку подвешивают на штативе. На кожу
задней лапки прикладывают кусочек фильтровальной бумаги,
смоченной 0,5%-ным раствором серной кислоты, и определяют
время рефлекса. Фильтровальную бумагу убирают, ополаскивают
кожу водой. Затем одну из лапок сильно сдавливают пинцетом, а
на кожу другой лапки прикладывают кусочек фильтровальной
бумаги, смоченной 0,5%-ным раствором серной кислоты, и
вновь определяют время рефлекса. Торможение нервного центра
проявляется уменьшением силы ответной реакции, увеличением
времени рефлекса.
Если реакция на раздражение кожи лапки изменится, то
объясните, каков механизм этого явления. Каковы биологический
смысл и практическое значение знаний подобных явлений?
Явление положительной индукции хорошо проявляется у
крупных животных. У лошадей раздражение кожи в области
венчика надавливанием специальным механическим стержнем
вызывает сгибание конечности. Такое же раздражение рецепторов
кожи венчика вслед за наложением закрутки на верхнюю губу,
сопровождающееся сильным возбуждением другого нервного
центра, не вызывает реакции.
Контрольные вопросы и задания. 1. Что является основным структурным
элементом нервной системы? 2. Какова структура нейрона? 3. Как
классифицируют нейроны? 4. Как соединены между собой нейроны? 5. Что понимают под
нервным центром? 6. Нарисуйте схему рефлекторной дуги и укажите
локализацию нервного центра. 7. Каковы свойства нервных центров? 8. Опишите
механизм замедленного проведения возбуждения в нервном центре. 9. Каков
механизм суммации возбуждений в нервном центре? 10. Каков механизм
рефлекторного последействия? 11. Каков механизм утомления нервных центров?
12. Каков механизм тонуса нервных центров? 13. Каковы механизм и виды
торможения в центральной нервной системе? 14. Что понимают под
координацией рефлекторных центров? 15. В чем суть конвергенции, окклюзии и принципа
общего конечного пути? 16. В чем суть иррадиации возбуждения и каков
механизм ограничения иррадиации возбуждения? 17. Что такое реципрокная
(сопряженная) иннервация и в чем ее суть? 18. В чем суть явления индукции?
19. В чем суть феномена «отдачи» и ритмических рефлексов? 20. В чем суть
принципа обратной связи? 21. В чем суть принципа доминанты и каковы
основные свойства доминантного очага возбуждения? 22. В чем суть
пластичности нервных центров и компенсаторных приспособлений? 23. Взаимодействие
каких процессов в центральной нервной системе составляет суть
координации?
71
Занятие 7. Физиологическая роль отделов и структур
центральной нервной системы
в функциональных системах организма
Отделы функциональных систем (нервные центры) имеют свое
представительство почти в каждом отделе центральной нервной
системы. Роль отделов нервного центра в обеспечении
приспособительных реакций увеличивается по мере возрастания места
расположения отдела нервного центра в отделах центральной
нервной системы от низшего к высшему, от спинного мозга до
больших полушарий головного мозга.
Цель занятия. Уяснить особенности строения
структурно-физиологических образований центральной нервной системы,
специфическую роль их в регуляции физиологических процессов;
освоить методы изучения роли структурно-физиологических
образований центральной нервной системы.
Объект исследования, материалы и оборудование. 1. Лягушки,
ягненок или козленок, лошадь, голубь с удаленными
полушариями головного мозга, морская свинка, кролик, кошка, собака,
корова. 2. Рисунки и схемы по теме. 3. Электронный стимулятор,
ножницы с острыми концами, изогнутый глазной пинцет, глазной
скальпель, иглодержатель, хирургические иглы, стеклянный крючок,
нитки, вата, препаровальная пластинка, булавки; эфир, 0,5%-ный
раствор серной кислоты, таз с водой; комплект приборов для
физиологического исследования нервной системы;
электроэнцефалограф (компьютерная биологическая установка «Конан»),
электроды (шлем с электродами) и электродная паста для записи
электроэнцефалограммы (ЭЭГ).
Выполнение работы. Исследование роли отделов центральной
нервной системы в осуществлении полноценных
приспособительных реакций с большой демонстративностью можно
провести на примере проявления двигательной реакции, роли всех
отделов — на примерах проявления соматических и вегетативных
рефлексов.
I. Определение физиологической активности различных
отделов центральной нервной системы у животного по проявлению
рефлексов — спинного, брюшного, анального, перинеального,
подошвенного, роговичного, мигательного, жевательного,
чихательного.
Проявления рефлексов лучше исследовать на молодых лошадях
и коровах. Подходя к животному, следует соблюдать меры
предосторожности.
Корнеальный, или роговичный, рефлекс
возникает при легком прикосновении к роговице глаза тонким
кусочком ваты: проявляется смыканием век.
72
Рефлекс холки возникает и проявляется при легком
прикосновении к коже холки: происходит сокращение подкожной
мышцы.
Рефлекс спины возникает и проявляется при
сдавливании рукой складки кожи в области поясницы или пощипывании
кожи по ходу сагиттальной линии позвоночника: происходят
прогибание спины и вращательные движения хвоста.
Брюшной рефлекс возникает и проявляется при
штриховом раздражении (надавливании) кожи брюшной стенки
рукояткой перкуссионного молоточка: происходит сокращение
брюшных мышц.
Рефлекс хвоста возникает и проявляется при легком
уколе иглой кожи в области промежности: происходит
подтягивание корня хвоста к промежности.
Анальный рефлекс возникает при легком уколе иглой
кожи в области ануса: происходит сокращение наружного
анального сфинктера.
Глазосердечный рефлекс возникает и проявляется
при надавливании на глазное яблоко: происходит урежение
сокращений сердца. Оптимальная сила давления на глазное яблоко
составляет 20...30 мм рт. ст. В этих целях используют наглазничную
повязку, эластическую камеру и манжету из комплекта
инструментов Шаптала (рис. 17). Реакцию считают оптимальной, если
число сердечных сокращений урежается на 25 % исходного.
Губо-ушно-сердечный рефлекс возникает и
проявляется при сдавливании губы или ушной раковины закруткой
(давление должно быть 20...30 кг): происходит урежение сокращений
сердца. В исследованиях используют закрутку с динамометром.
Если все перечисленные реакции проявляются выраженно, то
можно сделать заключение о высокой активности деятельности
центральной нервной системы.
II. Исследование проявлений статических тонических рефлексов;
определение роли продолговатого и среднего мозга в осуществлении
тонических рефлексов.
Статические и статокинетические рефлексы осуществляются с
участием спинного, продолговатого (рефлексы позы), среднего
(выпрямительные рефлексы) мозга.
Проявления тонических (статических и статокинетических)
рефлексов: позы с рецепторов вестибулярного аппарата, мышц
шеи; установочных рефлексов с рецепторов вестибулярного
аппарата, мышц шеи и кожи туловища; статокинетических рефлексов
с рецепторов вестибулярного аппарата на мышцы глаз, головы и
конечностей можно исследовать на морской свинке, кролике,
кошке, лягушке, но лучше на крупных животных (овца). Обратите
внимание на положение туловища, головы и всех конечностей
73
Рис. 17. Комплект приборов и инструментов для исследования нервной системы
и анализаторов животных (по И. П. Шаптала):
а, б, в — динамометр с рукояткой для определения болевой чувствительности; г —
наконечники разной формы; д — инструмент для определения тактильной чувствительности и
исследования кожного анализатора; е — инструмент для дозированного раздражения рецепторов кожи и
слизистых оболочек; ж — молоток для определения сухожильных рефлексов и дермометрии;
з — прибор для эндоскопии и определения зрачкового рефлекса; и — наглазная повязка; к —
прибор для определения губо-ушно-сердечного рефлекса
(тонус мышц сгибателей и разгибателей) животного в обычных
условиях; на положение конечностей (тонус мышц сгибателей и
разгибателей) при положении животного на спине (теменем вниз),
при опускании головы, запрокидывании головы, повороте головы
набок (тонические рефлексы); на положение головы при
поднимании животного за таз, поворачивании таза вокруг продольной
оси вправо и влево (установочные рефлексы на положение
головы); на положение туловища по отношению к голове при
положении животного «на боку» и поворачивании головы вокруг
горизонтальной оси теменем вверх (установочные рефлексы с рецеп-
74
торов шеи на туловище); на изменение положения туловища при
переводе животного в положение набок и удерживании руками
головы без и при наложении на бок животного деревянной
дощечки с грузом, равным половине массы тела подопытного животного
(установочные рефлексы с кожной поверхности); на тонус мышц
разгибателей конечностей при сгибании одной передней
конечности и на положение конечностей при быстром опускании
животного, при быстром подъеме (статокинетические рефлексы).
Опишите эти реакции и их механизм, физиологическое значение.
III. Исследование роли отделов центральной нервной системы в
регуляции двигательных реакций, обеспечении позы.
Роль различных отделов центральной нервной системы
убедительно проявляется в изменениях позы и двигательных реакций
животного после удаления того или иного отдела центральной
нервной системы. Определяют изменения позы и двигательных
реакций животного (защитные, локомоторные и установочные)
после последовательного удаления больших полушарий
головного мозга, мозжечка, среднего, продолговатого и спинного мозга.
По характеру и степени изменений двигательных реакций и позы
делают заключение о роли того или другого отдела центральной
нервной системы в регуляции двигательных реакций.
Исследование проводят на
млекопитающих животных или птицах с предварительно
удаленными полушариями головного мозга
или мозжечка. Обратите внимание на позу
животного, двигательную активность, тонус
мышц, координацию движений, проявление
реакций на условные и безусловные
раздражители, проявление защитных, установочных
и локомоторных рефлексов.
У лягушек, предварительно изучив
топографию отделов головного мозга и оценив
двигательную активность, удаляют большие
полушария (рис. 18): наблюдают за
двигательной активностью, отмечая, изменилась
или нет поза животного.
У крупных лягушек после вскрытия
черепа удаляют разные участки мозга. Готовят
Рис. 18. Строение головного мозга лягушки и линии
разреза:
/—большие полушария; 2— промежуточный мозг; 3— средний
мозг; 4— мозжечок; 5— продолговатый мозг; 6— спинной мозг;
/—линия разреза по отделению больших полушарий; //—
линия разреза на границе между зрительными долями среднего
мозга и мозжечком; III— линия продольного разреза мозжечка —
разделение его на две половины
75
препаровальный набор, пробковую пластинку, деревянную
пластинку, индукционную катушку, ключ-рубильник, переносные
электроды, сосуд с водой, марлевые салфетки, ватные шарики,
иглу хирургическую с шелком. Лягушку заворачивают в
марлевую салфетку (оставив свободной голову), берут в левую руку,
фиксируя указательным пальцем голову. На середине черепа
скальпелем делают поперечный разрез кожи. Продвинув в разрез
браншу ножниц, рассекают кожу вперед и назад так, чтобы поле,
освобожденное от кожи, имело ромбовидную форму. Кожные
лоскуты разводят в стороны и укрепляют стежками. Максимально
согнув голову лягушки, подрезают мышцы и желтую связку, затем
вводят браншу ножниц в обнажившееся затылочное отверстие и,
направляя острие так, чтобы оно касалось внутренней
поверхности черепа, двумя дуговыми разрезами вырезают костный лоскут с
обеих сторон и отгибают его пинцетом. Кровотечение
останавливают тампонадой. Рассмотрите строение мозга.
Удаление больших полушарий. Прижав голову
лягушки к пластинке, глазным скальпелем отделяют большие
полушария по их заднему краю и удаляют. Рану обсушивают ватными
шариками, костный лоскут возвращают на место, на кожу
накладывают швы. Животное с сохраненным промежуточным мозгом
называют таламическим.
Через 10...15 мин приступите к наблюдениям. Таламическая
лягушка сохраняет обычную позу и отличается от нормальной
лишь ограниченностью спонтанных движений. Все рефлексы у
нее сохранены. При попытке оттянуть лапку пинцетом лягушка
подтягивает ее. При раздражении лапки индукционным током
она реагирует координированным прыжком. Если ее положить
на спину, она снова переворачивается на брюшко. Если
посадить лягушку на дощечку и медленно переворачивать дощечку
на ребро, лягушка, удерживая равновесие, постепенно
переползает на противоположную сторону. Таким образом, у
лягушки с удаленными полушариями головного мозга сохранены
все тонические, защитные и координированные двигательные
реакции.
Удаление промежуточного и среднего мозга.
У лягушки с обнаженным головным мозгом делают поперечный
разрез на границе между зрительными долями среднего мозга и
мозжечком. Зрительные доли вместе с промежуточным мозгом и
большими полушариями удаляют, рану обсушивают ватными
шариками, костный лоскут возвращают на место, на кожу
накладывают швы. Лягушку с сохраненными мозжечком и продолговатым
мозгом называют бульварной, или булъбо-спиналъной.
К наблюдениям приступают через 30...40 мин. Поза у лягушки
при посадке неправильная. Из всех установочных и локомоторных
76
рефлексов сохраняется лишь рефлекс переворачивания. При
сильных раздражениях она не реагирует прыжком, а лишь
ползает. Посаженная на медленно переворачиваемую дощечку, лягушка
падает.
Удаление половины мозжечка. Продольным
разрезом разделяют мозжечок на две половины и одну из них удаляют.
К наблюдениям приступают через 15...20 мин. Мышечный
тонус у лягушки распределяется несимметрично: туловище
изгибается в сторону удаленной части мозжечка, конечности этой
стороны вытянуты. При нанесении раздражения лягушка перемещается
по кругу в сторону повреждения. Особенно это наглядно, если
поместить лягушку в сосуд с водой (манежные плавательные
движения).
Удаление продолговатого мозга. У лягушки
после пересечения спинного мозга сразу под продолговатым и
удаления головного мозга исчезают все тонические и локомоторные
рефлексы, в том числе рефлекс переворачивания. Мышцы тела
расслабляются, животное остается пассивным в любом приданном
ему положении. Дыхательные движения отсутствуют.
Двигательные реакции при механическом и химическом раздражении
характерны для спинальной лягушки.
Производят раздражение (сдавливание) задней конечности и
наблюдают при этом за характером ответной реакции.
Проявляются сгибание и разгибание конечности (определите, какой это
рефлекс). Затем раздражают наружную поверхность верхней трети
бедра путем наложения квадратика фильтрованной бумаги,
смоченной 1%-ным раствором серной кислоты, наблюдая, сбросит
или нет лягушка раздражающий агент. Проявляется двигательная
реакция, обеспечивающая устранение раздражителя (определите,
какая это реакция).
IV. Электрофизиологические методы изучения роли структурно-
физиологических образований центральной нервной системы.
Роль различных отделов центральной нервной системы
животного проявляется в изменении биоэлектрической активности
мозга, что связано с происхождением и значением суммарной
биоэлектрической активности мозга или электроэнцефалограммы
(ЭЭГ) и механизмами, лежащими в основе ее изменений при
различных состояниях животного. Для исследования в основном
применяют электрофизиологические методы, которые связаны с
изучением высших отделов головного мозга и в первую очередь
коры больших полушарий.
Наиболее широко распространен способ регистрации биотоков
мозга непосредственно с поверхности черепа с помощью
электродов, накладываемых на кожу головы. Биоэлектрическая
активность мозга на ЭЭГ выражается периодическими и апериодичес-
77
кими волнами различного вольтажа и частоты. Выделяют
несколько видов периодических колебаний биопотенциала коры
головного мозга: альфа-, бета-, тета-, дельта- и другие волны, которые
характеризуют состояние организма животного. По характеру
суммарной биоэлектрической активности делают заключение о роли
того или другого отдела центральной нервной системы в
регуляции тех или иных приспособительных реакций.
Регистрацию электроэнцефалограммы проводят в специальной
экранированной камере, которая предохраняет животное от
воздействия внешних электрических и магнитных полей.
Животное (лошадь, корову, собаку, кролика) фиксируют (в
зависимости от вида) в положении стоя, лежа или сидя в станке или
на столике. Укрепляют специальные электроды, смоченные
электропроводной пастой или гелем, на голове исследуемого
животного с помощью резинового бинта или шлема. Зона прикрепления
электродов зависит от задач исследования мозга. Ведут запись
электроэнцефалограммы с помощью биологической лаборатории
с компьютерной программой «Конан» или другого вида
энцефалографа.
Запись электроэнцефалограммы проводят в покое и при
разного вида воздействиях: для регистрации вызванных потенциалов
коры — при действии зрительного (свет лампы) или звукового
(звонок) раздражителя. В отделах коры больших полушарий в
ответ на действия зрительных и звуковых раздражителей возникают
биопотенциалы с различными латентными периодами и
различной конфигурации.
После распечатки на принтере или визуально с экрана
компьютера проводят анализ энцефалограммы, выделяя характерные
виды волн, их диапазоны и амплитуду. В тетради зарисовывают
выявленные волны ЭЭГ или вклеивают полученные при
распечатке ээг.
Контрольные вопросы и задания. 1. Назовите методы исследования функций
центральной нервной системы. 2. Какие виды деятельности выполняют
спинномозговые корешки? 3. Какие виды деятельности выполняет спинной мозг? 4.
Назовите восходящие и нисходящие проводящие пути спинного мозга. 5. Назовите
рефлексы спинного мозга. 6. Назовите проводящие пути продолговатого мозга.
7. Какие виды деятельности осуществляет продолговатый мозг? 8. Какие
структуры входят в средний мозг? 9. Какие виды деятельности выполняет четверохолмие?
10. Какие виды деятельности выполняет черная субстанция? 11. Какие виды
деятельности выполняет красное ядро? 12. Как принято разделять тонические
рефлексы? 13. Какова структурная организация ретикулярной формации? 14. Какие
деятельные системы различают в ретикулярной формации? 15. Какова роль
мозжечка? 16. Какие виды деятельности выполняет таламус? 17. Какова роль
бледного ядра? 18. Какова роль полосатого ядра? 19. Что понимают под сенсорными,
ассоциативными и моторными зонами коры больших полушарий? 20. Как
осуществляется кортикальный контроль двигательных реакций? 21. Что такое
биопотенциалы мозга, каково их происхождение и виды? 22. Что такое энцефалограмма и
78
энцефалография? 23. Какие существуют методы исследования биопотенциалов
мозга? 24. Какие виды волн различают в энцефалограмме?
5.3.3. ВЕГЕТАТИВНЫЙ ОТДЕЛ НЕРВНОЙ СИСТЕМЫ
Вегетативный отдел нервной системы представлен
парасимпатической, симпатической и метасимпатической (энтеральной)
иннервацией. Каждая из них имеет определенные особенности.
Вегетативная нервная система образована вегетативными
нейронами, расположенными в среднем, продолговатом и спинном
мозге, а также в ганглиях на периферии. Для нее характерен двух-
нейронный принцип образования. Первые нейроны расположены
в среднем, продолговатом и спинном мозге, составляя
центральную часть вегетативной нервной системы.
Периферическим звеном парасимпатической и симпатической
иннервации являются аксоны первых нейронов (нервные
волокна), которые выходят из ЦНС и заканчиваются обязательно на
вторых нейронах, объединенных в ганглии (узлы), ганглии,
аксоны вторых нейронов (ганглий), которые идут к иннервируемому
органу. К периферической части относят и висцеральные аффе-
ренты (рецепторные нейроны, расположенные в ганглиях, их
отростки — чувствительные нервные волокна), проходящие в
составе вегетативных нервов — блуждающих, тазовых, грудных
внутренностных, чревных и др.
Вегетативный отдел нервной системы обеспечивает регуляцию
деятельности внутренних органов, сосудов, потовых желез, а
также регулирует трофику (питание) всех структур.
Через симпатические и парасимпатические нервные волокна
осуществляются сосудистые, трофические и функциональные
влияния.
Высшие нервные центры вегетативного отдела нервной
системы находятся в гипоталамусе: в передних ядрах — центры
парасимпатической иннервации, в задних ядрах —центры
симпатической иннервации, имеют представительство в коре больших
полушарий головного мозга.
Занятие 8. Физиология вегетативного отдела
нервной системы, его роль
в функциональных системах организма
Цель занятия. Изучить особенности строения и специфику
деятельности вегетативного отдела нервной системы.
Объект исследования, материалы и оборудование. 1. Лягушки,
собака, кролик, морская свинка, белая мышь, овца или собака с
фистулой кишечника. 2. Рисунки и схемы. 3. Препаровальный на-
79
бор, кимограф, писчик Энгельмана со штативом, канюля Штрау-
ба; индукционная катушка, электроды, аккумулятор или
электронный импульсатор; 3 глазные пипетки, операционный набор,
оборудование и материалы для общей анестезии,
вивисекционный столик; раствор Рингера—Локка, ванна для погружения
животного или кишечника, фонокардиограф; сфигмограф,
фонендоскоп; стерильный шприц с иглами, стерильные растворы норад-
реналина (1 : 1000) и ацетилхолина (1 : 10 000), карбохолин.
Выполнение работы.
I. Исследование рефлекторного принципа деятельности
вегетативного отдела нервной системы.
Деятельность вегетативного отдела нервной системы
осуществляется по принципу рефлексов: висцеро-висцерального,
висцеро-кожного, кожно-висцерального, висцеро-соматическо-
го. Рефлекторный принцип деятельности вегетативного отдела
нервной системы выраженно проявляется в простых опытах. У
животного раздражают рецепторы кишечника и ведут наблюдения
за сокращениями сердца. Изменение частоты сокращений
сердца в этих условиях может возникать только рефлекторно: с
рецепторов кишечника по афферентным нервным волокнам,
спинному и продолговатому мозгу (сердечный центр), эфферентным
нервным волокнам блуждающих нервов на сердце.
Исследование можно проводить на лягушке, овце или другом
виде животных с предварительно наложенной фистулой
кишечника.
1. Опыт на лягушке. У лягушки удаляют все отделы головного
мозга, кроме продолговатого. Собирают цепь для раздражения
тканей электрическим током. Фиксируют лягушку на пробковой
пластинке брюшной стороной кверху и обнажают сердце.
Соединяют верхушку сердца с рычажком Энгельмана и записывают
исходную кардиограмму. Затем вскрывают брюшную полость и
извлекают петлю кишечника. Записывают кардиограмму, производя
легкое постукивание по кишечнику пинцетом, и наблюдают за
изменением деятельности сердца. Эффект проявляется урежением
или остановкой сокращений сердца. После нормализации
деятельности сердца повторяют ход работы, но кишечник
раздражают электрическим током. Далее разрушают продолговатый мозг и
повторяют весь опыт.
2. Опыт на млекопитающем животном с фистулой кишечника.
Животное фиксируют в станке и через фистулу вводят в кишечник
баллон. Определяют деятельность сердца по числу сердечных
сокращений с помощью фонендоскопа, фонокардиографа или
электрокардиографа до и при механическом раздражении стенки
кишечника путем нагнетания в баллон воздуха, создавая давление
5,3...7,9кПа.
80
Если работа сердца в этих условиях изменяется, то необходимо
пояснить, каков механизм этих изменений. Как называют эту
ответную реакцию? Какие еще подобные реакции осуществляются в
организме и каково их физиологическое значение?
II. Исследование регуляторных влияний через парасимпатические
волокна блуждающих нервов и симпатические волокна.
Регуляторные влияния вегетативных нервных центров на
органы осуществляются через парасимпатические волокна и
симпатические волокна нервов. О характере и степени их влияния судят
по эффектам сердца на раздражение периферического конца
предварительно перерезанного нерва.
Определяют характер реакции сердца (изменение частоты и
силы сокращений) при раздражении в течение 5...30 с
периферического конца предварительно перерезанного блуждающего нерва
индукционным током.
Устанавливают, сохранится ли реакция сердца на раздражение
механорецепторов кишечника после предварительного
выключения влияния блуждающих нервов раствором атропина (атропин
блокирует передачу возбуждения в мионевральном синапсе).
Подготовить для исследования лягушку, как в первом опыте.
Обнажают сердце таким образом, чтобы передний разрез кожи
прошел по переднему краю нижней челюсти и открылась бы
нижняя поверхность рта. Ориентиром для нахождения вагосимпатичес-
кого нерва служат два нерва: языкоглоточный и подъязычный. По
ним спускаются к углу челюсти, рассекают мышцы и связки:
плечевой нерв отчетливо виден. Выше него находится
сосудисто-нервный пучок, над которым делает петлю языкоглоточный нерв. Ниже
подъязычный нерв пересекает поперек этот пучок. Сосудисто-
нервный пучок включает в себя кожную артерию, яремную вену,
блуждающий, симпатический и гортанный нервы. Стеклянным
крючком отпрепаровывают сосудисто-нервный пучок,
накладывают на него лигатуру дальше от сердца и перерезают таким образом,
чтобы его периферический конец остался на лигатуре. Осторожно
приподнимая нерв за нитку, подводят под него электроды.
Записывают исходную кардиограмму. Раздражают вагосимпа-
тический нерв в течение 5... 10 с ритмическим индукционным
током или электростимулятором. Слабое раздражение нерва
уменьшает частоту и силу сокращений сердца, более сильные
раздражения вызывают остановку сердца. После раздражения частота и
сила сокращений сердца постепенно увеличиваются. Это явление
обусловливается возбуждением симпатического нерва, который
возбуждается позже парасимпатических волокон.
III. Исследование регуляторных влияний медиаторов
парасимпатической и симпатической иннервации — ацетилхолина и норадрена-
лина.
81
Регуляторные влияния вегетативных нервов на органы
передаются через синапсы с помощью медиаторов: с
парасимпатических нервов — ацетилхолина, с симпатических нервов —
норадреналина.
Характер и степень влияний медиаторов ацетилхолина и
норадреналина легко выявляются в исследованиях на сердце лягушки.
Лягушку обездвиживают, фиксируют на пробковой пластинке
и обнажают сердце (рис. 19). Удаляют сердечную сорочку и
подводят тонкие лигатуры (нитки длиной 8... 10 см) под луковицу
аорты, венозный синус, правую дугу аорты, корни обоих
легких. Лигатуры, подведенные под корни легких, сразу
завязывают и легкие отрезают. В правой дуге аорты делают небольшой
разрез и вводят канюлю, заполненную раствором Рингера. В
момент систолы канюлю мягко проводят в полость желудочка через
аортальное отверстие: фонтанчик крови поступает в канюлю.
Затем перевязывают все лигатуры, закрепляют канюлю в желудочке.
Сердце вырезают из организма. Канюлю с подвешенным сердцем
закрепляют в штативе, а верхушку сердца с помощью серфина и
нитки соединяют с большим плечом кардиографа Энгельмана.
Сердце несколько раз промывают раствором Рингера.
Записывают на кимограмме кардиограмму. Сменяют раствор в
канюле. Добавляют к раствору 2...3 капли раствора норадреналина
Рис. 19. Схема изолирования
сердца лягушки и регистрация его
деятельности:
А — введение канюли через аорту в
желудочек (по методике Штрауба): / —
желудочек; 2—предсердие; 3 — венозный
синус; 4 — перевязанная полая вена;
5— канюля; Б— вырезанное сердце с
канюлей и серфином; i?— запись
сокращений сердца: /—канюля, вставленная
в сердце; 2 —рычажок Энгельмана; 3 —
барабан кимографа; Г— введение
канюли через предсердие
82
(1:1000) — сердце начинает сокращаться сильнее. Отмывают сердце
раствором Рингера. Добавляют к раствору 1...2капли раствора аце-
тилхолина (1:10 000) — сердце начинает сокращаться реже и слабее.
По результатам исследований оформляют заключение о роли
медиаторов.
Контрольные вопросы и задания: 1. Где расположены центры вегетативной
нервной системы? 2. Как построена периферическая часть всех симпатических и
парасимпатических нервных путей? 3. На основе чего классифицируют
вегетативные ганглии? 4. Какова роль вегетативных ганглиев? 5. Опишите свойства
волокон вегетативной нервной системы. 6. Как осуществляется передача импульсов в
синапсах вегетативной нервной системы? 7. Каково значение вегетативной
иннервации тканей и органов? 8. Какие рефлекторные реакции называют
вегетативными рефлексами? 9. Назовите особенности строения рефлекторной дуги
вегетативных рефлексов. 10. Как классифицируют вегетативные рефлексы? 11. Какие
центры регуляции вегетативных функций расположены в спинном мозге? 12.
Какие центры регуляции вегетативных функций расположены в продолговатом
мозге? 13. Какова роль гипоталамуса в регуляции вегетативных функций? 14. Каково
значение ретикулярной формации, мозжечка и подкорковых ядер в регуляции
вегетативных функций? 15. Какова роль коры больших полушарий головного мозга
в регуляции вегетативных функций?
5.4. СЕНСОРНЫЕ СИСТЕМЫ
Приспособление деятельности органов и организма к
меняющимся условиям внешней и внутренней среды возможно только в
том случае, если эти изменения будут восприниматься и
оцениваться. Восприятие изменений условий внешней и внутренней
среды рецепторами и передача информации в ЦНС, восприятие
ее сенсорными нейронами коры больших полушарий головного
мозга называют рецепцией. Она осуществляется определенными
структурными образованиями, называемыми сенсорными
системами (анализаторами).
Сенсорная система (анализатор) — это совокупность
рецепторов и нейронов, участвующих в восприятии раздражений
(изменений внешней и внутренней среды) и проведении возбуждений
(информации с рецепторов), а также сенсорные (чувствительные)
нейроны коры больших полушарий головного мозга. Она состоит
из трех звеньев: рецептора, афферентного проводника (рецептор-
ный и интернейроны) и сенсорных нейронов коры (сенсорная
зона). Рецепторами служат воспринимающие раздражители
нервные окончания, или специализированные клетки, или
специализированные органы. Они очень разнообразны и обладают
определенными свойствами: высокой возбудимостью
(чувствительностью), высокой приспосабливаемостью (адаптацией),
кодированием информации, специфичностью и др.
Рецептор составляет I звено сенсорной системы, воспринима-
83
ющее изменения внешней или внутренней среды; II звено — ре-
цепторный нейрон, или афферентный проводник, — проводит
информацию от рецепторов в центральную нервную систему;
III звено — корковое звено, сенсорные нейроны коры —
воспринимают информацию.
Рецепторы и рецепции подразделяют на две большие группы:
внутренние (интерорецепторы и интерорецепция) и внешние (эк-
стерорецепторы и экстерорецепция).
Занятие 9. Рецепция. Рецепторы, анализаторы.
Общие свойства рецепторов и анализаторов
Цель занятия. Уяснить роль рецепции раздражения в нервной
регуляции.
Объект исследования, материалы и оборудование. 1. Лягушки,
морские свинки, овца, корова, лошадь, овца с фистулой рубца,
собака с изолированной петлей тонкой кишки и фистулой мочевого
пузыря. 2. Рисунки и схемы. 3. Фонокардиограф, сфигмограф,
резиновый баллончик с трубкой для раздражения кишечника,
тройник; манометр, резиновый нагнетательный баллон, воронка,
волоски Фрея, цилиндр, мерная пробирка; 5%-ный раствор хлорида
натрия, мелкие стерильные иглы, шприц, хлороформ, новокаин,
глазная пипетка, скальпель, тупая загнутая игла, тампоны.
Выполнение работы.
I. Исследование интероцептивных (висцеральных) влияний с пред-
желудков на вегетативные функции.
В регуляции вегетативных функций важную роль играет
висцеральная рецепция, связанная с приспособлением деятельности
внутренних органов к меняющимся условиям в них и внутренней
среде организма. Разнообразными рецепторами снабжены полые
внутренние органы. Они имеют иннервацию, обеспечивающую
непрерывное поступление импульсов в ЦНС.
Роль висцеральной рецепции в деятельности внутренних
органов, поддержании гомеостаза можно выявить в опытах с
раздражением рецепторов желудка и кишечника и наблюдением за
изменением вегетативных функций.
Интероцептивные влияния с преджелудков на показатели
пульса, дыхания, температуры тела и кожи исследуют на овце с
фистулой рубца.
Овцу с фистулой рубца в состоянии натощак помещают в
станок. Подсчитывают частоту пульса и дыхания, измеряют
ректальную температуру и температуру кожи. Извлекают содержимое
рубца и измеряют те же показатели. Затем в рубец вводят
резиновый баллон, заполняют его прохладной водой (10... 15 °С) и через
84
15...20 мин вновь измеряют те же показатели. Частота дыхания и
пульса при этом уменьшаются, температура тела падает.
Извлекают холодную воду из баллона. После восстановления всех
показателей до исходного уровня заполняют баллон теплой водой (45 °С)
и через 10... 15 мин исследуют те же параметры: частота дыхания и
пульса, температура тела и кожи повышаются.
II. Исследование ынтероцептивных (висцеральных) влияний с
кишечника на функцию почек.
Собаку с фистулой мочевого пузыря и с изолированной петлей
кишечника фиксируют в станке. Открывают фистулу мочевого
пузыря. Вводят в изолированную петлю кишечника тонкую
резиновую трубочку. Под фистулу мочевого пузыря подвешивают
воронку и мерную пробирку. Исходный диурез регистрируют каждые
10 мин. Через 30 мин орошают слизистую кишечника 5%-ным
раствором хлорида натрия и продолжают регистрацию диуреза.
Объем мочи уменьшается.
Объясните, каким образом воспринимаются раздражения
(состояние внутренних органов). Каково физиологическое значение
висцеральной сенсорной системы?
III. Исследование физиологической роли вестибулярной сенсорной
системы.
Вестибулярная сенсорная система (вестибулярные рецепторы
отолитового аппарата в преддверии улитки и ампул трех
полукружных каналов в пирамиде височной кости) обеспечивает
перераспределение тонуса скелетных мышц, равновесие, позу. Для
исследований роли вестибулярной сенсорной системы используют
метод выключения (подавления) деятельности рецепторов. О роли
системы при этом судят по характеру и степени изменений
движений и позы (рис. 20).
Выясните, изменяются ли и как тонус мышц шеи, туловища,
конечностей, равновесие, поза и движение животного при
одностороннем выключении вестибулярных рецепторов.
Роль вестибулярной сенсорной системы изучают на морской
свинке или лягушке.
1. Морскую свинку кладут набок, оттягивают ушную раковину
и в слуховой проход вводят глазной
пипеткой 0,5 мл хлороформа.
Некоторое время удерживают в той же
позе, чтобы не вылился хлороформ.
Через 10... 15 мин должен проявиться
результат выключения лабиринта;
если изменения отсутствуют,
вливание хлороформа повторяют или
берут ДЛЯ ОПЫТа Другое ЖИВОТНОе. Рис. 20. Голубь после удаления
Обычно через 10... 15 МИН морская справа вестибулярного аппарата
85
свинка поворачивает голову: сторона с выключенным лабиринтом
оказывается внизу, здоровая — вверху. Постепенно поворот
головы и скручивание мышц шеи становятся более сильными, и
животное начинает вращаться вокруг продольной оси. При введении
хлороформа в другое ухо перечисленные явления исчезают.
Симметричное положение головы и туловища восстанавливается, но
установочные и статокинетические рефлексы отсутствуют.
2. Завернутую в марлю лягушку берут в левую руку таким
образом, чтобы спина лежала на ладони. Пинцетом оттягивают
нижнюю челюсть и прихватывают ее марлей, в которую завернута
лягушка. В раскрытом рту на основании черепа находят бугорок
височной кости (рис. 21).
Бугорок протыкают острым концом скальпеля, в отверстие
вводят кончик загнутой тупой иглы и поворотом иглы разрушают
весь лабиринт. Оправившаяся после операции лягушка сидит в
характерной позе: с оперированной стороны лапки поджаты, со
здоровой — несколько вытянуты, голова и корпус повернуты в
прооперированную сторону, при прыжках лягушка движется по кругу
в оперированную сторону. Более резко нарушения координации
движений выражены у лягушки в воде: она плавает по кругу, а при
сильных плавательных движениях иногда даже переворачивается
вдоль продольной оси.
Если указанные реакции проявятся, то поясните, чем они
обусловлены. Каково физиологическое значение влияний с
вестибулярных рецепторов?
IV. Исследование физиологической роли болевой рецепции,
рецепции прикосновения и давления.
Огромной рецепторной поверхностью является кожа. В коже
располагаются болевые, тактильные (прикосновения, давления,
Рис. 21. Исследование роли вестибулорецепции: разрушение полукружных каналов
у лягушки:
а: х, х —места расположения лабиринтов у лягушки; б— разрушение лабиринтов; в
—лягушка после разрушения лабиринта с правой стороны. Голова наклонена в правую сторону,
правые конечности согнуты, а левые вытянуты
86
осязательные), тепловые и холодовые рецепторы кожных
сенсорных систем. Рецепторы болевые (чаще всего это голые нервные
окончания) расположены в коже, роговице глаза, слизистых
оболочках, воспринимают действие неестественных раздражителей:
прикосновения — в коже, слизистых оболочках губ и носа (у
животных на морде есть еще специальные осязательные волоски —
вибриссы)] давления —в глубине кожи губ, носа, спины, живота,
шеи и других участков тела, отличаются от других свойством более
высокой адаптации.
Для определения физиологической роли этих сенсорных
систем используют методы стимуляции и условных рефлексов.
Выясните, воспринимаются ли животным болевое раздражение
кожи уколом иглы, прикосновение к коже и давление на кожу.
Для исследований можно использовать лошадь, корову, овцу,
собаку.
У животного (лошадь, корова), спокойно стоящего в станке,
прикрывают глаза специальной уздечкой. Волосяной кисточкой
прикасаются к коже животного в области холки, брюшной
складки, локтевого отростка. Затем через 5... 10 мин производят укол
иглой в области шеи, спины, поясницы, конечности. Далее через
10...50 мин давят на кожу в тех же областях специальным
устройством с измерителем давления. Необходимо каждый раз вести
наблюдение за реакцией кожи и самого животного.
Если указанные воздействия воспринимаются специальными
рецепторами наружного покрова животного, то опишите эти
реакции и поясните, чем воспринимаются раздражения и каков
механизм этих приспособительных реакций.
Определение мест расположения и возбудимости рецепторов
прикосновения или давления проводят с помощью волосков
Фрея. Волоски Фрея — это волоски или щетинки разной толщины
(диаметра), около 2,5 см длиной, прикрепленные к деревянной
палочке. Величину давления волоска определяют в весовых
единицах: волоском надавливают (до его прогибания) на чашку
аналитических весов. Минимальный груз, вызвавший прогибание
волоска, и есть величина давления волоска. С помощью волосков
Фрея отыскивают осязательные точки на коже животного и
определяют порог их возбудимости путем надавливания
соответствующим волоском. Каждую точку, раздражение которой вызывает
ощущение прикосновения, обозначают и наносят на рисунок.
Определяют число осязательных точек на площади кожной
поверхности 1 см2 (участок на коже животного, определенный для
исследования, очерчивают), внутри которой волосок прикладывают ко
всем точкам поверхности.
V. Исследование проявления свойства сенсорных систем —
адаптации.
87
Сенсорные системы, их рецепторное звено обладают важным
свойством адаптации. В основе адаптации лежит повышение или
понижение возбудимости и, как следствие, повышение силы
ответной реакции или прекращение восприятия действия
раздражителя, или уменьшение силы ответной реакции на действие
раздражителя. Показателем адаптационных возможностей системы
являются время развития адаптации, сила биологически значимого
раздражителя, которое система может воспринять или к которому
может адаптироваться.
Выяснить, как долго продолжаются ответная реакция сердца и
кровеносных сосудов при механическом раздражении
(растяжении баллоном) участка кишечника; болевая реакция при
раздражении кожи уколом иглы, реакция на прикосновение к коже
кисточкой.
Животное помещают в станок. С помощью фонокардиографа
или сфигмографа определяют сердечный ритм, с помощью сфиг-
моманометра — кровяное давление. Продолжая наблюдения,
вызывают механическое раздражение кишечника. Сравните ритм
работы сердца и величину кровяного давления до и после
раздражения кишечника. Не прекращая раздражения, определите время, в
течение которого продолжается реакция.
У животного (лошадь, корова), спокойно стоящего в станке,
прикрывают глаза специальной уздечкой. Волосяной кисточкой
прикасаются к коже животного в области холки, брюшной
складки, локтевого отростка или укалывают иглой в области шеи,
спины, поясницы, конечности. Определяют характер реакции. Не
прекращая раздражения, отмечают время, в течение которого
продолжается реакция. Определяют минимальную силу
раздражителя, которую животное воспринимает, и максимальную силу
раздражителя, к которой животное может приспособиться, перестать
отвечать реакцией при длительном действии. По результатам
исследований оформляют выводы.
Если ответная реакция на раздражение рецепторов
продолжается недолго, то поясните, почему и как называется такое явление.
Каково его биологическое значение?
VI. Исследование функциональных возможностей сенсорных
систем методом условных рефлексов.
Знание функциональных возможностей сенсорных систем
имеет большое биологическое и практическое значение.
Функциональные возможности сенсорных систем учитывают при
разработке технологий содержания и эксплуатации животных. Метод
условных рефлексов является основным для изучения
деятельности сенсорных систем. Он основан на выработке у животного
условных рефлексов на раздражители разного качества, на
раздражители, адресованные к различным сенсорным системам.
88
Для исследования используют любой вид животного в
зависимости от цели, изучаемой сенсорной системы.
Вырабатывают условный рефлекс: двигательный защитный,
двигательный пищевой или другой. Для определения
функциональных возможностей той или иной сенсорной системы
применяют условный раздражитель от минимальной до максимальной
силы. Учитывают факт образования условного рефлекса, степень
выраженности его, устанавливают предел различий условного
раздражителя по качеству, ниже которого животное уже не в
состоянии дифференцировать раздражитель.
По результатам оформляют вывод о функциональных
возможностях сенсорной системы.
Контрольные вопросы и задания. 1.Что понимают под рецепторами? 2. Что
понимают под органами рецепции? 3. Какие органы относят к органам
рецепции и почему называют их органами чувств? 4. Что называют анализаторами
(по И. П. Павлову)? 5. Какие анализаторы у животных вы знаете? 6. Из каких
частей состоит анализатор? 7. Что понимают под сенсорной системой? 8.
Охарактеризуйте биологическую роль сенсорных систем. 9. Какие сенсорные
системы вы знаете? 10. Каковы адекватные раздражители каждой сенсорной
системы? 11. Какие приспособительные реакции обеспечиваются с участием каждой
сенсорной системы? 12. Какие методы исследования сенсорных систем вы
знаете?
5.5. ВЫСШАЯ НЕРВНАЯ ДЕЯТЕЛЬНОСТЬ
Высшая нервная деятельность — это совместная деятельность
коры больших полушарий и подкорковых образований, которая
обеспечивает более быстрое и тонкое, чем
безусловно-рефлекторное, приспособление поведения, состояния и деятельности всех
органов животных к меняющимся условиям внешней и
внутренней среды. Она осуществляется по принципу условного рефлекса
и называется еще условно-рефлекторной деятельностью.
Условные рефлексы — это рефлексы, приобретенные в
процессе индивидуальной жизни животного. Они осуществляются с
участием коры больших полушарий и связаны с образованием
временной связи между той или иной сенсорной зоной и корковыми
нейронами центров рефлекторных дуг безусловных рефлексов в
результате многократного сочетания действия пока безразличных
(условных) раздражителей с действием безусловных
раздражителей, вызывающих безусловный рефлекс. Условные рефлексы
образуются на основе безусловных, которые являются
врожденными, передаются по наследству и осуществляются по
прирожденным нервным путям. По характеру проявления условный рефлекс
соответствует безусловному, на основе которого он образовался.
Раздражители, вызывающие безусловный рефлекс, называют
безусловными, вызывающие условный рефлекс — условными.
89
Для образования условных рефлексов необходимо соблюдение
следующих условий: одновременное действие на организм
условного и безусловного раздражителей; начало действия условного
раздражителя должно предшествовать действию безусловного
раздражителя (за 5...30 с); условный раздражитель должен быть
слабее безусловного раздражителя; одновременное действие
условного и безусловного раздражителей должно повторяться несколько
раз (не менее 5).
Проявление ответной реакции на действие одного условного
раздражителя после неоднократных совместных действий
условного и безусловного раздражителей является свидетельством
образования условного рефлекса.
Занятие 10. Физиология коры больших полушарий
головного мозга. Ее роль в высшей нервной деятельности
Цель занятия. Уяснить роль больших полушарий головного
мозга — коры больших полушарий и ближайших к ней
подкорковых образований — в обеспечении высшей нервной деятельности;
в образовании временных связей (условных рефлексов); в
наиболее тонком, быстром и совершенном приспособлении
физиологических процессов к меняющимся условиям.
Объект исследования, материалы и оборудование. 1. Собака и
овца с фистулой околоушной слюнной железы, овца с фистулой
рубца, собака и овца, собака или птица (голубь) с удаленными
полушариями головного мозга. 2. Рисунки и схемы по теме. 3.
Станки для собак и овец; воронка и стеклянный циллиндр для
собирания слюны; менделеевская замазка, спиртовка, спички,
полотенце, мясо, хлеб, сено; устройство для регистрации движений рубца,
кимограф, метроном; настольный звонок или звуковой генератор,
или электрическая настольная лампа; аккумулятор,
индукционный аппарат, ключ; электроды, вмонтированные в ремешки с
пряжкой; гибкий шнур, провода, экран из фанеры; бритва, вода,
мыло.
Выполнение работы.
I. Исследование проявлений условных рефлексов на агенты (вид,
запах корма и др.), которые в естественных условиях сопутствуют
раздражителям, вызывающим безусловные рефлексы (жевание,
слюноотделение, движение желудка, кишечника и др.).
В естественных условиях у животных в процессе
индивидуальной жизни образуется большое количество различных условных
рефлексов на условные раздражители, действие которых
сочетается с действием безусловных раздражителей, вызывающих
безусловные рефлексы. Исследование проявлений таких условных реф-
90
лексов, которые называют натуральными условными рефлексами,
можно провести на собаке с предварительно выведенным на
поверхность кожи протоком околоушной слюнной железы и на овце
с предварительно наложенной фистулой рубца.
Собаку с фистулой протока околоушной слюнной железы или
овцу с фистулой рубца ставят в станок, фиксируют.
Собаке к коже щеки в том месте, где выведен проток слюнной
железы, приклеивают с помощью менделеевской замазки воронку.
Овце в рубец через фистулу вставляют баллон, который с
помощью резиновой трубки соединяют с капсулой Марея: пишущий
рычажок приводят в соприкосновение с барабаном кимографа и
начинают запись сокращений рубца.
Отмечают, что вне приема пищи и при отсутствии каких-либо
раздражителей, связанных с пищей, слюноотделение у собаки не
происходит; у овец рубец сокращается в определенном ритме.
Показывают собаке мясо, овце сено и поддразнивают ими в течение
2...3мин. Наблюдение ведут за функциональным состоянием
слюнной железы и рубца в этих условиях: у собаки начинает
выделяться слюна, у овец учащаются сокращения рубца.
Опишите реакции и поясните, как называются наблюдаемые в
этих условиях у животных условные рефлексы. Каков механизм их
образования, выражением какой деятельности коры они являются
и какое биологическое значение имеют?
II. Исследование образования у животных условных рефлексов
на новые сигналы, начавшие сопутствовать раздражителям,
вызывающим безусловные рефлексы с наружных и внутренних
рецепторов.
Условные рефлексы у животных в течение индивидуальной
жизни постоянно образуются на новые условные раздражители,
если они начинают совпадать по времени с действием
безусловных раздражителей, и угасают (исчезают), если теряют
биологическую значимость, перестают подкрепляться (сочетаться) с
действием безусловных раздражителей. Если условные рефлексы
образуются на условные раздражители, которые искусственно
начинают сочетать с действием безусловных раздражителей, то такие
условные рефлексы называют искусственными условными
рефлексами.
Исследование образования новых условных рефлексов можно
провести на любом виде домашних животных (корове, свинье,
лошади, овце, собаке и др.) на примере любого вида рефлекса: дви-
гательно-пищевого, оборонительного или интероцептивного, при
ограничении во времени — лучше на примере образования
условного двигательно-оборонительного рефлекса.
Животное помещают в станок. Собирают установку для
раздражения индукционным током (рис. 22). Электроды прикрепляют
91
Рис. 22. Методика выработки двигательно-оборонительных условных рефлексов у
крупного рогатого скота:
7— манжета с электродами; 2— манжета для регистрации движения конечности; 3— источники
условных раздражителей
на конечность животного в области голени или стопы. На участке
кожи, который будут раздражать, сбривают волосы. Далее
подбирают такую оптимальную силу тока, чтобы раздражение вызывало
четкое отдергивание (сгибание) конечности. (Экспериментатор и
приборы должны находиться за экраном. Все студенты на этом
занятии обязаны соблюдать тишину и не производить во время
опыта лишних движений.) Дают условный раздражитель (ход
метронома, свет, звонок), после 2...3 с (до 10) его изолированного
действия конечность животного раздражают индукционным током.
Оба раздражителя действуют одновременно 3 с. Конечность
должна сгибаться. Через каждые 4...5 мин повторяют сочетание
действий условного раздражителя с безусловным. После 4...6 (до
15...20) сочетаний дают только условный раздражитель и ведут
наблюдения за положением конечности. Если собака или овца
только на условный раздражитель отдергивает конечность, условный
рефлекс образовался.
Оформите выводы и приведите обоснование по вопросам: если
новые условные рефлексы могут образовываться, то при каких
условиях (правила образования их)? Выражением какой
деятельности коры больших полушарий они являются и какое биологическое
значение имеет это свойство коры?
92
III. Исследование угасания (торможения) условных рефлексов.
Торможение условных рефлексов возникает при прекращении
периодического подкрепления условного рефлекса действием
безусловного раздражителя (угасание), при одновременном действии
условного раздражителя еще с одним новым условным
раздражителем без подкрепления их действием безусловного раздражителя
(условный тормоз), при действии на организм нового условного
раздражителя, близкого по характеристике к условному
раздражителю, на который был выработан условный рефлекс (дифферен-
цировочное торможение). Временно проявляющееся
(запаздывающее) торможение или запаздывание возникает при
подкреплении действия условного раздражителя через значительное время
действия условного раздражителя, на это время проявление
условного рефлекса тормозится.
Выясните, сохраняется ли условный рефлекс на агент,
переставший сопутствовать действию безусловного раздражителя,
вызывающего безусловный рефлекс.
Исследование проводят на животном, у которого ранее был
выработан условный рефлекс. Проверяют у него наличие
выраженного условного рефлекса на действие условного раздражителя.
Затем начинают действовать условным раздражителем, не
подкрепляя его действием безусловного раздражителя, с промежутками
3...4 мин. Животное некоторое время на первые несколько
раздражений будет реагировать соответствующей реакцией, а затем
перестанет на действие условного раздражителя отвечать реакцией.
Необходимо определить количество действий условного
раздражителя до прекращения ответных реакций животного на его
действие. Прекращение ответных реакций на действие условного
раздражителя является свидетельством развития торможения.
Торможение развивается в центре рефлекторной дуги и поэтому его
называют внутренним.
Оформите вывод по результатам исследований и поясните,
каково биологическое значение явления торможения условного
рефлекса.
IV. Исследование проявления дифференцировочного
торможения.
Дифференцировочное торможение проявляется в деятельности
коры больших полушарий, связанной с различением
раздражителей, близких по качеству, но имеющих разную биологическую
значимость. Развивается и проявляется дифференцировочное
торможение в тех случаях, когда один условный раздражитель,
действующий на животное, подкрепляется действием безусловного
раздражителя, а действие другого условного раздражителя,
близкого по качеству к первому раздражителю, не подкрепляется
действием безусловного раздражителя. На развитие дифференциро-
93
вочного торможения необходимо определенное время,
определенное число действий дифференцировочного раздражителя без
подкреплений действиями безусловного раздражителя.
Исследование проявления дифференцировочного торможения
проводят на животном, у которого был выработан и хорошо
проявляется условный рефлекс на условный раздражитель, который
легко дозировать (например, звук по частоте колебаний тона,
свет).
Проверяют у животного проявление выработанного условного
рефлекса. Затем приступают к выработке дифференцировки:
периодически наряду с подачей условного раздражителя,
подкрепляемого действием безусловного раздражителя, подают условный
раздражитель, близкий по качеству к первому и действующий на
ту же сенсорную систему. Животное первоначально будет
реагировать на этот дифференцировочный раздражитель, но после ряда
действий этого раздражителя без подкрепления действием
безусловного раздражителя реакция (рефлекс) на него прекращается.
Прекращение реакции — это и есть проявление развития
дифференцировочного торможения в коре больших полушарий
головного мозга животного.
По результатам исследования оформите вывод и поясните
биологическую значимость этого торможения.
V. Исследование проявления внешнего торможения условного
рефлекса.
Временное торможение условного рефлекса может
происходить при совпадении действия на организм условного
раздражителя с действием на организм другого более сильного раздражителя.
Этот другой более сильный раздражитель вызывает более сильное
возбуждение соответствующего раздражителю центра в коре
больших полушарий, по принципу координации — индукции он
наводит процесс торможения на центр условного рефлекса и действие
условного раздражителя не вызывает условный рефлекс. Такое
торможение условного рефлекса называют внешним торможением,
так как оно вызывается извне рефлекторной дуги условного
рефлекса.
Выясните, сохраняется ли условный рефлекс, если во время
действия условного раздражителя будет действовать на животное
какой-либо сильный посторонний раздражитель.
Для исследования используют животное, у которого
предварительно выработан какой-либо условный рефлекс. На животное
одновременно действуют условным раздражителем и каким-либо
сильным посторонним индифферентным раздражителем. Ведут
наблюдение за проявлением условного рефлекса. Условный
рефлекс у животного не проявляется (внешнее торможение). Внешнее
торможение так же быстро исчезает, как и возникает. После того
94
как перестает действовать посторонний раздражитель, условный
рефлекс обычно восстанавливается.
По результатам исследований оформите вывод.
VI. Исследование роли коры больших полушарий в условиях
рефлекторной деятельности.
Кора больших полушарий головного мозга осуществляет свою
деятельность по принципу условного рефлекса. Информация с
рецепторов сенсорных систем поступает в сенсорные зоны коры; если
эта информация имеет биологическую значимость, то сенсорная
зона временной связью объединяется с корковым отделом центра
рефлекторной дуги безусловного рефлекса и по этой дуге
(эфферентной части ее) осуществляется ответная реакция (условный рефлекс).
Выясните, сохраняются ли условные рефлексы на агенты,
которые в естественных условиях сопутствуют безусловным
раздражителям, и образуются ли новые условные рефлексы на новые
агенты после удаления коры больших полушарий.
Для исследования используют животное с выработанными
двигательными условными рефлексами на вид и запах пищи, на вид
«врага», вид раздражителя, вызывающего ощущение боли до и
после удаления полушарий, и проверяют степень выраженности
этих рефлексов. На все эти условные раздражители должны
проявляться отчетливые двигательные реакции — условные рефлексы.
Затем проводят операцию по удалению у животного больших
полушарий головного мозга. После выздоровления проверяют,
сохранились ли у животного рефлексы на перечисленные условные
раздражители. Проводят выработку условных рефлексов на
естественные условные раздражители.
Если условные рефлексы в этих условиях не сохраняются и не
образуются, то о чем свидетельствует это обстоятельство?
Поясните и оформите вывод.
Контрольные вопросы и задания. 1.Что понимают под высшей нервной
деятельностью? 2. Каков принцип работы высшей нервной деятельности? 3. С
какими видами деятельности коры больших полушарий связано образование
условных рефлексов? 4. Что понимают под сигнальной деятельностью коры? 5. Что
понимают под замыкательной деятельностью коры? 6. Условные рефлексы
вырабатываются на базе безусловных рефлексов. Как вы это представляете? 7. В
чем различие условных и безусловных рефлексов? 8. Как классифицируют
безусловные и условные рефлексы? 9. Назовите правила образования условных
рефлексов. 10. Каковы структура и механизм образования временной связи
(условного рефлекса)? 11. Каковы возможные сигналы условного рефлекса? 12. Какова
методика изучения условных рефлексов (высшей нервной деятельности)? 13. Каково
биологическое значение условных рефлексов? 14. Каковы виды торможения
условных рефлексов? 15. В чем суть анализа и синтеза информации, поступающей с
рецепторов в кору больших полушарий? 16. В чем суть системности в работе
больших полушарий? 17. Какие показатели легли в основу деления высшей нервной
деятельности на типы? 18. Назовите типы высшей нервной деятельности. 19. Что
характерно для животных сильного типа? 20. Что характерно для животных
слабого типа?
95
5.6. ФИЗИОЛОГИЯ ЖЕЛЕЗ ВНУТРЕННЕЙ СЕКРЕЦИИ
Железы внутренней секреции, или эндокринные,
представляют собой специализированные органы железистого
строения. У них отсутствуют выводные протоки, и продукты их
жизнедеятельности поступают непосредственно в кровь или лимфу. Они
вырабатывают биологически активные вещества — гормоны,
основное назначение которых — участие в регуляции обмена
веществ и энергии, а также влияют на рост, дифференцировку
органов и тканей, половое созревание и размножение, изменяют
функцию отдельных органов.
Гормоны могут оказывать влияние на органы и ткани
непосредственно и путем воздействия на нервную систему: нервные
центры и рецепторы.
В регуляции функций желез внутренней секреции участвуют
кора больших полушарий, промежуточный мозг и другие отделы
головного мозга. На некоторые железы внутренней секреции
(мозговой слой надпочечников, околощитовидные железы,
поджелудочная железа) ЦНС влияет через симпатические и
парасимпатические нервы. Однако на ряд желез внутренней
секреции ЦНС оказывает свое влияние через гипофиз, функцию
которого регулирует гипоталамус. Гипоталамус и гипофиз образуют
единую гипоталамо-гипофизарную систему, обеспечивающую
переключение нервных импульсов на эндокринную регуляцию
функций органов и тканей. Одним из путей регуляции функции
желез внутренней секреции является система обратной связи
периферической железы внутренней секреции, гипофиза и
гипоталамуса.
Функцию желез внутренней секреции изучают различными
методами.
Занятие 11. Инкреторная деятельность эндокринных желез
Цель занятия. Уяснить особенности инкреторной деятельности
желез внутренней секреции в соответствии с потребностями
организма в каждый период жизни; участии гормонов в регуляции
обмена веществ и энергии, стимулировании роста, развития и
физиологических функций животных.
Объект исследования, материалы и оборудование. 1. Животные
(ягнята, поросята, щенки, куры, кролики, крысы). 2. Рисунки и
схемы по теме. 3. Операционный стол, набор хирургических
инструментов и материалов; средства для анестезии; термометры,
фонендоскоп, колбы, цилиндры, обменные клетки; набор реактивов
для определения сахара и натрия (в крови и моче).
96
Выполнение работы.
I. Определение роли гормонов щитовидной железы в регуляции
обмена веществ и энергии, роста и развития.
Роль гормонов желез внутренней секреции чаще определяют
двумя методами: 1) введением животному гормона с последующим
наблюдением за изменениями физиологических процессов и
функций; 2) удалением железы с последующим наблюдением за
изменениями физиологических процессов и функций.
Гормоны щитовидной железы (тироксин и трийодтиронин)
выраженно стимулируют окислительные процессы, освобождение
энергии, теплообразование, рост и развитие. Уменьшение или
исключение их влияния ведет к снижению температуры тела,
активности деятельности органов (уменьшению ритма сокращений
сердца), задержке роста.
Исследование проводят на щенятах или ягнятах 1...2-месячного
возраста с использованием метода удаления щитовидной железы.
У животного определяют массу, температуру тела, частоту пульса.
Необходим аналог для сравнения показателей.
Под общей анестезией у животного экстирпируют щитовидную
железу. По средней линии шеи делают разрез кожи (6...8 см),
начиная несколько выше нижнего края щитовидного хряща.
Продольные мышцы шеи разъединяют тупым путем препаровальной
иглой, обнажают трахею, ниже щитовидного хряща отыскивают
щитовидную железу. Осторожно отпрепаровывают
околощитовидные железы и с идущими к ним кровеносными сосудами
отводят в сторону. На щитовидную железу на обоих ее полюсах
накладывают лигатуры, на уровне которых ее целиком и отрезают.
Операцию повторяют на противоположной стороне. Кожную рану
зашивают отдельными узловыми швами.
Ведут длительные наблюдения за ростом и развитием
животного, поведением, частотой сердечных сокращений, температурой
тела (в обычных условиях и при изменении температуры
окружающей среды). У животного с удаленной щитовидной железой
отмечают вялость, малую подвижность, задержку роста, снижается
температура тела, уменьшается частота сердечных сокращений (рис. 23).
По данным наблюдений поясните, чем обусловлены изменения
состояния животного, сделайте заключение о роли гормонов
щитовидной железы.
II. Определение роли гормонов околощитовидных желез в
регуляции содержания кальция в крови.
Гормоны паращитовидных желез стимулируют деятельность
остеокластов, поддерживают оптимальный уровень содержания
кальция в крови и костях. Эта роль паратгормона выраженно
проявляется у животного после удаления паращитовидных желез.
Удобный объект исследования — щенки.
97
Рис. 23. Щенки 4-месячного возраста (справа — после удаления щитовидной железы
в месячном возрасте)
У животного удаляют околощитовидные железы. Техника
операции в основном такая же, как и при удалении щитовидных
желез. Железы отпрепаровывают, под них подводят тонкую лигатуру
и после ее завязывания железы отрезают маленькими ножницами.
Ведут наблюдение за состоянием животного. На 3...4-е сутки у
него появляются тетанические припадки, свидетельствующие о
снижении содержания кальция в крови. Отмечают и другие
изменения: вялость, неуверенные движения, учащение пульса и
дыхания.
Объясните причины появления отмеченных изменений в
состоянии животного, сделайте заключение о роли гормонов около-
щитовидных желез.
III. Определение роли гормонов надпочечников в регуляции
содержания натрия и глюкозы в крови животного.
Надпочечники содержат условно четыре железы: клубочковую
зону, пучковую зону, сетчатую зону коркового слоя и мозговой
слой, которые продуцируют соответственно альдостерон, корти-
зол и кортикостерон, половые гормоны, адреналин и норадрена-
лин. После удаления надпочечников выраженно проявляется роль
альдостерона, кортизола и кортикостерона, половых гормонов,
адреналина и норадреналина. Удобные объекты для
исследования — крысы, собаки.
У животного под наркозом удаляют надпочечники. По средней
линии живота делают кожно-мышечный разрез длиной 10... 12 см.
Разрез можно вести и вдоль края последних ребер без
повреждения брюшины. Отыскивают верхний полюс почки. Надпочечник
лежит в жировой клетчатке впереди почки. Под надпочечную вену
накладывают две лигатуры по обеим сторонам надпочечников.
Вену между лигатурами рассекают, надпочечник удаляют, переры-
98
вая препаровальной иглой остатки удерживающей его
соединительной ткани. Рану зашивают.
Одномоментное полное удаление обоих надпочечников
вызывает у собак смерть через 8... 10 ч после операции. Для сохранения
жизни собаке с удаленными надпочечниками необходимо через 3 ч
после операции вводить гормон кортикостерон, давать соленую
воду. Помещение, где находится животное, должно быть теплым.
У животного отмечают мышечную слабость, снижение
давления крови, уменьшение частоты пульса, температуры тела,
повышенную потребность в воде и натрии.
Ведут наблюдение за состоянием животного с удаленными
надпочечниками, измеряют температуру тела, определяют пульс,
объем выпитой воды, содержание глюкозы и натрия в крови и моче.
Объясните механизм развития изменений в состоянии
животного. На основании наблюдений сделайте заключение о роли
надпочечников.
IV. Определение роли гормонов островкового аппарата
поджелудочной железы в регуляции содержания глюкозы в крови.
Островковый аппарат поджелудочной железы вырабатывает
гормоны инсулин и глюкагон, которые регулируют
содержание глюкозы в крови. Эта роль гормонов хорошо проявляется
после разрушения островкового аппарата поджелудочной железы.
Удобные объекты исследования — собака, кролик, крыса.
У животного разрушают островковый аппарат с помощью ал-
локсана — препарата, который избирательно действует на клетки,
продуцирующие инсулин, и вызывает их некроз. Собаке вводят
200...300 мг 5%-ного раствора аллоксана. На 3-й сутки после
введения препарата происходит некроз клеток островкового аппарата
поджелудочной железы: в крови и моче повышается содержание
сахара, животное худеет.
Ведут наблюдение за состоянием животного после введения
аллоксана, обращают внимание на проявление пищевой возбудимости,
потребление воды. Определяют содержание сахара в крови и моче.
На основании наблюдений объясните, чем обусловлены
изменения состояния животного, сделайте заключение о роли
островкового аппарата поджелудочной железы.
Занятие 12. Исследование влияния окситоцина
и прогестерона на изолированные рога матки
Гормон задней доли гипофиза — окситоцин вызывает
сокращение гладких мышц матки. Чувствительность мышц матки к
окситоцину различна в зависимости от фазы полового цикла:
наибольшая чувствительность во время течки.
99
Гормон желтого тела — прогестерон понижает
чувствительность матки к окситоцину.
Цель занятия. Определить роль гормонов окситоцина и
прогестерона в регуляции состояния и сократительной деятельности
мышц матки.
Объект исследования, материалы и оборудование. 1. Морская
свинка (самка не в период течки) массой 200 г. 2. Рисунки и схемы
по теме. 3. Набор операционных инструментов и материалов,
необходимых для извлечения рога матки у морской свинки; раствор
Рингера; установка для регистрации сокращений изолированного
рога матки; стаканы; питуитрин, разбавленный раствором
Рингера в 10 раз; 0,5%-ный раствор прогестерона, 5%-ный раствор гек-
сенала, этаминал натрия.
Выполнение работы. Исследование характера и степени
влияния гормонов окситоцина и прогестерона на сократительную
деятельность матки проводят на морской свинке. Морскую свинку
после анестезии (вводят 3 мл 5%-ного раствора гексенала или
70...100 мг этаминала натрия на 1кг массы тела) фиксируют на
операционном столике. Вскрывают брюшную полость, находят
рога матки.
Под левый рог (недалеко от места его соединения с телом
матки) подводят две лигатуры, завязывают их и между ними
перерезают рог. Вторую пару лигатур подводят под другой конец рога,
граничащий с яйцепроводом. После их завязывания рог матки
перерезают между лигатурами и извлекают. Один конец рога
присоединяют к стеклянному крючку регистрационной установки, а
другой конец с помощью оставленного конца лигатуры соединяют
с коротким плечом рычага установки. Рог полностью погружают в
теплый (38 °С) раствор Рингера. Чтобы обеспечить ткань
кислородом, через полый стеклянный крючок установки с помощью
резиновой груши непрерывно подают струю воздуха, аэрируя раствор
Рингера, в котором находится изолированный рог матки.
Записывают на барабане кимографа спонтанные сокращения
изолированного рога матки. Затем, не прекращая записи, в
стакан, в котором помещен рог матки, добавляют 0,5 мл
разбавленного питуитрина (питуитрин содержит окситоцин) и дальше
следят за сокращениями матки.
Второй, т. е. правый, невырезанный рог матки орошают
раствором прогестерона. Затем его тоже вырезают и присоединяют к
регистрационной установке. Записывают на барабане сокращение
правого рога. После этого добавляют в стаканчик, в который
помещен данный рог, питуитрин в той же дозе и опять
записывают сокращения. Определяют характер действия
окситоцина на сократительную деятельность матки. Сравнивают
сократительную деятельность левого и правого рогов матки. Делают за-
100
ключение, как изменяет прогестерон чувствительность матки к
окситоцину, отмечают физиологическое значение этого явления,
физиологическую роль окситоцина и прогестерона.
Занятие 13. Исследование роли гормонов
в регуляции обмена углеводов и резистентности организма
Цель занятия. Определить роль адреналина и инсулина в
регуляции содержания глюкозы в крови, а кортикостероидов — в
обеспечении работоспособности и резистентности организма
животного.
Объект исследования, материалы и оборудование. 1. Кролики (по
три на исследовательскую группу студентов), крысы. 2. Рисунки и
схемы по теме. 3. Растворы адреналина, инсулина; шприцы с
инъекционными иглами (стерильные), микропипетки на 0,1 мл,
центрифужные пробирки, обычные пробирки, пипетки на 1, 2 и 5 мл;
6%-ный раствор трихлоруксусной кислоты, серно-тимоловый
реактив (0,25 г тимола и 100 мл концентрированной серной
кислоты); водяная баня, вата, спирт, эфир; ножницы, набор
хирургических инструментов и материалов для операции по удалению
надпочечников у крыс; операционный столик, ванна с теплой
водой, термометр; банки для крыс; специальные щипцы для
пересадки крыс; холодильник.
Выполнение работы.
I. Исследование влияния адреналина и инсулина на углеводный
обмен.
Гормоны мозгового слоя надпочечников адреналин и остро-
вкового аппарата инсулин играют основную роль в регуляции
содержания глюкозы в крови, обеспечении тканей субстратом. Эта
роль гормонов выраженно проявляется при введении их
животному.
Удобный объект для исследований — кролик.
У трех кроликов (их нумеруют) определяют исходное
содержание сахара в крови колориметрическим методом Шмора в
модификации Григорьевой. В центрифужные пробирки наливают по
1,9 мл 6%-ного раствора трихлоруксусной кислоты. У кроликов из
ушной вены с помощью иглы и микропипетки берут по 0,1 мл
крови и быстро выдувают ее в пробирки с кислотой (пробирки
нумеруют соответственно номерам кроликов). Содержимое
пробирок центрифугируют З...4мин (до полной прозрачности). Для
постановки цветной реакции в другие пробирки вносят по 0,75 мл
дистиллированной воды, 0,5 мл полученного центрифугата и
2,5 мл серно-тимолового реактива. В контрольную пробирку
наливают те же реактивы, но центрифугат заменяют 0,5 мл 6%-ного
101
раствора трихлоруксусной кислоты. Все пробы кипятят точно
10 мин в водяной бане, затем пробирки погружают в холодную
воду. Колориметрию проводят на фотоэлектроколориметре.
Показания
фотоколориметра
0,05
0,10
0,12
0,14
0,16
0,18
Содержание
сахара
в крови, г/л 1
0,20
0,49
0,60
0,73
0,85
0,92
1 Показания
фотоколори-
| метра
0,20
0,22
0,24
0,26
0,28
0,30
Содержание
сахара
в крови, г/л
1,08
1,20
1,32
1,44
1,56
1,68
Показания
фотоколори-
| метра
0,32
0,34
0,36
0,38
0,40
0,44
Содержание
сахара
в крови, г/л
1,80
1,91
2,03
2,14
2,38
2,50
После взятия крови первому кролику внутримышечно вводят
1 мл адреналина. Через 2...2,5 ч после инъекции вновь берут кровь
и определяют содержание сахара в крови. Второму кролику вводят
подкожно 3...4 ME инсулина и через 1,5...2 ч вновь определяют в
крови содержание сахара. Сопоставляют результаты исследований
и делают заключение, как адреналин и инсулин изменяют
концентрацию сахара в крови, какова их роль в регуляции
содержания сахара в крови.
П. Исследование роли кортикостероидов в обеспечении
работоспособности и резистентности организма.
Кортикостероиды — кортизол и кортикостерон — пучковой
зоны коры надпочечников играют важную роль в обеспечении
тканей субстратом энергии. Эта роль их выраженно проявляется
при нагрузках на организм: физическая работа, пребывание при
низкой температуре, требующие больших количеств энергии,
и др.
Исследование роли этих гормонов удобнее проводить на
молодых белых крысах.
У крысы удаляют надпочечники через разрез между последним
ребром и тазовым поясом: надпочечники расположены близ
верхнего полюса почек. Оперируют под легким эфирным наркозом.
Анатомическим пинцетом захватывают надпочечник вместе с
окружающей его тканью и соединительнотканным тяжом и удаляют.
Рану зашивают.
Для определения работоспособности интактных (неопе-
рированных) и оперированных крыс опускают в ванну с водой.
Отмечают время, в течение которого животное плавает, т. е. не
опускается на дно. По данному времени судят о
работоспособности животного. Для установления резистентности организма к
низким температурам и тех и других крыс помещают в стеклянные
банки, которые ставят в холодильник. За животными наблюдают
102
с получасовыми интервалами до момента гибели одного из них.
В этих условиях у животных отмечают быструю утомляемость
(животное через короткое время опускается на дно), понижение
резистентности к холоду (животное через короткое время в
холодильнике погибает).
По результатам исследований дают объяснения, чем
обусловлено у животных с удаленными надпочечниками снижение
работоспособности и резистентности к холоду, делают заключение о
роли кортикостероидов в обеспечении работоспособности
мышечной системы и резистентности организма.
Контрольные вопросы и задания. 1. Назовите методы исследования функции
желез внутренней секреции. 2. Каковы классификация и основные свойства
гормонов? 3. Какова роль гипоталамо-гипофизарной системы в регуляции функций
желез внутренней секреции? 4. Какие гормоны выделяет каждая железа внутренней
секреции? 5. Какие гормоны регулируют рост и развитие животных, обмен веществ,
водный обмен, оказывают коррегирующее действие на функции органов, процессы
размножения и лактации и каковы механизмы их действия? 6. Какие гормоны
применяют в животноводстве и ветеринарии для увеличения прироста массы тела,
повышения молокообразования, плодовитости, ускорения роста шерсти, повышения
резистентности?
5.7. СИСТЕМА ДВИЖЕНИЯ
Основу жизнедеятельности организма животного составляют
его двигательные приспособительные реакции — движения,
которые обеспечивают возможность его самосохранения, сохранения
вида. Двигательные приспособительные реакции, обеспечиваемые
скелетом и скелетными мышцами, дают возможность животному
поддерживать принятую позу, перемещать звенья и все тело в
пространстве, ориентироваться, защищаться, совершать
поведенческие движения.
Скелет образует кинематические цепи конечностей и тела.
Кости, движущиеся в суставах при сокращении мышц, образуют
рычаги двигательного аппарата, т. е. движение рассматривается как
механическая работа костных рычагов, к которым прикладывается
сила сокращения мышц. При этом точкой опоры рычага служит
сустав, точкой приложения силы — место прикрепления мышцы,
точкой сопротивления — место действия на кость силы тяжести. В
зависимости от расположения точек сопротивления и
приложения силы относительно точки опоры различают рычаги 1, 2 и 3-го
рода.
Рычаг 1-го рода, или рычаг равновесия, — это двуплечий рычаг,
в котором точка опоры находится между точкой приложения силы
и точкой сопротивления. Примером такого рычага является
удержание и перемещение черепа: сила приложена к затылочной кос-
103
ти, точка опоры — сустав, точка сопротивления — сам череп.
Рычаг 2-го рода, или рычаг силы, — это одноплечий рычаг, в котором
точка сопротивления (точка действия на кость силы тяжести)
находится между точкой опоры и точкой приложения силы
(например, перемещение копыта в момент отталкивания). В рычаге 3-го
рода, или рычаге скорости, точка приложения силы находится
между точкой опоры и точкой сопротивления (например,
сгибание конечности).
Занятие 14. Наблюдение за поддержанием позы
и движениями животных
Цель занятия. Уяснить роль системы движения в обеспечении
двигательных приспособительных реакций — поддержании
принятой позы, перемещении звеньев и всего тела в пространстве,
ориентировочные, защитные, поведенческие движения.
Объект исследования, материалы. 1. Лягушки, овца, корова,
лошадь. 2. Рисунки и схемы по теме.
Выполнение работы. Каждый вид животных имеет репертуар
фиксированных последовательных движений. Способ
перемещения животного называют аллюром. Он связан с преодолением
силы тяжести. Виды аллюра: шаг, рысь, галоп, иноходь, карьер.
Удобный объект для наблюдений за движениями — лошадь.
Наблюдения за движениями животных проводят на большой
площадке. Животному создают условия для свободного
движения. Движениями лошади может управлять наездник.
При проведении наблюдений необходимо следить за порядком
перемещения конечностей животным при медленном движении и
быстром (беге).
На основании результатов наблюдений опишите способы
перемещений лошади, коровы, овцы; движения, связанные с
переходом в положение лежа, при вставании.
Контрольные вопросы и задания. 1. Как организована система, обеспечивающая
позу и перемещение животного, какова ее роль в жизнедеятельности организма?
2. Какие исполнительные органы системы обеспечивают позу и перемещение
животного? На какие группы делят мышцы по их роли в системе? 3. Какова
структурно-физиологическая организация скелетных мышц? 4. Назовите виды
сокращения мышц. 5. Какова структурно-физиологическая организация скелета? 6. Как
проявляется поза и как она поддерживается? 7. Чем характеризуются рычаги
двигательного аппарата? Приведите примеры их проявления при движении
животного. 8. Каковы способы перемещения животного и проявление каждого из них?
9. Назовите параметры приспособительных реакций системы, обеспечивающей
позу и перемещение, по которым проводится оценка ее состояния и
деятельности. Какие методы и приборы используют для определения этих параметров?
Какова практическая значимость их определения?
104
5.8. СИСТЕМА КРОВИ
Кровь —жидкая соединительная ткань, составляет вместе с
лимфой и тканевой жидкостью внутреннюю среду организма,
омывающую все клетки тела.
Исследование состава и свойств крови у животного проводят
после ее взятия (рис. 24). Принудительной фиксации животных
при взятии крови следует по возможности избегать. Для
получения крови у мелких животных и птиц иногда прибегают к
пункции желудочков сердца.
У лошадей и рогатого скота небольшие
количества крови для морфологического анализа берут из ушной вены
путем ее надреза или прокола инъекционной иглой. Перед
взятием крови у животных проводят обработку операционного поля
(выстригание или выбривание волосяного покрова, протирание
кожи спиртом и эфиром). Затем надрезают (прокалывают)
кровеносный сосуд или вводят в него иглу определенной формы и
диаметра, предварительно подвергнутую стерилизации.
Выступившую кровь насасывают в пипетку или собирают по каплям на
часовое стекло, предварительно промытое антикоагулянтом. У овец
можно проводить, кроме того, пункцию кожной вены,
расположенной под внутренним углом глаза.
Для взятия больших количеств крови, а также для
внутривенных вливаний проводят пункцию яремной вены на границе
верхней и средней трети шеи (см. рис. 24). После фиксации
животного большим пальцем левой руки сдавливают вену ниже
места пункции (у крупного и мелкого рогатого скота
накладывают резиновый жгут), а затем прокалывают кровопускательной
или инфузионной иглой кожу и стенку вены. Иглу вводят
против тока крови под углом 45°. Кровь собирают в
стерильный сосуд.
Для взятия крови у крупных животных используют ряд простых
приборов-держателей или приборов-автоматов (см. рис. 24).
Автоматы имеют разную конструкцию, но в состав их обязательно
входят металлический корпус, иглодержатель, держатели для
пробирок, ударный механизм с пружиной.
Для хронического получения крови из глубокорасположенных
сосудов (воротной, печеночной, задней полой, общей
брыжеечной, рубцовой и других вен) проводят их катетеризацию с
помощью нейлоновых или тефлоновых катетеров.
У свиней малые количества крови получают путем надреза
скальпелем большой ушной вены. Центральный конец сосуда у
корня уха зажимают при этом пальцами. Для получения больших
количеств крови отсекают ножницами или скальпелем кончик
хвоста длиной 1...1,5 см. По окончании кровопускания рану дез-
105
левой стороны, В2—с правой стороны; Г— взятие крови у птиц. Внутренняя поверхность
крыла кур: х — место пункции подкрыльцовой вены; Д — взятие крови из хвостовой артерии у рыб
инфицируют, а кончик хвоста сдавливают резиновым кольцом
или перетягивают бинтом на 1...2 сут.
У поросят удобнее получать кровь путем прокола иглой или
микропипеткой орбитального венозного синуса. Животное при
этом фиксируют лежа в спинном положении. За один раз берут от
5 до 30 мл крови.
У собак (кошек) кровь получают путем надреза края уха
или прокола мягкой части ступни. Для получения больших пор-
106
ций крови проводят пункцию передненаружной плюсневой вены,
расположенной на наружной поверхности голени. Животное
кладут на бок или фиксируют в станке; конечности сдавливают
руками или жгутом ниже коленного сустава. Иглой прокалывают
сначала кожу, а затем стенку вены. Кровь насасывают в шприц.
У кроликов кровь получают путем надреза или прокола
вены, расположенной снаружи по тонкому краю уха. Ухо
предварительно протирают ксилолом.
У кур и индеек кровь получают путем надреза или
скарификации гребня (сережек). У гусей и уток делают прокол
мякоти ступни. В большом количестве кровь у птиц получают из
подкожной подкрыльцовой вены, расположенной на внутренней
поверхности крыла. Перья выщипывают, вену сдавливают
пальцем в области локтевого сустава, прокол делают под углом на
уровне локтевого сгиба (см. рис. 24). Можно предварительно
обнажить сосуд коротким разрезом кожи.
Ввиду быстрого свертывания крови у птиц место прокола
протирают противосвертывающей жидкостью. Выступившие капли
крови переносят пипеткой в бюкс или собирают в центрифужную
пробирку с антикоагулянтом. После взятия крови место пункции
на несколько минут зажимают тампоном.
У гусей, уток и индеек кровь можно получать из внутренней
плюсневой вены, расположенной под кожей на медиальной
поверхности плюсны, ближе к ее плантарному краю. Прокол делают
на 1 см ниже межтарзального сустава, где вена направляется косо
вперед и вверх — на переднюю поверхность сустава и выступает
под кожей в виде валика. Появившуюся кровь собирают
описанным выше способом.
У кур, гусей, индеек можно брать одновременно до 10...15 мл, у
голубей — 1... 1,5 мл крови.
У рыб небольшие количества крови берут из подкожной
артерии или глубокой хвостовой артерии (см. рис. 24).
У лягушек кровь получают при срезании ножницами
концов пальцев лапки.
Примечание. Кровь у человека берут путем прокола мякоти пальца иглой
Франка или специальными копьями-скарификаторами одноразового
пользования. Место взятия крови тщательно обрабатывают спиртом и эфиром. После
взятия крови к месту прокола прикладывают тампон, смоченный настойкой
йода.
Кровь состоит из жидкой фракции — плазмы и находящихся в
ней во взвешенном состоянии форменных элементов —
эритроцитов, лейкоцитов и тромбоцитов.
Для получения плазмы кровь предохраняют от свертывания
добавлением антикоагулянтов. Такая кровь после длительного сто-
107
яния в пробирке или центрифугирования разделяется на плазму
(верхний слой) и форменные элементы. Плазма составляет
60...65 % общего объема крови, а форменные элементы — 35...40 %.
Это соотношение изменяется в зависимости от вида, возраста,
породы животных, функционального состояния, а также при
некоторых заболеваниях. Показатель гематокрита используют при
вычислении ряда других важных характеристик крови (среднего объема
эритроцитов, среднеклеточной концентрации гемоглобина и пр.).
Если набранную в сосуд кровь не стабилизировать
антикоагулянтом, происходит ее свертывание — образование сгустка,
содержащего форменные элементы и выпавший в осадок белок
фибриноген. Сгусток постепенно уплотняется, стягивается, и от него
отделяется прозрачная желтоватого цвета жидкость — сыворотка.
Сыворотка представляет собой плазму, лишенную фибрина. Если
выделить из крови фибриноген механическим путем, то такая
кровь теряет способность к свертыванию. Она содержит все
составные части, за исключением белка фибриногена, и ее называют
дефибринированной кровью.
Занятие 15. Исследование объема,
состава и свойств крови
Цель занятия. Убедиться в наличии у животных определенного
объема крови, состоящей из плазмы и форменных элементов —
эритроцитов, лейкоцитов, тромбоцитов в определенном
соотношении; изучить свойства крови.
Объект исследования, материалы и оборудование. 1. Овца,
корова, собака, кролик, курица, морская свинка. 2. Рисунки и схемы
по теме. 3. Иглы или автомат для взятия крови; стеклянные
цилиндры вместимостью 10...20 мл; пробирки химические и
центрифужные в штативе, центрифуга, пипетки от аппарата Панченкова
(с предварительно отрезанным верхним концом и длиной
10 11 см), колбочка на 50... 100 мл; стеклянные шарики и
антикоагулянты: порошок цитрата или оксалата натрия (20...30 мг на
10 мл крови); раствор оксалата калия и оксалата аммония (7 г
оксалата калия, 4,5 г оксалата аммония, 100 мл воды) в дозе 0,2 мл на
10 мл крови; этилендиаминтетрауксусная кислота (ЭДТА) в дозе
0,2 мл 0,01%-ного раствора на 10 мл крови, Na-ЭДТА в дозе
0,5... 1 мг на 5 мл крови; полисахарид гепарин: 100 ЕД на 1 мл
крови (примерно 2 капли неразведенного гепарина на 10 мл крови);
водяная баня с температурой 37 °С, секундомер, пробирки;
фарфоровые чашки; кисточки; маленькие пробирки; сыворотка
крови; термостат; гематокрит; стандартные сыворотки крови всех
групп (можно только II и III); предметные стекла, иглы-ланцеты,
108
стеклянные палочки, восковой карандаш, пипетки; спирт, эфир,
кровь.
Выполнение работы.
I. Взятые крови у животных.
У крупного рогатого скота, овец, коз, лошадей, собак,
кроликов и морских свинок удобно кровь брать из ушной вены,
расположенной под кожей наружной поверхности ушной раковины.
Большие объемы крови берут из яремной вены на шее.
Животное фиксируют, подготавливают операционное поле для
пункции воротной вены: шерсть на месте укола выстригают, кожу
протирают спиртом и эфиром. Слегка прижимают пальцем
центральный отрезок вены. Быстрым движением прокалывают
набухший сосуд иглой от шприца. Кровь берут в пробирку или
колбочку с предварительно внесенным в них антикоагулянтом. После
взятия крови кожу смазывают настойкой йода, прижимают к
месту укола стерильную вату.
II. Определение объема крови и плазмы у животных.
Циркулирующая в сосудистом русле кровь составляет только
часть всей имеющейся в организме крови. Другая ее часть
находится в кровяных депо, и ее называют депонированной кровью.
Обе эти части находятся в динамическом равновесии.
Для определения объема крови используют два метода. Один из
них основан на введении в кровь краски, которая связывается
альбуминами плазмы и достаточно равномерно распределяется по всей
крови (синяя Эванса, бромсульфалеин); по количеству введенной
краски и концентрации ее в плазме рассчитывают общее
количество плазмы, а с учетом гематокритного числа — общий объем
крови. Второй метод основан на введении в кровь меченных
радиоактивным фосфором или хромом (32Р, 51Сг) отмытых эритроцитов и
последующем определении радиоактивности проб крови.
Подготавливают прибор для внутривенного вливания,
пробирки для взятия крови, антикоагулянт, краску Эванса Т-1824 (2...4 г
краски, растворенные в 100 мл дистиллированной воды).
Делают пункцию яремной вены и набирают кровь в
специальную градуированную пробирку с антикоагулянтом (вместимость
пробирки 10... 12 мл, градуировка с точностью до 0,1 мл). С
помощью стеклянной воронки и резиновой трубки, соединенной с той
же иглой, вводят животному внутривенно краску Т-1824 из
расчета 0,1...0,2 мл на 1 кг массы тела.
Через 9...10 мин из противоположной вены берут в
градуированную пробирку с антикоагулянтом новую порцию крови. Обе
пробирки помещают в горизонтальную центрифугу и
центрифугируют при частоте вращения 4000 мин-1 в течение 15 мин.
Определяют гематокритное число. Пробу окрашенной плазмы
(1 мл) колориметрируют на фотоэлектроколориметре или спект-
109
рофотометре (при светофильтре с максимумом поглощения
614 ммк), сравнивая ее с образцом неокрашенной плазмы.
С помощью составленной ранее калибровочной кривой для
данного рабочего раствора краски по экстинкции окрашенной
плазмы находят содержание краски в 1 мл исследуемой плазмы.
Вычисляют объем плазмы в миллилитрах (мл) путем деления
количества введенной внутривенно краски (мкг) на ее содержание в
1 мл исследуемого образца плазмы. Общий объем крови
рассчитывают по формуле
K = 100-0,94gl00'
где VK — объем крови, мл; Vn — объем плазмы, мл; g — гематокритное число; 0,94
(6 %) — постоянный поправочный коэффициент на плазму, остающуюся после
центрифугирования в столбике форменных элементов.
Путем вычитания из объема крови объема плазмы вычисляют
общий объем эритроцитов (л).
III. Определение объемного соотношения плазмы и форменных
элементов крови.
В пробирку или стеклянный цилиндр с антикоагулянтом
собирают по 10 мл крови из яремной вены животного. Закрыв пальцем
или пробкой, сосуд несколько раз перевертывают для
перемешивания крови. Цилиндр ставят в термостат (кровь лошади на 1 ч,
крупного рогатого скота на 24...48 ч), пробирку —в центрифугу.
Центрифугируют при частоте вращения 3000 мин-1 в течение
20...30 мин. Убеждаются, что при стоянии или
центрифугировании кровь отстаивается на плазму и форменные элементы.
Представление о соотношении между объемами плазмы и
форменных элементов крови (главным образом эритроцитов)
дает гематокритное число. Определяют с помощью гематокрита.
В качестве унифицированных методов определения гематокрита
утверждены два метода, один из них — микрометод в
модификации Й. Тодорова.
Объемное соотношение плазмы и форменных элементов
можно определить центрифугированием предохраненной от
свертывания крови в специальном приборе — гематокрите. Рабочую часть
гематокрита составляют две тонкие капиллярные трубки по 50 мм
длиной в металлической оправе, калиброванные на 100 равных
делений. Трубки через узкий конец заполняют кровью и помещают
в металлическую рамку. Прибор с помощью втулки укрепляют на
оси угловой электрической центрифуги ЦУМ-1.
Принцип метода заключается в центрифугировании крови
определенное время при постоянной частоте вращения центрифуги
с последующим определением результата по градуированным
капиллярам.
ПО
Полученную от животного кровь разливают на часовые стекла.
Подготавливают к работе центрифугу с гематоКритом. В пипетку
набирают кровь до верхней метки (100 делений), закупоривают,
обтягивая ее резиновым кольцом, помещают в рамку гематокрита,
укрепляют ее с помощью втулки на оси центрифуги, закрывают
крышку и центрифугируют 30...40 мин при частоте вращения
3000 мин-1. Извлекают капилляры. Форменные элементы
располагаются в периферических концах капилляра, плазма — в центре.
Результат отмечают по градуировке капилляра, вычитая из 100
высоту столбика эритроцитов. По результатам (берут средние из
двух) определяют относительный объем форменных элементов и
плазмы, выражая их в процентах.
Нормальные гематокритные числа у лошадей, крупного
рогатого скота, овец, коз, свиней, собак, кошек, кроликов, кур
составляют 30...45 % по объему эритроцитов (плазмы 58...65 %). В
Международной системе единиц гематокритное число выражают в л/л
(1% = 1л/л).
IV. Получение сыворотки крови.
В пробирку или цилиндр без антикоагулянта собирают 10 мл
крови животного и ставят в термостат при 38 °С на несколько
часов. Образование кровяного сгустка и частичная ретракция, т. е.
его стягивание и самопроизвольное отделение сыворотки,
наступают в крови лошади через 1...3ч, а полное отделение сгустка —
через 12... 18 ч. В крови крупного рогатого скота ретракция
протекает значительно медленнее. Из пробирки с полной ретракцией
сгустка сливают или отсасывают сыворотку и сравнивают ее с
плазмой. Сыворотка имеет желтовато-соломенный цвет и более
прозрачна, чем плазма.
V. Получение сыворотки из дефибринированной крови.
Дефибринированную кровь разливают в центрифужные
пробирки и центрифугируют при частоте вращения 3000 мин-1 в
течение 10... 15 мин. Форменные элементы оседают на дно, сверху над
ними — сыворотка.
VI. Получение дефибринированной крови.
В стеклянную колбочку кладут 10... 12 стеклянных бусинок и
собирают в нее 20...30 мл крови животного. Кровь взбалтывают
вращательными движениями в течение 10...15 мин.
Фибриноген, выпадающий в осадок в виде волокнистых нитей фибрина,
оседает на шариках (дефибринированную кровь можно также
получить, сбивая кисточкой или метелкой свежую кровь в
фарфоровой чашечке). Содержимое колбы фильтруют через 2 слоя
марли. Фильтрат представляет собой дефибринированную
кровь, содержащую сыворотку и форменные элементы.
Используют дефибринированную кровь для получения сыворотки (см.
п. 4).
111
VII. Получение фибрина.
Осевшие на шариках (метелке) нити фибрина отмывают от
форменных элементов теплой водой. Фибрин имеет вид белого
волокнистого вещества.
VIII. Определение содержания фибриногена в крови.
Для того чтобы определить содержание фибриногена в крови,
сначала необходимо получить цитратную плазму. С этой целью в
пробирку наливают 1 мл 3,8%-ного раствора цитрата натрия и
набирают в нее из кровеносного сосуда 9 мл крови, перемешивают и
центрифугируют в течение 20...30 мин при частоте вращения
3000 мин-1.
Затем 1 мл из полученного слоя плазмы переносят в другую
пробирку, добавляют 0,4 мл 5%-ного раствора СаС12 и
встряхивают. После свертывания плазмы образовавшийся сгусток фибрина
наматывают на стеклянную палочку и, вынув из пробирки,
помещают на беззольный фильтр. Сжимая фильтр, получают
воздушно-сухой остаток фибрина, который взвешивают на торзионных
весах. В норме в 1 мл цитратной крови содержится 6...9 мг
воздушно-сухого фибрина. Для определения фибриногена (мг%)
полученную величину умножают на коэффициент 22,2.
IX. Определение буферных свойств крови.
Для определения буферных свойств крови берут два чистых
стаканчика: в один наливают 1...2мл сыворотки крови, а в
другой — 1...2 мл воды. Прибавляют в них по 1 капле метилоранжа и
титруют из бюретки 0,1 н. раствором соляной кислоты до
появления не исчезающего при взбалтывании красного окрашивания.
Титрование начинают с воды, которая не обладает буферными
свойствами. За отчет титрования принимают объем (мл)
израсходованного раствора соляной кислоты.
Затем берут еще два стаканчика и наливают в один 1...2 мл
сыворотки крови, а в другой 1...2мл воды. Прибавляют в каждый
стаканчик по 1 капле фенолфталеина и титруют 0,01 н. раствором
гидроксида натрия до не исчезающего в течение 1 мин слабого
фиолетового окрашивания.
X. Определение групп крови.
По содержанию в крови специфических белков
агглютиногенов (на поверхности эритроцитов) и агглютининов (в плазме)
различают группы (системы) крови. У человека имеются два вида
агглютиногенов (А и В) и соответственно два вида агглютининов
(а и Ь), в зависимости от их наличия или отсутствия кровь его
относят к одной из четырех групп.
В пределах каждой группы одноименные агглютинины и агглю-
тиногены не встречаются, поэтому эритроциты не
агглютинируются. Однако их агглютинация (склеивание в комочки) наступает при
смешении одноименных агглютининов и агглютиногенов, что мо-
112
жет возникнуть при переливании несовместимой крови. При
переливании следует учитывать свойства сыворотки реципиента и
эритроцитов донора. Сыворотку донора во внимание не
принимают, так как, поступая в кровяное русло реципиента, она сильно
разводится и теряет свои агглютинирующие свойства.
Группу крови определяют по свойствам эритроцитов, которые
устанавливают с помощью стандартных сывороток, содержащих
известные агглютинины.
Использование сывороток всех групп крови.
Предметное стекло кладут на белую бумагу (или тарелку) и наносят на него
(тарелку) в разных местах по 1 капле (лучше 2) стандартных сывороток
разных групп крови, содержащих соответственно разные
агглютинины. Затем, получив кровь из вены, стеклянной палочкой наносят
небольшое количество ее (капля величиной с булавочную головку) в
каплю сыворотки одной группы, вторым чистым концом этой же палочки
такое же количество крови переносят во вторую сыворотку. Другой
чистой палочкой третью каплю крови переносят в третью сыворотку,
при этом каждый раз тщательно размешивая кровь в капле
сыворотки палочкой до тех пор, пока смесь не примет равномерно розовое
окрашивание (величина диаметра пятна 30 мм). Нельзя переносить
одним концом палочки кровь в разные сыворотки.
Наблюдают в течение 5 мин. Через 3 мин капают 2...3 капли
физиологического раствора, чтобы исключить неспецифическую
агглютинацию, и затем смотрят еще 2 мин, т. е. всего 5 мин. При
наличии агглютинации эритроцитов капля становится
прозрачной, а эритроциты склеиваются в виде комочков. Группу крови
устанавливают в зависимости от агглютинации. При этом нужно
твердо знать, какие агглютиногены в эритроцитах и агглютинины
в сыворотке содержат кровь всех групп, а также то, что
агглютинация происходит только при взаимодействии одноименных агглю-
тиногенов и агглютининов.
Использование сывороток только II и III групп
крови. На чистое предметное стекло наносят двумя разными
пипетками стандартные сыворотки II и III групп (предварительно на
обратной стороне стекла отмечают восковым карандашом номер
группы сыворотки). Прокалывают палец и выступившую кровь
(небольшое количество, в 10 раз меньше капли сыворотки)
переносят палочкой в сыворотку II группы; другой палочкой
переносят кровь в сыворотку III группы, избегая гемолиза. Смешивают
кровь с сывороткой легким покачиванием стекла. Спустя 3...4 мин
определяют результаты. Отсутствие агглютинации в обеих пробах
означает, что исследуемая кровь относится к I группе; при
агглютинации с сывороткой III группы — исследуемая кровь II группы;
при агглютинации с сывороткой II группы— кровь III группы.
Кровь IV группы агглютинирует с обеими сыворотками. Около
113
45 % людей имеют кровь I группы, 35 % — II группы, 15 % —
III группы, 6 % — кровь IV группы.
Примечания: 1. В эритроцитах 86 % людей помимо описанных агглютино-
генов содержится антиген, называемый резус-фактором. Введение его людям с
резус-отрицательной кровью может вызвать образование соответствующих
агглютининов и гемолизинов, а повторное введение — агглютинацию эритроцитов донора
и гемотрансфузионный шок. Наличие или отсутствие резус-фактора определяют с
помощью специальных стандартных сывороток (прилагаются к комплекту
приборов «Резус-2»).
2. У домашних животных установлено большое количество антигенных
факторов в эритроцитах и почти полное отсутствие или нерегулярное присутствие
естественных антител в сыворотке крови. Поэтому группы крови животных
определяют только эритроцитарными антигенами, присутствующими в разных
сочетаниях и передающимися по наследству. Антигены, наследование которых
взаимообусловлено, составляют генетическую систему групп крови; их выявлено
несколько у каждого вида животных. Для определения групп крови используют
специально изготовленные иммунные сыворотки. Изучение этого вопроса
является предметом иммуногенетики.
Контрольные вопросы и задания. 1. Что такое кровь и из каких частей она
состоит? 2. Каков принцип метода разделения крови на плазму и форменные
элементы? 3. В чем отличия плазмы и сыворотки? 4. На каком принципе основан
способ получения сыворотки крови? 5. Что понимают под внутренней средой
организма и гомеостазом? 6. Какие роли выполняет кровь? 7. Сколько крови в
организме различных животных? 8. Что понимают под осмотическим давлением?
Каковы метод определения и величина осмотического давления крови? 9. Какова
реакция крови и чем обеспечивается относительно постоянный уровень ее?
10. Какие буферные системы имеются в крови? 11. Опишите принцип действия
буферных систем. 12. Чем образуется щелочной резерв крови и как определяют
его величину? 13. Каков состав плазмы? 14. Какие белки содержатся в плазме
крови и каково их биологическое значение? 15. Что понимают под свертыванием
крови и какова схема процесса свертывания крови? 16. Чем представлена проти-
восвертывающая система в крови? 17. Какие вы знаете вещества и способы:
1) предотвращающие или замедляющие свертывание крови; 2) ускоряющие
процесс свертывания крови? 18. Что лежит в основе деления крови на группы?
19. Охарактеризуйте кровь каждой группы. 20. На каком принципе основана
методика определения групп крови?
Занятие 16. Определение количества эритроцитов.
Исследование свойств и роли эритроцитов
Форменными элементами крови являются эритроциты,
лейкоциты и тромбоциты.
Эритроциты — наиболее многочисленные форменные
элементы крови, основное содержимое которых составляет гемоглобин.
Зрелые эритроциты млекопитающих не имеют ядра
двояковогнутой формы: при поперечном разрезе напоминают гантели.
Мембрана эритроцита имеет двойной слой липидных и белковых
компонентов и содержит большой набор ферментов.
Эритроциты обладают антигенными свойствами, участвуют в гомеостазе,
но основная роль их — транспорт кислорода к тканям и участие в
114
транспорте диоксида углерода от тканей к легким. Количество
эритроцитов в крови у животных каждого вида и возраста
относительно постоянно. В этой связи знание величины показателей
содержания эритроцитов у каждого вида и возраста животных и
умение определять количество эритроцитов необходимы для
суждения об обменных процессах в организме, о характере, уровне и
границах приспособительных реакций.
Форменные элементы содержатся в единице объема крови в
определенном количестве у каждого вида животных.
В ветеринарной практике подсчет форменных элементов крови
имеет большое диагностическое значение. Подсчет эритроцитов,
лейкоцитов и тромбоцитов проводят в определенном объеме
крови (1 мм3) с помощью специальных счетных камер с
предварительным разбавлением крови. Разработаны также автоматические
методы подсчета с помощью фотометрических и электронных
приборов, разнообразных гематологических анализаторов.
Цель занятия. Освоить методики подсчета, определения
скорости оседания эритроцитов, количества гемоглобина в крови;
определить основные свойства и роль эритроцитов.
Объект исследования, материалы и оборудование. 1. Овца, собака,
кролик, курица, морская свинка; цельная или стабилизированная
кровь животных. 2. Рисунки и схемы по теме. 3. Эритроцитарные
смесители (меланжеры), счетные камеры Горяева, микроскопы,
эритрогемометр; реактив 1 (0,9%-ный раствор хлорида натрия);
реактив 2 — раствор Гайема (ртути хлорид — 0,5 г, натрия сульфат —
5 г, натрия хлорид — 1 г, вода дистиллированная — до 200 мл),
3%-ный раствор хлорида натрия; 0,04%-ный раствор аммиака
(1,6 мг 25%-ного раствора аммиака довести до 1 л
дистиллированной водой); аппарат Панченкова (штатив и капилляры); 4%-ный
раствор трехзамещенного цитрата натрия (C6H507Na3 • 5Н20) —
раствор фильтруют (рН нейтральная или слабощелочная);
пробирки (короткие) или часовые стекла; фильтровальная бумага,
предметные и покровные стекла, дистиллированная вода; гемометры
Сали, 0,1 н. раствор соляной кислоты; глазные пипетки,
спектроскоп, пробирки; 5%-ный раствор железного купороса; 5%-ный
раствор сегнетовой соли; 0,1%-ный раствор соды; спирт, настойка
йода, эфир.
Выполнение работы.
I. Определение количества эритроцитов в крови.
Для подсчета количества эритроцитов в крови принято два
унифицированных метода: подсчет в счетной камере Горяева и с
помощью автоматического счетчика, гематологического
анализатора.
1. Унифицированный метод подсчета эритроцитов в счетной
камере. Для работы необходимо знать устройство счетной камеры
115
Горяева. Счетная камера Горяева представляет собой толстое
предметное стекло, в средней части которого имеется четыре
желобка с площадками между ними. Средняя площадка ниже
боковых на 0,1 мм и разделена пополам поперечными желобками. По
обе стороны от этого желобка расположены сетки, нанесенные на
стекло. При наложении покровного стекла на боковые площадки
над сеткой образуется камера глубиной 0,1 мм. Сетка Горяева
состоит из 225 больших квадратов. Каждый третий большой квадрат
разделен дополнительно поперечными и продольными линиями
на 16 маленьких квадратов. Всего больших квадратов,
разделенных на маленькие, в сетке 25. Общая площадь сетки равна
9 мм2. Сторона маленького квадрата составляет 1/20 мм, площадь
(1/20 • 1/20) равна 1/400 мм2, а объем пространства над маленьким
квадратом (1/400 • 1/10) равен 1/4000 мм3.
Поместите камеру под микроскоп. Рассмотрите сетку вначале
под малым, а затем под большим увеличением (лучше при
искусственном освещении с синим фильтром).
Принцип метода заключается в подсчете эритроцитов под
микроскопом в определенном количестве квадратов счетной сетки и
пересчете на 1 мкл крови, исходя из объема квадратов и
разведения крови.
Разводят исследуемую кровь в 200 раз. Можно использовать две
методики: в меланжере (смесителе) и в пробирке.
Разведение крови в пробирке. Для этого в сухую
пробирку отмеривают 4 мл реактива 1 или 2. Пипеткой (капилляр
Сали) набирают 0,02 мл крови. Кончик пипетки вытирают
фильтровальной бумагой или марлей и кровь выдувают на дно
пробирки; пипетку тщательно промывают в верхнем слое жидкости,
повторно набирая ее и выдувая в пробирку. Содержимое пробирки
перемешивают и оставляют стоять до момента счета
(рекомендуется считать эритроциты в ближайшие 2...3 ч после взятия крови,
так как эритроциты могут разрушаться).
Разведение в меланжере (смесителе). Меланжер
для эритроцитов представляет собой стеклянный капилляр с
ампул ообразным расширением в верхней части. В ампуле помещена
стеклянная бусинка (красная) для перемешивания крови. На
капилляре имеются метки 0,5; 1,0; 101. Таким образом,
вместимость ампулы в 100 раз больше вместимости капилляра (рис. 25).
Проверяют чистоту и проходимость капилляров смесителя.
Держа капилляр смесителя горизонтально, насасывают в него с
часового стекла или с места прокола до метки 0,5 свежей или
стабилизированной крови животного (в капилляр не должны
попадать пузырьки воздуха). Приставшую к кончику смесителя
кровь осторожно удаляют ватным тампоном или фильтровальной
бумагой. Держа капилляр под углом, опускают его в склянку с
116
Рис. 25. Счетная камера Горяева
для подсчета форменных элементов
крови:
А — вид сверху; Б— вид сбоку; В— сетка
камеры (/—малый квадрат, 2—большой
квадрат); Г— смеситель
1
В
2
3%-ным раствором NaCl и
насасывают раствор до
метки 101 (кровь при этом
разводится в 200 раз). Зажав
смеситель между большим и средним пальцами, встряхивают в
течение 2...3 мин и оставляют до момента подсчета.
Подготавливают счетную камеру: протирают насухо камеру с
сеткой и покровное стекло, затем покровное стекло притирают к
камере, слегка надавливая на стекло таким образом, чтобы по
краям его появились радужные полосы — кольца Ньютона (это
свидетельствует о требуемой высоте камеры — 0,1 мм).
Заполняют счетную камеру разводимой кровью: 1)
предварительно несколько раз тщательно встряхивают содержимое
пробирки, затем пастеровской пипеткой или стеклянной палочкой
отбирают каплю разведенной крови и подносят ее к краю покровного
стекла, следя за тем, чтобы она равномерно без пузырьков воздуха
заполнила всю поверхность камеры с сеткой, не затекая в бороздки;
2) несколько раз тщательно встряхивают смеситель, удаляют
первые 2...3 капли из капилляра на фильтровальную бумагу и
заполняют счетную камеру, приложив смеситель с выступающей
небольшой каплей к краю покровного стекла. Заполненную камеру
оставляют на 1 мин в горизонтальном положении (для оседания
эритроцитов и прекращения их движения).
117
Для подсчета эритроцитов (см. рис. 25), не меняя
горизонтального положения камеры, помещают ее на столик микроскопа и под
малым увеличением микроскопа (объектив х40, окуляр х 10 или
х 15; в поле зрения при этом помещается один большой квадрат)
находят верхний левый край стенки (для лучшего контрастирования
следует опустить конденсор и прикрыть диафрагму). Подсчет
эритроцитов проводят в 5 больших квадратах, разделенных на 16 малых,
т. е. в 80 малых квадратах. Рекомендуется считать клетки в
квадратах сетки, расположенных по диагонали. Для того чтобы одни и те
же эритроциты, лежащие на линиях, дважды не считать, принято
для каждого квадрата, кроме элементов, лежащих внутри квадрата,
считать расположенные на определенных двух линиях — на левой и
верхней (правило буквы Г), а элементы, касающиеся или лежащие
на нижней и правой линиях квадратика, не считают.
Количество эритроцитов в 1 мкл крови рассчитывают, исходя
из разведения крови (1 : 200), числа сосчитанных квадратов (80) и
объема 1 (одного) малого квадрата (1/4000 мкл):
Х= а - 4000 • 200/80,
где X— число эритроцитов в 1 мкл крови; а — число подсчитанных эритроцитов.
Пример. В 5 больших квадратах (80 маленьких) обнаружено 488
эритроцитов. Число эритроцитов в 1 мм3 составит
488-4000-200/80 = 4 880 000.
Можно воспользоваться более простой формулой (при
разведении крови 1 : 200 и подсчете эритроцитов в 5 больших квадратах)
X— а • 10 000. Полученные результаты переводят в единицы СИ.
Подсчет эритроцитов в счетной камере — трудоемкий и
недостаточно точный метод.
2. Унифицированный метод автоматического подсчета
эритроцитов. Использование счетчика форменных элементов
значительно облегчает подсчет и делает его более производительным. Для
автоматического подсчета эритроцитов существуют
многочисленные гематологические комплексы: «Пикоскел» (Венгрия),
Celloscope (Швеция), Cell-Counter (ФРГ), СС-1006 (Япония) и др.
Применяют помимо счетчиков и гематологические автоматы «Ге-
матолог-8» и SMA-7 (США), Coulter Counter S (Франция), гемо-
анализатор — S-1500 Operator Manual Biochem Ymmno Systems и др.
Принцип работы счетчиков основан на кондуктометрическом
методе. Определенное количество разведенной изотоническим
раствором натрия хлорида или другим электролитом крови
пропускают через микроотверстие. Проходящая клетка увеличивает
сопротивление между электродами, возникающий импульс
передается на счетное устройство с цифровой индикацией.
118
Исследования проводят согласно инструкции, приложенной к
прибору.
В норме количество эритроцитов в 1 л крови составляет у
лошадей (8...10)1012, крупного рогатого скота — (5,6...7,5)1012, овец и
коз — (7,5...12,7)1012, свиней — (6,8...7,5)1012, кроликов —
(5...7,5)1012, кур-(2,5...4,5)1012.
II. Определение скорости оседания эритроцитов (СОЭ).
Если предотвратить кровь от свертывания и оставить ее в
вертикальном сосуде, эритроциты в силу тяжести постепенно
оседают и над ними остается желтоватая жидкость — плазма.
Эритроциты имеют одноименный электрический заряд, вследствие чего
они отталкиваются друг от друга. Если этот заряд уменьшается,
электростатическая сила их взаимного отталкивания исчезает и
соответственно увеличивается способность к склеиванию и
оседанию. В ускорении оседания существенное значение имеет
увеличение в плазме грубодисперсных белков — глобулинов и прежде
всего фибриногена.
СОЭ характерна для каждого вида, пола и возраста животных.
Крайне медленно протекает СОЭ у крупного рогатого скота и
овец, умеренно быстро — у свиней, очень быстро — у лошадей.
Ускорение СОЭ происходит при нормально протекающей
беременности, аллергических состояниях организма, воспалительных
реакциях и некоторых инфекционных процессах. Замедляется
СОЭ после интенсивной работы. Поскольку СОЭ —
неспецифическая реакция общего характера, клиническое значение имеет не
только абсолютная цифра скорости оседания, но и динамика ее
изменений при развитии патологического процесса. СОЭ у
сельскохозяйственных животных возрастает в следующей
последовательности: овцы = козы < коровы < птица < свиньи < лошади.
Определение СОЭ — одно из самых распространенных в
лабораторной практике исследований и входит в состав общего
клинического анализа крови. При этом используют цельную или
цитратную кровь крупного рогатого скота, лошадей и птиц.
Для исследования СОЭ чаще применяют унифицированный
микрометод Панченкова, используя приборы типа ПР-1, аппарат
Вестергрена, эритроседиометр Неводова.
Прибор типа ПР-1 представляет собой штатив из двух пластмассовых
дисков на алюминиевой стойке. На нижний диск надевается полое резиновое
кольцо для установки на нем в вертикальном положении 20 стеклянных
капилляров Панченкова. Каждому капилляру соответствует порядковый номер на
штативе. Капилляры Панченкова — это пипетки с делениями от «0» (верхняя
метка) до «100». На уровне деления «50» обозначена буква Р (реактив), на уровне
отметки «0» — буква К (кровь). Для установки пипеток Панченкова могут быть
использованы и другие модели штативов.
Аппарат Вестергрена отличается от ПР-1 тем, что его пипетки имеют
больший размер (длина 30 см, диаметр 2,5 мм, деления от «0» до «100»). Этот
аппарат удобнее использовать для определения СОЭ у крупных животных. Рекоменду-
119
ется определять СОЭ в пипетках Вестергрена, установленных под углом 30...50°.
При положении пипеток под углом оседание эритроцитов ускоряется.
Эритроседиометр Неводова представляет собой градуированную
пробирку (диаметр 9 мм, объем 10 мл, высота 17 см) с делениями от 0 (верхняя
метка) до 100. Его используют при определении СОЭ у крупных животных, чаще
лошадей.
Принцип метода заключается в следующем: смесь крови с
цитратом при стоянии разделяется на два слоя (нижний —
эритроциты, верхний — плазма); при этом СОЭ, т. е. величина столбика
плазмы, бывает различной в зависимости от изменений физико-
химических свойств крови.
Перед использованием химически чистый капилляр пипетки
Панченкова промывают 4%-ным раствором цитрата натрия.
Затем набирают цитрата натрия до метки Р и выдувают в пробирку
или на часовое стекло. Делают прокол вены, набирают полный
капилляр (до метки 0) дважды и переносят в пробирку или на
часовое стекло. При этом получают соотношение крови и
цитрата 4: 1 (т. е. 4 объема крови и 1 объем антикоагулянта).
Перемешивают содержимое и набирают в капилляр до метки 0. Закрыв
пальцем верхний конец капилляра, осторожно, чтобы кровь из
капилляра не вылилась, устанавливают капилляр в штатив строго
вертикально, упирая нижний его конец в резиновую прокладку и
прижимая верхний конец прокладкой или пробкой. Замечают
время установки капилляра в штатив и через 1 ч отмечают
скорость оседания эритроцитов по высоте (мм) отстоявшегося слоя
плазмы. Желательно одновременно исследовать кровь лошади,
крупного рогатого скота и свиней.
В эритроседиометр наливают 2 мл 4%-ного раствора цитрата
натрия. Из яремной вены лошади набирают кровь до метки 0.
Закрывают эритроседиометр резиновой пробкой, осторожно
перемешивают кровь и ставят в штатив. Отмечают уровень оседания
эритроцитов каждые 15 мин в течение 1 ч.
Примечания: 1. Для занятий можно взять кровь у животных
заблаговременно, разбавив ее (1 :4) 4%-ным раствором цитрата натрия. Капилляры
Панченкова заполняют этой кровью с часового стекла без дополнительного
разведения. Кровь можно хранить 4...6 ч при комнатной температуре.
2. Установлено, что СОЭ может быть в 5...6 раз ускорена, если капиллярные
трубки устанавливать не вертикально, а под углом 45 или 60°. Для этой цели
разработаны специальные модели штативов. Данный способ удобен для
исследования крови жвачных, свиней и птиц.
III. Исследование осмотической устойчивости эритроцитов.
Осмотическая устойчивость — резистентность эритроцитов по
отношению к гипотоническим растворам хлорида натрия.
Гемолиз—это выход гемоглобина в плазму (раствор), вызванный
повреждением (разрывом или растворением) оболочки эритроцита.
Гемолиз может быть вызван воздействием разных повреждающих
факторов — механических, термических, химических, осмоти-
120
ческих, биологических (гемолизинов). Наибольшее
распространение в клинической практике получило определение
осмотической резистентности.
Осмотический гемолиз происходит при помещении
эритроцитов в гипотонический раствор (т. е. раствор с меньшим
осмотическим давлением) или в изотонический раствор веществ,
способных диффундировать через оболочку эритроцитов (мочевина,
глюкоза). Под устойчивостью (резистентностью) эритроцитов
понимают их способность противостоять различным
разрушительным воздействиям. В нормальных условиях эритроциты
выдерживают снижение концентрации NaCl до 0,60...0,40 %, не
гемолизируясь.
Примечание. В клинической практике резистентность определяют как
процент гемолиза эритроцитов в 0,5%-ном растворе NaCl (при рН 7,4)
относительно величины гемолиза в 0,1%-ном растворе NaCl или растворе аммиака
(1 : 200). Гемоглобин в центрифугате пробы определяют
фотоколориметрическим методом.
У сельскохозяйственных животных наименьшую
резистентность имеют эритроциты овец, коз и свиней, наибольшую — птиц
и рыб. В летний период времени резистентность эритроцитов у
животных повышается.
Работа 1. В опыте используют дефибринированную кровь
крупного рогатого скота (лошадей) и птиц или 30%-ную взвесь
эритроцитов. Готовят микроскоп, штатив с пробирками, бюретки
на 25 мл, пипетки мерные и глазные, предметные и покровные
стекла, 1, 0,9 и 0,6%-ный растворы NaCl, нашатырный спирт,
дистиллированную воду, 5%-ный (изотонический) раствор глюкозы,
1%-ный раствор мочевины.
Нумеруют шесть пробирок: в пробирку № 1 наливают 5 мл
физиологического раствора, в пробирку № 2 — 5 мл
дистиллированной воды, в пробирку № 3 — 5 мл 5%-ного раствора глюкозы, в
пробирку № 4 — 4 мл физиологического раствора и 1 мл
хлороформа, в пробирку № 5 — 4 мл физиологического раствора и 1 мл
нашатырного спирта.
В каждую из пробирок вносят пипеткой по 10 капель дефибри-
нированной крови или взвеси эритроцитов, тщательно
перемешивают содержимое и ставят в штатив на несколько минут.
Рассматривают пробирки в проходящем свете. Во всех пробирках, кроме
первой (контрольной), происходит гемолиз; раствор приобретает
прозрачность и «лаковый» оттенок. В пробирках № 1...3 гемолиз
вызван осмотическим фактором, в пробирках № 4 и 5 —
химическим (хлороформ растворяет липоидную мембрану эритроцитов,
аммиак разрушает ее).
Работа 2. На трех предметных стеклах помещают по
небольшой капле крови, взятой из надрезанного пальца лягушки. К кап-
121
ле на первом стекле добавляют каплю 0,6%-ного раствора NaCl,
на втором — каплю дистиллированной воды, на третьем — каплю
1%-ного раствора мочевины. Накрывают капли покровными
стеклами и наблюдают под микроскопом. В препарате № 1 гемолиз не
наступает (изотонический раствор), в препаратах № 2 и 3
эритроциты деформируются и разрушаются.
Работа 3. Нумеруют 7 пробирок и заполняют их растворами
NaCl с целью получения нужной концентрации.
Схема разведения
Содержимое пробирок
1 | 2
№ пробирок
3 4 5
6
7
NaCl, 1%-ный раствор, мл 9 7 5 4 3 2 1
Дистиллированная вода, мл 1 3 5 6 7 8 9
Всего, мл 10 10 10 10 10 10 10
Концентрация NaCl, % 0,9 0,7 0,5 0,4 0,3 0,2 0,1
В каждую пробирку вносят по 5 капель дефибринированной
крови или взвеси эритроцитов; зажав пробирки пальцем,
перемешивают содержимое. Через 5... 10 мин отмечают результаты.
Обычно в первых трех пробирках (№ 1...3) гемолиз не происходит, в
пробирке № 4 — частичный гемолиз (раствор приобретает желтую
или слабо-розовую окраску, непрозрачен), в пробирках № 5...7 —
полный гемолиз.
Содержимое каждой пробирки центрифугируют в течение
5 мин при частоте вращения 2000 мин-1: отмечают наличие или
отсутствие осадка эритроцитов. Заносят в таблицу результаты
(«+» — полный гемолиз, «+,—»— частичный гемолиз, «—» —
отсутствие гемолиза). Минимальная резистентность эритроцитов
соответствует концентрации NaCl, в которой происходит
частичный гемолиз, максимальная — концентрации NaCl,
обусловливающей полный гемолиз (жидкость прозрачна, окрашивается в
ярко-красный цвет, осадок эритроцитов отсутствует).
Максимальная и минимальная резистентность эритроцитов (по
Jain, 1993) у животных разных видов следующая (% NaCl): лошадь —
0,34...0,54, корова-0,38...0,59, овца-0,46...0,56, коза —0,43...
0,66, верблюд —0,21...0,30, осел— 0,35...0,54, свинья— 0,29...0,52,
кролик — 0,30...0,50, собака — 0,29...0,50, кошка — 0,36...0,60.
IV. Определение количества гемоглобина в крови.
Гемоглобин (НЬ) — дыхательный пигмент крови позвоночных,
содержащийся в эритроцитах. По химической структуре он
относится к хромопротеидам и состоит из белковой части — глобина и
простетической группы — гема, содержащего железо.
Гемоглобин—коллоид с высокой молекулярной массой (около 70 000);
через оболочку эритроцитов он не проходит. Гемоглобин выпол-
122
няет роль переносчика кислорода и диоксида углерода. Образуя с
кислородом непрочное и легкодиссоциирующее соединение —
оксигемоглобин, гемоглобин служит основным переносчиком
кислорода к тканям. Биосинтез гемоглобина происходит в
костном мозге, в эритробластах. В крови эмбрионов и отчасти
молодых животных содержится наряду с гемоглобином взрослых и так
называемый фетальный гемоглобин.
Содержание гемоглобина в крови зависит от вида, возраста, пола
и состояния здоровья животных. Поэтому определение
гемоглобина — важнейшая составляющая клинического анализа крови.
Для определения содержания гемоглобина в крови существует
много различных методов. Наибольшее распространение
получили колориметрические, основанные на колориметрии
производных гемоглобина. Наиболее простым и широко
распространенным методом была колориметрия солянокислого гематина, на
котором основан метод Сали. Метод чрезвычайно прост и быстро
выполним, но недостаточно точен: ошибка при определении
гемоглобина составляет +30 %. Поэтому в настоящее время метод не
может быть рекомендован для точных исследований, но может
быть использован для учебных целей.
Исследуют цельную кровь или кровь, стабилизированную
гепарином.
Работа 1. Принцип метода — гемоглобин образует с соляной
кислотой солянокислый гематин. Образующийся окрашенный
солянокислый гематин определяют колориметрически. Если
исследуемый раствор путем разбавления довести до окраски,
одинаковой со стандартным раствором, то концентрации растворенных
веществ в обоих растворах будут одинаковы, а количество веществ
будет относиться, как их объемы.
Подготавливают к работе гемометр ГС-3 (гемометр Сали),
который представляет собой штатив, задняя стенка которого сделана
из матового стекла. В штатив вставлены 3 или 2 пробирки
одинакового диаметра. Две или одна пробирки сверху запаяны и
содержат раствор солянокислого гематина, средняя — градуирована и
открыта. К прибору приложены капилляр с меткой 20 мм3 и
стеклянная палочка.
Гемометр ГС-3 имеет пластмассовый корпус, задняя стенка которого сделана
из матового стекла, рассеивающего свет. В корпус вмонтированы две или одна
запаянные пробирки со стандартным раствором солянокислого гематина в
глицерине. Они видны сквозь прорези. Между двумя пробирками или рядом с
контрольной вставлена градуированная пробирка того же диаметра. На всех пробирках
нанесены контрольные круговые метки, которые при анализе крови должны
находиться на одном уровне. Средняя пробирка гемометра имеет две шкалы: одна
выражает содержание гемоглобина в грамм-процентах (от 2 до 23 г%), другая — в
относительных единицах (16,7 % НЬ принимают за 100 единиц, т. е. 1 г% НЬ
соответствует 6 единицам). К гемометру прилагаются капиллярная пипетка на 0,02 мл,
стеклянная палочка и глазная пипетка.
123
В среднюю пробирку вносят ОД н. раствор соляной кислоты до
нижней метки «кольцо» (0,2 мл). Затем с помощью
градуированного капилляра берут 20 мм3 (0,02 мл) крови и, обтерев кончик его
фильтровальной бумагой, выдувают кровь на дно пробирки так,
чтобы верхний слой соляной кислоты оставался неокрашенным.
Не вынимая капилляра, промывают его соляной кислотой из
верхнего слоя 2...Зраза. Перемешивают содержимое пробирки,
ударяя пальцем по ее концу, и оставляют пробирку стоять на
5... 10 мин. За это время гемоглобин полностью превратится в
солянокислый гематин. После этого к раствору прибавляют по
каплям дистиллированную воду до тех пор, пока цвет полученного
раствора не будет совершенно одинаков с цветом стандарта. При
добавлении воды раствор перемешивают стеклянной палочкой.
Цифра, стоящая на уровне нижнего мениска полученного
раствора, показывает содержание гемоглобина в исследуемой крови в
грамм-процентах (г%): показатель переводят в единицы СИ.
Работа 2. Гемиглобинцианидный метод с применением
ацетонциангидрина в последнее время принят в качестве
унифицированного метода определения гемоглобина. Его принцип —
гемоглобин окисляют в метгемоглобин красной кровяной
солью. Образующийся с ацетонциангидрином окрашенный циан-
метгемоглобин определяют колориметрически (с помощью фо-
тоэлектроколориметра).
Работа 3. Подготавливают к работе эритрогемометр. В
пробирку или стаканчик наливают 6 мл 0,04%-ного раствора аммиака
и с помощью капиллярной пипетки вносят 0,04 мл крови
(разведение 1 : 50). Перемешивают содержимое, наливают в кювету до
метки «Г» и помещают ее в прибор. Переводят переключатель «Э—Г»
в положение «Г», устанавливают фильтр «К» и нажимают на
кнопку. Вращением ручки отсчетного диска приводят стрелку
микроамперметра в нулевое положение. Цифра на шкале гемоглобина,
совпадающая с риской на стекле эритрогемометра, указывает
количество гемоглобина (г%): показатель переводят в единицы СИ.
Примечание. При использовании прибора ФЭК определяют сначала
гемоглобин гемометром ГС-3. Затем 0,02 мл пробы крови смешивают с 4 мл
0,04%-ного раствора аммиака (разведение 1 :200). Исходную пробу гемолизиро-
ванной крови фотометрируют при зеленом светофильтре в кювете с толщиной
слоя 10 мм. Затем готовят ряд последующих разведений и фотометрируют. На
основании полученных данных строят калибровочную кривую, а также таблицу
оптических плотностей и соответствующих им количеств гемоглобина. В
последующем фотометрируют только исходную пробу гемолизированной крови и по
оптической плотности находят количество гемоглобина.
V. Определение спектра поглощения гемоглобина
(восстановленного) и оксигемоглобина.
В специальную пробирку от ручного спектроскопа вносят не-
124
много крови и приливают 0,1%-ный раствор соды (гидрокарбонат
натрия), чтобы получился слабый раствор гемолизированной
крови. Пробирку ставят перед щелью спектроскопа. Передвижением
окуляра вперед и назад достигают резкости картины спектра.
Обращают внимание на желто-зеленую часть спектра.
Определяют спектр поглощения оксигемоглобина.
Далее берут 5... 10 мл такой же разведенной крови и приливают
0,3...0,5 мл восстановителя. Восстановитель готовят
непосредственно перед опытом: 5 мл 5%-ного раствора железного купороса
смешивают с 1 мл 5 %-ного раствора сегнетовой соли. Через
З...4мин оксигемоглобин перейдет в восстановленный
гемоглобин. Пробирку с таким раствором ставят перед щелью
спектроскопа.
Обратите внимание на желто-зеленую часть спектра.
Определяют спектр поглощения восстановленного гемоглобина.
Отмечают, при каких условиях происходит в крови окисление
и восстановление гемоглобина и физиологическую роль этого
процесса.
Спектрофотометрическим методом проводят спектральный
анализ соединений гемоглобина — Hb02, COHb, MetHb.
Гемоглобин при определенных условиях кристаллизуется, и
форма кристаллов имеет видовые особенности.
Контрольные вопросы и задания. 1. Что представляют собой эритроциты? 2.
Какова структура эритроцита? 3. Сколько содержится эритроцитов в 1 мм3 (мкл)" и
1 л крови у животных разных видов? 4. Опишите физиологическое значение
гемоглобина. 5. Какую роль выполняет в организме гемоглобин? 6. Что
представляет собой гемоглобин? 7. Какая группа гемоглобина обладает способностью
присоединять и отдавать молекулу кислорода? 8. Какое количество гемоглобина
содержится в крови у сельскохозяйственных животных разных видов? 9. Что
представляет собой гемоглобин, присоединивший кислород, и каким символом его
обозначают?
Занятие 17. Определение количества лейкоцитов.
Исследование свойств лейкоцитов.
Выведение лейкоцитарной формулы
Лейкоциты — клетки крови, отличающиеся характерной
структурой и сложным внутриклеточным метаболизмом. Они
различаются по форме и структуре ядра, характеру цитоплазмы. Это более
крупные клетки, чем эритроциты (их диаметр 10...20мк), имеют
неодинаковую форму ядер и неоднородную протоплазму.
Лейкоциты — высокоспециализированные клетки, обладающие
различными защитными свойствами. Благодаря фагоцитарной активности,
участию в клеточном и гуморальном иммунитете, обмене гистами-
на, гепарина обеспечиваются антимикробные, антитоксические,
125
антителообразующие и другие компоненты иммунологических
реакций.
Количество лейкоцитов в крови изменяется под влиянием
различных внешних факторов (сезонных, метеорологических и др.), а
также при разных физиологических состояниях организма
(возрастные изменения, беременность и др.) и разнообразной
патологии. Поэтому исследование числа лейкоцитов в крови — одно из
самых распространенных в практике.
Цель занятия. Освоить методику подсчета лейкоцитов,
выведения лейкоцитарной формулы; уяснить свойства и роль
лейкоцитов.
Объект исследования, материалы и оборудование. 1. Овца,
собака, кролик, курица, морская свинка; цельная или
стабилизированная кровь животных. 2. Рисунки и схемы по теме. 3. Смеситель
(меланжер) для лейкоцитов; счетные камеры Горяева; клавишный
счетчик для подсчета лейкоцитарной формулы; микроскопы;
3...5%-ный раствор уксусной кислоты, подкрашенный
несколькими каплями генцианвиолета или метиленовой синью — жидкость
Тюрка (1мл ледяной уксусной кислоты, 1мл 1%-ного водного
раствора генцианвиолета и 100 мл дистиллированной воды);
предметные стекла; 2%-ный раствор мыла, смесь Никифорова;
стеклянная палочка, шлифовальное стекло; метиловый спирт, краска
Романовского—Гимза, дистиллированная вода, иммерсионное
масло; капиллярные пипетки, часовые стекла, фильтровальная
бумага.
Выполнение работы.
I. Определение количества лейкоцитов в крови.
Сделайте заключение, у животных какого вида содержится
лейкоцитов в крови больше. Сравните полученные результаты
подсчета лейкоцитов с нормой. Желательно для сравнения
определить количество лейкоцитов в крови двух-трех видов животных
(овца, кролик, курица).
Для подсчета лейкоцитов в крови используют
унифицированные методы: в автоматическом счетчике и в счетной камере.
1. Унифицированный метод подсчета в счетной камере. Для
работы необходимо знать устройство счетной камеры (см.
«Определение количества эритроцитов»).
Принцип метода заключается в подсчете лейкоцитов под
микроскопом в определенном количестве квадратов счетной сетки и
пересчете на 1 мкл крови, исходя из объема квадратов и
разведения крови.
Исследуемую кровь разводят в 20 раз.
Разведение крови в пробирке. В сухую пробирку
наливают 0,4 мл раствора Тюрка. Пипеткой (капилляр Сали)
набирают 0,02 мл крови. Кончик пипетки вытирают фильтровальной
126
бумагой или марлей, следя за тем, чтобы из пипетки кровь не
вылилась. Выдувают кровь из пипетки на дно пробирки, тщательно
перемешивают (повторно набирая и выдувая смесь). Маркируют
пробирку и оставляют до момента счета (допускается подсчет
лейкоцитов не более чем через 2...4 ч после взятия крови).
Разведение в меланжере (смесителе). Смеситель
(меланжер) для лейкоцитов представляет собой стеклянный
капилляр с ампулообразным расширением в верхней части. В
ампуле помещена стеклянная бусинка (синяя или серая) для
перемешивания крови. На капилляре имеются метки «0,5»; «1,0»; «11».
Таким образом, вместимость ампулы в 10 раз больше вместимости
капилляра. В смеситель для лейкоцитов до метки «0,5»
насасывают кровь и разбавляют ее до метки «101» подкрашенной уксусной
кислотой (кровь разводится в 20 раз). Эритроциты при такой
обработке гемолизируются, ядра лейкоцитов прокрашиваются и
отчетливо выделяются.
Подготавливают счетную камеру. Заполняют счетную камеру
разведенной кровью. Заполненную камеру оставляют в
горизонтальном положении на 1 мин (для оседания лейкоцитов). Не
меняя горизонтального положения камеры, помещают ее на столик
микроскопа и подсчитывают лейкоциты в 100 больших квадратах
(условно 1600 маленьких) под малым увеличением (окуляр х 10,
объектив х 8). Для большей точности лейкоциты подсчитывают по
всей сетке в больших квадратах (не разделенных на малые
квадраты и полосы), начиная с левого верхнего угла сетки. Для лучшего
контрастирования затемняют поле зрения, опуская конденсор и
закрывая диафрагму. Считают клетки, расположенные внутри
квадрата и лежащие на любых двух линиях (чтобы дважды не
подсчитывать одну клетку).
Расчет числа лейкоцитов проводят, исходя из разведения
крови (1 :20), числа сосчитанных квадратов (100) и объема одного
большого квадрата (1/250 мкл, так как сторона квадрата 1/5 мм,
высота 1/10 мм):
Х= А • 250 • 20/100, т. е. Х= А • 50,
где X— число лейкоцитов в 1 мкл крови; Л — число лейкоцитов в 100 больших
квадратах.
Пример подсчета. В 100 больших (т.е. 1600малых) квадратах
100лейкоцитов. Кровь разведена в 20 раз. Количество лейкоцитов в 1 мм3 крови согласно
формуле (см. выше)
100 • 400 • 20/1600 = 5000 или, проще, 100 • 50 = 5000.
Примечание. Для определения количества лейкоцитов в крови птиц и рыб
описанный метод разбавления непригоден, так как слегка окрашенные лейкоци-
127
ты на фоне ядер лизированных эритроцитов плохо заметны. Поэтому используют
разбавители, позволяющие в одной капле подсчитывать одновременно и
лейкоциты, и эритроциты.
Разбавитель для крови птиц: NaCl — 0,9 г, СаСЬ безводный — 3,35 г, вода
дистиллированная — 90 мл. В солевой раствор добавляют 6 мл краски Гимза, 3 мл
1%-ного раствора метилвиолета, 1 мл формалина и фильтруют. При подсчете
используют меланжер для эритроцитов; кровь разводят в соотношении 1 : 100.
Лейкоциты окрашиваются в фиолетовый цвет, ядра эритроцитов остаются
неокрашенными.
Разбавитель для крови рыб: нейтральрот — 25 мг, NaCl — 0,6 г, вода
дистиллированная — 100 мл (раствор № 1); кристаллвиолет — 12 мг, лимоннокислый
натрий — 3,8 г, формалин — 0,4 мл, вода дистиллированная — 100 мл (раствор № 2).
Растворы готовят ex tempore. Кровь набирают в смеситель для эритроцитов до
метки 1,0, затем насасывают до половины расширения меланжера раствор № 1 и
заполняют до метки 101 раствором № 2. Ядра эритроцитов прокрашиваются
слабо, ядра лейкоцитов приобретают фиолетово-красный цвет, протоплазма —
розовый.
В норме количество лейкоцитов в 1 л крови животных
следующее: крупный рогатый скот —(6... 10)1092, лошади — (7... 12)1092,
овцы - (6...11)1092, свиньи - (8...16)1092, кролики - (6...9)1092,
куры-(20...40)1092.
II. Выведение лейкоцитарной формулы.
Для выведения лейкоцитарной формулы находят в мазке крови
под микроскопом различные формы лейкоцитов (нейтрофилы па-
лочкоядерные и сегментированные, эозинофилы, базофилы,
лимфоциты, моноциты) (цв. рис. II).
Отдельные формы лейкоцитов в крови находятся в
определенных соотношениях. Различные формы лейкоцитов выполняют
различные роли, поэтому количество их может изменяться
раздельно и отражать ту или иную реакцию на действие
специфического раздражителя.
При микроскопии окрашенного мазка крови можно
обнаружить, что лейкоциты имеют неодинаковые размеры, различную
форму ядра и неоднородную протоплазму. Клетки, содержащие в
протоплазме зернистость, относят к группе гранулоцитов; без
зернистости — к группе агранулоцитов. Зернистые формы
лейкоцитов по их отношению к различным краскам делят на базофилы,
эозинофилы и нейтрофилы. Нейтрофилы по возрасту могут быть
юными, палочкоядерными и сегментоядерными. Среди
незернистых форм различают лимфоциты и моноциты. Для приобретения
опыта исследований необходимо руководствоваться при
определении формы лейкоцита атласом крови животных. Желательно
зарисовать в свою тетрадь все формы лейкоцитов.
Процентное соотношение отдельных форм лейкоцитов,
определяемое при подсчете их в мазке крови под микроскопом с
иммерсионной системой, называют лейкоцитарной формулой. При
описании лейкоцитарной формулы используют буквенные обо-
128
значения: Б — базофилы, Э — эозинофилы, Ю — юные нейтро-
филы, Я — палочкоядерные нейтрофилы, С — сегментоядерные
нейтрофилы, Л—лимфоциты, М — моноциты. В крови
сельскохозяйственных животных и птиц в наибольшем количестве
содержатся лимфоциты и нейтрофилы (см. цв. рис. II). Изменения
лейкоцитарной формулы могут быть в сторону как увеличения,
так и уменьшения тех или иных форм лейкоцитов. Анализ
лейкоцитарной формулы имеет большое диагностическое и
прогностическое значение при оценке функциональной способности
кроветворных органов.
Для выведения лейкоцитарной формулы готовят тонкий мазок
крови на предметном стекле, обрабатывают его фиксатором и
окрашивают смесью щелочной и кислой красок.
Лейкоцитарную формулу (процентное соотношение различных
видов лейкоцитов) подсчитывают в окрашенных мазках крови.
Методы фиксации и окраски мазков крови, а также
микроскопического исследования мазков унифицированы.
2. Унифицированный метод морфологического исследования
форменных элементов крови с дифференцированным подсчетом
лейкоцитарной формулы. Необходимы мазки крови,
окрашенные по Романовскому—Гимзе (эозин—метиленовая синь) или
по Нохту (желтый эозин—азур II). Кровь птиц окрашивают по
Лейшману.
Принцип метода заключается в микроскопии сухих
фиксированных и окрашенных мазков крови с дифференцированием
различных форм лейкоцитов.
Исследование включает подготовку предметных стекол,
приготовление мазков крови, фиксацию мазков, их окраску и
микроскопию мазков.
Подготовка стекол. Их моют, затем кипятят в 2%-ном
растворе хозяйственного мыла, промывают 5... 10 мин в проточной
воде, насухо вытирают и помещают в смесь Никифорова (равные
части этилового спирта 96%-ного и диэтилового эфира) на
30...60 мин. Насухо вытирают и хранят в посуде с притертой
пробкой.
Приготовление мазков. На сухое предметное стекло
ближе к короткой стороне наносят небольшую каплю крови
(стеклянной палочкой). Оставляют стекло в горизонтальном
положении и размазывают каплю крови по стеклу с помощью
шлифованного стекла, помещая его под углом 45°; подождав, пока вся кровь
расплывется по нему, быстро проводят по предметному стеклу.
Мазки высушивают на воздухе и маркируют. Высохший мазок
должен быть равномерно тонким, желтоватого цвета, достаточной
величины (располагаться на 1... 1,5 см от краев, занимать почти
всю длину стекла) и оканчиваться «метелочкой».
129
Мазки фиксируют метиловым спиртом (х. ч.). Помещают
мазки в контейнер, который опускают в кювету с фиксатором (или
кладут по одному в посуду) на 5... 10 мин. Вынимают, оставляя на
воздухе до полного высыхания.
Окраска по Романовскому —Гимз е. В качестве
красителя используют готовый раствор Романовского—Гимзы,
который перед употреблением разводят из расчета 1 капля краски
на 1 мл дистиллированной воды. Время окраски устанавливают
опытным путем для каждой новой партии красителя (25...40 мин).
Микроскопия мазков. Под объективом х 10 находят
край мазка крови. Наносят каплю иммерсионного масла и, не
меняя положения стекла, переводят иммерсионный объектив (х 90)
таким образом, чтобы он погрузился в каплю масла. Подбирают с
помощью микровинта фокусное расстояние, устанавливая четкую
видимость клеток крови. Приступают к дифференцированию
лейкоцитов, отмечают клетки с помощью клавишного счетчика:
необходимо подсчитать не менее 100 лейкоцитов. Подсчет
лейкоцитов проводят таким образом: стекло двигают по зигзагу; просчитав
около половины клеток на одном крае мазка, меняют положение
стекла и другую половину лейкоцитов считают на
противоположном крае.
Счетчик для подсчета лейкоцитарной формулы имеет 11 клавиш с буквами,
соответствующими названиям отдельных лейкоцитов (дополнительно 3 клавиши
для учета патологических форм). Над клавишами размещены окошечки, в
которых при нажиме соответствующих рычагов появляются цифры 1, 2, 3 и т. д.
В крайних правых окошечках подсчитывается общая сумма нажатых при подсчете
клавиш. При подсчете 200 клеток раздается звонок, указывающий на окончание
подсчета. Гашение итогов во всех смотровых окнах производится с помощью
рукоятки.
Сетка для подсчета изготовляется типографским способом или чертится от
руки. Состоит из 100 квадратов (10x10). Четыре верхних ряда предназначаются
для сегментоядерных нейтрофилов, пятый — для палочкоядерных, следующие
четыре ряда — для лимфоцитов и последний ряд — для прочих клеток.
Занятие 18. Определение количества тромбоцитов.
Исследование свойств и роли тромбоцитов
Тромбоциты (кровяные пластинки) — образования овальной
или округлой формы диаметром 2...4 мкм. Морфологически в них
различают периферическую (беззернистую) часть и внутреннюю,
содержащую небольшое количество гранул (см. цв. рис. II).
Тромбоциты участвуют почти во всех фазах свертывания крови,
уменьшают проницаемость капилляров, способствуют местному спазму
кровеносных сосудов (через серотонин).
Цель занятия. Освоить методику подсчета количества
тромбоцитов; убедиться в участии тромбоцитов в свертывании крови.
130
Объект исследования, материалы и оборудование. 1. Овца,
корова, собака, кролик, курица, морская свинка. 2. Рисунки и схемы
по теме. 3. Иглы или автомат для взятия крови; антикоагулянты:
можно использовать порошок цитрата или оксалата натрия
(20...30 мг на 10 мл крови); раствор оксалата калия и оксалат
аммония (7,0 г оксалата калия, 4,5 г оксалата аммония, 100 мл воды)
в дозе 0,2 мл на 10 мл крови; этилендиаминтетрауксусную кислоту
(ЭДТА) в дозе 0,2 мл 0,01%-ного раствора на 10 мл крови; Na-ЭДТА
в дозе 0,5... 1 мг на 5 мл крови; гепарин (примерно 2 капли нераз-
веденного гепарина на 10 мл крови); цельная или
стабилизированная кровь животных; смесители для эритроцитов; счетные камеры
Горяева; микроскопы, капиллярные пипетки, часовые стекла,
мерные пипетки на 1 и 5 мл, фильтровальная бумага;
дистиллированная вода; разбавитель для тромбоцитов (3,8 г нитрата натрия,
0,15 г метиленовой сини растворяют в 100 мл дистиллированной
воды: раствор кипятят, охлаждают, фильтруют и добавляют в него
2...3 капли крепкого формалина).
Выполнение работы.
I. Определение количества тромбоцитов.
Подсчитывают тромбоциты или в мазке крови, или в камере
Горяева.
В меланжер для эритроцитов обычным способом набирают
кровь до метки «0,5» и разбавляют ее в 200 раз разбавителем для
тромбоцитов. Откладывают меланжер на 10 мин, чтобы
тромбоциты прокрасились метиленовой синью.
Повторно перемешивают раствор и заполняют камеру Горяева
обычным способом. Производят подсчет тромбоцитов под
средним увеличением (х 15...Х 40) микроскопа в 25 больших квадратах
сетки. Тромбоциты распределяются в камере равномерно между
эритроцитами и имеют вид голубоватых глыбок. (Четко
проявляются тромбоциты в виде контурированных темных образований
при исследовании фазово-контрастной микроскопией.)
Количество тромбоцитов в 1 мм3 крови согласно формуле составит
Х= а -4000 -200/1400.
Примечание. Количество тромбоцитов можно определить и «сухим»
методом в окрашенном по Романовскому—Гимзе мазке крови. Подсчитывают под
иммерсией число пластинок, приходящихся на 1000 эритроцитов.
II. Исследование свертывания крови.
Тромбоциты играют существенную роль в обеспечении
свертывания крови. Знание механизмов свертывания крови
необходимо для понимания причин и диагностики геморрагических
диатезов, а также заболеваний, связанных с нарушением гемокоагу-
ляции.
131
Свертывание крови — защитная реакция, предохраняющая
организм от кровопотери. Это сложный ферментативный
процесс, находящийся под нервно-гуморальным контролем.
В крови животных содержатся многочисленные факторы,
которые способствуют свертыванию — прокоагулянты и препятствуют
свертыванию — антикоагулянты. Прокоагулянты (факторы
свертывания) находятся в плазме, кровяных пластинках и
эритроцитах. В циркулирующей крови эти факторы находятся в неактивной
форме, так как их деятельность подавляется естественными
антикоагулянтами или ингибиторами свертывания.
Свертывание крови, вытекающей из кровеносных сосудов,
происходит в 3 фазы: образование кровяного (тромбоцитарного) и
тканевого тромбопластина (тромбокиназы); образование
тромбина из протромбина; образование нитей фибрина из фибриногена
и образование тромба. В каждой из этих фаз участвует ряд прокоа-
гулянтов и антикоагулянтов.
Фибрин выпадает в виде тончайших нитей и образует остов, в
котором задерживаются форменные элементы и плазма:
возникает тромб.
Для работы необходимы: цельная кровь, полученная из вены; иглы для взятия
крови; предметные стекла обезжиренные; аппарат Безарона, водяная баня,
пробирки центрифужные, спирт, вата, йод.
Аппарат Безарона состоит из двух металлических камер: воздушной и
водяной, с термометрами. На металлической рамке внутри воздушной камеры
установлено вогнутое стекло, покрытое парафином. Стекло поворачивается с
помощью винта, водяная камера подогревается горелкой.
Время свертывания крови можно определить различными
методами (Шульца, Шиллинга, Егорова—Ситковского, Фонио,
Маса и Магро, Безарона и др.).
1. Унифицированный метод определения времени свертывания
крови. Наиболее современный метод.
Принцип метода заключается в определении времени
свертывания цельной крови (свежей нестабилизированной) при 37 °С.
Сухой иглой с широким просветом без шприца прокалывают
вену. Выпустив первые капли крови на вату, набирают по 1 мл в
две сухие пробирки одинакового размера. Немедленно включают
секундомер и ставят пробирки в водяную баню при 37 °С. Через
1 мин, а затем через каждые 30 с пробирки наклоняют на 45...60°,
дожидаясь момента, когда кровь свернется (вначале она свободно
стекает по стенке пробирки). Отмечают время образования
сгустка крови в каждой из пробирок и вычисляют средний результат.
В норме время свертывания крови у животных следующее,
мин: лошадь — 6... 13, крупный рогатый скот —6...13, овца —2...6,
коза — 5...8, свинья — 2...6, собака — 2...6, кошка — 2...6, кролик —
1...2, курица— 1...2.
132
2. Другие методы. 1. На обезжиренное предметное стекло
наносят 2 капли крови, полученной из вены, и кладут его под
стеклянную воронку, где находится марля, смоченная водой. Через
каждые 2 мин (при исследовании крови курицы через 1 мин)
извлекают стекло и наблюдают за формой капли при наклоне стекла. При
наступлении свертывания капля крови не меняет формы.
Сравнивают показатели свертывания крови у овец, кролика и птиц.
3. Протирают смотровое стекло аппарата Безарона, смачивают
водой марлевый мешочек, на дно воздушной камеры наливают
15 мл теплой воды. Водяную камеру аппарата заполняют на 3/4
объема водой. Закрывают аппарат крышкой. Нагревают воду в
водяной бане так, чтобы температура воздуха в воздушной камере
составляла 37 °С. После взятия крови 2 капли ее немедленно
наносят на вогнутое стекло аппарата. Воздушную камеру закрывают
крышкой.
Через каждые 30 с слегка поворачивают вогнутое стекло (на
себя), следя за поведением капли. Вначале она катается как ртуть,
затем движения замедляются. За окончание свертывания
принимают момент, когда при повороте стекла на 90° кровь с него не
стекает.
Примечание. В клинической практике учитывают ряд показателей гомео-
стаза: время рекалыдификации плазмы, количество и агрегация тромбоцитов,
активность антитромбина III, протромбиновое время, частичное тромбопластическое
время, активность плазменного тромбопластина, протромбиновый индекс, время
свободного гепарина, активность фактора XIII, концентрация общего
фибриногена, количество фибриногена, фибринолитическая активность и др.
Занятие 19. Подсчет форменных элементов с помощью
фотоколориметрических и кондуктометрических приборов
Подсчет форменных элементов в счетных камерах —
трудоемкий процесс, дающий к тому же ошибку в пределах 6... 10 %
вследствие возможных методических погрешностей (недостаточное
перемешивание взвеси эритроцитов, неравномерность их
распределения по сетке, перемещение эритроцитов и т. д.). Поэтому
разработаны более быстрые и не менее точные методы, основанные на
принципах электрофотоколориметрии и кондуктометрии.
Цель занятия. Ознакомиться с некоторыми моделями электро-
фотометрических и кондуктометрических счетчиков частиц.
Выполнение работы.
1. Фотоэлектроколорыметрический метод подсчета.
Принцип этого метода состоит в фотоэлектрическом
измерении степени поглощения взвесью эритроцитов световых волн
определенной длины в инфакрасной части спектра. Для этой цели
133
можно использовать фотоэлектроколориметр или специальный
прибор — эритрогемометр. При использовании фотоэлектроколо-
риметров исходную взвесь крови в 3%-ном растворе NaCl (1 : 400)
подсчитывают несколько раз в камере Горяева и через 1,5...2 ч
фотометрируют в кювете с толщиной слоя 3 мм при красном
светофильтре № 8. Затем готовят ряд последующих разведений крови
и снова фотометрируют. На основании полученных данных строят
среднюю калибровочную кривую с указанием оптических
плотностей (экстинции) взвесей и соответствующих им количеств
эритроцитов в 1 мм3 крови. При последующей работе фотометрируют
только исходную взвесь эритроцитов и по оптической плотности
и калибровочной кривой находят содержание эритроцитов.
Эритрогемометр фотоэлектрический модели 065
представляет собой стрелочный фотоэлектроколориметр, специально
предназначенный для определения содержания эритроцитов и
гемоглобина в крови при условии, что их количество не слишком
отклонено от нормы. На панели прибора смонтированы гнездо
для кювет, щель для фильтров, микроамперметр с корректором,
ручка переменного сопротивления, ручка отсчетного диска, от-
счетный диск, сетевая колодка, кнопка микровыключателей,
переключатель «эритроциты—гемоглобин», ручка подстройки
ширины шкалы, сигнальная лампочка.
Содержание эритроцитов исследуют в цельной или
стабилизированной крови. При работе с кровью сельскохозяйственных
животных по методике, описанной в инструкции, показатели
получаются неточными. Требуется дополнительная калибровка прибора с
параллельным подсчетом эритроцитов в камере Горяева. Однако,
применяя соответствующие разбавители и разведения, можно
определять содержание эритроцитов в крови лошадей, крупного
рогатого скота, овец без изменения заводской калибровки прибора. Для
разведения используют раствор следующего состава: NaCl x. ч. —
35 г, чистый формалин плотностью 1,081...4,086 —5 мл, вода
дистиллированная — до 1000 мл.
Включают прибор в сеть и дают ему прогреться. Оправу с
рабочими фильтрами ставят в нижнее положение до упора. В гнездо для
кюветы помещают установочный фильтр «У», переключатель «Э—Г»
ставят в положение «Э». Ручкой отсчетного диска переводят диск до
совпадения риски с делением градусной шкалы на торце
установочного фильтра против буквы «Э». Заменяют фильтр «У» фильтром
«К». Стрелка амперметра отклоняется вправо: вращая ручку
отсчетного диска, возвращают стрелку к нулевому делению.
Наливают в пробирку или стаканчик 9 мл указанного выше
раствора. Насасывают в пипетку гемометра 20 мм3 цельной или
стабилизированной крови и вносят ее в раствор (разведение
1 : 950). Не вынимая пипетки, промывают ее несколько раз рас-
134
твором. Тщательно перемешивают содержимое пробирки и
наполняют им до метки кювету «3» прибора. Помещают кювету в
гнездо эритрогемометра: стрелка микроамперметра отклоняется
влево. Вращением ручки отсчетного диска приводят стрелку в
положение «О». Цифра диска, совпадающая с ценой, нанесенной на
стекле эритрогемометра, будет указывать число эритроцитов в
1 мм3 исследуемой крови.
Примечание. При исследовании крови человека используют разбавители и
разведения крови, указанные в инструкции, прилагаемой к прибору.
2. Подсчет с помощью электронных кондуктометрыческих
счетчиков частиц.
Работа кондуктометрических счетчиков частиц основана на
следующем принципе. Разведенные в растворе электролита
форменные элементы под действием вакуума проходят по одному
через микроотверстия в пробирке, изменяя сопротивление между
платиновыми электродами. Это приводит к появлению импульса
напряжения, амплитуда которого пропорциональна объему
частиц. Поступающие от счетчика импульсы усиливаются, проходя
через дискриминатор, где «фильтруются» по высоте, затем
попадают на автоматический счетчик. Имеющийся в схеме некоторых
моделей осциллоскоп позволяет осуществлять визуальный
контроль за правильностью работы прибора и амплитудой потенциала
(пропорциональной размерам частиц). К приборам прилагаются
микропипетки для забора крови и последующих разведений или
автоматические дозаторы.
Основные достоинства кондуктометрических счетчиков
частиц: высокая скорость счета и измерения частиц (до 10 000 в 1 с);
высокая чувствительность (при небольшой концентрации частиц)
и хорошая воспроизводимость результатов (2 %); малый объем
проб для анализа (0,02...0,1 мл); возможность распределения
частиц по размерам.
К счетчикам Коултера некоторых моделей выпускаются
вычислительные приставки для определения гематокрита и среднего
объема клеток. Наиболее распространенные приборы такого типа:
счетчики Коултера (США, Франция, Англия) разных моделей,
приборы «Целлоскоп-302» и «Целлоскоп-401» (Швеция),
счетчики ЦГ-2 (Германия), приборы «Пикоскел» (Венгрия).
Отечественные аналогичные приборы — СФЭК-62, ИКМ-2 и др.
Прибор готовят к работе в соответствии с инструкцией,
приложенной к нему: выбирают и готовят растворы-разбавители,
регулируют прибор (настройка вакуума, оптической системы,
осциллоскопа, тока датчика и усиления, дискриминатора), получение
крови и приготовление проб для анализа. Все это происходит в
присутствии студентов в форме демонстрационного занятия.
135
Стакан с подготовленной пробой для подсчета эритроцитов
помещают в прибор и проделывают основные рабочие операции:
открывают управляющий кран, производят сброс счетчика на нуль,
закрывают управляющий кран (в некоторых моделях счетчиков
необходима лишь одна операция — нажать кнопку или повернуть
ручку). Повторяют процедуру подсчета и используют средние
данные из ряда подсчетов. Подставляют к показаниям счетчика
количество нулей, указанное в инструкции, определяют содержание
эритроцитов в 1 мм3 цельной крови. Проводят серию подсчетов
при последовательно увеличивающихся значениях шкалы
дискриминатора и путем вычитания каждого показания счетчика из
предыдущего получают дифференциальную кривую распределения
частиц по размерам (у приборов с нулевым дискриминатором
счетчик сразу показывает значения дифференциальной кривой
распределения).
Установив дискриминатор по шкале на соответствующее
деление, подсчитывают аналогичным образом число лейкоцитов в
разведенной пробе крови с гемолизированными эритроцитами, а
затем делают пересчет на цельную кровь.
Контрольные вопросы и задания. 1. Каковы различия в методах подсчета
эритроцитов и лейкоцитов? 2. Чем вызвано различие в методах подсчета эритроцитов
и лейкоцитов? 3. Каково количество лейкоцитов в крови у животных различных
видов? 4. Какова главная роль лейкоцитов? 5. Какое значение для практики имеет
подсчет лейкоцитов? 6. Какие формы лейкоцитов различают? 7. Каково
происхождение гранулоцитов? 8. Каково происхождение агранулоцитов? 9. Каковы
количество, морфология, свойства и роли: а) эозинофилов; б) базофилов; в) нейтро-
филов; г) моноцитов; д) лимфоцитов? 10. Что такое лейкоцитарная формула (лей-
кограмма)? 11. Одинакова ли лейкоцитарная формула у животных различных
видов? 12. С какой целью определяют лейкоцитарную формулу? 13. Что такое
лейкопоэз? 14. Какие факторы стимулируют лейкопоэз? 15. Что называют
лейкоцитозом? 16. Какие виды лейкоцитоза различают? 17. Опишите механизм
регуляций количества лейкоцитов в крови. 18. Каков характер рефлекторных влияний
на систему белой крови, осуществляемых через блуждающие нервы? 19. Каков
характер рефлекторных влияний на систему «белая кровь», осуществляемых через
симпатические нервы? 20. Какие гормоны и какое влияние они осуществляют на
систему «белая кровь»?
5.9. СИСТЕМА КРОВООБРАЩЕНИЯ
И ЛИМФООБРАЩЕНИЯ
Система кровообращения обеспечивает нагнетание сердцем в
сосуды такого объема крови в единицу времени и поддержание
такого уровня кровяного давления, тока крови, перераспределения
ее между органами, которое необходимо для обеспечения
потребного уровня обмена веществ, деятельности органов.
Движение крови по сердцу и сосудам, обеспечиваемое работой
сердца и сосудов, называют кровообращением. Движение крови
осуществляется по двум кругам кровообращения: большому и малому.
136
Занятие 20. Нагнетание крови сердцем в сосуды.
Цикл сердечной деятельности.
Возникновение и проведение возбуждения в сердце
Сердце животных — полый мышечный орган, разделенный
перегородкой на правую и левую половины: каждая состоит из
предсердия и желудочка, между которыми имеется атриовентрикуляр-
ное отверстие. Оба отверстия снабжены створчатыми клапанами,
которые открываются только в сторону желудочков. У места
выхода аорты из левого желудочка и легочной артерии из правого
желудочка располагаются полулунные клапаны, которые
открываются только в одну сторону, пропуская кровь из желудочков в аорту
и легочную артерию.
Работа сердца заключается в нагнетании крови, поступающей
из вен, в аорту и легочную артерию, что обеспечивает кровяное
давление и поддержание разницы давления крови в начальных и
конечных отделах большого и малого кругов кровообращения.
Сердце нагнетает кровь в сосудистую систему благодаря
синхронному сокращению мышечных клеток, которые образуют
сердечную мышцу — миокард. Работа сердца связана с
последовательным сокращением (систола) и расслаблением (диастола)
предсердий и желудочков, что обеспечивает перекачивание крови.
Взаимосвязанное последовательное сокращение предсердий,
вслед за ним сокращение желудочков и расслабление предсердий,
а затем и желудочков называют сердечным циклом.
Цель занятия. Уяснить специфику системы, обеспечивающей
оптимальные для метаболизма уровни нагнетания крови в сосуды
и кровяного давления, движения крови, перераспределения крови
между органами, которая определяется деятельностью сердца и
кровеносных сосудов.
Объект исследования, материалы и оборудование. 1. Лягушки,
овца, собака, лошадь. 2. Рисунки и схемы по теме. 3. Набор для
препаровки лягушек; универсальный штатив, рычажок Энгельма-
на с писчиком и ниткой с легким зажимом (серфином);
электромагнитный отметчик, связанный проводами с отметчиком
времени и источником тока; кимограф, ванночка для фиксажа;
раствор Рингера для холоднокровных.
Выполнение работы.
I. Исследование деятельности сердца.
Деятельность сердца удобно первоначально исследовать на
лягушке. Сердце лягушки трехкамерное — состоит из двух
предсердий и одного желудочка. В правое предсердие впадают две
полые вены, образующие в устье расширение — венозный синус;
в левое предсердие впадают легочные вены. От желудочка
отходит аорта, которая дает начало правой и левой аортальным вет-
137
вям. Деятельность сердца осуществляется по принципу
сердечного цикла — систола венозного синуса, систола предсердий,
систола желудочка.
Приготовленную для исследования деятельности сердца
лягушку обездвиживают либо путем анестезии, либо разрушив ЦНС.
Лягушку с помощью булавок фиксируют на пробковой пластинке
брюшком кверху. Обнажают сердце. Захватывают пинцетом кожу
брюшной стенки в середине брюшка, надрезают ее ножницами и
делают два симметричных разреза кожи до плечевых суставов.
Получившийся лоскут кожи отрезают у основания. Затем
приподнимают пинцетом нижний конец грудины и делают ножницами два
боковых разреза грудной стенки, включая и ключицы.
Образовавшийся костно-мышечный лоскут откидывают кверху и отделяют у
основания. Осторожно с помощью анатомического пинцета
освобождают сердце от покрывающего его прозрачного перикарда.
Видны бледноокрашенные предсердия и желудочек, имеющий
вишневый цвет. Хорошо выделяются беловатая луковица аорты и
две ее ветви. Приподняв сердце лягушки за верхушку, можно
увидеть в области его основания синеватый венозный синус (рис. 26).
Пластинку с лягушкой укрепляют в штативе под рычажком для
записи деятельности сердца (кардиограф). Верхушку сердца
захватывают зажимом, а нить, идущую от зажима, прикрепляют к
короткому плечу рычажка. Нить, соединяющая сердце с рычажком,
при этом должна быть протянута строго вертикально, а рычажок
должен принять горизонтальное положение и свободно вращаться
вокруг своей оси. В этих условиях можно отчетливо наблюдать
последовательные сокращения венозного синуса, предсердий и
желудочка. Каждое сокращение сердца заставляет короткое плечо
рычажка опускаться, а писчик — подниматься кверху; при
расслаблении сердца рычажок возвращается в исходное положение.
Присоединяют писчик рычажка к барабану кимографа и
записывают кардиограмму. На восходящей части каждой волны
кардиограммы заметен небольшой уступ, соответствующий
систоле предсердий. Верхняя часть волны отражает систолу желудочка,
а впадина между волнами — диастолу сердца.
II. Определение времени сердечного цикла, его
продолжительности, ритмичности сердечных циклов.
Исследование проводят на лягушке. Подготавливают все
необходимое для записи сокращений сердца (см. рис. 26).
Одновременно с записью работы сердца на той же ленте
(записи) под кардиограммой с помощью электромагнитного писчика,
соединенного с отметчиком времени, запишите определенные
интервалы времени (например, 5 или Юс), а затем рассчитайте,
сколько сердечных циклов приходится на 5 или 10 с. Далее
определите время одного сердечного цикла. С помощью циркуля и
138
Рис. 26. Регистрация работы сердца лягушки:
/— подготовка сердца лягушки для графической регистрации: А — вскрыта грудная полость;
Б— наложена лигатура на уздечку; В — уздечка перерезана, к верхушке желудочка прикреплен
серфин с нитью; II— схема графической регистрации работы сердца лягушки. Вверху —
кардиограмма
миллиметровой линейки определите длину записи на ленте
одного сердечного цикла (мм), систолы и диастолы предсердий и
желудочка. Зная время сердечного цикла, длину цикла и его фаз на
ленте, легко рассчитать длительность систолы и диастолы
предсердий и желудочка (находят путем деления времени сердечного
цикла на длину последнего на ленте, какому времени
соответствует 1 мм длины; это время умножают на длину систолы и диастолы
предсердий и желудочка).
III. Определение длительности сердечного цикла у животного в
покое и после функциональной нагрузки (бег).
Длительность сердечного цикла изменяется в зависимости от
частоты сокращений сердца в единицу времени.
Исследование желательно проводить на крупных животных. С
помощью фонендоскопа или по пульсу определяют количество
сокращений сердца у животного в 1 мин. Затем животному дают
139
физическую нагрузку — бег в течение 10 мин и вновь определяют
количество сокращений сердца в 1 мин. Рассчитывают
длительность одного сердечного цикла в первом и во втором случаях.
Объясните, какие факторы определяют продолжительность
сердечного цикла и его фаз.
IV. Исследование роли проводящей системы сердца в обеспечении
согласованных сокращений и расслаблений предсердий и желудочков,
частоты сокращений.
Согласованное последовательное сокращение и расслабление
предсердий и желудочков, частота сокращений обеспечиваются
специальной проводящей системой сердца. Проводящая система
сердца представлена синоатриальным узлом, расположенным в
стенке правого предсердия, атриовентрикулярным узлом,
расположенным в стенке правого предсердия около атривентрикуляр-
ного отверстия, ножкой и пучками Гиса, расположенными вдоль
перегородки между желудочками, переходящими в волокна Пур-
кинье, которые идут к мышечным волокнам сердца. Проводящая
система сердца обладает свойством генерировать импульсы.
Водителем ритма сокращений сердца является синоатриальный узел.
Возбуждение возникает в синоатриальном узле, распространяется
на предсердия, достигает атриовентрикулярного узла,
распространяется по пучкам Гиса и волокнам Пуркинье на мышечные
волокна, вызывает последовательное сокращение предсердий и
желудочков. Чем выше возбудимость синоатриального узла, чем
больше импульсов генерируется в нем, тем чаще сокращается сердце, и
наоборот.
Примечание. В проводящей системе сердца лягушки имеется два узла: узел
Ремарка в венозном синусе и узел Биддера в межпредсердной перегородке на
границе с желудочком (рис. 27). Узел Ремарка обладает наибольшей степенью
автоматизма, является водителем ритма.
Выясните характер изменения сердечных сокращений при
понижении и повышении возбудимости проводящей системы сердца.
Исследования проводят на лягушке с обнаженным сердцем.
Записывают сердечные сокращения на кимографе в течение 1 мин.
Затем, не прекращая запись, орошают в течение 1 мин по каплям
область у основания сердца холодным раствором Рингера
(5...7°С). Отмечают на кимограмме момент, когда проводилось
орошение.
Обратите внимание, как изменились ритм и сила сокращений
сердца. Дают сердцу в течение 2...3мин восстановить обычный
ритм. Затем продолжают запись сокращений при орошении
сердца теплым раствором Рингера (около 25 °С) также в течение 1 мин.
Делают заключение о значении функционального состояния
проводящей системы сердца в определении ритма и силы
сердечных сокращений.
140
о б в
Рис. 27. Схема строения сердца лягушки и наложение лигатур Станиуса:
/— строение сердца (А — вид с брюшной стороны, Б— вид сбоку, В— вид со спины): /— правая
дуга аорты; 2—левая дуга аорты; 3 — левое предсердие; 4—правое предсердие; 5— конус аорты;
б—желудочек; 7—правая передняя полая вена; 8— левая передняя полая вена; 9—венозный
синус; 10 — задняя полая вена; 11 — узел Ремарка; 12— узел Биддера; Я—наложение лигатур:
а— подведена нитка под дуги аорты; б— затянута первая лигатура, подведена вторая, синус
отделен от предсердий; в — затянута вторая лигатура
V. Исследование свойства генерировать импульсы атриовентри-
кулярного узла и пучка Тиса.
Атриовентрикулярный узел и пучок Гиса также способны
генерировать импульсы, но эта способность их менее выражена, чем у
синоатриального узла, и в естественных условиях подавляется им.
Определите характер изменений ритма и согласованности
сокращений предсердий и желудочков при искусственном
нарушении функциональной связи синоатриального узла с атриовентри-
кулярным узлом, с пучком Гиса.
Надо знать расположение узлов, пучков и волокон проводящей
системы сердца. Подготавливают лягушку с обнаженным сердцем.
Подводят лигатуру пинцетом под обе дуги аорты (см. рис. 27).
Верхушку сердца откидывают кверху, при этом обнаруживается
тонкий тяж-уздечка, прикрепляющийся к задней поверхности
сердца. Далее накладывают (не очень туго; цель — нанести
механическое раздражение на атриовентрикулярный узел, узел
Биддера) вторую лигатуру на границе между предсердиями и
желудочком. Обычно сокращения желудочка возобновляются.
141
Подсчитайте частоту сокращений венозного синуса и
желудочка, определите, согласованы ли их сокращения. Сокращения
желудочка в этих условиях обычно вдвое реже, чем синуса.
Опыт с наложением лигатур называют опытом Станиуса
(соответственно лигатуры Станиуса).
Сделайте заключение о роли синоатриального узла в
деятельности проводящей системы сердца.
Контрольные вопросы и задания. 1.В чем проявляется деятельность системы
кровообращения? 2. В чем проявляется деятельность сердца? 3. Благодаря какой
деятельности и каких структур возможна деятельность сердца? 4. Как называют
сокращения и расслабления предсердий и желудочков сердца? 5. Что понимают
под сердечным циклом? 6. Опишите фазы сердечного цикла. 7. Какова средняя
продолжительность сердечного цикла и его фаз у крупного рогатого скота? 8.
Какие факторы определяют различия в количестве сердечных сокращений у
различных животных? 9. Чем обусловлено последовательное и согласованное
сокращение отделов сердца? 10. Чем представлена проводящая система сердца? 11. Какова
роль проводящей системы сердца? 12. Где расположен и какова роль
синоатриального узла в деятельности проводящей системы сердца? 13. Где расположен и
какова роль атриовентрикулярного узла в деятельности проводящей системы сердца?
14. Где расположены и какова роль пучка Гиса и волокон Пуркинье в
деятельности проводящей системы сердца? 15. Опишите, как происходит ток крови в
полостях сердца. 16. Чем обусловлен односторонний ток крови из предсердий в
желудочки, из желудочков в крупные артерии? 17. Какие клапаны имеются в сердце и
где они расположены? 18. От чего зависят открытие и закрытие клапанов сердца?
19. Какова величина давления крови во время диастолы и систолы в правом и
левом предсердиях и желудочках?
Занятие 21. Структурно-физиологические
особенности сердечной мышцы.
Физиологические свойства сердечной мышцы.
Движение крови по сосудам
Сердечная мышца, или миокард, — поперечно-полосатая
мышца с рядом структурных особенностей. Образована сердечными
мышечными клетками (волокнами), которые имеют все
компоненты животной клетки и сократительный аппарат, как и у
скелетных мышц. Мышечные волокна вытянуты в длину,
соединяются между собой через вставочные диски и образуют единое
целое — функциональный синтиций.
Сердечная мышца обладает теми же свойствами, что и
скелетная мышца, и рядом специфических свойств (автоматия,
воспроизведение разного ритма возбуждений в синоатриальном узле
и др.).
Цель занятия. Уяснить роль структурно-физиологических
свойств сердечной мышцы в нагнетательной деятельности сердца,
обеспечивающей непрерывное движение крови в организме,
перераспределение крови между органами в зависимости от их
функционального состояния.
142
Объект исследования, материалы и оборудование. 1. Лягушки,
овца, собака, крыса. 2. Рисунки и схемы по теме. 3. Набор для
препаровки лягушек, универсальный штатив, рычажок Энгельмана с
писчиком, ниткой и серфином; установка для изолированного
сердца лягушки, 2 стеклянные канюли для сердца лягушки;
раствор Рингера для холоднокровных; микроскоп с
окуляром-микрометром, секундомер; пластинка с отверстиями для фиксации
лягушки, булавки; индукционная катушка с проводами и
электродами в виде тонких проволочек, источник тока, ключ для замыкания
или электронный стимулятор; «мачта» — стеклянная трубка
высотой 70...80 см с поперечными отростками, которые отходят через
каждые 10 см, и с надетыми на них резиновыми снабженными
винтами зажимами; канюля для сосудов; сосуд Мариотта,
заполненный раствором Рингера; трубки резиновые, зажимы винтовые,
градуированные цилиндры на 20...25 мл, пипетки; миорелаксант
(0,1%-ный раствор дитилина).
Выполнение работы.
I. Исследование изменений свойства возбудимости сердечной
мышцы в процессе возбуждения, сокращения.
Возбудимость сердечной мышцы, как и других возбудимых
тканей, изменяется в процессе возбуждения, но эти изменения
имеют особенности — более длительные фазы абсолютной и
относительной рефрактерности.
Определите, как реагирует сердечная мышца на раздражение ее
в момент систолы и в момент диастолы.
Лягушку обездвиживают общепринятыми приемами.
Фиксируют на пластинке, обнажают сердце и укрепляют пластинку с
лягушкой в штативе. Захватывают верхушку сердца зажимом,
соединенным с пишущим рычажком. Собирают установку для
раздражения сердечной мышцы электрическим током (источник тока
соединить с индукционной катушкой, минуя прерыватель).
Подбирают ток достаточной силы (приложив электроды к какой-либо
мышце лягушки, произведите ключом замыкание и размыкание
тока в первичной цепи; как в момент замыкания, так и при
размыкании мышца должна вздрагивать). Затем один из электродов
закрепляют в области основания сердца, другой вкалывают в
верхушку сердца. Записывают на кимографе несколько нормальных
сокращений сердца. Далее, не прекращая записи, наносят на
сердечную мышцу одиночные импульсы (раздражения) с интервалом
5...6 сокращений сердца во время очередной систолы, а затем в
начале и в конце диастолы.
Проанализируйте реакции сердечной мышцы по
кардиограммам и сделайте заключение об особенностях изменений
возбудимости сердечной мышцы в процессе возбуждения, в различные
фазы сокращения, о биологической значимости отмеченных осо-
143
бенностей изменений возбудимости сердечной мышцы при
сокращении.
II. Исследование свойств сердечной мышцы.
В целях выявления свойств сердечной мышцы увеличивать
силу сокращения по мере увеличения степени ее растяжения,
увеличивать работу до определенного предела (по закону средних
нагрузок) по мере увеличения сопротивления (давления крови)
выясните, как изменяется работа сердца в зависимости от величины
венозного притока к сердцу; определите, как изменяется работа
сердца в зависимости от величины артериального сопротивления.
Наиболее удобный объект для исследования названных
свойств сердечной мышцы — сердце лягушки. Лягушку
обездвиживают бескровным способом, фиксируют на пластинке и
обнажают сердце. Перевязывают и перерезают уздечку. Подводят
нитки (лигатуры) раздельно под правую и левую ветви аорты.
Освобождают заднюю полую вену от окружающих образований и,
подведя под нее нитку, делают на вене надрез, вставляют и
фиксируют в ней лигатурой канюлю. Канюлю соединяют
резиновой трубкой с сосудом Мариотта и с помощью зажима, надетого
на соединительную трубку, обеспечивают небольшой приток
раствора к сердцу. Одну из ветвей аорты перевязывают наглухо.
Делают надрез на другой ветви аорты, введя и фиксируя в ней
канюлю. Эту канюлю резиновой трубкой соединяют с «мачтой».
Сердце должно проталкивать в «мачту» раствор, который заменяет
кровь. Сосуд Мариотта с раствором Рингера служит в качестве
искусственной венозной системы. «Мачта» представляет собой
модель артериальной системы; открывая и закрывая зажимы на
поперечных отростках, можно менять артериальное давление.
Для определения производимой сердцем работы измеряют с
помощью градуированного цилиндра объем раствора,
вытекающего из отростка «мачты» за единицу времени (1 мин), и
умножают его на высоту над уровнем сердца отростка «мачты», из
которого выпускают раствор (артериальное давление — р). Чтобы
вычислить работу (гсм) сердца за 1 систолу (а), следует вместо
минутного объема (м) взять систолический (с):
а = с • р.
Определите работу сердца при малом, среднем и большом
объеме венозного притока к сердцу. Установите постоянный
(средний) приток раствора к сердцу. Определите работу сердца.
Закройте зажим на нижнем отростке «мачты», заставляя сердце
поднимать раствор до следующего отростка (при увеличенном
артериальном давлении). Определите работу сердца в этих условиях.
Далее закройте и этот отросток, повышая таким образом давление
еще на 10 см. Вновь определите работу сердца.
144
7 —отсечение верхней челюсти с головным мозгом; 2— перерезка позвоночника; 3— снятие
кожи с обеих задних лапок; 4—удаление копчика; 5—задние лапки лягушки: Л —передняя
сторона, /> —задняя сторона; о —портняжная мышца, б— нежная, в — икроножная, г
—трехглавая мышца бедра, д —двуглавая мышца бедра, е — полуперепончатая, ж —седалищный
нерв; 6— отпрепаровка седалищного нерва от бедренного сочленения; 7—перевернув лапку,
раздвинуть двуглавую и полуперепончатую мышцы, освободив нерв; 8— приподняв нерв с
кусочком позвоночника, отпрепарировать его до коленного сустава; 9— откинуть нерв на
голень, освободить бедренную кость от тканей и вылущить ее головку из тазобедренного
сустава. Препарат готов, называется «реоскопическая лапка»; 10— захватить пинцетом ахиллово
сухожилие и подрезать ножницами его дистальный конец; 77 — отделить икроножную мышцу
от окружающих тканей, удалить голень ниже коленного сустава. Препарат готов, называется
«нервно-мышечный препарат»
По результатам исследований сделайте заключение о
зависимости работы сердца от степени растяжения сердечной мышцы в
диастоле.
III. Исследование характера поступления крови в аорту при
работе сердца.
Исследование легко провести на сердце лягушки. Обнажают
сердце, осторожно снимают перикард и перевязывают уздечку.
Сердце за нитку, привязанную к уздечке, перевертывают и
оттягивают так, чтобы был виден синус. Освобождают нижнюю полую
вену от окружающих образований, подводят под нее нитку. На
вене делают маленький надрез, вводят в него канюлю и
закрепляют ее с помощью подведенной под вену тонкой нитки. Концы
нитки крепко связывают поверх резинового пояска, надетого на
канюлю. Канюлю резиновой трубкой соединяют с сосудом Мари-
отта, заполненным раствором Рингера. Затем делают надрез в
одной из дуг аорты и вводят вторую канюлю. Канюлю следует
зафиксировать. Вторую дугу аорты перевязывают. К канюле
присоединяют резиновую трубку. С помощью зажима, надетого на
соединительную трубку, обеспечивают небольшой приток раствора
к сердцу из сосуда Мариотта (искусственная венозная система).
По току раствора из аортальной канюли определите характер
поступления крови при работе сердца в аорту. Объясните, какие
условия определяют направление и характер движения крови по
сердцу в аорту.
IV. Исследование характера движения крови в мелких сосудах.
Кровь поступает из желудочка в аорту только во время систолы
и движется по аорте прерывисто, скачкообразно, ток ее
ускоряется во время систолы. В мелких же сосудах кровь движется
непрерывно.
Проведите наблюдение за характером движения крови в
сосудах разного диаметра (рис. 28).
Удобным объектом для исследования является плавательная
перепонка лапки лягушки. Обездвиживают лягушку бескровным
способом (подкожным введением 0,5...1,0 мл 0,1%-ного раствора
дитилина). Фиксируют ее спинкой вверх к пробковой пластинке с
отверстиями. Над отверстием дощечки осторожно растягивают
плавательную перепонку задней конечности, лапку фиксируют. Во
время эксперимента перепонку смачивают раствором Рингера.
Вначале сосуды плавательной перепонки рассматривают при
малом увеличении микроскопа и отмечают различную скорость и
характер движения крови в артериолах и венулах; находят арте-
риовенозные анастомозы. Затем при большом увеличении
рассматривают капилляры, отмечают замедленное движение
форменных элементов крови. Зафиксировав визуально один эритроцит,
проходящий через просвет данного капилляра, с помощью секун-
145
///
IV
Рис. 28. Исследование
кровообращения в мелких кровеносных
сосудах у лягушки:
/— фиксация органов лягушки для
наблюдения кровообращения; II —
кровообращение в плавательной
перепонке: Л — фиксация лапки; Б —
сосуды под микроскопом: / —
артерия, 2— артериолы при малом
увеличении, 3 — артерии при большом
увеличении, 4 — капилляры при
малом увеличении, 5—капилляры
при большом увеличении, 6— вена,
7—венулы, 8— хроматофоры;
III— в легком: А, Б — вставление
канюли в голосовую щель, В—
положение надутого легкого между
стеклами под объективом
микроскопа; Г— сосуды под
микроскопом: 1 — легочная доля,
2—разветвление легочной артерии, 3 —
капилляры, 4—хроматофоры; IV—
кровообращение в языке; V—
кровообращение в брыжейке (мелкие
артериолы, венулы и капилляры)
домера определяют время прохождения им измеренного участка
капилляра, т. е. линейную скорость кровотока в капилляре.
Контрольные вопросы и задания. 1. Назовите основные физиологические
свойства сердечной мышцы. 2. Какова особенность структуры сердечной мышцы?
3. Какова особенность реакции сердечной мышцы при действии на нее
раздражителей различной силы? 4. Чем обусловлено свойство сердечной мышцы отвечать
на пороговое раздражение максимальной силой сокращения? 5. Всегда ли
одинакова возбудимость сердечной мышцы и какие факторы ее определяют? 6. Какова
особенность в проявлении потенциала действия сердечной мышцы? 7. Как изме-
146
няется возбудимость сердечной мышцы в течение сердечного цикла? 8. Что
понимают под относительной и абсолютной рефракторными фазами изменения
возбудимости сердечной мышцы? 9. Какое значение имеет длительный абсолютный
рефракторный период для деятельности сердца? 10. Чем обусловлено появление
экстрасистолы и компенсаторной паузы при раздражении сердечной мышцы в
момент диастолы? 11. Почему сердечная мышца не способна отвечать на
раздражения тетаническим сокращением? 12. Какова скорость распространения
возбуждения в мышцах предсердий и желудочков, меньше или больше, чем в скелетных
мышцах? 13. Существует ли и какая зависимость силы сокращения сердечной
мышцы от степени растяжения мышечных волокон в диастолу? 14. Как
изменяется работа сердца при увеличении венозного притока к сердцу и при росте
артериального давления? 15. С каким свойством сердечной мышцы связано
приспособление работы сердца к повышенной нагрузке? 16. Что понимают под
систолическим объемом сердца? 17. Какова величина систолического объема сердца у
лошади, крупного и мелкого рогатого скота, свиньи? 18. При каких условиях может
повыситься систолический объем? 19. Какие факторы определяют систолический
объем сердца? 20. Какие процессы — аэробные или анаэробные — преобладают в
сердечной мышце при ее сокращении? 21. Назовите особенности кровоснабжения
сердечной мышцы.
Занятие 22. Механизмы приспособления
деятельности сердца и сосудов к меняющимся условиям
Цель занятия. Изучить механизм приспособления
нагнетательной деятельности сердца и тонической деятельности сосудов к
меняющимся условиям, роль в нем обратной информации с
рецепторов сердца и сосудов, органов об изменившихся условиях;
блуждающих и симпатических нервов и концентрации в крови
гормонов.
Объект исследования, материалы и оборудование. 1. Собака,
кролик, морская свинка, белая крыса, мышь, лягушки (крупные).
2. Рисунки и схемы по теме. 3. Операционный набор; канюли
сосудистые, трубки резиновые, тройник стеклянный, стеклянная
трубка длиной 2 м и укрепленная вертикально на стойке с
градуированной шкалой, шприцы; кимограф с удлинителем; манометр V-образ-
ный ртутный, снабженный поплавком с писчиком; индукционная
катушка с раздражающим электродом, источник тока, ключ для
замыкания, провода (набор); операционный столик; раствор
адреналина (норадреналина) 0,1%-ный, раствор цитрата натрия 5%-
ный (или гепарин), физиологический раствор; набор для
препаровки лягушки; универсальный штатив, рычажок Энгельмана с
писчиком; сердечный зажим (серфин) с ниткой, канюля Штраубе,
пипетки; раствор хлорида кальция (1%-ный) и хлорида калия
(1%-ный), 10%-ный спирт; резиновый баллон с трубкой,
соединенный через тройник с манометром и баллоном Ричардсона; микроскоп.
Выполнение работы.
I. Исследование нервно-гормональной регуляции деятельности
сердца и сосудов.
147
Сердце и сосуды обладают механизмами местной
саморегуляции. Чем больше растягивается каждая клетка миокарда во время
диастолы, тем больше она сокращается во время систолы.
Афферентные, вставочные и эфферентные нейроны внутрисердечных
нервных структур образуют внутрисердечные рефлекторные дуги,
через которые осуществляются внутрисердечные периферические
рефлексы. Гладкие мышцы сосудистой стенки капилляров очень
чувствительны к действию продуктов обмена. Уменьшение или
увеличение объема и давления крови в органе, сдвиг реакции
крови вызывают раздражение баро- и хеморецепторов сосудов, поток
импульсов в сердечно-сосудистый центр, расположенный в
продолговатом мозге. Программа действия из центра передается к
сердцу путем изменения тонуса сердечных парасимпатических
волокон блуждающих нервов и симпатических волокон грудных
внутренностных нервов. Через парасимпатические волокна
осуществляются влияния, понижающие возбудимость и проводимость
проводящей системы сердца, уменьшающие ритм и силу
сокращений сердца, понижающие уровень давления крови в сосудах.
Через симпатические нервы осуществляются влияния, которые
повышают возбудимость и проводимость проводящей системы
сердца и сердечной мышцы, увеличивают ритм и силу сокращений
сердца, оказывают суживающее влияние на сосуды, повышают
давление крови в сосудах. Специфическое влияние, повышающее
частоту и силу сокращений сердца, давление крови в сосудах,
осуществляет адреналин, выделяемый при возбуждении
симпатической иннервации.
Для достижения цели исследования: 1. Выяснить, изменяется ли и как ритм
сердечных сокращений и тонус сосудов при раздражении рецепторов каротидного
синуса путем повышения давления в сонной артерии на участке разветвления ее
на две ветви. 2. Выяснить, изменяется ли и как ритм сердечных сокращений и
тонус сосудов при раздражении рецепторов кишечника или афферентных нервных
волокон, проводящих импульсы с рецепторов сосудов и тканей кишечника. 3.
Выяснить, изменяется ли ритм сердечных сокращений и тонус сосудов при
раздражении афферентных нервных волокон, проводящих импульсы с рецепторов
сосудов и тканей задних конечностей. 4. Определить характер влияний,
осуществляемых через блуждающие нервы, на сердце и сосуды. 5. Определить характер
влияний, осуществляемых через симпатические нервы, на сердце и сосуды.
6. Выяснить, как изменяется ритм сердечных сокращений и тонус сосудов при
повышении содержания адреналина (норадреналина) в крови.
Исследование связано с постановкой острого опыта.
Собаку (или кролика) наркотизируют, затем фиксируют на
станке животом вверх. Готовят операционное поле: 1) по средней
линии шеи; 2) в области расположения бедренной вены; 3) по
средней линии живота. Собирают систему для записи давления
крови в сонной артерии. Канюлю (для ввода в артерию)
посредством резиновой трубки, снабженной тройником, соединяют с
148
ртутным манометром. Всю систему от канюли до поверхности
ртути в манометре заполняют 5%-ным раствором цитрата натрия
(противосвертывающая жидкость). После этого на стеклянную
трубку надевают резиновую трубку, через которую заполняют эту
систему физиологическим раствором и закрывают ее зажимом
(рис. 29).
По средней линии шеи делают разрез. Тупым путем обнажают
идущий сбоку трахеи сосудисто-нервный пучок, состоящий из
блуждающего нерва и сонной артерии. Артерию выделяют на
протяжении 6...7 см из пучка в средней части шеи и в области
разветвления на наружную и внутреннюю ветви. Выделяют и
берут на лигатуры блуждающий нерв и нерв-депрессор (рис. 30).
Затем отпрепаровывают бедренную вену и большеберцовый
нерв. По средней линии живота вскрывают брюшную полость,
вставляют в кишечник и фиксируют в нем баллон или берут на
лигатуру нервную веточку брыжейки. Затем на центральный
отрезок бедренной вены накладывают зажим. Периферический
отрезок вены перевязывают ниткой. Осторожно надрезают сосуд,
вставляют в его просвет канюлю и укрепляют ее лигатурой. На канюлю
надевают резиновую трубку, которая соединена с длинной
стеклянной трубкой. Снимают зажим. Уровень жидкости в
стеклянной трубке покажет давление в вене. На центральный конец
среднего участка артерии накладывают зажим, а
периферический и выделенные ветви артерии перевязывают. Под среднюю
часть отпрепарованного сосуда подводят нитку, надрезают^его
стенку и вводят в артерию канюлю, соединенную с ртутным
манометром. Канюлю закрепляют лигатурой. Снимают зажимы с
артерии и трубки, ведущей к манометру. Писчик поплавка
ртутного манометра прислоняют к
поверхности ленты кимографа, запускают барабан и
записывают величину кровяного давления.
Запишите в течение нескольких минут
исходный уровень кровяного давления в сонной
артерии.
1
Рис. 29. Исследование
нервно-гормональной регуляции деятельности
сердца и сосудов у кролика:
7 —канюля; 2 — соединительная трубка;
3— манометр; 4 —записывающее
устройство (поплавок с рычажком);
5—запись на барабане кимографа
149
Рис. 30. Топография некоторых
нервов у лягушки (в подмышечной
области) и кролика (на шее):
А — у лягушки: / — блуждающий нерв,
2—гортанный нерв, 3 — подъязычный
нерв, 4—языкоглоточный нерв; Б — у
кролика: / — блуждающий нерв, 2 —
депрессор, 3— симпатический нерв,
4— возвратный нерв, 5— сонная артерия,
6— вена, 7— пищевод
Определите влияние на деятельность сердца и сосудов (с
интервалом 5 мин) раздражения рецепторов каротидного синуса
путем введения физиологического раствора под давлением в
изолированный лигатурами участок сонной артерии (ритм сердечных
сокращений и давление крови в сосудах должны уменьшаться);
раздражения в течение 1 мин рецепторов кишечника путем
раздувания в нем баллона (давление 7,9 кПа); слабого
кратковременного в течение 2...3 с раздражения индукционным током
центрального конца предварительно перерезанного брыжеечного и
болыпеберцового нервов (частота сердечных сокращений,
давление должны повышаться); раздражения в течение 2...3 с
индукционным током центрального конца предварительно перерезанного
нерва-депрессора; раздражения в течение 5...6 с индукционным
током периферического конца предварительно перерезанного
блуждающего нерва (частота сердечных сокращений и давление
крови в сосудах должны уменьшаться); введения в вену 0,3...0,5 мл
раствора адреналина (частота сердечных сокращений и давление
крови в сосудах должны уменьшаться).
При анализе кривой обратите внимание на изменения
величины кровяного давления, ритма колебаний его, связанного с
деятельностью сердца, а также на продолжительность этих
изменений. Оформите выводы и заключение о механизме
нервно-гуморальной регуляции деятельности сердца и сосудов по результатам
исследований.
Исследования можно проводить на лягушке. Декапитацию
проводят с таким расчетом, чтобы вместе с верхней челюстью были
удалены только полушария. Лягушку фиксируют на пластинке
брюшком кверху, обнажают сердце и устанавливают кимографическую
запись его сокращений.
Отпрепарируйте и возьмите на лигатуру чревный и седалищный
нервы. Перережьте нервы так, чтобы на лигатуре остались
центральные концы нервов. Составьте электрическую цепь для раздражения
индукционным током. Ток должен быть умеренной силы.
Запишите на кимографе работу сердца в обычных условиях.
150
Продолжая запись, раздражают индукционным током в
течение 3...1 с центральный конец (афферентных нервных волокон)
перерезанного чревного нерва. Через 2...3 мин аналогичным путем
изучают влияние на работу сердца раздражения афферентных
волокон седалищного нерва. Обращают внимание на изменение
ритма и амплитуды сердечных сокращений.
Затем найдите вагосимпатический ствол (см. рис. 30). С этой
целью одну из передних лапок как можно сильнее оттягивают в
сторону и вниз, закрепляя ее в таком положении на пластинке
булавкой. Осторожно перерезают поверхностные мышцы, лежащие
между областью сердца и углом челюсти. При этом обнажаются
два нерва: языкоглоточный и подъязычный. Глубже обоих нервов
и поперек их хода лежит сосудисто-нервный пучок в составе
сонной артерии, яремной вены, гортанного и сравнительно толстого
вагосимпатического нерва. Под сосудисто-нервный пучок
подводят пинцетом нитку, а затем электроды.
Запишите на кимографе работу сердца в обычных условиях.
Продолжая запись, включают на 3...4 с индукционный ток. Запись
сердца производят в течение 2 мин после прекращения
раздражения. Обратите внимание на ритм и амплитуду сокращений сердца
до раздражения, в момент раздражения и после раздражения.
Эффект раздражения блуждающего нерва проявляется сразу,
симпатического нерва — спустя несколько секунд после прекращения
раздражения.
Для исследования роли симпатической иннервации возьмите
другую лягушку и введите ее в состояние наркоза погружением в
10%-ный раствор спирта на 10 мин. Затем положите ее на
пробковую пластинку. Плавательную перепонку одной из задних лапок
растяните над отверстием в пробковой пластинке. Пластинку с
лягушкой положите на столик микроскопа так, чтобы отверстие с
плавательной перепонкой оказалось под объективом. Проследите
за движением крови по артериям до и после введения шприцем в
спинной лимфатический мешок лягушки 1 мл 0,01%-ного
раствора адреналина. Далее на задней поверхности бедра лягушки
сделайте разрез на коже и найдите седалищный нерв. Нерв
перевяжите ниткой и перережьте центральные места перевязки.
Периферический конец нерва положите на электроды и в течение 10... 15 с
раздражайте индукционным током. Обратите внимание при этом
на просвет сосудов.
По результатам исследований оформите выводы и заключение
о механизме регуляции деятельности сердца и сосудов.
II. Исследование роли кальция и калия в регуляции деятельности
сердца.
Влияние нервной системы на сердце и сосуды связано с
выделением медиаторов ацетилхолина и норадреналина, которые из-
151
меняют распределение ионов кальция и калия между
внутриклеточной и внеклеточной средами. Увеличение концентрации калия
во внеклеточной среде вызывает снижение мембранного
потенциала клетки (в связи с уменьшением градиента концентрации
внутри и снаружи клетки); сердце сокращается реже и слабее.
Повышение концентрации кальция во внеклеточной среде вызывает
усиление сокращений сердца в связи с вхождением кальция
внутрь клетки и стимуляцией процесса сокращения мышцы.
Для достижения цели исследования выяснить: 1. Как изменяются сила и частота
сердечных сокращений при повышении содержания ионов кальция в крови,
протекающей через сердце? 2. Как изменятся сила и частота сердечных
сокращений при повышении содержания ионов калия в крови, протекающей через
сердце?
Исследование проводят на изолированном сердце лягушки по
Штраубу, что технически проще (см. рис. 19). В этих целях у
лягушки после анестезии обнажают сердце, перевязывают нитками
как можно дальше от сердца обе дуги аорты. Под луковицу аорты
подводят нитку, но не завязывают ее. Приподняв верхушку
сердца, находят и перевязывают ниткой уздечку. Перевязывают
венозный синус и корни легких. На левой аорте делают
ножницами косой надрез. Берут канюлю Штрауба, наполненную
раствором Рингера, и вводят ее кончик через надрез в просвет аорты по
направлению к сердцу. Канюлю осторожно продвигают, слегка
вращая, в желудочек сердца. При этом в каждую систолу в
канюлю будет проталкиваться порция крови. Убедившись, что канюля
вставлена верно, завязывают над ее шейкой нитку — ту, которую
ранее подвели под луковицу аорты.
Взявшись за канюлю, поднимают сердце кверху. Перерезают
обе дуги аорты, вырезают венозный синус дальше от сердца.
Отрезают от сердца легкие и другие ткани. Сердце несколько раз
промывают раствором Рингера, чтобы избежать закупорки канюли
свернувшейся кровью. Канюлю с подвешенным на ней сердцем
закрепляют в штативе. Верхушку сердца с помощью крючка или
зажима соединяют с рычажком. Перо подвигают к барабану
кимографа. Записывают сокращения сердца в обычных условиях.
Затем прибавляют к раствору, находящемуся в канюле, 2...3 капли
1%-ного раствора хлорида калия. Обращают внимание на
изменение ритма и амплитуды сердечных сокращений. Затем быстро
удаляют пипеткой раствор из канюли и несколько раз тщательно
промывают сердце новыми порциями раствора Рингера. Далее
аналогичным путем выясняют влияние на сокращение сердца
раствора хлорида кальция (4...5 капель).
По результатам исследований оформляют выводы о влиянии
кальция и калия на деятельность сердца.
152
Контрольные вопросы и задания. 1. Что понимают под регуляцией деятельности
сердца и сосудов? 2. Каков механизм регуляции деятельности сердца и сосудов?
3. Опишите механизм регуляции деятельности сердца и сосудов. 4. Какие
рецепторы имеют особое значение в регуляции работы сердца и сосудов? 5. Чем
возбуждаются рецепторы, участвующие в регуляции деятельности сердца и сосудов?
6. С каких рецепторных полей и при каких условиях осуществляются влияния,
стимулирующие работу сердца и тонус сосудов? 7. С каких рецепторных полей и
при каких условиях осуществляются влияния, тормозящие работу сердца и тонус
сосудов? 8. С каких рецепторных полей, кроме сосудистых, осуществляются
влияния на работу сердца и сосудов? 9. Через какие функциональные единицы
центральной нервной системы осуществляются влияния с рецепторов на сердце и
сосуды, где они расположены и каковы их свойства? 10. Каково биологическое
значение влияний с рецепторов на сердце и сосуды? 11. Через какие структуры
передаются на сердце и сосуды влияния в ответ на информацию, поступающую с
рецепторов? 12. Какие влияния осуществляются на сердце через эфферентные
волокна блуждающих нервов? 13. К каким структурам сердца поступают импульсы
по блуждающим нервам? 14. Какие влияния осуществляются на сердце и сосуды
через симпатические нервы? 15. Какова функциональная связь проводящей
системы с сердечно-сосудистым центром? 16. Существует ли другой путь передачи
информации из центра на сердце и сосуды кроме нервного? 17. Какие гормоны и
какое влияние они оказывают на работу сердца и сосудов? 18. Какое влияние на
работу сердца оказывает повышение содержания в крови ионов калия и кальция?
19. Нарисуйте схему рефлекторных дуг сердечных и сосудистых рефлексов. 20.
Какие методы используют для изучения роли нервов сердца и сосудов? 21. Как вы
представляете объемную и линейную скорость тока крови? 22. Какие факторы
определяют скорость движения крови по сосудам? 23. Каковы особенности
движения крови в аорте и легочной артерии, в капиллярах и венах и чем они
обусловлены? 24. Как классифицируют сосуды по физиологической роли? 25. Чем
обусловлены колебания давления в сосудах?
Занятие 23. Исследование внешних проявлений деятельности
сердца и сосудов
Работа сердца сопровождается целым рядом механических и
физических явлений, которые могут быть зарегистрированы. Это
внешние показатели деятельности сердца — сердечный толчок,
тоны сердца, систолический объем крови, минутный объем крови,
биологические токи сердца, пульс, кровяное давление. Внешними
показателями деятельности сосудов являются пульс, кровяное
давление, реограмма, плетизмограмма.
В качестве внешних показателей полезного результата
нагнетательной деятельности сердца (систолический и минутный объем
крови) и состояния сердечной мышцы служат сердечный толчок
(колебание участка грудной стенки от касания сердца при
систоле), тоны (звуки) сердца, электрокимограмма (кривая движения
контура сердечной тени на экране рентгеновского аппарата),
электрокардиограмма (кривая биопотенциалов сердца,
отражающих возникновение и распространение возбуждения), векторкар-
диограмма (векторная величина разности потенциалов), а
деятельности сердца и сосудов — артериальный пульс (колебание
стенки артерии, связанное с систолой и диастолой), артериальное
153
давление (систолическое, диастолическое, среднее и пульсовое),
венный пульс, венозное давление, реограмма (изменение
электрического сопротивления), плетизмограмма (кривая изменения
объема органа в связи с систолой и диастолой).
Цель занятия. Изучить внешние проявления деятельности
сердца и сосудов у животных, ознакомиться с основными
принципами и техникой исследования внешних проявлений
деятельности сердца и сосудов.
Объект исследования, материалы и оборудование. 1. Лошадь,
корова, овца, свинья, собака, кролик. 2. Рисунки и схемы по теме.
3. Кардиограф, фонендоскоп, стетоскоп, фонокардиограф,
электрокардиограф, векторкардиоскоп, осциллосфигмограф, сфигмо-
манометр, тонометр, ИАД-1 (измеритель артериального
давления), флебоосциллометр, сфигмограф, реограф; плетизмограф,
кимограф; марля, 10%-ный раствор хлорида натрия.
Выполнение работы.
I. Определение и обозначение области на грудной стенке
животного, где отчетливо обнаруживается сотрясение участка грудной
стенки от соприкосновения с ним сердца во время систолы и запись
сердечного толчка. Определение частоты сердечных сокращений,
их ритмичности и силы.
Исследование можно проводить на различных видах животных.
Следует помнить, что у сельскохозяйственных животных
сердечный толчок «боковой», проявляется слабо.
Приложите ладонь на поверхность грудной клетки животного
на 2...4 см выше левого локтевого сустава. Определяют и
обозначают участки, где отчетливо обнаруживается сердечный толчок. Для
записи сердечного толчка укрепляют на грудной клетке (стенке)
кардиограф так, чтобы расположенная в середине кнопка (пилон)
приходилась на место «верхушечного» толчка. Соединяют
кардиограф с регистрирующей капсулой Марея. Запишите
кардиограмму на ленте барабана кимографа.
По полученной кривой оцените частоту, ритмичность и силу
сердечных сокращений.
II. Выслушивание (аускулътация) тонов сердца. Определение и
обозначение на грудной стенке животного места, где наиболее
отчетливо выслушиваются составные части I и II тонов.
Выслушивание (аускультацию) составных частей тонов сердца
проводят в определенной области грудной стенки животного
(рис. 31). У каждого животного звуковые проявления
захлопывания левого атриовентрикулярного клапана лучше прослушиваются
в 4...5-м межреберном промежутке слева в середине нижней трети
грудной клетки; правого атриовентрикулярного клапана —в 4-м
межреберном промежутке справа в середине нижней трети грудной
клетки; полулунных клапанов легочной артерии — в 3-м межре-
154
Рис. 31. Схема зон наилучшей
слышимости при аускультации сердца,
проецируемых на левую половину грудной клетки:
/ — зона выслушивания первого тона
(систолического); 2 и 3— зоны выслушивания
второго тона (диастолического)
берном промежутке слева в середине
нижней трети грудной клетки;
полулунных клапанов аорты — в 4-м межреберном промежутке справа и
слева на 2 см ниже плечевого сустава.
Поясните, каковы происхождение, продолжительность и
высота тонов, необходимость их выслушивания.
III. Фонокардыографыя — регистрация тонов сердца,
количественный и качественный анализ фонокардиограммы.
Тоны сердца можно записать. Запись тонов сердца
осуществляют фонокардиографом. Записанные тоны — фонокардиограмма.
Для регистрации фонокардиограммы укрепляют резиновой
лентой микрофон фонокардиографа на участке грудной стенки
животного слева, где отчетливо слышны тоны сердца. Включают
лентопротяжный механизм и производят запись
фонокардиограммы, регулируя усиление звуковых проявлений сердца поворотом
ручки усилителя.
Можно провести одновременную регистрацию фоно- и
электрокардиограммы на электрокардиографе с фонокардиогра-
фической приставкой. При регистрации фонокардиограммы на
электрокардиографе провода отведений соединяют с фоноэлект-
рокардиографической приставкой.
Дайте характеристику фонокардиограммы. Отметьте
преимущества метода фонокардиографии.
IV. Электрокардиография — регистрация с помощью
электрокардиографа биопотенциалов сердца, возникающих во время сердечного
цикла.
Для записи электрических явлений сердца —
электрокардиограммы — необходимо подготовить к работе электрокардиограф:
тщательно его заземлить, установить на каналах полосу
пропускания высоких частот; установить переключатели грубого усиления
на «большие синусоиды», включить прибор в сеть и перевести
тумблер в положение «ВКЛ». После 15-минутного прогрева элект-
155
рокардиографа установить с помощью ручек стрелки приборов в
нулевое положение, поворачивая регуляторы, отрегулировать
усиление таким образом, чтобы при нажатии кнопки калибратора
писчики отклонялись на 1 см. Затем наложить электроды на кожу
животного. Для лучшего контакта между кожей и электродами
помещают прокладки из марли, смоченные 5...10%-ным раствором
поваренной соли и слегка отжатые (рис. 32).
У сельскохозяйственных животных обычно делают три отведения токов сердца:
I отведение — от пясти правой и левой грудных конечностей; II отведение — от
пясти правой передней и плюсны левой задней конечности; III отведение — от пясти
левой передней и плюсны левой задней конечности. После наложения электродов к
ним подключают разноцветные штепсели проводов (I отведение: красный — на
правую переднюю конечность, желтый — на левую переднюю конечность). Далее
устанавливают коммутаторы на нужные отведения. После этого включают тумблер
электродвигателя лентопротяжного механизма и производят запись.
М. П. Рощевским предложена методика записи ЭКГ по трем сагиттальным
грудным отведениям (рис. 32).
Дайте характеристику электрокардиограммы. Поясните
природу зубцов электрокардиограммы.
V. Определение величин максимального, минимального, среднего и
пульсового кровяного давления.
Определение величин максимального и минимального
давления осуществляют с помощью осциллосфигмоманометра или
сфигмотонометра. Пульсовое и среднее давление рассчитывают по
величинам максимального и минимального давления.
Для определения артериального кровяного давления у
животных используют осциллосфигмоманометр. Прибор состоит из
ртутного манометра и осциллометра, соединенных между собой с
помощью вспомогательных приспособлений в одну систему.
Определение кровяного давления начинают с наложения манжетки
на участок тела, где проходит артерия. У крупных
сельскохозяйственных животных давление обычно измеряют в хвостовой
артерии (рис. 33): манжетку накладывают на корень хвоста. У
мелких животных кровяное давление измеряют в бедренной
артерии. Манжетку надувают до такого состояния, чтобы она не
спадала и не сдавливала артерию до прекращения пульсации.
Затем при открытом кране осциллометра в систему с помощью
баллона Ричардсона накачивают воздух заведомо больше, чем
требуется для прекращения пульсации (обычно до 180...200 мм рт. ст.).
После этого устанавливают осциллометр на «работу». С этой
целью винт с обозначением «Регулятор осцилляции» повертывают
вправо до тех пор, пока уровень спирта в правом колене
осциллометра не поднимется на З...5мм выше, чем в другом колене.
Этим приемом в осциллометрической трубке создается разница
давления, благодаря которой будут заметны пульсации различ-
156
Я-ft
p-q i
!0/?5i
I" Q-T
P-T
T-P
ШШ
1 1 1 i I 1 1 1 л 1J |M| 1 L L 1 1 1 1 1 1 1 i 1 1 I 1 1 i
i III 1 ^ f'p 4" ■ "'T,_[ ■f,~j ' " i j
11 1 "V 1 1 ГГЧм' Г" 11 ТлТ' i Г! \ '1 1 ГиГТ]
IN Н Ч
! 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 ! 1 1 1 1 1 1 1 1 1 I I
Рис. 32. Запись электрокардиограммы:
А — схема присоединения электродов при регистрации сагиттальных отведений
электрокардиограммы у крупного рогатого скота: / — электрод, накладываемый на краниальный конец
грудины (с красным наконечником), 2 — электрод, накладываемый на холку (с желтым
наконечником), 3 — электрод, накладываемый на область пупка (с зеленым наконечником); /— первое
отведение, Я—второе отведение, /Я —третье отведение; Б— электрокардиограммы: / — схема
электрокардиофаммы лошади, 2— нормальные электрокардиограммы (//отведение) у лошади
и 3 — у коровы; Р— Q, Q— Т— интервалы; Р— Т— систолический период; Т— Р — диастоличес-
кий период; Я—Я — интервал, характеризующий деятельность одного полного сердечного цикла
ной силы в форме ритмичных
синхронных колебаний
величиною до 12 мм.
Далее с помощью зажима
Мора выпускают медленно из
системы воздух. При этом
необходимо следить за правым коленом
ртутного манометра и осцилло-
метра. При появлении в осцилло-
метре колебаний спирта
величиной 1...2мм отмечают уровень
ртути в манометре — он соответ-
Рис. 33. Измерение кровяного дав- ствует максимальному кровяному
ления у лошади в хвостовой артерии давлению. По мере дальнейшего
выпускания воздуха из системы
осцилляция увеличивается и достигает своего максимума. При
этом вновь отмечают уровень ртути в манометре — он
соответствует среднему давлению. Затем осцилляция довольно быстро
снижается до 1...2 мм: уровень ртути в манометре в это время
соответствует минимальному давлению.
Кровяное давление у животных можно определить пальпатор-
ным и слуховым способами с помощью ртутного манометра. При
пальпаторном способе после наложения манжетки находят место
пульсации артерии. Накачивают воздух в манжетку до
исчезновения пульсации. Затем приоткрывают выпускной кран — давление
в манжетке постепенно падает. Следят, при каком давлении снова
появляется пульсация. Найденная величина соответствует
максимальному давлению. При слуховом методе ниже наложения
манжетки с помощью фонендоскопа прослушиваются звуковые
явления в артерии. Когда при выпускании воздуха из системы
давление в манжетке снижается до уровня максимального кровяного
давления, появляются шумы (кровь проходит через сдавленную
артерию толчками и только во время систолы). Момент
исчезновения этих звуковых явлений свидетельствует о соответствии
давления в манжетке минимальному кровяному давлению в артерии.
В последнее время давление крови измеряют с помощью
электронного измерителя давления.
VI. Сфигмография — запись артериального пульса.
Пульс у сельскохозяйственных животных исследуют на
наружной челюстной, височной или плечевой артерии (у лошади), на
наружной лицевой артерии (у крупного рогатого скота), на
бедренной артерии (у мелкого рогатого скота), на плечевой
артерии (у собак и кошек). В этих целях указательным и большим
пальцами прощупывают место наиболее отчетливой пульсации
артерии и делают его оценку. Характеризуя состояние пульса, сле-
158
дует обратить внимание на его частоту — число ударов в минуту,
величину — высоту колебаний стенки сосуда, быстроту —
продолжительность пульсовой волны, напряжение — силу, с которой
можно сдавить артерию, чтобы пульс исчез, ритм —
продолжительность интервалов времени между пульсовыми волнами.
С помощью сфигмографа записывают пульс на хвостовой,
плечевой или бедренной артерии. Манжетку сфигмографа укрепляют
на участке тела, где проходит артерия. Систему прибора с
помощью баллона заполняют воздухом. Отрегулировав при этом размах
рычажка регистрирующего приспособления, производят запись
сфигмограммы на барабане кимографа. В этих целях в последнее
время используют сфигмограф СФ2-01 — приставку к
электрокардиографу с фотоэлектрическим самописцем, а также пульсотахо-
метр.
Дайте характеристику сфигмограммы.
VII. Плетизмография — запись колебаний объема органа.
Объем органа несколько увеличивается во время систолы и
уменьшается во время диастолы в связи с изменением состояния
сосудов. Запись объема органа осуществляют с помощью
плетизмографа.
Плетизмограф — высокочувствительный прибор с емкостным
датчиком и устройством, регистрирующий изменения давления в
закрытой системе. Конечность животного помещают в циллинд-
рический датчик и проводят регистрацию плетизмограммы в
норме. Затем другую конечность раздражают льдом (или теплом) и
регистрируют изменения плетизмограммы. В последнее время
запись плетизмограммы осуществляют с помощью
электроплетизмографов.
Контрольные вопросы и задания. 1. Какими внешними проявлениями
сопровождается деятельность сердца? 2. Что понимают под сердечным толчком и
какова его природа? 3. Что понимают под тонами сердца и каковы особенности
первого и второго тонов сердца? 4. Опишите механизм образования первого и второго
тонов сердца. 5. Что такое электрокардиограмма и отражением каких явлений,
происходящих в сердце, она является? 6. Опишите механизм генеза отдельных
зубцов и интервалов электрокардиограммы. 7. Что понимают под систолическим
и минутным объемом крови? 8. Каковы величины систолического и минутного
объема крови у сельскохозяйственных животных? 9. Что понимают под кровяным
давлением? 10. С чем связаны колебания величины кровяного давления и каково
название этих величин? 11. Каково в норме максимальное, среднее и
минимальное артериальное давление крови? 12. Назовите факторы, которые определяют
величину кровяного давления в каждый данный момент. 13. Что такое пульс и
сфигмограмма? Как выглядит сфигмограмма? 14. Какова скорость распространения
пульсовой волны и чем можно объяснить значительную разницу между скоростью
распространения пульсовой волны и линейной скоростью движения крови в
одном и том же участке сосудистого русла? 15. Что такое реограмма и отражением
какого явления, возникшего в результате деятельности сердца и колебания
кровенаполнения сосудов, она является? 16. Какие способы используют для
характеристики тонов сердца? 17. Какие преимущества имеет фонокардиографическое ис-
159
следование перед обычной аускультацией сердца? 18. Что понимают под
электрокардиографией, телеэлектрокардиографией, векторкардиоскопией? 19. Какие
способы используют для определения кровяного давления? 20. Что понимают
под реографией, на чем она основана и с использованием каких приборов
связана?
5.10. СИСТЕМА ДЫХАНИЯ
Оптимальный для метаболизма газовый состав организма —
относительное постоянство диоксида углерода и кислорода в
альвеолярном воздухе, крови и тканях — обеспечивается системой
дыхания. В процессе метаболизма в клетках тканей постоянно
используется кислород и образуется диоксид углерода. Система дыхания
обеспечивает снабжение тканей кислородом и удаление диоксида
углерода.
Дыхание — совокупность физиологических процессов,
обеспечивающих поступление в организм кислорода и удаление
диоксида углерода, т. е. поддержание относительного постоянства
диоксида углерода и кислорода в альвеолярном воздухе, крови и
тканях. Дыхание включает в себя следующие физиологические
процессы: 1. Обмен газами между внешней средой и смесью газов в
альвеолах (внешнее дыхание); 2. Обмен газами между
альвеолярным воздухом и газами крови (в легких); 3. Транспорт газов
кровью; 4. Обмен газами между кровью и тканями; 5. Использование
кислорода тканями и образование диоксида углерода
(биологическое окисление в митохондриях клеток).
Частота дыхательных движений, четыре первичных легочных
объема (дыхательный, резервный объем вдоха, резервный объем
выдоха, остаточный объем), четыре емкости легких (общая,
жизненная, вдоха, функциональная), минутный объем, являясь
внешними показателями системы дыхания, характеризуют ее
деятельность.
Занятие 24. Исследование внешнего дыхания у животных
У млекопитающих животных внешнее дыхание осуществляется
легкими. Обмен воздуха между альвеолами легких и внешней
средой происходит в результате ритмических дыхательных движений
грудной клетки. Во время вдоха при сокращении наружных
межреберных мышц диафрагмы расширяется (увеличивается в
объеме) грудная клетка, что вызывает, в свою очередь, увеличение
объема легких. Давление в легких становится ниже атмосферного,
и воздух через воздухоносные пути входит в легкие. В механизме
вдоха имеет большое значение отрицательное давление в
плевральной полости, которое обеспечивает расширение легких.
160
Выдох происходит при расслаблении вдыхательных мышц и
диафрагмы, грудная клетка при этом возвращается в исходное
положение. Объем ее уменьшается, она сдавливает легкие и
выжимает из них воздух. При вдохе воздух по дыхательным путям
проходит в альвеолы, а при выдохе часть альвеолярного воздуха уходит
наружу. Эту циркуляцию воздуха называют легочной
вентиляцией. Умножая объем воздуха отдельного вдоха на число дыханий в
минуту, можно рассчитать минутный объем вентиляции легких.
Цель занятия. Исследовать внешнее дыхание у животных путем
наблюдения и записи дыхательных движений; измерить давление
в плевральной полости при вдохе и выдохе; определить величину
минутного объема дыхания и его обусловленность.
Объект исследования, материалы и оборудование. 1. Лошадь,
корова, свинья, овца, коза, кролик, собака. 2. Рисунки и схемы по
теме. 3. Установка для электрографической регистрации дыхания
с помощью аппарата ЭИД-1 или пневмограф; кимограф,
фонендоскоп, перкуссионный молоточек, плессиметр; хирургический
набор, операционный столик; модель Дондерса, легкие от свежего
трупа животного; нитки; 0,5%-ный раствор новокаина; шприц и
широкая игла к нему; манометр; дыхательная маска с
гофрированными трубками, мешок из прорезиненной ткани (Дугласа);
газовый счетчик; газоанализатор для определения кислорода и
диоксида углерода.
Выполнение работы.
I. Наблюдение за движениями грудной стенки и мышц живота при
вдохе и выдохе.
Наблюдают за движениями грудной стенки и мышц живота
при вдохе и выдохе у животных разных видов и делают
сопоставления. Выявляют особенности по выраженности, силе движений
грудной стенки и мышц. Полученные результаты описывают и
делают заключение о типе дыхания (грудной, брюшной,
грудобрюшной).
II. Запись дыхательных движений.
Животное фиксируют в станке. Собирают установку для
графической регистрации дыхания с помощью электронного
измерителя давления или простого пневмографа. Манжетку
(градуированные трубки) пневмографа фиксируют на грудной клетке
животного с помощью резиновых трубок и тройника с
нагнетательным баллоном, соединяют ее с капсулой Марея или датчиком,
заполняют воздухом и записывают дыхательные движения на
барабане кимографа (или на электрокардиографе при
использовании ЭИД-1). Проводят регистрацию дыхательных движений,
анализируют пневмограмму, объясняют происхождение волн. Делают
заключение о продолжительности вдоха и выдоха, ритмичности
дыхания.
161
III. Наблюдение за движением ребер и диафрагмы.
Для определения характера и степени движения ребер и
диафрагмы при вдохе и выдохе кролика (или собаку) анестезируют и
фиксируют на операционном столике в положении на спине.
Делают разрез кожи и мышц по средней линии живота от
мечевидного отростка. Края раны, ближе к грудной клетке, захватывают
пинцетом и приподнимают их. При этом хорошо видна
диафрагма. Обращают внимание, как изменяется положение диафрагмы
при вдохе и выдохе. Затем отделяют кожу на грудной стенке,
обнажают несколько ребер. Описывают характер движений
диафрагмы и ребер.
IV. Наблюдение за изменением объема легких при вдохе и выдохе.
Изменение объема легких при вдохе и выдохе можно
проследить на модели Дондерса (рис. 34): в стеклянную бутыль, дно
которой заменено плотной резиновой мембраной с рукояткой,
имитирующей диафрагму, помещают извлеченные легкие с трахеей,
зафиксированной на трубке, пропущенной через пробку, плотно
закрывающую отверстие бутыли. Используют свежеотпрепарован-
ные легкие кролика. В трахею вводят стеклянную трубку,
пропущенную через пробку отверстия бутыли, легкие погружают в
глицерин и надувают их. Затем легкие извлекают из глицерина и
вставляют в бутыль, которую плотно закрывают пробкой.
Оттягивая за рукоятку резиновое дно бутыли, имитируя сокращение
диафрагмы при вдохе и уменьшая тем самым внутриплевральное
давление, наблюдают за изменением объема легких. Вдавливая
резиновое дно бутыли, имитируя расслабление диафрагмы при
выдохе и повышая тем самым внутриплевральное давление,
продолжают наблюдение за изменением объема легких. Можно через
пробку, которой закрывается бутыль,
пропустить вторую трубку в полость
бутыли. Наружный конец этой трубки
соединяют с манометром и
одновременно наблюдают за изменением объе-
Рис. 34. Модель Дондерса:
/—отводная трубка; 2 — трубка,
вставленная в полость сосуда; 3, 4—зажимы на
тройниках; 5, 6— ртутные манометры; 7—
сосуд для легких; 8— резиновое дно
бутыли, имитирующее диафрагму; 9— легкие,
зафиксированные на отводной
трубке
162
ма легких в описанных условиях. После этого необходимо описать
характер изменений, объяснить, какова причина растяжения
легких при вдохе и сжимания их при выдохе.
V. Измерение давления в плевральной полости.
Для определения давления в плевральной полости при вдохе и
выдохе используют кролика, собаку или животное другого вида. В
области 3...4 межреберий в верхней трети грудной стенки
выстригают шерсть на небольшом участке, обрабатывают кожу спиртом и
вводят подкожно или внутримышечно 2...5 мл 0,5%-ного раствора
новокаина. Затем берут широкую предварительно
продезинфицированную иглу, соединяют ее резиновой трубкой с водяным
манометром — V-образной трубкой, заполненной до половины высоты
подкрашенной водой. Иглу осторожно вводят в подготовленный
участок межреберья, при этом прокалывают кожу, межреберные
мышцы и наружный листок плевры. В момент попадания кончика
иглы в плевральную щель жидкость в колене манометра изменит
уровень. По шкале манометра устанавливают размеры и
направления изменения внутриплеврального давления при вдохе и выдохе,
рассчитывают силу эластической тяги легких —силу, с которой
легкие противодействуют их растяжению. Она равна величине
разницы между атмосферным давлением и давлением в
плевральной полости. После исследования описывают результаты,
объясняют, чем обусловлено отрицательное давление в плевральной
полости, чем оно вызвано и роль его изменений при вдохе и выдохе.
VI. Определение дыхательного и минутного объемов легких.
Для исследования дыхательных движений (вдоха и выдоха),
дыхательного и минутного объемов на морду животного (лошадь,
овца и др.) надевают маску и соединяют выдыхательный клапан
гофрированным шлангом через переключатель с мешком Дугласа.
Собирают выдыхаемый животным воздух в течение 5... 10 мин.
Определяют число дыхательных движений в 1 мин. Снимают маску с
животного, отсоединяют мешок. Гофрированную трубку мешка
соединяют с газометром и, слегка надавливая на мешок,
пропускают воздух через счетчик: вычисляют минутный объем дыхания
(количество вдыхаемого или выдыхаемого воздуха в 1 мин) и
дыхательный объем (количество вдыхаемого или выдыхаемого
воздуха).
При исследовании определяют величину дыхательного (объем
воздуха, входящий в легкие при вдохе в состоянии покоя) и
минутного (произведение дыхательного объема воздуха на число
дыхательных циклов в минуту) объемов легких, объясняют,
показателем какого физиологического процесса они являются и как
изменяются в зависимости от интенсивности этого процесса.
С помощью спирометра (рис. 35) каждый студент у себя определяет
дыхательный объем, резервные объемы вдоха и выдоха, жизненную емкость и ем-
163
Рис. 35. Спирометр водяной:
У и 2 — наружный и внутренний металлические
цилиндры; 3— смотровое окошко с меткой, до
которой заполняется вода в наружный цилиндр;
4— поплавок внутреннего цилиндра; 5—
трубка для прохождения воздуха (открывается
выше уровня воды); 6— резиновая трубка с
мундштуком
кость вдоха; на спирографе можно
записать (спирограмма) дыхательные объемы
воздуха.
1. Стерилизуют и промывают
мундштук спирометра. Колокол спирометра
должен быть в самом нижнем
положении, т. е. спирометр пуст. Выдыхают,
делают возможно более глубокий вдох
атмосферного воздуха (на нос наложите
зажим), а затем без чрезмерной
поспешности максимальный выдох в спирометр.
Измеренный таким образом объем
воздуха составляет жизненную емкость легких.
2. Колокол спирометра наполняют атмосферным воздухом и устанавливают на
определенном уровне (2000 или 3000 мл). Испытуемый накладывает зажим на нос,
делает 8...9 обычных дыхательных циклов, а затем после спокойного вдоха берет в
рот мундштук и делает максимальный вдох из спирометра. Таким образом
определяют резервный объем вдоха.
3. Колокол спирометра опустошают, ставят в самом нижнем положении.
Испытуемый вновь накладывает зажим на нос, некоторое время дышит нормально,
вдыхая атмосферный воздух, а затем после спокойного выдоха берет в рот
мундштук, производит максимальный выдох в спирометр. Это резервный объем выдоха.
4. Колокол спирометра вновь наполняют атмосферным воздухом и
устанавливают на определенном уровне. Испытуемый некоторое время дышит нормально
(на нос накладывают зажим), делает несколько обычных дыхательных циклов, а
затем берет в рот мундштук и делает после спокойного вьщоха максимальный вдох
из спирометра, что позволяет определить емкость вдоха.
Сумма резервного объема выдоха и емкости вдоха должна равняться величине
жизненной емкости легких.
Занятие 25. Исследование газового состава
выдыхаемого воздуха и крови
В легочном газообмене участвуют кислород и диоксид углерода
(двуокись углерода, углекислота). Кислород диффундирует через
стенки альвеол в кровь, а диоксид углерода — из крови в
альвеолярный воздух. Выдыхаемый воздух содержит меньше кислорода
и больше диоксида углерода, чем атмосферный воздух.
Определение содержания газов во вдыхаемом и выдыхаемом животным
воздухе позволяет определить количество потребленного в единицу
164
времени кислорода и выделенного диоксида углерода, т. е.
интенсивность газообмена.
Газовый состав воздуха исследуют с помощью приборов —
газоанализаторов.
Кислород, проникая из альвеол легких в кровь, связывается с
гемоглобином в виде непрочного, легкодиссоциирующего
соединения — оксигемоглобина. Связывание кислорода с гемоглобином
зависит от напряжения кислорода и диоксида углерода в крови,
величины рН и температуры. Степень насыщения крови
кислородом определяют приборами оксигемометром и оксигемографом.
Цель занятия. Ознакомиться с методикой исследования
газового состава воздуха, определить процентное содержание кислорода
и диоксида углерода во вдыхаемом и выдыхаемом воздухе, а также
степень насыщения кислородом артериальной крови животных в
зависимости от поступления кислорода.
Объект исследования, материалы и оборудование. 1. Лошадь,
корова, свинья, овца. 2. Рисунки и схемы по теме. 3. Дыхательная
маска с гофрированными трубками, мешок из прорезиненной
ткани (мешок Дугласа), газовый счетчик, газоанализатор.
Выполнение работы.
I. Определение содержания кислорода и диоксида углерода во
вдыхаемом и выдыхаемом воздухе.
Для определения химического состава воздуха используют
несколько типов газоанализаторов с различными принципами
действия. Наиболее простые газоанализаторы Орса и Холдена.
Принцип действия этих аппаратов основан на поглощении кислорода
пирогалловой кислотой (в аппарате Холдена) и аммиачным
раствором оксида меди (в аппарате Орса), а также на связывании
диоксида углерода (С02) концентрированными растворами щелочей
(КОН и NaOH), используемыми в этих же аппаратах.
Для определения содержания 02 и С02 во вдыхаемом воздухе
подготавливают для работы аппарат Орса. В нем заполняют сосуд
30%-ным раствором КОН, другой сосуд (с медными
проволочками) — поглотителем кислорода: смесью из равных объемов
насыщенного раствора NH4C1 и 25%-ного раствора аммиака. В
напорный сосуд, соединенный с измерительной бюреткой, наливают
дистиллированную воду и подкрашивают ее розаловои кислотой
(индикатор: в кислой среде — розовый цвет, в щелочной —
желтый). Измерительную бюретку помещают в стеклянный цилиндр,
который заполняют водой для стабилизации температурных
условий. Устанавливают уровень поглотителей (по меткам), с помощью
кранов последовательно соединяют сосуды с измерительной
бюреткой и вертикально перемещают напорный сосуд. Поднимая
напорный сосуд, заполняют измерительную бюретку дистиллированной
водой с розаловои кислотой и вытесняют из нее имеющийся воздух.
165
С помощью дыхательной маски в мешок Дугласа собирают
выдыхаемый животным воздух, а из мешка в газоприемник
набирают исследуемый воздух. Соединяют аппарат с газоприемником
и, опуская напорный сосуд, набирают в измерительную бюретку
100 мл исследуемого воздуха. Эту операцию повторяют трижды,
причем первую и вторую порции воздуха вытесняют в атмосферу,
а третью анализируют. Вначале измерительную бюретку с
помощью крана соединяют с поглотителем С02. Поднимая и опуская
напорный сосуд, пропускают пробу воздуха З...5раз через
поглотитель. Затем уровень поглотителя доводят до метки и закрывают
кран. Совмещают уровни жидкости в напорном сосуде и
измерительной бюретке. По шкале бюретки определяют количество
поглощенного диоксида углерода (пример: взято 100 мл воздуха,
осталось 96 мл, поглотилось 4 мл, следовательно, содержится 4 %
диоксида углерода). После этого измерительную бюретку с помощью
крана соединяют с поглотителем кислорода. Исследуемую пробу
воздуха пропускают через этот поглотитель 16...20 раз.
Устанавливают уровень поглотителя по метке, закрывают кран и
выравнивают уровень жидкости в напорном сосуде и измерительной
бюретке. По шкале измерительной бюретки определяют количество
поглощенного кислорода и его процентное содержание.
При использовании аппарата Холдена порядок работы подобен
описанному. В этом аппарате емкость измерительной бюретки
10 мл, напорный сосуд заполняется ртутью.
Определение содержания 02 и С02 в воздухе можно провести и
с помощью современных электронных газоанализаторов (спиро-
лит П, универсальный спирограф ПТ-400 и др.). Работа их
основана на различной удельной теплоемкости кислорода и диоксида
углерода. В качестве датчиков используют термопары,
включенные в цепь измерительного моста. Пропуская через
газоанализатор атмосферный воздух, производят балансировку
измерительного моста. При пропускании воздуха другого состава
балансировка нарушается, что и регистрируется газоанализатором.
Для экспресс-анализа содержания С02 и 02 в газовых смесях
предложены приборы — анализатор ГУХ-2 и оксианализатор
ММГ-7.
Определяют содержание 02 и С02 во вдыхаемом и выдыхаемом
животным воздухе. Объясняют, чем обусловлены изменения в
составе вдыхаемого воздуха.
II. Оксигемометрия и оксигемография.
Оксигемоглобин в крови определяют с помощью приборов ок-
сигемометра и оксигемографа. Работа этих приборов основана на
фотоэлектрическом принципе действия. Интенсивность светового
потока, падающего на фотоэлемент датчика, зависит от степени
насыщения гемоглобина кислородом. Оксигемометр имеет стре-
166
лочный индикатор, его шкала градуирована в процентах
содержания оксигемоглобина в крови. Оксигемограф — регистратор,
записывающий изменения содержания оксигемоглобина в крови
на движущейся бумажной ленте. Прибор к работе готовят в
соответствии с инструкцией.
Животное (лучше свинью) ставят в станок. Фотоэлектрический
датчик укрепляют на предварительно очищенном от волос участке
уха. Определяют процентное содержание гемоглобина сначала в
обычных условиях, а затем при затрудненном дыхании (на морду
животного надевают маску).
Во время исследования определяют процентное содержание 02
в указанных условиях, объясняют, свидетельством какого явления
служит изменение содержания 02 в крови при задержке дыхания.
Занятие 26. Исследование регуляции дыхания
Дыхание регулируется дыхательным центром, который
находится постоянно в состоянии активности. Изменение дыхания
происходит рефлекторно. В дыхательный центр поступают
импульсы от рецепторов легких, сосудистых рефлексогенных зон,
дыхательных мышц. Определенное влияние на дыхательный
центр оказывает химический состав крови. Накопление в крови
диоксида углерода, уменьшение кислорода, повышенное
содержание молочной кислоты раздражают хеморецепторы. КрЪме
того, эти вещества могут изменять дыхание, действуя
непосредственно на дыхательный центр.
Цель занятия. Исследовать влияние на дыхание физической
нагрузки, химического состава вдыхаемого воздуха и крови;
выяснить роль блуждающего нерва в регуляции дыхания.
Объект исследования, материалы и оборудование. 1.0вца,
лошадь, теленок, собака, кролик. 2. Рисунки и схемы по теме.
3. Мешки из прорезиненной ткани для сбора воздуха, устройство
для фиксации мешка на спине животного, дыхательная маска с
гофрированными трубками, газовый счетчик; хирургический
набор, операционный столик; трахеальная канюля для собаки и
кролика, стеклянный тройник, резиновые трубки, винтовые зажимы;
капсула Марея с записывающим рычажком, кимограф, нитки,
электростимулятор, погружные электроды; шприц с иглами,
флакон с аммиаком, 5%-ный раствор молочной кислоты, вата, марля,
нембутал.
Выполнение работы.
I. Исследование влияния диоксида углерода на дыхание.
На возбудимость дыхательного центра большое влияние
оказывает концентрация С02 в крови.
167
Животное (овцу) ставят в станок и на морду ему надевают
маску, которую гофрированной трубкой соединяют с воздухосборным
мешком. В течение 5 мин собирают в мешок выдыхаемый воздух.
Одновременно подсчитывают дыхательные движения в 1 мин
(показатель возбудимости дыхательного центра). Собранный воздух
пропускают через газовый счетчик, определяют объем
выдохнутого воздуха, рассчитывают дыхательный и минутный объемы (тоже
показатели возбудимости дыхательного центра).
Затем вновь присоединяют воздухосборный мешок к маске и в
течение 8... 10 мин собирают в него выдыхаемый воздух.
Определяют число дыханий в 1 мин. Через 5 мин отсоединяют от маски
трубку, соединенную с мешком, и присоединяют ее к маске через
отросток с вдыхательным клапаном. Животное начинает дышать
воздухом с повышенным содержанием С02. К отростку маски с
выдыхательным клапаном присоединяют также через
гофрированную трубку другой мешок и в течение 5 мин в него собирают
воздух. Устанавливают частоту дыхания. По окончании
исследований определяют объем выдыхаемого воздуха, рассчитывают
дыхательный и минутный объемы, сопоставляют результаты,
объясняют механизм изменений (приспособления) частоты дыхательных
движений и вентиляции легких в этих условиях, делают
заключение о влиянии С02 на возбудимость дыхательного центра.
При выполнении данной работы можно испытать влияние на
дыхание газовой смеси, содержащей 15 и 5 % С02.
II. Влияние физической нагрузки на дыхание.
На морду животного надевают газообменную маску. Мешок
для сбора выдыхаемого воздуха укрепляют на спине животного,
которому дают нагрузку: движение шагом или бег в течение 5 мин.
Определяют частоту дыхания, дыхательный и минутный объемы.
Во время исследования сопоставляют полученные показатели
частоты и глубины дыхания, дыхательного и минутного объемов с
таковыми, полученными в покое. Объясняют, чем вызваны сдвиги
названных показателей при движении, делают заключение о
влиянии физической нагрузки на дыхание.
III. Влияние реакции крови на дыхание.
При сдвиге реакции крови в кислую сторону можно провести
определение частоты и глубины дыхания, а также вентиляции
легких (так, как это описано выше) до и после введения в кровь
раствора молочной кислоты.
Анестезированных кролика или собаку фиксируют на столике
на спине. Готовят операционное поле в области шеи. Разрезают
кожу по средней линии шеи, отпрепаровывают трахею и
производят трахеотомию. В трахею вставляют канюлю и соединяют ее с
помощью резиновых трубок через тройник с капсулой Марея.
Записывают на кимографе пневмограмму. Не прекращая записи ды-
168
хательных движений, животному внутривенно вводят 1 мл 5%-ного
раствора молочной кислоты.
Определяют, как изменяется в этих условиях дыхание,
объясняют полученные результаты, делают заключение о влиянии
молочной кислоты на возбудимость дыхательного центра.
IV. Исследование роли блуждающих нервов в регуляции
дыхания.
Исследование продолжают на подготовленных для работы
кролике или собаке (см. выше). У кролика тупым путем отпрепаровы-
вают правый и левый блуждающие нервы (белого цвета, плотные)
и берут их на две лигатуры. Готовят электростимулятор.
Записывают исходное дыхание на кимографе. Затем перевязывают
лигатурами (0,5 см одна от другой) блуждающие нервы и перерезают
их ножницами между лигатурами. Продолжая запись дыхания,
обращают внимание, как изменяются частота и глубина дыханий.
Центральный конец перерезанного блуждающего нерва
помещают на электроды электростимулятора и раздражают его
одиночными импульсами пороговой силы сначала в период вдоха, а затем в
период выдоха. Обращают внимание, как изменится при этом ход
вдоха и выдоха (по пневмограмме). Объясняют полученные
результаты. Делают заключение о роли афферентных влияний с ме-
ханорецепторов легких через блуждающие нервы в обеспечении
смены вдоха выдохом.
Контрольные вопросы и задания. 1. С деятельностью каких органов связано
дыхание? Какова физиологическая роль каждого из этих органов? 2. Что понимают
под вдохом и выдохом? Каковы механизмы и физиологическая роль вдоха и
выдоха? 3. Какими методами исследуют дыхание у животного? 4. Назовите типы
дыхания у животных. 5. Что такое минутный объем дыхания, от чего он зависит? 6.
Каков газовый состав альвеолярного воздуха, венозной и артериальной крови?
7. Как осуществляется обмен газами между альвеолярным воздухом и венозной
кровью? 8. Как осуществляется рефлекторная регуляция дыхания? 9. Какое
влияние на дыхательный центр оказывают избыток СО2 и недостаток СЬ в крови?
5.11. СИСТЕМА ПИЩЕВАРЕНИЯ
Пищеварение — физиологический процесс расщепления в
пищеварительном аппарате питательных веществ корма с помощью
физической и химической его обработки в более простые
соединения, которые могут всасываться в кровь и усваиваться
организмом. Существенной стороной пищеварения является гидролиз
белков, липидов и углеводов до более простых компонентов,
освобождение минеральных веществ и витаминов.
Методические приемы, используемые для изучения
физиологии пищеварения, весьма многочисленны и разнообразны.
Основы современного учения о пищеварении заложены академиком
И. П. Павловым и его учениками. Успех их исследований в значи-
169
тельной мере был обеспечен широким внедрением разработанной
ими фистульной методики. Операции по наложению фистул
описаны в учебниках по оперативной хирургии.
Занятие 27. Наблюдение за приемом корма
и воды животными
В ядрах гипоталамуса располагаются центры голода,
насыщения и жажды. Уменьшение концентрации в крови глюкозы,
летучих жирных кислот, аминокислот, жирных кислот, других
эндогенных раздражителей, воды, снижение потока афферентной
информации с рецепторов пищеварительного аппарата в связи с
завершением физико-химического превращения принятого корма
вызывают возбуждение центра голода (при недостатке воды —
центра жажды), которое проявляется в поиске корма, приеме
корма (при жажде — воды).
Цель занятия. Исследование приема корма животным,
процесса пережевывания, продолжительности поедания различных
кормов, приема воды, а также особенностей поведения животных при
приеме корма и воды.
Объект исследования, материалы и оборудование. 1. Корова,
лошадь, овца, свинья, курица, гусь. 2. Рисунки и схемы по теме.
3. Набор различных кормов, вода, кормушки, секундомер.
Выполнение работы. Не кормленному и не поенному с вечера
животному дают определенное количество корма, отмечают, как
животное захватывает его, ведут подсчет жевательных движений,
затраченных на пережевывание каждой захваченной порции
корма, определяют продолжительность пережевывания этой порции
и время поедания известного количества корма. Обращают
внимание на поведение животного, на участие в приеме корма губ,
языка, зубов, на характер движения нижней челюсти при жевании.
Животному дают воду. Наблюдают за приемом воды.
Результаты наблюдений записывают в тетрадь. Проводят
сравнительную оценку приема корма и воды животными различных
видов, отмечают особенности приема корма и воды, характерные
для животного каждого вида.
Занятие 28. Исследование ротового пищеварения
Ротовое пищеварение, или физико-химическое превращение
корма в ротовой полости, обеспечивается двигательной
деятельностью жевательного аппарата и секреторной деятельностью
слюнных желез.
170
Цель занятия. Изучить зависимость скорости пережевывания
от вида корма, а также характер слюноотделения и состав слюны
при различном кормлении.
Объект исследования, материалы и оборудование. 1.
Сельскохозяйственные животные с канюлей в протоке или с выведенным
на поверхность кожи протоком околоушной или другой слюнной
железы. 2. Рисунки и схемы по теме. 3. Станок; мастикоциограф,
кимограф, отметчик времени; воронки для собирания слюны,
менделеевская замазка, градуированные пробирки, штатив с
пробирками; секундомер, резиновая груша, простейший
вискозиметр, дистиллированная вода, пипетки стеклянные; 10%-ный
раствор уксусной кислоты, свежее сено, комбикорм, свекла, хлеб,
сухарный порошок, мясо, мясной порошок, молоко, речной песок,
0,2%-ный раствор соляной кислоты.
Выполнение работы.
I. Запись жевательных движений.
Исследование лучше проводить на спокойной корове или овце,
предварительно приученной к станку и к фиксации мастикоциографа.
Животному в состоянии натощак с помощью специального
недоуздка фиксируют мастикоциограф так, чтобы воспринимающий
движение нижней челюсти баллон располагался в межчелюстном
пространстве. В систему мастикоциографа с помощью баллона
накачивают воздух в объеме, необходимом для хорошего движения
пишущего рычажка капсулы Марея. Для регистрации
жевательных движений используют кимограф. Животному дают сено и
подсчитывают число жевательных движений. С интервалами
4...5 мин ему дают комбикорм, овес и др. Записанные жевательные
движения посредством мастикоциографа называют мастикоцио-
граммой. Она состоит из так называемых жевательных волн.
Нижние петли между волнами — это петли смыкания зубных рядов.
При анализе записи жевательных движений учитывают
величину и ритмичность жевательных волн, форму петель смыкания,
число жевательных движений в 1 мин на одну порцию
захваченного корма. По результатам записи дают характеристику
жевательных движений.
Для изучения жевательных движений нижней челюсти
используют и другие методические приемы: электромиографию
жевательных мышц (электромиомастикоциография), рентгеномио-
графию (рентгеномиомастикоциография).
II. Изучение закономерностей секреторной деятельности слюнных
желез.
Исследования проводят на собаке с выведенным на
поверхность кожи щеки протоком околоушной или подчелюстной
слюнной железы, на овце или теленке (6... 12-месячного возраста) с
хронической канюлей протока околоушной слюнной железы.
171
Животное в состоянии натощак ставят в станок. Собаке к
отверстию протока плотно приклеивают разогретой менделеевской
замазкой стеклянную или металлическую воронку. Овце и теленку
к канюле протока слюнной железы присоединяют резиновую
трубку, другой конец которой опускают в колбу (рис. 36).
Определяют исходный уровень слюноотделения за 2-минутные
интервалы в течение 6...8 мин. Проводят поддразнивание животного кор-
Рис. 36. Фистулы слюнных желез:
А — изучение слюноотделения у собаки: /— фистульная собака с приклеенными воронками и
подвешенными к ним пробирками; II— слюнные воронки (а — для околоушной слюнной
железы и б—для подчелюстной слюнной железы); ///—пробирки для сбора слюны (/ — с
проволочной петлей и 2—с прищепкой); IV— наложение фистулы на проток околоушной
слюнной железы: А — у собаки: / — в проток введен зонд, впереди и сзади отверстия наложены
лигатуры; 2—выведенный кусочек слизистой с отверстием протока околоушной слюнной
железы; 3— собака с выведенным протоком околоушной слюнной железы; Б— у жвачных:
/— отвернут кожный лоскут с папиллой протока и 2— проток выведен в кожный лоскут;
В — теленок с мостиком околоушной и ротовой фистул
172
мом в течение 2 мин. Корм подносят так, чтобы животное его
видело и обоняло, но схватить не могло. При этом определяют,
возбуждаются ли слюнные железы на вид корма по типу условного
рефлекса, увеличивается ли выделение слюны. Затем животному
скармливают корм и наблюдают за выделением слюны.
Проверяют реакцию слюнных желез на введение в ротовую полость
отвергаемых веществ (песок, 0,2%-ный раствор НС1). Уточняют объем
выделенной слюны на каждый раздражитель.
При анализе результатов исследований обращают внимание на
связи физических и химических свойств раздражителя и
количества выделенной слюны, время действия раздражителя и время
ответной реакции. Делают заключение о закономерностях
секреторной деятельности слюнных желез в ответ на действие
раздражителя. Зарисовывают рефлекторную дугу слюноотделительного
рефлекса и объясняют механизм приспособления секреторной
деятельности слюнных желез к различным раздражителям.
III. Определение свойств слюны (вязкость, наличие муцина,
щелочность) на различные раздражители.
1. Вязкость слюны выражают отношением времени истечения
слюны через капиллярную трубку вискозиметра ко времени
истечения через тот же вискозиметр и при той же температуре равного
количества дистиллированной воды. Вязкость воды принимают за
единицу. Устанавливают вязкость слюны, полученной на
различные раздражители.
2. Для определения наличия муцина в слюне в пробирку
набирают 1...2 мл слюны (см. рис. 36) и добавляют к ней 0,5... 1 мл воды, а
затем 4... 10 капель 10%-ного раствора уксусной кислоты.
Встряхивают пробирку. В ней появляются хлопья свернувшегося белка,
выпадает осадок белка — муцина. Слюна теряет свой слизистый
характер. Отмечают, как много содержится муцина в слюне.
3. Для определения щелочности слюны берут в стаканчик 1 мл
слюны и добавляют к ней 2 капли индикатора метилоранжа. Затем
пробу слюны титруют 0,01 н. раствором серной кислоты до
красновато-оранжевого цвета. Вычисляют щелочность слюны в
процентах NaHC03 по количеству раствора серной кислоты,
пошедшего на титрование.
Пример. На титрование 1 мл слюны пошло 6 мл 0,01 н. раствора H2S04. 1 мл
0,01 н. H2S04 связывает 1мл 0,01 н. NaHC03, или по массе 0,00084 г NaHC03.
6 мл 0,01 н. H2S04 связывают 6-0,00084 г NaHC03, а щелочность слюны,
выраженная в процентах NaHC03, будет составлять 6-0,00084-100%, т.е. 0,5%
NaHC03.
При исследовании определяют щелочность полученной слюны и ее рН (с
помощью потенциометра). Сопоставляют результаты определений вязкости, муцина
и щелочности слюны, полученной на различные раздражители, определяют
зависимость свойств слюны от физико-химических свойств корма, от роли белка,
муцина и щелочных солей.
173
Занятие 29. Исследование желудочного пищеварения
Желудочное пищеварение, или физико-химическое
превращение корма в желудке, обеспечивается двигательной
деятельностью желудка и секреторной деятельностью желудочных желез.
Цель занятия. Исследовать двигательную деятельность желудка
моногастричных животных и преджелудков у жвачных; изучить
закономерности секреции пищеварительного сока и его
пищеварительные свойства; выяснить роль микроорганизмов в процессе
рубцового пищеварения.
Объект исследования, материалы и оборудование. 1. Эзофагото-
мированная собака с фистулой желудка; собаки с изолированным
желудочком по способу Р. ГейденгайнаипоспособуИ. П. Павлова;
ягненок-молочник с фистулой сычуга, овца, теленок, корова с
фистулой рубца, овца с изолированным сычугом; свинья с
изолированным желудочком, свинья с фистулой желудка. 2. Рисунки и схемы
по теме. 3. Пробки с пропущенными сквозь них стеклянными
трубками и соответствующие диаметру просвета канюли желудка или
рубца; воронки, резиновые трубки, мерные цилиндры,
градуированные пробирки, секундомер, кюветы, дренажные трубки для
собирания желудочного сока из изолированного желудочка; устройство
для регистрации двигательной деятельности желудка — резиновый
баллон-датчик, тройник, нагнетательный баллон и капсула Марея,
кимограф (можно использовать электронный измеритель давления
в желудке); руминограф Горяиновой РГ-4; штативы, пробирки,
бюретки, воронки, пипетки на 5 и 10 мл, стаканчики, фильтры,
капельницы; индикаторы — 1%-ный спиртовой раствор
фенолфталеина, 0,5%-ный спиртовой раствор диметиламидоазобензола; 0,1 н.
раствор гидроксида натрия для титрования; кусочки фибрина и
мышц лягушки; 0,5%-ный раствор соляной кислоты; 0,5%-ный и
2%-ный растворы питьевой соды, 10%-ный раствор гидроксида
натрия, 0,3%-ный раствор медного купороса; водяная баня.
Выполнение работы.
I. Исследование сократительной деятельности желудка.
Сократительная деятельность желудка обеспечивает
смешивание корма с желудочным соком и перемещение его (порционную
эвакуацию) в двенадцатиперстную кишку.
Исследования можно провести на собаке с фистулой желудка
или на ягненке с фистулой сычуга. Животное в состоянии
натощак фиксируют в станке. Для изучения сократительной функции
желудка используют методику баллонной кимографии. В полость
желудка через канюлю вводят резиновый баллон, соединенный с
помощью резиновых трубочек и вспомогательных
приспособлений через гласс-баллон с капсулой Марея. Система заполняется
воздухом; она должна быть герметична.
174
Регистрируют сокращения желудка в течение 10 мин у
голодного животного, а затем в течение часа после дачи ему небольшого
количества корма (молока). Через 40 мин животному можно
ввести подкожно 0,5%-ный раствор атропина (0,15...0,20 мг/кг) и
продолжить наблюдения. Запись движений желудка называют гастро-
кимографией, а записанные движения — гастрокимограммой.
Последняя состоит из простых однофазных волн низкой и средней
амплитуды перистальтического характера, поддерживающих
тонус желудка, и однофазных волн высокой амплитуды пропульсив-
ного характера.
На гастрокимограмме обращают внимание на амплитуду (силу
сокращений желудка) и частоту волн в состоянии натощак, сразу
после приема корма, спустя некоторое время после его приема и
после введения атропина (атропин блокирует передачу регулятор-
ных рефлекторных влияний на мышцы желудка через
парасимпатические нервные волокна блуждающих нервов).
После этого делают заключение о закономерностях моторики
желудка в связи с желудочным пищеварением. Зарисовывают
нервные и гуморальные механизмы регуляции моторики желудка,
объясняют механизм приспособления движений желудка к
меняющимся условиям, а также роль парасимпатических волокон
блуждающих нервов в регуляции двигательной деятельности
желудка.
II. Запись сокращений преджелудков жвачных.
У жвачных животных проглоченная порция корма поступает в
преддверие рубца, а затем за счет движений рубца распределяется
в рубце. Движение преджелудков (рубца, сетки, книжки)
осуществляется взаимосвязанно, в определенной последовательности,
турами или циклами.
Двигательную деятельность преджелудков исследуют на овце
или теленке с фистулой рубца. Животное фиксируют в станке.
Открывают канюлю рубца и через нее вводят баллончики,
укрепленные на гибких медных трубках, в сетку, вентральный и
дорсальный мешки рубца. Каждый баллончик соединяют с
помощью резиновых трубок с отдельной капсулой Марея. Запись
движений преджелудков ведут на электрическом кимографе в течение
10 мин до кормления, в период 3...5-минутного кормления и в
течение 10...15 мин после него. Сокращения преджелудков
регистрируются в виде волн разной амплитуды (рис. 37).
На кимограмме преджелудков обращают внимание на
последовательность сокращений преджелудков и отделов рубца, силу
сокращений (амплитуду волн), продолжительность двигательного
цикла преджелудков, интервалы между сокращениями одного и
того же отдела, а также на то, как изменяются сокращения
преджелудков при приеме корма и после его приема.
175
4 A-W- _
Рис. 37. Схема расположения резиновых
баллончиков в сетке:
/ — в сетке; 2 и 3 — в дорсальном и вентральном
мешках рубца; 4.. 6— соответственно кривые
сокращения сетки, дорсального и
вентрального мешков рубца; 7— отметка времени (5 с)
Зарисуйте механизмы
регуляции двигательной деятельности
преджелудков, объясните, как
осуществляется приспособление
двигательной деятельности преджелудков к меняющимся условиям
(прием корма, поступление корма в преджелудки).
Сокращения рубца у крупного рогатого скота можно
регистрировать с помощью руминографа Горяиновой (рис. 38), который
укрепляют в левой голодной ямке животного. Он состоит: из
большой металлической планки, один конец которой кладут на мак-
лок, а другой — на последнее ребро; металлического стержня с
рабочей пружиной и с диском на конце; металлической коробки со
шкалой, показывающей давление в килограммах (кг); муфты,
закрепленной винтом к стержню; регистрирующего прибора с
часовым механизмом. При работе руминографа давление рубца
передается через брюшную стенку на диск, а затем на стержень,
пружина растягивается, указатель показывает давление.
Одновременно происходит запись сокращений рубца на движущейся
бумажной ленте.
III. Наблюдение за проявлением жвачного процесса.
Жвачкой называют процесс
пережевывания кормовой массы,
периодически отрыгиваемой в ротовую полость
из начальных отделов многокамерного
желудка — рубца и сетки. Возникает
регулярно между приемами корма.
Рис. 38. Руминограф Горяиновой:
1 — металлическая планка; 2 — барабан с
часовым механизмом; 3 —
металлический стержень с рабочей пружиной и с
диском 4 на конце (пелоном)
176
Наблюдают за проявлением жвачного процесса и движениями
сетки и рубца (по записям на кимографе). Обращают внимание на
изменение глубины вдыхательного движения перед отрыгиванием
порции корма, на характер изменения положения головы и шеи,
на появление и движение в левом яремном желобе по
направлению к голове волны (это движется пищевой ком по пищеводу), тут
же следующей обратной волны от головы к рубцу (это
проглатывается жидкая фракция отрыгнутого содержимого), на
возникновение вслед за поступлением отрыгнутого содержимого в ротовую
полость жевательных движений. Подсчитывают число
жевательных движений при пережевывании порции корма и время
пережевывания. Описывают свои наблюдения, отмечая, как часто
происходит отрыгивание газов, механизм регуляции его, обосновывают
физиологическую значимость процесса отрыгивания газов.
IV. Изучение секреторной деятельности желудочных желез.
Секреторной деятельностью называют образование и
выделение желудочными железами сока в количестве и по составу,
соответствующими потребностям переваривания в желудке
принятого корма.
Для изучения закономерностей секреторной деятельности
желудочных желез используют животных (собака, овца, свинья,
теленок) с изолированным желудком (жвачных с изолированным
сычугом) по способу И. П. Павлова. Желудочек сохраняет
нервные связи с основным желудком и поэтому полностью отражает
секреторную функцию желудка (рис. 39).
Животное, которое в течение 18...20ч не получало корм,
фиксируют в станке. В изолированный желудочек вставляют
дренажную трубку и укрепляют ее с помощью резиновых колец и тесьмы
на животе у животного.
Желудочный сок собирают в градуированную пробирку
(цилиндр или мерную колбу), подвешенную к дренажной трубке или
канюле. В течение 10...20 мин через 5... 10-минутные интервалы
определяют количество отделяемого желудочного сока в
состоянии натощак. Отмечают время и скармливают животному корм
(собаке — 100 г мясного фарша или 600 г молока в течение 2 мин,
овце — 300 г комбикорма или 0,5 кг нарезанной свеклы, теленку —
1 кг комбикорма или 3 кг свеклы, свинье — 0,5 кг комбикорма или
0,5 кг вареного картофеля).
Подготавливают набор пробирок или колб (при использовании
крупных животных) и наблюдают за отделением желудочного сока
при тех же интервалах, что и до скармливания корма.
По количеству отделяющегося желудочного сока вычерчивают
кривую его секреции по часовым периодам на конкретный вид и
объем принятого корма. По кривой секреции прослеживают
закономерность секреторной реакции желудочных желез на принятый корм.
177
/ //
V. Исследование механизмов регуляции секреции желудочного
сока.
Приспособление секреторной деятельности желудочных желез
к количеству и качеству принятого корма, к постоянно
меняющимся объему и составу содержимого желудка в связи с
перевариванием принятого корма является обязательным условием
жизнедеятельности организма. Приспособление секреторной
деятельности к меняющимся условиям обеспечивается специальным
нервно-гуморальным механизмом.
Исследуют, возбуждаются ли желудочные железы по типу
условного рефлекса — на вид и запах корма, по типу безусловного
рефлекса — с вкусовых рецепторов ротовой полости и с механо- и
хеморецепторов желудка, гуморально — с помощью местных
(желудочных) гормонов и биологически активных веществ.
1. При исследовании возбуждения желудочных желез по типу
условного рефлекса поддразнивают животное кормом в течение
5 мин: голодную собаку (или поросенка) с фистулой желудка или
изолированным желудочком. Отмечают время появления из
желудка секрета кислой реакции. В течение нескольких 5-минутных
интервалов учитывают количество отделяющегося желудочного
сока и по нему составляют кривую. Рисуют и объясняют механизм
условно-рефлекторного возбуждения желудочных желез.
2. При исследовании возбуждения желудочных желез по типу
безусловного рефлекса с вкусовых рецепторов языка ставят так
называемый опыт мнимого кормления на эзофаготомированной
(с перерезанным на шее пищеводом и выведенными концами его
на кожу шеи) собаке с фистулой желудка. Животное, не корм-
178
ленное в течение 16...20 ч, ставят в станок. Желудок промывают
теплой (35 °С) водой. Для сбора сока под фистулой подвешивают
воронку и мерный цилиндр. В качестве пищевого раздражителя
заранее готовят мясной фарш. Собаку в течение 5... 10 мин кормят
мясным фаршем из большого таза. Проглоченное собакой мясо
вываливается через пищевод обратно в таз и вновь съедается
(рис. 40).
Учитывают количество отделяющегося сока за 10-минутные
интервалы. Определяют скрытый период возбуждения желудочных
желез, время отделения желудочного сока (ответной реакции
желудочных желез). По окончании опыта составляют кривую
секреции желудочного сока. На вертикальной оси отмечают количество
выделившегося сока в миллилитрах, а на горизонтальной оси —
время по 10-минутным интервалам. Зарисовывают схему
рефлекторной дуги, через которую возбуждаются желудочные железы с
вкусовых рецепторов. Объясняют механизм
безусловно-рефлекторного возбуждения желудочных желез с вкусовых рецепторов.
Вместо собаки в данном опыте можно использовать молочных
поросенка с фистулой желудка, ягненка и теленка с фистулой
сычуга. В качестве пищевого раздражителя используют молоко.
Опыт проводят по той же схеме. Поросенку и ягненку дают
50...100 мл молока, а теленку — 500...1000 мл. Выпитое животным
молоко выливается через фистулу желудка наружу (его собирают в
сосуд, который ставят под фистулу), а через 10... 15 мин после
скармливания молока из фистулы желудка уже выделяется чистый
желудочный сок, без примесей.
3. Исследование возбуждения желудочных желез по типу
безусловного рефлекса с механо- и хеморецепторов желудка проводят
на двух собаках или свиньях с изолированным желудочком по
И. П. Павлову (см. рис. 39) и фистулой большого желудка. В
качестве пищевого раздражителя используют молоко, мясной фарш
(для собак), жидкую кашу (для свиней), которые вводят из
специального шприца непосредственно в
большой желудок через фистулу.
Учитывают количество
отделяющегося сока за 10-минутные
интервалы. Определяют скрытый период
возбуждения желудочных желез,
время нарастания возбуждения
желудочных желез (нарастания
количества отделяющегося сока), общее
время секреции желудочного сока
на введенный корм.
ДЛЯ выяснения РОЛИ блуждаю- Рис. 40. Схема опыта мнимого
щих и чревных нервов, иннервиру- кормления
179
ющих желудок, в рефлекторном возбуждении желудочных желез
на одном из животных можно сразу после введения пищевого
раздражителя в желудок провести новокаиновую блокаду
блуждающих нервов в области шеи или чревных нервов надплеврально
впереди последней пары ребер.
Рефлекторные влияния через эфферентные парасимпатические
волокна на желудочные железы можно устранить путем
подкожного введения 0,5%-ного раствора атропина животному в дозе 0,15 мг/кг
сразу после попадания в желудок пищевого раздражителя.
По результатам учета количества отделяющегося желудочного
сока у животных при всех названных условиях необходимо
построить отдельные графики и сопоставить их. Рисуют
рефлекторную дугу и объясняют механизм рефлекторного возбуждения
желудочных желез с рецепторов желудка. Делают заключение о
характере изменений закономерности секреторной деятельности
желудочных желез на введение пищевого раздражителя
непосредственно в желудок по сравнению с закономерностью секреторной
деятельности желудочных желез изолированного желудочка по
Павлову на дачу животному корма. Объясняют, с чем связано
изменение закономерности деятельности желудочных желез при
введении корма непосредственно в желудок.
Описывают, как изменилась секреторная деятельность
желудочных желез в условиях новокаиновой блокады блуждающих и
чревных нервов или подкожного введения атропина. Делают
заключение о роли нервов желудка в рефлекторной регуляции
деятельности желудочных желез.
4. Исследования возбуждения желудочных желез гуморально
(через кровь) с помощью местных гормонов и биологически
активных веществ проводят на собаке или свинье с изолированным
желудочком по Р. Гейденгайну (см. рис. 39), а также на собаке или
свинье с фистулой желудка, молочном ягненке с фистулой сычуга
(рис.41).
Рис. 41. Фистульные животные:
А — поросенок с фистулами желудка и кишечника; £— теленок с фистулой рубца; В— петух
с фистулой зоба
180
Гуморальное возбуждение желудочных желез вызывают путем
дачи животному с изолированным желудком по Р. Гейденгайну
корма. Прием корма не может возбудить секреторные железы
изолированного желудка рефлекторно (перерезаны нервные
проводники желудка), железы будут возбуждаться только гуморальным
путем, т. е. гормонами, которые образуются специальными
инкреторными клетками желудка при желудочном пищеварении.
При исследовании на животных с фистулой желудка в качестве
гуморального возбудителя используют гистамин (подкожно
вводят 1 мл 0,1%-ного раствора). По результатам учета количества
отделившегося желудочного сока строят графики. Сопоставляют
секреторную деятельность желез изолированного желудка по
Р. Гейденгайну с секреторной деятельностью желез в тех же
условиях изолированного желудка по И. П. Павлову (по графикам
секреции), выявляют различия, объясняют, чем они обусловлены.
На основании всех проведенных исследований составляют
схему нервно-гуморального механизма возбуждения и регуляции
желудочных желез.
VI. Исследование пищеварительных свойств желудочного сока.
Собственно пищеварительная деятельность желудка
обеспечивается желудочным соком. Желудочный сок содержит ферменты
(пепсины, парапепсины, гастриксин, желатиназу, катепсины,
ренины, липазу) и соляную кислоту. В желудочном пищеварении
основную роль играют пепсины и соляная кислота.
Определяют кислотность желудочного сока, роль соляной
кислоты в активации пепсинов, в переваривании белков, действие
пепсинов на белок, действие ренина на казеин молока.
Для определения кислотности желудочный (сычужный) сок
берут у эзофаготомированных животных, животных с фистулой
желудка или с изолированным желудком по И. П. Павлову.
1. В желудочном соке определяют свободную, связанную и
общую соляную кислоту, а также общую кислотность методом
титрования 0,1 н. NaOH. Содержание кислоты выражают в условных
титрационных единицах — количество (мл) 0,1 н. NaOH,
затраченное на титрование 100 мл сока, или в абсолютных количествах
соляной кислоты (зная, что 1 мл 0,1 н. NaOH нейтрализует 1 мл
0,1 н. НС1,а 1мл 0,1 н. НС1 содержит 0,00365 г НС1).
Для титрования берут бюретки, воронки, пипетки на 5 и 10 мл,
стаканчики, капельницы с индикаторами (1%-ным спиртовым
раствором фенолфталеина, 0,5%-ным спиртовым раствором
диметиламидоазобензола, 1%-ным водным раствором ализарино-
сульфоновокислого натрия). Бюретки с помощью воронок
заполняют 0,1 н. NaOH.
В два пронумерованных химических стаканчика (№ 1 и 2)
вносят по 5 мл желудочного сока. В стаканчик № 1 прибавляют по
181
2 капли фенолфталеина и диметиламидоазобензола (должно
появиться красное окрашивание). В стаканчик № 2 прибавляют
2 капли ализариносульфоновокислого натрия (должно появиться
желтое окрашивание).
Отмечают количество раствора NaOH в бюретке и начинают
титрование. Желудочный сок из стаканчика № 1 титруют до
появления розово-желтого окрашивания, отмечают количество
щелочи, затраченной на титрование. Затем продолжают титрование до
устойчивого розового цвета, снова отмечают количество щелочи,
затраченной на титрование. Желудочный сок из стаканчика № 2
титруют до серо-фиолетового цвета.
По количеству щелочи, пошедшей на титрование желудочного
сока до розово-желтого окрашивания, рассчитывают содержание в
соке свободной НС1 (п мл 0,1 н. NaOH умножают на 20 так, как
титровали 5 мл желудочного сока, а расчет ведут на 100 мл). По
количеству щелочи, пошедшей на титрование желудочного сока
до розового цвета, рассчитывают также общую кислотность
желудочного сока. По количеству — разнице щелочи, пошедшей на
титрование желудочного сока из стаканчика № 2 до
серо-фиолетового окрашивания и на титрование желудочного сока из
стаканчика № 1 до розовой) цвета, рассчитывают также содержание всех
кислых эквивалентов, кроме связанной НС1. Содержание
связанной кислоты определяют путем вычитания из общей кислотности
содержания всех кислых эквивалентов. Количество органических
кислот и кислотореагирующих солей рассчитывают путем
вычитания из общей кислотности количества свободной и связанной
соляной кислоты.
Определяют и рН желудочного сока с помощью
потенциометров. Существуют специальные датчики, которые вводят
непосредственно в желудок. Разработан и радиотелеметрический метод.
В желудок вводят миниатюрную радиокапсулу, внутри которой
находятся микродатчик, полупроводниковый генератор и
источник питания. Сигналы радиокапсулы принимаются специальной
антенной и подаются на приемно-анализирующее устройство.
Самопишущее приспособление фиксирует сигналы на движущейся
ленте.
2. Действие желудочного сока (пепсинов) на белок определяют
качественными цветными реакциями продуктов гидролиза и
количественно — по активности пепсинов.
В качестве субстрата используют белок плазмы крови фибрин
или мышцы лягушки. Подготавливают натуральный желудочный
сок собаки или свиньи, водяную баню, штатив с пробирками,
индикатор фенолфталеин, 0,5%-ный раствор НС1, 0,5%-ный раствор
NaHC03, стеклограф, лакмусовую бумагу, 10%-ный раствор
NaOH, 1%-ный раствор CuS04.
182
Нумеруют 4 пробирки. В пробирку № 1 наливают 2 мл
желудочного сока, в № 2 — 2 мл желудочного сока, предварительно
прокипяченного, в № 3 — 2 мл желудочного сока,
нейтрализованного раствором соды до слабощелочной реакции (красная
лакмусовая бумага окрашивается в синеватый цвет), в №4 —2 мл
0,5%-ного раствора НС1. Во все пробирки вносят по 0,1 г
фибрина и помещают их на 30...40 мин в водяную баню (или термостат)
при температуре 38 °С. По истечении этого времени пробирки
извлекают из водяной бани и определяют, как изменились кусочки
фибрина во всех пробирках; отмечают наличие продуктов
гидролиза в содержимом с помощью биуретовой реакции. Обращают
внимание на состояние белка в пробирке № 4 по сравнению с
пробирками № 2 и 3.
Ставят также биуретовую реакцию: к содержимому пробирки
добавляют 1 мл 10%-ного раствора NaOH и 3 капли 1 %-ного
раствора CuS04, взбалтывают. При наличии белка появляется
фиолетовое окрашивание, при наличии смеси пептидов — розовое.
По результатам исследований делают заключение, за счет чего
желудочный сок обладает протеолитическим действием, в каких
условиях проявляется действие пепсинов, о роли соляной кислоты
в превращении белка в желудке.
Для определения активности пепсина (по В. П. Тин)
подготавливают натуральный желудочный сок, пробирки, центрифужные
пробирки, 2%-ный раствор сухой плазмы крови на 0,1 н. растворе
НС1, микропипетки, пипетки на 5 и 10 мл, 20%-ный раствор трй-
хлоруксусной кислоты (ТХУ), 1,5 н. раствор NaOH, биуретовый
реактив (9 г сегнетовой соли растворяют в 500 мл 0,1 н. NaOH,
прибавляют 5 г сульфата меди, растворяют, добавляют 5 г йодида
калия, растворяют и доводят объем до 1000 мл 0,1 н. NaOH).
Желудочный сок разводят водой в 100 раз. В центрифужную
пробирку с 0,5 мл воды добавляют 0,5 мл разведенного
желудочного сока и 2,0 мл раствора сухой плазмы. В контрольную пробирку
вместо разведенного желудочного сока берут 1,0 мл воды.
Пробирки помещают в термостат на 20 ч при температуре 37 °С. После
этого в пробы вносят по 1 мл раствора ТХУ, смешивают и через
10 мин центрифугируют в течение 10 мин при частоте вращения
1500 мин-1. В чистые пробирки вносят по 1,5 мл центрифутата,
добавляют по 0,5 мл 1,5 н. NaOH, смешивают и приливают по 3 мл
биуретового реактива. Смешивают и через 30 мин колориметриру-
ют на ФЭК при зеленом светофильтре в кювете с толщиной
рабочего слоя 10 мм: контролем служит вода. Отсчет ведут по шкале
правого барабана. Из показателя оптической плотности опытного
образца вычитают оптическую плотность контроля и по
калибровочной таблице находят содержание пепсина в пробе.
При составлении калибровочной таблицы основной стандарт-
183
ный раствор пепсина готовят на 0,1 н. НС1, а рабочие растворы —
на воде. В пробы берут от 0,0005 до 0,01 мг пепсина: 1 мг пепсина
расщепляет 5000...6000 мг белка.
3. В сычужном соке телят, ягнят содержится фермент ренин,
обладающий специфическим действием. Он коагулирует,
створаживает молоко, расщепляет белок молока казеин на параказеин и
сывороточную альбумозу. Параказеин в присутствии ионов
кальция превращается в нерастворимую кальциевую соль,
выпадающую в виде осадка.
Подготавливают сычужный сок: через фистулу сычуга берут
сычужное содержимое, фильтруют через 2 слоя марли, а затем
через бумажный фильтр: фильтр содержит фермент ренин. Берут
свежее молоко, пробирки, 10%-ный раствор NaOH, 0,5%-ный
раствор NaHC03, 2%-ный раствор оксалата натрия, лакмусовую
бумагу.
Нумеруют 4 пробирки. В пробирку № 1 наливают 1 мл
сычужного сока (фильтрата сычужного содержимого); в № 2 — 1 мл
сычужного сока, нейтрализованного 0,5 мл 0,5%-ного раствора соды;
в № 3 — 1 мл предварительно прокипяченного сычужного сока; в
№ 4 — 1 мл сычужного сока и 0,3 мл 2%-ного раствора оксалата
натрия (для удаления солей кальция). Во все пробирки вливают по
5 мл свежего молока и помещают их на 15...20 мин в водяную баню
или термостат при 38 °С. По истечении этого времени во всех
пробирках определяют состояние молока — обращают внимание,
произошло ли его створаживание.
По результатам исследований делают заключение, в какой
среде проявляется специфическое ферментативное действие ренина,
какова роль ионов кальция в створаживании молока данным
ферментом.
VII. Исследование превращения корма в преджелудках жвачных
животных.
Превращение веществ корма в преджелудках обеспечивается
ферментами микроорганизмов (бактерии, инфузории, грибы). В
преджелудках ферментируются углеводы (в больших количествах
клетчатка, крахмал), белки и другие азотистые вещества, липиды;
одновременно бактерии и инфузории осуществляют синтез
углеводов, белков и липидов (в микроорганизмах преджелудков
определяются собственные полисахариды, белки, липиды); в
содержимом преджелудков по сравнению с принятым кормом возрастает
количество бактериального белка и липидов.
Методические приемы исследования процессов превращения
веществ в преджелудках сложны и трудоемки. Поэтому на
лабораторных занятиях изучают только отдельные стороны превращения
веществ, в преджелудках исследуют микроорганизмы, обитающие в
них, переваривание клетчатки, крахмала и растворимых углеводов.
184
1. Исследование простейших, обитающих в преджелудках,
проводят путем микроскопирования.
Подготавливают микроскоп, камеру Горяева, предметные,
покровные и часовые стекла, пипетки, метиленовую синь (1 : 1000).
У овцы или бычка с фистулой рубца до очередного кормления
получают содержимое рубца и фильтруют его через 4 слоя марли в
стаканчик, находящийся в сосуде с теплой водой (39...40 °С).
Несколько капель фильтрата наносят на часовое стекло и добавляют
1 каплю метиленовой сини (1 : 1000). Затем пипеткой каплю
окрашенного фильтрата наносят на покровное стекло, которое быстро
переворачивают и накладывают на предметное стекло с круглым
отшлифованным углублением. Края покровного стекла
окаймляют вазелином. В таком препарате («висячая капля») под
микроскопом наблюдают за движением инфузорий (сначала под малым,
затем под средним увеличением). Обращают внимание на размеры
инфузорий и наличие ресничек. Простейших можно подсчитать,
используя смеситель для лейкоцитов и камеру Горяева.
Устанавливают, какие виды инфузорий обитают в преджелудках.
2. Под действием целлюлозолитических бактерий и
инфузорий в преджелудках расщепляется до 60...70 % переваримой
клетчатки рациона. Продуктами расщепления ее являются простые
сахара, которые сбраживаются с образованием летучих жирных
кислот (уксусной, пропионовой, масляной) и газов (С02, Н2,
СН4, H2S, N2).
Для исследования переваривания клетчатки подготавливают
большие пробирки диаметром 20 мм и длиной 160 мм, штативы,
торзионные весы, стеклянные цилиндры, пипетки, вазелиновое
масло.
Через фистулу рубца берут содержимое рубца, которое
фильтруют через 4 слоя марли в стакан, помещенный в водяную баню
при 39 °С. В качестве источника целлюлозы используют
целлофановые полоски (80 х 17 мм), предварительно промытые
дистиллированной водой и высушенные при 70...80°С в течение 24 ч. На
торзионных весах взвешивают целлофановую полоску,
помещают ее в пробирку и заливают 25...30 мл фильтрата рубцового
содержимого. Сверху на фильтрат наносят тонкий слой
вазелинового масла для создания анаэробных условий
(микроорганизмы преджелудков анаэробны). Пробирку закрывают пробкой,
ставят в термостат на 30 ч. По истечении указанного времени
полоску из пробирки извлекают, промывают несколько раз теплой
дистиллированной водой (60 °С) и высушивают до постоянной
массы в термостате при 70...80 °С, а затем взвешивают. По разнице
массы полоски до и после инкубации вычисляют переваривание
клетчатки в процентах (%) за 30 ч.
В результате интенсивного превращения клетчатки, крахмала и
185
Сахаров в содержимом рубца всегда присутствуют летучие жирные
кислоты — уксусная, пропионовая, масляная (в малых
количествах продукт промежуточного превращения — молочная); общая
их концентрация 50... 150 ммоль/л.
Для исследования летучих жирных кислот подготавливают
пробирки, штатив, колбочки, эфир, 1%-ный раствор хлорного железа,
пипетки.
В пробирку наливают 5...7 мл фильтрата рубцового
содержимого и нагревают ее на пламени горелки. Над пробиркой, не касаясь
ее, держат синюю лакмусовую бумагу. При наличии летучих
жирных кислот в содержимом лакмусовая бумага краснеет.
Для определения уксусной кислоты в пробирку наливают
5 мл фильтрата рубцового содержимого и добавляют 5 мл эфира,
закрывают пробкой, тщательно взбалтывают и дают отстояться.
В другую пробирку наливают 3 мл дистиллированной воды,
добавляют 2 капли 1%-ного раствора хлорного железа и на этот раствор
наслаивают пипеткой эфирную вытяжку из пробирки. На границе
жидкостей появляется темно-красное окрашивание — показатель
присутствия уксусной кислоты.
Для определения масляной кислоты в пробирку наливают 2 мл
эфирной вытяжки и добавляют несколько капель спирта. Вытяжка
окрашивается в оранжевый цвет — показатель присутствия
масляной кислоты.
Для определения молочной кислоты в колбочку наливают
20 мл дистиллированной воды, прибавляют 3 капли 1%-ного
раствора хлорного железа (вода приобретает слегка желтоватый цвет).
Воду разливают в пробирки, по каплям приливают к ней
профильтрованное содержимое рубца. При наличии молочной
кислоты жидкость окрашивается в канареечно-желтый цвет.
По завершении работы нарисуйте схему превращений в пред-
желудках белков, углеводов, жиров.
Занятие 30. Исследование кишечного пищеварения
Кишечным пищеварением называют физико-химическое
превращение веществ корма в кишечнике, обеспечиваемое
секреторной деятельностью поджелудочной железы, печени, кишечных
желез, моторной и всасывательной деятельностью кишечника.
В толстой кишке превращение определенной части
питательных веществ корма (больше клетчатки, особенно у лошадей)
обеспечивается ферментами, продуцируемыми микроорганизмами,
обитающими в толстом кишечнике.
Цель занятия. Изучить двигательную деятельность кишечника,
секрецию поджелудочного и кишечного сока; исследовать состав
186
и роль желчи в пищеварении, а также ферментативные свойства
кишечного сока.
Объект исследования, материалы и оборудование. 1. Животные с
фистулой тощей кишки, с внешним анастомозом
двенадцатиперстной кишки, с изолированным отрезком кишечника, с
выведенным протоком поджелудочной железы, выведенным общим
желчным протоком. 2. Рисунки и схемы по теме. 3. Установки и
приборы для регистрации перистальтики; набор посуды и реактивов;
оборудование для исследований закономерностей секреторной
деятельности поджелудочной железы, печени и кишечника,
пищеварительных свойств поджелудочного сока, желчи, кишечного
сока, всасывательной деятельности кишечника.
Выполнение работы.
I. Исследование сократительной деятельности кишечника.
Моторная деятельность кишечника обеспечивает
депонирование корма (химуса), смешивание его с кишечным и
поджелудочным соком, с желчью и перемещение по кишечнику. Она
проявляется в нескольких видах сокращений — продольного и
кругового мышечных слоев кишечника. К основным видам сокращений
относятся ритмическая сегментация, маятникообразные
движения, перистальтические и тонические сокращения. В толстом
кишечнике сокращения частые, сравнительно слабые в отдельных
участках, редкие, но сильные координированные и тонические.
Определяют характер поступления химуса из сычуга в
кишечник. Проводят анализ моторной деятельности кишечника баллОн-
но-графическим методом на фистульных животных, методом
непосредственного наблюдения за движениями кишок у
анестезированного животного и методом регистрации сокращений
изолированной петли кишечника до и в условиях направленных
нервных и гормональных влияний на кишечник.
1. При определении характера поступления химуса из сычуга в
кишечник овцу с внешним анастомозом двенадцатиперстной
кишки и фистулой тощей кишки ставят в станок. Анастомоз
разъединяют и на концы фистульных трубок надевают резиновые
трубки. Конец от подающей фистульной трубки опускают в банку,
подвешенную под фистулу. На конец принимающей трубки
прикрепляют широкогорлую воронку из белой жести (рис. 42).
Определяют размер волн химуса, поступающего в двенадцатиперстную
кишку из сычуга, и частоту поступления в течение 30 мин.
Учтенный химус вливают вновь в кишечник через воронку и
принимающую фистулу.
Наблюдают за поступлением химуса в кишечник, делают
заключение о характере его и объеме.
2. Для исследования движений тонкого кишечника через
фистулу кишечника в просвет кишки вставляют тонкостенный рези-
187
Рис. 42. Сбор химуса, поступающего в двенадцатиперстную кишку овцы
новый баллончик объемом 2...2,5 мл, который воздушной
передачей соединяют с капсулой Марея. На электрическом кимографе
записывают сокращения тощей кишки и отметку времени. Запись
можно вести также с помощью аппарата ЭИД-1 и емкостного
датчика с регистрацией сокращений на ленте самопишущего прибора
или электрокардиографа.
Движения кишечника животного исследуют натощак при
приеме корма и через 12 ч после его приема. Отмечают особенности
движений в этих условиях, объясняют механизм приспособления
движений кишечника к меняющимся условиям.
3. Наблюдения всех видов движений кишечника и выяснение
роли эфферентных волокон парасимпатических нервов в
регуляции движений кишечника можно провести на кролике.
Анестезированное животное (эфир или нембутал вводят внутрибрюшинно
в дозе 40 мг/кг) фиксируют на операционном столике в
положении на спине. На вентральных поверхностях шеи и живота
готовят два операционных поля. Кожный разрез ведут по средней
линии шеи. Разъединяют мышцы шеи тупым путем, отпрепаровыва-
ют слева или справа от трахеи сосудисто-нервный пучок (сонная
артерия, блуждающий нерв, нерв-депрессор и шейный
симпатический ствол). Под блуждающий нерв подводят лигатуру, освобождают
нерв от окружающих тканей. Временно нерв прикрывают тканями.
Быстро вскрывают брюшную полость по белой линии, разводят в
стороны края раны, обкладывают их салфетками, смоченными
теплым раствором Рингера, и наблюдают за движениями кишечника в
течение 10... 15 мин. Обращают внимание на характер движения
тонкого и толстого кишечника. Отмечают и описывают маятникооб-
разные сокращения, ритмическую сегментацию, перистальтику
тонкого кишечника и характер сокращений толстого кишечника.
Затем подведенной под блуждающий нерв лигатурой
перевязывают нерв и перерезают его выше лигатуры. Периферический
конец блуждающего нерва кладут на электроды, соединенные с
источником тока (индукционного или импульсного определенного
188
параметра), и наблюдают за движениями кишечника. При
раздражении блуждающего нерва серией электрических
импульсов (по З...5с с перерывами) обращают внимание на изменение
силы и частоты сокращений кишечника, на появляющиеся
эффекты. Объясняют роль блуждающего нерва в регуляции
движений кишечника.
4. Влияние некоторых гуморальных факторов на движения
кишечника удобно наблюдать на изолированном отрезке кишки
кролика или на извлеченном из организма кишечнике белой
мыши. После исследования движений кишечника в условиях
стимуляции блуждающих нервов у кролика вырезают участок
тонкой кишки. На один конец кишки накладывают лигатуру и
прикрепляют ее к капиллярному стеклянному крючку, а другой
конец соединяют лигатурой с регистрирующим рычажком.
Отрезок кишки с помощью капиллярного стеклянного крючка и
штатива помещают в специальный стеклянный стакан (300 мл) с
теплым раствором Рингера (38...40°С). Через капилляр
стеклянного крючка раствор периодически аэрируют из резиновой
груши или микрокомпрессора (как и при записи движений рога
матки). Температуру раствора контролируют термометром. Пис-
чик рычажка присоединяют к барабану кимографа, пускают
последний и записывают сокращения отрезка кишки в течение
5... 10 мин. Установив фон сокращений кишки, в раствор вносят
несколько (5...8) капель ацетилхолина (медиатор парасимпатических
волокон, естественный раздражитель). Отмечают и описывают
характер и степень изменений сокращений кишки в этих условиях.
Делают заключение о влиянии ацетилхолина на движения
кишечника.
Раствор Рингера в стакане заменяют на свежий и вновь в
течение 5...10 мин записывают сокращения отрезка кишки. Затем в
раствор Рингера вносят 10 капель адреналина, который также
является естественным раздражителем для кишечника. Описывают
характер и степень изменений сокращений кишки в этих
условиях. Делают заключение о влиянии адреналина на движения
кишечника. Отмечают, с какими свойствами гладких мышц
связаны те или иные эффекты (сокращения изолированной петли,
отчетливая реакция на действие ацетилхолина и адреналина).
В этих же целях у белой мыши после анестезии вскрывают
брюшную полость, вырезают желудок и весь кишечник,
помещают их в теплый (38...40 °С) раствор Рингера, налитый в чашку
Петри или ванночку. Наблюдают за сокращениями кишечника до и
после добавления в раствор Рингера ацетилхолина и адреналина.
5. Роль перистальтических движений кишечника в
продвижении содержимого и механорецепции кишечника в
приспособлении движений кишечника к меняющимся условиям легко выявить
189
на собаке или другом животном с изолированной петлей кишки
по способу Тири—Веллы (рис. 43).
Собаку с изолированным участком кишечника по Тири—Веллу
фиксируют в станке. В переднее отверстие изолированной кишки
вкладывают пинцетом 3...5 горошин и наблюдают, через какое
время они проходят до ануса. (Исследование можно повторить после
предварительного орошения в течение 2 мин слизистой оболочки
кишки раствором новокаина.) Если известна длина кишки, то
определяют и скорость прохождения горошин. Делают заключение о
роли перистальтических сокращений кишечника и механорецеп-
ции в приспособлении сокращений кишечника к меняющимся
условиям. Рисуют общую схему механизмов, обеспечивающих
приспособление двигательной деятельности кишечника к принятому
корму, меняющемуся количеству и составу химуса. Отмечают роль
отдельных звеньев этого механизма.
При исследовании двигательной деятельности кишечника
используют и другие методические приемы: регистрацию изменений
внутрикишечного давления, регистрацию электрических
потенциалов кишечника; рентгенологические наблюдения за
продвижением контрастного вещества по кишечнику; регистрацию
звуковых явлений, возникающих при движениях кишечника;
радиотелеметрию с применением радиопилюль и эндорадиозонда.
И. Исследование секреторной деятельности поджелудочной
железы.
Секреторная деятельность поджелудочной железы
представляет собой совокупность процессов образования и выделения в
двенадцатиперстную кишку сока, содержащего набор ферментов,
гидролизующих все основные группы пищевых полимеров.
Реакция секреции поджелудочной железы на прием корма
осуществляется по общим закономерностям, характерным для
пищеварительных желез.
Рис. 43. Схема формирования
изолированного отрезка тонкого кишечника:
7 —по Тири—Веллу; 2—по Тири, 3— по Бабкину,
4— по Тири—Павлову; 5—с изоляцией отрезка
между двумя внешними анастомозами (мостиками).
Стрелками показано движение химуса вне опыта
190
Исследование секреторной деятельности поджелудочной
железы проводят на животных (собака, свинья, теленок) с выведенным
протоком поджелудочной железы: участок двенадцатиперстной
кишки лучше изолировать в месте впадения протока железы,
вставить в него и в кишечник канюли, сделать анастомоз (рис. 44).
Для работы необходимо иметь 2...3 животных.
Животное натощак фиксируют в станке. Разъединяют
анастомоз. К канюле подвешивают колбочку или градуированную
пробирку для сбора поджелудочного сока. Сокоотделение учитывают
каждые 10 мин (фон).
1. Для определения условно-рефлекторного возбуждения
поджелудочной железы животное поддразнивают кормом в течение
5 мин и продолжают учитывать сокоотделение в течение
последующих 3...4 10-минутных интервалов. Отмечают скрытый период
возбуждения железы.
2. Для установления возбуждения секреторного аппарата
поджелудочной железы с вкусовых рецепторов ротовой полости
животному скармливают корм (собаке — молоко, мясо) при
открытой канюле фистулы желудка: принимаемый корм вываливается
(выливается) через канюлю наружу (под канюлю фистулы ставят
таз). За ответной реакцией поджелудочной железы наблюдают в
течение 5...6 10-минутных интервалов. Отмечают скрытый период
возбуждения железы.
3. Для определения ответной реакции поджелудочной жедезы
на принятый корм собаке скармливают 150 г мяса или 300 мл
молока, свинье — 1 кг вареного картофеля или 800 мл молока.
Собирают поджелудочный сок в течение 4...5 ч, измеряя его объем
через каждые 10 мин. Отмечают латентный период.
С помощью лакмусовой бумаги определяют реакцию
поджелудочного сока. Для демонстрации роли блуждающих и чревных
нервов в рефлекторно-гуморальной регуляции деятельности
поджелудочной железы этот опыт можно повторить в условиях ново-
каиновой блокады вышеупомянутых нервов.
4. Желудочная рефлекторно-гуморальная фаза возбуждения и
регуляции поджелудочной железы в значительной степени
связана с растяжением дна желудка при наполнении его пищей. Чтобы
Рис. 44. Схема наложения внешнего
мостика двенадцатиперстной кишки с
хронической фистулой
поджелудочной железы по А. В. Синещекову:
/—поджелудочная железа с протоком;
2— канюля в протоке поджелудочной
железы; 3— внешний мостик;
4—канюля в кишечнике
191
определить рефлекторные влияния с механорецепторов желудка
на поджелудочную железу, животному в желудок через фистулу
вводят резиновый баллон, зафиксированный на резиновой трубке.
В баллон накачивают 500 мл воздуха, резиновую трубку
перекрывают зажимом. Баллон оставляют в желудке на 30 мин, после чего
воздух из него постепенно спускают. Поджелудочный сок
собирают в течение 1...2 ч, измеряя его объем каждые 10 мин. Отмечают
скрытый период возбуждения поджелудочной железы.
5. Кишечная рефлекторно-гуморальная фаза — основная фаза
возбуждения поджелудочной железы. Зависит она в основном от
высвобождения специальными инкреторными клетками
кишечника секретина и панкреозимина. Секреция этих
гормонов стимулируется главным образом соляной кислотой
желудочного сока и продуктами превращения белков и жиров.
Для определения влияния соляной кислоты наблюдают за
секрецией поджелудочного сока в состоянии относительного
покоя в течение двух 10-минутных интервалов. Затем через фистулу
в двенадцатиперстную кишку вводят 50 мл теплого 0,3%-ного
раствора НС1. Ответную реакцию наблюдают в течение 3...4 10-
минутных интервалов. Отмечают скрытый период.
Можно приготовить вытяжку из слизистой оболочки
двенадцатиперстной кишки (секретин) и испытать ее действие на
образование поджелудочного сока путем введения в кровь (вену) животного.
6. Значение желудочной и кишечной рефлекторно-гумораль-
ных фаз возбуждения и регуляции секреторной деятельности
поджелудочной железы определяют по секреторной ответной реакции
железы на введение корма (в том же количестве, как и при
скармливании) непосредственно в желудок через фистулу.
Взяв за основу объем отделившегося поджелудочного сока во всех
проведенных исследованиях, строят графики. По кривой секреции
поджелудочного сока на принятый корм описывают закономерность
секреторной приспособительной реакции поджелудочной железы
(указывают состояние железы натощак, скрытый период
возбуждения, время нарастания секреции, время максимального уровня
секреции, время снижения секреции, общее время ответной
реакции).
Проводят сравнительный анализ кривых секреции
поджелудочного сока на поддразнивание, мнимое кормление, введение
корма в желудок, раздражение рецепторов в полости желудка
баллоном, на введение в двенадцатиперстную кишку раствора НС1 и
на скармливание корма в обычных условиях при выключении
блуждающих и чревных нервов.
На основании сравнительного анализа составляют схему
нервно-гуморального механизма возбуждения и регуляции
секреторной деятельности поджелудочной железы.
192
III. Исследование ферментативной активности поджелудочного
сока.
В соке поджелудочной железы содержатся ферменты протеоли-
тические (трипсин, химотрипсин, панкреатопептидаза Е или эла-
стаза, карбоксипептидаза, каликреин, дезоксирибонуклеаза, ри-
бонуклеаза и др.), амилолитические (амилаза, глюкозидаза, фрук-
тофуронидаза, галактозидаза) и липолитические (липаза, фосфо-
липаза). Протеолитические ферменты синтезируются в виде
неактивных предшественников (зимогенов), которые в
кишечнике превращаются в активные формы. Другие ферменты
синтезируются в поджелудочной железе в активной форме, причем
для проявления этих свойств требуется наличие эффекторов,
находящихся в двенадцатиперстной кишке.
Используют поджелудочный сок от животных с фистулой
поджелудочной железы. Можно использовать панкреатин (1 г
растворяют в 250 мл 0,3%-ного раствора NaHC03). Подготавливают
водяную баню или термостат, спиртовки, штативы с пробирками,
бюретки, желчь, фибрин, крахмал вареный и сырой, масло
растительное, фенолфталеин, раствор Люголя, бромную воду (4%-ный
раствор брома в воде), 0,01 н. раствор NaOH, стеклограф.
Нумеруют 9 пробирок; в каждую наливают по 2 мл
поджелудочного сока (если сок не подвергался действию кишечного сока, его
активируют добавлением к нему кишечного сока или соскоба
слизистой оболочки кишечника). В пробирку № 1 опускают кусочек
фибрина; в пробирке № 2 сок кипятят, охлаждают и опускают в
него также кусочек фибрина; в пробирке № 3 поджелудочный сок
подкисляют соляной кислотой и добавляют кусочек фибрина; в
пробирку № 4 добавляют 2 мл вареного крахмала, а в № 5 — 50 мг
сырого крахмала; в пробирке № 6 сок кипятят, охлаждают и
добавляют 2 мл вареного крахмала; в пробирку № 7 вносят 0,3 мл
желчи и 2 мл растительного масла, а в № 8 — 2 мл растительного
масла; в пробирке № 9 сок кипятят и добавляют 0,3 мл желчи и
2 мл растительного масла. При кипячении ферменты сока
разрушаются. Все пробирки помещают на 30 мин в термостат или
водяную баню при 38...40 °С. По истечении этого времени пробирки
извлекают, охлаждают, ставят реакции с содержимым пробирок
на наличие в них продуктов гидролиза.
В пробирки № 1, 2, 3 добавляют бромную воду, которая в
присутствии аминокислот (триптофана) приобретает
красновато-фиолетовый цвет; отсутствие окрашивания указывает на то, что
фибрин не переваривается. В пробирки № 4, 5, 6 добавляют по
1...2 капли раствора Люголя и определяют присутствие крахмала
(синее окрашивание). Содержимое пробирок № 7, 8 и 9 титруют
0,01 н. раствором NaOH в присутствии индикатора
фенолфталеина и по количеству раствора, пошедшего на титрование каждой
193
пробы, судят о липолитической активности поджелудочного сока.
Раствор NaOH нейтрализует продукты гидролиза — жирные
кислоты: о завершении нейтрализации судят по появлению розового
окрашивания, которое дает фенолфталеин. После этого
записывают результаты и делают заключение о ферментативной
активности поджелудочного сока, об условиях, в которых проявляют свое
действие ферменты на белки, углеводы и жиры.
IV. Исследование выделения желчи.
Желчеобразовательная деятельность печени заключается в
образовании и выделении желчи печеночными клетками.
Поступление желчи в желчный пузырь, накопление и выведение ее из
последнего в двенадцатиперстную кишку в связи с пищеварением
обеспечивается желчевыделительным аппаратом, включающим в
себя желчные протоки (правый и левый печеночные протоки,
общий печеночный проток, пузырный проток, приводящий и
отводящий желчь из желчного пузыря, и желчный проток,
формирующийся путем соединения общего печеночного и пузырного
протоков, имеющий сфинктер при впадении в двенадцатиперстную
кишку) и желчный пузырь.
Исследование проводят на животных (собака, теленок) с
изолированным отрезком двенадцатиперстной кишки и
открывающимся в него желчным протоком, фистулой двенадцатиперстной
кишки, фистулой желчного пузыря (при этом используют и
канюли с двумя внутренними ходами, один из которых вставляется в
отрезок двенадцатиперстной кишки, а другой — в каудальную
часть двенадцатиперстной кишки).
1. Для определения закономерностей желчевыделения на
принятый корм животное натощак ставят в станок, снимают внешний
анастомоз, а канюлю двенадцатиперстной кишки закрывают
пробкой со стеклянной трубкой, соединенной с помощью
резиновой трубки с воронкой (воронку фиксируют на станке). К канюле,
вставленной в изолированный участок кишки, подвешивают
колбочку и в течение 30 мин собирают выделяющуюся желчь,
учитывая ее количество за 10-минутные интервалы. Затем животному
скармливают молоко (200...300 мл собаке, 1л теленку) и
продолжают наблюдение за количеством выделяющейся желчи в течение
4...5 ч. Определяют скрытый период возбуждения секреторного
аппарата печени. Полученную желчь вливают через воронку,
соединенную с фистулой кишечника.
Одновременно (или отдельно) можно исследовать движения
желчного пузыря в связи с пищеварением. Для этого животному в
желчный пузырь через фистулу вставляют баллончик,
соединенный с капсулой Марея. Движения пузыря регистрируются на
кимографе. Для регистрации движения желчного пузыря можно
использовать аппарат ЭИД-1.
194
Для выяснения механизма возбуждения и регуляции исследуют
желчевыделение у животного на поддразнивание в течение 5 мин
кормом (возбуждение по типу условного рефлекса), на введение
раствора соляной кислоты в двенадцатиперстную кишку.
Если подопытное животное имеет и фистулу желудка, то
исследуют желчевыделение и на мнимое кормление (возбуждение
по типу безусловного рефлекса с вкусовых рецепторов), на
введение корма непосредственно в желудок (желудочная и
кишечная рефлекторно-гуморальные фазы возбуждения), на
раздражение механорецепторов желудка введенным в него баллоном
(см. «Исследование секреторной деятельности поджелудочной
железы»).
Большую роль в возбуждении и регуляции
желчевыделительного аппарата играют рефлекторно-гуморальные (с участием
гормона панкреозимина) влияния с рецепторов кишечника,
воспринимающих состав химуса.
У животного определяют в течение трех 10-минутных
интервалов исходный фон желчевыделения, а затем через воронку,
соединенную с фистулой кишечника, вводят подогретый до
38 °С 0,3%-ный раствор НС1 (50 мл собаке, 200 мл теленку).
Продолжают собирать и учитывать объем выделяющейся желчи в
течение 1 ч.
2. Определение закономерностей желчеобразования и
механизма приспособления желчеобразования к меняющимся условиям в
связи с пищеварением проводят на животных в тех же условиях
(дача корма, поддразнивание кормом, введение корма
непосредственно в желудок, раздражение механорецепторов желудка
введением в его полость баллона, введение в двенадцатиперстную
кишку раствора НС1, введение в кровь секретина), но при этом
учитывают объем желчи, поступающей как из общего желчного
протока, так из желчного пузыря через фистулу.
Участие блуждающих и чревных нервов в механизме регуляции
желчеобразовательной деятельности печени и желчевыделения
определяют путем временного выключения их новокаиновой
блокадой с последующими функциональными нагрузками (дача
корма, введение корма в желудок, раздражение рецепторов желудка
введенным в его полость баллоном, введение раствора НС1 в
двенадцатиперстную кишку) и учетом объема образующейся и
выделившейся желчи. По полученным данным о количестве
выделенной желчи во всех исследованиях составляют графики. По
графику описывают закономерности секреторной деятельности печени
и двигательной деятельности желчевыделительного аппарата на
принятый корм (молоко). Отмечают, чем и почему отличаются
желчеобразование и желчевыделение на принятый корм и на
введенный непосредственно в желудок, а также силу и про-
195
должительность ответных реакций секреторных клеток печени и
желчевыделительного аппарата на поддразнивание животного
кормом и на введение раствора соляной кислоты в
двенадцатиперстную кишку. Указывают характер и степень изменений
образования и выделения желчи в условиях новокаиновой блокады
блуждающих и чревных нервов. Делают заключение о механизме
возбуждения и регуляции деятельности секреторных клеток
печени и желчевыделительного аппарата. Рисуют общую схему
механизмов регуляции образования и выделения желчи.
V. Исследование состава желчи и ее роли в пищеварении.
Наличие желчных кислот и желчных пигментов в желчи, а
также пищеварительную роль желчи определяют с помощью простых
реакций и способов.
Подготавливают свежую желчь, штатив с пробирками,
воронки, пипетки, бумажные фильтры, растительное масло, 20%-ный
раствор сахарозы, серную кислоту, смесь азотной и азотистой
кислот, лупы, предметные стекла, воду, часовые стекла, стеклянные
палочки.
1. Для определения желчных кислот в желчи часовое стекло
ставят на белую бумагу, пипеткой наносят на него 2 капли желчи и
2 капли 20%-ного раствора сахарозы, перемешивают их
стеклянной палочкой. Затем на часовое стекло по краям жидкости
добавляют 3...4 капли серной кислоты. На месте слияния капель
появляется розовая окраска, переходящая при стоянии в красную и
красно-фиолетовую. Эту окраску дает оксиметилфурфурол,
который образуется из фруктозы в присутствии серной кислоты,
взаимодействуя с желчными кислотами.
2. Для определения пигмента билирубина берут пробирку и
наливают в нее 2 мл смеси концентрированной азотной и азотистой
кислот, затем осторожно пипеткой наслаивают 1 мл желчи. На
границе жидкостей появляются кольца желтого, красного,
фиолетового, синего и зеленого цвета (соответствуют разной степени
окисления билирубина). Эту реакцию можно проделать на
фильтровальной бумаге. На бумагу наносят желчь, а затем в середину
несколько капель смеси кислот. Вокруг кислоты возникают
кольца разной окраски.
3. Для определения характера влияния желчи на жиры на
предметное стекло в разных местах наносят каплю дистиллированной
воды и каплю желчи. К каждой капле добавляют по капле
растительного масла, перемешивают и рассматривают содержимое
обеих капель под лупой. Желчь и воду с растительным маслом в
равных соотношениях можно взболтать в пробирках. Обращают
внимание на наличие жировой эмульсии. Делают заключение о
влиянии желчи на жиры.
При изучении ферментативной активности поджелудочного
196
сока отмечают роль желчи в активации ферментов
поджелудочного сока, а также в кишечном пищеварении.
VI. Исследование секреторной деятельности кишечных желез.
Под исследованием секреторной деятельности кишечных
желез понимают совокупность процессов образования и выделения
кишечного сока.
Исследование проводят на животных с изолированными
отрезками кишечника (см. рис. 43). Определяют закономерности
секреторной деятельности на принятый корм, на местные механические
(введение в отрезок кишки резинового катетера на 1 ч) и химические
(введение в изолированную петлю 0,3%-ного раствора соляной
кислоты на 10 мин) воздействия на слизистую оболочку кишечника.
По полученным данным о количестве выделившегося
кишечного сока за 30-минутные интервалы строят графики. Описывают
закономерности секреторной деятельности кишечника в связи с
пищеварением. По графикам делают заключение о роли в
приспособительной секреторной реакции кишечника на принятый корм
рефлекторно-гормональных влияний с вкусовых, зрительных и
обонятельных рецепторов, с механо- и хеморецепторов желудка и
кишечника.
VII. Исследование ферментативных свойств кишечного сока.
Исследуют собранный натуральный кишечный сок.
Подготавливают термостат или водяную баню, штативы с пробирками, пипетки,
3%-ный раствор пептона, 5%-ный раствор сахарозы, кусочки
фибрина, спиртовки, бромную воду (4%-ный раствор брома в воде).
1. Для определения особенностей протеолитического действия
кишечного сока нумеруют 3 пробирки и в каждую наливают по
2 мл кишечного сока. В пробирку № 1 добавляют 2 мл 3%-ного
раствора пептона; в пробирке № 2 сок кипятят, охлаждают и затем
добавляют 2 мл 3%-ного раствора пептона; в пробирку № 3 вносят
кусочек фибрина. Все пробирки помещают в термостат или
водяную баню на 45 мин при 39 °С. Далее в каждую из них прибавляют
по 10 капель бромной воды: при наличии аминокислот
содержимое приобретает розовое окрашивание. По результатам делают
заключение об особенности ферментативного действия
кишечного сока на белки. Объясняют отмеченную особенность.
2. Для определения гидролитического действия кишечного
сока на дисахариды в 2 пробирки наливают по 2 мл кишечного
сока: в одну добавляют 3 мл 5%-ной сахарозы, сок в другой
пробирке кипятят, охлаждают и добавляют в нее также 3 мл 5%-ной
сахарозы. Пробирки ставят в термостат на 30 мин при 39 °С. После
этого в содержимое каждой из них добавляют реактивы пробы
Троммера (на глюкозу). По результатам исследований делают
заключение о присутствии в кишечном соке фруктофуронидазы,
расщепляющей сахарозу.
197
Занятие 31. Исследование пристеночного пищеварения
в кишечнике
В тонкой кишке, а также в преджелудках гидролиз питательных
веществ происходит непосредственно на поверхности клеток
слизистой оболочки. Такое пищеварение называют пристеночным,
контактным или мембранным.
Цель занятия. Уяснить, как происходит ферментативное
расщепление питательных веществ пищеварительными соками.
Объект исследования, материалы и оборудование. 1. Свежие
кусочки тонкого кишечника только что убитых животных (крыс,
кроликов, птиц и др.). 2. Рисунки и схемы по теме. 3. 1%-ный
раствор сахарозы, раствор Рингера, реактивы для пробы Троммера;
пипетки, термостат, ванночки, лед, наборы хирургических
инструментов.
Выполнение работы. Из стенки тощей кишки подготавливают
5 кусочков площадью примерно 1 см2. В пробирку наливают 32 мл
раствора Рингера, опускают все 5 кусочков и инкубируют 10 мин в
термостате при 38 °С. В 10 пробирок наливают по Змл 5%-ной
сахарозы и по 1 мл инкубированного раствора. В пробирки
№6...10 опускают по кусочку отмытой тонкой кишки. Все
пробирки ставят в термостат при 38 °С. Извлекают по одной пробирке
с кусочком кишки и без него каждые 3 мин, охлаждают. С
содержимым пробирок проводят пробы Троммера на наличие глюкозы.
Обращают внимание, в каких пробирках (с кусочком кишки и без
него) наблюдается раньше выраженная положительная реакция
при проведении пробы Троммера. Если будут различия, то
объясняют, с чем они связаны.
Занятие 32. Исследование всасывательной деятельности
кишечника
Наиболее распространенные методы исследования кишечного
всасывания основаны на введении в кишечник на какое-то время
определенного вещества с последующим определением
параметров его содержания (уменьшение или увеличение) в крови и
моче. Быстро можно определить всасывание глюкозы, натрия,
жира.
Цель занятия. Уяснить, что всасывание продуктов гидролиза
питательных веществ, воды и др. происходит из полости
кишечника.
Объект исследования, материалы и оборудование. 1. Животные
(собака, свинья, овца) с фистулой изолированного участка
кишечника, кролик или курица. 2. Рисунки и схемы по теме. 3. Установ-
198
ка для изучения всасывательной деятельности кишечника
(бюретка, резиновые трубки, тройник, зажим, пробка со стеклянной
трубкой, проходящей через нее); 0,9%-ный раствор поваренной
соли; 1%-ный раствор глюкозы; набор реактивов для определения
содержания глюкозы в растворе с использованием
фотоколориметра; пламенный фотометр; хирургический набор,
операционный столик; оливковое масло, эфир, шприцы, иглы.
Выполнение работы.
I. Определение всасывания глюкозы и натрия в кишечнике.
Животное с фистулой изолированного участка кишечника
натощак ставят в станок. В фистульную трубку вставляют пробку,
сквозь которую пропущена стеклянная трубка, соединенная
резиновыми трубками через тройник с бюреткой. В изолированный
участок кишки вводят через бюретку 1%-ный раствор глюкозы
(38 °С), чтобы он заполнил отрезок кишки и выступал в бюретку
не менее чем на 20...25 см (над уровнем нижней поверхности
брюха). Заметив положение мениска жидкости в бюретке,
наблюдают за всасыванием в течение 30 мин. После этого через
боковой отросток тройника выливают из кишки весь невсосавшийся
раствор. По разности объема раствора в начале и в конце
наблюдения определяют параметры всасывания раствора. Затем
определяют в невсосавшейся части раствора содержание глюкозы.
Высчитывают абсолютное массовое количество глюкозы, которое
всосалось в кишечнике.
Таким же образом устанавливают параметры всасывания
0,9%-ного раствора NaCl и натрия. Определение натрия в 0,9%-
ном растворе NaCl и в растворе, извлеченном из кишечника в
конце наблюдения за процессом всасывания, проводят на
пламенном фотометре. Пользуясь стандартной кривой,
высчитывают абсолютное массовое количество натрия, которое всосалось
через стенку кишки.
П. Всасывание жира в кишечнике.
Анестезированного кролика (40 мг/кг нембутала внутрибрю-
шинно) или курицу фиксируют на операционном столике в
положении на спине и вскрывают брюшную полость, предварительно
подготовив операционное поле, выстригая (или раздвигая)
шерстный (перьевой) покров в этой области. Извлекают петлю тонкого
кишечника, расположенную ближе к двенадцатиперстной кишке,
и вводят в нее 30...50 мл оливкового масла в смеси с эфиром
(30 %). В течение 20...30 мин наблюдают за изменениями сосудов
брыжейки, периодически извлекая петли кишки из брюшной
полости. О всасывании жира судят по появлению обширной сети как
бы налитых молоком, контрастно выделяющихся лимфатических
сосудов. Результаты исследований заносят в тетрадь и делают
заключение о всасывательной деятельности кишечника.
199
Контрольные вопросы и задания. 1. Какие пищеварительные органы образуют
пищеварительный аппарат (структура этих органов и особенности преджелудков у
жвачных)? 2. Назовите методы изучения функций органов пищеварения. 3. В чем
заключаются особенности приема корма и воды у сельскохозяйственных
животных различных видов? 4. Как осуществляются пережевывание и проглатывание
корма? 5. Каковы виды и физиологическая роль сокращений желудка и
кишечника у жвачных? 6. Как осуществляется жвачный процесс у животных? 7. Каков
состав слюны у жвачных? 8. Каков состав желудочного, поджелудочного и
кишечного соков? 9. На какие питательные вещества, при какой реакции среды действует
каждый отдельный фермент секретов пищеварительных желез и до каких
продуктов расщепляет их? 10. В чем особенности полостного и пристеночного
пищеварения? 11. Как происходит расщепление клетчатки, крахмала, Сахаров, белков и ли-
пидов в рубце жвачных? 12. Как осуществляется процесс пищеварения в толстой
кишке у лошадей? 13. Как происходит всасывание продуктов расщепления
углеводов, белков, липидов в пищеварительном тракте; каков механизм всасывания?
14. Как происходит всасывание воды и минеральных веществ в пищеварительном
тракте? 15. Назовите особенности пищеварения у сельскохозяйственной птицы.
5.12. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ.
ТЕРМОРЕГУЛЯЦИЯ
Обмен веществ и энергии — совокупность процессов
превращения веществ и энергии, происходящих в живых организмах, и
обмен веществами и энергией между организмом и окружающей
средой. Обмен веществ и энергии обеспечивается согласованной
деятельностью всех систем организма, определяющих прием
корма и воды, гидролиз питательных веществ и освобождение
минеральных веществ и витаминов корма, всасывание, распределение,
превращение и использование этих веществ, освобождение и
использование энергии принятых питательных веществ,
поддержание определенных концентраций обменных веществ в крови и
тканях, определенной температуры тела, а также выведение из
организма непереваренных и невсосавшихся веществ, отдачу в
окружающую среду образующейся тепловой энергии.
Обмен веществ и энергии включает четыре основные
приспособительные реакции: 1) извлечение энергии из окружающей
среды и преобразование ее в энергию высокоэргических
соединений в количестве, достаточном для обеспечения всех
энергетических потребностей организма; 2) образование из экзогенных
веществ промежуточных соединений, являющихся
предшественниками макромолекулярных компонентов клеток; 3) синтез
белков, нуклеиновых кислот, углеводов, липидов, комплексных
соединений из этих предшественников в клетках; 4) синтез и
разрушение специальных биомолекул, образование и распад
которых в клетках связаны с выполнением различных специфических
функций.
В обмене веществ и энергии участвует множество ферментных
200
систем. Приспособление его к меняющимся условиям
обеспечивается сложнейшей регуляцией на различных уровнях.
Занятие 33. Определение физиологической роли белков,
жиров, углеводов, аминокислот, жирных кислот, глюкозы,
летучих жирных кислот
Цель занятия. Изучить роль белков, жиров и углеводов в
жизнедеятельности; транспорт их с кровью; поступление в клетки
тканей для обновления структур и как источник энергии, для синтеза
биологически активных веществ; что превращение белков, жиров
и углеводов осуществляется по определенным закономерностям.
Объект исследования, материалы и оборудование. 1. Овца,
собака, кролик, белые крысы. 2. Рисунки и схемы по теме. 3.
Рефрактометр; пипетки с тонким оттянутым концом; дистиллированная
вода; ФЭК; набор пробирок, набор химических реактивов для
определения глюкозы в биологических жидкостях о-толуидиновым
методом, который включает реактивы: 1) о-толуидиновый реактив
(состоит из 8%-ного раствора о-толуидина в 80%-ной уксусной
кислоте, стабилизирован тиомочевиной и щавелевой кислотой);
2) кислота трихлоруксусная (приготовление 3%-ного раствора
ТХУ кислоты — 3,0 г ТХУ количественно перенести в мензурку и
довести дистиллированной водой до объема 100 мл); 3)
калибровочный раствор глюкозы (500 мг/100 мл).
Выполнение работы.
I. Определение белкового обменного профиля у животного.
Белковый обменный профиль у животных определяют по
содержанию общего белка и белковых фракций в крови: после
голодания в течение 16... 18 ч и через З...4ч после кормления.
Белки являются высокомолекулярными соединениями. В их
состав входят более 20 видов аминокислот, соединенных между
собой пептидной связью (СО—NH). Плазма крови в норме
содержит более 100 видов белков. Примерно 90 % общего белка
составляют альбумины, иммуноглобулины, липопротеиды, фибриноген,
трансферин; другие белки присутствуют в небольших количествах.
В биологических жидкостях определяют общий белок, фракции
белков, близкие по физиологическим и химическим свойствам, и
индивидуальные белки. Методы определения общего белка в
сыворотке крови основаны на различных принципах: азотометрические,
весовые, спектрофотометрические, фотометрические,
рефрактометрические. Наиболее распространены рефрактометрические и
фотометрические биуретовые методы.
Унифицированный рефрактометрический
метод определения общего белка в сыворотке
крови. Для работы необходимо знать устройство рефрактометра.
201
Принцип метода основан на определении с помощью
рефрактометра коэффициентов рефракции, или преломления света. В
сыворотке крови величина рефракции в первую очередь зависит от
содержания белков; другим составным частям принадлежит меньшая роль.
Практически коэффициент преломления сыворотки довольно точно
свидетельствует о количественном содержании в ней белка.
Перед началом работы рефрактометр должен быть проверен на
правильность установки на нуль. Для этого пипеткой с тонким
оттянутым концом наносят несколько капель дистиллированной
воды на нижнюю измерительную призму камеры и осторожно
прикрывают верхней призмой: наблюдая в окуляр, устанавливают
прибор на нуль. Для исследования получают сыворотку крови от
животного. Для определения общего белка 1...2 капли сыворотки
крови наносят на измерительную призму камеры, при хорошо
освещенном поле зрения устанавливают контрастность границы
светотени и проводят отсчет по шкале с прибавлением отсчета по
лимбу. Полученные данные переводят по таблице Рейса в
показатели преломления и далее определяют процентное содержание
белка.
Пересчет показателей рефрактометра РПЛ-2 на показатель преломления
и содержание белка (по Рейсу)
Отсчет
о шкале
24,0
1
2
3
4
5
6
7
8
9
25,0
1
2
3
4
5
6
7
8
9
26,0
1
2
3
4
Показатель
преломления
1,34483
1,31488
1,34493
1,34498
1,34503
1,34508
1,34512
1,34517
1,34522
1,34527
1,34532
1,34537
1,34542
1,34547
1,34552
1,34557
1,34561
1,34566
1,34571
1,34576
1,34581
1,34586
1,34591
1,34596
1,34601
Kpttov %
JJCJ1U14., /О
5,030
070
ПО
150
190
230
270
310
350
390
430
470
496
523
549
575
601
627
654
680
711
743
774
806
837
Отсчет
по шкале
26,5
6
7
8
9
27,0
1
2
3
4
5
6
7
8
9
28,0
1
2
3
4
5
6
7
8
9
Показатель
преломления
1,34606
1,34610
1,34615
1,34620
1,34625
1,34630
1,34635
1,34640
1,34644
1,34649
1,34654
1,34657
1,34664
1,34668
1,34673
1,34678
1,34683
1,34688
1,34692
1,34697
1,34702
1,34707
1,34712
1,34716
1,34720
T-»PrrOV Qn
JJCJIUiN., /О
5,868
900
928
955
983
6,010
038
065
093
120
148
175
203
230
258
285
313
340
366
394
420
446
472
499
528
202
Продолжение
Отсчет
о шкале
29,0
1
2
3
4
5
6
7
8
9
30,0
1
2
3
4
5
6
7
8
9
31,0
1
2
3
4
5
6
7
8
9
32,0
1
2
3
4
5
6
7
8
9
33,0
1
2
3
4
5
6
7
8
9
34,0
1
Показатель
преломления
1,34726
1,34732
1,34736
1,34740
1,34745
1,34750
1,34755
1,34760
1,34764
1,34769
1,34774
1,34779
1,34784
1,34788
1,34793
1,34798
1,34803
1,34808
1,34812
1,34817
1,34822
1,34827
1,34832
1,34836
1,34841
1,34846
1,34851
1,34856
1,34860
1,34865
1,34870
1,34875
1,34880
1,34884
1,3488
1,34894
1,34899
1,34904
1,34908
1,34913
1,34918
1,34923
1,34928
1,34932
1,34937
1,34942
1,34947
1,34952
1,34956
1,34961
1,34966
1,34971
Белок, %
6,580
581
613
644
676
707
770
793
796
823
849
875
901
928
954
980
7,008
035
063
090
118
145
173
200
231
263
294
326
357
388
420
443
467
490
513
537
560
583
606
630
661
693
724
756
787
818
850
876
903
929
955
981
1 Отсчет
1 по шкале
34,2
3
4
5
6
7
8
9
35,0
1
2
3
4
5
6
7
8
9
36,0
1
2
3
4
5
6
7
8
9
37,0
1
2
3
4
5
6
7
8
9
38,0
1
2
3
4
5
6
7
8
9
39,0
1
2
3
Показатель
преломления
1,34976
1,34980
1,34985
1,34990
1,34995
1,35000
1,35004
1,35009
1,35014
1,35019
1,35024
1,35028
1,35033
1,35038
1,35043
1,35048
1,35052
1,35057
1,35062
1,35067
1,35072
1,35077
1,35082
1,35087
1,35091
1,35096
1,35101
1,35106
1,35111
1,35116
1,35120
1,35125
1,35130
1,35135
1,35139
1,35144
1,35149
1,35153
1,35158
1,35163
1,35168
1,35172
1,35177
1,35182
1,35187
1,35192
1,35196
1,35201
1,35206
1,35211
1,35216
1,35220
Белок, %
8,009
035
060
091
123
154
186
217
248
280
306
333
359
385
411
438
464
490
518
545
573
600
628
655
683
710
740^
770
800
830
860
890
920
948
975
9,003
030
058
085
113
140
166
193
219
245
271
297
324
350
378
405
433
203
Продолжение
Отсчет
по шкале
39,4
5
6
7
8
9
40,0
1
2
3
4
5
6
Показатель
преломления
1,35225
1,35230
1,35235
1,35240
1,35244
1,35249
1,35254
1,35259
1,35264
1,35268
1,35273
1,35278
1,35283
Крипта %
Uwl\JI4.9 /U
9,460
490
515
543
570
600
630
660
690
720
750
780
807
Отсчет ]
1 по шкале
40,7
8
9
41,0
1
2
3
4
5
6
7
8
9
Показатель
преломления
1,35288
1,35292
1,35297
1,35302
1,35307
1,35312
1,35316
1,35321
1,35326
1,35331
1,35336
1,35340
1,35345
КрППк' %
UCJIV7I4., /О
9,833
859
885
911
938
964
990
10,020
060
080
ПО
140
170
И. Определение углеводного обменного профиля у животного.
Углеводный обменный профиль у животного определяют по
содержанию глюкозы в крови после голодания в течение 16... 18 ч
и через З...4ч после кормления. Делают заключение о
физиологической роли углеводов, глюкозы, жирных кислот.
Более 90 % всех растворимых низкомолекулярных углеводов
крови приходится на глюкозу; в небольших количествах могут
присутствовать фруктоза и пентозы. У жвачных животных в крови
большое количество летучих жирных кислот. Глюкоза
распределена почти равномерно между плазмой и эритроцитами, поэтому
для ее определения с равным успехом можно использовать
цельную кровь, плазму или сыворотку.
Методы определения глюкозы разделяют на 3 группы:
ферментативные, редуктометрические и с использованием цветных
реакций. Наиболее часто применяют методы последней группы,
которые основаны на цветных реакциях с продуктами,
образующимися при нагревании углеводов с кислотами. Наибольшее значение
имеет ортотолуидиновый метод.
Метод определения глюкозы в биологических
жидкостях ортотолуидиновым методом. Глюкоза
при нагревании с ортотолуидином в растворе уксусной кислоты
дает окрашивание, интенсивность которого пропорциональна
концентрации глюкозы.
Для исследования надо взять кровь, подготовить водяную
баню, ФЭК, набор пробирок.
Опытная проба. В пробирку вносят 0,9 мл 3%-ной три-
хлоруксусной кислоты и выдувают в нее 0,1 мл крови (или
сыворотки). Центрифугируют. К 0,5 мл центрифугата добавляют
4,5 мл о-толуидинового реактива. Пробирку помещают в
непрерывно кипящую водяную баню на 8 мин (точно). Пробирку вы-
204
нимают и сразу охлаждают под струей водопроводной воды до
комнатной температуры. Измеряют на ФЭКе при длине волны
590...650нм (оранжевый или красный светофильтр) в кювете с
толщиной слоя 1 см против холостой пробы (контроля).
Холостая проба. 0,5 мл трихлоруксусной кислоты, 4,5 мл о-то-
луидинового реактива.
Калибровочная проба. Калибровочные пробы ставят, как
опытные: вместо сыворотки берут калибровочный раствор глюкозы с
концентрацией 100 мг% (300 или 500 мг% в случае высокого
содержания сахара в крови).
Приготовление рабочих калибровочных растворов
Рабочий
калибровочный раствор,
№ пробы
Основной
калибровочный
раствор 500 мг%, мл
Дистиллированная
вода, мл
Концентрация
глюкозы, мг%
1 5 0 500
2 3 2 300
3 1 4 100
Расчет ведут по формуле
С —С оп
^ОП ^СТ гу 5
^СТ
где Соп — концентрация глюкозы в опытной пробе, мг%; Сст — концентрация
глюкозы в калибровочном растворе, мг%; Е0П — оптическая плотность опытной
пробы; £ст — оптическая плотность калибровочной пробы.
Примечания: 1. Калибровочный график строить не следует, так как
интенсивность окраски проб зависит от условий опыта. Правильнее отрабатывать
стандартные пробы одновременно с опытными и вести расчет по формуле.
2. Наличие белка в моче на определение глюкозы не влияет.
3. Прямолинейная зависимость между оптической плотностью и
концентрацией глюкозы сохраняется до 300 мг%.
III. Определение липидного обменного профиля у животного.
Обменный липидный профиль у животного определяют по
содержанию общих липидов, жирных кислот, холестерина в крови
после голодания в течение 16...18 ч и через З...4ч после кормления.
Занятие 34. Определение физиологической роли макро-
и микроэлементов, воды, витаминов
Минеральные вещества, витамины и вода необходимы для
жизнедеятельности, катаболизма и анаболизма в клетках, тканях и
органах. Всосавшиеся макро- и микроэлементы, витамины, вода с
205
кровью разносятся по всему организму, поступают в клетки
тканей, где и используются, пополняют убыль их в крови.
Существуют закономерности поддержания оптимальных для метаболизма
концентраций минеральных веществ в крови, концентрации
витаминов в крови и тканях, оптимального количества внеклеточной
воды.
Цель занятия. Уяснить физиологическую роль микро- и
макроэлементов, воды и витаминов для жизнедеятельности.
Объект исследования, материалы и оборудование. 1. Овца, собака
с фистулой кишечника, белые крысы, морские свинки. 2.
Рисунки, таблицы, диаграммы и схемы по теме. 3. Пламенный
фотометр; калибровочные растворы для натрия и калия; центрифуга;
набор пробирок, мерных цилиндров, колб; лимонный сок;
растворы: красной кровяной соли, хлорида железа; молоко;
дистиллированная вода; 0,001 н. раствор 2,6-дихлорфенолиндофенола; колбы,
стаканчики, автоклав, фарфоровые чашки; рыбий жир,
хлороформ, бром в хлороформе; витамины С и D.
Выполнение работы.
I. Определение обменного профиля натрия и калия у животных.
Необходимо определить содержание натрия и калия в крови у
животного в норме и после дачи или введения через фистулу в
кишечник растворов их солей, для чего используют одинаковые
физические принципы.
Для определения содержания натрия и калия в сыворотке и
плазме крови применяют унифицированный метод
пламенной фотометрии. Разведенная водой плазма или
сыворотка крови распыляется и в виде мельчайших капелек
(аэрозоля) с током воздуха поступает в пламя газовой горелки. Калий
окрашивает пламя в слабый красно-фиолетовый цвет, а натрий —
в ярко-желтый. Интенсивность окраски измеряется
фотоэлементом. Концентрация калия в плазме невелика, поэтому
окрашивание слабее, натрия в плазме много — окрашивание яркое.
1. Вначале приготавливают калибровочные растворы из
солей натрия и калия, высушенных при 100... 180 °С. При
построении калибровочного графика из основного раствора готовят
рабочие калибровочные растворы путем разведения водой во
столько же раз, во сколько разводят исследуемую плазму или
сыворотку.
2. Плазму получают (путем центрифугирования в течение
15 мин при частоте вращения 3000 мин-1) не позднее чем через
45...60 мин после взятия крови, чтобы избежать гемолиза.
3. Для определения калия исследуемую плазму разводят водой
обычно в 20 раз, а для определения натрия — в 100 раз, но
разведения могут быть и другими в зависимости от чувствительности
прибора.
206
4. Определение начинают с того, что вначале сжигают серию
калибровочных растворов, а затем исследуемые пробы.
5. Расчет ведут по калибровочному графику: содержание
натрия и калия выражают в ммоль/л крови.
II. Определение роли витамина С (аскорбиновой кислоты) и
витамина D (кальциферолов) в обмене веществ.
Витамины служат биокатализаторами отдельных
биохимических и физиологических процессов; обладают высокой
биологической активностью. В растениях витамины находятся в виде
комплексных соединений с белками и другими веществами. У
животных в процессе пищеварения освобождается и усваивается
25...50 % витаминов.
В целях определения участия витаминов в обмене веществ
предлагается при решении задачи определить содержание
некоторых витаминов в кормах, а затем наблюдать за животными,
которым эти витамины не давались с кормом.
1. Определение витамина С. Витамин С (аскорбиновая
кислота) содержится в растительных кормах, молозиве, молоке.
Опыт 1. В пробирку внести 4...5 капель лимонного сока,
добавить 1 каплю раствора красной кровяной соли (железосинеродис-
тый калий) и 1 каплю хлорного железа. При наличии аскорбиновой
кислоты жидкость окрашивается в синий или зеленый цвет, позже
появляется осадок берлинской лазури.
Опыт 2. К 5 мл молока добавить 10мл дистиллированной
воды. В два стаканчика внести по 5 мл этой смеси, 9 мл
дистиллированной воды, 1 мл 2%-ного раствора соляной кислоты и
перемешать. Титровать с помощью микробюретки 0,001 н.
раствором 2,6-дихлорфенолиндофенола до появления слабо-розового
цвета, не исчезающего в течение 1 мин.
Количество витамина С рассчитывают по формуле
X=A-K-5,2S,
где ^—количество витамина С, мг%; А — количество 0,001 н. раствора
2,6-дихлорфенолиндофенола, израсходованного на титрование молока, мл; К—
поправка к титру индикатора (обычно она равна 1,333); 5,28 — постоянный
коэффициент.
Экспериментальный С-авитаминоз можно вызвать у морских
свинок. Морские свинки — удобный объект исследования, так как
не способны синтезировать в организме аскорбиновую кислоту.
Формируют две группы из молодых морских свинок: I группе
дают корма, лишенные аскорбиновой кислоты (для этого корма
подвергают автоклавированию в течение 1...2ч при 120 °С);
II группе дают эти же корма, но без обработки автоклавировани-
ем. Свинок обеих групп взвешивают каждые 5 сут.
207
В I группе через 10... 15 сут после начала опыта отмечают
быстрое падение массы тела, у животных появляются первые
симптомы гиповитаминоза С (скорбута): кровоизлияния под кожей и в
других частях тела, дистрофия тканей, потеря аппетита, малая
подвижность, сгорбленная поза, потускнение шерсти. В более
поздние сроки С-авитаминоз проявляется гиперемией десен,
расшатыванием зубов, болезненностью и припухлостью суставов,
отеками, диареей. Смерть наступает через 25...30 сут.
При первых признаках С-авитаминоза начинают вводить
витамин С в состав рациона или парентерально (25...50 мг/сут).
2. Определение витамина D (кальциферолов). Витамин D
содержится в масле, молоке, рыбьем жире и других кормах.
Переходит в активную форму в коже под действием ультрафиолетового
излучения (УФИ).
В фарфоровую чашку вносят 1 каплю рыбьего жира и
растворяют ее в 1 мл хлороформа. Затем добавляют по каплям 0,25 мл
раствора брома в хлороформе. Чашку слегка наклоняют в
стороны. При наличии витамина D появляется синее
окрашивание.
Экспериментальный D-авитаминоз можно вызвать у крысят.
Формируют две группы из молодых животных массой 35...40 г.
Помещают их в темное помещение. I группе дают обычный корм,
II — корм в виде лепешек, приготовленных по рахитогенному
рецепту (пшеница — 33 %, кукуруза — 32, желатин — 15, пшеничный
глютин — 15, хлорид натрия — 1, карбонат кальция — 3 %;
приготовить тесто и выпечь лепешки). Один раз в неделю взвешивают
крысят обеих групп. Во II группе через 35...40 сут у животных
проявляются признаки D-авитаминоза (рахита): заметное отставание
в росте, затрудненное движение; на более поздней стадии —
прогрессирующая общая слабость, искривление грудной клетки,
бедер и голеней.
При первых признаках D-авитаминоза части крысят дают
корма с витамином D (рыбий жир) или масляный раствор витамина D
(5...10 тыс. МЕ/сут).
Занятие 35. Определение затрат энергии
по газообмену
Жизнедеятельность каждой клетки организма, поддержание ее
структурной организации обеспечиваются благодаря
непрерывному использованию энергии.
Клетки организма относят к гетеротрофным: они получают
высокомолекулярные питательные вещества — белки, жиры и
углеводы, в которых аккумулирована солнечная энергия. Энергия этих
208
веществ освобождается в организме в процессе их окисления.
Ценность корма примерно на 50 % обусловливается содержанием
в нем энергии. Обычные корма содержат приблизительно 4,4 ккал
(18,4 кДж) в 1 кг сухого вещества корма (соотношение с единицей
СИ: 1 ккал = 4,19 кДж). При превращении в организме 1 г
углеводов корма дает 4,1 ккал (17,16 кДж), 1 г жиров —9,3 (38,94 кДж) и
1 г белков —4,1 ккал (17,16 кДж).
Вся используемая организмом энергия в конечном счете
превращается в тепловую. Таким образом, о затратах энергии можно
судить по количеству теплоты, выделяемой организмом в единицу
времени. Единицей измерения количества теплоты служит джоуль
(Дж). Тепловая мощность, выраженная в ккал/ч, может быть
переведена в ватты (единица тепловой мощности) в соответствии с
соотношением 1 ккал/ч =1,163 Дж/ч = 1,163 Вт.
Измерить количество освобождающейся в организме энергии
можно путем прямой калориметрии в специальных камерах. Но
чаще используют методы непрямой калориметрии, при которых
показателем теплопродукции служит количество поглощенного
кислорода и выделенного диоксида углерода, а точнее,
дыхательный коэффициент (отношение С02/02).
Цель занятия. Освоить методику определения обмена энергии у
животных, определить расход энергии.
Объект исследования, материалы и оборудование. 1. Лошадь,
корова, овца, свинья. 2. Рисунки и схемы по теме. 3. Маски
дыхательные; насос воздушный (НВ-500); счетчик объема воздуха (СВ-
600); мешки для выдыхаемого воздуха; ресивер; переключатель
воздухопроводов, набор воздухопроводов; оголовье для крепления
маски; воздухоприемники резиновые для отбора средней пробы
выдыхаемого воздуха; воздухоприемники (пипетки) стеклянные;
полуавтоматический газоанализатор (ПАГ-4) или аппарат Орса
или Холдена; секундомеры.
Выполнение работы. Животное ставят в станок, застегивают
шейный ремень оголовья и с помощью боковых и лобного
ремней укрепляют заранее собранную маску (рис. 45). Произведя
быструю проверку готовности к опыту, поставив счетчик НВ-500
на отметку «0», переводят клапан переключателя на ресивер.
Одновременно пускают секундомер. Ресивер начинает наполняться
выдыхаемым воздухом. Вращением ручного привода НВ-500
поддерживают ресивер в полунаполненном состоянии.
Одновременно следят за наполнением подключенного воздухоприемни-
ка, куда откачивается средняя проба для химического анализа.
Регистрируют частоту дыхания, пульса, температуру тела и
температуру в НВ-500, барометрическое давление. Точно через
10 мин опыт заканчивают, клапан переключателя ставят на
отметку «Атмосфера». Кран насоса средней пробы переставляют на
209
Рис. 45. Исследование обмена энергии у сельскохозяйственных животных масочным
методом:
Ли Б — дыхательные маски для лошади и крупного рогатого скота
второй воздухоприемник, а в первом закрывают стеклянный кран
и затем отделяют его от насоса.
Исследования позволяют получить следующие показатели:
объем легочной вентиляции (л/ч), частоту дыхания (мин), емкость
выдоха (л), концентрации С02 и 02 в выдыхаемом воздухе (%),
общий объем выдыхаемого С02 и потребленного 02 за опыт (л),
дыхательный коэффициент.
I. Определение минутного объема легочной вентиляции.
Объем собранного воздуха за 10 мин делят на число минут, в
течение которых забирался воздух. Приводят объем
выдохнутого воздуха за 1 мин к нормальным условиям, т. е. к объему,
который занимал бы этот воздух при 0 °С и барометрическом
давлении 760 мм рт. ст. По данным температуры воздуха и
атмосферного давления находят в таблице коэффициент поправки и
умножают на него величину объема выдыхаемого воздуха за
1 мин.
II. Анализ пробы воздуха помещения и выдыхаемого воздуха.
Содержание 02 и С02 в воздухе помещения и выдыхаемом
воздухе определяют на полуавтоматическом газоанализаторе или
аппарате Орса или Холдена (см. «Дыхание»).
Ввиду того что самостоятельное освоение техники газового
анализа на практических занятиях представляется
затруднительным, эта часть работы выполняется под руководством
преподавателя или лаборанта.
III. Вычисление потребления (поглощения) С>2за 1 мин.
Объем 02 во вдыхаемом за 1 мин воздухе рассчитывают по
объему вдыхаемого воздуха и процентному содержанию 02 в
атмосферном воздухе. Объем 02 в выдыхаемом за 1 мин воздухе
рассчитывают по объему выдыхаемого воздуха и проценту 02 в
210
выдыхаемом воздухе, полученному при анализе. По разности этих
величин определяют объем поглощения кислорода.
IV. Вычисление выделения С02 за 1 мин.
Расчет проводят аналогично вычислению поглощения
кислорода.
V. Расчет дыхательного коэффициента.
Это отношение объема выделенного С02 к объему
поглощенного 02.
VI. Определение соотношения окисляющихся в организме
углеводов и жиров (окислением белков можно пренебречь, при
использовании белков в качестве энергетического материала они
переходят преимущественно в углеводы).
По таблице (приложение 4) находят калорический эквивалент
1 л кислорода при установленном дыхательном коэффициенте.
Калорическим эквивалентом называют количество энергии,
вырабатываемой при окислении этих веществ на 1 л поглощенного
кислорода.
VII. Расчет расхода энергии животным за 1мин.
Умножают объем поглощенного 02 (л/мин) на калорический
эквивалент 1 л 02 (приложение 4). Далее можно узнать, сколько
энергии тратится животным в сутки, а также на 1 кг массы в 1 ч.
Пример. Исследован газообмен у овцы с массой тела 40 кг. За 10 мин
собрано 50 л воздуха. Состав выдыхаемого воздуха следующий, %: О2 — 16,9, ССЬ — 3,5,
N2 — 79,6. Температура воздуха во время исследований 19 °С, барометрическое
давление 748 мм рт. ст. Состав вдыхаемого (атмосферного) воздуха, %: 02 — 20,93,
СО2-0,03, N2-79,04.
Объем выдыхаемого воздуха за 1 мин = 50 л : 10 = 5 л. По таблице
(приложение 2) для данной температуры находим напряжение водяного пара, оно равно
16,32 мм рт. ст. Поэтому давление сухого воздуха будет равно 748 — 16,32 = 732. По
таблице (приложение 3) для данных температуры и давления сухого воздуха
коэффициент поправки равен 0,9005. Значит, выдыхаемый воздух в нормальных
условиях занял бы объем 5,0 • 0,9005 = 4,5 л. Объем вдыхаемого воздуха равен
проценту азота выдыхаемого воздуха, умноженному на объем выдыхаемого воздуха и
деленному на процент азота вдыхаемого воздуха: (100-16,9-3,5)4,5:79,04 =
= 4,53 л/мин.
Составляем пропорцию: в 100 л вдыхаемого воздуха 02 содержится 20,93 л, в
4,53 л вдыхаемого воздуха 02 содержится 0,948 л (4,53 - 20,93 : 100). В выдыхаемом
воздухе кислорода будет 0,76 л (4,5 - 16,9 : 100). Потребление кислорода составило
0,188 л/мин (0,948-0,76), а количество диоксида углерода во вдыхаемом
воздухе — 0,001 л (4,53 • 0,03 : 100). Количество диоксида углерода в выдыхаемом
воздухе равно 0,157л (4,5-3,5:100), отсюда выделение С02 0,157 - 0,001 =
= 0,156 л/мин.
Дыхательный коэффициент равен выделенному С02, деленному на
поглощенный 02, или 0,156:0,188 = 0,82. Калорический эквивалент 1л О? для данного
дыхательного коэффициента равен 20,201 кДж.
Расход энергии за 1 мин = 0,186 • 20,201 = 3,757 кДж/мин. Если
полученную цифру умножить на 1440 (минут в сутки), то расход энергии за сутки
составит 3,757 • 1440 = 5410,08 кДж, а на 1кг массы тела в 1ч —
3,757-60:40= 5,635 кДж.
211
Занятие 36. Исследование терморегуляции у животных
Температура тела — один из важнейших факторов,
определяющих обмен веществ, интенсивность роста и развития животных,
потому что определяет скорость химических реакций.
Температура тела животных поддерживается на относительно постоянном
уровне независимо от температуры окружающей среды и
находится в пределах 37,5...40,0 °С (у птиц — 40,5...43,0 °С). Такая
температура является оптимальной для ферментов тканей.
Поддержание температуры тела обеспечивают два основных
процесса: теплопродукция и теплоотдача. Теплопродукция
осуществляется во всех тканях организма в процессе окисления белков,
жиров и углеводов. Теплоотдача осуществляется в основном с
поверхности тела, кожи (температура которой определяется
состоянием сосудов), путем испарения пота и влаги со слизистых
органов дыхания.
Цель занятия. Освоить методику измерения температуры тела у
животных ртутным термометром и электротермометром;
исследовать влияние температуры окружающей среды и физической
нагрузки на температуру тела.
Объект исследования, материалы и оборудование. 1. Лягушки,
мыши, морские свинки, кролики, куры, овца, собака, лошадь.
2. Рисунки и схемы по теме. 3. Два набора стаканов, ветеринарные
термометры, электротермометр, вата, марля, вазелин,
лабораторные чашки, стеклянные банки, ванны, приборы для нагревания и
охлаждения воды, водяные термометры, пневмограф, тепловая
камера для животного, стерильные шприц и иглы, раствор
адреналина (1: 1000).
Выполнение работы.
I. Образование и отдача теплоты у теплокровных.
Чтобы убедиться в образовании и отдаче теплоты организмом,
берут 2 набора стаканов, по 2 стакана в каждом, причем один
стакан должен свободно входить в другой с просветом между ними
1 см. Во внешние стаканы наливают воду температурой 10 °С, в
нее опускают термометр. Во внутренний стакан первого набора
помещают 2 мыши. Второй набор оставляют для контроля. Через
30 мин определяют, как изменилась температура воды в стаканах.
II. Измерение температуры тела.
Температуру тела у животных измеряют термометром в прямой
кишке, у птиц — в клоаке. Используют ветеринарный термометр
или электротермометр. Вводят термометр в прямую кишку на
5 мин. Чтобы он не выпадал, его привязывают шелковой нитью к
зажиму, который укрепляют на волосяном покрове животного в
прилегающей области.
По результатам измерения делают заключение об образовании
212
теплоты в организме, постоянстве температуры тела. Отмечают,
одинаковая ли температура тела у животных различных видов.
III. Сравнительная оценка температуры тела у животного в
прямой кишке и кожи в различных областях тела (голова, спина,
конечности).
Исследование проводят на собаке, овце, свинье, корове или
лошади. Температуру в прямой кишке измеряют ветеринарным
ртутным термометром, а температуру различных областей —
электротермометром. Последний имеет датчик из
полупроводникового материала, сопротивление которого меняется в зависимости от
температуры, и измерительный агрегат, построенный по схеме
неравновесного моста. После включения и регулировки прибора
наконечник датчика прикладывают к исследуемой точке. Стрелка
гальванометра показывает температуру объекта в градусах (°С).
Сравнивают температуру в прямой кишке и кожи различных
областей тела у животного. Если показатели температуры
отличаются, то объясняют, чем это обусловлено.
IV. Измерение температуры тела и кожи у животного при
понижении и повышении температуры окружающей среды.
Исследование можно выполнить на морской свинке или
кролике (в зимних условиях и на крупных животных). У животного
измеряют температуру в прямой кишке и кожи в области спины.
Затем животное помещают в стеклянную банку, которую
опускают на 15 мин в ванну с водой заданной температуры: 30...35 и
0°С. Через 10 мин после нахождения в таких условиях
температуру тела и кожи измеряют вновь. Объясняют механизм и
биологический смысл поддержания постоянства температуры тела и
причины изменения температуры кожи у животных при
изменении температуры окружающей среды.
V. Измерение температуры тела и кожи у животного при
повышенном образовании теплоты в организме.
У кролика определяют температуру тела или печени с
помощью предварительно вживленного датчика и кожи в области
спины. Затем в вену вводят 1 мл адреналина (1 : 1000) и через каждые
30 мин в течение 2 ч измеряют температуру тела и кожи.
У лошади увеличение образования теплоты можно вызвать
путем физической нагрузки. Температуру тела и кожи в области
спины определяют до и после 20-минутного пробега с наездником
или в упряжке. Сопоставляют данные температуры тела и кожи в
обычных условиях и после нагрузки. Делают заключение о роли
кожи в поддержании постоянства температуры тела при
увеличении образования тепла.
VI. Определение участия системы дыхания в поддержании
постоянства температуры тела.
Собаку (или поросенка) ставят в станок и измеряют температу-
213
ру тела и кожи в области спины. На грудной клетке животного
фиксируют манжетку, соединенную с капсулой Марея. На
кимографе записывают дыхательные движения, определяют их ритм.
Затем на заднюю часть туловища животного надвигают тепловую
камеру (деревянный ящик без дна) с занавеской вместо передней
стенки и с рефлектором, соединенным с помощью широкой
жестяной трубы через заднюю стенку с камерой. Занавеску стягивают
вокруг туловища животного, включают рефлектор, температуру
внутри камеры доводят до 45...50°С и поддерживают ее на этом
уровне в течение 5... 10 мин. После этого вновь записывают
дыхательные движения и подсчитывают их число. Повторно измеряют
температуру тела и кожи. Сопоставляют данные измерений
температуры тела и кожи, ритма дыхания до и после помещения
животного в тепловую камеру. Делают заключение об участии системы
дыхания в поддержании постоянства температуры тела, о
значении изменения температуры кожи при изменении температуры
окружающей среды.
Контрольные вопросы и задания. 1. Какие вещества необходимы для
жизнедеятельности организма? В каком виде поступают эти вещества в кровь из
пищеварительного аппарата? 2. Как превращаются в организме всосавшиеся
аминокислоты? 3. Какова физиологическая роль отдельных аминокислот и белков?
4. Как превращаются в организме всосавшиеся жирные кислоты и глицерин и
как выводятся из организма липиды? 5. Опишите механизм превращения в
организме глюкозы. 6. Каковы физиологическая роль углеводов, конечных
продуктов обмена их и пути выведения из организма? 7. Каковы особенности
обмена углеводов у жвачных животных? 8. В чем физиологическая роль воды,
макро- и микроэлементов и взаимосвязь обмена их в организме? 9. В каком виде
поступают витамины в организм с кормами? 10. Назовите методы исследований
обмена энергии у животных. 11. Как меняется величина обмена энергии в
зависимости от физиологического состояния организма и температуры окружающей
среды? 12. Какова температура тела у животных? 13. Как осуществляются
теплообразование и теплоотдача в зависимости от температуры окружающей среды и
физиологического состояния организма животного?
5.13. СИСТЕМА ВЫДЕЛЕНИЯ
Выделение — это выведение из организма продуктов
метаболизма благодаря деятельности почек, потовых желез, легких,
желудка и кишечника. Из организма выводятся вода, диоксид
углерода, конечные продукты белкового обмена (мочевина, алланто-
ин, мочевая кислота, креатинин и др.), продукты неполного
окисления жиров и углеводов (молочная, р-оксимасляная, ацето-
уксусная кислоты, ацетон и др.), неорганические соединения
(хлориды, фосфаты, нитраты, бикарбонаты и др.), чужеродные
вещества, поступающие в организм, и др.
Важнейшая роль в процессах выделения принадлежит почкам.
214
Благодаря процессам фильтрации, реабсорбции, превращения
веществ и секреции они поддерживают постоянство внутренней
среды организма — гомеостаз. При этом образуется моча.
Количество и состав мочи отражают деятельность почек.
Занятие 37. Изучение деятельности почек
Цель занятия. Изучить мочевыделение у животных, определить
величину фильтрации и реабсорбции; исследовать роль почек в
выведении воды, хлоридов и чужеродных веществ.
Объект исследования, материалы и оборудование. 1. Животное с
фистулой мочевого пузыря (или выведенными мочеточниками) и
фистулой желудка. 2. Рисунки и схемы по теме. 3. Мерный
цилиндр, мерная пробирка, штатив с пробирками, пипетки на 10, 5 и
1 мкл, колба на 100 и 500 мкл, глазные пипетки; 10%-ный раствор
NaOH, 0,04 М раствор пикриновой кислоты, 0,75 н. раствор
NaOH, стерильный 0,5%-ный раствор краски фенолрот; шприцы
на 1, 5 и 20 мкл с иглами, система для введения воды в желудок,
колбы, теплая вода; раствор нитрата серебра (29,061 г нитрата
серебра на 1л дистиллированной воды), 10%-ный раствор хромата
калия, 10%-ный раствор диоксида натрия, 10%-ный раствор
уксусной кислоты; бюретки с краном, стаканчики для титрования,
дистиллированная вода, синяя и красная лакмусовая бумага;
фотоколориметр, пламенный фотометр.
Выполнение работы.
I. Изучение мочевыделения у животных натощак.
Не кормленное с вечера животное (овца, свинья или собака)
ставят в станок (рис. 46). Вынимают пробку фистулы мочевого
пузыря. Против отверстия фистулы укрепляют воронку с цилиндром
для сбора мочи. Если у животного выведены мочеточники, то
воронку с цилиндром укрепляют против отверстия выведенных
мочеточников. Определяют характер отделения мочи (непрерывное,
периодическое) и объем ее за 10-минутные интервалы.
Объясняют, какие условия определяют установленный характер отделения
мочи.
II. Определение размеров фильтрации в почечных тельцах по
клиренсу (очищению) эндогенного креатинина.
Исследование проводят на собаке (или свинье) с фистулой
мочевого пузыря или выведенными мочеточниками при условии
умеренного диуреза (у собак относительно постоянно содержание
креатинина в крови, он только фильтруется в почечных тельцах; у
жвачных животных креатинин наряду с фильтрацией секретирует-
ся в канальцах).
Животное, не кормленное с вечера, за 2 ч до занятия необходи-
215
Рис. 46. Сбор мочи у животных:
/— клетки (а, б) и воронки (в) для сбора мочи у лабораторных животных; II— приспособление
для сбора мочи у быка (г) и хряка (д): 1 — мочеприемник из непромокаемого материала,
2— отводная трубка, 3 — фиксирующие лямки; III— выведение мочеточника у овцы на
поверхность кожи брюшной стенки
мо напоить. В случаях отказа в воду можно добавить молоко или
ее ввести в желудок через фистулу желудка из расчета 10 мл/кг
массы тела. Животное ставят в станок. Определяют объем
выделяющейся мочи за 10-минутные интервалы. При относительно
стабильном выделении мочи в ней определяют содержание креати-
нина. Разводят 1 мл мочи дистиллированной водой в 50 раз (при
относительно низком диурезе —в 100 раз). К 3 мл разведенной
мочи добавляют 1 мл 0,04 М раствора пикриновой кислоты, а
затем 1 мл 0,75 н. раствора NaOH. Через 16 мин на фотоэлектроко-
лориметре определяют оптическую плотность этого раствора.
216
Пользуясь заранее выведенной стандартной кривой оптической
плотности растворов креатинина различной концентрации,
устанавливают концентрацию креатинина в исследуемой моче.
С учетом степени разведения мочи рассчитывают
концентрацию креатинина в 1 и 100 мл мочи. Содержание эндогенного
креатинина в плазме крови, а следовательно, и в почечном фильтрате,
как отмечалось, относительно постоянно и составляет 1 мг%.
Концентрацию креатинина в плазме крови можно определить.
По установленным показателям содержания креатинина в 100 мл
мочи ив 100 мл плазмы (или фильтрата) рассчитывают размеры
фильтрации в почках в 1 мин.
Размер почечной фильтрации (мл/мин) равняется содержанию
креатинина в 100 мл мочи, деленному на содержание креатинина в
100 мл плазмы крови и умноженному на объем диуреза (мл/мин).
Размеры реабсорбции фильтрата в канальцах почек определяют,
исходя из размеров фильтрации и диуреза. Реабсорбция (мл/мин)
равняется фильтрации (мл/мин) минус диурез (мл/мин). Процент
реабсорбции будет равен реабсорбции (мл/мин), деленной на
фильтрацию (мл/мин) и умноженной на 100.
III. Исследование гидроуретической функции почек.
Не кормленное с вечера животное с фистулой желудка и
фистулой мочевого пузыря (или выведенными мочеточниками) ставят в
станок. В течение 2...3, 5 или 10-минутных интервалов
определяют уровень диуреза. Затем через канюлю фистулы в желудок
вливают подогретую до 25 °С воду из расчета 20 мл/кг массы тела и
продолжают определение количества выделяющейся мочи в
каждые очередные 5 или 10-минутные интервалы в течение 1,5...2 ч.
Через 1 ч после введения в желудок воды вновь определяют
размеры фильтрации и реабсорбции. Введенная в желудок вода
поступает в кишечник, где всасывается, создавая избыток воды в крови
и межклеточном пространстве.
В конце занятия вычерчивают кривую диуреза, объясняют
механизм приспособительной реакции почек по поддержанию
постоянства внеклеточной воды в организме.
IV. Исследование натрийуретической функции почек.
Не кормленное с вечера животное с фистулой мочевого пузыря
(или выведенными мочеточниками) ставят в станок и в течение
2...3, 5 или 10-минутных интервалов определяют исходный
уровень диуреза. После сбора мочи в последний интервал животному
вводят в желудок 2%-ный раствор NaCl из расчета 15 мл/кг и
продолжают учет диуреза за 10-минутные периоды в течение
40...60 мин. Мочу, собранную за каждый 10-минутный период до
и после нагрузки хлоридом натрия, сливают в отдельные
пробирки или колбочки, записывают количество.
В моче, собранной за последний 10-минутный период до на-
217
грузки и в последний 10-минутный период после нагрузки
хлоридом натрия, определяют содержание хлоридов (натрий выделяется
в виде хлорида натрия) или натрия. Сопоставляют результаты
определения хлоридов (и натрия) в моче, полученной до и после
нагрузки хлоридом натрия, и делают вывод о реакции почек на
повышенное содержание натрия в организме, о существе натрий-
уретической функции почек, о механизме приспособительной
реакции почек по поддержанию постоянства внеклеточного натрия
в организме.
Хлориды в моче определяют титрованием раствором нитрата
(азотнокислого) серебра. В стаканчик на 100 мл вносят пипеткой
(точно) 10 мл исследуемой мочи и 40 мл дистиллированной воды.
Если реакция мочи кислая, то к ней добавляют 2 мл (или больше)
10%-ного раствора диоксида (двууглекислого) натрия до
слабощелочной реакции. О последней судят по изменению цвета
лакмусовой бумаги (красная лакмусовая бумага после помещения в
разведенную мочу становится синей). Затем в стаканчик вносят
5...6 капель 10%-ного раствора хромата (хромовокислого) натрия и
проводят титрование хлоридов. Под колбу кладут лист белой
бумаги. Из бюретки со стеклянным краном в стаканчик с
разведенной мочой постепенно по каплям приливают раствор нитрата
серебра до перехода слегка желтоватого осадка хлорида серебра в
коричневый (данная окраска связана с образованием осадка
хромата серебра).
При вычислении содержания хлоридов исходят из того, что
1 мл раствора нитрата серебра осаждает 0,01 г хлорида натрия. В
10 мл исследуемой мочи содержание хлорида натрия равно
0,01л, где п — объем нитрата серебра, израсходованного на
титрование, мл. Содержание хлоридов в моче (X) можно выразить
и в процентах:
V. Исследование выделительной функции почек.
Животное с фистулой мочевого пузыря (или выведенными
мочеточниками) ставят в станок, собирают мочу за 1-минутные
интервалы в течение 5 мин. Затем ему вводят под кожу с помощью
стерильного шприца и иглы краску фенолрот в дозе 0,5... 1 мл
0,5%-ного стерильного раствора. Кожу на месте введения
предварительно смазывают настойкой йода. Продолжают сбор мочи за
1-минутные интервалы. В полученную мочу до и после введения
краски вносят по 1...2 капли 10%-ного раствора NaOH. Малино-
218
вый цвет свидетельствует о появлении в моче краски.
Определяют, выделяется ли почками введенное в организм чужеродное
вещество (краска), и делают заключение о сущности
выделительной функции почек.
Занятие 38. Изучение регуляции деятельности почек
и мочевыводящего аппарата
Цель занятия. Изучить роль нервной системы и гормонов в
регуляции функции почек; исследовать влияние нервной системы
на выведение мочи.
Объект исследования, материалы и оборудование. 1. Собака, овца
или другое животное с фистулой мочевого пузыря и фистулой
желудка. 2. Рисунки и схемы по теме. 3. Станок для фиксации;
воронка для сбора мочи, мерный цилиндр и мерные пробирки,
штатив для введения раствора в мочевой пузырь; воронка с резиновой
трубкой и пробкой со стеклянной трубкой для введения воды в
желудок; физиологический раствор, вода; стерильные шприцы на
1, 10 и 20 мл с инъекционными иглами; 0,5%-ный стерильный
раствор новокаина, питуитрин.
Выполнение работы.
I. Исследование влияния питуитрина на диурез.
Не кормленное с вечера животное ставят в станок. Открывают
канюлю фистулы мочевого пузыря и определяют исходный
уровень диуреза за 10-минутные интервалы (он должен быть средней
величины). Если диурез низкий, то животному в желудок вливают
150...200 мл воды. После установления размеров исходного
диуреза животному вводят под кожу 1 мл питуитрина (вытяжка из
задней доли гипофиза, содержащая антидиуретический гормон) и
продолжают наблюдение за диурезом. Определяют размеры
фильтрации и реабсорбции.
Результаты наблюдений заносят в таблицу и на их основании
делают вывод о влиянии антидиуретического гормона на диурез,
на фильтрацию и реабсорбцию. Объясняют роль
антидиуретического гормона в гидроуретической функции почек.
II. Исследование влияния новокаиновой блокады пограничных
симпатических стволов на диурез.
Подопытное животное с фистулой мочевого пузыря (или
выведенными мочеточниками) ставят в станок и регистрируют диурез
за каждые 10 мин в течение 30 мин. Затем к пограничным
симпатическим стволам надплеврально подводят раствор новокаина
сначала с одной стороны, затем с другой. Продолжают
регистрацию диуреза по 10-минутным интервалам. Блокада симпатическо-
219
го ствола наступает через 10...20 мин. Диурез регистрируют за
каждые 10 мин в течение часа. Определяют размеры фильтрации и
реабсорбции до и после блокады симпатических нервных ветвей
почек.
Результаты наблюдений записывают в таблицу и на их
основании делают вывод о влиянии блокады симпатической иннервации
почек на почечные процессы, на диурез. Объясняют роль
симпатической иннервации в регуляции почечных процессов и
функций.
III. Исследование рефлекторной регуляции работы мочевыводяще-
го аппарата.
Для выяснения рефлекторного принципа работы мочевыдели-
тельного аппарата животному через фистулу непосредственно в
мочевой пузырь вводят физиологический раствор (30 °С).
Присоединив с помощью тройника к резиновой трубке (через которую
вводят физраствор в мочевой пузырь) манометр, измеряют
давление в мочевом пузыре. При заполнении его физиологическим
раствором наблюдают за поведением животного. Определяют, при
каком давлении в мочевом пузыре наступает мочеиспускание.
Объясняют механизм этой реакции.
Занятие 39. Изучение выделительной
функции желудка
Выделительную функцию пищеварительного аппарата
можно изучить методом хромоскопии, т. е. с применением различных
красителей (нейтральный красный, метиленовый синий и др.).
О выделительной функции желудка, как и других органов
пищеварительного аппарата, судят по интенсивности выведения им
красителя.
Цель занятия. Убедиться в наличии выделительной функции у
пищеварительного аппарата.
Объект исследования, материалы и оборудование. 1. Собака или
овца с изолированным желудком (изолированным участком
сычуга). 2. Рисунки и схемы по теме. 3. Шприц, часы; 1%-ный
раствор краски фенолрот, 10%-ный раствор NaOH.
Выполнение работы. Животное ставят в станок и приступают к
сбору желудочного сока. Убеждаются в выделении желудочного
сока. Затем животному под кожу вводят 1 мл 1%-ного стерильного
раствора фенолрота, засекают время и через каждые 2 мин
определяют появление и нарастание количества краски в желудочном
соке. В собранный желудочный сок вносят по каплям 10%-ный
раствор NaOH: при наличии краски сок приобретает малиновый
цвет.
220
Занятие 40. Изучение функции потовых желез
Потовые железы входят в системы, обеспечивающие
поддержание постоянства температуры тела и выделение с потом конечных
продуктов обмена.
Цель занятия. Исследовать функцию потовых желез и влияние
на потоотделение физической нагрузки.
Объект исследования, материалы и оборудование. 1. Лошадь,
корова или овца. 2. Рисунки и схемы по теме. 3. Кусочки
хлопчатобумажной ткани, пропитанные крахмалом, спиртовой раствор
йода, лейкопластырь, ножницы.
Выполнение работы. У животного на коже (10x10 см)
выстригают волосы и лейкопластырем фиксируют кусочки
хлопчатобумажной ткани, пропитанные раствором крахмала. Через 30 мин
кусочки ткани снимают. Об интенсивности потоотделения судят по
изменению окраски и массы кусочков ткани. Под действием пота
ткань синеет. На испытуемой лошади исследование можно
повторить при физической нагрузке, после пробега.
На основании полученных результатов делают вывод о
влиянии физической нагрузки на потоотделение лошади. Объясняют
механизм отмеченного влияния.
Контрольные работы и задания. 1. Какие органы участвуют в процессе
выделения, каково их физиологическое значение? 2. В чем заключается выделительная
функция легких? 3. Какие функции выполняют почки? 4. Что является морфо-
функциональной единицей почки? Из каких частей она состоит? 5. Каков состав
мочи и как образуется первичная и конечная моча? 6. Какие методы используют
для определения величины фильтрации? 7. Как осуществляется нервная и
гуморальная регуляция деятельности почек? 8. Опишите механизм мочеиспускания.
9. Какую роль в выделительных процессах играет кожа?
5.14. ФИЗИОЛОГИЯ РАЗМНОЖЕНИЯ
Организм животных не только поддерживает свое
существование, но и производит себе подобных путем размножения —
осуществляет деятельность, обеспечивающую воспроизводство себе
подобных организмов, сохранение и продолжение вида. Новый
организм развивается из оплодотворенного яйца — зиготы,
образовавшейся путем слияния женской половой клетки (яйцеклетки)
и мужской половой клетки (спермия). Воспроизведение
организма возможно с момента полового созревания — половой зрелости
его и до такой стадии старения, когда репродуктивная функция
его угасает (климакс).
Возраст наступления половой зрелости у животных разных
видов: крупный рогатый скот —8...10 мес, овцы —6...8, свиньи —
6...8, лошади — 18, собаки — 5...6 мес. Половая зрелость проявля-
221
ется у мужских особей началом образования спермиев — мужских
половых клеток, а у женских особей созреванием яйцеклеток —
женских половых клеток.
Занятие 41. Образование спермиев, формирование половых
мотиваций, половое ритуальное поведение,
половое взаимодействие, выведение спермы.
Физиология спермия у самцов
Приспособительными реакциями системы поддержания
оптимального уровня образования спермиев, обеспечения полового
ритуального поведения, полового взаимодействия и выведения
спермы являются: спермиогенез (осуществляется в канальцах
семенника и придатке семенника), сложные двигательные половые
поведенческие реакции (обнюхивание, преследование самки,
поднимание головы и верхней губы, расширение ноздрей, эрекция
полового члена, садка на самку, обхватывание ее передними
конечностями, введение полового члена во влагалище самки,
характерные движения крупа), выведение спермиев и секретов
придаточных половых желез при совокуплении.
Цель занятия. Ознакомиться с приспособительными
реакциями половой системы самца: исследовать сперму и
жизнедеятельность спермиев.
Объект исследования, материалы и оборудование. 1. Свежий боен-
ский материал половых органов самца (быка, барана, хряка,
жеребца и животных других видов). 2. Рисунки, таблицы, графики и
схемы по теме. 3. Гистологические препараты семенников, придатков
семенников. 4. Спермоприемники со спермой быка и хряка;
микроскопы, скальпели, пинцеты, ножницы, стерильные пипетки,
смесители, предметные и покровные стекла, глазные пипетки,
сливные чашки; 0,1%-ный раствор метиленовой сини на 0,9%-ном
растворе хлорида натрия; стеклянные трубочки с диаметром канала
0,8... 1 мм и длиной 6...8 см; столик; лед в чашке, горячая вода;
часовые стекла; 0,9%-ные и 3%-ные растворы хлорида натрия.
Выполнение работы.
I. Наблюдение за половым ритуальным поведением самца и
самки.
Самцы животных проявляют характерное половое ритуальное
поведение при встрече и общении с самкой. В этом поведении
много общего у самцов животных разных видов, но вместе с тем
характерны и видовые особенности. Половое ритуальное
поведение свойственно и самке.
Наблюдение проводят на скотном (физиологическом) дворе, в
манеже, на специальной площадке, куда выводят самца и самку
222
(желательно в состоянии половой охоты), соблюдая все условия,
связанные с безопасностью.
Наблюдение за половым ритуальным поведением
сопровождают описанием, фотографированием, записью кинокамерой
поведенческих реакций, регистрацией времени.
По результатам наблюдений делают описание полового
ритуального поведения самца и самки.
II. Исследование процесса спермиогенеза.
Спермиогенез осуществляется в извитых канальцах
семенников; дозревание спермиев завершается в придатке семенника.
Определите, имеются ли в извитых канальцах семенников и в
канале придатка семенника сперматогонии, сперматоциты, спер-
матиды и спермии.
Осматривают свежий боенский материал половых органов
самца. Разрезают семенник с придатком продольно на две части.
Опишите, как выглядит железистая ткань семенника.
Затем на готовых гистологических препаратах семенника и
придатка при малом, а затем и при большом увеличении
микроскопа определяют наличие в извитых канальцах сперматогонии,
сперматоцитов, сперматидов и спермий.
Опишите кратко процесс спермиогенеза.
III. Исследование цвета, консистенции, запаха спермы.
При хорошем освещении в пробирке определяют цвет, затем
запах, консистенцию (насыщенность спермы спермиями) спермы.
IV. Исследование внешних признаков жизнедеятельности
спермиев.
Исследуют свежую сперму под микроскопом. На чистое
предметное стекло стерильной пипеткой наносят каплю спермы,
накрывают покровным стеклом и ставят на предметный столик
микроскопа.
Определите внешние признаки спермиев, тип их движений.
Далее на чистое предметное стекло глазной пипеткой наносят
каплю свежеполученной спермы быка и добавляют к ней каплю
раствора метиленовой сини. С помощью стеклянной трубки обе
капли быстро перемешивают и смесь набирают в ее канал. Трубку
со столбиком окрашенной спермы кладут на лист белой бумаги и
определяют по секундомеру время, в течение которого наступит
обесцвечивание голубого столбика (обесцвечивание обусловлено
использованием спермиями кислорода синьки — показатель
дыхания спермиев).
V. Исследование влияния на активность спермиев высокой и
низкой температуры, гипотонических и гипертонических растворов,
антисептиков.
Исследование проводят на свежеполученной сперме под
микроскопом. Определяют подвижность спермиев. Затем на сперму
223
воздействуют высокой и низкой температурами: предметное
стекло помещают на обогревательный столик с температурой 50...55 °С
или ставят на 1...2мин на лед. Вновь определяют подвижность
спермиев.
На другие предметные стекла наносят по капле свежеполучен-
ной спермы и добавляют каплю дистиллированной воды, или 3%-ного
(гипертонического) раствора хлорида натрия, или раствора пер-
манганата калия (1 :3000), накрывают покровным стеклом и под
микроскопом определяют подвижность спермиев.
Опишите характер и степень влияния внешних факторов на
двигательную активность спермиев.
Контрольные вопросы и задания. 1. Какие органы входят в систему
размножения у самца? 2. Какие органы входят в систему размножения у самки? 3. Какие
виды деятельности осуществляются половыми органами самца? 4. Где и как
происходит спермиогенез? 5. Какие виды деятельности осуществляются придатком
семенника, спермопроводами, мочеполовым каналом и половым членом? 6.
Какие виды деятельности осуществляются придаточными половыми железами
(пузырьковидные, предстательная, луковичные и уретральные)? Каковы состав и
свойства секретов этих желез? 7. Каковы строение, состав и свойства спермиев?
8. Каковы состав и свойства спермы? 9. Какие половые рефлексы проявляются у
самцов в связи с половым взаимодействием с самкой? 10. Опишите
закономерность выделения спермиев и секретов добавочными половыми железами при
эякуляции у самцов.
Занятие 42. Развитие яйцеклеток, половые циклы,
формирование половых мотиваций,
половое ритуальное поведение,
половое взаимодействие и оплодотворение у самок
Приспособительными реакциями системы, обеспечивающей
цикличное развитие фолликулов и яйцеклеток в яичниках,
половое ритуальное поведение, совокупление и оплодотворение,
являются: развитие фолликул и яйцеклеток в яичниках (фолликулоге-
нез и овогенез), сложные двигательные половые ритуальные
поведенческие реакции, течка, половое возбуждение, охота,
спаривание, овуляция, слияние яйцеклетки и спермия с образованием
зиготы; системы, обеспечивающей беременность — развитие
плода в матке, изменение гормонального статуса, обмена веществ,
деятельности органов и организма в целом; системы,
обеспечивающей роды — сокращениями матки (схватки) и мышц брюшной
стенки (потуги), выведение последа.
Цель занятия. Ознакомиться с приспособительными
реакциями половой системы самки; системы, обеспечивающей
беременность, роды; изучить строение яйцеклетки.
Объект исследования, материалы и оборудование. 1. Свежий бо-
енский материал половых органов самки (коровы, овцы, свино-
224
матки, кобылы, крольчихи); молодые морские свинки массой
200 г или взрослая небеременная кошка, белые мыши, овцы.
2. Рисунки, таблицы, графики и схемы по теме. 3.
Гистологические препараты яичников. 4. Операционный набор, кимограф,
универсальный штатив и рычажок Энгельмана, металлический
крючок диаметром 30...50 мм и высотой 80... 100 мм; раствор Рин-
гера для матки (38 °С); тонкие выструганные палочки, вата,
стаканчики с водой; насыщенный раствор метиленовой сини,
разбавленный в 4 раза; стеклянная банка с «рельсами» над ней для
окраски мазков; спирт, спиртовки, полоски фильтровальной бумаги,
пипетка с резиновым баллончиком; микроскоп, бинокулярная
лупа, пастеровская пипетка, физиологический раствор,
предметные и покровные стекла.
Выполнение работы.
I. Исследование развития фолликул и желтых тел в яичниках.
В яичниках у половозрелых самок происходит развитие
фолликула и яйцеклетки в нем. После завершения развития фолликула
происходит овуляция — разрыв фолликула и выход яйцеклетки.
На месте фолликула развивается желтое тело. Если не происходит
оплодотворение, начинается обратное развитие желтого тела и
созревание нового фолликула с новой яйцеклеткой. В яичнике
можно обнаружить фолликулы и желтые тела на различной стадии
развития.
Исследование можно провести на корове ректально (через
прямую кишку). В прямую кишку вводят руку, пальцами
нащупывают яичник и пальпацией определяют наличие и степень
развития фолликула, степень развития и обратного развития
желтого тела.
В лабораторных условиях исследование можно провести на
свежем боенском материале — яичниках коровы. Рассматривая
яичники, обратите внимание на наличие в них развивающихся
фолликул и по величине его определите стадию развития.
Найдите желтое тело и по величине его определите, на какой стадии
развития или обратного развития оно находится.
Затем на готовых гистологических препаратах яичника под
малым и большим увеличением микроскопа определите наличие
фолликулов. Найдя фолликул, обратите внимание на его
строение.
Дайте характеристику состояния яичника.
II. Исследование яйцеклетки.
В пастеровскую пипетку насасывают физиологический раствор
(1/3 капилляра). Острым концом пипетки прокалывают стенку
фолликула. Пипетку наклоняют так, чтобы содержимое
фолликула поступило в нее. Затем содержимое пипетки каплями наносят
на предметные стекла и просматривают под малым увеличением
225
микроскопа. Предметное стекло с каплей, в которой обнаружена
яйцеклетка, накрывают покровным стеклом и изучают яйцеклетку
под большим увеличением микроскопа.
Зарисуйте и опишите яйцеклетку.
III. Исследование сократительной деятельности матки.
Матка осуществляет сократительную деятельность. Активность
сократительной деятельности изменяется в течение полового
цикла.
1. Исследование можно провести на анестезированных
молодой свинке или кошке. Вскрывают брюшную стенку спереди от
лонного сочленения. Рог матки на уровне средней трети
прокалывают иглой и перевязывают длинной ниткой. Затем таким же
образом прошивают ниткой рог ближе к матке и эту нитку
накоротко привязывают к металлическому крючку. Конец первой
нитки и свободный конец крючка проводят через стеклянный
цилиндр. Стеклянный цилиндр нижним концом ввяжите в
брюшную полость с помощью кисетного шва. Свободный конец
крючка закрепить зажимом на стенке стеклянного цилиндра.
Конец первой нитки, отходящей от рога матки, соединить с пис-
чиком Энгельмана.
Цилиндр дополнительно зафиксировать в зажиме
универсального штатива. В брюшную полость через цилиндр налить
достаточное количество теплого раствора Рингера. Писчик подвести к
барабану кимографа и вести наблюдение за сокращением матки.
Через 10 мин в раствор по каплям вносить раствор ацетилхолина и
продолжать запись.
2. Исследование сократительной деятельности матки можно
провести на небеременной овце или корове. Животное ставят в
станок и фиксируют. Через влагалище и шейку матки осторожно,
в стерильных условиях, в матку вводят резиновый баллончик,
который соединяют заранее с регистрационной капсулой Марея.
Систему заполняют воздухом. Запись сокращений матки ведут на
барабане кимографа.
По результатам исследований сделайте заключение, как
проявляются сокращения матки.
IV. Исследование циклических изменений слизистой оболочки
половых органов самки в связи с половыми циклами.
Созревание фолликула в яичнике сопровождается повышением
в крови концентрации эстрогенов, что вызывает изменение
клеток слизистой оболочки половых органов.
Исследование легче провести на половозрелых мышах-самках
(рис. 47). На закругленные концы тонких палочек намотайте
небольшой слой ваты. Конец палочки с намотанным на нем ватным
тампоном погрузите в стаканчик с водой и вслед за тем осторожно
введите во влагалище мыши. Палочку слегка поверните во влага-
226
Стадия покоя Стадия перед течкой
Рис. 47. Исследование полового цикла у грызунов:
Л~ взятие влагалищного мазка у мыши; Б — влагалищные мазки мышей (окрашенные),
характеризующие половой цикл: У — ядерные эпителиальные клетки, 2— слизь, 3 — лейкоциты,
4— ороговевшие эпителиальные клетки
лище, а затем извлеките. Сразу по извлечении концом тампона
сделайте на ограниченном пространстве предметного стекла
несколько мазковых движений.
Исследование можно провести и на овцах. У овец во влагалище
вводят пипетку с резиновым баллончиком и насасывают
небольшое количество влагалищной жидкости. Для изготовления мазка
используют каплю жидкости.
Мазок подсушите на воздухе, затем на зону мазка нанесите
несколько капель спирта (для фиксации материала на стекло).
После испарения спирта стекло с мазком установите на
«рельсах», лежащих на стеклянной банке. На зону мазка пипеткой
налейте раствор метиленовой сини и окрашивайте 10... 15 мин.
После этого, наклонив стекло, слейте с него краситель, смойте
избыток красителя струей воды. Затем поверхность мазка просушите
полосками фильтровальной бумаги. Проведите
микроскопическое исследование изготовленных мазков. Картину мазков
зарисуйте в рабочей тетради. Проведите сопоставление мазков. Если
картина мазков разных животных неодинаковая, то это дает
основание считать, что функциональная активность половых
органов периодически изменяется.
У мышей в фазе полового покоя в мазке обнаруживают
лейкоциты, слизь и ядерные эпителиальные клетки; в фазе предтечки —
ядерные эпителиальные клетки; в фазе течки — крупные
ороговевшие безъядерные клетки, в фазе послетечки — лейкоциты и
эпителиальные клетки.
Контрольные вопросы и задания. 1. Какие виды деятельности осуществляются
яичниками? 2. Где и как осуществляются фолликуло- и овогенез, формирование
желтого тела? 3. Какие функции осуществляются яйцеводами, маткой, шейкой
матки, влагалищем? 4. Что понимают под половым циклом? 5. Назовите
внешние проявления полового цикла. 6. Опишите механизм регуляции полового
цикла. 7. Каковы строение и свойства яйцеклетки, сущность оплодотворения?
8. Каковы физиологические особенности самки при беременности? 9. Каков
механизм родов? 10. Каковы физиологические особенности самки в послеродовой
период?
5.15. СИСТЕМА ЛАКТАЦИИ
В организме самки с возрастом, с наступлением половой
зрелости, в процессе и после завершения беременности и родов, а
также при систематическом доении или сосании происходит и
завершается формирование системы лактации в целях обеспечения
образования молока, распределения и накопления образующегося
молока в емкостной системе вымени и молоковыведения (моло-
коотдачи) при доении или сосании.
228
Занятие 43. Образование молока, распределение, накопление
и удержание молока в емкостной системе, молоковыведение.
Молоко, его состав и свойства
Система лактации обеспечивает следующие
приспособительные реакции: поддержание определенного на данный отрезок
времени уровня образования и состава молока; распределение,
накопление и удержание образующегося молока в емкостной
системе молочной железы, выведение молока при сосании и доении
(молокоотдача). Молоко имеет определенные состав и свойства.
Цель занятия. Ознакомиться с особенностями
приспособительных процессов системы лактации: молокообразование,
распределение и накопление образующегося молока, молокоотдача;
овладеть наиболее распространенными методами исследования моло-
коотдачи и состава молока.
Объект исследования, материалы и оборудование. 1. Молоко
(свежее) от разных видов животных, разного срока лактации.
2. Рисунки, таблицы, графики и схемы по теме. 3. Стаканчики и
колбочки вместимостью 25, 50, 100, 250 и 300 мл; мерные
цилиндры на 100 и 250 мл; пипетки на 0,5, 1,5, 10 и 20 мл, глазные
пипетки; пробирки без и с пробками, в которые вставлены стеклянные
трубки длиной 25 см; бюретки обычные и микробюретки,
стеклянные трубочки; водяная баня; термометр химический;
предметные и покровные стекла; счетные камеры Горяева; микроскоп с
окуляром х 15 и объективом х40, алюминиевые стаканчики с
крышкой; эксикатор; технические весы с разновесами; марля,
ножницы, сушильный шкаф; воронки с фильтрами; рефрактометр
для определения белка; гигроскопическая вата, фильтровальная
бумага, дистиллированная вода; 2%-ный раствор фенолфталеина;
20%-ный раствор гексаметафосфата натрия (2 г гексаметафосфата
натрия растворяют в 70 мл дистиллированной воды при 60...70 °С,
нейтрализуют при фенолфталеине 10%-ным раствором
гидроксида натрия и доводят объем до 100 мл водой: через 1...2 ч еще
теплый раствор фильтруют); формалин 30%-ный (к 25...40 мл его
добавляют 0,3...0,5 мл раствора фенолфталеина и по каплям 1 н.
раствор гидроксида натрия до розового окрашивания. Применяют в
анализах свежеприготовленный раствор формалина); 0,04 н.
раствор серной кислоты, 0,1 н. раствор гидроксида натрия, 5%-ный
раствор уксусной кислоты, 4%-ный раствор хлорида кальция, 1%-ный
раствор крахмала, 3%-ный раствор йодида калия, 2%-ный раствор
хлороводородной (соляной) кислоты, 0,001 н. раствор 2,6-дихлор-
фенолиндофенола, физиологический раствор.
Выполнение работы.
I. Исследование деятельности емкостной системы молочной
железы.
229
Емкостная система молочной железы обеспечивает
распределение, накопление и удержание молока. Емкостная система состоит
из альвеолярно-протокового и цистернального отделов. Постоянно
образующееся молоко заполняет альвеолярно-протоковый отдел.
Заполнение альвеолярно-протокового отдела молоком рефлектор-
но с рецепторов альвеол через центр молоковыведения,
расположенный в пояснично-крестцовом отделе спинного мозга, вызывает
расслабление сфинктеров протоков и поступление молока в цис-
тернальный отдел порциями. Уменьшение давления в альвеолярно-
протоковом отделе, сопровождающееся прекращением
раздражения рецепторов, ведет вновь к смыканию сфинктеров. Поступление
молока в цистернальный отдел вызывает рефлекторно до
определенного момента понижение тонуса цистернального отдела. В ци-
стернальном отделе молоко удерживается благодаря постоянно
высокому тонусу сфинктера соскового канала.
Исследование можно провести на л актирующей корове, козе
или овце. Животное фиксируют в станке. Подготавливают
молочный катетер, посуду для сбора молока. В цистерну одного из
сосков через сосковый канал вводят стерильный катетер, смазанный
вазелиновым маслом. Через катетер в подставленный сосуд
выделится молоко — это цистернальное молоко. Продолжая
наблюдение, можно отметить, что из цистерны через катетер
периодически небольшими порциями продолжает поступать молоко — это
альвеолярное молоко, оно поступает в цистерну при каждом
расслаблении сфинктеров протоков в связи с повышением давления
постоянно образующегося молока. Убедиться в этом можно и
другим приемом: выдаивают молоко из других долей и одновременно
наблюдают за выделением молока из катетера, вставленного в
канал одного из сосков. Из катетера молоко начинает при этом
выделяться сплошной струей — это альвеолярная часть молока
(доение вызывает расслабление сфинктеров протоков, выделение
молока из альвеол в цистерны железы и соска). После выдаивания
молока выделение молока из катетера, вставленного в сосковый
канал, на длительное время прекращается. Оно вновь
возобновляется после заполнения альвеолярно-протокового отдела молоком.
Сравнивая количество молока, полученного через катетер из
цистерны и альвеол, с количеством выдоенного молока из другого
соска, можно еще раз убедиться в распределении молока между
альвеолами и цистерной.
II. Исследование скорости молокоотдани у коров.
Мерой скорости молокоотдачи служит количество молока (кг),
выдаиваемого в 1 мин при машинном доении. Скорость молоко-
отдачи является показателем функциональной активности
емкостной системы. Доение сопровождается повышением давления в
емкостной системе. Изменение давления в емкостной системе
230
можно легко измерить с помощью воздушного манометра,
который соединяется резиновой трубкой с катетером, введенным через
сосковый канал в цистерну соска.
Для определения скорости молокоотдачи используют
доильный аппарат для раздельного выдаивания молока из долей
вымени. Подготавливают вымя для доения (обмывают, насухо
вытирают, массажируют в течение 40...50 с). Доильный аппарат
подключают к вакуум-проводу 46,5 кПа (350 мм рт. ст.), надевают
доильные стаканы. Осуществляют доение, контролируя движение струй
молока по шкалам и секундомеру, учитывают количество молока,
выделенного из четвертей вымени за каждую минуту. Проводят
машинный додой. Снимают аппарат.
Проводят анализ полученных данных. Оформляют заключение
0 скорости молокоотдачи.
III. Исследование свойств молока (цвет, консистенция, запах и
вкус).
Молоко имеет специфические свойства. Свойства молока
исследуют путем осмотра (цвет), определения вязкости
(консистенция), по данным ощущений при смачивании глотком молока всей
поверхности ротовой полости до основания языка (вкус) и при
захватывании ртом воздуха и медленным выдыханием его через
нос (запах). Описывают свойства.
IV. Определение содержания в молоке воды и сухого вещества.
Для определения процентного содержания воды и сухого
вещества в молоке в алюминиевый стаканчик с хорошо подогнанной
крышкой (бюкс) вкладывают 5...6 кружков марли, вырезанных по
диаметру стаканчика, и открытым ставят в сушильный шкаф при
температуре 102... 110 °С на 30 мин. По истечении времени
стаканчик закрывают крышкой и ставят в эксикатор для охлаждения.
Затем стаканчик взвешивают (массу записывают) и на марлю
наносят пипеткой 5 мл молока, распределяя его по всей поверхности.
Стаканчик закрывают и взвешивают (массу записывают). После
взвешивания стаканчик открытым ставят в сушильный шкаф на
1 ч при указанной температуре. Обязательное условие при
высушивании — постоянный приток свежего воздуха. Сухой остаток,
распределенный по марле, имеет светло-лимонный цвет. Через 1 ч
стаканчик закрывают, охлаждают и взвешивают.
Содержание сухого вещества, %
С= 100(Mi - М2) I (М- М2),
где М\ — масса бюкса после высушивания; Mi — масса бюкса с марлей; М— масса
бюкса с молоком до высушивания.
Содержание воды равно: 100 % минус (%) С сухого вещества.
231
V. Определение содержания в молоке белков.
Общее количество белков в молоке определяют методом фор-
мольного титрования (метод основан на свойстве формалина
нейтрализовать аминные группы аминокислот белков молока, когда
они замещаются метиленовыми группами: в результате
увеличивают кислые свойства аминокислот. По степени повышения
кислотности устанавливают количество белков).
В химический стакан отмерить 20 мл свежего неконсервиро-
ванного молока. Для максимальной прозрачности раствора к
молоку прибавить 2 мл 20%-ного раствора гексаметафосфата натрия.
К содержимому стакана прилить 0,25 мл 2%-ного раствора
фенолфталеина, через 2 мин смесь в колбе титровать 0,1 н. раствором
гидроксида натрия до розовой окраски. Окраска должна
соответствовать эталону (20 мл молока, 2 мл гексаметафосфата натрия и
1,2 мл 0,0005%-ного раствора основного фуксина). После
титрования в стакан внести 5 мл 30%-ного или 4 мл 40%-ного формалина
и вторично титровать до такой же окраски. Объем (мл) 0,1 н.
раствора гидроксида натрия, израсходованного на титрование в
присутствии формалина, умноженный на 0,861, показывает
содержание общего белка в молоке. Содержание белков можно определять
рефрактометром РЛ-2 со специальной камерой.
VI. Определение содержания в молоке белка казеина.
Специфическим белком молока является казеин. Определение
содержания казеина основано на нейтрализации казеина 0,1 н.
раствором гидроксида натрия: 1 мл NaOH эквивалентен 0,11315 г
казеина. В две колбы отмеряют по 20 мл молока и по 80 мл
дистиллированной воды. В одну колбу при помешивании добавляют
из бюретки 0,04 н. раствор серной кислоты до появления хорошо
заметных хлопьев казеина (около 25 мл). В другую колбу вливают
из бюретки такой же объем раствора серной кислоты, как в
первую колбу. Содержимое первой колбы фильтруют в мерную колбу
на 100 мл. Во вторую колбу вносят 2...3 капли фенолфталеина и
титруют смесь 0,1 н. раствором NaOH до слабо-розового
окрашивания. Переливают 100 мл прозрачного фильтрата, собранного в
мерной колбе, в коническую колбу, добавляют 2...3 капли
фенолфталеина и титруют 0,1 н. раствором NaOH до слабо-розового
окрашивания. Пересчет количества щелочи на 125 мл фильтрата (на
объем в первой колбе): по разности между количеством (мл) 0,1 н.
раствора гидроксида натрия, израсходованного на нейтрализацию
двух проб одного молока (одну с казеином, другую без казеина),
находят количество щелочи. Умножением полученного числа на
0,11315 определяют количество казеина в исследуемом образце
молока. В 100 мл молока казеина в 5 раз больше. При переводе в
процентное содержание это число делят на величину плотности
молока: средняя плотность молока равна 1,030.
232
VII. Определение наличия в молоке альбуминов и глобулинов.
В молоке кроме специфического белка казеина в меньших
количествах содержатся альбумины и глобулины.
Наличие альбуминов и глобулинов выявляют осаждением их
путем кипячения фильтрата, полученного после осаждения
казеина. В коническую колбу пипеткой вносят 10 мл молока и
разбавляют его 3 мл воды. Из бюретки по каплям добавляют уксусную
кислоту до появления заметных хлопьев казеина,
отфильтровывают выпавший осадок казеина. Берут 3...5 мл прозрачного
фильтрата и нагревают до кипения. Если в молоке присутствуют
альбумины и глобулины, то в фильтрате вначале появится муть, а затем
выпадут хлопья альбуминов и глобулинов.
VIII. Определение содержания в молоке молочного сахара
(лактозы).
Лактоза — специфический углевод молока. Содержание
молочного сахара (лактозы) определяют рефрактометрическим методом.
В пробирку отмеряют пипеткой 5 мл молока и добавляют 5...6
капель 4%-ного раствора хлорида кальция. Пробирку закрывают
пробкой, через центр которой пропущена стеклянная трубка
длиной 25 см. Нижний конец стеклянной трубки устанавливают выше
уровня молока на 0,5 см. Пробирку помещают в кипящую
водяную баню на 10 мин, после чего ее охлаждают до исходной
комнатной температуры. Капли воды, сконденсировавшейся на
стенках, осторожным наклоном пробирки сливают в образовавшуюся
из молока сыворотку, не взмучивая последнюю. Затем стеклянную
трубку затыкают небольшим кусочком гигроскопической ваты,
осторожно опуская ее нижним концом в пробирку с сывороткой,
и без взмучивания втягивают несколько капель сыворотки через
слой ваты в трубку. Две капли выдувают обратно, а следующие
1...2 капли прозрачной сыворотки (слабая муть допустима)
помещают на поверхность нижней призмы (откинув предварительно
верхнюю призму) рефрактометра, не касаясь при этом стеклянной
трубкой поверхности призмы. Затем верхнюю призму немедленно
опускают.
Свет с помощью зеркала направляют в верхнее отверстие — в
призму. Наблюдение ведется в окуляр: вращением его головки
устанавливают фокус, а вращением рычажка устраняют
расплывчатость и радужность окраски границы светотени. Затем с помощью
рукоятки передвигают окуляр вдоль прорези. Одновременно с
передвижением окуляра, смотря в него, добиваются совпадения
границы света и тени с указателем, имеющим вид пунктира. На левой
шкале рефрактометра точно на уровне пунктирной линии
отсчитывают коэффициент преломления. Согласно коэффициенту в
специальной таблице находят процентное содержание молочного
сахара в исследуемом молоке.
233
Определение содержания в молоке молочного сахара по коэффициенту преломления
Коэффициент
преломления
Молочный
сахар, %
Коэффициент
преломления
Молочный
сахар, %
Коэффициент
преломления
Молочный
сахар, %
Коэффициент
преломления
Молочный
сахар, %
3400
01
02
03
04
05
06
07
08
09
3,52
3,57
3,61
3,65
3,69
3,73
3,77
3,82
3,87
3,93
1,3410
11
12
13
14
15
16
17
18
19
3,98
4,03
4,08
4,13
4,18
4,23
4,28
4,33
4,38
4,44
1,3420
21
22
23
24
25
26
27
28
29
4,49
4,54
4,59
4,64
4,69
4,74
4,79
4,84
4,89
4,95
1,3430
31
32
33
34
35
36
37
38
39
5,00
5,05
5,10
5,15
5,20
5,25
5,30
5,35
5,40
5,45
IX. Определение содержания в молоке жировых шариков.
Молочный жир находится в парном молоке в состоянии
эмульсии, а в охлажденном — в виде суспензии — жировых шариков.
Диаметр шариков колеблется от 0,5 до 10 мкм; число их составляет
до 3,5 млрд.
Для исследования 1 мл молока помещают в 50-миллилитровую
колбочку, доливают до метки физиологическим раствором и
тщательно перемешивают. Одну каплю такого разведенного молока с
помощью глазной пипетки наносят на зону сетки счетной камеры
или на предметное стекло и закрывают покровным стеклом
(рис. 48). Вначале исследование проводят под малым
увеличением, затем — под большим увеличением.
Обратите внимание на наличие в поле зрения шариков жира,
их величину. Можно определить их диаметр и количество,
используя методику подсчета эритроцитов.
•. '.
о •
0.5 0
и
♦ о
6 •
о . °0
®
о о
Рис. 48. Жировые шарики молока на фоне шкалы окуляра-микрометра
234
X. Определение содержания в молоке фермента амилазы.
В молоке содержатся ферменты, один из которых — амилаза.
Наличие фермента амилазы в молоке определяют по его
способности расщеплять крахмал. Берут два стаканчика. В один из них
наливают 10 мл свежего молока, а в другой — 10 мл
прокипяченного. В каждый стаканчик прибавляют по 0,5 мл 1%-ного раствора
крахмала (растворимого). Перемешивают содержимое и ставят
стаканчики в термостат на 1 ч при 37 °С. Затем стаканчики
охлаждают в холодной воде, тщательно перемешивают содержимое и
прибавляют в каждый стаканчик по 3 мл йодокалиевого раствора
крахмала и по 5 мл 5%-ного раствора уксусной кислоты. Через
2...3 мин жидкость отфильтровывают через сухой складчатый
фильтр в конические колбы. Сравнивают окраску фильтрата из
обоих стаканчиков. Фильтрат с расщепленным крахмалом —
чисто-желтый (свидетельствует о наличии амилазы), фильтрат с
крахмалом — сине-фиолетовый (амилаза отсутствует).
XI. Определение содержания в молоке витамина С.
В молоке содержатся жирорастворимые и водорастворимые
витамины. Один из них аскорбиновая кислота — витамин С.
Определение наличия в молоке витамина С проводят путем титрования
подкисленного молока окислительно-восстановительным
индикатором — 0,0001 %-ным раствором 2,6-дихлорфенолиндофенола
(синий краситель). При наличии витамина С индикатор
восстанавливается до бесцветной формы.
Берут в коническую колбу 5 мл молока и 10 мл
дистиллированной воды, содержимое взбалтывают. В другую колбу наливают
последовательно 1 мл соляной кислоты, 9 мл дистиллированной
воды и 5 мл разбавленного молока из первой колбы, содержимое
также взбалтывают.
Содержимое второй колбы титруют из микробюретки 2,6-ди-
хлорфенолиндофенолом до появления слабо-розового
окрашивания, не исчезающего в течение 0,5... 1 мин.
Содержание витамина С (мг%) в молоке равняется объему (мл)
раствора 2,6-дихлорфенолиндофенола, затраченного на
титрование, умноженному на объем разбавленного молока (15 мл), на
0,0088 — количество (мг) аскорбиновой кислоты,
соответствующее 1 мл 0,001 н. раствора 2,6-дихлорфенолиндофенола, и на 100,
а затем деленному на произведение объема разбавленного молока,
взятого для титрования (5 мл), на объем молока (цельного),
взятого для анализа (5 мл).
Контрольные вопросы и задания. 1.Что понимают под лактацией? 2. Какие
функции осуществляет молочная железа? 3. Что понимают под секреторной
функцией молочной железы? 4. С какими структурами молочной железы связано
осуществление секреторной функции? 5. Что представляет продукт секреторной
функции молочной железы — молоко (консистенция, цвет, вкус, запах; чем они
235
обусловлены)? 6. Опишите состав молока. 7. Каков процент воды и сухого
вещества в молоке? 8. Содержатся ли в молоке и в каком количестве белки? 9. Какие
виды белка содержатся в молоке и в каком количестве? 10. Содержится ли в
молоке жир, в каком количестве и виде, какого состава? 11. Содержится ли в молоке
сахар, если содержится, то как называется и в каком количестве? 12. Какое
количество неорганических веществ содержится в молоке? Что это за вещества и
содержание каких отдельных веществ преобладает? 13. Содержатся ли в молоке
ферменты, если да, то какие? 14. Содержатся ли в молоке витамины, если да, то
какие? 15. Одинаков ли состав молока у различных животных? 16. У какого вида
домашних животных в молоке наибольшее количество белка и минеральных
веществ? 17. У какого вида домашних животных в молоке наименьшее количество
белка и минеральных веществ? 18. У какого вида домашних животных в молоке
наибольшее количество жира? 19. У какого вида домашних животных в молоке
наименьшее количество жира? 20. Где и как осуществляется биосинтез белков
молока? 21. Где и как осуществляется биосинтез жира молока? 22. Где и как
осуществляется биосинтез молочного сахара (лактозы)? 23. Каков механизм включения
в состав молока неорганических веществ? 24. Опишите механизм регуляции
процесса молокообразования. 25. С каких рецепторных полей осуществляются
влияния на секреторный аппарат молочных желез? 26. Через какие эфферентные
нервы осуществляются рефлекторные влияния на секреторный аппарат молочных
желез? 27. Какими структурами представлено эфферентное звено рефлекторной
дуги рефлекса на секреторный аппарат молочных желез? 28. Где расположен
центр регуляции молокообразования и какое влияние на секреторный аппарат
молочных желез осуществляется им через эфферентные нервы? 29. Какие железы
внутренней секреции принимают участие в рефлекторно-гормональной
регуляции молокообразования? 30. Какие гормоны и какое действие оказывают на
секреторный аппарат молочных желез? 31. Какие факторы кормления и содержания
оказывают положительное влияние на молокообразование? 32. Какие факторы
кормления и содержания отрицательно влияют на молокообразование? 33. Какие
возбудители осуществляют влияние с рецепторных полей на секреторный аппарат
молочных желез? 34. Оказывает ли и какое влияние на секреторный аппарат
молочных желез массаж вымени? 35. Оказывает ли и какое влияние на процесс
образования молока степень выдаивания молока из молочной железы? 36. Когда
интенсивнее происходит образование молока — ночью или днем? 37. Как меняется
интенсивность образования молока в молочной железе в зависимости от промежутка
времени, прошедшего после отела у коров? 38. Как меняется интенсивность
образования молока в молочной железе в зависимости от возраста коров? 39.
Каковы отличия в составе цистернального, альвеолярно-протокового и остаточного
объемов молока? 40. Назовите характерные особенности состава молозива.
5.16. ФИЗИОЛОГИЧЕСКАЯ АДАПТАЦИЯ ЖИВОТНЫХ
Занятие 44. Изучение физиологической адаптации животных
Физиологическая адаптация — совокупность процессов
наследственных и развивающихся в течение индивидуальной жизни
животного, обеспечивающих возможность жизнедеятельности в
измененных условиях среды и в условиях, ранее не совместимых с
жизнью.
Кратковременное действие неблагоприятных факторов
вызывает срочную адаптацию, стресс — реакцию, возбуждение
симпатической и парасимпатической систем, возбуждение желез внут-
236
ренней секреции, мобилизацию энергетических ресурсов,
повышение содержания в крови глюкозы, жирных кислот и кислорода,
учащение сокращений сердца, дыхательных движений и др.
Длительное и многократное действие неблагоприятных
факторов ведет к долговременной адаптации. Она проявляется
гипертрофией нейронов, понижением возбудимости и возбуждения,
гипертрофией желез внутренней секреции, увеличением мощности
систем кровообращения и дыхания.
Цель занятия. Убедиться в наличии у животных срочной и
длительной адаптации и в том, что адаптация осуществляется к фактору
и соответственно сопровождается выраженной адаптацией и
отдельных структурных образований (рецепторов, центров, органов).
Выполние работы. Работа, связанная с исследованием
адаптации, требует больших затрат времени, поэтому на лабораторных
занятиях можно ограничиться демонстрацией животных,
адаптированных к действию тех или иных неблагоприятных факторов, и
демонстрацией реакций адаптированных животных на действие
неблагоприятного фактора, к которому животное адаптировано:
холода, тепла, света, звука, машинного доения, специфического
корма и др.
Можно использовать в качестве демонстрационного материала
и органы адаптированных животных, взятые после их убоя.
5.17. ОБЩАЯ ЭТОЛОГИЯ
Занятие 45. Изучение основ этологического исследования
,>
Для практического усвоения этологии животных разных видов
необходимо изучить и представлять вопросы общей этологии:
1. Дать определение этологии.
2. Назвать главную задачу этологии.
3. Назвать и описать, какими врожденными механизмами
обусловлена целенаправленная адаптивная форма поведения животного.
4. Назвать и описать виды генетически обусловленных,
инстинктивных поведений животных (виды и свойства инстинктов).
5. Назвать и описать, какими механизмами обусловлены
приобретенные в процессе индивидуальной жизни формы поведения
животных.
6. Перечислить все формы научения.
7. Назвать и описать все формы облигатного неассоциативного
научения.
8. Дать определение факультативного ассоциативного научения.
9. Назвать и описать физиологические механизмы
факультативного ассоциативного научения.
237
10. Назвать и описать детерминанты поведения, составляющие
поведения, эмоции.
11. Назвать и описать все формы поведения животных.
12. Назвать и описать типы социального поведения.
13. Определить и описать методы этологических исследований,
а затем составить план-схему этограммы для индивидуального и
группового исследования жизненных поведенческих проявлений
животных.
14. Определить индивидуальное и социальное поведение
животных на ферме и пастбище.
15. Определить и проанализировать на животных с
вживленными в структуры гипоталамуса и лимбической системы
электродами реакции на раздражение этих структур.
Цель занятия. Освоить методы этологических исследований,
индивидуальных и групповых жизненных поведенческих
проявлений животных, основы общей этологии животных.
Объект исследования, материалы и оборудование. 1. Животное
(животные) того или иного вида без и с вживленными в структуры
гипоталамуса и лимбической системы электродами. 2. Рисунки и
схемы по теме. 3. Бланки этограммы, ручка (карандаш);
фотоаппарат, кино- или видеокамера, магнитофон; часы, устройство для
измерения интенсивности движения (шагомер); измерительная и
регистрационная аппаратура для телеметрии и др.;
электростимулятор; вспомогательные устройства.
Выполнение работы. Отвечают на первые 13 вопросов,
предварительно изучив соответствующие разделы учебника и учебных
пособий по этологии животных, лекционный курс по общей
этологии животных.
При составлении плана-схемы этограммы для
индивидуального и группового исследования жизненных поведенческих
проявлений животных необходимо исходить из того, что на первом этапе
этологических исследований ставится задача описать
последовательность суточных жизненных проявлений и составить каталог
всех возможных реакций животных (этограмма), время, число,
объем и характер приема корма, воды, движения, покоя, лежания,
стояния, дефекации, мочеиспускания и др. Наблюдения
фиксируют простым протоколированием (посредством записей)
поведения животного в соответствующие бланки — этограммы.
Поведение можно фиксировать фотографированием, кино- и
видеосъемкой, звукозаписью и др.
При изучении поведения группы животных этологические
показатели снимают 2...3 исполнителя. Животных необходимо
метить (цветной краской, пластмассовыми бирками). Исследование
должно вестись непрерывно в течение суток. Специфика
определенных отрезков суточного режима может быть изучена только
238
при многократных повторениях записей о поведении,
характерном для соответствующего периода суток.
Для выяснения роли центральных механизмов регуляции
поведенческих актов животного используют методы стимуляции
структур этих механизмов на животных с предварительно
вживленными в структуры центральной нервной системы электродами,
а также введение специальных химических веществ
избирательного действия в организм. В этих же целях проводят
предварительное удаление отдельных структур этих механизмов или
подавление их активности специальными химическими веществами
избирательного действия. При этом (или затем) определяют,
описывают, анализируют характер и степень изменений поведенческих
актов.
5.18. ЧАСТНАЯ ЭТОЛОГИЯ
Занятие 46. Изучение частной этологии
крупного рогатого скота
Цель занятия. Уяснить особенности поведения крупного
рогатого скота: 1. Наблюдение и описание жизненных проявлений у
телят в период молочного питания. 2. Определение и описание
основных жизненных проявлений у коров при содержании на
привязи, при беспривязном содержании, на пастбище; социального
поведения дойных коров.
Объект исследования, материалы и оборудование. 1. Телята,
дойные коровы, бык. 2. Рисунки и схемы по теме. 3. Бланки этограм-
мы, ручка (карандаш); фотоаппарат, кино- или видеокамера,
магнитофон; часы, устройство для измерения интенсивности
движения (шагомер); измерительная и регистрационная аппаратура для
телеметрии и др.
Выполнение работы. Этнологические исследования телят
включают в себя изучение их основных жизненных проявлений в
процессе роста и развития.
Определите и опишите особенности основных форм
поведения: пищевого, комфортно-гомеостатического, пассивного и
активного оборонительного, исследовательского, игрового,
подражательного, экстраполяционного, в экстремальных ситуациях,
сна, а также формирование типов социального поведения —
стадного, ритуального, полового, коммуникационного. При этом
ведите учет и регистрацию с помощью специальной аппаратуры
времени, затраченного на лежание, сон, стояние, ходьбу, питье,
поедание грубого корма, концентрированного корма и жвачку, а
также количества актов дефекации, мочеиспускания, характера
239
реакции телят на появления и действия коровы-матери,
ухаживающего персонала, посторонних людей, животных, новых
предметов, проявлений общения и коммуникации после объединения
телят в группы.
У взрослого крупного рогатого скота обратите внимание: на выбор
(предпочтение) вида корма, продолжительность времени приема
корма, скорость потребления корма, распределение приема корма
по времени, приема воды (количество приемов и объем), время
потребления воды и его распределение по периодам, жвачный
процесс (число периодов и продолжительность), дефекацию и
мочеиспускание (ритуальное поведение, частота, объем кала и мочи),
отдыха (число периодов, время, поза, выбор места для лежания, сна,
распределение времени стояния, лежания, сна), двигательную
активность (распределение времени, продолжительность,
расстояние), поведение коров на пастбище (выбор корма, причины
беспокойства, двигательная активность, время пастьбы, соблюдение
индивидуальных дистанций), проявления оборонительного
поведения, исследовательского, экстраполяционного и социального
поведения (способы взаимного общения между животными,
социальные отношения), поведение быка, поведение коровы в период
полового возбуждения, поведение, связанное с доением.
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения
крупного рогатого скота.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем крупного рогатого скота. 2. Назовите основные
особенности высшей нервной деятельности крупного рогатого скота. 3. Каковы формы
индивидуального поведения крупного рогатого скота? 4. Каковы типы
социального поведения крупного рогатого скота? 5. Каковы особенности пищевого
поведения крупного рогатого скота? 6. Каковы особенности питьевого поведения
крупного рогатого скота? 7. Как проявляется комфортно-гомеостатическое
поведение крупного рогатого скота? 8. Как проявляется пассивное и активное
оборонительное поведение крупного рогатого скота? 9. Как проявляется
исследовательское поведение крупного рогатого скота? 10. Как проявляются игровое и
подражательное поведение крупного рогатого скота? 11. В чем особенности
экстраполяционного поведения и поведения в критических ситуациях крупного рогатого скота?
12. Как проявляется половое поведение коровы и быка? 13. Как проявляется
материнское поведение у коров? 14. Как проявляется стадное поведение крупного
рогатого скота? 15. Как проявляются ритуальное поведение и коммуникации у
крупного рогатого скота? 16. Каковы особенности жизненных проявлений у
телят?
Занятие 47. Изучение частной этологии овец
Цель занятия. Уяснить особенности поведения овец: 1.
Наблюдение и описание жизненных проявлений у ягнят в период
молочного питания. 2. Определение и описание основных жизненных
240
проявлений у овец при содержании на фермах, при стадном
содержании.
Объект исследования, материалы и оборудование. 1. Ягнята,
овцы, баран. 2. Рисунки и схемы по теме. 3. Бланки этограммы,
ручка (карандаш); фотоаппарат, кино- или видеокамера,
магнитофон; часы, устройство для измерения интенсивности движения
(шагомер); измерительная и регистрационная аппаратура для
телеметрии и др.
Выполнение работы. Этологические исследования ягнят
включают в себя изучение их основных жизненных проявлений в связи с
интенсивной перестройкой структур и процессов тканей и
органов, приспособлением к новым типам питания, микроклимату,
погодным влияниям. Обратите внимание, определите и опишите
особенности пищевого поведения в раннем постнатальном
периоде. Ягнята рождаются высоконогими; их рост в высоту
продолжается интенсивно и в последующем. Как при сосании ягненок
изменяет положение шеи и головы, конечностей? Интенсивный
рост связан с большими потребностями в питательных веществах.
Как часто ягненок сосет? Стимулирует ли ягнят к сосанию
временная изоляция их от матерей? Как на число сосаний влияет
степень освещенности? Ведет ли нарушение режима у ягнят к
компенсации более тесным контактом с матерью? Как с возрастом
меняется предпочтение к видам кормов? Влияет ли степень
освещения на продолжительность сна ягнят? Как рано у ягнят
начинают выраженно проявляться исследовательское, игровое,
подражательное, пассивное и оборонительное типы поведения,
формироваться тип социального поведения?
При изучении жизненных проявлений у взрослых овец обратите
внимание и оцените способность выбора (предпочтения)
съедобных частей растений (листочков, тонких стебельков, зерен) в
грубых кормах, лучших растений на пастбище; проявление вкусовой
избирательности, чередование пастьбы с периодом жвачки,
изменение пищевого поведения в зависимости от рациона; пищевого,
питьевого и комфортного поведения в зависимости от погоды и
микроклимата, значительность приспособляемости к способам
содержания, жизненные проявления, обусловленные
внутренними и внешними стимулами, связанными с особенностями
использования территории, степень проявления стадного поведения по
сравнению с поведением, связанным с самосохранением,
выраженность проявления преимущества положения одних особей по
отношению к другим, полового ритуального поведения у баранов,
способность адаптации к различным стрессам, выраженность
проявления пассивного оборонительного поведения, выраженность
агрессивного поведения баранов, способность преодолевать
большие расстояния.
241
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения овец.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем у овец. 2. В чем основные особенности высшей нервной
деятельности у овец? 3. Какие формы индивидуального и типы социального
поведения у овец? 4. Как проявляется пищевое и питьевое поведение у овец? 5. Как
проявляется комфортно-гомеостатическое поведение у овец? 6. Как проявляются
пассивное и активное оборонительное поведение у овец? 7. Как проявляются
исследовательское игровое и подражательное поведение у овец? 8. Назовите формы
полового поведения овцы и барана. 9. Назовите материнское поведение у овец.
10. Каково стадное поведение у овец? 11. В чем проявляются ритуальное
поведение и коммуникации у овец? 12. В чем особенности жизненных проявлений у
ягнят?
Занятие 48. Изучение частной этологии лошадей
Цель занятия. Уяснить особенности поведения лошадей: 1.
Наблюдение и описание жизненных проявлений (поведения) у
жеребят в период молочного питания. 2. Определение и описание
основных жизненных проявлений (поведения) у лошадей при
содержании в конюшне и на пастбище.
Объект исследования, материалы и оборудование. 1. Жеребята,
кобылы, жеребец. 2. Рисунки и схемы по теме. 3. Бланки этограм-
мы, ручка (карандаш); фотоаппарат, кино- или видеокамера,
магнитофон; часы, устройство для измерения интенсивности
движения (шагомер); измерительная и регистрационная аппаратура для
телеметрии и др.
Выполнение работы. Этнологические исследования жеребят
включают в себя изучение их основных жизненных проявлений в связи
с нарастающей двигательной активностью, с частыми актами
сосания, выраженным проявлением пассивного оборонительного
поведения, бдительной охраной матерью. Обратите внимание,
определите и опишите особенности пищевого поведения жеребят,
частоту и продолжительность актов сосания, число подходов к
вымени; на возраст, когда жеребенок начинает принимать грубый
корм; на позу при пастьбе; на особенности комфортного
поведения, тип активности (время лежания, стояния, движения); число
и продолжительность мочеиспусканий, дефекаций; когда и как
начинают проявляться исследовательское, игровое,
подражательное, пассивное и активное оборонительное, экстраполяционное
типы поведения, каковы особенности сна.
При изучении жизненных проявлений (поведения) у взрослых
лошадей обратите внимание, определите и опишите все формы
индивидуального и типы социального поведения; особенности
поведения, связанные с рядом физиологических особенностей лошади:
242
кишечным типом пищеварения, хорошим восприятием близких и
отдаленных предметов, довольно широким частотным диапазоном
улавливаемых звуков, острым обонянием, значительной
тактильной чувствительностью, эмоциональностью, обусловленной
филогенетическим развитием, большими способностями
ориентироваться в пространстве, наличием статического аппарата;
проявлением безотчетного страха, ужаса («стампед») при чрезвычайных
ситуациях.
При оценке пищевого поведения лошади опишите все
особенности приема корма в конюшне и на пастбище, а также
особенности комфортно-гомеостатического поведения (особенности
реакции систем потоотделения и дыхания на повышенную
температуру среды), сна, исследовательского поведения, оборонительного,
подражательного, полового поведения жеребца, материнского,
стадного, ритуального, коммуникационного поведения.
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения лошадей.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем у лошадей. 2. Каковы основные особенности высшей
нервной деятельности у лошадей? 3. Каковы формы индивидуального и типы
социального поведения лошадей? 4. В чем особенности пищевого и питьевого поведения
у лошадей? 5. В чем особенности комфортно-гомеостатического поведения у
лошадей? 6. В чем особенности пассивного и активного оборонительного поведения
у лошадей? 7. Каковы особенности исследовательского, игрового,
подражательного, экстраполяционного поведения, поведения в критических ситуациях у
лошадей? 8. Каковы особенности полового поведения кобылы и жеребца? 9. В чем
особенности материнского поведения кобыл? 10. Каковы особенности стадного
поведения у лошадей? 11. Каковы особенности ритуального поведения, эмоций,
коммуникации у лошадей? 12. Опишите особенности поведения жеребят.
Занятие 49. Изучение частной этологии свиней
Цель занятия. Уяснить основные особенности поведения
свиней: 1. Наблюдение и описание жизненных проявлений
(поведения) у поросят в период молочного питания. 2. Определение и
описание основных жизненных проявлений (поведения) у свиней
при различных технике и технологии выращивания.
Объект исследования, материалы и оборудование. 1. Поросята,
свиньи, хряк. 2. Рисунки и схемы по теме. 3. Бланки этограммы,
ручка (карандаш); фотоаппарат, кино- или видеокамера,
магнитофон; часы, устройство для измерения интенсивности движения
(шагомер); измерительная и регистрационная аппаратура для
телеметрии и др.
Выполнение работы. Этологичесше исследования поросят
включают в себя изучение их основных жизненных проявлений с уче-
243
том их биологических потребностей. Учтите способ содержания
поросят (на твердом полу с обогреваемым логовом, на твердом
полу с обогревом животных инфракрасным обогревателем, в
клетках с решетчатым полом, ограничивающих поросят в движении);
возраст, в котором осуществлен отъем; температуру воздуха в
свинарнике; занимаемую животным площадь; свойственное им
соперничество в форме отталкивания друг от друга головой.
У поросят отсутствует защитный подкожный слой жира.
Показателем дискомфорта у поросят служит лежание друг на друге,
беспокойство. Комфортными можно считать показатели
температуры, при которых лежит не менее 75 % поросят.
При изучении жизненных проявлений (поведения) у взрослых свиней
определите: хуже или лучше, чем у других видов животных, у них
развита зрительная сенсорная система; распознают ли они черный
и белый цвета; звуковые раздражители воздействуют на них
интенсивнее или слабее световых; хорошо ли распознают звуковые
сигналы. Голоса, издаваемые свиньями, разнообразны и
характерны для разных жизненных ситуаций или нет? С помощью
обонятельной сенсорной системы различают ли они разные предметы, с
помощью вкусовой сенсорной системы тонко ли
дифференцируют сладкое, горькое, соленое, кислое, металлическое. Свиньи
большинство осязательных восприятий осуществляют через
рецепторы рыла.
При изучении жизненных проявлений у взрослых свиней
определите и опишите все основные формы поведения (пищевое,
комфортное, оборонительное, исследовательское, игровое,
подражательное, в критических ситуациях, сон, половое, материнское), а
также типы социального поведения (стадное, ритуальное,
коммуникационное). Учтите при этом распределение времени приема
корма и воды при ненормированном кормлении в течение суток,
время отдыха и положение тела во время отдыха, число дефекаций
и мочеиспусканий, проявление других форм поведения, влияние
числа свиней в станке на поведение, влияние среды и технологии
содержания.
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения
свиней.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем у свиней. 2. Каковы основные особенности высшей
нервной деятельности у свиней? 3. Опишите формы индивидуального и типы
социального поведения свиней. 4. В чем особенности пищевого и питьевого поведения у
свиней? 5. В чем особенности проявления комфортно-гомеостатического
поведения у свиней? 6. В чем особенности проявления пассивного и активного
оборонительного поведения у свиней? 7. В чем особенности проявления
исследовательского, игрового, подражательного, экстраполяционного поведения,
поведения в критических ситуациях у свиней? 8. В чем особенности проявления поло-
244
вого поведения у свиньи и хряка? 9. В чем особенности проявления материнского
поведения у свиньи? 10. В чем особенности проявления стадного поведения у
свиней? П. В чем особенности проявления ритуального поведения и коммуникации
у свиней? 12. В чем особенности поведения поросят и каково влияние на
поведение поросят изменений условий окружающей среды?
Занятие 50. Изучение частной этологии кроликов
Цель занятия. Уяснить основные особенности поведения
кроликов: 1. Наблюдение и описание жизненных проявлений
(поведения) у крольчат в период молочного питания. 2. Определение и
описание основных жизненных проявлений (поведения) у
кроликов на фермах.
Объект исследования, материалы и оборудование. 1. Крольчата,
кролики. 2. Рисунки и схемы по теме. 3. Бланки этограммы, ручка
(карандаш); фотоаппарат, кино- или видеокамера, магнитофон;
часы, устройство для измерения интенсивности движения
(шагомер); измерительная и регистрационная аппаратура для
телеметрии и др.
Выполнение работы. Этологические исследования крольчат
включают в себя изучение их основных жизненных проявлений с
учетом биологических потребностей. Крольчата рождаются слепыми
и голыми. Первые 20 сут жизни новорожденные крольчата
питаются только молоком и остаются в гнезде. Ведите наблюдение за
материнским поведением крольчихи-матери и определите,
кормит ли крольчат она в гнезде в определенное время или в разное,
при отсутствии отвлекающих факторов или независимо от них. У
крольчат в первые 45 сут жизни ограничены возможности
механизмов теплорегуляции поддерживать температуру тела на
нормальном уровне при температурном дискомфорте. Определите,
как долго вне гнезда могут пребывать крольчата в зависимости от
возраста.
При изучении жизненных проявлений у кроликов определите и
опишите все основные формы поведения (пищевое, комфортное,
оборонительное, исследовательское, игровое, подражательное, в
экстремальных и критических ситуациях, половое, материнское,
стадное, ритуальное, коммуникацию). Определите, высокие или
низкие у кроликов функциональные возможности всех сенсорных
систем, как тонко они реагируют на изменение условий внешней
среды. Большие ли у них потребности в питательных веществах в
связи с интенсивным обменом веществ. Часто ли они едят корма в
течение суток. Свойственна ли кроликам копрофагия — поедание
собственного кала. У кроликов нет потовых желез и в связи с этим
обусловлены особенности их реакции на повышение температуры
воздуха. У кроликов низкая степень развития ума. Опишите осо-
245
бенности поведенческих реакций в критических ситуациях. У
самцов проявляется выраженная агрессивность к сопернику.
Опишите, как проявляется эта агрессивность. В общении у кроликов
существенную роль играют химическая, звуковая, тактильная и
визуальная сигнализации. Проведите наблюдение и опишите
особенности поведенческих реакций кроликов на запах и вид новой
особи, на новые звуки, при возможности выбора комфортного
пола.
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения
кроликов.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем у кроликов. 2. Каковы основные особенности высшей
нервной деятельности у кроликов? 3. Каковы формы индивидуального и типы
социального поведения кроликов? 4. В чем особенности пищевого и питьевого
поведения кроликов? 5. В чем особенности комфортно-гомеостатического
поведения кроликов? 6. Как проявляется пассивное и активное оборонительное
поведение у кроликов? 7. Каковы проявления исследовательского, игрового,
подражательного, экстраполяционного поведения и поведения в критических
ситуациях у кроликов? 8. В чем особенности проявления полового поведения у
крольчихи и кролика-самца? 9. В чем особенности проявления материнского
поведения у крольчих? 10. Как проявляется социальное поведение кроликов при
групповом содержании? И. В чем особенности проявления ритуального
поведения и коммуникации у кроликов? 12. Опишите особенности поведения
крольчат.
Занятие 51. Изучение частной этологии птиц
Цель занятия. Уяснить основные особенности поведения птиц:
1. Наблюдение и описание жизненных проявлений (поведения) у
цыплят, гусят, утят. 2. Определение и описание основных
жизненных проявлений (поведения) у птиц в условиях группового
содержания в птичниках.
Объект исследования, материалы и оборудование. 1. Цыплята,
гусята, утята, обоего пола куры, гуси и утки. 2. Рисунки и схемы
по теме. 3. Бланки этограммы, ручка (карандаш); фотоаппарат,
кино- или видеокамера, магнитофон; часы, устройство для
измерения интенсивности движения (шагомер), измерительная и
регистрационная аппаратура для телеметрии; набор разных видов
зерновых и мучных кормов; участки в птичнике с разной
температурой воздуха, с разной скоростью движения воздуха.
Выполнение работы. Этологические исследования цыплят, гусят,
утят включают в себя изучение их основных жизненных
проявлений в процессе взаимосвязей с птицей-матерью или возле
искусственной наседки, или в социальной ячейке (семье) при
свободном доступе к корму. У птенцов недостаточно развит терморегуля-
246
ционный механизм, для них характерен частый ритм приема
корма, связанный с интенсивными обменом веществ и
пищеварением. Терморегуляционные механизмы оказываются хорошо
развитыми на 15...20-е сутки после вылупления. До 2-недельного
возраста зона термонейтральности не превышает 1...2 °С и колеблется в
пределах 35 °С.
При изучении жизненных проявлений (поведения) у взрослых птиц
определите и опишите все основные формы поведения (пищевое,
комфортное, оборонительное, исследовательское, игровое,
подражательное, экстраполяционное и в экстремальных ситуациях, сон,
аномальное, половое, родительское, стадное, ритуальное,
коммуникационное).
Возьмите несколько видов корма, отличающихся по величине,
твердости частиц и по вкусовым качествам, разложите их в
доступности для птицы и ведите наблюдение за пищевым
поведением. У птиц слабо развита вкусовая сенсорная система. Определите,
по каким показателям предложенного корма преимущественно
они оценивают корм. Обратите внимание, что оценка птицами
корма осуществляется преимущественно зрительной и
тактильной сенсорной системами, по величине и твердости частиц или
по вкусовым качествам, что оптимальная величина частиц
принимаемого корма связана с величиной клюва, шириной
пищевода. Глаза птиц отличаются быстрой и точной аккомодацией.
Обратите внимание и определите, как быстро птицы отыскивают
место расположения предпочитаемого корма среди набора
большого ряда разных кормов. Определите комфортное поведение
птиц после помещения их в условия с разным микроклиматом
(температурой, скоростью движения воздуха). Одним из важных
факторов, определяющих поведение птиц, является
микроклимат в птичнике. Нижняя граница комфортной температуры для
кур 16...18°С и верхняя граница 29...32°С. У птиц нет хорошо
развитых потовых желез, защита организма от перегрева
обеспечивается с помощью учащенного дыхания открытым клювом,
растопыривания крыльев, повышенного потребления воды. Как
стрессовый фактор на птиц действуют высокая скорость
движения воздуха, повышенная влажность, загрязненность воздуха,
сильные звуковые раздражители, перемещение на новое место. У
птиц слабо развита память, они плохо запоминают место
обитания, у них длительное время формируются условные рефлексы.
Им свойственна социальная иерархия. Спариванию
предшествует характерный ритуал ухаживания. У птиц проявляется реакция
на гнездо.
С учетом этих особенностей оцените и опишите поведение
птиц при действии сильных звуковых раздражителей, при
перемещении на новое место и возвращении на старое место после дли-
247
тельного отсутствия. Определите особенности социальной
иерархии, полового, ритуального поведения, коммуникации.
По результатам наблюдений, описаний, различных форм
регистрации оформите заключение об особенностях поведения птиц.
Контрольные вопросы и задания. 1. Назовите основные особенности
физиологии сенсорных систем у птиц. 2. Каковы основные особенности высшей нервной
деятельности у птиц? 3. Какие формы индивидуального и типы социального
поведения птиц вы знаете? 4. В чем особенности пищевого и питьевого поведения
птиц? 5. Каковы особенности комфортно-гомеостатического поведения у птиц?
6. Как проявляется пассивное и активное оборонительное поведение у птиц?
7. В чем особенности проявления исследовательского, игрового,
подражательного, экстраполяционного поведения, поведения в критических ситуациях у птиц?
8. Каковы особенности проявления полового поведения у курицы, гусыни, утки,
индейки и петуха, гусака, селезня, индюка? 9. В чем особенности проявления
материнского поведения у птиц? 10. Как проявляется социальное поведение птиц
при групповом содержании? 11. Каковы проявления ритуального поведения и
коммуникации у птиц? 12. Опишите особенности поведения цыплят, гусят, утят,
индюшат.
ПРИЛОЖЕНИЯ
о
1. Основные физиологические константы домашних животных
Показатель
Масса тела, кг
Масса кожи, % от
массы тела
Толщина кожи,
мм
Объем крови, % от
массы тела
Гематокрит, %
Эритроциты, 1012/л
Гемоглобин,
ммоль/л
СОЭ, мм, через:
15 мин
30 мин
45 мин
60 мин
Лейкоциты, 109/л
Тромбоциты, 109/л
Лейкоцитарная
формула (лейкограмма):
Базофилы
Эозинофилы
Палочкоядерные
нейтрофилы
Сегментоядерные
нейтрофилы
Лимфоциты
Моноциты
Лошади
400...
700
3...4
1,5...
5,0
10
39
8...10
1,24...
2,02
35
54
58
64
7...12
350
0,5
4
4,5
54
34
3
Крупный
рогатый
скот
400...
600
4...5
2,7...
10,6
8,2
36
5,6...
7,5
1,4...
1,86
0,15
0,35
0,50
0,70
6...10
450
1
6,5
3
28
57
4,5
Овцы,
козы
40...70
5...7
0,7...
3,0
8,7
32
7,5...
12,5
1,09...
1,7
0,2
0,4
0,6
0,6
6...11
350
0,5
7,5
4
40
45
3
Свиньи
100...
300
4...5
1,5...
3,0
7
42
6...
7,5
1,4...
1,7
1,0
3,0
5,0
8,0
8...16
210
0,5
2
4
44
45
4,5
Птицы
(куры)
1,5...3
0,31...
2,38
8,5
37
2,5...
4,5
1,24...
2,02
0,5
2,0
3,5
4,0
20...40
50
2(1—3)
8
(4...10)
—
30(36)
54(50...
60)
6...7
Кролики
2...4
7...8
(Н,5)
0,13...
0,88
5,4
40
(35...45)
5...
7,5
1,55...
1,86
0
0,3
0,9
1,5
6...9
190
Ц2...6)
2(0,5...
3,5)
7
36(38...
58)
52(45...
65)
2(4...9)
Собаки
6...15
3,8...8
0,52...
1,04
6,8
37...55
5,2...
8,4
1,705...
2,635
0,2
0,9
1,7
2,5
8,5...10,5
250...550
0...2
2...6
60...80
12...30
1...7
Кошки
1,5...2
8...10
0,39...
0,65
5
35...45
5...12
1,24...
1,86
7...9
4...30
9...90
0
4...8
59...78
22...40
1...4
249
Продолжение
Показатель
Лошади
Крупный
рогатый
скот
Овцы,
козы
Свиньи
Птицы
(куры)
Кролики
Собаки
Кошки
Свертываемость крови, 11
мин
рН крови 7,3...7,5
Число групп (систем)
крови
2,5
3 0,5...2
7,2... 7,46... 7,44... 7,40... 7,4
7,45 7,52 7,47 7,44
13
16
Частота сердечных 25...
сокращений, 42
в покое за 1 мин
17
14
Круговорот крови, с 31,5 31,5 23,6 27,0 2,9
60... 60... 60... 130... 100...
75 80 80 200 140
2,5 2,5
7,36... 7,28...
7,6 7,44
21,0
60... 100...
160 140
Артериальное
давление, мм рт. ст.:
максимальное
минимальное
Венозное давление,
мм вод. ст.
Частота дыхания,
в покое за 1 мин
Дыхательный объем,
45...100
80...130
8...16
л 4...6
(1,75...
12)
110...160 110...140 100... 135... 130... 90...
120 155 200 ПО
30...50 50...65 45...55 100...130 65..J6
80...130 90...115 90...110
120... 125...
140 145
30...40 95
90... 100
10...30 10...20 8...18 18...34 15...30 10...30 20...30
Общая (жизненная) 24...26
емкость легких (и
воздухоносных мешков
у птиц), л
5...6 0,3...0,5 0,3...0,7 0,019...
(1,9...7) 0,02
30 1,4...4 2...4 0,16...0,18
0,175 0,037...
0,047
Суточный объем
слюны, л
Суточный объем
желудочного (сычужного)
сока, л
Суточный объем
поджелудочного сока, л
Суточный объем
кишечного сока, л
Суточный объем
желчи, л
50
30...40
5...8
15...30
6
90...190
40...80
5...7
50
7...9,5
6...16
6
0,6
5
0,8
15
6...9
10
10
3
0,01...
0,015
0,011...
0,013
л/ч
0,05
0,135
0,26...
0,36
0,08
0,15
0,05
од
0,03
0,12... 0
0,24
0,3
1
0,3
250
Продолжение
Показатель
Лошади
Крупный
рогатый
скот
Овцы,
козы
Свиньи
Птицы
(куры)
Кролики
Собаки
Кошки
Необходимый суточный
объем воды, л
50
Объем выведенной во- 4... 18
ды из организма в сутки,
мл/кг массы тела
Период биологического 8,4
полувыведения воды,
сут
Выведение воды 50
с испарениями, %
Суточный объем выде- 6... 11
ляемой мочи, л
40...90 3...11 10...26 0,15...
0,26
17...45 10...40 5...30 25...120
3,5.-4,2 5,4
23,8 26,1
15
6...20 0,5...1,5 2...6
3,61..
7,3
17
24,4
27... 0,04..
70 мл/кг 0,1
2...100
24,4
0,25...
1,0
0,1...
0,2
Температура тела, °С 37,5... 37,5... 38,5... 38,0... 40,5... 38,5...
38,5 39,5 44,0 40,0 42,0 39,5
Возраст наступления 15...18 6...10 6...10 5...8 5 4...9
половой зрелости, мес
Возраст спаривания, 3... 16...18 12...18 9...11 5...6 8...10
мес 4 года
Длительность деятель- 25...30 14...17 8...10 7...10 4...5 4
ности половых органов,
лет
Продолжительность 42 53 48 34 25 41
развития спермиев, сут
Объем эякулята (спер- 40...200 1...5 1...5 200... 0,4... 0,5...
мы), мл 500 1,6 4
Продолжительность 1... 2...10 с 2...10 с 7... 2...3 с 20...
эякуляции 3 мин 8 мин 50 с
Число спермиев в 1 мл 0,1...
спермы, млрд 0,15
1...1,5 2...5 0,15... 1,3...3,5 0,1
0,21
Продолжительность 20...21 18...22 14...19 19...21
полового цикла, сут (10...37) (19...23) (12...27)(19...23)
Продолжительность
половой охоты
5...7
сут
10...23
ч
30...
38 ч
40...
60 ч
5...9
(не -
лярный)
3...5
сут
37,5... 38,2...
39,0 38,9
6...12 4...12
12...18 9...12
7...9 9...10
56
0,5-20, 0,2...
3 фрак- 0,5
ции:
0,2...2;
0,5.-3;
15...20
10... 20...
30 мин 50 с
0,5... 0,2...
0,1(1) 0,05
(0,5)
90...150 18
(11...
51;
15...
28)
1...3 суг 6...8
(3...20)
сут
251
Продолжение
Показатель
Лошади
Крупный
рогатый
скот
Овцы,
козы
Свиньи
Птицы
(куры)
Кролики
Собаки
Кошки
Время овуляции, ч
24...36
(до
конца
течки)
Продолжительность 335
беременности, сут (307...
412)
Продолжительность
родов:
подготовительная 12 ч
стадия
выведения плода
выведения последа
Послеродовой период, 8... 12
сут
Выведение лохий, сут 2...3
Оптимальная длитель- 180...
ность лактации, сут 210
Продолжительность
фаз антенатального
онтогенеза, сут:
зародышевая До 13..
15
эмбриональная
плодная
Продолжительность
фаз постнатального
онтогенеза:
новорожденное™,
сут
молочного питания,
сут
переходная, мес
Масса тела при
рождении, кг/% от массы
тела матери
Продолжительность
жизни, лет
До 97
До 335
До 10
До 45
До 6...8
26...50/
8...12
25...30
(до 67)
10...12 24...36, 36...40
(после 36...40 (после
конца (после начала
течки) начала течки)
течки)
284 150 114
(240... (140... (ПО...
310) 310) 140)
10...12 24 24...30
(после (после (после
коиту- начала
коитуса) течки) са)
Тнку-
>ации
яиц
30
(28...
32)
62
(59...
65)
56...66
20...21
4...6 ч 4...6 ч 2...6 ч
2...7 сут З.-.Юч З...6ч
10...30
мин
5...30
мин
8...12
30
мин...
4ч
7...12 ч
15...27
20... 2...6 ч
90
мин
1...2 ч Вместе
с
плодом
18...20 15...17
15...
30
мин
Вместе
с
плодом
10...15
1.-6 ч 10
мин...
12 ч
Вместе Вместе
с пло- с
плодом дом
10...14 10...15
10 7...9 5...7
365 120... 60
150
4...5 5...8 4...5
10...20 30...49
До 13... До И... До 11... Разви- До
15 13 13 тие 7...9
эмбриона
20....21
До
7...9
До
7...9
сут
До 60 До 46 До 38
До 284 До 150 До 114
До7...10До6...Ю До 5
До 28 До 20 До 14
До 3...8 До 4 До 2
20...45/ 2...4,3/ 1...1,5/
7...9 6...8 0,5...1
До 18
До 30 До 62 До 63
До3...4 До3...4До3...4
До 20 До 21 До 21
До До 49 сут До
40 сут 49 сут
0,04... 0,1...0,3/"0,09..
0,09/ 0,18/
2..А5 3,6...7,2
20 14 15...20 12...13 5...7 20...25 10...20
(до 40) (до 18) (12) (13...35)
252
2. Напряжение водяного пара
Температура,
°С
Напряжение,
мм рт.
ст.
Температура,
"С
Напряжение,
мм рт
ст.
Температура,
°С
Напряжение,
мм рт.
ст.
Температура,
°С
Напряжение,
мм рт
ст
Температура,
°С
Напряжение,
мм рт
ст.
10,0
10,1
10,2
10,3
10,4
10,5
10,6
10,7
10,8
10,9
11,0
11,1
11,2
11,3
11,4
11,5
11,6
11,7
11,8
11,9
12,0
12,1
12,2
12,3
12,4
12,5
12,6
12,7
12,8
12,9
13,0
13,1
13,2
13,3
13,4
13,5
13,6
13,7
13,8
13,9
9,14
9,20
9,26
9,32
9,39
9,45
9,51
9,57
9,64
9,70
9,77
9,83
9,90
9,96
10,03
10,09
10,16
10,23
10,30
10,36
10,43
10,50
10,57
10,64
10,71
10,78
10,85
10,92
10,99
11,06
11,14
11,21
11,28
11,36
11,43
11,50
11,58
11,65
11,73
11,81
14,0
14,1
14,2
14,3
14,4
14,5
14,6
14,7
14,8
14,9
15,0
15,1
15,2
15,3
15,4
15,5
15,6
15,7
15,8
15,9
16,0
16,1
16,2
16,3
16,4
16,5
16,6
16,7
16,8
16,9
17,0
17,1
17,2
17,3
17,4
17,5
17,6
17,7
17,8
17,9
11,88
11,96
12,04
12,11
12,19
12,27
12,35
12,43
12,51
12,59
12,67
12,75
12,83
12,92
13,00
13,09
13,17
13,25
13,34
13,42
13,51
13,60
13,68
13,77
13,86
13,99
14,03
14,12
14,21
14,30
14,39
14,49
14,58
14,67
14,76
14,86
14,95
15,04
15,14
15,23
18,0
18,1
18,2
18,3
18,4
18,5
18,6
18,7
18,8
18,9
19,0
19,1
19,2
19,3
19,4
19,5
19,6
19,7
19,8
19,9
20,0
20,1
20,2
20,3
20,4
20,5
20,6
20,7
20,8
20,9
21,0
21,1
21,2
21,3
21,4
21,5
21,6
21,7
21,8
21,9
15,33
15,43
15,52
15,62
15,72
15,82
15,92
16,02
16,12
16,22
16,32
16,42
16,52
16,63
16,73
16,83
16,94
17,04
17,15
17,26
17,36
17,47
17,58
17,69
17,80
17,91
18,02
18,13
18,24
18,35
18,46
18,58
18,69
18,81
18,92
19,04
19,16
19,27
19,39
19,51
22,0
22,1
22,2
22,3
22,4
22,5
22,6
22,7
22,8
22,9
23,0
23,1
23,2
23,3
23,4
23,5
23,6
23,7
23,8
23,9
24,0
24,1
24,2
24,3
24,4
24,5
24,6
24,7
24,8
24,9
25,0
25,1
25,2
25,3
25,4
25,5
25,6
25,7
25,8
25,9
19,63
19,75
19,87
19,99
20,11
20,23
20,36
20,48
20,61
20,73
20,86
20,98
21,11
25,5
21,37
21,50
21,63
21,76
21,89
22,02
22,15
22,28
22,42
22,55
22,69
22,82
22,96
23,10
23,24
23,33
23,52
23,66
23,80
23,94
24,08
24,23
24,37
24,52
24,66
24,81
26,0
26,1
26,2
26,3
26,4
26,5
26,6
26,7
26,8
26,9
27,0
27,1
27,2
27,3
27,4
27,5
27,6
27,7
27,8
27,9
28,0
28,1
28,2
28,3
28,4
28,5
28,6
28,7
28,8
28,9
29,0
29,1
29,2
29,3
29,4
29,5
29,6
29,7
29,8
29,9
24,95
25,10
25,25
25,40
25,55
25,70
25,85
26,01
26,16
26,31
26,47
26,63
26,78
26,94
27,10
27,26
27,42
27,58
27,74
27,90
28,06
28,23
28,39
28,56
28,73
28,89
29,06
29,23
29,40
29,57
29,74
29,92
30,09
30,26
30,44
30,61
30,79
30,97
31,15
31,33
253
3. Коэффициент для приведения 1 л влажного воздуха (при t= 10...25 °С
и давлении 740...780 мм рт. ст.) к нормальным условиям
(абсолютная сухость, t= 0 °С, давление 760 мм рт. ст.)
Тем-
пе-
рату-
ра,
°С
Атмосферное давление, мм рт. ст.
715
716
717
718
719
720
721
722
723
724
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
0,9096
0,9044
0,9012
0,8981
0,8950
0,8918
0,8888
0,8857
0,8827
0,8796
0,8766
0,8737
0,8707
0,8678
0,8648
0,8619
0,
0,9056
0,9025
0,8993
0,8962
0,8931
0,8900
0,8869
0,8839
0,8808
0,8778
0,8749
0,8719
0,8690
0,8660
0,8631
0,9101
0,9069
0,9037
0,9006
0,8975
0,8946
0,8913
0,8882
0,8851
0,8821
0,8791
0,8761
0,8731
0,8702
0,8673
0,8644
0,9114
0,9082
0,9050
0,9018
0,8987
0,8956
0,8925
0,8894
0,8863
0,8833
0,8803
0,8773
0,8743
0,8714
0,8685
0,8655
0,9127
0,9095
0,9063
0,9031
0,9000
0,8968
0,8937
0,8907
0,8876
0,8845
0,8815
0,8785
0,8756
0,8726
0,8697
0,8668
0,9139
0,9107
0,9075
0,9044
0,9012
0,8981
0,8950
0,8919
0,8888
0,8857
0,8828
0,8798
0,8768
0,8738
0,8709
0,8680
0,9152
0,9120
0,9088
0,9056
0,9025
0,8993
0,8962
0,8931
0,8900
0,8870
0,8840
0,8810
0,8780
0,8750
0,8721
0,8692
0,9165
0,9133
0,9100
0,9069
0,19037
0,9006
0,8975
0,8944
0,8913
0,8882
0,8852
0,8822
0,8792
0,8763
0,8733
0,8704
0,9177
0,9145
0,9113
0,9081
0,9050
0,9018
0,8987
0,8056
0,8925
0,8894
0,8864
0,8834
0,8804
0,8775
0,8745
0,8716
0,9190
0,9158
0,9126
0,9094
0,9062
0,9031
0,9000
0,8968
0,8938
0,8907
0,8877
0,8846
0,8817
0,8787
0,8757
0,8728
Продолжение
Тем-
пе-
рату-
<£
725
726
727
Атмосферное давление, мм рт. ст.
728
729
730
731
732
733
734
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
0,9203
0,9170
0,9138
0,9106
0,9075
0,9043
0,9012
0,8981
0,8650
0,8919
0,8889
0,8859
0,8829
0,8799
0,8769
0,8740
0,9215
0,9183
0,9151
0,9119
0,9087
0,9056
0,9024
0,8993
0,8962
0,8931
0,8901
0,8871
0,8841
0,8811
0,8782
0,8752
0,9228
0,9196
0,9163
0,9131
0,9100
0,9068
0,9037
0,9006
0,8974
0,8944
0,8913
0,8883
0,8853
0,8823
0,8723
0,8764
0,9241
0,9208
0,9176
0,9144
0,9112
0,9080
0,9049
0,9018
0,8987
0,8956
0,8956
0,8895
0,8865
0,8835
0,8806
0,8776
0,9254
0,9221
0,9189
0,9156
0,9125
0,9093
0,9062
0,9030
0,8999
0,8968
0,8938
0,8908
0,8877
0,8847
0,8808
0,8788
0,9266
0,9234
0,9201
0,9169
0,9137
0,9105
0,9074
0,9043
0,9012
0,8981
0,8950
0,8920
0,8890
0,8859
0,8830
0,8800
0,9279
0,9246
0,9214
0,9182
0,9150
0,9118
0,9087
0,9055
0,9024
0,8993
0,8963
0,8932
0,8902
0,8872
0,8842
0,8812
0,9292
0,9259
0,9226
0,9194
0,9162
0,9130
0,9099
0,9068
0,9036
0,9005
0,8975
0,8944
0,8914
0,8884
0,8854
0,8824
0,9304
0,9271
0,9239
0,9207
0,9175
0,9143
0,9111
0,9080
0,9049
0,9017
0,8987
0,8956
0,8926
0,8896
0,8866
0,8836
0,9317
0,9284
0,9252
0,9219
0,9187
0,9155
0,9124
0,9092
0,9061
0,9030
0,8999
0,8969
0,8938
0,8908
0,8878
0,8849
254
Продолжение
Тем-
пе-
рату-
$
Атмосферное давление, мм рт. ст
735
736
737
738
739
740
741
742
743
744
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
0,9313
0,9297
0,9264
0,9232
0,9200
0,9168
0,9136
0,9105
0,9073
0,9042
0,9012
0,8981
0,8951
0,8920
0,8890
0,8861
0,9342
0,9310
0,9277
0,9244
0,9212
0,9180
0,9149
0,9117
0,9086
0,9054
0,9024
0,8993
0,8963
0,8932
0,8902
0,8873
0,9355
0,9322
0,9280
0,9257
0,9225
0,9193
0,9161
0,9130
0,9098
0,9067
0,9036
0,9005
0,8975
0,8945
0,8915
0,8885
0,9368
0,9335
0,9302
0,9270
0,9237
0,9205
0,9174
0,9142
0,9110
0,9067
0,9048
0,9018
0,8987
0,8957
0,8927
0,8897
0,9380
0,9347
0,9314
0,9282
0,9250
0,9218
0,9186
0,9154
0,9123
0,9091
0,9060
0,9030
0,8999
0,8969
0,8939
0,8909
0,9393
0,9360
0,9327
0,9295
0,9262
0,9230
0,9198
0,9167
0,9135
0,9104
0,9073
0,9042
0,9011
0,8981
0,8951
0,8921
0,9406
0,9373
0,9340
0,9307
0,9275
0,9243
0,9211
0,9179
0,9147
0,9116
0,9085
0,9054
0,9024
0,8993
0,8963
0,8933
0,9418
0,9335
0,9352
0,9320
0,9287
0,9255
0,9223
0,9191
0,9160
0,9128
0,9097
0,9066
0,9036
0,9005
0,8975
0,8945
0,9431
0,9398
0,9365
0,9332
0,9300
0,9268
0,9236
0,9204
0,9172
0,9140
0,9110
0,9079
0,9048
0,9017
0,8987
0,8957
0,9444
0,9411
0,9378
0,9345
0,9312
0,9280
0,9248
0,9216
0,9184
0,9153
0,9122
0,9091
0,9060
0,9029
0,8999
0,8969
Продолжение
Тем-
пе-
рату-
ра,
°С
Атмосферное давление, мм рт. ст.
745
746
747 748
749
750
751
752
753
754
10
11
12
13
14
15
16
17
18
19
20
21
22
23
24
25
0,9457
0,9423
0,9390
0,9357
0,9325
0,9293
0,9261
0,9229
0,9197
0,9165
0,9134
0,9103
0,9072
0,9042
0,9011
0,8981
0,9469
0,9436
0,9403
0,9370
0,9337
0,9130
0,9273
0,9241
0,9209
0,9177
0,9146
0,9115
0,9084
0,9054
0,9023
0,8993
0,9482
0,9449
0,9415
0,9382
0,9350
0,9317
0,9285
0,9253
0,9221
0,9190
0,9159
0,9127
0,9097
0,90616
0,9035
0,9005
0,9495
0,9461
0,9428
0,9395
0,9362
0,9330
0,9298
0,9266
0,9234
0,9202
0,9171
0,9140
0,9109
0,9078
0,9048
0,9017
0,9507
0,9474
0,9441
0,9408
0,9375
0,9342
0,9310
0,9278
0,9246
0,9214
0,9183
0,9152
0,9121
0,9090
0,9060
0,9029
0,9520
0,9487
0,9453
0,9420
0,9387
0,9355
0,9323
0,9290
0,9258
0,9227
0,9195
0,9164
0,9130
0,9102
0,9072
0,9041
0,9533
0,9499
0,9466
0,9433
0,9400
0,9367
0,9335
0,9303
0,9271
0,9239
0,9208
0,9176
0,9145
0,9114
0,9084
0,9053
0,9545
0,9512
0,9478
0,9445
0,9413
0,9380
0,9348
0,9315
0,9283
0,9251
0,9220
0,9189
0,9158
0,9127
0,9096
0,9065
0,9558
0,9525
0,9491
0,9458
0,9425
0,9392
0,9360
0,9328
0,9296
0,9264
0,9232
0,9201
0,9170
0,9139
0,9108
0,9078
0,9571
0,9537
0,9504
0,9470
0,9438
0,9405
0,9372
0,9340
0,9308
0,9276
0,9244
0,9213
0,9182
0,9151
0,9120
0,9090
255
4. Калорический эквивалент 1 л кислорода
при разных значениях дыхательного коэффициента (ЦК)
дк
0,71
0,72
0,73
0,74
0,75
0,76
0,77
0,78
0,79
0,80
0,81
0,82
0,83
0,84
0,85
кДж ( ккал)
19,636 (4,690)
19,686 (4,702)
19,736 (4,714)
19,791 (4,727)
19,841 (4,739)
19,896 (4,752)
19,948 (4,764)
19,996 (4,776)
20,050 (4,789)
20,101 (4,801)
20,151 (4,813)
20,201 (4,825)
20,256 (4,838)
20,306 (4,850)
20,360 (4,863)
| ДК
0,86
0,87
0,88
0,89
0,90
0,91
0,92
0,93
0,94
0,95
0,96
0,97
0,98
0,99
1,00
кДж ( ккал)
20,411 (4,875)
20,461 (4,887)
20,515 (4,900)
20,566 (4,912)
20,616 (4,924)
20,666 (4,936)
20,716 (4,948)
20,766 (4,960)
20,821 (4,973)
20,871 (4,985)
20,921 (4,997)
20,976 (6,010)
21,027 (5,022)
21,076 (5,034)
21,131 (5,047)
5. Приготовление реактивов
Бульон питательный. Хорошее свежее мясо очистить от костей и жира и
измельчить; залить двойным количеством водопроводной воды и оставить в
прохладном месте на ночь. Процедить настой через полотно. Жидкость кипятить
полчаса, при этом часть белков свернется. Фильтровать жидкость через бумажный
фильтр. Фильтрат долить водой до прежнего (исходного) количества. Полученный
препарат называют «мясной» водой. Для приготовления бульона к «мясной» воде
при подогревании и помешивании прибавить 1 % сухого пептона и 0,5 %
химически чистой поваренной соли. Когда пептон и соль растворятся, добавить 10 %
раствора соды до слабощелочной реакции на лакмус. Кипятить бульон полчаса
(он мутнеет от выпадения фосфатов) и отфильтровать. Сохранять бульон в темном
прохладном месте.
Бромная вода. Готовят растворением в дистиллированной воде 4 % брома.
Раствор хранить под тягой.
Гайнеса, реактив (готовят отдельно 3 раствора): 1) 13,3 г х. ч. кристаллической
сернокислой меди растворить в 400 мл дистиллированной воды; 2) 50 г едкого
калия растворить в 400 мл дистиллированной воды; 3) 15 г чистого глицерина
растворить в 200 мл дистиллированной воды. Смешать первый и второй реактив и
тотчас прилить третий. Реактив стоек.
Гимза, краска. Краска состоит из 0,8 г азура II, 3 г эозина, 250 мл глицерина
(х. ч.) и 250 мл метилового спирта. Для окрашивания препаратов краситель перед
употреблением развести в 5... 10 раз.
Гимза, краска (фиксирующий раствор по Добродицкой). 1 г сухой краски Гимза
(смесь азура с эозином) растереть в ступке с 2 г глицерина, приливая 400 мл
96%-ного этилового спирта. Раствор слить в колбу, закрыть пробкой и выдержать
в течение 72 ч при комнатной температуре. Одну часть раствора смешать с двумя
частями 96%-ного этилового спирта и оставить на трое суток, после чего раствор
готов к употреблению.
2,6-Дихлорфенолиндофенол. Для приготовления 0,001 N реактива взять 0,25 г
красителя и развести в 1 л дистиллированной воды. Через сутки раствор отфильт-
256
ровать. В связи с тем что водный раствор 2,6-дихлорфенолиндофенола нестоек,
необходимо перед каждым опытом установить его титр.
Диета А-авитаминозная. Состоит из 67 частей крахмала, 18 частей очищенного
казеина, 10 частей пивных дрожжей, 1 части поваренной соли, 3 корм. ед.
витамина D на 1 кг смеси и 4 частей солевой смеси Менделя—Осборна. Солевая смесь
Менделя—Осборна состоит из углекислого кальция — 134,8 части, двууглекислой
соды — 54,21 части, фосфорной кислоты — 103 части, серной кислоты — 5 частей,
сернокислого магния — 0,079 части, йодистого калия — 0,02 части, фтористого
натрия — 0,248 части, калийно-алюминиевых квасцов — 0,0245 части, углекислого
магния — 24,2 части, углекислого калия — 141,3 части, соляной кислоты —
120,5 части, лимонной кислоты — 111,1 части, лимоннокислого железа — 6,34
части. Казеин и дрожжи для разрушения возможных следов витамина А
предварительно прогревают в сушильном шкафу при температуре 110 °С, дрожжи в течение
24 ч, а казеин в течение 7 сут.
Диета рахитогенная. Смесь Стинбока: мука из желтой кукурузы — 76 %,
пшеничная клейковина — 20, хлористый натр — 1, углекислый кальций — 3 %. Смесь
Мак—Коллюма: пшеничная мука — 33 %, кукурузная мука — 33, желатина — 15,
пшеничный глютин — 15, хлористый натр — 1, углекислый кальций — 3 %. Из
приготовленного теста выпекают небольшие лепешки.
Желудочный сок искусственный. Свежий желудок (свиньи, собаки) или сычуг
жвачного разрезают по большой кривизне, распластывают его и тупым ножом или
ложкой соскабливают слизистую оболочку. Соскоб смешивают с 50 объемами
0,5%-ной соляной кислоты и настаивают в течение суток в термостате при 38 °С,
после чего жидкость фильтруют. Фильтрат содержит ферменты желудка.
Изотонические растворы (в г вещества на 1 л дистиллированной воды).
Вещество
Раствор
физиологический
для
лягушек
для
теплокровных
Рингера
для
лягушек
для
теплокровных
Рингера-
Локка
Тироде
для теплокровных
Хлористый натр
Хлористый калий
Хлористый кальций
Двууглекислый натр
Хлористый магний
Фосфорнокислый натр
Глюкоза
6,5
9,0
6,5
0,14
0,12
0,1
—
_
—
9,0
0,42
0,24
0,2
—
—
—
9,0
0,42
0,24
0,2
—
—
1,0
8,0
0,2
0,2
0,2
0,1
0,05
1,0
Йод в йодистом калии (реактив Люголя). В 100 мл дистиллированной воды
растворяют 2 г йодистого калия и 1 г йода.
Крахмальный клейстер (однопроцентный). 2 г крахмала взболтать с 30 мл
холодной воды (в стаканчике) и вылить раствор в 150 мл кипящей воды. Ополоснуть
стаканчик 20 мл воды, вылить ее в кипяток и, помешивая, варить крахмал 3 мин.
Крахмал йодокалиевый. 3 г крахмала смешать с 30 мл холодной
дистиллированной воды до образования однородной массы и приливать постепенно в 100 мл
кипящей воды. Ополоснуть стакан 20 мл воды и вылить ее в кипяток. В
полученной однородной жидкости растворить 3 г кристаллического йодистого калия.
Крахмал растворимый. 100 г картофельного крахмала смешать с раствором
соляной кислоты с таким расчетом, чтобы кислота покрыла полностью крахмал
(концентрированную НС1 плотностью 1,19 разводят в 5 раз водой). Оставить смесь
стоять на 7 сут. Разбавить водой в 3,5 раза и отсосать раствор с разрежением на
фильтре бюхнеровской воронки. С фильтра крахмал перенести в широкогорлую
колбу, налить 300 мл воды, размешать и отфильтровать содержимое. Еще раз
промыть крахмал и отфильтровать его. Промытый крахмал смешать с 250 мл
0,5%-ного раствора двууглекислой соды, перемешать и отфильтровать. Выделив-
257
шийся крахмал вновь промыть 300 мл воды с фильтрованием. Промытый крахмал
перенести на лист фильтровальной бумаги, разложить его тонким слоем и сушить
при 25...35 °С.
Кармин для определения фагоцитарной активности лейкоцитов. 1 г кармина
растирать в течение 15 мин в агатовой ступке с небольшим количеством
физиологического раствора. Растертый кармин смыть в эрленмейеровскую колбу и добавить
физиологического раствора до 150 мл. Взболтать раствор, разлить его по
пробиркам и центрифугировать. Верхний розовый слой жидкости отсосать и вновь
налить физиологического раствора до прежнего объема, перемешать и вновь
центрифугировать. Эту процедуру повторить 7...8 раз. Затем пастеровской пипеткой
извлечь немного жидкости ниже верхней границы кармина, в ней будут частицы
приблизительно одинакового диаметра. Количество зернышек кармина в единице
объема полученной суспензии подсчитать в счетной камере, затем разбавить
раствор кармина до нужной концентрации из расчета, что наиболее подходящей
является суспензия, содержащая 15 000 зернышек кармина в 0,001 мл раствора.
Липазы, вытяжка. Тщательно измельченную поджелудочную железу
настаивают двойным по массе количеством 0,5%-ного раствора углекислого натрия в
течение 12 ч при 30 °С, прибавив несколько капель толуола. Затем жидкость
фильтруют. В фильтрате содержится липаза.
Менделеевская замазка. 100 г канифоли и 25 г желтого воска расплавить и при
помешивании смеси всыпать в нее 40 г железного сурика. Смесь перенести на
водяную баню и нагревать 2...3 ч для вытеснения воздуха, прибавив 1...2 мл олифы.
Метиленовая синька, раствор. В коническую колбу вместимостью 50 мл налить
10 мл 95%-ного этилового спирта и всыпать 3...5 г метиленовой синьки, чтобы
получился насыщенный раствор. Взболтать хорошо и оставить стоять на 4...5 ч при
комнатной температуре. Профильтровать раствор, взять 5 мл фильтрата и смешать
его со 195 мл дистиллированной воды. Раствор сохранять в хорошо закрытой
склянке.
Метилоранж, индикатор (0,1%-ный раствор). 0,1 г красителя растворить в
100 мл горячей воды, охладить и отфильтровать раствор.
Нейтральный красный, краситель (0,1%-ный раствор). 0,1 г нейтральрота
растворить в 50 мл 95%-ного этилового спирта и долить дистиллированной воды до
100 мл.
Сернокислая медь, раствор для определения плотности крови (по Косякову).
Растворить 340 г х. ч. медного купороса в 1,8 л дистиллированной воды, довести
объем раствора до 2 л. Опустить в раствор ареометр и добавлять воду до тех пор,
пока плотность раствора не будет равна 1,10. Для получения раствора медного
купороса плотностью 1,050 необходимо прилить в мерную колбу на 100 мл 49 мл
исходного раствора и добавить 51 мл воды. Для получения раствора плотностью
1,055 надо прилить 54 мл исходного раствора и прибавить 46 мл воды и т. д.
Стокса, реактив. 1 часть сернокислого железа и 2 части винно-каменной
кислоты растворить в 15 частях дистиллированной воды. Перед употреблением
прибавить аммиак до слабощелочной реакции. Раствор должен быть прозрачным,
зеленого цвета.
Соляная кислота. Для приготовления 0,5%-ного раствора разбавляют
концентрированную соляную кислоту плотностью 1,19 в 90 раз.
Серная кислота плотностью 1,82. К 1 объему воды прибавляют 10 объемов
концентрированной серной кислоты плотностью 1,84.
Стабилизатор крови. Растворить в 125 мл дистиллированной воды 9 г
щавелевокислого калия и 6 г щавелевокислого аммония. Раствор брать в количестве
0,01 мл на 1 мл крови.
Трипсин, вытяжка. Свежую поджелудочную железу свиньи или другого
животного очищают от жира и соединительной ткани, измельчают на мясорубке,
смешивают с 4-кратным количеством 0,03%-ного аммиака и, прибавив несколько
капель толуола, настаивают в течение суток при 30 °С. После настаивания вытяжку
фильтруют, к фильтрату добавляют разведенную уксусную кислоту. Осадок (с
258
ферментами) отфильтровывают, а затем растворяют в 0,5%-ном двууглекислом
натре.
Фенолфталеин (1%-ный спиртовой раствор). 1 г фенолфталеина растворить в
50 мл 95%-ного этилового спирта и прибавить дистиллированной воды до объема
100 мл. Так же готовят 0,5%-ный или 2%-ный растворы, только с
соответствующим изменением величины навески.
Фиксаторы закопченных лент. 1) 25 г шеллака внести в 500 мл 95%-ного спирта
и поставить на водяную баню для полного растворения шеллака. После
охлаждения раствор профильтровать через вату и добавить 2 г касторового масла для
придания эластичности; 2) в 1000 мл бензина растворить 60 г канифоли и 0,5 г воска;
3) в 100 мл скипидара растворить 15 г воска на водяной бане. Взять по 7 мл
горячей смеси на каждые 100 мл денатурированного спирта. При этом воск выпадает в
осадок; отфильтровать его и на фильтре приготовить 7%-ный фиксирующий
раствор канифоли.
Хромовая смесь. 1 часть (по массе) двухромовокислого калия растворяют в
10 частях концентрированной серной кислоты.
Чернила для записи на кимографе. Два порошка анилинового черного
красителя (для окраски шерстяной ткани) или порошок нигрозина (черная краска для
окрашивания кожи) растворяют в 400 мл теплой дистиллированной воды. Раствор
энергично взбалтывают в течение 15...20 мин, после чего чернильная основа
готова. Для приготовления чернил взять 100 мл чернильной основы, 10 мл 96%-ного
спирта и 20 мл глицерина и смешать их.
Энтерокиназа. Измельченную слизистую оболочку двенадцатиперстной кишки
собаки или свиньи настаивают с двойным по массе количеством хлороформенной
воды в течение двух суток, отжимают через марлю (сито), а затем фильтруют.
Фильтрат готов к употреблению.
Эрепсин, вытяжка. Участок тонкой кишки (около 50 см) от только что убитого
животного промывают водопроводной водой, разрезают вдоль, соскабливают
слизистую оболочку и растирают ее в ступке с песком. Затем заливают 5 объемами
воды и 1...2 мл хлороформа и оставляют при комнатной температуре на сутки,
после чего вытяжку пропускают через полотно и фильтр.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
о
Автоматия сердца. Свойство сердченой мышцы ритмически сокращаться и
расслабляться независимо от внешних и внутренних воздействий. Сокращения
сердечной мышцы вызывают периодически появляющиеся в ней электрические
импульсы возбуждения, которые возникают в клетках проводящей системы
сердца. В норме импульсы возбуждения возникают в синусно-предсердном узле
проводящей системы, расположенном в месте впадения полых вен в правое
предсердие; он называется водителем ритма сердца.
Антенатальный перид развития организма. Период с момента оплодотворения
яйцеклетки до начала родовой деятельности. Включает в себя три фазы:
зародышевую, эмбриональную, фетальную (или плодную).
Афферентное звено. Часть рефлекторной дуги; образовано рецепторным
нейроном. Проводит возбуждение от рецептора к нервному центру.
Беременность. Особое физиологическое состояние организма самки,
обусловленное оплодотворением и развитием плода в матке.
Биологическая реакция. Ответная реакция всех живых тканей организма на
действие раздражителя, сопровождающаяся обратимыми изменениями структуры,
физическими и химическими явлениями.
Биологический ток действия (биоэлектрические явления). Обязательный и
общий признак возбуждения возбудимых тканей.
Вегетативный отдел нервной системы. Образован вегетативными нейронами,
расположенными в среднем, продолговатом и спинном мозге, а также в ганглиях
на периферии, состоящих из нервных клеток. Характерен двухнейронный
принцип образования: первые нейроны расположены в среднем, продолговатом и
спинном мозге (их сером веществе), их аксоны выходят из ЦНС и заканчиваются
обязательно на вторых нейронах, объединенных в ганглии; на теле второго
нейрона образуют синаптическое окончание; волокна первого нейрона называют пре-
ганглионарными. Аксоны вторых нейронов идут к иннервируемому органу;
волокна второго нейрона называют постганглионарными. Скорость проведения
возбуждения по вегетативным нервным волокнам 2... 14 м/с. Вегетативный отдел нервной
системы обеспечивает регуляцию структурной организации и деятельности
внутренних органов, сосудов, потовых желез, а также регулирует трофику (питание)
скелетных мышц, рецепторов и самой нервной системы. По современным
представлениям симпатический отдел вегетативной нервной системы рассматривается
как система тревоги, мобилизации защитных сил и ресурсов для активного
взаимодействия с факторами окружающей среды. Обеспечивая максимальное
напряжение функций органов и систем, он дестабилизирует постоянство внутренней
среды. В целостном организме функции вегетативной нервной системы тесно
взаимосвязаны с функциями соматической. Вегетативная нервная система
представлена парасимпатической, симпатической и метасимпатической иннервацией;
каждая из них имеет определенные особенности. Высшие нервные центры вегета-
260
тивного отдела нервной системы находятся в гипоталамусе: в передних ядрах —
центры парасимпатической иннервации, в задних ядрах — центры симпатической
иннервации. Автономная нервная система находится под постоянным контролем
лимбической системы и коры больших полушарий.
Вестибулорецепция. Тип интерорецепции; обеспечивает восприятие
положения головы и тела в пространстве, ускорение или замедление движения вестыбу-
лорецепторами, находящимися в трех полукружных каналах лабиринта пирамиды
височной кости и отолитовом аппарате и преддверии улитки, передачу
информации в ЦНС и восприятие этой информации нейронами коры больших
полушарий, а также обеспечивает перераспределение тонусов скелетных мышц,
сохранение равновесия, естественную позу, переход из неестественного в естественное
положение.
Взаимодействие (координация) нейронов, нервных центров, нервных процессов.
Обеспечивает согласованную деятельность ЦНС. Основано на определенных
принципах, явлениях и феноменах: конвергенция — возможность схождения
возбуждений к одним контактным и эффекторным нейронам; иррадиация —
возможность распределения возбуждения; реципрокные связи —
возбуждение одного центра сопровождается торможением центра-антагониста;
индукция — наведение на соседние центры пртивоположного процесса; отдача —
быстрая смена одного рефлекса другим; цепные и ритмические рефлексы; общий
конечный путь; обратная связь; доминанта; пластичность нервных центров.
Виды движений животных. Каждый вид и особь имеет репертуар
«фиксированных» стереотипных последовательных движений. У животных при большом числе
опорных конечностей (четвероногие) поза стояния является статически
устойчивой, и для ее поддержания достаточно обеспечивать необходимую упругую
жесткость конечностей. Ходьба представляет непрерывную смену статически
устойчивых поз. При ходьбе и беге движения создаются за счет отталкивания от
грунта. Различают способы движения животного (аллюры): шаг (основной вид),
рысь, галоп, иноходь, карьер.
Виды мышц. Различают поперечно-полосатые скелетные,
поперечно-полосатые сердечные и гладкие мышцы.
Виды нейронов. Различают сенсорные, рецепторные нейроны; ассоциативные,
интернейроны, вставочные; эффекторные, двигательные, мотонейроны.
Висцерорецепция. Один из видов интерорецепции. Осуществляет восприятие
висцерорецепторами (механорецепторы, хеморецепторы, осморецепторы, бароре-
цепторы, волюморецепторы и др.), расположенными в сосудах и внутренних
органах, изменений условий внутренней среды и состояния внутренних органов,
передачу информации в ЦНС и восприятие ее сенсорными нейронами коры
больших полушарий; участвует в регуляции деятельности внутренних органов,
обеспечивает тонкое и быстрое приспособление функции внутренних органов к
условиям, складывающимся в этих органах в каждый данный момент,
поддержание гомеостаза.
Влияние вегетативной иннервации. Через вегетативные нервные волокна
осуществляются сосудистые, трофические и функциональные влияния на органы,
обеспечивающие регуляцию деятельности внутренних органов, приспособление
уровня обмена веществ и энергии к потребностям органов.
Внешние показатели деятельности сердца. Сердечный толчок —
колебание участка грудной стенки от касания сердца при систоле; тоны (звуки)
сердца — систолический («лубб») возникает в начале систолы и диастолический
(«дуп») возникает в начале диастолы; электрокимограмма — кривая
движения контура сердечной тени на экране рентгеновского аппарата,
воспринимаемого фотоэлементом и осциллографом; электрокардиограмма (ЭКГ) —
кривая биопотенциалов сердца; вектор-кардиограмма — векторная
величина разности потенциалов; артериальный пульс — колебания стенки арте-
261
рии, связанные с систолой и диастолой; артериальное давление —
систолическое, диастолическое, среднее, пульсовое; венный пульс; венозное
давление.
Внешние показатели деятельности сосудов. Артериальный пульс, венный пульс,
объемный пульс, реограмма, время кругооборота крови.
Внешние показатели деятельности системы дыхания. Частота дыхательных
движений, 4 первичных легочных объема (дыхательный, резервный вдоха, резервный
выдоха и остаточный), а также 4 емкости легких (общая, жизненная, вдоха и
функциональная остаточная), минутный объем.
Внешняя (окружающая среда). Окружает организм и необходима для его
жизнедеятельности.
Внутренняя среда организма. В ней находятся и функционируют клетки, ткани
и органы.
Вода. Один из основных компонентов всех клеток живых организмов,
составляющий до 85 % их массы. Поступает в организм из внешней среды; у животных,
кроме того, может образовываться при расщеплении жиров, белков, углеводов.
Вода находится в цитоплазме и ее органеллах, вакуолях, ядре, межклеточном
пространстве. Функции ее многообразны: она определяет физические свойства
клеток — объем, упругость, служит универсальным растворителем, средой для
физиологических и биохимических процессов, источником катионов водорода при
фотосинтезе, химическим компонентом, осмо- и терморегулятором. Вода
участвует в реакциях синтеза (фотосинтеза), гидролиза и окисления. Присутствует в
клетке в различных формах. 1.Гидратационная вода связана с белками и
ионами, обеспечивает набухание коллоидов. 2. Обменная вода заключена
между молекулами белка, мембранами, волокнами и является растворителем
веществ. 3. Свободная вода находится в межклеточном пространстве, сосудах,
вакуолях, полостях органов. Она служит для переноса веществ из окружающей
среды в клетку и из клетки.
Возбудимость. Способность возбудимой ткани отвечать на действие
возбудителя возбуждением.
Возбудимые ткани. Специально приспособленные к осуществлению быстрых
ответных реакций на действие раздражителя: нервная ткань, железистая ткань,
мышечная ткань.
Возбудители. Специфические раздражители возбудимых тканей.
Возбуждение. Ответная реакция возбудимой ткани на действие возбудителя,
проявляющаяся в совокупности физических, физико-химических, химических,
метаболических процессов и изменений деятельности; распространяющийся
волнообразный процесс. Проявляется в тканях специфическим образом: в
мышечной — сокращением, в железистой — образованием и выделением секрета, в
нервной — возникновением и проведением нервного импульса.
Волосы. Роговые производные кожи, развиваются из волосяных фолликулов.
По особенностям строения и по роли различают: кроющие, или покровные;
щетинистые, или остевые; грубые, или переходные; шерстные, синусоидные, или
осязательные. В волосе различают стержень (состоит из кутикулы, коркового
и мозгового вещества; располагается на поверхности кожи) и корень
(располагается в волосяном мешке из соединительной ткани и эпителиальных клеток, в
центре имеется волосяной сосочек из соединительнотканных элементов,
кровеносных сосудов). Смена волос — линька — происходит постоянно, перманентно,
сезонно — весной и осенью. Возрастную линьку, связанную с установлением
постоянных волос, масти, называют ювеналъной.
Всасывание в пищеварительном тракте. Переход веществ через структуры
слизистой оболочки стенки пищеварительного тракта в кровь и лимфу. Переход
веществ через мембраны клеток и межклеточные каналы осуществляется пассивно и
активно. Пассивный переход не связан с затратой энергии и определяет-
262
ся в основном физическими законами фильтрации, диффузии и осмоса.
Транспорт веществ против градиентов концентрации и градиента электрохимического
потенциала, сопровождающийся затратой энергии, — активный транспорт;
источником энергии является АТФ. Активный транспорт веществ обеспечивают
переносчики — молекулы белка; на поверхности клетки переносимое
вещество связывается переносчиком и транспортируется внутрь клетки, при
участии ферментов вещество освобождается от переносчика, связывается
внутриклеточным переносчиком и транспортируется к базальной мембране, где
передается другому переносчику, и так через ряд переносчиков других структур
поступает в кровь и лимфу. Различные вещества транспортируются
различными переносчиками. Основное всасывание питательных веществ
происходит в ворсинках тонкой кишки; желчь способствует всасыванию жиров и
жирных кислот, переводя их в растворимую форму; незначительное
всасывание происходит в желудке; в толстой кишке всасываются в основном вода и
витамины.
Вторая сигнальная система. Высшая нервная деятельность (ВНД) человека по
сравнению с ВНД животных имеет важные качественные особенности. Главное
отличие связано с наличием у человека речи, умением выражать мысли словами.
На основе этого и создано И. П. Павловым учение о первой и второй сигнальных
системах. Кора больших полушарий обладает свойством воспринимать
раздражения (сигналы) окружающего мира. Структуры и процессы, связанные с
восприятием непосредственных сигналов раздражителей и осуществлением ответных
реакций на них, получили название первая сигнальная система. Она присуща и
человеку, и животным. Наряду с первой сигнальной системой человеку присуще новое
свойство коры больших полушарий, которое было выработано в процессе
эволюции, — воспринимать и обеспечивать реакции на вторые сигналы раздражителей.
Вторыми сигналами являются слова, которые характеризуют данный
раздражитель. Например, огонь — безусловный раздражитель, вид огня — первый сигнал
раздражителя, слово «огонь» — второй сигнал раздражителя, т. е. сигнал сигнала.
Способность коры больших полушарий головного мозга человека воспринимать и
обеспечивать ответные реакции на вторые сигналы раздражителей (сигналы
сигналов) получила название вторая сигнальная система. Она присуща только
человеку.
Вымя. Железисто-мышечный орган, обеспечивающий молокообразование и
молоковыделение. Снаружи покрыто тонкой эластичной кожей; имеет соски.
Железистая ткань представлена молочными альвеолами — шаровидной,
овальной или продолговатой формы, мелкими образованиями диаметром 100...
800 мкм; состоят из одного слоя клеток железистого эпителия, которые
располагаются на базальной мембране; объединяются в группы — дольки, дольки
группируются, образуя доли железы. От альвеол начинаются мельчайшие первичные
молочные протоки, которые, соединяясь, образуют более крупные молочные
протоки долей, последние — молочные каналы долей. Они образуют молочные ходы,
которые в количестве от 5 до 20 и более открываются в полость, расположенную в
нижней части железы, — цистерну молочной железы; состоит из цистерны
железы и соска; цистерна соска отделена от цистерны железы круговой складкой,
расположенной на уровне основания соска.
Высшая нервная деятельность. Совместная деятельность коры больших
полушарий и подкорковых образований, обеспечивающая более быстрое, тонкое,
совершенное приспособление состояния и деятельности организма к факторам
внешней среды и целенаправленное поведение животного; осуществляется по
принципу условного рефлекса и называется еще условно-рефлекторной
деятельностью.
Гиподинамия. Ограничение и уменьшение мышечных усилий, затрачиваемых
на перемещение тела в пространстве, у животных при содержании в замкнутых
263
помещениях малого объема. Вызывает ослабление деятельности всех органов,
систем и расстройство их взаимосвязей в организме: уменьшаются энергообмен и
потребность в корме, развиваются детренированность сердечно-сосудистой
системы, дистрофия мышечной ткани, перестраивается обмен веществ, увеличивается
доля жирового компонента в массе тела, происходит деминерализация костной
ткани, снижается концентрация ряда гормонов в крови, падают устойчивость
организма к воздействию неблагоприятных факторов, продуктивность, отмечают
бесплодие и задержку последа после родов.
Гипоталамус. Расположен на основании мозга, образует вентральную часть
промежуточного мозга. Состоит из ядер: преоптической и передней групп, их
нейроны продуцируют либерины и статины, регулируют деятельность передней
доли гипофиза; средняя группа содержит нейроны-датчики, реагирующие на
изменения состава и свойств внутренней среды; латеральные ядра формируют пути
к верхним и нижним отделам ствола мозга. В передних и преоптических ядрах
расположены высшие центры парасимпатического отдела, а в задних и
латеральных ядрах — симпатического отдела нервной системы. В целом гипоталамус
обеспечивает интеграцию деятельности эндокринной, вегетативной и соматической
систем.
Гликолиз. Ферментативный анаэробный (бескислородный) процесс распада
углеводов (главным образом глюкозы). Наиболее древний путь расщепления
глюкозы; широко распространен в природе и играет важную роль в обмене веществ
живых организмов. Обеспечивает клетку энергией в условиях недостаточного
снабжения кислородом, а в аэробных условиях является стадией,
предшествующей окислительному распаду углеводов до СО2 и Н2О (дыханию). Многим
микроорганизмам свойствен идентичный гликолизу процесс молочнокислого
брожения. Ферменты гликолиза находятся в растворимой части цитоплазмы клеток.
При распаде 1 молекулы глюкозы во время гликолиза образуется 2 молекулы пи-
ровиноградной кислоты и 2 молекулы АТФ. Гликолиз энергетически менее
выгоден, чем дыхание (кислородное расщепление), так как поставляет около 5 %
энергии, которая может быть получена при полном окислении глюкозы до СО?
и Н20.
Гомеостаз. Постоянство состава и физико-химических свойств внутренней
среды организма за счет деятельности всех его органов и систем.
Гормональный статус. Складывающиеся на определенный период фактические
оптимальные концентрации отдельных гормонов в крови животного.
Гормоны. Это химические, биологически активные вещества. Образуются в
железах внутренней секреции, поступают непосредственно в кровь и оказывают
регулирующее действие на обмен веществ, процессы и функции, рост и развитие
организма. По химической природе различают: стероидные, производные
холестерина, к ним относят все гормоны коры надпочечников и половых желез;
полипептидные и белковые гормоны — низкомолекулярные пептиды (гормоны
гипоталамуса); простые белки — инсулин, гормон роста и другие сложные белки гли-
копротеиды — фолликулостимулирующий, лютеинизирующий и тиреотропный
гормоны гипофиза; производные аминокислоты тирозина — адреналин, норадре-
налин, тироксин, трийодтиронин. Гормоны специфичны по своему
физиологическому действию, обладают высокой биологической активностью; разрушаются
соответствующими ферментами.
При взаимодействии гормона с внутриклеточным
рецептором (для стероидных гормонов) гормон диффундирует через
плазматическую мембрану и взаимодействует с рецептором, находящимся в цитоплазме;
гормон-рецепторный комплекс переносится в ядро и действует непосредственно
на геном, стимулируя или угнетая его активность, т. е. действует на синтез ДНК,
изменяя скорость транскрипции и количество информационной (матричной)
РНК (мРНК): увеличение или уменьшение количества мРНК влияет на синтез
264
белка в процессе трансляции, что приводит к изменению функциональной
активности клетки.
При взаимодействии гормона с рецептором,
локализованным на плазматической мембране (для белковых
гормонов) гормон вызывает его трансформацию, что приводит к активации адени-
латциклазы, которая катализирует дефосфорилирование АТФ с образованием
цАМФ. Она вызывает в клетке разнообразные эффекты — активирование проте-
инкиназ и т. д., что приводит к изменению функции клетки.
При взаимодействии гормона с рецептором,
локализованным в ядре (для тиреоидных гормонов), гормон проникает в
цитоплазму, из нее — в ядро клетки, где взаимодействует с рецепторами, образуя
активный гормон-рецепторный комплекс. Он действует непосредственно на
геном, стимулируя или угнетая его активность, изменяя скорость транскрипции и
количество мРНК. Увеличение или уменьшение количества мРНК влияет на
синтез белка в процессе трансляции и приводит к изменению функциональной
активности клетки.
Гормоны аденогипофиза. Соматотропный гормон животных
отличается по строению, т. е. обладает видовой специфичностью; повышает синтез белка,
ускоряет включение в белки аминокислот, синтез РНК, увеличивает строму
организма, поглощение неэтерифицированных жировых кислот мышцами и их выход
из жировых депо, регулирует захват и вывод свободных жирных кислот,
стимулирует использование углеводов, увеличивает размеры тела, способствует росту
скелета, вызывая разрастание хрящевой ткани в эпифизах трубчатых костей, рост
костей в длину. Лактотропный гормон (пролактин)по структуре,
физико-химическим свойствам и физиологическому действию сходен с гормоном
роста; стимулирует развитие молочных желез, синтез белков и других
компонентов молока (поэтому его называют лактогенным гормоном), ускоряет процесс мо-
локоотдачи (сосание или доение стимулирует образование и выделение пролакти-
на), обладает гипергликемическим и липотропным эффектом, поддерживает
существование и активность желтого тела (поэтому его называют лютеотропным
гормоном), тормозит образование и выделение ФСГ, усиливает проявление
материнских инстинктов, активизирует функцию сальных желез, рост волос, развитие
внутренних органов. Липотропный гормон — липомобилизующий пептид;
мобилизует жир из жировых депо, вызывает липолиз с увеличением содержания
неэстерифицированных жирных кислот в крови. Адренокортикотропный
гормон обладает специфическим влиянием на пучковую и сетчатую зоны коры
надпочечников, увеличивает размеры и массу надпочечников, усиливает в них
окислительное фосфорилирование, повышает скорость синтеза белка,
активизирует глюкогенолиз и усиливает образование и выведение кортикостероидов,
уменьшает размер и массу лимфатических узлов, селезенки, зобной железы,
вызывает распад, тормозит синтез белка, является антагонистом гормона роста,
усиливает распад жира, увеличивает накопление гликогена. Тиреотропный
гормон избирательно действует на щитовидную железу: вызывает увеличение
ее размеров, разрастание фолликулярного эпителия, накопление йода, биосинтез
тиреоидных гормонов и выделение их в кровь. Фолликулостимулирую-
щий гормон — гонадотропный гормон; стимулирует рост и развитие
фолликулов (пролиферацию клеток гранулезы) в яичниках, пролиферацию клеток Серто-
ли и сперматогенного эпителия в семенниках, сперматогенез, рост и функцию
придаточных половых желез. Лютеинизирующий гормон —
гонадотропный гормон; стимулирует развитие интерстициальной ткани яичников и
семенников; в яичниках половозрелых самок вместе с ФСГ обеспечивает дозревание
граафовых фолликулов; под его влиянием происходят разрыв стенки фолликула
(овуляция) и образование желтого тела на месте лопнувшего фолликула;
стимулирует образование в яичниках и семенниках половых гормонов — эстрогенов и ан-
265
дрогенов, прогестерона. Меланоцитостимулирующий гормон
стимулирует биосинтез пигмента меланина, равномерное распределение пигментных
гранул в пигментных клетках-меланоцитах кожи, волос, приводящее к
потемнению кожи и волос; стимулирует активность световоспринимающего аппарата
глаза, участвует в темновой адаптации, повышает остроту зрения.
Гормоны гипоталамуса (см. Гипоталамус).
Гормоны диффузной эндокринной системы (тканевые гормоны). Продуцируются
эндокринными клетками тканей органов; кровью приносятся к
клеткам-мишеням или выделяются в межклеточное пространство, не попадая в кровь, и
действуют на рядом находящуюся клетку-мишень, оказывая регуляторное действие.
Каждый вид клеток продуцирует специфические гормоны: желудок — гастрин и
энкефалин, мотилин, гастрон, антральный халон, серотонин, мелатонин, бомбе-
зин и соматостатин; кишечник — вазоактивный интестинальный, или кишечный,
полипептид, серотонин, мелатонин, субстанцию Р, мотилин, бомбезин, секретин,
холецистокинин-панкреозимин, гастроингибирующий полипептид, энтероглюка-
гон, нейротензин, энтерогастрин и энтерогастрон, динэнтерин, арэнтерин, химоде-
нин, дуокринин, энтерокринин, инкретин, вилликинин; поджелудочная железа —
гастроингибирующий полипептид, соматостатин, панкреатический полипептид,
лопокаин, ваготоин, центропнеин; подчелюстная и околоушная железы, легкие,
поджелудочная железа — калликреин, паротин; слизистая оболочка носовых
ходов, гортани, трахеи, бронхов, легкие — серотонин, дофамин, бомбезин, а также
простагландины; почки — ренин, медуллин, эритропоэтин, лейкоцитопоэтин,
тромбоцитопоэтин; гипоталамус, нервная ткань, клетки крови, гипофиз —
нейротензин, серотонин, кохерин.
Гормоны желтого тела. Это прогестерон (максимум продукции приходится на
середину лютеальной фазы, с наступлением инволюции желтого тела снижается)
и релаксин. Прогестерон действует на матку как эстрогены, вызывая
разрастание слизистой оболочки матки и дальнейшее развитие и секрецию ее желез, тем
самым подготавливая матку к развитию плода, обеспечивает при беременности
развитие в эндометрии кровеносных сосудов, усиливает образование секрета
железами, необходимого для питания зиготы и зародыша до образования
плаценты, расслабляет мышечные волокна матки, понижает возбудимость матки и
чувствительность к окситоцину; стимулирует развитие альвеол в молочных железах,
тормозит выделение пролактина из гипофиза, понижает чувствительность альвеол
к пролактину и специально тормозит образование молока при беременности.
Релаксин обеспечивает расслабление связок, размягчение лонного сращения,
снижает тонус шейки матки, облегчает роды.
Гормоны надпочечников. Образуются корковым и мозговым слоями, которые
представляют самостоятельные железы внутренней секреции.
Гормоны коры надпочечников — стероидные, производные
уксусной кислоты и холестерина. В клубочковой зоне синтезируются минер алокортико-
иды — альдостерон, дезоксикортикостерон, 11-дегидрокортикостерон. Альдосте-
рон наиболее активный: действует на дистальные отделы почечных канальцев,
увеличивает в них обратное всасывание натрия в кровь, обеспечивает
поддержание оптимальной концентрации натрия, хлора, воды в крови, способствует
выведению калия, кальция, магния, водорода и аммония и таким образом участвует в
регуляции водно-минерального обмена; снабжает энергией «натриевый насос»
путем увеличения образования внутри клетки аденозинтрифосфата и стимуляции
окислительного фосфорилирования. Минералокортикоиды обладают слабым
глюкокортикоидным действием. В пучковой и сетчатой зонах синтезируются
глюкокортикоыды — кортизол, кортикостерон, 11-дегидрокортикостерон и 11-дез-
оксикортизол. Кортизол наиболее активный из них. Они стимулируют распад
белков, угнетают их биосинтез, особенно в мышечной ткани; в печени
увеличивают синтез белков; увеличивают распад жира, в результате чего увеличивается в
266
крови количество свободных жирных кислот; стрессовые раздражители
стимулируют образование и выделение глюкокортикоидов, что повышает устойчивость
организма, обеспечивают сохранение жизни; обладают противовоспалительным
действием — уменьшают гиперемию, отек, боль; осуществляют и минералокорти-
коидное действие. В сетчатой зоне синтезируются половые гормоны — андрогены,
эстрогены, прогестерон и 17-кетостероиды — дегидроэпиандростерон, андростен-
диан — 11-бета-гидроксиандростендион, андростерон, эстрон. Прогестерон
является основным промежуточным продуктом синтеза кортикостероидов и половых
гормонов (физиологическая активность их слаба; они ответственны за рост,
происходящий во время полового созревания).
Гормоны мозгового вещества надпочечников — катехоламины
(адреналин, норадреналн, дофамин; дофамин и норадреналин —
предшественники синтеза адреналина), производные аминокислоты тирозина. Действие
гормонов на органы в основном аналогично влияниям, осуществляемым через
симпатические нервные волокна; в тканях катехоламины инактивируются моноамино-
оксидазой (больше в печени) и катехол-О-метилтрансферазой (в крови);
участвуют в регуляции всех видов обмена веществ: усиливают распад жира в
жировой ткани и окисление жирных кислот, распад гликогена в тканях и повышают
концентрацию глюкозы в крови, обеспечивают распад белка при недостатке
углеводов (при стрессе), повышают перенос электролитов через мембраны,
поглощение кислорода тканями, образование макроэргических соединений (АТФ);
мобилизуют энергетические ресурсы, готовность организма к оборонительным,
защитным и агрессивным реакциям, обеспечивают приспособление организма к
условиям, требующим напряжения, повышенной деятельности, интенсивной
мышечной работы; восстанавливают работоспособность утомленных скелетных
мышц, улучшают их кровоснабжение, стимулируют работу сердца, усиливают
коронарный кровоток, повышают давление крови в сосудах; расслабляют гладкие
мышцы бронхов, пищеварительного аппарата, мочевого пузыря, возбуждают
мышцы матки, глаза (вызывают увеличение зрачков); возбуждают ЦНС,
повышают возбуждаемость рецепторов, стимулируют секрецию глюкокортикоидов,
являются «гормонами тревоги»; повышают теплообразование, основной обмен.
Гормоны нейрогипофиза. Антидиуретический гормон и окситоцин.
Синтезируются в нейронах гипоталамуса, соответственно супраоптического и паравентрику-
лярного ядер, и в виде секреторных гранул, где гормоны находятся в комплексе с
белками — нейрофизинами, переносятся по нервным волокнам в заднюю долю
гипофиза, где хранятся и по мере необходимости поступают в общую
циркуляцию. Антидиурети чески й гормон действует на почки, увеличивает
проницаемость мембран клеток дистальных сегментов почечных канальцев,
обеспечивает встраивание «водных каналов» (агрефоров) в апикальную мембрану, в
результате чего усиливается обратное всасывание воды из канальцев нефронов в
кровь, стимулирует секрецию гиалуронидазы, вызывает деполимеризацию кислых
мукополисахаридов межклеточного вещества и так увеличивает проницаемость
стенки дистальных отделов канальцев для воды; большие дозы вызывают
сокращение гладких мышц сосудов (артериол), что ведет к повышению кровяного
давления. Окситоцин выделяется в кровь рефлекторно при сосании и доении,
вызывает сокращение миоэпителиальных клеток, окружающих альвеолы, и
перемещение молока из альвеол в цистерны молочной железы (молокоотдачу),
участвует и в поддержании оптимального уровня молокообразования, усиливает
поглощение и окисление глюкозы железой; выделяясь в больших количествах при
родах, вызывает сокращение матки, способствуя выходу плода; обеспечивает
сокращение матки при совокуплении; выделение его стимулируется с рецепторов
влагалища и шейки матки.
Гормоны островкового аппарата поджелудочной железы. Бета-клетки
продуцируют гормон инсулин, альфа-клетки — глюкагон. Инсулин оказывает влияние
267
на все виды обмена веществ в органах и тканях, повышает проницаемость
клеточных мембран для глюкозы (в 20 раз), ускоряет транспорт глюкозы через мембрану
инсулинчувствительных клеток (больше в печени и мышцах), стимулирует синтез
гликогена из глюкозы, стимулирует полное окисление глюкозы и образование
АТФ, понижает содержание глюкозы в крови; в жировой ткани стимулирует
превращение глюкозы и жирных кислот в жир, понижает концентрацию жирных
кислот в крови; повышает проницаемость клеточной мембраны к некоторым
аминокислотам и стимулирует синтез белка (ускоряет синтез РНК), ферментов
пищеварительных соков за счет активирования ферментов метаболизма. Глюкагон
действует противоположно инсулину: стимулирует распад глюкогена в печени
путем активации фермента фосфорилазы, одновременно тормозится синтез
гликогена, ускоряется превращение гликогена в глюкозу, повышается содержание
глюкозы в крови; стимулирует превращение аминокислот в глюкозу, активирует
липазу и повышает расщепление триглицеридов с образованием свободных
жирных кислот, особенно в жировой ткани, кетоновых тел; повышает потребление
кислорода, увеличивает диурез, выделение натрия, калия, кальция, угнетает
моторную и секреторную функции пищеварительного аппарата.
Гормоны паращитовидных желез. В большой степени концентрируются в
коллоидном веществе. Синтезируется парагормон: обеспечивает вместе с
тиреокальцитонином постоянство — содержание кальция в крови, увеличивает
активность остеокластов — клеток, вызывающих местное разрушение костной
ткани, — освобождающиеся кальций и фосфор поступают в кровь, повышается
их концентрация, воздействует и на цикл трикарбоновых кислот, вызывает
накопление цитратов, местный ацидоз, воздействующий на извлечение кальция
из кости, в почках увеличивает реабсорбцию кальция — и это ведет к
увеличению его концетрации в крови — снижает реабсорбцию натрия, фосфора,
усиливает всасывание кальция из кишечника в кровь за счет повышения
активности витамина D.
Гормоны плаценты. Хорионический гонадотропин и хорионические сомато-
маммотропины, прогестерон, эстрогены, релаксин, простагландины.
Хорионический гонадотропин продуцируется с первых недель беременности,
максимальный уровень биосинтеза соответствует фазе функциональной
активности желтого тела и процессу формирования плаценты, действие его подобно
действию ФСГ и ЛГ. Хорионические соматомаммотропины
(плацентарный лактогенный, хорионический лактосоматотропный) обладают лактогенной,
лютеотропной и соматотропной активностью, во вторую половину беременности
стимулируют обменные процессы, увеличивают задержку азота в организме,
синтез белка, содержание жирных кислот, усвоение жира, углеводов,
активируют эритропоэз, иначе регулируют адаптационные изменения обменных
процессов в организме матери и плода. Прогестерон — синтез возрастает с
развитием беременности (о действии см. Гормоны яичников). Эстрогены —
образование повышается в поздние сроки беременности (о действи см.
Гормоны яичников), участвуют в обеспечении родов. Релаксин — образование
нарастает во второй половине беременности (о действии см. Гормоны
яичников) . Простагландины — предшественник — арахидоновая кислота;
вызывают сокращения матки при родах.
Гормоны семенников (интерстициальных клеток, клеток Лейдига). Андрогены, в
меньших количествах эстрогены и гормон ингибин; наиболее активным андроге-
ном является тестостерон. Тестостерон обеспечивает дифференциацию
клеток тканей половых органов и придаточных половых желез у самца в раннем
онтогенезе, рост и развитие их в постнатальный период, функционирование
системы органов размножения с наступлением половой зрелости, способствует
спермиогенезу. Андрогены у плода влияют на дифференцировку центров
головного мозга, которые у взрослых животных определяют непрерывный характер
268
секреции половых гормонов, половое поведение; вызывают развитие вторичных
половых признаков самца, определяют особенности строения скелета, развитие
мышечной системы и др.; обладают выраженным анаболическим действием,
стимулируют синтез белка, развитие мышц, скелета и сердца, костной ткани;
стимулируют нервные процессы, улучшают высшую нервную деятельность, повышают
адаптационные возможности организма и сопротивляемость к неблагоприятным
факторам, обеспечивают работоспособность организма. И н г и б и н
осуществляет тормозящее влияние на образование фолликулостимулирующего гормона в
передней доле гипофиза.
Гормоны тимуса (вилочковой, зобной железы). Тимозин, тимин и
Т-активин стимулируют лимфопоэз, индукцию незрелых претимических
клеток в Т-лимфоциты и функциональную активность Т- и В-лимфоцитов,
активируют ферменты клеточных мембран, участвуют в контроле за нервно-мышечной
передачей, состоянием углеводного обмена и обмена кальция.
Гормоны щитовидной железы. Специфические гормоны тироксин (тетра-
йодтиронин) и трийодтиронин синтезируются из аминокислоты тирозина и
неорганического йода фолликулами (происходит на молекуле белка тиреоглобу-
лина), депонируются в составе коллоида фолликулов, в кровь поступает лишь
активная форма гормонов, в тканях освобождаются из связи с белком и проявляют
свое физиологическое действие. Кальцитонин продуцирует парафолликулярная
ткань. Тироксин и трийодтиронин оказывают влияние на все клетки организма,
участвуют в регуляции всех видов обмена веществ, процессов роста и дифферен-
цировки, увеличивают интенсивность окислительных процессов, в результате
чего повышается распад углеводов, жиров, белков и освобождается большее
количество энергии, одновременно стимулируют синтез гликогена в печени и синтез
жира, синтез жира молочной железой, выведение воды, стимулируют рост
животного, развитие и функцию половой системы, дифференциацию всех тканей в
раннем отногенезе, обеспечивают нормальную функцию кожи, рост волос,
характерную окраску перьев, смену оперения, участвуют в регуляции развития нервной
системы и ее возбудимости. Тиреокальцитонин (кальцитонин)
действует на скелет (костную ткань) противоположно паратгормону паращитовидных
желез, тормозит деятельность разрушающих кость клеток — остеокластов,
активирует функцию остеобластов — клеток, участвующих в формировании кости,
вследствие этого увеличивается отложение кальция в кости, снижает интенсивность
всасывания кальция в кишечнике, концентрацию кальция в крови, увеличивает
выделение с молоком фосфата, кальция, калия и особенно натрия.
Гормоны эпифиза. Наиболее изучены серотонин, мелатонин, адреногломеру-
лотропин. Серотонин участвует в суточных колебаниях активности гипотала-
мо-гипофизарно-надпочечниковой системы, в трофической функции нервной
системы; медиатор тех межнейронных связей в стволе мозга, которые участвуют в
центральной регуляции кровяного давления, температуры тела, дыхания,
почечной фильтрации; поддерживает нормальный тонус и проницаемость сосудов;
активизирует перистальтику кишечника, тонус матки, бронхов. Мелатонин
является производным серотонина: обеспечивает связь эпифиза с гипоталамо-
гипофизарной системой, а также с щитовидной и половыми железами,
надпочечниками; участвует в регуляции развития половой системы,
предотвращает преждевременное развитие ее. Адреногломерулотропин является
продуктом восстановления мелатонина: стимулирует синтез и выделение клубочко-
вой зоной коры надпочечников гормона альдостерона.
Гормоны яичников. Эстрогены: эстрадиол и продукты его метаболизма
эстриол и эстрон. Биосинтез значительных количеств эстрогенов
происходит после наступления половой зрелости. Эстрогены стимулируют рост и развитие
половых органов — яичников, яйцеводов, матки, влагалища, а также молочных
желез; стимулирует развитие фолликулов, созревание яйцеклетки; у взрослых жи-
269
вотных поддерживают структурную организацию половых органов и
обеспечивают половые циклы (половое возбуждение, течку, охоту); вызывают половую
доминанту, соответствующее половое поведение; вызывают рост протоков молочных
желез; обеспечивают развитие вторичных половых признаков — усиление роста
рогов, тазовых костей; участвуют в регуляции обменных процессов, повышают
содержание фосфолипидов в крови, увеличивают синтез белков и накопление
мышечной ткани, повышают сопротивляемость организма к вредным
воздействиям, усиливают регенерацию при повреждении тканей, улучшают высшую
нервную деятельность.
Группы крови. В эритроцитах человека и животных обнаружены антигенные
факторы (у человека — 4, у сельскохозяйственных животных — большое
количество). Обозначают буквами латинского алфавита (А, В, С ... и др.) в соответствии с
международной номенклатурой. В плазме крови — естественные антитела —
агглютинины (у человека — 4, у сельскохозяйственных животных отсутствуют или
мало). Группа крови обусловлена сочетанием антигенов; систему групп крови
составляют антигены, наследование которых взаимообусловлено. Антигенные
факторы у сельскохозяйственных животных определяют с помощью антител,
образовавшихся после предварительной иммунизации животных — введения им
эритроцитов: у крупного рогатого скота идентифицировано 100 антигенных факторов,
объединенных в 12 систем; у свиней — 50 антигенов, образующих 14 систем; у
овец — около 100, образующих 7 систем; у лошадей — около 30, образующих 8
систем; у кур — 60 антигенов, сгруппированных в 14 систем.
Двигательная (моторная) деятельность желудка (рубца, сетки, книжки, сычуга),
тонкой и толстой кишок. Обеспечивает смешивание и продвижение содержимого в
желудке (сычуге), тонические, перистальтические и систолические сокращения; в
кишках — тонические, перистальтические, маятникообразные, ритмические
сегментирующие, антиперистальтические сокращения.
Дефекация. Сложный физиологический процесс, обусловленный
согласованной деятельностью сфинктеров прямой кишки, самой прямой кишки и мышц
брюшного пресса, обеспечивающий выведение кала из прямой кишки. У каждого
вида животных сопровождается характерными позами.
Динамический стереотип. Если изо дня в день в строго определенной
последовательности на животных действуют различные условные и безусловные
раздражители, вызывающие разные по силе условные рефлексы, то у них создается
определенный стереотип (последовательность) реакций коры на эту систему
раздражителей. Реакция на один раздражитель становится условным раздражителем
последующей реакции, облегчая осуществление реакции на очередной
раздражитель. Условный сигнал воспринимается не как изолированный раздражитель, а
как элемент определенной системы сигналов, находящихся в связи с
предыдущими и последующим раздражителями. Образуется динамический стереотип. Кора в
этих условиях реагирует на сигналы по определенному шаблону, с наименьшими
затратами энергии, обеспечивая более полное осуществление приспособительных
реакций.
Диффузная эндокринная система. Совокупность эндокринных клеток тканей
органов организма, образующих специфические гормоны —тканевые
гормоны. По числу инкреторных клеток превышает все известные железы
внутренней секреции; каждый вид клеток продуцирует специфические гормоны,
возбуждаясь через местные механизмы и с участием нервной системы; в ее составе
выделяют: гастроэнтеропанкреатическую эндокринную систему, почки,
околоушную железу, нервную ткань, тромбоциты и др.
Дыхание. Совокупность физиологических процессов, происходящих в
организме растений и животных, обеспечивающих поступление в организм О2 и СО2.
Дыхание у животных включает в себя следующие физиологические процессы:
1) обмен газами между внешней средой и смесью газов в альвеолах; 2) обмен газа-
270
ми между альвеолярным воздухом и газами крови; 3) транспорт газов кровью;
4) обмен газами между кровью и тканями; 5) тканевое дыхание.
Дыхание у птиц. Воздух, поступающий в организм при вдохе (мышцы грудной
стенки расслабляются, грудина смещается вниз, грудная полость расширяется,
становится большой, создается разность давлений воздуха между внешней средой
и в легких, осуществляется вдох, сопровождается движением воздуха
преимущественно через дорсальные бронхи), входит и заполняет легкие и воздушные
мешки — фактически контейнеры для запасной поставки порций свежего воздуха, где
он остается богатым 02. При выдохе мышцы грудной стенки сокращаются,
грудина поднимается, полость грудной клетки становится меньше и легкие сжимаются
так, что обогащенный С02 воздух вытесняется из дыхательных емкостей,
сопровождается движением воздуха преимущественно через вентральные бронхи. В
легочной ткани происходит так называемый двойной газообмен, который
осуществляется при вдохе и выдохе, благодаря этому вдох и выдох сопровождаются
извлечением 02 из воздуха и выделением С02.
Железы внутренней секреции. Это органы, образующие и выделяющие
химические вещества (гормоны), поступающие непосредственно в кровь: гипоталамус,
гипофиз, шишковидное тело (эпифиз), щитовидная железа, паращитовидные
железы, надпочечники, панкреатические островки (островки Лангерганса),
инкреторные аппараты яичников, семенников, плаценты, специальные клетки вилоч-
ковой (зобной) железы, слюнных желез, желудка, кишечника, поджелудочной
железы, печени, почек, селезенки, матки, легких, предстательной железы,
параганглий и др. — образуют диффузную эндокринную систему. Выполняют
роль эфферентного структурно-функционального звена различных
функциональных систем, участвуют в обеспечении различных приспособительных реакций.
Гипоталамус включает в себя кроме ядер из нервных клеток, не
обладающих инкреторной функцией, также и ядра, состоящие из нейроинкреторных
клеток. В клетках аденогипофизотропной зоны образуются 7
гормонов-стимуляторов (либерины) и 3 гормона-ингибитора (статины) инкреторной функции
передней доли гипофиза, которые по портальной системе поступают в аденогипо-
физ и осуществляют свое действие; меланолиберин и меланостатин по аксонам
доставляются к железистым клеткам промежуточной доли гипофиза; клетки суп-
раоптического ядра вырабатывают антидиуретический гормон, паравентрикуляр-
ного ядра — окситоцин. Образующиеся гормоны поступают по гипоталамо-гипо-
физарному пучку в заднюю долю гипофиза, накапливаются и по мере
необходимости поступают в ток крови. Каждый отдельный гормон гипоталамуса обладает
специфическим действием: кортиколиберин действует на переднюю долю
гипофиза (орган-мишень), стимулирует процесс образования и выделения в кровь ад-
ренокортикотропного гормона, тиролиберин — тиреотропного гормона, сомато-
либерин — гормона роста, фоллиберин — фолликулостимулирующего гормона,
люлиберин — лютеинизирующего гормона, пролактолиберин — пролактина,
меланолиберин — меланоцитостимулирующего гормона; соматостатин угнетает
образование и выделение гормона роста, пролактостатин — пролактина,
меланостатин — меланоцитостимулирующего гормона.
Гипофиз включает: аденогипофиз (железистая доля): клетки его
вырабатывают соматотропный, лактотропный, фолликулостимулирующий, лютеинизи-
рующий, тиреотропный, адренокортикотропный и липотропный гормоны;
клетки промежуточной доли — меланоцитостимулирующий гормон; нейрогипофиз
(мозговая часть), где накапливаются окситоцин и антидиуретический гормон.
Надпочечники — парные железы. Состоят из коркового слоя (2/3) и
глубокого мозгового слоя (1/3), которые представляют собой самостоятельные
железы внутренней секреции. Кора надпочечников состоит из трех зон: клубочковая,
сетчатая и пучковая различаются морфологически и функционально;
продуцируют различные гормоны, общее название которых стероидные; основными пред-
271
шественниками гормонов коры надпочечников являются уксусная кислота и
холестерин, соответственно минералокортикоиды, глюкокортикоиды и половые.
Мозговое вещество надпочечников состоит из крупных клеток с большим ядром и
зернистой протоплазмой (хромаффинные клетки), образованных из той же
эмбриональной ткани, что и клетки симпатических ганглиев; синтезирует и выделяет
гормоны — адреналин, норадреналин, дофамин, называемые катехоламинами.
Островков ый аппарат поджелудочной же л езы, или
панкреатические островки, составляет 3...10 % массы поджелудочной железы. Состоит
в основном из бета-клеток (около 70 %) и альфа-клеток — 20 %: бета-клетки
продуцируют гормон инсулин, альфа-клетки — гормон глюкатон.
Тимус (вилочковая, зобная железа) состоит из клеток лимфоид-
ных и ретикулярных. Является центральным органом системы иммуногенеза,
ответственным за формирование и функционирование клеточной системы
иммунитета: процесс дифференцировки полипотентной стволовой кроветворной клетки
костного мозга происходит через ряд стадий в иммунокомпетентный Т-лимфо-
цит; инкретирует гормоны тимозин, тимин и Т-активин.
Щитовидная железа — структурно-функциональной единицей железы
является фолликул, имеющий стенку из одного слоя эпителиальных кубических
клеток и полость круглой или овальной формы; вне железистых фолликулов
располагаются парафолликулярные клетки. Фолликулярные клетки активно
поглощают йодит из крови, преобразуя его в органически связанный йод, синтезируют
специфические гормоны тироксин (тетрайодтиронин) и трийодтиронин из
аминокислоты тирозина и неорганического йода; парафолликулярная ткань
продуцирует кальцитонин.
Эпифиз — паренхима железы состоит из богатых цитоплазмой с большим
ядром клеток и мелких, бедных цитоплазмой клеток. Трансформирует нервные
импульсы от зрительных рецепторов в инкреторный процесс. Участвует в
обеспечении циркадных ритмов, «биологических часов». В ней образуется большое
количество биологически активных веществ, наиболее изучена физиологическая
роль серотонина, мелатонина, адреногломерулотропина.
Яичник — парный орган, ответственный за продукцию гормонов —
фолликул, клетки внутренней оболочки которого под влиянием лютеинизирующих
гормонов продуцируют андрогены, которые проникают в клетки гранул езы и под
влиянием системы ферментов превращаются в эстрогены.
Желтое тело образуется после овуляции в процессе лютеинизации
гранулезных клеток, при этом клетки теряют способность ароматизации в них анд-
рогенов и превращения их в эстрогены. Продуцирует гормоны прогестерон и
релаксин.
Плацента — временная эндокринная железа в перид беременности. В ней
осуществляются процессы синтеза, секреции и превращения гормонов в эпителии
ворсин — синцитиотрофобласте и цитотрофобласте; продуцирует хорионический
гонадотропин и хорионические гормоны.
Паращитовидные (околощитовидные) железы — основную
массу их составляют «темные» главные клетки. В паренхиме железы содержится
коллоидное вещество, где в большой степени концентрируется синтезируемый
железой паратгормон.
Семенники включают в себя интерстициальные клетки; клетки Лейдига
семенников обеспечивают инкрецию гормонов андрогенов, в меньших
количествах — эстрогенов и гормона ингибина.
Желудочные (сычужные) железы. Состоят из главных, обкладочных и
добавочных клеток; продуцируют кислый (рН 1,0...4,0) желудочный (сычужный) сок,
содержащий свободную и связанную соляную кислоту (продуцируют обкладочные
клетки желез фундальной части), неорганические (натрий, калий, кальций,
магний, хлориды, фосфаты, сульфиты, бикарбонаты) и органические вещества —
272
ферменты пепсин и реннин, или химозин, желудочную липазу (продуцируют
главные клетки желез), в небольшом количестве белки, пептоны, аминокислоты,
молочную кислоту, мочевину. Секреция желудочного сока начинается через
10 мин после начала приема корма и достигает максимума к концу первого часа,
сычужного сока — осуществляется непрерывно: натощак на низком уровне, после
приема корма повышается.
Иммунная система. Специальная система организма, обеспечивающая защиту
его от всего генетически чужеродного, распознающая антигены, поступающие
извне, и собственные измененные клетки. Представлена совокупностью органов,
тканей и клеток, деятельность которых обеспечивает иммунитет. Вместе с
нервной и эндокринной системами обеспечивает поддержание постоянства
иммунного статуса организма и его приспособление к изменяющимся условиям
внешней и внутренней среды, котролируя качественное постоянство генетически
обусловленного клеточного и гуморального состава организма.
Иммунитет. Невосприимчивость организма к инфекционным и другим
чужеродным агентам (антигенам), обусловленная наличием в крови и тканях
специальных защитных веществ — антител; известно два основных вида иммунитета
(иммунного ответа) к антигену: гуморальный и клеточный.
Гуморальный иммунитет связан с образованием антител. При
связывании антигена с соответствующим рецептором и под влиянием цитокинов,
вырабатываемых моноцитами, макрофагами и Т-лимфоцитами, происходит
активация В-лимфоцитов (антигенраспознающие рецепторы В-лимфоцитов
представляют собой молекулы иммуноглобулинов), которые начинают делиться и
дифференцироваться в лимфатических узлах в плазматические клетки.
Клеточный иммунитет связан с образованием специализированных
клеток, реагирующих с антигеном посредством его связывания и последующего
разрушения. Иммунная реакция опосредована клетками — цитотоксическими
Т-лимфоцитами и Т-хелперами.
Интерорецепция. Обеспечивает приспособительные реакции организма к
изменениям условий внутренней среды (состояния внутренних органов, мышц,
суставов, сухожилий и фасций, положение тела и отдельных его частей в
пространстве). Включает три вида рецепций: висцерорецепцию, проприорецепцию и вес-
тибулорецепцию.
Интранатальный период развития организма. Промежуток времени от начала
родовой деятельности до рождения; сравнительно короткий, в нем фазы не
выделяют.
Кишечные железы. В начальной части двенадцатиперстной кишки трубчатые
(бруннеровы железы), дальше, в тонкой кишке — кишечные крипты — трубчатые
углубления эпителия, в толстой кишке желез мало, больше бокаловидных энтеро-
цитов. Секретируют кишечный сок щелочной реакции (рН 7,4...8,2), содержащий
много ферментов: энтеропептидазу, щелочную фосфатазу, нуклеазы, нуклеозида-
зы, катепсин, лейциноаминопептидазу, аминотрипептидазы, пролиназу, дипепти-
дазу, глюкозидазу, галактозидазу, амилазу, липазу. Секреция начинается через
15...30 мин после начала приема корма, достигая максимума к концу 2...3-го часа.
У жвачных происходит непрерывно на низком уровне натощак, уровень секреции
повышается после приема корма, достигает максимума в разгар кишечного
пищеварения.
Клетка (животная). Сложное образование, представляет собой
структурно-физиологическую единицу тканей, органов, организма в целом.
Кожа животных. Эпителиально-соединительнотканный орган, состоящий из
наружного эпителиального слоя — эпидермиса, среднего
соединительнотканного — дермы, внутреннего рыхлого соединительнотканного —
подкожной клетчатки. Выполняет большую роль: защитную, дыхательную,
абсорбционную, перспирационную, выделительную, пигментообразующую, терморегу-
273
лирующую, обменную, рецепторную; служит депо крови, воды, минеральных
веществ и витаминов. Структурная организация и деятельность кожи
обеспечиваются рефлекторно-гормонально.
Комплемент. Группа белков крови, состоящая из протеаз и их активаторов
(более 25 белков — компонентов комплемента, выявляемых в крови и на
поверхности некоторых клеток). Играет важную роль в защите от чужеродного
(микроорганизмов), являясь неспецифическим гуморальным защитным механизмом:
разрушает бактериальные и инфицированные вирусами собственные клетки, участвует
в регуляции воспалительных и иммунных реакций.
Кора больших полушарий головного мозга. Высший и особо сложный по своей
структуре и функции отдел ЦНС — тонкий слой серого вещества (1,3...4,5 мм),
покрывающий большие полушария. Состоит из нейронов (в основном
пирамидных, веретенообразных и звездчатых) с множеством типов соединений,
расположенных в шесть слоев: молекулярный, образован в основном нервными
волокнами; наружный зернистый, образован мелкими звездчатыми клетками; наружный
слой пирамидных клеток разной величины; внутренний зернистый, образован
звездчатыми клетками; больших пирамидных клеток, полиморфный, состоит из
веретеновидных клеток. Имеется большое количество (в 10 раз больше, чем
нейронов) глиальных клеток, выполняющих опорную, обменную, секреторную
(выделяют вещества, регулирующие возбудимость нейронов) роли, а также
участвующих в хранении следов осуществленных реакций (память). По функциональной
значимости нейроны коры подразделяют на сенсорные (третий и четвертый слои),
воспринимают афферентные импульсы от ядер таламуса, с рецепторов сенсорных
систем; моторные (пятый слой пирамидных клеток), посылают импульсы к
подкорковым ядрам, промежуточному, среднему, продолговатому мозгу, мозжечку и
ретикулярной формации, спинному мозгу, образуют корковые отделы нервных
центров; контактные, или промежуточные, нейроны. По
структурно-функциональной организации в коре выделяют: сенсорные зоны — корковые концы
анализаторов, состоящие из ядра и рассеянных нейронов; ассоциативные зоны,
или области, прилегающие к сенсорным зонам (вторичные сенсорные зоны);
моторные зоны, или корковые отделы нервных центров (с премоторной зоной
кпереди от моторной и дополнительной моторной областью на медиальной
поверхности полушарий). В целом кора больших полушарий осуществляет свою
деятельность по принципу условного рефлекса, поэтому ее деятельность называется
условно-рефлекторной; обеспечивает быструю связь с внешней средой и более
полное приспособление состояния и деятельности всего организма через
периферическую нервную систему и железы внутренней секреции к меняющимся
условиям внешней и внутренней среды; с деятельностью коры больших полушарий
связаны память, мышление, речь.
Корм. Источник энергии, пластических веществ и большого ряда
биологически активных элементов. Служит источником питательных веществ: белков,
жиров, углеводов, минеральных веществ, витаминов и воды.
Красное ядро. Получает импульсы с рецепторов мышц, от коры больших
полушарий, подкорковых ядер и мозжечка. Оказывает постоянное корригирующее
влияние на мотонейроны спинного мозга через ядро Дейтерса, руброспинальный
тракт.
Кровеносные сосуды. Множество трубок со стенкой из эластических, коллаге-
новых, гладкомышечных, фибриллярных элементов, соединенных параллельно и
последовательно, обеспечивающих движение крови по организму. По структурно-
физиологическим особенностям различают сосуды «котла», или растяжимые
(аорта, крупные артерии, легочная артерия), буферные сосуды, стабилизаторы
давления; прекапиллярные сосуды сопротивления (мелкие артерии и артериолы),
сосуды высокого давления; прекапиллярные сфинктеры; обменные сосуды
(капилляры); посткапиллярные сосуды сопротивления (венулы и мелкие вены);
274
емкостные сосуды (вены), аккумулирующие сосуды (мелкие и средние вены) —
емкости и сосуды возврата крови (крупные вены); шунтирующие сосуды.
Кровообращение. Это движение крови по кровеносной системе,
обеспечиваемое главным образом сокращениями сердца и тонусом сосудом. От левого
желудочка начинается аорта, переходит в артерии, артериолы и капилляры всех
органов и тканей, капилляры переходят в венулы, они объединяются в вены,
впадающие в виде двух полых вен (краниальной и каудальной) в правое предсердие, —
составляют большой круг кровообращения. От правого желудочка
начинается легочная артерия, делится на ряд артерий, переходящих в артериолы,
капилляры легких, капилляры переходят в венулы и легочные вены (5...7),
впадающие в левое предсердие, — составляют малый круг
кровообращения.
Кровь. Представляет собой жидкую ткань. Имеет красный цвет, который ей
придают эритроциты. Состоит из жидкой части (58...62 %) — плазмы крови и
форменных элементов — эритроцитов, лейкоцитов и тромбоцитов (38...42 %).
Характеризуется постоянством свойств и компонентов. Вместе с тканевой жидкостью и
лимфой образует внутреннюю среду организма; принимает непосредственное
участие в процессах обмена веществ.
Кровяное давление. Давление, которое оказывает кровь на стенки кровеносных
сосудов, по которым она движется. Различают артериальное и
венозное давление крови. Величина артериального давления крови
определяется силой сердечных сокращений, количеством крови и сопротивлением
кровеносных сосудов. В артериях различают максимальное (систолическое),
минимальное (диастолическое), среднее и пульсовое кровяное давление. Максимальное
давление крови возникает во время сокращения (систолы) желудочков, составляет
115...125 мм рт. ст. Минимальное давление (70...80 мм рт. ст.) возникает при
расслаблении сердечной мышцы (диастоле); пульсовое давление — разница между
максимальным и минимальным; среднее давление — сумма максимального и
минимального, деленная на 2.
Кровяное депо. Орган или ткань, обладающие способностью накапливать в
своих сосудах значительное количество крови. При необходимости,
функциональных нагрузках кровь из депо поступает в сосуды, чем предотвращается
падение артериального давления и притока крови к сердцу.
Лабильность (функциональная подвижность). Скорость тех элементарных
(ответных) реакций, которыми сопровождается деятельность ткани или органа после
воздействия раздражителя; показатель (мера) ее — наибольшее (максимальное)
число ответных реакций, которое ткань или орган способны воспроизвести в 1 с
при частых их раздражениях; наибольшая лабильность у нервной ткани —
способна воспроизвести ритм раздражений, равный 1000 импульсов в 1 с.
Лимбическая система. Самостоятельное структурно-физиологическое
образование, кольцеобразно охватывает основание среднего мозга на границе со
стволовой частью мозга; включает в себя свод, гиппокамп, поясную извилину и др.,
основная структура — гиппокамп. Нейроны лимбической системы получают
импульсы с коры, подкорковых ядер, таламуса, гипоталамуса, ретикулярной
формации, со всех внутренних органов. Участвуют в афферентном синтезе,
включаются в механизмы памяти — фиксации прежнего опыта, в контроле
электрической активности мозга, бодрствования и развития сна, обеспечении вегетативных
реакций (ее называют висцеральным мозгом), в формировании эмоционального
поведения животного.
Лимфа. Жидкая ткань организма, содержащаяся в лимфатических сосудах и
узлах. Вместе с тканевой жидкостью и кровью образует внутреннюю среду
организма; принимает непосредственное участие в процессах обмена веществ.
Медиатор. Передатчик нервного импульса — химическое соединение,
выделяемое нейросекреторным аппаратом нервного окончания — пресинаптической
275
мембраны синапса. Роль медиатора у животных в скелетных мышцах играет
ацетил хол и н.
Мембранное пищеварение. Гидролиз веществ корма на ворсинках и
микроворсинках в тонкой кишке; осуществляется ферментами, адсорбированными из
полости тонкой кишки, а также собственно кишечными ферментами,
синтезируемыми в энтероцитах и встроенными в мембрану. Расщепляются преимущественно
промежуточные продукты гидролиза белков, жиров и углеводов (пептиды, дигли-
цериды, дисахариды), образуются мономеры, которые и транслируются в кровь.
Метасимпатическая нервная система. Представлена интрамуральными
ганглиями, расположенными в толще стенок полых внутренних органов. По
физиологической роли выделяют чувствительные нейроны, интернейроны, эффекторные
нейроны и необходимые для автономной и интегративной деятельности звенья —
сенсорное, ассоциативное и эфферентное. Объединяются в рефлекторные дуги с
помощью синапсов, медиаторов. Имеются собственные сенсорные элементы: ме-
хано-, хемо-, термо-, осмо- и другие рецепторы, которые постоянно посылают в
свои внутренние нейронные сети информацию о состоянии стенки внутреннего
органа. Не имеет представительств в ЦНС в отличие от симпатической и
парасимпатической и является в значительно большей степени самостоятельной,
автономной; не имеет своего центрального аппарата: все звенья ее рефлекторного
пути локализуются только в интрамуральных ганглиях. Ее эфферентные связи с
центральными структурами опосредованы нейронами симпатической и
парасимпатической нервной системы, образующими синаптические контакты на
телах и отростках метасимпатических интернейронов и эффекторных нейронов.
Относительно независимая самостоятельная интегративная система;
эффективно контролирует и управляет висцеральными системами, обеспечивает
надежность регуляции их функций. Медиаторную роль в системе осуществляют не
менее 20 медиаторов и модуляторов холинергической, адренергической, серотони-
нергической, пуринергической, пептидергической, дофаминергической,
ГАМК-ергической и другой природы. Метасимпатическая нервная система
программирует и координирует двигательную, секреторную и всасывательную
активность желудка и кишечника, активность местных эндокринных элементов и
локальный кровоток.
Метод наблюдения. Оценка проявления того или иного физиологического
процесса, той или иной функции органа, ткани в естественных условиях.
Предусматривает использование простых и сложных приборов, вспомогательных
операций (наложение фистул на исследуемый орган, вживление электродов и др.).
Метод эксперимента (или опыта). Определение роли факторов,
обеспечивающих деятельность тканей, органов, организма, путем направленного устранения
или усиления действия того или иного условия (фактора) жизнедеятельности
тканей, органов, организма. По результатам делают заключение, почему
осуществляются данный физиологический процесс или функция. Предусматривает
использование простой и сложной современной аппаратуры, приборов, входящих в
системы, предназначенные для воздействия на объект, для регистрации различных
проявлений жизнедеятельности, а также вспомогательных приемов (перерезка
нерва, вживление электродов, наложение фистул и др.).
Механизм неспецифической защиты (естественная резистентность). Представлен
механическими барьерами кожи и слизистых оболочек, препятствующими
проникновению микроорганизмов и другого чужеродного внутрь организма;
дополняются деятельностью мерцательного эпителия, свойствами слизи, лизоцима,
лактоферина и интерферонов. В случае проникновения генетически чужеродного
через кожу и слизистые оболочки в их удалении и удалении собственных
измененных клеток участвуют комплемент, нейтрофилы, другие гранулоциты,
макрофаги.
Механизм специфической защиты. Представлен иммунной системой, лимфо-
276
цитами, антителами, которые являются продуктом деятельности иммунной
системы.
Микроциркуляция. Ток крови через терминальные артериолы, метартериолы,
прекапиллярные сфинктеры, капилляры и посткапиллярные венулы.
Мион (мышечная единица). Мышечное волокно с нервными окончаниями,
кровеносными и лимфатическими капиллярами; мышечные волокна объединены
в пучки I, II и III порядка.
Мозжечок. Структурно-физиологическое образование ЦНС из нейронов,
которые образуют ядра мозжечка, имеют прямые и обратные связи (пучками
нервных волокон) с корой больших полушарий, средним и продолговатым (красным
ядром и вестибулярными ядрами) и спинным (проекционными и
мотонейронами) мозгом. Различают три части: вестибулярную, спинальную и корковую.
Мозжечок вносит необходимые поправки в двигательные реакции, обеспечивая их
точность, согласованность быстрых и медленных компонентов двигательных
актов, координацию движений, вегетативных реакций, возбудимость и лабильность
соматических и вегетативных центров.
Молозиво. Секрет, образующийся в молочной железе в первые дни лактации
(2... 10 сут), желтовато-коричневого цвета, вязкой консистенции, солоноватого
вкуса. Содержит много белков, минеральных солей (особенно много магния),
углеводы, жиры, витамины, гидролитические ферменты; состав молозива отдельных
видов животных имеет большие различия; имеет высокую биологическую
ценность и калорийность, необходимо для поддержания жизни новорожденного.
Молоко. Секрет, образующийся в молочной железе во время установившейся
лактации. Имеет сложный химический состав: в нем более 100 различных
веществ — белки и аминокислоты, липиды и жирные кислоты, различные углеводы,
около 40 различных минеральных веществ, 17 витаминов, десятки ферментов
и др.
Молоковыведение. Переход образующегося молока из альвеолярно-протоково-
го отдела в цистернальный (распределение молока) в период от доения (сосания)
до следующего доения.
Молокоотдача. Выведение молока из альвеолярно-протокового отдела в
цистернальный при доении и сосании.
Моторная единица мышц. Объединение из одного нейрона и иннервируемой
им группы мышечных волокон.
Мышечные волокна скелетных мышц. Специализированные клетки
цилиндрической формы длиной до 10... 12 см, диаметром 10... 100 мкм. В саркоплазме
располагаются все компоненты животной клетки: вдоль оси мышечного волокна —
миофибриллы (более 2000), в них — протофибриллы (нити белков
миозина и актина) — сократительный аппарат мышечного волокна.
Мышечные клетки гладких мышц (миоциты). Веретенообразной формы клетки
длиной 60...400 мкм, диаметром 4... 10 мкм; соединены между собой особыми
межклеточными контактами (десмосомами), образуя «функциональный синцитий».
Имеют все компоненты животной клетки (ядро одно); сократительный аппарат
представлен нерегулярно распределенными миозиновыми и актиновыми прото-
фибриллами.
Мышцы гладкие. Находятся в полых внутренних органах (желудок, кишечник
и др.), в кровеносных сосудах, коже.
Мышцы скелетные. Вместе со скелетом составляют опорно-двигательную
систему организма, которая обеспечивает поддержание позы и перемещение
отдельных частей тела и всего тела в пространстве. Выполняют и защитную функцию,
предохраняя внутренние органы от повреждений.
Нейроглия. Клетки нейроглии располагаются между нейронами; пространство
между ними заполнено жидкостью; между нейронами и глиальными клетками
осуществляется обмен веществ.
277
Нейрон. Это структурно-физиологическая единица нервной системы. Состоит
из тела (сомы) и отростков (чаще двух — биполярные нейроны и большего
количества — многоотростковые или мультиполярные). Отростки: длинный неветвя-
щийся аксон и короткие ветвящиеся дендриты; аксон проводит
возбуждение от тела нейрона, а дендриты — к телу нейрона.
Нерв. Сложное образование, состоящее из большого числа нервных волокон,
заключенных в общую соединительнотканную оболочку.
Нервно-гормональная регуляция. Регуляция, обеспечиваемая нервной и
гормональной системами. Совместная рефлекторно-гормональная регуляция —
основная форма регуляции в организме.
Нервная система. Образована нейронами и клетками нейроглии (они
выполняют опорную, защитную и трофическую роли): нейроны составляют 10... 15 %
(примерно 50 млрд) общего числа, основная часть — клетки нейроглии.
Подразделяется на центральную (включает головной и спинной мозг) и
периферическую (нервы, отходящие от центральной нервной системы к органам). Благодаря
нервной системе организм осуществляет свою деятельность по принципу
рефлекса.
Нервное волокно. Отросток нервной клетки (нейрона) — дендрит или аксон.
Состоит из осевого цилиндра и покрывающей его миелиновой оболочки,
прерывающейся через каждые 1 ...2,5 мм, — мякотные волокна, не имеющие
миелиновой оболочки — безмякотные.
Нервный центр. Образован большим количеством интернейронов и
двигательных нейронов. Сложное образование рефлекторной дуги, представляющее собой
ансамбль нейронов, расположенных в различных отделах ЦНС, включая кору
больших полушарий, и обеспечивающих конкретную приспособительную
реакцию.
Нефрон. Структурно-физиологическая единица почки (в почках животных —
миллионы). Обеспечивают ряд процессов: фильтрацию в почечном тельце, реаб-
сорбцию, секрецию, синтез и превращение веществ в канальцах, выделение из
организма чужеродных веществ и нелетучих продуктов обмена, поддержание
кислотно-щелочного равновесия в крови, постоянство условий внутренней среды
организма.
Обмен веществ и энергии. Согласованная деятельность ряда систем,
обеспечивающая прием корма, гидролиз белков, жиров и углеводов, воды, освобождение
минеральных веществ и витаминов корма в пищеварительном аппарате,
всасывание продуктов гидролиза, воды, освободившихся минеральных веществ и
витаминов, распределение, превращение и использование всосавшихся веществ в тканях
и органах, освобождение и использование энергии, поддержание определенных
концентраций обменных веществ в крови и тканях, определенной температуры
тела, а также выведение из организма непереваренных и невсосавшихся
компонентов корма, конечных продуктов превращения и избытка всосавшихся веществ,
отдачу в окружающую среду образующейся тепловой энергии.
Образование условных рефлексов. Образуются по определенным правилам: при
неоднократном сочетании, одновременном действии индифферентного
раздражителя и какого-либо безусловного раздражителя, вызывающего определенный
безусловный рефлекс; при условии, когда действие индифферентного (т. е.
вначале безразличного к данному виду деятельности) сигнала предшествует не менее
чем на 0,1 с началу действия безусловного раздражителя; будущий условный
раздражитель должен иметь определенную силу, но меньшую, чем безусловный. В
основе образования лежит формирование временной связи в коре больших
полушарий между той или иной сенсорной зоной (в зависимости от того, какие
рецепторы воспринимают индифферентный раздражитель) и нейронами моторной
зоны, связанными с обеспечением проявляемого в данный момент безусловного
рефлекса. Временная связь между названными пунктами коры может замыкаться
278
через кору, подкорковые образования (таламус) и путем образования связи в
одном нейроне коры с химическим взаимодействием в молекулярных организациях
аксоплазмы. Образование временной связи возможно благодаря законам
взаимодействия нервных процессов в коре: иррадиации, коцентрации, доминанте.
Одиночное сокращение мышцы. Сокращение мышцы в ответ на одиночное
раздражение; осуществляется очень быстро (0,04...0,1 с). В нем различают три фазы:
скрытую, укорочения и расслабления.
Оплодотворение. Физиологический процесс взаимодействия, слияния
яйцеклетки и спермия с образованием новой клетки — зиготы. Связано с процессами
спаривания, секреции специфических секретов железами половых органов, с
движением половых органов.
Орган. Объединение различных тканей, которое структурно и функционально
специализировано выполнять сложную деятельность.
Организм. Открытая, самостоятельно существующая, саморегулирующаяся
единица органического мира, которая отвечает реакцией как единое целое на
изменение условий окружающей среды.
Остеоны. Наружный и внутренний слои пластинок за надкостницей, между
которыми помещается система пластинок, расположенных концентрически
вокруг кровеносных сосудов. В каждом остеоне в центре находится канал, в котором
проходят кровеносные сосуды и симпатические нервные волокна; между
пластинками располагаются остеоциты.
Остеоциты. Костеобразующие клетки, расположенные во внутреннем слое
надкостницы. Различают три вида костных клеток: остеобласты, остеокласты и
остеоциты. Обеспечивают два процесса: построение и разрушение костной ткани.
Парасимпатическая иннервация. Образована парасимпатическими нейронами
среднего, продолговатого мозга и крестцового отдела спинного мозга, а также
парасимпатическими нейронами ганглий, расположенных чаще в органах. В
среднем мозге находятся ядра глазодвигательного нерва (III пара черепных нервов); в
продолговатом мозге — три пары ядер, от которых отходят три пары черепных
нервов: лицевой (VII пара), языкоглоточный (IX пара), блуждающий (X пара), в
спинном мозге в боковых рогах трех сегментов крестцовой части располагаются
ядра преганглионарных парасимпатических нейронов. Роль парасимпатической
иннервации в регуляции деятельности органов организма сравнительно
ограничена: иннервирует мышцы глаз, слюнные железы, мышцы языка, трахеи и бронхов,
легкие, все органы пищеварения, сердце, почки, мочевой пузырь и мочеточники
и другие внутренние органы, некоторые кровеносные сосуды (языка,
подчелюстной железы, пещеристых тел полового члена). Влияния осуществляет либо прямо
на иннервируемые органы, как в кольцевых мышцах радужной оболочки глаза
или в слюнных железах, либо посредством метасимпатической нервной системы.
В первом случае постганглионарный нейрон непосредственно контактирует с
эффектором и вызываемое им действие зависит главным образом от прямых
влияний ЦНС. Основная роль парасимпатической нервной системы (совместно с
метасимпатической) состоит в регуляции механизмов различных функций,
обеспечивающих гомеостаз — относительное динамическое постоянство внутренней
среды и устойчивость основных физиологических функций; обеспечивающих
также восстановление и поддержание этого постоянства, дестабилизированного
симпатической нервной системой; совместно с симпатической обеспечивающих
оптимальную деятельность органов, которые они иннервируют при стрессовых
воздействиях, оказывают чаще влияния, противоположные действию симпатической
нервной системы.
Периферический соматический отдел нервной системы. Обеспечивает
осуществление ЦНС двигательных реакций. Образован аксонами мотонейронов и ак-
соноподобными дендритами рецепторных нейронов, идущими из ЦНС,
спинномозговых и черепно-мозговых ганглиев к периферическим исполнительным
279
органам, не прерываясь; скорость проведения возбуждения в них высокая
(З0...120м/с).
Пищеварение. Совокупность процессов механического и химического
превращения корма до такого состояния питательных и биологически активных
веществ, в котором они могут всосаться в кровь и лимфу. Механическое
превращение корма представляет собой измельчение, расплющивание, растирание его до
состояния кашицы с помощью зубов и мышц пищеварительного аппарата.
Химическое превращение корма происходит с помощью ферментов пищеварительных
соков желез пищеварительного аппарата, ферментов микроорганизмов и
ферментов пищи.
Пищеварение в желудке (сычуге). Происходит в основном превращение белка
(в сычуге — погибающих бактерий и простейших): соляная кислота желудочного
сока вызывает набухание, денатурацию белка, активирует продуцируемый
неактивный пепсиноген в активный пепсин, пепсин путем гидролиза расщепляет
белок до пептидов, альбумоз и пептонов, частично — до аминокислот; реннин в
период молочного питания действует на молочный белок — казеиноген, превращает
его в казеин, створаживает молоко; желудочная липаза расщепляет
эмульгированные жиры до жирных кислот и глицерина.
Пищеварение в кишечнике. Продолжается гидролиз белков, осуществляется
гидролиз углеводов и жиров под действием ферментов поджелудочного сока,
желчи, кишечного сока. Трипсин поджелудочного сока вырабатывается в неактивной
форме — трипсиноген, под действием энтеропептидазы кишечного сока
превращается в трипсин, который активирует продуцируемые в неактивной форме хи-
мотрипсиноген в химотрипсин, прокарбоксипептидазу — в карбоксипептидазу,
пропанкреатопептидазу — в панкреатопептидазу, профосфолипазу — в фосфоли-
пазу. Трипсин и химотрипсин действуют на белки и полипептиды и
расщепляют их до пептидов и аминокислот, карбоксипептидазы и
пептид азы расщепляют пептиды до аминокислот, дезоксирибонуклеаза
и рибонуклеаза расщепляют нуклеиновые кислоты на нуклеотиды и
фосфорную кислоту. Амилаза расщепляет крахмал и гликоген до декстрина и
мальтозы; глюкозидаза гидролизует мальтозу до глюкозы;
фруктофуронидаза — сахарозу до фруктозы и глюкозы; галактозидаза — лактозу до
глюкозы и галактозы. Липаза активизируется ионами кальция и желчными
кислотами; расщепляет жиры на глицерин и жирные кислоты. Гидролиз олиго- и
дипептидов, фосфорных эфиров, липидов, дисахаридов осуществляется в
основном на цитоплазматических мембранах микроворсинок (пристеночное или
мембранное пищеварение соответствующими ферментами). В толстой кишке гидроли-
зуются клетчатка, крахмал, жиры; синтезируются жиры бактериями.
Плацента. Комплекс тканевых образований: материнская часть представлена
измененной оболочкой матки; плодная часть состоит из сосудистой (хорион),
водной, околоплодной (амнион) и мочевой (аллантоис) оболочек.
Поджелудочная желаза. Состоит из секреторных клеток, продуцирующих
поджелудочный сок щелочной реакции (рН 7,8...8,4). Содержит неорганические
вещества — бикарбонаты, хлориды, фосфаты, сульфаты, натрий, калий, НСОз и др.;
органические вещества — липиды, белки, различные ферменты: протеиназы
(трипсин, химотрипсин, панкреатопептидаза Е, или эластаза), карбоксипептидазу —
пептидаза, калликреин, дезоксирибонуклеаза, рибонуклеаза, а-амилаза,
глюкозидаза, фруктофуронидаза, галактозидаза, липаза, фосфолипаза А. Секретируется
через 15...30 мин после начала приема корма, максимум — к концу 2...3-го часа; у
жвачных — непрерывно на низком уровне натощак, уровень секреции
повышается после приема корма, достигает максимума в разгар кишечного пищеварения.
Подкорковые (базальные) ядра, или стриопаллидум. Самостоятельные
структурно-физиологические образования, расположены в белом веществе больших
полушарий. Представлены хвостатым ядром, скорлупой и бледным шаром: хвостатое
280
ядро и скорлупа образуют полосатое тело — стриатум, а бледный шар — паллидум.
Имеют обширные связи с другими отделами ЦНС. Стриопаллидум играет роль
высшего подкоркового двигательного центра, обеспечивает сложные
двигательные реакции организма и согласование с ними вегетативных реакций (ритма
сокращений сердца, тонуса сосудов, частоты дыхания и др.). Стриатум
осуществляет корригирующие влияния на активность паллидума, а паллидум — на
моторные ядра таламуса, через таламус осуществляются влияния на гипоталамус,
красное ядро, ретикулярную формацию и через них — на периферические
исполнительные органы.
Поедание корма. Связано с поиском корма, захватыванием его языком, губами
и зубами, пережевыванием, увлажнением слюной, формированием пищевого
кома, проглатыванием и продвижением его по пищеводу. Захват корма
осуществляется зубами и губами с участием языка, далее порция корма направляется на
поверхность зубов и пережевывается, животное делает 22...60 жевательных
движений.
Половая зрелость. Определенная фаза постнатального развития организма,
когда половая система становится способной обеспечивать развитие и выведение
половых клеток.
Половой цикл. Совокупность процессов созревания фолликула (фолликулов) и
яйцеклетки (яйцеклеток), овуляции, развития желтого тела в яичнике,
обусловленная повышением активности полового центра и сопровождающаяся
связанными с ней структурно-функциональными изменениями яйцепровода, матки,
влагалища, формированием половой доминанты, полового возбуждения, половой
охоты и полового успокоения.
Послеродовой период. Отрезок времени с момента выделения последа до
завершения инволюции половых органов, возвратных изменений состояния и
деятельности половых и других органов.
Постнатальный период. Период развития организма с момента разобщения с
материнским организмом до естественной смерти. Выделяют 4 фазы: молозивную
форму питания (или новорожденное™), молочную, молочно-растительную,
растительную форму питания.
Потенциал (ток) покоя. Ток в возбудимых тканях в состоянии покоя; величина
определяется соотношением числа положительно заряженных ионов калия,
диффундирующих в единицу времени из клетки наружу, и положительно заряженных
ионов натрия — через мембрану в противоположном направлении.
Потовые железы. Простые трубчатые железы. Дистальный конец железы имеет
вид извитого клубочка (или мешочка) и располагается в дерме; выводной проток
(проксимальный конец) открывается на поверхность эпидермиса или во
влагалище волоса либо самостоятельно потовой порой. Секреторная часть железы
представлена железистыми клетками, образующими два типа потовых желез: э к-
кринные, выделяющие жидкий секрет (у человека и лошади), и эпокрин-
н ы е, выделяющие секрет с большим содержанием жироподобных веществ
(деятельность протекает с распадом отдельных собственных клеток) — жиропот.
Превращение белковых и небелковых азотсодержащих веществ в преджелудках
жвачных. Протеин (составляет 7...30 % в сухом веществе растительных
кормов) расщепляется бактериями и простейшими микроорганизмами,
продуцирующими ферменты протеиназы, карбоксипептидазы, лейцинаминопептидазы, деза-
миназы, до пептидов и свободных аминокислот; аминокислоты в значительной
степени дезаминируются дезаминазами, в преджелудках появляется большое
количество аммиака; образующийся аммиак используется микроорганизмами для
синтеза всех аминокислот и собственного белка в связи с их размножением и
ростом. Небелковые азотсодержащие вещества (мочевина и др.)
расщепляются бактериями, продуцирующими фермент уреазу, до аммиака и С02;
благодаря аминированию отщепляющийся от мочевины аммиак используется для
281
синтеза аминокислот; для синтеза аминокислот из аммиака бактериям
необходимы углеродный скелет и энергия, источником последних являются углеводы;
бактерии и простейшие служат источником биологически полноценного белка для
животных (300...600 г в сутки у крупного рогатого скота).
Превращение липидов в преджелудках жвачных. Липиды подвергаются
гидролизу липолитическими бактериями, продуцирующими липазы, до жирных
кислот, глицерина и галактозы; глицерин и галактоза сбраживаются бактериями до
летучих жирных кислот; ненасыщенные жирные кислоты, образующиеся при
гидролизе липидов, подвергаются гидрированию и изомеризации ферментами
бактерий и простейших, превращаются в насыщенные (пальмитиновую, стеариновую).
Бактерии синтезируют липиды; основным предшественником липидов бактерий
является уксусная кислота; в синтезе липидов используются СО2, соли угольной
кислоты, глюкоза, аминокислоты; липиды могут синтезироваться и из нелипид-
ных источников.
Превращение углеводов в преджелудках жвачных. Под действием ферментов
целлюлазы и деполимеразы, продуцируемых целлюлозолитическими бактериями,
целлюлоза (клетчатка) расщепляется на более мелкие составляющие и
частично до целлобиозы; неспецифическая глюкозидаза расщепляет промежуточные
продукты гидролиза целлюлозы с образованием целлобиозы, других дисахаридов,
глюкозы; целлобиоза расщепляется под действием другого фермента бактерий — цел-
лобиазы до глюкозы и глюкозо-1-фосфата; образующиеся глюкоза и целлобиоза
подвергаются сбраживанию ферментами других бактерий до летучих жирных
кислот: уксусной, пропионовой и масляной. Гемицеллюлозаи пектин
подвергаются ферментации вначале соответственно до ксилотриозы и ксилобиозы, га-
лактуроновой кислоты и метанола, а затем до ксилозы, которая сбраживается до
летучих жирных кислот. Крахмал расщепляется бактериями,
продуцирующими амилазу и глюкозидазу; образующаяся глюкоза сбраживается до летучих жирных
кислот. Растворимые углеводы и сахара (мальтоза, глюкоза,
фруктоза, ксилоза и др.) подвергаются ферментации до летучих жирных кислот.
Предмет или объект изучения физиологии животных. Организм животного.
Принцип деятельности вегетативного отдела нервной системы. Деятельность
осуществляется по принципу безусловных и условных рефлексов через
рефлекторные дуги, образованные тремя видами нейронов: рецепторными, вставочными
и эффекторными. Афферентное звено образовано рецепторными нейронами,
может быть общим для вегетативной и соматической рефлекторных дуг; второе
звено может быть упрощенно представлено в виде скопления нейронов в боковых
рогах спинного мозга; третье звено — эффекторный нейрон в одном из
периферических узлов, аксон которого идет к исполнительному органу.
Проводимость. Это свойство возбудимой ткани активно проводить волну
возбуждения.
Программа действия. Эфферентные возбуждающие или тормозящие влияния и
гормоны, поступающие к периферическим исполнительным органам, действуя на
них, обеспечивают перевод органа из состояния покоя в состояние деятельности
или изменяют интенсивность деятельности органа соответственно сложившимся
условиям.
Продолговатый мозг и варолиев мост. Структурно-физиологическое
образование ЦНС из нейронов, формирующих ядра ряда черепно-мозговых нервов:
тройничных (V пара), отводящих (VI пара), лицевых (VII пара), слуховых (VIII пара),
языкоглоточных (IX пара), блуждающих (X пара), добавочных (XI пара),
подъязычных (XII пара). Обеспечивает как относительно простые, так и более сложные
рефлексы: дыхательный, сердечный, сосудистый, потоотделительный, пищевой,
жевания, сосания, глотания, чихания, кашля, мигания, положения головы и
туловища (мышечного тонуса, позы), а также механизмы ориентирования в
окружающей среде.
282
Промежуточный мозг. Самостоятельное структурно-физиологическое
образование ЦНС, нейроны образуют структуры — таламус, гипоталамус и
эпиталаму с.
Процесс образования молока. Включает в себя фильтрацию ряда компонентов
молока; секрецию специфическихх компонентов секреторными клетками; реаб-
сорбцию некоторого избыточного количества отдельных компонентов
образовавшегося молока в альвеолах, протоках, каналах, ходах и цистерне.
Процессы системы дыхания. Относительное постоянство СО2—O2 в
альвеолярном воздухе и в крови обеспечивается за счет вентиляции легких
(движение воздуха через легкие за счет постоянно осуществляемых дыхательных
циклов — вдоха и выдоха) или внешнего дыхания; обмена газов в легких
между альвеолярным воздухом и кровью капилляров малого круга
кровообращения — диффузия 02 из альвеолярного воздуха в кровь и С02 из крови в
альвеолярный воздух вследствие разности парциального давления этих газов в
альвеолярном воздухе и в крови; транспорта газов кровью (транспорт 02
кровью осуществляется в виде оксигемоглобина; 1 г гемоглобина способен
присоединить 1,36 мл 02; транспорт С02 — в трех формах: 2,5 об. % в состоянии
физического растворения, 52 об.% в виде кислых солей угольной кислоты, 4,5 % в
виде карбгемоглобина); обмена газов между кровью
капилляров большого круга кровообращения и клетками тканей;
использования 02 тканями и образования С02 — биологического окисления в
митохондриях клеток.
Работа мышц. Под работой мышц понимают удержание или перемещение
тяжести за счет их сокращения. Сокращаясь, мышца действует на кость, как на
рычаг, и производит механическую работу; если обеспечивается поза —
статическая работа, если движение — динамическая работа.
Рабочий орган. Тот или иной орган организма, осуществляющий
свойственную ему деятельность.
Раздражение. Процесс воздействия раздражителя на живые структуры.
Раздражимость. Свойство всех живых структур реагировать на изменение
условий внешней и внутренней среды обратимыми изменениями своих структур,
обменами веществ и энергии, физическими и химическими процессами.
Раздражитель. Любое изменение условий внешней и внутренней среды, если
оно возникает внезапно, имеет достаточную силу и удерживается определенное
время, вызывает обратимые изменения структур и деятельности живых тканей и
клеток. Различают физические (термические, механические,
электрические, световые, звуковые), физико-химические (изменение
осмотического давления, реакция среды, электролитный состав) и химические
(вещества пищи, гормоны, продукты обмена, токсины, лекарственные вещества)
факторы; особо выделяют как раздражитель нервный импульс; адекватные
(действуют на организм и его структуры в естественных условиях, и структуры
организма приспособлены к восприятию этого раздражителя) и
неадекватные (в естественных условиях не действуют на организм, и структуры организма
не приспособлены к их восприятию) раздражители.
Регуляция. Приспособление процессов жизнедеятельности организма, его
систем, органов, тканей к меняющимся условиям среды.
Регуляция физиологических процессов. Приспособление процессов
жизнедеятельности организма к меняющимся условиям среды, которые складываются на
каждый данный момент, осуществляется тканевыми, органными и центральными
механизмами. Местная регуляция осуществляется тканевыми и органными
механизмами. ЦНС через периферические нервы осуществляет нервную регуляцию по
принципу рефлекса. Рефлекторная регуляция структурной организации и
деятельности органов с участием гормонов желез внутренней секреции называется
нервно-гуморальной регуляцией.
283
Ретикулярная, или сетчатая, формация. Самостоятельное
структурно-физиологическое образование ЦНС, нейроны которой расположены главным образом в
продолговатом мозге, зрительных буграх и образуют восходящую и нисходящую
проекции ретикулярной формации. Восходящая проекция начинается от
медиального отдела варолиева моста, продолговатого и среднего мозга до таламуса и
гипоталамуса, коры. Нисходящая проекция представлена ретикулоспинальным
трактом. По функциональной значимости представляет интегральный аппарат
мозга.
Рефлекс. Закономерная ответная реакция тканей, органов, организма в целом
на действие раздражителя на рецепторы с участием ЦНС. Рефлекс осуществляется
через специальное структурное образование нервной системы, которое называют
рефлекторной дугой.
Рефлексы безусловные. Врожденные, наследственно передающиеся.
Осуществляются через сформированные рефлекторные дуги; являются видовыми, т. е.
свойственны всем животным данного вида; относительно постоянны и
осуществляются в ответ на адекватные раздражения определенных рецепторов.
Рефлексы вегетативные. Осуществляются вегетативной нервной системой,
число их велико, и они разнообразны: висцеро-висцеральные —
рефлексы с рецепторов внутренних органов на эти же или другие внутренние органы,
основой для их осуществления служат местные рефлекторные дуги,
замыкающиеся в ганглиях — интрамуральных метасимпатической нервной системы, пара- или
превертебральных ганглиях симпатической; висцерокутанные —
рефлексы с рецепторов внутренних органов на сосуды и другие структуры кожи, при
этом зона повышенной чувствительности ограничивается участком кожи, иннер-
вируемым сегментом, к которому поступают импульсы от раздражаемого
внутреннего органа; кутановисцеральные — рефлексы с рецепторов кожи на
сосуды и другие структуры внутренних органов, вызывают изменение их функций;
висцеросоматические рефлексы включают пути, по которым
возбуждение в дополнение к висцеральным вызывает также соматические ответы в виде
усиления или торможения сокращений.
Рефлексы статические. Две большие группы рефлексов: положения, или
позно-тонические, обеспечивающие сохранение положения, или позы,
тела; установочные, или выпрямительные, обеспечивающие
возвращение тела из неестественного положения в нормальное.
Рефлексы статокинетические. Возникают при движении, относительном
перемещении отдельных частей тела. Различают 4 рефлекса: с рецепторов мышц одной
конечности на мышцы других — возникает при движении тела животного;
«нистагм головы» — при вращательных движениях головы, проявляется в движении
головы противоположно вращению туловища, а затем в скачкообразном
перемещении головы в положение, соответствующее положению туловища; «нистагм
глаз» — при вращательных движениях глаз, проявляется в движении глаз в
противоположную сторону вращения туловища, а затем в скачкообразном
перемещении глаз в положение, соответствующее положению туловища; лифтные — при
линейном ускорении вверх повышается тонус мышц разгибателей, при линейном
ускорении вниз повышается тонус мышц сгибателей.
Рефлексы тонические. С участием продолговатого и среднего мозга
обеспечивают перераспределение тонуса различных мышц в связи с положением тела в
пространстве, различают статические и статокинетические тонические рефлексы.
Рефлексы условные. Приобретенные организмом в процессе его
индивидуальной жизни. Осуществляются через вновь сформированные рефлекторные дуги на
базе рефлекторных дуг безусловных рефлексов с временной связью в коре
больших полушарий между теми или иными сенсорной зоной и корковым
представительством нервного центра рефлекторной дуги безусловного рефлекса.
Рефлексы с участием нервных центров спинного мозга. В клинической практике
284
исследуют следующие рефлексы: спинной — проявляется в прогибании спины
и вращательных движениях хвоста, осуществляется с участием нейронов,
расположенных в грудных, поясничных и крестцовых сегментах; брюшные —
передний, средний и задний, проявляются сокращением соответствующих участков
брюшных мышц, осуществляются с участием нейронов, расположенных,
например, у крупного рогатого скота в 8...9, 9...10 и 11...12-м грудных сегментах;
анальный — проявляется сокращением наружного сфинктера прямой кишки,
осуществляется с участием нейронов, расположенных в 4...5-м крестцовых
сегментах (крупный рогатый скот); перинеальный — проявляется
толчкообразными подтягиваниями корня хвоста, осуществляется с участием нейронов,
расположенных в 3...4-М крестцовых сегментах (крупный рогатый скот); к р е-
мастерный — проявляется сокращением кремастера и подниманием
семенника, осуществляется с участием нейронов, расположенных в 1.,.2-м поясничных
сегментах (крупный рогатый скот); подошвенный (венчиковый) —
проявляется в поднимании конечности, осуществляется с участием нейронов,
расположенных с 6-го шейного по 2-й грудной и в 1.,.2-м крестцовых сегментах
(крупный рогатый скот); кожный — проявляется в смещении участка кожи в
области раздражения, осуществляется с участием нейронов, расположенных в тех
или иных трех сегментах спинного мозга (крупный рогатый скот),
соответствующих месту раздражения. Центры спинного мозга осуществляют рефлексы
сгибания и разгибания конечностей, почесывания, ряд миотати-
ческих рефлексов, мочеиспускания, дефекации, эрекции,
эякуляции, молоковы ведения, сосудодвигательные и др.
Рефлексы с участием нервных центров продолговатого мозга и варолиева моста.
В клинической практике у животных исследуют следующие рефлексы: конъ-
юнктивальный и роговичный — проявляется смыканием век,
осуществляется через ядра тройничного (афферентные) и лицевого (двигательные)
нервов; надглазничный — проявляется смыканием век, осуществляется через
ядра тройничного и лицевого нервов; мигательный — проявляется
сокращением круговой мышцы глаза при освещении глаза (зрительный и лицевой нервы);
назальный — проявляется смыканием век при легком поколачивании по но-
согубному зеркалу (тройничный и лицевой нервы); жевательный —
проявляется жевательными движениями при раздражении рецепторов языка кормом
(тройничный нерв); чихательный — проявляется при щекотании слизистой
оболочки носа (тройничный и блуждающий нервы); глазосердечный —
проявляется замедлением пульса и падением кровяного давления при
надавливании пальцами руки на один или оба глаза (блуждающие нервы); кожно-сер-
д е ч н ы й — проявляется изменением пульса при различных кожных
раздражениях (блуждающие нервы).
Рефлекторная дуга. Структурное образование нервной системы. Образована
разным числом нейронов трех видов (от трех до нескольких сотен): рецепторных,
контактных (промежуточных, интернейронов) и моторных. В ней различают
5 звеньев: рецептор, афферентный (или центростремительный) путь, нервный
центр, эфферентный (или центробежный) путь и рабочий орган, или эффектор.
Рефрактерность абсолютная. Состояние исчезновения возбудимости в период
возникновения и развития возбуждения; фаза короткая, в нервных волокнах
продолжается около 0,5 мс.
Рефрактерность относительная. Фаза постепенного восстановления
возбудимости, сменяет абсолютную рефрактерность.
Рецептор. Образование, воспринимающее раздражение. Представляет собой
ветвящееся окончание дендрита рецепторного нейрона или специализированные,
высокочувствительные клетки, или клетки с вспомогательными структурами,
образующими рецепторный орган.
Рецепция. Восприятие изменений условий внешней и внутренней среды ре-
285
цепторами и передача информации в ЦНС, восприятие ее сенсорными
нейронами коры больших полушарий головного мозга; осуществляется определенными
структурными образованиями, называемыми сенсорными системами
(анализаторами).
Рецепция болевая. Один из видов экстерорецепции. Обеспечивает восприятие
болевыми рецепторами — ноцицепторами, ноцирецепторами (свободные нервные
окончания с высоким порогом возбудимости, расположены в коже, роговице
глаза, слизистых оболочках; к ним относятся и все другие рецепторы, когда на них
действуют естественные раздражители чрезвычайной силы: сильный звук и др.)
болевых раздражений (действие чрезмерных раздражителей), передачу
информации в ЦНС и восприятие ее сенсорными нейронами коры больших полушарий;
также обеспечивает целый ряд соматических и вегетативных приспособительных
реакций, связанных с защитой, повышением сопротивляемости организма, но
могут привести и к вторичным патологическим эффектам, например к шоку.
Рецепция вкусовая. Один из видов экстерорецепции. Обеспечивает восприятие
вкусовыми хеморецепторами (колбовидной формы клетки, объединенные по 2...6
с опорными клетками во вкусовые почки, которые располагаются в сосочках
языка, на задней стенке глотки, мягком нёбе, надгортаннике, исчисляются
миллионами — у собак свыше 200 млн; не достигают поверхности слизистой оболочки
языка и соединены с поверхностью через вкусовую пору почки, имеют на конце,
обращенном в просвет поры, 30...40 тончайших микроворсинок, только после
растворения вещество воспринимается рецепторами) вкусовых раздражителей
(четыре основных вида раздражителей вкуса: сладкое, кислое, горькое и соленое),
передачу информации в ЦНС и восприятие ее сенсорными нейронами коры;
также обеспечивает вкусовые ощущения, приспособительные пищевые реакции:
образование и выделение слюны, желудочного и других пищеварительных соков,
сокращение желудка и кишечника.
Рецепция давления. Один из видов экстерорецепции. Обеспечивает восприятие
рецепторами давления — тельца Пачини (расположены в глубине кожи губ, носа,
спины, живота, шеи и других участках тела, отличаются от других более высокой
адаптацией) — раздражителей, которые вызывают деформацию кожи; передачу
информации в ЦНС и восприятие ее сенсорными нейронами коры; обеспечивает
защитные двигательные реакции.
Рецепция зрительная. Один из видов экстерорецепции, обеспечивающий
восприятие зрительными рецепторами (специальные клетки, называемые палочками
и колбочками, расположенные в сетчатке глаза, их миллионы) световых
раздражений, цвета, предметов; перемещение их; передачу информации в ЦНС и
восприятие ее сенсорными нейронами коры; связана с деятельностью вспомогательных
приспособлений (оптическая система и защитный аппарат глаза), которые вместе
со зрительными рецепторами формируют орган зрения, называемый глазом.
Осуществляет большой ряд поведенческих приспособительных реакций: пищевых,
комфортных, оборонительных, исследовательских, игровых, ритуальных,
половых, коммуникационных и др.
Рецепция мышечно-суставная, или проприорецепция. Один из видов интероре-
цепции. Осуществляет восприятие проприорецепторами мышц {мышечные
веретена), сухожилий (тельца Голъджи), фасций и суставных сумок (тельца Пачини)
состояния мышц, положения тела и его частей в пространстве; передачу
информации в ЦНС и восприятие ее сенсорными нейронами коры больших полушарий;
обеспечивает постоянный тонус мышц, сохранение позы и осуществление
движения.
Рецепция обонятельная. Один из видов экстерорецепции. Обеспечивает
восприятие обонятельными хеморецепторами (биполярные нервные клетки с
ресничками, создающими большую поверхность обоняния, располагаются в
слизистой оболочке верхних половин носовых раковин между опорными клетками и об[
286
ладают высокой возбудимостью) пахучего вещества (запаха); передачу
информации в ЦНС и восприятия ее сенсорными нейронами коры; обеспечивает целый
ряд приспособительных поведенческих реакций: пищевых, половых,
оборонительных, исследовательских.
Рецепция прикосновения. Один из видов экстерорецепции. Обеспечивает
восприятие рецепторами прикосновения — мейснеровы тельца и меркелевы диски
(расположены в коже, слизистой оболочке языка), вибриссы (у животных
специальные осязательные волоски, расположенные на морде) — прикасающих
предметов; передачу информации в ЦНС и восприятие ее сенсорными нейронами
коры; а также обеспечивает приспособительные реакции в виде смещения кожи,
различных движений в целях устранения или избежания действия раздражителя.
Рецепция слуховая. Один из видов экстерорецепции. Обеспечивает восприятие
слуховыми рецепторами (специальные волосковые клетки, объединенные в
кортиев орган, расположенный в средней части улитки — внутреннем ухе —
на основной мембране) слуховых раздражений (звука); передачу информации в
ЦНС и восприятие ее сенсорными нейронами коры. Связана с деятельностью
вспомогательного аппарата, вместе с которым образует орган слуха — ухо,
каждый структурный компонент которого играет свою роль, что и обеспечивает
восприятие звука; обеспечивает пищевые, половые, оборонительные,
исследовательские поведенческие приспособительные реакции, пространственную
ориентацию.
Рецепция температурная. Один из видов экстерорецепции. Обеспечивает
восприятие рецепторами тепла — тельца Руффини и холода — колбочки Карузе
(расположены в коже: холода — поверхностно (0,17 мм), а тепла — глубоко (0,3 мм); в
слизистых оболочках, роговой оболочке глаза, а также в гипоталамусе) —
изменений температуры окружающей и внутренней среды; передачу информации в
ЦНС и восприятие ее сенсорными нейронами коры; а также обеспечивает
реакции организма на повышение и понижение температуры окружающей среды,
сопровождающиеся изменением обмена веществ, увеличением или
уменьшением поверхности тела, расширением или сужением кровеносных сосудов,
увеличением или уменьшением образования и отдачи тепла, поддержанием
постоянства температуры тела.
Роды. Сложная приспособительная реакция организма беременной самки,
возникающая в связи с завершением развития плода и выражающаяся в
выведении из матки плода и плодных оболочек. Обеспечиваются сокращениями матки и
мышц брюшной стенки.
Рычаги двигательного аппарата. Образование из костей скелета, движущихся в
суставах при сокращении мышц. Точкой опоры рычага служит сустав, точкой
приложения силы — место прикрепления мышцы, точкой сопротивления —
место действия на кость силы тяжести. В зависимости от расположения точек
сопротивления и приложения силы относительно точки опоры различают рычаги I, II и
III типа.
Сальные железы. Выросты волосяных мешков. Открываются во влагалище
волоса или самостоятельно, выделяют кожное сало, располагаются в сетчатом слое
кожи; верхняя часть грушевидной формы. Сало и пот составляют жиропот,
который склеивает шерсть в пучки, смазывает кожу и волосы, предохраняет кожу от
мацерации и волосы от высыхания.
Свертывание крови. Переход крови из жидкого состояния в желеобразный
сгусток. Возникает при ранении кровеносного сосуда, сопровождается образованием
сгустка (тромба), который закупоривает пораненный кровеносный сосуд и тем
самым предотвращает кровотечение. Происходит при обязательном участии так
называемых факторов плазмы крови (их всего 13) и ионов кальция.
Свойства гормонов. Воздействуют только на определенный орган
(орган-мишень); действуют на больших расстояниях от места образования; обладают высо-
287
кой биологической активностью; оказывают свое действие через
белки-ферменты; не имеют видовой специфичности (кроме соматотропного и некоторых других
гормонов); быстро разрушаются специальными ферментами и др.
Свойства нервных центров. Одностороннее проведение возбуждения с
афферентных проводников на эфферентные; замедленное проведение возбуждения;
окклюзия — взаимное угнетение двух и более афферентных посылок
возбуждений, проявляющееся в ответе меньшей величины, чем сумма ответов на каждый
из них; суммация возбуждений подпороговой силы, временная и
пространственная; трансформация возбуждений изменением ритма и силы; последействие,
проявляющееся в сохранении какое-то время возбуждения после прекращения
поступления импульсов в центр; утомление; тонус; посттетаническая потенция —
повышенная возбудимость после предшествующих частых и сильных действий
возбудителя; торможение тормозными нейронами, пресинаптическое, постсинап-
тическое, пессимальное, вслед за возбуждением.
Свойства синапсов. Одностороннее проведение возбуждения — с нерва
(аксона) на мышцу (другой орган); замедленное проведение возбуждения (с задержкой)
в сравнении с нервным волокном за счет многоэтапного процесса: время
затрачивается на секрецию медиатора, его диффузию к постсинаптической мембране,
активацию мембраны, рост потенциала действия до пороговой величины;
утомление, связанное с уменьшением резерва медиатора при длительном поступлении
импульсов; низкая лабильность — проведение возбуждения через синапс
сопряжено с затратой относительно большого количества времени.
Сенсорная система (анализатор). Совокупность рецепторов и нейронов,
обеспечивающих восприятие раздражителей (изменений условий внешней и
внутренней среды), проведение импульсов (информации) с рецепторов в ЦНС, а также
сенсорные (чувствительные) нейроны коры больших полушарий головного мозга,
воспринимающие эту информацию. Состоит из трех звеньев: рецептор,
афферентный проводник и сенсорные нейроны коры (сенсорная зона).
Сердечный цикл. Это последовательное сокращение и расслабление
предсердий и желудочков сердца. Один сердечный цикл состоит из систолы
(последовательное сокращение предсердий и желудочков) и диастолы
(последовательное расслабление предсердий и желудочков); продолжительность сердечного
цикла у крупного рогатого скота около 0,8 с. Работа сердца состоит из сердечных
циклов.
Сердце. Полостной мышечный орган конусообразной формы. Нагнетает кровь
в сосудистую систему благодаря периодическому синхронному сокращению
мышечных клеток, составляющих миокард предсердия и желудочков.
Сила мышцы. Измеряют по максимальному грузу, который мышца в
состоянии поднять, либо по максимальному напряжению, которое она может развить в
условиях изометрического сокращения: зависит от ее поперечного сечения.
Отношение максимальной силы мышцы к ее анатомическому поперечнику называют
относительной силой, к ее физиологическому поперечнику — абсолютной силой
мышцы.
Симпатическая иннервация. Образована симпатическими нейронами,
расположенными в ядрах боковых рогов серого вещества грудного и поясничного отделов
спинного мозга (от первых грудных до 2...4-го поясничного сегмента), а также
симпатическими нейронами ганглий, расположенных по обе стороны около
грудных и поясничных позвонков (вертебральные ганглии) или вдали от позвонков
(превертебральные ганглии: краниальный и каудальный шейные, звездчатый,
чревный и краниальный брыжеечный, объединяются как солнечное сплетение,
каудальный брыжеечный). Формация универсальная — иннервирует ткани всех
органов и кровеносные сосуды скелетных мышц; деятельность ее активизируется
при действии на организм неблагоприятных факторов; иннервация мобилизации
резервов, отдел тревоги и защиты, необходимый для взаимодействия организма со
288
средой; активирует деятельность головного мозга, усиливает метаболические
процессы (катаболизм) и освобождение энергии в клетках органов и тканей;
стимулирует работу сердца (учащение и усиление сокращений сердца, увеличение его
ударного объема), секреторную деятельность потовых желез, обмена веществ в
мышцах, сужение кровеносных сосудов, расслабление бронхиальных мышц,
ослабление сокоотделения и тормозит моторику желудка и кишечника,
расслабление желчного пузыря, расширение зрачков, расслабление стенки мочевого пузыря
и др.; повышает возбудимость и лабильность соматических нервов и
поперечнополосатых скелетных мышц; активирует механизмы свертывания крови,
иммунные реакции, процессы терморегуляции; обусловливает эмоциальное состояние и
напряжение, является начальным звеном реакций стресса, запускающим
последующие гормональные факторы. Симпатическая иннервация, обеспечивая
максимальное напряжение функций органов и систем защиты организма,
дестабилизирует постоянство внутренней среды. Задачу восстановления и поддержания этого
постоянства, нарушенного в результате возбуждения симпатической нервной
системы, берут на себя парасимпатическая и метасимпатическая нервные системы.
Синапс. Структурно-физиологическое образование, обеспечивающее передачу
возбуждения с нервного волокна на иннервируемую им клетку (мышечную,
нервную или железистую).
Система. Объединение органов и процессов, участвующих в выполнении
сложной деятельности.
Система движения. Обеспечивает в организме двигательные
приспособительные реакции: поддержание принятой позы, перемещение звеньев и всего тела в
пространстве, ориентировочные, защитные и поведенческие движения,
обеспечивающие возможность его самосохранения, сохранения вида. Исполнительный
аппарат формируется из скелета и мышц (поперечно-полосатых, динамических и
статодинамических).
Система дыхания. Обеспечивает снабжение тканей О2 и удаление СО2, т. е.
поддержание оптимального для метаболизма газового состава организма.
Исполнительные органы системы: инспираторные мышцы— диафрагма,
наружные косые межреберные, межхрящевые и вспомогательные дыхательные
(лестничные, большая и малая грудные, зубчатая); экспираторные мышцы —
внутренние косые межреберные, брюшной стенки (косые, поперечная прямая);
грудная клетка; плевра; легкие, бронхи; трахея, гортань, носовые ходы; сердце и
сосуды.
Система крови. Обеспечивает в организме оптимальные для обмена веществ
массу циркулирующей крови за счет органов кроветворения, деятельности сердца,
кровеносных сосудов, органов депо крови (печень, селезенка, кожа, легкие,
почки, мышцы), пищеварительных желез, всасывательного аппарата желудка и
кишечника; количество форменных элементов крови, которое поддерживается
красным костным мозгом, лимфатическими узлами, селезенкой, лимфоидной тканью
кишечника и миндалин, печенью, почками, вилочковой железой.
Исполнительный аппарат системы представлен органами кроветворения (красный костный
мозг, лимфатические узлы, селезенка, лимфоидная ткань кишечника и миндалин,
печень, почки, вил очковая железа), сердцем и сосудами, органами депо крови
(печень, селезенка, кожа, легкие, почки, мышцы), пищеварительными железами,
всасывательным аппаратом желудка и кишечника.
Система кровообращения. Обеспечивает нагнетание сердцем в сосуды такого
количества крови в единицу времени и поддержание такого уровня кровяного
давления, тока крови, перераспределение объема его между органами, которое
необходимо для обеспечения потребного уровня метаболизма, деятельности
органов. Исполнительные органы: сердце и кровеносные сосуды.
Система лактации. Обеспечивает образование молока, распределение и
накопление образующегося молока в емкостной системе вымени и молоковыведение
289
при доении или сосании. Исполнительные органы: вымя (молочные железы, мо-
локовыделительный аппарат), пищеварительный аппарат, сердечно-сосудистая
система, система дыхания, печень, жировая и костная ткани.
Система лимфатическая. Структуры и механизмы, обеспечивающие
образование лимфы и лимфообращение. Исполнительные органы и процессы системы:
лимфатические капилляры, сосуды и узлы, лимфообразование, движение
лимфы.
Система пищеварения. Обеспечивает прием корма, физико-химическое
превращение веществ корма и всасывание продуктов превращения и освободившихся
веществ в пищеварительном аппарате. Исполнительные органы: губы, язык,
жевательные мышцы, челюсти, зубы, слюнные железы, глотка, пищевод, желудок с
желудочными железами, тонкий и толстый кишечник с кишечными железами,
поджелудочная железа, печень.
Система половая. Структурно-физиологическое объединение органов,
обеспечивающих развитие и выведение половых клеток у самок и самцов,
оплодотворение, питание и защиту развивающегося в матке у самки зародыша, рождение
завершившего созревание плода.
Скелет. Пассивная часть опорно-двигательной системы. Состоит из костей,
хрящей, суставов и связок. Выполняет опорную функцию и служит защитой для
многих внутренних органов.
Слюнные железы (околоушные, подчелюстные, нижние щечные,
подъязычные, верхние и задние щечные, губные железы). Продуцируют секрет (слюну),
содержащий муцин, щелочные компоненты (рН 7,5...8,1), белковые вещества (в
том числе амилазу, глюкозидазу) и низкомолекулярные органические
соединения. У жвачных в слюне много мочевины, есть аскорбиновая кислота, летучие
жирные кислоты. Возбуждаются и секретируют слюну только в период приема
корма.
Сосудистые влияния вегетативной нервной системы. Определяют просвет
сосудов, давление крови, кровоток. Различают сосудорасширяющие и
сосудосуживающие. Через симпатические нервные волокна осуществляются
сосудосуживающие влияния; в их составе кроме иннервирующих сосуды скелетных мышц
имеются и нервные волокна, обеспечивающие расширение артерий (передача
возбуждения в них осуществляется с помощью медиатора ацетилхолина); через
парасимпатические нервы осуществляются сосудорасширяющие
влияния на сосуды нижнечелюстной слюнной железы, языка, пещеристые тела
полового члена и др.
Спинной мозг. Структурно-физиологическое образование ЦНС из нейронов
(13... 15 млн) трех видов: промежуточных, а- и у-моторных (эффекторные) и
вегетативных; тела и отростки образуют серое вещество (расположено в центре), а
только отростки нейронов — белое вещество (расположено по периферии).
Средний мозг. Структурно-физиологическое образование ЦНС из нейронов,
формирующих новые образования среднего мозга: четверохолмие, красное ядро,
черную субстанцию и ядра глазодвигательного и блокового нервов. Каждому
присуща определенная роль.
Субнормальная фаза. Фаза пониженной возбудимости; сменяет
супернормальную.
Супернормальная фаза. Фаза повышенной возбудимости; сменяет фазу
относительной рефрактерности.
Таламус. Парное образование, занимающее основную массу промежуточного
мозга. Состоит из сложно организованных ядер, образующих
специфическую таламокортикальную систему (передние медиальное и латеральное,
медиальное и латеральное коленчатые тела и др.), ядра которой связаны с
конкретными зонами коры, и неспецифическую (диффузную) таламокортикальную
систему, ядра которой не связаны с конкретными зонами коры (центральные,
290
конверта, мелкие и др.). В основном ядра таламуса участвуют в переработке
(анализе и синтезе) получаемой информации, формировании ощущений, программ
действия, которые передаются через структуры самого таламуса (моторные
нейроны), гипоталамуса, среднего, продолговатого и спинного мозга, ретикулярной
формации к периферическим исполнительным органам, обеспечивая более
сложные приспособительные реакции к складывающимся новым условиям.
Температура тела. Один из важнейших факторов, определяющих обмен
веществ, интенсивность роста и развития животных, скорость химических реакций.
Поддерживается на относительно постоянном уровне независимо от температуры
внешней среды (находится в пределах 37,5...40,0 °С, у птиц — 40,5...43,0 °С) за счет
двух основных процессов: теплопродукции и теплоотдачи.
Теплоотдача. Осуществляется в основном с поверхности тела, кожи
(температура которой определяется состоянием сосудов), путем испарения пота и влаги со
слизистой оболочки органов дыхания; происходит в основном четырьмя путями:
теплоизлучением, конвекцией, теплопроведением и испарением влаги с
поверхности кожи (пота) и слизистой дыхательных путей; незначительное количество
теплоты теряется с мочой и калом. Теплоотдача проведением и излучением
зависит от разности температуры кожи и окружающей среды: чем больше разница, тем
больше отдается теплоты, путем конвенции (отдача теплоты в поток воздуха) тем
больше, чем больше скорость движения воздуха; при температуре воздуха, равной
или незначительно меньшей температуры тела, единственным путем отдачи
теплоты является испарение с поверхности кожи пота и влаги со слизистой оболочки
дыхательных путей. Размер теплоотдачи зависит от 5 физических факторов:
температуры воздуха, влажности, температуры излучения, скорости движения
воздуха, тепловой изоляции (волосяного покрова и подкожного жирового слоя).
Теплопродукция. Осуществляется во всех тканях организма в процессе
окисления белков, жиров и углеводов. Происходит непрерывно в процессе обмена
веществ (три источника — теплота, образующаяся при постоянных затратах
энергии, переменных затратах и затратах на синтез продукции). Наибольшее
количество теплоты образуется в органах с интенсивным обменом веществ и большой
массой — в печени и мышцах; при мышечной работе накопленная в мышцах
химическая энергия только на 1/3 переходит в механическую работу, остальные 2/3
переходят в теплоту. Образование теплоты путем обменных процессов называют
несократительным термогенезом.
Если для поддержания температуры тела требуется дополнительная теплота,
она вырабатывается путем непроизвольной тонической или ритмической
мышечной активности (феномен дрожи), а также путем произвольной двигательной
активности животного. Такой путь образования теплоты называют сократительным
термогенезом.
Тетаническое (или длительное) сокращение мышц. В естественных условиях к
мышце поступает, как правило, не один импульс, а серия импульсов, на которые
она отвечает длительным сокращением. Различают гладкий тетанус —
возникает при частых ритмах раздражения, когда каждый очередной импульс застает
мышцу в фазе укорочения предыдущего сокращения, на это сокращение
накладывается новое сокращение; зубчатый тетанус — возникает при редких
ритмах раздражения, когда каждый очередной импульс застает мышцу в начале
фазы расслабления и вызывает новое сокращение.
Типы высшей нервной деятельности. Совокупность индивидуальных
особенностей нервных процессов: возбуждения и торможения, обусловленных
наследственностью данного животного и его предыдущим жизненным опытом. Зависят
от силы, уравновешенности и подвижности нервных процессов. Различают (по
И. П. Павлову) 4 основных типа высшей нервной деятельности: I — сильный
неуравновешенный, который характеризуется преобладанием силы процессов
возбуждения над силой процесса торможения, когда требуется значительное напря-
291
жение тормозного процесса, у животных с таким типом высшей нервной
деятельности отмечается срыв; II — сильный уровновешенный подвижный,
характеризующийся сильными подвижными процессами возбуждения и торможения и
наибольшей приспособленностью к перемене условий среды; III — сильный
уравновешенный инертный, обладающий довольно сильными процессами возбуждения
и торможения, но недостаточно подвижными, инертными, животные такого типа,
возбуждаясь, длительное время успокаиваются; IV — слабый, характеризующийся
слабой силой как процесса возбуждения, так и процесса торможения.
Тканевая жидкость. Заполняет межклеточное пространство. Содержит вещества,
поступающие из крови, продукты обмена веществ, СЬ, С02; является
промежуточной средой между кровью и клетками тканей органов, организма, переносит из
крови в клетки кислород, питательные вещества, макро- и микроэлементы и др.,
возвращает в кровь через лимфу воду, продукты обмена веществ, переносит С02.
Ткань. Система специфически дифференцированых клеток, а также
неклеточных структур, объединенных на основе общности строения, деятельности и
происхождения. В организме животных 4 основные группы тканей: эпителиальная,
соединительная, мышечная и нервная, отличающиеся по строению,
происхождению и деятельности (свойствам).
Торможение. Угнетение проявлений жизнедеятельности возбудимых тканей.
Неразрывно связано с возбуждением и может быть его результатом; является
активным процессом, чем отличается от утомления. Торможение и возбуждение
могут немедленно сменять друг друга.
Трофические влияния вегетативной нервной системы. Проявляются в изменении
проницаемости мембран клеток и активности ферментов, обмена веществ в
тканях и органах, выражаются в повышении работоспособности органа, его
устойчивости ко всем вредным воздействиям.
Утомление мышцы. Временное понижение работоспособности мышцы,
наступающее при длительной работе и исчезающее после отдыха (проявляется
уменьшением силы сокращения мышцы и степени расслабления мышцы); различают
истинное и ложное. При ложном утомлении утомляется особый
механизм по передаче импульсов с рецепторного нейрона на вставочный и
эфферентный и с нерва на мышцу — синапс, где истощаются резервы медиатора; при
истинном утомлении в мышце накапливаются недоокисленные продукты
распада питательных веществ вследствие недостаточного поступления кислорода
и истощаются запасы источников энергии для мышечного сокращения.
Факторы внешней среды. Лучистая энергия Солнца, ионизирующее излучение,
магнитное поле, шум, температура среды, барометрическое давление, окись
углерода, аммиак, озон, пыль, мочевина, азот. Организм отвечает на действие каждого
фактора среды определенной реакцией.
Ферменты. Вещества белковой природы, являющиеся биологическими
катализаторами. Относятся к белкам типа глобулинов, оказывают свое действие в
достаточно малых концентрациях, ускоряют течение химической реакции. Различают
простые (однокомпонентные) и сложные (двухкомпонентые) ферменты: имеется
белковая часть (апофермент) и небелковый компонент (кофермент, кофактор),
который определяет активность молекулы фермента, осуществляет контакт между
апоферментом и субстратом — веществом, на который действует фермент. К о-
ферменты могут быть представлены органическими веществами (нуклеоти-
ды, витамины) или неорганическими веществами (металлы). Ферменты
специфичны, т. е. действуют только на вещество определенного химического строения,
зависят от рН и температуры среды. Различают три группы ферментов: протеоли-
тические — расщепляют белки; гликолитические — расщепляют углеводы; липо-
литические — расщепляют жиры.
Физико-химическое превращение веществ корма и всасывание продуктов
превращения и освободившихся веществ. Обеспечивается сократительной деятельностью
292
жевательных мышц, желудка и кишечника, секреторной деятельностью слюнных
желез, желудочных желез, кишечных желез, поджелудочной железы и
секреторного аппарата печени, всасывательной деятельностью всасывательного аппарата
желудка и кишечника.
Физиологическая адаптация. Совокупность процессов наследственных и
развивающихся при индивидуальной жизни животного, обеспечивающих возможность
жизнедеятельности в измененных условиях среды и в условиях, ранее не
совместимых с жизнью. Обеспечивается генетическими, сформированными
механизмами и формирующимися в процессе индивидуальной жизни при определенных
условиях.
Физиологическая функция. Проявление жизнедеятельности ткани, органа,
организма, обеспечивающее приспособление к меняющимся условиям
внутренней и внешней среды.
Физиологически зрелые животные. Новорожденные животные, у которых
физиологические показатели соответствуют их истинному календарному возрасту;
физиологически незрелые — новорожденные животные, у которых
физиологические показатели не соответствуют их истинному календарному
возрасту, отличаются особенностями своей физиологии, появившимися в результате
выраженной задержки развития.
Физиологические роли нейронов. Воспринимают нервные импульсы с
рецепторов или других нейронов; рождают (генерируют) собственные импульсы;
проводят рожденные импульсы (возбуждение) к другому нейрону или органу.
Физиологические роли нервного центра. Воспринимают импульсы от
рецепторов через афферентный путь, осуществляют анализ и синтез воспринятой
информации, передачу сформированной программы по центробежному пути к
периферическому исполнительному органу и восприятие обратной информации с
исполнительного органа о выполнении программы, о совершенном действии.
Физиологический процесс. Проявление жизнедеятельности клеток, тканей,
органов, систем в виде физических и химических процессов.
Физиология возрастная. Система достоверных знаний об особенностях и
становлении физиологических процессов и функций у животных в различные
периоды индивидуального развития (онтогенеза). Она включает в себя физиологию
молодняка животных.
Физиология животных. Один из важнейших разделов биологической науки,
представляет собой систему достоверных знаний о процессах жизнедеятельност и
функциях организма, поведении животных; изучает физиологические процессы и
физиологические функции живого организма на уровне клеток, тканей органов и
организма в целом в их взаимосвязи между собой и с учетом влияний условий
окружающей среды и технологии содержания животных, поведенческие реакции
животных.
Физиология общая. Система достоверных знаний о физиологических
процессах, свойственных всем живым существам. Она включает в себя физиологию
клетки, физиологию возбудимых тканей.
Физиология отраслевая. Система достоверных знаний об особенностях
физиологических процессов и функций у животных в связи с продуктивностью:
физиология лактации, откорма и др.
Физиология сравнительная, или частная. Система достоверных знаний о
физиологических процессах и функциях у животных разных видов.
Физиология эволюционная. Система достоверных знаний об особенностях
процессов и функций у животных, стоящих на разных ступенях эволюционного
развития.
Физиология экологическая. Система достоверных знаний о процессах и
функциях животных, обитающих в различных экологических условиях.
Функциональная система. Представляет собой широкое объединение различно
293
локализованных структур и процессов в целях обеспечения той или иной
конкретной приспособительной реакции.
Архитектура — определенное количество узловых механизмов (звеньев),
ее составляющих: 1) звено пусковой афферентацыы (рецепторы, воспринимающие
изменения условий внешней и внутренней среды и афферентные проводники
информации с этих рецепторов); 2) центральное звено, или нервный центр
(объединение большого количества нейронов различных уровней центрального отдела
нервной системы, обеспечивающих восприятие информации с рецепторов, анализ и
синтез ее, формирование программы действия и передачу к периферическим
исполнительным органам); 3) эфферентное звено (эфферентные нервные
проводники, железы внутренней секреции и их гормоны, с помощью которых программа
действия передается к периферическим исполнительным органам); 4)
периферические исполнительные органы (отдельные структуры различных внутренних и
внешних органов или ряд органов, входящих в различные анатомические системы);
5) звено обратной афферентации (рецепторы, воспринимающие результат действия
программы на периферические исполнительные органы или параметры
деятельности органов, результаты их деятельности, параметры физиологических констант
или отклоенния от них, а также афферентные проводники обратной информации
с этих рецепторов и акцептор действия — совокупность нейронов в нервном
центре, хранящая копию программы действия, или прообраз ответной реакции, ее
параметров и воспринимающая информацию о приспособительных результатах).
Функциональные влияния. Различают пусковые, корригирующие,
стимулирующие и тормозящие деятельность органов. Пусковые переводят орган из состояния
покоя в состояние деятельности; корригирующие (стимулирующие) сводятся к
коррекции деятельности органов, находящихся в постоянной активности (сердце
и др.), соответственно условиям, складывающимся на каждый момент;
корригирующие (тормозящие) выражаются в угнетении деятельности органов,
находящихся в постоянной активности (сердце и др.).
Цель физиологии животных. Глубокое познание механизмов и
закономерностей осуществления процессов и функций, их регуляции.
Центральная нервная система (ЦНС). Это головной (включает задний, или
продолговатый, мозг и варолиев мост, средний мозг, ретикулярную формацию,
мозжечок, промежуточный мозг, лимбическую систему, подкорковые ядра, кору
больших полушарий) и спинной мозг. Образована нейронами: тела образуют
серое вещество, а отростки нейронов — белое вещество; нервные центры имеют
свое представительство во всех отделах ЦНС.
Частная физиология систем организма. Система достоверных знаний о
механизмах и закономерностях физиологических процессов и функций отдельных
систем организма: нервной, сенсорной и моторной, кровообращения, дыхания и др.
Черная субстанция. Нейроны участвуют в формировании программы действия,
обеспечивающей координирование сложных актов жевания, глотания, а также
пластического тонуса мышц.
Четверохолмие. Структурно-физиологическое образование среднего мозга.
Через нейроны передних бугров осуществляются зрительные ориентировочные и
сторожевые рефлексы (движение глаз и поворот головы) на световые раздражения
(глазодвигательный и блоковый нервы), зрачковый рефлекс, аккомодация глаза,
сведение зрительных осей — конвергенция; через нейроны задних бугров —
слуховые ориентировочные и сторожевые рефлексы (настораживание ушей и
поворот головы) на новый звук; через ядра четверохолмия обеспечиваются сторожевые
приспособительные реакции (перераспределение мышечного тонуса — усиление
тонуса сгибателей, изменение ритма сокращений сердца, артериального
давления) на новое внезапное раздражение.
Экстерорецепция. Осуществляется различными специальными рецепторами,
сенсорными системами и обеспечивает приспособительные реакции организма к
294
изменениям условий внешней среды. Подразделяют на 8 видов: болевую,
температурную, прикосновения и давления, вкусовую, обонятельную, слуховую и
зрительную рецепцию.
Этология. Наука, система достоверных знаний биологических основ,
закономерностей и механизмов поведенческих актов (целенаправленной деятельности
организма для удовлетворения тех или иных биологических потребностей)
животных. Изучает все направления поведенческих актов животных, взаимосвязи и
изменения их в разных условиях внешней среды и при различном состоянии
организма, видовое и индивидуальное развитие поведенческих актов, изменение и
приспособление их к постоянно меняющимся условиям внешней среды,
физиологические механизмы, лежащие в основе поведенческих актов.
Эфферентное звено. Образование рефлекторной дуги из аксонов двигательного
нейрона; проводит возбуждение от нервного центра к рабочему органу.
ПРЕДМЕТНЫЙ
Автоматия гладких мышц 53
— сердца 136
Адреналин 97
Анализаторы 80
Аппарат Панченкова 114
— индукционный 27
Ацетилхолин 55, 78
Взятие крови 101, 104
Время рефлекса 66
Всасывание в кишечнике 190, 191
Выделение 206
Газообмен 154
Газовый состав
воздуха вдыхаемого 158
выдыхаемого 152
крови 160
Гематокрит 106
Гемоглобин 117, 118
Гемолиз 115
Гемометр 118
Гормоны 92
Давление артериальное 149
— в плевральной полости 156
Движение диафрагмы 155
296
УКАЗАТЕЛЬ
— у животных 99
— крови по сосудам 139, 140
Деятельность сердца 132
Диастола 131, 133
Дыхание 153
Железа(ы)
— внутренней секреции 92
— желудочные 170
— молочная 220
— околощитовидные 94
— поджелудочная 182
— потовые 212
— слюнные 164
— щитовидная 93
Желудочный сок 170
Жидкость Тюрка 121
Запись жевательных движений
171
Индукция 90
Инсулин 97
Калий — влияние на сокращение
сердца 145
Кальций — влияние на
сокращение сердца 145
Камера счетная Горяева 112
Каналы полукружные 82
Капсула Марея 32
Кимограф 34
Кортикостероиды 98
Красная кровяная соль 119
Кровообращение
— в плавательной перепонке 140
— в языке 140
Кровяные пластинки (см.
Тромбоциты) 125
Кровь 100
— дефибринированная 104
— определение групп 108
— объем
— форменные элементы 103, ПО,
120, 125
Лактация 20
Лейкоциты 120
— подсчет общего количества 121
Мазки крови 123, 124
Миограмма 51
Миограф 52
Молоко 221
Молокоотдача 220
Молочный жир 222
Мышцы 50
— скелетные 51
— гладкие 53
Набор препаровальный 43
Наркоз для животных 18, 19,20
Нерв(ы)
— блуждающий 144
— свойства 56
— симпатический 144
Нервная деятельность высшая 88
Нервная система 61
— рефлекторная деятельность 59
дуга 60
Нервно-мышечный препарат 44
Нервный центр 62, 63, 64, 65
Норадреналин 55, 78
Обезболивание животных 18
Обменный профиль
белковый 193
витаминный 198
минеральный 197
углеводный 195
Обучающие программы
внешнеуправляемая 5
внутриуправляемая 5
линейная 5
Объем легких дыхательный 156,
157
— минутный 156, 157
Окраска мазков крови
— по Романовскому— Гимзе 124
Оксигемоглобин 118, 120
Оксигемограф 160
Оксигемография 160
Оксигемометр 160
Оксигемометрия 160
Окситоцин 95
Опыт Гальвани 48
— Гольди 60
Писчики 32, 33
Пищеварение 162
— желудочное 167
— кишечное 179
— ротовое 163
297
Плазма крови 103, 104
— определение объема 104
Поведение животных 182, 185
Поджелудочный сок 182, 185
Потенциал действия 49
Приборы
— для регистрации функций 30
воздействия на объект 25
Прогестерон 96
Пульс 152
Пучок Гиса 134, 135
Работа мышц 52, 53
Раздражители 42
Размножение 213
Ретракция 127
Рефлекс(ы) 59
— анальный 71
— брюшные 70
— выпрямительные 71
— двигательно-оборонитель-
ные 88
— двигательно-пищевые
условные 88
— корнеальный 69
— позы 71
— спины 70
— тонические 71
— хвоста 71
— холки 70
Рефлекторная дуга 60
Рецепторы свойства 80
Руминограф 169
Рычаги двигательного аппарата
99
Свертывание крови 126
Сердце 131
— движение крови 139
Систола 131, 133
Скорость свертывания
крови 127
Слюна 164, 165
Сокращение желудка 167, 168
— мышц 50, 53
— сердечной мышцы 132
СОЭ 114
Спирт метиленовый 124
Стабилизатор для крови 103
Счетчик форменных элементов
крови 125
Сыворотка крови 104, 106
— определение буферных
свойств 107
Температура тела 203
Тетанус
— гладкий 51
— зубчатый 51
Техника безопасности в учебном
процессе 37
Толчок сердечный 147
Тонометр 148
Тоны сердца 148
Торможение безусловное 90
— внешнее 90
— дифференцировочное 89
— по Сеченову 66
— угасательное 88
Тромбоциты 125
— методика подсчета 125
Узел атриовентрикулярный 134
— Биддера 134, 138
— Ремарка 134, 138
— синоатриальный 134
298
Условный рефлекс
образование 87
проявление 87
Фибрин 107, 126
Фиксация животных 15
— фистул желез желудочных
172, 173
кишечных 183
поджелудочных 180, 184
слюнных 166
Формула лейкоцитарная 123
Хронаксиметрия 47
Экстрасистола 136, 137
Электрокардиограмма животных
150
Электрокардиограф 149
Электрокардиография 149
Электроды 29
Электроседиометр Неводова 114
Электростимулятор 29
Энергия газообмена 200
Эритроциты ПО
— гемолиз 115
— подсчет эритроцитов 111
— осмотическая резистентность
115, 117
— скорость оседания 114
Этология
ОГЛАВЛЕНИЕ
о
1. ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ПРОВЕДЕНИЮ
ЛАБОРАТОРНЫХ ЗАНЯТИЙ 3
1.1. Программированное обучение 4
1.2. Методические приемы 8
2. ОСНОВНЫЕ ВИДЫ АКТИВНЫХ МЕТОДОВ ОБУЧЕНИЯ
И ЦЕЛЕВЫЕ УСТАНОВКИ К ИХ ПРИМЕНЕНИЮ 11
3. ПОДОПЫТНЫЕ ЖИВОТНЫЕ 17
4. ОСНОВНАЯ АППАРАТУРА, МЕТОДЫ СТИМУЛЯЦИИ
И РЕГИСТРАЦИИ ФИЗИОЛОГИЧЕСКИХ ФУНКЦИИ 27
4.1. Приборы, предназначенные для воздействия на объект 27
4.2. Приборы для регистрации физиологических функций (различных
проявлений жизнедеятельности объекта) 32
5. ЛАБОРАТОРНО-ПРАКТИЧЕСКИЕ ЗАНЯТИЯ 39
5.1. Вводные занятия 39
Занятие 1. Предмет физиологии. Задачи практикума. Методы
и методические приемы физиологических
исследований. Физиологическая аппаратура и
современные методы регистрации параметров деятельности
функциональных систем организма 40
5.2. Возбудимые ткани 43
5.2.1. Общая физиология возбудимых тканей 44
Занятие 2. Общие свойства возбудимых тканей. Законы
раздражения. Биоэлектрические явления 44
5.2.2. Физиология мышц 52
Занятие 3. Специфические физиологические свойства
скелетных мышц. Работа мышц. Свойства гладких
мышц 52
300
5.2.3. Физиология нервов 57
Занятие 4. Специфические физиологические свойства нервных
волокон, нерва, афферентных и эфферентных
проводников и синапсов 58
5.3. Нервная система 60
5.3.1. Принципы регуляции деятельности органов
и систем организма 60
Занятие 5. Общие принципы деятельности организма.
Нервно-гуморальные механизмы регуляции
деятельности организма. Нейрон, его деятельность. Рефлекс.
Функциональная система 61
5.3.2. Центральная нервная система. Физиологическая роль частных
образований центральной нервной системы 64
Занятие 6. Физиология центральных звеньев функциональных
систем, нервных центров. Свойства нервного центра.
Координация нервных центров 64
Занятие 7. Физиологическая роль отделов и структур
центральной нервной системы в функциональных
системах организма 72
5.3.3. Вегетативный отдел нервной системы 79
Занятие 8. Физиология вегетативного отдела нервной системы,
его роль в функциональных системах организма 79
5.4. Сенсорные системы 83
Занятие 9. Рецепция. Рецепторы, анализаторы. Общие свойства
рецепторов и анализаторов 84
5.5. Высшая нервная деятельность 89
Занятие 10. Физиология коры больших полушарий головного
мозга. Ее роль в высшей нервной деятельности 90
5.6. Физиология желез внутренней секреции 96
Занятие 11. Инкреторная деятельность эндокринных желез 96
Занятие 12. Исследование влияния окситоцина и прогестерона
на изолированные рога матки 99
Занятие 13. Исследование роли гормонов в регуляции обмена
углеводов и резистентности организма 101
5.7. Система движения 103
Занятие 14. Наблюдение за поддержанием позы и движениями
животных 104
5.8. Система крови 105
Занятие 15. Исследование объема, состава и свойств крови 108
Занятие 16. Определение количества эритроцитов. Исследование
свойств и роли эритроцитов 114
Занятие 17. Определение количества лейкоцитов. Исследование
свойств лейкоцитов. Выведение лейкоцитарной
формулы 125
Занятие 18. Определение количества тромбоцитов. Исследование
свойств и роли тромбоцитов 130
Занятие 19. Подсчет форменных элементов с помощью
фотоколориметрических и кондуктометрических
приборов 133
301
5.9. Система кровообращения и лимфообращения 136
Занятие 20. Нагнетание крови сердцем в сосуды. Цикл сердечной
деятельности. Возникновение и проведение
возбуждения в сердце 137
Занятие 21. Структурно-физиологические особенности сердечной
мышцы. Физиологические свойства сердечной
мышцы. Движение крови по сосудам 142
Занятие 22. Механизмы приспособления деятельности сердца и
сосудов к меняющимся условиям 147
Занятие 23. Исследование внешних проявлений деятельности
сердца и сосудов 153
5.10. Система дыхания 160
Занятие 24. Исследование внешнего дыхания у животных 160
Занятие 25. Исследование газового состава выдыхаемого воздуха
и крови 164
Занятие 26. Исследование регуляции дыхания 167
5.11. Система пищеварения 169
Занятие 27. Наблюдение за приемом корма и воды животными 170
Занятие 28. Исследование ротового пищеварения 170
Занятие 29. Исследование желудочного пищеварения 174
Занятие 30. Исследование кишечного пищеварения 186
Занятие 31. Исследование пристеночного пищеварения
в кишечнике 198
Занятие 32. Исследование всасывательной деятельности
кишечника 198
5.12. Обмен веществ и энергии. Терморегуляция 200
Занятие 33. Определение физиологической роли белков, жиров,
углеводов, аминокислот, жирных кислот, глюкозы,
летучих жирных кислот 201
Занятие 34. Определение физиологической роли макро- и
микроэлементов, воды, витаминов 205
Занятие 35. Определение затрат энергии по газообмену 208
Занятие 36. Исследование терморегуляции у животных 212
5.13. Система выделения 214
Занятие 37. Изучение деятельности почек 215
Занятие 38. Изучение регуляции деятельности почек
и мочевыводящего аппарата 219
Занятие 39. Изучение выделительной функции желудка 220
Занятие 40. Изучение функции потовых желез 221
5.14. Физиология размножения 221
Занятие 41. Образование спермиев, формирование половых
мотиваций, половое ритуальное поведение, половое
взаимодействие, выведение спермы. Физиология
спермия у самцов 222
Занятие 42. Развитие яйцеклеток, половые циклы, формирование
половых мотиваций, половое ритуальное поведение,
половое взаимодействие и оплодотворение у самок 224
5.15. Система лактации 228
302
Занятие 43. Образование молока, распределение, накопление
и удержание молока в емкостной системе, молоко-
выведение. Молоко, его состав и свойства 229
5.16. Физиологическая адаптация животных 236
Занятие 44. Изучение физиологической адаптации животных 236
5.17. Общая этология 237
Занятие 45. Изучение основ этологического исследования 237
5.18. Частная этология 239
Занятие 46. Изучение частной этологии крупного рогатого
скота 239
Занятие 47. Изучение частной этологии овец 240
Занятие 48. Изучение частной этологии лошадей 242
Занятие 49. Изучение частной этологии свиней 243
Занятие 50. Изучение частной этологии кроликов 245
Занятие 51. Изучение частной этологии птиц 246
Приложения 249
Термины и определения 260
Предметный указатель 296
Учебное издание
Лысов Виктор Федорович,
Ипполитова Татьяна Владимировна,
Максимов Владимир Ильич,
Шевелев Николай Серафимович
ПРАКТИКУМ ПО ФИЗИОЛОГИИ
И ЭТОЛОГИИ ЖИВОТНЫХ
Учебное пособие для вузов
Художественный редактор В. А. Чуракова
Компьютерная верстка В. Л. Маланиневой
Компьютерная графика К. В. Максимова
Корректор В. Н. Маркина
Сдано в набор 25.05.09. Подписано в печать 01.12.09. Формат 60x88 Vi6- Бумага
офсетная. Гарнитура Ньютон. Печать офсетная. Усл. печ. л. 18,62+0,25 цв. вкл.
Изд. № 09. Тираж 3000 экз. (1-й завод: 1—750 экз.). Заказ
ООО «Издательство «Кол ос С»,
101000, Москва, ул. Мясницкая, д. 17.
Почтовый адрес: 129090, Москва, Астраханский пер., д. 8.
Тел. (495) 680-99-86, тел./факс (495) 680-14-63, e-mail: sales@koloss.ru,
наш сайт: www.koloss.ru
Отпечатано с готовых диапозитивов
в ООО «Марийское Рекламно-издательское полиграфическое предприятие»
424020, г. Йошкар-Ола, ул. Машиностроителей, 8 г.
ISBN 978-5-9532-0770-6
9 ЧЬ5^БТ20770&
• 9§
1 2 3
• 9 •
ft t
7 8 9 10 11 12
Рис. Па. Форменные элементы крови крупного рогатого скота:
1, 2— базофилы; 3 — эозинофил; 4— юный нейтрофил; 5 и б—палочкоядерный и сег-
ментоядерный нейтрофилы; 7—малый, 8 и 9— средний и большой лимфоциты; 10,
77 —моноциты; 12 — клетка Тюрка (по Н. П. Рухлядеву)
Рис. Пб. Форменные элементы крови овцы:
7 —базофил; 2— эозинофил; 3— юный, 4, 5 и 6— палочкоядерный и сегментоядерные
нейтрофилы; 7—малый, #—средний и 9— большой лимфоциты; 10 и 77 —моноциты;
12 и 13— клетки Тюрка; 14— эритроциты и ретикулоциты; 75—тромбоциты
•
8 9 10 11 12 13
Рис. Пв. Форменные элементы крови лошади:
7 —базофил; 2— эозинофил; J—юный, 4, 5—палочкоядерные и 6, 7— сегментоядер-
ные нейтрофилы; 8, 9 и 10 — лимфоциты; 77 и 12— моноциты; 13 — клетка Тюрка; 14—
эритроциты и тромбоциты
• •'♦'*''/ -к
10
11
12
Рис. Пг. Форменные элементы крови свиньи:
7 —базофил; 2— эозинофил; 3, 4— юные, 5— палочкоядерный и 6—
сегментоядерный нейтрофилы; 7 и #—лимфоциты; 9— моноцит; 10— клетка Тюрка; 77
—эритроциты разной величины; 12 — тромбоциты
12 3 4 5
Шь Шк Шк 1Ь ШЩш
6 7 8 9 10
Рис. 11д. Форменные элементы крови собаки:
7 —базофил; 2— эозинофил; 3 и 4 — палочкоядерный и сегментоядерный нейтрофилы;
5 и 6— малый и большой лимфоциты; 7 и 8— моноциты; 9— клетка Тюрка; 10—
эритроциты и тромбоциты
• Q
ю
11
м
tl ф
12
13
14
Рис. Не. Форменные элементы крови курицы:
7 —базофил; 2 и 3 — эозинофилы; 4—псевдоэозинофил с круглыми гранулами; 5—
псевдоэозинофил с гранулами в виде заостренных палочек; d»—малый и 7, 8— более
крупные лимфоциты; 9 и 10— моноциты; 77 —клетка Тюрка; 12 — эритроциты; 13 —
ретикулоциты; 14— тромбоциты
^ ш •
12
13
14
15
Рис. 11ж. Форменные элементы крови верблюда:
7 —базофил; 2 и 3 — эозинофилы; 4— юный, 5—палочкоядерный, 6 и 7—сегменто-
ядерные нейтрофилы; 8— малый, 9— средний и 10— большой лимфоциты; 77 и 72 —
моноциты; 73 — клетка Тюрка; 14 — эритроциты; 75—тромбоциты