Текст
кристаллография
и минералогия
С. А. Гумилевский, В. М. Киршон, Г. П. Луговской
КРИСТАЛЛОГРАФИЯ
И МИНЕРАЛОГИЯ
ПОД РЕДАКЦИЕЙ ДОКТОРА ГЕОЛОГО-
МИНЕРАЛОГИЧЕСКИХ НАУК
ПРОФЕССОРА А. И. ГИНЗБУРГА
Допущено Министерством высшего
и среднего специального
образования СССР
в качестве учебного пособия
для студентов высших учебных заведений
ИЗДАТЕЛЬСТВО «ВЫСШАЯ ШКОЛА»
МОСКВА —1972
552
Г93
УДК 548/549(075)
Гумилевский С. А. и др.
Г93 Кристаллография и минералогия. Учебн. пособие для
втузов. М., «Высшая школа», 1972.
280 с. с илл.
Перед загол. авт. С. А, Гумилевский, В. М. Киршон,
Г. П. Луговской.
В книге излагаются основные сведения по кристалло-
графии и минералогии;
В первом разделе рассматриваются наиболее важные
аспекты геометрической и физической кристаллографии,
а также основные положения кристаллохимии.
Во втором и третьем разделах приведен исторический
очерк, описываются физические свойства, химический со-
став, генезис и современные методы исследования мине-
ралов, а также систематическое описание минералов,
содержащее характеристику каждого класса и сведения
о наиболее распространенных и практически ценных ми-
нералах.
552
2—9—2 и 2—9—3
114—72
РЕЦЕНЗЕНТЫ:
КАФЕДРА ГЕОЛОГИИ И МАРКШЕЙДЕРИИ
ТУЛЬСКОГО ПОЛИТЕХНИЧЕСКОГО ИНСТИТУТА,
ЗАВ. КАФЕДРОЙ ПРОФ. В. С. ОГАРКОВ;
ДОКТ. ГЕОЛ.-МИНЕРАЛОГ. НАУК
ЛАУРЕАТ ГОСУДАРСТВЕННОЙ ПРЕМИИ СССР
В. В. ИВАНОВ
ПРЕДИСЛОВИЕ
В последние годы в минералогии произо-
шли существенные изменения, вызванные ин-
тенсивным развитием кристаллохимии, кото-
рая позволила связать физические свойства и
состав минералов с их внутренним строением.
Современная техника дала возможность син-
тезировать ряд минералов с заранее заданны-
ми свойствами, необходимыми для практиче-
ского использования в промышленности. С
каждым годом увеличивается число минера-
лов, которые вовлекаются в сферу промыш-
ленного использования. В существующих учеб-
никах (В. В. Критский, С. Д. Четвериков,
Н. В. Титов и др.) по курсу кристаллографии
и минералогии для негеологических специаль-
ностей отсутствуют новые сведения, получен-
ные за последние годы.
Авторы данного учебного пособия постави-
ли перед собой задачу восполнить в некоторой
степени этот пробел. Пособие по своему содер-
жанию соответствует, в основном, програм-
мам курса кристаллографии и минералогии,
составленным и утвержденным Министерством
высшего и среднего специального образования
СССР для студентов негеологических специ-
альностей. При этом особое внимание авторы
уделили изложению кратких сведений по кри-
сталлохимии, без знания которых невозможно
освоить основы современной минералогии.
Большое внимание в работе обращено также
на области применения минералов. Значитель-
но расширен раздел, касающийся процессов
минералообразования.
При написании данной работы авторы ис-
пользовали основную учебную и справочную
литературу по минералогии: курсы минерало-
3
гии А. Г. Бетехтина и Е. К. Лазаренко, справоч-
ники X. Штрунца, У. А. Дира и др., а также с
любезного согласия проф. А. И. Гинзбурга
некоторые его лекции, прочитанные во Всесо-
юзном заочном политехническом институте для
студентов геологической специальности.
Главы 2—4, 8, 9 написаны В. М. Киршон.
Остальные — совместно С. А. Гумилевским и
Г. П. Луговским.
Авторы выражают глубокую благодарность
рецензентам — докт. геол.-минералог, наук
В. В. Иванову, коллективу кафедры геологии
и маркшейдерии Тульского политехнического
института за критические замечания, данные
при рецензировании рукописи, а также проф.
А. И. Гинзбургу, взявшему на себя труд отре-
дактировать рукопись и сделавшему ряд цен-
ных указаний.
РАЗДЕЛ I
КРИСТАЛЛОГРАФИЯ
ГЛАВА 1
КРАТКИЕ СВЕДЕНИЯ ИЗ ИСТОРИИ
РАЗВИТИЯ КРИСТАЛЛОГРАФИИ
Название науки «кристаллография» происходит от двух грече-
ских слов: «кристаллос» — лед и «графо» — пишу, т. е. кристалло-
графия возникла как наука, изучающая кристаллы.
На первых этапах своего развития кристаллография являлась
частью минералогии, но в середине прошлого века она выделилась
в отдельную дисциплину и с тех пор развивается самостоятельно.
В настоящее время кристаллография настолько тесно связана с
физикой твердого тела, что рассматривается как раздел физических
наук.
В 1867 г. А. В. Гадолин установил для кристаллов 32 вида сим-
метрии и разработал математические основы кристаллографии.
Через несколько лет, в 1889 г., Е. С. Федоров изобрел окружной
гониометр для измерения кристаллов. Это изобретение стимулиро-
вало дальнейшее развитие кристаллографии. Много лет (1853—
1919 гг.) Е. С. Федоров посвятил разработке методики кристалло-
графического анализа и изучению законов пространственного рас-
положения точек на основе сочетаний различных элементов
симметрий. Им были выведены все возможные 230 пространствен-
ных групп и тем самым заложены основы теории структуры кри-
сталлов.
Открытие рентгеновских методов исследования сильно отрази-
лось и на развитии кристаллографии. От кристаллографии отпочко-
валась новая наука — кристаллохимия, изучающая связь состава
и внутреннего строения кристаллов. Одним из первых русских
кристаллохимиков был Г. В. Вульф. Развитие современной кристал-
лохимии тесно связано с именами В. М. Гольдшмидта, Ф. Махачки,
Г. Штрунца и особенно академика Н. В. Белова.
Почти все твердые вещества (минералы, горные породы, раз-
личные руды, цемент, керамика, продукты химической промышлен-
ности и др.) являются кристаллическими. Кристаллография изуча-
ет законы строения кристаллического вещества.
На современном этапе развития науки в связи с необходимостью
: 5
решения ряда практических вопросов перед кристаллографией воз-
никли новые задачи. Она становится не только теоретической нау-
кой, но и помогает решению важнейших народнохозяйственных
проблем. Возникает новая область кристаллографии, занимающая-
ся изучением законов роста кристаллов и получением искусственных
кристаллов, применяемых в различных отраслях промышленности.
В настоящее время наша промышленность изготовляет искусст-
венные кристаллы корунда для резцов, точных измерительных при-
боров и часов, а также различные кристаллы для квантовых гене-
раторов; кристаллы алмаза, кварца, оптического флюорита,
кальцита, сильвина, слюды, широко применяющихся в оптике, элек-
тротехнике, радиотехнике, при обработке металлов.
Курс кристаллографии делится обычно на четыре части:
1. Геометрическую кристаллографию, рассматривающую раз-
личные формы кристаллов. В этот раздел входит также изучение
геометрических законов кристаллографии, учение о симметрии кри-
сталлов;
2. Кристаллохимию, изучающую внутреннее строение кристал-
лических веществ, их структуру и зависимость внутреннего строе-
ния от химического состава;
3. Физическую кристаллографию, занимающуюся изучением
разнообразных физических свойств кристаллического вещества в
зависимости от его внутреннего строения;
4. Физико-химическую кристаллографию, трактующую вопросы
роста и растворения кристаллов.
ГЛАВА 2
ПОНЯТИЕ О КРИСТАЛЛЕ
И КРИСТАЛЛИЧЕСКОМ ВЕЩЕСТВЕ
Кристаллами называются твердые тела, имеющие естественную
форму многогранника и характеризующиеся закономерным распо-
ложением в пространстве элементарных частиц (атомов, ионов,
молекул).
В древние времена считали, что кристаллы встречаются в при-
роде редко, в действительности же, если вооружиться лупой, то
можно легко убедиться, что очень многие камни, форма которых
неправильная, состоят из отдельных кристалликов. Если же рас-
сматривать неправильные выделения минералов под микроскопом,
то кристаллических образований окажется еще больше. Образец
любой породы или кусок любого металла представляет собой скоп-
ление кристаллических зерен.
Благодаря использованию рентгеновских лучей возможность
выявления кристаллических веществ резко возросла.
В настоящее время установлено, что подавляющее большинство
твердых веществ являются кристаллическими. Металлы и сплавы,
горные породы, слагающие земную кору, состоят из отдельных
кристаллов.
б
Основные особенности
кристаллического вещества
определяются его внутрен-
ним строением. Мельчайшие
материальные частички лю-
бого кристаллического ве-
щества, будь то атомы, ио-
ны или молекулы, законо-
мерно расположены в про-
странстве, образуя правиль-
ные ряды. Эти правильные
ряды частиц в трехмерном
пространстве образуют так
называемые кристалличес-
кие решетки (рис. 1).
Каждый кристалл состо-
Рис. 1. Кристаллическая решетка пова-
ренной соли
ит из огромного количества
мельчайших материальных
частиц (ионов, атомов, мо-
лекул), расположенных в
строго определенном поряд-
ке. Кроме того, частицы не находятся в неподвижном состоянии, а
непрерывно колеблются около некоторых положений — узлов кри-
сталлической решетки.
На рис. 2 показано строение кристаллической решетки. Если
обозначить узлы решетки, лежащие на одной прямой, через До, Аь
А2, Ап, а промежутки между ними через а (причем ДоД1=Д1Д2 =
A2A3... = d), то получится ряд пространственной решетки, где а яв-
ляется промежутком ряда (рис. 2, а).
Рассмотрим ближайший к узлу До узел В\ (рис. 2, б), находя-
щийся в плоскости чертежа, но расположенный под каким-нибудь
углом к прямой 4оЛ1,... Ап. Расстояние Д0В1 обозначим буквой b и,
проложив прямую АВ, отметим на ней ряд узлов В2, В3,..., Вп. Затем
проведем через узлы Вь В2, В3,...,Вп прямые, параллельные перво-
му ряду, т. е. До, ДьАп, а через узлы Ah А2, ...,Ап — аналогичные
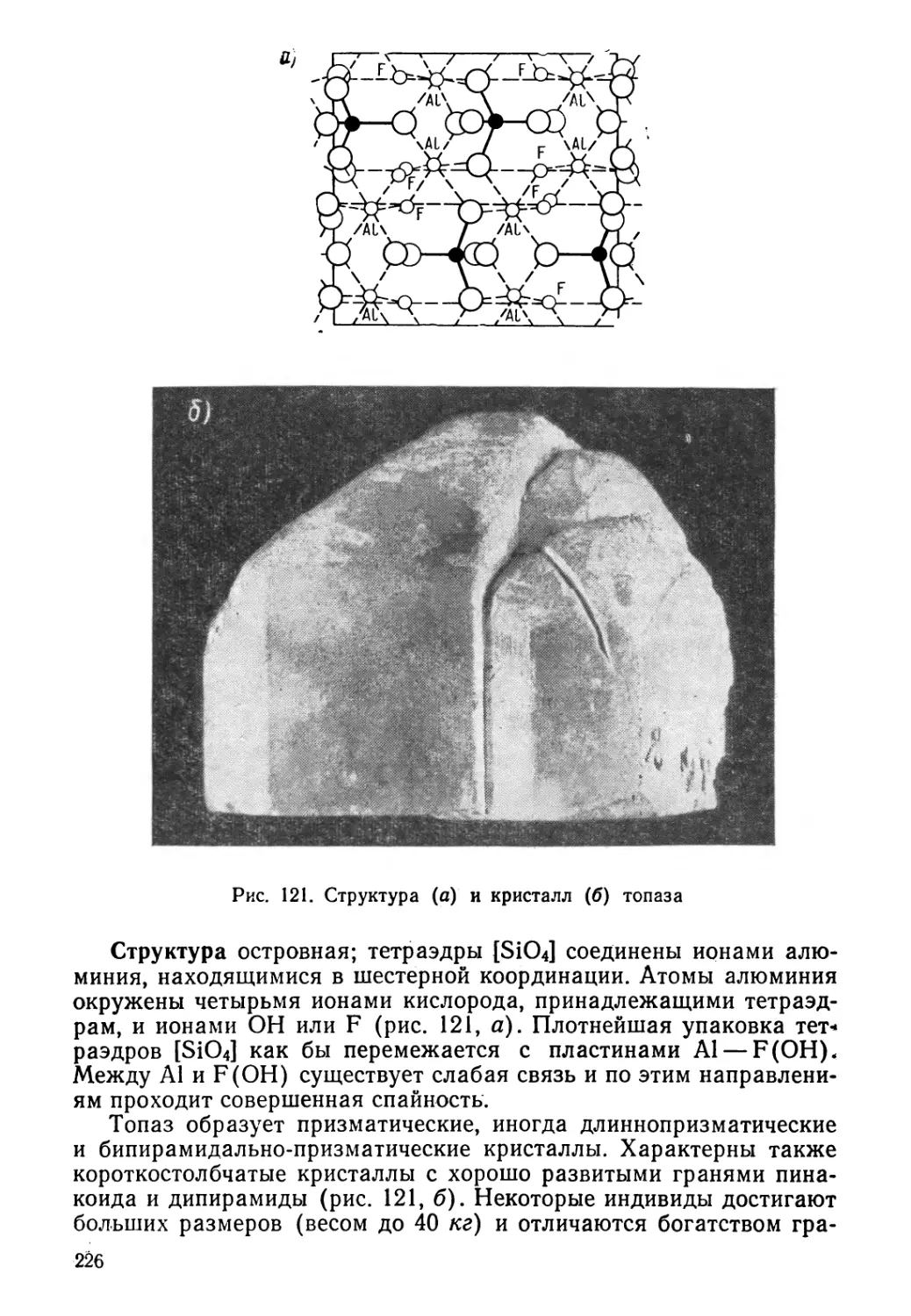
прямые, параллельные второму ряду (До, Вь..., Вп) и получим плос-
кую сетку, которая, как видно, разделена двумя сериями параллель-
ных рядов на систему равных параллельных параллелограммов.
Следующий этап построения пространственной решетки происходит
вне плоскости чертежа.
Аналогично предыдущему рассуждению рассмотрим ближай-
ший к узлу До узел Cj (рис. 2, в), не лежащий в плоскости чертежа.
Продолжаем прямую До^ и находим ряд узлов С2, С3, ..., Сп (про-
межуток ряда равен с). Затем, проведя через эти узлы плоские сет-
ки, параллельные первой сетке Д1ДОВЬ получим пространственную
решетку, состоящую из ряда параллелепипедов, которые принято
называть элементарными ячейками пространственной решетки.
Форма элементарной ячейки зависит от ее параметров, т. е. от
размеров отрезков а, б, с и углов между ними а, 0, у.
7
Рис. 2. Строение кристаллической решетки:
а — ряд пространственной решетки; б — плоская
сетка пространственной решетки; в — пространст-
венная решетка
Для решетки поварен-
ной соли а=6 = с и а =
= Р=у=90°. При таком
соотношении параметров
форма элементарной
ячейки представляет со-
бой куб. Если а = &=/=с, а
а = р=у = 90°, то форма
ячейки будет представ-
лять собой тетрагональ-
ную призму (рис. 3, а);
при а=/=Ь=/=с и а = р=
=у=90° — ромбическую
призму (рис. 3, б); при
и а=у=90°, a
Р=/=90° — наклонный па-
раллелепипед (рис. 3, в);
при а=/=б=/=с и а=/=р=й=
#=у#=90° —косоугольный
параллелепипед (рис. 3,
г).
Итак, основная осо-
бенность всех кристалли-
ческих веществ заключа-
ется в том, что они по-
строены закономерно, т. е.
их атомы, ионы или мо-
лекулы располагаются в
узлах кристаллической
решетки. Узлы соответст-
вуют вершинам реальных
кристаллов, ряды — ребрам, плоскости — граням.
Рентгеноструктурные исследования позволили установить, что
существуют и такие твердые тела, в которых частицы расположены
совершенно беспорядочно, подобно тому, как это наблюдается в
жидкостях или газах. Такие тела называются аморфными т. е. бес-
форменными, поскольку в отличие от кристаллических они не обра-
зуют многогранников. Иными словами, слагающие их элементарные
частицы располагаются в пространстве не закономерно, а беспоря-
дочно, не составляя правильных кристаллических решеток. Интерес-
но, что одни и те же вещества во многих случаях могут быть и кри-
сталлическими и аморфными. Так, например, из сахарного расплава
может образоваться кристаллический сахар, если расплав будет
застывать медленно, и сахар-леденец, если тот же расплав будет
застывать быстро.
Итак, главное отличие кристаллического вещества от аморфного
состоит в том, что его атомы, ионы или молекулы располагаются в
пространстве закономерно в определенном порядке, а у аморфного
в беспорядке. Со временем частички и в аморфном веществе могут
8
Рис. 3. Различные формы параллелепипедов (элементарных ячеек) прост-
ранственной решетки:
а — тетрагональная призма; б — ромбическая призма; в — наклонный параллелепипед;
г — косоугольный параллелепипед
приобрести закономерное расположение, т. е. образовать кристалли-
ческую решетку. Время, в течение которого происходят такие изме-
нения, может быть различным — от нескольких часов до сотен лет
и более.
Свойства кристаллических веществ. Кристаллические вещества
обладают характерными свойствами, обусловленными внутренним
строением кристаллов. К таким свойствам относятся: однородность,
анизотропность, способность самоограняться, определенные физи-
ческие константы, связанные с разрушением кристаллической ре-
шетки (например, определенные постоянные температуры плав-
ления).
Однородность. Это свойство проявляется в том, что два
одинаковых элементарных объема кристаллического вещества, оди-
наково ориентированные в пространстве, но вырезанные в разных
точках этого вещества, абсолютно одинаковы по всем своим свойст-
вам: имеют один и тот же цвет, удельный вес, твердость, теплопро-
водность, электропроводность и др.
Необходимо иметь в виду, что реальные кристаллические вещест-
ва очень часто содержат постоянные примеси и включения, иска-
жающие их кристаллические решетки, поэтому абсолютной одно-
родности в реальных кристаллах часто не бывает.
Анизотропность. При изучении кристаллической решетки
можно убедиться, что расстояние между составляющими ее части-
цами в параллельных и непараллельных рядах различны; физиче-
ские свойства кристаллов (прочность, хрупкость, твердость, величи-
на теплового расширения, скорость прохождения различных волн,
теплопроводность, электропроводность и др.) проявляются в зави-
симости от направления рядов решетки: для горизонтальных рядов
они могут иметь одно значение, для вертикальных — другое.
Это явление называется анизотропностью, или неравносвойст-
венностью, в противоположность изотропности (равносвойственно-
сти). У веществ, характеризующихся изотропностью, физические
свойства по всем направлениям проявляются одинаково.
9
Рис. 4. Коэффициенты теплопроводности одинаковы во всех на-
правлениях для изотропных тел (а) и различны для анизотроп-
ных кристаллов (б)
Изобразим для примера графически коэффициент теплопровод-
ности для изотропных и анизотропных тел (рис. 4).
Для изотропного тела он выразится тремя одинаковыми по ве-
личине, но различно направленными векторами:
AB = AC = AD.
Для анизотропного же тела величины векторов будут различны-
ми. Аморфные тела, как правило, изотропны; большинство же крис-
таллических веществ отличаются анизотропностью. В некоторых
кристаллических веществах те или иные свойства проявляются изо-
тропно. Например, в кристаллах кубической сингонии свет распро-
страняется по разным направлениям с одной и той же скоростью,
т. е. такие вещества оптически изотропны.
Способность самоограняться — свойство кристаллов
образовывать грани при свободном их росте. Так, если выточенный
из какого-либо кристаллического вещества шарик, например пова-
ренной соли, поместить в ее пересыщенный раствор, то через неко-
торое время этот шарик примет форму куба. В противоположность
этому, стеклянный шарик не изменит своей формы, так как аморф-
ное вещество не может самоограняться.
Способность самоограняться, т. е. принимать многогранную фор-
му в результате свободного роста в соответствующей среде, харак-
терна только для кристаллических веществ.
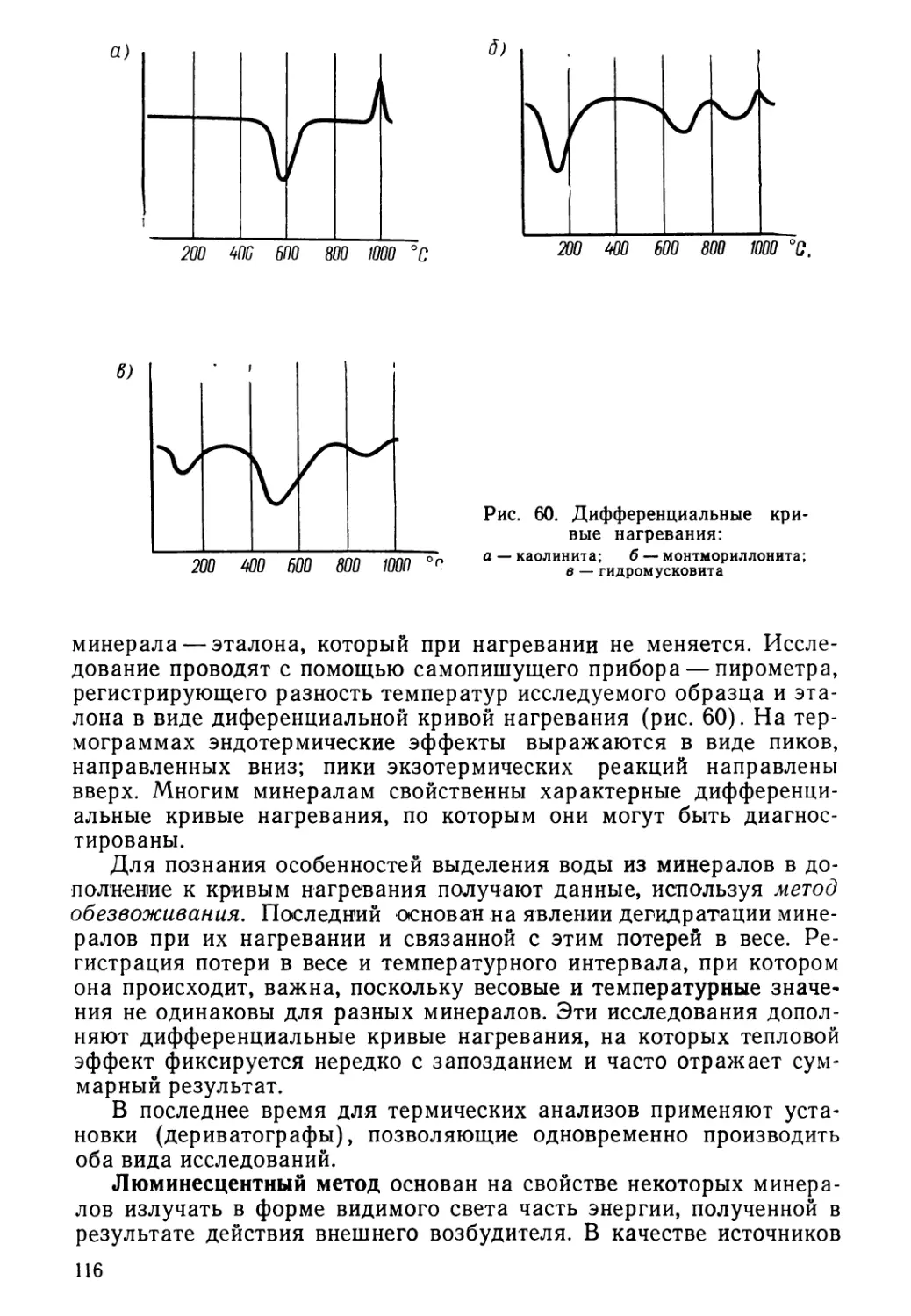
Рис. 5. Кривые нагревания аморфных (а) и кристаллических (б) тел
10 .
Постоянная точка плавления. Если нагревать кристал-
лическое тело, то температура его будет повышаться до определен-
ного предела; при дальнейшем нагревании вещество начнет пла-
виться, а температура некоторое время останется постоянной, так
как все тепло пойдет на разрушение кристаллической решетки.
Температура, при которой начинается плавление, называется тем-
пературой плавления.
Если повышение температуры аморфных и кристаллических ве-
ществ изобразить графически, то для аморфных тел кривая нагре-
вания будет иметь плавный характер (рис. 5, а); для кристалличе-
ских тел кривая нагревания будет иметь ломаный характер, где го-
ризонтальный участок соответствует температуре плавления
(рис. 5, б).
ГЛАВА 3
ГЕОМЕТРИЧЕСКАЯ КРИСТАЛЛОГРАФИЯ
Геометрическая кристаллография изучает законы симметрии
кристаллов, различные формы кристаллических веществ, сочетания
различных форм и законы срастания кристаллов.
Симметрия кристаллов. Учитывая, что все кристаллические
вещества имеют прерывно равномерное строение, следует ожидать
проявления в них симметрии. Симметричность любой фигуры,
в том числе и многогранника, выявляется при помощи элементов
симметрии.
Элементами симметрии называются геометрические образы
(точки, прямые, плоскости), при помощи которых выявляется сим-
метричность фигуры или многогранника. Рассмотрим следующие
элементы симметрии: центр инверсии, оси симметрии и плоскость
симметрии.
Центр инверсии (С). Центром инверсии называется точка,
расположенная внутри фигуры многогранника и характеризующая-
ся тем, что любая прямая, проведенная через эту точку на равных
расстояниях и по обе стороны от нее, встретит одинаковые точки
фигуры.
На моделях кристаллов центр инверсии можно определить сле-
дующим образом. Положим модель какой-нибудь гранью на стол.
Если во всех случаях вверху оказывается грань, параллельная и
равная первой, то центр инверсии имеется, если же вверху окажется
ребро, или вершина^ или грань, параллельная, но не равная первой,
то центра инверсии у кристалла не существует (рис. 6).
Плоскость с им метр ии (Р). Плоскостью симметрии назы-
вается воображаемая плоскость, делящая фигуру на две равные
части, которые относятся друг к другу как предмет и его зеркаль-
ное изображение (рис. 7).
Для определения плоскостей симметрии модель многогранника
необходимо установить в определенное положение (чтобы не по-
считать одну и ту же плоскость несколько раз). Плоскости симмет-
11
Рис. 6. Многогранник с центром инвер- Рис. 7. Плоскости симметрии тет-
сии (а)—каждой грани соответ- рагональной призмы
ствует параллельная и равная грань.
Многогранник без центра инверсии
(б) — грань А не имеет параллельной
и равной ей грани
рии проходят через середины граней ребер, а также вдоль ребер или
через противоположные вершины.
Ось симметрии (L). Осью симметрии называется такая ли-
ния, при повороте вокруг которой фигура совмещается сама с собой.
При определении оси симметрии фигура как бы нанизывается на
ось и затем вращается вокруг нее. В зависимости от того, сколько
раз при вращении вокруг оси на 360° эта фигура совместится сама
с собой, определяется порядок ее оси (следует помнить, что осей
выше шестого порядка в кристалле не бывает). Угол поворота, при
котором происходит совмещение, называется элементарным углом
поворота; например, если при вращении кристаллографической мо-
дели вокруг своей оси (т. е. при повороте на 360°) она совместится
4 раза (через каждые 90°), то такая фигура будет обладать осью
четвертого порядка, а элементарный угол равняется 90°. Если она
совместится 2 раза, то ось будет второго порядка и т. д.
Практически оси проходят через середины граней, через середи-
ны ребер, противоположные вершины, а также через середину реб-
ра и грани.
В кристаллах могут быть оси второго, третьего, четвертого и
шестого порядков.
Почему не может быть, например, оси пятого порядка?
Допустим, что ось пятого порядка в кристаллах существует и
проходит перпендикулярно к плоскости чертежа. Обозначим ее вход
точкой О (рис. 8). Возьмем ближайший, но не совпадающий с точ-
кой выхода пятой оси узел кристаллической решетки Ль лежащий
в плоскости рисунка. Естественно, что при вращении вокруг оси пя-
12
Рис. 8. Рисунок, иллюст-
рирующий невозмож-
ность в кристаллах оси
пятого порядка
L
Рис. 9. Много-
гранник с ин-
версионной
осью шестого
порядка
того порядка при повороте на 72° узел А{ перейдет в положения 42,
43, А4, 45, пока не опишет полный круг и не вернется в свое исход-
ное положение. Эти пять узлов, лежащие в одной плоскости, долж-
ны образовать плоскую сетку, которая представляет собой совокуп-
ность узлов пространственной решетки. Соединив точки Ai и А4,
получим прямую, параллельную стороне А2А3 правильного пяти-
угольника. Известно, что все параллельные ряды решетки имеют
одинаковые межузловые промежутки. Поэтому, отложив на прямой
4i44 отрезок, равный 4243, мы получим внутри пятиугольника узел
Ах, лежащий ближе к О, т. е. к оси пятого порядка, чем любая из
точек 41, 42, 43, 44, 4s.
Таким образом, мы пришли к выводу, противоречащему приня-
тому условию, что точка 41 взята ближайшей к оси пятого поряд-
ка (О), что противоречит решетчатому строению кристаллических
веществ.
Такое же доказательство можно привести для осей седьмого,
восьмого и других высших порядков. Что касается осей второго,
третьего, четвертого и шестого порядков, то придерживаясь выше-
приведенного доказательства, можно прийти к выводу, что они су-
ществуют.
Итак, в кристаллах могут существовать только оси второго —
L2, третьего — L3y четвертого — L4 и шестого — порядков.
Инверсионной осью (Lf) называется такая линия, при по-
вороте вокруг которой на некоторый угол с последующим отраже-
нием в центральной точке фигуры, как в центре инверсии, фигура
совместится сама с собой.
Следует отметить, что центр инверсии, который участвует в ка-
честве составной части инверсионной оси, может не являться само-
стоятельным элементом симметрии. Рассмотрим инверсионную ось
в многограннике, изображенном на рис. 9. Он имеет ось третьего
13
порядка Lz (прямая LL), которая одновременно является инверси-
онной осью симметрии шестого порядка (L/e). При повороте всех
частей многогранника вокруг оси LL на 60° и дальнейшем отраже-
нии их в центральной точке фигура совместится сама с собой. Так,
после поворота ребра АВ вокруг LL на 60°, оно займет положение
Л1ВЬ которое путем отражения через центр совместит Л1В1 с реб-
ром НЕ.
При полном повороте на 360° таких совмещений будет шесть.
Следовательно, ось LL является инверсионной осью шестого по-
рядка.
Доказано, что в кристаллах имеют место инверсионные оси пер-
вого, второго, тертьего, четвертого и шестого порядков.
Практически в кристаллографии имеют место инверсионные оси
четвертого и шестого порядков, остальные оси соответствуют ранее
рассмотренным элементам симметрии: L/t = C; L/t =Р; Li9 соответ-
ствует оси симметрии третьего порядка (L3) при наличии центра
инверсии.
Следует отметить, что инверсионная ось четвертого порядка
Л/4 одновременно является простой двойной осью симметрии L2, а
инверсионная ось шестого порядка Li, равна тройной оси и плос-
кости симметрии, перпендикулярной к ней, т. е. Li9=L2P.
Для примера определим элементы симметрии куба (рис. 10).
В кубе можно установить центр инверсии С, 3 оси четвертого поряд-
ка— 3L4, проходящие через середины граней; 4 оси третьего поряд-
ка— 4L3, проходящие через вершины куба; 6 осей второго поряд-
ка— 6L2, проходящие через середины ребер, и 9 плоскостей симмет-
рии. Все они могут быть выражены формулой: 3L44L36L29PC.
Понятие о сингониях. Совокупность всех элементов симметрии
в одном кристалле определяет вид симметрии, который зависит от
внутреннего строения кристалла. Вывод всех возможных видов сим-
метрии был сделан впервые в 1829 г. проф. Гесселем. Спустя 38 лет,
Рис. 10. Возможные элементы симметрии куба
14
русский ученый А. В. Гадолин, независимо от Гесселя, вывел 32 ви-
да элементов симметрии. Он показал, что по видам симметрии кри-
сталлы разделяются на 32 класса, объединяемые в семь систем или
сингоний, причем последние делятся на три категории: низшую,
среднюю, высшую.
Категории Сингонии
{Триклинная
Моноклинная
Ромбическая
{Тетрагональная
Тригональная
Гексагональная
Высшая Кубическая
Неообходимо подчеркнуть, что совокупность элементов симмет-
рии зависит от внутреннего строения, а внутреннее строение каждо-
го кристалла, в свою очередь, от формы его элементарной ячейки и
ее параметров. Отсюда происходят названия различных сингоний.
Так, например, триклинная названа в связи с тем, что все три угла
между ребрами элементарной ячейки косые (клино, по-гречески,
наклонять); моноклинная — в элементарной ячейке только один
угол косой, остальные прямые; ромбическая — сечение элементар-
ной ячейки имеет форму ромба и т. д.
Итак, сингонией называется совокупность видов симметрии или
система, объединяющая одинаковые элементы симметрии. В табл. 1
сведены все элементы симметрии и виды симметрии, типичные для
всех сингоний.
Из таблицы следует, что для кристаллов кубической, т. е. выс-
шей сингонии, во всех группах сочетаний элементов симметрии всег-
да имеется четыре оси третьего порядка и нет единичного направ-
ления (т. е. единственного неповторимого направления в кри-
сталле) .
Для кристаллов средних сингоний характерно наличие только
одной оси высшего порядка. Эта ось может быть третьего (для три-
гональной сингонии), четвертого (для тетрагональной сингонии)
или шестого (для гексагональной сингонии) порядков. Эти оси всег-
да совпадают с единичными направлениями в кристаллах. В кри-
сталлах низшей сингонии всегда есть несколько единичных направ-
лений и нет осей симметрии высшего (т. е. выше второго) порядка.
Для ромбической сингонии может быть несколько осей второго по-
рядка в сочетании с другими элементами симметрии; для моноклин-
ной— только одна ось второго порядка; в триклинной сингонии все
элементы симметрии, кроме центра инверсии, отсутствуют.
Формы кристаллов. Под формой кристаллов подразумевается
совокупность всех его граней. По внешней форме или облику (га-
битусу) кристаллы весьма многообразны. Различают пластинчатые,
игольчатые, столбчатые и изометрические кристаллы. Кроме того,
15
Виды симметрии
ТАБЛИЦА I
Категории Сингонии Число ечинидных направле- нна Характерные элементы сим - метрии и их сочетания Сочетания элементов симметрии (виды симметрий)
Низшая Триго- нальная Все С С
Моно- клинная Множе- ство Р; Z2; L2PC Р; Z2; L2PC
Ромби- ческая Три L22P; 3£2; за2зрс L22P\ 3£2; 3Z23PC
Средняя Триго- нальная Одно £3 £3; L3C; L33P; £32£2; L33L23PC
Тетраго- нальная Одно L4 или Li L4; L4PC; Ц4Р; L44L2; L44L25PC; Lit^L2); L^L^LgP
Гексаго- нальная Одно Lq или £6; LePC; L$L2-, L$L21PC\ Llt = L3P; Lit3L23P = L33L24P
Высшая Кубичес- кая Нет 4£3 4£33£23PC; 4£33£2 (3£zJ6P; 3L44L3SL2; 3L44L£L29PC
различают простые формы кристаллов и комбинациии простых
форм.
Под простой формой кристаллов понимают совокупность граней,
связанных между собой элементами симметрии: т. е. все грани од-
ного кристалла могут быть выведены при помощи симметричных
преобразований из одной грани.
Под комбинационными формами, или комбинациями простых
форм, понимают совокупность двух или нескольких простых форм.
Такой кристалл нельзя вывести из одной грани при помощи симмет-
ричных преобразований (элементов симметрии). В природе подав-
ляющее большинство кристаллов представлено комбинациями прос-
тых форм.
Названия простых форм образуются от греческих слов: моно —
один (одно); ди — два (двух, дважды); три — три (трех, трижды);
тетра — четыре (четырех, четырежды); пента — пять (пятью);
гекса — шесть (шестью); окта — восемь (восьми, восемью); дека —
десять; додека — двенадцать; эдра — грань; тонна — угол; пина —
доска.
Простые формы. В кристаллических многогранниках может
быть всего 47 простых форм. Наиболее распространенные простые
формы приводятся ниже.
16
a) -
Рис. 11. Моноэдр (а); пинакоид (б); диэдр (в)
Рис. 12. Виды призм:
а — тригональная; б — тетрагональная; в — гексагональная;
г — дитригональная; д — дитетрагональная; е — дигексаго-
нальная
17
Моноэдр — форма, состоящая из одной грани (рис. 11, а).
Пинакоид — форма, состоящая из двух параллельных граней
(рис. 11, б).
Диэдр — форма, состоящая из двух граней, пересекающихся
между собой под каким-нибудь углом (рис. 11, в).
На рис. 12 показаны призмы, т. е. простые формы, состоящие из
трех или большего числа граней. В зависимости от формы основа-
ния различают следующие виды призм:
тригональная — основание треугольник;
тетрагональная — основание четырехугольник;
гексагональная — основание правильный шестиугольник;
дитригональная — сечение удвоенный треугольник (дитригон);
дитетрагональная — сечение удвоенный четырехугольник (дите-
трагон) ;
Рис. 13. Виды пирамид:
а — тригональная; б — тетрагональная; в — гексагональная; г — дит-
ригональная; д — дитетрагональная; е — дигексагональная
18
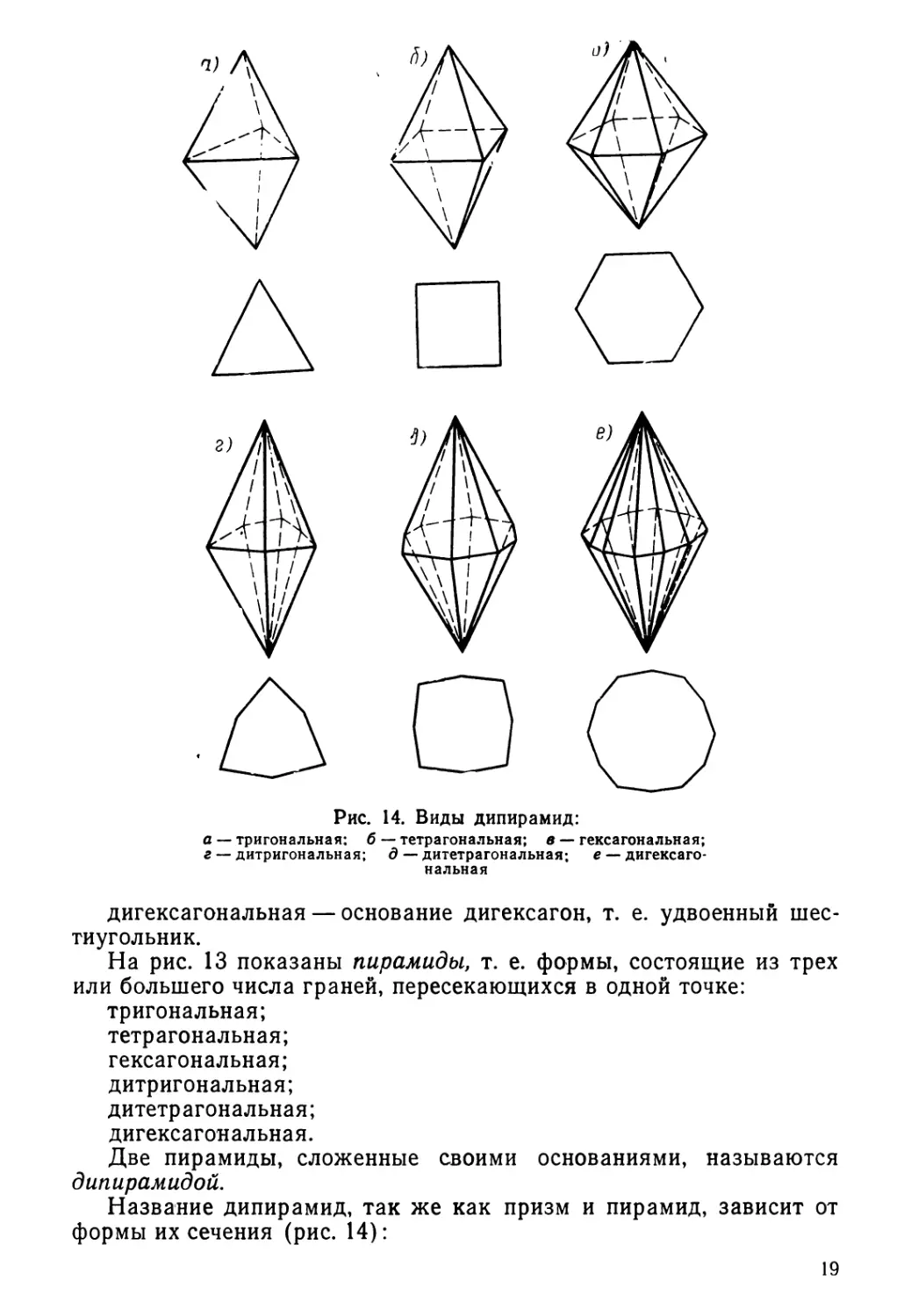
Рис. 14. Виды дипирамид:
а — тригональная: б — тетрагональная; в — гексагональная;
г — дитригональная; д — дитетрагональная; е — дигексаго-
нальная
дигексагональная — основание дигексагон, т. е. удвоенный шес-
тиугольник.
На рис. 13 показаны пирамиды, т. е. формы, состоящие из трех
или большего числа граней, пересекающихся в одной точке:
тригональная;
тетрагональная;
гексагональная;
дитригональная;
дитетрагональная;
дигексагональная.
Две пирамиды, сложенные своими основаниями, называются
дипирамидой.
Название дипирамид, так же как призм и пирамид, зависит от
формы их сечения (рис. 14):
19
Рис. 15. Виды скаленоэдров:
а — тетрагональный; б — дитригональный
тригональная;
тетрагональная;
гексагональная;
дитригональная;
дитетрагональная;
дигексагональная.
Скаленоэды — формы, • име-
ющие грани в виде разносто-
ронних треугольников (скале-
но — разносторонний) (риг.
15):
тетрагональный;
дитригональный.
Трапецоэдры (от слова тра-
пеза— стол) —формы, состоящие из непараллельных граней в ви-
де неправильного четырехугольника (рис. 16):
тетрагональный;
тригональный;
гексагональный.
Тетраэдры — формы, состоящие из четырех непараллельных гра-
ней в виде треугольников (рис. 17). Если эти треугольники равно-
сторонние, получается кубический тетраэдр, если они равнобедрен-
ные— тетрагональный тетраэдр, а если сечением тетраэдра являет-
ся ромб, — ромбический тетраэдр.
Рис. 16. Виды трапецоэдров:
а — тетрагональный; б — тригональный; в — гексагональ-
ный
Рис. 17. Различные тетраэдры:
а — кубический; б — тетрагональный; в — ромбический
8)~
20
Рис. 18. Ромбоэдр (а), куб (б) и октаэдр (в)
Ромбоэдр — форма, состоящая из шести граней в виде ромба
(перекошенный куб, рис. 18, а).
Куб — форма, состоящая из шести квадратов (рис. 18, б).
Октаэдр — форма, состоящая из восьми равносторонних тре-
угольников, четырех вверху и четырех внизу (рис. 18, в).
Следующие 12 форм относятся также к кубической сингонии. Че-
тыре из них отличаются по форме и числу граней, например:
ромбододекаэдр — двенадцать граней, каждая из которых имеет
вид ромба (рис. 19, а);
пентагон-додекаэдр — двенадцать граней; каждая грань являет-
ся пятиугольником (рис. 19, б);
дидодекаэдр — удвоенный двенадцатигранник (рис. 19, в);
тетрагексаэдр — куб, грани которого разбиты на четыре тре-
угольника (рис. 19, г).
Остальные 8 форм (рис. 20) являются производными тетраэдра
(рис. 20, а) и октаэдра (рис. 20, е), грани которых разбиты на три
треугольника, четырехугольника или пятиугольника. В первом слу-
чает получается тригон-тритетраэдр или тригон-триоктаэдр, во вто-
ром — тетрагон-тритетраэдр или
тетрагон-триоктаэдр и т. д. Пос-
ледние формы называют гекса-
тетраэдр и гексаоктаэдр, потому
что их грани разбиты на 6 тре-
угольников. Таким образом выде-
ляются следующие простые фор-
мы:
тетраэдр;
тригон-тритетр аэдр;
тетрагон-тритетраэдр;
пентагон-тритетраэдр;
гексатетраэдр;
октаэдр;
тригон-триоктаэдр;
тетрагон-триоктаэдр;
пентагон-триоктаэдр;
гексаоктаэдр.
Комбинации простых форм.
Как было указано выше, комби-
нации состоят из нескольких про-
Рис. 19. Простые формы кубической
сингонии:
а — ромбододекаэдр; б — пентагон-додека-
эдр; в — дидодекаэдр; г — тетрагексаэдр
21
Рис. 20. Формы кубической сингонии, производные от тетраэдра (а) и окта-
эдра (е):
б — тригон-тритетраэдр; в — тетрагон-тритетраэдр; г — пентагон-тритетраэдр; д —
гексатетраэдр; ж — тригон-триоктаэдр; з — тетрагон-триоктаэдр; и — пентагон-три-
октаэдр; к — гексаоктаэдр
стых форм. Пример образования комбинации призмы и дипирами-
ды показан на рис. 21.
Чтобы разобраться в комбинациях, необходимо:
а) определить число простых форм,
из которых состоит данная комбина-
ция. Оно равно числу различных гра-
ней исследуемой фигуры;
б) подсчитать число граней для
каждой простой формы. При подсчете
граней не следует забывать, что все
грани простой формы должны быть
связаны между собой элементами
симметрии;
в) установить названия простых
форм, входящих в данную комбина-
цию. При этом необходимо помнить,
что очень часто простые формы, со-
Рис. 21. Образование слож-
ной формы — комбинации
призмы (а) и дипирамиды
(б)
22
ставляющие комбинацию, имеют очертания, отличающиеся от рас-
смотренных ранее простых форм. В этих случаях для уточнения
простых форм необходимо мысленно продолжить все грани исссле-
дуемой формы до взаимного пересечения.
ГЛАВА 4
ОСНОВНЫЕ ЗАКОНЫ
ГЕОМЕТРИЧЕСКОЙ КРИСТАЛЛОГРАФИИ
Закон постоянства углов. Углы между соответствующими граня-
ми и ребрами во всех кристаллах одного и того же вещества (при
одинаковых условиях) всегда постоянны. Этот закон был открыт
Стено (1638—1687 гг.), Ломоносовым (1711—1765 гг.), Роме-де-Ли-
ла (1736—1790 гг.) независимо друг от друга.
На рис. 22 показаны различные кристаллы кварца. По внешнему
виду они не похожи один на другой, но у всех этих кристаллов уг-
лы между соответствующими гранями одинаковы, поэтому можно
говорить о том, что они принадлежат к одному и тому же минераль-
ному виду.
Для измерения углов между гранями применяются приборы, на-
зываемые гониометрами.
Закон рациональных двойных отношений, или закон целых чисел
(закон Аюи). Важнейшим законом геометрической кристаллогра-
фии является закон рациональных отношений, выведенный в 1810 г.
французским ученым Аюи: двойные отношения параметров, отсека-
емых любыми двумя гранями кристалла на трех пересекающихся
его ребрах, равны отношениям целых и сравнительно малых чисел.
На основании этого закона можно определить положение любой
грани в пространстве.
Можно сказать, что двойные отношения параметров представля-
ют собой целые числа. Так как речь идет о положении грани в про-
странстве, необходимо прежде всего выбрать оси координат. Для
этого три ребра кристалла переносятся в одну точку и принимаются
за оси координат (/, //, III. рис. 23).
Благодаря решетчатому строению кристаллов, на его ребрах
располагаются через одинаковые промежутки узлы решетки. На
Рис. 22. Различные кристаллы кварца, иллюстрирующие закон Стено
23
Ill
ребре I обозначим этот промежуток через букву а; на ребре II —
через b и на ребре III — через с. По закону Аюи двойные отношения
параметров, отсекаемые двумя любыми гранями кристалла на трех
пересекающихся ребрах, равны отношениям целых чисел. Грань
Д1В1С1 в нашем случае отсекает отрезки ( они же являются пара-
метрами) на осях координат ОЛЬ ОВь ОС\. Грань Л2В2С2 на этих
же осях отсекает отрезки ОЛ2, ОВ2 ОС2.
Из рис. 23 следует, что OA\=ra\ OB\=sb\ OC\ = tc, где г, s, t —
целые числа, соответствующие количеству промежутков между уз-
лами кристаллической решетки.
Для нашего примера г=2, $=3, /=1. Отрезки ОА2=иа; OB2 = vb\
OC2 = wc, Из рисунка видно, что и = 6, v = 4, w = 2.
Возьмем двойные отношения параметров:
ua.vb.wc и л v , w
га sb tc г s t
Подставляя числовые значения для и, г, у, s, w, t и проведя ма-
тематические преобразования, имеем:
6 . 4 . 2 18 . 8 -21 = 9.4-6
2*31 6*6 6 ’
т. е. мы получили целые числа, что и требовалось доказать.
Доказательство второй части закона связано с реальным ростом
кристаллов и с образованием граней. Возьмем два ребра и ряд ре-
альных граней, их пересекающих (рис. 24). Если принять отрезки, от-
секаемые на ребрах первой гранью Л1ВЬ за единичные отрезки, то
двойные отношения для грани Л1В1 будут 1:1; для грани А\В2 —
2:1; для грани Л1В3 — 3 : 1 и т. д.
Из рассмотренного видно, что двойные отношения параметров
возрастают и могут быть большими только для граней с очень ма-
лыми ретикулярными плотностями, которых по закону Браве в
24
кристаллах не бывает. Согласно
закону Браве, кристаллы покры-
ваются гранями только с боль-
шой ретикулярной плотностью.
(Под ретикулярной плотностью
грани подразумевается количест-
во узлов, приходящихся на еди-
ницу ее площади.) Следователь-
но, двойные отношения парамет-
ров будут представлены малыми
числами. В окончательном виде
закон Аюи выразится так:
0^2 . ОВ2 . ОС2 __ .
ОА\ ' ОВ\ ' ОС\ Р'4' ’
где р, р, z — целые числа.
Символы и индексы граней. Закон Аюи дает возможность опре-
делить положение любой грани в пространстве.
Примем три ребра кристалла за координатные оси О/, ОН, ОШ
(рис. 25) и нанесем грань AiBiCj, которую примем за единичную.
Эта грань отсечет на осях координат отрезки ОАЬ ОВЬ ОСЬ кото-
рые можно принять за единицу масштаба. (Отрезок ОА\ является
масштабом для оси 01, отрезок ОВ\ — для оси ОН, ОС\ — для оси
ОШ.} В зависимости от параметров элементарной ячейки кристал-
ла величины отрезков по той или иной оси могут быть разными, так
как каждой сингонии соответствуют определенные параметры. Для
того чтобы определить положение некоторой грани Ах, Вх, Сх в про-
странстве, нанесем ее на выбранные оси координат параллельно
единичной грани. По закону Аюи следует, что
ОАХ . ОВХ ОСХ
—— : ——: ——=р : q : z.
OAi ОВХ OCi r v
Но для числовой характеристики удобнее брать обратные ве-
личины:
1 1 . 1 _ 1 . 1 . 1
ОАХ ОАХ ОВ* овх ОСХ ОС1 Р ’ Q г
упростив отношения, получим:
в левой части
111 1.1.
— : — : — = qz: pz: pq = h :к\1\
р q г
в правой части
1 . 1 . 1 __ ОА\ . ОВ1 ОС\
ОАХ ' ОВХ ' ОСХ ОАХ ’ ОВХ ' ОСХ ’
OAi ОВ\ ОС\
25
где qz = h\ pz=K\ pq = l — целые простые числа.
В окончательном виде это отношение может быть выражено так:
ОЛ1 : jOg, : OCy = h . к . t
ОАХ ОВХ ОСХ
Числа й, к, I являются индексами грани Ах ВХСХ\ эти же числа,
заключенные в круглые скобки без запятых, выражают ее символ
(йк/). Из уравнения следует, что символ грани АХВХСХ выражает-
ся тремя целыми и простыми числами, представляющими собой от-
ношение трех дробей, числители которых являются параметрами
единичной, грани (ОЛЬ OBi, OCi), а знаменатели соответствуют
параметрам искомой грани (ОЛЖ, ОВХ, ОСХ).
Единичной грани всегда придают символ (111), индексы ее при-
нимаются за единицу, несмотря на то, что отрезки единичной грани
по трем осям могут быть различной величины. Составляем для это-
го случая уравнение двойных отношений:
ОЛ1 . ОВ1 ОС] 0л1 ов\ . ос\ р ।
ОАХ * ОВХ * ОСХ ~ ОЛ1 ’ OBi ОС]
Символ грани, параллельной одной из кристаллографических
осей, всегда обозначается через 0.
Определим символ грани AXCEF, показанной на рис. 26. Она па-
раллельна второй и третьей кристаллографическим осям. Следова-
тельно, величины ее параметров по этим осям равны бесконечно-
сти (оо). Параметр по первой оси будет ОАХ.
Обратные величины двойных отношений параметров для этой
грани будут равны
. ОВ1 . OC1==OA1.q. 0=А:0:0
ОАХ со оо ОАХ
Сократив на общий множитель й, получим отношение индексов
1:0:0. Символ грани AXCEF будет “
тельства, мы нашли бы, что
символ
(100). Приводя те же доказа-
искомой
грани, параллельной
Рис. 27. Принятое расположение кри-
сталлографических осей:
а. Р, Y. ао, Ьо, со — геометрические константы
кристаллов
II
26
первой кристаллографической оси, равен (011); параллельной вто-
рой кристаллографической оси,— (101), а символ грани, параллель;
ной третьей оси, равен (ПО).
Установка кристаллов. До сих пор при определении символов
граней считалось, что положение кристаллографических осей как
бы уже известно. На самом деле для определения символов граней
необходимо каждый раз выбирать систему координат и масштаб
единичной грани. Выбор кристаллографических осей и масштаба
единичной грани называется установкой кристалла. Основным пра-
вилом установки кристаллов является то, что кристаллографические
•си должны совпадать или быть параллельны рядам пространствен-
ной решетки.
В кристаллографии принято в общем случае располагать кри-
сталлографические оси так, как это показано на рис. 27. Для каж-
дой сингонии установка кристалла имеет свои особенности.
Триклинная сингония. Оси и плоскости симметрии от-
сутствуют, поэтому кристаллографические оси проводятся парал-
лельно ребрам. За единичную грань принимается любая грань, пе-
ресекающая все три кристаллографические оси (рис. 28, а).
Моноклинная сингония. В кристаллах моноклинной син-
гонии присутствует или одна ось второго порядка (L2), или одна
плоскость симметрии (Р), или же эти элементы симметрии присут-
ствуют совместно.
За вторую кристаллографическую ось принимается ось второго
порядка или перпендикуляр к плоскости симметрии. Первая и
третья кристаллографические оси проводятся в плоскости, перпен-
дикулярной к оси второго порядка. Угол между этими осями всегда
косой.
За единичную грань принимается любая грань, пересекающая
все три кристаллографические оси (рис. 28, б).
Ромбическая сингония. За кристаллографические оси
принимаются три взаимно перпендикулярные направления, совпа-
дающие с осями второго порядка. Следовательно, они образуют
прямоугольную систему координат. За единичную грань принимают
любую грань, пересекающую все три оси, и отсекающую на них
(как во всех кристаллах низших сингоний) неравные отрезки
(рис. 28, в).
Тетрагональная сингония. В тетрагональной сингонии
за третью кристаллографическую ось принимается ось четвертого
порядка; первая и вторая кристаллографические оси перпендикуляр-
ны к третьей и между собой (они обычно совмещаются с двойными
осями). За единичную грань принимается грань, пересекающая три
оси, отсекающая на первой и второй равные отрезки (рис. 28, г)
и неравный на третьей.
Тригональная и гексагональная сингонии. В
кристаллах тригональной сингонии в плоскости, перпендикулярной
к оси третьего или к оси четвертого порядка, всегда имеются три
симметрично равных направления, проходящие под углом 60° друг
к другу. В связи с этим в кристаллах тригональной и гексагональ-
27
ной сингоний принято брать не три кристаллографические оси, а че-
тыре, и символы граней выражать четырьмя индексами.
За единичную грань принимается грань, отсекающая на двух
горизонтальных осях равные отрезки и пересекающая четвертую
ось (рис. 28, д).
Рис. 28. Установка кристаллов различных сингоний:
а — триклинной; б — моноклинной: в — ромбической; г — тет-
рагональной; д — гексагональной; е — кубической
28
Кубическая сингония. Зя кристаллографические оси в
кристаллах кубической сингонии принимаются три равные взаимно
перпендикулярные оси четвертого порядка или, при отсутствии по-
следних, три оси симметрии второго порядка (рис. 28, е); за единич-
ную грань — грань, отсекающую на всех трех осях равные отрезки,
т. е. грань тетраэдра или грань октаэдра, символ которых будет
(111).
ГЛАВА 3
ОСНОВЫ КРИСТАЛЛОХИМИИ
За последнее время сформировалась и приобрела особо важное
значение одна из самых молодых наук — кристаллохимия, изучаю-
щая строение кристаллических веществ и распределение различных
атомов, ионов и молекул в пространстве.
Внутреннее строение кристаллического вещества в конечном
итоге определяет все его особенности: форму кристаллов, химиче-
ские и физические свойства. Вот почему кристаллохимия тесно свя-
зана с кристаллографией, минералогией, металлургией, синтетиче-
ской химией и другими науками.
В своем развитии кристаллохимия ставит перед собой все новые
задачи и, в частности, изучение не только структур минералов, но
и создание новых кристаллических веществ с заранее заданными
свойствами. '
Эта проблема имеет исключительно большое народнохозяйст-
венное значение, поскольку развитие новой техники требует созда-
ния новых материалов с особыми свойствами.
В связи с этим студентам необходимо ознакомиться с основами
кристаллохимии и с современными представлениями о структурах
кристаллических веществ.
Типы химических связей. В первой главе, при характеристике
кристаллического вещества отмечалось, что составляющие его ча-
стички, будь то атомы, ионы или молекулы, расположены в про-
странстве строго закономерно, благодаря чему и возникает кристал-
лическая решетка минерала. Естественно, возникает вопрос, какие
силы обусловливают закономерное положение частиц и удерживают
их на определенном расстоянии друг от друга. Какие связи дейст-
вуют между этими частицами?
Существует несколько различных типов связей. В зависимости
от того, какие элементарные частички располагаются в узлах кри-
сталлических решеток, следует различать ионные, атомные и мо-
лекулярные связи.
Ионная, или гетерополярная, связь наблюдается в
ионных кристаллических постройках и возникает между двумя раз-
ноименно заряженными ионами. Взаимодействие электростатиче-
ских сил притяжения и отталкивания удерживает ионы на опреде-
ленном расстоянии друг от друга. Ионная связь наиболее простая
и чаще всего распространена среди неорганических соединений, в
29
частности, она наблюдается у многих минералов: галоидов, нитра-
тов, карбонатов, сульфатов и др.
Соединения с ионными связями легко диссоциируют в водном
растворе, т. е. хорошо растворяются. Они отличаются высокой тем-
пературой плавления, стеклянным блеском. Такие соединения плохо
проводят электричество. Примером минералов с ионным типом свя-
зи может служить галит NaCl.
Ковалентная, или гомополярная, связь осущест-
вляется в атомных и частично ионных кристаллических постройках
за счет появления у соседних атомов общих электронов. В этом
случае два атома или иона как бы «стягиваются» вместе благодаря
появлению у них общих электронных оболочек. Эта связь очень
прочна, чем и объясняется повышенная твердость минералов с ко-
валентной связью.
Все минералы с ковалентной связью обычно хорошие изолято-
ры, нерастворимы в воде; большинство из них отличается алмаз-
ным блеском и повышенной твердостью. Типичным примером мине-
ралов с ковалентной связью является алмаз.
Металлическая связь проявляется только в атомных
постройках. Она характеризуется тем, что в узлах кристаллической
решетки размещаются ядра атомов, как бы погруженные в газ,
состоящий из свободных электронов, которые движутся подобно
частицам газа. Каждый атом кристаллической решетки отдает свои
электроны и становится при этом положительно заряженным ионом,
так называемым атомным остовом. Отданные же электроны не за-
крепляются за каким-нибудь атомом, а находятся «в общем поль-
зовании» в виде электронного газа.
Притяжение между положительно заряженными ионами и отри-
цательно заряженными свободными электронами уравновешивает
силы отталкивания, возникающие между одинаково заряженными
частицами. Это и обусловливает прочность структуры.
Свободное перемещение электронов определяет целый ряд
свойств, характерных для веществ с подобным типом связи: хоро-
шую электро- и теплопроводность, металлический блеск, ковкость.
Примером веществ с таким типом связи являются самородные
металлы (медь, золото, серебро и др.).
Остаточная связь. В молекулярных кристаллических ре-
шетках связь осуществляется между двумя молекулами за счет так
называемых остаточных сил (или связей Ван-дер-Ваальса).
Хотя каждая молекула электростатически нейтральна и в ней
уравновешены все заряды, многие молекулы представляют собой
диполь, т. е. центр тяжести всех положительно заряженных частиц
у них не совпадает с центром тяжести всех отрицательно заряжен-
ных частиц. Вследствие появления диполя различные части одной
и той же молекулы приобретают определенный заряд, хотя в целом
молекула остается нейтральной, поскольку разноименные заряды
друг друга уравновешивают. Тем не менее вследствие образования
диполя между двумя молекулами возникают остаточные связи —
они взаимодействуют друг с другом, так как разные их части при-
30
Fe
Ковалентная
Рис. 29. Схема струк-
туры пирита, характе-
ризующаяся наличием
ковалентной и ионной
связей
обретают разноименные заряды. Естествен-
но, что эти остаточные силы, или, как их на-
зывают, силы Ван-дер-Ваальса, очень неве-
лики. Поэтому при малейшем внешнем воз-
действии (нагревании, давлении и др.) мо-
лекулы легко разъединяются. Этим объяс-
няется, например, хрупкость, а также лету-
честь серы. При нагревании серы молеку-
лы приобретают большую скорость движе-
ния и при этом легко отрываются друг от
друга.
Кристаллические структуры с молеку-
лярной связью являются хорошими диэлек-
триками, отличаются небольшой твер-
достью, хрупкостью, имеют невысокие точ-
ки плавления и кипения.
Молекулярный тип связи наиболее характерен для органических
соединений.
Таким образом, характер связи определяет все основные свой-
ства кристаллических веществ.
Надо только оговориться, что в большинстве природных кри-
сталлических веществ проявляется не одна, а две или даже несколь-
ко типов связей; например, для графита характерно наличие кова-
лентной связи между атомами и остаточной между слоями (см.
ниже рис. 66).
В структуре пирита, имеющего формулу FeSa, два иона серы
связаны друг с другом ковалентной связью, в то время как между
ионами серы и железа проявляются ионно-ковалентные связи
(рис. 29).
Если разделить все кристаллические решетки на атомные, ион-
ные и молекулярные, то у первых будут проявляться металлические
и ковалентные связи, в то время как у вторых — в основном ионные
и ковалентные, а у третьих главным образом остаточные. У преоб-
ладающего большинства минералов (кроме самородных элементов)
связи сложные — ионно-ковалентные.
Ионные радиусы. Известно, что атом представляет собой слож-
ную систему, состоящую из положительно заряженного ядра и от-
рицательно заряженных электронов. В случае неравенства зарядов
ядра и электронной оболочки возникают положительно или отрица-
тельно заряженные ионы — катионы или анионы. Естественно, что
между ионами действуют и силы притяжения, и силы отталкивания,
которые в конечном итоге определяют те расстояния, которые меж-
ду ними устанавливаются. В результате у каждого иона или атома
появляется известная сфера действия, характеризующаяся опреде-
ленным радиусом, ионным для иона и атомным для атома.
Таким образом, атомным или ионным радиусом называется то
минимальное расстояние, на которое центр сферы данного атома
(иона) может приблизиться к поверхности соседних атомов (ионов).
Атомные (ионные) радиусы фактически определяют расстояние
31
Ионные радиусы (А)
H (1—) 1,54 He (0)1,22 Li (!+)0,78
В (3+) 0,20 C (4+) 0,20 N (5+) 0,1-0,2 0 (2-) 1,32 F (1~) 1,33 Ne (0) 1,52 Na (1+) 0,98
Al (3+) 0,57 Si (4+) 0,39 p (5+) 0,35 S (2—) 1,74 (6+) 0,34 Cl (1-) 1,81 Ar (0)1,92 к (1+)1,33
Си (1+) 0,96 Zn (2+) 0,83 Ga (3+) 0,62 Ge (44-) 0,44 As (34-)0,69 Se (3—) 1,91 (6+) 0,35 Br (1—)1,96 Kr (0)2,04 Rb (1+) 1,49
Ag (1+) 1,13 Cd (2+) 1,03 In (2+) 0,92 Sn (44-) 0,74 Sb (3+)0,90 Те (2-) 2,11 (6+) 0,56 I (1—)2,20 X (0)2,18 Cs (1+) 1,65
Аи (1+) 1,37 Hg (2+) 1,12 T1 (1+) 1,49 (2+) 1,05 Pb (2+) 1,32 (4+) 0,84 Bi (3+)0,96 (5+) 0,74 Po (4+) 1,10 At Rn Fr
Примечание. В скобках даны величины и знак зарядов ионов.
между узлами решетки и, таким образом, характер структуры дан-
ного кристаллического вещества. Совершенно ясно, что атомные
(ионные) радиусы различных химических элементов имеют неоди-
наковую величину.
Существует две различные системы определения ионных радиу-
сов. Первая система дана на основании рентгено-структурных изме-
рений расстояний между атомами или ионами в кристаллических
решетках. Вычисленные радиусы по предложению В. М. Гольд-
шмидта названы эффективными (система Гольдшмидта).
Другая система основана на теоретических вычислениях ионных
радиусов исходя из квантовой механики. Впервые эти расчеты бы-
ли произведены Полингом, а затем Аренсом и Грином. Эта система
получила название системы Полинга — Аренса. Величины ионных
радиусов, определенные Гольдшмидтом, оказались очень близкими
к теоретическим расчетным радиусам Полинга. В табл. 2 приводят-
ся ионные радиусы по Гольдшмидту.
Величина атомного (ионного) радиуса зависит от ряда причин,
главными из которых являются:
32
ТАБЛ ИЦА 2
по В. М. Гольдшмидту
Be (2+)0,34
Mg (2+)0,78
Са (2+) 1,06 Sc (3+)0,83 Ti (44-) 0,64 V (54-) 0,40 Cr (6+) 0,35 Mn (2+)0,91 (6+) 0,52 Fe (2+) 0,83 (3+) 0,67 Co (2+) 0,82 Ni (2+) 0,78
Sr (2+) 1,27 Y (34-) 1,06 Zr (44-) 0,87 Nb (54-) 0,69 Mo (4+) 0,68 Tc Ru (44-) 0,65 Rh (34) 0,68
Ва (2+) 1,43 TR (34-) 1,22-0,99 Hf (4+) 0,86 Ta (5 + ) 0,69 w (4-4)0,68 (64-) 0,62 Re (44-) 0,68 Os (44-) 0,67 Ir (4+) 0,66
Ra (2+) 1,52 Ас (3+)1,11 Th (4+) МО Pa (4+) 1,06 U (4 + ) 1,05 (64-) 0,83
1) заряд иона; положительно заряженные катионы имеют обыч-
но меньший радиус сферы действия, а отрицательно заряженные
анионы — больший радиус, чем радиус сферы действия нейтрально-
го атома. Это объясняется тем, что положительно заряженный
ион несет меньшее количество электронов по сравнению с ато-
мом, а у отрицательно заряженного иона имеется избыток элек-
тронов;
2) поляризационная способность атома или иона (см. ниже «по-
ляризация»), т. е. способность атома или иона под влиянием внеш-
него электрического поля изменять свою конфигурацию, что, естест-
венно, сказывается на величине атомного или ионного радиуса.
Поскольку поляризационная способность зависит от типа связи и
интенсивно проявляется при ковалентной связи, то и величина ион-
ного (атомного) радиуса существенно зависит от степени ионности-
ковалентности связи;
3) термодинамические условия, в которых находится данное
кристаллическое вещество (температура, давление). Ионный ради-
ус тем больше, чем больше температура и чем меньше давление.
2—3628 33
В заключение приведем пример расчета эффективного радиуса
иона натрия для соединения NaF.
Рентгенометрически было найдено, что расстояние между цент-
рами ионов Na1+ и F1- в решетке фтористого натрия равно 2,31 А.
Это расстояние равно сумме радиусов ионов Na1+ и F1-. Так как ра-
диус иона F1- составляет 1,33 А, то простым вычитанием получается
радиус иона натрия:
2,31 — 1,33=0,98А.
Плотнейшие упаковки атомов и ионов. Для удобства изображе-
ния структур минералов можно все атомы или ионы представлять
в виде идеально образованных шаров разных размеров с радиусами,
равными их атомному или ионному радиусу. Тогда структуру мине-
рала можно представить себе в виде совокупности ряда шаров раз-
ного размера.
Одним из важнейших факторов устойчивости любой такой сис-
темы является плотность ее упаковки, т. е. насколько плотно эти
шары прилегают друг к другу.
В природе наблюдается четко выраженная тенденция к появле-
нию структур с наиболее плотной упаковкой (принцип плотнейших
упаковок), поскольку такие системы энергетически наиболее вы-
годны и, следовательно, устойчивы.
В атомных структурах все шары, представляющие собой одни
и те же атомы, имеют одинаковые размеры. В этом случае задача
создания структуры плотнейшей упаковки упрощается; для этого
необходимо все шары уложить таким образом, чтобы они плотно
прилегали друг к другу, т. е. чтобы каждый шар второго слоя поме-
щался в углубления между тремя шарами первого слоя. Что же ка-
сается укладки шаров третьего слоя, то здесь уже возможно два
варианта:
1) каждый шар третьего слоя может лежать на трех шарах вто-
рого слоя таким образом, что под шаром третьего слоя не окажется
шара первого слоя — этот вариант соответствует плотнейшей куби-
ческой упаковке (рис. 30);
* 2) каждый шар третьего слоя также укладывается на трех ша-
рах второго слоя, но под шаром третьего слоя будет располагаться
а) z-4- 4- “1" **“' LLJLJw ° , ° . ° . ° . + 4-4-4- ООО Рис. 30. Плотнейшая кубическая упаковка: а — общий вид; б — проекция центров шаров, лежа- щих в разных слоях, на горизонтальную плоскость; О — шара 1-го слоя; ч шара 2-го слоя; •—шара 3-го слоя 34 шар первого слоя — этот вариант соответ- ствует плотнейшей гек- сагональной упаковке (рис. 31). В указанных струк- турах кристаллизуются многие металлы. На- пример, плотнейшая кубическая упаковка характерна для само- родной меди, самород- ного серебра, золота
и др. По типу плотней-
шей гексагональной
упаковки построены ре-
шетки оомистого ири-
дия, цинка и др.
Следует обратить
особое внимание на
пустоты между ша-
рами.
Различают два рода
таких пустот: тетраэд-
рические и октаэдриче-
ские. Эти названия да-
ны в зависимости от
геометрической формы
пустот, обр азующихся
между шарами. Окта-
эдрические пустоты об-
разуются при участии
шести шаров упаковки,
а тетраэдрические —
четырех (рис. 32).
Различные типы
Рис. 31. Плотнейшая гексагональная упаковка:
а — общий вид; б — проекция центров шаров, лежащих
в разных слоях, на горизонтальную плоскость
ионных кристалличес-
КИХ структур могут Рис. 32. Тетраэдрические (а) и октаэдрические
быть изображены пу- пустоты
тем заполнения пустот,
образующихся плотнейшей упаковкой анионов (меньшими по
размерам шарами), соответствующими катионами. Так, напри-
мер, структуру хлористого натрия (минерал галит) можно пред-
ставить себе, размещая все ионы хлора в форме плотнейшей
кубической упаковки, а ионы натрия — в октаэдрических ее
пустотах.
Координационное число. Структура каждого кристаллического
вещества в большой степени зависит от количества ближайших
атомов (ионов), окружающих данный атом (ион), т. е. от коорди-
национного числа. В разобранных выше случаях для структур меди,
золота, магния, цинка (кубической и гексагональной плотнейшей
упаковки) каждый атом окружен другими двенадцатью атомами и
координационное число в этом случае, следовательно, равно 12. В
случае ионных решеток в структуре объединяются ионы различных
радиусов, поэтому координационное число (т. е. число атомов, груй-
пирующихся вокруг каждого катиона или число катионов, окружа-
ющих анион) будет зависеть от отношения радиуса катиона RK к
радиусу аниона /?а, т. ё. от величины RK: /?а.
Координационные числа обусловливают различное расположе-
ние анионов и катионов и, следовательно, позволяют предсказать
наиболее характерные особенности структур того или иного хими-
ческого соединения.
2*
35
ТАБЛИЦА 3
Координационное число Форма координационного полиэдра Отношение радиусов
2 Гантель От 0 до 0, 15
3 Треугольник От 0,15 до 0,22
4 Тетраэдр От 0,22 до 0,41
6 Октаэдр От 0,41 до 0,73
8 Куб От 0,73 до 1,37
12 Кубооктаэдр 1
Из табл. 3 и рис. 33 видно, что при различных координационных
числах расположение анионов вокруг катионов будет различным.
Если соединить центры тяжестей всех анионов, окружающих дан-
ный катион, то образуются определенные геометрические фигуры,
различные для каждого координационного числа. Эти геометриче-
ские фигуры получили название координационных полиэдров.
Если координационное число равно 2, что может быть при отно-
шении Як:Яа^0,15, то два аниона будут находиться на равном
расстоянии от катиона и образовывать фигуру в виде гантели.
При отношении радиусов Як • Яа = 0,1 54-0,22 координационное
число равно 3; в этом случае три аниона находятся на равном рас-
стоянии от катиона и при соединении их центров тяжести образует-
ся треугольник, в центре которого располагается катион. При коор-
динационном числе 4 (что может быть при Як • Яа = 0,224-0,41)
анионы располагаются по вершинам тетраэдра, а катион в его цент-
ре; в этом случае координационный полиэдр имеет форму тетраэд-
ра. При Як • К& = 0,414-0,73 координационное число равно 6, а коор-
динационный полиэдр представляет ^бой октаэдр. При отношении
Рис. 33. Различные способы расположения анионов
около центрального иона:
а — гантель; б — треугольник; в — тетраэдр; г —октаэдр;
д — куб; е — кубооктаэдр
Зв
Rk : Ra= 1 координационное число равно 12. В этом случае наиболь-
шее число анионов размещается вокруг катиона и координационная
фигура имеет форму кубооктаэдра.
В случае, когда отношение радиусов /?к: /?а близко к предель-
ным значениям (0,22; 0,41; 0,73), некоторые катионы могут нахо-
диться в различных координациях. Так, например, у алюминия
/?к • /?а = 0,40 и он может иметь координационное число 4 или 6, т. е.
находиться в одной группировке либо с Mg2+, Fe2+ (координацион-
ное число 6), либо с Si4+ (координационное число 4).
Для более ясного представления о координационном числе при-
ведем несколько примеров.
1. Определим координационное число натрия для структуры
галита — NaCl. Ионный радиус Na = 0,98 А, ионный радиус С1 =
= 1,81 А. Отношение /?к*^а = 0,54. Из табл. 3 находим, что для
такого отношения радиусов координационное число равно 6, т. е.
шесть анионов хлора окружают один катион натрия. Ионы распо-
лагаются по вершинам октаэдра.
2. Определим координационное число титана в структуре рути-
ла TiO2. В этом случае /?к :/?а = 0,64: 1,32 = 0,47, т. е. координаци-
онное число титана равно 6.
3. Определим координационное число кальция в структуре флю-
орита CaF2: /?к:/?а= 1,06: 1,33=0,79, т. е. координационное число
кальция равно 8, а координационный полиэдр имеет форму куба.
Итак, координационным числом называется число ближайших
атомов (или ионов противоположного знака), окружающих данный
атом (или ион), находящихся с ним в соприкосновении и обеспечи-
вающих устойчивость структуры. Координационное число зависит
в первую очередь от величины ионных радиусов катионов и анио-
нов. Если рассматривать только кислородные соединения, то коор-
динационное число, естественно, будет зависеть от размеров ион-
ных радиусов катионов.
Ниже приведены наиболее характерные координационные числа
для различных катионов *в кислородных соединениях.
Координационное Катионы
число
з.....................в3+,с4+, №+
4.....................Si4+, Ge4+, Ве2+, Р5+, S6+1, А13+
6.....................Mg2+, Fe2+, Zr2+, Ni2+, Al3+, Fe3+,
Ti3+,Ti4+, V5+ , Sn2+, Nb5+, Ta5+, Mn2+
8.....................Ca2+, Na1+, Ce3+, Y3+, U4+, Th4+
12....................K1+, Rb1+, Cs1+, Ba2+, Pb2+
Способы изображения структур минералов. Существует три спо-
соба изображения структур.
37
Рис. 34. Различные способы изображения структуры галенита, имеющей
координационный мотив
1. Способ изображения структур шарами. В этом
случае каждый ион изображается шаром определенного цвета, раз-
мер которого соответствует размеру иона. При плотнейшей упаковке
шары соприкасаются друг с другом. Различные структуры минера-
лов отличаются друг от друга по расположению этих шаров, изоб-
ражающих ионы. Такой способ изображения структур наиболее
реалистичен и удобен для изготовления моделей структур, на кото-
рых хорошо видно в пространстве взаимное расположение ионов
(рис. 34, а). В плоскости же (на бумаге) изображать такие струк-
туры крайне сложно и неудобно.
2. Способ изображения структур путем нанесе-
ния центров тяжести шаров. При таком изображении на
чертеж наносятся не сами шары; изображающие ионы, а только их
центры тяжестей, которые изображаются обычно маленькими круж-
ками разного цвета. Эти центры тяжестей шаров-ионов соединяются
друг с другом линиями (на пространственных моделях проволокой)
таким образом, что становятся видны координационные полиэдры
(рис. 34, б). Этот способ изображения структур наиболее распро-
странен и удобен.
3. Способ изображения структур координацион-
ными полиэдрами. Академик Н. В. Белов предложил изобра-
жать структуры минералов не шарами, представляющими ионы или
их центры тяжести, а готовыми координационными полиэдрами —
треугольниками, тетраэдрами, октаэдрами, кубами и т. д. Посколь-
ку, например, все силикаты состоят из кремнекислородных тетра-
эдров, соединенных друг с другом большей частью кислородными
октаэдрами, в центре которых располагаются катионы, то любой
силикат может быть изображен сочетаниями тетраэдров, по-разно-
му соединенных друг с другом, с которыми соизмеримы октаэдры
определенного размера (рис. 34, в). Такой способ изображения
весьма удобен для сложных структур.
Мотивы структур. Структура кристаллических веществ определя-
ется как формой самих координационных полиэдров (т. е. опреде-
ленными группировками катионов и анионов), так и характером их
взаимного сочетания. Различают следующие мотивы структур.
38
Рис. 35. Островной мотив структуры на примере струк-
туры кальцита, в котором изолированные треугольники
связаны ионами кальция
1. Координационный мотив структуры. В этом слу-
чае все координационные полиэдры (треугольники, тетраэдры, ок-
таэдры, кубы и др.) соединены друг с другом общими гранями и
ребрами. Примером структуры с координационным мотивом слу-
жит структура галенита (см. рис. 34).
2. Островной мотив структуры. Отдельные координа-
ционные полиэдры друг с другом не соприкасаются и соединены по-
средством общих катионов или анионов. Различают несколько ти-
пов островных мотивов структур:
а) отдельные изолированные координационные полиэдры (тре-
угольники, тетраэдры, октаэдры, кубы и др.) соединены друг с дру-
гом только катионами (рис. 35);
б) группы координационных полиэдров (например, сдвоенные
тетраэдры и октаэдры и др.) образуют как бы изолированные
«островки», соединенные катионами;
в) несколько (три, четыре, шесть) координационных полиэдров
соединены друг с другом в кольца (рис. 36), которые образуют изо-
лированные «островки», соединенные катионами. Такой мотив
структуры часто называют кольцевым. В целом же кольцевой мо-
тив структуры является разновидностью островного.
3. Цепочечный и ленточный мотивы структуры.
В этом случае координационные полиэдры соединены друг с другом
в бесконечные, вытянутые в одном направлении цепочки или сдво-
енные цепочки — ленты (рис. 37).
4. Слоистый мотив структуры. Координационные поли-
эдры соединены друг с другом в бесконечные в двух измерениях
слои. В пределах слоя или листа отдельные полиэдры сближены
друг с другом (рис. 38). В то же время отдельные слои или листы
располагаются на значительном расстоянии друг от друга.
39
Рис. 36. Кольцевой мотив структуры на при-
мере структуры турмалина; координацион-
ные полиэдры соединены катионами магния
5. Каркасный мо-
тив структуры. В
данном случае все коор-
динационные фигуры сое-
динены друг с другом
только одними вершина-
ми в бесконечные в трех
измерениях каркасы (рис.
39). В этой структуре ко-
ординационные полиэдры
имеют общие вершины, но
нигде не соприкасаются
ребрами или гранями.
Особенностью каркасной
структуры является нали-
чие между отдельными
соединенными вершинами
полиэдров больших пус-
тот.
Зависимость физичес-
ких свойств минералов от
их мотива структур. Мо-
тив структуры кристалли-
ческих построек опреде-
ляет многие физические
их свойства. Так, мине-
ралы с координационным
или островным мотивом
структуры обычно изо-
метрические (галит, сфа-
лерит, галенит, алмаз
и др.), с цепочечным — сильно вытянутые в одном направлении,
игольчатые или столбчатые (актинолит — лучистый камень, анти-
монит и др.), со слоистым — чешуйчатые, пластинчатые, листова-
тые, слюдоподобные (графит, молибденит, тальк, слюды). Мине-
ралы слоистой структуры всегда имеют весьма совершенную спай-
ность в одном направлении, очень мягкие. Минералы с кольцевой
и особенно каркасной структурой отличаются наличием значитель-
ного количества пустот, куда легко могут входить молекулы воды
и других соединений, и т. д.
Таким образом, физические свойства кристаллических веществ
определяются, в основном, составом самих атомов или ионов, вхо-
дящих в кристаллические постройки (удельный вес, цвет), типом
связи (электропроводность, теплопроводность, твердость, ковкость,
растворимость, летучесть) и мотивом структуры (габитус кристал-
лов, твердость, сингония и др.).
Изоморфизм. Сплавы металлов представляют собой кристалли-
ческие структуры переменного состава, в которых атомы одного
элемента располагаются в промежутках кристаллической решетки
40
б)
Рис. 37. Цепочечный мотив структуры. Кремнекис-
лородные тетраэдры образуют одинарную цепоч-
ку (а) или сдвоенные цепочки-ленты (б)
другого. Это так называемые твердые растворы второго рода. В
природе они встречаются реже и представлены главным образом
интерметаллическими соединениями.
В отличие от твердых растворов второго рода в твердых раство-
рах первого рода атомы или ионы одного кристаллического вещест-
ва могут замещаться атомами или ионами другого. Последние рас-
полагаются в узлах кристаллической решетки. Подобного рода
растворы называются изоморфными смесями. Такие смеси широко
распространены в природных условиях и определяют вариации со-
става многих минералов.
Большое внимание изучению изоморфизма уделяется в послед-
нее время, поскольку сейчас приобретают практическое значение
элементы, которые большей частью не образуют своих собственных
минералов, а встречаются в виде изоморфных примесей в рассеян-
ном состоянии в других минералах (один ведущий элемент в не-
большой степени изоморфно замещается другим второстепенным,
Рис. 38. Слоистый мотив структуры — лист кремнекислородных тетраэдров
41
SI О О
рассеянным элементом). К таким эле-
ментам, находящимся в природе обыч-
но в рассеянном состоянии, относятся
рубидий, индий, кадмий, галлий, гаф-
ний, рений, германий, таллий и др.
Знать, в какой форме они входят в со-
став минералов, из которых они будут
извлекаться, в каких типах месторож-
дений они концентрируются, чрезвы-
чайно важно для их извлечения.
Итак, способность элементов (ато-
мов или ионов) замещать друг друга
Рис. 39. Каркасный мотив в кристаллических решетках, не нару-
структуры на примере струк- шая их строения, называется изомор-
туры кварца физмом.
Прежде чем перейти к изложению
условий, при которых возможны явления изоморфизма, необходи-
мо остановиться на понятиях об энергии кристаллической решетки
и поляризации.
Энергия кристаллической решетки. Под энергией кристалличе-
ской решетки понимают количество энергии, которое выделяется
при соединении катионов и анионов, находящихся в изолированном
состоянии, в твердую кристаллическую решетку. Эту энергию мож-
но также определить как работу, которую необходимо затратить,
чтобы разорвать грамм-молекулу вещества на составляющие его
ионы.
Поляризация. Под влиянием электрического поля, создаваемого
соседним ионом, в кристаллической решетке происходит деформа-
ция шарообразной формы ионов, т. е. изменение их точных радиу-
сов. Это явление называется поляризацией.
Как пример поляризации, рассмотрим соединение КВг. Здесь
положительно заряженный большой ион калия притягивает к себе
электронную оболочку брома, а отрицательный ион брома, в свою
очередь, несколько изменяет (деформирует) оболочку калия. В ре-
зультате такого взаимодействия изменяются и связи между К и Вг.
Если у NaCl они ионные, то у КВг они уже ионно-ковалентные.
На поляризацию влияют следующие факторы:
1) размеры ионов. Естественно, что с увеличением размера иона
увеличивается расстояние электронных оболочек иона от его ядра.
Следовательно, чем больше ион. тем слабее электронные оболочки
связаны с ядром, в связи с чем он будет легко поляризоваться (де-
формироваться). Ионы же маленького размера будут труднее по-
ляризоваться;
2) валентность иона. Чем больше зарядов несет ион, тем больше
его валентность, тем труднее он поляризуется. В то же время из-
вестно, что при повышении валентности элемента размер его иона
уменьшается. Следовательно, чем больше валентность иона, тем
труднее он поляризуется, но зато сам хорошо поляризует.
Явление поляризации оказывает значительное влияние на все
42
кристаллохимические и физико-химические свойства вещества. В
результате поляризации в соединениях усиливается ковалентность
связи, в некоторых случаях изменяется координационное число,
уменьшается растворимость, стеклянный блеск сменяется алмаз-
ным и т. п.
Условия, необходимые для проявления изоморфизма. Для про-
явления изоморфизма необходимо соблюдение ряда условий:
1) замещаться могут только ионы одного знака, т. е. катион на
катион, а анион на анион;
2) замещаться могут только атомы или ионы близкого размера,
т. е. разница величины ионных радиусов иона замещаемого и заме-
щающего не должна превышать, согласно В. М. Гольдшмидту, при
совершенном изоморфизме 15 и несовершенном 25%. Если же вели-
чина [(Т?2—7?1):7?1]’100>40% (где Ri — меньший ионный радиус),
изоморфизм вообще невозможен. При совершенном изоморфизме
один ион может в любых соотношениях замещаться другим ионом
(например, ион Fe2+ на Mg2+,npn несовершенном изоморфизме та-
кое замещение возможно только в строго ограниченных пределах
(например, замещение Са2+ на Mg2+);
3) замещаться могут только ионы, близкие по степени поляриза-
ции (т. е. по степени ионности-ковалентности связи);
4) замещаться могут только элементы, имеющие одинаковое
координационное число в данной кристаллической структуре;
5) изоморфные замещения должны происходить таким образом,
чтобы не нарушался электростатический баланс кристаллической
решетки;
6) изоморфные замещения. протекают в сторону приращения
энергии кристаллической решетки.
Из всего изложенного ясно, что степень изоморфизма у каждых
пар элементов, близких по своим геохимическим свойствам, разная.
Кроме того, изоморфизм зависит и от структуры кристаллической
решетки. Так, например, калий может замещаться цезием в широ-
ких пределах в слюдах, но в калиевых полевых шпатах такое заме-
щение возможно только в весьма ограниченных пределах. Таким
образом, следует учитывать, что каждый ион в кристаллической
решетке имеет определенную изоморфную емкость, которая опреде-
ляет предел изоморфной замещаемости его другим ионом.
Для того что.бы показать, что несколько ионов изоморфно заме-
щают друг друга, их ставят в круглые скобки, разделяя друг друга
запятыми, при этом на первом месте ставят основной ион, а далее
располагают ионы в последовательности уменьшения их содержа-
ния. Так, например, формула (Са, Мп, Fe, Sr)CO3 показывает, что
кальций в карбонате изоморфно замещается Мп, Fe и Sr, при этом в
нем Mn>Fe>Sr.
Типы изоморфизма. Различают 4 типа изоморфных замещений:
1) изовалентный;
2) гетеровалентный;
3) изоструктурный;
4) изоморфизм особого рода.
43
1. И з ов а л е нтн ы й изоморфизм характеризуется тем, что
в этом случае происходит замещение ионов одинаковой валентно-
сти, причем разница в размерах ионных радиусов не должна быть
более 15% (при соблюдении всех остальных перечисленных выше
условий изоморфизма).
Так, например, если рассматривать все одновалентные ионы:
Li1+ Cu1+ Na1+ Ag1+ K1+ Au1+ Tl1+ Rb1+ Cs1+
0,78 0,96 0,98 1,13 1,33 1,37 1,49 1,49 1,65 A,
то обращает на себя внимание, что у натрия и меди радиусы-ионы
весьма близки по размерам и отношение
'г--'?с“.100_°'98 - 0-96.100
*Си 0,96
составляет всего 2% (что значительно меньше допустимых 15%).
Следовательно, натрий и медь должны были бы быть изоморфны-
ми. Тем не менее, благодаря различным поляризационным свой-
ствам, изоморфизм между ними невозможен. По этой же причине
неизоморфны, например, калий и золото, но в то же время совер-
шенным изоморфизмом отличаются рубидий и одновалентный тал-
лий. Из приведенных данных следует, что изоморфизм между лити-
ем и натрием крайне ограничен, а между калием и рубидием совер-
шенен. Точно так. же, рассматривая размеры двухвалентных ионов,
можно прийти к выводу:
Ве2+ Mg2+ Fe2+ Zn2+ Ni2+ Co2+ Mn2+ Ca2+ Sr2+ Ba2+ □
0,34 0,78 0,83 0,83 0,78 0,82 0,91 1,05 1,27 1,43
что магний изоморфен с железом, никелем, кобальтом, в несколько
меньшей степени с марганцем и в незначительной степени с каль-
цием. Из приведенного выше ряда видно, например, что бериллий
не может быть изоморфен ни с одним двухвалентным катионом, а
барий изоморфен фактически только с одним стронцием.
2. Гетеровалентный изоморфизм. При гетеровалент-
ном изоморфизме происходит замещение ионов различной валент-
ности. При таком замещении один ион не может замещаться дру-
гим без того, чтобы не нарушился электростатический баланс
кристаллической решетки, поэтому при гетеровалентном изомор-
физме замещается не ион на ион, как при изовалентном, а группа
ионов определенной валентности на другую группу ионов при со-
хранении той же суммарной валентности.
Необходимо в этом случае всегда помнить, что замещение иона
одной валентности на ион другой всегда связано с компенсацией
валентности. Эта компенсация может происходить как в катионной,
так и в анионной части соединений. При этом необходимо соблю-
дение следующих условий:
44
а) сумма валентностей замещаемых ионов должна быть равна
сумме валентностей замещающих ионов;
б) сумма ионных радиусов замещаемых ионов должна быть
близка к сумме ионных радиусов замещающих ионов и может от-
личаться от нее не более чем на 15% (для совершенного изомор-
физма).
Поскольку ионные радиусы катионов увеличиваются по мере
продвижения сверху вниз в вертикальных группах таблицы
Д. И. Менделеева и уменьшаются по мере продвижения слева на-
право в горизонтальных рядах, то ионы с близкими размерами рас-
полагаются по диагоналям. В этом и состоит так называемое «пра-
вило диагоналей», сформулированное А. Е. Ферсманом. Согласно
этому правилу, при гетеровалентном изоморфизме элементы, спо-
собные замещать друг друга, располагаются в диагональных рядах
периодической системы. Выделяются следующие диагональные
ряды:
I. Li — Mg — Sc — Zr
II. Na — Ca — Y
III. К — Sr — TR - Th
IV. Ti — Nb — W
Однако, вследствие явления «лантанидного сжатия» * наблюда-
ются некоторые отклонения от правила диагоналей. Так, кальций
изоморфен не только с иттрием, но и со всеми элементами редко-
земельной группы. Точно так же титан изоморфен не только с нио-
бием, но и с танталом, и т. д.
Разберем явления гетеровалентного замещения, например в ми-
нерале перовските — CaTiO3. В этом минерале Са2+ может заме-
щаться на Се3+ по схеме:
(l)2Ca2+-«-Ce3++Na1+, в таком случае формула перовскита бу-
дет иметь вид: (Са, Се, Na)TiO3. Такая разновидность перовскита
называется кнопитом.
Замещение Са2+ натрием может происходить и по схеме:
(2) Ca2++Ti4+-^Na1+Nb5+, т. е. в этом.случае компенсация ва-
лентностей осуществляется за счет замещения титана ниобием.
Формула перовскита может быть тогда изображена в виде (Са,
Na) (Ti, Nb)O3. Эта разновидность называется дизаналитом.
* В вертикальных группах периодической таблицы Д. И. Менделеева по мере
возрастания порядкового номера закономерно увеличиваются ионные радиусы
элементов. Однако в III, IV и V группах эта закономерность нарушается у эле-
ментов с большими порядковыми номерами, что объясняется специфическим
строением их атомов. У этих элементов (например, в группе редких земель —
лантанидов) по мере увеличения порядкового номера происходит не увеличение
количества элементов на внешней электронной оболочке, а достройка внутренних
оболочек (с 18 электронов до 32). В этой связи размер их ионных радиусов не
увеличивается, а остается по мере увеличения порядкового номера постоянным
(например, у Nb5+ и Та5+) или даже несколько уменьшается (в группе лантани-
дов, у La5+ ионный радиус 1,22А, у последнего элемента группы лантанидов —
лютеция Lu3+ — 0,99А). Это явление получило в геохимии название лантанид-
ного сжатия. Вследствие лантанидного сжатия все элементы группы редких
земель весьма близки по своим химическим свойствам, так же, как весьма близки
Zr4+ и Hf4+ или Nb5+ и Та5+.
45
Наконец, если весь Са2+ заместится на Na1+, то образуется ми-
нерал, сохраняющий структуру перовскита, но имеющий уже состав
NaNbO3 (луешит). Обычно же Са2+ замещается Na1+ по схеме (2)
и TR по схеме (1), в результате чего возникает разновидность пе-
ровскита, называемая лопаритом, состав которого может быть изо-
бражен в виде (Са, TR, Na, Th) (Ti, Nb, Ta)O3.
При компенсации валентностей могут замещаться не только ка-
тионы, но и комплексные анионные радикалы, если их ионный ра-
диус близок. Так, группа [SiO4]4~ может легко замещаться (РО4]3~,
[ВеО4]6- и даже [SO4]2~.
В табл. 4 приводятся наиболее типичные гетеровалентные заме-
щения.
ТАБЛИЦА 4
Замещаемая группа Замещающая группа Примеры минералов
Са2+А1з+ Nai + Si4+ Плагиоклазы, скаполиты
Са2-*Са2 + Nai+TR3+ Апатит, перовскит
Са2 *-Ti4+ Nai+Nb5+ Перовскит, лопарит, сфен
Ca2'Mg2+ Nai+A13+ Актинолит
Mg2 <-Mg2 + Lii+A13+ Биотит, лепидолит, роговая обманка
Mg2 * Si« A13+A13+ Авгит, роговая обманка
3. Изоструктурный изоморфизм. При этом изомор-
физме происходит замещение не одного иона на другой или группы
ионов на другую группу, а замещение целого «блока» одной крис-
таллической решетки на другой такой же «блок». Это может про-
исходить только в том случае, если структуры минералов однотип-
ны и имеют близкие размеры элементарных ячеек. Так, например,
в минерале виллемите Zn2 [SiO4] постоянно обнаруживается берил-
лий, но ионный радиусу цинка 0,78 А, а у бериллия 0,34 А; формаль-
но цинк и бериллий неизоморфны, но оказывается минерал вилле-
мит Zn2[SiO4] изоструктурен с фенакитом Be2[SiO4]. Вследствие
этой изоструктурности в кристаллической решетке виллемита про-
исходит замещение Zn2[SiO4] на Be2[SiO4].
4. Изоморфизм «особого рода». В некоторых минера-
лах при гетеровалентном изоморфизме компенсация валентностей
происходит за счет высвобождения из кристаллической решетки
отдельных ионов и образования в узлах ее вакантных мест — де-
фектов. Так, например, при замещении в пирохлоре Ca2Nb2O7 Са2^
на Се3+ или U4+ компенсация валентностей может осуществляться
за счет уменьшения числа катионов кальция с образованием в
структуре минерала вакантных положений, не заполненных катио-
нами. В этом случае формула пирохлора будет иметь вид: (Са,
Се)2_хКЬ2О7. Подобные изоморфные замещения, приводящие к воз-
никновению в кристаллических решетках катионных или анионных
вакансий, получили название «изоморфизма с вычитанием». Более
редкий случай, когда компенсация валентностей происходит за
46
счет появления дополнительных анионов, располагающихся в меж-
дуузлиях кристаллической решетки. Известно, например, что мно-
гие флюориты содержат редкие земли, компенсация валентностей
при замещении Са2+—Се3+ осуществляется в этом случае за счет
появления в структуре минерала избыточного количества фтора по
сравнению со стехиометрической формулой флюорита CaF2. Такой
церийсодержащий флюорит будет иметь состав: (Са, Ce)F2+x. За-
мещения подобного типа в литературе называют «изоморфизмом
с прибавлением». Оба разобранных случая «изоморфизма с при-
бавлением» и «изоморфизма с вычитанием» объединяют под назва-
нием изоморфизма «особого рода».
Для примера изоморфных замещений приведем схемы, состав-
ленные А. И. Гинзбургом для ряда элементов.
Sr
Os'
----- ИзоЯалентные замещения
-----Гетеройалентные замещения
Как следует из данной схемы, одновалентный калий легко изо-
морфно замещается одновалентным рубидием. Вследствие этого
обстоятельства рубидий в присутствии калия всегда будет рассеи-
ваться, поскольку концентрация калия в сотни раз превосходит
концентрацию рубидия. Подобного рода рассеяние А. Е. Ферсман
предложил называть эндокриптией. Поскольку цезий легко изо-
морфно замещает рубидий, то он в какой-то степени будет замещать
и калий, но в калиевых минералах рубидия почти всегда бывает
больше цезия. Геохимическим аналогом рубидия является одно-
валентный таллий, который также будет легко входить в состав
калиевых минералов.
Калий в незначительном количестве способен замещаться и нат-
рием, изоморфизм калий — натрий проявляется четко при высоких
температурах, с понижением же температур происходит распад изо-
морфных смесей. В калиевых минералах могут быть также незна-
чительные примеси РЬ2+, Ва2+ и Sr2+, при этом всегда Ba2+>Sr2+.
Однако эти гетеровалентные замещения всегда требуют компен-
сации валентностей или приводят к возникновению дефектных
структур.
47
Кальций по линии изовалентного изоморфизма легко замещает-
ся стронцием, а стронций, в свою очередь, барием. В связи с этим
в кальциевых минералах в небольших количествах может присутст-
вовать и барий. Изоморфизм кальция с марганцем и двухвалентным
железом несовершенен. По линии гетеровалентного изоморфизма
кальций легко замещается натрием, редкими землями как церие-
вой, так и иттриевой группы.
В связи с тем, что редкие земли, в свою очередь, легко могут
замещаться ураном и торием, то в кальциевых минералах, обога-
щенных редкими землями, почти всегда содержатся радиоактивные
элементы — уран и торий.
Фтор играет в минералах роль кислорода и во многих минера-
лах его замещает. В то же время он легко замещается другими
одновалентными анионами — гидроксилом и хлором.
48
Цинк вследствие близости размера своего иона к двухвалент-
ному железу играет роль железа и входит в состав многих желе-
зистых минералов, а также сам может во всех своих соединениях
замещаться Fe2+. Поскольку двухвалентное железо в свою очередь
легко замещается Мп2+, то цинк может в какой-то степени заме-
щаться и марганцем.
К цинку же близок двухвалентный германий, поэтому в восста-
новительной среде образуются иногда германийсодержащие сфале-
риты. Кадмий весьма часто входит в состав сфалеритов, что объяс-
няется его близостью к цинку. При значительном содержании его
образуется разновидность сфалерита — пшибрамит.
Вопрос об изоморфизме цинка и меди сложный, поскольку при
высоких температурах они, по-видимому, замещают друг друга в
широких пределах, а при понижении температуры происходит рас-
пад твердых растворов и образование мельчайших эмульсионных
включений халькопирита в сфалерите.
Следует также указать на тесную связь цинка с индием и гал-
лием; эти рассеянные элементы всегда входят в- состав ефале-
ритов.
Аналогичным же образом можно разобрать и изоморфные за-
мещения для всех других элементов.
Полиморфизм в буквальном смысле слова означает многофор-
менность, т. е. явление, когда одинаковые по химическому составу
вещества кристаллизуются в различных структурах и образуют
кристаллы различных сингоний. Например, алмаз и графит имеют
одинаковый химический состав, но различные структуры, оба ми-
нерала резко отличаются по своим физическим свойствам. Другим
примером может служить кальцит и арагонит — они имеют одина-
ковый состав — СаСОз, но представляют собой различные поли-
морфные модификации.
Явления полиморфизма связаны с условиями образования кри-
сталлических веществ и обусловлены тем, что в различных термо-
динамических условиях устойчивыми являются только определен-
ные структуры. Так, металлическое олово (так называемое белое
олово, рис. 40, а) при понижении температуры ниже —18° С стано-
вится неустойчивым и рассыпается в порошок, образуя «серое оло-
во» уже иной кристаллической структуры * (рис. 40, б).
Различные полиморфные модификации SiO2 (кварц, тридимит,
кристобалит) применяются в разных областях промышленности,
например, в стекольной, фарфоровой и др. В настоящее время из-
вестны следующие полиморфные модификации SiO2:
1) а-кварц — гексагональной сингонии; существует только при
температурах свыше 575°С (высокотемпературный кварц);
2) р-кварц — тригональной сингонии; образуется при темпера-
туре ниже 575°С (низкотемпературный кварц);
* Разрушение оловянных изделий во время сильных морозов носит название
«оловянной чумы».
49
Рис. 40. Структура белого (а) и серого (б) олова
3) тридимит — возникает при нагревании а-кварца до темпера-
туры 870° С, при которой гексагональный кварц переходит в три-
димит;
4) кристобалит — в него переходит тридимит при нагревании
свыше 1470° С, но свыше 1710° С кристаллическая решетка кристо-
балита разрушается и он переходит в аморфное стекло;
5) коэсит — моноклинной сингонии; образуется при температуре
порядка 400—500° С, но при давлении 35000—75 000 ат отличается
высокой плотностью упаковки и соответственно большим удель-
ным весом.
ГЛАВА 6
ОСНОВНЫЕ ПОНЯТИЯ
ИЗ ФИЗИЧЕСКОЙ КРИСТАЛЛОГРАФИИ
Физическая кристаллография изучает зависимость между фи-
зическими свойствами кристаллов и их внутренним строением.
Изучение физики кристаллов имеет большое практическое и на-
учное значение и в настоящее время этот раздел кристаллографии
выделился в самостоятельную науку — физику твердого тела.
Тепловой эффект рубина, оптические свойства кальцита и флюо-
рита, пьезоэлектрический эффект турмалина и кварца, а также
различные свойства металлических сплавов находят широкое при-
менение в радиотехнике, медицине, в оборонной промышленности,
в металлургии и во многих других отраслях народного хозяйства.
В настоящем пособии кратко рассматриваются некоторые физи-
ческие свойства кристаллов.
Спайность — способность кристаллов раскалываться по опреде-
ленным параллельным плоскостям, соответствующим плоским сет-
кам кристаллов. Они всегда параллельны действительным или воз-
можным граням кристалла.
Спайность различается по направлению и степени совершенства.
Если спайность наблюдается в одном направлении, то говорят о
пинакоидальном характере спайности, в двух направлениях — по
призме, в трех — по кубу и т. д. Спайность и степень ее совершенст-
ва определяются особенностями внутреннего строения кристаллов.
50
Рассмотрим плоскую сетку (рис. 41), где по
направлению АВ узлы располагаются чаще,
чем по АС. Силы сцепления между частицами
в горизонтальных рядах (по АВ) значительно
больше, чем в вертикальных (по АС). Ясно,
что сетка, показанная на рисунке, будет легче
разрываться по линии 1—1, чем по линии 2—2.
Следовательно, спайность в кристаллах будет
наблюдаться в направлениях, параллельных
плоскостям с наибольшей ретикулярной плот-
ностью, т. е. спайность будет проходить парал-
лельно сеткам, наиболее слабо связанным
между собой.
Спайность является важным диагностиче-
ским признаком для определения минералов.
Так, например, совершенная спайность в двух
направлениях под углом 56° наблюдается у
роговых обманок, а угол между плоскостями
трещин спайности 87° характерен для пирок-
Рис. 41. Плоская сет-
ка с различной плот-
ностью узлов по на-
правлениям АВ и АС.
Спайность по линии
1—1 более совершен-
ная, чем по линии
2—2
сенов и т. д.
Твердость кристаллов. Твердостью называется степень сопро-
тивления вещества какому-либо внешнему механическому воздей-
ствию. Твердость, как и спайность, является важным диагностиче-
ским признаком при определении минералов.
Для определения твердости минералов применяют обычно ме-
тод царапания, который заключается в том, что более твердый ми-
нерал царапает более мягкий, т. е. оставляет на нем след — цара-
пину. При этом методе пользуются так называмой шкалой Мооса,
в которую (входят 10 минералов, принятых за эталоны твердости:
1) тальк; 2) гипс; 3) кальцит; 4) флюорит; 5) апатит; 6) ортоклаз;
7) кварц; 8) топаз; 9) корунд; 10) алмаз.
Бели какой-нибудь минерал царапается ортоклазом, а сам остав-
ляет царапину на апатите, то его твердость заключается между 5
и 6. Существует так называемая бытовая шкала Мооса, где за эта-
лоны твердости принимаются следующие предметы:
1. Карандаш мягкий..................твердость 1
2. Ноготь................................. » 2
3. Медная монета.......................... » 3
4. Простое (оконное) стекло............... » 5
5. Лезвие стального ножа.................. » 6
6. Напильник.............................. » 7
Твердость относится к тем свойствам, в отношении которых
кристаллы обнаруживают анизотропию (за исключением кристал-
лов кубической сингонии). Весьма резкая анизотропия твердости
наблюдается у кристаллов кианита (дистена): вдоль призматиче-
ской грани твердость равна 4,5, а в поперечном направлении — 6.
Твердость, как и многие физические свойства кристаллов, зави-
сит от их внутреннего строения и особенностей составляющих их
химических элементов, а именно: а) чем меньше межплоскостные
51
расстояния, тем больше твердость; б) для различных кристаллов
с одинаковым типом структуры (табл. 5) твердость возрастает с
повышением валентности катионов; в) твердость возрастает с
увеличением координационного числа катионов; г) чем меньше ион-
ный радиус химических элементов, тем выше твердость.
ТАБЛИЦА 5
Химический состав NaF MgO ScN TiC
Валентность 1 2 3 4
Твердость . . . 3,2 6,5 7,8 8,9
Способность к пластическим деформациям. Под пластической
деформацией кристалла понимается изменение его формы под дей-
ствием механических сил, приложенных извне. Различаются пласти-
ческие деформации скольжения и сдвига с образованием двойников.
Скольжение заключается в параллельном перемещении слоев
кристаллического вещества вдоль плоскости, которая должна быть
параллельна одной из плоских сеток пространственной решетки.
Скольжение происходит без разрывов кристалла и характеризуется
тем, что частицы кристалла сохраняют свою параллельную ориен-
тировку. То направление, по которому происходит скольжение, на-
зывается направлением скольжения. Обычно эти направления па-
раллельны рядам пространственной решетки, в которых элемен-
тарные частицы наиболее прочно связаны между собой.
Деформации скольжения широко распространены среди метал-
лов, чем объясняется их ковкость, т. е. способность принимать лю-
бую форму под влиянием внешнего воздействия. На ковкость метал-
лов влияют температура и примеси: повышение температуры увели-
чивает ковкость, а увеличение количества примесей уменьшают ее.
При деформации сдвига с образованием двойников также про-
исходит перемещение слоев вдоль плоскости двойникования, но в
этом случае частицы кристалла меняют свою ориентировку.
Образование двойников при деформации сдвига характерно для
некоторых кристаллов, в частности, для кальцита.
Пьезоэлектрические свойства. Под пьезоэлектрическим эффек-
том (пьезоэлектричеством) понимается появление электрических
зарядов на поверхности кристалла при его деформации (сжатии).
Впервые это явление было изучено П. Кюри в 1880 г. на кристаллах
кварца, турмалина, сахара. Необходимым условием существования
пьезоэлектричества является отсутствие центра симметрии в кри-
сталлах-диэлектриках, т. е. наличие в них геометрических полярных
направлений.
Полярными направлениями называются такие направления в
кристалле, концы которых не связаны элементами симметрии. Для
турмалина полярным направлением является тройная ось симмет-
рии, у кварца это двойная ось.
52
Явление пьезоэлектричества — явление обратимое, а именно,
если кварцевую пластинку поместить в электрическое поле, то она
начнет испытывать механические деформации. Эти свойства кварца
и турмалина используются в радиотехнике, электро- и ультрааку-
стике, пьезометрии и др.
Пироэлектрические свойства. Под пироэлектричеством подразу-
мевается электричество, возникающее в кристаллах в связи с ко-
лебаниями температуры. Пироэлектричество возникает в кристал-
лах по определенным направлениям, которые являются одновре-
менно полярными и единичными. Естественно, что полярные
направления могут быть в кристаллах, у которых отсутствует
центр инверсии.
Явление пироэлектричества наблюдается только у диэлектриков.
Наиболее ярко эти пироэлектрические свойства проявлены в кри-
сталлах турмалина, у которых полярным направлением является
тройная ось симметрии. Благодаря пироэлектрическим свойствам
пластинки турмалина могут использоваться как датчики для реги-
страции температуры.
Теплопроводность кристаллов характеризуется коэффициентом
теплопроводности, т. е. количеством тепла, прошедшим в единицу
времени через единицу поверхности кристалла при разности темпе-
ратур в один градус. Было установлено, что коэффициенты тепло-
проводности по разным направлениям в одних и тех же кристаллах
неодинаковы. Следовательно, коэффициент теплопроводности зави-
сит от химического состава кристалла, а также и от его сингонии.
Например, коэффициент теплопроводности для кристаллов кубиче-
ской сингонии будет постоянным для всех направлений в кристалле,
а для кристаллов средних и низших сингоний коэффициент тепло-
проводности будет меняться в зависимости от направлений в кри-
сталлах.
В природе известны минералы, характеризующиеся высоким
коэффициентом теплопроводности, например самородная медь, се-
ребро и др. Наиболее низкой теплопроводностью отличаются вер-
микулит и асбест.
Оптические свойства кристаллов и изучение их под микроскопом.
К основным оптическим свойствам кристаллов относятся показате-
ли преломления, двойное лучепреломление, поляризация, интерфе-
ренция света и др.
Свет представляет собой сложные электромагнитные колебания.
Различают обыкновенный свет, у которого колебания световой вол-
ны происходят перпендикулярно к световой нормали во всех воз-
Рис. 42. Колебания обыкновенного света
53
Рис. 43. Колебания плоскополяризованного света:
ABCD — плоскость поляризации
можных направлениях (рис. 42), и плоскополяризованный свет,
световые колебания которого совершаются только в одной плоско-
сти, называемой плоскостью поляризации (рис. 43).
В изотропной среде свет распространяется волнами, имеющими
шаровую поверхность. Направление распространения волны опре-
деляется направлением нормали к касательной, проведенной к ша-
ру. В изотропной среде нормаль к касательной совпадает с направ-
лением радиуса (луча), проведенного к точке касания; в оптически
анизотропной среде такого совпадения не будет.
Световым лучом принято называть направление распростране-
ния световой энергии.
В оптически анизотропной среде поверхность распространения
световых волн представляет сложную фигуру (эллипсоид, а не
шар), следовательно, для оптически анизотропных сред направле-
ния распространения волн в большинстве случаев не совпадут с на-
правлением лучей. В геометрической оптике при построениях поль-
зуются нормалями, а не световыми лучами.
Показатель преломления. Показателем преломления
какой-либо среды (минерала) называется отношение скорости све-
та в безвоздушном пространстве к скорости света в данной среде:
Vi
п, = — ,
где Vi — скорость света в безвоздушном пространстве;
иг—скорость света в данной среде.
При определении показателя преломления для кристаллов ку-
бической сингонии и некристаллических сред показатель преломле-
ния сохраняется постоянный во всех направлениях. Такие вещества
называются оптически изотропными. Кристаллы средних сингоний
(гексагональной, тригональной и тетрагональной) характеризуются
двумя величинами показателей преломления и отличаются двойным
лучепреломлением.
Явление двойного лучепреломления заключается в том, что
естественный свет, входя в кристалл, распадается на две световые
волны, распространяющиеся с различными скоростями. Обе волны
поляризуются и имеют взаимно перпендикулярные плоскости коле-
баний. Разность наибольшего и наименьшего показателей прелом-
54
ления называется силой двойного лучепреломления. Кристаллы, у
которых фиксируется двойное лучепреломление, называются опти-
чески анизотропными.
Было установлено, что в кристаллах средних сингоний .одна вол-
на распространяется с одинаковой скоростью во всех направлениях.
Следовательно, ей соответствует постоянный показатель преломле-
ния, который обозначается п0 (обыкновенный показатель прелом-
ления).
Волне, меняющей свою скорость в зависимости от направления,
соответствует переменный показатель преломления, который обоз-
начается пе (необыкновенный показатель преломления). Направле-
ние в кристалле, где не наблюдается двойного лучепреломления,
называется оптической осью.
Кристаллы средних сингоний имеют одно направление, в кото-
ром не происходит двойного лучепреломления, поэтому они называ-
ются оптически одноосными.
Принято считать, что если величина ие больше величины п0, то
кристалл оптически положителен, и, наоборот, если п0 больше пе, то
кристалл оптически отрицателен.
Кристаллы низших сингоний (ромбической, моноклинной и три-
клинной) характеризуются тремя величинами показателей прелом-
ления (rig — наибольший, пт — средний, пр — наименьший) и двумя
направлениями, по которым не происходит двойного лучепреломле-
ния, т. е. двумя оптическими осями, в связи с чем они называются
оптически двуосными.
Принято считать двуосный кристалл положительным, если
ng—пт>пт—nPi и отрицательным, если пт—np^rig—пт.
Понятие об оптической индикатрисе. Оптической
индикатрисой называется поверхность, построенная на величинах
показателей преломления, отложенных в направлениях колебания
световой волны. Направления же колебаний световой волны (коле-
бания электрического вектора) происходят в перпендикулярном на-
правлении к распространению той же волны.
Если откладывать в кристалле кубической сингонии в направле-
ние. 44. Индикатрисы одноосных кристаллов:
а — положительного; б — отрицательного
NfN,
55
Рис. 45. Оптическая индикатриса
двуосного кристалла
Рис. 46. Схематический разрез инди-
катрис двуосных кристаллов:
а — положительного; б — отрицательного
нии колебания волны отрезки, пропорциональные показателям пре*
ломления, то получится поверхность, имеющая форму шара.
Для кристаллов средних сингоний построенная индикатриса бу-
дет иметь форму эллипсоида вращения, вытянутого по оптической
оси, если кристалл положительный (We=Afg), и, наоборот, сплюс-
нутого, если кристалл отрицательный (Ne=Np) (рис. 44).
В кристаллах средних сингоний оптическая ось всегда совпада-
ет с вертикальной кристаллографической осью (III или Z),t. е. по-
ложение индикатрисы в кристаллах средних сингоний строго опре-
делено.
Для кристаллов низших сингоний оптическая индикатриса бу-
дет иметь форму эллипсоида с тремя неравными друг другу глав-
ными осями. Меньшая из них обозначается Wp, средняя по величи-
не Nm и наибольшая Ng.
В трехосном эллипсоиде появляются уже два круговых сечения,
лежащих перпендикулярно к оптическим осям (рис. 45).
Оптические оси лежат в плоскости, перпендикулярной к оси Nm
(следовательно, в плоскости Ng и Wp).
Ось, перпендикулярная к плоскости оптических осей, называет-
ся оптической нормалью.
Углы, образованные оптическими осями, называются углами
оптических осей (2 V). Линия, делящая пополам острые углы, на-
зывается острой биссектрисой, а тупые — тупой биссектрисой.
Двуосный кристалл называется оптически положительным, если
острая биссектриса совпадает с Ng, и отрицательным, если острая
биссектриса совпадает с Np (рис. 46).
Для кристаллов ромбической сингонии оси индикатрисы совпа-
дают с кристаллографическими осями.
56
Для кристаллов моноклинной сингонии только одна ось индика-
трисы совпадает с кристаллографической осью (II или У). Что ка-
сается кристаллов триклинной сингонии, то совпадения между ося-
ми индикатрис и кристаллографическими нет.
Исследование минералов под микроскопом осно-
вано на постоянстве оптических свойств минералов и тесной зависи-
мости их от химического состава минералов.
Для изучения оптических свойств кристаллов применяются спе-
циальные поляризационные микроскопы, которые снабжены смен-
ными объективами и окулярами, имеющими различные увеличения.
Комбинируя различными окулярами и объективами, можно полу-
чить увеличение от 15 до 1000 раз и изучать даже мельчайшие ми-
нералы— размером до 0,01 мм. Исследование оптических свойств
кристаллов производят или в прозрачных шлифах, представляющих
тонкие (0,03 мм) срезы минералов или в специальных препаратах,
изготовляемых путем дробления изучаемого минерала или горной
породы.
Шлифы и препараты изучают на вращаемом предметном столи-
ке поляризационного микроскопа. Столик имеет по краям деления
через 1 градус; в центре столика находится отверстие, через кото-
рое проходит свет от осветительного устройства. Главной же осо-
бенностью поляризационных микроскопов является наличие в их
оптической системе специальных призм — поляризатора и анализа-
тора, способных пропускать только поляризованный свет. Упомяну-
тые приспособления позволяют определять в минералах ряд харак-
терных оптических свойств.
В настоящее время используются поляризационные микроскопы
различных марок, например МП-3, МИН-8 и др. На рис. 47 пока-
зана схема микроскопа МИН-8.
Работа с микроскопом может производиться при помощи одного
поляризатора (в проходящем свете) и с введенным анализатором
(при скрещенных николях).
При работе с одним поляризатором определяют форму и разме-
ры кристаллов, устанавливают такие характеристики, как окраска,
спайность, изменение окраски у некоторых минералов при враще-
нии столика микроскопа — плеохроизм, показатели преломления.
Последние определяют качественно путем сравнения с показателя-
ми преломления бальзама (равным 1,537) или других минералов.
На границе сред с разными показателями преломления возникает
тонкая сц^тлая полоска (полоска Бекке). По положению ее при
подъеме и опускании столика микроскопа МИН-8 с препаратом
устанавливают показатели преломления сопоставляемых сред. По-
лоска Бекке будет перемещаться при подъеме столика микроскопа
(например, МИН-8) на минерал или среду (бальзам, жидкость) с
меньшим и, напротив, при опускании столика на минерал с боль-
шим показателем преломления (рис. 48).
Точное значение этих констант определяют чаще всего в иммер-
сионных средах (иммерсионные наборы состоят из 99 жидкостей с
показателями преломления от 1,400 до 1,780). Определение произ-
57
Рис. 47. Схема микроскопа МИН-8:
/ — объектив; 2 — окуляр; 3 —станина; 4 — фонарь; 5 — трансфор-
матор; 6—рукоятка для включения и выключения дополнительной
линзы; 7 — маховики грубой наводки; 8 — барабаны микронаводки;
9 — тубус микроскопа; 10 — щипцовое устройство; 11 — рукоятка
для поворота анализатора; 12 — наклонная насадка; 13 — центриро-
вочный винт линзы Бертрана; 14 — корпус поляризатора и конден-
сора; 15 — рукоятка кремальерного устройства
водят путем погружения зерен минералов в разные жидкости; при
совпадении показателей преломления минерала и жидкости грани-
ца раздела между ними становится незаметной.
Показатели преломления относительно крупных кристаллов мо-
гут быть определены на специальных приборах — рефрактометрах.
Микроскопические исследования при введенном анализаторе
различны для минералов разных сингоний. Минералы кубической
сингонии (флюорит, гранат и др.) характеризуются однородными
оптическими свойствами, имеют один, характерный для каждого
минерала показатель преломления. При введенном анализаторе они
всегда остаются темными в любом положении вращаемого столика
микроскопа. Аналогично ведут себя аморфные (некристаллические)
вещества (стекло, вода и др.). Они, так же как и кубические мине-
ралы, принадлежат к оптически изотропным веществам. Установив
изотропность для кубических минералов, заканчивают исследование
с введенным анализатором.
Большинство прозрачных минералов является оптически анизо-
тропными. Они принадлежат к средним и низшим сингониям. Свет,
58
Рис. 48. Схема перемещения полоски Бекке:
а — при опускании столика микроскопа (МИН-8)
полоска Бекке перемещается на минерал с бдль-
шим показателем преломления (пс > л^); б —
при подъеме столика микроскопа полоска Бекке
перемещается на минерал с меньшим показате-
лем преломления (п <пь)
проходя через такие кристаллы, преломляется неодинаково в разных
направлениях. Под микроскопом с введенным анализатором эти
минералы приобретают окраску различного цвета.
Для минералов средних сингоний (тетрагональной, тригональ-
ной, гексагональной) характерно два взаимно перпендикулярных
направления с разным значением показателей преломления. Свет
проходит вдоль этих направлений с неодинаковой скоростью.
В кристаллах низших сингоний (ромбической, моноклинной,
триклинной) существует три главных взаимно перпендикулярных
направления, по которым свет распространяется с разной скоро-
стью, и соответственно имеются три показателя преломления.
С помощью анализатора для анизотропных минералов можно
получить следующие наиболее важные оптические константы.
1. Величину двупреломления R — разность между наи-
большим ng и наименьшим*пр показателями преломления. Свет,
пройдя через анизотропный кристалл, разложится на две составля-
ющие. Возникшие световые лучи, взаимодействуя между собой, да-
дут интерференционную окраску, цвет которой постоянен для ми-
нерала одного и того же состава и зависит от величины разности
показателей преломления. Интерференционная окраска изменяется
при вращении шлифа со столиком микроскопа. Четыре раза (при
повороте на 360°) окраска будет максимальной и четыре раза прои-
зойдет погасание кристалла. Последнее будет иметь место, когда
направления световых колебаний в кристалле и поляризаторе сов-
падут. При повороте от этих положений на 45° окраска будет мак-
симальной.
Двупреломление может быть установлено путем нахождения
максимальной окраски и определения по ней с помощью специаль-
ной номограммы значения этой константы. Характер окраски меня-
ется в зависимости от толщины минерала в шлифе или препарате,
поэтому при определении двупреломления по номограмме учитыва-
ется толщина шлифа d. Величина двупреломления может быть оп-
ределена по формуле
R=d{ngl-tiPt).
59
Более точно двупреломление устанавливают с применением
специального приспособления — компенсатора, или путем непосред-
ственного замера наибольшего и наименьшего паказателей прелом-
ления и вычисления их разности.
Величина двупреломления неодинакова для разных минералов;
например, для кварца она составляет 0,009, а для кальццта 0,172.
2. Угол погасания — угол между одним из кристаллогра-
фических направлений и направлением распространения света. Эта
константа характерна для минералов моноклинной и триклинной
сингоний, у которых имеется соответственно два и три таких угла,
указывающих на косое погасание. Для минералов ромбической и
средних сингоний типично прямое погасание, т. е. совпадение кри-
сталлографических направлений (спайности, двойниковых швов
и др.) с оптическими (рис. 49). Угол погасания измеряют между
одним из кристаллографических направлений и направлением наи-
большего пё или наименьшего пр показателей преломления.
3. Оптический характер (знак) удлинения опре-
деляется для минералов, имеющих удлиненную форму. С направле-
нием удлинения может совпадать направление наибольшего или
наименьшего показателей преломления. В первом случае кристаллы
имеют положительное, во втором отрицательное удлинение. Опре-
деление характера удлинения производят с помощью специальной
кварцевой пластинки. Если при повороте кристаллов, имеющих
удлиненную форму, на 45° и введении кварцевой пластинки интер-
ференционная окраска понизится, минерал характеризуется поло-
жительным удлинением и, напротив, повышение окраски типично
для минералов с отрицательным удлинением.
4. Оптический знак и угол оптических осей.
В анизотропных минералах имеется одно или два изотропных сече-
ния. При прохождении света перпендикулярно этим сечениям он
не испытывает двойного лучепреломления. В минералах средних
сингоний имеется одно такое сечение, в минералах низших синго-
ний— два. Нормали к этим сечениям носят название оптических
осей. Соответственно в минералах тетрагональной, тригональной и
гексагональной сингоний имеется одна оптическая ось и они отно-
Рис. 49. Угасание кристаллов:
а — прямое; б — косое
60
Рис. 50. Схема определения знаков одноосных кристаллов:
а — отрицательного; б — положительного
сятся к оптически одноосным минералам. К оптически двуосным
минералам принадлежат минералы ромбической, моноклинной и
триклинной сингоний. Оптическая ось одноосных минералов совпа-
дает с направлением наибольшего или наименьшего показателей
преломления. В соответствии с этим определяется оптический знак
минералов; для первого случая он считается положительным, для
второго — отрицательным.
В двуосных минералах направления наибольшего или наимень-
шего показателей преломления являются биссектрисами угла, об-
разуемого оптическими осями. Если ось наибольшего показателя
преломления является биссектрисой острого угла, то минерал имеет
положительный оптический знак, тупого — отрицательный.
Определение оптического знака и угла между оптическими ося-
ми (2V) производят в сходящемся свете — в узком, направленном
через центр зерна пучке световых лучей. Такой свет получают при
помощи короткофокусной линзы — конденсора (линзы Лазо), кото-
рую вводят между поляризатором и предметным столиком микро-
скопа. Для лучшего наблюдения получающейся при этом картины
вводят вторую линзу (линзу Бертрана) между анализатором » оку-
ляром микроскопа. Изучение минералов в сходящемся свете (ко-
носкопичесйий метод) позволяет получить четкую интерференцион-
ную фигуру минерала. Она различна для одноосных и двуосных ми-
нералов.
Одноосные минералы имеют черную крестообразную фигуру на
фоне концентрических цветных интерференционных колец. При вра-
щении столика микроскопа со шлифом эта фигура сохраняет форму
креста. Двуосные минералы дают также крестообразную фигуру на
фоне цветных лемнискат, имеющих форму, подобную восьмерке.
В случае вращения столика микроскопа крест распадается на две
дугообразные кривые (изогиры), которые вновь сходятся и образу-
ют крест при повороте на 90°. Расстояние, на которое расходятся
изогиры при повороте на 45°, характеризует величину угла оптиче-
61
ских осей; чем больше это расстояние, тем больше значение угла
оптических осей.
Определение оптического знака минералов производят с помо-
щью кварцевой пластинки (рис. 50). В оптически положительных
кристаллах с введенной пластинкой появится окраска желтого цве-
та во II и IV октантах. Она будет располагаться непосредственно
около центра креста одноосных минералов и с внутренней стороны
разведенных дугообразных изогир, направленных вершинами в
центр ноля зрения микроскопа — в случае двуосных кристаллов.
Для оптически отрицательных минералов в этих же положениях
появится характерная синяя окраска.
Следует иметь в виду, что определение оптических свойств мине-
ралов необходимо производить в определенных сечениях. Напри-
мер, угол оптических осей и оптический знак определяют в пластин-
ке минерала, ориентированной перпендикулярно оптической оси од-
ноосных или биссектрисе угла оптических осей двуосных минера-
лов. В любом произвольном сечении угол оптических осей будет
определен приблизительно.
Точное исследование оптических констант минералов, таких, как
угол между направлениями спайности, закон двойникования, угол
погасания, угол оптических осей и других производят с помощью
четырех- или пятиосных столиков Е. С. Федорова. Этот прибор уста-
навливают на предметный столик микроскопа. Он позволяет прида-
вать шлифу различные, но всегда фиксированные положения в про-
странстве путем поворота вокруг ряда осей. Этот метод дает воз-
можность ориентировать минерал и выбирать сечения, в которых
можно наиболее точно установить нужные константы.
РАЗДЕЛ II
МИНЕРАЛОГИЯ
Минералами называются природные химические соединения,
возникающие в результате различных процессов, протекающих в
земной коре. Минералы являются составными частями горных по-
род и руд, они отличаются друг от друга по химическому составу
и физическим свойствам (цвету, твердости, удельному весу, блеску
и т. д.).
Каждый минерал образуется в конкретных физико-химических
условиях и характеризуется определенными пределами устойчивого
состояния. В случае резкого повышения или понижения температу-
ры, давления и концентрации химически активных компонентов ми-
нералы подвергаются изменениям, которые могут привести или к
разрушению последних, или к замещению их другими минералами,
устойчивыми в новых термодинамических условиях.
В природе насчитывается около 4000 минеральных видов и при-
мерно такое же количество разновидностей, причем каждый год
открывают до 40—50 новых минералов.
Минералы имеют различные размеры — от нескольких метров
(сподумен и др.) до тысячных долей миллиметра (глинистые ми-
нералы).
Практическое значение минералов огромно. Нет ни одной отрас-
ли промышленности, где бы не использовались те или иные полез-
ные ископаемые, состоящие из различных минералов.
Некоторые минералы сами по себе представляют ценные полез-
ные ископаемые и применяются в народном хозяйстве в естествен-
ном виде, например слюды, алмаз, сера, корунд, кварц, флюорит,
каменная соль и т. д. Значительная часть минералов содержит в
себе ценные компоненты, которые извлекаются из них путем техно-
логической переработки и используются в промышленности и сель-
ском хозяйстве. Так получают практически все металлы, многие ви-
ды химического сырья, удобрения и др. Ряд минералов использует-
ся как драгоценные и поделочные камни, абразивные и строитель-
ные материалы и т. п.
Наука, изучающая образование минералов, их свойства, хими-
ческий состав, кристаллическое строение, называется минералогией.
63
Минералогия принадлежит к числу геологических наук, изучаю-
щих земную кору, но она тесно связана и опирается на точные
науки — физику твердого тела, кристаллографию, кристаллохимию,
коллоидную и физическую химию. В. И. Вернадский рассматривал
минералогию как химию земной коры. От минералогии по мере ее
развития отпочковались такие науки, как кристаллография, геохи-
мия и кристаллохимия. Данные минералогии используются в об-
ласти петрографии, геохимии, а также в учении о месторождениях
полезных ископаемых.
ГЛАВА 7
КРАТКАЯ ИСТОРИЯ МИНЕРАЛОГИИ
И ОСНОВНЫЕ НАПРАВЛЕНИЯ
ЕЕ РАЗВИТИЯ В РОССИИ
Минералогия самая древняя геологическая наука. Как и другие
науки, она выросла и окрепла в результате практической деятель-
ности человека.
Еще задолго до развития письменности первобытные люди вла-
дели сначала каменными, а потом и металлическими орудиями тру-
да и охоты. Следовательно, они уже тогда знали многие минералы
и способы их обработки, а впоследствии и передела.
Первые попытки классифицировать минералы были сделаны
древнегреческими учеными: Аристотелем (384—322 гг. до н. э.) и
его учеником Теофрастом (371—285 гг. до н. э.). Известны также
труды римского ученого Плиния Старшего (погибшего при извер-
жении Везувия в 79 г.), посвященные описанию всех известных к
тому времени минералов.
В годы мрачного средневековья накапливался громадный фак-
тический материал, но он не обобщался, минералогия как наука
развивалась слабо. Правда, в странах Востока в период раннего
средневековья появились работы, посвященные описанию минера-
лов и сплавов. Так, уроженцем Хорезма Аль-Бируни (972—1048 гг.)
была написана «Книга сводок для познания драгоценностей», где
впервые при описании минералов были даны физические признаки
последних, а именно: твердость и удельный вес. Другой ученый,
уроженец Бухары Авиценна (980—1037 гг.) разработал классифи-
кацию известных к тому времени минералов. В «Трактате о кам-
нях» он разделил все минералы на 4 класса: 1) камни и земли;
2) горючие и сернистые ископаемые; 3) соли и 4) металлы.
Минералогия как самостоятельная наука начала оформляться
в эпоху Возрождения —в эпоху, связанную с великими географиче-
скими открытиями, с бурным ростом промышленности, торговли и
науки. Еще в начале эпохи Возрождения чешский врач Георгий
Бауэр-Агрикола (1490—1555 гг.) в книге «О происхождении мине-
ралов» обобщил фактический материал, накопившийся при разра-
ботке рудных месторождений. В этой книге Агрикола дал более
подробную классификацию минералов, чем его предшественники, и
64
детально охарактеризовал их физические свойства, а именно: твер-
дость, вес, спайность, прозрачность, вкус. Агрикола первый провел
границу между минералами и горными породами.
Развитие отечественной минералогии можно разделить на четы-
ре этапа.
Первый этап связан с именем гениального русского ученого
М. В. Ломоносова (1711—1765 гг.) и его последователя в области
минералогии В. М. Севергина (1765—1826 гг.). Ломоносов написал
ряд работ по вопросам геологии и минералогии («О слоях земных»,
«Слово о рождении металлов от трясения Земли», «О рождении и
природе селитры»). Высказанные в этих работах взгляды о строе-
нии кристаллического вещества, о происхождении минералов и про-
цессах метаморфизма являются по существу глубоко материалисти-
ческими.
М. В. Ломоносов составил первый отечественный каталог мине-
ралогических коллекций кабинета Академии наук (начало государ-
ственной коллекции минералов было положено Петром I в 1714 г.
Им был создан фактически первый в России минералогический му-
зей— раздел минералов в Кунсткамере).
Большой вклад в развитие минералогии внес последователь
М. В. Ломоносова акад. В. М. Севергин, который осуществил замы-
сел своего учителя по созданию «Общей минералогии Российской».
В. М. Севергиным написаны 2 тома «Опыта минералогического зем-
леописания Государства Российского», а также и другие работы
(«Первые основания минералогии или естественной истории тел»,
«Подробный словарь минералогический», «Новая система минера-
лов, основанная на наружных отличительных признаках» и т. д.).
В. М. Севергин первый ввел понятие о парагенезисе, определив
его термином «смежность» минералов.
В целом этот этап можно охарактеризовать господством мате-
риалистического направления.
Второй этап характеризуется сбором большого количества
фактического минералогического материала и детальным описани-
ем последнего.
Этот этап длился около 150 лет. Особое внимание в это время
обращали на изучение формы кристаллов, определение твердости,
удельного веса и химического состава. В целом этот период харак-
теризуется развитием описательной минералогии. Наиболее значи-
тельную роль в описательной минералогии сыграли академики
Н. И. Кокшаров (1818—1892 гг.) и П. В. Еремеев (1830—1899 гг.).
Оба русских ученых преподавали в Горном институте в Петербурге
и стояли во главе Российского Минералогического общества. Перу
Н. И. Кокшарова принадлежит одиннадцатитомный труд «Материа-
лы для минералогии России», в котором были детально описаны и
систематизированы минералы России. Акад. В. И. Вернадский вы-
соко оценил работы Н. И. Кокшарова. Он писал, что Н. И. Кокша-
ров «...путем точных исследований образцовых кристаллов положил
прочный фундамент навсегда, для всех обобщений в данной об-
ласти».
3—3628
65
П. В. Еремеев, так же как и Н. И. Кокшаров, занимался иссле-
дованием минералов и детальным изучением их кристаллографиче-
ских форм, но в отличие от Н. И. Кокшарова, изучавшего главным
образом совершенные кристаллы, П. В. Еремеев исследовал обыч-
ные минералы, найденные в различных месторождениях России.
Под редакцией П. В. Еремеева было издано 22 тома записок мине-
ралогического общества и 14 томов «Материалов для геологии Рос-
сии».
В конце XIX в. начинается третий этап в развитии
отечественной минералогии, характеризующийся обобщением ранее
накопившегося материала и развитием генетической минералогии.
Этот этап тесно связан с именем акад. В. И. Вернадского (1863—
1945 гг.), которого по праву можно считать основоположником гене-
тической минералогии и геохимии.
В. И. Вернадский подошел к изучению минералов с точки зре-
ния химии. Он рассматривал минералы как продукты природных
химических реакций, а минералогию — как химию земной коры.
Много времени В. И. Вернадский посвятил изучению процессов
образования минералов и минеральных ассоциаций, а также их из-
менению при эволюции физико-химических условий. Высказанные
им взгляды, что минералы образуются в определенной геологиче-
ской обстановке, при изменении которой преобразовываются и са-
ми минералы, как бы «оживили» минералогию. В. И. Вернадский
дал четкие понятия о парагенезисе как о естественных ассоциациях
минералов.
Изучая процессы минералообразования, В. И. Вернадский при-
шел к важному выводу, что в алюмосиликатах алюминий может
играть роль кремния и изоморфно его замещать. Это положение
подтвердилось значительно позднее рентгеноструктурными исследо-
ваниями.
Ученик и последователь В. И. Вернадского А. Е. Ферсман
(1883—1945 гг.) развил идеи В. И. Вернадского. Детально изучая
многочисленные месторождения Советского Союза, он собрал ко-
лоссальный фактический материал. Наибольшей известностью
пользуются его работы «Драгоценные и цветные камни России»,
«Пегматиты», «Геохимия» (в четырех томах), «Цвета минералов»
и др.
Рассматривая минералы в развитии, начиная от их зарождения
в определенных физико-химических условиях и кончая их преоб-
разованиями (превращениями в другие минеральные виды) при из-
менении этих условий, В. И. Вернадский изучал поведение отдель-
ных химических элементов и, таким образом, фактически создал
новую науку — геохимию, науку, которая получила в настоящее
время исключительно важное значение. Геохимия, созданная
В. И. Вернадским и его учениками и последователями А. Е. Ферс-
маном и В. М. Гольдшмидтом, непосредственно выросла из генети-
ческой минералогии и теснейшим образом с нею связана.
В. И. Вернадский является родоначальником минералого-геохи-
мического направления в геологии, которое успешно развивается
66
всей современной советской школой минералогов и геохимиков
(акад. А. Е. Ферсман, акад. В. Г. Хлопин, акад. А. П. Виноградов,
акад. Д. И. Щербаков, К. А. Ненадкевич, Я. В. Самойлов, Н. М. Фе-
доровский, И. И. Гинзбург, П. П. Пилипенко, Н. А. Смольянинов,
В. И. Крыжановский, А. А. Сауков, В. В. Щербина, Ф. В. Чухров,
Г. П. Барсанов, С. М. Курбатов, Е. К. Лазаренко и многие другие).
Одновременно с развитием химико-генетического направления
в минералогии развилось и другое направление, получившее назва-
ние кристаллохимического. Родоначальником этого направления
следует считать акад. Е. С. Федорова (1853—1919 гг.).
Е. С. Федоров, задолго до развития рентгеноструктурного ана-
лиза математическим путем, исходя из симметрии кристаллов, вы-
вел все возможные правильные системы расположения материаль-
ных точек в кристалле и все виды групп симметрии, а также раз-
работал теорию параллоэдров — многогранников. Е. С. Федоров
впервые ввел понятие о кристаллохимическом анализе, пользуясь
которым, при изучении граней кристаллов можно определить типы
их структуры.
Четвертый этап в развитии минералогии связан с широким
прогрессом в развитии физических методов исследования минера-
лов. В первую очередь рентгеноструктурных, методов инфракрасной
спектроскопии (ИКС), электронной микроскопии и др. и с бурным
расцветом кристаллохимии. Особенно большую роль в развитии
современной кристаллохимии сыграли работы акад. Н. В. Белова,
который по-новому подошел к трактовке структур силикатов. Ра-
ботами Н. В. Белова и его учеников расшифрованы многие струк-
туры минералов, в особенности силикатов, содержащих крупные
катионы.
Благодаря развитию кристаллохимии, которая вскрыла связь
между структурой вещества, его составом и свойствами, стало воз-
можным не только предсказывать, какие свойства должны быть у
минерала, имеющего ту или иную структуру, но и создавать новые
соединения с заданными свойствами. На этом принципе основана
новая ветвь минералогии и кристаллографии — синтез минералов,
разрабатывающая вопросы получения в промышленном масштабе
кристаллов с особыми свойствами — сверхтвердыми (алмаз, боро-
зон), пьезоэлектрическими (кварц и др.), полупроводниковыми
(ферриты), диэлектрическими (слюды), оптическими (флюорит,
кальцит, селитра), детекторными, свойствами квантовых генерато-
ров и др.
ГЛАВА 8
МОРФОЛОГИЯ МИНЕРАЛОВ
В природе минералы далеко не всегда встречаются в форме от-
дельных хорошо образованных кристаллов, гораздо чаще они пред-
ставлены агрегатами различных зерен неправильной формы, сро-
стками, землистыми массами, налетами, корками, оолитами и т. п.
3*
67
Следует различать морфологию собственно кристаллов и мор-
фологию агрегатов.
Морфология кристаллов. Кристаллы минералов имеют различ-
ные размеры и характеризуются своеобразным обликом — габиту-
сом. По габитусу кристаллы бывают чешуйчатые, листоватые, плас-
тинчатые, изометрические, призматические, шестоватые, игольча-
тые. Для каждой сингонии характерен тот или иной габитус кри-
сталлов, который обычно сравнивают с простой формой, например,
кристаллы дипирамидального облика, ромбоэдрического, гексаго-
нального и т. д. Более подробно о простых формах кристаллов из-
ложено в соответствующем разделе кристаллографии. В данной
главе лишь кратко перечислены факторы, влияющие на форму кри-
сталлов.
Внутреннее строение. Согласно закону Бравэ, развитие
или частота появления различных форм кристаллов зависит от
плотности расположения элементарных частиц в кристаллической
решетке в тех или иных направлениях; чем гуще располагаются эти
частицы, т. е. чем выше ретикулярная плотность, тем более интен-
сивно развиты в кристалле соответствующие грани. Наиболее раз-
витые грани кристалла и определяют его внешнюю форму.
Условия роста кристаллов. В природе редко создают-
ся условия для идеального роста кристаллов, т. е. такие, когда все
их грани развиваются строго пропорционально согласно их внут-
реннему строению. Нормальному росту кристаллов препятствуют
многие явления, в частности неравномерность притока растворов,
которая способствует более быстрому развитию граней сетки, об-
разованной разноименными ионами, высокая степень подвижности
компонентов минералообразующей среды, резкое изменение темпе-
ратуры или давления, наличие примесей и др., вследствие чего кри-
сталлы одного и того же минерала могут иметь различный внешний
вид (рис. 51). При преимущественном развитии одной или несколь-
ких граней могут возникать искаженные («ложные») формы кри-
сталлов.
Сростки кристаллов. Очень часто кристаллы образуют между
собой сростки. Последние бывают как закономерными, так и слу-
Рис. 51. Кристаллы апатита различного габитуса
68
Рис. 52. Одиночный (а) и сдвой-
никованный (б) кристаллы гипса
Рис. 53. Двой-
ник кристалла
ортоклаза
чайными. К закономерным сросткам относятся двойники, парал-
лельные и эпитаксические срастания.
Двойниками называются закономерные срастания двух
кристаллов, из которых один может быть выведен из другого по-
средством поворота на 180° или отражением в некоторой плоскости
(двойниковая плоскость). Двойниковая плоскость чаще всего соот-
ветствует плотнейшей упаковке ионов. Двойники разделяются на
двойники срастания и двойники прорастания.
В двойниках срастания кристаллы соприкасаются плоскостью,
которая называется плоскостью срастания, или двойниковым швом,
последний часто совпадает с двойниковой плоскостью (плоскостью
симметрии двойника). На рис. 52 изображен одиночный кристалл
гипса и его двойник. В данном случае двойниковый шов совпадает
с двойниковой плоскостью.
У двойника ортоклаза (рис. 53) двойниковый шов не совпадает
с двойниковой плоскостью.
В двойниках прорастания один кристалл прорастает другой.
Срастаться и прорастать друг друга могут одновременно не-
сколько кристаллов. Такие срастания называются полисинтетиче-
скими. У некоторых минералов двойники настолько часто встре-
чаются, что способы их срастания получили название законов, на-
пример, у карлсбадского закона, характерного для калиевых поле-
вых шпатов, плоскость срастания (010), у галльского, типичного для
кристаллов гипса («ласточкин хвост»),— (100) и т. д.
Параллельные и эпитаксические сростки. Па-
раллельными сростками называются такие срастания кристаллов,
у которых грани одного кристалла параллельны граням другого.
Эпитаксическими сростками называются срастания двух кристал-
лов различных минералов, одноименные грани которых одинаково
ориентированы, т. е. параллельны друг другу. Эпитаксические срас-
тания возникают в том случае, когда у минералов параметры эле-
ментарной ячейки в каком-либо одном направлении весьма близки.
69
Штриховатост ь. Часто грани кристаллов бывают покрыты
различной штриховкой. Штриховатость граней относится также к
морфологическим признакам кристаллов. Причинами ее возникно-
вения могут служить:
а) нарастание малых узких граней на большой грани кристал-
ла — комбинационная штриховатость;
б) двойниковое сложение кристаллов — двойниковая штрихова-
тость;
в) штриховатость, образуемая от пересечения плоскостей спай-
ности с гранью.
Морфология агрегатов. Как было указано выше, минералы
встречаются либо в форме одиночных кристаллов, либо, что гораз-
до чаще, в виде агрегатов, состоящих из отдельных неправильно
сросшихся зерен одного или нескольких минералов. В первом слу-
чае они называются мономинеральными, во втором — полимине-
ральными. В зависимости от величины и формы зерен, входящих в
агрегат, они могут быть крупнозернистыми (при величине зерен
свыше 5 мм в диаметре), среднезернистыми (при величине зерен от
1 до 5 мм в диаметре), мелкозернистыми (при величине зерен до
1 мм) и микрозернистыми, или плотными (при величине, определяе-
мой только под микроскопом). Форма зерен, слагающих агрегаты,
бывает различной: чешуйчатой, волокнистой, шестоватой, скорлу-
поватой, землистой. Различают следующие морфологические типы
агрегатов.
Дендриты своей формой напоминают ветви дерева, что и
определяет их название («дендрос» — по-гречески означает дере-
во). Образуются они вследствие неравномерного роста кристаллов
по различным направлениям. В виде дендритов часто встречаются
окислы марганца, а также некоторые самородные элементы (медь,
золото, серебро).
Секреции образуются в тех случаях, когда какая-нибудь по-
лость в горной породе заполняется минеральным веществом. Запол-
нение идет от периферии к центру, в результате чего получаются
шаровидные образования с пустотой внутри. Диаметр секреций
колеблется от долей миллиметра до нескольких метров. Крупные
секреции называются жеодами, мелкие — миндалинами (рис. 54).
Конкреции, как и секреции, имеют шаровидную форму, но
отличаются от последних тем, что отложение минерального веще-
ства происходит от центра к периферии. Внутри они заполнены.
Строение их радиально-лучистое или концентрическое. Мелкие кон-
креции, диаметр которых не превышает нескольких миллиметров,
называются оолитами.
Натечные формы возникают большей частью в полых про-
странствах за счет коллоидных растворов, которые обволакивают
стенки пустот, постепенно теряют воду, густеют и под влиянием си-
лы тяжести свисают вниз в виде затвердевших столбчатых образо-
ваний, называемых сталактитами. Если рост этих столбчатых
образований происходит в нижних частях пустот, то они поды-
маются вверх и носят название сталагмитов,
70
Рис. 54. Жеода
Натечные формы могут быть почковидными, гроздевидными.
Крупные шаровидные натечные формы с блестящей поверхностью
называются стеклянными головами. В натечных формах встречают-
ся самые различные минералы: гидроокислы железа — лимонит,
гидроокислы марганца — псиломелан, малахит, гипс, барит.
ГЛАВА 9
ФИЗИЧЕСКИЕ СВОЙСТВА МИНЕРАЛОВ
Каждый минерал имеет ту или иную форму, цвет, может быть
легким или тяжелым, характеризуется определенным блеском, т. е.
отличается внешними признаками, по которым, в первом прибли-
жении, он и опознается, т. е. определяется макроскопически.
Прежде всего необходимо указать, что все физические свойства
минералов связаны с их внутренним строением. Разберем после-
довательно главнейшие физические свойства минералов и опреде-
ляющие их факторы.
Форма минералов. Как было сказано выше (см. морфологию
минералов), форма минералов зависит от их внутреннего строения,
в частности, от мотива структуры. Минералы с островным, коорди-
национными и каркасными мотивами структур встречаются в виде
кристаллов, имеющих изометричную форму. У минералов с цепо-
чечным мотивом структуры всегда развиты грани призмы — внешне
они вытянуты, часто имеют игольчатое, волокнистое строение. Для
71
слоистых структур характерна весьма совершенная спайность и
пластинчатый габитус.
Окраска минералов является наиболее характерным их фи-
зическим свойством.
На окраску минералов влияют следующие причины: содержание
в кристаллической решетке ионов красителей или хромофоров,
валентность ионов, координационное число, размеры координацион-
ного полиэдра, присутствие в решетке молекул Н2О. А. Е. Ферсман
различает три типа окрасок минералов: идиохроматический, алло-
хроматический и псевдохроматический.
Идиохроматическая окраска является собственной
окраской минерала. Она зависит от наличия в его кристаллической
решетке окрашивающих ионов — хромофоров. На такую окраску
может влиять валентность иона, его координационное число, при-
сутствие ОН, Н2О и других ионов.
Чаще всего хромофорами являются ионы Fe2+, Fe3+, Mn2+, Ti4+,
Ni2+, Co2+, Cu1+, Cu2+. Так, двухвалентное железо придает минера-
лам бутылочно-зеленый цвет, трехвалентное — бурый. При содер-
жании двух- и трехвалентного железа, а также групп (ОН) появ-
ляются синие окраски (например, у вивианита, турмалина — идиго-
лита, голубого асбеста и др.). Трехвалентный хром придает минера-
лам зеленую окраску (изумруд, уваровит и др.), двухвалентный
марганец — светло-зеленую, трехвалентный — розовую, а семива-
лентный— темно-фиолетовую и т. д. На идиохроматическую окрас-
ку влияют многие факторы, в том числе нагревание, облучение
рентгеновскими лучами и др.
Аллохроматическая окраска является следствием на-
личия в минералах включений посторонних механических примесей.
Так, например, бесцветный кварц при включении зеленых иголочек
актинолита становится зеленым, при включении тонких пластинок
гематита — буровато-красным и т. д.
Псевдохроматическая, или ложная, окраска
возникает вследствие явления дифракции лучей света от каких-ли-
бо внутренних трещин. Эту окраску можно уподобить игре цветов
пленок нефти на воде. В этом случае происходит дифракция свето-
вых ^олн при прохождении их через несколько сред (воздуха, воды
и нефти). Подобные явления имеют место в некоторых минералах
при развитии в них трещин и посторонних включений, что и выра-
жается ложной окраской, побежалостью (например, борнит обычно
покрывается ярко-синей побежалостью, что и используется при
его диагностике). Ложная окраска не имеет ничего общего с при-
родой самого минерала. Окраска минералов может служить иног-
да поисковым признаком. Так, например, если каменная соль —
галит, имеет синюю окраску, это свидетельствует о появлении
совместно с галитом калийных солей — сильвина и карналлита;
черная окраска флюорита иногда вызвана ассоциацией с ним
радиоактивных минералов и т. д.
Цвет черты. Одним из физических признаков минералов
является цвет черты, который определяется следом, оставляемым
72
минералом на неглазурованной фарфоровой пластинке. Это цвет
измельченного его порошка. Очень часто он не совпадает с внеш-
ним цветом определяемого минерала. Так, темно-серый гематит
дает характерную вишнево-красную черту; ярко-желтый халькопи-
рит— темно-серую с зеленоватым оттенком и т. д.
Блеск минерала является следствием отражения от его по-
верхности световых лучей. Блеск зависит прежде всего от типа свя-
зи кристаллической решетки минерала. Так, металлический блеск
характерен для минералов с металлическим или ковалентным ти-
пом связи, алмазный — для минералов с ковалентной связью, стек-
лянный— с ионной. Поскольку у большинства минералов связи
ионно-ковалентные, то и блеск их (кроме самородных металлов и
сульфидов) варьирует от стеклянного до алмазного. Блеск минера-
ла обусловливается в некоторых случаях также внутренним строе-
нием. Так, у многих волокнистых минералов (например, у волокнис-
той разности гипса — селенита) блеск шелковистый, у чешуйча-
тых— перламутровый, у стеклоподобных метамиктных тел — смо-
листый.
Спайность, излом, отдельность. Спайностью называется способ-
ность минералов раскалываться в определенных направлениях с
образованием параллельных плоскостей (плоскостей спайности).
Спайность зависит от внутреннего строения минерала (см. гл. 6)
и может быть по степени совершенства разделена на следующие
виды:
1) весьма совершенная спайность—минерал легко расщепляет-
ся на отдельные параллельные плоскости, листочки (слюды, гипс
и др.);
2) спайность совершенная — разделение на параллельные плос-
кости происходит уже с некоторым затруднением, например, при
ударе (полевые шпаты);
3) спайность ясная (средняя) — при ударе некоторые обломки
минералов раскалываются по нечетко выраженным плоскостям
(группа пироксенов, скаполит);
4) спайность несовершенная — спайности почти нет, ярко выра-
жен неровный или раковистый излом (кварц, апатит).
Спайность проявляется по определенным кристаллографическим
направлениям. Так, в каменной соли и в галените спайность прохо-
дит по кубу, у кальцита — по ромбоэдру, у флюорита — по октаэд-
ру и т. д.
Кроме спайности, некоторые минералы имеют еще и плоскости
отдельности. По предположению Н. В. Белова, это плоскости мель-
чайших включений других минералов, расположенные в виде тон-
ких прокладок вдоль плоскостей плотнейшей упаковки в структуре
того или иного минерала. Примером могут служить часто встречаю-
щиеся отдельности у минерала корунда.
При разламывании минерала образуются не только плоскости
спайности и отдельности, но и поверхности раскола, называемые
изломом. Различают следующие типы изломов: ровный, ступенча-
тый, неровный, занозистый и раковистый.
73
Раковистый излом характерен для минералов, у которых отсут-
ствует спайность, например, для кварца.
Ровный излом типичен для минералов с совершенной спайно-
стью.
Ступенчатый излом — для минералов со спайностью в несколь-
ких направлениях, например, для полевого шпата.
Занозистый излом характерен для минералов цепочечной струк-
туры и волокнистого сложения.
Удельный вес зависит от химического состава минералов. Есте-
ственно, что минералы, имеющие в своем составе элементы с боль-
шим порядковым номером, обладают и большим удельным весом.
Например, удельный вес галенита (PbS) значительно больше, чем
галита (NaCl), хотя оба эти минерала имеют одинаковую структу-
ру. Удельный вес зависит также от плотности упаковки и мотива
структуры. Так, каркасные структуры наиболее рыхлые и удельный
вес у них значительно меньше, чем у минералов островной и слоис-
той структуры. Например, в состав топаза и каолинита входят одни
и те же элементы, но у топаза удельный вес 3,57, а у каолинита —
2,6. Химический состав алмаза и графита одинаковый, но у алмаза
удельный вес 3,5, а у графита — 2,2.
Для макроскопического определения минералов могут служить
еще следующие физические свойства: вкус, запах, устойчивость к
действию кислот, твердость, магнитность и др.
ГЛАВА 10
ХИМИЧЕСКИЙ СОСТАВ
И ФОРМУЛЫ МИНЕРАЛОВ
Изучение химического состава минералов является одной из
важнейших задач современной минералогии. Как отмечалось выше,
минералы представляют собой природные химические соединения,
возникающие в результате естественных процессов, протекающих в
земной коре. Для того чтобы лучше познать и изучить процессы
минералообразования, необходимо, в первую очередь, изучить со-
став минералов как конечных продуктов этих процессов. Следует
отметить, что в состав минералов входят почти все элементы перио-
дической системы Менделеева, но их участие в составе минералов
неодинаково.
Некоторые элементы играют весьма большую роль в образова-
нии кристаллических решеток минералов, например, кремний участ-
вует в образовании более 600 минералов, однако известны химиче-
ские элементы, которые практически не образуют своих собствен-
ных минералов — рубидий, гафний, галлий и другие, но охотно вхо-
дят в виде изоморфных примесей в состав других минералов. По-
этому в составе минералов принято различать основные элементы
и элементы-примеси.
Некоторые минералы (касситерит, турмалин и многие др.) могут
возникать в результате различных природных процессов. Среда, в
74
которой они образуются, оказывает определенное влияние на их
состав, хотя в целом они сохраняют свою химическую формулу и
присущую им кристаллическую структуру. Таким образом, состав
минералов зависит, в первую очередь, от условий их образования —
одни и те же минералы различного происхождения характеризуют-
ся, как правило, содержанием различных примесей. Эти примеси
могут обусловливать появление различных окрасок (например, у
турмалина), изменение удельного веса (колумбит), оптических
свойств, кристаллографических форм и других физических свойств.
Следовательно, один и тот же минерал, образующийся в различ-
ных условиях, приобретает в зависимости от этих условий некото-
рые характерные свойства, называемые типоморфными,
В основе приобретения этих типоморфных свойств лежит незна-
чительное изменение химического состава минерала. Изучая эле-
менты-примеси в минералах, можно во многих случаях говорить об
условиях их образования, последовательности выделения и гене-
зисе.
Приведем несколько примеров:
1) самородная сера вулканического происхождения отличается
от серы осадочной по высокому содержанию селена;
2) касситериты из пегматитовых жил отличаются от касситери-
тов других типов месторождений повышенным содержанием нио-
бия и тантала, незначительньш количеством или полным отсутст-
вием индия и ванадия;
3) бериллы пегматитов отличаются от бериллов пневматолито-
гидротермальных месторождений наличием значительных количеств
щелочей (натрия, лития и цезия).
Изучение элементов-примесей необходимо не только для реше-
ния генетических вопросов. Следует помнить, что современная про-
мышленность предъявляет большой спрос и на редкие элементы,
которые не образуют значительных концентраций в форме своих
собственных минералов, а встречаются, как правило, в рассеянном
состоянии в других минералах (индий, галлий, германий, гафний,
кадмий и др.), из которых попутно и извлекаются. Наряду с цен-
ными примесями редких элементов в минералах могут содержать-
ся «вредные» компоненты, которые снижают качество руд и препят-
ствуют их практическому использованию. Например, высокое со-
держание серы в железных рудах—магнетите и гематите, значи-
тельное содержание железа в полевых шпатах, использующихся как
керамическое сырье, и т. д. Следовательно, изучение химического
состава минералов, в том числе и изучение в них элементов-приме-
сей, а также форм их вхождения в состав минералов, представляет
важную задачу современной минералогии. Кроме того, большинство
основных физических свойств минералов, а именно: показатели пре-
ломления, твердость, удельный вес, а также многие свойства, важ-
ные для их обогащения, находятся в зависимости от их химическо-
го состава.
Химический состав минералов определяется в основном путем
химического анализа в лабораториях. Результаты анализов пред-
75
ставляют в цифрах валового химического состава в процентах. Эти
данные пересчитывают и выражают в виде эмпирических формул.
Существует несколько способов пересчета минералов. Ниже при-
водится один из наиболее простых приемов.
Для расчета формулы минерала по результатам химического
анализа необходимо весовые проценты каждого элемента или окис-
ла разделить на соответствующий атомный или молекулярный вес
(для окислов) и определить атомные или молекулярные количест-
ва. Полученные числа — коэффициенты в химической формуле ми-
нерала, показывают, в каком отношении находятся между собой
элементы, входящие в состав минерала. Обычно эти значения при-
водят к целым числам. Например, в результате химического анали-
за минерала был получен состав компонентов в весовых процентах
(табл.6).
ТАБЛИЦА 6
Компоненты Химический состав, % Атомные количества Отношения между атомными количествами Формула и название минерала
Fe 30,48 0,544 1 CuFeS2 — халькопирит
Си 34,40 0,541 1
S 35,86 1,118 2
Полученная эмпирическая формула минерала выражает его ко-
личественный состав, но не дает представления о способах связи
между элементами.
Кроме эмпирических формул, состав минерала можно выразить
в структурных формулах, которые дают представление о типах хи-
мического соединения и о взаимных связях между его отдельными
элементами. Так, например, структурная формула биотита имеет
следующий вид: К (Mg, Fe)3 [Si3AlOi0] (ОН, F)2.
Структурные формулы минералов устанавливают исходя из эле-
ментарной ячейки кристаллов, выявляемой с помощью рентгено-
структурного анализа, удельного веса минералов и результата его
химического анализа.
ГЛАВА 11
ТИПЫ ВОДЫ В МИНЕРАЛАХ
Вода может входить во многие минералы и оказывать сущест-
венное влияние на их свойства. Различают воду, находящуюся в
минералах в виде ионов гидроокисла (ОН)1-, занимающих опре-
деленное положение в кристаллической структуре минерала, и мо-
лекулярную, воду, находящуюся в минералах в виде отдельных
молекул Н2О или отдельных групп, состоящих из молекул Н2О.
Молекулярная вода может входить в структуру минерала или быть
76
от нее обособлена, т. е. заполнять пустоты в структуре вещества
(ячейки, каналы, межслоевые пространства). Определение характе-
ра воды в минералах производится методом термического анализа,
инфракрасной спектроскопии (ИКС), изучением изменения диэлек-
трической проницаемости минералов, а также методом ядерно-маг-
нитного резонанса (ЯМР) и др.
Выделяют следующие типы воды в минералах.
1. Конституционная вода представлена в минералах
ионами гидроокисла (ОН)1- и в единичных случаях ионами Нг+
располагающихся в узлах кристаллической решетки. Эта вода
прочно удерживается минералами и выделяется при нагревании в
температурном интервале от 300 до 1300° С. Выделение воды сопро-
вождается разрушением кристаллической решетки минерала.
К минералам, содержащим конституционную воду, относятся
тальк — Mg3[Si4Oi0] (ОН) 2, брусит — Mg (ОН) 2, гидроксил апатит —
Са5[РО4]з(ОН, F), серпентин —Mg6[Si4Oi0](ОН)8 и др.
2. Кристаллизационная, или кристаллогидрат-
ная, вода содержится в минералах в виде молекулы Н2О. Она
входит в структуру минерала. Выделение воды из минералов про-
исходит при нагревании до 400—500° С, причем отдача воды сопро-
вождается изменением структуры и образованием новой фазы.
Примером минерала с кристаллогидратной водой может слу-
жить гипс Ca[SO4] • 2Н2О, при нагревании которого происходит
ступенчатое выделение воды. На первой стадии нагревания обра-
зуется ангидрит — Ca[SO4]-0,5 Н2О, содержащий меньшее количе-
ство воды, далее в процессе нагревания он переходит в безводный
ангидрит — Ca[SO4], при этом физические свойства меняются скач-
кообразно.
3. Структурно свободная вода. К этому типу отно-
сится вода (исключительно в виде молекул Н2О), располагающаяся
в пустотах, характерных для некоторых структур минералов (на-
пример, в каналах кольцевых структур или ячейках каркасных
структур). Вода может располагаться в виде единичных молекул
или групп молекул Н2О. Удаление воды при нагревании происходит
постепенно, в значительном температурном интервале и не вызы-
вает перестройки структуры минерала, но при этом могут произой-
ти изменения некоторых физических свойств минерала — твердости,
удельного веса, показателей преломления. Следует отметить, что
обезвоженный минерал может вновь легко поглощать воду. Струк-
турно свободная вода содержится в берилле, канкрините, шабазите
и др.
4. Адсорбционная (или коллоидная) вода — моле-
кулярная вода, удерживаемая на поверхности дисперсных частичек
под влиянием их силового поля. Для этого типа характерно непо-
стоянное содержание воды. Значительная часть ее выделяется при
нагревании до 110° С. Примером такой воды может служить вода
в опале.
5. Гигроскопическая, или капиллярная, вода
располагается в трещинах, капиллярах, а также в порах и удер-
77
живается в минерале силами поверхностного натяжения; удаляет-
ся при нагревании до температуры 100—110° С.
Иногда в минералах встречается вода, которая носит переход-
ный характер от одного типа к другому. Так, некоторые исследова-
тели выделяют особый тип молекулярной межплоскостной воды в
некоторых слоистых силикатах (монтмориллоните и др.). В этом
случае молекулы воды располагаются слоями между слоистыми
пакетами. Кристалл без изменения структуры разбухает или сжи-
мается при поглощении или отдаче воды. Такая вода ведет себя как
структурно свободная, но в то же время рассматривается и как
адсорбированная на поверхности слоистых пакетов.
ГЛАВА 12
КОЛЛОИДЫ И КОЛЛОИДНЫЕ МИНЕРАЛЫ
Кристаллические горные породы, подвергаясь процессам вывет-
ривания, раздробляются и в конечном итоге переходят в тонкодис-
персный агрегат, который далее переносится водными потоками.
Так возникают природные дисперсные (распыленные) системы,
состоящие из дисперсионной среды («растворителя») и тонко из-
мельченных частиц дисперсной фазы.
В зависимости от размера частиц дисперсной фазы все дисперс-
ные системы можно разделить на три группы:
1) грубодисперсные системы, у которых размер частиц превы-
шает 100 нм. Эти частицы можно наблюдать под микроскопом, они
задерживаются фильтром и с течением времени осаждаются вслед-
ствие действия силы тяжести;
2) коллоидно-дисперсные системы (или просто коллоиды) имеют
размер частиц от 1 до 100 нм. Они не видны под обыкновенным
микроскопом, не подвергаются действию силы тяжести и не фильт-
руются через бумажный фильтр;
3) молекулярно-дисперсные системы характеризуются размером
частиц менее 1 нм.
При изучении дисперсных систем надо помнить, что дисперсион-
ной средой может являться как жидкость, так и твердое вещество
и газ. Различные варианты природных дисперсных систем приведе-
ны в табл. 7.
Коллоидные растворы и их свойства. Коллоидные растворы на-
зывают иногда псевдорастворами или золями. В зависимости от
характера дисперсионной среды различают: аэрозоли (среда —
газ), лизоли (среда — жидкость) и кристаллозоли (среда — твер-
дое тело).
В природе коллоидные растворы образуются в результате из-
мельчения вещества (например, при механическом истирании пород
в движущемся потоке воды) или вследствие соединения ионов или
молекул при различных химических и физико-химических процес-
сах и образования молекул или групп молекул больших размеров.
Такие явления происходят часто при процессах окисления, восста-
78
ТАБЛИЦА 7
Типы дисперсных систем (по Ф. В. Чухрову, 1955)
Дисперсионная среда Дисперсная фаза Грубодисперсные системы Коллоидно-дисперсные системы
Жидкость Газ Газовые"? пузырьки в жидкостях (минераль- ные газированные ис- точники) Газовые пузырьки в жидкостях
Твердое веще- ство > Включения газов в ми- нералах и породах (пемза, пористый пес- чаник) Включения газов в тон- чайших порах минера- лов (опал и др.)
То же Жидкость Жидкие включения в ми- нералах Вода в геле кремнезема
Газ > Туман Мельчайшие капли воды в атмосфере
Жидкость > Эмульсии Эмульсоиды (капли неф- ти в воде)
> Твердое вещество Суспензии или взвеси Дисперсоиды (золи, вод- ные коллоидные раст- воры) Металлический натрий в галите
Твердое веще- ство То же Гематит в сильвине; ге- матит в полевом шпате
Газ > Вулканический пепел; космическая пыль Вулканический дым
новления или гидролиза. Например, при окислении сероводород-
ных источников образуется коллоидная самородная сера; при вос-
становлении сульфатных растворов меди происходит образование
коллоидного ковеллина, а в результате гидролиза различных соеди-
нений алюминия и железа образуются коллоидные А1(ОН)3 и
Fe(OH)3.
Коллоидные растворы характеризуются некоторыми особенно-
стями, которые обусловливают ряд свойств образующихся из них
минералов.
1. Особенностью коллоидных частиц является наличие у них
электрического заряда, причем знак этого заряда для всех частиц
одного и того же вещества в определенном растворителе всегда
одинаковый.
В природных условиях положительно заряжаются коллоидные
частицы водных окислов железа, алюминия, титана; отрицатель-
но— сульфиды, кремнезем, двуокись марганца, коллоидные глинис-
тые частицы и др.
Наличием у коллоидных частиц одноименного заряда объясняет-
ся неслипаемость этих частиц, а также то, что они находятся в не-
прерывном движении.
Заряженная коллоидная частица, на поверхности которой на-
ходятся анионы или катионы, насыщающие свободные валентности
ионов, располагающихся по их периферии, называется гранулой.
Если пропустить через коллоидный раствор Электрический ток,
то заряженные частицы будут перемещаться к разноименно заря-
79
Рис. 55. Структура мицеллы
женному электроду и на нем вы-
деляться. Это явление называет-
ся электрофорезом.
2. Коллоидные частицы отли-
чаются способностью сорбиро-
вать различные примеси. Ввиду
того что коллоидные частички в
растворах несут на себе электро-
статический заряд, они притяги-
вают к себе катионы или анионы.
В результате вокруг коллоидных
частичек образуется двойной
электрический слой. Коллоидная
частичка с двойным электричес-
ким слоем называется мицеллой
(рис. 55). Таким образом, колло-
идные частички обладают способ-
ностью притягивать и удерживать
у своей поверхности ионы.
Способность увеличивать концентрации одного вещества на
поверхности другого называется адсорбцией или просто сорбцией.
На характер и степень сорбции влияют: знак заряда коллоидной
частицы, размер адсорбируемых ионов (для ионов одной и той же
валентности сорбционная способность увеличивается с увеличением
ионного радиуса), валентность иона (чем выше валентность иона,
тем интенсивней он сорбируется) и степень поляризации ионов
(адсорбируемость ионов возрастает с увеличением их поляриза-
ции).
Некоторые коллоидные минералы, например монтмориллонит,
обладают высокой сорбционной способностью. Монтмориллонито-
вые глины используются как природные адсорбенты для очистки
нефтяных продуктов, тканей, шерсти и т. п.
3. Коллоидные частицы легко поглоЩают воду (гидратация кол-
лоидов). Заряженные коллоидные частицы могут удерживать на
своей поверхности не только катионы и анионы, но и слабо диссо-
циированные молекулы воды, которые можно рассматривать как
постоянные диполи (Н — ОН). Такие дипольные молекулы воды
ориентируются вокруг коллоидных частичек, причем ориентировка
их будет противоположной для положительно и отрицательно заря-
женных частиц. Это явление образования оболочек дипольных мо-
лекул вокруг заряженных коллоидных частиц называется гидрата-
цией. Коллоидные частицы как бы обволакиваются пленкой воды.
Коллоиды, частицы которых легко присоединяют к себе воду,
называются гидрофильными (большинство коллоидов являются
гидрофильными). Коллоиды, частицы которых с трудом присоеди-
няют к себе воду, называются гидрофобными (к ним относятся гид-
розоли металлов ихульфидов).
Благодаря явлению гидратации большинство коллоидных мине-
ралов содержит переменное количество воды. (При нагревании этих
80
минералов до температуры 100—300°С происходит удаление
воды.)
Коагуляция коллоидов. По мере испарения дисперсионной среды
коллоидных растворов или нейтрализации коллоидных частичек,
несущих на себе электростатический заряд, происходит сгущение
коллоидных растворов, превращение их в студнеобразную массу —
гель. Этот процесс называется коагуляцией коллоидов.
Коагуляция коллоидных растворов наиболее просто достигается
нейтрализацией заряда коллоидных частиц. В случае, когда части-
цы теряют свой заряд, они при движении сталкиваются друг с дру-
гом, слипаются и укрупняются, что вызывает коагуляцию.
Нейтрализация заряда коллоидных частиц может быть достиг-
нута:
а) в результате действия электролитов, когда заряды коллоид-
ных частиц нейтрализуются катионами или анионами электролита;
б) в результате взаимного свертывания коллоидов, которое про-
исходит при взаимодействии двух коллоидных растворов, имеющих
частички с разными зарядами. В этом случае происходит их совме-
стная коагуляция. Такое явление может произойти в природных
условиях при слиянии двух водных потоков, когда один поток несет
отрицательно заряженные коллоидные частички, например SiO2, а
другой — положительно заряженные частички, например А1(ОН)3.
В результате произойдет взаимное свертывание коллоидных частиц
с образованием осадка, состоящего из смеси мельчайших частиц
SiO2 и А1(ОН)3 (глинистые минералы типа аллофана);
в) при коагуляции под воздействием испарения дисперсионной
среды, что имеет место в природных условиях, соответствующих су-
хому и жаркому климату;
г) при коагуляции в капиллярах, когда коллоидные растворы
протекают по капиллярам, стенки которых, как правило, приобре-
тают отрицательный заряд, что приводит к свертыванию положи-
тельно заряженных частиц.
Особенности коллоидных минералов. Студнеобразные коллоиды,
или гели, характеризуются следующими свойствами: способностью
адсорбировать различные примеси, поглощать воду, изотропностью,
отсутствием явлений дифракции при облучении их рентгеновскими
лучами (т. е. они рентгеноаморфны).
Коллоидные минералы с течением времени вследствие процес-
сов дегидратации и перекристаллизации приобретают скрытокри-
сталлическое строение, т. е. становятся метаколлоидными.
Коллоидные образования имеют вид хлопьевидных масс или же
характеризуются шарообразными или сферическими формами.
В результате раскристаллизации они приобретают радиально-лу-
чистое строение. Часто параллельно-волокнистые агрегаты образу-
ют концентрические кольца причудливой формы или же ритмиче-
ски полосчатые образования. Подобные структуры получили назва-
ние колломорфных.
Коллоидные и метаколлоидные агрегаты возникают также при
образовании в открытых пустотах (сталактиты, сталагмиты, почки).
81
Все коллоидные и метаколлоидные минералы характеризуются
отсутствием спайности, раковистым изломом.
Значительное количество минералов, относящихся к различным
классам (начиная от самородных элементов до силикатов), встре-
чаются в природе в виде коллоидных и метаколлоидных образова-
ний. В табл. 8 приводятся минералы, наиболее часто встречающие-
ся в природе в форме коллоидных и метаколлоидных образований.
ТАБЛИЦА 8
Наиболее распространенные коллоидные минералы
Классы минералов Название коллоидных минералов
Самородные элементы Сульфиды Окислы Золото, самородный мышьяк, самородная сера Ковеллин, сфалерит, марказит, пирит, вюрцит Бёмит, гидраргиллит, диаспор, халцедон, опал, касситерит, настуран, пиролюзит, вад, псиломе-
Карбонаты Фосфаты Силикаты лан, лимонит, гидрогетит, гётит Магнезит, смитсонит, арагонит Вавеллит, бирюза Монтмориллонит, галлуазит, каолинит
ГЛАВА 13
МЕТАМИКТНЫЕ МИНЕРАЛЫ
Метамиктными называются такие минералы, которые имели
кристаллическое строение, а впоследствии, в результате действия
каких-то причин, стали аморфными, сохранив при этом внешне
кристаллическую форму. Каковы же причины, ведущие к образова-
нию метамиктных минералов? В основном их можно разделить на
две группы — внутренние и внешние. К внутренним причинам от-
носятся:
1) наличие в составе минералов радиоактивных элементов, под
воздействием излучения которых происходит разрушение кристал-
лической решетки. Однако известно, что в природе существуют ура-
новые минералы (например, уранинит, урановые слюдки и др.), ко-
торые находятся в кристаллическом состоянии и не являются мета-
миктными. Следовательно, наличие только одного радиоактивного
излучения еще недостаточно для образования метамиктных мине-
ралов;
2) кристаллическая решетка минерала должна быть с ослаблен-
ными химическими связями. Метамиктный распад осуществляется,
согласно В. М. Гольдшмидту, в соединениях слабых кислот и сла-
бых оснований (например, титано-тантало-ниобатах, цирконе и др.).
Из этих двух причин основной является первая. Доказательст-
вом того, что метамиктные превращения происходят под воздей-
82
ствием радиоактивного облучения, служат проведенные в последние
годы эксперименты по искусственному превращению кристалличе-
ских тел в метамиктное состояние при облучении их в ядерных
реакторах.
В природе метамиктным превращениям способствуют иногда и
внешние факторы, приводящие к еще большему ослаблению связей
между ионами в кристаллической решетке. К таким внешним фак-
торам относятся: резкое повышение окислительного потенциала,
гидратация, явление выщелачивания катионов и др. При наличии
внутренних факторов (радиоактивных элементов, ослабленных свя-
зей в решетке) внешние причины могут ускорить процесс перехода
кристаллического минерала в метамиктное состояние. Как пока-
зали проведенные в последние годы детальные исследования, при
метамиктных превращениях происходит смещение ионов из узлов
кристаллической решетки, т. е. переход в неупорядоченное стек-
лоподобное состояние.
Метамиктные минералы характеризуются почти одинаковыми
физическими свойствами, макроскопически мало отличаясь друг
от друга. Для них характерен коричневый, бурый, иногда черный
цвет, реже они бывают темно-зелеными, желтыми. Твердость их
порядка 6—7, характерно отсутствие спайности, раковистый излом,
в изломе они напоминают темноокрашенные стекла. Оптически они
всегда изотропны. При рентгеновских исследованиях ведут себя как
аморфные тела. Диагностируются они главным образом с помощью
рентгеноструктурного и термического анализов. Применение.послед-
него основано на одном из замечательных свойств метамиктных
минералов, которое заключается в том, что при нагревании до оп-
ределенной температуры они восстанавливают свою кристалличес-
кую структуру. Следует отметить, что превращение метамиктных
минералов в исходное кристаллическое состояние всегда сопровож-
дается выделением значительного количества тепла, т. е. носит рез-
ко выраженный экзотермический характер. После превращения в
исходное кристаллическое состояние минерал приобретает свойства,
которые он имел до метамиктного превращения, и может быть
подвергнут всестороннему исследованию. В заключение приведем
наиболее распространенные метамиктные минералы:
Титано-тантало-ниобаты
Силикаты
Пирохлор
Фергюсонит
Эвксенит
Самарскит
Эшинит
Циркон, содержащий примеси урана и тория
(циртолит, малакон)
Торит
Ортит
Г адолинит
Бритолит
Итриалит
k Чивкинит
83
ГЛАВА 14
ГЕНЕЗИС МИНЕРАЛОВ
В результате каких геологических процессов образовались ми-
нералы и горные породы? Как протекают эти процессы в природе?
Полные ответы на эти вопросы Вы найдете в курсах петрологии и
месторождений полезных ископаемых.
Ниже даются краткие сведения по процессам минерйлообразо-
вания.
Все многочисленные процессы, в результате которых происхо-
дит образование минералов, можно разделить на три большие
группы.
1. Эндогенные процессы, происходящие внутри Земли и связан-
ные с магматической деятельностью. Минералообразование проте-
кает в условиях высоких температур и больших давлений. Эти про-
цессы весьма сложны и большей частью недоступны непосредствен-
ным наблюдениям (за исключением вулканических процессов).
2. Экзогенные процессы, протекающие на поверхности Земли в
основном за счет солнечной энергии. Минералообразование проис-
ходит в условиях нормального давления и низких температур.
3. Метаморфические процессы, происходящие на различных глу-
бинах в результате преобразования ранее сформировавшихся гор-
ных пород при изменении физико-химических условий (температу-
ры, давления и концентрации химических компонентов). Метамор-
физму подвергаются породы и минералы, возникшие как в эндоген-
ных, так и в экзогенных условиях.
Следует оговориться, что в природе нет четких границ между
всеми названными процессами, они тесно между собой связаны.
Примером минералообразования, связанным с развитием одновре-
менно нескольких процессов, может служить осадконакопление на
дне морей и океанов при подводных извержениях вулканов. Естест-
венно, что при этом образуется осадочная порода, но вместе с ти-
пично осадочным материалом она состоит в значительной степени
из пепла, а слои осадочных пород часто перемежаются с потоками
лав. Таковы, например, осадочно-вулканогенные образования.
Эндогенные процессы
Все эндогенные процессы в зависимости от физико-химических
условий, в которых они протекают, делятся на магматические и
постмагматические.
Магматический процесс охватывает все явления, происхо-
дящие при кристаллизации магмы. Этот процесс протекает при
высоких давлениях и температурах свыше 600—700° С.
Постмагматический процесс объединяет все явления, про-
исходящие после кристаллизации основной части магмы, когда маг-
матический расплав обогащается летучими компонентами и пере-
ходит в надкритическое состояние и далее в водный раствор.
84
Все постмагматические процессы в свою очередь могут быть раз-
делены на следующие.
Пегматитовый — процесс кристаллизации остаточного расплава,
обогащенного летучими компонентами, протекающий при темпера-
туре ниже 700° С и приводящий к образованию специфических пород
крупнокристаллического строения, называемых пегматитами.
Пневматолито-гидротермальный процесс охватывает явления,
связанные с выделением минералов из надкритического раствора-
флюида, при этом, если первоначально минералы выделяются
непосредственно из газовой фазы, то при понижении температуры
и переходе флюида в гидротермальный раствор образование мине-
ралов происходит уже непосредственно из водного раствора еще
при относительно высокой температуре (примерно 500°С).
Некоторые ученые (В. А. Николаев и др.) выделяют особый
пневматолитовый процесс, относя к нему процесс образования ми-
нералов непосредственно из газовой фазы (например, кристаллиза-
ция минералов, в частности самородной серы в кратерах вулканов
путем возгона), другие отрицают необходимость выделения особого
пневматолитового процесса, считая, что он имеет место только в
вулканах, а в глубинных образованиях самостоятельно развиваться
не может. Поскольку, однако, надкритические явления имеют место
при высоких давлениях, то, по-видимому, правильней говорить о
пневматолито-гидротермальном процессе, понимая под ним явления
минералообразования из растворов, находящихся в надкритическом
состоянии при одновременном существовании газа и жидкости.
Гидротермальный процесс — образование минералов происходит
из нагретых водных (гидротермальных) растворов, возникновение
которых связано в основном с магматической деятельностью. Про-
цесс протекает при температурах порядка 400—100° С.
Магматический процесс. Как было отмечено выше, магматичес-
кий процесс протекает в условиях высоких температур.
Образование минералов и горных пород происходит в резуль-
тате застывания силикатного расплава, называемого магмой. С точ-
ки зрения физической химии, магма представляет собой многоком-
понентную силикатную систему, содержащую газовую фазу. В маг-
ме может находиться в растворенном состоянии до 8—10% газовой
фазы (летучих компонентов).
В настоящее время можно только предполагать, что химические
элементы находятся в расплаве в виде комплексных анионов
[SiOJ, [AIOJ, [AlSiO4], [AlSiaOs] и свободных катионов металлов
(Na1*, Са2*, Mg2*, Fe2*, Fe3* и т. д.).
Что касается газовой фазы (летучих компонентов), то она пред-
ставлена в большей или меньшей степени диссоциированной водой,
а также СО2, СН4 и др.
В результате понижения температуры магматического расплава
в первую очередь начинают кристаллизоваться наиболее тугоплав-
кие безводные минералы, в частности, оливин, ромбические и моно-
клинные пироксены, нефелин, апатит, полевые шпаты, гранат и др.,
85
а также рудные минералы — пирротин, пирит, магнетит, пентландит,
ильменит, самородная платина и др.
В течение длительного времени между геологами дискутировал-
ся вопрос, образовались ли все разнообразные изверженные породы
из одной магмы или же из нескольких различных по составу магм.
Некоторые ученые (Боуэн) предполагали, что существует только
одна ультраосновная магма, которая, дифференцируясь, дает нача-
ло ряду различных по составу магм; другие предполагали, что су-
ществуют две родоначальные магмы (основная и кислая), и, нако-
нец, современные геофизические исследования дают основание ут-
верждать, что существует три типа магмы (ультраосновная, или
перидотитовая, основная, или базальтовая, и кислая, или гранитная).
Ультраосновная магма возникает в верхних частях мантии на
глубинах от 10—15 (на жестких платформах, кристаллических щи-
тах и океанах) до 40—60 км (в складчатых областях) ниже раздела
Мохоровичича («линия Мохо»).
Основная магма зарождается в нижних частях земной коры на
глубинах от 7—12 (на платформах и щитах, в некоторых районах
непосредственно под дном океанов) до 20—40 км (в складчатых
районах) в области, ограниченной линией Мохо и разделом Конра-
да. Наконец, кислая магма зарождается на глубинах от 4—5 до
15—20 км в верхних частях земной коры и преимущественно в
складчатых областях.
Возникает вопрос, почему в природе такое разнообразие горных
пород, когда существует так мало родоначальных магм?
Причину разнообразия магматических пород следует искать в
развитии самой магмы, в изменении ее состава. Предполагают
несколько путей развития (разделения) магм.
Ликвация заключается в разделении одной силикатной маг-
мы на несколько несмешивающихся между собой магм, различных
по составу. Этот процесс подобен разделению нагретой смеси воды
и жира при понижении температуры на две несмешивающиеся жид-
кости. Аналогичным образом при понижении температуры до
1500° С происходит разделение первичной магмы на сульфидную и
силикатную. В результате такого разделения среди основных сили-
катных пород появляются капли сульфидных минералов, которые,
концентрируясь, могут образовывать месторождения никеля и меди.
Примерами ликвационных месторождений являются медно-никеле-
вые месторождения Садбери (Канада) и Норильское (СССР).
При формировании горных пород этот процесс большого значе-
ния не имеет.
Кристалли з аци он н ая (гравитационная) диффе-
ренциация заключается в том, что сначала из магмы выкристал-
лизовываются тугоплавкие безводные темноцветные преимущест-
венно железисто-магнезиальные минералы, характеризующиеся,
как правило, большим удельным весом, бедные кремнекислотой.
Эти минералы опускаются в более глубокие части магматического
бассейна, при этом первоначальная магма теряет соединения маг-
ния, железа и обогащается соединениями кальция и алюминия, ще-
86 .
лочами, кремнекислотой и летучими компонентами. Следует учесть
и то обстоятельство, что ранее выделившиеся минералы могут реа-
гировать с окружающей их магмой и снова изменять состав послед-
ней. Таким образом, состав родоначальной магмы в процессе ее
эволюции претерпевает, значительные изменения.
В результате кристаллизационной дифференциации образуются
месторождения платины и хромитов (Южная Африка, Урал).
Ассимиляционная дифференциация. На изменение
состава магмы влияют процессы ее взаимодействия с окружающи-
ми породами. Последние могут расплавляться и изменять состав
магмы. Так, например, при внедрении гранитной магмы в основные
породы магма будет обогащаться кальцием, магнием и железом.
Этот процесс носит название ассимиляции, или контаминации.
Минералы, образующиеся в результате магматического процес-
са, принято делить на главные, или породообразующие, акцессор-
ные и вторичные.
К породообразующим относятся минералы, принимающие суще-
ственное участие в составе горной породы и определяющие ее при-
надлежность к классификационной группе.
Породообразующие минералы в зависимости от содержания в
них основных химических компонентов Fe, Mg, Al, Si и др. подраз-
деляют на мафические (меланократовые), или темноцветные, и са-
лические (лейкократовые), или светлоцветные. К мафическим, или
темноцветным, относятся минералы, в составе которых главную
роль играют железо и магний. Это минералы группы оливина, пи-
роксенов, амфиболов, биотита и рудные. К салическим, или светло-
цветным, принадлежат минералы, характеризующиеся повышенным
содержанием кремния, алюминия, кальция и щелочей. К ним отно-
сятся кварц, полевые шпаты, нефелин, цеолиты и др. Несмотря на
то что большинство мафических минералов характеризуется тем-
ной окраской, а салических светлой, можно встретить темно-дымча-
тый кварц и, наоборот, светлый амфибол. Поэтому термин «светло-
цветный» или «темноцветный» приобретает условное значение, свя-
занное с химическим составом минералов.
К акцессорным относятся минералы, встречающиеся в породе в
незначительных количествах (не более 1%). Эти минералы, хотя и
не определяют название горной породы, служат корреляционным
признаком для сопоставлений различных массивов. Примером ак-
цессорных минералов являются циркон, магнетит, ильменит, сфен,
апатит, рутил, монацит и др.
И, наконец, ко вторичным относятся минералы, образовавшиеся
под влиянием различных агентов, действующих на породы после
их образования, т. е. вторичные минералы возникают за счет изме-
нения первичных. Так, например, по плагиоклазам могут развивать-
ся эпидот, пренит, цоизит, серицит; по оливину — серпентин, по
пироксенам — амфиболы и хлорит; по нефелину — канкринит, сода-
лит, цеолиты и т. д.
В результате экспериментальных исследований в области кри-
сталлизации расплавов и изучения минерального состава горных
87
пород Боуэн выдвинул принцип, объясняющий процесс кристаллиза-
ции минералов из магмы. Этот принцип заключается в том, что ми-
нералы, выпадающие из силикатного расплава, тесно связаны с
остаточной магмой и по мере ее дифференциации реагируют с ней
и выпадают из магмы, сменяя друг друга в определенной последо-
вательности. В результате реакции между остаточной магмой и вы-
делившимися минералами образуются реакционные каемки одного
минерала вокруг другого. Эта последовательность выделения ми-
нералов была представлена Боуэном в виде схемы, названной его
именем.
Схема Боуэна
Оливин
Са Мд Пироксен
Амфибол
биотит
Анортит
и
битовнит
! я
Лабрадор
/
Андезин
/
Олигоклаз
/
Альбит
V
Калиевый полевой шпат
Кварц
В зависимости от условий застывания магматические горные
породы делят на интрузивные, или глубинные, и эффузивные, или
излившиеся.
Интрузивные породы образовались на значительных глубинах
в условиях высоких температур, больших давлений при медленном
охлаждении магматического расплава. Эффузивные породы сфор-
мировались около земной поверхности при незначительном давле-
нии (близком к атмосферному) и быстром охлаждении расплава.
Магматический процесс приводит, в основном, к образованию
изверженных горных пород, состоящих из минералов, небольшая
часть которых используется промышленностью в качестве рудного
сырья (см. табл. 9).
Пегматитовый процесс, как отмечалось, представляет собой
процесс развития остаточного расплава — раствора, оставшегося
после кристаллизации магматических пород. Он протекает при зна-
чительных давлениях и начинается при температуре порядка 700° С.
В ходе этого процесса образуются пегматиты (или, как их часто
называют, пегматитовые жилы), под которыми понимают глубин-
88
ТАБЛИЦА 9
Краткая характеристика основных типов магматических пород
Тип пор’од Химическая характеристи- ка (содержа- ние SlOi), % Название интрузивных пород Название эффузивных пород Главнейшие породообразую- щие минералы Главнейшие акцессорные минералы Главнейшие вторичные минералы Главные минералы промышленного значения
лейкократовые (салические) меланократо- вые (мафиче- ские )
Ультраос- новные <45 Дунит Пироксенит Пикрит — Оливин Пироксен Хромит, магнетит Серпентин, асбест, тальк Хромит, платина, ал- мазы
Основные 45—55 Габбро Базальт Плагиоклаз (основной) Пироксены, амфибол Апатит, магнетит, ильменит Уралит, эпидот Ni — Си — сульфид- ные руды (пент- ландит 4- халькопи- рит), титаномагне- тит
Средние 55-65 Диорит Андезит Плагиоклаз (средний) Роговая обманка Апатит, циркон Хлорит, серицит Золото
Кислые 65-75 Гранит Липарит, кварцевый порфир Плагиоклаз (кислый) микроклин, кварц Биотит, роговая обманка Апатит, циркон, монацит, ильменит, флюорит Серицит Касситерит, колумбит, берилл
Щелочные 62—55 Нефелино- вый сиенит Фонолит Микроклин, альбит, нефелин Эгирин, Na-роговые обманки Сфен, иль- менит, лопа- рит, апатит Канкринит Апатит, нефелин, лопарит
ные породы, имеющие состав, близкий к родоначальным магмати-
ческим породам и отличающиеся от них лишь крупными размерами
минеральных зерен. Следует отметить, что пегматиты наблюдаются
среди магматических пород самого различного состава, но наиболь-
шим распространением они пользуются в кислых и щелочных по-
родах.
До настоящего времени нет единой точки зрения на образование
пегматитов. Наиболее полно пегматитовый процесс освещен клас-
сическими работами акад. А. Е. Ферсмана, согласно которым пег-
матитовый процесс заключается в кристаллизации остаточных
расплавов, обогащенных летучими компонентами.
Выше было указано, что в ходе магматического процесса про-
исходит образование горных пород, причем их разнообразие
объясняется, в основном, дифференциацией магмы. К концу маг-
матического процесса в верхних или краевых частях интрузивов
накапливается остаточный расплав, обогащенный летучими компо-
нентами и редкими элементами. Повышенное содержание в оста-
точных магмах редких элементов объясняется тем, что ионные ра-
диусы последних имеют или очень большие, или очень малые
размеры по сравнению с элементами, входящими в состав
магматических пород. Необходимо также отметить, что присутствие
большого количества летучих компонентов в остаточном расплаве
сильно снижает его вязкость, и тем самым создается благоприятная
среда для роста крупных кристаллов.
Процесс кристаллизации остаточного расплава А. Е. Ферсман
разделяет на три этапа:
1) эпимагматический (при температуре до 600° С>,
2) пневматолитовый (при температуре до 400° С);
3) гидротермальный (при температуре ниже 400°С).
Итак, весь ход пегматитового процесса обусловлен постепенным
охлаждением расплава, начиная от температуры порядка 700° С.
А. Е. Ферсман разделил процесс пегматитообразования на ряд
стадий (геофаз), каждая из которой охватывает температурный
интервал в 100° С. Для каждой стадии характерны определенные
парагенетические ассоциации минералов, которые закономерно
сменяют друг друга на всем протяжении процесса. В тех случаях,
когда один и тот же минерал выделяется на разных стадиях, он в
каждой ассоциации приобретает свои характерные типоморфные
особенности. Вначале расплав кристаллизуется как любая гранит-
ная магма, причем остаточный расплав все время обогащается
кремнекислотой и летучими компонентами, в первую очередь, водой.
После выделения основной массы кварца, образующего в ряде слу-
чаев гигантские скопления в центральных частях пегматитовых тел
(«кварцевые ядра»), остаточный расплав настолько обогащается
водой, что переходит в гидротермальный раствор.
Точка зрения А. Е. Ферсмана в целом разделяется многими со-
временными учеными и получила дальнейшее развитие в работах
чл. корр. АН СССР К. А. Власова, проф. А. И. Гинзбурга -и др.
Вторая гипотеза принадлежит советскому петрографу акад.
90
A. H. Заварицкому, который отрицает существование особого пег-
матитового расплава и высказывает мысль, что в последнюю фазу
кристаллизации магмы, в момент, когда внутреннее давление, раз-
виваемое летучими компонентами, становится больше внешнего,
происходит вскипание магмы, и она превращается в газ, с которым
выделившиеся до этого твердые минералы находятся первоначально
в равновесии. Этот газовый раствор, проникая по трещинам и по-
рам, перекристаллизовывает мелкозернистые вмещающие материн-
ские породы (аплиты, граниты, сиениты и др.) в крупнозернистые
пегматиты. В дальнейшем газовый раствор переходит в гидротер-
мальный, из которого начинают выпадать в осадок некоторые ми-
нералы. Одновременно эти растворы взаимодействуют с ранее воз-
никшими минералами пегматитов, растворяя некоторые из них и
образуя новые, т. е. происходит процесс метасоматоза. К этому
последнему этапу А. Н. Заварицкий относит появление в пегмати-
тах минералов редких элементов.
Существует также гипотеза об образовании пегматитов метасо-
матическим путем, впервые выдвинутая американскими геологами
В. Шеллером, Ф. Хессом ’и К. Ландесом. По мнению этих ученых,
образование пегматитов протекает в два этапа. На первом этапе
происходит кристаллизация минералов из пегматитового расплава,
при этом возникают простые крупнозернистые пегматиты, состоя-
щие из кварца и полевых шпатов. Затем под влиянием поступаю-
щих по трещинам гидротермальных растворов образуются более
сложные пегматиты — письменные граниты с редкими минералами
и слюдами, т. е. главную роль на втором этапе играют метасомати-
ческие процессы.
К высказанной А. Н. Заварицким, а также В. Шеллером и
Ф. Хессом точкам зрения близки и взгляды проф. В. Д. Никитина,
который считал, что пегматиты возникают первоначально путем пе-
рекристаллизации гранитов и аплитов, а затем развития метасома-
тических процессов, протекающих под воздействием поступающих
из глубин гидротермальных растворов, привносящих основную мас-
су рудных компонентов. Согласно В. Д. Никитину, растворы, про-
изводящие метасоматические преобразования в пегматитах, ничем
не отличаются от растворов, дающих начало рудным жилам.
Пегматитовые тела, как правило, формируются на глубинах от
2,5 до 8 км от земной поверхности и характеризуются различными
размерами, доходящими по протяженности до нескольких километ-
ров, а по мощности до 40—50 м.
Формы пегматитовых тел очень разнообразны, но наиболее час-
то наблюдаются жилообразные, линзообразные и плитообразные
тела, реже трубчатые.
Обычно пегматиты не встречаются в виде одиночных тел, а об-
разуют пегматитовые поля, протягивающиеся нередко на многие
десятки километров. Очень характерно для пегматитов зональное
строение (рис. 56).
Минеральный состав пегматитов крайне разнообразен; по дан-
ным А. Е. Ферсмана, в гранитных пегматитах встречается более
91
4
Рис. 56. Схема строения пегматитовой жилы:
/ — контактовая зона мелкозернистого пегматита (аплитовая зона); 2 — зо-
на среднезернистого и графического (письменного) пегматита; 3 — зона
апографического пегматита; 4 — зона блокового пегматита; 5 — кварцевое
ядро; 6 — граниты
280 минералов, часть которых представляет большой практический
интерес, так как содержит такие элементы, как ниобий, тантал, ли-
тий, бериллий, рубидий, цезий, группу элементов редких земель и
др. В табл. 10 приведена краткая характеристика минерального
состава гранитных и щелочных пегматитов.
Пневматолито-гидротермальный процесс, как отмечалось выше,
протекает в интервале температур примерно от 500 до 350° С и ох-
ватывает явления, связанные с выделением минералов из надкри-
тического раствора-флюида. Следует отметить, что первоначально
минералы выделяются непосредственно из газовой фазы, и лишь
при понижении температуры и переходе флюида в гидротермальный
раствор образование минералов происходит непосредственно из вод-
ного раствора при высокой температуре.
В настоящее время считают, что чисто пневматолитовые процес-
сы («пневма» в переводе с греческого означает — газ) могут иметь
место только в условиях низкого давления, т. е. в условиях, близ-
ких к вулканическим. Минералы, образующиеся при этих процес-
сах, крайне немногочисленны, хотя и своеобразны — это самород-
ная сера, нашатырь, хлориды, фториды, значительно реже реальгар
и гематит.
При больших давлениях и при температурах от 500 до 350° С
возможно одновременное существование газа и жидкости, поэтому
такие растворы, находящиеся в надкритическом состоянии *, назы-
ваются пневматолито-гидротермальными (газо-водными).
Отделившиеся от магмы на постмагматическом этапе растворы
содержат много растворенных газовых компонентов и сильно ми-
нерализованы.
Появление в пневматолито-гидротермальных растворах высоких
концентраций рудных элементов может быть связано с различными
явлениями:
а) рудные элементы могут приноситься растворами из больших
глубин (из верхних слоев мантии);
* Как известно, критическая температура чистой воды равна 374,16° С.
92
ТАБЛИЦА 10
Основные минералы главных типов пегматитов
Типы пегматитов Глубина обра- зования, км Главные породообразующие минералы Второстепенные и акцессор- ные минералы Минералы промышленного значения
Редкоземельный (весь- >8 Гранитные Микроклин, плагиоклаз, пегматиты Биотит, колумбит, уранинит, роговая Самарскит, монацит
ма больших глубин) Мусковитовый (больших 6-8 кварц Плагиоклаз, микроклин, обманка, циркон, монацит рутил, сфен, магнетит, ортит Турмалин (шерл), мусковит, апатит, Мусковит
глубин) Редкометальный (сред- них глубин): тантало-бериллиевый 3-6 кварц Микроклин, альбит, биотит, дистен, уранинит, монацит, берилл Берилл, колумбит-танталит, касси- Берилл, колумбит-танта-
сподуменовый или ли- 3-6 кварц Микроклин, кварц, сподумен, альбит терит, мусковит, турмалин, апатит Лепидолит, розовый турмалин, топаз, апатит, танталит, поллуцит, амбли- гонит, воробьевит (цезиевый бе- рилл) Кварц (в пустотах), топаз, берилл, лит, касситерит Сподумен, лепидолит,
тиевый поллуцит, колумбит-
Хрусталеносный (малых 3-2,5 Микроклин, кварц танталит, касситерит, берилл Пьезокварц, оптический
глубин) Щелочной пегматит Щелочные Нефелин, микроклин, флюорит, альбит пегматиты Биотит, арфведсонит, мурманит, эвди- флюорит Нефелин, циркон, пиро-
СО СО альбит, эгирин, сода- лит алит, натролит, лопарит, ильменит, апатит, сфен, циркон, содалит, пиро- хлор хлор
б) рудные компоненты способны накапливаться в остаточных
расплавах и поровых растворах после кристаллизации основной
массы пород;
в) рудные элементы могут высвобождаться («мобилизоваться»)
из породообразующих и акцессорных минералов магматических по-
род при развитии в последних явлений замещения;
г) рудные элементы могут выщелачиваться («мобилизовать-
ся») из вмещающих осадочных и метаморфических пород при про-
хождении через них пневматолито-гидротермальных растворов и
переотлагаться этими растворами на пути следования.
Для пневматолито-гидротермальных растворов характерно на-
личие таких летучих компонентов, как Н2О, F, О, В, СО2 и т. д.
Эти летучие, в основном, и определяют развитие пневматолито-ги-
дротермального процесса, поскольку они являются переносчиками
(транспортными агентами) минералообразующих и рудообразую-
щих веществ.
Существует несколько точек зрения на форму переноса рудных
компонентов в водных растворах.
Долгое время считали, что рудные компоненты выносятся в виде
летучих соединений — простых фторидов или хлоридов (например,
SnF4). Однако при изучении ряда месторождений было обнаружено
незначительное количество фтора или хлора, которое не в состоянии
перенести громадные массы рудных элементов. Кроме того, фтори-
ды и хлориды большинства металлов имеют весьма высокую темпе-
ратуру возгона.
Некоторые ученые считают, что вынос рудного вещества осущест-
вляется коллоидными растворами, в которых твердые частицы явля-
ются дисперсной фазой. Согласно данной теории, минералы, обра-
зованные в результате этих процессов, первоначально были колло-
идными, а затем подверглись процессам перекристаллизации,
доказательством чего являются наблюдаемые в отдельных случаях
остатки колломорфных структур в минералах.
В настоящее время экспериментальными исследованиями дока-
зано, что пневматолито-гидротермальные, а также и гидротермаль-
ные растворы переносят в большинстве случаев рудные элементы в
форме комплексных соединений, состав которых может быть выра-
жен в следующем общем виде:
Ап1ВтХр\
где группа [ВтХр] представляет собой комплексный анионный ра-
дикал; А—элемент, находящийся во внешней сфере комплекса;
В— элемент внутренней сферы комплекса (центральный ион) и
X — анион-аденд.
В состав элементов группы А входят обычно К, Na, Li, Rb, Cs,
реже Mg, Ca, Ba, Sr, Zn, Cu, Ag и др. В состав группы В — Si, Al,
Be, Та, Mo, Sn, В, С, Р, As, Сг, V, Ti, Nb и др., в состав груп-
пы X — F, С1, О, S2-, (ОН).
Следует отметить, что комплексные соединения, находящиеся
в растворах, устойчивы только в известном интервале давления и
94
температур, а также при определенных значениях pH. В случае же
изменения вышеуказанных параметров (особенно pH) комплексные
соединения начинают разрушаться, и происходит процесс минера-
лообразования.
Пневматолито-гидротермальные процессы протекают обычно в
интервале глубин от 2 до 3, реже 4 км, постепенно затухая с глу-
биной.
Выше были рассмотрены условия, при которых возникают пнев-
матолито-гидротермальные растворы, а также их особенности и
состав. Каков же механизм возникновения минералов и руд из
пневматолито-гидротермальных растворов? Минералообразование
может осуществляться в основном двумя путями: 1) в результате
взаимодействия растворов с твердыми вмещающими породами, т. е.
метасоматическим путем; 2) вследствие осаждения минералов из
растворов в открытых трещинах и полостях.
1. Образование минералов путем метасоматоза весьма типично
для пневматолито-гидротермальных процессов. Происходит оно
при просачивании растворов по тончайшим порам пород и реак-
ционном взаимодействии поровых растворов с минералами вмеща-
ющих пород. Естественно, что такое взаимодействие возможно при
химической активности раствора и реагирующих с ним пород. Мета-
соматоз происходит с растворением ранее существовавших мине-
ралов и почти одновременном замещении их новыми. Преобразуе-
мые породы в течение всего процесса сохраняют твердое состояние.
Растворы, осуществляющие замещение, привносят минералообра-
зующие и выносят замещенные компоненты.
Явления метасоматоза начинаются еще в конце магматического
процесса, после кристаллизации значительной части расплава. Вы-
звано это тем, что в- остаточной магме накапливаются летучие ком-
поненты, которые реагируют с ранее выделившимися минералами
и частично их замещают. Этот процесс носит название позднемаг-
матического замещения.
После кристаллизации расплава, например гранитного, остаточ-
ный надкритический раствор, находящийся в порах породы, может
реагировать с раскристаллизовавшимся гранитом. Подобные явле-
ния относятся к автометасоматическим. Поскольку остаточные раст-
воры обогащены чаще всего летучими компонентами и характери-
зуются кислотными свойствами, они реагируют с минералами гра-
нита, содержащими щелочные компоненты. В гранитах такими
минералами являются калиевый полевой шпат и плагиоклаз, кото-
рые замещаются мусковитом и кварцем. Например, преобразование
калиевого полевого шпата может происходить по следующей схеме:
ЗК [ А1S13О8] -J- Н2О=КА12 [AlSi3O10l (ОН)2+6S1O2 - Ь КгО
Калиевый Мусковит Кварц
полевой шпат
Одновременно происходит замещение биотита К (Mg, Fe)3X
X[AlSi3Oio] (ОН) 2 мусковитом KAl2[AlSi3Oio}(OH)2. Процесс
взаимодействия гранитов с остаточными растворами с образовани-
95
ем пород, богатых кварцем, мусковитом и другими минералами,
содержащими летучие компоненты, носит название грейзени-
зации.
В процессе грейзенизации некоторые рудные элементы, рассеян-
ные в минералах гранита— биотите (Sn, Та, Nb), плагиоклазе (Be,
Y, Се), будут высвобождаться и давать самостоятельные минералы.
Таким путем могут образоваться касситерит, берилл, колумбит и др.
Часть рудных элементов сохраняется в постмагматических раство-
рах в форме сложных комплексных соединений и при изменении
физико-химических условий выделяется в виде самостоятельных
минералов. Явления грейзенизации гранитов сопровождаются обра-
зованием мусковит-кварцевых, топаз-кварцевых, турмалин-муско-
вит-кварцевых пород — грейзенов.
Пневматолито-гидротермальные растворы легко проникают во
вмещающие гранитный массив породы, вызывая в них изменения.
Особенно значительные преобразования происходят при просачи-
вании растворов через карбонатные породы. В частности на контак-
тах известняков и гранитов под воздействием пневматолито-гидро-
термальных растворов за счет замещения известняков и гранитов
возникают своеобразные контактовые породы — скарны. Последние
состоят из силикатов Са, Mg, Fe и Al (пироксена, граната, везувиа-
на и др.) и рудных минералов магнетита, шеелита, сфалерита, га-
ленита, молибденита.
Под действием богатых фтором растворов известняки иногда
преобразуются во флюорит-слюдистые породы, содержащие, поми-
мо флюорита, бериллиевые минералы — фенакит, хризоберилл. При
просачивании подобных растворов по ультраосновным породам, в
частности по пироксенитам, кальций, входящий в состав моноклин-
ных пироксенов, переходит в раствор и отлагается в виде карбонат-
ных минералов (например, кальцита), а по пироксенам развивается
флогопит.
2. При просачивании растворов по трещинам в условиях резко-
го падения давления (связанного с раскрытием трещин) непосред-
ственно из растворов происходит осаждение минералов на стенках
трещин. Таким путем образуются касситерит-кварцевые, берилл-
топаз-кварцевые, вольфрамит-кварцевые жилы или серии маломощ-
ных различно ориентированных прожилков того же состава; серия
таких прожилков называется штокверком.
При развитии пневматолито-гидротермального процесса обра-
зуется целая гамма различных минералов. Так, характерными по-
родообразующими минералами, возникающими в результате выпол-
нения жил или замещения гранитных пород и сланцев, являются
кварц, мусковит, топаз, иногда альбит, литиевые слюды, турмалин.
Рудные минералы представлены касситеритом, вольфрамитом, бе-
риллом, молибденитом, колумбитом и др.
При замещении карбонатных пород и образовании скарнов ти-
пично появление таких минералов, как пироксены, гранаты, везуви-
ан, волластонит, скаполит, эпидот, кальцит, иногда флюорит, мар-
гарит, мусковит, турмалин. Практическое значение в этих ассоциа-
96
циях имеют магнетит, сфалерит, галенит, молибденит, а также
флюорит и бериллиевые минералы.
Изменение ультраосновных пород сопровождается образованием
флогопита, диопсида, апатита и кальцита, из которых большое
практическое значение имеет флогопит.
Гидротермальный процесс охватывает все явления образования
минералов из нагретых водных (гидротермальных) растворов. Про-
цесс протекает в интервалах температур от 400—350° С вплоть до
температур, близких к поверхностным.
Вода, принимающая участие в гидротермальном минералообра-
зовании, может быть связана как с магматической деятельностью —
ювенильные воды, так и с поверхностными явлениями — вадозные
воды. Последние могут проникать на значительные глубины и на-
греваться за счет внутренней энергии Земли. Кроме того, в гидро-
термальном процессе может играть роль и вода, связанная с мета-
морфогенными процессами. Так, например, вода, входящая в
состав глин, в результате метаморфических преобразований может
освободиться при повышении температуры и дать начало гидротер-
мальным растворам.
Причины повышенной минерализации и образования минералов
из гидротермальных растворов во многом сходны с таковыми для
пневматолито-гидротермальных процессов (см. выше «Пневматоли-
то-гидротермальный процесс»). Особенностью гидротермального
процесса является то, что он происходит при более низких темпера-
турах и давлениях. Минеральные ассоциации образуются как в ре-
зультате отложения на стенках трещин и пустот, по которым цир-
кулируют гидротермальные растворы, так и метасоматическим
путем.
Гидротермальный процесс делят на три этапа:
1) высокотемпературный, или гипотермальный, процесс проте-
кает на относительно больших глубинах (до 3—4 км), характери-
зуется относительно высокой температурой (порядка 300—400° С)
и значительным давлением. Породообразующие минералы (слагаю-
щие гидротермальные жилы) представлены, в основном, кварцем
и калиевым полевым шпатом, иногда встречается мусковит, цинн-
вальдит, топаз. Из рудных минералов наиболее характерны касси-
терит, вольфрамит, молибденит, берилл, висмутин, самородное зо-
лото, арсенопирит, пирит, шеелит;
2) среднетемпературный или мезотермальный процесс протека-
ет при температурах порядка 200—300° С. Жилы в этом случае сло-
жены карбонатами (кальцитом, анкеритом), реже баритом. Рудные
минералы представлены галенитом, пирротином, сфалеритом, халь-
копиритом, молибденитом, касситеритом, блеклыми рудами и др.
Типичными околорудными процессами изменения являются оквар-
цевание, серицитизация, хлоритизация, элидотизация, кальци-
тизация;
3) низкотемпературный, или эпитермальный, процесс протекает
при температурах ниже 200° С и незначительном давлении на малых
глубинах. Основные породообразующие минералы, слагающие эпи-
4—3628 97
термальные жилы, представлены баритом, флюоритом, халцедоном
и низкотемпературным кварцем. Из рудных минералов наиболее
типичны киноварь, реальгар, аурипигмент, никелин, самородное се-
ребро, 1пирит, марказит, теллуриды золота.
Следует отметить, что в близповерхностных условиях большую
роль приобретают процессы минералообразования из коллоидных
растворов (встречаются коломорфные образования пирита, марка-
зита, сфалерита, антимонита).
Экзогенные процессы
Экзогенные процессы минералообразования совершаются на
поверхности Земли за счет солнечной энергии. Эти процессы сво-
дятся к выветриванию и разрушению ранее образовавшихся горных
пород и минералов, их переносу и накоплению осадков, а также к
образованию новых вторичных минералов.
Экзогенные процессы охватывают следующие явления:
1) процессы выветривания, которые в свою очередь подразде-
ляются на процессы физического и процессы химического выветри-
вания;
2) осадочные процессы — механические и химические осадки.
Процессы физического и химического выветривания и связанное
с ними минералообразование. Физическое выветривание горных по-
род заключается в их механическом разрушении под действием
колебаний температуры как сезонной, так и суточной. Так, напри-
мер, летом породы нагреваются и расширяются, зимой охлаждают-
ся и сжимаются, причем разные минералы имеют различные коэф-
фициенты расширения, что, естественно, ускоряет процессы разру-
шения. Сначала возникают небольшие трещины, в которые
проникают атмосферные осадки; зимой вода замерзает, увеличива-
ется в объеме и разрушает горные породы. Наиболее интенсивно
физическое выветривание протекает в районах с резко континен-
тальным климатом.
Химическое выветривание состоит в том, что атмосферные воды,
которые содержат в растворенном состоянии кислород, углекислый
газ и другие компоненты, просачиваясь по трещинам горных пород,
выщелачивают определенные компоненты из минералов (так как
воды обладают сильной окислительной и растворяющей способно-
стью) и изменяют их.
Процессы химического выветривания усиливаются за счет обра-
зования гумусовых и других природных органических кислот.
Обычно процессы химического и физического выветривания про-
текают совместно. В зависимости от климатических и природных
условий и рельефа местности может в значительной степени доми-
нировать химическое или физическое выветривание. Так, например,
в странах с тропическим климатом преобладает в основном хими-
ческое, а в полярных — физическое выветривание.
Физическое выветривание заключается в основном в механиче-
98
ском разрушении горных пород, химическое же приводит к образо-
ванию большого количества новых минералов. В результате про-
цессов выветривания образуются как остаточные меторождения
полезных ископаемых за счет труднорастворимых в поверхностных
условиях минеральных веществ, так и инфильтрационные месторож-
дения за счет выноса окислов ряда металлов (Fe, Mg, Ni) поверх-
ностными водами и переотложения последних.
К остаточным месторождениям относятся следующие типы:
древние и современные коры выветривания, элювиальные и делю-
виальные россыпи, а также участки окисленных сульфидных руд
(«железные шляпы»).
К инфильтрационным относятся — конкреционные и секреци-
онные месторождения, а также зоны вторичного сульфидного обо-
гащения первичных сульфидных руд.
Процессы выветривания, протекающие в средних и тропических
широтах преимущественно с влажным климатом и слабо расчле-
ненным рельефом, приводят к формированию коры выветривания.
Под корой выветривания понимается совокупность горных пород
верхней части земной коры, образовавшихся за счет разрушения
и преобразования первичных горных пород на месте разрушения
в результате выветривания (физического, химического и биологи-
ческого). Кора выветривания представляет собой скопление первич-
ных, очень стойких к химическому воздействию минералов (таких,
как кварц, рутил золото, магнетит), а также труднорастворимых
гидроокислов, возникших при химическом выветривании. Коры
выветривания формировались в различные геологические эпохи,
поэтому по возрасту образования они делятся на современные и
древние. В зависимости от того, какие первичные горные породы
подвергались процессам выветривания, а также от географических
факторов, образуются различные типы коры выветривания.
Выделяются следующие типы коры выветривания:
1) обломочный, характерный для арктического климата или вы-
сокогорного рельефа; возникает в результате развития, в основнохм
физического выветривания;
2) гидрослюдистый, характерный для холодного климата; обра-
зуется чаще при физическом и реже при химическом выветривании;
3) монтмориллонитовый, типичный для степных или полупус-
тынных районов при небольшой влажности; возникает вследствие
физического и химического выветривания, сопровождается накоп-
лением щелочей и в связи с этим отличается повышенной щелоч-
ностью;
4) каолиновый, характерный для жаркого климата; образуется,
в основном, при химическом выветривании в условиях повышенной
кислотности;
5) латеритовый, образуется в условиях жаркого и влажного
климата при преимущественном развитии химического выветри-
вания;
6) красноземный тип характерен для зоны саванн.
Наиболее распространенным типом коры выветривания явля-
4*
99
ются каолиновый и латеритовый, с которыми связаны промышлен-
ные месторождения бокситов, никеля и других полезных ископа-
емых.' Так, например, при выветривании полевошпатовых пород
(гранитов, гранито-гнейсов) образуются месторождения каолинов
и огнеупорных глин. Образование каолинита происходит в резуль-
тате следующей реакции:
4К [ Al Si3O8] -]-4Н2О 4- 2СО2 = Al4 [Si4O10] (ОН)8 + 2К2СО3 + 8SiO2
Ортоклаз Каолинит
Каолинит (как труднорастворимое соединение) сохраняется на
месте, а карбонат калия выносится растворами.
Если выветриванию подвергались ультраосновные породы, то
минералы, образующиеся в коре выветривания, представлены нон-
тронитом, гарниеритом, опалом, халцедоном, кальцитом, гидроокис-
лами никеля и хрома, имеющими практическое значение.
При выветривании .нефелиновых сиенитов, гранитоидов, порфи-
ритов и сланцев образуются гидраргиллит А1(ОН)3, гематит ЕегОз
и другие окислы.
К остаточным образованиям относятся также и элювиальные
месторождения золота, платины, монацита, касситерита, хромита,
ильменита. Эти россыпные месторождения возникли за счет разру-
шения материнских пород, содержащих вкрапленники редких
минералов. Физическое выветривание материнских пород приво-
дит к механическому их разрушению и накоплению устойчивых тя-
желых минералов (вольфрамита, золота и др.), а химическое — к
выносу легкорастворимых соединений; при этом отложение устой-
чивых минералов происходит на месте их образования.
Если выветриванию подвергаются залежи полезных ископаемых,
то образуются месторождения типа «железных шляп», с характер-
ными для них минеральными новообразованиями. Например, при
окислении карбонатных марганцевых руд возникает «марганцевая
шляпа» с минеральными новообразованиями, представленными пси-
ломеланом, вадом и другими окислами марганца.
Изменение сульфидных месторождений сопровождается появле-
нием зоны окисленных железных руд («железная шляпа»), ниже
которой формируется зона вторичного сульфидного оруденения
(зона цементации). Окисленные и вторичные руды возникают в ос-
новном при химическом выветривании, при котором активная роль
принадлежит атмосферным водам, обогащенным кислородом и
углекислотой.
Как известно, атмосферные осадки, попадая на земную поверх-
ность, просачиваются вглубь и тем самым дают начало подземным
водам, условия циркуляции которых различны в разных зонах (рис.
57): самая верхняя располагается от земной поверхности до уровня
грунтовых вод и называется зоной просачивания (рис. 57, а); ниже
уровня грунтовых вод находится зона истечения (рис. 57, б); ее
нижняя граница определяется горизонтальной поверхностью, сов-
падающей с местом истечения грунтовых вод (воды этой зоны
содержат незначительное количество кислорода); под зоной исте-
100
чения находится зона застой-
ных вод (рис. 57, в), свободно-
го кислорода эти воды не со-
держат.
Рассмотрим процессы из-
менения первичных сульфид-
ных руд и проследим за обра-
зованием новых минералов, ко-
торые возникают в результате
Рис. 57. Схема циркуляции подземных
вод:
а — зона просачивания; б — зона истече-
ния; в — зона застойных вод
воздействия поверхностных
вод на эти руды.
При взаимодействии вод с
верхними частями сульфидных
месторождений в зонах проса-
чивания, богатых свободным кислородом и углекислотой, происхо-
дит окисление сульфидов, поэтому измененная верхняя часть суль-
фидных месторождений называется зоной окисления. Пирит, на-
пример, в этой зоне окисляется до сульфата закиси железа
(FeSO4), последний же, являясь неустойчивым соединением, пере-
ходит в сульфат окиси. Сульфат окиси, подвергаясь гидролизу,
переходит в гидрат окиси, который, теряя воду, образует лимонит.
Изложенное можно представить в виде следующих реакций:
FeS2 + 70-4- Н20 = FeSO4 + H2SO4
Пирит
6FeSO4 4-30-1- ЗН2О = 2Fe (0Н)3 + 2Fe2 (SO4)3
Fe2(SO4)3+ 6H2O^±2Fe(OH)3 + H2SO4
4Fe (OH )3=2Fe2O3 • 3H2O + 3H2O
Лимонит
Подобные же реакции будут происходить с пирротином, по нему
также образуются лимонит и другие гидроокислы железа. Посколь-
ку в сульфидных месторождениях наиболее распространены пирит
и пирротин, то в конечном итоге происходит образование лимонита
за счет изменения верхней части сульфидного месторождения. Эти
вторичные образования, как отмечалось выше, называются «же-
лезной шляпой».
Рассмотрим, какие изменения претерпевают другие минералы
сульфидных месторождений в зоне окисления. Пирротин может лег-
ко разлагаться серной кислотой и сульфатом окисного железа:
FeS + H2SO4=FeSO4+H2S
FeS + Fe2 (SO4)3 = 3FeSO4 + S
При этом часть серы будет выделяться, однако большая часть ее
в момент выделения окисляется до SO2(2S + 2O2=2SC>2). Появляю-
щаяся свободная серная кислота и сульфат окисного железа повы-
шают кислотность вод, что ведет к дальнейшему разложению
сульфидов.
101
Один из распространенных минералов сульфидных месторож-
дений — халькопирит, окисляется по схеме
CuFeS2 + 4О2 = CuSO4 -j- FeSO4
Халькопирит
Сульфат меди (CuSO4) стекает в зону истечения, поскольку
отличается хорошей растворимостью. Сульфат же закиси железа,
окисляясь, в конечном итоге превращается в лимонит. Халькопирит
легко разлагается также сульфатом окисного железа:
CuFeS2 -L 2Fe2(SO4)3=CuSO4 + 5FeSO4+S2
Некоторое количество CuSO4 взаимодействует с кремнеземом,
давая начало хризоколле — CuSiO3*nH2O. При наличии карбонат-
ной среды, нейтрализующей серную кислоту, возникают водные
карбонаты меди — азурит и малахит.
При окислении сфалерита (ZnS) появляется сульфат цинка,
который хорошо растворим и поэтому выносится из зоны окисления;
если же вмещающими породами будут известняки, то в них обра-
зуются скопления смитсонита:
ZnS + 2O2=ZnSO4; ZnSO4 + CaCO3 = Zn[СО3] FCaSO4
Смитсонит
Галенит (PbS) очень устойчивый минерал, но при действии сер-
ной кислоты в присутствии кислорода он окисляется и образует
англезит (Pb{SO4]); в карбонатной среде англезит замещается
церусситом по следующей реакции:
Pb [SO4] 4- Н2О + СО2- РЬ [СО3] Н- H2SO4
Церуссит
Церуссит вместе с англезитом накапливается иногда в количе-
стве, достаточном для промышленного использования.
Ниже зоны окисления первичные сульфиды также претерпевают
изменения и замещаются вторичными сульфидами. Возникшие зоны
вторичных руд носят название зон вторичного сульфидного обога-
щения. Образуются они под действием вод, просачивающихся через
зону окисления. Воды, обогатившиеся наиболее растворимыми и
устойчивыми сульфатами (CuSO4, AgSO4), воздействуют на еще
неизмененные сульфиды в условиях щелочной среды без доступа
кислорода. Эти преобразования происходят на' уровне зоны исте-
чения грунтовых вод, т. е. примерно на глубинах нескольких десят-
ков, а иногда сотен метров от поверхности.
Наибольший интерес представляют зоны вторичных сульфидных
руд меди. Они характерны для месторождений, содержащих бога-
тые халькопиритом и пиритом первичные руды. В зоне окисления
эти руды полностью разлагаются, образующийся сульфат меди
(CuSO4), как было показано выше, просачивается вниз и реагирует
102
с первичными сульфидами. Вначале вдоль трещин и по периферии
зерен халькопирита возникает борнит:
2CuFeS2 4- 3CuSO4 + 2Н2О=CuFeS4 + FeSO4 + 2H2SO4 + O2
Халькопирит Борнит
Затем происходит замещение реликтов первичных сульфидов —
халькопирита (1), пирита (2) и частично борнита (3) с обра-
зованием ковеллина и иногда халькозина. Впоследствии ковел-
лин замещается халькозином по реакции (4), более устойчивым
в зоне вторичного сульфидного обогащения. Возможные реакции
образования указанных сульфидов можно представить .в следую-
щем виде:
CuFeS2 + CuSO4= 2CuS + FeSO4 (1)
Халькопирит Ковеллин
4FeS2 -Ь 7CuSO4+ 4Н2О = 7CuS + 4FeSO4 + 4H2SO4 (2)
Пирит Ковеллин
Cu5FeS4 + CuSO4=2Cu2S + 2CuS + FeSO4 (3)
Борнит Халькозин
5CuS + 3CuSO4+4H2O=4Cu2S + 4H2SO4 (4)
Ковеллин Халькозин
В местах, где возможно появление свободного кислорода, в част-
ности, высвободившегося при образовании борнита, происходит вы-
деление незначительных количеств самородной меди:
Cu2S 4“ 2О2=CuSO4 4- Си
Халькозин Самородная
медь
Вторичные сульфиды отличаются более высоким содержанием
меди (в халькозине — 79,8, ковеллине — 66,5, в борните — 63,3%
Си) по сравнению с первичным минералом — халькопиритом 34,6%
Си). Образование зон вторичного сульфидного обогащения способ-
ствует концентрации меди и появлению руд, имеющих значительно
большую ценность по сравнению с первичными сульфидными ру-
дами.
Осадочные процессы протекают в тех случаях, когда продукты
выветривания захватываются поверхностными водами и привносят-
ся в крупные водоемы (озера, моря), где и происходит их отложе-
ние. Эти процессы, происходящие в различные геологические эпохи,
привели к образованию в морских бассейнах мощных толщ оса-
дочных пород. В результате осадочных процессов образуются как
механические, так и химические осадки.
Механические осадки возникают при переносе водными потока-
ми труднорастворимых, химически стойких минералов, а также об-
ломков горных пород и их дальнейшем переотложении в руслах рек
и водных бассейнах. В процессе накопления механических осадков,
как правило, не возникают новые минералы, а происходит переот-
103
ложение труднорастворимых, ранее образовавшихся минералов и
обломков горных пород в виде галечника, гравия, песков, глин. Ес-
ли водными источниками захватывались продукты выветривания
месторождений или пород, содержащих химически стойкие ценные
минералы, то в результате механической дифференциации «и пов-
торных -перемывов образуются россыпи золота, платины, кассите-
рита, алмазов, монацита и др.
Химические осадки образуются преимущественно в озерах, бо-
лотах и морских бассейнах за счет выпадения минеральных ве-
ществ, растворенных в этих водах. Продукты выветривания, пере-
носимые в виде истинных и коллоидных растворов, осаждаются в
водоемах вследствие изменения физико-химических условий среды
(температуры, концентрации раствора или pH и т. д.).
Образование осадков может происходить различными путями:
вследствие кристаллизации насыщенных солями истинных раство-
ров (хемогенные осадки), путем осаждения из коллоидных раство-
ров (коллоидные осадки), вследствие жизнедеятельности организ-
мов (биогенно-осадочные породы), влияния подводного вулканизма
(вулканогенно-осадочные породы) и др.
Осаждение из истинных растворов наступает в случае перенасы-
щения их солями преимущественно в условиях жаркого климата,
когда поверхностное испарение преобладает над притоками пресной
воды.
Известно, что морская вода, которая является основным источ-
ником формирования месторождений солей, представляет собой
слабый солевой раствор, иными словами это обычный истинный
(ионный) раствор. Соленость морской воды колеблется от 0,5 — в
Финском заливе до 4,3%—в Красном море и в среднем состав-
ляет 3,5%.
Средний химический состав морской воды приведен в табл. 11.
ТАБЛИЦА И
Химический состав солевой массы морской воды, %
Растворенные соли К массе солей К весу морской волы
NaCl 77,8 2,72
MgCl2 10,9 0,38
MgSO4 4,7 0,17
CaSO4 3,6 0,12
k2so4 2,5 0,09
MgBr2 0,2 0,01
CaSO4 и др. 0,3 0,01
100,0 3,50
В первую очередь начинают осаждаться труднорастворимые со-
ли, а затем более растворимые. Благодаря физико-химическим ис-
следованиям акад. Н. С. Курнакова, была установлена следующая
104
последовательность кристаллизации солей из морской воды при
естественном ее испарении:
1) ГИПС ...................
2) галит ..................
3) эпсомит.................
4) сульфат калия и магния
5) карналлит................
6) бишофит...............
.Са [SO4] 2H2O
.NaCI
Mg[SO4]7H2O
.MgSO4K2SO46H2O
.MgCl2KC16H2O
,MgCl26H2O
Возможность образования мощных соляных залежей объясняет-
ся теорией барров, предложенной Оксениусом. Согласно этой тео-
рии, накопление соли происходит не в открытом море, а в замкнутой
бухте, отделенной или полуотделенной от моря подводным барье-
ром или барром. При наличии сухого и жаркого климата, в резуль-
тате испарения уровень воды в бухте будет понижаться, что вызо-
вет в свою очередь приток в нее воды из моря, а следовательно, и
дополнительный привнос солей. Таким образом, при постоянном
объеме воды концентрация солей в бухте будет все время расти,
что приведет к осаждению соли. Причем толщина залежи будет
зависеть от глубины бухты и продолжительности процесса.
Согласно теории Оксениуса, различают четыре стадии солеобра-
зования (рис. 58).
Первая стадия — кристаллизация из морской воды карбонатов
(при увеличении концентрации солей в бухте в пять раз начинается
осаждение гипса).
Вторая стадия — при увеличении концентрации солей в одиннад-
цать раз начинается кристаллизация галита с примесью гипса.
В случае, когда концентрация увеличится в 22 раза, поверх отло-
жившейся каменной со-
ли образуется маточ-
ный раствор с легко
растворимыми солями
К и Mg.
Третья стадия, ког-
да маточный раствор,
поднявшийся до уров-
ня барра, смешивается
с протекающей мор-
ской водой, что приво-
дит к образованию гип-
са (так как в раство-
рах, насыщенных сер-
нокислым магнием, сер-
нокислый кальций не-
растворим). Гипс опус-
кается на дно маточно-
го раствора, обезвожи-
вается и отлагается в
виде ангидрита.
Четвертая стадия
Рис. 58. Схема солеобразования по гипотезе
барров:
а — начальная стадия притока воды из моря и обра-
зование карбонатов; б — средняя стадия отложения
солей Са и Na и образование маточного раствора;
в — конечная стадия отложения солей К, Mg и пере-
крытие соляной залежи слоем глины
105
характеризуется увеличением концентрации до 60 раз и выделени-
ем легко растворимых солей К и Mg (причем выпадение калийных
солей происходит уже в лагуне).
Осадки, образующиеся из коллоидных растворов, весьма широ-
ко распространены в земной коре. Значительная часть элементов
переносится водами в коллоидном состоянии, в частности реками в
виде коллоидных частиц переносится большая часть гидроокиси
железа, марганца, а при развитии тропического выветривания и
глинозема.
В случае, когда реки вымывают из берегов большое количество
солей, являющихся электролитами, происходит коагуляция кол-
лоидных осадков в руслах рек. Таковы третичные бурые железня-
ки осадков речных фаций. Аналогичным же образом в областях
тропического выветривания могли образоваться и речные осадочные
месторождения бокситов.
Следует отметить, что наличие в водах рек гумусовых веществ
препятствует коагуляции коллоидов, вследствие чего, например, во-
ды Нила, несущие колоссальное количество коллоидных веществ,
не отлагают их, как этого следовало бы ожидать.
При впадении рек в моря и океаны происходит смешение прес-
ной речной воды с соленой морской. Морская вода в этом случае
играет роль Электролита, коллоидные частицы, выносимые реками,,
коагулируют и осаждаются на дне моря вблизи устья рек. Таким
образом образуются громадные залежи осадочных коллоидных же-
лезных и марганцевых руд. Такого происхождения, например,
крупнейшие в мире марганцевые месторождения — Чиатурское
(Кавказ) и Никопольское (УССР).
Некоторая часть коллоидных частичек отлагается на значитель-
ном удалении от берегов и на больших глубинах. Наиболее устой-
чивы в морской воде коллоиды кремнезема, питающие водоросли.
Последние накапливаются в форме диатомитовых илов, в которых
сосредоточено большое количество коллоидного кремнезема.
Озерные воды также отличаются изобилием коллоидных частиц,
накапливающихся в придонных илах. Изредка на дне озер проис-
ходит образование коллоидных руд железа (бобовые руды, конкре-
ции). Для болотных руд характерно обилие золей и гелей, возни-
кающих при разложении различных органических остатков. Тор-
фяная масса представляет смесь гелей (гумусовых и минеральных)
и растительных остатков. Она характеризуется высокой сорбцион-
ной способностью и в процессе торфообразования из притекающих
в торфяники вод сорбирует различные элементы. Таким образом,
происходит обогащение торфов и впоследствии углей германием,
ураном, молибденом, бериллием, кобальтом и другими элементами.
Так, например, в золе углей содержится Ge в 120—70 раз выше,
чем в литосфере, Be в 150—30 раз, Со в 30 раз, Sc — в 20—10 раз,
Мо — в 13 раз, Ga — в 10—7 раз и т. д. Отсюда следует, что зола
некоторых каменных углей может быть использована как руда для
извлечения из нее ряда редких элементов.
106
Осадки биохимического происхождения возникают в результа-
те жизнедеятельности организмов. Общая масса органической ма-
терии, по данным В. И. Вернадского, составляет приблизительно
0,001 % от веса всей земной коры, причем большая ее часть нахо-
дится в водах океанов. Некоторые организмы могут аккумулиро-
вать в себе большие количества тех или иных элементов. Например,
фосфатизированные рыбьи остатки часто обогащены редкими зем-
лями.
Биогенные осадки могут возникать путем накопления различ-
ных скелетов животных организмов, кораллов, мшанок, губок,
брахиопод и др. Таким путем образуются органические известняки.
К осадкам биохимического или биогенного происхождения, кро-
ме известняков, относятся фосфориты, диатомиты, сера, ископае-
мые угли, нефть и др.
Метаморфические процессы
Метаморфические процессы заключаются в глубоком преобразо-
вании ранее сформировавшихся горных пород и минералов вслед-
ствие изменения физико-химических урловий (температуры, давле-
ния и концентрации химически активных компонентов).
Эти процессы возникают при изменении термодинамического
режима и нарушении равновесия в ранее образовавшихся горных
породах.
Метаморфизм проявляется в изменении минерального состава и
структурных особенностей пород, чаще всего в твердых породах без
существенного изменения их химического состава, за исключением
содержания воды и углекислоты.
Физико-химические условия образования минералов определя-
ются тремя основными -параметрами: температурой Т, давлением р
и химически активными компонентами с. Необходимо отметить, что
температуру и давление не следует рассматривать как взаимосвя-
занные параметры.
В зависимости от геологической обстановки и превалирующего
значения того или иного фактора выделяют три основных вида ме-
таморфизма: динамометаморфизм, контактный (термальный) и
региональный метаморфизм.
Динамометаморфизм характерен для небольших зон тек-
тонических нарушений и вызывается действием направленного дав-
ления (стресса). При этом процессе происходит механическое раз-
рушение горной породы с изменением первоначальной структуры, но
без изменения минерального состава.
Контактный метаморфизм возникает на глубине у кон-
тактов интрузивных тел с вмещающими породами. Главным фак-
тором данного типа метаморфизма является температура. На кон-
тактах интрузивных тел с вмещающими породами происходят изме-
нения как во вмещающих, так и в породах, слагающих краевые
части самого интрузивного тела. Изменения вмещающих пород на-
107
зывают экзоконтактовыми, а изменения краевых частей интрузив-
ного тела — эндоконтактовыми, причем мощность изменений в экзо-
контактовой зоне бывает обычно значительно больше, чем в эндо-
контактовой.
Контактный метаморфизм вмещающих пород сопровождается
интенсивной перекристаллизацией минералов, при которой проис-
ходит укрупнение мелких зерен и образование за их счет более
крупных выделений.
Рассмотрим несколько типичных примеров образования новых
минералов (минеральных ассоциаций) при контактном метамор-
физме.
Известняки, состоящие из кальцита Са[СО3], при контактном
метаморфизме перекристаллизовываются в мраморы, характеризу-
ющиеся более крупнозернистой структурой, при этом процессе под
действием высокой температуры не происходит образования новых
минералов.
В том случае, когда метаморфизму подвергаются доломиты,
происходит не только перекристаллизация, но и образование новых
минералов по реакции
Са Mg [СО3]2 -> Са [СО3] 4- MgO + СО2
Доломит Кальцит Периклаз
В доломитах, содержащих кремнезем, образуется при этом фор-
стерит Mg^SiOJ и диопсид CaMgfSiOab:
2CaMg [CO3]2-f-SiO2=2Ca [СО3] 4-Mg2 [SiOJ + 2СО2
Ca Mg [ С О3]2 + 2S1O2=Са Mg [ S i O3]2 + 2CO2
Если в доломитах присутствует глинозем, то в результате кон-
тактного метаморфизма в мраморе возникает шпинель:
Са Mg [СО3]2+Л12О3=MgAl2O4 + Са [СО3] + СО2
Шпинель
Если в известняках содержатся примеси глинозема и кремне-
зема, то при высокой температуре образуется анортит, а при более
низкой возникают эпидот, цоизит или пренит.
На контактах интрузивных тел с глинистыми породами появ-
ляются андалузит и кордиерит.
Продукты контактного метаморфизма находятся в прямой зави-
симости от состава метаморфизуемой породы и температуры, при
которой протекает процесс метаморфизма. Естественно, что мине-
ралы, возникающие при этом типе метаморфизма, ближе к контак-
ту становятся все более высокотемпературными. Согласно данным
В. М. Гольдшмидта, Н. А. Елисеева и др., контактный метаморфизм
протекает при температуре от 500° С и выше.
Региональный, или дин а мот ер м а льный, мета-
морфизм проявляется на больших площадях и тесно связан с
горообразовательными явлениями. Основными факторами его
являются температура, гидростатическое и одностороннее (направ-
108
ленное) давление. При погружении огромных масс, в основном
осадочных пород на значительные глубины происходит -резкая сме-
на физико-химических условий (значительно повышается темпера-
тура, увеличивается гидростатическое давление), что приводит к
глубоким изменениям первоначальных пород, их структуры и мине-
рального состава.
Так, при повышении температуры возрастает интенсивность про-
явления перекристаллизации минералов, сопровождаемая их де-
гидратацией и декарбонатизацией, в результате чего возникают
безводные высокотемпературные минералы.
С увеличением гидростатического давления происходит образо-
вание минералов с наибольшей плотностью и меньшим объемом.
При региональном метаморфизме возникают следующие харак-
терные минералы: гранат, волластонит, сфен, роговая обманка, сил-
лиманит, дистен, ставролит, тремолит, актинолит, биотит, мусковит,
скаполит и др.
Приведем несколько характерных примеров образования новых
минералов в условиях регионального метаморфизма.
Если метаморфизму подвергались породы, богатые железом и
глиноземом, но бедные магнием и щелочами, то происходит обра-
зование хлоритоида по реакции
3Al4lSi4O10](OH)8 + 2Fe3O4^
Каолинит Магнетит
-» 3Fe2Al2 [ A l2Si2O10] (ОН)4 + 6SIO2+6Н2О + О2
Хлоритоид
Эта реакция протекает в условиях сравнительно невысоких темпе-
ратур и умеренных давлений. В случае увеличения одностороннего
давления хлоритоид переходит в ставролит:
Fe2Al2[Al2Si2O10](OH)4=FeAl4[SiO4]2O2(OH)2-| Fe(OH)2
Хлоритоид Ставролит Гидрат окиси
железа
С повышением температуры в присутствии кварца ставролит
преобразуется в дистен и гранат.
В условиях больших давлений и высоких температур слюда и
амфиболы становятся неустойчивыми. Вместо мусковита возника-
ет в этом случае калиевый полевой шпат и дистен:
КА12 [AlSi3O10]OH2 + SIO2=К [Al Si3O8] + Al2 [SIO4] О + H2O
Мусковит Кварц Калиевый Дистен
полевой шпат
ГЛАВА 15
МЕТОДЫ ИССЛЕДОВАНИЯ МИНЕРАЛОВ
Для диагностики минералов, установления их свойств, струк-
туры, химического состава и условий образования разработаны
различные методы. Существуют сравнительно простые приемы, поз-
109
воляющие производить визуальную диагностику видимых невооору-
женным глазом минералов, и очень сложные методы исследования,
с помощью которых изучают мельчайшие дисперсные минеральные
образования, устанавливают тонкие особенности свойств, структу-
ры и состава минералов.
В практике минералогических работ для решения различных за-
дач применяют обычно следующие методы исследования:
1. Методы определения минералов по внешним признакам, мик-
роскопические, рентгенометрические; для диагностики тонковкрап-
ленных и дисперсных минералов используют микроскопические,
электронномикроскопические, термические и рентгеноструктурные
методы.
2. Методы изучения свойств минералов — физические, микро-
скопические, термические, люминесцентные, радиометрические и др.
3. Методы изучения структуры минералов — рентгенометриче-
ские, электроннографические, инфракрасной спектроскопии (ИКС).
4. Методы изучения состава минералов — химические, спект-
ральные, рентгеноспектральные, рентгенорадиометрические, радио-
активационные и др.
5. Методы изучения условий образования минералов — термо-
барометрические, парагенетический анализ, моделирование при-
родных процессов.
При минералогических исследованиях используют, естественно,
не все методы. Комплекс применяемых методов и их последователь-
ность определяются особенностями изучаемых минеральных объек-
тов и задачами, стоящими перед минералогом. В начальной стадии
исследования определяют минералы, применяя для этого визуаль-
ные методы; затем минералы изучают простыми лабораторными
методами и, наконец, с целью получения очень точных (прецизион-
ных) характеристик свойств, состава и структуры минерала произ-
водят детальные исследования.
Методы визуального изучения минералов
Эти методы применяются для диагностики минералов, разли-
чаемых невооруженным глазом, на основе качественных характе-
ристик 1их свойств (формы кристаллов, цвета, твердости и др.).
Иногда такого макроскопического исследования бывает достаточно
для точной диагностики минеральных образований, чаще же визу-
альные определения предшествуют более точным лабораторным ис-
следованиям.
Определение минералов основано на широкой вариации их
свойств. Поскольку каждый минерал обладает комплексом опреде-
ленных характерных признаков, его всегда можно отличить от дру-
гих. К внешним признакам, используемым для визуальной диагнос-
тики, относятся: форма кристаллов, наличие характерных двойнико-
вых или более сложных срастаний, цвет черты, прозрачность, блеск,
спайность, излом, твердость, хрупкость, магнитность, удельный вес
НО
и др. Все эти признаки по мере выработки некоторого опыта легко
можно использовать для определения минералов. Выяснение неко-
торых из них требует применения несложного вспомогательного
оборудования. Так, определение цвета черты минералов производят
с помощью матовой (неглазурованной) поверхности фарфоровой
пластинки. В результате трения о фарфоровую пластинку многие
минералы оставляют черту — порошок минерала, цвет которого
иногда отличается от цвета образца и служит дополнительной ха-
рактеристикой. Например, минерал гематит имеет вишнево-красную
черту, тогда как цвет его в образце железо-черный.
Твердость минералов определяют путем сравнения изучаемого
образца с минералами, принятыми в качестве эталонов по шкале
Мооса (ем. стр. 51). Испытуемым минералом по очереди царапают
эталонные минералы и устанавливают, какой из них царапается
последним. Допустим, определяемый минерал царапает ортоклаз и
не оставляет царапин на кварце, сам же царапается кварцем — оче-
видно его твердость находится между 6 и 7.
Магнитность минералов определяют с использованием легко
вращающейся магнитной стрелки, которая притягивается даже на
расстоянии минералами с явно выраженными магнитными свойст-
вами, например магнетитом или пирротином. Стрелка обнаружи-
вает незначительное притяжение или волнение при поднесении к
ней минералов со слабыми магнитными свойствами — ильменита,
вольфрамита и др.
Для диагностики многих минералов может быть использована
различная стойкость их к действию кислот, в частности к дей-
ствию соляной кислоты. Этот метод нетрудно применять для диаг-
ностики таких минералов, как кальцит, арагонит, которые бурно
растворяются в соляной кислоте с выделением пузырьков СОг. Дру-
гие минералы — сидерит, доломит, разлагаются этой кислотой лег-
ко, но не так бурно. Ряд минералов, в частности лимонит, гематит
и другие, слабо растворимы в соляной кислоте.
Для диагностики трудно определимых или тонковкрапленных
минералов,особенно в полевых условиях, применяют качественные
химические реакции. С помощью этих реакций можно установить
химические элементы, входящие в состав минерала, и тем самым
получить дополнительные данные для его диагностики.
Например, чтобы установить, входит ли в состав минерала же-
лезо, достаточно смочить фильтровальную бумагу азотнокислым
раствором исследуемого минерала и поместить на нее каплю
1 %-ного водного раствора роданистого калия. Интенсивное покрас-
нение бумаги укажет на присутствие в минерале железа. Боль-
шинство других элементов можно установить с помощью сходных
качественных реакций.
В процессе визуального определения минералов, с целью более
точного установления некоторых свойств, таких как спайность, из-
лом, твердость и других, применяют лупы или бинокулярные микро-
скопы типа МБС-1, МПС-2.
111
Лабораторные методы исследования минералов
Лабораторные работы проводят с целью диагностики трудно оп-
ределимых, тонковкрапленных и дисперсных минералов. На этом
этапе также исследуют минералы, для которых необходимо полу-
чить достоверные, часто количественные характеристики свойств,
выяснить структуру, определить точный химический состав.
В лабораторных условиях применяют разнообразные методы
исследования минералов: микроскопические, рентгеновские, анали-
тические, люминесцентные, термические, различные методы опреде-
ления физических свойств и др.
Микроскопические методы исследования занимают ведущее мес-
то в лабораторных работах. Применение их основано на постоянст-
ве оптических свойств минералов определенного состава и структу-
ры и позволяет достаточно быстро и с большой точностью произво-
дить диагностику изучаемых образцов.
Прозрачные, просвечивающие минералы исследуют в проходя-
щем свете с помощью поляризационного микроскопа (МП-3,
МИН-4, МИН-8 и др.). Непрозрачные минералы изучают в отра-
женном свете с применением специального поляризационного мик-
роскопа, приспособленного для работы с отраженным светом
(МИН-6, МИН-9). Тонкодисперсные минералы, которые трудно оп-
ределить в обычных микроскопах, диагносцируют с помощью элект-
ронных микроскопов.
Исследования минералов в проходящем свете
производят в прозрачных шлифах. Шлиф готовят на предметном
стекле, к которому приклеивают канадским бальзамом или сосно-
вой смолой тонкий срез минерала или породы. Затем его шлифуют
до толщины около 0,03 мм. Сверху такой срез покрывают тонким
покровным стеклом.
Иногда изучение минералов осуществляют в препаратах, изго-
товляемых из мелких, обычно .раздробленных до состояния порош-
ка, зерен. Порошок помещают на предметное стекло в капле жид-
кости с различными показателями преломления.
При изучении минералов под микроскопом устанавливают фор-
му кристаллов, спайность, окраску, плеохроизм, показатели пре-
ломления, величину двойного лучепреломления, характер удлине-
ния, угол угасания, осность и оптический знак минерала. Подроб-
нее методы исследования оптических свойств минералов рассмот-
рены в разделе «Кристаллография» (см. «Оптические свойства
кристаллов»).
Исследование минералов в отраженном свете.
Непрозрачные минералы изучают в полированных шлифах, изго-
товляемых из куска руды или минерала путем тщательной зеркаль-
ной полировки плоскости среза.
Полированный шлиф помещают на столик микроскопа и иссле-
дуют, как и прозрачные шлифы, в поляризованном свете. Для осве-
щения и наблюдения изучаемого объекта применяют специальное
приспособление, называемое опак-иллюминатором. Эта осветитель-
112
ная система позволяет направить световой луч через объектив к
полиро*ванной поверхности шлифа, установленного на предметном
столике микроскопа. Свет, отразившийся от минерала, снова про-
ходит через объектив и попадает -в окуляр. С помощью микроскопа,
в котором используется отраженный свет, устанавливают ряд опти-
ческих свойств минералов.
1. Цвет минерала в отраженном свете.
2. Относительную твердость, определяемую путем царапания
исследуемого объекта и сопоставления его с окружающими мине-
ралами или минералами-эталонами.
3. Отражательную способность — свойство минералов отражать
падающий на них свет. Разные минералы отражают неодинаковое
количество падающего на них света и выглядят под микроскопом
освещенными в различной степени. Отражательная способность или
показатель отражения (как принято его называть по аналогии с
показателем преломления) выражается отношением интенсивности
света, отраженного от зеркальной плоскости минерала, к интенсив-
ности света, падающего на эту плоскость:
где R— показатель отражения;
1Г — интенсивность света, отраженного минералом;
1г — интенсивность света, падающего на минерал от источника.
Качественно показатель отражения определяют путем сравне-
ния исследуемого минерала с эталоном и количественно — при по-
мощи фотометрирования. Для анизотропных минералов определяют
два или три показателя отражения и величину двуотражения Д7?,
равную разности наибольшего Rg и наименьшего Rp показателей
отражения. Величина двуотражения функционально связана с вели-
чиной двупреломления. Отражательная способность находится так-
же в известной зависимости от показателей преломления минерала.
4. Изотропность и анизотропность непросвечивающих минера-
лов. Это свойство, как и последующее, устанавливают с введен-
ным анализатором.
5. Цвет внутренних рефлексов — характерный отблеск минера-
лов. Этот эффект обусловлен частичным просвечиванием минера-
лов. Свет, проникший в минерал и отразившийся от его внутренних
слоев, имеет определенный цвет.
Для диагностики минералов в отраженном свете применяют
часто качественные микрохимические реакции. Результаты воздей-
ствия реакций на минерал изучают под микроскопом.
Электронномикроскопический метод. Исследования на электрон-
ном микроскопе с успехом выполняются для диагностики и изуче-
ния тонкодисперсных минералов (менее 0,01 мм в поперечнике),
входящих в состав глин, бокситов и других пород. Электронный
микроскоп дает возможность получить увеличения в 25—30 тысяч
раз и более, что позволяет наблюдать форму, строение, степень
раскристаллизации весьма тонких минералов, а также получить
данные об их структуре. При больших увеличениях можно изучать
113
периодичность и дефекты кристаллической решетки, исследовать
структуру и дефекты поверхности минералов.
В электронном микроскопе источником света служит раскален-
ная вольфрамовая нить, испускающая электроны. Электронный луч
проходит через препарат и специальные магнитные или электроста-
тические линзы и проецируется на фосфоресцирующем экране. По-
лученное изображение фотографируют. В зависимости от задач ис-
следования и особенностей минеральных объектов существуют
разные способы приготовления препаратов и методы их изучения.
Тонкодисперсные минералы исследуются обычно в препаратах,
получаемых путем осаждения частиц из приготовленной суспензии
на специальные пленки — подложки. Препараты изучают на про-
свет по позитивному изображению и судят о форме, размерах, од-
нородности минералов. Для более естественного и объемного на-
блюдения можно получить негативные изображения. С этой целью
на частицы минералов напыляют угольную или платиновую пленку.
Диагностику неизвестных минералов производят, сочетая исследо-
вание их на просвет и метод микродифракции. Последний основан
на явлении рассеивания электронных лучей от плоскостей кристал-
лической решетки. Возникающая дифракционная картина позво-
ляет судить о параметрах решетки минерала.
Изучение агрегатов и непрозрачных в электронном микроскопе
минералов производят методом реплик. На образец наносится
угольная пленка, которую затем отделяют. Полученный отпеча-
ток— реплика, исследуется под микроскопом. Этот метод дает
возможность выявить не только форму и размеры минеральных
частиц, но и получить информацию о взаимоотношении минералов,
особенностях микрорельефа, дефектах поверхности.
Кристаллографический метод основан на постоянстве формы
кристаллов и углов между гранями для минералов одного и того
же состава и структуры. Исследования производят с применением
теодолитного отражательного гониометра на минералах с развиты-
ми кристаллографическими формами.
С помощью гониометра определяют углы между гранями и сфе-
рические координаты граней. На основе полученных данных доста-
точно точно устанавливают принадлежность кристаллов к опреде-
ленному минеральному виду, выявляют его симметрию и символы
граней. Помимо диагностики, гониометрическое изучение минера-
лов дает возможность получить дополнительную информацию о ха-
рактере огранения минералов и типичных для них гранях.
Рентгенометрические методы. Изучение минералов с примене-
нием специальной рентгеновской аппаратуры весьма эффективно.
Рентгеновский анализ позволяет при наличии весьма ограниченно-
го количества минерала, часто двух-трех мелких зерен, произво-
дить расшифровку структуры минерала и таким путем подойти к
его диагностике.
Рентгеновский анализ исходит из способности рентгеновских лу-
чей проникать в кристаллическое вещество и частично отражаться
от наиболее плотных сеток кристаллической решетки.
114
п
^DIlLlimill IHII1LIL Ю1 III II III 11IIИШШ
59. Схемы дебаеграмм:
a — алмаза; б — графита
Существуют различные методы рентгеновских исследований.
Широко распространен метод порошка (метод Дебая), который да-
ет возможность изучать очень мелкие зерна минералов.
Порошок исследуемого минерала спрессовывают и помещают в
центр специальной камеры Дебая. Камера имеет цилиндрическую
форму. Через отверстие в стенке камеры пропускается узкий пучок
рентгеновских лучей, попадающих на объект изучения. Отраженные
от решетки минерала лучи фиксируются на лентовидной пленке,
выстилающей стенки камеры по всему ее периметру. Лучи, отра-
женные от характерных (наиболее плотных) сеток решетки, фикси-
руются на пленке в виде дуг, симметрично расположенных по отно-
шению к ее центру (рис. 59). Определив на полученной таким пу-
тем порошкограмме (дебаеграмме) расстояния между симметрично
расположенными дугами, вычисляют межплоскостные расстояния.
По межплоскостным расстояниям и интенсивности соответствующих
дуг можно произвести диагностику исследуемого минерала, поль-
зуясь эталонными данными. На основании межплоскостных рас-
стояний рассчитывают величину элементарной ячейки минералов.
Минералы, имеющие кристаллическую форму и грани не менее
0,5 мм, можно исследовать другими методами — методом вращения
кристалла или методом неподвижного кристалла, что позволяет
получить дополнительные данные об особенностях структуры кри-
сталлов.
Тонкюди!сперсные минералы, которые показывают нечеткие,
«размазанные» линии на рентгеновских порошкограммах, изучают
с помощью электронных лучей, которые не могут проникать в глубь
кристаллического вещества и отражаются от его поверхностного
слоя. Получение порошкограмм электроннографическим методом
во многом сходно с рентгеновским способом.
Термические методы. Термический анализ используется для ис-
следования тонкодисперсных, содержащих воду и аморфных мине-
ралов. Сущность этого метода заключается в выявлени эндо- и эк-
зотермических реакций, происходящих при нагревании образца.
Термические реакции связаны с выделением воды из минералов,
процессами окисления или восстановления и переходом в новую по-
лиморфную модификацию. Эти явления фиксируются по выделению
или поглощению тепла. Термический анализ осуществляют путем
одновременного нагревания испытуемого вещества и инертного
1 i5
Рис. 60. Дифференциальные кри-
вые нагревания:
а —каолинита; б — монтмориллонита;
в — гидромусковита
минерала — эталона, который при нагревании не меняется. Иссле-
дование проводят с помощью самопишущего прибора — пирометра,
регистрирующего разность температур исследуемого образца и эта-
лона в виде диференциальной кривой нагревания (рис. 60). На тер-
мограммах эндотермические эффекты выражаются в виде пиков,
направленных вниз; пики экзотермических реакций направлены
вверх. Многим минералам свойственны характерные дифференци-
альные кривые нагревания, по которым они могут быть диагнос-
тированы.
Для познания особенностей выделения воды из минералов в до-
полнение к кривым нагревания получают данные, используя метод
обезвоживания. Последний основан на явлении дегидратации мине-
ралов при их нагревании и связанной с этим потерей в весе. Ре-
гистрация потери в весе и температурного интервала, при котором
она происходит, важна, поскольку весовые и температурные значе’
ния не одинаковы для разных минералов. Эти исследования допол-
няют дифференциальные кривые нагревания, на которых тепловой
эффект фиксируется нередко с запозданием и часто отражает сум-
марный результат.
В последнее время для термических анализов применяют уста-
новки (дериватографы), позволяющие одновременно производить
оба вида исследований.
Люминесцентный метод основан на свойстве некоторых минера-
лов излучать в форме видимого света часть энергии, полученной в
результате действия внешнего возбудителя. В качестве источников
116
возбуждения используются ультрафиолетовые, катодные, рентгенов-
ские лучи, а также радиоактивное излучение и нагрев.
Причиной люминесценции может быть:
а) наличие в минерале в качестве одного из основных компо-
нентов люминесцирующих комплексных ионов — люминофоров.
Такими люминофорами могут быть WO4-2 в шеелите (CaWO4),
МоО42- — в повеллите (СаМоО4), уранил-ион (UO2)2+ в отеките
(Ca(UO2)2[PO4]2 • 8Н2О);
б) содержание элементов-люминофоров в виде изоморфных
примесей в минералах Мп, Сг, TR, U и др. (при отсутствии Fe);
в) микродефекты в решетках минералов, связанные с содержа-
нием чуждых элементов (механические примеси) или с внешним
воздействием на минерал.
Для возбуждения люминесценции минералов применяются ртут-
но-кварцевые лампы. Облученные ультрафиолетовым светом неко-
торые минералы дают в темноте характерное свечение. Например,
для алмаза типично голубое или фиолетовое свечение, шеелита —
яркожелтое, корунда — красное, сфалерита — желтое и т. д. Одна-
ко следует иметь в виду, что не всегда минералы, содержащие лю-
минофоры, оказываются люминесцирующими. Одной из причин,
препятствующей свечению, может быть наличие в минерале эле-
ментов, гасящих это явление. К элементам-гасителям относятся Fe,
V, As и др. В частности, сфалериты, содержащие повышенное ко-
личество железа, не люминесцируют.
Явление люминесценции используется для диагностики минера-
лов, количественного определения люминесцирующих элементов,
выявления условий образования минералов. Для люминесцентных
исследований применяются установки типа ЛЮМ-1, Л ЮМ-2 и др.
Радиометрический и радиографический методы применяются
для диагностики и изучения минералов, содержащих радиоактивные
элементы. О присутствии этих компонентов в минералах можно су-
дить по их радиоактивности, обусловленной превращением неустой-
чивых изотопов одного химического элемента в изотопы другого
с излучением элементарных частиц.
Метод радиометрии позволяет обнаружить в минерале элемент,
вызывающий радиацию, и установить его принадлежность к уран-
радиевому, ториевому или уран-актиниевому рядам. Содержание
радиоактивных элементов в минерале можно определить путем из-
мерения интенсивности а-, р- и у-излучения определенной навески
минерала в единицу времени (собственно радиометрический метод)
или путем установления количества продуктов распада (радиохи-
мический метод). Для производства точных лабораторных радио-
метрических исследований применяют установку типа ЛАУ-52 и др.
Метод радиографии используют преимущественно для обнару-
жения радиоактивных минералов и выяснения закономерностей
распределения их в породах. Он основан на явлении воздействия
радиоактивного излучения на фотоэмульсию. Фотопластинку свето-
чувствительным слоем прижимают к ровной поверхности минерала
или к пришлифованной поверхности образца породы. Время экспо-
117
нирования различно и зависит от степени радиоактивности изучае-
мого объекта и чувствительности пластинки. При наличии радиоак-
тивных элементов в минерале последний оставляет отпечатки на
фотопластинке.
Для более точного суждения о природе радиоактивности приме-
няют метод микрорадиографии, который заключается в учете ко-
личества следов-треков а-частиц и длины их пробега в светочувст-
вительном слое эмульсии.
Методы изучения физических свойств минералов. С целью изу-
чения физических свойств минералов — удельного веса, твердости,
магнитной восприимчивости, электропроводности, диэлектрической
проницаемости, применяют разнообразные методы исследования.
Наиболее часто в минералогической практике определяют удель-
ный вес, твердость и магнитную восприимчивость, так как установ-
ление этих характеристик необходимо для разработки промышлен-
ных схем извлечения минералов из руд.
Определение удельного веса. Удельный вес минера-
лов является важным диагностическим признаком. В частности, по
величине удельного веса минералов переменного состава можно
косвенно судить об их химическом составе. Существует несколько
методов определения удельного веса.
1. Объемный метод. Определение удельного веса осуществляет-
ся путем измерения объема минералов в объемометре (волюмомет-
ре), заполняемом жидкостью. В зависимости от жидкости (ртуть
или органические жидкости) волюмометры имеют разную конструк-
цию. Например, волюмометр, заполняемый дистиллированной во-
дой, представляет собой стеклянную колбу с длинной трубковидной
горловиной, на которой нанесены деления. Замер объема произво-
дят следующим путем: наливают воду и определяют ее уровень, за-
тем помещают исследуемый образец и снова берут отсчет. Искомый
объем представляет разность двух отсчетов. Удельный вес вычис-
ляют путем деления веса минерала на его объем.
2. Метод гидростатического взвешивания основан на определе-
нии потери веса тела (минерала) в жидкости. Для определения
удельного веса устанавливают вес минерала в воздухе Р, затем вес
его в жидкости и рассчитывают удельный вес d по формуле
d=[P/(P-Px)]-dx,
где d-ж — удельный вес жидкости.
3. Пикнометрический метод. Определение удельного веса про-
изводят при помощи сосудов — пикнометров. Пикнометры имеют
различную форму. В частности, они могут представлять собой стек-
лянную колбу с притертой пробкой, в которой имеется капиллярное
отверстие для выхода воздуха. Последовательность работы по это-
му методу заключается в установлении веса пустого пикнометра
Pi, пикнометра с водой или другой жидкостью Р2, пикнометра -с
минералом Р3, пикнометра с минералом и жидкостью Р4. Расчет
удельного веса d производят по формуле:
d=[(^3-
118
Охарактеризованные методы используют для определения
удельного веса относительно крупных зерен минералов (более не-
скольких мм). Наиболее точным методом является пикнометриче-
ский.
Для определения удельного веса тонкозернистых минералов или
при наличии ограниченной навески минерала применяют различные
микрометоды. К ним относятся микропикнометрический метод и ме-
тод Руденко и Василевского. Последний основан на непосредствен-
ном замере объема минерала путем измерения вытесненной им
жидкости из тонкой трубки, устанавливаемой на столике микроско-
па при горизонтальном положении тубуса микроскопа.
Определение твердости. В лабораторных условиях
твердость минералов устанавливают методом микровдавливания
на специальных приборах микротвердометрах (например, приборе
ПМТ-3). Исследования производят на гранях минералов или на
плоскостях полированных шлифов. Процесс определения заклю-
чается в получени отпечатка алмазного наконечника-штока прибо-
ра, имеющего форму пирамиды. Вдавливание осуществляется опре-
деленной нагрузкой. Минералы разной твердости не одинаково
реагируют на вдавливаемый в них наконечник. В общем случае,
чем больше твердость минерала, тем слабее вдавится наконечник
и тем меньшего размера будет его отпечаток. Измерив размер диа-
гонали отпечатка под микроскопом, совмещенным с твердометром,
и зная нагрузку на шток, можно произвести расчет твердости ми-
нерала.
Определение магнитной восприимчивости. Маг-
нитные свойства минералов характеризуются их магнитной воспри-
имчивостью (х), которая выражает интенсивность намагничивания
минерала в магнитном поле определенной напряженности. Для ус-
тановления магнитной восприимчивости минералов применяют не-
сколько методов, основанных на следующих главных принципах:
1) измерении магнитного поля минерала, создаваемого под
влиянием внешнего магнитного поля;
2) измерении индукционного действия, возникающего при изме-
нении величины или направления магнитного потока;
3) измерении механических сил, действующих на испытуемый
минерал под влиянием внешнего однородного или неоднородного
магнитного поля.
Определение магнитной восприимчивости производится с по-
мощью специальных приборов— магнитометров типа М-14 и др.
Аналитические методы. Основной задачей аналитических иссле-
дований является определение химического состава минералов и со-
держащихся в них элементов — примесей. В настоящее время
имеется целый ряд аналитических методов, позволяющих решать
эти задачи.
Химический метод основан на обычных приемах аналити-
ческой химии. Разнообразные виды анализа позволяют установить
главные химические компоненты минералов. Чувствительность ме-
тода составляет обычно несколько сотых долей процента, что яв-
Н9
ляется достаточным для установления состава минералов. Химиче-
ские методы являются сравнительно дорогими и трудоемкими, они
требуют значительной навески минерала (2—3 г). Поэтому хими-
ческий анализ применяется в особых случаях — при изучении новых
минералов или разновидностей, при исследовании особенно ценных
в практическом отношении минералов, для изучения минералов пе-
ременного состава, когда необходимо установить не только глав-
ные компоненты, но и выявить их валентное состояние (например
Fe3+ и Fe2+).
Метод спектрального анализа. Спектральный ана-
лиз осуществляют путем сжигания порошка минерала в электри-
ческой дуге, возникающей между электродами при пропускании
высоковольтного электрического заряда. Минерал в процессе сжи-
гания испаряется, излучая светящийся поток, который, проходя
через специальный оптический прибор — спектрограф, разлагается
в спектр, фиксируемый на фотопластинках. Каждый из элементов
характеризуется своими линиями спектра. На отснятых фотоплас-
тинках регистрируют типичные для химических элементов линии
спектра и определяют .наличие в минерале тех или иных компонен-
тов. По степени потемнения (интенсивности) линий судят о содер-
жании элемента. Для получения спектра в настоящее время приме-
няются спектрографы типа ИСП-28, ДФС-13 и др.
Спектральный анализ позволяет очень быстро из небольшой на-
вески (обычно 20—200 мг) установить качественный состав мине-
рала или определить количественно содержание некоторых элемен-
тов. Спектральный анализ применяют обычно для диагностики ми-
нералов, выяснения составляющих минерал химических компонен-
тов, установления содержания элементов примесей, анализ кото-
рых химическим способом весьма сложен и дорог (Be, Ge, Ga, Zr,
Hf, Ta, Nb и др.). Следует отметить высокую чувствительность это-
го метода, позволяющего обнаруживать некоторые элементы при
содержании их до 0,001, а иногда и до 0,0001 %.
Существует ряд разновидностей спектрального анализа: метод
фотометрии пламени, атомно-абсорбционный и другие, целью ко-
торых является количественное определение содержания наиболее
характерных элементов примесей в минералах и полезных (рудных)
компонентов. Так, метод фотометрии пламени позволяет весьма точ-
но определять содержание щелочей К, Na, Li, Rb, Cs, а также Sr.
Заключается он в сжигании аэрозоли раствора минералов в пламени
газовой горелки с последующим анализом пламени путем разложе-
ния свечения в спектр и фиксацией последнего фотоэлементом и
связанным с ним самопишущим прибором.
В последнее время широко внедряются методы спектрального
анализа микронавесок и мельчайших зерен. Для возбуждения све-
чения используют искровые генераторы и лазеры.
Рентгеноспектральный метод основан на способно-
сти большинства элементов давать вторичное излучение под дей-
ствиехМ катодных или рентгеновских лучей. Существует несколько
методов этого вида анализа. В частности, широко применяется ме-
120
тод, основанный на первичных спектрах испускания. Навеску иссле-
дуемого минерала помещают на антикатод в специальных катод-
ных установках. Под действием катодных лучей на минерал возни-
кает свечение в определенных длинах волн, которое пропускается
через специальные кристаллы (анализаторы). Полученный спектр
регистрируется счетчиками и самописцами.
Этот анализ используют для количественного определения неко-
торых тяжелых компонентов (редких земель, тантала, ниобия, це-
зия и др.).
В настоящее время широкое распространение приобретает рент-
геноспектральный анализ по вторичным рентгеновским спектрам
испускания — флуоресцентный рентгеноспектральный метод. Этот
метод отличается тем, что исследуемое вещество облучают не ка-
тодными лучами, а пучком рентгеновских лучей. Большие перспек-
тивы флуоресцентного метода открылись после создания установок
для микроанализа (микроанализаторов). Принцип этого метода
сходен с обычным рентгеноспектральным, однако в качестве источ-
ника возбуждения вторичного рентгеновского излучения использу-
ют поток быстро летящих электронов. Имеющиеся очень сложные
электроннооптические установки позволяют определять в минера-
лах содержания элементов с порядковым номером 12 (Mg) и боль-
ше. Значительное преимущество этого метода заключается в воз-
можности производить полный анализ химического состава микро-
объектов (размером около 0,001 мм).
Микрорентгеноспектральным методом можно исследовать твер-
дые включения в минералах, изучать закономерности изменения со-
става минерала в пределах одного кристалла и распределение в
нем элементов.
Радиоактив ад ионный метод базируется на свойстве
химических элементов образовывать радиоактивные изотопы под
действием радиационного облучения. Пробу исследуемого минера-
ла помещают в атомный реактор и подвергают облучению. Содер-
жание определяемых элементов устанавливают по продуктам ядер-
ных превращений радиометрическим или радиохимическим спосо-
бами. Радиоактивационный метод отличается высокой чувствитель-
ностью определения (1 • 10—6-е-1 • 10~8%), требует незначительной
навески минерала (10—100 мг). Этим способом устанавливают со-
держания таких элементов, как W, Та, Sc и др.
Приведенными выше методами не исчерпываются все способы
лабораторного изучения минералов. Более полно и подробно они
рассмотрены в специальных работах по минералогии и методам ис-
следования минералов.
Методы детальных лабораторных исследований
Задачей детальных исследований является углубленное изучение
свойств, состава, структуры минералов, установление взаимосвязи
свойств с кристаллохимией, выяснение физико-химических условий
образования и возраста минералов.
121
П/ри решении этих вопросов, наряду со специальными, использу-
ют и обычные методы лабораторных исследований, однако на этой
стадии изучение производят с повышенной точностью, часто с при-
менением более сложных методик. Например, оптические свойства
исследуют с помощью столика Федорова. Применяют также спе-
циальные микроскопы для изучения минералов в ультрафиолето-
вом свете.
С целью более детальной расшифровки структур минералов ис-
пользуют весьма точные дифракционные методы рентгеноструктур-
ного анализа. Исследование пространственного положения элемен-
тарных частиц в структуре кристаллов осуществляют методами ин-
фракрасной спектроскопии, ядерного магнитного резонанса и др.
Углубленное изучение состава минералов производят, применяя вы-
сокочувствительные спектральные и ядерно-физические анализы.
Данные об условиях образования минералов получают с помощью
парагенетического анализа, термобарометрии, масс-спектроскопии
и экспериментальных исследований.
Парагенетический анализ основан на том, что минералы обра-
зуются в конкретных физико-химических условиях при определен-
ных температуре, давлении и концентрации химических компонен-
тов, при этом они постоянно встречаются совместно, в ассоциации
друг с другом. Те ассоциации, в которых минералы возникают од-
новременно, при единых физико-химических условиях, называются
парагенетическими. В природе имеется большое разнообразие па-
рагенетических ассоциаций. Весьма часто одни и те же минералы,
например кварц, обнаруживаются в разных парагенетических ассо-
циациях. По комплексу минералов, с которыми они ассоциируются,
почти всегда можно судить об условиях их образования. Так, если
кварц находится совместно с калиевым полевым шпатом, плагиок-
лазом и биотитом в составе гранита — очевидно, что он образовался
из магматического расплава при относительно высоких температу-
ре (600—700° С) и давлении. Кварц, находящийся в жилах совмест-
но с топазом, касситеритом и вольфрамитом, возникает обычно из
пневматолито-гидротермальных растворов. В этом случае минера-
лизующая среда представляет собой надкритический раствор с тем-
пературой порядка 400—500° С. Для месторождений сульфидных
руд типична ассоциация кварца с галенитом, сфалеритом, халько-
пиритом и арсенопиритом и другими минералами. Нахождение
кварца в подобной ассоциации указывает на образование его из
гидротермальных растворов при температурах 100—300° С.
На основе изучения природных ассоциаций акад. Д. С. Кор-
жинский разработал метод парагенетического анализа, позволяю-
щий, исходя из наблюдений над природными ассоциациями,
строить физико-химические диаграммы минеральных парагенези-
сов и судить о возможных парагенетических ассоциациях и усло-
виях их образования.
Термобарометрический метод заключается в определении темпе-
ратуры, давления, а иногда и состава минералообразующей среды
по результатам исследования газово-жидких включений в минера-
122
лах. Многие минералы, особенно образующиеся из пневматолито-
гидротермальных и гидротермальных растворов, содержат мель-
чайшие жидкие, газово-жидкие или еще более сложные по составу
включения с твердой фазой. Включения исследуют путем нагрева-
ния или охлаждения в специальных камерах, что позволяет уста-
новить примерную температуру, при которой они были законсерви-
рованы, и их состав. Зная объем фаз во включениях и температуру
их образования, можно определить и давление в момент образова-
ния минералов. При наличии сравнительно крупных включений их
вскрывают и микрохимическим методом определяют химический
состав минералообразующей среды.
Масс-спектрометрический метод основан на фиксации опреде-
ленных изотопов химических элементов (К40, Аг40, РЬ206), возник-
ших в результате естественных ядерных превращений в минералах
после их образования. По количеству изотопов в некоторых мине-
ралах (в частности, содержащих калий — калиевом полевом шпате,
биотите, или содержащих свинец — галените и др.) можно судить
об абсолютном возрасте минералов. Для определения содержания
изотопов применяют специальные приборы — масс-спектрометры.
Экспериментальные исследования. Условия образования некото-
рых минералов могут быть установлены путем моделирования при-
родных процессов. С этой целью производят экспериментальные
исследования и получают искусственные минералы. На основе экс-
периментов иногда удается судить о физико-химической обстанов-
ке, существовавшей в процессе образования природных аналогов.
Современные методы изучения минералов исключительно раз-
нообразны. Выше были кратко рассмотрены основные методы, с
помощью которых производят диагностику минералов, выясняют
их основные свойства и условия образования. Существуют и дру-
гие методы, направленные на углубленное познание минералов с
целью выяснения тех их качеств, которые используют в промышлен-
ности — пьезоэлектрических, тепловых, оптических и др., а также
на установление свойств (магнитных, электромагнитных, смачивае-
мости, прилипаемости и др.), важных для разработки промышлен-
ных схем извлечения минералов из пород и руд.
ГЛАВА 16
КЛАССИФИКАЦИЯ МИНЕРАЛОВ
Исключительно широкое распространение в природе минераль-
ных видов (около 4000), наличие еще большего числа разновиднос-
тей создает известные затруднения в диагностике и изучении ми-
нералов. Разобраться в царстве минералов, определить минераль-
ный вид, особенно новый, бывает подчас очень трудно. Нередко ми-
нералы близкого, а иногда и одного и того же состава (например,
андалузит, дистен, силлиманит) несколько отличаются друг от дру-
га по структуре и свойствам и, напротив, минералы разного соста-
ва могут иметь аналогичную структуру и сходные свойства.
123
Необходимость разобраться в обилии минеральных видов тре-
бует создания единой систематики минералов.
Наиболее ранние классификации основывались на внешних при-
знаках— цвете, форме кристаллов и др. Эти признаки и сейчас ис-
пользуются для визуальной диагностики минералов, на них бази-
руются все многочисленные существующие определители мине-
ралов.
С развитием минералогии в XIX столетии появились классифи-
кации, в основу которых был положен химический состав минера-
лов; иногда минералы систематизировались по преобладающему
компоненту (например, рассматривались все минералы вольфрама,
бериллия и т. п.); известны классификации по кристаллографическо-
му признаку, в которых в одной группе оказывались, например, ку-
бические минералы пирит — FeS2 и галит — NaCl и др. Наконец,
существовали классификации, построенные по генетическому приз-
наку— они объединяли в группы минералы одинакового происхож-
дения— минералы вулканов, гидротермальных жил, минералы оса-
дочного генезиса и др. В этих классификациях в разных группах
находились минералы одного вида, образующиеся при различных
природных процессах.
Для того чтобы можно было широко пользоваться классифика-
цией, необходимо, чтобы каждый минерал в ней занимал строго
определенное положение, т. е. она должна быть однозначной.
База для создания такой современной научно обоснованной
классификации была заложена работами Е. С. Федорова и П. Гро-
та, обнаружившими взаимосвязь между химическим составом и
симметрией кристаллов. В 30-х годах нашего столетия кристалло-
химический принцип был применен В. Л. Бреггом и В. М. Гольд-
шмидтом для классификации силикатов. С кристаллохимических
позиций в последующие годы созданы классификации минералов в
СССР А. Г. Бетехтиным, В. С. Соболевым, Г. П. Барсаковым,
А. С. Поваренных. Ч. Пэлачем, Г. Берманом и К. Фронделем взята
за основу кристаллохимическая систематика при переработке фун-
даментального издания системы минералогии Дж. Д. Дэна. Извест-
ны также классификации X. Штрунца (ГДР), И. Костова (Болга-
рия) и др.
Классификационной единицей в минералогии служит минераль-
ный вид. Одно из современных определений минерального вида
было дано акад. В. С. Соболевым, который к минеральным видам
относит природные соединения, имеющие однотипную структуру и
состав, изменяющийся в определенных пределах.
Кристаллохимическая классификация опирается на два основ-
ных признака — химический состав и структуру минералов. Оба
эти признака теснейшим образом связаны между собой, они опре-
деляют форму и свойства минералов. Так, все минералы в зависи-
мости от характера построек можно разделить на четыре типа:
1) простые атомарные постройки; 2) ионные, большей частью
двойные, соединения; 3) сложные соединения с анионными ради-
калами; 4) молекулярные соединения.
124
В каждом из выделенных типов превалируют определенные хи-
мические связи между структурными элементами. Для атомарных
построек характерны ковалентные и металлические связи, в ионных
соединениях доминируют ионные и ковалентные, для сложных
построек с анионными радикалами характерны ионно-ковалентные
связи. Схематически первые три типа можно изобразить следую-
щим образом: I—А; II—АпХт; III — Ап[ВХт]р, где А, В — катио-
ны; X — анионы; п, т и р — коэффициенты при катионах, анионах
и ионных радикалах. Четвертую группу мы не рассматриваем, по-
скольку она объединяет главным образом органические соеди-
нения.
В зависимости «от участвующих в образовании минералов анио-
нов типы делятся на классы (табл. 12). Ионные соединения типа
АпХт подразделяются, в свою очередь, на три класса, которые об-
разованы следующими анионами:
1) X = S, As, Se, Те — сульфиды, арсениды, селениды, теллу-
риды;
2) Х = О— окислы;
3) X = Cl, F, Вг, I — галогениды (хлориды, фториды, бромиды,
иод иды).
Промежуточное положение -между окислами и сложными соеди-
нениями с анионными радикалами занимают соединения типа
Ап[ВХт]р, в которых X—О; В—Та, Nb, Ti; А—Са, Na, Fe и др. Они
представлены классом титано-тантало-ниобатов.
Тип сложных соединений самый многочисленный, он объединя-
ет следующие классы, выделенные по разным катионам группы В
в соединениях Ап[ВХт]р. В роли катиона В могут выступать:
1) B = N — нитраты;
2) В = С — карбонаты;
3) В — S — сульфаты;
4) B = W, Мо — вольфраматы, молибдаты;
5) В = Р, As, V—•фосфаты, арсенаты, ванадаты;
6) В = В — бораты;
7) B = Si — силикаты.
Во всех этих соединениях в качестве анионов (X) могут быть
О, F, ОН.
Классы, в свою очередь, подразделяются по химическому соста-
ву, структурным особенностям, типам связей на подклассы. Напри-
мер, в классе силикатов выделяются по структурному мотиву ост-
ровные, цепочечные, слоистые и каркасные подклассы.
Подклассы делятся на группы минералов, имеющих сходный
состав и строение и, наконец, минеральные ниды (см. табл. 12).
Описание минералов дано ниже в последовательности, соот-
ветствующей классификации, при этом из многочисленных групп
рассмотрены наиболее распространенные минералы, и только неко-
торые группы приведены полностью или почти полностью. В на-
стоящем пособии не охарактеризованы некоторые классы, напри-
мер, нитраты, молибдаты и другие, которые рассматриваются в
полных курсах минералогии.
125
Схема классификации минералов
ТАБЛИЦА 12
Тип Класс Подкласс Группа * Минеральный вид *
I. Простых соединений А Самородных эле- ментов Металлов Металлоидов Золота Углерода Си — медь Аи — золото Ag — серебро С — алмаз С — графит
II. Ионных соединений А пХт Сульфидов, суль- фосолей Простых сульфидов Дисульфидов Сульфосолей Сфалерита Пирита Тетраэдрита ZnS — сфалерит ZnS — вюрцит Fe$2 — пирит FeS2 — марказит Си38Ь$з —тетраэдрит Cu3AsS3 —теннантит
Окислов Простых окислов Сложных окислов Г идроокислов Корунда Шпинели Гидроокис- лов железа AI2O3 — корунд Fe2O3 —гематит MgAl^C^ —шпинель FeFe2O4 — магнетит РеСг2О4 — хромит А1гВеО4 — хризоберилл НРеОг — гетит Ге20з-л Н2О — лимонит
Г алогенидов — Галита NaCl — галит KCI —сильвин
Па. Сложных ионных со- единений типа А пВХт Титано-тантало- -ниобатов — Колумб и т- танталита (Fe, Мп) ЫЬгОб — колумбит (Fe, Мп) ТагОб — танталит
|
1
III. Сложных соедине- ний с анионным ра- дикалом Дп[ВХт]р Нитратов —
Карбонатов Безводных карбонатов
Карбонатов с добавочны- ми анионами
Сульфатов —
Вольфраматов —
Фосфатов, ванада- тов, арсенатов Безводных фосфатов, ва- надатов
Водных фосфатов, вана- датов
Боратов —
— NaNO3 —натриевая се- литра
Кальцита Са [СО3] — кальцит Mg [СО3] — магнезит MgCa [CO3J2 — доломит Fe [СО3] — сидерит
Малахита Си2 [СО3] (ОН)2 — малахит Си3 [СО3]2 (ОН)2 — азурит
Барита Ba [SO4] — барит * Sr SO4] — целестин Pb [SO4] — англезит
Вольфрами- та FeWC>4 — ферберит MnWC>4 — гюбнерит
Монацита (Се, La...) [РО4] — монацит Се [РО4] — ксенотим
Урановых слюдой Си [UO2]2 [РО4]2 • 12Н2О — торбернит Са [UO2]2 [РО4]2-8Н2О — отенит К2 [UO2]2 [VO4]2-3H2O—^карнотит Са [UO2]2 [VO4]2-8H2O — тюямунит
Гидробора- цита CaMg [В2ВС>4 (ОН)3]2-ЗН2О — гидроборацит
Продолжение табл. 12
Тип Класс Подкласс Группа ♦ Минеральный bh i *
Силикатов Островных силикатов Граната Mg3Al2 Fe3Al2 Мп3А12 Сз3А 12 Ca3Fe2 Са3Сг2 SiO4 S1O4 SiO4 SiO4 S1O4 SiO4 3 — пироп 3 — альмандин 3 — спессартин з — гроссуляр з — андратит 3 — уваровит
Цепочечных силикатов Амфиболов Ca2Mg5 [S14O] J2 (ОН)2 — тремолит Саг (Mg, Fe)5 [S14O11]2(ОН)2 — актинолит NaCa2 (Mg, Fe)4(Fe, A1)X X[(Si, А1)40ц]2 (OH)2 — роговая обманка Na3(Mg, Fe)4(Fe, Al) x X [Si4011]2 (OH)2 — арфведсонит
Слоистых силикатов Слюд KMg3 [AiSi3Ojo] (F, OH)2 — флогопит К (Mg, Fe)3 [AISi3O10] X X (F, OH)2 — биотит К Al2 [ A IS i3Oio] (OH)2 — мусковит KLi 1 A11,5[ A1S i3Oi0](F,OH)2— лепидолит
Каркасных силикатов Полевых шпатов Ca [A12Si2Og Na AlSi<O8 K[AlSi3O8 K[AlSi3O8 — аиоргит — альбит — ортоклаз — микроклин
IV. Молекулярных со- единений — — — C40H64O4 — янтарь
• В таблице в качестве примера приведены только некоторые группы минералов и входящие в них минеральные виды.
Для каждого минерального вида в пособии приводится проис-
хождение его названия, указаны наиболее широко распространен-
ные разновидности, охарактеризован химический состав и особен-
ности структуры минералов. Приведена характеристика чаще всего
встречающихся кристаллических форм и агрегатов, главные физи-
ческие свойства и наиболее яркие диагностические признаки. Крат-
ко рассмотрены основные природные процессы, при которых обра-
зуются минеральные виды. Указаны ведущие области практическо-
го применения минералов.
Названия минеральных видов в минералогии не имеют строгой
унификации. Некоторые названия связаны с химическим составом
минералов (например, натролит), другие происходят от того или
иного физического свойства — цвета (лазурит), характера спайно-
сти (плагиоклаз) и др. Многие минералы названы по месту их на-
хождения (мусковит), в честь ученых (ферсмит) или имеют другое
происхождение.
Поскольку широким распространением пользуются минералы
переменного состава, следует указать и на понятие «минеральная
разновидность». Так, существуют минералы одного вида с несколь-
ко различным химическим составом, возникшим за счет частичного
изоморфного замещения одного какого-либо химического компонен-
та другим (например, при замещении в сфалеритах части цинка
железом образуется разновидность — марматит). Разновидности
выделяются также по таким признакам, как наличие в минералах
характерных примесей (кадмийсодержащий сфалерит-пршибра-
мит), необычной окраски (фиолетовый кварц—аметист, зеленый
микроклин — амазонит), специфических агрегатов (пластинчатый
альбит — клевеландит, лучистый топаз — пикнит) и др.
5—3628
РАЗДЕЛ III
ОПИСАНИЕ МИНЕРАЛОВ
ГЛАВА 17
КЛАСС САМОРОДНЫХ ЭЛЕМЕНТОВ
К самородным элементам относятся такие ценные минералы, как
золото, платина, серебро, алмаз. В природе они довольно редки.
Самородные элементы можно разделить на два подкласса: метал-
лы и металлоиды.
К металлам относятся золото, медь самородная, серебро, плати-
на. К металлоидам — сера самородная, алмаз, графит и Др. Метал-
лы из класса самородных элементов представлены атомными струк-
турами с металлическим типом связи. Металлический тип связи
определяет все физические свойства этих минералов: сильный ме-
таллический блеск, хорошую электропроводность, ковкость и тепло-
проводность.
Среди (минералов подкласса металлоидов встречаются структуры
с ковалентной или молекулярной связью с характерными для этих
типов связи физическими свойствами.
По своему происхождению самородные элементы чрезвычайно
разнообразны.
Подкласс металлов
МЕДЬ САМОРОДНАЯ — Си.
Химический состав: бывает химически чистой, иногда содержит
типичные примеси Au, Fe, Ag до 2—3%.
Сингония кубическая.
Структура — плотнейшая кубическая упаковка. В элементарной
ячейке, имеющей форму куба, атомы меди располагаются по верши-
нам и в центре граней куба (рис. 61).
Медь встречается в виде дендритов (рис. 62), пластинок или
сплошных масс.
Физические свойства — цвет красный, медно-красный; блеск ме-
таллический, характерна побежалость; спайность отсутствует; отли-
чается ковкостью и высокой электропроводностью; твердость 2—3;
удельный вес 8,5—8,9.
Диагностические признаки — цвет, ковкость, удельный вес.
Происхождение — чаще всего самородная медь образуется в
нижних частях зоны окисления медно-сульфидных руд. В частности,
130
образование меди при окислении халькопирита происходит следую-
щим путем:
2CuFeS2 + Н2О Н- 5,5О2 -> Cu2S'+ 2FeSO4 + H2SO4
Халькопирит Халькозин
Cu2S + 2О2 CuSO4 + Си
Халькозин Мель
В гидротермальных условиях самородная медь образуется зна-
чительно реже. В этом случае она ассоциирует с кальцитом и цео-
литами (известно гидротермальное месторождение самородной
меди вблизи Верхнего озера в США).
Месторождения: в СССР — Турьинские рудники (Урал) и др.;
за рубежом — район Верхнего озера (США) и др.
Практическое значение — применяется в электропромышленно-
сти, машиностроении, для чеканки монет.
СЕРЕБРО — Ag.
Химический состав: помимо химически чистого серебра, в приро-
де встречаются разности с примесью Au, Си, Sb.
Сингония кубическая.
Структура аналогична структуре меди. Серебро образует сплош-
ные скопления — самородки, характерны также листочки, волосо-
видные формы.
Физические свойства — цвет белый, серебряно-белый, однако час-
то поверхность самородков бывает покрыта черным налетом; блеск
металлический; спайность отсутствует; ковко; прекрасный провод-
ник тепла и электричества; твердость 2,5; удельный вес 10—11.
Диагностические признаки — большая ковкость (острие ножа
легко оставляет след); крючковатый излом; характерные формы
дендритов; белый цвет на свежей поверхности.
Происхождение: а) гидротермальное; в жильных месторождени-
ях совместно с кальцитом и аргентитом, часто появляется в ваде
мельчайших включений в галените; б) в зоне окисления и цемен-
тации сульфидных руд -может образоваться при окислении аргенти-
та. Скопления серебра иногда связаны с окислением галенита,
содержащего серебро, причем последнее выносится растворами и
отлагается в зоне цементации. Спутники —
аргентит, блеклые руды, кальцит.
Месторождения: в СССР встречается,
главным образом, в зоне окисления свин-
цово-цинковых месторождений Алтая, Ка-
захстана и Восточного Забайкалья; за ру-
бежом известны месторождения в Норвегии
(Конгсберг), Чили и Мексике.
Практическое значение — применяется в
приборостроении, для предохранения раз-
личных металлов от окисления (серебре-
ние), изготовления специальных тиглей,
Рис. 61. Структура меди
ювелирных изделий.
5*
131
Рис. 62. Дендриты самородной меди в медистом
песчанике
ЗОЛОТО —Au.
Химический состав: в химически чистом виде встречается редко,
обычно содержит примеси Ag от 4 до 15% (разновидность золота,
богатая серебром до 30—50%, называется электрумом), Си до 20%
(медистое золото), Pd от 5 до 11% и одновременно Ag до 4% (пор-
пецит), Bi до 4% (висмутистое золото), а также примеси теллура.
Сингония кубическая.
Структура аналогична структуре меди. Встречается обычно в
виде зерен, иногда дендритов, изредка наблюдаются кристалличе-
ские формы (кубы, октаэдры); самородки золота в редких случаях
могут достигать значительного веса — на Урале был найден само-
родок весом 36 кг.
Физические свойства — цвет ярко-желтый, при повышенном со-
держании серебра бледно-желтый; блеск металлический; черта
золотисто-желтая до оранжево-красной; спайности нет; ковко;
удельный вес 15—18,3 (чистого золота — 19,3); твердость 2,5—3.
Диагностические признаки — характерный цвет, ковкость, не-
большая твердость; отличается от похожих на «него пирита и халь-
копирита сильным блеском и высокой твердостью.
Происхождение — золото встречается, главным образом, в гид-
ротермальных жилах в ассоциации спиритом, арсенопиритом и дру-
гими сульфидами; часть его находится в рассеяном тонкодисперс-
ном состоянии в сульфидах (арсенопирите, пирите, галените) и об-
наруживается при помощи химического анализа. Образуется также
в низкотемпературных гидротермальных месторождениях вместе
с антимонитом, халцедоном, иногда теллуридами. В зоне окисления
132
сульфидных месторождений золото переносится в растворенном вй-
де (золото легко растворяется сернистыми и хлористыми соедине-
ниями, а также образует растворимые соединения с органическими
кислотами) и вторично отлагается, концентрируясь в нижних час-
тях зоны окисления среди лимонита, малахита, азурита и различ-
ных охр. Благодаря своей химической стойкости частицы золота
переносятся поверхностными водами, образуя россыпи, откуда зо-
лото добывается в значительном количестве.
Месторождения: в СССР Березовское (Урал), Дарасунское, Ба-
лейское, Дмитровское (Забайкалье), в Магаданской области и др.;
за рубежом Трансвааль (Ю. Африка), ряд месторождений на Аляс-
ке, Виктория в Австралии и др.
Практическое значение—основной валютный металл; применя-
ется для изготовления физических и химических приборов, а также
для ювелирных изделий.
ПЛАТИНА—Pt.
Химический состав: самородная платина из-за обилия изоморф-
ных примесей (Fe, Ir, Os, Pd) в чистом виде в природе встречается
очень редко. Под названием самородная платина обычно имеют
в виду поликсен, содержащий 9—И % Fe.
Сингония кубическая.
Структура аналогична структуре меди. Встречается обычно в
зернах или сплошных массах;кристаллы в виде кубов очень редки.
Физические свойства — цвет стальной, серый; блеск металличе-
ский; спайности нет; ковка; богатые железом разности слабо маг-
нитны; твердость 4,5; удельный вес 14—19.
Диагностические признаки — большой удельный вес, от похоже-
го на него серебра отличается высокой твердостью, а также тем,
что не растворяется ни в каких кислотах, кроме царской водки.
Происхождение магматическое. Платина относится к самым вы-
сокотемпературным минералам и выделяется в начале магматиче-
ского процесса. Обычно образует вкрапления в ультраосновных по-
родах (дунитах), часто встречается вместе с хромитом и осмистым
иридием. Кроме того, платина появляется в магматических медно-
никелевых месторождениях, связанных с основными породами. В
этом случае она обогащена палладием и тесно ассоциируется с пир-
ротином, пенталандитом, халькопиритом. Платина очень устойчива
к выветриванию и в связи с этим накапливается в россыпях.
Месторождения: в СССР — на Урале; за рубежом — Садбери
(Канада) и др.
Практическое значение. Благодаря своей тугоплавкости и кис-
лотоупорности применяется в химической и электротехнической
промышленности, является также валютным металлом.
Подкласс металлоидов
СЕРА САМОРОДНАЯ — S.
Химический состав: химически чистая сера встречается редко,
обычно она содержит примеси Se, Те, иногда As.
133
Сингония ромбическая (другие модификации в природных усло-
виях неустойчивы).
Структура кольцевая. Восемь атомов серы соединены между
собой так, что образуют электрически нейтральную кольцо-молеку-
лу Ss (рис. 63). Элементарная ячейка решетки самородной серы
образована шестнадцатью такими молекулами, очень слабо связан-
ными между собой связями Ван-дер-Ваальса, что и определяет фи-
зические свойства самородной серы — хрупкость, летучесть и др.
Самородная сера встречается в виде кристаллов бипирамидаль-
ного облика, характерны также усеченные бипирамиды, ромбоэдри-
ческие кристаллы и сплошные массы (рис. 64).
Физические свойства — цвет от светло-желтого, зеленовато-жел-
того до коричневого; блеск на гранях алмазный, в изломе жирный;
спайность несовершенная; хрупка; летуча; хороший изолятор; твер-
дость 1—2; удельный вес 2—2,1.
Диагностические признаки — характерный цвет, небольшая твер-
дость, хрупкость, легкоплавкость, жирный блеск в изломе.
Происхождение: а) вулканическое; при извержении вулканов
сера возгоняется и осаждается в виде налетов на стенках кратеров
вместе с реальгаром, аурипигментом и другими минералами;
б) осадочно-биогенное; в болотах, стоячих водоемах, на дне морей
вследствие гниения организмов возникает сероводородистый режим,
способствующий отложению серы. Образованию самородной серы,
способствует также жизнедеятельность особых бактерий. По по-
следним данным, обнаружено присутствие этих бактерий в подзем-
ных водах и нефти. Самородная сера этого типа встречается в из-
вестняках, мергелях вместе с гипсом, целестином, битумами,
коллоидальной глиной; в) экзогенное — в коре выветривания при
разложении сульфидов. Образование серы может происходить по
реакции FeS + Fe2(SO4)3 = 3FeSO4 + S; г) при разложении ангидри-
то-гипсоносных толщ под воздействием битумов. Спутниками серы
в данном случае являются гипс, ангидрит. В сере часто появляются
примазки битумов.
Месторждения: в СССР — Гаурдак (Турк-
менская ССР), Шор-Су (Узбекская ССР), Алек-
сеевское (Куйбышевская обл.); за рубежом в Си-
цилии.
Практическое значение — применяется для
производства серной кислоты, которая исполь-
зуется в различных отраслях промышленности, в
частности для получения суперфосфата из апа-
титового сырья, в сельском хозяйстве для борь-
бы с вредителями; в бумажном производстве, при
вулканизации резины; для производства спи-
чек и др.
АЛМАЗ —С (название произошло от гречес-
Рис. 63. Структура
серы (кольцо-моле-
кула)
кого слова «адамас»—непобедимый, непреодо-
лимый; по-видимому, из-за высокой твердости и
химической стойкости минерала).
134
Рис. 64. Кристаллы самородной серы
Химический состав: бесцветный алмаз представляет собой чис-
тый углерод. Окрашенный алмаз содержит включения графита.
Сингония кубическая.
Структура координационная, близка к структуре плотнейшей
кубической упаковки (рис. 65). Элементарная ячейка в виде куба
разбивается тремя взаимно перпендикулярными плоскостями на
восемь малых кубов, по вершинам каждого из них расположены че-
тыре атома углерода. Еще четыре атома находятся в центрах четы-
рех из восьми маленьких кубов. Таким образом, кубы с заполнен-
ными и незаполненными центрами чередуются. Координационное
число углерода равно 4. Плотнейшая структура и ковалентная связь
между всеми атомами сказывается на физических свойствах алма-
за — исключительной твердости, высокой температуре плавления.
Алмаз находится в виде хорошо образованных кристаллов —
октаэдров, реже — кубов и тетраэдров.
Разновидности — плотный, иногда зернистый буровато-черный
алмаз — карбонадо; тонкозернистый и скрытокристаллический ал-
маз серого или черного цвета — борт.
Физические свойства — бесцветный, реже голубой; блеск силь-
ный, алмазный; спайность совершенная (по октаэдру); твердость
наивысшая—10, люминесцирует в рентгеновских лучах; удельный
вес 3,47—3,56.
Диагностические признаки — высокая твердость, характерный
алмазный блеск, типичные формы кристаллов — октаэдры с закруг-
ленными гранями, люминесцирует голубым цветом.
Происхождение магматическое; встречается в ультраосновных
породах — кимберлитах, слагающих специфические трубки взрыва,
135
Рис. 65. Структура алмаза:
1—11 — атомы углерода
Рис. 66. Структура графита
прослеживающиеся на значительную глубину. Алмаз возникает при
высоких температурах и давлении приблизительно в 2200 ат. Спут-
никами алмаза являются оливин, гранат (пироп), ильменит, хром-
диопсид. Алмаз очень устойчив и при разрушении кимберлитов
переходит в россыпи, где он постоянно ассоциируется с пиропом.
Месторождения: в СССР — в Якутии; за рубежом — в Южной
Африке, Бразилии, Индии.
Практическое значение — применяется в металлообрабатываю-
щей и абразивной промышленности, а также в ювелирном деле как
драгоценный камень (бриллиант).
ГРАФИТ — С (от греческого слова «графе» — пишу).
Химический состав: графит редко бывает чистым, обычно при-
сутствуют примеси минеральных частиц, битумы, газы.
Сингония гексагональная.
Структура слоистая (рис. 66). Атомы углерода образуют отдель-
ные слои. В каждом таком слое они расположены по вершинам
правильного шестиугольника. Связи между слоями очень слабые.
Из особенностей структуры графита вытекает целый ряд свойств
этого минерала: весьма совершенная спайность, меньший удельный
вес по сравнению с алмазом и очень низкая твердость.
Графит встречается в виде чешуек или сплошных мелкозернис-
тых масс, реже он образует кристаллы.
Физические свойства—цвет черный; черта черная, блестящая;
блеск металлический, серебристый; хороший проводник электриче-
ства; твердость 1—2; удельный вес 2,1—2,2.
Диагностические признаки — черный цвет, низкая твердость,
пачкает бумагу и руки.
Происхождение: графит образуется в восстановительных усло-
виях при высокой температуре (выше 300° С) и сравнительно не-
большом давлении (десятки атмосфер). Процесс идет путем разло-
жения углеводородов по схеме СН4—*С+2Н2 или окиси углерода
по реакции Будуара 2СО + СО2 + С. Наличие углеводорода опреде-
ляется той или иной геологической обстановкой, большей частью он
поставляется битумами, содержащимися в осадочных и метамор-
фических породах.
136
При магматическом образовании графита источником углерода
служат вмещающие горные породы. Такой графит (кристалличес-
кий, высшего сорта) ассоциируется с волластонитом, пироксенами,
плагиоклазом, кальцитом.
При пневматолито-гидротермальных процессах образуется круп-
ночешуйчатый графит в виде жил, пересекающих известняки, со-
держащие органичесские вещества или каменные угли. В этом слу-
чае графит часто ассоциируется с турмалином и кварцем.
Метаморфические месторождения графита возникают за счет
каменных углей или органических веществ, когда последние подвер-
гаются действию регионального или термального метаморфизма.
Месторождения: в СССР — Батагольское (Восточная Сибирь),
Ждановское (УССР), Мурзинское (Урал) и др.; за рубежом —
Онтарио !И Квебек (Канада); в Южной Африке, Бразилии, Индии
и др.
Практическое значение — применяется для производства тиглей,
используемых в литейном деле, электродов, смазки трущихся частей
машин, производства карандашей, в лакокрасочной промышленно-
сти. Из графита изготовляют специальную замазку, применяющую-
ся в паровых котлах как средство, предохраняющее их от ржавчи-
ны и накипи. В атомной промышленности графит, характеризую-
щийся весьма низкой способностью поглощать нейтроны,
используется при изготовлении реакторов.
ГЛАВА II
КЛАСС СУЛЬФИДОВ
К классу сульфидов относятся соединения серы с различными
металлами. В земной коре количество сульфидов, по В. И. Вернад-
скому, составляет 0,15% по весу.
По типам связей сульфиды должны были быть типично ионными
соединениями. Однако, вследствие большого ионного радиуса серы
(1,74 А) при соединении с катионами большого размера происходят
явления поляризации, в результате которых у катиона и аниона по-
являются общие электронные оболочки. Таким образом, у сульфи-
дов возникают не чисто ионные, а ионно-ковалентные связи, а в
некоторых случаях — чисто ковалентные.
Ковалентный тип связей в сульфидах определяет и характерные
их физические свойства, сходные со свойствами предыдущего
класса — самородными элементами. Многие минералы этого клас-
са также имеют металлический блеск, отличаются электро- и тепло-
проводностью, большим удельным весом. Как правило, все они
имеют небольшую твердость (порядка 3—4). Молибденит, антимо-
нит, аурипигмент и реальгар обладают низкой твердостью (1—2), и
только некоторые из сульфидов, в частности, пирит, марказит, ар-
сенопирит и кобальтин характеризуются средней твердостью (око-
ло 5—6). Цвет большинства сульфидов темный: свинцово-серый и
стально-серый у галенита, антимонита, висмутина, тетраэдрита,
халькозина, молибденита, арсенопирита; темно-коричневый у сфа-
137
лерита; бронзово-желтый и латунно-желтый у пирротина, пентлан-
дита, халькопирита, пирита и марказита. Только некоторые из суль-
фидов отличаются яркой и светлой окраской — желтой (аурипиг-
мент, некоторые безжелезистые сфалериты — клейофаны) и красной
(киноварь, реальгар). Большинство сульфидов оставляет на фарфо-
ровой пластинке черную или зеленовато-черную черту; для сфале-
рита характерна коричневая черта; молибденит (в меньшей степени
антимонит) прочерчивают на бумаге темную черту и этим молибде-
нит несколько напоминает графит (черта у молибденита более
светлая, слегка голубоватая).
По своему химическому составу сульфиды можно рассматривать
как соли сероводородистой кислоты H2S, в связи с чем они могли
бы быть разделены в зависимости от валентностей катионов на
группы: T?21+S, 7?2+S, T?23+S3 и 7?4+S3, где 7? — катион.
Наиболее типичными катионами, образующими соединение с се-
рой, являются: Ag1+, Cu1+, Cu2+, Pb2+, Hg2+, Zn2+, Fe2+, Sb3+, Bi3+,
As3+, Mo4+, As5+, Sb5+ Характерными элементами-примесями, кото-
рые в ряде случаев извлекаются из сульфидов, являются: кадмий,
индий, галлий, германий (присутствуют в сфалерите), таллий (в
галените и пирите), селен (в пирите, халькопирите, молибдените,
киновари). Кроме того, в сульфидах часто находятся мельчайшие
механические примеси самородного золота, серебра, теллуридов
и селенидов. Теллуриды и селениды близки к сульфидам и рассмат-
риваются обычно совместно с ними.
Все сульфиды, в зависимости от их состава, типа связей и
свойств, могут быть разделены на три подкласса.
1. Простые сульфиды, состав которых определяется фор-
мулой RnSm, где величины п и т зависят от валентности катиона.
Связи между катионами R и анионом S2- ионно-ковалентные. По
составу катионов среди простых сульфидов выделяют:
7?I + S —халькозин — Cu2S;
R2+ S — аргентит — AgS,
галенит — PbS,
сфалерит — ZnS,
халькопирит — CuFeS2 или CuS-FeS,
борнит — Cu5FeS4 или 2Cu2S-CuS-FeS,
киноварь — HgS;
пирротин — FeS (поскольку часть железа в пирротине
находится в виде Fe3+, то правильная фор-
мула его Fei-xS),
пентландит — [(Fe, Ni)S] (более правильная формула
[(Fe, Ni)9S8]);
реальгар — AsS;
/?2+5з — антимонит — Sb2S3,
висмутин — Bi2S3,
аурипигмент — As2S3;
Т?4+ S2— молибденит — MoS2.
Из всех этих сульфидов по типу связей резко выделяются реаль-
гар и аурипигмент, которые характеризуются появлением молеку-
лярных связей. Эти сульфиды могут рассматриваться как аналоги
самородной серы. Если в молекуле серы Se, имеющей кольцевое
138
строение, заменить половину атомов серы на мышьяк, то состав
такого минерала может быть представлен в виде As4S4 или As2S2.
Это определяет сходство реальгара и самородной серы (низкая
твердость, хрупкость, возгоняемость и т. д.). При окислении мышья-
ка реальгар As2S2 легко переходит в аурипигмент Аб25з. Этот пере-
вод происходит даже под воздействием солнечного света.
Среди сульфидов с ионно-ковалентными связями выделяются ми-
нералы различных мотивов структур.
Координационный мотив имеют все сульфиды типа /?2+S и
/?21+S. Так, в структуре NaCl кристаллизуется галенит PbS, структу-
ра алмаза свойственна сфалериту только с той разницей, что в
узлах решетки располагаются не атомы углерода, а ионы цинка и
серы. Данное обстоятельство определяет изометрический облик
кристаллов этих минералов, кубическую сингонию, наличие у га-
ленита спайности по кубу, а у сфалерита — по граням ромбододе-
каэдра, а также все физические свойства. Если удвоить элементар-
ную ячейку сфалерита (2ZnS = Zn2S2) и заменить ионы цинка на
ионы меди и железа, то из сфалерита легко можно вывести структу-
ру халькопирита CuFeS2. Сингония при этом понизится до тетраго-
нальной, но свойства все сохранятся. Отсюда родство сфалерита и
халькопирита, их постоянное совместное нахождение в природе.
Цепочечный мотив структуры характерен для сульфидов типа
/?23+5з: антимонита Sb2S3 и висмутина Bi2S3. Цепочечный мотив
структуры определяет вытянутую игольчатую и лучистую форму их
кристаллов, ромбическую сингонию, появление совершенной спай-
ности, проходящей вдоль удлинения кристаллов.
Слоистый мотив структуры типичен для сульфидов /?4+S2, в
частности, для молибденита MoS2. Отсюда низкая твердость мине-
рала, весьма совершенная спайность, образование его в форме гиб-
ких листочков гексагональной сингонии, сходство с графитом, к
которому он весьма близок по своей структуре.
2. Дисульфиды. Наряду с простыми сульфидами — солями
сероводородистой кислоты H2S, в природе встречаются соедине-
ния, у которых два иона серы тесно соединены друг с другом кова-
лентными связями в один общий анион S22~. Такие соединения по-
лучили название дисульфидов. Общий состав их может быть изо-
бражен в виде 7?2+S2, при этом связи между катионом /?2+ и
анионом S22~ ионно-ковалентные, а между двумя анионами серы —
ковалентные. Естественно, что такие соединения будут отличаться
весьма большой прочностью, что определяет высокую их твердость.
В дисульфидах один из ионов серы в группе S22~ легко может за-
мещаться мышьяком, образуя группу [AsS]2~. В других случаях оба
иона серы замещаются на As22-. К этому подклассу относятся
минералы:
Кубической сингонии
Пирит FeS2
Кобальтин CoAsS
Герсдорфит NiAsS
Шмальтин CoAs2
Ромбической сингонии
Марказит FeS2
Арсенопирит FeAsS
139
3. Сульфосоли. К ним относятся комплексные соединения,
общий состав которых может быть изображен в виде /?n[(As, Sb) Sm]’.
В. И. Вернадский рассматривал их как соли сложных сульфокислот
типа H3AsS3, H3SbS3, H3AsS4 и т. п., в связи с чем эти минералы час-
то называют сульфосолями. Катион в этих соединениях может
быть представлен Си, РЬ и Ag, поэтому выделяется ряд медных
сульфосолей, называемых обычно блеклыми рудами, ряд свинцо-
вых и ряд серебряных сульфосолей. Состав этих минералов еле*
дующий:
Си — сульфосоли—тетраэдрит (сурьмянистая блеклая руда) —
Cu3SbS3,
теннантит (мышьяковистая блеклая руда) —
Cu3AsS3,
энаргит — Cu3AsS4;
РЬ — сульфосоли — джемсонит — Pb2Sb2S5,
буланжерит — Pb5Sb4Sn;
Ag — сульфосоли — прустит (красная светлая серебряная руда) —
Ag3AsS3,
пираргирит (красная темная серебряная ру-
да) — Ag3SbS3,
стефанит — Ag5SbS4.
Условия образования сульфидов разнообразны. В природе они
возникают следующим путем:
а) в магматическом процессе при ликвации основной силикат-
ной магмы. При этом происходит отделение от силикатного распла-
ва капель сульфидов, иногда скапливающихся в донных участках
магматического резервуара. Таким путем образуются медно-нике-
левые сульфидные руды, состоящие из пирротина, пентландита и
халькопирита;
б) наиболее часто встречаются сульфиды гидротермального
происхождения. Они выделяются на протяжении всего гидротер-
мального процесса. При этом одни сульфиды выделяются почт»
непрерывно (например, пирит), тогда как другие характерны толь-
ко для определенных стадий процесса. На схеме (табл. 13) показа-
ны диапазоны выделения различных сульфидов.
в) сульфиды могут образовываться и осадочным путем вследст-
вие (развития на дне моря сероводородного режима, .возникающего
при массовой гибели организмов и их гниении. В этих условиях
происходит выделение коллоидного черного дисульфида железа —
мельниковита, переходящего впоследствии в марказит или пирит.
Реже таким путем образуются сфалерит или галенит;
г) сульфиды возникают также при вулканогенно-осадочных про-
цессах, когда происходят подводные извержения вулканов и значи-
тельные количества сероводорода поступают из вулканов в
морскую воду;
д) в нижней части зоны окисления сульфидных месторождений
в результате взаимодействия халькопирита с сульфатом меди, об-
разующимися при окислении халькопирита, возникают специфи-
ческие сульфиды зоны вторичного сульфидного обогащения — бор-
нит и халькозин.
140
ТАБЛИЦА 13
Минералы
Высокотемпературные
(гипотермальные)
Среднетемпературные
(мезотермальные)
Низкотемпературные
(эпитермальные)
Арсенопирит ----------------
Висмутин ----------------
Мол иб д ен иг -------------------------
Пирит---------------------------------------------------------
Пи рро т vн -------------------------
Сфалерит ---------------------------------•
Галенит -------------------------
Халькопирит -------------------------
Блеклые руды --------
РЬ и Ag-сульфосоли ----------------
Антимонит ----------------
Киноварь ----------
М а рка зИт ----------
Реальгар ----------
Сульфиды являются важнейшими рудами для извлечения из них
свинца (галенит), цинка (сфалерит), меди (халькопирит, борнит,
халькозин, ковеллин), серебра (аргентит, красная серебряная ру-
да), ртути (киноварь), сурьмы (антимонит), мышьяка (арсенопи-
рит, аурипигмент, реальгар), молибдена (молибденит), висмута
(висмутин), кобальта (кобальтин, шмальтин), никеля (пентландит,
никелин, герсдорфит), кадмия (сфалерит), германия (сфалерит,
германит), рения (молибденит, халькопирит). Кроме того, сульфи-
ды могут являться источником получения серной кислоты (в первую
очередь пирит и пирротин), необходимой для химческой промыш-
ленности.
Подкласс простых сульфидов
ХАЛЬКОЗИН — Cu2S (от греческого слова «халькос» — медь).
Химический состав: Си — 79,9%, S — 20,1%; примеси Ag, Au,
Fe, Со, As.
Сингония ромбическая.
Структура очень сложная и точно не выяснена. Встречается
халькозин чаще всего в виде сплошных масс и таблитчатых выде-
лений. Кристаллы образуются редко (рис. 67).
Физические свойства — цвет свинцово-серый; черта темно-серая;
хрупок; блеск металлический; спайность несовершенная; твердость
2—3; удельный вес 5,5—5,8.
Диагностические признаки — темный, свинцово-серый цвет, низ-
кая твердость.
Происхождение — типичный минерал зоны вторичного обогаще-
ния. Образуется при реакциях .между первичными сульфидами
меди, например, халькопиритом и растворами, содержащими суль-
фат меди (медный купорос). В более редких случаях кристаллизу-
141
Рис. 67. Формы кристаллов халькозина
ется совместно с эндогенным борнитом в гидротермальных услови-
ях в резко восстановительной среде. В окислительной обстановке
легко изменяется, переходя в куприт и малахит.
Месторождения: в СССР—Коунрад, Джезказган (Казахская
ССР), Алмалык (УзССР), Турьинские рудники (Урал); за рубе-
жом— Бьюте, Теннеси (США), Тсумеб (Юго-Западная Африка)
и др.
Практическое значение — самая богатая медная руда.
ГАЛЕНИТ — PbS (от латинского слова «галена» — свинцовая
руда), синоним—свинцовый блеск.
Химический состав: РЬ — 86,6%; S—13,4%; примеси Se , Ag,
Au, Zn.
Сингония кубическая.
Структура координационная подобна структуре NaCl; свинец
и сера находятся в шестерной координации (рис. 68), каждый ион
свинца окружен шестью ионами серы .и каждый ион серы находит-
ся в окружении шести ионов свинца.
Часто встречается в виде кристаллов (рис. 69), представленных
кубами, кубо-октаэдрами, пентагон-додекаэдрами; характерны
также зернистые массы (мелкозернистые агрегаты галенита полу-
чили название «свинчака»).
Физические свойства — цвет свинцово-серый; черта серовато-
черная; блеск металлический; спайность совершенная; слабо элек-
• Р&. о s
Рис. 68. Структура гале-
нита
тропроводен; кристаллы галенита имеют
детекторные свойства; твердость 2—3;
удельный вес 7,4—7,6.
Диагностические признаки — большой
удельный вес, цвет, сильный металличе-
ский блеск, совершенная спайность.
Происхождение преимущественно гид-
ротермальное. Типичными спутниками
являются сфалерит, халькопирит, пирит,
блеклые руды; из нерудных минера-
лов— кварц, кальцит, барит. В зоне
окисления легко изменяется, переходя в
англезит и церуссит.
Месторождения: в СССР — Алтын-
Топкан (Таджикская ССР), Садонское
142
Рис. 69. Агрегат кристаллов галенита
(Сев. Кавказ), Змеино горское, Зыряновское (Рудный Алтай), Те-
тюхе (Приморье) и др.; за рубежом — Галена, район Миссисипи,
Ледвилл в Колорадо (США), Сулливан (Канада), Пршибрам
(ЧССР) и др.
Практическое значение — главнейшая руда на свинец, применя-
ющийся для производства сплавов, красок, белил, свинцовых камер
для хранения радиоактивного сырья, в сернокислотном производ-
стве и др.
СФАЛЕРИТ — ZnS (название происходит от греческого слова
«сфалерос» — обманчивый, из-за необычных для сульфида внешних
признаков минерала), синоним — цинковая обманка. Светло окра-
шенная разновидность, по цвету напоминающая канифоль и не со-
держащая примесей железа, называется клейофаном. Темно-корич-
невые, почти черные сфалериты, обогащенные железом, называют-
ся марматитом.
Химичский состав: Zn — 67,1 %, S — 32,9; обычны примеси Fe
(до 20%), Cd (до 5% —пршибрамит), In, Ge, Ga, Мп.
Сингония кубическая.
Структура аналогична структуре алмаза; вокруг каждого иона
серы расположены по вершинам тетраэдра четыре иона цинка
(рис. 70).
Встречается в виде кристаллов представленных обычно тетра-
эдрами или комбинациями нескольких тетраэдров (рис. 71), иногда
в виде сплошных масс и зернистых агрегатов. На гранях тетраэд-
ров характерна треугольная штриховка.
143
Рис. 70. Структура сфа-
лерита
Рис. 71. Кристаллы сфалерита тетраэдрического
габитуса
Физические свойства — цвет от светло-желтого (клейофан) до
тем1но-коричневого, почти черного (марматит), реже бывает бес-
цветным или светло-зеленым; соответственно цвет черты — от белой
до коричневой; светлые разности прозрачны; блеск алмазный; спай-
ность весьма совершенная; люминесцирует; твердость 3—4; удель-
ный вес 3,9—4,1.
Диагностические признаки — алмазный блеск, совершенная
спайность по шести направлениям.
Происхождение: чаще всего образуется в гидротермальных ус-
ловиях совместно с галенитом, халькопиритом, пирротином; встре-
чается также в скарнах; весьма редко бывает осадочным. В зоне
окисления легко изменяется, переходя в смитсонит и каламин.
Месторождения: в СССР — Змеиногорское, Зыряновское (Руд-
ный Алтай), Садонское (Сев. Кавказ), Нагольный кряж (УССР),
Тетюхе (Приморье); за рубежом — Пршибрам (ЧССР); Биннен-
таль (Швейцария); Сантандер (Северная Испания) и др.
Практическое значение — основная руда на цинк; попутно могут
извлекаться кадмий, индий, германий.
КИНОВАРЬ— HgS ( название индийское, происхождение его
точно не установлено).
Химический состав: Hg — 86,2%, S — 13,8%.
Сингония тригональная.
Структура цепочечная. В основе структуры находятся бесконеч-
ные спиральные цепочки S—Hg—S, протягивающиеся вдоль верти-
кальной оси (рис. 72).
Кристаллы ромбоэдрической формы, часты двойники. Иногда
встречается в виде вкрапленных зерен, сплошных масс, примазок
и налетов.
Физические свойства — цвет красный; черта красная; прозрачна
в тонких обломках; блеск полуметаллический, алмазный; спайность
совершенная; твердость 2—2,5; удельный вес 8,0—8,2.
Диагностические признаки — характерный ярко-красный цвет,
красная черта, большой удельный вес.
144
Рис. 72. Структура кинова-
ри
OFe О S
Рис. 73. Структура пирроти-
на
Происхождение: типичный гидротермальный минерал, выделяю-
щийся при низких температурах и давлениях — в близповерхност-
ных условиях; часто киноварь выпадает непосредственно из горячих
вод, выходящих на поверхность земли. Такого, например, происхо-
ждения киноварь в штате Невада, США. Обычными спутниками
являются антимонит, реальгар, халцедон, кальцит, флюорит, барит.
Месторождения: в СССР — Никитовское (УССР), Хайдаркан-
ское, Чаувайское (Киргизская ССР); за рубежом — Альмаден (Ис-
пания), Идрия (Югославия).
Практическое значение — источник получения ртути, применяет-
ся в электропромышленности и приборостроении, для извлечения
золота (методом амальгамации), изготовления взрывчатых веществ,
в медицине и др.
ПИРРОТИН —Fei_xS (от греческого слова «пиррос» — красно-
ватый), синоним — магнитный колчедан.
. Химический состав: Fe — 63,6%, S — 36,4%, часто содержит при-
меси Си, Ni, Со, реже Мп, Zn.
Сингония гексагональная.
Структура типа гексагональной плотнейшей упаковки (рис. 73).
Ионы железа располагаются в узлах гексагональной призмы.
Каждый ион железа окружен шестью ионами серы, в свою очередь,
каждый ион серы окружен шестью ионами железа. В пирротине
часть железа находится в трехвалентном состоянии. Компенсация
валентностей происходит при этом за счет частичного выноса двух-
валентного железа. В результате некоторая часть узлов кристалли-
ческой решетки остается незаполненной. Стуктуры подобного типа
называются дефектными. Вследствие выноса части железа состав
145
пирротина не отвечает формуле FeS, как этого требует его структу-
ра. Правильнее состав пирротина изображать в виде FesSg или &
общем виде Fej_xS.
Кристаллы исключительно редки. Встречается большей частью
в виде сплошных масс или зернистых агрегатов.
Физические свойства — цвет бронзово-желтый, иногда с красным
оттенком; черта серовато-черная; блеск металлический; в разной
степени магнитен; спайность несовершенная; хрупок; твердость 4;
удельный вес 4,6—4,7.
Диагностические признаки — характерный цвет, магнитность.
Происхождение: а) типичный минерал магматических, ликваци-
онных медно-никелевых месторождений, связанных с основными
породами. Встречается вместе с пентландитом, халькопиритом, маг-
нетитом; б) образуется в контактово-метасоматических скарновых
месторождениях в ассоциации со сфалеритом, арсенопиритом, ше-
елитом, реже касситеритом, магнетитом, кальцитом; в) характерен
для гидротермальных месторождений, где встречается совместно со
сфалеритом, галенитом, халькопиритом, касситеритом, арсенопири-
том, пиритом,карбонатами, кварцем.
При выветривании в зоне окисления легко изменяется, образуя
в конечном итоге лимонит, при этом возникает свободная серная
кислота.
Месторождения: в СССР — Норильское (Красноярский край},
Богословское (Северный Урал), Мончетундра (Кольский п-ов), Те-
тюхе (Приморье); за рубежом — Садбери (Канада), Теннеси
(США).
Практическое значение — служит сырьем для производства сер-
ной кислоты.
ПЕНТЛАНДИТ — (Fe, Ni)9S8 (назван в честь первооткрывателя
минерала Дж. Пентландау).
Химический состав: Ni — 22%, Fe — 42%, S — 36%; обычно со-
держит примесь кобальта (иногда до 2,5%).
Сингония кубическая.
Структура—анионы серы образуют плотнейшую кубическую
упаковку, часть катионов никеля и железа заполняет тетраэдриче-
ские пустоты, другая же часть катионов находится в октаэдрической
координации.
Физические свойства — цвет бронзово-желтый (более желтый,
чем у пирротина); черта зеленовато-черная; блеск металлический;
спайность совершенная; немагнитный; твердость 3—4; удельный вес
4,5—5.
Диагностические признаки — на глаз определяется с большим
трудом по ярко-желтому цвету и совершенной спайности; от сход-
ного пирротина отличается по отсутствию магнитности и наличию
совершенной спайности.
Происхождение — встречается исключительно в срастании с пир-
ротином в месторождениях, связанных с основными породами. В
ассоциации с ними обычно находится халькопирит.
Месторождения: в СССР — Мончетундровское (Кольский п-ов);
146
Норильское (Красноярский край); за рубе-
жом— крупнейшее месторождение в мире
Садбери (Канада), Бушвельд (Африка).
Практическое значение — руда на ни*
кель. Попутно из медно-никелевых руд из-
влекается кобальт, медь, металлы платино-
вой группы, селен, теллур.
ХАЛЬКОПИРИТ — CuFeS2 (от гречей
ких слов «халькос» — медь и -«пирит»—
огонь), синоним — медный колчедан.
Химический состав: Си —34,57%, Fe—
30,54%, S — 34,9%; наиболее характерны
примеси Ag, Au, Ga, Se.
Сингония тетрагональная.
Структура — элементарная ячейка халь-
копирита представляет собой удвоенную
элементарную ячейку сфалерита, в которой
места, занимаемые Zn, заполнены ионами
Си и Fe (рис. 74).
Кристаллы исключительно редки, обычно
ных массах.
Рис. 74. Структура
халькопирита
встречается в сплош-
Физические свойства — цвет латунно-желтый с зеленоватым от-
тенком; блеск металлический; черта черная с зеленоватым оттен-
ком; -спайность (несовершенная; твердость 3,5—4; удельный вес
4,1—4,3.
Диагностические признаки — латунно-желтый цвет, небольшая
твердость (в отличие от пирита), наличие побежалости.
Происхождение: а) магматическое — образуется совместно с
пирротином и пентландитом при ликвации основных магм; б) гид-
ротермальное— совместно с пиритом, пирротином, сфалеритом,
галенитом и блеклыми рудами. Характерен для полиметалличе-
ских месторождений. Кроме того, халькопирит является составной
частью колчеданных залежей, где он тесно ассоциирует с пиритом,
в меньшей степени с арсенопиритом и сфалеритом. Из жильных
минералов халькопириту сопутствуют кварц, кальцит, эпидот, хло-
рит, флюорит; в) осадочное — халькопирит встречается в виде це-
мента в песчаниках («медистые песчаники»).
В зоне вторичного обогащения халькопирит изменяется, перехо-
дя в борнит, халькозин, ковеллин, а в верхней части зоны окисле-
ния по нему развивается куприт, малахит, азурит, лимонит, хризо-
колла и другие вторичные минералы.
Месторождения: в СССР — Блявинское, Турьинские рудники
{Урал), Джезказганское (Казахская ССР); Алмалыкское (Узбек-
ская ССР), Агаракское (Армянская ССР); за рубежом — Бисби
(шт. Аризона, США), Катанга (Конго), Садбери (Канада).
Практическое значение — основная руда на медь.
БОРНИТ — Cu5FeS4 (назван по имени И. Борна — австрийского
минералога).
147
Химический состав: Си — 63,3%, Fe—11,2%, S — 25,5%, при-
меси Pb, Ag.
Сингония кубическая.
Структура координационная. Борниту свойственна усложненная
кубическая решетка. По вершинам и в центрах граней элементар-
ного куба, а также в центрах четырех из восьми его октантов нахо-
дятся тетраэдры [Fe3+S4]. В вершинах их вокруг иона Fe3+ разме-
щаются ионы S2-. На ребрах тетраэдров между ионами серы рас-
полагаются ионы Си1+. Поскольку не все эти позиции заняты иона-
ми Си1+, часть их окислена до Си2+. В связи с этим в формуле
борнита четыре иона меди одновалентны, а пятый ион меди имеет
валентность два.
Кристаллы крайне редки. Встречается чаще всего в виде сплош-
ных масс.
Физические свойства — цвет в свежем изломе медно-красный до
лилового; обычно минерал покрыт радужной ярко-синей побежа-
лостью; черта серовато-черная; блеск полуметаллический; спайно-
сти нет; твердость 3; удельный вес 4,9—5,0.
Диагностические признаки — ярко-синяя побежалость, на све-
жем изломе характерный медно-красный цвет.
Происхождение: а) гидротермальное — борнит встречается
вместе с халькопиритом, иногда сфалеритом и галенитом; б) в зо-
не вторичного сульфидного обогащения борнит постоянно образует-
ся по халькопириту и тесно ассоциируется с халькозином. В зоне
окисления борнит легко изменяется, переходя в ковеллин, а затем
в куприт, лимонит и малахит.
Месторождения: в СССР — Дзержинское (Урал), Успенский
рудник, Джезказганское (Казахская ССР); за рубежом — Бьютт,
Бисби (США), Браден (Чили) и др.
Практическое значение — руда на медь.
АНТИМОНИТ— Sb2S3 ( от латинского слова «антимониум» —
сурьма).
Химический состав: Sb — 71,4%, S — 28,6%, часты примеси As,
Ag, Au.
Сингония ромбическая.
Структура — в основе структуры антимонита лежат ленты, сло-
женные зигзагообразными цепочками тригональных пирамид SbS3.
Цепочечный характер структуры отражается на облике кристал-
лов— они вытянуты вдоль грани призмы, имеют столбчатые или
игольчатые формы (рис. 75).
Физические свойства — цвет свинцово-серый; цвет черты анало-
гичен цвету минерала; блеск металлический; иногда появляется ра-
дужная побежалость; спайность совершенная; твердость 2—2,5;
удельный вес 4,6.
Диагностические признаки — характерная форма кристаллов —
игольчатые и лучистые агрегаты. От похожего на него висмутина
отличается более темным цветом и поперечной штриховкой (от бу-
ланжерита— только поперечной штриховкой). Часто встречается
148
Рис. 75. Агрегат игольчатых кристаллов антимонита
совместно с киноварью, что может также служить диагностическим
признаком.
Происхождение гидротермальное—низкотемпературное; типич-
ные спутники: киноварь, флюорит, кальцит, барит, халцедон, реаль-
гар и аурипигмент. В зоне окисления легко изменяется и переходит
в различные окислы сурьмы (охры) желтого и белого цвета (сер-
вантит, стибиконит и др.).
Месторождения: в СССР — Раздольнинское (Красноярский
край), Кадамджайское, Хайдарканское (Средняя Азия); за рубе-
жом— Ишинокава (Япония), в провинции Юнань (КНР).
Практическое значение — основной источник получения сурьмы,,
использующейся в сплавах, для изготовления подшипников (анти-
фрикционные сплавы), типографских шрифтов; применяется также
в текстильном производстве, стекольном деле, в медицине и др.
ВИСМУТИН — Bi2S3 (назван по содержащемуся в минерале
элементу — висмуту), синоним — висмутовый блеск.
Химический состав: Bi — 81,3%, S—18,7%, обычные примеси
Sb, Pb, Fe.
Сингония ромбическая.
Структура аналогична структуре антимонита. Встречается, как
и антимонит, в виде призматических кристаллов, часты лучистые
агрегаты.
Физические свойства — цвет оловянно-белый до свинцово-серо-
го; блеск металлический; черта серая; спайность совершенная; твер-
дость 2—2,5; удельный вес 6,4—6,8.
Диагностические признаки — висмутин похож на антимонит и
149*
отличается от него более светлым цветом и более сильным метал-
лическим блеском.
Происхождение гидротермальное — образуется в высокотемпе-
ратурных гидротермальных месторождениях совместно с вольфра-
митом, арсенопиритом, молибденитом, касситеритом, топазом, бе-
риллом, пиритом и халькопиритом.
Месторождения: в СССР — Брич-Мулла, Варзоб (Средняя
Азия); за рубежом — Таена, Чоролк (Боливия), Сьерро-де Паско
(Перу) и др.
Практическое значение — сырье для получения висмута, приме-
няющегося в легкоплавких сплавах, идущих для изготовления пре-
дохранителей, припоев; используется также в стекольной промыш-
ленности для поверхностного покрытия, сплавления стекла с метал-
лом, в красочном деле, а также в качестве лечебных препаратов в
медицине.
АУРИПИГМЕНТ — As2S2 (от латинских слов «аурум» — золото,
•«пигментум» — краска. В древности считали, что аурипигмент со-
держит золото).
Химический состав: As — 61%, S — 39%, примеси Se, Sb.
Сингония моноклинная.
Структура слоистая. Сетчатые слои состоят из пирамидальных
трупп, связанных друг с другом общими атомами серы. Слои соеди-
няются между собой слабыми ван-дер-ваальсовскими связями.
Слоистый мотив структуры обуславливает .весьма совершенную
спайность и низкую твердость аурипигмента.
Кристаллы призматические очень редки; встречаются в основ-
ном листоватые агрегаты и зернистые массы.
Физические свойства — цвет лимонно-желтый; черта желтая;
•блеск перламутровый; спайность совершенная; твердость 1—2;
удельный вес 3,4—3,5.
Диагностические признаки — определяются по ярко-желтому
цвету и по характерному спутнику — реальгару.
Происхождение — типичный минерал низкотемпературных гид-
ротермальных месторождений, встречается совместно с реальгаром,
:марказитом, кварцем, кальцитом. Иногда отложение происходит
прямо из горячих водных источников.
Месторождения: в СССР — Лухумское, Джульфинское (Кав-
каз); за рубежом — Аллахар (Югославия), Меркур (штат Юта,
•США).
Практическое значение — является рудой на мышьяк, приме-
няется также в качестве сырья для изготовления красок.
РЕАЛЬГАР — AsS (происхождение названия неизвестно).
Химический состав: As — 70,1 %, S — 29,9%.
Сингония моноклинная.
Структура подобна структуре самородной серы (см. рис. 63).
Различие заключается в том, что часть атомов серы в реальгаре
замешена атомами мышьяка. Основу структуры составляют коль-
цевое MO^j2^r^As4S4.
150
Кристаллы редки, чаще всего встречает-
ся в виде зернистых агрегатов, землистых
масс, налетов, корок.
Физические свойства — цвет красный;
черта оранжевая; блеск в изломе жирный;
спайность совершенная, твердость 1,5—2;
удельный вес 3,4—3,6.
Диагностические признаки — ярко-крас-
ный цвет, в отличие от киновари имеет
оранжевую черту.
Происхождение — типичный минерал
низкотемпературных гидротермальных ме-
сторождений; реальгар на воздухе легко
окисляется и переходит в аурипигмент, по-
этому оба минерала встречаются всегда
совместно.
Месторождения — те же, что и для аури-
пигмента.
Практическое значение — как и аурипиг-
мент, является рудой для получения
мышьяка.
МОЛИБДЕНИТ — MoS2 (название ми-
нерала связано со свинцово-серым цветом,
дос» — свинец, синоним — молибденовый блеск.
Химический состав: Мо — 60%, S — 40%; обычны примеси'
Re, Se.
Сингония гексагональная.
Структура слоистая, сходна со структурой графита, отсюда и'
большое сходство этих двух минералов. Слои ионов Мо распола-
гаются между двумя слоями ионов S (рис. 76). Связь между слоями
остаточная, очень слабая, чем и объясняется низкая твердость мо-
либденита и совершенная спайность.
Встречается в виде отдельных листочков, иногда радиально-лу-
чистых агрегатов, довольно часто образует кристаллы таблитчатого
облика.
Физические свойства — цвет стально-серый с голубоватым от-
тенком; черта серая; блеск металлический; спайность весьма совер-
шенная; твердость 1; удельный вес 4,7—5,0.
Диагностические признаки — низкая твердость, металлический
блеск, жирен на ощупь. От сходного с ним графита отличается
голубоватым оттенком (черта на бумаге тоже имеет голубоватый
оттенок), а также более сильным металлическим блеском и боль-
шим удельным весом.
Происхождение: характерный минерал пневматолито-гидротер-
мальных и гидротермальных месторождений — встречается в грей-
зенах совместно с вольфрамитом, бериллом, топазом и висмутином,
в высокотемпературных кварцевых жилах в ассоциации с флюори-
том, пиритом и другими сульфидами, а также в скарнах и средне-
температурных гидротермальных месторождениях медно-молибде-
151
новой формации, для которой весьма характерна ассоциация мо-
либдена с халькопиритом, серицитом и кварцем.
В зоне окисления легко изменяется, переходя в повеллит и фер-
римолибдит.
Месторождения: в СССР — Тырныауз (Кавказ), Джидинское
(Бурятская АССР) и др.; за рубежом — Клаймакс (США), Кингс-
гейте (Австралия) и др.
Практическое значение — руда на молибден; последний приме-
няется в металлургической промышленности для изготовления раз-
личных сортов легированных сталей (быстрорежущих, нержавею-
щих, жаростойких); используется также в химической промышлен-
ности при производстве лаков и красок.
Добываемый из молибденита рений идет на производство спла-
вов рения с вольфрамом, молибденом и танталом, имеющих наибо-
лее высокие температуры плавления.
Подкласс дисульфидов
ПИРИТ —FeS2 ( от греческого слова «пирос» — огонь; проис-
хождение названия связано, по-видимому, со свойством пирита
при ударе давать искры), синоним — серный колчедан.
Химический состав: Fe — 46,6%, S — 53,4%, примеси Ni, Со, Se,
Т1, Си, Мп, As, Sb, иногда Au. Предполагается, что золото находит-
ся в пирите в тонкодисперсном состоянии.
Сингония кубическая.
Структура — основу составляет кубическая решетка, подобная
решетке NaCl (см. ниже рис. 82). Ионы железа занимают места
натрия, а спаренные ионы серы [S2]2-— позиции хлора (рис. 77).
Встречается пирит в виде хорошо образованных кристаллов в фор-
ме куба, пентагондодекаэдра и др. (рис. 78), реже в виде вкрапле-
ний и сплошных масс.
Физические свойства — цвет золотисто-желтый, латунно-жел-
тый; блеск металлический; черта зеленовато-черная; спайность не-
совершенная; твердость 6—6,5; удельный вес 4,9—5,2.
Диагностические признаки — золотисто-желтый цвет, большая
твердость, характерные кристаллы в форме куба, штриховка на
гранях.
Происхождение — пирит является чрезвычайно распространен-
ным минералом и образуется почти при всех процессах минерало-
образования: а) в виде вкраплений или как акцессорный минерал
связан с различными горными породами — гранитами, диоритами
и другими, возникающими при магматической кристаллизации;
б) встречается в скарнах — контактово-метасоматических образо-
ваниях, где пирит ассоциирует с другими сульфидами, магнетитом,
пироксенами, гранатами; в) образует самостоятельные крупные
скопления в гидротермальных жилах и встречается как спутник
многих рудных минералов; г) встречается в виде сплошных масс
совместно с халькопиритом в колчеданных типах месторождений;
452
Рис. 77. Структура пирита
: -
Рис. 78. Пирит
д) в осадочных породах образуется в восстановительной среде в
виде конкреций и приурочен к песчано-глинистым и угленосным
толщам.
На земной поверхности неустойчив и переходит в лимонит.
Месторождения: в СССР в большом количестве пирит распро-
странен в Калитинском, Дегтярском, Карабашском, Блявинском
месторождениях (Урал), Чирагидзорском (Азербайджанская ССР)
и др.; за рубежом крупнейшие месторождения известны в Испании
(Р.ио-Тинто), Норвегии (Сулительма).
Практическое значение — пиритовые руды служат сырьем для
получения серной кислоты. Попутно из них добывают селен, таллий.
МАРКАЗИТ — FeS2 (название арабского происхождения).
Химический состав аналогичен пириту.
Сингония ромбическая.
Структура — в основе структуры марказита, в отличие от пири-
та, лежит элементарная ячейка ромбической призмы — ионы желе-
за размещены по углам и в центре призмы и окружены группами
ионов серы [S2]2“
Кристаллы марказита имеют таблитчатый, короткостолбчатый
или копьевидный облик. Характерны конкреции радиально-лучис-
того строения, натечные и почковидные формы (рис. 79).
Физические свойства — цвет, так же как и у пирита, латунно-
желтый, но с серовато-зеленым оттенком; черта зеленовато-серая;
блеск металлический; спайность несовершенная; твердость 5—6;
удельный вес 4,6—4,9.
Диагностические признаки — характерная форма кристаллов,
конкреции и натечные формы, зеленоватый оттенок в свежем изло-
ме. Более точно диагностируется при микроскопических и рентге-
новских исследованиях.
153
Происхождение — образуется
в основном в осадочных породах
и приурочен к угленосным и пес-
чано-глинистым толщам. В коре
выветривания неустойчив и пере-
ходит в гидроокислы железа. Из-
редка возникает при гидротер-
мальных процессах в ассоциации
с пиритом, галенитом, сфалери-
том. Значительных скоплений не
образует.
Месторождения: в СССР —
Блявинское (Ю. Урал), Борович-
ское (Новгородская обл.); за ру-
бежом— Клаусталь (ФРГ) и др.
Практическое значение — мо-
жет служить источником для по-
лучения серной кислоты.
КОБАЛЬТИН — CoAsS (наз-
ван по химическому элементу —
кобальту, входящему в состав
минерала).
Химический состав: Со — 35,4%, As — 45,3%, S — 19,3%, приме-
ни Fe, Ni.
Сингония кубическая.
Структура сходна со структурой пирита. Различие заключается
в том, что место иона Fe занимает Со, а один ион S2“ замещен
на As2-.
Встречается в кристаллах — чаще всего в комбинациях пента-
гондодекаэдра и октаэдра (рис. 80), образует также зернистые
агрегаты.
Физические свойства — цвет серебряно-белый, стально-серый с
розоватым оттенком; черта серовато-черная; блеск металлический;
хрупкий; спайность совершенная; твердость 5—6; удельный вес
6,0—6,5.
Диагностические признаки — характерный розоватый оттенок,
типичные формы кристаллов.
Происхождение гидротермальное; встречается в скарнах сов-
местно с магнетитом, гранатами, эпидотом,
пиритом и в гидротермальных жилах в ассо-
циации с серебряными сульфосолями, арсени-
дами никеля и кобальта, кальцитом и бари-
том.
При изменении минерала в условиях ги-
пергенеза образуются розовые кобальтовые
выцветы (эритрин).
Месторождения: в СССР — Дашкесан (За-
кавказье), Покровское (Урал); за рубежом —
Скуттеруд (Норвегия), Кобальт (Канада).
Рис. 80. Габитус кри-
сталла кобальтина
154
Рис. 81. Форма
кристаллов ар-
сенопирита
Практическое значение — основная руда на ко-
бальт, применяющийся в металлургии как легирую-
щий элемент при изготовлении специальных ста-
лей.
АРСЕНОПИРИТ — FeAsS (назван по сходству
состава и структуры с пиритом, в котором часть се-
ры замещена мышьяком).
Химический состав: Fe —34,3%, As —46,0%,
S—19,7%, типичные примеси Со, Ni, Sb, Au.
Сингония ромбическая.
Структура близка к структуре пирита — один
атом серы замещен атомом мышьяка. Атомы желе-
за октаэдрически окружены атомами серы и
мышьяка.
Арсенопирит встречается в виде зернистых агре-
гатов и хорошо образованных кристаллов (рис.
81).
Физические свойства — цвет оловянно-белый;
обычна побежалость желтого цвета; черта темно-
серая; блеск металлический; хрупкий; спайность
совершенная; твердость 5,5—6; удельный вес
5,9—6,2.
Диагностические признаки — оловянно-белый цвет, большая
твердость, чесночный запах при ударе, штриховка на гранях кри-
сталлов.
Происхождение — образуется преимущественно в гидротермаль-
ных высокотемпературных жилах, а также в контактово-метасома-
тических месторождениях. Ассоциируется с вольфрамитом, пири-
том, самородным золотом, шеелитом и др. В зоне выветривания
арсенопирит разлагается и переходит в скородит.
Месторождения: в СССР — Качкарское (Урал), Брич-Мулла
(УзССР), Дарасунское, Запокровское (В. Забайкалье); за рубе-
жом— Миттерберг (Австрия), Сулительма (Норвегия), Тавистоке
(Англия).
Практическое значение — используется для получения мышьяка
и его соединений.
ГЛАВА 19
КЛАСС ГАЛОИДНЫХ СОЕДИНЕНИЙ
[ГАЛОГЕНИДЫ]
Галогениды имеют большое практическое значение. Они приме-
няются в пищевой, химической, стекольной промышленности, а так-
же в сельском хозяйстве.
Минералы этого класса представлены солями кислот HF, НС1,
HJ и НВг. В природе большим распространением пользуются НС1
и HF, в связи с чем наиболее распространены простые — NaCI (га-
лит), КО (сильвин) и сложные MgCI2-КО • 6Н2О (карналлит) хло-
155
риды, а также фториды CaF (флюорит). Большинство из этих сое-
динений кристаллизуется в кубической сингонии.
Для галлоидов натрия и калия характерна типичная ионная
связь, которая определяет их физические свойства: прозрачность,
стеклянный блеск, небольшой удельный вес, низкую твердость, лег-
кую растворимость в воде, низкие показатели преломления. При
замене натрия и калия тяжелыми металлами (например, Ag) ион-
ные связи в этих минералах вследствие поляризации ионов меняют-
ся на ионно-ковалентные, в результате чего изменяются их физиче-
ские свойства. Точно так же, при замене С1 на F, ионные связи ме-
няются на ионно-ковалентные, поэтому такой минерал, как флюо-
рит, нерастворим в воде, хотя он сохраняет прозрачность, стеклян-
ный блеск, низкие показатели преломления и другие свойства, ха-
рактерные для хлоридов.
Хлориды образуются преимущественно в экзогенных условиях,
крупные скопления их имеют осадочное происхождение (соляные
залежи).
Фториды (флюорит) имеют в основном эндогенное происхожде-
ние, образуя значительные концентрации в месторождениях гидро-
термального типа.
Ниже рассмотрены только наиболее распространенные мине-
ралы.
ГАЛИТ — NaCl (от греческого слова «галос» — соль), сино-
ним — каменная соль.
Химический состав: Na — 39,4%, Cl — 60,6%.
Сингония кубическая.
Структура — характеризуется плотнейшей кубической упаковкой
<рис. 82). Каждый ион хлора окружен шестью ионами натрия, каж-
дый ион натрия — шестью ионами хлора. Координационное число
Na и С1 равно 6. Очень часто встречается в форме хорошо образо-
ванных кристаллов — кубов, образует друзы, сплошные массы,
корки.
Физические свойства — большей частью бесцветный, белый, но
благодаря различным механическим примесям (железа, битумов)
может быть красным, серым, синим (синий цвет характерен в тех
случаях, когда галит встречается вместе с сильвином — КС1. Объяс-
няется это тем, что под воздействием радиоактивного изотопа К40
ионы натрия приобретают свободные электроны и становятся ней-
тральными, что и придает галиту синюю окраску*); блеск стеклян-
ный; легко растворим; спайность совершенная по кубу; твердость 2;
удельный вес — 2,1—2,2.
Диагностические признаки — соленый вкус, низкая твердость,
спайность по кубу.
Происхождение преимущественно осадочное. Главным источни-
ком галита являются воды океанов, в которые Na и С1 сносятся
водными потоками из разрушенных горных пород. Кроме того,
* Такая же окраска получается при пропитывании прозрачной каменной соли
парами металлического натрия или при облучении ее рентгеновскими лучами.
156
большое количество NaCl попадает в море благодаря деятельности
подводных вулканов. Испарение замкнутых бассейнов, заливов, со-
леных озер приводит к накоплению каменной соли.
Древние соленосные осадки при деформации, под действием
толщ вышележащих пород, образуют сплошные пласты твердой
каменной соли. Иногда такие пласты выдавливаются и залежи ка-
менной соли образуют штоки — диапиры, или скопления более
сложной формы. Залежи каменной соли и отложения самосадочной
соли являются основными типами месторождений промышленного
значения.
В небольшом количестве галит образуется из возгонов вулканов
<и отлагается на стенках кратеров вулканов (белые корки галита
Рис. 82. Структура (а) и
кристалл (б) галита
• Na .ОСЬ
157
известны в кратере Везувия). Отмечаются также отложения солей,
в том числе и галита, из вод соляных источников. Галит присутст-
вует в составе солончаков, представляющих собой выцветы солей;
они появляются на почвах засушливых, пустынных районов.
Месторождения: в СССР — Артемовское (УССР), Илецкая за-
щита (Казахская ССР), Соликамское (Урал), оз. Баскунчак; за
рубежом наиболее известны Величка (Польша), месторождения в
районе Пенджаба (Северная Индия) и др.
Практическое значение — применяется в пищевой промышлен-
ности, в химической — для производства хлора, соды, едкого натра,
соляной кислоты, получения металлического натрия; как восстано-
витель— в черной и цветной металлургии; в электротехнической
промышленности — для изготовления разрядных ламп и электро-
проводов, состоящих из натриевых нитей, покрытых оболочкой
меди.
СИЛЬВИН — КС1 (назван в честь голландского врача и хими-
ка Сильвия де Баги).
Химический состав: К — 52,5%, О — 47,5%, примеси КВг, RbCl,
CsCl, NaCl, Fe2C>3. Часто содержит включения углекислоты, азота,
водорода, метана и даже гелия.
Сингония кубическая.
Структура аналогична структуре галита. Кристаллы в виде ку-
бов редки; обычно сильвин встречается в сплошных зернистых мас-
сах в парагенезисе с галитом, образуя породу, называемую силь-
винит.
Физические свойства — чистые разности бесцветны, но чаще все-
го сильвин бывает молочно-белым (из-за многочисленных включе-
ний пузырьков газа) или красным, оранжевым, розовым (вследст-
вие механической примеси окислов железа); блеск стеклянный;
спайность весьма совершенная; вкус горько-соленый; твердость
1,5—2; удельный вес 1,9—2,0.
Диагностические признаки — горько-соленый вкус, легкая раст-
воримость, парагенезис с галитом, окрашенным в синий цвет.
Происхождение — встречается вместе с галитом в усыхающих
соленых озерах, где выпадает одним из последних. В природе рас-
пространен значительно меньше, чем галит. Возможно образование
при извержении вулканов на стенках кратеров и в трещинах за-
стывших лав. Возникает при разложении карналлита (MgCl2X
ХКСЬ6Н2О).
Месторождения: в СССР — Соликамское (Урал), Калушское и
Стебникское (Прикарпатье); за рубежом — Страссфуртское (ГДР),
в Эльзасе (Франция).
Практическое значение — является важнейшим сырьем для по-
лучения калийных удобрений, частично используется в химической
промышленности для производства различных препаратов калия.
КАРНАЛЛИТ — MgCl2 • КС1 • 6Н2О ( назван в честь немецкого
инженера Карналля).
Химический состав: Mg — 8,7%, К—14,1%, С1 — 38,3%, Н2О —
38,9%, примеси Вг, Rb, Cs.
158
Сингония ромбическая.
Структура минерала изучена слабо. В кристаллах почти не
встречается, образует сплошные мелкозернистые массы. Редкие
кристаллы имеют псевдогексагональный облик.
Физические свойства — цвет от розового до красного, иногда бу-
ровато-желтого, реже наблюдаются бесцветные разности; блеск
стеклянный, на воздухе жирный; спайности нет; вкус горько-соле-
ный; сильно гигроскопичен — на воздухе легко расплывается; твер-
дость 2—3; удельный вес 1,6.
Диагностические признаки — большая гигроскопичность (на
воздухе быстро сыреет); при нагревании на стекле растворяется
в собственной кристаллизационной воде. При сверлении ножом из-
дает характерный треск, вследствие вскрытия и разрыва вклю-
чений.
Происхождение — образуется совместно с галитом и сильвином
при осаждении из вод и рассолов в замкнутых водных бассейнах.
Карналлит осаждается в последней стадии высыхания бассейнов.
Месторождения: в СССР — Соликамское (Урал), Стебникское
(Закарпатье), Старобинское (Белоруссия); за рубежом — Страсс-
фуртское (ГДР), в штатах Техас, Оклахома (США).
Практическое значение — используется для получения калийных
удобрений, а также является сырьем для получения металлического
магния, используемого в виде сплавов с алюминием в авиационной
промышленности, для производства сигнальных огней, ярких свето-
вых вспышек.
ФЛЮОРИТ —CaF2 (от латинского слова «флюо» — теку, из-за
способности минерала легко плавиться при нагревании), синоним —
плавиковый шпат.
Химический состав: Са — 51,2%, F — 48,8%, обычны примеси
редких земель, U, Мп и Sr.
Сингония кубическая.
Структура координационная, в узлах и центрах граней большого
куба расположены ионы кальция (рис. 83, а), в центрах, восьми
малых кубов, заключенных в большом, находятся ионы фтора. Каж-
дый ион кальция окружен восемью ионами фтора, а ионы фтора
заключены между четырьмя ионами кальция. Соответственно, ко-
ординационное число кальция равно 8, фтора — 4. Такая структура
носит название флюоритовой.
Встречается в виде кристаллов кубической, октаэдрической и
додекаэдрической форм (рис. 83, б), образует также неправильные
зерна, сплошные зернистые массы, натечные и радиально-лучистые
агрегаты.
Физические свойства — цвет различный — белый, зеленый, фио-
летовый, желтый; характерны зонально окрашенные кристаллы,
иногда встречаются прозрачные кристаллы (оптический флюорит);
блеск стеклянный; спайность совершенная по октаэдру; типична
люминесценция; твердость 4; удельный вес 3—3,2.
Диагностические признаки — характерные кристаллы; спайность
159
Рис. 83. Структура (а) и кри-
сталл (б) флюорита
по октаэдру. От кварца и топаза, с которыми иногда сходен, отли-
чается меньшей твердостью и наличием спайности по октаэдру.
Происхождение — главным образом гидротермальное. Флюорит
встречается в жилах с сульфидами, вольфрамитом, кальцитом.
Весьма часто образуется в грейзенах совместно с вольфрамитом,
топазом, молибденитом. Крупные флюоритовые месторождения
возникают в результате замещения известняков гидротермальными
фторсодержащими растворами. В этих породах флюорит ассоции-
руется с литиевым мусковитом, хрупкими слюдами (эфеситом, мар-
гаритом) и бериллиевыми минералами. Флюорит является также
характерным минералом некоторых типов пегматитов (хрустале-
носных или камерных), в которых он выполняет миароловые пус-
тоты. Флюорит слагает также низкотемпературные гидротермаль-
ные жилы, цементирует брекчии и зоны дробления. В этом случае
он часто ассоциируется с баритом, халцедоном, киноварью и анти-
монитом.
Месторождения: в СССР — Калангуй (Забайкалье), Аурахмат,
Брич-Мулла (Уз.ССР), Амдерминское (Архангельская обл.), Пок-
ровско-Киреевское на Украине; за рубежом — в штатах Иллинойс
и Кентукки (США), Дербишир, Кумберленд, Дерхэм (Англия)
и др.
Практическое значение — используется в химической промыш-
ленности для производства фтористоводородной кислоты; в метал-
лургической — как плавень при производстве алюминия, в качестве
флюса; в оптической — для изготовления линз (оптический флюо-
рит) ; в керамической — при производстве матовых стекол.
160
ГЛАВА 20
КЛАСС ОКИСЛОВ
О кислы представляют собой соединения металлов с кислородом.
В строении их кристаллических решеток принимают участие
анионы О2" или гидроксильные группы (ОН)1", имеющие близкий
ионный радиус, равный соответственно 1,32 и 1,33 А. Разнообразие
минералов определяется присутствием в них различных катионов:
Mg, Fe, Ni, Zn, Cu, Si, Al, Cr, Ti, Sn, U.
Класс окислов разделяется на три подкласса: 1) простые окис-
лы; 2) сложные окислы; 3) гидроокислы.
По своей структуре это ионные постройки с ионным типом свя-
зи. Соединения с подобными структурами характеризуются высо-
кой твердостью (5—7), высокой химической стойкостью, тугоплав-
костью. Для многих минералов, содержащих железо, типичен тем-
ный, почти черный цвет, полуметаллический блеск (хромит,
магнетит, ильменит).
Большинство гидроокислов характеризуется слоистой структу-
рой с ионной связью в пределах слоев, которые, в свою очередь,
соединены друг с другом слабыми остаточными связями. Появление
слоистой структуры обусловливает изменение физических свойств —
понижение твердости до 3—3,5, появление совершенной спайности.
Минералы класса окислов более дробно подразделяются в зави-
симости от особенностей структуры на следующие типы: 1) минера-
лы координационной структуры — уранинит, магнетит, хромит;
2) каркасной структуры — куприт, кварц; 3) цепочечного строе-
ния— гётит, касситерит, пиролюзит; 4) слоистой структуры — ко-
рунд, ильменит, гематит.
Минералы класса окислов широко распространены и составляют
17% от веса земной коры. Большая часть окислов образуется в
верхних частях земной коры в условиях наличия свободного кисло-
рода, при этом имеет значение не только свободный кислород воз-
духа, но также и кислород, содержащийся в водах, приникающих в
земную оболочку.
Образование окислов происходит при различных процессах, в
том числе и эндогенном минералообразовании — магматическом,
пегматитовом, гидротермальном.
Окислы являются также типичными образованиями зоны окис-
ления рудных месторождений (куприт, гематит); часто они возни-
кают в водных бассейнах (морях, озерах, болотах), например гид-
роокислы марганца, железа, кремния.
Подкласс простых окислов
КУПРИТ — Си2О (от латинского слова «купрум» — медь).
Химический состав: Си — 88,8%, примеси —медь самородная.
Сингония кубическая.
6—3628
161
• Си О О
Рис. 84. Структура куприта
характерный цвет; парагенезис
Структура каркасная. Ионы
кислорода расположены в верши-
нах куба и в его центре, ионы ме-
ди размещаются по диагонали ку-
ба между ионами кислорода, об-
разуя тетраэдры (рис. 84).
Облик кристаллов октаэдри-
ческий, но большей частью куп-
рит встречается в виде сплошных
зернистых или землистых масс.
Физические свойства — цвет от
темно-красного с лиловым оттен-
ком до красновато-черного; черта
буровато-красная (при растира-
нии желтеет); блеск алмазный;
спайность ясная; твердость 3,5-^
4; удельный вес 5,8—6,2.
Диагностические признаки —
: малахитом, азуритом, самород-
ной медью.
Происхождение — образуется преимущественно в зоне окисле-
ния медно-сульфидных руд. Встречается вместе с самородной
медью, малахитом, азуритом и хризоколлой.
Месторождения: в СССР — Джезказган (Казахская ССР),
Турьинские рудники (Урал), группа месторождений Алтая; за ру-
бежом — Шесси (Франция), в Мексике, в Южной Австралии.
Практическое значение — руда на медь.
КОРУНД — А12О3 («корундум» — старинное индийское название
минерала).
Химический состав: А1 — 52,9%; незначительные примеси Сг и
Ti придают красную и синюю окраску разновидностям корунда—-
рубину и сапфиру.
Сингония тригональная.
Структура слоистая (рис. 85). Ионы кислорода находятся в
плотнейшей гексагональной упаковке и располагаются листами,
наложенными один на другой. Катионы А1 находятся между двумя
такими листами в виде гексагонов, заполняя две трети октаэдри-
ческих пустот.
Встречается корунд в виде боченковидных кристаллов, а также
в зернах и сплошных зернистых массах.
Физические свойства — цвет корунда серый, синевато-серый;
блеск стеклянный; спайность отсутствует, часто проявлена отдель-
ность в одном направлении; твердость 9; удельный вес 3,95—4,10.
Диагностические признаки — цвет, характерные формы кристал-
лов и высокая твердость.
Происхождение: образуется в породах, бедных кремнеземом, или в
обстановке, характеризующейся значительным избытком глинозема
при ограниченном содержании щелочей. Известны следующие типы
месторождение корунда: а) магматические — корундовые сиениты
162
и анартозиты; б) пегматитовые — сиени-
товые пегматиты, не содержащие кварца
(в сиенитовых пегматитах корунд нахо-
дится с полевым шпатом и биотитом);
в) контактово-метасоматические — во
вторичных кварцитах, образующихся за
счет кислых эффузивов при воздействии
на них гидротермальных растворов, и в
кристаллических известняках на контак-
те их с изверженными поподами; г) ме-
таморфические— при метаморфизме бок-
ситов или бедных основаниями алюмо-
силикатных пород, в которых корунд об-
разуется вместе с мусковитом, рутилом,
диаспором.
Месторождения: в СССР — Семиз-Бу-
гу (Казахская ССР), район Кыштыма
(Урал); за рубежом — в Бирме, Индии
(драгоценные разновидности корунда —
сапфир, рубин), Таиланде (сапфир в рос-
сыпях). -
Практическое значение — благодаря
своей большой твердости является абра-
зивным материалом (точильные корундо-
вые круги, диски, наждачные бумаги),
используемым главным образом в метал-
лообрабатывающей промышленности. Ру-
бин и сапфир применяются в ювелирном
Деле. Рис. 85. Структура ко-
ГЕМАТИТ —Fe2O3 (от греческого ело- рунда
ва «гематикос» — кровавый), синони-
мы — железный блеск, красный железняк.
Химический состав: Fe — 70%, изоморфные примеси Ti, Mg.
В виде механических примесей присутствуют кремнезем и глино-
зем.
Сингония тригональная.
Структура аналогична структуре корунда. Встречается гематит
в виде таблитчатых или пластинчатых кристаллов, но особенно час-
то образует сплошные скрытокристаллические массы, листоватые,
чешуйчатые и землистые агрегаты. Характерные агрегаты имеют
собственные названия: а) железный блеск — тонкокристаллические,
иногда чешуйчатые агрегаты черного цвета; б) красный железняк —
плотные агрегаты красного цвета; в) красная стеклянная голова —
крупные почковидные образования концентрически-скорлуповатого
или радиально-лучистого строения (рис. 86).
Физические свойства — цвет от железно-черного до стально-се-
рого; окисленные, землистые разности гематита обладают кирпич-
ным цветом; блеск полуметаллический; черта вишнево-красная;
спайности нет; твердость 5,5—6; удельный вес 5,0—5,3.
163
Рис. 86. Почковидные образования
гематита
Диагностические призна-
ки — вишнево-красная черта,
сравнительно высокая твер-
дость, отсутствие магнитности.
Происхождение — образует-
ся при различных процессах
минералообразования в усло-
виях окислительной среды. Из-
редка гематит возникает в маг-
матических породах и в пегма-
титах. Встречается на стенках
кратеров вулканов. Обычен в
гидротермальных месторожде-
ниях вместе с кварцем, бари-
том. Предполагается, что же-
лезо находится в гидротер-
мальных растворах в виде
комплексных соединений типа
Na[Fe3+C14] или Na2[Fe2+Cl4], из
которых в зависимости от низ-
кого или высокого потенциа-
ла кислорода образуется гема-
тит или магнетит.
Согласно А. Г. Бетехтину, гематит может ооразоваться путем
гидролиза хлорного железа
2FeCl3+ 3H2O->Fe2O3+6НС1
Основная масса гематита возникает: а) в результате метамор-
физма толщ бурого железняка, которые в условиях повышенного
давления и температуры обезвоживаются и превращаются в гема-
титсодержащие породы. Таким путем образуются железистые
кварциты месторождений КМА и района Кривого Рога; б) в коре
выветривания — при дегидратации бурого железняка в условиях
жаркого климата. Гематит в таких месторождениях встречается
часто совместно с гидроокислами алюминия — диаспором и бёми-
том; г) при окислении (марматизации) магнетита в верхних зонах
магнетитовых месторождений. Окисление магнетита происходит по
следующей реакции:
4FeFe2O4 -f- 02->6Fe203
Месторождения: в СССР — Кривой Рог (УССР), КМА (Курская
магнитная аномалия), Кутимское, гора Магнитная, гора Высокая
(Урал); за рубежом — в районах Верхнего озера (США), Минас-
Жерайс (Бразилия), о. Эльба, Сен-Готтард (Альпы) и др.
Практическое значение — руда на железо.
РУТИЛ — TiO2 (от латинского слова «рутилус» — красноватый,
в связи с тем, что минерал просвечивает красноватым цветом).
Химический состав: Ti — 60%; иногда отмечаются примеси Fe,
164
• Tl OO
Рис. 87. Структура рутила. Расположение ионов титана и
кислорода в элементарной ячейке (а); цепь октаэдров, вы-
тянутых по вертикальной оси (б)
Sn, Сг, Та, Nb. Железистая разновидность называется нигрином,
богатая ниобием — ильменорутилом, танталом — стрюверитом.
Сингония тетрагональная.
Структура цепочечная. В элементарной ячейке ионы Ti нахо-
дятся в вершинах и в центре параллелепипеда и окружены шестью
ионами кислорода, образующими слегка искаженный октаэдр
(рис. 87, а). Кислород же окружен тремя ионами титана. Окта-
эдры соединяются друг с другом ребрами и образуют непрерывные
цепи, вытянутые по оси четвертого порядка в виде колонок
(рис. 87, б). Структурными особенностями объясняется призмати-
ческий (до игольчатого) облик кристаллов и наличие совершенной
спайности, параллельной удлинению кристаллов.
Рутил образует призматические, столбчатые и игольчатые крис-
таллы, зернистые, сетчатые и волосовидные агрегаты. На гранях
кристаллов часто наблюдается штриховка. Весьма типичны колен-
чатые двойники.
Физические свойства — цвет желтый, бурый, красный до черного
{нигрин, стрюверит); черта желтая, светло-бурая; блеск алмазный
до металловидного (у стрюверита); спайность совершенная вдоль
удлинения и средняя в другом направлении; излом раковистый;
хрупок; твердость 6—6,5; удельный вес 4,2—4,3 (до 5,5 у стрюве-
рита).
Диагностические признаки — призматические кристаллы с тет-
рагональным (квадратным) сечением, коленчатые двойники; от
сходного с ним касситерита отличается меньшим удельным весом.
Происхождение: а) магматическое — в виде акцессорного мине-
рала в гранитах и сиенитах; б) пегматитовое — в жилах вместе с
полевыми шпатами, биотитом; в) гидротермальное — в ассоциации
с кварцем, корундом, ильменитом, магнетитом; г) метаморфиче-
ское— в гнейсах, слюдяных сланцах, амфиболитах.
Рутил устойчив при процессах выветривания и вместе с магне-
титом, цирконом и другими минералами накапливается в россыпях.
Месторождения: в СССР — в Ильменских горах (Урал), Само-
тканское (УССР), Семиз-Бугу (Казахская ССР); за рубежом — в
165
штате Сев. Каролина (США), в
Норвегии, на о. Мадагаскар, в=
Австралии и др.
Практическое значение — при
значительных концентрациях явля-
ется рудой на титан и используется
для выплавки ферротитана, получе-
ния металлического титана, приме-
няемого в самолетостроении, радио-
технике (при изготовлении детекто-
ров), для производства титановых
белил, для окраски керамических
изделий в бурый цвет.
КАССИТЕРИТ — SnO2 (от гре-
Рис. 88. Формы кристаллов касси-
терита
ческого слова «касситерос» — оло-
во) , синоним — оловянный камень.
Химический состав: Sn — 78,8%*; примеси Fe2+, Fe3+, Та, Nb, Mix.
реже Zn, W.
Сингония тетрагональная.
Структура цепочечная, аналогична структуре рутила (см.,
рис. 87, а), в которой место титана занимает олово.
Касситерит образует кристаллы столбчатого бипирамидального>
и бипирамидально-призматического облика (рис. 88). Наблюдают-
ся также зерна неправильной формы, реже натечные образова-
ния — «деревянистое олово».
Физические свойства — цвет в зависимости от примесей бурый,,
коричневый, желтый, белый, иногда черный, изредка почти бесцвет-
ный; блеск алмазный, слегка жирный; спайность несовершенная;
излом раковистый; хрупок, твердость 6—7; удельный вес 6,8—7,0..
Касситерит весьма устойчив к химическому и механическому воз-
действиям и поэтому часто встречается в россыпях.
Диагностические признаки — определяется по высокой твер-
дости, большому удельному весу, форме кристаллов. Более точно,
диагностируется при действии НС1 на предполагаемое зерно касси-
терита, помещенное на цинковую пластинку. В результате реакции,
зерно касситерита покрывается характерным налетом металличе-
ского олова.
Происхождение: а) пегматитовое — встречается вместе с муско-
витом, кварцем, полевыми шпатами, танталитом, колумбитом, тур-
малином. Касситерит в пегматитах образует бипирамидальной фор-
мы кристаллы темно-бурого почти черного цвета. Обычно содержит
примеси тантала и ниобия; б) пневматолито-гидротермальное — в
оловоносных грейзенах и жилах касситерит-кварцевой формации в
парагенезисе с топазом, флюоритом, турмалином, вольфрамитом,,
бериллом. Кристаллы из этого типа месторождений имеют боль-
шей частью короткопризматическую форму, более светлую окраску
бурых тонов. Содержание примесей обычно не столь высокое по
сравнению с содержанием их в касситеритах из пегматитов; в) гид-
ротермальное— в жилах касситерит-кварцевой и касситерит-суль-
166
фидной формаций, в которых касситерит встречается в ассоциации
с кварцем, турмалином, хлоритом, а также с халькопиритом, пирро-
тином, сфалеритом, галенитом. Касситерит имеет форму неправиль-
ных зерен или ярко выраженных столбчатых кристаллов. Цвет его
светло-бурый, иногда очень светлый, почти бесцветный. В качестве
примесей в касситерите из этих месторождений типичны индий и
вольфрам.
Месторождения: в СССР — Хрустальное (Приморье), Хинган-
ское (Хабаровский край), Шерловая гора, Хапчерангинское (За-
байкалье); за рубежом — в Боливии, Нигерии, Бирме, Таиланде и
в Малайзии.
Практическое значение — основная руда на олово, которое на-
ходит широкое применение для производства белой жести, различ-
ных сплавов с медью (бронз), цинком, медью и свинцом (латуни)
и др.; для лужения посуды; изготовления станиоля.
ПИРОЛЮЗИТ — МпО2 (от греческих слов «пир» — огонь и
«люсис» — уничтожение, мытье, в связи с применением в стеколь-
ном производстве для уничтожения зеленого оттенка у стекла).
Химический состав: Мп — 63,2%; в тонкозернистых и сплошных
массах характерны механические примеси Ре20з, SiO2.
Сингония тетрагональная.
Структура аналогична структуре рутила. Обычно образует
сплошные зернистые, сажистые или плотные порошковатые массы,
почковидные конкреции, волокнистые или радиально-лучистые аг-
регаты. Кристаллы очень редки. Они имеют игольчатый или изо-
метрический облик.
Физические свойства — цвет черный до стально-серого, черта
черная, иногда синевато-черная; блеск полуметаллический, у рых-
лых разновидностей матовый; непрозрачен; хрупок; излом неров-
ный; спайность совершенная; твердость кристаллов 6—5, агрегатов
и землистых масс — 5—2; удельный вес 5,0 (кристаллы), 4,5—5,0
(агрегаты).
Диагностические признаки — черный цвет минерала и черты. От
других марганцевых минералов (псиломелана, манганита) отли-
чается незначительно — более совершенной спайностью, большей
хрупкостью и отсутствием в его составе воды.
Происхождение, в основном, экзогенное, реже возникает при ме-
таморфических и гидротермальных процессах. Экзогенные место-
рождения образуются осадочным путем, а также при развитии про-
цессов выветривания в зонах окисления осадочных месторождений
(марганцевых шляпах). Обычно пиролюзит находится совместно с
другими марганцевыми минералами (манганитом, псиломеланом,
гаусманитом и др.). В зоне окисления пиролюзит (наиболее устой-
чивый в этих условиях) замещает большинство марганцевых мине-
ралов.
Месторождения: в СССР — Никопольское (УССР), Чиатурское
{Груз. ССР); за рубежом — Платтен (ЧССР), Балагат (Индия),
в Гане и др.
167
Практическое значение — один из главных компонентов марган-
цевых руд, используемых для получения ферромарганца и специ-
альных сталей, а также применяется в качестве восстановителя
при плавке железных руд с целью удаления вредных примесей
(фосфора, кремния, серы). Пиролюзит используется в химической
промышленности для получения кислорода и хлора, изготовления
реактивов; в электротехнической промышленности — для производ-
ства сухих батарей.
УРАНИНИТ — UO2 (назван по основному компоненту —
Урану).
Химический состав — является промежуточным соединением
между UO2 и UO3, часто содержит продукты радиоактивных пре-
вращений Ra, Ас, Ро, а также радиогенные изотопы РЬ206, РЬ207 и
РЬ208. Некоторые разности уранинита содержат редкие земли (Се,
La, Er), Zr (до 7,5%), иногда в этих разностях присутствуют вода
и газы (Не, Аг, СО2).
Сингония кубическая.
Структура типа структуры флюорита (см. рис. 83, а). Уранинит
редко встречается в форме кристаллов — комбинации куба и окта-
эдра, куба и ромбододекаэдра, чаще находится в виде почковидных
натечных форм, называемых «урановой смолкой», «настураном», и
сажистых налетов — «урановой черни».
Физические свойства — цвет черный; блеск смолистый; излом
неровный; спайность совершенная; твердость 5,5—6 (снижается до-
3 у сильно измененных разностей); удельный вес 10,3—10,6; отли-
чается сильной радиоактивностью.
Диагностические признаки — черный цвет, сильный смолистый
блеск, радиоактивность.
Происхождение: а) гидротермальное — урановая смолка встре-
чается с минералами кобальта и никеля, иногда с самородным се-
ребром, висмутом и мышьяком, часто с молибденитом; б) осадоч-
ное— в восстановительных условиях при наличии органических
остатков; в) при процессах выветривания урановых месторожде-
ний в зоне их окисления; г) изредка уранинит образуется в пегма-
титах с полевыми шпатами, с минералами тория, тантало-ниобата-
ми. Уранинит из пегматитов часто содержит торий и редкие
земли.
Месторождения: за рубежом — Витватерсранд (ЮАР),
район Большого Медвежьего озера (Канада), Шинколобве
(Конго).
Практическое значение — основное сырье для получения урана
и радия. Уран применяется как горючее при получении атомной
энергии. Препараты радия используются в медицине.
КВАРЦ—SiO2 (происхождение названия неизвестно).
Химический состав: Si — 46,7%; примеси практически не харак-
терны.
Сингония тригональная. Существует несколько полиморфных
модификаций кварца, устойчивых при определенных температурах
и нормальном давлении: 0-кварц (тригональный) устойчив при тем-
168
Рис. 89. Структура (а) и кристаллы (б) кварца
пературе менее 573° С; а-кварц (гексагональный) существует в ин-
тервале 573—870° С; р-тридимит (гексагональный) устойчив при
870—1470° С; p-кристобалит (кубический) кристаллизуется в интер-
вале температур 1470—1710° С.
Структура низкотемпературного наиболее распространенного
кварца показана на рис. 89, а\ основу ее составляет кремнекисло-
родные тетраэдры, в середине каждого из которых помещается ион
кремния, а по вершинам — ионы кислорода. Тетраэдры соединяют-
ся друг с другом и образуют каркас. Поэтому кварц можно отно-
сить как к окислам, так и к каркасным силикатам.
Кварц часто встречается в виде удлиненных призматических
кристаллов с развитыми гранями ромбоэдров (рис. 89, б). На гра-
нях призмы кварца типична поперечная штриховка. Иногда наблю-
даются двойники. В пустотах кварц обычно образует друзы срос-
шихся кристаллов. Значительная часть кварца встречается в виде
зерен и сплошных зернистых агрегатов.
Физические свойства — бесцветный, белый, серый, реже розо-
вый, фиолетовый (аметист), прозрачный (горный хрусталь), иногда
дымчатый до черного (морион); блеск стеклянный; спайность не-
совершенная; излом раковистый; твердость 7; удельный вес
2,65—2,66.
Диагностические признаки — стеклянный блеск, высокая твер-
дость, раковистый излом, поперечная штриховка на призматических
гранях.
Разновидности: халцедон — скрытокристаллическая разновид-
ность, встречается в виде почек, жеод (рис. 90, а). Полосчатые хал-
цедоны называются агатами (рис. 90, б).
169
Рис. 90. Жеода, выполненная халцедоном (а); агат (б)
Опал — аморфная, содержащая воду разновидность ЗЮг-пНгО.
Встречается в виде натеков и сплошных масс. Отличается от квар-
ца и халцедона пониженной твердостью (до 5 по шкале Мооса).
Блеск матовый, восковой. Обычно бесцветный, но за счет примесей
может иметь различную окраску — черную (примеси битумов), зе-
леную (примеси меди), желтую, бурую (примеси железа); прозрач-
ные разности опала называются благородным опалом.
170
Яшма — плотные образования криптокристаллического халцедо-
на метаморфического происхождения. Яшмы имеют различную пе-
струю или полосчатую окраску.
Происхождение — кварц и его разновидности распространены
исключительно широко и возникают при самых различных процес-
сах минералообразования: а) магматических — кварц образуется в
кислых интрузивных и эффузивных породах — гранитах, кварцевых
порфирах и др., где он встречается вместе с полевыми шпатами 'и
слюдами; б) пегматитовых — кварц слагает значительный объем
пегматитовых тел, в пустотах некоторых из них он образует пре-
красно ограненные кристаллы; в) гидротермальных — кварц яв-
ляется главным жильным минералом; с поздними низкотемператур-
ными стадиями связано также отложение халцедона; г) при экзо-
генных процессах раскристаллизация гелей кремнезема часто
приводит к образованию кварца или халцедона, иногда возникает
опал. В результате отмирания живых микроорганизмов — губок,
водорослей, которые концентрируют кремнезем, возникают своеоб-
разные кремнистые породы — диатомиты.
Месторождения кварца необычайно многочисленны: в СССР
горный хрусталь известен на Урале, в Сибири, Средней Азии; хал-
цедон— в Карпатах; агаты — в Грузии, Якутии; яшмы — на Урале,
Алтае. Месторождения кварцевого песка находятся в Московской
(Люберецкое) и Владимирской (Гусь-Хрустальное) областях; за
рубежом горный хрусталь добывается в Бразилии (Минас-Же-
райс), Альпах, на о-ве Мадагаскар; аметисты — в Уругвае, Бирме.
Лучшие агаты находятся в Индии и Бразилии.
Практическое значение — применение кварца и его разновидно-
стей исключительно разнообразно. Кристаллы прозрачного кварца
применяются в радиотехнике (пьезокварц), в оптике. Агаты исполь-
зуются в точной механике в качестве подшипников, часовых кам-
ней. Зернистый и жильный кварц применяется в силикатном, кера-
мическом производстве для изготовления стекла, огнеупоров и хи-
мически стойкой посуды. Яшмы и благородный опал используют в
качестве поделочных камней, диатомит — как полировочный ма-
териал.
Подкласс сложных окислов
МАГНЕТИТ — FeFe2O4 (предполагается, что название происхо-
дит от имени пастуха Магнеса, который впервые обнаружил ка-
мень/притягивающий к себе железный наконечник его палки).
Химический состав: Fe — 72,4%; FeO — 31%, Fe2O3— 69%; при-
меси Ti, Сг, Mg.
Сингония кубическая.
Структура координационная (рис. 91); основным элементом
структуры являются октаэдры, пустующие колонки между ними
выполнены полосами из тетраэдров. Трехвалентные катионы нахо-
дятся в окружении шести ионов кислорода, занимающих вершины
октаэдра, двухвалентные катионы окружены четырьмя ионами кис-
171
лорода, расположенными по
вершинам тетраэдра. При
этом каждый ион кислорода
связан с одним двухвалент-
ным и тремя трехвалентны-
ми катионами. Такая струк-
тура магнетита определяет
его октаэдрическую форму
и физические свойства — вы-
сокую твердость, отсутствие
спайности и др.
Магнетит встречается в
виде сплошных мелкозерни-
стых масс, отдельных вкрап-
лений и кристаллов. Послед-
Рис. 91. Структура магнетита
ние образуют ясно выраженные октаэдры, реже ромбододекаэдры
(рис. 92).
Физические свойства — цвет черный; черта черная; блеск полу-
металлический; спайность отсутствует, иногда появляется отдель-
ность; сильно магнитен; твердость 5,5—6; удельный вес 4,9—5,2.
Диагностические признаки — сильно выраженная магнитность.
Происхождение: а) магматическое — в основных породах; б) ме-
тасоматическое— в карбонатитах, где образует иногда крупные
скопления; в) контактово-метасоматическое — в скарнах, к которым
приурочены крупные месторождения магнетита. Магнетит в этих
Рис. 92. Кристаллы магнетита в агрегате кальцита
172
образованиях ассоциируется с кальцитом, гранатами, пироксенами,
сульфидами, эпидотом, хлоритом; г) гидротермальное. Самостоя-
тельные месторождения очень редки. Большей частью в этом типе
месторождений встречается как спутник сульфидов; д) при явле-
ниях регионального метаморфизма 'магнетит образуется в результа-
те дегидратации гидроокислов железа в восстановительных усло-
виях по следующей реакции:
Fe2O3 • пН2О -> Fe2O3 + Н2О
Бурый железняк Гематит
6Fe2O3 -> 4Fe3O4+О2
Гематит Магнетит
Таким путем за счет осадочных отложений гидроокислов железа
возникли месторождения железистых кварцитов Курской магнитной
аномалии (КМА), района Кривого Рога, которые представлены ге-
матитовыми и магнетитовыми рудами.
Месторождения: в СССР — гора Магнитная, гора Благодать,
гора Высокая, Кусинское (Урал), Дашкесан (Азербайджанская
ССР), район Кривого Рога, Ковдор (Кольский п-ов), КМА; за ру-
бежом— Кирунаваара, Люоссаваара (Швеция), Верхнее Озеро
(США).
Практическое значение — руда для производства чугуна и стали.
ХРОМИТ — FeCr2O4 (минерал назван по своему химическому
составу).
Химический состав: Сг2О3—18—62%, FeO —0—18%, MgO —
6—16%, А12О3 — 0—3%, Fe2O3— 2—30%; содержит примеси ТЮ2 до
2%, VO3 — до 0,2%, МпО — до 1% (разновидности с высоким со-
держанием Mg и А1 называются соответственно манганохромитом
и алюмохромитом).
Сингония кубическая.
Структура аналогична структуре магнетита.
Большей частью встречается в виде сплошных зернистых масс
или отдельных округлых вкрапленников — нодулей.
Физические свойства — цвет черный; черта бурая; блеск полуме-
таллический; спайность отсутствует; твердость 5,5—7,5; удельный
вес 4,0—4,8.
Диагностические признаки — цвет черты; парагенезис с серпен-
тином, минералом зеленого цвета (вкрапленники хромита в серпен-
тине придают породе пятнистый, рябой вид, и эти руды часто на-
зывают «рябчиком», они легко узнаются по внешнему виду).
Происхождение магматическое. Образуется в ультраосновных
породах — дунитах, перидотитах в ассоциации с серпентином, оли-
вином, реже хромдиопсидом, уваровитом, иногда вместе с платиной
и осмистым иридием.
Месторождения: в СССР — Донское, Сарановское (Урал);
Шорджинское, Гейдаринское (Закавказье); Миллионное (Актюбин-
ская обл.); за рубежом — на Кубе, в Родезии, на о-ве Новая Кале-
дония, в Турции.
173
Рис. 93. Характерные формы кристаллов ильменита
Практическое значение — основная руда на хром. В виде ферро-
хрома используется при изготовлении специальных сортов сталей
с повышенной твердостью, кислотоупорными и антикоррозионными
свойствами. Размельченный хромит вместе с каолином, бокситом,
известью и каменноугольной смолой является огнеупором. В тек-
стильной промышленности соли и окислы хрома применяются в ка-
честве протравы и красок.
ИЛЬМЕНИТ — FeTiO3 (название происходит от Ильменских
гор, где он впервые был найден); синоним — титанистый железняк.
Химический состав: FeO — 47,3%, TiO2 — 52,7%, примеси Mg,
Мп.
Сингония тригональная.
Структура слоистая, аналогична структуре корунда, отличие за-
ключается в том, что вместо ионов А1 попеременно чередуются ионы
Fe и Ti. Ильменит встречается в виде пластинчатых или таблитча-
тых кристаллов (рис. 93), вкрапленников, зерен или сплошных
зернистых масс.
Физические свойства — цвет черный; блеск от полуметалличе-
ского до металлического; черта черная; слабо магнитен; спайность
несовершенная; твердость 5—6; удельный вес 4,7.
Диагностические признаки — характерный блеск, слабая маг-
нитность.
Происхождение: а) магматическое, в виде вкрапленников в ос-
новных и щелочных изверженных породах. При выветривании ус-
тойчив и скапливается в россыпях; б) пегматитовое — вместе с по-
левым шпатом, биотитом, сфеном, цирконом в пегматитах щелоч-
ных гранитов; в) гидротермальное — в измененных изверженных
породах, где ильменит часто присутствует в титаномагнетитах, яв-
ляющихся смесью ильменита и магнетита; г) осадочное—в морских
современных и погребенных прибрежных россыпях, где встречается
совместно с цирконом, гранатом, монацитом.
Месторождения: в СССР — на Урале (Ильменские горы, Кусин-
ское), на Украине (Саматканское); за рубежом — в Норвегии
(Экерзунд-Зоггендаль, Крагере), морские россыпи в Индии, штате
Флорида (США), Новой Зеландии.
Практическое значение — руда на титан, в виде ферротитана
применяется в металлургической промышленности для производст-
ва особых сортов стали. Окись титана используется в качестве бе-
лой краски.
174
Подкласс гидроокислов
Гидроокислы ЖЕЛЕЗА: ГЕТИТ—HFeO2 и ЛИМОНИТ—
mF2O3«nH2O. Скопления гидроокислов железа в природе представ-
ляют обычно смеси гётита, лимонита и других окислов железа, от-
личающихся друг от друга количеством воды. Кроме окислов желе-
за, в таких соединениях присутствуют гидроокислы кремнезема и
глинистые вещества. Называются они бурыми железняками. Гётит
назван в честь поэта Гёте, лимонит — от греческого слова «ле-
мон» — луг (ранее так назывались луговые и болотные руды гид-
роокислов железа).
Химический состав — рентгеноструктурным анализом установ-
лено, что большинство гидроокислов являются гидрогелями с раз-
ным количеством адсорбированной воды и только гётит с отношени-
ем Ре2Оз:Н2О=1 : 1 имеет кристаллическую структуру. Его состав:
Fe2O3 —89,9%, Н2О— 10,1%.
Сингония гётита ромбическая.
Структура гётита представляет собой плотнейшую гексагональ-
ную упаковку. Ионы железа размещены между шестью ионами
кислорода, ионы же водорода, вероятнее всего, располагаются
между парами ионов кислорода.
Гётит редко встречается в форме кристаллов, имеющих столб-
чатый или игольчатый облик; чаще всего он образует сталактиты
плотные или пористые массы.
Бурые железняки по форме нахождения можно разделить на
следующие разновидности: а) натечные образования в виде стек-
лянных голов; б) почковидные натечные формы с радиально-лу-
чистой структурой и блестящей поверхностью черного или темно-
бурого цвета; в) сталактитоподобные натечные формы (рис. 94);
г) массивные сплошные массы темно-бурого или желтого цвета;
д) оолитовые, бобовые и луговые руды, в которых бурые железня-
ки образуют желваки и жеоды.
Физические свойства — цвет лимонита и гётита светло-желтый,
темно-бурый до черного; черта лимонита светло-бурая или желто-
вато-бурая, гётита — бурая с красноватым оттенком; блеск гётита
от алмазного до полуметаллического; твердость гётита 4,5—5,5, ли-
монита 4,1; спайность у гётита в одном направлении совершенная;
удельный вес гётита 4,0—4,4, лимонита 3,3—4,0.
Диагностические признаки — минералы легко опознаются по
бурому цвету, характерной черте и формам образования (сталак-
титы, жеоды, натечные формы).
Происхождение: а) осадочное — в морских и озерных бассей-
нах. Накопление происходит вследствие коагуляции приносимых
сточными водами коллоидных растворов: в морских бассейнах
под действием электролитов, в пресных вследствие деятель-
ности организмов — ферробактерий; осаждение происходит в кис-
лой среде; б) в зоне окисления — в так называемых «железных
шляпах» сульфидных месторождений.
Для большинства гидроокислов железа характерно исключи-
175
Рис. 94. Сталоктитоподобные образования бурого
железняка
тельно экзогенное происхождение. Как исключение, встречались
кристаллы гётита гидротермального происхождения в месторожде-
ниях Волк-остров на Онежском озере и Пршибрам в Чехословакии.
Месторождения: в СССР — Керченское (УССР), Бакальское и
Халиловское (Южный Урал), Елизаветинское (Свердловская
обл.), Тульское, Липецкое и др.; за рубежом крупные месторожде-
ния в Лотарингии (Франция), Люксембурге, на о. Куба и др.
Практическое значение — руда на Железо.
Гидроокислы АЛЮМИНИЯ. К этой группе относятся гидраты
глинозема: диаспор, бёмит и гидраргиллит. Гидроокислы алюминия
имеют близкий состав, сходные свойства и исключительно тесно
ассоциируют друг с другом в природе. Они являются основными
компонентами бокситов, служащих ценнейшим сырьем для произ-
водства алюминия.
ГИДРАРГИЛЛИТ — А1(ОН)з (название происходит от грече-
ских слов «гидро» — вода, и «аргиллос» — белая глина); сино-
ним — гиббсит (в честь собирателя минералов Д. Гиббса).
Химический состав: А12О3— 65,4%, Н2О — 34,6%; в качестве
примесей могут присутствовать Fe2O3 (до 2%) и Ga.
Сингония моноклинная.
Структура слоистая. Основой структуры является слой ионов
алюминия, заключенный между слоями гидроксильных ионов. В
целом такие слои построены из октаэдров А1(ОН)б, соединенных
друг с другом общими боковыми ребрами.
176
Гидраргиллит образует преимущественно тонкочешуйчатые или
скрытокристаллические массы. Встречаются натечные и радиально-
лучистые агрегаты. Кристаллы в соответствии с особенностями
структуры имеют шестиугольно-таблитчатый облик.
Физические свойства — цвет белый, иногда гидраргиллит имеет
серый, красный или зеленоватый оттенок; блеск стеклянный, на
плоскостях спайности перламутровый; спайность весьма совершен-
ная; хрупок; твердость 2,5—3,5; удельный вес 2,3—2,4.
Диагностические признаки — совершенная спайность, светлый,
часто белый цвет, малый удельный вес, низкая твердость. От сход-
ного с ним диаспора отличается по твердости (у диаспора 6—7),
от светлых слюд — по оптическим свойствам и малому удельному
весу.
Происхождение — возникает в основном при экзогенных про-
цессах и вместе с диаспором и бёмитом входит в состав бокситов.
Последние образуются при выветривании алюмосиликатов в ще-
лочной среде в условиях тропического климата при так называемом
латеритном выветривании. В результате распада алюмосиликатов
легко образуются золи А12О3, Fe2O3, SiO2 и щелочи. Последние
создают щелочную среду, препятствующую коагуляции золя SiO2,
который уносится растворами. Золи же А12О3 • аиН2О и железа
Fe2O3 • рН2О коагулируют и остаются на месте, образуя месторож-
дения бокситов остаточного, или латеритового, типа. В дальнейшем
водные окислы алюминия могут быть переотложены в водных
бассейнах. Таким путем возникают месторождения осадочного
типа.
Бокситы образуют сплошные массы, оолиты и конкреции. Цвет
их белый, а также красный или бурый за счет примесей гидроокис-
лов железа. Химический состав бокситов непостоянен: А12О3 — от
28 до 65%, Fe2O3 — от 3 до 50%, SiO2 — от 2 до 20%, Н2О — от 12
до 30%.
Иногда гидраргиллит образуется при низкотемпературном гид-
ротермальном процессе и встречается вместе с алунитом и каоли-
нитом.
Месторождения: в СССР — в бокситовых месторождениях
Красная Шапочка (Урал), Тихвинское (Ленинградская обл.); за
рубежом — в округе Прованс (Франция), на о. Наксос (Греция),
в штате Арканзас (США), в Гвинее и др.
Практическое значение — гидраргиллитсодержащие бокситы
являются основной рудой для получения алюминия.
БЕМИТ — АЮ(ОН) (назван по фамилии первооткрывателя
И. Бёма, установившего присутствие этого минерала в боксите пу-
тем рентгенометрических исследований).
Химический состав: А12О3 — 84,97%, Н2О—15,03%; из приме-
сей характерны Fe2O3, Ga2O3.
Сингония ромбическая.
Структура слоистая. Основу ее составляют двойные слои из це-
почек октаэдров А1(О, ОН)б, в центре которых расположены ионы
алюминия. Цепочки в слоях соединены посредством ребер окта-
177
эдров. Двойные же слои между собой соединены посредством гид-
роксильно-водородных связей. В структуре бемита находится два
типа ионов кислорода. Одни из них связаны только с ионом алю-
миния, другие же с ионами алюминия и водорода, поэтому фор-
мула минерала имеет вид АЮ(ОН). Бёмит образует обычно
скрытокристаллические агрегаты, изредка находится в виде пла-
стинчатых или чечевицеобразных кристаллов.
Физические свойства — цвет бледно-желтый, иногда бесцвет-
ный; спайность совершенная; хрупок; твердость 3,5—4; удельный
вес 3,0.
Диагностические признаки — надежно устанавливается с
мощью рентгенометрических исследований.
Происхождение — образуется преимущественно в экзогенных
условиях; как и гидраргиллит, входит в состав бокситов. Весьма
редко встречается в щелочных пегматитах совместно с цеолитами.
Месторождения: находится в большинстве бокситовых место-
рождений—Красная шапочка (Урал), Тихвинское (Ленинград-
ская обл.); за рубежом — Бо (Франция) и др.
Практическое значение — бокситы, содержащие бёмит, — важ-
нейшая руда для получения алюминия.
ДИАСПОР — НА1О2 (от греческого слова «диаспора» — рас-
сеивание; связано со свойством минерала растрескиваться при
нагревании и распадаться на мелкие чешуйки).
Химический состав сходен с бёмитом: А120з — 85%, Н2О — 15%;
характерны примеси железа (до 6,6% Ре20з), марганца (манган-
диаспор —до 4,5% Мп2О3 и 2% Fe2O3), хрома (до 5% Сг2О3),
часто галлия (до сотых долей процента).
Сингония ромбическая.
Структура цепочечная. Сдвоенные цепочки состоят из октаэдров
А1(О, ОН)6.
Внутри цепочки октаэдры связаны друг с другом ребрами, а с
соседней цепочкой вершинами. Цепочки удерживаются также гид-
роксильно-водородными связями. В отличие от бёмита, в структуре
диаспора все ионы кислорода связаны между собой только водо-
родной связью. Вытянутость цепочек вдоль вертикальной оси обус-
ловливает столбчатый и игольчатый облик кристаллов и наличие
спайности, параллельной удлинению кристаллов.
Диаспор встречается в виде тонколистоватых и чешуйчатых
агрегатов. Кристаллы его имеют тонкопластинчатый, столбчатый
и таблитчатый габитус.
Физические свойства — цвет белый, желтовато-бурый, светло-
фиолетовый; мангандиаспор — розовый; блеск стеклянный, на плос-
костях спайности близкий к алмазному; черта белая; спайность со-
вершенная; очень хрупкий, излом неровный; твердость 6—7; удель-
ный вес 3,3—3,5.
Диагностические признаки — пластинчатые и чешуйчатые агре-
гаты, большая твердость и хрупкость, при нагревании выделяет во-
ду и переходит в корунд.
Происхождение — как и другие гидроокислы алюминия, возни-
178
кает главным образом в экзогенных условиях, в месторождениях
бокситов. Известен также в метаморфических сланцах вместе с
дистеном, корундом, рутилом и другими минералами. Иногда обра-
зуется в метасоматических месторождениях в ассоциации с корун-
дом, мусковитом и топазом.
Месторождения: в СССР наиболее широко распространен в мес-
торождениях бокситов Косой брод (Урал), Акташ (Уз.ССР); за
рубежом — на о. Наксос (Греция), в копях Честер (США) и др.
Практическое значение — бёмит-диаспоровые и другие типы
бокситов, содержащие диаспор, являются сырьем для получения
алюминия.
Гидроокислы МАРГАНЦА. К этой группе относится манганит и
разнообразные и сложные по составу гидроокислы марганца, струк-
туры и химическая конституция которых недостаточна изучена, на-
пример, псиломелан.
МАНГАНИТ — Мп2+Мп4+О2(ОН)2 (назван по химическому со-
ставу).
Химический состав: МпО — 40,4%, МпО2 — 49,4%, Н2О— 10,2%;
примеси SiO2, Ре20з, СаО; в скрытокристаллических агрегатах при-
сутствует обычно избыточная адсорбированная вода.
Сингония моноклинная.
Структура не изучена. Манганит образует преимущественно
тонкокристаллические и землистые агрегаты часто вместе с дру-
гими марганцевыми минералами. Характерны почковидные образо-
вания и округлые конкреции концентрически-зонального строения
(рис. 95, а), а также агрегаты волокнистого, лучистого и шестова-
того строений. Для редко встречающихся кристаллов типичен приз-
матический до столбчатого облик. Грани их покрыты вертикальной
штриховкой. Кристаллы часто образуют параллельные сростки,
пучки, друзы.
Физические свойства — цвет черный, иногда с серым оттенком;
черта бурая до черной; блеск полуметаллический; прозрачный в
тонких осколках (бурый, красновато-бурый); хрупкий; излом не-
ровный; спайность несовершенная; твердость 3—4; удельный вес
4,2—4,3.
Диагностические признаки — бурый до черного цвет, бурая чер-
та, столбчатый и шестоватый облик кристаллов с типичной верти-
кальной штриховкой. Трудно отличается от других гидроокислов
марганца и надежно диагностируется с помощью рентгенометриче-
ского анализа.
Происхождение — образуется в основном осадочным путем в
морских бассейнах в виде оолитов и сплошных масс в ассоциации
с другими марганцевыми минералами. Более редко он возникает
при низкотемпературных гидротермальных процессах вместе с каль-
цитом, баритом, гётитом. Манганит в зоне окисления неустойчив
и переходит в пиролюзит.
Месторождения: в СССР — Никопольское, Илецкое (УССР),
Чиатурское (Груз. ССР); за рубежом — в окрестностях Ильменау,
Эльгерсбаха в Тюрингии (ГДР).
179
Рис. 95. Конкреция гидроокислов марганца (а) и дендриты гидро-
окислов марганца на стенке трещины (б)
Практическое значение — является одним из компонентов мар-
ганцевых руд, идущих на выплавку ферромарганца, а также полу-
чения соединений марганца.
ПСИЛОМЕЛАН — тМпО • МпО2 • яН2О (от греческих слов «пси-
лос» — голый, лысый и «мелас» — черный, характеризующих облик
натечных образований, известных как «черная стеклянная голо-
ва») , синоним — вад.
Химический состав непостоянен и зависит от степени окисления:
МпО2 — 60—80%, МпО — 8—25%, Н2О —4—6%; примеси Ва, К.
Na, Са, Со, Mg, Zn, SiO2, Fe2O3, A12O3, иногда W (разновидность^
содержащая 5—8% WO3, называется тунгомеланом).
Сингония ромбическая.
Структура не выяснена. Псиломелан встречается в виде натеч-
ных и почковидных форм с концентрически-зональным строением,,
тонкокристаллических агрегатов, землистых, сажистых и порошко-
образных агрегатов, характерных дендритовидных налетов
(рис. 95, б).
Физические свойства — цвет железо-черный, буровато-черный;,
черта черная; блеск полуметаллический, у порошкообразных агре-
гатов матовый; непрозрачен; хрупок; твердость плотных разностей1
4—6; удельный вес 4,4—4,7.
Диагностические признаки — черный цвет, натечные формы, бо-
лее точно диагностируется с помощью химического анализа.
Происхождение экзогенное. Псиломелан образуется: а) в зонах
окисления марганцевых месторождений, в которых ассоциируется^
с пиролюзитом, иногда манганитом и другими марганцевыми мине-
ралами, а также с гидроокислами железа; б) при осадкообразова-
нии в морских бассейнах, где псиломелан встречается в виде плот-
ных прослоев или конкреций среди других марганцевых отложений.
Месторождения: в СССР известен в Чиатурском (Груз. ССР) и
Никопольском (УССР) месторождениях; за рубежом — в Балахате
(Индия), в Тюрингии (ГДР).
Практическое значение — один из основных компонентов мар-
ганцевых руд, идущих на выплавку ферромарганца и для получе-
ния соединений марганца.
ГЛАВА 21
КЛАСС ТИТАНО-ТАНТАЛО-НИОБАТОВ
За последние годы во многих отраслях народного хозяйства воз-
рос спрос на такие элементы, как тантал и ниобий. Они извлекают-
ся из минералов группы колумбит-танталита, пирохлора, гатчетто-
лита, фергюсонита, эвксенита, лопарита и др. Все эти минералы
объединяются под общим названием титано-тантало-ниобатов, при-
чем многие из них часто встречаются в метамиктном состоянии.
Почти все минералы этой группы характеризуются сложным хими-
ческим составом, а также трудностью их диагностики. Титано-тан-
тало-ниобаты ранее рассматривали как соли титановой, ниобиевой
и танталовой кислот и в связи с этим выделяли их в особый класс.
181
В дальнейшем кристаллохимическими исследованиями было пока-
зано, что структуры некоторых минералов этого класса идентичны
окислам. Так, например, идентичны структуры колумбита FeNb2O6
и брукита TiO2. Из утроенной элементарной ячейки брукита TiO2 =
= Ti3Oe легко может быть получен колумбит, если два иона титана
заместить на два иона ниобия, а один ион титана на двухвалентный
ион железа, т. е.
ЗТ14+Fe2+-|-2Nb5+
В этой связи все титано-тантало-ниобаты стали относить к слож-
ным окислам (А. Г. Бетехтин, Е. К. Лазаренко, А. С. Поваренных,
справочник «Минералы»). В то же время некоторые исследователи
(Г. П. Барсанов, А. И. Гинзбург, Г. А. Сидоренко и др.) считают,
что вряд ли правильно относить все титано-тантало-ниобаты к
сложным окислам, поскольку рентгено-структурным анализом до-
казано существование у некоторых из них (например, у фергюсони-
та — YNbO4) анионных радикалов.
Титано-тантало-ниобаты можно рассматривать как комплексные
соединения типа АпВтХр, где в группу А объединяются крупные
катионы — Са, Na, Y, TR, Th, U, Pb, реже Fe и Мп, в группу В —
Ti, Nb, Та, реже AI, в группу X — О, (ОН), F. В тех случаях, когда
связи между ионами групп В и X значительно более ковалентные,
чем между катионами групп А и X, у минералов возникает прочная
анионная группировка (ВХР], как например, у фергюсонита Y[NbO4].
В тех же случаях, когда характер связи между катионами групп
Л и В с анионами X одинаков или очень близок (как, например, у
колумбита), минералы можно рассматривать как сложные окислы.
По количественному соотношению ионов групп А и X титано-тан-
тало-ниобаты можно подразделить на ряд подклассов (табл. 14).
Значительная часть титано-тантало-ниобатов являются метамикт-
ными.
В большинстве случаев минералы этого класса встречаются в
виде отдельных неправильных кристаллов, мелких включений, зе-
рен. Для пирохлора характерны кристаллические формы — октаэд-
ры. Перовскит образует кубы, иногда комбинации куба и октаэдра.
Цвет минералов темно-бурый, желто-зеленый, красновато-бурый
до черного. Блеск алмазный и полуметаллический; для метамикт-
ных разностей характерен смолистый, для измененных, гидратиро-
ванных— жирный, восковой, тусклый.
У большинства минералов этой группы спайность практически
‘Отсутствует, характерны различные изломы — неровные, раковис-
тые, иногда занозистые. Твердость от 5 до 6, у гидратированных
разностей пирохлоров снижается до 4. Удельный вес колеблется от
•4,5 до 6,5 и зависит главным образом от химического состава —
.атомного веса входящих катионов и изоморфных замещений.
По физическим свойствам многие тантало-ниобаты мало чем от-
личаются друг от друга и по внешнему виду в большинстве случаев
точно диагностированы быть не могут. Определить их можно мето-
дами химического, термического и рентгеноструктурного анализов.
182
ТАБЛИЦА 1Ф
Титано-тантало-ниобаты
Подкласс Минералы Структурный тип Сингония Формула
АВХ3 (Перовскит Перовскита Кубическая СаТ1О3
(Лопарит > > (Na,Ce,Ca)(Nb, Ti)O,
А2В2Х7 Пирохлор Пирохлора > (Na, Ca)2(Nb,Ti)2(O> F, OH)7
авх4 Фергюсон ит Фергюсонита Тетрагональная YNbO4
Тапиолит Тапиолита > FeTa2Oe
Колумбит Колумбита- танталита Ромбическая (Fe, Mn)Nb2Off
Танталит » > (Fe, Mn)Ta2Og,
AB2Xq Ферсмит Ферсмита-эвк- сенита > CaNbiOg
Эвксенит > > Y (Ti, NbhOe Ce (Ti, Nb)2O6
Эшинит Эшинита >
Самарскит Самарскита > (Y, Er)(Nb, Ta)2Off
Значительная часть титано-тантало-ниобатов встречается в гра-
нитных пегматитах и метасоматических образованиях, связанных
со щелочными породами и карбонатитами.
Тантало-ниобаты являются важнейшим источником для получе-
ния тантала и ниобия, широко используемых в промышленности:
а) в металлургической — ниобий в виде феррониобия применяет-
ся для получения нержавеющих, жаропрочных инструментальных:
сталей. Тантал и ниобий применяются для изготовления твердых,
сплавов;
б) в электровакуумных приборах используется тантал, так как
он выдерживает высокие температуры в сочетании с высокой эмис-
сионной способностью поглощать газы. Из сплавов с танталом изго-
товляют аноды, катоды, сетки в мощных генераторных лампах, ис-
кровые предохранители. Из тантала изготовляют электролитические
микроконденсаторы;
в) в химическом производстве тантал применяется для изготов-
ления химически стойкой аппаратуры;
г) в атомной технике ниобий, имеющий низкую способность к
поглощению нейтронов, применяется в различных видах защитных
чехлов;
д) в приборостроении тантал и ниобий используются для изго-
товления криотронов, применяемых в счетно-решающих машинах,
так как при высокой температуре тантал и ниобий приобретают
свойства сверхпроводников.
ПЕРОВСКИТ — СаТЮ3 (назван в честь Л. Перовского).
Химический состав: СаО — 41,1%, ТЮ2 — 58,9%; примеси Nb,
Th, Fe, Та, TR (разность с повышенным содержанием ниобия назы-
вается дизаналитом, обогащенная редкими землями — кнопитом).
Сингония кубическая.
183
Тис. Уб. Структура перов-
скита
Структура весьма характерна и
представляет каркас из октаэдров
TiO6, соединенных вершинами. В круп-
ных полостях располагаются ионы
кальция. Элементарная ячейка пред-
ставляет собой куб, в центре которого
находится ион титана, окруженный
шестью ионами кислорода, располо-
женными в центре граней. Ионы каль-
ция приурочены к вершинам куба
(рис. 96). Перовскит встречается в ви-
де кристаллов кубического облика, ре-
же находится в форме тонкозернистых
почковидных образований.
Физические свойства — цвет серовато-черный, светло-желтый,
оранжево-желтый, красновато-бурый до желтого; черта белая или
серовато-желтая; блеск алмазный; спайность несовершенная; твер-
дость 5,5—6; удельный вес 4.
Диагностические признаки — характерная форма кристаллов со
штриховкой, параллельной ребрам куба.
Происхождение магматическое и метасоматическое. Встречает-
ся в виде вкраплений в ультраосновных щелочных породах в ассо-
циации с титаномагнетитом, сфеном и др.
Месторождения: в СССР — на Урале; за рубежом — Церматт
(Швейцария).
ЛОПАРИТ — (Na, Се, Са) (Nb, Ti)O3 (название получил по на-
родности Кольского п-ва).
Химический состав: лопарит отличается от перовскита появле-
нием в его составе натрия, редких земель и ниобия, которые час-
тично замещают кальций (Na и TR) и титан (Nb, незначительно
Та). Состав минерала в связи с этим непостоянен: TiO2— 39—40%;
TR2O3 — 32—34%; (Nb, Та)2О3 — 8—10%; СаО —4—5%; Na2O —
8-9%; SrO — 2—3,5%; К2О —0,1—1%; Н2О —до 3,5%.
Сингония кубическая.
Структура подобна структуре перовскита. Встречается преиму-
щественно в виде кристаллов, имеющих форму куба, иногда комби-
нации куба и октаэдра. Характерны двойники прорастания.
Физические свойства — цвет от серовато-черного до черного;
черта коричнево-бурая; спайности нет; излом неровный; твердость
5,5—6; удельный вес 4,7—4,9.
Диагностические признаки — цвет черты, большая твердость,
характерные двойники.
Происхождение магматическое — в нефелиновых сиенитах
(луявритах) и их пегматитах. В парагенезисе с нефелином, микро-
клином, альбитом, эгирином, сфеном и др.
Месторождения: в СССР — на Кольском п-ове.
ПИРОХЛОР —(Na, Са) (Nb, Ti)2 (О, F, ОН)7 (от греческих
слов «пирос» — огонь и «хлорос» — зеленый).
Химический состав — весьма непостоянен: в группе Л, где содер-
184
жание кальция и натрия варьирует,
СаО —4—18%, Na2O — 1—6%, мо-
гут присутствовать редкие земли
(Се, Ьа)2О3—2—13%, (Y, Ег)2О3 —
0—5%, UO2 — 0—11 %, Th — 5%,
FeO — 0—10%, Мп О — 0—7%,
КгО — 0—1,5%; в группе В ниобий
(Nb2Os — 0—63%) может замещать-
ся титаном (TiO2 — 2—13%), тан-
талом (Та2О5 — 0—77%); изредка
присутствуют ZrO2 — 0—5%, SnO2—
0—4%; в группе X Н2О — до 12%,
F — до 5,5 %. Существенно танта-
ловые разности называются микро-
литами. в П0ЛИЭДРах
Сингония кубическая.
Структура. Пирохлор имеет структуру, производную от кубиче-
ской структуры флюорита (см. рис. 83, а). Если представить струк-
туру флюорита в виде координационных полиэдров (кубов), то
структура пирохлора будет отличаться тем, что половина кубов в.
ней замещена октаэдрами (рис. 97). В кубах ионы кальция или нат-
рия и замещающие их элементы располагаются в окружении анио-
нов (О, F, ОН), а в октаэдрах находятся мелкие атомы ниобия, тан-
тала и др.
Пирохлор образует кристаллы октаэдрического габитуса. Встре-
чаются также мелкозернистые агрегаты и сплошные массы.
Физические свойства — цвет темно-бурый, красновато-бурый,
желтовато-зеленый, иногда буровато-черный; черта желтовато-бе-
лая до светло-бурой; блеск алмазный, жирный, смолистый; хруп-
кий; твердость 5—5,5; удельный вес 4,03—4,36; часто радиоакти-
вен; разности, содержащие U и Th, обычно метамиктны.
Диагностические признаки — октаэдрический облик; жирный,
смолистый блеск; иногда радиоактивность.
Происхождение: в пегматитах, связанных с сиенитами и нефели-
новыми сиенитами, в парагенезисе с полевым шпатом, цирконом,
ильменитом, сфеном и биотитом; в карбонатитах в ассоциации с
магнетитом, флогопитом, форстеритом, апатитом и сульфидами;
микролит — в гранитных пегматитах совместно с альбитом, лепидо-
литом, турмалином, танталитом, касситеритом.
Месторождения: в СССР — в Сибири, Казахстане, на Кольском
п-ове; за рубежом — в Барейро де Аракше (Бразилия), Норвегии,
штате Вирджиния (США) и др.
ФЕРГЮСОНИТ—(Y, Ce)(Nb, Та)О4 (назван по фамилии шот-
ландского физика Р. Фергюсона).
Химический состав непостоянен: (Y, Ег)2О3—30—40%, (Се,
La)2O3— 1— 5%, Nb2O5 — 2—40%, Та2О5 —2—55%, Н2О —4—8%.
Танталовые разности более редки, они носят название форманита.
В качестве примесей присутствуют TiO2 — до 6%, а также Са, F, U,
Th, Zr, Al.
V85
oNb «Ее Oo
Рис. 98. Структура ко-
лумбита
устойчивый минерал и
Сингония тетрагональная.
Структура — встречается обычно в мета-
миктном состоянии. Редкие кристалличе-
ские разности имеют структуру, сходную
со структурой шеелита (см. ниже рис. ПО),
и относятся к островному типу.
Встречается в виде призматических,
игольчатых и боченковидных кристаллов.
Характерны зерна и сплошные массы.
Физические свойства — цвет светло-бу-
рый до темно-бурого, почти черный, иногда
желтый, серый; черта бурая, желтовато-бу-
рая, зеленовато-серая; блеск на поверхно-
сти кристаллов тусклый, в изломе стеклян-
ный, жирный до алмазного; излом раковис-
тый, хрупкий; твердость 5,5—6; удельный
вес — 4—5, у танталовых разностей 6—7;
обычно метамиктный.
Диагностические признаки — характер-
ная призматическая боченковидная форма
кристаллов, бурый цвет, иногда радиоак-
тивность.
Происхождение магматическое — встре-
чается как акцессорный минерал в грани-
тах, сиенитах, характерен также для неко-
торых типов пегматитов. Фергюсонит —
при разрушении гранитов часто скапливает*
ся в россыпях. Известен в россыпях Цейлона, Африки и др.
КОЛУМБИТ-ТАНТАЛИТ—(Fe, Мп) (Та, Nb)2O6. Название
происходит от главных компонентов минерала — ниобия (элемент
ниобий называется также колумбием) и тантала.
Химический состав непостоянен в связи с широким изоморфиз-
мом тантала и ниобия, а также железа и марганца. Содержание
главных компонентов колеблется: Nb2Os— от 2 до 75%; Ta2Os — от
2 до 83%; FeO — от 2 до 16%; МпО— от 1 до 16%. В качестве при-
месей обнаруживаются Ti, Sn, W, Mg, U. Существенно ниобиевые
разности (Fe, Mn)Nb2Os называются колумбитом, танталовые (Fe,
Мп)Та2Об — танталитом. В природе более часто встречаются мине-
ралы промежуточного состава. Различают также железистые и
марганцевые разновидности.
Сингония ромбическая.
Структура — основу структуры составляют октаэдры. В одних
октаэдрах в окружении шести ионов кислорода находятся ионы же-
леза (или марганца), в других — ионы ниобия (или тантала). Окта-
эдры одного типа связаны в цепочки (рис. 98). Цепочки через вер-
шины октаэдров соединены в слои. Два слоя октаэдров ниобия
(тантала) переслаиваются с одним слоем октаэдров железа (мар-
ганца).
186
Колумбит-танталит встречается в пластинчатых, таблитчатых,
реже короткостолбчатых кристаллах.
Физические свойства — цвет черный, буровато-черный, иногда
красновато-бурый (марганцевые танталиты); черта красновато-бу-
рая до темно-бурой; блеск полуметаллический, характерна побежа-
лость; обычно непрозрачен; хрупок; спайность в одном направлении
ясная; твердость 6; удельный вес для ниобиевых разностей 5—6, для
танталовых 6—8.
Диагностические признаки — пластинчатый габитус, большой
удельный вес; легко спутать с ильменитом (отличается по удельно-
му весу) и с вольфрамитом (последний имеет совершенную спай-
ность и меньшую твердость — 4,5—5).
Происхождение — встречается в пегматитах в ассоциации с аль-
битом, мусковитом, касситеритом и др.; образуется также при ме-
тасоматическом изменении гранитов (альбитизации и грейзениза-
ции), развивается иногда по минералам группы пирохлора.
Месторождения: в СССР — в Казахстане, Восточной Сибири; за
рубежом — плато Джос (Нигерия), Маноно (Конго), Блэк-Хиллс
(США), Бикита (Ю. Родезия), Параиба (Бразилия).
ГЛАВА 22
КЛАСС КАРБОНАТОВ
Карбонаты широко распространены в природе, особенно это
относится к соединениям типа Са[СОз] (кальцит), Mg[CO3] (магне-
зит), которые часто слагают мощные толщи осадочных и метамор-
фических пород. Химически карбонаты представляют собой соли
угольной кислоты. Структурной единицей этого класса является
плоская группа [СО3]2~; ионы кислорода размещены в вершинах
равностороннего треугольника, а ион углерода — в его центре. Ра-
дикалы соединяются с различными, в основном, двухвалентными
катионами, главнейшими из которых являются Alg, Fe, Zn, Са, Ba,
Sr, Pb, TR и дополнительными анионами (OH)1”, F1- и СР~.
Наиболее широко распространенные в природе карбонаты имеют
островное строение — радикалы [СО3]2- изолированы друг от друга
катионами и добавочными анионами. Наличие в структуре минера-
лов плоских радикалов [СО3]2“ обусловливает анизотропию некото-
рых свойств. Они различны в направлениях, перпендикулярных и
параллельных плоским радикалам. В частности, резко различны
показатели светопреломления (наибольший показатель светопре-
ломления имеет направление, перпендикулярное плоским радика-
лам), неодинакова твердость (например, у кальцита она изменяется
от 2,5 до 3,5). Кристаллизуются карбонаты преимущественно в три-
гональной и ромбической сингониях.
Общими физическими свойствами минералов этого класса яв-
ляются: средняя твердость (от 2,5 до 5 по шкале Мооса); для боль-
шинства разновидностей характерна совершенная спайность; стек-
лянный блеск; кроме карбонатов меди, железа, урана, все они или
187
бесцветны, или имеют светлую окраску. Характерным свойством
карбонатов является также выделение СО2 при действии на них со-
ляной кислоты (следует отметить, что без нагревания с соляной
кислотой реагируют только некоторые минералы — кальцит, араго-
нит, малахит и азурит, остальные же карбонаты вскипают при по-
догреве) .
Происхождение карбонатов преимущественно гидротермальное
и экзогенное; это связано, очевидно, с тем, что в природе анион
(СОз]2“ образуется при диссоциации угольной кислоты в водном
растворе. Экзогенные минералы — малахит, азурит, смитсонит, це-
руссит, арагонит, аморфный магнезит; гидротермальные — анкерит,
стронцианит и др.; карбонаты, которые могут образовываться гид-
ротермальным и экзогенным путем, — кальцит, доломит, магнезит,
сидерит.
Минералы класса карбонатов широко применяются в металлур-
гической промышленности, являясь, с одной стороны, рудами цин-
ка, свинца и железа (смитсонит, церуссит, сидерит), с другой —
«флюсами и огнеупорами (кальцит, магнезит); используются также
в качестве строительных материалов для производства различных
дементов, в химической промышленности — для получения соды и
других химикатов.
Подкласс безводных карбонатов
КАЛЬЦИТ — Са[СО3] (название происходит от латинского сло-
ва «кальке» — известь).
Химический состав: СаО — 56%, СО2 — 44%, примеси Mg, Fe,
Мп, Zn, Sr, Ba, С.
Сингония тригональная.
Структура островная. Структуру кальцита (см. рис. 35) часто
рассматривают как деформированную структуру галита, в которой
места ионов Na и С1 заняты соответственно Са и [СОз]2~; кроме то-
го, кубическая ячейка сжата вдоль оси симметрии третьего поряд-
ка. Плоские радикалы расположены параллельно друг другу и пер-
пендикулярно направлению оси третьего порядка. Каждый атом
кальция окружен шестью ионами кислорода. Ионы кислорода свя-
заны с двумя ионами кальция и атомом углерода, находящимся в
центре плоского треугольника. Кальцит образует различные по фор-
ме кристаллы ромбоэдрического, скаленоэдрического, иногда приз-
матического габитусов (рис. 99). Характерны таблитчатые формы,
но особенно часто образуются зернистые агрегаты, плотные скры-
токристаллические массы и натечные формы.
Физические свойства — цвет молочно-белый, за счет примесей
приобретает желтую, розовую, голубую, серую и даже черную
окраску; бесцветные прозрачные разности получили название ис-
ландского шпата (в этих кристаллах отчетливо наблюдается силь-
ное двупреломление); спайность совершенная по ромбоэдру; бурно
выделяет СО2 при действии соляной кислоты; часто люминесцирует;
твердость 3; удельный вес 2,6—2,8.
188
Диагностические призна-
ки— «вскипаемость» при дей-
ствии соляной кислоты; весьма
совершенная спайность по ром-
боэдру; от сходного доломи-
та отличается по более актив-
ной реакции с соляной кисло-
той, от арагонита — по спайно-
сти в трех направлениях.
Происхождение: а) в при-
роде основная масса кальцита
образуется в водных бассейнах
осадочным или биогенным пу-
тем и является главной состав-
ной частью известняков, мела;
при метаморфизме известня-
ков возникают мраморы;
б) кальцит является характер-
ным гидротермальным мине-
ралом, он слагает значитель-
ный объем жил различного со-
става; прозрачные кристаллы
исландского шпата возникают
изредка в пустотах эффузивных пород; в) кальцит образуется при
контактово-метасоматических процессах (скарны) и является по-
родообразующим минералом пород, называемых карбонатитами.
Последние имеют магматическое или метасоматическое происхож-
дение и связаны с массивами ультраосновных пород; г) характер-
но отложение кальцита из вод различных источников и поверх-
ностных вод в виде натечных форм и сталактитов.
Месторождения: в СССР — исландский шпат — в районе Ниж-
ней Тунгуски, в Средней Азии; мел — Белгородское, Славянское,
Кременецкое (УССР); мрамор — Козиевское (УССР), Уфалейское
(Урал), в Крыму, Карелии, на Кавказе и др.; за рубежом — исланд-
ский шпат — в Исландии, США (Нью-Мексико); мрамор — в Ита-
лии (Каррара), в Греции и др.
Практические значения — кальцит применяется в металлургиче-
ской промышленности в качестве флюса при доменном процессе и
производстве алюминия; в химической промышленности — для по-
лучения соды, углекислоты, извести; в строительном деле исполь-
зуется в виде мела, для приготовления цемента и в качестве обли-
цовочного материала (мрамор). В оптической промышленности
исландский шпат используется для изготовления николей в микро-
скопах.
МАГНЕЗИТ — Mg[CO3] (название происходит от местности
Магнезия в Греции).
Химический состав: MgO — 47,6%, СО2 — 52,4%; примеси Са,
Fe, Мп.
Сингония тригональная.
189
Структура аналогична структуре кальцита. Встречается в виде
сплошных -зернистых масс, желваков, натеков; реже образует ром-
боэдрические кристаллы. Сплошные массы могут быть мелкокри-
сталлическими и аморфными.
Физические свойства — цвет белый, серовато-белый до серого,
иногда желтоватый; блеск стеклянный; спайность у кристалличе-
ского магнезита совершенная по ромбоэдру; без нагревания в соля-
ной кислоте не вскипает; твердость 4,0—4,5; удельный вес 2,9—3,1.
Диагностические признаки — для кристаллических разновидно-
стей характерен сильный блеск, спайность по ромбоэдру; для
аморфных — матовый блеск. В соляной кислоте вскипает при подо-
греве.
Происхождение — магнезит встречается в природе реже, чем
кальцит. Значительные его концентрации образуются при следую-
щих процессах: а) гидротермальных — магнезит возникает в ре-
зультате взаимодействия магнезиальных восходящих вод с извест-
няками, при этом вначале образуется доломит, который позднее пе-
реходит в магнезит:
Са [СО3] + Mg [СО3] -> Са Mg [СО?]2
Доломит
CaMg [СО3]2+Mg [НСО3]2-> Са [HCO3]2+2Mg [COJ
Магнезит
б) при химическом выветривании ультраосновных пород под
действием глубинных или поверхностных вод, содержащих углекис-
лоту. Реакция протекает следующим образом:
4Mg2 [SIOJ -ЬН2О + 5СО2 -> Mg3 [Si2O5] (ОН)2 + 5Mg [СО3]
Оливин Тальк Магнезит
Магний, освободившийся из решетки оливина, переносится кол-
лоидными растворами и выпадает в виде аморфного магнезита.
Магнезит в этом типе месторождений ассоциируется с опалом, таль-
ком, серпентином; в) небольшие скопления магнезита могут воз-
никать при осаждении в замкнутых мелководных бассейнах с по-
вышенной концентрацией сернокислых и углекислых солей.
Месторождения: в СССР — Сатка, Халилово (Урал); за рубе-
жом— Вейтш (Австрия), Гренвилл, в доломитах Юта (США), в
ЧССР и др.
Практическое значение — поскольку обожженный магнезит вы-
держивает высокую температуру (до 3000°), он используется для
изготовления различных огнеупорных материалов; частично приме-
няется также в производстве цемента и глазури.
ДОЛОМИТ — CaMg[CO3]2 (назван в честь французского мине-
ралога Д. Доломье).
Химический состав: СаО — 30,4%, MgO — 21,7%, СО2 — 47,9%;
примеси Fe, Мп, Zn, Ni, Со; возможны включения битумов.
Сингония тригональная.
Структура подобна структуре кальцита и отличается тем, что
ионы Са попеременно чередуются с ионами Mg вдоль направления
тройной оси.
190
Встречается доломит в виде кристаллов ромбоэдрической фор-
мы, чаще же он образует кристиллически-зернистые агрегаты, по-
хожие на мрамор, а также сплошные или пористые массы.
Физические свойства — цвет белый, часто с желтым, зеленова-
тым или бурым оттенком; блеск перламутровый; с соляной кисло-
той без нагревания реагирует слабо; спайность совершенная; твер-
дость 3,5—4; удельный вес 2,8—2,9.
Диагностические признаки — кристаллы диагностируются по
ромбоэдрической спайности и изогнутым граням; в основном доло-
мит определяется химическим путем.
Происхождение: а) гидротермальное — в жилах вместе с каль-
цитом, магнезитом, сульфидами и другими рудными минералами;
б) метасоматическое — в результате действия на 'известняки раст-
воров сернокислого или хлористого магния, например:
2Са СО3 4- MgSO4 -> Са Mg [СО3]2 + Са SO4
Доломит
в) осадочное — значительные массы доломита образуются вместе
с осадочными толщами известняков и слагают в них отдельные
прослои или мощные пласты. Доломит осаждается также в оста-
точных соленосных бассейнах вместе с гипсом и ангидритом.
Месторождения: в СССР —находятся вдоль западного и восточ-
ного склонов Урала, в Донбассе, Подмосковье; за рубежом — в Ти-
рольских Альпах (Австрия), ГДР, штатах Колорадо и Юта (США).
Практическое значение — применяется в качестве строительно-
го материала; в металлургической промышленности как флюс и
огнеупор; в химической промышленности, а также для изготовле-
ния вяжущих веществ и термоизоляционных материалов.
СИДЕРИТ —Fe[CO3] ( от греческого слова «сидорос» — железо),
синоним — железный шпат.
Химический состав: FeO — 62,1%, * СО2 — 37,9%; примеси
Mg, Мп.
Сингония тригональная.
Структура аналогична структуре кальцита. Кристаллы, имею-
щие ромбоэдрический облик, редки, чаще встречаются зернистые
агрегаты, шаровидные и землистые массы.
Физические свойства — цвет серый, желтовато-серый, бурый;
блеск стеклянный; спайность у кристаллических разностей совер-
шенная; в соляной кислоте разлагается при нагревании легко; твер-
дость 3,5—4,5; удельный вес 3,9.
Диагностические признаки — темно-серый или желтовато-бурый
цвет; характерная спайность по ромбоэдру; разлагается в соляной
кислоте при нагревании; повышенный удельный вес.
Происхождение: а) гидротермальное — сидерит образует само-
стоятельные жилы или находится совместно с галенитом и сфале-
ритом; б) метасоматическое — при замещении известняков или до-
ломитов растворами, содержащими железо; в) осадочное — в гли-
нах в восстановительной обстановке, где сидерит образует конкре-
191
ции так называемых сферосидеритов. Сидерит в поверхностных ус-
ловиях неустойчив и превращается в гидроокислы железа.
Месторождения: в СССР — Бакальское, Алапаевское (Урал), в
Воронежской и Курской областях; за рубежом — в Шотландии и
Ю. Уэльсе (Англия), на побережье Бискайского залива (Испания),
в Алжире, Тунисе (Сев. Африка).
Практическое значение — является ценной рудой на железо,
поскольку в сидеритовых рудах обычно не содержатся вредных для
металлургического процесса примесей серы и фосфора.
СМИТСОНИТ — Zn[CO3] (назван в честь английского минеро-
лога Д. Смитсона).
Химический состав: ZnO — 64,8%, СО2 — 35,2%; примеси Fe,
Мп, Mg, Al, иногда Со (до 2,3%), РЬ (до 1%).
Сингония тригональная.
Структура аналогична структуре кальцита. Кристаллы — боль-
шая редкость, они имеют ромбоэдрический габитус. Обычно смит-
сонит встречается в виде натечных форм или почковидных масс.
Физические свойства — цвет белый с розовым, серым или с зеле-
ным оттенком; черта белая; блеск стеклянный; хрупок; спайность
по ромбоэдру ясная; люминесцирует; твердость 5; удельный вес
4,3—4,4.
Диагностические признаки — большой удельный вес, разлагает-
ся в соляной кислоте, точное определение производится с помощью
химического анализа.
Происхождение экзогенное. Смитсонит является характерным
минералом зоны окисления сульфидных свинцово-цинковых руд,
располагающихся в известняках или в жилах, содержащих каль-
цит. Смитсонит возникает вследствие окисления сфалерита, причем
вначале образуется сульфат цинка, который, реагируя с кальци-
том, дает начало смитсониту:
ZnS + 2О2= ZnSO4; СаСО3+ ZnSO4= Zn [СО3] + CaSO4
Кальцит Смитсонит
Вследствие легкой растворимости сульфата цинка, цинк выно-
сится из зоны окисления и иногда концентрируется во вмещающих
цинковую руду карбонатных породах в виде смитсонита. При бла-
гоприятной обстановке смитсонит может образовывать промышлен-
ные скопления.
Месторождения: в СССР — Турланское (Ю. Казахстан), Тетюхэ
(Приморье); за рубежом — Ледвилл (США).
Практическое значение — руда на цинк.
АРАГОНИТ — Са[СО3] (назван по местности Арагония в Испа-
нии).
Химический состав такой же, как у кальцита: СаО — 56,0%,
СОг — 44,0%; в качестве примесей в арагоните чаще, по сравне-
нию с кальцитом, встречаются Sr (до 5,6%), Ва и РЬ, а также Mg,
Fe, Zn.
192
Рис. 100. Агрегаты арагонита
Сингония ромбическая.
Структура — в отличие от кальцита, имеющего деформирован-
ную структуру с плотнейшей кубической упаковкой, для арагонита
характерна сжатая гексагональная плотнейшая упаковка. Ион
кальция связан с девятью ионами кислорода, а каждый ион кисло-
рода— с тремя ионами кальция и ионом углерода. Изменение в
структуре арагонита, по сравнению с кальцитом и, прежде всего,
повышение координации кальция до 9, обусловливает увеличение
твердости, удельного веса минерала, отсутствие спайности. По этой
же причине арагонит менее устойчив и, как следствие, реже встре-
чается.
Арагонит образует призматические и игольчатые кристаллы,
шестоватые лучистые агрегаты; часто находится в виде корок, на-
течных и оолитовых форм, ветвистых агрегатов (рис. 100).
Физические свойства — цвет белый, желтовато-белый, светло-
зеленый, серый; блеск стеклянный, на изломе жирный; спайность
ясная в одном направлении; неустойчив, переходит в кальцит; бур-
но вскипает в соляной кислоте; твердость 3,5—4; удельный вес
2,9—3,0.
Диагностические признаки — по цвету и поведению в соляной
кислоте сходен с кальцитом, от которого отличается повышенной
твердостью.
Происхождение — арагонит распространен в природе гораздо
реже, чем кальцит. Образуется путем осаждения из вод горячих
и холодных источников. В основной своей массе возникает в экзо-
генных условиях в коре выветривания изверженных горных пород
в ассоциации с доломитом, гипсом и в зоне окисления сульфидных
месторождений.
Месторождения — арагонит не образует самостоятельных боль-
ших концентраций; он встречается в некоторых рудных месторож-
дениях Алтая, известен на Бакальском руднике (Урал); за рубе-
7—3628 193
жом — в источниках Карловых Вар (ЧССР), в месторождении гип-
са и серы Джирдженти в Сицилии (Италия).
ЦЕРУССИТ—РЬ[СО3] (от латинского слова «церусса» — бели-
ла).
Химический состав: РЬО — 83,5%, СО2—16,5%; могут присут-
ствовать механические примеси пылевидного галенита и аргенти-
та, придающие церусситу черный цвет.
Сингония ромбическая.
Структура аналогична структуре арагонита. Встречается в кри-
сталлах, имеющих бипирамидальную, столбчатую, таблитчатую и
игольчатую формы, в виде агрегатов зернистого строения, реже во-
локнистых и землистых масс.
Физические свойства — цвет белый с серым, желтым или бурым
оттенком, иногда черный; блеск алмазный или стеклянный; спай-
ность иногда ясная; хрупок; люминесцирует; твердость 3—3,5;
удельный вес 6,4—6,6.
Диагностические признаки — для церуссита характерен боль-
шой удельный вес, алмазный блеск; при разламывании он издает
хрустящий звук.
Происхождение — образуется, как и смитсонит, в зоне окисления
свинцово-цинковых руд, залегающих в известняках. Церуссит воз-
никает за счет англезита (Pb[SO4]), развивающегося при окислении
галенита. Церуссит образует псевдоморфозы по англезиту, гале-
ниту и кальциту. Поскольку PbSC>4 не отличается высокой мигра-
ционной способностью, церуссит, в отличие от смитсонита, образу-
ется непосредственно в зоне окисления месторождений, и скопле-
ния его нередко имеют промышленное значение.
Месторождение: в СССР — Кадаинское, Тайнинское (Забай-
калье), Змеиногорское (Алтай); за рубежом — Брокен-Хилл (Ав-
стралия).
Практическое значение — руда на свинец.
Подкласс карбонатов с добавочными анионами
МАЛАХИТ—Си2[СО3](ОН)2 (от греческого слова «маляхе» —
мальва, очевидно, в связи со сходством цвета минерала с зеленым
цветом растения).
Химический состав: СиО —71,9%, СО2—19,9%, Н2О — 8,2%;
примеси Zn (до 12%), Fe, Са.
Сингония моноклинная.
Структура островная. Атомы меди находятся в искаженной чет-
верной координации. Они окружены двумя ионами ОН и двумя
ионами О (рис. 101).
Малахит встречается, главным образом, в виде натечных форм,
почек, имеющих радиально-лучистое или волокнистое строение.
Крупные почки имеют концентрически зональное строение. Харак-
терны также землистые массы и налеты (медная зелень). Очень
редко образующиеся кристаллы имеют призматический облик.
Физические свойства — цвет зеленый, светло-зеленый; блеск
194
Рис. 101. Структура малахита
° • а О О
С Си, Си,, О ОН
Рис. 102. Струк-
тура азурита
стеклянный до алмазного, иногда шелковистый; кристаллы имеют
совершенную спайность в одном направлении; бурно вскипает в
соляной кислоте; твердость 3,5—4; удельный вес 4.
Диагностические признаки — характерный зеленый цвет, легко
растворяется в соляной кислоте, ассоциируется с азуритом.
Происхождение — малахит образуется в зоне окисления медных,
большей частью сульфидных руд. В результате окисления минера-
лов, содержащих медь, возникает сульфат меди (C11SO4). Если
медные месторождения залегают в известняках или руды содержат
карбонаты, то происходит замещение карбонатов малахитом. Воз-
можно возникновение малахита и путем взаимодействия сульфата
меди с растворами, насыщенными углекислотой. Малахит часто
образует псевдоморфозы по самородной меди, куприту, а также
азуриту, который яляется самым характерным спутником мала-
хита. Реакция образования малахита может быть представлена
следующим образом:
2CuSO4+2CaCO3+H2O=Cu2[CO3](OH)2+2CaSO4 + CO2
Малахит
Месторождения: в СССР мировую известность получили Мед-
норуднянское и Гумишевское (Урал) месторождения (малахитом
из этих месторождений облицован малахитовый зал в Эрмитаже
и колонны Исаакиевского собора в Ленинграде); за рубежом —
Шесси (Франция), Тсумеб (Юго-Западная Африка), Коппер-Куин
(США).
Практическое значение — ценный поделочный камень; вместе
с другими медными минералами является рудой на медь.
АЗУРИТ—Си^[СО3]2(ОН)2 (от персидского слова «лаза-
вард» — голубой).
Химический состав: СнО — 69,2%, СО2 —25,6%, Н2О —5,2%.
7*
195
Сингония моноклинная.
Структура островная (рис. 102); отличается от структуры мала-
хита тем, что часть атомов меди находится в четверной координа-
ции; эти атомы связаны с двумя ионами ОН и двумя ионами О;
другая же часть имеет координационное число 5 и атомы меди ок-
ружены двумя ионами ОН и тремя ионами О.
Азурит обычно представлен хорошо образованными, хотя и
мелкими кристаллами. Они имеют таблитчатый и призматический
облик, иногда подобны ромбоэдру. Встречаются землистые раз-
ности (медная синь) и налеты.
Физические свойства—цвет темно-синий, реже голубой; черта
синяя, светлее, чем окраска минерала; блеск стеклянный, почти ал-
мазный; спайность совершенная в одном направлении; легко вски-
пает в соляной кислоте; твердость 3,5—4; удельный вес 3,7—3,9.
Диагностические признаки — характерный синий цвет, растворя-
ется в соляной кислоте, ассоциируется с малахитом.
Происхождение — встречается в зонах окисления медных суль-
фидных месторождений и отлагается после образования малахита.
Поскольку азурит менее устойчив, он иногда замещается мала-
хитом.
Месторождения: в СССР известен в небольших количествах в
Золотушинском и других рудниках на Алтае, за рубежом — Шесси
(Франция), Бисби (США), Тсумеб (Юго-Западная Африка).
Практическое значение — используется в качестве синей краски,
с другими медными минералами идет в плавку для получения меди.
ГЛАВА 23
КЛАСС СУЛЬФАТОВ
Класс сульфатов включает соединения различных катионов с
комплексным анионом [SO4]2-. Химически сульфаты предсталяют
собой соли серной кислоты. В отличие от сульфидов, в которых сера
находится в виде отрицательного иона S2“, в сульфатах она является
шестивалентной — S6+ и входит в комплексный анион [SOJ2”. В сос-
таве этого комплекса ион серы тетраэдрически окружен ионами
кислорода. В свою очередь анионы [SO4]2“ соединяются с катиона-
ми Na, К, Al, Fe3+, Mg, Са, Ва; некоторые минералы содержат до-
бавочные анионы [ОН]1”, [С1]1—, [СО3]2“ или молекулы воды.
Структуры минералов этого класса принадлежат к островному,
цепочечному и слоистому типам. Наиболее широко распространены
минералы островной структуры—без добавочных анионов (ангид-
рит, барит, целестин), с добавочными анионами (алунит, ярозит) и
слоистые (гипс). Большинство сульфатов кристаллизуется в низших
сингониях — моноклинной и ромбической. Сульфаты характери-
зуются определенными физическими свойствами — небольшой твер-
достью (не более 3,5), преимущественно светлой окраской, низкими
показателями светопреломления, хорошей растворимостью (в осо-
бенности сульфаты, содержащие молекулы воды).
196
Большинство сульфатов возникает путем осаждения в различ-
ных водоемах (чаще всего морских) в условиях повышенной кон-
центрации кислорода, при сравнительно невысокой температуре и
низком давлении. Гораздо реже минералы этого класса образуются
гидротермальным путем, главным образом, это относится к безвод-
ным сульфатам.
По происхождению их можно разбить на три группы:
а) сульфаты, возникающие в морских засоленных лагунах или
озерах, — ангидрит, гипс, тенардит, мирабилит и др.;
б) сульфаты, образующиеся в зоне окисления сульфидных ме-
сторождений — ангидрит, ярозит, гипс;
в) сульфаты гидротермального происхождения — барит, целес-
тин, гипс, алунит.
Минералы класса сульфатов применяются в различных отрас-
лях промышленности: в химической для производства серных сое-
динений (алунит), солей бария (барит); в металлургической для
получения металлов Sr, Al (целестин, алунит); в строительном де-
ле (гипс) и др.
БАРИТ — Ba[SO4] (от греческого слова «барос» — тяжесть; име-
ется в виду большой удельный вес этого минерала), синоним —
тяжелый шпат.
Химический состав: ВаО —65,7%, SO3 — 34,3%; примеси Sr, Са,
РЬ и Ra. Разновидности с большим содержанием Sr называются
баритоцелестином, с примесью РЬ и Ra — хокутолитом.
Сингония ромбическая.
Структура островная. Каждый ион бария (рис. 103) окружен
двенадцатью ионами кислорода, принадлежащими к семи различ-
ным группам [SO4]2-. Ионы серы окружены четырьмя ионами кис-
лорода, образующими несколько искаженный тетраэдр. Барит
встречается в виде кристаллов таблитчатого или пластинчатого
облика, реже столбчатых кристаллов; характерны также сплошные,
землистые массы, конкреции и иногда друзы.
Рис. 103. Структура барита
7* — 3628
197
Физические свойства — бывает бесцветный, прозрачный, но
обычно за счет механических примесей, включений газов и жидко-
стей окрашен в молочно-белый, серый, зеленый и черный цвета;
блеск стеклянный, на некоторых плоскостях спайности перламутро-
вый; хрупок; спайность совершенная в одном направлении; твер-
дость 3—3,5; удельный вес 4,3—4,5.
Диагностические признаки — большой удельный вес, спайность
в одном направлении.
Происхождение гидротермальное: в сульфидных жилах с гале-
нитом, сфалеритом, пиритом; в полевошпатовых, существенно бари-
товых, барит-кальцитовых, барит-сидеритовых и барит-флюорито-
вых жилах. Реже возникает в зоне выветривания, иногда в виде
конкреций встречается в морских осадках.
Месторождения барита многочисленны, главнейшие из них — в
бассейне р. Риони (Груз. ССР), в Каракалинском районе (Туркмен-
ская ССР), попутно добывается из полиметаллических месторож-
дений Алтая; за рубежом — Дербиширское (Англия), Меггон
(ФРГ), в штатах Вашингтон, Миссури (США).
Промышленное значение — барит используется для получения
различных солей*и препаратов бария, применяемых в кожевенном,
сахарном производстве, при изготовлении фотобумаги, керамиче-
ских эмалей. Высокий удельный вес барита обусловливает примене-
ние его в качестве утяжелителя глинистых растворов, используемых
при бурении скважин; в качестве утяжелителя в специальных сор-
тах бумаги, резины, пластических масс. Барий используется для
приготовления белил, светлых красок. Способность барита погло-
щать рентгеновские лучи обусловливает его применение в специаль-
ных стройматериалах, медицине—при рентгеновской диагностике
внутренних заболеваний.
ЦЕЛЕСТИН — Sr[SO4] (от латинского слова «целестис» — не-
бесный из-за голубого цвета минерала).
Химический состав: SrO — 56,4%, SO3 — 43,6%; примеси Са,Ва,
иногда Mg, Fe, Мп.
Сингония ромбическая.
Структура аналогична структуре барита. Встречается в виде
пластинчатых, таблитчатых и призматических кристаллов, в
пустотах образует друзы (рис. 104), находится также в форме
зернистых и шестоватых агрегатов, в виде натечных форм и
желваков.
Физические свойства — цвет голубой, голубовато-белый, голу-
бовато-серый, редко встречаются бесцветные разности; блеск стек-
лянный, на плоскостях спайности перламутровый; хрупок; спай-
ность совершенная в одном направлении; твердость 3—3,5; удель-
ный вес 3,9—4,0.
Диагностические признаки — голубой цвет , большой удельный
вес, характерная ассоциация с гипсом и серой.
Происхождение: а) в основном осадочное—при образовании
известняков, доломитов, мергелей, среди которых встречаются лин-
зы, прослои целестина в ассоциации с гипсом, баритом, серой; це-
198
Рис. 104. Друза призматических и игольчатых кристал-
лов целестина
лестин обнаружен также в соляных отложениях; б) метасоматиче-
ское— возможна концентрация целестина в доломитах в результате
привноса стронция растворами с последующим развитием псев-
доморфоз целестина по доломиту и гипсу; в) гидротермальное —
иногда происходит образование целестина в гидротермальных жи-
лах с галенитом, сфалеритом и другими сульфидами.
Месторождения: в СССР — в Архангельской области, в По-
волжье, Башкирии, Чкаловской области, на о. Мангышлак, Ляккан-
ское (Уз. ССР); за рубежом — в районе Бристоля (Англия), в
Вестфалии и Вельдеке (ГДР).
Промышленное значение — является основной рудой для полу-
чения стронция. Применяется для производства сплавов с цветными
металлами (алюминием, свинцом и др.). Металлический стронций
и его сплавы высокой чистоты используются в радиотехнике и элек-
тронике в качестве геттеров (поглотителей газов). В пиротехнике
используется свойство соединений стронция окрашивать пламя в
ярко-красный цвет. В химической промышленности находят приме-
нение различные соли стронция.
АНГИДРИТ — Ca[SO4] («ангидрит» в переводе с греческого —
безводный, происходит от слов «ан» — без, и «гидор» — вода и
указывает на отсутствие в этом минерале воды в противополож-
ность гипсу, близкому к нему по химическому составу).
Химический состав: СаО — 41,2%, SO3 — 58,8%; примеси Си,
Sr, Ba, СО2, Fe2O3.
Сингония ромбическая.
7**
199
ОСа •$ Qu
Рис. 105. Структура ангидрита
Структура островная. Ионы S6+ располагаются в центрах пра-
вильных тетраэдров кислорода. Ионы кальция находятся на линиях
пересечения двух систем зеркальных плоскостей и окружены во-
семью ионами кислорода (рис. 105). В двух направлениях ионы Са
и SO4 находятся примерно на равных расстояниях, в третьем они
располагаются на меньшем интервале, что обусловливает совершен-
ную спайность по двум и среднюю в третьем направлении.
Кристаллы ангидрита очень редки, большей частью он встреча-
ется в виде сплошных мелкозернистых масс, напоминающих мрамор.
Физические свойства — цвет белый, часто с голубым, серым или
красноватым оттенком; спайность по трем взаимно перпендикуляр-
ным направлениям; блеск на разных плоскостях неодинаков — жир-
ный, стеклянный, перламутровый; твердость 3—3,5; удельный вес
2,8—3,0.
Диагностические признаки — малый удельный вес; невысокая
твердость; от сходного с ним кальцита отличается тем, что не вски-
пает в соляной кислоте; от гипса — по твердости, не царапается
ногтем.
Происхождение — ангидрит образуется преимущественно в эк-
зогенных условиях при высыхании водных бассейнов и является
составной частью соленосных осадков. Спутники ангидрита — га-
лит, гипс. Часто ангидрит возникает в результате изменения извест-
няков и доломитов под действием вод, содержащих серную кислоту.
Возможно образование ангидрита в результате обезвоживания
толщ гипса при условии попадания гипсоносных отложений в об-
ласти высокого давления. Имеет место и обратный переход ангид-
рита в гипс в приповерхностных зонах за счет обводнения отложе-
ний ангидрита. Оба минерала — ангидрит и гипс, обычно встре-
чаются вместе.
200
Месторождения: в СССР — Артемовское (УССР), в Архангель-
ской и Вологодской областях; за рубежом — Страссфуртское
(ГДР), в провинции Пенджаб (Индия).
Практическое значение — применяется, главным образом, для
производства цемента.
ГИПС—Ca[SO4]-2H2O (от греческого слова «гипсос», означав-
шего название самого минерала или продукта его обжига).
Химический состав: СаО — 32,5%, SO3 — 46,6%, Н2О — 20,9%;
иногда присутствуют механические примеси битумов, сульфидов.
Сингония моноклинная.
Структура слоистая. Два слоя анионов [SO4] связаны ионами Са
так, что образуют двойные слои. На рис. 106 эти слои расположены
перпендикулярно плоскости чертежа (пограничные линии, разгра-
ничивающие слои, показаны пунктиром). Молекулы воды занимают
места в промежутках между двойными слоями. Слабые связи моле-
кул воды, принадлежащих к разным двойным слоям, и обусловли-
вают появление весьма совершенной спайности минерала в одном
направлении. Каждый ион кальция окружен шестью кислородными
ионами, принадлежащими к группам SO4, и двумя молекулами
воды. В свою очередь, молекула воды связывает ион кальция с
одним ионом кислорода в том же двойном слое и с другим ионом
кислорода — в соседнем слое. В одних направлениях ионы Са и О
расположены на большем расстоянии (эти направления соответст-
вуют совершенной спайности), в других связаны более тесно (на-
правления с менее совершенной спайностью).
Гипс встречается в виде толсто- и тонкотаблитчатых кристаллов,
часто образует двойники, некоторые из них напоминают ласточкин
хвост (рис. 107). Характерны также плотные тонкозернистые агре-
гаты. Некоторые кристаллические формы гипса и агрегаты носят
собственные названия, например, пластинчатый гипс — тонкие про-
зрачные кристаллы, напоминающие слюду; гипсовые розы — ро-
зетковидные сростки кристаллов; селенит — волокнистые разности,
алебастр — плотные землистые массы.
Физические свойства — цвет белый, за счет примесей — серый,
медово-желтый, розовый; часто минерал совершенно прозрачен;
201
Рис. 107. Агрегат сдвойникованных кристаллов
гипса
блеск стеклянный, перламутровый; спайность весьма совершенная;
кристаллы часто легко расщепляются на тонкие листочки; твер-
дость 2; удельный вес 2,3.
Диагностические признаки — весьма совершенная спайность, не-
большая твердость — чертится ногтем.
Происхождение — гипс, как и ангидрит, образуется, глав-
ным образом, в усыхающих озерах, морских бассейнах и ла-
гунах.
Значительные массы его возникают при гидратации толщ ангид-
рита, попадающих в зону действия поверхностных вод, по следую-
щей схеме:
Са [SO4] + 2Н2О -> Са [SOJ • 2Н2О
Гипс образуется в известняках и мергелях под действием на них
поверхностных вод, содержащих серную кислоту, а также в зоне
окисления сульфидных руд. Реже он встречается в гидротермаль-
ных жилах.
Промышленно ценными являются осадочные месторождения
гипса.
Месторождения: в СССР весьма многочисленны — в Башкир-
ской и Татарской АССР, в Архангельской, Вологодской, Горьков-
ской, Артемовской областях, в Дагестане, Туркмении, Узбекистане
и др.; за рубежом — в штатах Мичиган, Айова, Канзас (США),
Страссфуртское (ГДР).
Практическое значение — гипс, как и ангидрит, широко приме-
няется для приготовления различных цементов. В химической про-
мышленности используется в производстве сульфата аммония
(азотное удобрение) и серной кислоты. Кроме того, гипс применя-
ется в сельском хозяйстве для гипсования почв, в бумажном произ-
202
водстве в качестве наполнителя, а также в медицине (гипсовые
слепки).
АЛУНИТ—КА1з{8О4]2(ОН)б (название произошло от сокраще-
ния слова «алюминолит» — так назвали минерал из Толфа, Италия).
Химический состав: К2О — 11,4%, А12О3 — 37,0 %, Н2О —
13,0%, SO3 — 38,6%, иногда калий наполовину замещен натрием
(натроалунит), встречаются также примеси железа, редких земель.
Сингония тригональная.
Структура островная. Редко образует мелкие кристаллы ромбо-
эдрической или таблитчатой форм. Обычно встречается в виде
плотных или рыхлых глиноподобных масс (рис. 108).
Физические свойства — цвет белый, за счет примесей железа
желтый, розовый, бурый, серый; блеск стеклянный, на плоскостях
спайности перламутровый, глиноподобные массы характеризуются
матовым блеском; спайность ясная; хрупкий; твердость 3,5—4;
удельный вес 2,6—2,8.
Диагностические признаки — макроскопически диагностируется
с большим трудом, определяется с помощью микрохимических ре-
акций или путем термического анализа.
Происхождение в основном гидротермальное. Алунит образует-
ся при метасоматической переработке богатых калием и алюмини-
ем эффузивных пород (лав, туфов) под действием сернокислых ра-
створов. Процесс изменения пород с образованием алунита получил
название алунитизации. Известно также образование алунита из
растворов в ассоциации с флюоритом и сульфидами, а также в
результате отложения из коллоидов.
Месторождения: в СССР — Загликское (Азербайджанская
ССР), Журавлинское (Урал), Часовярское (УССР); за рубежом —
Толфа (Италия), Фаншань Тайху (Китай).
Рис. 108. Алунитовая порода
203
Промышленное значение — алунит является важнейшим сырьем
для получения калиевых квасцов, широко применяемых в качестве
протравы в красильном, типографском, кожевенном, бумажном
производствах; из алунита получают также различные сернистые
соединения. В настоящее время алунит стали использовать в каче-
стве алюминиевого сырья.
ГЛАВА 24
КЛАСС ВОЛЬФРАМАТОВ
Минеральные разновидности этого класса немногочисленны. По
химическому составу они являются солями вольфрамовой кислоты
с общей формулой /?2+[WO4], где может быть Мп, Fe, Са, РЬ. В ос-
нове структуры вольфраматов лежат искаженные тетраэдры WO4.
Минералы имеют островное строение. Для вольфраматов харак-
терно высокотемпературное, гидротермальное происхождение. Из
этого класса рассмотрим минералы, имеющие промышленное зна-
чение,— вольфрамит и шеелит.
ВОЛЬФРАМИТ — (Мп, Fe)[WO4] (происхождение названия точ-
но не установлено, возможно, оно возникло от немецких слов
«вольф» — волк и «рам» — пена, поскольку примесь вольфрамита в
рудах олова дает при плавке нежелательную пену).
Химический состав — вольфрамиты являются изоморфными сме-
сями двух крайних членов: Fe[WO4]— ферберита и Mn[WO4] — гю-
бнерита. Содержание WO3 — 73—75%, МпО в гюбнеритах 17—
23%, FeO в ферберитах до 17%; примеси Та, Nb, Sn, Sc, Са, Mg.
Сингония моноклинная.
Структура близка к структуре рутила, а также колумбит-танта-
лита. Основу структуры составляют октаэдры (Fe, Mg)O6 и [WO6],
соединенные в зигзагообразные цепочки. Цепочки из октаэдров
(Fe, Mg)Об чередуются с цепочками, составленными октаэдрами
WOe (рис. 109). Попеременное чередование различных октаэдров
обусловливает лучшую спайность у вольфрамита по сравнению с
колумбит-танталитом, у которого разные октаэдры, чередуются в
отношении 1 :2.
Вольфрамит встречается в кристаллах короткостолбчатого или
призматического облика (рис. 109, б),,образует также сплошные
крупнозернистые агрегаты.
Физические свойства — цвет темно-бурый до черного (ферберит)
и бурый до красновато-бурого (гюбнерит); черта бурая, темно-бу-
рая у ферберита и светло-бурая или желтая у гюбнерита; спайность
в одном направлении совершенная, блеск на плоскостях спайности
алмазный, в других направлениях жирный; ферберит слабо магни-
тен; твердость 4,5—5,5; удельный вес 6,7—7,5.
Диагностические признаки — бурый цвет, большой удельный
вес; от черного сфалерита отличается большим удельным весом,
спайностью в одном направлении (у сфалерита в шести).
Происхождение пневматолито-гидротермальное. Встречается в
грейзенах вместе с топазом, слюдой, флюоритом, молибденитом,
204
Рис. 109. Структура (а) и формы (б) кристаллов вольфрамита
касситеритом, турмалином; в кварцевых жилах — в ассоциации с
пиритом, молибденитом, сфалеритом, висмутином, халькопиритом.
При разрушении вольфрамит превращается в гидроокислы же-
леза, марганца и вольфрамовую охру (минерал ферритунгстит).
Месторождения: в СССР — Джидинское, Букукинское (Забай-
калье), Караобинское (Казахская ССР); за рубежом — в Южном
Китае, Бирме, в штатах Колорадо, Ю. Дакота (США), в Боливии.
Практическое значение — руда на вольфрам. Металл применя-
ется в основном (90%) для получения твердых сплавов, частично
в электропромышленности для изготовления нитей ламп, антикато-
дов рентгеновских трубок, используется в химической промышлен-
ности, а также для окраски стекла и фарфора.
ШЕЕЛИТ — Ca[WO4] ( назван в честь шведского химика Шееле,
впервые открывшего вольфрам в этом минерале).
Химический состав: СаО — 19,4%, WO3 — 80,6%; примеси МоО3
до 24% (молибдошеелит), СиО до 7% (купрошеелит), иногда ред-
ких земель.
Сингония тетрагональная.
Структура островная; состоит из тетраэдров [WO4], несколько
сплющенных по вертикальной оси и соединенных между собой ани-
онами кальция (рис. ПО). Кальций имеет восьмерную, а вольфрам
шестерную координации.
205
•w Qp ©СП
Рис. ПО. Структура шеелита
Облик кристаллов октаэдрический,
иногда таблитчатый, чаще встречается
в виде мелкозернистых агрегатов и
сплошных масс.
Физические свойства — цвет в зави-
симости от примесей может быть се-
рый, желтый, зеленый (купрошеелит),
иногда наблюдаются бесцветные раз-
новидности; прозрачный; черта белая;
блеск жирный, алмазный; спайность
ясная; излом неровный, раковистый;
твердость 4,5—5; удельный вес 5,8—
6,2.
Диагностические признаки — окрас-
ка светлых, чаще желтых тонов, жир-
ный блеск и большой удельный вес.
Макроскопически диагностируется с
трудом, определяется по характерной
реакции на вольфрам и голубому све-
чению в ультрафиолетовом свете.
Происхождение: а) чаще всего встречается в скарнах, в ассо-
циации с пироксенами, гранатами, пирротином. Скарновые место-
рождения шеелита являются главным промышленным типом; б) в
гидротермальных жилах, где шеелит встречается вместе с вольф-
рамитом, различными сульфидами и золотом.
Месторождения: в СССР — Чорух-Дайрон, Лянгар (Средняя
Азия), Тырныауз (Кавказ), Гумбейское (Урал); за рубежом —
Цинновец (ЧССР), Корнуэлл (Англия), в Швейцарии.
ГЛАВА 25
КЛАСС ФОСФАТОВ И ИХ АНАЛОГОВ
Фосфаты и их аналоги — ванадаты и арсенаты, весьма много-
численны и образуют около 250 минералов. Однако большинство
из них редко встречается в природе. По химическому составу они
являются солями фосфорной, ванадиевой и мышьяковой кислот.
Не касаясь всех многочисленных минеральных видов этого клас-
са, остановимся на характеристике некоторых наиболее распростра-
ненных фосфатов и ванадатов.
Основную структурную единицу рассматриваемых минералов
составляют театраэдры [POJ3-, [AsO4]3“ или [VO4]3“ Тетраэдры,
соединяясь с катионами, а также с добавочными анионами, обра-
зуют различные структуры — островные, цепочечные, слоистые,
каркасные. Из катионов характерны трехвалентные элементы А1,
Fe, редкие земли, двух- и одновалентные элементы — Са, Мп, Mg,
Zn, Pb, Fe, Ni, Co, Li, Na, а также U.
Кроме того, широко распространены соединения, содержащие
воду. Водные соединения и соединения с добавочными анионами
206
(F, Cl) образуются чаще при наличии катионов низкой валент-
ности. Кристаллизуются фосфаты и ванадаты преимущественно в
низших сингониях. Формы кристаллов варьируют от призматиче-
ских, игольчатых до пластинчатых и чешуйчатых, характерны так-
же сплошные мелкозернистые массы, налеты, корки.
Физические свойства этих минералов весьма различны, они из-
меняются в зависимости от состава, наличия воды, добавочных
анионов, структуры.
Происхождение минералов, в основном, экзогенное (особенно
для арсенатов и ванадатов). Некоторые фосфаты образуются при
магматическом, пегматитовом и гидротермальном процессах.
Фосфаты имеют большое практическое значение. Они являются
сырьем для производства искусственных удобрений, получения ред-
ких земель, урана.
Ниже рассматриваются некоторые безводные (без добавочных
анионов) фосфаты — монацит, ксенотим; безводные фосфаты, со-
держащие добавочные анионы,— апатит, водные фосфаты и вана-
даты из группы урановых слюдок.
МОНАЦИТ—(Се, Ьа...)[РО4] (от греческого слова «монайд-
зен» — уединенный; название дано в связи с тем, что монацит обыч-
но встречается в единичных кристаллах).
Химический состав: содержание (Се,Ьа...)20з достигает 55—70%,
Р2О5 —22—31%, примеси Y2O3 до 5%, ThO2— 5—28%, SiO2 до 6%;
в незначительных количествах устанавливаются Mg, Мп, Pb, Fe, Al
и Н2О.
Сингония моноклинная.
Структура островная состоит из несколько искаженных тетра-
эдров [РО4] и ионов церия (или лантана), имеющих координацион-
ное число девять. Каждый ион церия связан с шестью тетраэдрами
РО4 (рис. 111).
Монацит образует таблитчатые, реже призматические кристал-
лы. Особенно хорошо развиты грани пинакоидов, характерна штри-
ховка.
Физические свойства — цвет свет-
ло-желтый, желтовато-бурый, реже
розовый, зеленовато-серый; прозра-
чен или просвечивает; блеск стек-
лянный, жирный; спайность в од-
ном направлении совершенная; хру-
пок; почти всегда радиоактивен;
твердость 5—5,5; удельный вес
4,9—5,5.
Диагностические признаки — ха-
рактерная таблитчатая форма кри-
сталлов большей частью желто-бу-
рой окраски; радиоактивность.
Происхождение: а) магматичес-
кое, встречается как акцессорный
минерал в кислых и щелочных по-
• р ©Се Оо
Рис. 111. Структура монацита
207
родах (гранитах, сиенитах); б) пегматитовое, характерен для гра-
нитных пегматитов, встречается в ассоциации с полевыми шпата-
ми, биотитом, цирконом, апатитом, сфеном, ильменитом; г) гидро-
термальное— в доломитовых прожилках вместе с магнетитом, в
полевошпатовых и карбонатных прожилках с сульфидами, карбо-
натами редких земель, торитом и цирконом.
При разрушении магматических пород концентрируется в россы-
пях, являющихся практически единственным типом промышленных
месторождений монацита.
Месторождения: россыпные месторождения широко известны в
Индии — Траванкор, на островах Цейлон, Мадагаскар, в Бра-
зилии.
Практическое значение — является рудой, из которой извлека-
ют редкие земли (церий, лантан и другие редкие земли цериевой
группы и торий).
КСЕНОТИМ —Y[PO4] ( название произошло от греческих слов
«ксенос» — чужой, и «тими» — честь, в связи с тем, что иттрий в
этом минерале был ошибочно принят за новый элемент).
Химический состав: содержание Y2O3 до 63%; Р2О5 — 25—38%;
примеси Ег, Се, La, Th и U (до 5%), Zr, Si, Sn, Fe, Al.
Сингония тетрагональная.
Структура островная, аналогична структуре циркона (см. ниже
рис. 117, а). Ионы иттрия находятся в восьмерной координации и
окружены ионами кислорода, принадлежащими шести разным тет-
раэдрам [РО4]. Вследствие близости структур ксенотима и циркона,
они часто образуют взаимные прорастания; в ксенотимах нередко
встречается примесь циркония (до 3%).
Кристаллы ксенотима весьма сходны с кристаллами циркона и
имеют призматический облик. Для них характерна комбинация
призмы и пирамиды. Иногда встречаются тонкозернистые массы.
Физические свойства—цвет желтый, желтовато-бурый, красно-
вато-бурый, серый; черта светло-бурая и желтовато-бурая; блеск
стеклянный, восковой или жирный; спайность совершенная в одном
направлении, излом неровный; хрупкий; часто радиоактивен; твер-
дость 4—5; удельный вес 4,4—4,6.
Диагностические признаки — призматическая форма, радиоак-
тивность; от сходных минералов рутила, касситерита отличается по
радиоактивности, меньшей твердости, от циркона — по меньшей
твердости.
Происхождение — образуется, как и монацит, в гранитах и свя-
занных с ними пегматитах, встречается также и в гидротермальных
образованиях. Характернейшими минералами-спутниками являются
циркон, монацит, фторкарбонаты редких земель, апатит, ильменит.
Ксенотим — устойчивый минерал и вместе с цирконом, монаци-
том, ильменитом переходит в россыпи, откуда и добывается.
Месторождения — наибольшей известностью пользуются ксено-
тимсодержащие пегматиты района Минас Жерайс (Бразилия), рос-
сыпи Новой Зеландии, Цейлона, Африки.
Практическое значение — при значительных концентрациях мо-
208
Рис. 112. Структура апатита:
а-и поперечное сечение; б — вертикальные кальциевые цепочки
жет использоваться как руда на иттрий и редкие земли иттриевой
группы.
АПАТИТ —Ca5tPOJ3(Cl, F, ОН) (от греческого слова «апа-
гао» — обманываю, поскольку апатит долгое время принимался за
другие минералы — берилл, флюорит).
Химический состав — апатит имеет непостоянный состав в свя-
зи с тем, что дополнительные анионы могут взаимно замещаться
вплоть до образования чистых разностей фторапатита, хлорапати-
та и гидроксил-апатита. Содержание СаО — 52—56%, Р2О5 — 40—
42%, F — 5,6%, С1 — до 4,2%, Н2О —до 4,5%; характерными приме-
сями являются Sr, Мп, TR, СО2.
Сингония гексагональная.
Структура островная. Основу структуры составляют изолиро-
ванные тетраэдры [РО4]3“. Ионы кальция имеют различную коор-
динацию. Одни ионы располагаются по вертикальной оси третьего
порядка, связаны с девятью ионами кислорода и образуют цепоч-
ки. Эти цепочки соединены между собой с помощью тетраэдров
(рис. 112, б) таким образом, что возникает каркас с полыми ци-
линдрами, имеющими шестигранное сечение. Ионы кальция второго
типа располагаются на стенках цилиндров. Они имеют координа-
ционное число 7 и связаны с шестью ионами кислорода и одним
анионом (F, С1, ОН), находящимся в центре полого цилиндра
(рис. 112, а). Структура апатита благоприятствует вхождению
большого количества примесей TR (до 12%), Sr (до 11%), Мп (до
209
10%) и других, которые могут легко замещать кальций, располо-
женный в полых цилиндрах.
Апатит встречается обычно в виде хорошо образованных приз-
матических кристаллов с шестиугольным сечением, завершающих-
ся пинакоидами или бипирамидами (рис. 113). Иногда возникают
игольчатые кристаллы. Широко распространены также зернистые
сахаровидные массы, конкреции и желваки.
Физические свойства — цвет бледно-зеленый, голубой, желтый,
бурый, характерны бесцветные разности; блеск стеклянный до жир-
ного; излом неровный; спайность в одном направлении несовер-
шенная; типична отдельность; хрупок; твердость 5; удельный
вес 3,2.
Диагностические признаки — форма кристаллов; от сходного
берилла отличается меньшей твердостью.
Происхождение — апатит образуется при самых различных про-
цессах. Незначительные концентрации его встречаются в большин-
стве типов пород. Так, например, апатит является акцессорным
минералом гранитов, сиенитов, диоритов и других магматических
пород. Крупные кристаллы апатита образуются в пегматитах. Ха-
рактерен он для контактово-метасоматических пород и различных
жильных месторождений. Скопления апатита возникают и при про-
цессах выветривания. Главное же промышленное значение имеют
следующие типы месторождений: а) магматические — в связи со
щелочными апатит-нефелиновыми породами или апатит-магнетито-
выми образованиями; б) метасоматические — в месторождениях
Рис. 113. Шестигранный кристалл апатита в кальците
210
Рис. 114. Конкреции фосфорита
карбонатитов в ассоциации с флогопитом, магнетитом, пирохло-
ром; в) осадочные — фосфоритовые.
Фосфориты представляют собой отложения глин, мергелей, из-
вестняков, значительно обогащенных фосфатным веществом, или
скопления конкреций и желваков, почти полностью состоящих из
фосфатов группы апатита (рис. 114) и постоянно содержащих
карбонатапатит. Образование фосфоритов происходит в связи
с массовой гибелью микроорганизмов, скелеты которых состоят из
фосфорнокислого кальция, извлеченного из морской воды. В ре-
зультате возникают значительные по масштабам и мощности
сплошные или желваковые фосфориты. Отложения фосфоритов
могут быть и континентального происхождения. Они образуются в
результате выноса фосфора водными растворами из пород, содер-
жащих этот элемент, и отложения его в виде апатита. Экзогенные
фосфорные месторождения возникают также за счет крупных скоп-
лений остатков живых организмов и их экскрементов (в частности
гуано).
Месторождения: в СССР: а) апатитовые на Кольском п-ове;
б) фосфоритовые — Верхнекамское, Егорьевское (Московская обл.),
Каратауское (Казахская ССР), Подольское (УССР); за рубежом
наиболее известны апатитовые в Канаде, Швеции (Кирунаваара)
и фосфоритовые в Африке, Тунисе, Алжире, в США (в штатах Фло-
рида, Южная Каролина).
Практическое значение — апатит и фосфориты используются в
основном для получения удобрений (различных супер- и термофос-
фатов), частично в химической промышленности для производства
фосфорной кислоты и соединений фосфора, при производстве спи-
чек, в керамической — для изготовления «костного фосфора» и др.
УРАНОВЫЕ СЛЮДКИ. Под этим названием объединена груп-
па (около 20) минералов, напоминающих по внешнему виду слю-
211
ды. Урановые слюдки имеют сходные физические свойства, общее
происхождение. Не давая детальной характеристики каждого из
них, приведем общее описание наиболее распространенных ми-
нералов.
Химический состав. Все минералы этой группы являются вод-
ными фосфатами и ванадатами урана. По своей природе это двой-
ные соли двухвалентных металлов — Си, Са, иногда Mg, Fe, Ba, Pb,
одновалентного калия и шестивалентного урана. Последний обра-
зует комплексный катион [UO2]2+. Химический состав минералов
приведен в табл. 15.
ТАБЛИЦА 15
Химический состав урановых слюдок в %
Название минерала Формула минерала К80 CaO CuO UO8 р,о5 vto5 Н8О
Торбернит Отенит Карнотит Тюямунит Си (1)02)2 [РСМгХ Х12Н2О Са (UO2)2 [РО4]2-8Н2О К2 (UC>2)2 [VO4]2X х ЗН2О Са (UC2)2 [VO4]2X Х8Н2О 10,44 6,10 5,87 7,70 57,50 62,70 63,41 59,96 14,50 15,50 20,16 19,06 20,30 15,70 5,99 15,11
В качестве примесей присутствуют Ra, Ас, Ро.
Сингония отенита и торбернита тетрагональная, тюямунита —
ромбическая, карнотита — моноклинная.
Структура — минералы группы урановых слюдок имеют типич-
ную слоистую структуру. Слои состоят из двойных листов тетраэд-
ров [РО4] или [VO4], связанных между собой катионами урана в
шестерной координации (рис. 115). Между слоями находятся
катионы Са, Си, К и молекулы воды. Слабая связь между листами
обусловливает пластинчатый характер минералов и совершенную
спайность Уоановые слюлки встречаются в виде чешуек, тонких
пластинок, порошковатых масс и
Рис. 115. Схема структуры ура-
новых слюдок
налетов.
Физические свойства — единая
структура, близость химического со-
става минералов обусловливают,
помимо сходного габитуса и совер-
шенной спайности, низкую твердость
урановых слюдок, сильную радио-
активность. Физические свойства
минералов приведены в табл. 16.
Диагностические признаки —
минералы этой группы отличаются
по совершенной спайности, яркой
зеленой или желтой окраске, высо-
кой радиоактивности. Отличить же
212
минералы друг от друга макроскопически трудно и приходится
прибегать к помощи микроскопических исследований, спектраль-
ного и химического анализа.
Происхождение — образуются в зоне окисления урановых мес-
торождений в кислой среде, которая возникает за счет окисления
пирита или арсенопирита. При окислении сульфидов возникают
различные сульфаты, в том числе урана, меди, которые, взаимо-
действуя с фосфорной кислотой, дают вторичные минералы. На-
пример, образование торбернита может происходить по следую-
щей схеме:
CuSO4+ 2(UO2) [SOJ4- 2Са (НРО4)+ 13Н2О+ ЧА
-»Cu(UO2)2[PO4]r 12Н2О + 2Са [SO4]-2H2O
Торбернит Гипс у
Торбернит часто ассоциируется с гипсом. Спутниками урановых
слюдок являются урановая чернь, барит, лимонит, гипс и др.
ТАБЛИЦА 16
Физические свойства минералов группы урановых слюд
Название минерала Цвет Блеск Спайность Твер- дость Удельный вес Диагностические признаки
Тор- бернит Изум- рудно- зеленый Стеклян- ный, на плоско- стях спайно- сти перла- мутро- вый Весьма совер- шенная 2-2,5 3,2-3,6 Ярко-зеленый цвет. Точ- но определяется но оп- тическим свойствам
Отенит Зеленый, зелено- вато- желтый То же То же 2—2,5 3,1-3,2 От других урановых слюдок отличается на основании химических или спектральных ана- лизов
Карно- тит Канаре- ечно- желтый Мато- вый, на плоско- сти спайно- сти стек- лянный, перла- мутро- вый > 2-3,5 4,5-5,0 Похож на тюямунит, от- личается при помощи микроскопических ис- следований
Тюяму- нит То же То же > 1,0 3,3-3,4 Похож на карнотит, от- личается при помощи микроскопических ис- следований
213
Месторождения — Юта и Колорадо (США), Катанга (Конго),
Радиум-Хилл (Австралия) <
Практическое значение — сырье для получения урана, радия,
реже ванадия.
ГЛАВА 26
КЛАСС БОРАТОВ
Бор имеет большое значение в разных отраслях промышлен-
ности: атомной, металлургической, химической, керамической, сте-
кольной и др. В настоящее время насчитывается около 100 мине-
ралов бора, но из них только 10—12 имеют промышленное значе-
ние. Большее количество минералов бора (около 80) падает на
класс боратов, являющихся солями борных кислот. К ним относят*
ся ортоборная Н3ВО3, метаборная НВО2 и полиборные кислоты.
Главными катионами, входящими в состав боратов, являются Са,
Mg, Na, Fe, а также Мп, А1 и др. Значительная часть боратов со-
держит кристаллизационную воду.
В основе структур боратов лежат плоские радикалы [ВО3]3“ и
тетраэдры [ВО4]5~, а также сложные комплексные радикалы типа
[В2О4ОН], [В2ВОз(ОН)5] и др. Построение сложных радикалов про-
исходит путем соединения простых радикалов вершинами, в кото-
рых находятся атомы кислорода, являющиеся общими для соеди-
ненных радикалов, свободные же вершины заполняются ионами
гидроксила. В связи с этим в комплексных радикалах атомы бора
имеют различную координацию — тройную и четверную. Бораты
по своему строению являются аналогами силикатов. Радикалы,
соединяясь между собой подобно кремнекислородным тетраэдрам,
образуют островные, цепочечные, кольцевые структуры.
Чаще всего среди боратов встречаются цепочечные, реже ос-
тровные и совсем редко слоистые и каркасные структуры. Между
цепочками находятся каналы, в которые входит кристаллизацион-
ная вода.
Бораты кристаллизуются преимущественно в низших сингониях
и только отдельные представители имеют гексагональную, триго-
нальную и кубическую сингонии.
Данные о составе и свойствах главнейших боратов приведены
в табл. 17.
Большинство боратов белого цвета (исключение составляет
людвигит—минерал черного цвета), имеют небольшую твердость,
стеклянный блеск. Для многих из них характерно игольчатое, ра-
диально-лучистое, волокнистое строение. Часто они встречаются
также в виде землистых сплошных масс.
Происхождение обычно осадочное, однако некоторые бораты
возникают в эндогенных условиях и связаны со скарнами и гидро-
термальными жилами. Главные промышленные месторождения
боратов принадлежат к следующим генетическим типам:
214
Минерал Химическая формула Содержа- ние В2Оа (теорети- ческое) Синго- ния Структура
Ашарит Mg2[B2O4OH](OH) 40,40% Ром- бичес- кая Остров- . наяз,
Гидро- бора- цит CaMg[B2BO4(OH)3]X ХЗН2О 50,53% Моно- клин- ная Цепочеч- ная
Иниоит (иньо- ит) Са[В2ВОз(ОН)б] • 4Н2О 37,62% > Слоистая
Людви- гит (Mg,Fe2+)2Fe3+[BO3]O2 13,48— 17,83% Ром- бичес- кая Остров- ная
Улексит ЫаСа[ВзВ2О7(ОН)4]Х Х6Н2О 42,95% Три- клин- ная Цепочеч- ная
to
сл
ТАБЛИЦА 17
Облик кристаллов Спайность Блеск Цвет Удель- ный вес Твер- дость
Волокнистые или мик- роволокнистые аг- регаты — Шелко- вистый до туск- лого Белый, серый, желтова- тый 2,6— 2,7 4—4,5
Пластинчато - волок- нистый, радиальный и столбчатый Совер- шенная Стеклян- ный, шелко- вистый Бесцвет- ный, бе- лый 2,2 2—3
Короткопризметиче- ский до таблитча- того, также массив- ный, зернистый в виде сферолитовых агрегатов > Стеклян- ный Бесцвет- ный, бе- лый 1,9 2
Волокнистые, ради- ально-лучистые, ре- же призматические агрегаты Несовер- шенная Алмаз- ный, шелко- вистый Черный, сизо-чер- ный 3,6- 4,7 5
Округлые конкреции или волокнистые массы Совер- шенная в одном направ- лении Стеклян- ный, шелко- вистый, матовый Бесцвет- ный, бе- лый 2,0 2,5
а) контактово-метасоматическому. Месторождения этой фор-
мации приурочены к магнезиальным скарнам, образованным на
контактах доломитов, магнезитов и алюмосиликатных пород. Та-
ким путем образуется людвигитовое оруденение, часто ассоцииру-
ющееся с магнетитовыми рудами;
б) вулканогенно-осадочному. Бораты отлагаются в пресных или
соленых озерах, в которые поступают воды из действующих или
затухающих вулканов. Возможно отложение боратов в соленых
озерах, не связанных с вулканами, но расположенных среди по-
род, обогащенных бором. Этот тип месторождений является основ-
ным источником получения боратов;
в) осадочному (галогенному). Отложение боратов происходит
из морских вод в крупных солеродных бассейнах вместе с калий-
но-магнезиальными солями или гипсом и ангидритом. Месторожде-
ния этого типа встречаются в толщах галоидных солей, гипса и
ангидрита.
Месторождения Советского Союза — район оз. Индер; из зару-
бежных наиболее известны оз. Серлз, Иньо (США), Страссфурт-
ское (ГДР).
Бораты используются для получения бора, борной кислоты, бу-
ры и других соединений, применяемых в различных отраслях на-
родного хозяйства. В черной металлургии использование присадок
бора повышает глубину закалки сталей, позволяет заменять более
дефицитные легирующие добавки — молибден, хром, никель. При
производстве сплавов цветных металлов присадки бора повышают
их тугоплавкость и твердость. Такие сплавы применяются для из-
готовления особо прочных деталей реактивных двигателей, газо-
вых турбин, высокотвердых режущих инструментов. Давно извест-
но применение бора в химической промышленности для производ-
ства различных соединений бора.
ГЛАВА 27
КЛАСС СИЛИКАТОВ
Класс силикатов наиболее широко распространен в земной ко-
ре. По подсчету А. Е. Ферсмана, он составляет 75% от всех мине-
ральных видов и разновидностей. Большинство из них породооб-
разующие минералы, но вместе с тем некоторые являются рудами
(руды лития, бериллия, циркония, цезия и др.). Большую роль
силикаты играют в керамике, где они применяются в значительном
количестве. В последние годы возникла даже особая отрасль про-
мышленности— силикатная. Силикаты применяют также в строи-
тельном деле, в электротехнической промышленности (слюда, ас-
бест), во многих областях техники и используются как драгоцен-
ные и поделочные камни.
Основываясь на достижениях кристаллохимии, Шибольдом,
Л. Полингом, Ф. Махачкой, Г. Штрунцом и особеннно Н. В. Беловым
216
проведены большие работы в области изучения структур сили-
катов.
Все силикаты построены как бы из мельчайших кирпичиков —
кремнекислородных тетраэдров, которые по определенным законам
соединяются друг с другом. В центре такого тетраэдра помещает-
ся кремний, а в вершинах четыре иона кислорода. Кремнекисло-
родный тетраэдр имеет состав [SiO4]4- и соединяется с катионами.
В зависимости от сочленения кремнекислородных тетраэдров друг
с другом выделяются различные подклассы силикатов:
если тетраэдры располагаются в виде отдельных островков, со-
единенных между собой катионами, то возникает подкласс остров-
ных силикатов;
если кремнекислородные тетраэдры вытягиваются в бесконеч-
ные цепочки, соединенные катионами, возникает подкласс цепочеч-
ных силикатов;
в том случае, когда они располагаются слоями, образуя сет-
ки, — слоистые;
при образовании кремнекислородными тетраэдрами трехмерно-
го каркаса — подкласс каркасных силикатов.
Необходимо отметить, что во всех случаях кремнекислородные
тетраэдры могут сочленяться между собой только вершинами.
Физические свойства и внешний вид каждого подкласса тесно
связан с их внутренним строением. Так, например, для цепочечных
силикатов характерна вытянутая форма; для слоистых — появле-
ние пластинок, чешуек, а также весьма совершенная спайность;
для каркасных, благодаря образованию внутри структуры воздуш-
ных камер, небольшой удельный вес и т. д.
Подкласс силикатов с изолированными
тетраэдрами [SiO4] в кристаллических структурах
[островные силикаты)
В этом подклассе силикатов кремнекислородные тетраэдры рас-
полагаются в виде отдельных изолированных групп — «островков».
В зависимости от того, являются ли этими «островками» отдель-
ные тетраэдры [SiO4]4“, сдвоенные тетраэдры [Si2O7]6- или несколь-
ко тетраэдров (три, шесть), соединенные в кольца (рис. 116), в
пределах этого подкласса различают:
а) собственно островные силикаты с изолированными тетраэд-
рами [SiOJ4” (ортосиликаты);
б) силикаты со сдвоенными тетраэдрами [SigO?]6" (диортоси-
ликаты) ;
в) кольцевые силикаты.
Связь между отдельными кремнекислородными тетраэдрами
или их группами осуществляется посредством катионов. Для сили-
катов с изолированными тетраэдрами [SiO4]4*" такие катионы на-
ходятся в шестерной координации, ими обычно являются Mg, Fe,
Al; реже появляются катионы в восьмерной координации — Zr, Th,
8—3628 ?i7
Рис. 116. Типы связей кремнекислородных тетраэдров в силикатах островной структуры
в двух изображениях:
а —единичный тетраэдр; б—группа из двух тетраэдров;в, г, д — группы тетраэдров, связанных в кольца
Са. Для силикатов со сдвоенными тетраэдрами характерны катио-
ны, находящиеся в восьмерной координации — Са, TR, для кольце-
вых силикатов — Be, Al; бериллий окружен четырьмя кислородами,
а алюминий — шестью.
Необходимо указать, что алюминий в этих минералах никогда
не бывает в четверной координации и не замещает кремний, а иг-
рает роль типичного катиона, занимая место магния и железа.
Островные силикаты характеризуются весьма компактной кри-
сталлической структурой, следствием чего является повышенный
удельный вес (обычно более 2,8—2,9), высокие показатели прелом-
ления (более 1,6), большая твердость (чаще всего 6—7, реже 8).
Для минералов этого подкласса характерна изометрическая форма.
Силикаты с изолированными тетраэдрами [SiO4]4“ могут рас-
сматриваться как соли ортокремниевой кислоты H4SiO4, в связи с
чем их ранее и называли ортосиликатами. Особенностью этих ми-
нералов является то, что при воздействии на них кислот они раз-
лагаются с выделением студнеобразного кремнезема.
В силикатах с изолированными тетраэдрами основной строи-
тельной единицей, из которой построены минералы, являются оди-
ночные тетраэдры [SiO4]4~. К ним приспосабливаются катионы Mg,
Fe, Al, располагающиеся в октаэдрах, ребра которых соизмери-
мы по своим размерам с ребрами кремнекислородных тетраэдров.
В диортосиликатах такими основными единицами являются груп-
пы [Si2O7]6“, к которым приспосабливаются октаэдры, образован-
ные крупными катионами (Са, Na, TR) и кислородом (рис. 116, б).
При крупных катионах кремнекислородные постройки с группа-
ми [Si2O7]6~ становятся более рыхлыми, поэтому такие силикаты
бывают обычно более легкими и светлыми, поскольку все крупные
катионы не являются хромофорами.
Минералы этого подкласса могут быть без добавочных анио-
нов— оливин, гранат, циркон и с добавочными анионами О2“ —
сфен, дистен, или анионами F1- и ОН1- — топаз, эпидот, каламин;
кольцевые силикаты известны также без добавочных анионов —
берилл, или с анионами — турмалин.
ОЛИВИН — (Mg, Fe)2[SiO4] (название дано по оливково-зеле-
ному цвету минерала).
Химический состав: MgO — 45—50%, FeO — 8—12%, SiO2 —
около 40%. Оливин является промежуточным членом изоморфного
ряда — форстерит (Mg2[SiO4])—фаялит (Fe2[SiO4]). В качестве
примесей в минералах этого ряда характерны Мп, Ni, Со.
Сингония ромбическая.
Структура островная. Между кремнекислородными тетраэдра-
ми помещаются ионы магния или железа так, что каждый из них
находится в шестерном окружении ионов кислорода.
’ Оливин образует в основном зернистые массы. Кристаллы встре-
чаются редко и имеют короткостолбчатый облик.
Физические свойства — цвет желтый с зеленоватым оттенком,
оливково-зеленый, редко темно-зеленый, почти черный (железис-
тая разновидность); блеск стеклянный; излом раковистый; спай-
8* 219
ность несовершенная; твердость 6—7; удельный вес 3,3—4,3. Про-
зрачные желтовато-зеленые разности носят название хризолита и
являются драгоценным камнем.
Диагностические признаки — зеленовато-желтый цвет, стеклян-
ный блеск.
Происхождение магматическое. Типичный минерал ультраос-
новных пород, в которых он встречается вместе с пироксенами и
хромитом. Значительно реже находится в основных породах.
Месторождения: в СССР крупные массивы оливиновых и оли-
вино-пироксеновых пород распространены на Урале, в Закав-
казье, на Северном Кавказе, в Сибири и Туве; хризолит встречает-
ся на Урале, за рубежом — драгоценные разновидности оливина
(хризолита) известны в россыпях в АРЕ.
Практическое значение — разновидности, не содержащие желе-
за, могут служить огнеупором. Хризолит применяется как драго-
ценный камень.
ЦИРКОН — Zr[SiO4] ( название происходит от искаженных пер-
сидских слов «цар» — золотой и «гун» — цвет. Разновидности, со-
держащие уран и торий, называются соответственно циртолитами
и малаконами. Красные и красно-бурые прозрачные цирконы на-
зываются гиацинтами).
Химический состав: ZrO — 67,1%, SiO2 — 32,9%; примеси Hf
обычно до 4% (встречены разности до 22—24%), U, Th, TR, Fe, V,
Та, Nb.
Сингония тетрагональная.
Структура островная. Тетраэдры [SiOJ4- и катионы циркония
чередуются вдоль оси четвертого порядка. Катионы циркония на-
ходятся в окружении восьми ионов кислорода, принадлежащих
шести разным тетраэдрам (рис. 117, а).
Циркон почти всегда встречается в форме кристаллов. Как пра-
вило, они вытянуты вдоль оси четвертого порядка и имеют приз-
матический или длиннопризматический облик. Большинство крис-
таллов завершается тетрагональными пирамидами. Встречаются
также бипирамидальные кристаллы (рис. 117, б).
Физические свойства — цвет белый, серый, желтый, темно-крас-
ный, бурый, встречаются прозрачные бесцветные разности; блеск
алмазный; спайность отсутствует, излом неровный (для изменен-
ных разновидностей малакона, циртолита — раковистый); твер-
дость 7—8; удельный вес 4,6—4,7 (у малаконов и циртолитов сни-
жается до 3,8); циртолит и малакон метамиктны и слабо радиоак-
тивны.
Диагностические признаки — характерная форма кристаллов.
Происхождение: а) магматическое — циркон является харак-
терным минералом кислых и щелочных пород (гранитов, нефели-
новых сиенитов); б) пегматитовое — в пегматитах кислого, щелоч-
ного и субщелочного состава, в ассоциации с биотитом, монацитом,
ильменитом или нефелином, апатитом, биотитом, полевым шпатом,
пирохлором; в) пневматолито-гидротермальное в связи с явления-
ми альбитизации в щелочных и субщелочных породах, в которых
220
спутниками циркона яв-
ляются альбит, эгирин,
пирохлор или альбит, не-
фелин, титано-тантало-
ниобаты, кальцит.
Являясь химически
устойчивым минералом,
циркон при выветривании
образует россыпи — ос-
новной источник добычи
циркона.
Месторождения — за
рубежом наиболее из-
вестны цирконсодержа-
щие пегматиты в Южной
Норвегии, цирконовые
россыпи находятся в Бра-
зилии, на островах Цей-
лон и Мадагаскар.
Практическое значе-
ние — циркон является
сырьем для получения
циркония и практически
единственным источником
гафния.
Цирконий применяет-
ся в металлургии как ле-
гирующий элемент, повы-
шающий износоустойчи-
вость, жаропрочность и
коррозионную стойкость
сплавов. При производст-
Рис. 117. Структура (а) и кристаллы (б) цир-
кона
ве сталей он играет роль
раскислителя, освобож-
дая сплав от вредных при-
месей. Жаропрочность и кислотоустойчивость циркона позволяют
использовать его как огнеупор в различных установках, печах и фор-
мах для литья. Цирконий применяется в качестве защитной обо-
лочки в атомных реакторах. Добавки циркония используются для
изготовления специальных стекол и химической посуды; в некото-
рых приборах он заменяет платину.
Гафний используется в термоядерной технике в регулирующих
и защитных устройствах ядерных реакторов, благодаря большой
способности поглощать нейтроны. Карбид гафния обладает темпе-
ратурой плавления 4200° С и поэтому применяется как особый ту-
гоплавкий материал.
Группа ГРАНАТОВ (название происходит от плодов гранатово-
го дерева, которые похожи на кристаллы гранатов по форме, а
иногда и цвету).
221
Химический состав: общая формула минералов этой группы
Л3В2[5Ю4]з, где A = Mg, Fe2+, Мп, Са; В=А1, Fe3+, Сг. В зависимос-
ти от химического состава различают несколько разновидностей
гранатов (табл. 18).
ТАБЛИЦА 18
Химический состав гранатов
Минералы Химическая формула MgO FeO MnO CaO A1,O, FetO, Cr,O8 sio.
Пироп Mg3Al2 [SiO4]3 29,8 25,4 - 44,8
Альмандин Fe3Al2 [S 1О4]з — 43,3 — — 20,5 — — 36,2
Спессартин Mn3Al2 [ SiO4]3 — — 43,0 — 20,6 — — 36,4
Гроссуляр Са3А12 [SiO4]3 — — — 37,3 22,7 — — 40,0
Андрадит Ca3Fe2 [SiO4]3 — — — 33,0 — 31,5 — 36,5
Уваровит Ca3Cr2 [SiO4]3 — — 33,5 —- — 30,6 35,9
В природе каждый из этих минералов редко встречается в «чис-
том» виде, обычно они образуют друг с другом твердые растворы,
например, в составе альмандина постоянно присутствуют молеку-
лы пиропа, андрадита или гроссуляра. Из примесей, входящих в
состав гранатов, отмечаются К, Na, V, Zr, Be и др.
Сингония кубическая.
Структура островная, основу составляют кремнекислородные
тетраэдры и октаэдры — АЮ6, FeOe, СгОб, в последних трехвалент-
ные катионы Al, Fe3+, Сг имеют шестерную координацию. Тетраэд-
ры и октаэдры связаны общими вершинами в каркас, в промежут-
ках которого размещаются двухвалентные катионы Mg, Fe2+, Мп,
Са. Двухвалентные катионы находятся в восьмерной координации.
Гранаты встречаются обычно в кристаллах характерной ромбо-
додекаэдрической, пентагондодекаэдрической или тетрагонтриок-
таэдрической формах (рис. 118), реже образуют сплошные зернис-
тые массы.
Физические свойства—цвет различных гранатов значительно
варьирует — пироп — темно-красный, альмандин — красный, буро-
красный; спессартин — розовый, красный, оранжево-желтый; грос-
суляр — бледно-зеленый, оранжево-желтый, фисташковый, редко
розовый; андрадит — темно-желтый, бурый до черного; уваровит —
изумрудно-зеленый; гранаты просвечивают (прозрачная разновид-
ность гроссуляра зеленого цвета называется демантоидом); блеск
стеклянный, жирный; спайность отсутствует; излом неровный; твер-
дость 6,5—7,5; удельный вес 3,5—4,2.
Диагностические признаки — характерный облик кристаллов.
Диагностика разновидностей производится по химическому соста-
ву, удельному весу, иногда цвету.
Происхождение альмандина преимущественно метаморфичес-
кое, встречается в гнейсах, амфиболитах, в слюдяных и хлорито-
вых сланцах; для гроссуляра и андрадита наиболее характерно
222
Рис. 118. Формы кристаллов граната
контактово-метасоматическое происхождение, особенно часто эти
минералы встречаются в магнетитовых месторождениях скарново-
го типа, причем андрадит образуется чаще всего при замещении
известняков, а гроссуляр развивается по алюмо-силикатным поро-
дам. Типичными минералами-спутниками их являются кальцит,
диопсид, везувиан, эпидот, магнетит. Спессартин характерен для
пегматитов и встречается с полевым шпатом,.кварцем, слюдой, тур-
малином. Уваровит и пироп приурочены к ультраосновным магма-
тическим породам; первый ассоциируется с хромитом в ультраос-
новных породах, второй находится в измененных ультраосновных
породах вместе с ильменитом, хромдиопсидом, а также в кимбер-
литах, где является характерным спутником алмаза. Гранаты хи-
мически устойчивы и хорошо сохраняются в россыпях.
Месторождения: в СССР — альмандин в Карелии, на Ю. Ура-
ле; демантоид —ст. Полдневая, район Н. Тагила (Урал); пироп —
в кимберлитах Якутии; за рубежом пироп известен в россыпях в
Чехословакии, гранаты различных окрасок встречаются в россыпях
на Цейлоне и в Африке.
Практическое значение — равномерно окрашенные разности ис-
пользуются как драгоценный камень (особенно пироп и деманто-
ид); менее качественные гранаты — как абразивный материал
(шлифовальные круги, наждачная бумага) для полировки дере-
ва, кожи, резиновых, целлулоидных и других изделий.
СФЕН — CaTi[SiO4]O (от греческого слова «сфен» — клин, так
как кристаллы сфена часто имеют клиновидную форму), сино-
ним — титанит.
Химический состав: TiO2 — 40,8%, СаО —28,6%, SiO2— 30,6%;
примеси Fe, Mg, Мп, Zr, Nb, Та. Разновидность, содержащая до
12% (Y, Се)2О3, называется итротитанитом.
Сингония моноклинная.
Структура островная; изолированные кремнекислородные тет-
раэдры, соединены между собой катионами кальция и титана, ко-
торые образуют группы СаСЬ и TiOe, находясь соответственно в
семерной и шестерной координации. Один ион кислорода не свя-
зан с тетраэдрами [SiO4]4“ (рис. 119, а).
Сфен встречается, как правило, в виде кристаллов, имеющих
вид уплощенных конвертообразных призм; в разрезе они имеют
клиновидную форму (рис. 119, б).
223
Рис. 119. Структура (а) и формы кристаллов (б) сфена
Физические свойства — цвет чаще всего бурый, желтый, реже
темно-бурый до черного, зеленый; блеск шочти алмазный, перехо-
дящий в смолистый; спайность несовершенная; твердость 5—6;
удельный вес 3,4—3,5.
Диагностические признаки — характерная форма кристаллов
различных оттенков бурой окраски.
Происхождение: а) магматическое — в качестве акцессорного
минерала в изверженных породах различного состава в ассоциа-
ции с полевыми шпатами, нефелином, эгирином, цирконом, апати-
том; б) встречается в гранитных пегматитах совместно с полевыми
шпатами, цирконом, биотитом, ильменитом; в) контактово-метасо-
матическое— в скарнах в парагенезисе с диопсидом, гранатом, маг-
нетитом, эпидотом; г) метаморфическое в гнейсах и амфиболитах;
д) в зоне выветривания накапливается в россыпях.
Месторождения: в СССР — в Ильменских, Назямских и Ши-
шимских горах (Урал); за рубежом наиболее известны месторож-
дения Сен-Готтард, Бинненталь, Церматт (Швейцария), Пьемонт
(Италия).
Практическое значение — в настоящее время в промышленнос-
ти не используется; потенциальный источник получения титана.
ДИСТЕН — Al2[SiO4]O, синоним — кианит (первое название
происходит от двух греческих слов: «ди» — два, «стенос» — проч-
ность, и связано с различной твердостью минерала по двум направ-
лениям; второе название — кианит — от слова «килнос» — голубой,
из-за цвета минерала).
Химический состав: А12О3 —63,1%, SiO2 — 36,9%; примеси Fe,
Cr, Са, Mg, Ti.
Сингония триклинная.
224
Структура цепочечная. Тетраэдры [SiO4] и октаэдры [АЮб] сое-
динены в цепочки. В построении цепочек участвует только полови-
на атомов алюминия, остальные атомы соединяют цепочки и также
находятся в шестерной координации и только с ними связаны до-
полнительные ионы кислорода.
Дистен встречается в виде столбчатых кристаллов, вытянутых
по оси С (по направлению цепочек). Кристаллы сильно уплощены
и имеют доскообразный вид (рис. 120) .
Физические свойства — цвет голубой, синий, реже минерал бес-
цветный; блеск стеклянный до перламутрового; твердосгь парал-
лельно удлинению — 4,5, в поперечном направлении — 6; спайность
совершенная в одном направлении; удельный вес 3,5—3,7.
Диагностические признаки — голубой или синий цвет, различ-
ная твердость.
Происхождение метаморфическое. Возникает при процессах ме-
таморфизма глиноземистых пород в условиях высокого давления
и температуры — в кристаллических сланцах и гнейсах. Спутником
дистена являются мусковит, биотит, гранат, кварц, корунд. Будучи
химически устойчивым минералом, переходит в россыпи.
Месторождения: в СССР — Борисовское (Урал), Чайнит (Якут-
ская АССР), в Карелии; за рубежом — Лапса-Буру (Индия), Се-
верная Каролина (США).
Практическое значение — используется, главным образом, как
высококачественное огнеупорное сырье для керамических изделий.
ТОПАЗ — A12[SiO4](F, ОН)2 (название происходит от острова
Топазос в Красном море, где в древнее время добывался этот ми-
нерал).
Химический состав: А12О3 —55—57%, SiO2 —32—33%, Н2О —
0,2—2,7%, F— 13—20%; примеси редки — Ga, Ge, Мп, Fe, Mg.
Рис. 120. Кристаллы дистена
225
Рис. 121. Структура (а) и кристалл (б) топаза
Структура островная; тетраэдры [SiOJ соединены ионами алю-
миния, находящимися в шестерной координации. Атомы алюминия
окружены четырьмя ионами кислорода, принадлежащими тетраэд-
рам, и ионами ОН или F (рис. 121, а). Плотнейшая упаковка тет’
раэдров [SiO4] как бы перемежается с пластинами А1 — F(OH).
Между А1 и F(OH) существует слабая связь и по этим направлени-
ям проходит совершенная спайность.
Топаз образует призматические, иногда длиннопризматические
и бипирамидально-призматические кристаллы. Характерны также
короткостолбчатые кристаллы с хорошо развитыми гранями пина-
коида и дипирамиды (рис. 121, б). Некоторые индивиды достигают
больших размеров (весом до 40 кг) и отличаются богатством гра-
226
ней. Кроме того, встречаются мелкозернистые и радиально-лучис-
тые агрегаты.
Физические свойства — бесцветный, голубого, розового, желто-
го цвета, иногда окраска меняется в пределах одного кристалла;
часто совершенно прозрачный; блеск стеклянный, сильный; спай-
ность совершенная; излом раковистый; твердость 8; удельный вес
3,5—3,6.
Диагностические признаки — сильный стеклянный блеск, совер-
шенная спайность, очень высокая твердость, большой удельный вес.
Происхождение: а) пегматитовое — находится совместно с по-
левым шпатом, кварцем, бериллом, турмалином, флюоритом, ле-
пиодолитом; б) пневматолито-гидротермальное — в грейзенах с
вольфрамитом, мусковитом, циннвальдитом, лепидолитом, касси-
теритом, флюоритом.
Месторождения: в СССР — Ильменские горы, Мурзинка
(Урал), Борщевочный кряж, Шерлова гора (Забайкалье), Волынь
(УССР); за рубежом — в районе Минас-Жерайс (Бразилия) и
на о. Мадагаскар.
Практическое значение — прозрачные разности используются в
ювелирном деле как драгоценный камень, при значительной кон-
центрации топаз может служить сырьем для высококачественных
огнеупоров.
ЭПИДОТ — Са2(А1, Fe)3[Si2O7][SiO4]O(OH) ( название проис-
ходит от греческого слова «эпидозис» — приращение, так как в ос-
новании призм минерала одна сторона длиннее другой).
Химический состав весьма непостоянен в связи с широким изо-
морфизмом между трехвалентным железом и алюминием. Часто
присутствует и трехвалентный марганец. Теоретически химический
состав эпидота СаО — 23,5%, А12О3 — 24,1%, Fe2O3—12,6%,
SiO2 — 37,9%, Н2О—1,9%. Существенно алюминиевая разновид-
ность носит название клиноцоизита. В качестве примесей могут
присутствовать Fe2+, Mg, Ti, TR.
Сингония моноклинная.
Структура островная. Основу составляют колонки из алюминие-
вых октаэдров [АЮ6] и [А1О4(ОН)2]. Эти октаэдры имеют общие
ребра. Отдельные тетраэдры [SiO4] и двойные тетраэдрические груп-
пы [Si2O7] соединяют колонки. При этом тетраэдрические радикалы
и октаэдры алюминия имеют общие ионы кислорода. Внутри кар-
каса, образованного тетраэдрами и октаэдрами, располагаются
железо и часть атомов алюминия, имеющих шестерную координа-
цию, а также атомы кальция в восьмерной координации.
* Эпидот встречается в виде длиннопризматических и шестова-
тых кристаллов, вдоль удлинения которых проходит характерная
штриховка. Более часты лучистые или сплошные агрегаты.
Физические свойства — цвет фисташково-зеленый, темно-зеле-
ный, желтый, бурый; блеск стеклянный; спайность совершенная в
одном направлении; твердость 6,5; удельный вес 3,4—3,5.
Диагностические признаки — фисташково-зеленый цвет, приз-
матический облик кристаллов.
227
Рис. 122. Структура каламина
Происхождение: а) кон-
тактово-метасоматическое —
эпидот является характер-
ным минералом скарнов, в
которых он находится в па-
рагенезисе с кальцитом, маг-
нетитом, диопсидом, грана-
том; б) гидротермальное —
возникает за счет изменения
плагиоклазов, амфиболов,
гранатов и других кальций-
содержащих минералов.
Эпидотизация сопровожда-
ется позеленением пород. С
гидротермальным эпидотом
часто ассоциируется хлорит.
Месторождения: в СССР широко распространен в Ахматовской
копи, на Поляковском руднике (Урал); за рубежом наиболее из-
вестны хорошо образованные кристаллы в Арендале (Норвегия),
в Зальцбургских Альпах (Австрия).
Практическое значение — иногда используется как поделочный
камень.
КАЛАМИН — Zn4[Si2O7](OH)2-2H2O (название происходит от
латинского слова «каламус» — тростник, из-за образования этим
минералом сильно вытянутых сталактитов), синоним — галмей.
Химический состав: ZnO — 67,5%, SiC>2 — 25,0%, Н2О — 7,5%.
Сингония ромбическая.
Структура островная: сдвоенные кремнекислородные тетра-
эдры, связаны со спаренными группами Zn2(O, ОН)7. Ионы цинка,
как и кремния, имеют четверную координацию, но соединены с тре-
мя ионами кислорода тетраэдров [SiO4] и с одним ионом гидро-
ксильной группы. Каждая гидроксильная группа лежит между
двумя ионами цинка. В свободных полостях между группами
сдвоенных тетраэдров кремния и цинка располагаются молекулы
воды, имеющие слабые связи (рис. 122).
Каламин встречается чаще всего в агрегатах радиальнолучис-
того строения, в виде корок, почковидных и сталактитовых масс.
Реже образует мелкие таблитчатые кристаллы.
Физические свойства — бесцветный или окрашен примесями в
серый, желтый, светло-зеленый и голубой цвета; блеск стеклянный;
спайность совершенная в одном направлении; твердость 4—5;
удельный вес 3,4—3,5.
Диагностические признаки — в сплошных массах сходен со
смитсонитом, с которым он часто ассоциирует. Отличается от по-
следнего тем, что не растворяется в соляной кислоте.
Происхождение — типичный минерал зоны окисления свинцо-
во-цинковых сульфидных руд, где встречается вместе с церусситом,
смитсонитом, лимонитом.
228
Месторождения: в СССР встречается в некоторых полиметал-
лических месторождениях — Кличкинском, Тайнинском (Забай-
калье), Акджальском, Кызыл-Эспе (Казахстан); за рубежом бо-
гатые скопления каламина известны в месторождениях Олькуша
(Польша), Райбл и Блейберг (Восточные Альпы).
Практическое значение — руда на цинк.
БЕРИЛЛ — Be3Al2[Si60i8] (назван по содержащемуся в нем хи-
мическому элементу бериллию).
Химический состав: ВеО—14,1 %), А12О3—19%, SiO2 — 66,9%;
примеси Na, К, Li, Rb, Cs, Сг, Н2О. Разновидность, содержащая
около 3% Cs2O, называется воробьевитом, а Сг2О3 — изумрудом.
Сингония гексагональная.
Структура кольцевая; гексагональные кольца состоят из тетраэд-
ров [SiO]4, соединенных друг с другом таким образом, что каждые
смежные тетраэдры имеют по два общих иона кислорода. Каждые
отдельные кольца [SieOie] соединены тетраэдрами бериллия [BeOJ
и октаэдрами [А10б]. Структура подобна сотовой (рис. 123, а). В по-
лые трубки легко могут входить многие элементы, и поэтому бе-
риллы часто содержат Na, К, Rb, Cs, Li и воду.
Берилл встречается в виде характерных призматических, столб-
чатых кристаллов (рис. 123, б). Шестигранные призмы завершают-
ся обычно гранями пинакоида. Кристаллы берилла иногда достига-
ют значительных размеров (до нескольких метров в длину).
Физические свойства — цвет белый, голубой, зеленый, серовато-
белый, розовый; блеск стеклянный; спайность несовершенная; из-
лом раковистый; твердость 7,5—8; удельный вес 2,6—2,9. Прозрач-
ные бериллы являются драгоценным камнем и носят собственные
названия: цвета морской волны — аквамарин; ярко-зеленые —
изумруд.
Диагностические признаки — характерная форма кристаллов,
большая твердость.
Происхождение: а) пегматитовое — встречается в мусковитовых
и особенно редкометальных пегматитах, в последних спутниками
берилла являются сподумен, альбит, цветные турмалины, лепидо-
лит, танталониобаты, касситерит; б) пневматолито-гидротермаль-
ное— в грейзенах в ассоциациях с мусковитом, кварцем, топазом,
вольфрамитом; в) гидротермальное — в жилах с полевым шпатом,
слюдами, кварцем, вольфрамитом, флюоритом, молибденитом и др.
Месторождения: Блэк-Хиллс, Южная Дакота (США), Минас-
Жерайс (Бразилия); месторождения изумрудов в Музо (Колум-
бия), Бразилии, Южной Африке (Трансвааль).
Практическое значение. Если ранее бериллы использовались
только как драгоценные камни, то в настоящее время они являются
одним из основных источников получения металлического бериллия,
имеющего важное значение в современной промышленности. Берил-
лий применяется: а) в атомной технике как источник и замедлитель
нейтронов и конструкционный металл; б) для производства особо
прочных, жаростойких, коррозионноустойчивых легких сплавов с
медью, алюминием, никелем, применяемых в самолето- и ракето-
229
CD
Рис. 123. Структура (а) и кристаллы (б) берилла
строении; в) окись бериллия используется как жаростойкий мате-
риал с низкой электропроводностью, а также как химически инерт-
ный и высокоогнеупорный материал.
ТУРМАЛИН -Na(Mg, Fe)6[B3Al3Si6(O, ОН)30] (от сингалезско-
го слова «турмали» — так назывался минерал, впервые привезен-
ный с Цейлона в Европу).
Химический состав. Под названием турмалин объединена груп-
па минералов, в которой широко проявлен изоморфизм катионов.
Так, существенно железистый турмалин носит название шерл, маг-
230
незиальный — дравит. При замещении магния литием образуется
эльбаит. В составе наиболее широко распространенного турмали-
на — шерла, присутствуют: SiO2 — 34—35%, В2О3 — 8,5—11 %,
А120з — 28,5—34,5%, FeO—10—15%‘, Fe2O3 —0,2-5%, MgO —
1—5%, Na2O — 2—2,5%, Н2О — 2—4%, Помимо элементов Li, Са,
Fe2+, постоянно находящихся в небольшом количестве в минералах
этой группы или являющихся основными компонентами некоторых
разновидностей, в турмалинах могут присутствовать примеси К,
Мп, Fe3+, Сг, Ti, а также F и С1.
Сингония тригональная.
Структура кольцевая. В основе структуры турмалина лежат
сдвоенные кольца {SieOie], состоящие из кремнекислородных тетра-
эдров. Соединение тетраэдров в кольцо {SieOie] происходит подобно
соединению их в бериллах. В результате сдваивания колец [SieOie]
шесть ионов кислорода становятся общими и анионный радикал
приобретает состав [Sii203o]12-. Поскольку половина кремния в рас-
сматриваемых минералах замещается бором и алюминием, нахо-
дящихся, как и кремний, в четверной координации, радикал приоб-
ретает вид [BsAUSieCbo]18-. Двухслойные (сдвоенные) чгольца рас-
полагаются в вершинах ромбоэдрической элементарной ячейки и
соединяются между собой с помощью ионов магния, железа (Fe2+)
и алюминия, которые окружены шестью атомами кислорода, т. е.
имеют шестерную координацию. Сдвоенные кольца по вертикаль-
ной оси соединяются ионами Na(Ca), находящимися в восьмерной
координации (см. рис. 36). Таким образом, в структуре турмалина
находятся три группы элементов с различными координационными
числами, что обусловливает широкий диапазон возможных в нем
изоморфных замещений.
Турмалин встречается в виде кристаллов столбчатого облика
с вытянутыми гранями призмы вдоль оси третьего порядка. Неред-
ко кристаллы завершаются пирамидальными головками. Весьма
типичны сечения кристаллов, имеющие вид сферического треуголь-
ника. На гранях призмы развивается характерная продольная
штриховка. Турмалин часто образует радиально-лучистые сростки
(«турмалиновые солнца»).
Физические свойства — цвет в зависимости от химического со-
става бывает бурый (дравиты), красный, розовый (рубеллиты),
черный (шерлы), синий (индиголиты), зеленый (верделиты), часто
кристаллы турмалина имеют неоднородную зональную окраску (так
называемые полихромные турмалины); блеск стеклянный; спай-
ность отсутствует; излом неровный; твердость 7—7,5; удельный
вес 2,9—3,2.
Диагностические признаки — большая твердость, характерная
штриховка на гранях призмы, сечение в виде сферического тре-
угольника.
Происхождение — образуется при различных процессах минера-
лообразования, связанных с гранитами и их постмагматическими
производными. Наиболее часто он встречается: а) в пегматитах
различных типов — шерлы в ассоциации с мусковитом, апатитом,
231
кварцем; дравиты с альбитом, кварцем; рубеллиты с альбитом, спо-
думеном, лепидолитом, поллуцитом, тантало-ниобатами (в этой же
ассоциации встречаются и полихромные турмалины); б) в грейзе-
нах— дравиты, шерлы вместе с мусковитом, бериллом, флюоритом;
в) для гидротермальных жил и метасоматических пород типичны
шерлы, дравиты и другие разновидности. Ассоциации гидротер-
мальных турмалинов различны — кварц, касситерит, флюорит, слю-
ды, топаз, бериллиевые минералы. Часто турмалин развивается по
вмещающим породам в ореоле рудных жил и находится в сраста-
нии с биотитом, хлоритом, кварцем.
Месторождения: в СССР — на Урале, в Карелии, Украине, Вос-
точной Сибири; за рубежом наиболее известны на о. Мадагаскар,
Сан-Диего (Калифорния, США), россыпи на о. Цейлон.
Практическое значение — может использоваться как пьезоэлек-
трическое сырье и как драгоценный камень.
Подкласс силикатов с непрерывными цепочками
тетраэдров [SiO4] в кристаллических структурах
(цепочечные силикаты)
К этому подклассу силикатов относятся бесконечные постройки
кремнекислородных третраэдров, вытянутые в цепочки. На рис. 37, а
показана одинарная цепочка кремнекислородных тетраэдров, на
рис. 37, б — сдвоенная цепочка — лента.
Для определения формулы таких бесконечных кристаллических
построек необходимо выделить те элементы структуры, которые по-
вторяются в них бесконечное количество раз. Для одинарной це-
почки таким элементом структуры (структурной единицей) будут
два повернутых друг против друга кремнекислородных тетраэдра,
содержащих два иона кремния и пять ионов кислорода. Кроме то-
го, в состав такой структурной единицы входят и два иона кисло-
рода, которые делятся пополам с соседними единицами. Таким об-
разом, общее количество кремния и кислорода выразится формулой
[SisOe]4” которая и будет представлять собой анионный радикал
для всех минералов цепочечной структуры. Отношение Si : О в них
1 : 3.
В сдвоенных цепочках — лентах, повторяющаяся бесконечное
количество раз структурная единица состоит из двух целых и че-
тырех половинок ионов кремния и восьми целых и шести половинок
ионов кислорода (поскольку четыре тетраэдра имеют общие ионы
с соседними звеньями). Таким образом, общее количество ионов
кремния составит 2+ 4/2 = 4, а ионов кислорода 8 + 6/2=11; анион-
ный же радикал силикатов со сдвоенными цепочками кремнекисло-
родных тетраэдров будет [Si40n]6“. Отношение Si : О в данном слу-
чае 4:11 или 1 : 3,75.
Структуры с одинарными цепочками составляют группу пирок-
сенов, со сдвоенными цепочками — группу амфиболов. Катионами,
соединяющими цепочки, являются Fe2+, Са, Na, Fe3+, Al, Si. Для
232
группы амфиболов характерно наличие гидроксильной группы ОН.
Кроме того, в анионный радикал, помимо кремния, часто входит
и алюминий, находящийся здесь в четверной координации и заме-
щающий кремний. Связь, как у пироксенов, так и у амфиболов,
между ионами кислорода и кремния очень прочная.
Физические свойства и внешний вид минералов этого подкласса
связаны непосредственно с их внутренним строением. Почти все
они имеют вытянутую, часто даже игольчатую форму, большую
вязкость. В то же время твердость их меньше (обычно 5,5 по шкале
Мооса), а также меньше удельный вес по сравнению с минералами
предыдущего подкласса. Сапйность проходит по граням призмы.
Пироксены отличаются от амфиболов углом между плоскостями
спайности. У пироксенов этот угол равен 87°, а у амфиболов 124°.
Минералы этого подкласса являются, главным образом, породооб-
разующими и только литиевый пироксен — сподумен, имеет важное
промышленное значение, являясь литиевой рудой.
Группа ПИРОКСЕНОВ. Минералы этой группы подразделяют-
ся на две подгруппы — ромбические (энстатит, гиперстен) и моно-
клинные (диопсид, геденбергит, авгит, эгирин, сподумен и др.).
Ромбические пироксены—(Mg, Fe) 2[Si2O6], представляют собой
изоморфный ряд, в пределах которого характерно полное взаимное
замещение Mg и Fe. Наибольшим распространением пользуется
магнезиальная разновидность Mg^S^Oe] — энстатит, реже встре-
чается железистая (Fe, Mg)2[Si2O6] — гиперстен.
Моноклинные пироксены более сложны и разнообразны по со-
ставу катионов. В некоторых из них (диопсид, геденбергит) вместе
с Mg2+, Fe2+, изоморфно замещающими друг друга, присутствует
Са2+; в авгите, наряду с Mg2+, Fe2+, находится А13+, при этом в ра-
дикале [Si2O6] часть кремния замещается алюминием; катионы в
эгирине и сподумене представлены соответственно Na1+, Fe3* и
Li1+, Al3-**. Моноклинные пироксены встречаются в природе чаще,
чем ромбические.
ЭНСТАТИТ — Mg2[Si2O6] (от греческого слова «энстатес» — оп-
понент, в связи с тугоплавкостью минерала).
Химический состав: MgO — 40%, SiO2 — 60%; примеси Fe2+,
иногда Ni, Са, Мп, Al, Fe3+.
Сингония ромбическая.
Структура цепочечная. Одинарные цепочки кремнекислородных
тетраэдров [Si2O6] соединены друг с другом с помощью атомов маг-
ния, находящихся в шестерной координации.
Энстатит встречается обычно в виде зерен неправильной или
удлиненной формы. Редкие кристалы имеют призматический или
таблитчатый облик.
Физические свойства — энстатит бесцветный, иногда белый, се-
ровато-бурый или оливково-зеленый; блеск стеклянный; спайность
ясная в двух направлениях; твердость 5,5; удельный вес 3,1—3,3.
Диагностические признаки — от гиперстена отличается по цвету,
от других моноклинных пироксенов по оптическим свойствам.
Происхождение магматическое. Энстатит типичный породообра-
233
зующий минерал ультраосновных и основных пород — перидотитов,
пироксенитов, габбро-норитов; встречается и в эффузивных образо-
ваниях— базальтах, андезитах. Известен на Кольском п-ове, Ура-
ле, в Сибири.
ГИПЕРСТЕН (Fe, Mg)2[Si2O6] (от греческих слов «гипер» —
очень, и «стенос» — крепкий). ч
Химический состав. К гиперстену относят разности ромбических
пироксенов, содержащие свыше 14% железа. Состав их обычно сле-
дующий: FeO — 15—26%; MgO — 16—24%, SiO2 — 50—53%; при-
меси Мп, Са, Al, Fe3+.
Сингония ромбическая.
Структура аналогична структуре энстатита, отличие заключает-
ся в том, что часть ионов Mg2+ замещена Fe2+.
Гиперстен образует короткопризматические или таблитчатые
кристаллы, а также зерна неправильной формы.
Физические свойства — цвет темно-бурый, буровато-зеленый, до
буровато-черного; блеск стеклянный; спайность ясная в двух на-
правлениях; твердость 5,5—6; удельный вес 3,4—3,5.
Диагностические признаки — цвет, от моноклинных пироксенов
отличается по оптическим свойствам.
Происхождение: а) магматическое—в обогащенных железом
основных породах габбро-норитах, некоторых андезитах и др.;
б) метаморфическое — гиперстен — характерный минерал пироксен-
амфиболовых, биотит-амфиболовых и гранат-пироксеновых гней-
сов. Встречается на Урале, в Забайкалье и других районах Сибири.
ДИОПСИД — CaMg[Si2O6] (от латинских слов «ди» — два и
«опсис» — облик, чем подчеркивался различный габитус кристал-
лов).
Химический состав — является крайним магнезиальным членом
изоморфного ряда диопсид — геденбергит. В этом ряду имеет место
совершенный изоморфизм кальций-магнезиальных и кальций-желе-
зистых членов. Диопсид имеет состав: СаО — 25,9%, MgO— 18,5%,
SiO2 — 55,6%; примеси Fe2+, иногда Мп, Al, Fe3+, Сг, V, Ti.
Сингония моноклинная.
Структура цепочечная. Подобно энстатиту, основу структуры
диопсида составляют кремнекислородные цепочки, однако связь
между ними осуществляется катионами, которые находятся в раз-
ной координации. Атомы магния связаны с шестью кислородами, а
более крупные атомы кальция окружены восемью анионами кисло-
рода.
Диопсид встречается в виде зернистых агрегатов, а также обра-
зует короткостолбчатые кристаллы с преимущественным развитием
граней пинакоида (рис. 124).
Физические свойства — цвет грязно-зеленый, серый, иногда дио-
псид бесцветный; блеск стеклянный; спайность ясная в двух на-
правлениях; твердость 5,5—6; удельный вес 3,3—3,4.
Диагностические признаки — характерный облик кристаллов,
цвет. Точное определение производится при оптических исследова-
ниях.
234
Рис. 124. Кристаллы диопсида
Происхождение: а) магматическое —диопсид является породо-
образующим минералом основных и ультраосновных изверженных
и излившихся пород (перидотитов, пироксенитов, диоритов, габбро,
диабазов, базальтов); б) контактово-метасоматическое и метасома-
тическое — диопсид входит в состав скарнов, роговиков, карбонати-
тов вместе с кальцитом, флогопитом, гранатами, волластонитом,
тремолитом.
Широко известен во многих районах Урала, Забайкалья.
ГЕДЕНБЕРГИТ — CaFetSi2O6] (название дано в честь шведско-
го химика Л. Геденберга, впервые проанализировавшего этот ми-
нерал).
Химический состав: СаО — 22,2%, FeO — 29,4%, SiO2 — 48,4%;
разновидности, содержащие Мп (до 7%), называются мангангеден-
бергитом.
Сингония моноклинная.
Структура аналогична структуре диопсида, в которой место ато-
мов магния занимают атомы железа.
Кристаллы имеют вид коротких призм. Обычно геденбергит
встречается в виде шестоватых, лучистых, иногда волокнистых агре-
гатов.
Физические свойства — цвет от темно-зеленого до черно-зелено-
го; черта светло-серая с зеленоватым оттенком; блеск стеклянный;
спайность ясная в двух направлениях; твердость 5,5—6; удельный
вес 3,5—3,6.
Диагностические признаки — легко узнается по шестоватым аг-
регатам и цвету.
Происхождение — является характерным минералом контакто-
во-метасоматических скарновых месторождений. Находится в пара-
235
генезисе с магнетитом,
гранатом, пирротином,
халькопиритом, сфалери-
том, кальцитом, эпидотом.
Распространен на Ура-
ле, в Средней Азии, Си-
бири.
АВГИТ —Ca(Mg, Fe,
Al) [(SiAI)2O6] (от грече-
ского слова «авге» —
блеск, так как его крис-
таллы имеют характер-
ный блеск на плоскостях
спайности).
Химический состав непостоянен в связи с изоморфными замеще-
ниями, имеющими место в этом минерале: СаО— 17—20%, MgO —
10—18%, FeO — 4—14%, А12О3—1—6%, Fe2O3— 1-4%, SiO2-
47—53%. В качестве примесей характерны Ti, Na, Мп, Сг, Ni.
Сингония моноклинная.
Структура цепочечная, типа структуры диопсида, но с тем от-
личием, что часть ионов кремния в цепочках замещена ионами
алюминия. Авгит встречается в виде сплошных зернистых масс
и кристаллов короткостолбчатого или таблитчатого облика
(рис. 125). По сравнению с диопсидом у авгита хорошо развиты
грани призмы, а не пинакоида.
Физические свойства — цвет черный, зеленовато- и буровато-
черный, иногда темно-зеленый; блеск стеклянный; спайность ясная
в двух направлениях; твердость 5—6; удельный вес 3,2—3,6.
Диагностические признаки — форма кристаллов, цвет, спайность
в двух направлениях под углом 87°.
Происхождение магматическое; авгит — породообразующий ми-
нерал основных изверженных и излившихся пород (габбро, нори-
тов, базальтов, диабазов), реже он встречается в кристаллических
сланцах.
Известен на Урале, Кавказе, в Туве.
ЭГИРИН — NaFe[Si2O6] (минерал впервые был найден в Нор-
вегии и назван по имени скандинавского бога моря «Эгира»).
Химический состав: Na2O—13,4%, Fe2O3 —34,6%, SiO2 —52%;
примеси К, Са, Fe, Мп, Mg, Al, Ti, V.
Сингония моноклинная.
Структура аналогична структуре диопсида. Ионы натрия, подоб-
но кальцию в диопсиде, имеют восьмерную координацию, железа —
шестерную.
Встречается в виде шестоватых, лучистых или радиально-лучис-
тых агрегатов. Одиночные кристаллы имеют столбчатый или иголь-
чатый облик (рис. 126).
Физические свойства — цвет зеленый, темно-зеленый; черта
светло-зеленая; блеск стеклянный; спайность ясная в двух направ-
лениях; твердость 5,5—6; удельный вес 3,4—3,6.
236
Рис. 126. Кристаллы эгирина в нефелине
Диагностические признаки — характерный облик кристаллов,
цвет, ассоциация с нефелином, щелочными амфиболами.
Происхождение: а) магматическое — в составе щелочных пород
(нефелиновых сиенитов, фонолитов и др.). Крупные кристаллы эги-
рина встречаются в пегматитах нефелиновых сиенитов; б) метасо-
матическое— в альбититах, развивающихся по щелочным и субще-
лочным породам (нефелиновым сиенитам, сиенитам, гранитам) в
ассоциации с альбитом, биотитом.
Встречается на Кольском п-ове, в Сибири и др.
СПОДУМЕН — LiAl[Si2O6] (от греческого слова «сподиос» — пе-
пельный, из-за пепельно-серого цвета некоторых кристаллов споду-
мена).
Химический состав: LiO2 — до 8%, А120з — 27,5%, SiO2 — 64,5%;
примеси Na, Мп, реже Са, Mg, изредка Сг.
Сингония моноклинная.
Структура, как и у других пироксенов, цепочечная; литий и
алюминий, соединяющие цепочки, находятся, подобно катионам в
энстатите и гиперстене, в шестерной координации.
Сподумен встречается в виде пластинчатых, иногда очень круп-
ных (до 10 м) кристаллов, реже образуются тонкопризматические
и игольчатые агрегаты (рис. 127).
Физические свойства — цвет белый, светло-серый, желтый, ред-
ко розовый (кунцит), у измененных разностей зеленый различных
оттенков; блеск стеклянный до перламутрового; спайность совер-
237
Рис. 127. Пластинчатый кристалл сподумена
шенная; характерна штриховка; твердость 6,5—7 (у измененных
разностей снижается до 4—5); удельный вес 3,1—3,2.
Диагностические признаки. Цвет, форма кристаллов, ассоциация
с минералами пегматитов — кварцем, альбитом; от некоторых пи-
роксенов отличается с трудом (по меньшему удельному весу, опти-
ческим свойствам).
Происхождение пегматитовое. Сподумен — характерный породо-
образующий минерал редкометальных (натро-литиевых) пегмати-
тов, в которых он находится в ассоциации с кварцем, микроклином,
альбитом, мусковитом, бериллом, иногда лепидолитом, поллуцитом,
колумбит-танталитом.
Месторождения: в СССР — в Восточной Сибири, Ср. Азии; за
рубежом — Кийстон, Ю. Дакота, Бренчвилл (США), в Канаде, на
о. Мадагаскар.
Практическое значение — важнейшая руда на литий. Послед-
ний применяется: а) в атомной промышленности; б) в металлурги-
ческой промышленности для получения антифрикционных подшип-
никовых сплавов и др.; в) для производства высококачественных
керамических изделий.
Группа АМФИБОЛОВ. К этой группе относятся широко рас-
пространенные силикаты кальция, магния, железа и алюминия,
имеющие ленточную структуру.
Из большого числа амфиболов здесь рассмотрены наиболее
часто встречающиеся породообразующие минералы — тремолит,
актинолит, роговая обманка и арфведсонит.
В настоящее время амфиболы не находят практического приме-
нения и только плотная разновидность актиолита — нефрит ис-
пользуется в качестве поделочного камня.
ТРЕМОЛИТ—Ca2Mg5[Si4Oii]2(OH)2 (название дано по месту
открытия его — долине Тремоль в Альпах).
238
Химический состав: СаО—13,8%, MgO—24,6%, SiC>2—58,8%,
Н2О — 2,8%. В качестве изоморфной помеси, замещающей маг-
ний, присутствует железо, характерны также Na, Мп, А1.
Сингония моноклинная.
Структура ленточная, состоящая из двух цепочек. В строении
лент участвуют радикалы [Si4On]. Ленты соединяются атомами
магния и кальция, которые находятся в окружении шести ионов
кислорода и группы ОН. Ленточная структура обусловливает обра-
зование удлиненных длиннопризматических кристаллов, шестова-
тых, игольчатых и лучистых сростков.
Физические свойства — цвет белый, светло-серый, светло-зеле-
ный; блеск стеклянный; хрупок; спайность совершенная; твердость
5,5—6; удельный вес 2,9—3.
Диагностические признаки — форма кристаллов и сростков; от
сходного актинолита отличается по светлой окраске.
Происхождение: а) контактово-метасоматическое — в скарнах
на контакте известняков и силикатных пород вместе с диопсидом»
кальцитом, тальком; б) метаморфическое — в кристаллических
сланцах.
Тремолит известен во многих районах СССР — Слюдянка (оз.
Байкал), в Качкарском районе (Южный Урал); за рубежом — в
Альпах.
АКТИНОЛИТ — Ca2(Mg, Fe)5[Si4Oii]2(OH)2 (от греческих слов
<актис» — луч и «литое» — камень; связано с нахождением мине-
рала в виде лучистых сростков).
Химический состав: актинолит представляет собой железистую
разновидность тремолита: FeO — 6—15%, MgO — 11—20%,
СаО— 10—13%, SiO2 — 51—56%, Н2О — 1,8—2,5%; примеси К,
Na, Мп, Al, Fe3+, F.
Сингония моноклинная.
Структура — аналогична структуре тремолита, в которой часть
ионов магния замещена ионами железа. Кристаллы длиннопризма-
тические до игольчатых, очень характерны волокнистые и лучистые
агрегаты. Скрытокристаллические плотные и вязкие массы различ-
ных оттенков зеленого цвета называются нефритами; волокнистые
агрегаты, подобные асбесту — амфиболовым асбестом.
Физические свойства — цвет зеленый разных оттенков; блеск
стеклянный; спайность совершенная; хрупок; излом занозистый;
твердость 5,5—6; удельный вес 3,1—3,3.
Диагностические признаки — форма кристаллов и сростков;
цвет.
Происхождение: а) в основном метаморфическое, в тальковых
и хлоритовых сланцах; б) контактово-метасоматическое в ассо-
циации с эпидотом, магнетитом и сульфидами — халькопиритом,
молибденитом, пиритом и др.
Месторождения: в СССР амфиболовый асбест известен в Бело-
реченском и Калатинском месторождениях (Урал); нефрит встре-
чается по рекам Онон и Урик (В. Саяны) в Бурятской АССР; за
рубежом — в Западном Китае, Новой Зеландии.
239
Рис. 128. Формы кристаллов роговой обманки
Практическое значение — нефрит используется как поделочный
камень.
РОГОВАЯ ОБМАНКА — NaCa2(Mg, Fe2+)4(Fe3+ Al) X
X[(SiAl)4On]2(OH)2 (русское название происходит от немецкого
слова «горнбленд» — рог и маскировать, в связи со сходством ми-
нерала с рогом, от которого он отличается большей твердостью).
Химический состав. Роговая обманка — собирательное название
серии минеральных разновидностей. Состав непостоянен. Содержа-
ние главных компонентов варьирует в следующих пределах:
Na2O — от 0,5 до 12%, СаО — от 0,5 до 29%, MgO — от 0,5 до 36%,
FeO — от 2 до 4%, Fe2O3 — от 0,5 до 11%, А12О3— от 4,5 до 22%,
SiO2 — от 35 до 60%, Н2О — от 1 до 3%.
Сингония моноклинная.
Структура ленточная, подобна структуре тремолита. Отличие
заключается в том, что в кремнекислородных радикалах часть Si
замещена на А1.
Роговая обманка встречается в виде призматических, столбча*
тых, иногда изометрических кристаллов (рис. 128). Наблюдаются
также игольчатые и волокнистые агрегаты.
Физические свойства — цвет от светло-зеленого до темно-зеле-
ного, иногда от буро-зеленого до черного; блеск стеклянный, шел-
ковистый; черта зеленая различных оттенков; спайность по призме
совершенная под углом 124°; твердость 5,5—6; удельный вес
3,1—3,3.
Диагностические признаки — цвет, облик кристаллов, характер-
ный угол между плоскостями спайности.
Происхождение: а) магматическое — является породообразую-
щим минералом сиенитов, диоритов, гранодиоритов, иногда грани-
тов; б) метаморфическое — роговая обманка — типичный компо-
нент некоторых метаморфических пород — гнейсов, амфиболитов.
Широко распространена в районах развития метаморфических по-
род (Восточная Сибирь, Карелия и др.).
АРФВЕДСОНИТ—Na3(Mg, Fe2+)4(Fe3+ Al)[Si4On]2(OH)2 (на-
зван в честь шведского химика Арфведсона).
240
Химический состав непостоянен: Na2O— 7—13%, MgO — 0,5—
11%, FeO —6—35%, Fe2O3—1—17%, А12О3—1-5%, SiO2 -
46 — 54%, Н2О — 1—2%; примеси К, Са, Мп, Ti, F.
Сингония моноклинная.
Структура ленточная, подобна структуре тремолита. Встреча-
ется в виде столбчатых кристаллов и шестоватых или зернистых
агрегатов.
Физические свойства — цвет черный; черта голубовато-серая;
спайность совершенная в двух направлениях; твердость 5,5—6;
удельный вес 3,4—3,5.
Диагностические признаки — форма кристаллов, цвет, цвет чер-
ты, характерная для амфиболов спайность.
Происхождение: а) магматическое — породообразующий мине-
рал щелочных изверженных пород — нефелиновых сиенитов, в ко-
торых встречается с нефелином, содалитом, эвдиалитом; б) частич-
но образуется метасоматическим путем в связи с процессом альби-
тизации в щелочных породах.
Арфведсонит известен в массивах нефелиновых сиенитов на Ук-
раине, Кольском п-ове и других районах.
СИЛЛИМАНИТ — A1[A1S1O4]O (назван в честь американского
ученого Б. Силлимана).
Химический состав аналогичен дистену. Силлиманит является
более высокотемпературной полиморфной модификацией дистена.
Сингония ромбическая.
Структура цепочечная. Основу ее составляют тетраэдры [SiO4],
которые чередуются не с октаэдрами алюминия, как у дистена, а
с тетраэдрами [А1О4]. Параллельно этим цепочкам, соединяя их,
располагаются цепочки октаэдров [А10б], в которых алюминий на-
ходится в шестерной координации.
Типично цепочечный характер структуры обусловливает шесто-
ватый и игольчатый облик кристаллов. Характерны также волок-
нистые массы, называемые фибролитом.
Физические свойства — цвет серый, светло-бурый, бледно-зеле-
ный; блеск стеклянный; спайность совершенная в одном направле-
нии; твердость 6,5—7; удельный вес — 3,2.
Диагностические признаки — характерная волокнистая или
игольчатая форма кристаллов, высокая твердость.
Происхождение метаморфическое, образуется в условиях высо-
ких ступеней термального метаморфизма за счет высокоглинозе-
мистых пород. Встречается совместно с гранатом, иногда андалу-
зитом, биотитом, мусковитом.
Месторождения: в СССР — Кяхтинское в Бурятской АССР и в
других районах Восточной Сибири; за рубежом — Хази-Хилс, Пип-
ра (Индия) и др.
Практическое значение — силлиманитовые сланцы с высоким
содержанием силлиманита являются сырьем для керамического
производства, а также могут служить источником получения силу-
мина.
241
Подкласс силикатов
с непрерывными слоями
тетраэдров [SiO4]
в кристаллических структурах
(слоистые силикаты)
В этом подклассе кремнекислородные тетраэдры соединены
друг с другом в бесконечные слои, состоящие из шестичленных ко-
лец (рис. 129, а), в вершинах которых располагаются ионы крем-
ния, окруженные четырьмя ионами кислорода. Для установления
формулы радикала слоистых силикатов необходимо выделить
элементарное гексагональное кольцо, которое бесконечное количе-
ство раз повторяется в слое, и подсчитать, сколько приходится на
него ионов кремния и кислорода. Из рис. 129, а видно, что любой
тетраэдр выделенного кольца принадлежит еще двум соседним
шестичленным кольцам, так что ион кремния является одновремен-
но общим для трех колец — гексагонов. Следовательно, на одно
кольцо от каждго иона кремния приходится 1/3 часть; поскольку
же в кольце всего 6 ионов кремния, то состав такого кольца будет
6- (l/3)Si = 2Si. Ионы кислорода расположены в этом кольце по-
разному. Три иона кис-
Рис. 129. Плоская сетка из шестичленных ко-
лец, образованных тетраэдрами [SiO4], (а) и
разрез сдвоенного пакета, состоящего из двух
сеток, (б)
лорода, окружающие
ион кремния, находят-
ся в плоскости черте-
жа, а четвертый распо-
лагается над ионом
кремния (над плос-
костью чертежа). Ионы
кислорода, находящие-
ся над кремнием в вер-
шинах гексагона, при-
надлежат одновремен-
но трем кольцам — гек-
сагонам, и, следова-
тельно, от каждого из
них данному кольцу
принадлежит только
1/з часть. Те же ионы
кислорода, которые
располагаются на сто-
ронах гексагона, при-
надлежат одновремен-
но только двум коль-
цам, т. е. от них рас-
сматриваемому кольцу
принадлежит только
V2 часть. Таким обра-
зом, общее количество
ионов кислорода, при-
242
надлежащее одному кольцу — гексагону, составит: !/з • 6 + !/2 • 6 =
=5, а состав кольца будет отвечать формуле [Si2O5]2~.
Все слоистые силикаты состоят из двух сеток {Si20s]2“, соеди-
ненных вместе катионами в компактные пакеты состава [Si40io]4-.
Особенностью каждой сетки [Si20s]2“ является наличие нескомпен-
сированного электростатического заряда, обусловленного тем, что
с одной стороны сетки из кремнекислородных тетраэдров (рис.
129, б) имеют одну свободную валентность, что определяет появ-
ление только на одной стороне сетки тетраэдров отрицательного
заряда. В сдвоенных пакетах [Si4Oi0]4“ отрицательные заряды обе-
их сеток направлены внутрь пакета и скомпенсированы катионами
Mg и А1. Фактически в слоистых пакетах [Si4Oi0]4“ между двумя
сетками состава [Si20s]2” располагается либо бруситовый слой
Mg (ОН) 2, либо гидраргиллитовый А1(ОН)3 (табл. 19). При соеди-
нении слоев [Si2O5]2“+Mg(OH)2 + [Si2O5]2“ или Al(OH)3 + [Si2O5]2“
в плотные пакеты часть гидроксильных групп теряется, и состав
таких компактных слоистых пакетов определяется формулами:
[ s i4O10]4- + 3Mg (ОН)2=Mg3 [Si4O10] (ОН)2 + 4 (ОН)’-
[Si4O10l4"+ 2А1(ОН)з =Al2[Si4O10](OH)2 + 4(OH)1-
Из пакетов первого типа Mg3[Si4Oio](OH)2 состоит минерал тальк, из
пакетов вторго типа Al2[Si4Oio](OH)2 — пирофиллит. В этих минера-
лах отдельные пакеты связаны друг с другом только остаточными
(ван-дер-ваальсовскими) связями, поскольку в каждом пакете все
заряды скомпенсированы.
Специфическое строение слоистых силикатов — наличие пакетов,
состоящих из гексагональных сеток — слоев, связанных друг с дру-
гом очень слабыми связями, определяет и все свойства этих минера-
лов: очень низкую их твердость (у талька и пирофиллита — 1 по
шкале Мооса), весьма совершенную спайность и расщепляемость
на тонкие пластинки, гексагональную форму листочков, а также
свойства хороших диэлектриков, поскольку отдельные пакеты раз-
делены друг от друга воздушными прослоями; фактически сама
структура этих силикатов является естественным конденсатором.
В слоистых силикатах кремний в анионном радикале [Si40io]4-
может легко замещаться алюминием. Если заменить один ион крем-
ния на алюминий в тальке или пирофиллите, то появляется необхо-
димость в компенсировании электрических зарядов, что достигается
вхождением между слоистыми пакетами крупных одновалентных
катионов калия, реже натрия. При таком замещении из талька мож-
но легко вывести слюду — флогопит, а из пирофиллита муско-
вит (тальк — Mg3[Si4Oio](OH)2, флогопит — KMg3[AlSi3Oi0](OH)2,
биотит — К (Mg, Fe) 3[А1 Si3Oiо] (ОН) 2, пирофиллит — Ai4010] X
Х(ОН)2, мусковит—KAl2[AlSi3Oio](ОН)2. В мусковите алюминий
располагается в двух координациях: А12 находится в шестерной ко-
ординации и располагается на месте Mg3, алюминий же, находя-
щийся в анионном радикале, замещает кремний и находится в
четверной координации.
243
Вхождение крупных катионов калия между слоистыми пакетами
обусловливает изменение свойств слоистых силикатов. Так, у слюд
повышается твердость (до 2—2,5), возрастает гибкость листочков,
но сохраняются весьма совершенная спайность и диэлектрические
свойства. В этой связи слюды, не содержащие железа (мусковит и
флогопит), весьма широко применяются в электротехнической про-
мышленности.
При выветривании слюд калий, располагающийся между слоис-
тыми пакетами, может легко выщелачиваться, а на его место ста-
новятся молекулы воды. При нагревании таких выветрелых слюд
вода переходит в пар и разрывает отдельные пакеты. В этой связи
выветрелые флогопиты и биотиты переходят в гидратированные
разности— вермикулиты, которые отличаются особым свойством —
при нагревании они резко увеличивают свой объем и превращаются
в очень легкую пеноподобную массу, не пропускающую тепло и
звук.
Если в тальке или пирофиллите два иона кремния заместить дву-
мя ионами алюминия, то для компенсирования валентности необхо-
димо вместо калия между двумя пакетами помещать крупные по
размеру двухвалентные катионы кальция, при этом возникает груп-
па хрупких слюд, отличающаяся повышенной твердостью и хруп-
костью (тальк — Mg3[Si4Oio](OH)2, хлоритоид — CaMg3(Al2Si2Oi0]X
X (ОН)2, пирофиллит — AySi4Oio](OH)2, маргарит — СаА12Х
X(Al2Si2O10](OH)2).
Между пакетами [Si4Oio] (ОН) 2 могут помещаться также бруси-
товые Mg(OH)2 или гидраргиллитовые А1(ОН)3 слои. Если между
Схема строения различных групп слоистых силикат^
Группа талька
Тальк
- [м5!
Группа слюд
Флогопит
мд(он), — [Ms]
— [Sl20sj
мд(он)2 fSl2os]
- [Sv205]
ид(он)2 —
Пирофиллит
-----------“ LSl205 J
------------ — [Si205]
At(QH)3" » » rs.^
-------------lSi-2 Or J
А1(ЛН)3» " "
— [(ALSl)205]
M9(0H)2 — [(AISlJjOj]
K - [<AISi)205]
Мд(0Н)2 [-WlSv)2osj
•K
— [(ALSl)2 Oc J
Мусковит
-------------L(AL5l)20s]
А1(0Н)3» " — f(Al,sL).Qj
•K ,
-------------- [(A IS 1)2 O5 j
А1(0Н)3» ” . " [(ALSb}.05]
•K
--------------• ^(ALSL^Ogj
Al(0H)3 ™ ™ T [(AiSl);05]
244
пакетами талька помещаются бруситовые слои, то возникают мине-
ралы группы серпентина:
Mg3 [Si4O10] (ОН)2+3Mg (ОН)2 = Mg6 [ Si4O10] (ОН)8
Если же между пакетами прирофиллита располагаются гидраргил-
литовые слои, то образуются (минералы группы каолинита:
Al2 [Si4O10] (ОН)2 + 2А1 (ОН)3 = Al4 [Si4O10] (ОН)8
Наконец, если в структуре серпентина (антигорита) вместо слоев
брусита помещать слои гидраргиллита, то возникает сложная груп-
па хлоритов (см. табл.19).
Ниже рассматриваются характерные минералы слоистых сили-
катов. Некоторые группы этого подкласса, например группа слюд,
приведены почти полностью, поскольку слюды имеют важное прак-
тическое значение.
ТАЛЬК — Mg3[Si4Oio](OH)2 (название минерала имеет араб-
ское происхождение).
Химический состав: MgO — 31,7%, SiO2 —63,5%, Н2О —4,8%;
примеси Са, Fe, Al, иногда Ni до нескольких процентов.
Сингония моноклинная.
Структура слоистая, характеризуется тем, что между слоями —
пакетами кремнекислородных тетраэдров, помещается бруситовый
слой, который нейтрализует отрицательный заряд этих пакетов
(рис. 130). Связь между пакетами очень слабая, остаточная. Струк-
тура талька определяет специфические свойства минерала. В пер-
ТАБЛИЦА 19
Группа хрупких слюд
Группа '^серпентина
l руппа хлоритоЬ
Хлоритоид
[ (A LSl)2 О5 ]
l(AI,S(.)2O5]
[ (A LSl)205 J
[(ALSl)2O5J
[(ALSl)205 ]
;(ALSl)205 ]
Группа каолинита
Каолинит
• Са
Мд(0Н)2
• Са
Мд(0Н)2 ——
Мир'гЩ'ит
_ (A l,Sl)2 0$
AL(OH^ — '(ALSl)9O5
• Са
AUOHjy — l(AI,Sl)205
•Са
/ALSl)2O5
AL(OH^ м [(ALSl)2O5
AL(0H)3« в
AL(OH)3— _ _ _
А1(0Н)з~
АКОН)3» м "
LSl205]
LS L2 О5 >
lSl205]
245
• si >’g co О пн
Рис. 130. Структура талька
вую очередь его незначительную твердость (1—по шкале Мосса),
легкую расщепляемость, жирность, отсутствие упругости у лис-
точков.
Тальк почти никогда не встречается в виде кристаллов, он обра-
зует характерные листоватые, чешуйчатые агрегаты или плотные
массы.
Физические свойства — цвет светло-зеленый, иногда желтовато-
бурый, белый; блеск перламутровый; спайность весьма совершен-
ная; жирен на ощупь; твердость 1; удельный вес 2,7—2,8.
Диагностические признаки — низкая твердость (свободно чер-
тится ногтем), жирен на ощупь.
Происхождение: а) гидротермальное. Образование талька свя-
зано с гидротермальным изменением ультраосновных пород и мо-
жет происходить по следующей схеме:
4(Mg, Fe)2[SiO4] + H2O + 5CO2->Mg3[Si4O10](OH)2 F5(Mg, Fe)CO3
Оливин Тальк
б) контактово-метасоматическое — при действии гидротермальных
растворов, связанных с кислыми породами, на вмещающие их доло-
миты по реакции
3CaMg [СО3]24-4SiО2 Н2О Mg3 [Si4O10] (ОН)2 ± ЗСа [СО3] + ЗСО2
Доломит Тальк Кальцит
246
Месторождения: в СССР — Шбаровское, Миасское (Урал),
Онотское (В. Сибирь); за рубежом — в районах Ливорно, Пизы
(Италия), в Шгарии (Австрия), Мэдокском округе (Канада), в
штатах Сев. Каролина, Виргиния (США).
Практическое значение. Тальк используется: а) в керамической
промышленности — из талька (с добавкой каолина) изготовляют
высоковольтные изоляторы, радиодетали, керамику для нагрева-
тельных приборов и др.; б) в производстве огнеупоров — изделия
из естественного талько-магнезитового и талько-хлоритового камня
характеризуются огнеупорностью и химической стойкостью; в) в
бумажной промышленности тальк применяется в качестве наполни-
теля. Кроме того, тальк применяется в сельском хозяйстве для
удобрений в виде талько-магнезитовой муки, а также в парфюмер-
ной и кожевенной промышленности.
ПИРОФИЛЛИТ — Al2[Si4Oio](OH)2 (от греческих слов «пи-
рос»— огонь, «филлон» — лист, в связи с тем, что минерал расщеп-
ляется на листочки при сильном нагреве).
Химический состав: А12О3— 28,3%, SiO2— 66,7%, Н2О — 5,0%;
примеси Mg, Fe, Са, иногда Na и Ti.
Сингония моноклинная.
Структура слоистая, подобна структуре талька. Различие заклю-
чается в том, что между сетками [Si2O3] располагаются не брусито-
вые, а гидраргиллитовые слои.
Встречается в виде пластинчато-лучистых агрегатов. Часто об-
разует плотные скрыточешуйчатые массы.
Физические свойства — цвет белый, нередко имеет желтый или
зеленый оттенок; блеск стеклянный до перламутрового; спайность
весьма совершенная; жирный на ощупь; твердость I; удельный вес
2,7—2,9.
Диагностические признаки — низкая твердость^ жирен на ощупь,
от талька отличается по результатам химического анализа.
Происхождение гидротермальное — в результате изменения кис-
лых изверженных пород — гранитов и др. Распространен также в
богатых глиноземом метаморфических породах — дистен-мусковито-
вых, андалузитовых и других сланцах.
Месторождения: в СССР — Пышминское, Березовское, Миасское
(Урал): за рубежом — в Китае, штатах Арканзас, Северная Каро-
лина (США), Минас-Жирайс (Бразилия).
Практическое значение — при значительном скоплении может
использоваться в качестве огнеупорного материала, наполнителя (в
резиновой промышленности), изоляционного материала.
Группа СЛЮД. Общая формула минералов этой группы может
быть представлена в следующем виде:
/?’+(/?2+, /?3+)2-з [AlSi3Oi0](F, ОН)2
где 7?1+ = К, Na; /?2*=Mg, Fe2*, Li; 7?3+=Al, Fe3*.
Широко проявленное замещение в шестерной координации маг-
ния железом или литием и алюминием приводит к образованию ряда
разновидностей, из которых наиболее часто встречаются в природе
247
биотит, флогопит и лепидолит, а при появлении вместо магния алю-
миния — мусковит. Все они кристаллизуются в моноклинной синго-
нии. Структуры различных слюд близки. Например, для биотита и
флогопита они могут быть выведены из структуры талька (см.
табл. 19) при замещении в радикале одного иона кремения алюми-
нием. Слои кремнеалюмокислородных радикалов, как и у талька,
соединены бруситовым слоем. Связь между пакетами осуществляет-
ся одновалентным катионом — калием, и становится более прочной
по сравнению с тальком.
Структура мусковита (см. табл. 19) отличается тем, что вместо
бруситового слоя, связывающего кремнеалюмокислородные радика-
лы, так же, как у пирофиллита, находится гидраргиллитовый
слой.
Структуру, сходную со структурами этих минералов, имеет лепи-
долит.
Слоистый характер структуры минералов группы слюд, более
прочная связь между пакетами по сравнению с тальком и пирофил-
литом (она становится не только остаточной, а частично ионной),
обусловливает повышение их твердости до 2—3. Листочки приобре-
тают упругость, однако спайность сохраняется весьма совершенной.
ФЛОГОПИТ — KMg3[AlSi3Oio](F, ОН)2 (название происходит от
греческого слова «флогопос» — огнеподобный из-за красного оттен-
ка некоторых кристаллов).
Химический состав: КгО— 7—10%, Mg — 21—29%, А12О3— 10—
17%, SiO2 —39—45%, Н2О —0,5—5,5%, F до 6%; примеси Fe, Na,
Мп, Са, Ва, Сг.
Структура слоистая; флогопит образует таблитчатые и пластин-
чатые кристаллы, часто имеющие вид плоских шестигранников
(рис. 131). Иногда встречаются пирамидальные кристаллы. Харак-
терны также мелкие листочки и чешуйки.
Физические свойства — цвет желтовато-бурый до янтарного,
красновато-бурый, зеленовато-бурый, реже бесцветный с серебрис-
тым или зеленым оттенком; блеск стеклянный, на плоскостях спай-
ности перламутровый; тонкие листочки упруги; спайность совершен-
ная; твердость 2—3; удельный вес 2,7—2,85.
Диагностические признаки — от биотита отличается более свет-
лой окраской; темно-бурые, почти черные разности требуют для
определения применения точных методов диагностики.
Происхождение: а) контактово-метасоматическое — находится
в скарновых образованиях в ассоциации с кальцитом, апатитом,
диопсидом, скаполитом; б) метасоматическое — образуется в кар-
бонатитах при развитии процессов замещения вместе с кальцитом,
диопсидом, апатитом, иногда магнетитом и пирохлором.
Месторождения: в СССР — Слюдянское (район оз. Байкал),
Эмельджакское, Леглиерское (Якутская АССР), Ковдорское (Коль-
ский п-ов); за рубежом — в провинции Онтарио (Канада), Грен-
ландии, на о. Мадагаскар, в Индии.
Структура слоистая. Встречается в виде пластинчатых и таблит-
чатых кристаллов, часто образует тонкие листочки и чешуйки.
248
Рис. 131. Кристалл флогопита
Практическое значение — применяется в электропромышленно-
сти как диэлектрик.
БИОТИТ — K(Mg, Fe)3[AlSi3Oio](OH, F)2 (назван в честь фран-
цузского физика Ж. Био).
Химический состав — магнезиально-железистая слюда, от фло-
гопита отличается высоким содержанием железа: КгО—6—11%,
Mg — 0,5—28 %, FeO — 2,5—28 %, А12О3 — 3—32 %, SiO2 — 32—
45%, Н2О— 1—5%, F до 4,5%; в виде примеси постоянно присутст-
вует Fe2O3 — 0,2—20%, а также Ti, Na, иногда Li, Cs, Мп, Ba, Sr.
Физические свойства — цвет темно-бурый до черного, иногда
темно-зеленый; непрозрачен или слабо просвечивает; блеск стеклян-
ный до матового; спайность совершенная; твердость 2—3; удельный
вес 3—3,1.
Диагностические признаки — темный, почти черный цвет.
Происхождение: а) магматическое — биотит — характерный по-
родообразующий минерал гранитов, гранодиоритов, диоритов, сие-
нитов; б) пегматитовое — в жилах вместе с полевыми шпатами,
кварцем, мусковитом; в) метаморфическое — встречается в значи-
тельном количестве в различных сланцах и гнейсах.
Месторождения: в СССР — Ильменские горы (Урал), Борщовоч-
ный кряж (В. Сибирь); за рубежом — в Гренландии, Скандинавии
и др.
Практическое значение — изредка используется в качестве изо-
ляционных прокладок в бытовых приборах.
МУСКОВИТ— KAl2[AlSi3Oio](OH)2 (название происходит от
старинного итальянского названия города Москвы — Муска. Выво-
зимые из России на запад, через Москву, большие листы мусковита
называли «московским стеклом»).
9—3628
249
Химический состав — калий — алюминиевая слюда, характери-
зуется более постоянным, нежели биотит, составом: К2О— 11,8%,
А120з — 38,5%, SiO2 —45,2%, Н2О — 4,5%; примеси Na, Li, Rb, Са,
Mg, Fe, Ti, Сг, F.
Структура слоистая; встречается в виде таблитчатых или плас-
тинчатых кристаллов, достигающих иногда 0,5—1,5 nt. Часты таблит-
чатые индивиды с шестигранным или ромбовидным сечением. Ха-
рактерны также столбчато-пирамидальные кристаллы. Нередко
мусковит представлен агрегатами чешуек и листочков. Тонкочешуй-
чатая разновидность, образующая плотные массы с шелковистым
блеском, называется серицитом.
Физические свойства — бесцветен, прозрачен, но нередко окра-
шен в буроватые, зеленые и розовато-красные тона; блеск стеклян-
ный до серебристого, листочки гибки и упруги; спайность весьма
совершенная; твердость 2—3; удельный вес 2,7—2,8.
Диагностические признаки — светлая окраска, прозрачность,
весьма совершенная спайность.
Происхождение: а) пегматитовое — мусковит — характерный
минерал гранитных пегматитов. Скопления крупных кристаллов
мусковита находятся в так называемых слюдоносных пегматитах
в ассоциации с полевыми шпатами, кварцем, иногда биотитом, тур-
малином, апатитом; б) гидротермальное — мусковит встречается в
грейзенизированных гранитах, грейзенах и кварцевых жилах вместе
с кварцем, топазом, бериллом, касситеритом, вольфрамитом, колум-
бит-танталитом; в) метаморфическое — в различных сланцах, квар-
цитах и в других образованиях.
Месторождения: мусковит промышленного значения находится
только в пегматитах. В СССР — Мамские месторождения (В. Си-
бирь), Тэдино, Чупинское (Карелия), Енское (Кольский п-ов); за
рубежом — в штатах Бенгалия и Мадрас (Индия), Северная Каро-
лина, Мэриленд (США), в Бразилии,
Практическое значение—применяется как высококачественный
электроизоляционный материал в радиопромышленности, электрон-
ных приборах и авиационной промышленности.
ЛЕПИДОЛИТ — KLi1>5Al1)5[AlSi301o](F, ОН)2 ( название проис-
ходит от греческого слова «лепидос» — чешуйка, в связи с чешуй-
чатым обликом этого минерала.
Химический состав — лепидолит — литиевая слюда; состав ее —
К2О — 9—10%, Li2O — 3,7—6,0%, А12О3 — 22—29 %, SiO4 — 49—
53%, F — 5—8%, Н2О — 0,5—2,5%; постоянными примесями явля-
ются Rb2O — 1—4%, Cs2O — 0,2—2% (в связи с чем этот минерал
используется иногда как сырье на цезий и рубидий). Кроме того,
присутствуют Fe, Мп, Mg, Na.
Структура слоистая; встречается в виде мелких листочков, че-
шуек и скорлуповатых агрегатов, а также образует пластинчатые и
столбчатые кристаллы.
Физические свойства — цвет розовый, розовато-фиолетовый,
иногда белый; блеск стеклянный до серебристого; листочки гибки,
250
но не так упруги, как у мусковита; спайность весьма совершенная;
твердость 2—3; удельный вес 2,8—2,9.
Диагностические признаки — характерный цвет; неокрашенные
разности отличаются от мусковита по оптическим свойствам или с
помощью спектрального анализа по содержанию лития.
Происхождение: а) пегматитовое — лепидолит — характерный
минерал натро-литиевых пегматитов, где спутниками его являются
альбит, полихромные турмалины, поллуцит, иногда сподумен, тан-
талит; б) пневматолито-гидротермальное — в грейзенах в ассоциа-
ции с топазом, кварцем, бериллом, колумбит-танталитом, кассите-
ритом.
Месторождения: Бикита (Ю. Родезия), о. Утэ (Швеция), в шта-
те Мэн (США).
Практическое значение — используется как руда на литий, це-
зий, рубидий.
ВЕРМИКУЛИТ—(Mg, Fe2+, Fe3+)3[(Si, А1)4О10](ОН)24Н2О
(от латинского слова «вермикулос» — порождающий червей, из-за
способности минерала разбухать при нагревании с образованием
червеобразных агрегатов).
Химический состав непостоянен: MgO—18—27%, FeO — 0,5—
3%, Fe2O3 —3—11%, А120з— 11—18%, SiO2 —33—36%, Н2О —8—
19%; примеси Na, Са, Tiy Ni.
Сингония моноклинная.
Структура слоистая, подобна структуре флогопита и биотита,
трехслойные пакеты, состав которых (MgFe)3[(SiAl)4Oi0](OH)2, пе-
ремежаются с двумя мономолекулярными слоями воды.
Кристаллы вермикулита подобны кристаллам флогопита и био-
тита, за счет которых они образуются. Вермикулит иногда нахо-
дится в виде тонкодисперсных отложений среди глин.
Физические свойства — цвет желтовато-бурый, золотисто-жел-
тый, бронзовый, бурый, темно-бурый; блеск матово-стеклянный, час-
то жирный; спайность совершенная; упругость слабая; хрупкий; при
прокаливании вспучивается, увеличиваясь при этом в объеме в
15—20 раз, обожженные массы плавают на воде; твердость 1 —1,5;
удельный вес 2,4—2,7.
Диагностические признаки — вспучивание при прокаливании.
Происхождение гидротермальное — в результате изменения био-
тита и флогопита, а также экзогенное — при выветривании биотита.
Месторождения: В СССР — Ильменское, Булдымское (Урал), в
Побужье и на Волыни (УССР), Ковдор (Кольский п-ов); за рубе-
жом— Либби (Монтана, США), в Западной Австралии.
Практическое значение — применяется как термо- и звукоизоля-
ционный материал. Способность вермикулита насыщаться водой
позволяет использовать его для гидропонного выращивания овощей
в парниках.
СЕРПЕНТИН — Mg6[Si4Oio](OH)8 («серпенс» по-латыни — зме-
евидный, название происходит от сходства пятнистых серпентинсо-
держащих пород с кожей змеи; русское название пород, состоящих
из серпентина = змеевик) •
9* 251
Химический состав: MgO —43%, SiO2 —44%, Н2О—13%; при-
меси Fe24-, Fe3+, Ni, Ti.
Сингония моноклинная.
Структура слоистая. Она представляет (см. табл. 19) как бы
пакеты талька, между которыми помещаются бруситовые слои
Mg(OH)2.
Серпентин встречается в виде волокнистых и спутанно-волокни-
стых агрегатов, реже он образует опаловидные и листоватые агре-
гаты.
Физические свойства — цвет темно-зеленый, бутылочно-зеленый
до зеленовато-черного, иногда оливково-зеленый, в некоторых раз-
ностях (опаловидных) имеет синеватый оттенок; блеск стеклянный,
жирный до воскового; у пластинчатых разностей спайность совер-
шенная; листочки ломкие; твердость 2,5—3; удельный вес 2,5—2,7.
Диагностические признаки — зеленый цвет, волокнистые агрега-
ты, жирный блеск на изломе.
Происхождение гидротермальное — в результате изменения уль-
траосновных, главным образом, оливинсодержащих пород (дуни-
тов, перидотитов). Замещение может происходить по следующей
схеме:
3Mg2 [ S i О4] + 4Н2О + SiO2=Mg6.[Si4O10] (ОН)8
Оливин Серпентин
Месторождения: в СССР серпентинсодержащие породы широ-
ко распространены на Урале, в Закавказье (Армения), Сибири; за
рубежом — в Квебеке (Канада), в районе Трансвааля (Ю. Африка).
Практическое значение — массивные, красиво окрашенные раз-
ности используются в качестве облицовочного камня. Серпентини-
зированные дуниты применяются для изготовления огнеупоров.
ХРИЗОТИЛ-АСБЕСТ ( название хризотил происходит от грече-
ских слов «хризос» — золото и «тилос» — волокно, в связи с золотис-
тым цветом некоторых волокнистых агрегатов) является волокнис-
той разновидностью серпентина и имеет аналогичный химический
состав и структуру. Часто минерал называют асбестом. Встречается
хризотил-асбест в виде параллельно-волокнистых агрегатов
(рис. 132).
Физические свойства — цвет зеленовато-желтый, золотистый,
иногда белый или бурый, расщепленные волокна белые; блеск шел-
ковистый; спайность совершенная; твердость 2—3; удельный вес
2,5—2,6. Асбест характеризуется огнестойкостью, плохой проводи-
мостью звука, тепла и электричества.
Происхождение — как и серпентин, образуется в процессе гидро-
термального изменения ультраосновных пород (дунитов, перидоти-
тов).
Предполагают (В. П. Еремеев и др.), что образование хризотил-
асбеста связано с трещинами разрыва. В этих трещинах по мере
расхождения их стенок и образуется тонковолокнистая масса ас-
беста с расположением волокон по направлению растяжения.
252
Рис. 132. Трещинки в перидотите, выполненные асбестом
Месторождения: в СССР — Баженовское, Алапаевское (Урал),
Молодежное (Бурятия^, Актовракское (Тувинская АССР), Ильчир-
ское (Саяны); за рубежом — в Квебеке (Канада), на о. Кипр, в
Шабани (Ю. Родезия).
Практическое значение — применение асбеста как звуко-, тепло-
и электроизоляции весьма разнообразно. Из асбеста изготовляют
огнезащитные ткани и костюмы, тормозные автомобильные ленты,
электроизоляционные ленты, асбестоцементные кровельные и сте-
новые плиты, трубы для водопроводов, термоизоляционные мате-
риалы — асбестовая вата, теплоизоляционный шнур, асбестовый
гофрированный картон. Отходы от асбеста используются в качестве
удобрений.
Группа КАОЛИНИТА включает минералы — каолинит, диккит,
накрит, являющиеся полиморфными модификациями; близки к ним
водные минералы монтмориллонит, гарниерит и др. Все они явля-
ются минералами глин. Ниже рассматривается только каолинит,
монтмориллонит, хризоколла и гарниерит.
КАОЛИНИТ — A14[Si4Oio](OH)8 (название произошло от китай-
ского слова «кау-линг», означавшего «высокая гряда» — горный
район, где располагалось месторождение каолинита).
Химический состав: А12О3 — 39,5%, SiO2 — 46,5%, Н2О — 14%,
примеси Fe, Mg, Са, Na, К, Ва.
.253
Сингония моноклинная.
Структура слоистая (рис. 133),
сходная со структурой серпентина, от
которой отличается тем, что пакеты
талька связаны не бруситовыми, а
двумя гидраргиллитовыми слоями
А1(ОН)3. Каолинит встречается в мел-
ких чешуйках, рыхлых землистых мас-
сах, иногда находится в виде натечных
форм, состоящих из скрытокристалли-
СЮ ю OD ческих образований.
Физические свойства — цвет белый,
за счет примесей серый, желтый, бу-
Рис. 133. Строение слоя као- рый; блеск матовый; спайность весьма
линита совершенная; твердость 1; удельный
вес 2,6.
Диагностические признаки — белый цвет, в сухом виде легко
растирается между пальцами, жадно поглощает воду, во влажном
состоянии очень пластичен.
Происхождение экзогенное — образуется в основном при процес-
сах выветривания различных горных пород, содержащих алюмоси-
ликаты (полевой шпат, слюды, нефелин). Под влиянием растворов,
содержащих СО2, каолинит может возникать по следующей
реакции:
4КIA1S13O8] + 4Н2О + 2СО2= Al4 [Si4O10] (ОН)8 4- 8SiO2 + 2К2СО3
Микроклин Каолинит
Возможно переотложение первичных образований каолинита
водными потоками с концентрацией их в виде вторичных пластов
на дне водных бассейнов. Переотложенные месторождения встре-
чаются даже чаще первичных. Высказывается предположение о
происхождении каолинита благодаря действию гумусовых кислот
на алюмосиликаты. Основывается оно на том, что каолиновые за-
лежи очень часто встречаются вместе с торфяными месторожде-
ниями бурых углей.
Месторождения: в СССР — Просянское, Часов-Ярское (УССР),
Кирьинское, Троицко-Байновское (Урал); за рубежом наиболее
крупные месторождения в Корнуэлле и Девоншире (Англия), вбли-
зи Карловых Вар (ЧССР), в Баварии и Саксонии (ФРГ), Лиможе
(Франция), Kay-Линг (Китай).
Практическое значение — применяется в керамической промы-
шленности при производстве фарфора и фаянса, в бумажной про-
мышленности как наполнитель для придания бумаге гладкой по-
верхности и большей плотности, а также используется при произ-
водстве клеенки, линолеума, красок и получения окиси алюминия.
МОНТМОРИЛЛОНИТ — nAl2[Si4O10](OH)2.m(Mg, Fe)3 X
X(Si4O10](OH)2 pH2O ( название дано по месту нахождения ми-
нерала в Монтмориллоне во Франции).
Химический состав (устанавливается с большим трудом из-за
254
нахождения минерала в составе
глин вместе с другими минеральны-
ми компонентами): MgO — 3—31%;
AI2O3 — 1—28%, SiO2 —34—59%;
Н2О — 4—14,5%; в качестве приме-
сей наиболее часты Fe2O3— иногда
до 29%, Са, Na, К, Ti.
Сингония моноклинная или ром-
бическая.
Структура слоистая; может быть
представлена как производная от
структуры пирофиллита (рис. 134) —
между пакетами пирофиллита
Al2[Si40io](OH)2 располагаются об-
менные катионы Mg, Fe, Al, Са и
молекулы воды.
Монтмориллонит встречается в
виде тонкодисперсных, скрытокрис-
таллических плотных или землистых
агрегатов, реже он образует че-
шуйки.
Физические свойства — цвет бе-
лый, за счет примесей серый, бурый,
красноватый, зеленый; блеск мато-
вый, часто восковой; излом плот-
Рис. 134. Структура монтморилло-
ных разновидностей восковой; силь- нита
но набухает от влаги; твердость 1 —
2; удельный вес 2,2—2,9.
Диагностические признаки — сильное набухание от влаги, при-
липает к языку. Точная диагностика боз детальных исследований
(электронномикроскопических и др.) невозможна.
Происхождение экзогенное — образуется в щелочной среде при
выветривании эффузивных пород (вулканических пеплов), а так-
же основных изверженных пород (диабазов, базальтов, габбро).
Месторождения: в СССР — вблизи Кутаиси, в селах Гумбри и
Аскони (Грузия), около г. Нальчика (Сев. Кавказ), Черкасское
(УССР), Горбское (Закарпатье); за рубежом — в штатах Флори-
да, Джорджия (США), в Монтмориллоне (Франция), в Японии.
Практическое значение — монтмориллонит и другие глины по-
добного типа (бентониты) находят широкое применение в про-
мышленности благодаря высокой способности поглощать жидко-
сти и другие вещества. В частности, монтмориллонитовые глины
используются для очистки нефтепродуктов, воды и пищевых про-
дуктов, а также для очистки тканей от жиров и масел после кра-
шения. Как наполнитель, эти глины применяются в резиновой,
мыловаренной и парфюмерной промышленности.
ХРИЗОКОЛЛА — CuSiO3 • пН2О (от греческих слов «хри-
зос» — золото, «колла» — клей, в связи с применением его в древ-
ности вместе с бурой для пайки золотых изделий).
255
Химический состав непостоянен, помимо основных компонен-
тов, часто содержит Al, Р2О5.
Структура точно не выявлена, возможно, что она близка к
структуре монтмориллонита. Минерал встречается в виде коллоид-
ных скрытокристаллических образований, корочек, примазок и на-
течных землистых масс.
Физические свойства — цвет голубой, зеленовато-голубой или
синий, бурый (от примесей гидроокислов железа); черта зелено-
вато-белая; блеск стеклянный или восковой, матовый; хрупкий,
излом неровный; твердость 2—3; удельный вес 2—2,3.
Диагностические признаки — голубовато зеленый цвет, колло-
морфные образования, небольшая твердость.
Происхождение — образуется в зоне окисления медных место-
рождений. Часты псевдоморфозы хризоколлы по малахиту, азу-
риту.
Месторождения: в СССР хризоколла встречается на Турьинских
рудниках (Урал), в Джезказгане (Казахстан); за рубежом — в
медных месторождениях Чили, Конго.
Практическое значение — самостоятельно почти не использу-
ется, вместе с другими медьсодержащими минералами может
идти в плавку.
ГАРНИЕРИТ—(Ni, Mg)4[Si4O10](OH)44H2O (названпо фами-
лии французского геолога Гарнье).
Химический состав очень непостоянен: NiO от 15 до 45%, MgO
до 15%; примеси Fe, Мп, Са, Сг.
Сингония неизвестна. Встречается в виде скрытокристалличес-
ких сплошных или натечных масс.
Физические свойства — цвет ярко-зеленый различных оттенков;
блеск матовый, иногда жирный; спайность отсутствует; хрупок;
твердость 2—2,5; удельный вес 2,3—2,8.
Диагностические признаки — характерный цвет, низкая твер-
дость — полируется ногтем.
Происхождение — образуется при процессах выветривания
ультраосновных пород (за счет оливина, серпентина), ассоцииру-
ется с магнезитом, опалом, лимонитом и др.
Месторождения: в СССР — Уфалейское, Петровское, Халилов-
ское, Ново-Черемшанское (Урал); за рубежом — в Новой Каледо-
нии, Орегоне (США), Силезии (Польша) и др.
Практическое значение — руда на никель.
Подкласс силикатов с непрерывными
трехмерными каркасами из тетраэдров [SiO4]
или [(Si, Д1)О4] в кристаллических структурах
(каркасные силикаты)
При соединении всех кремнекислородных тетраэдров вершина-
ми друг с другом возникает непрерывный трехмерный каркас
(рис. 135). Такова, например, структура кварца, состав которого
может быть изображен в виде [SiSiO4] или [SiO2]m. ,
256
Особенностью каркасных си-
ликатов является то, что наряду
с кремнекислородными тетраэдра-
ми, в них принимают участие и
алюмокислородные тетраэдры,
т. е. в некоторых кремнекислород-
ных тетраэдрах, образующих не-
прерывную вязь, место кремния
занимает алюминий. Сочленение
тетраэдров [SiO4] и [А1О4] проис-
ходит таким же образом, как и в
структуре кварца, т. е. каждая
вершина любого тетраэдра яв-
ляется общей для соседнего тет-
раэдра. Формула такого кремне-
алюмокислородного каркаса мо-
жет быть изображена в следую-
щем виде:
[AlpSUpO2X“
•si Оо
Рис. 135. Каркас из кремнекислород-
ных тетраэдров
Обязательное условие, которому должны удовлетворять все кар-
касные силикаты, состоит в том, что сумма всех ионов алюминия
и кремния всегда должна быть в два раза меньше, чем число ионов
кислорода, т. е. должно соблюдаться условие
(Alp+Sin-p): О2л=1:2
Необходимо указать, что в каркасных силикатах алюминий мо-
жет замещать не больше половины всех ионов кремния, т. е. долж-
но удовлетворяться и второе условие
Весь алюминий в каркасных силикатах располагается на месте
кремния и находится в четверной координации. Таким образом,
каркасные силикаты всегда являются алюмосиликатами. Посколь-
ку замещение кремния алюминием в каркасе [SiO2]m приводит к
появлению отрицательного заряда, то полости, возникающие в
бесконечной вязи тетраэдров [AlpSin_pO2n]?“, заполняются круп-
ными катионами Na1+, К1+, Са2+, Ва2+, Cs1+, которые компенсиру-
ют появившийся у каркаса отрицательный заряд.
Рассмотрим, какие могут возникать каркасные силикаты, если
замещать различное число ионов кремния алюминием.
В самой структуре кварца [SiO2]m при ли=1 алюминий не мо-
жет замещать кремний в сколько-нибудь существенных количест-
вах. Но уже при ли = 2, (SiO2]2=[Si2O4] один ион кремния может за-
меститься алюминием с образованием анионного радикала
[AlSiO4]1—. Поскольку при этом возникает один отрицательный за-
257
ряд, то он может погаситься только ионом Na или К. Соответствен-
но с этим образуется группа нефелина:
Na [AIS1O4].................нефелин
К [AlSiO4]...............калиофилит
Поскольку размер иона натрия существенно меньше иона ка-
лия, то в свободные полости нефелина могут легко входить моле-
кулы СаСОз, NaCl, Na2S и Na2SO4 (группа внедрения), при этом
возникают минералы, образующиеся обычно при изменении нефе-
лина:
Na [AlSiO4]nNaCi.....................................содалит
Na [AlSiO4]-n (CaSO4, Na2S, NaCl)....................лазурит
Если принять /п = 3, формула каркаса будет иметь вид [SisOe],
но поскольку алюминий здесь также может замещать ион кремния,
то алюмокремнекислородный каркас будет иметь состав
[AlSi2O6p-.
При вхождении в полости каркаса Na, К или Cs возникают ми-
нералы группы лейцита:
К [A1S12O6]......................................лейцит
Cs [AISi2O8]...................................поллуцит
Na [А1812Об] иН2О..............................анальцим
Как видно в данном случае, в натриевом аналоге лейцита по-
являются группы внедрения — молекулы воды.
При т=4 формула каркаса—[Si4O8]. В этом случае алюминий
может замещать один или два иона кремния. В первом случае
возникает группа калиевых и натриевых полевых шпатов, характе-
ризующихся наличием анионного радикала [AlSi3O8]1-:
К [AISi3O8] . . . ортоклаз (моноклинной сингонии)
и микроклин (триклинной синго-
нии)
Na [AISi3O8] . . . альбит
При внедрении в каркас альбита молекул NaCl возникает нат-
риевый член группы скаполита — мариалит:
Na [AlSi3O8]-nNaCl
При замещении в каркасе состава [Si4Oe] двух ионов кремния
двумя ионами алюминия возникает радикал [Al2Si2O8]2~ и в по-
лости решетки должен входить двухвалентный катион большого
размера, которым является кальций:
Са [А128120з].........анортит
Поскольку между Na[AlSi3O8] и Ca[Al2Si2O8] существует непре-
рывный ряд, то возникают минералы, содержащие переменное ко-
личество Na[AlSi3O8] и Ca[Al2Si2O8], называемые плагиоклазами.
Аналогично плагиоклазам существует и ряд между
Na[AlSi3O8] • nNaCl и Ca[Al2Si2O8] • пСаСО3, называемый скаполи-
тами.
258
При m = 5 кремнекислородный каркас имеет состав [SisOio]. За-
мещая в нем один или два иона кремния на алюминий, можно вы-
вести два типа анионных радикалов:
[AlSi4O10]’- и [Al2Si3O10]2".
При вхождении в полости этих силикатов Na и Са возникают
многочисленные минералы, характеризующиеся постоянным на-
личием в полостях каркаса переменного количества цеолитной
воды, в связи с чем они получили название цеолитов. Наиболее
характерными минералами группы цеолитов являются:
Na2 [Al2Si3Oin]-2H2O........................натролит
Са [ А1281з01о]-ЗН20........................сколецит
При т = 6, т. е. [SieOi2]» могут возникать минералы с анионными
радикалами [AlSisO^]1”, [Al2Si40i2]2- или [Al3Si30i2]3“-
К таким минералам следует, отнести цеолит — филлипсит
(K2Ca)[Al2Si40i2] • 4Н2О и др.
При т = 8, т. е. [SieOie] теоретически возможно появление мно-
гочисленных цеолитов с анионными радикалами [AlSiyOie]1”,
[А1281бО1б]2—, [AlsSisOie]3-- К ним относится, например, цеолит-дес-
мин
(Na2Ca)[Al2Si6O16]-6H2O
Поскольку в состав каркасных силикатов входят только Na, К,
Са, Cs, Al, Si — ионы, не являющиеся хромофорами, то все они
характеризуются светлой окраской. Наличие рыхлого каркаса обу-
словливает их низкий удельный вес (обычно менее 2,7) и низкие
показатели преломления.
НЕФЕЛИН — KNa3[AlSiO4]4 (название происходит от греческо-
го слова «нефелос» — облако; при разложении нефелина в кисло-
тах выпадает облаковидный и студенообразный кремнезем).
Химический состав: Na2O— 12—17%, А12О3 — 31—34,6%, SiO2 —
40,2—46,4%; постоянно присутствует примесь КгО— 3—11%, иног-
да Са, Mg, Ga, Be, Cl, F, H2O.
Сингония гексагональная.
Структура каркасная. Ионы натрия и калия располагаются в
пустотах каркаса, состоящего из алюмокремнекислородных тетра-
эдров (рис. 136).
Большей частью нефелин встречается ввиде сплошных масс или
зернистых агрегатов, очень редко в виде призматических, коротко-
столбчатых или таблитчатых кристаллов.
Физические свойства — цвет мясо-красный, зеленый, светло-се-
рый; блеск жирный; спайность отсутствует; твердость 5—6; удель-
ный вес 2,6.
Диагностические признаки — жирный блеск, отсутствие спай-
ности.
Происхождение: а) магматическое — является основным поро-
дообразующим минералом щелочных пород (нефелиновых сиени-
259
Рис. 136. Структура нефелина
тов, фонолитов). Типичные спутники нефелина — эгирин, щелочные
полевые шпаты, щелочная роговая обманка, апатит, сфен и др.;
б) пегматитовое — в щелочных пегматитах вместе с цирконом, эв-
диалитом, сфеном, ильменитом; в) метасоматическое — при заме-
щении ультраосновных щелочных пород, гранитов, гнейсов, иногда
известняков (процесс нефелинизации).
Месторождения: в СССР — Ильменские горы (Урал), Горяче-
ключинское, Кияшалтырское (Кузнецкий Алатау), Батагольское
(В. Сибирь), Хибинское (Кольский п-ов, где апатит-нефелиновые
породы являются рудами на фосфор и алюминий).
Практическое значение — при высоком содержании нефелина в
породе — руда на алюминий; используется также для получения си-
ликагеля адсорбента, применяемого в нефтеобрабатывающем, кок-
сохимическом и металлургическом производствах, в керамической
промышленности вместо полевого шпата и др.
ЛАЗУРИТ—Na[AlSiO4] • n(CaSO4, Na2S, NaCl) (название дано
по ярко-синей окраске минерала).
Химический состав: Na2O—16,8%, СаО — 8,7%, А120з—27,2%,
SiO2 — 31,8%, SO3— 11,8%, S — 0,34% (иногда содержание S дости-
гает 2,7%), С1 — 0,25%, в небольших количествах присутствуют К,
Mg, Fe, Sr, Н2О, СО2.
Сингония кубическая.
Структура каркасная, характеризуется тем, что в пустотах, об-
разованных алюмокремнекислородными тетраэдрами, располагают-
ся молекулы группы внедрения CaSO4, Na2S, NaCl.
Встречается в виде сплошных плотных масс. Редко обнаружи-
ваемые кристаллы имеют кубический облик и образованы гранями
куба и ромбододекаэдра.
260
Физические свойства — цвет ярко-синий, фиолетово-синий, реже
голубой; блеск стеклянный; спайность несовершенная; твердость
5—5,5; удельный вес 2,4—2,5.
Диагностические признаки — характерный синий цвет разных
оттенков.
Происхождение — образуется при натриевом метасоматозе об-
ломков гранитов и сиенитов, располагающихся в скарнах и извест-
няках, содержащих мельчайшие включения самородной серы. Ассо-
циируется с кальцитом, пиритом, скаполитом.
Месторождения: в СССР — Мало-Быстринское (Юж. Прибай-
калье), на Памире; за рубежом — Бадахшанское (Афганистан).
Практическое значение — применяется как поделочный камень.
Прежде из лазурита изготовлялись голубые и синие краски.
ГЕЛЬВИН — (Мп, Fe, Zn)8[BeSiO4]6S2 (название происходит от
греческого слова «гелиос» — солнце, в связи с желтым цветом ми-
нерала).
Химический состав: МпО — 26,5—51,5%, ВеО— 13—14%, SiO2—
31,5—33,5%, S — около 5,5%. Известны железистая — даналит, и
цинковая — гентгельвин, разновидности, в которых марганец заме-
щен соответственно железом или цинком. Примеси Al, Са, Mg,
Н2О.
Сингония кубическая.
Структура каркасная, близка к структуре лазурита. Отличие за-
ключается в том, что алюминий в кремнеалюмокислородном карка-
се замещен бериллием, находящимся, как и алюминий, в тетраэдри-
ческой координации. Место Na, Са и SO4 в лазурите занимают ио-
ны Мп и S.
Гельвин встречается в виде кристаллов тетраэдрического габи-
туса или зернистых агрегатов.
Физические свойства — цвет желтый, желто-бурый, красновато-
бурый, иногда зеленовато-желтый; блеск стеклянный, смолистый;
полупрозрачный; излом раковистый; спайность ясная; твердость 6;
удельный вес 3,2—3,4.
Диагностические признаки — тетраэдрическая форма кристал-
лов, ясная спайность, цвет; очень похож на гранат, от которого
отличается только после установления содержания серы и
бериллия.
Происхождение: а) пегматитовое — гельвин известен в гранит-
ных и щелочных пегматитах. В первых он встречается с альбитом,
микроклином, кварцем, во вторых — с эгирином, нефелином, цирко-
ном; б) контактово-метасоматическое — в магнетит-флюорит-гель-
виновых скарнах, локализующихся в известняках. Спутниками гель-
вина в скарнах являются бериллиевые минералы — хризоберилл и
бертрандит; в) гидротермальное — в кварцевых жилах с сульфи-
дами, флюоритом, гранатом, а также среди щелочных метасомати-
тов-микроклинитов (гентгельвин).
Месторождения: в штатах Нью-Мексико и Вирджиния (США),
в Норвегии.
261
Практическое значение — гельвин в метасоматических месторож-
дениях образует значительные скопления, которые могут использо-
ваться как руда на бериллий.
ПОЛЛУЦИТ—Cs[AlSi2O6] • пН2О (назван по имени мифическо-
го героя Поллукса, старое название — поллукс).
Химический состав: Cs2O —32%; А12О3—16,3%; SiO2 —
46,4%, в незначительных количествах присутствуют Na2O до 2,8%
и Н2О 2,5, а также Rb, К, Т1.
Сингония кубическая.
Структура каркасная; состоит из колец, образуемых сочлене-
нием алюмокремнекислородных тетраэдров. В каркасе возникают
полости — каналы, в которых располагаются ионы цезия, а также —
натрий, вода и др.
Поллуцит в виде кристаллов встречается очень редко, наблюда-
ется обычно в виде сплошных зернистых масс и прожилков.
Физические свойства — минерал бесцветный, белый, иногда с ро-
зовым оттенком; блеск стеклянный; спайность отсутствует; харак-
терен раковистый излом; твердость 6,5; удельный вес 2,8—2,9.
Диагностические признаки — при прокаливании мутнеет. Очень
похож на кварц, от которого отличается только под микроскопом.
Происхождение — типичный минерал пегматитов. Характерен
парагенезис с литиевыми минералами — петалитом, лепидолитом,
амблигонитом, а также с кварцем, турмалином и др.
Месторождения: Сан-Пьедро-ин-Кампо на о. Эльба (где поллу-
цит был найден впервые), Карибиб (Ю.-З. Африка), Варутреск
(Швеция), Геброн (США), Берник Лейк (Канада).
Практическое значение — является основной рудой на цезий.
Цезий применяется в ионных двигателях, солнечных батареях, для
изготовления фотоэлектрических элементов, телевизионной аппара-
туры, приборов с инфракрасной оптикой и др.
Группа ПОЛЕВЫХ ШПАТОВ. Полевые шпаты наиболее широ-
ко распространены в земной коре и составляют от нее 50% по весу.
Из них 60% приходится на изверженные породы и 30% на мета-
морфические (кристаллические гнейсы и сланцы), остальные
10—11% падают на долю осадочных пород, в которых полевые
шпаты встречаются в составе песчаников, конгломератов и галек.
По своему составу полевые шпаты являются алюмосиликатами
К, Na, Са, реже Ва. В виде изоморфных примесей в них могут при-
сутствовать Rb, Ba, Sr, РЬ. Для большинства минералов этой груп-
пы характерны сходные физические свойства, связанные с их внут-
ренним строением — преимущественно светлые окраски, небольшой
удельный вес — 2,5—2,7 (благодаря рыхлой каркасной структуре
минералов), довольно большая твердость 6—6,5, совершенная
спайность по двум направлениям.
Полевые шпаты делятся на три большие подгруппы:
плагиоклазы — натрий-кальциевые полевые шпаты —
Na[AlSi3O8]-Ca[Al2Si2O8];
калиевые полевые шпаты — K(AlSi3O8];
калий-бариевые полевые шпаты — K[AlSi3O8] • Ba[Al2Si2O8].
262
Минералы последней подгруппы встречаются редко, поэтому
ниже подробно рассматриваются только минералы первых двух
подгрупп.
ПЛАГИОКЛАЗЫ представляют собой изоморфные смеси двух
минеральных видов — анортита Ca[Al2Si2O8] и альбита NafAlSisOe].
Промежуточные разности, содержащие определенное количество
анортитовой и альбитовой молекул, имеют собственные названия
(табл.20).
ТАБЛИЦА 20
Содержание в %
Название минерала Са [AlsSisOe] Na [AlSi,Oe]
Альбит 0-10 100-90
Олигоклаз 10-30 90—70
Андезин 30—50 70-50
Лабрадор 50—70 50-30
Битовнит 70—90 30—10
Анортит 90-100 10—0
Встречаются минералы с самым различным соотношением альбито-
вой и анортитовой составляющих, в связи с чем Е. С. Федоровым
была предложена классификация плагиоклазов по процентному со-
держанию анортитовой молекулы. Так, например, лабрадор, содер-
жащий 62% анортитовой и 38% альбитовой молекул, отнесен к
плагиоклазу № 62.
Название «плагиоклаз» греческое, переводится как косой, нак-
лонный из-за расположения плоскостей спайности под углом при-
мерно 86°.
Химический состав. В ряду от альбита до анортита происходит
возрастание содержания кальция, алюминия и уменьшается содер-
жание натрия и кремния. Вариации главных компонентов следую-
щие: Na2O от И, 7 до 0,2%, СаО от 0,03 до 19,5%; А12О3 от 19,1 до
36,2%; SiO2 от 68,7 до 43,9%. В качестве примесей присутствуют
К, Ba, Sr.
Сингония триклинная.
Структура каркасная. Каркас состоит из связанных между собой
кремне- и алюмокислородных тетраэдров. Большие полости в кар-
касе заполнены атомами натрия и кальция. Единство структуры и
близость состава минералов этой группы определяют сходство фи-
зических свойств минералов, незначительно меняющихся от альбита
к анортиту.
Плагиоклазы образуют призматические и таблитчато-призмати-
ческие кристаллы. Чаще они встречаются в виде зернистых агрега-
тов или одиночных зерен. Большим разнообразием форм характери-
зуется альбит; помимо зерен, он нередко образует пластинчатые
кристаллы самых различных размеров (рис. 137). Мельчайшие, едва
различимые пластинки в агрегате придают альбитовой породе саха-
263
Г" ровидный облик, крупные же пластинчатые крис-
/ / \ таллы (до 5—6 см) нередко образуют друзы. Пла-
стинчатый альбит имеет собственное название —
клевеландит.
Для плагиоклазов исключительно характерно
* двойникование, почти все их зерна представляют
1 собой полисинтетически сдвойникованные сростки,
/ которые можно установить при внимательном изу-
\ \\ / чении плагиоклазов даже под обычной лупой.
>—Физические свойства — цвет белый, серый до
темно-серого (за счет примесей); блеск стеклян-
Рис. 137. Форма ныд. спайность совершенная в двух направлениях;
Кальбита3 твердость 6—6,5; удельный вес 2,62 (альбит) —
2,76 (анортит). Некоторые плагиоклазы обладают
специфическим свойством — ирризацией (особым
блеском), вызванной наличием тонкодисперсных включений. Отра-
зившийся от них свет придает минералам характерный блеск. Так,
для олигоклазов иногда характерен нежно-голубой или искристо-
золотистый блеск. Такие олигоклазы называются соответственно
лунным и солнечным камнем. Более часто ирризация наблюдается
у лабрадора — у него появляется переливающийся синий, иногда
зеленовато-синий отблеск.
Диагностические признаки — спайность, белый или серый цвет.
От калиевых полевых шпатов отличается по наличию полисинтети-
ческих двойников, устанавливаемых под лупой или микроскопом.
Различить плагиоклазы между собой можно только под микро-
скопом.
Происхождение: а) магматическое — плагиоклазы являются по-
родообразующими минералами почти всех магматических пород.
Для ультраосновных и основных пород характерны битовинит, лаб-
радор, а иногда и анортит; для средних — андезин, олигоклаз; для
кислых — олигоклаз и альбит; б) пегматитовое — в пегматитах од-
ним из главных породообразующих минералов является олигоклаз
или альбит; в) метасоматическое — при развитии процессов заме-
щения в гранитах, сиенитах и других породах часто образуется аль-
бит; г) метаморфическое — андезин, олигоклаз, а иногда и более
основные плагиоклазы, характерны для различных гнейсов и слан-
цев; д) гидротермальное — в рудных жилах часто наблюдается об-
разование кислого плагиоклаза — альбита.
На земной поверхности плагиоклазы неустойчивы, при выветри-
вании они разлагаются (из них выносятся кальций и натрий) и при
этом переходят в глинистые минералы.
Месторождения: в СССР пользуется известностью Турчинское
(Украина) месторождение декоративного лабрадора и др. За рубе-
жом лабрадор известен на п-ове Лабрадор.
Практическое значение — плагиоклазы в целом не представляют
промышленного интереса, из них ценится как облицовочный декора-
тивный камень только лабрадор. Иногда на поделки используется
солнечный камень.
264
Рис. 138. Кристалл ортоклаза в пегматите
КАЛИЕВЫЕ ПОЛЕВЫЕ ШПАТЫ — K[AlSi3O8J. Различают два
главных минерала, входящих в эту подгруппу — ОРТОКЛАЗ и
МИКРОКЛИН. Оба минерала имеют одинаковый химический сос-
тав, сходную структуру, но кристаллизуются в разных сингониях:
ортоклаз — в моноклинной, а микроклин — в триклинной.
Название «ортоклаз» имеет греческое происхождение и означа-
ет— прямораскалывающийся. Угол между направлениями спайно-
сти у ортоклаза составляет 90°. «Микроклин» с греческого языка
переводится как незначительно отклоненный, что связано с тем,
что угол между направлениями спайности отклоняется от 90° на 20'.
Химический состав: КгО — 16,9 %, А12О3 — 18,4 %, SiO2 — 64,7 %;
весьма часто в микроклине и ортоклазе присутствует примесь аль-
бита и содержание Na2O достигает нескольких процентов (1—3 до
5). Из других примесей характерны Ba, Rb, Cs, Fe.
Структура каркасная, сходная со структурой плагиоклазов — в
каркасе крупные ячейки заполнены ионами калия.
Микроклин и ортоклаз образуют кристаллы призматического или
таблитчатого облика с хорошо развитыми гранями призмы или пи-
накоида (рис. 138). Весьма часто оба минерала встречаются в виде
зернистых и таблитчатых агрегатов. Иногда микроклин наблюдает-
ся в крупных (до 0,5—1 м) блоках.
Физические свойства — оба минерала имеют белую и за счет
примесей (главным образом, железа) розовую, кремовую, желтую,
зеленовато-серую до мясо-красной и серую окраску; для микрокли-
на иногда характерна нежная голубовато-зеленая или зеленая
окраска (такие разности называются амазонитами); блеск стеклян-
ный; иногда полупрозрачный; спайность совершенная; твердость
6—6,5; удельный вес 2,55—2,58.
Диагностические признаки — микроклин от ортоклаза макроско-
пически неотличим. От плагиоклазов оба минерала отличаются по
265
прямому углу между направлениями спайности, отсутствию поли-
синтетических двойников, по наличию в некоторых микро-
клинах тонких извилистых прожилков — выделений примеси
альбита.
Происхождение: а) магматическое — ортоклаз встречается пре-
имущественно в кислых изверженных породах; микроклин распро-
странен шире, он является типичным минералом кислых и щелочных
пород; б) пегматитовое — породообразующим минералом пегмати-
тов является обычно микроклин, изредка в них встречается орто-
клаз. Крупные скопления чистых блоков микроклина наблюдаются
в слюдоносных пегматитах. Нередко такие пегматитовые жилы со-
держат мало слюды и обогащены калиевым полевым шпатом. Эти
пегматиты называются керамическими и являются источником ке-
рамического сырья; в) метасоматическое — микроклин часто развит
в метасоматических щелочных, субщелочных, а иногда и кислых
образованиях; г) гидротермальное — в полевошпатовых жилах с
флюоритом, карбонатами редких земель; иногда с кварцем и то-
пазом.
На земной поверхности полевые шапты неустойчивы, при разло-
жении переходят в различные глинистые минералы.
Месторождения: в СССР — Чупинское (Карелия), в Приазовье,
на Волыни (УССР); за рубежом широко известны керамические
пегматиты в Канаде, Скандинавии, США.
Практическое значение — используются как керамическое сырье,
для изготовления фарфора и фаянса. Амазонит используется как
поделочный камень.
СКАПОЛИТ (название происходит от греческих слов «ска-
пос» — столб, и «литое» — камень, и связано со столбчатой формой
кристаллов). Подобно плагиоклазам, представляет непрерывный ряд
двух крайних членов: мариалита Na^lSisOebCl и мейонита Са4Х
X(A12Si2O8]3 (СОз, SO4).
Химический состав: содержание SiO2 изменияется от 41 до 64%,
достигая максимума в мариолите;А12О3 — 24—29%,Na2 — 5—10%,
СаО —7—9%; содержание суммы С1, СО2 и SO3—1—3%.
Сингония тетрагональная.
Структура каркасная. Основу структуры составляют сложные
кольца, образованные четырьмя кремне- и алюмокислородными тет-
раэдрами. Тетраэдры слагают колонки вдоль длинной оси с и свя-
заны между собой в кольца вокруг оси, на которой располагаются
ионы хлора. В пустотах каркаса находятся атомы натрия, кальция,
а также анионы [SO]42“, [СОз]2- или С11-.
Скаполит образует призматические кристаллы, обычно вытяну-
тые по оси с и имеющие хорошо выраженные грани призм. Часто
скаполит встречается в виде неправильных зерен или зернистых аг-
регатов.
Физические свойства — бесцветный, но обычно за счет примесей
белый, серовато-зеленый до бурого; блеск стеклянный, до перла-
мутрового; как правило, непрозрачен; спайность несовершенная;
хрупок; твердость 6; удельный вес 2,6—2,75.
266
Диагностические признаки — призматические кристаллы, несо-
вершенная спайность, неровный излом.
Происхождение: а) контактово-метасоматическое — в различ-
ных скарнах в ассоциации с диопсидом, флогопитом, кальцитом,
апатитом; б) метаморфическое — в некоторых гнейсах и сланцах;
в) гидротермальное (редко) —в пустотах вулканических пород.
Месторождения. Скаполит часто встречается в контактово-мета-
соматических флогопитовых месторождениях: в СССР — Слюдянка
(Ю. Прибайкалье), на Алдане; за рубежом известен на о. Паргас
(Финляндия), в Норвегии.
Практическое значение — не имеет.
НАТРОЛИТ— Na2[Al2Si3Oio]-2H20 (назван по содержанию в
минерале натрия)—относится к группе водных алюмосиликатов,
имеющих общее название — цеолиты.
Химический состав: Na2O—16,3%, А12О3— 26,8%, SiO2—47,4°/0,
Н2О — 9,5%; примеси К, Sr, Ga, Fe.
Сингония ромбическая.
Структура каркасная, основу ее составляют кольца из кремне-
и алюмокислородных тетраэдров, крупные пустоты между которыми
заполнены щелочами и водой. Последняя при нагревании удаляется
через каналы, не изменяя структуру минерала. Если натролит по-
местить в воду, он вновь поглотит потерянную так называемую
структурно-свободную воду. Слабую связь с каркасом имеет и ка-
тион натрия.
Кристаллы натролита столбчатые, призматические Иногда за-
вершаются пирамидами. Натролит часто образует радиально-лучис-
тые агрегаты, волокнистые массы корки, плотные скопления.
Физические свойства — бесцветный или белого цвета, за счет
примесей железа приобретает желтоватый, зеленоватый или крас-
новатый оттенки; блеск стеклянный до шелковистого; спайность яс-
ная; хрупкий; твердость 5—5,5; удельный вес 2,2—2,5.
Диагностические признаки — отличается от других цеолитов по
оптическим свойствам.
Происхождение гидротермальное, образуется в результате изме-
нения нефелина. Встречается также в пустотах эффузивных пород.
Известен в Ильменских горах (Урал).
Практическое значение —не имеет.
ГЛАВА 28
ЗНАЧЕНИЕ МИНЕРАЛОВ
В НАРОДНОМ ХОЗЯЙСТВЕ
Трудно переоценить роль минералов в народном хозяйстве. Не
существует ни одной отрасли промышленности, где не использова-
лись бы те или иные компоненты, извлеченные из минералов, или
же сами минералы в природном виде.
В связи с интенсивным развитием народного хозяйства в сферу
промышленного использования вовлекаются все новые и новые ми-
нералы и содержащиеся в них полезные компоненты.
267
Знание минералов, их состава, различных свойств и областей
практического применения необходимо как геологам, так и широ-
кому кругу специалистов, работающих в разных отраслях народно-
го хозяйства. Следует иметь в виду, что не каждое скопление того
или иного минерала или минеральных агрегатов может служить
сырьем для промышленности.
Если концетрация полезного минерала (минералов) или компо-
нента (компонентов), содержащегося в одном или нескольких ми-
нералах, рентабельна для их практического использования, то такие
природные скопления минералов являются ценным сырьем и назы-
ваются рудами.
По установившейся традиции твердые полезные ископаемые (мы
не рассматриваем жидкие и газообразные—нефть, газ) подразде-
ляют на рудные (полезные компоненты — различные металлы и их
соединения) и нерудные (сырье для химического, агрохимического
производства и др.).
Рудные полезные ископаемые подразделяются в
свою очередь на руды черных, цветных, редких, радиоактивных и
благородных металлов. Рассмотрим, какие же минералы являются
главными компонентами различных руд.
Руды черных металлов. К ним относятся руды железа, марганца,
хрома и др. (табл. 21). Они представлены минералами, относящи-
мися преимущественно к классу окислов и реже к классу карбо-
натов.
Черные металлы и их сплавы находят широкое применение во
всех отраслях народного хозяйства — для производства станков,
машин, различного оборудования, строительных конструкций, ин-
струментов и бытовых изделий.
ТАБЛИЦА 21
Главные минералы руд черных металлов
Рулы Главные минералы Формула Содержание ме- талла или полез- ного компонента, %
Железа Магнетит Гематит Лимонит Гетит Сидерит FeFe2O4 Fe2O3 Fe2O3-n Н2О HFeO2 Fe [CO3] Fe 72,4 Fe 70 Fe 48-63 Fe 48-63 Fe 48
Марган- ца Пиролюзит Псиломелан Браунит Гаусманит Манганит Родохрозит Родонит MnO2 nMnO-MnO2-« H2O Mn2O3 Mn3O4 Mn2+Mn3+O2 [OH]2 Mn [CO3] Mn [SiO3] Mn 60-63 Mn 45—60 Mn 60-69 Mn 72,1 M n 62,4 Mn 47,8 Mn 41,9
268
Продолжение табл. 21
Руды Главные минералы Формула Содержание ме- талла или полез- ного компонента, %
Хрома Хромит и его разновид- ности FeCr2O4 (Mg, Fe)(Cr, Al, Fe)2O3 Сг2О3 18—62
Ванадия Ванадинит Ванадийсодержащий ти- таномагнетит Pb5[VO4]3Cl V2O5 19,3 V2O5 0,2—8,8
Титана Ильменит Рутил FeTiO3 TiO2 Ti 31,6 Ti 60
Руды цветных металлов. Сырьем для производства цветных ме*
таллов служат, в основном, руды, сложенные сульфидами, в мень-
шей степени окислами и карбонатами (табл. 22). Вместе с тем
руды некоторых цветных металлов редко или совсем не связаны с
сульфидными месторождениями. Так, алюминий извлекается преи-
мущественно из бокситов, представленных гидроокислами алюми-
ния, а вольфрам — из различных вольфраматов.
Цветные металлы и их сплавы играют большую роль в различ-
ных отраслях народного хозяйства. Они применяются в авиацион-
ной, оборонной, судостроительной, машиностроительной, электро- и
радиопромышленности.
ТАБЛИЦА 22
Главные минералы руд цветных металлов
Руды Главные минералы Формула Co ержание металла или полез- ного компонента, %
Меди Халькопирит Борнит Халькозин Ковеллин Малахит Азурит Хризоколла Куприт Медь самородная CuFeS2 Cu.5FeS4 Cu2S CuS Cu2 [CO3](OH)2 Cu3 [CO3]2(OH)2 CuSiO3-n H2O Cu2O Cu Си 34,57 Си 55,5 Си 79,8 Си 64,4 Си 57,5 Си 55,4 Си 45 Си 88,8 Си 100%
Никеля Пентландит Герсдорфит Никелин Гарниерит (Fe, Ni)9S8 NiAsS Ni As Ni4 [Si4OI0] (OH)4-4H2O Ni 21 Ni 35,4 Ni 36,3 Ni 15-46
269
Продолжение табл. 22
Руды Главные минералы Формула Содержание металла или полез- ного компонента, %
Свинца Галенит Буланжерит Церуссит Англезит PbS Pb5Sb4Su РЬ [СО3] Pb [SO4] РЬ 86,6 РЬ 55,4 РЬ 77,6 РЬ 68,3
Цинка Сфалерит Смитсонит Г идроцинкит Каламин ZnS Zn [CO3] Zn5[CO3]2(OH)fi Zn4 [Si2O7] (OH)2-H2O Zn 67 Zn 52 Zn 60 Zn 53,7
Олова Касситерит Станнин SnO2 Cii2FeSnS4 Sn 76 Sn 27
Магния Магнезит Брусит Карналлит Бишофит Mg [CO3] Mg(OH)2 KClMgCl2-6H2O MgCl2-6H2O Mg 28,8 Mg 41,6 Mg 8,8 Mg 12,0
Алюми- ния Гидраргиллит Бемит Диаспор Алунит Нефелин Al[OH]3 AIO(OH) HA1O2 KAI3[SO4]2(OH)6 Na[AlSiO4] A12O3 65,4 A12O3 84,79 A12O3 85,0 A12O3 37,0 A12O3 31-34
Молиб- дена Молибденит Ферримолибдит MoS Fe? [MoO4]3-7H2O Mo 59,96 Mo 59,5
Вольфра- ма Вольфрамит Шеелит (Fe, Mn)WO4 CaWO4 W 60,6 W 63,9
Сурьмы Антимонит Sb2S3 Sb 71,4
Ртути Киноварь HgS Hg 86,2
Мышьяка ; Реальгар 1 Аурипигмент Арсенопирит AsS As2S3 FeAsS As 70,1 As 61 As 46,0
270
Руды редких металлов. К ним относятся те металлы, которые
ограниченно или в небольшом количестве применяются в промыш-
ленности— литий, бериллий, тантал, ниобий, цезий, германий и др.
Руды этих металлов представлены, главным образом, различными
силикатами и окислами (табл. 23).
ТАБЛИЦА 23
Главнейшие минералы руд редких металлов
Руды Главнейшие промышлен- ные минералы, минера- лы — носители ценных компонентов Формула Содержание полезных компонентов, %
Лития Сподумен Амблигонит Петалит Лепидолит Циннвальдит Li Al [Si2O6] Li Al [PO4J(F, OH) Li [Si4AlOio] KLi] 5[A1i 5Si3O1()] (F, OH)2 KLiFe-Al [ AlSi3O10] (F, OH)2 L2O 7,5 L2O 10 L2O 4,9 L2O 4-6 L2O 1—3
Бериллия Берилл Фенакит Бертрандит Гельвин Хризоберилл Al2Be3 [SieOie] Be2 [SiO4J Be4 [Si2O7l(OH)2 Mn3 [BeSiO4]6*S2 Al2BeO4 BeO 10-12 BeO 41—45 BeO 42 BeO 11—14 BeO 19,8
Тантала и ниобия Колумбит-танталит Пирохлор Микролит Лопарит Дизаналит (Fe, Mn)(Nb, Та)гО6 (Na, Ca...)2(Nb, Ti...)2O6 (F, OH) (Na, Ca...)2(Ta,Nb)2O6(F, OH) (Na, Ca, TR)(Ti, Nb, Ta)O3 (Ca, TR)(Ti, Nb)O3 Nb2O5 5-77 Ta2O5 2-84 Nb2O5 37-65 T a2O5 6 8—80 (Nb,Ta)2O5 до 11 Nb2O54O 22
Цезия Поллуцит Cs [AISi2O6] Cs2O 23,5-34
Рубидия В виде примесей в ле- пидолите и карналлите KLii,5AlI>5 [AlSi3OI0] (F, OH) KCl-MgCl2-6H2O Rb2O до 3,7 Rb2O 0,015— 0,04
Германия Бурый уголь Примесь в сфалерите Германит Реньерит ZnS Cu3 (Ge, Fe) S4 Cu3 (Fe, Ge) S4 Ge до 1,1— 0,5 (в породе) Ge до 0,01 Ge до 10 Ge до 7,7
Галлия Примесь в бокситах и сфалерите ZnS Ca до 0,01— 0,1
271
Продолжение табл. 23
Рулы Главнейшие промышлен- ные минералы, минера- лы — носители ценных компонентов Формула Содержание полезных компо- нентов, %
Циркония Циркон Бадделеит Zr [SiO4] ZrO2 ZrO2 ДО 67 ZrO2 до 100
Г афния В виде примеси в цир- коне (Zr, Hf) [SiO4] НЮ2 0,65— 7
Рения В виде примесей в молибдените Джезказганит (Mo, Re) S2 CuReS4 1 Re 0,001 — 1 0,1
Таллия В виде примесей в сфалерите, халькопирите, марказите, псиломелане, пирите, карналлите Лорандит ZnS CuFeS2 FeS2 лМпО«МпО2*л H2O FeS2 KCI-MgCl2-6H2O T1AsS2 TI 0,0001- 0,002 TI до 55
Индия В виде примесей в сфалерите, касситерите, халькопирите, борните Индит ZnS SnO2 CuFeS2 Cu5FeS4 FeIn2S4 , In 0,01— 0,1 In до 35
Скандия В виде примесей в вольфрамите, касситерите, железных рудах Тортвейтит (Fe, Mn) WO4 SnO2 (Sc, Yh[Si2O7] 1 ScO3 до 1 0,3 ScO3 35-40
Особенностью рассматриваемых руд является незначительное
содержание полезных компонентов в минералах, из которых они
извлекаются. Кроме того, большинство редких элементов (рубидий,
гафний, рений и др.) не образует своих собственных минералов, а
находится в рассеянном состоянии в виде изоморфных примесей
в других минералах. Редкие металлы по праву можно назвать ма-
териалами новейшей техники. Они используются в электронике, ра-
диотехнике, атомной и оборонной промышленности.
Радиоактивные руды. К ним относятся руды урана и тория.
Практически важные минералы урана и тория содержатся в рудах
в незначительном количестве и представлены преимущественно
272
окислами, фосфатами, ванадатами, реже силикатами (табл. 24).
Радиоактивные элементы применяются в атомной технике, медици-
не, оборонной промышленности и т. д.
ТАБЛИЦА 24
Главные минералы радиоактивных руд
Руды Минералы Формула Содержание полезных компонентов, %
Урана Уранинит (настуран) Торбернит Отенит Тюямунит Карнотит ио2 Си UO2]2[PO4]2-12H2O Са UO2]2[VO4]2-8H2O Са [UO2 2[VO4]2-8H2O К2 UO2]2 VO4]2-3H2O ио2 4-74, ио3 2—60 UO3 57,5 UO3 62,7 UO3 60,0 UO3 63,4
Тория Торит Монацит ThSiO4 (Се, La, Th, . . ) [РО4] | ThO2 81,5 | ThO2 5-1®
Руды благородных металлов. К благородным металлам относят-
ся золото, серебро и платиноиды — платина, иридий, палладий,
осьмий и др. Руды этих металлов представляют собой различные
породы с рассеянными в них самородными золотом, платиной или
серебром. Последнее, однако, добывается чаще из различных суль-
фидных месторождений, в которых, наряду с другими минералами,
присутствуют сульфиды серебра и иногда самородное серебро.
Благородные металлы рассматриваются как валютные ценности.
Применяются они также для производства особо ответственных ту-
гоплавких и химически стойких изделий в химической, электротех-
нической и других отраслях промышленности.
Нерудные полезные ископаемые используются в на-
родном хозяйстве непосредственно в виде минералов, кристаллов и
минеральных агрегатов — горных пород, реже перерабатываются
для получения различных химических соединений. Нерудные полез-
ные ископаемые служат сырьем для различных отраслей производ-
ства и применяются в металлургии в качестве флюсов и огнеупоров,
используются в технических изделиях — диэлектрики, абразивы
и т. д., в сельском хозяйстве и других областях народного хозяйст-
ва (табл.25).
ТАБЛИЦА 25
Нерудные полезные ископаемые
Виды сырья и области их применения Минералы и породы Формула минералов
Сырье для метал- лургии (флюсы) Флюорит Кальцит Доломит Кварц Известняк CaF2 Са [СО3] MgCa [СО3]2 SiO2
273
Продолжение табл. 25
Виды сырья и области их применения Минералы и породы Формула минералов
Огнеупорные и теп- лоизоляционные материалы Магнезит Брусит Доломит Дистен Силлиманит Монтмориллонит Каолинит Mg[CO3] Mg(OH)2 MgCa [СО3]2 Al2 [SiO4] О Al[AlSiO<jO Al2Mg3[Si4O10]2(OH)4.«H2O Al4 [Si4OI0] (ОН)8
Теплоизоляцион- ные материалы Тальк Асбест Вермикулит Mg3 [Si4Ojol (OH)2 Mg6 [Si4OIQ] (OH)8 (Mg, F2+, F3+)3[(AlSi)4Oj0(OH)2X X4H2O
Химическое сырье Натриевая и калиевая селитра Галит Сильвин Карналлит Мирабилит Датолит Ашарит Борацит NaNO3 и KNO3 NaCl KC1 KCbMgCl2-6H2O Na2SO4«10H2O Са2Вг [SiO4]2(OH)2 Mg2 [B^OH] (OH) Mg3 [B3B4OJ2] OC1
Агрономические РУДЫ Сильвин Селитра Карналлит Апатит Фосфориты KCl NaNO3, KNO3 KCl-MgCl2-6H2O CasfPO^tF, Cl]
Техническое сырье: абразивные ма- териалы пьезоэлектриче- ское и оптиче- ское сырье диэлектрики Алмаз Корунд Топаз Гранат Диатомит Бокситы Пьезокварц Турмалин Флюорит Исландский шпат Оптический кварц Мусковит Флогопит C A12O3 Al2[SiO4](F, OH)2 (Fe, Mg)3Al2 [SiO4]3 SiO2 Na (Mg, Fe)6 [Si6B3Al3(O, OH)^] CaF2 Ca [CO3] 5Юг KA12 [AlSkOio] (OH)2 KMg3[A!Si3O10](F, OH)2
274
Продолжение табл. 25
Виды сырья и области их применения Минералы и породы Формула минералов
Строительные ма- териалы Известняки Мергель Песчаники Гравий Пески Глины Некоторые магмати- ческие и метамор- фические породы 1 1 1 1 1 11
Стекольно-кера- мическое сырье Стекольные вые) пески Пегматиты Глины Каолинит (кварце- A14[Si4O!0] (ОН)8
ЛИТЕРАТУРА
Аншелес О. М Начала кристаллографии. Изд. МГУ, 1952.
Б ок ий Г. Б. Кристаллохимия. Изд. МГУ, 1960.
Бетехтин А. Г. Курс минералогии. Госгеолтехиздат, 1961.
Винчел А. Н., Винчел Г. Оптическая минералогия. ИЛ, 1953.
Дэна Дж. Д., Дэна Э. С., П э л а ч Ч. [и др.]. Система минералогии,
т. I, II. ИЛ, 1951—1953.
Лазаренко Е. К. Курс минералогии. Изд-во «Высшая школа», 1963.
Минералы (справочник), т. I, II, III. Изд-во «Наука», 1960—1965.
Попов Г. М. и Шафрановский И. И. Кристаллография. Госгеол-
техиздат, 1955.
Смольянинов Н. А. Практическое руководство по минералогии. Гос-
геолтехиздат, 1955.
Соболев В. С. Введение в минералогию силикатов. Изд. Львовского уни-
верситета, 1949.
Современные методы минералогических исследований. Изд-во «Недра», 1969.
Чухров Ф. В. Коллоиды в земной коре. Изд. АН СССР, 1955.
Флинт Е. Е. Начала кристаллографии. Госгеолиздат, 1952.
Штрунц X. Минералогические таблицы. Госгеолтехиздат, 1962.
УКАЗАТЕЛЬ МИНЕРАЛОВ
Авгит 236 Галенит 142
Агат 169 Галит 156
Азурит 195 Галмей 228
Аквамарин 229 Гарниерит 256
Актинолит 239 Геденбергит 235
Алмаз 134 Гельвин 261
Алунит 203 Гематит 163
Альбит 263 Герсдорфит 269
Альмандин 222 Гётит 175
Амазонит 265 Гиацинт 220
Аметист 169 Гиббсит 176
Амфиболы 238 Гидраргиллит 176
Амфиболовый асбест 239 Гидроборацит 215
Анальцим 258 Гидроксилапатит 209
Ангидрит 199 Гидроокислы железа 176
Англезит 270 Гидроокислы алюминия 175
Андезин 263 Гиперстен 234
Андрадит 222 Гипс 201
Анортит 263 Горный хрусталь 169
Антимонит 148 Гранат 221
Апатит 209 Графит 136
Арагонит 192 Гроссуляр 222
Аргентит 138 Гюбнерит 204
Арсенопирит 155
Арфведсонит 240 Датолит 274
Аурипигмент 150 Демантоид 222
Ашарит 215 Деревянистое олово 1G6
Десмин 259
Барит 197 Джемсонит 140
Баритоцелестин 197 Джезказганит 272
Бёмит 177 Диаспор 178
Берилл 229 Дизаналит 183
Биотит 249 Диопсид 234
Битовнит 263 Дистен 224
Борнит 147 Доломит 190
Брукит 182 Дравит 231
Брусит 243
Буланжерит 140 Железный блеск 163
Бурый железняк 175
Змеевик 251
Верделит 231 Золото 132
Вермикулит 251
Висмутин 149 Изумруд 229
Висмутовый блеск 149 Ильменит 174
Вольфрамит 204 Индиголит 231
Воробьевит 229 Индит 272
276
Иниоит 215
Исландский шпат 188
Итротитанит 223
Каламин 253
Калиофилит 258
Калиевая селитра 274
Кальцит 188
Каменная соль 156
Каолинит 253
Карналлит 158
Карнотит 212
Касситерит 166
Кварц 168
а-кварц 169
|3-кварц 168
Кианит 224
Киноварь 144
Клейофан 143
Кнопит 183
Клиноцоизит 227
Кобальтин 154
Ковеллин 269
Колумбит 186
Корунд 162
Красная стеклянная голова 163
Красный железняк 163
0-кристобалит 169
Ксенотим 208
Кунцит 237
Куприт 161
Лабрадор 263
Лазурит 260
Лейцит 258
Лепидолит 250
Лимонит 175
Лопарит 184
Лорандит 272
Лунный камень 264
Людвигит 215
Магнезит 189
Магнетит 171
Магнитный колчедан 145
Малакон 220
Малахит 194
Манганит 179
Мангангеденбергит 235
Маргарит 244
Мариалит 266
Марказит 153
Марматит 143
Медный колчедан 147
Медь самородная 130
Мейонит 266
Микроклин 265
Микролит 185
Мирабилит 274
Молибденит 151
Монацит 207
^Монтмориллонит 254
Морион 169
Мусковит 249
Настуран 168
Натриевая селитра 274
Натроалунир 203
Натролит 267
Нефелин 259
Нефрит 238
Никелин 269
Оливин 219
Олигоклаз 263
Оловянный камень 166
Опал 170
Ортоклаз 265
Отенит 212
Пентландит 146
Перовскит 183
Петалит 271
Пираргирит 140
Пирит 152
Пироксены 233
» моноклинные 233
» ромбические 233
Пиролюзит 167
Пироп 222
Пирофиллит 247
Пирохлор 184
Пирротин 145
Плавиковый шпат 159
Плагиоклаз 263
Платина 133
Повеллит 152
Полевые шпаты 262
Поллуцит 262
Прустит 140
Пршибрамит 143
Псиломелан 181
Реальгар 150
Реньерит 271
Роговая обманка 240
Родонит 268
Родохрозит 268
Рубеллит 231
Рубин 162
Рутил 164
Самарскит 183
Сапфир 162
Свинцовый блеск 142
Сера самородная 133
Сервантит 149
Серебро самородное 131
Серицит 250
Серный колчедан 152
Серпентин 251
Сидерит 191
277
Силлиманит 241
Сильвин 158
Скаполит 266
Сколецит 259
Смитсонит 192
Содалит 258
Солнечный камень 264
Спессартин 222
Сподумен 237
Станин 270
Стибиконит 149
Сфалерит 143
Сфен 223
Тальк 245
Танталит 186
Тапиолит 183
Теннантит 140
Тетраэдрит 140
Титанит 223
Титанистый железняк 174
Титаномагнетит 174
Топаз 225
Торбернит 212
Торит 273
Тортвейтит 272
Тремолит 238
Р-тридимит 169
Тунгомелан 181
Турмалин 230
Тюямунит 212
Тяжелый шпат 197
Уваровит 222
Улексит 215
Уранинит 168
Урановые слюдки 211
Урановая смолка 168
Урановая чернь 168
Фаялит 219
Ферберит 204
Фергюсонит 185
Ферримолибдит 152
Ферсмит 183
Фибролит 241
Филлипсит 259
Флогопит 248
Флюорит 159
Форстерит 219
Фторапатит 209
Халцедон 169
Халькозин 141
Халькопирит 147
Хлорапатит 209
Хлорит 244
Хлоритоид 245
Хокутолит 197
Хризоберилл 271
Хризоколла 255
Хризолит 220
Хризотил — асбест 252
Хромит 173
Целестин 198
Цеолит 259
Церуссит 194
Цинковая обманка 143
Циннвальдит 271
Циркон 220
Циртолит 220
Шмальтин 139
Шеелит 205
Шерл 231
Эвксенит 183
Эгирин 236
Эльбаит 231
Энаргит 140
Энстатит 233
Эпидот 227
Эшинит 183
Яшма 171
ОГЛАВЛЕНИЕ
Стр.
Предисловие............................................................ 3
Раздел I. Кристаллография
Глава 1. Краткие сведения из истории развития кристаллографии .... 5
Глава 2. Понятие о кристалле и кристаллическом веществе........... 6
Глава 3. Геометрическая кристаллография . . .,.....................П
Глава 4- Основные законы геометрической кристаллографии...........23
Глава 5. Основы кристаллохимии....................................29
Глава 6. Основные понятия из физической кристаллографии...........50
Раздел II. Минералогия
Глава 7. Краткая история минералогии и основные направления ее раз-
вития в России.....................................................64
Глава 8. Морфология минералов.....................................67
Глава 9. Физические свойства минералов............................71
Глава 10. Химический состав и формулы минералов...................74
Глава 11. Типы воды в минералах .,................................76
Глава 12. Коллоиды и коллоидные минералы..........................78
Глава 13. Метамиктные минералы....................................82
Глава 14. Генезис минералов.......................................84
Эндогенные процессы.......................................84
Экзогенные процессы ......................................98
Метаморфические процессы.................................107
Глава 15. Методы исследования минералов..........................109
Методы визуального изучения минералов.....................ПО
Лабораторные методы исследования минералов...............112
Методы детальных лабораторных исследований...............121
Глава 16. Классификация минералов............ . ..................123
Раздел III. Описание минералов
Глава 17. Класс самородных элементов................................130
Подкласс металлов..........................................130
Подкласс металлоидов.......................................133
Глава 18. Класс сульфидов...........................................137
Подкласс простых сульфидов................................141
Подкласс дисульфидов......................................152
Глава 19. Класс галоидных соединений (галогениды).................155
Глава 20. Класс окислов...........................................161
Подкласс простых окислов..................................161
Подкласс сложных окислов..................................171
Подкласс гидроокислов ................................... 175
Стр.
Глава 21. Класс титано-тантало-ниобатов.............................181
Глава 22. Класс карбонатов..........................................187
Подкласс безводных карбонатов..............................188
Подкласс карбонатов с добавочными анионами.................194
Глава 23. Класс сульфатов ......................................... 196
Глава 24. Класс вольфраматов............. ..........................204
Глава 25. Класс фосфатов и их аналогов..............................206
Глава 26. Класс боратов............................................ 214
Глава 27. Класс силикатов...........................................216
Подкласс силикатов с изолированными тетраэдрами [SiO4] в кри-
сталлических структурах (островные силикаты)...............217
Подкласс силикатов с непрерывными цепочками тетраэдров
[SiOJ в кристаллических структурах (цепочечные силикаты) . . 232
Подкласс силикатов с непрерывными слоями тетраэдров [SiO4]
в кристаллических структурах (слоистые силикаты) , . . . . . 242
Подкласс силикатов с непрерывными трехмерными каркасами
из тетраэдров [SiO4] или [(Si, А1)О4] в кристаллических струк-
турах (каркасные силикаты).................................256
Глава 28. Значение минералов в народном хозяйстве...................267
Литература.................... . .........................275
Указатель минералов ...................................... 276
Гумилевский Сергей Алексеевич
Киршон Валентина Михайловна
Луговской Герман Павлович
КРИСТАЛЛОГРАФИЯ И МИНЕРАЛОГИЯ
Редактор Н. Н. Бородина
Переплет художника А. В. Алексеева
Художественный редактор Т. А. Дурасова
Технические редакторы Н. А. Битюкова и Н. В. Яшукова
Корректор Г. А. Чечеткина
Т-03008 Сдано в набор 17/VIII 1971 г. Подп. к печати 28/1 1972 г.
Формат 60Х90’/1б Объем 17,5 печ. л. Уч.-изд. л. 18,24
Изд. № Стр — 186 Тираж 12 000 экз. Цена 75 коп.
План выпуска литературы для вузов и техникумов
изд-ва «Высшая школа» на 1972 г. Позиция № 114
Москва, К-51, Неглинная ул., 29^14,
Издательство «Высшая школа»
Московская типография № 8 Главполиграфпрома
Комитета по печати при Совете Министров СССР,
Хохловский пер., 7. Зак. 3628
Опечатки
Й со f- S О х Строка Напечатано Следует читать
127 6 снизу Се [РО4] Y[PO4]
136 4 снизу 2СО+СО2+С 2CO—"СОг+С
150 16 сверху AS2S2 AS2S3
150 22 сверху групп, групп AsSs
197 Рис. 103 В правой части рисунка ного кружочка 1 не должно быть нижнего чер-
243 15 сверху Al(OH)3+[Si2O5]2- [Si2O5]2-+Al(OH)3+[Si2O5]2-
248 1 и 2 снизу Текст относится к биотиту [AlpSin- p02n]m Р~
257 19 сверху [Alp Sin — p02n]ma_
260 Рис. 136 К Na •к ONa
271 Табл. 23 4 строка графа 3 Там же, KLii,5[Ali,5Si3O10] (F, OH)2 KLii,5Ali,5[AlSi3O10] (F, OH)2
графа 4 L2O Li2O
Зак. 3628