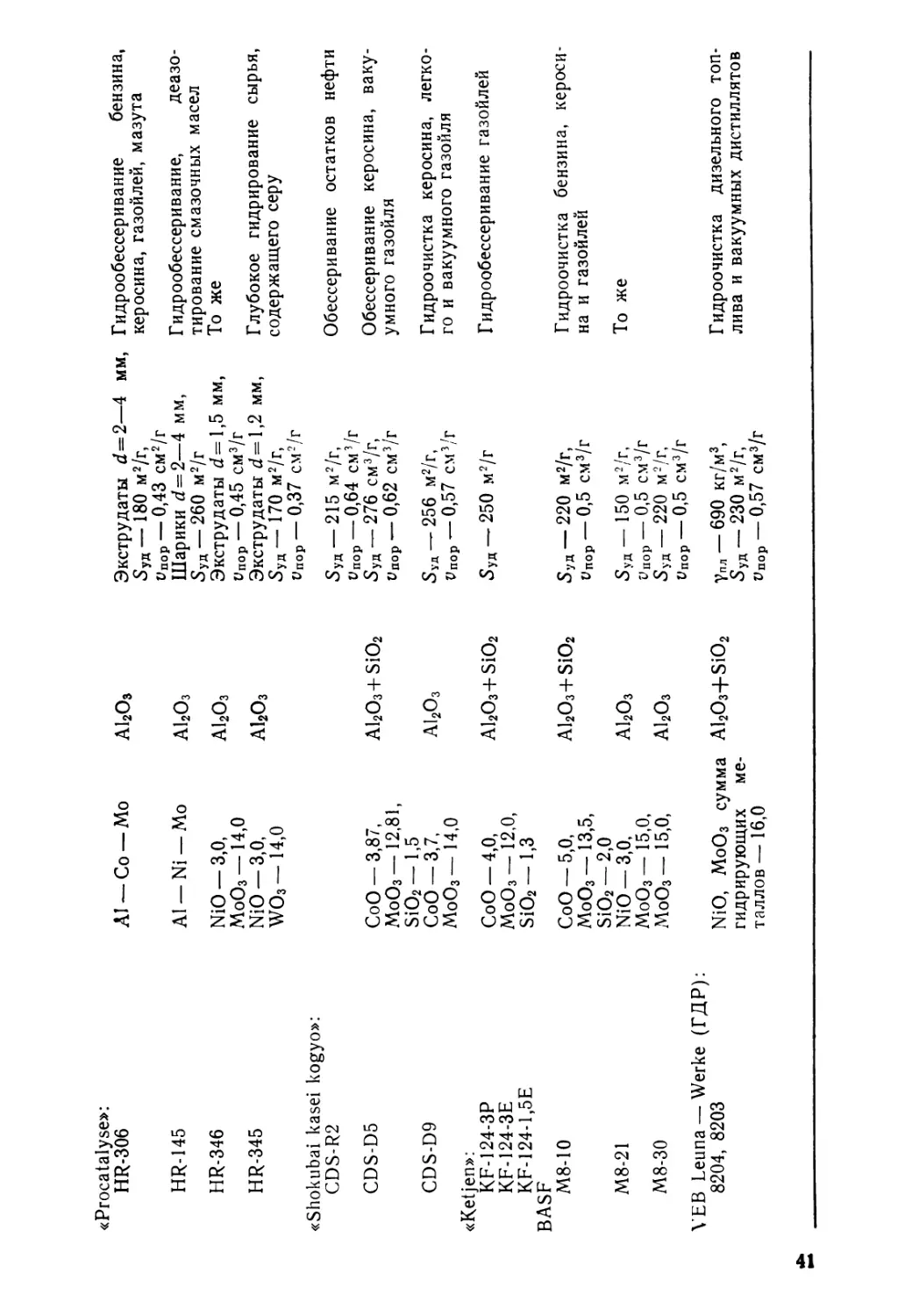
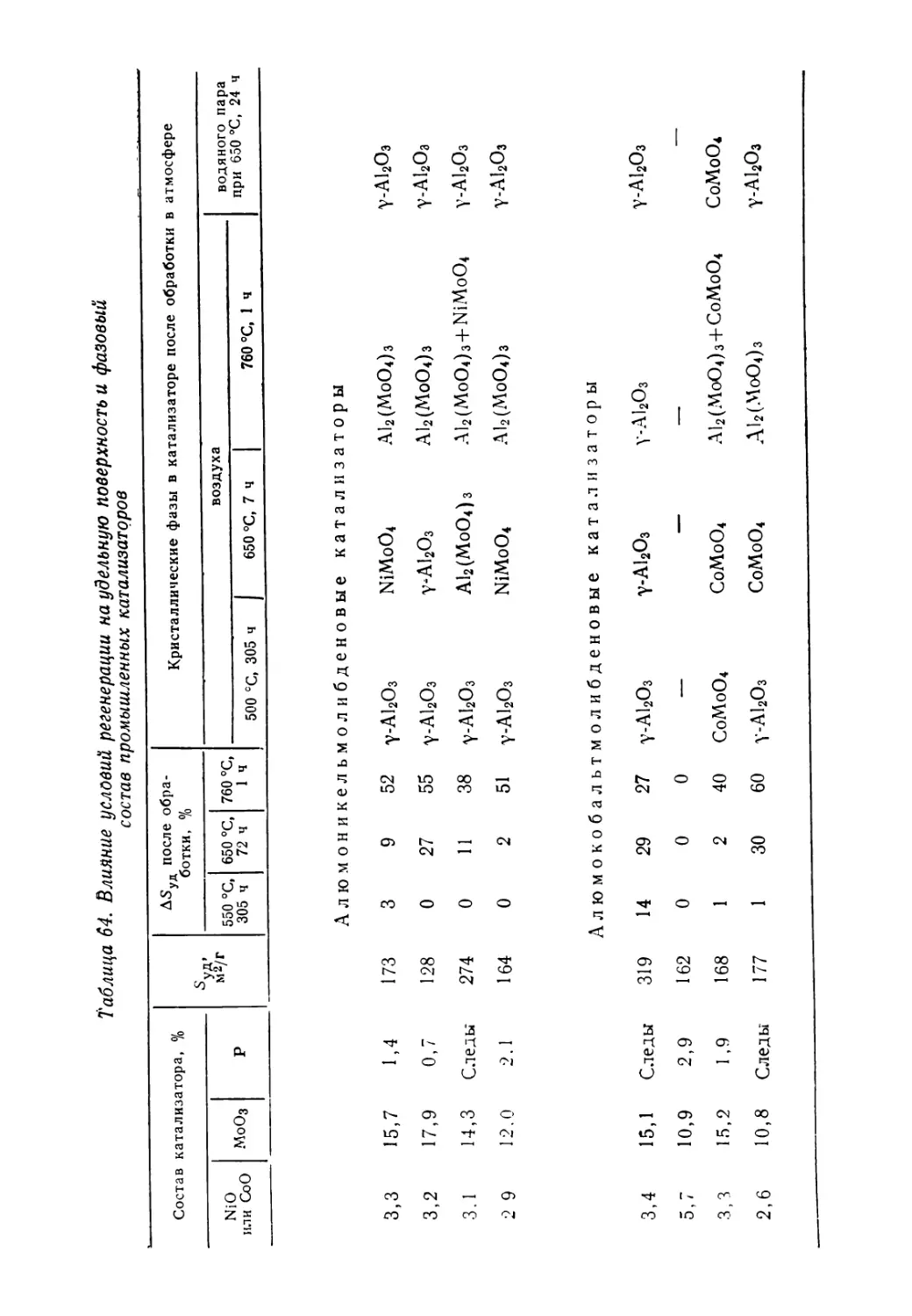
Текст
Е. ДЕАДЧЕНКО, Б.К.НЕФЕДОВ, Р. Р.АЛИЕВ
ПРОМЫШЛЕННЫЕ
КАТАЛИЗАТОРЫ
ГИДРОГЕНИЗАЦИОННЫХ
ПРОЦЕССОВ
НЕФТЕПЕРЕРАБОТКИ
Е.Д.РАДЧЕНКО, Б.К.НЕФЕДОВ, Р.Р.АЛИЕВ
ПРОМЫШЛЕННЫЕ
КАТАЛИЗАТОРЫ
ГИДРОГЕНИЗАЦИОННЫХ
ПРОЦЕССОВ
НЕФТЕПЕРЕРАБОТКИ
МОСКВА«ХИМИЯ» 1987
6П 7.43
Р 159
УДК 665.644.26+665.658.6
Рецензент: нач. отдела катализаторов ВПО «Союзнефте-
оргсиптез» Л. Г. Манатов
УДК 665.644.26+665.658.6
Радченко Е. Д., Нефедов Б. К., Алиев Р. Р. Про-
мышленные катализаторы гидрогенизационных про-
цессов нефтепереработки. М.: Химия, 1987. 224 с.
Описаны современные гидрогенизационные процессы нефтепереработ-
ки — гидроочистка, гидрокрекинг, деароматизация и др. Обобщен отечест-
венный и зарубежный опыт производства промышленных катализаторов,
этих процессов, даны рекомендации по их эксплуатации и регенерации,
а также по контролю качества. Намечены основные тенденции и направ-
ления совершенствования катализаторов с целью улучшения экономиче-
ских показателей процессов и снижения энергетических затрат.
Книга предназначена для инженерно-технических работников нефте-
перерабатывающей и нефтехимической промышленности, а также для спе-
циалистов научных лабораторий, занимающихся вопросами синтеза и
применения катализаторов.
Табл. 64. Ил. 84. Библиогр. список: 355 назв.
2803020300-074
Р 050(01)87 74-87
© Издательство «Химия», 1987 г.
ВВЕДЕНИЕ
Основными направлениями экономического и социального
развития СССР на 1986—1990 годы и на период до 2000 г. пе-
ред нефтеперерабатывающей промышленностью поставлена за-
дача: «...обеспечить дальнейшее углубление переработки нефти
и существенное увеличение выработки моторных топлив, а так-
же сырья для химической, нефтехимической и микробиологиче-
ской промышленности. Расширить выпуск смазочных масел,
улучшить их качество».
Указанная задача может быть выполнена главным образом
за счет использования процессов каталитического крекинга,
гидроочистки, гидрокрекинга, гидрирования, гидроизомеризации
и др. Эти процессы позволяют удалять из нефтяных фракций
гетероатомные соединения и металлы, регулировать углеводо-
родный состав топливных и масляных фракций и тем самым
получать товарные продукты, удовлетворяющие требованиям
современной техники [1].
Широкое применение процесса каталитического риформинга
для получения высокооктановых бензинов и ароматических уг-
леводородов обеспечивает нефтеперерабатывающие заводы
большим количеством водородсодержащих газов (выход водо-
рода до 2% на сырье риформинга), которые стали использовать
в различных процессах переработки нефтяных фракций. Вовле-
чение в переработку сернистых и высокосернистых нефтей,
а также необходимость углубления переработки нефти потре-
бовали расширения использования вторичных процессов пере-
работки нефтяных фракций и в первую очередь тех, в которых
участвует водород, это — гидроочистка, гидрокрекинг и гидри-
рование.
Процессы гидрооблагораживания нефтяных фракций широ-
ко применяют в мировой нефтеперерабатывающей и нефтехи-
мической промышленности. В табл. 1 приведены данные о доле
гидрогенизационной очистки по сравнению с прямой перегон-
кой для ведущих стран мира [2].
Гидрогенизационная очистка нефтяных топлив в значитель-
ной степени вытеснила ранее применявшиеся химические про-
цессы. Преимущества использования водорода для процессов
очистки нефтяных фракций заключаются в более полном уда-
лении серы и других нежелательных примесей, уменьшении
потерь нефтепродуктов и устранении проблем, связанных
с обезвреживанием и сбросом отработанных растворов, а так-
же в обеспечении высокого выхода целевых продуктов.
Гидрокрекинг является универсальным процессом, позволяю-
щим комплексно перерабатывать тяжелые нефтяные фракции
и получать при этом широкий ассортимент продуктов, отвечаю-
щих современным требованиям.
При осуществлении гидрогенизационных процессов проте-
кает ряд последовательных и параллельных реакций: расщеп-
Таблица 1. Доля процессов гидроочистки в различных странах мира
(% от прямой перегонки)
Процесс СССР США Англия Ита- лия Фран- ция Япония ФРГ
Гидроочистка сырья для каталитического риформин- 6,2 19,4 14,5 8,8 11,4 9,0 11,6
Г<1 Гидроочис!ка средних дис- тиллятов 19,2 31,2 20,6 10,6 16,1 15,2 17,3
Г идрообесссриваиие неф- тяных остатков — 10,3 13,3 10,8 14,7 37,5 20,9
ленпе алканов, нафтеновых и олефиновых углеводородов, отрыв
боковых цепей ароматических и алкановых углеводородов, гид-
рогенолиз гетероатомных соединений, гидрирование продуктов
расщепления, изомеризация, уплотнение полупродуктов и кок-
сообразование.
Как правило, гидрогенизационные процессы осуществляются
при повышенном давлении водорода и высоких температурах.
В зависимости от способа осуществления процесса к применяе-
мым катализаторам предъявляют разные требования.
Каталитические свойства различных металлов и их соедине-
ний в гидрогенизационных процессах широко исследованы.
За последние годы как в СССР, так и за рубежом проведены
большие работы по созданию высокоактивных каталитических
систем для гидрогенизационной переработки нефтяных фрак-
ций. Такие работы проводятся и в настоящее время в широких
масштабах. Однако строго научных основ подбора и разработки
каталитических композиций для гидрогенизационных систем
пока еще не создано. Это объясняется, с одной стороны, слож-
ностью состава и взаимным влиянием компонентов, входящих
в состав каталитических систем, с другой — сложностью угле-
водородного и химического состава.
В то же время накопленный опыт и широкие исследования
с применением современной техники позволяют как исследова-
телям, так и производителям катализаторов создавать эффек-
тивные каталитические системы, обеспечивающие высокую ак-
тивность, селективность, а также длительность их работы в про-
мышленных условиях.
В настоящей работе обобщены имеющиеся патентные све-
дения, а также исследования, проведенные авторами по созда-
нию каталитических систем и носителей для них применительно
к катализаторам гидрогенизационной переработки нефтяных
фракций. Авторы надеются, что их труд принесет пользу широ-
кому кругу специалистов в области катализа и нефтеперера-
ботки, занимающихся разработкой каталитических систем и их
применением.
Авторы благодарны за помощь в работе над книгой сотруд-
никам Л. В. Туровской и Н. А. Осокиной.
Глава 1
ОСНОВНЫЕ ГИДРОГЕНИЗАЦИОННЫЕ
ПРОЦЕССЫ НЕФТЕПЕРЕРАБОТКИ
Применение водорода при переработке нефтяных фракций
обеспечивает получение товарной продукции высокого качест-
ва. За последнее время в связи с углублением переработки неф-
ти, а также поступлением на переработку более тяжелых, высо-
косернистых нефтей возникла необходимость расширения ис-
пользования процессов с участием водорода. Гидрогенизацион-
ные процессы отличаются высокой технологичностью и надеж-
ностью в эксплуатации. Их применение позволяет регулировать
углеводородный и фракционный состав перерабатываемых неф-
тяных фракций, удалять из них серо- и азотсодержащие соеди-
нения, улучшать эксплуатационные характеристики нефтяных
топлив, масел и сырья для нефтехимической переработки.
Основными гидрогенизационными ‘процессами, широко рас-
пространенными в промышленности, являются: 1) гидроочистка
нефтяных фракций от серы, азота и кислорода с целью повы-
шения качества продуктов или подготовки к дальнейшей пере-
работке; 2) гидрирование алкенов и ароматических углеводо-
родов, содержащихся в нефтяных фракциях; 3) гидрокрекинг
нефтяных фракций.
В настоящее время известно много модификаций гидрогени-
зационных процессов. Важные характеристики этих процес-
сов— давление, при котором осуществляется процесс, число
ступеней, а также способ применения катализатора (стационар-
ный, движущийся или псевдоожиженный слой). Выбор той или
иной модификации зависит как от характеристики сырья, посту-
пающего на переработку, так и от возможностей катализаторов,
применяемых для переработки данного вида сырья.
В настоящей главе приведены краткие сведения об основ-
ных промышленных гидрогенизационных процессах, условиях
эксплуатации, а также сведения о превращениях углеводородов
при гидрогенизационной переработке. Ознакомление с процес-
сами и их назначением позволит читателям лучше понять тре-
бования, предъявляемые к катализаторам для данных про-
цессов.
1.1. ГИДРООЧИСТКА прямогонных дистиллятов
И СЫРЬЯ ВТОРИЧНОГО ПРОИСХОЖДЕНИЯ
Гидроочистка нефтепродуктов — один из основных процес-
сов нефтепереработки. В процессе гидроочистки в результате
каталитического гидрирования органических соединений удаля-
ются сера и азот. Выбор технологической схемы, параметров
5
процесса и катализатора определяются видом перерабатывае-
мого сырья (его фракционным и групповым составом), химиче-
ским составом присутствующих в нем примесей (соединений
серы, азота, металлов, асфальтенов), а также требованиями
к качеству получаемого продукта.
Известно, что распределение органических соединений серы
и азота по фракциям нефтепродуктов различно. В бензиновых
фракциях прямой перегонки (к.к. 180—200°С) содержится до
0,5% соединений серы, в основном меркаптанов, сульфидов
и тиофенов [3]. В керосиновых фракциях (180—240°C) тиофе-
ны и дисульфиды отсутствуют, а соединения серы (0,2—0,5%)
представлены в основном меркаптанами, нафтеновыми и али-
фатическими сульфидами [4]. В дизельных фракциях (180—
350°С) содержится до 1,5% соединений серы, из которых 98%
составляют сульфиды и тиофены. В масляных фракциях присут-
ствует 0,5—1,5% соединений серы; они представлены примерно
равными количествами сульфидов (в основном, насыщенные
моно- и бициклические соединения с атомом серы в пятичлен-
ном цикле) и тиофенов (бензо- и дибензотиофены) [5].
В вакуумных дистиллятах сера (1,5—2%) представлена
главным образом циклическими соединениями — конденсирован-
ными тиофеновыми углеводородами (тионафтенами, дибензо-
тиофенами, нафтотиофенами, бензонафтотиофенами), а доля
сульфидов и меркаптанов не превышает 10—20% [6]. В про-
дуктах термического и каталитического крекинга присутствуют
в основном тиофеновые соединения [7].
В условиях гидроочистки органические соединения серы
гидрируются до сероводорода и углеводородов. Их реакционная
способность определяется как термодинамическими (прочность
связи С—S), так и кинетическими факторами (изменение ско-
рости гидрогенолиза в присутствии других соединений). Термо-
динамические расчеты показывают, что гидрирование связи
С—S при температурах до 500 °C можно осуществлять прак-
тически полностью без заметной деструкции связей С—С [8].
Алифатические соединения серы (тиолы, дисульфиды), али-
циклические и алкилароматические сульфиды гидрируются в ус-
ловиях гидроочистки полностью и с большей скоростью, чем
ароматические сульфиды и тиофены. В пределах одного класса
соединений скорость гидрирования уменьшается с увеличением
молекулярной массы. По реакционной способности органиче-
ские соединения серы можно расположить в следующий ряд
(в скобках даны относительные скорости гидрирования) [9]:
тиолы (7,0) =дибензилсульфид (7,0) >вторичные алкилсульфи-
ды (4,3—4,4) >*тиоциклопентан и его производные (3,8—
4,1) >нервичные алкилсульфиды (3,2) >производные тиофена
и дпарилсульфиды (1,0—2,0). В присутствии азотсодержащих
соединений скорость гидрогенолиза органических соединений
серы всех классов снижается [10].
Технология процессов гидроочистки нефтепродуктов, техни-
6
ко-экономическая их эффективность, роль и место в современ-
ных схемах переработки нефти обсуждались многими специа-
листами [И —13]. Поэтому в настоящей главе рассмотрены ос-
новные технологические показатели и особенности современных
процессов гидроочистки различных видов нефтяного сырья с тем,
чтобы выявить тенденции их развития и наметить требования
к катализаторам.
1.1.1. ГИДРООЧИСТКА БЕНЗИНОВЫХ ФРАКЦИИ
Гидроочистку прямогонных бензиновых фракций проводят
в основном с целью подготовки сырья для последующего про-
цесса каталитического риформинга, в котором используют вы-
сокоэффективные катализаторы на основе металлов платино-
вой группы. Для этих катализаторов органические соединения
серы являются ядами. Поэтому глубина гидроочистки бензино-
вых фракций должна быть высока: остаточное содержание серы
после гидроочистки не должно превышать 4—5 млн -1 для алю-
моплатиновых катализаторов и 1 млн-1 для биметаллических
катализаторов.
Гидроочистка прямогонных бензинов проводится на алюмо-
кобальтмолибденовых (АКМ) и алюмоникельмолибденовых
(АНМ) катализаторах при температурах 320—360 °C, давлении
3—5 МПа, объемной скорости подачи сырья 5—10 ч-1 и цирку-
ляции водородсодержащего газа 200—500 м3/м3 сырья [11].
Существующая промышленная технология гидроочистки прямо-
гонных бензинов обеспечивает получение качественного сырья
для процесса риформинга. Дальнейшее совершенствование гид-
роочистки будет состоять в интенсификации промышленных
установок и уменьшении энергоемкости за счет повышения
объемной скорости подачи сырья, снижения давления и началь-
ной температуры, уменьшения коэффициента циркуляции путем
подбора специальных, более эффективных катализаторов, а так-
же увеличения их срока службы.
Более сложной является гидроочистка бензинов вторичного
происхождения — каталитического крекинга, коксования, тер-
мического крекинга, доля которых в балансе моторных топлив
будет неуклонно возрастать в связи с углублением переработки
нефти. Бензины каталитического крекинга характеризуются
высоким содержанием ароматических углеводородов (30—45%)
и алкенов (16—40%). Содержание соединений серы в них дос-
тигает 0,15—0,60%. Основная задача гидроочистки этих бен-
зинов— селективное удаление алкенов и в первую очередь не-
стабильных диенов, а также органических соединений серы и
азота, не затрагивая ароматических углеводородов.
Анализ кинетических закономерностей гидрирования модель-
ных смесей олефины — тиофен и бензол — тиофен показывает,
что подбором условий реакции можно обеспечить гидрирование
лишь тиофена, не затрагивая бензола. Добиться достаточно
7
полного гидрогенолиза тиофена без одновременного гидриро-
вания олефинов практически* невозможно [14]. Действительно,
еще в ранних работах было показано, что гидроочистка бензи-
нов крекинга без снижения октанового числа возможна только
при степени гидрообессеривания около 60%. Более глубокое
удаление сернистых соединений (до 80% и выше) сопровожда-
ется снижением октанового числа с 89,7 до 85,0 и менее пунк-
тов [15].
Скорость гидрирования олефинов зависит от их структуры,
используемого катализатора, давления и времени контакта. Ско-
рость гидрообессеривания бензинов каталитического крекинга
до степени ^95% описывается уравнением первого порядка
типа [15]
1п р/р* = kx,
где р — парциальное давление на выходе из реактора; р* — парциальное дав-
ление на входе в реактор; k — константа скорости; т — время контакта.
Установлено, что гидрирование олефинов осуществляется
в верхних слоях катализатора, а гидрогенолиз сернистых соеди-
нений протекает медленно во всем объеме [16]. Гидроочистку
бензинов с высоким содержанием моноолефинов рекомендуют
проводить с предварительной отгонкой низкокипящих соедине-
ний, что позволяет получать после смешения стабильный бен-
зин с содержанием серы до 0,06% без снижения октанового
числа [17]. В результате гидроочистки бензинов, полученных
при крекинге вакуумного газойля туймазинской, ромашкинской
и арланской нефтей, на АКМ катализаторе при 340—360°C,
давлении 2 МПа, объемной скорости подачи сырья 5 ч-1 и цир-
куляции водородсодержащего газа 300 м3/м3 сырья, можно по-
лучить стабильный бензин с выходом 98,5—98,7% и октановым
числом по моторному методу 74—78 [18].
Бензины термических процессов по сравнению с бензинами
каталитического крекинга характеризуются пониженным содер-
жанием ароматических углеводородов и алканов изостроения,
а также качественно иным составом органических соединений
серы. При гидроочистке таких бензинов даже в мягких условиях
(температура 350°C, давление 1 МПа, объемная скорость 5 ч-1,
циркуляция водородсодержащего газа 300 м3/м3) при сравни-
тельно небольшой глубине обессеривания (70—80%) гидрирует-
ся 50—60% алкенов, что снижает октановое число на 4—7 пунк-
тов. Чтобы получить из бензинов термических процессов сырье
для риформинга, рекомендуется следующий режим: температу-
ра 400 °C, давление 4 МПа, объемная скорость подачи сырья
0,5 ч 1 и циркуляция водородсодержащего газа 600 м3/м3 [19].
Для улучшения технико-экономических показателей процес-
са предложено проводить гидроочистку бензинов вторичного
происхождения в смеси с прямогонными, в том числе и с тяже-
лыми дистилляциями фракциями [пат. США 3475327, 1969].
Так, при гидроочистке смеси 70% (об.) прямогонного бензина,
8
3% (об.) бензина коксования, 2% (об.) бензина термического
крекинга, 10% (об.) газойля каталитического крекинга,
8% (об.) атмосферного газойля и 7% (об.) газойля коксования
при температуре 343°C, давлении 3,5 МПа, объемной скорости
подачи сырья 2 ч-1 и циркуляции водородсодержащего газа
89 м3/м3 сырья получено: 10% (об.) бензина с к.к. 71 °C (содер-
жание серы 10~4%), 30% (об.) сырья для риформинга (фрак-
ция 71—177°С, содержание серы 3,5-10“4%) и 25% (об.) ди-
зельного топлива (фракция 177—371 °C, содержание серы
0,12%).
Показано, что суммарная скорость процесса гидроочистки
бензинов термических процессов и каталитического крекинга
также описывается уравнением первого порядка [20]:
lgx/x0 = — k/W,
где xQ и х — концентрация серы (азота) в сырье и гидрогенизате; w — объ-
емная скорость подачи сырья; k— константа скорости.
Скорости гидрирования олефинов и диенов описываются сле-
дующими уравнениями:
1g = V 77 и Т=7Г = *2^н.
где kx и k2 — константы скорости гидрирования олефинов + диенов и диенов
соответственно; fi и f2— доли прореагировавших олефинов + диенов и диенов
соответственно; рн, ро—парциальные давления водорода и олефинов соответ-
ственно; хн — мольная доля водорода на входе в реактор; V — объем газо-
образных реагентов, приведенных к условиям реакции, на объем катализато-
ра в час.
Энергия активации гидрирования сернистых соединений со-
ставляет 15,9 кДж/моль, соединений азота — 83,7 кДж/моль.
1.1.2. ГИДРООЧИСТКА КЕРОСИНОВЫХ ФРАКЦИЙ
Гидроочистка керосиновых фракций как прямогонных, так
и вторичного происхождения преследует цель подготовить сырье
для получения реактивных топлив [21—23], получить качест-
венный осветительный керосин или растворитель. В керосинах
прямой перегонки содержится 10—40% алканов, 20—60% наф-
тенов и 14—30% ароматических углеводородов. В легком га-
зойле каталитического крекинга содержится 60—70% аромати-
ческих углеводородов. Содержание органических соединений се-
ры колеблется в пределах 0,03—1,50%, органических соединений
азота 0,04—0,10% и кислорода 0,10—0,25% [23—24]. В товар-
ных реактивных топливах содержание серы не должно превы-
шать 0,1%, а в осветительных керосинах — 0,05—0,10% [25].
Для гидроочистки реактивных топлив используют специали-
зированные установки типа Л-24-9РТ, а также блоки гидро-
очистки в составе комбинированных установок ЛК-6У Гидро-
обессеривание керосиновых фракций проводят в присутствии
АКМ или АНМ катализатора. Процесс осуществляется при тем-
9
пературе 350—380 °C, давлении 2—4 МПа и объемной скорости
подачи сырья до 10 ч-1 [26]. Степень удаления органических
соединений серы составляет при этом 90—95% [21].
Глубина гидроочистки керосиновых фракций, используемых
затем в качестве сырья для процессов каталитической деарома-
тизации с целью повышения качества реактивных топлив, зави-
сит от выбранной технологии деароматизации. В двухступенча-
тых процессах фирм «Atlantic Richfild», «Shell International»,
«Lummus», UOP на второй ступени для гидрирования арома-
тических углеводородов, как правило, используют катализаторы
на основе металлов VIII группы периодической системы, кото-
рые быстро отравляются соединениями серы. Поэтому на пер-
вой ступени проводят глубокое обессеривание керосиновых дис-
тиллятов до остаточного содержания серы не выше 100 млн-1.
Разрабатываются и одноступенчатые процессы, в которых при-
меняют специальные катализаторы, стабильные к отравлению
сернистыми соединениями.
Кинетические закономерности гидрообессеривания керосино-
вых дистиллятов и бензиновых фракций аналогичны. На при-
мере гидрообессеривания керосиновых фракций троицко-ана-
стасьевской нефти показано, что порядок реакции гидрирования
сернистых соединений по водороду в интервале давлений 3,5—
4,5 МПа близок к нулевому, а реакция протекает во внешне-
диффузионной или переходной области. Экспериментальные дан-
ные хорошо описываются уравнением [27]
dx/dt = [А*Р/( Л* + Р)1“,
или в интегральной форме
(1—а) . , । (1—ос)
х = (а — 1) k*i + х0
где х— суммарная концентрация сернистых соединений; k*— истинная кон-
станта скорости реакции; 0 — коэффициент массопередачи; а — порядок ре-
акции по сере.
Энергия активации реакции гидрирования сернистых соеди-
нений керосиновых фракций составляет 71,2 кДж/моль, а=1,11.
1.1.3. ГИДРООЧИСТКА ДИЗЕЛЬНЫХ ФРАКЦИЙ
Малосернистые дизельные топлива с улучшенными эксплуа-
тационными характеристиками получают гидроочисткой как
прямогонных фракций [11, 28], так и сырья вторичного проис-
хождения [29]. Повышенный интерес в последние годы к раз-
витию процессов гидроочистки средних дистиллятов связан
с увеличением объема переработки сернистых и высокосерни-
стых нефтей, а также с широкой дизелизацией транспортных
средств.
Прямогонные дизельные фракции подвергают гидроочистке
без заметного изменения нх группового и фракционного состава
при температуре 350 400'С, давлении 3- 4 МПа, объемной
10
скорости подачи сырья 2—5 ч~! и циркуляции водородсодержа-
щего газа 300—600 м3/м3 сырья. Степень гидрообессеривания
при этом составляет 85—95%. Наиболее полно удаляются мер-
каптаны («86%), сульфиды («86%) и дисульфиды («88%)
[29]. В зависимости от вида сырья, активности примененного
катализатора и жесткости процесса расход водорода в процессе
гидроочистки дизельных фракций колеблется от 0,16 до 0,45%,
из которых только «50% расходуется на гидрирование серни-
стых соединений [2]. На глубину и скорость реакции гидриро-
вания сернистых соединений среднедистиллятных фракций за-
метное влияние оказывают давление, температура и отношение
водород : сырье.
При понижении парциального давления водорода в системе
до 3,0 МПа снижается глубина гидрирования сернистых соеди-
нений и алкенов, а также сокращается срок службы катализато-
ра из-за повышения скорости отложения кокса. При подъеме
температуры процесса скорость гидрообессеривания возрастает,
однако снижается селективность, увеличивается выход газа
и бензина, повышается расход водорода и уменьшается общий
срок службы катализатора. Отношение водород : сырье влияет
на продолжительность контакта сырья с катализатором и на ис-
паряемость сырья.
В настоящее время более 80% дизельных фракций в СССР
подвергается гидрооблагораживанию, при этом выпуск дизель-
ных топлив с содержанием серы 0,2—0,5% достигает 90% об-
щего объема. В табл. 2 приведены технико-экономические пока-
затели промышленных установок гидроочистки дизельных топ-
лив [2].
В связи с увеличением потребностей народного хозяйства
в дизельном топливе приобретает особую актуальность пробле-
ма получения качественных дизельных топлив из дистиллятов
вторичного происхождения: продуктов каталитического крекин-
га, замедленного коксования, висбрекинга, термоконтактного
крекинга. Это сырье характеризуется более высоким по сравне-
нию с прямогонными дистиллятами содержанием сернистых и
азотистых соединений, смолистых веществ, алкенов и аромати-
ческих углеводородов [30]. При переработке такого сырья
с целью получения малосернистых дизельных топлив необходи-
мо проводить его гидрооблагораживание, направленное на уда-
ление сернистых и азотистых соединений, смолистых веществ,
а также на гидрирование значительного количества ароматиче-
ских соединений и алкенов.
Гидроочистка газойля каталитического крекинга [фр. 200—
350°С, содержание серы «1,5%, сульфирующихся соединений
47% (об.), иодное число 47 г 12/100 г, цетановое число 37] эф-
фективно протекает на АКМ катализаторе при температуре
380°C, давлении 2—4 МПа и объемной скорости подачи сырья
1 ч-1. Степень гидрообессеривания при этом достигает 90%.
Однако для повышения цетанового числа до 42—45 на этом ка-
11
Таблица 2. Технико-экономические показатели промышленных установок
гидроочистки дизельных топлив
Показатель Л-24-5 Л-24-6 Л-24-7, ЛЧ-24-7 ЛК-6У ЛЧ-24-2000
Мощность ПО сы- 900 900 1200 2000 2000
рыо, тыс. т в год* 1000—1200 1200—1450 1500—1900 । 2000 2000
Давление в реак- торе, МПа Температура в ре- акторе, °C 3,0—3,6 2,8-3,7 2,8—4,0 5,2-5,5 5,0
340—400 340—400 340—400 350—400 360—400
Кратность цирку- ляции водородсо- держащего газа, м3/м3 сырья 250-300 250—300 200—350 350—500 250
Объемная скорость подачи сырья, ч-1 Содержание се- ры, %: 2,2—2,5 3,0—5,0 3,0-5,0 4,3 4,5
в сырье 0,6—1,2 0,6-1,6 0,6-1,6 0,6—1,6 0,8
в продукте Расход на 1 т сырья: 0,1—0,15 0,1-0,20 0,1—0,20 0,12—0,16 . 0,15
пар, МПа — 4,20 6,06 3,15—4,50 1,19
электроэнер- гия, МДж — 72,2 54,8 38,0 39,4
охлаждающая вода, м3 — 8,4 8,0 0,47 1,27
катализатор, кг — 0,04 0,018 0,0086 0,0086
газ, м3 — 4,2 7,5 2,1—5,2 9,64
мазут, кг — 19,4 14,0 5,8—14,4 —
* В числителе — проектные данные, в знаменателе — фактические.
тализаторе необходимо увеличить давление до 13—14 МПа [31].
Более пригодны для получения дизельного топлива дистилля-
ты замедленного коксования [29]. Так, летнее дизельное топли-
во с цетановым числом 57 и выше получено из фракций 160—
338 и 200—350°C дистиллятов замедленного коксования в ре-
зультате гидроочистки, проводимой при температуре 350 °C,
давлении 5 МПа, объемной скорости подачи сырья 1 ч-1 и цир-
куляции водородсодержащего газа 400 м3/м3 сырья. С повыше-
нием температуры до 380 °C объемную скорость можно увели-
чить до 1,5—2 ч-1, а давление снизить до 3 МПа.
Эффективность гидрооблагораживания сырья вторичного
происхождения в чистом виде можно повысить за счет подбора
катализатора. Однако более целесообразно гидрооблагоражи-
ванпе дизельных фракций вторичного происхождения проводить
в смеси с прямогонными дистиллятами. При гидроочистке сме-
сей газойлей замедленного коксования (до 30%) и прямогон-
ных фракций дизельного топлива западносибирской нефти в ус-
ловиях промышленной установки (360—380°C, давление 3—
12
4 МПа, объемная скорость подачи сырья до 4 ч-1, циркуляция
водородсодержащего газа до 300 м3/м3 сырья) на специальном
АКМ катализаторе степень гидрообессеривания достигала 95%
и возрастала до 98% при увеличении давления до 8 МПа [29].
Аналогичные результаты получены при гидроочистке смесей
прямогонных фракций и газойлей термоконтактного крекинга.
Процесс гидроочистки вторичного сырья характеризуется
повышенным тепловым эффектом (209,4 кДж на 1 кг сырья при
содержании в смеси 30% газойля замедленного коксования)
за счет гидрирования алкенов. Поэтому при разработке техно-
логии процесса гидроочистки дистиллятов вторичного проис-
хождения важным моментом, кроме подбора специального эф-
фективного катализатора, является обеспечение теплового режи-
ма реактора.
1.1.4. ГИДРООЧИСТКА ВАКУУМНЫХ ДИСТИЛЛЯТОВ
Вакуумные дистилляты (газойли) являются сырьем для про-
цессов каталитического крекинга, гидрокрекинга, получения
электродного кокса. Для повышения выхода и улучшения каче-
ства продуктов, полученных указанными процессами, и с целью
уменьшения загрязнения окружающей среды оксидами серы
все большая доля вырабатываемых вакуумных газойлей под-
вергается гидроочистке. Эффективность процесса гидроочистки
вакуумного газойля во многом определяется качеством исходного
сырья и требованиями к качеству продуктов для последующих
процессов.
Качество вакуумных газойлей определяется глубиной отбора
и четкостью ректификации мазута. Вакуумные дистилляты
с температурой конца кипения 500°C практически не содержат
металлорганических соединений и асфальтенов, а их коксуе-
мость не превышает 0,2%. С повышением /к.к. до 540—560 °C
коксуемость возрастает в 4—10 раз, содержание металлов —
в 3—4 раза, содержание тяжелых полициклических углеводоро-
дов— в 1,5—4 раза, серы — на 20—45% (табл. 3) [2]. Влияние
содержащихся в сырье металлов, азотистых соединений, серы
проявляется в снижении активности и стабильности работы ка-
тализатора за счет отложения кокса и необратимого отравления
металлами.
Гидроочистка вакуумного газойля с ^к.к. до 500°C не пред-
ставляет значительных трудностей и проводится в условиях
и на оборудовании, аналогичных для гидрообессеривания сред-
них дистиллятов [30]. При давлении 4—5 МПа, температуре
360—410 °C и объемной скорости подачи сырья 1 —1,5 ч-1 дос-
тигается 89—94%-я степень обессеривания; содержание азота
снижается на 20—35%, металлов — на 75—85%, ароматических
углеводородов — на 10—12%, коксуемость—на 65—70% [2].
Суммарная скорость реакции гидрообессеривания в зпачи-
13
Таблица 3. Характеристика вакуумных газойлей, полученных из типичных
нефтей СССР
Показатель Ромаш- кинская нефть Западносибирская нефть Арланская нефть
350-500 °C 350—500 °с| 350—540 °C 350—500 °с| 350—540 СС
Выход на нефть, % 21-23 23-24 29 23,5 29-33,5
Плотность, кг/м3 Элементный состав, %: 908,4 915,0 923,4 928,5 934,0
С 85,80 86,11 86,10 84,88 84,88
Н 12,10 12,18 12,11 12,10 11,96
N 0,10 0,11 0,14 0,13 0,15
S 2,00 1,60 1,73 2,89 3,03
Коксуемость, % Групповой углеводородный состав, %: 0,20 0,18 0,80 0,45 1,05
парафино-нафтеновые 45,3 38,1 36,0 35,2 32,6
ароматические 51,5 57,8 57,9 60,0 61,0
Смолы, % Содержание металлов, 10-4 %: 3,2 4,1 6,1 4,8 6,4
никель 0,31 0,30 0,60 0,34 0,60
ванадий 0,46 0,40 1,00 0,50 1,40
тельной степени зависит от массопередачи (впутридиффузион-
ное торможение в гранулах) и достаточно удовлетворительно
описывается уравнением второго порядка [31, 32]. С повыше-
нием температуры конца кипения сырья скорость гидрообессе-
ривания снижается: степень обессеривания 80% вакуумного га-
зойля с Лек. = 470°C достигается при объемной скорости в 1,5 ра-
за большей, чем вакуумного газойля с tK.K. = 540 °C, а константа
скорости реакции снижается в 1,7 раза (с 12,6 до 7,6) [31].
Хороший результат при гидроочистке вакуумных газойлей
с повышенной коксуемостью и содержанием металлов выше
1—2 г/т дает метод предварительной гидроподготовки на спе-
циальном катализаторе [32]. Малосернистое котельное топливо
с содержанием серы 0,3—0,7% можно получить гидрообессери-
ванием вакуумного газойля (фр. 350—520°C, содержание серы
2%, коксуемость 0,25%) или газойлей термокоптактного крекин-
га (фр. с /к.к. 4854-520°C, содержание серы 2,0—3,5%) или из
их смесей при давлении 5—10 МПа, температуре 360—390°С
и объемной скорости подачи сырья I ч-1 [33].
Гидроподготовка тяжелых вакуумных дистиллятов вторич-
ного происхождения (тяжелые газойли замедленного коксова-
ния, висбрекинга, термоконтактного крекинга) с целью их вов-
лечения в переработку в качестве сырья для получения светлых
нефтепродуктов имеет некоторые особенности по сравнению
с гидроподготовкой дистиллятного сырья. Вторичные тяжелые
газойлевые фракции характеризуются высоким содержанием
серы, азота, ароматических углеводородов и алкенов, повышен-
ной коксуемостью и содержанием металлов (табл. 4). Поэтому
14
Таблица 4. Характеристика дистиллятов вторичного происхождения,
полученных в процессах термоконтактного крекинга гудрона
высокосернистых нефтей (I), замедленного коксования (II)
и термоконтактного крекинга (III) западносибирской нефти
Показатель I II ш
Плотность, кг/м3 931 911 884
Фракционный состав, °C: н. к. 305 210 186
10% 342 242 204
50% 409 278 250
90% 480 312 324
к. к. 506 328 346
Содержание сульфирующихся углеводородов, 58,0 58,5 57,5
% (об.)
Элементный состав, %:
С 84,80 86,72 89,98
Н 11,80 11,10 10,95
N 0,20 0,08 0,07
S 3,20 2,10 2,00
Групповой углеводородный состав, %:
парафино-нафтеновые 36,0 24,0 15,6
ароматические 60,0 59,1 37,3
непредельные — 16,9 47,1
Коксуемость, % 0,7 — —
для получения качественного сырья каталитического крекинга
или гидрокрекинга такие газойли лучше перерабатывать в сме-
си с вакуумными дистиллятами в количестве до 30%. В этом
случае при температуре 370—380 °C, давлении 4—5 МПа и
объемной скорости подачи сырья 1 ч-1 можно получить ста-
бильный гидрогенизат с содержанием серы 0,10—0,25% и кок-
суемостью 0,10—0,13%.
Если тяжелые газойли вторичных процессов используют
в качестве сырья для получения технического углерода, то в
процессе их гидроподготовки необходимо удалить только соеди-
нения серы и азота, не затрагивая ароматических углеводоро-
дов. Такую задачу можно решить подбором специального ката-
лизатора и условий процесса [34, 35].
1.1.5. ГИДРООЧИСТКА НЕФТЯНЫХ ОСТАТКОВ
Каталитическая переработка нефтяных остатков (мазутов
и гудронов), потенциальное содержание которых достигает 46—
56% нефти, представляет несомненный интерес в решении
проблемы углубления переработки нефти. Так, повышение от-
бора светлых нефтепродуктов всего на 1% за счет переработки
остатков по сравнению с традиционной переработкой при вы-
работке одинакового объема топлив эквивалентно добыче и пе-
реработке дополнительно 5—6 млн. т нефти [30]. Эффективная
переработка остатков сернистых нефтей должна сочетать воз-
15
Таблица 5. Характеристика остатков западносибирских нефтей
Показатель Вакуумный дистиллят Мазут Гудрон
Выход на нефть, % Содержание, %: 24 47 23
серы 1 ,7 2,2 2,7
азота 0,1 0,3 0,4
никеля (млн-1) 0,5 2,9 57,0
ванадия (млн-1) 0,5 58,0 114,0
асфальтенов Отсутствие 2,2 4,4
Коксуемость, % 0,2 8,6 17,2
можность получения качественных моторных топлив и малосер-
нистого котельного топлива или малосернистого кокса. При
этом, однако, необходимо учитывать ряд факторов: состав ис-
ходной нефти, номенклатуру требующихся нефтепродуктов, от-
работанность технологии и эффективность имеющихся катали-
заторов.
По сравнению с дистиллятным сырьем нефтяные остатки ха-
рактеризуются более высокой плотностью, повышенной коксуе-
мостью, содержанием органических соединений серы, азота, ме-
таллов, асфальтенов, нефтяных смол, золы. В качестве примера
в табл. 5 приведена характеристика остатков западносибирских
нефтей [30].
Для переработки нефтяных остатков в малосернистое котель-
ное топливо предложены следующие методы «непрямого» гид-
рообессеривания [36]:
вакуумная перегонка мазута с последующим обессериванием
вакуумного газойля и смешение последнего с гудроном (содер-
жание серы в котельном топливе 1,4—1,8%);
вакуумная перегонка мазута и деасфальтизация гудрона
с последующим обессериванием вакуумного газойля и деасфаль-
тизата и смешением их с остатком деасфальтизата (содержание
серы в котельном топливе 0,4—1,4%);
вакуумная перегонка мазута и деасфальтизация гудрона
с последующим гидрообессериванием вакуумного газойля и де-
асфальтизата и их смешением (содержание серы в котельном
топливе 0,2—0,3%, остаток деасфальтизации в котельное топли-
во не поступает и подвергается газификации).
Однако в современных схемах нефтеперерабатывающих пред-
приятий наиболее часто применяют прямое гидрообессеривание
мазута или раздельную каталитическую переработку вакуумно-
го дистиллята и гудрона. Прямое гидрообессеривание нефтяных
остатков проводят при температуре 370—427°C, давлении 10—
15 МПа и объемной скорости подачи сырья около 0,5 ч-1.
В промышленности реализованы модификации процесса со ста-
ционарным, движущимся или псевдоожиженном слоем катали-
затора [37]. В табл. 6 приведена характеристика процессов
z >-J5’.
Таблица 6. Характеристика процессов прямого гидрообессеривания
остатков (мазутов) со стационарным слоем
Процесс, фирма Содержание серы в мазу- те, % Целевой продукт
Resid — HDS, «Gulf Research» 3,5-4,5 Фракция 190 °C и выше (S = 0,3%)
RDS — Isomax, «Shevron Research» 3,0 Фракция С5 и выше (S=0,5%)
RCD — Unibon, «Universal Oil Pro- ducts» 4,2 Котельное топливо (S = = 0,3%)
«Shell International Research» 4,0 Фракция 165 °C и выше (S = 0,5%)
Institut Fragais du Petrole 4,0 Фракция 204 °C и выше (S = 0,5%)
Ultrafining, «Standart Oil» 4,5 Котельное топливо (S = = 0,55%)
Unicracking, «Union Oil» 3,8 Фракция 191 °C и выше (S = o,3%)
«British Petroleum» 4,0 Фракция 177 °C и выше (S = 0,5%)
гидрообессеривания нефтяных остатков со стационарным слоем
катализатора, осуществленных зарубежными фирмами [37].
Например, по технологии фирмы «Gulf» гидропереработке под-
вергается мазут с содержанием серы 3,5—4,5% и металлов
(Ni-j-V) 60 млн-1. Выход котельного топлива составляет 97—
99% с содержанием серы до 0,3%. Расход водорода колеблется
в пределах 92—156 м3/м3 сырья, расход катализатора составляет
1,43 кг/м3 сырья при переработке мазута или 3,86 кг/м3 при пе-
реработке гудрона.
В качестве примера возможной переработки нефтяных ос-
татков нефтей СССР в котельное топливо марок М-40 и М-100
в табл. 7 приведены данные опытно-промышленных испытаний
с использованием мелкосферического АКМ катализатора
[38].
Процесс с трехфазным псевдоожиженным слоем, например,
процесс Н—Oil фирмы «Hydrocarbon Research» или японский
процесс с коаксиальным двухтрубным реактором отличается
большей гибкостью, чем процесс со стационарным катализато-
ром, позволяет перерабатывать остаточное сырье с содержа-
нием металлов 0,04% и выше даже без предварительной подго-
товки (обессоливания и фильтрования) сырья [37—39]. Сниже-
ние активности катализатора компенсируется его регулярным
обновлением без нарушения технологического режима. Расход
катализатора при этом составляет 0,09—0,11 кг на 1 т сырья
[40].
Исследование кинетических закономерностей процесса гидро-
обессеривания мазутов показало, что скорость реакции описы-
вается уравнением второго порядка [38, 41]
2—922
Таблица 7. Показатели процесса переработки остатков нефтей
в котельное топливо на АКМ катализаторе [35]
Показатель Мазут ро- машкинской нефти Гудрон ромаш- кинской нефти Гудрон арланской нефти Гудрон западно- сибирской нефти
Характеристика сырья
Содержание, %:
углерод 85,38 35,76 83,65 85,34
водород 11,13 10,8 10,62 11,19
азот 0,25 0,40 0,46 0,42
сера 2,58 3,08 4,0 2,48
кислород 0,18 0,20 1,28 0,57
ванадий (г/т) 98 216 250 90
никель (г/т) 40 150 100 20
асфальтены 7,15 14,7 17,3 —
смолы 9,2 26,2 16,4 —
механические примеси и зола 0,096 0,194 0,324 —
Коксуемость, % 8,38 18,52 16,20 10,19
Показатели процесса
Расход водорода, % 1,0—1,2 1,4 1,3 1,1
Марка топлива М-40 М-100 М-40 М-40 М-40
Расход топлива, % 96,7 94,1 92,7 91,0 94,3
Качество продукта
Содержание серы, % 1,02 0,98 0,47 1,0 0,95
Зольность, % 0,018 0,06 — 0,08 0,05
Коксуемость, % 5,4 7,5 6,6 8,3 5,9
Температура застывания, °C 4-6 +13 — 1 +2 +5
1/хк = 1/Лн + k/w,
где хк и хн — конечное и начальное содержание серы; w — объемная скорость
подачи сырья; k — константа скорости реакции.
Зависимость константы скорости удаления серы от темпера-
туры подчиняется уравнению Аррениуса [41]:
k= 10,55— 10 800/(27).
Кажущаяся энергия активации гидрообессеривания мазутов
арланской и смеси татарских нефтей при 10 МПа составляет
2,5 кДж/моль. По другим данным, энергия активации гидро-
обессеривания мазутов аравийской и иранской нефтей состав-
ляет 5,0—7,0 кДж/моль. Константа скорости реакции линейно
возрастает с повышением давления в пределах 5—20 МПа.
Для мазута арланской нефти найдена следующая зависимость
138, 42]
, 1 , ч 0,704-0,72
^1/^2 = (Р1/Р-)
Скорость обессеривания мазутов из различных нефтей зави-
сит, главным образом, от содержания асфальтенов в сырье, что,
no-видимому, связано с их ингибирующим действием и присут-
ствием трудноудаляемых соединений серы, содержащихся в ас-
фальтенах.
18
Зависимость между константой скорости и содержанием ас-
фальтенов в сырье можно представить уравнением
lg k = —h »
где xa — содержание асфальтенов в сырье; аь Ь\—.константы, зависящие от
используемого катализатора и условий реакции; k — константа скорости.
В случае мазутов, полученных из одной и той же нефти,,
но с различными пределами выкипания, справедлива другая
зависимость:
lgfe= a2lgi/ + Ьг,
где у — выход мазута в % на нефть; д2, Ь2— константы, зависящие от сырья,
условий реакции и катализатора.
Одновременно с обессериванием протекают и другие реак-
ции: удаление азота, асфальтенов, смол и частичная деструк-
ция сырья; между ними существует взаимозависимость. Об этом
свидетельствуют значения коэффициента корреляции: степень
обессеривания — степень удаления асфальтенов — 0,95, азота —
0,92, снижение коксуемости — 0,93. Константы скорости удале-
ния серы, азота, асфальтенов и уменьшения коксуемости, рас-
считанные по уравнению второго порядка при давлении 15 МПа
и температуре 380°С, соотносятся как 1,46:0,26 1,15:0,45.
Не существует прямой взаимосвязи между реакциями уда-
ления серы и деструкции сырья, так как глубина деструкции
сырья определяется не столько разрывом связи С—S, сколько
связи С—С. Для описания кинетики реакции деструкции наибо-
лее приемлемо уравнение первого порядка с торможением про-
дуктами реакции, предложенное А. В. Фростом. Аналитические
зависимости константы скорости деструкции от температуры
выражаются следующими уравнениями [41]:
для мазута арланской нефти k = 23,20 — 29300/(27);
для мазута смеси татарских нефтей k 26,85 — 33 300/(27).
Найдена прямолинейная зависимость между степенью гид-
роочистки мазута и степенью удаления ванадия:
Cv = 0,32 + 0,583Cs,
где Су—количество удаляемого из сырья ванадия, %; Cs — количество
удаляемой из сырья серы, %.
При одинаковой степени обессеривания на крупнопористом
катализаторе асфальтены и металлы удаляются более полно,
чем на мелкопористом. При этом снижение содержания ванадия
почти пропорционально степени удаления серы. Порядок реак-
ций удаления асфальтенов и металлов может быть первым или
вторым в зависимости от условий [41]. Энергия активации
удаления асфальтенов, ванадия и никеля равна соответственно
67,0, 81,6 и 108,0 кДж/моль.
Основным недостатком всех процессов прямого гидрообессе-
ривания остатков является быстрая дезактивация катализато-
2*
19
Таблица 8. Влияние концентрации металлов на физико-химические
свойства катализатора после окислительной регенерации
I кжазатель Время от начала работы, ч
0 1 1001 240 350 450 | 1000 | 1750 | 2700
Содержание углерода на ка- тализаторе до регенерации, % Содержание металлов, %: 0 12 21 12 13 18 21 21
V — 0,7 1,5 3,1 3,8 4,8 8,5 11,7
Ni — 0,2 0,7 1,3 1,5 1,7 2,6 3,2
Na 0,1 0,4 0,5 0,6 0,5 0,5 1,7 1,8
Fe 0,1 0,2 0,3 0,5 1,0 1,3 1,1 1,3
Насыпная плотность, кг/м3 700 700 720 810 830 850 1120 1170
Удельная поверхность, м2/кг 160 135 130 99 96 93 70 65
Объем пор, см3/г 0,38 0,32 0,31 0,22 0,22 0,21 0,17 0,15
Средний радиус пор, нм 4,6 4,8 4,7 4,5 4,5 4,4 4,8 4,6
Степень обессеривания, % 82 80 76 69 66 62 45 39
Относительная активность 1,00 0,98 0,94 0,84 0,81 0,76 0,55 0,48
ров из-за отложения в них кокса и металлов [41, 42]. В сред-
нем срок службы катализатора в стационарном слое составляет
6 мес— 1 год при содержании металлов в сырье 100—150 млн-1
[43].
Влияние металлов и их концентрации в сырье на активность
АКМ. катализатора в процессе гидрообессеривания мазута ар-
ланской нефти при температуре 360—425 °C, давлении 10—
15 МПа, объемной скорости подачи сырья 0,5—1,0 ч-1 и цирку-
ляции водорода 1000 м3/м3 сырья показано в табл. 8 [44]. После
окислительной регенерации гидрообессеривающая активность
катализатора не восстанавливается. Показано, что отравляю-
щее действие V и Ni усиливается при увеличении содержания
натрия в катализаторе.
Обратимая дезактивация катализаторов в результате отло-
жения кокса зависит от содержания в сырье асфальтенов
и смол. В работе [45] показано, что с увеличением степени де-
асфальтизации сырья активность и стабильность катализатора
возрастают, а коксообразование снижается. Следовательно, для
улучшения технико-экономических показателей процессов пере-
работки нефтяных остатков необходимо проводить предвари-
тельную подготовку сырья с целью снижения в нем содержания
металлов, асфальтенов и смол. Введение в технологию гидро-
обессеривания нефтяных остатков стадии деметаллизации (кон-
тактная деметаллизация, термическое разложение металлорга-
ничсскнх соединений, обработка растворителями в присутствии
адсорбентов) [46] позволяет снизить расход катализатора гид-
рообессеривания в 3—5 раз.
Гидроочистка гудронов представляет более сложную задачу,
чем гидроочистка мазутов. ("одержи и не соединений азота, ме-
таллов и асфальтенов в гудронах значительно выше, чем в ма-
зутах. Эффективная переработка такого сырья в моторные топ-
20
лива, малосернистое котельное топливо или в сырье для после-
дующей каталитической переработки, по-видимому, возможна
с помощью комбинированного процесса гидрообессеривания,
проводимого при давлении 15—20 МПа в псевдоожиженном слое
катализатора с предварительной деметаллизацией [47] или де-
асфальтизацией [48] сырья. Так, процесс переработки гудрона,
имеющего температуру кипения выше 540°C, с предваритель-
ной деметаллизацией осуществляют при давлении 15 МПа и
температуре 400—420 °C. При этом получают [30]:
бензиновую фракцию н.к.— 160 °C (выход 6,3%, содержание
серы 0,02%, иодное число 3,45 г 12/100 г);
дизельную фракцию 160—350°С (выход 20,8%, содержание
серы 0,9%, температура застывания —32 °C);
сырье для каталитической переработки — фракция 350—
450°C (выход 20,9%, содержание серы 0,4%, ванадия— 1 млн-1,
никеля 0,5 млн-1, коксуемость 0,12%);
сырье коксования — фракция, выкипающая выше 450 °C (вы-
ход 47,8%, содержание серы 0,66%, ванадия 24 млн-1, никеля
17 млн-1, коксуемость 12%);
малосернистое котельное топливо (выход 89,5%, содержание
серы 0,5%).
Процесс переработки гудрона с предварительной деасфаль-
тизацией можно проводить на стационарном катализаторе. Ка-
чество деасфальтизатов гудронов западносибирских и арланской
нефтей показано в табл. 9.
Таблица 9. Качество деасфальтизатов гудронов западносибирских
и арланской нефтей
Показатель Деасфальтизиро- ванный гудрон Показатель Деасфальтизиро- ванный гудрон*
западно- ардапской сибирских „сфти нефтей 4 западно- арланской сибирских нефти нефтей
Выход на исход- 90 85 ный гудрон, % Плотность, кг/м3 978 982 Коксуемость, % 9,8 11,0 Содержание, %: серы 2,6 4,0 асфальтенов 0,8 0,8 ванадия, 10~4 80 160 никеля, 10-4 90 60 Молекулярная мае- 630 626 са Групповой угле- водородный со- став: парафино- 15,0/0,06 13,5/0,11 нафтеновые моноаромати- 18,0/1,6 15,2/2,49 ческие ди- и триаро-34,7/3,2 37,5/4,9 матические смолы бен- 15,8/3,6 11,5/5,3 зольные смолы спирто- 15,6/3,8 21,5/5,5 бензольные асфальтены 0,9/3,3 0,8/5,8
* В числителе — содержание углеводородов, в знаменателе — концентрация
серы, %.
21
При исследовании кинетики гидрообессеривания деасфальти-
затов в изотермических условиях (температура 360—420°C, дав-
ление 14,7 МПа, объемная скорость 0,5—8 ч-1, кратность цирку-
ляции Нг—1000 м3/м3, длительность опыта 300 ч) показано, что
наиболее полно процесс описывается моделью двух параллель-
ных реакций первого порядка (для легко- и трудноудаляемой
серы) [42, 49]
x/Xq = d exp (—k^x) 4- (1 — a) exp (—A?2t) , nr = n2 ~ 1;
или моделью реакции второго порядка [42, 49]:
l/x"”1 = 1/V"1 + (п — 1) kx\ п > 1,
где х, %о — концентрация серы в гидрогенизате и исходном сырье; т — время
контакта; a — доля легкоудаляемой серы; п — порядок реакции.
Доля легкоудаляемой серы составляет для деасфальтизатов-
западносибирских нефтей «64% и арланской нефти «71%.
Срок службы известных катализаторов гидрообессеривания
гудронов (стоимость катализатора — основная статья расхода
при эксплуатации промышленной установки [50]) составляет
7—11 мес при относительно невысокой (65—75%) глубине обес-
серивания и жестком ограничении по содержанию металлов
в сырье (54-12-10"4%) [51].
1.2. ГИДРООЧИСТКА МАСЕЛ И ПАРАФИНОВ
Гидроочистка масляных фракций служит для улучшения их
качества, в частности таких характеристик, как стабильность,
цвет, деэмульгируемость и коксуемость. Этот процесс нашел
широкое распространение как в Советском Союзе, так и за ру-
Таблица 10. Сравнительные результаты контактной доочистки
и гидроочистки масел
Показатель Сырье Продукт после доочистки Сырье Продукт после доочистки
контакт- ной гидриро- ванием гидриро- ванием
Вязкость кинематиче- ская, мм2/с: при 50 °C при 100 °C Индекс вязкости Содержание серы, % Тсмпера 1 \ ра, пк'1 ывапия вспышки Коксуемость, % Цвет, ед. ЦИТ Дистиллятное I масло И-2 0 19,83 20,05 20,63 5,01 5,00 5,00 84 84 85 1,0 1,0 0,6 18 18 17 186 186 187 0,15 0,10 0,06 3.5 3.0 2,0 Остаточное масло МС-2 0 21,63 21,40 21,10 84 «4 86 1,0 1,0 0,7 16 —16 —15 223 223 256 0,60 0,53 0,43 4,5 4,0 3,0
22
Таблица 11. Характеристика индустриальных масел, полученных
гидроочисткой при различных температурах (в скобках)
Катализатор Д-60, давление 2,8 МПа, объемная скорость подачи сырья 1,2 ч-*,
кратность циркуляции водородсодержащего газа 250—350 м3/м3. Для сравнения
в знаменателе приведены данные для сырья
Показатель Масло И-12А (при 225 СС) Масло И-20А (при 225 СС) Масло И-12А + оста- ток гидрокрекинга (50 50) Остаток гидро- крекинга (при 250 °C)
(при 225 СС) (при 275 СС)
р, кг/м3 867/867 867/876 851/850 846 838/838
Лд20 1,4808 1,4876 1,4739 1,4732 1,4872
•/вСП, °C 164/176 164/176 150/162 152/164 146/152
Цвет, ед. ЦНТ 1,5/0,5 4,0/2,5 2,5/1,5 2,5/1,5 3,5/2,0
Cs, % 0,72/0,67 0,94/0,92 0,45/0,40 0,44/0,32 0,95/0,89
/заст, °C —35/-35 —26/—26 — 33/—33 —33/—33 -34/-34
Индекс вязкости 97/87 91/91 103/104 102/106 110/111
/ан.т °C 86,1/85,8 85,6/85,5 92,7/92,6 92,7/92,6 97,7/97,6
бежом [52, 53]. В основном это обусловлено тем, что процесс
гидроочистки масел более технологичен по сравнению с серно-
кислотной и контактной доочисткой. В табл. 10 приведено со-
поставление качества дистиллятного и остаточного масла, полу-
ченного разными способами [52].
В Советском Союзе нашел применение процесс гидроочистки
масел при давлении 4 МПа и температуре 300—325 °C на АКМ
или АНМ катализаторе с целью получения компонента мотор-
ных и индустриальных масел широкого ассортимента
[А.с. СССР 757588, 1980 г.]. Однако лучшие результаты могут
быть получены при использовании железомолибденового катали-
затора Д-60 следующего состава (% в расчете на оксиды): же-
леза 20,5—20,7, молибдена 19,3—19,7, промотора 0,9—1,0, бора
4,7—5,1, алюминия 54,6—53,5 [54]. Этот катализатор позво-
ляет проводить процесс гидроочистки индустриальных масел
И-12А, И-20А, а также их смеси с остатком гидрокрекинга при
температуре 225—250 °C, давлении 2,7—3,0 МПа и объемной
скорости подачи сырья 1—2 ч-1. Результаты опытно-промыш-
ленных испытаний катализатора Д-60 на установке Г-24/1 пока-
зали (табл. 11), что из западносибирских нефтей можно полу-
чить индустриальные масла с удовлетворительными показате-
лями индекса вязкости, температуры застывания и цвета.
Для получения высоковязких смазочных масел процесс гид-
роочистки рекомендуют проводить при высоком давлении (10—
24 МПа) в одну или две ступени. Изменяя условия процесса
(температуру, объемную скорость) и применяемый катализатор,
можно получить масла с высоким индексом вязкости практи-
чески из любых нефтей.
23
В качестве примера одноступенчатого процесса можно при-
вести гидрирование тяжелого вакуумного дистиллята ромаш-
кинской нефти на АНМС катализаторе с объемной скоростью
0,5 ч-1 [53]. Показано, что при повышении температуры процес-
са на 15—20 °C индекс вязкости вырабатываемого масла повы-
шается с 80 до 115, снижается вязкость масла и содержание
в нем ароматических углеводородов, прежде всего полицикличе-
ских, серо- и азоторганических соединений. Однако, как прави-
ло, в одноступенчатом процессе при гидрировании под высоким
давлением параллельно протекают реакции деструкции, что
снижает выход целевого продукта и требует введения стадии
отгона легких фракций.
В значительной мере эти недостатки устраняются в двухсту-
пенчатом процессе. Так, предлагают [Пат. США 3649519, 1972 г.],
для переработки деасфальтизата на первой ступени процесс
вести при температуре 413—441 °C, давлении 19 МПа и объем-
ной скорости 0,5 ч^1 в присутствии АНМС катализатора. После
разделения продуктов в горячем сепараторе выделенную фрак-
цию смешивают с вакуумным газойлем и подвергают гидриро-
ванию во втором реакторе на другом катализаторе в более мяг-
ких условиях: температура 385—413°С, давление 17—18 МПа
и объемная скорость 1 ч-1. В результате получают продукт
с высоким индексом вязкости, но по сравнению с одноступенча-
тым процессом снижается расход водорода и образуется мень-
ше легких фракций.
Как правило, в промышленных установках процессы гидро-
очистки масел комбинируют с процессами гидроочистки пара-
финов, получаемых при депарафинизации масел. В результате
такой гидроочистки в парафинах снижается содержание смо-
листых веществ, сероорганических соединений и алкенов, улуч-
шается цвет продукта и стойкость к воздействию света. Гидро-
очистку парафинов, церезинов и петролатумов проводят при
давлении 3,6—4,0 МПа, температуре 200—350°C, объемной ско-
рости подачи сырья 0,5—1,0 ч-1 и кратности циркуляции водо-
родсодержащего газа 600—800 м3/м3 с использованием катали-
заторов АКМ, АНМ, алюмохроммолибденовых, сульфидного
никельвольфрамжелезного и др. [11].
1.3. ГИДРОКРЕКИНГ нефтяных дистиллятов
Гидрокрекинг является одним из наиболее эффективных и
гибких процессов нефтепереработки, позволяющий получать
широкий ассортимент нефтепродуктов практически из любого
нефтяного сырья путем подбора соответствующих катализато-
ров и условий проведения процесса. Наибольшее промышленное
развитие процесс гидрокрекинга получил в США, где впервые
фирмой «Standart Oil» в I960 г была пущена установка мощ-
ностью 1,6 тыс. м3/сут | 551
24
По целевому назначению реализованные в промышленности
процессы гидрокрекинга можно разделить на следующие [И,
55, 56]:
1) гидрокрекинг бензиновых фракций с целью получения
сжиженного нефтяного газа, бутановых и пентановых углеводо-
родов изостроения для нефтехимического синтеза;
2) гидрокрекинг средних дистиллятов (прямогонных и вто-
ричного происхождения с т. кип. 200—350 °C) с целью получе-
ния бензинов и реактивных топлив;
3) гидрокрекинг атмосферных и вакуумных газойлей, газой-
лей коксования и каталитического крекинга с целью получения
бензинов, реактивных и дизельных топлив;
4) гидрокрекинг тяжелых нефтяных дистиллятов с целью
получения реактивных и дизельных топлив, смазочных масел,
малосернистых котельных топлив и сырья для каталитического
крекинга;
5) селективный гидрокрекинг бензинов с целью повышения
октанового числа, реактивных и дизельных топлив с целью сни-
жения температуры застывания, масляных фракций с целью
снижения температуры застывания, улучшения цвета и стабиль-
ности, котельного топлива, стабилизаторов, пластификаторов
и технических масел с целью снижения температуры застыва-
ния, а также микрокристаллического парафина для увеличения
его текучести.
1.3.1. ГИДРОКРЕКИНГ БЕНЗИНОВЫХ ФРАКЦИЙ
Основным назначением процесса гидрокрекинга бензиновых
фракций является получение алканов изостроения С5—Сб, ис-
пользуемых в качестве легкого высокооктанового компонента ав-
томобильных бензинов («изокомпонента»), изоалканов С4—С5—
сырья для производства синтетических каучуков [57, 58]. Про-
цесс гидрокрекинга бензиновых фракций не получил большого
распространения в мировой практике (эксплуатируется всего
5 установок) [58], однако он имеет перспективу промышленно-
го развития в связи с необходимостью перерабатывать значи-
тельное количество низкооктановых бензольно-толуольных и то-
луольно-ксилольных рафинатов и газоконденсатов с целью по-
лучения сырья для нефтехимии [56].
Главными компонентами прямогонных бензиновых фракций
и бензольно-толуольных рафинатов являются н-алканы С6—С8.
В интервале температур 300—500°С в зависимости от приме-
няемого катализатора превращения этих углеводородов могут
протекать по следующим маршрутам [59]:
[крекинг] +Н2
СпН2п+2 Гпу2НП4 2 “г изо-Сп/2Нп * Сп/гВп+г изо-Сп/2Нп.|-2
25
или
СпН2п4 2
[крекинг] +Н2
СпН2п 2Сп/2Нп 2Сп/2Нп + 2
[изомеризация] + Н2
1 ^зо-СпН2я > цзо-СпНп+2
[крекинг] +Н-2
2изо-^7112^п 2w3o-Czl/2Hn4-2.
Цель гидрокрекинга бензиновых фракций — получение изоалка-
нов С4—С6 при минимальном получении газообразных продук-
тов Ci—С3 — достигается подбором бифункциональных катали-
заторов [60]. Из многочисленных катализаторов, предложенных
для этого процесса, промышленное значение имеют только цео-
литсодержащие биметаллические катализаторы, стойкие к ката-
литическим ядам [57, 61].
Процесс гидрокрекинга бензиновых фракций проводят при
давлении 2—8 МПа, температуре 340—390 °C, объемной скоро-
сти подачи сырья 1—2 ч^1 и циркуляции водородсодержащего
газа (концентрация Н2>75%) 1000—1500 м3/м3 сырья. В таких
условиях получают 20—35% углеводородов изостроения
С5—С6(С7) при выходе углеводородов С4 12—36% и Ct—С3.
3—20 (15)% [62]. Материальный баланс процесса гидрокрекин-
га бензина на промышленной установке Л-35-11/300 с исполь-
зованием катализатора ГКБ-3 приведен в табл. 12 [58].
В СССР (ВНИИНП) разработан процесс изориформинга,,
в котором стадии каталитического риформинга предшествует
Таблица 12. Материальный баланс процесса гидрокрекинга бензина
на установке Л-35-111300
Показатель Цикл Регене- рация катали- затора
середина конец
Сырье — фракции, °C 110—170 ПО—170 130—180 110—170 Температура на входе в реактор, °C 345 375 375 340—345 Получено, %: Cj—С2 1,4 1,5 2,5 1,5 Сз—С4 14,6 14,5 19,0 14,5 в том числе: Сз 3,1 2,0 5,0 3,0 изо-С4 7,8 8,0 8,5 8,0 н-С4 3,7 3,5 5,5 3,5 изокомпонента 15,5 16,0 16,0 15,5 в том числе: «зо-С5 9,5 9,0 8,2 8,5 н-Сь 1,1 1,1 2,3 1,0 изо-С() 3,4 4,0 5,4 4,0 н-С6 0,3 0,5 1,1 0,5 нафтены С(, 1,2 1,4 1,0 1,5 фракции 85 180 °C 68,5 68,0 61,5 68,5 Итого: 100,0 100,0 100,0 100,0
26
стадия гидрокрекинга на катализаторе ГКБ-ЗМ. В результате
процесса получается товарный бензин с октановым числом 78—
80 по моторному методу [61].
Для получения сырья для нефтехимии методом гидрокрекин-
га рекомендованы два варианта процесса: с рецикуляцией
фракции С7 — к.к. или с рециркуляцией фракции С7—130 °C и
выводом остатка (130°C—к.к.), представляющим собой кон-
центрат ароматических углеводородов. В качестве сырья исполь-
зуют фракцию 95—165 °C, а процесс проводят при температуре
340—350 °C, давлении 4—5 МПа, объемной скорости подачи
сырья 1,5 ч-1 и циркуляции водородсодержащего газа (концент-
рация Н2—85%) 1000 м3/м3 [58].
Степень превращения бензина в процессе гидрокрекинга на
катализаторе ГКБ-3 в основном зависит от температуры и объ-
емной скорости подачи сырья. Давление в интервале 4—9 МПа
мало влияет на выход основных продуктов, за исключением
Z/30-C4 [57]. Однако при повышении давления уменьшаются вы-
ход метана и соотношение углеводородов нормального и изо-
строения.
В интервале температур 300—350 °C глубина превращения
углеводородов бензиновой фракции снижается в ряду: алканы>
>нафтеновые> ароматические [63]. Выход углеводородов
Ci—С2 не зависит от температуры, но выход углеводородов С5
и С6 и степень превращения сырья возрастают с увеличением
температуры процесса. Из алканов наиболее легко в указанном
температурном интервале превращаются Сю, наиболее труд-
но — С8. Нафтеновые углеводороды начинают расщепляться при
температуре выше 315 °C. С увеличением температуры отноше-
ние изо- к нормальным углеводородам С4—Сб уменьшается,
а для углеводородов С8—Сю возрастает [64].
Увеличение объемной скорости подачи сырья в интервале
1—10 ч-1 приводит к уменьшению выхода практически всех
продуктов гидрокрекинга.
Для получения сжиженного нефтяного газа с выходом 65—
100% гидрокрекинг бензина проводят в диапазоне температур
380—450 °C предпочтительнее в присутствии никельцеолитсодер-
жащего катализатора [Пат. США 3594310, 1971 г.; Пат. Англии
1222772, 1971 г.].
Исследование кинетики гидрокрекинга углеводородов бензи-
новой фракции показывает, что уравнение скорости Wi имеет
первый порядок по каждому веществу и водороду [65] и может
быть записано в следующем виде
wi = ^oi ехР ( Et/RT) х0 = k^i exp ( Ei/RT) 4»
2jG/(^ + nH2)
где koi — предэкспоненциальный множитель i реакции; Ei— энергия актива-
ции; R— универсальная газовая постоянная; G, М — массовый поток и моле-
кулярная масса п вещества.
27
1.3.2. ГИДРОКРЕКИНГ СРЕДНИХ дистиллятов
Процесс гидрокрекинга прямогонных фракций 150—380 °C
и легкого газойля каталитического крекинга предназначен для
получения бензина, реактивных и дизельных топлив одновре-
менно с углеводородами С!—С4 или сжиженного нефтяного га-
за и сырья для нефтехимии [62]. Процесс довольно подробно
изучен, разработана его технология и катализаторы, однако
практического применения он не нашел. Перспективы гидрокре-
кинга средних дистиллятов весьма неблагоприятны в связи с от-
сутствием ресурсов керосиновых и дизельных фракций. Однако
закономерности этого процесса и разработанная технология в
определенной мере моделируют более перспективный и важный
процесс — легкий гидрокрекинг вакуумного газойля.
В зависимости от исходного сырья и используемого катали-
затора гидрокрекинг средних дистиллятов проводят по двух-
ступенчатой (катализаторы на основе металлов VIII группы)
или одноступенчатой (сульфидные катализаторы) схеме. Сте-
пень превращения сырья за проход составляет 50—90 (60—
80)%; выход основных продуктов: тяжелого бензина 15—70%,
легкого бензина— 15—60%, реактивных топлив — 50—70% (об.),
дизельного топлива — 20—50%, легких углеводородов Ci—С4—
8—30% и углеводородов С4—С6—15—40%. Процесс проводят
при объемной скорости подачи сырья 0,8—3,0 (1—2) ч-1 и цир-
куляции водородсодержащего газа 400—2200 (900—2000) м3/м3
при температуре 340—450 °C в одноступенчатом и 315—380°C
в двухступенчатом процессе. В качестве примера в табл. 13
приведены показатели двухступенчатого процесса гидрокрекин-
га фракции 180—320 °C, на катализаторе MoO3HNaY при тем-
пературе 380 °C, давлении 4 МПа, объемной скорости подачи
сырья 1 ч^1 и циркуляции водородсодержащего газа 18 000 м3/м3.
Таблица 13. Показатели двухступенчатого процесса
гидрокрекинга фракции 180—320 °C
Показатель Время от начала работы, ч
100 | 400 | 600 | 800
Выход гидрогенизата, % 90,5 90,8 92,7 91,8
Выход бензина с температурой кипе- ния до 180 *С, %:
на гидрогенизат 56,2 57,2 52,7 57,2
на сырье 51,0 52,0 49,0 52,5
Степень превращения сырья, % 60,2 61,2 56,2 61,7
Расход водорода, % 1 ,4 1,3 1,5 1,6
Выход га <ов, %
с. 0,2 0,3 0,1 0,2
с2 0,2 0,2 0,2 0,2
Сз 2,2 2,2 2,1 2,2
н-С4 1,8 1,8 1,6 1,7
изо-С4 4,4 4,5 4,4 4,5
28
1.3.3. ГИДРОКРЕКИНГ ГАЗОЙЛЕВЫХ ФРАКЦИЙ
Процессы гидрокрекинга атмосферного и вакуумного газой-
ля, газойлей коксования, каталитического или термоконтактно-
го крекинга направлены на получение компонентов моторных
топлив либо основы высокоиндексных масел. Направление про-
цесса, выход и качество образующихся продуктов определяются
качеством исходного сырья, катализатором, условиями проведе-
ния процесса и типом реактора. При исследовании химизма
процесса гидрокрекинга на примере индивидуальных углеводо-
родов и углеводородных смесей было показано, что основными
реакциями при этом являются: гидрогенолиз алканов и нафте-
новых углеводородов, гидродеалкилирование алкил(поли)цикли-
ческих соединений, гидрирование ароматических углеводородов,
гидрогенолиз гетероорганических соединений [И].
Суммарный процесс гидрокрекинга тяжелых дистиллятов —
экзотермическая реакция, протекающая с выделением 607—
670 кДж/кг сырья при степени его превращения 70—90% и рас-
ходе водорода 1,5—2,0% [66]. Тепловой эффект гидрокрекинга
зависит от степени превращения и расхода водорода (рис. 1).
Преобладающую роль в суммарной величине теплового эффек-
та играет гидрирование ароматических углеводородов. Основное
количество расходуемого водорода идет на гидрогенолиз алка-
нов и нафтеновых углеводородов и на деалкилирование алкил-
ароматических углеводородов [66]. Анализ распределения про-
дуктов гидрокрекинга вакуумных дистиллятов в широком диа-
пазоне условий как за один проход, так и с рециркуляцией ос-
татка на различных катализаторах показывает, что выход ос-
новных продуктов взаимосвязан и является однозначной функ-
цией степени превращения сырья.
Рис. 1. Изменение теплового эффекта Q гидрокрекинга вакуумного газойля
западносибирских нефтей от степени превращения сырья ф и расхода водо-
рода бц2:
А — расчетные значения тепловых балансов отдельных зон; ф—среднее значение юп-
лового эффекта за 20 дней обследования; О — расчетные значения по закону I есса
29
На глубину превращения сырья, коксообразование и состав
продуктов существенное влияние оказывает давление водорода
[67, 68]. В частности, по мере снижения давления от 15 до
5 МПа уменьшается глубина расщепления, гидрирования и гид-
рообессеривания вакуумного газойля, а в остатке увеличивает-
ся содержание ароматических углеводородов. В интервале 5—
15 МПа скорость коксообразования практически не меняется,
при давлении ниже 5 МПа начинается интенсивное закоксовы-
вание катализатора. При фиксированном давлении степень
превращения исходного сырья возрастает с увеличением темпе-
ратуры реакции и уменьшением объемной скорости подачи
сырья [69].
Реакции расщепления при гидрокрекинге вакуумных дистил-
лятов в интервале давлений 5—10 МПа имеют кажущийся пер-
вый порядок, а при 15 МПа — нулевой [68]. При степени превра-
щения сырья до 70% экспериментальные данные хорошо описы-
ваются уравнением реакции первого порядка с торможением
образующимися продуктами. Кажущаяся энергия активации
в диапазоне температур 390—420 °C составляет 140—255 кДж
на 1 моль [69].
Аналогичные закономерности влияния параметров процесса
на степень превращения сырья наблюдаются и при гидрокрекин-
ге сырья, полученного вторичными процессами [70].
Практическое значение имеют процессы гидрокрекинга пря-
могонных газойлей и продуктов вторичного происхождения
с целью получения бензина, среднедистиллятных фракций и ос-
новы масел. В зависимости от исходного сырья и требований
к качеству целевого продукта применяют различные техноло-
гические схемы процесса [62, 71].
Одноступенчатый процесс осуществляют на катализаторах,
стойких к отравлению сернистыми и азотистыми соединениями
сырья. Степень превращения сырья за проход составляет 45—
70%, выход бензина, как правило, равен 30—40%, но может
достигать 80—90% (об.). Для переработки сырья, содержащего
до 1,5% серы и 500—2500 млн-1 азота, применяют двухступен-
чатые процессы со стадией гидроочистки на первой ступени.
Степень превращения сырья при этом составляет 40—70%, вы-
ход бензина — 70—125% (об.) на сырье. Известен и трехступен-
чатый процесс Unicraking— JHC, по которому можно перераба-
тывать вакуумный газойль с /к.к. = 580°С [72].
Одноступенчатые процессы гидрокрекинга проводят при дав-
лении водорода 10,5—21,0 МПа, двухступенчатые — при 7,0—
10,5 МПа. Температуру в реакторах поддерживают в интервале
290—380 °C (при использовании катализаторов на основе ме-
таллов VIII группы) и 340—450°C (при использовании сульфид-
ных катализаторов) Получающийся легкий бензин (фракция
н.к.—190°C) используют непосредственно как компонент бен-
зина, тяжелый бензин направляют на риформинг.
Гидрокрекинг газойлей в средиедистиллятные продукты (ре-
30
активное и дизельное топлива) также проводят по одно- или
двухступенчатой схеме. Наиболее распространены одноступен-
чатые схемы без рециркуляции на катализаторах, не чувстви-
тельных к каталитическим ядам. Процесс гидрокрекинга осу-
ществляют при давлении 12—15 МПа, температуре 380—410 °C,
объемной скорости подачи сырья 0,5—1,5 ч-1 и циркуляции
водорода 1500—1800 м3/м3 сырья. Режим для каждого конкрет-
ного катализатора подбирают таким, чтобы при невысоких вы-
ходах бензина получать до 85% реактивного или дизельного
топлива. Например, по технологии одноступенчатого гидрокре-
кинга тяжелых газойлей с /к.к. = 520°С (содержание серы
2,97%)—процесс Unicraking— JHC получают 9,8% (об.) легко-
го бензина, 14,5% (об.) тяжелого бензина и 86,7% (об.) дизель-
ного топлива [72].
Применяют также двухступенчатые варианты гидрокрекинга
на катализаторах, чувствительных к каталитическим ядам [62].
В процессах, направленных на получение низкозастывающих
реактивных топлив с пониженным содержанием ароматических
углеводородов, включают дополнительно реактор гидрирования
или реактор для селективной каталитической депарафинизации.
По двухступенчатой схеме гидрокрекинг проводят при давлении
7—15 МПа и температуре 315—380 °C.
Получаемые топливные дистилляты характеризуются малым
содержанием ароматических углеводородов и практически пол-
ным отсутствием соединений серы и азота. Высококипящий ос-
таток гидрокрекинга может быть использован для получения
масел с высоким индексом вязкости.
В СССР разработаны три модификации процесса гидрокре-
кинга, направленные на получение моторных топлив при давле-
нии 15, 10 и 5 МПа [69]. В табл. 14 представлены показатели
процесса по двум вариантам: с преимущественным получением
бензиновых фракций (бензиновый вариант) и с получением ди-
зельного топлива (дизельный вариант).
В последние годы разработан двухстадийный процесс гид-
рокрекинга при 15 МПа, позволяющий получать продукты с ре-
гулируемым содержанием ароматических углеводородов.
На первой стадии в присутствии специального катализатора
осуществляется глубокая гидроочистка и гидрирование арома-
тических соединений сырья, на второй — гидрокрекинг облаго-
роженного сырья при степени превращения 60—70%. Благодаря
предварительному гидрированию гидрокрекинг протекает при
температурах на 30—40 °C ниже, чем при одноступенчатой схе-
ме, а ведение процесса при умеренных степенях превращения
обеспечивает большую селективность и упрощает регулирование
теплового баланса. В табл. 15 приведены результаты двухста-
дийного гидрокрекинга при безостаточной переработке сырья.
Из-за сравнительно высокой энерго- и капиталоемкости процесс
гидрокрекинга под давлением 15 МПа экономически оправдан
для получения в основном реактивного топлива.
3t
Таблица 14. Режим и материальный баланс двухступенчатого
процесса гидрокрекинга (в %)
Условия процесса: I ступень — / = 425 °C, ус = 1,0 ч-1;
II ступень бензиновый вариант—/=425 °C, ис=0,5 ч-1;
II ступень дизельный вариант—/ = 400 °C, vc = 1,0 ч-1
Показатель I ступень II ступень
бензиновый нариант дизельный вариант
Поступило:
сырье 100,0 100,0 100,0
водород 1,4 2,5 2,0
Итого: 101 ,4 102,5 102,0
Получено:
гидрогенизат 92,3 91,4 93,2
в том числе фракции:
н. к. —85 °C — 19,0 10,0
85—195 °C — 36,0 22,0
195—345 °C —— 27,0 51,0
345 — к. к. °C — 9,0 10,2
углеводородный газ 6,0 10,0 7,7
сероводород 2,5 0,1 0,1
аммиак 0,1 — —
Потери 0,5 1,0 1,0
Итого: 101,4 102,5 102,0
Для получения дизельных топлив разработаны процессы
гидрокрекинга при пониженных давлениях [73], например для
получения летнего дизельного топлива разработан процесс лег-
кого гидрокрекинга вакуумного газойля при давлении 5 МПа.
Процесс проверен по двухстадийному варианту с предваритель-
ной гидроочисткой сырья. Показано, что за счет использования
каталитической системы из двух новых активных и селективных
Таблица 15. Баланс двухстадийного гидрокрекинга вакуумного
дистиллята западносибирских нефтей, содержащего 1,5% серы
______________________и 0,11% азота_______________________
Поступило, % Реактив- ный вариант Дизельный вариант Получено, !% Реактив- ный вариант Дизельный вариант
Сырье 100,0 100,0 Сероводород + + аммиак 1,8 1,8
Водород 3,1 3,0 Углеводородный 7,1 6,2
газ
Рециркулят 100,0 70,0 Бензин 25,2 22,0
Итого: 203,1 173,0 Целевое топливо 68,0 72,0
Остаток 100,0 70,0
Потери 1,0 1,0
Итого: 203,1 173,0
32
катализаторов обеспечивается выход летнего дизельного топли-
ва более 45% с температурой застывания от —16 до —18 °C,
а также выход единого судового топлива около 60% за проход.
1.4. СЕЛЕКТИВНЫЙ ГИДРОКРЕКИНГ
Процесс селективного гидрокрекинга предназначен для улуч-
шения эксплуатационных свойств различных нефтепродуктов:
бензинов, реактивных и дизельных топлив, гидравлических жид-
костей и масел. Основная направленность процесса — селектив-
ное удаление из перерабатываемого сырья алканов нормально-
го строения и частичное регулирование группового химического
состава. В последние годы особое значение селективный гидро-
крекинг приобретает в связи с возросшей потребностью в ди-
зельных и реактивных топливах с улучшенными низкотемпера-
турными свойствами, а также в низкозастывающих маслах, ко-
торые не могут быть получены из массовых сернистых высоко-
парафинистых нефтей традиционными способами. Практическое
развитие получили процессы селективного гидрокрекинга бен-
зинов, реактивных и дизельных топлив, масел с использованием
специальных цеолитсодержащих катализаторов, характеризую-
щихся специфичным молекулярно-ситовым действием [62, 74].
1.4.1. ГИДРОКРЕКИНГ БЕНЗИНОВЫХ ФРАКЦИЙ
Селективный гидрокрекинг прямогонных бензинов, бензинов
риформинга, бензилов пиролиза, а также легких фракций
(% -С7 различного происхождения осуществляют с целью полу-
чения высокооктановых бензинов за счет удаления к-алканов.
Процесс проводят в одну ступень на установках типа гидро-
очистки при давлении 2,0—4,5 МПа, температуре 350—500 °C,
объемной скорости подачи сырья 0,5—3,0 ч-1 и циркуляции во-
дородсодержащего газа 350—1000 м3/м3 сырья [75]. Выход фрак-
ций С4 и выше составляет 60—90%, октановое число катализата
возрастает на 10—50 пунктов. Процесс может быть реализован
на отдельной установке либо в качестве последней ступени ка-
талитического риформинга [76].
1.4.2. ГИДРОКРЕКИНГ СРЕДНИХ ДИСТИЛЛЯТОВ
Селективное удаление н-алканов из керосиновых и дизель-
ных фракций позволяет получать низкозастывающме реактив-
ные топлива (—50 н--60°C), зимнее дизельное топливо, а так-
же фракции углеводородов С3—С5, используемые в качестве
нефтехимического сырья.
Процессы селективного гидрокрекинга реактивных топлив
осуществляют по одно- или двухступенчатой схеме (включая
стадию предварительной гидроочистки сырья) при температуре
205—510 (350—400) °C, давлении 3—14 МПа, объемной скоро-
сти подачи сырья 0,5—5,0 ч-1 и циркуляции водородсодержа-
3—922
33
iiK in 1.1 hi ‘>00 1500 м3/м3 сырья. Выход реактивного топлива
мн 75 90%; депрессия температуры начала кристалли-
зации (температуры застывания) по отношению к сырью дости-
гает 10—60 (20—60) °C [62].
Фирма «Mobil Oil» разработала одно- и двухступенчатый
варианты процесса получения низкозастывающих дизельных
топлив каталитической депарафинизацией средних дистиллятов
[78]. В качестве сырья используют как средние атмосферные
газойли (фракции с температурой выкипания 260—400 °C), так
и тяжелые газойли (370—460°C). Процесс осуществляют при
температуре 260—425°C, давлении 2,0—5,6 МПа и циркуляции
водородсодержащего газа 270—480 м3/м3 сырья. Выход дис-
тиллятных продуктов с температурой кипения 165°C (цетано-
вое число 53—59, температура застывания —15ч—18°C) сос-
тавляет 83—85%, выход бензина с октановым числом 85—91
(исследовательский метод) —7—10%.
1.4.3. ГИДРОКРЕКИНГ ТЯЖЕЛЫХ ГАЗОЙЛЕЙ
И МАСЛЯНЫХ ФРАКЦИЙ
С целью расширения ресурсов получения низкозастывающих
дизельных топлив фирмой «Mobil Оа!» разработан процесс
MDDW, в котором в качестве сырья используют тяжелые атмо-
сферные и вакуумные газойли [78].
При переработке вакуумного газойля легкой аравийской
нефти (плотность 911,0 кг/м3, содержание серы 2,36%, содер-
жание фракции до394°C—10%,температура помутнения 26,7°C)
получено 81% фракции с температурой выкипания 217—456 °C
(плотность 904,7 кг/м3, содержание серы 0,43%, температура
застывания —10°C) и 7,3% бензина с октановым числом 71 по
исследовательскому методу. Предложено также сочетать про-
цесс MDDW с гидроочисткой или каталитическим крекингом.
Для производства низкозастывающих масел из прямогонных
фракций и рафинатов разработан процесс селективной катали-
тической депарафинизации MLDW [79], который осуществляют
при температуре 300—430 (370—398) °C, давлении 2—10 МПа,
объемной скорости по сырью 0,5—2 ч-1 и циркуляции водород-
содержащего газа 1500—1800 м3/м3 сырья. Выход базовых ма-
сел — моторных, индустриальных, трансформаторных — состав-
ляет 80—87%, а их качество близко к качеству масел, получае-
мых методом низкотемпературной депарафинизации раствори-
телями.
1.5. ГИДРОДЕАРОМАТИЗАЦИЯ ПРЯМОГОННЫХ
КЕРОСИНОВЫХ ФРАКЦИИ И ГАЗОЙЛЕЙ
КАТАЛИТИЧЕСКОГО КРЕКИНГА
Каталитическая гидродеароматизация — основной процесс
получения качественных реактивных топлив как из прямогонно-
го, так и из сырья вторичного происхождения [21, 80]. Важной
34
проблемой, возникающей при гидродеароматизации нефтяных
фракций, является присутствие сернистых и азотистых соедине-
ний, отрицательно влияющих на активность катализаторов, так
как в качестве гидрирующих металлов в большинстве случаев
используют металлы платиновой группы. Эти нежелательные
соединения следует исключить до стадии гидрогенизации или
использовать композиции, которые оказались бы стойкими
к действию серы и азота в рабочих условиях процесса.
Снижение содержания ароматических улеводородов, с одной
стороны, улучшает эксплуатационные характеристики топлива,
поэтому понятен интерес к гидропереработке с целью получения
очищенного керосина для бытового применения и керосина, ис-
пользуемого как топливо с высокой теплотворной способностью.
С другой стороны, снижается токсичность продукта, что позво-
ляет применять его в качестве растворителя, а также как основу
для приготовления инсектицидов.
В зависимости от происхождения нефти в прямогонных
средних дистиллятах содержится 10—40% алканов, 20—60%
нафтеновых и 14—35% ароматических углеводородов. Содер-
жание ароматических углеводородов в дистиллятах вторичного
происхождения — легких газойлях каталитического крекинга или
коксования — достигает 70%. Количество и природа названных
соединений в составе реактивного топлива определяют его ос-
новные эксплуатационные показатели — характеристики горе-
ния, энергетические, низкотемпературные и антикоррозионные
свойства.
При температурах ниже 350 °C и давлении до 5 МПа состав
продуктов реакции характеризуется кинетическими факторами,
при более высоких температурах — термодинамическим равно-
весием. Поэтому выбор соответствующего катализатора будет
во многом влиять на технологию процесса.
Таблица 16. Характеристика сырья (числитель) и получаемых продуктов
(знаменатель) в процессе каталитической гидродеароматизации
зарубежных фирм
Показатель Процесс «Gulf» Процесс «Arofining» Процесс «Union Oil of California» Процесс «Lummus»
Плотность, кг/м3 Пределы кипения, °C: — — 837/820 788/771
н. к. 195/198 166/168 159/158 162/160
к. к. Содержание, %: 236/238 236/236 276/277 206/205
ароматических углеводородов 14/1 15/1 42/14 16/1
общей серы 0,02/0,0003 0,20/0,0001 0,001/0.0001 I 0,150/<0,0001
Температура застыва- ния, °C —51 /-50 — 0/-60 —45,6/—46,1 I —
Высота некоптящего пламени, мм 25/38 27/40 15/23 —
3*
35
lui> ища 17 Показатели отечественных процессов гидродеароматизации
реактивных топлив
Показатель Олп ступенчатый процесс Дву> с । упеп- чатый про- цесс
сырье про- дук г сырье про- дукт сырье про- дукт*
Характеристика сырь я п р о д у к т о в Плотность, кг/м3 784 784 818 815 855,4 840,7 Пределы кипения, °C: и к. 135 139 161 165 187 195 к. к. 228 224 273 271 313 309 Содержание, %: ароматических углеводородов 22,5 14,0 16,0 6,7 20,5 9,0 серы 0,07 0,001 0,045 0,001 0,09 0,001 Высота неконтящего пламени, мм 24 29 22 27 29 25 Показатели процесса Общее давление, МПа 4,0 4,0 5,0/5,0 Температура, °C: в начале цикла 280 280 260/300 в конце цикла 340 340 300/360 Кратность циркуляции, м3/м3 сырья 500—800 750—800 500/1000 Объемная скорость подачи сырья, ч“’ 4 2—3 2—3
Материальный б а л а и с
Поступило, %: сырья водорода Итого: 100,0 0,55 100,55 100,0 0,60 100,60 100,0 0,95 100,95
Получено, де- стабильного топлива 95,00 94,00 93,20
бензина 3,05 4,35 4,20
углеводородного газа 1,20 1,15 1,49
сероводорода 0,30 0,10 0,06
Итого: 100,55 100,60 100,95
* В числителе даны показатели I ступени, в знаменателе — II ступени.
Как правило, гидрирование ароматических углеводородов
и сернистых соединений проводят в паровой фазе в реакторах
проточного типа с неподвижным слоем катализатора. Условия
процесса выбирают в зависимости от активности и серостойко-
сти используемого катализатора.
Существуют три типа технологических схем промышленных
процессов гидродеароматизации [21]:
одноступенчатый, в котором используется стойкий к серни-
стым соединениям катализатор (фирмы «Gulf», «Texaco», UOP,
«Labofina»);
совмещенный двухступенчатый, включающий стадии гидро-
очистки и гидрирования (фирмы «Union Oil of California»,
«Lummus», «Kellog»);
36
двухступенчатый с выделением гидроочистки в отдельную
стадию (фирмы UOP, «Atlantic Richfild»).
Большинство процессов гидродеароматизации прямогонного
сырья осуществляют в сравнительно мягких условиях: при тем-
пературе 200—350 °C и давлении 5—10 МПа. Некоторые про-
цессы, в которых перерабатывают сырье вторичного происхож-
дения, проводят при высоких температуре (350—400°C) и дав-
лении (25—35 МПа). В табл. 16 в качестве примера приведены
показатели некоторых современных процессов гидродеаромати-
зации зарубежных фирм.
В Советском Союзе разработан процесс гидродеароматиза-
ции при умеренных давлении и температуре на цеолитсодержа-
щем катализаторе [81] в одно- и двухступенчатом варианте.
В качестве сырья одноступенчатого процесса используют пря-
могонные керосиновые фракции, выкипающие в пределах 130—
240 и 160—280 °C. Платиновый цеолитсодержащий катализатор
позволяет перерабатывать сырье без его предварительной гид-
роочистки с содержанием серы<0,2% н азота<0,001 %• Техно-
логическое оформление одноступенчатого варианта близко к су-
ществующему процессу гидроочистки реактивных топлив.
В двухступенчатом процессе предусмотрена стадия предвари-
тельной гидроочистки с промежуточной очисткой циркулирую-
щего газа от сероводорода и аммиака.
Процесс гидродеароматизации реактивных топлив характе-
ризуется высокими технико-экономическими показателями. По-
казатели процессов гидродеароматизации приведены в табл. 17.
Глава 2
СОСТАВ И СТРОЕНИЕ ПРОМЫШЛЕННЫХ
КАТАЛИЗАТОРОВ
2.1. КАТАЛИЗАТОРЫ ГИДРООБЕССЕРИВАНИЯ
Среди катализаторов гидрогенизационных процессов нефте-
переработки катализаторы гидрообессеривания нефтепродуктов
являются многотоннажной продукцией, поскольку процессы гид-
роочистки занимают ведущее место в современных схемах пере-
работки нефти как в нашей стране, так и за рубежом. Катализа-
торы гидрообессеривания существуют более 50 лет и за этот
период претерпели несколько этапов эволюции. В настоящее
время в мировой практике широко распространены в основном
алюмокобальтмолибденовые (АКМ) и алюмоникельмолибдено-
вые (АНМ) каталитические системы. В табл. 18 приведены
усредненные показатели работы современных промышленных
37
I tin ища /Л Усредненные показатели работы современных катализаторов
. 11<>р<и)6есссривания различных видов сырья на промышленных установках
Показатель Бензин (керосин) Дизельное топливо Вакуумный газойль I (ефтяные остатки
Температура, °C 300 310 3-10 -100 380—410 380—410
Давление, МПа 1,') 2,0 2,5 -1,0 4,0-5,0 7,0—15,0
Объемная скорость подачи сырь> 5,0 10,0 3,5 5,0 1,0- 2,0 0,5—1,0
Циркуляция подородсодер/Kamei<» :i;i, м ’/м ' 1 50 200 500 До 1000
()с । л । очное <•( >дгр /К.1 и нс серы, % 0,0001 0,1—0,2 0,1—0,5 0,3-0,5
< leiirni. обессеривания, % 99 92—97 85—95 70—75
Ресурс л у ж С>ы катализатора, '1 сырья/кг 100 150—200 50—80 —
(.рок службы катализатора, годы 5—8 4—6 2-4 1—2
Число регенераций 2—3 2—4 2—3 1—2
катализаторов на установках гидроочистки различных видов
нефтепродуктов [11, 28, 29].
Ведущие зарубежные фирмы — «American cyanamid», «Har-
shaw Chemical», «Universal Oil», «Procatalys», «Ketjen»— рас-
полагают широким ассортиментом промышленных катализато-
ров (табл. 19). Такой ассортимент катализаторов — явление не
случайное, оно обусловлено конкуренцией различных фирм
и отражает главную тенденцию развития катализаторов гидро-
обессеривания. Это гибкое реагирование на изменение качества
перерабатываемого сырья, ужесточение требований к глубине
очистки с учетом ресурсов и качества водородсодержащего газа,
а также требований технологии процесса конкретного нефтепе-
рерабатывающего предприятия [82].
Промышленные катализаторы гидрообессеривания должны
удовлетворять следующим основным требованиям:
1) обладать высокой активностью при гидрогенолизе серо-
и азотсодержащих органических соединений без расщепления
углеводородов;
2) обеспечивать высокий выход целевого продукта и, следо-
вательно, обладать высокой селективностью;
3) длительно работать при минимальном расходе водорода;
4) при переработке тяжелого остаточного сырья быть стой-
кими к отравлению соединениями металлов, содержащимися
в сырье;
5) иметь низкую насыпную плотность и высокую механиче-
скую прочность как на раздавливание, так и на истирание;
6) частично проводить гидрирование алкенов и ароматиче-
ских углеводородов при переработке некоторых видов сырья
(керосиновые дистилляты, масляные фракции).
Эффективность катализаторов гидроочистки определяется
как их химическим составом и структурой, так и способами
приготовления и активации. Имеется достаточно обширная ли-
тература, посвященная исследованию алюмокобальтмолибдено-
38
вых и алюмоникельмолибденовых каталитических систем раз-
личными физико-химическими методами. Однако до сих пор
вопрос об определяющих факторах формирования оптимальной
структуры и направленного регулирования активности катали-
заторов гидрообессеривания окончательно не решен.
2.1.1. СТРУКТУРА И ФАЗОВЫЙ СОСТАВ
Известно, что структура и фазовый состав катализатора
являются одними из определяющих факторов его эффективно-
сти. Как правило, изучают структуру и состав катализаторов
гидрообессеривания в оксидной форме. При этом предполагают,
что имеется тесная взаимосвязь между активными поверхно-
стными фазами катализатора в процессе эксплуатации и его
оксидными предшественниками.
Алюмокобальтмолибденовые системы. По данным исследова-
ний модельных систем, включая бинарные Со/А12О3 и Мо/А12О3,
в составе АКМ катализаторов можно ожидать существование
следующих объемных и поверхностных соединений: МоО3,
А1(МоО4)з, Со3О4, СоА12О4, СоМоО4, .СоО, комплексы перемен-
ного состава CoMoAl [83].
При исследовании промышленных катализаторов с содержа-
нием 2—3% СоО и 10—12% МоО3 различными методами было
установлено, что основной фазой являются СоМоО4 и оксид алю-
миния [84]. Фаза СоА12О4 рентгенографически не обнаруживает-
ся, по-видимому, потому, что при низком содержании кобальта
эта фаза находится в высокодисперсном состоянии, а ее струк-
тура отличается от объемной шпинели. Однако образование фа-
зы COAI2O4 обнаружено по линии 1612 см^1 в ИК-спектрах об-
разцов, что свидетельствует о взаимодействии кобальта с мо-
либденом |[85]. Кроме того, методом РФЭС показано стабили-
зирующее влияние кобальта на молибдат и на его дисперсность
[86]. Методом дериватографии установлено, что в промышлен-
ных АКМ катализаторах может образоваться фаза А12(МоО4)3
[87].
Состав и количество фаз может различаться в зависимости
от суммарного содержания металлов, атомного отношения
Со/Мо, природы носителя, способа введения металлов и темпе-
ратуры прокаливания. Например, показано, что даже при оди-
наковом способе приготовления (пропитка носителя) порядок
введения металлов существенно влияет на его фазовый состав
[88]. Так, катализатор с содержанием 1—4% кобальта и 2—8%
молибдена, полученный ступенчатым внесением кобальта, имеет
синюю окраску. Катализаторы, полученные однократной про-
питкой, изменяют свой цвет от светло-голубого до черного при
содержании кобальта >2%, что обусловлено образованием Со3О4.
По данным спектроскопии диффузного отражения в катали-
заторах с содержанием до 2% кобальта, последний находится
в тетраэдрической координации, а при его содержании >3% как
39
Таблица 19. Характеристика зарубежных промышленных катализаторов для гидроочистки нефтяных фракций
Фирма и марка катализатора Состав, % Носитель Свойства Назначение
«American cyan amid»:
HDS-2 CoO — 3,2, MoO3 — 15,1, SiO2 —0,1 А120з ?пл — 550 кг/м3, 5УД — 275 м2/г, Упор —0,75 см3/г
HDS-3 NiO — 3,2, МоОз — 15,1, SiO2 —0,1 А120з Тпл — 600 кг/м3, 5УД — 180 м2/г, Упор — 0,60 см3/г
HDS-16 CoO — 5,7, MoO3 — 12,2 А120з Упл — 750 кг/м3
HDS-20 CoO — 5,0, МоОз—16,2 А120з уп л — 660 кг/м3, Зуд — 230 м2/г, Упор — 0,52 см3/г
HDS-30 NiO — 5,0, MoO3 — 20,5 А120з Тпл — 740 кг/м3, Зуд — 160 м2/г, Упор — 0,44 см3/г
«Harshaw Chemical»:
HT-400E CoO — 3,0, МоОз — 15,0 А12О3 уп л — 750 кг/м3, Зуд — 230 м2/г, Упор — 0,50 см3/г
HT-100 NiO — 3,8, MoO3 — 16,8, SiO2 —1,5 А120з+SiO2 уП1 — 700 кг/м3, Зуд — 175 м2/г, Упор — 0,54 см3/г
«Universal Oil»:
Hydrobon S-3 Al — C0M0 А120з Таблетки d=3 мм, Упл — Ю00 кг/м3
Hydrobon S-6 Al — Co(Ni) —Mo А12О3 Шарики d=- 1,5 мм, Упл — 500 кг/м3
Hydrobon S-7 Al —Co(Ni) — Mo Al —Si Шарики d = 1,5 мм, Упл — 600 кг/м3
Обессеривание, деазотирование
средних дистиллятов
То же
>
Гидрообессеривание, деазоти
рование газойлей
То же
Обессеривание газойлей
То же
Гидрообессеривание, деазоти-
рование легких и тяжелых га-
зойлей
То же
«Procatalyse»: HR-306 Al —Co —Mo А120з
HR-145 Al — Ni — Mo А120з
HR-346 NiO — 3,0, МоОз —14,0 А120з
HR-345 NiO —3,0, WO3 — 14,0 А120з
«Shokubai kasei kogyo»: CDS-R2
CDS-D5 CoO — 3,87, МоОз — 12,81, SiO2 — 1,5 А120з+SiO2
CDS-D9 CoO — 3,7, МоОз — 14,0 А120з
«Ketjen»:
KF-124-3P KF-124-3E KF-124-1.5E CoO — 4,0, МоОз — 12,0, SiO2 — 1,3 А120з + SiO2
BASF
М8-Ю CoO — 5,0, МоОз — 13,5, SiO2 —2,0 А120з+SiO2
M8-21 NiO —3,0, МоОз — 15,0, А120з
M8-30 МоОз — 15,0, А120з
VEB Leuna — Werke (ГДР):
8204, 8203 NiO, МоОз сумма гидрирующих ме- таллов — 16,0 А12Оз+81О2
Экструдаты d=2—4 мм, 5УД — 180 м2/г, Упор — 0,43 см2/г Шарики d=2—4 мм, 5УД — 260 м2/г Экструдаты d =1,5 мм, Упор — 0,45 см3/г Экструдаты d =1,2 мм, 5УД — 170 м2/г, Упор — 0,37 см2/г Гидрообессеривание бензина, керосина, газойлей, мазута Гидрообессеривание, деазо- тирование смазочных масел То же Глубокое гидрирование сырья, содержащего серу
5УД — 215 м2/г, Упор —0,64 см3/г 5УД — 276 см3/г, Упор — 0,62 см3/г Обессеривание остатков нефти Обессеривание керосина, ваку- умного газойля
5УД — 256 м2/г, Упор — 0,57 см3/г Гидроочистка керосина, легко- го и вакуумного газойля
Зуд — 250 м2/г Гидрообессеривание газойлей
8уД — 220 м2/г, Упор — 0,5 см3/г Гидроочистка бензина, кероси- на и газойлей
Зуд — 150 м2/г, Упор — 0,5 с.м3/г Зуд — 220 м2/г, То же
Упор — 0,5 см3/г
Упл — 690 кг/м3, 3Уд — 230 м2/г, Упор—0,57 см3/г Гидроочистка дизельного топ- лива и вакуумных дистиллятов
в тетраэдрической, так и октаэдрической координации. В ката-
лизаторах, приготовленных методом совместной однократной
пропитки кобальт присутствует преимущественно в тетраэдриче-
ской координации, т. е. не входит в состав СоМоО4. При увели-
чении температуры прокаливания в интервале 500—750 °C
происходит образование фазы COAI2O4. При ступенчатом введе-
нии кобальта в концентрации >2% последний присутствует
первоначально в основном в октаэдрической координации. Одна-
ко при повышении температуры прокаливания с 500 до 750 °C
«октаэдрический» кобальт переходит в «тетраэдрический».
При совместной пропитке носителя солями Со и Мо создают-
ся условия для образования фазы СоМоО4, которая обнаружи-
вается рентгенографически при концентрации кобальта >2%.
В процессе прокаливания возможно взаимодействие СоМоО4
с А120з с образованием фазы СоА12О4.
Значительные различия в структуре АКМ катализатора на-
блюдаются также при изменении атомного отношения Со/Мо
[89]. Исследование серии алюмокобальтмолибденовых оксидных
катализаторов с постоянным содержанием суммы оксидов Со
и Мо (15±0,6%) и различным атомным отношением Со/(Со+
+ Мо) (табл. 20) методом РФЭС и спектроскопии диффузного
отражения [90] показало, что возможно существование пяти ти-
пов различных частиц: молибден в полимолибдатных структу-
рах, монослой Мо6+, двойной слой, кристаллиты Со3О4 и
COAI2O4. Наличие этих частиц и их количество зависит от спо-
соба получения, атомного отношения Со/(Со + Мо), удельной
поверхности оксида алюминия и температуры прокаливания.
Из изменения относительной интенсивности пиков Со2рз/2,
Моза и А12р в спектрах РФЭС указанных образцов (рис. 2) сле-
дует, что с увеличением содержания в катализаторе Со или Мо
увеличивается доля поверхности оксида алюминия, не покры-
тая металлом, а дисперсность обоих металлов уменьшается.
Из рис. 2 следует также, что при отношении Со/(Со + Мо) > 0,5
кобальт находится на поверхности носителя, а его дисперсность
Таблица 20. Характеристика алюмокобальтмолибденовых
оксидных катализаторов
Номео образца Цвет катализатора Содержание окси- дов, % Атомное отношение Со/(Со + Мо) ?уд> м2/г
МоОз | СО3О4
1 Белый 14,80 0,00 0,00 109
о ("ветло-фиолетовый 13,97 0,45 0,05 152
3 ('еро-синий 12,08 2,52 0,27 125
4 (.еро-синий 10,86 3,82 0,38 123
5 Серо-зеленый 9,65 5,96 0,52 140
6 Черный 6,03 9,95 0,75 142
7 Черный 0,00 14,46 1,0 111
42
Рис. 2. Изменение относительной интенсивности / пиков Со2рз/2, Мозд и
А12р от атомного отношения Со/(Со + Мо)
возрастает по мере увеличения концентрации молибдена. При
отношении < 0,5 наблюдается миграция кобальта в носитель
с образованием COAI2O4.
Полоса поглощения с максимумом при 200—300 нм в спект-
рах диффузного отражения (рис. 3) свидетельствует о наличии
тетраэдрического молибдена Мо6+. Однако значительное расши-
рение этой полосы доказывает присутствие и октаэдрического
Мо6+. О существовании тетраэдрического Со2+ в COAI2O4 можно
судить по наличию в спектрах диффузного отражения широ-
кой тройной полосы при 500—700 нм, интенсивность которой
относительно полосы Мо6+ увеличивается с уменьшением содер-
жания кобальта. Авторы делают вывод, что образование
COAI2O4 в катализаторе с отношением < 0,5 промотпруется
Мо6+ не только в результате увеличения дисперсности кобальта,
но и из-за образования энергетически более активных тройных
поверхностных частиц Со—Мо/А12О3.
При изучении влияния окислительно-восстановительных об-
работок на АКМ катализаторы методами ЭПР и РФЭС уста-
новлено наличие взаимодействия Со и Мо с А12О3. Причем по-
казано, что ионы молибдена препятствуют прониканию ионов
кобальта в объем (91]. Окислительная обработка приводит
к обогащению поверхности АКМ катализатора молибденом, вос-
становительная — кобальтом.
Высказано предположение, что для промышленных АКМ ка-
тализаторов в оксидной форме характерна двухслойная струк-
тура поверхностных СоМо-комплексов, в которых Мо6+ диспер-
гирован монослойно на поверхности носителя и покрыт слоем
Со3+ [83].
В сульфидированных АКМ катализаторах обнаружены
MoS2, CogSe и в малых концентрациях сульфид алюминия и по-
лимерные продукты S22“ и S32~ [92, 93]. При этом, как показы-
43
Рис. 3. Спектры диффузионного отражения катализаторов (образцы 1—7,
см. табл. 20) и некоторых модельных соединений:
8 — СоЛ12О4; 9 — а-СоМоОъ 10 — Со3О4; 11 — (NU4)cMo7O24; 12 — МоО3; 13 - Na2Mo04-2H20
вают данные магнитных измерений, ИК- и УФ-спектроскопии,
сульфидирование оксидных предшественников происходит не-
полностью и не образуется дисперсных фаз MoS2 и CogSe [94].
Но относительно полноты сульфидирования оксидных АКМ
катализаторов в литературе имеются противоречивые данные.
По-видимому, процесс сульфидирования протекает по-разному
в зависимости от температуры, давления, сульфидирующего
агента и структуры оксидных предшественников [95]. По дан-
ным РФЭС, в сульфидированных катализаторах отмечается
очень слабое взаимодействие молибдена с А12О3 в отличие от
оксидных систем [96, 97]. Что же касается состояния кобальта
в сульфидированных катализаторах, то обнаружено два типа
ионов Со2+. Установлено, что кобальт, связанный с А12О3 в виде
псевдоалюмината, не сульфидируется. Второй тип ионов Со2+
образует сульфиды, причем соотношение между ионами молиб-
дена и сульфидирующимися ионами Со2+ достаточно хорошо
коррелирует с гидрообессеривающей активностью (рис. 4).
Выявлено, что условия предварительной обработки (окис-
лительная или восстановительная среда, температура, длитель-
ность, давление, природа сульфидирующего агента) могут зна-
чительно изменять состав сульфидных фаз АКМ катализатора
[95, 98]. В общем степень сульфидирования кобальта зависит
от скорости диффузии ионов Со2+ нз объема к поверхности
[92]. Часть из них образует CogSe, а остальные внедряются в но-
ситель или локализуются между слоями фазы MoS2, способст-
вуя восстановлению ионов Мо41 до Мо3(
44
Рис. 5. Кривые ДТА различных образ-
цов АНМ катализаторов:
1—4% NiO; 2 — 4% NiO+12% МоОз; 3 — 4%
NiO+15% МоО3; 4 — 4% NiO-j-20% МоО3- 5 —
4% NiO+25%MoO3; 6—12% МоО3; 7 — 4%
NiO+20% МоОз+6% SiO2
На примере серии образцов
катализаторов с отношением Со/
/(Со-]-Мо) =0,3, включая про-
мышленный с содержанием 3,5%
Со и 10% МоОз, установлено,
что при содержании МоО3>10%
в процессе восстановления и
сульфидирования происходит
обогащение поверхности молиб-
деном. При содержании МоО3
менее 10% весь молибден прочно
связан с носителем и миграции
не происходит '[99, 100]. Более того, кобальт препятствует ми-
грации молибдена на поверхность и способствует стабилизации
активной формы с отношением S/Mo4+~1,0.
Алюмоникельмолибденовые системы. АНМ катализаторы
являются многофазными системами, содержащими, кроме окси-
да алюминия, NiO, МоО3, NiMoO4, NiAl2O4 и А1(МоО4)3, а так-
же алюмоникельмолибдаты неопределенного состава [101]. Ката-
лизаторы с суммарным содержанием оксидов металлов до 20—
25% являются рентгеноаморфными.
Методом дифракции рентгеновских лучей установлено, что
промышленные АНМ катализаторы с содержанием 12—15%
МоО3 состоят из связанных друг с другом оксидов никеля и мо-
либдена, диспергированных на поверхности носителя, типа
A'NiO-MoO3-z/H2O [102]. При взаимодействии молибдена с носи-
телем может образоваться фаза А12(МоО4)3, в которой молиб-
ден находится в октаэдрической координации. При концентра-
ции молибдена выше 15% и никеля 5% в катализаторах, про-
каленных при 500 °C, обнаружены молибдат никеля и МоО3
в двух кристаллографических модификациях. Введение в ката-
лизатор никеля препятствует образованию трудносульфидируе-
мон малоактивной фазы А12(МоО4)3.
При исследовании АНМ катализаторов методом деривато-
графии отчетливо фиксируется экзотермический эффект при
700—850 °C (рис. 5), обусловленный превращением алюмомо-
либденовых соединений переменного состава [103, 104]. Причем
максимум экзопика смещается в сторону более низких темпера-
тур, а интегральная интенсивность возрастает с увеличением
содержания МоО3 (рис. 6). Кроме экзоэффекта наблюдается
также и эндотермический эффект в диапазоне температур 920—
930 °C, обусловленный, по-видимому, плавлением А12(МоО4)3,
45
Рис. 6. Изменение относительной потери массы при нагревании образцов
АНМ (/) и АНМС (2) катализаторов в интервале 700—1100°C и температу-
ры максимумов экзопиков (3) от содержания МоОз в катализаторе Хмоо 3
Рис. 7. Изменение интегральной интенсивности /Инт от содержания МоОз (О
и NiO (2) в АНМ катализаторах
содержание которого возрастает по мере увеличения содержа-
ния МоОз (рис. 7). Снижение интенсивности экзо- и эндоэффек-
тов в АНМ катализаторах при увеличении в них содержания
NiO может быть обусловлено взаимодействием последнего как
с носителем, так и с МоОз и образованием алюмоникелевых
и никельмолибденовых соединений разного состава [105].
Существенное влияние на величину интегральной интенсив-
ности наблюдаемых тепловых эффектов оказывает присутствие
в составе катализаторов SiO2. В АНМС катализаторах интенсив-
ность экзопиков падает почти в два раза по сравнению с АНМ
катализаторами, содержащими те же количества оксидов нике-
ля и молибдена. Если в АНМ катализаторах наблюдается четко
выраженный эндоэффект при 920—930 °C, то в АНМС катализа-
торах и алюмосиликате, содержащих 6% SiO2, кривая ДТА
в указанном интервале температур характеризуется более слож-
ной формой (см. рис. 5, образец 14). Введение цеолита в ком-
позицию АНМ катализатора уменьшает интенсивность как
экзо-, так и эндоэффекта вплоть до полного исчезновения по-
следнего (см. рис. 5, образцы 5 и 9) [105]. Эти данные свиде-
тельствуют о том, что в катализаторах, содержащих SiO2 или
цеолит, происходит эффективное взаимодействие никеля и мо-
либдена с образованием большого количества никельмолибде-
новых соединений различного стехиометрического состава.
Данные термогравиметрического (ТГ) анализа катализато-
ров (табл. 21) в интервале температур 700—1100 °C показывают,
что в цеолитсодсржащих катализаторах образуются более тер-
мостабильпые соединения молибдена, причем последний, по-ви-
димому, взаимодействует с цеолитпой частью катализатора бо-
лее эффективно, чем с у-Л12О3.
46
Таблица 21. Результаты исследования образцов алюмоникельмолибденовых
катализаторов методами ПТ ДА, ТГ и ЭПР
Показатель Номер образца
1 I 2 I 3 1 4 5 1 6 1 1 7 1 1 8 1 9
Состав катализатора, %: 91,4 77,8 82,8 77,8 77,8
AI2O3 100 91,4 82,8 74,2
NiO — 8,6 — 8,6 8,6 — 8,6 — 8,6
МоОз — — 8,6 8,6 8,6 17,2 17,2 17,2 17,2
NaY Содержание десорбиро- вавшегося аммиака (ммоль/г) при темпера- турах, °C: 5,0 5,0 5,0
25—550 1,55 1 ,60 1,80 2,00 2,50 2,30 2,40 2,40 2,50
50—200 0,64 0,61 0,80 0,74 1,20 0,95 1,00 1,20 1,25
200—350 0,44 0,53 0,60 0,76 0,73 0,85 0,80 0,76 0,70
350—550 0,40 0,42 0,32 0,41 0,49 0,41 0,43 0,28 0,38
Относительная потеря массы А/п* 0,9 0,8 9,2 8,3 5,2 16,0 14,6 11,5 10,0
Интенсивность сигнала ЭПР Мо5+** — — 27 13 8 45 10 43 10
* При нагревании от 700 до 1100 °C, Дпг = [(tn700—mUOo)/m7Q0]X 100%.
!* В восстановленных при 400 °C образцах, 10~18 спин/г.
Методом программированной термодесорбции NH3 (ПТДА)
показано, что цеолит в составе АНМ катализаторов способст-
вует более однородному распределению кислотных центров,
увеличивая число центров, непрочно удерживающих NH3,
а в случае образцов с низким содержанием молибдена также
и суммарную кислотность. Изменение состава поверхностных
гидрирующих фаз АНМ катализаторов можно видеть из дан-
При -196°С
Мо5+
Рис. 8. Спектры ферромагнитного резонанса никеля в образцах катализато-
ров, восстановленных при 500 еС
Цифры соответствуют номеру образца
47
Таблица 22. Характеристика сигналов ферромагнитного резонанса
в образцах АНМ катализаторов, восстановленных
при различных температурах
ХН — ширина сигнала, Э; А — амплитуда отн. ед.;
У — интегральная интенсивность, отн. ед.
Номер образца* При 300 °C При 400 °C При 500 °C
ДН | Л | У ХН 1 Л 1 •' Д// 1 л Li_
2 Сигнал отсутствует — 0,1 0,05 — 0,6 0,3
4 То же — 0,1 0,05 — 1,6 0,9
5 700 0,5 0,3 700 6,0 3,1 700 14,0 7,3
7 Сигнал отсутствует 530 0,6 0,2 530 6,0 2,0
9 620 1,8 0,8 620 14,0 7,3 620 48,0 18,0
♦ Номер образца — см. табл. 21; в образцах анизотропный сигнал. 2 и 4 при 400 и 500 °C наблюдаете
ных, полученных методом ЭПР и ферромагнитного резонанса
(ФМР) (см. табл. 21, а также рис. 8). При восстановлении
алюмомолибденовых образцов водородом, начиная с 200°C,
на их поверхности образуются ионы Мо5ь Зависимость интен-
сивности сигналов Мо51 от температуры восстановления имеет
экстремальный характер с максимумом при 300—400 °C.
При температуре выше 500 °C происходит более глубокое вос-
становление молибдена до Мо4+ и Мо3+ (см. табл. 21). Посколь-
ку при восстановлении МоОз сигналы ЭПР Мо5+ не обнаружи-
ваются, можно предположить, что возникновение ионов Мо5+
связано с восстановлением поверхностной алюмомолибденовой
фазы [106]. В восстановленных АНМ и особенно цеолитсодержа-
щих катализаторах интенсивность сигналов ЭПР Мо5+ значи-
тельно ниже. Данный факт свидетельствует о том, что никель
препятствует образованию поверхностных алюмомолибдатов,
взаимодействуя с молибденом с образованием никельмолибде-
новых и алюмоникельмолибденовых ассоциатов, а цеолит ин-
тенсифицирует этот процесс. Об этом свидетельствует также
и то, что при восстановлении синтезированных иикельмолибда-
тов ионы Мо5+ не образуются.
Особенно наглядно влияние цеолита на образование поверх-
ностных фаз АНМ катализаторов проявляется при анализе
ферромагнитного резонанса спектров восстановленных образцов
(табл. 22) [105]. Из таблицы видно, что количество ферромаг-
нитного никеля возрастает с увеличением содержания в ката-
лизаторе МоОз и особенно цеолита.
Анализ спектров ФМР показывает, что в присутствии цеоли-
та образуется более мелкодисперсная фаза металла, чем
в АНМ катализаторах без цеолита. Из результатов исследова-
ний процесса восстановления бинарных систем элементов, сос-
тавляющих катализатор, выявлено, что мелкодисперсный фер-
48
ti,103crrJ
Рис. 9. Оптические спектры АНМ и АНМС катализаторов (образцы 1—5 и
ЗС—5С) и никельмолибдата (образец 11), снятые с образцами сравнения:
а — оксид алюминия; б — образец 1
ромагнитный никель особенно легко образуется при восстанов-
лении никельмолибдатов, причем ферромагнитный Ni в никель-
молибдате и в цеолитсодержащем АНМ катализаторе (см.
рис. 5, образец 9) появляется при одной и той же температу-
ре —300 °C.
Анализ спектров ФМР (см. рис. 8) позволяет сделать неко-
торые выводы о размере и форме металлического Ni в восста-
новленных катализаторах. Величина g-фактора (2,2 во всех об-
разцах) свидетельствует о сферической симметрии частиц Ni.
Анизотропная форма сигнала в образцах 2 и 4 при 24 °C обус-
ловлена, по-видимому, эффектом магнитной кристаллографиче-
Рис. 10. Оптические спектры АНМ катализаторов (образцы 6—10), снятые
с образцами сравнения:
а — оксид алюминия; б — образец 6
4—922
49
ской анизотропии, которая еще в большей степени проявляется
при температуре —196 °C. Симметричные сигналы в остальных
образцах указывают на то, что в этих катализаторах частицы
Ni настолько малы, что эффект магнитной кристаллографиче-
ской анизотропии при 24 °C не проявляется. В цеолитсодержа-
щих катализаторах обнаруживается по крайней мере два вида
частиц металлического Ni (сигнал с g = 2,2 и g = 4,4 при 24°C
и 5,2 при —196°C).
Поскольку ширина линии спектра ферромагнитного резонан-
са обусловлена в основном обменным сужением, большая шири-
на сигналов ФМР никеля в цеолитсодержащих катализаторах
по сравнению с АНМ контактами указывает на то, что частицы
никеля в цеолитсодержащих катализаторах имеют меньший
размер. Следовательно, цеолит в АНМ катализаторах не толь-
ко увеличивает степень восстановления никеля и его диспер-
сность, но и способствует стабилизации Ni в мелкодисперсном
состоянии.
В электронных спектрах алюмоникелевых катализаторов
(рис. 9, образец 1) наблюдается характерный дублет с макси-
мумом 16 700 и 15 700 см-1 и полоса поглощения с максимумом
9500 см-1, которые соответствуют переходам в ионах Ni2+ в тет-
раэдрической координации и свидетельствуют об образовании
никелевой шпинели (101]. Алюмоникелевый катализатор (рис. 10,
образец 6) обладает широкой полосой поглощения в ультра-
фиолетовой области, что характерно для молибдата алюминия
[107]. В спектре АНМ катализатора (см. рис. 9, образец 2),
содержащего 4% NiO и 12% МоО3, отчетливо наблюдаются
полосы поглощения, характерные для бикомпонентных образ-
цов. Вместе с тем, спектр этого катализатора не соответствует
суммарному поглощению света образцами 1 и 6. При исполь-
зовании в качестве сравнения алюмоникелевого катализатора
в спектре образца 2 образуются новые полосы с Лтах = 1300
и 8000 см”1 (рис. 9,6). Поскольку ионы Мо6ь в этой области
свет не поглощают, наблюдаемые для АНМ катализатора до-
полнительные полосы обусловлены ионами Ni2+ в координаци-
онном состоянии, отличном от никелевой шпинели. В частности
для АНМ катализатора наблюдаются дополнительные полосы
с Хтах = 24 000—20 000, 13 000 и 8000 см-1, характерные для Ni24'
в октаэдрической координации NiOh2 н [101]. На этом основании
можно полагать, что Ni2+ находится в окружении анионов
МоО42-
Введение в АНМ катализатор SiO2 промотирует образование
поверхностных никельмолибденовых соединений [108], количе-
ство которых увеличивается при росте концентрации никеля
или молибдена [109]. Как следует из рис. 9, а, для АНМС ката-
лизаторов при увеличении концентрации МоО3 интенсивность
поглощения ионами Ni2b падает более резко, чем для АНМ
композиций. При этом резко возрастает интенсивность погло-
щения при Хтах= 12 500—13 000 см 1 Особенно четко указанный
50
Таблица 23. Фазовый состав АНМ катализаторов после сульфидирования
Цвет в ок- сидной форме Атомное отношение Ni/(Ni+Mo) Фазовый состав Цвет в ок- сидной форме Атомное отношение Ni/(Ni+Mo) Фазовый состав
Бледно- 0 МоО2 Черный 0,73 MoS2, NiS,
зеленый Желто- 0,30 МоО2, MoS2 Черный 0,79 NiS2 MoS2, NiS, p-Ni7S6 MoS2, NiS,
зеленый Желто- 0,41 МоО2, MoS2 Черный 0,92
зеленый Горчичный 0,55 MoS2, Ni3S4 Черный 1,0 p-Ni7S6 Ni3S2
эффект проявляется для образцов 4С и 5С. Спектры АНМС
катализаторов, измеренных относительно образцов 1С и 6С
(см. рис. 9,6), характеризуются увеличением интенсивности ли-
ний, обусловленных присутствием Ni21 в никельмолибдате.
Количество и состав поверхностных никельмолибденовых
соединений зависит от соотношения NiO/MoO3 в катализаторе
и от температуры прокаливания [102]. Методом дифракции
рентгеновских лучей показано, что при отношении NiO/MoO3 =
= 5: 10 образуется только NiMoO4H2O, а при 5:^15 — NiMoO4
и МоО3. При нагревании до 300 °C происходит удаление части
воды без изменения кристаллической структуры, при повыше-
нии температуры до 700—800 °C образуется А12(МоО4)3.
При сульфидировании АНМ катализаторов можно ожидать
образование Ni3S2 и MoS2 [110]. Однако фазовый состав суль-
фидных АНМ катализаторов значительно сложнее и во многом
определяется отношением Ni/(Ni + Mo) (табл. 23) [111]. Уста-
новлено, что при Ni/(Ni + Mo) <0,3 в АНМ катализаторах
содержание серы значительно ниже, чем следует из состава
Ni3S2, MoS2. При сульфидировании смесей оксидов Ni и Мо
с отношением Ni/(Ni + Mo) =0,6 образуется хорошо ©кристалли-
зованная фаза a-NiS и MoS2 [112, 113].
Алюмоникель(кобальт)вольфрамовые катализаторы. Алю-
моникельвольфрамовые (АНВ) и алюмокобальтвольфрамовые
(АКВ) катализаторы в промышленности используют мало. Од-
нако они найдут большее применение в будущем при перера-
ботке тяжелого сырья. Такие катализаторы с содержанием
гидрирующих металлов до 25% по своей структуре в оксидной
и сульфидной формах близки к АКМ системам [114]. По дан-
ным рентгеновской спектроскопии £115], РФЭС [114] и кислород-
ного титрования [116], установлено, что в АНВ катализаторах
никель присутствует в форме Ni2O3 и NiAlO4 в соотношении,
равном 3: 1. При прокаливании образуются алюмовольфраматы
и алюмоникельвольфраматы, которые при сульфидировании
дают WS2. Катионы Ni2+ при сульфидировании изменяют тетра-
эдрическую координацию на октаэдрическую, вытесняя катионы
Ni3+ и увеличивая их концентрацию на поверхности [117].
4*
51
2.1.2. ПРИРОДА АКТИВНОСТИ
Гидрообессеривающая активность АКМ и АНМ катализато-
ров зависит от многих факторов: химического состава и соотно-
шения компонентов, структуры объемных и поверхностных фаз,
природы носителя и промотора, условий получения и предвари-
тельной обработки, текстуры, размера и формы частиц и др.
Выяснению природы каталитической активности такой слож-
ной системы с целью создания физико-химической модели, как
основы направленного синтеза катализаторов гидроочистки
с заданными свойствами, посвящены многочисленные работы.
Однако вопрос пока еще далек от окончательного решения.
Тем не мопсе кажется целесообразным рассмотреть найденные
экспериментально корреляционные закономерности влияния от-
дельных факторов и основные модели катализаторов гидрообес-
серивания для того, чтобы наметить пути их совершенствования.
Важную роль сульфидов металлов, как носителей активно-
сти промышленных катализаторов гидрообессеривания, устано-
вили еще в 60-х годах [83, 119]. Из предыдущего раздела оче-
видно, что» в сульфидированных АКМ и АНМ катализаторах
присутствует фаза MoS2. Экспериментально установлено, что
в катализаторах, достигших стационарной активности в процес-
се длительной эксплуатации, наряду с MoS2 присутствуют окси-
ды Мо5^ и Мо4+, достаточно прочно связанные с носителем,
а степень сульфидирования металла никогда не достигает тео-
ретической— 1 [118]. Количество серы в катализаторах мень-
ше значения, отвечающего стехиометрической реакции полного
перехода оксидов металлов в сульфиды (рис. 11) [118, 120].
В бинарных алюмомолибденовых катализаторах при кон-
центрации МоОз до 15% оксид молибдена находится в высоко-
дисперсном состоянии в основном в виде тетраэдрически коор-
динированного иона (МоО4)2- [100, 121—123]. Степень восста-
новления и координация ионов Мо6+ изменяются при восстанов-
лении и сульфидировании особенно в присутствии катионов Со2+
или Ni2+ В результате формируется структура поверхностных
фаз катализатора [122, 124]. Сульфидирование алюмомолибде-
нового катализатора в токе H2S + H2 при 150—480 °C приводит
к последовательному восстановлению ионов Мо64’, причем при
низких температурах молибден присутствует в виде парамагнит-
ных соединений Мо54- и MoS2, а при высоких температурах —
в виде Мо5+, МоО2 и MoS2 [125]. При этом преобладающей
реакцией является обмен ионов О2- на ионы S2-, причем суммар-
ная стехиометрия соответствует образованию фазы MoOASt/
(х + у = 3), а не MoO2 + MoS2 [98]. Полагают, что процесс суль-
фидирования включает обязательно стадию образования ва-
кансий*:
О.. zO НО. /70 НО. /ОН О^ х*
\ / 0,5Н2 \ 0,5Н2 \ / \ /
Мо6+ ---► Мо54 -------► Мо4+ --------> Мо4+ + Н2О.
.52
Рис. 11. Содержание серы Xs в сульфидирован-
ном АКМ катализаторе теоретическое (1) и экспе-
риментальное (2)
Рис. 12. Изменение константы скорости /г гидрообессеривания тиофена от
природы и содержания промоторов Хм
Способность анионов кислорода к образованию вакансий, как
и к обмену с серой, зависит от характера взаимодействия мо-
либдена с у-А12О3 и от температуры сульфидирования.
Для объемных сульфидов молибдена влияние химического
состава (Mo/S) на гидрообессеривающую активность подробно
изучено в работе [126]. Аналогичная, хотя и более сложная,
картина состояния поверхностных молибденсодержащих фаз
наблюдается и в случае нанесенных катализаторов. Однако для
промышленных катализаторов интерес представляет алюмомо-
либденовая система, промотированная кобальтом или ни-
келем.
На алюмомолибденовую систему промотирующее влияние
оказывают не только Со или Ni, но и другие металлы, причем
максимальный эффект достигается при определенном соотно-
шении металл : молибден, в частности: 0,3 для Мп, 0,6 для Ni,
0,7 для Со и 1,0 для Zn (рис. 12, 13) [83].
Из данных по фазовому составу оксидных форм катализато-
ров гидрообессеривания можно сделать вывод, что роль промо-
тора состоит в регулировании взаимодействия молибдена с но-
сителем и в стабилизации образующихся при этом фаз. Иссле-
дования же последних лет указывают на то, что влияние
промоторов, как и влияние носителя, более сложное.
В АКМ катализаторах кобальт может находиться либо
в виде диспергированных катионов Со2Ь, занимающих вакансии
А13+ в А120з (так называемая, 6-фаза, которая практически не
восстанавливается), либо в виде восстанавливающихся соедине-
ний (р-фаза) [126]. Данные РФЭС свидетельствуют о том, что
только сульфидирующаяся часть катионов Со2+ оказывает про-
мотирующий эффект: наблюдается корреляция между актив-
53
ностью АКМ катализатора и соотношением между ионами Со24\
способными образовывать Co9S8, и ионами молибдена (см.
рис. 4) [97].
Молибден на поверхности в АКМ катализаторах, по-видимо-
му, присутствует в виде трех фаз: прочносвязанных тетраэдри-
чески координированных ионов Мо6+, не восстанавливающихся
даже при высоких температурах (фаза А), ионов Мо6+, почти
не связанных с носителем, которые при сульфидировании обра-
зуют сульфиды (фаза В), и монослой МоОз, в котором катионы
молибдена частично восстанавливаются под влиянием Со или
Ni, а сера обратимо координируется с поверхностными анион-
ными вакансиями (фаза С).
Гидрообессеривающая активность, как полагают, связывает-
ся со степенью восстановления молибдена и степенью дефект-
ности M0S2, а роль промотора может состоять в обеспечении
оптимального соотношения ионов кислорода и серы, координи-
рованных с катионами Мо в упомянутой фазе С [127—129]. Роль
оксида Со или Ni состоит в регулировании степени восстанов-
ления МоО3 по реакции [130]: Со2+ + Мо64- Со3+ + Мо5^ Ме-
таллический же кобальт и никель (или их сульфиды) в мелко-
дисперсном состоянии обеспечивают гидрирование ненасыщен-
ных молекул и тем самым предупреждают закоксовывание ка-
тализатора.
Взаимосвязь между содержанием ионов Мо5+ и гидрообес-
серивающей активностью АНМ катализаторов показана в рабо-
те [131] (рис. 14). Как видно из данных табл. 24, зависимости
содержания образующихся ионов Мо5+ от температуры в вос-
становленных АНМ катализаторах характеризуются максиму-
мами разной интенсивности при 350 °C и минимумами — при
450—500 °C. Восстановление АНМ катализаторов в интервале
температур 500—600 °C вновь приводит к увеличению интенсив-
ности сигналов ЭПР ионов Мо5+. Подобный волнообразный ха-
рактер зависимости свидетельствует о том, что в АНМ катали-
заторах имеются, по крайней мере, два типа молибденсодержа-
Рис. 13. Изменение степени превращения тиофена ф от природы и содержа-
ния металлов
54
Таблица 24. Влияние состава катализатора на интенсивность
сигналов ионов Мо5+, наблюдаемых после восстановления АНМ
катализаторов при разных температурах, и активность
в гидрообессеривании тиофена
Показатель Номер образца
1 1 2 1 3 1 4 1 5 1 6 7 1 8
Состав катализато-
ра, 7о* Д120з 63,2 66,8 73,7 76,2 78,0 84,0 91,0 75,0
NiO 11,8 8,2 5,5 7,7 10,0 5,0 9,0 —
МоОз 25,0 25,0 20,8 16,1 12,0 11,0 — 25,0
Концентрация ионов
Мо5+ • 1018, спин/г:
200 °C 1,0 1,5 1,0 1,0 0,3 0,5 — 4,0
250 °C 5,0 9,0 10,0 6,0 7,5 4,0 — 20,0
300 °C 7,0 12,0 15,0 12,0 10,5 10,5 — 45,0
350 °C 7,0 13,0 20,0 14,5 12,0 21,0 — 66,0
400 °C 5,5 7,0 13,0 10,0 9,5 15,0 — 45,0
450 °C 5,5 11,0 10,0 10,0 9,5 14,5 — 42,0
500 °C 7,5 13,0 15,0 11,0 10,0 15,0 — 42,0
550 °C 9,0 14,0 16,0 15,0 11,0 15,0 — 39,0
600 °C 14,0 18,0 20,0 17,0 15,0 18,0 — 39,0
Активность по тио-
фену, % 60 56 47 52 51 32 — 16
щих соединений, в которых процессы восстановления ионов Мо6+
до Мо54" протекают при разных температурах. Интенсивность
сигналов ионов Мо5и в максимумах при 350°C зависит от соот-
ношения молибдена и никеля в образцах и в первую очередь
от содержания оксида никеля: чем больше в составе катализа-
тора никеля, тем менее интенсивен сигнал ЭПР ионов Мо5+
((см. образцы 1, 2 и 8 с одинаковым содержанием МоО3). По-ви-
димому, уменьшение интенсивности сигнала ЭПР ионов Мо54"
в АНМ катализаторах обусловлено образованием в них никель-
молибденовых соединений.
Рассмотренные выше структурные особенности АКМ и АНМ
каталитических систем положены в основу теории активных
центров и попыток объяснить природу их каталитического дей-
ствия. В основе модели монослоя, предложенной авторами ра-
боты ![132], лежит экспериментально установленный факт, что
кристаллы у-А^Оз с поверхностными гранями [56] покрыты
эпитаксиальным, монослоем МоО3, состоящим из тетраэдров
(МоО4)2- Катионы Со или Ni внедряются в приповерхностный
слой носителя и вытесняют в монослой МоО3 катионы А13+,
которые из-за своей стойкости к восстановлению и сульфидиро-
ванию повышают прочность связи монослоя МоО3 с носителем.
При сульфидировании происходит обмен анионов О2~ в поверх-
ностных тетраэдрах (МОО4)2"" на ионы S2- без образования
отдельной фазы MoS2. Часть ионов кислорода и серы в резуль-
тате восстановления удаляется с образованием анионных ва-
кансий или катионов Мо3+, играющих роль активных центров.
55
Рис. 15. Структура слоя сульфида молибдена
состоянии
Рис. 14. Взаимосвязь между активностью АНМ катализаторов и сигналами
ЭПР ионов Мо5+ в восстановленных катализаторах при 430 °C
• Mo;
Согласно модели монослоя, промотирующее действие Со или
Ni состоит в стабилизации монослоя МоОз на поверхности но-
сителя и в повышении способности молибдена к восстановлению.
Экспериментальную основу и доказательство правильности
этой модели ее сторонники видят в работах, в которых инстру-
ментальным методом нс обнаружена фаза MoS2, а также в дан-
ных по определению содержания серы в сульфидированных ка-
тализаторах, которое всегда ниже (S/Mocl) по сравнению со
стехиометрическим (S/Mo = 2) для объемных сульфидов.
Синергетическая модель [133] исключает взаимодействие ак-
тивной фазы с носителем, а также химическое связывание про-
мотора с MoS2. Эффект активации обеспечивается электронны-
ми переходами на границе контакта объемных фаз MoS2 и
сульфида промотора. В частности, авторы считают, что на не-
восстановленном сульфиде кобальта или никеля протекает ре-
акция активации Н2, который затем обеспечивает восстановле-
ние сульфида молибдена. Вся система находится в состоянии
динамического равновесия и сульфиды промотора осуществля-
ют «контроль на расстоянии» за состоянием и количеством ак-
тивных центров сульфида молибдена. При этом важным факто-
ром синергического эффекта является наличие сверхстехиомет-
рической серы |[132]. В подтверждение этой модели экспери-
ментально обнаружен эффект активации при механическом сме-
шении сульфидов молибдена и кобальта [134], а также изме-
нение энергии связи 3d и 2р электронов атомов молибдена
и серы с ростом отношения Ni(Co)/[Ni(Co)+Мо] в системе
Со—Мо—S [135] и присутствие на поверхности катализатора
восстановленных частиц [133]. Однако, нет никаких данных
о величине поверхности контакта объемных сульфидов и' ее
влиянии на каталитическую активность.
Следующая группа моделей также исходит из предположе-
ния, что активные фазы не связаны с носителем, но между про-
бе
мотором и M0S2 существует химическое взаимодействие. Согла-
сно «модели прослойки», или «слоистой» модели, атомы промо-
тора внедряются и локализуются в тетраэдрических и октаэд-
рических пустотах между двойными слоями ионов серы в кри-
сталлах MoS2 [136]. При этом образуется слоистое соединение,
и в результате передачи электронов промотором происходит
восстановление катионов молибдена и образование дополни-
тельных анионных вакансий. Авторы модели исходят из слои-
стой структуры MoS2, существующей в двух модификациях:
гексагональной (а = 3,16 нм, с=1,22 нм) и ромбической (а =
= 3,7 нм, с= 1,838 нм) [133]. Установлено [134], что отдельные
слои M0S2 могут быть случайным образом ориентированы во-
круг оси «с», а атомы серы, локализованные на базальной и
торцевой грани кристаллов, энергетически неравноценны
(рис. 15).
Поскольку внедрение атомов промоторов в идеальный крис-
талл дисульфида молибдена энергетически невыгодно [117],
предложены уточненные модели «поверхностного внедрения»,
или «декорирования» [138] и модель «компенсирующих катио-
нов» [137]. Согласно модели декорирования, внедрения промо-
тора происходит на ребрах (боковых гранях) кристаллов MoS2.
Во второй модели ионы Со2+ или Ni2+ компенсируют избыточ-
ный отрицательный заряд атомов серы на торцевых гранях
кристаллов M0S2, который возникает при разрыве связей
S—Мо. Эти катионы промотора играют роль дополнительных
центров гидрирования.
Советскими исследователями показано, что в промышлен-
ных АНМ катализаторах гидрообессеривания имеется два типа
активных центров: один на поверхности нанесенных частиц про-
мотированного M0S2, обеспечивающий наряду с гидрообессери-
ванием гидрирование ненасыщенных связей; другой — аналогич-
но модели монослоя, обладающий кислотной природой и уско-
ряющий только реакцию гидрообессеривания [139]. Обработка
смешанной никельмолибденовой системы соляной кислотой се-
лективно удаляет объемную фазу сульфида и остается фаза
состава NixMoS^, где y = S/Mo в M0S2 и у выражается уравне-
нием
О < у < {58,7х - 91 - 32у [1 - (1/П)]}/32 [1 - (1 /П)]
(здесь ц — массовое содержание серы в катализаторе). Эта фа-
за по данным рентгенографии, РФЭС и магнитной восприимчи-
вости отличается от сульфида, оксида или металла [140].
Методом ИК-спектроскопии показано, что в АНМ катализа-
торах имеется два типа атомов серы: сера в объеме кристаллов
M0S2 (Av = 383 см-1) и нестехиометрический анион серы в сое-
динении (NixSpJ/MoS,, (Av = 374 см-1). Существование CoMoS
фазы в АКМ катализаторах, образующейся в результате ком-
пенсации катионами Со2+ избыточного заряда, возникающего
при заполнении анионных вакансий на поверхности боковых
граней M0S2 нестехиометрическими анионами серы, показано
57
Со /Мо
Рис. 16. Изменение содержания Лео в АКМ катализаторе Co9S8 (/), фазы
Мо — Мо — S (2), алюмината кобальта (3) и константы скорости реакции
гидрообессеривания тиофена (4) в зависимости от атомного отношения Со/Мо
Рис. 17. Изменение константы скорости k реакции гидрообессеривания тио-
фена от содержания Со в АКМ катализаторе
методом мессбауэровской эмиссионной электронной микроско-
пии [141] , а также весовым методом [142]. При этом показано,
что содержание CoMoS фазы зависит от атомного соотношения
Со/Мо (рис. 16), а гидрообессеривающая активность АКМ ка-
тализаторов коррелирует с содержанием Со в этой фазе
(рис. 17). Аналогичную по структуре фазу наблюдали также
в Fe—Мо/А12О3 катализаторах [143].
Эти данные свидетельствуют в пользу слоистой модели в ее
разновидности модели компенсирующих катионов, по которой
роль промотора состоит в основном в генерировании дополни-
тельного количества анионных вакансий, и согласуется с мо-
делью Р. Филипса и А. Фите, предложенной ранее для объясне-
ния функциональной зависимости каталитической активности
от концентрации промотора [144]. Последняя модель предло-
жена на основании допущения, что концентрация промотора на
поверхности значительно выше, чем в объеме, а активность про-
мотора равна нулю. Поэтому удельная константа скорости на
границе раздела фаз активного комплекса, молибдена и промо-
тора значительно выше, чем на непромотированном катализато-
ре. Действительно, экспериментальные данные достаточно хоро-
шо коррелируют с теоретической зависимостью разности кон-
стант скорости реакции на промотированном и непромотирован-
ном катализаторах.
2.1.3. ПОРИСТОСТЬ, КИСЛОТНОСТЬ И РАЗМЕР ГРАНУЛ
Пористость катализаторов гидрообессеривания является
важным фактором их эффективности при переработке конкрет-
ных видов нефтяного сырья [12, 145]. Пористая структура ха-
58
рактеризуется удельной поверхностью 5УД, объемом пор vI1(,p
и распределением пор по радиусам и имеет достаточно большое
значение для повышения эффективности катализаторов. Осо-
бенно она важна при работе с высокими объемными скоростями
и в случае переработки тяжелого сырья, поскольку скорость
процесса в пористом катализаторе определяется соотношением
скоростей реакции и массопереноса [146]. Коэффициент эффек-
тивности катализатора т], который можно рассчитать из урав-
нения
Tl = 3[l/th(p— 1/<р]/ф,
где ф — модуль Тиле, равный: ф = ЛУас/ОЭф; L — размер зерна катализатора;
а — удельная активность; с — концентрация реагента; ОЭф — эффективный ко-
эффициент диффузии.
зависит от параметров пористой структуры. В реальных ката-
лизаторах еще необходимо учитывать неоднородность пор по
сечению, их извилистость, шероховатость.
Формирование пористой структуры катализаторов гидро-
очистки зависит от конкретных условий синтеза — природы и ви-
да носителя, способа его модифицирования, гранулометрическо-
го состава основы, способа введения активных компонентов
и др. [147]. Несмотря на то, что важность такого параметра,
как пористая структура, для промышленных катализаторов не-
однократно подчеркивалась и в научной и в патентной литера-
туре, до сих пор нет единой точки зрения относительно опти-
мальной структуры катализаторов гидрообессеривания.
В работе [145] изучено влияние распределения пор по ра-
диусам на адсорбцию водорода и эффективность некоторых
промышленных катализаторов в гидроочистке дизельного топ-
Таблица 25. Характеристика катализаторов гидроочистки
дизельного топлива
Номео образца drp» мм Содержание ме- таллов, % 5УД’ М2/Г ^пл, КГ/мЗ Распределение- пор по размерам Адсор- бция Нг при 350 °C, ммоль/ /см3 Относи- тельная актив- ность
Мо Ni Со V, м3/кг для пор радиу-, сом 1—30 нм максимум для Ди/Дг, нм Ди для пор радиусом 3,75—5,50 нм, м3/м3
1 2 12,6 2,6 184 820 560 4,3 243 218,5 1,05
2 2 9,4 2,1 — 143 850 492 2,9 222 191,6 1,00
3 3 И,1 — 4,0 222 650 617 3,3 126 125,0 0,90
4 4 9,4 2,1 — 156 950 419 2,9 180 219,5 0,83
5 2 7,8 — 2,1 231 760 611 3,4 166 141,4 0,82
6 2 8,6 — 2,1 252 860 542 2,5 101 144,8 0,69
7 4 6,2 2,2 — 112 550 639 2,3 162 121,2 0,59
8 2 9,6 — 3,5 207 770 542 3,5 133 125,0 0,50
9 4 5,7 — 1,7 182 570 340 2,2 017 47,9 0,50
10 2 6,7 — 2,7 210 820 207 — 005 46,0 0,41
59
Таблица 26. Распределение объема пор в интервале
радиусов 1,0—7,5 нм с шагом 2 нм
Номер Объем пор (см'/г) с радиусом, нм
образца 1,0-3,0||,5-3,5|2,0-4,0|2,5-4,5|з,0-5.0|з,5 З.йр.О-б.О 4,5—6,5|5,0—7, о| 5.5—7,5
1 0,076 0,145 0,221 0,312 0,358 0,342 0,279 0,178 0,097 0,041
2 0,078 0,014 0,159 0,198 0,336 0,285 0,285 0,242 0,164 0,080
3 0,176 0,284 0,362 0,392 0,340 0,247 0,157 0,086 0,059 0,036
4 0,096 0,140 0,197 0,244 0,248 0,231 0,168 0,101 0,046 0,018
5 0,157 0,276 0,378 0,431 0,388 0,283 0,169 0,074 0,036 0,015
6 0,300 0,340 0,373 0,321 0,225 0,160 0,079 0,018 0,008 0,004
7 0,061 0,144 0,180 0,249 0,328 0,343 0,323 0,263 0,180 0,117
8 0,159 0,269 0,362 0,393 0,346 0,232 0,118 0,044 0,018 0,011
9 0,200 0,217 0,191 0,125 0,067 0,040 0,024 0,019 0,017 0,013
10 0,136 0,063 0,034 0,012 0,009 0,008 0,007 0,006 0,006 0,005
лива (фракция 208—360 °C) при температуре 360 °C, давлении
4,2 МПа, объемной скорости подачи сырья 0,95 ч-1 и объемном
отношении водород сырье, равном 260. Характеристика катали-
заторов приведена в табл. 25 и 26. Анализ приведенных данных
показывает, что гидрообессеривающая активность и количества
адсорбируемого Н2 лучше всего коррелирует с содержанием
в катализаторе пор радиусом 3,7—5,5 им (рис. 18, 19).
Для количественной характеристики корреляции текстуры
и гидрообессеривающей активности, по крайней мере, светлых
нефтепродуктов, предложен фактор распределения пор по ра-
диусам [Пат. США 2890162, 1971], выражаемый формулой
(D = [Z)f2AZ)]X Ю—4 (Df — преобладающий диаметр пор; AZ) —
интервал шага дифференциального распределения пор — не ме-
нее 1 нм).
Таблица 27. Характеристика катализаторов гидрообессеривания деасфальтированного гудрона арланской нефти
Показатель АКМ КГ-1 КГ-2 кг-з КГ-4
Состав катализатор; %:
МоО3 13,0 13,2 12,0 6,8 7,4
СоО 4,4 4,0 3,9 2,4 2,5
Отношение МоО3/СоО 3,0 3,3 2,8 2,9 3,0
Насыпная плотность, кг/м3 680 680 620 640 580
Удельная поверхность, м2/г 181 237 211 104 128
Общий объем пор, см3/г 0,62 0,58 0,70 0,69 0,70
Преобладающий радиус пор, нм 2,7 2,1 3,6 5,0 7,5
Относительная гидрообессеривающая ак- тивность на единицу:
массы каылизатора 1 ,00 1,42 1,58 1,74 1,32 1,46
массы моаллов 1,00 1,44 2,53 2,60
иовсрхиос।и катализатора 1,00 1,08 1,34 2,28 2,04
объема катали штора 1,00 1 ,42 1,44 1,24 1,25
60
Рис. 18. Изменение адсорбции водорода в зависимости от объема пор для
образцов Со — Мо (ф) и Ni — Мо (О)
Рис. 19. Изменение гидрообессеривающей активности (степени обессеривания
ф) Со — Мо (ф) и Ni— Мо (О) образцов от объема пор радиусом
3,7—5,5 нм
Для гидроочистки остаточного сырья (деасфальтированного
гудрона) лучшие результаты получаются при использовании
крупнопористых катализаторов [145]. Из данных табл. 27
и рис. 20 видно, что модифицирование пористой структуры в на-
правлении увеличения примерно в два раза преобладающего
размера микропор и на 35—40% объема переходных пор с пре-
обладающим радиусом 10—30 нм приводит к увеличению гидро-
обессеривающей активности АКМ катализаторов и их стабиль-
ности. Так, общая длительность работы катализатора КГ-2
с 68%-ой степенью обессеривания деасфальтированного гудрона
при подъеме температуры в реакторе на 25 °C составила 4700 ч
против 2200 ч для стандартного АКМ катализатора.
Влияние размера пор на стабильность работы катализатора
при гидрообессеривании тяжелого сырья (крупнопористый ката-
лизатор дезактивируется медленнее, чем мелкопористый) можно
объяснить различным изменением константы скорости реакции
под влиянием фактора проницаемости при закоксовывании по-
верхности и закупорке пор [148]. В частности, показано, что из-
менение фактора проницаемости промышленного и крупнопори-
стого катализаторов происходит по степенной зависимости, но
для первого значительно быстрее (рис. 21, 22). Фактор прони-
цаемости для промышленного АКМ катализатора после 1600 ч
работы составлял всего 0,1 первоначальной величины. В случае
крупнопористого катализатора уменьшение проницаемости до
такого же уровня происходит только после 8000 ч.
В промышленном АКМ катализаторе имеется большое число
очень мелких пор, которые легко закоксовываются или блоки-
руются уже в первые часы работы, что резко уменьшает поверх-
61
ность. В крупнопористом катализаторе таких пор практически
нет, и кокс откладывается на стенках крупных пор, в меньшей
степени препятствуя доступу молекул сырья и водорода к ак-
тивным центрам.
Сведения о кислотности катализаторов гидрообессеривания
немногочисленны и достаточно противоречивы, по-видимому, по-
тому, что при изучении кислотности ставились различные цели
и использовались разные методы. Исходя из данных о структу-
ре катализаторов гидроочистки, можно предполагать, что их
кислотно-основные свойства должны определяться как кислот-
ными центрами носителя, так и координационно-ненасыщенными
центрами катиона и молибдена.
При исследовании катализаторов методом адсорбции орга-
нических оснований удается определить их суммарную кислот-
ность и распределение кислотности по силе. Авторами работы
[149] изучено влияние содержания молибдена, никеля и цеоли-
та на структурные характеристики и кислотность АНМ катали-
затора, полученных введением солей гидрирующих металлов
в суспензию гидроксида алюминия. Из данных табл. 28 сле-
дует, что МоОз в количестве до 8,6% (образец 3) увеличивает
поверхность катализатора по сравнению с у-А12О3, тогда как
NiO, напротив, несколько ее уменьшает (образец 2). Увеличение
концентрации МоО3 до 17,2% (образец 6) несколько уменьшает
поверхность катализатора и практически не влияет на объем
и средний радиус пор. АНМ катализаторы (образцы 4 и 7) по
сравнению с алюмомолибденовыми катализаторами (образцы 3
и 6), содержащими одинаковое количество молибдена, имеют
меньшую поверхность, а при 17,2% МоО3 — объем и средний
радиус пор. Это может быть связано либо с отложением NiO
на поверхности при прокаливании катализатора, либо с химиче-
ским взаимодействием никеля с носителем и молибденом.
Добавка цеолита во всех случаях приводит к увеличению
поверхности катализатора. Идентичность структуры образцов 8
Рис. 20. Изменение степени обессеривания от длительности испытаний х
для образцов катализаторов:
О — КГ 1; X — КГ-2; А — КГ А — КГ-4; • — АКМ
€2
Рис. 21. Изменение фактора проницаемости f/f0 по мере отработки промыш-
ленного (1) и специального (2) катализаторов:
fo — фактор проницаемости свежего катализатора
Рис. 22. Изменение фактора проницаемости активной поверхности х и ре-
зультирующего параметра К по мере отработки промышленного катализатора
и 9 свидетельствует о том, что в отличие от АНМ контактов
в цеолитсодержащих катализаторах никель связывается более
эффективно с молибденом, чем с носителем, а поэтому прак-
тически не влияет на структуру катализатора.
Хемосорбция Nh3 дает сведения о суммарной величине кис-
лотности поверхности: протоно-донорной (бренстедовской)
и электроно-акцепторной (льюисовской). На рис. 23 приведены
спектры термодесорбции NH3, а в табл. 28 — данные о суммар-
ной удельной хемосорбции NH3 и о количестве NH3, десорбиро-
ванного с единицы поверхности в температурных интервалах
50—200, 200—350 и 350—500 °C на различных АНМ катализато-
Таблица 28. Состав, структурные характеристики, количество NH3,
десорбированного с поверхности катализаторов, и относительная
потеря массы образцов Дтотп в интервале 700—1100 °C
Номер образца Состав катализа- тора, % 5УД’ м2/г гср» нм &NH3’ 106 моль А/МОТН*
6 < 6 о NiO 25-50 °C 50-200 °C 200—350 °C 350-500 °C
1 100,0 184 3,0 8,3 3,6 2,4 2,2 0,9
2 91,4 — 8,6 175 2,9 9,1 3,5 3,1 2,4 0,8
3 91,4 8,6 — 236 3,1 7,7 3,4 2,6 1,4 9,2
4 82,8 8,6 8,6 230 3,1 8,7 3,7 3,0 1,8 8,3
5 77,8 8,6 8,6 250 2.6 10,0 4,9 2,9 2,0 5,2
6 82,8 17,2 — 220 2,9 10,2 4,3 3,9 1,8 16,0
7 74,2 17,2 8,6 207 2,4 11,5 4,8 3,8 2,1 14,6
8** 77,8 17,2 — 234 2,7 10,6 5,3 3,3 1,3 11,5
9** 69,2 17,2 28,6 232 2,8 10,6 5,5 3,0 1,8 10,0
* АШОТ|| — [ (///700—//J100 |)Л^7Оо] X 100%.
** Содержится также 5% цеолита типа У.
63
Рис. 23. Спектры термодесорбции NH3 с поверхности катализаторов (образ-
цы 1—9)
рах. Соответственно этому центры по силе адсорбции NH3 ус-
ловно подразделяются на «слабо», «умеренно» и «сильно» свя-
зывающие.
Из рис. 23 можно видеть, что общая кислотность алюмони-
келевых катализаторов изменяется слабо по сравнению с кис-
лотностью А12О3, однако происходит перераспределение цент-
ров по силе адсорбции в основном в сторону увеличения коли-
чества «умеренно» связывающих: величина удельной адсорбции
несколько возрастает для всех трех типов центров, но особенно
сильно для «умеренно» адсорбирующих аммиак.
Поскольку NiO практически не адсорбирует NH3 при тем-
пературах выше 50 °C, перераспределение центров адсорбции
в алюмоникелевых катализаторах по сравнению с А12О3, по-ви-
димому, связано с образованием поверхностных алюмоникеле-
вых оксидных соединений.
Иную форму имеет спектр термодесорбции алюмомолибдено-
вого контакта (образец 3): он характеризуется более интенсив-
ным, чем в А12О3, пиком при 130 °C, а также перегибом при
240—230 °C, что свидетельствует о наличии в катализаторе двух
типов адсорбционных центров. Вероятно, в алюмомолибденовом
катализаторе в температурном интервале до 200°C происходит
десорбция NH3, адсорбированного на льюисовских кислотных
центрах алюмомолибденовых соединений, а пик с максимумом
при 230—240 °C, видимо, обусловлен термодесорбцией аммиака
с поверхности кластеров или поверхностных полислоев МоО3.
Десорбционные хроматограммы АНМ катализаторов (см.
рис. 23, образцы 4, 7) отличаются от соответствующих спектров
алюмомолибденовых контактов (образцы 3 и 6) прежде всего
тем, что в них наблюдается уменьшение интенсивности пика при
230—240 °C при одинаковом количестве МоО3 и возрастание
интенсивности пика с максимумом при 120—130°С, что харак-
терно для термодесорбции NH3 с поверхности никельмолиб-
датов.
64
Особенно сильное влияние на спектры термодесорбции ам-
миака оказывает введение в катализатор цеолита. Уменьшается
доля «умеренно» связанного аммиака и несколько возрастает
количество «слабо» и «сильно» связанного NH3, что свидетель-
ствует об образовании дополнительного количества поверхност-
ных никельмолибдатов.
Аналогичные результаты получены авторами работы [150].
В частности, установлено, что введение NiO в алюмоникелевый
катализатор повышает число кислотных центров «средней» силы
(рКа между 5 и 2) и к снижению «сильных» кислотных центров
{рКа<.—2,4). Этим объясняется большая устойчивость к коксо-
ванию АНМ катализаторов по сравнению с алюмомолибдено-
выми [150, 151].
Наличие двух типов активных центров — сильнокислотных
(рКа—5,6) и слабокислотных (5 > рКа > 3,3) центров уста-
новлено также и для АКМ катализаторов [152]. При этом соот-
ношение между ними изменяется в зависимости от содержания
натрия (’калия) и порядка нанесения кобальта и молибдена
[153]. С уменьшением кислотности катализатора, особенно силь-
нокислотных центров, скорость коксообразования, по одним дан-
ным [154], уменьшается, по другим [155], напротив, возрастает.
Установлено, что количество хемосорбированного NH3 на вос-
становленных и сульфидированных алюмомолибденовых катали-
Рис. 24. ИК-спектры для различных образцов катализатора на А120з:
1 — А120з; 2-3,8% СоО и 8,5% МоО3- 3 — 4,3% NiO и 8,7% МоО3; 4—1,0% Мо(),. 5—
8,2% МоО3
Рис. 25. Изменение степени превраще-
ния тиофена ф и кислотности кобальт-
молибденового катализатора, нанесенно-
го на 5Ю2+А120з, от содержания в нем
А12О3 (атомное отношение Со/Мо—1 2)
5—922
65
заторах прямо пропорционально концентрации анионных ва-
кансий [156].
Исследование кислотности катализаторов методом ИК-спект-
роскопии позволяет, хотя бы качественно, охарактеризовать
природу их кислотных центров. На рис. 24 приведены ИК-спект-
ры носителя, АКМ и АНМ катализаторов [157, 158]. Для А12О3
характерно наличие изолированных поверхностных ОН-групп
(3790, 3748, 3735, 3710 см-1) и ОН-групп с подвижными атома-
ми водорода (3650, 3550 см-1), обладающих бренстедовской
кислотностью. При нанесении молибдена подвижность ОН-групп
носителя исчезает, по-видимому, в результате их взаимодействия
с МоО3. В спектрах АКМ и АНМ катализаторов, полученных
совместной пропиткой носителя, вновь появляются группы
Si—ОН (3710, 3770 см-1) и В-центры (3650, 3550 см-1), что
свидетельствует об образовании никель (кобальт) молибдатов.
Рассмотренные выше данные о кислотности катализаторов
гидроочистки носят качественный характер и не позволяют вы-
явить влияния этого фактора на гидрообессеривающую актив-
ность. Такая попытка была сделана авторами в работе [159]
для АМК катализаторов, однако, как можно видеть из рис. 25,
корреляции между кислотностью катализатора и его гидрообес-
серивающей активностью не обнаружено.
2.1.4. ПРИРОДА НОСИТЕЛЯ
Промышленные катализаторы гидрообессеривания нефтепро-
дуктов являются кобальтмолибденовыми или никельмолибдено-
выми системами, нанесенными на оксид алюминия. Хотя ряд
авторов [160] считают, что любое пористое вещество с доста-
точно развитой удельной поверхностью может быть использо-
вано в качестве носителя катализаторов гидрообессеривания,
выбор оксида алюминия не случаен.
Носитель в составе катализатора гидрообессеривания играет
роль не только инертного разбавителя и служит в качестве
структурного промотора, создающего оптимальную пористую
структуру, но и оказывает большое влияние на формирование
активных фаз.
Влияние природы носителя на свойства кобальтмолибдено-
вых катализаторов, нанесенных на А12О3, SiO2 и активирован-
ный уголь, исследовано методами рентгенографии, РФЭС [161]
и мессбауэровской электронной спектроскопии [162]. Установ-
лено, что в катализаторах, нанесенных на SiO2 или активиро-
ванный уголь как в оксидной, так и в сульфидной формах,
практически отсутствует взаимодействие металлов с носителем.
Так, из мессбауэровских спектров оксидных систем Co/Si02
и Со—Mo/SiO2 (рис. 26) видно, что кобальт присутствует в виде
СО3О4. В кремнекобальтмолибденовой системе наблюдается об-
разование поверхностного соединения СоМоО, возможно, плохо
окристаллизованного СоМоО4. При сульфидировании образуют-
ся Co9S8 и фаза CoMoS2.
66
В оксидных Со—Мо/А12О3 катализаторах наблюдается внед-
рение ионов Со2+ в А120з, а также сильное взаимодействие мо-
либдена с носителем. В сульфидированных контактах кобальт
обнаруживается по крайней мере в двух формах в виде фазы
C0M0S2, но не в виде Co9S8.
Об образовании поверхностных CoMoS фаз и сильном элект-
ронном взаимодействии молибдена с А12О3 свидетельствует так-
же смешение линии Мо3^3/2 и Мозй5/2 в АКМ катализаторах по
отношению к МоО3:
Моз</э/2 моз</6/
МоО3 . 234,7 231,7
Мо/А12О3 . 234,9 232,0
Со—Мо/А12О3 оксидный 235,1 232,1
Со—Мо/А12О3 сульфидный 231,3 228,3
^-4 -2 0 2 4 6-6-4 -2 0 2 4 6
^ц.2р > отн. вд.
РФЭС-спектры сульфидированных Со—Мо/А12О3 катализа-
торов также подтверждают образование двух новых форм ко-
бальта с максимумом энергии связи Со2рз/( 778,0 и 780,9 эВ
[162].
В целом системы на SiO2 или активированном угле по своим
«физико-химическим свойствам близки к ненанесенным кобальт-
молибденовым системам, тогда как алюмокобальтмолибденовая
система отличается от них достаточно сильно. Различия прояв-
ляются и в каталитической активности. Из рис. 27 видно, что
гидрообессеривающая и гидрирующая активность кобальтмо-
либденовых катализаторов, нанесенных на А12О3, выше, а интер-
вал отношения Со/(Со + Мо), в котором проявляется активирую-
щий эффект кобальта, значительно больше, чем катализаторов,
нанесенных на SiO2. Эти
данные хорошо коррелиру-
ют с результатами, полу-
ченными в работе [159], и
свидетельствуют о том, что
А120з в отличие от SiO2
действует как специфичес-
кий активатор на кобальт- S
молибденовую систему. |
С помощью спектров о
диффузного отражения по- В
В
Рис. 26. Мессбауэровские спектры §
оксидных (образцы 1—7) и суль-
фидных (образцы 8—14) катали-
заторов при комнатной темпера-
туре:
1 — СоМоО4; 2— Со]— Моб- 3 J0 —
Со0,25/А12О3; 4, 11 - Col— Мо6/А12О3- 5,
12 — Col/SiO2; 6, 13 — Col— Mob/SiO2;
7, 14 — Col— Моб/С; 8 — Co9S8; 9 —
Co—MoS2; цифры у элементов означа-
ют их содержание в катализаторе
5’
67
Рис. 27. Изменение активности аОтп
образцов на А120з (а) и SiO2 (б)
в реакции гидрогенолиза тиофена
сульфидированных кобальтмолибдеиовых
от атомного отношения Со/(Со + Мо)
(1) и гидрирования циклогексана (2)
казано, что путем легирования у-А12О3 добавками Ве2^, Mg2+,
Са2+, Sr2+ и Ва2+ можно регулировать тип соединения кобаль-
та, наносимого па носитель [163]. В частности Ве2+ и Mg2+
значительно снижают температуру разложения нитрата кобаль-
та в оксиде и, кроме того, тормозят твердофазную реакцию
между Со3О4 и у-А120з с образованном СоЛ1204 и замедляют
растворение Со2+ во внешних слоях решетки носителя. Катио-
ны Са2+, Sr2+ и Ва2+, напротив, ускоряют эти реакции.
Присутствие в А12О3 примесных катионов Na+ существенно
увеличивает способность АКМ катализаторов к восстановле-
нию [164] и ингибирует образование сильнокислотных центров
(2,0 > рКа > —5,6) при взаимодействии кобальта и молибде-
на при их нанесении на носитель.
2.2. КАТАЛИЗАТОРЫ ДЕАРОМАТИЗАЦИИ
Основным назначением промышленного процесса деаромати-
зации керосиновых и газойлевых фракций, как уже отмечалось
в гл. 1, является улучшение эксплуатационных свойств реактив-
ных топлив (увеличение высоты некоптящего пламени, люмино-
метрического числа, теплотворной способности) путем гидриро-
вания содержащихся в них ароматических углеводородов [21,
82]. Реакция каталитического гидрирования индивидуальных
ароматических углеводородов и их смесей достаточно хорошо
изучена и по этому вопросу опубликована обширная литература
[И, 163—165].
Специфичность реакции деароматизации нефтяных фракций
состоит в том, что гидрирование ароматических углеводородов
протекает в присутствии углеводородов других классов, а так-
же органических соединений серы и азота. Состав исходного
68
сырья и требования к качеству целевого продукта определяют
выбор катализатора и технологии проведения процесса. Из дос-
таточно широкого круга известных катализаторов гидрирова-
ния для процесса деароматизации на практике используют ме-
таллы VIII группы Периодической системы на носителе и ок-
сидные или сульфидные катализаторы [80].
Катализаторы первой группы наиболее активны и позволяют
проводить гидрирование ароматических углеводородов кероси-
новых фракций в мягких условиях при температуре 80—200 °C
и давлении 1—5 МПа с объемной скоростью подачи сырья до
5 ч-1. Однако при деароматизации нефтяного сырья их актив-
ность довольно быстро снижается, что связано с обратимым
отравлением содержащихся в сырье серо- и азоторганических
соединений. Поэтому при использовании таких катализаторов,
как Ni, Pd, Pt на А12О3 или специальном носителе, Pt(Pd)—Re
на А12О3, Pt—Ge—Re на А12О3, Pd (Pt)/цеолит У, применяют, как
правило, двухстадийную технологию, включающую стадию пред-
варительной глубокой очистки сырья от серооргапических сое-
динений до их остаточного содержания 1-10 4% [21].
Патентные сведения о катализаторах гидрирования аромати-
ческих углеводородов и способах их синтеза обобщены в
табл. 29.
В Советском Союзе для гидрирования керосиновых фракций
разработаны палладийцеолитсодержащий катализатор ГТ-15
[81, 166] и катализатор, не содержащий цеолита, типа ГР [167].
Катализатор ГТ-15 при содержании в сырье сернистых соедине-
ний не более 0,2% и азотистых соединений не более 0,001%
обеспечивает стабильную деароматизацию прямогонных кероси-
новых фракций в одну ступень при давлении 4 МПа, темпера-
туре 280—340 °C и объемной скорости до 4 ч-1. Глубина удале-
ния ароматических углеводородов в этих условиях составляет
75—90%. При более высоком содержании в сырье каталитиче-
ских ядов требуется предварительная гидроочистка сырья, а де-
ароматизация на второй ступени протекает в более жестких
условиях: температуре 300—380 °C, давлении 5 МПа и объемной
скорости 2—3 ч-1 [81]. В аналогичных условиях проводят деаро-
матизацию гидроочищенных керосиновых фракций на катализа-
торах ГР-3 [167], АП-56 [168] и Pt/Al2O3 [169].
В последние годы для процесса низкотемпературного жидко-
фазного гидрирования ароматических углеводородов в керосино-
вых фракциях предложены катализаторы: Rh, Ru, Pt—Rh,
Pd—Rh, нанесенные на AI2O3, активные при температуре до
200 °C и давлении 1—4 МПа [170].
В присутствии оксидных и сульфидных катализаторов реак-
ция деароматизации проходит в более жестких условиях, чем
в присутствии металлических: температура 360—425°C и давле-
ние 25—32 МПа. В промышленной практике применяют смешан-
ные сульфидные катализаторы: сульфиды Cr, Fe, Со, Ni, Мо
и W, нанесенные на А12О3 или SiO2 [21, 171].
69
Таблица 29. Патентные сведения о катализаторах гидрирования ароматических углеводородов
Состав
Способ приготовления
Источник информации
0,4% Pt на носителе с 5уд = 400 м2/г
и vnop = 0,5 см3/г
0,4% Re, 0,4% Pt на А12О3
6,0% МоОз, 2,2% NiO, 28% MgO,
5-20% В2О3 и 3,0% F
0,5% Pd на цеолите Y (морденит
или NaX), 5уд = 670 м2/г
1,0% Pd (Pt, Os) на Al —Si с
Упл = 450 кг/м3, 5уд = 320 м2/г с до-
бавками до 10% цеолита
0,8% Pt, 0,1% Na на оффретите
1,0% Ge, 1,0% Со, 0,4% Pt и
0,9% Li на А12О3
0,5% —1,0% Pt и Pd на у-А12О3 со-
держанием 2% С1
0,2—1,0% Pt, 1,0—5,0% Sn, 0,4% Re
и 0,5% Li на А12О3
0,3% Pt и 4,8% F на А12О3
0,6 % Pt или Pd на А1 — Si с 5УД =
= 100—250 м2/г, гСр = 7,0—13,0 нм,
уп- = 300—500 кг/м3
0,3% Pt, 0,1% Rh, 0,1% Со и
0,2% Ge на кристаллическом алю-
мосиликате
Осаждение ионным обменом на носитель — А12О3, SiO2, TiO2
или их смеси
Пропитка гранул А12О3 растворами HReO4 и H2PtCl6, про-
мывка водой и пропитка раствором Li(NO3)2, сушка катали-
затора при 150 °C и прокаливание при 590 °C
Смешение силиката магния с раствором (NH4)6-Mo7-O24-
•4Н2О, сушка пасты, прокаливание и пропитка раствором
(CH3CoO)2-Ni-4H2O
Декатионирование исходного цеолита до 0,9% Na2O, введе-
ние в него ионным обменом Pd
Добавление NH4OH к раствору А1С13, затем жидкого стекла
и воды; к смеси приливают карбонат аммония при 90 °C;
формование массы в экструдаты и пропитка их раствором
PdCl2
Нанесение активного компонента на цеолит (SiO2: А12О3=
= 5—10), который предварительно декатионируют раствора-
ми NH4NO3 или NH4C1
Добавление (CH2)6N4 к золю А1ОНС12 с образованием геля,
его промывка, прокаливание; пропитка носителя раствором,
полученным смешением GeCl4 с H2PtCl6, LiCl, СоС12 и НС1
Растворение H2PtCl6 в водном растворе, содержащем 5%
PdCl6, подкисление НС1, добавление сухой у-А12О3, сушка,
прокаливание при 220 °C
Пропитка носителя растворами H2PtCl6, НС1, SnCl4
Пропитка гранул А12О3 раствором, содержащим Pt, обработ-
ка F-содержащим раствором
Носитель — смесь А12О3 и SiO2 в соотношении 1 1—17 1,
таблетируют, подвергают ионному обмену растворами
Pt(NH3)6(OH)4 или Pd(NH3)6-(ОН)4; полученный катализа-
тор сушат при 260 °C в токе воздуха
К раствору, содержащему H2PtCl6, СоС12, трихлоргидрат Rh
и НС1, добавляют GeCl4; смесь используют для пропитки
носителя при 20 °C в течение 0,5 ч, затем при 107 °C; пропи-
танные частицы подвергают окислительной обработке при
525 °C на воздухе, обрабатывают смесью Н2О и НС1
Па г США 3816239,
1974 г.
Пат. США 3529029,
1970 г.
Пат. США 3269938,
1966 г.
Пат. США 1173469,
1969 г.
Пат. США 4218308,
1980 г.
Пат. Англии 1399655,
1975 г.
Пат. США 4003954,
1977 г.
Пат. США 4049576,
1977 г.
Пат. США 3649703,
1972 г.
Пат. Англии 1400455,
1975 г.
Пат. США 3637878,
1972 г.
Пат. США 4079092,
1978 г.
Несмотря на то, что никельвольфрамсульфидные катализато-
ры разработаны еще в 40-х годах, некоторые из них [172] сохра-
нили свое значение до настоящего времени. По принятой техно-
логии их готовят таблетированием подготовленной шихты суль-
фидов на пресс-машинах. Дальнейшие научно-исследовательские
работы показали, что активность никельвольфрамсульфидного
катализатора 3076А может быть значительно повышена, если
его получать не прессованием, а экструзионным формованием
[173]:
Таблетирование Экструзия*
Насыпная плотность, кг/м3 1500 1200/1150
Индекс прочности, кг/мм 10,0 6,0/3,0
Диаметр гранул, мм 10,0 4,5/1,5
Удельная поверхность, м2/г 70 105/110
Объем пор, см3/г 0,1 —
Радиус пор, нм 2,0 —
Гидрирующая активность, % 33,3 42,8/45,0
♦ В числителе — для крупных экструдатов,
в знаменателе — для мелких.
Достоинством сульфидных катализаторов является их не-
восприимчивость к воздействию каталитических ядов сырья, что
позволяет проводить процесс деароматизации как прямогонных
керосинов, так и сырья вторичного происхождения в одну ста-
дию. Недостаток таких систем — их невысокая гидрирующая
активность, что требует применения жестких условий проведе-
ния реакции.
В последние годы предприняты попытки разработать высоко-
активные, стойкие к воздействию сернистых соединений ката-
лизаторы гидрирования ароматических углеводородов в нефтя-
ных фракциях. Рассмотрим основные пути создания таких ката-
лизаторов [21, 174].
Металлсодержащие катализаторы. Это — высокодисперсные
системы с относительно высокой удельной поверхностью. Струк-
тура модельных систем с содержанием металлов 0,2—1,5%,
а также генезис в процессе приготовления и активации рассмот-
рены в работе [175].
Основной причиной отравления таких катализаторов серни-
стыми соединениями нефтяного сырья является изменение элек-
тронного состояния металла в результате хемосорбции сероор-
ганических молекул и сероводорода, а также изменение струк-
туры и фазового состава катализатора [174]. В частности, в об-
ласти низких температур (до 200—250°C) снижение активности
металлсодержащих катализаторов в процессе непрерывной ра-
боты обусловлено избирательной хемосорбцией органических
соединений серы, вызывающей блокировку активных центров
и изменение электронного состояния металла. В области сред-
них температур (250—350°C) протекают процессы гидрогеноли-
за сероорганических соединений и сульфидирование металла.
В области высоких температур (350°C и выше) главной причи-
71
ной дезактивации является конкурентная хемосорбция водо-
рода.
На практике для повышения сопротивляемости металличе-
ских катализаторов к дезактивации сернистыми соединениями
в процессе гидрирования нефтяного сырья используют следую-
щие способы [21, 174]:
увеличение дисперсности (удельной поверхности) активного
металла;
введение в катализатор поглотителей серы;
легирование активного металла добавками металлов IV и
VI группы Периодической системы;
выбор носителя и модифицирование его поверхности.
При увеличении дисперсности металла или его удельной по-
верхности возрастает свободная металлическая поверхность на
единицу массы катализатора, что замедляет скорость сульфи-
дирования металла. Это можно объяснить тем, что при увеличе-
нии дисперсности металла возможен переход электронной плот-
ности от металла к носителю. Тем самым на атомах металла
создается дефицит электронной плотности, и замедляется ско-
рость химического взаимодействия металла с серой:
^2Mn+-|-2ne_+0,5nS2. Способ повышения серостойкости метал-
лических катализаторов за счет увеличения дисперсности метал-
ла наиболее эффективен в области высоких температур. В об-
ласти средних температур более эффективен способ модифици-
рования катализатора или носителя [176].
В качестве легирующих добавок используют Sn, Re, Ge, Ti,
Zr и другие металлы [21, 174], которые, образуя сплавы с гид-
рирующими металлами, замедляют процесс сульфидирования,
стабилизируют дисперсность и могут изменять электронное сос-
тояние системы. Метод модифицирования носителя заключается
в создании на поверхности электроноакцепторных функциональ-
ных групп, способных взаимодействовать с атомами металла и
препятствовать передаче электронной плотности на атом серы
адсорбированного контактного яда. В качестве таких электроно-
акцепторных групп могут выступать кислотные ОН-группы А120з.
Причем их акцепторную способность можно увеличить введе-
нием в оксид алюминия 0,10—15% SiO2 или ионов галогена
[21].
При использовании в качестве носителя катализаторов цео-
литов сильнокислотные протонные центры создаются в резуль-
тате модифицирования цеолитов в процессах ионного обмена
[177—180). Так, было установлено, что металлический Pd, дис-
пергированный в цеолитной матрице типа Y, L, морденит, сохра-
няет высокую гидрирующую активность при содержании серы
в сырье до 0,5% [177].
Активность и селективность металлцеолитсодержащих ката-
лизаторов гидрирования ароматических углеводородов зависят
от многих факторов: типа цеолитсодержащего носителя, приро-
ды обменных катионов, степени ионного обмена, мольного от-
72
Рис. 28. Изменение активности и
селективности с Pd-цеолитсодер-
жащих катализаторов а в реакции
гидрирования о-ксилола в зависи-
мости от отношения SiO2/Al2O3
Условия гидрирования: / = 300 °C, р =
= 5,0 МПа, х' = 1,0 ч-1, 0,5% серы в
о-оксилоле
ношения SiO2/Al2O3 в каркасе цеолита, фазовой и кристалло-
графической чистоты, наличия связующих веществ и их природы,
количества и природы активного гидрирующего металла, его
распределения в носителе и др.
Для Pt- и Pd-цеолитсодержащих катализаторов иа примере
гидрирования модельных углеводородов (толуола, о-ксилола,
а-метилнафталина) установлено, что носители по активности ка-
тализаторов с содержанием металла 1% располагаются в сле-
дующий ряд: У>Х>2>морденит>эрионит>А.
Мольное отношение SiO2/Al2O3 в каркасе цеолита оказывает
влияние как на активность и селективность, так и на серостой-
кость металлцеолитсодержащих катализаторов. Увеличение
мольного отношения SiO2/Al2O3 от 3,8 до 5,0 в катализаторе
PdY приводит к росту его активности в гидрировании а-метил-
нафталина (178]. Дальнейшее увеличение SiO2/Al2O3 до 5,7 прак-
тически не влияет на активность, а более глубокое деалюмини-
рование приводит к падению активности, по-видимому, за счет
разрушения цеолитного каркаса. При увеличении силикатного
модуля цеолита Y серостойкость Pd-цеолитсодержащих ката-
лизаторов проходит через максимум при SiO2/Al2O3 = 7,0,
(рис. 28) [181]. Более глубокое деалюминирование снижает се-
ростойкость. Такое влияние деалюминирования на стойкость
к отравляющему действию серы объясняют увеличением силы
протонных кислотных центров цеолита, способных взаимодейст-
вовать с атомами Pd по донорно-акцепторному механизму [181,
182]. В результате такого взаимодействия на атомах Pd возни-
кает дефицит электронной плотности, что препятствует химиче-
скому взаимодействию атомов палладия с атомами серы.
Эффективный положительный заряд на металле возникает
при образовании комплексов переноса заряда типа:
6+ I
Pd ---Н -О—Цеолит.
Данные ИК- и РФЭ-спектроскопии подтверждают это пред-
положение. Так, сдвиг полосы комплекса PdCO от 1980 см1 для
Pd/Al2O3 и 2110 см-1 для PdHY (рис. 29) указывает на изме-
73
2000 2200 2400
^СГГ1
332 336 340 344 348
Энергия связи, эВ
Рис. 29. ИК-спектры оксида углерода, адсорбированного на металлсодержа-
щих катализаторах:
1 — Pd/Al2O3, окисленный и восстановленный затем при 300 °С: 2 — PdHY, окисленный и
затем восстановленный при 300 °C; 3 — то же, что и 2, после адсорбции бензола
Рис. 30. Положение линии 3d 5/2 в спектре ЭСКА для палладия в цеолитах
PdHY, обработанных воздухом при 300 °C:
/, 2— после вакуумирования при 20 и 150 °C соответственно; 3, 4 — после восстановления
в водороде при 150 и 300 °C соответственно
нение электронного состояния палладия [183]. Данные РФЭС
[184, 185] также свидетельствуют о том, что состояние восста-
новленного палладия в цеолитах отличается от состояния Pd на
А120з и в металлической черни. Смещение величины энергии
связи уровня Pd3d5/? на 1 эВ (рис. 30) свидетельствует о том,
что, вероятно, после восстановления атомы палладия на цеоли-
те HY сохраняют положительный заряд порядка 0,4—0,6 элект-
ронных единиц.
Цеолиты в составе катализаторов гидрирования применяют
в катионообменной форме. Установлено, что палладиевые ката-
лизаторы, приготовленные на основе цеолита Y, содержащего
поливалентные катионы (рис. 31, образцы 5—9), более актив-
fl 0,05 0,10 0,15 0,20 0 0,05 0,10 0,15 0,20
гк ,нм
Рис. 31. Изменение степени превращения а-метилнафталина ф в зависимо*
сти от радиуса катиона цеолита типа Y:
Условия гидрирования: р = 4,0 МПа, w = I,0 ч-1, расход Н2 1000 м3/мэ, температура реак-
ции 250 °C (/), 275 °C (//), 300 °C (///);
1 — Na+; 2 — К+; 3 — Rb+; 4 - Cs+; 5 — Вс2+; 6 — Mg2+; 7 — Са2*; 8 — Sr^; 9 — Ва2+
74
Таблица 30. Состав гидрогенизатов толуола на Pd-цеолитсодержащих
катализаторах
Условия процесса: температура 260—280 °C, давление 4 МПа,
объемная скорость подачи сырья 1 ч-1, расход водорода 1000 м3/м3 сырья
Катализатор* Состав гидрогенизата, %
углеводоро- ды Ci—Ce циклогексан метилцикло- гексан (толуол)
0,68 Pd — NaY — 100,0
0,69 Pd — 0,80 MgNaY — 28,8 71,2
0,68 Pd — 0,89 SrNaY — 11,9 88,1
0,67 Pd — 0,90 BaNaY — — 100,0
0,65 Pd —0,81 ZnNaY — 11,7 52,8(36,0)
0,69 Pd — 0,93 CrNaY — 39,0 61,0
0,67 Pd — 0,94 HNaY 9,3 44,0 46,7
0,61 Pd —0,95 LaNaY 3,3 24,2 72,0
* Цифры у элементов означают их процешное содержание в образце.
ны, чем на основе того же цеолита, содержащего одновалент-
ные катионы металлов I группы (образцы 1—4). При этом
в обоих случаях активность катализатора снижается с увеличе-
нием порядкового номера элемента (см. рис. 31) [165].
Хотя поливалентные формы цеолитов позволяют получать
активные катализаторы гидрирования ароматических углеводо-
родов, селективность таких катализаторов ухудшается: наряду
с реакцией гидрирования ускоряются реакции деалкилирования
и расщепления. В качестве примера в табл. 30 приведены дан-
ные по составу гидрогенизата толуола на Pd-цеолитсодержащих
катализаторах [178], из которых видно, что из толуола наряду
с метилциклогексаном образуются значительные количества
циклогексана и углеводородов Cj—С5.
Однако катионообменное модифицирование цеолита оказы-
вает положительное влияние на повышение серостойкости
Pd-цеолитсодержащих катализаторов. В частности, показано,
что стабильная активность этих катализаторов в присутствии
серы возрастает при введении в цеолит катионов Са2+, Mg2+
и редкоземельных элементов (III) или при декатионировании
цеолита [177, 181]. Рост серостойкости катализаторов начинается
с некоторой пороговой степени обмена катионов Na+, зависящей
от типа обменного катиона (рис. 32). Значение пороговой сте-
Рис. 32. Изменение серостойкости
Pd-цеолитсодержащих катализаторов
от степени обмена катионов Na+ (о:
f — обмен на Са2+; 2 — обмен на Mg2+; 3 —
обмен на La3+; 4 — обмен на NH<
75
Рис. 33. Изменение степени превращения цеолитсодержащих катализаторов
в зависимости от содержания палладия:
/ — PdNaY (SiO2/Al2O3=4,5): 2 — PdNaY (SiO2/AI2Oj-5,1); 3 — Pd 0,7?CaNaY (SiO2/Al2O3 =
= 5,1); 4 — Pd—0,90CaNaY (SiO2/Al2O3-4,5)
Puc. 34. Изменение серостойкости Pd-цеолитсодержащего катализатора при
гидрировании о-ксилола
пени обмена составляет: для Са2+ 85—90%, для Mg2+ 80—85%,
для La3+ 65—80% и для NH4+ 40—50% • Подавление кислотной
функции цеолитного носителя с целью уменьшения доли побоч-
ных реакций возможно при селективном отравлении или нейтра-
лизации бренстедовских кислотных центров или термопаровой
обработкой, преобразующей брепстедовские кислотные центры
в льюисовские [165].
Серостойкость Pd-цеолитсодержащих катализаторов возрас-
тает также с увеличением содержания Pd (рис. 33). Однако
вводить Pd в количестве более 5% экономически нецелесооб-
разно.
При приготовлении промышленных катализаторов подготов-
ленный цеолит формуют со связующим. На рис. 34 показана
зависимость стабильной активности Pd-цеолитсодержащего ка-
тализатора (5% Pd, 95% деалюминированный цеолит Y в Са-
форме с SiO2/Al2O3 = 5,8) от содержания связующего. Как вид-
но, при увеличении содержания А12О3 до 20% стабильная актив-
ность катализатора возрастает в 1,3 раза. Наличие максимума
можно объяснить достижением оптимального соотношения меж-
ду объемом транспортных пор в гранулах катализатора и со-
держанием активного цеолитсодержащего компонента.
Механическая прочность цеолитсодержащих катализаторов,
полученных формованием цеолита со связующим, зависит от
содержания связующего, дисперсности и размера кристаллов
цеолита, влажности массы и ряда других факторов. Таким об-
разом, связующее в составе металлцеолитсодержащих катали-
заторов деароматизации, с одной стороны, играет положитель-
ную роль: повышает их механическую прочность и серостой-
кость. С другой стороны, введение связующего увеличивает
вторичную пористость гранул и создает систему макропор, что
снижает и скорость диффузии за счет капиллярной конденсации,
76
и эффективность действия катализатора. Поэтому для повыше-
ния эффективности предлагают готовить катализаторы на ос-
нове цеолитов без связующего [165]. Так, в сравнимых условиях
(давление 4 МПа, объемная скорость подачи сырья 1 ч-1, пода-
ча Н2 1000 м3/м3 сырья, температура 250—300 °C) удельная ско-
рость гидрирования а-метилнафталина на катализаторе 1%
PdNaY (SiO2/Al2O3 = 5,0), сформованном без связующего, была
в 1,2—1,4 раза выше, чем на катализаторе того же состава,
сформованном с 20% А12О3.
Путем оптимизации состава и методов синтеза Pd-цеолит-
содержащих катализаторов был разработан катализатор ГТ-15М
(0,5—0,7% Pd), предназначенный для гидродеароматизации
прямогонных дистиллятов реактивных топлив без их предвари-
тельной гидроочистки [182]. Pd-цеолитсодержащие катализато-
ры устойчивы при переработке сырья с содержанием серы до
0,8% [181].
Способ повышения стабильности металлических катализа-
торов путем введения в них поглотителей серы, например окси-
дов щелочных или щелочноземельных металлов, малоэффекти-
вен, так как емкость по сере этих добавок невелика.
Оксидные и сульфидные катализаторы. Смешанные оксид-
ные системы на основе Со, Ni, Мо или W при переработке сер-
нистого сырья применяют в основном в сульфидной форме. По-
этому в период стабильной работы имеет место не оксидная,
а сульфидная система, гидрирующая активность которой зави-
сит от следующих факторов [126]:
типа исходного соединения Мо или W, используемого в син-
тезе (оксиды, соли, тиосоли, сульфиды);
типа носителя;
соотношения Ni(Co)/Mo(W) и метода смешения компо-
нентов;
метода и режима сульфидирования оксидных предшествен-
ников.
Вопросы синтеза, структуры, физико-химических свойств и
промышленного применения катализаторов на основе Мо и W,
особенно приготовленных в оксидной форме, а затем подвергну-
тых сульфидированию, достаточно полно рассмотрены в обзорах
и монографиях [21, 165, 186]. С точки зрения практического
использования интерес представляют смешанные и объемные
сульфидные катализаторы.
Активность смешанных сульфидных систем, содержащих
сульфиды Mo(W) и Ni(Co), определяются такими факторами
[126]: природа промотора, атомное соотношение r = Ni(Co)/
/ [Ni (Со)+Mo(W)] (атомного параметра), методы введения
промотора, активность исходного сульфида Mo(W) (при введе-
нии промотора в готовый дисульфид).
Имеющиеся в литературе данные по текстуре и структуре
смешанных сульфидных систем немногочисленны и касаются
преимущественно фазы MoS2 и WS2. По данным реитгеногра-
77
фии, сульфиды Мо и W в смешанной сульфидной системе пред-
ставляют собой гексагональные пластины толщиной до 15 мкм.
При этом структура сульфидов характеризуется дефектами упа-
ковки слоев призм. Поверхность Ni—W и Со—W сульфидных
систем (10—15 м2/г) ниже, чем аналогичных молибденсульфид-
ных катализаторов (^60 м2/г) [187]. Причем максимум удель-
ной поверхности наблюдается при г = 0,4—0,6.
Совокупность данных по структуре, содержанию серы и
удельной поверхности смешанных сульфидных систем позволя-
ют выделить три области составов [126]:
г < 0,1 —0,4, о,1 — 0,4 < г <0,5 — 0,65, г > 0,5 —0,65.
В средней области содержание серы отвечает объемным суль-
фидам, а удельная поверхность и удельная активность таких
систем максимальны. Физико-химические свойства объемных
сульфидов молибдена и их адсорбционные и каталитические
свойства, а также методы синтеза описаны в работах [126, 187].
Каталитическая активность сульфидов молибдена (вольфра-
ма) связывается с наличием на боковых гранях кристаллитов
анионных вакансий [188, 189]. Так, в структуре M0S2 (см.
рис. 15) имеется три типа атомов серы с разной координацией
по молибдену. Часть ионов Mo(W)41 локализована в частично
недостроенных тригональных призмах — на торцевых гранях
и в углах слоев. Кроме координационно ненасыщенных ка-
тионов Mo(W)4+ в нестехиометрических сульфидах возможно
образование координационно ненасыщенных ионов Mo(W)3+
с появлением анионных вакансий по сере на боковой и базаль-
ной плоскостях. Поэтому активность сульфидов молибдена
(вольфрама) может меняться в зависимости от способа их при-
готовления, коррелируя с отношением S/Mo (табл. 31) [140].
Введение в дисульфид молибдена (вольфрама) сульфидов
никеля (кобальта) приводит к возрастанию активности систе-
мы по сравнению с удельной активностью компонентов. При этом
максимум! активности соответствует величине атомной доли
Таблица 31. Влияние способа приготовления на гидрирующую
активность сульфидов молибдена
Способ получения $уд, м2/г Содержа- ние серы, % Отношение S/Mo КсХнстанта скорости гидрирова- ния о-ксилола
Природный молибденит 10 40,1 2,008 1
Разложение (NH4)2MoS4 (Н2, 300 °C) 4 39,1 1,926 20
Восстановление M0S3 (Н2, 300 °C, скорость нагрева 12 °С/мин) 3 38,6 1,886 43
Восстановление M0S3 (Н2, 400 °C, скорость нагрева 70 °С/мин) 52 37,6 1,808 131
78
промотора от 0,05 до 0,50 в зависимости от способа синтеза
катализатора. Представления о природе эффекта активации
опираются на следующие физико-химические свойства смешан-
ных сульфидных систем [126]: слоистую структуру дисульфидов
молибдена (вольфрама), их полупроводниковые свойства и спо-
собность промоторов образовывать сульфиды переменного со-
става.
Слоистая структура MoS2(WS2) предполагает возможность
внедрения ионов Ni или Со в октаэдрические пустоты, образо-
ванные основаниями призм Mo(W)S6 в смешанных слоях как
в объеме, так и в приповерхностных слоях боковых граней
[190]. Атомы Ni(Co) могут также замещать атомы Mo(W)
в структуре дисульфидов. Введение примесей промоторов мо-
жет приводить к изменению электронных свойств поверхности
[189, 190].
В литературе описано несколько моделей для объяснения
эффекта промотирования. Согласно модели внедрения [190]',
атомы промотора «встраиваются» между слоем кристаллов
Mo(W)S2. При этом формируется слоистая структура с переда-
чей электронов внутри слоев S—Mo(W)—S и восстановлением
катионов Mo(W)4+ до Mo(W)3+. В результате образуются до-
полнительные анионные вакансии — дополнительные центры ка-
тализа.
С учетом того, что внедрение Ni(Co) в объем идеального
кристалла энергетически невыгодно, предложена модель поверх-
ностного внедрения на боковой грани кристаллов, а также мо-
дель, в которой катионы промотора компенсируют избыточный
отрицательный заряд на торцевых гранях кристаллов дисуль-
фидов [189].
В модели замещения атомы промотора замещают катионы
Mo(W) с образованием двухмерной фазы, например Со—Мо—S,
в которой электронное состояние атомов более благоприятно
для катализа, чем в дисульфиде молибдена (вольфрама) [190].
Наконец, согласно модели синергизма [133, 191], эффект акти-
вации обеспечивается электронным взаимодействием на грани-
це контакта фаз сульфидов молибдена (вольфрама) и промо-
тора.
Рассмотренные модели предполагают различные направле-
ния совершенствования смешанных сульфидных катализаторов.
В цикле работ советских авторов [140, 192] были исследо-
ваны образцы, полученные разложением различных соединений
молибдена. Испытания их были проведены в реакции гидриро-
вания о-ксилола с добавкой 3% тиофена. Из полученных ре-
зультатов можно сделать вывод, что эффект промотирования
обусловлен химическим связыванием на поверхности Mo(W)S2
катионов Ni2+, введение которых увеличивает активность ди-
сульфида молибдена (вольфрама) без изменения кинетических
параметров реакции (рис. 35). Структура активных центров
смешанных сульфидных катализаторов наиболее удовлетвори-
79
Рис. 35. Изменение константы скорости k
гидрирования о-ксилола от температуры на
катализаторах:
/—NiMoS; 2 MoS2; 3 — NiMoS2; 4 — NiMoS3
тельно описывается моделью ком-
пенсирующих катионов. Поэтому
основным направлением совершен-
ствования сульфидных катализато-
ров гидрирования является разра-
ботка способов получения и стаби-
лизации кристаллитов дисульфида
минимальных размеров, имеющих
максимальную емкость по катио-
нам промотора [140].
С использованием этого принци-
па был разработан новый тип смешанных сульфидных катали-
заторов для глубокой деароматизации как прямогонных ди-
стиллятов, так и сырья вторичного происхождения при невысо-
ком давлении [193]. Катализатор НВС-30 при давлении 5 МПа,
объемной скорости подачи сырья 0,3—0,5 ч-1, циркуляции во-
дородсодержащего газа 1500 м3/м3 сырья в интервале темпера-
тур 300—340 °C удаляет ароматические углеводороды из газой-
ля каталитического крекинга (фракция 170—280 °C, содержание
ароматических углеводородов 70—75% об.) до остаточного со-
держания 5—10%. По уровню гидрирующей активности этот
катализатор приближается к катализаторам на основе метал-
лов VIII группы, но он не отравляется соединениями серы.
Кроме процесса деароматизации керосиновых фракций
в нефтеперерабатывающей промышленности большой интерес
вызывают процессы гидроочистки жидких и твердых парафинов
и масляных фракций. Жидкие и твердые парафины, выделяе-
мые из среднедистиллятных фракций нефти, используются в мик-
робиологической, нефтехимической и пищевой промышленности.
К ним предъявляют весьма жесткие требования по остаточному
содержанию ароматических углеводородов, которое не должно
превышать 0,05%. В пищевом парафине ароматические углево-
дороды, особенно полициклические, должны практически отсут-
ствовать [194]. Для гидроочистки жидких и твердых парафинов
предложен катализатор ГО-115 при температуре 250 °C, давле-
нии 4—5 МПа и объемной скорости подачи сырья 0,5 ч-1 [195Jr
а также Pd-цеолитсодержащий катализатор при температуре
240 °C, давлении 5 МПа и объемной скорости 0,5 ч-1 [196]'
В указанных условиях эти катализаторы обеспечивают удаление
ароматических углеводородов с 2—3 до 0,1—0,5%.
Для глубокой деароматизации изомеризата петролатума —
сырья для получения гидравлических масел — наиболее эффек-
тивен катализатор никель на кизельгуре при температуре 260 °СЪ
80
давлении 5 МПа и объемной скорости 0,5 ч-1 [197]. Для получе-
ния белого масла из масляных фракций, содержащих до 25%
ароматических углеводородов, предложены нанесенные Pt-
и Pd-катализаторы, эффективные при температуре 230—290 °C,
давлении 17—21 МПа и объемной скорости 0,25—1,0 ч-1 [198].
2.3. КАТАЛИЗАТОРЫ ГИДРОКРЕКИНГА
В процессе гидрокрекинга, предназначенном для регулирова-
ния фракционного и группового состава нефтяного сырья
с целью получения качественных моторных, реактивных топлив
и основы смазочных масел, на катализаторе протекают реакции
расщепления, гидрирования, изомеризации и гидрообессерива-
ния. В зависимости от целевой направленности процесса, его
технологии и вида исходного сырья наблюдаются две тенденции
в развитии катализаторов гидрокрекинга:
создание системы катализаторов для стадийного проведения
процесса с разделением функций, в частности гидрирующей
и расщепляющей;
создание полифункциональных катализаторов, способных
проводить гидрокрекинг в одну стадию.
Катализаторы гидрокрекинга, как правило, состоят из сле-
дующих основных компонентов: 1) кислотного компонента
(аморфного или кристаллического алюмосиликата, обеспечи-
вающего расщепляющую и изомеризующую функцию катализа-
тора); 2) металла или сочетания металлов в восстановленной,
оксидной либо сульфидной форме, обеспечивающих гидрирую-
щую и оказывающих влияние на изомеризующую и расщепляю-
щую функции; 3) связующего, обеспечивающего механическую
прочность и оказывающего влияние на формирование пористой
структуры катализатора.
Ассортимент катализаторов гидрокрекинга достаточно широк,
что объясняется назначением процесса, разнообразием техноло-
гии и применяемого сырья [368]. В промышленной практике
в настоящее время применяют два типа катализаторов гидро-
крекинга: цеолитсодержащие и оксидносульфидные. Характери-
стика катализаторов, по патентным данным, приведена в
табл. 32. Среди них наиболее распространены цеолитсодержа-
щие катализаторы, которые более эффективны в процессе об-
щего гидрокрекинга различных направлений [62]. Существую-
щий ассортимент цеолитсодержащих катализаторов гидрокре-
кинга определяется многообразием катионных форм и структур-
ных типов цеолитов, а также способов введения цеолита
в каталитическую систему, что позволяет изменять ее актив-
ность и селективность.
Катализаторы гидрокрекинга бензинового направления обла-
дают высокой расщепляющей активностью, гидрирующей актив-
ностью по отношению к полициклическим ароматическим угле-
6—922
81
Таблица 32. Патентные сведения о катализаторах гидрокрекинга
Состав Назначение Способ приготовления Источник информаци
2-10% NiO, 18—20% WO3, 43—57% Гидрокрекинг угле-
AI2O3 + S1O2 водородов
1—11% СоО,
98% А120з
4—18% МоОз, 71— Гидрокрекинг тяже-
лых углеводородов
5—30% Ni, Со или Fe, 5—15% Мо,
Zn, Pb, до 30% РЗЭ; природный
морденит или клиноптилолит и А120з,
глины
Гидрокрекинг широ-
ких нефтяных фрак-
ций
Металлы наносят пропиткой на носи-
тель, приготовленный смешением со-
ответствующих гидрогелей с массо-
вым соотношением А120з: SiO2=
= 1 1
К раствору парамолибдата аммония
и нитрата кобальта добавляют носи-
тель (моногидрат А120з), смесь на-
гревают при перемешивании, форму-
ют и высушивают при 120 °C
Цеолит обрабатывают минеральной
кислотой с промежуточными прока-
ливаниями при 500—800 °C, смешива-
ют с матрицей (А120з, алюмосиликат,
глины), пропитывают растворами
металлов
Пат. ПНР 104849,
1980 г.
Пат. Канады 1094004,
1981 г.
А. с. ЧССР 211719,
1983 г.
1—7% NiO, 5—25%МоО3, 1—4% Переработка тяже-
SiO2, остальное А12О3 (5уд = 250— лого нефтяного сырья
450 м2/г, Упор = 0,9—2,0 см3/г)
Pt (Pd), сульфиды металлов ПВ, Гидрокрекинг нефтя-
VIB, VIIB и VIII групп, SiO2, цео- ных фракций для
лит Y (SiO2/Al2O3= 15—20)+глина, улучшения вязкост-
алюмосиликат или А120з ных свойств
Пат. США 4309278,
1982 г.
10—30% металлов VIII и VIB групп, Гидрокрекинг для по-
цеолит Y лучения топлив
Цеолит модифицируют катионным
обменом на NH4+ (степень замеще-
ния 89%), смешивают со связующим,
формуют, пропитывают раствором со-
лей металлов, нагревают при 500 °C
15 ч в атмосфере воздуха, затем
12 ч в атмосфере Н2
Исходный цеолит (SiO2/Al2O3=4,5—
9,0) пропитывают растворами солей
металлов
Заявка Франции
2492838,
1982 г.
Пат. США 4401556,
1983 г.
СП * 0,1—2,0% Pt, 4—15% МоОз, 2—80% Гидрокрекинг с целью Природный ферьерит обрабатывают Пат. США 4335019,
алюмосиликат или природный ферье- рит повышения октаново- щавелевой го числа или темпе- 20—200 °C ратуры застывания 10 сут при кислотой 1—10 сут при и оксалатом аммония 1 — 20—100 °C, затем нано- 1982 г.
сят металлы
0,5—8,0% CoO, 5—24% МоОз, ДО
30% В2О3, остальное А12О3
Гидрокрекинг тяже-
лых масел
во
9?
1—6% NiO, 5—16% МоОз, осталь-
ное А12О3 с добавкой СоО
1 — 10% NiO, 2—25% МоО3, ТЮ2,
цеолит Y, алюмосиликат
1,5-8,0 % СоО, 8-20% WO3, алю-
мосиликат или А12О3 остальное
1—7% СоО, 10—20% МоО3, 0,1 —
5,0% соединения Р, 15—35% борсо-
держащий цеолит + 65—85% А12О3
Гидрокрекинг тяжело-
го нефтяного сырья
Гидрокрекинг нефтя-
ного сырья
Гидрокрекинг тяже-
лого нефтяного сырья
Гидрокрекинг угле-
водородного сырья
с целью получения
смазочных масел с
высоким индексом
вязкости и низкой
температурой засты-
рания
Катализатор готовят пропиткой со-
единениями металлов носителя, со-
стоящего из А12О3 и В2О3 или бората
алюминия
На носитель (£уд=150—300 м2/г,
^пор = 25—80 нм) наносят пропиткой
соли Ni и Мо, прокаливают при
620—675 °C
TiO2 контактирует с Ni(NOs) и с
соединениями Mo(W), сушат, прока-
ливают, размалывают вместе с цео-
литсодержащим катализатором кре-
кинга, увлажняют, сушат и прокали-
вают при 475—700 °C
Алюмосиликат, полученный паровой
обработкой кристаллического алюмо-
силиката (SiO2/Al2Os = 4,6, Na2O^
5^2,4%), пропитывают водным рас-
твором соли Fe при pH ^1,5, нано-
сят гидрирующие металлы
Носитель готовят диспергированием
борсодержащего цеолита в А120з, за-
тем наносят остальные компоненты
Заявка Японии
58—112049, 1983 г.
Пат. США 4414141,
1983 г.
Пат. США 4447555,
1984 г.
Пат. США 4446008,
1984 г.
Пат. США 4431517,
1984 г.
Продолжение табл. 32
Состав Назначен Способ пр Источник информации
3—10% СоО, 10- цеолиты Y, Z и А120з -30% МоО3 РЗЭ, X, алюмосиликат, Гидрокрекинг тяже- лых нефтяных фрак- ций для получения средних дистиллятов Цеолит после декатцонирования и катионного обмена на РЗЭ (остаточ- ное содержание Na2OCO,6%) сме- шивают с у-А120з и алюмосилика- том, формуют, прокаливают и про- питывают растворами солей Со и Мо Пат. 1983 США 4419271, г.
18% СоО, 18—22% WO3, 0,1—5.0% F, алюмосиликат Гидрокрекинг с целью получения реактивно- го и дизельного топ- лива — 11ат. 1984 США 4427534, г.
3,5—5,0% СоО, 16,5—18,5% МоО3, 0,5—1,5% SiO2, остальное у^ЬО3 (5уд = 200—250 м2/г, уПОр = 0,5 см3 г) Гидрокрекинг с целью получения бензино- вых фракций — Пат. 1983 ГДР 204103, г.
1,0—6,0% СоО, 10% SiO2, А120з 5—20% МоО3, до Гидрокрекинг ных фракций масля- Пропитывают растворами солей ме- таллов носитель из агломерата час- тиц А12О3 и SiO2 с Зуд = 350— 500 м2/г и иПор = 0,05—0,2 см3 г со средним диаметром ^40 нм Пат. 1981 США 4276201, г.
1—10% Ni, V МоО3, SiO2, TiO. или Си, 5—20% или Р2О5, А12О3 Гидрокрекинг лых нефтяных ций тяже- фрак- — Пат. США 4440631, 1984 г.
0,1—2,0% Pd ДО 8% РЗЭ, ультра- стабильный цеолит Y Гидрокрекинг ного сырья нефтя- Pd/РЗЭ — цеолит Y формуют с ок- сидной матрицей и 5—30% воды Пат. 1984 США 4456693, г.
£во дор одам и стойкостью к отравлению сернистыми и азотисты-
ми соединениями.
Для получения бензинов из тяжелых видов нефтяного сырья
(прямогонные тяжелые газойли, вакуумные газойли и газойли
каталитического крекинга) используют катализаторы исключи-
тельно на основе цеолитов типа фожазита. Методы модифици-
рования фожазитов (декатионирование, катионный обмен, в том
числе получение ультрастабильных форм цеолитов) подробно
описаны в работе [200].
Высокой эффективностью обладают катализаторы на основе
поливалентных катионных форм цеолита Y (например, P33Y
со степенью обмена катионов Na+ на РЗЭ"+ 30—80%) или ка-
тиондекатионированных форм (например, HMgY со степенью
катионного обмена Na+ на Н+ 45—60% и на Mg2+ 40—45%).
При синтезе катализаторов, в которых гидрирующая функция
обеспечивается фазой Ni(Co)—Мо, в цеолит Y ионным обме-
ном вводят также Со или Ni. Для усиления расщепляющей
функции катализаторов в них вводят галогены, дополнительные
оксидные добавки или проводят предварительное деалюминиро-
вание цеолита.
В качестве гидрирующих компонентов катализаторов гидро-
крекинга используют металлы платиновой группы в количестве
0,5—3,0%, 2—10% Ni или 2,5—5,0% Ni(Co) и 5—15% Mo(W)
в сульфидной форме. В качестве связующего используют AI2O3,
алюмосиликаты, SiO2, MgO, AIPO4. Иногда в состав катализа-
торов вводят трудновосстанавливаемые оксиды Ti, Zr, Hf, Th
и галогены. Содержание цеолита в катализаторе варьируется
в пределах 10—90%.
Перед использованием в процессе металлцеолитсодержащие
катализаторы прокаливают и восстанавливают водородом. Ка-
тализаторы, содержащие Мо или W, обычно сульфидируют.
Катализаторы гидрокрекинга среднедистиллятного направ-
ления должны обладать умеренными расщепляющими свойства-
ми и высокой гидрирующей активностью, чтобы обеспечить по-
лучение качественных реактивных и дизельных топлив и основы
масел.
Подавляющее большинство катализаторов этого направ-
ления содержит цеолиты типа фожазита, хотя описаны также
катализаторы на основе морденита, цеолитов типа L, Т, альфа,
омега [62, 200]. Наиболее эффективны катализаторы на основе
поливалентных катионных форм (Cd, Со, Ni, Zn, РЗЭ) цеолита
Y и смешанных катиондекатионированпых форм, например
HMgNaY, HP33NaY, НСа (Mg, Zn) NaY, HYP33NaY.
В качестве гидрирующих компонентов нспользуют металлы
платиновой группы в количестве 0,1—2,0%, сочетания 5—10%
Sn+1 —15% Mn(V,Zn) или 4—6% Ni (Со) + 10—20% Mo(W)
в оксидной или сульфидной форме. В качестве связующего нс-
пользуют А12О3, алюмосиликаты, SiO2, MgO, ВеО, TiO2, ZrO2,
магнийсиликаты, цирконийсиликаты.
85
Перед использованием катализаторы, содержащие металлы
VIII группы, восстанавливают водородом, а содержащие Мо или
W, — сульфидируют. Для увеличения селективности в отноше-
нии выхода среднедистиллятных фракций цеолит перед вводом
в катализатор подвергают термопаровой обработке или катали-
затор частично закоксовывают.
Наиболее распространенным вариантом технологии гидро-
крекинга тяжелого нефтяного сырья с целью получения бензина
или среднедистиллятных фракций является одноступенчатый
процесс без рециркуляции. Технологический режим с учетом
свойств катализатора подбирают таким, чтобы обеспечить либо
максимальный выход бензина (до 80% об.) наряду с сырьем ка-
талитического крекинга (фракция >340 °C) или высокоиндекс-
ным маслом (фракция > 360°C), либо с преимущественным
выходом реактивного топлива (до 85% об.) с невысоким выхо-
дом бензина (10—40%).
При использовании катализаторов, содержащих металлы
платиновой группы и чувствительных к сернистым и азотистым
соединениям сырья, применяют обычно двухступенчатый про-
цесс с предварительной гидроочисткой сырья и частичной ре-
циркуляцией высококипящего остатка. При получении низко-
застывающих реактивных топлив с пониженным содержанием
ароматических углеводородов в двухступенчатую схему вклю-
чают еще стадию гидрирования или селективной депарафини-
зации [62]. Качество получаемых целевых продуктов определя-
Таблица 33. Материальные балансы (в %) и качество продуктов,
получаемых в процессе одноступенчатого гидрокрекинга вакуумного
дистиллята в присутствии катализатора ГК-8
Показатель Дизельный вариант Реактив- ный вариант Показатель Дизельный вариант Реактивный вариант
Температура, °C 405—410 405—410 Свойства продук-
Объемная ско- 0,70 0,56 тов:
рость, ч-1 фракционный
Поступило: состав, °C
сырье 100,0 100,0 и. к. 204 167
водород 3,3 3,4 к. к. 327 260
рециркулят 51,0 42,7 температура —36 — 64
Итого: 154,3 146,1 застывания, °C 10,0
Получено: содержание —
углеводород- ный газ 7,4 8,4 ароматических углеводородов, о/
сероводо- 1,8 1,8 /0 вязкость кине- 3,52 1,87
род + аммиак бензин целевое топ- 24,0 69,1 39,9 52,3 матическая при 20 °C, мм2/с A Q
ливо остаток цетановое 4 о —’
51,0 42,7 1,0 число плотность, 848 806
потери 1 ,о кг/м3
Итого: 154,3 146,1
86
ется соотношением расщепляющей, гидрирующей и изомеризую-
щей функцией катализатора и частично условиями процесса
[67].
В Советском Союзе для процесса глубокого гидрокрекинга
вакуумного газойля разработан полифункциональный цеолит-
содержащий катализатор ГК-8 [73, 201, 202]. Катализатор поз-
воляет при температуре 405—410 °C, давлении 15 МПа и объем-
ной скорости 0,6—0,7 ч-1 в одну ступень получать до 52% реак-
тивного' топлива либо до 70% зимнего дизельного топлива
(табл. 33). Катализатор ГК-8 имеет достаточно высокую рас-
щепляющую, изомеризующую, деароматизующую и гидрообес-
серивающую активность. Соотношение указанных функций мо-
жет изменяться в зависимости от способа подготовки цеолита,
его содержания в катализаторе и от условий процесса [201—
203]. Так, выход бензиновых фракций, как критерий расщеп-
ляющих свойств катализатора, можно варьировать от 12—15
до 35—48%• При этом содержание алканов изостроения во
фракции до 160°C достигало 26,4%, т. е. 75% от суммы алканов,
а содержание соединений серы и; азота составило 1 млн-1
и менее.
Остаточное содержание ароматических углеводородов в гид-
рогенизате, полученном при объемной скорости 0,56 ч-1, состав-
ляло 5—7%, а при объемной скорости 1 ч-1 — не выше 15%.
Содержание серы в гидрогенизате не превышало 0,02%, азо-
та — 5 мг/л.
Показано [203], что степень превращения ароматических
углеводородов возрастает с увеличением объемной скорости
подачи сырья, температуры процесса и содержания цеолита
в катализаторе в интервале 10—30% (рис. 36). Методом коле-
бательной спектроскопии показано, что структура цеолита NiY
и кислотные свойства катализатора ГК-8 не изменяются ни
в процессе работы, ни после регенерации [202].
Для процесса легкого гидрокрекинга вакуумного газойля
при давлении 5 МПа с целью получения дизельного топлива
предложен алюмоникельмолибденовый катализатор ГК-35, со-
держащий 5—10% цеолита типа Y [73].
Оксидно-сульфидные катализаторы. В результате исследова-
ний, проведенных во ВНИИНП в период 1975—1982 гг., было
показано, что высокоэффективные катализаторы гидрокрекинга
вакуумного газойля можно получить на основе гидросиликатов
металлов Ni, Со, Mg, Мп и других металлов [182]. Установлено,
что при синтезе гидросиликатов формируется слоистая высоко-
пористая структура (£уД = 300—500 м2/г), обладающая льюисов-
скими кислотными центрами. Поэтому катализаторы на основе
гидросиликатов металлов в оксидной форме обладают высоки-
ми расщепляющими, изомеризующими и гидрирующими свойст-
вами.
При введении в гидросиликат никеля А1—Ni—Мо-компонен-
та гидрирующие свойства катализатора в сульфидной форме
87
IV, У"7
Рис. 36. Изменение степени превращения сырья ф (а) и содержания арома-
тических углеводородов Хар (б) во фракции 165—270 °C при гидрокрекинге
вакуумного газойля западносибирских нефтей от объемной скорости подачи
сырья w при 420 °C (1), 410 °C (2), 400 °C (3) и 390 °C (4)
Содержание цеолита в катализаторе 10% (--- )» 20% (-----) и 30% (~ — “)
возрастают, а расщепляющая активность несколько снижается.
В случае гидросиликата Mg введение А1—Ni—Мо-компонента
приводит к увеличению расщепляющей, изомеризующей и гид-
рирующей активности системы. С использованием модельных
реакций было показано, что расщепляющая активность гидро-
силиката магния больше, чем гидросиликата никеля. Изомери-
зующие свойства этих систем близки между собой, а гидрирую-
щая активность выше у гидросиликата никеля. Эти данные по-
служили основой для разработки серии металлснликатных ка-
тализаторов гидрокрекинга при давлении 15, 10 и 5 МПа.
Катализатор ГК-60, синтезированный на основе гидросили-
ката никеля, рекомендуется для одноступенчатого процесса
гидрокрекинга вакуумного газойля при давлении 15 МПа
с целью получения реактивного топлива [182]. Катализатор
отличается высокой активностью и селективностью. В его при-
сутствии при температуре 405—410 °C, давлении 15 МПа, объ-
емной скорости 0,6—0,7 ч-1 и циркуляции водородсодержащего
газа 1500 м3/м3 можно получать реактивное топливо с выходом
42,9% за проход или 64,3% с рециркуляцией остатка. Выход
зимнего дизельного топлива в тех же условиях достигает соот-
ветственно 53,3 и 71,8%.
88
Для второй стадии гидрокрекинга вакуумного газойля при
давлении 10 и 5 МПа лучшие результаты дают катализаторы на
основе гидросиликата магния — Л ГК-22 и ЛГК-23.
Катализаторы гидрокрекинга средних нефтяных дистиллятов.
Для получения бензина, реактивных и дизельных топлив, сжи-
женного нефтяного газа и сырья для нефтехимии гидрокрекин-
гом среднедистиллятных видов сырья используют цеолитсодер-
жащие катализаторы, преимущественно на основе цеолита Y,
морденита или их смесей [62]. Эффективные катализаторы по-
лучены на основе поливалентных катионных и катиондекатиони-
рованных форм цеолита Y(CaNaY, HMgNaY, HP33NaY, HCaY,
CdHY). В качестве гидрирующих компонентов используют ме-
таллы VIII группы в количестве до 5,0%, иногда с добавками
Re, Sn, галогенов, а также Ni—Cr, Ni—Pd, Pd—Rh—Sn, MoO3,
Ni(Fe, Co, Zn)—Mo(W) в оксидной или сульфидной форме.
В качестве связующего применяют А12О3, алюмосиликаты,
А12О3—TiO2, А120з—ZrO2, А12О3—MgO. Содержание цеолита
в катализаторах составляет 5—50%.
Перед применением катализаторы, содержащие металлы
VIII группы, восстанавливают, а в некоторых случаях сульфи-
дируют. Для уменьшения выхода легких углеводородов реко-
мендуется подвергать катализаторы частичному закоксовыва-
нию или проводить термопаровую обработку цеолитсодержащего
компонента.
Катализаторы гидрокрекинга бензина. Основным назначе-
нием гидрокрекинга бензиновых фракций является получение
изо-алканов С4—Сб, являющихся высокооктановым компонен-
том автомобильных бензинов, или изо-алканов С4 и С5 — сырья
для получения синтетических каучуков. Выход и состав про-
дуктов гидрокрекинга бензиновых фракций зависит от соотно-
шения гидрирующей и кислотной функций катализатора, приро-
ды сырья и рабочих параметров процесса [59, 62].
Для гидрокрекинга бензинов, как правило, используют цео-
литсодержащие катализаторы — на основе цеолита Y в декатио-
нированной (HNaY), деалюминированной Н-форме и катион-
декатионированной форме (HMgY). Хорошие результаты дают
также катализаторы на основе морденита. В качестве гидрирую-
щего компонента таких катализаторов используют металлы
VIII группы (Pt, Pd, Ni) или сочетания Re—Те—Cu(Ag),
Ni(Co)—Мо. Катализаторы, содержащие металлы VIII группы,
перед использованием восстанавливают, а содержащие Ni(Co) —
—Мо — сульфидируют. Для повышения селективности образова-
ния углеводородов С4—Сб рекомендуют проводить термопаро-
вую обработку цеолитсодержащего компонента, а в случае мор-
денита— селективную обработку сернистыми соединениями ме-
таллов, локализованных на внешней поверхности цеолита.
Процесс гидрокрекинга бензинов осуществляют, как правило,
в одну ступень. Условия процесса подбирают такими, чтобы
получить 20—35% изокомпонента автомобильного бензина при
89
Таблица 34. Показатели работы на промышленной установке
катализаторов ГКБ-3 и ГКБ-ЗМ в процессе изориформинг
Условия процесса: температура 350 °C, давление 3,8 МПа, объемная скорость
подачи сырья 2 ч-’, циркуляция водородсодержащего газа — 1000 м3/м3 сырья
Пока 1атс: ГКБ-3 ГКБ-ЗМ Пока Патель ГКБ-3 ГКБ-ЗМ
Поступило, %• сырье (фракция 130— 180 °C) Получено, %: сухой газ (Ci—С2) 100 1,0 100 0,0 изокомпонент: в том числе изо-Сь w-Cs изо-Съ 20 10,8 1,3 6,0 29 12,0 1,2 8,0
жирный газ (С3—С4) 15,0 14,0 h-Cq 0,7 0,5
в том числе С3 3,2 2,0 фракция 85—180 °C 64 57
изо-С^ 8,8 10,2 Октановое число изо - 83,4 89,0
h-Ci 3,0 1,8 компонента Содержание серы во 1,0 фракции 85—180 °C, млн-1 0,8
выходе углеводородов С4 12—36% и Ci—С3 3—20% или напра-
вить процесс на получение 65—100% сжиженного нефтяного
газа.
В Советском Союзе разработан процесс изориформинг, в ко-
тором объединены стадии гидрокрекинга бензина и каталитиче-
ского риформинга [61, 63, 204]. Для этого процесса разработан
катализатор ГКБ-ЗМ. Катализатор представляет собой компо-
зицию 50—70% цеолита Y в редкоземельной форме в сочетании
с гидрирующими металлами, нанесенными на гидроксид алюми-
ния [205]. Показатели работы катализатора ГКБ-ЗМ на про-
мышленной установке в процессе изориформинга приведены
в табл. 34. Изменяя способ подготовки цеолитсодержащего ком-
понента, способ и последовательность введения гидрирующих
металлов, а также их содержание, можно регулировать актив-
ность и селективность катализатора. В частности, выход изоком-
понента автомобильного бензина с октановым числом 89 (мотор-
ный метод) может быть увеличен до 27—37%.
Для получения нефтехимического сырья (алканов изострое-
ния С4 и С5) предложена модификация процесса гидрокрекинга
бензина с использованием металлцеолитсодержащих катализа-
торов, в которых усилены расщепляющая и изомеризующая
функции. В частности, высокой эффективностью обладает ката-
лизатор 0,6% HY с мольным отношением SiO2/Al2O3 = 3,9—4,9
[206]. Введение в катализатор до 20% в качестве связующего
глуховской глины увеличивает его расщепляющую активность:
степень превращения прямогонного бензина (фракция 105—
180°C) в углеводороды Q—С5 возрастала с 15,7 до 70%).
Катализатор ГКП-20, полученный введением цеолита
PdHNaY в алюмоникельмолибденовую композицию [207],
90
в опытно-промышленных испытаниях показал высокую актив-
ность и стабильность при гидрокрекинге бензина, не содержаще-
го серу. Однако он легко отравлялся и быстро терял активность
при переработке сернистых бензинов.
Для переработки специфичного сырья — фракция 180—320 °C
жидкофазного гидрогенизата смеси каменного угля и прямогон-
ного остатка арланской нефти методом гидрокрекинга предло-
жен катализатор — 3,5% МоО3 на цеолите HNaY [208]. Резуль-
таты опытно-промышленных испытаний показали, что этот ка-
тализатор при температуре 380 °C, давлении 4 МПа и объемной
скорости подачи сырья 1 ч-1 отличается высокой стабиль-
ностью: в течение 800 ч выход гидрогенизата достигал 91—93%
при образовании газообразных продуктов 7—9%. Выход бензи-
на за проход [составлял 49—53%. Полученный бензин можно
использовать в качестве компонента высокооктанового бензина
(октановое число по моторному методу составляло 81,8), а фрак-
ция 180—320 °C — в качестве компонента зимнего дизельного
топлива (цетановое число — 50, температура кристаллизации —
26 °C).
2.4. КАТАЛИЗАТОРЫ СЕЛЕКТИВНОГО ГИДРОКРЕКИНГА
Процесс селективного гидрокрекинга предназначен для
улучшения эксплуатационных свойств различных нефтепродук-
тов, получаемых из высокопарафинистого сырья [62, 209].
В частности, промышленное применение нашли процесс селекто-
форминга бензиновых фракций с целью повышения их октано-
вого числа, а также селективная депарафинизация реактивных
и дизельных топлив и масел с целью снижения их температуры
застывания и улучшения вязкостных характеристик.
Физико-химические основы процесса селективного гидрокре-
кинга состоят в селективной адсорбции и расщеплении «-алка-
нов исходной фракции. Процесс был разработан с использова-
нием катализаторов, в композиции которых введены цеолиты со
специфичным по отношению к «-алканам молекулярно-ситовым
действием: морденита, эрионита, офферитита, высококремнезем-
ных цеолитов семейства ZSM [210].
Решетка эрионита имеет гексагональную структуру с двумя
осями симметрии, состоящую из относительно больших цилинд-
рических полостей (1,30X0,63 нм), которые соединяются вось-
мичленными кислородными кольцами (0,365X0,52 нм). Пористая
структура морденита образована системой параллельных кана-
лов эллиптического сечения размером 0,70 X 0,58 нм. В цеоли-
тах ZSM-5 и ZSM-11 десятичленпые кислородные кольца обра-
зуют две системы пересекающихся каналов, лежащих во взаим-
но перпендикулярных плоскостях. Десятичленные кислородные
кольца могут быть круглыми или эллиптическими размером
0,60—0,65 нм [211]. Поэтому поры этих цеолитов доступны
только для молекул «-алканов. Молекулярно-ситовая избира-
91
который проявляется в том, что
Рис. 37. Изменение активности а
(1) и селективности С (2) ката-
лизатора в зависимости от темпе-
ратуры процесса
тс.'1Ы1ость указанных цеоли-
тов сохраняется и при вве-
дении в них катионным об-
меном гидрирующих метал-
лов. Важным свойством це-
олитов такого типа являет-
ся также клеточный эффект,
скорость гидрогенолиза и за-
висимость коэффициента диффузии от длины цепи н-алкана вы-
ражается кривой с минимумом при С8 и максимумом при
С6 и Сю—С12 [212].
Эти свойства цеолитов использованы для разработки эффек-
тивных катализаторов селективного гидрокрекинга или селек-
тивной депарафинизации нефтепродуктов. Катализаторы, как
правило, состоят из модифицированного цеолита, гидрирующе-
го металла и связующего. В качестве гидрирующего металла
используют металлы VIII группы Периодической системы —
обычно Pt, Pd, Ni — в количестве 0,1 —10%, оксиды молибдена
или вольфрама в количестве 2—10% либо сочетание Ni(Co)
с Mo(W). Содержание цеолита в катализаторе составляет 60—
70% • Перед нанесением гидрирующих металлов цеолит подвер-
гают декатионированию или проводят катионный обмен на ионы
Cd2+, Zn2, РЗЭ3+ и др., в качестве связующего используют А12О3.
Для процесса селективного гидрокрекинга бензинов в Со-
ветском Союзе разработан бифункциональный катализатор
СГ-3 и его модификация СГ-ЗМ на основе эрионита. Катализа-
тор содержит, кроме цеолита, 7% МоО3 и 37% А12О3 [213—214].
Эффективность катализатора СГ-ЗМ зависит от температуры и
среды прокаливания, температуры восстановления, содержания
сероорганических соединений в сырье. Максимальная актив-
ность катализатора достигается при температуре прокаливания
в атмосфере воздуха, равной 520—550°C (рис. 37). Селектив-
ность с повышением температуры прокаливания от 450 до 550°C
возрастает и далее до 600 °C не изменяется [213]. В одинако-
вых условиях глубина гидрокрекинга н-акланов и селективность
на катализаторе, прокаленном в среде дымовых газов, ниже чем
в атмосфере воздуха. При повышении температуры восстанов-
ления от 380 до 450 °C степень превращения н-алканов снижается
на 3,5%, а от 450 до 530°C — на 15%. Селективность при этом
практически не изменяется.
Характер воздействия на катализатор СГ-ЗМ различных се-
роорганических соединений одинаков и зависит лишь от их кон-
центрации в сырье. Органические соединения серы снижают ак-
тивность катализатора. Однако отравляющее действие обрати-
92
мо: при повышении температуры реакции на 20 °C или при пере-
ходе на малосернистое сырье активность катализатора восста-
навливается.
Катализатор СГ-ЗМ прошел промышленную проверку на ус-
тановке Л-35-5 для улучшения антидетонационных свойств бен-
зинов-рафинатов риформинга при следующих параметрах про-
цесса: давление 3 МПа, температура 410 °C, объемная скорость
подачи сырья 2,2 ч-1, циркуляция водородсодержащего газа
1000 м3/м3 [215]. При этом был получен стабильный бензин
с выходом 85—88% с октановым числом 68,8—71,6 по мотор-
ному методу (исходное сырье имело октановое число 49,9—
57,3).
Аналогичные результаты получены при использовании ката-
лизатора на основе отечественного высококремнеземного цео-
лита ЦВМ (SiO2/Al2O3 = 30—40) [216].
Для селективного гидрокрекинга бензинов платформинга и
вторичного происхождения рекомендуют катализаторы на осно-
ве морденита [217] и цеолита ZSM-5 [218].
Катализаторы на основе эрионита проявляют высокую ак-
тивность также в депарафинизации керосиновых и дизельных
фракций. В результате комплекса исследований по влиянию
структуры и свойств эрионита в различных катионообменных
формах поливалентных металлов, природы и содержания гид-
рирующего металла, количества и способа ввода связующего
на активность и селективность расщепления н-алканов были
созданц две модификации катализаторов депарафинизации сред-
них дистиллятных фракций: 1) с использованием в качестве
гидрирующего компонента благородного металла VIII группы,
предназначенного для переработки гидроочищенного сырья,
и 2) с использованием металлов VI и VIII групп, способного
перерабатывать сернистые дистилляты. В табл. 35 приведены
результаты селективного гидрокрекинга керосиновых фракций
с использованием эрионитных катализаторов [182].
Предложены также катализаторы на основе цеолитов типа
морденит, A, ZSM-5, ZSM-8, смеси офферитита с цеолитом Y,
содержащие в качестве гидрирующих металлов Pt, Pd, Ru и Ni
в количестве 0,5—5,0% [62].
В Советском Союзе разработан катализатор селективной де-
парафинизации среднедистиллятного сырья на основе отечест-
венных высококремнеземных цеолитов ЦВК и ЦВМ, представ-
ляющий собой композицию из модифицированного цеолита, свя-
зующего и гидрирующего металла VI или VIII групп в оксид-
ной либо сульфидной форме [218]. Эффективность катализатора
СГК-1 представлена данными табл. 36.
В процессе селективного гидрокрекинга высококипящего
сырья с целью получения низкозастывающих трансформаторных,
индустриальных, холодильных масел и гидравлических жидко-
стей из высокопарафинистого сырья применяют катализаторы
на основе морденита или ZSM-5 [62]. Морденит используют
93
g Таблица 35. Результаты селективного гидрокрекинга различных видов
сырья на эрионитных катализаторах
Условия процесса: давление 4 МПа; объемная скорость подачи сырья 1,0 отношение Н2: сырье= 1000 м3/м3
Показатель Сырье I Целевая фракция после работы, ч Сырье II Целевая фракция после работы, ч Сырье III Целевая фракция после работы, ч
8 20 28 10 15 26 9 25 73
Активнь I Й К 0 м МоОз п о н е н т — Активный компонент — Pd Активе [ ы й ком Pd [ п о н е н т —
Температура процесса, °C — 410 420 420 — 400 400 420 — 400 390 385
Фракционный состав, °C:
н. к. 157 165 165 165 189 160 160 160 139 165 165 165
10% 160 182 179 180 214 176 180 175 166 173 180 174
50% 216 217 219 220 252 248 252 248 213 216 220 221
90% 261 254 252 260 330 311 324 316 257 254 260 264
к. к. 282 260 262 265 344 318 341 337 270 268 273 270
Содержание,
серы 0,50 0,03 0,04 0,04 0,05 — —. — — — — —
н-алканов 21,0 4,0 Отсутствие 21,0 2,0 4,5 18,0 Отсутствие 2,0
Температура, °C:
начала кристаллизации —36 —50 —60 —60 —2 -55 —18 -35 —34 —60 -60 -60
застывания — — — — —10 —55 —33 —48 — — — —
Выход, %:
газа Ci—С4 — 6,0 7,5 8,5 — 3,0 3,5 4,5 — 5,5 4,5 3,0
фракция до 160 °C — 23,7 15,0 14,0 — 13,0 1,0 16,0 — 28,0 22,2 22,0
целевой фракции — 69,3 76,0 76,0 — 73,0 94,0 78,0 — 65,0 71,8 74,0
Потери, % — 1,0 1,5 1,5 — 1,0 1,5 1,5 — 1.5 1,5 1,0
Таблица 36. Результаты селективного гидрокрекинга различных видов сырья на катализаторе СГК-1
Условия процесса: давление 4,0 МПа, объемная скорость подачи сырья 1,0 ч-1, отношение Нг: сырье—1000 м3/м3
Показатель Керосиновая фракция Целевая фракция после работы, ч Дизельное топливо Целевая фракция по- сле работы, ч Газойль ка- талитическо- го крекинга Целевая1 фракция после работы, ч
200 250 500 250 850 24 120 230
Температура 315 °C Температура 320 °C Температура 340 °C Фракционный состав, °C: н. к. 168 167 165 167 195 163 160 160 160 161 160 10% 180 188 206 205 230 209 205 146 143 195 191 50% 215 211 217 218 278 275 273 240 237 235 229 90% 261 258 263 261 335 337 340 293 291 293 230 98% 282 281 283 285 359 346 348 323 314 312 316 Содержание н-алканов, % 21,0 — — — 17,0 2,5 3,0 8,1 1,0 1,2 1,2 Температура, °C: застывания — — — — —12 —50 —50 — — — — начала кристаллизации —36 —60 —60 —60 — — — —3 —60 —60 —60 Выход, %: С,—С4 — 6,4 6,1 5,8 — 5,5 5,4 — 4,0 4,5 4,0 С5—160°С — 17,5 18,3 18,2 — 10,6 9,1 — 9,0 7,8 8,5 фракции 160°C — к. к. — 74,3 74,2 74,2 — 82,5 83,8 — 86,0 86,5 86,5 Потери, % — 1,8 1,4 1,5 — 1,4 1,7 — 1,0 1,2 1,0
в декатионированной форме при содержании 2% Na2O или
в деалюминированной и декатионированной форме (SiO2/
/А12Оз = 20—60), а цеолит ZSM-5 —в декатионированной форме.
Цеолит формуют со связующим и наносят гидрирующий компо-
нент: металлы VIII группы (Pt, Pd, Rh) либо сочетание
Ni(Co)—Mo(W) в оксидной или сульфидной форме. Характе-
ристики промышленного процесса селективного гидрокрекинга
масел на катализаторе Pt/H-морденит, разработанном фирмой
«British Petroleum» [219], приведены ниже:
Сырье А Сырье Б
Характеристика сырья:
пределы выкипания, °C 260- 400 330—440
содержание серы, % 1.2 -2,5 1,5—2,7
содержание азота, млн-1 кинематическая вязкость при 150-800 400—1000
98,8 °C, мм2/с . . 2,0 3,8
температура застывания, °C 6,1 —
содержание «-алканов, % 14—16 10—16
Выход масла, % • Характеристика масла: 62—76 70—80
индекс вязкости кинематическая вязкость при 46—51 31—38
98,8 °C, мм2/с 2,2—2,4 4,17—4,38
температура застывания, °C -56,6 —32,74- —42,2
В Советском Союзе для получения качественных трансфор-
маторного масла и гидравлической жидкости из высокопарафи-
нистых фракций западносибирских нефтей разработан и приме-
няется в промышленности катализатор СГК-1 на основе высоко-
кремнеземного цеолита ЦВМ [220].
Глава 3
ПРОИЗВОДСТВО КАТАЛИЗАТОРОВ
3.1. СПОСОБЫ ПОЛУЧЕНИЯ КАТАЛИЗАТОРОВ
Качество промышленных катализаторов определяется их
технологией, которая должна обеспечить заданный химический
состав, структуру и текстуру, разработанные и оптимизирован-
ные на стадии лабораторных и опытных исследований. Про-
мышленное производство катализаторов осуществляется в со-
ответствии с технологическим режимом, в котором предусмат-
ривается последовательность и условия проведения всех опера-
ций, включая пуск и аварийные остановки аппаратов, технику
безопасности и охрану окружающей среды, а также в соответ-
ствии с техническими условиями, в которых регламентированы
основные показатели качества катализатора, условия хранения
и транспортирования.
56
К качеству промышленных катализаторов предъявляются
специфические и достаточно жесткие требования, так как от
эффективности катализатора в итоге зависят технико-экономи-
ческие показатели процесса, в котором он применяется. К та-
ким требованиям следует отнести:
1) высокую активность, обеспечивающую насколько воз-
можно мягкие технологические параметры процесса (темпера-
туру, давление) и тем самым определяющую выбор технологи-
ческой схемы, конструкцию и материал аппаратов;
2) селективность, обеспечивающую максимальный выход
целевого продукта в расчете на переработанное сырье;
3) высокую производительность (съем продукта с единицы
массы или объема катализатора);
4) продолжительность эксплуатации без потери активности
(большая длительность общего срока с минимальным числом
регенераций);
5) высокую термическую стабильность и способность к ре-
генерации;
6) повышенную механическую прочность гранул для катали-
заторов, работающих в стационарном слое, или износостой-
кость для катализаторов, работающих во взвешенном или дви-
жущемся слое;
7) устойчивость к воздействию контактных ядов, содержа-
щихся в исходном сырье и водородсодержащем газе.
Все эти требования обеспечиваются как химическим, мине-
ралогическим составом и текстурой, так и способом приготов-
ления контакта. При промышленном приготовлении катализа-
тора даже в пределах выбранной технологии его качество за-
висит не только от строгого соблюдения технологического рег-
ламента, но и от качества исходного сырья, применяемой ап-
паратуры и оборудования.
Исходное сырье и реагенты должны иметь постоянный
химический, фазовый и гранулометрический состав, содержать
минимальное количество примесей, отрицательно воздействую-
щих на свойства катализатора, должны быть доступными, пред-
почтительно недорогими, стабильными при хранении и транс-
портировании.
В производстве катализаторов используются почти все из-
вестные процессы [221]: химические (взаимодействие в систе-
мах газ — жидкость, жидкость — жидкость, твердое тело —
жидкость, твердое тело — газ, твердое тело — твердое тело),
гидродинамические (смешение, перемешивание жидкостей,
фильтрование, репульпация осадков, разделение суспензий),
массообменные (растворение, экстракция, кристаллизация, про-
мывка осадков), механические (измельчение, классификация,
формование, транспортирование твердых частиц), тепловые
(нагревание, сушка, прокаливание, охлаждение, выпаривание).
По всем этим процессам и их аппаратурному оформлению
имеется специальная литература. Поэтому в данной главе бу-
7—922
97
дут рассмотрены способы получения промышленных катализа-
торов гидрогенизационной переработки нефтепродуктов. В на-
стоящее время основными промышленными способами являются
соосаждение компонентов из водных растворов и пропитка вод-
ными растворами активных металлов сформованного и спе-
циально подготовленного носителя. В производстве цеолитсо-
держащих катализаторов добавляются стадии модифицирова-
ния цсолитпого компонента — декатиопирование, деалюминиро-
вание, катионный обмен.
3.1.1. ПОЛУЧЕНИЕ КАТАЛИЗАТОРОВ СООСАЖДЕНИЕМ
Соосаждение компонентов из водных растворов и суспен-
зий— это наиболее старый способ приготовления катализато-
ров для процессов гидрообессеривания, гидрокрекинга ц деаро-
матизации. При получении катализаторов гидрообессеривания
молибдаты кобальта или никеля осаждают из водных раство-
ров солей (нитрата кобальта или никеля и парамолибдата ам-
мония) в присутствии суспензии гидроксида алюминия или
алюмосиликата [И, 222]. Полученную катализаторную массу
отжимают затем па фильтре, промывают водой, упаривают в
смесителе (при необходимости ее пластифицируют), формуют,
сушат и прокаливают. Схема производства катализаторов ме-
тодом соосаждения приведена ниже:
Качество катализатора по этой технологии регулируется на
стадиях смешения компонентов, формования массы и термиче-
ских обработок (сушка, прокаливание).
При смешении компонентов гидроксида алюминия, нитрата
кобальта или никеля и парамолибдата аммония происходит их
взаимодействие с образованием кобальт(пикель)молибдатов,
алюмокобальт(никель)молибдатов, алюмомолибдатов, алюми-
натов кобальта (никеля). Количество образующихся продуктов
зависит как от условий смешения, т. е. от порядка ввода ком-
понентов, температуры, pH среды, так и от присутствия моди-
фицирующих добавок и их концентрации. В гл. 2 было пока-
зано, что введение в суспензию гидроксида алюминия 5—10%
SiO2, алюмосиликата или цеолита способствует образованию
98
Таблица 37. Влияние условий синтеза на свойства АКМ катализаторов
Состав ката- лизатора, .% pH А1(ОН)« ''гр- мм Удельная проч- ность, кг* Насыпная плотность у, кг/м3* Влагопо- глощение, см3/г*
МоОз СоО исход- ный форму- емый на гранулу на 1 мм диаметра
А1(ОН)3+ (NH4) 6Mo7O24 + Co(NO3)2
12 4,0 6,8 5,8 3,2/1,8 5,7/2,5 1,8/1,4 800/790 0,43/0,45
12 2,5 6,8 5,6 3,2/1,8 6,6/2,8 2,0/1,5 820/750 0,42/0,48
10 2,5 6,8 5,9 3,5/1,9 4,4/1,7 I,2/0,9 760/750 0,45/0,44
10 2,5 6,8 5,9 3,5/1,9 5,6/2,1 1,6/1,1 780/710 0,46/0,46
10 4,0 6,8 6,0 3,2/1,7 6,2/3,3 1,9/1,9 790/760 0,47/0,05
Al(OH)3+Co(N03)2+ (NH4)6Mo7O24
12 4,0 12 2,5 6,8 6,8 5,6 5,7 3,5/1,9 3,4/1,9 6,3/2,7 6,5/1,8 1,8/1,4 1,9/1,0 800/800 800/760 0,48/0,43 0,42/0,43
12 4,0 А1(ОН)3 7,4 2,8 1 IINO3-HNH4)6Mo7O2 3,1/1,7 5,7/3,9 44-Co(NO:))2 1,8/2,3 870/880 0,43/0,46
12 2,5 7,4 2,9 3,1/1,6 5,5/3,5 1,7/2,2 880/890 0,44/0,51
* Данные числителя и знаменателя — для соответствующих значений d} гр-
активных фаз (никельмолибдатов и алюмоникельмолибдатов)
и снижает содержание малоактивных алюмомолибдатов и ко-
бальтовых (никелевых) шпинелей.
Условия .приготовления катализаторной массы влияют на
ее формуемость, а условия формования — на механическую
прочность катализаторов, объем пор и распределение их по
размерам [223, 224]. В табл. 37 приведены данные, иллюстри-
рующие влияние условий синтеза АКМ катализаторов на их
физико-механические свойства [224]. Без пептизатора—
HNO3 — удельная прочность крупных гранул выше прочности
мелких, и отмечается экстремальная зависимость прочности от
общего содержания активных компонентов. Введение пептиза-
тора в целом повышает .прочность гранул. При снижении со-
держания СоО в присутствии HNO3 прочность крупных гранул
практически не изменяется, а прочность мелких гранул сни-
жается. Сложная зависимость влияния порядка введения солей
и их концентрации на кислотность массы, на прочность и на-
сыпную плотность катализатора обусловлена, по-видимому,
многообразием катионных и анионных форм молибдена, зави-
сящим от концентрации и pH исходных водных растворов его
солей.
Механическая прочность катализаторов, получаемых по
технологии соосаждения, особенно при введении в А1(ОН)3
добавок SiO2 или цеолита, зависит также от способа формова-
ния и конструкции формовочной машины [209, 225]. Так, при
формовании иа машине ФМК-2 катализаториая масса влаж-
ностью 70—75% поступает между роликом и формующим ба-
7* 99
Таблица 38. Влияние способа формования на качество катализаторов
Показатель Катализатор
ДИМС ГК-35
Г рануляци я на Ф М К-2
Насыпная плотность, кг/м3 690 700 670 680 690 690
Диаметр гранул, мм 4,5 4,4 4,7 4,5 4,3 4,3
Индекс прочности, кг/мм 2,2 2,2 2,0 1,2 1,3 1,2
Удельная поверхность, м2/г 141 138 138 131 138 130
Экструзия н а ГФШ- 150
Насыпная плотность, кг/м3 780 780 770 830 820 860
Диаметр гранул, мм 4,0 4,0 4,0 4,5 4,4 2,6
Индекс прочности, кг/мм 3,2 3,4 3,3 2,0 2,1 2,8
Удельная поверхность, м2/г 134 138 131 140 138 138
Экструзия н а ГФР -150
Насыпная плотность, кг/м3 790 800 800 820 800 860
Диаметр гранул, мм 4,0 4,0 4,0 4,5 4,3 2,7
Индекс прочности, кг/мм 3,5 3,6 3,8 2,5 2,3 2,9
Удельная поверхность, м2/г 140 141 142 138 140 139
рабаном с отверстиями 5—6 мм. Сформованные гранулы под-
сушиваются и выдуваются сжатым воздухом в шахтные су-
шилки.
При формовании на шнековой формовочной машине ката-
лизаторная масса предварительно упаривается до влажности
50—60%, а затем подвергается формованию на машинах
ГФШ-150 или ГФР-150, различающихся конструкцией шнеко-
вого и срезающего устройств. При таком способе формования
из одной и той же массы получаются более прочные гранулы
катализатора. Влияние способа формования на качество ката-
лизатора иллюстрируется данными, представленными в табл. 38
[225].
3.1.2. ПОЛУЧЕНИЕ КАТАЛИЗАТОРОВ МЕТОДОМ
ПРОПИТКИ НОСИТЕЛЯ
Активность катализаторов гидроочистки, приготовленных
методом пропитки носителя, как правило, выше активности
катализаторов, приготовленных методом соосаждения [226].
В свою очередь, способ пропитки, порядок нанесения активных
компонентов, pH пропиточного раствора, последовательность
операций (промежуточная промывка и прокаливание) также
влияют на активность катализаторов. Полагают [227], что
наиболее активные катализаторы получаются при двойной про-
питке у-А12О3: вначале раствором парамолибдата аммония,
затем раствором нитрата кобальта или никеля с промежуточ-
ной сушкой и прокаливанием.
Влияние способа пропитки и порядка введения металлов
на свойства АКМ катализатора подробно изучено авторами
100
Рис. 38. Изменение содержания адсорбированного молибдена Хадсмоо3 от
содержания (NH4)6Mo7O24 Хпррмо методом атомной спектроскопии (1) про-
питочного раствора и по данным рентгеновского флюоресцентного анализа
высушенных образцов (2)
Рис. 39. Изменение содержания Хмооэ в образцах катализаторов, полученных
методами равновесной адсорбции (/) и по водопоглощепию (2), в зависи-
мости от промывки
работы [226]. При введении у-А12О3 в раствор гептамолибда-
та аммония (NH4)6Mo7O24 происходит адсорбция ионов МоО42-
и их взаимодействие с поверхностными ОН-группами носителя
с образованием оксомолибдатов или молибдатов:
А1—ОН + МоО42~ ----> А1-ОМоО3" + ОН’
А1О—Н + МоО42- ----> АЮ-МОО3- + ОН’.
Изотерма адсорбции молибдена на у-А12О3 показана на
рис. 38. Содержание нанесенного молибдена и прочность его
связи с у-А12О3 зависят как от содержания (\Н4)бМо7О24 в
растворе, так и от способа пропитки. Так, промывка водой
МоО3/А12О3 до сушки и прокаливания показывает, что количе-
ство молибдена, остающегося в катализаторе полученным мето-
дом равновесной адсорбции, выше чем при влагопоглощении
(рис. 39). Это объясняется тем, что в последнем случае локаль-
ная величина pH в порах выше.
В УФ-спектрах диффузного отражения (рис. 40) образцов
МоО3/А12О3 после промывки водой, высушивания при НО °C
в течение 24 ч и прокаливания при 550 °C в течение 24 ч имеется
полоса при 37 000 см-1, ха-
рактеризующая тетраэдриче-
ские оксомолибденовые ио-
ны. В образцах, получен-
Рис. 40. Электронные спектры
алюмомолибденовых образцов,
приготовленных методом пропит-
ки по способу равновесной ад-
сорбции (1, 3) и по водопоглоще-
нию (2, 4t 5, 6), подвергнутых
различной термической обработке
101
Рис. 42. Изменение равновесной адсорбции молибдена от величины pH по
данным [232] (1) и [255] (2)
ных по влагопоглощению и не подвергнутых отмывке и прока-
ленных при 550 °C, появляется дополнительно полоса при
32 000 см-1. Она свидетельствует о наличии октаэдрического
молибдена, образовавшегося при термическом разложении
объемного молибдата аммония в порах. Полоса поглощения
при 37 000 см-1 в образцах, полученных методом адсорбции,
имеет большую интенсивность. Поэтому можно полагать, что
дисперсность нанесенного молибдена методом адсорбции выше.
Особенно сильное влияние на структуру поверхностных мо-
либденовых соединений, их дисперсность и взаимодействие с
А12О3 оказывает величина pH пропиточного раствора [228—
237]. Характер кривых адсорбции молибдат-ионов при различ-
ных pH одинаков: 95% анионов адсорбируется в течение 0,5—
1,0 ч, и равновесие достигается через 2—3 ч (рис. 41). Однако
количество адсорбированного молибдена уменьшается с увели-
чением pH пропиточного раствора (рис. 42). Кроме того, из-
меняется и структура адсорбирующихся молибдат-ионов.
При адсорбции молибдена (рис. 43) из пропиточных растворов
при рН= 11 молибден присутствует в виде мономера МоО42-,
при pH = 7 — в основном гсктамер Мо7О246- и МоО42-, в кис-
лых растворах при pH = 3,0—4,5 — преимущественно Мо7О24,
а при рН = 1—2 — гектаэдр и октаэдр Мо8О204- Данные лазер-
ной рамановской спектроскопии свидетельствуют о том, что
на поверхности у-А120з адсорбируются те же анионы, которые
присутствуют в растворе. После сушки наблюдается сильное
взаимодействие молибдат-ионов с поверхностью носителя, ха-
рактеризующиеся поглощением в области 950—970 см-1 и широ-
кой линией при 840—860 см-1 особенно, если пропитка проводи-
лась в кислых растворах.
Данные РФЭС и ионной сканирующей спектроскопии [232,
233, 237] показывают, что при адсорбции молибдена из кислых
102
Рис. 43. Рамановские спектры образцов катализаторов, полученных методом
пропитки у-А12О3 при различных pH:
1 — NiMo прокаленный; 2 — СоМо прокаленный; 3 — NiMo сушеный; 4 — СоМо сушеный;
5 — Мо прокаленный; 6 — Мо сушеный; 7 — Мо влажный; 8 — раствор гептамолибдата
аммония
растворов их дисперсность на поверхности носителя выше, чем
при нейтральных и щелочных величинах pH. Максимальные
значения дисперсности молибденовых фаз достигаются при
pH 4—5, что коррелируется с максимумом гидрообессериваю-
щей активности алюмомолибдеиового катализатора (рис. 44).
С введением в алюмомолибдсиовую систему кобальта или
никеля существенно изменяется состояние адсорбированного
молибдена. Как видно из рис. 45, дисперсность молибдена в
сушеных образцах, полученных в области нижних pH, несколь-
ко понижается, о чем можно судить по изменению отношения
Мо/Al. После прокаливания эта
величина снова возрастает, кро-
ме того, в рамановском спектре
появляется полоса при 860 см-1,
характеризующая связь Мо— g
о
-о
Рис. 44. Изменение гидрообессериваю- |
щей активности по тиофену (1), отно- S
тения Мо/Al по данным ионной скани-
рующей спектроскопии (2) и данным
РФЭС (3) в зависимости от pH молиб-
денсодержащего раствора
103
Рис. 45. Отношение интенсивности пиков Mo3d/Al2P (а) и Co(Ni)2P3/2/Al2p (б)
в спектрах РФЭС на различных стадиях приготовления катализаторов:
I — Мо/А12О3 сушеный; II — Мо/А12О3 прокаленный; III — Co(Ni)Mo/Al2O3 сушеный; IV —
Co(Ni)Mo/Al2O3 прокаленный; V — Co(Ni)Mo/Al2O3 сульфидный; 1 — для Со—Мо/А12О3;
2 — для Ni—Мо/А12О3; 3 — для Мо/А1203
О—Мо [228]. Образцы, полученные при нейтральных и щелоч-
ных pH, практически не изменяют свои состояния после введе-
ния кобальта или никеля в процессе сушки, прокаливания (см.
рис. 42). Однако уменьшение поглощения при '935 см-1 сви-
детельствует о том, что при контакте с раствором промотора
снижается количество тетраэдрически координированных ионов
молибдена, а исчезновение линии 820 см-1 указывает на пол-
ное превращение свободной МоОз.
Величина pH влияет также на состояние и направление
взаимодействия промотора. Как видно из рис. 45, а, часть
Co(iNi) связывается не с молибденом, а непосредственно с но-
сителем с образованием никелевой (кобальтовой) шпинели.
Таблица 39. Энергия связи элементов в сульфидированных АКМ. и АНМ
катализаторах, полученных пропиткой при различных pH
Образец pH Энергия связи, эВ
МозЛ/з М°3<й/2 Nl2p3/2’ С°2рЗ '2 S2P s2- SO2- °1S
Co9S8 778,6 Со (металл) 778,4 MoS2 232,1 228,9 162,0 NiO* 853,4 162,0 СоМо* 11 232,5 229,3 781,0 782,6 161,6 169,6 531,6 СоМо* 7 232,5 229,8 779,35 782,05 162,5 169,6 531,65 СоМо* 2 232,5 229,2 779,5 781,9 162,5 169,5 531,6 NiMo' И 232,5 229,0 853,25 856,45 162,1 169,2 531,5 NiMoi: 7 232,35 229,05 852,3 856,5 161,95 169,35 531,6 NiMo* 2 232,35 229,15 853,75 857,75 162,05 169,35 531,7
* Образцы, предварительно сульфидированные.
104
Рис. 46. Электронные спектры
образцов катализаторов МоОз/
/А120з (-----------------) и
СоО—МоОз/Л12О3 ( —) в за-
висимости от способа пропит-
ки носителя:
/ — пронитка v-A12O3 раствором со-
тен Со и Мо; 2 — сушка МоОз/АЬОз
при 110 °C, пропитка раствором со-
ли Со и прокаливание при 550 °C;
3 — прокаливание МоО3/А12О3 при
550 °C, пропитка раствором соли Со
и прокаливание при 550 °C; 4 —
сушка МоОз/А12О3 при ПО °C и про-
питка раствором соли Со
Причем максимальное
количество неактивных
шпинелей образуется в
образцах, полученных
пропиткой при низких pH-
В результате сульфидирования содержания шпинелей в катали-
заторе уменьшается, причем более заметно для алюмоникель-
молибденовых образцов. Анализ спектров РФЭС сульфидиро-
ванных образцов (табл. 39) позволяет сделать вывод, что ато-
мы Мо, Co(iNi) связаны как с атомами серы, так и с атомами
кислорода. Уменьшение отношений Мо/Al и Ni(Co)/Al в суль-
фидированных катализаторах по сравнению с прокаленными
может свидетельствовать о некоторой агрегации поверхностных
частиц в фазе Co(Ni)—Мо/А1.
При введении в систему кобальта происходят следующие
изменения. Как показывают данные ИК-спектроскопии (рис. 46)
и магнитных измерений, эффект кобальта, введенного совмест-
ные. 47. Электронный микроскопический анализ содержания Мо в образцах
без добавок (а) и промотированных пероксидами (б), солями аммония (в),
солями аминов (г)
105
Рис. 48. Изменение содержания влаги в
катализаторе Хн2о в зависимости от
длительности и условий сушки:
/ — 30 °C, 2 л/ч; 2— 30 °C, 10 л/ч; 3 — 50 °C,
10 л/ч; 4 — 100 °C, 10 л/ч
ной пропиткой по влагопоглоще-
НИЮ ИЛИ пропиткой МоОз/АЬОз,
высушенного при 110 °C, прояв-
ляется в смешении полосы пог-
лощения связи Мо—О в низко-
волновую область. После прока-
ливания при 550 °C уменьшается
также интенсивность этой поло-
сы. Эффект усиливается по мере
увеличения концентрации ко-
бальта в катализаторе. Эти дан-
ные свидетельствуют об образо-
вании связи Со—О—Мо и возра-
стании количества оксомолибда-
тов октаэдрической симметрии.
На физико-химические свой-
ства и активность катализатора большое влияние оказывают
также добавки, вводимые в пропиточный раствор [238]. Так,
при использовании в качестве модификатора солей аммония,
пероксидов или аминов улучшается взаимодействие солей ме-
таллов с носителем и профиль распределения металлов по гра-
нуле носителя получается более равномерный (рис. 47).
Кинетика удаления влаги при сушке (промежуточной или
окончательной) описывается кривой с участками уменьшающей-
ся и постоянной скорости (рис. 48) и лучше всего согласуется
с механизмом движения потока жидкости в капиллярах [238].
Чем мягче условия сушки, т. е. чем ниже температура и мень-
ше скорость удаления влаги, тем более равномерно распреде-
ление металлов по грануле катализатора и выше гидрообессе-
Таблица 40. Влияние условий сушки на гидрообессеривающую
и гидродеметаллизирующую активность АНМ. катализаторов
Условия процесса: сырье — мазут с содержанием 2,5% серы
и 130—150 млн-1 ванадия, /=380 °C, о>=0,32 ч~'; катализатор
содержит 15% МоОз, ЫЮ/МоОз=0,3
Условия сушки Степень удаления, % Степень удаления, %
t, °C | v, л/ч серы | ванадия серы | ванадия
drp=5,0 ММ ^гр= =0,36 ММ
30 10 38 30 50 47
50 10 30 27 45 43
50 100 27 22 40 38
106
Lи гр, отн.ед. t°C
Рис. 49. Кривые распределения металлов по грануле катализатора при раз-
личных условиях сушки:
1 — 30 °C, 10 л/ч; 2 — 50 °C, 10 л/ч; 3 — 50 иС, 100
Рис. 50. Изменение степени удаления сернистых соединений (1) и степени
деметаллизации (2) в зависимости от порядка пропитки:
▲ Д — NiMo:> О — MoNi; — (NiMo)
ривающая и гидродеметаллизирующая активность контакта
(рис. 49, табл. 40).
Влияние порядка введения гидрирующих металлов на гид-
рообессеривающую активность АНМ катализатора [238] такое
же, как и при их введении в АКМ катализатор [227]. Гидро-
деметаллизирующая активность АНМ катализатора выше,
если вначале вводят никель, а затем молибден (рис. 50).
Схема производства катализаторов методом пропитки но-
сителя водными растворами солей активных компонентов пред-
ставлена ниже:
107
Качество катализатора, получаемого по такой технологии,
можно регулировать на различных стадиях: при приготовле-
нии носителя с заданной пористой структурой и химическим
составом, и изменением последовательности введения металлов,
концентрации их солей в растворе, осуществлением промежу-
точных сушки и прокаливания полупродукта.
3.2. ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫХ
ОТЕЧЕСТВЕННЫХ КАТАЛИЗАТОРОВ
3.2.1. КАТАЛИЗАТОРЫ ГИДРООЧИСТКИ НЕФТЯНЫХ ФРАКЦИИ
В промышленной практике наибольшее распространение
получили катализаторы, представляющие собой сочетания
оксидов и сульфидов кобальта или никеля с оксидами либо
сульфидами молибдена или вольфрама. На первых отече-
ственных установках гидроочистки использовали алюмокобальт-
молибденовый катализатор АКМ. Основные физико-химиче-
ские характеристики этого и других промышленных отечествен-
ных катализаторов приведены в табл. 41 [11].
Катализатор АКМ обладал механической прочностью, стой-
костью к ядам и сохранял активность длительное время. Так,
при гидроочистке прямогонных бензиновых, керосиновых и
дизельных фракций он обеспечивал необходимую глубину
обессеривания в течение 30 мес. [11; А. с. 757588].
Другой массовый катализатор — алюмоникельмолибденовый
(АНМ); его использование предпочтительно при переработке
Таблица 41. Физико-химические свойства промышленных отечественных
катализаторов для гидроочистки нефтяных фракций
Показатель АКМ АНМС ГК-35 О ГКД-202 ГС-168Ш ГКД-205 ГКД-202П
Размер гранул, мм: диаметр длина Насыпная плот- ность, кг/м3 Индекс прочности, кг на 1 мм диа- метра гранулы Удельная поверх- ность, м2/г Промотирующая добавка Суммарное со- держание гидри- рующих металлов, % 4,5 6,0 670 1,1 120 17,0 4,0 3,5 6,0 6,0 670 800 1,1 1,8 120 247 SiO2 Цеолит 17,0 26,0 4,0 1,6-2,2 6,0 5,0 830 720 1,2 2,2 190 236 — Цеолит 28,0 17,0 3,7 4-6 750 1,8 220 SiO2 17,0 1,7-2,5 6,0 700 2,3 240 Цеолит 17,0 1,5-2,0 7,0 620 2,5 235 Цеолит 11,0
W8
Таблица 42. Условия работы промышленных установок гидроочистки
фракции дизельного топлива на различных катализаторах
Показатель Новогорьковский НПЗ Киришский НПЗ Новоярославский НПЗ
АНМ + + АКМ ГК-35 АКМ ГК-35 АНМ+ + АКМ ГК-35
Сырье
Плотность, кг/м3 845 851 840
Фракционный состав, °C: н. к. 10% (об.) 50% (об.) 90% (об.) к. к. Содержание серы, % 185 227 288 347 366 0,95- 1,10 200 245 280 342 360 0,90 200 234 278 338 365 0,80—0,90
Условия процесса
Давление, МПа Количество циркулирующего Н2 при нормальных условиях, м3/м3 сырья Объемная скорость подачи сырья, ч-1 Температура, °C: начальная через 400 ч через 8000 ч Остаточное содержание сер- 3,1 230 4,1 4,4 380 360 402 370 420 385 0,14 0,11 3,0 220 3,0 4,0 375 350 380 360 395 379 0,11 0,09 3,0 240 3,2 380 400 406 0,13 4,0 360 379 384 0,11
нистых соединений, %
сырья с повышенным содержанием соединений азота и поли-
циклических ароматических углеводородов. Введение в компо-
зицию катализатора диоксида кремния позволяет увеличить
механическую прочность и повысить термическую стабильность
контакта.
Режимы промышленных установок гидроочистки, перераба-
тывающих различные виды сырья при эксплуатации катализа-
торов АКМ и АНМС, представлены ниже:
Фракция из вы- сокасернистой нефти Фракция из сер- нистой нефти
Среднее давление в реакторах, МПа 3—5 3—4
Перепад давления в системе, МПа 1,0 1,0
Средняя температура в реакторе, °C 380-400 365—395
Перепад температуры в реакторах, °C 2—7 5—10
Объемная скорость подачи сырья, ч_| 1,6 1,6—2,5
Циркуляция водородсодержащего газа, м3/м3 сырья 400 500 250—400
Содержание водорода в циркуляцион- ном газе, % (об.) 70-85 70-85
Следует отметить, что длительность межрегенерационного
цикла АКМ и АНМ катализаторов составляет не более 12 мес
при общем сроке службы около трех лет.
109
В последние годы наметилась тенденция создания промыш-
ленных катализаторов гидроочистки, связанная с вовлечением
в переработку утяжеленных и высокосернистых дизельных
фракций, вакуумного газойля, фракции 200—320 °C (для про-
цесса «Парскс»), фракций термической переработки нефти,
а также необходимостью повышения производительности уста-
новки, увеличения глубины удаления серо- и азотсодержащих
соединений. Разработан и внедрен ряд новых эффективных
каталитических систем для процессов гидроочистки различных
нефтяных фракций (см. табл. 41). Среди них особое место
занимают цеолитсодержащие катализаторы, в частности алю-
моникельмолибденовые системы, модифицированные цеолитом
в различных катионных формах. Эти композиции успешно
применяют в процессах гидрогенизациопной переработки раз-
личных нефтяных фракций. Катализатор ГК-35, 'разработанный!
во ВНИИ НИ, представляет собой модифицированный цеоли-
том в редкоземельной форме АНМ катализатор. Он исполь-
зуется на И промышленных установках и показал высокую
эффективность при переработке фракций 200—320°C — сырья
для процесса выделения парафинов адсорбцией на цеолитах
[239]. Пр.и объемной скорости подачи сырья 3,0—3,5 ч-1 и тем-
пературе 345—360 °C катализатор ГК-35 обеспечивал стабиль-
ное проведение процесса. Результаты гидроочистки в присут-
ствии катализатора ГК-35 приведены ниже:
Сырье Продукт
Плотность, кг/м3 . . 825 820
Фракционный состав, °C: н. к. 213—214 214—216
50% (об.) 255 254
к. к. 313-320 312—316
Содержание, %: серы 0,60—0,71 0,02—0,03
ароматических углеводородов 23 20—21
Температура, °C: застывания —24 —22
помутнения . . . -19 —17
Иодное число, г 12/100 г 0,52 0,43
Базовое число, мг NH3/100 мл 11,0 3,5—5,0
Преимущество ГК-35 заключается в том, что при равной
степени обессеривания топлива повышается объемная скорость
подачи сырья и при этом снижается температура процесса.
Это позволяет увеличить производительность реакционного
объема на 10—20%, увеличить ресурс катализатора по расхо-
ду перерабатываемого сырья, а также срок его службы
(табл. 42), что важно для технико-экономических показателей
процесса.
При некотором повышении температуры в присутствии ка-
тализатора ГК-35 можно получать дизельные топлива из
утяжеленных прямогонных фракций. Сравнивая алюмокобальт-
молибденовые и алюмоникельмолибденовые сульфидированные
ПО
катализаторы с катализатором ГК-35, можно отмстить, что
в присутствии ГК-35 увеличивается объемная скорость подачи
сырья на 17%, снижается содержание серы в продукте на 22%
и повышается срок службы катализатора. Преимущество в
стабильности катализатора ГК-35 подтверждается длитель-
ностью межрегенерационного пробега (30 мес на Новоярослав-
ском НПЗ), сроком службы (6 лет на Новогорьковском НПЗ)
и ресурсом перерабатываемого сырья («200 т/кг).
Уязвимым моментом при изготовлении катализатора ГК-35,
учитывая дефицитность ресурсов цветных металлов, является
повышенное в нем содержание никеля и молибдена. Поэтому
при дальнейшем совершенствовании катализаторов подобной
композиции стремились к сокращению в нем гидрирующих ме-
таллов. В частности, в катализаторе ГКД-202 содержание ак-
тивных металлов на 30% меньше. Опытно-промышленная пар-
тия этого катализатора успешно прошла испытания на уста-
новке Л-24-7 гидроочистки дизельного топлива [239]. Как вид-
но из данных, представленных в табл. 43, в присутствии ката-
лизатора ГКД-202 температура проведения процесса снижает-
ся. на 15—20 °C, что позволяет увеличить межрегенерационный
пробег до 20—28 мес. Катализатор проработал на данной уста-
новке в течение 52 мес с одной регенерацией. Показатели ра-
боты установок гидроочистки и других заводов свидетельствуют
о возможном увеличении общего срока службы катализатора
ГКД-202 до 6—7 лет.
Модифицированный вариант этого катализатора выпускает-
ся под маркой ГКД-205, он успешно использован для гидро-
очистки вакуумного дистиллята на промышленной установке
Л-24-5 при парциальном давлении 2,5 МПа и температуре
350—360 °C. В течение 13 мес работы установки степень обес-
Таблица 43. Показатели работы установок гидроочистки
на катализаторе ГКД-202
Показатель Уфимский НПЗ Ново- куйбы- шевский НПЗ Рязан- ский НПЗ Киришский НПЗ
Объемная скорость подачи сырья, ч"1 Температура процесса, °C: 4,6 3,8 5,0 4,0
начальная 360 342 368 345
через 1000 ч 363 358 373 351
через 3000 ч 370 360 380 359
через 6000 ч Содержание серы, %: 376 365 385 362
сырье 1,20 0,80 0,80 0,70
продукт 0,15 0,10 0,15 0,08
Межрегенерационный период, мес 23 28 15 23
Срок службы катализатора, мес* 62/72 36/72 20/60 40/72
♦ В числителе — фактический срок службы катализатора, в : мый. знаменателе : — ожидае-
111
серивания составляла 78—80%. Использование гидроочищен-
ного сырья на установке каталитического крекинга позволило
увеличить выход малосернистого бензина на 2—3%.
Успешными оказались работы в области модифицирования
аморфных носителей катализаторов гидроочистки. Разработан-
ный во ВНИИ НП катализатор ГС-168Ш представляет собой
алюмоникельмолибденовую систему с использованием оксида
алюминия, модифицированного гидроксилированным алюмоси-
ликатом (табл. 44). Катализатор ГС-168Ш эффективно экс-
плуатировался на установке Л-24-7 в процессе гидроочистки
смесевого дизельного топлива в течение 18 мсс. При давлении
3,5 МПа, температуре 365—370 °C и объемной скорости подачи
сырья 4,0 ч-1 катализатор стабильно обеспечивает остаточное
содержание серы в гидроочищенном смесевом дизельном топ-
ливе, равное 0,08—0,11% [182]. Промышленное производство
катализатора ГС-168Ш организовано на установке Г-43-7. Ре-
зультаты лабораторных и опытных испытаний катализаторов
ГКД-205 и ГС-168Ш в процессе гидроочистки вакуумного
газойля позволили рекомендовать их для использования на
установках Г-43-107.
В работе [240] обобщен опыт эксплуатации катализатора
ГО-117 на установке гидроочистки Л-16-1.
Катализатор ГО-117 при переработке вакуумного газойля
характеризуется более высокой гидрообессеривающей актив-
ностью, чем АКМ катализатор (табл. 45). Температура про-
цесса гидроочистки на АКМ катализаторе на 10—15 °C выше,
чем на катализаторе ГО-117, при одинаковой глубине удале-
ния сернистых соединений.
Таблица 44. Показатели работы промышленных установок гидроочистки
дизельного топлива на различных катализаторах
Показатель АКМ (АНМС) ГК-35 ГС-168Ш ГКД-202
Давление, МПа 3,1 3,0 3,1 3,5 3,4 3,3
Объемная скорость подачи сырья, ч '* Температура, °C: 3,0 -3,5 4,0 4,0 4,0 4,4 5,0
в начале цикла 375 380 360 350 3G0 360 356
через 100 сут 386-390 370 360 376 364 368
через 300 сут Содержание серы, % • 406—420 385 369 390 375 379
в сырье 0,70—0,85 1,0 0,8 0,65 1,20 0,90
в продукте 0,10—0,15 о,н 0,07 0,09 0,14 0,12
Межрегенерационный период, мес 11 20 11 22 28 23
Общий срок службы катализатора, мес 36 60 48 36/48* 60/72* 30/60*
* В числителе — фак мый. 1ическ срок службы катализатора, в знаменателе — ожидае-
112
Таблица 45. Результаты использования катализаторов
ГО-117 и АКМ в процессе гидроочистки вакуумного газойля
W, Ч—1 Содержание серы, % | t, °C Содержание <еры. %
в сырье в гидро- генизате в сырье в гидро- гениза!е
Катализатор Г 0-117
Катализатор АКМ
0,88 360 2,70 0,29 0,86 375 2,75 0,30
0,96 365 2,72 0,31 0,92 365 2,60 0,45
1,03 365 2,67 0,29 1,07 365 2,16 0,51
0,69 365 2,89 0,16 0,79 375 2,88 0,29
1,14 370 2,80 0,22 1,10 380 3,10 0,29
1,05 370 2,70 0,20 0,86 375 2,71 0,31
3.2.2. ЦЕОЛ ИТСОД ЕРЖАЩИ Е КАТАЛИЗАТОРЫ
Анализ литературных и патентных данных позволяет выде-
лить следующие основные способы получения цеолитсодержа-
щих катализаторов нефтепереработки [62]:
введение металла (металлов) в цеолит катионным обменом
с последующим формованием, восстановлением или сульфи-
дированием;
нанесение металла (металлов) на внешнюю поверхность
цеолитных кристаллов с последующим формованием, восста-
новлением или сульфидированием;
формование металлцеолита со связующим;
нанесение металла на сформованный со связующим цеолит,,
содержащий или не содержащий металл;
формование металлцеолита со связующим, на который так-
же нанесен металл.
В соответствии с этим существует достаточно много техно-
логических схем производства цеолитсодержащих катализато-
ров. Однако для всех схем характерна стадия подготовки цео-
лита, так как цеолит в составе катализаторов применяют не
в исходной Na-форме, а в декатионированной, деалюминирован-
ной либо катион-декатионированной форме. Это обусловлено
тем, что, как показано многочисленными исследованиями (по-
дробно проанализированными в работе [59]), активность и се-
лективность катализаторов в значительной мере определяются
кислотностью цеолитного компонента (остаточным содержа-
нием натрия или степенью декатионировання), природой, кон-
центрацией и способом введения металла в цеолит и степенью
его дисперсности, а также мольным отношением S1O2/AI2O3
в цеолите, природой компонента и его структурой. Кроме того,
известно, что остаточное содержание натрия в цеолите играет
существенную роль в термической стабильности самого ката-
лизатора при его эксплуатации и регенерации [61].
8—922 113
Общие методы модифицирования цеолитов — декатиониро-
вание, катионный обмен, деалюминирование — подробно описа-
ны в ряде работ [200, 209]. При приготовлении катализаторов
нефтепереработки, в которых цеолит нс является носителем
гидрирующих металлов, обычно проводят предварительное де-
катионировапие и затем катионный обмен па металлы II или
VI группы. Декатионирование фожазитов и морденита заклю-
чается в обработке суспензии цеолита водным раствором соли
аммония [1NH4CI, NH4NO3, (NH4)2SO4]. Максимальная степень
декатионирования зависит от природы цеолита, температуры
и длительности обработки, концентрации н объема раствора
соли аммония. Характерные условия декатионирования таковы:
температура 90—100 °C, концентрация водного раствора соли
аммония 10—20%, длительность обработки 2—4 ч. В этих усло-
виях степень декатионирования фожазитов составляет 60—70%
[61, 200, 241], морденита — 90—96% [242—244]. Для получе-
ния большой степени декатионирования необходимо чередовать
катионный обмен с промежуточными прокаливаниями при
500—550 °C в течение 4 ч [200, 241—244]. При этом для ста-
билизации структуры цеолита рекомендуют проводить допол-
нительный катионный обмен на полизарядные катионы метал-
лов II, III или VI группы с промежуточным прокаливанием при
температуре 140—550 °C [А. с. 261278]. Если в цеолитный ком-
понент необходимо ввести гидрирующий металл, после дека-
тионирования проводят катионный обмен из водного раствора
соли или аммиачного комплекса этого металла [200].
Установлено {61, 241], что при глубоком декатионировании
низкомодульных цеолитов, например NaY, после удаления 60—
65% катионов натрия термостабильность цеолита резко сни-
жается и при остаточном содержании Na2O 1,0—1,5% дости-
гает минимального значения (рис. 51). Причиной дестабилиза-
ции кристаллической решетки цеолита в области степеней об-
мена ^65% может быть дегидроксилирование поверхности и
миграция катионов натрия из малых полостей в большие с
перестройкой кристаллической решетки [200, 245].
В промышленной
практике для получе-
ния термостабильного
цеолитного компонен-
та с низким содержа-
нием натрия исполь-
зуют метод ступенча-
того деалюминирова-
Рис. 51. Изменение влаго-
емкости IFoth образцов цео-
литов, прокаленных при
различных температурах, от
степени декатионирования
ССдек
114
ния без заметного разрушения структуры цеолита и метод од-
новременного деалюминирования и катионного обмена на ка-
тионы А13+, -позволяющие в широком диапазоне изменять моль-
ное отношение ЗЮг/АЬОз, повышать термическую стабильность
кристаллографической структуры и гидроксильного покрова и
изменять силу кислотных центров [245, 246]. Отличительной
особенностью второго метода является то, что стабилизацию
проводят при повышенной температуре в присутствии водяного
пара и аммиака. Такая обработка ускоряет гидролиз каркасного
алюминия и способствует рекристаллизации в результате за-
полнения образующихся при деалюминировании вакансий иона-
ми кремния.
Деалюминирование фожазитов рекомендуют проводить так-
же мягкими комплексообразователями, например, этилен-
диаминтетрауксусной кислотой [200], а высококремнеземных
цеолитов, например, морденита — водными растворами мине-
ральных кислот [247, А. с. 503587, А. с. 513714].
Модифицирование цеолитов методом декатионирования и
катионного обмена на поливалентные катионы широко распро-
странено в промышленной практике. Модификация методОхМ по-
следовательного чередования катионного обмена и прокалива-
ния используется реже из-за сложности аппаратурного оформ-
ления. В отечественной практике разработан и применяется
способ получения глубокодекатионированных форм цеолита Y
с высокой термической стабильностью без промежуточного
прокаливания [61, 241].
Ниже в качестве типичного примера представлена принци-
пиальная схема приготовления цеолитсодержащих катализато-
ров нефтепереработки, в частности катализатора для процес-
сов гидрирования [А. с. 513714]:
8'
115
Исходный цеолит NaY (содержащий 61,0% SiO2, 23,4% А12О3, 0,4% СаО,
0,6% MgO, 14,6% Na2O) подвергают двухкратному обмену катионов Na+ на
катионы Са2+, Ni2+, Мо3+ или РЗЭ, либо предварительно проводят деалю-
минирование двухкратной обработкой водным раствором этилендиаминтетра-
уксусной кислоты при температуре 90—95 °C в течение 2 ч. Если проводят
деалюминирование, то перед катионным обменом цеолит промывают водой,
сушат при 100—120 °C в течение 4—5 ч и прокаливают 4 ч при 500—550 °C.
При прямом декатионировании NaY водным раствором СаС12 получают
цеолит, содержащий 9,7% СаО и 2,7% Na2O. Если перед декатионированием
проводят деалюминирование, остаточное содержание Na2O в цеолите снижа-
ется до ^0,6%. Например, при обработке деалюминированного цеолита Y
(SiO2/Al2O3 = 6,5, содержание Na2O 11,7%) водным раствором нитратов про-
мышленного концентрата редких земель получают цеолит, содержащий 18,56%
оксидов РЗЭ, 0,53% Na2O, 58,11% SiO2 и 22,8% А12О3.
В следующей стадии на цеолит, подготовленный пропиткой или катион-
ным обменом, наносят гидрирующий металл, например Pt или Pd из водного
аммиачного раствора соли в расчетном количестве (обычно 0,01—8,0%). Цео-
литный компонент высушивают при 105—120 °C в течение 5 ч, прокаливают
4 ч при 500—550 °C, смешивают с пастой гидроксида алюминия, формуют в
гранулы, сушат при 105—120 °C и снова прокаливают 4—5 ч при 500—550 °C.
В качестве примера технологии приготовления цеолитсодержащих ката-
лизаторов с введением гидрирующего металла не в цеолит, а в связующее
ниже приведена схема получения катализаторов селективного гидрокрекинга
[А. с. 513714]. Первая стадия — подготовка цеолита. При получении ката-
лизаторов типа СГ-3, основой которых является эрионит, декатионирование
проводят обработкой водным раствором NH4C1 до степени обмена катионов
Na1 и Кь на NH4+, равной 75—85%. Остаточное содержание в цеолите нат-
рия составляет 0,20—0,25%, калия 2,0—2,6%. Во второй стадии подготовлен-
ный цеолит смешивают с влажным гидроксидом алюминия (25% А12О3). По-
лученную массу формуют в гранулы, сушат при 120 °C и прокаливают в токе
воздуха при 450—500 °C в течение 4 ч. Затем гранулы пропитывают водным
раствором молибдата аммония (из расчета 4—8% Мо в катализаторе) при
величине pH 4—8 в течение 1 ч, сушат при 120 °C и прокаливают в токе
увлажненного воздуха при 500 °C в течение 4 ч.
Вариантом предложенной технологии является способ вве-
дения гидрирующего компонента (молибдена) не в сформован-
ную и прокаленную основу, а во влажный гидроксид алюминия
перед смешением с цеолитом [248]. Последующие операции
остаются такими же: формование гранул, сушка, прокалива-
ние. Однако в этом случае должен быть изменен температур-
ный режим прокаливания, так как максимальная активность и*
селективность катализатора достигаются при более высокой
температуре (520—560°C).
3.2.3. НИКЕЛЬВОЛЬФРАМСУЛЬФИДНЫЕ КАТАЛИЗАТОРЫ
Никельвольфрамсульфидные катализаторы, выпускаемые в
промышленности под марками 3076 и 3076А, в настоящее вре-
мя производятся в небольшом количестве. Однако их приме-
няют для процессов глубокого гидрирования высокоароматизи-
рованного сернистого нефтяного сырья как прямогонного, так
и вторичного происхождения в целях получения реактивных
топлив, деароматизированных растворителей, смазочных ма-
сел, а в химической промышленности — для производства цик-
логексана из бензола и в других процессах гидрирования.
116
Процесс приготовления катализаторов состоит из следую-
щих стадий: осаждение и отмывка основного карбоната нике-
ля, приготовление оксидной никельвольфрамовой массы, осер-
нение катализаторной массы и формование катализатора.
При производстве катализатора 3076А на стадии приготовле-
ния оксидной никельвольфрамовой массы дополнительно вво-
дятся операции получения активного оксида алюминия, измель-
чения сухого А120з и введения измельченного порошка разме-
ром частиц 150 мк.
Основной карбонат никеля, как правило, осаждают из ра-
створа нитрата никеля (концентрация 115—132 г/л) при тем-
пературе 20 °C и pH 8,0—8,5. В случае использования в каче-
стве сырья сульфата никеля pH раствора должен быть увели-
чен до 9,0, чтобы избежать образования основного сульфата
никеля, затрудняющего отмывку осадка от иона SO4.
Операция отмывки осадка карбоната никеля существенно
влияет на физико-химические свойства и активность катализа-
тора. Отмывку осадка, отделенного от маточного раствора,
проводят на фильтр-прессе водой при температуре не выше
50—.60 °C с последующей продувкой воздухом. Длительность
промывки водой в случае нитрата никеля составляет 10—25 ч,
а в случае сульфата никеля — 20—35 ч. Установлено, что уско-
рение процесса промывки за счет повышения температуры до
70°C, а также применение пропаривания осадка приводят к
ухудшению пористой структуры основного карбоната никеля —
•образованию тонкопористой стекловидной темно-зеленой моди-
фикации в отличие от обычного меловидного светло-зеленого
основного карбоната никеля, что отражается на свойствах ка-
тализатора (табл. 46) [172].
При приготовлении катализатора 3076 для обеспечения за-
данного состава (37,8—44,6% NiS, 55,4—62,2% WS2, мольное
отношение NiS WS2 = 2 1) готовят оксидную никельвольфра-
мовую массу, содержащую (считая на абсолютно сухое веще-
ство) 35,0—41,5% NiO и 58,5—65,0 WO3. Для удобства после-
Таблица 46. Влияние свойств соединений никеля на свойства
и гидрирующую активность катализатора 3076
Соединение никеля Пористая структ/ра осадка Пористая структура катализатора формы Степень гид- рирования, %
6УД’ М2/Г 7> ПОР’ см3/г оксидной сульфидной нефтя- ного сырья бен- зола
6 УД’ М2/Г см3/г \д' м‘2/г г'пор’ см3/г
Меловидный основной 144 0,22 102 0,13 20 0,02 80,6 90,0
карбонат никеля Стекловидный основ- 111 0,14 ПО 0,10 20 0,14 73,8 90,0
ной карбонат никеля Гидроксид никеля 58 0,06 39 0,03 6 0,04 57,7 61 ,0
117
дующей обработки оксидную массу формуют в виде экструда-
тов. Приготовление массы проводят следующим образом. Смесь
сухих порошков карбоната никеля и вольфрамовой кислоты
увлажняют и тщательно перемешивают в бегунах. При исполь-
зовании смесителей-упаривателей можно использовать влаж-
ный основной карбонат никеля. В этом случае упаривание про-
водят до влажности массы 40—45%.
Осернение высушенной оксидной катализаторной массы осу-
ществляют в шнековых «печах при непрерывном перемешивании
и перемещении массы при температуре 430 -470 (,С в течение
5—6 ч газом, содержащим 28—30 м3 Н2 и 530 -550 м3 H2S
па 1 т катализатора. Осерненная катализаториая масса пред-
ставляет собой тяжелый синевато-черный порошок с содержа-
нием серы 27—31%, который таблетируют после измельчения
частиц до размера <:6О мк.
При приготовлении катализатора 3076А на стадии смеше-
ния карбоната никеля с вольфрамовой кислотой в массу вво-
дят порошок сушеного оксида алюминия — частицы размером
150 мк. Оксид алюминия снижает насыпную плотность ка-
тализатора с 2,4—2,6 до 1,6—1,8 кг/л, в 2—5 раз увеличивает
удельную поверхность и объем пор и оказывает стабилизирую-
щее действие па вольфрамат никеля при переходе его из оксид-
ной в сульфидную форму.
Глава 4
ПРОИЗВОДСТВО НОСИТЕЛЕЙ
КАТАЛИЗАТОРОВ
4.1. ХАРАКТЕРИСТИКА НОСИТЕЛЕЙ
Наиболее распространенный носитель катализаторов гидро-
генизациопной переработки нефтепродуктов— активный оксид
алюминия. Поскольку в составе катализаторов носитель играет
роль не только инертного разбавителя, а участвует в формиро-
вании активных фаз и служит в качестве структурного промо-
тора, создающего специфическую пористую структуру, способы
приготовления и модифицирования активного оксида алюминия
являются важной составной частью технологии катализаторов
гидрогенизационной переработки.
Для приготовления катализаторов используют оксид или
гидроксид алюминия, либо их сочетание. Структура активного
оксида алюминия как носителя катализаторов закладывается
на всех стадиях ее получения, включая формование, термиче-
скую обработку и специальные приемы модификации. Активный
118
оксид алюминия получают термической дегидратацией гидрок-
сидов алюминия или термическим разложением солей [249—
252]. Практическое значение в качестве предшественников окси-
да алюминия как носителя имеют гидроксиды алюминия.
По химическому составу гидроксид алюминия подразделяет-
ся [253, 254} на: тригидраты, из которых наибольшее значение
для приготовления катализаторов имеют гиббсит и байерит;
моногидраты — хорошо окристаллизованные бём1ит и диаспор и
плохо окристаллизованный псевдобёмит, аморфный оксид алю-
миния переменного состава.
Гиббсит и байерит имеют формулу А1(ОН)3, поскольку
вся вода в них находится в связанном состоянии в виде
ОН-групп. Гиббсит сравнительно хорошо кристаллизуется, об-
разуя крупные кристаллы (50—70 мкм) псевдогексагональной
структуры. Структура байерита аналогична структуре гиббси-
та, однако анионы расположены не в псевдогексагональной,
а в правильной гексагональной решетке,
Кристаллическая структура гиббсита и байерита является
структурой двойного слоя плотноупакованных гидроксильных
ионов с 2/3 октаэдрических пустот, заполненных атомами алю-
миния [254]. Двойные слои соединяются друг с другом в .па-
кете в последовательности АВВААВВА (гиббсит) и АВАВАВ
(байерит). Расстояние между соседними слоями А и В состав-
ляет 0,281 нм в гиббсите и 0,204 нм в байерите, а внутри двой-
ного слоя расстояние АВ равно соответственно 0,203 и 0,207 нм.
Вследствие этого минимальное расстояние 0—0 между сосед-
ними слоями в байерите (0,313 нм) несколько больше, чем в
гиббсите (0,281 нм), и плотность байерита (2,50) выше плот-
ности гиббсита (2,43).
Гиббсит в качестве непосредственного предшественника ак-
тивного оксида алюминия не используют, поскольку при его
прокаливании образуется грубодисперспый оксид алюминия с
низкой удельной поверхностью. Однако он является сырьем для
приготовления оксида алюминия переосаждением либо термо-
диспергированием с последующей гидратацией и получением
нужных гидратных форм.
Байерит — предшественник активного оксида алюминия с
развитой поверхностью в виде у- и ^-модификаций в зависи-
мости от условий дегидратации.
Диаспор из группы моногидратов в качестве сырья для
производства оксида алюминия не используют, так как в при-
роде в виде минерала встречается крайне редко, а в искусствен-
ных условиях образуется только при высоких температурах и
давлениях.
Бёмит широко распространен в природе, однако для при-
готовления катализаторов применяют более чистый синтетиче-
ский бёмит. Вода, входящая в состав бёмита, находится в виде
ОН-групп, а молекулярная вода не обнаружена. На этом осно-
вании бёмиту приписывается формула О = А1—Н [254].
119
Бёмит имеет плотноупакованную структуру из атомов кис-
лорода, содержащую атомы алюминия в некоторых октаэдриче-
ских полостях. Октаэдры АЮ4 деформированы и связаны друг
с другом общим атомом кислорода в вершинах октаэдров в.
бесконечную цепочку
/—0-А1-0 \
II
\ О—А1-О—Jn
с периодом идентичности 0,285 нм в направлении оси а.
Псевдобёмит дает рентгенограммы с широкими линиями,
относительное расположение которых сходно с положением наи-
более интенсивных линий хорошо окристаллизованного бёмита..
Псевдобёмит обладает весьма развитой поверхностью и содер-
жит 1,3—1,8 моль воды на 1 моль А12О3, что значительно боль-
ше, чем требуется по стехиометрии формулы моногидроксида
АЮОН. По-видимому, избыточная вода в псевдобёмите присут-
ствует не в виде свободных молекул, а связана прочными во-
дородными связями в межслоевом пространстве кристалличе-
ской решетки бёмита [254—256]. Вследствие этого решетка
бёмита расширяется, причем отдельные слои накладываются
друг на друга беспорядочно, что и приводит к смещению и
расширению линий на рентгенограмме.
Поскольку наибольшее практическое значение в промыш-
ленном производстве активного оксида алюминия имеет моно-
гидроксид алюминия в форме бёмита или псевдобёмита, их
свойства рассмотрены ниже подробнее.
При вакуумировании псевдобёмита при комнатной темпера-
туре в отличие от бёмита часть воды может быть удалена без
изменения структуры. Различный характер связи воды в псев-
добёмите и бёмите подтверждается также кривыми обезвожи-
вания этих веществ. Поэтому считают, что псевдобёмит являет-
ся не индивидуальным гидроксидом, а промежуточным продук-
том при превращении аморфного вещества в кристаллический
гидроксид [254]. Модель полимерной молекулы псевдобёмита,
по данным '[257, 258], имеет вид:
н2ох Z°H zH2o
/А\ /А1( /А1( уА1^
H2°Z V V V \н2о.
Формула молекулы псевдобёмита в соответствии с этой мо-
делью может быть представлена в виде AU(OH)ni-Ozz_i-4H2O.
Очевидно, при п—>-оо эта формула аппроксимируется до
АЮОН, т. е. до формулы бёмита. Таким образом, исходя из
данной модели, различие между бёмитом и псевдобёмитом за-
ключается в длине полимерных цепочек (А1ООН)„ или в раз-
мере кристаллитов. Малые размеры кристаллитов псевдобёми-
та обусловливают большую степень их дефектности, что вызы-
вает смешение и расширение линий на рентгенограмме. Про-
120
цесс дегидратации псевдобёмита протекает при более низких
температурах (300—450°C) по сравнению с бёмитом (550°C),
причем температурный интервал дегидратации псевдобёмита
тем ниже, чем мельче размер его кристаллитов.
При термической обработке гидроксида алюминия обра-
зуется широкий набор кристаллографических разновидностей
AI2O3, которые к тому же могут содержать заметные количества
других веществ, например воду, оксиды щелочных или щелоч-
ноземельных металлов.
Известно несколько классификаций оксидов алюминия.
Практически удобно пользоваться классификацией, подразде-
ляющей оксиды алюминия по температуре их получения из
гидроксидов.
Последовательность фазовых превращений различных гид-
роксидов алюминия при их нагревании на воздухе можно пред-
ставить следующей схемой [252, 254, 259]:
250 °C 850—000 °C 1000 'С
Гиббсит -----х-А12О3 -----------> x-AL2O3 -----► а-А12О3,
Гиббсит') 180 °C 450 °C 1000 °C 1000 °C
У ----Бемит ---------► ?-А12О3 -----► 6-А12О3 ------*• а-А12О3,
Байерит J
230 °C 850 °C 1050 °C
Байерит------->- трА12О3 ------►- 0-А12О3 ------► а-А12О3,
450 °C
Бёмит ------у-А12О3
300 °C
Псевдобёмит -----
900 °C 1000 °C
?-А12О3 ------> 6-А12О3 ------> а-А12О3,
450 °с
Диаспор --------► а-А12О3.
Как видно из этой схемы, дегидратация тригидратов — гибб-
сита и байерита — может протекать через моногидрат (бёмит)
или непосредственно приводить к оксиду алюминия. Образова-
ние бёмита при нагревании тригидратов обусловливается гидро-
термальными условиями процесса, которые могут иметь место
в случае крупных кристаллов тригидрата [260, 261]. При даль-
нейшем нагревании бёмит переходит в у-А12О3.
Для приготовления катализаторов наибольший интерес
представляет так называемая группа у-оксидов, включающая
разновидности у-, т|-, д- и %-оксиды алюминия, которые полу-
чаются при прокаливании гидроксида при температурах до
600 °C.
Образующиеся при прокаливании бёмита, псевдобёмита и
байерита,у- и т|-А12О3 по строению близки к,шпинели MgAlO4
(рис. 52) [254]. Установлено, что в элементарной ячейке
у-А120з, образованной в результате плотной кубической упаков-
ки 32 атомов кислорода, по 24 катионным позициям располо-
жено всего 217з атомов алюминия, а решетка шпинели яв-
ляется тетрагонально деформированной. Модификацию т)-А12О3
121
И V
Рис. 52. Идеальная поверхность оксида алюминия шпинельного типа для вы-
сушенного (а) и гидратированного (б) образцов:
/ — поверхностная решетка из кислородных ионов, остающихся после удаления Н2О; // —
нижележащая плоскость — попеременно чередующиеся ионы А13+ (ф) располагаются под.
кислородными ионами поверхностной решетки; III, V/— сечения, перпендикулярные по-
верхности х—х; /V — поверхностный слой ионов ОН-; V — нижележащая плоскость —
ионы А13+ (ф) располагаются непосредственно под ионами ОН- поверхностного слоя
рассматривают как кубическую шпинель, в которой имеет
место тетрагональная деформация, усиливающаяся при повы-
шении содержания в ней воды.
Рентгенографические данные указывают на то, что решетки
у- и т|-А12О3 сильно разупорядочены, и различия между этими
оксидами следует отнести к степени разупорядочения решетки,
зависящей от псевдоморфных соотношений между гидроксида-
ми и оксидами (табл. 47) [254].
Различия в строении кристаллических решеток у- и г]-А120з
настолько малы, что с трудом фиксируются на рентгенограм-
мах. Однако их поверхностно-каталитические свойства весьма
специфичны и поэтому идентификация этих оксидов необходи-
ма. Идентифицируют оксиды на стадии гидроксидов — бёмита
и псевдобёмита для у-А12О3 и байерита для т|-А120з — рентге-
нографически и термоаналитически.
При прокаливании тригидратов алюминия (гиббсита и байе-
рита), характеризующихся небольшой удельной поверхностью
и небольшим объемом пор, до температуры 400—500 °C про-
исходит резкое возрастание удельной поверхности — с 2—5 до
300—500 м2/г. При этом лишь незначительная часть удельной
поверхности приходится на долю пор диаметром более 2,0 нм.
122
Дальнейшее повышение температуры прокаливания (>550°C)
приводит к сокращению удельной поверхности в два раза.
Продукт разложения байерита в интервале температур
250—450 °C т]-А120з обладает высокоразвитой поверхностью
(400—450 м2/г), которая постепенно понижается до 150 м2/г с
увеличением температуры до 800 °C.
Термическое разложение моногидрата алюминия (бёмита)
начинается при температуре 400°C. Удельная поверхность до-
стигает максимального значения 90—100 м2/г при температуре
500 °C. Выше 550 °C микропоры исчезают и удельная поверх-
ность снижается до 15—20 м2/г. Удельная поверхность бёмита
возрастает по мере уменьшения степени кристалличности и уве-
личения температуры предварительной сушки. Однако предва-
рительная дегидратация в процессе сушки приводит к тем
меньшему увеличению удельной поверхности оксида алюминия,
чем менее кристалличным является исходный материал, вплоть
до снижения удельной поверхности у плохо окристаллизован-
ных и гелеобразных бёмитов.
Превращение псевдобёмита в у-А12О3 не сопровождается
значительным изменением удельной поверхности вплоть до
температуры прокаливания 800 °C. Только в интервале 800—
1000 °C, когда начинает удаляться содержащаяся в у-А12О3
избыточная вода, отмечается постепенное снижение удельной
поверхности, причем для образцов разной дисперсности отно-
сительное изменение удельной поверхности одинаково [259].
Выбор у- и т)-А120з в качестве носителя катализаторов гид-
рогенизационной переработки нефтепродуктов обусловлен их
Таблица 47. Псевдоморфные соотношения между некоторыми
гидроксидами алюминия и продуктами их дегидратации
Гидроксид алюминия Оксид алюминия Степень
ось | d, нм ось | d. нм усадки, %
Байер ит —4-AI2O3
а 0,867 [011] 0,558 —3,3
b 0,506 [222] 0,324 —3,9
0,472 [Hl] 0,457 -52*
Бёмит —>- у-АЬОз
а 0,285 [НО] 0,562 —1,2
b 0,369 [001] 0,782 +6,0
с 1,224 [ПО] 0,563 —31*
Гиббсит —>- Х-А12О.,
а 0,864 ь 0,556 —3,5
b 0,506 и 0,964 —4,8
(001) 0,969 с 1,344 -54*
* При расчете и шенения межплоскостного расстояния в направлении, перпендику-
лярном плоскости спайности, учитывалась потеря ОН-групп в процессе дегидратации.
123
высокой термической стабильностью в интервале температур
эксплуатации и регенерации контакта, а также высокой удель-
ной поверхностью (300—400м2/г).
4.2. ПОЛУЧЕНИЕ ГИДРОКСИДА И ОКСИДА
АЛЮМИНИЯ И НОСИТЕЛЕЙ НА ИХ ОСНОВЕ
В настоящее время существуют следующие основные спо-
собы получения гидроксида алюминия: переосаждепие глинозе-
ма, гидролиз алюминийорганических соединений, термическое
диспергирование гиббсита и из металлического алюминия. По-
скольку в промышленной практике получили наибольшее рас-
пространение первые три способа, они рассмотрены ниже бо-
лее подробно.
Переосаждение глинозема с получением гидроксида бёмит-
но-псевдобёмитного и байеритного типов является самым рас-
пространенным в отечественной и зарубежной практике спосо-
бом получения активного оксида алюминия в форме у- и
т)-А12О3.
Возможность получения различных модификаций гидрокси-
да алюминия при переосаждении глинозема следует из диа-
граммы А120з—Н2О [262]. Фазовый состав для равновесной
системы частиц макроскопических размеров гидроксидов алю-
миния определяется диаграммой Р—Г, но для частиц размером
10~6 см наблюдается корреляция между их размером, мор-
фологией и фазовым составом [263]. Регулируя химическим со-
ставом или pH смеси растворов, можно управлять фазовым
составом как гидроксидов, так и оксидов алюминия.
Известно несколько вариантов технологии приготовления
активного оксида алюминия по способу переосаждения [11],
из них основные кислотный (нитратный) и щелочной (алюми-
натный).
При кислотном способе осаждение ведется из кислых раст-
воров солей алюминия (нитрата, сульфата, хлорида) раство-
рами оснований (аммиака, карбоната аммония). Глинозем ра-
створяют в кислоте и осаждают раствором щелочи при темпе-
ратуре 20—25°C и pH 8,0 -8,3:
А1(ОН)3 + 3HNO3 -> A1(NO3)3 + 3H2O,
A1(NO3)3 + 3NH4OH -> A1(OH)3 + 3NH4NO3.
Осадок гидроксида алюминия отфильтровывают, промывают
на фильтр-прессе, формуют в гранулы, которые сушат и про-
каливают. Принципиальная схема получения активного оксида
алюминия по этому варианту приведена ниже:
Раствор соли алюминия —
(нитрат, сульфат, хлорид)
Раствор щелочи
(аммиак, карбонат алюминия) —
Осаждение
---> Промывка
----> Формование -----> Сушка и прокаливание.
124
Кислотный способ получения гидроксида алюминия пред-
почтителен при получении байерита — предшественника т]-А12О3.
Алюминат натрия в качестве сырья для производства т)-А120з
нежелателен, так как в режиме получения байерита (рН>10)
осадок всегда сильно загрязнен примесью натрия (0,2—0,5%
Na2O).
При щелочном (алюминатном) способе осаждение ведется
из щелочных растворов (алюминатов) кислотами (серной, азот-
ной, соляной) или кислыми растворами солей, например суль-
фатом алюминия. Глинозем растворяют в гидроксиде натрия.
Из полученного раствора алюмината натрия гидроксид алюми-
ния осаждают кислотой:
А1(ОН)3 + NaOH ---> NaA102 Ч- 2Н2О,
NaA102 + HNO3 + Н2О ----> А1(ОН)3 + NaNO3.
Сравнение нитратного и алюминатного методов получения
оксида алюминия из одного и того же сырья в одинаковых
условиях (pH 9,2 и температура 50°C) показало сильное влия-
ние природы исходного соединения на свойства получаемого
оксида алюминия [265]. Присутствие примесей катионов нат-
рия и железа в исходном сырье способствует снижению удель-
ной поверхности и механической прочности оксида алюминия.
Существует несколько вариантов щелочных (алюминатных),
способов приготовления оксида алюминия. На некоторых ка-
тализаторных производствах готовят две модификации оксида
алюминия раздельным осаждением при разных температурах.
Затем обе модификации оксида алюминия смешивают и полу-
чают хорошо отмывающийся и фильтрующийся осадок, состоя-
щий из псевдобёмита и бёмита. По такой технологии получают-
ся гранулы активного оксида алюминия высокой механической
прочности с насыпной плотностью 500—600 кг/м3. Принци-
пиальная схема получения активного оксида алюминия из.
алюминатных растворов приведена ниже:
—*- Холодное осаждение —
Раствор серной КИСЛОТЫ —| (20—25 °С, pH 9,3—9,5) _
Раствор алюмината натрия—• —►- Горячее осаждение —
(90—95 °C, pH 9,3—9,5)
---> Периодическое смешение --> Фильтрование --> Промывка --->
(90-95 °C)
---> Формование ---> Сушка и прокаливание.
Получение гидроксида алюминия методом непрерывного од-
нопоточного осаждения из растворов основного сульфата алю-
миния и низкомодульного алюмината натрия позволяет полу-
чать оксид алюминия, повышающий активность катализаторов
гидрогенизационных процессов [266] Однако в промышленных
условиях эта технология до конца нс отработана, хотя имеются
реальные предпосылки для получения указанным способом
активного оксида алюминия высокого качества [267].
125
Таблица 48. Сравнительная характеристика активного оксида алюминия,
полученного различными способами переосаждения гиббсита
Реагент Условия процесса Характеристика активного оксида алюминия Источник информации
Нитратный способ
Сульфат алюминия, раствор аммиака pH 3—10 Зуд=200—300 м2/г, Упор=0,65—0,85 см3/г Пат. США 3919403, 1975
Хлорид алюминия, гидрок- сид аммония 38—42 °C гСр= 10—12 нм, 5УД=350—550 м2/г Пат. США 4018881, 1975
Соль алюминия, алюминат щелочного металла pH 7-8, 60—82 °C Зуд= 180—250 м2/г Пат. Франции 2405899, 1979
Сульфат алюминия, алюми- pH 5—12, 72—135 °C 5уд=200—320 м2/г Пат. Англии 1352921, 1974
нат аммония или натрия Алюминат ный способ
Алюминат натрия, азотная кислота pH 8,5; 0,1 моль HNO3 на 1 моль А120з 3Уд=250—400 м2/г, гСр=12—50 нм Пат. ФРГ 1542386, 1975 г.; Пат. Франции 2090258, 1972, 2283863, 1976 г.; Пат. Японии 52-13800, 1977 г.
Пат. Англии 1323257, 1973 г.
30—75 °C, 10—300 мин, pH 8,0; 5уд=200—300 м2/г, упор =
Al2O3/Na2O=0,7—0,9 =0,5 см3/г, гсР=12—60 нм
То же
Алюминат натрия или ам-
мония, дикарбоновая кис-
лота
1 моль кислоты на 2 моль ам-
миака
Пат. США 4102818, 1978 г.
Карбонизация алюминатных растворов
Алюминат натрия, бикар-
бонат натрия или СО2
75 г/л NaHCO3
5Уд = 320 м2/г, 0,3% Na2O
А. с. СССР 132622, 1960 г.;
Пат. США 4157382, 1978 г.
4036931, 1977 г.
Нитрат алюминия, бикар-
бонат натрия
pH 4,0—7,5, 20 °C
Заявка Японии 67-80806,
1974 г.
Соль алюминия, карбонат
или бикарбонат щелочного
металла
20—25 °C
А. с. СССР 852798, 1981 г.
Обработка органическим соединением
Алюминат натрия, этилен-
хлоргидрин
10—50 °C, 5—10 ч
Упор=2—6 см3/г, 3Уд=200—
500 м2/г
Пат. Японии 48-38774, 1973 г.
Хлорид алюминия, этилен-
оксид
Ут = 50—200 кг/м3, Зуд = 375—
580 м2/г
Пат. США 3961036, 1976 г.
ho
Одним из вариантов щелочного способа получения оксида
алюминия является карбонизация алюминатных растворов.
Ниже представлена схема получения активного оксида алюми-
ния из алюминатных растворов глиноземного производства по
варианту, разработанному ИНХС АН СССР:
Раствор алюмината натрия —
глиноземного производства
после удаления кремнезема —* Карбонизация (осаждение; ->
35—40 °C, pH 9—10)
Дымовые газы —
(источник СОг)
----------> Фильтрование --> Промывка ---►
-----------------------------------------> Формование -> Сушка и прокаливание.
При выборе способа производства активного оксида алюми-
ния помимо требований к качеству получаемого продукта (со-
держание примесей, гранулометрический состав, насыпная
плотность, механическая прочность) необходимо обеспечить
ряд технологических требований производства — быструю и
полную отмывку осадка гидроксида алюминия на фильтре,
хорошую фильтруемость, удовлетворительное отстаивание сус-
пензии.
Хара ктер и ст и к а а кт ивного оксида алюминия, полученного
различными способами переосаждения, приведена ниже [264]:
Осаждение из Осаждение из
кислых раство- алюминатных
ров солей растворов
Химический состав, %:
AI2O3 99,0 99,9
Na2O 0,10 0,03-0,12
Fe2O3 . . 0,03 0,03—0,05
Насыпная плотность, кг/м3 600—660 500—650
Удельная поверхность, м2/г 200 180-200
•Объем пор, см3Д 0,40—0,50 0,40—0,45
Радиус пор, нм 4,5 4,0
Получение активного оксида алюминия методом переосаж-
дения глинозема широко используется зарубежными фирмами,
причем исходные реагенты и условия процесса варьируются.
Из данных, представленных в табл. 48, следует, что в алюми-
натных способах в качестве осаждающего реагента часто ис-
пользуют азотную кислоту. В кислотном способе получения
гидроксида алюминия исходным реагентом в большинстве слу-
чаев служит сульфат алюминия, а осаждение ведут гидрокси-
дом аммония.
Оксид алюминия с высокой пористостью (2—4 см3/г)
и удельной поверхностью (200—500 м2/г) может быть получен,
если осаждение гидроксида алюминия проводить при темпера-
туре 50°C из раствора алюмината натрия галогеногидринами,
например этилен- и пропиленхлоргидрином или моно- и дихлор-
гидринглицеринами. Для получения оксида алюминия высокой
чистоты гидроксид алюминия осаждают из хлорида или суль-
128
Таблица 49. Изменение свойств гидроксида алюминия, находящегося
в контакте с раствором аммиака (pH 9, t = 30°C)
Длитель- ность кон- такта, ч Содержание в А12Оз, г/100 г м^/г Структура по рентгено- грамме
н2о SiO2
0 81,3 23,2 1 12 Аморфная
1 40,2 13,1 Гелеобразный бёмит
44 27,8 4,0 201 То же
166 26,7 3,5 230 То же
290 26,2 3,0 242 То же + некоторое коли- чество байерита
430 32,7 2,1 192 То же-|-байерит
850 48,6 0,8 75 Почти чистый байерит
1400 51,4 0,3 34 Байерит
фата алюминия низшими алифатическими эпоксисоединениями,
например этилен- или про.пиленоксидом.
При получении активного оксида алюминия как носителя
катализаторов существенную роль играет процесс созревания
или старения гелей гидроксида алюминия (табл. 49). Старение
гелей протекает при отмывке их от примесей натрия, железа,
сульфат-ионов, при хранении в виде лепешки и может продол-
жаться от нескольких часов до нескольких суток и даже меся-
цев. Для удаления примесей сульфат-ионов и катионов натрия
суспензию гидроксида алюминия промывают, как правило, во-
дой с низким содержанием примесей или химически очищенной
водой (10—20 об. <i. воды на 1 об. ч. суспензии концентрацией
200—400 г А12О3 на 1 л). Для более глубокого удаления при-
месей из гидроксида алюминия, кроме промывки водой, реко-
мендуют проводить дополнительную обработку раствором ам-
миака [Пат. Японии 53-28392; А. с. 132622]. Для уменьшения
содержания катионов натрия до 0,005% и менее рекомендуют
предварительно промытую суспензию гидроксида алюминия на-
гревать при 190—210 °C под давлением диоксида углерода 1 —
2 МПа [Заявка Японии 67-80806]. В результате такой обра-
ботки натрий удаляется в виде бикарбоната. Обработанная
суспензия гидроксида алюминия после охлаждения до 20—
25 °C фильтруется и промывается водой до практически пол-
ного удаления катионов натрия.
При старении аморфного гидроксида алюминия происходит
его кристаллизация с образованием смеси модификаций гидр-
оксидов [268], бёмит через метастабильиую фазу байерита пе-
реходит в гидраргиллит [269]. Авторы работы [270] пришли
к выводу, что аморфный гель гидроксида состоит из полимер-
ных частиц двух видов: один кристаллизуется в байерит, дру-
гой— в псевдобёмит. Последний в ходе старения превращает-
ся в хорошо окристаллизованную модификацию, что сопровож-
дается снижением содержания стехиометрической воды до
9—922
129
1 моль на 1 моль А12О3, некоторым уменьшением удельной,
поверхности А12О3 и частичным удалением сульфат-ионов из
фибрилл гелеобразного бёмита [254].
Скорость и направление старения гидроксида алюминия за-
висят от исходной его модификации и условий процесса: тем-
пературы, pH, состава среды, влажности и ряда других фак-
торов. Продолжительность старения определяет размер кри-
сталлов и пористую структуру гидроксида и оксида алюминия.
Обнаружено, что процесс кристаллизации гидроксида алюми-
ния в изотермических условиях состоит из распада первичных
кристаллитов и агломерации, протекающих одновременно [271].
Таким образом, варьируя исходные реагенты, условия осаж-
дения и последующей дополнительной обработки, можно полу-
чать оксид алюминия с заданными свойствами. Однако в целом
технология получения активного оксида алюминия методом
переосаждения характеризуется большой металло- и энергоем-
костью, низкой производительностью, большим объемом сточ-
ных вод. Качество получаемого при этом активного оксида
алюминия уже не отвечает возросшим требованиям к носите-
лям катализаторов по содержанию в них примесей (особенно
Na2O и сульфат-ионов), удельной поверхности и пористой
структуре. Рекомендации ио улучшению указанных показате-
лей, предложенные в патентах, вряд ли могут быть реализо-
ваны в промышленных условиях, так как они усложняют тех-
нологию, требуют применения специальной аппаратуры, рабо-
тающей под давлением, или органических растворителей, что
приводит к появлению дополнительного количества сточных
вод и промышленных отходов.
Гидролиз алюминийорганических соединений. Активный ок-
сид алюминия высокой чистоты с большой удельной поверх-
ностью может быть получен гидролизом алюминийорганических
соединений. В основе способа лежит реакция алюминийоргани-
ческих соединений и их комплексов с водой в присутствии
алифатических, алициклических или ароматических углеводо-
родов либо без них с образованием тонкодисперсной суспензии
гидроксида алюминия. Например, согласно работам [Заявка
США 279508; пат. США 2682246], гидроксид алюминия полу-
чают гидролизом алкоголятов алюминия, содержащих С2—С2&
на каждую группу спиртового остатка, с образованием суспен-
зии, содержащей! до 32% оксида алюминия. Водную фазу от-
деляют от органических продуктов, обрабатывают органиче-
ским растворителем (например, алифатическим спиртом Ci—С4
или ацетоном) с последующей термической обработкой. Полу-
ченный оксид алюминия имеет удельную поверхность от 250—
300 до 400—500 м2/г, объем пор от 0,6—1,1 до 2—2,5 см3/г
и насыпную плотность от 120—160 до 320—560 кг/м3; он сво-
боден от примесей натрия, железа и серы.
Фирма «Union Carbide» предлагает готовить активный оксид
алюминия с использованием двух несмешивающихся фаз: воды
130
и раствора алкоголята алюминия в алифатическом спирте
Ci—С24 [Пат. США 4202870]. Реакционную смесь нагревают
до температуры образования азеотропной смеси воды со спир-
том при атмосферном давлении и снизу вверх барботируют
водяной пар. Из нижней части реактора непрерывно отводят
водную суспензию гидратированного оксида алюминия. Сырьем
Для получения активного оксида алюминия по такой техноло-
гии являются алкоголяты алюминия, получающиеся в качестве
побочного продукта в процессе Циглера.
Для получения оксида алюминия с большой удельной по-
верхностью гидролиз алкоголятов алюминия рекомендуется про-
водить в водном растворе, содержащем 8—20% соединения,
от которого при термической обработке отщепляется NH3 и/или
СО2, например, карбонат аммония или мочевину в количестве
5—30% от алкоголята алюминия при температуре 40—90°C
[Пат. ФРГ 2556804]. С целью снижения насыпной плотности
оксида алюминия гидролиз можно проводить контактированием
алкоголята алюминия с водой, содержащей более 0,6% ионов
лития [Пат. США 4177251].
Фирма «Sumitomo Chemical» [Пат. Японии 48-13793,
52-10800] предлагает двухстадийную технологию получения
гидроксида алюминия гидролизом алкилалюминиевых соедине-
ний. Вначале соединения общей формулы AIRR'R" (где R = H,
алкил Ci—С6 или алкоксил; R' и Т^'-алкил) взаимодействуют
с простым эфиром с образованием комплекса, затем протекает
неполный гидролиз комплекса в присутствии инертного раство-
рителя при температуре 150 °C и перемешивании до взаимо-
действия 0,8 моль воды с 1 моль комплекса без выделения
гидроксида алюминия. Во второй стадии проводят полный
гидролиз при повышенной температуре при расходе 2—10 моль
воды на 1 моль исходного алюминийорганического соединения.
Чистый коллоидный раствор моногидрата алюминия полу-
чают взаимодействием 1 моль алкоголята алюминия с 8 моль
воды в присутствии 0,03—0,25 моль кислоты, например азот-
ной, соляной, уксусной, с последующим нагреванием раствора
при температуре >80 °C [Пат. Англии 1931304].
Таким образом, гидролизом алюминийорганических соедине-
ний можно получать активный оксид алюминия высокой чисто-
ты, большой удельной поверхности и высокой пористости. Ука-
занный способ осуществлен в промышленности некоторыми за-
рубежными фирмами. Недостатками этого способа являются
специфичность исходного сырья (алюмнпиноргаппческие соеди-
нения), необходимость применения органических веществ, а сле-
довательно, специального оборудования, а также наличие зна-
чительных объемов сточных вод.
Термическое диспергирование гиббсита. В последнее десяти-
летие интенсивно и успешно разрабатывается технология полу-
чения активного оксида алюминия методом термического дис-
пергирования трпгидрата глинозема — гиббсита. Это связано
9'
131
прежде всего с тем, что в отличие от способа получения актив-
ного оксида алюминия переосаждепием при термическом дис-
пергировании практически отсутствуют малопроизводительные
и трудоемкие «мокрые» операции, что делает процесс практи-
чески бессточным и высокоэффективным. Ниже рассмотрена
схема получения активного оксида алюминия способом терми-
ческого диспергирования гиббсита по технологии, разработан-
ной совместно Институтом катализа СО АН СССР и ВНИИ НП
([272].
Физико-химическая сущность процесса термического дис-
пергирования тригидрата глинозема состоит в одновременно
идущих процессах разупорядочения кристаллической структуры,
дегидратации и диспергирования за счет большой скорости
нагрева частиц гиббсита. Продуктом термического диспергиро-
вания гиббсита является аморфизованная р-А12О3 с качествен-
но новыми свойствами. В частности, она способна к набуханию
в воде с образованием гидратированных осадков оксида алю-
миния, обладает пластичностью и формуется в гранулы. Режим
процесса термического диспергирования можно подобрать та-
ким, что получаемый затем активный оксид алюминия по хими-
ческому и рентгенографическому составу практически не от-
личается от оксида алюминия, приготовленного переосажде-
нием глинозема.
Технология получения активного оксида алюминия терми-
ческим диспергированием и на ее основе катализаторов нефте-
переработки выгодно отличается от существующей технологии
переосаждения, так как не расходуются кислота и щелочь,
резко сокращаются сточные воды, уменьшается число стадий
процесса. Принципиальная схема получения активного оксида
алюминия термическим диспергированием гиббсита приведена
ниже:
Подготовка сырья -->- Термическое диспергирование ->
(размол, сушка) (450—500 °C)
---> Гидратация продукта --> Промывка гидратированного
(70-80 °C, рн 7,0—9,5)
продукта от примесей---> Пластификация азотной кислотой ->
(115—135 е С, 5—8 ч, расход HNO3
0,1—0,2 моль)
---> Формование гранул ---> Сушка, прокаливание.
Основную операцию — термическое диспергирование прово-
дят в каталитических генераторах тепла в псевдоожиженном
слое твердого катализатора. При сгорании газообразного (про-
пан— бутан, газ пиролиза) или жидкого топлива температура
в слое катализатора достигает 450—500 °C и при контакте ча-
стиц гиббсита с нагретым катализатором происходит образо-
вание аморфизованного р-А120з.
Условия осуществления процесса термического диспергиро-
вания, предлагаемые в патентах, весьма различны. Температу-
132
ра варьируется от 350 до 1000 °C, время пребывания гиббсита
в зоне реакции от одного до нескольких часов. Существуют и
различные варианты создания высокотемпературной зоны. На-
пример, предлагается проводить импульсный нагрев в зоне вы-
сокотурбулентного потока газа с температурной на входе в зону
500—1200 °C, движущегося со скоростью 30—150 м/с [Пат.
Англии 1352921]. Для этого используют конический реактор,
в узкий конец которого тангенциально вводится горячий газ,
проходящий через реактор по спирали. При этом часть газа
образует в осевом направлении обратный поток, в который
подают гиббсит. По другому способу [Пат. Англии 1419439]
предлагается вдувать тонкоизмельченный тригидрат оксида
алюминия или алюмоаммонийные квасцы вместе с воздухом
непосредственно в камеру сгорания, в которой температура
пламени достигает 1200—1800 °C. Ниже представлены условия
термического диспергирования согласно патентным данным:
Температура, °C Время контакта Источник информации
350—800 1 С Пат. ФРГ 2059946, 1972; 2227804, 1974
450—600 5-30 с А. с. СССР 477113, 1975
350—600 0,05-0,5 с То же
400—600 10 с Пат. Японии 50-21319, 1975
500—1000 1-10 с Пат. Японии 54-75489, 1979; 55-25132, 1980
Нагрев при интенсивной Пат. Англии 1388451, 1974
циркуляции воздуха Заявка США 737304, 1977
420—480 3 ч
200—800 2-17 ч Пат. США 4177105, 1978
1200—1800 — Пат. Англии 1419439, 1975
Быстрое — Заявка Франции 2359791, 1979
нагревание
Имеются различные варианты технологического оформления
и следующей стадии процесса — гидратации продукта термо-
диспергирования. По способу, запатентованному японской фир-
мой [Пат. Японии 50-21319, 55-25132], к прокаленной массе
добавляют воду и получают оксид алюминия переходного со-
става размером частиц 1—20 мк. Смесь формуют и выдержи-
вают в токе водяного пара или влажного инертного газа при
температуре 50—150 °C до полной гидратации.
Фирма «Bayer» рекомендует продукт термического диспер-
гирования измельчать, формовать с добавкой воды и выдержи-
вать гранулы во влажном состоянии в течение 10 ч. По другому
варианту технологии [Пат. Японии 48-137934] водный шлам
продукта термического диспергирования подвергают обработке
в автоклаве при температуре 140 200’43 в течение 0,5—6 ч.
При этом происходит кристаллизация и получается шлам бё-
мита с коллоидным размером частиц.
Вместо воды для обработки продукта термического диспер-
гирования предлагают использовать гептан при температуре
270°С в автоклаве в течение 0,5—10 ч [Пат. США 4177251].
Гидратированный продукт термического диспергирования пла-
133
стифицируют, формуют, сушат и активируют при температуре
300—600°C {Заявка США 737304; Пат. Англии 1419439]. Полу-
ченный термическим диспергированием активный оксид алюми-
ния отличается высокой механической прочностью и устойчи-
востью к истиранию, высокой удельной поверхностью (выше
200 м2/г) и пригоден для приготовления катализаторов гидро-
очистки нефтепродуктов, равноценных или превосходящих по
активности аналогичные катализаторы на основе оксида алю-
миния, полученного методом переосаждения.
4.3. ФОРМОВАНИЕ ОКСИДА АЛЮМИНИЯ
Эффективность катализаторов гидроочистки нефтепродуктов
в значительной мере зависит от формы и размера гранул.
На стадии формования закладывается и такой показатель ка-
чества катализаторов, как механическая прочность. Способы
формования катализаторов и активного оксида алюминия ана-
логичны. Цилиндрические гранулы получают методом экструзии
на шнек-прессах или таблетированием; сферические гранулы
получают углеводородно-аммиачным способом, механической
вибрацией или распылительной сушкой (микросфера) [273].
В последние годы наметилась тенденция формования оксида
алюминия в гранулы иной формы — кольца, полые цилиндры,
экструдаты со сложным поперечным сечением. Наиболее рас-
пространенным способом формования активного оксида алюми-
ния и катализаторов на его основе является экструдирование
на шнек-прессах.
Перед формованием экструзией отжатый на фильтр-прессе
осадок гидроксида алюминия обрабатывают водой или слабым
раствором кислоты для придания массе пластичности. В ре-
зультате такой обработки образуются основные соли алюминия,
которые не только увеличивают пластичность массы и ее фор-
муемость [262, 274, 275], но и играют роль связующего, обес-
печивая достаточную механическую прочность экструдатов.
Обычно в практике для пептизации гидроксида алюминия ис-
пользуют азотную кислоту (0,10—0,15 моль на 1 моль А12О3).
Иногда для пептизации используют водный раствор аммиака
или вводят добавки поверхностно-активных веществ (табл. 50).
В качестве связующего при формовании можно использовать
гель псевдобёмита и водные растворы нитрата или хлорида
алюминия [Заявка Японии 56-35931]. В качестве веществ, об-
легчающих формование оксида алюминия, применяют неорга-
нические (MgO, СаО) или органические (гуммиарабик, крах-
мал, желатин, метилцеллюлоза) добавки [Пат. ПНР 84506].
Условия формования и предварительного смешения оказывают
большое влияние на твердость и стойкость к истиранию окси-
да алюминия [277]. Кроме экструзии широко распространен
способ формования оксида алюминия в виде шариков и микро-
сферы (табл. 51).
134
Таблица 50. Условия формования оксида алюминия экструзией
Состав массы Способ обработки Источник информации
Моногидрат оксида алю- миния Пептизация кислотой с Пат. США 3917808, добавлением воды 1975 г., 3975509, 1976; Пат. ФРГ 2349773, 1978 г.
Гидрогель оксида алю- миния Пептизация моно- или Пат. США 4145316, поликарбоновой кисло- 1979 г.
Порошок оксида алю- миния Добавление гелеобраз- Заявка Японии 56-35931, ного бёмита и водных 1981 г. растворов нитрата или хлорида алюминия
Суспензия, содержащая 47—100% А120з Бёмит и байерит Добавление воды (40— Пат. ФРГ 2237861, 125 г на 50 г А12О3) 1977 г. Пептизация азотной кис- А. с. СССР, 384538 лотой с добавкой воды
Гидроксид алюминия с ПАВ (1 мл/л обрабаты- ваемой массы) Гидроксид алюминия с ПАВ Гидроксид алюминия с целлюлозой Оксид и гидроксид алю- миния Гидроксид алюминия Пептизация минеральной [276] кислотой Пептизация кислотой Пат. ФРГ 2511967, 1978 г. Обработка водой Заявка США 811341, 1977 г. Обработка водой Пат. Англии 1295133, 1972 г. Обработка водой, со- Пат. Англии 1404017, держащей до 5% кисло- 1975 г. ты (минеральной или Ci—Сз алифатической)
Гидроксид алюминия (влажность 72%) Гидроксид алюминия, соляная кислота и рас- твор гидроксида алю- миния Обработка борной кисло- А. с. СССР, 474505, той Добавление водного рас- Заявка Японии 52-40487, твора аммиака или рас- 1977 г. твора NH4OH и алю- минийаммопийных квас- цов
Смесь гиббсита, байери- та и микрокристалличе- ского бёмита Смесь 30—80 г гиббсита, 20—40 г бёмита, 0—50 г микрокристаллического бёмита Обработка одноосновной Пат. США 2488351, органической кислотой 1972 г. Пептизация кислотой, Пат. США 4102938, например пропионовой, 1978 г. с добавлением воды (80—120 г на 100 г сме- си)
Сущность процесса формования шарикового оксида алюми-
ния углеводородно-аммиачным способом заключается в быст-
ром затвердевании массы, содержащей соединение алюминия,
при контакте с водным раствором аммиака. Часто в качестве
исходного сырья берут раствор основного оксихлорида алюми-
ния. Этот раствор, в который можно добавлять гидроксид алю-
миния, вводят в колонну, заполненную в верхней части жид-
ким углеводородом (например, керосином), а в нижней части —
135
Таблица 51. Условия формования оксида алюминия
в виде шариков и микросферы
Состав массы Способ формования Источник информации
Соединения алюминия с Диспергирование в масло Пат. Англии 1269273,
муравьиной кислотой в растворе при 65—200 °C 1972 г.
Золь алюминия с добав- Диспергирование в мае- Пат Франции 2109250,
кой гексаметилентетр- амина л о при 50—100 °C 1972 г.
Гидрозоль алюминия в Распыление гидрозоля в Пат Японии 47-8447,
гидрозоле диоксида кремния масло 1972 г
Гидрозоль алюминия кис- Диспергирование по кап- Пат. США 4216122,
лый (с галогеном) и гексаметилентетрамин лям в масло при 50— 105 °C 1980 г.
Золь соли алюминия и Введение золя по кап- Пат. ФРГ 1592166,
полимера типа полиса- харида лям в масло при 50— 90 °C • 1973 г.
Гидрогель оксида алю- Диспергирование смеси в 1 Пат. США 3968285,
миния и ненасыщенный мономер нагретое масло 1976 г.
Оксихлорид алюминия Диспергирование в ке- росин, затем в раствор аммиака А. с. СССР 136335, 1965 г.
Оксихлорид алюминия и Диспергирование в мас- • Пат. Франции 2399276,
уротропин ло при 90 °C 1979 г.
Суспензия оксида алю- Диспергирование в на- • Пат. ФРГ 2592098,
миния гретое масло, содержа- щее коагулянты • 1973 г.
То же Диспергирование в мас- ло при 50—100 °C Пат. США 553170, 1966 г.
Гидроксид алюминия Распыление воздухом [278] или другим газом, не взаимодействующим с массой, над слоем жид- кого углеводорода
Гидроксид алюминия и Диспергирование смеси : Пат. США 3943070,
слабое основание в горячее масло 1976 г.
Суспензия гидроксида Распыление воздухом при 1 А. с. СССР 176273,
алюминия, содержащая 6% сухого вещества 200 °C 1965 г.
Основной ацетат или ос- Диспергирование в рас- Пат. Японии 50-89682,
новной сульфат алюми- ния И Н3РО4 творитель, не смешиваю- щийся с водой при 50— 100 °C • 1975 г.
водным раствором аммиака. Капли оксихлорида алюминия,
проходя через керосин, под действием сил поверхностного на-
тяжения, приобретают шаровидную форму и при контакте с
водным аммиаком затвердевают.
Для получения сферических частиц модификации трАЬОз
кислый гидрозоль АЬОз (гидрозоль хлорида алюминия, содер-
жащий 0,9—1,5 масс. ч. алюминия на 1 масс.ч. ионов хлора)
смешивают при температуре ниже температуры гелеобразова-
136
ния и отношении Cl NH3=1,5—2,5:1 с источником аммиака
(при повышении температуры выделяется NH3), затем смесь
диспергируют в горячую масляную баню [Пат. США 3887493].
В другом способе [Пат. США 3968285] предусматривается
использование гексаметилентетрамина, обладающего буферным
действием и способным к термической деструкции при повышен-
ной температуре.
Сферические частицы, образующиеся при диспергировании
смеси, подвергают старению вначале в масле, а затем в вод-
ном растворе аммиака в две стадии: в течение 2 ч при 50—
100 °C с концентрацией NH3«0,l% и в течение 8 ч при 50—
100°C с концентрацией NH3 до 1,5%.
В варианте технологии получения шарикового оксида алю-
миния фирмы «Labofina» водную суспензию, содержащую гид-
рогель оксида алюминия и водорастворимый ненасыщенный
мономер (акриламида, акриловой кислоты, акрилонитрила)
в количестве 0,25—20%, диспергируют в нагретое до 50 -100°C
масло. При этом мономер полимеризуется и образуются сфе-
рические гранулы, содержащие гидрогель оксида алюминия и
полимерное связующее |[Пат. Бельгии 695533]. Предложен спо-
соб получения шарикового оксида алюминия виброобработкой
(частота до 105 Гц) увлажненной массы оксида или гидроксида
алюминия в несмешивающейся с водой жидкости. Получаемый
таким способом активный оксид алюминия после сушки и про-
каливания имеет широкопористую структуру и высокую стой-
кость к истиранию.
В СССР разработан способ получения микросферического
оксида алюминия распылительной сушкой суспензии гидрокси-
да алюминия [А. с. 176273]. Распыление суспензии, содержащей
6% сухого вещества, проводят в прямоточном пневматическом
распылителе при температуре дымовых газов 550 °C с подачей
Таблица 52. Механические способы формования гидроксида алюминия
Состав массы Условия формования Источник информации
Гидроксид алюминия,
кислота и вода
Механическая вибрация
(частота до Ю5 Гц) в
жидкости, не смешива-
ющейся с водой
То же
Обработка водой,
шивание
Формование экструзией,
фракционирование и за-
мешивание
Пат. Франции 1223306,
1974 г
Гидроксид алюминия и
вода
Порошок AI2O3 (80%
менее 0,04 мм, 20% бо-
лее 0,04 мм)
Оксид или дроксид
алюминия и «ль или
золь алюминия
Заявка Франции
7310899, 1973 г.
Заявка ФРГ 227804,
1974 г
Заявка ФРГ 2935914,
1981 г.
137
воздуха в количестве 0,23 кг/кг суспензии. Получают микросфе-
рический оксид алюминия с преимущественным размером ча-
стиц 50—400 мк.
Некоторые фирмы предлагают механические способы фор-
мования гидроксида алюминия (табл. 52).
4.4. ТЕРМИЧЕСКАЯ ОБРАБОТКА ГИДРОКСИДА
АЛЮМИНИЯ
Заключительной операцией приготовления носителя являет-
ся термическая обработка сформованного гидроксида алюми-
ния, в процессе которой происходят те или иные превращения
с одновременным изменением свойств поверхности, пористой
структуры и, следовательно, адсорбционных и каталитических
свойств. Для получения продукта с заданными свойствами не-
обходимо правильно выбрать режим термической обработки с
учетом исходной модификации гидроксида алюминия и атмо-
сферы прокаливания, что позволит регулировать направление
и скорость процессов обезвоживания, кристаллизации и спека-
ния гидроксида.
На практике активный оксид алюминия получают из гидро-
ксида алюминия типа бёмита или байерита при прокаливании
до 800 °C. Наибольшей термической стабильностью обладает
активный оксид алюминия, полученный из бёмита, и его мож-
но использовать при приготовлении катализаторов для процес-
сов, протекающих при температуре выше 400 °C. Термическая
обработка включает, как правило, две операции: сушку при
температуре 100—120 °C и прокаливание при 600—800 °C
(табл. 53).
Для придании оксиду алюминия специфических свойств пе-
ред прокаливанием его дополнительно обрабатывают различ-
ными реагентами. Так, для получения оксида алюминия низкой
плотности, высокой пористости и большой удельной поверх-
ности сушку водной суспензии, содержащей до 32% оксида
алюминия, рекомендуют проводить парами спиртов Ci—С8 до
содержания оксида алюминия 50%, а затем перегретым вод-
ным паром [Пат. ФРГ 2255463]. Предложен способ обработки
сухого геля оксида алюминия в автоклаве в присутствии 0,5—
2,0%-го водного аммиака при температуре 150—250 °C в тече-
ние 2—12 ч с последующей сушкой и прокаливанием [Пат.
СРР 66902]. По технологии [Пат. Англии 1422451] термиче-
ская обработка включает следующие операции: сушку экстру-
датов оксида алюминия при 60—120 °C в течение 8 ч, гидро-
термальную обработку в автоклаве при температуре 170 °C
и давлении 0,6 МПа в течение 4 ч, прокаливание при 600 °C
в течение 2 ч.
В процессе прокаливания оксида алюминия происходит
уменьшение ее удельной поверхности, сопровождающееся ис-
чезновением тонких пор и увеличением не только относитель-
на
Таблица 53. Способы термической обработки гидроксида алюминия
Условия обработки Атмосфера прокаливания Характеристика продукта Источник информации
Нагрев со скоростью 12— 80 °С/мин Вакуум Увеличение 5УД на 30% по от- ношению к исходной Пат. Франции 2134118, 1973 г.
Обработка в автоклаве 1 —12 ч при 150—250 °C Воздух 5уд = 250 м2/г, КПроч = 1,2 кг/мм Пат. СРР 66902, 1971 г.
Нагрев при 175 °C Смесь газов: воздух, N2, Аг, Н2 5уд = 270—400 м2/г, с11ор = 1,0— 2,7 см3/г Пат. США 3907982, 1973 г.
Нагрев 3 ч при 480 °C Перегретый водяной пар 5уД = 300 м2/г, уп = 200— 400 кг/м3, иПОр =1,8—2,0 см3/г Пат. ФРГ 2255463, 1976 г.
Нагрев при 260 °C Смесь газов: N2, Нс, Н2, СО 5уд = 270—400 м2/г, с'пор = 1,0— 2,7 см3/г Пат. США 3979504, 1976 г.
Нагрев 6 ч при 600 СС В токе сухого воздуха 5уд = 310 м2/г [279]
Нагрев в две стадии: 1 ч при 550 °C, 2 ч при 700 °C Влажный воздух (30% во- ды) Высокая термостабильность Заявка Японии 52-20117, 1977 г.
Гидротермальная обработка в автоклаве при 170 °C и 0,6 МПа, затем при 600 °C в течение 2 ч Воздух Sv;i=150 м2/г, у;1 = 400— 800 кг/м3, иПОр = 0,4—1,0 см3/г, Кпроч=1,0—1,2 кг/мм Пат. США 4224302, 1980 г.
кого, но и абсолютного числа крупных пор [280]. Уменьшение
поверхности активного оксида алюминия происходит значи-
тельно быстрее, чем сокращение объема пор: при 1200 °C объ-
ем пор уменьшается приблизительно в два раза, а удельная
поверхность — в 60 раз.
При прокаливании в вакууме при температуре до 800 °C
поверхность оксида алюминия не изменяется; при более высо-
ких температурах уменьшается [281]. Поэтому прокаливание
в вакууме (13,3—26,6 кПа) со скоростью нагрева 10—80°С/мин
рекомендуют для получения активного оксида алюминия с вы-
сокой удельной поверхностью. На практике прокаливание окси-
да алюминия проводят в атмосфере воздуха или дымовых га-
зов. Предлагают также использовать инертный газ с содержа-
нием 1—2% (об.) СО2 [Пат. США 3907982].
Для повышения термической стабильности А12О3 рекомен-
дуют прокаливать сушеный оксид алюминия в атмосфере
воздуха, содержащего более 30% (мол.) водяного пара
{Заявка Японии 52-20117; Пат. США 3979504]. В результате
такой обработки получается активный оксид алюминия плот-
ностью 350 кг/м3, объемом пор 1,4 см3/г и размером пор 30—
36 нм; термостабильность его в 2 и более раза выше, чем окси-
да алюминия, полученного в атмосфере сухого воздуха.
4.5. РЕГУЛИРОВАНИЕ ПОРИСТОЙ СТРУКТУРЫ
АКТИВНОГО ОКСИДА АЛЮМИНИЯ
Свойства активного оксида алюминия как носителя катали-
заторов определяются такими характеристиками, как удель-
ная поверхность, размер и объем пор, распределение пор по
радиусам. Пористая структура носителя существенно влияет
на дисперсность и распределение активных компонентов по по-
верхности, на селективность и объемную активность катализа-
торов, обусловленные процессами транспорта реагентов внутри
гранул, а также на процесс коксообразования и распределе-
ния кокса на катализаторе. Экспериментально доказано, что
гидрообессеривающая активность алюмокобальтмолибденового
катализатора повышается, если его структура является бидис-
персной, за счет более высокой степени использования внутрен-
ней поверхности зерна и улучшения условий массообмена.
Пористая структура неформованного оксида алюминия опре-
деляется степенью кристаллизации гидроксида алюминия, ко-
торая зависит от температуры, величины pH осаждения, ско-
рости отмывки и других технологических параметров
[А. с. 352839]. Кроме того, большое влияние на пористую
структуру оксида алюминия оказывают условия формования
гидроксида алюминия [252].
Для получения оксида алюминия с контролируемым раз-
мером пор рекомендуют на стадии осаждения использовать
различные органические добавки. В частности, предлагают
140
Таблица 54. Способы регулирования пористой структуры активного
оксида алюминия
Агент и способ обработки 5уд* М2/Г г'поР’ см3/г Источник информации
Ацетон, алифатические спир- 200—300 0,7- 1,3 Пат. США 3846540, 1971 г. ты Ci—С4 Ацетон, алифатические спир- 250—400 1,0—2,7 Пат. Франции 2168318, ты Ci—Се 1973 г. ПАВ (1—5%) 150-250 — Пат. США 4066740, 1978 г. Триэтиленгликоль 260 0,7—1,1 [278] Обработка 25%-м водным 300 0,6—0,8 Пат. Бельгии 695533, аммиаком 6—12 ч 1979 г. Смешение с 5—30% волок- 250 0,5 Пат. США 2139026, 1972 г. нистого органического ма- териала Смешение гидрогеля алюми- 210 0,7—1,0 Пат. США 4169874, 1979 г. ния с 1—25% органиче- ского наполнителя (целлю- лоза, крахмал, древесная мука) Обработка многоатомным 200—300 0,8—1,1 Пат. Японии 54-43056, спиртом (пропиленгликоль, 1979 г. глицерин) Разложение сульфата алю- 350 — Пат. Японии 54-24298, миния в горячем водном 1979 г. 40%-м растворе уксусной кислоты
вводить в реакционную смесь мочевину или тиомочевину [За-
явка США 2172286] или осаждать гель гидроксида алюминия
в присутствии 0,10—15% водорастворимой алифатической кис-
лоты С4—С22, например, лимонной '[Пат. США 4179411].
Для увеличения удельной поверхности и механической проч-
ности сформованные гранулы гидроксида алюминия предлагают
обрабатывать парами аммиака в течение 6—12 ч [А. с. 384538].
Основные способы регулирования пористой структуры ак-
тивного оксида алюминия приведены в табл. 54. Можно ви-
деть, что для изменения параметров пористой структуры ши-
рокие возможности дает обработка гидроксида алюминия орга-
ническими соединениями, а также введение ПАВ в пластифи-
цированные массы. Действие ПАВ проявляется в изменении
характера упаковки кристаллических частиц с образованием
более крупных вторичных частиц. Формованию крупных пор
способствует также добавка высокомолекулярных соединений,
которые выгорают при прокаливании.
Для получения оксида алюминия с большой поверхностью
на стадии формования можно вводить соединения аммония
либо муравьиную кислоту [Пат. Англии 1269273]. При полу-
чении сферических частиц оксида алюминия с высокой проч-
ностью и низкой плотностью золь гидроксида алюминия сме-
шивают с гексаметилентетрамином при температуре ниже тем-
141
пературы гелеобразования и затем полученную смесь диспер-
гируют в масло [Пат. Франции 2109256]. В результате обра-
ботки водным раствором полиэтиленгликоля или полипропилен-
гликоля и последующей пептизации моно- и поликарбоновой
кислотой после прокаливания получают активный оксид алю-
миния, практически не содержащий поры диаметром менее
5,0 нм [Пат. США 4145316; Пат. Японии 53-35559].
Регулируемое введение на стадии формования в гидроксид
алюминия ПАВ [А. с. 679527; Пат. США 4066740] способ-
ствует получению крупнопористого носителя с большой удель-
ной поверхностью в отличие от способа термопаровой обра-
ботки активного оксида алюминия, в процессе которого круп-
ные поры формируются за счет исчезновения мелких, что зна-
чительно сокращает удельную поверхность контакта [282].
Увеличение объема макропор происходит также при введе-
нии в формуемую массу выгорающей при прокаливании орга-
нической добавки, например дихлорбензола [Заявка
США 248356], или органического наполнителя, например цел-
люлозы, древесных опилок [Пат. США 4169874].
Для получения мелкопористого активного оксида алюминия
используют метод пептизации переосажденного гидроксида
алюминия минеральной или органической кислотой. Чаще ис-
пользуют азотную или соляную [Пат. США 3975509]; можно
использовать также фтористоводородную или бромистоводород-
ную кислоту [Пат. США 4113661]. Полученный при этом ак-
тивный оксид алюминия более чем на 70% общего объема
имеет поры диаметром 8—15 нм.
Введение в пасту гидроксида алюминия перед формова-
нием минеральной кислоты вместе с ПАВ (ОП-7 или ОП-Ю)
в количестве 1 мл на 1 л обрабатываемой массы способствует
получению активного оксида алюминия бидисперсной структу-
ры с мелкими (3—5 нм) и крупными («250 нм) порами
[А. с. 679527].
Оксид алюминия с пониженным содержанием пор диамет-
ром 10—120 нм получают введением водорастворимой много-
основной кислоты С2—С22, например лимонной [Пат.
США 4102821]. Для приготовления носителя катализаторов с
крупными порами формованный гидроксид алюминия промы-
вают органическим растворителем (спирты, кетоны, эфиры,
амины, карбоновые кислоты Ci—Сю) и прокаливают при тем-
пературе 400—700°C [Заявка Японии 13-125415].
Разработан метод получения активного оксида алюминия
бидисперсной структуры обработкой азотной кислотой смеси
тонкоизмельченных порошков сухого и прокаленного оксида
алюминия [250]. Бидисперсная структура образуется за счет
первичных микропор взятого активного оксида алюминия и
макропор, образующихся при «склеивании» частиц прокален-
ного оксида алюминия азотной кислотой.
142
4.6. МОДИФИЦИРОВАНИЕ ОКСИДА АЛЮМИНИЯ
НЕОРГАНИЧЕСКИМИ ДОБАВКАМИ
Одним из способов улучшения термической стабильности,
механической прочности, регулирования пористости и катали-
тической активности активного оксида алюминия является мо-
дифицирование его неорганическими соединениями. Активные
компоненты катализаторов — оксиды молибдена, никеля, ко-
бальта— изменяют скорость фазовых превращений оксида
алюминия [283].
Самый распространенный модификатор оксида алюминия —
диоксид кремния. В качестве кремнеземной добавки исполь-
зуют также цеолит [28; Пат. США 4212771]. Введение в гидро-
гель алюминия 5—20% алюмокремнегеля придает массе пла-
стичность и улучшает ее формуемость [А. с. 513004], что по-
зволяет получать активный оксид алюминия с высокой меха-
нической прочностью и термической стабильностью [Пат. Ита-
лии 639439; Пат. ФРГ 2451849; Заявка Японии 47-8446,
52-10438]. Диоксид кремния можно вводить также при обра-
ботке гидроксида алюминия кремнийорганическими соединения-
ми, например эфирами ортокремниевой кислоты или силокса-
новыми соединениями с последующей термической обработкой.
Для стабилизации оксида алюминия в качестве модифика-
тора используют также оксиды магния, циркония или титана,
борную, фосфорную кислоту. Например, носитель, обладающий
высокой механической прочностью, получают осаждением гид-
роксида алюминия из основного ацетата алюминия фосфорной
кислотой. После прокаливания активный оксид алюминия со-
держит немного фосфата алюминия. При введении фосфорной
кислоты в гидроксид алюминия наблюдается увеличение общей
пористости и доли макропор [Заявка Японии 47-8446; 284].
Для увеличения удельной поверхности рекомендуют прово-
дить обработку гидроксида алюминия борной кислотой
[А. с. 474504]. Возможно одновременное введение в гидрогель
оксида алюминия борной и фосфорной кислот с образованием
метафосфата бора [Пат. ФРГ 2725385].
Модификаторы и способы их введения в гидроксид алюми-
ния приведены ниже:
Модификатор
Метафосфат бора
(13-15%)
Борная кислота
Оксид кремния (5—
20%)
Оксид кремния
Способ введения
О б р а бот к а гид рок сид а
алюминия борной и фос-
форной кислотами
Обработка гидроксида
алюминия борной кисло
той
Смешение гидроксида
алюминия с золем окси-
да кремния
Пропитка гидроксида
алюминия эфирами ор-
токремниевой кислоты
Источник информации
Наг ФРГ 2725385, 1978
А с. СССР 829570, 1971;
474505, 1975
А. с. СССР 513004, 1976
Пат. ФРГ 2451849, 1978
143
Оксид кремния
Оксид титана (1 —
10%)
Фосфорная кислота
(3%)
Пропитка гидроксида
алюминия кремнийорга-
ническими соединениями
Обработка гидроксида
алюминия алкоголятами
или галогенидами ти-
тана
Смешение соли алюми-
ния с кислотой
Пат. Японии 52-10438,
1977
Пат. США 4196101, 1980;
4087194, 1978
Пат. Японии 55-4691,
1980
Диоксид титана (в количестве 1—40%) вводят, обрабаты-
вая водную суспензию гидроксида алюминия гидролизующи-
мися соединениями титана или пропитывая у-А12О3 смесью НС1
и TiCl4 с последующей обработкой водой [Пат. США 4196101,
4018714].
Модифицирование активного оксида алюминия 10—15%
В2О3 резко изменяет природу поверхности и ее каталитические
свойства [285]. Добавка к у-А12О3 3—10% ВаО позволяет по-
лучать носитель с повышенной термической стабильностью
[286]. Стабилизирующее действие ионов Ва2+ особенно замет-
но, если А12О3 содержит ионы SO42-. Кроме того, заметно уве-
личивается механическая прочность носителя. Ионы Ва2+ вво-
дят в гидроксид алюминия в виде Ba(NO3)2 одновременно или
перед введением HNO3 [Пат. ПНР 83850].
Введение Са(ОН)2 в качестве связующего позволяет полу-
чать активный оксид алюминия непосредственно из техниче-
ского гидроксида алюминия, предварительно измельченного до
частиц размером 1—7 мкм [А. с. 559900]. Положительный эф-
фект на термическую стабильность оксида алюминия оказы-
вают также добавки ВаО, который замедляет спекание пор
оксида алюминия как в атмосфере воздуха, так и водорода
[287]. При необходимости снизить температуру полиморфных
превращений оксида алюминия используют специальные мине-
рализаторы, например фтористоводородную кислоту.
4.7. МЕХАНИЧЕСКАЯ ПРОЧНОСТЬ НОСИТЕЛЕЙ
Механическая прочность катализаторов на основе оксида
алюминия во многом определяется прочностью носителя и за-
кладывается в процессе приготовления последнего. Для харак-
теристики прочности носителя и катализаторов в СССР ис-
пользуют величину раскалывающего усилия, отнесенного к
1 мм диаметра гранулы, за рубежом — величину раздавливаю-
щего усилия, отнесенную к таблетке определенного размера.
Для микросферического оксида алюминия определяют индекс
истирания, выражаемый в процентах износа. Такое различие
в подходе к оценке прочности затрудняет сравнение абсолют-
ных значений прочности носителей и катализаторов разного
происхождения. Из практики установлено, что механическая
прочность гранул носителя 1 кг/мм диаметра и выше является
удовлетворительной для эксплуатации в промышленных уста-
144
новках. С целью повышения механической прочности оксида
алюминия, как носителя катализаторов, в формуемую массу
В1водят различные связующие добавки, например кислоты, со-
единения кальция, кремния, титана. Способы повышения ме-
ханической прочности оксида алюминия приведены ниже-
смешение гидроксида алюминия, золя гидроксида алюминия
и кислоты [Заявка Японии 53-44432];
смешение порошка оксида алюминия (25—45 мкм) с водой
[Пат. Франции 862090; Пат. США 3714313];
смешение порошка оксида алюминия (60 мкм) с гелем
крахмала [Пат. СРР 72453];
уплотнение порошка оксида алюминия до кажущейся плот-
ности 2,4 г/см3 [Пат. Франции 2267982];
смешение гиббсита, байерита и бёмита с водой [280];
смешение гиббсита и бёмита с кислотой (2—10%) и водой
[Пат. США 4102938];
смешение геля гидроксида алюминия с золем алюмокрем-
негеля (3—20%) '[Пат. ФРГ 2451849];
смешение порошков оксида алюминия с размером частиц
10—40 и 40—200 мкм в соотношении 1,0:0,25 с добавлением
кислоты [А. с. 701700];
добавление в порошок гидроксида алюминия (1—7 мкм)
гидроксида кальция (10—25%) [287];
введение в гидроксид алюминия диоксида титана (1—10%)
(Пат. США 4018714];
обработка гидроксида алюминия и автоклаве при темпера-
туре 200 °C в присутствии аммиака [Заявка ФРГ 2935914].
Известно, что в качестве связующего могут служить также
соединения одного из активных компонентов катализатора, на-
пример нитрат никеля [288].
На прочность носителя существенно влияют параметры фор-
мования (формующее усилие, зависящее от конструкции фор-
мующего устройства, а также размер и форма гранул) и рео-
логические свойства формуемой массы (влажность, вязкость,
формуемость и др.) [224, 288]. Вязкость и формуемость массы
в настоящее время количественно не определяются, что не по-
зволяет проследить за их влиянием на механическую проч-
ность и структурные характеристики носителей катализаторов.
Влажность формуемой массы контролируется потерями при
прокаливании. Однако и этот показатель, в величину которого
входит количество газообразных продуктов термического раз-
ложения всех компонентов массы, включая дегидратацию гид-
роксида алюминия, не является определяющим.
10-922
145
Глава 5
АКТИВАЦИЯ И РЕГЕНЕРАЦИЯ
ПРОМЫШЛЕННЫХ КАТАЛИЗАТОРОВ
5.1. АКТИВАЦИЯ АЛЮМОКОБАЛЬТ- И
АЛЮМОНИКЕЛЬМОЛИБДЕНОВЫХ КАТАЛИЗАТОРОВ
Катализаторы процессов гидрогенизационной переработки
нефтепродуктов, как товарную продукцию катализаторных
производств, выпускают, как правило, в оксидной форме. По-
этому перед использованием в промышленной установке про-
водят их активацию: сульфидирование или восстановление во-
дородом либо водородсодсржащим газом. Порядок проведения
операции и режим подготовки катализатора перед пуском про-
мышленной установки строго регламентирован, так как от
этого во многом зависят активность и стабильность работы
контакта. Инструкции по подготовке и пуску реакторного бло-
ка различны и зависят от размеров и внутренних устройств
реактора, типа, размера и формы катализатора. Общими опе-
рациями являются загрузка катализатора, подготовка его к
активации (сушка и прокаливание) и собственно активация.
Загрузка катализатора. В промышленных установках гидро-
генизационных процессов нефтепереработки в основном исполь-
зуют реакторы со стационарным фильтрующим слоем катали-
затора и режимом работы, близком к идеальному вытеснению.
Реже применяют реакторы с движущимся слоем катализатора.
Объем промышленных реакторов составляет от 10 до 100 т
по загрузке катализатора.
При загрузке в реактор катализатора в виде экструдатов
диаметром от 1,2 до 4,5 мм и длиной от 2—3 до 6—9 мм их
предварительно отсеивают от пыли и крошки, которые обра-
зуются при транспортировании. Катализатор загружают на
сетку нижней решетки реактора и сверху укладывают фарфо-
ровые шары переменного размера, например диаметром после-
довательно 20, 15, 12 и 6 мм. Для сохранения катализатора от
истирания и раскалывания используют специальные приспособ-
ления, например гибкий резиновый или тканевый рукав, кото-
рый погружают до уровня насыпаемого слоя. После заполне-
ния реактора и выравнивания верхнего слоя катализатора его
покрывают защитным слоем фарфоровых шаров. Они служат
для выравнивания гидравлических потоков перерабатываемого
нефтепродукта и для предохранения решетки и распределитель-
ных устройств от сгорания в период проведения окислительной
регенерации.
Продувка системы и термическая обработка. После загруз-
ки реактора его продувают воздухом для удаления катализа-
146
торной пыли. Расход воздуха регулируется таким, чтобы ли-
нейная скорость его движения в слое катализатора не превы-
шала 0,5 м/с. По окончании выделения пыли систему проду-
вают инертным газом (азотом) до содержания кислорода в от-
ходящем газе не более 0,3% (об.). Затем инертный газ пере-
ключают на циркуляцию и постепенно поднимают температуру
и повышают давление. Воздух и инертный газ, используемые
для продувки реактора, должны быть сухими во избежание
насыщения катализатора влагой.
Сушку и термическую обработку катализатора для удаления
из него влаги (до 1—3%) проводят при температурах до
450 °C [290]. Скорость нагрева и температурный предел строго
контролируют, особенно если используют не инертный, а водо-
родсодержащий газ. Основная влага, содержащаяся в катали-
заторе, удаляется при 120—150 °C. До этой температуры ско-
рость подъема составляет 5 °C в час. При данной температуре
катализатор выдерживают до тех нор, пока скорость выделе-
ния воды в сепараторе составит 0,1% 1290]. Затем температу-
ру повышают со скоростью 10—20 °C в час до 250 °C (200 °C
в водородсодержащем газе) и нагревают до практически пол-
ного прекращения выделения воды.
В некоторых случаях дополнительно проводят прокаливание
катализатора при температуре 400—450 °C в течение 4—5 ч.
Для этого по окончании сушки температуру повышают до
425 °C, поднимают давление инертного газа до 2 МПа, затем
повышают температуру до 450 °C и выдерживают в течение
4—5 ч. После этого реактор охлаждают до 120—150 °C, пре-
кращают циркуляцию, снижают давление до 0,2 МПа и про-
дувают холодным сухим водородсодержащим газом.
Некоторые фирмы рекомендуют вместо сушки проводить
паровоздушную обработку, особенно для катализаторов, пред-
назначенных для переработки легкого сырья. В таком случае
катализатор нагревают в токе воздуха до 250 °C, вводят водя-
ной пар (соотношение пар: воздух= 1 1), повышают темпера-
туру до 400—450 °C, увеличивают расход пара до 0,40—0,45 кг
на 1 кг катализатора в час, выдерживают в указанных усло-
виях 16 ч, охлаждают до 200—230 °C, прекращают подачу па-
ра, охлаждают до 25—50 °C и продувают азотом [290].
Методы активации катализатора. Стадия активации являет-
ся наиболее ответственной операцией при подготовке к пуску
промышленной установки. При этом катализатор из оксидной
формы переводится в состояние, обеспечивающее проведение
целевого процесса. В зависимости от природы катализатора,
назначения и качества перерабатываемого сырья катализаторы
гидрогенизационных процессов активируют одним из следую-
щих способов: прокаливанием при температуре 450—500 °C;
восстановлением водородом или водородсодержащим газом, ко-
торому может предшествовать окислительная термическая об-
работка; осернением или сульфидированием.
10’
147
Как было отмечено, алюмокобальт- и алюмоникельмолиб-
деновые катализаторы применяют в процессах гидрообессери-
вания в сульфидированной форме. Структура сульфидирован-
ных катализаторов гидрообессеривания окончательно не уста-
новлена. Предложено несколько моделей строения активных
центров сульфидированных промышленных катализаторов.
Из них наиболее адекватно отражает свойства промышленных
катализаторов гидроочистки слоистая модель «компенсирующих
катионов», согласно которой активная поверхностная фаза
Со—Мо—S или Ni—Мо—S образуется при локализации катио-
нов промоторов (Со2+, Ni2+) на торцевых гранях кристаллов
M0S2, связанных с носителем. Установлено {186], что гидро-
обессеривающая активность АКМ и АНМ катализаторов про-
порциональна содержанию серы, связанной с промотором в со-
ставе этой фазы.
Катализаторы в оксидной форме имеют низкую гидрообес-
серивающую активность. С течением времени при контактиро-
вании с сернистым сырьем активность катализаторов возра-
стает, что связано, по-видимому, с частичным его осернением
в ходе реакции {291]. Так, при исследовании гидрирования
этилмеркаптана на промышленном АКМ катализаторе в интер-
вале температур 200—280 °C было показано, что при достиже-
нии 10—15%-й ^конверсии скорость разложения по уравнению
C2H5SH <7=^ С2Н4 -|- H2S
увеличивается, а скорость образования этана по уравнению
C2H5SH + Н2 --------------------> С2Нб + H2S
остается неизменной [293]. При повторном использовании ка-
тализатора, а также на предварительно сульфидированном
катализаторе ускорение разложения этилмеркаптана не наблю-
дается. Константа равновесия разложения этилмеркаптана при
250 °C равна 0,093—0,096, а диэтилсульфида составляет 0,035—
0,036 при 275 °C. Показано, что независимо от способа сульфи-
дирования (сероводородом или этилмеркаптаном) процесс
осернения прекращается, когда с 1 г катализатора, содержаще-
го 53,4-1019 атомов Мо и 29,6-1019 атомов Со, выделяется
30-1019 атомов кислорода в виде воды и поглощается эквива-
лентное количество серы. Кажущаяся энергия активации реак-
ции сульфидирования этилмеркаптаном по (реакции
C2H5SH + (Мо-О)п --> С2Н4 + Н2О + (Мо—S)n
составляет 195 кДж/моль [292].
Как на оксидном, так и на сульфидированном катализато-
ре легко протекает реакция дейтероводородного обмена.
На оксидном катализаторе не отмечено различия в скоростях
обмена по связям С—Н и S—Н. При этом обмен протекает
ступенчато и скорость обмена примерно в 10 раз выше ско-
рости разложения этилмеркаптана. На сульфидных катализа-
148
.Рис. 53. Изменение степени превращения бензотиофена ф при 250 °C от дли-
тельности испытаний т при различных условиях:
1 — без обработки; 2 — восстановление 10 ч при 250 °C; — восстановление 1 ч при
400 °C; 4 — то же, затем сульфидирование при 250 °C; 5 — сульфидирование при 250 °C
Рис. 54. Изменение степени превращения тиофена ф от длительности испы-
таний и температуры восстановления:
/ — 700 °C; 2 —500 °C; 3 — 450 °C; 4 — 400 иС; 5 —350 °C; 6 — 300 “С
торах обмен по связям S—Н протекает почти в 50 раз быст-
рее, чем по связям С—Н. Селективность реакции a-обмена в
тиофене на оксидном АКМ катализаторе выше p-обмена при-
мерно в 5 раз. На сульфидированном катализаторе реакции
сравнимы как по скорости, так и по селективности а-обмена.
Причем селективность a-обмена на сульфидированном катали-
заторе в 20 раз выше, а скорость обмена сравнима с таковой
на оксидном катализаторе.
Реакция межмолекулярного дейтерообмена CD2 = CHCH3
и СП2 = С(СН3)2 на сульфидированном катализаторе в отсут-
ствие дейтерия свидетельствует о том, что сульфидированные
катализаторы ведут себя как бифункциональные, содержащие
центры, присущие как MoS, так и оксидному катализатору
[293].
Увеличение активности АКМ катализатора после предвари-
тельного сульфидирования или восстановления в реакции гид-
рообессеривания бензтиофена при 250 °C и давлении 8,7 МПа
показано па рис. 53. Оксидный АКМ катализатор в первые
3 ч реакции неактивен, затем активность его постепенно уве-
личивается; константа скорости гидрообессеривания составила
2,27-10-5 с"1.
Предварительно восстановленный катализатор значительно
активнее (& = 3,49-10-5 с1), причем через 3 ч константа ско-
рости увеличивается до 5,87-10-5 с1 и становится примерно
равной активности предварительно сульфидированного катали-
затора (Ze = 5,67 10-5 с-1).
Аналогичные результаты получены и другими исследовате-
лями как для алюмокобальтмолибденовых [295, 296], так и
149
Рис. 55. Кривые термопрограммированного
восстановления катализаторов:
а — алюмомолибденовые образцы; б — алюмоволь-
фрамовые; в — образцы МоОз/?-А12Оз, приготовлен-
ные жидкофазной адсорбцией при pH = 9,0 (/), 6,0
(2) и 1,0 (3), промышленный АКМ катализатор
(4); г — образцы МоОз/Т-АЬОз, приготовленные
пропиткой бёмита
для алюмоникельмолибденовых .[151, 297] катализаторов. По-
казано, что активность предварительно восстановленных ката-
лизаторов и (Продолжительность достижения стационарной ак-
тивности зависят от температуры восстановления, температуры
и давления реакции гидрообессеривания, концентрации тиофе-
на или бензтиофена в растворителе и от природы растворителя
(бензол, гептан, гексан, додекан). Влияние некоторых из этих
факторов показано на рис. 53 для промышленного АКМ ката-
лизатора и на рис. 54 для АНМ катализатора, полученного
методом пропитки (5 г катализатора, 90 мл водорода, отноше-
ние Нг: тиофен = 13 : 1). Предварительно восстановленные ка-
тализаторы достигают стационарной активности значительно
быстрее, чем невосстановленные [151]. Причем, чем ниже тем-
пература восстановления, тем выше уровень стабильной ак-
тивности. Восстановление при высокой температуре, например,
150
при 400 °C, приводит к высокой начальной активности, кото-
рая, однако, быстро снижается: с 61 до 32% после 20 ч рабо-
ты [295].
Известно, что чем легче восстанавливаются катализаторы
гидрообессеривания, тем выше их активность [297]. Однако
способность к восстановлению, как показано на примере серии
катализаторов МоО3/А12Оз, WO3/AI2O3 и Re2O7/Al2O3, получен-
ных различными способами, а также промышленного АКМ. ка-
тализатора KF-120-3E, зависит от многих факторов: условий
восстановления, состава восстановительной среды, прочности
связи активных металлов с носителем, степени их дисперсности,
которая в свою очередь зависит от степени покрытия поверх-
ности носителя атомами металла. На рис. 55 показаны условия
термопрограммированного восстановления, а на рис. 56 — за-
висимость константы скорости реакции гидрообессеривания
тиофена па этих катализаторах от степени покрытия поверх-
ности носителя. Можно видеть, что максимальная активность
в реакции гидрообессеривания достигается при степени покры-
тия 4 атома Мо на 1 нм2 [160, 298], т. е. при условии дости-
жения теоретического монослойного покрытия, исходя из вели-
чины площади атомов Мо 0,17 нм2 [299].
Однако в реальных катализаторах равномерность покрытия
поверхности, особенно с учетом способа приготовления, отлич-
на от идеальной монослойной. Кроме того, необходимо учиты-
вать распределение и состояние промотора в катализаторе.
Исходя из представлений о природе промотирующего действия
катионов Ni24 и Со2+ как компенсирующих катионов на реб-
рах и гранях кристаллов MoS2 (см. гл. 2), можно представить
полный цикл активации катализаторов гидрообессеривания по
реакциям {151]:
Ni2+ + H2S -> 2Н+ + Ni,
Ni + 2Mo4+ -> Ni2+ -|- 2Mo3+,
2Mo3+ + RS + H2 -> 2Mo4+ + RH2 + S2",
2H+ + S2- > H2S.
Очевидно, что эти реакции связаны с переносом электронов и
приводят к возрастанию электронной плотности катализатора
при удалении серы:
Н2 + S2“(O2-) = H2S(H2O) 4- 2е + иа,
где иа—анионная вакансия. В присутствии сероводорода рав-
новесие последней реакции сдвинуто влево, что способствует
возрастанию катионных вакансий, ответственных за реакцию
обессеривания:
0,5S2(MoS2) <—> S2“ -|- 2р 4- ик,
где ик—катионная вакансия.
Из этой схемы следует, что предварительное восстановле-
ние катализатора водородом, особенно при высоких температу-
151
Рис. 56. Изменение константы скорости реакции гидрообессеривания k тио-
фена в зависимости от степени покрытия Q поверхности носителя катализа-
торов МоОз/т-А12О3 (1) и WO3/T-AI2O3 (2)
Рис. 57. Изменение содержания серы в катализаторе Xs при сульфидирова-
нии АКМ катализатора от температуры реакции t (концентрация H2S
90% об.)
рах, приводит к избытку электронов и восстановлению МоОз,
в трудпосульфидирующийся МоО2. Предварительное же суль-
фидирование приводит к возникновению на поверхности ката-
лизатора катионных вакансий и, следовательно, повышению ка-
талитической активности.
Данные по влиянию условий активации на гидрообессери-
вающую активность АКМ катализатора (Gildler G-35) [295],
предварительно восстановленного при 400 °C, представлены
ниже:
Условия и порядок активации
H2+H2S, 250°С, 1 ч . . .
H2+H2S + Ci2H26, 250 °C, 1ч..
Н2+С2Н2б, затем H2+H2S, 250 °C, 2 ч
H2 + H2S, затем H2 + Ci2H26, 250 °C, 2 ч
Без обработки . .
Н2 + С12Н26, 250 °C, 1 ч
H2+C4H4S, 250 °C, 5ч..
H2 + C4H4S + Ci2H26, 250 °C, 5 ч
Степень превраще-
ния бензтиофена
после достижения
стационарной актив-
ности, %
75
58
50
45
36
33
43
28
Как видно, максимальная активность достигается в случае
предварительного сульфидирования смесью (H2+H2S). Как
правило, лучший результат получается, если катализатор под-
вергается сульфидированию без восстановления. Сульфидиро-
вание в присутствии углеводорода или смесью водород + тиофен
и особенно водород + тиофен + парафин резко снижает гидро-
обессеривающую активность. Это можно объяснить результатом
дезактивации активных центров за счет коксообразования при
гидрокрекинге углеводородов.
152
В промышленных условиях используют следующие способы
сульфидирования катализаторов гидроочистки [А. с. 757588;
300]: сероводородом в токе Н2; сернистым сырьем; сырьем с
добавлением осерняющего агента и свободной серой.
Осернение сероводородом проводят в газовой фазе в токе
водорода с содержанием 3—10% H2S при температуре ниже
температуры процесса обессеривания. Полнота сульфидирова-
ния и прочность связи серы с катализатором зависят от темпе-
ратуры и продолжительности обработки. Оптимальной темпе-
ратурой, при которой достигается практически полное сульфи-
дирование, считается 400—450 °C (рис. 57). Дальнейшее по-
вышение температуры незначительно повышает содержание
серы в (Катализаторе и, кроме того, становится возможным
термическое разложение сероводорода и образование элемен-
тарной серы. Продолжительность начального периода сульфи-
дирования, характеризующегося высокой скоростью протекания
процесса, уменьшается с повышением температуры, объемной
скорости смеси (H2+H2S) и содержания сероводорода
(рис. 58).
Однако на практике сульфидирование обычно проводят при
более низкой температуре. В частности, рекомендуют нагревать
катализатор до 300—325 °C и затем при атмосферном давле-
нии пропускать водород, содержащий 10% (об.) H2S, со ско-
ростью 650 ч-1. После достижения на выходе из слоя катали-
затора концентрации H2S 10% (об.) контакт выдерживают
30 мин, затем температуру повышают в течение 1 ч до 370 °C,
охлаждают до температуры процесса и начинают подавать
сырье [301; Пат. США 4104152]’. Если сульфидирование про-
водят при давлении до 3,0—3,5 МПа, температуру понижают
до ^250 °C. Более высокая температура в слое катализатора
в процессе сульфидирования может вызвать восстановление
оксидов до металлов, которые практически не сульфидируются
от объемной скоро-
в смеси Xn?s (б)
катализаторе Xs
сероводорода
0 0,5 1,0 1,5 2,0
W, ч~!
Рис. 58. Изменение содержания серы в
сти подачи сырья w (а) и содержания
при 500 °C:
Расход сульфидирующего агента — 660 л/ч (/), 330 л/ч (2) и 165 л/ч (3)
15а
Таблица 55. Влияние условий предварительного восстановления
на гидрообессеривающую активность катализаторов
Катализатор АКМ промышленный: 4,3% СоО, 13,1% МоО3; ТПл=67° кг/м3. 5уд=188 м2/г.
Катализатор КГДО-1: 2,4% СоО, 7,0% МоО3; упл G30 кг/м3, 5уд=122 м2/г
Восстановление Сульфидирование сырьем (сероводородом) Степень обессери- вания дизельного топлива, %
р, МПа | t, °C р, М|Па t, °C
Катализатор АКМ
5 450 5 350 33,1
— — 5 350 50,2
8 400 8 400 54,0
5 450 (50) (400) 67,3
Катализатор КГДО-1
5 450 5 350 35,0
— — 5 350 44,2
[302]. Во избежание резкого повышения температуры, особен-
но в начальный период сульфидирования, рекомендуют концент-
рацию сероводорода в циркулирующем газе поддерживать в-
пределах 1—2% с последующим постоянным ее повышением
до 10—12% [А. с. 757588]. При этом лучше использовать азото-
водородную смесь циркулирующего газа или водородсодержа-
щий газ другой установки гидроочистки [299].
Метод предварительного сульфидирования катализатора
сернистым сырьем основан на взаимодействии содержащихся
в нем органических соединений серы. Способ наиболее досту-
пен и достаточно широко распространен в промышленной прак-
тике. Однако в этом случае следует уделять еще большее вни-
мание температурному режиму процесса, так как вероятность
восстановления оксидов металлов и закоксовывания катализа-
тора очень высока [299, 302]. Изучение влияния условий ста-
дии восстановления (200—500°C, 1—8 МПа) при постоянных
условиях сульфидирования сырьем (350 °C, 2 МПа) показало
[303], что и в этом случае независимо от условий предвари-
тельное восстановление снижает гидрообессеривающую актив-
ность (табл. 55).
Для улучшения условий сульфидирования предлагают пред-
варительно обрабатывать катализатор в мягких условиях бо-
лее легким по фракционному составу сырьем или смачивать,
катализатор перед сульфидированием сырьем, например ва-
куумным газойлем при температуре ^150 °C [1]. Как показа-
но на примере активации серии промышленных катализаторов
типа KF оптимальной температурой сульфидирования сырьем
является 270—330 °C (табл. 56) [290], причем скорость подъ-
ема температуры до 300 °C должна составлять 12—25°C в час.
В случае необходимости подъема температура выше 300 °C
154
скорость нагрева катализатора не должна превышать 10°C
в час.
Процесс протекает более гладко и достигается большая сте-
пень сульфидирования, если к сырью добавляют органические
соединения серы (сероуглерод, меркаптаны, Ci—С2о органиче-
ские сульфиды, дисульфиды или их смеси), способные легко
разлагаться в диапазоне температур 150—230 °C в присутствии
водорода с образованием H2S без заметного отложения кокса
на катализаторе [56, 290, 299, 302, 304]. Промышленный опыт
показывает, что лучшие результаты получаются при использо-
вании сероуглерода, диметилсульфида и диметилдисульфида
[290]. Выбор осерняющего агента зависит от его доступности,
стоимости, температуры разложения и ограничений с точки
зрения загрязнения окружающей среды. Сульфидирование
сырьем с добавлением 1—2% осерняющего агента при темпе-
ратуре 230—270 °C и давлении до 3 МПа [290, 304] дает более
высокое содержание серы в катализаторе и более высокую гид-
рообессеривающую активность, чем предварительное сульфи-
дирование только сырьем. Так, начальная температура 90%-го
обессеривания легкого газойля на катализаторе KF-742, суль-
фидированного с применением диметилдисульфида (содержа-
ние серы в катализаторе 7,89%, относительная гидрообессери-
вающая активность 145%) составляет 335°C, тогда как тот
же катализатор, сульфидированный только сырьем (содержа-
ние серы 6,95%, относительная гидрообессеривающая актив-
ность 138%), достигает 90%-й степени гидрообессеривания
только при температуре 352 °C [290].
Сульфидирование катализаторов свободной серой проводят
следующим образом. В реактор поверх слоя катализатора за-
гружают 3,0—8,0% серы от массы катализатора, повышают
температуру за счет циркуляции водородсодержащего газа до
120—140 °C и выдерживают при этой температуре и давлении
0,5—0,7 МПа в течение 2,0—2,5 ч. Затем повышают темпера-
туру до 180—200 °C со скоростью 25—30 °C в час, а давление
до 2,0—2,5 МПа и выдерживают в таких условиях 2—3 ч до
выравнивания температуры в слое катализатора. После этого
реактор выводят на режим гидроочистки и подают сырье и во-
Таблица 56. Влияние температуры предварительного сульфидирования
на активность промышленных катализаторов
Температура предваритель- ного сульфиди- рования, °C Относительная активность, %
гидрообессе- ривания гидродеазо ги- рования гидрообессери- вание! гидродеазоти- рования
Катализатор KF-742-1,3 Катализатор KF-153-S-1.5E
270 138 103 101 122
300 132 103 107 118
330 127 101 105 119
370 120 101 89 108
155
дородсодержащий газ. Преимуществом данного способа являет-
ся его простота, небольшая продолжительность и минимальное
вредное воздействие на катализатор. К недостатку его следует
отнести трудность осуществления в промышленном реакторе,
ввиду неравномерного взаимодействия образующегося из серы
сероводорода по всему объему катализатора.
5.2. АКТИВАЦИЯ ЦЕОЛИТСОДЕРЖАЩИХ
КАТАЛИЗАТОРОВ
Способы активации цеолитсодержащих катализаторов раз-
нообразны, как и разнообразны сами катализаторы, их целе-
вое назначение и условия применения композиций. В гидроге-
низационных процессах нефтепереработки в основном исполь-
зуют металлцеолитные компоненты в катион-деалюминирован-
ной, деалюминированной и катионнообменной формах. Наибо-
лее распространенным способом активации катализаторов на
основе цеолитов является их термическая обработка в атмо-
сфере водорода, кислорода воздуха, инертного газа или в ва-
кууме [165, 200, 305]. В процессе термической обработки уда-
ляется адсорбированная влага и формируются активные цент-
ры или активная металлическая фаза в мелкодисперсном со-
стоянии с сохранением структуры цеолита.
Фожазиты в Н+, NH4+ или катионообмепной форме метал-
лов II группы и редкоземельных элементов обычно прокали-
вают при температуре 400—650 °C в атмосфере сухого воздуха
или дымовых газов в течение 1—16 ч. Редкоземельные формы
фожазитов проявляют максимальную активность после обра-
ботки при более низких температурах, чем другие катионные
формы, причем температура активации закономерно снижается
с увеличением мольного отношения ЗЮг: А120з.
Условия предварительной обработки влияют не только на
активность, но и на селективность и стабильность цеолитсодер-
жащих катализаторов [305]. В реакциях кислотно-основного
типа активность цеолитсодержащих катализаторов можно ре-
гулировать термопаровой обработкой. В случае би- или поли-
функциональных катализаторов, в которых цеолит играет роль
инертного носителя, обработку проводят в условиях, обеспечи-
вающих оптимальную активацию всех компонентов {200], т. е.
получение активной металлической фазы в высокодисперсном
состоянии. Металлцеолитные катализаторы процессов нефтепе-
реработки гидрирования, получаемые ионными обменами, вна-
чале дегидратируют в токе воздуха, азота или водородом до
содержания остаточной воды менее 0,2%, а затем восстанав-
ливают водородом при атмосферном или повышенном дав-
лении.
Наиболее эффективным является обезвоживание в токе во-
дорода при температуре 400—450 °C [165]. В процессе окисли-
тельной обработки после удаления адсорбционной (100—120 °C)
156
и кристаллизационной (200—270°C) воды при температурах
выше 300 °C происходит разрушение аммиакатных комплексов
по реакции [306]:
(A1O4)2“[M2+(NH3)4] --> (А1О4)2“М2++ 4NH3.
На примере Pt-цеолитпых катализаторов показано [307],
что в этом случае большая часть платины находится в виде
катионов Pt2+, локализованных в больших полостях достаточно
далеко друг от друга и связанных с каркасом цеолита ионны-
ми связями. При температуре 600 °C ионы Pt2+ мигрируют в
содалитовую ячейку в места si [307, 308] с образованием коор-
динационного комплекса с каркасом цеолита. Так, катализа-
тор, содержащий высокодисперсную платину, с повышенной
устойчивостью к отравлению сернистыми соединениями, по-
лучен прокаливанием цеолита [Pt(NH3)42H ]/Ca Y в токе возду-
ха при 500 °C с последующим восстановлением водородом при
300 °C [309].
При нагревании в токе инертного газа термическое разло-
жение аммиачного комплекса протекает по уравнению [310,
311]
3(AIO4)2-[M2+(NH3)4] -> 3(А1О4)2-МН+ + ЗН+ + N2 + 10NH3,
а при восстановлении комплекса водородом без предваритель-
ного термического разложения при температурах выше 95 °C
образуется нейтральный гидрид, который разрушается с агло-
мерацией металла. При восстановлении прокаленного катализа-
тора при 200 °C и выше катионы М2+ полностью восстанавли-
ваются до металла без разрушения решетки цеолита с образо-
ванием кислотных центров Бренстеда по схеме [312]:
(А1О4)2-М2+ + Н2 ч=±: 2(А1О4)-Н+ + М.
В результате получается -цеолит, «заряженный» металлом,
отрицательный заряд алюмосиликатного каркаса которого ком-
пенсируется протоном.
В восстановлении катионов металлов наряду с водородом
могут принимать участие протоны решетки цеолита с образо-
ванием ОН-групп [313].
Легкость восстановления катионов металла зависит от при-
роды катиона, расположения его в решетке цеолита и от кис-
лотности поверхности. Вначале восстанавливаются катионы,
расположенные в больших плоскостях в позиции Sn, а при бо-
лее высоких температурах в больших полостях в позиции Si
[308, 314]. Повышение кислотности цеолита, например путем
деалюминирования или обмена катионов Na+ на поливалент-
ные катионы, затрудняет восстановление металлцеолитных ка-
тализаторов, однако способствует увеличению дисперсности
восстановленного металла [312, 316]. Если восстановление про-
водить в интервале температур 25—200 °C, то может образо-
ваться металл, атомарно диспергированный в полостях цеоли-
157
Таблица 57. Влияние состава и условий предварительной обработки
металлцеолитных катализаторов на размер частиц металлов
Состав Условия обработки Условия восста- новления Размер частиц ме- талла, нм
0,24% Pt —NaY, 3 ч, 100 °C, воздух To же, 300 °C Н2, 3 ч, 500 °C 15
SiO, А1,О3 = 5 То же 15—55
• To же, 500 °C » 30—65
0,5% Pt —NaY, Si О- A12O3 = 5 Сушка на воздухе, 100—НО °C Н2, 3 ч, 200 °C 10
0,289% Pt —NH4Y, 3 ч, 400 °C, воздух Н2, 3 ч, 500 °C 30—65
SiO2 Al2O3-5 То же, 500 °C То же, 600 °C 3 ч, 400 °C, N2, затем 3 ч, 500 °C, воздух 3 ч, 500 °C, N2, затем 3 ч, 500 °C, воздух 500 °C, воздух, затем откачка при 550 °C, 18 ч То же » Н2, 3 ч, 500 °C То же 15—75 15-20 40—60 60
0,5% Pt —0,45% La —0,45% NH4Y, SiO2: A12O3 = 5 20 ч, 300 °C 25
10% Pd —HNaY, SiO21 A12O3=4,8 600 °C, О2, затем от- качка при 600 °C и 5-10-6 тор, 6 ч Н2, 300 °C, 10 тор, 15 ч 18—20
ГУ Ni —NaY Нагрев в токе Н2 до температуры восста- Н2, 538 °C от 2,5 до 20 ч 275 (немного 70)
новления со скоро- стью 65 °С/ч Н2, 521 °C от 1 до 20 ч Н2, 304—418 °C, 2 ч 320 (немного 70) 250 (немного 50)
та. Однако эти изолированные атомы, имеющие электродефи-
цитный характер, практически не хемосорбируют водород и
не проявляют каталитической активности 1[308].
В интервале 200—350 °C происходит миграция атомов ме-
талла из позиции Si в большие полости цеолита с образова-
нием кристаллов размером 1—2 нм [317]. При более высоких
температурах происходит образование агломератов от 1,5 нм
и выше с частичным разрушением кристаллической решетки
[318] и даже миграция атомов металлов из объема на внеш-
нюю поверхность цеолита, где образуется фаза металла с раз-
мером до 10 нм [307, 315, 318]. Одновременно катионы натрия
поверхностных слоев мигрируют в объеме, где занимают места
вышедших на поверхность катионов металлов [319].
Влияние состава и условий предварительной обработки ме-
таллцеолитных катализаторов на размер частиц можно видеть
из табл. 57 по данным, систематизированным в [200].
Активацию металлцеолитных катализаторов гидрокрекинга
и изомеризации проводят в условиях низкотемпературной гид-
ратации и восстановления в токе водорода при температурах
ниже 300 °C [319]. Например, для катализатора изомеризации
я-алканов 0,5% Pd/CaY найдены следующие оптимальные
условия активирования [320]: обработка воздухом при 380 °C
158
в течение 5 ч и восстановление водородом при атмосферном
давлении и 250—400 °C в течение 20 ч. При более низких тем-
пературах палладий полностью не восстанавливается, что сни-
жает дегидрирующую и общую активность катализатора.
При более высоких температурах (400°C), вероятно, умень-
шается дисперсность металла и изменяется характер кислот-
ности (часть бренстедовских кислотных центров превращается
в льюисовские), в результате чего активность также снижается.
Катализатор с повышенной стойкостью к отравлению сер-
нистыми соединениями получают нагреванием катионнообмен-
ного цеолита ,[Pt (NH3)42+]/CaY в атмосфере воздуха при
500 °C с последующим восстановлением водородом при 300 °C
[329].
Активность и селективность металлцеолитных катализато-
ров повышается при предварительной обработке сероводоро-
дом, алкил- и арилхлоридами, основаниями Льюиса (N- и
Р-органическими соединениями) [200]. В качестве примера
рассмотрим влияние условий предварительной активации на
каталитические свойства промышленного цеолитсодержащего
катализатора гидрокрекинга ГК-8 [322].
Этот катализатор предназначен для переработки вакуумного дистиллята
с высоким содержанием сернистых и азотистых соединений, смол и поли-
циклических ароматических углеводородов. Промышленная установка имеет
два последовательных реактора, секционированных на зоны для отвода тепла
реакции. Катализатор загружают в каждую зону слоями разной высоты.
В первый реактор, имеющий пять зон, загружают 5,4 м3 катализатора, при-
чем верхний слой наименьший, так как в начале реакции выделяется наи-
большее количество тепла. Следующие три слоя катализатора имеют вы-
соту по 1,7—2,0 м каждый и последний — 3,4 м. Для предотвращения «про-
вала» катализатора в нижнюю зону, уменьшения перепада давления на гра-
нице сетка — катализатор сверху и снизу слоев засыпают фарфоровые шары
На входе в реактор расположен фильтр для предотвращения попадания про-
за каждый час
15»
Таблица 58. Влияние способа и условий предварительной обработки
на активность и селективность катализатора ГК-8
Условия обработки t, °C 4? 3 1 о н* - Характеристика жидких продуктов
содер- жание серы, % фракционный со- став, % темпера- тура засты- вания фр. 160— 360 °C
н. к.— 160 160— 360 °C >360 °C
Восстановление Н2 и суль- 425 1,0 0,14 11,9 40,1 46,8 —32
фидирование дизельным топ- ливом при 15 МПа и 400 °C 425 0,7 0,05 18,5 46,9 45,6 —23
То же, р=2 МПа 425 0,8 0,04 15,7 43,9 40,0 —34
Восстановление Н2 и сульфи- 400 0,9 0,12 17,2 35,4 46,0 —37
дирование H2S при 400 °C и 0,1 МПа 400 0,8 0,11 30,3 31,0 37,4 —36
.Закоксовывание при 400 °C 415 1,0 0,13 33,8 26,3 38,1 —38
в течение 1 ч, восстановле- ние Н2 и сульфидирование H2S при 400 °C и 0,1 МПа 400 0,7 0,17 25,1 27,1 47,1 —35
Восстановление Н2 при 400 1,0 — 16,6 41,8 41,0 —26
50 °C и 0,1 МПа, сульфиди- рование H2S с подъемом температуры в интервале 350-420 °C 400 0,7 0,11 15,7 48,2 35,6 —22
Восстановление Н2 при 400 1 ,о 0,10 19,1 39,1 41,1 —19
360 °C 4 ч и сульфидиро- вание дизельным топливом при 360 °C 400 0,7 — 20,8 43,4 34,8 — 17
То же при 310 °C 400 1,2 0,12 21,5 41,8 35,2 —27
Восстановление Н2 при 260 °C 4 ч и сульфидирова- ние дизельным топливом при 310 °C 400 0,8 0,09 30,8 50,0 18,7 —29
дуктов коррозии. С целью равномерного распределения газосырьевой смеси
над каждым слоем катализатора установлены контактно-распределительные
устройства. Второй реактор секционирован на три зоны, катализатор загру-
жают в него высотой соответственно 3,4, 4,6 и 3,1 м. Над каждым слоем ка-
тализатора и на входе в реакторы предусмотрена подача холодного водорода
для регулирования температурного режима.
Сушку и активацию катализатора ГК-8 осуществляют водородсодержа-
щим газом при рабочем давлении 15 МПа и ступенчатом повышении темпе-
ратуры. Кратность циркуляции водородсодержащего газа— 1500 м3/м3
сырья. Катализатор нагревают со скоростью 20—25 °C в час до температуры
в слое катализатора 260 °C, причем при температурах 50, 100, 125, 200 и
260 °C катализатор выдерживают в течение 6 ч до полного прекращения вы-
деления воды. Заметное выделение воды начиналось при 230—240 °C и
продолжалось 12 ч (рис. 59) [322]. Так как условия восстановления и суль-
фид ированетя существенно влияют на активность и селективность, было про-
ведено специальное исследование по подбору условий активации катализа-
тора ГК-8.
Катализатор, сульфидированный сероводородом при 400—420 °C, облада-
ет высокими расщепляющими свойствами (табл. 58). При восстановлении
водородом и сульфидировании сероводородом при 350 °C катализатор сохраня-
ет высокую активность и обеспечивает высокие выходы дизельных фракций.
Предварительное закоксовывание катализатора или сульфидирование ди-
160
зельным топливом при температурах 360—400 °C снижает его активность.
Однако, если провести восстановление и затем сульфидирование дизельным
топливом при пониженных температурах 210—310 °C, катализатор имеет вы-
сокую активность.
Поэтому для промышленных условий рекомендуется катализатор ГК-8
сульфидировать в среде водородсодержащего газа (расход газа 1200—
1500 м3/ч, циркуляция 1500 м3/м3 сырья) дизельным топливом (фракция
с к. к. = 315°С, 0,5% серы) с объемной скоростью подачи сырья 0,7 ч-1 при
рабочем давлении 15 МПа. Во избежание резкого роста температуры дизель-
ное топливо подают в реактор при 240—260 °C в течение 16 ч, затем темпе-
ратуру повышают до 300—315 °C в течение 32 ч и проводят окончательное
сульфидирование при 330—340 °C до достижения насыщения катализатора
серой.
5.3. ДЕЗАКТИВАЦИЯ КАТАЛИЗАТОРОВ
Известно, что дисперсные металлические катализаторы, со-
держащие металлы VIII группы, чувствительны к воздействию
серо- и азоторганических соединений. Многочисленные примеры
дезактивации (отравления) металлических катализаторов та-
кими соединениями систематизированы в работе [9]. Для каж-
дого конкретного катализатора максимально допустимое содер-
жание серы и азоторганических соединений в сырье, при кото-
ром катализатор работает достаточно долго (например, в про-
цессе гидрирования), различно. Современные промышленные
катализаторы гидрирования ароматич^еских углеводородов в
нефтяных фракциях длительное время стабильны при содер-
жании в сырье «0,01% серы, некоторые катализаторы могут
перерабатывать сырье с содержанием серы до 0,1%.
Проблемы повышения стабильности дисперсных металличе-
ских катализаторов гидрирования изложены в гл. 2. Ниже рас-
смотрены характер воздействия сернистых и азотистых соеди-
нений и механизм отравления металлических промышленных
катализаторов гидрирования.
В работе [166] исследовано влияние сернистых и азотистых
соединений на активность катализатора ГТ-15 в процессе де-
ароматизации керосиновых фракций. Влияние сернистых и
азотистых соединений на степень гидрирования ароматических
углеводородов в керосиновых дистиллятах ромашкинской неф-
ти показано на рис. 60. Как видно, дезактивирующее действие
азотистых соединений проявляется в большей степени, чем
сернистых. Аналогичные результаты получены при гидрирова-
нии керосиновых дистиллятов троицко-анастасьевской нефти,
содержащих 21,5% ароматических углеводородов, 0,05% серы
и 0,0038% азотистых оснований (рис. (И). Уже через 120 ч
работы катализатор теряет половину своей первоначальной
активности. Если провести гидроочистку сырья до остаточного
содержания азотистых оснований не более 0,00045%, актив-
ность катализатора ГТ-15 не измени гея в течение 3000 ч ра-
боты.
Согласно современным представлениям [21], отравление
металлических катализаторов соединениями серы и азота,
11—922
161
Рис. 60. Изменение степени гидрирования
ароматических углеводородов аар в керо-
синовой фракции ромашкинской нефти от
содержания азота Xn2 (7) и серы Xs (2)
имеющими пару свободных элект-
ронов на гстероатоме, происходит
в результате хемосорбции этих со-
единений на атомах металла. При
этом возникает прочная координа-
ционная связь за счет перехода
электронов атома серы или азота
в d-зону металла [323]. В области
низких температур (до 100 °C) в ус-
ловиях жидкофазного гидрирова-
ния хемосорбированные молекулы
серо- и азоторганических соедине-
ний блокируют участки поверхнос-
ти катализатора, равные их площади. При этом энергия актива-
ции не изменяется, а скорость реакции уменьшается пропор-
ционально количеству поглощенного вещества. В области тем-
ператур до 350°C протекают процессы гидрогенолиза адсорби-
рованных серо- и азоторганических соединений и сульфидиро-
вание металла по реакции
M + H2S ч—> MS + H2.
Активность катализатора постепенно снижается со временем
и затем стабилизируется на некотором уровне, который опреде-
ляется установившимся равновесием сульфидирования и хемо-
сорбции. В результате отравления катализатора возрастает
энергия активации реакции гидрирования, так как гидрирова-
ние протекает на сульфидных центрах, и, кроме того, происхо-
дит блокировка несульфидированных атомов металла из-за
конкурентной хемосорбции молекул сероводорода.
В области температур 350—550°C отравление (катализато-
ра происходит в основном за счет конкурентной хемосорбции
H2S, поскольку равновесие сульфидирования смещено в сторо-
ну образования металла, а уровень стабильной активности за-
висит от парциального давления сероводорода.
Отравляющее действие на дисперсные металлические ката-
лизаторы, кроме серо- и азоторганических соединений, оказы-
вают содержащиеся в водородсодержащем газе примеси, осо-
бенно оксид углерода [324]. Установлено, что при содержании
оксида углерода в газе до 0,05% (об.) гидрирующая активность
Pd-цеолитного катализатора не изменяется, а крекирующая ак-
тивность его резко падает (рис. 62). Дальнейшее увеличение
содержания СО в газе до 0,15% (об.) приводит к резкому сни-
жению и гидрирующей активности. По-видимому, молекулы
оксида углерода, обладающие особенностью адсорбироваться
162
Рис. 61. Изменение содержания ароматических углеводородов Хар в гидро-
генизате от длительности испытаний т при работе на негидроочищенном (1)
и гидроочищенном (2) керосиновом дистилляте m троицко-анастасьевской
нефти
Рис. 62. Изменение гидрирующих (1) и крекирующих (2) свойств катализа-
тора от содержания СО в водородсодержащем газе
с образованием сильной донорно-акцепторной связи, блокируют
атомы палладия, препятствуя адсорбции ароматических угле-
водородов. Прокаливание катализатора, дезактивированного
оксидом углерода, в токе воздуха в течение 6 ч восстанавли-
вает его гидрирующую активность.
В процессе эксплуатации промышленных катализаторов на
установках гидроочистки степень (глубина) обессеривания
сырья снижается вследствие дезактивации контакта. Поэтому
периодически температуру в реакторе повышают, тем самым
поддерживают требуемую глубину обессеривания и деазотиро-
вания. Скорость дезактивации, которую можно охарактеризо-
вать скоростью подъема температуры при постоянной степени
обессеривания, зависит от химического состава и структуры
катализатора, физико-химических характеристик сырья и усло-
вий проведения процесса.
Основные причины дезактивации катализаторов гидрообес-
серивания— отложения кокса в порах катализатора и адсорбг
ция на поверхности содержащихся в сырье металлов (натрия,
никеля, ванадия, кремния, свинца, мышьяка) и сульфат-ионов
[132, 302, 325]. Эти вещества не удаляются при регенерации
катализатора и отрицательно влияют на процесс регенерации.
Рис. 63. Изменение относительной активное!и катализатора аОТц в зависимо-
сти от содержания Na2O и SiO2
11
163
Таблица 59. Характеристика свежего и равновесного
алюмокобальтмолибденового катализатора при переработке
остаточного сырья
Показатель Свежий катали ni гор Равновесный катализатор при переработке
мазута | гудрона
Насыпная плотность, кг/м3 832 1260 1340
Объем пор, см3/г 0,42 0,24 0,13
Удельная поверхность, м2/г 200 95 27
Средний радиус пор, нм Содержание, %: 4.2 5,1 10,0
кокса — 14,85 17,22
серы — 5,73 5,63
В частности, влияние натрия становится заметным при его со-
держании в катализаторе 0,2% (рис. 63). Натрий не только
закупоривает лоры катализатора, но и вызывает спекание при
температурах, ниже максимально допустимых при регенерации.
Кремний попадает в сырье с добавками, например с деэмуль-
гаторами, и дезактивирует катализатор, блокируя активные
центры, при содержании SiO2 выше 3—5% (см. рис. 63). Отрав-
ляющее действие металлов сходно между собой и сводится к
уменьшению удельной поверхности и объема пор.
Существующие промышленные катализаторы при переработ-
ке дистиллятных нефтепродуктов (включая вакуумные газойли
с к. к. 490—500°C), в которых практически не содержатся тя-
желые металлы, обладают достаточно высокой стабильной ак-
тивностью: срок службы до первой регенерации достигает 2—
0 1000 2000 3000 6000 5000 0 2000 6000 6000 6000
'загр>г/100г
Рис. 64. Изменение структуры катализатора КГ ДО в процессе гидрообессе-
ривания деасфальтизата арланской нефти:
/ — объем микропор (<15,0 нм); 2 — объем макропор (>15,0 нм); 3 — общий объем пор
F (3,7-7500,0 нм)
Рис. 65. Динамика изменения общего объема пор катализатора КГДО и
суммы загрязнений (С + S+V+Ni-I-Fe) в слое при длительных испытаниях
по гидрообессериванию деасфальтизатов арланской (1, V) и западносибир-
ских (2, 2') нефтей
164
Рис. 66. Динамика измене-
ния состава отложений на
катализаторе при гидро-
обессеривании деасфальти-
зата арланской нефти (низ
слоя)
3 лет. Для катализаторов гидрообессеривания тяжелых вакуум-
ных газойлей и нефтяных остатков проблема дезактивации
имеет первостепенное значение, так как стабильность и реге-
нерируемость таких катализаторов являются основными пока-
зателями, определяющими экономику процесса в целом [326,
327].
Дезактивация катализаторов гидрообессеривания тяжелого
нефтяного сырья состоит из двух стадий [145, 328]'; быстрое
снижение активности свежего катализатора в (начальный период
работы (50—100 ч), связанный с интенсивным отложением
кокса, и медленное снижение активности, обусловленное даль-
нейшим накоплением кокса и отложением металлов. При этом
происходит довольно значительное изменение структуры ката-
лизатора (табл. 59, рис. 64).
Таблица 60. Изменение характеристик алюмокобальтмолибденового
катализатора в процессе переработки остаточного сырья
Условия работы Объем пор, см¥г 5УД’ М2/Г Состав отложений, г/100 г
общий 1 микро С | S | V | Ni | Fe
Свежий 0,64 0,45 132 — — — — —
Сульфидированный сырьем 30 ч, 380 °C 0,63 0,41 107 1,2 2,7 — — —
Деасфальтизат арланской неф т и
10 ч, 380 °C, низ 0,58 0,35 116 4,4 4,8 0,6 0,3 0,05
50 ч, 380 °C, низ 0,48 0,31 83 5,0 6,1 2,2 0,8 0,15
300 ч, 380 °C, низ 0,40 0,24 79 5,7 7,8 6,6 2,5 0,20
То же, верх 0,52 0,33 — 5,3 3,2 1,2 0,5 0,15
1200 ч, 380 °C, низ 0,28 0,13 71 8,0 24,7 24,9 9,3 1,00
То же, верх 0,46 0,28 92 7,0 5,0 3,4 2,1 0,44
5000 ч, 410 °C, низ 0,08 0,01 12 10,3 35,2 34,2 Н,1 0,70
То же, верх 0,17 0,02 22 18,0 31 ,9 23,8 11,9 0,80
Деасфальтизат зап а д и ос и б и р( ' к о й нефти
300 ч, 380 °C, низ 0,43 0,26 — 6,0 4,0 3,4 0,8 0,20
То же, верх 0,57 0,32 7,0 3,0 0,9 0,5 0,20
1200 ч, 380 °C, низ 0,36 0,21 95 8,2 7,9 7,6 2,3 0,23
То же, верх 0,48 0,33 104 10,9 5,1 3,4 1,5 0,20
8000 ч, 410 °C, низ 0,05 0,02 11 11,4 21 ,4 25,2 5,1 1,10
То же, верх 0,09 0,03 16 16,4 18,9 14,8 7,8 1,20
165
Рис. 67. Профили распределения дезактивирующих элементов в зерне катали-
затора после 200 сут (а) и 333 сут (б) его эксплуатации
Исследование закономерностей изменения физико-химиче-
ских характеристик алюмокобальтмолибденовых катализаторов
в процессе их дезактивации при длительной эксплуатации по-
зволяет сделать следующие выводы [329—331]. По мере ра-
боты катализатора уменьшаются общий объем пор и удельная
поверхность, значительное изменение претерпевает и распреде-
ление пор по радиусам (табл. 60, рис. 65). Однако уменьше-
ние общего объема пор происходит преимущественно за счет
образования микропор радиусом до 15,0 нм. В отработанном
катализаторе средний радиус микропор составляет 5—6 <нм,
а их объем не превышает 1—2% объема микропор свежего
катализатора.
Снижение объема пор происходит симбатно увеличению за-
грязнений в объеме зерен катализатора. В начальный период
работы наиболее резко увеличивается содержание углерода и
серы (рис. 66). Через 50 ч работы содержание углерода во
входной зоне слоя катализатора достигает 5% ив дальнейшем
изменяется весьма незначительно. Наибольшее отложение угле-
рода наблюдается на краю зерна до глубины 150—200 мкм,
в остальной части зерна концентрация углерода одинакова.
Содержание металлов в катализаторе пропорционально дли-
тельности работы и зависит от их содержания в сырье, макси-
мум находится на глубине 200—300 мкм от поверхности зерна
катализатора. Характерно, что железо проникает в глубь гра-
нул не более чем на 60—100 мкм и в основном блокирует вход-
ные поры (рис. 67).
Распределение серы характеризуется двумя пиками: основ-
ной пик, максимум которого расположен на глубине 200—
300 мкм, соответствует отложению ванадия, второй — железа.
Показано [330, 331], что металлы отлагаются в гранулах ка-
тализатора в сульфидной форме.
Экспериментальные данные позволили высказать следующую
гипотезу о механизме отравления катализаторов металлами.
166
Соединения металлов, например порфириновые комплексы,
самостоятельно или совместно с мицеллами асфальтенов диф-
фундируют в поры и отлагаются на поверхности. При их раз-
рушении происходит образование кокса и отложение металлов.
Скорость разложения асфальтенов описывается уравнением
второго порядка [331]:
(Xsc + %sr)/(*sc*sr) = « (Хас + Ха9/(ХасХаг),
где Xcs, Xrs — содержание серы в сырье и гидрогенизате, %; Хса, Хга— со-
держание асфальтенов в сырье и гидрогенизате, %; а— селективность ка-
тализатора.
Уменьшение активной поверхности катализатора во време-
ни для процесса в трехфазном псевдоожиженном слое выра-
жается уравнением
dtydx = —Ж + kr (1 — 0) + g (0О — 0),
где k — константа скорости отравления катализатора; k\ константа скорости;
частичной регенерации; 0О — активная поверхность свежего катализатора;
0 — доля свободной поверхности катализатора.
Первое слагаемое уравнения учитывает отравление катали-
затора асфальтенами, второе — отражает частичное восстанов-
ление активности за счет гидрирования асфальтенов, третье —
учитывает замену катализатора с кратностью циркуляции g.
Долю свободной поверхности в любой момент времени 0Т
можно определить из уравнения, полученного интегрированием
предыдущего уравнения:
Л — (л+лц т л л । л —ат
От = е или 0т = Л3 + Л1е
Содержание серы в гидрогенизате в момент времейи т опре-
деляется выражением
W = 1/Xsc + (k0/w) (Л3 4- Aie)~2\
где kQ — константа скорости гидрообессеривания при начальной активности
катализатора.
Это выражение хорошо описывает процесс быстрого отрав-
ления катализатора. Для описания свободной поверхности ка-
тализатора с учетом экспоненциальной зависимости изменения
содержания серы с различным показателем экспоненты на уча-
стках быстрого и медленного отравления предложено уравне-
ние
л . OCjT (Х'2^ . .
0-р = ~ |_ A^q | A:t.
Высказано предположение, что первое слагаемое характе-
ризует быстрое снижение активности катализатора за счет кок-
сообразования, второе — отравление катализатора металлами
и коэффициент А3 — остаточную активность отработанного ка-
тализатора.
167
Таблица 61. Экспериментальные значения коэффициентов
для мазутов, полученных из различных нефтей
Показатель Венесуэль- ская нефть Татарская нефть Арланская нефть
Температура обессеривания, °C 416 400 400
Давление, МПа 14 10 10
Объемная скорость подачи сырья, ч~‘ 1,0 0,5 0,5
Содержание серы, % 2,03 2,65 3,86
Коксуемость, % 14,0 8,5 9,0
Значения коэффициентов:
А 0,325 0,665 0,810
А 0,486 0,285 0,154
0Ц 0,00497 0,0529 0,0576
(12 0,000345 0,00335 0,00833
А 0,189 0,050 0,035
*0 0,70 2,08 3,50
Используя это уравнение, содержание серы в гидрогенизате
будет равно
1/Xsr = 1/-Vsc + (k0/w) (A1e~ai't + Л2е-“2Т + Д3).
Экспериментальные значения коэффициентов Alf А2, оц, аг,
А3 приведены в табл. 61.
5.4. РЕГЕНЕРАЦИЯ КАТАЛИЗАТОРОВ
Срок службы промышленных катализаторов определяется
скоростью дезактивации, которая зависит как от состава ката-
лизатора (природы и концентрации активных металлов), сте-
пени дисперсности металлов на носителе, наличия и содержа-
ния модификаторов, способа синтеза композиции, так и от
качества перерабатываемого сырья (фракционный и групповой
состав, содержание примесей, являющихся каталитическими
ядами) и условий проведения процесса. Для катализаторов
гидрогенизационных процессов нефтепереработки характерен
достаточно длительный срок службы. В табл. 62 в качестве
Примера приведены усредненные данные показателей работы
отечественных промышленных катализаторов на установках
гидроочистки дизельного топлива. Срок службы до регенера-
ции катализаторов гидрокрекинга, гидродеароматизации и се-
лективного гидрокрекинга также составляет не менее 11 мес.
Причиной постепенного снижения активности катализаторов
дистиллятных фракций и вакуумного газойля является, как
показано в предыдущем разделе, накопление кокса на поверх-
ности. Поэтому периодически для восстановления активности
катализатор регенерируют непосредственно в реакторах путем
окислительного выжига кокса при температурах 450—550 °C
[332—338].
168
Таблица 62. Свойства отечественных промышленных катализаторов
гидрообессеривания и показатели работы установок
гидроочистки дизельного топлива
Показатель АКМ АНМС ю U 6 ГС-168Ш ГКД-202
Суммарное содержа- ние гидрирующих компонентов, % 16 17 26 28 17 16
Насыпная плотность, кг/м3 680 680 800 830 750 650
Удельная поверхность, м2/г 120 120 227 180 220 230
Диаметр гранул, мм 4—5 4—6 3,5 4 3-5 1,5-2,2
Индекс прочности, кг/мм 1,1 1,1 1,8 1,2 1,9 2,2
Общее давление в ре- акторе, МПа 3,1 3,1 3,1 3,0 3,4 3,4 3,4 3,3
Объемная скорость 3,0—3,5 3,5 подачи сырья, ч-1 4,0 4,0 4,0 4,0 4,4 5,0
Начальная темпера- тура процесса, °C Содержание серы, %: 375 375 360 365 380 366 360 350
сырье 0,70 0,75 । 1,00 0,80 0,80 0,65 1,20 0,80
гидрогенизат 0,10 0,15 0,12 0,08 0,09 0,09 0,14 0,10
Межрегенерационный период, мес 11 11 20 11 11 22 22 24
Общий срок службы 36 катализатора, мес 36 48 48 48 36/48* 48/60* 50/60*
* В числителе указан фактический срок службы, в знаменателе — ожидаемый.
Динамика отложений кокса на катализаторе гидрогениза-
ционной переработки дистиллятных фракций в зависимости от
рабочих условий в период стационарной активности может
быть представлена в виде уравнения
1/С = 1/Соо + В/т,
где 1/С — величина, обратная содержанию кокса; т—время работы катали-
затора; С» — предельное содержание кокса при т—оо; В — коэффициент
учитывающий скорость коксообразования в зависимости от условий процесса.
Установлено, что содержание кокса на катализаторе умень-
шается при снижении температуры процесса, объемной скоро-
сти подачи сырья, показателя коксуемости сырья и повышении
рабочего давления [339]. Предельное содержание кокса и серы
на катализаторе перед регенерацией при переработке различ-
ных видов нефтяного сырья показано в табл. 63.
Кинетика окисления кокса. В зависимости от природы
металлов и химического состава катализаторов состав и мор-
фологические характеристики отложений кокса могут суще-
ственно различаться. Методами ДТА было показано, что для
169
алюмокобальтмолибденовых катализаторов кокс, полученный
при разном времени закоксовывания и при переработке раз-
личного сырья, практически не отличается по своим свойствам.
Степень окисления кокса зависит от температуры процесса, от
концентрации и скорости подачи кислорода [332]. Так, из
рис. 68 видно, что абсолютное содержание трудновыжигаемых
компонентов кокса возрастает пропорционально общему коли-
честву кокса на катализаторе. При низких температурах и не-
которой минимальной концентрации кислорода окисление кокса
протекает в кинетической области по всему объему частицы.
Повышение температуры интенсифицирует окисление с перехо-
дом его во внешнедиффузионную область, где основными фак-
торами, определяющими скорость реакции, становятся скорость
подвода кислорода и отвода продуктов окисления из глубины
частицы. Выявлены следующие общие закономерности [333]:
для данного носителя (катализатора) скорость выжигания
углерода практически не зависит от происхождения и струк-
туры кокса;
кинетика горения кокса на оксидах кремния и алюминия
имеет как качественные, так и количественные сходства с ки-
нетикой горения чистого графита, что свидетельствует о нека-
талитичсском характере процесса;
введение оксидов некоторых переходных металлов (хрома,
никеля, ванадия) повышает скорость горения кокса при лю-
бых температурах.
Справедливость этих закономерностей можно проиллюстри-
ровать зависимостями на рис. 69, из которого видно, что про-
цесс выжига совершенно не зависит от природы или метода
отложения кокса на алюмосиликатном катализаторе, оксидном
АКМ катализаторе, на оксиде кремния, магния и алюминия
(прямая /). Введение Сг2О3 (кривые 2, 3) резко увеличивает
скорость окисления без изменения величины кажущейся энер-
гии активации, которая составляет 157,4+6,7 кДж/моль [332].
Кинетика окислительного выжига кокса на промышленном
катализаторе гидроочистки, в частности АКМ катализаторе (со-
Рис. 68. Изменение степени окисления кокса акоксокис от температуры t на
образцах с содержанием кокса 2,3% (О), 5,7% (•) и 10,8% (^)
300400 500 600
t°c
Рис. 69. Изменение времени окисления кокса от температуры (пояснения в
тексте)
170
Рис. 70. Скорость горения кокса на оксидном (1) и сульфидном (2) ката-
лизаторах
Рис. 71. Изменение степени окисления серы от окисления кокса на оксидном
(1) и сульфидном (2) катализаторах
держание кокса 8,5—12,3%) исследована в кинетической обла-
сти при температуре 400—420 °C и подаче смеси воздуха и
азота (концентрация кислорода 1,1%) со скоростью 600 м3/м3
катализатора. Результаты подчиняются реакции первого по-
рядка:
k = (1/C) (dC/dx) = 4-107 exp [— (37 600 ± 1600)//??].
Для оксидного катализатора £ = 0,00023 мин-1 или 0,138 ч-1,
для сульфидированного катализатора £ = 0,00322 мин-1 или
0,193 ч-1. Увеличение константы для сульфидированного ката-
лизатора на 40% свидетельствует о катализирующем влиянии
на процесс горения кокса сульфидов молибдена и кобальта
(рис. 70).
В промышленных условиях скорость выжига кокса даже в
интервале температур 500—550 °C ниже в сравнении с лабора-
торными опытами при 420 °C. Это связано с тем, что процесс
ведут при недостатке кислорода из-за неполного отвода тепла
Таблица 63. Содержание кокса и серы на катализаторе
перед регенерацией
Сырье р, МПа /, °C W, ч—1 Расход газа, мЗ/мЗ сырья с, Xs. %
Бензин 30 360-400 5 200 300 7 8 0,5—1,0
Керосин 30 360—400 3 400—600 8-9 0,5—1,0
Дизельное топли- 30 370-420 3 300—400 9—10 1,0-1,5
во Вакуумный дис- 50 380 1 ,о 600 12,2 —
тиллят То же 50 420 1,0 600 13,5
200 460 0,5 1000 4,9 —
Мазут 100 425 1,4 1000 20,0 —
171
Рис. 72, Уменьшение удельной поверхности катализаторов А5УД, прокален-
ных в атмосфере водяного пара при 650 °C в течение 24 с, в зависимости от
начальной удельной поверхности оначуд (а) и содержания активных метал-
лов Хм (б):
О — NiMo; СоМо
реакции. Такие условия обусловливают проведение регенера-
ции в диффузионной области с послойным выгоранием кокса в
слое и в гранулах катализатора.
Во время регенерации катализатора наряду с выжигом
кокса протекает окисление сульфидов гидрирующих металлов.
Этот процесс особенно важен для АКМ и АНМ катализаторов,
которые перед использованием подвергаются сульфидированию.
Установлено, что при температурах 400—420 °C сульфиды ко-
бальта и молибдена практически полностью окисляются (98%)
на предварительно несульфидированном катализаторе, а кокс
окисляется всего на 65% (рис. 71). В тех же условиях для
предварительно сульфидированного катализатора наблюдается
большая глубина окисления кокса (86%). Для обоих катали-
заторов отмечено резкое замедление окисления сульфидов ме-
таллов по мере увеличения степени выжига кокса. Для оксид-
ного катализатора после регенерации характерно меньшее со-
держание серы во внутренних слоях и большее — во внешних;
остаточный кокс располагается в обратном порядке. В случае
предварительно сульфидированного катализатора остаточная
сера преимущественно сосредоточена во внутренних слоях гра-
нул.
Температура и скорость нагрева. Алюмокобальт- и алюмо-
никельмолибденовые катализаторы обладают достаточно высо-
кой стабильностью при термической и термопаровой обработ-
ке. Недостаточно высокая активность катализатора после ре-
генерации может быть следствием как неполного выжига кокса,
так и необратимых изменений фа-
зового и структурного состава
(уменьшение активной поверхности
и объема пор). На примере
промышленных АКМ и АНМ
серии
ката-
прочно-
Рис. 73. Изменение механической пр-
ети катализатора Дпр от скорости подъема
температуры А/:
-------- — исходная механическая прочность
172
Таблица 64. Влияние условий регенерации на удельную поверхность и фазовый
состав промышленных катализаторов
Состав катализатора, % 5уд’ М2/Г Д5уд после обра- ботки, % Кристаллические фазы в катализаторе после обработки в атмосфере
NiO или СоО МоОз Р 550 °C, 305 ч 650 °C, 72 ч 760 °C, 1 ч воздуха водяного пара при 650 °C, 24 ч
500 сС, 305 ч 1 650 °C, 7 ч | 760 °C, 1 ч
Алюмоникельмолибденовые катализаторы
3,3 15,7 1,4 173 3 9 52 у-А12О3 NiMoO4 А12(МоО4)3 у-А12О3
3,2 17,9 0,7 128 0 27 55 у-А120э у-А12О3 А12(МоО4)3 у-А12О3
3.1 14,3 Следы 274 0 11 38 у-А1203 А12(МоО4)3 Al2(MoO4)3 + NiMoO4 у-А12О3
2 9 12.0 2.1 164 0 2 51 у-А12О3 NiMoO4 А12(МоО4)3 у-А120з
Алюмокобальтмолибденовые катали заторы
3,4 15,1 Следы 319 14 29 27 у-А120з у-А12О3 у-А120з у-А12О3
5,7 10,9 2,9 162 0 0 0 — — — —
3,3 15,2 1,9 168 1 2 40 СоМоО4 СоМоО4 А12 (Мо04) з 4“ СоМоО4 CoMoOi
2,6 10,8 Следы 177 1 30 60 у-А120з СоМоО4 АММоО4)3 у-А120з
лизаторов установлено [334], что относительная активность
в атмосфере воздуха при 550 °C в течение 305 ч или водяного
пара при 650 °C в течение 24 ч не оказывает существенного вли-
яния на удельную поверхность и фазовый состав катализаторов
(табл. 64).
При температуре 550°C образуются каталитически неактив-
ные компоненты — никелевые и кобальтовые шпинели — и в
значительной степени происходит спекание, сопровождающееся
уменьшением удельной поверхности и объема микропор [334—
336]. При этом спекание в большей степени отмечается у ка-
тализаторов с высокой исходной удельной поверхностью
(рис. 72) и с высоким содержанием оксидов металлов [334].
При температурах 600—760 °C происходит возгонка молибдена
[302], а при более высоких температурах (800—900 °C) изме-
няется фазовый состав носителя, что ведет к снижению актив-
ности и прочности катализатора [332, 336, 338].
Таким образом, окислительную регенерацию катализаторов
гидрогенизационных процессов нефтепродуктов рекомендуется
проводить при температурах в реакторе не выше 550—600 °C.
Кроме того, следует учитывать, что при использовании катали-
заторов не допускается резкое снижение или повышение тем-
пературы. Поэтому нагревают или охлаждают катализатор
при пониженных скоростях с целью выравнивания температур-
ного поля по всему слою и сечению гранул. Так, при увеличе-
нии скорости изменения температуры до 300 °C в час прочность
катализатора снижается вдвое (рис. 73). Для промышленных
катализаторов рекомендована скорость подъема до 30°C в час
и, как исключение, не более 50 °C в час [332].
Технология процесса регенерации. Процесс регенерации ка-
тализаторов включает следующие стадии [332]:
подготовка катализатора,
замена водородсодержащего газа на инертный газ или во-
дяной пар,
нагрев катализатора до начала горения кокса,
начальный период выжига кокса,
установившийся режим регенерации,
окончательная стадия регенерации.
Ниже стадии регенерации катализаторов гидрогенизацион-
ных процессов нефтепереработки рассмотрены более подробно.
Подготовка катализатора — первая стадия регенерации.
Перед регенерацией! расход перерабатываемого сырья посте-
пенно понижают и переходят на циркуляцию водородсодержа-
щего газа для десорбции части адсорбированных тяжелых про-
дуктов. Если переработке подвергали вторичное сырье, подачу
сырья прекращают и затем проводят промывку катализатора
растворителем (бензином или легким дизельным топливом)
[382, 340]. Обработка катализатора раствором позволяет со-
кратить на 20—30% время выжига кокса, избежать резких
подъемов температур, особенно в начальный период регенера-
174
Рис. 74. Температурный режим в начальный период регенерации с промывкой
(а) и без промывки (б):
цифры у кривых — номера термопар
ции. Из рис. 74 видно, что если регенерацию проводить без
промывки растворителем, то отмечаются резкие колебания,
превышающие 550 °C [332]. Рекомендуемые режимы промывки
катализаторов растворителями приведены ниже:
Температура, °C 200 (бензин)
300 (дизельное топливо)
Давление, МПа . 2,5—5,0
Расход газа, м3/м3 катализатора . 300—600
Удельный расход растворителя, м3/м3 катализа-
тора . . 10—15
Объемная скорость подачи растворителя, ч-1 2—5
Контроль за ходом промывки растворителем ведут по объ-
ему остатка после разгонки дизельного топлива или бензина,
пропущенного через реактор.
На стадии замены водородсодержащего газа при газовоз-
душной регенерации всю систему продувают инертным газом,
поддерживая избыточное давление до 0,3 МПа, до концентра-
ции Н2 в отходящем газе ^0,2% (об.). При паровоздушной ре-
генерации после продувки системы инертным газом последний
постепенно заменяют водяным паром с выводом отходящих
газов в дымовую трубу при температуре 300—350°C и давле-
нии до 0,3 МПа во избежание конденсации пара.
Катализатор «пропаривают» при температуре 370—420°C
и удельном расходе водяного пара 400—900 м3/ч на 1 м3 ката-
175
лизатора в течение 2—4 ч. Если катализатор предварительно
промыт растворителем, то остатки растворителя, а также вы-
сокомолекулярных соединений, наиболее богатых водородом,
десорбируются в течение нагрева катализатора от температуры
окисления до температуры регенерации.
Начальный период выжига кокса — наиболее ответственная
операция с тонкой регулировкой подачи воздуха во избежание
перегрева и спекания катализатора. Расход воздуха в этот
период поддерживается минимальным — около 1,0% в потоке
инертного газа, и далее его увеличивают постепенно, послойно
регулируя плавное повышение температуры во всех зонах до
500—530 °C с максимальной температурой в отдельных точках
не выше 550 °C (см. рис. 74) [332]. По достижении темпера-
туры катализатора 500—530 °C расход воздуха устанавливают
постоянным — 5,0—8,0% общего расхода циркулирующего газа.
После завершения подъема температуры процесс регенера-
ции протекает в установившемся режиме, при этом тщательно
контролируют температуры по зонам и поддерживают концент-
рацию кислорода не выше 1,0% (после конденсации водяного
пара). Максимальная температура горения кокса наблюдается
в верхних слоях катализатора, где концентрация кислорода
максимальна. Градиент температуры газового потока по реак-
тору при газовоздушной регенерации достигает 40—50 °C и при
паровоздушной регенерации 55—65 °C.
Основные условия газовоздушной и паровоздушной регене-
рации АКМ и АНМ катализаторов приведены ниже:
Газовоздушная Паровоздушная
регенерация регенерация
Температура в зоне катализатора, °C 520—550 500—520
Давление в реакторе, МПа 3—4 0,2—0,3
Расход газа, м3/ч на 1 м3 катализатора 450—900 250—625
Температура циркулирующего газа, °C: на входе в реактор 370-420 370-420
на выходе из реактора 430—470 430-470
Содержание О2 в инертном газе (паре) на входе в реактор, % (об.): в начале регенерации 0,5 0,5
в конце регенерации До 2,0 До 2,0
В завершающем периоде регенерации для выжига глубин-
ного трудноокисляемого кокса необходимо повысить темпера-
туру газа на выходе из печи. При этом снижается температура
в реакционной зоне и увеличивается содержание кислорода в
отходящих газах. Регенерация считается законченной, когда
концентрация кислорода в дымовых газах сравняется с кон-
центрацией его на входе в реактор, т. е. 15,0—18,0% (об.),
а концентрация оксида углерода будет менее 5,0 (об.).
Для перевода регенерированного катализатора в рабочий ре-
жим прекращают подачу воздуха, систему продувают водяным
паром для удаления кислорода и одновременно понижают тем-
пературу до 250—300 °C. Систему продувают инертным газом,
176
Рис. 75. Схема регенерации катализаторов с промывкой дымовых газов:
1 — теплообменники; 2, 3 — циркуляционные компрессоры; 4 — колонна; 5 — печь; 6 — ды-
мовая труба; 7 — реакторы; 8, 9 — ресиверы
охлаждая ее до 200°C, переводят на циркуляцию сначала
инертного газа, затем водородсодержащего газа; ступенчато
повышают температуру до рабочей и начинают подачу сырья.
Технологические схемы регенерации. Газовоздушная регене-
рация осуществляется по следующим технологическим вариан-
там. Схема регенерации с промывкой дымовых газов пред-
ставлена на рис. 75 [332].
Инертный газ циркуляционным компрессором 3 через теп-
лообменник 1 направляется в печь 5 и после нагрева до 400—
450 °C поступает в последовательно соединенные реакторы 7.
В поток циркулирующего инертного газа компрессором 2 на-
гнетается воздух в заданном количестве. Дымовые газы, про-
ходя теплообменники, нагревают перед печью поток инертного
газа и поступают в скруббер 4, где промываются раствором
соды, подаваемым противотоком, и охлаждаются до 40—45 °C.
Из верхней части скруббера газы, охлажденные и очищенные
от кислых компонентов, проходят через каплеотбойник 8, рес-
сивер 9 и поступают на прием циркуляционного компрессора3.
Часть газов через дымовую трубу 6 может отводиться в атмо-
сферу.
Особенностью бесскрубберной технологической схемы газо-
воздушной регенерации (рис. 76) является следующее. Дымо-
вые газы из реактора 5 поступают в смеситель 6, куда насосом
подается раствор щелочи или соды. Газожидкостной поток пос-
ле охлаждения в теплообменнике 3 поступает в сеператор вы-
сокого давления 7, из которого дымовые газы, освобожденные
от кислых компонентов, направляются па прием к циркуля-
12—922
177
Щелочь
Рис. 76. Схема бесскрубберной газовоздушной регенерации:
/ — компрессор подачи воздуха; 2 — циркуляционный компрессор инертного газа; 3 — теп-
лообменник; 4 — печь; 5 — реактор; 6 — смеситель; 7 — сепаратор; 8 — ресивер; 9 — ем-
кость щелочи; 10 — насосы
ционному компрессору 2, а вода из сепаратора 7 сбрасывается
в канализацию.
С целью сокращения объема сточных вод и экономии щело-
чи предложена технология с рециркуляцией 6,0—7,0%-го раство-
ра соды в верхнюю часть скруббера 4. Частично отработанный
раствор соды охлаждается в холодильниках 8 (рис.77).Охлаж-
денный содовый раствор собирается в промежуточную емкость
7 и закачивается в скруббер 4 [341, 342].
Технология паровоздушной регенерации (рис. 78) отличает-
ся простотой. Водяной пар поступает из заводского коллекто-
ра, смешивается с потоком воздуха перед печью 1 и поступает
в реактор 2. Процесс осуществляют при давлениях, близких к
атмосферному. Дымовые газы вместе с водяным паром после
реактора отводятся в дымовую трубу 3 [332].
Регенерация цеолитсодержащих катализаторов. Для реге-
нерации металлцеолитных катализаторов применяют те же
способы, что и для других катализаторов. Однако особое вни-
мание следует уделять сохранению кристаллической структуры
цеолита и предотвращению дезактивации катализаторов в ре-
зультате миграции катионов, агломерации металлов и дегидра-
тации поверхности [200].
Легкость окислительной регенерации при 400—550 °C (пос-
ле отдувки летучих компонентов с катализатора инертным га-
зом или водяным паром) зависит от типа цеолита, состава ка-
тализатора и от продолжительности непрерывной работы. Как
178
Свемая бода
Рис. 77. Схема регенерации катализатора с рециркуляцией содового рас-
твора:
/ — трубчатая печь; 2 — реакторы; 3 — теплообменники высокого давления; 4 — скруббер;
5 — водоотделитель дымовых газов; 6 — дымовая труба; 7 — щелочный отстойник; 8 —
погружные холодильники; 9 — емкость МЭА; 10, 12 — емкости; // — циркуляционный ком-
прессор; 13 — насосы
правило, мелкопористые цеолиты регенерируются труднее круп-
нопористых. Термическая и термопаровая стабильность цеоли-
тов возрастает с увеличением мольного отношения SiC^/AUOa
в цеолите.
Кинетика окислительной регенерации цеолитов зависит от
структуры кристаллической решетки. Показано, например,
[339], что в начальный период окислительной регенерации за-
коксовывания цеолитов СаА, СаХ и NaX порядок реакции по
коксу составил 1 и 0 соответственно. После выгорания 30—40%
кокса для СаА он становится равным 2, для цеолита СаХ—1,
а для NaX после выгорания 55—60% кокса — 2. При этом сле-
дует учитывать, что условия окислительной регенерации часто
не совпадают с условиями активации. Поэтому после регенера-
Рис. 78. Схема паровоздуш-
ной регенерации:
/ — печь; 2 —реактор; 3 — дымо-
вая труба
пар
12
17»
ции необходимо вновь проводить активацию. Если после окис-
лительной регенерации происходит агломерация кристаллов,
то катализатор обрабатывают сероводородом, вторично сульфи-
дируют и затем восстанавливают воздухом.
Глава 6
МЕТОДЫ ИССЛЕДОВАНИЯ КАТАЛИЗАТОРОВ
Соответствие показателей качества промышленного катали-
затора техническим условиям является обязательным требова-
нием при его выпуске и отгрузке потребителю. Для катализа-
торов гидрогенизационных процессов нефтепереработки опреде-
ляют физико-механические характеристики (гранулометриче-
ский состав, насыпную плотность, содержание влаги, механиче-
скую прочность гранул, удельную поверхность, пористую струк-
туру) и каталитическую активность.
Каждая товарная партия катализатора, количество которой
специально регламентируется в технических условиях, оцени-
вается по этим показателям в соответствии со стандартными
методами по ОСТ 3801130—77. Кроме того, в процессе произ-
водства катализатора на промышленной установке проводят
аналитический контроль качества полупродуктов по отдельным
операциям. Места отбора проб для аналитического контроля,
методы контроля и их периодичность указаны в технологиче-
ском регламенте на производство катализатора.
Наряду со стандартизованными методами анализа качества
промышленных катализаторов существуют многочисленные ме-
тоды исследования, применяемые в лабораторной практике.
Это — физические методы исследования разрабатываемых ка-
тализаторов с целью изучения генезиса структуры и фазового
состава на каждом этапе технологической цепочки, а также
исследование изменения состояния катализатора в процессе
его эксплуатации.
Для оценки удельной поверхности, объема пор и распреде-
ления пор по радиусу используют метод физической адсорбции
газов и ртутной порометрии. Информацию о структуре катали-
заторов дают такие методы, как электронная и лазерная спект-
роскопия, рентгеноструктурный анализ. Состояние поверхности
катализатора, т. е. химия поверхностных соединений, валентное
и электронное состояние, источник и направление электронного
переноса позволяют оценить такие методы, как ИК-, ЭПР-,
ЯМР-спектроскопия, РФЭС, термогравиометрия, термопрограм-
мированное восстановление, дифракция электронов.
180
6.1. ОТБОР ПРОБ КАТАЛИЗАТОРА
От того насколько правильно выполнена операция отбора
проб катализатора, зависит представительность средней пробы,
по качеству которой судят о качестве партии в целом. Партия
катализаторов гидрогенизационных процессов загружается в
бочки вместимостью 100—200 л и может достигать общей мае-
ты до 5 т. Средняя проба отбирается при помощи щупа из
каждой пятой бочки в количестве 100—200 см3 (из нижних,
средних и верхних слоев). Отдельные пробы смешивают и по-
лучают исходную пробу, объем которой, как правило, превы-
шает необходимый для анализа и определения активности.
Для отбора лабораторной пробы исходную пробу сокращают
методом квартования. Для этого исходную пробу катализатора
высыпают на ровную поверхность, тщательно перемешивают в
течение 5—6 мин и формуют коническую кучу, насыпая ката-
лизатор на ее вершину со всех сторон. Затем конус сплющи-
вают, надавливая на вершину твердой пластиной, и получают
цилиндрический слой. Этот слой с помощью делителя-кресто-
вины делят на четыре равные части и из двух противополож-
ных частей убирают весь .'катализатор. Оставшиеся две части
катализатора используют в качестве лабораторной пробы.
Если объем оставшейся пробы оказался слишком большим,
его сокращают последовательным квартованием. Аналогично
отбирают арбитражную пробу катализатора, которая хранится
на заводе-изготовителе в течение 2—3 лет.
От лабораторной пробы отбирают 150—200 см3 катализа-
тора для оценки каталитической активности на опытно-про-
мышленных установках. Оставшуюся часть пробы высыпают
на гладкую поверхность, перемешивают, придают ей форму
конуса, разравнивают тонким слоем и с помощью специальной
линейки делят на квадраты со сторонами 2—5 см и в шахмат-
ном порядке отбирают катализатор для аналитической пробы.
6.2. ФИЗИКО-МЕХАНИЧЕСКИЕ ХАРАКТЕРИСТИКИ
Гранулометрический состав катализаторов, т. е. содержание
частиц различных размеров, определяют в лабораторной про-
бе ситовым методом. Через сита с отверстиями уменьшающих-
ся размеров последовательно пропускают пробы катализатора
и взвешивают массы вещества, проходящего через каждое
сито. Крупность гранул катализатора обозначают в миллимет-
рах соответственно размерам отверстий сита или его номеру.
Для рассева сыпучих материалов существуют специальные наборы сит.
По отечественной системе сетки, из которых изготавливаются сита, делятся
на шесть классов: наименьшая с площадью отверстий до 0,025 мм?, мель-
чайшая— от 0,025 до 0,250 мм2, мелкая —от 0,250 до 1,00 мм2, средняя —
от 1,00 до 25,00 мм2, крупная — от 25,00 до 625,00 мм'1, очень крупная —
свыше 625,00 мм2 Для рассева гранулированных к; алн кагоров применяют
181
сита из штампованных сеток с крупными или щелевидными отверстиями.
Обычно номер сита определяется линейным размером отверстий в свету.
У промышленных катализаторов, выпускаемых в виде экс-
трудатов-цилиндров диаметром от 1,0 до 5,0 мм практическое
значение имеет не абсолютный гранулометрический состав,
а содержание в партии пыли и мелочи, которое регламентиро-
вано техническими условиями. Пыль и мелочь могут образо-
ваться не только при производстве катализатора, но и в ре-
зультате неправильного транспортирования и хранения. Поэто-
му перед загрузкой катализатора в реактор промышленной
установки следует определить гранулометрический состав его
и в случае необходимости провести рассев катализатора.
Насыпная плотность — важный показатель качества катали-
затора, работающего в стационарном слое. По этому показа-
телю находят массу загрузки в промышленный реактор, а сле-
довательно, и производительность катализатора. Для опреде-
ления насыпной плотности используют образец катализатора
в сухом состоянии, поэтому предварительно катализатор сушат
при температуре более 150 °C до постоянной массы. Если влаж-
ность пробы известна, определение насыпной плотности прово-
дят без сушки, вводя поправку на содержание влаги.
Мерный цилиндр вместимостью 100 см3, взвешенный с точностью до
0,01 г, с соотношением высоты к внутреннему диаметру не менее 10 : 1, за-
полняют катализатором, осторожно постукивая цилиндр о деревянную по-
ставку. Для уплотнения можно использовать вибратор. Цилиндр заполняют
до отметки 100 см3. Затем взвешивают цилиндр с катализатором и вычисля-
ют насыпную плотность (в кг/м3).
Чтобы получить более полную информацию, определяют также кажу-
щуюся и истинную плотности. В лабораторной практике с этой целью исполь-
зуют прямые методы, основанные на измерении объема жидкости, вытесняе-
мой при погружении катализатора, и косвенные с использованием замеров
потери массы при гидростатическом взвешивании или на измерении гидроди-
намических характеристик слоя при фильтровании через него жидкости или
газа [343].
Ртутный пикнометрический метод определения кажущейся плотности ос-
нован на измерении объема навески катализатора, численно равной разно-
сти объемов (массы) ртути, помещающейся в пустом и заполненном катали-
затором пикнометре. Кажущуюся плотность катализатора вычисляют по
формуле
р = 13546/?гк/(/П1 + шк — ш2),
где 13546 — плотность ртути при 20 °C, кг/м3; тк—масса навески катализа-
тора, г; mi — масса пикнометра со ртутью, г; т2 — масса пикнометра с ката-
лизатором и ртутью, г.
Водяной метод основан на определении объема воды, вытесняемой при
погружении в нее частиц катализатора, поры которого предварительно за-
полнены водой. Этот метод можно использовать в том случае, когда погру-
жение катализатора в воду не приводит к его набуханию, растворению ком-
понентов или химическому взаимодействию. Методика определения описана
в работе [343]. Кажущуюся плотность катализатора вычисляют по урав-
нению
Рк = mK'(V2 — vj,
где тк — навеска катализатора, г; Vi, V2— объем воды в цилиндре до и после
погружения катализатора, см3.
182
Истинную плотность катализатора определяют пикнометрическим спосо-
бом, основанном на вытеснении катализатором ртути, воды, спиртов, угле-
водородов, инертных газов. Истинную плотность вычисляют по формуле
Рк = /ПкРж/(«’1 + П1К — т2)>
где т:< — навеска катализатора, г; рж — плотность жидкости в условиях из-
мерения, кг/м3; — масса пикнометра с жидкостью, г; т2— масса пикно-
метра с катализатором и жидкостью, г.
Содержание влаги адсорбированной и химически связанной
в катализаторах зависит от их структуры, химических свойств,
условий получения, транспортирования и хранения. При анали-
зе катализаторов многие показатели качества определяют в
расчете на сухое вещество.
Для определения содержания влаги в катализаторе навеску 2,0—3,0 г
помещают в фарфоровый или платиновый тигель, доведенный до постоянной
массы и взвешенный с точностью 0,0002 г. Прокаливают тигель с навеской в
муфельной печи при 550—650 °C до постоянной массы и после охлаждения
в эксикаторе над СаС12 взвешивают. Содержание влаги (W, %) вычисляют
по формуле
U7 = (т0 — гП]) • 1ОО/то,
где zn0, — масса влажной и прокаленной навески катализатора, г.
Механическую прочность гранул определяют по усилию, вы-
зывающему разрушение гранул при раскалывании или раздав-
ливании, а также по сопротивлению на истирание при стати-
ческих или динамических нагрузках. Большинство катализато-
ров гидрогенизационных процессов применяют в реакторах со
стационарным слоем с загрузкой от 10 до 120 т. При загрузке
я эксплуатации катализатор не должен разрушаться, поэтому
показатель механической прочности гранул регламентируется
техническими условиями.
Известны различные методы и приборы для оценки механи-
ческой прочности катализаторов, однако на практике исполь-
зуют лишь некоторые из них. Для катализаторов гидрогениза-
ционных процессов, получаемых экструзионным формованием
в виде гранул, используют метод разрезания или раскалыва-
ния и метод раздавливания [343}.
Механическую прочность гранул катализаторов на раскалы-
вание определяют в соответствии с ОСТ 3801130—77 и техни-
Рис. 79. Прибор для определения механической прочности гранул катализа-
тора методом раздавливания:
/ — стойка; 2 — рейка; 3 — противовес; 4 — стальной нож; 5 — подо анк.
грузы
183
ческими условиями на приборе типа десятичных весов со спе-
циальным ножом. Устройство прибора показано на рис. 79.
Рейка 2 имеет риски и цифры через каждые 10 мм, а сменные-
грузы — это набор стальных дисков 100, 200, 400, 800, 1000
и 2000 г. Обычно механическую прочность катализатора на
раскалывание определяют, разрезая гранулу поперек, реже —
вдоль ее образующей. С этой целью гранулу катализатора
укладывают в желоб подставки, подводят под нож, одевают
на рейку до крайнего левого положения грузы и осторожно
опускают рычаг до соприкосновения ножа с гранулой. Затем
постепенно передвигают грузы вправо до разрушения гранулы.
Разрушающую нагрузку рассчитывают по правилу рычага:
Р =
Р — разрушающая нагрузка, Н; т— вес груза, г; 1\ — расстояние от на-
чала шкалы (ось рейки) до центра груза, см; /2— расстояние от начала шка-
лы до середины ножа, см.
За показатель прочности образца катализатора на раскалы-
вание принимают среднее значение разрушающей нагрузки из
30 определений. На практике для сравнения катализаторов ис-
пользуют не абсолютное значение разрушающей нагрузки,
а величину удельной прочности или коэффициент прочности,
который вычисляют отнесением величины разрушающей на-
грузки на 1,0 мм диаметра гранулы.
Прочность гранул на раздавливание можно определять на
описанном выше (приборе типа десятичных весов, в котором
вместо ножа устанавливают специальный кулачок с плоским
торцом. Гранулу катализатора помещают на ровную сторону
подставки и аналогичным образом находят разрушающую на-
грузку на раздавливание. Удельную разрушающую нагрузку
на раздавливание Руд вычисляют по формуле
руд = 4Р/(лб/2),
где Р — разрушающая нагрузка на раздавливание по торцу, Н; d — диаметр
гранулы, мм.
Для определения прочности гранул на раздавливание ис-
пользуют также механические и гидравлические прессы.
Из них интерес представляют приборы на основе гидравличе-
ских (масляных) прессов со специальной гидравлической си-
стемой, обеспечивающей равномерность повышения нагрузки
с заданной скоростью. По этому методу гранулу катализатора
помещают между стержнем с плоским торцом и поршнем. Аб-
солютное значение разрушающего усилия Р вычисляют по
уравнению
Р = -Рм^п,
где —давление по манометру в момент разрушения, Н/см2; Sn — площадь
поршня, см2.
184
Удельное разрушающее усилие на единицу площади сечения
гранулы находят по формуле
Руд = 0,01 PMsn/SK,
где SK — площадь сечения гранулы катализатора, мм2.
Механическая прочность катализаторов, оцененная по со-
противляемости динамическим нагрузкам по методу разбива-
ния гранул на копре, имеет значение для выбора способа за-
грузки промышленного реактора. Для определения механиче-
ской прочности гранулы сбрасывают с разной высоты на мас-
сивную плиту или грузы (бойки) на гранулы [344]. Прибор
для определения механической прочности гранул методом ди-
намических испытаний представлен на рис. 80.
Устройство для регулирования высоты сбрасывания состоит
из направляющей трубки 8, держателя 10, шкалы 6 и указа-
теля высоты 7. Имеется набор бойков с массами 0,5, 1,0, 2,0,
5,0, 10,0, 20,0, 50,0 г. Высоту сбрасывания бойков можно регу-
лировать в пределах от 1,0 до 125,0 см.
Механическую прочность гранул оценивают по энергии, не-
обходимой для разрушения половины гранул пробы. Для со-
кращения продолжительности анализа строят вспомогательный
график. Выбирают боек с массой т и сбрасывают его на гра-
нулы с разных высот h с интервалами 2—5 с. При каждом
сочетании mh испытывают 10—15 гранул, определяя долю не-
разбитых. По результатам строят график зависимости доли
целых гранул от энергии бойка и находят значение энергии
разрушения половины гранул.
Удельная поверхность вместе с суммарным объемом пор
и распределением их по размеру характеризует структуру но-
сителя и оказывает влияние на ак-
тивность катализатора. Для опре-
деления поверхности катализатора
(удельная поверхность — отноше-
ние поверхности, доступной для
физической адсорбции газов, паров
или жидкости, к массе образца)
используют методы, основанные на
изменении физической адсорбции
[343, 345]. Наиболее точными и
распространенными методами явля-
ются статические (объемные и вс-
Рис. 80. Прибор для определения механи-
ческой прочности гранул методом динами-
ческих испытаний:
1 — основание; 2 — защитный цилиндр; 3 — столик,
4 — гранула катализатора; 5 — стойка; 6 — шкала
для замера высоты сбрасывания бойка; 7 — ука ia
гель высоты; 8 — направляющая трубка; 9 — pei у
лятор высоты сбрасывания бойка; 10 — держатель
185
совые), базирующиеся на получении изотерм адсорбции азота
при низких температурах. Физическая адсорбция азота, обус-
ловленная равновесием сил межмолскулярного притяжения и
отталкивания, происходит только на поверхности адсорбента
(катализатора), с которой удалены газы (воздух). Поэтому пе-
ред определением поверхность образца катализатора подверга-
ют обработке в вакууме. При получении изотермы адсорбции
азота объемными методами в емкость, содержащую навеску
катализатора, вводят известный объем газа. Объем газа, адсор-
бированного при равновесном давлении, определяют как раз-
ность между объемом введенного газа и объемом газа, необ-
ходимым для заполнения при равновесном давлении. Емкость,,
занимаемую газом, калибруют с использованием гелия. Изо-
термы строят по нескольким точкам, последовательно вводя
новые порции газа после установления равновесия в системе.
При использовании весового метода, основанного на перио-
дическом взвешивании навески катализатора в адсорбционной
системе, не требуется калибровки пространств.
Для построения изотермы адсорбции минимальное число
проводимых измерений составляет 54-6 в интервале относи-
тельных давлений от 0,05 до 0,35 [345]. В настоящее время
промышленностью выпускаются установки для проведения ад-
сорбционных измерений в автоматическом режиме с обработ-
кой полученных результатов на ЭВМ. Результаты адсорбции
азота обрабатываются с помощью уравнения БЭТ:
m(Ps — P) п1тс "Г ттс ps *
где р — давление, при котором измеряют объем адсорбированного азота,.
кПа; р8 — давление насыщенных паров, кПа; т — масса (или объем) адсор-
бата в нормальных условиях в момент измерения, г (или см3); тт — иско-
мое значение массы (или объема) адсорбата в нормальных условиях при об-
разовании монослоя, г (или см3); с — константа.
Это уравнение получается из модели Лэнгмюра, распростра-
ненной на полимолекулярную адсорбцию путем введения ряда
упрощающих предположений. Так, теория БЭТ допускает, что
адсорбция первого слоя происходит на центрах энергетически
однородной поверхности. Молекулы первого слоя служат цент-
рами для образования полимолекулярного слоя, который при
р—^ps достигает бесконечной толщины. Кроме того, допускает-
ся, что для всех слоев, кроме первого, параметры испарения
и конденсации идентичны, а теплоты адсорбции, начиная со
второго слоя, равны теплоте конденсации газа. Уравнение БЭТ
выражает линейную зависимость между p/[m(ps—р)] и р/р$
в области значений p/ps от 0,05 до 0,30.
Поверхность катализатора вычисляют по формулам:
для объемного метода S = 10-20/22 400,
для весового метода S лМдат- 10-20/А1,
186
где М — молекулярная масса адсорбата; Na—число Авогадро (6,02-1023);
ат — элементарная площадка, занимаемая молекулой адсорбата, нм2.
Наряду со статическими объемными и весовыми методами
определения изотерм адсорбции для определения измерения
удельной поверхности катализаторов используют, особенно в
лабораторной практике, динамические методы адсорбции и га-
зовой хроматографии [346, 347]. Эти методы отличаются про-
стотой и, главное, позволяют провести адсорбционные измере-
ния при повышенных температурах или при низкой летучести
адсорбата.
Пористую структуру катализатора характеризуют удельным
объемом пор иуд, т. е. отношением суммарного объема пор
навески катализатора к ее массе, средним радиусом пор и
распределением пор по радиусам.
Удельный объем пор определяют либо непосредственными
измерениями, либо расчетами, если известны значения истин-
ной и кажущейся плотности, по формуле:
^уд= 1/Тк — 1/Ти-
Объем пор измеряют путем заполнения жидкостью (обычно во-
дой) навески катализатора как при определении кажущейся
плотности с той лишь разницей, что для этого необходимо
знать только массу навески и объем воды, требуемый для на-
сыщения.
Навеску 8,0—10,0 г катализатора, высушенного до постоян-
ной массы, взвешенную с точностью до 0,0002 г, пропитывают
водой. После удаления избытка воды навеску переносят в пред-
варительно взвешенный сухой стакан с притертой пробкой и
вновь взвешивают. Удельный объем пор находят по уравне-
нию
VyA = (mi — т0)/(тп -1,0),
где mi — масса навески, насыщенной водой, г; mQ — масса сухой навески, г;
1,0 — плотность воды, г/см3.
Средний радиус пор катализатора рассчитывают в предпо-
ложении, что поры имеют цилиндрическую форму:
гСр = 104-2^/5.
Значительно большую информацию о структуре пор ката-
лизаторов дает другой параметр — распределение пор по раз-
мерам. Кривые распределения строят дифференцированием за-
висимости суммарного объема нор от их радиусов. В настоя-
щее время, согласно классификации 13451, норы подразделяют
по их эффективной ширине: до 2,0 нм мнкропоры, от 2,0 до
50,0 нм — мезопоры и свыше 50,0 нм — макропоры. Характер
заполнения пор различен. Заполнение мпкропор имеет харак-
тер монослойно-многослойной адсорбции на открытой поверх-
ности. В мезопорах капиллярной конденсации предшествует
образование адсорбированного слоя на стенках нор. В макро-
187
порах капиллярная конденсация не происходит до тех пор, пока
давление паров не достигнет величины, близкой к насыщению.
В связи с этим для изучения структуры шор разработаны и
используются различные методы. Для микро- и мезопор —
в основном адсорбционные методы, для макропор — метод ртут-
ной порометрии.
Микропористость катализаторов и адсорбентов принято оце-
нивать по изотермам физической адсорбции. М. М. Дубинин
с сотр. использовали принцип «характеристической кривой»
потенциальной теории Поляни [348, 349]. Для степени запол-
нения объема микропор п/пр предложено уравнение
п/пр = ехр [— (A/E)m]t
где т — показатель, характеризующий адсорбционные системы адсорбата »
адсорбента (выражается целым числом); Е — характеристическая свободная
энергия адсорбции для данной системы; А — изменение дифференциальной
свободной энергии адсорбции, равная: А = —RT \n(p/ps).
При гп = 2 изотерма адсорбции описывается уравнением Ду-
бинина — Радушкевича:
lg n= 1g пр — D[lg(ps/p)]2,
где D — константа.
Зависимость 1g л от [1g (p/pj]2 является прямой линией, от-
секающей на оси ординат отрезок, равный lgnp.
Для систем с неоднородными по размерам микропорами
адсорбция определяется суммированием отдельных вкладов,
пор каждого размера [350]:
П = 2 ЛР7 ехР D (Ps/P)la} •
Существует также метод анализа микропор по размерам,,
согласно которому строится зависимость количества азота,,
адсорбированного твердым телом, от величины, соответствую-
щей величине адсорбированного азота на непористом стандарт-
ном твердом теле [351, 352]. Для оценки распределения мезо-
пор по размерам используют метод капиллярной конденсации,
которой предшествует моно- и полимолекулярное покрытие
стенок. Размеры мезопор рассчитывают по уравнению Кель-
вина
In (p/ps) = — 2ava/(rKRT),
где у — поверхностное натяжение жидкости (адсорбата), мН/м; v& — объем:
конденсированной жидкости (адсорбата), см3.
При этом принимают, что объем пор va, заполненных кон-
денсирующимся адсорбатом, при определенном отношении
p/ps численно равен значению адсорбированного вещества,
определяемому в соответствующей точке десорбционной ветви
петли гистерезиса изотермы адсорбции (рис. 81). Поскольку
часть адсорбата на этом участке петли гистерезиса находится
188
d-ba/dr
Рис. 81. Построение кривой распределения пор по размерам на основании
результатов адсорбционных измерений:
а—изотерма адсорбции — десорбции с петлей гистерезиса; б —кривая зависимости сум-
марного объема пор, имеющих эффективные радиусы, пор меньше гэ; в — кривые распре-
деления пор по размерам
в виде пленки, эффективный радиус для цилиндрических мезо*
пор определяют по уравнению
, Л 2(JVa , X
гэ = гк + 6 или r3 = -RTln(ps/p) +6,
где 6 — толщина пленки адсорбата, нм.
Для щелеобразных мезопор применяют уравнение
_ 2avg
Гэ~ RT In (ps/p) +20-
Толщину пленки адсорбата находят интерполяцией по экс-
периментальным кривым или вычисляют по формуле
6 = ОХЬк/Зуд,
где а — адсорбция при данном значении p/ps, ммоль/г; — объем 1 ммоль
жидкости, см3; 5УД — удельная поверхность катализатора, см2/г.
При использовании в качестве адсорбата азота можно исполь-
зовать уравнение i[353]:
6 = 0,354 [5/1п (ps/p)]V3,
где 0,354 — среднее значение толщины молекулярного слоя азота.
Для построения кривых распределения пор по радиусам
одним из методов адсорбции для исследуемого образца полу-
чают изотерму с петлей гистерезиса, из которой для соответ-
ствующих значений plps находят величину адсорбированного
вещества и рассчитывают значение Затем строят зависи-
мость 1>а=/(гэ), по которой находят производную dva!dr3. Рас-
пределение пор по размерам представляют графически в виде
зависимости dv)dr3 от г3 (рис. 82).
Объем и распределение по размерам макропор определяют
методом ртутной порометрии, который основан на том, что
зависимость между эффективными радиусами пор, в которые
189
dlTa/dr
Рис. 82. Построение кривой распределения пор по размерам на основании
данных ртутной порометрии:
а — зависимость объема ртути, вдавленной в поры катализатора, от внешнего давления;
б — кривая зависимости суммарного объема пор, имеющих эффективные радиусы больше
гэ; в —кривая распределения пор по радиусам
вдавливается ртуть, и давлением определяется соотношением
р = —2ocos ф/гэ,
где о — поверхностное натяжение ртути, 480 мН/м; ф— угол смачивания,
равный 140 °C.
Из экспериментальной зависимости между давлением и
объемом ртути, вдавленной в поры, строят кривую va = f(rz)
и затем график распределения пор по размерам.
6.3. КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ
Для контроля качества промышленных катализаторов гид-
рогенизационных процессов нефтепереработки используют
метод испытаний на реальном сырье в сравнении с эталоном
в определенных условиях. Согласно ОСТ 3801130—77, за эта-
лон принят образец промышленного алюмокобальтмолибдено-
вого (АКМ) катализатора. Испытания проводят на лаборатор-
ной циркуляционной установке высокого давления с реактором
емкостью не менее 50 см3, который обеспечивает равномерность
температурного поля в зоне расположения образца с отклоне-
нием не более 3°С. Схема циркуляционной и проточной уста-
новки для определения активности катализаторов показана на
рис. 83.
Испытания активности катализаторов гидрирования прово-
дят на сырье — фракции прямогонного дизельного топлива за-
падносибирских нефтей с температурой выкипания 200—
350 °C и содержанием сернистых соединений — 1,0%. Катали-
затор (100—150 см3) загружают в реактор, отношение высоты
слоя катализатора к внутреннему диаметру должно быть не
менее 7:1. Продувают реактор водородом со скоростью 100 ч-1
и опрессовывают трижды по 30 мин при */з, V2 и полном рабо-
чем давлении. Для сушки катализатора реактор нагревают в
токе водорода до 200 °C со скоростью подъема температуры
50°С/ч при давлении 2 МПа. Сульфидирование катализатора
190
проводят сырьем или сероводородсодержащим газом по спе-
циальному графику. По окончании сульфидирования при 250°C
давление повышают с 2 до 4 МПа и при объемной скорости
подачи сырья 2,5 ч~! поднимают температуру до 380 °C. Одно-
временно с повышением температуры увеличивают циркуляцию
водорода до 500 м3/м3 сырья. Испытания активности катализа-
тора проводят в следующих двух режимах:
Рабочее давление, МПа 4,0 2,0
Температура, °C 380 380
Объемная скорость подачи сырья, ч*1 2,5 6,0
Расход водорода, м3/м3 500 500
Длительность опыта, ч . . . . 20 20
Периодичность отбора пробы гидрогенизата, ч 4,0 4,0
Отобранные пробы гидрогенизата промывают 10%-м раство-
ром NaOH для удаления сероводорода и из пяти проб состав-
ляют одну среднюю для анализа на содержание серы. Опре-
деляют степень обессеривания и затем находят относительную
активность катализатора (в %) как отношение степени обессе-
ривания испытуемого и эталонного образцов.
Недостатком данного метода испытания является то, что
современные промышленные катализаторы в указанных усло-
виях обладают степенью гидрообессеривания более 90,0%,
а это затрудняет их сравнительную оценку. Лучшие результаты
дает способ оценки активности катализаторов при малых сте-
пенях обессеривания, разработанный во ВНИИ НП [354]. Ме-
тод основан на определении объемной скорости (или фиктив-
ного времени контакта сырья), при которой достигается 70%-я
степень гидрообессеривания. С этой целью на испытуемом и
эталонном образцах катализатора проводят три опыта по гид-
Рис. 83. Схема лабораторной установки высокого давления для определения
активности катализаторов гидрирования:
1 — насосы высокого давления; 2 — сырьевые емкости; 3 — подогреватель; 4 — реактор с
катализатором; 5 — холодильник; 6 — сепаратор высокого давления; 7 — скруббер; д’—
сепаратор низкого давления
191
рообессериванию фракции дизельного топлива при 2 МПа,
380 °C, циркуляции водорода 500 м3/м3 и с разной объемной
скоростью подачи сырья — 2,4 и 6 ч-1. По результатам испыта-
ния строят график зависимости степени гидрообессеривания
(в %) от объемной скорости подачи сырья, по которому и на-
ходят значение объемной скорости соответствующей 70-й сте-
пени обессеривания.
Индекс активности испытуемого катализатора (Д, °/о) рас-
считывают по формуле
А = ^-100/^2,
где wi, w2 — объемные скорости подачи сырья, при которых достигается
70%-я степень обессеривания сырья на испытуемом и эталонном образцах
катализатора.
Для оценки катализаторов в лабораторных исследованиях
предложена ускоренная методика определения каталитической
активности образцов {355]. Схема для проведения испытания
катализаторов приведена на рис. 84. Реакцию проводят в
микрореакторе проточного типа. Сырье подают в поток газа-
носителя— водорода непрерывно, а продукты реакции периоди-
чески вводят в хроматографическую колонку с помощью кра-
на. В качестве детектора используют катарометр. Предусмот-
рена возможность сульфидирования образца смесью водорода
и сероводорода, получаемой в реакторе из серы и водорода.
В качестве сырья при определении гидрообессеривающей
активности был выбран тиофен. Это обусловлено тем, что, во-
первых, тиофен является одним из основных типов серооргани-
ческих соединений нефти и, во-вторых, тем, что при гидрогено-
Рис. 84. Схема лабораторной установки для определения микроактивности
катализаторов гидроочистки и гидрокрекинга:
/ — вентиль тонкой регулировки; 2 — реактор для получения сероводорода; 3 — многохо-
довые краны; 4 — барботеры; 5 — микрохолодильпик; 6 — реактор с катализатором; 7 —
электрообогрев; 8 — хроматографическая колонка; 9 — катарометр
192
лизс его получается простая смесь продуктов — преимуществен-
но углеводороды С4 и сероводород. Измельченный катализатор
(фракция 0,25—0,50 мм) в количестве 0,05 г загружают в реак-
тор и нагревают в токе водорода при 400 °C. Затем в реактор
подают смесь водорода и сероводорода и проводят сульфиди-
рование в течение 1,0 ч. По окончании сульфидирования в поток
водорода подают тиофен со скоростью 2,0 ч-1. Для каждой
скорости подачи тиофена записывают не менее четырех хрома-
тограмм, на основании которых рассчитывают состав продуктов
реакции.
Гидрообессеривающую активность определяют как отноше-
ние степени превращения тиофена на испытуемом и эталонном
образцах катализатора. По результатам анализа продуктов
реакции можно оценивать гидрирующие, изомеризующие и
крекирующие свойства образцов. Гидрирующая активность —
это отношение выхода предельных углеводородов С4 к суммар-
ному выходу всех углеводородов С4, т. е. степень гидрирова-
ния бутенов; изомеризующая способность катализатора — от-
ношение содержания углеводородов С4 изостроения к суммар-
ному содержанию углеводородов С4 в продуктах реакции. Кре-
кирующую активность образцов можно оценить при проведении
реакции гидрокрекинга изооктана на этой же установке при
следующих параметрах: навеска катализатора—1,0 г, скорость
подачи изооктана — 0,05-4-1,00 ч-1 и температура реакции —
400 °C. Мерой крекирующей активности служит степень конвер-
сии изооктана, определяемая суммарным выходом всех продук-
тов реакции — углеводороды Ci—С4. Во всех случаях катали-
затор характеризуется относительной активностью, т. е. отно-
шением соответствующего показателя к показателю, получен-
ному на эталонном образце.
Время, затрачиваемое на один опыт, зависит от разделения
на хроматографической колонке и составляет 20—40 мин.
За 6—8 ч можно практически полностью оценить качество ис-
следуемого катализатора, т. е. получить данные по влиянию
температуры и объемной скорости подачи сырья. Результаты
сопоставления испытаний в микрореакторе по тиофену (I) и на
установке высокого давления на реальном сырье (II) представ-
лены ниже:
Образец катализатора . № 1 № 2 № 3 № 4 №5
Относительная гидрообессеривающая
активность:
I 0,82 0,95 0,74 0,86 0,84
II 0,80 0,93 0,77 0,85 0,83
Как следует из этих данных, предлагаемая методика по
тиофену позволяет в достаточной степени экспрессно оценить
качество катализатора и может быть использована для пред-
варительной оценки функциональных свойств исследуемых об-
разцов катализаторов.
13—922
193
*
В структуре современной нефтеперерабатывающей промыш-
ленности гидрогенизационные процессы имеют определяющее
значение. В дальнейшем их роль будет неуклонно возрастать.
В XII пятилетке перед нефтеперерабатывающей промышлен-
ностью нашей страны поставлена задача резко увеличить глу-
бину ее переработки с вовлечением в качестве сырья утяже-
ленных вакуумных газойлей и мазутов. Решение поставленной
задачи потребует создания и внедрения новых процессов и
более эффективных катализаторов.
В СССР и за рубежом созданы достаточно активные про-
мышленные катализаторы гидрогенизационных процессов неф-
тепереработки. Их совершенствование проводится на базе глу-
боких фундаментальных исследований структуры, механизма
формирования фаз и их генезиса в процессе синтеза и акти-
вации, кислотно-основных свойств поверхности, природы актив-
ных центров. Полученные в настоящее время закономерности
позволяют проводить направленный синтез катализаторов с
заданными свойствами для решения конкретных задач перера-
ботки того или иного сырья. Основные направления развития
промышленных катализаторов на ближайшую перспективу —
повышение их эффективности за счет снижения начальной тем-
пературы, процесса, увеличения межрегенерационного срока,
удлинения общего срока службы катализатора, а также сниже-
ние энергоемкости промышленных процессов. Для катализато-
ров гидрогенизационной переработки тяжелого и остаточного
сырья большое значение будут иметь вопросы стабильности и
селективности, а следовательно, вопросы механизма каталити-
ческого действия и дезактивации. Намечаемая тенденция в раз-
витии катализаторов гидрогенизационной переработки — от
универсальных катализаторов одноступенчатых процессов к
системе катализаторов с выраженными функциональными
свойствами.
Промышленная технология получения катализаторов и влия-
ние качества сырья на их свойства изучаются весьма интенсив-
но, однако результаты исследований недостаточно освещаются
в литературе. В последние годы особое внимание уделяется
проблеме синтеза носителей и их пористой структуре, что об-
условлено новыми проблемами создания эффективных катали-
заторов гидропереработки тяжелого и остаточного сырья. Тем
не менее до сих пор основным носителем остается оксид алю-
миния, и с точки зрения разработки малосточных технологий
производства промышленных катализаторов ставится задача
получения различных модификаций А12О3 по бессточной техно-
логии.
Особое место в нефтеперерабатывающей промышленности
занимает катализ с использованием цеолитсодержащих компо-
зиций. Бифункциональные цеолитсодержащие катализаторы
194
процессов гидрогенизационных переработок изучены достаточ-
но подробно, они являются основными для получения топлив-
ных и масляных фракций. В последние годы разработаны ката-
лизаторы селективного гидрокрекинга на базе цеолитов с ярко
выраженным молекулярно-ситовым действием, например высо-
кокремнеземных цеолитов. Это связано с тем, что запасы уни-
кальных нефтей нафтенового основания практически исчерпа-
ны, а задача получения нефтепродуктов, особенно масел,
с низкотемпературными и вязкостными свойствами из высоко-
парафинистых массовых нефтей не может быть решена пол-
ностью известными технологическими приемами.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Радченко Е. Д., Курганов В. М., Мелик-Ахназаров Т X.//Химия и тех-
нология топлив и масел. 1986. № 9. С. 2.
2. Агафонов А. В., Козлов И. Т., Ботников А. Я., Чаговец А. //.//Нефть, про-
цессы и продукты ее углубленной переработки. М.: ЦНИИТЭнефтехим,
1983. С. 31.
3. Чертков Я. Б., Спиркин В. Г Сернистые и кислородные соединения неф-
тяных дистиллятов. М.: Химия, 1971. 307 с.
4. Чертков Я. Б., Серегин Е. П., Кирсанова Т И., Романов А. //.//Химия и
технология топлив и масел. 1976. № 2. С. 53; № 3. С. 11.
5. Рубинштейн И. А., Соболев Е. П., Клейменова 3. А.//Химия сера- и азот-
содержащих соединений в нефтях и нефтепродуктах. Т. 3. Уфа: изд-во
Баш. ФАН СССР, 1960. 186 с.
6. Лобанова Г А., Буянова //. С., Котова А. В., Беньковский В. /".//Химия
и технология топлив и масел. 1976. № 12. С. 3.
7. Лившиц Р С., Мелик-Ахназаров Т X., Орочко Д. //.//Химия и технология
топлив и масел. 1972. № 10. С. 1.
8. Schuman S. С., Shalit //.//Catal. Rev. 1970. V. 4. Р 245; Хорн У А., Ма-
кофи Дж.//Новые достижения нефтехимии и нефтепереработки. М.: Гос-
топтехиздат, 1962. Т. 3. С. 116.
9. Машкина А. В. Гетерогенный катализ органических соединений серы. Но-
восибирск: Наука. СО, 1977. 339 с.
10. Satterfield С. N., Model М., Wilkens J. A.//Ind. Eng. Chem. Proc. Des. Dev.
1980. V. 19. P. 154.
11. Орочко Д. И., Сулимов А. Д., Осипов Л. Н. Гидрогенизационные процессы
в нефтепереработке. М.: Химия, 1971. 350 с.; Суханов В. П. Каталитиче-
ские процессы в нефтепереработке. М.: Химия, 1979. 343 с.; Аспель Н. Б.,
Демкина Г. Г. Гидроочистка моторных топлив. М.: Химия, 1977. 158 с.
Курганов В. М., Васейко А. И., Финелонов В. П. и др. Гидроочистка неф-
тепродуктов на алюмоникельмолибденовом катализаторе. М.: ЦНИИТЭ-
нефтехим, 1975. 103 с.
12. Becker К., John //., Franke ll Schiitter //.//J. Chem. Tech. 1981. V 34.
P. 420.
13 Bohlmann D., Dohler E., Limmer II., Schiitter 11.//J. Chem Tech. 1981. V 33.
P 358; Becker K., Berrouschot H -I) Heubauer II. I), et al //J Chem. Tech.
1977 V 29. P 61.
14. Калечиц И В. Химия гидрогенизационных процессов в переработке топ-
лив М.. Химия, 1973. 336 с.
15. Cole R М., Davidson D. Z).//Ind. I'.iig С|1Иц. 1919 V. 4 1 Р 2711;
Kir\(h /•’ U” Heinemann H., Stevenson I) 11 //Ibid 1957 V 49. P 646
16. Hoop П.//У 1 nst. Petrol. 1950. V 36. P 738.
17 IIcinemann // Kirsch F. W Burtis T A //l\r<l<»l iiikI Kohle 1957 B. 10.
S 225.
195
18. Осипов Л. Н., Гольдштейн Д. Л.//Химия и технология топлив и масел.
1959. № 8. С. 22; Осипов Л. Н., Берг Г. Л., Хавкин В. А. и др.//Нефтепе-
реработка и нефтехимия. 1969. № 2. С. 1.
19. Агафонов А. В., Рысаков М. В., Гольдштейн Д. Л. и др.//Пути интенси-
фикации основных процессов нефтеперерабатывающей промышленности в
связи с перспективами ее развития. М.: ЦНИИТЭнефтехим, 1964. С. 34.
20. Wilson W A., Voreck W Е., Malo R. V.//Ind. Eng. Chem. 1957. V 49.
P. 657; Hoeman E. J., Lewis E. W., Wadley E. F.//Ibid. P. 656.
21. Радченко E. Д., Ландау M. В., Кругликов В. Я. и др. Повышение качества
реактивных топлив и регулирование их углеводородного состава. М.г
ЦНИИТЭнефтехим, 1976. 75 с.
22. Чертков Я. Б. Современные и перспективные углеводородные реактивные
и дизельные топлива. М.: Химия, 1968. 356 с.
23. Энглин Б. А., Алиев Р. Р., Радченко Е. Д. и др.//Моторные, реактивные и
котельные топлива. М.: Изд-во ВНИИ НП, 1977 С. 3.
24. Пискунов В. А., Зрелое В. Н. Испытания топлив для авиационных реактив-
ных двигателей. М.: Машиностроение, 1974. 199 с.; Hydrocarb. Ргос.//1970.
V. 49. Р 208.
25. Зарубежные топлива, масла и присадки. М.: Химия, 1971. 327 с.
26. Агафонов А. В., Рысаков М. В., Гольдштейн Д. Л. и др. Пути интенсифи-
кации основных процессов нефтеперерабатывающей промышленности в
связи с перспективами ее развития. М.г ЦНИИТЭнефтехим,. 1964. С. 37.
27. Гальперин Л. Б., Дорохов А. П., Железняк А. С. и ^.//Каталитические
методы переработки углеводородов. Л.: ВНИИнефтехим, 1975. С. 14.
28. Алиев Р. Р., Козлов И. Т Радченко Е. Д. и ^.//Нефтепереработка и неф-
техимия. 1980. № 3. С. 3; Алиев Р. Р., Радченко Е. Д., Нефедов Б. К.//Хи-
мия и технология топлив и масел. 1983. № 4. С. 16.
29. Козлов И. Т., Осипов Л. Н., Зенченков А. 77.//Каталитические процессы
глубокой переработки нефти. М.: ЦНИИТЭнефтехим, 1980. С. 71; Тимо-
феев А. А., Куприянов В. А., Говрун В. Е. и др.//Химия и технология топ-
лив и масел. 1972. № 7. С. 1; Байбурский Л. А., Кречетова Т. И., Азизо-
ва 3. Х.//Труды ГрозНИИ. М.: Химия. 1968. Вып. XXII. С. 172; Ма-
хов А. Ф., Смирнов Н. П., Рисов Б. Я. и др.//Химия и технология топлив
и масел. 1973. № 6. С. 9.
30. Радченко Е. Д., Мелик-Ахназаров Т X., Каминский Э. Ф.//Каталитические
процессы глубокой переработки нефти. М.: ЦНИИТЭнефтехим, 1980. С. 3.
31. Чаговец А. Н., Осипов Л. Н., Ботников А. Я., Лебедев Б. Л.//Каталити-
тические процессы глубокой переработки нефти. М.: ЦНИИТЭнефтехим,,
1980. С. 57.
32. Вайль Ю. К., Маншилин В. В., Пугач И. А., Князев В. С.//Каталитические
процессы глубокой переработки нефти. М.: ЦНИИТЭнефтехим, 1980. С. 64.
33. Ботников А. Я., Низяева Г. С., Рогов С. П., Рысаков М. В.//Химия и тех-
нология топлив и масел. 1972. № 7. С. 5; Терегулов Д. X., Каржев В. И.,
Рабинович Б. Я. и др.//Химия и технология топлив и масел. 1972. № 12.
С. 14.
34. Пестриков С. В., Козик Б. Л., Кричко А. А. и ^.//Исследования и при-
менение гидрогенизационных процессов в нефтеперерабатывающей и неф-
техимической промышленности. М.: ЦНИИТЭнефтехим, 1968. С. 160.
35. Агафонов А. В., Абаева Б. Т., Курганов В. М., Андреева А. С.//Нефть, про-
цессы и продукты ее глубокой переработки. М.: ЦНИИТЭнефтехим, 1983.
С. 60.
36. Mills J. С., Bunn J. A.//Proc, of the IX World Petroleum Congr. 1975. V 6.
P 77; Гальбрит P. Б., Вен-Дреден P. //.//Труды VIII Мирового нефтяного
конгресса. М.: Гостоптехиздат, 1971. Симпозиум 12. С. 31.
37. Hydrocarb. Proc. 1972. V. 51. N 10. Р. 151; Oil and Gas J. 1975. V. 73. N 21.
P. 90; Kubo /.//Ibid. 1975. V. 73. N 33. P 105.
38. Маншилин В. В., Вайль Ю. К., Агафонов А. В. и др.//Химия и технология
топлив и масел. 1973. № 10. С. 1.
39. Маншилин В. В., Вайль Ю. К., Манахов Н. X.//Химия и технология топ-
лив и масел. 1971. № 11. С. 7; 1968. № 7. С. 6; Vail J. К., Manahov N. W.,
Manschilin V. V.//Ind. Chem. Eng. 1968. V 8. N 3. P. 108.
196
40. Oil and Gas J. 1972. V 70. N 37. P. 82.
41. Ботников А. Я., Рысаков M. В., Рогов С. П., Тычкин В. С.//Каталитические
процессы глубокой переработки нефти. М.: ЦНИИТЭнефтехим, 1980. С. 33.
42. Nomura И., Sekido Y., Ohguchi Y.//J. Jap. Petrol. Inst. 1979. V 22. N 5.
P. 288, 296; Брейтер Г., Шмид Б.//Труды VI Мирового нефтяного конгрес-
са. М.: Гостоптехиздат, 1965. С. 106; Takematsu Т., Shumada К., Kuriki Y.,
Ohshitna S.//Nippon Kagaku Kaishi. 1974. N 12. P 2384; Johnson A. R.,
Wolk R. H., Hippeli R. F., Nongbri Cr.//Oil and Gas J. 1972. V 70. N 23.
P. 29; Flinn R., Beuther //., Schmid B.//Petrol Ref. 1961. V. 40. N 4.
P 139; Ohtsuka T., Hasegawa J Koizumi M. Ono 7\//BulL Jap. Petrol.
Inst. 1968. V 10. N 14. P. 95.
43. Nelson W L.//OA and Gas J. 1976. V 74. N 5. P 191.
44. Ботников А. Я., Рысаков M. В.//Химия и технология топлив и масел. 1975.
№ 8. С. 7.
45. Эйгенсон А. С., Берг Г. А., Хабибуллин С. Г и др.//Химия и технология
топлив и масел. 1974. № 1. С. 1.
46. Hastings К. Е., James J. С., Mounce W. R.//OU and Gas J. 1975. V. 73.
N 26. P. 122, 127—130; Fischer H„ Garwood W E.f/Ind. Eng. Chem., Proc.
Res. Dev. 1976. V 15. N 4. P. 570.
47. Вайль Ю. К., Маншилин В. В., Липкинд Б. А. и др.//Химия твердого топ-
лива. 1978. № 4. С. 99.
48. Григорьев В. И., Маликов Ф. X., Баширов В. В.//Гидрообессеривание оста-
точного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978. С. 13.
49. Хабибуллин С. Г., Эйгенсон А. С., Балаев А. Вк и др.//Гидрообессеривание
остаточного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978. С. 45;
Shcuit G. С. A., Gates В. S.//AIChEJ. 1973. V. 19. N 3. Р. 417.
50. Nelson W. L.//OW and Gas J. 1976. V 74. N 46. P. 72.
51. Берг Г А., Хабибуллин С. Г., Байтов Л. Я. и ^.//Гидрообессеривание
остаточного нефтяного сырья. М.; ЦНИИТЭнефтехим. 1978. С. 35.
52. Федоров В. С.//Химия и технология топлив и масел. 1981. № 2. С. 3;
Алиева Л. Г.//Химия и технология топлив и масел. 1972. № 3. С. 32.
53. Шаволина Н. В., Злотников В. 3.//Химия и технология топлив и масел.
1973. № 2. С. 54; Novak V Kubicka R.//Erddl u. Kohle. 1972. В. 25. N 6.
S. 333.
54. Хасанов А. К., Нурматов Г., Мирусманова M. и др.//Химия и технология
топлив и масел. 1984. № 10. С. 14.
55. Баран В. И., Гуфман Г С.//Гидрокрекинг остатков и дистиллятов, вклю-
чая гидрообессеривание остатков и нефтей. Материалы дискуссионного
симпозиума 13—19 июля 1971 г./М.: Внешторгиздат. 1971. С. 1.
56. Ference R. A.//Molybdenium Mosaic. 1978. V 3. N 3. P. 12; Конь M. Я.//
//Нефтепереработка и нефтехимия. 1978. № 10. С. 23; Агафонов А. В.,
Гельме И. Э.//Применение цеолитов в катализе. Новосибирск: Наука. СО,
1977. С. 176; Weizkamp Т. //.//Erdol u. Kohle. 1978. В. 31. N 1. Р. 13;
Федоров В. С.//Теоретические основы химической технологии. 1972. Т. 6.
№ 5. С. 699.
57. Агафонов А. В., Хавкин В. А.//Нефтяник. 1977. № 6. С. 16.
58. Хавкин В. А., Агафонов А. В., Рогов С. П. и др.//Гидрогенизационные
процессы получения моторных топлив. М.: ЦНИИТЭнефтехим, 1978. С. 17.
59. Ионе К. Г. Полифункциональный катализ на цеолитах. Новосибирск: Нау-
ка. СО, 1982. 269 с.
60. Панченков Г. М., Васильева И. И., Жоров Ю. Л4.//Изв. вузов/Сер. «Нефть
и газ». 1967. № 12. С. 68.
61. Хавкин В. А., Агафонов А. В., Козлов И. Т., Алиев Р. Р.//Нефтепереработ-
ка и нефтехимия. 1978. № 10. С. 11; Нефедов Б. К., Алиев Р. Р., Камен-
ский А. А.//Каталитические процессы глубокой переработки нефти. М.:
ЦНИИТЭнефтехим, 1980. С. 165.
62. Радченко Е. Д., Кругликов В. Я., Ландау М. В. Цеолитсодержащие ката-
лизаторы в процессах гидрокрекинга нефтяного сырья. М.: ЦНИИТЭпеф-
техим, 1981. 86 с.
63. Козлов И. Т Хавкин В. А.//Гидрогенизационные процессы получения мо-
торных топлив. М.: ЦНИИТЭнефтехим, 1978. С. 45.
197
64. Хавкин В. А., Рогов С. П. Агафонов А. В. и др.//Химия и технология
топлив и масел. 1973. № 11. С. 3.
65. Qazdaz S. A., Hill G. R.//Ind. Eng. Chem., Proc. Des. Dev. 1969. V 8. N 1.
P. 98.
66. Чернакова Г И., Пережигина И. Я., Агафонов А. В. и </р.//Гидрогениза-
ционные процессы получения моторных топлив. М.: ЦНИИТЭнефтехим,
1979. С. 50.
67. Курганов В. М., Горштейн А. Б., Стародубская Г. >/.//Гидрогенизацион-
ные процессы получения моторных топлив. М.. ЦНИИТЭнефтехим. 1979.
С. 35, 55; Агафонов А. В.//Пути интенсификации основных процессов неф-
теперерабатывающей промышленности в связи с перспективами ее разви-
тия. М.: ЦНИИТЭнефтехим, 1964. С. 14.
68. Курганов В. М., Радченко Е. Д., Акимов Ш. ^.//Kaтaлитичecкиe процессы
глубокой переработки нефти. М.: ЦНИИТЭнефтехим, 1980. С. 38.
69. Радченко Е. Д., Чернакова Г. Н., Пережигина И. Я. и др.//Там же. С. 43.
70. Ботников А. Я-, Низяева Г С., Рогов С. П. и др.//Гидрогенизационные
процессы получения моторных топлив. М.: ЦНИИТЭнефтехим, 1978. С. 29.
71. Флюгтер И. К., Вант Спийкер //.//Гидрокрекинг остатков и дистиллятов,
включая гидрообессеривание остатков и нефтей. Материалы дискуссион-
ного симпозиума 13—19 июня 1971 г./М.: Внешторгиздат. 1971. С. 119.
72. Ward J. W., Hansford R. С., Reichle A. D., Sosnowski J.//Oil and Gas J.
1973. V. 71. N 22. P. 69.
73. Радченко E. Д., Горштейн А. Б., Школьник Б. Л. и др.//Нефть, процессы
и продукты ее углубленной переработки. М.: ЦНИИТЭнефтехим, 1983.
С. 100.
74. Коновальчиков Л. Д., Нефедов Б. К., Кругликов В. Я. и др.//Химия и тех-
нология топлив и масел. 1984. № 1. С. 15; Burbige В. W., Keen I. М.,
Eybes М /(.//Adv. Chem. Ser. 1971. V. 102. Р. 417.
75. Burd S. D., Maziuk /.//Hydrocarb. Proc. 1972. V. 51. N 5. P. 97; Chen N. Y.,
Maziuk J., Schwartz А. В.//ОП and Gas J. 1968. V. 47. P. 154.
76. Георгиевский В. Ю., Куковицкий М. М., Жарков Б. Б. и др.//Химия и тех-
нология топлив и масел. 1983. № 2. С. 2.
77. Ireland Н. R. е. a.//Oil and Gas J. 1979. V. 77. P. 82, 84—87.
78. Donnelly S. P„ Green J. R.//Oil and Gas J. 1980. V. 78. N 43. P. 77.
79. Smith K. W., Starr N. C., Shen N. /.//Oil and Gas J. 1980. V. 78. N 21.
P. 75, 83.
80. Радченко E. Д. Получение реактивных топлив с применением гидрогени-
зационных процессов. М.: ЦНИИТЭнефтехим, 1980. 94 с.; Tregilgas Е. Т.,
Growly D. М.//Hydrocarb. Proc. 1969. V. 48. N 5. Р. 120; Ewing R. C.//Oil
and Gas J. 1969. V. 67. N 40. P. 125.
81. Радченко E. Д., Лихтерова H. M., Алиев P. P. и др.//Гидрогенизационные
процессы получения моторных топлив. М.: ЦНИИТЭнефтехим, 1978. С. 14;
Нефтепереработка и нефтехимия. 1978. № 3. С. 7.
82. Томас Ч. Промышленные каталитические процессы и эффективные катали-
заторы. М.: Мир, 1973. 385 с.
83. Richardson J. T.//Ind. Eng. Chem. Fund. 1964. V 3. N 2. P. 154; Gran-
ge P.//Catal. Rev. Sci. Eng. 1980. V. 2. N 1. P. 135.
84. Lipsch J. M. J. G., Schuit G. С. A.//T. Catal. 1969. V 15. P. 179; Ерофе-
ев В. H., Бурмитрова Н. В., Коваль Л. М. и др.//Нефтепереработка и неф-
техимия. 1977. № 5. С. 9; Topse Н., Clausen В. S., Burriesci N. et alj/
//Preparation of Catalysts/II. Amsterdam: Elsevier, 1979. P 479; Villa P. V.,
Trifiro F., Pasquon /.//React. Kinet. Catal. Lett. 1979. V. 1. P. 341;
Ashley J. H., Mitchell P. С. H.//S. Chem. Soc. 1965. P. A2821; Ramaswa-
my A. V., Sivasanker S., Ratnasamy P.//S. Catal. 1970. V. 19. P. 85.
85. Mone ^.//Preparation of Catalysts/II, Amsterdam: Elsevier, 1976. P. 381;
blot J., Pommery J., Beaufils J. Р.//У Less-Common Met. 1974. V 36. P 381.
Ishii Y., Kaido A. ^.//Nippon Kagaku Kaishi. 1979. V. 12. P. 2255; Grim-
86. Okamoto Y., Nakano H., Shimokaua T. et al.//J. Catal. 1977. V 50. P 447;
Martinez N. P., Mitchell P. С. H., Chiplunker P./M. Less-Common Met. 1977.
V. 54. P. 333.
87. Эльберт Э. И., Трясунов Б. Т.//Кинетика и катализ. 1975. Т. 16. С. 552.
198
88. Chung К. S., Massoth F. Е.//У Catal. 1980. V 64. N 2. P. 320.
89. Delmon B., Grunge P., Gajarde P., Delannay F. C. R. Acad. Sci./Ser. C.
1979. V 288. P. 391.
90. Giardo P., Grange P., Delmon B.//3. Catal. 1980. V 63. N 1. P. 201.
91. Слинкин А. А., Антоишн T. В., Локтев M. И. и др.//Изв. АН СССР/Сер.
хим. 1978. с. 2225.
92. De Beer V Н. J., Bevelander С. Van Sint Fiet T H. М. et al.I/] Catal.
1976. V. 43. P. 68.
93. Van der Aalst M. J. ЛЦ De Beer V. H. J.//J. Catal. 1977 V 49. P 247
94. Mitchell P. C. H., Trifiro F.//L Catal. 1974. V. 33. P. 350.
95. Patterson T. A., Carker J. C., Leyden D. E. et al.I/У Phys. Chem. 1976.
V. 80. P 1700.
96. Gajardo P., Declerck-Grimee R. I., Delvaux G. et al.//S. Less-Common Met.
1977. V. 54. P 311.
97. Declerck-Grimee R. /., Canesson P Friedman R. M.//J. Phys. Chem. 1978.
V 82 P 885 889
98. Massoth F. E.//L Catal. 1975. V. 36. P. 164.
99. Gantherin J. C., Colson J. С.//С. r. Acad. Sci./Sec. C. 1974. V. 278. P. 815;
J. Phys. Chem. 1974. V 71. P. 771; Sotani W.//Bull. Chem. Soc. Jap. 1975.
V. 48. P 1820.
100. Харлампова P H., Зайдман H. M., Плясова Л. M. и dp.//Кинетика и ка-
тализ. 1973. Т. 14. Вып. 6. С. 1538.
101. Воробьев В. Н., Талипов Г /^/.//Синтез и исследование катализаторов
нефтехимии. Ташкент: изд-во ФАН. 1973. Вып: О. С. 27; Талипов Г. Ш.,
Хакимов У. Б., Воробьев В. Н. и др.//Кинетика и катализ. 1972. Т. 13.
№ 6. С. 1558; Талипов Г. Ш., Хасанов Ф. Н., Воробьев В. //.//Кинетика и
катализ. 1978. Т. 19. № 4. С. 1015.
102. Laime J., Pratt К. С.//Ind. Eng. Chem. Fund. 1981. V 20. N 1. P. 1.
103. Ирисова К. H., Ермолаев М. В., Смирнов В. /(.//Химия и технология топ-
лив и масел. 1977. № 12. С. 17; Jovanovic М. R., Selakovic О. К.//Глас.
Хем. Друшт:. Белград, 1978, Т. 43. № 5. С. 217; Алиев Р. Р., Сурин С. А.,
Нефедов Б. К. и др.//Применение цеолитов в катализе/Вторая Всесоюз-
ная конференция. М.: ИОХ АН СССР. 1981. С. 92. Сидельковская В. Г.,
Абрамкина Н. И., Сурин С. А. и др.//Кинетика и катализ. 1981. Т. 22.
Вып. 4. С. 986.
104. Ерофеев В. И., Бурмистров Н. В., Коваль Л. М,- и ^.//Нефтепереработка
и нефтехимия. 1977 № 5. С. 9.
105. Сурин С. А., Алиев Р. Р., Нефедов Б. К. и др.//Нефтехимия. 1981. Т. 21.
№ 3. С. 385.
106. Gour Р. К., Upadhay S. N., Tiwar Т S. е. а.//У Res. Inst. Catal. 1977.
V. 25. N 2. Р. 91.
107. Асмолов Т Н., Крылов О. В.//Кинетика и катализ. 1970. Т. 11, № 4.
С. 1028.
108. Ландау М. В., Нефедов Б. К., Алексеенко Л. Н. Катализаторы на основе
молибдена и вольфрама для процессов гидропереработки нефтяного сырья.
М.: ЦНИИТЭнефтехим, 1985. 80 с.
109. Сурин С. А., Алиев Р. Р. и др.//Кинетика и катализ. 1980. Т. 21. Вып. 1.
С. 252; Сурин С. А., Нефедов Б. К., Сидельковская В. Г и др.//Кинетика
и катализ. 1982. Т. 23. Вып. 3. С. 688.
ПО. Brewer М. V., Cheavens Т //.//Oil and Gas J. 1966. V 64. N 17. P 176,
181.
111. Pratt К. C. e. a.//T. Catal. 1980. V. 66. P 82; Sanders J. V Pratt К C.j/
//Micron. 1980. V 11. N 3—4. P 303.
112. Кипнис M. А., Агиевский Д. А., Ландау M. В. и др.//Катализаторы про-
цессов получения и превращения сернистых соединений. Новосибирск:
изд-во ИК СО АН СССР. 1979. С. 127
ИЗ. Kullernd G., Yund R. А.//У Petrology. 1962. V. 3. Р. 126.
114. Nag К. Т Hercules D. М.//У Phys. Chem. 1976. V 80. Р 2094.
115. Bilocn Р., Pott G. T.//S. Catal. 1973. V 30. P. 169.
116. Sondag P Quang K. D., Marion F.//C. R. Acad. Sci. Ser C. 1946. V 259.
P. 4704.
199
117. De Beer V. H. J., Van Sint Fiet T. H. M., Van Deer Steen et al.//}. Catal.
1974. V. 35. P. 297; Farragher A. L., Cosse J. №.//Proc. 5-th Congr. Catal./
/North-Holland, Amsterdam. 1973. V. 2. P. 1301.
118. Ahuja S. P., Derrien NI. L., Lepage J. F.//Ind. Eng. Chem., Prod. Res. Dev.
1970. V. 9. P. 272.
119. Султанов А. С., Хасанов А. К., Сафаев А. С.//Каталитическая переработка
углеводородного сырья. М.: ЦНИИТЭнефтехим, 1968. Вып. 2. С. 156.
120. De Beer V. Н. J., Van Sint Fiet T. H. Nt., Engelen J. F. e. a.//3. Catal. 1972.
V. 27. P. 357; Kabe T., Yamadaya S., Oba M. c. a.//Int. Am. Eng. 1972.
V. 12. P. 366.
121. Giordano N., Bart J. C. J., Castellan A., Vaghi A.//}. Less-Common Met.
1974. V. 36. P. 367.
122. Giordano N., Bart J. C. J., Vaghi A. e. a.//S. Catal. 1975. V. 36. P. 81.
123. Medema J., Van Stam C., De Beer V. H. J. e. a.//}. Catal. 1978. V. 53.
P. 386; Praliaud H.//}. Less-Common Met. 1977. V. 54. P. 387; Frasen T.,
Van der Meer 0., Mars P.//J. Phys. Chem. 1976. V. 80. P. 2103.
124. Giordano N., Bart J. C. J., Vaghi A., Ragaini V.//React. Kinet. CataL Lett.
1975. V. 2. P. 305; J. Catal. 1975. V. 37. P. 204.
125. Hall W. K., Lo Jacono AL//Proc. 6-th Inter. Congr. Catalysis/London. 1976,
V. 1. London 1977. P. 246; Seshadri K. S., Massoth F. E., Petrahis L.//J.
Catal. 1970. V. 19. P. 95.
126. Агиевский Д. А., Ландау M. В., Кипнис M. А., Павлова Л. И. Сульфидные
катализаторы гидрогенизации на основе молибдена и вольфрама и пути их
совершенствования. М.: ЦНИИТЭнефтехим, 1982. 78 с.; Ramaswamy А. V.,
Sivasanker S., Ratnasamy Р.//У Catal. 1976. V. 42. Р. 107; Tanaka К.,
Okuhara T.//Catal. Rev. Sci. Eng. 1977. V. 15. N 2. P. 249.
127. Okuhara T Tanaka K., Miyahara K.//3. Catal. 1977. V. 48. N 1. P. 229.
Okuhara T„ Kondo T., Tanaka K., Miyahara K.//L Phys. Chem. 1977. V. 81.
N 1. P. 90. Ueda H., Todo H.//L Less-Common Met. 1974. V. 36. P. 387.
128. Ueda H., Todo //.//Bull. Chem. Soc. Jap. 1975. V. 48. N 4. P. 1146.
129. Ratnasamy P„ Ratnasamy A., Banerjee K. e. a.//L Catal. 1975. V. 38. N 1.
P. 10.
130. Ueda H., Todo H.//L Catal. 1972. V. 27. P. 281.
131. Гуллыев Ч., Сурин С. А., Лебедев Б. Л. и др.//ЖПХ. 1982. № 1. С. 84;
Абидова М. Ф., Агзамходжаева Д. Р., Самигов К. А.//Труды ВНИИНП.
1977. Т. 23. С. 10; Султанов А. С., Талипов Г. Ш„ Иноятов Н. Ш. и др.//
//Кинетика и катализ. 1971. Т. 12. С. 1259.
132. Schuit G. С. A., Gates В. C.//AJChEJ. 1973. V. 19. Р. 417.
133. Hagenbach G., Courty Р. Н., Delman В //}. Catal. 1973. V. 31. Р. 264;
Delmon В. С. r.//Acad. Sci. Ser. С. 1979. 289. Р. 173; Grande Р., Del-
mon B.//S. Less-Common Met. 1974. V. 36. N 1. P. 353.
134. Zabala J. M., Mainil M., Grande P., Gelmon B.//React. Kinet. Catal. and
Lett. 1975. V. 3. N 3. P. 285.
135. Delvaux G., Grande P., Delmon B.//J. Catal. 1979. V. 56. P. 99; C. R. Acad.
Sci. Ser. C. 1977. 285. P. 365.
136. Voorhoeve R. J. H., Wolters H. B. M.//Z. Anorg. Allg. Chem. 1970. B. 376.
S. 165; Voorhoeke R. J. H., Stuiker J. С. M.//L Catal. 1971, V. 23. P. 228,
238.
137. Ratnasamy P, Sivasanker S.//Catal. Rev. 1980. V. 22. N 3. P. 401.
138. Konnings A. J. A., Brentjens W L. J., Koningsberger D. C., De Beer V. H. J.//
//}. Catal. 1981. V. 67. N 1, P. 145.
139. Алексеенко Л. H., Ландау M B„ Нефедов Б. /(.//Кинетика и катализ.
1984. Т. 25. № 2. С. 462.
140. Radchenko Е. D., Landau М. V., Nefedov В. К. е. a.//Proc. 8-th Inter, congr.
on Catalysis Berlin/West/Dechema. 1984. V 2. P. 399; Ландау M. B.,
Агиевский Д. А., Слинкин А. А. и др.//Кинетика и катализ. 1982. T. 23.
С. 963.
141. Topsoe Н., Clausen В. S., Candia R. е. а.//У Catal. 1981. V. 68. Р. 433;
Wivel С., Candia R., Clausen В. S. е. a.//Ibid. 1981. V. 68. Р. 443.
142. Chung К. S., Massoth F. E.//J. Catal. 1980. V. 64. Р. 320—332.
143. Morup S., Clausen В. S., Topsoe H.//L Phys. Chem. 1979. V. 40. Р. С. 2.
200
144. Phillips R. W.f Fote A. A.f/У Catal. 1976. V 41. P. 168.
145. Берг Г. А., Эйгенсон А. С., Заитова А. Я. и др.//Гидрообессеривание оста-
точного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978. С. 103; Хабибул-
лин С. Г., Берг Г. А., Степанова Г. Г., Ярочкин В. Н./ДТам же, с. 67;
Dicks A. L., Ensell R. L., Phillips Г R. е. a.//J. Catal. 1981. V 72. Р 266.
146. Боресков Г /(.//Пористая структура катализаторов и процессы переноса
в гетерогенном катализе/IV Международный конгресс по катализу. Симп.
III. Новосибирск: Наука. СО, 1970. С. 5.
147. Слинько М. Г., Малиновская О. Л., Бесков В. С.//Химическая промышлен-
ность. 1979. № 9. С. 641; Дзисько В. А.//Научные основы подбора и про-
изводства катализаторов. Новосибирск: Наука. СО, 1964. С. 75, 84; Вла-
сенко В. М.//Проблемы теории и практики исследований в области ката-
лиза. Киев: Наукова Думка, 1973. С. 17; Maatman R. W Prater С. D.//Ind.
Eng. Chem. 1957. V 49. N 2. P. 253.
148. Эйгенсон А. С., Берг Г А., Соколова В. И., Галимова Р. //.//Гидрообес-
серивание остаточного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978.
С. 57.
149. Сурин С. А., Алиев Р. Р., Нефедов Б. К. и др.//Кинетика и катализ. 1981.
Т. 22. Вып. 5. С. 1327.
150. Laine J., Brito J., Yunes S.//J. Chem. Tech. 1983. V 33A. P 227.
151. Laine J., Pratt К. C., Trimm 0. L.//Ind. Eng. Chem. Prod. Rc\ Dev. 1979.
V. 18 N 4. P. 329.
152. Owens P. J., Amberg C. Chem. Ser. 1961. V 33. P 182; Kol-
boe S., Amberg C. //.//Can. J. Chem. 1966. V. 44. P. 2623.
153. Ratnasamy P., Sharma D. K., Sharma L. D.//J. Phys. Chem. 1974. V. 78.
P. 2069; Sinhamahapatra P. K., Sharma L. Z).//Termochimica acta. 1976.
V. 15. P. 333.
154. Липович В. Г„ Ветлугина Л. Н., Минаев В. 3.//Тезисы Всесоюзной науч-
ной конференции «Превращение углеводородов на кислотно-основных ге-
терогенных катализаторах». (Грозный)/1977. С. 234.
155. Kurita S., Vatanabe Т., Takaiyma N.//3. Chem. Soc. Jap., Ind. Chem. sec.
1971. V. 74. P. 939.
156. Крылов О. В., Киселев В. Ф. Адсорбция и катализ на переходных метал-
лах и их оксидах. М.: Химия, 1981. 286 с.; Yamadaya S., Kabe Т., Oba М.,
Miki Y.//J. Chem. Soc. Jap., Chem. and Ind. Chem. 1976. V. 2. P. 227.
157. Agudo A. L., Gie F. J., Ambias L. L. e. a.//Applied Catalysis. 1981. V 1.
P 59.
158. Gil F. J., Gareia Fierro J. L„ Agudo A. L.//Т. Phys. Chem., Neue Folg. 1980.
V. 123. P. 115.
159. Wakabayashi K., Matsuzahi T., Matada H.//L Chem. Soc. Jap., Chem. and
Ind. Chem. 1977. N 10. P. 1562; Tokyo nogyo shikensho hokoku. 1978. V 73.
N 8. P. 375.
160. De Beer V. H. J., Van der Aalst M. J. M., Machiels C. J„ Schuit G. C. A.//}.
Catal. 1976. V. 43. P. 78.
161. Topsee H„ Clausen B. S., Burriesei N. e. a.//Proc. of the Second Interna-
tional Symposium/Louvain-Ca-Nouve/Sept. 4—7. 1978/V. II. Preporation
of Catalysis, Elsevier Sci. Publ. Corp. Amsterdam — Oxford — New-York.
1979. P 479.
162. Lycourghiotis A., Tsiatsios A., Katsanos N. А.//Т. phys. Chem. 1981. V 126.
N 1. P. 95.
163. Сокольский Д. В., Сокольская Л. М//Металлы — катализаторы гидроге-
низации. Алма-Ата: Наука, 1970. С. 66.
164. Rylander Р. N. Catalytic Hydrogenation over platinum metalls. New-York —
London: Acad. Press, 1967. 309 p.
165. Дорогочинский A. 3., Есипко E. А. Гидрирование ароматических углеводо-
родов на металлоцеолитных катализаторах. М.: ЦНИИТЭнефтехим, 1980.
48 с.; Лихтерова Н. М., Хавкин В. А., Радченко Е. Д. и др.//Тезисы Всесо-
юзной научной конференции «Превращение углеводородов на кислотно-
основных гетерогенных катализаторах»/Грозный. 1977 С. 84.
166. Лихтерова II. М., Хавкин В. А., Рогов С. П. и др.//Химия и технология
топлив и масел. 1977. № 12. С. 8.
201
167. Гальперин Л. В., Федоров А. П., Маслянский Г П. и др.//Химия и тех-
нология топлив и масел. 1974, Хз 1. С. 42.
168. Смольник Ю. Е., Журба А. С., Катруш Р. В. и др.//Химия и технология
топлив и масел. 1972. № 2. С. 9.
169. Mueka V., Osirihonova A., Koperneky J. «.//Collect. Czech. Chem. Com-
mon. 1982. V. 47. N 11. P 2858.
170. Aboul-Cheit A. К.//У Appl. Chem. and Biotcchnol. 1977. V. 27. N 3. P. 121;
Цисун E. Л., Литвин E. Ф., Нефедов Б. К., Стоякина К. И.//Нефтехимия.
1981. Т. 21. № 3. С. 342; Цисун Е. Л., Нефедов Б. /(.//Нефтепереработка и
нефтехимия. 1983. № 2. С. 27.
171. Weiser О., Landa S. Sulphide Catalysts, their Properties and Applications.
Oxford — New-York: Pergamon Press, 1973. 506 p.
172. Семенова E. С.//Научные основы подбора и производства катализаторов.
Новосибирск: изд-во ИК СО АН СССР, 1964. С. 401.
173. Лихова 3. Н., Семенова Е. С., Нефедов Б. К., Зенченков А. //.//Нефтепе-
реработка и нефтехимия. 1981. № 7. С. 3.
174. Ландау М. В., Кругликов В. //.//Катализаторы процессов получения и
превращения сернистых соединений. Новосибирск: изд-во ИК СО АН
СССР, 1979. С. 108.
175. Андерсон Дж. Структура металлических катализаторов/Пер. с англ./Под
ред. Т. К. Борескова. М.: Мир, 1978. 478 с.
176. Stafford К. V.//Metalls Materials. 1969. V. 3. N 10. Р. ИЗ.
177. Ландау М. В., Кругликов В. Я., Коновальчиков О. Д. и др.//Химия и тех-
нология топлив и масел. 1976. № 4. С. 10.
178. Есипко Е. А., Дорогочинский А. 3.//Вопросы химии и химической техно-
логии нефти и газа. Грозный: Изд-во Чечено-Ингушского государственного
ин-та. 1978. С. 101.
179. Кричко А. А., Юлин М. К., Макарьев С. С. и др.//Тезисы Всесоюзной науч-
ной конференции «Превращение углеводородов на кислотно-основных гете-
рогенных катализаторах»/Грозный. 1977. С. 221.
180. Ландау М. В., Кругликов В. Я., Гончарова Н. В.//Кинетика и катализ.
1978. Т. 17. С. 1281.
181. Агафонов А. В., Кругликов В. Я., Ландау М. В. и др.//Химия и техноло-
гий топлив и масел. 1976. № 6. С. 12.
182. Гончарова Н. В., Коновальчиков Л. Д., Кругликов В. Я., Нефедов Б. К.//
//Нефть, процессы ' и продукты ее углубленной переработки. М.:
ЦНИИТЭнефтехим, 1983. С. 130; Чукин Г Д., Ландау М. В., Кругли-
ков В. Я.//Применение цеолитов в катализе/Материалы I Всесоюзной
конференции. Новосибирск: изд-во ИК СО АН СССР, 1976. Т. 2. С. 66.
183. Haccachu С., Primet М., Mathetn N. V.//Adv. Chem. Ser. 1973. V. 121.
P..266.
184. Mиначе в X. M., Антошин Г В., Шпиро Е. С.//Изв. АН СССР. Сер. хим.
1974. № 5. С. 1012; 1973. № 9. С. 2131.
185. Романников В. Н,, Ионе К. Г Орлова Л. П., Ждан П. А.//Труды IV со-
ветско-французского семинара по катализу; Тбилиси. 1978. С. 136,
1-86 . Shuit G. С. A.//Am. Inst. Chem. Eng. 1973. V. 19. Р. 417; Massoth F. E.//
//Adv. in Catal. 1978. V. 27. P. 265; Кордэро ^.//Свойства и применение
никельвольфрамовых катализаторов в реакциях гидродесульфурирования
и гидродеазотирования. М.: НИИТЭхим, 1981. Вып. 9. С. 40; Локтев М. И.,
Слинкин А. А.//Итоги науки и техники. Кинетика и катализ. М.: ВИНИТИ,
1980. С. 3.
187. Thakur D. S.//S. Less-Common Met. 1979. V 64. N 2. P. 202.
188. Самсонов Г. В., Дроздова С. В. Сульфиды. М.: Металлургия, 1972. 152 с.
189. Ratnasamy Р., Siuasanker S.//Catal Rev. 1980. V 22. N 3. P. 401.
190. Farragher A. L., Cossee P.//Proc. 5-th Intern. Congr. on Catalysis, North-
Holland, Amsterdam. 1973. P. 1301; Thomas R., de Beer V H. J., Mou-
lijn J. A.//Bull. Soc. Chim. Belg. 1981. V. 90. P. 1349; Vooihoeve R. J. H.,
Stuiver J. C. M.//J. Catal. 1971. V 23. N 2. P. 24; Konings A. J. A.//Ibid,
i 1981. V. 67. P. 145; Wivel C.//Ibid. 1981 V. 68, N 2, p. 453.
191. Hagenbach G. Courty P H., Delmon B.//S. Catal. 1973. V 31. P. 264.
202
192. Есипко Е. А., Дорогочинский А. 3.//Нанесенные металлические катализа-
торы превращения углеводородов. Новосибирск: изд-во ИК СО АН СССР,
1978, с. 108; Алексеенко Л. Н., Ландау М. В., Нефедов Б. К. и (^.//Кине-
тика и катализ. 1984. Т. 25. № 2. С. 492; Ландау М. В., Агиевский Д. А.,
Слинкин А. А. и др.//Там же. 1982. Т. 23. С. 963.
193. Ландау М. В., Зенченков А. Н. Кругликов В. Я. и др.//Нефтехимия. 1981.
Т. 21. № 6. С. 835.
194. Гончаренко А. Д., Леонтьев А. С., Переверзев А. Н. и др. Современные
состояния процессов очистки парафинов. М.: ЦНИИТЭнефтехим, 1978.
52 с.
195. У митинская О. П., Бадымтова К. М., Шабалина Т //.//Химия и техноло-
гия топлив и масел. 1982. № 7. С. 1.
196. Есипко Е. А., Кастерин В. Н., Гончаренко А. Д.//Нефтепереработка и неф-
техимия. 1982. № 9. С. 25.
197. Калянина Ю. Т., Шабалина Т. Н., Филиппова Г //.//Химия и технология
топлив и масел. 1979. № 3. С. 30.
198. Алиев Р. Р., Туровская Л. В., Каменский А. А. и Зр.//11аучные основы при-
готовления катализаторов. Новосибирск: изд-во ИК СО АН СССР, 1983.
С. 202.
199. Алиев Р. Р., Туровская Л. В., Вьюнова Г. М., Осокина //. А.//Химия и
технология топлив и масел. 1980. № 9. С. 57.
200. Миначев X. М., Исаков Я. //.//Металлсодержащие цеолиты в катализе.
М.: Наука, 1976. 85 с.; Топчиева К. В., Хо Ши Тхоанг. Активность и физи-
ко-химические свойства высококремнеземных цеолитсодержащих катали-
заторов. М.: Изд-во МГУ, 1976. 167 с.; Козлов Н. С., Урбанович И. И.,
Русак М. Ф. Ультрастабильные цеолиты. Минск: Наука и техника, 1979.
158 с.; Пионтковская М. А. Физико-химические, адсорбционные и катали-
тические свойства модифицированных фожазитов. Киев: Наукова Думка,
1978. 201 с.
201. Агафонов А. В., Пережигина И. Я., Радченко Е. Д. и др.//Гидрогенизаци-
онные процессы получения моторных топлив. М.: ЦНИИТЭнефтехим, 1978.
С. 23.
202. Радченко Е. Д., Сергиенко С. А., Чукин Г Д. и др.//Химия и технология
топлив и масел. 1982. № 6. С. 5.
203. Радченко Е. Д., Чернакова Г. Н., Пережигина И. Я., Полякова А. А.//Ка-
талитические процессы глубокой переработки нефти. М.: ЦНИИТЭнефте-
хим, 1980. С. 25.
204. Агафонов А. В., Маслянский Г Н., Рогов С. П. и дрУ/Нефтеперерабо^ка и
нефтехимия. 1971. № 4. С. 1.
205. Каменский А. А., Нефедов Б. К., Алиев Р. Р. и др.//Нефтепереработка и
нефтехимия. 1983. № 2. С. 6.
206. Цибулевский А. М., Вольфсон И. С., Липкинд Б. А. и др.//Химия и тех-
нология топлив и масел. 1973. № 7. С. 3.
207. Вольфсон И. С., Окружное А. М.//Нефтепереработка и нефтехимия. 1971.
№ 3. С. 32; № 8. С. 22; 1970. № 9. С. 21.
208. Кричко А. А., Юлин М. К, Заманова Л. П. и др.//Нефтепереработка
и нефтехимия. 1973. № 8. С. 10.
209. Алиев Р Р., Каменский А. А., Нефедов Б. К. и др.//] 1ефтенереработка
и нефтехимия. 1981. № 5. С. 9.
210. Нефедов Б. К., Алексеева Т В.//Химия и технология юплив и масел.
1983. № 4. С. 14; Коновальчиков Л. Д., Нефедов Б. К , Кругликов В. Я.,
Коновальчиков О. Д.//Там же. 1984. № 1. С. 15; Брек /I Цеолитные моле-
кулярные сита. М.: Мир, 1976. 781 с.
211. Kokotailo G. Т., Chu ^.//Nature. 1978. V 275. Р 119; Kokotailo G. Т.,
Lawton S. L., Olson D. //.//Ibid 1978. V 272 P 437; Hattingen E. M.,
Bennett J. M., Grose R. W. et a/.//Ibid. 1978. V 271. P 512.
212. Chen /V. Y., Garwood W £.//Adv. Chem. Ser 1975 V 121. P 175.
213. Шипикин В. В., Георгиевский В. Ю., Бровко В. Н. и др.//.Химия и техно-
логия топлив и масел. 1982. № 6. С. 7
214. Шипикин В. В., Толкачева И. Н., Георгиевский В. 10., Осадченко Л. //.//
//Химия и технология топлив и масел. 1984. № 8. С. II.
203
215. Куковицкий М. М., Дагаев Н. П., Сушко Л. Г. и ^.//Нефтепереработка и
нефтехимия. 1978. № 9. С. 29; Жукова Л. В., Станчева 3. С., Киселе-
ва Э. А.//Там же. 1983. № 6. С. 3; Бортов В.Ю., Шипикин В. В., Семе-
нов В. Ф. и др.//Там же. 1985. № 1. С. 3.
216. Хавкин В. А., Козлов И. Т., Нефедов Б. /(.//Химия и технология топлив и
масел. 1985. № 7. С. 23.
217. Гереченкова Н. А., Цибулевский А. М.//Химия и технология топлив и ма-
сел. 1975. № 1. С. 16.
218. Нефедов Б. /(.//Химия и технология топлив и масел. 1985. № 9. С. 18.
219. Bennett R. N., Eekes С. Т Weilss G. Т.//ОН and Gas J. 1975. V. 73. N 1.
P. 69.
220. Коновальчиков Л. Д., Нефедов Б. К., Радченко Е. Д., Коновальчиков О. Д.//
//IV Нефтехимический симпозиум Академии наук Социалистических стран:
12—17 ноября 1984 г. г. Балатон-Фюред. Венгрия. Будапешт: изд-во Ин-
ститута изотопов Венгерской АН, 1984. С. 91.
221. Технология катализаторов/Под ред. проф. Мухленова И. П. Л.: Химия,
1974. 95 с.
222. Kotera Y., Ogawa К., Oba М. е. a.//Preparation of Catalysts. Elsevier,
Amsterdam, 1976. P. 371; Inoguchi M., Mizutori T., Tate K. e. a.//Bull. Jap.
Petrol. Inst. 1976. V. 13. P. 19.
223. Piwowarski F., Radomyski B.//Nafta. 1977. V. 33. N 7. P. 240.
224. Ирисова К. H., Абрамкина Н. П., Смирнов В. К., Нефедов Б. /(.//Химия
и технология топлив и масел. 1982. № 6. С. 15.
225. Силин Н. Г., Каменский А. А., Нефедов Б. К. и ^.//Нефтепереработка и
нефтехимия. 1981. № 8. С. 26.
226. lannibello A., Mitchell Р. С. //.//Proc, of the Second Intern. Symp./Louvain-
la-Neuve, Sept. 4—7, 1978. V. П/Preparation of Catalysts. Amsterdam —
Oxford — New-York: Elsevier Sci. Publ. Co. 1979. P. 469.
227. Mckinley J. B.//Catalysis/Ed. Emmett P. H., Reinhold. New-York. 1957.
V. 5. P. 405.
228. Abert J., Delgado E., Ertl G. e. a.//Appl. Catal. 1982. V. 2. P 155.
229. Delannay F., Haeussber E. N., Delmon B.//J. Catal. 1980. V. 66. P. 469;
Bull. Soc. Chem. Belg. 1980. V. 89. P. 255.
230. Canosa R. B., Jeziorowski H. Knozinger H. e. a.//Bull. Soc. Chem. Belg.
1981 V 90 P 1339
231. Jeziorowski H., Knozinger H.//J. Phys. Chem. 1979. V. 83. N 9. P. 1166.
232. Wang L., Hall W. K.//J. Catal. 1982. V 72. P. 232; 1980. V 66. P. 251.
233. Kasztelan S., Gremblot J., Bonnelle J. P. e. a.//Appl. Catal. 1983. V. 7.
P. 91.
234. Cheng С. P., Schrader G. L.//J. Catal. 1979. V. 60. P. 276.
235. lannibello A., Trifiro F.//Т. Anorg. Allg. Chem. 1976. B. 413. P. 293.
236. Sonnemans J., Mars P.//J. Catal. 1973. V 31. P. 209.
237. Houalla M., Kibly C. L., Petrakis L., Hercules D. M.//J. Catal. 1983. V. 83.
P. 50.
238. Ochoa O., Galiasso R., Andreu P.//Proc. of the Second Intern. Symposium/
/Louvain-la-Neuve, Sept. 4—7, 1978. V П/Preparation of Catalysts. Am-
sterdam— Oxford — New-York: Elsevier Sci. Publ. Co. 1979. P. 493.
239. Гельме И. Э., Нефедов Б. К., Радченко Е. Д., Алиев Р. Р.//Нефть, про-
цессы и продукты ее углубленной переработки. М.: ЦНИИТЭнефтехим,
1983. С. 113.
240. Беляева 3. Г., Назаров В. И., Кутлучильдин Н. 3.//Химия и технология
топлив и масел. 1985. № 7. С. 39.
241. Алиев Р. Р., Погребной Ф. Н., Нефедов Б. К. и др.//ДАН СССР. 1982.
Т. 265. № 1. С. 89.
242. Дубинин М. М., Федорова Г М., Плавник Г М. и др.//Изв. АН СССР.
Сер. хим. 1968. № И. С. 2429.
243. Беленькая И. М., Дубинин М. М., Кршитофери И. //.//Изв. АН СССР.
Сер. хим. 1962. № 10. С. 2164.
244. Василенко Л. В., Нефедов Б. К-, Липкинд Б. А., Маслова А. А.//Химия
и технология топлив и масел. 1982. № 6. С. 10.
245. Жданов С. П., Егорова Е. Н. Химия цеолитов. Л.: Химия, 1968. 158 с.
204
246. Kerr G. T.//L Phys. Chem. 1967 V 71. P 4155; 1968. V 72. P. 2594;
1969. V. 73. P 2780.
247. Василенко Л. В., Нефедов Б. К., Липкинд Б. А., Маслова А. А.//Химия
и технология топлив и масел. 1982. № 11. С. 21.
248. Поезд Н. П., Радченко Е. Д., Пережигина И. Я., Агафонов А. В.//Химия
и технология топлив и масел. 1978. № 8. С. 37.
249. Ирисова К. Н., Костромина Т С., Нефедов Б. К. Носители катализаторов
гидроочистки на основе активной окиси алюминия. М.: ЦНИИТЭнефте-
хим, 1983. 48 с.
250. Левицкий Э. Л.//Химическая промышленность. 1960. № 7. С. 577.
251. Куклина В. Н., Плясова Л. М., Левицкий Э. А.//Кинетика и катализ. 1973.
Т. 14. Вып. 3. С. 726.
252. Дзисько В. А., Карнаухов А. П., Тарасова Д. В. Физико-химические осно-
вы синтеза окисных катализаторов. Новосибирск: Наука. СО, 1978. 384 с.
253. Чалый В. П. Гидроокиси металлов. Киев: Наукова Думка, 1972. 108 с.
254. Строение и свойства адсорбентов и катализаторов/Под ред. Б. К. Лин-
сена. М.: Мир, 1973. 643 с.
255. Imelik В., Petifjean M.t Pratt М.//С. г. Acad. Sci. 1954. V. 238. Р. 900.
256. Glemser О., Rieck G.//Augew. Chem. 1955. В. 67. S. 652; 1966. В. 68.
S 182
257 Bye G. E., Robinson J. E.//J. Appl. Chem. 1974. V. 24. P 633.
258. Baker B. R., Pearson R. M.//J. Catal. 1974. V. 33 N 2. P. 265.
259. Винникова T. С.//Кинетика и катализ. 1968. № 2. Вып. 9. С. 1331.
260. Зеленцов В. И., Чертов В. Я.Ц1Аз&. АН СССР/Серия Неорг. материалы.
1979. Т. 15. № 10. С. 1796.
261. Glemser O.//Naturwissenschaft. 1957. В. 44. S. 180.
262. lorkar К., Krishner //.//Monatsch. Chem. 1960. В. 91. S. 757; Шкряби-
на Р. А., Мороз Э. А., Левицкий Э. А.//Кинетика и катализ. 1981. Т. 22.
С. 1293.
263. Куклина В. Н., Плясова Л. М., Кефели Л. М., Левицкий Э. А.//Кинетика
и катализ. 1971. Т. 12. № 4. С. 1078; 1972. Т. 13. № 5. С. 1269.
264. Манетов А. Г.//Химия и технология топлив и масел. 1982. № 4. С. 2.
265. Петина А. П., Левинтер М. С.//Химическая промышленность. 1975. № 10.
С. 772.
266. Поезд Н. П., Пережигина И. Я., Радченко Е. Д. и др.//Химия и технология
топлив и масел. 1971. № 5. С. 31.
267. Силин Н. Г., Балашова Т. И., Наливайко М. М., Бударина Н. А.//Нефтепе-
реработка и нефтехимия. 1977. № 5. С. 7.
268. Lewis J. A., Taylor С. A.//L Appl. Chem. 1958. V. 8. Р 223.
269. McKenzie R. С., Meldan R.//Staub. 1962. V 22. P 329.
270. Криворучко О. П., Буянов Р. А., Федотов М. А., Плясова Л. М.//Журнал
неорг. химии. 1978. Т. 23. № 7. С. 1798.
271. Halfon A., Kaliagnine S.//Can. J. Chem. Eng. 1976. V. 54. N 3. P. 168.
272. Алексеева И. А., Семенова E. С., Нефедов Б. К., Липкинд Б. А.//Катали-
тические процессы глубокой переработки нефти. М.: ЦНИИТЭнефтехим,
1980. С. 174.
273. Научные основы производства катализаторов/Под ред. Р А. Буянова.
Новосибирск: изд-во ИК СО АН СССР, 1982. С. 223.
274. Лещев Н. П., Каменский А. А., Силин И Г Наливайко М. Л1.//Нефтепе-
реработка и нефтехимия. 1985. № 1. С. 5.
275. Шморуненко Н. С., Левицкий Э А.//И «в. АН БССР Сор хим. 1966. Т. 2.
С. 43.
276. Поезд Н. П., Радченко Е. Д. Поезд Д. Ф. I1ронзводсiво активной окиси
алюминия — носителя катализаторов для гидрогени «анионных процессов.
М.: ЦНИИТЭнефтехим, 1978. 35 с.
277 Friedrich K.//Kcram. Z. 1977. N 8. S 395
278. Плаксина В. В., Фомичев Ю. В. Левинтер М /:’.//! 1аучпые основы приго-
товления катализаторов. Новосибирск- и «д но ПК СО АН СССР, 1983.
С. 216.
279. Ч истякова В. А., Красий Б. В., Кус юна Т С. и др //'Гам же. С. 224.
205
280. Боресков Г. К., Дзисько В. А., Борисова М. С., Краснопольская В. Н.//
//ЖФХ. 1952. Т. 26. № 4. С. 492.
281. Боресков Г К., Дзисько В. А., Борисова М. С.//ЖФХ. 1953. Т. 27 № 8.
С. 1176.
282. Ермоленко Н. Ф., Эфрос М. Д.//Регулирование пористой структуры окис-
ных адсорбентов и катализаторов. Минск: Наука и техника, 1971. 51 с.
283. Куркова Н. С., Кацобашвили Я. Р.//ЖПХ. 1973. Т. 46. № 5. С. 918.
284. Власова Е. А. Дерюжкина В. И., Мухленов И. //.//Исследование гетеро-
генных каталитических процессов. Л.: Химия, 1976. С. 76.
285. Ермоленко Н. Ф., Габулина Л. В., Васильева 3. И., Эфрос М. Д.//Кинети-
ка и катализ. 1976. Т. 14. № 4. С. 946.
286. Janiak S., Jaw or ska-Galas Z., Miecznikovski A .//Clicm i a. Stosowana. 1975.
V. 19. N 2. P. 185.
287. Федоров Г И., Кижаев Б. В., Измайлов Р. //.//Кинетика и катализ. 1980.
Т. 21, № 2. С. 557.
288. Bahadur W., Mohapatra Н., Muhheryu D. R., Sen S. ^.//Technology (India).
1974. V 11. N 2—3. P 87.
289. Лещев H. П., Фомичев Ю. В., Томина H. Н. и (/^.//Нефтепереработка и
нефтехимия. 1986. № 2. С. 3.
290. Halle //.//Oil and Gas J. 1982. V. 80. N 51. P. 69; Brewer M. B., Chea-
vens T. //.//Hydrocarb. Proc. 1960. V. 45. N 4. P. 203.
291. McKinley J. //.//Catalysis. Reinhold: New-York. 1957. V. 5. P 405.
292. John C. S., Williamson J. G., Kennedy V F., Tyler T. К-//J. Chem. Soc.,
Faraday Trans. 1980. V 76. N 6. P. 1356.
293. Williamson J. G., John C. S., Kemball C.//J. Chem. Soc., Faraday Trans.
1980. V 76. N 6. P 1366.
294. Daly F. P.//J. Catal. 1978. V. 51. P. 221.
295. Gissy H., Bartsch R., Tanielian C.//J. Catal. 1980. V. 65. P. 150, 158.
296. Kilanowski R., Tecuwen H., De Beer V H. J. e. a.//J. Catal. 1978. V. 55.
P. 129.
297. Blidisel I., Welther £.//Petrol. Gas. 1972. V. 23. P 241, 881.
298. Thomas R.f Van Oers E. M., De Beer V. H. e. a.//5. Catal. 1982. V. 76.
P. 241.
299. Sonnemans J., Mars P.//S. Catal. 1973. V 31. P. 209.
300. Зайнуллин X. H„ Танатаров M. А., Фасхутдинов P. А.//Изв. вузов: серия
«Нефть и газ». 1982. № 10. С. 41; Курганов В. М., Рогов С. П., Мыно-
ва 3. И., Агафонов А. //.//Нефтепереработка и нефтехимия. 1969. № 1.
С. 4.
301. Brewer Н. В., Cheavens Т. //.//Hydrocarb. Proc. 1966. V. 45. N 4. Р. 203.
302. Эдгар М. Д., Джонсон А. Д., Писториус Д. Т Варади Т.//Нефть. газ и
нефтехимия за рубежом. 1984. № 5. С. 77.
303. Берг Г А., Соколова В. И., Ярочкин В. //.//Гидрообессеривание остаточ-
ного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978. С. 151.
304. Lipsch J. М. J. G., Schuit G. С. A.//J. Catal. 1969. V 15. N 2. Р. 179.
305. Миначев X. М., Исаков Я. //.//Приготовление, активация и регенерация
цеолитных катализаторов. М.: ЦНИИТЭнефтехим, 1971. 84 с.
306. Николаев К. М., Полякова Н. С.//Адсорбция и пористость. М.: Наука,
1976. С. 237, 278.
307. Миначев X. М., Шпиро Е. С., Юсифов Ю. А. Кинетика и катализ. 1977.
Т. 18. С. 587.
308. Кипнис М. А., Агиевский Д. А. ЖПХ. 1979. № 2. С. 461; Garbowski Е.,
Nathien М. V.//J. Chim. phys. et phys. chim. biol. 1975. V 72. N 11 —12.
P. 1249.
309. Афанасьев А. И., Дорогочинский A. 3., Вольнова E. Г Мирский Я. В.//
//Нефтепереработка и нефтехимия. 1968. № 10. С. 18.
310. . Uitterhoeven I. //.//Acta phys. et chem.: Szeged. 1978 V 24. N 1—2.
P. 53.
311. Winkler H., Ebert W., Riedel £.//Surface Sci. 1975. V 50. P. 565.
312. Naccachi C., Ben Taarit Yonnes//Acta phys. et chem.: Szeged. 1978. V 24.
N 1—2. P 23.
206
313. J. Phys. Chem. 1977. V. 81. P 1317; Beyer H., Jacobs P., Uytherhoeven L.//
//J. Chem. Soc., Faraday Trans. 1976. V 72. P 674.
314. Агиевский Д. А., Квашонкин В. И. Кипнис М. А.//Нанесенные металли-
ческие катализаторы превращения углеводородов. Новосибирск: изд-во
ИК СО АН СССР. 1978. С. 89, 93.
315. Herd A., Pope C.//J. Chem. Soc., Faraday Trans. 1979. V. 69. P. 833.
316. Z. Anorg. Allg. Chem. 1974. B. 410. N 3. S. 225.
317 Gallezot P.//J. microscop, et sped rose 1976. V 1. P. 1.
318. Gallezot P.//§-\h Int. Congress on Catalysis. London. 1976. All. P. 1.
319. Миначев X. M., Антошин Г В., Шпиро Е. С., Исаков Я. И.//Изв. АН
СССР. Сер. хим. 1973. № 9. С. 213.
320. Миначев X. М., Гаранин В. И Харламов В. В.//Нефтехимия. 1969. Т. 8.
С. 808.
321. Rabo J. Н., Schomaker V., Pickert Р. Е.//Ргос. of the 3-d Int. Congress on
Catalysis. V 2. Amsterdam. 1965. P. 1264.
322. Букреев В. Ф., Васейко А. И., Войтехов А. А. и ^.//Нефтепереработка и
нефтехимия. 1975. № 10. С. 5; Войтехов А. А., Филиппова 3. С. Кар-
жев В. И. и др.//Там же. 1973. № 10. С. 17.
323. Ридил Э. Развитие представлений в области катализа. М.: Мир, 1971,
с. 251.
324. Алиев Р. Р., Шостаковский М. Ф., Радченко Е. Д., Туровская JE В//ДАН
СССР 1977 Т 232 № 2 С 350
325. Montagna A. A., Chun S. W Frayer J. А.//Ргос. of the 9-th World Petrol.
Congr., 18. P. 1.
326. Nelson W. L.//Oil and Gas J. 1976. V. 74. N 46. P. 72.
327. Картер К- //.//Нефть, газ и нефтехимия за рубежом. 1980. № 9. С. 75.
328. Хабибуллин С. Г., Берг Г. А., Шмель А. С. и ^.//Гидрообессеривание
остаточного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1978. С. 78.
329. Beuther Н., Schmid В.//6-th World Petrol. Congr./Frankfurt. West Germany.
June 21, 1983, Sect 3. Paper 20. 1963. P. 297.
330. Липович В. Г., Минаев В. 3., Афанасьев А. Д. и dp.//Нефтепереработка и
нефтехимия. 1974. № 6. С. 1.
331. Kwan Т., Sato A4.//Nippon Kagaku Kaishi. 1970. V. 91. N 12. P 1103.
Ohtsuka T Hasegawa Y Ono T.//Bull. Jap. Petrol. Inst. 1969. V 11.
P. 3.
332. Курганов В. M., Кушнер Б. Э., Агафонов А. В. Паровоздушная регенера-
ция катализаторов гидроочистки. М.: ЦНИИТЭнефтехим, 1973. 68 с.; Вар-
фоломеев Д. Ф., Уразаев Ф. X., Ахметов Ф. Г. и ^.//Нефтепереработка..
1972. № 3. С. 5; Липович В. Г., Минаев В. 3., Афанасьев А. Д. и др.//Там
же. 1974. № 7 С. 4; Курганов В. М., Кушнер Б. Э., Финелондв В. П.
и др.//Там же. 1972. № 8. С. 1.
333. IFes Z. Р., Gudurn К. D.//J. Catal. 1976. V. 2. N 6. Р. 227
334. Hopkins Р. D., Meyers В. L.//Ind. Eng. Chem. Prod. Res. Dev. 1983. V 22.
N 3. P. 421.
335. Parehin B. S., Weller S. W.//J. Catal. 1978. V. 55. P. 58.
336. Nahin P. G., Huffmann H. C.//Ind. Eng. Chem. 1949. V. 41. P. 2021.
337 Ratnasamy P., Mehrotra R. P., Ramaswamy A. V.//J. Catal. 1974. V 32.
P 32.
338. Giordano N., Bart J. C. J., Vaghl A. e. a.//J. Catal. 1975. V 36. P. 81.
339. Галич П. H., Гутыря В. С., Комовальчиков О. Д. Тюряев И Я.//ДМА
СССР. 1966. Т. 168. № 2. С. 379.
340. Курганов В. М., Мынова 3. А., Рогов С. П. и ^.//Нефтепереработка и
нефтехимия. 1968. № 7. С. 13.
341. Осипов Л. Н., Пережигина И. Я., Козлов И. /'.//Нефтепереработка и неф-
техимия. 1972. № 9. С. 16.
342. Рогов С. П., Пережигина И. Я., Финелонов В. И и (^.//Нефтепереработка
и нефтехимия. 1973. № 10. С. 10.
343. Галимов Ж- Ф., Дубинин Г. Г., Масагутов Р М Методы анализа катали-
заторов нефтепереработки. М.: Химия, 1973. 192 с
344. Щукин Е. Д., Бессонов А, И., Паранский С. А. Механические испытания
катализаторов и сорбентов. М.: Наука, 1971. 55 с.
207
345. Методы исследования катализаторов: Пер. с англ./Под ред. Д. Томаса,
Р. Лемберта. М.: Мир, 1983. 304 с.
346. Буянова И. Е., Гудкова Г Е., Карнаухов А. П. и др.//Методы исследо-
вания катализаторов и каталитических реакций. Новосибирск: изд-во ИК
СО АН СССР. 1965. Т. 11. С. 55.
347. Морозов Б. Ф., Берг Г А., Соколова В. //.//Нефтепереработка и нефтехи-
мия. 1969. № 4. С. 53.
348. Dubinin М. М.//Progress in Surfuce and Membrane Science. (Eds. Daniel-
li J. F., Rosrnberg M. D., Cadenhead D. A.). V. 9. New-York: Academic
Press. 1975. P. 1.
349. Dubinin M. M, Stoeckli H. F.//S. Colloid Interface Sci. 1980. V. 75. P. 34.
350. Stoeckli H. F.//J. Colloid Interface Sci. 1977. V. 59. P. 184.
351. Lippens В. C., De Boer J. Н.//Г Catal. 1965. V. 4. P. 319.
352. Michail R. S., Brunauer S., Bodor E. Е.//Г Colloid Interface Sci. 1968. V 26.
P. 45.
353. Dollimore D„ Heal G. RJ/Г Applied Chem. 1964. V. 14. P. 109.
354. Осипов Л. H., Семенова E. С., Рогов C. 77.//Нефтепереработка и нефтехи-
мия. 1963. № 3. С. 5.
355. Соколова В, И., Берг Г. А., Ярочкин В. Н., Галимова Р. //.//Гидрообес-
серивание остаточного нефтяного сырья. М.: ЦНИИТЭнефтехим, 1976.
С. 133.
ПРИЛОЖЕНИЕ
МЕТОДЫ АНАЛИЗА КАТАЛИЗАТОРОВ
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ТРИОКСИДА МОЛИБДЕНА
Метод основан на фотометрическом определении МоО3 в виде
комплекса Mo(V) с роданидом калия.
Реактивы
Серная кислота, концентрированная и разбавленная в соот-
ношении 1 1 и 1 : 2
Соляная кислота, концентрированная
Молибдат аммония
Аммиак водный, 10%-й раствор
Ацетат аммония, 2,5%-й раствор
Уксусная кислота, 80%-я
Ацетат свинца, 2%-й раствор
Сульфат меди, 4%-й раствор
Нитрат никеля (или сульфат кобальта)
Метилоранж, 0,1-й раствор
Тиомочевина, 20-й раствор
Приготовление стандартного раствора. На-
веску 0,3 г молибдата аммония (МН4)бМо7О24-4Н2О растворяют
в 100 мл дистиллированной воды, прибавляют 10 мл раствора
NH4OH, 2—3 капли метилоранжа и концентрированную соляную
кислоту до кислой реакции. Затем добавляют еще 5 мл соляной
кислоты, 10 г ацетата аммония и 50 мл уксусной кислоты. Смесь
нагревают до кипения и из бюретки добавляют раствор ацетата
свинца. Нагревают смесь на водяной бане и фильтруют. Осадок
на фильтре промывают горячим раствором ацетата аммония,,
фильтр с осадком подсушивают в фарфоровом тигле при 100 °C
и затем прокаливают при температуре 600 °C до постоянной
массы.
Содержание МоО3 (Ск, %) в (NH4)6Mo7O24-4H2O рассчиты-
вают по формуле:
0,39207.а 100
ск= I ,
где а — масса прокаленного осадка, г; b масса молибдата аммония, г.
Для приготовления стандартного раствора с учетом найден-
ного содержания МоО3 берут навеску молибдата аммония
(NH4)6Mo7O24-4H2O (содержание МоО3 0,1500 г/л), помещают
в мерную колбу и растворяют в дистиллированной воде (раст-
вор А). Из раствора А отбирают 20 мл и переносят в мерную
колбу емкостью 200 мл, разбавляют дистиллированной водой до
метки и получают раствор Б.
Построение калибровочного графика. В фар-
форовом стакане в 15 мл серной кислоты (1 1) растворяют
0,1 г оксида алюминия, переносят в колбу емкостью 250 мл.
К содержимому добавляют 0,016 г нитрата никеля или сульфата
кобальта (в зависимости от того, какой металл, кроме молиб-
дена, входит в состав катализатора). Разбавляют дистиллиро-
ванной водой до метки и получают раствор В. Из стандартного
раствора Б, взятого в количестве 6, 9, 12, 15, 18, 21, 24 мл, в кол-
бах емкостью 100 мл готовят растворы с добавлением по 5 мл
раствора В, 2 мл 4,0%-го раствора сульфата меди, 30 мл серной
кислоты (1:2), 5 мл горячего 20%-го раствора тиомочевины и
10 мл 10%-го раствора роданида калия. Доводят объем дистил-
лированной водой до метки. Через 10 мин измеряют оптическую
плотность полученных растворов на фотоколориметре и строят
калибровочную кривую.
Методика определения МоО3. При отсутствии в ка-
тализаторе диоксида кремния навеску растертого образца
0,2—0,3 г прокаливают при температуре 600 °C и растворяют в
фарфоровом стакане в 20 мл серной кислоты (1:1) при нагре-
вании. Раствор переносят в мерную колбу емкостью 500 мл, до-
водят объем дистиллированной водой до метки. В мерную кол-
бу емкостью 100 мл переносят 2—5 мл полученного раствора,
добавляют 2 мл 4 %-го раствора сульфата меди, 30 мл серной
кислоты (1 : 2), 5 мл 20 %-го раствора роданида калия. Доводят
объем до метки дистиллированной водой и через 10 мин опреде-
ляют оптическую плотность.
Содержание МоО3 в катализаторе (СМоо3, %) рассчитывают
по формуле:
ChV-100
СМоО3 — aVi. Ю00 ’
где Ск — содержание МоО3, найденное по калибровочной кривой, мг; а — на-
веска катализатора, г; V — объем анализируемого раствора, мл; У1 — объем
разведения навески катализатора, мл.
14-922
209
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ДИОКСИДА КРЕМНИЯ
Метод определения SiO2 основан на выделении осадка крем-
ниевой кислоты и ее дегидратации в среде сильной кислоты.
Реактивы
Кислота серная, концентрированная и разбавленная в соот-
ношении 1 1
Кислота плавиковая
Методика определения SiO2. Навеску измельченного
катализатора 0,2—0,3 г, прокаленного при температуре 600 °C,
растворяют в серной кислоте (1:1) и нагревают до появления
паров SO3. После охлаждения прибавляют равный объем ди-
стиллированной воды, нагревают до кипения и разбавляют го-
рячей водой до 100—150 мл. Осадок отделяют на фильтре,
промывают разбавленной серной кислотой, помещают в плати-
новый тигель, подсушивают и прокаливают при температуре
1000—1100 °C в течение 2 ч. Фильтрат и промывную жидкость
собирают и используют далее для определения содержания
МоО3 (по методике, описанной выше) и других компонентов.
Если осадок в тигле загрязнен (имеет голубоватый оттенок),
то в него добавляют дистиллированную воду, несколько капель
концентрированной серной кислоты (до появления осадка) и
плавиковую кислоту. Выпаривают осадок до появления белых
паров, повторно прокаливают при температуре 1000—1100 °C
в течение 1 ч, охлаждают и взвешивают.
Содержание SiO2 (CSio2, %) рассчитывают по формуле:
(а-6). 100
Чю2 = -с ,
где а — масса тигля с осадком после первого прокаливания, г; b — масса
пустого тигля или тигля после прокаливания, г; с — навеска катализатора, г.
Остаток в тигле после второго прокаливания растворяют
в серной кислоте (1 1) и раствор присоединяют к фильтрату.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОКСИДА НИКЕЛЯ(Н)
Анализ можно проводить весовым или колориметрическим
методом.
Весовой метод основан на определении содержания диметил-
глиоксимата никеля, образующегося при взаимодействии соли
никеля с диметилглиоксимом в щелочной среде.
Реактивы
Серная кислота, разбавленная в соотношении 1 1
Аммиак водный, 25- и 10%-й растворы
210
Винная кислота
Диметил глиоксим, 0,1 М щелочной раствор или 1,0%-й спир-
товый раствор
Методика определения NiO. Навеску 0,5—0,6 г
измельченного и прокаленного при температуре 600 °C катали-
затора растворяют в серной кислоте (1 1), добавляют 5—7 г
винной кислоты, дистиллированную воду до 70—100 мл и ней-
трализуют раствором NH4OH. Затем добавляют еще раствор
NH4OH и титруют 0,1 М раствором димстилглиоксима.
Содержание iNiO (Сжо, %) находят по формуле:
Т-Г 100
^NiO “ »
где Т — титр раствора диметилглиоксима, г/мл; V — объем 0,1 М раствора
диметилглиоксима, израсходованный на титрование, мл; а — навеска катали-
затора, г.
Колориметрический метод основан на реакции образования
окрашенного в малиново-красный цвет внутрикомплексного
соединения никеля с диметилглиоксимом в присутствии окисли-
теля.
Реактивы
Азотная кислота, концентрированная
Персульфат аммония, 3,0%-й раствор
Диметилглиоксим, 1,0%-й спиртовый раствор
Нитрат никеля, стандартный раствор
Аммиак водный, 10%-й раствор
Приготовление стандартного раствора.
В 1000 см3 дистиллированной воды, подкисленной 1 мл азотной
кислоты, растворяют 0,991 г нитрата никеля !Ni(NO3)2-6H2O.
Точное содержание никеля определяют весовым методом. Нагре-
вают содержимое до температуры 60—80 °C и осаждают никель
1,0%-м спиртовым раствором диметилглиоксима. Затем добав-
ляют раствор NH4OH до слабого запаха аммиака и выдержива-
ют 1,0—1,5 ч. Образовавшийся осадок отделяют на фильтре,
промывают горячей водой, осторожно обугливают в фарфоро-
вом тигле и прокаливают при температуре 700—800°C до посто-
янной массы.
Содержание никеля (CNi, %) определяют по формуле:
т-0,7858
Cnj - 100
где m — масса осадка, г.
Готовят 5 эталонных растворов с концентрацией никеля 0,01,
0,02, 0,05, 0,1 и 0,2 мг/л путем разбавления, выдерживая
pH 2—3, добавлением HNO3. Измеряют оптическую плотность
и строят калибровочный график.
211
Методика определения NiO. В мерную колбу ем-
костью 50 мл переносят 5 мл рабочего раствора, добавляют 5 мл
3,0%-го раствора персульфата аммония, 5 мл 1,0%-го раствора
диметилглиоксима и доводят объем до метки дистиллированной
водой. Раствор перемешивают и через 15 мин определяют опти-
ческую плотность, а затем находят концентрацию никеля по
калибровочному графику.
Содержание NiO в катализаторе (Cnio, %) определяют по
формуле:
Зд/.юо
где Cni — концентрация никеля, найденная по калибровочному графику, г/л;
V — объем приготовленного раствора, мл; т — навеска катализатора, г.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОКСИДА КОБАЛЬТА(П)
Определение можно проводить методом потенциометрическо-
го титрования или фотоколориметрии. Первый метод основан на
окислительно-восстановительной реакции:
Со2+ + [Fe(CN)e]3+ Со3+ + [Fe(CN)e]4-.
Реактивы
Аммиак водный 25%-й раствор
Сульфат аммония, 10%-й раствор
Соляная кислота, концентрированная
Серная кислота, концентрированная и разбавленная в соот-
ношении 1 1
Нитрат кобальта
Феррицианид калия, 0,033М титрованный раствор
Методика определения СоО. Навеску 0,3—0,5 г
измельченного и прокаленного при температуре 600 °C катали-
затора растворяют в серной кислоте (1: 1), добавляют дистил-
лированную воду до 50 мл, затем раствор сульфата аммония
и водный раствор аммиака. В связи с подготовленным раство-
ром, электродами и мешалкой при перемешивании по каплям
добавляют раствор железосинеродистого калия. После резкого
изменения потенциала добавляют 0,1—0,2 мл раствора
K3Fe(CN)6 и заканчивают титрование.
Содержание СоО в катализаторе (ССоо, %) определяют по
формуле:
TV-юо
Qoo = — .
где V — объем раствора КзРе(СГ^)б, пошедший на титрование, мл; Т — титр
раствора КзРе(СЬ1)б по СоО, г/мл; т — навеска катализатора, г.
Фотоколориметрический метод определения СоО основан на
образовании комплекса с роданидом калия в растворе ацетона
(или этанола).
212
Реактивы
Гидроксид натрия, 25%-й раствор
Соляная кислота, разбавленная в соотношении 1 1
Аммиак водный, 20—25%-й раствор
Роданид калия
Ацетон (или этанол)
Методика определения СоО(П). Из раствора ката-
лизатора, приготовленного для определения МоО3, осаждают
кобальт. Переводят А1(ОН)3 в алюминат натрия, добавляя
25%-й раствор гидроксида натрия. Горячий раствор фильтруют,
промывают на фильтре 4—5 раз горячей водой, осадок раст-
воряют на фильтре горячей соляной кислотой, фильтр про-
мывают горячей водой. Фильтрат и промывные воды собира-
ют в колбу емкостью 1000 мл, нейтрализуют 20—25 %-м раст-
вором NH4OH (pH 7—8), доводят до метки дистиллированной
водой и получают раствор для определения содержания оксида
кобальта.
В колбу емкостью 100 мл переносят 5 мл подготовленного
раствора, добавляют 1 г роданида калия, 5 мл воды, 10 мл аце-
тона, колбу охлаждают (0°С) и проводят фотоколориметриро-
вание. В качестве раствора сравнения используют раствор, со-
держащий 2 г роданида калия, 20 мл воды и 20 мл ацетона (или
2 г роданида калия, 16 мл воды и 24 мл спирта).
Концентрацию кобальта (ССоо, %) находят по калибровоч-
ному графику. Содержание СоО в катализаторе рассчитывают
по формуле:
г СсоГ.ЮО
Ссоо= -------.
где Ссо — концентрация кобальта в растворе, найденная по калибровочному
графику, г/мл; V — объем раствора, взятый для анализа, мл; m — навеска
катализатора, г.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОКСИДА НАТРИЯ
Определение проводят пламенно-фотометрическим методом,
основанным на изменении интенсивности излучения атомов
натрия, возбуждаемых в пламени газовой горелки.
Реактивы
Карбонат натрия 0,05 М или хлорид натрия 0,1 М — фикса-
налы
Нитрат натрия
Серная кислота, разбавленная в соотношении 1 1
Плавиковая кислота
Молибдат аммония
Сульфат кобальта (или никеля)
Нитрат никеля
213
Приготовление стандартного раствора. В кол-
бу помещают 50 мл раствора фиксанала, добавляют 100 мл ди-
стиллированной воды и перемешивают. Готовят растворы мо-
либдата аммония концентрацией по МоО3, 2,4 г в 1 л сульфата
кобальта или никеля концентрацией по CoO(iNiO) 0,8 г/л.
Готовят растворы концентрацией по Na2O (в %): 0,0001,
0,0002, 0,0003, 0,0004 и 0,0005. В каждый раствор добавляют по
50 мл молибдата аммония, 50 мл сульфата кобальта (никеля) и
доливают дистиллированную воду до метки.
Методика определения Na2O. Навеску 0,2—0,3 г из-
мельченного и прокаленного при температуре 600 °C катализа-
тора помещают в платиновый тигель, увлажняют водой, добав-
ляют несколько капель серной кислоты (1 1), 10—15 мл
плавиковой кислоты и нагревают до полного удаления паров
серной кислоты.
Затем добавляют 10—15 мл дистиллированной воды, 10—
15 мл серной кислоты (1:1) и растворяют остаток при нагрева-
нии. Раствор переносят в мерную колбу 100 мл и разбавляют
водой до метки.
Пламенно-фотоколориметрическую установку приводят в ра-
бочее состояние, проводят градуировку шкалы прибора по
3—4 эталонным растворам. Измеряют показания гальванометра
и строят калибровочный график. Затем горелку и распылитель
промывают дистиллированной водой и вводят анализируемый
раствор.
Содержание Na2O (CNa2o, %) в катализаторе рассчитывают
по формуле:
с-100
Сыа2О = —— .
где С—концентрация Na2O в растворе, найденная по графику, %; т — на-
веска катализатора, г.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ОКСИДА ЖЕЛЕЗА(П1)
Метод основан на фотоколориметрическом определении же-
леза (III) в виде его комплекса с роданидом калия или аммония.
Реактивы
Кислота азотная, концентрированная и разбавленная в отно-
шении 1 1
Кислота соляная, 10%-й раствор
Роданид калия (или роданид аммония), 10,0%-й раствор
Квасцы железоаммонийные
Метилрот
Хлорид аммония, 10,0%-й раствор
Аммиак водный, 10,0%-й раствор
Нитрат аммония, 2,0%-й раствор
Приготовление стандартного р а с т в о р а. В мер-
ной колбе емкостью 250 мл растворяют 0,216 г кристаллов
железоаммонийных квасцов, добавляют 5 мл концентрирован-
214
ной серной кислоты, доводят объем до метки дистиллированной
водой и разбавляют в 100 раз до концентрации 0,001 мг железа
в 1 мл раствора.
Отбирают 100 мл раствора, добавляют к нему несколько
капель азотной кислоты, кипятят до удаления паров оксидов
азота, затем добавляют 2—3 капли индикатора метилрота,
30 мл 10,0%-го раствора соляной кислоты и осаждают 10,0%-м
раствором NH4OH до слабощелочной реакции. Раствор нагре-
вают 2—3 мин на водяной бане, фильтруют в горячем состоянии,
осадок промывают несколько раз горячим 2,0%-ным раствором
нитрата аммония с несколькими каплями водного раствора
аммиака, затем водой. Переносят осадок в фарфоровый тигель,
сушат и прокаливают до постоянной массы при температуре
500 °C.
Концентрацию железа (CFe, %) в растворе определяют по
формуле:
т•0,6993
CFe = 100
где т — масса осадка, г.
Построение калибровочного графика. В 6 мер-
ных колб емкостью 50 мл наливают 4, 8, 12, 16, 20 и 24 мл
стандартного раствора, добавляют 1 мл HNO3, 10 мл раствора
роданида аммония или калия и доводят до метки дистиллиро-
ванной водой. По результатам измерения оптической плотности
строят калибровочный график.
Методика определения содержания Fe2O3. В мер-
ную колбу вводят 10—20 мл раствора катализатора после
отделения диоксида кремния, азотную кислоту (1 1), серную
кислоту (1 1) и раствор роданида аммония. Доводят объем до
метки дистиллированной водой, измеряют оптическую плотность
и находят концентрацию железа по градуировочному графику.
Содержание Fe2O3 в катализаторе (CFe2o8> %) определяют
по формуле:
„ CFe-500-1,43.100
Сге2о3 - юои/п
где Сге — концентрация железа в растворе пробы, найденная по калибровоч-
ному графику, мг; т — навеска катализатора, г; V — объем раствора пробы,
взятый для измерения оптической плотности, мл.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ СЕРЫ
Серу, которая находится в катализаторе в виде сульфат-
ионов, определяют йодометрическим методом.
Реактивы
Соляная кислота, концентрированная
Гидроксид калия, 40%-й раствор
Ацетат кадмия, 52%-й раствор
Иод, 0,1 М раствор
215
Гипосульфит натрия, 0,1 М раствор
Крахмал, 5,0%-й раствор
Методика определения. Навеску катализатора поме-
щают в колбу Вюрца, через капельную воронку приливают кон-
центрированную соляную кислоту и продувают воздухом в тече-
ние 1 ч, затем нагревают содержимое колбы 10—15 мин и про-
пускают воздух еще в течение 10—15 мин. Выделяющийся газ
пропускают через 40%-й раствор гидроксида калия и сероводо-
род поглощают раствором ацетата кадмия.
После поглощения сероводорода растворы переносят в мер-
ную колбу емкостью 250 мл, доводят объем до метки дистилли-
рованной водой. Далее в коническую колбу с притертой пробкой
наливают 5 мл концентрированной соляной кислоты, 50 мл
воды, 20 мл 0,1 М раствора иода, вводят 50 мл анализируемого
раствора и титруют 0,1 М раствором гипосульфита натрия в при-
сутствии крахмала. Параллельно титруют контрольную пробу
(50 мл воды, 5 мл соляной кислоты и 20 мл раствора иода).
Содержание серы (Cs, %) вычисляют по формуле:
г Т (Го 100
где Т — титр раствора гипосульфита натрия по сероводороду, г/л; Го и Г1 —
объемы раствора гипосульфита натрия, пошедшего на титрование контрольной
и анализируемой пробы, мл; m — навеска катализатора, г.
217
Таблица, Характеристики цеолитов [210, с, 356]
1 г а Цеолит Структурный тип Катионы Состав каркаса Стабильность Размер пор, нм-1 Объем пор, смЗ/г
А A Na Si/Al-l.Ge Стабилен 4,0 0,30
Na-А A Na, ТМА Si/Al= 1,25—3 4,3 0,30
Р-Аб A Na Si-Al-P 4,0 0,27
а A Na, ТМА Si/Al=2—3,5 4,3 0,30
Li-A Неизвестен Li Si/Al=l 2,6 0,15
Анальцим Анальцим Li Si/Al= 1,5—3,0 2,6 0,10
В(Р) Жисмондин Na Si/Al= 1—2,5 Нестабилен 2,6 0,24
Na-B Анальцим Na Si/AI=2 Стабилен 2,6 —
₽ Неизвестен Na, TEA Si/Al=2,5—5,0 6,0 0,20
Бикитаит Бикитаит Li Si-Al — — —
Р-Ва Жисмондин Na Si-Al-P Нестабилен — —
Р-Са Анальцим Na Si-Al-P Стабилен — —
Клиноптилолит Клиноптилолит Li Si-Al — — —
Ca, Sr, Ba Si-Al — — —
D Шабазит Na, К Si/Al = 2,3—2,5 Стабилен 4,0 0,26
Ca-D Вайракит Ca Si/Al = 2 — — 0,11
nh4-d Анальцим nh4 Si-Al — — —
Na-D Мор денит Na Si/Al=5 Стабилен 4,0 0,13
Rb-D Z Rb Si/Al=2 — — —
Sr-D Феррьерит Sr Si/Al«3,5 Стабилен 3,5 0,13
E Неизвестен Na, К Si/Al=l—2 Нестабилен 2,8 0,21
to
oo
Цеолита Структурный тип Катионы
Ca-E Анальцим Са
K-E К
TMA-E" Эрионит Na, ТМА
F Неизвестен К
K-F —»— К
Sr-F Гмелинит Sr
Феррьерит Феррьерит Na, Са
G Шабазит К
P-Ga Шабазит К
Sr-G Шабазит Sr
Ba-G L Ва
Жисмондин Жисмондин ТМА
H Неизвестен К
Li-H Li
Гейландит Гейландит Са
HS Содалит Na
Ca-I Томсонит Са
K-I (см. H)
Sr-I Анальцим Sr
J Неизвестен К
Продолжение табл.
Состав каркаса Стабильность Размер пор, нм—1 Объем пор, см3/г
Si-Al — — —
Si/Al = 2 — — —
Si/Al «3 Стабилен — —
Si/Al = 1 3,6 0,16
Si/Al = 1 2,6 0,13
Si-Al 3,5 0,22
Si-Al — — —
Si/Al= 1,15—2,7 Стабилен — 0,26
Si-AI-P — —
Si-Al — 0,28
Si/Al =1,5 3,0 0,15
Si/Al =1,5 — — —
Si/Al =1 Нестабилен 2,6 0,22
Si/Al = 4 Стабилен 2,6 0,16
— — — —
Si/Al =1 — 2,6 —
Si-Al — — —
Si-Al — — —
Si/Al = 1—1,15 Стабилен 2,8 0,08
Цео Структурный тип Катионы
Ba-J Неизвестен Ва
Ca-J Эпистильбит Са
Ba-K Неизвестен Ва
L L К, Na
Ca-L Гармотом Са
P-La L К
Лосод Лосод Na, C8Hi6N+
M Неизвестен К
Ba-M Гармотом Ва
Sr-M Морденит Sr
Морденит Li
Широкопористый Na
Na, Li
Ca
X Неизвестен Na, TMA
Ba-X » Ba
Натролит Натролит Na
OB Оффретит TMA, K, Na
Омега3 Омега Na, TMA
Оффретит3 Оффретит TMA, K, Na
Pc 1 Жисмондин Na
Продолжение табл.
Состав каркаса Стабильность Размер пор, им-1 Объем пор, см3/г
Si/Al=4 Стабилен — 0,10
Si-Al — — 0,19
Si-Al — — 0,08
Si/AI = 2,6—3,5 Стабилен 8,0 0,20
Si-Al — — —
Si-Al-P Стабилен 6—7 0,14
Si-Al 2,6 0, 18
Si/Al=l 2,6 0,10
Si-Al — - 0,13
Si-Al — — —
Si-Al Стабилен — —
Si/Al=5 7,0 0,20
Si/Al = 5 4,0 —
— — —
Si/Al=l 2,6 0,16
Si/Al=l Нестабилен — —
— — — —
Si/Al=8,4—4,25 Стабилен 6,0 —
Si/Al=2,5—10 9,0 0,20
Si/Al=2,5—5 6,0 0,15
Si/Al= 1—2,5 — 2,6 0,24
to to
о
Цеолит a Структурный тип Катионы
Р/ Жисмондин —
N-PB » Na, ТМА
P-(C1)6 ZK-5 Ва
Филлипсит Филлипсит Li
Q Неизвестен К
Q-(Br)« ZK-5 —
Ca-Q Морденит Са
Sr-Q Югаваралит Sr
R Шабазит Na
P-R Na
Sr-R Гейландит Sr
S Гмелинит Na
T Оффретит Na, К
Эрионит
Ba-T Неизвестен Ba
Na-V Томсонит Na
W Филлипсит К
P-Wa W К
X Фожазит Na
N-XB Na, TMA
Продолжение табл.
Состав каркаса Стабильность Размер пор, нм—1 Объем пор, см3/г
Si/Al = 1,5—2,5 — 2,6 0,22
— — — —
Si/Al = 4,4—4,9 Стабилен — —
— — — —
Si/Al= 1—1,2 Нестабилен 2,8 0,23
Si/Al = 4,3—5,1 Стабилен — —
Si/Al = 5 — — —
Si/Al = 3 — — 0,12
Si/Al= 1,7—1,8 Стабилен 3,5 0,26
Si-Al-P 3,5 0,19
Si-Al — — —
Si/Al = 2,3-2,95 Стабилен 3,5 0,23
Si/Al = 3,2—3,7 4,0 0,23
Si/Al =1 Нестабилен — 0,06
Ga-Si — — —
Si/Al =1,15-2,45 Стабилен 2,8 0,22
Si-Al-P 3,8 0,19
Si/Al= 1 — 1,5, Ga, Ge 8,0 0,36
Si/Al= 1—1,5 8,0 0,36
Цеолит а Структурный тип Катионы
Y Фожазит Na Si/.
N-YB » Na, ТМА Si/
Z Неизвестен К SiA
Z (Cl)6 Типа Z К
Z-21 Неизвестен Na SiA
ZK-4B А Na, ТМА si/;
ZK-5 ZK-5 Na, C8H18N22+ SiA
ZK-19 Филлипсит Na, К SiA
ZK-20 Левинит Na, C7H15N2+ Si/?
ZK-21 А Na, TMA SiA
ZK-22 А Na, TMA SiA
ZSM-2 Неизвестен Li SiA
ZSM-3 Фожазит Na, Li Si/.
ZSM-4B Неизвестен Na, TMA SiA
ZSM-5r Na, TPA Si/
ZSM-8* Na, TEA Si/
ZSM-10 K, C8Hi8N22+ SiA
а Фосфатный цеолит. ^Содержит соли, например ВаС12, ВаВг2.
д Катион тетраметиламмония (ТМА). гКатион тетрапропиламмония (ТРА).
Катион тетраэтиламмония (TEA),
Продолжение табл.
Состав каркаса Стабильность Размер пор, нм-1 Объем пор, смЗ/г
А1=>1,5—3,0 Стабилен 8,0 0,34
А1=>1,5-3,0 8,0 0,34
11=2 2,6 0,И
— — — —
11=1,7—2,1 Стабилен — 0,14
11 = 1,25—2,0 Стабилен 4,3 0,25
11=2—3 4,3 0,27
11=1,5—3,1 2,6 0,14
11=2—2,5 3,5 —
11=1—2 4,3 0,25
11 = 2—3,5 4,3 0,25
11=1,65—2,0 6,0 0,22
11=1,0—3,0 8,0 0,30
11 = 3—7,5 6,0 0,14
А1=2,5—50 6,0 0,10
А1=2,5—50 5,0 0,10
11=2,5-3,5 » 6,0 0,14
ОГЛАВЛЕНИЕ
Введение 3
ГЛАВА 1. ОСНОВНЫЕ ГИДРОГЕНИЗАЦИОННЫЕ ПРОЦЕССЫ
НЕФТЕПЕРЕРАБОТКИ 5
1.1. Гидроочистка прямогонных дистиллятов и сырья вторичного
происхождения 5
1.1.1. Гидроочистка бензиновых фракций 7
1.1.2. Гидроочистка керосиновых фракций 9
1.1.3. Гидроочистка дизельных фракций Ю
1.1.4. Гидроочистка вакуумных дистиллятов 13
1.1.5. Гидроочистка нефтяных остатков 15
1.2. Гидроочистка масел и парафинов 22
1.3. Гидрокрекинг нефтяных дистиллятов 24
1.3.1. Гидрокрекинг бензиновых фракций 25
1.3.2. Гидрокрекинг средних дистиллятов 28
1.3.3. Гидрокрекинг газойлевых фракций 29
1.4. Селективный гидрокрекинг 33
1.4.1. Гидрокрекинг бензиновых фракций 33
1.4.2. Гидрокрекинг средних дистиллятов 33
1.4.3. Гидрокрекинг тяжелых газойлей и масляных фракций 34
1.5. Гидродеароматизация прямогонных керосиновых фракций и
газойлей каталитического крекинга 34
ГЛАВА 2. СОСТАВ И СТРОЕНИЕ ПРОМЫШЛЕННЫХ КАТАЛИЗА-
ТОРОВ 37
2.1. Катализаторы гидрообессеривания 37
2.1.1. Структура и фазовый состав 39
2.1.2. Природа активности 52
2.1.3. Пористость, кислотность и размер гранул 58
2.1.4. Природа носителя 66
2.2. Катализаторы деароматизации 68
2.3. Катализаторы гидрокрекинга 81
2.4. Катализаторы селективного гидрокрекинга 91
ГЛАВА 3. ПРОИЗВОДСТВО КАТАЛИЗАТОРОВ 96
3.1. Способы получения катализаторов 96
3.1.1. Получение катализаторов соосаждением 98
3.1.2. Получение катализаторов методом пропитки носителя 100
222
3.2. Технология получения промышленных отечественных катали-
заторов 108
3.2.1. Катализаторы гидроочистки нефтяных фракций 108
3.2.2. Цеолитсодержащис катализаторы ИЗ
3.2.3. Никсльвольфрамсульфидные катализаторы 116
ГЛАВА 4. ПРОИЗВОДСТВО НОСИТЕЛЕЙ КАТАЛИЗАТОРОВ 118
4,1. Характеристика носителей 118
4.2. Получение гидроксида и оксида алюминия и носителей на
их основе 124
4.3. Формование оксида алюминия 134
4.4. Термическая обработка гидроксида алюминия 138
4.5. Регулирование пористой структуры активного оксида алю-
миния 140
4.6. Модифицирование оксида алюминия неорганическими добав-
ками 143
4.7. Механическая прочность носителей 144
ГЛАВА 5. АКТИВАЦИЯ И РЕГЕНЕРАЦИЯ ПРОМЫШЛЕННЫХ
КАТАЛИЗАТОРОВ 146
5.1. Активация алюмокобальт- и алюмоникельмолибденовых ка-
тализаторов 146
5.2. Активация цеолитсодержащих катализаторов 156
5.3. Дезактивация катализаторов 161
5.4. Регенерация катализаторов 168
ГЛАВА 6. МЕТОДЫ ИССЛЕДОВАНИЯ КАТАЛИЗАТОРОВ 180
6.1. Отбор проб катализатора 181
6.2. Физико-механические характеристики 181
6.3. Каталитическая активность 190
Библиографический список 195
Приложение. Методы анализа катализаторов . 208
Производственное издание
ЕВГЕНИИ ДМИТРИЕВИЧ РАДЧЕНКО
БОРИС КОНСТАНТИНОВИЧ НЕФЕДОВ
РАМИЗ РЗА ОГЛЫ АЛИЕВ
ПРОМЫШЛЕННЫЕ
КАТАЛИЗАТОРЫ
ГИДРОГЕНИЗАЦИОННЫХ
ПРОЦЕССОВ
НЕФТЕПЕРЕРАБОТКИ
Редактор И. А. ЗАХАРЬЯНЦ
Художник Е. В. БЕКЕТОВ
Художественный редактор В. И. КИСЕЛЕВА
Технический редактор В. М. СКИТИНА
Корректор М. В. ЧЕРНИХОВСКАЯ
ИБ № 1729
Сдано в наб. 19.03.87. Подп. в печ. 29.05.87. Т-09072.
Формат бумаги 60X90V16. Бумага тип. № 1.
Гарнитура литературная. Печать высокая.
Усл. печ. л. 14,0. Усл. кр.-отт. 14,0. Уч.-изд. л. 16,75.
Тираж 2100 экз. Заказ № 922. Цена 1 р. 20 к. Изд. № 2815.
Ордена «Знак Почета» издательство «Химия».
107076, Москва, Стромынка, 21.
Московская типография № 11 Союзполиграфпрома
ори Государственном комитете СССР по делам издательств,
полиграфии и книжной торговли.
113105, Москва, Нагатинская ул., д. 1.