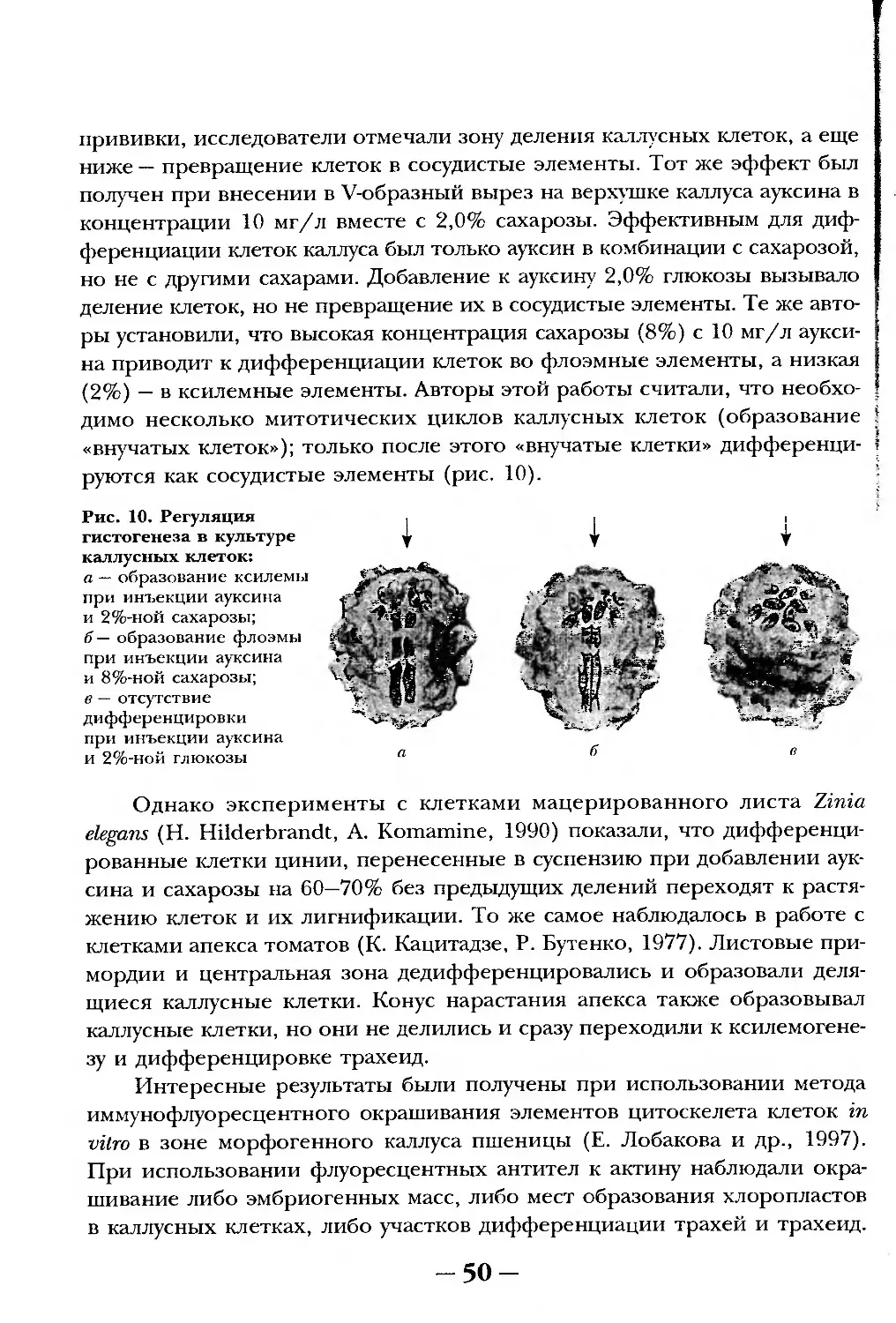
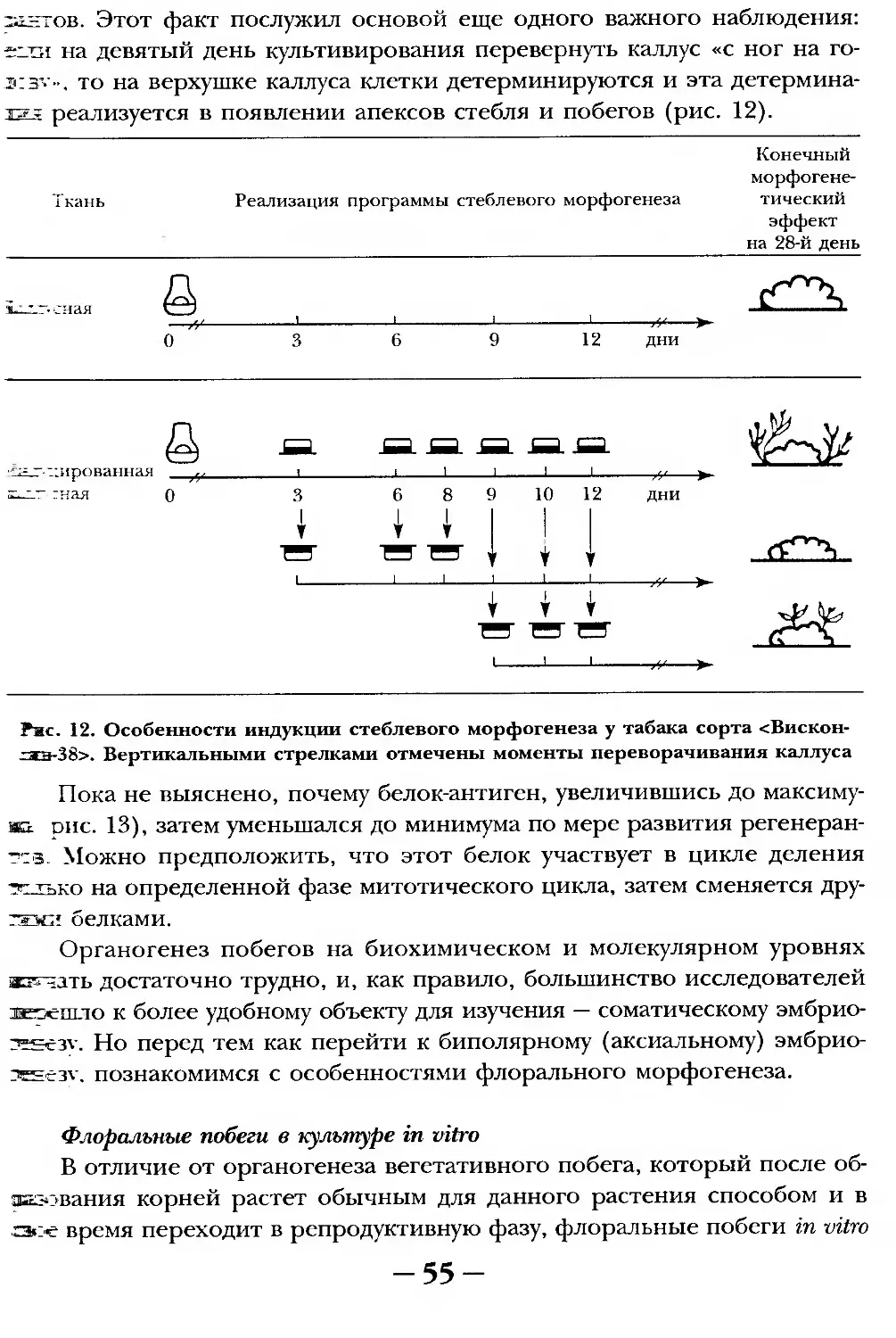
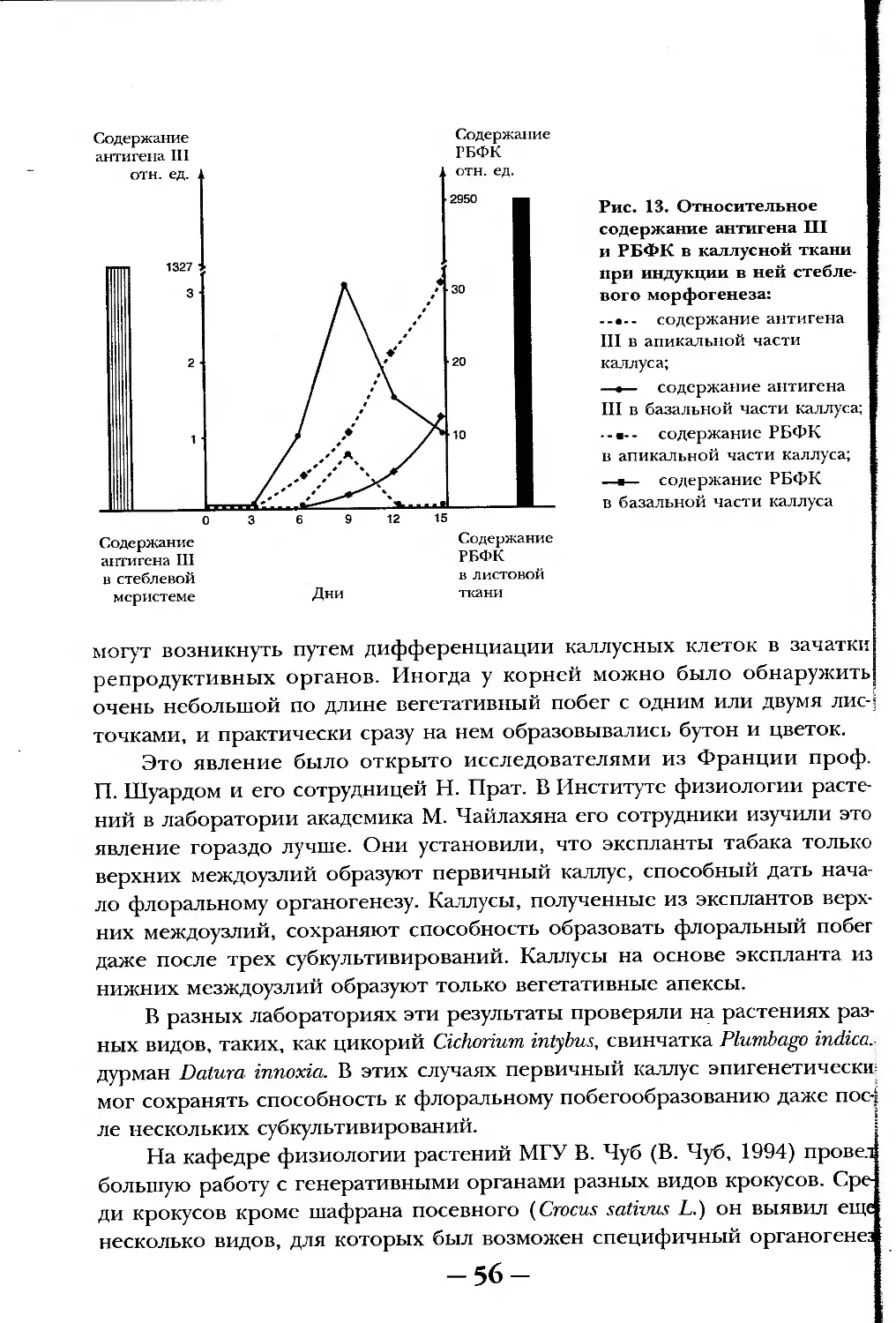
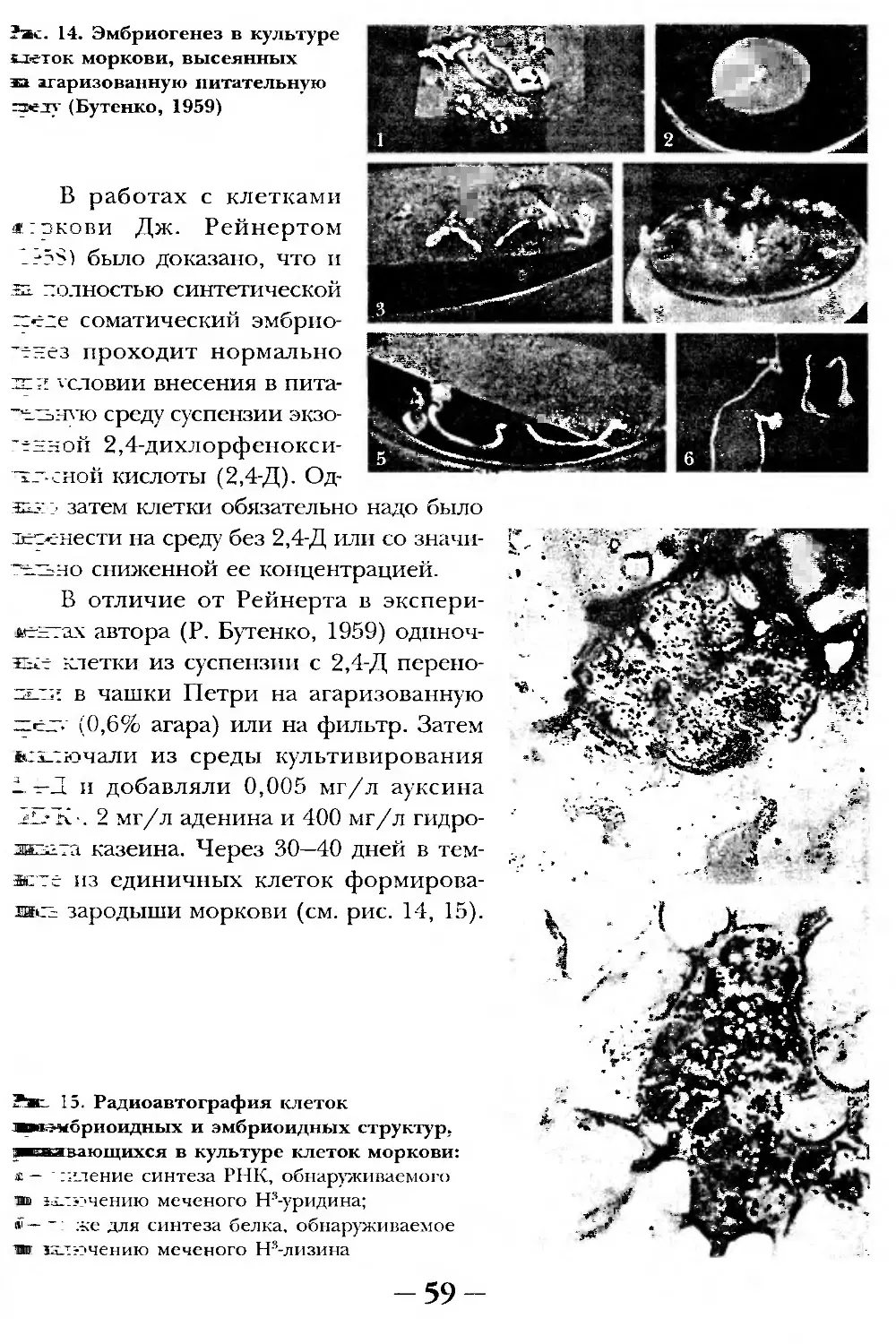
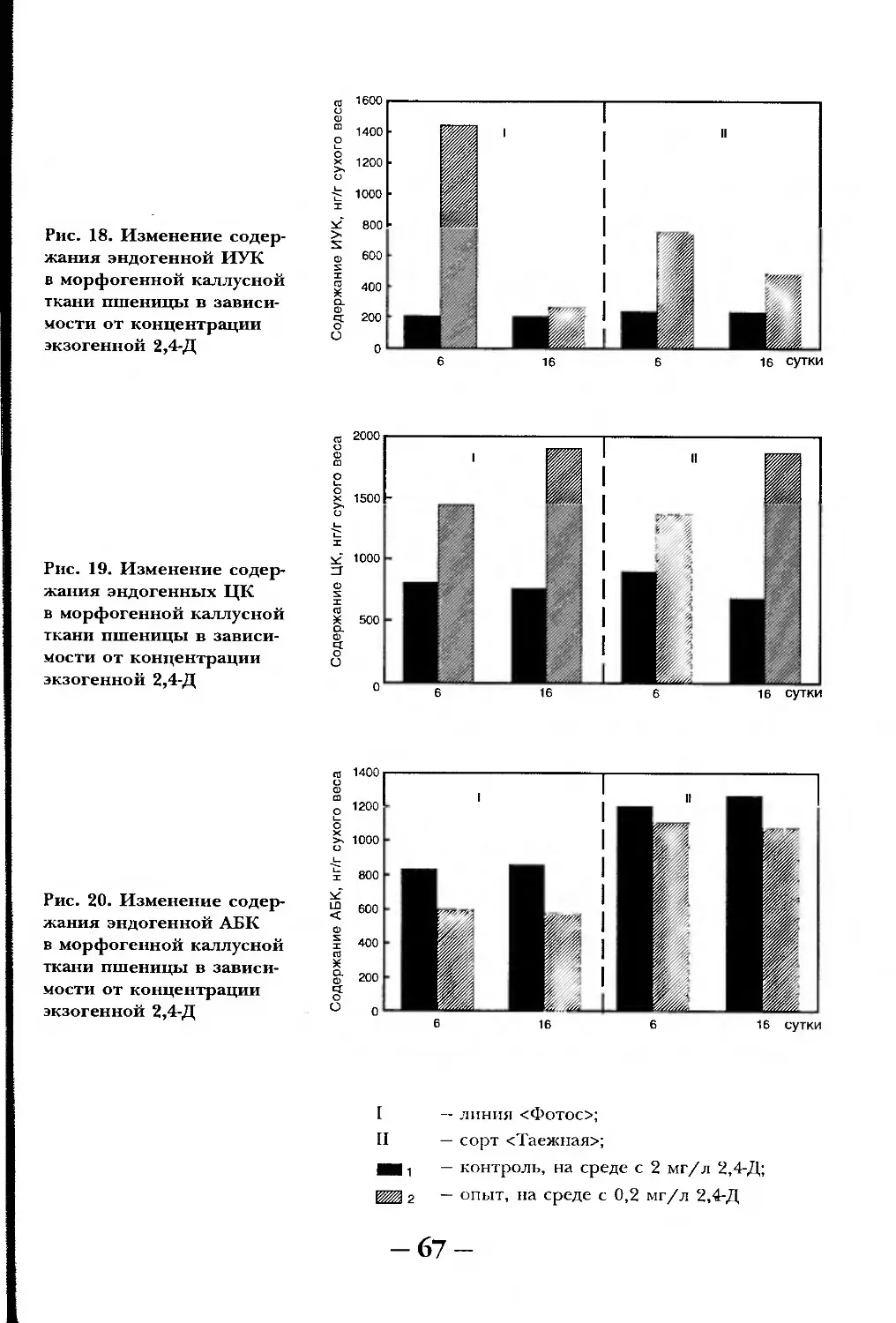
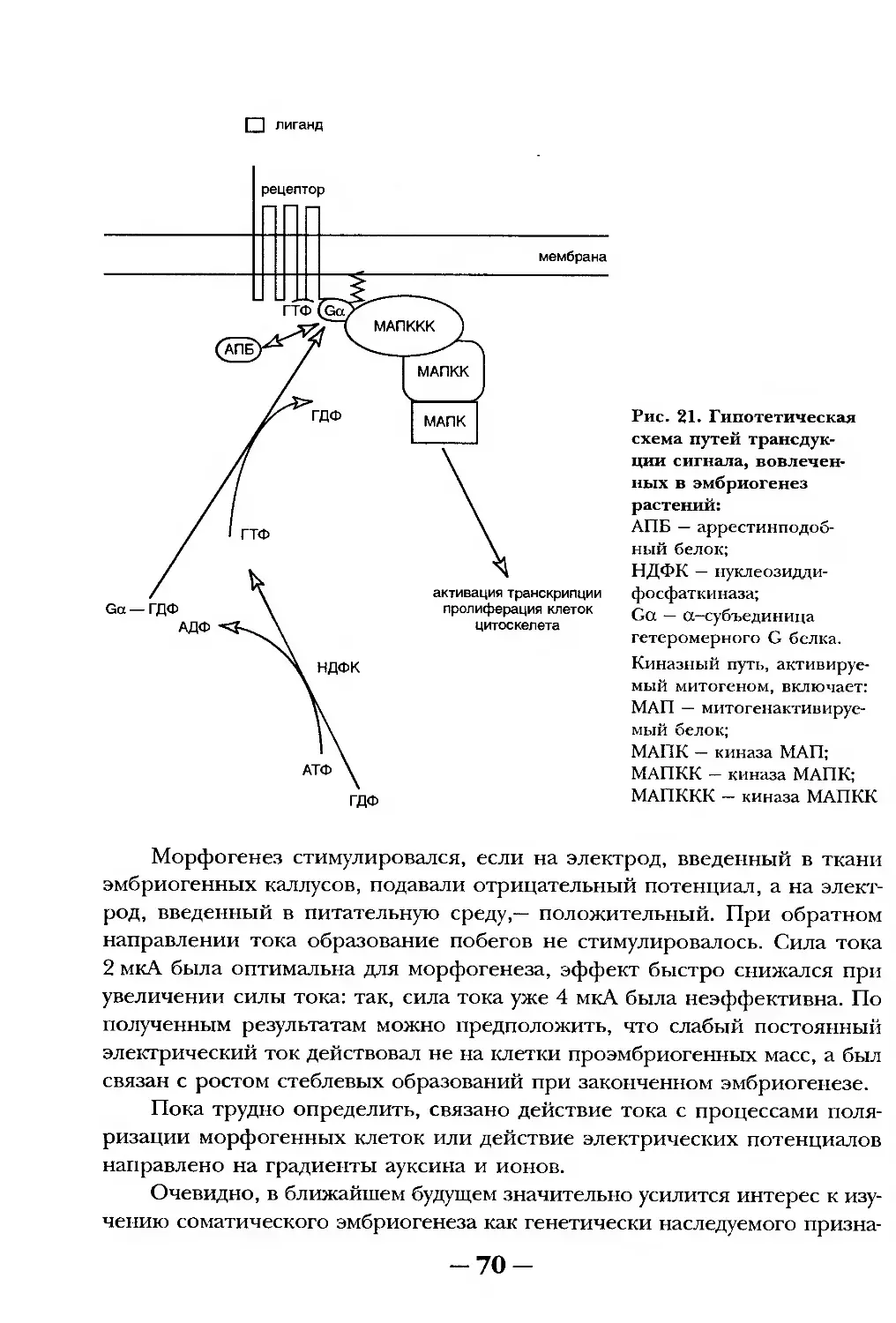
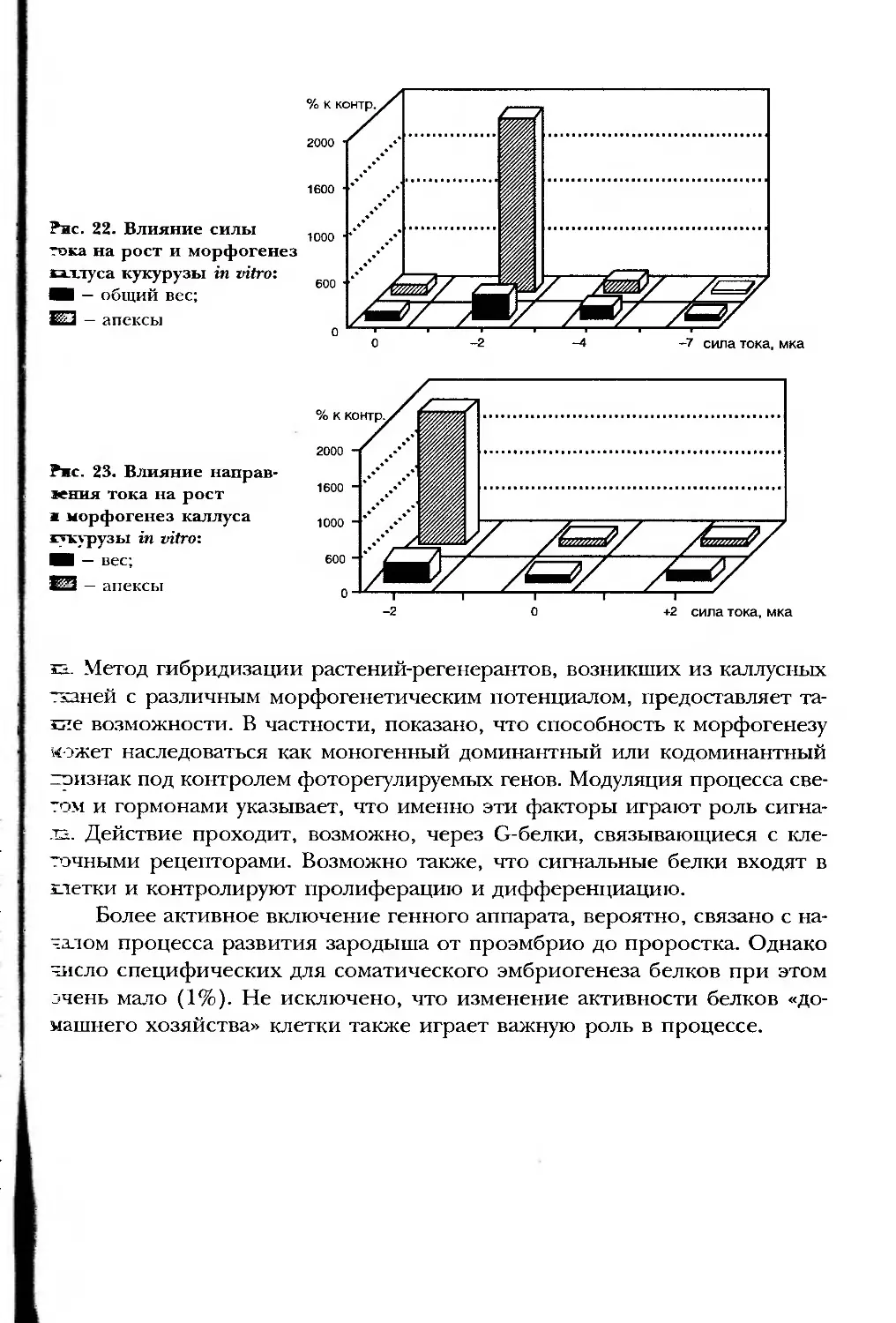
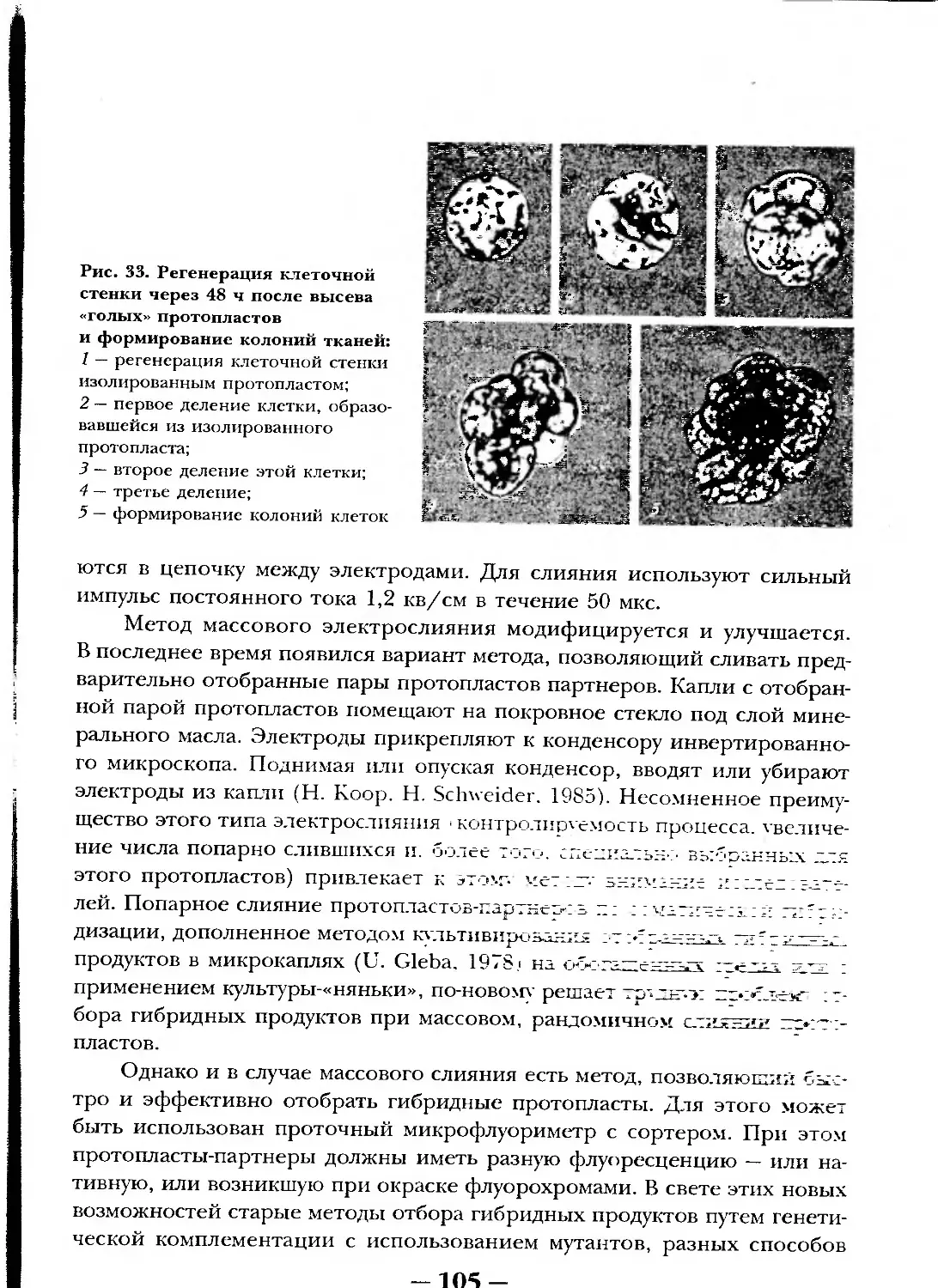
Текст
Р.Г. БУТЕНКО
Биология клеток
высших растений
in vitro
и биотехнологии
на их основе
Учебное пособие
МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
им. М.В. ЛОМОНОСОВА
Р.Г. БУТЕНКО
Биология клеток
высших растений in vitro
и биотехнологии на их основе
Учебное пособие
Москва ФБК-ПРЕСС 1999
Большая благодарность И.М. Давыдовой и П.В. Лапшину за верную работу вместе.
Благодарности тем, кто дал свои интересные работы: А.М. Носову,
А.В. Носову, Л.Г. Копертех, А.Б. Бургутину, НО. Юрьевой, А.В. Орешникову,
И.Е. Князькову, З.Б. Шаминой, Ю.И. Долгих, А.С. Попову,
О.Н. Высоцкой, С.Э. Зоринянц, И.Н. Смоленской.
УДК 58
ББК 28.5 + 30.16
Б93
Ответственный редактор
профессор Ермаков Игорь Павлович
Рекомендовано к изданию в качестве учебного пособия
Ученым советом Биологического факультета
Московского государственного университета им. М.В. Ломоносова
Бутенко Р.Г.
Б93 Биология клеток высших растений in vitro и биотехнологии на их основе:
Учеб, пособие.- М.: ФБК-ПРЕСС, 1999,- 160 с.
ISBN 5-89240-059-х
С 1972 года на кафедрах «Физиологии растений» и «Клеточной биологии и
иммунологии» Биологического факультета МГУ читается курс лекций «Биология
клеток высших растений in vitro и биотехнологии на их основе». По своему жела-
нию студенты выбирают темы для рефератов, которые близки к тематике лекций,
и делают доклады на семинарах.
Учебное пособие, написанное по материалам этих лекций, будет полезно не
только студентам университетов, но и других высших учебных заведений, а также
научным работникам, интересующимся фундаментальными проблемами клеток
in vitro и ex vitro. Биотехнология важна растениеводам — для селекции in vitro, спе-
циалистам в области фармации, косметики, пищевой промышленности — для полу-
чения новых продуктов. Культивируемые клетки и ткани растений, семена и пыль-
цу можно хранить в криобанках, что позволяет сохранить редкие и исчезающие
растения. Таким образом можно сохранят!, их генофонд неограниченно долго.
УДК 58
ББК 28.5 + 30.16
ISBN 5-89240-059-х
© Бутенко Р.Г., 1999
© Оформление. ФБК-ПРЕСС, 1999
Оглавление
IP5 УСЛОВИЕ РЕДАКТОРА.............................................................5
- первая. Введение в предмет............................................6
tlaja вторая. Краткая история длительных стараний
овладеть методами клеток in vitro..................................7
птлЗа третья. Методы культивирования in vitro клеток
л тканей высших растений..........................................13
§ 1. МЕТОДЫ культивирования (асептика) ...........................14
5 2. ПИТАТЕЛЬНЫЕ СРЕДЫ И ФИЗИЧЕСКИЕ ФАКТОРЫ, ОПТИМАЛЬНЫЕ ДЛЯ КУЛЬТУР...16
тт.аза четвертая. Дедифференгциация тканей высших растений
:п vitro и первичный каллусогенез.................................21
пятая. Прокариотические и эукариотические клетки
~ природе и при культивировании in vitro..........................28
гтаХа шестая. Особенности неполовых популяций длительно
культивируемых клеток высших растений in vitro....................33
tlaIa седьмая. Вторичный метаболизм вне организма
в популяциях клеток растений in vitro.............................42
восьмая. Тотипотентность культивируемых клеток
в популяциях in vitro.............................................48
§ 1. ТИПЫ ДИФФЕРЕНЦИРОВКИ ........................................49
§ 2. ГИСТОГЕНЕЗ ..................................................49
§ 3. МОРФОГЕНЕЗ IN VITRO — ВЕГЕТАТИВНЫЙ И ФЛОРАЛЬНЫЙ ОРГАНОГЕНЕЗ .51
§ 4. СОМАТИЧЕСКИЙ ЭМБРИОГЕНЕЗ.....................................57
ттлда девятая. Клональное микроразмножение и оздоровление
посадочного материала.............................................72
§ 1. КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ .................................72
§ 2. ПОЛУЧЕНИЕ БЕЗВИРУСНОГО ПОСАДОЧНОГО МАТЕРИАЛА.................79
те*э.а десятая. Создание с помощью биотехнологий растений
: новыми полезными признаками.....................................84
§ 1. СОЗДАНИЕ ГОМОЗИГОТНЫХ ДИПЛОИДОВ МЕТОДАМИ АНДРОГЕПЕЗА И ГИНОГЕНЕЗА.84
§ 2. СОМАКЛОНАЛЫ1ЫЕ ВАРИАНТЫ И КИСТОЧНАЯ СЕЛЕКЦИЯ.................91
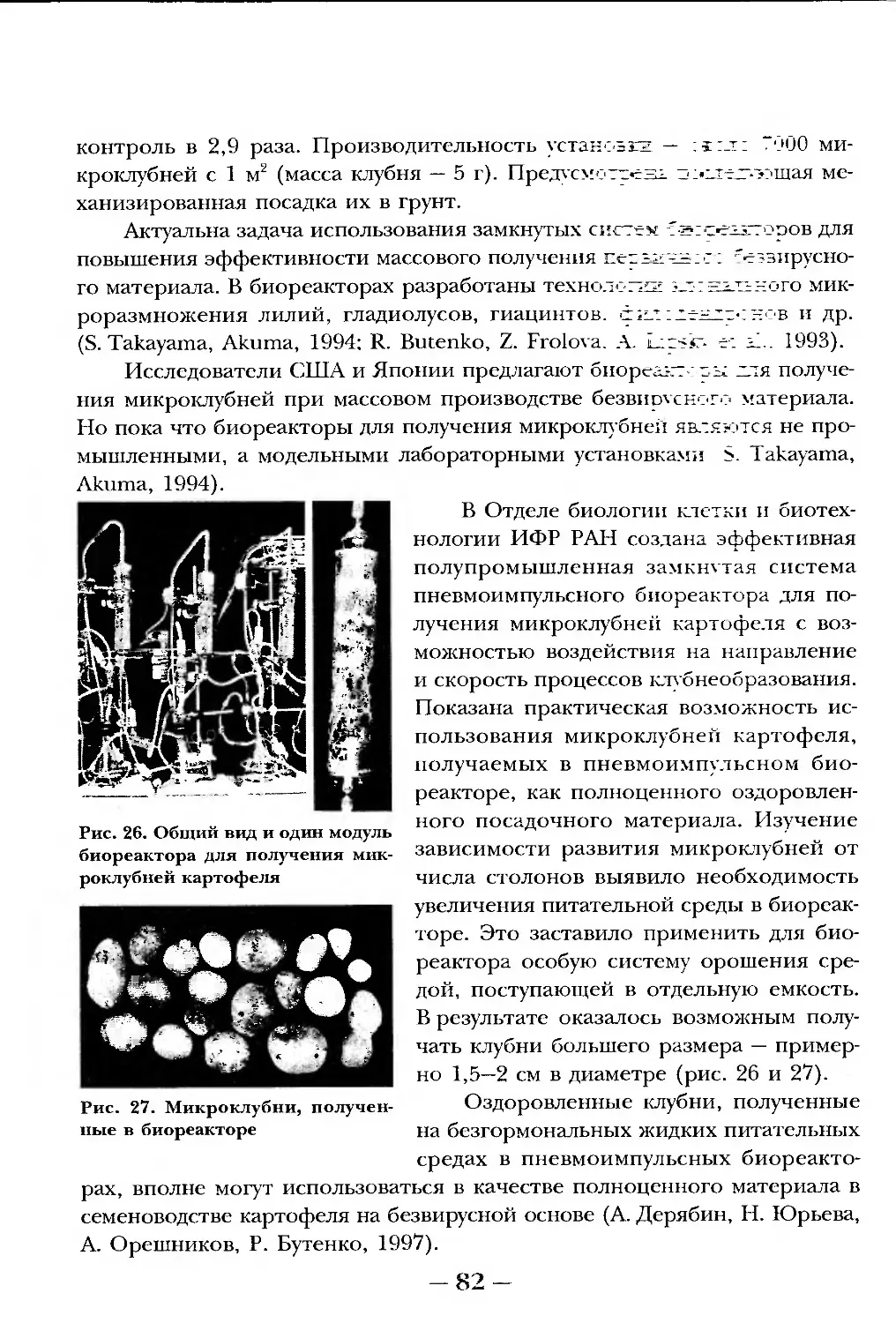
тдаз.а одинАдцАТАя. Изолированные протопласты, генная инженерия
д получение трансгенных растений.................................101
тд-ла двенадцатая. Биотехнология и биоинженерия клеток -
продуцентов метаболитов для промышленности.......................118
~тлза тринадцатая. Сохранение генофонда высших растений
г коллекциях и в криобанках......................................133
-*л-Тэ:чение..........................................................142
ТЕРЕЧЕНЬ ОСНОВНЫХ ТЕРМИНОВ............................................143
тете? АТУТА...........................................................147
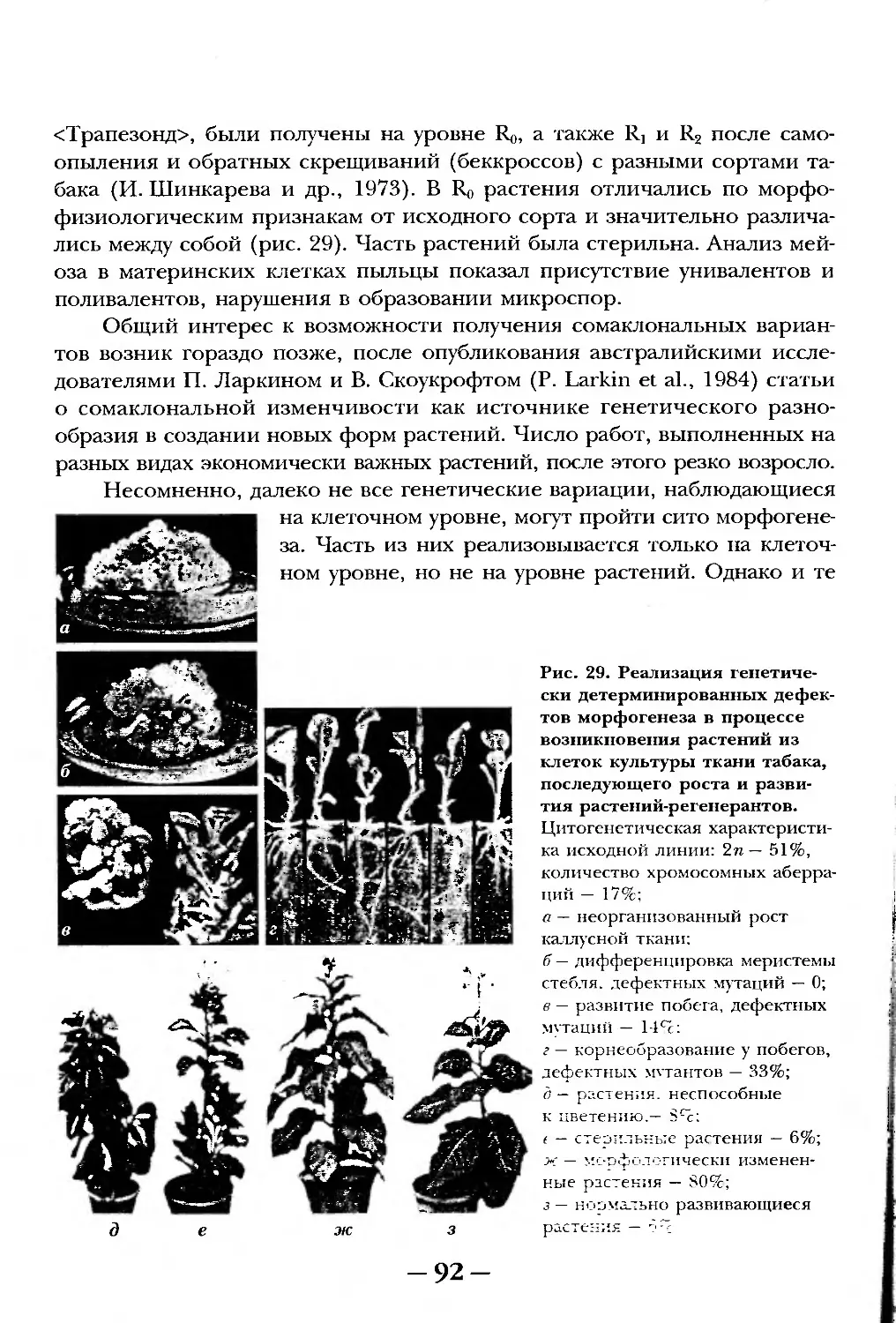
ПРЕДИСЛОВИЕ РЕДАКТОРА
Автор предлагаемого учебного пособия член-корр. РАН, академик РАСХН
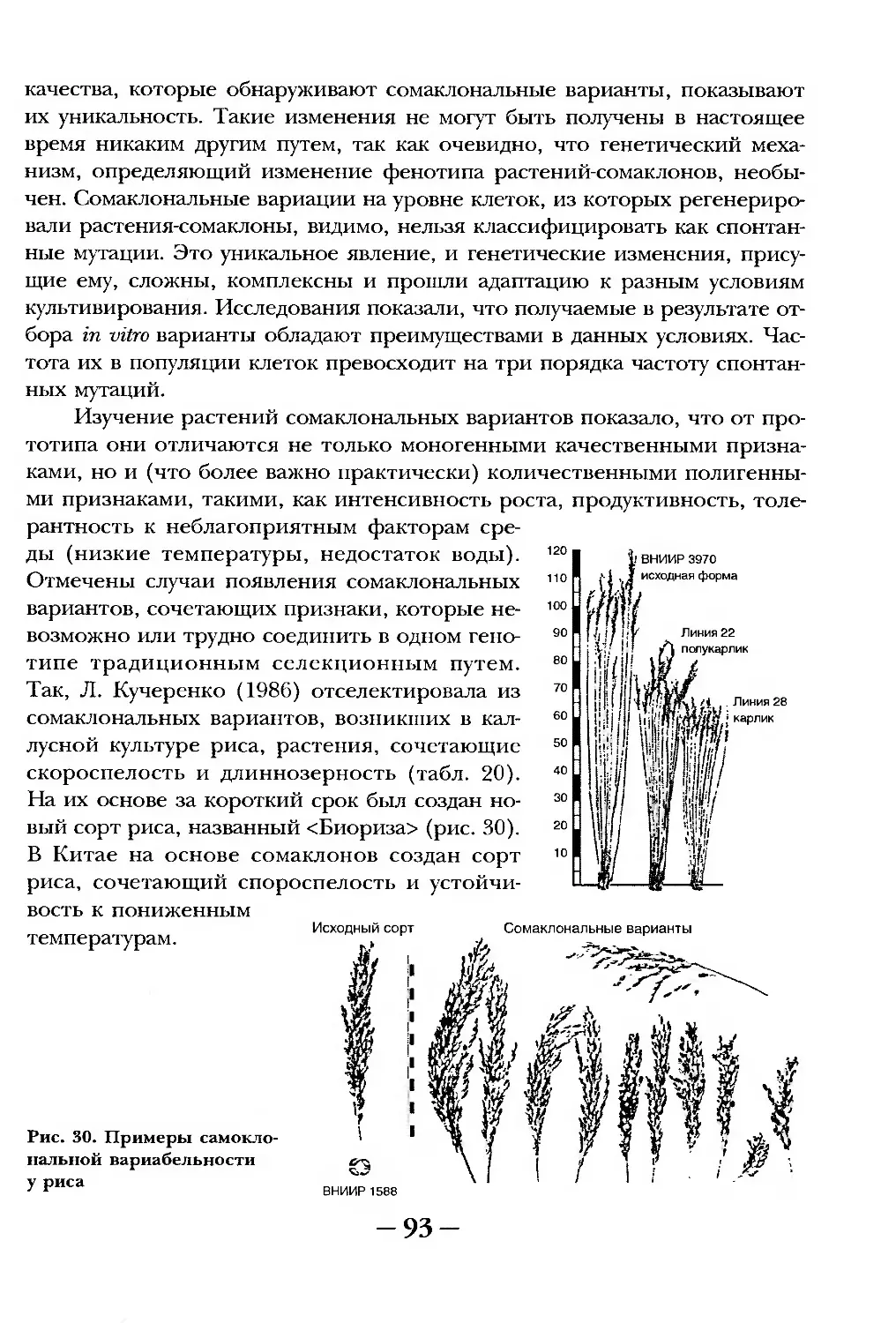
Рзиса Георгиевна Бутенко уже 40 лет занимается исследованием биологии кле-
тв-к в культуре in vitro. Крупный организатор науки, она выступила создателем в
'светском Союзе научного направления, сыгравшего важнейшую роль в разви-
тей! многих разделов биотехнологии растений, на базе которых при ее непо-
: родственном участии создавались промышленные производства физиологиче-
::<и активных и лекарственных веществ, внедрялись новые методы в селекцион-
:-зто практику и в растениеводство, проводились работы по сохранению гено-
фонда исчезающих и редких видов. Ее обширные контакты с зарубежными ис-
следовательскими центрами, активная работа в Международной ассоциации по
вт-льтуре клеток и тканей растений способствовали тому, что отечественная
биотехнология растений многие годы развивается на высоком теоретическом и
методическом уровне.
Р.Г. Бутенко сыграла огромную роль в пропаганде идей биологии культи-
вируемых клеток, в консолидации исследователей России и стран СНГ, работа-
ющих в этой области. Под ее руководством прошли семь всесоюзных и между-
народных конференций, каждая их которых являлась демонстрацией успехов и
интересных поисков десятков ученых, большей частью являющихся учениками
?.Г. Бутенко.
Более 20 лет Р.Г. Бутенко служит профессором в Московском государствен-
нэм университете им. М.В. Ломоносова и все эти годы читает большой курс
лекций по биологии культивируемых клеток и биотехнологии растений для сту-
дентов кафедры физиологии растений и кафедры клеточной физиологии и
в иммунологии. Ее педагогическая деятельность играет большую роль в формиро-
вании у студентов и аспирантов современного научного мировоззрения, базиру-
ющегося на глубоких и обширных знаниях фундаментальных закономерностей
природных явлений. Увлеченный исследователь, прекрасный лектор и искрен-
ний собеседник — черты, привлекающие к профессору Р.Г. Бутенко многих ее
щеников.
По материалам своих лекций Р.Г. Бутенко написала учебное пособие, в
этором дана исчерпывающая картина физиологических, цитологических, гене-
тических и молекулярных закономерностей, свойственных биологии клеток,
ю-.тьтивируемых in vitro. В нем освещаются многие фундаментальные процессы,
которые лежат в основе разных направлений биотехнологии растений, приво-
дятся полезные рекомендации для проведения экспериментальных работ. Посо-
*ие будет полезно всем, кто соприкоснется с этой интересной и важной обла-
:тью физиологии растений.
Зав. кафедрой физиологии растений
биологического факультета МГУ
проф. И.П. Ермаков
-5-
введение в предмет
ГЛАВА ПЕРВАЯ
Уважаемые коллеги, мне было непросто выбрать материал для учеб-
ного пособия «Биология клеток высших растений in vitro и биотехноло-
гии на их основе». Наиболее важным при этом выборе было значение
фундаментальных особенностей клеток in vitro, роль различий их генети-
ческих и эпигенетических характеристик, знание молекулярных основ их
жизнедеятельности. Фундаментальные исследования клеток в составе
многоклеточного организама, находящихся под генетическим и физиоло-
гическим контролем растения, в целом безусловно открывают более
сложные стороны их существования, которые видоизменяются при пере-
воде клеток в искусственные условия.
Развитие физиологии культивируемых клеток и каллусной ткани in
vitro несомненно привело к изменению парадигмы. Культивируемые клет-
ки не просто удобная модель для изучения процессов в тканевых клетках
интактного растения. Очевидно, что клетки in vitro сложнее, чем ткане-
вые клетки. В условиях in vitro реализуется тотипотентность клеток, по-
давляемая в многоклеточном организме, что позволяет моделировать
уникальные дифференцировки и эспериментально исследовать феномен
эпигенетической наследственности.
В этом учебном пособии по биологии клеток in vitro и биотехнологи-
ям на их основе автор старалась не только описать историю этой облас-
ти физиологии растений, но и показать новые биологические перспекти-
вы теоретического анализа и новые подходы практического использова-
ния клеток, живущих вне растительных организмов.
Современные данные молекулярной и клеточной биологии позволя-
ют установить эволюционную общность многих особенностей раститель-
ной и животной клетки. Это проявляется и в близких подходах к при-
емам биотехнологии и биоинженерии.
-6-
Американский исследователь В. Роббинс (W. Robbins, 1922) и неза-
висимо от него немецкий ученый В. Котте (W. Kotte, 1922) показали воз-
можность культивирования на синтетической питательной среде мерис-
темы кончиков корней томатов и кукурузы. Эти опыты можно считать на-
чалом развития метода культуры изолированных корней растений. По
разным причинам, получив успех, эти исследователи не продолжили ра-
боты с изолированными корнями.
1932-1940 гг.
Начало успешному развитию метода культуры тканей и клеток выс-
ших растений положили работы двух исследователей — французского
Р. Готре и американского Ф. Уайта (1932). Они начали с анализа и повто-
рения опытов Роббинса и Котте и пошли дальше, показав, что если кон-
чики культивируемых корней периодически пересаживать на свежую пи-
тательную среду, то они могут расти и культивироваться неограниченно
долго. Р. Готре (R. Gautheret, 1934) ввел в культуру новые объекты — кал-
лусные ткани древесных растений камбиального происхождения и кал-
лусные ткани запасающей паренхимы. Ф. Уайт (F. White, 1939) показал
способность к неограниченному росту при субкультивировании тканей
растительных опухолей (см. термины).
1940—1960 гг.
В период между 1940—1960 гг. ученики и последователи Готре и Уай-
та закрепляют успех. Множится число видов растений, ткани которых
выращиваются in vitro — их список, приведенный в классической моно-
графии по культуре ткани, написанной Р. Готре (R. Gautheret, 1942—
1959), включал уже 142 вида высших растений. В это время были разра-
ботаны составы разных питательных сред, что позволило получать пере-
садочные культуры из разных органов и тканей растений. Изучено значе-
ние индивидуальных макро- и микроэлементов для поддержания росто-
вой активности каллусной ткани (R. Heller, 1953). Выявлена потребность
тканевых культур в витаминах и стимуляторах роста. Опытами ученых из
США Ф. Скуга и С. Миллера (F. Skoog, S. Miller, 1955) изучены способно-
сти к делению и образованию каллуса клетками сердцевинной паренхи-
мы стебля табака сорта <Висконсин>. Был открыт новый класс стимуля-
торов роста растений — цитокинины. Полученный этими исследователя-
ми в результате щелочного гидролиза ДНК животного происхождения
кинетин (Р-фурфуриламинопурин) оказался способным в комбинации с
Р-индолил-З-уксусной кислотой (ИУК) стимулировать деление клеток серд-
цевинной паренхимы табака, лишенной проводящих пучков и камбия.
Клетки сердцевинной паренхимы, помещенные на питательную среду с
-8-
но без добавления этого нового стимулятора (кинетина), не дели-
~:ь. В последующих работах комбинация известных экзогенных аукси-
е : = с обнаруженными цитокининами (кинетин или другие 6-замещенные
-.инотрины) широко использовались при культивировании in vitro. В
ыдиспмости от концентрации и соотношения стимуляторов можно было
.—филировать деление клеток экспланта, поддерживать рост каллусной
—длин. индуцировать морфогенез. В этот период было оценено значение
-гт'.-ральных экстрактов типа эндосперма кокосового ореха, каштана, ку-
•т'-зы и других растений для поддержания неорганизованного клеточно-
: поста и стимуляции процессов органогенеза и соматического эмбрио-
'тнеза в культуре каллусных тканей и клеточных суспензий (F. Steward,
. .--52 *. В этот же период был разработан метод получения и выращивания
'ппьших масс клеточных суспензий (Z. Nickell, W. Tulecke, 1959), а также
г под культивирования одиночной клетки, выделенной из суспензии, де-
*ение которой индуцируется с помощью ткани-«няньки» (М. Павлова,
5 Бетенко, 1969).
1960-1975 гг.
Наиболее важным событием в период 1960—1975 гг. была разработка
профессором Ноттингемского университета (Англия) Е. Кокингом
Е. Coking, 1960) метода получения изолированных протопластов из тка-
ней корня и плодов томатов путем обработки их смесью пектолитиче-
::их и целлюлитических ферментов, полученных из культуральной жид-
кости грибов. Изолированные протопласты, по словам А. Галстона, вы-
вели клетку из «деревянной тюрьмы» и открыли перспективы различных
манипуляций с ней. Были найдены условия культивирования изолирован-
ных протопластов, при которых они образуют новую клеточную стенку,
делятся и дают начало клеткам, способным в ряде случаев к морфогенезу
J. Takebe et al., 1971). Вместе с тем изолированные протопласты, еще не
образовавшие клеточную стенку, были использованы для разработки ме-
тодов гибридизации соматических клеток путем слияния протопластов с
помощью полиэтиленгликоля (ПЭГ), а также для введения в них вирус-
ных РНК, клеточных органелл, клеток прокариотов.
Первые соматические гибриды послужили моделями для изучения
поведения ядерного и цитоплазматических геномов партнеров в гибрид-
ных клеточных линиях и в потомстве соматических гибридов растений,
дегенерировавших из соматических гибридных клеток (обзоры Р. Бутен-
п.э. 1979; R. Butenko, 1979; Ю. Глеба, 1975).
В этот период был разработан метод культуры меристем (клонально-
го микроразмножения) (J. Morel, 1959; Р. Бутенко, 1960, 1964), позволяю-
-9-
щий быстро, с высоким коэффициентом, клонально размножать расте-
ния в асептических условиях. Было показано, что растения, полученные
из меристем, в ряде случаев освобождались от вирусных инфекций. Тес-
тирование их на отсутствие вирусов и массовое клональное микроразм-
ножение позволяло получать оздоровленный посадочный материал эко-
номически важных растений.
Много внимания в этот период продолжают уделять индукции мор-
фогенеза в культуре тканей и клеток. Большое фундаментальное и при-
кладное значение имело открытие индукции андрогенеза при культиви-
ровании изолированных пыльников и гиногенеза при культивировании
клеток зародышевого мешка (S. Guha, S. Maheshwari, 1964). Использова-
ние андрогенеза и гиногенеза для получения гаплоидов и дигаплоидных
линий представляло интерес для селекции.
В лаборатории автора было обнаружено явление сомаклональной из-
менчивости — получены и генетически изучены растения-регенеранты та-
бака, непохожие ни на исходную форму, ни на собственное потомство
(Н. Загорска и др., 1971).
Заключительный этап — после 1976 г.
С 1976 г. и по настоящее время продолжается быстрое развитие тех-
ники in vitro, изучение биологии культивируемых растительных объектов
и создание биотехнологий на их основе. Разработка методов электросли-
яния изолированных протопластов (U. Zimmerman, 1984) и разнообраз-
ных методов селекции гибридных клеток значительно облегчила гибри-
дизацию соматических клеток растений. Методы мутагенеза и клеточной
селекции, получение сомаклональных вариантов и экспериментальных
гаплоидов используются для создания новых форм и сортов сельскохо-
зяйственных растений. С использованием изолированных протопластов
и генетических векторов на основе Ti-плазмид, электропорации и балли-
стического введения генов в клетки и ткани реципиентов стало возмож-
ным получение трансгенных растений (1990—1998).
Характерной чертой настоящего времени является особая организа-
ция исследований для эффективного получения результатов. Как прави-
ло, исследователи работают группами, включающими специалистов по
разным проблемам. Более того, часто такие группы являются интерна-
циональными.
Одним из важнейших факторов, содействующих связям ученых, за-
нимающихся культурами in vitro, является активная деятельность Между-
народной ассоциации по культуре тканей и клеток растений (IAPTC).
Ассоциация была создана в 1965 г. В ее обязанности входила организа-
ция каждые 5 лет международных конференций, которых к настоящему
- 10-
ьэемени было уже 8. Они проходили во Франции, Англии, Японии, Гол-
ландии, Канаде, США, Италии, Израиле. Последняя конференция состо-
ялась в 1998 г. Каждые два месяца IAPTC выпускает журнал, где печата-
ется новые важные результаты исследований in vitro.
В нашей стране начиная с 1968 г. каждые 4 года также проводятся
энференции: всесоюзные, с приглашением зарубежных ученых (Моск-
ва. Киев, Ереван, Кишинев), международные (Новосибирск, Алма-Ата,
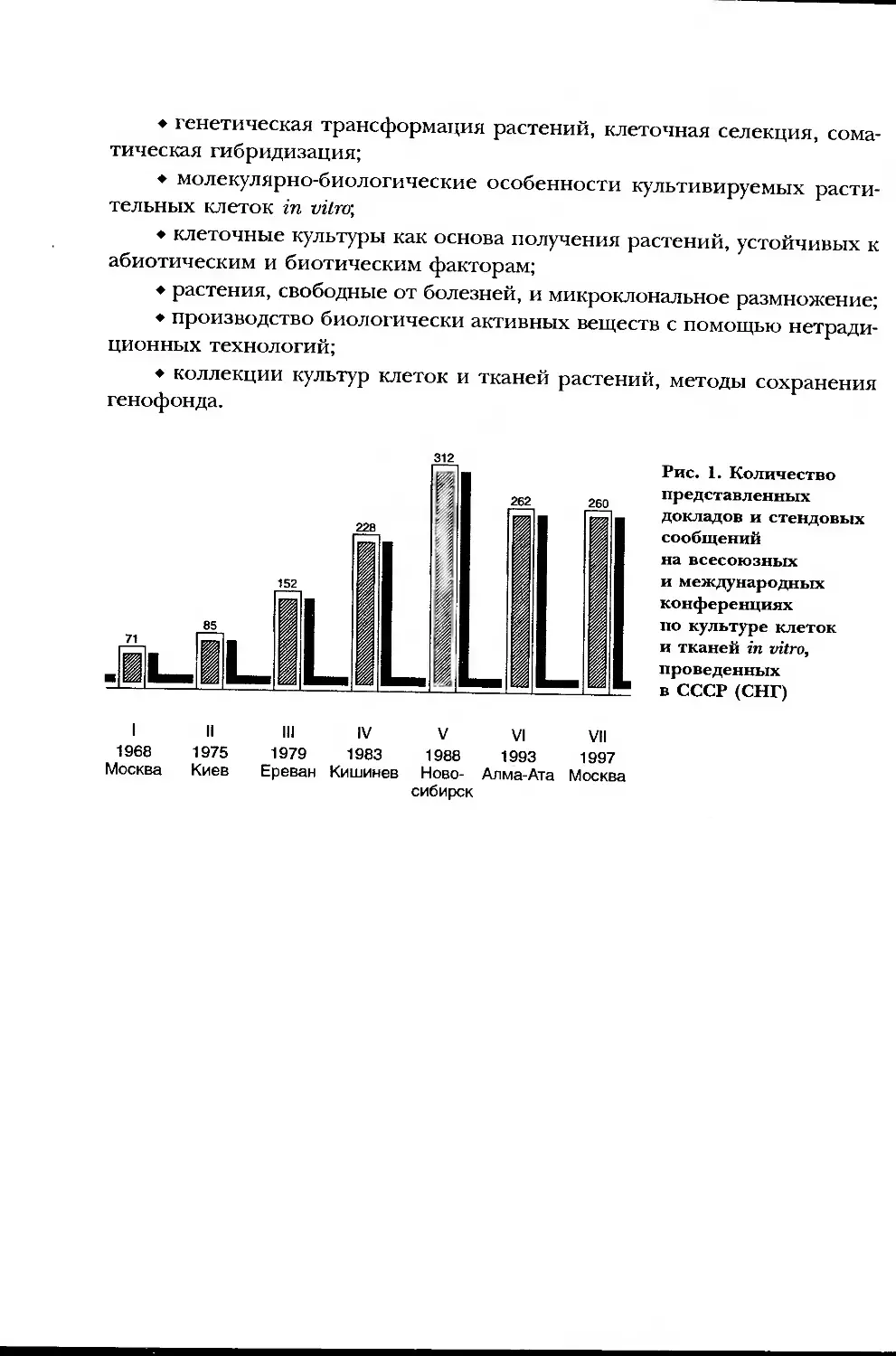
Москва). На рис. 1 можно видеть, как возрастало число участников кон-
ференций в нашей стране и представленных на них докладов и посте-
оов. Наиболее интересные материалы конференций публиковались в
коллективных монографиях. Ниже представлены краткие сведения о
конференциях:
Москва, 1968. Регулирование генетических потенций растительной
клетки. Модель для роста и питания растений. Вирусы и опухолевый
рост. Особое внимание было уделено цитогенетике.
Киев, 1975. Изолированные клетки, модели живого растения, тоти-
потентность, самосборка клеток.
Ереван, 1979. Начало интереса к вторичным метаболитам, изолиро-
ванным протопластам, лектиновым зондам, росту и метаболизму в куль-
Tvpe.
Кишинев, 1983. Клетки в культуре и биотехнология. Моделирование
физиологических процессов. Гаплоиды, клеточная селекция, генетиче-
ская инженерия.
Новосибирск, 1988. Морфогенез, сомаклональная изменчивость, капсу-
лирование соматических эмбриоидов. Морфогенез и соматический эмб-
риогенез. Изменчивость в потомстве регенерантов однодольных (пшени-
ца, ячмень), соматическая гибридизация.
Алма-Ата, 1993. Вопросы генетики, молекулярной биологии клеток in
vitro, клеточная и генная биотехнология, крупномасштабное выращива-
ние продуцентов для промышленности, сохранение генофонда высших
растений и клеток in vitro в криобанках.
Москва, 1997. Международная конференция «Биология клеток выс-
ших растений in vitro, биотехнология и сохранение генофонда» (25—
28 ноября 1997 г.). На конференции рассматривались следующие вопро-
сы:
♦ первичный и вторичный метаболизм культивируемых клеток;
♦ тотипотентность и морфогенез растительных клеток in vitro;
♦ особенности соматических клеток растений при длительном куль-
тивировании;
♦ сомаклональные вариации культивируемых клеток растений;
- 11 -
♦ генетическая трансформация растений, клеточная селекция, сома-
тическая гибридизация;
♦ молекулярно-биологические особенности культивируемых расти-
тельных клеток in vitro-,
♦ клеточные культуры как основа получения растений, устойчивых к
абиотическим и биотическим факторам;
♦ растения, свободные от болезней, и микроклональное размножение;
♦ производство биологически активных веществ с помощью нетради-
ционных технологий;
♦ коллекции культур клеток и
генофонда.
тканей растений, методы сохранения
Рис. 1. Количество
представленных
докладов и стендовых
сообщений
на всесоюзных
и международных
конференциях
по культуре клеток
и тканей in vitro,
проведенных
в СССР (СНГ)
I II
1968 1975
Москва Киев
III IV V VI VII
1979 1983 1988 1993 1997
Ереван Кишинев Ново- Алма-Ата Москва
сибирск
JX^LemodbL 1<,улъти(^ир()(И1нил
in vitro клеток
и тканей высших растении
ГЛАВА ТРЕТЬЯ
Различные генотипы в пределах вида по-разному реаги-
руют на сходные химические и физические условия куль-
тивирования
Р. Диксон
Набор объектов растительного происхождения, который можно пе-
ревести в культуру in vitro, значительно шире, чем набор, представленный
з этой книге. Как правило, большинство исследований проводятся с эксп-
лантами разных органов, тканей и клеток семенных растений (голо- и по-
крытосеменных). Низшие растения (многоклеточные водоросли) и спо-
ровые высшие растения (мхи, хвощи, папоротники) привлекаются в куль-
туру реже. Это можно объяснить большой ролью в жизни человечества
покрыто- и голосеменных растений начиная с древесных форм, луговых
трав и культивируемых в сельском хозяйстве растений, которые кормят
человечество. Многоклеточные водоросли трудны для поддержания их в
культуре, хотя они, несомненно, перспективны в качестве источников
литопродуктов для медицины, пищевой промышленности и других био-
технологий. В литературе в качестве объектов, используемых для культи-
вирования in vitro, можно встретить мхи, лишайники, папоротники.
В этих случаях культуры клеток используют для изучения специфических
для указанных растений процессов.
Большое внимание биологи отводят выращиванию микроводорос-
лей. Их культивирование в ферментерах при условии обеспечения све-
том процесса фотосинтеза, с одной стороны, позволяет решать фунда-
ментальные проблемы фотосинтеза и связи его с клеточным циклом и
судьбой популяции (Л. Цоглин и Н. Гавель, 1994), а с другой стороны, в
ферментерах микроводоросли выращиваются с целью использования их
биомассы и фитопродуктов в качестве сырья для промышленности.
-13-
Вернемся к эксплантам, полученным от разных таксонов высших ра-
стений. Они очень различны, однако в настоящее время нет такого выс-
—его растения, от которого нельзя получить культивируемые ткани и
клетки. Растущие поверхностно на агаре, агарозе, гель-рите каллусные
ткани и растущие в жидкой питательной среде суспензионные клеточные
культуры требуют создания разных условий для разных таксонов.
Наиболее легкими объектами для культивирования являются дву-
дольные травянистые растения, затем следуют однодольные травянистые
виды и зерновые культуры. Труднее создать условия для стабильных in
vitro культур древесных растений, особенно голосеменных. Древесные
растения по мере старения теряют способность к образованию каллуса.
Особенно это свойственно хвойным породам в возрасте более 12—15 лет.
Для работы с наиболее интересными для практики «сильными» деревья-
ми (а это становится явным в более зрелом их возрасте) применяется ме-
тод омоложения. Для этого используется обработка черенков смесью ре-
гуляторов роста (цитокинины, ауксины, витамины, стимуляторы роста).
В работах Е. Калашниковой (1992) и К. Хмары (1990) манипуляции с че-
ренками хвойных таксонов ели и сосны позволили получить размноже-
ние этих древесных пород как путем черенкования побегов, так и путем
морфогенеза из каллусных тканей. Подробно используемый ими метод
будет описан в главе^«Биотехнология клонального микроразмножения».
л/10
§ 1. МЕТОДЫ КУЛЬТИВИРОВАНИЯ (АСЕПТИКА)
Первичный эксплант должен быть полностью освобожден от всех
микроорганизмов (бактерий, грибов, микоплазм и т.д.), и его дальнейшее
существование in vitro требует поддержания абсолютной асептики, так
как грибная и бактериальная инфекция ингибирует рост клеток и приво-
дит культуру к гибели.
Перед стерилизацией экспланта фрагмент растения тщательно промы-
вается водой с мылом, затем следует процедура поверхностной стерилиза-
ции эксплантов в растворах дезинфицирующих средств (сулема, диацид, ги-
похлориты кальция, натрия, калия). В стерилизующий раствор хорошо до-
бавить эмульгатор, например Твин-20 (одна капля на 100 мл раствора).
В табл. 1 представлены условия стерилизации эксплантов разных
объектов (концентрация и время инкубации).
После инкубации эксплантов в стерилизующем растворе их промы-
вают тремя порциями стерильной воды по 10 минут в каждой. Затем по-
лезно острым дезинфицированным ланцетом удалить наружный слой кле-
ток на срезах экспланта, так как наружный слой клеток мог быть повреж-
ден при дезинфицировании.
-14-
Таблица 1
Стерилизация исходного растительного материала
Объект Время стерилизации, мин
диацид 0,1% сулема 0,1% гипохлориты Na, Са 5-9% перекись водорода 10-12% антибио- тики
'с-гени г»тие 15-20 10-15 15-20 12-15
набухшие 6-10 6-8 10-15 6-8
мясистого корня, Т ня 20-30 15-25 15-20 —
стебля 20-40 20-25 20-25 — Ткани
1-3 0,5-3 3-6 3-5 стебля
1-10 0,5-7 3-15 2-7 чая
Иногда кроме поверхностной стерилизации приходится прибегать к
х^тйбиотикам, убивающим микробиальную флору внутри ткани. Выбрать
гтизно действующий антибиотик трудно, и не всегда оздоровление экс-
~юнта при этом удается. В качестве одной из удач можно привести при-
нте освобождения от внутренных микробов эксплантов чая (Ниссанка
' щ... 1990).
В литературе отмечены случаи, когда образование каллуса и рост
юедок кажутся вполне благополучными, однако после ряда субкультиви-
дсзаний рост клеточной массы начинает снижаться. При этом явного
гтиотствия микробиальной флоры незаметно, однако состояние культу-
Z zZ существенно ухудшается. Можно полагать, что в этом случае споры
'ютерий в течение длительного срока задерживались в развитии выде-
тгниями растительных клеток.
В лаборатории автора наблюдали такой процесс для одного из кло-
е : з диоскореи дельтовидной — продуцента стероидных гликозидов (ан-
т:стрессового фитопродукта этой культуры). В течение длительного вре-
-тни рост культуры диоскореи был нормальным, но после ряда переса-
z: к рост клеток снижался, среда становилась мутной, в ней обнаружива-
юсь бактериальные клетки, и культура постепенно погибала. Можно
дд-едположить, что споры некоторое время ингибировались стероидны-
и гликозидами диоскореи дельтовидной. Вряд ли описанный феномен
тд эсто результат занесения бактерий, тогда бы гибель культуры про-
дзэшла быстро, а не была бы растянута на длительный срок. Вопрос о
: : существовании клеток растений и бактериальных спор и бактериаль-
ных эндосимбионтов в культуре in vitro еще требует изучения.
Стерильные условия выращивания обязательны для манипуляций с
объектами in vitro. Обычно работы с культурами проводятся в ламинар-
' эксах, где асептика достигается подачей фильтрованного стерильного
-15-
воздуха в рабочий объем. В ночное время, чтобы увеличить надежность
сохранения асептики, рекомендуется включать УФ-лампы. В последнее
время при работе с клетками животных и растений вместо ламинар-бок-
сов предпочитают работу в асептических комнатах. Экспериментатор, ра-
ботающий в такой комнате, обязан иметь специальную одежду и быть
подготовленным к асептической работе.
Посуда, инструменты, бумага стерилизуются, как правило, в сухожар-
ных шкафах при температуре 160 °C либо в автоклаве при избыточном
£ _ давлении мм ртутного столба в течение 60 минут.
Компоненты питательных сред, которые не разрушаются при темпе-
ратуре около 120 °C, можно стерилизовать в автоклаве. Фильтрованием
через ультрафильтры можно стерилизовать все компоненты сред (кроме
агарозных основ) или только те компоненты, которые заведомо не выно-
сят нагрева до 120 °C. Фильтрование производят в стерильных условиях
(в ламинар-боксах). Агар и агарозу обычно добавляют в питательные сре-
ды в твердом виде перед автоклавированием.
§ 2. ПИТАТЕЛЬНЫЕ СРЕДЫ И ФИЗИЧЕСКИЕ ФАКТОРЫ,
ОПТИМАЛЬНЫЕ ДЛЯ КУЛЬТУР
Генетически и эпигенетически различные экспланты и каллусные
ткани даже в пределах вида часто требуют разных химических и физи-
ческих условий выращивания in vitro. Начнем с главного — с питательных
сред.
В 1932 г. французским ученым Роже Готре были созданы питатель-
ные среды, которые позволили ему получить первичные каллусы на сре-
зах ветвей древесных растений и каллусов паренхимы корнеплодов. В то
же самое время американский ученый Р. Уайт (1934) модифицировал
среду Успенских и применил ее для пересадочной культуры корней рас-
тений.
Наиболее часто используемой питательной средой по праву можно
назвать среду Мурасиге (правильнее — Мурашиге) и Скуга — среда MS.
Она была предложена Тошио Мурашиге и Фольке Скугом в 1962 г. Эта
среда, как правило, подвергается разным модификациям, что реже отно-
сится к макро- и микроэлементам минеральной среды и чаще касается
наборов витаминов, гормональных и других регуляторных факторов.
Основная минеральная среда MS была подобрана авторами для кал-
лусной ткани табака сорта <Висконсин>, возникшей на экспланте — па-
ренхиме стебля в средней его части. Именно при этих условиях Ф. Скуг
и С. Миллер в 1954—1957 гг. манипулировали соотношением кинетина и
ауксина в среде, направляя культуру на разные пути развития. При при-
-16-
мерно равных количествах кинетина и ауксина в среде происходило об-
разование быстро растущего каллуса. При увеличении дозы ауксина воз-
никали корни, при преобладании кинетина — стеблевые культуры.
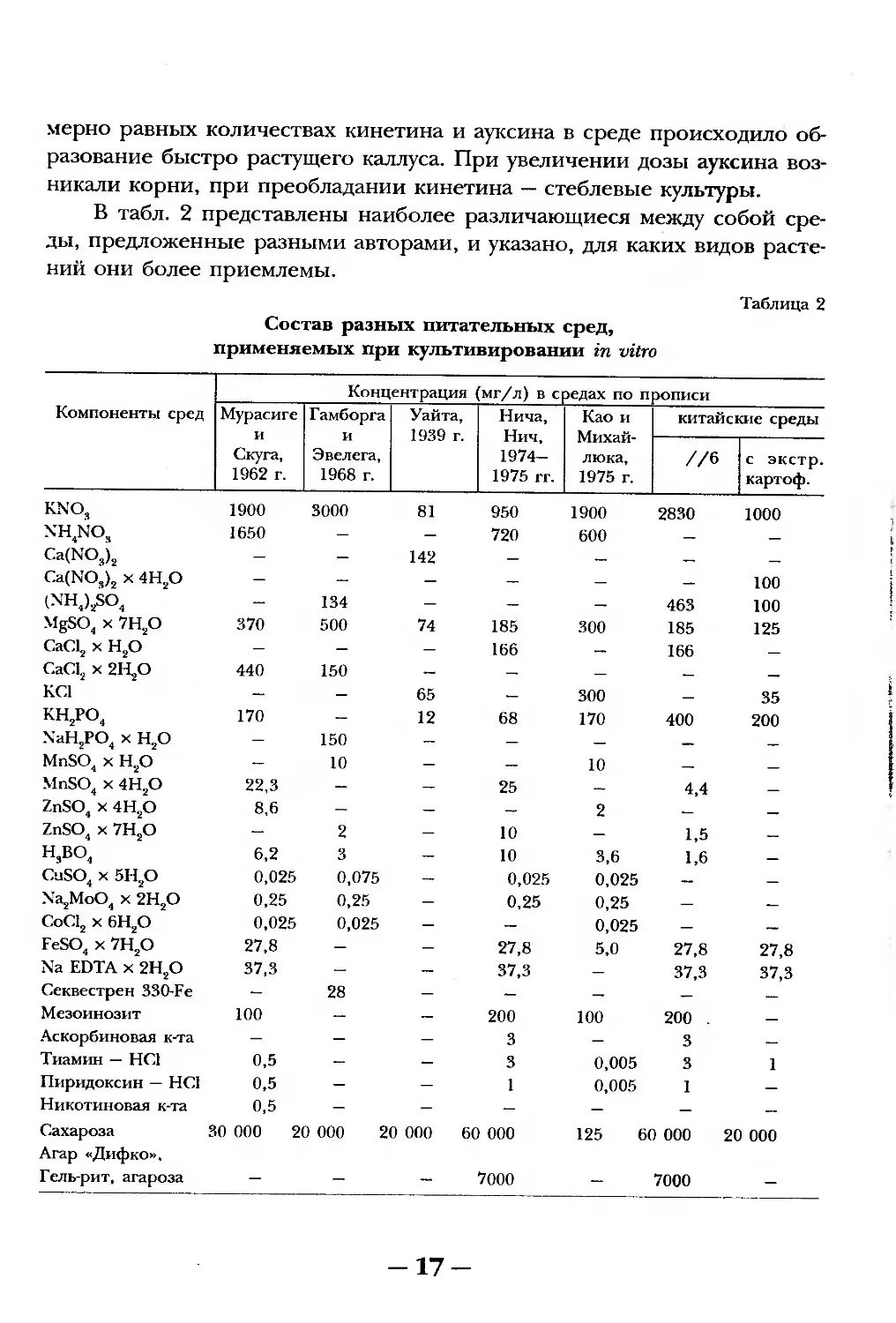
В табл. 2 представлены наиболее различающиеся между собой сре-
ды, предложенные разными авторами, и указано, для каких видов расте-
ний они более приемлемы.
Таблица 2
Состав разных питательных сред,
применяемых при культивировании in vitro
Компоненты сред Концентрация (мг/л) в средах по прописи
Мурасиге и Скуга, 1962 г. Гамборга и Эвелега, 1968 г. Уайта, 1939 г. Нича, Нич, 1974— 1975 гг. Као и Михай- люка, 1975 г. китайские среды
//6 с экстр, картоф.
KNO, 1900 3000 81 950 1900 2830 1000
nh4no, 1650 — — 720 600 — —
Ca(NO,j2 — — 142 — — — —
Ca(NO,)2 х 4Н2О — — — — — — 100
(NH4)2SO4 — 134 — — — 463 100
MgSO4 x 7H2O 370 500 74 185 300 185 125
CaCl2 x H2O — — 166 — 166 —
CaCl2 x 2H2O 440 150 — — — — —
KC1 — — 65 — 300 — 35
kh2po4 170 — 12 68 170 400 200
NaH9PO4 x H2O — 150 — — — — —
MnSO4 x H2O — 10 — — 10 — —
MnSO4 x 4H2O 22,3 — — 25 — 4,4 —
ZnSO4 x 4H2O 8,6 — — — 2 — —
ZnSO4 x 7H2O — 2 — 10 — 1,5 —
H,BO4 6,2 3 — 10 3,6 1,6 —
CuSO4 x 5H2O 0,025 0,075 — 0,025 0,025 — —
Na2MoO4 x 2H2O 0,25 0,25 — 0,25 0,25 — —
CoC12 x 6H2O 0,025 0,025 — — 0,025 — —
FeSO4 x 7H2O 27,8 — — 27,8 5,0 27,8 27,8
Na EDTA x 2H2O 37,3 — — 37,3 — 37,3 37,3
Секвестрен 330-Fe — 28 — — — — —
Мезоинозит 100 — — 200 100 200 —
Аскорбиновая к-та — — — 3 — 3 —
Тиамин — НС1 0,5 — — 3 0,005 3 1
Пиридоксин — HCI 0,5 — — 1 0,005 1 —
Никотиновая к-та 0,5 — — — — — —
Сахароза 30 000 20 000 20 000 60 000 Агар «Дифко». 125 60 000 20 000
Гель-рит, агароза — — — 7000 — 7000 —
— 17 —
1 литр среды Као и Михайлюка содержит дополнительно: рибозы, ксилозы, ман-
нозы, рамнозы, целлобиозы, сорбита — по 125 мг, маннита, никодинамида, аскорбино-
вой кислоты — по 1 мг; витамина А — 10 мг; витамина Ds — 0,5 мг; Са-пантотената — 0,01
мг, витамина В12 — 0,2 мг; n-аминобензойной кислоты — 0,01 мг; биотина — 0,005 мг; хо-
линхлорида — 0,5 мг; рибофлавина — 0,1 мг; 2,4-Д — 0,2 мг; зеатина — 0,5 мг; НУК — 1 мг;
гидролизата казеина — 125 мг, кокосового молока — 10 мл; СаСБ, 30% — 1,5 мл; глюко-
зы — 68 400 мг; пирувата Na — 5 мг; лимонной кислоты — 10 мг; яблочной кислоты — 10
мг; фумаровой-кислоты — 10 мг.
Продолжение табл. 2
Способ приготовления концентрированной (1 X 10) минеральной основы
среды по прописи Мурасиге и Скуга
А Б В Г д Е
MgSO4 х 7Н2О MnSO4 х Н2О ZnSO4 х 7Н2О KNO, NH4NO, СаС12 х 2Н2О кн,ро4 Н3ВО4 Ч CuSO4 х 5Н2О Na,MoO4 х 2Н2О СоС12 х 6Н2О
Ингредиенты частей А, Б, В растворить в 100 мл бидистиллированной воды, сме-
шать А + Б, добавить В, добавить по 1 мл растворов CuSO4, Na2MoO4 и СоС12. Развести в
10 раз при приготовлении среды.
ПРИЛОЖЕНИЕ К ТАБЛИЦЕ 2
1. Среда Мурасиге и Скуга — наиболее универсальная и многоцелевая среда, при-
годная для растительных клеток многих видов.
Среда MS (Мурасиге и Скуга) дает хорошие результаты при каллусообразовании
у большинства растений, хорошо поддерживает неорганизованный каллусный рост и вы-
зывает индукцию морфогенеза у большинства двудольных видов.
2. Среда Гамборга и Эвелега (Среда В-5) дает хорошие результаты при культивиро-
вании клеток и тканей бобовых растений и злаков.
3. Среда Уайта — для укоренения побегов и нормального роста стеблевой части
после регенерации.
4. Среда Ничей, китайские среды — рекомендуются для индукции андрогенеза в
культуре пыльников. Последние также используются для индукции морфогенеза у злаков.
5. Среда Као и Михайлюка — для культивирования единичных (или с малой плот-
ностью высева) изолированных протопластов и клеток.
Физические параметры: pH 4,0—5,0, температура 26 + 1°, свет белый, 16 часов.
Следует отметить, что при использовании среды MS в качестве ми-
неральной основы многие объекты, прежде всего злаки, обычно плохо
реагируют на большую дозу азота, особенно в случае преобладания азота
в аммиачной форме.
По этой же таблице можно оценить различия в содержании витами-
нов и угдеводов сред (обязательного источника питания гетеротрофных
культур) и, наконец, pH среды. Последний фактор достаточно важен, так
как однодольные растения, особенно злаки, в культуре растут при повы-
шенном pH (примерно 6,0), тогда как обычно pH среды после автоклави-
рования остается на уровне 4,5—5,0.
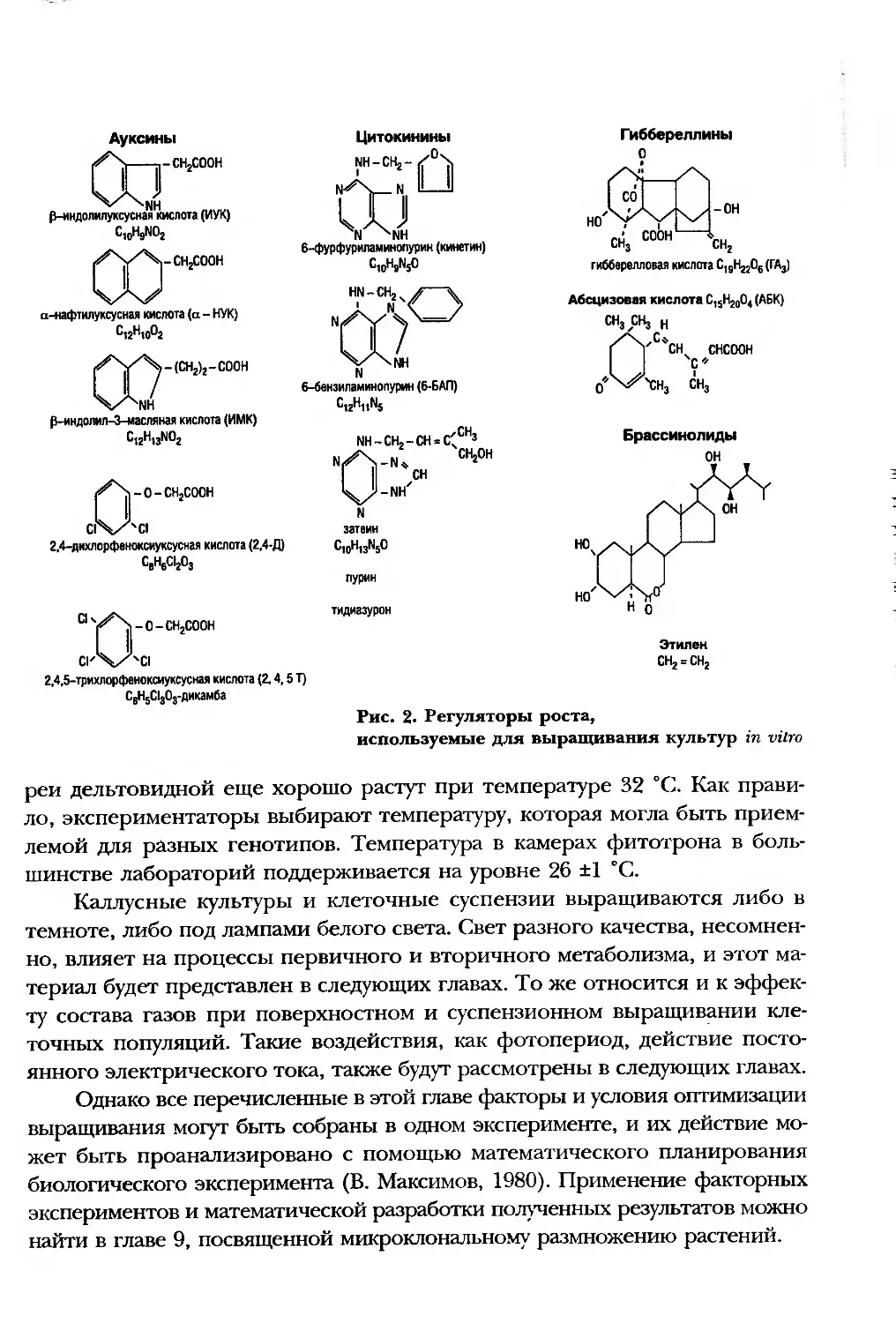
На рис. 2 приведены формулы регуляторов роста гормонального
типа; в табл. 3 собраны данные о регуляторах — экстрактах растительно-
-18-
го происхождения. Как правило, это эндоспермы незрелых зародышей и
весенняя пасока некоторых деревьев. Добавление их в среду почти все-
гда эффективно, но при этом эксперименты трудно воспроизводятся, так
как действующий компонент, как правило, точно неизвестен. В табл. 4 —
концентрации антиоксидантов, вносимых в питательные среды. Фактор
кондиционирования и его роль будут рассмотрены в следующих главах.
Таблица 3
Экстракты и комплексные добавки к питательным средам
для культивирования незрелых гибридных зародышей
Добавки Концентрация, %
1. Эндоспермы:
кокосовый орех 7-20
конский каштан 5—15
кукуруза и другие злаки 10-15
2. Березовый сок 10-20
?. Экстракты из органов вегетирующего растения 0,1-1
4. Томатный сок 5-10
5. Солодовый экстракт 5-10
5. Дрожжевой экстракт 0,1-0,2
7. Гидролизат казеина 0,02-0,1
Таблица 4
Набор и концентрация антиоксидантов,
вносимых в питательные среды
Антиоксидант Концентрация в среде, мг/л Примечание
1. Аскорбиновая кислота 1 2. Глютатион (восста- новленная форма) 4—5 3. Дитиотриэтол 1—3 4. Диэтилдитиокарбамат 2—5 5. Поливинилпирролидон (ПВП) 5 000—10 000 Стерилизовать фильтрова- нием и добавлять к автокла- вированной среде м.в. 40 000
При выращивании каллусных культур поверхностным способом ис-
пользуют очищенный агар-агар типа «Дифко» или агарозу. В последнее
время большим успехом пользуется гель-рит.
Несомненно, что кроме питательной среды и регуляторов при куль-
тивировании большое значение имеет точное соблюдение физических
факторов. Генетически и эпигенетически разные культуры неодинаково
относятся к температуре. Так, каллус и суспензия клеток женьшеня прекра-
щают рост при температуре 27 °C, а каллусы и суспензия клеток диоско-
-19-
Ауксины
-сн2соон
р-индолилуксусная'кислота (МУК)
CloH9NO2
Цитокинины
6-фурфуриламинопурин (кинетин)
C,0H9N5O
-СН2СООН
Гиббереллины
о
а
гибберелловая кислота Cl9Hj206(rA3)
Абсцизовая кислота С,5Н20О4 (АБК)
снъсн3 н
С*
СН СНСООН
а-нафтилуксусная кислота (а - НУК)
С12нто0г
X-(CH2)2-COOH
МН-СН2-СН = <СНз
"0> "
N
затеин
CioHt3N50
NH
р-«ндолил-3-масляная кислота (ИМК)
c12h13no2
2,4-дихлорфеноксиуксусная кислота (2,4-Д)
С8Н6С12О3
тидиазурон
О'
!3 сн3
Этилен
СН2 = СН2
2,4,5-трихлорфеноксиуксусная кислота (2.4,5 Т)
С8Н5С1303-дикамба
Рис. 2- Регуляторы роста,
используемые для выращивания культур in vitro
реи дельтовидной еще хорошо растут при температуре 32 °C. Как прави-
ло, экспериментаторы выбирают температуру, которая могла быть прием-
лемой для разных генотипов. Температура в камерах фитотрона в боль-
шинстве лабораторий поддерживается на уровне 26 ±1 °C.
Каллусные культуры и клеточные суспензии выращиваются либо в
темноте, либо под лампами белого света. Свет разного качества, несомнен-
но, влияет на процессы первичного и вторичного метаболизма, и этот ма-
териал будет представлен в следующих главах. То же относится и к эффек-
ту состава газов при поверхностном и суспензионном выращивании кле-
точных популяций. Такие воздействия, как фотопериод, действие посто-
янного электрического тока, также будут рассмотрены в следующих главах.
Однако все перечисленные в этой главе факторы и условия оптимизации
выращивания могут быть собраны в одном эксперименте, и их действие мо-
жет быть проанализировано с помощью математического планирования
биологического эксперимента (В. Максимов, 1980). Применение факторных
экспериментов и математической разработки полученных результатов можно
найти в главе 9, посвященной микроклональному размножению растений.
'^^дифференциация тканей
высших растений m nitro
и первичный каллу со генез
ГЛАВА ЧЕТВЕРТАЯ
Каллусные клетки — основной объект при длительном культивирова-
нии in vitro. Вместе с тем каллус (название происходит от греческого «мо-
золь») присущ и высшим растениям как один из типов тканей, участвую-
щих в заживлении механических повреждений. Известный ученый-бота-
ник Н. Кренке 50 лет назад часть своих работ посвятил изучению роли
каллусной ткани в целом растении. Он связал ее с фазами, которые про-
ходит каллусная ткань:
♦ первая фаза — быстрый рост каллусных клеток, защищающий место
повреждения;
♦ вторая фаза — запасание питательных веществ в клетках каллуса;
♦ третья, наиболее важная, фаза — регенерация из каллусной ткани ут-
раченных органов (корни, побеги).
Каллусную ткань in vitro можно получить практически из любой жи-
вой ткани растения. На рис. 3 представлены различно дифференцирован-
ные специализированные ткани и клетки высших растений, которые
можно путем дедифференциации превратить в каллусные ткани и клетки,
а затем опять вернуть их в дифференцированное состояние (рис. 4).
Общими факторами, определяющими эффективность дедифферен-
цировки ткани экспланта и развития первичного каллуса, являются:
1. Генотип исходного растения. При этом сорта, линии в пределах
вида могут существенно различаться.
2. Эпигенетическая характеристика экспланта, в том числе однород-
ность или неоднородность ткани за счет групп разных клеток.
3. Внешние условия, из которых наиболее важны экзогенные регуля-
торы роста (преимущественно фитогормоны), а также вещества, действу-
ющие как средства против выделения эксплантом блокирующих каллусо-
генез веществ (активированный уголь, антиоксиданты).
Достаточно важным фактором для дедифференциации клеток и ин-
дукции каллусогенеза является механическое повреждение ткани экспланта.
-21-
Рис. 3. Органы, ткани и клетки расте-
ний, используемые для получения
культуры изолированных клеток
Рис. 4. Типы экспериментального
морфогенеза в культуре неорганизован-
но растущих каллусных клеток
— 22 —
Еще со времен Хаберландта (J. Haberlandt, 1930) быстрое деление каллус-
ных клеток связывалось с выделением растением в связи с травмой не-
йрогормонов (позже эти стимулирующие рост вещества получили назва-
ние травматиновой кислоты). Однако необходимо заметить, что дедиф-
ференциация ткани пыльников, зародышевых органов и некоторых дру-
гих объектов и образование каллусной ткани происходят без наружного
травмирования. В этих случаях достаточно изолировать орган и перенес-
ти его в условия культуральной среды.
Здесь уместно сказать, что возникновение опухолей, вызываемых
почвенной агробактерией Agrobacterium tumefaciens, тоже связано с повреж-
дением ткани растения. Морфологически клетки опухолевой ткани так-
же близки к каллусным. Однако метаболизм опухолевой клетки значитель-
но отличается от каллусной, поскольку в ее геном внесены гены Ti-плазми-
ты бактерии, в частности гены, регулирующие синтез цитокининов и аук-
гинов (Rol-гены). Образующиеся под их контролем фитогормоны «застав-
ляют» клетки постоянно делиться и «метастазировать» первичные опухо-
ли. Работа других встроенных генов Ti-плазмиды приводит к тому, что
клетка опухоли начинает синтезировать несвойственные для нее веще-
ства — опины, которые самой клеткой утилизироваться не могут, но слу-
жат пищей для бактерий. Таким образом, непрерывное размножение под
влиянием принудительного синтеза фитогормонов и синтез опинов дела-
ют опухолевые клетки несопоставимыми с каллусными.
Для образования каллусной ткани in vitro клетки экспланта (см. тер-
мины) должны пройти процесс дедифференциации, т.е. утратить специ-
фические характеристики исходной ткани.
Перестройка клеток эксплантов разных специализаций, предшеству-
ющая каллусогенезу, проходит сходным образом. Клетки эксплантов в
первую очередь теряют вещества запаса — липиды, крахмал, белки. Фото-
синтезирующие клетки теряют хлорофилл и липиды хлоропластов, но
при этом возрастает количество амилопластов, разрушается аппарат
Гольджи, перестраиваются эндоплазматический ретикулюм и элементы
цитоскелета. Клетка синтезирует РНК и ДНК, и начинается экспрессиро-
вацие генов белков, присущих каллусным клеткам. Синтез белков экс-
плантов (паренхима стебля табака) начинается через несколько часов
после переноса экспланта в условия in vitro. Однако эта первая стадия свя-
зана с механическим повреждением, и синтез белка останавливается. Ве-
роятно, в этой фазе действуют нативные гормоны растения, которые
транспортируются, но возможность длительного синтеза для них исклю-
чена. Добавление к среде экзогенных гормонов приводит к началу каллу-
согенеза. Примечательно, что экзогенные гормоны ауксин и цитокинин
-23-
эффективно действуют только в определенной последовательности. Сна-
чала к среде надо добавить ауксин, а потом цитокинин; это приводит к деле-
нию клеток и каллусогенезу. Добавление к среде сначала кинетина, а по-
том ауксина не приводит к делению клеток и каллусогенезу. Можно пола-
гать, что паренхимные клетки вышли из цикла деления в Gj-фазе и имен-
но в этой фазе активен ауксин. Добавление кинетина в G -фазе неэффек-
тивно, так как кинетин действует после фазы синтеза ДНК и, очевидно,
активен при подготовке клетки к митозу. Можно предположить, что аук-
сины активны при перестройке тубулина и микротрубочек, а также акти-
новых элементов. Четких доказательств этого пока нет, однако в следую-
щей главе мы встретимся с подобными данными при обсуждении экспе-
риментов по синхронизации клеток женьшеня. В последнее время уста-
новлено, что ауксины являются индукторами «главной» протеинкиназь;
клеточного деления Р^2, а цитокинины — циклинов. Начало каллусоге-
неза связано также с активированием синтеза ядерных белков, однако функ-
ция их пока не исследована.
В результате процесса дедифференцировки происходит образование
in vitro первичного каллуса.
По прошествии 3—4 недель первичный каллус может быть перенесен
на новую агар изо ванную питательную среду в колбы или чашки Петри.
Оптимальный размер каллуса для пересадки около 4x4 мм. Иногда по-
лезно при переносе каллуса захватывать также небольшой слой клеток
экспланта, не повреждая при этом каллусные клетки. Если условия опти-
мальны для роста данной каллусной ткани, то субкультивирование мож-
но продолжать длительное время. Помимо поверхностного субкультиви
рования из каллусной ткани можно получить суспензионную культуру кле-
ток, выращиваемую в жидкой питательной среде (глубинно). Получение
клеточных суспензий возможно из каллусных тканей (рис. 5). Для этого
наиболее подходят каллусы рыхлого типа, которые на поверхности ага-
ризованной среды распадаются на кластеры и небольшие группы клеток
Обычно при первом переносе рыхлых каллусов в жидкую среду на 100 мл
той же питательной среды, но без агара, вносится около 2 г каллусной
ткани. Колбы помещаются на качалку (шейкер), причем скорость враще-
ния качалки при этом желательно увеличить до 110—120 об/мин. Примерно
через две недели образовавшуюся суспензию полезно фракционировать —
разделить мелкие кластеры клеток и большие каллусные агрегаты. Фрак-
ционирование может проводиться разными методами. Обычно использу-
ют отстаивание в течение 1—2 мин. После отстаивания поверхностная
фаза пересаживается как суспезионная культура, к оставшимся на дне
крупным агрегатам добавляется свежая питательная среда, и повторяется
культивирование клеточной суспензии.
— 24 —
Рис. 5. Аппарат
для выращивания
тканей
и клеточных
суспензий
в жидкой питатель-
ной среде
по методу Стыоарда
(F. Steward, 1962)
Если каллус плотный, то описанный выше способ получения суспен-
зионной культуры может не привести к успеху. В этом случае можно «раз-
рыхлить» каллус с помощью исключения из питательной среды солей
Да (в том числе витамина пантотената кальция). Для этой же цели мож-
но при выращивании в качестве ауксина применить 2,4-дихлорфенокси-
жсусную кислоту (2,4-Д) и, наконец, добавить в питательную среду фер-
менты — 0,2 мг/л пектиназы и 0,01 мг/л целлюлазы. Последнее, как пра-
вило, позволяет добиться значительного разрыхления каллуса.
Следует сказать, что суспензионные культуры клеток можно полу-
чить не только из каллуса, но и непосредственно из экспланта. Впервые
такой подход применил проф. Ф. Стьюард (F. Steward, 1962). По его ме-
тод)’ используют роллерный аппарат со специальными продолговатыми
:ссудами с жидкой питательной средой. В сосуды помещают экспланты.
При вращении роллера питательная среда переливается из одного конца
зосуда в другой и таким образом эксплант оказывается попеременно либо
з воздухе, либо в питательной среде. Дедифференцированные клетки от-
деляются от экспланта и переходят в питательную среду. Отделившиеся
дедифференцированные клетки в питательной среде делятся и образует-
ся суспензионная культура клеток. Для непосредственного получения суспен-
зионной культуры клеток из экспланта не обязательно использовать рол-
лерный аппарат. Можно помещать экспланты непосредственно в колбы с
жидкой питательной средой и культивировать их на качалке.
И, наконец, необходимо остановиться на существенном моменте
культивирования клеток и тканей in vitro — факторе кондиционирования.
Давно было замечено, что при очень малом инокулюме клетки в культуре
-25-
прекращают деление, оставаясь при этом живыми. Было сделано предпо-
ложение, что клетки выделяют в среду так называемые факторы конди-
ционирования, которые инициируют деление клеток. При небольшом ко-
личестве клеток концентрация выделяемых факторов кондиционирова-
ния недостаточна для индукции деления. В связи с этим для культивиро-
вания отдельных клеток, взятых от рыхлых каллусов, необходимо приме-
нение методов культуры ткани-«няньки», или кормящего слоя. Отдельная
клетка должна получить сигнал в виде факторов кондиционирования от
соседних клеток или от клеток «кормящего слоя», и только тогда деле-
ние индивидуальной клетки становится возможным. На рис. 6.1 демонст-
рируется метод выращивания единичных клеток с помощью ткани-«нянь-
ки». На рис. 6.2 приведена схема эксперимента, доказывающего, что фак-
тор кондиционирования имеет химическую природу. При отделении
клетки от ткани-«няньки» стеклянной пластинкой деления не наблюдает-
ся. При использовании целлофана (полупроницаемая мембрана) деление
начинается с задержкой. Фактор кондиционирования играет важную
роль не только при делении единичной клетки, но и при субкультивиро-
вании клеток при малом инокулюме.
Рис. 6.1. Метод выращивания
отдельных клеток с помощью
ткани-«няньки »
Рис. 6.2. Выяснение характера
стимулирующего действия
ткани-«няньки»
Перед тем как охарактеризовать каллусные и суспензионные культуры в
режиме субкультивирования, следует сказать, что, помимо дедифференциации
и каллусогенеза, судьба клеток экспланта может быть различной. Например:
1. Процесс дедифференцировки клеток экспланта может оказаться
незавершенным, т.е. клетки экспланта не достигают окончательной спе-
циализации каллусных клеток.
-26-
2. Может происходить процесс редифференциации, при которой
Ь- клетки экспланта переходят на иную программу специализации без пред-
Ь- чествующего деления клеток.
р- Возможности различного развития экспланта экспериментально
а- были показаны в лаборатории автора (А. Соболев, Р. Бутенко, 1971) при
t>- использовании в качестве объекта незрелого эндосперма клещевины. На
В- среде для каллусогенеза можно было получить из этого экспланта первич-
я ный каллус. При изменении состава среды, варьировании компонентов
[г незрелые клетки эндосперма проходили этапы созревания и накаплива-
Ь- ли запасной крахмал и затем белки. По-другому процессы дедифференци-
г- ловки и редифференцировки проходили при использовании в качестве
у эксплантов меристем конуса нарастания томатов с двумя примордиями.
f- В этих эксплантах in vitro прекращались клеточные деления меристемных
а клеток, и только после превращения клеток в каллусные деления возоб-
- новлялись, но уже по типу каллусных. Однако деления каллусных клеток
“ происходили только в зоне примордий конуса и его основания. Сам ко-
[> hvc не превращался в делящиеся каллусные клетки, а перепрограммиро-
вался без деления, превращаясь непосредственно в сосудистые элементы
трахеиды).
В этой главе впервые продемонстрирована изменчивость развития
эукариотических клеток высших растений, особенно при культивирова-
i нии их in vitro. Клетки эксплантов разных растений и разных тканей
могут дедифференцироваться (образуя каллусы), редифференцироваться
и додифференцироваться (см. термины). Каллусные клетки оказались
очень интересным объектом как для фундаментальных исследований, так
и для биотехнологического использования. Становится очевидным, что
тля создания эффективных биотехнологий необходимо знать биологию
клетки, которая культивируется вне организма независимо от способа вы-
ращивания — поверхностного или глубинного (суспензионного). Это
сложная проблема, но уже сейчас ясно, что клетки растения in vitro зна-
чительно отличаются от тканевых клеток растения in vivo. Пока трудно
сказать, ведут себя клетки растений in vitro архаично или, наоборот, вы-
сокоспециализированно и есть ли у них что-то общее с клетками-организ-
мами низших эукариот (одноклеточные водоросли, дрожжи) и прокари-
от (бактерии). В следующей главе я постараюсь сравнить клетки in vitro
высших растений и клетки-организмы разного уровня развития.
11рокариотические
и эукариотические клетки в природе
и при культивировании in nitro
ГЛАВА ПЯТАЯ
Наука, как правило, исходит из гипотезы, что прирэх ;
упорядочена. Это должно относиться и к клеткам г.л- i
кариотическим и эукариотическим, культивируемым гг
vitro.
А.А. Баэ
Представляет интерес сравнение культивируемых эукариотических кле- ’*
ток высших растений, существующих в условиях in intro, с прокариотическг- |
ми и эукариотическими клетками-организмами, существующими в природе Г
Для начала следует сказать, что прокариотическим и эукариотиче- f
ским клеткам высших и низших растений присуще деление клетки от г
клетки. Они реагируют на раздражение и способны видоизменяться.
Из всех известных прокариотов самые простые — бактерии, в том чис- *
ле фотосинтезирующие цианобактерии (ранее именуемые синезелеными вс- ’
дорослями). Однако первые прокариоты, вероятно, были гетеротрофами г
использовали энергию восстановленных соединений, накопившихся в «до- ‘
биологический» период. Первые прокариоты были, вероятно, анаэробами
После исчерпания запасов экзогенных восстановленных соединений ’
для первых гетеротрофных прокариотов наступил серьезный «энергети-
ческий кризис». Он был решен с возникновением фотосинтеза и первых
фотосинтезирующих бактерий. Образовались они не раньше чем милли-
ард лет назад. Вероятно, это были цианобактерии. В ряде случаев группа
цианобактерий окружена желеобразной капсулой. Клетки непосредствен-
но соприкасаются в пределах капсулы. При делении важно наличие вере-
тена деления (из микротрубочек — тубулин) и односторонняя передача
генетической информации из клетки в клетку.
В результате фотосинтеза на Земле существенно увеличилось содер-
жание кислорода, появился озоновый экран и возникли аэробные фор-
мы прокариотов.
— 28 —
Схема эволюции живых организмов на нашей планете представлена
5 ТхОЛ. 5.
Таблица 5
Схема эволюции живых организмов на нашей планете
Зземя, млн тпсседших лет Этап развития
‘ 10-300 А Высшие растительные организмы
. >1'0—700 Клетки эукариот, низшие растительные организмы
КОО—2000 Аэробные прокариоты, фотосинтез зеленых аэробных прокариотов
’4-1-0—1500 Цианобактерии (синезеленые прокариоты), зеленые прокариоты Биогенное образование кислорода
1 500-2000 Первые анаэробные бактерии (прокариоты), брожение, пентозо-фосфат- ный цикл, синтез АТФ
До сих пор нет единого мнения, как возникли эукариотические клетки.
Первая гипотеза — симбиотическая — принадлежит Л. Маргулис.
7-дя по ней, эукариотические клетки возникли в результате симбиоза
гз’ х । гетеротрофные эукариоты) или трех (фотосинтезирующие эукари-
различных клеток. При этом произошел захват (слияние) большой
серной клеткой одной или нескольких прокариотических клеток с ды-
га-тельной или фотосинтетической системой. Из этих прокариотических
сеток образовались соответственно митохондрии и хлоропласты. Ядро
сетки хозяина делится митозом и мейозом, тогда как митохондрии и
с: ропласты размножаются простым делением. Способность к мутациям
гсределяется и ядром, и органеллами.
Вторая гипотеза — мембранная, или инвагинационная. Согласно
уг:й гипотезе эволюция одной из аэробных прокариотических клеток и
ттевращение ее в эукариотическую происходит путем инвагинации мем-
тсгн. Такая клетка должна была иметь многочисленные геномы, каждый
с которых был прикрепленным к наружной мембране. При инвагинации
леморан геномы сегрегировались, и в процессе эволюции их функции
ггзделились. Ядро эволюционировало и становилось все более сложным,
~:гда как органеллы сохраняли свои первичные функции, а некоторые
зз них передавали их либо ядру, либо теряли.
И, наконец, третья гипотеза. Прокариотические клетки образовыва-
ли скопления отдельных элементов генома. В ходе эволюции эти скопле-
ния клонировались, в результате чего функции отдельных клонов генома
разделились. Отдельные клоны генома приняли участие в образовании и
регуляции деятельности как органелл, так и ядра. Отбор будущих эукарио-
т: з происходил при наиболее усложненной роли ядра.
Можно предположить также, что процесс возникновения эукариоти-
ческих клеток происходил разными путями, и весьма возможно, что на
разных этапах естественного отбора эукариотические клетки получали
возможность для эволюционных изменений ядра, митохондрий и хлоро-
пластов.
Выход растений на сушу был связан с приобретением многих новых
функций — например, появлением комплекса защитных покровов (эпи-
дермис, кутикула), возникновением транспортных систем воды и веществ
в растениях. Вместе с тем есть веские доказательства, что почти 93*4
всех ферментов, характерных для клеток эукариот, найдены и играют су-
щественную роль и в жизни прокариот.
Симбиотическое возникновение эукариот кажется более простой и
эффективной гипотезой, недаром симбиоз у эукариотических и прокари-
отических растительных организмов существует и в наши дни. При этом
митохондрии сохранили свою изначальную функцию — аэробное дыха-
ние, но в клетках растений популяция митохондрий очень гетерогенна.
число их разновидностей даже внутри одного вида очень велико. Хлоре-
лл асты хотя и подвергались изменениям пигментных систем, но также
сохранили свою изначальную функцию — процесс фотосинтеза. Ядро со-
хранило двойную мембрану, как хлоропласты и митохондрии.
Культура клеток высших растений может оказаться весьма полезной
для изучения изменений клеточных органелл в клетках in vitro. Это мо-
жет оказаться эффективным для выяснения происхождения и эволюции
эукариотических клеток. В эукариотической клетке in vitro возможно из-
менение состояния пластидного генома. В отдельных экспериментах
можно получить фотосинтезирующие клетки и автотрофные суспензии
однако это редкие случаи (например, автотрофная культура клеток манд-
рагоры, полученная в Отделе биологии клетки и биотехнологии ИФР
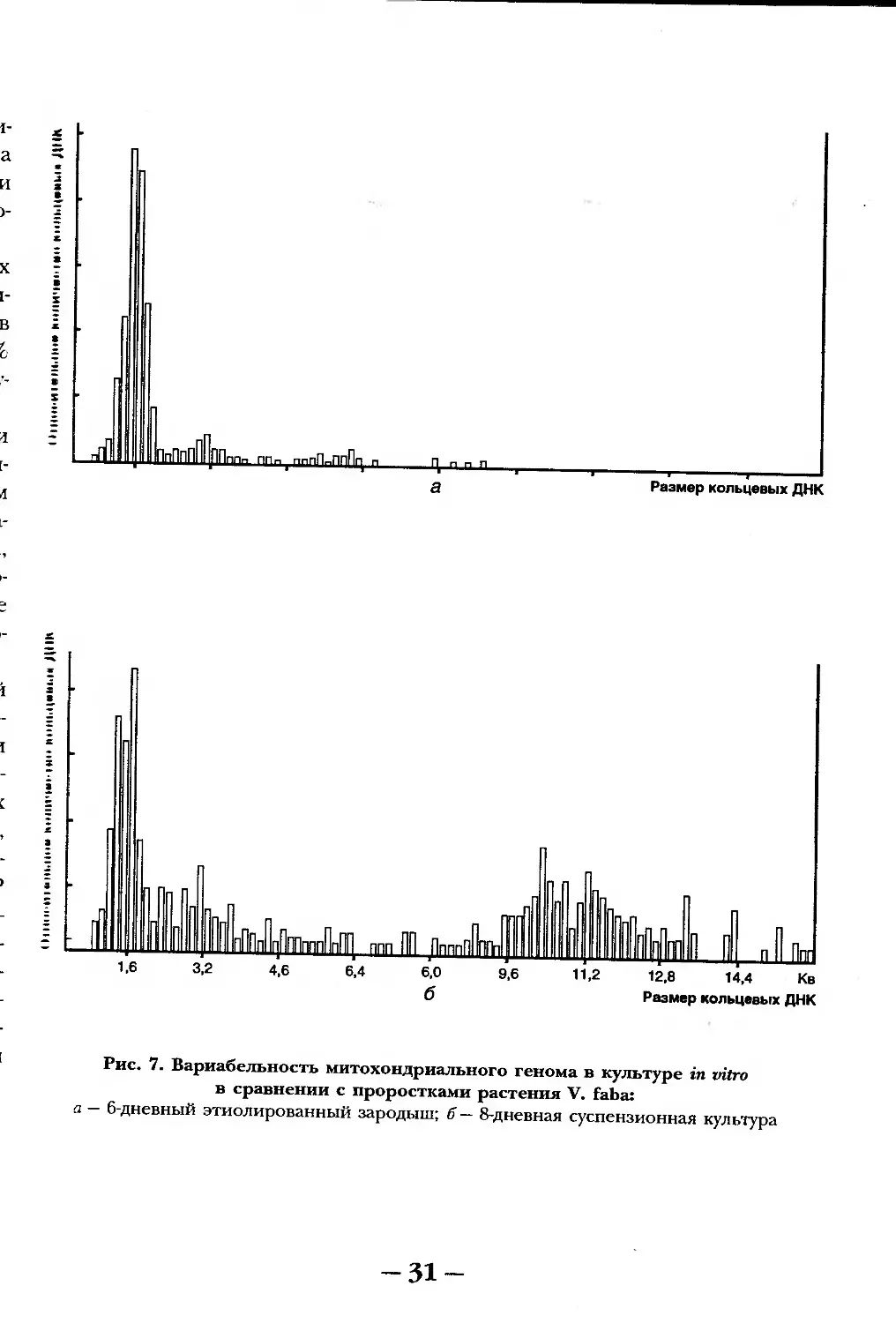
РАН). Наиболее интересны изменения митохондрий, наблюдаемые в cv-
спензионных культурах клеток. При этом митохондрии могут сильно из-
меняться морфологически (менять форму), однако более существенны ва-
риации генома митохондрий. В культуре клеток Vida faba отмечены изме-
нения в популяциях кольцевых ДНК митохондрий, в частности, появле-
ние специфичных миникольцевых ДНК в сравнении с проростками
(см. рис. 7) по данным В. Негрука.
-зо-
-
г
Рис. 7. Вариабельность митохондриального генома в культуре in vitro
в сравнении с проростками растения V. faba:
а — 6-дневный этиолированный зародыш; б — 8-дневная суспензионная культура
-31-
В табл. 6 сопоставлены некоторые характерные признаки прокарио-
тических и растительных эукариотических клеток in vivo и in vitro.
Таблица б
Характерные признаки прокариотических и эукариотических
клеток растений in vivo и in vitro
Признак Прокариоты Эукариоты (высшие растения)
in vivo in vitro
Величина клетки 2—10 мкм 5—200 мкм 5—1000 мкм
Статус Одноклеточная Клетки тканей растений Клетки вне организма. 4—20 в кластере
Геном (хромосомы) Область тяжей ДНК в цитоплазме Ядро, окруженное двойной мембраной, тяжи РНК + белок (хромосомы) То же, что и in vivo
Способ Простое расщепление Митоз (образование То же, что и in vivo.
размножения Время (мезосома, связанная с тяжами ДНК) Делятся, образуя дочерние клетки веретена из микротрубочек) но с нарушениями
удвоения 1 час 24—30 часов 30—48 часов
Стабильность при стрессах Стабильны Вариабельны Чувствительны
Спонтанная мутагенность Редко В зависимости от вида В зависимости от видо- вых особенностей и действия экзогенных стрессовых факторов
Контроль Экзогенный и популяционный Организменный Популяционный и экзогенный
Кмсобеивсости неполовых популяции
длительно культивируемых клеток
высших растении in vitro
ГЛАВА ШЕСТАЯ
Длительно культивируемые in vitro клетки высших растений образу-
ют специфическую популяцию. Такие популяции относятся к типу непо-
ловых популяций, т.е. популяций соматических клеток, не размножа-
ющихся половым путем. Клетки каллусов, выращиваемые поверхностно,
и клетки суспензий, выращиваемые глубинно, являются самостоятельны-
ми единицами и размножаются клонально. Клетки разных клонов фор-
мируют неполовую популяцию. Популяции соматических клеток физио-
логически асинхронны и генетически гетерогенны.
Наиболее важной характеристикой популяции является ее рост.
Обычно рост популяции клеток in vitro оценивают по числу составляю-
щих ее клеток или по их общей биомассе. Несмотря на асинхронность
популяции и относительную самостоятельность составляющих ее клонов,
клетки in vitro в целом проходят фазы ростового цикла, характерные для
роста клеток высших растений in vivo.
При переносе транспланта или инокулюма на свежую питательную
среду увеличение числа клеток описывается сигмоидной кривой — так на-
зываемой S-кривой роста. Весь цикл роста принято разделять на несколь-
ко фаз: латентная (лаг-фаза), фаза ускорения роста, фаза экспоненциаль-
ного роста, фаза замедления роста, стационарная фаза и фаза деграда-
ции. В табл. 7 представлены основные фазы ростового цикла. В этой же
таблице представлены также наиболее важные изменения функций боль-
шинства клеток, находящихся в определенной фазе цикла.
В зависимости от вида растения, используемого экспланта или кло-
на полученной культуры сигмоидная кривая роста может видоизменять-
ся. В работе Р. Бутенко, М. Гусева, Т. Корженевской и Н. Юриной (1981)
сравнивались кривые ростового цикла популяций клеток in vitro табака и
диоскореи дельтовидной. Инокулюмы были взяты в фазе замедления ро-
ста. Длительность латентной фазы ростового цикла этих разных популя-
ций совпадала по времени, то же наблюдалось и в начале экспоненты, в
-33-
Фазы ростового цикла
Таблица 7
Лаг-фаза Экспоненциальная фаза Фаза замедления роста Фаза деградации
Увеличивается Начало интенсивных Увеличение Резкое уменьшение поглощение и экскре- делений (1—2 пика) морфофизиологиче- объема цитоплазмы ция веществ; объем Рост клеток растя- ской гетерогенности Вакуоль достигает цитоплазмы и число жением клеток и органелл максимальной величи- органелл; содержание Плотная гиалоплаз- Число органелл ны АТФ, ГТФ, НАДФН ма> много органелл уменьшается, мито- Разрушение орга- Активизируется Полисомы прикреп- *ОНДРИИ изменяют нелл дыхание, в том числе ленные форму Резко падает по пентозофосфатному Максимум синтеза Выбросы этилена активность дыхания пути РНК и белка Синтез фермен- Увеличение свобод- на свету активи- дктивное дыхание тов> ключевых «ля ных серина, треонина зируется ФЕП-карбок- Синтез ИНдуцибель- вторичного метабо- ферментов: оксидаз, силаза ных ферментов лизма (ФАЛ, Кума- гидролаз Полисомы свобод- пластидный синтез PaJ-CoA™ra3a) ные м Начало синтеза Начинается синтез ЛИПИД°В> ПУРИН°В’ “белков старения» начинается синтез уреидов, терпенов
Активация проте-
инкиназы Рз4,
генов cdc25, cdc!3
которой были отмечены пики максимумов митозов, одинаковые по вре-
мени для обеих популяций. Далее кривые роста популяции диоскореи
дельтовидной и табака расходились. Популяция диоскореи быстро до-
стигла фазы максимального (экспоненциального) роста, фазы замедления,
и, не переходя в фазу стационара, клетки деградировали и погибали. На-
против, популяция клеток табака характеризовалась большой длительно-
стью фазы стационара (до 60 дней). В период от 60 до 70 дней клетки
были живыми, но при высеве их в качестве инокулюма не размножались
и погибали на 80-й день.
Проблема долговечности, старения и смерти клеток в популяции
имеет большое теоретическое и практическое значение. Гибель клеток
популяции может происходить по разным причинам.
1. Случайная гибель (фитовирусы, бактерии).
2. Из-за преждевременного изнашивания клетки в результате неопти-
мальных условий существования.
3. Смерть в результате нормальных процессов развития и старения,
(«генетический счетчик», отсутствие теломеразы).
Можно предположить, что в приведенном примере клетки табака
оказались значительно выносливее к стрессам культивирования, имели
более высокий биосинтетический потенциал, но лимитация по питанию
в периодическом режиме выращивания в конце концов привела их к ги-
бели. В случае диоскореи, клетки которой еще до фазы стационара пре-
кращали деление и погибали, можно предположить накопление в клет-
ках или среде токсичных веществ. Такими соединениями могли быть сте-
роидные сапонины, которые синтезируют клетки диоскореи.
Наиболее важным свойством неполовой популяции является ее асинх-
ронность. Асинхронность популяции характеризуется тем, что в одно и то
же время ростового цикла одни клетки делятся, другие растут, третьи нахо-
дятся в стадии физиологической зрелости, четвертые стареют. Однако об-
щее физиологическое состояние асинхронной популяции обычно оценива-
ют по состоянию преобладающего числа клеток.
Причины асинхронности популяции клеток in vitro различны. Одной
из причин асинхронности могут быть особенности вида, сорта, генотипа
индивидуального растения и экспланта, выбранных для получения пер-
вичного каллуса. Асинхронность популяции может быть вызвана также
стрессами культивирования, в частности неоптимальной средой для дан-
ного типа клеток. Изменения баланса эндогенных гормонов в течение
цикла выращивания и концентрации экзогенных гормонов в среде, фи-
зические факторы (температура, свет, аэрация) также могут влиять на
физиологическое состояние клеток. И, наконец, асинхронность клеток в
популяции прочно связана с генетической гетерогенностью клеток и кло-
нов, о которых будет сказано ниже.
В большей степени асинхронность популяции связана с особенно-
стями и аномалиями митотического цикла (МЦ) клеток in vitro.
Представляет значительный интерес нормальный митотический
цикл эукариотической клетки и его аномалии, которые часто встречаются.
Как правило, дифференцированные клетки экспланта находятся в G - перио-
де митотического цикла. Меристемные клетки, использованные в каче-
стве экспланта, дедифференцируются и только после этого входят в цикл
деления. Нормальный митотический цикл включает в себя смену собы-
тий на макромолекулярном уровне, что определяется экспрессией генов,
связанных с делением клетки. Белки-циклины взаимодействуют с проте-
инкиназой Р34 (кодируется геном cdc2). Эти белки в интерфазе регулиру-
ют также активность реорганизации микротрубочек цитоскелета. Активи-
рованная циклинами протеинкиназа Р34 вызывает цепь реакций, которые
в конечном итоге приводят к конденсации хромосом в метафазе митоза.
Клетки проходят все фазы митотического цикла и могут повторить деле-
ние несколько раз. Выход клетки из митотического цикла может про-
изойти или в Gp или в С2-фазе.
Фазоспецифичность экспрессии генов может служить je-
ством их участия в митотическом цикле. В докторской ди
— 35 —
А. Носова (1995), выполненной в Отделе биологии клетки и биотехноло-
гии ИФР РАН, показано, что в качестве одного из маркеров фаз клеточ-
ного цикла может служить фермент тимидинкиназа. По мнению автора
диссертации, тимидинкиназа — один из участников сборки комплекса
репликации ДНК в клеточном цикле.
Для детального изучения молекулярных факторов регуляции митоти-
ческого цикла и выяснения их функциональной связи с физиологическим
состоянием клетки, проходящей фазы митоза, необходимо синхронизиро-
вать асинхронную популяцию клеток. В синхронизированной культуре боль-
шинство клеток в каждый момент времени находится в одинаковой фазе
митотического цикла. К настоящему’ времени разработаны различные мето-
ды синхронизации клеток. Обычно для синхронизации используются при-
емы, останавливающие клеточный цикл на границах его фаз.
Первый вариант — двукратное исключение из питательной среды
фосфора (в начале эксперимента и после определенного интервала вре-
мени).
Второй вариант — введение в питательную среду 5-аминоурацила, ко-
торый задерживает клетки на границе Gj/S-цикла.
Третий вариант — использование 5-метилоксимочевины, который,
пожалуй, наиболее удачен. Он позволяет собрать более 80% клеток в од-
ной фазе цикла (И. Смоленская и др., 1988).
В работе, проведенной с длительно выращиваемой культурой Рапах
ginseng (Т. Бычкова, Р. Бутенко и др., 1974), получены интересные резуль-
таты по синхронизации клеток с помощью 5-аминоурацила (5-АУ)
(рис. 8). Синхронизация задерживала деление клеток на границе Gj/S,
но и после удаления ингибитора деления клеток не начинались до тех
пор, пока в питательную среду не внесли фитогормоны — вначале ауксин,
а затем цитокинин.
Рис. 8. Синхронизация
длительно субкультивируе-
мой культуры Рапах ginseng
(Г. Бычкова, Р. Бутенко и
ДР-, 1974)
-36-
tn III It!
Следует сказать, что синхронизировать популяцию можно лишь на
еболыпой промежуток времени. Через три-четыре деления клеток, если
е принимать специальных мер, популяция вновь становится асинхрон-
ен.
Одной из важнейших особенностей популяции соматических клеток
' vitro является нестабильность генома клеток и их генетическая гетеро-
генность. Впервые генетическая гетерогенность популяций клеток выс-
лих растений in vitro была показана в лаборатории культуры ткани и мор-
фогенеза ИФР АН СССР (3. Шамина, Р. Бутенко, 1964). Стоит отметить,
что генетическая гетерогенность клеточных популяций in vitro прочно
гзязана с физиологией составляющих популяцию индивидуальных клеток
и клонов. Разорвать связь между генетикой и физиологией в популяции
невозможно.
Можно назвать несколько причин нестабильности генома клеток in
-.v.ro. Среди них и те, которые мы уже знаем, но, несомненно, много и
таких, которые еще предстоит изучить. Из известных причин можно
выделить следующие:
1. Генетическая гетерогенность определенного вида, сорта, органа,
ткани, которые используются как экспланты для получения первичного
каллуса.
2. Обычно клетки экспланта выходят из митотического цикла в G -
тазе. Таким образом, деление клеток экспланта связано с синтезом ДНК
а необычных для клеток экспланта условиях, что может привести к ано-
малиям митоза.
3. Условия in vitro, в которых культивируется эксплант и возникает
первичный каллус при перепрограммировании клеток и первых делени-
ях каллуса, могут быть аномальными.
4. Мутагенное действие экзогенных гормонов и стимуляторов.
5. Длительное субкультивирование каллусных культур, приводящее к
накоплению в популяции генетически измененных клеток и клонов.
В результате действия перечисленных факторов популяция клеток
мажет иметь в своем составе полиплоидные, моноплоидные и анеуплоид-
ные клетки, а также клетки с хромосомными аберрациями. Обычно наи-
более интенсивно процесс престройки генома происходит при получе-
нии культуры клеток, а также при существенном изменении условий куль-
тивирования.
После периода перестройки наступает период стабилизации генома
лопуляцнн. Процесс стабилизации кариотипа разных штаммов клеток,
полученных либо от первичного каллуса, либо от разных эксплантов и
-37-
трансплантов, обычно требует около 5—6 субкультивирований при обяза-
тельном сохранении неизменных условий выращивания. Согласно тео-
рии эгоистичной клетки гены, преобладающие в популяции, способству-
ют выживанию и размножению клеток. Происходящие при субкультиви-
ровании популяции генетические изменения в клетках растений адапти-
руют их к измененным условиям.
Так, на примере штамма клеток гаплопапуса (Z. Shamina, 1965) было
показано, что за два года культивирования (с пересадками один раз в ме-
сяц) меристематические ткани, исходно содержащие геном 2п, преврати-
лись в ткани, содержащие до 95% высокоплоидных клеток (8п и более).
Вместе с тем в лаборатории Т. Эриксона в Упсале (Швеция) в 1967 г. был
получен и длительное время поддерживался путем пересадок с интерва-
лом в два дня диплоидный штамм гаплопапуса.
Обычно за 5—6 пересадок после получения первичного каллуса про-
цесс стабилизации кариотипа завершается и цитогенетическая характе-
ристика популяции в константных условиях выращивания бывает сравни-
тельно устойчивой. В то же время изменения состава среды и физиче-
ских факторов культивирования могут вновь стимулировать генетические
изменения клеток в популяции.
В ряде случаев процесс стабилизации генетического статуса популя-
ции может быть значительно более длительным. Одним из интересных
примеров этого явилась перестройка генома популяции клеток бобов
V. faba, обнаруженная в исследованиях Л. Фроловой (L. Frolova, 1986).
В качестве исходной была использована стабильно растущая популяция,
содержащая 50% диплоидных и 50% тетраплоидных клеток. Наблюдения
за этой популяцией в течение 4 лет показали, что постепенно ее состав
изменился — до 95% клеток оказалось диплоидными. Было показано, что
диплоидные клетки проходили латентную фазу ростового цикла значи-
тельно быстрее, чем клетки полиплоидные. Таким образом, отбор клеток
в популяции в этом случае проходил по интенсивности роста, что приве-
ло к увеличению числа диплоидных клеток.
Несомненный интерес для изучения генетических особенностей по-
пуляции клеток in vitro представляют гибридные виды. К таким видам
относится пшеница Тимофеева Triticum timopheevii Zhik, которая была
объектом исследования кандидатской диссертации С. Зоринянц (S. Zori-
nyants et al., 1995), выполненной в лаборатории автора (руководитель
И. Смоленская). Гибридный геном T.timopheevii состоит из 28 хромосом,
14 из них принадлежат исходному геному At и 14 — исходному геному G
(по исследованию апексов корня растения). В диссертационной работе
методами дифференциального окрашивания (С-бэндинга) были изучены
-38-
характеристики и реорганизация генома клеток в популяции in vitro. Ока-
залось, что при длительном культивировании клеток in vitro они частич-
но теряли хромосомы А-генома — их становилось меньше, чем G-хромо-
сом. Клетки популяции в основном были анеуплоидны (около Зх). В хро-
мосомах наблюдалось значительное количество хромосомных аберраций,
причем их число также было различным для разных исходных геномов.
Был отмечен полиморфизм кариотипов. Популяция Т. timopheevii быстро
адаптировалась к условиям in vitro, и ее клетки активно пролиферирова-
ли, но были неспособны к морфогенезу.
Несомненно, популяции клеток гибридных растений еще нуждаются
з новых подходах к их изучению и использованию, что может оказаться
важным при изучении морфогенеза in vitro.
Следует особо отметить, что генетическую гетерогенность клеток
любой популяции не следует рассматривать как недостаток, более того,
это, как правило, необходимое условие ее существования, основа адапта-
ционных возможностей популяции.
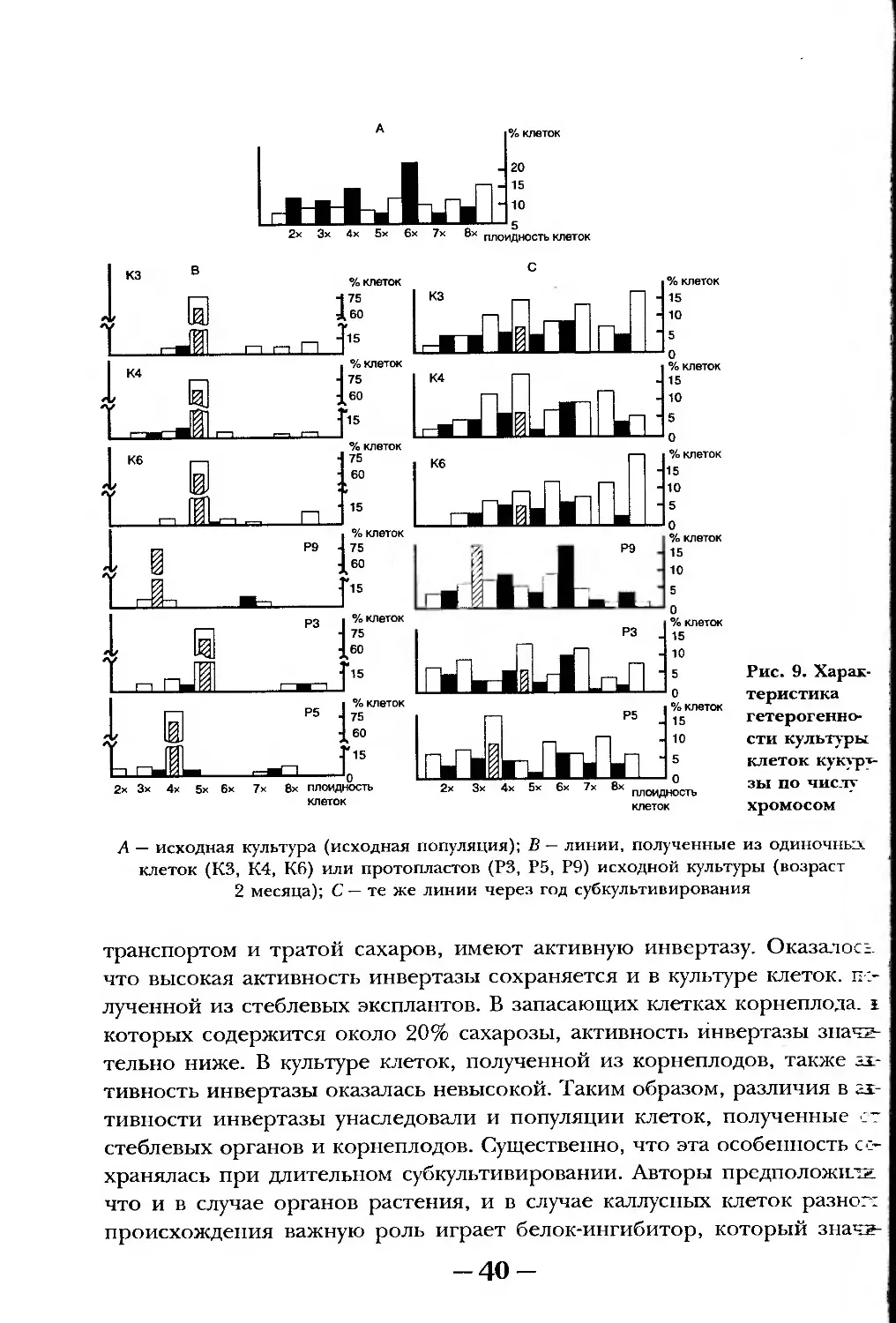
В качестве особого примера можно привести результаты кандидат-
ской работы By Дык Куанга, выполненной в лаборатории автора (руково-
дитель — проф. 3. Шамина). Эта работа была проведена с единичными
клетками и изолированными протопластами, взятыми из популяции кле-
ток суспензионной культуры кукурузы. Предварительно популяция была
:характеризована по плоидности клеток. Выделенные индивидуальные
клетки начинали делиться, и примерно через 12 месяцев суб культивиро-
ваний популяция оказалась практически идентичной исходной по асинх-
ронности и генетической гетерогенности генотипов. Возобновление фи-
лологической асинхронности и генетической гетерогенности в процес-
се восстановления популяции из единственной клетки еще раз говорит о
т:-м, что они являются важными факторами гомеостаза популяции
□ис. 9) (By Дык Куанг, 3. Шамина, 1983).
Несмотря на генетическую гетерогенность популяций эукариотиче-
ских клеток in vitro, в их геноме сохраняются генетические основы вида
z индивидуального генотипа растения-донора. Более того, несмотря на
троцесс дедифференцировки при получении культуры клеток, в клетках
я. vitro часто сохраняются и эпигеномные характеристики, связанные с
исходной дифференцировкой экспланта.
Прямым подтверждением сохранения эпигеномных функций служат ре-
>льтаты исследований А. Курсанова и И. Дубининой (А. Курсанов и др.,
1?76). Хорошо известно, что в корнеплодах и надземных органах сахарной
сзеклы активность фермента инвертазы, расщепляющей сахарозу на фрук-
те^’ и глюкозу, значительно различается. Стеблевые органы, связанные с
-39-
Рис. 9. Харак-
теристика
гетерогенно-
сти культуры
клеток кукуру-
зы по числу
хромосом
А — исходная культура (исходная популяция); В — линии, полученные из одиночных
клеток (КЗ, К4, Кб) или протопластов (РЗ, Р5, Р9) исходной культуры (возраст
2 месяца); С — те же линии через год субкультивирования
транспортом и тратой сахаров, имеют активную инвертазу. Оказалось,
что высокая активность инвертазы сохраняется и в культуре клеток, по-
лученной из стеблевых эксплантов. В запасающих клетках корнеплода, г
которых содержится около 20% сахарозы, активность инвертазы значи-
тельно ниже. В культуре клеток, полученной из корнеплодов, также ак-
тивность инвертазы оказалась невысокой. Таким образом, различия в ак-
тивности инвертазы унаследовали и популяции клеток, полученные ст
стеблевых органов и корнеплодов. Существенно, что эта особенность со-
хранялась при длительном субкультивировании. Авторы предположили
что и в случае органов растения, и в случае каллусных клеток разног:
происхождения важную роль играет белок-ингибитор, который значг-
— 40 —
тельно снижает активность инвертазы в корнеплоде сахарной свеклы.
Эксперимент показал, что каллусные клетки, полученные из корнеплода,
можно отмыть от белка-ингибитора и активность инвертазы после от-
мывки в них приближается к активности инвертазы клеток, полученных
от стеблевых органов. Ингибитор оказался активным в клетках каллуса,
зозникшего из корнеплода, но не востребован, так как клетки in vitro не
запасают сахарозу. Мы еще обратимся к характеристике инвертазных ге-
нов и их регуляции в главе, где будут рассматриваться трансгенные рас-
тения.
Таким образом, не только генетические характеристики популяции,
но и эпигенетические их особенности могут сохраняться длительное вре-
мя при субкультивировании популяций.
Итак, главные особенности популяции in vitro- асинхронность; гене-
тическая гетерогенность клеток, сохранение генетических особенностей
исходного вида, растения-донора и некоторых эпигенетических характе-
ристик.
Несомненно, популяции клеток гибридных растений нуждаются в
дальнейшем изучении с применением новых подходов.
Вторичный метаболизм
вне организма в популяциях клеток
растений in vitro
ГЛАВА СЕДЬМАЯ
В этой главе вторичный метаболизм рассматривается только с точ-
ки зрения клеток вне организма высших растений. Биотехнологии, свя-
занные с получением клеток-сверхпродуцентов экономически важных
метаболитов, будут представлены во второй части книги (глава 12).
Способность высших растений к синтезу веществ вторичного проис-
хождения уже была известна пионерам в области физиологии растений —
Саксу и Пфефферу (J. Sax, W. Pfeffer). Чем больше становилось извест-
ным широкое распространение этих веществ в растительном царстве,
тем быстрее менялись взгляды ботаников на значение их для растений и
человека. Професор К. Мотес (К. Mothes, 1972, 1973), пожалуй, первым
четко сформулировал идею о том, что вторичные вещества играют важ-
ную роль для сохранения видов растений в данной среде обитания. Они
являются экологическими сигналами, определяющими роль растения в
биоценозе.
В настоящее время изучено много вторичных веществ высших рас-
тений и, соответственно, все повышается интерес к ним как к лекар-
ственным препаратам, вкусовым и ароматическим добавкам для пищевой
и парфюмерной промышленности. Содержание экономически важных
вторичных метаболитов в высших растениях определяется активностью
их синтеза, эффективностью транспорта и депонирования в органах за-
паса растения. Все эти признаки определяются генетически, находятся
под контролем развития организма и максимально реализуются в опти-
мальных внешних условиях.
Методы культуры клеток растений открыли новые перспективы для
изучения путей биогенеза и регуляции метаболизма вторичных веществ.
Вместе с тем эти методы могут создавать источники новых коммерчески
важных продуктов благодаря возможности получать мутантные, вариант-
ные, гибридные и трансгенные клеточные линии.
— 42 —
Анализ литературных данных и опыт, накопленный в Отделе биоло-
гии клетки и биотехнологии ИФР РАН при работе с культурами клеток-
продуцентов, вторичных метаболитов, позволяет нам сделать ряд обоб-
щений о функционировании культивируемых клеток.
В предыдущей главе было много сказано о популяциях клеток вне
организма. Все это полностью присуще и растениям, синтезирующим ме-
таболиты, которые по старинке называю'!’ вторичными. В этой главе бу-
дут рассмотрены важные биологические особенности популяций кле-
ток— продуцентов метаболитов: первое — это стабильность или неста-
бильность синтезов метаболитов при длительном культивировании кле-
ток в популяции, второе — особенности синтеза, транспорта и запасания
метаболитов у разных клонов.
Список вторичных продуктов, синтезируемых культивируемыми
клетками растений, приведен в табл. 8. Он все время пополняется как в
отношении традиционных растительных соединений вторичного метабо-
лизма, так и необычных, а также продуктов биотрансформации с помо-
щью культивируемых клеток.
Таблица 8
Некоторые экономически важные продукты, синтез которых получен
в культуре клеток высших растений
Традиционные растительные продукты Новые активные вещества Продукты биотрансформации
V-калоиды ~тероиды Ингибиторы фитовирусов (полипептиды) Метилдигоксин Дигоксин
Терпены и терпеноиды Еетанины Гтикозиды Антиканцерогены Коптомицин Ментол Неоментол
Т элифенолы Т злисахариды тоирные масла Натуральные красители тигменты) Тихинон Qio 1*-«совые добавки •Инсектициды .Т±текс Ингибиторы протеиназ Необычные белки Гераниол Нерол Цитронеллол
В качестве источников экономически важных продуктов культивируе-
мые клетки высших растений имеют ряд преимуществ по сравнению с це-
лыми организмами.
— 43 —
К таким преимуществам относятся:
1. Получение экологически чистых продуктов независимо от клима-
та, сезона, погоды.
2. Создание клеточных линий-сверхпродуцентов путем генетических
манипуляций.
3. Сохранение пула генов редких и исчезающих растений — проду-
центов (подробнее см. в главе «Биотехнология и биоинженерия клеток —
продуцентов метаболитов для промышленности»).
Важной характеристикой клеток популяции является ее стабиль-
ность в отношении синтеза, транспорта и депонирования метаболитов
«интереса». Стабильность может сохраняться в течение всего времени су-
ществования популяции (пример — синтез стероидных гликозидов в куль-
туре клеток Dioscorea deltoidea Wall.). При этом сохраняются и активно ра-
ботают гены синтеза, системы транспорта и депонирования.
Возможен случай постепенного (в течение нескольких лет) увеличе-
ния числа клеток со сниженным синтезом метаболитов.
И наконец, в случае полной «нестабильности» клетки популяции
очень быстро теряют способность к синтезу вторичных метаболитов.
Иногда это связано с утратой генов, участвующих в синтезе метаболитов
in vitro, однако гораздо чаще — с прекращением их экспрессии.
Вопрос о стабильности и нестабильности тесно связан с изучением
биологии клеток разных популяций. В организме растения синтез метабо-
литов, их транспорт и отложение в запас находятся под строгим контро-
лем развития. Часто эти события разведены во времени и в разные орга-
ны растения. Клетка вне организма обычно не транспортирует метаболи-
ты в соседние клетки или в питательную среду. Хотя в ряде случаев это
наблюдается — например, это характерно для алкалоидов мака. Эпибласты
и млечники — редкие структуры в популяциях каллусных клеток. Таким
образом, изучение клетки, где проходят все стадии вторичного метаболиз-
ма — от синтеза до депонирования,— требует самого пристального внимания.
Чтобы получить высокопродуктивные клоны клеток, обычно приме-
няют последовательный скрининг, который начинается с выбора вида с
наиболее высоким содержанием интересующего нас вторичного метабо-
лита. Далее следуют установление различий в содержании продукта в ин-
дивидуальных растениях и использование наиболее продуктивных орга-
нов и тканей в качестве экспланта. С моей точки зрения, наибольшее зна-
чение имеет видовая принадлежность растения, от которого получены
культивируемые клетки (генотип вида).
В Отделе биологии клетки и биотехнологии ИФР РАН собрана боль-
шая коллекция клеточных культур in vitro. Среди них много растений из
-44-
различных семейств, синтезирующих стероиды, алкалоиды, сердечные
гликозиды, фенолы и др.
Наиболее интересная и хорошо изученная из них — культура клеток
Jioscorea deltoidea Wall. Эта культура была получена из ткани корневища ин-
тактного растения (М. Саркисова, Р. Бутенко, А. Синюхин, 1971) на твер-
ззй питательной среде. Для каллусов, растущих на агаре, был характерен
яощный ризогенез. После обработки химическим мутагеном (азотистым
ипритом) ризогенез прекратился и культуру легко перевели в суспензию
3. Шамина, М. Саркисова). Далее, после обработки другим химическим
мтгагеном (N-нитрозометилмочевиной) (С. Каранова), из исходного
тгтамма были получены мутантные штаммы: ИФР ДМ-0,5; ИФР ДМ-1;
ИФР ДМ-8. Все штаммы имели одинаковый качественный состав синтези-
~ темых стероидных гликозидов, но значительно отличались по их количе-
ственному содержанию. Штамм ИФР ДМ-0,5 оказался сверхпродуцентом
из фуростаноловым гликозидам. Разные мутантные штаммы D. deltoidea
'ыли стабильны длительное время (около 26 лет). Штаммы различались
из скорости роста и накоплению стероидных гликозидов и стероидов.
Наиболее интересным оказалось то, что все штаммы синтезировали толь-
ас фуростаноловые гликозиды, но не спиростаноловые, характерные для
с рневища интактного растения. Любопытно, что многие свойства фуро-
гтаноловых и спиростаноловых гликозидов диаметрально противополож-
ны. В табл. 9 представлены свойства фуростаноловых и спиростаноловых
сапонинов.
Таблица 9
Сопоставление свойств фуростаноловых и спиростаноловых сапонинов
Свойства Фуростаноловая форма Спиростаноловая форма
Нетзоримость Водорастворимые Водонерастворимые
21Егрхностная активность Отсутствует Поверхностноактивны
Тействие на мембраны Не лизирует мембраны, возможно, стабилизирует их Лизирует мембраны
.ZezzTBiie на клетку Стимулирует пролифера- цию клеток Цитотоксическая и цито- статическая активность
^егствие на иммунную Иммуномодулирующая Иммуносупрессорная
зитему животных активность активность
Зыгтвие на Red-Ox-систему Антиокс идантная активность Активность не показана
Как уже было сказано, особое значение для вторичного метаболизма
и -.Лго имеет их внутриклеточная локализация. В 1996 г. в Отделе биоло-
п=з клетки и биотехнологии была защищена кандидатская диссертация
зе тему «Изучение внутриклеточной локализации стероидных гликозидов
-45-
в культивируемых клетках Dioscorea deltoidea Wall.» И. Князьковым (руково-
дитель — проф. А. Носов). Автор изучал локализацию фуростаноловых
гликозидов (штамм ДМ-0,5), используя различные подходы. Основным
методом был непосредственный анализ гликозидов в нативных клетках,
изолированных протопластах этих клеток и в вакуолях протопластов.
Вторым методом была электронно-микроскопическая гистохимия, кото-!
рую автор проводил на кафедре клеточной биологии и иммунологии ?
МГУ совместно с Е. Лобаковой.
Прямое определение фуростаноловых гликозидов в клетках и прото-
пластах диоскореи показало, что около половины этих соединений нахо-
дится в периплазматическом пространстве клеток.
Электронно-микроскопическое исследование культивируемых клеток
диоскореи позволило идентифицировать их структуру как структуру кле-
ток терпеноидного типа. В начале активного роста в популяции преобла- _
дали клетки меристематического типа (55—85%). На 10—17-е сутки (середи- *
на и конец экспоненциального роста) изучали ультраструктуру этих клеток
терпеноидного типа. Ядро было с большими порами, развит эндоплазма- ~
тический ретикулум (ЭПР), образующий своеобразные «футляры» вокруг х
пластид. ЭПР — чередующийся агранулярный и гранулярный, плазмалемма *
складчатая. В межклетниках осмиофильные фибриллярные структуры. Для т
штамма ДМ-0,5 сильно развиты диктиосомы, ЭПР и ретикулярные футля- -
ры пластид. К концу экспоненциальной фазы роста в клетках мутантного -
штамма ДМ-0,5 образуется одна большая вакуоль сферической формы.
При двойной фиксации материала (глутаральдегид-осмий) были вы-
явлены значительные количества электронно-плотных веществ в пери-
плазматическом пространстве и в вакуолях. После вымывания из клеток
фуростаноловых гликозидов электронно-плотные вещества в этих ком-
партментах не обнаруживались.
Анализируя полученные данные, можно сделать вывод, что фуроста-
ноловые гликозиды штамма ДМ-0,5 депонируются в вакуолях и в свобод-
ном пространстве клеток. Для штамма ДМ-0,5 характерны большие ваку-
оли, что, возможно, способствует высокому накоплению фуростаноловых
гликозидов. В целом можно сказать, что синтез гликозидов связан с ак-
тивными компартментами клетки (цитоплазма, ЭПР, пластиды). В вакуо-
лях депонируется реутилизируемая форма гликозидов, в клеточной стен-
ке и в свободном пространстве могут накапливаться метаболиты, несу-
щие защитные и сигнальные функции. В табл. 10 представлены сведения
о местах синтеза и накопления различных вторичных метаболитов в
клетках растений. Из данных таблицы можно видеть, что вакуоли и сво-
i R I а
-46-
годное пространство клетки часто используются для накопления метабо-
титов, тогда как синтез связан с внутриклеточными органеллами (глав-
ным образом пластидами, ЭПР). Следует отметить, что аналогичная для
жлеток in vitro закономерность характерна и для клеток in vivo.
Таблица 10
Внутриклеточная локализация синтеза и накопления
вторичных метаболитов
Внутриклеточные метаболиты Синтез Накопление
--1КАЛОИДЫ Пластиды, цитоплазма Вакуоль, хлоропласты, сноб, пр-во
ТЕРПЕНОИДЫ Жцнотерпены Т^йтерпены Лейкопласты Хлоропласты, лейкопласты Своб. пр-во Вакуоль, своб. пр-во, цитоплазма
5 1-НОЛ ы Р223ОНОИДЫ Тьнины Хлоропласты Вакуоль, пластиды Вакуоль, хлоропласты, ЭПР ЭПР, хлоропласты, митохондрии Своб. пр-во, вакуоли, хлоропласты Вакуоль, своб. пр-во, ЭПР Вакуоль Вакуоль, своб. пр-во, хлоропласты
х'хзрины 11кгикоричные СЭС-ЮТЫ
ДРЕаНОГЕННЫЕ Т.ТИКОЗИДЫ ЭПР Вакуоль
Г.ПОКОЗИНОЛАТЫ ЭПР Вакуоль
1ГГАИНЫ Предположительно цитоплазма Вакуоль
Т^отипотептностъ
культивируемых клеток
в популяциях in vitro
ГЛАВА ВОСЬМАЯ
Морфогенез - последовательная цепь изменений формы в
онтогенезе. В морфогенезе реализуются наследственные
нормы реакции на внешние условия, и все это направле-
но на процветание индивидуума и сохранение вида.
Vochting (1906)
Развитие многоклеточных организмов животных и растений — одна
из сложнейших проблем биологии. У высших растений молекулярные и
клеточные функции связаны с организменным контролем и нормами ре
акций на внешние условия.
При изучении онтогенеза растений можно выбрать разные подходы.
1. Изучение развития растения, считая растение единой сложной,
саморегулирующейся системой.
2. Детальное изучение молекулярных, биохимических и физиологи-
ческих функций разных органов и тканей.
3. Моделирование процессов с помощью более простых систем, ко-
торыми являются органы, ткани, клетки и изолированные протопласты
in vitro.
Преимуществом последнего подхода является возможность для ис-
следователя самому выбирать и контролировать условия культивирова-
ния объектов in vitro, не изучая процессы в соответствии с последователь-
но осуществляемой «жизненной программой» растения. Наиболее важ-
ным при этом является возможность использования тотипотентности ра-
стительных клеток вне организма, позволяющая изучить, как клетка пе-
репрограммируется и превращается в растение. Синонимом тотипотент-
ности in vitro является термин «полипотентность» — и то и другое означа-
ет, что перепрограммирование клетки in vitro может проходить различ-
ными способами и вызывать дифференцировку в разных направлениях.
§ 1. ТИПЫ ДИФФЕРЕНЦИРОВКИ
Дифференцировка клеток растений in vitro может происходить раз-
личными путями и с различной степенью — от дифференцировки отдель-
ных клеток до развития целого растения.
♦ Наиболее простой вид дифференцировки — появление в каллусной
ткани дифференцированных клеток, имеющих специфичное морфологи-
ческое строение и несущих особые функции. Достаточно часто наблюда-
ется возникновение эпибластов — клеток, депонирующих запасные веще-
ства, а также вторичные метаболиты.
♦ Гистологическая дифференцировка каллусных клеток (гистоге-
нез) — образование в каллусе различных тканей. В каллусной ткани мо-
жет проходить образование млечников, волокон, трихом; сюда же можно
гтнести образование элементов сосудистой системы — трахеи и трахеиды
тсилемы, ситовидные трубки и клетки-спутницы флоэмы.
♦ Органогенез (монополярные структуры) — это дифференциация
гзллусных клеток в целые органы: превращение их в апексы стеблей или
горней, флоральные элементы.
♦ Соматический эмбриогенез (биполярные структуры) — образова-
ние в каллусной или суспензионной культуре эмбриоидов, т.е. зачатков
гнтактного растения, способных развиваться во взрослое растение.
Дифференциация тотипотентных клеток популяции in vitro зависит
~~ следующих факторов:
1. От вида растения и генотипа растения-донора.
2. От органа растения и характеристик клеток экспланта этого органа.
3. От условий культивирования: различных питательных сред, экзо-
генных гормональных факторов, стимуляторов.
4. От физических факторов культивирования: фотопериода, каче-
ства и интенсивности освещения, температурного режима, pH, аэрации.
§ 2. ГИСТОГЕНЕЗ
Важным объектом для изучения дифференциации каллусной клетки
езляются сосудистые элементы ксилемы (трахеи и трахеиды) и флоэмы
ситовидные трубки и клетки-спутницы). Превращение каллусной клетки
а - золистый элемент определяют прежде всего гормональные факторы,
1 основном ауксины. Исследователи из Франции (R. Wetmore at S. Soroki-
u. 1955) первыми применили меристемы апекса стебля для изучения
жё-ствия ауксинов на дифференциацию каллусной ткани. Напомним, что
икзхы стебля в интактном растении являются местом синтеза ауксинов.
Езс.тированные апексы прививали в вырез, сделанный в верхней части
«з-ттуса. Апексы не погибали, а в клетках каллуса, несколько ниже места
— 49 —
прививки, исследователи отмечали зону деления каллусных клеток, а еще
ниже — превращение клеток в сосудистые элементы. Тот же эффект был
получен при внесении в V-образный вырез на верхушке каллуса ауксина в
концентрации 10 мг/л вместе с 2,0% сахарозы. Эффективным для диф-
ференциации клеток каллуса был только ауксин в комбинации с сахарозой,
но не с другими сахарами. Добавление к ауксин}' 2,0% глюкозы вызывало
деление клеток, но не превращение их в сосудистые элементы. Те же авто-
ры установили, что высокая концентрация сахарозы (8%) с 10 мг/л аукси-
на приводит к дифференциации клеток во флоэмные элементы, а низкая
(2%) — в ксилемные элементы. Авторы этой работы считали, что необхо-
димо несколько митотических циклов каллусных клеток (образование
«внучатых клеток»); только после этого «внучатые клетки» дифференци-
руются как сосудистые элементы (рис. 10).
Рис. 10. Регуляция
гистогенеза в культуре
каллусных клеток:
а — образование ксилемы
при инъекции ауксина
и 2%-ной сахарозы;
б— образование флоэмы
при инъекции ауксина
и 8%-ной сахарозы;
в — отсутствие
дифференцировки
при инъекции ауксина
и 2%-ной глюкозы
Однако эксперименты с клетками мацерированного листа Zinia
elegans (Н. Hilderbrandt, A. Komamine, 1990) показали, что дифференци-
рованные клетки цинии, перенесенные в суспензию при добавлении аук-
сина и сахарозы на 60—70% без предыдущих делений переходят к растя-
жению клеток и их лигнификации. То же самое наблюдалось в работе с
клетками апекса томатов (К. Кацитадзе, Р. Бутенко, 1977). Листовые при-
мордии и центральная зона дедифференцировались и образовали деля-
щиеся каллусные клетки. Конус нарастания апекса также образовывал
каллусные клетки, но они не делились и сразу переходили к ксилемогене-
зу и дифференцировке трахеид.
Интересные результаты были получены при использовании метода
иммунофлуоресцентного окрашивания элементов цитоскелета клеток in
vitro в зоне морфогенного каллуса пшеницы (Е. Лобакова и др., 1997).
При использовании флуоресцентных антител к актину наблюдали окра-
шивание либо эмбриогенных масс, либо мест образования хлоропластов
в каллусных клетках, либо участков дифференциации трахей и трахеид.
-50-
(J. Schafer et al., 1985). В зоне, близкой к перициклу побега, каллусы пер*
выми дифференцировались как зачатки корней. В зоне коровой паренхи-
мы каллусы, через некоторое время после образования корней, диффе-
ренцировались как зачатки побегов. Значительно позже в субэпидермаль-
ной зоне возникали биполярные эмбриоиды. Возможно, что эпигенети-
ческое влияние экспланта на первичные каллусные клетки в момент экс-
перимента было еще велико, и такой эффект вряд ли можно было полу-
чить после нескольких субкультивирований каллуса.
Вегетативные побеги в культуре in vitro
Как и в других случаях in vitro, способность к органогенезу определяется
по-разному у растений разных семейств, видов, сортов. Принципиально важ-
ным является генотип данного растения, тип экспланта, а также то, является
ли растение однодольным или двудольным. В табл. 11 представлена способ
ность к органогенезу разных семейств начиная с наиболее «отзывчивых».
Таблица Е
Перечень семейств высших растений,
расположенных по степени снижения способности к органогенезу
Максимальная способность Минимальная способность 1 Пасленовые Крестоцветные Зонтичные Сложноцветные Бобовые (травы) Бобовые (зерновые) Злаки (травы) Злаки (зерновые)
Оптимальная питательная среда, физические факторы, баланс экзо-
генных и нативных гормонов, стимуляторы, а также присутствие сигналь-
ных белков и белков-акцепторов — условия, обязательные для получения
клеток, способных к морфогенезу.
Первым исследователем условий органогенеза был известный уче
ный Фольке Скуг (работы, выполненные совместно со своими сотрудни-
ками С. Миллером и Т. Мурашиге в 1944—1957 гг.). Объектом исследова
ния была паренхима стебля табака в его средней части, используемой в
качестве источника эксплантов для получения первичного, а потом суб
культивируемого каллуса. Питательная среда была разработана Т. Мура
шиге и Ф. Скугом (1962) и стала одной из оптимальных не только для
морфогенеза, но и в целом для культур клеток растений (см. табл. 2).
Работая с экзогенными гормональными факторами, Скуг и Миллер
изучили сначала влияние ауксина, а затем ими был получен новый стиму
лятор роста растений, названный кинетином,— б-фурфуриламинопурин
Экспериментируя с экзогенными ауксином и кинетином, ученые пришли
— 52 —
х выводу, что примерно равные концентрации их в среде вызывают
язллусогенез у паренхимного экспланта. При этом наблюдались быстрая
лоолиферация клеток и значительное (в 31 раз) увеличение массы каллуса.
Преобладание содержания ауксина над кинетином приводило к по-
явлению зачатков корней и развитию корневой системы на поверхности
ягаризованной среды.
Увеличение дозы кинетина или уменьшение концентрации ауксина при-
водило к дифференциации клеток в зачатки побегов и растения-регенеранты.
Скуг и Миллер доказали, что морфогенез присущ не только первич-
ному каллусу. Оказалось, что после нескольких субкультивирований у та-
'ака также можно вызвать органогенез при той же схеме концентрации
г/ксина и кинетина (ауксина больше, чем кинетина). Результаты экспери-
мента Скуга и Миллера представлены на рис. 4 гл. 4.
Процесс морфогенеза in vitro зависит от многих факторов.
Использование экзогенных гормональных препаратов является сей-
час одним из основных подходов для получения растений-регенерантов
vitro. При этом диапазон варьирования концентрации ауксинов и их
аналогов, цитокининов, абсцизовой и гибберелловой кислот, этилена, а
также ингибиторов их синтеза достаточно широк.
Из трофических факторов для морфогенеза важны азотсодержащие
минеральные соли. Присутствие NII^ в питательной среде важно для на-
чала морфогенеза, тогда как NOj или смесь аммонийного и нитратного
азота необходимы для роста и развития возникших морфогенных струк-
тф (Р. Бутенко, А. Кучко, 1979).
Аминокислоты, особенно тирозин, часто добавляют в среду для мор-
фогенеза, что нередко способствует дифференцировке (F. Skoog, 1954;
Н Моисеева и др., 1979).
Особо следует выделить влияние стрессовых факторов на морфоге-
нез. В лаборатории автора еще тридцать лет назад было показано на кал-
г сах моркови, что добавление к питательной среде 0,5% NaCl увеличи-
зает морфогенез и регенерацию в каллусных тканях in vitro. Эти данные
'ыли подтверждены на каллусах пшеницы при внесении в среду 1,5%
\зС1 или 3% маннита (Р. Бутенко и др., 1967; R. Butenko et al., 1988). Ак-
тивно стимулируют морфогенез и низкие положительные температуры.
Это показано, в частности, на культуре клеток риса (Л. Кучеренко, 1984).
Стимуляцию процесса морфогенеза с помощью стрессовых факторов
*:<жно объяснить, сославшись на математическую теорию катастроф и би-
ст-тжаций на их основе (Т. Постон, Ф. Стюарт, 1980). Эти авторы предпола-
Тхзэт, что в условиях стресса клетки выходят за норму реакции данной про-
тзаммы дифференцировки и могут переходить на одну из других программ,
имеющихся в клетках растений, в том числе на программу морфогенеза.
— 53 —
Увеличение знаний о структуре геномов высших растений, клониро-
вание важных генов и использование приемов клеточной и генной инже-
нерии являются в настоящее время методами, помогающими понять ре-
гуляцию процессов, связанных с морфогенезом. Используя системы in
vitro, можно эмпирически реализовать тотипотентность клетки высшего
растения индукцией в каллусных тканях или культивируемых клетках
цепи событий, связанных с образованием меристематических очагов,
развитием на их основе зачатков стеблевых апексов, появлением побе-
гов, которые развиваются в целое растение.
Чрезвычайно важным представляется исследование сигналов и меха-
низмов, запускающих процесс морфогенеза у недифференцированных
клеток in vitro.
Цитологическое, физиологическое и биохимическое изучение стебле-
вого органогенеза у табака сорта <Висконсин> было проведено в Отделе
биологии клетки и биотехнологии Н. Моисеевой, показавшей, что детер-
минация каллусных клеток, реализующаяся затем в появлении апексов
стебля, составляет 9 дней. За это время в каллусной ткани, не изменившей-
ся на анатомическом уровне, достигает максимума содержание белка-анти-
гена, специфичного только для стеблевой меристемы растений табака сор-
та <Висконсин-38>. Позже появляется белок-антиген, свойственный как
апексам стебля, так и листовой ткани. Однако тканеспецифичные белки
появляются в этих опытах не сразу после переноса клеток на среду с ин-
дукторами, так что вопрос о ранних событиях на клеточном уровне оста-
ется пока открытым. Вместе с тем можно считать, что при стеблевом орга-
ногенезе гены тканеспецифичных белков активируются последовательно и
являются каузальными для появления морфологических изменений.
При изучении морфогенеза in vitro очень важным является правиль-
ный выбор объекта. В изложенном
примере объект этих эксперимен-
тов— табак сорта <Висконсин-38> —
существенно облегчил возможность
работать с белками-антигенами.
Дело в том, что разные виды и сор-
та табака образуют меристемные
очаги в разных зонах каллусной тка-
ни, причем асинхронно, тогда как
табак сорта <Висконсин-38> образует
меристемные очаги и апексы побе-
гов только в нижней части каллуса
(рис. 11). Верхушка каллуса не обра-
зует при этом ни апексов, ни регене-
Рис. 11. Особенности морфогенного
каллуса табака сорта <Висконсин-38>
гшнтов. Этот факт послужил основой еще одного важного наблюдения:
на девятый день культивирования перевернуть каллус «с ног на го-
э:зт.. то на верхушке каллуса клетки детерминируются и эта детермина-
IZ2 реализуется в появлении апексов стебля и побегов (рис. 12).
1 кань
Реализация программы стеблевого морфогенеза
Конечный
морфогене-
тический
эффект
на 28-й день
Р»с. 12. Особенности индукции стеблевого морфогенеза у табака сорта <Вискон-
гяв-38>. Вертикальными стрелками отмечены моменты переворачивания каллуса
Пока не выяснено, почему белок-антиген, увеличившись до максиму-
жа рис. 13), затем уменьшался до минимума по мере развития регенеран-
—з. Можно предположить, что этот белок участвует в цикле деления
"ттлъко на определенной фазе митотического цикла, затем сменяется дру-
гззс! белками.
Органогенез побегов на биохимическом и молекулярном уровнях
зс^чзть достаточно трудно, и, как правило, большинство исследователей
леоешло к более удобному объекту для изучения — соматическому эмбрио-
л^эезу. Но перед тем как перейти к биполярному (аксиальному) эмбрио-
тс^езу. познакомимся с особенностями флорального морфогенеза.
Флоральные побеги в культуре in vitro
В отличие от органогенеза вегетативного побега, который после об-
згээвания корней растет обычным для данного растения способом и в
гзое время переходит в репродуктивную фазу, флоральные побеги in vitro
-55-
Содержание
антигена III
отн. ед.
Содержание
РБФК
отн. ед.
2950
Рис. 13. Относительное
содержание антигена III
и РБФК в каллусной ткани
при индукции в ней стебле-
вого морфогенеза:
..... содержание антигена
III в апикальной части
каллуса;
—•— содержание антигена
III в базальной части каллуса:
содержание РБФК
в апикальной части каллуса;
—— содержание РБФК
в базальной части каллуса
могут возникнуть путем дифференциации каллусных клеток в зачатки
репродуктивных органов. Иногда у корней можно было обнаружить
очень небольшой по длине вегетативный побег с одним или двумя лис-}
точками, и практически сразу на нем образовывались бутон и цветок.
Это явление было открыто исследователями из Франции проф.
П. Шуардом и его сотрудницей Н. Прат. В Институте физиологии расте-
ний в лаборатории академика М. Чайлахяна его сотрудники изучили это
явление гораздо лучше. Они установили, что экспланты табака только
верхних междоузлий образуют первичный каллус, способный дать нача-
ло флоральному органогенезу. Каллусы, полученные из эксплантов верх-
них междоузлий, сохраняют способность образовать флоральный побег
даже после трех субкультивирований. Каллусы на основе экспланта из
нижних мезждоузлий образуют только вегетативные апексы.
В разных лабораториях эти результаты проверяли на растениях раз-
ных видов, таких, как цикорий Cichorium intybus, свинчатка Plumbago indica.
дурман Datura innoxia. В этих случаях первичный каллус эпигенетически!
мог сохранять способность к флоральному' побегообразованию даже пос-1
ле нескольких субкультивирований.
На кафедре физиологии растений МГУ В. Чуб (В. Чуб, 1994) провел
большую работу с генеративными органами разных видов крокусов. Сре-
ди крокусов кроме шафрана посевного (Crocus sa.ti.vus L.) он выявил еще
несколько видов, для которых был возможен специфичный органогенез
-56-
vitro — образование рыльцеобразных структур шафрана. Рыльца шафра-
на являются источником ценных веществ для пищевой и парфюмерной
лоомышленности. Об этом будет разговор далее, в главе, повествующей
I биотехнологии и биоинженерии клеток — продуцентов ценных метабо-
литов. В этой же главе уместно рассмотреть закономерности получения
первичного, а иногда и длительно субкультивируемого каллуса из различ-
ных эксплантов, способного к дедифференциации генеративных орга-
не в. Возникновение на эксплантах первичных каллусов зависело как от
сезона, так и от вида крокусов. В. Чуб из большой коллекции крокусов
становился на двух весеннецветущих (Crocus angustifolius и С. chrysanthus)
z энном осеннсцветущем (С. speciosus') видах. У отобранных видов в каче-
стве эксплантов исследовали разные генеративные органы, а также ткани
листа и клубнелуковицы. Наибольшую способность к каллусогенезу и мор-
ге генезу проявили экспланты завязи. Образование рыльцеобразных струк-
~т отмечалось для всех используемых весеннецветущих и осеннецветущих
зи.сов. В аналогичных условиях субкультивирования можно было наблю-
ы.ть и образование каллуса. В некоторых случаях у С. angustifolius наблюда-
ли образования новых рыльцеобразных структур из субкультивируемых
Егтлусов. Возможно, что при создании подходящей технологии можно
шпечать рыльца шафрана при культивировании in vitro.
В последнее время установлено, что при дифференциации флораль-
тых почек in vitro активируются 5 различных генов. Ген FB-7 похож на
табачные тауматинподобные гены. Был выделен также ген FB-702. Мето-
пе м иммуноблотинга белков исследовали поверхностные слои ткани
лы слоя клеток под эпидермой), которые образуют флоральные и веге-
тттизные почки и корни. Установили, что активность гена FB-702 способ-
~ет образованию цветочных почек, но не переходу к цветению in vivo.
Наблюдали также флоральные зачатки, связанные с ксилемогенезом и об-
за-эсзанием трахеид (L. Richard, К. Tran-Tan-van, 1990).
§ 4. СОМАТИЧЕСКИЙ ЭМБРИОГЕНЕЗ
Соматический эмбриогенез с точки зрения биотехнологии имеет
в: го преимуществ перед органогенезом. Регенерант на основе сомати-
ческого зародыша полностью сформирован, тогда как побеги, получен-
звые в результате органогенеза, надо укоренять, а лишний труд неэконо-
вчен для биотехнологии.
Незаменим соматический эмбриогенез и для фундаментальных ис-
лзелований. Фундаментальные проблемы, связанные с морфогенезом,
жгче изучать в суспензиях, с которыми чаще всего связано культивиро-
жеие соматических эмбриоидов. Изучение проэмбриогенных клеток и
-57-
развития зародышевых структур дает исследователю много информации
о сигналах и белках-акцепторах, экзогенных стимуляторах и нативных эн-
догенных гормонах, участвующих в морфогенезе.
При эмбриогенезе соматические клетки высших растений должны
пройти перепрограммирование и превратиться в клетки, детерминиро-
ванные к образованию биполярных органов. Перепрограммирование —
изначально возникший в процессе эволюции цветковых растений про-
цесс, в котором под влиянием ряда сигналов детерминированные клетки
превращаются в способные к развитию эмбриональные структуры. Все
эти структуры возникают de novo из отдельной или нескольких клеток, а
не из существующих in situ инициал ей.
Экспериментально созданная система — популяция свободно культи-
вируемых клеток высших растений — многообразна. Определенные клет-
ки в этой системе могут сохранять способность к дифференциации по
типу соматического эмбриогенеза. Процент таких клеток в популяции за-
висит от вида, индивидуума, генотипа и клеток экспланта, образующих
первичный каллус. Сохранение проэмбриогенных клеток при субкульти-
вировании также зависит от разных характеристик популяции, трофиче-
ских и гормональных факторов.
Примечательно, что соматические эмбриоиды, в отличие от органо-
генеза побегов, более точно воспроизводят генотип исходного растения.
Обратимся к концепции первых авторов, пытавшихся объяснить
дифференциацию каллусной клетки в эмбриональную структуру. К. Ге-
бель (1902) и Г. Хабсрландт (1922) считали, что изолирование клетки от
организма и отсутствие связи между каллусными клетками заставляет не-
которые из этих клеток вести себя аналогично зиготе. Одним из корифе-
ев, изучавших биологию клеток in vitro, был профессор Ф. Стюард. Полу-
ченные им экспериментальные результаты (F. Steward et al., 1958) приве-
ли к гипотезе об образовании эмбриоидов в суспензии клеток моркови
при внесении в питательную среду жидкого эндосперма кокосового оре-
ха. Сотрудники Ф. Стюарда попытались выделить из эндосперма соеди-
нения, стимулирующие эмбриогенез in vitro. Они расфракционировали
эндосперм кокосового ореха (для чего было использовано 20 000 л коко-
сового молока) и добавляли к суспензии полученные фракции эндо-
сперма. Ни одна из используемых фракций не привела к стимуляции эм-
бриогенеза. Когда же все полученные фракции объединили и добавили к
питательной среде, стимуляция эмбриогенеза была восстановлена.
Не только эндоспермы разных растений, но и весенняя пасока бере-
зы, добавленная к суспензии клеток моркови, также стимулировала эм-
бриогенез (Р. Бутенко, 1956).
-58-
14. Эмбриогенез в культуре
ждеток моркови, высеянных
яа аг ар изованну ю питательную
гз»гду (Бутенко, 1959)
В работах с клетками
«:окови Дж. Рейнертом
1?5S) было доказано, что и
52. полностью синтетической
~-zze соматический эмбрио-
'тнез проходит нормально
т~ и условии внесения в пита-
-птьную среду суспензии экзо-
'гнной 2,4-дихлорфенокси-
т.- сной кислоты (2,4-Д). Од-
кнс' затем клетки обязательно надо было
перенести на среду без 2,4-Д или со значи-
пёньно сниженной ее концентрацией.
В отличие от Рейнерта в экспери-
ментах автора (Р. Бутенко, 1959) однноч-
клетки из суспензии с 2,4-Д переио-
птт?: в чашки Петри на агаризованную
~еп. (0,6% агара) или на фильтр. Затем
ьтз_тючали из среды культивирования
— —Д и добавляли 0,005 мг/л ауксина
ИУК-. 2 мг/л аденина и 400 мг/л гидро-
дсзата казеина. Через 30—40 дней в тем-
звсте из единичных клеток формирова-
жса зародыши моркови (см. рис. 14, 15).
йас. 15. Радиоавтография клеток
ж»и.5-мбриоидных и эмбриоидных структур,
ifw кающихся в культуре клеток моркови:
s — лечение синтеза РНК, обнаруживаемого
не Ы-Т-очению меченого Н3-уридина;
S— ;х;е для синтеза белка, обнаруживаемое
w 1з_т?эчению меченого Н3-лизина
— 59 —
К настоящему времени разработаны различные способы получения
соматических эмбриоидов. Уже имеются технологии получения сомати-
ческих зародышей для многих видов и сортов растений, которые могут
быть использованы для создания искусственных семян.
Возвращаясь к главной фундаментальной задаче — тотипотентности кле-
ток высших растений, обратимся к первичным процессам в проэмбриоген-
ных клетках, а также к изменениям в клетках эксплантов, дедифференци-
рующихся в клетки первичных каллусов. Несомненно, что этот первый этап
наиболее важен для соматического эмбриогенеза, он нехарактерен для зиго-
ты, развивающейся в зародышевом мешке. В то же время дальнейшие процес-
сы зиготического и соматического эмбриогенеза имеют много общего. Гло-
булярный эмбриоид, а также стадии «сердца», «Торпедо» и сформированного
зародыша морфологически практически одинаковы in vivo и in vitro.
В отличие от зиготического эмбриогенеза соматический эмбриоге-
нез можно разделить на две части:
1) начальную клеточную фазу, которая менее других изучена и наи-
более важна;
2) переход к эмбриогенезу или развитию зародыша in vitro начиная
от фазы глобулы, через фазы «сердца» и «Торпедо» к фазам сформиро-
ванного зародыша и регенеранта. При этом также есть некоторые воз-
можности регулировать развитие соматического зародыша, используя ме-
ханизмы тканевого, органного и организменного контроля.
Исследователи соматического эмбриогенеза в 1958—1969 гг. сосредото-
чились на моркови. Была даже выпущена книга, посвященная соматическому
эмбриогенезу у моркови. Авторы в шутку предложили ввести в биологию
клеток и биотехнологию новое название «морковеология» и тех исследовате-
лей, которые работали в основном с морковью, назвали «морковеологами».
На рис. 16 изображена схема морфогенеза in vitro на примере обра-
зования биполярных структур — соматических зародышей, возникающих
потеря детерминации
Рис. 16. Схема цитодифференциации у моркови in vitro
-60-
зе клеток моркови. Исходные («компетентные») клетки отличаются от
дд-тих клеток размером, формой, плотностью цитоплазмы. В процессе
деления компетентных клеток образуются проэмбриогенные массы
ПЭМ) (стадия 1). Эти клетки детерминируются к развитию структур, что
гзязано с переносом клеток на среду без 2,4-Д. Из клеток ПЭМ образуют-
zi глобулярные зародыши с хорошо выраженной протодермой (стадия
i Далее соматические зародыши развиваются по схеме зиготического
задюдыша моркови (сердцевидный эмбриоид — торпедовидный эмбрио-
— зародыш — проросток).
Использование ингибиторов развития зародышей и индуцированно-
го мутагенеза позволяет определить наиболее чувствительные состояния
деоехода от одной стадии эмбриогенеза к другой.
Эмбриогенез in vitro широко используется для изучения экспрессии
генов и выявления белков-маркеров эмбриогенеза (Z. Sung и R. Okimoto,
П90).
Принципиально важным моментом в изучении процесса эмбриогене-
за in vitro является изучение самых ранних его этапов, когда некоторые
5_тетки в суспензии вдруг приобретают способность развиваться в эмбри-
: ид. Здесь важно выяснить не только сигналы и индукторы этого процес-
но и механизмы, заставляющие дедифференцированную клетку (клет-
:сл ) in vitro переключаться на другой путь развития.
В Отделе биологии клетки и биотехнологии ПФР РАН много работ
'ыло посвящено именно этим проблемам.
Пожалуй, наиболее ранняя фаза детерминации клетки на эмбриогенный
гг-ть развития — приобретение ею свойств полярности или аксилярности.
Хорошо известно, что активный базипетальный транспорт ПУК яв-
ляется отражением (возможно, и причиной) полярности каждой индиви-
дуальной клетки. Одиако в суспензии вектор полярности каждой клетки
имеет произвольное значение (направлен в неопределенную сторону).
3 то же время установлено, что проэмбриогенные массы клеток находят-
:я в зоне электрического поля со специфическим рисунком силовых ли-
ний. С помощью сверхчувствительного виброзонда (Browley et al., 1984)
определили плотность БЭП (биоэлектрического потенциала) для группы
из четырех морфогенных клеток (после двух делений). Максимум плот-
ности электрического тока был на полярных полюсах (на «входе» и на
выходе» — базальном конце) этой группы клеток. При переходе клеток
з глобулярную фазу эмбриогенеза рисунок поля не менялся, но плотность
тока значительно увеличивалась и на «входе», и на «выходе».
Можно считать, что аксилярность морфогенных клеток и «физиоло-
гическая ось полярности» в проэмбриогенных массах поддерживается
различными механизмами, в которые входят:
-61-
1) активный базипетальный транспорт эндогенного ауксина;
2) градиент биоэлектрических потенциалов;
3) градиенты ионов кальция.
Поляризация присуща всем фазам эмбриогенеза.
Важное значение для детерминации морфогенных клеток имеет пе-
рестройка их цитоскелета. Элементы цитоскелета — микротрубочки (ту-
булин) и актиновые филаменты обязательны для деления клеток, в том
числе морфогенных. По имеющимся данным, перестройка актиновых
филаментов способствует возникновению новой оси полярности морфо-
генной клетки.
В частности, с применением метода иммунофлуоресцентного окра-
шивания актина под электронным микроскопом наблюдали особенности
морфогенных клеток в составе проэмбриогенных масс (Е. Лобакова и
др., 1997). На рис. 17 видны центры перестройки цитоскелета и филамен-
ты, идущие от центров, объединяющие морфогенные клетки. Примеча-
тельно, что хлоропласты вакуолизированных клеток, расположенные по
периферии клетки, также связываются с филаментным актином.
Из каллусных тканей пшеницы была выделена фракция термоста-
бильных Са-кальмодулинзависимых актинсвязывающих белков — изоме-
ров тропомиозина и кальдесмона (М. Туркина и др., 1995). При этом ус-
тановлено повышенное содержание этих белков в клетках проэмбриоген-
ных фракций.
Ключевым белком клеточного митотического цикла является проте-
инкиназа Р34, кодируемая геном cdc2. Она универсальна для индукции де-
лений клеток растений, в том числе и для морфогенных клеток пшени-
цы in vitro. В интерфазе активность протеинкиназы Р”^2 подавлена бел-
Рис. 17. Различные
формы актина в морфо-
генных каллусах пшени-
цы (имуннофлуоресцент-
ное окрашивание):
I — фрагмент бесцветно-
го морфогенного каллуса.
Диффузное распределе-
ние полимеризованного
актина в клеточной массе:
2 — фрагмент зелене-
ющего каллуса;
3 — фрагмент бесцветно-
го каллуса с трахеиподоб-
ной клеткой;
4 — фрагмент бесцветно-
го морфогенного каллуса
с активным центром
I >1 R И и И r Г а Ж И К- .. Г f |
-62-
гэвыми ингибиторами. Активирует протеинкиназу ген cdc25. Клеточное
деление включается путем фосфорилирования протеинкиназой Р ряда
телков (Arellano М., Moreno S. et al., 1997). Протеинкиназа одновре-
менно образует комплекс с продуктом гена cdclS, который осуществляет
реорганизацию цитоскелета (образование микротрубочек веретена),
взаимодействие Р34 с белком гена Sus приводит к ингибированию фосфо-
тглирования и окончанию деления. Клетки переходят к состоянию но-
гтя R, или R2, что сопровождается перестройкой цитоскелета.
В проэмбриогенных массах в каллусных тканях часто наблюдается
тнгибирование фосфорилирования и окончания деления. Клетки перехо-
дит в состояние покоя, что сопровождается перестройкой цитоскелета,
вероятно, детерминация разных групп клеток, переходящих к эмбриоге-
нез. может зависеть как от активности протеинкиназы Р и связанного
: лей актиномиозинового комплекса, так и от питательной среды, несу-
леи стимуляторы и ингибиторы, которых нет при половом эмбриогенезе.
До сих пор мало изучен процесс перехода от морфогенных клеток к
эмбриогенезу. В работе М. Toonen et al. (1996) получены важные результа-
тд о связи определенных отдельных клеток с эмбриогенезом. В популяции
гдш точных клеток моркови в суспензии на 10 000 клеток приходилось от
56 до 105 соматических эмбриоидов. Одиночные клетки были разделены
агторами на группы по морфологическим признакам. Наибольшее число
эмбриоидов было в группе клеток нерегулярной формы, затем шла группа
овальных вакуолизированных клеток, меньше всего эмбриоидов было в
д'дпе сферических мелких вакуолизированных клеток (табл. 12).
Таблица 12
Развитие соматических эмбриоидов моркови из различных групп клеток
через симметричные, асимметричные и аберрантные клеточные кластеры
(M.A.J. Toonen et aL, 1996)
Группа Число эмбриоидов Симметрич- ное развитие Асимметрич- ное развитие Аберрантное развитие
<иенькие сферические автолизированные клетки 8 7 0 1
•аленькие сферические, шглтые цитоплазмой клетки 12 12 0 0
’fc~-ые вакуолизированные 38 1 32 15
Зх»:л?лговатые вакуолизи- зив^лные клетки 9 0 4 5
Ждс-злт неправильной формы 60 11 13 36
We:г : клеточные агрегаты 28 4 5 19
ЗЬхг j 155 35 44 76
-63-
Как уже было сказано, процесс соматического эмбриогенеза части
изучают на модельных объектах — прежде всего на моркови. Изучение
процессов соматического эмбриогенеза на молекулярном и клеточном
уровнях также нуждается в более простых объектах с меньшим числом
хромосом в геноме, с коротким циклом размножения. К таким объектам
относятся арабидопсис, капселла, крепис и др. Их использование значи
тельно облегчает проведение фундаментальных исследований. Однако
помимо модельных объектов фундаментальные исследования необходима
проводить и на ценных сельскохозяйственных культурах, например зер
новых злаках. Это диктуется тем, что только при условии учета специфи
ки объекта можно получить практически значимые результаты.
При исследовании эмбриогенных и неэмбриогенных линий мягки!
пшениц б разных сортов были обнаружены впечатляющие различия.
Было установлено, что в тех случаях, когда соматические эмбрион!
ды развивались, число их в первичном каллусе практически полностью
зависело от характеристики экспланта. При этом использование в каче-
стве экспланта незрелого зародыша было более эффективно, чем сфор-
мировавшегося зародыша. Щиток (васкуляризированный орган) и эпи-
бласт незрелого зародыша в возрасте 14—15 дней в качестве эксплантов,,
содержащих клетки, способные превратиться в проэмбриогенную массу,
превосходили другие ткани незрелого зародыша. При индукции каллуса
рекомендуется обращать щиток вниз — к поверхности среды.
Особенности соматического эмбриогенеза яровой мягкой пшеницн
3%
(Tr. aestivum) разных генотипов (сорт <Таежная> и линия <Фотос>)
(Л. Копертех, Р. Бутенко, 1995), а также разных линий кукурузы (Ю. До4
гих) были изучены в лаборатории автора. В качестве эксплантов для по
лучения первичного каллуса (табл. 13) были выбраны незрелые зароди
ши пшеницы (14—15 дней после цветения), а именно: щиток и эпибласт
те части незрелого зародыша, которые являются лучшими эксплантами!
Таблица 1J
Характеристика первичного каллуса двух разных генотипов пшеницы
на стандартной среде (MS; 2 мг/л 2,4-Д; 10 мг/л AgNo3) i
Ж
.'ЗИ
ж
я
я
ж
к
д
Jwi
ПМЯ
3
я
з
«
IK
Генотип Побеги из незрелых зародышей, % Морфогенные каллусы, % 4 Число регенерирова ших эксплантов, 1
<Фотос> 40 + 3 25 + 1 28 + 1
<Таежная> 23 ± 3 45 ± 3 62 + 6
Незрелые зародыши и каллусные ткани культивировали под ламп я
ми белого света (интенсивность освещения 3000 лк, длина дня 16 ч). Gi я
дует сказать, что при использовании в качестве эксплантов незрелых з я
родышей наблюдалось развитие их собственных побегов. Было необя я
Tzrvo удалять их 2—3 раза, так как в присутствии побегов каллус растет
л-^чительно хуже. В результате оптимизации каллусогенеза было установ-
лено. что добавление к среде ацетона (1,5% к объему) увеличивало число
г<:плантов, не образующих побегов, как у сорта <Таежная>, так и у ли-
<Фотос>. В отсутствие побегов увеличились интенсивность первич-
ного каллусообразования и как следствие — общее число морфогенных
£аллусов (табл. 14). При этом механизм действия ацетона не выяснен.
Таблица 14
Эффект действия ацетона на культивируемые ткани пшеницы
, енэтип Контроль 1,5% ацетона
1 2 3 1 2 3
43,1 ± 4,2 24,2 + 2,1 28,4 ± 0,5 27,6 + 2,8 42,3 ± 2,8 18,9+1,3
?2г;кная> 36,7 + 5,1 37,5 ± 0,8 62,2 + 6,4 21,6 ± 2,0 46,6 + 2,3 30,9 + 2,4
Примечание. 1 — побеги из незрелых зародышей, %;
2 — морфогеииые каллусы, %;
3 — число регенерировавших эксплантов, %.
Для длительного субкультивирования каллусной ткани в питатель-
гг-зо среду необходимо внести 2 мг/л 2,4-Д и 10 мг/л AgNO3, но для полу-
чения проэмбриогенных клеток 2,4-Д снижали до 0,2 мг/л.
Использование первичных каллусов, несущих проэмбриогенные
злетки, очень важно для исследования индукции соматического эмбрио-
генеза у пшеницы.
Установлено, что принципиально важным для индукции эмбриогенеза
: называется эндогенное содержание фитогормонов. При этом внесение эк-
i< генных регуляторов роста может по-разному влиять на это содержание.
В наших экспериментах с пшеницей иммунохимическим методом
тз'.'чали эндогенное содержание ауксина, зеатин-рибозида, абсцизовой
1ПСЛОТЫ в незрелых зародышах и морфогенных каллусах пшеницы. Из
~бл. 14 следует, что незрелые зародыши разных генотипов содержат
газные количества эндогенных гормонов и это существенно влияет на
«чофогенную способность эксплантов. В частности, существенным ока-
зывается содержание ИУК и АБК (табл. 15). Установлено, что исключе-
se из питательной среды экзогенного 2,4-Д (или снижение его концент-
гагши) в процессе субкультивирования часто приводит к значительному
изменению синтеза эндогенных гормонов. Показано, что после переноса
хлеток ПЭМ на среду с низким содержанием (0,2 мг/л) 2,4-Д через пять
х=ей субкультивирования происходит значительное увеличение содержания
ггхсина по сравнению с его количеством в присутствии экзогенной 2,4-Д в
зысокой (2 мг/л) концентрации (контроль — незрелые зародыши пшепи-
лы . При этом содержание эндогенного ауксина повысилось в 7,5 раза
-65-
(рис. 18), тогда как содержание эндогенных цитокининов и абсцизовой
кислоты почти не изменилось (рис. 19, 20).
Таблица 15
Содержание нативных фитогормонов
в первичных эксплантах (незрелые зародыши)
и морфогенном каллусе разных генотипов пшеницы (3-е субкультивирование)
Содержание фитогормона, нг/г сухой массы Повторность Незрелый зародыш Морфогенный каллус
<Фотос> <Таежная> <Фотос> <Таежная>
И ПЛ 1 103 + 1 45 ± 1 399 ± 1 263 ± 6
2 100 + 1 44 + 1 357 + 4 253 + 5
3-Р 1 532 + 6 301 + 3 499 ± 4 663 ± 3
2 447 ± 3 298 ± 4 424 + 3 623 + 3
ИУК 1 58 + 1 88 + 2 211 + 1 208 + 2
2 56 ± 2 82 ± 1 214 ± 1 203 + 1
АБК 1 840 + 5 3352 + 6 861 + 1 1390 + 3
2 781 + 4 3301 ± 4 805 ± 1 1334 ± 2
На 16-й день, когда прошел цикл эмбриогенеза, появились зароды-1 j
ши и регенеранты пшеницы, количество эндогенного ауксина уменьши-! а
лось до его количества в незрелых зародышах, тогда как содержание ци- ’
токининов несколько увеличилось по сравнению с контролем. Количе- t
ство эндогенной абсцизовой кислоты, обусловленное развитием сомати- =
ческих зародышей, также увеличилось.
При перенесении первичного каллуса на среду для соматического
эмбриогенеза у пшеницы сорта <Таежная> было получено больше реге-
нерантов из зародышей, чем у линии <Фотос>.
Значительно различались эти два генотипа и по сохранению морфо-
генного потенциала при длительном субкультивировании. Морфогенез v
сорта <Таежная> можно было получить только в течение 4 месяцев с мо-
мента введения в культуру in vitro, тогда как морфогенез у линии <Фотос> ’
продолжался в течение двух лет. ’
Из изложенных результатов становится очевидным, что популяции , ,
каллусных клеток этих двух генотипов значительно различаются. Клетки |
сорта <Таежная> свой морфогенный запас тратят быстро, тогда как у ли-| *
нии <Фотос> высокие концентрации эндогенных цитокининов (ЦК), воз-
можно, длительно поддерживают «запас» морфогенных клеток.
До сих пор соматический эмбриогенез мы рассматривали с точки
зрения тотипотентности каллусной клетки и превращения ее в проэмб-
риогенную массу клеток или, реже, — в суспензию с одиночными морфо-
генными клетками.
— 66 —
Рис. 18. Изменение содер-
жания эндогенной ИУК
в морфогенной каллусной
ткани пшеницы в зависи-
мости от концентрации
экзогенной 2,4-Д
1600
о
ш 1400
о
S 1200
О
1000
X
* 800
S
ф 600
s
х
g 400
ф"
СЕ 200
о
О
0
6 16 6 16 сутки
Рис. 19. Изменение содер-
жания эндогенных ЦК
в морфогенной каллусной
ткани пшеницы в зависи-
мости от концентрации
экзогенной 2,4-Д
Рис. 20. Изменение содер-
жания эндогенной АБК
в морфогенной каллусной
ткани пшеницы в зависи-
мости от концентрации
экзогенной 2,4-Д
I — линия <Фотос>;
II — сорт <Таежная>;
-I — контроль, на среде с 2 мг/л 2,4-Д;
? — опыт, на среде с 0,2 мг/л 2,4-Д
-67-
Вместе с тем первичная «клеточная» фаза существенно влияет на
дальнейший процесс эмбриогенеза, что хорошо иллюстрируют данные,
представленные в табл. 12.
Получение большого числа эмбриоидов требует применения специ-
альных воздействий, главным образом стимулирующих. В результате со-
матического эмбриогенеза необходимо получить зародыши, которые при
развитии дают начало нормальным растениям-регенерантам (если целью
не является получение сомаклональных вариантов и мутантов).
Приведем некоторые факторы, влияющие на эмбриогенез, регенера-
цию и онтогенез полученных растений.
Прежде всего велика роль эндогенных и экзогенных гормонов, о ко-
торой уже было сказано выше. Стоит добавить, что большую роль играют
не только сами фитогормоны, но и их рецепторы. Известно, что в мем-
бранах клеток есть специфические места, связывающие ПУК (здесь же мо-
гут быть связаны и ингибиторы ИУК — ТИБК, морфактин, апигенан и др.).
Очень значительна роль светового комплекса и сигнальных белков.
Регуляция активности генов может определять непосредственное взаимо-
действие фитохрома с ДНК, изменяющее транскрипцию. Известно, что
свет увеличивает трансляцию РНК. Мембраносвязанная форма фитохро-
ма может выполнять пермеазную функцию, осуществляя аксиальные гор-
мональные градиенты ауксина. Таким образом, не исключена роль фито-
хрома как медиатора в процессе фотоморфогенеза (Д. Эванс и М. Смит).
Вероятно, велика роль качества света в регуляции морфогенеза. Изу-
чая влияние спектрального состава света на рост и морфогенез у несколь-
ких сортов мягких пшениц, Л. Коппель (1992) в лаборатории автора по-
казала, что незрелые зародыши, изолированные из растений, выращен-
ных на синем свету, образуют морфогенный каллус значительно чаще,
чем зародыши, взятые от растений, росших на белом или красном свету.
В других эспериментах импульсное облучение изолированных зародышей
на 1-й и 8-й дни после помещения их на питательную среду светом разно-
го качества влияло на интенсивность роста и способность к морфогенезе
у формирующегося каллуса (табл. 16). У сорта <Саратовская-29> процент
морфогенеза был самым высоким на синем свету. У сорта <Целинная-
Юбилейная> при облучении в первый день культивирования морфоген-
ный каллус был получен только на синем свету, а при облучении на 8-й
день культивирования частота морфогенеза была выше у каллуса, полу-
ченного на красном свету.
-68-
Таблица 16
Влияние спектрального состава света на рост и морфогенез пшениц
(импульсное облучение)
Сорт День облучения Красный свет Красный свет + дальний красный Синий свет
'Г-ратовская-29> 1-й Рост 2—3 16,4% морф. Рост 2—3 10,2% морф. Рост 2—3 24,1% морф.
8-й Рост 2—3 10,5% морф. Рост 2 12,2% морф. Рост 2-3 20% морф.
Целинная- 1-й Рост 2 Рост 0-1 Рост 2-3
»:;:лейная> 0% морф. 0% морф. 11,4% морф.
8-й Рост 3—5 20% морф. Рост 2 0% морф. Рост 2 8% морф.
Проведенные эксперименты пока не могут ответить на многие воп-
росы: действуют ли спектральный состав света и его рецепторы (фито-
оэм и криптохром) на первичные процессы соматического эмбриогене-
за •• пшениц? Действуют ли разные формы фитохрома (Р I и Р II) и крип-
ттхром в фазу превращения каллусной клетки в клетку аксиальную (мор-
се генную) или спектральный состав света влияет на разные фазы эмбри-
огенеза и, возможно, на развитие побега?
Одним из факторов, регулирующих соматический эмбриогенез, яв-
пется экспрессия сигнальных молекул (A. Nato et al., 1990). Их функция
"ьгла исследована на примере образования проэмбриогенных масс (ПЭМ)
1 каллусах, полученных из незрелых зиготических зародышей 42 анеупло-
азных линий яровой пшеницы <Chinese spring> (рис. 21). С помощью им-
лгнохимических методов было установлено, что все экспланты и каллу-
ггг имели перекрестную реакцию с моно- и поликлональными антитела-
ми. 2.4-Д вызывала индукцию объектов, пролиферацию клеток экспланта
ж увеличивала количество белков, связывающихся с антителами (арре-
гтином, белком 29 КЮА и нуклеозид-дифосфаткиназой). Пролиферация
ггвпадала с появлением минорного, возможно, сигнального белка. Авто-
эмп высказана гипотеза, что специфические для соматического эмбрио-
генеза белки играют роль центров самосборки белковых ансамблей, об-
г«взующихся в процессе перепрограммирования каллусной клетки.
Установлено, что слабый постоянный электрический ток также мо-
кет быть индуктором эмбриогенеза. В экспериментах по индукции сома-
тического эмбриогенеза у кукурузы (Ю. Долгих, 1994) слабый постоян-
5нгй электрический ток не действовал на неэмбриогенные каллусные тка-
чи. но при действии на эмбриогенный каллус наблюдался достоверный
зофект, стимулирующий стеблевые образования. Величина эффекта за-
висела от силы тока и его направления (см. рис. 22 и 23).
-69-
о лиганд
Рис. 21. Гипотетическая
схема путей трансдук-
ции сигнала, вовлечен-
ных в эмбриогенез
растений:
АПБ — аррестинподоб-
ный белок;
НДФК — нуклеозидди-
фосфаткиназа;
Ga — а-субъедпиица
гетеромерного G белка.
Киназный путь, активируе-
мый митогеном, включает:
МАП — митогенактивируе-
мый белок;
МАПК — киназа МАП;
МАПКК — киназа МАПК;
МАПККК — киназа МАПКК
Морфогенез стимулировался, если на электрод, введенный в ткани
эмбриогенных каллусов, подавали отрицательный потенциал, а на элект-
род, введенный в питательную среду,— положительный. При обратном
направлении тока образование побегов не стимулировалось. Сила тока
2 мкА была оптимальна для морфогенеза, эффект быстро снижался при
увеличении силы тока: так, сила тока уже 4 мкА была неэффективна. По
полученным результатам можно предположить, что слабый постоянный
электрический ток действовал не на клетки проэмбриогенных масс, а был
связан с ростом стеблевых образований при законченном эмбриогенезе.
Пока трудно определить, связано действие тока с процессами поля-
ризации морфогенных клеток или действие электрических потенциалов
направлено на градиенты ауксина и ионов.
Очевидно, в ближайшем будущем значительно усилится интерес к изу-
чению соматического эмбриогенеза как генетически наследуемого призна-
-70-
Ряс. 22. Влияние силы
тока на рост и морфогенез
каллуса кукурузы in vitro'
! — общий вес;
— апексы
Рис. 23. Влияние направ-
ления тока на рост
я морфогенез каллуса
кукурузы in vitro:
I — вес;
— апексы
зз. Метод гибридизации растений-регенерантов, возникших из каллусных
тханей с различным морфогенетическим потенциалом, предоставляет та-
хие возможности. В частности, показано, что способность к морфогенезу
может наследоваться как монотонный доминантный или кодоминантный
признак под контролем фоторегулируемых генов. Модуляция процесса све-
том и гормонами указывает, что именно эти факторы играют роль сигна-
ла. Действие проходит, возможно, через G-белки, связывающиеся с кле-
точными рецепторами. Возможно также, что сигнальные белки входят в
слетки и контролируют пролиферацию и дифференциацию.
Более активное включение генного аппарата, вероятно, связано с на-
чалом процесса развития зародыша от проэмбрио до проростка. Однако
число специфических для соматического эмбриогенеза белков при этом
:чень мало (1%). Не исключено, что изменение активности белков «до-
машнего хозяйства» клетки также играет важную роль в процессе.
1Слоналъное микроразмножение
и оздоровление посадочного
материала
ГЛАВА ДЕВЯТАЯ
...Овладение всякой новой областью явлений природы
всегда приводит к практическим применениям.
И.Е. Тамм
Человек одомашнил растения около 10 000 лет назад. С этого време-
ни начался отбор диких видов по признакам полезности для человека.
Этот процесс, основанный на естественном разнообразии сначала дико-
растущих, а затем одомашненных растений, продолжается и сейчас. Се-
лекционная практика создаст генетическое разнообразие и отбирает же-
лательные генотипы. Возникший более 65 лет назад метод культуры тка-
ней и клеток развивается быстрыми темпами. Ученые стали использовать
клетки, протопласты, пыльники и завязи высших растений, выращивае-
мые in vitro, для практического растениеводства.
В предыдущих главах было рассказано о биологии клетки вне орга-
низма, а также о возможностях дифференциации клеток и превращения
их в разные анатомические органы: побеги, корни, эмбриоиды и расте-
ния-регенеранты. На основе этих знаний о возможностях клеток и тка-
ней in vitro в этой и последующих главах будут представлены различные
биотехнологии с практическим выходом, инженерными подходами и воз-
можностью получать продукты для использования человеком.
§ 1. КЛОНАЛЬНОЕ МИКРОРАЗМНОЖЕНИЕ
Изучение процесса экспериментального морфогенеза in vitro на всех
уровнях организации — от отдельной клетки до верхушки побега — при-
вело к созданию технологии клонального микроразмножения растений,
которая в большинстве стран стала уже коммерческой. Термин «клон»
(от греч. don — “отпрыск”) был предложен Вэббером (1903) для вегета-
тивно размножаемых растений. Предполагается, что отпрыски растения,
размножаемого неполовым путем, не являются индивидуальностями в
-72-
обычном смысле слова. Они лишь части (клоны) материнской особи,
идентичные ей и между собой. Таким образом, клональное микроразмно-
жение — это использование техники in vitro для быстрого получения не-
половым способом растений, идентичных исходному. Преимуществами
клонального микроразмножения растений в сравнении с традиционными
методами являются:
— значительно более высокие коэффициенты размножения. При
микроклональном размножении можно получить до 100 000—1 000 000 ме-
риклонов в год, тогда как при обычном размножении — 5—100 растений
за тот же срок;
— миниатюризация процесса, приводящая к экономии площадей, за-
нятых маточными и размножаемыми растениями;
— особенно важно, что клональное микроразмножение часто оздо-
равливает растения от грибных и бактериальных патогенов, вирусов, ми-
коплазменных, вироидных и нематодных инфекций;
— большим преимуществом данной технологии является также то об-
стоятельство, что в условиях in vitro часто размножаются и укореняются
те растения, которые совсем не размножаются или плохо размножаются
обычными способами.
Области применения клонального микроразмножения разнообразны
и имеют тенденцию к расширению.
Клональное микроразмножение растений можно производить разны-
ми способами. Основные типы микроразмножения:
1) микрочеренкование;
2) образование микроклубней, микролуковиц;
3) индукция адвентивных почек;
4) подавление апикального доминирования и развитие пазушных по-
чек;
5) размножение в биореакторах микроклубнями (картофель, малина,
гладиолус и др.).
В соответствии с количеством продукции технологии размножения
in vitro можно разделить на мелко- и крупномасштабные. Это деление свя-
зано с целями и областями применения. Создание нужного для селекцио-
нера количества копий уникальных генотипов (линий, гибридов, мутан-
тов, трансгенных растений) не требует больших масштабов. Напротив,
быстрое клональное микроразмножение вновь созданных и уже существу-
ющих хозяйственных сортов с целью массового получения оздоровленно-
го посадочного материала должно быть крупномасштабным процессом.
Масштабы применения технологии в этом случае определяются потреб-
ностью и рентабельностью.
-73-
Следует назвать еще три области применения клонального микрораз-
множения, значение которых будет со временем возрастать.
Первая — это быстрое клональное размножение in vitro лучших эк-
земпляров взрослых лесных деревьев и «плюсовых» их форм, особенно
хвойных. Хотя в этой области и появились успехи, но технологию для
хозяйственного применения еще нельзя считать разработанной.
Вторая — использование техники in vitro по отношению к гетерози-
готным, расщепляющимся при скрещивании растениям.
Третья — для сохранения редких и исчезающих видов. В этом слу-
чае пока не разработан этап технологии, связанный с возвращением этих
растений в соответствующую среду обитания.
Обязательным условием клонального микроразмножения является
использование объектов, полностью сохраняющих генетическую стабиль-
ность на всех этапах процесса — от экспланта до растений в поле. Этому
условию удовлетворяют апексы и воздушные почки органов стеблевого
происхождения. В культуре in vitro различие между генетической стабиль-
ностью меристем и нестабильностью каллусных клеток очевидно. Меха-
низм, определяющий это различие, вероятно, имеет комплексную приро-
ду. По мнению Д. Амато (Д. Амато, 1985), у ряда видов уже дифференци-
ровка соматических клеток в онтогенезе растений ведет к утрате гено-
мом стабильности (эндополиплоидия, амплификация некоторых генов,
изменения на уровне повторов ДНК). Эти генетические отклонения от
нормы умножаются при получении каллуса и при субкультивировании
каллусных клеток. Генетическая гетерогенность становится нормой суще-
ствования культивируемых in vitro клеток высших растений.
Мсристемные ткани растений in vivo непрерывно поддерживаются в
активно пролиферирующем состоянии. Они устойчивы к генетическим
изменениям, возможно, вследствие высокой активности систем репара-
ции ДНК, а также негативной селекции изменившихся клеток. Можно
предположить, что организация апикальных и пазушных меристем стебля
в виде дискретных зон также вносит вклад в их генетическую стабиль-
ность. Генетически стабильные апексы и пазушные почки стебля являют-
ся в настоящее время наиболее предпочтительными объектами для кло-
нального микроразмножения. При использовании в качестве эксплантов
дифференцированных тканей растений, способных образовывать адвен-
тивные почки, возможно появление мутантных форм. Однако для луко-
вичных растений, пальм, многих декоративных растений при использо-
вании подобных эксплантов отклонения от прототипа, как правило, не
наблюдалось.
— 74 —
Процесс клонального микроразмножения можно разделить на не-
сколько этапов. Обычно их четыре:
1-й этап — выбор растения донора, изолирование и стерилизация экс-
планта, создание условий для его роста на питательной среде in vitro.
2-й этап — собственно размножение путем:
— стимуляции развития всех пазушных почек экспланта в результате
подавления апикального доминирования как первичного, так и всех
вновь возникающих побегов;
— микрочеренкования побега, сохраняющего апикальное доминиро-
вание;
— стимуляции образования микроклубней и микролуковичек;
— индукции образования адвентивных почек тканями листа, стебля,
чешуйками и донцем луковиц, корневищем, зачатками соцветий (без об-
разования каллусной ткани).
3-й этап — укоренение размноженных побегов и адаптация проби-
рочных растений к условиям in vivo.
4-й этап — выращивание извлеченных из культуральных сосудов расте-
ний и перенос их в условия теплицы в почву или на искусственный субстрат.
5-й этап — подготовка к реализации пли высадка в поле.
Как уже было сказано выше, одно из основных преимуществ кло-
нального микроразмножения над традиционным — высокий коэффици-
ент размножения (число мериклонов или растений от одного экспланта
в год). Коэффициент размножения зависит от ряда факторов: генотипа
растения-донора и его физиологического состояния; состава питательной
среды и физических условий в культуральном сосуде и вне его (освеще-
ние, влажность, газовый состав); уровня стабильности процесса размно-
жения при субкультивировании образовавшихся мериклонов; соблюде-
ния асептических условий выращивания с особым вниманием к хрони-
ческой инфекции, вызываемой медленно растущими патогенами
iPseudomonas, Erwinia, Bacillus).
Как правило, для клонального микроразмножения на первом и вто-
ром этапах используют среду по прописи Мурасиге и Скуга, варьируя
состав и сочетание стимуляторов роста в зависимости от объекта. Основ-
ной сложностью технологии на первом этапе для ряда растений является
возможность ингибирования ростовых процессов экспланта токсически-
ми веществами, выделяемыми ими в среду. В результате травмы, получен-
ной эксплантом при изолировании, активируются ферменты, окисляю-
щие фенолы растений (различные фенолазы). Продукты окисления фе-
нолов обычно ингибируют деление и рост клеток экспланта. Улучшить
ситуацию можно отмывкой экспланта в течение 4—24 ч дистиллирован-
ной водой или слабым раствором аскорбиновой кислссь; 1 нг л i. Мани-
пуляции с эксплантом после его стерилизации и промызхг тьхже следует
проводить в растворе аскорбиновой кислоты. В питатетьнтк- следу реко-
мендуется в этих случаях добавлять антиоксиданты асхс»з6иновую или
лимонную кислоту, дитиотриэтол, глутатион, поливинглцирролидон)
(см. табл. 4).
Первые 4—5 дней после помещения экспланта на тгтзтельнхю среду
культуры следует держать в темноте и только затем перенесись их на свет.
Условия на втором этапе должны обеспечить быстрое размножение
экспланта или транспланта в течение длительного ехбюльтивирования.
Основную роль при этом играют оптимальное соотношение и концентра-
ция внесенных в питательную среду стимуляторов роста — цитокининов
и ауксинов. Из цитокининов наиболее часто используют 6-БАП в концен-
трациях от 1 до 10 мг/л, из ауксинов — ИУК и а-НУК в концентрациях
от 0 до 0,5 мг/л. Почти каждый новый объект требует корректировки
этих количеств.
В работе Н. Катаевой (1982), применившей методы математического
планирования эксперимента для оптимизации процесса клонального мик-
роразмножения герберы, были поставлены следующие цели: увеличение
коэффициента размножения, поддержание стабильной скорости размно-
жения при длительном субкультивировании, упрощение состава (удешев-
ление) среды, получение высокого процента растений с нормальной мор-
фологией (табл. 17). Первый («отсеивающий») эксперимент с примене-
нием метода математического планирования Н. Катаева проводила с при-
влечением 26 разных факторов, далее шла серия опытов по матрицам
факториальных экспериментов (В. Максимов, 1980). Результаты работы
показали, что таким путем возможно значительно упростить состав сре-
ды и добиться стабильного коэффициента размножения.
Таблица 17
Результаты оптимизации питательной среды
для клонального микроразмножения на примере герберы (Катаева, 1982)
Среда Исходная МС Оптимизированная
Коэф, размножения Число субкультивирований со стабильной скоростью размножения Витрификация Образование каллуса Упрощение состава среды: 8-10 8-12 4—5 >12 + — Исключены ИУК, тирозин, никотиновая кислота, мезо- инозит, пиридоксин; снижены концентрации сахарозы, кинетина, тиамина, аденина
-76-
Для некоторых древесных растений основные трудности при осуще-
ствлении технологии клонального микроразмножения связаны с третьим
этапом. На этом этапе обычно изменяют основной состав среды (уменьша-
ют наполовину количество солей по прописи MS или заменяют ее средой
Уайта), уменьшают количество сахара до 0,5—1%, исключают полностью
цитокинины и добавляют ауксины — [3-индолил масляную кислоту ([3-ИМК)
в количестве 1—2 мг/л или в тех же количествах сс-НУК.
В некоторых случаях корнеобразование стимулируется добавлением
к среде хлорогеновой или феруловой кислот (1—2 мг/л). Можно также
рекомендовать обработку базальной части побегов, извлеченных из про-
бирок, растворами стимуляторов роста
ауксинового типа в более высокой
концентрации (30—50 мг/л) в течение
3—6 ч, а затем укоренение их на среде
без стимуляторов роста в агаризован-
ной среде или ex vitro в подходящем
субстрате. Этот метод в ряде случаев
может быть предпочтительнее для уве-
личения процента укоренения, чем по-
стоянное присутствие ауксинов в сре-
де. Плохое укоренение побегов может
определяться длительным временем их
размножения на среде с цитокинина-
ми. Для хвойных инъекция микоризы
(рис. 24, 25) может стимулировать кор-
невую систему (Е. Калашникова, 1993).
Вероятно, целесообразно при субкуль-
тивировании побегов использовать
среды вначале с более высокими, а за-
тем с более низкими концентрациями
цитокининов.
Недостаточно пока разработаны
условия адаптации пробирочных расте-
ний к последующему выращиванию ех
vitro в теплице. Как правило, для этого
в первую очередь увеличивают интен-
сивность освещения. Если интенсив-
ность освещения на первом и втором
этапах обычно не превышает 1000—
2000 люкс, то во время адаптации про-
Рис. 24. Развитие корневой систе-
мы ели обыкновенной в почве с
микоризой
Рис. 25. Густое оплетение корней
микоризой (разное увеличение)
бирочных растений к высадке в почву и переносу в теплицу ее увеличи-
вают до 8—10 тысяч люкс.
Подбор оптимального субстрата, способы увеличения влажности в
первое время после пересадки пробирочных растений требуют специаль-
ной доработки, как технологической, так и с точки зрения экономики
процесса.
В последнее время разрабатываются методы клонального микрораз-
множения с привлечением фотосинтеза. Как уже было сказано, при пере-
несении пробирочных растений в грунт необходимо создать оптимальные
условия для их приживания. Как правило, наиболее важна влажность, по-
этому сосуды или вся теплица закрываются пленкой. В зависимости от
объекта микроразмножения необходим грунт, обеспечивающий быстрое
развитие корневой системы. Хорошо развитые растения могут быть пере-
несены в условия поля после проверки на отсутствие вирусной инфекции.
Однако можно подойти к этой проблеме и по-другому — перевести ра-
стения на фототрофное питание. Для этого создают условия, при которых
растения в пробирках или колбах получают освещение люминесцентными
лампами 40—60 вт/м2 и увеличивают до 0,3—0,4% концентрацию СО2.
Одновременно необходимо снизить количество сахарозы в среде.
Получаемые при этом преимущества достаточно ощутимы.
Фотосинтезирующие растения не вытягиваются так, как гетеротроф-
ные при высаживании в грунт. Они не требуют пленок, не боятся света,
значительно легче адаптируются в полевых условиях (Л. Цоглин, Б. Га-
бель, 1994).
Очень мало сведений пока о влиянии фотопериода и качества света
на процессы, связанные с разными этапами клонального микроразмноже-
ния. Несомненно, что значение светового фактора даже при культивиро-
вании эксплантов и мериклонов на питательной среде с сахарозой очень
велико. Добавление к питательной среде морфактина. стимулирующего
фотосинтетическую продукцию углеводов, увеличивает развитие побегов.
Наиболее активно влияют на морфогенез красные и синие области спек-
тра. Не исключено участие фитохрома в стимуляции развития почек
(красный свет) или корней (дальний красный).
Недостаточно уточнены для разных объектов оптимальные темпера-
турные условия и благоприятный газовый состав в культуральных сосу-
дах. С неблагоприятным газовым составом в культуральных сосудах (на-
копление СО2 и этилена) связывают такое нежелательное явление, как
витрификация («стеклообразование») пробирочных растений. При этом
из-за сильного оводнения и изменения структуры листья и стебли кажут-
ся прозрачными («стеклянными»), часто изменяется и Форма органов.
-78-
Витрифицированные растения подлежат выбраковке. Витрификацию
наблюдали при размножении in vitro лука, цветной капусты, сельдерея,
гвоздики и др., чаще — при размножении in vitro на жидкой, а не на ага-
ризованной среде. Нет единого мнения о механизмах этого нарушения
нормального развития пробирочных растений.
По мнению некоторых исследователей, основной причиной витри-
фикации является высокий водный потенциал среды. Для его снижения
часто увеличивают концентрацию агара в среде, а связанное с этим
уменьшение коэффициента размножения компенсируют внесением в пи-
тательную среду одновременно трех цитокининов — кинетина, б-БАП и
зеатина.
По гипотезе Кеверса (С. Kevers et al., 1984) витрификация — это от-
вет на стресс, который вызывают ионы NH4, цитокинины и этилен, при-
сутствующие в избытке. Витрификацию, согласно этому автору, можно
преодолеть улучшением газообмена в сосудах и применением циркулиру-
ющих жидких сред, в которых контролируются концентрации NH4 и ци-
токининов.
Биологические исследования показывают, что в витрифицирован-
ных листьях увеличивается активность основных пероксидаз и уменьша-
ется активность кислых, снижается активность фенилаланинаммиаклиа-
зы, что приводит к уменьшению лигнификации. Разнообразие гипотез,
связанное с разнообразием объектов, показывает, что пока мало ясности
в понимании причин витрификации, а отсюда и способы борьбы с ней
имеют сугубо эмпирический характер.
§ 2. ПОЛУЧЕНИЕ БЕЗВИРУСНОГО ПОСАДОЧНОГО МАТЕРИАЛА
Небольшой размер экспланта, применяемого для клонального ми-
кроразмножения, его поверхностная стерилизация, асептический пере-
нос на питательную среду и субкультивирование в условиях, исключаю-
щих инфицирование, приводят к оздоровлению полученных растений от
нематод, грибных и бактериальных патогенов. Но этого недостаточно
для оздоровления созданного клонального посадочного материала от ви-
русов, вироидов, микоплазм. Вместе с тем именно вирусные болезни —
причина потери от 10 до 50% урожая сельскохозяйственных культур, раз-
множающихся вегетативно. Более того, выяснено, что соя и некоторые
другие важные бобовые растения передают вирусы потомству даже при
семенном размножении, т.е. таким образом сорта отягощаются постепен-
но грузом вирусных инфекций.
Наиболее эффективный для оздоровления от вирусов, вироидов и ми-
коплазм способ — культивирование меристем стебля или органов стебле-
-79-
вого происхождения. В трудных случаях метод культуры меристем допол-
няют термо- и хемотерапией.
Специалисты по культуре тканей и клеток растений уже давно научи-
лись выращивать растения из апикальной меристемы, состоящей из ко-
нуса нарастания и одного или двух листовых зачатков. Можно создать ус-
ловия и для получения растений из ткани только конуса нарастания без
листовых зачатков, хотя при этом эффективность процесса резко снижа-
ется. Это связано с тем, что чем больше размер меристематического экс-
планта, т.е. чем больше листовых зачатков и ткани стебля он имеет, тем
легче идет процесс морфогенеза, заканчивающийся получением целого,
нормального пробирочного растения. Вместе с тем зона, свободная от
вирусных частиц, очень различна для разных вирусов. Это зависит также
от вида и сорта растения. Так, при вычленении под бинокулярным мик-
роскопом апикальной меристемы картофеля величиной 0,2 мм (конус на-
растания апекса с одним листовым зачатком) среди полученных растений
только 10% были свободны от Х-вируса, но от Y-вируса картофеля — 70%.
Выбирая размер меристемного экспланта, биолог должен находить
компромисс с учетом возможностей методов, т.е. получить максимальное
число растений при максимальном проценте безвирусных среди них.
Одни биологи предпочитают использовать предельно малый размер экс-
планта (0,075—0,1мм) и разрабатывают оптимальные условия для получе-
ния нормального пробирочного растения. Другие предпочитают соче-
тать термотерапию и культуру меристем. Предварительная термотерапия
исходных растений позволяет получать оздоровление от вирусов расте-
ния при использовании меристемных эксплантов размером 0,3—0,8 мм.
Однако применение термотерапии в ряде случаев приводит к отставанию
в росте и деформации органов меристемных растений. Этот прием мо-
жет также увеличить латентные вирусные инфекции. Все это заставляет
искать другие способы увеличения эффективности выхода оздоровлен-
ных меристемных растений.
В частности, было использовано много препаратов для оптимизации
сочетания метода культивирования меристем с хемотерапией. В послед-
нее время получены хорошие результаты при внесении в питательную
среду, на которой культивируют меристемы, аналога панозина — 1-рибо-
фуранозил-1,2,4-триазол-карбоксамида. Этот препарат, полечивший ком-
мерческое название «Вирозол» (синоним — «Рибавирин i. добавленный
к питательной среде в концентрации 40—200 мМ. увеличивал процент
безвирусных меристемных растений для ряда обычных для растений ви-
з'.сов до 80—100% при 0—41% в контроле.
-80-
Для технологии оздоровления посадочного материала от вирусов уз-
ким местом пока является недостаток высокоспецифичных и высокочув-
ствительных диагностикумов на вирусные инфекции. Сейчас наиболее
широко используются иммуноферментная техника, особенно в ее микро-
варианте, а также моноклональные антитела. Разработаны методы моле-
кулярной гибридизации меченых фрагментов РНК- и ДНК-вироидов и
вирусов с вирусами тестируемого объекта, позволяющие просто и быст-
ро детектировать присутствие патогенов в капельке экстракта из расте-
ния. Эти методы вполне удовлетворительны исходя из требований спе-
цифичности и чувствительности, однако достаточно трудоемки и дорого-
стоящи.
Сложность детектирования вироидов привела китайских исследова-
телей к необходимости использования антигенов против некоторых ви-
роидов. Однако при этом значительно возрастают стоимость тестирова-
ния и цена оздоровленного растения.
На данный момент очевидно, что необходимы экономические расче-
ты и прогноз — при каком соотношении оздоровленных растений in vitro
в лаборатории и ex vitro в поле затраты на диагностику будут минимальны.
Оздоровленные применением меристемной культуры растения раз-
множают далее обычным методом клонального микроразмножения. Ис-
ключением является техника микропрививок, которую применяют для
оздоровления цитрусовых растений, персика, иногда яблони. Для цитру-
совых необходимость этой техники связана с плохими результатами, по-
лучаемыми при использовании меристем малого размера. Более успеш-
ные результаты были получены при прививке меристемы лимонов и
апельсинов размером 0,14—0,18 мм на пробирочные подвои, полученные
из семян. Согласно Наварро (Z. Navarro, 1984) можно получить 30—50%
успешных прививок и 95% привитых растений, которые сохраняются
при высадке в почву. Развивающиеся побеги цитрусовых лишены юве-
нильных признаков, цветение и плодоношение их ускоряется.
Из семи вирусов, распространенных у цитрусовых, для пяти оздоров-
ление наблюдали на уровне 100% привитых растений, для двух — на уров-
нях 80 и 98%.
Одним из способов ускоренного размножения оздоровленного мате-
риала микроклубней in vitro (Р. Бутенко, 1960; О. Мелик-Саркисов, Н. До-
нец и др., 1984) является их размножение в пробирках или гидропонике.
Для производства микроклубней картофеля О. Мелик-Саркисов скон-
струировал гидропонное производство (1984) для выращивания безвирус-
ных семенных микроклубней. Гидропонное производство позволяет в ус-
тановке в 2,5 раза увеличить рост микроклубней и за 12 суток превысить
-81-
Рис. 26. Общий вид и один модуль
биореактора для получения мик-
роклубней картофеля
контроль в 2,9 раза. Производительность устанс-зги — “ООО ми-
кроклубней с 1 м2 (масса клубня — 5 г). Предусмо~ен2. э:с1тЗ??шая ме-
ханизированная посадка их в грунт.
Актуальна задача использования замкнутых систем с-эгседзгторов для
повышения эффективности массового получения геззирусно-
го материала. В биореакторах разработаны технологии: «_т:н2_ть:-:ого мик-
роразмножения лилий, гладиолусов, гиацинтов. :тенге-:нов и др.
(S. Takayama, Akuma, 1994: R. Butenko, Z. Frolova. A. Frisk". e: F.. 1993).
Исследователи США и Японии предлагают биореакт-:! ьг для получе-
ния микроклубней при массовом производстве безвипгеного материала.
Но пока что биореакторы для получения микроклубней являются не про-
мышленными, а модельными лабораторными установками S. Takayama,
Akuma, 1994).
В Отделе биологии клетки и биотех-
нологии ИФР РАН создана эффективная
полупромышленная замкнутая система
пневмоимпульсного биореактора для по-
лучения микроклубней картофеля с воз-
можностью воздействия на направление
и скорость процессов клгбнеобразования.
Показана практическая возможность ис-
пользования микроклубней картофеля,
получаемых в пневмоимпульсном био-
реакторе, как полноценного оздоровлен-
ного посадочного материала. Изучение
зависимости развития микроклубней от
числа столонов выявило необходимость
увеличения питательной среды в биореак-
торе. Это заставило применить для био-
реактора особую систему орошения сре-
дой, поступающей в отдельную емкость.
В результате оказалось возможным полу-
чать клубни большего размера — пример-
но 1,5—2 см в диаметре (рис. 26 и 27).
Рис. 27. Микроклубни, получен-
ные в биореакторе
Оздоровленные клубни, полученные
на безгормональных жидких питательных
средах в пневмоимпульсных биореакто-
рах, вполне могут использоваться в качестве полноценного материала в
семеноводстве картофеля на безвирусной основе (А. Дерябин, Н. Юрьева,
А. Орешников, Р. Бутенко, 1997).
В заключение следует сказать, что в Голландии общее число расте-
ний, клонированных in vitro, на 1987 год достигало около 50 миллионов.
В основном это декоративные растения, а также овощные и полевые, не
считая цветущих кустарников. В нашей стране созданы и развиваются ла-
боратории клонального микроразмножения, связанные с нуждами селек-
ции, а также те, которые составляют начало цепочки семеноводства кар-
тофеля на безвирусной основе. Однако в ряде случаев для нашей страны
интерес могли бы представить чисто коммерческие фирмы-лаборатории.
Их созданию должно предшествовать прогнозирование рентабельности
и социальной необходимости производства данного вида продукции (по-
садочного материала). Стоимость продукции, рыночная цена, емкость
рынка, сезонность поставки, необходимость «встроиться» наиболее вы-
годно в существующую сельскохозяйственную технологию, выбор видов
и сортов растений — все эти факторы должны быть учтены перед приня-
тием решения об организации коммерческих лабораторий. Вместе с тем
технологии должны непрерывно улучшаться. Их основные недостатки се-
годня — большая трудоемкость и как следствие — высокие затраты. Необ-
ходима автоматизация большинства процессов. Однако как для автомати-
зации, так и вообще для уменьшения затрат труда, материалов, энергии
и других ресурсов необходима разработка уже сегодня принципиально
новых приемов в сравнении с теми, что применяют сейчас в системах in
vitro. Среди них можно назвать отказ от укоренения растений in vitro и
привлечение для этого техники гидро- и аэропоники ex vitro; регуляцию и
стимуляцию процессов морфогенеза короткими световыми импульсами
разного спектрального состава; применение полимеров и т.д.
С/оздание с помощью биотехнологии
растении с новыми
полезными признаками
ГЛАВА ДЕСЯТАЯ
Клетки in vitro могут быть использованы для создания растений с
новыми полезными признаками двояким образом. Во-первых, для облег-
чения и ускорения селекционного процесса и, во-вторых, для создания
генетического разнообразия исходных форм для селекции. Основные
применяемые клеточные технологии приведены в табл. 18.
Таблица 18
Клеточные технологии в селекции растений
Для облегчения и ускорения селекционного процесса Для создания генетического разнообразия и скрининга генотипов с важными признаками
Оплодотворение in vitro Культура незрелых гибридных семяпочек и зародышей Регенерация растений из тканей летальных гибридов Экспериментальная гаплоидия Клональное микроразмножение новых сортов, гибридов, линий (включая создание искусственных семян) Криосохранение генофонда Использование сомаклональных вариаций и получение индуцированных мутантов на клеточном уровне Клеточная селекция Гибридизация соматических клеток Перенос чужеродных цитоплазматических генов Перенос чужеродной генетической информации различного происхождения Адресованный перенос ядерных генов
§ 1. СОЗДАНИЕ ГОМОЗИГОТНЫХ ДИПЛОИДОВ
МЕТОДАМИ АНДРОГЕНЕЗА И ГИНОГЕНЕЗА
Интерес к получению гаплоидов определяется большими возможно-
стями, которые они открывают для технологий на основе культивируе-
мых клеток растений, особенно ориентированных на селекционный про-
цесс. Гаплоидные клетки и растения позволяют легче обнаружить рецес-
сивные мутации, редкие рекомбинации, экспрессию введенного извне
генетического материала. Протопласты, полеченные из гаплоидных клеток,
-84-
образуют гибридные клетки и растения с диплоидным числом хромосом,
что в ряде случаев является достоинством. Удвоение числа хромосом
превращает гаплоид в фертильное гомозиготное диплоидное растение.
Изогенные линии для получения гетерозиса гибридов на основе удвоен-
ных гаплоидов можно создать в течение года, тогда как метод инбридин-
га требует 4—6 лет. Изогенные линии на основе гаплоидов, полученных в
Fp и F2-гибридных поколениях, облегчают селекционеру оценку и отбор
искомых комбинаций, признаков для самоопыляющихся растений, позво-
ляют ускорить процесс создания сорта в 2—3 раза (рис. 28).
С. Гуха и С. Магешвари (1964) были первыми, кто открыл возмож-
ность получения in vitro спонтанных гаплоидов при аномальном развитии
пыльников, пыльцы, зародышей или каллусов. Очень быстро к этой рабо-
те проявили интерес J. Nitsch и С. Nitsch (1974).
Вскоре изучение андрогенеза в пыльниках и пыльце, а затем гиноге-
неза в зародышевом мешке из мегаспоры или антипод привлекло внима-
ние многих ученых.
Метод андрогенеза
Как уже было сказано, создание гаплоидов и гомозиготных дигапло-
идов методом андрогенеза значительно ускоряет (в 2—3 раза) получение
гаплоидов по сравнению с методом инбридинга.
-85-
На процесс андрогенеза влияют многие факторы. Условия выращи-
вания, возраст растения-донора, положение цветочной почки на расте-
нии, время, прошедшее с начала зацветания, по мнению большинства ис-
следователей, имеют существенное значение для эффективности процес-
са. Несомненно, состав питательной среды также важен для эффективно-
сти процесса, но он имеет меньшее значение, чем стадия развития пыль-
цы, используемой для андрогенеза.
Рекомендуемые многими авторами среды:
— 0,5 солей по прописи С. Мурасиге и Ф. Скуга (1962) — широко ис-
пользуется для представителей семейства пасленовых;
— китайская среда № 6 (Ch. Chu, 1982);
— среда с картофельным экстрактом (С. Chuang et al., 1978) для зла-
ков.
В ряде случаев хорошие результаты дает среда Ничей (Nitsch, Nitsch,
1974). Состав перечисленных сред можно найти в табл. 3.
Влияние стимуляторов роста типа ауксинов и цитокининов строго
не установлено. В целом можно утверждать, что для представителей се-
мейства пасленовых ауксин можно не добавлять к среде, тогда как виды
семейства злаковых и крестоцветных требуют добавления к среде 2,4-ди-
хлорфеноксиуксусной кислоты (2,4-Д).
Можно рекомендовать добавление к питательной среде MS карто-
фельной среды № 6 (см. табл. 2). Для культивирования пыльников расте-
ний семейств Gramineae и Cruciferae требуются добавки фитогормонов. Для
Solanaceae добавляются аминокислоты (в частности, глутамин) 2,4-Д и
Р-ИУК. Температуры для культивирования пыльников растений семей-
ства Solanaceae оптимальны около 25 °C, для Brassicaceae (рапс) можно ис-
пользовать температуру около 35 °C.
В начале развития метода культивирования изолированных пыльни-
ков использовалась в основном агаризованная среда, на поверхности ко-
торой помещались пыльники. Однако затем было сделано предположе-
ние, что некоторые компоненты агар-агара токсичны для пыльников. По-
этому агар-агар в ряде исследований заменили очищенной агарозой, и
это имело благоприятное влияние на культивируемые пыльники риса,
пшеницы, ячменя. Высокая стоимость агарозы, однако, затрудняет ее ис-
пользование на практике при больших масштабах работы.
В качестве самых общих рекомендаций по выбору растительного
материала можно принять следующее: использовать выращенные в поле
растения-доноры лучше, чем выращенные в тепличных условиях (А. Куч-
ко, И. Маруненко, 1983; П. Харченко, 1986; J. Bajaj, 1977). Цветки (коло-
сья), образовавшиеся в начале цветения, предпочтительнее образовав-
-86-
шихся позже. Нормальные условия освещения, питания и водного режи-
ма растения-донора также способствуют получению хороших результатов.
В большинстве случаев оптимальным сроком для изолирования яв-
ляется стадия «средних» или «поздних» микроспор. На этой стадии микро-
споры, освободившись от тетрад, вакуолизируются и готовятся к перво-
му митозу. Однако оптимум для разных видов может варьировать от ста-
дии тетрад до двуядерного пыльцевого зерна.
Для выполнения практических программ, требующих больших мас-
штабов изолирования пыльников, желательно установление корреляции
между определенной стадией развития микроспор и пыльцы и размера-
ми цветочной почки или венчика цветка. К сожалению, часто такие точ-
ные корреляции объективно отсутствуют (А. Кучко, И. Маруненко, 1983).
Деление зрелой пыльцы на двухклеточную и трехклеточную зависит
от осмотичности питательной среды (процента сахарозы). При первом
делении используют низкую концентрацию, при втором — более высо-
кую. Характерно, что у всех андрогенных видов в пыльце обнаружены
пропластиды, у неандрогенных — амилопласты.
Оптимальные стадии развития пыльцы и все остальные факторы
при работе с пыльцой специфичны для разных видов растений. Пыльца
чаще всего оптимальна в стадии первого митоза или микроспоры после
стадии тетрады.
Процесс перехода микроспор от гаметофитного на спорофитный
путь развития определяется на генетическом уровне, но реализуется в за-
висимости от конкретных физиологических условий и различных по дей-
ствию индуцирующих факторов. А. Тураев и 3. Шамина (1986), изучая об-
разование каллуса в культуре пыльников хлопчатника Gossypium hirsutum,
на трех инбредных линиях продемонстрировали, что степень реакции на
условия культивирования резко различна между линиями Л-501, Л-101 и
линией Л-70.
Изучение каллусообразования у пыльников разных сортов риса и у
их гибридного потомства показало, что способность к индукции каллуса
наследуется при этом как простой рецессивный признак (М. Miah et al.,
1985). В работе И. Маруненко, А. Кучко (1986), использовавших культуру
пыльников сортов диких видов картофеля для получения дигаплоидов и
моноплоидов, были выявлены генотипы с высокой потенцией к образо-
ванию каллусов и/или эмбриоидов (сорта <Гибридный>, <Гатчинский>
и <Свитанок>).
Культура пыльцы используется реже, чем культура пыльников. Вы-
ход растений-регенерантов ниже в расчете на один пыльник в случае
культивирования пыльцы.
-87-
Трудно работать с пыльцой злаков и некоторых других видов покрыто-
семенных. Для многих видов пыльник спонтанно раскрывается и в жид-
кой среде микроспоры флотирует (сем. Solanaceae. Brassicareae. некоторые
злаки). При получении пыльцы путем гомогенизации и фильтрации реге-
неранты злаков часто бывают альбиносами.
Для получения культуры пыльцы пыльники предварительно инкубиру-
ют 3—4 дня. Затем их осторожно разрушают в жидкой среде, фильтруют
(размер пор 50—100 мкм) и центрифугируют при 100 g в течение 5 мин.
Удаляют надосадочную жидкость, промывают пыльцу и суспендиру-
ют в жидкой среде.
Обязательный этан исследования — идентификация полученных гап-
лоидных растений. Зародыши могут быть полиплоидными на основе пер-
вичной гаплоидности. Истинно гаплоидные растения легко идентифици-
ровать цитогенетически и морфологически. Для этого используют под-
счет хромосом в кончике корней, анализ замыкающих клеток устьиц листа.
У гаплоидов они обычно меньше по размерам. Число хромосом в замыкаю-
щих клетках картофеля п— 5—8, 2п — 10—15, 4п — 18—24 (химерность). Воз-
можны мутации в начале эмбриоидного образования.
Широкому использованию техники получения гаплоидов в культуре
пыльников мешает низкая эффективность, которую можно рассчитать как:
1) процент изолированных пыльников, образовавших в культуре эм-
бриоиды или каллус из микроспор;
2) процент гаплоидных растений-регенерантов в расчете на изоли-
рованный пыльник.
Недостатком метода является появление большого числа (особенно
у злаков) альбиносных растений-регенерантов.
Для получения гаплоидов ячменя очень эффективен так называемый
«бульбозум» («bulbosum») — метод, название которого происходит от Ног-
deum bulbosum («дикий ячмень»). Именно использование этого вида опре-
деляет преимущества данного метода. При оплодотворении яйцеклетки
Н. vulgare пыльцой Н. bulbosum отцовские хромосомы элиминируются и
развивается гаплоидный зародыш. Нормальное развитие при этом тормо-
зится, и выращивание происходит in vitro. Гибридные проростки отбра-
ковываются, а гаплоидные обрабатываются колхицином для удвоения
числа хромосом. В Канаде таким методом были созданы новые сорта яч-
меня. В разных центрах России также был эффективно использован «буль-
бозум». В Одессе этим методом С. Лукьянюк и С. Игнатовой (1983) были
получены новые сорта ячменя за 4—5 лет (вместо 10—12 лет при обычной
селекции). При использовании метода «бульбозум» вероятность получения
-88-
негаплоидных растений очень мала, как правило, растения-альбиносы не
возникают. Этим же методом можно получить изогенные линии пшеницы,
но для других видов злаков преимущества метода не отмечалось.
Методом культуры пыльников в разных странах созданы высокоуро-
жайные и устойчивые сорта риса и пшеницы. В Китае такие сорта сей-
час занимают площади 170 000 га (рис) и 70 000 га (пшеница).
В Краснодаре этим же методом получены различные сорта риса, та-
бака. В Поволжье метод культуры пыльников успешно применяли для се-
лекции ячменя и тритикале.
Итак, получение гаплоидов разными методами in vitro позволяет бы-
стро создать гомозиготные линии, и в этом ценность данной технологии
для селекции. Некоторый скептицизм, проявляемый селекционерами,
связан, в частности, с тем, что при использовании Fj-поколения реком-
бинации могут произойти только в одном мейотическом цикле, этого не-
достаточно для обмена признаками, контролируемыми полигенно. Как
выход предлагается либо использование Г2-поколения, либо применение
половой гибридизации полученных in vitro регенерантов разных геноти-
пов и повторный цикл получения гаплоидов in vitro у отселектированных
половых гибридов.
Очевидно, лучшее понимание генетических и физиологических про-
цессов, лежащих в основе экспериментальной гаплоидии in vitro, даст воз-
можность стандартно оптимизировать технологии получения гаплоидов
и дигаплоидных линий, и это, несомненно, ускорит и облегчит процесс в
ряде случаев. Однако столь же несомненно, что в других случаях для со-
здания изогенных линий будут предпочтительнее традиционные методы
(например, в случае сцепленных признаков).
Метод гиногенеза
Получение растений гиногенетического происхождения может быть
также полезным для селекционеров. Эти растения свободны от некото-
рых вирусов, альбинизма и нежелательных генов, передающихся по муж-
ской линии. В частности, шведские исследователи показали, что зароды-
ши из неоплодотворенных семяпочек сахарной свеклы гиногенетическо-
го происхождения позволяют выращивать сахарную свеклу на семена (D.
Bossontrot, D. Nosemans, 1985).
Гиногенез можно получить непосредственно из клеток формирующе-
гося женского гаметофита или опосредованно — через дедифференциа-
цию и формирование каллусной ткани с последующей дифференциров-
кой. Работы по гиногенезу менее распространены, чем по андрогенезу.
-89-
Низкий процентный выход эмбриоидов, необходимость подбирать эмпи-
рически условия для индукции формирующихся клеток гаметофита ус-
ложняют получение положительных результатов. При получении зароды-
ша из каллусов возможны различные сомаклональные варианты и спон-
танные мутанты.
Техника культивирования изолированных семяпочек была разрабо-
тана сначала для ячменя, затем начала применяться и для других видов
растений. Преимуществом метода гиногенеза является значительно мень-
шее число хлорофиллдефектных растений, чем при культивировании
пыльников. К настоящему времени метод успешно применен для получе-
ния гаплоидов сахарной свеклы, подсолнечника, картофеля, риса, пше-
ницы, кукурузы, ячменя, райграсса пастбищного.
Исследование процессов, происходящих при культивировании не-
оплодотворенных семяпочек сахарной свеклы, показало, что гиногенети-
ческие зародыши развиваются в данном случае либо из яйцеклетки, либо
из антипод. Синергиды обычно разрушаются. Частота образования гапло-
идов — 2 растения на 1000.
Развитие гаплоидов из неоплодотворенных яйцеклеток после несов-
местимого опыления с успехом использовалось для картофеля, люцерны,
пшеницы, при этом были использованы варианты У tuberosum х S. phurea,
Medicago sativa х М. falcata, Tr. aestivum x Aegllops speltoides.
Большая экспериментальная работа с 23 сортами мягкой пшеницы
(Tr. aestivum) была проведена на кафедре физиологии растений МГУ
М. Гусаковской, Мохамед али Наджаром, И. Ермаковым (1994). Было осу-
ществлено методическое исследование как большого количества пита-
тельных сред, различавшихся по основному составу и гормональным до-
бавкам, так и способов культивирования объектов. Наиболее эффектив-
ной оказалась жидкая среда MS с бедным составом фитогормонов. Пше-
ницу культивировали в темноте (1 мес), затем она была пересажена на
агаризованную среду с гормонами. После этого ее переносили на свежую
среду каждые 10 дней.
При инокуляции семяпочек и завязей на стадии макроспоры после
культивирования в течение 1—3 мес выявлялась стадия зрелого 8-ядерного
зародышевого мешка (ЗМ8). При культивировании в течение 5—9 мес воз-
никали эмбриогенные структуры. При инокуляции завязей цветков на ста-
дии ЗМ8 выход эмбриоидов становится массовым.
У сорта <Siete Cerros> получено 5 проростков, из них 2 были выра-
щены в целые растения. Анализ кончиков корня на содержание ДНК по-
казал, что эти растения — гиногенетические гаплоиды.
-90-
Таким образом, в условиях экспериментов у Tr. aestivum гиногенез in
vitro осуществлялся через формирование зародышевого мешка и развитие
яйцеклетки в зародыш. Подтвердилась также необходимость обработки
холодом, что является существенным и для пыльников. Оптимальная про-
должительность действия холода связана с генотипом экспланта, стадией
инокуляции и условиями культивирования и обычно составляет минимум
1—4 сут. Увеличение продолжительности действия холода до 10—15 сут.
от начала формирования макроспоры приводит при инокуляции семяпо-
чек на стадии макроспоры к их превращению в ЗМ через 1 мес. В тех же
условиях при инокуляции на стадии ЗМ8 через такое же время можно
ожидать появления зародышей.
Фактором, лимитирующим образование регенерантов, является от-
сутствие соответствующего развития зародыша и нормально функциони-
рующего эндосперма.
Нарушение целостности пыльников обычно не влияет на развитие
мужского гаметофита. В то же время при гиногенезе в культуре цветков
партеногенетическое развитие яйцеклетки происходит с высокой часто-
той, однако развитие зародыша в проросток, как правило, блокируется в
начале органогенеза в глобулярной или сердцевинной стадии. Это может
быть связано с особенностями эмбриогенеза у злаков, но, возможно, за-
висит и от нехватки различных добавок к среде, которые стимулируют
переход от глобулярной стадии к эмбриоиду и регенеранту.
§ 2. СОМАКЛОНАЛЬНЫЕ ВАРИАНТЫ И КЛЕТОЧНАЯ СЕЛЕКЦИЯ
Мы уже характеризовали особенности неполовых популяций дли-
тельно культивируемых каллусных клеток высших растений. Сомакло-
нальные вариации, возникшие в популяциях, могут реализоваться в появ-
лении генетически измененных растений-регенерантов (табл. 19).
Таблица 19
Эпигенетическая и генетическая вариабельность
Признак Генетическая вариабельность Эпигенетическая вариабельность
Частота Природа изменений Стабильность Наследование в половом потомстве 1(1* — 107 на регенерацию Случайная Стабильна Да 10* на регенерацию Направленная Часты инверсии Возможно
Такие измененные растения получили название сомаклональных ва-
риантов. Впервые сомаклональные варианты табака были получены в
нашей стране (Н. Загорска, Р. Бутенко, 3. Шамина, 1971). Растения-реге-
неранты, возникшие из пересадочной каллусной ткани табака сорта
-91-
<Трапезонд>, были получены на уровне Ro, а также R] и R2 после само-
опыления и обратных скрещиваний (беккроссов) с разными сортами та-
бака (И. Шинкарева и др., 1973). В Ro растения отличались по морфо-
физиологическим признакам от исходного сорта и значительно различа-
лись между собой (рис. 29). Часть растений была стерильна. Анализ мей-
оза в материнских клетках пыльцы показал присутствие унивалентов и
поливалентов, нарушения в образовании микроспор.
Общий интерес к возможности получения сомаклональных вариан-
тов возник гораздо позже, после опубликования австралийскими иссле-
дователями П. Ларкином и В. Скоукрофтом (Р. Larkin et al., 1984) статьи
о сомаклональной изменчивости как источнике генетического разно-
образия в создании новых форм растений. Число работ, выполненных на
разных видах экономически важных растений, после этого резко возросло.
Несомненно, далеко не все генетические вариации, наблюдающиеся
на клеточном уровне, могут пройти сито морфогене-
за. Часть из них реализовывается только на клеточ-
ном уровне, но не на уровне растений. Однако и те
Рис. 29. Реализация генетиче-
ски детерминированных дефек-
тов морфогенеза в процессе
возникновения растений из
клеток культуры ткани табака,
последующего роста и разви-
тия растений-регенерантов.
Цитогенетическая характеристи-
ка исходной линии: 2?г — 51%,
количество хромосомных аберра-
ций — 17%;
а — неорганизованный рост
каллусной ткани;
д
е
б— дифференцировка меристемы
стебля, дефектных мутаций — 0;
в — развитие побега, дефектных
мутаций — 14%;
г — корнеобразование у побегов,
дефектных метантов — 33%;
д — растения, неспособные
к цветению,— 8%;
i — стеэильные растения — 6%;
— морфологически изменен-
ные растения — 80%;
j — ноэма_тьно развивающиеся
растения — ~
-92-
качества, которые обнаруживают сомаклональные варианты, показывают
их уникальность. Такие изменения не могут быть получены в настоящее
время никаким другим путем, так как очевидно, что генетический меха-
низм, определяющий изменение фенотипа растений-сомаклонов, необы-
чен. Сомаклональные вариации на уровне клеток, из которых регенериро-
вали растения-сомаклоны, видимо, нельзя классифицировать как спонтан-
ные мутации. Это уникальное явление, и генетические изменения, прису-
щие ему, сложны, комплексны и прошли адаптацию к разным условиям
культивирования. Исследования показали, что получаемые в результате от-
бора in vitro варианты обладают преимуществами в данных условиях. Час-
тота их в популяции клеток превосходит на три порядка частоту спонтан-
ных мутаций.
Изучение растений сомаклональных вариантов показало, что от про-
тотипа они отличаются не только моногенными качественными призна-
ками, но и (что более важно практически) количественными полигенны-
ми признаками, такими, как интенсивность роста, продуктивность, толе-
рантность к неблагоприятным факторам сре-
ды (низкие температуры, недостаток воды).
Отмечены случаи появления сомаклональных
вариантов, сочетающих признаки, которые не-
возможно или трудно соединить в одном гено-
типе традиционным селекционным путем.
Так, Л. Кучеренко (1986) отселектировала из
сомаклональных вариантов, возникших в кал-
лусной культуре риса, растения, сочетающие
скороспелость и длиннозерность (табл. 20).
На их основе за короткий срок был создан но-
вый сорт риса, названный <Биориза> (рис. 30).
В Китае на основе сомаклонов создан сорт
риса, сочетающий спороспелость и устойчи-
вость к пониженным
температурам.
Рис. 30. Примеры самокло-
нальной вариабельности
у риса
Сомаклональные варианты
— 93 —
Таблица 20
Сомаклональные вариации риса с генетически обусловленными
ценными признаками (Л. Кучеренко, 1986)
Исходные сорта Способ отбора вариантов Хозяйственные признаки, отличные от исходных сортов Передано селекционерам
ВНИИР, номера: 22,1588, 3718,1405, 2471,3973, 3970, <Солярис>, <Казачок> Регенерация из длительно культивируемой ткани, отбор устойчивых к пирикуляриозу вариантов на провокационном фоне, стабильность признака в потомстве Устойчивость к пирикуляриозу 32 формы
сСолярио Скрининг каллусных клеток + + скрининг семенного потомства регенерантов при низких поло- жительных температурах Устойчивость к пониженным 2 формы температурам
<Родина>, Регенерация из каллусов <Ортикон>, разных субкультивирований <Спальчик>, Отбор растений с ценными сСолярио, признаками в Rz-регенерации <Казачок> Проверка генетической природы признака в Rs и R< — повышенная продуктив- ность; — раннее созревание, сочета щееся с длиннозерностью; — повышенная стекловид- ность; — увеличение содержания белка; — устойчивость к полеганию и осыпанию Всего 120 форм, в том числе сорт <Биориза>
Таблица 21
Этапы получения новых сортов размножающихся семенами
сельскохозяйственных растений с использованием различных подходов
(по D. Evans, 1984)
Использование сомаклональных вариаций Использование отдаленной гибридизации и беккроссов
Растения-регенеранты Ro Самоопыление Получение семян Оценка и селекция Ri в поле Оценка Rs Получение семян и оценка Rs Оценка R« Гибридизация с диким видом Беккросс Fi Оценка и беккросс ВС1 Селекция лучших ВС2 и беккросс Селекция лучших ВСЗ и беккросс Селекция лучших ВС4 и беккросс Селекция лучших ВС5 и беккросс Селекция лучших ВС6 и беккросс Оценка сорта
Получение сорта за 4 года Получение сорта за 7—8 лет
-94-
В табл. 21 представлен расчет, сделанный американским исследова-
телем Д. Эвансом с соавторами (D. Evans et al., 1984), показывающий, что
использование сомаклональных вариантов может в два раза ускорить
процесс создания нового сорта даже в случае размножаемых семенами ра-
стений. Эти ученые получили и изучили генетически сомаклональные ва-
рианты томатов и выделили ряд форм с такими важными хозяйственны-
ми признаками, как цвет и форма плодов, форма роста куста, легко обла-
мывающаяся плодоножка.
К настоящему времени сомаклональные варианты получены у риса,
пшеницы, кукурузы, люцерны, картофеля, льна, табака и других растений.
В нашей стране успешно развиваются работы по получению и оцен-
ке сомаклональных и протоклональных (полученных нз протопластов)
вариантов картофеля. В частности, с использованием двух сортов карто-
феля в НИИКХ Госагропрома РСФСР Л. Хромова и др. (1984) получили
многочисленные сомаклоны. В ряде случаев они отличались от исходных
сортов и демонстрировали значительное разнообразие по морфофизио-
логическим признакам (табл. 22). Из большого числа линий, полученных
для каждого сорта, отобраны и проверяются в полевых условиях на ста-
бильность те, которые обладают хозяйственно важными признаками,
корректирующими отдельные недостатки исходного сорта. Например,
после трехлетних полевых испытаний сомаклонов сорта <Любимец> уда-
лось выделить линии, превосходящие сорт по урожайности, устойчиво-
сти к фитофторе и степени устойчивости к вирусам.
Таблица 22
Сомаклональные варианты картофеля с положительными отклонениями
от исходных сортов (лаб. клеточной селекции НПО «Картофель»)
Исходный сорт Способ отбора Хозяйственно-ценные признаки Передано селекционерам
<Раменский> <Былина> Регенерация после культивирования in vitro 100—250 дней Высокая продуктивность мощного куста Устойчивость к фитофторозу > 10—25% 5 исходных форм <Былина> и <Смена> в конкурсном испытании института
<Былина> Регенерация после культивирования in vitro 600-700 дней Улучшенные формы клубней Устойчивость к фитофторозу > 50—80%
<Смена> Регенерация после культивирования in vitro 100-200 дней Высокая продуктивность Устойчивость к фитофторозу
<Ульянов- ский> Клеточная селекция на среде с токсином С. sepedonicum, затем регенерация Повышение устойчивости к кольцевой гнили на 40—50%
Без клеточной селекции Повышение устойчивости на 10%
— 95 —
Протоклоны, полученные в Украинском НИИКХ V. Sidorov, М. Zubko,
A. Kuchko, 1987) и превосходящие исходные сорта по ряду признаков,
были включены в конкурсные испытания этого института. В работе Ган-
на и Дея (R. Gunn, Р. Day, 1986) 235 сомаклонов сорта <Feitwell> были
испытаны в поле, 92 из них были урожайнее прототипа, и все они обла-
дали геном устойчивости к одной из форм нематод, некоторые из них
были также резистентны к Y-впрусу картофеля.
Можно предположить, что получение сомаклонов наиболее важно
для селекции зерновых злаков, где традиционными методами сорта созда-
ются на узкой наследственной основе. Анализ сомаклонов, полученных
разными группами исследователей из каллусов сортов озимой и яровой
Рис. 31. Изменение формы и
размера колоса у сомаклональ-
пых вариантов яровой пшеницы
сорта <Целиноградская>:
1 — исходный сорт; 2, 3 — вари-
анты
пшеницы Tr. aestivum, показал большую из-
менчивость среди сомаклонов и отличие
их от исходного сорта по таким морфоло-
гическим признакам, как высота растения,
интенсивность кущения и число побегов,
отношение колоса к соломине, остистость
или безостость колоса, его форма (рис. 31),
окраска семян. По физиологическим при-
знакам растения различались по времени
вегетации, по устойчивости к низким тем-
пературам и условиям перезимовывания и
устойчивости к болезням (табл. 23)
(R. Butenko, I. Nikiforova, 1988).
Изучение запасных белков семян пше-
ницы в опытах Скоукрофта и др.
(W. Scowcroft et al., 1985) показало измене-
ние у сомаклонов спектра полипептидов
глиадина.
Таблица 23
Сомаклональные варианты яровой пшеницы Tr. aestivum
с генетически обусловленными ценными признаками
(Отдел биологии клетки и биотехнологии ИФР РАН)
Исходный сорт Способ отбора вариантов Включены в селек- ционный процесс Передано селекци- онерам Хозяйственно-ценные признаки, отличные от исходных сортов
сЦелино- градка> Сомаклоиальная вариабельность 13 10 форм Повышенная урожайность
-96-
Окончание
Исходный сорт Способ отбора вариантов Включены в селек- ционный процесс Передано селекци- онерам Хозяйственно-ценные признаки, отличные от исходных сортов
<Целин- ная — Юби- лейная> Сомаклональная вариабельность 3 1 форма Отличий не зафиксировано
Клеточная селекция 46 20 форм Весь комплекс хозяйственно-ценных признаков, высокая масса зерна с главного колоса
<Целин- ная-21> Сомаклональная вариабельность 4 1 форма Хорошая высокая кустистость
Клеточная се- лекция, низкие t, засуха 10 6 форм Весь комплекс хозяйственно-ценных признаков, высокая устойчивость
сСаратов- ская-29> Сомаклональная вариабельность 1 1 форма Отличий не зафиксировано Работа прекращена
Клеточная селекция, низкие 1, засуха 4 8 форм Повышенная устойчивость
Изучение R, сомаклонов 5 сортов озимой пшеницы, полученных в
совместных опытах ИФР РАН, ИМБ АН и Института земледелия Казах-
стана, показало большие морфофизиологические отличия сомаклонов от
исходных сортов и позволило отобрать формы с хозяйственно важными
признаками. Отобранные формы прошли проверку в разных регионах
Казахстана.
Вопрос о стабильности сохранения признаков сомаклонов очень ва-
жен и нуждается в проверке на большом экспериментальном материале.
Можно предположить, что у сомаклонов растений, размножающихся се-
менами, признаки, связанные с амплификацией генов, а также эпигене-
тические варианты будут элиминированы в процессе мейотического де-
ления. В то же время у картофеля и у других растений, размножаемых
вегетативно, они могут сохраняться в течение длительного времени, од-
нако затем могут быть утерянными, что и отмечается некоторыми иссле-
дователями (Л. Хромова и др., 1984). Значительный интерес представля-
ет вопрос об использовании или неиспользовании методов клеточной се-
лекции в комплексе с получением сомаклонов. Одной из наиболее силь-
ных сторон культуры in vitro в создании технологий для сельского хозяй-
ства является возможность на основе сомаклональных вариаций или ин-
дуцированных мутаций отобрать в жестких селективных условиях клет-
ки, характеризующиеся искомыми признаками. Технически нетрудно со-
— 97 —
здать селективные условия для отбора клеток на устойчивость к небла-
гоприятным факторам: высоким концентрациям солей, низким pH, гер-
бицидам, осмотическим стрессам, низкой или высокой температуре, па-
тотоксинам. Для этого селективные факторы либо добавляются в пита-
тельную среду, либо чашки Петри с высеянными на поверхность агаризо-
ванной среды клетками переносятся в селективные условия (например,
экстремальные температуры). Принцип отбора на устойчивость применя-
ют также и в случае необходимости отселектировать клетки, характери-
зующиеся повышенной способностью к синтезу незаменимых аминокис-
лот и синтезу белков. При этом в качестве селективных факторов исполь-
зуют аномальные аналоги незаменимых аминокислот или сами эти
аминокислоты в повышенных концентрациях.
Достаточно часто мутагенез значительно повышает эффективность
клеточной селекции. В качестве примера можно привести эксперименты
по клеточной селекции на устойчивость к высоким концентрациям NaCl
и этионина — аналога аминокислоты метионина, проведенные в лабора-
тории автора (В. Ошмарина и др., 1983). В эксперименте были использо-
ваны клетки, обработанные химическим мутагеном Н-нитрозо-К-мстилмо-
чевиной, и необработанные клетки, где источником генетического раз-
нообразия являлись сомаклональные вариации. Согласно полученным
данным мутагенез повысил выход стабильно устойчивых по данному при-
знаку клеточных клонов в 1,6 раза, а при селекции к двум неблаго-
приятным факторам (NaCl и этионину) — в 15,3 раза.
Из схемы экспериментов следует, что получение стабильно устойчи-
вых линий — процесс длительный. Первично полученные на средах с се-
лективными факторами колонии клеток могли возникнуть вследствие
физиологической адаптации или определенного состояния дифференци-
ровки клеток и не быть генетически устойчивыми. В течение 4—6 субкуль-
тивирований на селективной среде проверяется стабильность клонов. За-
тем их переносят на среду без селективного фактора и субкультивируют
еще 2—3 раза. И только после возвращения клонов опять в селективные
условия отбирают стабильные клоны и регенерируют из них растения. По-
лучение растений и их гибридологический анализ позволяют подтвердить
генетическую природу признака и дать его характеристику. На клеточном
уровне это делают или по ряду косвенных характеристик (низкая частота
появления клеток, характеризующихся данным признаком: устойчивое со-
хранение признака в селективных и неселективных условиях: увеличение
частоты появления признака после обработки мутагеном: гптем выявления
продукта измененного гена), или прямым изучением изменений в ДНК.
-98-
Сложность изучения генетической природы признака связана еще и
с тем, что механизмы создания устойчивости (в частности, к NaCl) могут
быть совершенно различны на уровне клетки и растения. Растение для
сохранения оптимальных для жизнедеятельности низких концентраций
ионов Na+ и СГ, а также для поддержания нормального осмотического
давления в условиях засоления использует особенности своих морфоло-
гических и анатомических структур и биохимических реакций. Клеточ-
ная устойчивость — только часть этого общего механизма. Однако in vitro
именно она является целью селекции. При этом устойчивость клетки к
NaCI и устойчивость интактного растения к засолению могут совпадать
или не совпадать.
Более сложным селективным фактором являются патотоксины как
патогенные, так и вирулентные. Сложность применения токсина в кле-
точной селекции была выявлена в работе Г. Рассадиной и Л. Хромовой
(1987), использовавших метод клеточной селекции для получения карто-
феля, устойчивого к кольцевой гнили, вызываемой Corinebacterium
sepedonicum. В качестве селективного фактора в работе использовали гру-
бо очищенный токсин этой бактерии, вызывающий те же симптомы за-
болевания, что и сам патоген. На питательную среду, содержащую разные
концентрации токсина, высевались клетки двух сортов картофеля — бо-
лее устойчивого и неустойчивого к патоген}’. На клеточном уровне раз-
личие их в устойчивости к токсину коррелировало с устойчивостью рас-
тений к патогену. Были отобраны стабильно устойчивые клеточные кло-
ны и на их основе получены растения. Однако не все растения из ста-
бильных клонов были устойчивы к токсину, и не все растения, устойчи-
вые к токсину, оказались устойчивыми к самому патогену. Более того, ав-
торам удалось обнаружить среди растений, регенерировавших из не под-
вергавшихся селекции клеток, сомаклоны, устойчивые и к токсину, и к
патогену. Эти результаты свидетельствуют о сложности оценки вклада
клеточной селекции в случае растений с высоким уровнем сомаклональ-
ной изменчивости in vitro.
Говоря о возможностях клеточной селекции, следует также упомя-
нуть о методах отбора культивируемых клеток по признак)7 ауксотрофно-
сти в отношении аминокислот, витаминов, пуриновых и пиримидиновых
оснований и других метаболически важных веществ. Ауксотрофные кле-
точные мутанты очень важны для понимания механизмов генной регуля-
ции синтеза этих веществ в клетке и растении. Метод негативной селек-
ции, применяемый для отбора ауксотрофных мутантов, описан в работе
Ю. Долгих (1982). Спонтанные клеточные мутанты и индуцируемые му-
-99-
тагеном будут представлены в главе, посвященной биотехнологии и био-
инженерии клеток — продуцентов метаболитов для промышленности. Ин-
тересен и метод отбора клеток табака по признаю высокого содержания
в них вируса мозаики табака (Н. Toyoda et al.. 1985 >. Растения, регенери-
ровавшие после нескольких субкультивирований клонов, отбираемых по
высокому титру вируса в них, были наследственно устойчивы к ВТМ.
Созданные методами клеточной селекции растения широко исполь-
зуются в селекционном процессе. Вместе с тем ж сейчас ощущается не-
достаток идей в области создания нетривиальных условий с целью полу-
чения растений, толерантных к засухе, высоким или пониженным темпе-
ратурам, болезням и вредителям.
.я Изолированные протопласты,
генная инженерия и получение
трансгенных растении
ГЛАВА ОДИННАДЦАТАЯ
Изолированные протопласты — новые и важные модели
клеток, освободившихся из деревянной тюрьмы.
Галстон
Изолированный протопласт — это вся клетка, за исключением цел-
люлозной стенки.
Еще со времен Клеркера (Klercker, 1892) был известен механический
метод получения протопластов с помощью плазмолиза и последующего
нарезания ткани мезокарпа огурца и других мясистых клубней. При этом
выделялись протопласты. В 1960 г. проф. Э. Коккинг из гриба Myrothecium
впервые получил изолированные протопласты высших растений энзима-
тическим способом. В дальнейшем именно энзиматический способ стал
основным методом выделения протопластов.
Таблица 24
Ферменты, разрушающие стенки
Название продукта Производитель
Целлюлаза R-10, Japan, а также другие фирмы
Целлюлизин Calbiochem, USA
Дрейселаза Kyoto Hakko, Japan
Г емицеллюлаза Sigma, UK
Мейселаза Tokio, Japan
Мацерозим R-10, Japan
Пектолиаза R-10, Japan
Розим Rohm a. Haas, USA
Рогамент Rohm, Darmstadt
Ксилоназа Russia
Ткани растений обрабатывают смесью ферментов: пектиназ и цел-
люлаз (табл. 24). При ферментной обработке необходимо найти опти-
мальные для данной ткани концентрацию и время действия ферментов,
а также добавить осмотики: сорбит или маннит (0,4—0,7 М). Осмотики
-101-
вызывают обезвоживание клетки, протопласт стх:дит ?т клеточной стен-
ки, собирается в виде шарика в середине клетьлт Эт: предохраняет про-
топласт от повреждения во время разрушения стенки После разрушения
клеточной стенки следуют отмывка изолированных протопластов от фер-
ментов и высев их на питательную среду с добавлением маннита или сор-
бита. В зависимости от вида и ткани растения для выделения протоплас-
тов используются различные комбинации ферментов и подбираются оп-
тимальные условия обработки. Стандартные условия обработки приведе-
ны ниже.
Стерилизующие растворы,
используемые при изолировании протопластов мезофилла листа
I. 1. 70% этиловый спирт (5 сек)
2. 0,5% гипохлорит кальция + 0,01% твин-80 (5 мин)
3. Промыть в 5 порциях стерильной воды
II. 1. 70% этиловый спирт (5 сек)
2. 0,1% диацид (этанол-меркурхлорид + цетил-пиридинийхлорид) — 3—5 мин
3. Промыть в 3 порциях стерильной воды
Подготовка листьев к инкубации в растворе ферментов
Удалить нижний эпидермис и разрезать на полоски шириной 0,5—1 мм (желательно в
растворе плазмолитика).
Поместить в раствор ферментов и плазмолитика (на поверхность раствора), инфильт-
рировать в вакууме, инкубировать в растворе ферментов (время, темературу и pH буфера или
среды подобрать эмпирически).
Раствор ферментов для изолирования протопластов мезофилла листа табака
Целлюлаза Р-1500 — 2%
Мацерозим — 0,5%
Маннит — 0,5 М
Декстрансульфат (6000) — 0,5%
Раствор ферментов для изолирования протопластов
из мезофилла листьев пробирочных растений картофеля
1. Ксилоназа 2. Маннит - 2% — 0,3—0,4 М (в зависимости от вида)
Добавки 1 2 3
Серин — — 0,1
6-БАП 5 0,9 1
Глютамин — — 250
2,4-Д 0,4 5 —
Колонии величиной 1 мм переносить на среду Мурасиге и Скхга (Бутенко, 1964)
Условия культивирования изолированных протопластов
1. Температура — 25—26 °C
2. Влажность — 80—90%
3. Рассеянный свет низкой интенсивности — 300—1000 люкс
- 102-
Естественным является вопрос: для чего получают изолированные
протопласты, какие преимущества они имеют по сравнению с клеткой?
Несомненным преимуществом изолированных протопластов является
удобство использования их в качестве модели для изучения транспорта
различных веществ через внешнюю клеточную мембран}' (плазмалемму).
При этом легче определить, проникли ли вещества, транспорт которых
изучают исследователи, в протопласт или они остались на поверхности
плазмалеммы. Изолированные протопласты представляют несомненный
интерес для изучения электрических свойств мембраны и воздействий на
нее химических и физических факторов. К этому можно добавить воз-
можность изучения структуры плазмалеммы, биосинтеза веществ клеточ-
ной стенки и их транспорта; построения стенки de novo. Самое главное —
это возможность различных генетических манипуляций с изолированны-
ми протопластами, введение в них генетической информации из клеток
других растений, прокариотов-симбионтов, и даже клеток животных, в
том числе и млекопитающих.
Изолированный протопласт может быть реципиентом для:
1) ядерного, митохондриального или хлоропластного геномов дру-
гих, в том числе и таксономически удаленных растений (соматическая
гибридизация и цибридизация);
2) отдельных генов или фрагментов чужеродной ДНК (плазмиды,
синтетические генные векторы);
3) изолированных клеточных органелл.
В ранних опытах «отца» культуры изолированных протопластов про-
фессора Э. Кокинга было установлено, что до образования новой оболоч-
ки протопласт, окруженный тонкой внешней мембраной, способен погло-
щать из окружающей среды не только низкомолекулярные вещества: ионы,
сахара, аминокислоты, но и, используя механизм пиноцитоза, крупные мо-
лекулы, частицы ферритина и капли латекса.
При пиноцитозе клеточная мембра-
на выгибается внутрь протопласта, отшну-
ровывается от поверхности и захватывае-
мая частица, например вирус, белковая
молекула, хлоропласт, прокариотическая
клетка, оказывается внутри протопласта.
Очень часто мембрана при этом разруша-
ется и частицы обнаруживаются непо-
средствено В цитоплазме протопласта. Рис. 32. Слияние изолированных
В 1970 Г. Э. Кокинг И сГО СоТЭУДНИ- протопластов (обозначено стрелкой)
ки предложили метод слиянщч протопластов, основанный на индукции
этого процесса нитратами ри:
- юз -
В 1974 г. К. Као и М. Михайлюк предложили свою методик)' слияния
изолированных протопластов, включающую использование полиэтилен-
гликоля в качестве агглютинирующего протопласты агента. Схема этой
методики приведена ниже.
1. Пастеровской пипеткой суспензию протопластов i0.1 мл) перене-
сти каплей на покровное стекло, помещенное в чашку Петри (60 х 15 мм).
2. Через 5 мин (после того, как протопласты осели на дно капли)
осторожно добавить маленькими каплями 0,45 мл раствора полиэтилен-
гликоля (м.в.1540) в концентрации 40%.
3. Инкубировать при комнатной температуре 15—30 мин.
4. Осторожно добавлять в течение 10 мин 0,5 мл питательной сре-
ды, в которой будут культивироваться протопласты.
5. Промыть протопласты 5 раз добавлением свежей питательной
среды с интервалом 5 мин между добавлениями. При промывке перед
добавлением свежей порции необходимо оставлять тонкий слой старой
среды на покровном стекле, чтобы не подсушить протопласты.
6. Суспензию протопластов в среде для культивирования (среды На-
гата и Такебе, Као и Михайлюка) перенести в чашки Петри (60 х 15 мм)
по 2 мл в каждую.
7. Протопласты смешать с агаризованной (температура 40 °C) пита-
тельной средой и разлить в чашки Петри по 5 мл в чашку.
Метод был далее улучшен путем соединения с предложенным ранее
У. Келлером и Д. Мельхерсом (1973) способом слияния с помощью среды
с высоким pH (10,5—11,0) и высокой концентрацией ионов кальция (100—
300 мМ).
На первом этапе ПЭГ (концентрация 28% в инкубационной среде)
вызывает агглютинацию изолированных протопластов, на втором этапе
по каплям добавляют среду с высокими pH и содержанием Са2+, приводя-
щую к слиянию. Эффект улучшается добавлением на втором этапе 2%
ДМСО (Z. Menzel, К. Wolfe, 1984). Этим методом можно было повысить
число слившихся протопластов до 50% и выше. При этом наблюдали как
гомо- и гетерологичные парные слияния, так и групповые. Многоядер-
ные продукты слияния нескольких протопластов чаще всего были нежиз-
неспособны (рис. 33).
В настоящее время все шире используется метод электрослияния
изолированных протопластов (U. Zimmerman, 1974). Принцип метода
основан на применении неоднородного электрического поля, создаваемо-
го переменным током напряжением 100—300 В/см и частотой 1 МГц в
камере, куда помещают изолированные протопласты и вводят электроды.
В этих условиях наблюдается диэлектрофорез, протопласты выстраива-
-104-
Рис. 33. Регенерация клеточной
стенки через 48 ч после высева
«голых» протопластов
и формирование колоний тканей:
1 — регенерация клеточной стенки
изолированным протопластом;
2 — первое деление клетки, образо-
вавшейся из изолированного
протопласта;
3 — второе деление этой клетки;
4 — третье деление;
5 — формирование колоний клеток
ются в цепочку между электродами. Для слияния используют сильный
импульс постоянного тока 1,2 кв/см в течение 50 мкс.
Метод массового электрослияния модифицируется и улучшается.
В последнее время появился вариант метода, позволяющий сливать пред-
варительно отобранные пары протопластов партнеров. Капли с отобран-
ной парой протопластов помещают на покровное стекло под слой мине-
рального масла. Электроды прикрепляют к конденсору инвертированно-
го микроскопа. Поднимая или опуская конденсор, вводят или убирают
электроды из капли (Н. Koop. Н. Schweider. 1985). Несомненное преиму-
щество этого типа электрослияния контролируемость процесса, увеличе-
ние числа попарно слившихся и. более того, специально выбранных для
этого протопластов) привлекает к этому мет — внимание и: лсед: вал-
лей. Попарное слияние протопластов-партнедсв л: ;:мд—щесн:й л:':;:-
дизации, дополненное методом культивировали* ст данных лг'сидны...
продуктов в микрокаплях (U. Gleba. 1978.1 на обюгыденных еде пал илш :
применением культуры-«няньки», по-новому решает труды-э: пдо'ле'яп :т-
бора гибридных продуктов при массовом, рандомичном слиянии
пластов.
Однако и в случае массового слияния есть метод, позволяющий быс-
тро и эффективно отобрать гибридные протопласты. Для этого может
быть использован проточный микрофлуориметр с сортером. При этом
протопласты-партнеры должны иметь разную флуоресценцию — или на-
тивную, или возникшую при окраске флуорохромами. В свете этих новых
возможностей старые методы отбора гибридных продуктов путем генети-
ческой комплементации с использованием мутантов, разных способов
— 1OS —
физиологической комплементации, прямого отбора гибридных растений
по морфологическим признакам постепенно теряют значение.
Для доказательства того, что полученные растения являются истин-
ными ядерными гибридами, авторы обычно изучают морфологические
признаки, состав полипептидов малой субъединицы рибулезо-бисфосфат-
карбоксилазы, кодируемой ядерными генами, проводят изозимный ана-
лиз. Рестриктный анализ митохондриальной и хлоропластной ДНК при-
меняют для определения того, какие цитоплазматические геномы унасле-
дованы соматическим гибридом от партнеров по слиянию.
Итак, техника получения изолированных протопластов разработана
для многих растений, в том числе зерновых злаков, бобовых и др. Куль-
тивирование и получение растений на основе протопластов хорошо уда-
ется для представителей семейства пасленовых, крестоцветных, зонтич-
ных, рутовых и некоторых других, сложнее — для злаков и бобовых. Од-
нако и здесь уже есть успехи. Благодаря использованию эмбриогенных
клеточных суспензий как источника протопластов удалось получить рас-
тения-регенеранты сначала у риса, а затем и у других злаковых культур.
И наконец, в самое последнее время появилось сообщение, что исследо-
вателям фирмы Мицубиси в Японии удалось получить растение — сома-
тический гибрид путем слияния протопластов риса и проса.
Гибридизация соматических клеток методом слияния протопластов,
без сомнения, обогатила клеточную биологию. Появилась возможность
изучать поведение гибридных ядерных геномов при разной степени так-
сономической удаленности партнеров. Межродовая соматическая гибри-
дизация между картофелем (S. tuberosum) и томатом (Lycopersicon esculentum)
позволила Мельхерсу с сотрудниками (J. Melchers, 1978) получить гибрид-
ные растения двух типов, которые авторы назвали «томато» и «помато»,
в зависимости от родовой характеристики хлоропластов гибрида. В пер-
вом случае хлоропласты были томатные, во втором — картофельные. Эти
растения не обладали хозяйственно полезными свойствами, но позволи-
ли наблюдать проявление признаков партнеров.
Ю. Глеба и Ф. Хоффман (U. Gleba, F. Hoffman, 1979) получили еще
более отдаленный межтрибный гибрид путем слияния изолированных
протопластов из каллусных клеток арабидопсиса (Л. thaliana) и мезофил-
ла листа турнепса (Brassica compestris). Цитологический и биохимический
анализ подтвердил гибридную природу шести изученных клеточных кло-
нов. Хромосомы обоих партнеров долгое время сохранялись без элими-
нации. В трех клонах авторы наблюдали стеблевой органогенез и появле-
ние уродливых пробирочных растений. Хромосомный анализ подтвердил
- 106-
Рис. 34. Цветущее растение
картофеля, полученное из
изолированного протопласта
их гибридный характер. Эти гибридные уродливые растения не цвели и
не образовывали нормальных корней. В некоторых линиях, где большин-
ство хромосом турнепса элиминировалось при субкультивировании, воз-
никали более нормальные, похожие на арабидопсис растения, при сохра-
нении хлоропластного генома турнепса.
При межвидовой соматической гибридизации могут возникнуть как
стерильные (например, Solanum melongena + S. tisymrifolium), так и фертиль-
ные (S. tuberosum + S. chacoense, S. tuberosum + S. brevidens') растения. В по-
следнем случае возникает возможность получить потомство от самоопы-
ления или обратного скрещивания с культурными сортами. Последнее
важно, так как часто у гибридов, например между сортами культурного
картофеля и его дикими видами, преобладают признаки последних.
Соматический гибрид картофеля между'
S. tuberosum (сорт «Приекульский» ранний) и
S', chacoense, полученный в 1979 г. Р. Бутенко и
А. Кучко, имел ряд хозяйственно важных при-
знаков (табл. 25). Кроме того, он отличался
необычным сочетанием ядерных и цито-
плазматических геномов (табл. 26). Была сде-
лана попытка вовлечь его в практическую се-
лекционную работу (А. Кучко и др., 1983). Од-
нако длительный процесс беккроссирования
не позволил получить формы, в которых бы
полностью отсутствовали признаки «дикаря»,
хотя после восьми беккроссов был получен гиб-
рид, имеющий полевую устойчивость к Y-ви-
русу и хорошую продуктивность (рис. 34).
Таблица 25
Хозяйственно важные признаки исходных форм
и межвидового соматического гибрида картофеля (Кучко и др., 1983)
Растение Содержание в клубнях Устойчивость к болезням Устойчивость к У-вирусу картофеля
крах- мал, % белок,% свежей массы Phytophlora in- festans (баллы)
.S. tuberosum
сорт сПриекуль- ский> ранний 9,16 1,5 2,0 Неустойчив
.S', chacoense 13,61 3,55 9,0 Устойчив
Соматический Абсолютная поле-
гибрид 10,64 2,03 7,0 вая устойчивость
— 107 —
Преобладание признаков диких видов наблюдалось также при сома-
тической гибридизации сортов культурного картофеля с дикими видами
S. cardiophillum, S. pinnatisectum, S. bulbocastanum (X. Sidorov et al., 1987).
Таким образом, можно считать, что трудности, возникающие перед се-
лекционерами при соматической отдаленной гибридизации, те же, что и
при половой. Тщательная и длительная селекционная работа необходима
для перенесения индивидуальных генов, в частности генов устойчивости, от
дикого вида культурному сорту без значительного изменения уже сложивше-
гося генотипа последнего. В качестве одного из приемов для ускорения про-
цесса можно предложить получение сомаклональных вариантов из каллус-
ной ткани соматического гибрида. Разнообразные перестройки, наблюдаю-
щиеся в ядерных геномах культивируемых клеток, могут привести в резуль-
тате генетической рекомбинации к появлению растений регенерантов с
преобладанием признаков культурного сорта, но с присутствием отдельных
признаков «дикаря». Однако этот процесс вряд ли контролируем.
В связи с этим представляет интерес работа с гибридом .S’. tuberosum +
+ S. chacoense, которая длилась около 15 лет (А. Бургутин, М. Мусин, Р. Бу-
тенко, 1994; А. Бургутин, 1996).
Целью работы было изучение сомаклональных вариантных линий
растений соматического гибрида (А. Бургутин, 1996). Растения одной из
вариантных линий при выращивании в почве напоминали «культурного
родителя» (S. tuberosum) по габитусу куста и форме листа. Вполне понят-
но, что такие морфологические картины сходства могут быть результа-
том случайной конвергенции, аномальности и не связаны с генетическим
родством. Но мы не исключаем возможности сегрегации детерминант ге-
номов (или генов) партнеров по гибридизации и как результат — выщеп-
ления форм, повторяющих партнеров. Так как гибридологический ана-
лиз был нереален (отсутствие цветения), провели исследование изофер-
ментных спектров вариантных линий в сравнении с растениями гибрида
и партнеров по гибридизации (.S', tuberosum и .S'. chacoense). Анализ изофер-
ментов подтвердил гибридность формы, полученной в 1978 году. После
15 лет вегетативного размножения растения гибрида сохранили детерми-
нанты обоих партнеров, несмотря на потерю части хромосомного мате-
риала. С помощью анализа изоферментов авторами был обнаружен фе-
номен сегрегации детерминант партнеров по гибридизации у растений-
регенерантов (сомаклональных вариантов) соматического гибрида.
Так, маркерная изопероксидаза стеблей с Rf 0,36, специфичная для
.S', chacoense и обнаруженная у соматического гибрида, у линии № 5 и № 13 не
была найдена. У этих же линий отсутствовал компонент стеблей с Rf 0,40,
специфичный для S. tuberosum, найденный у гибрида и представленный у
остальных проанализированных вариантных форм.
- 108-
Наиболее ярким примером сегрегации детерминант партнеров в
изопероксидазной системе корней пробирочных растений была линия
№13. У этой линии отсутствовали маркерные компоненты S. tuberosum с
Rf 0,32 и 0,40, найденные у всех анализируемых вариантных линий и у
соматического гибрида.
Таким образом, принципиальный факт сегрегации детерминант
партнеров по гибридизации показан, по-видимому, впервые, в этой рабо-
те для сомаклональных вариантных растений соматического гибрида.
Единственное сообщение, где есть прямое указание на сегрегацию гене-
тических маркеров партнеров по соматической гибридизации, касается
сублиний культивируемых клеток 5. tuberosum + N. plumbaginifolia, но не ра-
стений-регенерантов (Gilissen et al., 1992).
Высокая изменчивость растений-регенерантов от гибридного каллу-
са позволила провести эффективную клеточную селекцию на устойчи-
вость к хлористому натрию. Предложена короткая схема клеточной се-
лекции — всего одно субкультивирование на питательной среде с хлорис-
тым натрием. Длительное наблюдение над отобранными клонами расте-
ний in vitro (с 1984 г.) показало сохранность индуцированного свойства —
толерантности к хлористому' натрию.
Принципиальное отличие соматических гибридов, полученных мето-
дом слияния протопластов, от гибридов, полученных половым путем,
состоит в том, что в большинстве случаев при половом скрещивании
цитоплазматические гены передаются только от материнского растения,
а при соматической гибридизации — двуродительски (Ю. Глеба и др.,
1975). В результате сегрегации и элиминации геномов органелл могут
быть получены необычные сочетания ядерных и цитоплазменных генов.
Так, соматический гибрид (S. tuberosum + S. chacoense) имел пентаплоидный
набор хромосом (24 хромосомы дикого вида + 36 хромосом культурного
сорта), хлоропластный геном, идентичный геному пластид дикого вида,
а митохондриальный — культурному сорту (см. табл. 26).
Таблица 26
Идиом соматического гибрида
S. tuberosum + S. chacoense
Ядро Хл. ДНК Мит. ДНК
36 хромосом (3n) S. tuberosum 24 хромосомы (2n) S. chacoense S. chacoense S. tuberosum
Сегрегация ядер соматических гибридов, слияние изолированного
протопласта с цитопластом, лишенным ядра, слияние протопласта-реци-
пиента с энуклеированным протопластом или протопластом, ядро кото-
-109-
рого инактивировано облучением и не способно к делению, приводят к
получению так называемых цибридов. Цибридизация — способ введения
важных цитоплазматических генов, несущих такие признаки, как ЦМС,
устойчивость к некоторым гербицидам и патогенам.
Судьба и проявление активности органелл донора в кооперации с ге-
нетически различными ядрами реципиента еще недостаточно изучены.
Изучение это несомненно важно для познания генетики органелл и реа-
лизации их активности.
В литературе есть сведения о переносе этим способом гена устойчи-
вости к гербициду триазину, кодирующего синтез белка мембраны хло-
ропластов с м.в. 32 000, от устойчивого растения паслена черного к кар-
тофелю (J. Gressel et al., 1983). Может представить интерес использова-
ние цибридизации с целью переноса гена устойчивости к тентоксину
(Alternaria solanii) от табака к картофелю, а также других цитоплазмати-
ческих генов, определяющих устойчивость. При переносах цитоплазма-
тических генов кроме метода слияния изолированного протопласта-реци-
пиента с цитопластом или протопластом с инактивированным ядром воз-
можно использование и других методов их введения: микроинъекция или
перенос с помощью липосом.
На рис. 35 приведена схема
возможного переноса в изолиро-
ванный протопласт информаци-
онных‘макромолекул, аналогич-
но можно осуществить перенос
отдельных хромосом, кариоплас-
тов, клеточных органелл и бак-
териальных клеток.
Методы и условия таких ма-
нипуляций с клеткой, которые
можно назвать собственно кле-
точной инженерией растений,
еще только разрабатываются биотехнологами, последствия их в большин-
стве случаев не изучены. Об их значении для практической селекции го-
ворить еще рано. Кажется, что наиболее важным методом могли бы стать
перенос индивидуальных хромосом и получение анеуплоидных серий,
создание которых традиционными способами трудоемко и требует дли-
тельного времени. Вероятно, изолированные протопласты могут облег-
чить введение генов и получение трансгенных растений, что будет под-
робно изложено в следующем разделе.
Рис. 35. Перенос химерных генов в изоли-
рованный протопласт
-110-
Протопласты и генная инженерия
Под общим названием «генная инженерия» объединена большая
группа методов и технологий, направленных на изменение генома. Цент-
ральным компонентом генно-инженерной технологии является набор
приемов для переноса генов из одной биологической системы в другую.
Такой перенос в 1973 г. был назван трансгенозом. Полученные путем
трансгеноза организмы получили название трансгенных. В таблице 27
представлен список трансгенных растений, полученных к 1994 году.
Таблица 27
Трансгенные растения, полученные из изолированных протопластов
методом генной инженерии
(из Bajaj, 1994 г.)
Актинидия Яблоня
Антиринум Банан
Антуриум Физалис
Спаржа Ель
Лиственница Роза
Лимон Бархатцы
Ясень Пшеница
Несмотря на сравнительно небольшой срок исследования, уже созда-
ны универсальные системы, позволяющие клонировать гены микроорга-
низмов, животных и растений, встраивать их в способную к переносу
конструкцию и эффективно вводить ее в клетки растений. Существуют
своего рода «библиотеки» клонированных генов, которые могут исполь-
зовать исследователи. Разработаны методы трансформации двудольных и
однодольных растений и регенерации трансформантов из культур тка-
ней, клеток и изолированных протопластов.
Генная инженерия носит, как правило, биотехнологический харак-
тер, так как конечной целью является разработка приемов, позволяющих
получать организмы с новыми полезными признаками. В отношении рас-
тений это могут быть устойчивые к стрессам и высокопродуктивные сель-
скохозяйственные культуры (рис, пшеница, кукуруза, картофель, овощи
и другие пищевые растения). Наиболее важными проблемами являются:
♦ улучшение качества запасных белков зерна;
♦ повышение устойчивости к биотическим и абиотическим стрессам;
♦ повышение эффективности азотфиксации и расширение круга
культурных растений, способных к симбиотической фиксации азота.
В табл. 28 приведены некоторые клонированные гены, наиболее
важные для переноса в растения. Это гены запасных белков, ферментов,
хлоропластных белков. Трансгеноз последних, возможно, увеличит фото-
синтез и продуктивность.
-111 -
С помощью генной инженерии можно улучшить продукты вторично-
го метаболизма (биотрансформация путем введения чужеродных генов),
что имеет большое значение для клеточных штаммов и растений — про-
дуцентов биологически активных веществ.
Таблица 28
Некоторые клонированные гены растений
Запасные белки Ферменты
Глицимин, р-конглицины, Алкоголь-дегидрогеназа. лектин семян — соя каталаза, цитохром-с-оксидаза. Гордеин — ячмень сахарозо-синтаза — кукуруза Легумин — горох, бобы а-амилаза — ячмень Фазеолин — фасоль Бициллин — горох Халкон-синтаза — петрушка Зеин — кукуруза Тауматин (сладкий белок) — тауматококкус
Хлоропластные белки Прочие
Белок хлорофилл-белкового комплекса, м.с.РБФК — горох Фитохром — овес АТФ-синтаза, цитохром-f. Тубулин — хламидомонада б.с.РБФК — пшеница Ингибитор протеазы, г-РНК — бобы легоглобин — соя t-PHK — кукуруза
Обозначения: б.с. — большая субъединица;
м.с. — малая субъединица.
В клетках растений возможна экспрессия генов, перенесенных не
только от других растений, но и от микроорганизмов или животных
(рис. 36). Так, ген, выделенный из печени кролика, перенесен в табак
(трансгенный табак синтезировал после этого некоторые составляющие
крови печени кролика).
Генетическая трансформация уже приводит к интересным результа-
там не только для растительных клеток. Большой неожиданностью было
воспроизведение животных методом клеточной инженерии (клонирова-
ты трансгеноза
-112-
ние). Профессор Рослинг (Институт Эдинбурга) в 1996 г. из яйцеклетки
овцы убрал ядро и с помощью электропорации слил in vitro эту безъядер-
ную яйцеклетку с соматической клеткой молочной железы. Продукты
слияния имплантировали животному и получили потомство от сомати-
ческой клетки. В результате этих экспериментов родилось пять генети-
чески идентичных овец. Такого рода клонирование возможно и для лю-
дей, однако для таких экспериментов пока не пришло время.
Процесс трансформации начинается с выбора интересующего иссле-
дователя гена. В генных «библиотеках» можно получить гены в чистом
виде и количестве, необходимом для их клонирования с помощью бакте-
рий (см. табл. 28). Выбранный ген ставится под контроль регуляторного
участка ДНК — промотора. В качестве промотора чаще всего используют
регуляторный участок гена 35S белка из генома вируса мозаики цветной
капусты. Большой интерес представляют так называемые индуцибельные
промоторы, которые активируют транскрипцию введенных генов в ответ
на действие специфического «индуктора» (свет, повышенная температу-
Таблица 29
Оптимальные промоторы
и схема конструкции для трансформации растений
Растение Промотор
Nicotians plumbagifolia, Beta vulgaris — легумин V. faba, 35 S Ca MV
Ячмень Hordeum vulgare — малая субъединица РБФК (свет)
| XXX | | = [ | [ | Промотор"] - | Кодирующий участок^ |
регуляторные участки маркер
ра, действие патогена). Для удобства контроля за процессом трансфор-
мации в переносимую конструкцию обычно включают маркерные гены,
по экспрессии которых можно судить о том, произошло встраивание чу-
жеродного гена в геном реципиента или нет. В таблице 29 представлены
оптимальные промоторы для различных растений, а также схема генети-
ческих конструкций для трансгеноза. Маркерными часто являются гены
устойчивости к различным антибиотикам или гербицидам. В этом случае
трансгенные организмы отбирают на селективных средах, содержащих
эти вещества в летальных концентрациях. Используют также репортер-
ные гены, экспрессия которых не дает клетке селективных преимуществ,
но приводит к изменению фенотипа трансгенного растения. В настоящее
время широко используемым репортерным геном является ген [3-глюкуро-
нидазы (GL/S). Трансгенные клетки, экспрессирующие этот ген, при по-
мещении на специфический субстрат окрашиваются в голубой цвет. Для
— 114 —
кукурузы в качестве репортерных используют гены биосинтеза антоциа-
нов. Встраивание этих генов в клетки кукурузы вызывает появление ан-
тоциановой окраски, заметной под микроскопом или даже невооружен-
ным глазом (В. Bowen, 1992).
Методов введения генетического материала в различные клетки дос-
таточно много.
1. Поглощение свободной ДНК изолированными протопластами
(с помощью ПЭГ и Са++).
2. Перенос с помощью липосом.
3. Введение ДНК с помощью микроинъекций.
4. Введение ДНК в клетки, травмированные культивированием с иг-
лами из карбида кремния.
5. Культивирование с клетками A. tumefaciens или A. rhizogenes.
6. Использование вирусов в качестве векторов для переноса чуже-
родной ДНК в клетки реципиента.
7. Электропорация.
8. Электрофорез.
9. Баллистический метод (различные модификации) — введение ге-
нов путем «бомбардировки» объекта.
10. «Генобустер» (новый баллистический и более простой бомбарди-
рующий способ).
Наиболее распространенным способом введения генетической ин-
формации в двудольные растения является агробактериальная трансфор-
мация. Agrobacterium tumefaciens — почвенная бактерия семейства Rhizobia-
сеае, вызывающая у растений образование опухолей (корончатые галлы),
имеет большую плазмиду, которая является природным вектором. Благо-
даря своему строению Ti-плазмида (от tumor induced) переносит в ДНК
клетки-хозяина часть своей последовательности, так называемую Т-ДНК.
В природе встраивание Т-ДНК в растительную клетку вызывает образо-
вание опухоли. Экспериментальным путем из Ti-плазмиды можно выре-
зать гены, индуцирующие опухолеобразование, и вставить вместо них
последовательности, которые желательно перенести в растения.
Другим естественным вектором является Ri-плазмида другого вида
почвенных'бактерий — A. rhizogenes. Встраивание этой плазмиды в геном
клеток растений вызывает интенсивное образование корней в месте ин-
фекции (отсюда и видовое название — «агробактерии»). Нативные, или пе-
рестроенные, Ri-плазмиды используют для получения «бородатых корней».
К сожалению, большинство видов однодольных растений в природе
не заражаются агробактериями, поэтому пригодность для них Ti- или Ri-
плазмид в качестве векторов остается проблематичной. Для введения ге-
-114-
нов в однодольные растения чаще всего используют прямой перенос
ДНК: электропорацию, баллистическую трансфекцию, метод силиконово-
карбидных волокон.
Суть метода баллистической трансфекции заключается в том, что
на частички металла (золота или вольфрама) осаждается ДНК, а затем
они разгоняются в установке с использованием электрического разряда
или давления газа и направляются в растительные ткани. Попадая внутрь
растительной клетки, металлические частицы вносят туда и ДНК.
Баллистический метод был успешно использован для многих сель-
скохозяйственных культур класса однодольных, в том числе для риса, ку-
курузы и пшеницы (М. Kinnon, М. Abedinia, R. Henry, 1996).
Легче всего ввести генетическую информацию в протопласты, од-
нако затем неизбежно возникают проблемы регенерации из трансформи-
рованных протопластов растений. Для некоторых видов они до сих пор
остаются непреодолимыми. При использовании баллистической транс-
фекции, электрофореза или агробактериальной трансформации реципи-
ентом чужеродных генов могут быть каллусные или суспензионные клет-
ки, меристематические зоны, щитки незрелых зародышей. Хотя эффек-
тивность трансформации сравнительно невысока, существует реальная
возможность получения трансгенных растений.
В Отделе биологии клетки и биотехнологии ИФР РАН совместно с
кафедрой сельскохозяйственной биотехнологии МСХА и ВНИИСБ ведут-
ся работы по генетической трансформации пшеницы методом электро-
фореза. Обьект исследования — яровая мягкая пшеница (сорт <Таежная>).
Использовали две генетические конструкции: рк22Ар24 (содержит ген
тауматин-осмотин подобного белка и ген nptll — устойчивости к канами-
цину) и рВ1 121 (содержит гены nptll и GUS).
Введение гена осмотина для яровой пшеницы имеет практический
интерес. Получение трансгенных регенерантов с введенным геном осмо-
тина полезно, так как такое растение может быть устойчивым к природ-
ным стрессам, таким, как засуха, засоление почвы, а иногда может про-
тивостоять и патогенам.
Были проведены эксперименты по электрофоретическому введению
чужеродной ДНК в морфогенные зоны каллусов. Временную экспрессию
гена GUS изучали через 48 ч после электрофоретического введения плаз-
мидной ДНК. Около 50% каллусов демонстрировало наличие транзиент-
ной экспрессии маркерного гена. Эти данные позволили продолжить
работу по созданию трансгенных растений пшеницы. В трех первых экс-
периментах было обработано 48 каллусов (табл. 30).
-115-
Таблица 30
Результаты экспериментов по электрофоретическому введению ДНК
в каллусные клетки пшеницы
№ эксперимента Число образовав- шихся каллусов Число регенерантов на селективной среде
зеленых белых
1996 год
1 18 — 1
2 16 7 4
3 14 8 3
Всего 48 15 8
1997 год
1 64 3 60
2 41 1 38
3 37 — 35
Всего 142 41 133
В двух зеленых канамицинустойчивых растениях, регенерированных
из обработанных каллусов, гистохимическим методом обнаружена эксп-
рессия гена GUS в листьях. Эти растения доведены до взрослого состоя-
ния, у них получены семена (Ri). При изучении наследования гена GUS в
потомстве R, получены следующие данные (табл. 31). Наличие расщепле-
ния по маркерному гену свидетельствует о том, что оба растения содер-
жат ген GUS в геноме. Анализ геномной ДНК растений с экспрессией
гена GUS методом ПЦР позволил установить наличие гена неомицинфос-
фотрансферазы (NPT II).
Таблица 31
Экспрессия гена GUS в листьях пшеницы (поколение Ri)
№ растения Число Экспресия гена GUS в листьях
положительная отрицательная
1 11 4 7
2 18 4 14
Следовательно, трансформация пшеницы методом электрофореза
дает возможность интегрировать в геном пшеницы рекомбинантную ДНК,
которая передается растениям последующего поколения (Ri). В настоящее
время продолжаются опыты по введению плазмиды рк22Ар24 методом
электрофореза в незрелые зародыши и каллусные ткани пшеницы.
Продолжаются поиски баллистических аппаратов компактного и
удобного типа. Такой аппарат сконструирован в Венгрии и получил на-
звание «Генобустер» (его производит фирма ELAKBT, Budapest, Hungary).
Авторы «Генобустера» проверяли возможность трансформировать эмбри-
- 116-
оиды и соцветия риса (Oriza sativa). Можно экспериментировать и с кле-
точными суспензиями риса. Камера «Генобустера» снабжена автоматичес-
кой электронной и контрольной системой.
Введение генетической информации в клетку еще не гарантирует ее
устойчивого встраивания в геном реципиента, а только в этом случае
возможно стабильное наследование трансгенов. Кроме того, нередки слу-
чаи слабой экспрессии или полного «молчания» встроенных генов. Наря-
ду с получением стабильных трансгенных растений, в которых чужерод-
ные гены успешно и активно работают на протяжении нескольких поко-
лений, известно немало фактов ослабления со временем экспрессии
трансгенов. Если проблема введения генетической информации в прин-
ципе уже решена, то изучение судьбы введенных генов, регуляция их
работы остаются в центре внимания исследователей.
В заключение хотелось бы подчеркнуть, что возможности манипули-
рования генами растений в настоящее время интересны для фундамен-
тальных исследований. Такие работы очень нужны для глубокого проник-
новения в молекулярную и клеточную биологию растительной клетки.
Вместе с тем уже сейчас многие исследователи, фирмы, селекционеры хо-
тели бы улучшить свойства существующих сортов растений с помощью
переноса генов. Зарубежные агрофирмы уже производят трансгенные ра-
стения риса, кукурузы, пшеницы, сои, картофеля, томатов, овощей и
фруктов (США, Канада, Китай). Трудно сказать, можно ли сейчас снаб-
жать фермеров семенами трансгенных растений. Возможно, надо обра-
тить внимание на побочные изменения растений. Пока неизвестно, бу-
дут ли такие изменения влиять на организм животных и человека. Веро-
ятно, ученым не надо забывать фундаментальные исследования, чтобы
подстраховать возможные последствия внесения чужих генов в растения.
.Ьиотехнологня и биоинженерия
клеток — продуцентов метаболитов
для промышленности
ГЛАВА ДВЕНАДЦАТАЯ
Технология - это Божий дар - ...Науки, так сказать, дружат
мать цивилизации, искусств и наук. с промышленностью, и они совокупными
усилиями хлопочут как могут
об общенародном благе.
Ф. Дайсон и Принстон Д.И. Менделеев
Еще более десяти тысяч лет назад, в эпоху собирательства дикорасту-
щих растений, люди начинали искать и собирать растения, которые обла-
дали лекарственными свойствами. Затем пришел черед растений, которые
становились пряными добавками к пище, собирали также растения, содер-
жащие различные красители. Шло время, человек осваивал землю, строил
города, создавал технику и выращивал разнообразные культурные расте-
ния. При этом прежде всего выращивали злаки, овощи, фрукты. В качестве
лекарственного сырья, как правило, использовали дикорастущие растения.
Однако постепенно природные запасы таких видов растений истощались.
Попытки плантационного культивирования растений, содержащих вторич-
ные метаболиты, далеко не всегда оказывались успешными. В частности,
выращивание некоторых растений (например, женьшеня) очень трудоем-
ко и длительно (минимум 7—8 лет). В ряде случаев при плантационном
культивировании резко снижается содержание вторичных метаболитов.
Многие растения тропической и субтропической флоры вообще невозмож-
но выращивать в культуре вне этих климатических зон.
В то же время возможно новое решение этой проблемы — культиви-
рование in vitro клеток растений, содержащих вторичные метаболиты.
Медицинская, пищевая, парфюмерная промышленность может рен-
табельно использовать метаболиты биомассы культуры клеток, продуци-
рующей вещества, идентичные интактным растениям. Однако возможно-
сти культуры клеток для получения ценных метаболитов шире. Биотех-
нолог может заняться поиском новых активных веществ, нехарактерных
- 118-
для целого растения, и, кроме того, с помощью биотрансформации полу-
чать более важные для промышленности метаболиты.
В шестой главе акцент в изложении вторичного метаболизма культи-
вируемых клеток растений был поставлен на выяснении его закономер-
ностей в популяции клеток in vitro — синтезе метаболитов, транспорте их
в клетке и депонировании в клеточных органеллах: вакуолях, свободном
пространстве. В той же главе были приведены таблицы основных мета-
болитов, синтезируемых клетками in vitro, — как присутствующих в
интактных растениях, так и новых активных веществ, характерных толь-
ко для клетки вне организма.
В данной главе основное внимание будет уделено биотехнологии
получения вторичных метаболитов на основе культур клеток растений.
Клеточная биотехнология для получения физиологически активных
веществ имеет ряд преимуществ по сравнению с использованием тради-
ционного растительного сырья:
1. Независимость получения биомассы клеток от климата, сезона,
погоды, почвенных условий.
2. Возможность оптимизировать и стандартизировать условия выра-
щивания суспензий клеток, синтезирующих нужные метаболиты.
8. Возможность автоматизации процессов.
Создание производств на основе клеточных биотехнологий требует:
1. Прогнозирования потребности и рентабельности предполагаемо-
го продукта.
2. Фундаментальных разработок и создания штаммов-сверхпродуцен-
тов.
3. В случае рентабельности продукта — исследования возможности
масштабирования процесса: переход к пилотным установкам и затем к
крупномасштабному производству.
4. Разработки полупромышленных и промышленных технологий (со-
здание промышленных биотехнологических центров).
Исполнители таких программ: молекулярные и клеточные биологи,
специалисты-биохимики, инженеры, экономисты, менеджеры, финансисты.
Принципиально важное значение для промышленного получения
ценных веществ с использованием культур клеток высших растений име-
ет способ их выращивания. Для разработки эффективных технологий не-
обходимы специальные инженерные разработки, выбор оптимальных ти-
пов биореакторов, разработка методов автоматизации процесса, оптими-
зация режимов культивирования для разных культур.
Вероятно, следует начать с условий выращивания клеточных куль-
тур, синтезирующих вторичные метаболиты.
-119-
Хорошо известно, что для успешного выращивания клеток растений
в жидкой среде необходимо создать непрерывное перемешивание суспен-
зии. В лабораторных условиях это обеспечивается использованием кача-
лок и роллерных установок, скорость вращения которых подбирается
таким образом, чтобы предотвратить седиментацию клеток и обеспечить
достаточную концентрацию растворенного кислорода. В большинстве
случаев скорость вращения составляет 50—120 об/мин для круговых ка-
чалок и 1—20 об/мин для роллерных установок (Р. Бутенко, А. Липский).
Клеточный рост при таком варианте периодического культивирования
описывается типичной S-образной кривой и достаточно изучен для боль-
шого числа клеточных культур (F. Wilson et al., 1971; P.King et al., 1973;
H. Street, 1977; P. Бутенко, 1963, 1990, и др.). Несмотря на отличия в спо-
собах перемешивания суспензионных клеточных культур при использова-
нии качалок и роллерных установок, эти способы культивирования по-
зволяют получать сходные результаты.
Для создания технологий промышленного выращивания суспензион-
ных клеточных культур необходимо использование биореакторов. При
выращивании суспензий в биореакторах проблемы перемешивания и аэра-
ции решаются другими спосбами. По своей конструкции биореакторы
(рис. 37) подразделяются на две большие группы по принципу перемеши-
вания культуральной жидкости.
1 — биореактор с механическим перемешивающим устрой-
ством; 2, 3 — барботажные биореакторы; 4, 5 — аэролифт-
ные биореакторы; 6 — биореактор с вынесенной циркуля-
ционной петлей; В — воздух
Рис. 37. Принципиаль-
ные схемы биореакто-
ров, наиболее часто
применяемых для
культивирования
суспензионных куль-
тур
В первой группе биореакторов перемешивание осуществляется толь-
ко путем аэрирования воздухом. При этом в барботажных биореакто-
рах — за счет поднимающихся пузырьков воздуха, в аэролифтных — с при-
менением специальной конструкции, создающей градиент плотности су-
спензии (как правило, это конструкция с внутренним цилиндром).
-120-
Вторая группа биореакторов — это аппараты с применением меха-
нических перемешивающих устройств.
Наиболее просто устроены конструкции барботажных биореакто-
ров. В этих биореакторах получены хорошие ростовые характеристики
для большого числа клеточных культур. Однако сложность поддержания
суспензии в гомогенном состоянии при высоких концентрациях биомас-
сы клеток ограничивает использование этих биореакторов. Несколько
больших значений максимальной концентрации клеточной биомассы
можно достичь созданием направленных циркуляционных потоков при
применении аэрлифтных биореакторов.
Аппараты с механическим перемешиванием позволяют изучать рас-
тительные клеточные популяции в очень широком диапазоне концентра-
ций биомассы клеток. Однако механическое стрессовое воздействие пе-
ремешивающего устройства на клеточную популяцию часто ограничива-
ет применение биореакторов этого типа.
Использование биореакторов для исследования растительных кле-
точных популяций дает целый ряд преимуществ (Р. Бутенко, 1977, 1978,
1986; Н. Street, 1977; М. Zenk, 1977):
♦ большой объем культивационного сосуда позволяет, не внося суще-
ственных возмущений, отбирать пробы большого объема, что очень важ-
но при анализе вторичных метаболитов, часто содержащихся в очень
низких концентрациях;
♦ возможность управления процессом культивирования по опреде-
ленному алгоритму на основе показаний датчиков, установленных в био-
реакторе (например, наращивание клеточной биомассы без лимитирова-
ния по кислороду путем варьирования скоростей вращения мешалки и
объемов барботируемого воздуха (А. Носов, 1992).
В то же время применение ферментеров оказывает дополнительные
воздействия на клеточную популяцию. Это воздействие механического
стресса при использовании механических перемешивающих устройств, из-
менения в концентрациях растворенных газов, пенообразование и образо-
вание так называемого «безе» — толстой корки, образующейся на границе
жидкой и газовой фазы и состоящей преимущественно из мертвых клеток.
Выращивание растительных клеточных культур в биореакторах воз-
можно проводить в различных режимах:
1. Периодическое культивирование. Это аналог выращивания в кол-
бах на качалке, однако с преимуществами, описанными выше.
2. Проточное культивирование. Этот режим характеризуется посто-
янным добавлением в биореактор свежей питательной среды и постоян-
ным отбором либо суспензии (открытое проточное культивирование),
-121-
либо отработанной среды (закрытое проточное культивирование). Про-
точное культивирование конструктивно более сложно, так как связано с
введением в схему биореактора дополнительных устройств (перистальти-
ческих насосов, разделительных устройств и др.).
Из практики микробиологических исследований широко известны
две разновидности открытого проточного культивирования: хемостат и
турбидостат.
Хемостатный метод реализуется при использовании биореактора, в
который с постоянной скоростью F (л/сут) подается питательная среда
и одновременно с той же скоростью (например, слив по уровню) отбира-
ется клеточная суспензия. Объем выращиваемой суспензии V (литры)
остается постоянным. Важным показателем хемостатного выращивания
является скорость разбавления D=F/V(сут~х). При этом роль внутреннего
регулирующего фактора в хемостате, определяющего концентрацию кле-
точной биомассы, играет количество лимитирующего субстрата.
Принцип турбидостата предусматривает измерение концентрации
клеточной биомассы в биореакторе и ее автоматическое поддержание на
постоянном уровне путем изменения скорости протока. Турбидостат ис-
пользуют при скоростях протока, близких к максимальной удельной ско-
рости роста, когда хемостат становится неустойчивым и может произой-
ти полное вымывание культуры из биореактора. Однако в силу сложности
непрерывного измерения светопоглощения культуры клеток растений, а
также из-за узкого диапазона корреляции между оптической плотностью и
сухой массой клеток турбидостатный метод для выращивания культур кле-
ток растений применялся достаточно редко (I. Wilson et al., 1971).
Хемостатный метод исследования растительных клеточных популя-
ций впервые был продемонстрирован Вильсоном с соавторами (I. Wilson,
Р. King, Н. Street, 1971) и в дальнейшем широко применялся (W. Kurz,
1971; I. Wilson, 1976; Н. Kato et al., 1976; I. Wilson, P. Marron, 1978;
M. Bertoia, F. Klis, 1979; C. Balague, I. Wilson, 1982; O. Sahai, M. Shuler,
1982; D. Dougall et al., 1983; W. Gulik et al., 1989). Использование хемо-
статного метода культивирования позволяет выделять фактор (чаще все-
го концентрацию ростлимитирующего компонента питательной среды),
определяющий физиолого-биохимическое состояние клеточной популя-
ции. Известные из микробиологии понятия стационарного и переходных
состояний клеточной популяции в целом верны и для хемостатного вы-
ращивания растительных клеточных культур. Так, было показано (Р. King
et al., 1973), что удельная скорость роста популяции клеток Acer
pseudoplatanus L. может контролироваться концентрацией нитрата в пита-
тельной среде согласно соотношению, определенному Моно для бакте-
-122-
рий (Monod, 1942). В работе Кинга (Р. King, 1977) показано существова-
ние переходных состояний клеточной популяции Acer pseudoplatanus при
изменении концентрации нитрата в среде и переключении лимитирую-
щего субстрата с нитрата на глюкозу. Во время переходных состояний,
вызванных этими ступенчатыми изменениями, наблюдали осцилляции
концентраций нитрата в питательной среде, внутриклеточного пула азо-
та, белка и некоторых других параметров.
Расчет удельных скоростей роста суспензионных культур во время
переходных состояний часто дает значение максимальной удельной ско-
рости роста большее, чем расчитанное для экспоненциальной фазы пе-
риодической культуры. В то же время в условиях хемостатного выращи-
вания не всегда удается поддерживать в течение продолжительного вре-
мени стационарное состояние. Например, было показано, что культура
клеток табака росла в условиях хемостата 1—2 недели, после чего клетки
темнели и лизировались (S. Azechi et aL, 1983). При этом в качестве про-
точной среды была использована стандартная питательная среда для пе-
риодического выращивания культуры клеток табака. Только после увели-
чения концентрации всех компонентов проточной питательной среды
удалось получить в условиях хемостата стационарное состояние в тече-
ние 73 суток. Авторы сделали вывод, что для поддержания стабильно
пролиферирующей культуры необходимо обеспечивать достаточно высо-
кую концентрацию компонентов питательной среды.
Наряду с лимитирующей концентрацией субстрата на развитие су-
спензивной культуры растительных клеток, растущей в условиях хемо-
стата, значительное влияние оказывает и скорость протока. Увеличение
скорости протока выше максимальной удельной скорости роста приводит
к вымыванию культуры растительных клеток из биореакторов. Поэтому
этот метод не пригоден для изучения нерастущих клеточных популяций.
Увеличение скорости протока, интенсивности аэрации и перемеши-
вания может существенным образом изменять морфофизиологические
характеристики клеточной популяции в хемостате (S. Azechi et al., 1983).
В измененных условиях размер клеток уменьшался, а их количество в
агрегате увеличивалось. При высоких скоростях протока изменяется со-
став популяции клеток — в ней остаются только интенсивно делящиеся
клетки. В ряде случаев состояние постоянной пролиферации для расти-
тельных клеток оказывается невозможным и популяция погибает
(О. Кандараков и др., 1994).
Новые возможности изучения физиолого-биохимического состояния
клеточной популяции появляются в системе закрытого протока, при ко-
торой не происходит удаления клеточной биомассы. При этом питатель-
-123-
ная среда добавляется в биореакторный сосуд постоянно и с той же ско-
ростью из него удаляется бесклеточная культуральная жидкость. Данную
систему выращивания растительных клеток правильнее называть «закры-
тым по биомассе протоком», однако обычно используется термин «за-
крытый проток», несмотря на его формальную нелогичность.
Наиболее сложным моментом в организации этой системы выращи-
вания является разработка конструкции непрерывного отделения биомас-
сы от культуральной жидкости. Возможны следующие варианты решения
этой проблемы: с использованием мембран и путем седиментации клеточ-
ной биомассы. Как и для режима открытого протока, концентрация ли-
митирующего компонента питательной среды и скорость протока — это
основные регулирующие воздействия при исследовании режима закрыто-
го протока. Изменяя эти параметры, можно управлять основными физи-
олого-биохимическими характеристиками клеточной популяции. Увели-
чение скорости протока питательной среды (I. Wilson et al., 1971) позво-
лило на протяжении 15 суток поддерживать экспоненциальный рост кле-
ток. Это происходило, вероятнее всего, за счет поддержания концентра-
ции питательных веществ на оптимальном для максимального клеточно-
го роста уровне. Однако увеличение скорости протока выше максималь-
ной удельной скорости роста культуры приводило к остановке роста и
последующей гибели культуры (А. Орешников и др., 1994). Этот феномен
объясняли вымыванием факторов кондиционирования (см. термины)
протоком питательной среды. В работе (А. Орешников, 1996) было пока-
зано, что в биореакторе в режиме закрытого протока можно получить
клеточную популяцию, состоящую из очень старых клеток, и поддержи-
вать ее в течение продолжительного времени.
Еще один способ использования культур клеток для получения вто-
ричных метаболитов — иммобилизация клеток. Суть его состоит в заклю-
чении живых клеток в определенный носитель. Затем через носитель с
клетками пропускают питательную среду (или просто помещают в пита-
тельную среду). При этом клетки прекращают рост, но могут достаточно
долго оставаться живыми и продуцировать необходимые вещества, выде-
ляя их в среду.
Установлено, что для крупных растительных клеток самым подходя-
щим из широко используемых методов иммобилизации является включе-
ние в гель. Известны также примеры иммобилизации растительных кле-
ток методами адсорбции. Наиболее трудный момент при иммобилиза-
ции — невозможность продолжать существование клеток достаточно дол-
гое время и быстрая гибель при накоплении метаболитов в клетках. Сам
процесс иммобилизации может изменять основные физиолого-биохи-
- 124-
мические характеристики клеточной популяции. Поэтому рассмотрим бо-
лее подробно, как влияет иммобилизация на свойства клеточных культур.
В серии статей Lindsey и Yeoman были проведены детальные иссле-
дования воздействия иммобилизации на культуру клеток перца Capsicum
frutescens (К. Lindsey, М. Yeoman, 1983, 1984). Было показано, что процесс
иммобилизации приводит к снижению скорости клеточных делений и
синтеза белка (К. Lindsey, М. Yeoman, 1983). При этом концентрация кап-
саицина в иммобилизованных клетках была значительно более высокой,
чем в суспензионной культуре (К. Lindsey, М. Yeoman, 1984). В продолже-
ние этой работы было показано (М. Holden et al., 1987), что другим важ-
ным следствием клеточной иммобилизации является снижение интенсив-
ности синтеза материалов клеточной стенки, которая содержит значи-
тельные количества фенольных соединений. Возможный результат этого
процесса — перераспределение части фенольных соединений для синте-
за капсаицина. Увеличение синтеза капсаицина иммобилизованными
клетками было объяснено изменением баланса первичного и вторичного
метаболизма в сторону последнего.
Другим важным фактором, определяющим разницу между свободны-
ми и иммобилизованными клетками, является отличие в агрегированно-
сти и степени клеточных контактов. Более высокая агрегированность в
случае иммобилизованных клеток приводит к значительной гетерогенно-
сти внутри гранул геля или другого материала. Это проявляется в значи-
тельном варьировании физического и химического микроокружения от
центра гранул тела к периферии, в частности — разнице в освещении,
градиентах по питательным веществам, кислороду, углекислому газу и
другим факторам. Считают, что суммарное воздействие регуляторного
градиента и увеличение клеточной агрегированности оказывают допол-
нительное воздействие на экспрессию в иммобилизированных клетках
метаболических путей синтеза вторичных соединений (М. Yeoman,
К. Lindsey, 1985). Другим важным следствием (R. Hal et al., 1988) может
быть снижение выхода метаболитов из клеток из-за наличия концентра-
ционного градиента от плазмалеммы к жидкой среде, в которую погруже-
ны гранулы геля. Этому процессу препятствует увеличение клеточной
агрегированности и/или существование гелевого слоя. Особое клеточное
окружение способствует более эффективному использованию кофакто-
ров, играющих существенную роль в клеточном метаболизме. Было пока-
зано, что более высокая способность клеточной культуры С. roseus транс-
формировать триптамин в алкалоиды аймалинового типа является ре-
зультатом эффективного оборота эндогенной HADPH внутри клеток при
их иммобилизации (Р. Brodelius et al., 1979). С другой стороны, Альфер-
-125-
ман и др. (A. Alfermann et al., 1980) изучали гидроксилирующую способ-
ность клеток Digitalis lanata продуцировать метилдигитоксин. При этом
было показано, что гидроксилирующая способность иммобилизованных
клеток в 2 раза меньше, чем суспензионной культуры. Однако период, в
течение которого можно было эффективно осуществлять процесс транс-
формации для иммобилизованных клеток, был более продолжительным
и составлял 170 суток.
Теперь остановимся на веществах, которые можно получать при
помощи культур клеток.
Одной из первых лабораторий, которая обратила внимание на воз-
можность использования культур клеток для получения ценных лекар-
ственных веществ, была руководимая автором Лаборатория культуры тка-
ни и морфогенеза Института физиологии растений АН СССР.
В 1960 г. в лаборатории уже культивировались клетки (в том числе и
суспензии в роллере) женьшеня настоящего (Panax ginseng), дихроа проти-
вомалярийной (Dichroa febrifuga). Были получены также культуры клеток
барвинка розового (Vinca rosea), имеющего противогипертонические свой-
ства, раувольфии змеиной (Rauwolfia serpentina), биомасса которой исполь-
зуется для получения лекарственных средств против аритмии.
За время существования лаборатории (впоследствии — Отдела био-
логии клетки и биотехнологии) в ней создана большая коллекция клеток
и тканей, в том числе продуцентов промышленно ценных метаболитов.
Чтобы было ясно, как ведут себя клетки, несущие лекарственные,
эфирно-масличные, пищевые и другие метаболиты, продемонстрируем
это на примере двух растений: женьшеня настоящего Panax ginseng и ди-
оскореи дельтовидной Dioscorea deltoidea. Начнем с женьшеня Panax ginseng,
который содержит тритерпеновые гликозиды даммаранового типа. Ле-
карственные свойства женьшеня разнообразны: стимулирующее действие
при общей усталости, снятие различных стрессов, увеличение иммуните-
та, снятие гипотонического состояния, невралгии, импотенции.
Медики изучают свойства гликозидов женьшеня, которые делятся на
две группы. Первая группа — гликозиды с агликоном протопанаксадио-
лом: Ra; Rb; Rb2; РЬЗ; Rc; Rd; Rg3; F2, (Rb — фактор роста нервной тка-
ни). Вторая группа гликозидов имеет в качестве агликона протопанаксат-
риол. К ней относятся гликозиды Re; Rf; Rgl; Rg2; Rhl.
За год прирост корня в тайге составляет 1 г, на плантации — 3 г. При
выращивании клеток корневого происхождения на агаре можно получить
0,4 г сухой массы на литр среды в день. Биомасса клеток женьшеня в сус-
пензии при выращивании в 50-литровом ферментере увеличивается на
2,0 г в литре среды за сутки, что в 1000 раз больше, чем при выращива-
- 126-
нии на плантации. Учитывая высокую стоимость женьшеня (килограмм
плантационного корня стоит 100—150 дол. США; цена дикорастущего
корня может доходить до нескольких тысяч долларов США), биотехно-
логический способ получения биомассы культуры клеток женьшеня весь-
ма привлекателен.
Для получения хорошей культуры клеток женьшеня очень важен
выбор исходного растения и экспланта. Женьшень предпочтительно
брать из тайги, а не с плантаций, с хорошо растущим и готовым к цвете-
нию стеблем. Корень желательно выбирать мужского типа с большим ко-
личеством боковых корней. Экспланты для получения первичных каллу-
сов лучше брать из паренхимы верхней половины корня. Затем эксплан-
ты стерилизуют, промывают и переносят кусочками в чашки Петри с
агаризованной средой, агарозой или гель-ритом. Последние (агароза и
гель-рит) лучше стимулируют развитие первичного каллуса. Женьшень
как каллусная культура хорошо растет на плотных средах и легко может
быть переведен в суспензию.
Следующий этап получения хорошего промышленного штамма — ис-
пользование различных генетических подходов для увеличения его про-
дуктивности по биомассе и целевому продукту. Можно обработать клетки
мутагеном (например, NMM), отселектировать и получить мутанты с
улучшенными признаками. Можно также отселектировать сомаклональ-
ные варианты, а можно прибегнуть к генной инженерии и ввести в изо-
лированные протопласты и клетки гены, которые могут увеличить син-
тез тритерпеновых гликозидов.
Несомненно, на продуктивность клеток женьшеня влияют факторы
культивирования: углеводное питание, фитогормоны, pH, действие света
разного спектра. Поэтому следующим этапом должна быть оптимизация ус-
ловий культивирования полученных штаммов. Особенно остро женьшень
реагирует на повышение температуры. При температуре выше 27 °C клетки
не пролиферируют и постепенно уменьшаются в числе. Оптимальной для
женьшеня является температура около 24—25 °C. При этом изменение тем-
пературы в сторону повышения гораздо опаснее, чем в сторону снижения.
Очень сильно влияет на продуктивность женьшеня режим выращи-
вания суспензии в ферментерах. Например, при периодическом режиме
культивирования сухая масса в конце цикла выращивания (2 недели) со-
ставляет 25 г/л, а при проточном культивировании ее можно получить
до 80 г/л за это же время. Мы еще вернемся к режимам культивирования
в биореакторах.
Поведение in vitro клеток женьшеня Panax ginseng близко к культурам
клеток других аралиевых, произрастающих в России и других странах. Это
-127-
женьшень американский Рапах quinquefolius (культура получена Р. Бутенко);
женьшень японский Рапах japonicus (И. Грушвицкий); Polyscias filicifolia
(Н. Писецкая); Eleutherococcus senticosus, Aristolochia manshuriensis (Ю. Журав-
лев). Медики считают, что американский женьшень, растущий в Канаде и
США, так же полезен, как и Рапах ginseng (дальневосточный). Японские
медики предпочитают смеси полисциаса Polyscias filicifolia с женьшенем (Р.
quinquefolius). Сохранившиеся в ледниковую эпоху реликтовые лекарствен-
ные растения семейства аралиевых являются лекарственными, и перевод
их в культуру in vitro, несомненно, полезен. Необходимо подключить их ге-
нофонд для криосохранения, чтобы не потерять изначальные клетки, а
также сверхпродуценты, которые получены как сомаклональные варианты,
мутанты или трансгенные растения. Клетки в криобанках могут долго со-
хранять тотипотентность и способность к морфогенезу, что позволяет раз-
множить исчезающие реликтовые растения (см. следующую главу).
Промышленное применение биомассы культуры клеток аралиевых
разнообразно. Прежде всего это медицина. В настоящее время разреше-
на к применению и производится настойка из культуры клеток женьше-
ня настоящего — «Настойка биоженьшеня». Для ее получения использу-
ется штамм культуры клеток, полученный Р.Г. Бутенко в 1960 году из ди-
корастущего дальневосточного корня женьшеня настоящего. Очень перс-
пективно использование биомассы культуры клеток женьшеня в космети-
ке и пищевой промышленности. В Отделе биологии клетки и биотехно-
логии получены авторские свидетельства на кремы, лосьоны и другую
парфюмерию на основе биомассы культуры клеток женьшеня. Эффектив-
но использование биомассы женьшеня в качестве пищевой добавки при
выращивании молодняка птиц и пушных зверей, что уменьшает их падеж
в начале роста.
Перейдем теперь от женьшеня к еще одному важному для медицины
растению, длительное время нами культивируемому in vitro. Это диоско-
рея дельтовидная (Dioscorea deltoidea), корневище которой содержит стеро-
идные гликозиды (сапонины) с диосгенином в качестве агликона. Долгое
время диосгенин, получаемый из корневищ диоскореи, был лучшим сы-
рьем для получения стероидных гормонов. Диоскорея дельтовидная ро-
дом из Индии, где она произрастала в диком виде и занимала большие
плантации. Теперь на родине она уже исчезает как в дикорастущем со-
стоянии, так и на плантациях. Другие виды диоскорей также очень ред-
ки — практически исчезли диоскорея кавказская и диоскорея ниппонская,
лишь в небольших количествах встречается диоскорея балканская. Эти
гри вида диоскореи в настоящее время перенесены в криобанк. Но ос-
новная работа длительное время (с 1971 г.) ведется в Отделе биологии
- 128-
клетки и биотехнологии ИФР РАН с Dioscorea deltoidea (М. Саркисова, Р.
Бутенко, А. Синюхин, 1971).
При получении культуры клеток в качестве эксплантов были избра-
ны паренхимные ткани корневища, которые и образовали на агаровой
среде первичные каллусы. Затем каллусные клетки были перенесены в
жидкую питательную среду. Каллусные культуры, растущие на агаре, были
обработаны мутагеном N-нитрозометилмочевиной (NMM), что позволи-
ло перевести клетки в суспензию (3. Шамина, М. Саркисова). После ста-
билизации в суспензии была продолжена работа с тем же мутагеном
(С. Каранова). Она обрабатывала клетки из суспензии в дозах 0,5, 1,0, 8,0
ммоль/час. В качестве контроля служил исходный штамм Д1 — необрабо-
танная NMM клеточная суспензия. Штаммы, полученные в результате мута-
генеза, и контрольный штамм значительно различались по содержанию сте-
роидов (диосгенина и его стереоизомера ямогенина). Лучшие результаты
были получены у штамма ИФР ДМ-0,5, полученного после обработки неболь-
шой дозой мутагена (0,5 ммоль/час). В этом штамме не было ямогенина, а
содержание наиболее важного стероида — диосгенина — на порядок прево-
сходило контрольный и иные мутантные штаммы. Интересно, что все штам-
мы различались между собой по содержанию ямогенина. Следующим за
ИФР ДМ-0,5 по этому признаку шел ИФР ДМ-8 (доза мутагена при получе-
нии 8 ммоль/час) — треть стероидов в нем была представлена ямогенином.
Ямогенина больше всего оказалось в штамме ИФР ДМ-1 (обработка NMM
1 ммоль/час) — более чем в два раза по сравнению с диосгенином. Конт-
рольный штамм, не подвергавшийся мутагенезу, имел почти одинаковое со-
держание диосгенина и ямогенина. Полученные штаммы незначительно раз-
личались по содержанию фитостеринов (стигмастерина, ситостерина,
кампестерина и холестерина). Только в мутантном штамме ИФР ДМ-1,0 стиг-
мастерина было от 3 до 10 раз больше по сравнению с другими штаммами.
Таким образом, разные дозы мутагена привели к существенным измене-
ниям в стероидном метаболизме в штаммах. При этом был получен штамм
со сверхпродукцией диосгенина — количество этого стероида в штамме ДМ-
0,5 значительно превосходило его содержание в других штаммах.
Интересно, что в клетках диоскореи in vitro наблюдается синтез толь-
ко фуростаноловых (водорастворимых) гликозидов с агликонами — диос-
генином и ямогенином. При этом один из гликозидов (дельтозид) в
интактном растении находится в корневище, а другой (протодиосцин) —
в надземных органах. В клетках in vitro, как было показано методом
ВЭЖХ, оба гликозида существуют вместе.
Представляют интерес физиологические особенности существова-
ния штаммов в суспензии. Как было сказано выше, в суспензионных куль-
-129-
турах практически не наблюдается одиночных клеток. Большинство кле-
ток собрано в кластеры (агрегаты). Размеры агрегатов могут быть различ-
ны — от 5—20 клеток в агрегате (оптимальный вариант) до нескольких
сотен (крупноагрегированная суспензия). Штаммы культуры клеток диос-
кореи дельтовидной значительно различаются количеством клеток в аг-
регатах. Контрольный (исходный) штамм имел преимущественно неболь-
шие группы клеток (по 2—5 клеток в агрегате), ДМ-0,5 в основном имел
кластеры по 10—20 клеток, ДМ-1,0 состоял из равных количеств агрега-
тов — по 2—5 и 10—20 клеток. Наиболее сильно отличался от других
штамм ДМ-8,0: он был крупноагрегированным и имел большие кластеры
(более 20 клеток в агрегате).
Работа продолжалась в основном со штаммом ДМ-0,5, так как он был
богат диосгенином и содержащими его стероидными сапонинами. Было
показано влияние различных форм азота на продуктивность стероидных
сапонинов. Оказалось, что соотношение аммиачного азота к нитратному
1 : 3 определило продуктивность в конце цикла выращивания по сухой мас-
се клеток 10 г/л и продуктивность по диосгенину 390 мг/л (13,7 мг/л/сут).
Соотношение NH^ : NOg = 2 : 3 не оказало влияния на продуктивность по
биомассе, но привело к снижению накопления диосгенина — 160 мг/л (5,7
мг/л /сут). В результате оптимизации углеводного питания культуры (саха-
роза в количестве в 1,5, 3,0, 5,0%) было установлено, что высокие концент-
рации более эффективны для роста массы клеток, но продуктивность по
диосгенину (в расчете мг/л/день) была больше при низкой концентрации
сахарозы. И наконец, вариация фитогормонов в среде практически не ока-
зывала влияния на продуктивность культуры по биомассе. Оптимальной
комбинацией фитогормонов оказалась 2,4-Д 0,25 мг/л и кинетина 0,1 мг/л.
Очень важным для промышленного использования является стабиль-
ность штаммов по росту и синтезу вторичных метаболитов. Штаммы
Dioscorea deltoidea были стабильны длительное время (около 27 лет).
Штамм ДМ-0,5 — сверхпродуцент фуростаноловых гликозидов — сохра-
нил в течение этого времени высокую способность к синтезу — 6—8% в
сухой массе клеток.
Последним этапом разработки технологии выращивания культур кле-
ток в биореакторах является масштабирование процесса, т.е. оптимиза-
ция культивирования в биореакторах большого объема. К настоящему
времени накопилось достаточно много фактов об успешном масштабиро-
вании различных культур клеток до биореакторов объемом несколько
кубометров. Например, специалисты немецкой фирмы DIVERSA (ныне —
FYTON) осуществили выращивание ряда культур в биореакторах объе-
мом до 75 000 литров.
-130-
Практика работы Отдела биологии клетки и биотехнологии показа-
ла необходимость точно соблюдать правила выращивания культур клеток
в биореакторах для поддержания высокой эффективности процесса
(А. Носов, А. Орешников, О. Кандараков). Оптимизированы режимы
культивирования целого ряда различных культур клеток высших расте-
ний в биореакторах объемом до 630 литров: женьшеня настоящего, поли-
сциаса и других аралиевых, диоскореи дельтовидной, маральего корня и
др. В промышленном масштабе в России осуществлено получение биомас-
сы женьшеня на Омутнинском биохимическом заводе в биореакторах
объемом до 2,5 м3. В последнее время в ТОО «Тэмбр» (г. Ярославль) осу-
ществлено проточное культивирование клеток женьшеня в промышлен-
ных биореакторах объемом 7,5 м3.
Биотрансформация
Очень часто растения или культуры клеток растений не доводят син-
тез метаболитов до наиболее важного продукта, и тогда можно использо-
вать процесс биотрансформации. Как пример можно привести суспензию
клеток наперстянки, которая синтезирует дигитоксин, тогда как медикам
нужен дигоксин.
Биотрансформация возможна для гликозилирования фенольных
продуктов клеток корня Рапах ginseng in vitro (Т. Furuya, М. Shiyaina,
М. Asada, 1994). Культура клеток женьшеня корневого происхождения ак-
тивно трансформирует фенольные вещества (гликозилирует и гептозили-
рует); модифицирует ароматические карбокислоты (продукты переносов
глюкозы, примоверозы, софорозы, связанной с глюкодиозой). Было по-
казано, что скорость трансформации и экскреции продуктов зависит от
количества замещенных групп и полярных соединений. От этих же осо-
бенностей зависит также спектр образующихся сахаров.
Культура клеток женьшеня также гликозилирует фенольные веще-
ства. При этом образуются 3,5-диметилоксифенол — таксикатигенин, ти-
генин-метил-салицилат; Р-оксиацетофенон и конифериловый спирт. Гин-
зенозиды содержат софорозу, связанную со спиртовой группой аглико-
нов. Софороза (в клетках) связывается также с гидроксигруппой примо-
верозы и гентобиозы.
Часть продуктов с длинной радикальной цепочкой и низкой поляр-
ностью экскретируется в субстрат. Гентобиозиды и примоверобиозиды
не экскретируются, 50% глюкозидов экскретируется.
И наконец, еще один пример биотрансформации монотерпеновых
соединений (компонентов эфирных масел) у разных видов мяты (В. Родов
и др., 1988). Накопление эфирного масла в каллусных штаммах и гибридах
-131-
мяты значительно варьирует. Содержание эфирного масла (от сухой мас-
сы) у Menta canadensis — 0,069 и у M.piperita — 0,098. Путем биотрансформа-
ции можно значительно изменить качественный состав компонентов
эфирного масла мяты. В частности, эффективна биотрансформация пуле-
гона в более ценные компоненты (ментол) в культуре клеток М. canadensis.
Схема превращения монотерпеновых соединений представлена на рис. 38.
Geraniol
(-) - carvone
5p-Hydroxy
neodihydrocarveol
Рис. 38. Схема биотрансфор-
мации монотерпеновых
соединений
(Сохранение генофонда
высших
растении в коллекциях
и в криобанках
ГЛАВА ТРИНАДЦАТАЯ
В настоящее время существуют несколько способов сохранения гено-
фонда высших растений. Многие из них связаны с техникой культивиро-
вания in vitro и/или криосохранением различных объектов (семян, орга-
нов, клеток) при температуре жидкого азота.
Более всего нуждаются в сохранении редкие и исчезающие виды,
главным образом занесенные в Красную книгу. Число таких растений бы-
стро увеличивается. В основном это дикорастущие растения, которые
гибнут из-за вырубки леса, распашки лугов, осушения болот. Вместе с тем
не исключено, что эти растения могут оказаться в будущем весьма необ-
ходимыми человечеству или даже спасти его от гибели.
Наиболее простым способом сохранения генофонда растений явля-
ется криосохранение их семян. В Отделе биологии клеток и биотехноло-
гии ИФР РАН совместно с Ботаническим садом РАН (В.Тихонова) были
собраны практически по всей территории бывшего СССР — от Курил до
южных степей — семена около 200 растений, занесенных в Красную кни-
гу. Они хранятся много лет в криобанке в жидком азоте при температуре
-196 °C. Регулярно проводятся проверки жизнеспособности семян, кото-
рые подтверждают возможность их длительного хранения в этих
условиях.
Примерно 65 лет назад начали разрабатываться методы выращива-
ния in vitro тканей растений, соматических зародышей и отдельных кле-
ток. На основе этих методов оказалось возможным разработать эффек-
тивные методы сохранения генофонда различных растительных объек-
тов. Это культивируемые in vitro миниатюрные растения и их части, изо-
лированные органы, ткани и клетки. Перечисленные объекты могут со-
ставлять сохраняемые коллекции. Коллекции могут поддерживаться пу-
тем субкультивирования в пересадочной культуре, быть депонированы
-133-
различными способами (при пониженных температурах, добавлением
консервантов) либо в криобанках. Каждый из перечисленных способов
сохранения коллекций имеет свои преимущества и недостатки. При суб-
культивировании возможны изменения коллекционных объектов. Кроме
того, такой способ поддерживания коллекции очень трудоемок и требу-
ет больших затрат. Криохранение объектов очень надежно, но требует
разработки специальных методов замораживания, что не всегда осуще-
ствимо.
Пересадочные коллекции
Объекты в пересадочных коллекциях могут быть как достаточно ста-
бильными, так и изменчивыми. Установлено, что при длительном суб-
культивировании каллусных клеток-продуцентов они могут потерять спо-
собность к синтезу вторичных метаболитов или, наоборот, сохранить
свои свойства сверхпродуцентов (Л. Фролова). При работе с растущими
коллекциями необходимо стабильно поддерживать условия выращивания
(температуру, влажность, освещенность), состав питательной среды так-
же не должен меняться. Строгое соблюдение этих требований способ-
ствует длительному сохранению различных признаков объекта и целост-
ности его генома. Эпигенетическая изменчивость обычно не приводит к
потере ценных признаков, но при генетическом изменении штамм может
потерять нужный признак.
В растущей коллекции в Отделе биологии клетки и биотехнологии в
течение 40 лет сохраняются, не теряя стабильности, штаммы Rauwolfia
serpentina и штаммы Рапах ginseng. В это же время ряд штаммов разных
растений (например, чая) проходят своеобразную эволюцию, протекаю-
щую по типу конвергенции или дивергенции. Чрезвычайно важной зада-
чей для любой растущей коллекции является определение стабильности
или нестабильности сохраняемых объектов, а также разработка методов
идентификации и разграничения штаммов. Сравнение штаммов сразу по
нескольким признакам может быть существенно облегчено при использо-
вании специальной компьютерной программы. В коллекции Отдела био-
логии клетки и биотехнологии эта программа способствует идентифика-
ции штаммов. При этом используется база данных, основу которой со-
ставляют паспортные характеристики штаммов. Такая идентификация
необходима при изучении эволюции коллекционных штаммов и может
служить своеобразным фильтром при поступлении в коллекцию новых
штаммов-синонимов.
В коллекции отдела, которую ранее вела старший научный сотруд-
ник Л. Фролова, а теперь ведут старшие научные сотрудники И. Смолен-
-134-
ская и С. Зоринянц, поддерживается на агаризованной среде и в суспен-
зии 85 штаммов in vitro, 97 линий растений в пробирках (табл. 32).
Таблица 32
Состав коллекции in vitro ИФР РАН
(в виде каллусов и суспензии — 85, растения в пробирках — 97,
всего — 182 единицы хранения)
________________________________Каллусы___
Название растений
русское латинское сорт, штамм
Василистник малый Thalictrum minus 1 штамм, 2 клона
Воробейник краснокорневой Lithospermum erythrorhizon ВК 39
Диоскорея дельтовидная Dioscorea deltoidea Wall ИФР-Д1; ИФР-ДМ1; ИФР-ДМ0.5; ИФР-ДМ8
Женьшень настоящий Panax ginseng C.A.May ИФР-Ж1; ИФР-Ж2; ИФР-ЖЗ; ИФР-Ж7; ИФР-Ж9; ИФР-Ж12; ИФР-Ж13; Панакс-13: R-l; 1С; ДАН-25
Женьшень японский Panax japonicus C.A.May ИФР-Ж7
Женьшень пятилистный Panax quinquefolius ИФР-Ж10
Гиностемма пятилистная Эпимедиум крупноголовый Gynostemma pentaphyllum Epimedium macrocephallum Stzearh Gyn.p.b.
Жгун-корень Моннье Cnidium monniery (L.)Cuss Cl
Кирказон маньчжурский Aristolochia manshuriensis Korn Ai, Аз
Мак снотворный Papaver somniferum L. PS-5, PS-1, М-44, ММ-1
Мандрагора туркестанская Mandragora turcomanica ИФР ЛМ-1
Левзея сафлоровидная (маралий корень) Rhaponticum carthamoides Rl; R2; R3; R4; R8
Незабудочник седой Eritricum incanum ErSR
Полисциас папоротниколистный Polyscias filicifolia ПП-1
Родиола розовая Rhodiola rosea ЗК-1
Раувольфия змеиная Рис посевной Rauwolfia serpentina Oriza sativa Ml с горм. и без него; М2 с горм. и без него; А
Рубия сердцелистная Rubia cordifolia L. RC-1
Скорцонера испанская Scorzonera hispanica Z. СФР-SH-l
Стевия Stevia rebaudiana SR-1
Табак виргинский Nicotiana tabacum Nt-0217; Nt-0218; Nt-0219
Унгерния Ungernia viscois (Vved.) J-l
Чай (чайный куст) Thea sinensis 40-1-1; 4C-1-2; 4C-2;
Арнебия красящая Arnebia euchroma AE-1
Картофель европейский (культурный) Solanum tuberosum сорта: <Дезире>, <Тава>
Горянка крупночашелистиковая Epimedium macrosephalum EM-1
Стефания гладкая Stephania glabra (Roxb) Miers ВИЛАР Sq-48
-135-
Суспензии Окончание
Название растений
русское | латинское сорт, штамм
Циоскорея дельтовидная Женьшень настоящий Женьшень пятилистный (американский) Левзея сафлоровидная (маралий корень) Люцерна посевная Пшеница мягкая Пшеница Тимофеева Раувольфия змеиная Сахарная свекла Традесканция виргинская Бобы конские Dioscorea deltoidea Panax ginseng Panax quinquefolius Rhaponticum carthamoides Medicago sativa Triticum aestivum Triticum timopheevii Rauwolfia serpentina Beta vulgaris L. Tradescantia virginiana Vicia faba L. Д1; ДМ1; ДМ0.5; ДМ8; Nl; N3 ИФР-Ж10 N2; N8 Л-1 Tr-1; Tr-4 ИФР-Т1 RIII ИФР CAC-2n TO-2 ИФР-КБ
Растения в пробирках (ведет А.Б. Бургутнн)
Название растений
русское латинское сорт, штамм
Картофель европейский (культурный) Картофель Картофель Картофель Соматический гибрид Solanum tuberosum Solanum chacoense Solanum bulbocastanum Solanum demisum Solanum tuberosum x, Solanum chacoense сорта: <Дезире>, <Тава>, <Невский>, <Элла>, <Ранняя роза> клоны; № 5, 6, 7, 9, 16
Растения в пробирках (ведет О.Н. Высоцкая)
Название растений
русское латинское сорт, штамм
Голубика Vaccinium corymbosum L. 1 сорт
Земляника Fragaria ananassa L. 48 сортов
Картофель европейский Solanum tuberosum 20 сортов
(культурный) Купена Polygonatum odoratum (Mill) Druce Клон
Ландыш майский Convallaria majalis L. Клон
Малина Rubus idaeus 1 сорт
Депонирование коллекций (сохранение коллекций без частых пересадок)
Периодическое субкультивирование трудоемко и значительно удоро-
жает содержание коллекции. Поэтому сейчас достаточно интенсивно раз-
рабатываются различные способы депонирования коллекций, т.е. воз-
можности удлинения периода между пересадками объектов.
-136-
Период без пересадок можно удлинить до 6—24 месяцев, поместив
коллекции в условия низких положительных температур (1 — 10 °C) при
интенсивности освещения 4000—5000 люкс. Выбор температуры опреде-
ляется холодостойкостью вида растения. Так, для депонирования коллек-
ции картофеля эффективно использовать температуру +9—10 °C, тогда
как для яблони — +1 °C.
Рост растений можно также задержать добавлением к питательной
среде осмотиков: маннита и сорбита, повышением концентрации сахаро-
зы. В ряде случаев использовали внесение в питательную среду веществ,
тормозящих рост. В качестве последних были эффективны гидразид ма-
леиновой кислоты, 2,2-метил-гидразид янтарной и абсцизовой кислот.
И наконец, в последнее время для замедления роста объектов в коллек-
циях начали применять такие методы, как снижение атмосферного давле-
ния .(до 0,5 мм рт. ст.) и гипоксию. Условия гипоксии создают, применяя
смесь 90% азота и 10% кислорода. Иногда комбинируют эти два факто-
ра, снижая концентрацию кислорода и одновременно снижая атмосфер-
ное давление. Так, в результате применения таких способов рост хризан-
тем (по числу междоузлий) снижался в 3 раза по сравнению с контролем
за период выращивания до 6 недель. Дополнительным достоинством со-
хранения генотипов с применением депонирования является возмож-
ность разместить на 1 м2 площади в камере для культивирования более
тысячи пробирок с растениями.
В качестве одного из примеров депонирования можно представить
небольшую часть диссертационной работы аспиранта нашего отдела Мо-
хаммеда Абдулваси Ибрахима (1997) «Длительное хранение растений ма-
лины красной при пониженной температуре». Им разработан метод дли-
тельного депонирования растений малины красной четырех сортов. Для
этого было испытано шесть различных питательных сред. Хранение осу-
ществлялось в холодной камере при +2 — +4 °C при слабом освещении и
6-часовом фотопериоде. Микропобеги перед депонированием культиви-
ровали на среде для укоренения в течение 10 дней, чтобы полностью ос-
вободить корни от цитокининов. Установлено, что оптимальной средой
для длительного депонирования растений малины красной была среда
Мурасиге и Скуга без добавления гормонов. В этих условиях наблюдалось
сильное замедление роста растений и резкое снижение формирования
молодых листьев. У депонированных растений малины красной были
тонкие стебли и листовые пластинки небольшого размера. При этом
были использованы небольшие количества питательных веществ и на-
блюдалось снижение уровня транспирации в течение депонирования.
После 12 месяцев депонирования жизнеспособность хранящихся четы-
рех сортов малины красной составила от 60 до 93% для разных сортов.
-137-
Сохранение в криобанках
В 1976 году в Лаборатории культуры тканей и морфогенеза ИФР
АН СССР было решено параллельно с коллекциями каллусных клеток гп
vitro и микроклональных растений в пробирках организовать криобанк
(Р. Бутенко, А. Попов). Для начала в качестве модельного объекта была
использована морковь (Z). carota) в виде молодой суспензии клеток. Был
разработан метод замораживания, после которого клетки моркови сохра-
нялись при -196 °C в жидком азоте. Клетки успешно сохранялись в крио-
банке, более того, была возможность регенерирования растений после
такого хранения. Этот успех дал возможность широко развернуть работы
по сохранению различных растительных объектов в криобанках. Была
разработана техника замораживания, сохранения и размораживания не-
скольких культур клеток. Затем были разработаны методы криохранения
пыльцы и меристем растений. Хранение клеток, органов и пыльцы расте-
ний при -196 °C обеспечивало возможность создания банка генов вегета-
тивно размножаемых и редких видов, а также гибридных и мутантных
клеточных линий (А. Попов и др.).
Принципиально важно, что хранение объектов происходит в жид-
ком азоте при температуре -196 °C (табл. 33—35). Лишь при столь низких
температурах гарантируется не только полное прекращение метаболиче-
ских процессов, но и отсутствие перестроек в водных средах, окружаю-
щих клетки. Именно сверхнизкие температуры обеспечивают длительное
(десятки и сотни лет) хранение биологических объектов, т.е. организа-
цию криобанков, из которых, как из базовых коллекций, исследователи
могут в любое время получить необходимый им материал: семена, пыль-
цу, меристемы, эмбриоиды и клетки. Базовые коллекции — криобанки, не
только обеспечивают практически вечное хранение, но и значительную
экономию затрат по сравнению с обычными коллекциями, даже депони-
рованными, не говоря уж о постоянно растущих. Кроме того, что очень
важно, криобанки гарантируют не только сохранность образца, но и всех
основных его свойств. Для сохранения генофонда редких растений необ-
ходимым свойством является способность к морфогенезу: хорошо извест-
но, что при длительном субкультивировании способность к регенерации,
как правило, снижается. Но и в случаях, когда клетки не обладали спо-
собностью к регенерации, их хранение в криобанке обеспечивает со-
хранение столь важной и значительной по объему части их генотипа, как
блоки генов, отвечающие за рост культуры, пролиферацию клеток и био-
синтез вторичных соединений, синтезируемых исходным растением.
-138-
Клеточные штаммы растений, постоянно хранящиеся в криобанке
ИФР РАН в жидком азоте (-196 °C)
Вид Штамм № в коллекции CKK-BP
Daucus carota M-34
Dioscorea deltoidea Д-1 5
ДМ-0,5 6
ДМ-1 8
ДМ-8 7
Panax gineng Ж1 3
Ж2 1
ЖЗ 2
Panax quinquefolius Ж10 16
Nicotiana sylvestris NrEs-1
Medicago sativa Л-1 23
Solanum tuberosum (cv.Tava) KT-4
Rhaponticum carthamoides Rhs-1 48
Rhs-2
Triticum timofeevii T-l 34
Triticum aestivum ЦЮ-194 (адаптирована к NaCl)
Dioscorea balcanica (органогенная каллусная ткань)
Dioscorea caucasica (органогенная каллусная ткань)
Таблица 34
Клеточные штаммы,
регенерировавшие растения после хранения в жидком азоте
Dioscorea balcanica (органогенная каллусная ткань)
Dioscorea caucasica (органогенная каллусная ткань)
Solanum tuberosum (cv.Tava) КТ-4
Daucus carota М-34
Таблица 35
Клеточные штаммы, спорадически возобновлявшие рост
после замораживания до жидкого азота
Rauwolfia serpentina R-I1I
Digitalis lanata Panax japonicus I VII Эмбриоиды Ж7 13
Rhaponticum carthamoides Polyscias filicifolia Rhs-8 ПП-1 24
-139-
Таблица 36
Меристемы, возобновившие рост и регенерировавшие растения
после хранения в жидком азоте
Fragaria ananassa (земляника садовая) 23 сорта
Solanum tuberosum (картофель) 9 сортов
Rubus idaeus (малина) 1 сорт
Ripes nigrum (черная смородина) Digitalis lanata (наперстянка шерстистая) Chamomila recutita (ромашка лекарственная) 1 сорт
Для сохранения уникальных генотипов принципиально важно крио-
сохранение дифференцированных тканей, главным образом апикальных
меристем. Здесь существенным достижением стала криоконсервация апи-
кальных меристем без использования обычного программного заморажи-
вания (О. Высоцкая и др., 1997). При этом объектами хранения стали
ценные сельскохозяйственные растения, подвергающиеся антропоген-
ным стрессам (ягодные культуры: земляника, малина) (табл. 36). Посто-
янно хранятся в криобанке меристемы 5 сортов земляники, 1 сорта ма-
лины и 1 сорта черной смородины.
В табл. 37 приведена схема криоконсервации меристем клубники и
малины.
Таблица 37
Криоконсервация меристематических верхушек земляники и малины
(О. Высоцкая, 1997)
Этап и его про- должительность Питательная среда Условия
1. Размножение Агаризованная питательная среда t = 20-25 °C,
1-4 мес Мурасиге и Скуга с цитокининами и сахарозой (3%) 16 ч/сут, освещенность — 5—10 килолюкс (клк)
2. Закаливание Агаризованная модифицированная t = 2-8 °C,
от 1 недели питательная среда MS с цитоки- темнота или
до 4 м ес нинами и повышенным содержанием сахаров (4—6%) свет до 8 ч/сут 0,5—0,8 клк
3. Выделение Жидкая среда MS с цитокининами t = 15-20 °C,
апикальных и повышенным содержанием саха- освещенность
верхушек от 2 до 6 ч ров (4—6%) 0—0.8 клк
4. Предваритель- Жидкая среда MS с цитокининами, t = 15-20 °C,
ное культиви- с повышенным содержанием саха- темнота
рование апи- ров (5—6%) и диметилсульфоксидом или свет до
кальных вер- хушек с крио- (DMSO) (5-7%) 0,8 клк
протекторами
19-36 ч
-140-
окончание
Этап и его про- должительность Питательная среда Условия
5. Замораживание В растворе криопротекторов, 5—6% сахаров, a) t = 0 °C, ледя-
а) прямое: 1—10 мин до -196 °C б) программное: 2-3 ч до -75 °C, затем быстро до -196 °C 5—10% DMSO. В криоампулах ная баня; б) криобаня от 0 до -30 °C;
6. Разморажива- ние Водяная баня, оттаивание криоампул t = 38-40 °C
7. Отмывание от криопротекторов Среда MS, агаризованная без гормонов 3% сахара t = 20-25 °C
8. Рекультивиро- вание Среда MS с цитокининами, на свету t = 20 °C, 1—3 клк 16 ч/сут
9. Размножение Среда MS с цитокининами, на свету t = 20-25 °C, 5—8 клк, 16 ч/сут
10. Укоренение 11. Высадка в грунт Среда MS с цитокининами, на свету —
Упрощение криоконсервации растительного материала и сведение к
минимуму количества необходимого для этого процесса оборудования по-
зволили существенно расширить область использования данного метода.
Детальная разработка технологии замораживания на основе тщательного
анализа состояния образцов на каждом из этапов с учетом их генетичес-
ких особенностей позволит в будущем накапливать в криобанках разно-
образные генотипы растений.
Недостаток информации об изменениях устойчивости растительных
объектов к сверхнизким температурам и отсутствие надежных методов ин-
тактного анализа динамики их состояния в различных условиях не позво-
ляют определить оптимальные сроки консервации того или иного расти-
тельного материала. Первые наши шаги в упрощении процесса крио-
консервации и регламентации его этапов привели к некоторым положи-
тельным результатам, представленным ниже. Детальная разработка метода
криоконсервации с использованием программируемого оборудования по-
зволила перейти к разработке технологически более простого способа глу-
бокого охлаждения растительного материала. Подготовленный для крио-
консервации растительный материал помещают в предварительно охлаж-
денный в криоампулах раствор криопротекторов. Дальнейшее охлаждение
образцов и первый этап замораживания проводят в парах жидкого азота с
помощью специально сконструированной для этого криобани. Затем крио-
ампулы с образцами помещают в жидкий азот, не вынимая их из криоба-
ни. Этим методом были заморожены и после хранения получены регене-
ранты 6 сортов земляники: <Алая зорька>, <3енга-зенгана>, <Джеско>,
<3енгатигайга>, <Профыожен>, <Вола> и малины сорта <Скромница>.
а'кл'кте'ние
Учебное пособие содержит основные разделы, характеризующие
биологию клетки in vitro и биотехнологию, включая перечень основных
терминов и список литературы. Почти в каждой главе мы имеем дело с
молекулярной и клеточной биологией. То же самое относится и к био-
технологии клеток и популяций. Цитоскелет, внешние сигналы, цикли-
ны, клонирование клеток in vitro — все это в растительной клетке in vitro
похоже на клетки животных. Это так, но в исследовании клеток расте-
ний еще много загадочного. На пути от клетки до соматического эмбри-
оида, а потом до целого растения не все так гладко, как кажется. Неясно,
какой сигнал вовлечен в эмбриогенез. Теломераза считывает и копирует
концы хромосом — теломеры, что заставляет клетку длительное время со-
вершать больше делений, чем они должны совершать по законам природы.
Возможно, и путь с клетками in vitro высших растений ведет нас в
будущее, открывая новые страницы в познании живой природы.
Перечень основных терминов
Есть случаи, когда за термином скрыто такое большое
содержание, что он действительно необходим.
Франк-Каменецкий
В этом разделе приводятся только основные термины, часто исполь-
зуемые в области биологии растительных объектов, культивируемых in
vitro. Быстрое развитие этого научного и практического направления
физиологии растений определило в ряде случаев недостаточную четкость
терминологии. Здесь фигурируют те из них, в отношении которых прин-
ципиальных расхождений во мнениях нет или они незначительны.
1. In vitro — выращивание растительных объектов «в стекле» (пробир-
ке, колбе, биореакторе) на искусственных питательных средах в асепти-
ческих условиях.
2. Культура зиготических зародышей — стерильное выращивание на
питательной среде незрелых или зрелых изолированных зародышей.
3. Культура корней — асептическое выращивание на искусственной
питательной среде в пересадочном режиме изолированных корней.
4. Культура трансгенных корней («бородатых корней») — выращива-
ние корней, полученных внесением Ri-плазмиды в геном клетки, которая
дает начало интенсивно ветвящимся трансформированным корням.
5. Культура меристем — асептическое выращивание на питательной
среде изолированного из апекса или пазушной почки побега конуса нара-
стания с одним или двумя листовыми примордиями.
6. Эксплант — фрагмент ткани или органа, инкубируемый на пита-
тельной среде самостоятельно или используемый для получения первич-
ного каллуса.
7. Культура эксплантов — инкубация в стерильных условиях на пита-
тельных средах, вызывающих или не вызывающих пролиферацию фраг-
ментов, изолированных из разных органов растений.
-143-
8. Пролиферация — новообразование клеток и тканей путем размно-
жения.
9. Каллус — ткань, возникшая in vivo или in vitro путем неорганизо-
ванной пролиферации клеток растений и эксплантов.
10. Культура каллусных тканей — выращивание в длительной переса-
дочной культуре каллусов, возникших путем дедифференцировки и про-
лиферации клеток, тканей, органов растения.
11. Культура опухолевых тканей — выращивание в длительной культу-
ре тканей, изолированных из растительных опухолей разного происхож-
дения, освобожденных от патогенов, индуцировавших развитие опухоли.
12. Трансплант — часть каллусной ткани, используемая для переноса
на свежую среду.
13. Инокулюм — часть клеточной суспензии, используемая для пере-
носа в свежую среду.
14. Субкулътивирование — перенос транспланта или инокулюма в куль-
туральный сосуд на свежую питательную среду.
15. Цикл выращивания — период от помещения клеточного инокулю-
ма или каллусного транспланта до последующего субкультивирования.
16. Ростовой цикл — рост популяции клеток в цикле периодического
выращивания, характеризующийся сигмоидальной кривой. Фазы ростово-
го цикла: латентная, экспоненциальная, замедления роста, стационарная,
деградации.
17. Штамм — культура, возникшая после первого субкультивирова-
ния. Состоит из многих клеточных линий, возникших из клеток, присут-
ствующих в первичной каллусной культуре.
18. Линия — культура, возникшая из штамма путем селекции или кло-
нирования, имеющая маркерные признаки.
19. Клон — культура, возникшая из одной клетки.
20. Культура одиночных клеток — выращивание одиночных клеток
при низкой плотности высева на очень богатых питательных средах с
помощью культуры-«няньки» или питающего слоя.
21. Время удвоения популяции — интервал времени, за который число
клеток в популяциях увеличивается вдвое.
22. Время генерации клетки — интервал между последовательными
клеточными делениями.
23. Дедифференциация — переход специализированных клеток к про-
лиферации и неорганизованному каллусному росту.
24. Редифференциация — переход специализированных клеток из од-
ного состояния дифференцировки в другое с предшествующими деления-
ми или непосредственно.
-144-
25. Дифференциация — комплекс процессов, приводящих к различиям
между дочерними клетками, а также между материнскими и дочерними
клетками.
26. Дифференцировка — состояние специализации клеток, отличаю-
щее их от других.
27. Кариотип — набор хромосом, характерных для данного вида.
28. Моноплоид — ядро, клетка, организм, характеризующиеся основ-
ным числом хромосом в полиплоидной серии (символ X).
29. Гаплоид — ядро, клетки, организм, характеризующиеся набором
хромосом, представляющим половину полного набора, свойственного
виду (символ п).
30. Диплоид — ядро, клетки, организм, характеризующиеся двойным
набором гомологичных хромосом, представленным числом, характерным
для данного вида (символ 2п).
31. Псевдодиплоид — ядро, клетки, организм, характеризующиеся дип-
лоидным числом хромосом, отличающиеся от зиготы данного вида по
кариотипу.
32. Полиплоид — ядро, клетки, организм, характеризующиеся умно-
женным основным числом хромосом (символ ЗХ, 4Х и т.д.).
33. Эуплоид — ядро, клетки, организм с числом хромосом, кратным X.
34. Анеуплоид — ядро, клетки, организм с числом хромосом, отклоня-
ющимся от X и от чисел, кратных X.
35. Мутация — изменение в генетическом материале клеток путем
перестройки ДНК ядер и органелл, изменения структуры хромосом или
полиплоидизации.
36. Рецессив — ген или генетически обусловленный признак, проявля-
ющийся в диплоидной клетке или организме при условии, когда оба на-
бора хромосом несут данные гены.
37. Доминант — ген, проявляющийся как признак при условии, когда
гомологичные наборы имеют разные гены.
38. Сомаклональные вариации и варианты — фенотипическое выраже-
ние непостоянства ядерного и органелльных цитоплазматических гено-
мов культивируемых клеток. От истинных генных мутаций отличаются
большей частотой возникновения и комплексностью изменений (измене-
ния в структуре генов, хромосом, геномов).
39. Клеточная селекция in vitro — метод выделения мутантных клеток
и сомаклональных вариаций с помощью селективных условий.
40. Эпигенетические вариации — фенотипическое выражение диффе-
ренциальной активности генов. От мутаций и сомаклональных вариаций
отличаются тем, что не сохраняются в цикле клетка — растение — клетка.
-145-
41. Соматическая (парасексуальная) гибридизация — система, вовлекаю-
щая в генетическую рекомбинацию хромосомы и гены ядра и органелл
вне сексуального цикла, например путем слияния изолированных прото-
пластов. Приводит к появлению гибридных клеточных линий и сомати-
ческих гибридов растений.
42. Изолированный протопласт — растительная клетка, лишенная кле-
точной стенки с помощью ферментативного разрушения или механиче-
ского способа.
43. Цитопласт — ограниченный мембраной участок цитоплазмы, воз-
никший при фрагментации изолированного протопласта.
44. Субпротопласт — изолированный протопласт, потерявший часть
цитоплазмы, сохранивший ядро.
45. Слияние изолированных протопластов — формирование одной клет-
ки из двух и более объединением их поверхностных мембран.
46. Культура изолированных протопластов — выращивание клеток, ли-
шенных стенок, в жидкой или на агаризованной среде, содержащей в ка-
честве дополнительного компонента осмотически активное вещество
(стабилизатор) в оптимальной для данного вида концентрации. При ре-
генерации стенок изолированные протопласты превращаются в культуру
клеток.
47. Соматический гибрид — растение, полученное путем гибридизации
изолированных протопластов.
48. Цибрид — растение, полученное при слиянии изолированного про-
топласта с цитопластом, протопластом с инактивированным ядром или с
энуклеированным протопластом.
49. Клональное микроразмножение — получение in vitro неполовым пу-
тем растений, генетически идентичных исходному.
50. Апикальное доминирование — явление подавления роста боковых
почек побега в присутствии терминальной почки.
51. Адвентивные почки — почки, возникшие из тканей и клеток в рас-
тениях, обычно их не образующих.
52. Трансгеноз — перенос любым способом чужеродных генов в клет-
ки растений.
53. ПЦР — полимеразная цепная реакция. Эффективна для диагнос-
тики микоплазменной контаминации культур клеток.
Литература
Баев А., 1998. Академик А.А. Баев. М.: Наука.
Бургутин А. Мусин С., Бутенко Р., 1994. Сегрегация биохимических ге-
нетических детерминант у сомаклональных вариантов межвидового сомати-
ческого гибрида картофеля. Физиол. раст., т. 41, вып. 6. С. 848—852.
Бургутин А., 1996. Вариабельность по солеустойчивости у сегрегантов
соматического гибрида картофеля. Канд. дисс. М.
Бутенко Р., 1956. Культура изолированных растительных тканей. Фи-
зиол. раст., т. 3, вып. 3. С. 277—286.
Бутенко Р., 1959. Культура изолированных тканей как метод изучения
процессов роста и морфогенеза растений. Сб. «Рост и развитие». С. 32—37.
Бутенко Р., 1960. Применение метода культуры изолированных верху-
шечных почек для изучения процесса роста и организации растений. Физи-
ол. раст., т. 7, вып. 6. С. 715.
Бутенко Р., 1963. Культура изолированных тканей и клеток растений.
Вестник АН СССР. № 2. С. 2.
Бутенко Р., 1964. Культура изолированных тканей и физиология мор-
фогенеза растений. М.: Наука.
Бутенко Р., 1977. Выращивание клеток высших растений в суспензион-
ной культуре. Изв. АН СССР, № 5. С. 697—709.
Бутенко Р., 1978. Физиология клеточных культур, состояние и перспек-
тивы. Физиол. раст., т. 25, вып. 5. С. 1009—1024.
Бутенко Р., 1979. Гибридизация соматических клеток растений. Сб.
«Мол. механизмы генетических процессов». С. 43—89.
Бутенко Р., 1986. Клеточные технологии для получения экономически
важных веществ растительного происхождения. В кн.: «Культура клеток
растений и биотехнология». М.: Наука. С. 3—20.
Бутенко Р., 1990. Клеточные технологии в с/х науке и практике. Осно-
вы с/х биотехнологии. М.: Агропромиздат. С. 154—235.
-147-
Бутенко Р., Строгонов Б., Бабаева Ж., 1967. Соматический эмбриогенез
в культуре тканей моркови в условиях высокой концентрации солей в сре-
де. ДАН СССР, т. 175, № 5. С. 1179-1181.
Бутенко Р., Витенко В., Кучко А., Аветисов В., 1977. Получение и куль-
тивирование изолированных протопластов мезофилла листа Solanun tubero-
sum и Solanun chacoense. Физиол. раст., т. 24, вып. 3. С. 660—665.
Бутенко Р., Кучко А., 1979. Физиологические аспекты получения, куль-
тивирования и гибридизации изолированных протопластов картофеля. Фи-
зиол. раст., т. 26, вып. 5. С. 1110—1118.
Бутенко Р., Попов А., 1979. Банк клеток растений — возможности и
проблемы. Природа, № 4. С. 2—11.
Бутенко Р., Гусев М., Корженевская Т., Юрина Т., 1981. Влияние возрас-
та суспензионных культур диоскореи и табака на репродуктивную выживае-
мость и характер роста клеток. Физиол. раст., т. 28, вып. 3. С. 562—569.
Бутенко Р, Воробьев А., Носов А., Князьков И., 1992. Синтез, накопление
и локализация стероидных гликозидов в клетках разных штаммов в Dioscorea
deltoidea Wall. Физиол. раст., т. 39, вып. 6. С. 1146—1153.
Бычкова Г., Бутенко Р., 1977. Действие ауксина и кинетина на митоти-
ческий цикл частично синхронизированной популяции клеток женьшеня
настоящего Panax ginseng May. in vitro. ДАН СССР, т. 217, № 2. С. 489—492.
Волкова Л., Попов А., Самыгин Г., 1984. Влияние аминокислот на суспен-
зионную культуру клеток диоскореи дельтовидной и ее возобновление пос-
ле хранения при -196 °C. Физиол. раст., т. 31, вып. 4. С. 632—638.
Волкова Л., Попов А., Носов А., Бутенко Р., 1982. Сохранение биосинте-
тического потенциала клетками Dioscorea deltoidea Wall, после криогенного
хранения. ДАН СССР, т. 265, № 2. С. 504-506.
By Дык Куанг, Шамина 3., 1983. Получение клонов из культивирумых
клеток и протопластов кукурузы и их цитогенетическая характеристика.
IV Всесоюз. конф. «Культура клеток растений и биотехнология». Киши-
нев. С. 177.
Высоцкая О., Мохаммед Али, Бутенко Р., 1997. Криоконсервация мери-
стем малины. Тезисный доклад на VII Международной конференции
«Биология клеток растений in vitro, биотехнология и сохранение гено-
фонда». М. С. 159.
Ралстон А., Девис П., Сешшер Р., 1983. Жизнь зеленого растения. М.:
Мир.
Глеба Ю., Бутенко Р., Ситник К., 1975. Слияние протопластов и пара-
сексуальная гибридизация у Nicotiana tabacum L. ДАН СССР, т. 221, № 5.
С. 1196-1198.
-148-
Гругивицкий И., 1981. Женьшень. Вопросы биологии. Изд-во Дальн.
ФСО АН СССР.
Русаковская М., Мохаммед Али Наджаром, Ермаков И., 1994. Гиногенез в
культуре неоплодотворенных завязей и семяпочек пшеницы. Ботан. жури.,
№ 1. С. 70-79.
Дерябин А., Юрьева Н., Орешников А., Бутенко Р., 1997. Рост столонов и
индукция микроклубней картофеля in vitro при разных типах культивирова-
ния. Докл. РАН, т. 355, № 6. С. 841—843.
Долгих Ю., Китлаев. Г., Бутенко Р., 1994. Физиологическое действие
электрического тока на культуру клеток кукурузы in vitro. Докл. РАН, т. 335,
№ 3. С. 393-395.
Долгих Ю., Шамина 3., 1982. Определение ростовых параметров клеток
женьшеня с целью разработки модели для негативной селекции. Физиол.
раст., т. 29, вып. 2. С. 400—405.
Ермаков И., Матвеева Н., Мохамед Али Наджаром, 1984. Регуляция на-
чальных этапов эмбриогенеза у высших растений. Физиол. раст., т. 41,
№ 3. С. 524-534.
Загорска Н., Бутенко Р., Шамина 3., 1971. Закономерности морфогене-
за в культуре тканей диплоидного и полиплоидного табака. ДАН СССР,
т. 196, № 5. С. 219-222.
Загорска Н, Шамина 3., Бутенко Р., 1971. Изучение растений-регенеран-
тов, полученных в культуре тканей табака. Генетика, т. 7, вып. 3. С. 23—36.
Калашникова Е., 1992. Оптимизация условий культивирования сосны и
ели в культуре тканей. Лесное хоз-во, № 8—9. С. 41—43.
Калашникова Е., 1993. Размножение хвойных пород методом культуры
тканей. Лесоводство и лесоразведение, № 24. С. 44.
Кандараков О., Воробьев А., Носов А., 1994. Биосинтетические характе-
ристики популяции клеток Dioscorea deltoidea Wall, при проточном культиви-
ровании. Физиол. раст., т. 41, вып. 6. С. 913—917.
Каранова С., Шамина 3., Ропоппорт И., 1975. Влияние N-метил-мочеви-
ны на изменчивость клеточных популяций Dioscorea deltoidea Wall, in vitro. Ге-
нетика, № 11. С. 5.
Каранова С., Шамина, 3., Бутенко Р., 1978. Индуцированная генетичес-
кая изменчивость соматических клеток Dioscorea deltoidea Wall, in vitro. Прото-
трофность по фитогормонам. Генетика, т. 14, № 6. С. 987—994.
Каранова С., Носов А., Пауков В., Шамина 3., 1986. Продуктивность раз-
личных линий диоскореи дельтовидной. В кн.: «Культура клеток растений
и биотехнология». М.: Наука. С. 83—87.
Катаева Н., 1982. Параметрическое регулирование морфогенеза и кло-
нального микроразмножения растений на примере герберы и фрезии. Канд,
дисс. Москва.
-149-
Кацитадзе К., 1977. Цитофизиологическое изучение редифференци-
ровки в культуре апексов томатов. Канд. дисс. Тбилиси.
Князьков И., 1996. Изучение внутриклеточной локализации стероидных
гликозидов в культивируемых клетках Dioscorea deltoidea. Канд. дисс. Москва.
Константинова Т., Аксенова Н., Баврина Т., Чайлахян М., 1969. О спо-
собности каллусов табака к образованию вегетативных и генеративных по-
чек в культуре in vitro. ДАН СССР, т. 187. С. 466—469.
Копертех Л., Бутенко Р., 1995. Ацетон — как нетрадиционная добавка к
среде культивирования. Докл. РАН, т. 342, № 1. С. 115—118.
Копертех Л., Бутенко Р., 1995. Нативные фитогормоны экспланта и
морфогенез пшеницы in vitro. Физиол. раст., т. 42, вып. 4. С. 555—558.
Коппелъ Л., Бутенко Р., 1992. Развитие апикальных меристем томатов в
условиях воздействия светом разного спектрального состава. Физиол.
раст., т. 39, вып.2. С. 378—392.
Кренке Н., 1950. Регенерация растений. М.—Л. Изд-во АН СССР.
Кронтовский А., 1917. Метод тканевых культур. Общий очерк и техни-
ка. Киев.
Курсанов А., Дубинина И., Кудрявцева Л., Бураханова Е., 1976. Некото-
рые особенности углеводного обмена в культурах дедифференцированных
тканей сахарной свеклы. Физиол. раст., т. 23, вып.6. С. 1119—1126.
Кучеренко Л., 1984. Условия получения растений-регенерантов в куль-
туре тканей риса. С/х биология, № 4. С. 70—72.
Кучеренко Л., 1986. Индуцированный морфогенез в культуре тканей риса
и его использование для создания исходного селекционного материала. В КН.:
«Культура клеток растений и биотехнология». М.: Наука. С. 211—214.
Кучко А., Бутенко Р., Тарасенко В., 1983. Соматическая гибридизация у
картофеля. С/х биология, № 7. С. 54—57.
Кучко А., Маруненко И., 1983. Культура изолированных пыльников кар-
тофеля. С/х биология, № 5. С. 16—19.
Лихтенштейн Е., 1978. Слово о науке. М.: Знание (эпиграфы).
Лобакова Е., Плетюшкина О., Бутенко Р., 1997. Морфология распреде-
ления актина в клетках морфогенного каллуса пшениц. Докл. РАН, т. 352,
№ 2. С. 284-286.
Лукъянюк С., Игнатова С., 1983. Получение гаплоидов ячменя с помо-
щью гаплопродюсеров. Методические рекомендации. Одесса. С. 21.
Максимов В., 1980. Многофакторный эксперимент в биологии. М., Изд-
во МГУ.
Маруненко И., Кучко А., 1986. Изучение влияния подготовки генератив-
ных органов на процесс каллусо- и эмбриогенеза в культуре пыльников кар-
тофеля. В кн.: «Культура клеток растений и биотехнология». М.: Наука.
С. 184-187.
_ 1СП —
Мелик-Саркисов О., Донец Н., 1984. Влияние способов получения исход-
ного материала на продуктивность картофеля. Докл. ВАСХНИЛ, вып. 6.
С. 18-19.
Моисеева Н., Володарский А., Бутенко Р., 1979. Выявление антигенов-марке-
ров стеблевой меристемы табака. Физиол. раст., т. 26, вып. 3. С. 479—484.
Мохаммед А.И., Бутенко Р., Калашникова Е., 1997. Длительное хранение
растений малины красной при пониженной температуре. III ежегодный
симпозиум «Физико-химические основы физиологии растений и биотех-
нология». С. 41.
Негрук В., Эйснер Г., Александров А., Черный Д., Бутенко Р., 1984. Элект-
ронно-микроскопический анализ митохондриальной ДНК. 1б-я конф.
ФЭБО. С. 261.
Ниссанка Иддагода, Катаева Н., Бутенко Р., 1990. Особенности получе-
ния асептической культуры и клональное микроразмножение взрослых рас-
тений чая. С/х биология, № 5. С. 98—104.
Князьков И., Лобанова Е., Носов А., 1994. Определение локазализации
стероидных гликозидов в культуре клеток Dioscorea deltoidea Wall, на основе
изучения их ультраструктуры. Физиол. раст., т. 41, вып. 6. С. 896—902.
Носов А., 1992. Особенности метаболизма стероидов в культивируемых
клетках диоскореи дельтовидной как основа биотехнологии получения фу-
ростаноловых гликозидов. Дисс. докт. 243 с.
Носов А., 1995. Тимидинкиназа в клетках высших растений I. Функцио-
нальная топография тимидинкиназы в клеточном цикле. Физиол. раст.,
т. 42, вып. 4. С. 539—546.
Орешников А., Носов А., Манаков М., 1994. Физиологические особеннос-
ти культивируемых клеток Dioscorea deltoidea Wall, при выращивании в режи-
ме закрытого типа. Физиол. раст., т. 41. вып. 6. С. 918—922.
Орешников А., 1996. Физиология популяции культуры клеток Dioscorea
deltoidea в условиях закрытого протока. Канд. дисс. М.
Ошмарина В., Шамина 3., Бутенко Р., 1983. Получение резистентных к
NaCl и этионину клеточных линий Nicotiana sylvestris и их характеристика.
Генетика, № 5. С. 822—827.
Павлова М., Бутенко Р., 1969. Действие ауксина и кинетина на процесс
образования ткани из отдаленных клеток табака в культуре in vitro. ДАН
СССР, т. 188, № 5. С. 1186-1188.
Попов А., 1987. Криоконсервирование культивируемых тканей и кле-
ток растений. Криобиология и биотехнология. Киев: Наукова Думка. С.
160-181.
Попов А., 1993. Некоторые механизмы криоповреждения клеток in vitro
и особенности их криосохранения. Физиол. раст., т. 40, вып. 3. С. 485—496.
-151-
Попов А., Волкова Л. и др., 1981. Криосохранение клеточных штаммов
и меристем растений. Биология культивирумых клеток и биотехнология
растений. М.: Наука. С. 260—270.
Попов А., Федоровский Д., 1992. Повреждение плазмалеммы клеток ди-
оскореи, культивируемых in vitro, в процессе их криосохранения. Физиол.
раст., т. 39, вып. 2. С. 335—343.
Постон Т, Стюард Ф., 1980. Теория катастроф. М.: Мир. С. 505—513.
Рассадина Г., Хромова Л., 1987. Эффективность клеточной селекции на
устойчивость к кольцевой гнили картофеля. Использование клеточных тех-
нологий в селекции картофеля. Труды НИИКХ. М. С. 57—65.
Родов В., Бугорский П, Бутенко Р., Попов А., 1988. О способности ткане-
вых культур высших растений к биотрансформации монотерпенов. Физиол.
раст., т. 35, вып. 3. С. 526—533.
Саркисова М., Бутенко Р., Синюхин А., 1971. Культура тканей Dioscorea
deltoidea Wall, как продуцент стероидных сапонинов и генинов. Раст, ресур-
сы, т. 7, вып. 4. С. 517—524.
Саркисова М., 1973. Культура тканей диоскореи дельтовидной как про-
дуцент стероидных сапонинов. Канд. дисс. М.
Смоленская И., Носов А., Ролдугина Г., 1988. Суспензионная культура
клеток кормовых бобов. Физиол. раст., т. 36, вып. 6. С. 1229—1237.
Соболев А., Суворов В., Бутенко Р., 1971. Культура тканей эндосперма
клещевины как модель изучения биосинтеза запасного белка. Физиол.
раст., вып. 2. С. 140—156.
Туманов И., Бутенко Р., Оголевец И., Сметюк В., 1977. Повышение моро-
зостойкости культуры каллусной ткани ели путем вымораживания менее
устойчивых клеток. Физиол. раст., т. 24, вып. 5. С. 895—900.
Тураев А., Шамина 3., 1986. Оптимизация состава среды для культиви-
рования пыльников хлопчатника. Физиол. раст., т. 33, вып. 3. С. 565—571.
Туркина М., Куликова А., Коппелъ Л., Агатова Л., Бутенко Р., 1995. Ак-
тин и термостабильные актинсвязывающие белки в культуре клеток пшени-
цы. Физиол. раст., т. 42, вып. 3. С. 303—309.
Федоровский Д., Попов А., 1992. Повреждение плазмалеммы различных
штаммов диоскореи дельтовидной при криосохранении. Физиол. раст.,
т. 39, вып. 3. С. 592-598.
Федоровский Д., Черняк Н., Попов А., 1993. Исследование повреждений
плазмалеммы клеток женьшеня при криосохранении. Физиол. раст., т. 40,
вып. 1. С. 117-122.
Харченко П., 1986. Получение гаплоидов и гомозиготных линий у риса
методом in vitro. Канд. дисс. Л.
-152-
Хмара К., 1990. Влияие фитогормонов на образование адвентивных
почек в культуре тканей ели обыкновенной. IV Всесоюз. конф, молодых
ученых по физиологии растительной клетки. М. С. 72.
Хромова Л., Седнина Г., Бутенко Р., 1984. Влияние условий выращива-
ния исходных растений картофеля на выделение протопластов и их жизне-
способность. С/х биология, № 11. С. 41—45.
Цоглин Л. и Гавелъ Н., 1994. Автоселекционные процессы при микро-
клональном размножении растений. Фототрофное размножение картофеля
in vitro. Физиол. раст., т. 41, вып. 3. С. 436—439.
Чернышева В., Долгих Ю., Шамина 3., Бутенко Р., 1988. Влияние генети-
ческих характеристик исходных растений на морфогенный потенциал кал-
лусных клеток кукурузы. ДАН СССР, т. 300, № 1. С. 227—229.
Чуб В., Власова Т., Бутенко Р., 1994. Каллусогенез и морфогенез в куль-
туре генеративных органов весеннецветущих видов Crocus L. Физиол. раст.,
т. 41, вып. 6. С. 815-820.
Шинкарева И., Шамина 3., 1973. Анеуплоидия в семенном потомстве
регенерантов табака. Генетика, т. 9, № 2. С. 21—28.