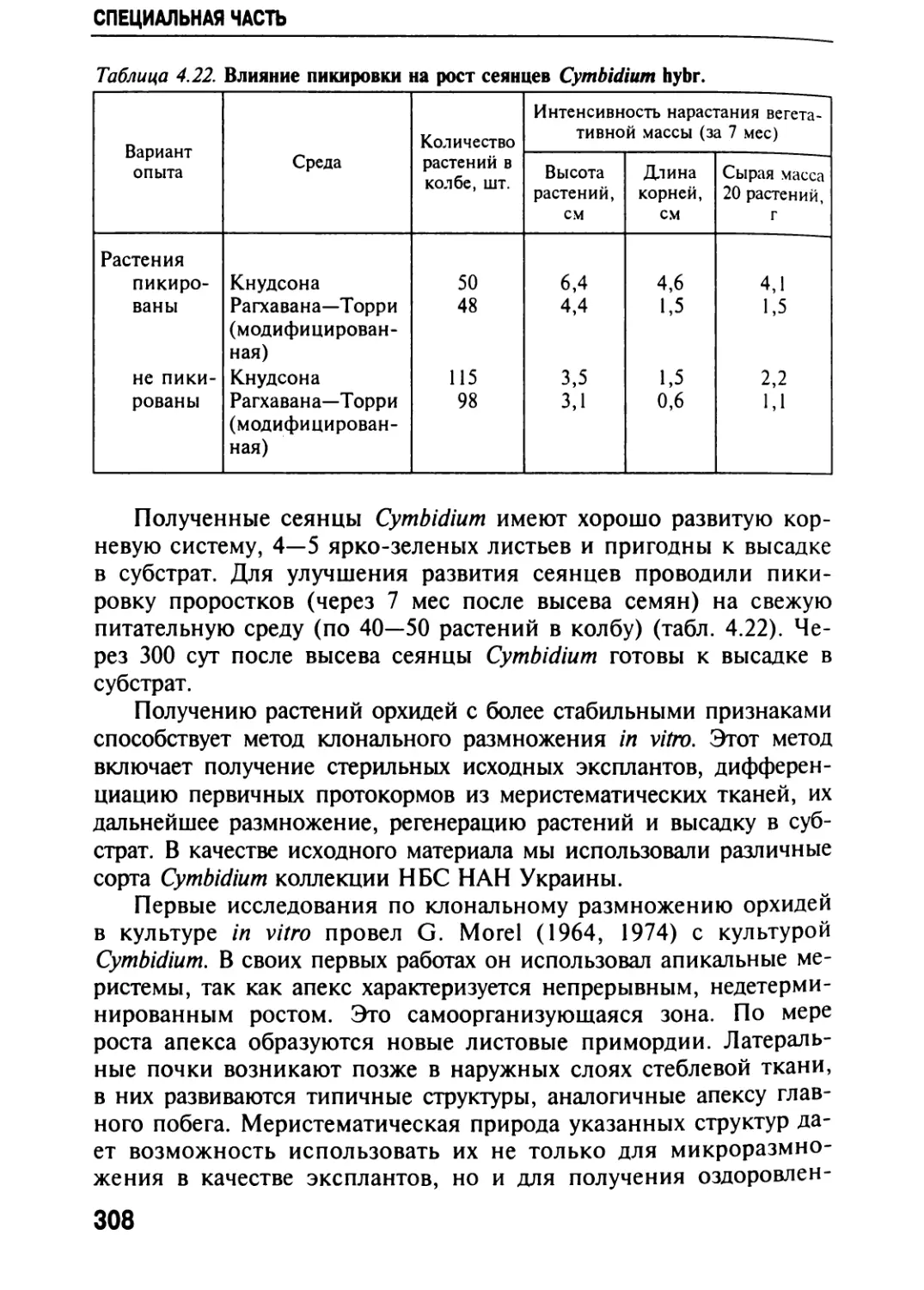
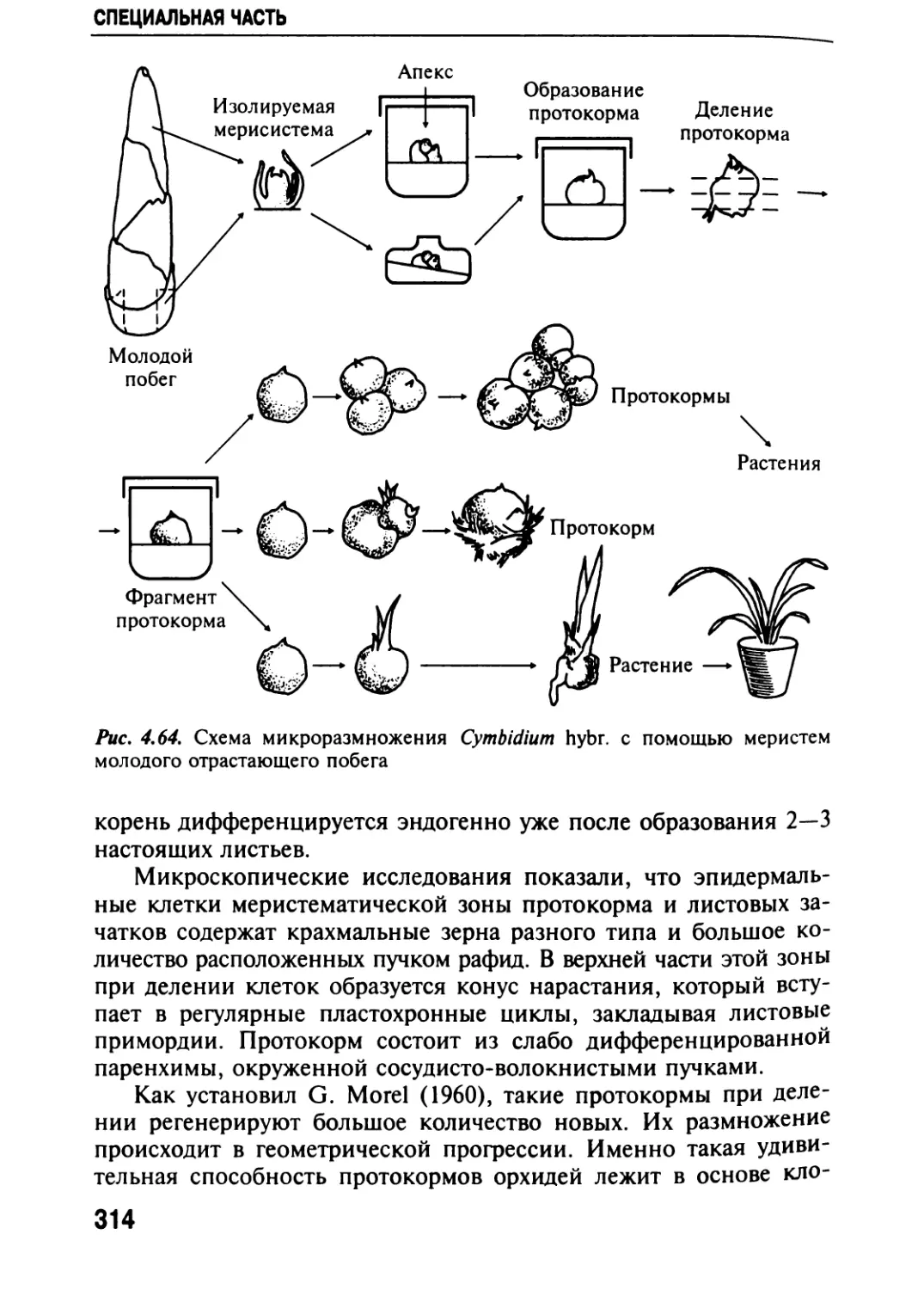
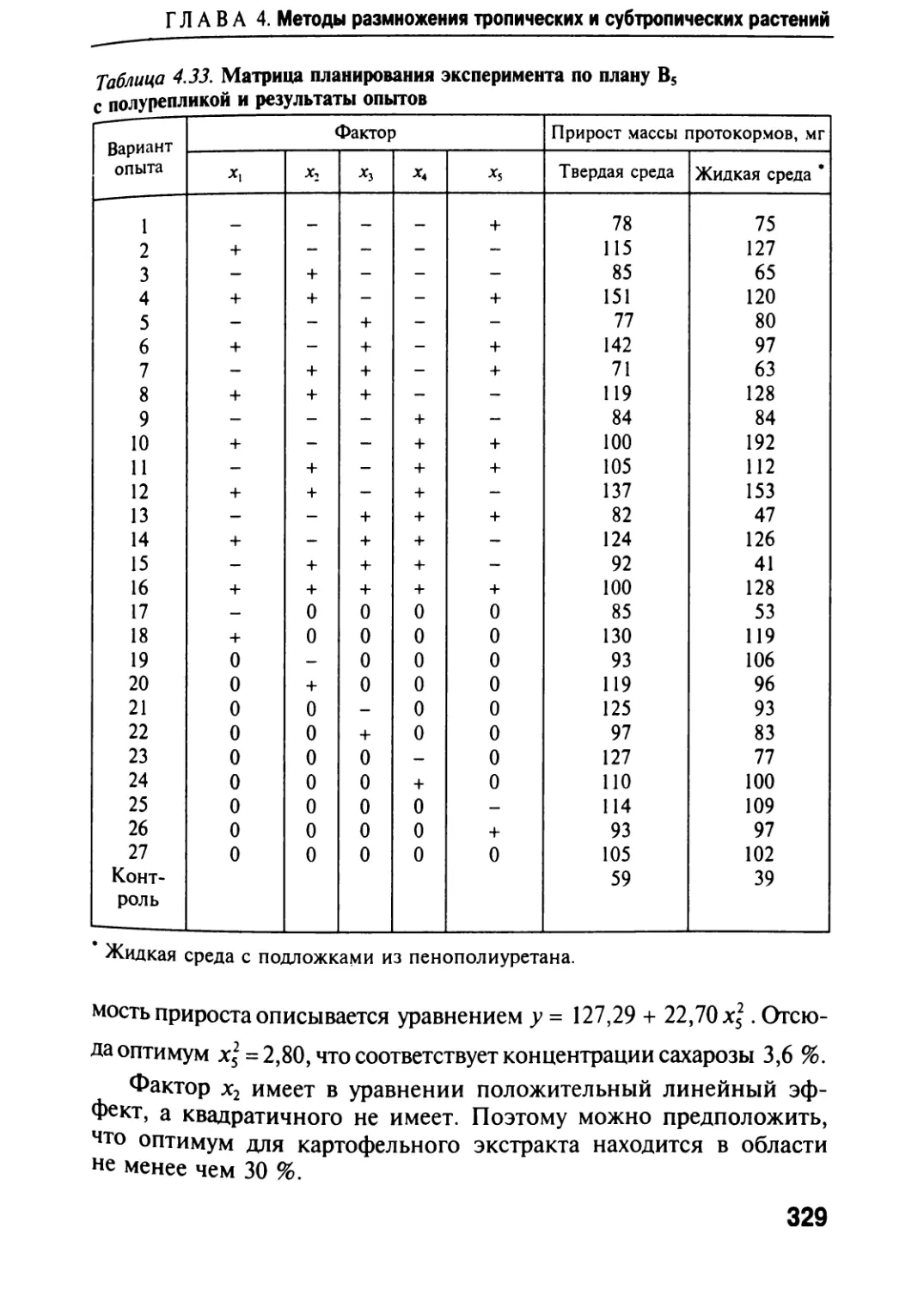
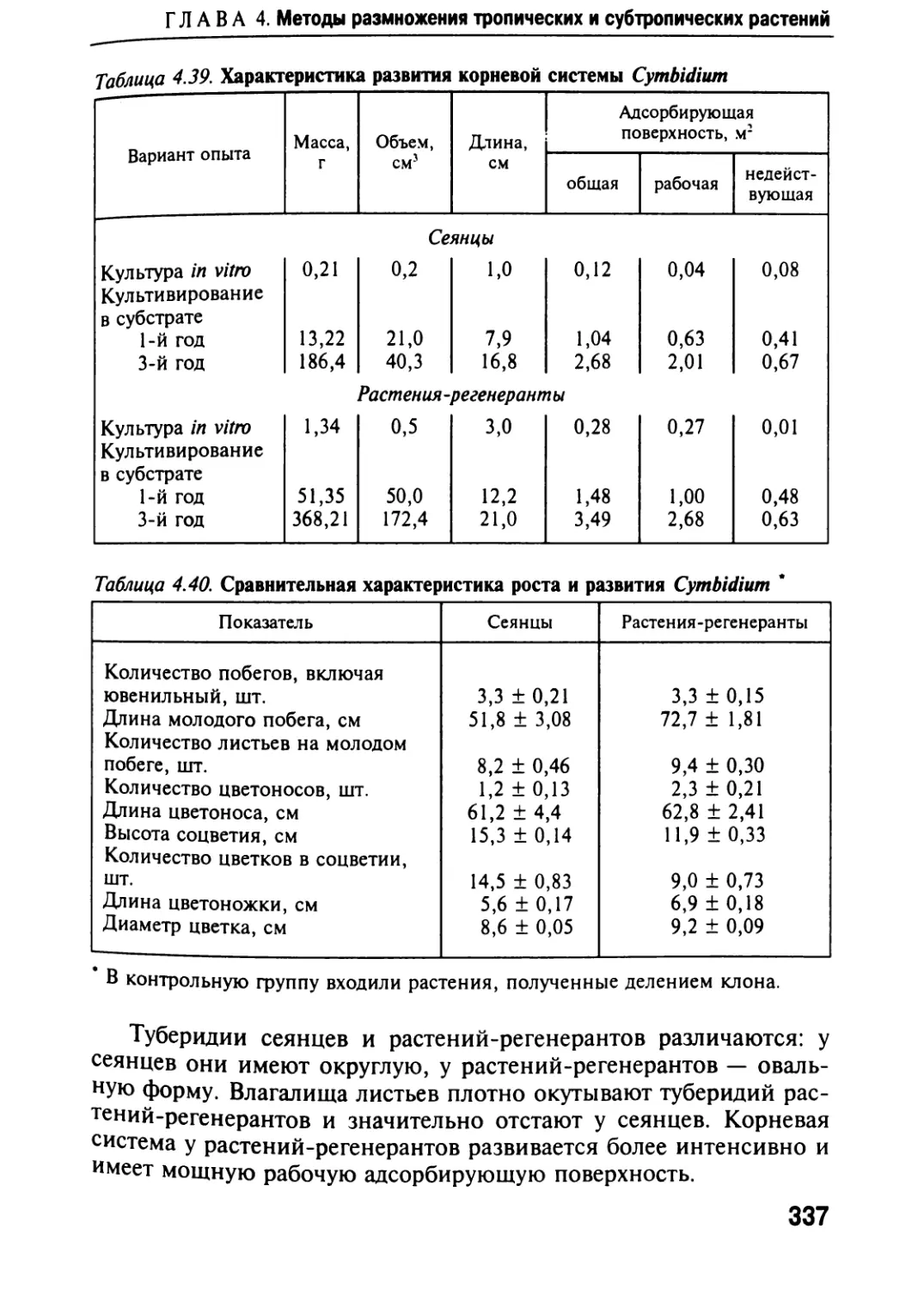
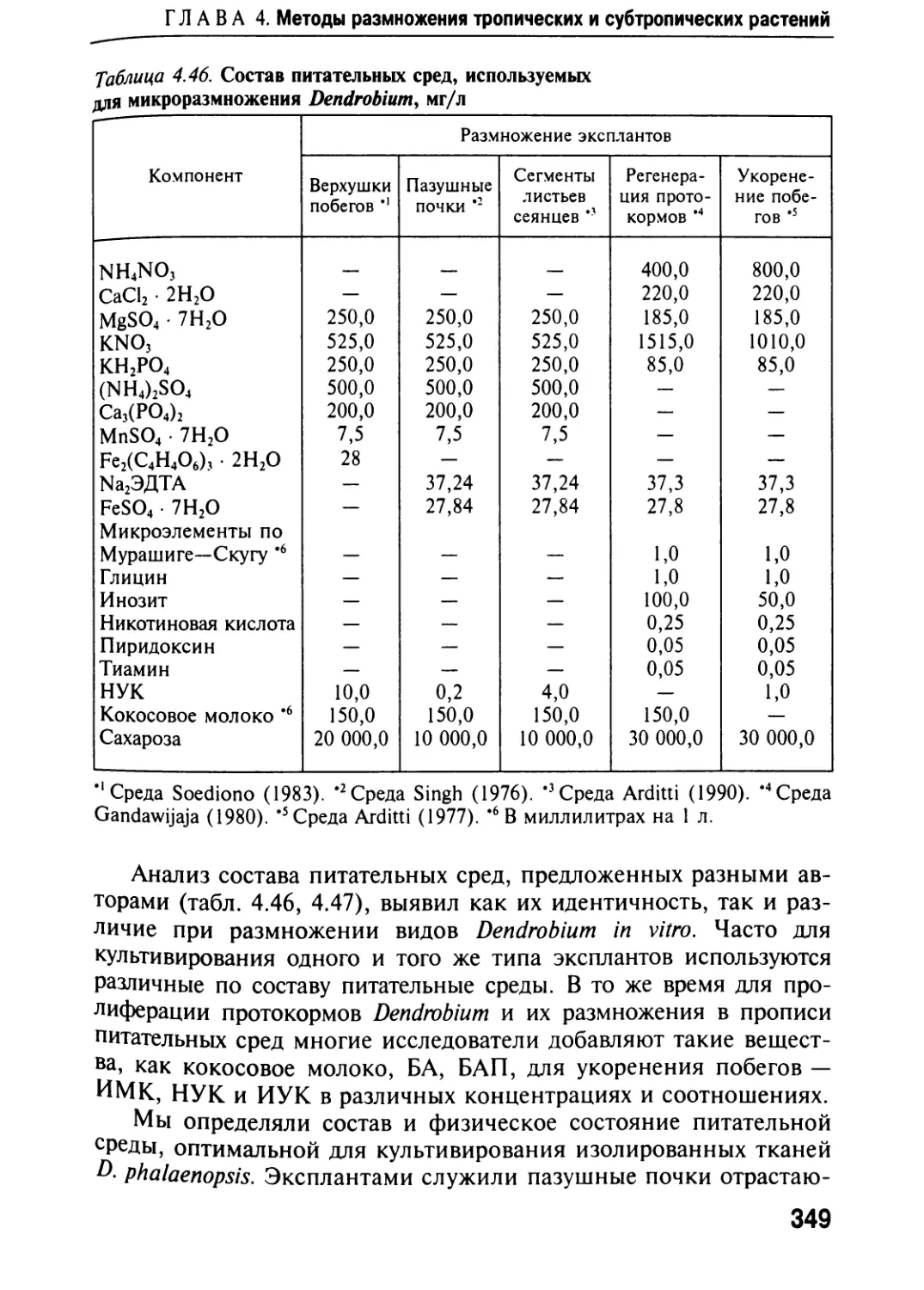
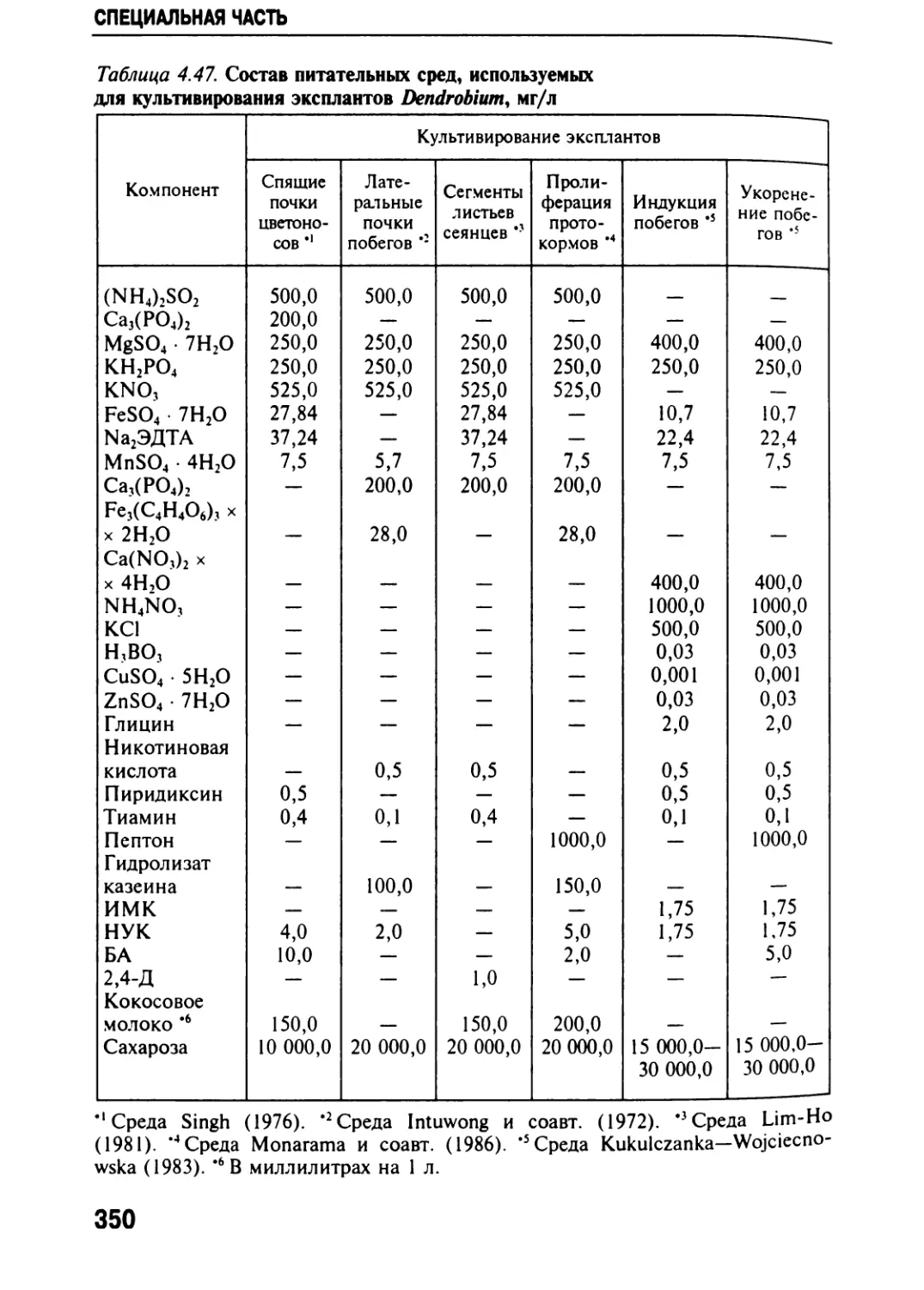
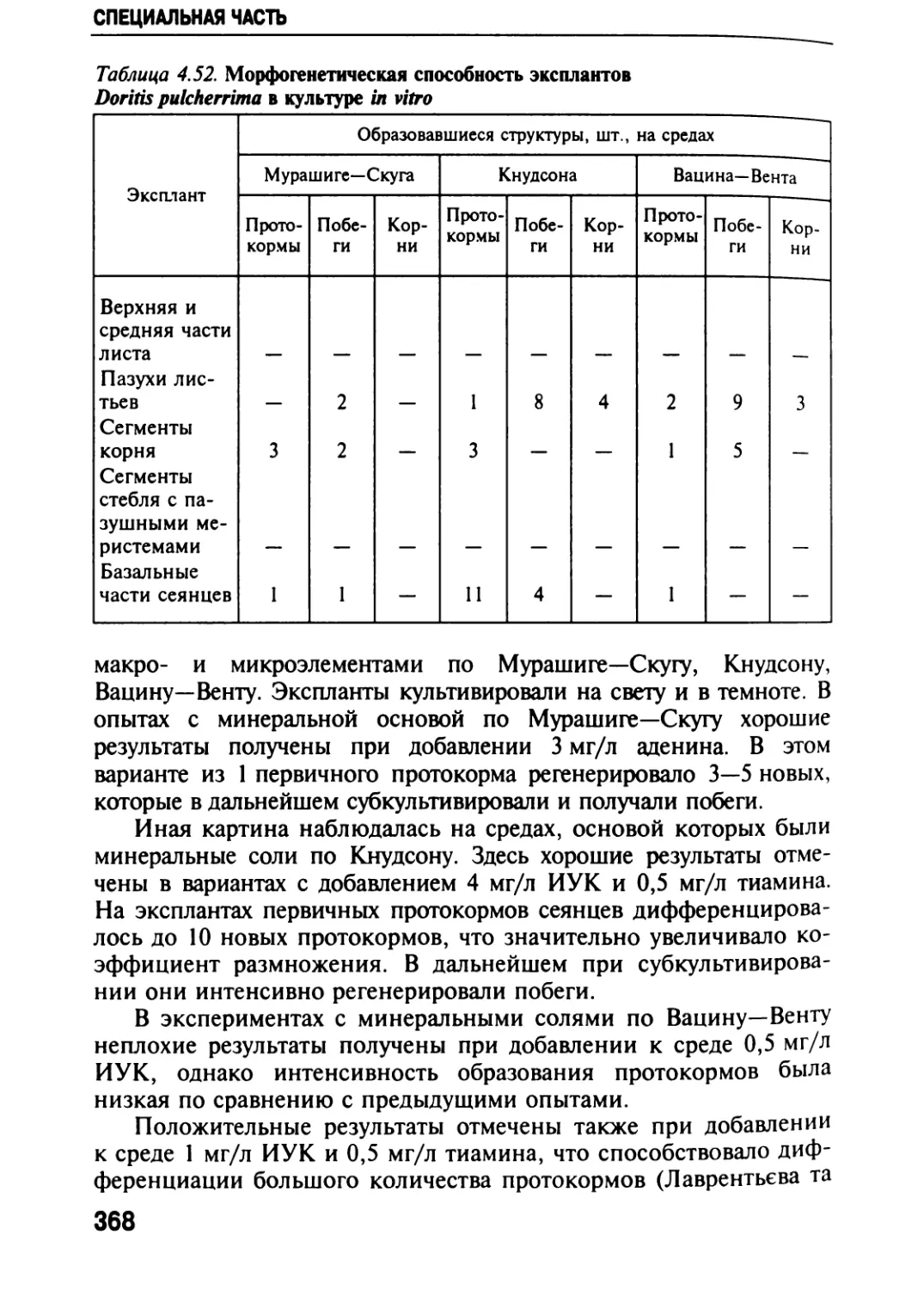
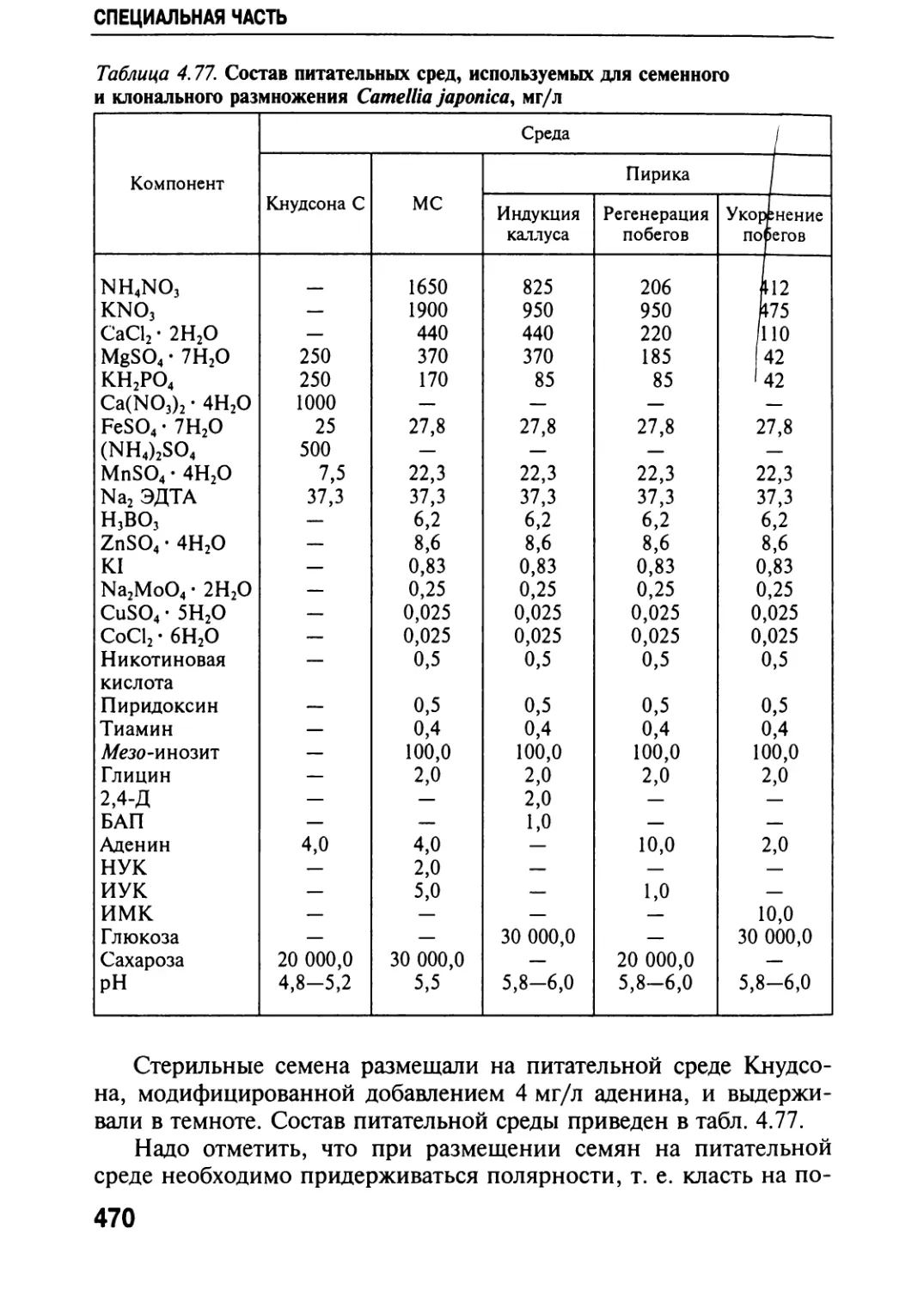
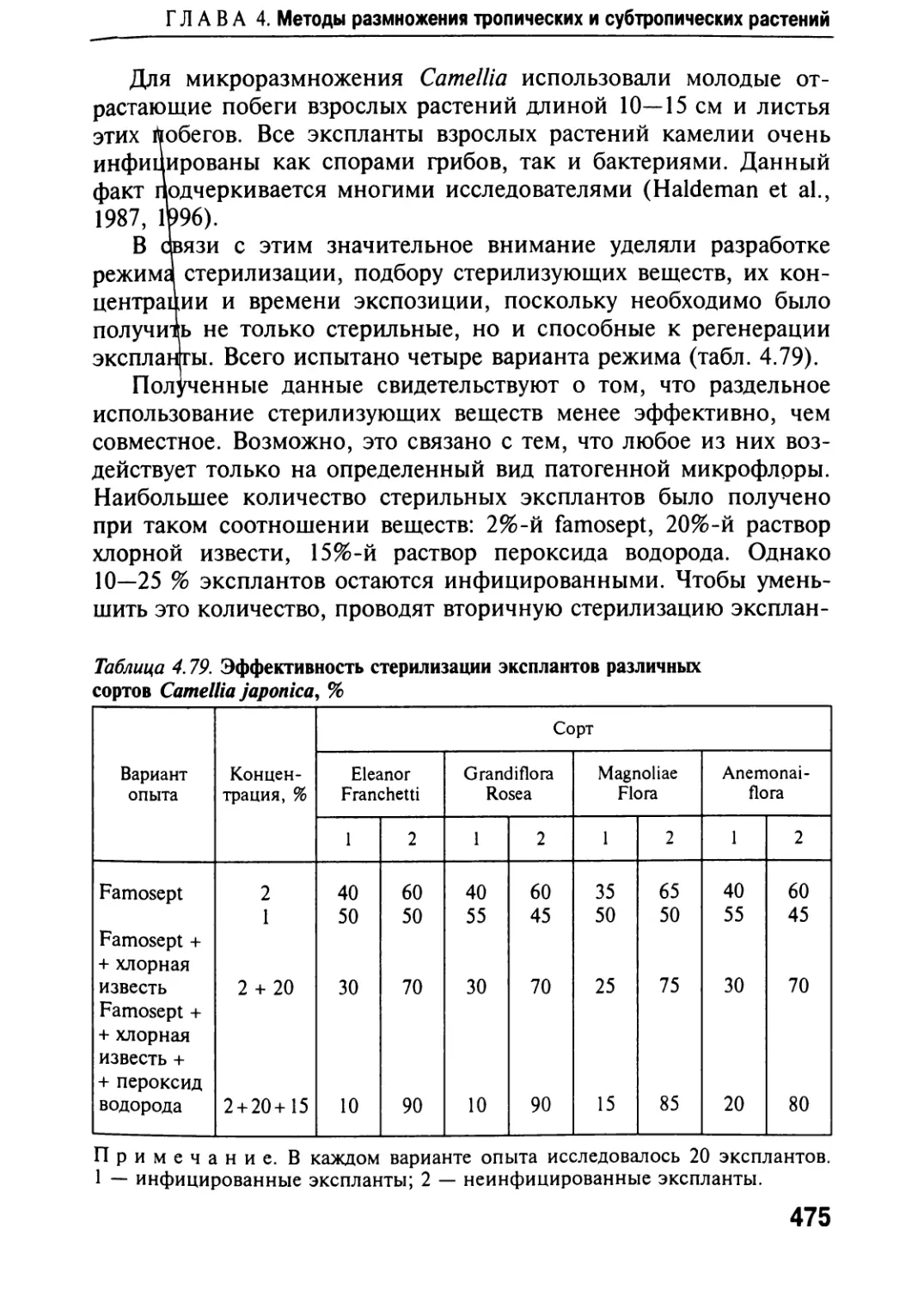
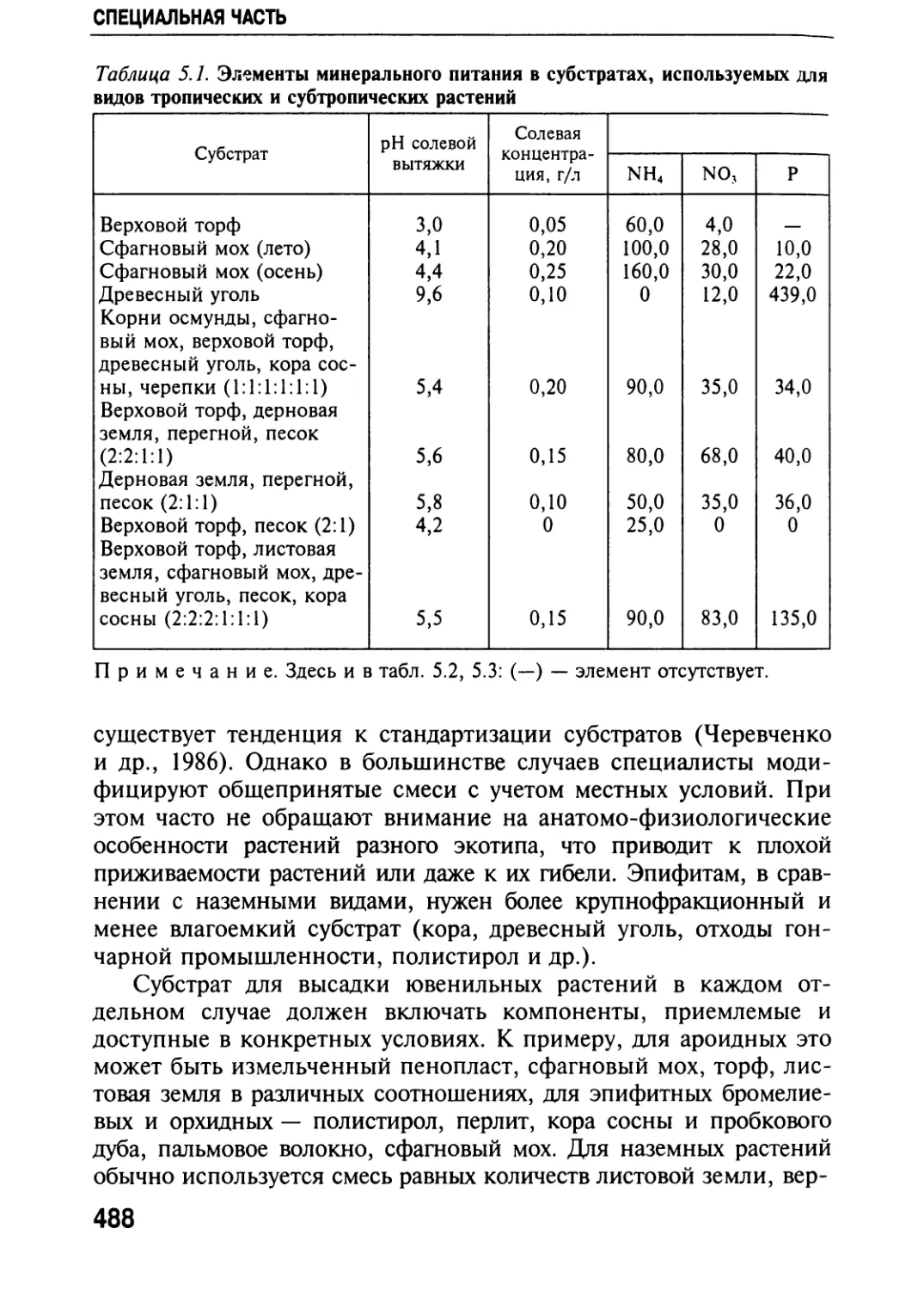
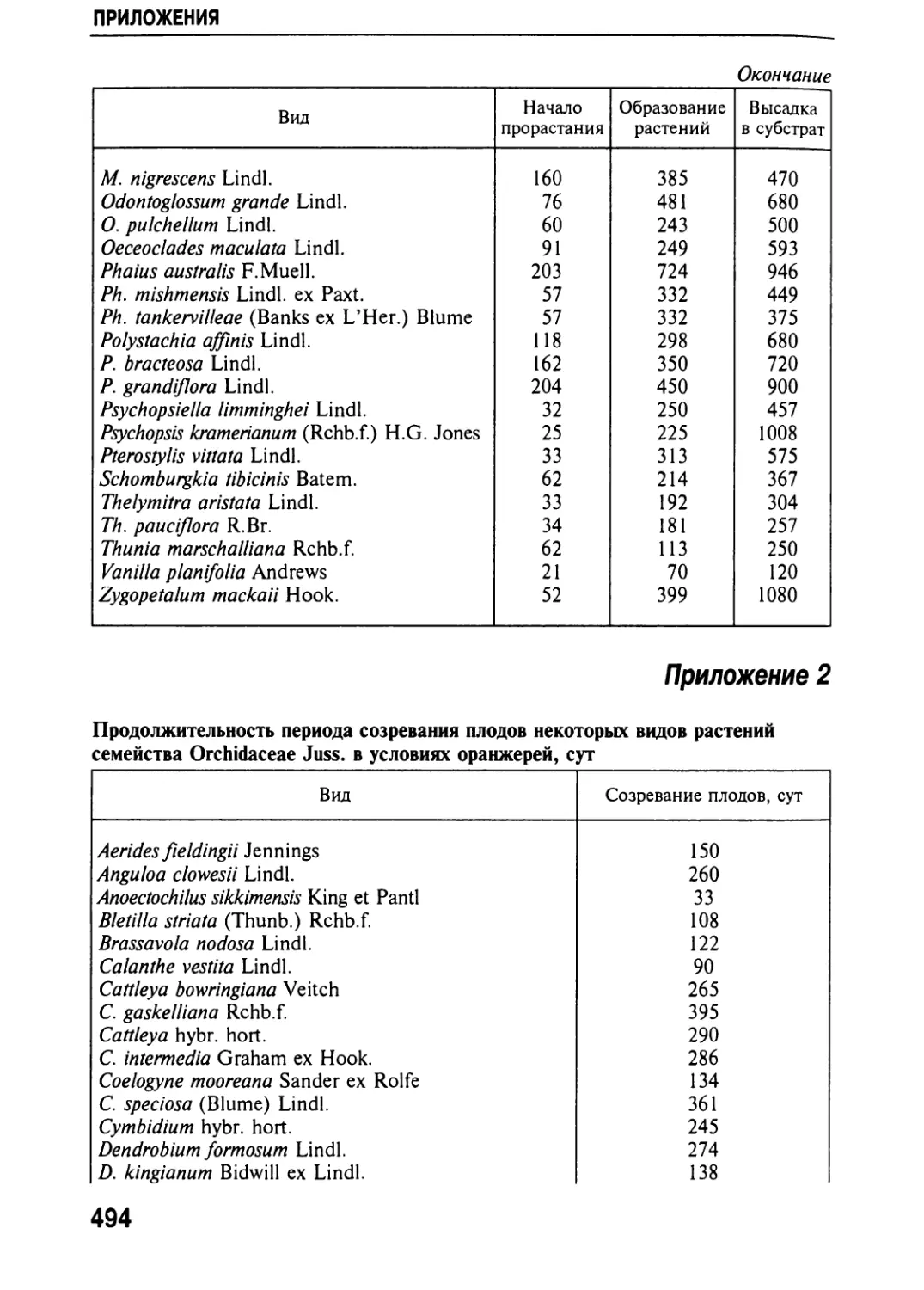
Автор: Черевченко Т.М. Лаврентьева А.Н. Иванников Р.В
Теги: декоративные растения декоративное садоводство ботаника физиология растений
ISBN: 978-966-00-0702-4
Год: 2008
Текст
Т.М. Черевченко, А.Н. Лаврентьева,
Р.В. Иванников
Т. M. Cherevchenko,
A.N. Lavrentyeva, R.V. Ivannikov
BIOTECHNOLOGY
OF TROPICAL
AND SUBTROPICAL
PLANTS in vitro
“SCIENTIFIC BOOK"
PROJECT - 2007
KYIV NAUKOVA DUMKA 2008
Т.М. Черевченко,
А.Н. Лаврентьева, Р.В. Иванников
БИОТЕХНОЛОГИЯ
ТРОПИЧЕСКИХ
И СУБТРОПИЧЕСКИХ
РАСТЕНИЙ in vitro
ПРОЕКТ
“НАУКОВА КНИГА ” - 2007
КИЕВ НАУКОВА ДУМКА 2008
УДК 635.918 : [57.085.2 + 579.6]
В монографии представлены результаты многолетних исследований различ¬
ных аспектов семенного и клонального размножения декоративных расте¬
ний. Описаны процессы онтоморфогенеза у сеянцев и растений-регенеран-
тов in vitro. Изложены методики стерилизации, культивирования и постасеп-
тической адаптации растений-регенерантов.
Для научных работников, изучающих вопросы размножения высших
растений in vitro, морфологов, физиологов растений, преподавателей и студентов
высших учебных заведений, специализирующихся в области ботаники, фи¬
зиологии растений и биотехнологии, а также широкого круга биологов.
У монографи наведено результати багатор1чних дослщжень р1зних аспеючв
HaciHHoro i клонального розмноження декоративних рослин. Описано процеси
онтоморфогенезу с1янщв i рослин-регенератчв in vitro. Викладено методики
стерил1зацп, культивування i постасептичноУ адаптацп рослин-регенератт
Для науковщв, яю вивчають питания розмноження вищих рослин in vit¬
ro, морфолопв, ф1зюлопв рослин, викладач1в i студент!в вищих заклад1в ocei-
ти, що спешал1зуються в галуз1 боташки, ф1зюлогн рослин i бютехнологи, а
також широкого кола бюлопв.
Results of long-term investigations of different aspects of the seed and clonal rep¬
roduction of ornamental plants are presented in the monograph. Processes of on-
tomorphogenesis in seedlings and plants-regenerates in vitro have been described.
Methoods of sterilization, cultivation and postaseptic adaptation of plants regene¬
rates are stated.
For scientific workers engaged in studying the problems of reproduction of
higher plants in vitro, morphologists, plant physiologists, teachers and students of
higher educational institutions specialized in botany, plant physiology and biotech¬
nology and for broad range of biologists.
Рецензенты
чл.-кор. HAH Украины, д-р биол. наук проф. В.А. КУНАХ,
чл.-кор. УААН, д-р биол. наук проф. Н.Н. МУСИЕНКО
Рекомендовано к печати ученым советом
Национального ботанического сада им. Н.Н. Гришко НАН Украины
Видання здшснене за державным контрактам
на выпуск науково! друкованоt продукци
Научно-производственный отдел медико-биологической,
химической и геологической литературы
Редактор Ж. В. Загоруйко
ISBN 978-966-00-0702-4
© Т.М. Черевченко, А Н. Лаврентьева,
Р.В. Иванников, 2008
Посвящается памяти
Андрея Михайловича
Гоодзинского—
известного ученого,
яркой личности и нашего учителя
Сегодня не подлежит сомнению тот факт, что в
основу решения проблемы сохранения биоразно¬
образия на Земле должен быть положен принцип
комплексной охраны генофонда, который упреж¬
дает потерю не только отдельных особей, но и всей
генетической структуры, разнокачественности видов
и культиваров. Важную роль в этом играют ботани¬
ческие сады, которые по своей структуре, возмож¬
ностям, исторически сложившейся тематике (интро¬
дукция и акклиматизация растений) являются уни¬
кальным местом для сохранения разнообразия фи¬
тогенофонда.
Возможности изучения растений в условиях
культуры значительно шире, чем в природе. С этой
точки зрения ботанические сады занимают уникаль¬
ное положение: имеют возможность изучать ритмы
развития растений, репродуктивную биологию и осо¬
бенности морфогенеза, а также разрабатывать ме¬
тоды массового размножения и технологию куль¬
тивирования.
В настоящее время в коллекциях ботанических
садов мира насчитывается свыше 80 тыс. видов рас¬
тений, а с учетом количества культиваров различ¬
ных групп растений, что свидетельствует о генети¬
ческом разнообразии живой природы, эта цифра
значительно выше (Jackson, 1999).
5
ВВЕДЕНИЕ
В последнее десятилетие все большее внимание уделяется
изучению и охране биологического разнообразия — основе суще¬
ствования и устойчивого экономического развития человеческого
общества. Угроза потери отдельных видов и экосистем еще нико¬
гда не была так велика, как сейчас, когда рост населения и по¬
следствия его хозяйственной деятельности приводят к необрати¬
мым изменениям природы всей планеты.
На XVI Международном ботаническом конгрессе, проходив¬
шем в августе 1999 г. в США, подчеркивалось, что если не при¬
нять в ближайшее время действенные меры по сохранению видо¬
вого разнообразия растений, то к середине XXI в. 2/3 из 300 тыс.
видов растений, обитающих на Земле, могут быть потеряны
(Рейвн, 2000).
Особое место занимает сохранение биоразнообразия тропи¬
когенной флоры, которая имеет весьма важное экологическое,
экономическое и социальное значение. Решение этого вопроса
возможно только при объединении усилий ученых на локальном,
национальном и международном уровнях. Отсюда очевидна не¬
обходимость разработки и реализации эффективных мероприя¬
тий по сохранению мирового растительного разнообразия. Важ¬
ным шагом в этом направлении было принятие мировым сооб¬
ществом в 1993 г. Международной конвенции о биологическом
разнообразии (Convention on Biological Diversity, 1994). Глобаль¬
ной миссией ботанических садов в этом аспекте является сохра¬
нение редких и исчезающих растений, изучение их биологиче¬
ских особенностей.
Как показывает практика, одно из максимально действенных
направлений по сохранению редких, исчезающих природных и
отбору новых хозяйственно ценных видов — разработка методов
их искусственного размножения и выращивания, в том числе и в
культуре in vitro. Применение последнего вносит ощутимый вклад
в сохранение их природных популяций, так как дает возмож¬
ность использовать фрагменты растений без нарушения их чис¬
ленности в природе, что особенно важно по отношению к ред¬
ким видам. Специфика метода позволяет получать фрагменты
растений или их семян с большого количества растений и лока-
литетов данного вида (по возможности).
Преимущество этого метода по сравнению с традиционными
методами размножения растений состоит в том, что он дает
возможность в короткие сроки получить много посадочного ма-
6
ВВЕДЕНИЕ
териала (высокий коэффициент размножения), а также выра¬
щивать сотни тысяч растений независимо от времени года.
Кроме того, метод позволяет повысить эффективность селекци¬
онных работ. Культивирование зародышей дает возможность
сохранить уникальные генотипы, полученные в результате меж¬
видового и межродового скрещивания, которые погибают при
обычных селекционных методах, ускорить процесс искусствен¬
ного получения и размножения полиплоидных форм.
С коммерческой точки зрения этот метод, по сравнению с
другими, имеет наибольшее значение для сельского хозяйства и
практики декоративного садоводства. К настоящему времени ко¬
личество видов растений, которые клонируются “в пробирке”,
уже составляет около 1 тыс. наименований. Более чем у 100 ви¬
дов данный метод находит реальное коммерческое применение,
среди них декоративные, плодово-ягодные, древесные, лекарст¬
венные и другие культуры (Лутова, 2003).
Предлагаемая монография — итог многолетней работы лабо¬
ратории микроразмножения Национального ботанического сада
им. Н.Н. Гришко НАН Украины (НБС НАН Украины). Особое
внимание уделено семейству орхидных, а также семействам аро¬
идных и бромелиевых, растения которых хорошо адаптируются в
интерьерах различного типа и вызывают интерес своеобразными
особенностями опыления. Кроме того, рассмотрен вопрос массо¬
вого размножения многих тропических растений, семена которых
в обычной культуре имеют очень низкую всхожесть, а вегетатив¬
ным способом размножаются крайне медленно.
Авторы благодарят сотрудников лаборатории семенного и кло¬
нального размножения растений — ведущего инженера Наталью
Станиславовну Иванникову, инженера 2 категории Людмилу Алек¬
сандровну Луневскую, коллег по отделу тропических и субтропиче¬
ских растений НБС им. Н.Н. Гришко — зав. отделом, ст. науч. со¬
трудника, канд. биол. наук Людмилу Ивановну Буюн, ст. науч. со¬
трудника, канд. биол. наук Людмилу Африкановну Ковальскую, ст.
науч. сотрудника, канд. биол. наук Наталью Алексеевну Денись-
евскую, науч. сотрудника Владимира Семеновича Вахрушкина, ст.
науч. сотрудника, канд. биол. наук Аллу Ивановну Жилу, ст. науч.
сотрудника, канд. биол. наук Жанну Николаевну Ярославскую, науч.
сотрудника, канд. биол. наук Игоря Ивановича Харченко, веду¬
щего инженера Ивана Владимировича Гурненко, д-ра биол. наук
7
ВВЕДЕНИЕ
Наталью Васильевну Заименко, мл. науч. сотрудника, канд. биол.
наук Ирину Прокофьевну Харитонову, коллег из Национального аг¬
рарного университета — группу сотрудников, возглавляемую канд.
биол. наук, доц. Ириной Николаевной Верхогляд — за совместную
экспериментальную работу, обсуждение результатов и помощь в
оформлении данной монографии.
Особую благодарность авторы выражают Валенти¬
не Евгеньевне Будак, которая на протяжении более
чем 25 лет являлась ведущим инженером лаборатории.
Благодаря ее пунктуальности, старательности и уси¬
лиям все это время поддерживалось полноценное функ¬
ционирование лаборатории и были размножены мно¬
гие тысячи редких и ценных декоративных растений.
Общая
часть
Глава 1
СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ
СОХРАНЕНИЯ МИРОВЫХ РАСТИТЕЛЬНЫХ
РЕСУРСОВ EX SITU
1.1. БОТАНИЧЕСКИЕ САДЫ - ЦЕНТРЫ
СОХРАНЕНИЯ ФЛОРИСТИЧЕСКОГО
РАЗНООБРАЗИЯ
На протяжении нескольких последних столетий бо¬
танические сады внесли выдающийся вклад в раз¬
витие общества. Появившись в XVI в. в Италии,
Франции, Германии и других странах, они стали сим¬
волом Европы эпохи Возрождения. Первые в миро¬
вой истории сады основывались при университетах
на базе аптекарских огородов, которые служили в
основном для сбора материалов и использовались в
качестве учебных лабораторий для студентов-меди-
ков. Начиная с раннего периода становления старей¬
шие ботанические сады Европы прошли долгий путь
развития, прежде чем превратились в крупные совре¬
менные центры, сочетающие в своей деятельности
не только научное, растениеведческое и образова¬
тельное направления, но и принимающие участие в
сохранении всемирно-исторического наследия, а
именно: зданий, пейзажей, живых растений и ред¬
ких коллекций (Джексон, 2005).
На ранних этапах становления ботанической
науки огромное значение имел личностный фак¬
тор — основной объем сведений обрабатывался и си¬
стематизировался признанными авторитетами (К. Лин¬
ней, Д. Дуглас, Дж. Бэнкс, А. Мензис и др.), ра¬
боты которых считались классическими. Не пос¬
леднюю роль в деятельности этих выдающихся
натуралистов своего времени сыграли связи с ботани-
11
ОБЩАЯ ЧАСТЬ
ческими садами. Во многом благодаря их коллекциям мы сего¬
дня широко используем целый ряд экзотических растений из от¬
даленных частей света, а множество интродуцентов стали неотъ¬
емлемыми элементами наших садов и парков. В немалой степени
этот процесс повлиял и на современный ассортимент сельскохо¬
зяйственных культур.
Таким образом, роль ботанических садов в экономическом
развитии отдельных стран (и даже целых регионов) в тропиче¬
ском и субтропическом поясах нашей планеты очень важна.
Флора тропиков и субтропиков, в 3 раза превосходящая по
количеству видов флору умеренных и арктических широт, тради¬
ционно вызывает особый интерес. Чрезвычайное богатство этой
флоры дало человечеству сотни видов полезных растений — пи¬
щевых, кормовых, лекарственных, технических, декоративных и
др., однако до настоящего времени они слабо изучены. Особенно
это касается бассейна р. Амазонки, тропических регионов Азии,
Западной Тропической Африки (Белоусова и др., 1986).
Некоторые ученые скептически относятся к созданию кол¬
лекций тропических и субтропических растений в условиях уме¬
ренной зоны в связи с малым количеством образцов и, соответ¬
ственно, низким уровнем генетического разнообразия. И тем не ме¬
нее бывают случаи, когда другим путем сохранить тот или иной
вид невозможно.
Феномен полного исчезновения вида из природных мест
обитания при сохранении его только в условиях культуры или в
виде натурализованных популяций — не такая уж редкость в со¬
временных условиях. Эта интродукционная особенность была
отражена в IUCN (1994) в качестве особой категории Extinct in
the Wild — таксон, исчезнувший в дикой природе, но сохра¬
нившийся в культуре или натурализованный за пределами ареа¬
ла. Из тропических орхидных к данной категории относится,
например, Phalaenopsis celebensis Sweet — эндемичный вид с о-ва
Сулавеси (Индонезия). Об экологии и распространении этого
вида на острове до сих пор ничего не известно, так как типич¬
ный образец был доставлен в США в 1980 г. без соответствую¬
щих характеристик; впоследствии вид был размножен искусст¬
венно и сегодня широко известен в культуре (Демидов, Коло¬
мейцева, 2004).
Таким образом, наряду с мониторингом природных популя¬
ций редких и исчезающих видов и охраны их in situ, одна из пре¬
вентивных мер охраны орхидных — сохранение видов ex situ.
12
ГЛАВА 1. Проблема сохранения мировых растительных ресурсов ex situ
Создание коллекций тропических и субтропических растений
в защищенном грунте умеренных широт можно рассматривать
как одну из форм охраны тропической и субтропической флоры
и их разнообразия ex situ, что является частью общей стратегии
охраны растений, направленной на сохранение видов в природе.
Это две стороны одного и того же процесса, два подхода, допол¬
няющие друг друга.
Для более рационального использования таких коллекций
очень важна специализация ботанических садов по тем или иным
группам либо семействам растений. Собранные коллекции долж¬
ны комплексно изучаться (биология индивидуального развития,
анатомия, морфология, биохимия, вегетативное, семенное и кло¬
нальное размножение). Чрезвычайно важен подбор субстратов для
культивирования коллекционных образцов в условиях оранжерей
и пр. Коллекции живых растений не только способствуют сохра¬
нению видов, но в случае необходимости могут быть источника¬
ми при их реинтродукции. Решение данного вопроса даст воз¬
можность определить количество видов, так как изучение будет
проводиться систематически на всех этапах — от высадки до
плодоношения.
Кроме того, такие коллекции позволят сконцентрировать в бо¬
танических садах специалистов и ученых, целенаправленно рабо¬
тающих в данном направлении. На сегодняшний день уникаль¬
ные виды флоры Австралии, Амазонии, Мексики, Кубы, Азии
любыми методами нужно сохранять и приумножать для будущих
поколений (Черевченко, 2003).
На многих островах тропиков и субтропиков, флористически
богатых узкоареальными, эндемичными и реликтовыми видами,
мало или совсем нет ботанических садов. В связи с этим крайне
необходима организация коллекционных фондов, цель которых —
сохранение редких и исчезающих растений данной зоны в защи¬
щенном фунте ботанических садов умеренных широт, где такие
коллекции, с одной стороны, будут апробированы по уровню
адаптивных стратегий, с другой — позволят не только сохранить
представителей природных популяций видов растений, но и вы¬
явить широкий спектр полиморфизма, обеспечивающий их ин¬
тродукцию (Джексон, 2001).
Возвращаясь к сказанному выше, отметим, что сегодня в
связи с относительно полной изученностью флоры Европы
ощутимое пополнение генофонда хозяйственно ценных расте¬
ний возможно лишь в результате изучения и интродукции рас¬
13
ОБЩАЯ ЧАСТЬ
тений тропических и субтропических зон земного шара. До не¬
давнего времени одним из путей мобилизации этих растений
для интродукционного процесса являлись научно-исследова-
тельские экспедиции. Особый интерес для интродукторов пред¬
ставляют флористические богатства Палеотропического царства
Земли с большим количеством эндемичных семейств, родов,
видов.
Значительная часть коллекций тропических и субтропических
растений НБС НАН Украины была сформирована в ходе трех
экспедиций в страны Атлантического и Индийского океанов в
15, 19 и 24-м рейсах НИС АН УССР “Академик Вернадский”
соответственно в 1977, 1979, 1981 гг. (Черевченко, 1989).
На сегодняшний день мы не можем говорить о полноценном
сохранении тропикогенных видов в условиях оранжерей уме¬
ренного климата, поскольку, как правило, имеем в своем рас¬
поряжении ограниченное количество экземпляров. Вследствие
огромных энергетических затрат ни одна, даже самая богатая
страна Евразии и Северной Америки не в состоянии финанси¬
ровать проекты, направленные на воспроизводство в условиях
оранжерей тою количества тропикогенных видов, которые в на¬
стоящее время признаны редкими или исчезающими. Вследствие
этого особую актуальность приобретают методы стабильного со¬
хранения генотипов, уже имеющихся в коллекциях ботаниче¬
ских садов.
Одним из способов сохранения генофонда редких и эндемич¬
ных видов орхидных в условиях установок искусственного кли¬
мата может быть создание коллекций живых растений in vitro
и/или банков зародышевой плазмы в виде семян, меристем, пыль¬
цы, культур клеток, культур тканей и другого генетического ма¬
териала (Тихонова и др., 2001).
Выращивание в условиях in vitro дает возможность контроли¬
ровать многие факторы внешней среды: температуру, влажность,
продолжительность и интенсивность светового дня, состав пита¬
тельных веществ. Это и определило широкое использование куль¬
туры растительных тканей in vitro в качестве модельной системы
для теоретических и прикладных исследований в области физио¬
логии и биотехнологии растений.
14
1.2. ЛАБОРАТОРИЯ МИКРОРАЗМНОЖЕНИЯ
РАСТЕНИЙ НАЦИОНАЛЬНОГО
БОТАНИЧЕСКОГО СДДА НАН УКРАИНЫ
Лаборатория семенного и микроклонального раз¬
множения растений была создана как подразделение отдела тро¬
пических и субтропических растений в Центральном республикан¬
ском ботаническом саду АН УССР (ныне — НБС НАН Украины)
в апреле 1974 г. Инициатором ее создания была д-р биол. наук,
чл.-кор. НАН Украины Татьяна Михайловна Черевченко. К концу
1974 г. лаборатория уже имела все необходимое оборудование, по¬
мещения и была укомплектована персоналом. У ее истоков также
стояли канд. биол. наук Галина Петровна Кушнир, канд. биол.
наук Алла Николаевна Лаврентьева, ведущий инженер Валентина
Евгеньевна Будак. Лаборатория была создана очень своевременно
и стала одной из первых в Украине. На то время ученые СССР
вели поисковые работы с отдельными цветочными культурами —
лилиями (Корнеева, 1977), ирисами (Лунева, 1977). В ряде инсти¬
тутов были разработаны методы культивирования меристематиче-
ских тканей для освобождения от вирусной инфекции растений
картофеля (Винклер, Бутенко, Лайнгер, 1974), земляники (Попов,
1974), малины (Щелкунова, 1973), смородины и винограда (Абра¬
менко, 1974). В промышленном цветоводстве уже был внедрен ме¬
тод культуры меристем при выращивании посадочного материала
ремонтантной гвоздики в г. Огре (Латвийская ССР) и совхозе
“Оранжерейный комплекс” Московской обл. (Цветоводство № 1,
№ 6, 1977). На тот момент разработкой методов выращивания in
vitro других цветочных культур никто не занимался.
На первом этапе перед лабораторией была поставлена сле¬
дующая задача — разработать методы культивирования изолиро¬
ванных тканей растений, представляющих интерес для внедрения
в промышленное цветоводство. Кроме того, объектами исследо¬
ваний служили некоторые виды растений семейства орхидных.
Это тем более актуально, так как к тому времени в отделе тропи¬
ческих и субтропических растений была собрана значительная
коллекция, в том числе и семейства орхидных. В то же время в
Других ботанических садах Украины не существовало сколько-
нибудь значительных коллекций и имелись лишь единичные эк¬
земпляры орхидей.
Орхидные можно размножать вегетативно, однако этим мето¬
дом добиться широкого внедрения их в культуру невозможно —
15
ОБЩАЯ ЧАСТЬ
нарастание вегетативной массы происходит крайне медленно и
до момента деления клона проходит 5—7 лет. И только разработ¬
ка и овладение методами семенного и клонального размножения
этих растений открыли перспективу введения их в культуру и
создания мошной базовой коллекции представителей Orchidaceae
Juss. в отделе тропических и субтропических растений НБС НАН
Украины.
В лаборатории с момента ее основания проводятся комп¬
лексные исследования, направленные на выяснение действия
компонентов питательных сред на процессы роста и развития
сеянцев разных видов орхидных, изучаются особенности их он¬
тогенеза in vitro. За годы существования лаборатории были раз¬
множены сотни видов тропикогенных орхидных и представите¬
лей других семейств декоративных растений. Так, в отчете за пе¬
риод с 1974 по 1977 г. есть данные о посевах более чем 90 видов
семейства Orchidaceae: Лсатре multiflora Lindl., Cyrtorchis arcuata
(Lindl.) Scher., Catasetum russellianum Hook., Cymbidium canalicu-
latum R.Br., Maxillaria nasuta Rchb.f., Stanhopea saccata Batem.,
Stanhopea oculata (Lodd.) Lindl., Thelymitra pauciflora R.Br. и мно¬
жество др. Кроме того, параллельно проводились работы по кло¬
нальному размножению некоторых видов орхидных: Coelogyna
cristata Lindl., Cattleya hybr., Cymbidium aloefolium (L.) Sw., Dendrobi-
um kingianum Bidwill ex Lindl., Epidendrum radicans Pav., Laelia go-
uldiana Rchb.f., Phalaenopsis hybr., Thunia marshalliana Rchb.f.,
Vanda tricolor Lindl. На этих видах отрабатывались самые обшие
приемы работы с растительными тканями in vitro: отбор экс-
плантов, стерилизация, условия культивирования (свет, темпера¬
тура, влажность, питательные среды). Одними из первых в сеп¬
тические условия были высажены растения Thunia marshalliana и
Calanthe vestita Lindl. Итогом исследований лаборатории в этот
период явились результаты, которые в дальнейшем привели к
разработке состава универсальной питательной среды для про¬
ращивания семян тропикогенных орхидных. Основа этой среды —
минеральные соли по Кнудсону, однако вместо экзотических и
малодоступных компонентов (жидкого эндосперма кокосового
ореха и др.), основываясь на всестороннем изучении биологии
индивидуального развития и эколого-физиологических особен¬
ностях проростков орхидных, были предложены такие соедине¬
ния, как гумат натрия, пептон, активированный уголь. Данная
композиция составляющих позволила получить позитивные ре¬
зультаты при проращивании семян большинства видов тропи¬
16
\ljpj ГЛАВА 1. Проблема сохранения мировых растительных ресурсов ex situ
когенных орхидных: увеличилось количество проросших семян,
уменьшился период их прорастания, ускорились темпы индиви¬
дуального развития сеянцев. За разработку состава среды для
проращивания семян тропикогенных орхидных коллектив авто¬
ров в 1981 г. получил авторское свидетельство на изобретение
(Кушнир, Будак, Лаврентьева, 1981).
В дальнейшем усилия сотрудников лаборатории были скон¬
центрированы как на решении перечисленных выше задач, так и
на разработке методов клонального размножения (микроразмно¬
жения) растений, изучении особенностей адаптации к условиям
оранжерей сеянцев и растений-регенерантов. Позже удалось на¬
ладить и параллельные анатомические исследования изучаемого
растительного материала, что давало возможность более полно
охарактеризовать описываемые процессы.
Со временем круг объектов значительно расширился и стал
охватывать не только семейство Orchidaceae, но и множество
других видов тропикогенной флоры. На протяжении последних
10 лет в лаборатории разработаны и модифицированы методы
массового размножения растений из целого ряда семейств: Aga-
vaceae Engl., Агасеае Juss., Begoniaceae Juss., Bromeliaceae Juss.,
Cactaceae Juss., Gesneriaceae Dum., Ericaceae Juss., Musaceae Juss.,
Proteaceae Juss., Nepentaceae Dum., Theaceae D.Don. Особое внима¬
ние уделяется размножению редких и исчезающих видов. В ча¬
стности, разработаны методы массового размножения 7 видов
Laelia Lindl. Среди них L. lobata (Lindl.) Veitch, занесенная в До¬
полнение № 1 CITES эндемов Бразилии и Венесуэлы (Cattleya
aclandiae Lindl., С. bowringiana O'Brien, С. percivaliana (Rchb.f.)
O'Brien), Вьетнама (Paphiopedilum delenatii Guill., Coelogyne law-
renceana Lindl.) и Мадагаскара (Angraecum eburneum Bory, Angrae-
cum sesquipedale Thou).
За длительный период накопилось много данных, которые, на
наш взгляд, будут интересны как с научной, так и с практиче¬
ской точки зрения и заслуживают, чтобы их опубликовали. Пред¬
ставленная монография — квинтэссенция тех работ, которые на
протяжении более чем 30 лет ведутся в лаборатории микроразмно¬
жения отдела тропических и субтропических растений НБС НАН
Украины.
ТЕХНОЛОГИЯ РАЗМНОЖЕНИЯ РАСТЕНИЙ
В АСЕПТИЧЕСКИХ УСЛОВИЯХ
2.1. ЛАБОРАТОРИЯ: ТРЕБОВАНИЯ
К ПОМЕЩЕНИЯМ, ИХ КОЛИЧЕСТВУ
И РАСПОЛОЖЕНИЮ
Работы по культивированию изолированных тканей
растений и семян проводятся в асептических услови¬
ях в специально оборудованной для этого лабора¬
тории. Лучше всего, если весь комплекс лаборатор¬
ных помещений будет размещен в отдельном здании
или все его комнаты сконцентрированы в одном
месте с отдельным входом. В помещениях лабора¬
тории должен соблюдаться режим стерильности и
ограничиваться доступ лиц, не имеющих непо¬
средственного отношения к данному процессу.
Лаборатория включает группу территориально
взаимосвязанных помещений — моечную, весовую,
автоклавную, ламинарную, световую, стерильный
бокс, культуральную, помещение для персонала,
кладовую и др. (рис. 2.1). Для удобства в работе
моечную, весовую и автоклавную необходимо со¬
единить в единый комплекс; то же относится к
ламинарной и световой комнатам. Кладовая и по¬
мещение для персонала должны находиться от¬
дельно. Во всех помещениях полы следует выло¬
жить кафелем или устлать линолеумом, стены по¬
крыть водоэмульсионной или масляной краской. В
конце рабочей недели в комплексе лабораторных
помещений обязательно проводится тщательная
уборка с дезинфицирующими средствами. Поме¬
щения для ламинаров и стерильный бокс стерили¬
зуются бактерицидными лампами (6—8 ч).
18
ГЛАВА 2. Технология размножения растений в асептических условиях
В моечной проводят основные подготовительные работы: мы¬
тье и первичную сушку посуды, обработку растительного мате¬
риала перед введением в культуру. Эту комнату оборудуют моеч¬
ными машинами, глубокими раковинами из кислотоустойчивого
материала, трубопроводами холодного и горячего водоснабжения.
В этом же помещении можно установить аппарат для дистилли¬
рования воды. Для удобства в работе дистиллятор располагают на
специальной подставке, прикрепленной к стене выше крана с
водой. Под аппаратом устанавливают емкость для сбора дистил-
лированой воды.
Питательные среды лучше готовить в отдельной комнате, ос¬
нащенной аналитическими и торзионными весами, рН-метром,
холодильником для хранения реактивов и маточных растворов,
шкафами для хранения чистой посуды и емкостей с приготов¬
ленной средой. В весовой также должен быть расположен стол с
большой (2,5—3,0 м2) влагостойкой столешницей для приготов¬
ления сред.
Согласно требованиям техники безопасности, автоклавную
комнату лучше изолировать от всех остальных помещений. Пол в
автоклавной должен быть кафельным с уклоном для стока воды в
Рис. 2.1. План-схема расположения помещений лаборатории микроразмно¬
жения НБС НАН Украины:
I — культуральная; 2— темновой отсек культуральной; 3 — ламинарная; 4 — кладовая;
э — стерильный бокс; 6— коридор; 7— лабораторное помещение; 8 — моечная; 9 —
весовая; 10 — автоклавная; 11 — помещение для персонала
19
ОБЩАЯ ЧАСТЬ
канализацию, стены обработаны водостойким покрытием. В по¬
мещении для стерилизации устанавливают автоклавы типа ГК-100
и сушильные шкафы.
Для проведения работ в септических условиях (высев семян,
стерилизация и вычленение эксплантов с последующим суб¬
культивированием на питательной среде) используют комнату с
ламинарными боксами или стерильный бокс. В этих комнатах
на потолках и над рабочими поверхностями необходимо размес¬
тить бактерицидные аргонно-ртутные (БУВ-15, -30) или ртутно¬
кварцевые (ПРК-7) лампы. Стерильные материалы (салфетки, вату,
химические стаканы, чашки Петри, воду и др.) удобно хранить
тут же, в ламинарной комнате в непосредственной близости от
ламинарных боксов и использовать по мере необходимости. Возле
каждого бокса должен стоять автономный передвижной столик
с легко моющейся поверхностью, который используют для про¬
ведения масштабных работ или для работ по введению эксплан¬
тов в стерильную культуру.
В стерильном боксе должен постоянно находиться биноку¬
лярный микроскоп марки МБС-9; с его помощью удобно вы¬
членять апикальные и пазушные меристемы исследуемых объ¬
ектов. Здесь устанавливают столы, покрытые легко моющимся
материалом, на которых размещают микроскопы и необходимый
для работы инструмент. Комната должна быть хорошо освеще¬
на; перед работой ее в течение 2—3 ч стерилизуют бактерицид¬
ными лампами.
Для культивирования изолированных тканей, сеянцев, расте-
ний-регенерантов и проращивания семян используют помеще¬
ние, оборудованное стеллажами для размещения емкостей с рас¬
тениями и искусственным освещением. Подсветку можно осуще¬
ствлять люминесцентными лампами ЛБ-40, -20, ЛД-40, -20 или
их современными энергосберегающими аналогами со спектром
свечения, близким к естественному. В световой необходимо под¬
держивать постоянную температуру (22—26 °С) с суточными ко¬
лебаниями около 2—4 °С. С этой целью помещение нужно обору¬
довать кондиционером. Управление освещением лучше вести из
отдельного помещения — аппаратной. Влажность в культураль¬
ном помещении должна составлять 70 %, фотопериод — 8—12 ч.
Лампы дневного света можно размещать как вертикально, так и
горизонтально — в зависимости от сортимента культивируемых
растений. Для дифференциации и культивирования каллусных
тканей используют темновой отсек. В этом помещении устанав¬
20
ГЛАВА 2. Технология размножения растений в асептических условиях
ливают термостаты и стеллажи для культивирования каллусов;
освещение должно быть автономным и включаться только в слу¬
чае проведения контроля.
2.2. ОСНАЩЕНИЕ ЛАБОРАТОРИИ
Посуда и вспомогательные материалы. Оснащение
лаборатории посудой зависит от объема и характера проводимых
работ. Обычно для высева семян используют плоскодонные ко¬
нические колбы Эрленмейера на 250, 300 и 500 мл, микробио¬
логические матрацы, биологические пробирки, аптечные склян¬
ки, флаконы, банки с жестяными крышками. Изолированные
ткани растений культивируют в конических колбах на 50—100 мл,
биологических пробирках, в чашках Петри. Для промывки и сте¬
рилизации растительного материала используют химические ста¬
каны. Приготовление питательных сред проводят в емкостях на
3—5 л (желательно в эмалированной или стеклянной посуде);
компоненты среды смешивают с агаром, расплавленным в от¬
дельной посуде. Для хранения маточных растворов необходимы
мерные колбы с притертыми пробками различных размеров,
стеклянные бутыли, склянки из темного стекла. Всю посуду пе¬
ред употреблением нужно тщательно вымыть. Новую посуду за¬
ливают хромпиком (раствор 9,2 г бихромата калия в 100 мл кон¬
центрированной серной кислоты) и выдерживают 2—4 ч, затем
посуду промывают горячей проточной водой и ополаскивают
дистиллятом. Вымытую посуду сушат и стерилизуют в сушиль¬
ном шкафу при температуре 170—180 °С в течение 1—2 ч.
Для вычленения апексов, почек и кусочков тканей из интакт-
ных растений применяют анатомические глазные скальпели, дис-
цизионные иглы, лезвия бритв, вставленные в специальные дер¬
жатели. Для высева семян орхидных на поверхность питательной
среды используют специальные лопаточки. Предварительно ме¬
таллический инструмент стерилизуют в сушильном шкафу, а во
время работы периодически опускают в стакан с ректифициро¬
ванным спиртом и обжигают в пламени спиртовки.
Вспомогательные материалы (вату, мешочки, салфетки из
фильтровальной бумаги, на которых проводят вычленение экс-
плантов и их субкультивирование, листы плотной оберточной
бумаги, между которыми хранится стерильный инструмент, цел¬
лофан, стаканы, чашки Петри, колбы с водой) стерилизуют 2 ч в
автоклаве при давлении 2 атм.
21
ОБЩАЯ ЧАСТЬ
При введении растительных тканей в культуру in vitro очень
удобно использовать многослойные складчатые конверты из
плотной бумаги “крафт” (рис. 2.2, см. вклейку). Конверты при¬
меняют для закладки в них на рабочем столе ламинарного бокса
стерильных инструментов, которые используют по мере необхо¬
димости. Такое приспособление существенно облегчает работу,
сокращает сроки ее выполнения, улучшает результаты и умень¬
шает вероятность травмирования и инфицирования экспланта.
Для высева небольшого количества семян или спор (1—4 ви¬
да) удобно применять коробку от фильтра “микропор”, последо¬
вательно соединенную с одноразовым шприцем (на 10—15 мл). Се¬
мена/споры вкладывают в пакет из фильтровальной бумаги, поме¬
щают в коробку от фильтра и последовательно проводят через
стерилизующие растворы. По окончании стерилизации пакеты с
содержимым извлекают и тщательно просушивают в камере ла¬
минарного бокса.
Приборы, необходимые для работы. Лаборатория микрораз¬
множения растений должна быть укомплектована аналитически¬
ми и торзионными весами, pH-метром, магнитными мешалка¬
ми с подогревом, дистиллятором, бидистиллятором, сушильными
шкафами, автоклавами (горизонтальной и вертикальной загруз¬
ки), ламинарными боксами, холодильной камерой и кондицио¬
нерами.
2.3. СТЕРИЛИЗАЦИЯ
ПИТАТЕЛЬНЫХ СРЕД, ИНСТРУМЕНТОВ
И ВСПОМОГАТЕЛЬНЫХ МАТЕРИАЛОВ
При культивировании растительных тканей и кле¬
ток особое значение придается стерилизации инструментов и пи¬
тательных сред. Стеклянную посуду подвергают воздействию сухого
горячего воздуха или насыщенного водного пара. С этой целью
применяют несколько вариантов стерилизации: посуду нагревают
в сухожаровых шкафах до температуры 180 °С (экспозиция
30 мин) или 160 °С (экспозиция 60 мин) либо выдерживают при
температуре 105 °С в течение 4—5 ч. Кроме того, дополнитель¬
ную стерилизацию посуда проходит и во время автоклавирования
среды.
Стеклянную посуду, в которой была выявлена грибковая или
бактериальная инфекция, следует сначала промыть в теплой воде
с добавлением детергентов, а потом оставить на несколько часов,
22
ГЛАВА 2. Технология размножения растений в асептических условиях
налив в нее хромовую смесь (хромпик). Последняя имеет сильно
выраженные окислительные свойства. Вместо хромовой смеси
можно использовать гидроксид натрия или кристаллическую со¬
ду. Затем посуду следует 6 раз прополоскать в проточной воде,
2 раза — в дистиллированной воде и поместить на 2 ч в сушиль¬
ный шкаф при температуре 105 °С.
Металлические инструменты, служащие для вычленения экс-
плантов и различных манипуляций с ними (лезвия, скальпели,
пинцеты), а также стеклянные стаканы, чашки Петри перед об¬
работкой нужно завернуть в бумагу и подвергнуть автоклавиро-
ванию при давлении 2 атм и температуре 121 °С в течение не ме¬
нее 60 мин. После стерилизации все материалы следует хорошо
высушить методом эжекции.
Существуют два основных способа стерилизации питательных
сред — автоклавирование и фильтрование. В первом случае при¬
готовленный раствор разливают в предварительно простерилизо-
ванную в сушильному шкафу посуду для культиёирования, а за¬
тем стерилизуют в автоклаве при давлении 0,75—0,9 атм (темпе¬
ратура 110—115 °С) в течение 20—25 мин. Можно сначала мето¬
дом автоклавирования простерилизовать большое количество
среды в одном объеме, а затем в ламинарном боксе разлить ее в
стерильную посуду для культивирования. Однако, на наш взгляд,
последний вариант более трудоемок. Кроме того, при таком спо¬
собе разлива среды увеличивается вероятность ее инфицирова¬
ния. Подобная последовательность действий более приемлема
при небольшом количестве среды.
Во втором случае используют стерильные фильтры Зейтца, Бер-
кефельда, свечи Шамберлана, мембранные фильтры, незамени¬
мые для приготовления сред с термолабильными компонентами
(некоторые стимуляторы роста, витамины, антибиотики, амино¬
кислоты, растительные экстракты), которые разрушаются при авто-
клавировании. Фильтрация сред (холодная стерилизация) приме¬
няется также для приготовления смесей ферментов и выделения
изолированных протопластов, сред с биологически активными ком¬
понентами, жидких сред.
Питательные среды, содержащие органические добавки, такие,
как кокосовое молоко, картофельный отвар и пр., дезинфицируют
путем фильтрования, используя специальные фильтры из диатомо¬
вой земли, плавленого стекла или сложных эфиров целлюлозы.
Однако полной стерилизации можно достичь лишь в процес¬
се тиндализации, которую обычно проводят в аппарате Коха. Суть
23
ОБЩАЯ ЧАСТЬ
методики состоит в 2—3-кратном нагревании посуды водным па¬
ром до температуры 90—100 °С с 24-часовыми интервалами.
Первое нагревание приводит к уничтожению вегетативных форм,
а последующие — к гибели микроорганизмов, которые образова¬
лись при температуре 25 °С из склероция в перерывах между на¬
гревами.
Тиндализацию также используют для стерилизации питатель¬
ных сред, содержащих соединения, которые разрушаются при
высоких температурах (например, гиббереллины инактивируются
при температуре выше 90 °С). То же относится и к сахарам, ко¬
торые карамелизируются при высоких температурах.
Время термической дезинфекции зависит от объема посуды, в
которую разлита питательная среда. Пробирки со средой стери¬
лизуют 15 мин при температуре 115 °С. Колбы, содержащие
100—500 мл питательной среды, дезинфицируют 30 мин при тем¬
пературе 121 °С и 45 мин при температуре 115 °С. Колбы, в ко¬
торых находится от 500 до 5000 мл питательной среды, стерили¬
зуют в автоклаве в течение 35—40 мин при температуре 121 °С и
50 мин при температуре 115 °С.
Ф.Л. Калинин и соавт. (1992) рекомендуют следующую дли¬
тельность стерилизации питательных сред в зависимости от их
объема:
После окончания стерилизации среды в камере автоклава
нужно постепенно уменьшать давление и температуру. Крышку
автоклава необходимо открывать только после того, когда стрел¬
ка манометра установится на отметке “0”. В противном случае,
при резком изменении давления, среда может моментально заки¬
петь, выплескиваясь из сосудов, в которых проводилась стерили¬
зация, и смачивая крышки (это может привести к дополнитель¬
ному инфицированию). В то же время нужно следить за тем,
чтобы автоклав был разгерметизирован в момент установления
стрелки манометра на отметке “0”; иначе крышку автоклава мо¬
жет засосать вследствие формирования градиента давлений. Если
это произошло, нужно кратковременно (на 1,5—2 мин) включить
24
Объем посуды,
мл
Время стерилизации
при 121 °С (1 атм), мин
ГО
0
1
<-*
О
15
75
20
250-500
25
1000
30
2000
40
ГЛАВА 2. Технология размножения растений в асептических условиях
тумблер автоклава, после чего крышку стерилизационной камеры
можно без усилий открыть.
Посуду с питательной средой после стерилизации помещают
в специальный шкаф для хранения готовых питательных сред и
выдерживают в течение 3—5 сут для выявления грибковой или
бактериальной инфекции.
Для закупоривания культуральных сосудов можно применять
различные пробки. Сегодня распространена одноразовая пласти¬
ковая посуда, однако кроме нее в обиходе широко используют
стандартные банки объемом 250 мл с жестяными крышками, колбы
Эрленмейера (на 250 мл) и пр. В жестяных крышках проделыва¬
ют отверстия диаметром 0,5—0,8 мм и вставляют в них пороло¬
новые пробки (для вентиляции). Кроме того, это помогает устра¬
нить градиент давлений при стерилизации питательной среды.
Если в работе используют ватно-марлевые пробки, их можно до¬
полнительно защитить от проникновения инфекции колпачками
из фольги. Алюминиевая фольга очень удобна в обращении и ее
часто применяют; она обеспечивает достаточную вентиляцию куль¬
турального сосуда и в то же время препятствует быстрому высы¬
ханию питательной среды. Пробки из полиуретана, используемые
для закрывания пробирок и колб, следует сначала вымыть в го¬
рячей воде с добавлением небольшого количества детергента, по¬
том несколько раз прополоскать в водопроводной воде, затем —
в дистиллированной. Сушат их при температуре 105 °С в течение
2,5—3 ч. Подобной процедуре подвергают и крышки из алюми¬
ниевой фольги, предварительно проверив их целостность.
2.4. ТЕХНОЛОГИЯ МИКРОРАЗМНОЖЕНИЯ
Данная технология состоит из нескольких этапов.
На первом этапе введения экспланта в культуру необходимо
обеспечить его стерильность и приживаемость на питательной
среде, так как от получения первичной культуры ткани зависит
дальнейший успех клонирования.
При введении в культуру in vitro нужно стимулировать изоли¬
рованный эксплант к дальнейшему развитию. Для этих целей
чаще всего используют основные питательные среды — Мура-
шиге—Скуга (МС), Гамборга (В5) и их модификации, как прави¬
ло, без внесения регуляторов роста. Добавление фитогормонов к
средам для культивирования прежде всего зависит от вида расте¬
25
ОБЩАЯ ЧАСТЬ
ния, экспланта и сезона, в течение которого проводится изоля¬
ция. Требования к температуре и свету различны и определяются
видом растения. Чаще всего используется интервал температур от
23 до 27 °С, интенсивность освещения от 1000 до 3000 л к и 16-
часовой фотопериод. Через 3—6 недель формируются единичные
вторичные побеги или розетки почек, которые необходимо пере¬
нести на питательную среду для их дальнейшего размножения.
Цель второго этапа — максимально быстрое увеличение ко¬
личества полученных протокормов, каллусной массы, побегов,
эмбриоидов или других структур. При размножении микрокло¬
нов необходимо стимулировать активно протекающие процессы
дифференцировки вновь образуемых морфогенных структур.
Обычно на этой стадии используют питательные среды того же
состава, что и для первого этапа, изменяя лишь фитогормональ¬
ный баланс.
Для достижения успеха на этом этапе решающее значение
имеет состав питательной среды, которая должна быть обогащена
веществами, усиливающими процессы морфогенеза. Обычно ис¬
пользуют среды Кнудсона, Мореля, МС, Андерсона, Линсмайе-
ра—Скуга (ЛС) с добавлением витаминов и регуляторов роста.
Морфогенетическая реакция экспланта часто зависит от соотно¬
шения ауксинов и цитокининов в питательной среде. Высокие
концентрации ауксинов способствуют образованию корней, но
подавляют морфогенез побегов. Увеличение концентрации цито¬
кининов активизирует появление побегов и угнетает корнеобра-
зование. Сбалансированное соотношение этих веществ приводит
к нормальному развитию растений.
При культивировании изолированных тканей очень часто на¬
блюдается витрификация растений, вызванная инфильтрацией
растительными тканями воды из атмосферы культурального со¬
суда или питательной среды. При каплусогенезе, по мере разви¬
тия “основного” каллуса, проявления витрификации могут умень¬
шаться, так как на его поверхности образуется ткань, сходная с
эпидермисом, которая препятствует проникновению жидкости.
Как известно из литературы, устьица у культивируемых в асепти¬
ческих условиях растений остаются широко открытыми. Резуль¬
таты электронно-микроскопических исследований показали, что
стенки замыкающих клеток выглядят водянистыми и деструк-
турированными. В клетках устьиц, а иногда и в других клетках
витрифицированных побегов, зафиксировано повышенное коли¬
чество крахмала и липидных капель. Это, возможно, связано с
26
ГЛАВА 2. Технология размножения растений в асептических условиях
усиленным снабжением сахарозой из питательной среды (Ко-
shuchowa, 1988).
Полученные в культуре in vitro почки необходимо отделять
друг от друга и по одной переносить на свежую питательную сре¬
ду. Если каждая почка в продолжение 1 мес дает примерно 5 но¬
вых почек, то через год, в зависимости от вида растений, их ко¬
личество может составить несколько сотен тысяч. В этой фазе
возможны некоторые нежелательные изменения, связанные с
поздним проявлением бактериального заражения исходного экс-
планта, что может неблагоприятно отразиться на конечном ре¬
зультате клонального размножения. Поэтому тестирование исход¬
ных эксплантов на наличие инфекции, а также обработка почек
разными антибиотиками — необходимые и эффективные приемы.
Условия третьего этапа должны соответствовать специальным
физиологическим потребностям размножаемых видов. Растения-
регенеранты необходимо подготовить к пересадке в субстрат.
Укоренение вновь образованных in vitro побегов связано с инду¬
цированием адвентивных корней. К этой фазе переходят тогда,
когда получено достаточное количество побегов. Степень укоре¬
нения зависит от вида и сорта клонируемых растений, а также от
продолжительности пассивирования in vitro и длительности куль¬
тивирования при последнем пассаже.
При укоренении некоторых трудноукореняющихся видов рас¬
тений эффективными могут быть такие фенольные соединения,
как флороглюцин, хлорогеновая кислота, кверцетин, рутин и
флоридзин.
В отличие от культуральной среды, используемой для раз¬
множения, концентрация минеральных солей и сахарозы в среде
для укоренения уменьшается вдвое, цитокинины отсутствуют, а
концентрация ауксинов увеличивается. Обычно на этом этапе
повышают интенсивность освещения до 5000—8000 лк и фотопе¬
риод до 14—16 ч. Температурный режим должен коррелировать с
условиями естественного произрастания.
Для укоренения используют как жидкие, так и твердые пита¬
тельные среды. К недостаткам первых можно отнести необходи¬
мость использования подложки для удержания побега в верти¬
кальном положении. Кроме того, в жидкой питательной среде
образуются хрупкие корни, что усложняет процесс пересадки рас¬
тений-ре генерантов.
Для оптимальной стимуляции корнеобразования можно при¬
менять кратковременное субкультивирование на средах, содер¬
27
ОБЩАЯ ЧАСТЬ
жащих ауксины, после чего растения пересаживаются на среды,
не содержащие гормоны, или непосредственно в субстрат. Мно¬
гие авторы рекомендуют проводить процесс инициации корнеоб-
разования в темноте, объясняя это усилением поглощения регу¬
ляторов роста в подобных условиях.
На этапе укоренения используют менее богатые среды, в том
числе разбавленные. Иногда укоренение можно осуществить и в
нестерильных условиях, однако в этом случае необходимо под¬
держивать высокую атмосферную влажность в теплице или каме¬
ре, где происходит укоренение микроклонов.
Приведенные выше данные свидетельствуют о том, что не¬
смотря на зависимость интенсивности ризогенеза от комплекса
различных факторов, процессом укоренения in vitro можно ус¬
пешно управлять. Вместе с тем достаточно большое количество
циклов размножения, по-видимому, не всегда благоприятно. У
некоторых ягодных культур, например у земляники, через несколь¬
ко циклов размножения возникают так называемые пассивные
почки, не способные к дальнейшему производству боковых по¬
чек и корнеобразованию (Попов, Высоцкий, 1978). Оптималь¬
ным надо, по-видимому, считать чередование двух-трех циклов
размножения с циклом укоренения.
2.4.1. Выбор экспланта
Метод культуры клеток, тканей и органов растений выдвигает
проблему дифференциации и морфогенеза потому, что клетки в
условиях in vitro лишены очень многих важных взаимодействий,
которые контролируют эти процессы в целом организме. Одно¬
временно дифференциация культивируемых клеток в определен¬
ных пределах подчиняется контролю со стороны эксперимента¬
тора. В результате работа с изолированными культурами показы¬
вает, что создавая различные условия, можно исследовать уровни
организации высших растений и процессы дифференциации.
Успешное введение в культуру in vitro того или иного вида
растений во многом зависит от правильного выбора экспланта.
На конечный результат влияет целый комплекс факторов, кото¬
рые нужно учитывать.
Желательно, чтобы исходные растения не были повреждены
грибковыми, бактериальными и вирусными болезнями и находи¬
лись в состоянии интенсивного роста. Растения в состоянии по¬
коя непригодны для этой цели. Луковицы, корневища и клубни
28
ГЛАВА 2. Технология размножения растений в асептических условиях
перед введением в культуру in vitro нужно предварительно обра¬
ботать высокими или низкими температурами.
Для обеспечения максимальной генетической стабильности
клонируемого материала и во избежание появления аномальных
растений в качестве исходного экспланта желательно использо¬
вать молодые, слабодифференцированные ткани. Для этой цели
наиболее подходят кончики стеблей, боковые (пазушные) почки,
зародыши и другие меристемные ткани. Можно использовать мо¬
лодые листья, черенки, соцветия и чешую луковиц, однако в этом
случае необходим цитологический и морфологический контроль.
Время отбора эксплантов (физиологическое состояние интакт-
ного растения). Поскольку большинство интродуцентов полно¬
стью (или с небольшим отклонением) сохраняют динамику своих
физиологических циклов ex situ, то при выборе времени проведе¬
ния работ нужно четко представлять, из какой климатической
зоны происходит растение. Это связано с тем, что в основе се¬
зонных различий регенерационных способностей растений лежат
изменения их физиолого-биохимического состояния.
Почки, вычлененные весной (апрель, май), обладают боль¬
шей регенерационной способностью, чем изолированные осенью
или зимой. Это связано с перестройкой фитогормонального ком¬
плекса растения. Например, у цимбидиума весной интенсивно
отрастают молодые побеги, что приводит к увеличению содержа¬
ния ауксинов, способствует активизации физиолого-биохимиче-
ских процессов в растении и положительно влияет на морфоге¬
нетическую способность эксплантов.
Экспланты, изолированные в фазу активного роста, обычно
более склонны к укоренению и развитию побегов по сравнению
с эксплантами, изолированными в фазу покоя. В то же время
способность меристематических верхушек некоторых растений к
образованию побегов почти не зависит от сроков вычленения
(Высоцкий, 1978).
По-видимому, лучшее время изоляции эксплантов — фаза
выхода интактного растения из состояния полного или относи¬
тельного покоя и последующая фаза активного роста. По нашим
Данным, весной наблюдаются более интенсивный рост изолиро¬
ванных тканей, протокормов орхидных и их органогенез, а вот
тропикогенных представителей Araceae Juss. лучше вводить в
культуру в зимние месяцы. Несмотря на сказанное выше, иногда
можно получить удовлетворительные результаты и при работе с
покоящимися эксплантами.
29
ОБЩАЯ ЧАСТЬ
Интактные растения — источник первичных эксплантов. На
протяжении всей жизни растение сохраняет участки меристема-
тических тканей, которые постоянно обновляются и способны
давать начало организованным структурам — почкам, корням,
эмбриоидам и целым растениям. Теоретически каждая соматиче¬
ская клетка тотипотентна, т. е. при условии выполнения некоего
комплекса условий она способна к регенерации и воспроизведе¬
нию материнского растения. Однако на сегодняшний день наука
располагает недостаточным объемом сведений о комплексе фи¬
зических, трофических и гормональных факторов, необходимых
для реализации генетической информации клеток многих видов в
условиях культуры in vitro. Некоторые исследователи полагают,
что проявление тотипотентности ограничивается только неболь¬
шим количеством морфогенно компетентных (меристемоидных)
клеток, которые могут давать начало различным органам. Для
получения изолированных культур отдельных групп растений луч¬
ше использовать разные органы. Например, для получения куль¬
туры Anthurium andreanum Lindl. удобно вычленять сегменты лис¬
товой пластинки, а для Chrysanthemum L. оптимальным первич¬
ным эксплантом являются сегменты цветоложа.
Не существует единого мнения о длине побегов, из которых
изолируют меристемы. К примеру, одни авторы (Arditti, 1977)
получали хорошие результаты, используя побеги Cymbidium Sw.
длиной 3—5 см, другие (Morel, 1964) — побеги, только начи¬
нающие расти (длиной 1 см). Вероятно, отсутствует прямая зави¬
симость между длиной побега-донора, из которого будет извле¬
чена меристема, и успехом в целом. Следует учитывать, что у рас¬
тений, имеющих симподиальный тип нарастания, терминальная
меристема прекращает развитие на ранних стадиях, поэтому ре¬
комендуется использовать очень молодые побеги высотой 5—7 см.
Такие побеги содержат кроме апекса много латеральных почек у
основания каждого листа.
У орхидных ценным исходным материалом для изоляции экс¬
плантов служат зеленые вегетирующие туберидии. В зависимости
от возраста и вида растений туберидии имеют 6—17 вегетирую¬
щих листьев, в пазухах которых расположены почки. На пла-
гиотропной части корневища такого растения есть также почки
возобновления, которые с успехом могут быть использованы для
культивирования.
Известно, что у некоторых видов ткани генеративного проис¬
хождения имеют более высокий морфогенетический потенциал по
30
ГЛАВА 2. Технология размножения растений в асептических условиях
сравнению с тканями вегетативного происхождения. При сопос¬
тавлении морфогенетической способности каллусов, полученных
из тканей семени, листа, стебля и пыльника, было обнаружено,
что наивысшей морфогенетической способностью обладают кал¬
лусы, образовавшиеся из пыльников. Более того, ткани одного и
того же органа могут проявлять разную способность к морфоге¬
незу. При проведении опытов с разными частями листа Bryophyl-
lum daigremonthianum (Hamet et H.Perrier) Berger, на изолирован¬
ных верхнем и нижнем эпидермисе и мезофилле определяли спо¬
собность этих эксплантов к каллусообразованию и морфогенезу.
Установлено, что каллус образовывался только на целостных
эксплантах листа, а также на изолированном нижнем эпидерми¬
се. Верхний эпидермис формировал лишь незначительный кал¬
лус. Изолированный мезофилл каллус не образовывал. Морфоге¬
нез с формированием стеблевых почек имел место только на
каллусе из нижнего эпидермиса (Дмитриева, 1981).
В исследованиях, выполненных на тканях 2 видов плюша
(Hedera L.), обнаружено, что на протяжении более чем 2 лет со¬
хранялись морфологические особенности каллусов, для которых
исходными эксплантами служили фрагменты стеблей на разных
стадиях развития растений. Подобный феномен продемонстри¬
рован и в экспериментах с различными представителями цит¬
русовых.
Существует и другое мнение, указывающее на поддержание
или сохранение определенной исходной дифференциации в про¬
цессе культивирования. Это исследования по изучению первона¬
чальной дифференциации в культивируемых клетках, проведен¬
ные A.J1. Курсановым и соавт. (1976), в которых на культурах ткани
корнеплода Beta vulgaris L. при культивировании in vitro обнару¬
жено частичное сохранение специфики углеводного обмена, свой¬
ственной исходному экспланту. В работе С.И. Мишарина и со¬
авт. (1977) показано, что в процессе культивирования не исчеза¬
ют белки, типичные для исходных тканей.
Исследования P. Lazzeri и соавт. (1986) были направлены на
изучение влияния различных физических факторов и состава среды
на рост in vitro эксплантов листьев, гипокотилей и корней пред¬
ставителей Brassica oleracea. Вначале экспланты культивировали
при температуре от 4 до 40 °С в течение 3—7 сут перед перено¬
сом в стандартные условия. Установлено увеличение количества
выживших эксплантов, имеющих большие размеры. Листовые дис¬
31
ОБЩАЯ ЧАСТЬ
ки размером 7 мм формировали на порядок больше побегов, чем
диски размером 4 мм. Отмечено увеличение количества образо¬
вавшихся побегов при высокой освещенности (1000 лк). Экс-
планты корней также формировали больше побегов в данных ус¬
ловиях. Для эксплантов всех типов наилучшие результаты полу¬
чены при освещении белым светом. Предварительное культиви¬
рование эксплантов при разной температуре не оказывало досто¬
верного влияния на их регенерационные способности.
Некоторые авторы изучали влияние регуляторов роста на раз¬
ные экспланты табака. Установлено, что экспланты листьев об¬
разовывали значительное количество стеблевых почек на среде с
добавлением кинетина. На стеблевых сегментах больше всего по¬
чек было при использовании среды с кинетином и 1-нафтилуксус-
ной кислотой (НУК). Гиббереллин оказывал стимулирующее воз¬
действие исключительно на экспланты листового происхождения
(Cohen, 1986).
Дифференциация в тканях первичного экспланта отражается
и на отдельных механизмах процесса вторичной дифференциа¬
ции in vitro. Общеизвестно, что перед данным процессом каллус-
ные клетки должны пройти серию делений. Это наблюдалось и
при органогенезе в каллусе табака, и при создании эмбриоген-
ного агрегата в культуре клеток моркови (Reinert et al., 1971).
Очевидно, необходимы предшествующие клеточные деления, иг¬
рающие регуляторную роль в определении пути развития, по ко¬
торому будет идти редифференцирующаяся клетка.
С учетом сказанного выше чрезвычайно важно учитывать
первоначальную дифференциацию в тканях исходного экспланта,
поскольку она теснейшим образом связана с морфогенетической
способностью тканей. Более того, специфика происхождения от¬
дельной группы клеток сохраняется при длительном культивиро¬
вании.
Однако общей закономерностью для культивируемых in vitro
тканей остается возрастание цитогенетической вариабельности в
процессе культивирования, что, в свою очередь, зачастую связано
с потерей морфогенетического потенциала (Кунах, 2005).
Онтогенетическое состояние интактных растений. Этот фактор
имеет большое значение. Из практики клонального размножения
известно, что наилучшие результаты дают экспланты из тканей
молодых, вновь формирующихся органов. Экспланты, вычленен¬
ные из сеянцев или молодых растений, активнее пролиферируют
каллус, формируют эмбриоиды, протокормы и побеги. Для ряда
32
ГЛАВА 2. Технология размножения растений в асептических условиях
культур нами отмечена повышенная способность к регенерации
терминальных почек по сравнению с боковыми (Ficus L., Моп-
stera Schott, Aglaonema Schott и др.).
Физиологический возраст экспланта является еще одним фак¬
тором, влияющим на органогенез. Например, у эхеверии (Eche-
veria D.C.) на эксплантах молодых листьев возникают только кор¬
ни, старых листьев — только побеги, а листья срединной форма¬
ции образуют и корни, и побеги.
Размер экспланта. Оптимальная величина экспланта зависит
от видовых особенностей растения-донора, а также от свойств
органа, служащего источником эксплантов, и должна обеспечи¬
вать как стерильность экспланта, так и активный его рост и
морфогенез. В целях массового размножения растений исполь¬
зуют экспланты апексов стебля и корня длиной 0,1—0,5 см. Для
освобождения от вирусной инфекции вычленяют экспланты дли¬
ной до 0,5 мм. Регенерация растений из таких эксплантов проис¬
ходит медленнее, они часто погибают, не начав развиваться.
Органогенез в значительной степени определяется размером
экспланта: чем меньше эксплант, тем меньшей регенерационной
способностью он обладает, и наоборот, крупные экспланты, со¬
стоящие из паренхимы, проводящей ткани и камбия, могут спон¬
танно образовывать почки, независимо от соотношения ауксинов
и цитокининов в среде. В то же время в крупном экспланте уве¬
личивается возможность наличия в его клетках вирусов и других
фитопатогенов.
В тех случаях, когда не преследуется цель освобождения от
вирусной инфекции, размер экспланта не играет решающего
значения и все зависит от возможностей и желания эксперимен¬
татора. В своих работах мы с одинаковым успехом использовали
как экспланты размером 230—550 нм, так и терминальные или
пазушные почки с участком ткани материнского растения.
Зависимость микроразмножения от генотипа растения. Наря- "
ДУ с прочими важными факторами, влияющими на процесс
микроразмножения, существенными остаются генотип исход¬
ного растения и время года, в которое вычленяется эксплант, j
так как в основе сезонных различий регенерационной способ¬
ности растений лежат изменения его физиолого-биохимического
СОСТОЯНИЯ.
Основываясь на множестве экспериментальных работ, опуб¬
ликованных на сегодняшний день, можно с уверенностью ска¬
зать, что генотип интактного растения в наибольшей степени влия-
33
ОБЩАЯ ЧАСТЬ
ет на морфогенетические потенции экспланта in vitro. Разница в
способности к регенерации начинает проявляться уже на уровне
различных особей одного вида, сильнее — на уровне культива-
ров. К примеру, у разных культиваров Laelia purpurata Lindl. ско¬
рость формирования вторичных протокормов может быть раз¬
личной. Подобную разницу можно наблюдать на уровне различ¬
ных таксономических групп высших растений тем больше, чем
выше ранг таксона. Двудольные травянистые растения обладают
значительно большей регенерационной способностью, чем одно¬
дольные и древесные культуры.
У некоторых групп декоративных травянистых растений нами
замечена прямая корреляция способности к вегетативному раз¬
множению ex situ и in vitro (Aglaonema Schott, Dieffenbachia Schott,
Nepenhtes L., Begonia L. и др.). Теоретически, чем лучше растение
размножается вегетативно традиционными способами, тем легче
будет наладить его размножение in vitro. Многие виды декора¬
тивных луковичных растений (Amaryllidaceae, Liliaceae) в асепти¬
ческой культуре размножаются адвентивными луковичками, что
соответствует традиционному методу их размножения (Катаева,
Бутенко, 1983). В то же время наши исследования показали, что
некоторые виды in vitro могут формировать эмбриоидоподобные
структуры (Camellia japonica L., Velthelmia viridifolia Jacq., Dracaena
draco (L.)).
Виды с ярко выраженным апикальным доминированием (Моп-
stera, Philodendron, Syngonium и др.) можно размножать in vitro по¬
средством микрочеренкования. В состав питательных сред вво¬
дится необходимое количество фитогормонов, которые способст¬
вуют либо пробуждению пазушных почек, либо адвентивному
побегообразованию. В конечном итоге подобные манипуляции
значительно ускоряют и удешевляют микроразмножение декора¬
тивных растений.
Локализация экспланта на интактном растении. Широко извес¬
тен эффект апикального доминирования терминальной меристе¬
мы. Поэтому при использовании в качестве эксплантов меристем
пазушных почек необходимо заранее удалить верхушку, чтобы
изменить фитогормональный баланс растения, или применять в
культуральной среде определенные качественные и количествен¬
ные композиции гормонов.
Чем ближе к поверхности фунта расположен орган, тем выше
вероятность того, что он будет инфицирован. В связи с этим уве¬
личивается количество растворов-стерилизаторов и их экспози-
34
ция. Все это негативно сказывается на физиологическом состоя¬
нии экспланта, поэтому для работы выбирают органы, как мож¬
но более удаленные от поверхности. К примеру, особую труд¬
ность представляет микроразмножение видов рода Paphiopedilum
Pfitz. Это связано с тем, что апексы побегов, служащие эксплан¬
тами, находятся практически на одном уровне с поверхностью
грунта, а иногда и ниже. Они плохо прикрыты листьями и силь¬
но колонизированы эпифитными бактериями и грибами, что
создает определенные трудности в получении асептической ткани
и введении ее в культуру.
Сеянцы как источник эксплантов. Использование частей сеян¬
цев, полученных в асептической культуре в качестве первичных
эксплантов, имеет ряд существенных преимуществ по сравнению
с традиционными методами введения в культуру in vitro (более
подробно см. в подразд. 3.3).
Принимая во внимание современный уровень развития при¬
кладных методик в области биотехнологии растений, можно ут¬
верждать, что в качестве экспланта может быть использован прак¬
тически любой орган интактного растения.
2.4.2. Стерилизация растительного материала
Процесс стерилизации интактного растительного
материала, из которого в дальнейшем вычленяют экспланты (груп¬
пы клеток, ткани или целые органы), необходимо производить с
особой тщательностью, поскольку от этого зависит, будет ли эк-
сплант развиваться или погибнет от инфекции. Однако часто
внутреннее заражение исходных эксплантов бывает намного силь¬
нее, чем поверхностное, поэтому экспланты предварительно об¬
рабатывают фунгицидами и антибиотиками против грибковой и
бактериальной инфекций. Хорошие результаты дает обработка
растительного материала бензоатом натрия. Более того, необхо¬
дим тщательный фитосанитарный уход за исходными растения¬
ми. Как показывает практика, особенно трудно поддаются обез¬
зараживанию части некоторых орхидных (Cymbidium, Paphiope¬
dilum), у которых эндофитные микоризные грибы проникают глу¬
боко в ткани.
Процесс стерилизации растительного материала можно ус¬
ловно разделить на несколько этапов. На первом этапе отобран¬
ные интактные части растений механически очищают от лишних
частей (чешуйчатые листья, основания сидячих листьев и пр.).
35
ОБЩАЯ ЧАСТЬ
Затем растительный материал тщательно (2—3 раза) промывают
под проточной водой и в слабом растворе калийного мыла, опять
ополаскивают проточной водой. После этого части растений раз¬
резают на сегменты такого размера, чтобы они могли свободно
помещаться в сосуды со стерилизаторами, и заливают дистилли¬
рованной водой. Затем переходят ко второму этапу стерилизации,
который, как правило, проводится уже в ламинарном боксе.
Меристемы изолируют под бинокулярным микроскопом или
с использованием лупы. Препаративной иглой или хирургиче¬
ским скальпелем отодвигают листья (оболочки) и вырезают ме¬
ристему с помощью 4 надрезов вокруг бугорка, а потом подреза¬
ют снизу. После вычленения эксплант помещают в сосуд с пита¬
тельной средой и переносят в культуральное помещение.
Второй этап — это собственно стерилизация, которую удобно
проводить в следующей последовательности.
В ламинарном боксе расставляют необходимое количество
стерильных стаканов на 250 мл, которые сверху накрывают про-
стерилизованными половинками чашек Петри. В стаканы в той
очередности, в которой будут проводиться стерилизационные ме¬
роприятия, наливают растворы стерилизаторов, чередуя их со
стаканами, наполненными стерильной дистиллированной водой.
В растворы можно добавлять по несколько капель так называе¬
мых увлажнителей/прилипателей (tween-20, citowett, sandowit) для
снижения поверхностного натяжения и улучшения смачиваемости
поверхности эксплантов. После обработки хлор- и ртутьсодержа¬
щими препаратами необходимо осуществлять двухкратную про¬
мывку стерильной водой. Стерилизация начинается со стакана с
70%-м^этиловым спиртом и заканчивается 1—2 стаканами со сте¬
рильной дистиллированной водой для промывки. Растительные
объекты удобно помещать в отдельные стерильные марлевые ме¬
шочки — это существенно упрощает процесс стерилизации. Ме¬
шочки, прошедшие серию растворов-стерилизаторов, расклады¬
вают между стерильными салфетками из фильтровальной бумаги
для удаления лишней влаги.
На заключительном этапе стерильным инструментом вычле¬
няют интересующие участки растительных тканей и переносят их
на питательную среду. Для обеспечения максимальной стериль¬
ности все манипуляции удобно проводить на стерильных однора¬
зовых салфетках из фильтровальной бумаги. Перед вычленением
каждого экспланта инструмент необходимо обжечь в пламени го¬
релки. Удобно иметь набор скальпелей и пинцетов (20—30 штук),
36
ГЛАВА 2. Технология размножения растений в асептических условиях
который лучше всего хранить в специальных конвертах из бумаги
“крафт”. Экспланты помещают в отдельные емкости; чаще это
сахарные пробирки или небольшие колбы с минимальным объе¬
мом питательной среды.
Для стерилизации семян и органов интактных растений ис¬
пользуют различные вещества. Наиболее применяемы в практике
растворы, содержащие активный хлор: гипохлорид кальция и на¬
трия, хлорная известь, хлорамин. Следует подбирать такие кон¬
центрации, которые не повреждали бы ткани, не воздействовали
на всхожесть семян и одновременно обеспечивали максимальную
стерильность растительных образцов.
Часто для стерилизации применяют растворы соединений
ртути — сулему, диацид, famosept, thimerosal. Эти вещества при
правильном выборе концентрации и экспозиции дают удовлетвори¬
тельные результаты, несмотря на их токсичность для растительных
тканей. После стерилизации в ртутьсодержащих препаратах необхо¬
дима тщательная промывка в 3—4 порциях стерильной дистилли¬
рованной воды. Кроме того, отработанные растворы требуют со¬
ответствующей утилизации. В качестве стерилизующего агента
также применяют пероксид водорода (Н202), который, по нашим
наблюдениям, менее всего повреждает ткани; после его приме¬
нения отпадает необходимость продолжительной промывки, так
как это вещество быстро разлагается.
Для стерилизации семян орхидных мы обычно используем
10%-й раствор хлорной извести и 15%-й пергидроль. Семена сте¬
рилизуют в ламинарном боксе в мешочках из плотной шелковой
ткани или батиста; их опускают в стаканы со стерилизующими
веществами на 15—20 мин, а затем 3—4 раза промывают сте¬
рильной водой, после чего просушивают между листами стериль¬
ной фильтровальной бумаги. При сильном загрязнении семян их
стерилизуют, последовательно погружая в слабый раствор пер¬
манганата калия (КМп04) на 5 мин, 70%-й раствор этанола —
2 мин, 10%-й раствор хлорной извести — 20 мин, 15%-й раствор
пероксида водорода — на 5—7 мин. В некоторых случаях хорошо
действует 0,1 %-й раствор сулемы или диацида, однако при этом
снижается процент всхожести семян.
При наличии семян орхидных собственной репродукции
удобнее всего использовать методику высева семян из недозрев¬
ших коробочек. Известно, что плоды у представителей Orchida¬
ceae Juss. созревают значительно дольше, нежели их семена
(Stancato et al., 1998). Применяя данную методику стерилизации,
37
ОБЩАЯ ЧАСТЬ
мы исключаем прямой контакт агрессивных стерилизующих реа¬
гентов с поверхностью семян, тем самым значительно повышая
процент всхожести (Arditti, 1979). При этом плод не должен быть
раскрытым. В своей работе мы практикуем два варианта стерилиза¬
ции коробочек. Первый заключается в том, что после поверхно¬
стной обработки в спирте (1 мин) и хлорной извести (15 мин) ко¬
робочки раскрывают, а семена рассеивают на питательную среду.
Во втором случае плод на 30—40 с опускают в 96%-й этанол, по¬
сле чего вынимают пинцетом и проносят над пламенем спиртов¬
ки. Во избежание повреждения семенного материала пламя на
поверхности плода следует затушить через 3—5 с. Процедуру по¬
вторяют 3—4 раза.
Для стерилизации исходного растительного материала орхид¬
ных используют следующий базовый режим обеззараживания рас¬
тительных тканей (в каждом конкретном случае он может быть
модифицирован). Так, туберидии орхидных освобождают от листь¬
ев и прочих остатков, промывают щеткой под проточной водой,
затем теплой водой с мыльным раствором порошка и ополаскива¬
ют дистиллированной водой. В ламинарном боксе растительный
материал помещают последовательно в 70%-й этанол (2—3 мин), в
один из ртутных препаратов (0,1 %-е растворы сулемы и диацида,
0,1%-й famosept, 0,01%-й thimerosal на 15—20 мин), а затем в 10%-ю
хлорную известь и 15%-й раствор пероксида водорода на 10 мин.
После каждого стерилизующего вещества растительный материал
промывают в стерильной дистиллированной воде. Особенной тща¬
тельности требует промывка после ртутных препаратов (4—5 раз
по 15—20 мин). Приведенная схема обеспечивает стерильность
наземных органов орхидных (туберидии, побеги, цветоносы), аро¬
идных (листья, побеги, латеральные почки) и других тропических
и субтропических растений.
Сильноинфицированные туберидии и побеги (Cymbidium, Ра-
phiopedilum) дополнительно обрабатывают растворами антибиоти¬
ков: нистатином, пенициллином, тетрациклином, микроцидом,
гентамицином. Иногда проводят повторную стерилизацию вы¬
члененных эксплантов в растворах хлорной извести, пергидроля
или сулемы. Однако при усилении режима стерилизации и уве¬
личении экспозиции стерилизующего агента жизнеспособность
эксплантов снижается.
При введении в культуру in vitro иногда наблюдается побуре-
ние тканей экспланта, возникающее в результате механических
повреждений отдельных тканей как результат окисления фено¬
38
ГЛАВА 2. Технология размножения растений в асептических условиях
лов, что характерно для многих видов (Cattleya Lindl., Laelia Lindl.,
Angraecum Bory, Doritis Lindl., Phalaenopsis Blume, Anthurium L.,
Monstera Schott, Philodendron Schott и др.). В дальнейшем это приво¬
дит к отмиранию эксплантов. Для удаления фенолов в воду для
промывки можно добавлять 1 — 10%-й раствор I-цистеина, а про¬
цесс вычленения проводить в стерильном растворе аскорбиновой
кислоты в чашках Петри.
Для отдельных видов растений (Doritis, Phalaenopsis, Angrae¬
cum), экспланты которых на первых этапах введения в культуру
могут выделять фенольные соединения, необходимо предусмот¬
реть применение протекторов — диэтилтиокарбоната, высокомо¬
лекулярного поливинилпирролидона. Протекторы, как правило,
добавляют в промывочные воды или вводят в состав питательных
сред. При активном выделении фенолов в толщу питательной
среды мы рекомендуем применять ряд последовательных суб¬
культивирований до прекращения этого процесса.
Стерилизацию обычно проводят с помощью растворов раз¬
личных веществ. Для стерилизации растительного материала
пригодными оказались следующие препараты и химические со¬
единения:
а) гипохлорит кальция или натрия; последнее соединение яв¬
ляется компонентом извести или хлорной извести, широко ис¬
пользуемой в быту; концентрация 7—15 %, экспозиция 7—30 мин
в зависимости от вида эксплантов, которые проходят стерили¬
зацию;
б) хлорамин Т, концентрация 2—7 %, экспозиция 10—35 мин;
в) 8-оксихинолин, концентрация 0,5—1,0 %, экспозиция 10—
15 мин;
г) сулема — высокоэффективный стерилизатор; концентрация
0,1—0,5 %, экспозиция до 15 мин; требует специальной утилиза¬
ции;
д) бромная вода — раствор брома (35 г/л); растительные тка¬
ни выдерживают в 1—2%-м растворе в течение 3—15 мин;
е) пероксид водорода, концентрация 10—15 %, экспозиция
5—12 мин;
ж) этиловый_хшфТг1еенцентрация 70 %, экспозиция до
I мин; используется для устранения поверхностного воскового
слоя с растительных тканей; ректификат применяют для обжига
поверхностей растительных тканей (коробочек с семенами).
Некоторые авторы кроме начальной стерилизации эксплан-
тов, сильно пораженных эпифитной микрофлорой, рекомендуют
ОБЩАЯ ЧАСТЬ
использовать и готовые средства для стерилизации растительных
тканей: бенлат (0,05—0,1 %) в течение 5—10 мин, цересан (0,1 %) —
7—10 мин, каптан (суспендированный) в концентрации 0,1 —
0,2 % в течение 5—10 мин.
Соединения под коммерческими названиями “Famosept” и
“Thimerosal” также хорошо зарекомендовали себя в работе.
2.4.3. Влияние внешних условий
на процесс введения в культуру in vitro
Наряду с составом питательной среды решающую
роль в успешности введения в стерильную культуру в целом иг¬
рают другие абиотические факторы окружающей среды, такие,
как освещенность (качественный и количественный состав света,
фотопериод), температура, влажность.
Температура. Для большинства эксплантов декоративных рас¬
тений температурный диапазон должен находиться в пределах
22—27 °С. На начальных этапах адаптации эксплантов к услови¬
ям асептической культуры желательно поддерживать одинаковую
температуру, хотя для некоторых культур, таких, как отдельные
представители Pelargonium L’Her., необходим суточный темпера¬
турный перепад: культура этих растений днем содержится при
температуре 24 °С, ночью — при 18 °С. Для эксплантов Cymbidium
при создании 20-часового дня и освещенности 4000—6000 лк опти¬
мальна следующая температура: днем — 25 °С, ночью — 21—22 °С.
Периодические изменения температуры благоприятно сказы¬
ваются на эксплантах луковичных растений (Grabowski et al.,
1987). Температурный диапазон, при котором лучше всего проте¬
кает регенерация луковичек, индивидуален. Для видов, имеющих
в своем годичном цикле развития период покоя, рекомендуется
временное содержание при пониженных температурах в периоды,
совпадающие с покоем в септических условиях.
Освещенность. Качественный и количественный состав света
(видимого излучения) и фотопериод — важнейшие факторы, не¬
посредственно влияющие на морфогенетические проявления в
культуре растительных тканей in vitro. В литературе данные о
влиянии света на культуру изолированных клеток и тканей рас¬
тительного организма достаточно ограничены и эпизодически
освещают те или иные аспекты, касающиеся этого вопроса. Так, в
работе Т.Н. Константиновой и соавт. (1987) изучалось комплексное
влияние красного и синего цветов видимого излучения в сово¬
40
ГЛАВА 2. Технология размножения растений в асептических условиях
купности с различными регуляторами роста на процессы мор¬
фогенеза у эксплантов табака и картофеля. Установлено, что рост
каллуса у табака и стебля у картофеля активировался красным
цветом излучения при любом соотношении фитогормонов в сре¬
де. Образование корней у табака стимулировалось синим цветом
при наличии индолил-3-уксусной кислоты (ИУК) в среде, обра¬
зование цветочных почек — кинетином в условиях красного и
ауксином в условиях синего цвета излучения. Клубнеобразование
у картофеля усиливалось кинетином при синем цвете и аукси¬
ном — при красном. Полученные данные свидетельствуют о вза¬
имном влиянии света и фитогормонов на процессы роста и диф-
ференцировки высших растений.
Не менее интересные данные о результатах исследования вза¬
имного влияния температуры и света на рост тканей и морфоге¬
нез в асептических условиях представлены в монографии
W. Huges (1981). Рассматривая активную роль света в указанных
процессах, автор акцентирует свое внимание на роли фотосинте-
тических пигментов, фитохромов, действии синего цвета излуче¬
ния, явлении фотопериодизма и интенсивности освещения. По¬
казано важное значение предварительной обработки экспланта
низкими температурами, а также совместное влияние температу¬
ры и фитогормонов. Отмечена роль этилена, углекислого газа,
этанола и ацетальдегида. Автор приходит к выводу о том, что при
работе с растительными тканями в асептических условиях нельзя
ограничиваться применением стандартных приемов культивиро¬
вания, необходимо модифицировать и изучать действие различ¬
ных абиотических факторов.
При исследовании влияния света на рост и развитие расти¬
тельных культур in vitro следует иметь в виду, что силикатное
стекло, из которого обычно сделаны культуральные сосуды, за¬
держивает часть спектра. Индукция каллусообразования у многих
видов растений более активно происходит в темноте, тогда как
процессы ризогенеза интенсифицируются при перенесении тка¬
ней на свет. На свету начинают активно формироваться комплек¬
сы фотосинтетических систем, растения-регенеранты приобретают
характерный габитус и в дальнейшем их можно размножать мик¬
рочеренкованием. Потребность в освещении — индивидуальная
характеристика, которая, вероятно, определяется у различных
культур генетически, поэтому трудно вывести общее правило. В
каждом случае режим освещения приходится подбирать индиви¬
дуально.
41
ОБЩАЯ ЧАСТЬ
Для индукции ростовых процессов культурам зародышей и
протопластов достаточно освещенности 500—1000 лк, для индук¬
ции размножения протокормов орхидей — 1000—3000 лк. Осве¬
щенности в пределах 2000—3000 лк требует основная масса куль¬
тур на начальном этапе введения. Мы практикуем выдержку экс¬
плантов первые 3—7 сут после введения в темноте или при сла¬
бом освещении (до 500 лк) и лишь после этого переносим их в
культуральное помещение с соответствующим режимом культи¬
вирования. Как показывают собственный опыт и многочислен¬
ные работы коллег, оптимальным для дальнейших процессов
органогенеза и микроразмножения является 8—12-часовой фото¬
период.
Положение экспланта на поверхности среды и в пространстве.
Принимать во внимание положение экспланта относительно по¬
верхности среды имеет смысл тогда, когда мы говорим о культи¬
вировании на твердых авизированных средах. Размещая экс-
плант на поверхности среды, надо учитывать его полярность. Мы
не рекомендуем сильно углублять ткани экспланта (протокорма)
в толщу среды, чтобы сохранить нормальный доступ кислорода к
поверхностным тканям. Во многих случаях при нарушении этих
рекомендаций мы наблюдали изменения в развитии растений-
регенерантов, их формы и фенологии. У некоторых видов (Bego¬
nia, Anthurium, Astmphytum) при размножении в асептической куль¬
туре методом регенерации каллуса из листовых и стеблевых экс¬
плантов имеет важное значение сторона, которой будет контак¬
тировать высечка листовой пластинки или стебля с поверхностью
питательной среды.
2.4.4. Приготовление питательных сред
Важным фактором, влияющим на успешность раз¬
множения того или иного вида растений, является питательная
среда, которая должна содержать сбалансированный состав мак-
ро- и микроэлементов, углеводов, витаминов, регуляторов роста,
аминокислот. Для успешного размножения in vitro в большинстве
случаев прописи сред приходится подбирать индивидуально для
каждого вида и даже сорта или культивара различных растений.
Некоторые среды, рекомендуемые в литературе, содержат много
компонентов, другие более просты. В прописи сред многие авто¬
ры включают вещества неопределенного состава: пептон, гидро¬
лизат казеина, дрожжевой автолизат, картофельный экстракт, рас¬
42
ГЛАВА 2. Технология размножения растений в асептических условиях
тительные соки, эндосперм кокосового ореха, гомогенат плодов
банана и т. д.
Среды могут быть авизированными или жидкими. К при¬
меру, для пролиферации новообразований и их роста удобнее ис¬
пользовать жидкие среды, прорастание семян и органогенез луч¬
ше происходят на твердых питательных средах.
Ткани, выращиваемые в жидких питательных средах, обычно
культивируют в роллерах с круговым перемешиванием среды или
в шейкерах вибрирующего типа, иногда используют стационар¬
ную среду, помещая ткань на мостики из фильтровальной бу¬
маги.
Химический состав среды, ее физические свойства должны
соответствовать задачам, поставленным на данном этапе иссле¬
дования. Основные задачи, которые решает исследователь при
размножении растений в асептических условиях, можно сформу¬
лировать так: ввести в культуру, размножить (этап мультиплика¬
ции), укоренить, высадить ex situ с последующей постасептиче-
ской адаптацией. В соответствии с задачами процесс клонального
размножения принято условно разделять на соответствующие
этапы.
На первом этапе часто в состав сред вводят антиоксиданты,
предупреждающие активацию гидролитических ферментов и ги¬
бель высаженных эксплантов. На втором этапе состав среды пре¬
имущественно такой же, однако во многих случаях ее обогащают
веществами, которые вызывают и многократно усиливают фор¬
мообразовательные процессы, применяя увеличенные концен¬
трации цитокининов. На третьем этапе подбирается состав сре¬
ды, способствующий укоренению регенерантов; она или вообще
не содержит фитогормонов, или содержит лишь небольшие ко¬
личества ауксинов.
Успех клонального размножения во многом зависит от нали¬
чия и концентрации в среде тех или иных элементов минераль¬
ного питания, органических соединений. Ошибки, допущенные
при составлении прописей или в процессе непосредственного
приготовления питательных растворов, во многих случаях очень
наглядно проявляются на культивируемых растениях (формооб¬
разовательные процессы, ритмы развития).
Как отмечалось ранее, практически каждый вид (во многих
случаях и отдельные формы вида) требует индивидуального под¬
хода. Необходимо, чтобы экспериментатор четко представлял, из
какой климатической зоны происходит растение, знал его био¬
43
ОБЩАЯ ЧАСТЬ
логию и особенности размножения. Только в этом случае можно
добиться полного успеха. Поэтому подбор и модификацию пита¬
тельных сред можно сравнить с творческим процессом, который,
однако, базируется на конкретных законах физиологии растений.
Сегодня широко известен целый ряд готовых базовых пита¬
тельных сред для всех этапов микроразмножения растений, од¬
нако предпочтительнее индивидуальное покомпонентное приго¬
товление каждого типа питательной среды. Во-первых, это на¬
много дешевле, во-вторых, позволяет своевременно и оперативно
реагировать на изменения в поведении культуры in vitro.
Состав питательных сред является важным фактором, влия¬
ющим на рост и развитие растений in vitro. Применительно к
эпифитам, как правило, этот показатель в искусственных услови¬
ях несколько выше, нежели в “питательном растворе”, который
стекает по стволам и ветвям деревьев — носителей эпифитов in
situ (Withner, 1959).
Кроме основных макроэлементов в состав большинства пита¬
тельных сред входят также и микроэлементы; определенное их ко¬
личество вносится вместе с макроэлементами. Для приготовления
среды отмеривают нужное количество каждого солевого раствора,
взвешивают соли железа, сахарозу, вносят те или иные добавки.
При необходимости питательные среды готовят на дистилли¬
рованной или бидистиллированной воде. Для удобства в работе и
ускорения процесса целесообразно заранее приготовить растворы
макро- и микроэлементов, соответственно в 10 и в 100 раз пре¬
вышающие концентрацию рабочих растворов. Маточные раство¬
ры солей хранят в холодильнике при температуре 2—4 °С в емко¬
стях из темного стекла не более 6 недель.
Растворы регуляторов роста и витаминов обычно готовят из
расчета 1 мг вещества на 1 мл раствора. Цитокинины (6-бензил-
аминопурин (БАП), зеатин, кинетин) сначала растворяют в не¬
большом количестве 1 н щелочи, ауксины (ИУК, 1-нафтил-
уксусная кислота (НУК), 2,4-дихлорфеноксиуксусная кислота
(2,4-Д)) — в 1 капле этанола и затем доводят до нужного объема
бидистиллированной водой. Растворы витаминов и фитогормо¬
нов также хранят в холодильнике, однако для лучшей сохранно¬
сти их можно разливать в емкости (эпендорфы) по 3—5 мл (для
разового использования) и хранить в морозильной камере.
Кинетин плохо растворим. С этой целью можно использовать
различные растворители: 1 М раствор НС1 (несколько капель),
50%-й раствор этанола, диметилсульфат или 2%-й раствор NaOH.
44
ГЛАВА 2. Технология размножения растений в асептических условиях
Гиббереллины растворяют в теплой дистиллированной воде.
При этом следует помнить, что эти соединения термонестабильны.
Гумат натрия, гидролизат казеина, дрожжевой автолизат гото¬
вят в день их использования.
Агар лучше расплавить непосредственно перед употреблением
в половинном объеме бидистиллированной воды, а затем добав¬
лять к среде.
С учетом того что в растворах катионы простых неорганических
солей железа, взаимодействуя с гидроксильными группами, могут
выпадать в осадок (Fe203 • ЗН20) и плохо растворяются в средах,
pH которых 5,0, железо в прописи питательных сред вводят в
виде особых комплексных соединений — хелатов (ЫаРеЭДТА,
РеЭДТА).
Приготовление растворов железа требует особенной тщатель¬
ности. Раствор №РеЭДТА готовится в следующей очередности: на
аналитических весах взвешивают 5,57 г FeS04 • 7Н20 и 7,45 г
№2ЭДТА. Далее в мерную колбу емкостью 1 л высыпают навески
и объем доводят до метки. Раствор РеЭДТА готовят так: 26,1 г
этилендиаминтетрауксусной (ЭДТА) кислоты нужно растворить в
268 мл 1 М раствора КОН, после чего добавить 24,9 г FeS04 х
х 7Н20 и довести объем дистиллированной водой до 1 л. Полу¬
ченный раствор необходимо аэрировать в течение нескольких по¬
следующих часов с целью окисления (Grabowski et al., 1987).
Все манипуляции по приготовлению растворов удобно прово¬
дить с помощью магнитной мешалки. Дистиллированная вода
должна быть теплой (37—40 °С). Полученные таким образом ма¬
точные растворы являются комплексными соединениями железа,
из которых по мере надобности берут необходимый объем, в за¬
висимости от состава питательной среды. Растворы железа, как и
все остальные растворы, должны храниться в холодильнике.
При расчете концентрации ингредиентов мы используем мет¬
рическую систему измерений, однако в зарубежной литературе
применяется и английская система. Метрическая система базиру¬
ется на числах, кратных 10, и, на наш взгляд, более проста в об¬
ращении. Однако необходимо ориентироваться и в английской
системе измерений. К примеру, 1 л эквивалентен ~ 1,1 кварты,
1 г 0,035 унции, 1 см 0,4 дюйма.
В процессе приготовления питательных сред нужно соблю¬
дать достаточную точность в дозировании ингредиентов, но при
любых измерительных действиях (будь то взвешивание сухого
вещества или измерение объема раствора) возможна небольшая
45
ОБЩАЯ ЧАСТЬ
погрешность. Важно иметь представление о степени допустимой
погрешности. При измерении объемов необходимо знать, что вся
лабораторная посуда (измерительные цилиндры, пипетки, колбы)
имеет небольшую погрешность в пределах 5 %. Другой пример:
если мы взвешиваем сахарозу, которая рекомендуется в прописи
среды в концентрации 30 г/л, то погрешность в 3—5 мг не отра¬
зится на полученных результатах, однако когда речь идет о взве¬
шивании 30 мг, то ошибка в 3 мг становится существенной, так
как составляет уже 10 % необходимого количества.
Иногда прописи сред в зарубежной литературе составлены не
в граммах на литр, а в молярных единицах. Молярность раство¬
ров вычисляется исходя из атомной массы химических элемен¬
тов, входящих в состав соединения. К примеру, возьмем 1 М
раствор гидроксида натрия (NaOH), часто используемый для
корректировки pH среды. Атомная масса натрия — 23, кислоро¬
да — 16, водорода— 1. Таким образом, молекулярная масса
NaOH: 23 + 16 + 1 = 40. Следовательно, растворив 40 г NaOH в
1 л воды, мы получаем 1 М раствор NaOH.
Химический состав некоторых органических соединений очень
сложен, в связи с чем иногда достаточно проблематично опре¬
делить их молекулярную массу. В таких случаях можно восполь¬
зоваться специальными справочниками или каталогами некото¬
рых компаний — производителей химреактивов (Donnelly et al.,
1988).
Для приготовления сред часто используют кристаллогидра¬
ты — соединения, в состав которых входит гидратированная во¬
да, химически связанная с молекулами вещества. К примеру, мо¬
лекулярная масса MnS04 = 151; в форме кристаллогидрата
(MnS04 • 4Н20) молекулярная масса этого соединения составляет
223, в форме моногидрата (MnS04 • Н20) — 169. Если в прописи
среды требуется 2,23 г MnS04 • 4Н20, то это количество эквива¬
лентно 1,69 г моногидрата (MnS04 • Н20).
Для более адекватного выражения соотношений химических
соединений в составе среды ее концентрацию иногда записы¬
вают в мили- или микромолях на 1 л среды. Сравнивая соста¬
вы сред, выраженные подобным способом, мы можем более
адекватно сопоставлять взаимодействующие компоненты сре¬
ды. Например, нам требуется 3 мМ СаС12 на 1 л среды. Для
этого вычисляем молекулярную массу СаС12 (она равна 110) и
затем умножаем ее на количество необходимых милимолей: 110 х
х 3 мМ = 330 мг/л.
46
ГЛАВА 2. Технология размножения растений в асептических условиях
Модифицируя прописи сред, надо также помнить о правиле
минимума, которое сформулировал еще в XIX в. немецкий хи¬
мик J. Liebig. Оно гласит, что любой необходимый элемент, де¬
фицит которого имеет место, становится лимитирующим факто¬
ром для нормального роста, даже если остальные элементы нахо¬
дятся в оптимальной концентрации.
Различные культуры, в силу своих биологических особенно¬
стей, для нормального развития требуют разных значений ки¬
слотности питательной среды. Символом pH обозначается значе¬
ние кислотности раствора, т. е. концентрация водородных ионов:
чем она выше, тем больше кислотность среды. Раствор, имеющий
pH 7,0, считается нейтральным, больше 7,0 — щелочным. Наи¬
более часто используются среды с показателем pH от 4,3 до 6,0,
т. е. в кислом диапазоне.
Иногда, при длительном культивировании некоторых видов, со
временем может произойти закисление культуральной среды, что
негативно влияет на темпы роста. В этом случае необходимо про¬
верить кислотность отработанной среды, и если сдвиг действи¬
тельно произошел, то нужно чаще проводить пассажи.
Как уже упоминалось, для коррекции кислотности использу¬
ются 1 н растворы гидроксида натрия (NaOH) и соляной кисло¬
ты (НС1). Корректировку проводят перед автоклавированием во
время активного перемешивания среды на магнитной мешалке,
постоянно контролируя значения pH и при необходимости до¬
бавляя по каплям указанные выше растворы. Корректируя pH,
нужно несколько завышать кислотность сред, так как во время
автоклавирования происходит небольшой сдвиг pH в кислую
сторону (~ на 0,5) вследствие образования сахарных кислот.
2.4.5. Компоненты питательных сред
На сегодняшний день разработано большое коли¬
чество стандартных прописей питательных сред для выращива¬
ния растений в асептической культуре. Условно их можно разде¬
лить на две большие группы: среды для культивирования травя¬
нистых и древесных растений. Вероятно, наиболее известной
средой для культивирования травянистых растений является сре¬
да, разработанная в 1962 г. Т. Murashige и его группой — среда Му-
рашиге—Скуга (МС). Как показывает практика, композиция ком¬
понентов этой среды оказалась наиболее универсальной для куль¬
тивирования (с минимальной коррекцией) представителей многих
47
ОБЩАЯ ЧАСТЬ
семейств травянистых растений. Для культивирования древесных
растений применяют другой тип сред. Наибольшее распростра¬
нение получила среда под аббревиатурой WPM (woody plant
medium), которую разработали В. McCown и G. Lloyd в 1990 г.
Ниже приведены прописи самых известных и употребляемых
сред для размножения декоративных растений. Концентрация
веществ указана в миллиграммах на 1 л среды (мг/л).
Среда Бургеффа
Ca(N03), • 4Н20 1000,0 КН2Р04 250,0
(NH4)2S04 250,0 К2НР04 250,0
MgS04 • 7Н20 250,0 Сахароза 20 000,0
FeS04 20,0 (pH 5,1-5,2)
Используется для проращивания семян Cymbidium,
Vanda, Paphiopedilum и Laeliocattleya. Эту среду с добав¬
лением тиамина, никотиновой кислоты и пиридоксина
можно применять для размножения протокормов
Cymbidium.
Среда Вацина—Вента
(NH4)2so4
500,0
KH2P04
250,0
MgS04. 7Н20
250,0
Ca3(P04)2
200,0
MgS04 7Н20
7,5
Fe-тартрат • 2Н20
28,0
KN03
525,0
Сахароза
20 000,0
(pH 5,6)
Эти среды рекомендуются для тканей Cymbidium, Cattleya,
Phalaenopsis и Vanda.
Среда Вимбера
(NH4)2S04
500,0
СаНР04
200,0
MgS04 7Н20
250,0
Fe-тартрат 2Н20
30,0
KN03
525,0
Триптофан
2000,0
KH2P04
250,0
Сахароза
20 000,0
(pH 5,6)
Среда Кнопа
Ca(NO,)2 • 4Н20
500,0
ZnS04 7Н20
0,033
KN03
125,0
7/шяс-коричная кислота 14,8
MgS04 • 7Н20
125,0
Изолейцин
13,2
KH2P04
125,0
Тиамин — НС1
0,4
Fe-цитрат
10,0
БАП
0,2
Мо03
0,016
Мезо- инозит
100,0
CuS04
0,040
Сахароза
20 000,0
(pH 5,0-5,5)
Используется для почек цветоносов Phalaenopsis.
48
ГЛАВА 2. Технология размножения растений в асептических условиях
Для проращивания семян орхидей L. Knudson (1922) предло¬
жил ряд сред, наибольшее распространение из которых получила
среда Кнудсона С:
Ca(N03)2 • 4Н20 1000,0 (NH4)2S04 500,0
КН2Р04 250,0 MnS04 • 4Н20 7,5
MgS04 ■ 7Н20 250,0 Сахароза 20 000,0
FeS04 • 7Н20 25,0 (pH 4,8-5,2)
Добавление к среде различных растительных соков (апельси¬
нового, бананового, картофельного, томатного) и кокосового мо¬
лока улучшает прорастание семян и рост сеянцев многих видов
орхидей.
Среда Линсмайера—Скуга
nh4no3
1650,0
KI
0,83
kno3
1900,0
Na2Mo04 • 2Н20
0,25
СаС12 2Н20
440,0
CuS04 5Н20
0,025
MgS04 • 7Н20
370,0
СоС12 • 6Н20
0,025
КН2Р04
170,0
Мезо- инозит
100,0
№2ЭДТА
37,3
Кинетин
0,1
FeS04 • 7Н20
27,8
ИУК
2,0
Н3ВО3
6,2
Тиамин — НС1
0,4
MnS04 4Н20
22,3
Сахароза
30 000,0
ZnS04 7Н20
9,0
(pH 5,5)
Рекомендуется для образования каллуса из верхушек ли¬
стьев Cattleya.
Среда Линдемана
(NH4)2S04
1000,0
CuS04 • 5Н20
0,019
Ca(N03)2 4Н20
500,0
А1С13
0,031
КС1
1050,0
NiCl2
0,017
MgS04 . 7Н20
120,0
KI
0,099
КН2Р04
135,0
НУК
0,1
Fe-цитрат
5,4
Кинетин
0,2
ZnS04 7Н20
0,565
Кокосовое молоко 150,0 мл
MnS04 • 4Н20
0,068
Сахароза
500,0
(pH 5,2-5,5)
Используется для
культивирования эксплантов Cattleya.
Среда Мореля
(NH4)2S04 1000,0 Лимонная кислота 125,0
КС1 1000,0 НУК 1,0
MgS04 • 7Н20 125,0 Кокосовое молоко 100,0 мл
ОБЩАЯ ЧАСТЬ
Ca(N03)2 • 4Н20 500,0 Микроэлементы по Ничу 1,0 мл
КН2Р03
Мочевина
125.0 Сахароза
500.0 (pH 5,0-5,5)
20 000,0
Жидкая среда используется для меристем орхидей, культиви¬
руемых в роллере. Для размножения протокормов Cymbidium, Cat-
tleya, Dendrobium, Vanda, Miltonia к среде добавляют 40 г/л гомо-
гената банана и 6—8 г агара, но исключают кокосовое молоко,
НУК, лимонную кислоту, мочевину.
Отличительная особенность состава среды МС — высокая
концентрация неорганического азота; по мнению некоторых ав¬
торов, соотношение аммонийной и нитратной форм азота в ней
оптимально для процессов органогенеза. Однако из практики тра¬
диционного размножения растений ex situ известно, что высокая
концентрация азота в среде для укоренения существенно снижает
интенсивность корнеобразовательных процессов.
В результате проведенных ранее исследований были разрабо¬
таны и предложены разнообразные по своему составу и назначе¬
нию питательные среды для культивирования орхидных. Для
роста и развития подавляющего большинства видов данного се¬
мейства может быть рекомендована среда с добавлением различ¬
ных регуляторов роста в разных концентрациях (Калинин и др.,
1992). Среду Кнудсона С также можно использовать для культи¬
вирования некоторых эпифитных видов.
Среда Мурашиге—Скуга
NH4N03
KN03
СаС12 • 2Н20
MgS04 7Н,0
КН,Р04
Na/ЭДТА
FeS04 7Н20
Н3В03
MnS04 • 4Н20
ZnS04 • 7Н,0
KI
1650.0 Na2Mo04 • 2Н20
1900.0 CuS04 • 5Н20
440.0 СоС12 • 6Н20
370.0 Глицин
170.0 Дрожжевой экстракт
37.3 Мезо-инозит
27,8 Никотиновая кислота
6,2 Пиридоксин — НС1
22.3 Тиамин — НС1
8,6 Сахароза
0,73 (pH 5,5)
0,25
0,025
0,025
2,0
1000,0
100,0
0,5
0,6
0,1
30 000,0
Среды Прасада—Митры
Для культивирования изолированных тканей
многих видов орхидей
Ca(N03)2 • 4Н,0
(NH4)2S04
КН2Р04
1000.0 1-Аспарагин
500.0 Аденин
250.0 Тиамин — НС1
3.0
3.0
0,1
50
ГЛАВА 2. Технология размножения растений в асептических условиях
MgS04 7Н20
250,0
Фолиевая кислота
0,1
FeS04 • 7Н20
25,0
Никотин
0,3
MnS04 • 4Н20
7,5
ИУК
0,1
Гидролизат казеина
200,0
Сахароза
20 000,0
Дрожжевой экстракт
200,0
Для проращивания семян
Ca(N03), • 4Н,0
1000,0
MnS04 • 4Н20
7,5
(NH4)2S04
500,0
Гидролизат казеина
200,0
КН,Р04
250,0
Аденин
3,0
MgS04 • 7Н20
250,0
Фолиевая кислота
0,1
FeS04 • 7Н,0
25,0
Сахароза
20 000,0
Для развития протокормов и роста проростков
Ca(N03)2 • 4Н20
200,0
CuS04 • 5H20
0,005
KN03
180,0
Na2Mo04 • 2H20
0,03
(NH4)2so4
100,0
Co(N03)2 • 6H20
0,1
NaH2P04
150,0
Тиамин — HC1
0,1
MgS04 • 7H20
250,0
Пиридоксин — HC1
0,1
FeNa23flTA
3,0 мл
Никотиновая кислота
0,5
KI
0,05
Рибофлавин
0,05
H,B03
0,6
Фолиевая кислота
0,1
MnCl2 • 4H20
0,4
Биотин
0,05
ZnS04 7H20
0,05
Сахароза
20 000,0
Следующая группа сред рекомендована для разных стадий
прорастания семян и роста сеянцев Cymbidium.
Среда Рейнерта—Мохра
(NH4)2S04
400,0 Ыа2ЭДТА
22,4
Ca(NO,)2 • 4Н20
1000,0 Лимонная кислота
150,1
КС1
500,0 Тиамин — НС1
0,1
КН2Р04
250,0 Никотиновая кислота
0,5
MgS04 7Н20
400,0 Пиридоксин — НС1
0,5
MnS04 Н20
7,5 Глицин
2,0
н3во3
0,03 ИМК
1,75
NaS04 Н20
0,03 НУК
1,75
CuS04 • 5Н20
0,001 Сахароза
20 000,0
Fe2(S04)3
10,67 (pH 5,5-5,6)
Используется для
выращивания меристем Cattleya и Cymbidium.
Среда Споерла
nh4no3
1600,0 ZnS04 • Н20
0,05
КН2Р04
270,0 CuS04 • Н20
0,05
MgS04 7Н20
240,0 Na2Mo04 • 2Н20
0,05
51
ОБЩАЯ ЧАСТЬ
CaS04 2Н20
80,0
KI
0,03
СаН4(Р04)2 • 2Н20
100,0
Co(N03)2 6Н20
0,05
н3во3
0,60
Fe-тартрат • 2Н20
3,0
МпС12 • 4Н20
0,40
Сахароза
20 000,1
(pH 5,5)
Среда Томпсона
Мочевина
540,0
CuS04
0,23
(NH4)2HP04
345,0
ZnS04
0,29
Са(СН3СОО)2 • Н20
79,0
н3во3
1,86
MgS04 • 7Н20
369,0
NH4Mn04
0,035
Na2 ЭДТА
25,0
Сахароза
30 000,0
МпС12
2,2
(pH 5,6)
Рекомендуется для эпифитных и диких видов орхидей, про¬
ращивания семян Cattleya.
Среда Хеллера
КС1
750,0
MnS04 • 4Н20
0,1
NaNO,
600,0
CuS04 5Н20
0,03
MgS04 7Н20
250,0
А1С13
0,03
NaH2P04 • Н20
325,0
NiCl3
0,03
FeCl3 • 6Н20
1,0
KI
0,01
ZnS04 • 7Н,0
1,0
Сахароза
20 000,0
H3B03
1,0
(pH 5,6-5,8)
Рекомендуется для выращивания тканей многих растений.
Раствор микроэлементов этой среды в количестве 1 мг/л
можно добавлять к средам для культивирования тканей ор¬
хидей.
Приведенный список питательных сред, используемых раз¬
ными авторами при культивировании тканей орхидей, далеко не
полный. Однако как свидетельствуют результаты наших много¬
летних исследований, для большинства видов орхидей состав
минеральной основы среды не имеет особого значения. Решаю¬
щую роль играют концентрация и сочетание регуляторов роста,
витаминов. Поэтому в нашей лаборатории чаще всего для высева
семян орхидей используется модификация среды Кнудсона с гу-
матом калия, для культивирования изолированных меристемати-
ческих тканей — среда МС.
52
ГЛАВА 2. Технология размножения растений в асептических условиях
Минеральные компоненты питательных сред
Принципы разделения всех химических соедине¬
ний на неорганические и органические общеизвестны. Большин¬
ство неорганических химических веществ имеют высокую темпе¬
ратуру плавления, немногие могут гореть, многие растворимы в
воде и способны проводить в ней электричество. Однако они в
основном не растворяются в органических растворителях. Реак¬
ции с участием неорганических химических веществ практически
всегда быстротечны.
В асептических условиях ионы минеральных солей могут по¬
ступать в растения как из водной фазы культуральной среды, так
и в результате обменных процессов, которые происходят на поверх¬
ности тканей, контактирующих с поверхностью среды. В раститель¬
ном организме одни минеральные элементы могут использоваться
в форме свободных ионов, другие связываются с органическими
соединениями, третьи включаются в их состав лишь после ряда
окислительно-восстановительных преобразований.
В растении mojjcho встретить практически все элементы пе¬
риодической системы Д.И. Менделеева, однако абсолютно необ¬
ходимые принято условно разделять на две группы в зависимости
от потребности в них растительного организма и, соответствен¬
но, их содержания: макро- и микроэлементы. К первым относят
7 основных химических элементов, которые растения получают
из культуральных сред: они необходимы для любого раститель¬
ного организма и входят в состав всех прописей и комплексных
удобрений: азот, кальций, калий, фосфор, магний, сера, крем¬
ний. Углерод, водород и кислород растения получают из водной
фазы культуральной среды и из воздуха.
К группе микроэлементов относят незаменимые химические
элементы, которые необходимы растениям в количествах 0,01 %
и менее (в расчете на сухую массу). Роль большинства микроэле¬
ментов определена участием в активных центрах ферментов, по¬
этому их дефицит может негативно сказываться уже на самых
ранних этапах онтогенеза (табл. 2.1).
На современном уровне технологического оснащения хими¬
ческих комбинатов по производству реактивов для использования
в биотехнологических процессах можно получать особо чистые
компоненты. Поэтому in vitro очень ярко проявляется недо¬
статок микроэлементов, которые раньше могли попадать в пи¬
тательные среды вместе с другими соединениями. И все же некото-
53
ОБЩАЯ ЧАСТЬ
Таблица 2.1. Среднее содержание элементов в тканях растений
(по Медведеву, 2004)
Элемент
Содержание в расчете
на сухую массу
Количество атомов
относительно молиб¬
мкМ/г
% (или млн-1)
дена (принят за 1)
Элементы, получаемые
из углекислоты и воды **
водород
60 ООО
6
60 000 000
углерод
40 ООО
45
40 000 000
кислород
30 000
45
30 000 000
Макроэлементы “
азот
1 000
1,5
1000 000
калий
250
1,0
250 000
кальций
125
0,5
125 000
магний
80
0,2
80 000
фосфор
60
0,2
60 000
сера
30
0,1
30 000
кремний
30
0,1
30 000
Микроэлементы *2
хлор
3,0
100
3 000
железо
2,0
100
2 000
бор
2,0
20
2 000
марганец
1,0
50
1 000
натрий
0,4
10
400
цинк
0,3
20
300
медь
0,1
6
100
никель
0,002
0,1
2
молибден
0,001
0,1
1
■' В процентах. '2 В миллионах '.
рые микроэлементы входят в состав используемых химических
соединений как примеси, от которых проблематично избавиться.
В таких случаях фирмы-производители обычно указывают это на
ярлыке реактива.
Макроэлементы. Азот — один из важнейших элементов, необ¬
ходимых для нормального роста и развития растений. В культу¬
ральных средах основными источниками азота являются аммо¬
нийные (NH4+) и нитратные (N03") формы, хотя известно, что
некоторые культуры могут использовать и азот, содержащийся в
аминокислотах. Согласно исследованиям J. Arditti (1979), практи¬
чески все аминокислоты, которые входят в состав питательных
сред, как и мочевина, могут быть дополнительным источником
ГЛАВА 2. Технология размножения растений в асептических условиях
азота для развивающихся семян орхидных. В связи с тем что
азот — достаточно дефицитный элемент питания, в продуктах,
выделяемых растениями в окружающее пространство, практи¬
чески отсутствуют азотистые вещества. Процессы распада азот¬
содержащих соединений в растительных клетках завершаются
образованием аммиака, который может сразу же реутилизиро-
ваться.
Азот входит в состав аминокислот (белков), нуклеиновых ки¬
слот, пигментов (хлорофиллы), алкалоидов, гормонов и других
органических соединений. Дефицит азота характеризуется хлоро-
тичностью, угнетением роста и замедлением общих темпов раз¬
вития растения в целом. Известно, что в септических условиях
небольшой избыток азота хотя и поддерживает интенсивный
рост, но подавляет развитие генеративных органов (Мусиенко и
др., 1989).
Большое значение для роста сеянцев имеет форма солей азо¬
та. Установлено, что проростки орхидных могут усваивать как
аммиачные, так и нитратные формы азота: первые способствуют
росту гетеротрофных и сапрофитных видов, вторые — автотроф-
ных. Опыты показали, что способность сеянцев Cattleya утилизи¬
ровать нитраты зависит от эндогенного синтеза нитратредуктазы.
Аммиачный азот необходим для прорастания семян Vanilla Mill,
Paphiopedilum Pfitz., Cymbidium Sw., в то время как для семян Van¬
da Jones он токсичен. Замечено, что низкие концентрации со¬
единений азота в составе питательной среды стимулируют про¬
растание семян орхидных, высокие — угнетают. Для проращива¬
ния семян эпифитных видов орхидных P. Thompson (1974) предло¬
жил среду, в состав которой входит мочевина, однако результаты
ее использования для сеянцев различных видов довольно про¬
тиворечивы. Внесение мочевины угнетало прорастание семян
и рост сеянцев Dendrobium phalaenopsis, Phalaenopsis и способ¬
ствовало росту сеянцев Laeliocattleya, Cattleya, Vanilla, Vanda. В
целом азотный обмен у сеянцев орхидных несущественно от¬
личается от такового у других групп высших растений (Arditti,
1967).
Фосфор входит в состав нуклеиновых кислот, белков, фосфо¬
липидов, фосфорных эфиров сахаров, нуклеотидов, фитина и
других соединений. В растительных тканях он содержится в ор¬
ганической форме в виде ортофосфорной кислоты и ее солей.
Трехзамещенные фосфорные соли плохо растворимы в воде и
мало доступны для растений, тогда как двухзамещенные, еще
55
ОБЩАЯ ЧАСТЬ
больше однозамещенные кальциевые и магниевые соли орто-
фосфорной кислоты или фосфорные соли калия, натрия и аммо¬
ния хорошо растворимы в воде и поглощаются корневой систе¬
мой растений. Поэтому фосфор обычно добавляют к питатель¬
ным средам в виде фосфата калия (КН2Р04) или фосфата натрия
(NaH2P04). Основное соединение, в виде которого запасается
фосфор в растительных тканях, — фитиновая (л<ио-инозитгекса-
фосфорная) кислота.
На ранних этапах развития, особенно в асептических услови¬
ях, сеянцы и растения-регенеранты наиболее чувствительны к
недостатку фосфора. Особенно богаты фосфором быстрорасту¬
щие ткани, в клетках которых интенсифицированы метаболиче¬
ские процессы (меристемы). Фосфор входит в состав нуклеиновых
кислот и в виде универсальных химических соединений прини¬
мает непосредственное участие во внутриклеточных энергетиче¬
ских превращениях как у растений, так и у животных. Уникальная
функция фосфора — его участие в фосфорилировании белков с
помощью протеинкиназ.
Визуальными признаками недостатка фосфора могут служить
пурпурный оттенок вегетативных органов и замедленный рост.
Калий — главный потенциалобразующий ион в процессах
электрогенеза растительной клетки. Концентрация калия внутри
клетки на несколько порядков превышает таковую в окружаю¬
щей среде, поэтому в частях растений, которые непосредственно
соприкасаются с питательным раствором, функционирует мощней¬
шая система ионных насосов, поддерживающая градиент кон¬
центрации на должном уровне. В растении калий находится в ос¬
новном в ионной форме, имеет очень высокую подвижность и
хорошо реутилизируется. На сегодня известно более 60 фермен¬
тов, для нормальной работы которых нужны ионы калия. Важ¬
ную роль играет калий в процессах поглощения и транспорта во¬
ды по растению, поскольку влияет на водный потенциал расти¬
тельных клеток. Механизм работы нижнего водяного насоса на
3/4 обусловлен наличием в сосудах ксилемы ионов калия (Мед¬
ведев, 2004; MycieHKO, 2005).
Калий в питательные среды иногда вносят в виде хлорида
(КС1), однако чаще в виде нитрата калия (KN03) или фосфата
калия (КН2Р04). Недостаток данного элемента слабо проявляется
визуально. Как правило, это пятнистость или изменение морфо¬
логии листа (скручивание, изорванный край). Калий необходим
для поддержания на оптимальном уровне процессов роста и раз¬
ГЛАВА 2. Технология размножения растений в асептических условиях
вития, прямо или опосредованно участвуя в биосинтезе основ¬
ных классов органических соединений.
Дефицит калия тормозит процессы деления и растяжения
клеток, что приводит к образованию розеточных форм растений,
угнетает проявление доминирующего эффекта апикальной поч¬
ки, а также снижает интенсивность фотосинтетических процес¬
сов, прежде всего вследствие уменьшения скорости оттока асси-
милятов (Медведев, 2004).
Кальций играет важную роль в клеточном метаболизме — свя¬
зывает побочные токсичные продукты белкового обмена (образуя
со щавелевой кислотой оксалат кальция). В клетке в основном
используется как строительный материал. В форме пектата каль¬
ция включается в клеточные стенки и в такой форме способству¬
ет проницаемости последних и транспорту углеводов и амино¬
кислот по растению. Кальций имеет важное значение в процес¬
сах клеточной сигнализации как вторичный посредник. Очень
чувствителен к флуктуациям концентраций цитозольного каль¬
ция цитоскелет. Кальцийзависимое функционирование цитоске¬
лета имеет место в таких процессах, как внутриклеточное движе¬
ние цитоплазмы (циклоз), клеточное деление, рост клеток растя¬
жением.
Кальций вводится в состав среды в виде хлорида кальция
(СаС12), нитрата кальция (Ca(N03)2) или сложного фосфата каль¬
ция (Са10(РО4)6(ОН)2). Манипулируя с концентрациями кальция,
нужно четко представлять биоэкологические особенности расти¬
тельного объекта, так как известно, что растения принято услов¬
но делить на три группы по отношению к солям кальция: каль-
циефилы, кальциефобы и нейтральные виды. Эти особенности
биологии необходимо учитывать при составлении питательных
сред. Кроме того, как правило, двудольные растения содержат в
своих тканях значительно больше этого элемента, чем однодоль¬
ные. Кальций не реутилизируется, а накапливается в старых тка¬
нях растений.
Визуальным признаком недостатка кальция в асептической
культуре могут быть отмершие кончики корней и верхушки по¬
бегов. При кальциевом дефиците резко возрастает текучесть
мембран, как следствие — нарушаются процессы мембранного
транспорта и биоэлектрогенеза, тормозится деление и растяже¬
ние клеток, изменяются процессы корнеобразования. Может
происходить также деформация формы листовых пластинок; их
кончики вначале белеют, а затем отмирают.
57
ОБЩАЯ ЧАСТЬ
Тестировать недостаток какого-либо минерального элемента
in vitro (в том числе и кальция) визуально достаточно проблема¬
тично. Сделать это может только специалист высокого класса,
долгое время работающий с данной культурой. Это обусловлено
тем, что в асептических условиях морфология растений претер¬
певает достаточно значительные изменения, которые можно
принять за те или иные симптомы недостатка минеральных эле¬
ментов питания. Поскольку именно кальций, как правило, вы¬
ступает в роли балластного иона при создании физиологически
уравновешенного ионного состава среды, кальциевое голодание
in vitro встречается достаточно редко. Однако при долгом культи¬
вировании без пассажей, когда происходит закисление питатель¬
ных сред, доступность кальция может резко снижаться.
Сера вводится в состав сред в виде сульфатов различных эле¬
ментов и может поглощаться растениями только в окисленной
форме в виде иона S042'. В растениях сера может находиться как
в окисленной, так и в восстановленной формах. В основном этот
элемент транспортируется в надземные, зеленые части растений.
Как и кальций, сера не реутилизируется, поэтому может в значи¬
тельных количествах накапливаться в стареющих частях расте¬
ний. Сульфгидрильные группы входят в состав аминокислот (цис-
теин, метионин), витаминов (липоевая кислота, биотин, тиамин),
липидов, кофермента А.
Одна из важнейших функций серы — формирование третич¬
ной структуры белков путем образования ковалентных связей ди-
сульфидных мостиков между остатками цистеина.
Внешними симптомами серного дефицита могут служить вновь
образуемые бледные побеги. При ее отсутствии тормозятся про¬
цессы роста и развития, фотосинтеза, синтеза белков и др. Сера
поддерживает нормальное развитие корневой системы.
Магний добавляют к средам в виде сульфата (MgS04 • 7Н20).
Именно этот химический элемент придает зеленую окраску мо¬
лекулам хлорофилла, следовательно — и фотосинтезирующим час¬
тям растений в целом.
В семенах большая часть магния находится в виде фитина.
Участие магния в процессе обмена веществ связано с его способ¬
ностью регулировать работу ряда ферментов: он является кофак¬
тором почти всех ферментов, катализирующих перенос фосфат¬
ных групп, необходим для работы многих ферментов гликолиза,
цикла Кребса, а также спиртового и молочнокислого брожения.
При повышении концентрации магния в растительных клетках
ГЛАВА 2. Технология размножения растений в асептических условиях
активируются ферменты, участвующие в метаболизме фосфата,
что приводит к повышению содержания в тканях органических и
неорганических форм фосфорных соединений (Медведев, 2004).
Недостаток этого элемента может вызывать хлороз листьев.
Магниевое голодание в первую очередь сказывается на фосфор¬
ном обмене, следовательно, и на общей энергетике растения,
структуре пластид, вызывает серьезные нарушения в биосинтезе
белка.
Кремний в растительных организмах используется в основном
как строительный материал для клеточных стенок, обеспечивая
их прочность и эластичность. И хотя он практически никогда не
вводится специально в состав питательных сред, отсутствие
кремния в питательной среде может повлечь серьезные наруше¬
ния в структуре клеточных органелл.
Микроэлементы. Железо часто относят к группе макроэлемен¬
тов, исходя из его достаточно высокой концентрации в расти¬
тельных тканях. Однако рассматривая функции, которые прису¬
щи этому химическому элементу в растительных организмах,
можно говорить о том, что они в большей степени характерны
для микроэлементов. В составе белковых молекул железо может
находиться как в гемовой (цитохромы, пероксидаза, каталаза),
так и в негемовой (в составе железосодержащих кластеров) фор¬
мах (Школьник, 1974). В связи с тем что железо принимает не¬
посредственное участие в биосинтезе хлорофиллов и функциони¬
ровании основных элементов электрон-транспортных цепей ды¬
хания и фотосинтеза, при его недостатке на молодых листовых
пластинках могут появляться признаки хлороза, особенно между
жилками листа. Кроме того, железо задействовано в процессах
фотосинтеза и дыхания (переходя из трехвалентной формы в
двухвалентную). Основная масса железа запасается в хлоропла-
стах в виде особой формы фосфопротеида — фитоферритина,
который является транспортабельным и может перемещаться по
растению.
В состав питательных сред этот элемент обычно включают в
форме сульфата (FeS04 • 7Н20). Чтобы оптимизировать доступ¬
ность железа для растений, его вводят вместе с №2ЭДТА
(C10HI6N2O8Na2 Н20).
Медь для большинства культур необходима в концентрациях
0,025—0,020 мг/л. Подобно железу, она связывается с ферментами
и участвует в окислительно-восстановительных превращениях. По¬
ловина меди, находящейся в растении, сконцентрирована в хлоро-
ОБЩАЯ ЧАСТЬ
пластах в виде пластоцианина. Кроме того, медь входит в состав
некоторых растительных ферментов (аскорбатоксидаза, полифено-
локсидаза, супероксиддисмутаза, цитохромоксидаза), участвует в
биосинтезе пигментов; переходя из одновалентного состояния в
двухвалентное, принимает участие в энергетических процессах.
При недостатке меди снижается эффективность процессов
дыхания и фотосинтеза, нарушается лигнификация клеточных
оболочек. Ее дефицит провоцирует чахлый рост, темно-зеленый
цвет растений с последующим развитием некрозов, хлороз кончи¬
ков листьев, отклонения в морфологическом развитии, отмира¬
ние апексов побегов, потерю тургора (Школьник, 1974). В среды
медь вводят в основном в виде сульфата (CuS04 • 5Н20).
Цинк добавляют к питательным средам как сульфат (ZnS04 х
х 7Н20). В растения поступает в виде катиона Zn2+. Выступает в
роли кофермента в биосинтезе хлорофиллов и некоторых аук¬
синов (необходим для синтеза триптофана — предшественника
ИУК). Недостаток фосфора провоцирует нарушения в фосфорном
обмене растений: увеличивается количество неорганических фосфа¬
тов, замедляется его превращение в органические формы. Как след¬
ствие — снижается содержание фосфора в составе нуклеотидов,
нуклеиновых кислот и фосфолипидов. Дефицит визуально про¬
является в изменении цвета листовых пластинок (они приобре¬
тают желтоватый оттенок) и нарушении нормального развития
корневой системы. Излишек этого элемента токсичен.
Марганец входит в состав тилакоидных мембран и участвует в
фотолизе воды в составе одного из полипептидов. Кроме того,
марганец способствует детоксикации активных форм кислорода,
являясь составной частью каталитического центра одного из фер¬
ментов (Мп-супероксиддисмутазы). На сегодняшний день из¬
вестно более 30 ферментов, для активации которых необходимы
ионы Мп2+ (Медведев, 2004).
При недостатке марганца существенно снижается выделение
кислорода в процессе фотосинтеза и количество углеводов в тка¬
нях, на листьях между жилками появляются признаки хлороза. В
среды этот элемент добавляют как кристаллогидрат сульфата
(MnS04 • Н20).
Молибден, как полагают, поступает в растения в виде аниона
Мо04‘ и концентрируется в молодых растущих органах расте¬
ния, больше в надземной части. В листьях он сконцентрирован в
основном в хлоропластах.
ГЛАВА 2. Технология размножения растений в асептических условиях
В среды для культуры тканей добавляют молибдат натрия
(Na2Mo04 • 2Н20). Это микроэлемент, передозировки которого в
культуре in vitro могут быть крайне токсичны. При закислении
сред доступность молибдена снижается. Его дефицит может из¬
менять морфологию побегов и угнетать рост вплоть до полной
остановки. Молибден принимает непосредственное участие в
процессах преобразования азота в усвояемые (аммиачные) фор¬
мы, поэтому его иногда называют микроэлементом азотного об¬
мена. При недостатке молибдена в растениях накапливаются в
большом количестве нитраты.
Бор — один из наиболее важных микроэлементов. В расти¬
тельных тканях может находиться в свободной форме В(ОН)3,
В(ОН)4' и в виде комплексов с органическими соединениями. В
клетках связывается с полисахаридами клеточных стенок.
К культуральным средам добавляют в виде борной кислоты
(Н3В03). Излишек бора токсичен и может вызвать гибель расте¬
ния. Этот важный микроэлемент принимает участие в делении
клеток и азотном обмене, регулирует процессы транспорта воды,
углеводов и гормонов, усиливает рост пыльцевых трубок. Дефи¬
цит бора проявляется в виде отмирания апикальных меристем,
деформации и хлорозов листовых пластинок, нарушения анато¬
мического строения осевых органов растения.
В отличие от других микроэлементов бор не является ком¬
понентом или активатором ферментов. Тем не менее выявлено,
что он принимает участие в метаболизме фенолов, углеводов,
нуклеиновых кислот, ауксиновом обмене, в формировании струк¬
туры клеточных стенок, регуляции процессов роста и развития.
Предполагается, что некоторые физиологические эффекты, вы¬
зываемые этим элементом, могут быть обусловлены регулирова¬
нием содержания в клеточных компартментах ионизированного
кальция. Двудольным растениям бор необходим на протяжении
всего онтогенеза, тогда как однодольные могут обходиться без
него вплоть до наступления репродуктивной фазы (MycieHKO,
2004).
Кобальт в растительном организме может находиться в ион¬
ной форме и как порфириновое соединение (цианокобаламин).
Растения не способны к синтезу витамина В12, поэтому его вво¬
дят экзогенно в виде кристаллогидрата (СоС12 • 6Н20). Симптомы
недостатка сходны с таковыми при азотном голодании.
Хлор растения усваивают в небольших количествах. В среды
он вводится в виде хлорида кальция (СаС12 • 2Н20). Необходим
61
ОБЩАЯ ЧАСТЬ
для процессов фотосинтеза (фотолиз воды) и поддерживает нор¬
мальный рост растений (регуляция осмотического давления).
При дефиците листья поникают, листовые пластинки желтеют.
Стойкий дефицит, как и излишек, летален. В среды может попа¬
дать как примесь. Некоторые культуры очень чувствительны к
наличию ионов хлора в среде (Ericaceae D.Don).
Иод добавляют к средам в виде йодида калия (KI). Входит в со¬
став некоторых аминокислот. Необходим в следовых количествах.
Органические соединения
Органические вещества, с точки зрения жизни на
нашей планете, — самые важные. Основу любого соединения,
которое мы классифицируем как органическое, составляет скелет
ковалентно связанных атомов углерода. В качестве примеров ос¬
новных классов органических соединений можно привести угле¬
воды, белки, гормоны, жиры, витамины и пр. В физическом от¬
ношении они могут представлять собой газы, жидкости или
твердые субстанции. Органические молекулы преимущественно
нерастворимы в воде и не проводят электричество. Большинство
органических соединений может гореть, хотя в химические реак¬
ции они вступают относительно медленно.
Растения, практически единственные на нашей планете авто-
трофные организмы, могут синтезировать органические вещества
из неорганических; они фактически не нуждаются в готовых ор¬
ганических соединениях in situ (хотя в случае наличия в среде
могут их усваивать).
Однако в условиях асептической культуры, после вычленения
из тела растений отдельных групп тканей и даже отдельных кле¬
ток для выращивания на искусственных средах, как правило, они
не могут синтезировать все необходимые органические соедине¬
ния, которые нужны для нормальной жизнедеятельности. По¬
этому органические вещества должны быть включены в культу¬
ральные среды.
Углеводы. В растениях синтезируются, содержатся и усваива¬
ются в основном /)-формы сахаров. L-формы встречаются очень
редко. К группе углеводов относят наиболее часто встречающие¬
ся в тканях растений органические соединения — моно-, дисаха¬
риды, крахмал, целлюлоза и др. Соединения данной группы поч¬
ти полностью состоят из углерода, водорода и кислорода. Это
первичные химические элементы, которые составляют основу их
62
ГЛАВА 2. Технология размножения растений в асептических условиях
молекул; они в достаточном количестве находятся в окружающей
растения среде (диоксид углерода, вода).
Метаболизм углеводов занимает важнейшее место в основном
обмене веществ высших растений. Существование культуры тка¬
ней растений, в сегодняшнем ее качестве, невозможно без внесе¬
ния в состав питательных сред различных форм углеводов. Более
того, сам факт накопления биомассы культуры, за редким ис¬
ключением, тесно связан с наличием углеводов в питательной
среде. Однако связь процесса роста культуры с углеводным мета¬
болизмом значительно глубже и сложнее, и для разработки основ
рационального культивирования изолированных тканей (как в
эксперименте, так и на практике) необходимо знание путей ме¬
таболизма углеводов, их контроля и регуляции.
Наиболее эффективным источником углерода для культур
клеток и тканей чаще всего служит сахароза. Легкость взаимо¬
превращений глюкозы, фруктозы и сахарозы обеспечивает вовле¬
чение любого из этих главных для роста изолированных культур
компонентов в основные пути деградации — гликолитический и
пентозофосфатный, все этапы которых детально исследованы и
описаны к настоящему времени (Дэгли, Никольсон, 1973; Myci-
енко, 1995; Медведев, 2004). В целом первый путь больше соот¬
ветствует высоким энергетическим затратам, второй — синтети¬
ческим запросам.
Сахароза — дисахарид, наиболее распространенный в расти¬
тельных тканях. Ряд структурных особенностей сахарозы, обес¬
печивающих высокий энергетический потенциал молекулы и за¬
щищенность ее главных реакционно-способных связей (двойной
глюкозид), и является той основой, которая определяет особое
положение сахарозы. Сахароза состоит из 2 химически связанных
монноз, p-фруктозы и а-глюкозы. Это основной энергетический
материал растений, который может использоваться и как источ¬
ник энергии для прохождения каких-либо энергозависимых про¬
цессов, и как строительный материал. Формирование молекул
сахарозы в растении — прямое следствие процессов фотосинтеза.
Она представляет собой основной транспортный сахар и пере¬
мещается по ситовидным трубкам флоэмы. Под действием фер¬
мента этот дисахарид легко гидролизуется с образованием смеси
равных количеств глюкозы и фруктозы.
Сахароза синтезируется в цитоплазме растительных клеток;
образование ее в хлоропластах еще окончательно не доказано. В
растениях есть два фермента, катализирующих образование саха¬
63
ОБЩАЯ ЧАСТЬ
розы: сахарозофосфатсинтаза и сахарозосинтаза. Однако принято
считать, что последний катализирует преимущественно распад
сахарозы (Красильникова и др., 2004).
К сожалению, растительные культуры не могут синтезировать
in vitro необходимое для их нормального развития количество са¬
харов, поэтому в культуральные среды добавляют сахарозу в кон¬
центрации 18—30 г/л. Это значение рекомендовано для боль¬
шинства прописей сред. Известно, что изменяя ее уровень, мож¬
но существенно влиять на характер морфообразовательного про¬
цесса, особенно при взаимодействии с регуляторами роста. Более
того, наличие сахарозы (или других производных) в среде для
укоренения необходимо, так как в случае ее отсутствия даже при
наличии ИМК процесс ризогенеза у большинства культур суще¬
ственно замедляется или же вообще прекращается. Сахара, полу¬
чаемые из сахарного тростника (Saccharum officinanim) или сахар¬
ной свеклы {Beta vulgaris), фактически являются 100%-й чистой
сахарозой и могут применяться для большинства сред в культуре
тканей.
Говоря об использовании углеводов в культуре растительных
тканей, мы хотели бы обозначить три основных аспекта этого
вопроса:
• качественный состав используемых сахаров;
• количество сахаров, добавляемых в питательные среды;
• транспорт углеводов в растении.
Из числа гексоз больше всего данных представлено по ис¬
пользованию глюкозы, фруктозы и галактозы. Рост на средах с
глюкозой или фруктозой для большинства культур происходит
очень успешно. Однако общая картина использования олигоса¬
харидов для роста культур, изолированных из растений разных
видов, оказалась довольно пестрой, хотя некоторые закономер¬
ности прослеживаются вполне определенно. Дисахариды, со¬
стоящие только из глюкозных субъединиц — мальтоз, целлобиоз,
трегалоз, большей частью используются так же успешно, как са¬
хароза и глюкоза. Видимо, это связано с высокой активностью
соответствующих гидролаз, скорость расщепления которых выше
скорости метаболизации глюкозы. В некоторых случаях повыше¬
ние концентрации сахарозы способствует образованию вторич¬
ных соединений (Запрометов, 1981).
Напротив, дисахариды, включающие помимо глюкозы еще и
галактозу (лактоза и мелибиоза), лишь немногими видами ис¬
пользуются наравне с сахарозой, а большинство культур не обна¬
64
ГЛАВА 2. Технология размножения растений в асептических условиях
руживает признаков роста с данными субстанциями (Холодова,
1981). Это свидетельствует о больших возможностях углеводного
обмена изолированных культур, способного включить даже те со¬
единения (например, лактозу), с которыми в интактном состоянии
растения не встречаются (Дэгли, Никольсон, 1973).
Более равномерно распределяются культуры разных видов по
способности использовать для роста трисахарид рафинозу, со¬
держащую помимо галактозной единицы еще глюкозную и фрук-
тозную и являющуюся в отличие от лактозы нормальным мета¬
болитом некоторых растений (Курсанов, 1976).
Если в видовом составе культур, контрастных по использова¬
нию галактозосодержащих олигосахаридов, не обнаруживается
каких-либо закономерностей, то в отношении крахмала просле¬
живается определенная связь: культуры разных видов довольно
равномерно распределяются по способности использовать крах¬
мал, причем достаточно эффективным источником углеродного
питания крахмал оказался в основном для злаков. У культур ро¬
зоцветных на среде с крахмалом рост отсутствует.
Другие группы углеводов исследованы слабее. Большая часть
изученных культур не способна расти на средах с сахароспиртами
(сорбитом или маннитом), пентозами (рибозой, арабинозой
или ксилозой), дезоксигексозой (рамнозой). Лишь немногие ви¬
ды (в том числе и роза) дают небольшой рост на пентозах, одна¬
ко максимальное накопление биомассы на них в несколько раз
ниже, чем на сахарозе.
Многоатомные спирты образуются в растениях путем восста¬
новления моносахаридов, их альдо- и кетогрупп. Наиболее рас¬
пространены в растениях сорбит, маннит, дульцит (галактит).
D-маннит — сахарный этиловый спирт, образуется в расте¬
ниях при восстановлении маннозы или фруктозы. Используется
как питательное вещество или как вещество, изменяющее осмо¬
тическое давление, особенно при стимулировании формирования
протопластов и их слияния.
Сорбит широко распространен в растениях; образуется при
восстановлении фруктозы или глюкозы. Содержится в основном
в плодах. Впервые был выделен из плодов рябины. Иногда до¬
бавляется к среде.
Логичным было бы предположить связь между структурой
используемых сахаров и систематическим положением растений.
Действительно, известно об успешном использовании крахмала
злаками, маннита — ясенем, сорбита — видами розоцветных, тогда
65
ОБЩАЯ ЧАСТЬ
как исследованные культуры растений других семейств не спо¬
собны расти за счет тех же углеводов или используют их значи¬
тельно хуже. Эти данные свидетельствуют о сохранении в изоли¬
рованных культурах некоторых биохимических особенностей ис¬
ходных растений (Холодова, 1981).
Также выявлено, что культуры, изолированные из растений
одного и того же вида или выделенные из разных органов одного
и того же растения, могут существенно различаться по использо¬
ванию разных источников углерода (Тараканова и др., 1979). Бо¬
лее того, одноклеточные клоны или даже вторичные одноклеточ¬
ные клоны могут давать широкий спектр реакций на отдельные
сахара. Поэтому клональная гетерогенность, причиной которой
является, видимо, мутационная изменчивость, затрудняет оценку
видовой специфики основного обмена. Это открывает новые
возможности исследования метаболизма углеводов в культуре
изолированных тканей растений вследствие получения биохими¬
ческих мутантов по тем или иным звеньям основного обмена.
Таким образом, собранные материалы в целом подтверждают
представление о сахарозе как лучшем источнике для роста изо¬
лированных культур тканей растений, которое сложилось еще на
основании ранних работ и обобщено в монографиях R. Gautheret
(1959) и Р.Г. Бутенко (1964).
Несколько слов о количественных показателях использования
сахаров. Казалось бы, этот вопрос не нуждается в обсуждении, по¬
скольку все стандартные среды предписывают использовать саха¬
розу в концентрации от 2,0 до 3,4 %. Действительно, экспери¬
ментальная проверка некоторых культур показала, что именно в
данных пределах лежит оптимальная для накопления биомассы
концентрация сахарозы (Yeoman, Mac Leod, 1977).
Однако позже оказалось, что для многих исследованных в этом
направлении культур оптимальная концентрация значительно вы¬
ше, чем рекомендуемая стандартными средами. Так, на 30-е сутки
выращивания культуры ткани одного из видов кактусовых Neo-
mammillaria prolifera Miller максимальное накопление биомассы,
оцениваемой по массе как сырого, так и сухого вещества, наблю¬
далось на среде с 10 % сахарозы (Minocha, Mehra, 1974).
Приведенные данные показывают, что оптимальная концен¬
трация сахарозы для роста культур некоторых видов растений в
несколько раз выше (до 14 %), чем обычно используемая. Имею¬
щийся ограниченный материал не позволяет выявить какую-либо
связь между способностью изолированных культур расти на среде
66
ГЛАВА 2. Технология размножения растений в асептических условиях
с высокой концентрацией сахарозы и систематическим положе¬
нием растений. Следует, однако, отметить, что для многих расте¬
ний в интактном состоянии характерны высокие концентрации
сахаров или растворимых полисахаридов. Важнее обратить вни¬
мание на другое обстоятельство: по-видимому, оптимальную для
роста концентрацию сахарозы можно повысить, если сбаланси¬
рованно изменить соотношение некоторых компонентов среды.
Выявление таких связей между компонентами питательных сме¬
сей успешно осуществляется при оптимизации среды на основе
метода математического планирования эксперимента (Федоров,
1969; Максимов, 1980).
На хорошо сбалансированных средах выход биомассы про¬
порционален концентрации сахара в среде, однако при наиболее
высоких концентрациях такая закономерность нарушается; при¬
чиной является развиваемое ими высокое осмотическое давление
(Mantell et al., 1987). В связи с этим можно предположить, что
более эффективное использование сахарозы в сравнении с дру¬
гими моносахаридами может быть следствием более низкого ос¬
мотического давления сахарозной среды при одинаковой нагру¬
женное™ углеродом.
Проведенные исследования показывают, что именно углево¬
ды, а не биогенные неорганические соединения азота или фос¬
фора определяют окончательную границу роста, если оценивать
его по накоплению сухой массы клеток. По-видимому, в прекра¬
тившей рост культуре происходит или отложение запасных углево¬
дов, или дополнительное включение веществ в клеточные оболоч¬
ки. Обратная утилизация ранее накопленных запасов углеводов при
исчерпании углеводов среды может быть следствием относительно
высокого уровня минеральных компонентов питательной смеси
(Холодова, 1981).
И наконец, о взаимосвязи транспорта углеводов с возможно¬
стями их использования. Понятно, что включению сахаров в ме¬
таболизм предшествует транспорт их через мембрану; в некото¬
рых случаях метаболические превращения начинаются уже во
время проникновения сахаров внутрь клетки. При этом транс¬
мембранный перенос сахаров может оказаться лимитирующим
звеном на пути их использования для ростовых процессов in vitro
(MycieHKo, 2005).
Данный вопрос к настоящему времени недостаточно изучен.
Имеются лишь косвенные данные, свидетельствующие против
такой возможности: значительный уровень сахаров в тканях (Хо¬
67
ОБЩАЯ ЧАСТЬ
лодова и др., 1978); отсутствие зависимости между скоростями
роста культуры и исчерпания сахаров из среды; превышение ско¬
рости мембранного транспорта по сравнению со скоростью ли¬
митирующих звеньев метаболизации сахаров (Fowler, 1978), од¬
нако они не дают окончательного ответа на этот вопрос.
Витамины — жизненно важные для нормального развития ве¬
щества. Это достаточно гетерогенная группа органических соеди¬
нений, наличие которых в питательной среде необходимо в ма¬
лых количествах, однако отсутствие одного или нескольких вита¬
минов может существенно сказаться на развитии растительного
организма. Добавлять витамины к питательным средам стали прак¬
тически сразу после открытия метода клонального размножения, но
установить дозу того или иного витамина и его необходимость
для определенных видов оказалось достаточно проблематично.
Отчасти это происходило потому, что для приготовления сред
использовались недостаточно очищенные компоненты (углеводы,
агар-агар), которые содержали в своем составе следовые количе¬
ства тех или иных соединений, в том числе и витаминов.
На протяжении истории развития метода размножения расте¬
ний в асептических условиях в качестве витаминов с перемен¬
ным успехом применялись многие соединения, однако из-за раз¬
розненности данных, различий в условиях постановки экспери¬
мента и разной трактовки их результатов достаточно сложно од¬
нозначно интерпретировать влияние того или иного витамина на
рост растительных культур. К примеру, в отношении орхидных
можно сказать, что, вероятно, уже на самых ранних этапах юве¬
нильного развития растений их метаболическая активность спо¬
собна удовлетворить потребность проростка в большинстве ве¬
ществ, которые мы относим к группе витаминов.
Основываясь на собственных наблюдениях, можем констати¬
ровать, что потребности в витаминах у представителей разных
родов (и даже видов) могут существенно отличаться. Однако на
сегодняшний день в физиологии и биотехнологии растений по¬
нимание роли этой группы веществ в метаболизме высших рас¬
тений значительно расширилось и на практике сформулировано
в виде основ прописей сред для культивирования растительных
тканей. Следует отметить, что еще во многом роль витаминов в
метаболических путях не изучена, особенно это относится к ви¬
дам, не имеющим важного значения для экономики.
Комплекс витаминов В содержит важные компоненты для
обмена веществ и роста растений. Большинство этих витаминов
68
Г J1А В А 2. Технология размножения растений в асептических условиях
входит в состав дрожжевого экстракта, который раньше обычно
использовался в культуре тканей. Теперь многие из компонентов
последнего идентифицированы и для более полного контроля над
процессами роста и развития их рекомендуется вносить отдельно. К
комплексу витаминов В относят целый рад соединений.
Тиамин (витамин В,; C,2H,7ClN4OS) рекомендован для боль¬
шинства прописей сред, потому что функционирует в форме пи¬
рофосфата как кофермент цикла трикарбоновых кислот (цикл
Кребса). В состав сред вводят в виде хлоргидрата тиамина в кон¬
центрациях 0,1—0,4 мг/л.
Известно, что тиамин в растении производят в основном ли¬
стья. Его молекула состоит из двух компонентов; первый из них
представляет собой остаток пиримидина, второй — половину мо¬
лекулы тиазола. Результаты проведенных экспериментов показы¬
вают, что некоторым культурам необходима молекула тиамина
полностью, тогда как другие могут вполне довольствоваться од¬
ной из ее половин. Кроме того, установлено, что синтез тиами¬
на — светозависимый процесс (Goodwin, 1963; Redei, 1965).
В результате исследований, направленных на выяснение роли
тиамина в метаболизме орхидных на стадии протокорма и юве¬
нильных растений, показано, что во многих случаях добавление в
среду тиамина или его составляющих усиливает рост испытуемых
растений и позитивно влияет на дифференциацию ювенильных
растений (Mariat, 1952).
Рибофлавин (витамин В2, витамин G; C17H20N4O6) активен в
углеводном обмене и важен для клеточного дыхания. Подобно
прочим водорастворимым витаминам рибофлавин может синте¬
зироваться в растениях, особенно на начальных этапах развития
семян (Goodwin, 1963). Добавление витамина В2 никак не сказы¬
вается на процессах прорастания семян орхидных, однако может
быть полезным на стадии дифференциации проростков (Mariat,
1952).
Никотиновая кислота (витамин В3, витамин Р, витамин РР;
C6H5N02) — универсальное соединение, которое широко встре¬
чается как у животных, так и у растений. Это вещество является
предшественником синтеза многих необходимых соединений в
метаболизме растений. Одна из важных функций никотиновой
кислоты проявляется в участии в синтезе НАДФ и НАФ. У мно¬
гих растений пути ее метаболизма сопряжены с триптофаном,
который в растительных организмах выступает в роли предше¬
ственника ИУК. Никотиновая кислота в системе обмена веществ
ОБЩАЯ ЧАСТЬ
часто входит в состав коферментов, активных в анаболических
реакциях. Витамин В3 добавляют ко многим средам обычно в
концентрациях от 0,1 до 10 мг/л.
Наличие экзогенной никотиновой кислоты в питательной
среде неоднозначно: в одних случаях проявляется явный позитив¬
ный эффект, в других можно наблюдать противоположный резуль¬
тат. Так, рост проростков Cattleya в возрасте до 190 сут ингибирует¬
ся триптофаном в концентрации 40—162,4 мкМ. В то же время по
истечении этого срока подавляющий эффект не был замечен. По¬
добные результаты зафиксированы и в экспериментах с пророст¬
ками Brassolaeliacattleya, Dendrobium (Kano, 1965).
В исследованиях J. Arditti (1982) примечателен тот факт, что
действие экзогенного триптофана элиминировалось у более взрос¬
лых растений. Основное значение в этом явлении он усматривает
в формировании листьев — основных, по его мнению, органов
растения, утилизирующих триптофан и включающих его в мета¬
болизм как предшественника ИУК и никотиновой кислоты.
Возможно, у сеянцев орхидных на ранних этапах развития отсут¬
ствуют механизмы преобразования этих веществ, поэтому из-за
чрезмерного накопления происходит ингибирование последних в
культуральном растворе. У этиолированных растений триптофан
быстро преобразуется в ИУК и значительно медленнее — в нико¬
тиновую кислоту (Gastrol, 1949).
Культивирование некоторых симбиотических штаммов Rhizo-
ctonia, изолированных из Cymbidium, показало их способность
синтезировать никотиновую кислоту и выделять ее в среду для
культивирования. Таким образом, предполагают, что потребность
проростков орхидных в никотиновой кислоте может быть удовле¬
творена за счет симбиотических грибов (Arditti, 1977).
Аденин (витамин В4, 6-аминопурин; C5H5N5) важен для клеток
растений как составляющая нуклеиновых кислот (ДНК и РНК).
В культуре тканей имеет слабый цитокининовый эффект. В кон¬
центрации 2—6 мг/л стимулирует образование вторичных прото¬
кормов у большинства тропикогенных орхидных. В состав сред
вводится в виде сульфата аденина (AdS04; (C5H5N)2 • H2S04 х
х 2Н20) и используется в основном как стимулятор адвентивного
побегообразования.
D-пантотеновая кислота (витамин В5; C9H16N05) — водорас¬
творимый витамин, который является частью молекулы коэнзи-
ма A (Goodwin, 1963). Ее включение в состав культуральных сред
не имеет смысла на ранних стадиях развития сеянцев орхидных в
ГЛАВА 2. Технология размножения растений в асептических условиях
связи с отсутствием эндогенных пантотеновой кислоты и СоА.
Вероятно, позже они могут синтезировать ее самостоятельно.
Активна как кофермент в жировом обмене. В среды для куль¬
туры растительной ткани добавляется в виде соли кальция
((C9H|6N05)2Ca). Термолабильна; необходима холодная стерили¬
зация.
Пиридоксин (витамин В6; C8H:1N03) также служит кофермен-
том некоторых реакций обмена веществ. В состав сред обычно
добавляется в форме хлоргидрата (C8HMN03 • НС1). Витамин В6 за¬
нимает видное место в метаболизме аминокислот, позитивно вли¬
яет на процессы прорастания семян и роста проростков орхид¬
ных, поэтому часто используется как компонент питательных
сред. Однако иногда наблюдается и обратный эффект. Вероятно,
ингибирование связано с супероптимальными (завышенными)
концентрациями экзогенного пиридоксина, который может ска¬
пливаться в растениях в тот момент, когда они находятся в фазе
активного роста, следовательно, активного метаболизма амино¬
кислот.
Цианокобаламин (витамин В12; С6зН88СоМ140,4Р) иногда добав¬
ляют к питательным средам для интенсификации ростовых и
формообразовательных процессов.
Фолиевая кислота (витамин Вс, витамин М; Cl9Hl9N706) обра¬
зуется в листьях и других растительных тканях. Действие подоб¬
но прочим витаминам группы В. Взаимодействуя с молекулами
ферментов, приобретает свойства кофермента. Данные о влиянии
фолиевой кислоты на процессы прорастания семян орхидных
противоречивы. Известно, что некоторым симбиотическим гри¬
бам необходимы для нормального развития фолиевая кислота
или ее производная — парааминобензойная кислота, которые они
могут получать от проростков орхидных на стадии протокормообра-
зования (Hijner, Arditti, 1973). Применение фолиевой кислоты в
культуре растительных тканей ограничено. Может быть исполь¬
зована для укоренения растений.
n-Аминобензойная кислота (парааминобензойная кислота
(ПАБК), витамин Вх; C7H7N02) иногда используется в средах как
антисептик. Это соединение также принимает участие в обмене
фолиевой кислоты.
Инозитол (лшо-инозитол; С6Н1206) как сахарный спирт ком¬
плекса витаминов В содержится во многих средах. В форме фос¬
фата может входить в состав различных мембран, особенно у таких
органелл, как хлоропласты. Инозитол непосредственно не стиму¬
71
ОБЩАЯ ЧАСТЬ
лирует ростовые процессы, но благоприятно влияет на развитие
растений-регенерантов в концентрации 100 мг/л. В дальнейшем
это соединение выявили в эндосперме незрелого кокоса (Steward,
1968). В растениях инозитол принимает участие в цикле синтеза
полиуронидов (polyuronides). Установлено, что он может поддер¬
живать in vitro рост отдельных клеток и каллуса Daucas corota. В на¬
шей повседневной практике инозитол используется в средах для
проращивания семян и доращивания сеянцев орхидных (Oncidium,
Paphiopedilum, Dendrvbium и др.).
L-Аскорбиновая кислота (витамин С; С6Н806) — наиболее из¬
вестное соединение из группы витаминов. Принимает участие в
окислительно-восстановительных процессах метаболизма. Неко¬
торые авторы отметили позитивное действие аскорбиновой ки¬
слоты на протокормообразование и дальнейшее развитие проро¬
стков орхидных.
Известно, что это соединение имеет некоторые качества дез¬
инфицирующего средства, однако в основном его используют
как мощный антиоксидант, чтобы предотвратить фенольное окис¬
ление растений, которые содержат фенольные смолы. Однако ви¬
тамин С нельзя использовать длительно, поскольку он может стать
окислителем непосредственно. Установлено, что у высших расте¬
ний аскорбиновая кислота синтезируется из некоторых углеводов
(глюкоза, галактоза). Насколько это верно для орхидей, неиз¬
вестно, однако в большинстве сред, которые мы использовали
для культивирования сеянцев и растений-регенерантов орхидей,
аскорбиновая кислота отсутствует, что не мешает их нормально¬
му росту и развитию. То же можно сказать и о галактозе (Arditti,
1977).
Использование аскорбиновой кислоты в питательных средах
затруднено в силу ее физико-химических свойств — это соеди¬
нение полностью разлагается при автоклавировании среды. По¬
этому аскорбиновую кислоту стерилизуют или через специаль¬
ные микрофильтры, или же к среде добавляют уже стерильное
вещество, которое можно приобрести в запаянных стеклянных
ампулах.
Биотин (витамин Н; С,оН16^035) — обычный компонент
сред. Важен в метаболизме жиров, белков и углеводов. Считают,
что он функционально связан с метаболизмом жирных кислот,
прежде всего — с карбоксилированием ферментов (ПВК-карбо-
ксилаза). Данные об использовании биотина в культуре тканей
орхидей достаточно противоречивы. Так, его наличие в составе
72
ГЛАВА 2. Технология размножения растений в асептических условиях
некоторых сред воспринимается индифферентно растениямй из
родов Cattleya, Epidendrum, тогда как у других он может стимули¬
ровать рост и синтез фотосинтетических пигментов (некоторые
виды Cattleya, Odontoglossum, Paphiopedilum, Cymbidium). Зависит
ли процесс протокормообразования от биотина, на сегодняшний
день не ясно, однако добавление к питательной среде гомогената
банана, по данным J. Arditti (1977), резко стимулирует рост сеян¬
цев Paphiopedilum. Он объясняет это наличием биотина в плодах
банана. В наших экспериментах с сеянцами Paphiopedilum, Odon¬
toglossum эти данные не нашли подтверждения, однако был отме¬
чен явный позитивный эффект наличия в среде гомогената банана
для видов рода Laelia Lindl. (L. sincorana, L. rubescens, L. purpurata,
L. mantiqueirae).
Витамин T — это комплекс ростостимулирующих веществ,
которые в литературе упоминаются под названиями tegotin, termi-
tin, torutilin, temina, фактор T и др. Первоначально был изолиро¬
ван из термитов. Структура его не установлена; предполагают,
что он может состоять из нескольких различных витаминов. В
настоящее время известны работы, сообщающие о позитивном
влиянии витамина Т на проростки Cattleya, Dendrobium (Arditti,
1977).
Холин (C5H15N02) — алкалоид со щелочными свойствами;
также может взаимодействовать с комплексом витаминов В. Это
происходит естественно в лецитине, который химически связан с
жирами и содержит фосфор и азот. Хлорид холина (C5HhNOC1)
иногда рекомендуют использовать в прописях сред.
(+)-а-Токоферол (витамин Е; С29Н5о02) иногда применяется в
культуре тканей растений. Его используют для поддержания во
взвешенном состоянии культур клеток. При отсутствии вита¬
мина Е клеточные агрегаты увеличиваются, что неприемлемо (Os¬
wald et al., 1977).
Регуляторы роста (гормоны) не являются питательными веще¬
ствами, однако они опосредованно влияют на процессы роста и
формообразования растений. Эти соединения синтезируются эн¬
догенно, их основная функция — обеспечивать общую и частную
координацию процессов развития растительного организма. Как
правило, in vitro растительные ткани не вырабатывают достаточ¬
ное количество гормонов и их приходится добавлять в культу¬
ральные среды.
Гормональная система растений менее специализирована по
сравнению с таковой животных, у которых гормоны образуются в
73
ОБЩАЯ ЧАСТЬ
специальных эндокринных железах и оказывают специфическое
влияние на некотором расстоянии от места их синтеза. У живот¬
ных шире спектр гормонов, совершеннее система их транспорта
и регулирования активности. Фитогормоны также синтезируются
в одних тканях растительного организма и транспортируются в
другие, вызывая функциональные изменения этих органов и тка¬
ней. Однако, в отличие от животных, гормоны растений могут
действовать и непосредственно в том месте, где они образуются
(Медведев, 2004).
Среди веществ, наиболее широко применяемых в качестве ре¬
гуляторов роста, известны гормоны, которые принадлежат к груп¬
пам ауксинов, цитокининов, гиббереллинов, а также этилен.
Как известно, цитокинины инициируют клеточное деление,
тогда как ауксины поддерживают рост клеток растяжением. Это
достаточно упрощенная схема, которая выполняется в той или
иной мере в зависимости от соотношения концентраций. Кроме
того, эффект действия гормонов может зависеть и от ряда других
абиотических факторов (температура, свет).
Процессы дифференциации и дедифференциации тканей,
формирования органов у растений связаны с синтезом, наличи¬
ем, распределением и соотношением эндогенных фитогормонов.
В процессах индукции ризогенеза главная роль отводится аукси¬
нам. Однако специфика гормонального ответа в растительных
тканях определяется преимущественно типом клеток, на которые
влияет фитогормон. Воздействуя одним и тем же фитогормоном
на разные ткани растения, можно получать различные реакции.
С одной стороны, каждый гормон полифункционален и способен
влиять на разные физиологические процессы, действие каждого
из них специфично. С другой стороны, в регуляции одного и то¬
го же процесса может принимать участие несколько фитогормо¬
нов. Они способны образовывать неактивные комплексы, храня¬
щиеся продолжительное время в тканях. Необходимо также учи¬
тывать, что оказываемые фитогормонами физиологические эф¬
фекты зависят от концентрации и условий внешней среды, в ко¬
торых находится растение (Медведев, 2004).
Согласно некоторым публикациям, тип морфогенеза опреде¬
ляется различием в балансе экзогенных гормонов цитокинино-
вого и ауксинового ряда (Skoog, Miller, 1957). Не имеет особого
значения, в какую по минеральному составу среду вводится регу¬
лятор роста. Однако на практике использование такого баланса
затруднено из-за неясности отдельных моментов механизма дей¬
74
ГЛАВА 2. Технология размножения растений в асептических условиях
ствия этого процесса. Достоверно установлено, что эффектив¬
ность действия ауксина при укоренении в значительной мере за¬
висит от доз цитокининов, используемых в питательных средах
на этапе микроразмножения растений-регенерантов.
Общеизвестно, что значение корней для жизни растения не
ограничивается только добычей воды и растворенных в ней пита¬
тельных веществ и механическим закреплением растения на суб¬
страте. Корень — это многофункциональный орган, деятельность
которого невозможно рассматривать вне контекста существова¬
ния растения в целом.
Многими авторами на примере изолированных участков кор¬
ней показана необходимость добавления солей, гормонов, вита¬
минов, аминокислот для их нормального роста. Особое значение
имеют образующиеся в корнях цитокинины, обусловливающие за¬
кладку почек и листовых примордиев и стабилизирующих содержа¬
ние хлорофилла, РНК и полисом в надземных частях растения.
От качественного и количественного содержания гормонов зави¬
сят фотосинтез, а также соотношение массы корня и побега. Ак¬
тивность гормонов корня влияет на переход к периоду покоя у
древесных пород. Засуха или засоленность почвы снижает пере¬
движение цитокининов из корней, уменьшает интенсивность
транспирации, фотосинтеза и обеспечение корней ассимилянта-
ми (Lyr et al., 1974).
Систему процессов роста и развития растений можно рас¬
сматривать как результат поляризации гормонов. В надземной
части локализуются ИУК, этилен, абсцизовая кислота (АБК), гу-
мат калия. Ауксин (ИУК) играет роль главного гормона домини¬
рующего центра побега, в качестве которого выступает его вер¬
хушка. Последняя служит другим доминирующим центром, обра¬
зующим цитокинин. Взаимодействие этих двух центров лежит в
основе координации функциональной активности и морфогенеза
растения в целом. Некоторыми авторами были рассмотрены во¬
просы влияния гормонов на транспортные процессы в растении.
Установлено, что такие ростовые вещества, как ауксины, цито¬
кинины, гиббереллины и АБК, имеют мембранный механизм
действия (Полевой, 1989; Мусатенко и др., 1997).
Получены интересные данные о медиаторной роли этилена в
апикальном доминировании, а также участии цитокининов и гиб-
береллинов в его гормональной регуляции. Автор делает вывод о
том, что в регуляции состояния покоя и прорастания пазушных
почек принимают участие все классы фитогормонов. Однако ос¬
75
ОБЩАЯ ЧАСТЬ
новным при этом является изучение причинных связей между
содержанием ауксинов в апексе и уровнем ингибиторов в пазуш¬
ных почках (Процко, 1982).
Хорошо известно, что регуляторы роста (гормоноподобные
эффекторы) оказывают влияние не только на рост и дифферен¬
циацию в культурах клеток и тканей, но и на вторичный метабо¬
лизм. Однако их действие помимо специфики эффектора зависит
как от природы вторичных соединений, так и от видовой при¬
надлежности растения, от штамма или клона данной культуры и
поэтому часто непредсказуемо (Запрометов, 1981).
Гормональная теория регуляции дифференциации и морфо¬
генеза in vitro оказывается несостоятельной по целому ряду при¬
чин. Во-первых, фитогормоны в этом процессе не обладают спе¬
цифичностью: одни и те же регуляторы (ауксин, цитокинин, в
меньшей степени гиббереллины и этилен) являются веществами,
которые регулируют и деление клеток при недифференцированном
росте каллуса, и деление, связанное с дифференциацией вплоть до
формирования органа. Поэтому, если мы предполагаем, что диф¬
ференциация обязательно включает изменения в экспрессии генов
на уровне транскрипции, тогда должны существовать и другие спе¬
цифические вещества, которые определяют компетентность клетки
к данной обработке экзогенными гормонами. Во-вторых, есть сис¬
темы, не реагирующие на гормональную обработку. Клетки таких
тканей не способны дедифференцироваться, пролиферировать в
условиях in vitro или, пролиферируя in vitro, не могут достичь та¬
кого состояния, которое позволило бы им проявить тотипотент-
ность. Наконец, известно, что у клеток in vitro способность к тоти-
потентности обусловлена целым рядом факторов. Иными словами,
эффект экзогенного фитогормона зависит от клеток. В первую
очередь морфогенетическая способность штамма или клона оп¬
ределяется генотипом (Дмитриева, 1981; Мельничук и др., 2003;
Кунах, 2005).
Фитогормоны, играющие важнейшую роль в индукции деле¬
ний в клетках экспланта, а также в образовании каллуса и мор¬
фогенезе, имеют, естественно, огромное значение и в процессе
клонального размножения растений.
На сегодняшний день нет (и, вероятно, быть не может) об¬
щих правил относительно концентраций и соотношений гормо¬
нов, которые можно было бы применять как постулат. Ясно толь¬
ко, что создание подходящего уровня экзогенных регуляторов рос¬
та — необходимое условие для получения каллуса, органов рас-
76
ГЛАВА 2. Технология размножения растений в асептических условиях
тений, эмбриоидов и регенерации растений (в том числе в куль¬
туре пыльцы или пыльников). Среда, разработанная для индук¬
ции дифференциации и органообразования тканей одного вида,
совсем не обязательно будет индуктивной в культуре тканей
другого. Вероятно, одна из главных причин такой вариабельно¬
сти в ответе тканей на внешние гормональные факторы лежит в
различной их способности синтезировать собственные эндоген¬
ные фитогормоны.
Ауксины — группа фитогормонов, которые поддерживают рост
клетки растяжением, инициируют образование корней и адвен¬
тивных почек и могут влиять на добавочное формирование заро¬
дышей.
Образующиеся в тканях ауксины играют большую роль в ре¬
гуляции передвижения пластических веществ в растительном
организме. Клетки, обогащенные ауксинами, обладают аттраги-
рующим свойством (Кефели, 1973). Кроме того, ауксины регули¬
руют полярность в тканях и органах растений, где они могут на¬
ходиться как в свободной форме, так и в виде различных ком¬
плексов. Ауксины могут образовывать соединения с белками и
нуклеиновыми кислотами и в такой форме храниться или транс¬
портироваться в растении. У двудольных растений апикальная ме¬
ристема — главное место синтеза ауксинов. Доказано, что они ак¬
тивно образовываются в зародышах семян. Транспорт ауксинов в
растении осуществляется в основном активно в базипетальном на¬
правлении, поэтому удаление апексов приводит к общему сниже¬
нию их концентрации и временному замедлению ростовых про¬
цессов (MycieHKO та iH., 2001; Мананков и др., 2002).
В последнее время вместо ИУК и зеатина часто используют
их синтетические аналоги. Это обусловлено целым рядом при¬
чин. Суть главной из них заключается в следующем: в питатель¬
ную среду добавляют оптимальное для развития каждой конкрет¬
ной культуры соотношение фитогормонов; однако пассируемые
ткани содержат какое-то количество эндогенных гормонов, вслед¬
ствие чего в начальный период культивирования создается избы¬
ток регуляторов роста. Позднее, по мере инактивации регулято¬
ров роста, концентрация их постепенно снижается и к концу
культивирования становится ниже оптимальной. В связи с этим в
любой культуре почти всегда отмечаются колебания концентра¬
ций регуляторов роста на протяжении периода культивирования,
что негативно сказывается на скорости роста. Чем интенсивнее
инактивируется гормон, тем выше амплитуда колебаний. Синте-
77
ОБЩАЯ ЧАСТЬ
тические аналоги гормонов в растительных организмах инакти¬
вируются намного медленнее, что, соответственно, значительно
сокращает амплитуду колебаний концентраций фитогормонов и
положительно сказывается на росте культур растительных тканей
in vitro.
Иногда рекомендуют использовать в качестве пролонгирован¬
ных источников ауксина конъюгаты ИУК, которые менее чув¬
ствительны к ИУК-оксидазам; постепенно распадаясь, они дли¬
тельно обеспечивают клетки ИУК (Hangarther et al., 1980).
Во второй половине прошлого столетия начались интенсив¬
ные работы по поиску и синтезу аналогов ауксинов. Наиболее
перспективными оказались производные нафталиновой кислоты
и фенола: а-нафтилуксусная, фенилуксусная, феноксиуксусная и
другие кислоты. Эти группы веществ и их производные также
обладают высокой физиологической активностью и сегодня ши¬
роко применяются в практике растениеводства (Мананков и др.,
2002).
Транспорт синтетических ауксинов может происходить бази-
и акропетально, в зависимости от способа введения, но наиболее
интенсивно они движутся в акропетальном направлении. Это пе¬
редвижение ауксинов носит пассивный характер и осуществляет¬
ся в процессе транспирации с током водных растворов. Синтети¬
ческие регуляторы, поглощаемые корнями или нижней частью
растения, поднимаются в надземные органы по ксилеме, затем они
перемещаются в латеральном направлении по паренхиме стебля.
Ауксины обычно используются в средах либо в комбинациях
с цитокининами (на стадии мультипликации), либо без них (если
необходимо укоренить растения). Раньше в качестве ауксина
применяли в основном ИУК, позднее предпочтение стали отда¬
вать НУК и 2,4-Д в концентрации 10-6—10“5 М.
Р-Индолилуксусная кислота (ИУК, индолил-3-уксусная кисло¬
та; C10H9NO2) часто применяется для укоренения микрочеренков
in vitro (в дальнейшем может угнетать корнеобразование). На све¬
ту нестабильна, поэтому ее надо хранить в темном месте. Исполь¬
зуется в качестве эффектора при работе с культурами клеток и
тканей значительно реже, чем синтетические ауксины. Объясня¬
ется это, возможно, тем, что такие культуры обычно сохраняют
способность к образованию достаточных количеств эндогенной
ИУК (Запрометов, 1981). ИУК в сочетании с гиббереллинами
индуцирует митозы в тканях растений. Содержится во всех частях
растения, особенно молодых. Наиболее интенсивно синтез ИУК
78
ГЛАВА 2. Технология размножения растений в асептических условиях
происходит в апикальных меристемах и молодых листьях. На
ювенильных этапах развития основным источником ИУК являет¬
ся эндосперм и семядоли, которые обеспечивают гормонами над¬
земную и подземную части растения. ИУК — главный гормон
растений и во многом именно она обусловливает апикальное до¬
минирование и аттрагирующий эффект. Основной предшествен¬
ник в растительных тканях — триптофан. В настоящее время вы¬
явлено около 50 ауксинрегулируемых генов, экспрессия которых
активируется (или подавляется) концентрацией ИУК.
$-Индолилмасляная кислота (ИМК, индолил-3-масляная ки¬
слота; C|2H13N02) — еще один гормон укоренения, обычно ис¬
пользуемый культиваторами. Может синтезироваться в растениях
природным путем, однако существует и искусственный аналог. В
составе сред структурно более устойчива, чем ИУК, поэтому
предпочтительна для индукции корнеобразования in vitro (в даль¬
нейшем может угнетать их формирование).
а-Нафтилуксусная кислота (НУК, 1-нафтилуксусная кислота;
С|2Н10О2) — очередной промотор корнеобразования, который
часто используют для поддержания стабильного роста каллуса (в
дальнейшем может угнетать корнеобразование).
2,4-Дихлорфеноксиуксусная кислота (2,4-Д; С8Н6С1203) — так¬
же синтетический ауксин, который получил наибольшее распро¬
странение на практике. Обычно способствует делению клеток,
тем самым поддерживая хороший рост культуры. Это соединение
широко используется при размножении in vitro для инициации
роста каллуса. Однако в некоторых случаях было отмечено инги¬
бирующее действие 2,4-Д на образование тех или иных вторич¬
ных соединений в каллусах. Известно, что 2,4-Д разобщает про¬
цессы окислительного фосфорилирования и тем самым нарушает
обеспечение митоза энергией. Следовательно, эти вещества пре¬
пятствуют началу митоза, но не удвоению хромосом, т. е. митоз
не наступает, но объем ядер увеличивается. Следует отметить,
что во многих случаях важное значение имеет используемая кон¬
центрация 2,4-Д.
' Дикамба (3,6-дихлор-2-метоксибензойная кислота; С*Н6С1203) —
синтетический регулятор роста типа ауксина, который использу¬
ется как гербицид. В асептической культуре в основном приме¬
няют для инициации каллусообразования.
Цшпокинины — вещества, которые стимулируют рост тканей
посредством деления клеток, мультипликацию побегов и проли¬
ферацию пазушных почек. Они помогают задерживать процессы
ОБЩАЯ ЧАСТЬ
старения растительных тканей и могут влиять на транспорт аук¬
синов.
Стимулирующее действие цитокинины оказывают на форми¬
рование митохондрий, эндоплазматического ретикулума, аппара¬
та Гольджи и рибосом. Они могут влиять на активность синтеза
белка в чувствительных к ним растительных объектах, изменяя
функциональную активность рибосом. Известно, что цитокини¬
ны способствуют увеличению размера листовой пластинки у
этиолированных растений, стимулируют рост адвентивных почек
и тем самым ослабляют эффект апикального доминирования
(Мусиенко, 2005).
Добавление цитокининов к питательным средам способствует
формированию более коротких побегов с крепкими стеблями,
что может быть полезным в период перед высадкой в субстрат.
Обычно вносятся в среды для укоренения.
Особенно четко проявляется потребность в цитокининах для
образования каллуса при использовании ИУК. Когда же в среду
вводят 2,4-Д, она резко уменьшается либо совсем исчезает (Wi-
tham, 1968). Однако в ряде случаев через несколько пассажей по¬
требность в них может полностью исчезнуть. Вероятно, это свя¬
зано с увеличением способности к синтезу растениями собствен¬
ных цитокининов (Мананков и др., 2002).
Зеатин (C|oH13N50) часто используют как альтернативу цито-
кининам типа 2-изопентиладенина (2-iP), бензиладенина (БА)
или кинетина. Молекулярные структуры зеатина и кинетина
сходны. Это производные аденина или аминопурина. Зеатин мо¬
жет существовать в растениях в цис- или /пранс-конфигурации;
они обе физиологически активны, хотя в растениях преобладает
последняя. Зеатин — доминирующий вид цитокининов в расти¬
тельных тканях; равно как и другие цитокинины, может содер¬
жаться в растениях в форме рибозидов, риботидов или гликози-
дов, являющихся транспортной или запасной формой гормона.
Нуклеотиды, обладающие цитокининовой активностью, входят в
состав тРНК (Медведев, 2004).
6-Бензиламинопурин или бензиладенин; 6-бензиламинопурин
(БАП; C,2HmN5) используется чаще других цитокининов как
промотор пробуждения пазушных почек. В культуру ткани вво¬
дится синтетическое соединение, хотя в норме это вещество со¬
держится в растении, но его тяжело идентифицировать. Одна из
форм 6-бензиламинопурина — рибозид (C^H^NsOJ — часто
применяется как альтернатива БА. Во многих случаях наличие
80
ГЛАВА 2. Технология размножения растений в асептических условиях
БАП необходимо для процессов клонального размножения, од¬
нако известно, что это препятствует нормальному корнеобразо-
ванию. Поэтому в работе часто практикуется промежуточное куль¬
тивирование на средах со сниженной концентрацией БАП, после
чего регенеранты переводят на среды для укоренения.
БПА, или ПБА (Ы-бензил-9-(2-тетрагодропиранил)аденин;
C|7H,9N50) — синтетический регулятор роста цитокининового
типа, который иногда используют для увеличения объема кал-
лусной массы или инициации пазушных почек.
2-iP (Ы6-(2-изопентил)аденин; C10H13N5) — обычный компо¬
нент прописей многих сред для культуры тканей высших расте¬
ний. Инициирует активное деление клеток и их последующий
нерегулируемый рост. Производится искусственно, однако пер¬
воначально был обнаружен в рибонуклеиновой кислоте и у неко¬
торых штаммов Corynebacterium fasscians.
Кинетин (6-фурфуриламинопурин; C10H9N5O) — регулятор
роста, который был выделен из ДНК. Часто используется в сре¬
дах как промотор деления клеток (увеличивает частоту митозов в
меристемах). В низких концентрациях это вещество сокращает
продолжительность интерфазы (Робертис и др., 1973).
Гиббереллины — группа природных соединений. Они регули¬
руют рост клеток растяжением и ответственны за рост (удлине¬
ние) стеблей растений. На сегодняшний день идентифицировано
более 110 гиббереллинов. Некоторые из них содержатся в заро¬
дышах растений и инициируют превращение крахмала в более
простые углеводы, стимулируют ряд ферментов. Иногда один из
гиббереллинов — гибберелловую кислоту (ГК3) — используют в
комплексе с ауксинами и цитокининами как регулятор роста в
культуральных средах.
ГК3 подавляет образование антоцианов и лигнина, но не ока¬
зывает влияния на образование проантоцианидинов. Удлинение
стеблей под действием гиббереллинов достигается вследствие
резкой активации процессов деления и растяжения клеток ин-
теркалярных меристем. Ауксины на этот процесс не влияют; в
свою очередь, гиббереллины не действуют или оказывают слабое
действие на рост изолированных междоузлий, сильно реагирую¬
щих на обработку ауксином. Предполагается, что гиббереллины
осуществляют специфическую регуляцию клеточного цикла на
этапе перехода от фазы G2 к митозу. Еще одним важным элемен¬
том проведения гиббереллинового сигнала являются ионы каль¬
ция: через 1—4 ч после обработки ГК3 их концентрация в цито¬
81
ОБЩАЯ ЧАСТЬ
плазме резко возрастает. Полагают, что ионы кальция и связы¬
вающий кальций белок кальмодулин участвуют в гиббереллин-
индуцируемой секреции а-амилазы и других гидролаз (Медведев,
2004).
Другие регуляторы роста изучены менее подробно.
Абсцизовая кислота (АБК) синтезируется во всех органах рас¬
тения, хотя долгое время было распространено мнение, что она
образуется преимущественно в хлоропластах. В клетках мезофил¬
ла биосинтез АБК осуществляется главным образом в цитозоле,
но накапливается фитогормон в основном в хлоропластах. Кон¬
центрация активной формы АБК, так же, как и других гормонов,
определяется процессами ее синтеза, метаболизма компартмен-
тации и транспорта. Угнетает рост и образование растворимых
фенольных соединений и лигнина в клетках.
Выяснено, что АБК ответственна за подавление роста корней
на свету и их геотропическую реакцию. Фитогормон обнаружен в
корневом чехлике, который проявляет повышенную чувствитель¬
ность и к свету, и к действию гравитации (Мусатенко та ш.,
2003). АБК передвигается из корневого чехлика в базипетальном
направлении, накапливается в активно растущей части корня и
наряду с ИУК принимает участие в регуляции протекающих
здесь процессов.
Образование in vitro соматических эмбриоидов часто происхо¬
дит с различными морфологическими нарушениями. В этом слу¬
чае добавление в среду АБК нормализует эмбриогенез (Kamada et
al., 1981). Основные пути инактивации АБК в растениях — окис¬
ление и конъюгирование с углеводами. В растительном организ¬
ме АБК выступает как антагонист ИУК, цитокининов и гиббе-
реллинов. Торможение роста, вызываемое АБК, сопровождается
подавлением синтетических процессов и ускорением старения
тканей (Медведев, 2004).
Ancymidol (C15H|6N202) — коммерческий препарат, ретардант с
цитокининовым эффектом, известный под названием A-Rest.
Иногда его используют, чтобы сократить количество нежелатель¬
ных боковых побегов или инициировать рост почек у некоторых
культур.
Пара-хлорфеноксиуксусная кислота (С8Н7С103) — ауксинопо¬
добный регулятор роста.
Этилен (С2Н4) — природное соединение, ненасыщенный уг¬
леводород, вырабатываемый растениями. Его предшественником
является метионин. В последние годы интерес к этилену значи¬
82
ГЛАВА 2. Технология размножения растений в асептических условиях
тельно возрос. Долгое время это соединение не относили к гор¬
монам, считая, что вызываемые им эффекты опосредованы аук¬
синами. Этилен влияет на многие жизненно важные процессы в
растительном организме (листопад, цветение, плодоношение). И
хотя он не является компонентом сред, при культивировании в
асептических условиях надо учитывать, что растения in vitro
также активно его продуцируют; это может иметь нежелатель¬
ные последствия в виде относительной замкнутости сосудов
для культивирования. Известно, что витрифицированные куль¬
туры выделяют значительно больше этилена (Kevers, Gaspar,
1985).
Поскольку синтез этилена индуцируется в стрессовых услови¬
ях (in situ — критические температуры, патогены, засуха, анок-
сия; in vitro — длительные пассажи), его иногда называют стрес¬
совым гормоном. Этилен способен угнетать процесс полярного
транспорта ауксина и таким образом влиять на динамику содер¬
жания ауксинов в тканях.
Paclobutrazol (/)£-1,2,4-триазол-3-аланин) — ретардант с цито-
кининовым эффектом; добавляется в культуральные среды на
последней стадии выращивания для оптимизации адаптации
пробирочных растений (Oliphant, 1990; Smith et al., 1992).
Phloroglucinol (1,3,5-триоксибензол), согласно данным некото¬
рых авторов, обладает бактерицидными свойствами; может ино¬
гда поддерживать рост отдельных культур (Donnelly, Vidaver, 1988).
Кроме того, может использоваться как антиоксидант (Smith,
1992) и при обработке витрифицированных растений (Phan et al.,
1986).
TIBA (2,3,5-трийодобензойная кислота) может замедлять об¬
разование нежелательного каллуса и поддерживать рост некоторых
культур; блокирует транспорт ауксинов в растительных тканях.
Фузикокцин — метаболит фитопатогенного гриба Fusicoccum
amygdali Del., известен как регулятор роста растений. Это глико-
зид карботрициклического дитерпена с элементарной формулой
Сз6Н56012. Кроме основного соединения (фузикокцин А) гриб
продуцирует ряд близких веществ, которые различаются степе¬
нью ацетилирования, положением ацетильных групп или мень¬
шей степенью окисления агликоновой части молекулы (Манан-
ков и др., 2002).
Пристальное внимание исследователей направлено на спо¬
собность фузикокцина активировать проницаемость плазматиче¬
ских мембран клетки и еще целый ряд изменений, в результате
83
ОБЩАЯ ЧАСТЬ
которых индуцируется прорастание семян. При этом его дейст¬
вие на покоящиеся семена даже превосходит эффект гибберел-
лина (Galli, Levi, 1981). Фузикокцин значительно стимулирует
прорастание светочувствительных семян в темноте и рост заро¬
дышей, действуя на них более эффективно, чем гиббереллины и
БА. Показана его способность полностью нейтрализовать инги¬
бирующее действие на прорастание семян красного цвета види¬
мого излучения, неблагоприятных температур и осмотического
давления, а также АБК (Galli et al., 1975; Lado et al., 1975).
В последнее время появились сообщения об использовании
ретардантов в культуре меристем в тех случаях, когда необходимо
длительно хранить определенный генотип. Их добавление замед¬
ляет рост меристем, что позволяет увеличить интервалы между
пересадками, следовательно, уменьшить затраты (Трускинов и
др., 1982).
Аминокислоты — мономеры белка; некоторые из них, объеди¬
няясь с нуклеиновыми кислотами, образуют нуклеопротеиды. На
сегодняшний день известно 20 основных незаменимых амино¬
кислот, многие из которых могут быть синтезированы искусст¬
венно. Все они представляют собой L-изомеры. Некоторые ами¬
нокислоты являются обычными компонентами культуральных
сред, к другим исследователи обращаются лишь изредка. Извест¬
но, что аденин повышает частоту спонтанных мутаций (Робертис
и др., 1973).
Согласно исследованиям J. Arditti (1979), практически все
аминокислоты, которые входят в состав питательных сред, как и
мочевина, могут быть дополнительным источником азота для
развивающихся зародышей орхидных.
L-Аланин (C3H7N02) может способствовать увеличению коли¬
чества эмбриоидов для некоторых культур.
L-Аргинин (C6HhN402), по некоторым данным, может стиму¬
лировать рост отдельных культур.
L-Аспарагин (C4H8N203) в комплексе с пролином и некоторы¬
ми другими аминокислотами может стимулировать эмбриогенез
бобовых. Иногда используется в клеточной культуре.
Глицин (C2H3N02) редко применяется в культуральных средах
(в частности, при культивировании Begonia и в клеточной куль¬
туре Poinsettia). В своей практике мы широко использовали его в
средах для культивирования орхидных.
L-Глутамин (C5H10N2O3) стимулирует соматический эмбрио¬
генез.
84
ГЛАВА 2. Технология размножения растений в асептических условиях
L-Лизин (C6H14N202) в комплексе с пролином может повы¬
шать качество и увеличивать количество эмбриоидов.
L-Пролин (C5H9N02) часто используется в комбинации с
другими аминокислотами для культуры эмбриоидов.
L-Серин (C3H7N03) может применяться при культивировании
микроспор для получения гаплоидных растений.
L-Тирозин (C9HuN03) — эффективный промотор побегообра¬
зования. Может выступать как дополнительный источник азота.
L-Цистеин (C3H7N02S) — серосодержащая аминокислота, кото¬
рую иногда вводят в состав сред как хлоргидрат (C3H7N02S • НС1).
Антибиотики — природные (выработанные растениями или
микроорганизмами) либо синтетические соединения, которые
угнетают рост других микроорганизмов или вовсе убивают их.
Обычно антибиотики не используют для освобождения от ин¬
фекций, проявившихся после очередного пассажа или после не¬
удачной стерилизации, поскольку с их помощью, как правило,
нельзя полностью избавиться от нежелательного микроорганиз¬
ма. Однако они могут быть эффективны как дополнительный
стерилизующий компонент при введении в культуру. Исходя из
собственного опыта, мы можем констатировать, что антибиотики
даже несколько угнетают рост отдельных культур (Ivannikov,
Lavrentyeva, 2003). Есть данные, что антибиотики могут влиять на
генотип, вызывая мутации в хромосомах (Smith et al., 1992).
Ампициллин успешно используется в культуре протопластов
Petunia в концентрациях 100—400 мг/л (Dixon, 1985).
Карбенициллин совместно с эугментином в концентрациях 500
и 250 мг/л применялись в некоторых генетических эксперимен¬
тах для эффективной работы (управления) с отдельными штам¬
мами Agrobacterium (Smith et al., 1992).
Цефотаксим используется при выделении некоторых эндо¬
фитных бактерий из высших древесных растений. Комбинация
25 мг/л цефотаксима с 6 мг/л тетрациклина и 6 мг/л рифампици-
на термически нестабильна (Kyte, Kleyn, 2003).
Сульфат гентамицина — антибактериальный препарат, кото¬
рый выдерживает автоклавирование. Компания “Sigma” реко¬
мендует применять гентамицин в концентрации 50 мг/л. Есть
сообщения об использовании его в растворах ферментов совме¬
стно с ампицилином (400 мг/л) и тетрациклином (10 мг/л) для
культуры протопластов Petunia (Dixon, 1985).
Methylolurea (оксиметилмочевина) может быть полезна при
борьбе с некоторыми штаммами дрожжевых клеток. Коммерче¬
85
ОБЩАЯ ЧАСТЬ
ский препарат называется UF-85. Соединение производится из
продуктов мочевиноформальдегидных реакций. Его можно авто-
клавировать.
Полимикст В — антибиотик, иногда используемый в клеточ¬
ной культуре.
Стрептомицин применяется в концентрациях 20—100 мг/л,
эффективен даже после автоклавирования.
Виразол — антивирусный препарат широкого спектра дейст¬
вия. Особенно эффективен против некоторых вирусов картофеля.
Антибиотики бацитрацин, микостатин, нистатин, пеницил¬
лин, фосфомицин и террамицин оказались неэффективными (Kyte
et al., 2003).
В опытах изучали влияние антибиотиков на рост культур сли¬
вы и малины. Продуктивность размножения и качество растений
были сильно снижены, побеги имели признаки стекловидности и
хлороза. Поэтому использование в средах антибиотиков нужно
ограничивать (Waldenmaier et al., 1986).
Химически неопределенные компоненты сред. Агар — смесь вы¬
сокомолекулярных полисахаридов из экстрактов нескольких раз¬
новидностей красных водорослей. Состоит, по крайней мере, из
двух полисахаридов — агарозы и агаропектина. Считают, что в
агарозе содержится галактоза. Совсем мало известно о строении
агаропектина. Предполагают, что он также состоит из цепочек
галактозы. Некоторые галактозные остатки имеют сложноэфир¬
ные связи с остатками H2S04. Используется как загуститель для
жидких питательных сред, придающий им желеобразное состоя¬
ние. В таком виде питательная среда может выдерживать на сво¬
ей поверхности растения и не препятствует свободному передви¬
жению питательных веществ к поглощающим зонам.
Известно, что агар не усваивается растениями, однако если
мы имеем дело не с синтетическим агаром, надо иметь в виду,
что в нем все равно есть следовые количества примесей, которые
могут влиять на результат. Концентрация примесей в агаре изме¬
няется в зависимости от источника морских водорослей и метода
его производства. В агаре могут содержаться хлориды, сульфаты,
ионы кальция, магния и железа (Rechcigl, 1978).
В продаже имеются очищенные агары, которые вполне при¬
менимы для культуры ткани растений. Приступая к работе с но¬
вым типом агара, надо сначала установить то его количество, ко¬
торое необходимо для приготовления геля нужной концентрации.
Как правило, эти данные предоставляет производитель. Обычно
86
ГЛАВА 2. Технология размножения растений в асептических условиях
это значение составляет 6—10 г/л среды, однако в нашей практи¬
ке встречались агары с оптимальной концентрацией 12—16 г/л.
Кроме того, надо иметь в виду, что при закислении среды агаро¬
вый гель несколько разжижается. Это происходит после автокла-
вирования и при культивировании отдельных видов, которые вы¬
деляют в культуральную среду специфические соединения.
На консистенцию геля влияет концентрация питательной среды
и ее кислотность: чем ниже значение pH, тем мягче гель. По¬
верхность геля должна быть достаточно устойчивой, даже если
мы переворачиваем культуральный сосуд вверх дном. В то же
время гель должен сохранять мягкость для того, чтобы на его по¬
верхности можно было свободно размещать растения-регенеран-
ты (или их части) и он не затруднял доступ питательных веществ
к ним. На поверхности среды не должно быть конденсата; если
он появляется, его нужно слить непосредственно перед исполь¬
зованием культурального сосуда. Надо иметь в виду, что чрез¬
мерно твердая питательная среда затрудняет доступ питательных
веществ к растениям, а чрезмерно мягкая может вызвать витри-
фикацию.
Опыты по культивированию тканей хвои сосны Picea на пла¬
стинах из пенополиуретана показали, что он создает более благо¬
приятные условия для фотосинтеза изолированных тканей, но
неэффективен при получении большого количества тканей. Пено¬
полиуретан химически нейтрален, автоклавируется и может исполь¬
зоваться неоднократно. Некоторые авторы применяют полиакрил¬
амидные гели, бусинки из пирекса и кварцевый песок. Однако
несмотря на некоторые преимущества они имеют все же больше
недостатков по сравнению с традиционными способами культи¬
вирования на агаре (Gas et al., 1971; Гутман и др. 1980).
Результаты исследований по определению оптимального ко¬
личества агара в среде показали, что увеличение его концентра¬
ции изменяет физическую и химическую характеристики среды.
Установлено также, что доступность кинетина в средах с 8—15
г/л агара снижается. Таким образом, количество вводимого в
среду агара определяется маркой и концентрацией среды
(Debergh, 1983).
Сегодня доступны несколько синтетических заменителей ага¬
ра, таких, как gelrite, gellan и phytagel. Среда, приготовленная с
этими заменителями, чрезвычайно прозрачна (не имеет приме¬
сей) и не оказывает никаких негативных воздействий на расти¬
тельные культуры (в редких случаях может наблюдаться витри-
87
ОБЩАЯ ЧАСТЬ
фикация). Agargel (смесь агара и phytagel) — одна из нескольких
наиболее популярных смесей на рынке. В зависимости от задач
добавляют от 3,5 до 5,0 г/л этого соединения. Себестоимость
сред с заменителями агара ниже, чем агаросодержащих (Kyte et
al., 2003).
Активированный уголь часто вносят в среды для укоренения на
последнем этапе микроразмножения. Благотворно влияет на про¬
ростки тропикогенных видов практически на всех этапах их
культивирования in vitro. Мы практикуем концентрации в пре¬
делах 0,5 мг/л, хотя при выращивании растений на средах с до¬
бавлением компонентов неопределенного химического состава
концентрации можно увеличивать до 1,0 г/л. Более высокие кон¬
центрации токсичны.
Предполагается, что активированный уголь связывает инги¬
биторы фитогормонов, в результате чего стимулируется эмбрио¬
генез (Fridborg et al., 1978). Наибольшее значение для индукции
этого процесса имеют температурные шоки.
Некоторые виды орхидей лучше развиваются на затемненной
питательной среде. Этот факт впервые отмечен при культивиро¬
вании некоторых сортов Cymbidium hybr. (Werksmeister, 1970а, b;
1971). В дальнейшем такие наблюдения были сделаны и при
культивировании различных видов Paphiopedilum и Phalaenopsis.
Для объяснения подобного явления выдвинуто несколько гипо¬
тез. Согласно одной, древесный уголь содержит группу зольных
элементов, которые благотворно влияют на рост и развитие се¬
янцев орхидных.
Другая гипотеза объясняет это своеобразным “эффектом за¬
темнения”, вследствие которого увеличивается количество кор¬
ней, улучшается процесс их дифференциации и корректируется
влияние геотропизма на растение в целом (Werksmeister, 1971).
Данная гипотеза достаточно правдоподобна, хотя противоречит
результатам, полученным в ходе другого исследования: рост и
развитие сеянцев на стекловолокне белого цвета в сравнении с
темной агаризированной средой были значительно лучше.
Также предполагают, что поглощение древесным углем инги¬
биторов роста (таких, как фенилуксусная, бензойная, пеларгоно-
вая, каприловая кислоты), которые выделяются растениями в пи¬
тательную среду в виде побочных продуктов жизнедеятельности,
может быть причиной лучшего развития сеянцев (Werksmeister,
1970b; David et al., 1978). Однако результаты предыдущего иссле¬
дования частично опровергают и это допущение.
88
ГЛАВА 2. Технология размножения растений в асептических условиях
Хороший рост и развитие сеянцев тропикогенных орхидных
на стекловолокне и твердой агаризированной среде с добавлени¬
ем активированного угля можно также объяснить и улучшенны¬
ми условиями аэрации в среде. По некоторым данным, наличие
в среде частиц угля значительно увеличивает количество воздуха в
толще питательной среды (Arditti, 1979). В природных условиях
прорастание семян и рост сеянцев тропикогенных орхидных проис¬
ходит в толще лесной подстилки либо на поверхности коры деревь¬
ев или горной породы. Аэрация в таких условиях оптимальная, по¬
этому и не удивительно, что растения развиваются лучше на сре¬
дах с добавлением активированного угля.
При культивировании пыльников Anemone на питательных
средах Нича с активированным углем интенсивность процесса
эмбриогенеза была прямо пропорциональна продолжительности
выращивания. Его добавление к среде уменьшало концентра¬
цию фенольных соединений более чем на 80 %. В то же время
в некоторых работах показано, что внесение этого компонента
(0,8 %) снижало ростовые показатели суспензионной культуры,
что, по мнению R. Beiderbeck и соавт. (1984), обусловлено ад¬
сорбцией фитогормонов активированным углем. В связи с этим
было выдвинуто предположение, что он может применяться как
сорбент, резервирующий фитогормоны у суспензионных культур
растений.
Резюмируя сказанное выше, мы склонны полагать, что пози¬
тивный эффект активированного угля можно объяснить ком¬
плексностью его влияния на развитие ювенильных растений in
vitro. Помимо того что данный компонент облегчает доступ воз¬
духа к частям растений, расположенным в толще среды, влияет
на увеличение количества корней, улучшая процесс их диффе¬
ренциации, он, вероятно, может еще частично усваиваться и свя¬
зывать продукты жизнедеятельности, выделяемые растениями,
которые приводят к аутоинтоксикации.
Гумат натрия активизирует ферментативные процессы в рас¬
тении, повышает проницаемость клеточных мембран; в условиях
недостатка кислорода стимулирует дыхание и способствует уси¬
лению ростовых процессов (Христева, 1957). Кроме того, он по¬
вышает митотическую активность меристематических клеток,
усиливает накопление ДНК в ядрах.
Гидролизат казеина представляет собой неопределенную смесь
аминокислот, которая в культуре in vitro выполняет функцию до¬
полнительного источника органического азота.
89
ОБЩАЯ ЧАСТЬ
Пептон (рыбная эмульсия) иногда добавляют в агаризирован-
ные среды для улучшения проращивания семян Cattleya Lindl.
(Черевченко, Кушнир, 1986).
Кокосовое молоко — жидкая часть эндосперма кокосового оре¬
ха (Cocos nucifera). Эта добавка широко использовалась еще на
заре формирования размножения растений in vitro как отдельного
направления биотехнологических исследований. Эндосперм ко¬
коса вносят в среды при культивировании тропикогенных видов
орхидных. Мы с успехом применяли этот компонент для микро¬
размножения Ananas comosus (L.) Мегг. и других видов Bromeliaceae
Juss., Orchidaceae Juss.
Лучший рост эксплантов Solanum tuberosum наблюдали при
добавлении 18 % кокосового молока и 6 мг/л 2,4-Д. Кокосовое
молоко исследовали как источник эндогенных цитокининов; ме¬
тодом хроматографии определили наличие в его составе зеатина,
который легко извлекался. В свежем и автоклавированном коко¬
совом молоке изучали состав свободных и связанных аминокис¬
лот, органических кислот, сахаров и нуклеиновых кислот; уста¬
новлено доминирование органических кислот. Аланин, у-амино-
бутуриковая кислота и глутамин составляли 75 % свободных
аминокислот сырого кокосового молока. Глутамин, аргинин, ас¬
парагин, аланин, аспарагиновая кислота могут составлять до
70 % в молодых зеленых кокосах. Концентрация сахара варьиро¬
вала от 0,9 г/100 мл в молодом кокосе до 2,2 г/100 мл — в зре¬
лом. Содержание РНК изменялось по мере созревания фруктов.
Состав кокосового молока был таким: 35—45 % — масло, 15 — раз¬
личные формы углеводов, 5 % — протеин (Zwar et al., 1970).
Как правило, концентрация кокосового молока в среде не
превышает 10—15 %. Для использования в культуральных средах
его можно приобрести в готовом виде у фирм-поставщиков реак¬
тивов или получить из кокосов, купленных в продуктовых су¬
пермаркетах. После извлечения жидкости из кокоса ее следует
отфильтровать через марлю и использовать для приготовления
питательных сред. Излишки хранят в холодильнике.
Экстракт эндосперма зерен кукурузы применяют редко. Пред¬
полагают, что позитивный эффект достигается вследствие нали¬
чия в нем зеатина.
Кукурузный крахмал недавно начали использовать как частич¬
ный заменитель агара вместе с искусственным заменителем агара
gelrite в пропорции 50,0 и 0,5 г соответственно на 1 л среды
(Stenley, 1995).
90
ГЛАВА 2. Технология размножения растений в асептических условиях
Картофельный экстракт мы с успехом применяем для куль¬
тивирования некоторых видов орхидных (Cymbidium, Laelia).
Иногда его добавляют к средам, инициирующим андрогенез пыль¬
ников высших растений.
Дрожжевой экстракт — естественный источник витаминов.
Препарат продается в виде порошка.
Березовый сок — это ксилемный сок Betulla pendulla. Содержит
некоторые регуляторы роста, витамины и углеводы в доступной
для растений форме. В нашей практике добавление этого ингре¬
диента в состав культуральных сред (10—12 %) для выращивания
представителей Bromeliaceae Juss. неизменно приносило положи¬
тельный результат. В умеренной климатической зоне, весной, в
период активного сокодвижения у В. pendulla этот компонент
можно заготавливать в необходимом количестве, а излишки хра¬
нить в холодильнике.
Морковный сок (свежеприготовленный) в концентрации 10—
15 % хорошо стимулирует развитие некоторых Laelia.
Гомогенат банана (Musa hybr.) может оказаться очень эффек¬
тивным при выращивании ряда тропикогенных орхидных (пред¬
ставители Cattleya, Laelia). Однако необходимо отметить, что этот
эффект достаточно избирателен. Так, на добавление данного ин¬
гредиента в культуральную среду отрицательно реагировали не¬
которые виды Paphiopedilum (P. insigne, P. delenatii и их гибриды),
Odontoglossum, Dendrobium, Laelia lobata.
Для его приготовления мы брали не полностью созревшие
плоды и измельчали их с помощью миксера или блендера непо¬
средственно перед использованием. Неизменно хороший резуль¬
тат получали при измельчении как очищенных, так и неочищен¬
ных плодов (что удешевляет себестоимость среды). Не отмечено
существенного ухудшения результатов в том случае, если мы ис¬
пользовали гомогенат банана, долгое время хранившийся в моро¬
зильной камере (до 6 мес).
2.4.6. Оптимизация питательных сред.
Математическое планирование эксперимента
В настоящее время многочисленные исследователи
и практики, основываясь на ранее разработанных методиках
культивирования, улучшают питательные среды с тем, чтобы при¬
способить их к требованиям отдельных видов растений. Добавле¬
ние к среде различных растительных соков — томатного, апель¬
91
ОБЩАЯ ЧАСТЬ
синового, яблочного, бананового, эндосперма кокосового ореха и
др. — увеличивает процент прорастания семян отдельных видов
орхидных и делает доступной культуру целого ряда растений тро¬
пикогенной флоры.
Известно, что оптимальная концентрация солей в питатель¬
ной среде — видоспецифический показатель. Например, семена
Vanilla planifolia лучше прорастают при 0,1%-й концентрации рас¬
твора Кнудсона. Повышение указанной концентрации вдвое зна¬
чительно затрудняло прорастание семян. Выяснено, что пророст¬
ки и сеянцы орхидей могут легко адаптироваться к различным
уровням концентрации солей в питательной среде — от очень
низких с осмотическим давлением 2,6 атм до высоких (10,4 атм).
Одна из основных задач клонального размножения — опти¬
мизация условий протекания всех этапов этого процесса. Наи¬
лучшим методом оптимизации, который обеспечивает учет боль¬
шого количества разнообразных факторов, действующих в системе,
в настоящее время является метод математического планирова¬
ния. Эго позволяет наряду с количественным учетом действия ка¬
ждого отдельного фактора установить наличие и оценить эффек¬
ты межфакторных взаимодействий (Максимов, Федоров, 1969;
Максимов, 1980).
Необходимым условием планирования служит правильный
выбор критерия оптимизации. На первом этапе клонального
размножения таким критерием может быть, например, быстрота
роста экспланта, каллуса, протокорма или побега, на втором —
количество образовавшихся инициалей на единицу экспланта, на
третьем — количество и длина корней, высота растеньица и т. д.
Результатом экспериментов, поставленных по этим планам,
является математическая модель процесса, которая позволяет
наилучшим образом и с наибольшей эффективностью осуществ¬
лять клонирование растений. В гл. 5 представлена математиче¬
ская модель эксперимента по оптимизации условий клонального
размножения Cymbidium hybr.
Глава 3
SB
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАЗМНОЖЕНИЯ
РАСТЕНИЙ В КУЛЬТУРЕ IN VITRO
История человечества с древнейших времен не¬
разрывно связана с растениеводством. Без опыта
культивирования растений или отдельных их ор¬
ганов (черенков, корней, листьев) немыслимо на¬
ше существование. Накоплен огромный опыт и раз¬
работан целый комплекс различных методов размно¬
жения сначала ценных в сельскохозяйственном,
позже — и в декоративном отношении культур, из
чего явствовало, что длительное сохранение изоли¬
рованных частей растений (за исключением семян)
невозможно, однако если из них регенерирует це¬
лое растение, то они могут сохраняться достаточ¬
но продолжительный промежуток времени, огра¬
ниченный лишь биологическими особенностями
вида.
В ходе научно-технического прогресса появи¬
лась возможность применять традиционные прие¬
мы вегетативного размножения в асептических ус¬
ловиях, в которых можно с большей эффективно¬
стью контролировать факторы, влияющие на успех
размножения. Растения, получаемые таким спосо¬
бом, генетически однородны, что также имеет свои
положительные стороны.
Сегодня в условиях защищенного грунта расте¬
ния размножают семенным способом, вегетативно
и в культуре in vitro. Последний состоит из двух
методик — семенного размножения, которую пред¬
ложил L. Knudson, и клонального размножения, ав¬
тором которой является G. Morel.
93
ОБЩАЯ ЧАСТЬ
3.1. ИСТОРИЯ РАЗВИТИЯ МЕТОДОВ
КУЛЬТИВИРОВАНИЯ РАСТЕНИЙ IN VITRO
Ввиду объективных причин и необходимой специ¬
альной материальной базы культура изолированных тканей (кле¬
ток) растений как самостоятельное направление исследований в
области физиологии, биохимии, морфологии и селекции расте¬
ний возникло не так давно. Начало временного отсчета работ, при¬
ведших к становлению этого метода, можно датировать 1839 г.,
когда Т. Schwann и М. Schleiden выдвинули основные положения
клеточной теории, или теории тотипотентности. Впоследствии
она была несколько дополнена и переработана и в современной
интерпретации звучит приблизительно так:
• клетка — элементарная единица любого живого организма;
• клетки растений и животных подобны по строению, хими¬
ческому составу и основным физиологическим функциям, что
свидетельствует об общности происхождения авто- и гетеротроф¬
ных организмов;
• клетка является не только структурной, но и функциональ¬
ной единицей организма (дополнено К. Бером);
• клетка происходит только из клетки (дополнено Р. Вирхо-
вым).
Таким образом, априори каждая соматическая клетка тотипо-
тентна, т. е. способна к регенерации, к воспроизведению целого
растения. Однако сегодня еще мало сведений о комплексе физи¬
ческих, трофических и гормональных факторов, необходимых
для полной реализации генетической информации клетки в усло¬
виях in vitro, поэтому вопрос о тотипотентности соматических
клеток интенсивно изучается и продолжает широко обсуждаться
(Калинин и др., 1980; Батыгина, Бутенко, 1981). Установлено,
что в условиях in vitro клетки изолированных тканей, лишенные
контроля со стороны органов растения, дедифференцируются,
растут неорганизованно, образуя массу каллуса. Наибольшей
способностью к дедифференциации обладают клетки меристема-
тических тканей завязи, семяпочки, апекса, эндосперма, пыль¬
ника, пыльцы, стебля, корня, листа, более слабой — клетки па¬
ренхимы, сердцевинных лучей, перицикла, незначительной — уз¬
коспециализированные клетки покровных тканей. Каллусную
ткань можно отделить от экспланта и культивировать. Под воз¬
действием различных факторов питательной среды или измене¬
ний условий в культуре каллусных клеток происходит меристема-
94
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
тизация, приводящая к возникновению эмбриоидов, формирова¬
нию морфологических структур: почек, корней, побегов, а затем
и целых растений. Во многих случаях пассируемый каллус про¬
должает расти неограниченное время как недифференцированная
масса клеток.
Формирование организованных структур в каллусной массе
начинается с группы недифференцированных клеток меристемо-
ида (Murashige, 1974, 1984) — структуры, состоящей из относи¬
тельно небольших сгруппированных изодиаметрических клеток с
тонкой оболочкой, плотной цитоплазмой и округлым ядром. Ме-
ристематические клетки тканевой культуры или верхушечных ме¬
ристем обладают способностью организованного развития.
Родоначальником экспериментов в этой сфере был немецкий
физиолог G. Haberlandt. Ему принадлежит заслуга разработки тео¬
ретических основ методов асептического выращивания изолиро¬
ванных органов и тканей растений в искусственных условиях. И
хотя проводимые им работы (1902), в силу объективных причин,
не дали положительных результатов, позднее, через несколько
лет, опираясь на его данные, группа исследователей — G. Ha¬
rrison, Y. Burrows, Y. Carrel — смогла некоторое время поддержи¬
вать жизнь в асептических условиях (образцы тканей человека и
животных). В 1922 г. появились первые публикации L. Knudson, в
которых он описывал разработанную им методику асимбиотиче-
ского проращивания семян орхидных.
В начале XX в. G. Robbins и S. Kotte независимо друг от друга
положили начало культивированию in vitro кончиков корней ор¬
хидных и почек различных растений. Вслед за ними в 1934 г.
М. White опубликовал результаты успешного изучения культиви¬
рования in vitro растительных тканей и целых органов. Ему пер¬
вому удалось сохранить жизнедеятельность и спровоцировать
рост корней томатов, используя в качестве основных компонен¬
тов питательной среды глюкозу и дрожжевую вытяжку.
Бурное развитие исследований в области культуры тканей
растений началось после того, как С. Went и F. Thimann в 1935—
1937 гг. обнаружили в растительных тканях ауксин — ИУК. В
1937—1939 гг. М. White и R. Gautherel, добавляя ИУК к пита¬
тельным средам, инициировали пролиферацию каллуса, а позже
и ризогенез. Открытие влияния ауксинов на рост и деление кле¬
ток сделало возможным исследование условий, необходимых для
роста и развития клеток тканей и органов растений in vitro. Та¬
95
ОБЩАЯ ЧАСТЬ
ким образом, появились практические предпосылки для искусст¬
венного размножения растений в асептической культуре.
Первые опыты по культивированию in vitro зародышей цвет¬
ковых растений провел К. Hanning в 1902 г. Его работы продол¬
жил A. Laibach: в 1929 г. он ввел в культуру зародыши льна. В
1941 г. R. Van Overbeek, используя эндосперм кокосового ореха в
качестве компонента питательной среды, получил положитель¬
ные результаты при культивировании зародышей дурмана.
Особенно важной датой в истории развития исследований
культур in vitro стал 1946 г., когда Е. Ball получил целые растения
из изолированных апексов побегов табака (Nicotiana tabacum) и
люпина (Lupinus L.). В 1948 г. F. Skoog и L. Tsui, эксперименти¬
руя с концентрациями ауксинов и цитокининов для питательных
сред, добились органогенеза из каллуса табака.
В начале второй половины прошлого столетия перед исследо¬
вателями открылись предпосылки практического применения куль¬
тур in vitro. F. Limasset и L. Comuet (1956), которые также работали
над размножением растений из конусов нарастания в асептиче¬
ской культуре, отметили, что используя этот метод, можно полу¬
чить оздоровленные растения. Апексы георгин, пораженные ви¬
русом мозаики, освободились от патогенов. Возможность выращи¬
вания таких растений благодаря стерильной культуре в 1952 г. под¬
твердили G. Morel и Т. Martin. Работая с разными частями сильно
зараженных разновидностей георгин, они в асептических услови¬
ях получили из верхушечных меристем этих растений потомство
без вирусов.
Изучая процессы регенерации тканей в условиях in vitro,
W. Tulecke в 1953 г. добилась пролиферации каллуса из пыльце¬
вых зерен Ginkgo biloba L.
В 1954 г. W. Muir и его группа впервые получили в культуре
in vitro целое растение из одной клетки.
В период 1954—1957 гг. результаты исследований С. Miller и
F. Skoog, S. Okamyra, I. Jablonski и других внесли новые данное в
понимание процессов размножения культур в условиях in vitro. В
1954 г. С. Miller и F. Skoog в лаборатории последнего открыли
кинетин и доказали его роль в процессах органогенеза; с тех пор
кинетин (6-фурфуриламинопурин) широко используется в рабо¬
тах по культуре тканей. В 1957 г., исследуя ткани каллуса табака,
они установили, что в зависимости от количества ИУК и кинетина,
используемых в питательной среде, можно избирательно добиться
возникновения побегов или образования корней. В 1960-х годах
96
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
F. Steward получил культуру прозародышей из культуры взве¬
шенных клеток каллуса, а 1. Reinert добился возникновения за¬
родышей из ткани каллуса моркови Daucus carrota. В 1959 г. вы¬
шел первый учебник по культуре in vitro растительных тканей,
составленный R. Gauther, а в 1960 г. G. Morel разработал мето¬
дику размножения орхидей из меристем в асептической культуре.
Новые пути использования растительных культур in vitro были
очерчены в период 1964—1966 гг., когда S. Guha и S. Maheshwari
впервые получили гаплоидное растение из пыльцевого зерна
дурмана Datura. В 1967 г. J. Bourgin и J. Nitsch добились образо¬
вания каллуса, способного к органогенезу в культуре in vitro, из
пыльцы табака. До 1979 г., по данным F. Preil и A. Hunke, с по¬
мощью культуры пыльников были получены гаплоиды от более
чем 20 родов растений.
Эксперименты по индукции цветения в культуре in vitro нача¬
ли в 1965 г., а в 1967 г. R. Pierik добился образования генератив¬
ных почек в каллусе лунника (Lunaria L.) после выдерживания
растений при низкой температуре.
Попытки выделения протопластов уже в 1892 г. проводил
J. Klercker, но впервые культуру изолированных протопластов
получили в 1969 г. Т. Eriksson и К. Jonassen. В 1970 г. Е. Cocking
добился восстановления клеточной стенки протопластов и инду¬
цировал последующие клеточные деления.
В 1970 г. было впервые достигнуто слияние 2 протопластов
одного вида, а в 1972 г. P. Carlson провел первое межвидовое скре¬
щивание растений в результате слияния 2 протопластов.
На территории бывшего СССР работы в области культивиро¬
вания растительных тканей проводились давно. Так, культура
изолированных корней широко использовалась Н.Г. Холодным в
работах, начатых еще в 1915 г. С помощью этой методики им
был установлен тот факт, что некоторые растительные гормоны
синтезируются в кончиках корней. Эти исследования в дальней¬
шем послужили основой для разработки гормональной теории
тропизмов. Систематические работы по культивированию расти¬
тельных тканей были продолжены в 1944 г. в Институте физио¬
логии растений им. К.А. Тимирязева АН СССР под руководством
акад. Н.А. Максимова и проф. А.А. Прокофьева. Эти исследования
были направлены на получение латекса корнями тау-сагыза in vitro
и выращивание изолированных зародышей на ранних этапах их
формирования. В последующие годы они продолжались под ру¬
ководством Ф.А. Калинина в Институте физиологии растений
97
ОБЩАЯ ЧАСТЬ
АН УССР (Киев) и были направлены на выращивание зароды¬
шей из нежизнеспособных семян, а также изучение условий и при¬
чин возникновения растительных опухолей.
В 1957 г. исследования методом культуры тканей возобновле¬
ны в Институте физиологии растений АН СССР по инициативе
акад. J1.A. Курсанова и под руководством Р. Г. Бутенко. В 1958—
1964 гг. Р.Г. Бутенко сконцентрировала свое внимание на изуче¬
нии физиологии изолированных верхушечных почек при перехо¬
де из вегетативного в генеративное состояние. Результаты этих
исследований освещены в изданной в 1964 г. монографии “Куль¬
тура изолированных тканей и физиология морфогенеза расте¬
ний”, которая была и остается настольной книгой многих поко¬
лений биотехнологов. В 1960-х годах в лаборатории культуры тка¬
ней и морфогенеза, возглавляемой Р.Г. Бутенко, начаты работы
по оздоровлению меристем растений и последующему их кло¬
нальному размножению. В данном аспекте были изучены условия
микроразмножения целого ряда ценных сельскохозяйственных и
промышленных культур. Интерес к микроразмножению привел к
интенсивному развитию этого метода применительно к плодово-
ягодным культурам, декоративным растениям, овощным культу¬
рам, кормовым травам и древесным лесным породам.
Необходимо особо подчеркнуть, что инициатором, вдохнови¬
телем и начинателем многих исследований была Р.Г. Бутенко.
Член-корреспондент Российской Академии наук, акад. Р.Г. Бу¬
тенко более 40 лет занималась изучением биологии клеток в
культуре in vitro. Она разработала научное направление, сыграв¬
шее важнейшую роль в развитии многих направлений современ¬
ной биотехнологии растений в Советском Союзе, на базе кото¬
рых были созданы промышленные производства физиологически
активных и лекарственных веществ, разрабатывались новые мето¬
ды в селекции и растениеводстве, проводились работы по сохра¬
нению редких и исчезающих видов растений в коллекциях и
криобанках. Многие ее работы и работы ее учеников посвящены
изучению процессов морфогенеза в культуре in vitro (Бутенко, 1964,
1975, 1999; Калинин и др., 1980; Черевченко, Кушнир, 1986).
Р.Г. Бутенко являлась инициатором, научным и идейным ру¬
ководителем при изучении следующих вопросов: клональное раз¬
множение и оздоровление посадочного материала; процессы вто¬
ричного метаболизма in vitro; работы с изолированными прото¬
пластами растений; генная инженерия и получение трансгенных
растений; создание с помощью биотехнологических методов рас¬
98
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
тений с новыми, полезными в хозяйственном отношении при¬
знаками.
Обширные контакты Р.Г. Бутенко с зарубежными исследова¬
тельскими центрами и известными учеными, активная работа в
Международной ассоциации по культуре клеток и тканей расте¬
ний способствовали тому, что биотехнология растений в СССР
развивалась на самом высоком уровне. Она сыграла огромную
роль в пропаганде и объединении биотехнологов России и стран
СНГ. Под ее руководством прошло восемь всесоюзных и между¬
народных конференций, где были представлены исследования
многих ученых, являющихся ее учениками. Каждая из конферен¬
ций демонстрировала успехи и новые направления в области ис¬
пользования фундаментальных и прикладных аспектов культуры
тканей и клеток растений.
Более 20 лет Р.Г. Бутенко работала в МГУ им. М.В. Ломоно¬
сова, где читала курс лекций по биологии культивируемых кле¬
ток и биотехнологии студентам, формируя у них современное
научное мировоззрение.
Начало работ по семенному размножению и гибридизации
тропикогенных орхидных в искусственных условиях положено в
1951 — 1957 гг. в лаборатории Главного ботанического сада (ГБС)
АН СССР. В.А. Поддубная-Арнольди и В.А. Селезнева получили
гибриды от межсортовых и межвидовых скрещиваний растений
из родов Cypripedium, Dendrobium, Cattleya и др. В то время эм¬
бриология представителей семейства орхидных была изучена не¬
достаточно, однако работы В.А. Поддубной-Арнольди (1976) по¬
казали, что к моменту опыления семяпочки представляют собой
недифференцированные бугорки. Пластиды в генеративных ор¬
ганах несколько редуцированы, но продолжают оставаться ос¬
новными фотосинтезирующими элементами и источниками син¬
теза ферментов и витаминов. Установлено, что по мере развития
семяпочек, макроспор и зародышевого мешка количество мито¬
хондрий и пластид в их клетках увеличивается.
Следует отметить, что исследования В.А. Поддубной-Арноль¬
ди эмбриологии орхидных являются актуальными и сегодня. По
ее мнению, у видов Cypripedium до оплодотворения и в момент
оплодотворения пластиды в клетках семяпочек, археспория, мак¬
роспор и зародышевого мешка синтезируют крахмал, а у Calanthe
veitchii обнаружены капельки жира. Особого внимания, на наш
взгляд, заслуживают гистологические исследования. Установлено,
что подвесочные гаустории у орхидных отличаются разнообрази¬
99
ОБЩАЯ ЧАСТЬ
ем и играют большую роль в питании развивающихся зароды¬
шей. По ним поступают питательные вещества из тканей ну-
целлуса к зародышевому мешку, компенсируя таким образом не¬
доразвитость зародыша. В них также сосредоточены пластиче¬
ские и физиологически активные вещества. В цитоплазме этих
клеток обнаружен жир, белки, аминокислоты, крахмал. Как уста¬
новила В.А. Поддубная-Арнольди, очень развитые гаустории име¬
ются у Dendmbium nobile Lindl., Cymbidium hybr. hort., Coelogyne
cristata Lindl., Phalaenopsis amabilis (L.) Blume, Stanhopea tigrina
Batem ex Lindl. Интересной особенностью обладают подвесочные
гаустории у видов Cattleya, которые часто выходят из семени на¬
ружу, используя питательные вещества среды, в которой культи¬
вируются.
Не менее интересные исследования проведены В.А. Поддуб-
ной-Арнольди по изучению процессов прорастания и дифферен¬
циации зародышей у семян орхидных. Установлено, что в анато¬
мической структуре зародышей нет проводящей системы, но есть
поверхностный слой, похожий на эпидермис. Кроме того, ею
было описано явление полиэмбрионии у орхидных: образование
дополнительных зародышей из синергид клеток, расположенных
под гаусторией, в результате почкования зародыша и при сраста¬
нии двух семяпочек в одну.
Изучая процессы созревания плодов, В.А. Поддубная-Арноль-
ди совместно с В.А. Селезневой установила, что плоды орхидных
созревают значительно дольше, чем семена. Ориентируясь на ее
исследования, многие ученые с успехом используют этот факт
при семенном размножении представителей данного семейства в
условиях асептической культуры, что значительно сокращает сроки
получения сеянцев.
Работая долгое время над изучением процессов прорастания
семян орхидных, В.А. Поддубная-Арнольди сделала вывод о том,
что представители рода Calanthe — одни из самых высокооргани¬
зованных групп своего семейства. Так, в семенных оболочках
Calanthe veitchii hort. можно обнаружить такие вещества, как жир,
белки, аминокислоты, клетчатку, каталазу, протеины, пектины и
аскорбиновую кислоту. Кроме того, установлено, что еще на ста¬
дии зиготы у зародышей этого вида в клетках содержатся хлоро-
пласты, количество которых все время увеличивается, в связи с
чем зародыши приобретают зеленую окраску. Наличие хлоро¬
филла способствует тому, что развиваясь, зародыш может накап¬
ливать питательные вещества автотрофным способом.
100
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Необходимо отметить, что исследования, которые провела
В.А. Поддубная-Арнольди, имели исключительное значение для
развития и становления метода семенного размножения орхид¬
ных в асептической культуре и изучения их эмбриологии. К со¬
жалению, в последующие годы эти работы были приостановлены
и только несколько позже нашли свое продолжение в исследова¬
ниях других ученых.
Как уже упоминалось, одним из важных событий в период с
1960 по 1970 г. стала разработка Е. Coking (1960) метода получения
изолированных протопластов из тканей корня и плодов томатов
(Lycopersicon Mill.). Были отработаны методики культивирования,
при которых они регенерировали новую клеточную стенку, вступа¬
ли в процессы деления и давали начало клеткам, способным к
морфогенезу (Takebe et al., 1971). Протопласты использовались
для соматической гибридизации и экспериментов по внедрению
в них вирусных РНК, различных клеточных органелл, клеток
прокариотов (Глеба, 1975; Бутенко, 1979).
Известно небольшое количество работ об изолированных про¬
топластах орхидных. Первые работы связаны с именами К. Тео и
К. Newman. Они провели исследования и разработали методики
выделения, изоляции и гибридизации протопластов Renantanda
’Rosalina Cheok‘ из листьев сеянцев и растений-регенерантов
(Тео, Newman, 1978а, b; Watts, King, 1984).
С использованием изолированных протопластов и генетиче¬
ских векторов на основе Ti-плазмид и баллистического введения
генов в клетки и ткани реципиентов стало возможным получение
трансгенных растений (Бутенко, 1999). Возможность манипуля¬
ции с геномом растения интересна с точки зрения исследования
клеточной биологии растительной клетки. Вместе с тем уже сей¬
час многие исследователи, фирмы-производители, селекционеры
хотели бы улучшить свойства растений с помощью переноса генов.
На сегодняшний день получены трансгенные растения куку¬
рузы, сои, пшеницы, картофеля, томатов и других сельскохозяй¬
ственных культур (Бутенко, 1999). В ряде случаев они имеют су¬
щественные преимущества перед традиционными сортами, одна¬
ко не стоит забывать и об исследованиях, посвященных изуче¬
нию последствий внесения чужеродных генов в растительный
организм.
В монографии J1.A. Луговой (2003) описан чрезвычайно инте¬
ресный метод практического использования соматических заро¬
дышей, открывающий в будущем широкие перспективы в расте¬
101
ОБЩАЯ ЧАСТЬ
ниеводстве. Виды, способные к соматическому эмбриогенезу in
vitro, могут переноситься в поле в стадии молодых эмбрионов,
если последние защищены методом флуид-дрилинга (так назы¬
ваемые “искусственные семена”). Метод флуид-дрилинга вклю¬
чает: индукцию соматического эмбриогенеза в оптимально кон¬
тролируемых условиях; покрытие эмбриоидов защитным слоем
геля (суспендирование семян в геле); высев защищенных гелем
“семян” флуид-дрилинг-сеялками. Этот метод способствует бы¬
строму и равномерному развитию всех растений, что в конечном
счете приводит к более ранней уборке урожая. Метод флуид-
дрилинга дал положительные результаты у многих сельскохозяй¬
ственных культур.
Гели, которые чаще всего при этом используются, подобны
агару; к ним можно добавлять регуляторы роста, питательные
компоненты, пестициды и т. д. Рекомендованы некоторые гели и
флуид-дрилинг-машины для высева проросших семян и сомати¬
ческих эмбриоидов.
Однако применение метода флуид-дрилинга возможно только
для тех видов растений, которые характеризуются высокой часто¬
той соматического эмбриогенеза в культуре in vitro. Кроме того,
вопросы синхронизации образования соматических зародышей, а
также поддержания их генетической стабильности трудноразре¬
шимы. Для получения суспензии эмбриоидов одинакового раз¬
мера на одной стадии развития можно использовать специальные
сита. После отделения эмбриоидов их необходимо сохранить в
состоянии покоя до момента высева. Это возможно при низких
температурах или в случае ингибирования митотических делений.
Несколько фирм США — “Agrigenetics incorporation”, “Plant
genetics incorporation”, “DNA plant technology incorporation” —
сделали достаточно крупные инвестиции в разработку и исполь¬
зование соматического эмбриогенеза в практике сельского хозяй¬
ства. Ожидается, что эта технология будет успешно отработана
для люцерны (Medicago L.), моркови (Daucus L.), сельдерея
(Apium L.), салата (Latuca L.), тмина (Carum L.) и т. д. Отобраны
генотипы Medicago sativa, М. uaria и М. falcata с высоким эм-
бриогенным потенциалом в культуре in vitro.
Последние 20—30 лет идет интенсивное накопление инфор¬
мации об особенностях культивирования различных видов миро¬
вой флоры в асептических условиях. Сегодня можно говорить о
2—3 тыс. видов и форм цветковых растений, для которых отрабо¬
тана данная технология культивирования. Виды, имеющие суше-
102
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
ственные особенности в своей экологии, ощутимо отличаются и
при культивировании in vitro. Данная работа представляет собой
попытку обобщить результаты многолетних исследований по куль¬
тивированию декоративных растений в искусственных условиях с
позиций современного понимания процессов, происходящих на
различных уровнях организации растительных организмов.
3.2. МИКРОРАЗМНОЖЕНИЕ
Микроразмножением растений принято считать
массовое бесполое размножение растений в культуре тканей и
клеток, при котором возникшие формы генетически идентичны
исходному экземпляру. Теоретической основой метода является
глубокое знание закономерностей развития растительной клетки
и разработка приемов управления механизмом морфогенеза. Веге¬
тативное размножение, давно используемое практиками, свиде¬
тельствует о том, что отдельные части растения автономны и при
изолировании, т. е. при нарушении корреляции между целым рас¬
тением и вырезанной частью способны воссоздать новое расте¬
ние. Следовательно, растениям в высшей степени свойственна
способность к регенерации, что проявляется как на клеточном и
тканевом, так и на организменном уровнях. На протяжении всей
жизни растение сохраняет участки меристематических тканей, ко¬
торые постоянно регенерируют и способны давать начало органи¬
зованным структурам — почкам, корням, эмбриоидам и растению.
Перенесение тканей и отдельных клеток в условия асептиче¬
ской культуры фактически представляет собой остановку их
функционирования в составе целостного растительного организ¬
ма как его отдельного структурного элемента. При этом ткани
выходят из многофакторной зависимости, в рамках которой они
находились в системе, и больше не “ощущают” направляющее
влияние материнского растительного организма. Условия и ха¬
рактер питания также претерпевают существенные изменения.
Все эти факторы по своей силе во многих случаях находятся на
грани нормы реакции генома клетки, и последняя впадает в со¬
стояние стресса, вследствие чего качественно и количественно
изменяется ее генная активность. Это влечет за собой кардиналь¬
ную перестройку процессов метаболизма. Так возникают адапти¬
рованные культуры растительных тканей того или иного вида in
vitro, которые и используются в дальнейшей работе.
103
ОБЩАЯ ЧАСТЬ
3.2.1. Преимущества метода
асептического размножения растений
Этот метод позволяет наиболее полно реализовать
потенциальные возможности высших растений к размножению.
К основным преимуществам данного вида размножения расте¬
ний перед традиционными относятся:
1. Количество посадочного материала. Главное преимущество
данного метода — значительно более высокий коэффициент раз¬
множения, который может на несколько порядков превышать
подобные показатели при традиционном вегетативном способе.
2. Экономичность. Простота химического состава, относитель¬
ная дешевизна и доступность компонентов питательной среды и
как следствие — низкая себестоимость растительного материала.
Круглогодичное получение растительного материала в лаборатор¬
ных условиях и планирование сроков постасептической адапта¬
ции растений-регенерантов. Выращивание сотен тысяч растений
без учета времени года на минимальных площадях, что сущест¬
венно снижает затраты на производство посадочного материала.
3. Временные параметры. Быстрое размножение интересных
форм растений и получение в промышленных масштабах генети¬
чески однородного потомства трудно размножаемых в обычных
условиях видов растений (луковичные, древесные и пр.).
4. Оздоровление посадочного материала. Получение оздоров¬
ленного растительного материала, свободного от вирусных, гриб¬
ковых и бактериальных инфекций, а также от нематод и прочих
паразитических гетеротрофов; элиминация вироидов при культи¬
вировании каллусной ткани.
5. Депонирование ценных генотипов. Создание “банков” цен¬
ных форм хозяйственных, декоративных, мутантных линий рас¬
тений (хлорофиллдефектные или биохимические мутанты), полу¬
ченных in vitro, или редких видов растений с помощью криоме¬
тодов, длительного хранения культур при пониженных положи¬
тельных температурах или добавления к компонентам питатель¬
ных сред осмотически активных веществ.
6. Реювенилизация посадочного материала. Размножение рас¬
тений в ювенильной фазе онтогенеза, что важно для последую¬
щей адаптации растений in vivo.
7. Безопасность. Купля-продажа (обмен) пробирочных расте¬
ний, в том числе и в международных масштабах, без риска ввоза
карантинных объектов.
104
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
8. Селекция. Расширение возможностей селекции, использо¬
вание индуцированного мутагенеза как способа получения расте¬
ний из единичных мутировавших клеток сомы, которые в обычных
условиях элиминируются вследствие отбора. Предпочтительность
в некоторых случаях методики клонального размножения по¬
средством прямого органогенеза по сравнению с традиционными
методами. Сохранение уникальных генотипов, полученных в ре¬
зультате межвидовых и межродовых скрещиваний, которые поги¬
бают при ведении традиционных методов селекции. Существен¬
ная интенсификация процессов искусственного получения и
размножения полиплоидных форм в условиях асептической куль¬
туры с помощью колхицина и прочих мутагенов. Значительное
ускорение селекционных процессов искусственного получения и
размножения полиплоидных форм с помощью методики микро¬
прививок в асептических условиях.
9. Объективность. Более детальное изучение отдельных абио¬
тических и биотических факторов окружающей среды при на¬
блюдении их действия в разных условиях на растения одного
клона.
10. Аллелопатия. Исследование аллелопатических взаимодей¬
ствий растений, оперативное тестирование отдельных культур на
совместимость и пр.
11. Искусственное семеноводство. Сегодня всерьез рассмат¬
ривается перспектива промышленного получения “искусствен¬
ных семян”. В условиях in vitro некоторые культуры могут проду¬
цировать миллионы соматических зародышей, которые после
специальных процедур можно использовать в сельском хозяйстве
в качестве посевного материала. Это придаст большую эффек¬
тивность и направленность процессам селекции.
12. Оперативное тестирование. Определение устойчивости ге¬
нотипа к воздействию негативных факторов окружающей среды,
в том числе и тестирование культур на устойчивость к болезням
в асептических условиях.
13. Яровизация и цветение. Стимулирование этих процессов у
таких культур, как сахарная свекла, капуста, морковь, лук и т. д.,
характеризующихся 2—3-летним циклом развития. К примеру,
инкубирование в пробирках культуры почек сахарной свеклы при
низких температурах (5 °С) в темноте в течение 70 сут аналогич¬
но получению маточного материала корнеплодов первого года.
Подобные же результаты были получены у ячменя. Индукция
цветения in vitro и образование семян у этих видов могут быть
105
ОБЩАЯ ЧАСТЬ
использованы для ускорения селекционного процесса (Лутова,
2003).
14. Модель для физиологических исследований. Широкое при¬
менение микроразмножения в физиологии растений и фитопато¬
логии для изучения метаболических процессов, связанных с образо¬
ванием всего комплекса органических соединений, и механизмов
устойчивости к различным фитопатогенам, а также для достовер¬
ного определения степени автономности процессов роста, диффе¬
ренциации и морфогенеза и их зависимости от растения в целом.
Таким образом, на сегодняшний день это мощно развиваю¬
щаяся часть общебиологических исследований, направленная на
выяснение связей между органами, тканями и отдельными клет¬
ками растительного организма, процессов роста, развития и
морфогенеза с целью оптимизации процессов массового размно¬
жения ценных растений. Анализируя различные направления био¬
технологии, можно с уверенностью утверждать, что в будущем раз¬
витие цивилизации будет во многом зависеть от успехов в этой
области естествознания.
3.2.2. Основные направления культивирования
частей растительных организмов in vitro
В настоящее время разработана масса методов для
культивирования в асептических условиях различных частей рас¬
тений. По степени организации культивируемых объектов их мож¬
но условно разделить на три основных направления: культура
клеток, культура тканей и культура органов (рис. 3.1).
Культура клеток
Культура отдельных клеток, как правило, ведется с
целью получения однородных клеточных популяций, которые в
дальнейшем могут быть использованы для изучения структуры
клетки и процессов ее жизнедеятельности, таких, как рост, диф¬
ференциация, обмен веществ и пр. Методы, с помощью которых
получают ткани (а в дальнейшем и целые растения), достаточно
трудоемки и требуют от экспериментатора определенных навы¬
ков и опыта, однако в большинстве своем достаточно хорошо
разработаны.
Суспензионные культуры можно рассматривать как один из
способов культивирования клеток. С этой целью клетки чаще все-
106
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Рис. 3.1. Основные направления разработок при культивировании раститель¬
ных организмов ш vitro
го выделяют из каллусных агрегатов; они бывают единичными и
в виде небольших конгломератов. Суспензионные культуры рас¬
тительных клеток можно поддерживать достаточно продолжи¬
тельное время. Как правило, их используют для изучения про¬
цессов дифференциации и начальных этапов органогенеза.
Растительные культуры in vitro не являются однородной кле¬
точной системой, как это предполагалось ранее. В настоящее
время накоплен большой фактический материал, демонстрирую¬
щий морфологическую изменчивость клеток в таких культурах. У
многих видов тканей in vitro показано разнообразие форм и раз¬
меров клеток, количества и формы ядер в них (Фролова, 1981;
Кунах, 2005).
Культуру протопластов получают главным образом из клеток
мезофилла или из недифференцированных клеток каллуса: пер¬
вые в большинстве своем генетически однородны, вторые обла¬
дают плоидностью различной степени.
107
ОБЩАЯ ЧАСТЬ
Получение и последующее культивирование протопластов — до¬
статочно трудоемкие процессы и осуществимы лишь в специализи¬
рованных лабораториях. Протопласты растений служат прекрасной
моделью для исследований в области физиологии, биохимии и ге¬
нетической инженерии растений (MycieHKO та iH., 2005). Однако
этот метод перспективен и на практике. С помощью культуры про¬
топластов можно получить ценные в сельскохозяйственном отно¬
шении соматические гибриды, которые не могут быть выращены
традиционными способами. Инициация последовательных делений
исходной клетки дает возможность получить однородную ткань, в
которой можно стимулировать органогенные процессы и выращи¬
вать растения-регенеранты.
Культура зародышей — объект для исследований процессов
роста и развития, действия эндогенных гормонов, влияния света,
температуры и других абиотических факторов (например, воздей¬
ствие мутагенных субстанций на зародыш) на формирование
полноценных растений. Однако культуры зародышей высших
растений имеют и практическое значение. Как уже отмечалось, с
помощью этого метода можно получать ценные в хозяйственном
отношении гибриды путем изоляции на начальных этапах и до¬
ращивания in vitro зародышей гибридных семян, которые обык¬
новенно гибнут на ранних этапах своего развития.
В практике садоводства благодаря использованию данной
культуры удалось сохранить зародыши, образовавшиеся в резуль¬
тате скрещивания систематически различных видов, которые в
естественных условиях часто не развиваются вследствие угне¬
тающего воздействия ингибиторов роста, находящихся в семенах.
Культуры зародышей могут значительно ускорить производство
растений, семена которых после сбора дозревают в течение про¬
должительного периода.
Культура пыльцевых зерен основывается на получении из не¬
вызревшей пыльцы сначала эмбриоидов, а затем целых растений.
При удвоении у гаплоидов количества хромосом, например в ре¬
зультате действия колхицина или других мутагенных факторов,
вновь образуются плодовитые гомозиготные растения. Наилуч¬
шие результаты в культуре пыльцевых зерен можно получить при
извлечении материала из еще не раскрывшихся бутонов. Как
правило, первичный каллус образовывается из соматических кле¬
ток пыльцевого мешочка, поэтому пыльники не должны быть по¬
вреждены во время отбора материала.
Применение данной методики дает возможность получить
растения, которые могут отличаться от материнского по многим
108
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
характеристикам. Особенно интересно в этом отношении ис¬
пользовать аборигенные сорта и формы растений, которые обычно
характеризуются генетической неоднородностью. Естественным
способом гаплоидные растения возникают крайне редко, их труд¬
но идентифицировать без специальных исследований. В даль¬
нейшем полученные растения широко используют в селекции,
что значительно облегчает и ускоряет процесс выведения новых
сортов.
Культура тканей
На рис. 3.2 и 3.3 схематично показаны потенциаль¬
ные экспланты, чаще всего применяемые для регенерирования
первичного каллуса растений в условиях асептической культуры.
Культура меристем — наиболее распространенное направление
культивирования, которое, как правило, используют для получе¬
ния растений, свободных от патогенов, и повышения коэффици¬
ента размножения. Меристематические ткани можно изолировать
из апикальной меристемы побега, боковых почек, глазков клуб¬
ней, меристематических узелков или бугорков, расположенных в
узлах листьев. Растения, из которых выделяют экспланты, долж¬
ны находиться в фазе интенсивного роста. Величина изолирован¬
ных меристем различна; от нее зависят скорость роста, а после обез¬
зараживания — количество растений, освобожденных от пато¬
генов.
Культура каллуса — наиболее распространенный тип культи¬
вирования; в ней встречаются настоящие меристематические
клетки и дифференцированные элементы, такие, как трахеиды.
Можно наблюдать возникновение сосудистых тканей, появление
и развитие апексов стебля, корня, а также образование эмбриои-
дов и флоральный морфогенез. Во многих случаях формирование
нового типа клеток или структуры является следствием контро¬
лируемой индукции. Например, в определенных условиях в куль¬
туре in vitro механически выделенные клетки палисадной парен¬
химы подвергаются вторичной дифференциации, в результате
образуются трахеиды. Известно, что меристематизация в культуре
каллусных клеток может приводить к возникновению эмбриои-
дов и, в конечном итоге, формированию нового растительного
организма.
Каллус состоит из множества недифференцированных клеток
и образуется в асептических условиях практически возле любого
109
ОБЩАЯ ЧАСТЬ
Рис. 3.2. Возможные экспланты для получения первичного каллуса и даль¬
нейшей регенерации органов и тканей в асептической культуре:
а — первичный каллус; б — корневые клубни; в — корнеплоды; г — корневая система;
д — лист (различные части листовой пластинки, черешок листа); е — луковица; ж —
корневище (клубень); з — побег; и — апикальная меристема; к — элементы завязи; л —
элементы пыльцевого мешка, пыльцевые зерна; м — лепестки; А — регенерация побе¬
гов и каллуса; Б — органогенез корней из каллуса (ризогенез)
травмированного места. Однако для дальнейшего культивирова¬
ния каллусов нужны специально подобранные среды. Их со¬
став — очень важный фактор, влияющий не только на дальней¬
шую пролиферацию, но и на консистенцию, цвет и форму кал-
лусных масс, продуцирование вторичных метаболитов и пр. Для
поддержания устойчивого роста каллусных культур их необходи¬
мо регулярно пересаживать на свежие среды, так как в процессе
развития каллус быстро истощает запасы питательных веществ
среды; одновременно в среде накапливаются метаболиты, вызы¬
вающие в дальнейшем аутоинтоксикацию.
Первый пассаж вновь образовавшегося (первичного) каллуса
проводят вместе с материнским фрагментом растения, из которо-
110
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Рис. 3.3. Локализация возможных первичных эксплантов у интактных расте¬
ний:
а — представители Агасеае Juss.; б — орхидные с моноподиальным типом нарастания
вегетативной сферы; в — орхидные с симподиальным типом нарастания вегетативной
сферы; 1 — участки корня; 2 — сегменты листовой пластинки; 3 — сегменты цветка;
4 — апикальные и пазушные почки; 5 — почки цветоноса
го он возник, предохраняя его таким образом от излишнего трав¬
мирования. Длительность пассажей — видоспецифическая вели¬
чина, которая в основном колеблется в пределах 3—8 недель. В
дальнейшем, по мере разрастания, каллусные массы необходимо
разделять и переносить на новую среду. При этом часть сегмен¬
тов погибнут, однако с каждым последующим пассажем количе¬
ство отмерших трансплантатов будет уменьшаться и, в конечном
итоге, в некоторых случаях сведется практически к нулю.
111
ОБЩАЯ ЧАСТЬ
Растущий в асептических условиях каллус иногда проявляет
способность к соматическому эмбриогенезу, т. е. образованию из
вегетативных клеток предзародышей или зародышей, способных
к органогенезу (регенерации отдельных органов, а со временем и
целых растений). Явление регенерации целых растений из клеток
каллуса используется для размножения многих декоративных рас¬
тений, таких, как Araceae, Liliaceae, Iridaceae, Amarillidaceae и др.
Несмотря на большое количество работ, описывающих орга¬
ногенез у представителей многих родов, на сегодняшний день нет
четкого представления о его механизмах в каллусных тканях. Важ¬
ную роль в этом процессе играет состав питательной среды, одна¬
ко влияние абиотических факторов также существенно. Кроме
того, значение имеют генетические особенности растений, их
происхождение, возраст, консистенция и возраст каллуса.
Иногда под воздействием различных компонентов, содержа¬
щихся в питательных средах, в клетках каллусной ткани изменяется
плоидность. Это нерегулируемый процесс, в результате которого
можно получать растения как с полезными фенотипическими
или физиологическими проявлениями, так и с бесполезными (и
даже вредными) или несовместимыми с жизнью растений-реге-
нерантов (хлорофиллдефектные растения).
Культура протокормов используется только для размножения
представителей семейства Orchidaceae Juss., поскольку протокорм
как одна из ювенильных стадий в онтогенезе спорофита высших
семенных растений характерен исключительно для представите¬
лей этого семейства. Более детально этапы семенного размноже¬
ния орхидных описаны в разд. 3.2.
Изучая возможности получения свободных от вирусов расте¬
ний орхидных, G. Morel (1964) установил, что эксплант верху¬
шечной меристемы на питательной среде дифференцировал про¬
токорм, подобный тому, который образуется при прорастании
семени. Такие протокормы можно делить, субкультивировать на
питательной среде, где они значительно разрастаются. Процесс
деления повторяют необходимое количество раз, в результате, по
его подсчетам, из одной меристемы Cymbidium можно в год полу¬
чить до 4 млн протокормов, из которых развиваются растения. У
Cattleya регенерационная способность гораздо меньше — 25—
100 растений.
В 1974 г. технология клонального размножения была разрабо¬
тана лишь для 20 видов орхидных (Murashige, 1974). Сегодня эта
цифра намного больше. Это главным образом симподиальные ор¬
112
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
хидные, у которых основание апекса перестает делиться и боко¬
вая меристема образует новую почку, занимающую положение
верхушечной. Моноподиальные орхидеи труднее ввести в культу¬
ру, так как их меристемы имеют другое расположение и их рост в
длину постоянен.
Культура органов
Апикальные или пазушные почки часто используют
для размножения в асептических условиях многих декоративных
растений (Ficus Tourn ex L., Yucca L., Philodendron Schott, Cordyline
Comm, ex Juss., Monstera Schott и пр.). Суть данного приема со¬
стоит в том, что образовавшийся из почки (апикальной или па¬
зушной) побег разделяют на отдельные сегменты, состоящие из
одного или нескольких междоузлий, из которых впоследствии
также формируются побеги. Их можно укоренять и высаживать в
субстрат. Процедуру микрочеренкования (микроклонирования)
при необходимости повторяют, получая таким образом необходи¬
мое количество растений с одинаковым генотипом. Регулируя в
среде количество цитокининов, можно добиться появления мно¬
жества побегов из основания одного материнского, после чего их
также можно разделять, укоренять и высаживать ex situ.
Первые морфологические изменения пазушной почки замет¬
ны через 7—10 сут с момента введения, каллус начинает проли¬
ферировать через 15 сут. В дальнейшем образуются адвентивные
почки (протокормы) и многочисленные побеги с нормальным
филлотаксисом.
Изучение морфогенеза покоящихся почек отмирающего тубе-
ридия показало, что апикальная и верхние почки не способны к
пролиферации протокормов, их морфогенетический потенциал
исчерпан. Почки средней части туберидия в основном регенери¬
руют побеги с корнями. Обогащение питательной среды МС ки¬
нетином, БАП или зеатином (3—5 мг/л) вызывает индукцию не¬
большого количества протокормов. Поэтому старые, отмираю¬
щие туберидии следует использовать для получения молодых по¬
бегов и их клонирования.
Применение апикальных меристем для клонирования орхи¬
дей приводит к гибели материнского растения, поэтому наши
исследования были направлены на использование потенциаль¬
ных возможностей воспроизведения орхидных без ущерба для
интактного растения. В результате нами разработана технология
113
ОБЩАЯ ЧАСТЬ
с применением резервных почек вегетирующих и отмирающих
туберидиев, спящих почек цветоносов, меристематических тка¬
ней кончиков и оснований листьев.
В основе культуры сегментов листовых пластинок лежат дан¬
ные вегетативного размножения и результаты исследований не¬
которых авторов, согласно которым лист — это самодифферен-
цируюшийся орган с многочисленными клетками, обладающими
меристематической активностью. Особенно активны меристемы
влагалища и кончика листа. Экспланты листьев большинства рас¬
тений в условиях культуры in vitro способны к образованию кал¬
луса и дифференциации адвентивных почек, побегов и корней.
Установлено, что процесс этот комплексный и зависит от многих
факторов. Продолжается поиск веществ и условий, вызывающих
дифференциацию, изучаются биохимические процессы, приво¬
дящие к морфогенезу (Юсуфов, 1988).
Многие декоративные растения размножают in vitro с помо¬
щью сегментов листовых пластинок или черешков листьев. Из¬
вестно, что основания черешков и ткани, окружающие проводя¬
щие пучки в толще листовых пластинок, имеют повышенные
органогенные свойства. Как правило, из них вначале образуется
органогенный каллус, в котором индуцируют процессы морфоге¬
неза, получая растения-регенеранты, пригодные для высадки в
субстрат. При данном способе размножения следует иметь в ви¬
ду, что на успех могут существенно влиять возраст листа и расте¬
ния, расположение листа на поверхности среды, часть, из кото¬
рой был извлечен эксплант, и др. Кроме того, полученные таким
образом растения могут существенно отличаться от исходной
формы генотипически.
Как показали исследования А.Г. Юсуфова (1988), изолирова¬
ние листа ведет к нарушению целостности, перестройке жизне¬
деятельности тканей и усилению гидролитических процессов.
Подобные изменения способствуют повышению подвижности
веществ в тканях и усилению регенеративных процессов в изоли¬
рованных листьях.
Использование листьев орхидных в качестве эксплантов для
микроразмножения сводит к минимуму ущерб, причиняемый ма¬
теринскому растению. Впервые L. Wimber обнаружил образова¬
ние протокормообразных тел в культуре листьев некоторых ви¬
дов. Позже были опубликованы работы по клональному размно¬
жению орхидей культурой ткани листа (Morel, 1964; Champagnat
et al., 1970). При размножении Cattleya изолированными почками
114
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
G. Morel (1974) установил, что апекс в большинстве случаев от¬
мирает, а органогенез происходит на примордиях листьев. Клет¬
ки пазушной меристемы и средней части листа способны к ин¬
дукции протокормов. При удалении оснований листьев на ране¬
вой поверхности образуется каллус, регенерирующий почки и
побеги.
Культура участков соцветия также используется для получения
первичного каллуса, а из него — растений-регенерантов. В со¬
цветиях есть несколько мест, которые могут выступать в роли
первичных продуцентов клеток, потенциально способных про¬
лиферировать каллус. Наиболее часто используют сегменты цве¬
толожа или поверхностные ткани цветоносов, из которых на
специальных питательных средах с помощью определенной по¬
следовательности процедур получают каллус, способный к мор¬
фогенезу. На асептической культуре цветоносов основано массо¬
вое размножение химерных Saintpaulia. Другими способами полу¬
чать эти растения не представляется возможным, так как при
обычных способах вегетативного размножения или микроразмно¬
жения в асептических условиях сортовые качества не передаются.
Как разновидность культуры участков соцветий можно рас¬
сматривать культивирование нижних участков цветоносов неко¬
торых орхидных. Важным резервом увеличения потенциальных
возможностей клонального размножения орхидей является ис¬
пользование покоящихся почек цветоносов. Большинство орхи¬
дей имеет кистевидное или колосовидное соцветие; как правило,
почки базальной части цветоноса остаются спящими. На каждом
цветоносе у растений Phalaenopsis, Doritis, Doritaenopsis в нижней
части расположены 3—4 такие почки, прикрытые брактеями, ко¬
торые потенциально могут формировать как вегетативные, так и
генеративные побеги. Если эти почки вычленить сразу после то¬
го, как соцветие отцвело, и поместить на питательную среду, то
можно получить вегетативные побеги, которые используют для
клонального размножения. Регенеранты, выращенные подобным
способом, сохраняют все качества материнского растения. Нами
получены положительные результаты при введении в культуру
нижних почек цветоносов некоторых орхидных, в частности
Phalaenopsis (рис. 3.4, см. вклейку). Были проведены эксперимен¬
ты по стимуляции роста этих почек у цветоносов различных ви¬
дов орхидей в условиях культуры. Обильная пролиферация про¬
токормов наблюдалась у эксплантов почек цветоносов Ascofinetia,
Neostilis, Oncidium, Vascotilis (Arditti, 1977). Через 15 мес при добав¬
115
ОБЩАЯ ЧАСТЬ
лении в среду эндосперма кокосового ореха или гомогената ба¬
нана образовались проростки.
Регенерация побегов наблюдалась и у почек цветоносов Den-
drobium phalaenopsis, Vanda, Oncidium, что способствовало увели¬
чению коэффициента размножения этих видов орхидей. Однако
дальнейшие исследования необходимо сосредоточить на разра¬
ботке методов индукции протокормообразования и получения
многочисленных адвентивных побегов. Культивирование почек
цветоносов миниатюрного Cymbidium на среде МС с 500 мг/л гид¬
ролизата казеина, 50 — кинетина и 0,3—2,7 мг/л НУК способст¬
вовало образованию агрегатов из 20—25 протокормов, которые в
дальнейшем регенерировали растения.
Культура фрагментов луковиц, клубней и корневищ в связи с
высокой регенерационной способностью часто используется для
получения стерильных растительных культур. Таким способом
хорошо размножаются растения, принадлежащие к семейству Lilia-
сеае, например Hosta. Эксплантами могут служить высечки из че-
шуй луковиц, фрагментов донца с основанием листовых чешуй и
пазушные почки, которые в изобилии расположены в пазухах ви¬
доизмененных листьев. Направление дальнейших морфогенети¬
ческих реакций во многом зависит от состава питательных сред,
используемых для размножения того или иного вида. Надо иметь в
виду, что растения, полученные таким способом, не всегда со¬
храняют генетическую стабильность.
Культура корней служит исключительно для теоретических ис¬
следований физиологических свойств, требований корневого пи¬
тания и морфогенеза. Однако известно, что корневые ткани не¬
которых растений (в том числе и орхидных) способны регенери¬
ровать растения.
Нами и другими исследователями были сделаны попытки ис¬
пользовать воздушные корни орхидей для регенерации растений
(Rao, 1967; Arditti, 1977). У многих видов орхидных корни зеле¬
ного цвета и способны к фотосинтезу.
3.2.3. Пути реализации репродуктивных свойств
спорофита цветковых растений in vitro
Меристематические клетки различных растений
обладают большой пластичностью поведения под воздействием
физиологических, генетических, трофических и гормональных
факторов. Выделяют четыре пути реализации морфогенеза в куль¬
116
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
туре in vitro: эмбриогенез, эмбриоидогенез, органогенез, гистоге¬
нез. Согласно данным Т.Б. Батыгиной и соавт. (1980, 1981), у ор¬
хидных морфогенез осуществляется по пути эмбриогенеза, кото¬
рый также свойственен развитию зародыша in vitro.
Морфогенез в культуре тканей растений является одним из
наименее изученных вопросов дифференцировки, о чем свиде¬
тельствует отсутствие единой классификации морфогенетических
реакций. Т. Murashige (1974) выделяет такие методы клонального
размножения растений:
• активация пазушных меристем;
• образование адвентивных побегов в тканях экспланта;
• возникновение адвентивных побегов в каллусе;
• индукция соматического эмбриогенеза в клетках экспланта;
• образование эмбриоидов в каллусе;
• формирование придаточных эмбриоидов в тканях, возник¬
ших in vitro из первичных соматических зародышей.
Данная классификация актуальна и сегодня и включает все
известные методы клонального размножения, описанные многи¬
ми авторами.
Особого внимания в этом отношении заслуживают орхидные.
Как известно, из недифференцированного зародыша у данной груп¬
пы цветковых растений формируется протокорм. Соматические за¬
родыши, возникающие при культивировании изолированных тка¬
ней орхидных, идентичны протокорму. G. Morel (1964) назвал их
протокормоподобными телами. Способность протокорма к ве¬
гетативному размножению лежит в основе микроразмножения ор¬
хидей: протокорм, разделенный на части, пролиферирует множе¬
ство протокормов; их рост и деление можно поддерживать долгое
время, получая необходимое количество исходного материала. В
дальнейшем на протокорме дифференцируются лист и корень,
образуется растение.
За основу классификации микроразмножения, которую пред¬
ложил G. Hicks (1980), взято два критерия: начальный эксплант,
введенный в культуру (семена, части сеянцев, апикальная мери¬
стема, ткань взрослого растения, целые неповрежденные органы,
протопласты) и способность к образованию каллуса. Рассматри¬
вая развитие эксплантов при культивировании, он различает два
пути морфогенеза: прямой органогенез, при котором из первич¬
ного экспланта регенерирует растение или образуется меристе-
моид и система органов, и непрямой органогенез, когда из началь¬
ного экспланта образуется каллус, меристемоиды, а затем проис¬
117
ОБЩАЯ ЧАСТЬ
ходит морфогенез. Как первый, так и второй варианты морфоге¬
неза основаны на способности изолированных частей растения при
благоприятных условиях восстанавливать недостающие органы и
регенерировать целое растение. Прямой органогенез, наиболее рас¬
пространенный тип регенерации высших растений, положен в
основу традиционных методов вегетативного размножения и мо¬
жет быть использован для клонального размножения высших
растений, так как гарантирует генетическую идентичность мате¬
ринским формам.
Таким образом, считают возможным разделить процессы
клонального размножения на два типа: активация развития уже
существующих меристем (апекс стебля, пазушные и спящие поч¬
ки) и индукция возникновения почек или эмбриоидов de novo, при
которой организованные структуры образуются непосредственно
из специализированных тканей экспланта, первичного каллуса
или субкультивируемой каллусной ткани (Катаева, Бутенко,
1983).
Эта классификация учитывает принципиальное различие ме¬
жду растениями, возникшими из меристемы, обеспечивающей
им генетическую идентичность с родительскими формами, и рас¬
тениями, образовавшимися из каллусных клеток, для которых
возможны мутации.
В основном морфогенетические потенции эксплантов реа¬
лизуются путем образования протокормов, адвентивных почек
и побегов. Каждая из этих структур может служить исходным
материалом для клонирования, что создает неограниченные
возможности размножения и получения необходимого количе¬
ства растений.
3.2.4. Цветение in vitro
Известно, что растения способны переходить к
цветению и плодоношению в сравнительно раннем возрасте, за¬
долго до обычных сроков цветения. Оказывается, что одни и те
же растения (по видовой принадлежности) нередко могут начи¬
нать цвести и плодоносить очень рано. Простейшим и общеизве¬
стным примером может служить зацветание однолетних расте¬
ний — эфемеров, которые иногда, едва выбросив семядоли и 1 —
2 пары первичных листьев, переходят к цветению и плодоноше¬
нию. Такие же явления наблюдаются и у других групп растений.
118
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Способностью давать инфантильные, но быстро зацветающие
особи обладают не только травянистые, но и древесные растения.
Отмечены цветение проростка кокосовой пальмы, образовавшего
всего 3 простых листа (обычно она зацветает на 4—6-й год) и не¬
обыкновенно ранний, в возрасте 1—2 лет, переход скумпии (Coti-
nus coggugria) к цветению. Известны случаи цветения сеянцев
хвойных пород (Pinus sinensis Lamb.) в однолетнем возрасте и мо¬
ложе 1 года (Васильченко, 1965). Цветение ювенильных форм
Rosa L. вообще не относится к числу редких явлений. В литера¬
туре сообщается о цветении проростка Rosa indica L., развившего
только первичные листья (Тахтаджян, 1964). Науке известно до¬
статочно много примеров раннего цветения и плодоношения
растений из разных семейств. Однако определить причины та¬
кого явления не всегда представляется возможным.
В связи с этим мы не можем не присоединиться к мнению
М.Х. Чайлахяна (1957) о том, что в учении об онтогенезе и до
сих пор еще много загадочного и скрытого — нет твердых пред¬
ставлений о физиологической природе возрастных изменений, а
также процессов вегетативного роста и репродуктивного разви¬
тия, отсутствуют сведения об интимных процессах, которые свя¬
зывают тот или иной обмен веществ в меристематических тканях
с образованием новых зачаточных структур.
Поэтому нам представляются чрезвычайно интересными ис¬
следования процессов, развивающихся в стеблевом апексе при
эвокации цветения, а затем и при структурном формировании
новых органов — цветков и соцветий. При этом некоторые из
процессов, происходящих в меристеме и при эвокации, общие
для большинства растений, но могут варьировать в зависимости
от видовой специфичности объекта.
Запуск программ цветения (флоральная индукция) обеспечи¬
вает превращение вегетативной меристемы в генеративную (ме¬
ристему соцветия) и регулируется различными факторами как
экзогенной, так и эндогенной природы. К факторам внешней
среды, оказывающим существенное влияние на флоральную ин¬
дукцию у некоторых растений, можно отнести длину светового
дня и температуру (Лутова, 2003).
В связи с вышеизложенным значительный научный интерес
представляют исследования, проводимые с изолированными экс¬
плантами и меристемами в культуре in vitro. Состояние всех мери¬
стем предопределено постоянным влиянием комплекса взаимо¬
действий каждой из них и некоторых других частей растений. Сле¬
119
ОБЩАЯ ЧАСТЬ
дует подчеркнуть также влияние апикального доминирования, ко¬
торое играет решающую роль в цветении растений.
Изолированные от растений и культивируемые in vitro вегета¬
тивные апексы закладывают цветки (Perilla) как при коротком,
так и при длинном дне. Образование цветков in vitro у Iris проис¬
ходит при отделении апексов из луковиц и понижении темпера¬
туры до 13 °С. У Helianthus, наоборот, цветение наступает в том
случае, если апексы были изолированы с кусочками прилегаю¬
щей семядольной ткани.
Предпринятые попытки культивирования эксплантов из ме¬
ристем выявили видовую специфичность и зависимость от раз¬
мера экспланта, что связывают с распределением регуляторов
роста в тканях.
Чрезвычайно много исследований по индукции цветения in
vitro выполнено с растениями табака. Например, сегменты соцве¬
тия нейтрального к длительности дня табака регенерируют in vitro
зачатки цветков, тогда как чувствительные растения — вегета¬
тивные почки. М.Х. Чайлахян (1957) объясняет это тем, что в
первом случае компоненты гормонального комплекса цветения
синтезируются во всех частях растения. У чувствительных к дли¬
тельности дня растений этот комплекс образуется только в ли¬
стьях (которые отсутствуют) и поэтому они регенерируют вегета¬
тивные почки. Обнаружено также, что градиент цветения и его
распределение по растению характеризуется видовой специфич¬
ностью.
Закладка цветков и цветение in vitro зависят от длительности
дня, температуры, состава среды и других условий культивиро¬
вания.
Факторы, необходимые для успешной преиндукции, различ¬
ны и взаимозаменяемы. Так, углеводы нужны в том случае, если
сегменты корня не находились в условиях пониженных темпера¬
тур. Во избежание лишней оводненности лучше применять ага-
ризированные среды. При использовании жидких сред цветение
стимулируется добавлением ГК3 или пролина. Интересен тот
факт, что ослабление индукции цветения под воздействием не¬
благоприятных факторов может восстанавливаться после 2-ме¬
сячного пребывания при пониженных температурах. Это свиде¬
тельствует о том, что эксплант в условиях in vitro во многом ведет
себя так же, как интактные растения in vivo (Бернье и др., 1985).
Самая простая и известная до сих пор система для исследова¬
ния цветения разработана T.V. Tran (1973). Для этого используют
120
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
небольшие экспланты, состоящие из 3—6 слоев эпидермальных и
субэпидермальных клеток, взятых из соцветия, и культивируют
на питательной среде при непрерывном освещении. Образо¬
вавшиеся цветки табака покрывают 1/2 поверхности экспланта.
Вследствие меньшего объема и низкого уровня эндогенных ве¬
ществ они более чувствительны к изменениям уровня экзогенных
регуляторных веществ и трофических факторов. Кроме того, в них
легче индуцировать морфогенетические процессы: образование
корней, вегетативных почек, цветков и каллуса (Бернье и др.,
1985).
Однако следует отметить, что рост таких небольших эксплан¬
тов зависит от фазы развития и генотипа материнских растений.
Этим они не отличаются от крупных эксплантов. Цветки, как
правило, образуются из эксплантов, которые взяты из верхней
части побега или соцветия.
Исходя из вышеизложенного, можно сделать вывод о том, что
взаимодействия тканей и органов, как и у интактных растений,
играют основную роль в регуляции закладки цветков in vitro. Раз¬
витие любой стеблевой меристемы в культуре in vivo или in vitro
прежде всего зависит от информации, поступающей из всех ор¬
ганов интактного растения. Ответная реакция меристем опреде¬
ляется балансом трофических и регуляторных факторов (Scorza,
1982).
Например, удалось получить высокий процент цветения при
культивировании эксплантов междоузлий побегов Fortunella hind-
sii на 1/2 концентрации среды МС с 5 % сахарозы и 0,01 мг/л БА
на свету (Jumin et al., 1996а). В литературе мы встретили описа¬
ние необычного случая цветения in vitro стабильной инбредной
линии африканского проса. Растения получили путем соматиче¬
ского эмбриогенеза из незрелых соцветий на среде МС с 0,2 мг/л
ИУК, 1,0 — кинетина, 40 мг/л аденина в течение 60 сут. Отмече¬
но, что образовавшаяся пыльца в 40 % случаев была фертильной
(вместо 99 %). Метелки имели размер 1,5—2,0 см (вместо 15—
18 см), формируя в соцветии по 10—12 цветков нормального
размера и строения (Kulkarni et al., 1995).
При изучении влияния фотопериода на цветение Cuscuta
japonica в культуре in vitro установлено: достаточно трех коротких
дней (фотопериод 8 ч), чтобы у 33 % эксплантов прошла ини¬
циация цветения. Увеличение длительности дневного освещения
повышает этот процесс до 83 % (Tanaka et al., 1995).
121
ОБЩАЯ ЧАСТЬ
Культивируя пыльник томата на среде МС с кинетином, 2,4-Д и
ИУК при фотопериоде 16 ч удалось получить плод 20 мм в длину
и 10 мм в ширину. Он отличался от нормального плода дольча-
тостью, отсутствием семязачатков. Однако повторить опыт и ус¬
тановить фактор, способствующий этому феномену, не удалось
(Pions et al., 1995).
Интересные данные получены при культивировании in vitro
эксплантов эпикотиля сеянцев и междоузлий взрослых цветущих
растений Murraya paniculata: в первом случае формировались только
почки, во втором — и почки, и цветки. Для индукции цветения у
эксплантов междоузлий абсолютно необходимыми были свет, на¬
личие в среде 5 % сахарозы и 0,01 мг/л БА (Jumin et al., 1996).
Большой интерес вызывает изучение опыления, оплодотворе¬
ния и получения семян in vitro. Исследований, посвященных этому
вопросу, сравнительно мало. В работе V. Tilton (1984) дана крат¬
кая история развития метода опыления и оплодотворения in vitro.
В настоящее время наиболее простым способом является искус¬
ственное нанесение пыльцы на рыльце культивируемого in vitro
гинецея. Этот прием обеспечивает получение большого количе¬
ства жизнеспособных семян у растений, имеющих лишь несколь¬
ко семяпочек в завязи. Часто наносят пыльцу непосредственно
на обнаженные семяпочки и плаценту. У Brassica oleraceae уда¬
лось получить семена при нанесении пыльцы на семяпочки, ос¬
вобожденные от всех тканей гинецея. Существуют различные мо¬
дификации метода опыления и оплодотворения in vitro: прививка
столбика с рыльцем совместимого гинецея в завязь несовмести¬
мого гинецея; нанесение пыльцы на свежесрезанную поверхность
столбика; удаление с рыльца его собственного экссудата и нане¬
сение экссудата с рыльца растения донора; применение различ¬
ных химических веществ.
Методы опыления in vitro могут использоваться для изучения
взаимодействия мужских и женских органов у растений, в раз¬
множении и селекции пыльцы. Комбинируя методику искусст¬
венного опыления с техникой культуры in vitro, можно отобрать
отдельные семяпочки, зная, что геном пыльцевых зерен содержит
в себе нужный ген. Можно вводить гены в пыльцу или пыльце¬
вые трубки микроинъекцией до опыления. Технология опыления
и оплодотворения in vitro, наряду с другими методами, приме¬
няемыми в биотехнологии, должна стать необходимой составной
частью селекционных программ (Tilton et al., 1984).
122
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Одним из первых, кто исследовал индукцию цветения у рас¬
тений из семейства Orchidaceae Juss., был С. Goh (1996). Он изу¬
чил процесс закладки цветочных почек у гибридов х Aranda и ус¬
тановил, что использование в качестве эксплантов сегментов и
спящих почек соцветий, а также флоральных почек не приносит
ущерба материнскому растению и дает хорошие результаты.
При индукции цветения у эксплантов х Aranda, х Renantanda
обнаружено, что этот процесс контролируется апикальным до¬
минированием верхушки побега. Удаление верхушки, а также об¬
работка пастой, содержащей цитокинины, приводит к появлению
терминальных и пазушных соцветий и у гибридов Dendrobium.
Установлено также, что экспланты соцветий различных гибридов
Dendrobium регенерируют 2 вида протокормов: один — медленно¬
растущий, но образующий побеги с нормальными листьями,
другой — с карликовыми листьями. Модифицируя состав пита¬
тельной среды и условия культивирования, удалось стимулиро¬
вать появление цветков, аналогичных по размеру взрослому рас¬
тению. Успешными были и опыты с протокормами, полученны¬
ми из семян гибрида Dendrobium ’Madam Trong‘. Используя пре¬
дыдущую методику, удалось вызвать развитие цветков за 5 мес
культивирования (Goh, 1996).
Изучением индукции цветения in vitro молодых растений се¬
мейства Orchidaceae Juss. занимались и другие исследователи.
Впервые растения, цветущие in vitro (х Laeliocattleya), наблюдал
L. Knudson (1946). Растение было получено из семян. Впослед¬
ствии многие ученые индуцировали цветение in vitro и у других
видов растений (Scorza, 1982). В большинстве случаев выявить
факторы, способствующие этому процессу, не удается. В лите¬
ратурном обзоре, посвященном цветению орхидей in vitro, под¬
робно анализируются все сопутствующие факторы (Chia et al.,
1999).
Например, совместное добавление к питательной среде
НУК, БА, БАП способствовало цветению in vitro Dendrobium
candidum и других гибридов (Wang et al., 1993). Стресс (темпера¬
турный) и добавление ингибиторов роста (АБК) к среде вызы¬
вало цветение у сеянцев Oncidium varicosum (Kerbany, 1984). Ис¬
пользование комплексных добавок (кокосовое молоко, гомоге-
нат банана, томатный или березовый сок) и других компонентов
как ростовых регуляторов не оказывало положительного действия
на цветение. Изучение влияния углеводов на этот процесс также
не является определяющим. Состав питательной среды (макро-
123
ОБЩАЯ ЧАСТЬ
и микроэлементы) может способствовать более быстрому разви¬
тию сеянцев и растений-регенерантов. Установлено, что в каче¬
стве источника азота лучше использовать NH4N03 (Duan et al.,
1995).
Многие виды орхидей очень чувствительны к фотопериоду.
Изменять его в культуре in vitro сложно, поскольку некоторые
виды чрезвычайно тонко реагируют на это. Чередуя разные вари¬
анты длительности фотопериода, удалось получить соцветия
Doriella (Duan et al., 1994a).
Значительное количество работ посвящено влиянию темпера¬
турного фактора на цветение in vitro. Особенно реагируют на его
изменения Cymbidium, Dendrobium, Oncidium, Phalaenopsis. Следует
отметить, что данный фактор — один из определяющих в этом
процессе (Kastenyuk, 1998).
На цветение in vitro влияет также pH среды, поскольку от его
значения зависят концентрация и потребление БА и БАП в пита¬
тельной среде. При pH 4—8 (среды Вацина—Вента, МС, Кнудсо-
на) отмечено цветение у Dendrobium. Наличие в среде НУК, БА,
спермидина, АБК или этилена может стимулировать цветение
сеянцев орхидных in vitro. Однако некоторые сеянцы цвели и без
этих добавок (Chia et al., 1999).
Имеются сообщения о цветении in vitro растений-регенеран¬
тов, полученных при клональном размножении. Как правило,
питательные среды, на которых они культивировались, содержа¬
ли ауксины, цитокинины, различные добавки (кокосовое молоко
и др.). Особо следует подчеркнуть эффект кокосового молока и
гомогената банана (Wang, 1988; Wang et al., 1992; Duan et al.,
1994).
В наших исследованиях, проводимых с различными видами
орхидей в течение нескольких лет, мы наблюдали цветение in
vitro орхидей Dendrobium parischii Rchb.f., Laelia sincorana Schltr.,
Psychopsis krameriana (Rchb.f.) H.G. Jones (рис. 3.5, см. вклейку).
К сожалению, выделить какие-то факторы, влияющие на этот
процесс, нам не удалось. Все случаи цветения имели спонтанный
характер. Единственным объединяющим фактором было доста¬
точно длительное (2—3 года) культивирование in vitro.
124
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
3.3. СЕМЕННОЕ РАЗМНОЖЕНИЕ
Своеобразные черты репродуктивной био¬
логии цветковых растений во многом обу¬
словлены неподвижностью их взрослых
особей. Одним из следствий этого явилось
формирование специальных образований (се¬
мян), которые обеспечивают расселение,
размножение и воспроизведение видов.
Т. Б. Батыгина
Под семенным размножением в условиях культуры
in vitro подразумевается получение из семян на искусственных пи¬
тательных средах сеянцев, пригодных для высадки в субстрат.
Использование семян (или изолированных зародышей) как
первичного источника растительного материала обусловлено сле¬
дующими объективными причинами:
• высев семян и дальнейшее их культивирование в условиях
in vitro существенно сокращает сроки получения сеянцев;
• удачная стерилизация семян намного проще методически,
чем живых тканей растений;
• на любом этапе семенного размножения растений в асепти¬
ческих условиях возможен перевод процесса в фазу клонального,
что значительно увеличивает количество получаемого раститель¬
ного материала;
• при правильно подобранном режиме стерилизации процент
всхожести семян in vitro не ниже, чем ex situ, а в некоторых слу¬
чаях и превышает его, что связано с меньшим травматическим
действием со стороны стерилизующих агентов;
• введение в культуру in vitro растений на стадии семени
практически полностью исключает наличие вирусной инфекции
(Porter et al., 1996);
• получение и культивирование сеянцев в стерильных услови¬
ях сводит к минимуму случайную гибель ювенильных растений в
результате воздействия негативных внешних факторов (бактери¬
альные инфекции, оранжерейные вредители и пр.);
• широко практикуемый в ботанических садах делектусный
обмен семенами делает их в ряде случаев более доступным мате¬
риалом, нежели сами растения;
• семенное размножение in vitro как единственный способ
получения массового посадочного материала растений-мико-
симбионтов предоставляет возможность дальнейшего проведения
125
ОБЩАЯ ЧАСТЬ
селекционной работы с данной
ФУппой растений.
Особый интерес в этом отно¬
шении представляют виды семей¬
ства Orchidaceae. Первые попыт¬
ки проращивания семян орхид¬
ных на питательных средах без
грибов были предприняты после
открытия N. Вегпаг в 1899 г. того
факта, что в процессе их жизне¬
деятельности в тканях растений
крахмал переходит в растворимые
сахара (сахарификация). Он при¬
шел к выводу, что микоризу мож¬
но заменить питательным раство¬
ром с высокой концентрацией
сахарозы.
Л. Кнудсон (1884-1958) Эти эксперименты продолжил
L. Knudson. В частности, совре¬
менный интерес к орхидным во многом обусловлен его исследо¬
ваниями. Используя растворы минеральных веществ и сахарозы,
он разработал методику проращивания семян орхидных на ис¬
кусственных питательных средах (Knudson, 1922, 1946).
Сегодня количество зарегистрированных межвидовых и меж¬
родовых гибридов во много раз превышает общее количество из¬
вестных науке представителей этого семейства. Конечно, орхид¬
ные можно размножать и микроклонально, однако с точки зре¬
ния сохранения редких и исчезающих видов подобные действия
приемлемы лишь в крайних случаях.
Особенности биологии цветения, процесса оплодотворения и
развития зародыша у орхидных издавна привлекали внимание ис¬
следователей. У данной высокоспециализированной группы расте¬
ний в процессе эволюции система воспроизведения претерпела
значительные изменения (Батыгина, Васильева, 1980).
Несмотря на то что в настоящее время уже накоплен боль¬
шой опыт семенного размножения орхидей и проведены много¬
численные исследования, продолжаются работы по дальнейшему
усовершенствованию метода и выяснению особенностей прорас¬
тания семян, роста и развития сеянцев различных видов орхид¬
ных. Особенности этого метода в асептических условиях обу¬
словлены заменой симбиотического развития проростков в есте¬
126
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
ственных условиях проращиванием семян в асимбиотической куль¬
туре на искусственных питательных средах. Успех размножения
орхидей с помощью семян определяется следующими основопо¬
лагающими моментами:
• выявление оптимальной стадии развития зародыша для по¬
лучения максимального процента прорастания семян;
• подбор таких стерилизующих веществ, которые, обеспечи¬
вая чистоту, не угнетали бы процессы прорастания семян и по¬
следующего развития сеянцев;
• подбор питательной среды и условий культивирования для
нормального прохождения начальных стадий онтогенеза проро¬
стками орхидных.
В связи с экологическими особенностями существования у
орхидных выработалась способность к образованию большого коли¬
чества семян. Так, у некоторых орхидных (Anguloa R.E.P., Cat¬
tleya) в одном плоде может образовываться до 4 млн редуциро¬
ванных семян (Поддубная-Арнольди, 1976; Терехин, 2000).
Методика размножения in vitro позволяет реализовать огром¬
ные потенциальные возможности репродуктивной сферы орхи¬
дей, так как дает возможность проращивать подавляющее боль¬
шинство полученных семян. Согласно нашим данным, для неко¬
торых видов тропических и субтропических орхидей возможно
100%-е прорастание семян. Однако в природе, как показали ис¬
следования A. Rao (1977), прорастает лишь около 5 % семян.
Существует два основных способа получения семян ex situ для
применения их в культуре in vitro.
Первый заключается в том, чтобы дать возможность плоду
полностью созреть и раскрыться, как это и происходит в приро¬
де, после чего семена собирают для дальнейшего использования
и хранения. Этот общеизвестный прием именуется DSC (dry seed
culture). Основным недостатком данного способа является утрата
стерильности семян после растрескивания плода. При стерилиза¬
ции поверхность таких семян непосредственно подвергается дей¬
ствию стерилизующих агентов, что при неправильном их подборе
и экспозиции может негативно сказаться на дальнейшем разви¬
тии сеянцев.
Второй способ именуется GCC (green capsule culture). В нем
используются плоды, которые созрели не полностью и, соответст¬
венно, не раскрылись. Применение данного метода базируется на
способности к развитию зародышей из незрелых семян орхидных
в условиях асимбиотической культуры и приблизительно на 1/3
127
ОБЩАЯ ЧАСТЬ
сокращает сроки получения проростков. Недостаток GCC — риск
неточного определения сроков сбора коробочек. Преждевремен¬
ное снятие плода с материнского растения может привести к зна¬
чительным трудностям с проращиванием семян и дальнейшим
доращиванием ювенильных растений. Кроме того, семена, полу¬
ченные таким способом, не пригодны для длительного хранения.
При хранении в обычных условиях семена большей части
тропикогенных видов орхидных не теряют всхожести в течение
6 мес. Для более длительного хранения семена подсушивают в
комнатных условиях на протяжении 1—2 сут, после чего поме¬
щают в бумажный пакет (бумага типа кальки) и хранят в холо¬
дильнике при 4 °С в эксикаторе над силикогелем или хлоридом
кальция (Черевченко и др., 2001). Показано, что большое коли¬
чество семян, которое формируется в одном плоде орхидей,
представляет собой гетерогенный материал (Буюн, 1986; Андро¬
нова, 1988).
Одна из главных проблем, с которой сталкиваются исследова¬
тели при высеве зрелых семян, — быстрая утрата всхожести, осо¬
бенно у видов умеренной зоны. Однако подобные явления мож¬
но наблюдать и у тропикогенных видов. Основываясь на собст¬
венных исследованиях, мы можем констатировать практически
полную утрату способности к прорастанию у большинства видов
этой группы на протяжении 1—2 лет.
Установлено, что у видов умеренной зоны высев семян из
вскрывшегося плода дает минимальный процент всхожести. Вве¬
дение in vitro изолированных зародышей неполной зрелости на
стадии вскрывания плода позволяет усилить прорастание в 5—
15 раз и в отдельных случаях довести его до 100 %. Другим
возможным приемом повышения процента прорастания семян из
вскрывшихся плодов является их предпосевная обработка фер¬
ментами (Андронова, 1988) или регуляторами роста (Полевой,
1989). В связи с изложенным выше при семенном размножении
тропических растений лучше использовать семена собственной
репродукции.
3.3.1. Эмбриогенез орхццных
В отличие от других покрытосеменных растений, к
моменту опыления семяпочки у орхидей находятся на ранней ста¬
дии развития, а у некоторых видов их дифференциация начинается
только после опыления (Swamy, 1948; Поддубная-Арнольди, 1976).
128
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Зародыш орхидей состоит
из небольшого количества сла¬
бо дифференцированных кле¬
ток (от 6 до 100) с плотной
гранулированной цитоплазмой
и отчетливым ядром. Различа¬
ют две зоны развития клеток
эмбриона: нижнюю, состоя¬
щую из крупных вакуолизиро-
ванных клеток, и верхнюю,
имеющую мелкие, более плот¬
ные клетки, которые впослед¬
ствии преобразуются в апи¬
кальную меристему сеянца.
В зависимости от структуры исследователи выделяют две ос¬
новные группы зародышей: бессемядольные и с рудиментарной
семядолей. У бессемядольных видов (большинство орхидных) эм¬
брион прикреплен к семенной оболочке несколькими клетками-
подвесками (Veyret, 1974); при прорастании и дифференциации
зародыша точка роста стебля формируется верхней частью заро¬
дыша.
Как упоминалось выше, эндосперм в семенах орхидных реду¬
цирован, что связывают с отклонением от классического хода
двойного оплодотворения. Многие авторы объясняют это “выпа¬
дением” второго звена оплодотворения, т. е. слияния спермия с
вторичным ядром зародышевого мешка. По мнению Э.С. Тере-
хина и соавт. (1969), редукционные изменения эндосперма ор¬
хидных не ведут к его исчезновению как особого вида трофиче¬
ской структуры покрытосеменных растений. Его роль ограничи¬
вается ранними фазами онтогенетического развития молодого
спорофита. Приведенные данные согласуются с результатами,
полученными В.А. Поддубной-Арнольди. Кроме того, в этих ра¬
ботах показано, что редуцированный эндосперм орхидных харак¬
теризуется высоким содержанием пероксидазы, цитохромоксида-
зы, полифенолоксидазы и обладает повышенной дегидрогеназ-
ной активностью; в его состав также входят аскорбиновая кисло¬
та и SH-группы.
Питание развивающихся зародышей осуществляется с помощью
подвесочных гаусторий, которые способствуют притоку питатель¬
ных веществ из тканей нуцеллуса и покровов семяпочки к зароды¬
шевому мешку (рис. 3.6). В подвесочной гаустории сосредоточены
Рис. 3.6. Халазальный конец семени
Laelia rubescens Lindl.
129
ОБЩАЯ ЧАСТЬ
пластические и физиологически активные вещества, ферменты и
витамины; в ее цитоплазме обнаружены зерна крахмала, белки,
аминокислоты, капли жира (Поддубная-Арнольди, 1976).
В созревшем семени питательные вещества содержатся толь¬
ко в зародыше и особенно в клетках, лежащих в верхней его
части. Наибольшую часть резерва питательных веществ состав¬
ляют липидные и белковые соединения, а вот углеводы в них не
обнаружены (Harrison, 1977).
3.3.2. Микотрофность спорофита орхидных
Орхидные относят к растениям, для которых парт¬
нерами по паразитическому симбиозу являются некоторые груп¬
пы грибов, образующие микоризу (Raven et al., 1987). Семенное
размножение у многих микопаразитных растений характеризует¬
ся резким усилением г-стратегии: они производят подчас огром¬
ное количество семян с редуцированными зародышами.
С одной стороны, степень микотрофности в онтогенезе ор¬
хидных — очень динамичная величина. Растения-микопаразиты об¬
мениваются с грибами различными метаболитами (Терехин, 2000).
До сих пор нет единого мнения о том, насколько они облигатны.
С другой стороны, если рассматривать биологию тропикогенных
орхидных в контексте их размножения в асептических условиях,
то, вероятно, можно сказать, что многие из них — необлигатные
микотрофы.
Известно, что наличие мицелия у совместимого микосимби¬
онта не является достаточным условием для прорастания семян
Cypripedium L. Возможно, оно стимулируется несимбиотической
почвенной микрофлорой или физическими факторами (измене¬
ние окислительно-восстановительного потенциала среды и пр.).
Поскольку сочетание условий, благоприятствующих прораста¬
нию, встречается редко, то и процент прорастающих семян не¬
значителен (Куликов, Филиппов, 2000).
Вероятно, степень специфичности эндофитной микрофлоры ор¬
хидных может быть различной. Так, выявлены примеры как стро¬
гой приуроченности отдельных видов грибов определенным ви¬
дам орхидных (Ramsay et al., 1986), так и более “свободных” от¬
ношений в системе гриб—орхидея (Dijk, 1988). По некоторым
данным, прорастание отдельных нетропических видов орхидных
может стимулироваться целыми группами видов эндофитных сим¬
бионтов из определенных родов и даже грибами, мицелии кото¬
130
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
рых морфологически абсолютно не схожи с мицелиями традици¬
онных сожителей (Андронова и др., 2000).
Результаты наших исследований свидетельствуют в пользу из¬
ложенных выше фактов. На протяжении многих лет нами высаже¬
ны десятки тысяч ювенильных растений сотен видов орхидных. В
большинстве случаев растения нормально преодолевали период
постасептической адаптации и в дальнейшем хорошо приспосабли¬
вались к условиям оранжерей. Высадка проводилась в субстраты (на
блоки), в которых никогда ранее не произрастали орхидеи. Поло¬
жительный результат подобных опытов показывает, что большин¬
ство видов тропикогенных орхидных могут вступать во взаимоот¬
ношения с неспецифическими группами грибов умеренной зоны.
Нами установлено, что процессы прорастания многих тропи¬
ческих видов в условиях асептической культуры определяются
наличием в питательной среде тех или иных фитогормонов и их
композицией. Как правило, это видоспецифические критерии,
однако можно говорить об общем положительном влиянии эк¬
зогенных ауксинов и цитокининов на процессы инициации про¬
растания и дальнейшего развития сеянцев в асимбиотической
культуре. Также можно согласиться с утверждением некоторых
авторов (Stoutamire, 1974), не исключающих возможность пере¬
дачи фибами экзогенных гормонов, необходимых для развития
проростков орхидей. Этим, вероятно, и обусловлено специфич¬
ное отношение некоторых видов орхидных к определенным ви¬
дам симбиотических фибов. Подобным образом можно интер¬
претировать и избирательность орхидных по отношению к раз¬
личным фуппам сахаров.
Исследования начальных стадий процессов онтоморфогенеза
тропикогенных видов in situ, как и видов умеренной зоны, за¬
труднительны (малый размер протокормов, большая область их
потенциального месторасположения и пр.), поэтому ответы на мно¬
гие вопросы могла бы дать симбиотическая культура орхидей.
В работах А.А. Захаровой показано, что у некоторых видов уме¬
ренной зоны темпы роста сеянцев в симбиотической культуре в
несколько раз больше, чем в асимбиотической (Zakharova, Batygina,
1996). Есть данные, что варианты онтогенеза сеянцев in vitro мо¬
гут существенно отличаться от таковых in situ (Куликов, 1995;
Филиппов, 1997). Это может выражаться в формировании вто¬
ричных протокормоподобных сфуктур и прочих отклонениях как
морфологического, так и фенологического характера. У боль¬
шинства нетропических видов в условиях культуры in vitro сохра¬
131
ОБЩАЯ ЧАСТЬ
няется четкая периодичность развития, которая, как правило, сов¬
падает с таковой в природных условиях.
Мы также наблюдали подобные закономерности при семен¬
ном размножении in vitro Calanthe vestita Lindl. и Dendrobium pari-
schii Rchb.f. Цикличность феноритмов у сеянцев этих видов в
асептических условиях частично или полностью совпадает с рит¬
мами развития генеративно зрелых растений в условиях оранже¬
рей (Буюн, Будак, 1986; 1ваншков, 2002).
По мнению Т.Б. Батыгиной (1980), гриб, проникающий в ба¬
зальную часть недифференцированного зародыша, нарушает его
целостность и вызывает дезинтеграцию. Это проявляется в уси¬
лении митотической активности клеток зародыша, а также в некро¬
зе некоторых из них. После инфицирования в клетках зародыша
исчезает крахмал, который превращается в сахар, и увеличивают¬
ся концентрация и осмотическое давление клеточного сока, что,
согласно данным N. Bernard (1909), вызывает прорастание семян.
Гриб служит поставщиком углеводов и витаминов, необходимых,
вероятно, для наращивания массы клеток и их дифференциации.
Интересен факт наличия иммунитета у зародыша орхидных к
симбиотическому грибу, что проявляется в фагоцитозе клубочков
мицелия фиба клетками определенной зоны зародыша. Гриб,
проникая через отверстие на халазальном конце семени, заполняет
клетки задней части зародыша, сливаясь в плотные клубочки
(цит. по: Мафу, 1949), и стимулирует, как правило, его бысфое
развитие. Образовавшиеся клубочки не подвергаются переварива¬
нию. Однако после того как мицелий достигает клеток, располо¬
женных непосредственно позади зоны усиленного роста, образуе¬
мые им клубочки почти сразу перевариваются; в результате зара¬
жение перестает распросфаняться и проростки более не изменя¬
ются. С этого момента фагоцитарная функция переходит к точно
локализированным клеткам вполне определенной зоны молодого
растения.
Такие специализированные фагоциты различимы даже до на¬
чала проникновения фиба по их многолопастным ядрам, анало¬
гичным ядрам лейкоцитов животных с наиболее активной фагоци¬
тарной функцией (цит. по: Батыгина, Васильева, 1980).
Взаимоотношения орхидеи и фиба изучаются давно, однако
и сегодня существует целый ряд невыясненных вопросов. На¬
пример, насколько тесна эта связь? Возможно, она основывается
лишь на отсутствии в клетках проростка специальных фермент¬
ных систем, которые переводили бы питательные вещества в дос¬
132
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
тупные для ювенильного растения формы — поли-, моносахари¬
ды и пр. Возможно, утрачены (полностью или частично) систе¬
мы, которые синтезируют биологически активные вещества, что
связано с редукцией зародыша.
3.3.3. Особенности прорастания семян орхидных
Наиболее интересные адаптивные признаки семей¬
ства орхидных проявляются в области физиологии прорастания
семян. Сложный комплекс совокупности факторов, необходимых
для прорастания, послужил причиной того, что длительное время
семена считали нежизнеспособными. Только в 1804 г. Г. Салис-
бури (цит. по: Veyret, 1974) обнаружил, что семена орхидных мо¬
гут прорастать.
Количество производимых растением семян характеризует
“репродуктивное давление” данной популяции на местообитание
(Злобин, 2000). Логично предположить, что количество ювениль¬
ных растений, которые возобновляются семенным путем (в том
числе и протокормов), в природных популяциях намного больше,
нежели генеративно зрелых особей; это соотношение находится в
определенных границах, стабильно поддерживающих жизнеспо¬
собность популяции.
На примере природных популяций показано (Куликов, Фи¬
липпов, 2000) наличие разных репродуктивных стратегий с пре¬
обладанием семенного или вегетативного размножения либо их
балансом. Вероятно, то же можно сказать и об орхидных тропи¬
ческих и субтропических зонах.
При интродукции у тропикогенных орхидных реальная се¬
менная продуктивность существенно отличается от потенциаль¬
ной. В наших условиях мы никогда не наблюдали прорастания
всех сформированных семян (рис. 3.7).
На примере Calanthe vestita показано, что на всхожесть семян
и их дальнейшую жизнеспособность могут существенно влиять
расположение плода на цветоносе и пространственное распо¬
ложение семени в плоде (Черевченко, 1984; Буюн, 1986).
Неоднородность семян может быть обусловлена не только асин-
хронностью фаз бутонизации, цветения и созревания плодов на
разных ярусах материнского растения, но и абиотическими усло¬
виями, сопровождающими вегетационный период, облиственно-
стью, площадью листьев и их фотосинтезирующей поверхности
(Бебин, 1969).
133
ОБЩАЯ ЧАСТЬ
Рис. 3.7. Всхожесть семян
исследуемых видов Laelia
Lindl. в условиях культу¬
ры in vitro:
а — L. anceps\ б — L. lobata\
в — L. lundii\ г — L. manti-
queirae\ d — L. purpurata; e —
L. rubescens\ ж — L. sincorana
Генетически разнокачественные семена обычно фенотипиче¬
ски неразличимы. С одной стороны, гетерогенность семян обу¬
словлена преимущественно различным происхождением зародыша
(Батыгина, 2000). С другой стороны, одной из причин разнород¬
ности ювенильных популяций у орхидных может быть гетеро-
спермия, которая у этой группы растений проявляется достаточ¬
но ярко (размер и форма семени, наличие или отсутствие заро¬
дыша, степень его развития).
Свойство семян сохранять свою жизнеспособность видоспеци¬
фично и сформировалось в определенных условиях в процессе эво¬
люционного становления каждого вида. Продолжительность жизни
семян разных видов (и не только у орхидных) очень варьирует: от
одного года (и даже меньше) у видов, которые сформировались в
условиях, устойчиво благоприятных для прорастания семян и раз¬
вития проростков, до десятков и сотен лет (Работнов, 1995).
Как правило, семена тропикогенных орхидных, в отличие от
видов умеренной зоны, не имеют периода покоя, что, по-види¬
мому, обусловлено отсутствием структурно-физиологических ба¬
рьеров, препятствующих прорастанию семян сразу же после рас¬
крытия коробочки.
По длительности сохранения жизнеспособности различают
три группы видов: микробиотики (семена сохраняют всхожесть
до 3 лет), мезобиотики (до 15 лет) и макробиотики (свыше
15 лет) (Ewart, 1908). Согласно данной классификации, подав¬
ляющее большинство тропикогенных орхидных — микробиоти¬
ки. Длительность сохранения жизнеспособности семян в почве
связана с наличием у них состояния покоя и может отличаться
от сохранения жизнеспособности в искусственных условиях
(Тихонова, 2000).
Как упоминалось выше, нельзя абсолютизировать условия и
составы используемых нами питательных сред и утверждать, что
фиб предоставляет возможность зародышу орхидеи утилизиро¬
134
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
вать доступные формы углеводов и только в этом заключается
его главная роль.
Напомним, что прорастание семени и установление симбио¬
тических отношений с грибом — взаимозависимые процессы. В
асептической культуре мы заменяем “эффект взаимодействия”
проростка с грибом различными росторегулирующими добавка¬
ми. На неуниверсальность такого приема указывают многочис¬
ленные неудачи в проращивании семян орхидных. По нашему
мнению, в пользу этого не свидетельствуют и приводимые в ка¬
честве доказательств данные о том, что начальные этапы прорас¬
тания семян (поглощение воды, увеличение размеров зародыша,
использование запасных питательных веществ) могут протекать
на средах без сахаров или же просто при увлажнении семян дис¬
тиллированной водой. Дело в том, что все вышеперечисленные
процессы действительно происходят на начальных этапах прорас¬
тания семян (и не только у орхидных), однако они совершаются
пассивно (энергонезависимо) по электрохимическому градиенту
и фактически не свидетельствуют о пробуждении зародыша (за¬
пуске его энергозависимых процессов). По сути, они формируют
необходимую “биохимическую основу” для дальнейшего разви¬
тия зародыша. Однако если последний не получает извне (с по¬
мощью мицелия или вследствие внесения в среду дополнитель¬
ных компонентов) необходимые органические вещества, главны¬
ми из которых являются различные формы углеводов, то на этом
все заканчивается и семена не прорастают.
Исследуя данную проблему, мы все больше склоняемся к
мнению, что нюансов в этом вопросе может быть столько, сколь¬
ко существует видов орхидных, в работе с которыми не получен
позитивный результат. Все это говорит в пользу предположения,
согласно которому семена орхидных обладают комбинированным
типом торможения прорастания, что делает актуальными работы
в области предпосевной обработки семян различными стимуля¬
торами и механической изоляции зародышей из семян с после¬
дующим культивированием in vitro и получением нормального
посадочного материала (Андронова и др., 2000).
Таким образом, для выведения семян из состояния покоя
наиболее эффективным должно быть сочетание факторов, повы¬
шающих проницаемость их покровов и устраняющих физиологи¬
ческие механизмы торможения прорастания.
Прорастание семян и рост проростков у разных видов орхидей
происходит с разной скоростью: семена Epidendrum, Calanthe, Phala-
135
ОБЩАЯ ЧАСТЬ
enopsis начинают прорастать уже на 7—10-е, Paphiopedilum — на 35—
51-е сутки (Черевченко и др., 1982; Залукаева, 1990). Известно, что
лучше прорастают семена из незрелых плодов орхидных (BuigefT,
1936; Linden, 1980; Arditti, 1982; Fast, 1982). Вероятно, стадия разви¬
тия зародыша семени в момент высева может быть определяющим
фактором для получения максимального количества проростков ор¬
хидных in vitro. Данное предположение неоднократно подтвержда¬
лось в работе как с видами умеренной зоны (Андронова, 1988), так
и с тропикогенными орхидными (собственный опыт работы).
По мнению Е.В. Андроновой (1988), механизм торможения
прорастания формируется по мере созревания семян, что и явля¬
ется причиной снижения способности семян орхидных к прорас¬
танию в асимбиотической культуре. Вероятно, характер зависи¬
мости прорастания от стадии развития зародыша и структур се¬
мени видоспецифичен.
В ходе проведенных исследований на примере видов умерен¬
ной зоны выявлена корреляция способности к прорастанию и
состояния клеток интегументов: установлено, что семена могут
прорастать до тех пор, пока клетки интегументов остаются жи¬
выми (Куликов, Филиппов, 1998). В целом, орхидные умеренной
зоны приобретают способность к асимбиотическому прораста¬
нию in vitro на более ранних этапах своего развития, чем пред¬
ставители тропических и субтропических зон.
Принято считать, что механизм торможения прорастания се¬
мян орхидных имеет сложную природу и основывается как ми¬
нимум на двух основных составляющих:
• физиологическое торможение (накопление ингибиторов
прорастания);
• “механическое торможение” (непроницаемость покровов
семян и пр.).
В связи с этим особую актуальность приобретают вопросы
изучения поверхностных структур семенных оболочек орхидных,
линейные размеры которых служат видоспецифическим призна¬
ком (Коломейцева, 2005) (рис. 3.8, 3.9). Для преодоления этих
барьеров можно с успехом использовать (порознь или вместе)
длительное вымачивание в воде (Капо, 1968) либо температурную
стратификацию (Филиппов, 1997).
В наших исследованиях мы достигли увеличения количества
проростков Paphiopedilum Pfitz. при обработке семян растворами
ГК3 и гумата калия в концентрациях 1 и 200 мг/л соответственно.
Однако получить удовлетворительные результаты удалось пока
136
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Рис. 3.8. Семена различных видов орхидей тропической зоны:
а ~~к ^ап[^а plonifolia Andrews; б — Stanhopea wardii Lodd. cx Lindl.; в — Anoectochilus
roxburchu Blume; г — Psichopsiella limminghci Lindl.; d — Paphiopedilum insigne (Wall, ex
Lindl.) Pfitz.; с — Dendrobium parichii Rchb.f.
137
ОБЩАЯ ЧАСТЬ
Рис. 3.9. Семена различных видов орхидей умеренной зоны:
а — Orchys purpurea Huds.; б — Gymnadenia conopsea (L.) R.Br.; в — Dactylorhixja incarnata
(L.) Soo.; г — Comperia comperana (Stev.) Aschers. et Graen.; d — Anacamptis pyramidalis
(L.) Rich.; e — Ophrys 1auric a (Agg.) Nevski
138
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
еше далеко не для всех исследуемых видов, что может быть обу¬
словлено целым рядом причин, о которых на сегодняшний день
известно ничтожно мало.
К примеру, можно предположить, что столь быстрое (во вре¬
мени) снижение процента проросших семян тропических эпифи-
тов _ это биологическая норма. Их коробочки созревают доста¬
точно длительный период (6—12 мес и более); после того как они
вскрываются, семена практически сразу попадают (или нет) в ус¬
ловия, пригодные для прорастания. В связи с этим у данной груп¬
пы видов нет необходимости (и возможности) формировать се¬
менной банк, а следовательно, обеспечивать длительную дееспо¬
собность своих семян. Их системы надежности проявляются на
другом уровне: количество семян; разница в темпах развития од¬
новозрастных растений; полиморфность ювенильных популяций.
Все это мы можем постоянно наблюдать как in vitro, так и ex situ.
У наземных видов орхидных умеренной зоны просматривает¬
ся иная тенденция. Допускаем, что для них имеет смысл форми¬
рование в слое подстилки семенного банка. Следовательно, пе¬
риод их вероятного прорастания должен быть более длительным,
нежели у предыдущей группы. Они могут иметь несколько волн
всхожести (одна из форм системы надежности этой группы ви¬
дов). Так, мы наблюдали данное явление у Paphiopedilum callosum
(Rchb.f.) Stein с разницей в 4—6 мес. В этом случае можно гово¬
рить о биологической разнокачественности семян, которая за¬
кладывается еще в процессе их формирования.
3.3.4. Образование протокорма
Постсеменное развитие зародыша орхидей протека¬
ет необычно, с формированием специфической структуры — про¬
токорма (Батыгина, Васильева, 1980). Протокорм (от греч. protos —
первый, cormos — ствол, побег, клубенек) — клубневидный про¬
росток у орхидных и некоторых птеридиофитов. Синонимы: эм¬
бриональный клубенек, проросток. Этот термин первым ввел
R Treub (1890) для описания структуры клубневидной формы,
развивающейся при прорастании зародыша плауна, который, как
и протокорм орхидных, ведет на ранних этапах микотрофный спо¬
соб существования. Данный термин был впервые использован в
1890 г. для обозначения проростка орхидных (цит. по: Андронова
и др., 2000). Согласно мнению большинства исследователей, про¬
токорм — это проросток, а не зародыш (Терехин, 1979).
139
ОБЩАЯ ЧАСТЬ
У подавляющего количества представителей семейства Orchi¬
daceae на первых этапах развития протокорм не дифференциро¬
ван на органы. На основании литературных данных (Veyret, 1965;
Батыгина и др., 1980) о развитии зародыша и протокорма приня¬
то считать, что процесс образования своеобразного проростка из
недифференцированного зародыша, находящегося в семени, яв¬
ляется многоступенчатым. Он связан с формированием качест¬
венно новой постсеменной структуры.
Развитие зародыша в условиях in vitro сопровождается ростом
апикальной зоны и значительными изменениями базальной. В
условиях in situ это происходит с помощью мицелия гриба, гифы
которого проникают в ткани зародыша.
Для клеток базальной зоны характерны полиплоидия и мно-
гоядерность, что свидетельствует об их высокой метаболической
активности. На более поздних этапах развития зародыша на¬
блюдается полная дегенерация интегументов базальной зоны и
формирование на основе его апикальной зоны протокорма, клет¬
ки которого подразделяются на меристематические, паренхим¬
ные и трихобласты (Батыгина, Васильева, 1983). Как и у заро¬
дыша, в теле протокорма различают апикальную и базальную зо¬
ны (рис. 3.10).
Не существует единого мнения в определении возрастных фаз
орхидных. Считают, что форма протокорма орхидных — таксоно¬
специфический признак (Андронова и др., 2000), т. е. она дает воз¬
можность судить о принадлежности протокорма если не к какому-
либо конкретному виду, то по крайней мере к роду (рис. 3.11).
Разные виды орхидей отличаются по форме и размеру прото¬
корма, что связано с отработанной для каждого вида “крити¬
ческой массой” в процессе эволюции. Ей соответствует “крити¬
ческая масса” меристематического центра, из которого эндогенно
образуется определенного размера почка. Формирование мери¬
стемы будущего побега всегда сопровождается дифференциацией
проводящего пучка, несколько позже происходит закладка корня
(Батыгина и др., 1980).
Закладка первых двух листьев на протокорме трактуется про¬
тиворечиво. Некоторые авторы рассматривают первый лист как
семядолю, второй — как настоящий лист (Bernard, 1909; Veyret,
1965, 1974). Другие считают два первых листовых органа семядо¬
лями (Терехин, 1979), третьи — настоящими листьями (Батыгина
и др., 1988; Batygina, Andronova, 1991). По мнению М.М. Лодки-
ной (1988), это связано не только со своеобразным постсеменным
140
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Рис. 3.10. Внешний вид протокормов Laelia sincorana Schltr. (эпифит, а) и
Laelia iundii Rchb.f. et Warm, (литофит, б)
развитием орхидных, но также с тем, что среди орхидей могут
встречаться разные варианты закладки первого листоподобного
органа.
Исходя из результатов наших исследований, первые листопо¬
добные органы в постсеменном развитии орхидных следует на¬
зывать листьями, так как сам термин “семядоля” достаточно ус¬
ловен; им обозначают первые листья спорофита цветковых рас¬
тений, формирующиеся на эмбриональной стадии развития (Жмы-
лев и др., 2005).
Мы можем констатировать, что в условиях асептической
культуры у тропикогенных орхидных на начальных этапах раз¬
вития формируются протокормы, имеющие более или менее
сферическую форму. У эпифитов протокормы шаровидные, слег¬
ка сжаты в дорсовентральном направлении. У наземных видов
орхидных протокормы, как правило, имеют более вытянутую
форму.
Чем же, с точки зрения биологии развития, может быть обу¬
словлен данный морфологический критерий? Понятно, что фор¬
ма любого живого организма на всех этапах его онтогенетиче-
141
ОБЩАЯ ЧАСТЬ
Рис. 3.11. Внешний вид протокормов и проростков различных видов орхид¬
ных тропической зоны:
а — Cattleya lueddemanniana Rchb.f.; б — Phalaenopsis hybr.; в — Coelogyna viscosa Rchb.f.;
г — Paphiopedilum delenatii Guill.; d — Odontoglossum grande Lindl.; e — Laelia lobata
(Lindl.) Veitch
ского развития — это результат суммирования влияния двух ве¬
личин: комплекса эдафических факторов окружающей среды и
внутренних морфофизиологических характеристик, обусловлен¬
ных генетически. Как было отмечено, протокормы в условиях in
vitro у большинства видов имеют шаровидную форму, которая
142
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
предполагает наличие максимального внутреннего объема при
минимальной наружной поверхности. На ранних этапах развития
для проростка очень важно иметь наименьшие поверхности ис¬
парения и взаимодействия с возможными негативными фактора¬
ми окружающей среды.
В процессе роста протокорм равномерно увеличивается в
размерах во всех направлениях, сохраняя при этом свою форму.
По нашему мнению, это также неслучайно. В природе созревшие
семена, высыпаясь из коробочек, попадают в различные неров¬
ности окружающих поверхностей (эпифиты — в трещины коры,
наземные виды — в слой подстилки), где при благоприятном
стечении целого комплекса факторов (тепло, влага, свет, наличие
мицелия гриба) зародыш семени может продолжить свое разви¬
тие. На данном этапе одна из возможных функций тела прото¬
корма — закрепление спорофита на поверхности субстрата. Ка¬
ким образом это может сделать протокорм, который не имеет на
своей поверхности никаких сколько-нибудь значительных вырос¬
тов, кроме групп всасывающих волосков в базальной части? Оче¬
видно, равномерно разрастаясь во всех направлениях, он прини¬
мает форму той неровности субстрата, в которую попало семя.
Исходя из подобного толкования становится понятно, почему
протокормы у многих видов in vitro имеют шаровидную форму, а
первый корень большинства эпифитов развивается над телом
протокорма (из пазухи первого или последующих листьев).
У наземных видов можно предположить иную жизненную
тактику: для семени, попавшего в слой лесной подстилки, в роли
лимитирующего фактора выступает свет. Поэтому задача проро¬
стка заключается в том, чтобы занять такое положение в про¬
странстве, при котором он бы имел доступ к данному жизненно
важному ресурсу. Определенные предпосылки для этого у него
имеются (запас питательных веществ и микотрофные отношения
с грибом, который некоторое время способен обеспечивать рост
и развитие протокорма). Этим, на наш взгляд, можно объяснить
вытянутую форму протокормов у наземных видов орхидных и
более позднее формирование их фотосинтетических систем, не¬
жели у эпифитов.
Полученные нами данные прямо свидетельствуют об угнетаю¬
щем влиянии света на начальных этапах прорастания семян назем¬
ных орхидей (Лаврентьева и др., 2003). Отсюда может следовать и
еще один очень интересный вывод: симбиотические взаимоотноше¬
ния у наземных видов орхидных должны быть более тесными, чем
143
ОБЩАЯ ЧАСТЬ
у эпифитов. Это подтверждает и тот факт, что протокормы неко¬
торых видов Ciprypedium L. из умеренной зоны могут находиться
под землей по несколько лет. В данный период, вероятно, мице¬
лий гриба выступает как основной источник питательных ве¬
ществ.
Таким образом, говорить о специфичности формы протокор¬
мов (во всяком случае, у тропикогенных видов) можно достаточ¬
но условно. В результате их формирования и развития образуется
биполярная структура — проросток орхидных. Зародыш, пророс¬
ток и структуры, дифференцирующиеся на протокорме, необхо¬
димо рассматривать как единую систему, сохраняющую опреде¬
ленный гомеостаз. Изменяя факторы внешней среды, можно вы¬
звать его нарушение; эти факторы целесообразно использовать
для управления онтогенезом орхидных, в частности для их раз¬
множения.
Апикальная часть протокорма состоит из мелких клеток, пред¬
ставляющих собой апекс побега. Базальная его часть функциони¬
рует как “запасающий орган”, включает крупные паренхимные
клетки (рис. 3.12) и покрыта волосками (1ваншков, 2001) (рис. 3.13).
Тип волосков, образующихся на протокорме и корне, одинаков:
однорядный (Coeloglossum, Dactylorhiza Nevski, Gymnadenia, Orchis)
либо многорядный (Bletilla Rchb.f., Dendrobium phalaenopsis, Thu-
nia) (Batygina et al., 1982).
Варианты закладки первого корня сеянцев орхидных могут
быть различными. У одних корни появляются после дифференциа¬
ции органов и имеют адвентивную природу (Andronova, 1997), у
других меристема зародышевого корня закладывается в базаль¬
ной части протокорма (рис. 3.14, см. вклейку).
144
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Рис. 3.13. Ризоидальный комплекс
протокорма Laelia purpurata Lindl. (про¬
дольный срез, х130)
Продолжительность жизни
протокорма значительно варьи¬
рует у различных видов (и даже
в пределах одного вида). В не¬
которых литературных источни¬
ках указывается, что “запасаю¬
щий орган” протокорма дегенерирует сразу же после формирова¬
ния первого корня (Batygina et а!., 1982). Однако исходя из опыта
собственных наблюдений за развитием тропикогенных видов in
vitro, мы не склонны утверждать это столь категорично. Во-пер¬
вых, в условиях in vitro у некоторых видов протокорм может су¬
ществовать довольно продолжительный срок — год и даже более
(Cattleya Lindl., Laelia Lindl., Odontoglossum H.B.K., Paphiopedilum
Pfitz.). Во-вторых, как мы уже отмечали, места закладки первого
корня могут существенно отличаться.
Процесс вегетативного размножения часто приводит к парти-
куляции растений. Прегенеративная партикуляция обычно со¬
провождается выраженным омоложением потомства. Предельная
длительность жизни, темпы роста и развития вегетативного по¬
томства сильно варьируют у разных видов и, по-видимому, опреде¬
лены генетически (Барыкина, 2000; Шорина, 2000).
Существуют также различные мнения об оценке процесса
формирования многочисленных точек роста на протокорме. Од¬
ни исследователи расценивают этот процесс как своеобразную
форму полиэмбрионии (Черевченко и др., 1986), другие (Батыги¬
на и др., 1980) отличают эмбриоидогенез от процесса органогене¬
за, имеющего место в протокорме. Полиэмбриония известна у
многих видов орхидных, но в этом случае большое количество
эмбриоидов образуется из разных клеток семяпочки и самого за¬
родыша.
Вероятно, образование вторичных протокормов можно рас¬
сматривать как особый вид партикуляции. В наших исследовани¬
ях мы наблюдали спонтанное формирование большого их количе¬
ства на теле первичного протокорма; впоследствии они отделя¬
лись и формировали самостоятельные растения. Насколько этот
процесс in vitro адекватен прохождению подобных стадий in situ —
вопрос дискуссионный и требует дополнительных исследований.
145
ОБЩАЯ ЧАСТЬ
3.3.5. Морфогенез
Обобщая результаты наших наблюдений, получен¬
ные при изучении онтогенеза сеянцев тропикогенных видов ор¬
хидных, мы условно выделяем два основных варианта прохожде¬
ния начальных этапов морфологического развития, которые
можно наблюдать в культуре in vitro (рис. 3.15).
В первом случае из семян формируются протокормы, имею¬
щие одну точку роста. Далее из них образуются сеянцы, для ко¬
торых на первых этапах развития присущ моноподиальный тип
роста и ортотропный характер нарастания вегетативной сферы.
Установлено, что эти сеянцы, как правило, не образуют вторич¬
ных протокормов. В дальнейшем они формируют побеги второго
и последующих порядков, а по достижении определенного воз¬
раста и размера их первыми переводят в септические условия.
Во втором случае деятельность апикальной меристемы пер¬
вичного протокорма тормозится. Вместо этого наблюдается ак¬
тивное образование новых меристематических центров на теле
протокорма, что приводит к формированию конгломератов вто¬
ричных протокормов. Последние либо приступают к процессам
органогенеза, либо продуцируют себе подобных.
В случае развития протокормов по второму варианту срок
культивирования растений in vitro увеличивается в 2 раза и боль¬
ше. Процент таких индивидуумов у различных видов значительно
варьирует (рис. 3.16). Так, у L. lundii в наших условиях мы вооб¬
ще не наблюдали формирование вторичных протокормов. В
культуре in vitro этот вид мы размножали, отделяя побеги второго
и последующих порядков. В то же время, например, сеянцы L. sin-
согапа развиваются преимущественно по второму варианту.
Таким образом, в стерильной культуре размножались экземп¬
ляры, которые активно продуцировали вторичные протокормы,
что, по-видимому, не характерно для этих видов в природных
условиях. По сути, мы отбирали только определенные варианты
генотипа. Подобный способ размножения чрезвычайно эффекти¬
вен и позволяет поддерживать культуру многие годы. Понятно,
что в этом случае мы уже имеем дело не с уникальными в гене¬
тическом отношении растениями, а с определенными генотипа¬
ми — клонами. Причем чем дольше поддерживается культура,
тем более моногенной становится популяция in vitro. Это связано
с искусственным отбором “наилучших” растений с наибольшим
коэффициентом размножения, которые в дальнейшем использу-
146
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
In vitro
2-й вариант 1-й вариант
Ex vitro
Рис. 3.15. Схема возможных вариантов начальных этапов онтогенеза сеянцев
тропикогенных видов орхидных в условиях культуры in vitro (объяснение в
тексте)
147
ОБЩАЯ ЧАСТЬ
Рис. 3.16. Процентное со¬
отношение индивидуумов
каждого из исследуемых
видов Laelia Lindl., имею¬
щих различные варианты
начального развития в он¬
тогенезе в условиях куль¬
туры in vitro:
а — L. anceps\ б — L. lobata\
в — L. lundir, г — L. manti-
queirae\ d — L. purpurata\ e —
L. rubescens\ ж — L. sincora-
na\ вариант развития. 1 —
первый, 2 — второй
ются как маточники. В данной ситуации исследователь выступает
в роли одного из главных факторов канализирующего отбора,
вектор направленности которого, скорее всего, не совпадает с
направлением вектора эволюционирования вида в целом.
На примере каллусных культур показано, что клетки с ис¬
ходным вариантом генотипа в культуре in vitro практически не
растут; они гибнут на первых этапах культивирования (Кунах, 1974,
1979, 1998, 1999). Кроме того, установлено, что экзогенными
гормонами, их предшественниками и синтетическими аналога¬
ми можно регулировать генетическую структуру популяции in
vitro, уровень и спектр ее хромосомных аберраций (Захленюк и др.,
1986; Соловьян и др., 1989). На организменном уровне все клетки
находятся в тесной субординации. Однако факт гибели части сеян¬
цев на ранних этапах онтогенеза, а также наличие нескольких ва¬
риантов начальных этапов онтоморфогенеза и акселерация се¬
янцев свидетельствуют, что изменчивость, наблюдаемая нами in
vitro, является следствием как минимум физиологической адап¬
тации, которая влечет за собой адаптацию морфологическую.
Логично допустить, что в сеянцах происходят и специфические
перестройки генома, однако, как было показано на клеточном
уровне, значительное количество генетических изменений, ко¬
торые тестируются в культивируемых in vitro клетках, не иден¬
тифицируются в жизнеспособных растениях-регенерантах (Ку¬
нах, 2001). Следовательно, эти изменения носят обратимый ха¬
рактер.
Безусловно, адаптация сеянцев к условиям in vitro — слож¬
ный и многоступенчатый процесс. Он в определенной степени
усложняется и тем фактом, что для каждого этапа онтогенеза
148
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
характерно определенное структурно-функциональное состоя¬
ние и соответствующий ему гормональный статус. Условия
культивирования в большинстве случаев подбираются эмпири¬
чески. В состав питательных сред вносят не только необходимые
макро- и микроэлементы, но и различные регуляторы роста, в пер¬
вую очередь фитогормоны. Таким образом, гормональная система
сеянцев испытывает на себе массированный прессинг экзоген¬
ных гормонов и прочих абиотических факторов окружающей
среды. Визуальное проявление этих процессов мы можем на¬
блюдать в виде различных вариантов начальных этапов онто¬
морфогенеза.
Соотношение количества сеянцев, развивающихся по перво¬
му и второму варианту, зависит не только от комплекса абиоти¬
ческих факторов, воздействующих на растения, но и от их видо¬
вой принадлежности, т. е. в основном определяется взаимодейст¬
вием системы генотип—питательная среда.
В работах (Куперман, 1977; Черевченко и др., 1986) указыва¬
ется на наличие у некоторых орхидных, прошедших период асим¬
биотической культуры, необычных индивидуумов — гиперморф.
Их численность по отношению к общему количеству сеянцев не¬
велика (до 0,5 %); темпы роста и развития in vitro и в течение не¬
которого времени после высадки в оранжереи существенно от¬
личаются от таковых у обычных растений. Однако по прошест¬
вии определенного времени после высадки в субстрат (Cymbidi¬
um sp. — до 2 лет) циклы их роста и развития нормализуются и
синхронизируются с циклами нормальных растений. Подобные
явления мы склонны рассматривать как пример морфофизиоло¬
гической адаптации, иллюстрирующий пластические реакции ор¬
хидных под воздействием смещения баланса фитогормональной
системы.
Преимущества метода клонального размножения растений
неоспоримы, особенно в промышленном цветоводстве. Однако
вопрос о его применении как основного при размножении ред¬
ких и исчезающих видов растений, по нашему мнению, доста¬
точно дискуссионный. Полагаем, оно оправдано только в том
случае, если в распоряжении исследователей находятся единич¬
ные экземпляры, которые не могут быть размножены половым
путем. Отдавая приоритет клональному размножению, мы тем
самым существенно снижаем уровень гетерогенности популяций,
которые будут воссозданы в дальнейшем из таких экземпляров.
На наш взгляд, это важный момент, на который следует обратить
149
ОБЩАЯ ЧАСТЬ
внимание при разработке методик размножения как in vitro, так и
ex situ (вегетативное размножение растений).
Исходя из изложенного выше, мы считаем метод семенного
размножения представителей природных видов Orchidaceae Juss.
в культуре in vitro однозначно более предпочтительным.
3.3.6. Влияние состава питательной среды
на морфогенез
Подбор питательных сред является важным эта¬
пом, так как дифференциация зародыша происходит во время
прорастания семян, а рост проростков и векторность процесса
органогенеза во многом зависят от их состава. В настоящее вре¬
мя наиболее часто используются питательные среды Кнудсона.
Многочисленные исследователи и практики пытаются улучшить
культуральные среды и приспособить их к требованиям отдель¬
ных видов орхидей (Кушнир и др., 1981, 1983).
Известно, что оптимальная концентрация минеральных со¬
единений зависит от вида растений. Так, семена Paphiopedilum
лучше прорастают на среде МС с 1/4 концентрации солей (Pierik
et al., 1988). Однако многие виды орхидей могут адаптироваться к
различным уровням концентрации среды: от очень низких (с ос¬
мотическим давлением 2,6 атм) до высоких (10,4 атм). Большое
значение для роста сеянцев имеют формы солей азота — нитрат¬
ная (NOj) или аммиачная (NH4). Катион NH4 необходим для
развития семян Vanilla, Cymbidium, Paphiopedilum, в то время как
для семян Vanda он токсичен (Arditti, 1967).
Как уже упоминалось, аммиачная форма азота способствует
росту видов, в метаболизме которых превалируют гетеротрофные
процессы (сапрофиты); она может без преобразований включать¬
ся в метаболизм и, кроме того, необходима на ранних стадиях
развития проростков. Нитратная форма особенно нужна расте¬
ниям, которые питаются преимущественно автотрофно.
Орхидные относят к группе лейкоэмбриофитов — растений, в
зародыше которых хлоропласты не формируются ни на одной из
фаз эмбриогенеза; их образование происходит одновременно во
всех клетках протокорма на определенной фазе развития пророст¬
ка (Жукова, 1997). Длительность периода, по истечении которого
в клетках протокормов начинают формироваться фотосинте-
тические системы, видоспецифична. На рис. 3.17 показана дина¬
мика изменения диаметра протокормов 4 видов рода Laelia Lindl.
150
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
Время, сутки
Рис. 3.17. Динамика увеличения диаметра (d) протокормов различных видов
Laelia Lindl.:
I — L. lobata; 2 — L. purpurata\ 3 — L. lundii; 4 — L. sincorana
Моменты начала интенсивного увеличения диаметра тел прото¬
кормов совпадают с началом формирования собственных фо¬
тосистем проростками и переходом к автотрофному способу пи¬
тания.
В результате ультраструктурных и гистохимических исследо¬
ваний показано, что для превращения протокормов орхидей в
автотрофные растения необходим внешний источник углеводов,
так как ферментные системы гликогенеза ими, по всей вероятно¬
сти, утрачены (Harrison, 1977). Для проращивания семян орхидных
к питательным средам также нужно добавлять один из сахаров.
Природа углевода, вводимого в состав питательной среды, зависит,
как правило, от вида орхидей: некоторые из них способны асси¬
милировать различные сахара, другие более избирательны.
Как показывает наш опыт, большинство орхидных успешно
развиваются при наличии в среде сахарозы. Однако для форми¬
рования проростков Vanilla и Cypripedium необходимы фруктоза и
глюкоза. Также наблюдаются различия концентрации сахаров. В
ходе наших исследований нашли подтверждение ранее получен¬
ные результаты (Pierik et al., 1988): проростки Paphiopedilum нор¬
мально развиваются лишь на средах с пониженным содержанием
сахарозы.
Сеянцам Cattleya сахароза необходима лишь в первые 20—
30 сут. Последующее развитие может происходить и без нее. Так¬
же показано, что активность фотосинтеза и синтеза рибулозобис-
фосфаткарбоксилазы у сеянцев, растущих на среде без сахарозы,
151
ОБЩАЯ ЧАСТЬ
постоянно возрастает в течение 60 сут; на питательных средах с
сахарозой она значительно ниже (Harrison et al., 1978).
Следовательно, уже на начальных этапах онтогенеза у юве¬
нильных растений сформирована и активно работает система эн¬
догенной внутриклеточной регуляции метаболизма на уровне ак¬
тивности энзимных комплексов. Это позволяет сеянцам оптими¬
зировать процессы роста и развития согласно условиям внешней
среды.
Необходимыми составляющими сред для проращивания се¬
мян орхидных также являются и витамины. Некоторые исследо¬
ватели рекомендуют добавлять в питательную среду тиамин, пи¬
ридоксин, никотиновую и фолиевую кислоты, биотин и рибо¬
флавин. По их наблюдениям, витамины ускоряют прорастание се¬
мян и улучшают рост проростков цимбидиума (Prasad, Mitra, 1975).
Установлено, что некоторые виды орхидей специфически реа¬
гируют на определенные витамины. Так, сочетание никотиновой
кислоты и ИУК стимулировало прорастание семян и рост сеян¬
цев Cattleya (Черевченко и др., 1986). По мере роста сеянцев раз¬
личия с контрольным вариантом исчезали, что может быть свя¬
зано с возрастанием синтеза ростактивирующих веществ при
формировании сеянца.
В большинстве случаев витамины ускоряют прорастание се¬
мян и развитие сеянцев, стимулируют органогенез проростков.
Так, биотин улучшает развитие протокормов Paphiopedilum и уве¬
личивает их способность образовывать хлорофилл (Arditti, 1967).
N. Ueda и N. Torikata (1968) выявили существенную корреля¬
цию влияния света и наличия в среде витаминов В2, С и биотина
при развитии сеянцев цимбидиума. На свету развитие шло по пути
протокорм -> образование стеблей -> образование корней -> целое
растение, а в темноте формировались лишь побеги без корней. До¬
бавление кинетина и аргинина способствует росту стебля и ин¬
дуцирует образование корней у большинства видов в темноте.
Важным фактором является наличие в среде регуляторов рос¬
та. Подбирая соотношение и концентрацию этих веществ, можно
регулировать их формообразовательные процессы. Низкие кон¬
центрации ауксинов усиливают действие цитокининов, направ¬
ленное на образование адвентивных почек, низкие концентрации
цитокининов — корнеобразующее действие ауксинов (Попов,
1976).
У наземных видов орхидей умеренной зоны обнаружена зави¬
симость между ростостимулирующими факторами и температу¬
152
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
рой: при 18—20 °С кинетин (1 — 10 мг/л) и ИУК (1 мг/л) могут
задерживать прорастание Dactylorhiza incarnata (L.)Soo. и других
наземных видов, но усиливают рост протокормов на стадии фор¬
мирования листьев (Черевченко и др., 1986).
Многие исследователи рекомендуют добавлять к питательным
средам вещества неопределенного химического состава: жидкий
эндосперм кокосового ореха (Morel, 1964; Steward et al., 1971),
гомогенат банана (Pierik et al., 1988). Однако данные компоненты
дороги и приемлемы для использования с определенными ого¬
ворками. В связи с этим ведутся поиски недорогих и доступных
добавок к питательным средам. В результате наших исследований
установлено, что в качестве добавок к среде для представителей
родов Cymbidium, Laelia можно использовать картофельный экс¬
тракт и гомогенат банана (Лаврентьева, 1984; 1ваннков та iH., 1999).
В лаборатории НБС НАН Украины на основании многочис¬
ленных экспериментов с более чем 140 видами орхидей была по¬
добрана оптимальная среда для проращивания семян орхидных с
добавлением гумата натрия, пептона и активированного угля (Куш-
нир и др., 1981).
Физиологически активные вещества гумусной природы повы¬
шали энергетический потенциал прорастающих семян, в резуль¬
тате чего увеличивались всхожесть и энергия прорастания. Мо¬
дифицированная нами среда Кнудсона позволяет в 1,5—2 раза
ускорить процесс прорастания и развития сеянцев различных ви¬
дов орхидных.
Каждый вид орхидей культивируют на питательной среде с
определенными значениями pH. Так, среда Бургеффа имеет pH
5,1—5,2 и применима для проращивания семян Cymbidium, Van¬
da, Laeliocattleya. Для Paphiopedilum оптимален pH 5,8—6,0 (Pierik
et al., 1988). В своей повседневной практике для проращивания се¬
мян тропикогенных орхидных мы используем среды с pH 5,5—5,8.
От величины pH зависят структура и активность биологиче¬
ских макромолекул, прежде всего белков (Калинин и др., 1980).
Кроме того, pH влияет на структурную стабильность и доступ¬
ность многих компонентов питательной среды, в том числе со¬
единений железа. Особенно чувствительны к значению pH фи¬
тогормоны и витамины.
153
ОБЩАЯ ЧАСТЬ
3.4. КУЛЬТИВИРОВАНИЕ
В ЖИДКИХ ПИТАТЕЛЬНЫХ СРЕДАХ
Как правило, выбор исследователем питательной
среды является произвольным и определяется различными фак¬
торами. Однако в последнее время было показано, что успех или
неудача в развитии тканевой культуры во многом зависит от то¬
го, какой тип среды (жидкую или агаризированную) применяли
для культивирования. Одни и те же виды растений могут нуж¬
даться в различных формах среды в течение разных фаз развития.
Биология растительной клетки в стерильной культуре в на¬
шей стране изучается давно. Исследования проводятся с ограни¬
ченным количеством клеточных штаммов, полученных от раз¬
личных растений. Видимо, не будет большим преувеличением счи¬
тать, что перевод культуры каллусной ткани в жидкую питатель¬
ную среду и получение стабильной клеточной популяции при
глубинном выращивании приводят к качественно новому состоя¬
нию растительных клеток. На это указывают увеличение скоро¬
сти роста и продуктивности стабилизировавшихся суспензион¬
ных культур клеток (Саркисова, 1973), изменение межклеточных
взаимодействий (Noguchi et al., 1977), приспособление к изме¬
нившимся условиям газового режима и др.
Можно предположить, что с первых же минут цикла перио¬
дического выращивания клеточная популяция находится в стрес¬
совом состоянии вследствие резкого изменения условий сущест¬
вования. Об этом свидетельствует трехкратное увеличение дыхания
клеток. Вероятно, в это время происходит запуск механизмов син¬
теза мРНК, белка, ДНК, реализуемых в лаг-фазе (Маркова и др.,
1979). Лаг-фазу определяют как процесс адаптации клеточной
популяции к новым условиям роста (Бутенко, 1981). Ее длитель¬
ность зависит от количества и физиологического состояния ино-
кулята, а также состава питательной среды, газового режима и
условий перемешивания.
Обычно для получения культуры клеток высших растений
используется культура каллусной ткани. Успех работы во многом
зависит от того, насколько удачно выбрана или подготовлена
каллусная ткань, которая должна быть рыхлой, легко распадаю¬
щейся на небольшие клеточные агрегаты и клетки. Для получе¬
ния культуры клеток берется наиболее жизнеспособная, проли¬
ферирующая часть каллусной ткани, а ее количество должно
быть в 1,5—2 раза больше (с учетом объема питательной среды),
154
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
чем при серийном субкультивировании на агаре. Если каллусная
ткань недостаточно рыхлая, то необходимо разделить ее на не¬
большие кусочки диаметром около 3—4 мм. Питательная среда
может быть та же, что и при культивировании ткани на агаре, но
в некоторых случаях увеличивают концентрацию ауксинов и/или
уменьшают концентрацию цитокининов. Режим перемешивания
и аэрирования при инициации культуры клеток обычно такой
же, как и при дальнейших ее серийных субкультивированиях на
роллерах и качалках.
Образование первичной суспензии растительных клеток мож¬
но считать результатом трех процессов: распада части каллусной
ткани на клетки и небольшие клеточные агрегаты в момент вне¬
сения в жидкую питательную среду; отделения клеток и клеточ¬
ных агрегатов с поверхности кусочков ткани в течение первых
субкультивирований; деления и роста клеток в результате первых
двух процессов и распада разрастающихся клеточных агрегатов на
более мелкие агрегаты и клетки. Последний процесс типичен для
роста стабилизировавшейся культуры клеток высших растений. С
накоплением информации о стабильности статистического рас¬
пределения отдельных клеток и клеток в агрегатах, характере роста
в агрегатах и их форме эти показатели можно будет использовать
как важные признаки штаммов. При первых субкультивировани¬
ях, даже в случае использования рыхлой каллусной ткани, необ¬
ходимо избавиться от крупных агрегатов (Бутенко, 1981).
Изменения клеток in vitro аналогичны возрастным состояни¬
ям растительной клетки in vivo. Так, молодые клетки меристема-
тической зоны корня после ряда делений достигают зоны растя¬
жения, выходят из цикла делений и увеличиваются в размерах. С
возрастом, все более дифференцируясь, они приобретают специ¬
фику окружающих их растительных тканей (Иванов, 1974). Раз¬
нообразие дифференцированных элементов в растительной куль¬
туре in vitro не так велико, как в растении. Несомненно, что от¬
сутствие коррелятивных связей интактного растения, а также ус¬
ловия культивирования сказываются на морфологии и размерах
клеток. Одним из таких факторов является состав среды (Фроло¬
ва, 1981; Кунах, 2005).
Для растительных клеток in vitro характерна изменчивость
формы, размеров и структуры ядер. Эти изменения связаны с
изменениями размеров клеток и плоидности ядер. Растительные
клетки in vitro, как правило, содержат одно ядро и делятся мито-
тически. Величина клетки зависит также от ее возраста: старею¬
155
ОБЩАЯ ЧАСТЬ
щие клетки могут достигать гигантских размеров (500—1000 мкм),
в то время как размеры молодых каллусных клеток небольшие —
15—30 мкм (Бутенко, 1975). Такая морфологическая гетероген¬
ность может быть следствием условий культивирования, видовых
особенностей, возраста и уровня плоидности клеток.
Причины цитогенетической изменчивости до сих пор не яс¬
ны, несмотря на широкую распространенность этого явления и
даже его прикладное применение. В числе возможных можно
привести следующие:
• нарушение коррелятивных связей при выделении первич¬
ного экспланта из растения;
• действие компонентов среды;
• влияние продуктов метаболизма, накапливающихся в среде
при периодическом режиме культивирования;
• гетерогенность исходного материала и селекция клеток оп¬
ределенного типа.
К образованию клеток различного уровня плоидности приво¬
дят эндомитоз и эндоредупликация. Эти процессы, называемые
также эндоциклами, связаны исключительно с клеточной проли¬
ферацией.
Таким образом, морфофизиологическая и цитогенетическая
гетерогенность свойственна растительным тканям in vitro. Ее мож¬
но несколько снизить при постановке эксперимента, если ис¬
пользовать культуры клеток с высоким пролиферативным пулом,
в которых преобладают клетки одного возраста, находящиеся на
одной стадии клеточного цикла, но нельзя избежать совсем. Гете¬
рогенность клеток не является признаком, присущим популяции
только в состоянии in vitro. Диплоидное состояние, типичное для
зиготы, сохраняется у растений в эмбриональных тканях, апексах,
прокамбии, перицикле, а также зародышевой линии, что требуется
для генетического продолжения вида (Фролова, 1981; Кунах, 2005).
Вопрос о стабильности цитогенетической характеристики в
растительных клетках in vitro очень важен, так как эти ткани ши¬
роко используются в качестве модельных объектов и имеют при¬
кладное применение. Поэтому к ним предъявляется ряд требова¬
ний, таких, как стабильное сохранение уровня плоидности, отсут¬
ствие цитологических нарушений, гомогенность состава не толь¬
ко генетическая, но и физиологическая.
Говоря о культивировании растительных тканей на жидких пи¬
тательных средах, необходимо отметить, что обычно первичные
экспланты культивируют на авизированных, реже — жидких пи¬
156
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
тательных средах. Последние часто, но не всегда имеют определен¬
ные преимущества перед агаризированными, так как в них обеспе¬
чивается ббльшая подвижность трофических элементов, их можно
частично или полностью изменять в процессе культивирования.
Среди других особенностей культивирования отметим стиму¬
ляцию развития эксплантов некоторых видов растений при куль¬
тивировании их на жидких или комбинированных питательных
средах. Перемешивание жидких сред осуществляется с помощью
специальных аппаратов — роллера, шейкера, ротора, качалки —
в вертикальном или горизонтальном направлении. Количество
оборотов различно (от 0,5 до 200 об/мин) и определяется каждым
исследователем индивидуально.
G. Morel (1960) выращивал меристематические ткани Cymbidium
на твердой среде. Однако проведенные в последующем многочис¬
ленные исследования показали, что жидкие среды более эффектив¬
ны для индукции каллуса и протокормов. Жидкие среды для выра¬
щивания меристем Cymbidium и других орхидных впервые предложил
D. Wimber. Результаты его исследований показали, что встряхива¬
ние (или перемешивание) способствует образованию многочислен¬
ных центров роста, т. е. тормозит (офаничивает) полярность разви¬
вающейся ткани и тем самым ингибирует развитие побегов.
Жидкие среды способствуют также хорошей аэрации и погло¬
щению поверхностного кислорода. Кроме того, в них более равно¬
мерно распределяются питательные вещества и растворяются токси¬
ческие метаболиты. Применение жидких сред увеличивает поверх¬
ность контакта ткани и питательной среды, обусловливая активиза¬
цию дыхания, а также благоприятствует синтезу белка и поглоще¬
нию солей. Можно успешно выращивать меристемы Cymbidium в
жидкой питательной среде Кнудсона, получая большое количество
протокормов. Сформировавшиеся протокормы затем переносят на
твердую среду, на которой происходит регенерация растений. Таким
образом, можно удачно сочетать две формы питательной среды.
Этот способ культивирования меристематических тканей ор¬
хидных применяли в дальнейшем многие исследователи. Добав¬
ление НУК и вращение со скоростью 5 об/мин способствовало
образованию многочисленных протокормов Cymbidium.
Особо следует сказать о влиянии pH в жидких питательных
средах. Твердые, агаризированные среды обычно не изменяют
pH, а если сдвиги и происходят, то они, как правило, незначи¬
мы. pH жидких питательных сред меняется довольно быстро, что
выражается в потемнении среды и появлении некрозов, а иногда
и гибели меристематических тканей. В этом случае среду либо
157
ОБЩАЯ ЧАСТЬ
заменяют, либо переносят ткани в другие сосуды на новую пита¬
тельную среду. Поэтому жидкие среды требуют более тщатель¬
ного контроля pH, чем твердые. В заключение отметим, что в
основном pH питательных сред для культивирования меристема-
тических тканей орхидных составляет 5,5—5,6.
Несколько иной способ культивирования протокормов цим¬
бидиума в 1973 г. предложил L. Koch, который использовал для
этого длинные трубки (50 х 600 мм). Затем для увеличения аэра¬
ции он пропускал стерильный воздух через трубки со средой и
тканями. При таком способе культивирования коэффициент
размножения увеличивался в сотни раз. За 8 недель масса прото¬
кормов повышалась на 270 %. W. Pieper и К. Zimmer, эксперимен¬
тируя с данной методикой, получили из 15 г протокормов Cymbidi¬
um в начале культивирования около 1 кг протокормов по оконча¬
нии исследования.
Результаты проведенных исследований показывают большую
перспективность этого метода. Однако к его недостаткам следует
отнести громоздкость и сложность необходимой аппаратуры и
увеличение количества обслуживающего персонала.
3.5. ФАКТОРЫ, ВЛИЯЮЩИЕ
НА КУЛЬТИВИРОВАНИЕ РАСТЕНИЙ
При культивировании изолированных тканей ос¬
новными факторами окружающей среды являются свет, темпера¬
тура и влажность. Культивационные сосуды, в которых выращи¬
вают растения, имеют ограниченное сообщение с окружающей ат¬
мосферой, вследствие чего внутри емкостей постоянно поддержива¬
ется высокая влажность. Во многом из-за этого в период постасеп-
тической адаптации страдают растения-регенеранты, так как их
устьичный аппарат и вообще весь комплекс метаболических про¬
цессов, связанных с водным режимом, претерпевают значитель¬
ные перестройки в работе.
Очень часто наибольшее значение для индукции процесса
эмбриогенеза имеют “температурные шоки”. Однако в целом при
культивировании тропикогенных видов in vitrv температуру в куль¬
туральном помещении поддерживают в диапазоне 24—28 °С, что
обеспечивает нормальное протекание метаболических процессов
у большинства видов.
Одним из решающих факторов является свет, в частности
длительность фотопериода и качество света. Освещение необхо¬
димо для регулирования определенных морфогенетических про¬
158
ГЛАВА 3. Теоретические основы размножения растений в культуре in vitro
цессов. Оно играет важную роль в формировании побегов и образо¬
вании корней. Для первого и второго этапов размножения опти¬
мальна освещенность 1000 лк, для третьего — 3000—10 000 лк и фо¬
топериод 16 ч. Применяют также короткие периоды темноты с по¬
следующим продолжительным освещением. В некоторых опытах
показано, что основной компонент видимого излучения, вызываю¬
щий морфогенез, — синий цвет (Maraschige, 1974).
К примеру, для индукции побегов Cymbidium критической ча¬
стью светового спектра является синий цвет. Длинноволновая ульт¬
рафиолетовая часть спектра стимулирует образование побегов цим-
бидиума, инфракрасная — корней. Качество света, его интенсив¬
ность и продолжительность влияют на морфогенез тканей Cym¬
bidium, усиливая или ослабляя их регенерационную способность.
Известно, что свет разного спектрального состава изменяет
гормональный баланс растений. Наблюдаемые морфологические
эффекты, возникающие в растениях под влиянием света разного
качества, позволяют провести аналогию с действием гормонов, а
добавление экзогенных гормонов способно вызывать многочислен¬
ные реакции, которые запускаются фоторецепторами. Такое взаи¬
модействие света и гормонов поднимает вопрос о том, действуют ли
они независимо или гормоны вовлечены в управление фотомор¬
фогенезом. Выяснение механизмов влияния света, гормонов и их
взаимного влияния в регуляции морфогенетических процессов —
один из актуальных вопросов биологии (Мусиенко, 1995).
Экзогенные гормоны воздействуют, изменяя баланс эндоген¬
ных фитогормонов. При клонировании растений необходимо оп¬
тимизировать гормональный состав среды культивирования, что
позволяет уменьшить затраты при размножении in vitro.
Культура in vitro служит удобной моделью для изучения фото-
регуляторных реакций и совместного действия света и экзоген¬
ных регуляторов роста (Бутенко, 1999). Однако данные о влия¬
нии этих факторов на образование пазушных побегов in vitro не¬
многочисленны и противоречивы.
При разработке метода микроразмножения Yucca elephantipes
Regel. доказано специфическое действие красного и синего цвета
на морфогенез и уровень эндогенных гормонов в листьях расте¬
ния, культивируемого in vitro. При культивировании побегов юк¬
ки на свету повышалась концентрация ИУК и гиббереллинов,
что способствовало быстрому укоренению. Однако длительное
воздействие красного цвета излучения угнетало рост побега, об¬
разование хлорофилла и развитие мезофилла; причиной угнете¬
ния роста, вероятно, было повышение уровня свободной АБК в
159
ОБЩАЯ ЧАСТЬ
2 раза. При сочетании видимого излучения с красным цветом отме¬
чали активное развитие побега и корней. Синий цвет не оказывал
существенного влияния на образование новых побегов, зато способ¬
ствовал увеличению концентрации фотосинтетических пигментов.
При рассмотрении совместного действия света и гормонов в
сочетании с синим цветом излучения наблюдали повышение эф¬
фекта экзогенного цитокинина, добавленного в среду культиви¬
рования. На основании полученных данных можно рекомендо¬
вать значительно меньшие концентрации цитокининов при ос¬
вещении белым светом в сочетании с синим цветом, что будет
способствовать уменьшению себестоимости питательной среды.
На этапе укоренения in vitro возможно полное исключение НУК
из среды при действии белого света в сочетании с красным цве¬
том излучения (Немойкина, 2003).
Известно, что от освещения зависит образование воздушных
корней: при его уменьшении или добавлении активированного
угля в среду формируются нормальные корни.
Стимулирующее действие света на образование вторичных
соединений показано на примере каротиноидов, эфирных масел,
коричных кислот, флавоноидов и пластохинонов. Так, лишь вы¬
ращиваемые на свету каллусные ткани эпикарпия различных ви¬
дов цитрусовых способны синтезировать специфические метили¬
рованные флавоны — нобилетин, синензетин, аурантин и др.
(Szubke et al., 1978).
Результаты наших исследований показали, что излучение бе¬
лых и голубых ламп дневного света (марки ЛД-40) угнетает процесс
прорастания семян наземных видов орхидей (Paphiopedilum), в то
время как у эпифитов (Laelia) оно начинается только при условии
освещенности. На наш взгляд, этот факт можно объяснить эко¬
логическими особенностями произрастания видов.
Оптимальная продолжительность фотопериода для каждой куль¬
туры может быть различной (Morel, 1964; Arditti, 1979). К примеру,
органогенез на теле протокормов Cymbidium лучше проходит при
фотопериоде от 16 до 24,5 ч и освещенности 2900 лк. Многие авто¬
ры считают, что наиболее оптимальна для развития изолирован¬
ных тканей температура 25—26 °С. На третьем этапе развития
культуры, когда получены растения, температуру снижают, а ос¬
вещенность увеличивают до 10 000 лк (Попов, 1973; Бутенко,
1975). На скорость развития растений положительно влияет куль¬
тивирование их в климатических камерах.
Специальная
часть
Глава 4
МЕТОДЫ РАЗМНОЖЕНИЯ
ТРОПИЧЕСКИХ И СУБТРОПИЧЕСКИХ
РАСТЕНИЙ В КУЛЬТУРЕ IN VITRO
MAGNOLIOPHYTA
Agavaceae End).
Agave L. Родина — США (южные штаты), Мекси¬
ка, Центральная Америка, острова Карибского мо¬
ря. Насчитывается более 400 видов. Декоративные,
короткостебельные растения; ксерофиты и суккулен¬
ты. Листья жесткие, волокнистые, мясистые, с ши¬
пами по краям. Окраска листьев разнообразна, часто
с мелкими точками и полосами. Цветонос высотой
до 12 м. Семена плоские, черные. Применяется в
озеленении. Размножают семенами, отпрысками, вер¬
хушками стебля.
Agave toureroydes Lem. была размножена в куль¬
туре in vitro, проведены морфологические и гисто¬
логические исследования. Установлено, что раз¬
множение может происходить в четыре стадии:
первая — индукция эмбриогенного каллуса на сре¬
де МС с 2,4-Д и БАП; вторая — формирование
глобулярных структур на среде МС с высокими
концентрациями БАП из вторичных меристем лис¬
товых и стеблевых эксплантов; третья — формиро¬
вание эмбриоидов; четвертая — образование рас¬
тений (Piven et al., 2002).
Изучена также регенерация растений in vitro;
установлено, что от концентрации NOJ и NHJ в
среде зависит образование каллуса и органогенез.
Высокие концентрации цитокининов способству¬
ют образованию адвентивных побегов на стебле¬
вых эксплантах. После получения побегов и суб-
163
СПЕЦИАЛЬНАЯ ЧАСТЬ
культивирования каллус формируется у основания новых побе¬
гов. Побеги образуют корневую систему in vitro в 90 % случаев,
после чего их высаживают в субстрат (Starling et al., 1984; Robert
et al., 1987).
Cordyline Comm, ex Juss. Распространена в тропических и суб¬
тропических зонах Азии, Австралии, Африки и Америки. Из¬
вестно 15 видов. В условиях закрытого грунта проблематично по¬
лучить необходимое количество семенного материала (для пест¬
ролистных форм это вообще неприемлемый способ размноже¬
ния), поэтому чаще всего практикуют черенкование.
Виды и сорта Cordyline в культуре in vitro можно размножить,
используя пазушные почки как растений, полученных в культуре
тканей, так и растений, культивируемых в оранжереях. Напри¬
мер, пазушные почки размером 0,5 х 0,5 см вырезали из молодого
побега Cordyline, растущего в теплице. Их стерилизовали и раз¬
мещали на среде МС с различными комбинациями фитогормо¬
нов. Растения, которые образовались, разрезали на сегменты дли¬
ной 0,5 см и культивировали на среде МС с БАП и НУК. Каллус
получали на среде с 1 мг/л НУК, адвентивные побеги — на среде
с 1 мг/л БАП. Увеличение концентрации БАП до 5 мг/л отрица¬
тельно сказывалось на культурах. Полученные побеги хорошо
укоренялись на среде МС с 0,1 мг/л БАП и 0,1 мг/л НУК
(Kunisaki, 1975).
Эксплантами для микроразмножения могут также служить
верхушки побегов взрослых растений. Сегменты верхушки побе¬
гов (длиной 3 мм) помещали на среду МС с добавлением 3 мг/л
2,4-Д, 100 мг/л мезо-инозита, 10 % кокосового молока, 9 г/л ага¬
ра. На этой среде проходила пролиферация каллуса, а регенера¬
ция побегов — на среде без 2,4-Д. Добавление к основной среде
5 мг/л НУК стимулировало рост корней. В результате за 3 мес
культивирования каждый апекс продуцировал 200—300 растений,
которые переносили затем в вермикулит (Grace, 1978).
В работе Н.В. Менковой и соавт. (1999) изучалось влияние
состава питательных сред на микроразмножение Cordyline и ее
морфогенетическую способность. Для индукции каллусогенеза
лучше использовать среду МС с 0,5 мг/л БАП и 0,25 мг/л 2,4-Д,
а для образования морфогенного каллуса — с 0,5 мг/л БАП и
0,15 мг/л НУК. Побегообразование лучше проходило на среде с
0,1 мг/л БАП и 2,0 мг/л НУК. Для активации роста латеральных
почек лучше добавлять 1,5 мг/л БАП и 0,1 мг/л ИМК. Индукцию
ризогенеза удалось получить, добавляя к среде МС 0,75 мг/л
164
ГЛАВА 4. Методы размножения тропических и субтропических растений
БАП и 0,5 мг/л ИМК. Показано, что длительность периода от
введения экспланта в культуру до получения укоренившегося
растения составляет 8 недель.
Некоторые авторы изучали действие заменителей агара в пи¬
тательной среде на размножение С. fruticosa (L.) A.Chev. in vitro.
Для этого к среде МС добавляли 7,0 г/л бактоагара, 7,0 — агара,
3 0—4,0 — агаргеля, 2,0 — phytogel и 2,0 г/л gelrit. Установлено,
что желатинирующие агенты не влияли на скорость размножения
побегов, но желатиновые калиди (phytogel и gelrit) увеличивали
сырую массу побегов. Показано, что культивирование на замени¬
телях агара снижает концентрацию в среде Mg на 25 %, Са — на
200—300 % (Podwyszynska et al., 1995).
При микроразмножении химерных сортов С. fruticosa может
образовываться больше настоящих и типичных побегов в культу¬
ре in vitro, но при этом не исключена их гибель. Увеличению ко¬
личества таких побегов способствует наличие сахарозы в пита¬
тельной среде. При повышении концентрации сахарозы до 3—
4 % скорость размножения уменьшается, но доля настоящих и ти¬
пичных побегов увеличивается. При концентрации сахарозы 1 —
2 % придаточные побеги образуются в виде маленьких бугорков,
при концентрации 3—4 % побеги или почки развиваются в лег-
коотделяемые экспланты (Lin et al., 1991; Samyn, 1995).
Для микроразмножения С. terminalis cv. Atoom эксплантами
служили пазушные почки взрослых растений, выращенных в ус¬
ловиях теплицы. Их культивировали на разных по составу пита¬
тельных средах с фитогормонами. Показано, что тип и концен¬
трация цитокининов определяют количество дополнительных по¬
бегов, развивающихся из эксплантов. Количество таких побегов
и их размеры связаны отрицательной корреляцией. Из всех ис¬
пытанных цитокининов БА оказался самым эффективным для
индукции дополнительных побегов. Добавление 0,1 мг/л НУК
также увеличивало их количество. По содержанию солей лучшей
средой оказалась МС. Установлено, что мелкие побеги, образую¬
щиеся на эксплантах при наличии БА, медленно развиваются in
vitro, в связи с чем для размножения побегов лучше использовать
кинетин. При этом образуется небольшое количество удлинен¬
ных побегов, которые легко укореняются и приживаются в суб¬
страте (Evaldsson et al., 1985).
Продолжается поиск эффективных заменителей природных
Цитокининов, влияющих на микроразмножение. Так, синтетиче¬
ский цитокинин ТДЗ добавляли к среде МС вместо БАП в кон¬
165
СПЕЦИАЛЬНАЯ ЧАСТЬ
центрации 0,1—5,0 мг/л при размножении Cordyline. Выявлено
незначительное образование почек на растеньицах при концен¬
трации 1 мг/л, а концентрация 5 мг/л оказывала ингибирующее
действие. Конгломераты почек делили на 4—5 частей и переса¬
живали на среду без регуляторов роста, на которой они успешно
укоренялись (Marinova et al., 1992).
Влияние освещенности (1000—5000 лк) и температуры культи¬
вирования (18, 21, 24 и 27 °С) изучали при размножении C.fru-
ticosa. Установлено, что температура должна быть выше 21 °С.
Для Cordyline оптимален самый низкий уровень освещенности —
1000 лк (Hvoslef-Eide, 1990).
С. australis Hook.f. распространена во влажных тропиках и на
влажных равнинах Новой Зеландии. Декоративное высокорослое
дерево. Листья узкие, жесткие, расположены крупным пучком на
верхушке ствола; цветки белые, ароматные. Коэффициент вегета¬
тивного размножения С. australis достаточно низкий. Кроме того,
посадочный материал получается разнородным, что существенно
снижает товарный вид растений.
В связи с изложенным выше мы попытались разработать тех¬
нологию микроразмножения С. australis. В качестве источника
эксплантов применяли части годовалых сеянцев — различные уча¬
стки листа, стебля и корня. Установлено, что для микроразмно¬
жения этого вида удобнее всего использовать части стебля сеян¬
цев, взятые из междоузлий. Процессы каллусообразования ини¬
циируются и активно проходят в темноте. В качестве базовой для
пролиферации каллуса применялась среда Пирика, модифициро¬
ванная добавлением 1,2 мг/л БАП и 0,1 мг/л 2,4-Д. Образование
каллуса наблюдалось только на стеблевых эксплантах. Каллус у
С. australis плотный, блестящий, белого цвета, изначально фор¬
мируется возле травмированных участков. В темноте в верхней час¬
ти каллусных конгломератов проходят процессы морфогенеза.
Этиолированные побеги растений-регенерантов имеют вытяну¬
тые междоузлия (5—8 мм), листовые пластинки редуцированы до
полупрозрачных чешуй, плотно охватывающих своим основанием
междоузлия (рис. 4.1, а, см. вклейку). При перенесении на свет
фотосинтетические пигменты восстанавливаются в течение 7—
9 сут, после чего изменяется характер роста конгломератов
каллусных тканей: процессы закладки и формирования адвен¬
тивных почек в верхних слоях каллусных клеток проходят зна¬
чительно интенсивнее. Из каждого меристематического центра
образуется 4—7 листообразных органов ярко-зеленого цвета длиной
166
ГЛАВА 4. Методы размножения тропических и субтропических растений
15—20 мм. Адвентивные почки закладываются в непосредствен¬
ной близости, поэтому каждый участок каллуса, перенесенный
на свет через 30—35 сут, представляет собой образование в виде
плотной зеленой щетки (рис. 4.1, б). В дальнейшем из участков
размером 10 х 10 мм можно получить 5—7 частей, пригодных для
дальнейшего культивирования. При перенесении сегментов кал-
лусных тканей с меристематическими центрами на среду наблю¬
дается формирование листовых пластинок характерной для юве¬
нильных растений формы. Параллельно формируется корневая
система. Корни закладываются эндогенно и развиваются в толще
питательной среды. Через 55—60 сут после перенесения на
среду МС растения-регенеранты пригодны к высадке в субстрат
(рис. 4.1, в). Ювенильные растения высаживают в стерильный
субстрат торф:перлит:листовая земля (1:1:1). Адаптация растений-
регенерантов к условиям ex situ проходит без осложнений.
С. terminalis Kunth. (С. fruticosa) распространена в Гималаях,
Китае, Северной Австралии, на Гавайских островах. Декоратив¬
ный полукустарник высотой до 2 м. Листья от зеленых до пур-
пурно-красных, ланцетовидные. Цветки белые, лиловые и крас¬
ные. Размножают черенками, семенами и в культуре тканей.
Отечественное промышленное цветоводство нуждается во
внедрении в массовое производство неизменно популярных, а
значит, стабильно реализуемых видов и сортов декоративных
растений. Один из таких видов — С. terminalis, которая благодаря
своему “пальмоидному” облику, сочетающемуся с большим раз¬
нообразием окраски листьев у различных сортов, пользуется по¬
стоянным спросом.
Размножение С. terminalis сопряжено с рядом трудностей. Се¬
менное размножение малоэффективно: во-первых, всхожесть се¬
мян этого вида в условиях закрытого фунта очень низкая, во-
вторых, многие наиболее декоративные разновидности при се¬
менном размножении дают расщепление признаков в потомстве.
С. terminalis довольно хорошо размножается стеблевыми черен¬
ками, однако ввиду того, что эти растения медленно растут и
прирост стебля очень мал, эффективность такого размножения
невелика. Поэтому разработка новых методов размножения дан¬
ного вида является актуальной задачей.
Для микроразмножения в качестве эксплантов использовали
латеральные и апикальные почки побегов взрослых растений,
выращенных в условиях оранжерей. Разработанный нами режим
167
СПЕЦИАЛЬНАЯ ЧАСТЬ
стерилизации обеспечивал получение 50—70 % стерильных экс¬
плантов, которые содержали в культуральном помещении при
температуре 25—26 °С, относительной влажности воздуха 70 %,
фотопериоде 16 ч, освещенности 4000—5000 лк. При температуре
18 °С развитие эксплантов снижалось в 2 раза. По нашим дан¬
ным, наибольшим морфогенетическим потенциалом обладали
пазушные почки размером более 3 мм, выделенные из средней и
апикальной областей облиственной части побегов. Наиболее оп¬
тимальный срок введения эксплантов в культуру in vitro — начало
активной вегетации (апрель—май). Проведенные исследования
позволили нам разработать следующий метод размножения
С. terminalis cv. Kiwi, включающий четыре этапа. Первый — ин¬
дукция образования морфогенного каллуса на среде МС с
0,3 мг/л 2,4-Д. Второй этап — индукция образования побегов из
каллусной ткани на среде МС без гормональных добавок
(рис. 4.2, а, см. вклейку). Третий этап — отделение побегов, по¬
лученных на предыдущем этапе, и пересадка их на среду МС с
2—4 мг/л БА для индукции образования адвентивных побегов из
латеральных меристем, что позволяет получить от 1 экспланта
6—8 новых. Для получения большего количества растений этот
этап можно повторить необходимое количество раз (рис. 4.2, б).
Четвертый этап — индукция ризогенеза на среде МС с 1/2 кон¬
центрации элементов, 1 мг/л БАП и 2 мг/л ИМК. Длительность
каждого этапа — около 3—4 недель. Укорененные растения вы¬
саживают в сфагновый мох и переносят в условия оранжерей для
дальнейшего выращивания. Разработанный метод размножения
позволяет получить до 80 растений-регенерантов от 1 экспланта в
первые четыре месяца и увеличивать их количество в 6—8 раз
каждый последующий месяц (Лаврентьева, Мальцов, 2003).
На первом этапе постасептической адаптации растения-реге-
неранты высаживают в сфагновый мох. Через 60—80 сут их мож¬
но рассаживать в индивидуальные емкости (рис. 4.2, в).
Yucca L. Известно 40 видов, произрастающих в Северной и
Центральной Америке. Декоративное многолетнее растение. Ли¬
стья разной формы, собраны пучком на верхушке, часто с нитя¬
ми и острым шипом на конце. Цветки белые, колокольчатые.
Некоторые волокна листьев применяют при производстве кана¬
тов. Используют в озеленении зимних садов. Размножают семе¬
нами, черенками и отпрысками.
Y. gloriosa L. распространена в южных штатах США. Декора¬
тивно-лиственные вечнозеленые растения с пучками темно-зеленых
168
ГЛАВА 4. Методы размножения тропических и субтропических растений
листьев на концах побегов. Размножают семенами, черенками и
корневыми отпрысками. Растения требуют яркого освещения.
Для регенерации растений использовали среду МС, содержа¬
щую 500 мг/л гидролизата казеина, 3 % сахарозы и 0,9 % агара.
Показано, что увеличение концентрации 2,4-Д в среде до 1 мг/л
стимулировало морфогенез. Интенсивное корнеобразование на¬
блюдали при использовании в среде различных комбинаций ви¬
таминов по Уайту и 1 мг/л 2,4-Д. Регенерацию проростков из
каллусных тканей получали на среде с 1 мг/л 2,4-Д и витамина¬
ми по Стабу (при 25 °С). Увеличение температуры при культиви¬
ровании до 28 °С способствовало повышению морфогенетиче¬
ской способности каллусов Y. gloriosa, образовавшихся из почек.
Каллус получали из почек, культивируя его в темноте, побеги —
на среде МС с 1 мг/л 2,4-Д и витаминами по Стабу (Durmishidze
et al., 1983).
Для микроразмножения Yucca также использовали растения-
регенеранты, полученные in vitro, высотой 2 см и с 2—3 листья¬
ми. Экспланты культивировали на среде МС без гормонов в те¬
чение 1 мес в условиях белого света, красного и синего цветов
излучения. Установлено, что красный цвет повышает уровень
эндогенной ИУК в 2 раза по сравнению с белым светом. По¬
следний способствует укоренению и растяжению побегов. Крас¬
ный цвет увеличивает уровень свободной ГК3 и уменьшает коли¬
чество зеатина и рибозидзеатина; культивирование эксплантов
более 15 сут при его воздействии способствует угнетению расте¬
ний. В целом, красный цвет плохо влияет на культивирование
юкки in vitro. Синий цвет видимого излучения задерживает рост
корней и побегов, увеличивая концентрацию АБК по сравнению
с белым светом. Повышение уровня зеатина в условиях синего
цвета объясняется стимуляцией клеточного деления. Качество
света не влияло на образование пазушных побегов. Устранение
апикального доминирования достигается внесением экзогенных
Цитокининов в сочетании с добавлением БАП. В условиях синего
цвета зафиксирован хороший гормональный баланс для размно¬
жения. Белый свет лучше использовать для роста побегов, крас¬
ный цвет видимого излучения — для укоренения, однако он за¬
держивает их рост. Авторы рекомендуют использовать кратко¬
временное включение красного цвета или применять сочетание
белых и красных ламп при освещении побегов (Kukulczanka et
а1-, 1984; Немойкина и др., 2002).
169
СПЕЦИАЛЬНАЯ ЧАСТЬ
Апикальные и пазушные почки Yucca культивировали на сре¬
де Куарина и Лепуавра с 1/2 концентрации макроэлементов, БА
и низкими концентрациями НУК. Адвентивные побеги были по¬
лучены, когда НУК заменили ИМК. Корнеобразование происхо¬
дило на среде МС с ИМК. Получены также каллус, эмбриоиды,
адвентивные почки, различные корневые структуры (Месхи и
др., 1978; Karpov, 2004).
Семена Yucca перед высевом in vitro выдерживали 12 ч в рас¬
творах стимуляторов — кинетина (0,3 мг/л), 2,4-Д (2,2 мг/л) и ГК3
(1 мг/л). Быстрее взошли семена, обработанные тремя регулятора¬
ми вместе. Семена проращивали на среде Уайта, получая пророст¬
ки. Из образовавшихся сеянцев вычленяли сегменты листьев,
стеблей, корней и культивировали их на среде МС с добавлением,
мг/л: хлорхолинхлорида — 10,0, никотиновой кислоты — 20,0, фи¬
тина — 5,0, гликокола — 200,0, НУК — 0,1, кинетина — 0,5, ГК3 —
0,1, 2,4-Д — 0,5, гидролизата казеина — 600,0. Обязательным яв¬
ляется добавление глутатиона, способствующего поглощению фе¬
нолов, выделяемых в среду (Волошина и др., 1975).
Amaryllidaceae Jaume St.-Hil.
Hippeastrum Herb. Род насчитывает около 75 видов,
распространенных в тропиках Южной Америки. Декоративно¬
цветковые луковичные растения. Цветонос высотой до 70 см с
2—4 цветками разных оттенков белого, розового и красного цве¬
та. Некоторые с запахом. Известно много сортов. Размножают
семенами, детками, делением луковиц и в культуре тканей.
В ряде работ изучалась возможная регенерационная способ¬
ность некоторых культиваров Hippeastrum в культуре in vitro. Ус¬
тановлено, что в культуре тканей собственно регенерация может
идти двумя путями: восстановлением целостного организма из
эксплантов на месте среза и новообразованием на неповрежден¬
ной поверхности экспланта. Различные органы Hippeastrum про¬
являют неодинаковую способность к прямой регенерации. Наи¬
более высокая регенерационная способность у эксплантов из ба¬
зальной части луковицы и запасающих чешуй. Регенерация в
культуре in vitro также зависит от фазы развития растений: в пе¬
риод выхода из покоя она усиливается (Mii et al., 1974; Bose et
al., 1977; Yanagawa et al., 1977; Попов и др., 1984).
Для микроразмножения Hippeastrum в культуре in vitro в каче¬
стве эксплантов использовали также верхушки побегов длиной
170
ГЛАВА 4. Методы размножения тропических и субтропических растений
5 см. Их помешали на среду МС с добавлением 25 мг/л глицина,
2 г/л гидролизата казеина, 9 мг/л 2,4-Д, 1—2 мг/л кинетина. Че¬
рез 6 недель культивирования на эксплантах дифференцировался
каллус, его отделяли и субкультивировали на той же среде. На
среде с 4 мг/л БА происходила регенерация побегов. Из общей
массы было выделено 1 карликовое растение. Оно имело корот¬
кие соцветия и мелкие мужские стерильные цветки. Эти морфо¬
логические изменения сохранялись на протяжении 2 лет микро¬
размножения. Очевидно, было получено растение с самоклональ-
ной изменчивостью (Griesbach, 1989).
Zephyrantes Herb. Представители рода распространены в тро¬
пических и умеренных областях Северной и Южной Америки.
Известно около 40 видов. Мелколуковичные растения. Цветки
крупные, разнообразные по окраске. Размножают вегетативно,
семенами и в культуре тканей.
Для культивирования in vitro использовали сегменты луковиц.
Экспланты выращивали на среде с фитогормонами. Наблюдали
образование побегов из зачатков листьев и апикальной меристе¬
мы. Рост пазушных почек усиливался при их развитии в луко¬
вички на среде МС с 4 мг/л БАП и 1 мг/л НУК. На среде с
2 мг/л кинетина и 400 мг/л гидролизата казеина наблюдали обра¬
зование кластеров луковичек, которые укореняли на среде с
2 мг/л НУК. От одной луковички получали 15—20 новых. Однако
с возрастом культуры ее регенерационная способность снижалась
(Philomena et al., 1987).
Araceae Juss.
В НБС HAH Украины находится одна из самых
многочисленных на территории бывшего СССР коллекций тро¬
пических и субтропических растений семейства Araceae Juss., на¬
считывающая 264 таксона из 33 родов. Значительная часть кол¬
лекции собрана в природных условиях во время экспедиций в
страны, расположенные на территории Палео- и Неотропических
царств (Черевченко и др., 1989).
Интродукционная оценка этой коллекции дает основание счи¬
тать данную группу растений одной из перспективных для озе¬
ленения различных типов интерьеров (Черевченко и др., 1987).
Наиболее ценны в этом отношении растения из родов Anthurium
L., Aglaonema Schott, Dieffenbachia Schott, Caladium Vent., Philoden¬
dron Schott, Spatiphyllum Schott.
171
СПЕЦИАЛЬНАЯ ЧАСТЬ
Изучение биологии развития растений этих родов показало,
что для декоративно-лиственных Anthurium, Aglaonema и некото¬
рых видов Philodendron приемлем семенной способ размножения.
Красивоцветущие Anthurium, Caladium, Dieffenbachia, Philodendron,
Spatiphyllum также могут быть размножены семенами. Однако по¬
лучение семян у этих растений в наших условиях затруднено, а в
семенном потомстве наблюдается сильное расщепление. При
вегетативном размножении (черенкование, деление куста) выход
посадочного материала очень ограничен.
Многие растения из семейства Агасеае Juss. перспективны для
промышленного цветоводства. В настоящее время существует
значительная потребность в здоровом высококачественном поса¬
дочном материале, которую обычные методы вегетативного и се¬
менного размножения не могут удовлетворить. Применение ме¬
тода клонального размножения позволяет получить необходимое
количество растений.
Приведенные литературные данные и результаты собственных
исследований отображают технологию данного метода. К сожа¬
лению, пока не получены результаты культивирования предста¬
вителей других родов этого семейства. Однако используя наши ре¬
зультаты и данные литературных обзоров, можно составить пред¬
ставление об этом методе и с успехом размножить те виды, кото¬
рые будут необходимы.
Aglaonema Schott. Представители данного рода распростране¬
ны во влажных тропических лесах Малайского архипелага, Ин¬
дии. Известно около 50 видов. Это многолетние декоративно¬
лиственные растения с одревесневающим у основания стеблем. У
некоторых видов побеги могут ветвиться. Листья цельные, ланце¬
товидные, зеленые или пестрые. Цветки разнополые, самоопыля¬
ющиеся, собраны в соцветие — початок, в верхней части кото¬
рого расположены мужские, в нижней — женские цветки.
В условиях культуры размножают семенами, черенками или
делением куста. Семена сохраняют всхожесть на протяжении 2 мес.
Получить большое количество посадочного материала в условиях
традиционной оранжерейной культуры достаточно проблематич¬
но. В связи с этим разработка методов микроразмножения видов
рода Aglaonema имеет не только научное, но и практическое зна¬
чение.
Мы исследовали возможность микроразмножения растений
разных генотипов: A. commutatum Schott, A. commutatum ’Pseudobrac-
teatum*, A. marantifolia Blume, Aglaonema ’Silver Queen*. Для размно¬
172
ГЛАВА 4. Методы размножения тропических и субтропических растений
жения отбирали молодые отрастающие побеги длиной 5—10 см. К
сожалению, такие побеги практически наполовину находились в
субстрате, что способствовало проникновению в ткани различ¬
ных патогенов — грибов, бактерий, нематод. Вследствие этого
ткани подземной части побега, как правило, были сильно коло¬
низированы микроорганизмами. Вероятно, ex situ существует оп¬
ределенная связь между корневой системой растений, с одной
стороны, и местными микроорганизмами, с другой, которая мо¬
жет существенно влиять на эффективность стерилизации. Однако
это предположение требует дальнейших исследований.
Большое внимание уделяли разработке режима стерилиза¬
ции — подбору стерилизующих веществ, их концентрации и вре¬
мени действия. В связи с этим побеги перед стерилизацией тща¬
тельно промывали водой со стиральным порошком, протирали
70%-м спиртом и только после этого в стерильном боксе вычле¬
няли экспланты. Части побега с пазушными почками обрабаты¬
вали в определенной последовательности стерилизующими веще¬
ствами. Всего было испробовано 6 вариантов режима стерилиза¬
ции (табл. 4.1).
Полученные данные свидетельствуют о том, что раздельное
использование стерилизующих веществ менее эффективно, чем
совместное. Наибольшее количество стерильных эксплантов бы¬
ло получено при таком соотношении: 2%-й famosept, 20%-я
хлорная известь, 15%-й пероксид водорода. Мы считаем, что вы¬
сокая эффективность комбинации нескольких стерилизующих
веществ обусловлена тем, что каждое из них угнетает определен¬
ный вид микроорганизмов. Несмотря на это, все же 20 % экс¬
плантов остаются инфицированными. Чтобы уменьшить это ко¬
личество, мы повторно стерилизовали экспланты в 20%-м перок¬
сиде водорода или в растворе ампициллина. Однако у 5 % экс¬
плантов не удается избежать внутренней инфекции и очень часто
она сохраняется во всех пассажах. Сходные результаты получены
и в других работах (Frank et al., 1987).
Во многих случаях успех микроразмножения зависит от пра¬
вильного выбора экспланта. В наших исследованиях эксплантами
были сегменты листьев и пазушные почки побегов. Установлено,
что использование сегментов листьев генеративных растений
Aglaonema нецелесообразно, поскольку получить из них каллус
или эмбриоиды не удается. Возможно, это связано с тем, что по¬
сле стерилизации из ткани листа в питательную среду выделяется
173
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.1. Эффективность стерилизации эксплантов Aglaonema
в культуре ткани, %
Коли¬
чество
эксплан¬
тов, шт.
Вид
Вариант
опыта
Концентра¬
ция, %
Aglaonema
’Silver
Queen4
А. сотти-
tatum
A. commutatum
’Pseudobractea-
tum‘
A. maran
tifolia
1
2
1
2
1
2
1
2
Famosept
2
15
40
60
40
60
35
65
40
60
Хлорная
1
15
50
50
5
45
50
50
55
45
известь
Хлорная
известь +
20
15
60
40
60
40
63
37
70
30
+ famosept
Пероксид
20 + 2
15
35
65
35
65
40
60
45
55
водорода
Famosept +
+ хлорная
известь +
+ пероксид
30
15
70
30
70
30
75
25
70
30
водорода
2 + 20+15
15
10
90
10
90
15
85
20
80
Примечание. 1 — инфицированные экспланты, 2 — неинфицирован-
ные экспланты.
жидкость, которая содержит большое количество фенольных со¬
единений. Это тормозит поступление регуляторов роста в ткани
и требует частой смены питательной среды.
Мы исследовали также морфогенетическую способность па¬
зушных почек молодых побегов. Побеги растений были условно
разделены на три части: апикальную, среднюю и базальную, что
позволило изучить поярусную регенерационную способность
эксплантов (табл. 4.2). Как видно из приведенных данных, реге¬
нерационная способность эксплантов зависит от их размещения
на побеге. Наибольшую регенерационную способность имеют
почки базальной части побега, самую низкую — апикальной. Это
можно объяснить тем, что данная способность зависит от возрас¬
та, фитогормонального баланса и емкости почек. Чем большее
количество составляющих элементов имеет почка, тем выше ее
регенерационная способность. Полученные нами результаты в
некоторой степени отличаются от данных других исследователей.
Возможно, они изучали другие виды Aglaonema, что и объясняет
174
ГЛАВА 4. Методы размножения тропических и субтропических растений
различную реакцию в культуре ткани. Только у A. commutatum
’Pseudobracteatum1 регенерационная способность была немного
ниже, чем у других видов.
Следует отметить, что медленный рост изолированных куль¬
тур всех генотипов Aglaonema является одним из сдерживающих
факторов при их микроразмножении. Попытка ускорить разви¬
тие эксплантов путем добавления к питательной среде гибберел-
лина не имела положительного результата ни у одной из культур.
Изолированные ткани и экспланты Aglaonema культивировали на
питательных средах Пирика и МС, модифицированных добавле¬
нием 0,5—1,0 мг/л 2,4-Д, 2—5 мг/л БАП, 1—2 мг/л НУК, витами¬
нов, 2—80 мг/л аденина, 1 г/л активированного угля (табл. 4.3).
Нами не выявлена стимуляция развития эксплантов при внесе¬
нии в среды разных концентраций 2,4-Д, БАП, и только добав¬
ление 80 мг/л аденина значительно ускорило их развитие и обра¬
зование растений. Интенсивность роста и развития эксплантов
разных видов на питательных средах практически одинакова.
На эти процессы в культуре ткани влияют и некоторые другие
факторы. Так, при культивировании следует учитывать, что боль¬
шинство сортов — гибриды с измененным количеством хромосом.
Одни сорта стерильны, другие проявляют значительный апо-
миксис. Ткани пестролистных форм отличаются низкой ассими¬
ляцией и продолжительностью жизни. Поэтому все виды Aglaone¬
ma относятся к растениям с низким коэффициентом размноже¬
ния. Учитывая это, были предприняты попытки ускорить рост
культур путем изменения условий культивирования, поскольку,
как было упомянуто выше, модификация питательных сред вслед¬
ствие добавления ростактивирующих веществ не всегда эффектив-
Таблица 4.2. Регенерационная способность эксплантов Aglaonema
в культуре ткани, %
Положение
Количество
Вид
эксплантов
на побеге
эксплантов,
шт.
Aglaonema
’Siver Queen‘
A. commu¬
tatum
A. commutatum
’ Pseudobracteatum4
A. maran-
tifolia
Апикаль¬
ная часть
Средняя
10
60,0
80,0
60,0
70,0
часть
Базальная
15
86,6
80,0
73,3
86,6
часть
18
88,8
83,3
77,7
88,8
175
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.3. Состав питательных сред для культивирования
эксплантов рода А
glaonema, мг/л
Среда
Компонент
Мурашиге-
-Скуга
Пирика
Культивирование
Регенерация
Культивирование
Регенерация
эксплантов
побегов
эксплантов
побегов
nh4no3
1650,0
825,0
1900,0
1900,0
KNO,
1900,0
1900,0
950,0
950,0
CaCI2 2Н20
440,0
440,0
440,0
440,0
MgS04 7Н20
370,0
370,0
370,0
370,0
КН2Р04
170,0
170,0
85,0
85,0
Н3В03
6,2
6,2
6,2
6,2
MnS04 4Н20
22,3
22,3
22,3
22,3
СоС12 6Н20
0,025
0,025
0,025
0,025
CuS04 Н20
0,025
0,025
0,025
0,025
ZnS04 7Н20
8,6
5,6
8,6
8,6
Na2Mo04 2Н20
0,25
0,25
0,25
0,25
KI
0,83
0,83
0,83
0,83
FeS04 7Н20
27,8
27,8
27,8
27,8
№2ЭДТА 2Н20
37,3
37,3
37,3
37,3
Тиамин
0,1
0,1
0,1
0,1
Пиридоксин
0,5
0,5
0,5
0,5
Никотиновая
кислота
0,5
0,5
0,5
0,5
Мезо- инозит
100,0
100,0
150,0
200,0
Глицин
2,0
2,0
2,0
2,0
Аденинсульфат
2,0
80,0
1,0
5,0
НУК
2,0
2,0
0,5
1,0
Активирован¬
ный уголь
1000,0
1000,0
1000,0
1000,0
Сахароза
20 000,0
20 000,0
20 000,0
20 000,0
pH
5,6
5,8
6,0
6,0
на. В связи с этим мы изменяли количественные показатели фо¬
топериода (с 16 до 10—12 ч) и температурного режима (от 24 до
28 °С), пытаясь воссоздать более близкий к природным условиям
произрастания данных видов режим культивирования. Это уско¬
ряло развитие эксплантов на питательной среде (рис. 4.3, а,
см. вклейку). Изменение условий культивирования дало возмож¬
ность получить положительные результаты в работе с изолиро¬
ванной культурой двух генотипов — A. commutatum и A. commuta¬
tum var. commutatum (Лаврентьева, 1999).
176
ГЛАВА 4. Методы размножения тропических и субтропических растений
Растения-регенеранты хорошо проходят период постасептиче-
ской адаптации. На начальных этапах необходимо поддерживать
повышенную влажность воздуха и температуру около 25 °С. Вы¬
саживали растения в стерильный субстрат, рекомендуемый для
культивирования ароидных, который облегчен добавлением (око¬
ло 30 %) перлита (рис. 4.3, б).
Анализируя полученные данные, следует отметить, что мето¬
ды клонального размножения необходимо подбирать индивиду¬
ально для каждого вида и формы Aglaonema, учитывая экологиче¬
ские условия мест их природного произрастания. Проблематич¬
ность микроразмножения in vitro подтверждает и отсутствие ли¬
тературных данных, обобщающих эти исследования.
Alocasia G.Don. Распространена в тропических лесах Юго-
Восточной Азии, Малайского архипелага. Род объединяет около
70 видов и декоративных форм. Это декоративно-лиственные
клубневые растения. Листовая пластинка стреловидно-сердцевид¬
ная, до 1 м в длину и 0,85 м в ширину, зеленая или пестрая, бар¬
хатистая или гладкая. Жилки вздуты, иногда ярко окрашены.
Плод — ягода. Размножают делением клона, корневыми отпры¬
сками, стеблевыми черенками или семенами. В культуре требует
искусственного опыления.
В наших исследованиях для микроразмножения использовали
A. macrorhiza (L.) G.Don., A. cuprea C.Koch, A. amazonica hybr. Andre,
Alocasia ’Black velvet*. Эксплантами служили части клубней, со¬
держащие резервные почки. Формирование каллуса проходило
по всему периметру экспланта на среде Пирика с 0,8 мг/л 2,4-Д
(рис. 4.4, а). Для регенерации эмбриоидов, а затем и побегов не¬
обходимо наличие в среде цитокининов. Внесения 2 мг/л БАП
или аденина достаточно для массового формирования побегов
(рис. 4.4, б). При потемнении питательной среды к ней добавля¬
ют 1 г/л активированного угля. Укоренение побегов происходило
спонтанно на этой же среде. Размножение также может осущест¬
вляться с помощью адвентивных побегов, формирующихся из
массы эмбриоидов (Lavrentyeva et al., 1999).
Anthurium L. Род насчитывает более 500 видов, произрастаю¬
щих во влажных тропических и субтропических лесах Америки.
Большинство из них — декоративно-лиственные растения. А. ап-
dreanum Lindl., A. scherzerianum Schott, A. lindenianum C.Koch et
Augustin, и полученные на их основе декоративные формы и сор¬
та имеют яркоокрашенные соцветия, необычную декоративную
форму и окраску прицветных покрывал. Это позволяет использо-
177
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.4. Alocasia macmrhiza (L.) G.Don.:
a — каллусогенез на частях клубней;
б — массовое формирование побегов из
каллуса
а б
вать их в промышленном цветоводстве как декоративно-цветко¬
вые горшечные культуры или на срез.
В коллекции растений семейства Araceae Juss. НБС НАН Ук¬
раины наиболее разнообразно представлен род Anthurium — 45 ви¬
дов, разновидностей и сортов, которые отражают все присущие
ему формы (наземные растения, лианы, эпифиты и полуэпифи-
ты). Подобранные оптимальные условия для их роста способст¬
вуют полноценному развитию декоративных качеств растений,
что дает возможность наблюдать ежегодное цветение всех видов,
а отработанная методика искусственного опыления — получать
для некоторых видов декоративные соплодия со всхожими се¬
менами.
Установлено, что одними из наиболее устойчивых в условиях
интерьера являются декоративно-лиственные виды A. leuconeurum
Lem. и A. lucidum Kunth. Из декоративно-цветковых видов наи¬
более перспективен A. andreanum и его сорта.
A. andreanum и его декоративные формы традиционно поль¬
зуются наибольшей популярностью у населения. На стеблях
взрослых 3—5-летних растений высотой до 1 м находятся мощ¬
ные воздушные светло-коричневые корни. Листовые черенки зе¬
леные, влагалищные, длиной до 80 см, у основания листовой
пластинки слегка вздутые, утолщенные. Молодые листья имеют
178
ГЛАВА 4. Методы размножения тропических и субтропических растений
коричневую, красно-бурую окраску, а после полного развертыва¬
ния приобретают зеленую. Листовые пластинки сердцевидные,
темно-зеленые, кожистые, длиной 30—100 см и шириной до
60 см. Обычно на растении 8—20 крупных листьев. Цветки мел¬
кие, невзрачные, обоеполые, собраны в соцветие (початок) жел¬
того, белого или розового цвета длиной 6—7 см. Початок окру¬
жен большим прицветковым покрывалом, диаметр которого у
некоторых гибридов и сортов достигает 15 см в наиболее широ¬
ком месте. Покрывало округлое или удлиненно-яйцевидное, глян¬
цевое, гладкое или морщинистое, ярко-красное, малиновое, ро¬
зовое или белое, в раскрытом состоянии располагается перпен¬
дикулярно цветоносу. Цветоносы зеленые или буроватые, длиной
60—85 см, выходят из пазухи листа. Одновременно на взрослом
растении может находиться до 3 цветоносов.
Соцветия сохраняют декоративность до 60—70 сут, в срезе —
до 35 сут, благодаря тому, что цветки в нем расцветают медленно
и постепенно. Срез Anthurium можно получать в течение всего
года. Наиболее интенсивное цветение в наших условиях наблю¬
дается во второй половине октября, в декабре и с января по ав¬
густ. Одно растение может дать до 15 соцветий в год, а крупные
экземпляры-маточники в возрасте 5—7 лет — до 35 соцветий.
Для получения семян соцветия необходимо искусственно
опылять, так как женские (пестичные) и мужские (тычиночные)
цветки созревают и раскрываются в разное время. Первыми со¬
зревают женские цветки и на рыльцах пестиков появляются ка¬
пельки сладковатой липкой жидкости (это происходит на 6—7-е
сутки после раскрытия покрывала). Через 2—3 недели созревает
пыльца мужских цветков, в связи с чем для опыления следует
подбирать цветки разной степени зрелости. Раскрытие женских и
мужских цветков одного соцветия происходит за 75—90 сут.
Иногда при повышенных значениях температуры цветки раскры¬
ваются на 10—12 сут раньше и соцветие увядает через 50—70 сут.
Опыленное соцветие теряет декоративность на 24—38-е сутки
после опыления.
Плод — желто-оранжевая ягода, созревает в течение 10—
11 мес после опыления. Семена мелкие, длиной 3—4 мм и ши¬
риной 1-1,5 мм, по 1—2 шт. в ягоде. В зависимости от величины
соцветия в нем может находиться от нескольких десятков до 300
ягод. Семена быстро теряют всхожесть, поэтому высевать их
следует сразу же после созревания плодов. Через 15—25 сут
хранения при комнатной температуре их всхожесть снижается до
179
СПЕЦИАЛЬНАЯ ЧАСТЬ
5 %, а при хранении в холодильнике — до 20 %. Семена прорас¬
тают на 5—8-е сутки при температуре 25—28 °С и влажности 95 %.
В условиях оранжерей высевают семена в неглубокие гончар¬
ные плошки или пикировочные ящики с землесмесью, состоя¬
щей из просеянной лиственной подстилки и крупного речного
песка (1:2). Через 30—40 сут их пикируют в такую же почвосмесь
на расстоянии 4—5 см. На стадии 3—5 хорошо развитых листьев
пересаживают в горшки высотой 7 см с последующими пересад¬
ками по мере роста растений.
Растения A. andreanum в таком возрасте могут служить отлич¬
ным источником эксплантов. Сеянцы зацветают через 2,5—3 го¬
да, однако в первые годы цветения размеры соцветия и прицвет¬
ника в 1,5—2 раза меньше обычного, в дальнейшем эта разница
исчезает. Следует отметить, что растения, выращенные из семян,
неоднородны (если это не природные виды). Часто происходит
расщепление сортовых признаков, вследствие чего окраска и
форма покрывала становятся менее декоративными, чем у мате¬
ринского растения. Поэтому традиционный способ семенного
размножения пригоден только для селекционных целей.
При вегетативном размножении Anthurium от материнских
экземпляров отделяют отпрыски с хорошо сформировавшимися
корешками. Обычно с одного растения можно получить до 10 от¬
прысков, которые зацветают через 8—24 мес и сохраняют полно¬
стью признаки материнского растения.
Для увеличения коэффициента размножения и лучшего со¬
стояния растения стебель с воздушными корнями окутывают
сфагновым мхом, поролоном или другим материалом и перио¬
дически увлажняют. Через 2—3 мес верхушку с хорошо разви¬
тыми молодыми корнями срезают и высаживают в субстрат
(увлажненную почвосмесь). В день пересадки не поливают, а
только сбрызгивают 2—3 раза водой. По мере подсыпания суб¬
страта через 2—3 сут растения поливают. Однако все вышеопи¬
санные приемы септического размножения весьма трудоемки и
не могут обеспечить достаточное количество качественного по¬
садочного материала Anthurium.
Впервые возможность клонального размножения антуриума
Андре в культуре in vitro была показана в работах R. Pierik (1966,
1976а). Основу разработанного им метода составляет способность
изолированных листьев пролиферировать на питательной среде
каллус. Образование и рост каллуса регулировали балансом аук¬
синов и цитокининов в питательной среде. В дальнейшем этот
180
ГЛАВА 4. Методы размножения тропических и субтропических растений
метод использовали для размножения других растений семейства
Araceae (Pierik et al., 1974; Новак и др., 1979; Kunisaki, 1980; Че¬
ревченко и др., 1983; Poole et al., 1983; Kukulczanka et al., 1984;
Ivanova, 2002). В результате проведенных исследований опреде¬
лены основные принципы и этапы работ, включающие индук¬
цию каллуса на сегментах листьев, размножение каллусной тка¬
ни, регенерацию побегов и их укоренение (табл. 4.4).
Для получения стерильных эксплантов применяют следую¬
щий режим стерилизации: промыть листья теплой проточной во¬
дой с мыльным порошком, затем дистиллированной водой; опус¬
тить на 1 мин в 70%-й этанол, промыть стерильной дистиллиро¬
ванной водой; погрузить в стакан с 10%-м гипохлоритом кальция
или хлорной известью на 20—25 мин, промыть стерильной дистил-
Таблица 4.4. Состав питательных сред, используемых для культивирования
эксплантов Anthurium andreanum, мг/л (Pierik, 1976)*
Компонент
Индукция
каллуса
Культивирование
каллуса
Регенерация
побегов
Укоренение
побегов
NH4NO,
825,0
825,0
206,0
412,0
KNOj
950,0
950,0
950,0
475,0
CaCI2 2Н20
440,0
220,0
220,0
110,0
MgS04 7Н20
370,0
185,0
185,0
92,0
KH2P04
85,0
85,0
85,0
42,0
H3B03
6,2
6,2
6,2
6,2
MnSO„ 4H20
22,3
22,3
22,3
22,3
ZnS04
8,6
8,6
8,6
8,6
KI
0,83
0,83
0,83
0,83
Na2Mo04
0,25
0,25
0,25
0,25
CuS04 5H20
0,025
0,025
0,025
0,025
CoC02 • 6H20
0,025
0,025
0,025
0,025
№2ЭДТА
37,3
37,3
37,3
37,3
FeS04 7H20
Никотиновая
27,8
27,8
27,8
27,8
кислота
0,5
0,5
0,5
0,5
Пиридоксин
0,5
0,5
0,5
0,5
Тиамин
0,4
0,4
0,4
0,4
Мезо- инозит
100,0
100,0
100,0
100,0
Глюкоза
30 000,0
20 000,0
'
30 000,0
Сахароза
—
20 000,0
БАП или зеатин
1,0
1,0
1,0
2,4-Д
0,08
Агар
8000,0
8000,0
8000,0
8000,0
PH 5,8 на всех этапах.
181
СПЕЦИАЛЬНАЯ ЧАСТЬ
лированной водой, затем поместить в 20%-й раствор пергидро¬
ля на 15—20 мин с последующим 4-кратным промыванием в сте¬
рильной дистиллированной воде.
Инфицирование эксплантов при таком режиме стерилизации
составляет 5—7 %. Удовлетворительные результаты (14 % инфи¬
цирования) получены при использовании 70%-го этанола (1 —
2 мин), 1%-го famosept (20 мин) с дальнейшей 4-кратной про¬
мывкой в стерильной воде. Применение 0,1%-го диацида (20 мин)
и пергидроля (15 мин) не дает желаемых результатов, инфициро¬
вание сегментов листьев довольно высокое — 83—90 %. Усиле¬
ние режима стерилизации — повышение концентрации или вре¬
мени действия диацида — вызывает пожелтение листовых экс¬
плантов и появление некрозов, в результате чего они теряют спо¬
собность к образованию каллуса.
Чрезвычайно важен, на наш взгляд, выбор экспланта для раз¬
множения. В наших исследованиях эксплантами служили листья
генеративнозрелых растений A. andreanum. Решающую роль при
этом играл возраст листа. Очень мягкие молодые листья с анто-
циановой окраской регенерировали каллус только вокруг жилок
листа; его масса составляла всего 10—12 мг (за 70 сут). Более
взрослые, 1,5—2-месячные листья пролиферировали каллус по
всему периметру экспланта и масса его в среднем равнялась 90—
100 мг (за 70 сут). Старые, 4—6-месячные листья не были спо¬
собны к пролиферации каллуса, так как экспланты, вычлененные
из них, быстро темнели и погибали. Поэтому в качестве источ¬
ника эксплантов наиболее целесообразно использовать 1,5—
2-месячные листья (Лаврентьева и др., 1997, 1999). Наибольшее
количество каллуса, как правило, формировалось вокруг жилок
листа. Такое явление, по нашему мнению, можно объяснить вы¬
сокой морфогенетической активностью этих зон, содержащих
большое количество клеток с достаточно высоким митотическим
потенциалом. В культуре in vitro они, очевидно, функционируют
как меристематические клетки, формируя каллусную ткань (Юсу¬
фов, 1988).
После стерилизации острым скальпелем или лезвием бритвы
вырезали сегменты листа (1 см) с боковыми жилками и помеша¬
ли их на поверхность авизированной среды Пирика-1. Образова¬
ние каллуса происходило в темноте при 25—26 °С в течение 2—
2,5 мес. Образовавшийся каллус отделяли, разрезали на части и
переносили на среду Пирика-2, на которой в течение последую¬
щих 2 мес нарастала каллусная ткань. Затем каллус опять делили
182
ГЛАВА 4. Методы размножения тропических и субтропических растений
и помешали на среду Пирика-3. Каллусная ткань объемом 1,5—
2 0 см3 в течение 1 мес регенерировала до 30 побегов A. andreanum
(рис. 4.5, а, см. вклейку). После их удаления каллус возобновлял
способность к органогенезу. Укоренение побегов и их рост про¬
исходили на среде Пирика-4. Следует отметить, что в наших
опытах спонтанное образование побегов и даже корней наблюда¬
лось не только на среде Пирика-2, но и на среде Пирика-1. Это
значительно сокращало цикл регенерации растений, исключало
дополнительные пересадки и удешевляло метод.
Высоким морфогенетическим потенциалом обладают сегмен¬
ты листьев A. andreanum var. roseum, A. andreanum var. giganteum:
100 % высаженных эксплантов образуют каллус с последующим
органогенезом в любое время года. Каллусообразование и мор¬
фогенез у A. andreanum var. rubrum колеблется от 10 до 30 % в за¬
висимости от физиологического состояния растения и возраста ли¬
стьев. Интенсивное каллусообразование происходило у A. olfersia-
пит Kunth., A. scherzerianum Schott, A. andreanum ’Ellerina*. Проли¬
ферация каллуса у них начиналась через 30—45 сут. Не удалось, к
сожалению, индуцировать каллус у A. wamgueanum Т.Мооге, A. va-
riabile Kunth., A. magnificum Linden.
Нами также изучена способность к каллусообразованию экс¬
плантов различных видов антуриума. Установлено, что скорость
и активность каллусообразования у видов рода Anthurium тесно
взаимосвязаны и зависят от видовых особенностей растений.
Так, у A. bakeri Hook.f. и A. longifolium G.Don отмечено слабое
формирование каллуса на эксплантах (каллус появился на 60-е
сутки).
Максимальным (100 %) морфогенетическим потенциалом об¬
ладали экспланты A. andreanum ’Porzellan1, пролиферация каллуса
и последующий органогенез которых активно проходят в любое
время года. В то же время интенсивность каллусообразования у
эксплантов A. andreanum ’lga-Gold‘ изменялась в течение годич¬
ного цикла развития растений (табл. 4.5). Так, если в зимне¬
весенний период каллус на молодых листьях образовывался за
15—20 сут, то в летние месяцы (июнь—июль) его пролиферация
длилась 50—60 сут, а масса была в 2—3 раза меньше, чем в зим¬
ний период. Скорость формирования зависела и от возраста мате¬
ринского растения: чем оно было моложе, тем выше оказывалась
его каллусообразовательная способность. Этот вывод подтверждают
и исследования статуса эндогенных регуляторов роста в листь¬
ях антуриума. Выявлена четкая корреляция интенсивности образо-
183
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.5. Интенсивность каллусообразования у эксплантов, изолированных
из листьев Anthurium andreanum в зависимости от сорта и времени года
Месяц
Сорт
Porzellana
Iga-Gold
Возраст
листа, сут
Интенсивность кал¬
лусообразования, %
Возраст
листа, сут
Интенсивность кал¬
лусообразования, %
Ноябрь-
15
30
15
95
январь
30
100
30
100
60
—
60
—
Февраль-
15
45
15
100
апрель
30
100
30
100
60
—
60
100
Май-
15
30
15
—
июль
30
100
30
—
60
—
60
30
Август-
15
30
15
10
октябрь
30
95
30
30
60
—
60
—
Примечание. (—) — каллус не формировался; длительность экспери¬
мента 70 сут.
вания каллуса и баланса стимуляторов и ингибиторов роста в ли¬
стьях, используемых для размножения (Черевченко и др., 1981;
Денисьевская и др., 1988).
Увеличения количества посадочного материала антуриума
можно достичь черенкованием in vitro полученных растений с их
последующим укоренением (рис. 4.5, б). Для этого побеги извле¬
кают из колб и делят на части, включающие отрезок стебля с
1 листом. На среде Пирика-3 из пазухи листа образуется новый
побег, иногда 2—3. Укоренение происходит спонтанно в той же
среде.
Часто у основания первичного побега, соприкасающегося с
агаризированной средой, образуется каллус, на котором через 1,5—
2 мес формируются новые побеги. За 9 мес такого черенкования
коэффициент размножения одного растения можно увеличить на
несколько порядков. Как правило, цикл развития растений-
регенерантов антуриума от начала культивирования до пересадки
в субстрат длится 11—12 мес. Однако, как подчеркивалось выше,
скорость клонального размножения, интенсивность образования
каллуса и его количество на экспланте, а также морфогенетический
184
ГЛАВА 4. Методы размножения тропических и субтропических растений
потенциал зависят от генотипа, возраста и фазы вегетации ма¬
точных растений.
A. scherzerianum Schott произрастает в горных лесах Коста-
Рики и Гватемалы. Декоративно-лиственные растения с укоро¬
ченным стеблем. Листья удлиненно-ланцетовидные, длиной до
35 см и шириной 9 см, кожистые, темно-зеленые. Цветонос дли¬
ной до 35 см. Соцветие длиной до 6 см, спирально закрученное,
желтое, оранжевое или красное. Покрывало длиной до 17 см и
шириной 9 см, отогнутое. Плод — оранжево-желтая яйцевидная
ягода. В культуре известно много декоративных форм (Черевчен-
ко и др., 1988).
Вегетативно этот вид размножают так же, как и A. andreanum.
В опытах A. Zens и соавт. (1986) в качестве эксплантов использо¬
вались сегменты листа, черешков, цветоноса. Их культивировали
на разных по составу жидких и твердых средах. Установлено, что
не все генотипы одинаково хорошо регенерируют каллус и по¬
беги. Кроме того, в работе использовали ткани проростков и вер¬
хушки побегов. Через 6 мес коэффициент размножения на твер¬
дой среде составил 3,6—6,7, в жидкой — в отдельных случаях
достигал 18,0. Оптимальной оказалась среда Пирика-2. Эти же
авторы изучали полученные растения-регенеранты. Выявлена их
генотипическая изменчивость, проведено гистологическое иссле¬
дование пролиферации побегов, образованных in vitro из прора¬
щенных семян (Zens und and., 1988а, b).
Некоторые авторы для размножения использовали вегетатив¬
ные почки, культивируя их на среде МС с 0,75 мг/л НУК и
0,5 мг/л БА. Полученные растения высаживали в субстрат (Gu,
1995). В то же время Т. Geier (1982), культивируя сегменты листа,
соцветия или покрывала на среде Нича, получал растения.
Для клонального размножения мы использовали высечки из
листовых пластинок (1x1 см), культивируя их в темноте на сре¬
де Пирика-1. Получали первичный каллус, в котором на протя¬
жении последующих 60 сут спонтанно проходили процессы орга¬
ногенеза, после чего формировались этиолированные побеги. Их
переносили на свет, где они зеленели, обретали характерный для
регенерантов данного вида габитус и формировали корневую
систему. После этого растения-регенеранты можно переносить в
субстрат. Аналогичные результаты получили многие исследовате¬
ли (Pierik, 1976b; Geier, 1986; Zimmer, 1989).
A. pedatum (H.B.K.) Kunth. размножали, используя в качестве
эксплантов сегменты молодых листьев, черешки, цветоносы и
185
СПЕЦИАЛЬНАЯ ЧАСТЬ
участки соцветий. После стерилизации их помещали на твердую
питательную среду МС с 2,4-Д, кинетином, БАП, зеатином и 2-iP.
Показано, что каллус лучше всего образуется на среде, содержа¬
щей 1 мг/л БАП и 0,1 мг/л 2,4-Д. Интенсивную пролиферацию
каллуса наблюдали на эксплантах, полученных из молодых ли¬
стьев со срединной жилкой. Процессы органогенеза спонтанно
происходили во всех типах каллусов, за исключением каллуса,
полученного из черешков листьев. Каллус способен к регенера¬
ции побегов даже после 2-годичного непрерывного культивиро¬
вания. Полученные побеги укореняли на среде, модифицирован¬
ной добавлением НУК, после чего переносили в субстрат (Еареп,
Rao, 1985; Wencheng, 1987).
A. leuconeurum Lem. имеет бархатистые сердцевидные изум¬
рудно-зеленые листовые пластинки с бело-серебристым рисун¬
ком вдоль жилок на изящных, тонких черешках. В наших оран¬
жереях регулярно цветет и образует до 8 соцветий на длинных
цветоносах. После опыления желтых соцветий формируются ори¬
гинальные соплодия из ярко-оранжевых односемянных ягод.
A. lucidum Kunth. имеет крупные блестящие кожистые сердце¬
видно-овальные темно-зеленые листовые пластинки на длинных
мощных черешках. В оранжерейной культуре регулярно цветет,
образуя 7—10 соцветий с длинным узким салатовым покрывалом.
После опыления развивается декоративное соплодие из кремовых
односемянных ягод.
С целью получения качественного, массового посадочного
материала мы исследовали возможность микроразмножения A. leu¬
coneurum и A. lucidum. В качестве источника первичных эксплан¬
тов использовали различные части сеянцев, полученных в куль¬
туре in vitro (лист, черешок листа, части стебля и корней). Воз¬
раст сеянцев на момент отбора эксплантов составлял 300 сут. В
работе использовали свежесобранные семена с околоплодником
и без него. Их стерилизацию проводили по следующей схеме:
спирт (70 %) — 2 мин, thimerosal (0,01 %) — 36 мин, chlorax
(10 %) — 18 мин, Н202 (15 %) — 17 мин. После каждого стерили¬
зующего вещества экспланты тщательно промывали стерильной
дистиллированной водой. В результате у семян, очищенных от
околоплодника, мы получили 100%-ю стерильность. Семена, ко¬
торые не были освобождены от околоплодника, не прорастали и
через 60—75 сут около большинства из них образовались округ¬
лые светлые колонии эндофитных микроорганизмов, поэтому
они были исключены из дальнейшего эксперимента. Мы предпо¬
186
ГЛАВА 4. Методы размножения тропических и субтропических растений
лагаем наличие в околоплодниках данных видов веществ, тормо¬
зящих процессы прорастания, что и объясняет инертность не¬
очищенных семян.
Семена антуриумов высевали на стандартную среду МС с
4 мг/л аденина. Она хорошо зарекомендовала себя при размно¬
жении многих представителей этого рода. Кроме того, в работе
использовали среду Лирика с 1 мг/л БАП. В эксперименте изу¬
чено влияние состава питательной среды и условий культивиро¬
вания (наличие или отсутствие света) на процессы каллусообра¬
зования и органогенеза (табл. 4.6).
Из данных табл. 4.6 следует, что обе среды в различной сте¬
пени обладают способностью к индукции каллусогенеза. Однако
более интенсивно этот процесс проявляется на среде Пирика.
Отсутствие света стимулировало образование каллусных масс как
у A. leuconeurum, так и у A. lucidum (особенно на среде Пирика;
рис. 4.6, см. вклейку). Более интенсивно каллус нарастал у A. leu¬
coneurum. Исходя из полученных нами результатов, наилучшими
эксплантами для клонального размножения являются части стеб¬
лей сеянцев и черешки листьев (их влагалищные части) (рис. 4.7,
см. вклейку). Образование каллуса на участках корней не на¬
блюдалось, за исключением единичных случаев у A. leuconeurum
(рис. 4.8).
Образовавшийся на эксплантах каллус отделяли и переносили
на среду МС. В дальнейшем его культивировали на свету. В этих
условиях он сразу приобретал темно-зеленый цвет и в нем начи-
Таблица 4.6. Влияние состава питательной среды и условий культивирования
на каллусообразование у эксплантов Anthurium в культуре in vitro, %
Условия куль¬
тивирования
Вид
A. leuconeurum
A. lucidum
Черешок
Лист
Стебель
Корень
Черешок
Лист
Стебель
Корень
На свету
среда Пи¬
рика
18
21
56
0
10
0
18
0
среда МС
15
0
31
0
7
0
0
0
В темноте
среда Пи¬
рика
22
28
87
3
12
45
100
0
среда МС
11
2
44
0
1
0
7
0
187
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.8. Органогенные потенции раз¬
личного по происхождению каллуса
Anthurium:
а — черешок, б — лист, в — стебель, г —
корень; 1 — A. leuconeurum, 2 — A. lucidum
нались процессы органогенеза
(рис. 4.9, см. вклейку). Следует
отметить, что различный по
происхождению каллус обладал
неодинаковыми органогенными
потенциями. Наибольшее коли¬
чество растений-регенерантов было получено из каллуса, кото¬
рый имел стеблевое происхождение. В темноте как у одного, так
и у другого вида мы наблюдали только отдельные случаи орга¬
ногенеза. Побеги, которые сформировались в этих условиях, бы¬
ли этиолированы, имели удлиненные междоузлия с редуциро¬
ванными чешуеобразными листьями, часть из них витрифициро-
вана. Этиолированные ростки антуриума при перенесении на
свет быстро зеленеют, образуют листья. Побеги отделяют и пере¬
носят для укоренения на четвертую среду с пониженной концен¬
трацией макроэлементов и без фитогормонов. У большинства
эксплантов часто происходит спонтанное образование побегов и
корней на второй среде, что значительно сокращает цикл регене¬
рации растений, исключает дополнительные пересадки.
В случае разделения невитрифицированных побегов на от¬
дельные микрочеренки и перенесения их на свет на питательную
среду МС они через 5—7 сут приобретали зеленую окраску, а из
пазушных почек начинали развиваться побеги. В дальнейшем
они формировали нормальные растения, пригодные для вы¬
садки в субстрат. На свету процессы органо- и каллусогенеза
происходили одновременно, а сформировавшиеся растения
имели нормально развитые вегетативные органы (Иванников и
др., 2005).
В субстрат высаживают растения с 4—5 листьями и хорошо
развитыми корнями. Для культивирования полученных растений
лучше иметь отдельную теплицу, в которой первые месяцы после
пересадки растений из колб можно поддерживать условия, близ¬
кие к культуральному помещению. В дальнейшем температура
воздуха составляет 22—23 °С, влажность 85—95 %, освещенность
3000—5000 лк. В весенне-летние месяцы во избежание ожогов
растения необходимо притенять от прямых солнечных лучей.
188
ГЛАВА 4. Методы размножения тропических и субтропических растений
Стеллажи в теплице могут быть бетонными или из металличе¬
ской сетки, под ними должны проходить трубы отопительной
системы. Это способствует прогреванию субстрата и хорошему
развитию корневой системы. На стеллажи настилают деревянные
решетки, которые предохраняют корневую систему от перегрева
и способствуют воздухообмену; их необходимо периодически
увлажнять.
Растения-регенеранты Anthurium рекомендуется высаживать в
субстрат весной или в начале лета. Их вынимают из колб, отмы¬
вают от остатков агара и сортируют по размерам для отдельной
пересадки, чтобы получить однородный материал.
Высаживают растения-регенеранты в субстрат из измельчен¬
ного сфагнового мха, кирпичного щебня и крупного речного
песка (2:0,5:!). Первые 5 сут после высадки растения только оп¬
рыскивают водой, а в дальнейшем умеренно поливают. Адапта¬
ция растений происходит в течение 15—30 сут. После этого рас¬
тения отделяют и выращивают как самостоятельные. Растения-
регенеранты A. andreanum начинают цвести с 3-летнего возраста.
Первые растения-регенеранты A. leuconeurum и A. lucidum бы¬
ли высажены в условия ex vitro спустя 733 сут с момента высева
семян. На начальном этапе адаптации их культивировали в суб¬
страте из измельченного сфагнового мха в течение 50—60 сут
(рис. 4.10, см. вклейку), а после пересаживали в землесмесь, ре¬
комендуемую для культивирования большинства растений из се¬
мейства Агасеае. При этом поддерживалась высокая влажность
воздуха (75—90 %), температура составляла 24—27 °С; в осенне-
зимний период проводилось искусственное освещение. В таких
условиях культивирования нами не было зарегистрировано ни од¬
ного случая гибели растений (Иванников и др., 2005). Приведен¬
ными выше способами могут быть размножены и другие виды.
Caladium Vent. Представители этого рода происходят из влаж¬
ных тропических лесов Америки, Больших и Малых Антильских
островов. Известно около 15 видов. Декоративные клубневые
бесстеблевые растения. Клубни округлые, коричневые, с розова¬
тыми почками. Листовая пластинка заостренная, мягкая, с ро-
зово-красно-бело-кремовыми пятнами и штрихами. Цветки мел¬
кие, собраны в желтый початок. Плод — ягода. В культуре не
плодоносит. Размножают делением клубня так, чтобы каждый
участок имел 1—2 почки. Известно множество культиваров. Ко¬
эффициент вегетативного размножения очень низок, поэтому
разработка усовершенствованных методов выращивания различ¬
189
СПЕЦИАЛЬНАЯ ЧАСТЬ
ных видов и форм Caladium весьма актуальна (Денисьевская и
др., 1985).
Для микроразмножения некоторые авторы использовали сег¬
менты листьев, культивируя их на среде МС с 1 мг/л БА и 30 г/л
сахарозы (Cooper et al., 1983; Kukulczanka, 1984). Растения
Caladium были получены также при культивировании листовых
эксплантов на среде МС без фитогормонов (Tamosiunas et al.,
2004).
Экспланты, изолированные из листьев и соцветий С. bicolor
(Ait.) Vent, и С. hortulanum cv. Birdsay, формировали на среде МС
с 0,5 мг/л 2,4-Д каллус. Из каллуса после перенесения тканей на
среду без ауксинов или содержащую низкие концентрации аук¬
синов и кинетина образовывались эмбриоиды (Zhu et al., 1984). В
опытах других исследователей экспланты сегментов листьев и
черешков молодых растений помещали на среду МС с 2 мг/л БА
и 0,6—1,0 мг/л НУК. Через 2—3 недели культивирования они об¬
разовывали каллус. Через 5 недель на каллусах возникали эм¬
бриоиды, которые впоследствии давали легкоукореняющиеся по¬
беги. Показано, что каллус и эмбриоиды могут образовываться
как на свету, так и в темноте. Установлено, что при применении
жидких сред коэффициент размножения увеличивается в 3—4 ра¬
за (Wencheng, 1987; Dexiang, 1988; Carpenter, 1990).
При разработке метода микроразмножения растений С. bico¬
lor, С. hortulanum cv. Candidum, С. hortulanum cv. Birdsay эксплан¬
тами служили сегменты листьев и спящие почки клубней.
В наших работах исследована возможность микроразмноже¬
ния целого ряда сортов и культиваров Caladium. Для этого листья
срезали, тщательно мыли и стерилизовали. Весь интактный рас¬
тительный материал (пазушные и резервные почки, сегменты ли¬
стьев, апикальные меристемы) стерилизовали сначала в 70%-м
этаноле (1 мин), затем в диациде и 15%-м пергидроле (по 15 мин)
с последующей 3-разовой промывкой в стерильной воде. Следует
отметить, что скорость и интенсивность каллусообразования у
листьев Caladium на 30 % выше, чем у видов Anthurium. Сходные
данные были получены и другими исследователями (Аветисов и
др., 1990).
Высечки из листьев помешали на питательную среду Пирика-1.
Колбы с растительным материалом устанавливали в термостат в
условия темноты при температуре 26 °С. Через 1 мес после вве¬
дения в культуру на эксплантах наблюдалась обильная пролифе¬
рация белого каллуса, причем он образовывался как по перимет¬
190
ГЛАВА 4. Методы размножения тропических и субтропических растений
ру экспланта, так и на местах повреждения (рис. 4.11, а, см.
вклейку). Согласно данным табл. 4.7, почти все исследуемые
формы достаточно активно пролиферируют каллус. Кроме того,
для увеличения коэффициента размножения в качестве источни¬
ка эксплантов можно использовать молодые листья растений-
регенерантов Caladium. В наших работах все экспланты активно
пролиферировали каллус, который служил дополнительным ис¬
точником растений. В дальнейшем каллус переносили на среду
Пирика-2 для его размножения. Однако, как показывает практи¬
ка, каллус можно и не переносить на новую среду. Мы наблюда¬
ли регенерацию побегов, рост каллусной массы и образование
корней непосредственно на среде Пирика-1 (рис. 4.11, б). В ре¬
зультате этого уже через 3—4 мес на одной среде можно получать
растения, готовые к высадке в субстрат. Это не требует дополни¬
тельных субкультивирований и намного удешевляет метод.
Значительно увеличивает коэффициент размножения исполь¬
зование в качестве эксплантов различных частей растений-реге¬
нерантов. В отличие от Anthurium, у которых каллус формируется
только из сегментов листьев, у Caladium он образовался как на
черешке, так и на частях побегов. Высокой степенью пролифера¬
ции каллуса обладали С. bicolor, С. bicolor ’White Christmas1, С. bico¬
lor cv. 1 и cv. 3, С. hortulanum cv. Candidum.
При использовании в качестве эксплантов спящих почек
клубней Caladium значительную трудность представляло получе¬
ние стерильных культур. К сожалению, большая часть эксплан-
Таблица 4.7. Интенсивность каллусообразования
у листовых эксплантов различных форм Caladium bicolor в культуре in vitro
Сорт, культи вар
Количество эксплантов, шт.
Интенсивность
каллусообразова¬
ния, %
всего
инфицированных
С. bicolor Triomphex de Exposition4
20
5 ’
80
С. bicolor cv. 1
20
20
100
С. bicolor су. 2
20
3
85
С. bicolor cv. 3
20
3
95
С. bicolor cv. 4
20
8
80
C. bicolor cv. 5
20
6
80
C. bicolor
20
20
C. bicolor ’White Christmas4
20
2
90
C. hortulanum cv. Candidum
20
20
100
C. bicolor ’Crimson Way‘
20
5
85
191
СПЕЦИАЛЬНАЯ ЧАСТЬ
тов оказалась инфицированной. Побеги были получены только у
С. bicolor ’Crimson Way1 и еще 3 сортов. Растения-регенеранты в
дальнейшем использовали в качестве эксплантов для образования
каллуса и адвентивных побегов (Денисьевская и др., 1994).
Цикл развития растений-регенерантов исследуемых форм Ca¬
ladium в культуре in vitro неодинаков и составляет 6—8 мес. Рас¬
тения, достигшие высоты 2—4 см и имеющие 1—3 корня и лис¬
та, высаживали из колб в субстрат и культивировали в теплице
(рис. 4.11, в, см. вклейку). Следует отметить, что главная труд¬
ность в получении растений Caladium состоит не в методике
микроразмножения, а в процессе постасептической адаптации
растений-регенерантов в условиях оранжерей. Это требует со¬
блюдения самых тщательных условий их выращивания.
Colocasia Schott. Представители этого рода предпочитают за¬
тененные влажные места и произрастают в тропических лесах
Юго-Восточной Азии. Известно около 10 видов и разновидно¬
стей. Декоративно-лиственные клубневидные травянистые расте¬
ния. Листья овальные, мягкие, зеленые, в период покоя отмира¬
ют. Плод — ягода. В культуре плодоносит редко. Вегетативно
размножают так же, как и Alocasia. На родине клубни некоторых
видов достигают 1,5 кг и являются ценным пищевым продуктом.
Кроме того, из листьев С. esculenta (L). Schott было выделено
8 флавоноидных гликозидов, используемых в медицине (Iwaschina
et al., 1999). В связи с пищевой ценностью, декоративностью и
необходимостью получения большого количества растений этот
вид размножают в основном в асептической культуре.
Для размножения используют кончики побегов длиной до
1 см. При стерилизации эксплантов необходима аскорбиновая
кислота, так как ткани выделяют большое количество фенолов.
Кончики побегов с 2 листовыми примордиями культивируют на
свету или в темноте на МС с НУК, 2-iP, кинетином. В темноте с
10 мг/л НУК и 9 мг/л кинетина из эксплантов образуются струк¬
туры, напоминающие протокормы орхидных. Их делят и культи¬
вируют на среде с 10 мг/л НУК и 0,45 мг/л 2-iP, после чего по¬
следние формируют многочисленные побеги. Укоренение проис¬
ходит на среде МС с 15 мг/л НУК и 0,4 мг/л кинетина (Abo El—
Nil et al., 1976; Krikorian, 1982; Nyman et al., 1983).
Некоторые авторы культивировали экспланты Colocasia в
жидкой среде ЛС с 1 мг/л БАП и 0,1 мг/л НУК. Через 4 мес
культивирования экспланты сначала регенерировали протокор-
моподобные структуры, а затем побеги (Nyman et al., 1988).
192
ГЛАВА 4. Методы размножения тропических и субтропических растений
Другие исследователи культивировали кончики побегов
(апекс с 2—3 листовыми примордиями) и пазушные почки на
средах ЛС, МС, Кнопа, Уайта, Кнудсона с добавлением НУК,
2 4-Д, ИУК, кинетина, БАП, аденина. Использовали также жид¬
кие и твердые среды. Были получены следующие результаты: на
твердых средах ЛС с 15 мг/л НУК или 5 мг/л НУК и 1 мг/л ки¬
нетина происходила регенерация побегов; укоренялись они луч¬
ше на среде без ауксинов. В жидких средах побеги формирова¬
лись более интенсивно в среде ЛС с 1,5 мг/л ИУК и 1 мг/л кине¬
тина. Последний в концентрации 10 мг/л был токсичен для всех
культур. Образование каллуса лучше всего происходило также в
среде ЛС с 5 мг/л 2,4-Д или 10 мг/л НУК, но без кинетина. Хо¬
рошие результаты получены и при использовании среды Кнопа
(Jackson et al., 1977; Chug et al., 1994).
Dieffenbachia Schott. Представители этого рода распростране¬
ны во влажных тропических лесах Южной Америки. Известно
около 30 видов. Декоративные вечнозеленые растения, имеющие
сочный, мясистый стебель со спящими почками. Листья крупные,
блестящие, с декоративным пестрым рисунком. Цветки мелкие,
собраны в соцветие (початок), в котором раскрываются только
верхние цветки. Семена в культуре, как правило, не завязывает.
Растения размножают отводками, черенками стебля, корневыми
отпрысками. Сок очень ядовит. Используется для озеленения ин¬
терьеров. Коэффициент вегетативного размножения невелик, по¬
этому работы по оптимизации методик асептического размноже¬
ния весьма актуальны.
Микроразмножение in vitro видов этого рода применяют не
только для получения массового посадочного материала, но и
для освобождения растений от грибковой и бактериальной ин¬
фекции. В качестве эксплантов используют кончики побегов и
латеральные почки. Их субкультивируют как на твердой, так и в
жидкой среде МС. Латеральные почки культивируют на твердой
среде МС с 80 мг/л аденина, 2 мг/л ИУК, 16 мг/л 2-iP в течение
2 мес. Затем экспланты переносят в жидкую среду МС с 2 мг/л
кинетина, в которой еще через 2 мес образуются побеги. Полу¬
ченные побеги черенкуют и укореняют на среде с 2 мг/л ИМК.
Чередуя культивирование на твердой и в жидкой средах, можно
значительно повысить коэффициент размножения (Knauss,1976;
Taylor et al., 1978; Zettler et al., 1978; Wilson, 1983; Henny, 1987).
Адвентивные побеги Dieffenbachia были получены также при
культивировании апекса побега. На разных этапах культивирова¬
193
СПЕЦИАЛЬНАЯ ЧАСТЬ
ния применяли как твердые, так и жидкие среды МС. На среде
МС с 40 мг/л аденина и 2 мг/л НУК получали побеги, которые
укореняли на безгормональной среде (Poole, 1983; Lipucci et al.,
1986; Voyiatzi et al., 1989). Для размножения брали молодые по¬
беги длиной 2 см (кончики побега с 2—3 листьями). Полученные
побеги использовали в дальнейшем как вторичные экспланты, че¬
ренкуя их. Укоренение лучше проходило на безгормональной
среде (Лаврентьева и др., 1992, 2002; Conover, 1995; Ivanova, 2004).
Проведенные нами наблюдения показали, что наиболее при¬
способлены к условиям интерьеров две формы: D. атоепа Bull,
cv. Tropic Snow и D. maculata (Lodd.) G.Don cv. Camilla. В связи с
этим мы исследовали возможность их микроразмножения. В ка¬
честве эксплантов использовали сегменты листьев, побеги, кор¬
ни, а также пазушные почки и апикальную меристему.
При изучении морфогенетических потенций изолированных
тканей D. maculata cv. Camilla установлено, что наибольшую реге¬
нерационную способность имели пазушные почки и апикальная
меристема. Полученные из этих эксплантов растения использо¬
вали как источник вторичных эксплантов, после чего проводили
черенкование побегов, увеличивая тем самым количество полу¬
ченных растений (рис. 4.12, см. вклейку).
Несмотря на то что сегменты листьев, стебля и корней имели
значительный процент образования каллуса (90, 88 и 50 % соот¬
ветственно), получить растения из него не удалось. Каллус был
рыхлым и неморфогенным. Пазушные почки в меньшей, а сег¬
менты корня — в большей степени формировали корневую систе¬
му, но сами при этом не развивались. Значительная часть апикаль¬
ных меристем регенерировала побеги и только незначительная —
каллус (рис. 4.13, см. вклейку), морфогенетический потенциал ко¬
торого был высоким (до 82 %). Для дифференциации каллуса
экспланты культивировали на среде Пирика с 1 мг/л 2,4-Д в ус¬
ловиях темноты и с добавлением 1 г/л активированного угля.
Результатом проведенных исследований по оптимизации пи¬
тательных сред для культивирования изолированных тканей
Dieffenbachia явилась модифицированная среда МС. При этом
для культивирования первичных эксплантов использовали состав
макроэлементов в полном объеме, а для регенерации и укорене¬
ния побегов — только их половинное количество.
Полученные побеги могут быть вторичными эксплантами
(рис. 4.14, см. вклейку). Установлено, что при культивировании
на среде МС с 40 мг/л аденина и 2 мг/л НУК они регенерирова¬
194
ГЛАВА 4. Методы размножения тропических и субтропических растений
ли адвентивные побеги, которые можно использовать для даль¬
нейшего размножения. Следует отметить, что высокая концен¬
трация цитокинина в среде часто приводила к образованию вит-
рифицированных побегов и побегов с измененной морфологией.
Поэтому мы рекомендуем применять метод микрочеренкования
адвентивных побегов.
Наилучшим субстратом для адаптации растений-регенерантов
ex vitro служит сфагновый мох. В остальном приемы адаптации
схожи с таковыми у представителей рода Anthurium (рис. 4.15,
см. вклейку).
Monstera Schott. Представители этого рода произрастают во
влажных тропических и горных лесах Центральной и Южной
Америки. Известно около 25 видов. Декоративные многолетние
лианы с мощными корнями. Листья круглые, кожистые, перфо¬
рированные, зеленые и пестрые. Цветки мелкие, обоеполые, соб¬
ранные в соцветие (початок). Плод — ягода, образует соплодие.
Семена формируются только при искусственном опылении. Раз¬
множают отводками и черенками.
Растения Monstera легко приспосабливаются к условиям раз¬
личных интерьеров благодаря своей высокой пластичности. В
связи с этим получение посадочного материала этих растений —
задача актуальная. Многие исследования посвящены изучению
способов стерилизации исходных эксплантов и их морфогенети¬
ческой активности в культуре in vitro. Хорошие результаты (60 %
стерильных эксплантов) были получены при использовании 70%-го
этанола (1—5 мин) и 0,1%-го диацида (20 мин). Установлено
также, что изолированные ткани Monstera обладают низкой мор¬
фогенетической активностью. Среди трех типов эксплантов (лис¬
товые, черешковые, стеблевые) наибольшей способностью к кал-
лусообразованию обладали стеблевые экспланты, наименьшей —
листовые (Печеницын и др., 1996).
Некоторые авторы для микроразмножения видов Monstera ис¬
пользовали 6—8-недельные сеянцы высотой 10—15 см и верхуш¬
ки побегов, содержащие латеральные почки размером 3—5 мм.
Экспланты культивировали на среде МС с кинетином, ИУК и
БАП. На этой среде с 0,4 мг/л тиамина, 100,0 — инозита, 10,0 —
кинетина, 2,0 мг/л ИУК проходила массовая регенерация побе¬
гов. На среде с 2 мг/л ИУК и 30 г/л сахарозы побеги образовы¬
вали хорошие корни. При этом необходимо увеличивать темпе¬
ратуру культивирования до 30 °С и фотопериод до 18 ч (Fonnes-
bech et al., 1980).
195
СПЕЦИАЛЬНАЯ ЧАСТЬ
М. deliciosa liebm. var. borsigiana (C.Koch.) Engl, произрастает во
влажных тропических лесах Центральной и Южной Америки.
Очень крупная лиана длиной до 15 м. Стебель толстый, одревесне¬
вающий, с мощными воздушными корнями. Листья крупные, ко¬
жистые, зеленые, с многочисленными отверстиями. Плод — ягода,
образует съедобные соплодия с приятным вкусом и запахом.
В результате проведенных нами исследований был предложен
метод размножения М. deliciosa в культуре in vitro. В качестве экс¬
плантов использовали пазушные почки ювенильных растений. За
5—7 сут до отбора интактного материала желательно удалить вер¬
хушку побега. Оптимальным сроком введения в культуру являет¬
ся период с апреля по май.
В своей работе мы использовали следующий режим стерили¬
зации: спирт (70 %) — 1 мин, thimerosal (0,01 %) — 20, chlorax
(20 %) — 15, Н202 (15 %) — 15 мин; при подобной последова¬
тельности и экспозиции стерилизующих агентов мы получали до
35—40 % стерильных эксплантов. В результате применения сте¬
рильного раствора антибиотика (1—2%-й гентамицин) количест¬
во стерильных эксплантов возрастало до 60 %.
На начальных этапах культивирования эксплантов мы ис¬
пользовали среду Кнудсона С. Фотопериод составлял 16 ч, тем¬
пература 23—26 °С, относительная влажность 70 %. Последующие
пассажи проводились на среду МС с 2 мг/л аденина, на которой
из покоящих почек развивались побеги. Корни формировались
как из тканей экспланта, так и непосредственно из междоузлий
отрастающего побега. В дальнейшем полученные молодые расте¬
ния (рис. 4.16) можно размножать посредством микрочеренкова¬
ния (Иванников и др., 2003).
Учитывая высокую декоративность и пластичность этих рас¬
тений в интерьерах различного типа, исследования по микрораз¬
множению видов рода Monstera должны быть продолжены. Прие¬
мы постасептической адаптации схожи с таковыми у представи¬
телей рода Anthurium.
Philodendron Schott. Представители этого рода произрастают
во влажных тропических лесах Америки и Азии. Растения пред¬
почитают селиться в долинах, вдоль заболоченных берегов рек и
ручьев. В основном это лианы, которые взбираются вверх и
плотно прижимают свой стебель к стволам деревьев с помощью
шнуровидных придаточных корней; последние могут образовы¬
ваться как из междоузлий, так и на участках между ними. Сте¬
бель мясистый, одревесневающий у основания. Листья разнооб-
196
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.16. Растения Monstera deliciosa Liebm. var. borsigiana (С.Koch.) Engl., при¬
годные к высадке в субстрат
разны по форме и окраске. Цветоносы зеленые или коричневые.
Соцветие — початок; в его нижней части расположены женские
цветки, в средней — стерильные, в верхней — мужские. В культу¬
ре виды данного рода требуют искусственного опыления. Плод —
ягода. Сок очень ядовит и может вызывать ожоги или аллергиче¬
ские реакции. Размножают черенкованием, реже — с помощью
семян. Наиболее перспективным и высокоэффективным методом
размножения для представителей данного рода можно считать ме¬
тод клонального размножения в асептических условиях.
Интересные данные получены при культивировании латераль¬
ных почек Ph. scandens С.Koch и Ph. houlletianum Schott с кусоч¬
ками стебля на среде МС с 1/2 концентрации макро- и микроэле¬
ментов (pH 5,6). Побеги формировались на среде с 8 мг/л БА; уко¬
ренение происходило при добавлении 5 мг/л БА, 0,5 мг/л НУК и
2 мг/л активированного угля (Cayral, 1981; Mai'a et al., 1983).
В своей практике при микроразмножении ряда видов Philo¬
dendron мы в качестве эксплантов использовали сегменты листьев
и латеральные почки молодых побегов. При культивировании
применяли питательные среды МС, Пирика и Кнудсона с 10 %
кокосового молока.
197
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.8. Морфогенетический потенциал эксплантов Philodendron
в культуре тканей
Вид
Количество эксплантов, шт.
Образовавшиеся
структуры, шт.
всего
инфици¬
рованных
неразви¬
тых
Побеги
Корни
Ph. tuxta Engl.
5
4
1
0
0
Ph. erubescens ’Burgundy4
5
3
2
0
0
Ph. laciniatum (Veil.) Engl.
4
2
2
0
0
Ph. bipinnatifidum Schott
6
1
2
3
3
Ph. scandens C.Koch
7
5
2
0
0
Ph. lacerum (Jacc.) Schott
10
4
2
4
5
Ph. sanquineum Regel.
5
2
3
0
0
Ph. gloriosum Andre.
4
2
2
0
0
Ph. speciosum Schott & Engl.
6
1
1
4
5
Ph. pinnatifldum (Jacq.) Huath.
5
2
1
2
2
Ph. giganteum x wendimbe
4
1
3
0
0
В результате исследований установлено, что использование в
качестве эксплантов сегментов разновозрастных листьев нецеле¬
сообразно, так как образование каллуса не отмечено ни у одного
из видов филодендронов. Несколько иные результаты получены
при культивировании латеральных почек (табл. 4.8).
Таблица 4.9. Влияние состава питательной среды на развитие эксплантов различ
Среда*
Компо¬
нент
Концентра¬
ция, мг/л
Количество
эксплантов, шт.
Ph. bipinnatifidum
1
2
3
Пирика
НУК
1,0
8
37,5
37,5
25,0
БАП
2,0
Пирика
Зеатин
2,0
10
30,0
50,0
20,0
НУК
2,0
Пирика (1/2
ИУК
2,0
9
22,2
22,2
55,5
концентрации)
МС
НУК
1,0
8
БАП
2,0
25,0
62,5
12,5
МС
Зеатин
2,0
10
НУК
2,0
40,0
50,0
10,0
МС (1/2 кон¬
ИУК
2,0
9
33,3
22,2
44,4
центрации)
Примечание. 1— неразвитые экспланты, 2 — побеги, 3 — корни.
198
Г Л А В А 4. Методы размножения тропических и субтропических растений
Анализируя данные табл. 4.8, можно утверждать, что скорость
регенерации побегов у различных генотипов Philodendron зависит
от видовых особенностей. Так, удалось получить побеги только у
4 видов {Ph. bipinnatifidum, Ph. lacerum, Ph. pinnatifldum, Ph. specio-
sum). Экспланты остальных видов были либо инфицированы, ли¬
бо погибли при стерилизации. Следует отметить, что изолиро¬
ванные ткани Philodendron содержат большое количество феноль¬
ных соединений, которые мешают процессу регенерации и часто
приводят к гибели эксплантов. Во избежание этого вычленение
эксплантов мы рекомендуем проводить в стерильном растворе
аскорбиновой кислоты (1 г/л), а изолированные культуры чаще пе¬
ресаживать и добавлять в культуральные среды активированный
уголь (1 г/л). Побеги Ph. bipinnatifidum, Ph. pinnatifldum, Ph. scandens
получены при культивировании на питательной среде Кнудсона с
добавлением 20 % кокосового молока, Ph. lacerum — на среде МС
с 2 мг/л БАП. Скорость регенерации побегов была неодинако¬
ва у разных видов (табл. 4.9). Быстрее этот процесс проходил у
Ph. bipinnatifidum, Ph. pinnatifldum, Ph. scandens.
На основании проведенных исследований мы предлагаем со¬
став питательных сред, которые можно использовать на различ¬
ных этапах микроразмножения растений рода Philodendron (табл.
4.10).
ных видов Philodendron, %
Вид
Ph. pinnatifldum
Ph. lacerum
1
2
3
1
2
3
25,0
50,0
25,0
50,0
25,0
37,5
20,0
60,0
20,0
30,0
60,0
10,0
33,3
22,2
44,4
22,2
33,3
44,4
37,5
37,5
25,0
25,0
50,0
25,0
30,0
40,0
30,0
40,0
30,0
30,0
22,2
22,2
55,5
33,3
33,3
33,3
Звездочкой обозначено добавление 1,5 г/л активированного угля во все среды.
199
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.10. Модификации питательной среды МС, используемые
для культивирования эксплантов Philodendron, мг/л
Компонент
Вариант среды
1
2
3
4
Макроэлементы
1/2
1/2
1/2
1/2
Микроэлементы*
1,0
1,0
1,0
1,0
Хелат железа*
5,0
5,0
5,0
5,0
Никотиновая кислота
1,0
0,4
1,0
0,4
Пантотенат кальция
1,0
5,0
0,1
0,4
Тиамин
0,4
1,0
0,4
1,0
Пиридоксин
0,5
1,0
0,5
0,4
Цистеин
1,0
0,5
0,2
1,0
Биотин
0,02
0,01
0,04
0,04
Аскорбиновая кислота
50,0
50,0
50,0
50,0
Инозит
100,0
100,0
100,0
100,0
БАП
0,4
2,0
10,0
—
НУК
0,1
0,25
1,0
0,5
ГК3
0,1
—
—
—
Сахароза
20 000,0
30 000,0
20 000,0
30 000,0
Активированный уголь
1000,0
750,0
2500,0
1000,0
pH
5,8
5,8
5,8
5,8
Примечание. Среду 1 можно использовать для индукции первичны)
эксплантов большинства видов, среду 2 применяют для массового размно¬
жения и индукции побегов, среда 3 оптимальна для микроразмножения
Ph. scandens, среда 4 может быть использована для укоренения растений ре-
генерантов. Звездочкой обозначена концентрация, мл/л.
Таким образом, описанную выше схему клонального размно¬
жения можно использовать для любого вида или декоративной
формы Philodendron (рис. 4.17, а, см. вклейку). Приемы адапта¬
ции схожи с таковыми у представителей рода Anthurium (рис.
4.17, б, в).
Spathiphyllum Schott. Представители этого рода распростране¬
ны в Центральной и Южной Америке и на Филиппинских ост¬
ровах. Растения произрастают во влажных тропических лесах и
саваннах, на затененных местах и лугах, в долинах рек и вдоль
морского побережья. Известно около 40 видов. Это декоративно¬
лиственные растения, которые к тому же имеют оригинальные
соцветия. Листья цельные, с заостренным вытянутым концом, зе¬
леные. Отдельные цветки мелкие, кремовые или белые, иногда
светло-желтые с приятным ароматом. Соцветие окружено белым
или салатовым покрывалом. Плоды — желто-бело-зеленые яго¬
200
ГЛАВА 4. Методы размножения тропических и субтропических растений
ды, в культуре образуются только при искусственном опылении.
Семена быстро теряют всхожесть. Популярны как неприхотливые
растения для интерьера, иногда используются на срез. Растения
этого рода размножают семенами или вегетативно — делением
клона, однако наиболее продуктивным является метод микро¬
размножения.
В качестве эксплантов можно использовать верхушечные поч¬
ки побегов. На питательной среде МС с 3 мг/л БА и 0,5 мг/л
НУК они регенерировали каллус, на котором в дальнейшем диф¬
ференцировались адвентивные побеги. Их укореняли на среде
МС с 1/2 концентрации макроэлементов, 0,5 мг/л НУК и 0,5 г/л
активированного угля (Chen, Bihua, 2000).
Для микроразмножения Spathiphyllum применяли и сегменты
соцветия. Их культивировали на среде МС с 10 мг/л БАП и НУК
в темноте. Через 85—90 сут можно получить первичный каллус.
Регенерация растений происходила на среде МС с 2 мг/л БА и
0.5 НУК. Укоренение побегов может осуществляться на среде без
фитогормонов либо с добавлением 0,5 мг/л ИМК (Strode et al., 1978;
Zimmer und and., 1985; Werbrouck et al., 1995).
Используя в качестве эксплантов пазушные почки, сегменты
молодых побегов и культивируя их на питательной среде МС с
10 мг/л аденина, можно получать адвентивные побеги и каллус
(Fonnesbech et al., 1979; Vargas et al., 1997).
При разработке метода микроразмножения двух культива-
ров — S. blandum cv. Santa Maria и S. blandum cv. Mauna Loa —
мы изучали морфогенетический потенциал различных эксплан¬
тов (сегменты листа и корня, пазушные почки). Быстрее и ин¬
тенсивнее регенерация каллуса происходила на листовых экс-
плантах. Для пролиферации каллуса использовали среду Пирика-
1, для регенерации побегов — среду МС с соотношением цито¬
кининов и ауксинов 2:1.
Установлено, что процесс размножения растений-регенерантов
Spathiphyllum может происходить двумя основными путями: вслед¬
ствие непрямого органогенеза (рис. 4.18, а, см. вклейку) и путем
формирования адвентивных побегов. Во втором случае в основа¬
нии материнского побега может образовываться до 10 и более ад¬
вентивных побегов (рис. 4.18, б). Их отделяли и культивировали
отдельно. Укоренение происходило на среде МС с небольшим ко¬
личеством ИМК (Лаврентьева и др., 1992; Lavrentyeva, 1994, 1996).
Вышеизложенные методы можно использовать и при размно¬
жении других видов и декоративных форм Spathiphyllum. Приемы
201
СПЕЦИАЛЬНАЯ ЧАСТЬ
адаптации схожи с таковыми у представителей рода Anthurium
(рис. 4.19, см. вклейку).
Scindapsus Schott. Распространен во влажных тропических ле¬
сах Малайского архипелага, на Соломоновых островах, п-ове Ма¬
лакка. Известно около 20 видов. Многолетние травянистые лианы с
придаточными корнями. Листья цельные, глянцевые, ярко-зеленые
с золотисто-белыми пятнами и штрихами. Плод — ягода. Вегета¬
тивно размножают отводками и черенками. Используют как де¬
коративные ампельные растения во всех типах интерьеров.
Технология микроразмножения Scindapsus такая же, как и у
растений рода Syngonium. Незначительные изменения отражены в
ряде работ (Miller et al., 1976; Kunisaki, 1977; Debergh et al., 1981).
Syngonium Schott. Представители данного рода распространены
во влажных тропических лесах Центральной и Южной Америки,
на Больших и Малых Антильских островах. Известно около 20 ви¬
дов. Это декоративно-лиственные вечнозеленые лианы с прида¬
точными корнями. Листовая пластинка стреловидная, лопастная,
зеленая или пестрая. Цветки собраны в початок, плод — ягода. В
культуре цветут и плодоносят редко. Размножают отводками и
стеблевыми черенками. Благодаря высокой пластичности расте¬
ния этого рода широко используются в условиях интерьеров.
Для микроразмножения видов и сортов Syngonium в качестве
эксплантов используют апикальные и пазушные почки. Для по¬
лучения побегов применяют среду МС с 3 мг/л НУК и 5 мг/л БА.
Эта среда обеспечивает массовое образование растений, которые
укореняются в 1/2 концентрации среды МС с 2 мг/л ИМК
(Jesch, 1988; Michel, 1988).
Представляет интерес разработанный метод культивирования
эксплантов Syngonium в жидкой среде в биореакторе и в роллере
(при 100 об/мин). Через 1 мес культивирования удвоилась масса
каллуса и увеличилось количество побегов в опыте с биореакто¬
ром. Однако биомасса была большей и при обычном способе
культивирования. Побеги регенерировали на среде МС с 30 г/л
сахарозы и 2 мг/л кинетина. Укоренение растений происходило
спонтанно на этой же среде (Levin et al., 1997).
Zantedeschia Spreng. Представители этого рода произрастают в
тропиках Африки. Известно 8 видов. Многолетние растения с
толстым корневищем. Листья прикорневые, стреловидные, тем¬
но-зеленые, большие. Соцветие — початок, желтого цвета, дли¬
ной до 1 м. Покрывало хрупкое, белое, реже желтое. Часто ис¬
пользуется как срезная культура.
202
ГЛАВА 4. Методы размножения тропических и субтропических растений
Для микроразмножения из почек вычленяли апексы (1—2 мм)
и культивировали на среде МС с 30 r/л сахарозы и 1—10 мг/л БАП.
После 2 мес культивирования побеги интенсивно образовывались
на среде с 5—10 мг/л БАП (Ciliozeris et al., 2002).
Эти же авторы для размножения использовали участки кор¬
невища, которые сначала стерилизовали в 10%-м хлорамине
30 мин. Затем их делили на части и стерилизовали в 70%-м спир¬
те 30 с и в 95%-м спирте 5 с. После этого вырезали апикальную
почку и помещали на среду МС с 30 г/л сахарозы, 100 мг/л ино-
зитола, витаминами по Мурашиге—Скугу и 10 мг/л БАП. Среда
такого состава обеспечивала стабильное и массовое образование
побегов (Ciliozeris et al., 2004).
Xanthosoma Schott. Растения этого рода распространены в тро¬
пиках Центральной и Южной Америки, Африки, Юго-Восточной
Азии. Известно около 45 видов. Декоративно-лиственные много¬
летние корневищные растения. Листовая пластинка крупная,
фиолетово-зеленая, иногда с фиолетовыми пятнами вдоль жилок.
Цветки мелкие, обоеполые. Покрывало белое или светло-лиловое.
Плод — ягода. Сок может вызывать ожоги. Способы размноже¬
ния такие же, как и у Alocasia. На родине листья и корневища в
отварном виде употребляют в пищу как овощи.
Для микроразмножения Xanthosoma из корневища молодых
побегов выделяли почки, которые стерилизовали в 70%-м спирте
(3 мин) и 10%-м растворе chlorax (30 мин). Затем вычленяли под
микроскопом меристему (0,5—1,0 мм) и помещали на питатель¬
ную среду, содержащую макроэлементы по Мурашиге—Скугу и
микроэлементы по Ничу, 30 г/л сахарозы и 10 % кокосового мо¬
лока. Через 4 недели выращивания на эксплантах появлялись
сферические структуры, напоминающие по внешнему виду про¬
токормы орхидных или эмбриоиды. Побеги из этих структур бы¬
ли получены на среде МС с 5 мг/л НУК и 40 мг/л БА. Растения
лучше всего развивались на среде МС с 5 мг/л ИМК и 4 мг/л БА.
Укоренение растений происходило спонтанно на среде без фи¬
тогормонов (Quynh et al., 1987).
Araucariaceae Henkel et W. Hochstet.
Вечнозеленые хвойные растения, двудомные, реже
однодомные. Листья шиловидные до широкояйцевидных, кожи¬
стые, густо расположенные на ветвях. Распространены в Южном
полушарии. В семействе 2 рода.
203
СПЕЦИАЛЬНАЯ ЧАСТЬ
Araucaria Juss. Род включает 25 видов, произрастающих в Юж¬
ной Америке (Чили, Бразилия, Аргентина), Филиппинах, Новой
Зеландии. Очень древняя группа хвойных, ее возраст 200—
240 млн лет. Вечнозеленые деревья высотой до 80 м. Максималь¬
ный возраст 2000 лет. Листья крупные. Растения двудольные.
Семена ореховидные.
A. angustifolia (Bert.) Kunt. распространена в горах Бразилии.
Дерево высотой 50 м. Ветви тонкие, поникшие.
A. araucana (Mol.) C.Koch растет в Чили и образует обширные
леса. Листья кожистые, с колючками.
A. cunninghammi Ait. произрастает в тропических влажных ле¬
сах Западной Австралии, в прибрежной части поднимаясь до вы¬
соты 830 м над у. м. Деревья высотой до 60 м с пирамидальной
кроной. Ветви расположены горизонтально. Листья прямые, ост¬
роконечные, длиной до 1,8 см.
A. excelsa (Lamb.) R.Br. распространена в США. Деревья вы¬
сотой до 60 м. Ветви расположены горизонтальными ярусами.
Листья зеленые, шиловидные. Очень декоративна. Размножают
семенами (Черевченко и др., 1988).
Для микроразмножения видов Araucaria часто используют
ювенильный материал (сеянцы, выращенные in vitro). Так, расте¬
ния A. cunninghammi были получены при культивировании па¬
зушных почек сеянцев на среде МС с 10—15 мг/л БАП и 50 мг/л
НУК (Haines et al., 1974).
Очень часто для размножения Araucaria используют культуру
зародышей in vitro. Жизнеспособность изолированных зароды¬
шей, определяемая характером роста на твердой среде, зависит от
достижения ими критической величины влажности в процессе
предварительного высушивания. Ниже этого порога у зародышей
существенно уменьшалась устойчивость к потере влаги и имел
место значительный неорганизованный рост. Способ быстрого
высушивания зародышей, изолированных в асептических услови¬
ях в потоке стерильного воздуха, обеспечивал высокую выживае¬
мость корневой меристемы во время их роста. Указанный спо¬
соб, в сочетании с обработкой зародышей жидким азотом, пред¬
ложен в качестве возможного метода консервации in vitro (Benies
et al., 1976; Pritchard et al., 1986; Тарбаева, 1995).
Для микроразмножения A. angustifolia использовали пазушные
почки, верхушки побегов и сегменты стебля ювенильных расте¬
ний. Экспланты культивировали на среде МС с 10—15 мг/л БАП и
50 мг/л НУК. Через 9—14 недель культивирования начиналось раз¬
204
ГЛАВА 4. Методы размножения тропических и субтропических растений
витие культур. Каллус дифференцировался на кончиках молодых
побегов и узлах стеблей. Пазушные почки росли и формировали
адвентивные побеги. Побеги получали также из узловых сегментов
этиолированных стеблевых эксплантов. Особо следует отметить,
что изолированные ткани Araucaria содержат очень большое коли¬
чество фенольных соединений, которые выделяют в питательную
среду. Поэтому во избежание гибели культур к среде необходимо
добавлять 1 г/л активированного угля, а ткани часто пересаживать
и содержать в темноте. В связи с этим использование этиолиро¬
ванных побегов также снижает отрицательное воздействие фено¬
лов на культуры. Образование побегов проходило при 1/2 концен¬
трации макроэлементов в среде МС с добавлением 5,0—10,0 мг/л
БАП, 1,0—5,0 — 2-iP, 10,0—50,0— НУК и 15,0 мг/л глютамина
(Cardemil et al., 1982; Handro, 1986; Maene et al., 1988).
Интересные опыты провели Y. Burrow и соавт. (1988) по микро¬
размножению Araucaria с использованием различных эксплантов. В
первом эксперименте использовали стеблевые сегменты 30-суточ-
ных сеянцев. Экспланты культивировали на средах МС или Кнопа
с витаминами по Ничу, 2 % сахарозы, 50 мг/л аденина, 20,0 — глу¬
тамина, 20,0 — мочевины, 150 мг/л лимонной кислоты, ауксинами
и цитокининами. Культуры содержали в темноте и на свету.
Во втором эксперименте источником эксплантов были 7-су¬
точные сеянцы. Сегменты (2 см) ортотропных стеблей и иголок
помещали горизонтально на среду МС с добавлением аминокис¬
лот и 1 — 10 мг/л БАП, на которой они через некоторое время
регенерировали адвентивные побеги. Укоренение побегов про¬
ходило при 1/4 концентрации макроэлементов в среде МС с
10 мг/л ИМК. Сегменты гаметофитов культивировали на среде
МС с 10 мг/л НУК и 1 мг/л кинетина.
В третьем эксперименте культивировали in vitro иголки и сег¬
менты длиной 1 см 25-летних деревьев Araucaria на средах МС и
Нича. Формирование каллуса происходило на свету. Листовые
экспланты (иголки) дифференцировали каллус в среде МС с до¬
бавлением 10 мг/л НУК и 2 мг/л кинетина или 2-iP. Другие экс¬
планты регенерировали каллус на среде с 3 мг/л 2,4-Д и 2 мг/л 2-iP.
Полученный каллус субкультивировали 6 раз на среде МС с 10 мг/л
НУК и 2 мг/л кинетина. Формирование адвентивных почек луч¬
ше проходило на среде с 0,1 мг/л ИМК и 2 мг/л кинетина. Од¬
новременное образование каллуса и почек наблюдалось на среде
с 0,1 мг/л 2,4-Д и 2 мг/л кинетина (Benies et al., 1976; Stockey et
al., 1986; Burrow, 1987).
205
СПЕЦИАЛЬНАЯ ЧАСТЬ
Агесасеае Sch.-Bip. (Palmae Juss.)
Phoenix L. Распространены в тропиках и субтропи¬
ках Африки и Азии. Род насчитывает до 17 видов. Пальмы с од¬
ним или несколькими стволами. Ствол низкий или высокий, на
вершине увенчан кроной листьев. Листья непарноперистые, изо¬
гнутые, крупные. Соцветия пазушные. Декоративные двудомные
растения, из них Ph. dactylifera L. — ценная плодовая культура.
Ph. dactylifera L. распространена от южной части Испании и
побережья Африки через оазисы пустыни Сахара, Ливии, Нами¬
бии, Ирака и Ирана до правого берега р. Инд. Вечнозеленое рас¬
тение высотой до 30 м, образует роши в оазисах. Культивирует¬
ся как плодовое дерево. Размножается семенами (Бобров и др.,
1973).
Для микроразмножения Ph. dactylifera в качестве эксплантов
использовали кончики побега, латеральные почки, ювенильные
листья. На среде МС с добавлением 3 мг/л БАП, 100 мг/л 2,4-Д
и 3 г/л активированного угля в течение 6 мес культивирования
дифференцировался сначала каллус, а потом и побеги. Иногда
наблюдалось формирование эмбриоидов, которые на питатель¬
ной среде без фитогормонов образовывали нормальные растения.
Добавление регуляторов роста в среду оказывало существенное
влияние на развитие проростков. Наличие ИУК в среде блокиро¬
вало рост корней, но не влияло на развитие листьев. Совместное
и раздельное внесение в среду НУК и 2,4-Д вызывало каллусоге-
нез. Перенесение каллуса в среду с 20 мг/л НУК и 10 мг/л БАП
индуцировало интенсивный органогенез, который позволял по¬
лучать нормальные растения (Anemas et al., 1983).
Исследования некоторых авторов были направлены также на
изучение индукции образования каллуса и морфогенетического
потенциала различных эксплантов: верхушечной и пазушной по¬
чек, сегментов корней, стеблей и листьев. Экспланты культиви¬
ровали на среде МС, дополненной 3 г/л активированного угля,
100 мг/л 2,4-Д, 3 мг/л 2-iP. На этой среде наблюдался активный
каллусогенез. В результате субкультивирования верхушечных и па¬
зушных почек на среде с 0,1 мг/л НУК, но без активированного
угля формировались побеги. Каллус, образовавшийся на листовых
сегментах, давал начало только корням, а на каллусе корневого
происхождения индуцировать морфогенез не удалось. В покоя¬
щихся пазушных почках и тканях стебля каллус не формировался
и в культуре in vitro (Tisserat, 1982; Abdelouahhab et al., 1983).
206
ГЛАВА 4. Методы размножения тропических и субтропических растений
Есть сообщения, согласно которым для микроразмножения
Ph. dactylifera в культуре in vitro использовали также соцветия
женских растений в возрасте 50 лет. Ко времени изолирования
цветочные побеги представляли собой мелкие сферические обра¬
зования, едва заметные на соцветии. Экспланты помещали на
твердую среду МС, дополненную смесью витаминов, аденина,
НУК, 2,4-Д, ИМК, БАП, кинетина и зеатина. В течение 2—3 мес
экспланты культивировали в темноте, при этом наблюдали ре¬
версию цветочных побегов из репродуктивного состояния в веге¬
тативное. Во второй фазе культивирования экспланты переноси¬
ли на свет; концентрацию НУК уменьшали до 0,3—0,5 мг/л,
концентрацию кинетина увеличивали до 2—3 мг/л. В течение
второй фазы, которая длилась 2—4 мес, наблюдали позеленение
побегов и появление первых листьев. Реверсия зависела не толь¬
ко от состава среды, но также от стадии дифференцировки цве¬
точных примордиев (Noureddine et al., 1985).
Несколько видов пальм было размножено в результате куль¬
тивирования верхушек побега и эмбриогенного каллуса. Апексы
проростков выращивали в жидкой или на твердой среде МС, мо¬
дифицированной добавлением 1 мг/л НУК, 15 мг/л БА или 2-iP.
Оптимальная длина апекса 3 мм (апикальная меристема с 2—
5 листовыми примордиями). Исследуемые виды пальм отличались
по морфогенетическим потенциям апексов побегов (СаЬг, 1985).
Elaeis Jacg. Деревья с прямым или слабонаклоненным ство¬
лом. Листья перистые. Соцветие короткое, на массивном цвето¬
носе, пазушное, с однополыми, реже — двуполыми цветками.
Произрастают в Тропической Африке, в Центральной и Южной
Америке. В роде 2 вида.
Е. guineensis Jacg. распространена в Экваториальной Африке.
Вечнозеленое дерево высотой до 18 м, растущее в прибрежных
влажных тропических лесах. Широко культивируется как мас¬
личная пальма во всей Тропической Африке. Размножается веге¬
тативно и семенами (Бобров и др., 1973).
Исследовалась возможность размножения Е. guineensis Jacg.
var. tenera в культуре in vitro. Каллусную массу получали из сег¬
ментов молодых листьев, собранных с 6-месячных растений. Ос¬
нование листа разрезали на сегменты (10 х 15 мм) и размешали
на твердой среде МС. Наилучший рост каллусных культур был
отмечен на среде с 50—70 мг/л 2,4-Д. Для индукции эмбриогене¬
за каллусы переносили на среду МС с 1/2 концентрации макро¬
207
СПЕЦИАЛЬНАЯ ЧАСТЬ
элементов, 170 мг/л NaH2P04, 10 мг/л 2,4-Д, 0,01 мг/л 2-iP, 1 г/л
гидролизата казеина и 0,5 г/л активированного угля. На среде
этого состава эмбриоиды появлялись через 1 неделю культивиро¬
вания каллусов. Из эмбриоидов образовывались побеги, которые
укореняли на среде, содержащей НУК и ГК3. Было установлено
также, что эмбриогенез в каллусных культурах из листьев Е. gui-
neensis происходил как на твердой, так и в жидкой среде. Укоре¬
ненные побеги переносили в субстрат со стерильной почвой
(Thomas et al., 1985; Rival et al., 1997).
Begoniaceae C.A. Agardh
Begonia L. Род насчитывает около 1000 видов, рас¬
пространенных в тропиках всего земного шара. Многолетние
травянистые растения с прямостоящим стеблем, лианы, эпифи¬
ты. Листья разнообразной формы и окраски, опушенные, с вы¬
пуклым рисунком и без него. Цветки белые или розовые.
В. гех Putz. распространена в Северном Вьетнаме, Гималаях.
Растения могут достигать до 40 см в высоту. Известно много са¬
довых форм с разнообразной окраской листьев и опушением.
Для размножения in vitro сортов В. гех в качестве эксплантов
использовали ткани черешка листьев. Для промышленного раз¬
множения В. гех необходимо подбирать питательную среду, обес¬
печивающую микроразмножение и получение растений многих
сортов. В связи с этим изучали роль генетических, онтогенетиче¬
ских и физиологических факторов на развитие эксплантов раз¬
ных сортов на питательной среде. Было установлено, что иссле¬
дуемые сорта отличались по способности образовывать прида¬
точные почки и формировать растения.
Полученные in vitro растения использовали в дальнейшем как
вторичные экспланты. Однако и при этом наблюдались некото¬
рые различия. Сегменты листьев растений-регенерантов при куль¬
тивировании на среде МС с БАП и НУК также имели сортовые от¬
личия в процессе морфогенеза. Для разработки питательной среды,
пригодной для культивирования разных сортов, необходимо урав¬
нивать морфогенетическую способность эксплантов путем балан¬
са регуляторов роста в среде. Возможно, целесообразно исключить
из размножения сорта, имеющие низкий морфогенетический по¬
тенциал (Chlyah, 1972; Sehgal, 1975; Cassells et al., 1985, 1987).
В ходе работ нами также были размножены несколько деко¬
ративных форм этого вида. В качестве первичных эксплантов ис¬
208
ГЛАВА 4. Методы размножения тропических и субтропических растений
пользовали листовые пластинки. Стерилизацию проводили без
хлорсодержащих соединений. Каждый эксплант имел участок цен¬
тральной жилки листовой пластинки. Перед тем как размещать
эксплант на поверхности среды, рекомендуем обновить места
срезов. Экспланты располагали на модифицированной твердой
среде МС. Процессы каллусо- и органогенеза активнее проходи¬
ли на эксплантах, которые были вычленены из основания листо¬
вой пластинки и расположены абаксиальной стороной вверх. На
среде МС с БАП формирование регенерантов мы наблюдали по
периметру всего экспланта (рис. 4.20, см. вклейку). Через 40—
50 сут после пассажа на стандартную среду МС растения выса¬
живали ex vitro (рис. 4.21, см. вклейку).
В первое время после высадки растения очень чувствительны
к влажности воздуха. Как первичный субстрат использовали из¬
мельченный сфагновый мох.
В. tuberhybrida Voss, получена в результате скрещивания юж¬
ноамериканских видов. Низкорослые растения, образующие клуб¬
ни. Известно много сортов, есть ампельные формы.
При микроразмножении эксплантами служили сегменты ли¬
стьев (2x2 см) с участком главной жилки. Все экспланты погру¬
жали на 1/3 в питательную среду МС с невысоким содержани¬
ем агара. К среде добавляли витамины, сахарозу, 1 мг/л НУК и
5 мг/л БАП. Через 8—10 недель полученные культуры делили на
4—5 частей и снова погружали в среду, содержащую 1 мг/л БАП.
В этой среде проходила регенерация побегов, которые делили и
укореняли на среде с 2 мг/л ИМК в течение еще 2 недель. В це¬
лом для получения растений требуется 5 мес культивирования
(Zimneer et al., 1978а; Duan et al., 1984; Peck et al., 1984; Lida et
al., 1986).
B. elatior Putz. в оранжерейной культуре отличается особой
декоративностью. Begonia х elatior — гибридная форма. Листья глад¬
кие. Цветки мелкие, разнообразные по окраске и махровости.
Разработка методов ее микроразмножения весьма актуальна.
Верхушки побегов культивировали на среде МС с ИМК и БА,
получая растения. Затем из этих растений вырезали сегменты и
размещали на среде с НУК и БА, выращивая на свету и в темно¬
те. Укоренение растений проходило на среде без фитогормонов
(Mikkelsen et al., 1978).
Изучалась также возможность микроразмножения Begonia х ela-
hor с использованием таких эксплантов, как сегменты цветонож¬
ки, ткани цветоноса, сегменты чашелистиков, лепестков, содержа¬
209
СПЕЦИАЛЬНАЯ ЧАСТЬ
щих базальную часть. Экспланты культивировали на среде Маг-
gara, дополненной различными концентрациями НУК, 2,4-Д,
кинетина и БАП. Образование лепестков или аномальных цвет¬
ков имело место только на сегментах лепестков или цветоноса.
На других эксплантах наблюдали образование меристемоидов,
которые впоследствии не образовывали адвентивные почки. Вне¬
сение 2,4-Д редко усиливало образование таких структур, эффект
среды зависел от наличия в ней цитокининов. Увеличение кон¬
центрации сахарозы в среде до 5 % и выше не влияло на образо¬
вание меристемоидов, но стимулировало образование цветков.
Было установлено также, что культивирование эксплантов свыше
2 недель значительно снижало способность культур к органогене¬
зу (Margara, 1982b).
Для микроразмножения Begonia х elatior в культуре in vitro в ка¬
честве эксплантов часто использовали сегменты лепестков. Их вы¬
ращивали на питательной среде МС с добавлением 0,5 мг/л БА,
2 мг/л НУК и 0,1 мг/л 2,4-Д. Через 3—4 недели культуры образо¬
вывались участки меристематической ткани (меристемоиды). На¬
блюдали формирование аномальных вегетативных почек. При ис¬
пользовании целого бутона часто образовывался нормальный цве¬
ток. Однако из лепестков цветок никогда не формировался, а воз¬
никали окрашенные лепестковые структуры (Margara et al., 1982а).
Также было изучено влияние питательных сред с различным
составом макроэлементов и разными концентрациями сахарозы
(3 и 6 %). На среде с цитокинином и ауксином образовывались
меристемоиды и каллусная ткань, которая лишь в редких случаях
переходила к органогенезу. Определена зависимость эффектив¬
ности размножения от состава минеральных компонентов и угле¬
водов в среде (Margara et al., 1982а).
В качестве первичных эксплантов у В. riger elatior использова¬
ли сегменты цветоноса и цветков. Морфогенный каллус был ин¬
дуцирован на среде МС с добавлением 0,9 мг/л 2,4-Д и 4,4 мг/л
БАП. Индукция побегов проходила на среде Пирика с 4,4 мг/л
БАП. Адвентивные почки и побеги были получены на среде
Кнопа (макроэлементы) с добавлением микроэлементов по Ничу,
витаминов по Мурашиге—Скугу и 4,4 мг/л БАП. Адвентивные
побеги активно пролиферировали на среде с 27 мг/л НУК,
1,14 мг/л ИУК, 2,9 мг/л ГК3. Полученные побеги хорошо укоре¬
нялись на среде МС (1/2 макроэлементов) с 5 мг/л ИМК. Ана¬
логичными методами была размножена in vitro и В. picta ’Snuth'
(Thakur, 1975).
210
ГЛАВА 4. Методы размножения тропических и субтропических растений
При микроразмножении В. franconis Liebm. изучали развитие
цветочных почек. В качестве эксплантов использовали соцветия
с 1 большой и 2 маленькими почками. Почки были помешены на
среду МС (жидкую и твердую) с регуляторами роста. Установле¬
но, что на рост почек in vitro влияет концентрация NOj и NHJ
в среде. Рост и развитие почек зависели также и от наличия ци¬
токининов, причем для развития больших почек их концентра¬
ция должна быть в 10—30 раз больше, чем для маленьких. Добав¬
ление ИУК к среде оказалось неэффективным. Аналогичным
было и действие ГК3. Однако наличие в среде ИМК способство¬
вало росту и размножению почек (Berghoef et al., 1979).
В. fimbristipula Hook, размножали в культуре in vitro с помо¬
щью сегментов листьев. Изучено влияние регуляторов роста (ко¬
косового молока, НУК, БАП, зеатина, 2,4-Д) на дифференциа¬
цию различных новообразований при культивировании эксплан¬
тов на среде Шенка—Хильдебранта. Установлено, что основное
влияние оказывали 2,4-Д, БАП, кокосовое молоко и гидролизат
казеина. Исследованы также различные комбинации и концен¬
трации этих компонентов. Выяснено, что при культивировании в
жидкой перемешивающейся среде (в шейкере) с добавлением
0,125 мг/л 2,4-Д, 0,25—0,5 мг/л БАП, 200 мг/л гидролиза казеи¬
на, 10 % кокосового молока проходила непосредственная индук¬
ция образования значительного количества соматических эм¬
бриоидов. Эмбриоды на глобулярной, сердечко- и торпедовидной
стадиях, а также на стадии формирования семядолей образовы¬
вались в таких условиях после 50 сут культивирования.
Кроме того, отмечено одновременное образование соматиче¬
ских зародышей и адвентивных почек из клеток эпидермиса. Со¬
матические зародыши проходили в своем развитии четыре пе¬
риода. Глобулярные эмбриоиды отделялись от экспланта и пере¬
ходили в среду, тогда как адвентивные почки постоянно сохраня¬
ли с ним контакт. Эмбриоиды на торпедовидной и семядольной
стадиях характеризовались специфической структурой с зачатка¬
ми стебля и корня, 2 семядолями со срединной апикальной ме¬
ристемой и прокамбием. К сожалению, адвентивные почки име¬
ли только апекс побега (Cohl et al., 1976; Zimner et al., 1978a;
Langyjng et al., 1988).
Для быстрого размножения сортов и гибридов Begonia х
х hiemalis использовали сегменты листьев, черешков, стеблевых от¬
резков. Экспланты разрезали на части длиной 0,5—1,0 см и по¬
мещали на твердую среду МС. К среде добавляли 0,5 мг/л НУК,
211
СПЕЦИАЛЬНАЯ ЧАСТЬ
2,0 мг/л БАП, 1,0 мг/л кинетина и культивировали в темноте и
на свету. Сегменты листьев и черешков в условиях темноты обра¬
зовывали каллус. Его отделяли и выращивали в жидкой переме¬
шивающейся среде МС с 1,0 мг/л БА и 0,1 мг/л ИУК, получая
гомогенную каллусную суспензию. В дальнейшем эту смесь
(1 мл) выливали на поверхность твердой среды МС с 4,0 мг/л БА
и 1,0 г/л активированного угля. На данной среде проходила массо¬
вая дифференциация побегов, которые отделяли и укореняли на
среде с 2,0 мг/л ИМК. Применение жидких перемешивающихся
питательных сред значительно усиливало эффективность раз¬
множения (Hilding et al., 1976; Westerhof et al., 1984; Janssens,
1987; Simmonds et al., 1987).
Bromeliaceae Juss.
Бромелии — это оригинальные декоративные рас¬
тения, перспективные для озеленения интерьеров и комнатного
цветоводства. Однако коэффициент вегетативного размножения
бромелиевых довольно низок и выход посадочного материала не
удовлетворяет растущий спрос.
Цель наших исследований — усовершенствование метода кло¬
нального размножения бромелиевых. Основным условием разра¬
ботки приемов массового размножения является решение ряда
методических вопросов: подбор оптимальных условий ведения
культуры, изучение режимов стерилизации растительного мате¬
риала, оптимизация состава питательных сред.
Aechmea Ruiz et Pav. Представители рода распространены в
Аргентине, Бразилии, Мексике. Известно около 180 видов.
Многолетние декоративно-лиственные растения, эпифиты или
наземные. Листья ланцетовидные, плотные, по краям с колюч¬
ками, собраны в розетку. По окраске темно-зеленые, пятнис¬
тые, полосатые, багряно-красные. Соцветие — метелки, кисти,
головки. Традиционно размножают семенами, вегетативно и в
культуре тканей. Устойчивы к неблагоприятным условиям ин¬
терьеров.
Первые результаты опытов с культурой тканей бромелиевых
опубликованы в 1973—1974 гг. (Mapes, 1973; Muraschige, 1974;
Zimmer und and., 1974). Однако авторы не указали подробностей
метода, и только К. Zimmer и соавт. (1976) отметили определен¬
ную трудность стерильной культуры пазушных почек взрослых
растений. Обычные методы стерилизации с применением хлор¬
212
ГЛАВА 4. Методы размножения тропических и субтропических растений
ной извести (20 г/140 мл воды) в течение 3—5 мин дали очень
низкий эффект. Поэтому было рекомендовано использовать мо¬
лодые латеральные побеги, что позволяет получить до 50 % сте¬
рильных эксплантов.
A. caudata Lindl. произрастает в прибрежных лесах Бразилии.
Это многолетние травянистые растения высотой до 1 м. Листья
ремневидные, жесткие, ярко-зеленые с кремовыми полосками,
собраны в плоскую розетку. Цветонос высокий, прямой, возвы¬
шающийся над розеткой (соцветие — разветвленный колос).
Цветки золотисто-желтого цвета, прицветники оранжево-желтые.
В культуре есть ряд декоративных форм.
A. fasciata (Lindl.) Bak. — травянистые многолетние расте¬
ния, которые произрастают в горных лесах Бразилии. Розетки
высотой до 50 см, листья длинные, кожистые, полосатые, с од¬
ной черной колючкой на конце, края зубчатые. Цветонос пря¬
мой, высотой до 40 см. Соцветие — короткий цилиндрический
колос. Цветки в начале цветения голубые, позже — сине¬
красные.
A. nudicaulis (L.) Griseb. распространена в Центральной Аме¬
рике, Вест-Индии, Венесуэле, Бразилии. Это многолетние травя¬
нистые растения высотой до 90 см, произрастающие наземно или
эпифитно в тропических лесах. Листья плотные, серо-зеленые с
коричневыми пятнами, острыми черными колючками по краям.
Цветонос прямой, красный, с белыми чешуйками по краям. Со¬
цветие — простая кисть, несущая большие ярко-красные при¬
цветники.
Для микроразмножения вышеуказанных видов мы использо¬
вали молодые, еще не раскрывшиеся побеги 5—7 см в длину. Для
стерилизации применяли 10%-й гипохлорид кальция и 20%-й
пергидроль (по 5—7 мин) с последующим промыванием материа¬
ла в стерильной воде. Следует отметить, что у некоторых видов
(A. caudata, A. fasciata, A. nudicaulis) указанный режим стерилиза¬
ции вызывает потемнение ткани. Положительных результатов мож¬
но добиться, применяя только гипохлорид кальция (15 мин). Хо¬
рошие результаты (до 80 % стерильных эксплантов) дает исполь¬
зование 1%-го раствора famosept (7 мин) и 20%-го пергидроля
(Ю мин).
Под бинокулярным микроскопом вычленяли латеральные
почки диаметром 3—5 мм и верхушку побега длиной 2—3 мм. С
соблюдением физиологической полярности почки быстро пере¬
носили на поверхность агаризированной среды.
213
СПЕЦИАЛЬНАЯ ЧАСТЬ
Т. Murashige (1974) рекомендует использовать среду МС с
ИМК и НУК (по 1,75 мг/л), лимонной кислотой (150 мг/л) для
первой стадии культивирования. Далее он советует вносить в среду
по 2,0 мг/л ИУК и кинетина, а также 80,0 мг/л аденинсульфата. В
таких условиях в жидкой среде в роллере происходило образова¬
ние адвентивных почек у эксплантов Aechmea, Ananas, Cryptanthus,
Cryptbergia (Vinterhalter et al., 1994). K. Zimmer и W. Piper (1974)
использовали жидкую среду Кнудсона с добавлением 0,1 мг/л
НУК, 1 мг/л БАП и 10 % березового сока. Пазушные почки Aech¬
mea в этой среде образовывали многочисленные побеги. Для даль¬
нейшего культивирования отделяли от растений-регенерантов ли¬
стья, на которых также индуцировалось побегообразование. Ко¬
эффициент при подобном способе размножения 1:10, т. е. за год
из 1 почки можно получить 10 растений-регенерантов.
В наших исследованиях были испытаны питательные среды,
отличающиеся количеством минеральных солей (Кнудсона, МС,
Пирика), и те же среды, дополненные различными концентра¬
циями аденина (10—20 мг/л), кинетина (0,5—1,0 мг/л), 2,4-Д
(0,1—0,2 мг/л) и березового сока (10—20 %). Оптимальными ока¬
зались следующие питательные среды: МС с добавлением
0,2 мг/л 2,4-Д и 10 % березового сока; Кнудсона с микроэлемен¬
тами по Ничу, 20 мг/л аденина и 20 % березового сока; Пирика
(табл. 4.11).
В зависимости от условий культивирования процессы регене¬
рации изолированных тканей проходили по-разному. Многие
почки в темноте не развивались и гибли. Однако у большинства
видов из эксплантов регенерировали растения. Поэтому в даль¬
нейшем все экспланты после вычленения помещали в темноту
при 24—25 °С до начала набухания почек (на 20—30 сут). Затем
их выставляли на свет, где в течение 60—70 сут индуцировалось
образование адвентивных почек и побегов. Через 3—4 мес каждая
почка образовывала по 15—20 побегов, которые можно было от¬
делять, отсаживать и непрерывно культивировать до получения
необходимого количества растений. Хорошо развитые проростки
с 3—4 листочками укореняли на среде Кнудсона (Кушнир и
др., 1984).
По нашим данным, использование среды Кнудсона с березо¬
вым соком способствует образованию генетически однородных
растений. В то же время, по наблюдениям К. Zimmer и W. Piper
(1976), длительное выращивание бромелиевых на средах с БАП
приводит к образованию более 50 % химерных растений.
214
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.11. Состав питательных сред, используемых для культивирования
эксплантов Bromeliaceae Juss., мг/л
Компонент
Среда
МС
Пирика
Кнудсона
NH4NO3
1650,0
825,0
—
KN03
1900,0
930,0
—
СаС12 Н20
440,0
220,0
—
MgS04 7Н20
370,0
185,0
250,0
КН4Р04
170,0
85,0
250,0
Ca(N03)2 4Н20
—
—
1000,0
(NH4)2S04
—
—
500,0
MnS04 4Н20
22,3
22,3
3,0
Н3ВО3
6,2
6,2
0,5
ZnS04 4Н20
8,6
8,6
0,5
KI
0,83
0,83
—
Na2Mo04 2Н20
0,25
0,25
0,025
CuS04 5Н20
0,025
0,025
0,025
CoCI2 6Н20
0,025
0,025
—
Fe-цитрат ■ 5Н20
—
—
10,0
FeS04 7Н20
27,8
27,8
—
Na23flTA
37,3
37,3
—
Аденин
—
—
20,0
Глицин
2,0
—
—
Гидролизат казеина
500,0
—
—
Мезо-инозит
100,0
100,0
—
Никотиновая кислота
0,5
0,5
—
Пиридоксин
0,5
0,5
—
Тиамин
0,1
0,4
—
2,4-Д
0,2
—
ИУК
2,0
Кинетин
0,2
1,0
БАП
1,0
Березовый сок*
100,0
100,0
Глюкоза
20 000,0
—
Сахароза
20 000,0
20 000,0
Агар
7000,0
8000,0
700,0
* В миллилитрах на 1 л.
Растения-регенеранты хорошо (до 100 %) приживаются в суб¬
страте из сфагнового мха и лиственной земли (1:1). Первые 2—
недели после пересадки в теплице поддерживалась высокая
влажность. Через 4 мес растения достигали высоты 7—8 см.
215
СПЕЦИАЛЬНАЯ ЧАСТЬ
Ananas Adans. Представители рода распространены в Южной
Америке от Бразилии до Парагвая и Гвианы, во Вьетнаме. Из¬
вестно около 9 видов.
A. comosus (L.) Merill — многолетние травянистые растения
высотой до 60 см. Стебель укороченный. Листья жесткие, ремне¬
видные, узкие, длиной до 1,5 м, с колючками по краям, зеленые
или полосатые, с согнутым вниз кончиком. Цветонос высотой до
60 см. На верхушке оранжево-коричневого шишкообразного мя¬
систого (2—15 кг) соплодия продолжает расти побег, образующий
розетку листьев и у основания которого развиваются отпрыски.
Размножают вегетативно-верхушечными или боковыми побе¬
гами, черенками, реже семенами. Соплодия используют как цен¬
ный пищевой продукт. Выращивают в зимних садах и помеще¬
ниях как декоративные растения, содержат в коллекциях ботани¬
ческих садов. Наиболее эффективный метод размножения —
культура тканей; его используют для получения посадочного ма¬
териала при промышленном выращивании.
В условиях асептической культуры A. comosus размножали с
помощью апикальных и терминальных почек. Для этого исполь¬
зовали среду МС с 2,0 мг/л ИМК, 2,0 мг/л НУК и 2,0 мг/л кине¬
тина. На ней проходила регенерация первичных побегов, а вот
мультипликацию осуществляли на среде МС с 2,0 мг/л БА. Сег¬
менты листьев побегов, полученных на среде МС с 0,5 мг/л 2,4-Д
и 2,0 мг/л БА, интенсивно пролиферировали каллус. Как прави¬
ло, он формировался у основания влагалищной части. Размно¬
жение образовавшихся побегов осуществляли как в жидкой (на
мостиках из фильтровальной бумаги), так и на твердой среде.
Жидкие среды МС были дополнены 5,4 мг/л ИУК и 2,1 мг/л ки¬
нетина. Твердые среды имели несколько иной состав: среда МС
с 10,0 мг/л НУК и 15 % кокосового молока. Обе среды были дос¬
таточно эффективны для регенерации адвентивных побегов. До¬
бавление кокосового молока к среде вызывало эффект, анало¬
гичный использованию фитогормонов. Поэтому его лучше при¬
менять на начальных этапах размножения. Отмечено также обра¬
зование большого количества побегов на среде МС с 2,0 мг/л БА.
Для укоренения полученных при размножении побегов рекомен¬
дуется использовать среду Уайта с 0,05 мг/л НУК и 0,4 мг/л
ИМК или безгормональную среду МС (Mathews et al., 1981).
При культивировании на питательной среде МС апикальных
почек A. comosus установлено, что на интенсивность регенерации
побегов влияет их размер, состав среды и соотношение регулято¬
216
ГЛАВА 4. Методы размножения тропических и субтропических растений
ров роста. Почки с большим количеством листовых примордиев
развивались очень медленно. После удаления основной их части
(почечных чешуек) наблюдалась стабильная (каждые 6 недель)
регенерация побегов (Fitchet, 1990b).
Другие исследователи культивировали апикальные почки
A. comosus на среде МС с цитокининами. Уже через 1 неделю
культивирования на среде МС с 2,5 мг/л БА, 2,0 мг/л НУК и
10 % кокосового молока образовались зеленые побеги. Формиро¬
вание адвентивных побегов проходило в жидкой среде того же
состава в течение 6 недель. Укореняли побеги на среде МС с
0,5 мг/л НУК или ИМК (Firoozabady et al., 1995).
Довольно часто различные части побегов ананаса, получен¬
ных в культуре in vitro (сегменты листьев, стеблей, корней), ис¬
пользуют как вторичные экспланты. Так, листовые сегменты (па¬
зухи листьев) на среде МС с 2,7 мг/л НУК и 4,4 мг/л БА форми¬
ровали сначала эмбриоиды, а потом побеги. Следует отметить,
что применение культуры тканей способствует получению оздо¬
ровленных от бактериальных болезней растений ананаса, в част¬
ности от Phytophthora. Данное заболевание может вызывать мас¬
совое поражение промышленных посадок этого растения.
Предприняты также попытки культивирования изолирован¬
ных тканей Ananas в специальных биореакторах с контролируемы¬
ми условиями выращивания. Весь процесс размножения включает
три фазы: пролиферация, собственно размножение и образование
адвентивных побегов. Установлено, что основным стимулирующим
фактором является свет. От интенсивности освещения зависело
качество получаемых растений, а также лучшее использование
компонентов питательной среды (Fitchet, 1990а).
В наших исследованиях эксплантами были пазушные почки
верхушечной части зрелых соплодий. Для их стерилизации при¬
меняли 1%-й famosept (15 мин) и 15%-й пергидроль (10 мин) с
последующей 3-кратной промывкой водой. Культивировали экс¬
планты на среде МС с 2,0 мг/л БАП и 15 % кокосового молока в
условиях темноты и на свету. Наилучшие результаты были полу¬
чены на среде с кокосовым молоком. Более 60 % эксплантов
пролиферировали адвентивные побеги, которые в дальнейшем
отделяли и субкультивировали. Укоренение происходило спон¬
танно на безгормональной среде МС (рис. 4.22).
Каллусные культуры A. comosus var. sativus (Lindl.) Mez., об¬
разующиеся при микроразмножении этого вида, можно при¬
менять для получения бромелайна в медицинских целях. В каче-
217
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.22. Растения-рсге-
неранты Ananas comosus
(L.) Merill, пригодные к
высадке в субстрат
стве эксплантов использовали листья и пазушные почки верху¬
шек зрелых плодов, а также полученные in vitro стерильные по¬
беги. Их культивировали на среде МС с добавлением 2,4-Д (8 мг/л)
и кинетина (4 мг/л). Наибольшую регенерационную способность
имели части стерильных побегов (100 %) и пазушные почки
(85 %). Образовавшийся каллус использовали для получения сус¬
пензии. Ее рассеивали на среду МС (1/2 макроэлементов) с
2 мг/л 2,4-Д и 1,0 мг/л кинетина. Протеометическая активность
каллусных тканей составила 2881 ед/ч клеток, что было значи¬
тельно выше, чем у самого взрослого растения ананаса (Tiejian et
al., 1994).
Billbergia Thunb. Представители рода распространены в Брази¬
лии, Уругвае, Аргентине, Перу, Боливии. Известно около 60 ви¬
дов. Многолетние эпифиты. Листья кожистые, линейные, мелко¬
зубчатые по краям. Цветет в течение года. Цветки собраны в по¬
никшие яркие соцветия. Размножают семенами, отпрысками.
Очень устойчивы к неблагоприятным условиям и эффектны, по¬
этому часто используются в разнопрофильных интерьерах, зим¬
них садах.
В. nutans H.Wendl. произрастает на территории Аргентины,
Бразилии, Уругвая, Парагвая во влажных тропических лесах. Ли¬
стья собраны в розетку длиной до 60 см, жесткие, сверху зеле¬
218
ГЛАВА 4. Методы размножения тропических и субтропических растений
ные, снизу серебристо-зеленые, чешуйчатые. Соцветие — про¬
стой колос. Цветки крупные, лепестки зеленые с синими кончи¬
ками. В наших условиях цветет в зимний период. Один из самых
неприхотливых и выносливых видов бромелиевых.
В. pyramidalis (Sims) Lindl. распространена в тропических ле¬
сах Бразилии. Часто растения произрастают эпифитно, реже —
наземно (на плодородных почвах, скалах и пнях). Листья длиной
до 60 см, ярко-зеленые, формируют трубчатую розетку. Цветонос
прямой, розовый, немного приподнят над розеткой. Соцветие
головчато-колосовидное и несет цветки с карминово-красными
лепестками. В условиях оранжерей цветет в летний период.
В. saundersii hort. Bull, произрастает на территории Бразилии.
Это многолетние травянистые розеточные растения, эпифиты.
Листья длиной до 40 см, плотные, кожистые, сверху зеленые,
снизу красно-бурые с желтовато-красными пятнами по всей по¬
верхности. Цветонос поникший, карминово-красный. Соцветие —
простая немногоцветковая кисть. Прицветники яркие, кармино¬
во-красные. В условиях притенения растения становятся зелены¬
ми. В оранжереях НБС НАН Украины цветение приходится на
февраль—июль.
В. vittata Brongn. ex Morel произрастает в тех же условиях, что
и В. pyramidalis. Листья кожистые, плотные, зеленые, с поперечны¬
ми серебристо-белыми полосками, отогнутой верхушкой, иногда
с пурпурным оттенком, до 1 м длиной. Цветонос изогнутый, сви¬
сает из розетки. Соцветие — метелка, несущая крупные красные
блестящие прицветники. Цветет летом.
Для клонального размножения мы использовали такие виды:
В. nutans, В. pyramidalis, В. vittata, В. saundersii. Метод получения
стерильных эксплантов (латеральные почки) такой же, как и у
Aechmea. Изолированные почки В. nutans на свету на среде МС с
2 мг/л БАП регенерировали растения. Через 1 мес культивирова¬
ния было получено уже 10—20 адвентивных побегов. На свету
проходило множественное побегообразование у почек В. vittata,
В. pyramidalis, В. saundersii. Через 3 мес в ходе дальнейшего пас¬
сивирования почек на свету образовались многочисленные зеле¬
ные побеги, которые после укоренения высаживали в субстрат.
Для размножения видов рода Billbergia можно применять и жид¬
кие питательные среды (Hosoki et al., 1980). Проведенные нами
исследования позволили разработать технологию, с помощью ко¬
торой за 9 мес культивирования можно получить из одной почки
200—300 растений.
219
СПЕЦИАЛЬНАЯ ЧАСТЬ
Cryptanthus Otto et Dietr. Представители данного рода произ¬
растают в Бразилии, Гвиане. Известно около 25 видов и разно¬
видностей.
C. sinuosus L. — многолетние растения с сильно укороченным
стеблем, произрастающие во влажных тропических лесах и в бо¬
лее сухих листопадных лесах как эпифиты или наземно. Розетки
могут достигать в диаметре до 60 см. Листья кожистые, ярко ок¬
рашены, по краям с колючками или без них, собраны в розетки.
Соцветие головчатое или колосовидное, цветки белые, скрыты в
пазухах листьев. Плод — ягода. Размножают семенами, отпры¬
сками и в культуре тканей. Используют в экспозициях.
Для микроразмножения можно использовать листовые и стеб¬
левые экспланты. Перед вычленением эксплантов растение 3 раза
опрыскивали фунгицидами. Затем отделяли столоны и стерилизо¬
вали в 70%-м спирте (1 мин) и 5%-м гипохлорите (30 мин), потом
разрезали на сегменты по 2 см длиной и культивировали на среде
МС с БАП и тидиазуроном (ТДЗ). Многочисленные побеги форми¬
ровались через 7 недель. Полученные побеги разделяли и исполь¬
зовали как источник ткани для образования адвентивных побегов.
В дальнейшем стеблевые экспланты этих побегов культивиро¬
вали на среде МС с 22 мкМ БАП. Через 4 недели регенерировал
один побег, а через 4 мес их было уже достаточно много. Для
стеблевых эксплантов лучше использовать среду МС с 4,4 мкМ
БАП. Культивирование всех типов эксплантов на среде МС с до¬
бавлением ТДЗ давало плохие результаты. Образование адвен¬
тивных побегов наблюдали и на среде МС с 0,1 мкМ БАП. Уко¬
реняли полученные побеги на среде МС без фитогормонов. Раз¬
множение адвентивными побегами может осуществляться на
протяжении 2 лет. Растения-регенеранты криптантуса переноси¬
ли в почву, акклиматизировали, и они имели нормальную мор¬
фологию (Carneiro et al., 1998).
Dyckia Schult. Родина — Центральная Бразилия, Уругвай, Па¬
рагвай, Северная Аргентина и Боливия. Род включает около 100 ви¬
дов, произрастающих на открытых солнечных местах, среди кам¬
ней и в расщелинах скал.
D. brevifolia Bak. распространены в кампосах на территории
Бразилии. Декоративно-лиственные растения с ползучим корне¬
вищем. Листья зеленые, суккулентные, жесткие, собраны в ком¬
пактную розетку длиной до 20 см. Соцветие — колос. Лепестки
яркие, желтого цвета. Очень выносливые растения. Применяют
для озеленения различных интерьеров.
220
ГЛАВА 4. Методы размножения тропических и субтропических растений
В наших исследованиях для микроразмножения были ис¬
пользованы части сеянцев, выращенных в стерильных условиях.
Наиболее активное формирование адвентивных побегов наблю¬
далось на модифицированной среде Пирика, после чего расте¬
ния доращивали на стандартной среде МС (рис. 4.23, см. вклей¬
ку). Постасептическую адаптацию проводили традиционно для
видов этого семейства. В качестве первичного субстрата исполь¬
зовали сфагнум. Растения-регенеранты приживались полностью.
В целом метод микроразмножения аналогичен таковому А. со-
mosus. Незначительные отличия в методах размножения изложе¬
ны в работах некоторых авторов (Van Dijck et al., 1988; Mercier
et al., 1993).
Guzmania Ruiz et Pav. Представители рода произрастают в
Южной и Центральной Америке на высоте до 2400 м над ур. м.
По данным различных авторов, в роде насчитывается около
130 видов. Много декоративных растений, получивших широкое
распространение в промышленном цветоводстве (Чеканова, Ко¬
ровин, 2000).
G. monostachia Rusby ex Mez. — многолетнее растение, дости¬
гающее до 40 см в высоту. Листья линейные, длиной до 30 см,
желтовато-зеленые, цельнокрайные, голые. Соцветие с цветоно¬
сом выступает над розеткой листьев. В культуре есть ряд гибри¬
дов и сортов.
Для получения стерильной культуры представителей этого
вида были использованы семена репродукции НБС НАН Украи¬
ны. Для стерилизации применялись стандартные методики. Вы¬
сев проводили из нераскрывшихся коробочек на среду МС. Все
семена оказались жизнеспособны. Сеянцы развивались асинхронно.
На среде Пирика с 1 мг/л БАП удалось индуцировать развитие па¬
зушных почек у листьев низовых формаций. С помощью данного
приема растения можно размножить в необходимом количестве.
Доращивание проводили на среде МС с 1 г/л активированного
угля (рис. 4.24, см. вклейку). Следует отметить, что в условиях in
vitro корни практически не формировались, что, однако, абсо¬
лютно не влияло на процесс дальнейшей постасептической адап¬
тации ювенильных растений. В качестве первичного субстрата
использовали сфагновый мох. Все прочие условия были такими
же, как и для других тропических бромелиевых. Адаптировались
практически все растения.
Neoreqelia L.B. Smith. Виды рода (всего около 40) распростра¬
нены в Южной и Восточной Бразилии, Колумбии, Перу. В связи
221
СПЕЦИАЛЬНАЯ ЧАСТЬ
с тем что маточные розетки растений после цветения погибают,
всегда существует необходимость в посадочном материале.
N. carolinae (Mez.) L.B. Smith. — декоративно-лиственные
бесстебельные розеточные растения. Произрастают как эпифиты
или наземно во влажных тропических лесах. Листья кожистые,
плотные, блестящие по краям, с колючками или без них. Окра¬
ска зеленая, серебристая, коричневая. Соцветие — щиток, распо¬
ложенный в центре. Лепестки у цветков яркой окраски. Размно¬
жаются семенами, которые образуются после гибели растений
(после цветения). Используются в интерьерах как устойчивые
декоративные растения.
В культуре in vitro мы размножали N. carolinae и N. carolinae
var. tricolor L.B. Smith. Эксплантами были латеральные почки и
верхушки побегов. На среде Кнудсона с 20 % березового сока и
20,0 мг/л аденина экспланты регенерировали адвентивные побе¬
ги, которые использовали для дальнейшего субкультивирования.
Только N. carolinae var. tricolor регенерировала по 1 растению.
Размножению in vitro растений этого рода посвящены исследова¬
ния и других авторов (Kukulczanka et al., 1989).
Nidularium Lem. Родина — Бразилия. Произрастают в тени¬
стых влажных тропических лесах. Известно 25 видов. Размножа¬
ют семенами, отпрысками и в культуре тканей. Используют для
озеленения.
N. burchellii Mez. — декоративно-цветущие растения с сильно
укороченным стеблем. Листья блестящие, мягкие, линейные,
зубчатые по краям, от зеленых до пурпурных с полосками и пят¬
нами. Цветки собраны в кисть на дне розетки. Цветонос корот¬
кий, слегка выдающийся из розетки. Соцветие — головка, на ко¬
торой расположены цветки с белыми лепестками.
N. innocentii Lem. — многолетние травянистые растения. Диа¬
метр розетки листьев до 60 см. Листья длиной до 30 см, жесткие,
ремневидные, однотонные или полосатые. Прицветные листья
крупные, длиной до 5 см, яркой окраски (от розовой до оранже¬
вой).
В качестве эксплантов для размножения указанных выше ви¬
дов использовали латеральные почки. При культивировании на пи¬
тательной среде МС с 4,0 мг/л аденина, 15 % березового сока или
кокосового молока они пролиферировали вначале каллус, а потом
побеги. Их отделяли и использовали как вторичные экспланты.
Множественное образование побегов характерно для N. burchellii, а
вот N. innocentii регенерирует только одиночные растения.
222
ГЛАВА 4. Методы размножения тропических и субтропических растений
Tillandsia L. Родина — Америка (от юга США до юга Арген¬
тины)- Известно около 400 видов, произрастающих на деревьях,
скалах и реже — на почве. Эпифиты, диаметр от 1,5 см до не¬
скольких метров. Листья узколинейные, блестящие, гладкие по
краям, с чешуйками разной формы и окраски. Лепестки разного
цвета, яркие. Прицветники яркие. Выращивают на кусочках ко¬
ры, корневищах папоротников. Наиболее эффективный метод
размножения — культура тканей. Используют для озеленения ин¬
терьеров.
Т. bulbosa Hook. — эпифит, высотой 7—22 см. В природе
обычно образует группы из особей различной величины и окра¬
ски. Листья (8—15 шт.) с толстыми влагалищами, которые и
формируют клубневидную розетку, резко переходят в зеленые
закрученные шиловидные пластинки длиной до 30 см. Цветонос
прямой. Соцветие метельчатое, с большими листьями красного
цвета. Вид распространен от Мексики и Вест-Индии до Эквадора
и Бразилии. Встречается в тропических и субтропических лесах
на высоте до 1350 м над ур. м. (Сааков, 1983; Чеканова, Коро¬
вин, 2001). Сходную биологию, распространение и внешний вид
имеют и такие виды, как Т. argentea Griseb., Т. balbisiana Schult.f.,
Т. butzii Mez., T. caput-medusae E.Morren, T. pseudobaileyi S.Gard.,
T. schiedeana Steud., которые также были размножены нами в ус¬
ловиях культуры in vitro.
Для получения стерильной культуры видов данного рода мы
рекомендуем применять семена. В работе нами были использо¬
ваны семена как собственной репродукции, так и полученные по
делектусному обмену. Растения, плодоносящие в оранжереях
НБС НАН Украины (Т. balbisiana, Т. butzii, Т. pseudobaileyi), вво¬
дили в культуру с помощью семян. Коробочки с семенами под¬
вергали поверхностному обжигу. После этого их вскрывали в
стерильных условиях, а семена высевали на питательную среду.
Всхожесть таких семян была практически 100%-й. Для семян,
полученных по обмену, применяли традиционный режим стери¬
лизации: спирт (70 %), thimerosal (0,01 %), chlorax (10 %), Н202
(Ю %). Всхожесть этих семян, как правило, значительно ниже.
Растения выращивали в колбах Эрленмейера (250 мл). Емкости с
сеянцами располагали на верхних полках стеллажей (температура
28—30 °С и максимальная освещенность до 4000 лк).
Семена высевали на стандартную среду МС с добавлением
г/л активированного угля. Прорастание начиналось на 25—30-е
сутки. В течение 150—200 сут формировались сеянцы, пригод¬
223
СПЕЦИАЛЬНАЯ ЧАСТЬ
ные к дальнейшим манипуляциям (рис. 4.25, см. вклейку). При
переносе на модифицированную среду Пирика-1 у большинства
видов активно пробуждались пазушные почки (рис. 4.26, см. вклей¬
ку). Отделяя дочерние побеги, можно получать интересующие виды
в неограниченном количестве. Доращивали ювенильные расте¬
ния на той же среде МС (рис. 4.27, см. вклейку). Первые сеянцы
были высажены ex vitro в возрасте 1 года. Растения можно пере¬
носить в сфагновый мох, однако лучшие результаты дает высадка
на блоки из коры пробкового дуба, сосны или амурского бархата
(рис. 4.28, см. вклейку).
Vriesea Lindl. Родина — Мексика, Центральная Америка, Пе¬
ру, Боливия, Парагвай, Северная Аргентина. Это большой род
(около 250 видов), объединяющий в основном растения, которые
произрастают на скалах, реже — на почве. Размножают семенами
и вегетативно. При культивировании требуют повышенной влаж¬
ности. Представители данной группы часто используются для
оформления интерьеров.
V. saundersii (K.Koch) E.Monren — наземное растение высотой
50—60 см. Распространена в Восточной Бразилии, обычно в тро¬
пических лесах, а также на прибрежных скалах. Листья собраны
в плотную воронковидную розетку, длиной до 30 см, широколи¬
нейные, с сильно отогнутым острым концом, цельнокрайные, густо
покрытые светло-серыми чешуйками, плотные, сверху голубовато¬
серые, снизу — с коричневыми пятнами. Цветонос прямой, проч¬
ный, голый. Соцветие метельчатое, густое, состоит из нескольких
кистей. Плод — коробочка. Цветет в декабре (Чеканова, Коро¬
вин, 2001).
V. splendens (Brongn.) Lem. — декоративно-лиственное розеточ-
ное растение, произрастающее на каменистых выступах и во
влажных тропических лесах Северной Венесуэлы, Гвианы, Три¬
нидада и Тобаго эпифитно или наземно на высоте 750—900 м над
ур. м. Диаметр розетки до 1 м. Листья плотные, линейные, с по¬
перечными темно-пурпурными полосками на обеих сторонах.
Цветет в феврале—апреле, мае—июне. Соцветие — колос. Жел¬
тые цветки расположены в 2 ряда, прицветники оранжево-крас-
ного цвета.
Для микроразмножения V. saundersii и V. splendens использо¬
вали сеянцы, полученные в условиях асептической культуры из
семян репродукции НБС НАН Украины. Высев проводили из
нераскрывшихся коробочек на среду МС с 1 г/л активированного
угля. У первого вида наблюдали дружные всходы на 15—20-е сутки.
224
ГЛАВА 4. Методы размножения тропических и субтропических растений
Семена V. splendens прорастали разрозненно. Скорость развития
сеянцев существенно отличалась. При пересадке на среду Пири¬
ка-1 мы наблюдали активное пробуждение пазушных почек у
обоих видов. Причем у V. splendens со временем начинали формиро¬
ваться частично витрифицированные каллусные массы (рис. 4.29,
см. вклейку). При перенесении на среду МС растения-регенеранты
развивались самостоятельно, после чего через 50—60 сут их вы¬
саживали ex vitro (рис. 4.30, см. вклейку). У обоих видов пост-
асептическая адаптация проходила без осложнений. В качестве
первичного субстрата использовали сфагновый мох.
Cactaceae L.
Кактусовые — одно из наиболее многочисленных
семейств цветковых растений, которые населяют аридные облас¬
ти Нового Света. Распространение Cactaceae на Американском
континенте неравномерно. Наибольшее количество их сосредо¬
точено вдоль горных цепей Тихоокеанского побережья, в пус¬
тынных и полупустынных областях. Из Южной и Центральной
Америки кактусы распространились в Северную Америку, где
образовали вторичный центр видового разнообразия (Борисен¬
ко, 1986).
Среди представителей Cactaceae есть множество видов, нахо¬
дящихся на грани вымирания или сохранившихся на сегодняш¬
ний день уже только в коллекциях. Кактусы издавна пользова¬
лись популярностью у населения как удобные для коллекциони¬
рования растения. Кроме того, целый ряд видов имеет большое
хозяйственное значение. Этим и обусловлен постоянный интерес
к растениям данного семейства.
Размножению кактусовых в асептических условиях посвяще¬
но много работ (Holder et al., 1984; Vyskot et al., 1984; Ault et al.,
1987; Clayton et al., 1990; Oliveira et al., 1995; Батов, 2001; Popovs,
2004).
Для поверхностной стерилизации растительных объектов
применяются хлорсодержащие (1 —1,4%-й гипохлорит натрия; 7—
10%-й гипохлорит кальция; 2—10%-й хлорамин) и ртутьсодер¬
жащие (0,1 %-я сулема, диацид) вещества, пероксид водорода (2—
•0 %), этиловый спирт (70—75 %). В каждом отдельном случае
необходимо подбирать вид и концентрацию этих веществ опыт¬
ным путем, так как разные экземпляры кактусов (даже одного
вида) и, естественно, их ткани неодинаково реагируют на воз¬
225
СПЕЦИАЛЬНАЯ ЧАСТЬ
действие различных стерилизующих веществ. Мелкий матери¬
ал — семена, ареолы — помещают в марлевый мешочек, который
завязывают ниткой. Семена предварительно обрабатывают спир¬
том, затем — дезинфицирующим веществом и оставляют до на¬
бухания в стерильной чашке Петри. После суточного интервала
семена стерилизуют повторно (табл. 4.12) (Батов, 2001).
Принципы отбора первичных эксплантов для представителей
данного семейства традиционны — в этом качестве чаще всего
используют меристематические ткани точек роста или ткани, уже
прошедшие процесс дифференцировки, как генеративно зрелых
растений, так и сеянцев, полученных в асептических условиях,
или зародышей, извлеченных из семенных оболочек. В дальней¬
шем как основу для микроразмножения можно использовать кал¬
лусы первичного или вторичного происхождения.
Ariocarpus Scheidw. Род включает 5 видов, которые являются
интересным и ценным коллекционным материалом.
A. retusus Scheidw. произрастает в Мексике (Сан-Луис-По¬
тоси), на перфоритовых скалах. Почвы в этих местах пористые, с
высоким содержанием органических соединений и кальция (Бо¬
рисенко, 1986).
W. Stuppy и W. Nagl (цит. по: Батов, 2001) описали методику
микроразмножения данного вида. Семена стерилизовали 70%-м эти¬
ловым спиртом и высевали на питательную среду. Через 4 мес от-
Таблица 4.12. Возможные варианты стерилизации отдельных частей растений
представителей Cactaceae L. (Батов, 2001)
Время стерилизации, мин
Орган растения
Гипохлорит натрия
или кальция
Сулема
Семена
20
10
Зародыши
выделенные из семян
10-15
5
незрелые
3-5
1-3
Меристема
апикальная
5-10
3-5
боковых вегетативных почек
10-15
3-10
Камбий
1—2-месячных сеянцев
3-5
1-3
верхней части стебля
10-15
8-10
одревесневшей части стелы
20
15-20
Раневой каллус
3-5
1
226
ГЛАВА 4. Методы размножения тропических и субтропических растений
бирали каллусную ткань и переносили на свежую среду с мень¬
шим количеством кокосового молока— 150,0 мл/л. Субкульти¬
вирование проводили каждые 8 недель. Первые соматические эм¬
брионы появлялись на 3—4-й месяц после первоначального высева.
В работе использовали агаризированную среду МС (10,0 г/л агара)
с добавлением 200,0 мл/л эндосперма кокосового ореха (в каче¬
стве цитокининового компонента) и 20,0 г/л сахарозы. Значение
pH доводили до 5,9.
За первые 12 мес было получено всего несколько соматиче¬
ских эмбрионов, которые при достижении размера 5—7 мм нача¬
ли дифференцировать каллус. Через 14—16 мес каллус стал ак¬
тивно формировать мелкие многочисленные тесно прижатые
друг к другу эмбрионы. Некоторые из них имели до 5 семядолей.
Эмбрионы отделяли и высаживали на среды МС и Шенка—
Хильдебрандта (без органических добавок). В таких условиях они
приобретали характерный для растений данного вида габитус и
уже на 2-е сутки начинали формировать корневые волоски. Ав¬
торами были предприняты безуспешные попытки перевода моло¬
дых растений в почвенную культуру, поэтому растения-реге-
неранты прививали на подвои Pereskiopsis sp. (цит. по: Батов,
2001).
Astrophytum Lem. Описано 6 видов и 13 разновидностей, отли¬
чающихся своеобразным габитусом. Растут они одиночно, боко¬
вые побеги образовывают редко. Ареал — США (штат Техас), Мек¬
сика. Встречаются на вулканических почвах пологих сухих террас
или на наносных грунтах, дернированных известковыми порода¬
ми, в долинах на высоте 100—1500 м над ур. м. Высокие декора¬
тивные качества Astrophytum делают их незаменимыми как в кол¬
лекциях, так и в составе композиций для озеленения малогаба¬
ритных интерьеров (Борисенко, 1986).
A. asterias Lem. имеет травянисто-зеленый или темно-зеленый
приплюснутый шаровидный стебель до 10 см в диаметре, без ко¬
лючек. Распространен на территории США (штат Техас, долина
Рио-Гранде), в Мексике (Тамаулипас, Нуэво-Леон). Встречается
на высоте до 200 м над ур. м., часто — на илистых намывных
почвах.
A. capricorne (D.Dietr.) Britton et Rose имеет шаровидный или
несколько удлиненный зеленый без боковых побегов стебель. In
situ растения произрастают в северной части Мексики, на скло¬
нах гор и ущелий на высоте от 1000 до 1500 м над ур. м., в мест¬
ностях с известняковыми почвами и малым количеством осадков.
227
СПЕЦИАЛЬНАЯ ЧАСТЬ
В качестве первичных эксплантов для микроразмножения
данного вида нами использованы стебли сеянцев, полученные из
пророшенных в асептических условиях семян репродукции НБС
НАН Украины. Семена обрабатывали с помощью стандартного
набора стерилизующих веществ: thimerosal (0,01 %) — 16 мин;
chlorax (10 %) — 8 мин; Н202 (15 %) — 10 мин. Всхожесть семян
при таком режиме стерилизации составляла 60 %. Высевали на
модифицированную среду МС с активированным углем. Стебли
сеянцев (в возрасте 100—120 сут) разрезали поперек оси роста,
получая таким образом диски высотой 3—4 мм. Для дальнейшего
образования каллусных масс диски раскладывали на поверхности
среды МС (с 1 г/л активированного угля и 5,0 мг/л БАП). Уста¬
новлено, что процессы образования каллуса активнее проходили
в том случае, если мы нарушали полярность расположения дис¬
ков (рис. 4.31, а, см. вклейку). В темноте каллус практически не
пролиферировал. Процессы морфогенеза проходили на этой же
среде параллельно с каллусообразованием (рис. 4.31, б— г). До¬
ращивали и укореняли растения-регенеранты на стандартной
среде МС с активированным углем (рис. 4.32, а, см. вклейку). В
ряде случаев мы наблюдали формирование витрифицированных
растений. По нашим наблюдениям, такие экземпляры нежизне¬
способны и в асептической культуре получить от них нормаль¬
ные растения нам не удавалось, поэтому их выбраковывали в хо¬
де работы (рис. 4.32, б).
Постасептическую адаптацию проводили двумя способами. В
первом случае после выемки из колб регенеранты подсушивали в
комнатных условиях в течение 1—2 сут, затем высаживали в про-
стерилизованный субстрат, состоящий из равных частей песка,
перлита и лиственной земли (из-под липы). Отметим, что адап¬
тировать можно растения и без корневой системы — регенеранты
хорошо укореняются ex vitro в обычных условиях (около 80 %)■
Во втором случае практиковали прививку растений-регенерантов.
Количество выживших регенерантов при подобном способе пост-
асептической адаптации доходит до 90 %.
Echinopsis Zucc. Обширный род, насчитывающий 57 видов.
Это шаровидные, с возрастом цилиндрические, кактусы с много¬
численными боковыми побегами. Центр видового разнообра¬
зия — Боливия, Аргентина, Бразилия, Уругвай и Парагвай (Бори¬
сенко, 1986). Растения данного рода — одни из наиболее распро¬
страненных, издавна известных и популярных. Однако в комнатной
культуре преобладают межвидовые гибриды и сорта, некоторые
228
ГЛАВА 4. Методы размножения тропических и субтропических растений
природные виды этого рода практически не встречаются в кол¬
лекциях.
Е. turbinata L. имеет стебель шаровидной формы и темно¬
зеленого цвета. В работах P. Holder и соавт. (1984) описаны ос¬
новные приемы микроразмножения Е. turbinata. Базовой средой
служила среда МС, в которую добавляли кинетин (до 6,5 мг/л),
НУК (до 1,4 мг/л) и 2,4-Д (до 1,1 мг/л). Побеги развивались в
течение 4—5 недель, корни — через 6—9 недель. Каллус форми¬
ровался на протяжении 1 недели. Для образования корней и по¬
бегов внесение 2,4-Д необязательно. Формирование каллуса тре¬
бует наличия в среде НУК. При отсутствии кинетина каллус рас¬
тет, но корни и стебли не образуются. Каждое материнское рас¬
тение способно образовать примерно 65 новых.
Neochilenia Backbg. Род насчитывает 57 видов. Стебли цилинд¬
рические или шаровидные, высотой до 25 см. Для большинства ви¬
дов характерна необычная окраска эпидермиса. Распространены на
территории Чили (преимущественно северные области от пустынь
до высокогорных долин Кордильер). Выращивают в основном в бо¬
танических садах как коллекционный материал (Борисенко, 1986).
N. deherdtiana Backbg. произрастает в Чили. Стебель коричне-
во-лиловый, по форме от шаровидного до булавовидного, чаще
одиночный, высота около 8 см, диаметр 4—5 см. Ребра (до 12 шт.)
волнистые, имеют около 6 изогнутых колючек.
Стерильная культура тканей растений этого вида была полу¬
чена из сеянцев, выращенных в асептических условиях. Приемы
клонального размножения и постасептической адаптации сходны
с Astrophytum.
Roseocactus Berger. Род объединяет 4 вида необычных по фор¬
ме и редких в природе кактусов, близких по морфологическому
строению к Ariocarpus. Эндемы, растут преимущественно в жар¬
ких и засушливых местах Мексиканского нагорья, на высоте
500—2000 м над ур. м., на выходах известковых пород и обна¬
женных склонах скал.
R. kotschoubeyanus (Lem.) A.Berger. — низкий миниатюрный
вид с мощным реповидным корнем, который может образовы¬
вать много побегов. Существует несколько разновидностей.
Ареал — Мексика (Дуранго, Нуэво-Леон, Сан-Луис-Потоси) (Ур¬
бан, 1983; Белоус, 2003).
В качестве эксплантов использовалась верхняя часть туберку¬
лы. Растительный материал после стерилизации культивировался
на среде МС (5 г/л агара). В качестве биологически активных и
229
СПЕЦИАЛЬНАЯ ЧАСТЬ
гормональных добавок применялась облученная ультрафиолетом
кашица из растертых незрелых плодов конского каштана (Aescu-
lus hippocastanum). Готовая среда имела оранжевый оттенок. Через
2,5—3 мес из продольной борозды эксплантов начинал появлять¬
ся боковой побег. По мере его роста активизировался рост собст¬
венно ареолы, расположенной в верхней части борозды. Сфор¬
мированные побеги прививались на подвои Pereskiopsis sp. У ос¬
тавшихся эксплантов рост отсутствовал и только после перенесе¬
ния их на среды с повышенной концентрацией ауксинов (ИУК)
наблюдался слабый рост каллусной ткани (Батов, 2001).
Более результативной нам представляется методика с приме¬
нением выделенных из семян зародышей, которые помешают на
увлажненную фильтровальную бумагу в чашки Петри для набуха¬
ния и наносят на них по 1 капле дистиллированной воды. Набух¬
шие зародыши стерилизуют и размещают на питательной среде с
соотношением ауксинов и цитокининов 10 : 1. Примерно через
1 мес вьщеляют наиболее активно растущие участки каллуса и пе¬
ресаживают их на свежую среду с соотношением ауксинов и цито¬
кининов 1 : 1. В своих опытах С. Г. Батов (2001) использовал заро¬
дыши из семян 93 видов кактусов (Ariocarpus Scheidw, Roseocactus
Berger, Neogomesia Castan, Astrophytum Lem., Mammillaria Haw.,
Parodia Speg., Gymnocalycium Peiff., Blossfeldia Werd., Aztekium Boed.,
Strombocactus Britt, et Rose, Discocactus Pfeif.f.). К концу 3-го месяца
культивирования они начинали формировать эмбрионы, а еще че¬
рез 1,5—2 мес количество эмбрионов достигало 20—30. Полученные
ювенильные растения отделяли и высаживали на первоначальную
среду с соотношением ауксинов и цитокининов 10 : 1, а через 7—
20 сут прививали на тонкие черенки Pereskiopsis sp.
Caricaceae Dum.
Carica L. Деревья. Листья верхушечные, дольчатые,
дпаневидно-рассеченные. Распространены в тропических стра¬
нах. В роде 25 видов.
С. papaya L. — древовидно-травянистое растение высотой до
6 м с прямым мясистым древеснеющим неветвящимся “стволом”
до 25 см в диаметре. В диком виде неизвестен. Считается, что это
растение получено в результате межвидового скрещивания раз¬
личных видов данного рода, распространенных в Центральной
Америке. Ценное плодовое растение, широко культивируемое в тро¬
пиках. Кроме того, высоко ценится папаин — энзим, получаемый
230
ГЛАВА 4. Методы размножения тропических и субтропических растений
из млечного сока. Его применяют в медицине и пивоваренной
промышленности.
На сегодняшний день имеется достаточное количество работ
о размножении С. papaya in vitro. К примеру, в работах М. Raje-
even и соавт. (1986) определены факторы, влияющие на образо¬
вание корней и развитие растений при культивировании побегов
папайи (это ауксины — ИУК, ИМК, НУК, 2,4-Д); концентра¬
ции неорганических и органических соединений среды МС и са¬
харозы; влияние агара, наличия в жидкой среде фильтровальных
мостиков и вермикулита. ИМК оказалась наиболее эффективным
ауксином и вызывала 100%-е укоренение побегов при концен¬
трации 10 мкМ. Также 100%-е укоренение было достигнуто при
нормальной и половинной концентрации соединений среды МС,
однако во втором случае количество корней, их ветвление и рост
снижались. Концентрация сахарозы 3 % оказалась оптимальной
для образования и развития корней. Лучшее развитие корней и
растений наблюдали только на среде с агаром.
R. Litz (1985) исследовал возможность клонального размно¬
жения различных тропических и субтропических плодовых (роды
Citrus L., Mango L., Musa L., Carica L., Eugenia L. и др.). Показана
зависимость условий образования каллуса из тканевых эксплан¬
тов от природы тропических плодовых растений — травянистые
они или древесные. Соматический эмбриогенез описан для не¬
скольких видов Carica в каллусной культуре, полученной из стеб¬
лей, черешков, цветоносов и семяпочек. У древесных тропических
плодовых этот процесс ограничивался каллусом, образованным
из нуцеллуса или адвентивных зародышей нуцеллярного либо
интегументального происхождения. При культивировании моно-
эмбриональных семяпочек зиготические зародыши изолировали
до того, как они заполняли зародышевый мешок. Для культиви¬
рования полиэмбриональных видов и сортов эффективным было
использование интактных семяпочек.
Convallariaceae Juss.
Ophiopogon Ker-Gawl. Известно 20 видов, распрост¬
раненных в тропических и субтропических областях Восточной
Азии, в Гималаях. Многолетние растения с коротким утолщен¬
ным или длинным корневищем. Листья собраны в пучки, тон¬
кие, прикорневые. Цветки белые, голубые, лиловые. Размножает¬
ся семенами, делением корневища.
231
СПЕЦИАЛЬНАЯ ЧАСТЬ
O.jaburan (Kunth.) Lodd. произрастает в лесах и тенистых
местах в Японии. Растение высотой до 20 см, корневище без об¬
лиственных побегов. Листья многочисленные, узколинейные,
прямые, длиной до 80 см. Цветонос длиной до 80 см. Цветки си¬
дячие, собраны по 6—9 в пазухах прицветников. Цветет в июле-
августе. Есть декоративная форма с пестрыми листьями — О. ja-
buratt var. variegates.
Стерильную культуру получали из тканей сеянцев О. jaburan
var. variegates, выращенных в асептических условиях. Стерилиза¬
цию проводили по стандартной схеме. Семена проращивали на
среде МС с активированным углем. В дальнейшем у сеянцев уда¬
ляли листья, стебель травмировали продольными глубокими над¬
резами и помещали в темноту на среду МС, модифицированную
добавлением 4 мг/л 2,4-Д и 2 мг/л кинетина. В таких условиях
через 40—45 сут при температуре 24—26 °С у данного вида начи¬
нал регенерировать морфогенный каллус (рис. 4.33, а, см. вклей¬
ку). После этого каллусные ткани и этиолированные побеги,
сформировавшиеся в условиях темноты, переносили на свет на
среду Пирика-2, на которой активно формировались растения-
регенеранты (рис. 4.33, б, см. вклейку). Укоренение и доращива¬
ние ювенильных растений проводили на среде МС с активиро¬
ванным углем.
Для микроразмножения О. jaburan ’Ker-Gawl‘ использовали
сегменты цветоноса длиной 5 мм. Экспланты культивировали на
среде МС, модифицированной добавлением 80,0 мг/л аденина,
2,0 мг/л НУК, 2,0 мг/л кинетина. Индукция каллуса была отме¬
чена у 16 эксплантов, а у 4 — регенерация побегов. После 8 не¬
дель культивирования наблюдался органогенез. Положительные
результаты отмечены и при культивировании в жидкой среде
(Frutt et al., 1983; Попов, 1986).
Dracaenaceae Salisb.
Dracaena Vand ex L. Известно около 150 видов,
произрастающих в тропических и субтропических областях Аф¬
рики и Азии. Вечнозеленые растения с одревесневшим стеблем,
кустарники или деревья. Корни желтые. Листья удлиненно-оваль¬
ные, зеленые или разнообразно окрашенные. Цветки белые, мел¬
кие. Рекомендуется для озеленения зимних садов, залов, фойе.
Очень декоративны. Размножают семенами, черенкованием вер¬
хушек стеблей и в культуре тканей.
232
ГЛАВА 4. Методы размножения тропических и субтропических растений
D. deremensis (N.E.Br.) Engl, размножали, используя части
стебля длиной 0,5—3,0 см. Экспланты культивировали на среде
МС с микроэлементами по Ничу и 20,0 г/л сахарозы. Каллус был
получен на среде с ИУК (1,0 мг/л) и 2-iP (5,0 мг/л). Индукция
побегов проходила на среде с 1,0 мг/л ИУК и 5,0 мг/л кинетина.
Полученные побеги укореняли на среде с 2,0 мг/л ИМК или
НУК (Debergh, 1976).
В наших условиях этот вид мы размножали так же, как и
D. draco L., что особенно актуально при мультипликации варие-
гатных форм. При размножении семенным способом сортовые
особенности могут быть утрачены.
D. marginata Lam. ’Tricolor4 размножали с помощью стеблевых
эксплантов длиной 0,5 см, включающих узел и междоузлия. Их
помещали на 10 мин в 10%-й chlorox и затем промывали водой.
Экспланты культивировали на питательной среде МС с добавле¬
нием 15 % кокосового молока, а также 2,4-Д, кинетина, НУК в
течение 4 недель. За это время на среде с 0,5—1,0 мг/л 2,4-Д об¬
разовывался каллус. Следует отметить, что каллус культивируют
не более 8 недель, так как на среде с 1—5 мг/л НУК при дли¬
тельном культивировании он становится коричневым и прекра¬
щает свой рост. Через 10 недель культивирования на среде с 0,5—
1,0 мг/л кинетина происходит дифференциация 2—7 побегов, ко¬
торые укореняют на среде с 1,0 мг/л НУК. Полученные растения
пересаживают в субстрат: сфагнум, перлит, вермикулит — 1:1:1
(Chuaet al., 1981).
D. draco L. произрастает на открытых скалистых местах Ка¬
нарских островов. Растения высотой до 18 м и до 4,5 м в диамет¬
ре у основания ствола; каждая ветвь завершается пучком густо
расположенных серовато-зеленых кожистых линейно-мечевид¬
ных листьев длиной 45—60 см. Размножают семенами или верху¬
шечными черенками. Культивируют как в холодных, так и в теп¬
лых оранжереях.
В оранжереях умеренной зоны добиться размножения (пло¬
доношения) представителей этого вида довольно проблематично
в силу объективных причин, поэтому нами был применен метод
микроразмножения. В качестве первичных эксплантов мы ис¬
пользовали ткани сеянцев, выращенных в стерильных условиях.
Были исследованы морфогенетические потенции различных час¬
тей ювенильных растений и выявлено два типа органогенеза. На
среде Пирика-2 в темноте из сегментов стеблей активно образо¬
вывался органогенный каллус, в котором интенсивно происходи-
233
СПЕЦИАЛЬНАЯ ЧАСТЬ
ли процессы органогенеза и побегообразования (рис. 4.34, а, см.
вклейку). При перенесении на свет ткани регенерировавших по¬
бегов зеленели, их отделяли и размещали на среде МС с активи¬
рованным углем для доращивания и укоренения (рис. 4.34, б),
после чего растения-регенеранты высаживали ex vitro. Во втором
случае на среде МС (с 4,0 мг/л 2,4-Д и 2,0 мг/л кинетина) в тем¬
ноте на влагалищных участках листьев мы наблюдали формиро¬
вание эмбриоидоподобных структур (рис. 4.34, в). Данные обра¬
зования можно культивировать и размножать в таких условиях по
мере надобности. При перенесении их на свет на среду Пирика-2
мы инициировали процессы ризогенеза (рис. 4.34, г). Разделяя и
культивируя растения-регенеранты на среде МС с активирован¬
ным углем, получали растения, пригодные к высадке в субстрат
(рис. 4.34, д).
Постасептическая адаптация может проходить с определен¬
ными трудностями. В этот период необходимо поддерживать вы¬
сокую влажность воздуха. Растения высаживают в легкий сте¬
рильный субстрат, состоящий из песка и перлита (1:1).
Nolina Michx. Представители рода распространены в Мекси¬
ке, США (Техас, Калифорния). Известно около 20 видов. Ствол
плотный, у некоторых видов ветвящийся, у основания луковице¬
образно расширен. Листья узкие, жесткие, длинные. Цветки мел¬
кие, собраны в крупные рыхлые кисти. Плод — коробочка. Рас¬
тения хорошо чувствуют себя в условиях современных жилых
помещений и не требовательны к уходу.
Ассортимент декоративных комнатных растений постоянно
расширяется, что продиктовано потребностями современного рын¬
ка. В последнее время все чаще для озеленения служебных и жи¬
лых помещений используются “новые” тропикогенные виды. К
подобным новинкам относится и N. recurvata, которая сегодня
достаточно популярна.
N. recurvata (Karw.) Hemsl. произрастает во влажных субтро¬
пиках Южной Мексики. Это очень декоративное растение, сте¬
бель которого может достигать в высоту до 2 м и нести на вер¬
хушке густую розетку узких длинных жестких листьев с заостренны¬
ми концами. Листья влагалищные, темно-зеленые, коричневато¬
красноватые у основания. Основание ствола вздуто в виде луко¬
вицы. Развиваются растения сравнительно медленно, в 3-летнем
возрасте достигают в высоту 40—50 см.
Семена имеют хорошую всхожесть, однако получить достаточ¬
ное их количество в условиях оранжерей умеренной зоны пробле-
234
ГЛАВА 4. Методы размножения тропических и субтропических растений
матично (Черевченко и др., 1988). Вегетативно этот вид размно¬
жается плохо.
В ходе литературного поиска нами установлено отсутствие
работ о микроразмножении N. recurvata. Однако в публикациях,
посвященных микроразмножению представителей Agavaceae
Engl., рекомендуется среда МС с добавлением 2,4-Д и БАП (Pi-
ven et al., 2002). Кроме того, на примере Agave fourcroydes Lem.
показано, что на процессы каллусо- и органогенеза оказывает
влияние форма азота (NOj, NH4). Высокие концентрации ци-
токининов способствуют образованию адвентивных побегов на
стеблевых эксплантах. После отделения вновь сформировавших¬
ся побегов и перенесения на свежую питательную среду новый
каллус может образовываться у их основания. Микрочеренки хо¬
рошо укореняются in vitro, поэтому ex situ имеют высокий про¬
цент приживаемости (Robert et al., 1987).
В нашей работе в качестве источника эксплантов использованы
сеянцы N. recurvata, выращенные в условиях асептической культу¬
ры. Семена получены при делектусном обмене. Перед высевом их
стерилизовали по следующей схеме: спирт (70 %) — 1 мин; thime-
rosal (0,01 %) — 20 мин; chlorax — 9 мин, Н202 (15 %) — 6 мин.
Подобная последовательность и экспозиция стерилизующих аген¬
тов обеспечила 100%-ю стерильность посевов, 3/4 семян взошло
в течение 25—30 сут. Высев производили на стандартную среду
МС. За следующие 90—100 сут сформировались ювенильные рас¬
тения высотой до 5 см, которые имели 7—10 листьев (длиной до
6 см, шириной 0,3 см), 3—5 корней (длиной до 7 см, толщиной
0,2 см).
В эксперименте использовали сегменты листьев сеянцев (их
влагалищную часть), кончики корней и участки стебля сеянцев с
продольными разрезами. Экспланты культивировали в темноте
при 24—26 °С на питательной среде Пирика (с 1,0 мг/л БАП) в
течение 180 сут. В результате из сегментов стебля N. recurvata на¬
ми был получен каллус, на котором спонтанно формировались
очаги органогенеза. В условиях темноты вновь сформировавшие¬
ся побеги образовывали удлиненные междоузлия. Листья редуци¬
ровались до чешуеподобных образований (рис. 4.35, а, см. вклей¬
ку). Каллус имел плотную консистенцию, гладкую блестящую
поверхность молочно-белого цвета. В отсутствие света ризогенез
не наблюдался.
В дальнейшем каллус с очагами органогенеза разрезали на
сегменты 5x5 мм и переносили на свет. Для последующих пас-
235
СПЕЦИАЛЬНАЯ ЧАСТЬ
сажей также использовали среду Пирика (с 1,0 мг/л БАП). В та¬
ких условиях ткани зеленели в течение 7—10 сут. Побеги пре¬
кращали формировать удлиненные междоузлия и приобретали
характерный для данного вида габитус (рис. 4.35, 6). На этом
этапе можно размножать растения посредством деления, так как
один сегмент каллуса формирует 2—4 побега. Субкультивирова¬
ния производятся через каждые 40—60 сут.
Для укоренения побегов их переносили на агаризированную
среду МС (с 1,0 мг/л аденина). Длительность этого этапа состав¬
ляет до 50 сут, после чего растения-регенеранты можно высажи¬
вать в субстрат (рис. 4.35, в). Первые растения были высажены
нами в септические условия через 650 сут с момента введения в
культуру.
Sansevieria Thunbg. Представители этого рода — многолетние
травянистые или полукустарниковые растения с мясистыми
плотными линейными листьями, которые ортотропно отходят от
толстых коротких корневищ и имеют вид розеток. Соцветия
формируются в центре розеток. Цветки белые или желтоватые.
Плод — ягода (Сааков, 1983; Белоус, 2003). Род насчитывает око¬
ло 60 видов, распространенных в Тропической Африке и Тропи¬
ческой Азии (Индия, о. Шри-Ланка).
Благодаря своей экологической пластичности многие виды
рода давно применяют в декоративном цветоводстве, некоторые
из них используют в медицине или как источник ценного техни¬
ческого волокна (Brown, 1915; Медведев, 1940; Тахтаджян, 1982).
S. cylindrica Boj. относится к малоизвестным и плохо изу¬
ченным видам рода, представители которого произрастают в за¬
падной части Африканского континента (Головкин и др., 1989).
Высокая декоративность растений обусловлена оригинальным
габитусом. S. cylindrica — растение с толстым (2,5—3,5 см в
диаметре) корневищем. Побеги несут от 3 до 6 цилиндрических
трубчато свернутых листьев длиной до 100 см. Соцветия белые,
до 90 см в длину. Побеги нарастают медленно, формируясь на
протяжении 3 лет. Регенерация побегов ex situ из листовых че¬
ренков достаточно низкая и по данным некоторых авторов не
превышает 5 % (Каляева и др., 1999). Получить семена от рас¬
тений этого вида ex situ достаточно проблематично. Поэтому
S. cylindrica в коллекциях традиционно размножают вегетативно.
В своей работе мы опирались на ранее проведенные исследо¬
вания растений из близких семейств вообще и представителей
236
ГЛАВА 4. Методы размножения тропических и субтропических растений
рода Sansevieria в частности (Schenk et al., 1972; Robert et al.,
1987; Abou-Mandour et al., 1991; Piven et al., 2002).
Согласно работам М.А. Каляевой и соавт. (1999), для успеш¬
ной регенерации растений этого вида из листовых эксплантов ре¬
шающее значение имеет фитогормональная композиция (НУК,
БАП, 2,4-Д) на фоне питательной среды МС. Авторами отмечена
низкая морфогенетическая способность листовых эксплантов
S. cylindrica в сравнении с другими видами рода. Указано, что в
предложенной схеме микроразмножения наибольшая частота ре¬
генерации составила 35,7 %. Растения-регенеранты укореняли на
среде МС с 1 мг/л НУК. При этом количество укоренившихся
черенков составило 94 %.
Отбор растительного материала с интактных растений мы
проводили в октябре. Стерильная культура была получена из
листовых эксплантов. В работе использовали верхнюю и средин¬
ную части листовой пластинки. Процедура стерилизации сле¬
дующая: спирт (70 %) — 2 мин, thimerosal (0,01 %) — 17 мин,
chlorax (10 %) — 15 мин, Н202 — 8 мин. После каждого раствора
экспланты тщательно промывали в стерильной дистиллирован¬
ной воде. Участки листа рассекали на сегменты длиной 2 см и
располагали их на поверхности питательной среды. На разных
этапах размножения использовали прописи сред МС и Пирика.
Схема методики микроразмножения состояла из нескольких
этапов: формирование каллусной ткани из листовых эксплантов;
инициация процессов органогенеза в каллусе и получение побе¬
гов S. cylindrica; укоренение растений-регенерантов и дальнейшая
их постасептическая адаптация.
Емкости с растениями культивировали при температуре 23—
27 °С и 10-часовом фотопериоде. Сначала для введения в куль¬
туру была выбрана пропись среды Пирика с 0,1 мг/л БАП.
Каллус S. cylindrica культивировали в темновом термостате при
24 °С. Количество образцов каллуса в каждом варианте состав-
ляло от 10 до 15 шт.
После стерилизации, перед размещением экспланта на по¬
верхности питательной среды, необходимо обновить места сре¬
зов. В ходе работы было установлено, что важнейшее значение име¬
ет также положение экспланта в пространстве — каллус образо¬
вывался на тех эксплантах, ориентация которых вдоль вертикальной
°си была нарушена. Экспланты, расположенные правильно, каллус
практически не формировали. По нашим наблюдениям, ткани лис¬
товой пластинки S. cylindrica способны к образованию двух типов
237
СПЕЦИАЛЬНАЯ ЧАСТЬ
каллуса: рыхлого и плотного. Последний имеет значительный
морфогенетический потенциал, светло-зеленый цвет и обычно фор¬
мируется непосредственно возле травмированного участка экс¬
планта (рис. 4.36, а, см. вклейку). Рыхлый каллус в нашем случае
не проявлял морфогенетические потенции, имел светло-корич¬
невую окраску, хаотично нарастал вокруг травмированных участ¬
ков экспланта.
Первые признаки каллусообразован ия замечены спустя 35—
40 сут с момента введения в культуру. Через 70 сут после этого
масса первичного каллуса была достаточной для первого пассажа
(рис. 4.36, б). Для уменьшения количества погибших после пас¬
сажа эксплантов их переносили на новую питательную среду вместе
с кусочками тканей листа. В таком случае отмечались только еди¬
ничные случаи гибели вновь пересаженных каллусных конгломе¬
ратов.
В дальнейшем наши усилия были направлены на оптимиза¬
цию фитогормонального баланса питательной среды для интен¬
сификации процессов каллусообразован ия и органогенеза. Осно¬
вой для пролиферации каллуса S. cylindrica являлась среда Пири¬
ка. В эксперименте различные варианты среды отличаются по
количеству и соотношению основных групп фитогормонов. Про¬
ведено два параллельных опыта: в темноте и на свету длительно¬
стью 40 сут (табл. 4.13).
Анализируя результаты, полученные нами в процессе регене¬
рации и дальнейшего органогенеза из каллуса S. cylindrica, отме¬
тим, что наибольшая частота регенерации зафиксирована на сре¬
де Пирика с 1 мг/л БАП, причем в темноте эти процессы прохо¬
дили интенсивнее, чем на свету. Растения-регенеранты, которые
сформировались в темноте, имели вытянутые междоузлия, их
листовые пластинки были редуцированы до этиолированных че¬
шуек, плотно охватывающих ось побега (рис. 4.36, в). В даль¬
нейшем такие побеги отделяли от каллуса и переносили на
свет. Каждый из них разделяли на отдельные сегменты по коли¬
честву междоузлий. Из пазушных почек каждого недоразвитого
листа на среде МС с 4,0 мг/л аденина в условиях освещенности
формировалась отдельная розетка растений, которая со време¬
нем укоренялась на этой же среде (рис. 4.36, г). Через 45—
55 сут мы получали растения, пригодные к высадке в субстрат.
Таким образом разделяя образовавшиеся в темноте побеги, мы
смогли в 2—4 раза увеличить количество растений-регенерантов
S. cylindrica.
238
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.13. Комбинированное влияние фитогормонов
на процессы регенерации и дальнейшего органогенеза в каллусных
тканях Sansevieria cylindrica
Компонент, мг/л
Условия пролиферации
В темноте
На свету
2,4-Д
БАП
СКР*, шт.
ЧР, %
СКР*, шт.
ЧР, %
1,0 ±0,05
10
1,1 ±0,08
8
0,5
2,6 ±0,12
53
2,6 ±0,13
50
1,0
3,2 ± 0,27
76
2,7 ±0,12
72
1,5
3,0 ±0,21
64
2,4 ± 0,34
63
2,0
2,5 ±0,21
57
1,9 ±0,30
54
0,1
—
1,2 ±0,06
13
1,0 ±0,02
14
0,5
1,2 ±0,06
38
1,0 ±0,04
42
1,0
2,2 ± 0,27
69
1,8 ±0,11
70
1,5
1,4 ± 0,11
24
1,4 ±0,09
27
2,0
1,5 ±0,12
17
1,0 ±0,02
12
0,5
0
0
0
0
0,5
1,4 ±0,08
13
1,0 ±0,07
18
1,0
1,2 ±0,07
15
1,0 ±0,04
18
1,5
0
0
0
0
2,0
0
0
0
0
1,0
—
0
0
0
0
0,5
1,0 ±0,03
13
0
0
1,0
0
0
0
0
1,5
0
0
0
0
2,0
0
0
0
0
Примечание. СКР — среднее количество регенерантов на один кал-
лусный конгломерат (5x5 мм), в котором проходили процессы органогенеза;
ЧР — частота регенерации (количество образцов каллуса, сформированных
регенерантами); звездочкой обозначены среднеарифметические величины и
среднеквадратичные отклонения; (—) — компонент в среду не добавляли.
В серии опытов на свету наиболее эффективной оказалась эта
же среда Пирика, однако показатели ЧР и СКР (табл. 4.13) были
несколько ниже. Кроме того, растения-регенеранты в таких ус¬
ловиях имели типичный для ювенильных растений габитус и их
междоузлия были сближены, что существенно усложняло проце¬
дуру микрочеренкования и, соответственно, снижало их количе¬
ство (рис. 4.36, д).
Растения-регенеранты высаживали в предварительно просте-
рилизованный субстрат (2 атм при 130 °С в течение 2 ч), который
239
СПЕЦИАЛЬНАЯ ЧАСТЬ
состоял из лиственной земли и песка (1:1). Их постасептическая
адаптация проводилась в климатической камере: относительная
влажность воздуха 80—90 %, температура 23—25 °С, фотопериод
8 ч. В таких условиях растения-регенеранты адаптировались на
100 %, а через 35—40 сут их переводили в условия оранжерей.
Необходимо отметить, что первоначально форма листовой
пластинки у растений-регенерантов была плоской, т. е. подобной
таковой у сеянцев и растений-регенерантов ex situ на начальных
этапах онтогенеза. Цилиндрические листья, характерные для ге¬
неративно зрелых растений этого вида, появляются у растений-
регенерантов лишь спустя 120—150 сут (рис. 4.36, е).
S. grandis Hook.f. — один из самых больших видов рода. Рас¬
тения произрастают в Южной Африке. Часто культивируют в
домашних условиях.
Микроразмножение и постасептическая адаптация представи¬
телей этого вида не вызвали у нас затруднений. Все приемы ана¬
логичны таковым для размножения S. cylindrica. Однако в лите¬
ратуре встречаются упоминания о проблемах, связанных с мик¬
роразмножением S. grandis (Каляева и др., 1997).
S. trifasciata Hort. ex Prain. — один из самых распространен¬
ных в культуре видов. Имеет множество декоративных форм.
Природный ареал находится на территории тропиков Западной
Африки, Восточной Индии, о-ва Шри-Ланка.
Для микроразмножения и постасептической адаптации этого
вида вполне приемлемы приемы, разработанные нами для S. cy¬
lindrica.
Ericaceae Juss.
Rhododendron L. Известно более 1000 видов, распро¬
страненных в Восточной Азии, Европе, Северной Америке, на Бал¬
канском полуострове, Кавказе, о-ве Шри-Ланка. Высоко- и низко¬
рослые вечнозеленые и листопадные деревья. Листья мелкие и
крупные, опушенные с нижней стороны. Цветки всевозможной ок¬
раски и махровости. Выделяют вечнозеленые фунтовые рододенд¬
роны, листопадные фунтовые азалии и культивируемые в оранже¬
реях вечнозеленые индийские азалии (Тимчишин, 2003).
В настоящее время всю фуппу сортов, производных от родо¬
дендрона R. simsii Planch, и R. obtusun (Lindl.) Planch., системати¬
ки относят к R. simsii или считают самостоятельным полигибрид-
ным видом, вошедшим в практику под названием индийская
азалия (Azalea indica L.). Известно множество сортов этой высо¬
240
ГЛАВА 4. Методы размножения тропических и субтропических растений
кодекоративной культуры, выращиваемой ex situ. Цветки белые,
розовые, красные, сиреневые с различными оттенками, рисун¬
ком и махровостью. Некоторые имеют слабый аромат. Раз¬
множают семенами, черенками и в культуре тканей (Приходь¬
ко и др., 1985).
Azalea считается культурой, которая плохо размножается веге¬
тативно. Особенно труден процесс укоренения черенков. Эффек¬
тивность вегетативного размножения зависит и от сортовых раз¬
личий. Следует отметить, что такая же тенденция сохраняется и
при размножении в культуре in vitro.
Экспланты, которые используются для микроразмножения
этого вида, условно можно разделить на две группы. К первой
относят экспланты, вычленяемые у взрослых растений, ко второй —
вычленяемые у сеянцев и растений-регенерантов, полученных in
vitro. Вторые — более предпочтительны, поскольку их не надо сте¬
рилизовать.
Рост и развитие эксплантов в культуре in vitro зависят также
от генотипа самого экспланта, времени его вычленения, состава
питательной среды для культивирования и условий выращива¬
ния. При искусственном опылении Azalea хорошо завязывает се¬
мена. Однако и здесь необходимо соблюдать определенные пра¬
вила и учитывать сортовые особенности. Количество семян в ко¬
робочке и их масса зависят от сорта и соблюдения определенных
условий опыления.
Свежесобранные семена Azalea прорастают на питательных
средах МС и Андерсона уже через 10 сут. Листья образуются че¬
рез 5 недель, в это же время формируется и корень. Первичный
корень очень тонкий и длинный. Сеянцы с одним корнем и 2—
3 листьями можно получить уже в течение 1 мес. Если сеянцы на
этом этапе развития не перенести на другую среду, то их листья
темнеют и опадают, и они отмирают. Образовавшиеся сеянцы
можно использовать как вторичные экспланты.
В результате проведенного нами искусственного опыления
были получены семена таких сортов отечественной селекции, как
Светлана, Орхидная, Смуглянка, Подолянка.
Различные части выращенных нами сеянцев (листья, черен¬
ки, корни, сегменты стебля) культивировали на питательных сре¬
дах МС и Андерсона, модифицированных добавлением 2,4-Д,
, БАП, НУК, ИУК, 2-iP. На средах с 2,4-Д в условиях темно¬
ты на сегментах стебля удалось индуцировать каллус, который
переносили на среду для его размножения.
241
СПЕЦИАЛЬНАЯ ЧАСТЬ
Кроме того, мы высевали на питательные среды и семена
R. luteum Sweet, которые собрали у растений, растущих в открытом
грунте. Следует отметить, что семена Azalea и Rhododendron очень
инфицированы, поэтому процент контаминации бывает высоким.
В связи с этим мы разработали методику стерилизации семян,
обеспечивающую получение асептически чистых проростков: 70%-й
спирт (2 мин), thimerosal (20 мин), пергидроль (15 мин). Особо
следует подчеркнуть, что семена этих видов не выдерживают сте¬
рилизацию в веществах, содержащих ионы СГ и Са2+.
После стерилизации семена рассевали на поверхность среды
Андерсона и МС с 1,0 г/л активированного угля. Семена начали
прорастать через 11 сут, а сеянцы с 2 листьями и 2 корнями мы
получили через 1 мес культивирования.
Нами проводились также исследования по введению некото¬
рых сортов Azalea в культуру in vitro. В качестве эксплантов ис¬
пользовали латеральные почки молодых отрастающих побегов,
которые формировались после цветения. Экспланты стерилизо¬
вали и помещали вертикально в питательную среду Андерсона
(рис. 4.37, см. вклейку). Использовали сорта Hermann, Суз1р’я,
Европа, Prof. Walthers. Следует подчеркнуть, что морфогенетиче¬
ский потенциал эксплантов в культуре in vitro зависит от их гено¬
типа. Так, развитие латеральных почек у сорта Суз1р’я началось
через 18 сут, в то время как экспланты остальных сортов начали
развиваться только через месяц. Установлено, что сорт Суз1р’я
хорошо размножается вегетативно, что подтверждает гипотезу о
значительной эффективности культивирования in vitro сортов, име¬
ющих высокий коэффициент вегетативного размножения. Через
2 мес культивирования побеги достигали в высоту 2—5 см и име¬
ли 2—4 листа. Их отделяли и переносили на свежую среду Ан¬
дерсона, на которой они подрастали и укоренялись. Полученные
растения-регенеранты можно применять для дальнейшего раз¬
множения как экспланты.
Размножением Azalea в культуре in vitro занимались и другие
исследователи, также используя экспланты стеблей с боковыми
почками. На среде МС они проходили четыре стадии развития:
индукция (4—8 недель), удлинение стеблей (6—8 недель), укорене¬
ние (2 мес), раскрытие почек (2—3 мес). Отмечено, что большое
значение имеет выбор сорта. Хорошо в культуре in vitro размно¬
жался сорт Хельмут Вогель и плохо — Мадам де Лаоз. Степень
укоренения составляла 15—20 % на среде с ИМК (Preil et al.,
1977; Dabin et al., 1983; Economon et al., 1987).
242
ГЛАВА 4. Методы размножения тропических и субтропических растений
Экспланты верхушек побегов выращивали на среде Андерсо¬
на с 15 мг/л 2-iP, 2 мг/л зеатина, 0,5 мг/л ТДЗ. Наибольшая ин¬
тенсивность пролиферации достигнута на средах с ТДЗ; его кон¬
центрации от 0,5 до 1,0 мг/л способствуют развитию почек и
росту их в длину. Совместное внесение ТДЗ и зеатина приводило
к увеличению количества побегов, однако добавление 2 мг/л зеа¬
тина снижало интенсивность их развития. Установлено также,
что лучшей солевой концентрацией среды Андерсона является раз¬
бавленная вдвое. Добавление 30 г/л сахарозы обеспечивает наи¬
большую интенсивность пролиферации (Hsia et al., 1997).
Верхушки побегов 20 сортов и видов Azalea культивировали на
среде Андерсона с 10,0 мг/л БА и 20,0 мг/л 2-iP в течение 4 недель.
Концентрация БА выше 10,0 мг/л вызывала некроз эксплантов. Оп¬
тимальными были концентрации БА 0,5—10,0 мг/л и 2-iP — 10—
20 мг/л. Максимальное количество побегов, образовавшихся на
среде с БА, составило 16,49, на среде с 2-iP — 11,78. Симптомов
токсичности на среде с 2-iP не отмечено, что обусловлено его спо¬
собностью распадаться под действием энзимов (Norton et al., 1985).
Побеги длиной 0,5 мм, образовавшиеся из пазушных почек,
мы использовали для размножения Azalea на среде Андерсона с
0,5 мг/л 2-iP в течение 8 недель. Для кончиков побегов исполь¬
зовали 0,2 мг/л БАП. Развитие проходило в течение 6 недель.
Добавление 1 г/л гидролизата казеина было равносильно добав¬
лению БАП (Fordham et al., 1982).
Размножением in vitro Rhododendron занимались многие ис¬
следователи. В качестве эксплантов использовали верхушки по¬
бегов. Листья с побегов удаляли, стерилизовали и помешали гори¬
зонтально на среду WPM (для древесных культур) с 50,0 мг/л 2-iP,
80,0 — аденина, 10,0 — инозита, 100,0 мг/л NaH2P04, 30,0 г/л саха¬
розы. Полученные побеги переносили на среду WPM с 16 мг/л 2-iP.
Укоренение побегов проводили в субстрате.
Цветочные почки вычленяли, стерилизовали и культивирова¬
ли на среде WPM с 1—4 мг/л ИУК и 15 мг/л 2-iP. Укоренение
побегов проходило на среде без фитогормонов и с активирован¬
ным углем (Meyer, 1981, 1982).
R■ ledebourii Pojark был размножен в культуре in vitro. Изоли¬
рованные пазушные почки на среде Андерсона с 20 мг/л ИМК
формировали единичные побеги. Многочисленные побеги были
получены на среде с 0,1 — 10,0 мг/л ИМК. Их укоренение лучше
проходило на среде с 10—20 мг/л НУК (Otmashkina, 2002; От-
машкина, 2003).
243
СПЕЦИАЛЬНАЯ ЧАСТЬ
Экспланты цветков Rhododendron культивировали на среде
Андерсона с 2—4 мг/л ауксинов и 10—15 мг/л цитокининов.
Каллусогенез был лучшим без НУК в среде. Обязательным для
развития побегов является добавление от 5 до 15 мг/л 2-iP, а
для развития верхушек побега — 1,6 мг/л 2-iP (Anderson, 1984;
Kavanagh et al., 1987; Ymel et al., 1988; Japichino et al., 1991,
1992).
Другие исследователи помещали экспланты цветков Rhodo¬
dendron на модифицированную питательную среду Андерсона с
различными соотношениями ТДЗ (0—2 мг/л), 2-iP (15 мг/л) и
ИМК (3 мг/л). Для пролиферации микропобегов оптимальной была
среда Андерсона с 2,0 мг/л ТДЗ. В концентрации 0,05—1,0 мг/л
ТДЗ индуцировал образование адвентивных побегов (Tomson et al.,
2004; Васильева, 2005).
Для микроразмножения Rhododendron также использовали
сегменты листьев растений-регенерантов, выращенных в культу¬
ре in vitro. Культивируя их на среде Андерсона с 4,9 мкМ ИМК и
73,8 мкМ 2-iP, получали адвентивные побеги (Ellinger et al., 1985;
Кондратовиче и др., 1988; Japichino et al., 1992).
Проведено сравнительное изучение интенсивности побегооб¬
разования у 8 видов Rhododendron в жидких и на агаризирован-
ных средах. В качестве эксплантов использовали вегетативные
почки растений открытого фунта, которые вычленяли в июне.
После стерилизации и удаления верхних чешуй экспланты по¬
мещали в жидкие и на твердые среды с микроэлементами по
Мурашиге—Скугу, ИУК, 2-iP, аденином, витаминами по Гам-
боргу, сахарозой. На среде этого состава они в течение 2—6 мес
формировали побеги. Продуктивность образования побегов в
жидкой среде была в 10 раз выше по сравнению с твердой. Для
укоренения использовали побеги, имеющие не менее 5 узлов.
Укоренение проходило двумя способами: на сфагновом торфе и
на питательной среде с 15 мг/л ИМК. В первом случае укореня¬
лось 50—70 %, во втором — 80—90 %. Наличие в среде 15 мг/л
ИМК увеличивало количество корней в 5—8 раз (Hannapel et al.,
1981; Douglas, 1984; Harbage et al., 1987).
Верхушки активно растущих побегов длиной 2—4 см срезали
с тепличных растений Rhododendron, стерилизовали и помешали в
жидкую среду WPM с 8,0 мг/л 2-iP. Через 2—3 мес культивиро¬
вания формировались пазушные побеги, которые отделяли и по¬
мещали горизонтально на твердую среду WPM с 49 мкМ 2-iP-
Культуры переносили на свежую среду каждые 4—5 недель и че¬
244
ГЛАВА 4. Методы размножения тропических и субтропических растений
рез 6 мес культивирования наблюдали образование множества
пазушных и придаточных побегов. Побеги разделяли и переноси¬
ли на среду WPM с 2,0 мг/л 2-iP. Микрочеренки длиной 10 мм
срезали и помещали на укоренение в пластиковые поддоны со
стерильной смесью вермикулита и торфа (1:1) при повышенной
влажности. Укореняемость составила 70—90 % при длине черен¬
ков 5 и 15 мм. Снижение концентрации 2-iP до 8,0 мкМ приво¬
дило к формированию более сильных побегов (Blazich et al.,
1986; Yapichino et al., 1992; Васильева, 2005).
Euphorbiaceae St. Heel.
Euphorbia L. Представители данного рода произра¬
стают в Африке, Америке, на Канарских островах, Ближнем Вос¬
токе, о-ве Мадагаскар. Род насчитывает свыше 1500 видов, в том
числе и зимостойкие. Характерной особенностью рода является
наличие ядовитого млечного сока во всех органах растения.
Стеблевые суккуленты, стебли разной формы с колючками.
Цветки в основном невзрачные, но у некоторых видов яркие, их
используют в аранжировке. Размножают черенками и прикорне¬
выми отпрысками (Черевченко и др., 1988).
Для микроразмножения в качестве эксплантов использовали
части молодых побегов разных видов. Их культивировали на сре¬
де МС, модифицированной добавлением 5 мкМ зеатина, 0,6—
0,8 мкМ инозита и 20 г/л сахарозы; pH 5,3. Получены адвентив¬
ные побеги, которые укореняли на среде МС с 2,0 мг/л ИМК
(Zhang et al., 1989).
В другом случае кусочки листьев после поверхностной стери¬
лизации помещали на питательную среду МС, содержащую по
1 мг/л НУК и БАП. Полученные каллусы переносили на среду
для регенерации с 0,5 мг/л НУК и 3,0 мг/л БАП. Образующиеся
побеги укореняли на среде с 2,0 мг/л ИУК. Через 2 недели куль¬
тивирования от каждого сегмента каллуса удавалось получить
15—22 побега (Baburaj et al., 1987).
Geraniaceae Juss.
Pelargonium L’Her. Насчитывает свыше 200 видов.
Низкорослые растения. Стебель прямостоящий или ползучий.
Листья цельные или рассеченные в разной степени. Цветки соб¬
раны в зонтик, окраска разнообразная.
245
СПЕЦИАЛЬНАЯ ЧАСТЬ
P. peltatum (L.) L’Her. распространена в Южной Африке. Сте¬
бель длинный, голый. Листья мясистые, щитковидные. Цветки
розово-лиловые.
Размножена in vitro с использованием листовых и пазушных
эксплантов на среде МС с 0,05 мг/л БАП, 0,1 — ИУК, 0,2 —
НУК, 0,3 — ИМК и 1,0 мг/л ГК3. На этой среде получены адвен¬
тивные побеги и каллус (Desilets et al., 1993; Stojka et al., 2002).
P. zonale (L.) L’Her. произрастает в Южной Африке. Вечнозе¬
леное растение с опушенным стеблем. Листья с кругами бурого
цвета. Цветки красные, крупные. Известно множество сортов.
Размножают черенкованием, семенами и в культуре тканей.
В ряде работ представлена методика размножения in vitro для
различных сортов P. zonale и P. peltatum. Экспланты (апикальные
и пазушные почки) на первой стадии культивирования, в течение
2 недель, выдерживали в условиях темноты. Их помешали на
среду МС с добавлением 250 мг/л дрожжевого экстракта и пеп¬
тона, 2,0 мг/л зеатина. На второй стадии экспланты культивиро¬
вали 4—6 недель на среде с 4,0 мг/л БА. Данная среда обеспечи¬
вала дифференциацию меристем. На третьей стадии размноже¬
ния среда содержала 0,2 мг/л зеатина. Образовавшиеся на второй
стадии побеги отделяли от листьев и помещали на среду горизон¬
тально, в результате каждый узел давал начало побегу. Укорене¬
ние проходило на четвертой стадии с 0,1 мг/л НУК в среде.
Предложенная схема культивирования меристем гарантирует ин¬
гибирование каллусообразования и появление адвентивных почек
(Щербакова и др., 1977; Menard et al., 1985).
Для микроразмножения 7 гибридов Pelargonium использовали
семянки. Семена высевали на среду МС. Через 3 недели культи¬
вирования проросло 75 % семян. Пересадку на среду МС с
2,0 г/л активированного угля и 0,5 мг/л НУК проводили ежеме¬
сячно. При культивировании пазушных почек аномальные расте¬
ния составляли 35 %, при черенковании — 16 % (Moncousin,
1977; Theiler, 1978; Becker-Zens, 1983).
Многие коммерческие сорта Pelargonium (90 %) являются тет-
раплоидами, 10 % — диплоидами. Снижение уровня плоидности
позволяет уменьшить расщепление популяций. Перевод дипло¬
идных сортов в гаплоидное состояние обеспечит устойчивую го-
мозиготность, что имеет большое значение для селекции.
Гаплоидные растения получали из культуры пыльников и за¬
родышей in vitro. Семена (для зародышей) и бутоны (для пыль¬
ников) использовали как экспланты. Их помещали в среду ЛС
246
ГЛАВА 4. Методы размножения тропических и субтропических растений
без регуляторов роста для культуры зародышей, с 0,5 мг/л ИУК и
2 0 мг/л кинетина — для пыльников. Первые 4 недели культуры
выращивали на среде с 0,1 мг/л 2,4-Д. Для культивирования
пыльников использовали среду Уайта. Лучшие результаты были
получены при выращивании зародышей старшего возраста. Рост
каллуса у пыльников 47 генотипов показал, что наиболее пригод¬
ной для этой цели является среда ЛС (Skirvin et al., 1976; Becker-
Zens, 1983).
Gesneriaceae Dum.
Episcia Mart. Известно около 40 видов, произра¬
стающих в тропиках Южной и Центральной Америки. Много¬
летние вечнозеленые растения с ползучими надземными побега¬
ми, или усами. Листья разной формы и окраски. Цветки разно¬
цветные.
Е. cupreata (Hook.) Hanst. распространена в Колумбии, Вене¬
суэле, Бразилии. Листья опушенные, зеленые с серебристым от¬
тенком и пятнами. Ампельное растение. Размножают в основном
вегетативно (Черевченко и др., 1988).
Для клонального размножения Е. cupreata в качестве эксплан¬
тов использовали листья побегов. После стерилизации из листьев
вырезали сегменты и размещали их на среде МС. При добавле¬
нии к среде кинетина и НУК экспланты регенерировали каллус,
а некоторые — корни. Совместное внесение кинетина и ИУК
вызывало выраженную пролиферацию каллуса и органогенез по¬
бегов через 6—8 недель культивирования. Установлено, что мак¬
симальное количество побегов (20—30 шт.) регенерировало на
среде с 0,2 мг/л кинетина и 0,2 мг/л ИУК. По достижении рас¬
тениями 0,5 см в высоту их пересаживали на среду, содержащую
НУК и ИУК в концентрации от 0,1 до 1,0 мг/л. Индукцию кор¬
необразования осуществляли на среде с НУК в течение 1—2 не¬
дель. На среде с ИУК корни не образовывались. Растения с 5—
• 0 корнями высаживали в субстрат, где приживаемость составля¬
ла 98 % (Johnson, 1978).
Gloxinia L’Her. Известно всего 6 видов. Родина — Южная Аме¬
рика. Многолетнее бесстебельное или короткостебельное рас¬
тение.
G. perennis (L.) Druce распространена от Колумбии до Перу.
Многолетнее растение с мясистым стеблем. Листья яйцевидные,
зеленые, со щетинками. Цветки с ароматом, разнообразной окра¬
247
СПЕЦИАЛЬНАЯ ЧАСТЬ
ски (Черевченко и др., 1988b). Размножают семенами, листовыми
черенками и в культуре in vitro.
Для микроразмножения использовали молодые листья расте¬
ний, растущих в теплице. Их стерилизовали, вырезали сегменты
и помещали на среду МС, содержащую НУК и кинетин. Основ¬
ная масса эксплантов на этой среде дифференцировала каллус и
лишь немногие — корни. Максимальное количество побегов
(20—30 шт.) регенерировало через 6—8 недель культивирования
на среде с 0,2 мг/л кинетина и НУК. По достижении побегами
0,5—1,0 см в высоту их пересаживали для укоренения на среду,
содержащую НУК и ИУК в концентрации 0,1 —1,0 мг/л. Лучшее
корнеобразование наблюдали на среде с НУК на протяжении 1 —
2 недель. Однако на среде с ИУК корни не формировались. По дос¬
тижении побегами высоты 2—3 см и после образования 5—
10 корней их высаживали в субстрат (Haramaki, 1971; Bigot, 1975,
1978b; Raman, 1977; Johnson, 1978a).
Saintpaulia Wendl. Род включает около 20 видов, произра¬
стающих в Тропической Африке. Вечнозеленые многолетние
травянистые растения высотой до 20 см. Короткостебельные ли¬
стья опушены по краю, могут быть зубчатыми или волнистыми.
Цветки разной окраски и махровости.
S. ionantha H.Wendl. — небольшое растение с зелеными опу¬
шенными листьями. Цветки синие. Имеется около 1000 сортов,
отличающихся размером, окраской, формой и махровостью цветка.
Размножают семенами, листовыми черенками, делением клона.
При микроразмножении S. ionantha использовали полностью
раскрытые листья и черешки. Черешки нарезали сегментами по
3 мм в длину, а из листьев делали высечки, чтобы каждая имела
крупную жилку. Из отрезков извлекали диски субэпидермальных
тканей. Все экспланты культивировали на средах МС (с витами¬
нами и аминокислотами) с добавлением 0,1 мг/л НУК и 0,5 мг/л
БАП. Образование побегов из целых отрезков черешка проходило
нормально; из субэпидермальных тканей (сердцевины) побеги не
образовывались, а регенерировал лишь светло-коричневый кал¬
лус. К сожалению, он не обладал морфогенетической способно¬
стью. На среде Гамборга В5 побеги образовывались из тканей
обоих типов.
После пересадки в грунт рост растений, регенерировавших из
субэпидермальных тканей, значительно усилился. Они были на¬
много крупнее растений из целых отрезков или черешка. Тип
эксплантов, используемых для размножения, не влиял на вели¬
248
ГЛАВА 4. Методы размножения тропических и субтропических растений
чину и количество образовавшихся цветков. Однако отметим, что
цветение у растений из субэпидермальных тканей наступило на
2 недели позже (Bilkey et al., 1981; Lubomski, 1986; Hanseh, 1988).
Для размножения in vitro S. ionantha cv. Diana эксплантами
служили сегменты листьев (диаметр 10 мм). Их помещали на
среду МС, имеющую в своем составе 50 мг/л инозита. Отмечена
способность к индукции адвентивных почек только на среде, со¬
держащей НУК и БАП. Установлено, что листья, возникшие из
новообразованных почек, способны формировать почки de novo
на среде без регуляторов роста. Эта способность сохранялась в
течение последующих культивирований. Также выявлена воз¬
можность индуцировать потерю способности к органогенезу без
фитогормонов путем добавления в среду антиауксина. Новообра¬
зование почек может быть снова вызвано при добавлении в среду
ауксина и цитокинина (Cassella et al., 1984; Jacques et al., 1985;
Cassella et al., 1986).
Для микроразмножения декоративных культур Saintpaulia в
качестве эксплантов использовали сегменты (диски) листьев,
цветки, узлы. Основной средой для культивирования была среда
МС, модифицированная добавлением 1,0 мг/л БАП, 0,5 мг/л
НУК, 30 г/л сахарозы. Через 1,5 мес образовались адвентивные
побеги. Для размножения и укоренения их культивировали на
среде без регуляторов роста (Cooke, 1977; Bilkey et al., 1978;
Gordienko, 2002).
Особую трудность вызывает размножение в культуре in vitro
пестролистных химер Saintpaulia. Дело в том, что использовать в
качестве эксплантов сегменты листьев, черешки листа, цветки не
представляется возможным, так как получить пестролистные рас¬
тения не удается. В связи с этим мы рекомендуем применять ли¬
бо апекс (что не очень целесообразно), либо спящие почки самих
цветоносов. На питательной среде МС с 10,0 мг/л БАП или аде¬
нина и 2,0 мг/л НУК они формируют сначала каллус, а потом
адвентивные побеги (Yungnivkel, 1976; Smith et al., 1983).
Streptocarpus Lindl. Род насчитывает около 100 видов, произ¬
растающих в Тропической Африке. Вечнозеленые многолетние
розеточные растения. Листья морщинистые, зеленые. Цветки
трубчатые, разной окраски. Цветет круглый год. Размножают се¬
менами, листовыми черенками, делением корня и в культуре
тканей.
S. nobilis Hook.f. размножали сегментами листьев. Экспланты
культивировали при 8-часовом фотопериоде на среде Симмондса,
249
СПЕЦИАЛЬНАЯ ЧАСТЬ
на которой наблюдали развитие цветочных почек. Индукция
отмечена при выдерживании эксплантов в условиях короткого
дня и последующем переносе в неиндуктивные условия для
экспрессии цветения. На среде с БАП зафиксирован органоге¬
нез. Регенерация тканей листьев без развития адвентивных по¬
чек отмечена на среде без БАП. Количественная реакция in vitro,
приводящая к цветению, возникая при фотоиндукции, может яв¬
ляться основой биотеста на предположительные химические со¬
единения, индуцирующие цветение (Grunewaldt, 1977; Simmonds
1985).
Как упоминалось выше, Streptocarpus чаще всего размножают
семенами или листовыми черенками. Однако семенное потом¬
ство обычно гетерозиготно по окраске цветка. Кроме того,
многие из получаемых растений стерильны. Поэтому размноже¬
ние в культуре in vitro очень актуально. Для микроразмножения
в качестве эксплантов использовали также незрелые венчики
или сегменты листьев и пестиков. Их культивировали на пита¬
тельной среде МС, модифицированной добавлением 200 мг/л
инозита, 12,5 — аденина, 85,0 — NaH2P04, 100 мг/л тирозина и
витаминов, мг/л: тиамина — 1,0, пиридоксина — 2,0, никотино¬
вой кислоты — 1,0, а также БАП — 5,0, НУК — 1,0. Через 5 не¬
дель выращивания дифференцировался каллус, который имел
зеленую окраску. Еще через 8 недель на нем индуцировались ад¬
вентивные почки. Полученные культуры делили на 5—6 частей и
культивировали на той же среде. Установлено, что один экс¬
плант может образовывать до 50 адвентивных почек. Кроме то¬
го, определено, что из одного цветка можно выделить до 3 эк¬
сплантов. Через 14—16 недель культивирования были получены
растения, которые высаживали в субстрат (Moucousin und and.,
1978; Peck et al., 1984).
Liliaceae Juss.
Bowiea Harv. ex Hook. Представители рода распро¬
странены в Южной и Восточной Африке. В роде 2 вида.
В. volubilis Harv. ex Hook. — многолетнее растение с зеленой
крупной луковицей, лежащей на земле. Побеги вьющиеся, дли¬
ной до 3 м. Встречается в полусаванне и пустынях Южной Аф¬
рики. Имеет довольно оригинальный внешний вид, светолюби¬
вое. Культивируют в холодных и полутеплых оранжереях. Раз¬
множают в основном вегетативно и семенами.
250
ГЛАВА 4. Методы размножения тропических и субтропических растений
Каллусы получали из сегментов осей соцветия В. volubilis при
культивировании на модифицированной основной среде МС с
добавлением 1 мг/л 2,4-Д и 15 % кокосового молока. Культуру
содержали при 22—25 °С, 55—60 % относительной влажности воз¬
духа и фотопериоде 16 ч. Формирование каллусов наблюдали у
80 % эксплантатов через 6—8 недель культивирования. Получен¬
ные выводковые почки использовали в качестве вторичных экс¬
плантатов для размножения. Индукцию побегов наблюдали в ус¬
ловиях основной среды с 2 мг/л БАП и 0,05 мг/л 2,4-Д. Образо¬
вавшиеся побеги росли и быстро размножались в жидкой пита¬
тельной среде (на шейкере). Через 16—20 недель от начала куль¬
тивирования получали 400—600 побегов из каждого исходного
эксплантата. Показано 50%-е выживание растений при их пере¬
носе в почвенные условия (Jha et al., 1985).
Malvaceae Juss.
Низкорослые деревья и кустарники, многолетние и
однолетние травянистые растения. Распространены в тропиче¬
ских, субтропических и умеренных зонах земного шара. Семей¬
ство включает 80 родов и 1500 видов.
Hibiscus L. В эту группу входят вечнозеленые деревья, кустар¬
ники или травянистые растения, опушенные или голые. Листья
на черешках очередные. Цветки пазушные, различной окраски.
Распространены в основном в тропиках. В роде насчитывается до
300 видов.
Н. acetosella L., согласно В. Reynolds (1983), отличается слож¬
ной технологией продуцирования растений из каллуса с исполь¬
зованием разных по составу питательных сред. Дана оценка
пригодности каждой из них для отмеченного процесса. В опыте
каллус получали от растений, выращенных как в лабораторных,
так и полевых условиях. Каллусную ткань толщиной 2—3 мм
срезали с молодых побегов и стерилизовали в 95%-м спирте. За¬
тем отобранные образцы помещали в стеклянные пробирки раз¬
мером 20 х 150 мм, содержащие 10 мл агаровой питательней сре¬
ды. Кроме агара, в разных вариантах, в состав среды включали:
глюкозу, сахарозу, кинетин, 2,4-Д, хлормекват, аденин, инозит и
Др. Всего было 5 видов питательных сред с разными сочетаниями
и концентрациями указанных выше веществ. Полученные расте¬
ния-регенеранты высаживали ex vitro.
251
СПЕЦИАЛЬНАЯ ЧАСТЬ
Могасеае Link.
Ecus Toum ex L. Распространены в тропических и
субтропических странах. В роде до 9000 видов. Среди предста¬
вителей рода имеются плодовые культуры, однако преимуще¬
ственно это парковые и декоративно-лиственные растения, при¬
годные для культивирования в оранжереях ботанических садов,
зимних садах и помещениях. Размножают в основном черенкова¬
нием.
F. carica L. — листопадные деревья высотой до 12 м. Произ¬
растают на карбонатных почвах, каменистых склонах гор Сре¬
диземноморья, Закавказья, Средней Азии, Индии, Афганистана, Ма¬
лой Азии и Ирана. Ценное плодовое растение. Культивируется в
холодных оранжереях.
Апексы длиной 0,3—0,5 мм изолировали у побегов 5-летних
растений, погружали на 10 мин в раствор диэтилтиокарбамата
(2 г/л), затем на мостике из фильтровальной бумаги помещали в
жидкую питательную среду. Использовали среду Миллера, обо¬
гащенную хелатом железа и дополненную 3 % сахарозы, витами¬
нами, мг/л: тиамин — 1,0, пиридоксин — 1,0, никотиновая ки¬
слота — 1,0, биотин — 0,01, мезо-инозит — 100,0. В среду вноси¬
ли также 2,4-Д (0,01 мг/л), БАП (0,2 мг/л) и ГК3 (0,1 мг/л). Через
2—3 недели роста материал с мостиков переносили на агаризиро-
ванную среду того же состава, но с измененным количеством регу¬
ляторов роста. Экспланты росли при освещенности 1000 лк, раз¬
личном фотопериоде (16 ч света и 8ч темноты) и температуре
24 °С. Установлено, что самое благоприятное время для изолиро¬
вания апексов — апрель и май. Укоренение побегов на агаризи-
рованной среде происходило при наличии 0,5 мг/л ИУК и
0,05 мг/л БАП (Jonard et al., 1983).
F. elastica Roxb. ex Hormen. среди всего ассортимента тро¬
пических и субтропических растений, выращиваемых в зимних
садах, жилых и производственных интерьерах, неизменно пользу¬
ется популярностью у населения. К этой группе можно отнести и
декоративные формы F, elastica, которые не так давно появились
на рынке и использовались нами в работе (F. elastica ’Brazil1,
F. elastica var. rubra, F. elastica ’Schriveriana1).
Родина данного вида — тропические леса Индии. В природе
это огромные вечнозеленые деревья. Листья крупные (до 30 см
длиной), кожистые, блестящие, разнообразной окраски, удлинен¬
но-овальные, с четкой центральной жилкой; в их тканях содер¬
252
ГЛАВА 4. Методы размножения тропических и субтропических растений
жится каучук. Ежегодный прирост в условиях закрытого грунта
составляет около 30 см, у вариегатных форм меньше. Зимой тре¬
бует более низких температур (18—20 °С), умеренных освещения
и полива; летом освещение яркое, полив обильный. Для роста
необходима почва средней плотности, питательная (pH 6,0—6,5).
В природе размножается как вегетативно, так и семенами, в усло¬
виях ex situ — преимущественно вегетативно.
Благодаря своей неприхотливости и элегантному внеш¬
нему виду F. elastica в некоторых областях на протяжении
многих десятилетий был неотъемлемым элементом интерьеров
жилых помещений. Популярность этого растения достаточно вы¬
сока и сейчас, о чем свидетельствуют значительные объемы им¬
порта и продаж горшечной культуры F. elastica.
Отбор растительного материала с интактных растений осущест¬
вляли весной, в конце апреля. Эксплантами были апикальные и
ближайшие к ним почки молодых побегов. В работе использова¬
ли два способа стерилизации: традиционный (с помощью серии
растворов: спирт (70 %), thimerosal (0,01 %), chlorax (10 %), Н202
(10 %)) и метод поверхностной стерилизации над огнем спиртов¬
ки. В обоих случаях получили положительный результат, однако
предпочтение отдаем последнему, так как он менее трудоемок и
менее травматичен для растений.
В качестве первичной среды для введения в культуру in vitro
мы использовали модифицированную пропись среды МС с
1 мг/л 2,4-Д. На ней проходила выбраковка инфицированных
эксплантов и пробуждение стерилизованных. Через 20—25 сут
необходимо сделать первый пассаж. На этом этапе у отдельных
эксплантов может проявиться инфекция — их также нужно
удалить. В целом при первом способе стерилизации было полу¬
чено 54 % чистых эксплантов, при втором нам удалось простери-
лизовать все экспланты.
Последующие пассажи проводили на среду МС, модифици¬
рованную БАП, на которой вокруг мест среза активно пролифе¬
рировал каллус. Экспланты формировали два типа каллуса —
рыхлый (не способный к органогенезу) и плотный (органоген¬
ный каллус). Пролиферация каллусных масс происходит доволь¬
но активно и через 30—40 сут масса каллуса может превысить
массу экспланта. В этот период в толще каллусных тканей начи¬
наются процессы морфогенеза: адвентивные почки формируются
хаотично (рис. 4.38, см. вклейку), на один конгломерат 10 х 10 мм
может приходиться 5—15 почек.
253
СПЕЦИАЛЬНАЯ ЧАСТЬ
При разделении и перенесении их на свежую питательную
среду процессы пролиферации каллуса и органогенеза продолжа¬
лись. Из каждой спонтанно сформировавшейся почки через 40—
45 сут образуется побег 1,5—2 см длиной с 3—4 листьями (рис.
4.39, см. вклейку). В дальнейшем побеги можно отделять от кал-
лусных тканей и переносить на среду для укоренения (рис. 4.40,
см. вклейку). Коэффициент размножения на среде для пролифе¬
рации каллуса и органогенеза составляет 1 : 3—1 : 4. Через 20—
25 сут образовавшиеся корни имеют длину 10—20 мм. Растения
пригодны к высадке в условия оранжерей через 30 сут с момента
их пересадки на последний тип среды.
Первичный субстрат для адаптации — сфагновый мох. Затем
ювенильные растения рассаживают по отдельным емкостям в
легкую питательную землесмесь (рис. 4.41, см. вклейку) (Иван¬
ников и др., 2006).
Известны работы по изучению внутриклеточного содержания
цитокининов в каллусных тканях F. elastica, растущих на средах со
сниженным содержанием БАП или без добавления гормона. Уста¬
новлено, что уменьшение количества вносимого извне БАП приво¬
дит к увеличению активности цитокининов. Предполагается, что
проявление цитокининовой активности связано с осуществлением в
культуре тканей синтеза гормонов из эндогенных ресурсов (Poole et
al., 1984; Kristiansen, 1989; Кольчугина и др., 1996).
F. lyrata Warb. размножали, используя в качестве эксплантов
сегменты молодых листьев. После стерилизации их помещали на
среду Hura, модифицированную добавлением 15 мг/л тиамина,
24 мг/л БА, 2-iP, кинетина и 12,5 мг/л ИМК. Через 3 мес культиви¬
рования образовалось множество адвентивных почек и побегов.
Полученные побеги отделяли, делили и переносили на среду, сос¬
тоящую из макроэлементов по Кнопу и микроэлементов по Ничу,
аминокислот, витаминов, 5 мг/л НУК. Максимальное количество
побегов было получено на среде с 12,5 мг/л ИМК и 24 мг/л кине¬
тина, 2-iP и БА. Отмечено также положительное влияние 4 мг/л
ГК3. Укоренение побегов проводили на среде без цитокининов, но
с 12,5 мг/л ИМК. Хорошие результаты по укоренению были полу¬
чены также при культивировании побегов на среде с 4 мг/л ГК3,
12,5 — ИМК и 24 мг/л БА (Jona et al., 1987; Tewari et al., 1987).
F. religiosa L. — листопадные деревья высотой до 18 м. Рас¬
тут во влажных вечнозеленых и смешанных лесах, на равнинах
на высоте до 1500 м над ур. м. в Индии, Мьянме (ранее — Бир¬
ма), на п-ове Малака, о-ве Шри-Ланка и островах Малайского
254
ГЛАВА 4. Методы размножения тропических и субтропических растений
архипелага. Декоративное растение. Культивируется в умеренных
и теплых оранжереях.
Изучали условия формирования почек на листовых дисках,
полученных от молодых побегов 20-летних деревьев. Диски, по¬
мешенные на агаризированную среду МС, содержащую 0,5 мг/л
2,4-Д, образовывали каллус через 5—6 недель. После переноса
каллуса на среду с БАП (0,5, 1,0 и 2,0 мг/л) наблюдали форми¬
рование стеблевых почек, которые развивались в побеги. Опти¬
мальная концентрация БАП составляла 0,5 мг/л. При сочета¬
нии 1,0 мг/л БАП с 0,5 мг/л НУК имело место одновремен¬
ное образование стеблей и корней. Побеги без корней укореняли
на мостиках из фильтровальной бумаги в жидкой среде МС, до¬
полненной 1,0 мг/л НУК (Narayan et al., 1986).
Первоначальными эксплантами F. religiosa служили отрезки
молодых побегов, полученные от 20-летних деревьев. Их культи¬
вировали при 25 °С и освещенности 4000 лк с фотопериодом,
равным 12 ч. На среде МС с 1 мг/л 2,4-Д происходило образова¬
ние каллуса. Формирование побегов наблюдали после переноса
каллуса на среду, дополненную БАП (0,05—2,0 мг/л). Для укоре¬
нения побегов использовали среду, модифицированную добавле¬
нием 1 мг/л НУК (Mokino et al., 1977; Jaiswal et al., 1985).
Участки молодых листьев 20-летних деревьев F. religiosa куль¬
тивировали на среде МС с различными комбинациями и кон¬
центрациями БАП, НУК и 2,4-Д при 25 ± 2 °С, 12-часовом фо¬
топериоде и освещенности 4000 лк. На среде с 2,0 мг/л БАП и
1,0 мг/л НУК наблюдали образование побегов непосредственно
из листьев. При наличии в среде 0,5—1,0 мг/л НУК у основа¬
ния образующихся побегов отмечено формирование корней.
Экзогенная 2,4-Д ингибировала органогенез. При переносе по¬
бегов с корнями в смесь стерильной почвы, песка и компоста
(3:3:1) 70 % растений приживались и через неделю у них форми¬
ровались новые листья (Debergh et al., 1977; Narayan et al., 1986).
Musaceae Juss.
Musa L. Родина — Тропическая Азия, Африка, Ав¬
стралия. Известно свыше 50 видов и множество культурных
форм. Многолетние травянистые высокорослые растения. Листья
эллиптические, крупные, длинные. Цветонос на длинных конеч¬
ных кистях. Растения монокарпические. Плод — банан. Размно¬
жают отпрысками, делением корневища и в культуре тканей.
255
СПЕЦИАЛЬНАЯ ЧАСТЬ
В тропических зонах Земли представители рода Musa широко
используются как плодовые и сельскохозяйственные растения. В
странах с умеренным климатом в основном применяются низко¬
рослые виды для озеленения помещений и оформления зимних
садов.
М. acuminata Colla и М. balbisiana Colla были размножены с
помощью каллуса, полученного из незрелых эмбрионов. Основ¬
ная среда — МС. Вместо агара к среде добавляли picloram
(7,5 мкМ) и gelrite (2 мкМ). Дифференциация первых соматиче¬
ских эмбрионов получена при внесении 7,5 мкМ picloram или
5,3 мкМ НУК (Escalant et al., 1989).
М. папа Lour, выгодно отличаются среди небольших по раз¬
мерам представителей рода. Они достаточно устойчивы в интерь¬
ерах и очень декоративны.
Для клонального размножения М. папа мы использовали
апикальные меристемы генеративно зрелых растений и почки
подземных корневищ. Стерильную культуру удалось получить толь¬
ко из апексов растений. Стерилизацию проводили по следующей
схеме: спирт этиловый (70 %) — 1 мин; thimerosal (0,01 %) —
30 мин; chlorax — 6 мин; Н202 (15 %) — 12 мин. Экспланты,
отобранные с интактных растений в декабре, культивировали
на среде с 0,1 мг/л ИУК. Первые признаки дифференциации
были отмечены через 27 сут с момента введения в культуру in
vitro. При этом наблюдался рост листьев и разрастание базаль¬
ной части эксплантов (рис. 4.42, а, см. вклейку). Через 126 сут,
после 2 пассажей на среде МС растительный материал переса¬
дили на модифицированную среду Пирика с 1 мг/л БАП. На
этой среде наблюдалось активное образование конгломератов
растений (рис. 4.42, б). Они формировались вследствие пробуж¬
дения адвентивных почек и, вероятно, развития новых мери¬
стематических центрор в тканях базальных частей побегов. Суб-
культивируя отдельные побеги на среде МС, через 45—60 сут
получали растения, пригодные для высадки в субстрат
(рис. 4.42, в). Коэффициент размножения при таком способе
ведения культуры составляет 1:7, цикл пассажей — 50—60 сут.
Первые растения-регенеранты были высажены в субстрат через
320 сут после введения в культуру первых эксплантов (Ivannikov
et al., 2004).
Постасептическая адаптация проходит без осложнений. На
этом этапе растения можно высаживать в легкую питательную
землесмесь. Отметим, что иногда у этого вида Musa при микро¬
256
ГЛАВА 4. Методы размножения тропических и субтропических растений
размножении появляются хлорофиллдефектные индивидуумы
(рис. 4.42, г).
Этому способу размножения представителей данного рода (в
основном промышленных сортов) посвящен целый ряд работ.
Так, описан способ, согласно которому терминальный (флораль-
ный) апекс Musa изолировали, стерилизовали и культивировали
на среде МС с добавлением 10 % кокосового молока, 5 мг/л БА в
условиях темноты и освещенности. Из почек формировались ад¬
вентивные побеги. Пересадку осуществляли каждые 3—4 недели.
Корни образовывались на среде, содержащей 1 мг/л НУК и
0,025 % активированного угля, добавление которого — необхо¬
димое условие успешного культивирования. Побеги получали на
среде с 1 мг/л ИУК и БА. Однако оптимальной является концен¬
трация 10 мг/л БА. Корни формировались на среде МС с 1 мг/л
ИМК (Mohan et al., 1964).
В другом случае эксплантами для микроразмножения были
кончики побегов длиной 2—3 мм с 2—4 листовыми зачатками.
Через некоторое время происходила пролиферация побегов, все
части которых использовали как экспланты. Их культивировали
на среде МС с добавлением 50 мг/л аденина, ИУК, ИМК, 2,4-Д,
2-iP, БА, кинетина. Побеги регенерировали через 4 недели куль¬
тивирования эксплантов в условиях темноты (Zi et al., 1988;
Matsumoto et al., 1989).
Изучали влияние освещенности (рассеянный солнечный свет
и искусственное освещение) и количества среды в сосудах на
микроразмножение Musa. Опыт включал три фазы развития: пер¬
вая — образование адвентивных почек, вторая — мультиплика¬
ция, третья — укоренение. Растения были получены после 7 суб¬
культивирований на среде МС с 4 мг/л БАП и 0,85 мг/л НУК
(Orellana et al., 1993).
Экспланты культивировали в жидкой среде МС с 5 мкМ
БАП, 30 г/л сахарозы, pH 4,0. Кислотность (значение pH среды)
ингибировала рост эксплантов через 3 недели культивирования.
Была установлена сортовая зависимость по отношению к pH
среды. Продолжительное выращивание эксплантов (в течение
3 мес) на среде с pH 4,0 благоприятствовало выживанию расте¬
ний-регенерантов при высаживании их в кислые почвы. Отмече¬
но, что культивирование in vitro с pH 4,0 снижало концентрацию
растворимых белков в растениях (Morziah et al., 1995).
В работах R. Litz (1985) показано, что соматические зароды¬
ши Musa могут развиваться у основания листьев и вдоль листо¬
257
СПЕЦИАЛЬНАЯ ЧАСТЬ
вого влагалища. У древесных тропических плодовых растений
соматический эмбриогенез ограничивался каллусом, образован¬
ным из нуцеллуса или адвентивных зародышей нуцеллярного или
интегументального происхождения. При культивировании моноэм-
бриональных семяпочек зиготические зародыши изолировали до
того, как они заполняли зародышевый мешок. Для размножения
полиэмбриональных видов и сортов эффективным было культи¬
вирование интактных семяпочек.
В работах К. Matsumoto и соавт. (1987) показано, что на сре¬
зах верхушек побегов банана, культивируемых in vitro, формиро¬
вались протокормы, однако добавление к среде после ее стери¬
лизации с помощью фильтрования оксипролина (4 мМ) ингибиро¬
вало их рост. Полученные результаты были использованы для отбо¬
ра культур, толерантных к аналогам аминокислот.
Ткани меристемы побегов 8 триплоидных сортов банана куль¬
тивировали на среде МС с различными концентрациями и комби¬
нациями цитокининов и ауксинов при температуре 30 ± 2 °С и не¬
прерывном освещении (3000 лк). На среде с 0,18 мг/л ИУК и
2,3 мг/л БАП наблюдали образование культур с большим коли¬
чеством почек. Эти культуры переносили для изучения возмож¬
ности длительного хранения в камеры с различной температурой
и низкой освещенностью (1000 лк). При 15 °С культуры можно
выдерживать 13—17 мес в зависимости от сорта. Образующиеся
побеги помещали на среду МС, разбавленную вдвое с 0,2 мг/л
ИМК. Обычно корнеобразование происходило в течение 2 недель.
Укорененные растения хорошо переносили пересадку в почву.
Наблюдались значительные различия между изученными сортами
по способности выдерживать минимальные температуры (Ва-
nerjee et al., 1985).
Myrtaceae Juss.
Вечнозеленые деревья и кустарники. Распростра¬
нены в тропических и субтропических зонах Южной Америки и
Австралии. Семейство включает до 100 родов и около 3000 видов.
Eucalyptus L’Her. Родина — Австралия, Филиппины. Известно
более 250 видов. Дерево до 150 м в высоту. Листья супротивно¬
очередные, содержат много ароматных эфиромасличных железок.
Е. citriodora Hook, произрастает в Австралии. Небольшое де¬
рево высотой до 4 м. Листья жесткие, с сильным запахом лимо¬
на. Размножают семенами и в культуре тканей.
258
ГЛАВА 4. Методы размножения тропических и субтропических растений
Для микроразмножения Eucalyptus в качестве эксплантов ис¬
пользовали семядоли, верхушки побегов, гипокотили и кончики
корней асептических 2-суточных проростков. Их культивировали
на питательной среде МС с добавлением БАП, зеатина, кинетина,
2-iP, НУК, ИУК, ИМК и ГК3 на свету. Высокая частота индукции
придаточных почек отмечена на эксплантах верхушек побегов.
Изредка почки дифференцировались на гипокотилях и никогда —
на корнях. При выращивании верхушек побегов на среде с 1 мг/л
зеатина частота индукции составляла 83 %. Добавление 0,001 мг/л
ИМК усиливало рост почек. Наибольшая частота (96 %) образова¬
ния почек достигнута при культивировании узлов стеблей. ИМК,
ИУК и НУК не усиливали образование почек, но стимулировали
их рост в низких концентрациях (0,001 мг/л). Культивирование
эксплантов на свету давало хорошие результаты. Полученные поч¬
ки разрезали на части и субкультивировали. Из одной почки реге¬
нерировало 5 новых. Дальнейшее развитие сформировавшихся по¬
чек происходило на среде без цитокининов с 25 г/л сахарозы и
1 г/л активированного угля (Mehra-Palta, 1982).
При микроразмножении Е. camaldulensis Dehnh. эксплантами
служили либо изолированные семядоли полученных 7-суточных
проростков, либо отрезки этих же проростков, но без гипокоти-
ля. В зависимости от концентрации используемых регуляторов
(НУК и БАП) получали или органогенный каллус, или пазушные
почки. Формирование почек происходило в каллусе без предва¬
рительного переноса на другую среду (Diallo et al., 1984). Таким
же методом был размножен и Е. sideroxylon A.Cunn. ex Wolls.
Исследована возможность микроразмножения Е. grandis L. В ка¬
честве эксплантов использовали небольшие участки стебля с узла¬
ми, которые были взяты от 5-летних деревьев. Сегменты стебля
культивировали на твердой среде МС, дополненной тиамином, БАП
и НУК. Через 2 мес выращивания формировался сначала каллус, а
потом и побеги. От одного экспланта было получено 30—50 по¬
бегов, которые укореняли на среде с 1—5 мг/л ИМК или НУК.
Укоренялось 70 % побегов (Cresswell et al., 1975; Sita et al., 1985).
Пазушные почки побегов 8—10-летних деревьев использовали
Для размножения in vitro Е. tereticornis Smith. На среде МС, моди¬
фицированной добавлением 0,1 мг/л НУК и 1 мг/л БАП, проис¬
ходила индукция адвентивных почек, которые в дальнейшем ре¬
генерировали побеги. Побеги укореняли на среде Кнопа с 1 мг/л
ИМК. Хорошие результаты были получены при добавлении к
среде 1 г/л активированного угля и 0,1 мг/л ГК3 (Gill et al., 1994).
259
СПЕЦИАЛЬНАЯ ЧАСТЬ
Для размножения in vitro Е. citriodora и Е. camaldulensis в каче¬
стве эксплантов использовали молодые побеги. Каллус регенери¬
ровал в условиях темноты на среде МС с 1 г/л гидролизата казеи¬
на, 3 мг/л НУК, 1 мг/л БА и 50 г/л сахарозы. Побеги формирова¬
лись через 4 недели на каллусе, перенесенном на свет, на среде с
10 % кокосового молока, 0,5 мг/л БА и 20 г/л сахарозы. Образо¬
вание корней наблюдали и в темноте на среде с 4 мг/л НУК.
Зиготические зародыши Е. citriodora, культивируемые в темноте
на среде с 3 мг/л НУК и 50 г/л сахарозы, дифференцировали сома¬
тические эмбриоиды. При перенесении на среду для органогенеза
они образовывали побеги (Gupta et al., 1981; Muralidharan et al.,
1987).
Myrtus L. Насчитывает не более 6 видов. Распространен в
Средиземноморье, Африке, Вест-Индии, на Азорских островах,
п-ове Флорида. Вечнозеленые деревья высотой до 4 м. Листья
мелкие, темно-зеленые, обладают фитонцидной активностью.
Цветки пазушные. Плод — ягода. Побеги голые. Размножают че¬
ренками и в культуре тканей.
М. communis L. — это деревья и кустарники высотой до 4 м.
Побеги четырехгранные, листья супротивные, цветки одиночные,
пазушные. Растет в подлеске вечнозеленых дубов и сосен, в за¬
рослях кустарников на Азорских островах, в Средиземноморье и
Северной Африке.
Для клонального размножения этого вида разработана техно¬
логия, согласно которой в стерильную культуру растения вводили
посредством апикальных и пазушных меристем. Оптимальной
для размножения была среда МС, модифицированная добавлени¬
ем 1,2—5,0 мг/л НУК и 10 мг/л БАП. На данной среде особенно
интенсивно размножался сорт М. communis ’Variegata*. Окраска
побегов, полученных у данного сорта, была зеленой, пятнистой
или кремовой. М. Khosh-Khui и соавт. (1984) предполагают, что
меристема у этого сорта представляет собой клетки как с зеле¬
ными, так и с измененными пластидами.
Nandinaceae Horan.
Nandina Thunb. Монотипный род.
N. domestica Thunb. — кустарник высотой до 3 м с
красновато-коричневыми побегами. Листья сложные, собраны в
основном в верхней части. Соцветие верхушечное, метелка. Рас¬
тет на горных склонах в Японии и Китае. Высокодекоративное
260
ГЛАВА 4. Методы размножения тропических и субтропических растений
растение, используется в основном для создания экспозиций и
оформления интерьеров. Карликовый кустарник N. domestica обыч¬
но размножают черенкованием.
Для увеличения коэффициента размножения использовали ме¬
тод in vitro. После стерилизации экспланты из терминальных по¬
бегов выдерживали при 26 °С и дополнительном освещении в
течение 16 ч. Основными были среда МС и модифицированная
среда Гамборга. Изучали влияние на развитие побегов активиро¬
ванного угля (1,0—6,0 г/л), 80 мг/л аденинсульфата, 17 мг/л
NaH2P04 • Н20, НУК и БАП. Показано, что без активированного
угля развитие побегов не происходит, а его оптимальная концен¬
трация — 1,5 г/л. Без регуляторов роста побеги лучше развива¬
лись на среде Гамборга: спустя 6—8 недель коэффициент их раз¬
множения составлял 4,6. Побеги на 1/3 концентрации среды МС
с 3 мг/л НУК или ИМК в течение недели укоренялись на 58 %.
Укорененные растения высаживали в смесь сфагновый торф:
перлит (1:1) при высокой влажности (Smith, 1983).
Nepenthaceae Dum.
Nepenthes L. Одними из наиболее оригинальных де¬
коративных растений являются представители рода Nepenthes L.,
относящегося к монотипному семейству Nepenthaceae Dum. Род
включает около 70 видов, область распространения которых про¬
ходит от о-ва Мадагаскар через Юго-Восточный азиатский архи¬
пелаг к Новой Каледонии и Австралии. Естественные места оби¬
тания Nepenthes весьма разнообразны. Они произрастают на ка¬
менистых известковых утесах с постоянным увлажнением; на бо¬
лотах, покрытых некоторое время водой; на побережье моря. Мно¬
гие из них эпифиты, поселяющиеся на деревьях, некоторые —
полулианы, стелющиеся по поверхности почвы. Среди непентесов
встречаются высокогорные и низинные виды, произрастающие
как в тени, так и на открытых солнцу местах.
Представители Nepenthes — многолетние травянистые или по¬
лукустарниковые насекомоядные растения. Листья у них узколан-
Цетные, очередные, состоящие из трех частей: расширенной час¬
ти у основания, которая выполняет типичную функцию листа,
средней части, состоящей из одной жилки и переходящей в тре¬
тью часть — сложноустроенный кувшин с крышечкой. В верхней
части кувшин обрамлен гладким блестящим как бы покрытым
воском валиком — перистомой. Окраска кувшинов различна —
261
СПЕЦИАЛЬНАЯ ЧАСТЬ
от зеленой до желто-зеленой с красными или пурпурными пят¬
нами и штрихами. Форма их очень разнообразна и отличается не
только у разных видов, но и в пределах одного вида и даже на
одном растении. Чаше всего непентесы имеют кувшины двух ти¬
пов: воздушные и наземные.
N. madagascariensis Poir. — двудомное растение. Цветки собра¬
ны в метелку, мелкие, невзрачные, зелено-коричневой окраски
с 4 редуцированными чашелистиками; тычинки и пестики нор¬
мально развиты. Кувшины зеленые, длиной до 14 см. Декоратив¬
ность и оригинальность этому виду придают довольно изящные
побеги полуампельного типа и кувшины.
Главная роль кувшинов, по мнению многих исследователей,
состоит в ловле и переваривании насекомых. Питаясь нектаром,
который выделяют пищеварительные железы, расположенные на
перистоме, насекомое скользит и, не удержавшись, падает внутрь
кувшина в вязкую жидкость. Она содержит ферменты, расщеп¬
ляющие белки до аминокислот. В пищеварении участвуют и бак¬
терии, также способствующие расщеплению белков. С одной
стороны, эта удивительная способность добывать подобным об¬
разом азот позволила непентесам заселять местности с дефици¬
том этого элемента. С другой стороны, такая физиологическая
особенность питания наводит на размышления о форме и коли¬
честве азотсодержащих соединений в питательных средах для
культивирования Nepenthes в асептических условиях.
В отделе тропических и субтропических растений НБС НАН
Украины в течение ряда лет проводилась работа по изучению эн¬
демичного и реликтового N. madagascariensis, завезенного с о-ва
Мадагаскар в 1981 г.
Для успешной интродукции Nepenthes в защищенный грунт
умеренных широт решающее значение имеет изучение их био¬
логии и размножения. Мы исследовали морфологическую струк¬
туру плодов и семян N. madagascariensis, а также разработали ме¬
тоды его семенного и вегетативного размножения.
Результаты морфологических исследований показали, что
плод имеет вид продольно вскрывающейся до половины по кар¬
динальным швам четырехгнездной коробочки цилиндрической
формы. Длина коробочки 21—23 мм, диаметр 6—8 мм. Около¬
плодник деревянистый, коричневый, с бородавчатой поверхно¬
стью и коричневыми плодоножками длиной до 12 мм и диамет¬
ром около 1 мм. Семена узкие, нитевидные, длиной 6—8 мм и
шириной до 0,5 мм, продольно-морщинистые, коричневого цве¬
262
ГЛАВА 4. Методы размножения тропических и субтропических растений
та голые, блестящие. Зародыш крупный, выпуклый, несколько
ноздреватый и прикреплен зародышевыми тяжами к верхушке
семени. Семена в холодильнике при температуре 4 °С сохраняют
жизнеспособность в течение года.
В связи с ограниченным количеством семян N. madagascariensis
для получения сеянцев мы использовали метод культуры in vitro.
Семена стерилизовали последовательно в 10%-м растворе хлорной
извести (15 мин) и 15%-м растворе пероксида водорода (10 мин),
затем промывали 2 раза в стерильной воде. Высев семян и культи¬
вирование растений осуществляли на питательной среде, основу
которой составляли минеральные соли по Кнудсону и витами¬
ны по Мурашиге—Скугу. На различных этапах развития семян к
среде добавляли пептон — 2 г/л, активированный уголь — 1 г/л,
гумат калия — 50 мг/л, аденин — 4 мг/л, ИУК — 2 мг/л, кокосо¬
вое молоко — 100 мл/л, сахарозу — 30 г/л; pH среды 5,5—5,8. По¬
сле высева семян колбы переносили в культуральное помещение
со следующим режимом: температура 25—27 °С, влажность 70 %,
фотопериод 16 ч, освещенность 10 000 лк (Черевченко и др., 1989).
Через 2 мес после высева семена начали прорастать. Спустя
3 мес образовались побеги длиной 3—6 мм с 2 маленькими листь¬
ями. На 5-й месяц культивирования на концах листьев появились
пучки очень тонких волосков, а еще через месяц — маленькие,
почти незаметные невооруженным глазом кувшины. В дальней¬
шем для пролиферации пазушных меристем побеги переносили
на модифицированную нами питательную среду. Через 3 мес по¬
сле пересадки из одного побега образовались 3—4 новых. Это по¬
зволило провести поиск оптимальной по составу питательной
среды, способной индуцировать закладку максимального количе¬
ства стеблевых меристем. Установлено, что минеральный состав
среды существенно не влияет на рост придаточных побегов, одна¬
ко для субкультивирования предпочтительнее использовать мине¬
ральные соли и витамины по Мурашиге—Скугу. Для усиления
индукции адвентивных побегов в питательную среду добавляли
цитокинины (рис. 4.43, а, см. вклейку). Как правило, адвентив¬
ные побеги (6—7 шт.) формировались из пазушных стеблевых ме¬
ристем. Необходимым условием культивирования непентесов яв¬
ляется добавление к питательной среде активированного угля, что
способствует адсорбции элементов метаболизма. Следует отме¬
тить, что адвентивные побеги Nepenthes плохо образуют корневую
систему. Наши исследования показали, что добавление к пита¬
тельной среде сахарозы и ИУК способствует ускорению корнеоб-
263
СПЕЦИАЛЬНАЯ ЧАСТЬ
разования и получению растений непентеса с нормально развитой
корневой системой. Повышенное содержание сахарозы в среде
также способствует адаптации растений непентеса перед высад¬
кой их в субстрат (Черевченко и др., 1992).
С целью изучения вегетативных меристем, выявления локали¬
зации и строения примордиальных меристем — источника высо¬
кой регенерационной способности Nepenthes — мы исследовали
анатомическое строение апикальной и латеральной меристем,
особенности закладки и развития листовых примордиев у семян,
которые проросли. Также было изучено развитие листьев и по¬
бегов у 5-месячных проростков непентеса.
С помощью цитологических методов нами впервые выявлены
особенности формирования и развития листьев Nepenthes. Уста¬
новлено, что его апекс имеет присущую покрытосеменным рас¬
тениям форму туники и корпуса. В конце пластохронного цикла
апекс формирует меристематические центры с зачатками буду¬
щих листьев. После отделения примордии листа нарастают своей
верхушкой, удлиняются и как-будто валиком окутывают апекс,
поэтому на протяжении всего периода роста и развития, до отде¬
ления листового узла на побеге, лист имеет округлую форму. Од¬
новременно с ростом, уже на самых ранних фазах развития, на
верхней части листового примордия формируется зачаток кры¬
шечки кувшина. Он легко определяется по зачаткам трихом и
эмергенцев, некоторые из которых разветвляются. Все примор¬
дии листьев несут на своих верхушках зачатки крышечек кувши¬
нов, а в пазухах — зачатки латеральной меристемы. Во время
роста листового примордия увеличивается в размерах централь¬
ная жилка листа. Листовые примордии имеют типичную ланце¬
товидную форму. С ростом листа возле крышечки появляется
зачаток самого кувшина, который увеличивается в размерах и
становится объемным. Размеры зачатка кувшина корелируют с
размерами листа, на котором он формируется.
У проростка в возрасте 5 мес высотой 5—7 см все листья
имеют зачатки кувшинов, но разного размера. Некоторые из них
уменьшаются в размерах и, возможно, со временем элиминиру¬
ют. У листа длиной 15—20 мм кувшин бывает до 7 мм длиной и
его хорошо видно; он имеет открытую крышечку со сформиро¬
ванной перистомой.
В клетках листьев 5-месячных растений преобладает парен¬
хима, состоящая из изодиаметрических клеток, большая часть
которых заполнена водой и воздухом. Эти клетки называют за¬
пасными трахеидами. У Nepenthes как у тропического растения с
264
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.44. Адаптированные растения-
регенеранты Nepenthes madagascariensis
Poir.
большими листьями, состоящи¬
ми из трех частей, в природных
условиях лист растет долгое вре-
мя (Черевченко и др., 1995).
Пересадка растений-регене-
рантов из стерильных условий
ex vitro весьма проблематична
(рис. 4.43, б, см. вклейку).
Именно на данном этапе гиб¬
нет значительная часть расте¬
ний. В связи с этим важным
является подбор оптимально¬
го субстрата для их культиви¬
рования. В результате прове¬
денных нами опытов установ¬
лено, что наиболее приемлем
воздухопроницаемый субстрат,
применяемый для выращива¬
ния орхидей и состоящий из коры хвойных пород, лесной подстил¬
ки, песка и древесного угля (2:1:1:0,5). pH субстрата варьирует от
5,0 до 5,5. Влажность субстрата не должна быть ниже 17 %. Кроме
того, положительные результаты получены и при культивирова¬
нии N. madagascariensis на свежесобранном сфагновом мху, кото¬
рый хорошо аэрируется и удерживает влагу (рис. 4.44).
Как отмечалось выше, непентесы любят свет, поэтому в теп¬
лицах поддерживали высокую освещенность. Только в таких
условиях растения образовывали нормально развитые листья, а
кувшины приобретали интенсивную окраску. Однако в летнее
время во избежание ожогов растений стекла теплиц притеняли
деревянными щитами на 40 %.
Полив растений лучше проводить отстоянной водой. В летний
период субстрат часто увлажняли, осенью и зимой — подсушивали.
Подобно многим другим насекомоядным растениям N. madagasca-
nensis весьма требователен к минеральному питанию, поэтому с
ранней весны и до осени растения подкармливали 2 раза в месяц
минеральными удобрениями в концентрации 0,001 %.
Таким образом, проведенные исследования показали, что
N. madagascariensis может быть с успехом размножен вегетативно
и семенами в культуре in vitro. Последний способ наиболее эф¬
фективный, так как позволяет выращивать бесчисленное мно¬
жество растений. Полученные растения, благодаря высокой де¬
265
СПЕЦИАЛЬНАЯ ЧАСТЬ
коративности, можно успешно использовать для озеленения зим¬
них садов и других типов интерьеров.
В условиях асептической культуры мы размножали и другие
виды этого рода. В частности, проводились работы по размноже¬
нию некоторых вьетнамских Nepenthes. Стерильная культура была
получена из семян, которые после стандартной процедуры стери¬
лизации имели 100%-ю всхожесть. В целом схема микроразмно¬
жения и постасептической адаптации идентична N. madagasca¬
riensis (рис. 4.45, см. вклейку).
Были предприняты попытки вырастить in vitro и другие насе¬
комоядные растения. Так, Nelianphora nutans хорошо размножа¬
лась на питательной среде МС: через 2 мес вместо одного кореш¬
ка появлялось шесть. Для выращивания цветочных стеблей ис¬
пользовали сегменты листьев Drosophyllum и Drosera stalonifera
Endl. На сегментах листьев Drosophyllum образовывался каллус.
Он хорошо размножался, но побегов и корней не было, и поэто¬
му добиться органогенеза не удавалось (Сэно, 1996).
Nyctaginaceae Juss.
Bougainvillea Comm, et Juss. Родина — тропические и
субтропические страны. На Черноморском побережье Кавказа рас¬
тет в фунте. Известно 14 видов и 3 культивара. Кустарник или лиа¬
на. Побеги часто в шипах. Листья разной формы, опушены. Цветки
собраны на верхушке побега, прицветники ярко окрашены. Широ¬
ко используется в озеленении разных интерьеров. Размножают вы¬
зревшими верхушечными черенками (Черевченко и др., 1988).
В. glabra Choisy. произрастает в Бразилии на каменистых карбо¬
натных почвах. Декоративное цветущее вьющееся растение высотой
до 5 м. Побеги несут редко расположенные шипы. Цветки верху¬
шечные, с сердцевидными лиловыми прицветниками. Рекомендует¬
ся для озеленения светлых помещений различного профиля.
В работах R. Swamy и соавт. (1988) описана методика клональ¬
ного размножения В. glabra. Для этого верхушки побегов сорта
В. glabra ’Trinidad* длиной 1 см культивировали на среде МС с
различными концентрациями цитокининов и ауксинов при 16-ча¬
совом фотопериоде. На среде с 4 мг/л БАП, а также 8 мг/л БАП и
4 мг/л НУК отмечали образование из пазушных почек множест¬
венных побегов, которые могли снова формировать побеги. Эту
способность изучали в течение 6,5 лет. На поверхности среза стеб¬
лей образовывался каллус. Формирующиеся многочисленные по¬
266
ГЛАВА 4. Методы размножения тропических и субтропических растений
беги часто не образовывали корней. Укоренения достигали, поме¬
щая верхушки побегов в жидкую среду МС с добавлением различ¬
ных ауксинов при использовании в качестве субстрата промытого
песка. Лучшие результаты получены в варианте с 5 мг/л ИМК.
Приживаемость растений при переносе в почву составила 77 %.
При размножении сортовых Bougainvillea верхушки побегов
растений культивировали на основной среде МС. Для их проли¬
ферации изучены комбинации 0,25—2,0 мг/л БАП или кинетина,
0,1 мг/л ИУК. Для индукции корней у формирующихся побегов
испытаны 0,5—2,0 мг/л ИМК, ИУК, НУК. Побеги вначале куль¬
тивировали 120 сут на основной среде, а затем переносили на
среду с 1 мг/л БАП и 0,1 мг/л ИУК. При этом сочетании фитогор¬
монов из каждой верхушки побега формировалось в среднем
7 побегов за 60 сут. Испытанные концентрации ауксинов укорене¬
ние не индуцировали. Однако 100%-е образование корней достиг¬
нуто в случае, когда побеги культивировали 15 сут в среде с 5 мг/л
НУК, а затем переносили на 15 сут в среду с 0,5 мг/л НУК. pH
среды во всех случаях составлял 4,5. Из каждой верхушки побега
за 1 год формировалось минимум 42 растения. Укорененные рас¬
тения хорошо переносили высадку в почву. Через год после этого
они зацветали и соответствовали по пятнистости листьев и окра¬
ске цветков исходному сорту (Sharma et al., 1988).
В ряде других работ (Sharma et al., 1981, 1988; Swamy et al.,
1988) для микроразмножения Bougainvillea использовали части
побега длиной 3 см. Побеги стерилизовали 2—5 мин в 0,1 %-м
растворе HgCl2. Питательная среда для культивирования экс¬
плантов содержала, мг/л: NH4N03 — 1500,0, KN03 — 200,0,
MgS04 — 300,0, CaClj — 400,0, KH2P04 — 160,0, тиамина — 0,5,
пиридоксина, никотиновой кислоты, биотина — по 0,1, глици¬
на — 3,0, аскорбиновой кислоты — 5,0, аденина — 15,0, сахарозы —
20 г/л, pH 4,5. Среду модифицировали добавлением БАП, ИУК,
кинетина. Адвентивные побеги регенерировали из пазушных по¬
чек на среде с 1 мг/л БАП, 0,1 — ИУК, 10 мг/л аргинина. Ризо-
генез сначала был индуцирован на среде с 0,5 мг/л НУК, а потом
концентрацию НУК повышали до 5 мг/л.
Bougainvillea можно размножить in vitro, используя экспланты
соцветий. Меристему соцветий на префлоральной стадии вычленя¬
ли и культивировали на среде с добавлением 3 % фруктозы и
0,001—1,0 мг/л ГК3 в условиях постоянного освещения. Через 2 не¬
дели определяли стадию развития меристемы. Стеблевые апексы,
индуцированные к цветению растений (постоянное освещение), об¬
267
СПЕЦИАЛЬНАЯ ЧАСТЬ
рабатывали 10 мкМ водного раствора ГК3 (150 мг/л) и через 1 —
17 сут определяли стадию их развития. Обработка ГК3 интактных
цветущих растений снижала скорость развития меристемы соцве¬
тий. Добавление ее в среду культивирования не влияло на инициа¬
цию цветков в соцветии. Полученный результат объясняется избыт¬
ком метаболитов в среде для роста и дифференциации культиви¬
руемых меристем (Chaturvedi et al., 1978; Steffen et al., 1988).
Onagraceae Juss.
К этой группе относятся маленькие деревья, кустар¬
ники и полукустарники, в основном многолетние, и однолетние
травянистые растения. Обитают во влажных лесах и аридных об¬
ластях Северной и Южной Америки, Новой Зеландии, поднимаясь
до высоты 3000 м над ур. м. В семействе 21(36) родов и 640 видов.
Fuchsia L. Известно около 100 видов, распространенных в
Мексике, Чили, Перу, Эквадоре, Новой Зеландии. Декоративные
растения, иногда имеют ампельную форму. Листья разные по фор¬
ме. Цветки разнообразной окраски и формы. Размножают черен¬
кованием, семенами и в культуре тканей.
Для микроразмножения in vitro использовали экспланты различ¬
ного происхождения: сегменты листьев, стеблей, цветков, междоуз¬
лий, верхушки побегов, черешков. Экспланты брали с цветущих
растений. Их помещали на среду МС с БАП, НУК, ИМК, ИУК,
ГК3. Индуцировать развитие удалось только у верхушек побегов и
пазушных почек. Оптимальной для развития побегов длиной 0,5—
1,0 см была среда с добавлением 1 мг/л БАП и 0,1 мг/л НУК. Уста¬
новлено, что НУК оказалась эффективней ИУК и ИМК. Из одного
побега получали 15 новых адвентивных побегов, которые укореняли
в течение 20 сут на среде с 1 мг/л ИМК. Всего размножено 18 сор¬
тов (Kever, 1983; Birngruberet al., 1988).
Orchidaceae Juss.
Перед многими современными государствами доста¬
точно остро стоит проблема сохранения аборигенной флоры. Осо¬
бую обеспокоенность вызывают Orchidaceae Juss. Большинство ви¬
дов этого обширного семейства в природе являются узкоареальны¬
ми эндемами. Их представители, как правило, имеют длительный
период онтогенеза, а популяции характеризуются низкой восста¬
навливаемостью. Сумма этих факторов в конечном итоге способст¬
268
ГЛАВА 4. Методы размножения тропических и субтропических растений
вует исчезновению или критическому состоянию орхидных in situ.
Семейство орхидных — одно из самых крупных и высокоспе¬
циализированных среди цветковых растений и, как подчеркивалось
выше, весьма уязвимо и плохо приспособлено к условиям глобаль¬
ного антропогенного прессинга. К наиболее негативным факторам
антропогенного воздействия относятся: нарушение природных мест
обитания; повышение рекреационной нагрузки; сбор растений в
природе. Отрицательную роль играют и некоторые биотические
факторы, влияние которых проявляется не прямо, а опосредованно,
например вследствие уничтожения насекомых-опылителей или хи¬
мических воздействий на грибы-симбионты (Демидов, Коломейце¬
ва, 2004).
В данной монографии краткие ботанические справки о видах
этого семейства и их номенклатуре приведены в соответствии с
A. Pridgeon (1992).
Acacallis Lindl. Представители данного рода распространены в
низинных лесах Бразилии, Венесуэлы, Колумбии. Род насчиты¬
вает всего 2 эпифитных вида.
А. cyanea Lindl. имеет овальные туберидии. Цветки до 5 см в
диаметре, очень красивой формы, редко встречающейся сине¬
фиолетовой окраски с розовым оттенком (Черевченко и др.,
2001). Размножают вегетативно, семенами и в культуре in vitro.
В условиях оранжерей НБС НАН Украины цветение А. суапеа
наблюдается в январе—феврале. Период бутонизации продолжа¬
ется 3—4 недели. Соцветие — малоцветковый колос (3—4 цвет¬
ка), хотя в литературе встречаются сообщения о том, что в соцве¬
тии может быть и 7—10 цветков (Bechtel et al., 1986; Pridgeon, 1992).
Продолжительность цветения 2,5—3 недели.
Для получения семян в наших условиях проводили искусст¬
венное опыление. Плод — трехреберная коробочка, которая со¬
зревает в течение 10—10,5 мес. Однако уже через 7 мес семена мож¬
но высевать на питательную среду. В одной коробочке их насчи¬
тывается около 400 тыс. Семена бело-кремовые, мелкие (длиной
0,4—0,6 мм, шириной 0,08—0,10 мм), без эндосперма, с хорошо
видным микропиле. Форма семян варьирует. Зародыш неразви¬
тый, мясистый, гладкий, голый, кремового цвета, каплевидной
формы, редко— продолговатый, длиной 0,14—0,18 мм и шири¬
ной 0,04—0,06 мм (Черевченко и др., 1994).
В результате проведенных микроскопических исследований
установлено, что около 30 % семян, содержащихся в одной коро¬
бочке, деформированы или совсем не имеют зародыша.
269
СПЕЦИАЛЬНАЯ ЧАСТЬ
Семена А. суапеа проращивали в культуре in vitro на модифи¬
цированной нами среде Кнудсона. Показано, что они имеют
разную скорость прорастания. В связи с этим период формиро¬
вания из семян разных морфоструктур растянут и может продол¬
жаться в течение 1 года. Так, 10—12 % семян прорастает через
2—2,5 мес после высева, 20—30 % — через 3—3,5, остальные —
через 5—6 мес и больше. Это объясняется, во-первых, тем, что
А. суапеа принадлежит к группе орхидей, для которых характерен
замедленный рост. Во-вторых, возможно, еще и тем, что опыле¬
ние было проведено в границах одного клона, что и привело к
формированию разнокачественных семян.
У прорастающих семян зародыши светло-салатовой окраски,
продолговато-яйцевидной формы, длиной 0,10—0,12 мм; они
имеют до 5 ризоидов, длина которых 0,11—0,13 мм.
В возрасте 3—3,5 мес зародыш разрывал семенную оболочку
и переходил к следующей стадии своего развития — протокорму,
который имел своеобразную дисковидную форму (диаметр 0,6,
высота 0,2 мм). На верхней части его находится апикальная ме¬
ристема, вокруг которой валиком располагается первый листопо¬
добный орган (Кушнир и др., 1988).
Еще через 2—2,5 недели протокормы, разрастаясь, приобрета¬
ли сферическую форму и достигали диаметра 0,6—0,9 мм. Они
имели верхнюю стеблевую часть с апикальной меристемой, ин¬
тенсивно нарастающим первым листом и 1—2 листовыми при-
мордиями. На нижней, базальной части располагались пучки (по
4—6 шт.) ризоидов. Затем в нижней части протокорма начинал
эндогенно развиваться первый корень, что свидетельствовало о
формировании новой структуры — проростка. Образовавшийся
корень недолговечный (существует 3—4 недели), питание и водо-
обеспечение проростка происходит за счет ризоидов.
В возрасте 6—6,5 мес на уровне первого узла формировался
зачаток первого придаточного корня в виде бугорка диаметром
до 0,5 мм. В это время растения имели по 2 листа длиной от 1,2
до 3 мм, зачаток третьего листа и апикальную меристему.
Первая боковая почка закладывалась в виде апикальной ме¬
ристемы в пазухе четвертого (редко третьего или пятого) листа в
возрасте 8—9 мес.
В дальнейшем у сеянцев последовательно происходили за¬
кладка, дифференциация и рост листьев, пазушных почек и при¬
даточных корней. В конце первого года жизни сеянцы достигали в
длину 25—30 мм, имели 5—6 листьев длиной 20—28 мм, 2 пазуш¬
ные почки, 5—10 придаточных корней длиной до 20 мм. В этом
270
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.46. Сеянцы Acacallis cyanea Lindl. перед высадкой в субстрат
возрасте сеянцы А. суапеа высаживали в сфагновый мох и пере¬
носили в оранжерею (рис. 4.46) (Ковальская и др., 1999).
В апреле—мае побег первого порядка сбрасывал листья и 2—
3 недели находился в состоянии относительного покоя. Затем из
второй боковой почки начинал развиваться побег второго поряд¬
ка ветвления, формирование которого продолжалось 4—5 мес. Со
временем, на протяжении этого же года, мы наблюдали второй
период относительного покоя у сеянцев А. суапеа.
В сентябре побеги второго порядка ветвления сбрасывали ли¬
стья и растения около 2 недель пребывали в периоде покоя. В
дальнейшем, как правило, из первой почки на побеге второго
порядка развивался побег третьего порядка, который также фор¬
мировался на протяжении 4—5 мес. В это время полностью от¬
мирал побег первого порядка. Таким образом, в конце декабря —
начале января сеянцы А. суапеа состоят из 2 побегов.
Изучая начальные этапы развития А. суапеа, мы установили,
что из семян в течение 17—19 мес (иногда этот период продол¬
жается 2 года и больше) через стадии протокорма и проростка
развивается побег первого порядка. Формирование побегов двух
последующих порядков ветвления длится значительно меньше —
271
СПЕЦИАЛЬНАЯ ЧАСТЬ
4—5 мес, т. е. побеги второго и третьего порядков могут развиваться
на протяжении 1 года. Следует отметить, что развитию каждого из
этих побегов предшествует период относительного покоя, который
длится 2—3 недели. Многолетние наблюдения за экземплярами
А. суапеа в оранжерее позволили установить, что для взрослых рас¬
тений данного вида также характерно наличие периода покоя в го¬
дичном цикле развития. Однако в отличие от ювенильных расте¬
ний этот период только один и по времени прохождения полно¬
стью совпадает с первым периодом покоя у сеянцев.
Angraecum Вогу. Род насчитывает более 200 эпифитных и на¬
земных видов. Моноподиальные высокие (до 1,5 м) растения с
мощными корнями.
A. sesquipedale Thou — эпифиты больших размеров, распро¬
странены на о-ве Мадагаскар. Цветки крупные (до 20 см), звезд¬
чатые, со шпорцем, до 50 см в длину.
A. eburneum Вогу — эпифиты или наземные крупные растения
с мощными воздушными корнями. Цветки белые, до 10 см в
диаметре.
Виды Angraecum размножают вегетативно, семенами и в куль¬
туре тканей. Семена этих видов мы получали, опыляя растения в
оранжерее. Плод — крупная коробочка. Семена на питательной
среде Кнудсона начинали прорастать не ранее, чем на 32-е сутки
(табл. 4.14). Еще через 2 недели формировались типичные для ор¬
хидей протокормы. На начальных этапах развития сеянцев функ¬
цию поглощения питательных веществ из среды выполняют ри¬
зоиды. Они представляют собой выросты эпидермальных клеток,
которые расположены, как правило, в базальной части прото¬
корма. В середине есть слой клеток, меньших по размеру, ком¬
пактной формы и с большими ядрами, что указывает на их вы¬
сокую метаболическую активность. Вероятно, эти клетки выпол¬
няют особую роль в активных транспортных процессах.
Таблица 4.14. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Angraecum, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
A. eburneum Вогу
32
150
240
A. modestum Hook.f.
90
203
285
A. sesquipedale Thou
34
210
274
A. sanderianum Rchb.f.
91
205
427
272
ГЛАВА 4. Методы размножения тропических и субтропических растений
В процессе дальнейшего адаксиального роста образовывался
проросток с характерным для Angraecum гребнем. Первый на¬
стоящий лист развивался через 30 недель. В этот период наблю¬
далось почкование первичного протокорма, который разрезали
на части и каждую культивировали отдельно, что позволяло уве¬
личить количество сеянцев в 6—7 раз. Семена высевали на пита¬
тельные среды — МС и модифицированную нами среду Кнудсо¬
на. Однако замена в средах КН2Р04 на К2НР04 приводила к уве¬
личению количества витрифицированных растений. В то же вре¬
мя растения с нормальной морфологией отличались более яркой
зеленой окраской и крупными размерами. Добавление к среде
МС 0,5 мг/л НУК, 0,2 мг/л 2,4-Д и 200 мг/л гидролизата казеина
способствовало образованию большого количества протокормов
и растений (рис. 4.47, см. вклейку).
Листовая пластинка сеянцев характеризуется типичным анато¬
мическим строением и отличается слабым развитием межклеточных
пустот мезофилла. Через 1 год после высева семян сеянцы имеют
2 листа, в пазухах которых можно обнаружить пазушные почки.
Впоследствии в базальной части сеянцев эндогенно закладыва¬
ется корень с характерным для орхидей строением. Веламен корня
имеет 2—4 слоя клеток, иногда склерифицированных, как у
A. sesquipedale', у A. eburneum веламен состоит из 2—3 слоев нескле-
рифицированных клеток. Клетки экзодермы одинаково утолщены
со всех сторон. В то же время для большинства видов характерно
утолщение боковых стенок клеток и тех из них, что примыкают к
веламену. Пневматоды у видов Angraecum не выявлены. Клетки
внешнего слоя веламена имеют типичную пятигранную форму.
Наибольший объем занимают округлые клетки паренхимы, размер
которых к центру корня уменьшается. При образовании корней
второго и третьего порядков базальная часть сеянцев усыхает. Ус¬
тановлено, что клетки корней содержат хлоропласты.
Сеянцы A. eburneum морфологически более идентичны, чем
сеянцы A. sesquipedale (рис. 4.48, см. вклейку), 95 % из них не
имеют морфологических отклонений (Буюн и др., 2002).
Постасептическая адаптация этих видов проходит без особых
осложнений. В качестве первичного субстрата использовали сфаг¬
новый мох. В дальнейшем сеянцы высаживали в субстраты, реко¬
мендуемые для выращивания эпифитных орхидных (рис. 4.49,
см. вклейку).
Anoectochilus Blume. Циклы развития семян A. dawsonianus Low.
и A. mxburgii (Wall.) Lindl. несколько отличаются. Так, семена A. daw-
273
СПЕЦИАЛЬНАЯ ЧАСТЬ
sonianus начинают прорастать на 57-е, A. roxburgii — на 74-е сутки
(рис. 4.50). В то же время формирование проростков у A. roxburgii
проходит в 2 раза быстрее, нежели у A. dawsonianus. Соответст¬
венно этому и в субстрат данный вид высаживают раньше, чем
A. dawsonianus (рис. 4.51).
х Aranda — гибрид Arachnis х Vanda. Культивируется в Малай¬
зии, Сингапуре, Таиланде. Размножают в культуре in vitro. В дос¬
тупной нам литературе, к сожалению, мы обнаружили сравнитель¬
но небольшое количество сообщений о клональном или семенном
размножении in vitro. Из-за отсутствия этих гибридов в коллекции
отдела опыты по их культивированию мы не проводили.
Данный гибрид можно размножать in vitro с использованием
различных частей растений в качестве эксплантов (табл. 4.15).
Например, можно вычленять апикальную меристему и культиви¬
ровать ее на питательной среде.
Для этого молодой побег делили на части так, чтобы каждая
имела по 1 почке. Листья удаляли и вырезали апикальную и па¬
зушные почки. После стерилизации из почек вычленяли экс¬
планты длиной 4 мм с апексом и помещали в жидкую питатель¬
ную среду Вацина—Вента с 0,3 мг/л НУК, 1,25 мг/л БА и 15 %
кокосового молока. На этой среде через 7 недель происходила
дифференциация сначала раневого каллуса, а потом и протокор¬
мов (Goh et al., 1975; Loh et al., 1975). Для образования побегов
использовали твердую среду с 3 мг/л глицина и 2 мг/л пептона.
Для культивирования таких эксплантов можно также использо¬
вать среду Уайта с 2 г/л пептона и 15 % кокосового молока; че¬
рез 2 мес они увеличивались в размерах и приобретали сфериче¬
скую форму. Протокормы регенерировали через 3 мес. В даль¬
нейшем их размножение проводили в жидкой среде. Получен¬
ные протокормы делили и переносили на твердую среду Кнуд¬
сона, где они формировали растения. Через 9 мес культивиро¬
вания растения имели высоту 6—7 см и 2—3 корня. Развитие па¬
зушных почек начиналось на среде Вацина—Вента через 3 мес
с момента введения в культуру. Через 4 мес они регенерирова¬
ли протокормы, а потом и растения. К сожалению, при таком
методе размножения получить большое количество растений
не удается.
В качестве эксплантов для размножения Aranda можно ис¬
пользовать листья сеянцев и растений-регенерантов. Сегменты
листьев длиной 5 мм вырезали и помещали в жидкую среду
Вацина—Вента с 15 % кокосового молока. Протокормы форми-
274
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.50. Проростки Anoectochilus roxburgii (Wall.) Lindl.
Рис. 4.51. Сеянцы Anoectochilus dawsonianus Low.
ровались только после 12 недель выращивания из эпидермальных
слоев. Размножение протокормов осуществляли в жидкой среде;
растения образовывались на твердой через 14 недель культивиро¬
вания (Sagava et al., 1982; Manorama et al., 1986).)
275
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.15. Состав питательных сред, используемых
для культивирования различных видов Aranda, мг/л
Компонент
Культивирование эксплантов
Размножение
протокормов
Укоренение
растений’1
Апекс
Сегменты листьев
сеянцев
взрослых
растений
(NH4)2so2
500,0
500,0
400,0
Са3(Р04)2
200,0
—
200,0
—
—
MgS04 7Н20
250,0
—
250,0
250,0
370,0
КН2Р04
250,0
170,0
250,0
100,0
170,0
KNO,
525,0
1900,0
525,0
—
1900,0
Fe,(C4H406), • 2Н20
28,0
—
—
—
—
MnS04 4Н20
7,5
22,3
7,5
7,5
22,3
nh4no,
—
1650,0
—
—
—
СаС12 2Н20
—
440,0
—
—
440,0
MgS04 7Н20
—
370,0
—
—
—
№2ЭДТА
—
37,3
—
37,3
37,3
FeS04 7Н20
—
27,8
—
27,8
27,8
н,во,
—
6,2
—
1,0
6,2
СоС12 6Н20
—
0,025
—
—
0,025
CuS04 5Н20
—
0,025
—
0,03
0,025
KI
—
0,83
—
1,0
0,83
Na2Mo04 2Н20
—
0,25
—
—
0,25
ZnS04 4Н20
—
8,6
—
1,0
8,6
Fe,(C4 Н406)3 • 2Н20
—
—
28,0
—
—
Ca(N03)2 4Н20
—
—
—
400,0
—
А1С13
—
—
—
0,03
—
nh4no3
—
—
—
—
1650,0
Никотиновая кислота
0,25
—
—
5,0
Тиамин
—
1,0
—
—
1,0
Пиридиксин
—
0,25
—
—
—
Кокосовое молоко*2
200,0
150,0
150,0
—
—
Гомогенат банана
—
—
—
75 000,0
—
Глицин
—
1,0
—
—
2,0
Инозит
—
100,0
—
—
100,0
2,4-Д
—
2,0
—
—
1,5
БА
—
2,0
—
—
1,25
НУК
—
—
—
0,3
Аденин
—
—
—
—
40,0
Сок ананаса *2
—
—
—
150,0
150,0
Сахароза
20 000,0
30 000,0
—
20 000,0
20 000,0
*' Среда МС (1974); остальные этапы проводили на среде Вацина—Вента.
*2 В миллилитрах на 1 л.
276
ГЛАВА 4. Методы размножения тропических и субтропических растений
Также проводили опыты по использованию листьев взрослых
растений. Для этого вычленяли сегменты молодых листьев (1 —
3 см в длину и 0,5 см в ширину). Экспланты помешали в жидкую
среду МС с 40 мг/л аденина и 15 % кокосового молока, на кото¬
рой они регенерировали протокормы. Размножение протокормов
и формирование растений осуществляли на твердой среде Ваци¬
на—Вента или Кнудсона с гомогенатом банана (75 г/л) (Cheah et
al., 1978; Hew et al., 1989).
В Сингапурском ботаническом саду проведены эксперименты
по размножению видов Aranda с использованием пазушных по¬
чек и сегментов листьев. Весь процесс был разделен на три эта¬
па. На первом этапе использовали жидкую среду Вацина—Вента,
в которой проходила пролиферация каллуса и протокормов. Про¬
токормы размножали на среде МС — это второй этап. На треть¬
ем этапе их переносили на твердую среду Кнудсона для образо¬
вания растений. К недостаткам этого способа следует отнести
низкий процент образовавшихся растений (Vajrabhaja et al., 1976;
Fu Fan, 1979). В литературе встречаются сообщения о том, что
виды Aranda могут быть размножены также по методикам, при¬
меняемым для видов Arachnis.
х Aranthera — межвидовой гибрид. Встречается в Индонезии,
Сингапуре, Таиланде. Используется как коммерческая промыш¬
ленная культура для продажи цветов на срез.
Впервые метод массового клонального размножения был раз¬
работан в Индонезии. В качестве эксплантов использовали апи¬
кальные и пазушные почки молодых побегов. Из частей стебля
вырезали почки размером 0,5 х 0,5 х 0,3 мм, помещали в жидкую
среду Кнудсона и содержали 3 недели в темноте. Сформировав¬
шиеся протокормы отделяли и размножали на твердой или в
жидкой среде Вацина—Вента с гомогенатом банана (50 г/л). На
этой же среде проходила и регенерация побегов (Alang, 1975).
Для размножения Aranthera в качестве первичных эксплантов
также использовали меристемы апикальных почек. Для этого под
микроскопом вычленяли апексы с 3—4 листовыми примордиями.
Их помещали в жидкую среду Вацина—Вента с 15 % кокосового
молока и 5 % гомогената банана. Образовавшиеся протокормы
размножали в той же среде, но без сахарозы. Побеги и корни об¬
разовывались на агаризированной среде (Cheah et al., 1978).
Наблюдения показали, что растения Aranthera, так же, как и
Cymbidium, содержат вирусы. Поэтому для микроразмножения
использовали апексы небольшого размера (0,5—1,0 мм) с 2 лис¬
277
СПЕЦИАЛЬНАЯ ЧАСТЬ
товыми примордиями. Такие апексы развивались и росли очень
медленно. В среде Вацина—Вента с 15 % кокосового молока пер¬
вые протокормы образовались только через 10 мес. Следует отме¬
тить большой процент контаминации, наблюдаемый при выра¬
щивании. В основном это бактериальная инфекция. Ее можно
удалить, если повторно простерилизовать эксплант в 15%-м пе¬
роксиде водорода. Размножение полученных протокормов лучше
проходило на среде без сахарозы. Необходимым условием успеш¬
ного культивирования и развития эксплантов было добавление в
состав среды от 50 мг до 1 г/л активированного угля. После 11 мес
культивирования только 3 экспланта из 10 формировали протокор¬
мы. Остальные были либо поражены бактериями, либо погибли, не
начав развиваться. Обязательным условием дальнейшего успешного
массового размножения является тестирование на наличие виру¬
сов в образовавшихся первичных протокормах. С целью получе¬
ния оздоровленных растений Aranthera для массового размноже¬
ния следует отбирать только те клоны, которые не содержат ви¬
русных частиц (Irawati et al., 1974; Lim-Ho et al., 1981).
Arundina Blume. Известно около 10 наземных видов, распро¬
страненных в Индии, Юго-Восточной Азии. Крупные растения с
жесткими стеблями, напоминающими тростник.
Семена A. bambusifolia Lindl. высевали на питательную среду
Рагхавана—Торри, на которой они проходили все стадии развития,
образуя сеянцы. Когда сеянцы достигали 8—10 см в высоту, их
использовали как вторичные экспланты. Стебель резали на сег¬
менты длиной 6—8 мм, каждый из которых имел пазушную поч¬
ку. Из верхушки побега вычленяли апикальную меристему. Ли¬
стья разрезали на сегменты размером 0,5 мм—1 см. На этой же
среде с добавлением 1 г/л пептона, 15 % кокосового молока поч¬
ки регенерировали побеги. Следует отметить, что образование
корней проходило только после развития листьев (Mitra, 1971).
Другие авторы размножали A. bambusifolia в культуре in vitro с
использованием эксплантов взрослых растений и сеянцев. Ис¬
следовано влияние питательных сред и дополнительных компо¬
нентов на рост и развитие различных по происхождению экс¬
плантов. Основу сред, используемых для микроразмножения, со¬
ставляли макро- и микроэлементы сред Вацина—Вента и Рагха¬
вана—Торри.
Установлено, что верхушки побегов сеянцев (длиной до 0,5 мм)
на среде Вацина—Вента с 0,5 мг/л НУК, 0,2 мг/л кинетина,
200 мл/л кокосового молока и 35 мл/л томатного сока вначале
278
ГЛАВА 4. Методы размножения тропических и субтропических растений
дифференцировали протокормы, а потом и побеги. Сегменты ли¬
стьев сеянцев (их базальные части) на среде Вацина—Вента с
0,3 мг/л ИУК, 0,2 — НУК, 1,5 — 2,4-Д, 1,25 мг/л БА и 150 мл/л
кокосового молока в течение 3 мес также регенерировали прото¬
кормы. Их разделяли и культивировали на среде Кнудсона, на
которой они образовывали растения.
Для регенерации протокормов и побегов использовали в ка¬
честве эксплантов сегменты побегов сеянцев с пазушными поч¬
ками. К среде Рагхавана—Тори добавляли: по 25—50 мг/л моче¬
вины и РНК, по 200 мг/л гидролизата казеина и дрожжевого экс¬
тракта, 1 г/л пептона и 10—20 % кокосового молока. Установлено,
что все эти компоненты положительно влияли на образование про¬
токормов, формирование листьев, регенерацию побегов и их укоре¬
нение. Множественное образование побегов отмечено при вне¬
сении пептона и кокосового молока. Добавление гидролизата ка¬
зеина, РНК и кокосового молока стимулировало корнеобразова-
ние. Формирование протокормов лучше проходило на среде с
пептоном, мочевиной, кокосовым молоком (Banik et al., 1986).
A. graminifolia (D.Don) Hochr. — большие наземные растения
с листьями, похожими на листья злаков. Самая распространен¬
ная орхидея Юго-Восточной Азии. Этот вид размножают вегета¬
тивно и в культуре тканей так же, как и A. bambusifolia (Черев¬
ченко и др., 2001).
Bletilla Rchb.f. Род насчитывает 8—10 наземных видов, рас¬
пространенных в Восточной Азии, на о-ве Тайвань.
B. striata (Thunb.) Rchb.f. — наземные растения, произра¬
стающие в Японии, Китае, Вьетнаме. Псевдоклубни подземные.
Листья ланцетные, 30 см в длину. Цветки до 4 см в диаметре,
фиолетовые, с запахом.
Сообщений о размножении В. striata в культуре in vitro чрез¬
вычайно мало. Изучению побеговой системы этого вида посвя¬
щены работы М.Н. Тихоновой (1971). Подбор питательных сред
для проращивания семян и получения сеянцев В. striata был вы¬
полнен японскими учеными. Они изучали влияние баланса ка¬
тионов (NH4, К, Са, Mg) и анионов (N03, H2P04, S04) в пита¬
тельной среде на развитие сеянцев, а также определяли сырую
массу, высоту сеянцев и процент всхожести. При 10 % Mg2*
всхожесть варьировала от 32 до 71 %, при наличии NH4 — от¬
сутствовала, при 90 % N03 и Р04 — составляла 5—35 %. Таким
образом, в состав оптимальной питательной среды для развития
279
СПЕЦИАЛЬНАЯ ЧАСТЬ
сеянцев В. striata входят: Ca(N03)2 — 826 мг/л; KN03 — 747 мг/л;
NH4, Н2Р04 — по 391 мг/л; микроэлементы по Мурашиге—Ску¬
гу; сахароза — 20 г/л; агар — 10 г/л (Yamaki, 1989).
Для микроразмножения В. striata можно применять и другие
методы. Некоторые исследователи предлагают использовать в ка¬
честве эксплантов части сеянцев, выращенных in vitro. Например,
кончики корней 6-месячных сеянцев длиной 1,5 мм. Сеянцы бы¬
ли получены на среде Кнудсона с 20 % кокосового молока, сег¬
менты корней культивировали на 1/2 концентрации среды МС.
Сначала формировался каллус, а затем, на протяжении 7 мес,
многочисленные побеги, которые переносили на среду Кнудсона
для укоренения.
Кроме того, в качестве эксплантов можно использовать также
кусочки побегов сеянцев длиной 1 см с латеральными почками.
Первичный рост таких сегментов получали на среде Кнопа, а
укоренение сформировавшихся побегов — на среде Кнудсона.
Время размножения — 6 мес (Yam et al., 1991).
х Brassolaeliocattleya — сложные гибриды, полученные в ре¬
зультате скрещивания в различных комбинациях видов из родов
Brassavola R.Br., Laelia Lindl., Cattleya Lindl. Размножают вегета¬
тивно или клонально. Методики клонального размножения и пост-
асептической адаптации такие же, как и для представителей ис¬
ходных родов.
Calanthe R.Br. Род включает от 40 до 120 видов, распространен¬
ных в Тропической Азии, Индонезии и Австралии. Некоторые про¬
израстают в Южной Африке, Китае, Японии, на о-ве Мадагаскар.
Большинство — наземные растения, немногие — эпифиты.
С. vestita Lindl. имеет туберидии высотой до 20 см и диаметром
3—4 см, яйцевидно вытянутые, покрытые серой пленкой. Листья
мягкие, продольно-складчатые, длиной до 20 см. Цветонос до
50 см длиной, соцветие — многоцветковая кисть (10—25 цветков).
Околоцветник белый, губа трехлопастная, волнистая по краю, бе¬
ло-розовая, с розовым пятном у основания. Опыление искусст¬
венное. Плод — удлиненная матовая опушенная коробочка дли¬
ной до 25 мм и шириной 15 мм. Созревает в течение 2—3 мес.
Размножается в местах естественного произрастания семенами,
вегетативно (в оранжерее) — отделенными туберидиями, в услови¬
ях умеренного климата — культурой тканей (семенное и клональ¬
ное размножение).
Для высева использовали семена С. vestita var. alba и С. vestita var.
rosea репродукции НБС. Масса семян одного плода составляет 25—
280
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.16. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Calanthe, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
С. vestita var. alba
45
157
359
С. vestita var. rosea
27
69
157
С. rubens Ridl.
94
250
400
100 мг, количество семян — более 2000 тыс. шт. Семена имеют
прозрачную сетчатую оболочку и быстро теряют всхожесть. Наши
исследования показали, что цикл развития сеянцев каланты за¬
висит от многих причин. Так, у С. vestita var. alba он составляет
330 сут, у С. vestita var. rosea — 160 сут, т. е. в 2 раза быстрее
(табл. 4.16).
Кроме того, одними из решающих факторов, влияющих на
рост сеянцев, являются разнокачествен ность семян в плодах,
расположение плодов на разных ярусах цветоноса. Установлено,
что масса семян в плодах первого яруса в 1,2—2 раза больше, чем
в плодах второго яруса и в 1,3—2,5 раза больше, чем в плодах по¬
следнего яруса. Количество семян с зародышами в плодах ниж¬
него яруса (1—2-я коробочка) больше, чем в плодах верхнего (5—
8-я коробочка). Даже в одной коробочке качество семян различ¬
но: в центре плода больше семян без зародышей, а ближе к стен¬
ке коробочки — семян с зародышами. Меняется качество семян
и по длине самого плода: процент семян с зародышами в центре
плода выше, чем на его концах. Полученные результаты объяс¬
няют колебания в сроках прорастания семян Calanthe разных сро¬
ков высева.
Свежесобранные семена всходят в основном через 1 мес, но в
отдельных случаях — и в течение 10 сут (рис. 4.52, см. вклейку).
Семена увеличиваются в размерах (набухают), образуя зеленые
шаровидные протокормы, на которых в последующем появляют¬
ся всасывающие волоски (ризоиды). Через 2—3 мес формируются
маленькие туберидии с 2—3 листьями в верхней части и корнями
в нижней. Через 5—6 мес сеянцы могут быть высажены в суб¬
страт.
Необходимо отметить, что сеянцы С. vestita так же, как и
взрослые растения, имеют период покоя (KyuiHip, 1979; Черев¬
ченко и др., 1980). В начале декабря (независимо от времени вы¬
сева) листья у сеянцев начинают темнеть, потом становятся су¬
281
СПЕЦИАЛЬНАЯ ЧАСТЬ
хими и отмирают, в то же время туберидии остаются зелеными.
Через 3,5 мес у основания туберидия начинает развиваться почка
возобновления, образуя новые растения. В культуре in vitro сеян¬
цы Calanthe могут находиться в течение нескольких лет (KyuiHip
та iH., 1979). Высаживать сеянцы необходимо до начала появле¬
ния новых побегов, лучше всего в период покоя.
Рост и развитие сеянцев Calanthe зависит от состава пита¬
тельной среды. Мы использовали среды Кнудсона (наша моди¬
фикация), Прасада—Митры и Кнудсона с 10 % кокосового моло¬
ка. Установлено, что прорастание семян на всех средах начина¬
лось в одно и то же время. Однако в дальнейшем рост сеянцев
был различным. Так, добавление витаминов и кокосового молока
угнетало их рост. В то же время на среде Кнудсона уже через
2 мес образовались протокормы с ризоидами и первым листом.
На средах с кокосовым молоком и витаминами формирование
ризоидов и листьев тормозилось. Наилучшие результаты получены
на среде Кнудсона с пептоном, гуматом калия и активированным
углем (среда КПГУ). Высота сеянцев на этой среде достигала
1,5—2,0 см, они имели 2—3 листа и корни. Через 6 мес сеянцы
сформировали туберидии и были готовы перейти в состояние
покоя (Черевченко и др., 1982).
Рост сеянцев С. vestita var. alba был несколько иным. Значи¬
тельно увеличился период прорастания семян (до 45 сут) и обра¬
зования растений (150—160 сут). Сеянцы можно было высажи¬
вать в субстрат только через 300—350 сут (Черевченко и др.,
1986). Не улучшался их рост и при добавлении к среде гомогена¬
та банана. Развитие сеянцев тормозилось, некоторые растения
были витрифицированными (Karasawa, 1966).
Попытки обработки семян С. discolor Lindl. ультразвуком так¬
же не дали ощутимых результатов (Migoshi et al., 1988).
Разработанный нами метод семенного размножения Calanthe
можно применять и для других видов этого рода.
Сведения о методе клонального размножения Calanthe очень
скудны. Некоторые авторы использовали технологию по размноже¬
нию Cymbidium (Morel, 1964). В литературе также приведен метод
размножения С. discolor с помощью протопластов мезофилла листа
сеянцев. Кроме того, описана методика выделения протопластов и
состав среды для их культивирования (Yasugi et al., 1986).
Catasetum Kunth. Род насчитывает свыше 50 эпифитных ви¬
дов, произрастающих в тропиках Центральной Америки с цент-
282
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.53. Проростки Catasetum russelНапит Hook.
ром видового разнообразия в Бразилии. Имеют интересное при¬
способление к опылению: на колонке мужского цветка форми¬
руются 2 чувствительные антенны — щетинки, которые при при¬
косновении к ним “выбрасывают” пыльцу, прилипающую к на-
секомым-опылителям. Виды этого рода — одни из наиболее инте¬
ресных оранжерейных культур. Размножают вегетативно и в куль¬
туре in vitro.
Семена С. russellianum Hook, были получены нами по делек-
тусному обмену из ботанического сада в Кью. Высев проводили
на среду Кнудсона. Образование протокормов было отмечено на
49-е сутки (рис. 4.53), образование растений — на 131-е сутки с
момента высева. По истечение 255 сут растения готовы к высадке
в субстрат.
Виды и гибриды Catasetum размножают in vitro, используя се¬
янцы как вторичные экспланты. Для этого из сеянцев высотой
6—7 см, растущих in vitro, вычленяли сегменты (кончики корней)
Длиной 1,5 мм и помещали на различные по составу питательные
среды. Основу этих сред составляли минеральные соли по Кнуд-
сону. Сегменты корней хорошо росли на средах, содержащих
г/л пептона, 5 мг/л НУК, 150 мл/л кокосового молока, 5 мг/л
тиамина. На среде этого состава были получены первичные про¬
283
СПЕЦИАЛЬНАЯ ЧАСТЬ
токормы, которые разрезали и субкультинировали на среде, со¬
держащей только тиамин (Fuchs, 1987; Chase et al., 1990). Регене¬
рация побегов из протокормов и каллуса проходил^ на среде
Кнудсона с тиамином, пептоном и кокосовым молрком, но без
НУК. Укоренение полученных растений проводили на среде Кнуд¬
сона без гормонов (Kerbauy, 1984).
Cattleya Lindl. Виды рода распространены в Центральной и
Южной Америке, в Андах и лесах Бразилии. Род насчитывает
65 видов. Cattleya встречаются во влажных джунглях Амазонки,
где растут как эпифиты, и в Андах, где температура может опус¬
каться ниже 0 °С. В связи с этим растения обладают широким
разнообразием типов и морфоструктур. Изысканная красота
цветков Cattleya делает ее королевой орхидей (Черевченко и др.,
2001).
Это эпифиты или литофиты с ползучим корневищем, на ко¬
тором находятся разные по форме и размерам псевдоклубни.
Цветки яркие, до 20 см в диаметре. Широко известны гибриды
каттлеи с представителями других родов орхидей (х Laeliocattleya,
х Brassocattleya, х Brassolaeliacattleya и др.).
Повышенный интерес к изучению этого рода связан с высо¬
кой декоративностью соцветий и возможностью использовать
виды рода в селекции (Withner, 1988). Кроме того, значительное
количество видов, представленных в колекции НБС НАН Ук¬
раины, являются узколокальными эндемами, требующими изуче¬
ния с целью их сохранения ex situ.
Эксперименты по разработке метода семенного размножения
Cattleya в культуре in vitro начали с получения семян. Для этого ис¬
кусственно опыляли цветки в оранжерее. К сдерживающим факто¬
рам в проведении исследований следует отнести достаточно долгий
период созревания плодов, что совсем не гарантирует получение
жизнеспособных семян. Так, плоды С. mossiae Hook, созревали
почти целый год, однако большинство семян не имело зароды¬
шей. Виды, задействованные в исследованиях, приведены ниже.
С. aclandiae Lindl. произрастает в Бразилии в штате Байя
(Bechtel et al., 1986). В природе встречается очень редко, растет
на деревьях на высоте 3—6 м над землей. Псевдоклубни цилинд¬
рические, образуют плотные группы; на верхушке имеется 2—
3 мясистых кожистых пятнистых листа. Цветки зеленые или жел¬
товатые, покрыты пятнами. Размножают вегетативно делением
клона, семенами и в культуре тканей.
284
ГЛАВА 4. Методы размножения тропических и субтропических растений
С. bicolor Lindl. произрастает в Бразилии в штате Минае-
Жейрас. В соцветии около 10 ярких цветков (до 10 см в диамет¬
ре). Лепестки мясистые, от светло-зеленого до медно¬
коричневого цвета. Губа малиновая, с белой окраской по краю.
С. bowringiana Veitch — литофитный вид, произрастающий в
Гватемале. Туберидии удлиненные. Листья кожистые, до 20 см в
длину. Соцветие — кисть с 5—20 цветками. Цветки до 5 см в
диаметре, темно-пурпурные.
С. forbesii Lindl. распространена на побережье двух штатов
Бразилии. Туберидии тонкие, листья кожистые. Цветки до 11 см
в диаметре, лепестки зелено-желтые. Губа охватывает колонку со
всех сторон.
С. granulose Lindl. — эпифит, произрастающий в Бразилии.
Псевдоклубни цилиндрические, тонкие. Соцветия до 25 см в вы¬
соту, несут до 9 мясистых цветков с запахом. Лепестки зеленова¬
тые, с пятнами сиреневого цвета.
С. intermedia Graham ex Hook. — эпифит. Ареал расположен
на территории Парагвая, Уругвая и Бразилии. Туберидии тонкие,
удлиненные. Соцветие несет до 9 цветков. Лепестки тонкие, с пур¬
пурными пятнами на концах.
С. percivaliana (Rchb.f.) O’Brien — литофит, произрастающий в
Венесуэле. Туберидии гладкие. Цветки до 10 см в диаметре, яр¬
кие, окрашены в сиреневые тона.
В результате проведенных нами исследований установлено,
что семена всех изучаемых видов Cattleya имеют значительно
меньшие размеры, чем семена межродовых гибридов Brassolaelio-
cattleya. Так, длина семени у С. aclandiae варьирует от 470 до
660 мкм, ширина — от 59 до 103 мкм, тогда как у гибридов эти
показатели составляют 690—820 и 88—118 мкм соответственно.
Как и у большинства орхидей, зародыш С. aclandiae представ¬
ляет собой округлое образование, состоящее из нескольких де¬
сятков недифференцированных клеток, эндосперм отсутствует.
Семенная оболочка сетчатая, темного цвета, непрозрачная, по¬
этому зародыш различим с трудом.
Прорастание семян начинается с развития недифференциро¬
ванного зародыша, длина которого через неделю после высева,
как правило, не превышает 235 мкм, а на 9-е сутки он увеличи¬
вается приблизительно вдвое. На 14—16-е сутки оболочка семени
разрывается, размер протокормов составляет 1 мм. На ранних
этапах развития они имеют шаровидную форму и состоят из не¬
дифференцированных паренхимных клеток, которые окружены
однослойной эпидермой. В это же время наблюдается образова¬
285
СПЕЦИАЛЬНАЯ ЧАСТЬ
ние всасывающих волосков, которые, по нашему мнению, явля¬
ются эпидермальными выростами (Arditti, 1982). В начале своего
развития протокормы окрашены в молочно-белый цвет, несколь¬
ко позже приобретают ярко-зеленую окраску, что свидетельству¬
ет о раннем образовании и развитии фотосинтетической системы
(Sheehan, 1983). Они имеют неоднородную консистенцию: верх¬
няя часть значительно уплотнена, ярко-зеленая, в то время как
нижняя — почти прозрачная. Это, на наш взгляд, можно объяс¬
нить тем, что в зародыше имеется два типа клеток, которые раз¬
личаются своими размерами. После высева на питательную среду
мелкие клетки начинают активно делиться, образуя меристима-
тически активный слой ткани, в то время как объем больших по
размеру клеток увеличивается, не делясь. Вследствие этого про¬
токормы приобретают грушевидную форму.
На 90—100-е сутки культивирования протокорм увеличивает¬
ся в 10 раз. На этом этапе начинается процесс дифференциации
и формирования проростка. В субэпидермальном слое возникает
меристематический центр, который на первых этапах состоит из
небольшой группы клеток. При дальнейшем развитии на прото¬
корме можно выделить две зоны. Апикальная зона имеет мелкие
слабовакуолизированные клетки с густой цитоплазмой, которые
активно делятся. Эта зона занимает приблизительно 1/3 прото¬
корма.
Клетки апикальной зоны содержат кристаллы оксалата каль¬
ция — рафиды. Разные исследователи объясняют их функции по-
разному. Мы установили, что рафиды находятся во всех активно
растущих частях проростков орхидей на всех этапах их роста и
развития, начиная с набухания семян. Мы поддерживаем мысль
В.А. Поддубной-Арнольди о том, что рафиды являются местом
отложения энергетических и строительных веществ, которые всту¬
пают в реакции обмена.
Наиболее крупные клетки базальной части занимают 2/3 про¬
токорма, содержат большое количество крахмала и выполняют
запасающую функцию.
Некоторые исследователи считают, что органогенез начинает¬
ся после того, как протокорм достигнет “критической массы”
(Шевцова и др., 1986). Однако проведенные нами исследования
убеждают в том, что этот термин не следует понимать дословно,
поскольку протокормы разных видов орхидных в фазе диффе¬
ренциации апекса побега могут значительно различаться линей¬
ными размерами. Вероятно, определяющим фактором является
286
ГЛАВА 4. Методы размножения тропических и субтропических растений
суммарное количество клеток, в том числе и клеток, которые
входят в меристематический центр. Они могут иметь разные раз¬
меры, однако их количество одинаково на этом этапе органоге¬
неза. В процессе образования многовершинного протокорма ре¬
шающими факторами служат экзогенный уровень и распределение
фитогормонов. Сильное увеличение размеров такого протокор¬
ма — явление вторичное. Эту гипотезу подтверждает возрастание
количества многовершинных протокормов при экзогенном вне¬
сении регуляторов роста (цитокининов) в питательную среду.
На относительно простой питательной среде Кнудсона такие
протокормы составляют 12 %, а на сложной среде МС их втрое
больше, что свидетельствует о тенденции к вегетативному раз¬
множению, которое, в свою очередь, может происходить не¬
сколькими способами.
В ходе дальнейшего роста протокорма и проростка диффе¬
ренцируются листовые примордии и развивается проводящая
система. Формирование первого листа было отмечено нами толь¬
ко через 2 мес после высева. Закладка листьев начинается на 19—
20-й неделе культивирования, когда проросток достиг 2 см в
длину. Листовая пластинка узкая, трубчатой формы. Листья за¬
кладываются в форме замкнутого валика. На 30-й неделе после
высева закладывается второй лист.
В дальнейшем развитие растений происходит за счет последо¬
вательной закладки и роста листьев следующего порядка и функ¬
ционирования одной апикальной меристемы. Первый корень за¬
кладывается эндогенно на 45—47-й неделе культивирования в
пазухе второго и третьего листьев, следующие — выше и ниже
этого уровня. С момента прорастания семян и до образования
сеянца с 3—4 листьями проходит от 8 мес до 1 года.
В связи с разнокачественностью семян и заторможенностью
развития отдельных растений мы можем обнаружить среди об¬
щей массы сеянцев группы как с запаздывающим, так и опере¬
жающим развитием по сравнению с основной группой синхрон¬
но развивающихся сеянцев (рис. 4.54). Так, на 47-й неделе куль¬
тивирования 76 % сеянцев имели по 3 листа, 15 % — по 2, 5 % —
по 1, 3 % — по 4 листа и 1 % — побеги без листьев.
Формирование побега второго порядка ветвления происходит
в возрасте 1 года в пазухе третьего листа побега первого порядка.
*■> возрасте 2 лет некоторые наиболее развитые растения имеют
4—5 побегов, корневую систему, образованную хорошо развиты¬
ми придаточными корнями, длина которых достигает 1,0—1,5 см.
287
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.54. Сеянцы Cattleya aclandiae Lindl.
Ювенильные растения по целому ряду признаков отличаются
от генеративно зрелых растений: формой и конфигурацией листь¬
ев, характером их расположения, количеством метамеров, кото¬
рые формируют побег, отсутствием типично выраженных псевдо¬
клубней и характерной для взрослых растений окраской листьев.
Сеянцы высотой 1,0—1,5 см с 3—4 листами и 2—3 корнями
(через 1,5—2 года) можно высаживать в субстрат. После пересад¬
ки ex vitro рост сеянцев значительно ускоряется, их вегетативная
масса в десятки раз больше таковой растений, которые остались
в колбах.
Исходя из собственного опыта рекомендуем высаживать юве¬
нильные растения С. aclandiae на блоки. При таком способе
культивирования выживает намного больше сеянцев, нежели при
традиционных приемах адаптации (рис. 4.55, см. вклейку).
В своих исследованиях по семенному размножению различ¬
ных видов Cattleya мы использовали наши модификации сред
Кнудсона и МС (табл. 4.17). Обязательным для всех сред являет¬
ся добавление от 0,5 мг/л до 1 г/л активированного угля и еже¬
месячная пересадка на свежие среды. Эти действия связаны с
чрезвычайно большим количеством фенольных веществ, выде¬
ляемых в питательную среду изолированными культурами.
288
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.17. Состав питательных сред, используемых
для культивирования эксплантов Cattleya, мг/л
Культивирование
эксплантов
Регенера¬
Формиро¬
Укорене¬
Компонент
Сегменты
листьев
сеянцев"
Пазушные
почки
ция каллу¬
са °
вание
побегов *4
ние побе¬
гов *5
nh4no3
1650,0
1650,0
1650,0
1650,0
СаС12 Н20
440,0
440,0
440,0
440,0
—
MgS04 7Н20
370,0
370,0
370,0
370,0
400,0
KN03
1900,0
1900,0
1900,0
1900,0
—
КН2Р04
170,0
170,0
170,0
170,0
250,0
(NH4)2S04
—
—
—
—
400,0
Ca(N03)2 4Н20
—
—
—
—
1000,0
КС1
—
—
—
—
500,0
Ыа2ЭДТА
37,3
37,3
37,3
37,3
37,3
FeS04 7Н20
27,8
27,8
27,8
27,8
27,8
Микроэлементы по
Мурашиге—Скугу *6
1,0
1,0
1,0
1,0
1,0
Инозит
100,0
—
100,0
100,0
100,0
Глицин
—
2,0
2,0
2,0
2,0
Лимонная кислота
—
—
—
—
150
Никотиновая кислота
—
—
0,5
0,5
0,5
Пиридоксин
—
—
0,5
0,5
0,5
Тиамин
0,4
0,1
0,1
0,1
0,1
ИМК
—
—
—
1,75
НУК
—
—
0,3
—
1,75
Кинетин
0,1
2,6
—
—
ИУК
2,0
1,0
—
0,1
—
Аденин
—
—
30,0
30,0
—
БА
—
1,0
—
Кокосовое молоко*6
—
250,0
—
160,0
—
Сахароза
30 000,0
30 000,0
30 000,0
30 000,0
30 000,0
1 Среда Churchill et al. (1971). *2 Среда Churchill et al. (1973). '5 Среда Huang
(1984). ’* Среда Arditti (1990). '5 Среда Reinert, Mohr (1967). ‘6 В миллилитрах
на 1 л.
Значительное количество работ посвящено влиянию мине¬
ральных солей, регуляторов роста, аминокислот, кокосового мо¬
лока и других компонентов на прорастание семян и развитие се¬
янцев Cattleya. Установлено, что аммиачная форма азота, тиомо-
чевина, а также такие аминокислоты, как фенилаланин и арги¬
289
СПЕЦИАЛЬНАЯ ЧАСТЬ
нин, ускоряют рост (Raghavan et al., 1964а, b). Недозрелые семена
С. aurantiaca (Batem. ex Lindl.) Pn. Don (высев из коробочек) на
среде Кнудсона с БА образовывали протокормы и растения. При
этом их количество и масса строго коррелировали с концентра¬
цией БА в среде (Pierik et al., 1972; Nishimura, 1981).
Некоторые авторы изучали влияние разных источников угле¬
водов на развитие сеянцев Cattleya. Выявлено, что наиболее при¬
емлемыми для культивирования являются 2%-е растворы сахаро¬
зы и фруктозы (Uesato, 1975; Zakrejs, 1976).
В результате наших исследований установлены сроки прорас¬
тания семян у Cattleya (табл. 4.18). Так, семена С. bowringiana да¬
ют всходы уже на 16-е сутки после высева, а семена С. labiata,
С. luedaemanniana, С. percivaliana, С. granulosa — лишь на 30—50-е
сутки. Позже всех начинают прорастать семена С. guttata, С. ас-
landia — на 60—86-е сутки. Образование растений быстрее про¬
исходит у С. granulose, С. luedaemanniana, С. bowringiana. Необходи¬
мо отметить также очень медленные темпы роста сеянцев и об¬
разования корней у всех без исключения исследуемых видов. В свя¬
зи с этим высадка ювенильных растений в субстрат происходит
лишь через 350—750 сут.
Разработке методов клонального размножения видов Cattleya
посвящено достаточно большое количество работ (Reinert et al.,
Таблица 4.18. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов и декоративных форм Cattleya, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
С. acladiae Lindl.
86
260
350
С. bicolor Lindl.
59
368
656
С. bowringiana Veitch
16
134
300
C.forbesii Lindl.
65
229
422
C. granulose Lindl.
10
120
400
C. guttata Lindl.
97
254
390
Cattleya hybr. hort.
60
320
455
C. intermedia Graham ex Hook
97
323
871
C. labiata Lindl.
35
253
360
C. lueddemanniana Rchb.f.
20
112
260
C. maxima Lindl.
62
409
869
C. percivaliana O’Brien
40
260
539
x Brassolaeliocattleya Parador ’Diva1
25
495
1052
x Brassolaeliocattleya Tchaikovski
’Mazeppa4
31
198
450
290
ГЛАВА 4. Методы размножения тропических и субтропических растений
1967; Scully, 1967; Champagnat, 1969; Vanseveren, 1969; Champag-
nat et al., 1970; Lindemann et al., 1970). В них представлены ос¬
новные условия введения растений в культуру in vitro, исследова¬
ны различные экспланты, испытаны разные питательные среды и
добавки к ним. Изучено влияние условий культивирования экс¬
плантов, формирования протокормов и растений (Lis, 1971; Gre-
gorini et al., 1975; Kusumoto, 1979; Yoneda et al., 1979; Huang,
1984).
Каждому из исследователей, занимающихся размножением
видов Cattleya в культуре in vitro, приходится сталкиваться с по-
бурением изолированных тканей, что связано с выделением ве¬
ществ фенольной природы в среду (Ichihashi et al., 1977; Kukul-
tczanka, 1983). Такие вещества тормозят рост и развитие эксплантов,
а также задерживают проникновение всех компонентов питатель¬
ной среды в ткани (Fu Fan, 1979). В связи с этим проводился
поиск веществ, способствующих снижению отрицательного дей¬
ствия фенолов. Установлено, что добавление к питательным сре¬
дам цианида кальция, аскорбиновой кислоты, цистеина, тиомо-
чевины, а также снижение pH до 6,0 повышает активность фер¬
мента полифенолоксидазы и уменьшает поступление фенолов в
среду (Ishii, 1980). Кроме того, культивирование изолированных
эксплантов Cattlleya в жидкой среде было более эффективным,
чем на твердой и уменьшало количество выделяемых фенолов.
Следует отметить также, что вычленение эксплантов в растворе
аскорбиновой кислоты, согласно нашим данным, значительно сни¬
жает побурение тканей (Kerbany, 1991).
Интересные опыты проведены с изолированными тканями
х Cattleya Alliance. В качестве эксплантов использовали латераль¬
ные почки псевдоклубней, которые культивировали в жидкой
среде. Затем образовавшиеся протокормы переносили на твердую
среду, на которой они формировали побеги. Установлено также,
что pH среды должен быть в пределах 5,5—6,0, а температура
культивирования не должна превышать 25 °С (Ishii et al., 1979).
Как показали проведенные нами исследования, одним из эф¬
фективных методов микроразмножения Cattleya может быть ин¬
дукция протокормообразования на сегментах листьев сеянцев и
растений-регенерантов. Для этого листья аккуратно отрывали от
стебля и культивировали на питательных средах МС или Пири¬
ка, модифицированных добавлением 2 мг/л БАП или зеатина,
03 мг/л НУК, 15 % кокосового молока, 1 г/л активированного угля
(Черевченко и др., 1997а, б; Черевченко, 1998). Через 1 мес у осно-
291
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.56. Схема вычленения эксплантов из нарастающего побега Cattleya.
I — побег предыдущего периода вегетации; 2 — вновь отрастающий побег; 3 — пазуш¬
ная почка; 4 — почки, пригодные к вычленению; 5 — апекс побега; 6 — апикальная
меристема
вания листьев (базальная часть) сначала образуются протокормы,
а потом — побеги (Черевченко и др., 2003). Следует отметить,
что сегменты молодых листьев сеянцев и растений-регенерантов
использовались многими исследователями, так как они являются
идеальными эксплантами.
При размножении Cattleya изолированными латеральными
почками показано, что пролиферация протокормов происходит
на примордиях почечных чешуй в течение 2—3 мес. В дальней¬
шем из них образуются побеги.
Нами изучены возможные способы микроразмножения пяти
генотипов Cattleya в культуре in vitro. Эксплантами были почки
молодых побегов высотой 10—15 см и почки возобновления
(рис. 4.56). Такая почка имеет 5—6 чешуевидных листьев и апи¬
кальную меристему; чешуи более мясистые и утолщенные, чем у
Cymbidium, и их трудно удалять. Выделение экспланта проводили
также, как и у Cymbidium, отрезая последовательно каждый че¬
шуйчатый лист. Эксплант состоял из апикальной меристемы с
несколькими листовыми зачатками размером 0,4 мм. Нами экс¬
периментально доказано, что именно у основания листовых за¬
чатков происходит дифференциация протокормов. Следует отме¬
тить, что только через 2 мес культивирования мы наблюдали на¬
бухание оснований листовых чешуек. Анатомические исследова¬
292
ГЛАВА 4. Методы размножения тропических и субтропических растений
ния выявили формирование многочисленных меристематических
центров в эпидермальных и субэпидермальных слоях листовых
чешуек. Как правило, именно у их оснований формировались
многочисленные протокормы с ризоидами.
Аналогичное явление мы наблюдали и у почек возобновления
Cymbidium. Однако между ними существуют и некоторые отличия в
процессе образования протокормов. Почка возобновления Cattleya
формирует протокормы только один раз, а такая же почка у
Cymbidium на протяжении 6 пассажей сформировала более 70 про¬
токормов. Полученные протокормы Cattleya отделяли от экспланта
и субкультивировали, получая новые протокормы и побеги.
Кроме того, для культивирования эксплантов из почек возоб¬
новления мы использовали жидкие перемешивающиеся (в ролле¬
ре) среды МС с цитокининами. Количество среды — не более
3 мл. Во время вращения происходит чередование условий куль¬
тивирования (воздух—среда), что способствует более интенсив¬
ной регенерации протокормов по сравнению с твердой средой.
При таком выращивании также устраняется негативное действие
фенолов на эксплант.
Наибольшим морфогенетическим потенциалом обладали поч¬
ки базальной части молодых побегов и почки возобновления
(табл. 4.19). Их культивировали на модифицированной питатель¬
ной среде МС (БАП — 10 мг/л, НУК — 1 мг/л, активированный
уголь — 1 г/л, кокосовое молоко — 10—15 %). За 6 мес выращи¬
вания только одна почка возобновления регенерировала более
70 многовершинных протокормов. В это же время почки средней
части побега образовали только 10 одновершинных протокормов.
Таблица 4.19. Морфогенетический потенциал изолированных тканей Cattleya
Количество эксплантов, шт.
Образовавшиеся структуры, %
Вид
всего
инфици¬
рованных
нераз¬
витых
Прото-
кормы
Побеги
Корни
С. aclandia
7
28,5
14,3
43,0
14,3
14,3
Cattleya hybr.
8
25,0
25,0
50,0
37,5
25,0
Cattleya hybr. OAB
7
28,5
14,3
28,5
28,5
14,3
Cattleya Frendly
Third ’La Tuilerie‘
10
30,0 -
10,0
30,0
30,0
10,0
Cattleya Angel Bells
’Suzie‘
9
33,3
22,2
44,4
44,4
22,2
293
СПЕЦИАЛЬНАЯ ЧАСТЬ
Проведенные нами морфогенетические исследования показали,
что апикальная меристема молодых побегов всех генотипов
инертна и в культуре in vitro не развивается. Кроме того, установ¬
лено, что наиболее активными зонами формирования протокор¬
мов являются базальные части листовых примордиев и почек. В
этих зонах, как правило, формируется большое количество прото¬
кормов. Полученные протокормы отделяли и субкультивировали.
Регенерационная способность эксплантов зависела также от
фазы развития растения-донора. Почки, которые были выделены
осенью, быстрее и интенсивнее формировали протокормы, что,
по нашему мнению, связано с усилением активности фитогор¬
монального комплекса растений в этот период.
Для культивирования эксплантов мы использовали разные
модификации питательных сред. Для пролиферации протокормов
оптимальными были питательные среды МС и Кнудсона, модифи¬
цированные добавлением 0,5—1,0 мг/л БАП, 2 мг/л НУК, 100 мг/л
пептона, 15 % кокосового молока, 1 г/л активированного угля,
1 мг/л ИМК. Экспланты культивировали при освещении и в
темноте. Получить протокормы и побеги удалось только у трех
генотипов Cattleya', остальные или погибли, или были инфициро¬
ваны. Следует отметить, что ткани Cattleya содержат очень боль¬
шое количество фенолов, которые мешают, а иногда и блокиру¬
ют проникновение как минеральных веществ, так и регуляторов
роста. Наиболее интенсивно протокормы формировались в усло¬
виях темноты.
Нами было установлено, что наиболее активными зонами об¬
разования протокормов являются базальные части листовых при¬
мордиев и почек. Как правило, в этих зонах формируется сразу
4—5 меристематических центров; на их основе образуется много
протокормов, которые, в свою очередь, можно отделять и суб-
культивировать. Необходимо помнить, что чем сложнее гибрид,
тем труднее ввести его в культуру in vitro. Протокормы формиру¬
ются из эпидермальных тканей базальных частей листьев. Даль¬
нейшее развитие протокормов проходит сравнительно быстро и
уже через 40 сут образуются растения.
Для массового размножения С. bowringiana и Cattleya hybr.
hort. мы использовали листья полученных in vitro сеянцев (рис.
4.57, см. вклейку), которые осторожно отрывали от стебля и раз¬
мещали на агаризированной среде МС. Ткани культивировали на
свету и в темноте при 22—24 °С. В процессе роста на свету 20—
30 % листьев темнеет и погибает, а в темноте гибель эксплантов
294
ГЛАВА 4. Методы размножения тропических и субтропических растений
возрастает до 75—80 %. Образование первых протокормов проис¬
ходит очень медленно. Только через 6—8 недель основание листа
слегка набухает, появляются округлые бесцветные, а затем зеле¬
новатые протокормы. На среде без регуляторов роста лишь единич¬
ные экспланты образуют небольшие протокормы. Внесение БАП
(0,3—1,0 мг/л) способствует образованию протокормов. Однако
наибольшее их количество отмечено при сочетании 0,3 мг/л НУК и
2 мг/л БАП (в 50—60 раз выше по сравнению с контролем). На
каждом экспланте образуются агрегаты из 12—15 ярко-зеленых
протокормов, которые легко распадаются. Их разделяют и пере¬
носят на свежую питательную среду. Последующий рост прото¬
кормов происходит довольно быстро: каждые 2—3 недели обра¬
зуются новые клоны, которые можно делить и повторно культи¬
вировать. После перенесения протокормов на среду с 0,3 мг/л
НУК и 1 мг/л БАП появляются многочисленные адвентивные
почки и побеги. Последние укореняют на среде без регуляторов
роста или с 0,3 мг/л ИУК. Растения с 3—4 листьями и 2 корнями
высаживают в субстрат.
Таким образом, детальное изучение биологии развития раз¬
ных генотипов Cattleya позволило нам разработать оптимальные
методы микроразмножения in vitro и получить массовый оздоров¬
ленный посадочный материал этих высокодекоративных расте¬
ний. Вместе с тем метод культуры in vitro является не только не¬
обходимой основой практических достижений, связанных с ре¬
продукцией растений, но и способствует выяснению целого ряда
отдельных теоретических вопросов морфогенеза покрытосемен¬
ных растений.
Cattleyopsis Lem. Род насчитывает только 3 вида, растущих на
Антильских островах, в основном на о-ве Куба. Это миниатюр¬
ные или средних размеров эпифиты. Листья кожистые, ксеро-
морфные. Размножают делением корневища и в культуре in vitro.
Таксономия рода связана с определенными трудностями. По
строению вегетативных органов его представители подобны ви¬
дам родов Brougntonia R.Br. и Laeliopsis Lindl., а по строению
цветка — видам рода Cattleya, хотя они имеют 8, а не 4 поллиния
(как у Cattleya). В 1984 г. проведена ревизия рода Cattleyopsis и
близких к нему вышеупомянутых родов. Был окончательно вы¬
яснен количественный состав каждого рода, а также основные
отличия между ними (Sheehan et al., 1984; Withner, 1996).
С. lindenii (lindl.) Cgn. — типичный представитель рода, рас¬
пространенный на о-ве Куба и Багамских островах (в границах
295
СПЕЦИАЛЬНАЯ ЧАСТЬ
а б
Рис. 4.58. Cattleyopsis lindenii (Lindl.) Cgn.:
a — обший вид семени; б — халазальный конец семени
Карибского бассейна). Растения имеют цилиндрические или
грушевидные однолистные (иногда с 3 настоящими листьями)
туберидии 50—80 мм в длину. Листья ланцетовидные или оваль¬
ные с пильчатым краем, жесткие, кожистые, до 120 мм в длину и
25 мм в ширину, серо-зеленые. Соцветие дугообразное, длинное
(до 1 м в длину), имеет 10—12 цветков (Hawkes, 1987). Цветки до
50 мм в диаметре, розовые или светло-сиреневые, без запаха. Гу¬
ба — самая яркая часть цветка, округлой формы, до 35 мм в диа¬
метре, с волнистым краем и пурпурными жилками (Черевченко и
др., 2001).
Несмотря на то что представители этого вида не имеют четко
выраженного периода цветения, в условиях оранжерей они чаше
всего цветут с мая по сентябрь. Продолжительность цветения 2—
3 недели. Для получения семян мы проводили искусственное
опыление.
Семена С. lindenii имеют характерную для большинства орхи¬
дей вытянутую веретеновидную форму. Халазальный конец шире
микропилярного и имеет отверстие (рис. 4.58). Семенная обо¬
лочка непрозрачная. Зародыш расположен в центре семени.
Целые недозрелые коробочки С. lindenii стерилизовали, триж¬
ды обжигая над огнем спиртовки. Потом коробочку разрезали, а
семена рассевали на поверхность питательной среды. Это пред¬
отвращало повреждение зародышей и угнетение их развития в
результате действия агрессивных реактивов во время процедуры
поэтапной стерилизации.
296
ГЛАВА 4. Методы размножения тропических и субтропических растений
Семена орхидей не имеют запасающих питательных веществ,
поэтому рост и развитие сеянцев полностью зависят от состава
питательной среды, на которой они культивируются. Для высева
семян использовали модифицированную нами среду Кнудсона.
Первые признаки прорастания отмечены только через 2 мес после
высева. Свежесобранные семена С. lindenii имеют почти 100%-ю
всхожесть. В начале прорастания зародыш в семени увеличивает¬
ся в размерах, разрывает семенную оболочку и выходит наружу,
образуя специфичный по форме грушевидный протокорм. Он
имеет сначала белую, а потом зеленую окраску. На базальной части
такого протокорма расположены всасывающие волоски. Как по¬
казали наши исследования, период от прорастания семян до об¬
разования протокорма у С. lindenii в среднем продолжается
180 сут.
При проведении исследований с С. lindenii мы наблюдали не¬
сколько путей развития протокормов: первый — образование из
одного семени одного или нескольких (3—4 шт.) протокормов,
второй — формирование на первичном протокорме большого ко¬
личества вторичных протокормов. Нами установлено, что их
дифференциация происходит из эпидермальных и субэпидер¬
мальных тканей первичного протокорма под действием регулято¬
ров роста, которые находятся в питательной среде. Интенсивное
образование вторичных протокормов наблюдалось на среде МС с
4 мг/л аденина.
Полученные конгломераты вторичных протокормов С. lindenii
разделяли и пересаживали. Увеличение количества протокормов
происходило в геометрической профессии. На протяжении 4 мес
из протокормов образовались проростки с 1—2 листьями и 1 —
2 корнями. Период с момента высева семян до образования про¬
ростков у С. lindenii составлял 360—370 сут. Проростки были вы¬
сотой до 10 мм и шириной 5 мм (рис. 4.59, а, см. вклейку). Для
нормального развития сеянцев регулярно (1 раз в месяц) на протя¬
жении последующих 288 сут мы проводили субкультивирование,
в результате чего они в 2—3 раза увеличивались в размерах и их
можно было высаживать в субстрат. По нашим данным, сеянцы
С. lindenii находились в условиях асептической культуры на про¬
тяжении 656 сут.
Таким образом, первые сеянцы С. lindenii были высажены из
колб в субстрат в ноябре 2000 г. Каждый из них имел по 2—3 по¬
бега (с 2—3 листьями) и 3—4 корня (длиной 10 мм и до 2 мм в
Диаметре), покрытых слоем веламена. Следует отметить, что мы
297
СПЕЦИАЛЬНАЯ ЧАСТЬ
не наблюдали формирование туберидиев в условиях культуры in
vitro.
Ювенильные растения высаживали на разные варианты суб¬
стратов — сфагновый мох (Sphagnum palustre L.); сфагновый
мох:кора сосны (Pinus sylvestris L.) (1:1); кора сосны. Однако наи¬
лучшие результаты получены нами при использовании блок-
культуры. Блоки, на которых культивируют сеянцы, обязательно
должны высыхать между поливами. Наилучшим материалом для
изготовления блоков является кора пробкового дуба (Quercus
suber L.) или амурского бархата (Phellodeneron amurense Rupr.).
Кору сосны также можно использовать, однако через 1,5—2 года
она начинает активно деградировать, что приводит к необходи¬
мости пересадки. Через 1—1,5 года после высадки крепления, с
помошью которых сеянцы фиксировали на блоках, можно снять.
За этот период растения формируют собственную корневую сис¬
тему, удерживающую их на блоках (рис. 4.59, б).
Интересной особенностью данного вида есть то, что после
перенесения из культуры in vitro сеянцы начинают активно на¬
ращивать массу корневой системы — в течение 4—5 мес интен¬
сивно отрастают корни, которые в 1,5—2 раза толще тех, что об¬
разовались в культуре in vitro. При этом практически не наблюда¬
ется формирование новых листьев и побегов. Первые настоящие
листья ex situ имеют пильчатые края, что является характерным
признаком этого вида. У отдельных экземпляров С. lindenii тубе-
ридии формируются уже на первом приросте ex vitro (туберидии
зеленого цвета, длиной 3—4 мм и шириной до 2 мм).
На типичном побеге 3—4-летнего сеянца С. lindenii располо¬
жено 6—8 листьев, из которых 1—2 — настоящие ассимилирую¬
щие (удлиненные, с заостренными концами, длиной до 50 мм и
шириной 8 мм). Своими влагалищами ненастоящие листья оку¬
тывают междоузлия и туберидий, выполняя при этом защитную
функцию.
В условиях оранжерей мы наблюдали два годичных прироста
сеянцев С. lindenii'. первый — с начала марта до июля, второй — с
середины сентября до конца января. Формирование одного по¬
бега продолжается около 120—140 сут.
Таким образом, в результате проведенных исследований были
подобраны условия культивирования для растений С. lindenii в
культуре ex situ, получены полноценные семена, разработан ме¬
тод семенного размножения этого вида в культуре in vitro и опре¬
делены подходы к адаптации сеянцев в постасептический период-
298
ГЛАВА 4. Методы размножения тропических и субтропических растений
Coelogyne lindl. Род насчитывает более 100 эпифитных видов,
распространенных в Азии, Индии, Индонезии, Китае, Филиппи¬
нах. Псевдоклубни овальные или цилиндрические, гладкие или
ребристые, расположены на небольшом расстоянии друг от друга
или плотно на ползучем корневище. Имеют до 4 листьев различ¬
ной конфигурации. Соцветие — прямая или свисающая кисть с
одним или несколькими цветками. Цветки мелкие, белого, жел¬
того, зеленого, коричневого цвета, с мелкими пятнами на губе и
приятным запахом. Размножают вегетативно, делением клона
или в культуре in vitro.
С. cristata Lindl. Эпифиты, произрастающие в восточных райо¬
нах Гималаев. Псевдоклубни яйцевидные, плотно расположены,
двулистные. Соцветие свисающее, несет 3—10 цветков. Цветки
до 10 см в диаметре, белые, губа с желтоватыми гребнями.
Для семенного размножения Coelogyne cristata Lindl., С. law-
renceana Rolfe, С. viscosa Rchb.f. использовали семена репродук¬
ции НБС НАН Украины. Их проращивали на питательных сре¬
дах КПГУ и МС с 2 мг/л аденина. Первые проростки появились
через 21—32 сут. У С. cristata и С. lawrenceana формирование рас¬
тений происходило на протяжении 82—95 сут, у С. viscosa —
136 сут. В течение этого периода растения субкультивировали на
средах того же состава с периодичностью 1—2 раза в месяц. Об¬
разовавшиеся сеянцы с 3—4 листьями и 2—3 корнями высажива¬
ли в субстрат через 184—250 сут после высева (см. прил. 1).
Cymbidium Sw. По данным ряда авторов, включает от 50 до 60
видов и большое количество естественных и садовых гибридов.
Подавляющее большинство видов распространено в Азии (Индия,
п-ов Индокитай, Китай, Индонезия, Филиппины, Япония), неко¬
торые виды встречаются в Австралии и на о-ве Мадагаскар. В ос¬
новном растения Cymbidium высокогорны, растут в труднодоступных
местах, в связи с чем особенности роста и развития в естествен¬
ных условиях произрастания не описаны. Одни авторы относят их
к эпифитам, другие — к наземным растениям. Некоторые иссле¬
дователи утверждают (мы также придерживаемся этого мнения),
что растения данного рода могут вести как эпифитный образ жиз¬
ни, так и наземный. Cymbidium имеет килеватые, острые или ту¬
пые листья. Соцветие — многоцветковая кисть. Крупные соцветия
высотой до 70 см имеют от 9 до 25 (и более) цветков разнообраз¬
ной окраски диаметром 5—9 см. Необычайная красота соцветий,
Длительность цветения (около 4 мес) в зимний период, сохранность
в срезе 1—1,5 мес, обильное цветение без дополнительного освеще¬
299
СПЕЦИАЛЬНАЯ ЧАСТЬ
ния при довольно низких температурах (10—12 °С) ставят Cymbi¬
dium на одно из первых мест для расширения ассортимента про¬
мышленных красивоцветущих срезных культур защищенного фунта
(Черевченко и др., 2001).
Изучение ювенильного развития Cymbidium представляет
большой практический интерес. Знание условий прохождения
органогенеза, времени закладки отдельных органов, в частности
генеративных, дает возможность направленно влиять на рост и
развитие растений с целью получения максимального количества
цветущих экземпляров в зимний период.
Семена Cymbidium, как и других видов орхидных, очень мел¬
кие, не содержат эндосперма, зародыши недифференцирован¬
ные, имеют вид округлого образования. В работе были задейст¬
вованы виды, приведенные ниже.
С. canaliculatum R.Br. — эпифит, распросфанен на юге Авст¬
ралии. Листья прямые, до 30 см в длину. Цветонос несет до
15 цветков (5 см в диаметре) зеленого, желтого или коричневого
цвета.
С. giganteum Wall, ex Lindl. — эпифит, до 50 см в высоту, про¬
израстает в Гималаях. Туберидии яйцевидные. Листья ланцето¬
видные, до 60 см в длину. Цветонос может иметь 7—15 цветков
до 10 см в диаметре с запахом, желто-зеленого цвета, с пурпур¬
ными штрихами.
С. lancifolium Hook. — один из наиболее известных видов,
ареал которого охватывает Индию, Китай, Непал, Мьянму и Ин¬
донезию. Наземное растение. Туберидии до 10 см в длину, листья
овальные, тонкие. Цветки до 5 см в диамефе, с запахом, желто¬
ватые или зеленые.
С. lawianum Rchb.f. — эпифит, произрастающий в Мьянме и
Индии. Листья заостренные, до 60 см в длину. Цветки крупные,
желто-зеленые, с коричневыми шфихами.
Согласно данным В.А. Поддубной-Арнольди (1957), прорас¬
тание семян орхидных, в том числе и Cymbidium, начинается с
внутрисемейного разрастания недоразвитого шаровидного заро¬
дыша. По нашим данным, семена Cymbidium набухают на 7-е су¬
тки после высева и видимы невооруженным глазом (табл. 4.20).
Зародыш быстро увеличивается и уже на 9—10-е сутки заполняет
всю оболочку семени. На 11—12-е сутки она прорывается, появ¬
ляются первые ризоиды, количество которых бысфо растет и уже
на 15—16-е сутки развития достигает в среднем 15—16 шт. К этому
времени семенная оболочка отторгается от проростка (рис. 4.60).
300
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.20. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Cymbidium, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
С. canaliculatum R.Br.
75
246
316
С. giganteum Wall, ex Lindl.
24
173
297
С. lancifolium Hook.
19
158
338
C. lawianum Rchb.f.
21
252
350
Через 1 мес формируется протокорм с одним меристематиче-
ским центром, в котором можно выделить зачаток первого лис¬
та — валик листового примордия и верхушечную меристему по¬
лусферической формы. Чаще всего через 1,5—2,5 недели после
появления первого меристематического центра на протокорме
появляется еще 2—3 таких же участка меристемы. Если прото¬
корм не разделить на несколько частей, соответствующих коли¬
честву меристематических центров, то в дальнейшем развивается
только один апекс, вступающий в регулярные пластохронные
циклы, закладывая последовательно, в строго очередном поряд¬
ке, листовые зачатки. В течение трех последующих месяцев жиз¬
ни ювенильного растения пластохрон составляет от 30 до 45 сут,
так как закладка листовых зачатков идет неравномерно.
Каждый лист по мере роста дифференцируется на замкнутую
влагалищную часть листовой пластинки, которая у первых трех
низовых листьев менее развита, чем у последующих. Между ме¬
стом прикрепления первого листа и основанием начинающего
ветвиться корня разрастается участок зародыша, формируется пер¬
вый в онтогенезе растения туберидиеподобный протокорм, кото¬
рый, по-видимому, можно назвать проростковым, или зароды¬
шевым.
В отличие от последующих туберидиев, формируемых расте¬
нием в ювенильном и зрелом возрасте, зародышевый туберидий
не имеет жизнеспособных почек. Изредка на нем ниже первого
узла можно видеть 1—3 беспорядочно расположенные точки рос¬
та. Они возникают еще в фазе зародыша, дифференцирующегося
в проросток одновременно с апикальной меристемой, которая
Дала начало главному побегу, но не получают дальнейшего раз¬
вития. От фазы проростка до фазы зародышевого туберидиепо-
Добного протокорма проходит 60—100 сут. Междоузлия между
первым и вторым, вторым и третьим, третьим и четвертым ли¬
301
СПЕЦИАЛЬНАЯ ЧАСТЬ
стьями сильно удлиняются, формируя столоновидное образова¬
ние. Оно соединяет зародышевый туберидиеподобный протокорм
с ювенильным, который имеет типичное строение, характерное
для всех туберидиев, формируемых растением на протяжении по¬
следующей жизни клона.
Туберидий ювенильного растения образуется из сильно утол¬
щенных и слаборазросшихся в длину междоузлий между четвер¬
тым и пятым, пятым и шестым и т.д. листьями (у сеянцев юве¬
нильный туберидий имеет до 10—11 листьев). В пазухах развер¬
нутых листьев формируются боковые почки.
В местах прикрепления первого и второго листьев образуются
придаточные корни, которые обеспечивают питание и снабжение
водой ювенильного растения. Иногда такие корни формируются
в местах прикрепления второго и третьего листьев зародышевого
туберидиеподобного протокорма на его столоновидной, удлинен¬
ной части. Зародышевый корень небольшой и в 11—12-месячном
возрасте отмирает вместе с зародышевым туберидиеподобным про¬
токормом, когда разовьется в достаточной степени новая корневая
система ювенильного туберидия. Обычно хорошо развитое одно¬
летнее ювенильное растение после отмирания зародышевого ту¬
беридиеподобного протокорма имеет только один главный побег
с 5—10 развернутыми листьями и 4—5 листовыми зачатками на
разных фазах развития (от листового валика у апикальной меристе-
302
ГЛАВА 4. Методы размножения тропических и субтропических растений
мы до листа, дифференцированного на влагалищную часть и лис¬
товую пластинку с зачатками проводящей системы, окружающи¬
ми главный конус нарастания).
Влагалища развернутых листьев замкнуты вокруг утолщен¬
ного стебля формирующегося туберидия диаметром 2—3 см и
высотой 3—4 см. У основания туберидия имеется 2—5 неразветв-
ленных корней и более, длина от 3 до 12 см и толщина 0,3—
0,5 см. В пазухах листьев на ювенильном туберидии располагают¬
ся боковые почки, которые различаются по структуре и уровню
развития: наиболее развитые почки, содержащие 6—7 листовых
зачатков, находятся в пазухах четвертого-седьмого листьев. Нижние
3 почки менее развиты. Выше седьмого-восьмого листьев на тубе¬
ридии в пазухах последующих ли¬
стьев находится недифференци¬
рованная меристема. Достигнув
такого уровня развития, юве¬
нильное растение начинает вет¬
виться, т. е. дает начало вегета¬
тивному клону — в этом заклю¬
чается его основная функция.
Первый-второй (реже третий-
четвертый) побеги ветвления об¬
разуются из наиболее развитых
почек в пазухах четвертого-седь¬
мого листьев в нижней части
туберидия. Развивающаяся в по¬
бег почка смещает вниз или раз¬
рывает кроющий лист, который
в последующем постепенно за¬
сыхает. Два-три нижних листа
побега ветвления развиваются
по типу листьев низовой фор¬
мации и образуют из влагалищ¬
ной части туникатную чешую, по-
Рис. 4.60. Развитие типичного сеянца
Cymbidium в условиях асептической
культуры:
а — проросток в возрасте 10—120 сут; 6 —
сеянец в возрасте 290—300 сут, пригодный
к высадке ex vitro
303
СПЕЦИАЛЬНАЯ ЧАСТЬ
крывающую молодой туберидий; листовая пластинка их редуци¬
рована. Последующие листья срединной формации, как и на
главном побеге, имеют развитую листовую пластинку. Ее длина
на всех вегетативных побегах у Cymbidium увеличивается от пер¬
вого срединного к последующим листьям по типу одновершин¬
ной кривой и составляет от 9 до 17 см.
В пазухах третьего-четвертого низовых листьев побега ветвле¬
ния, еще до их разветвления, когда боковой побег находится в
фазе начинающей расти почки, из ее пазушных меристем фор¬
мируются почки — зачатки побегов следующего, третьего поряд¬
ка ветвления. С началом роста бокового побега в первом-втором
нижних узлах развивается несколько мощных придаточных кор¬
ней, обеспечивающих побегу практически полную автономность
питания. Отделенный от главного побег ветвления способен при
достаточно благоприятных условиях расти и развиваться, образуя
новое растение.
Побеги ветвления все возрастающих порядков, формирую¬
щиеся в онтогенезе растения, образуют разрастающийся куст —
клон. Начало роста новых побегов ветвления очередного поряд¬
ка наблюдается в марте—апреле, т. е. ежегодно происходит прирост
клона, причем количество побегов определяется тем, сколько почек
начинают расти в данном году и развилось в предшествующие го¬
ды. Согласно литературным данным, первое цветение Cymbidium
наступает на 7-й год после высева, однако, по нашим наблюде¬
ниям, некоторые побеги второго порядка ветвления (7 %) уже в
3-летнем возрасте готовы к переходу в репродуктивный период.
Обычно у таких растений в цветочный побег развивается 1, ре¬
же — 2 наиболее развитые почки нижней части туберидия. На¬
чало развития цветоноса зафиксировано в июле—августе.
Следует отметить, что у сеянцев побеги второго порядка ветв¬
ления к моменту завершения роста (через год после начала их
развития из почки) по массе и размерам превышают главный по¬
бег в 2—4 раза. Побеги второго порядка, вступившие в генера¬
тивную фазу развития, обычно имеют 11 — 12 вегетирующих ли¬
стьев длиной 27—46 см, 13 корней и больше, максимальная дли¬
на которых достигает 40 см. Часть наиболее длинных корней раз¬
ветвлены до третьего порядка. Из самой нижней почки формиру¬
ется молодой туберидий — побег третьего порядка.
Вторая почка может также развиваться сразу во второй побег
третьего порядка или некоторое время оставаться резервной. В
304
ГЛАВА 4. Методы размножения тропических и субтропических растений
ней 10—12 листовых зачатков. В пазухах 5—6-листового зачатка
часто находится участок меристемы — зачаток побега четвертого
порядка.
Третья почка (возможно, четвертая) — генеративная, с 11 —
13 листовыми зачатками и верхушечным соцветием. Из листовых
зачатков на цветоносе развиваются видоизмененные чешуевидные
листья, которые обычно к началу цветения подсыхают.
Четвертая-шестая почки состоят из 11—12 листовых зачатков
и конуса нарастания.
Седьмая и восьмая почки характеризуются меньшими разме¬
рами, содержат по 7—9 листовых зачатков и конус нарастания.
Девятая-двенадцатая почки очень мелкие, вдавленные в ткань тубе-
ридия, имеют по 2 замкнутых “колпачка” листовых зачатков, за¬
крывающих апекс.
Верхушечная почка туберидия (побега второго порядка, давше¬
го первое соцветие) сухая или начинающая подсыхать. Меристе¬
ма не функционирует — новые листовые зачатки не образуются.
У основной массы сеянцев закладка и развитие соцветий на¬
блюдаются на 4—5-й год жизни на туберидиях побегов четвер-
того-пятого порядков ветвления (Черевченко, 1993).
Таким образом, ювенильное развитие Cymbidium продолжает¬
ся 3—5 лет, в течение которых формируются три основные струк¬
туры, отличающиеся морфологически и функционально. Пер¬
вая — зародышевый (проростковый) туберидиеподобный прото¬
корм, специфическое образование из зародышевых тканей, которое
имеет только одну апикальную меристему. Из нее развивается
вторая морфоструктура — первый настоящий ювенильный тубе¬
ридий, имеющий типичное строение в течение всей последую¬
щей жизни, но не способный к репродуктивному развитию. Его
основная функция в онтогенезе — дать начало разветвленной
вегетативной сфере растения — клону. Третья морфоструктура —
туберидий, готовый к переходу в репродуктивный период.
Нами были исследованы особенности питания прорастающих
семян и сеянцев Cymbidium. По мнению R. Prasad и G. Mitra
(1975), в развитии сеянцев данного рода следует различать три
стадии — семя, протокорм и проросток — с различными требо¬
ваниями к питательной среде.
Этими же авторами было испытано 20 веществ, которые от¬
носятся к разным классам соединений, добавляемых к среде Кнуд¬
сона. Установлено, что комплексные соединения — гидролизат
казеина, дрожжевой автолизат, кокосовое молоко, пептон — улуч¬
305
СПЕЦИАЛЬНАЯ ЧАСТЬ
шают прорастание семян на 15—30 %. Из всех использованных
аминокислот только триптофан, аспарагиновая кислота, аспарагин
ускоряли прорастание; гистидин, аргинин, цистеин — угнетали.
Влияние витаминов также не всегда положительно. Стимулирую¬
щим свойством обладали тиамин, пиридоксин, фолиевая и никоти¬
новая кислоты, рибофлавин. Сочетания 3—6 витаминов угнетали
процесс. Для прорастания семян R. Prasad и G. Mitra считают
лучшей среду Кнудсона С с добавлением гидролизата казеина
(200 мг/л), аспарагина, аденина, тиамина, фолиевой кислоты и
ИУК. Однако проросток постепенно становится более автотроф-
ным и для развития протокормов необходимы только некоторые
из этих веществ — гидролизат казеина, аденин и фолиевая ки¬
слота. В дальнейшем, когда сеянцы переходят к автотрофному
питанию, их потребность в экзогенных органических веществах
уменьшается. На этом этапе им нужны макро- и микроэлементы
для улучшения метаболизма и роста, поэтому к основной среде
добавляют NaH2P04, KN03, а также KI, H3B03, CuS04, Na2Mo04 х
х 2Н20, Co(N03)2 ■ 6Н20.
Исследования, проведенные указанными авторами, детально
характеризуют изменение физиологии питания прорастающих се¬
мян Cymbidium. Однако предложенный ими метод 3-кратной сме¬
ны питательной среды в процессе роста сеянцев совершенно не¬
приемлем в промышленных условиях.
Мы изучали особенности прорастания семян двух видов —
С. canaliculatum R.Br. и Cymbidium hybr. hort. Для проращивания
семян использовали среды Кнудсона с добавлением витаминов и
яблочного сока, среды Томпсона, Рагхавана—Торри и модифи¬
цированную нами среду Кнудсона.
Наблюдения показали, что у Cymbidium hybr. семена набухают,
увеличиваются в размерах, становятся светло-зелеными на 16—30-е
сутки (средние данные), в отдельных случаях свежесобранные се¬
мена начинают прорастать на 7-е сутки. Затем формируется про¬
токорм, появляются всасывающие волоски, листья, корни; сеянец
образуется в среднем через 150—170 сут после высева. Через 10 мес
сеянцы цимбидиума готовы к высадке в субстрат.
Цикл развития сеянцев С. canaliculatum составляет 275—300 сут.
Видимые признаки прорастания семян появляются через 75 сут
(изменяются цвет и форма семян — они становятся желто-зеле¬
ными и цилиндрическими). Образование листьев и корней отмече¬
но через 240—250 сут. Разработанная нами модификация среды
Кнудсона оказалась оптимальной для роста сеянцев Cymbidium.
306
ГЛАВА 4. Методы размножения тропических и субтропических растений
Для выяснения влияния отдельных компонентов среды на
рост проростков Cymbidium нами проведена серия опытов, ре¬
зультаты которых свидетельствуют о том, что добавление различ¬
ных веществ к стандартной среде Кнудсона приводит к более ин¬
тенсивному нарастанию вегетативной массы, в частности к уве¬
личению высоты сеянцев и длины корней (табл. 4.21).
При внесении в среду пептона с активированным углем, пеп¬
тона с гуматом калия, гумата калия с активированным углем улуч¬
шаются условия питания, что проявляется в увеличении вегетатив¬
ной массы сеянцев. Однако сочетание пептона с гуматом калия и
активированным углем, при котором все эти компоненты дейст¬
вуют синергически, наиболее оптимально.
При наличии пептона и физиологически активных веществ
гумусовой природы растения энергичнее используют элементы ми¬
нерального питания, в результате чего интенсивнее развивается ве¬
гетативная масса, активизируется корнеобразование, ускоряется
цикл развития проростков.
Таблица 4.21. Влияние различных модификаций среды Кнудсона
на рост сеянцев Cymbidium hybr. hort.
Интенсивность нарастания
вегетативной массы
Компонент
Концентрация,
(за 10 мес)
мг/л
Высота
Длина
Масса
растений,
корней,
растений,
см
см
г
Активированный уголь
1000,0
2,37
0,60
0,65
Пептон
2000,0
2,42
0,40
0,44
Гумат калия + пантоте-
нат кальция
50,0 + 0,5
1,90
0,40
0,40
Никотиновая кислота +
+ пиридоксин + тиамин +
+ глицин
0,2 + 0,2 + 0,2 + 5,0
1,50
1,10
0,60
Пептон + активирован¬
ный уголь
2000,0 + 1000,0
5,70
5,80
9,00
Пептон + гумат калия
2000,0 + 50,0
5,30
5,10
5,20
Гумат калия + активи¬
рованный уголь
50,0 + 1000,0
2,90
2,70
2,35
Пептон + гумат натрия +
+ активированный уголь
2000,0 + 50,0 + 1000,0
8,40
6,10
14,34
Контроль (среда Кнуд¬
сона)
1,20
0,20
0,34
307
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.22. Влияние пикировки на рост сеянцев Cymbidium hybr.
Вариант
опыта
Количество
Интенсивность нарастания вегета¬
тивной массы (за 7 мес)
Среда
растении в
колбе, шт.
Высота
растений,
СМ
Длина
корней,
СМ
Сырая масса
20 растений,
г
Растения
пикиро¬
Кнудсона
50
6,4
4,6
4,1
ваны
Рагхавана—Торри
(модифицирован¬
ная)
48
4,4
1,5
1,5
не пики¬
Кнудсона
115
3,5
1,5
2,2
рованы
Рагхавана—Торри
(модифицирован¬
ная)
98
3,1
0,6
1,1
Полученные сеянцы Cymbidium имеют хорошо развитую кор¬
невую систему, 4—5 ярко-зеленых листьев и пригодны к высадке
в субстрат. Для улучшения развития сеянцев проводили пики¬
ровку проростков (через 7 мес после высева семян) на свежую
питательную среду (по 40—50 растений в колбу) (табл. 4.22). Че¬
рез 300 сут после высева сеянцы Cymbidium готовы к высадке в
субстрат.
Получению растений орхидей с более стабильными признаками
способствует метод клонального размножения in vitro. Этот метод
включает получение стерильных исходных эксплантов, дифферен¬
циацию первичных протокормов из меристематических тканей, их
дальнейшее размножение, регенерацию растений и высадку в суб¬
страт. В качестве исходного материала мы использовали различные
сорта Cymbidium коллекции НБС НАН Украины.
Первые исследования по клональному размножению орхидей
в культуре in vitro провел G. Morel (1964, 1974) с культурой
Cymbidium. В своих первых работах он использовал апикальные ме¬
ристемы, так как апекс характеризуется непрерывным, недетерми¬
нированным ростом. Это самоорганизующаяся зона. По мере
роста апекса образуются новые листовые примордии. Латераль¬
ные почки возникают позже в наружных слоях стеблевой ткани,
в них развиваются типичные структуры, аналогичные апексу глав¬
ного побега. Меристематическая природа указанных структур да¬
ет возможность использовать их не только для микроразмно¬
жения в качестве эксплантов, но и для получения оздоровлен¬
308
ГЛАВА 4. Методы размножения тропических и субтропических растений
ного посадочного материала, так как апикальные меристемы
размером 100—200 мкм содержат незначительное количество ви¬
русных частиц.
Клональное размножение Cymbidium основывается на диффе¬
ренциации протокормов из меристематических тканей. Много¬
кратным делением образовавшихся протокормов и регенерацией
из них растений можно добиться получения большого количества
посадочного материала. Применение такого высокопродуктивного
метода размножения делает Cymbidium экономически выгодной про¬
мышленной культурой.
Как известно, одним из важных факторов, значительно влия¬
ющих на регенерационную способность изолированных тканей,
является выбор экспланта. При этом нужно учитывать следую¬
щее: характеристику растения, от которого берется эксплант; орган,
служащий источником ткани; его возраст; фазу развития растения;
размер экспланта. Для размножения может быть использована
любая часть растения, содержащая меристематический участок.
При проведении исследований мы использовали разнокачествен¬
ные побеги Cymbidium (отмирающий, вегетирующий, отрастаю¬
щий), спящие почки туберидиев, апикальные и латеральные ме¬
ристемы, сегменты корней и листьев, различные элементы
цветка.
Перед вычленением спящих почек туберидиев изучали их
ярусную изменчивость (рис. 4.61—4.63). Туберидии Cymbidium, в
зависимости от возраста, имеют от 6 до 14 вегетирующих листь¬
ев, в пазухах которых можно обнаружить до 10 спирально распо¬
ложенных почек.
Проведенный морфологический анализ почек туберидиев по¬
казал, что верхушечные (апикальные) почки у 95—98 % растений
нежизнеспособны, а конус нарастания у них редуцирован. Почки
среднего яруса, как правило, хорошо развиты и имеют размеры
от 0,5 до 1 см. Конус нарастания у них блестящий, тургорный,
округлой формы, размером от 0,25 до 0,3 мм. Почки, располо¬
женные на корневищной части туберидия, значительно крупнее
остальных и имеют размеры от 0,5 до 1,5 см. У них наибольшее
количество зачаточных листьев (от 9 до 14) и конус нарастания
размером от 0,35 до 0,4 мм. Около 80 % почек среднего яруса ту¬
беридиев образовывали как протокормы, так и растения. У 95 %
почек корневищной части туберидия почки возобновления также
формировали протокормы. Они дифференцировались вокруг почки,
образуя круг из 7—10 протокормов. Их отделяли и культивировали
309
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.61. Схема ярусного расположения почек на отмирающем туберидии
Cymbidium hybr. в возрасте 8 лет:
1—8 — боковые (резервные) почки; 1а— 8а — их структурные элементы (зачаточные
листья и меристематические конусы)
в новой среде. Почку снова помещали на питательную среду, где
она образовывала новые протокормы. Так, только одна такая
почка за полгода образовала 72 протокорма.
Очень важным и ответственным этапом является получение
стерильной культуры. Следует отметить, что стерилизация ста¬
рых туберидиев затруднена из-за сильной их загрязненности. В
связи с этим большинство эксплантов (80 %) остается инфици¬
рованными. Лучшие результаты получены у эксплантов, изоли¬
рованных из вегетирующих туберидиев, однако это сильно ос¬
лабляет маточное растение и уменьшает количество цветоносов.
Поэтому для работы более удобно использовать молодые побеги
высотой 6—12 см в фазе неразвернувшихся листьев. Как показа¬
ли наши исследования, для получения таких побегов лучше отде¬
лять и высаживать старые туберидии (во время деления клона) в
сфагновый мох. Спящие почки, прорастая, образуют молодые по¬
беги. От одного туберидия можно получить до 4—5 молодых побе¬
гов, используемых в качестве источника эксплантов. Кроме того,
они лучше стерилизуются и их удобно препарировать (Лаврентьева,
1985).
310
ГЛАВА 4. Методы размножения тропических и субтропических растений
А*с. 4.62. Схема ярусного расположения почек на вегетирующем побеге
Cymbidium hybr. в возрасте 4 лет:
1—9 — почки, расположенные в пазухах листьев; 1а—9а — структурные элементы по¬
чек; 10 — терминальная почка, 10а — ее структура
При морфологическом исследовании молодого побега в пазухах
листьев можно обнаружить спирально расположенные почки. Ниж¬
ние почки побега хорошо развиты, конус нарастания у них имеет
овальную форму, его размер зависит от возраста побега. В пазухах
самых верхних листовых чешуй почки недоразвиты и состоят из
меристемы и 2—3 листовых зачатков. Конус нарастания такого по¬
бега обычно тургорный, округлой формы, размером 0,3—0,35 мм.
Из литературных источников известно, что от размера изоли¬
руемого экспланта в значительной степени зависит тип морфоге¬
неза. Некоторые авторы полагают, что чем меньше клеток диф¬
ференцированных образований содержится в изолируемых мери-
сгемах, тем ниже их способность к морфогенезу на питательной
среде (Morel, 1960). Существуют также данные о том, что листовые
примордии, вычлененные вместе с апексом, увеличивают морфо¬
генетическую реакцию последнего (Morel, 1974).
В связи с этим были изучены особенности морфогенеза изо¬
лированных меристем Cymbidium в зависимости от их размеров
311
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.6J. Схема ярус¬
ного расположения по¬
чек на отрастающем по¬
беге Cymbidium hybr. в
возрасте 10 мес:
1—7 — почки, расположен¬
ные в пазухах листьев; 1а—
7а — структурные элементы
почек; 8— терминальная
почка отрастающего побега,
8а — ее структура; б — зона
расположения почек возоб¬
новления
(табл. 4.23). Результаты исследований показали, что апексы раз¬
мером 100 мкм либо совсем не способны к образованию прото¬
кормов, либо образуют их в незначительном количестве. Иногда
наблюдалась даже их гибель. Апикальные меристемы размером
200 мкм способны к незначительному росту. При изолировании
апексов размером 350 мкм их рост был более быстрым. Наи¬
большей протокормообразующей способностью обладали апи¬
кальные меристемы размером 500 мкм. Следует отметить, что
наличие листовых зачатков и субапикальной ткани заметно уве¬
личивает выход протокормов. Такая же закономерность наблю¬
далась и в опытах G. Morel (1964). Экспланты размером более
500 мкм обладали значительной органогенной способностью.
Поскольку размножение протокормами специфично для всех
орхидных, более подробно остановимся на процессе формирова¬
ния первичных протокормов из меристематических тканей Cym¬
bidium и последующем их размножении. Меристематические вер¬
хушки побегов, помещенные на питательную среду, формируют
специфические структуры, названные G. Morel (1964) протокор-
312
ГЛАВА 4. Методы размножения тропических и субтропических растений
моподобными телами, или протокормами, в связи со сходством с
протокормами, образованными из семян.
В литературе имеется большое количество наблюдений и тео¬
ретических предположений о процессе формирования протокор¬
ма in vitro, однако они носят противоречивый характер. Наши
исследования показали, что образование протокорма происходи¬
ло через 30—60 сут после помещения апикальной меристемы на
питательную среду. Его развитие начинается с набухания ткани,
образующей листовые зачатки, и апекс становится хорошо виден.
На поверхности экспланта и на основной части листовых зачат¬
ков происходит интенсивное деление клеток эпидермиса. При этом
образуется длинный ряд клеток, формирующих протокормы. Ино¬
гда может образовываться агрегат из 2—5 протокормов и более.
Они имеют вид округлых блестящих утолщений сначала белой, а
потом зеленоватой окраски, с длинным рядом ризоидов в ниж¬
ней конусовидной части (рис. 4.64).
В начале формирования на протокорме расположен один ме-
рисгематический центр, в котором можно выделить зачатки 2—4 лис¬
товых примордиев и верхушечную меристему. Через 2 недели на
нем появляются еще несколько (2—5) таких же участков меристе¬
мы. Если такой протокорм не разделить на части, то в дальнейшем
развивается только один апекс. Остальные точки роста останав¬
ливаются в своем развитии. В течение последующих 3 мес разви¬
тия ювенильного растения пластохрон составляет 30—45 сут, по¬
скольку закладка листовых зачатков идет неравномерно. Первый
Таблица 4.23. Морфогенетический потенциал различных
по размеру эксплантов Cymbidium
Образовавшиеся структуры, % общего количества
Тип *
Размер,
мкм
Количество,
шт.
Неразвившиеся
экспланты
Экспланты,
увеличивающиеся
в размерах
Прото кормы
А
100
20
73,0
2,0
25,0
Б
200
20
57,0
8,0
35,0
В
350
40
52,0
3,0
45,0
Г
500
40
2,5
1,5
96,0
Д
2000
40
13,0
2,0
85,0
Тип экспланта: А — апекс; Б — апекс с листовыми примордиями; В —
апекс с листовыми примордиями и субапикальной тканью; Г — апекс с
листовыми примордиями; Д — почка, состоящая из 8 листовых зачатков.
313
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.64. Схема микроразмножения Cymbidium hybr. с помощью меристем
молодого отрастающего побега
корень дифференцируется эндогенно уже после образования 2—3
настоящих листьев.
Микроскопические исследования показали, что эпидермаль¬
ные клетки меристематической зоны протокорма и листовых за¬
чатков содержат крахмальные зерна разного типа и большое ко¬
личество расположенных пучком рафид. В верхней части этой зоны
при делении клеток образуется конус нарастания, который всту¬
пает в регулярные пластохронные циклы, закладывая листовые
примордии. Протокорм состоит из слабо дифференцированной
паренхимы, окруженной сосудисто-волокнистыми пучками.
Как установил G. Morel (1960), такие протокормы при деле¬
нии регенерируют большое количество новых. Их размножение
происходит в геометрической профессии. Именно такая удиви¬
тельная способность протокормов орхидей лежит в основе кло¬
314
ГЛАВА 4. Методы размножения тропических и субтропических растений
нального размножения. Исследованию этого процесса посвящено
много работ. Так, М. Champagat и соавт. (1972) установили, что
только эпидермальные фрагменты протокорма растут и образуют
новые протокормы. В результате клеточных делений в субэпи-
дермальном слое образуются небольшие скопления из 2—6 клеток,
появляющихся спонтанно на поверхности протокорма. Вследствие
их активности через некоторое время формируются новые прото¬
кормы. На следующей стадии дифференцируются примордии
листа. У основания протокорма после образования нескольких
листьев эндогенно появляется корень.
Следует отметить, что для более интенсивного формирования
протокормов их деление необходимо проводить до дифференциа¬
ции первого листа. Оптимальный размер для деления протокорма
3—4 мм3, масса — не менее 30 мг. Часто в массе протокормов
регенерируют растения, их отделяют и культивируют отдельно, а
протокормы разрезают на части и субкультивируют. Таким обра¬
зом, делением протокормов можно поддерживать их рост дли¬
тельное время. Однако проведенные нами исследования показали
необходимость обновления культур после 3 лет непрерывного
культивирования.
Для микроразмножения Cymbidium можно использовать также
спящие почки вегетирующих туберидиев (рис. 4.65). Почки, вы¬
резанные с небольшим кусочком ткани, на питательной среде
чаще всего регенерируют растения, реже — протокормы, побеги.
Образование растений может проходить на средах Вудсона или
МС без регуляторов роста. Почки можно культивировать на твер¬
дых и в жидких средах. Жидкую среду лучше использовать для по¬
лучения протокормов из меристем, вычлененных из почек тубе¬
ридия.
На среде МС с 5—8 мг/л БАП почки образуют протокормы и
побеги. Высокая концентрация цитокинина в среде устраняет
апикальное доминирование, что приводит к формированию множе¬
ства протокормов и побегов. Их отделяют от почки и культивируют
отдельно. При длительном культивировании протокормы разраста¬
ются, занимая всю поверхность среды. Они начинают угнетать
Друг друга и желтеть, что отрицательно сказывается на их регене¬
рационной способности. Поэтому по мере подрастания прото¬
кормы делят и пересаживают на свежую питательную среду.
Было проведено изучение регенерационной способности раз¬
личных изолированных тканей Cymbidium (табл. 4.24). При ис¬
пользовании в качестве эксплантов апикальных меристем ско-
315
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.65. Схема микроразмножения Cymbidium hybr. спящими почками
вегетирующего туберидия:
а, в — растения-регенеранты; б, г, д — формирование вторичных протокормов, при¬
годных для дальнейшего микроразмножения
рость образования протокормов зависела от размера экспланта,
питательной среды и соотношения фитогормонов в ней. Значи¬
тельно сокращает время формирования протокормов добавление
к питательной среде цитокининов (аденина, БАП, кинетина) в
концентрации 2—5 мг/л. Более высокие концентрации цитоки¬
нинов (8—10 мг/л) вызывали образование адвентивных побегов.
Пазушные почки отрастающего побега на питательной среде
Кнудсона с аденином формировали протокормы, а без фитогормо¬
нов — побеги. У сегментов корней и листьев вегетирующих расте¬
ний ни одним из известных методов индуцировать морфо- или
органогенез не удалось. Аналогичные результаты были получены
при культивировании in vitro различных сегментов цветка (лепест¬
ков, губы, колонки) и. сегментов изолированных корней и листьев.
316
ГЛАВА 4. Методы размножения тропических и субтропических растений
Иными были результаты культивирования частей побегов
Cymbidium, полученных в культуре in vitro. Протокормы, как пра¬
вило, образовывались в пазухах листьев. Неразделенные прото¬
кормы формировали побеги. Увеличение концентрации цитоки¬
нинов в среде до 8 мг/л приводило к образованию адвентивных
побегов второго и третьего порядков у основания исходного. Од¬
нако дальнейшее увеличение концентрации цитокининов спо¬
собствовало формированию побегов с ненормальной морфологи¬
ей и без корневой системы.
Спящие почки туберидиев и почки возобновления в зависи¬
мости от концентрации фитогормонов в среде также регенериро¬
вали побеги или протокормы. При культивировании апикальных
меристем Cymbidium в жидкой среде в роллере (60 об/мин) фор¬
мировались многовершинные протокормы, которые делили и по¬
лучали новые протокормы и побеги.
В результате проведенных нами исследований определены
два метода микроразмножения Cymbidium'. индукция образования
протокормов из апикальных и латеральных меристем отрастаю¬
щих молодых побегов; индукция образования протокормов и
побегов из спящих почек отмирающих туберидиев и вегетирую¬
щих побегов. Наиболее рационален, на наш взгляд, первый метод,
Таблица 4.24. Морфогенетический потенциал различных эксплантов Cymbidium
Эксплант
Количество,
Образовавшиеся структуры,
% общего количества
шт.
Неразвившиеся
экспланты
Протокормы
Побеги
Верхушка отрастающего по¬
бега
Пазушные почки отрастаю¬
20
5
65
30
щего побега
Спящие почки туберидиев
20
50
60
0
вегетирующих
20
10
40
50
отмирающих
20
20
20
60
Сегменты листьев
40
0
0
0
Сегменты корней
Элементы цветка (губа, ле¬
40
70
25
5
пестки, колонка)
Сегменты изолированных
30
0
0
0
листьев и корней
20
0
0
0
Сегменты изолированных
побегов
30
4
66
30
317
СПЕЦИАЛЬНАЯ ЧАСТЬ
поскольку он обеспечивает получение большого количества про¬
токормов, являющихся основной структурой при микроразмно¬
жении.
Оптимизация условий клонального размножения Cymbidium
hybr. методами математического планирования эксперимента. Как
отмечалось выше, в результате экспериментальных исследований
были выбраны оптимальные экспланты для размножения
Cymbidium. Однако перед нами также стояла задача оптимизиро¬
вать все этапы размножения с целью увеличения его эффектив¬
ности. Решая этот вопрос, мы могли идти традиционным путем
эмпирического подбора различных факторов и их комбинаций, что
представляло бы собой большую и трудоемкую задачу, требующую
значительного количества времени.
В настоящее время благодаря разработанной теории матема¬
тической оптимизации условий эксперимента появилась возмож¬
ность ускорить и облегчить эту задачу, сделав результаты более
информативными. Использование методов математического пла¬
нирования эксперимента позволяет за небольшой срок опреде¬
лить оптимальные условия и изучить зависимость размножения от
многих факторов и их взаимодействий.
Широкое применение данный метод нашел еще в начале
1980-х годов при оптимизации условий культивирования калпусных
культур многих видов растений: женьшеня (Писецкая, 1971), са¬
харной свеклы (Бутенко и др., 1972), пшеницы (Хотылева и др.,
1979) и др.
Несмотря на большую эффективность этого метода, сообще¬
ний об оптимизации питательных сред при клональном размно¬
жении растений с его помощью нами обнаружено мало. Морфо¬
генез является очень сложным многоступенчатым процессом, за¬
висящим от большого количества факторов, возможно, разных на
всех этапах. Поэтому определить самые важные из них довольно
трудно. Кроме того, не исключена возможность, что некоторые из
них могут остаться неучтенными.
В литературе нам удалось обнаружить несколько сообщений
об оптимизации питательных сред при клональном размножении.
Так, С.Е. Морозовой (1981) для культивирования изолированных
апексов картофеля разных сроков созревания с помощью метода
математического планирования эксперимента были подобраны
два типа оптимальных питательных сред. Особый интерес вызы¬
вают данные, полученные Н.В. Катаевой (1982) при оптимизации
питательных сред для культуры тканей герберы и фрезии. В ре¬
318
ГЛАВА 4. Методы размножения тропических и субтропических растений
зультате проведенных ею исследований были подобраны опти¬
мальные среды для всех этапов размножения этих культур. Сле¬
дует отметить, что автору с помощью методов математического
планирования эксперимента удалось заменить дорогостоящие ком¬
поненты и подобрать оптимальные концентрации фитогормонов.
Это позволило разработать наиболее экономичную технологию
для данных культур, что обеспечило высокую рентабельность ме¬
тода.
В доступной нам литературе мы не нашли ни одного сообще¬
ния об оптимизации питательных сред для клонального размно¬
жения растений семейства орхидных. Согласно литературным
данным, в настоящее время известно более 20 питательных сред
для культивирования изолированных тканей орхидных, предложен¬
ных различными исследователями. Все они, как правило, содер¬
жат минеральные соли по Кнудсону или Мурашиге—Скугу и раз¬
личные биологически активные вещества и фитогормоны. Кроме
того, в состав многих сред входят кокосовое молоко, гомогенат
банана, различные соки и другие дорогостоящие компоненты
(табл. 4.25).
В то же время проведенные нами предварительные исследо¬
вания показали, что на регенерационную способность изолиро¬
ванных тканей и протокормов Cymbidium влияют состав среды, ее
консистенция и концентрация физиологически активных ве¬
ществ, а также условия культивирования.
Влияние каждого из этих факторов, а тем более их взаимо¬
действие трудно оценить постановкой опытов по обычной схеме.
Поэтому для оптимизации микроразмножения Cymbidium мы
применили метод математического планирования эксперимента,
проводимый в строго контролируемых условиях.
Как уже отмечалось, в процессе работы нам приходилось
сталкиваться с определенными затруднениями, прежде всего вы¬
званными воздействием стерилизующих веществ. Для получения
стерильных культур мы применяли жесткий режим стерилизации.
В связи с этим многие экспланты оказывались нежизнеспособ¬
ными, поэтому их первоначально высаживали на среду Кнудсо¬
на, а через неделю отбирали стерильный и жизнеспособный ма¬
териал.
В опыте мы использовали как апикальные, так и латеральные
меристемы молодых побегов. Для уменьшения ошибки равно¬
мерно распределяли материал по вариантам опыта. Для оптими¬
зации второго этапа микроразмножения протокормы культиви-
319
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.25. Состав питательных сред, используемых для культивирования
эксплантов Cymbidium, мг/л
Компонент
Культивирование
эксплантов
Размножение
Почки
туберидиев “
Сегменты
листьев "
протокор¬
мов
растений
Макроэлементы по
Мурашиге—Скугу *4
50,0
50,0
50,0
50,0
№2ЭДТА
37,3
37,3
37,3
37,8
FeS04 7Н20
27,8
27,8
27,8
27,9
Микроэлементы по
Мурашиге—Скугу *4
1,0
1,0
1,0
1,0
Инозит
100,0
100,0
100,0
100,0
Глицин
—
2,0
2,0
2,0
Никотиновая кислота
—
0,5
0,5
0,5
Пиридоксин
—
0,5
0,5
0,5
Тиамин
0,1
0,1
0,1
0,5
Кокосовое молоко *5
—
100,0
100,0
150,0
Гидролизат казеина
—
—
—
2000,0-3000,0
Триптон
—
—
—
3000,0-4000,0
ИУК
1,9
—
—
—
Кинетин
2,2
—
—
0,215
НУК
—
5,0
—
1,86
Сахароза
—
30 000,0
30 000,0
40 000,0
Глюкоза
30 000,0
—
—
—
''Среда Tran-Thanh-Van (1974). *2 Среда Muraschige-Skoog (1962). ‘J Среда
Fonnesbech (1972). ‘4 Способ приготовления концентрированных растворов
изложен в предыдущих главах. *5 В миллилитрах на 1 л.
ровали на простой среде без фитогормонов, затем уже в боксе раз¬
резали их на части, взвешивали и равномерно распределяли по ва¬
риантам опыта. Для определения минимальной массы фрагмента
протокорма был поставлен специальный опыт, позволивший уста¬
новить, что начальная масса протокорма в эксперименте должна
быть не менее 30 мг. Кроме того, в задачу исследования входило
также определение условий культивирования, при которых дос¬
тигалась максимальная скорость размножения. К тому же среды
не должны были содержать дорогостоящие компоненты. При
анализе результатов отбирались значимые факторы, положитель¬
ное действие которых было несомненным.
Весь процесс оптимизации микроразмножения Cymbidium мы
разделили на два этапа. Первый — подбор оптимальной питатель¬
ной среды и условий культивирования для образования протокор¬
320
ГЛАВА 4. Методы размножения тропических и субтропических растений
мов из изолированных меристематических тканей. Второй — оп¬
тимизация питательной среды и условий размножения протокор¬
мов. Каждый из этих этапов имел свои задачи и требования.
Оптимизация питательной среды и условий образования первич¬
ных протокормов. Предварительно проведенные исследования по¬
казали, что образование протокормов из меристематических тка¬
ней происходит очень медленно и зависит от целого комплекса
факторов. В связи с этим определены следующие задачи оптими¬
зации: увеличить скорость образования протокормов и изучить
зависимость процесса от влияния трофических и гормональных
факторов среды. Для этого были поставлены несколько опытов
по схеме полного факторного эксперимента (ПФЭ-23) с целью
изучения влияния таких факторов: консистенция среды (твердая
и жидкая), наличие в среде фитогормонов (БАП, НУК, 2,4-Д,
кинетин) и их сочетаний, условия культивирования (свет, темно¬
та) (табл. 4.26). При выборе основного уровня и единицы варьи¬
рования факторов исходили из данных опытов по изучению
морфогенеза изолированных тканей Cymbidium. Критериями оп¬
тимизации были размер и масса образовавшихся протокормов.
Каждый фактор исследовали на двух уровнях — верхнем (+) и
нижнем (-) (табл. 4.27). Все изучаемые вещества использовали в
качестве компонентов питательной среды как независимо друг от
друга, так и совместно согласно применяемой матрице планиро¬
вания (табл. 4.28). Основой питательной среды были минераль¬
ные соли по Мурашиге—Скугу, витамины, 0,7%-й агар. Каждый
вариант опыта имел 5 повторностей.
Каждый фактор и его взаимодействия оценивали с помощью
коэффициентов регрессии (/»,•). Их значения находили по схеме
Иейтса для полного факторного эксперимента (Максимов, 1980).
Положительный знак коэффициента регрессии указывает на
стимуляцию, отрицательный — на ингибирование процесса.
Для статистической оценки значимости факторов находили дис¬
персию воспроизводимости опыта и дисперсию коэффициента
регрессии s2{b,} по формулам, указанным в работе В.Н. Максимова и
соавт. (1969). Анализируя полученные коэффициенты регрессии и
их значимость, оценивали влияние каждого фактора и межфактор-
ные взаимодействия на процесс образования протокормов. Значи¬
мыми являются те факторы, для которых соблюдается неравенство
Ь > tv s2{bj}, т. е. абсолютное значение коэффициента регрессии
Должно превышать произведение критерия Стьюдента (t = 3,50 при
Уровне значимости Р = 99 %) на дисперсию коэффициента регрессии.
321
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.26. Схема полного факторного эксперимента
Фактор
Уровень фактора
+
-
Среда МС (дс,)
БАП (х2)
НУК (jt3)
Условия освещения (х,)
Сахароза (х2)
Цитокинин + ауксин (х3)
Эксперимент 1
Жидкая
5.0 мг/л
2.0 мг/л
Эксперимент 2
Свет (4000 лк)
2 %
БАП + НУК (2 мг/л +
+ 2 мг/л)
Твердая
0,5 мг/л
0,2 мг/л
Темнота
0,2 %
Кинетин + 2,4-Д (1 мг/л +
-1- 1 мг/л)
Примечание. Здесь и в табл. 4.27, 4.30, 4.32, 4.33, 4.35: (+) — верхний
уровень, (-) — нижний уровень.
Таблица 4.27. Матрица планирования полного факторного эксперимента
Вариант
опыта
Фактор
Вариант
опыта
Фактор
*\
х2
*3
*\
xi
Ху
1
_
_
_
5
__
+
2
+
-
-
6
+
-
+
3
-
+
-
7
-
+
+
4
+
+
—
8
+
+
+
Таблица 4.28. Результаты полного факторного эксперимента
Вари¬
ант
опыта
Эксперимент 1
Эксперимент 2
Фактор
Средний размер
протокормов, мм
Коэффициент
регрессии (/>,)
Средний размер
протокормов, мм
Коэффициент
регрессии (£,)
1
2,20
2,28
3,60
3,18
1
2
1,50
0,62
6,60
1,18
Х\
3
1,76
0,03
2,80
-0,10
*2
4
2,25
0,22
6,70
0,15
X,, *2
5
1,50
0,34
0,54
-1,75
Ху
6
3,80
0,66
2,40
-0,35
Х|, Ху
7
1,20
-0,06
0,32
0,08
ХЪ Ху
8
4,00
-0,09
2,50
-0,08
X,, хъ Ху
322
ГЛАВА 4. Методы размножения тропических и субтропических растений
В табл. 4.28 представлены результаты двух опытов и значения
коэффициентов регрессии для факторов и межфакторных взаи¬
модействий, рассчитанных по схеме Иейтса. Статистический
анализ результата опыта 1 показал, что значимы при 1%-м уровне
только положительные эффекты факторов х, и х3 и их взаимодейст¬
вие, так как с учетом величины дисперсии воспроизводимости, оп¬
ределенной во всех вариантах опытов 1 и 2 (i,2M = 0,08646), усло¬
вие значимости выражается неравенством /bj > 0,270. Этому не¬
равенству соответствуют коэффициенты регрессии в вариантах 2,
5, 6 опытов 1 и 2 (табл. 4.28). Уравнение регрессии, описывающее
результаты опыта 1, имеет вид:
у = 2,28 + 0,62х, + 0,34х3 + 0,66лг,дг3. (1)
Из этого следует, что наилучшие результаты получаются при
культивировании в роллере и добавлении в среду 2 мг/л НУК.
При культивировании в неподвижной среде (в пробирках) увели¬
чение концентрации НУК вызывает некоторое снижение роста, а
при низкой ее концентрации в среде рост протокормов практиче¬
ски одинаков (различие статистически недостоверно) как в ролле¬
рах, так и в пробирках. Изменение концентрации БАП в 10 раз
существенно не влияет на рост протокормов в этом опыте.
В опыте 2 обнаруживаются значимые эффекты факторов х, и
х3, причем эффект первого (разница в росте на свету и в темноте)
положителен, а эффект третьего — отрицателен. Зафиксирован
также сравнительно слабый (но достоверный) эффект взаимодей¬
ствия этих факторов. Соответствующее уравнение регрессии име¬
ет вид:
у = 3,18 + 1,38х, - 1,75*3 - 0,35xix3. (2)
Таким образом, наилучший рост должен наблюдаться при
культивировании на свету с добавлением в среду кинетина и 2,4-Д
(см. результаты опыта 2 в табл. 4.28, варианты 2 и 4). Увеличение
в 10 раз по сравнению с нижним уровнем концентрации сахаро¬
зы (фактор х2) не влияло на рост протокормов.
Проведенные исследования показали, что для образования
протокормов Cymbidium оптимальна жидкая питательная среда
МС с добавлением БАП и НУК (по 2 мг/л). Положительный эф¬
фект при внесении сахарозы выявить не удалось. При культиви¬
ровании изолированных меристематических тканей Cymbidium
необходимыми условиями являются свет и жидкая перемеши¬
вающая (в роллере) среда.
323
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.29. Схема экспериментов, поставленных по методу случайного баланса
Фактор
Уровень фактора
+
-
Среда (*,)
Мурашиге—Скуга
Кнудсона
Сахароза, % (х2)
4,0
2,0
Глюкоза, % (х3)
4,0
2,0
Мезо-инозит, мг/л (х4)
80,0
0
Тиамин, мг/л (х5)
1,0
0
Никотиновая кислота, мг/л (х*)
0,5
0
Пиридоксин, мг/л (х7)
0,5
0
Кинетин, мг/л (х8)
2,0
0
БАП, мг/л (л?)
1,0
0
НУК, мг/л (jc,q)
1,0
0
Картофельный экстракт, % (*,,)
15,0
0
Дрожжевой экстракт, мг/л (х,2)
1000,0
0
Гидролизат казеина, мг/л (х13)
500,0
0
Консистенция среды (х,4)
Твердая
Жидкая
Таблица 4.30. Матрица планирования эксперимента по методу случайного балан
Вариант
опыта
Фак
*\
X,
*3
*4
*5
*7
1
_
_
+
+
+
+
2
+
-
-
+
-
-
-
3
-
+
-
+
+
-
4
+
+
+
+
+
+
-
5
-
-
-
-
-
+
+
6
+
-
+
-
+
+
+
7
-
+
+
-
-
+
+
8
+
+
-
-
-
-
-
9
-
-
+
-
-
+
-
10
+
-
-
-
-
+
-
11
-
+
-
-
+
-
+
12
+
+
+
-
+
-
-
13
-
-
-
+
+
+
-
14
+
-
+
+
-
-
+
15
-
+
+
+
-
-
+
16
+
+
-
+
+
+
+
324
ГЛАВА 4. Методы размножения тропических и субтропических растений
Оптимизация питательной среды и условий размножения прото¬
кормов цимбидиума. Для оптимизации питательной среды второго
этапа микроразмножения были выбраны факторы (вещества),
наиболее часто встречающиеся в прописях сред и способствую¬
щие ускоренному размножению полученных в предыдущем экс¬
перименте протокормов. Основным критерием этого этапа слу¬
жил прирост массы протокормов.
Оптимизацию питательной среды мы начали с проведения
эксперимента по методу случайного баланса (отсеивающий экспе¬
римент). Все вещества испытывались на двух уровнях (табл. 4.29).
Реализацию эксперимента осуществляли согласно соответствую¬
щей матрице планирования (табл. 4.30).
Отсев существенных факторов проводили с помощью диа¬
грамм рассеяния (Налимов, 1971). На первом этапе был выделен
единственный значимый фактор — х14 с отрицательным эффек¬
том, который показывает, что в жидкой среде наблюдался более
интенсивный прирост массы протокормов, чем на твердой. После
исключения этого фактора на втором этапе удалось выявить поло¬
жительные эффекты добавления в среду никотиновой кислоты (л*),
кинетина (х*) и картофельного экстракта (*,,). Эффекты остальных
факторов оказались статистически незначимы.
са и результаты опытов
тор
Масса
*8
*9
*10
*11
*12
*1?
*14
протокормов, мг
—
+
+
+
_
+
50
-
-
+
-
-
-
+
88
+
+
+
+
-
+
-
149
-
+
+
-
+
-
+
83
+
-
—
+
—
-
-
318
-
+
+
+
-
+
+
105
-
+
+
—
+
+
-
120
+
-
-
+
-
-
-
137
+
-
+
+
+
+
+
50
-
-
—
—
—
+
+
83
-
+
—
—
—
-
-
113
-
-
—
_
-
+
-
145
+
-
+
+
+
+
-
304
+
+
-
+
+
-
-
130
+
+
+
-
+
+
+
82
+
-
-
+
-
+
94
325
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.31. Схема экспериментов, поставленных
по симплексно-суммнруемому плану второго порядка
Фактор
Уровень фактора
+
-
0
Среда (*,)
Картофельный экстракт, % (х2)
Кинетин, мг/л (х3)
Никотиновая кислота, мг/л (дс4)
Сахароза, % Сх5)
Аденин, мг/л (хь)
Фолиевая кислота, мг/л (х7)
Прасада—
Митры
30.0
6.0
5.0
2.0
8,0
1,0
Кнудсона
0
0
0,5
0
0
0
Прасада—
Митры
15.0
3.0
2,75
1.0
4,0
0,5
Наибольшим из них был отрицательный эффект фактора х2. По¬
скольку нижним уровнем факторов х4 и х|3 было их отсутствие в
среде, можно заключить, что добавлять в среду вещества, не ока¬
зывающие существенного влияния на прирост протокормов, не
нужно. Это .мезо-инозит, тиамин, пиридоксин, БАП, НУК, дрож¬
жевой экстракт и гидролизат казеина. Для роста протокормов
оказалось практически безразличным, на какой из двух сред —
Кнудсона или МС — проводили культивирование. По-видимому,
неэффективным было и увеличение в 2 раза концентрации саха¬
розы и глюкозы.
Следующая серия опытов была поставлена по симплексно-
суммируемому плану второго порядка, который включал 7 факто¬
ров, выделенных в предыдущем эксперименте (табл. 4.31).
Эксперимент проводили на двух средах — твердой и жидкой. В
жидкой среде протокормы выращивали на мостиках из фильтро¬
вальной бумаги. В опыте использовали жидкую и твердую среды
Кнудсона и Прасада—Митры. Критериями служили прирост мас¬
сы протокормов и количество регенерировавших растений. Прото¬
кормы взвешивали до и после окончания опыта (повторность опы¬
та — пятикратная), прирост их массы учитывали после 1 мес куль¬
тивирования. Влияние 7 различных факторов изучали в 37 вариан¬
тах по соответствующей матрице планирования (табл. 4.32).
Статистическая обработка результатов эксперимента позволи¬
ла представить данные, полученные в жидкой питательной среде,
в виде следующего уравнения регрессии:
у = 54,82 - 5,07 х] - 5,94 х2 + 6,79X4X7 + 7,85 х42 + 3,98х5 + 5,27 х] (3)
326
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.32. Матрица планирования эксперимента
по симплексно-суммируемому плану второго порадка и результаты опытов
Вариант
Фактор
Средний прирост массы
протокормов, мг
опыта
*3
*4
*5
*6
*7
Твердая среда
Жидкая среда
1
_
_
_
_
+
+
+
109,6
46,2
2
+
-
-
+
-
+
-
40,5
49,6
3
-
+
-
+
+
-
-
181,8
35,6
4
+
+
-
-
-
-
+
66,8
47,0
5
-
-
+
+
-
-
+
40,8
47,4
6
+
-
+
-
+
-
+
94,8
55,4
7
-
+
+
-
-
+
-
48,0
39,0
8
+
+
+
+
+
+
+
208,2
60,4
9
0
-
-
0
0
+
0
92,8
39,5
10
-
0
-
0
+
0
0
156,6
42,0
11
0
0
-
-
0
0
+
154,2
23,4
12
-
-
0
0
0
0
+
83,2
38,0
13
0
-
0
-
+
0
0
110,0
53,7
14
-
0
0
-
0
+
0
166,0
46,8
15
0
0
0
0
+
+
+
256,4
66,0
16
0
0
-
+
0
0
-
167,6
40,8
17
+
0
-
0
-
0
0
73,5
37,8
18
0
-
0
+
-
0
0
40,5
51,0
19
+
-
0
0
0
0
-
114,6
39,4
20
0
0
0
0
-
+
-
48,0
58,0
21
+
0
0
+
0
+
0
124,8
38,2
22
0
+
-
0
0
-
0
1,48
41,6
23
-
0
0
+
0
-
0
124,6
48,4
24
0
0
0
0
+
-
-
119,6
56,0
25
-
+
0
0
0
0
-
173,8
54,8
26
0
+
0
+
+
0
0
220,6
78,4
27
0
0
0
0
-
-
+
42,5
46,4
28
+
0
0
-
0
-
0
116,6
51,4
29
0
+
0
-
-
0
0
103,7
53,4
30
+
0
0
0
0
0
+
161,8
45,0
31
0
-
+
0
0
—
0
93,4
21,0
32
-
0
+
0
—
0
0
65,8
31,0
33
0
0
+
+
0
0
+
53,4
58,0
34
0
0
+
-
0
0
-
89,2
44,2
35
0
+
+
0
0
+
0
137,0
41,0
36
0
+
+
0
0
+
0
191,7
48,0
37
Конт¬
роль
0
0
0
0
0
0
0
158,8
80,0
53,2
85,0
327
СПЕЦИАЛЬНАЯ ЧАСТЬ
Квадрат множественного коэффициента корреляции для это¬
го уравнения равен 0,479. Следовательно, выявленная зависи¬
мость объясняет только 47,9 %, т. е. чуть меньше половины всего
рассеяния результатов. Остальное рассеяние, по-видимому, свя¬
зано только со случайными колебаниями между повторением ва¬
риантов или какими-то факторами, которые в плане эксперимен¬
та не учитывались.
Из полученного уравнения можно сделать следующие выводы.
Отсутствие в нем факторов *2 и % говорит о том, что в жидкой
среде не обнаруживается эффект добавления в среду картофель¬
ного экстракта и аденина. Для факторов *, и *3 в уравнении имеют¬
ся только квадратичные члены с отрицательными коэффициен¬
тами. Очевидно, наилучшие результаты достигаются на среднем
уровне этих факторов (табл. 4.33). Таким образом, минеральный
состав среды лучше выбирать как промежуточный между соста¬
вом сред Кнудсона и Прасада—Митры, а добавление кинетина
оптимально в концентрации 3 мг/л. Для х5 (сахароза) в уравне¬
нии есть и линейные, и квадратичные члены, и оба они положи¬
тельны. Это значит, что концентрация сахарозы на верхнем уровне
еще недостаточна и ее оптимум лежит выше 2 %. Фактор х4 имеет
в уравнении положительный квадратичный эффект и в то же
время взаимодействует с фактором х7. Поэтому можно утвер¬
ждать, что оптимальные концентрации никотиновой и фолиевой
кислот также находятся в области более высоких значений, чем
те, что изучались в данном эксперименте.
При культивировании на твердой питательной среде результа¬
ты описываются уравнением
у - 160,51 + 45,53*2 — З0,25*3*4 + 64,36*5 - 22,70 х52 +
+ 36,25*5*6 + 26,69*5*7, (4)
которое объясняет уже 82,1 % общего рассеяния, т. е. заслужива¬
ет большего доверия, чем предыдущее.
В уравнении отсутствуют члены с *,, следовательно, на всех трех
средах результаты практически одинаковы. Квадратичный член с
отрицательным коэффициентом есть у х$, т. е. оптимальную кон¬
центрацию можно рассчитать только для сахарозы. При этом мы
учитывали, что *5 имеет положительный эффект и входит во взаи¬
модействие с *6 и *7, тоже положительными. Поэтому оптимум
для сахарозы будет при условии, что концентрации аденина и фо¬
лиевой кислоты достигнут верхнего уровня. В таком случае зависи-
328
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.33. Матрица планирования эксперимента по плану В,
с полурепликой и результаты опытов
Вариант
опыта
Фактор
Прирост массы протокормов, мг
х2
*3
*4
*5
Твердая среда
Жидкая среда *
1
_
_
_
+
78
75
2
+
-
-
-
-
115
127
3
-
+
-
-
-
85
65
4
+
+
-
-
+
151
120
5
-
-
+
-
-
77
80
6
+
-
+
-
+
142
97
7
-
+
+
-
+
71
63
8
+
+
+
-
-
119
128
9
-
-
-
+
-
84
84
10
+
-
-
+
+
100
192
11
-
+
-
+
+
105
112
12
+
+
-
+
-
137
153
13
-
-
+
+
+
82
47
14
+
-
+
+
-
124
126
15
-
+
+
+
-
92
41
16
+
+
+
+
+
100
128
17
-
0
0
0
0
85
53
18
+
0
0
0
0
130
119
19
0
-
0
0
0
93
106
20
0
+
0
0
0
119
96
21
0
0
-
0
0
125
93
22
0
0
+
0
0
97
83
23
0
0
0
-
0
127
77
24
0
0
0
+
0
110
100
25
0
0
0
0
-
114
109
26
0
0
0
0
+
93
97
27
0
0
0
0
0
105
102
Конт¬
роль
59
39
Жидкая среда с подложками из пенополиуретана.
мость прироста описывается уравнением у = 127,29 + 22,70 х\ . Отсю¬
да оптимум х$ = 2,80, что соответствует концентрации сахарозы 3,6 %.
Фактор х2 имеет в уравнении положительный линейный эф¬
фект, а квадратичного не имеет. Поэтому можно предположить,
что оптимум для картофельного экстракта находится в области
не менее чем 30 %.
329
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.34. Схема эксперимента, поставленного по плану Бокса—Бенкена
Фактор
Уровень фактора
+
-
0
Картофельный экстракт, % (*,)
50,0
0
25,0
Никотиновая кислота, мг/л (х2)
9,5
0,5
5,0
Сахароза, % (х3)
6,0
0
3,0
Аденин, мг/л (х4)
16,0
0
8,0
Фолиевая кислота, мг/л (х5)
4,0
0
2,0
В связи с этим для постановки следующего эксперимента был
выбран план Бокса—Бенкена, в котором количество опытов су¬
щественно больше, чем в предыдущем плане В5, а опыт в центре
эксперимента повторяется 6 раз. Условия кодирования перемен¬
ных в этом плане приведены в табл. 4.34, матрица планирования
и результаты эксперимента — в табл. 4.35.
Полученные в ходе эксперимента данные можно представить
в виде следующего уравнения регрессии:
у = 227 + 18*1 + 22*з + 21*,*3 - 26jc2jc3— 31*2*4 - 21*2*5 +
+ 31*2*4 - 21*2*5 + 31*4* - 54 *,2 - 25 *22 - 58 *32 - 35 *4 - 26 *52. (5)
Анализ уравнения показывает, что в нем все квадратичные
эффекты значимы и имеют знак что позволят нам рассчи¬
тать оптимальные значения для всех пяти факторов. В кодиро¬
ванных переменных эти значения составляют: *, = 0,002, х2 = 4,63,
*з = -0,85, *4 = -3,91, *5 = -4,2. При переходе от кодированных
значений к натуральным получим для факторов *4 и *5 отрица¬
тельные значения коэффициентов регрессии аденина и фолиевой
кислоты. Это может свидетельствовать о том, что оптимум возмо¬
жен и при отсутствии в среде данных компонентов. Чтобы его най¬
ти, необходимо подставить в уравнение (5) значения *4 = -1 и *5 =
= -1, тогда получим новое уравнение:
у = 197 + 18*, + 22*з + 21*|*з - 26*2*3 + 52*2 - 54 *2 - 25 *2 - 58 *32 •
(6)
Из этого уравнения оптимальные значения кодированных пе¬
ременных следующие: *, = 0,164, *2 = 1,05, *3 = 0,016. При пере¬
ходе к натуральным значениям получаем, что оптимальные соот¬
ношения составляют: 29 % картофельного экстракта, 9,7 мг/л
никотиновой кислоты, 2,95 % сахарозы. Исходя из этих значений
330
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.35. Матрица планирования эксперимента по плану Бокса—Бенкена
и результаты опытов
Вариант
Фактор
Прирост массы
опыта
х2
*3
*4
*5
протокормов, мг
1
_
—
0
0
0
141
2
+
-
0
0
0
126
3
-
+
0
0
0
102
4
+
+
0
0
0
113
5
0
0
-
-
0
193
6
0
0
+
-
0
144
7
0
0
-
+
0
73
8
0
0
+
+
0
82
9
0
-
0
0
-
168
10
0
+
0
0
-
242
11
0
-
0
0
+
173
12
0
+
0
0
+
163
13
-
0
-
0
0
108
14
+
0
-
0
0
106
15
-
0
+
0
0
112
16
+
0
+
0
0
196
17
0
0
0
-
-
140
18
0
0
0
+
-
161
19
0
0
0
-
+
105
20
0
0
0
+
+
225
21
0
-
-
0
0
76
22
0
+
-
0
0
172
23
0
-
+
0
0
193
24
0
+
+
0
0
186
25
-
0
0
-
0
116
26
+
0
0
-
0
187
27
-
0
0
+
0
147
28
+
0
0
+
0
149
29
0
0
-
0
-
100
30
0
0
+
0
-
179
31
0
0
—
0
+
118
32
0
0
+
0
+
132
33
—
0
0
0
-
105
34
+
0
0
0
-
174
35
-
0
0
0
+
119
36
+
0
0
0
+
191
37
0
—
0
_
0
165
38
0
+
0
—
0
205
39
0
—
0
+
0
199
40
0
+
0
+
0
115
41
Конт¬
роль
0
0
0
0
0
228
82
331
СПЕЦИАЛЬНАЯ ЧАСТЬ
по уравнению (6) и при таком составе среды следует ожидать
прироста протокормов в среднем на 225 мг.
Однако анализ уравнения (5) показывает, что найденный та¬
ким образом локальный оптимум может быть не единственным.
Следует отметить, что факторы х4 и % входят в уравнение только во
взаимодействии с фактором х2, а значимых линейных коэффици¬
ентов не имеют (табл. 4.35).
Если принять ;с4 и х5 равным +1, то из уравнения (5) получим:
у = 197 + 18*1 +22х3 + 21дс,х3 - 26хгх} - 52х2 - 54 х^ - 25 х2 - 58 xj .
(7)
Из уравнения (7) следует, что линейный коэффициент факто¬
ра х2 имеет противоположный знак по сравнению с уравнени¬
ем (6). Исходя из этого возможен вариант, когда из среды исключе¬
на никотиновая кислота, но необходимо наличие в ней аденина и
фолиевой кислоты. Для определения наилучших сочетаний фак¬
торов в данных условиях подставим в уравнение (5) значение х2 =
— —1,111 и получим новое уравнение:
у = 196 + 18х| + 22;с3 + 2lxtx} + 29х} + 34х4 + 23х5 + 31х4х5 -
- 54 xf - 58 х22 - 35 х] - 26 х52, (8)
согласно которому оптимальные концентрации составляют: 32 %
картофельного экстракта, 4,5 % сахарозы, 15,5 мг/л аденина и
4 мг/л фолиевой кислоты. Ожидаемый прирост массы протокор¬
мов при этом в среднем равен 240 мг, т. е. практически такой же,
как и в варианте, рассчитанном по уравнению (6). В результате
получаем два практически равноценных состава сред: один с ни¬
котиновой кислотой без аденина и фолиевой кислоты, другой —
с противоположным сочетанием этих факторов.
Таким образом, в результате оптимизации нами определены
два варианта питательных сред, положительно влияющих на об¬
разование и размножение протокормов Cymbidium (табл. 4.36).
С учетом изложенного выше был поставлен опыт по проверке
двух вариантов рассчитанных в эксперименте оптимальных сред,
результаты которых представлены в табл. 4.37 и 4.38.
Анализируя приведенные в табл. 4.37 результаты, можно пред¬
положить, что рассчитанный теоретически по уравнению (5) при¬
рост массы протокормов соответствует полученному практически в
эксперименте. Данные табл. 4.38 свидетельствуют о том, что наи¬
больший прирост массы протокормов наблюдается при внесении
332
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.36. Состав питательных сред, используемых
для микроразмножения Cymbidium, мг/л
Компонент
Среда
исходная
оптимизированная
№ 1
№ 2
Ca(N03)2 • 4Н20
1000,0
1000,0
1000,0
кн2ро4
250,0
250,0
250,0
MgS04
250,0
250,0
250,0
FeS04 4Н20
25,0
25,0
25,0
(NH4)2S04
500,0
500,0
500,0
MnS04 4Н20
7,5
7,5
7,5
Гидролизат казеина
200,0
—
—
Дрожжевой экстракт
200,0
—
—
L-Аспарагин
3,0
—
—
Аденин
3,0
—
15,5
Тиамин — НС1
0,1
—
—
Фолиевая кислота
0,1
—
4,0
Никотиновая кислота
—
9,7
—
Кинетин
0,3
—
—
ИУК
0,1
—
—
Сахароза
20 000,0
29 500,0
45 000,0
Картофельный экстракт *
—
290,0
320,0
' В миллилитрах на 1 л.
в среду 40 % картофельного экстракта, что также близко к рас¬
считанному теоретически.
Таким образом, проведенные эксперименты позволяют с
большой степенью достоверности говорить о том, что разрабо¬
танные нами питательные среды действительно являются опти¬
мальными для размножения протокормов Cymbidium.
Таблица 4.37. Зависимость прироста массы протокормов Cymbidium
от типа питательной среды
Среда
Прирост массы протокормов, мг
рассчитанный по уравнению
полученный в опыте
Исходная
Оптимизированная
№ 1
№ 2
60,0 ± 1,1
240.0 ± 1,22
225.0 ± 0,57
66.0 ± 1,25
251.0 ± 1,34
230.0 ± 0,64
333
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.38. Зависимость прироста массы протокормов от содержания
картофельного экстракта в оптимизированной питательной среде Кнудсона
Вариант
опыта
Количество
картофельного
экстракта, %
Прирост
массы прото¬
кормов, мг
Вариант
опыта
Количество
картофельного
экстракта, %
Прирост
массы прото¬
кормов, мг
1
20
787,0 ± 0,93
4
50
978,0 ± 0,72
2
30
897,0 ± 1,43
5
60
934,0 ± 2,3
3
40
1017,5 ± 1,14
6
100
304,0 ± 1,27
В настоящее время в мире насчитывается сотни сортов и гиб¬
ридов Cymbidium. В коллекции НБС НАН Украины имеется
около 60 сортов. В результате проведенного изучения их призна¬
ков — продуктивности цветения, декоративности, скорости раз¬
множения, сроков цветения, поражаемости болезнями и вредите¬
лями — нами было выделено для массового размножения и вне¬
дрения в промышленное цветоводство 17 сортов. По срокам цве¬
тения их можно распределить в следующем порядке: раннецвету¬
щие (ноябрь—декабрь) — Paciefic ’PearP, Kurun ’Troubadour4, Orient
Legend ’Princess Rose1, Christmas Beauty ’St. Francis1, Orient Legend
’Cinnamon4; среднецветущие (январь—февраль) — Alexalban ’The
Bride1, Huber Camboume ’Benita4, Lilian Stewart ’St. Sherrie4, Angelica
’Advent4, Showgirl ’Mem. Rose Greer4, Cooksbridge ’Pinkie4, Lilian Ste¬
wart ’Gold4; позднецветущие (март—апрель) — Clarisse Carlton ’Ma¬
jestic4, Lump of Gold ’Glitter4, Caretta ’Fantaisie4,’Sirius4, ’Leo Liles4.
Проведенное нами изучение сортов Cymbidium в культуре in
vitro показало, что их регенерационная способность зависит от
генотипа растения, тип морфогенеза — от вида, концентрации и
соотношения фитогормонов в среде (рис. 4.66). Так, сорта Sensation
’Melita4, ’Warrawa4, California ’Pinkata4, Cassandra ’Gennifer4, Lilian
Stewart ’Sundown4 имели наивысшую интенсивность образования
протокормов (2700 шт. в месяц), в то время как сорта Arabian Nights
’Cooksbridge4, Lilian Stewart ’St. Sherrie4, Alexalban ’The Bride4,
’Fanfare4 — 250 шт. в месяц. Нами установлены также различия в
скорости образования и морфологии протокормов разных сортов
Cymbidium. Так, Durham Castle ’Irene4, относящийся к группе мини-
цимбидиумов, регенерирует на питательной среде единичные и
небольшие по размеру протокормы. В то же время размеры про¬
токормов Lagoon ’Braemar4, Lilian Stewart ’Sundown4, ’Fanfare4 в
2 раза больше по сравнению с другими сортами. Сорт ’Xantnos4 об-
334
ГЛАВА 4. Методы размножения тропических и субтропических растений
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Порядковый номер сорта
Рис. 4.66. Морфогенетический потенциал Cymbidium в зависимости от гено¬
типа растения:
1 — Sensation ’Melita‘; 2 — Ispahan ’LindfielcT; 3 — ’Warrawa4; 4 — Balkis ’Luath4 x
x Lusthous ’Betty4; 5 — Vintage Florence ’Orbar4; 6 — Arabian Nights ’Cooksbridge4; 7 —
Fusilier ’Thomas4; 8 — Lillian Stewart ’Sundown1; 9 — Alexalban The Bride4; 10 — Hubert
Cambourne ’Benita4; 11 — Burgundian ’Chateau4; 12 — California ’Pinkata4; 13 — Lagoon
’Braemar4; 14 — Cassandra ’Jennifer4; 15 — Fanfare ’St. Francis4; 16 — Lillian Stewart
’St Sherrie4; 1 — первый пассаж, 2 — второй пассаж
разовывал сразу не протокорм, а побег, отличающийся по мор¬
фологии от остальных сортов. Поэтому для увеличения коэффи¬
циента размножения его черенковали (как гвоздику), получая 3—
4 боковых побега.
Сорта, которые хорошо размножаются вегетативно, как пра¬
вило, обладают и повышенным морфогенетическим потенциалом
в культуре изолированных тканей. Например, экспланты Cooks¬
bridge ’Pinkie4 регенерировали до 12 протокормов, а экспланты
’Westonbirt4 никогда не образовывали более 2 протокормов.
Сравнительное изучение сеянцев и растений-регенерантов Cym¬
bidium, размноженных в культуре in vitro. Следует отметить огра¬
ниченное количество сообщений об изучении сортовых призна¬
ков у орхидей и других декоративных растений, размноженных
методом культуры тканей. В работе Н.В. Катаевой (1982) отмеча¬
ется, что растения герберы и фрезии, полученные в культуре in
vitro, по своим сортовым признакам не отличались от родитель¬
ских. Исследования, проведенные другими авторами, показали,
что при экзогенной обработке пастой БАП почек Phalaenopsis уже
в культуре in vitro образуются протокормы различной окраски:
одни зеленые, другие — белые. Отмечена также различная окра¬
ска губы и лепестков некоторых растений-регенерантов.
335
СПЕЦИАЛЬНАЯ ЧАСТЬ
В связи с этим нами было проведено сравнительное изучение
роста и развития растений Cymbidium, полученных при семенном
и клональном размножении. Растения-регенеранты и сеянцы
Cymbidium высотой 10—12 см с 4—5 листьями и 2—3 корешками
высаживали в субстрат (рис. 4.67, см. вклейку). Как показали
многочисленные опыты, наилучшим субстратом на этом этапе
была смесь сфагнового мха и песка (3:1), приживаемость расте¬
ний составляла 95—100 %. Высадку проводили в плошки диамет¬
ром 20 см и высотой 4—6 см. Высаженные растения помещали в
теплицу при температуре 27—28 °С и влажности воздуха 85—90 %.
Через 3 мес растения пересаживали в отдельные горшки диамет¬
ром 7—9 см с субстратом, состоящим из мха, верхового торфа,
песка, коры сосны, листьев дуба или бука (1:1:1:1:1). Данный
субстрат обеспечивает хорошие результаты, поскольку гарантиру¬
ет необходимую аэрацию корневой системы и стабильную струк¬
туру в течение 2—3 лет. Добавление верхового торфа, обладаю¬
щего высокой буферной способностью, обеспечивает стабилиза¬
цию реакции среды почвенного субстрата на требуемом уровне, а
введение лесной подстилки позволяет поддерживать необходи¬
мый уровень влажности. Деструкция листьев и коры удовлетво¬
ряет начальным потребностям растений в питании. Кроме того,
все компоненты субстрата доступны в наших условиях. Сосуды с
растениями переносили в теплицу со следующим режимом: опти¬
мальная температура в зимний период 12—14 °С, в летний — 20—
22 °С (регулируют притенением и проветриванием), влажность
воздуха 65—70 %. Следует отметить, что корневая система у расте¬
ний-регенерантов ex vitro развивается более интенсивно и имеет
мощную рабочую адсорбирующую поверхность по сравнению с
культурой in vitro (табл. 4.39).
Морфологическое изучение растений Cymbidium, полученных
при семенном и клональном размножении, выявило существен¬
ные различия между ними. Так, ювенильные побеги большинст¬
ва сеянцев на 2-м году жизни имели 9—10 вегетирующих листьев.
Как правило, у сеянцев после закладки десятого листа жизнедея¬
тельность апикальной меристемы прекращалась (иногда это про¬
исходило после закладки 12—45-го листа).
Ювенильные побеги меристемных растений имели большее
количество листьев (табл. 4.40). Побеги второго порядка появля¬
лись после образования 12—17-го, а иногда и 20-го листа. Апи¬
кальные меристемы у растений-регенерантов оставались актив¬
ными более продолжительный период.
336
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.39. Характеристика развития корневой системы Cymbidium
Вариант опыта
Масса,
г
Объем,
см3
Длина,
см
Адсорбирующая
поверхность, м2
общая
рабочая
недейст¬
вующая
Сеянцы
Культура in vitro
0,21
0,2
1,0
0,12
0,04
0,08
Культивирование
в субстрате
1-й год
13,22
21,0
7,9
1,04
0,63
0,41
3-й год
186,4
40,3
16,8
2,68
2,01
0,67
Растения -регенерант ы
Культура in vitro
1,34
0,5
3,0
0,28
0,27
0,01
Культивирование
в субстрате
1-й год
51,35
50,0
12,2
1,48
1,00
0,48
3-й год
368,21
172,4
21,0
3,49
2,68
0,63
Таблица 4.40. Сравнительная характеристика роста и развития Cymbidium *
Показатель
Сеянцы
Растения-регенеранты
Количество побегов, включая
ювенильный, шт.
3,3 ± 0,21
3,3 ± 0,15
Длина молодого побега, см
51,8 ± 3,08
72,7 ± 1,81
Количество листьев на молодом
побеге, шт.
8,2 ± 0,46
9,4 ± 0,30
Количество цветоносов, шт.
1,2 ± 0,13
2,3 ± 0,21
Длина цветоноса, см
61,2 ± 4,4
62,8 ± 2,41
Высота соцветия, см
15,3 ± 0,14
11,9 ± 0,33
Количество цветков в соцветии,
шт.
14,5 ± 0,83
9,0 ± 0,73
Длина цветоножки, см
5,6 ± 0,17
6,9 ± 0,18
Диаметр цветка, см
8,6 ± 0,05
9,2 ± 0,09
В контрольную группу входили растения, полученные делением клона.
Туберидии сеянцев и растений-регенерантов различаются: у
сеянцев они имеют округлую, у растений-регенерантов — оваль¬
ную форму. Влагалища листьев плотно окутывают туберидий рас¬
тений-регенерантов и значительно отстают у сеянцев. Корневая
система у растений-регенерантов развивается более интенсивно и
имеет мощную рабочую адсорбирующую поверхность.
337
СПЕЦИАЛЬНАЯ ЧАСТЬ
Анализируя полученные данные, отметим, что растения-ре -
генеранты сохраняют все основные признаки материнских форм,
а по таким показателям, как длина цветоноса, количество соцве¬
тий, количество и диаметр цветка, на 3-й год цветения даже пре¬
восходят контрольные растения.
Отличительной особенностью растений-регенерантов является
наличие 3 жилок на нижней стороне листа, как и у взрослых расте¬
ний, тогда как у сеянцев имеется только 1 жилка. По такому при¬
знаку можно отличать растения-регенеранты от сеянцев на ранних
этапах их развития. Листья у растений-регенерантов интенсивнее
окрашены и содержат большее количество хлорофилла (табл. 4.41).
Цветет Cymbidium на 4-й год вегетации при наличии клона, со¬
стоящего из 3 зрелых туберидиев и молодых побегов. Цветение у
растений-регенерантов дружное с одновременным раскрытием цвет¬
ков на всех соцветиях клона, что важно для промышленного цвето¬
водства, поскольку позволяет проводить одновременный срез. Один
клон Cymbidium, по нашим наблюдениям, при оптимальных усло¬
виях культивирования может дать 3—5 цветоносов, 30—75 цветков.
Количество цветущих особей у сеянцев составляло всего
4,4 %, а у растений-регенерантов — 25 %. На 2-й год цветения у
сеянцев этот показатель составлял около 27, а у растений-регене-
Таблица 4.41. Содержание пигментов в листьях Cymbidium,
мг/100 г сырого растительного материала
Вариант
опыта
Хлорофилл
Каротиноиды
(К)
Хлорофилл
а + Ь/К
а
Ь
а + b
а/Ь
Сеянцы
Культура in vitro
18,68
8,19
26,87
2,28
24,73
1,08
Культивирование
в субстрате
1-й год
27,35
11,49
38,84
2,38
28,30
1,37
3-й год
29,65
12,50
42,15
2,37
31,96
1,31
Растения -регене рант ы
Культура in vitro
19,86
8,57
28,43
2,31
24,96
1,13
Культивирование
в субстрате
1-й год
32,27
17,33
49,60
1,86
34,41
1,44
3-й год
33,01
18,96
51,97
1,74
35,08
1,48
338
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.42. Биоморфологические характеристики растений-регенерантов
И исходных материнских растений Cymbidium
Показатель
1-й год цветения
3-й год цветения
Опыт *'
Контроль
Опыт "
Контроль
Количество соцве¬
тий, шт.
Высота соцветия, см
Количество цветков
на цветоносе, шт.
Диаметр цветка, см
Длина лепестков, см
Высота колонки, см
Длина губы, см
Декоративность в
срезе, дни
1,6 ± 0,2
82.0 ± 3,08
9,6 ± 0,54
10.0 ± 0,12
5,3 ± 0,1
4,0 ± 0,17
4,2 ± 0,15
2,5 ± 0,12
1.2 ± 0,13
75,0 ± 1,54
8.2 ± 0,43
8,5 ±0,19
4,8 ± 0,25
3.7 ± 0,1
3.7 ± 0,24
2.2 ± 011
2,7 ± 0,16
94,8 ± 1,21
13.4 ± 0,48
10.5 ±0,3
6,0 ± 0,02
4.1 ±0,18
4.2 ± 0,2
2,6 ± 0,12
2.3 ± 015
80,5 ± 2,82
10,7 ± 0,4
9,0 ± 0,3
5,5 ± 0,01
3.8 ± 0,02
3.8 ± 0,1
2.3 ± 0,11
■' Растения-регенеранты. *2 Исходные материнские растения.
рантов — 100. Такое различие в количестве цветущих особей, воз¬
можно, связано с неодинаковой поглотительной способностью кор¬
ней, а также с тем, что растения-регенеранты находятся на более
поздних этапах развития.
Растения-регенеранты Cymbidium отличались повышенной
интенсивностью дыхания, активизацией всех физиолого-биохи-
мических процессов по сравнению с сеянцами, что, в конечном
счете, сказывалось на цветении (табл. 4.42).
При транспортировке цветы сохраняют форму, в упакован¬
ном виде без воды хранятся 4—5 сут, в холодильнике при темпе¬
ратуре 2 °С — более недели.
Как показали наши наблюдения, форма, рисунок и окраска
цветков у растений-регенерантов не отличались от материнских
растений, что имеет чрезвычайно большое практическое значение.
У сеянцев нами отмечены значительные отклонения в рисунке и
окраске лепестков и губы от исходных растений. Такое отличие, во-
первых, связано с тем, что все орхидные гетерозиготны и при се¬
менном размножении возможно получение растений с отличными
от исходных форм признаками, во-вторых, с тем, что в гибридиза¬
ции Cymbidium принимали участие 6 видов, что в значительной
степени отразилось на морфологических признаках сеянцев. От¬
клонение в сторону зеленой окраски части лепестков — возмож¬
ное проявление признаков, свойственных исходным видам. По
Данным Е.С. Смирновой (1990), отклонения в морфострукгуре на¬
339
СПЕЦИАЛЬНАЯ ЧАСТЬ
блюдаются не только при гибридизации, но даже и при перене¬
сении растений из природы в культуру оранжерей. Постоянство
морфологических признаков у растений-регенерантов Cymbidium
подтверждено и цитологическими исследованиями. Подсчет ко¬
личества хромосом в ядрах клеток апикальной зоны исходных
растений и растений-регенерантов показал, что оно одинако¬
вое — 44 хромосомы (Волховских и др., 1969).
Условия естественного местообитания Cymbidium определяют
чередование периодов роста и покоя в культуре. В связи с этим
растения в период покоя (январь—февраль) содержали в тепли¬
цах при температуре воздуха 10—14 °С. Влажность почвенного
субстрата поддерживали на уровне 30—35 % полной влагоемко-
сти. Исследования биологических ритмов показали, что в период
с III декады февраля (для раннецветущих сортов) по I декаду ап¬
реля (для поздноцветущих) растения выходят из состояния по¬
коя, возобновляется активный рост корневой системы. В это
время для лучшего развития вегетативных побегов температуру и
влажность воздуха в теплице повышают. В период активного рос¬
та (для раннецветущих сортов — I декада марта — II декада ию¬
ня; среднецветущих — II декада марта — III декада июня; позд-
ноцветуших — III декада марта — I декада июля) Cymbidium hybr.
выращивали при температуре 20—22 °С, высокой влажности воз¬
духа, обильном поливе и интенсивном удобрении. Корневая сис¬
тема растений характеризуется высоким солевым статусом, по¬
этому концентрация удобрений не должна превышать 0,2 %.
С конца июня по август у Cymbidium hybr. происходит фор¬
мирование генеративных органов. Для индукции закладки цвето¬
носов растения подвергали действию яркого солнечного света.
При этом ограничивали полив до уровня 25—30 %, суточный пе¬
репад температур составлял 10—12 °С. В умеренном поясе такие
перепады температур наблюдаются редко, поэтому следует во
второй половине дня проводить 3—4-кратное увлажнение доро¬
жек и стеллажей. Кроме того, во II декаде июля для закладки
массового количества цветоносов создавали рН-стресс 0,01 %-м
раствором серной кислоты, смещая реакцию среды в сторону
подкисления на 1,0—1,5. При резком колебании pH почвенного
раствора в значительной мере увеличивается подвижность фос¬
фатов, что положительно сказывается на закладке цветоносов. В
августе растения содержали при температуре воздуха 16—18 °С и
умеренном поливе. В сентябре у Cymbidium наступал период бу¬
тонизации и приостанавливался рост растений.
340
ГЛАВА 4. Методы размножения тропических и субтропических растений
Дальнейшее их выращивание осуществляют при температуре
воздуха 10—14 °С, прекращая подкормку и уменьшая полив. В
это время особенно опасен перепад температур и переувлажне¬
ние почвенного субстрата, так как резко снижается поступление
в растения кальция, что приводит к гибели бутонов. При необхо¬
димости в конце марта — начале апреля осуществляют пересадку
растений. При этом стараются не нарушать корневую систему,
удаляя только подгнившие корни. Для быстрого укоренения рас¬
тения выращивают при температуре воздуха 20—22 °С.
Проведенные исследования позволили разработать рациональ¬
ную биотехнологию Cymbidium, которая обеспечивает получение
массового чистосортного оздоровленного посадочного материала
для цветоводческих хозяйств нашей страны.
Dendrobium Sw. Один из самых многочисленных родов, на¬
считывающих до 1600 эпифитных, реже — литофильных видов и
около 1000 природных гибридов. Дендробиумы распространены
на очень обширной территории — от Кореи, Китая и Японии до
Австралии, Новой Гвинеи и Новой Зеландии (Черевченко и др.,
2001).
В ходе исследовательских работ различными способами нами
были размножены виды, описанные ниже.
D. antennatum Lindl. — эпифиты, встречающиеся на Соломо¬
новых островах и в Новой Гвинее. Стебли прямые, с листьями.
Цветки до 7 см в диаметре, с запахом. Лепестки белые или
зеленовато-желтые. Губа белая, с малиновыми прожилками.
D. bellatulum Rolfe — миниатюрные эпифиты, произрастаю¬
щие в Мьянме, Индии, Китае, Вьетнаме. Туберидии ребристые, ли¬
стья кожистые, с серым налетом. Цветки до 3 см в диаметре, кре¬
мово-белые, с запахом и желтой губой.
D. crumenatum (Rumph.) Sw. — эпифиты, ареал которых рас¬
положен на территории Китая, Мьянмы, Индонезии и Филип¬
пин. Стебель слегка изогнут, листья жесткие, сидячие. Соцветия
верхушечные. Цветки имеют белую окраску.
D. intricatum Gagnep. — эпифиты, распространенные преиму¬
щественно на территории Вьетнама, Камбоджи и Таиланда.
Стебли висячие, листья заостренные. Цветки до 2,5 см в диамет¬
ре, ярко-пурпурного цвета.
D. kingianum Bidwill ex Lindl. — литофиты, произрастающие на
территории Австралии. Стебли прямые, листья тонкие. В соцве¬
тии до 18 цветков. Цветки до 2,5 см в диаметре, с запахом. Лепе¬
стки белые. Губа с розовыми вкраплениями.
341
СПЕЦИАЛЬНАЯ ЧАСТЬ
D. lomatochilum Seidenf. — эпифиты, встречающиеся во Вьет¬
наме и Камбодже. Стебли тонкие, до 60 см в длину. Цветки до
0,6 см в диаметре. Лепестки белые, полупрозрачные. Губа с ма¬
линовыми жилками.
D. moschatum (Buch.—Ham.) Sw. — эпифиты, произрастающие
в солнечных местах в Индии, Мьянме, Лаосе, Таиланде. Стебли
свисающие. В соцветии до 15 цветков (до 10 см в диаметре) с
мускусным запахом. Лепестки абрикосовые. Губа по форме на¬
поминает башмачок, слегка опушена.
D. speciosum J.E. Smith. — крупные растения, распространен¬
ные в Австралии. Литофиты или эпифиты. Туберидии до 25 см в
длину, изогнутой формы. Соцветие длиной до 25 см, изогнутой
формы, может нести до 25 очень ароматных цветков. Лепестки
белые, желтые, кремовые. Губа с красными пятнами.
D. transparens Wall. — эпифитные листопадные растения, про¬
израстающие в Индии, Мьянме, Непале. Стебли свисающие, ли¬
стья ланцетные. Цветки до 5 см в диаметре. Лепестки волнистые,
белые, розоватые. Губа с малиновым пятном у основания.
D. nobile lindl. — эпифиты, ареал которых расположен на терри¬
тории Индии, Китая, Лаоса и Таиланда. Стебли прямые, поник¬
шие, до 90 см в длину. Цветки до 8 см в диаметре, с запахом. Лепе¬
стки розовые, сиреневые. Губа круглая, широкая, с пурпурными
краями.
D. phalaenopsis Fitzg. — солнцелюбивый эпифит. Распростра¬
нен в верхних ярусах влажных тропических лесов Северо-Восточ¬
ной Австралии и Новой Гвинеи, о-ва Тимор (Bailey, 1928; Вальтер,
1968; Kang, 1977; Уатсон, 1892). Псевдоклубни прямые, цилиндри¬
ческие, до 90 см в высоту, облиственные, плотно прилегают друг к
другу. Цветки похожи на цветки Phalaenopsis. Продолжительность
цветения — около 3 мес. Перспективная культура для промыш¬
ленного цветоводства. Размножается вегетативно и в культуре in
vitro. Вегетативно размножается делением клона, вегетативными
побегами, образующимися из почки возобновления, а также “воз¬
душными побегами” (из почек верхнего яруса), однако коэффи¬
циент размножения невысок. Поэтому для получения посадоч¬
ного материала лучше применять метод культуры in vitro.
Для проращивания использовали семена репродукции НБС
НАН Украины (опыление искусственное). Плод — коробочка, со¬
зревает через 8—8,5 мес после опыления. В одной коробочке со¬
держится около 500 000 шт. семян. Семена светло-желтые, мелкие,
длиной 0,5 мм и шириной 0,1 мм, с прозрачной сетчатой обо-
342
ГЛАВА 4. Методы размножения тропических и субтропических растений
ломкой, без эндосперма, зародыш не дифференцирован. Для вы¬
сева семян применяли следующие среды: МС, Вацина—Вента,
Кнудсона С и модифицированную нами среду КПГУ.
Прорастание семян начинается с внутрисемейного развития не¬
доразвитого зародыша. Семена набухают на 10—15-е сутки, зароды¬
ши имеют вид салатовых или зеленых шариков диаметром 0,12—
0,2 мм. Дальнейшее развитие D. phalaenopsis происходит следую¬
щим образом:
2—2,5 недели после высева — зародыши достигают 0,6—0,7 мм
в длину и 0,4—0,5 мм в ширину и занимают практически все се¬
мя. Оболочка семени целая и хорошо заметна. Она разрывается
растущим зародышем через 3—3,5 недели, в это время зародыш
достигает 0,8—0,9 мм в длину и 0,5—0,6 мм в ширину, имеет 1—3
ризоида длиной до 0,1 мм.
4—5 недель — протокормы зеленые, длиной 1,0—1,4 и шири¬
ной 0,6—0,7 мм, имеют 4—7 ризоидов длиной 0,3—0,5 и диамет¬
ром 0,025 мм, иногда встречаются разветвленные ризоиды. Еще
через 2—4 недели у основной массы протокормов уже можно вы¬
делить стеблевую часть с апикальной меристемой полусфериче¬
ской формы и валиком первого листового примордия. Одна часть
валика немного выше другой и со временем образует листовую пла¬
стинку, другая — влагалище листа. На корневой части сосредото¬
чены ризоиды (до 25 шт.), собранные в пучки по 3—6 шт. Иногда
встречаются протокормы с двумя и даже тремя меристематиче-
скими центрами.
6—7 недель — протокормы ярко-зеленые, булавовидные, дли¬
ной 2,0—2,8 и шириной 2—4 мм. Первый лист достигает длины
0,4—0,5 мм. Около 10 % протокормов листьев еще не образуют и
сохраняют округлую или овальную форму.
8—9 недель — высота сеянцев 2,8—3,0 мм, первый лист длиной
до 1 мм, прикрывает зачаток второго листа и апикальную мери¬
стему.
11—12 недель — высота растений 9—10 мм. У большинства
сеянцев (около 80 %) второй лист достигает окончательных раз¬
меров (5—6 мм в длину), имеется зачаток третьего листа и апи¬
кальная меристема. У места прикрепления первого листа форми¬
руется зачаток первого придаточного корня в виде бугорка диа¬
метром до 0,5 мм.
12—13 недель — у части сеянцев (около 15 %) в пазухе листа
Формируется пазушная почка в виде меристемы с валиком лис¬
тового примордия.
343
СПЕЦИАЛЬНАЯ ЧАСТЬ
15—16 недель — практически у всех сеянцев в пазухе первого
и второго листьев закладываются и дифференцируются боковые
почки, которые к концу 4-го месяца состоят из 1—2 листовых
зачатков и апикальной меристемы.
Поскольку развитие сеянцев идет с различной скоростью, то
к концу 1-го года можно было выделить такие группы растений:
у 40 % имеется по 3 листа, в пазухах первого и второго листьев
расположены боковые почки с 2—3 листовыми зачатками и апи¬
кальной меристемой; у 15 % сеянцев боковые почки уже образу¬
ют побег второго порядка высотой 2—4 мм с 1—2 листовыми за¬
чатками и апикальной меристемой; у 40 % сеянцев такой побег
второго порядка имеет утолщенную стеблевую часть, один лист
длиной 2—6 мм, листовой зачаток и апикальную меристему; у 5 %
сеянцев побег второго порядка расположен на столоновидном вы¬
росте длиной до 2 мм, имеет утолщенную стеблевую часть, 2—3
листа длиной 2—3 мм, листовой зачаток и апикальную меристему.
У сеянцев этого возраста ризоиды еще сохраняются и располага¬
ются пучками. Два-три придаточных корня достигают длины
1,0—1,5 мм и имеют диаметр 1 мм.
В возрасте 14—15 мес побеги первого и второго порядков
практически одинакового размера, иногда даже побег второго
порядка больше. Каждый побег имеет 4—5 листьев длиной 6—
13 мм, 2—3 листовых зачатка и апикальную меристему. В это вре¬
мя следует отделить побег второго порядка и высадить отдельно на
среду для улучшения роста обоих побегов. Если побег второго по¬
рядка не был отделен, то в возрасте 16—17 мес побег первого по¬
рядка замедляет свой рост, еще через 2 недели его апикальная ме¬
ристема перестает функционировать. Почка в пазухе первого или
второго листа также прекращает свое развитие. Если же побег
был отделен, как указывалось выше, то эта почка развивается и
образует побег. Побег второго порядка имеет 1—2 замкнутые зе¬
леные чешуи, 3—4 листа, 2—3 листовых зачатка и апикальную ме¬
ристему. В пазухах второго и третьего листьев расположены почки с
1—2 листовыми зачатками и апикальной меристемой. В этом воз¬
расте сеянцы высаживают из колб в плошки с измельченным
сфагновым мхом. Через полгода наиболее крупные растения можно
пересадить в горшки (7 см) с субстратом из лиственной земли и
измельченной сосновой коры (1:1) или только с лиственной
землей.
Таким образом, сеянцам D. phalaenopsis уже на ранних стади¬
ях развития присущ тип строения, характерный и для взрослых
344
ГЛАВА 4. Методы размножения тропических и субтропических растений
особей: метамерность, наличие пазушных почек, формирование
утолщенного стебля — туберидия.
Результаты исследований свидетельствуют о том, что состав
питательной среды для высева семян D. phalaenopsis очень важен
(табл. 4.43). Так, на среде МС семена начинали прорастать толь¬
ко на 60-е сутки, а затем чернели и погибали. Сравнительно мед¬
ленно развивались сеянцы на средах Вацина—Вента и Кнудсона.
Оптимальной для прорастания семян D. phalaenopsis явилась мо¬
дифицированная среда Кнудсона, в состав которой вместо мало¬
доступных и дорогостоящих компонентов введены гумат калия,
пептон и активированный уголь. При наличии физиологически
активных веществ гумусовой природы сеянцы более полно ис¬
пользуют элементы минерального питания, в результате чего ин¬
тенсивнее развивается ассимилирующая поверхность листьев и
активизируется корнеобразование. Добавление активированного
угля обеспечивает затемнение среды, что способствует нормаль¬
ному росту и распределению питательных элементов в среде и
удалению продуктов метаболизма развивающихся растений.
При прорастании семян зародыши, как уже указывалось, уве¬
личиваются в размерах, разрывают семенную оболочку и форми¬
руют специфическую для орхидей структуру — протокорм. Для
D. phalaenopsis характерно почкование протокормов: первичный
протокорм образует многочисленные вторичные протокормы, кото¬
рые можно отделять и таким образом получать большее количе¬
ство растений (Ernst, 1967; Поддубная-Арнольд и, 1976; Mitra et
al., 1976). В дальнейшем из протокорма образуются проростки,
которые по мере подрастания несколько раз в течение года пере¬
саживали на свежие питательные среды, что способствовало их
ускоренному росту и развитию. В возрасте 15—17 мес сеянцы
высаживали в субстрат (Назаров, 1973; Richter, 1978).
Таблица 4.43. Продолжительность периода прорастания семян и развития
сеянцев Dendrobium phalaenopsis в зависимости от состава питательных сред, сут
Среда
Начало
прорастания
Образование
протокормов
Образование
растений
Высадка
в субстрат
Мурашиге—Скуга
60
0
0
0
Вацина—Вента
60
162
420
670
Кнудсона С
40
150
368
656
Модифицированная
среда Кнудсона (КПГУ)
15
30
252
520
345
СПЕЦИАЛЬНАЯ ЧАСТЬ
Коэффициент семенного размножения очень высок, но у се¬
янцев D. phalaenopsis наблюдается расщепление признаков. Это
является недостатком при получении генетически однородного
материала, однако используется при гибридизации орхидей и вы¬
ращивании новых сортов (Черевченко и др., 1989; Kamemoto,
1989; Лаврентьева, 1997).
Необходимо отметить, что наблюдаемые нами фенотипические
различия у сеянцев в подавляющем большинстве случаев выра¬
жались в незначительных отклонениях размеров и окраски цвет¬
ков, что не влияло на их декоративность (Лаврентьева и др.,
1994). В связи с этим применение метода культуры изолирован¬
ных тканей гарантирует получение генетически однородного ма¬
териала, и данный метод был нами впервые применен для раз¬
множения D. phalaenopsis.
Разработку метода начали с выбора экспланта. Так же, как и
у Cymbidium, почки на отмирающих побегах D. phalaenopsis могут
прорастать, образуя молодые побеги, однако они более инфици¬
рованы и имеют слабую регенерационную способность. Пазуш¬
ные почки, расположенные на молодом побеге, как показали
наши исследования, служат хорошими эксплантами для размно¬
жения и обладают высокой регенерационной способностью. Кроме
того, они лучше подвергаются стерилизации. Хорошей регенера¬
ционной способностью обладают также почки нижней части ве¬
гетирующих побегов. В качестве эксплантов можно использовать
и спящие почки цветоносов.
Наиболее ответственный этап микроразмножения D. phalae¬
nopsis — выбор режима стерилизации интактных растений. Было
проведено несколько опытов по подбору режима стерилизации,
стерилизующих веществ и времени их действия. При использо¬
вании 70%-го этанола (1 мин), 10%-го гипохлорита кальция
(20 мин) и 30%-го пергидроля (20 мин) 70 % высаженных экс¬
плантов становятся стерильными. Если вместо гипохлорита каль¬
ция добавляют 1— 2%-й famosept (ртутный препарат), количество
инфицированных эксплантов снижается еще на 14 %, однако уг¬
нетается их регенерационная способность. Как показали иссле¬
дования, режим стерилизации для различных эксплантов должен
быть разным, с учетом индивидуальных особенностей и их фи¬
зиологического состояния (Lavrentyeva et al., 1996).
Для микроразмножения использовали пазушные почки веге¬
тирующих, отмирающих и отрастающих побегов, спящие почки
цветоносов, апикальную меристему отрастающих побегов, а так-
346
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.68. Сеянцы Dendrobium phalaenopsis Fitzg.
же части полученных in vitro растений — сегменты листьев, части
побегов, кончики корней. При культивировании на питательной
среде МС из меристематических тканей образовывались прото¬
кормы, затем наблюдалась регенерация адвентивных почек и по¬
бегов (рис. 4.68). При использовании в качестве эксплантов спя¬
щих почек цветоносов протокормообразование не наблюдалось,
почки сразу развивались в побеги. Для определения оптимальных
эксплантов был поставлен опыт, в котором все разновозрастные
побеги мы условно разделили на три части: верхнюю, среднюю и
базальную (табл. 4.44). Установлено, что наибольшим морфоге¬
нетическим потенциалом обладают экспланты, вычленяемые из
вегетирующего и отрастающего побегов, причем потенциал экс¬
плантов верхней части молодого побега гораздо выше, чем веге¬
тирующего. Скорости регенерации побегов из эксплантов ба¬
зальной части вегетирующего и отрастающего побегов отличают¬
ся незначительно и составляют соответственно 60,0 и 70,3 %. В
то же время скорость формирования протокормов у эксплантов
верхней части молодого побега в 20 раз выше, чем у вегетирую¬
щего. Однако процент образовавшихся растений у них практиче¬
ски одинаков (Лаврентьева и др., 1988, 1989).
Как уже указывалось, средняя часть отмирающего и вегети¬
рующего побегов почек не имеет, поэтому получить какие-либо
структуры из них не удалось. Почки нижней части вегетирующего
347
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.44. Морфогенетический потенциал эксплантов
разновозрастных побегов Dendrobium phalaenopsis
Расположение
эксплантов
на побеге
Образовавшиеся структуры, % общего количества
Отмирающий побег
Вегетирующий побег
Отрастающий побег
Прото¬
кормы
Растения
Прото¬
кормы
Растения
Прото¬
кормы
Растения
Верхняя часть
0
0
3,6
15,5
75,0
15,0
Средняя часть
0
0
0
0
20,5
46,3
Базальная часть
0
4,5
5,0
60,0
10,0
70,3
Таблица 4.45. Морфогенетический потенциал почек базальной части
вегетирующего побега Dendrobium phalaenopsis
Расположение
почек по ярусам
Образовавшиеся структуры, % общего количества
Неразвившиеся экспланаты
Прото кормы
Растения
Первый
34,3
19,4
46,3
Второй
64,3
8,2
27,5
Третий
86,3
2,5
11,2
и отрастающего побегов обладают повышенной регенерационной
способностью, поэтому мы решили провести более детальное их
исследование и изучить морфогенетический потенциал почек
первого, второго и третьего ярусов побега (табл. 4.45).
Установлено, что наибольшим морфогенетическим потенциа¬
лом — 46,3 % — обладали почки первого яруса (почки возобновле¬
ния). У почек второго яруса этот потенциал был значительно ни¬
же — 27,5 %, а у почек третьего яруса составил всего лишь 11,2 %.
Это, по нашему мнению, связано с морфологической структурой
почек: чем большее количество составляющих элементов имеет
почка, тем выше ее потенциал.
Одним из факторов, определяющим успех клонального размно¬
жения, является подбор оптимальной питательной среды. По лите¬
ратурным данным, наиболее часто для микроразмножения видов
рода Dendrobium Sw. используются питательные среды МС и Ваци¬
на—Вента в различных модификациях. Кроме того, для реализации
морфогенетического потенциала меристематических тканей в пита¬
тельные среды вносят различные вещества — регуляторы роста, ви¬
тамины, растительные соки, кокосовое молоко и др. (табл. 4.46, 4.47).
348
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.46. Состав питательных сред, используемых
для микроразмножения Dendrobium, мг/л
Размножение эксплантов
Компонент
Верхушки
побегов
Пазушные
почки *2
Сегменты
листьев
сеянцев
Регенера¬
ция прото-
кормов *4
Укорене¬
ние побе¬
гов *5
nh4no3
400,0
800,0
СаС12 • 2Н20
—
—
—
220,0
220,0
MgS04 • 7Н20
250,0
250,0
250,0
185,0
185,0
KN03
525,0
525,0
525,0
1515,0
1010,0
КН2Р04
250,0
250,0
250,0
85,0
85,0
(NH4)2S04
500,0
500,0
500,0
—
—
Са3(Р04)2
200,0
200,0
200,0
—
—
MnS04 • 7Н20
7,5
7,5
7,5
—
—
Fe2(C4H406), 2Н20
28
—
—
—
—
Ыа2ЭДТА
—
37,24
37,24
37,3
37,3
FeS04 • 7Н20
—
27,84
27,84
27,8
27,8
Микроэлементы по
Мурашиге—Скугу *6
_
1,0
1,0
Глицин
—
—
—
1,0
1,0
Инозит
—
—
—
100,0
50,0
Никотиновая кислота
—
—
—
0,25
0,25
Пиридоксин
—
—
—
0,05
0,05
Тиамин
—
—
—
0,05
0,05
НУК
10,0
0,2
4,0
—
1,0
Кокосовое молоко *6
150,0
150,0
150,0
150,0
—
Сахароза
20 000,0
10 000,0
10 000,0
30 000,0
30 000,0
Среда Soediono (1983). *2Среда Singh (1976). *3Среда Arditti (1990). *4Среда
Gandawijaja (1980). ф5 Среда Arditti (1977). *6 В миллилитрах на 1 л.
Анализ состава питательных сред, предложенных разными ав¬
торами (табл. 4.46, 4.47), выявил как их идентичность, так и раз¬
личие при размножении видов Dendrobium in vitro. Часто для
культивирования одного и того же типа эксплантов используются
различные по составу питательные среды. В то же время для про¬
лиферации протокормов Dendrobium и их размножения в прописи
питательных сред многие исследователи добавляют такие вещест¬
ва, как кокосовое молоко, БА, БАП, для укоренения побегов —
ИМК, НУК и ИУК в различных концентрациях и соотношениях.
Мы определяли состав и физическое состояние питательной
среды, оптимальной для культивирования изолированных тканей
Л phalaenopsis. Эксплантами служили пазушные почки отрастаю-
349
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.47. Состав питательных сред, используемых
для культивирования эксплантов Dendrobium, мг/л
Культивирование эксплантов
Компонент
Спящие
ПОЧКИ
цветоно¬
сов *'
Лате¬
ральные
ПОЧКИ
побегов
Сегменты
листьев
сеянцев *?
Проли¬
ферация
прото-
кормов *4
Индукция
побегов *5
Укорене¬
ние побе¬
гов *5
(NH4)2so2
500,0
500,0
500,0
500,0
_
Са3(Р04)2
200,0
—
—
—
—
—
MgS04 7Н20
250,0
250,0
250,0
250,0
400,0
400,0
КН2Р04
250,0
250,0
250,0
250,0
250,0
250,0
KNO,
525,0
525,0
525,0
525,0
—
—
FeS04 7Н20
27,84
—
27,84
—
10,7
10,7
№2ЭДТА
37,24
—
37,24
—
22,4
22,4
MnS04 • 4Н20
7,5
5,7
7,5
7,5
7,5
7,5
Са,(Р04)2
Fe,(C4H406), х
—
200,0
200,0
200,0
—
—
х 2Н20
Ca(NO,)2 х
—
28,0
—
28,0
—
—
х 4Н,0
—
—
—
—
400,0
400,0
NH4NO,
—
—
—
—
1000,0
1000,0
КС1
—
—
—
—
500,0
500,0
Н,ВО,
—
—
—
—
0,03
0,03
CuS04 5Н20
—
—
—
—
0,001
0,001
ZnS04 7Н20
—
—
—
—
0,03
0,03
Глицин
Никотиновая
—
—
—
—
2,0
2,0
кислота
—
0,5
0,5
—
0,5
0,5
Пиридиксин
0,5
—
—
—
0,5
0,5
Тиамин
0,4
0,1
0,4
—
0,1
0,1
Пептон
Гидролизат
—
—
—
1000,0
—
1000,0
казеина
—
100,0
—
150,0
—
—
ИМК
—
—
—
—
1,75
1,75
НУК
4,0
2,0
—
5,0
1,75
1,75
БА
10,0
—
—
2,0
—
5,0
2,4-Д
Кокосовое
—
—
1,0
—
—
—
молоко *6
150,0
—
150,0
200,0
—
—
Сахароза
10 000,0
20 000,0
20 000,0
20 000,0
15 000,0-
30 000,0
15 000,0-
30 000,0
ф| Среда Singh (1976). *2 Среда Intuwong и соавт. (1972). *3 Среда Lim-Ho
(1981). *4 Среда Monarama и соавт. (1986). ’5 Среда Kukulczanka—Wojciecno-
wska (1983). *6 В миллилитрах на 1 л.
350
ГЛАВА 4. Методы размножения тропических и субтропических растений
щих побегов, которые культивировали как на твердой авизиро¬
ванной, так и в жидкой питательной среде Вацина—Вента, кото¬
рую модифицировали 20 % кокосового молока и 2 мг/л БАП.
Для удобства культивирования эксплантов в жидких средах при¬
меняли подложки из стерилизованного пенополиуретана и мос¬
тики из стерильной фильтрованной бумаги. Как показали прове¬
денные исследования, наибольшее количество протокормов ре¬
генерировало на средах с добавлением БАП (табл. 4.48).
Максимальное количество протокормов (71,4 %) образовалось
в жидкой среде с применением подложки из пенополиуретана.
Хорошие результаты получены и при культивировании эксплан¬
тов на мостиках из фильтровальной бумаги. Очевидно, что жид¬
кая питательная среда более предпочтительна для культивирова¬
ния изолированных эксплантов D. phalaenopsis. Для формирова¬
ния растений наиболее подходящей оказалась агаризированная
среда (43,0 %).
В связи с этим нами были проведены исследования по куль¬
тивированию изолированных тканей в жидких перемешиваю¬
щихся питательных средах с использованием роллера. Эксплан¬
тами служили различные части полученных in vitro растений —
листья, побеги, корни. В опыте использовали разные по составу
питательные среды (табл. 4.49).
Экспланты помещали в специальные сосуды с питательной
средой. Количество среды в сосудах — от 3 до 5 мл, скорость
вращения роллера — 20 об/мин, время культивирования — 2 мес.
Таблица 4.48. Влияние состава и консистенции питательной среды
Вацина—Вента на морфогенез эксплантов Dendrobium phalaenopsis
Особенности
культивирования
Образовавшиеся структуры, % общего количества
на среде с
20 % кокосового молока
на среде
с 2 мг/л БАП
Протокормы
Растения
Прото кормы
Растения
Жидкая среда (мос¬
тики из фильтро¬
вальной бумаги)
0
28,6
43,0
14,3
Жидкая среда (мос¬
тики из пенополи¬
уретана)
0
0
71,4
0
Агаризированная
среда
0
43,0
43,0
14,3
351
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.49. Состав питательных сред, используемых для культивирования
эксплантов Dendrobium phalaenopsis в роллере, мг/л
Но¬
Компонент
мер
среды
Среда
БАП
Аденин
Гидролизат
казеина
НУК
Кокосовое
молоко *
Сахароза
1
Вацина—
Вента
2,0
—
—
—
—
-
2
То же
—
2,0
—
—
—
—
3
л
—
—
—
—
15,0
2000,0
4
Мураши¬
ге—С куга
10,0
10,0
1,0
1,0
30 000,0
* В процентах.
Наилучшие результаты были получены при культивировании экс¬
плантов на питательной среде № 3, основу которой составляли
макро- и микроэлементы среды Вацина—Вента с добавлением
кокосового молока и сахарозы. Следует отметить, что в этом ва¬
рианте протокормов образовалось в 2 раза больше, чем побегов
(табл. 4.50). По нашему мнению, кокосовое молоко, содержащее ве¬
щества цитокининовой природы, способствовало интенсивному де¬
лению клеток, что, в свою очередь, вызывало массовое формирова¬
ние протокормов. При добавлении БАП количество образован¬
ных протокормов и побегов одинаково и составляет 37 %. Однако
на средах с кокосовым молоком регенерация протокормов прохо¬
дила в 2 раза интенсивнее, чем на средах с БАП. На средах № 1
и № 4 индукция морфогенеза не наблюдалась.
Наибольшим морфогенетическим потенциалом обладали листья
и части побегов. Это объясняется, очевидно, тем, что данные экс¬
планты содержали пазушные меристемы, которые и формировали
протокормы. Добиться регенерации из тканей корней не удалось.
Полученные протокормы в дальнейшем культивировали на среде
Кнудсона, на которой они активно формировали растения. В воз¬
расте 12—14 мес растения-регенеранты имели 3—5 листьев и 4—
5 придаточных корней и их высаживали из колб в плошки.
Таким образом, на основании проведенных нами исследова¬
ний установлено, что оптимальными эксплантами для микрораз¬
множения D. phalaenopsis являются почки базальной части веге¬
тирующего и отрастающего побегов, апикальная меристема от¬
растающего побега, а также сегменты листьев и части побегов
полученных in vitro растений, оптимальной средой для культиви-
352
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.50. Влияние состава питательной среды на морфогенез
эксплантов Dendrobium phalaenopsis
Номер
среды
Эксплант *2
Образовавшиеся структуры,
% общего количества
Протокормы
Растения
1
Листья
0
0
Черенки побега
0
0
Корни
0
0
2
Листья
23
20
Черенки побега
14
17
Корни
0
0
3
Листья
70
20
Черенки побега
17
23
Корни
0
0
4
Листья
0
0
Черенки побега
0
0
Корни
0
0
4 Соответствует таковому в табл. 4.49. '2 Части растений, полученных in vitro.
рования — среда Вацина—Вента, модифицированная добавлени¬
ем кокосового молока (20 %) или БАП (2 мг/л). Причем культи¬
вирование в жидкой среде в роллере обеспечивает наибольший
процент протокормообразования, а для формирования растений
следует применять агаризированную среду Вудсона.
Размножением Dendrobium в культуре in vitro занимались и
многие другие исследователи (Kim et al., 1970; Singh et al., 1984;
Sagawa et al., 1996). В качестве эксплантов также использовали
почки молодых отрастающих побегов. С побегов удаляли листья,
оболочки и делили на 3 части: верхнюю (30 % узлов), среднюю
(45 %) и базальную (30 %), каждая из которых имела почку.
Дольше стерилизовали почки базальной и средней части, мень¬
ше — верхней. Культивировали экспланты на средах МС и Кно¬
па. Развитие почек наблюдали только на среде с гиббереллином.
При этом для почек базальной части побега концентрация гиб-
береллина в среде была выше в 2 раза. Для укоренения побегов к
среде добавляли 15 % гомогената банана (Mosich et al., 1974;
Intuwong et al., 1975; Hew et al., 1988).
Некоторые авторы для микроразмножения Dendrobium исполь¬
зовали апикальные сегменты активно растущих воздушных кор¬
чей, а также проростки длиной 3—5 см, полученные in vitro. Экс¬
планты культивировали на среде Вацина—Вента с 0,75—1,0 мг/л
353
СПЕЦИАЛЬНАЯ ЧАСТЬ
2,4-Д; сначала они дифференцировали протокормы, а потом по¬
беги (Kim et al., 1982; Thomas et al., 1986). Интенсивное прото-
кормообразование отмечено также на среде Кнопа с 0,3 мг/л тиа¬
мина, пиридоксина, кинетина и 10 % яблочного сока (Kukulczan-
ka et al., 1983).
В исследованиях S. Ketsa и соавт. (1990) образование прото¬
кормов из почек вегетирующих побегов Dendrobium наблюдалось
на среде МС с 0,3 мг/л НУК. Побеги интенсивно регенерировали
при добавлении в среду 2 мг/л БАП и 0,5 мг/л НУК. В качестве
эксплантов использовали также спящие почки цветоносов. На среде
МС с 0,5 мг/л АБК при культивировании в течение 15 сут они
образовали побеги, которые в дальнейшем культивировали на
среде с 2 мг/л БА. Укоренение проходило на среде без фитогор¬
монов.
Были проведены интересные опыты по индукции цветочных
почек у D. candidum Wall, ex Lindl. Использовали семена этого ди¬
корастущего вида. На агаризированной среде МС с 0,3 мг/л НУК
при рассеянном свете сначала формировался каллус, потом —
протокормы и побеги. Индукция цветочных почек проходила на
среде МС с 2 мг/л БА и 0,5 мг/л НУК. Частота такой индукции
составляла 27 %. Полученные побеги для инициации цветения
культивировали на разных по составу питательных средах. На
среде со спермидином (0,5 мкМ) количество цветущих растений
составляло 36,0 + 10,8 %, с 0,5 мг/л БА и 1,5 мг/л НУК — 20,3 ±
± 3,3, 2 мг/л БА — 45,8 ± 15,1 %. Часть протокормов и побегов
культивировали сначала на среде с 2 мг/л АБК в течение 2 мес, а
затем переносили на среду с 2 мг/л БА. В этом варианте количество
цветочных зачатков составляло 82,8 + 15,4 %. Цветение наблюдали
только у побегов, корнеобразование которых было ингибировано
(Wang et al., 1995).
Некоторые авторы исследовали влияние состава макроэле¬
ментов в среде МС на развитие изолированных тканей D. phalae¬
nopsis. Установлено, что нитратные формы азота более предпоч¬
тительны (Gandawijija, 1980). Очень часто для клонального раз¬
множения используют в качестве эксплантов различные части
сеянцев и растений-регенерантов Dendrobium (сегменты листьев,
корней, стебля). Экспланты культивировали в жидкой среде Ва¬
цина—Вента и на твердой среде МС. Сегменты листьев сеянцев
и части стебля с почкой через 40 сут культивирования регенери¬
ровали каллус и уже через 6 мес — протокормы. Побеги лучше
развивались на среде МС (Khaw et al., 1978; Fernando, 1979).
354
ГЛАВА 4. Методы размножения тропических и субтропических растений
С использованием кокосового молока, НУК, 2,4-Д и витами¬
нов были получены растения Dendrobium ’Jacqueline Thomas
White1 (Soediono, 1983). В Сингапурском ботаническом саду были
размножены 17 гибридов Dendrobium (Lim-Ho, 1981). Сообщается
также об успешном культивировании D. crumenatum из листьев се¬
янцев, полученных in vitro (Manorama et al., 1986). Растения
D. chysanthum Wall, были размножены с помощью сегментов
псевдоклубней на среде Вацина—Вента. Отмечается, что экспланты
располагали на питательной среде строго горизонтально (Vij et
al., 1989).
D. aduncum Lindl., D. loddigesii Rolfe, D. transparens Wall, раз¬
множали in vitro, используя различные части сеянцев и растений-
регенерантов, взятых из культуры тканей. На питательной среде
Кнопа с фитогормонами они через 6 мес регенерировали расте¬
ния (Yam, 1991).
D. parishii Rchb.f. — миниатюрные эпифиты, листопадные рас¬
тения, распространенные в Мьянме, Таиланде, Лаосе, Камбодже,
Вьетнаме, Китае. Стебли дуговидные, до 40 см в длину и 1,5 см в
ширину. Цветки до 7 см в диаметре. Размножают вегетативно и в
культуре тканей.
Для асимбиотического проращивания использовали семена
собственной репродукции. Семена у D. parishii мелкие, пылевид¬
ные, окрашены в ярко-желтый цвет. Высев проводили по разра¬
ботанной нами методике, применяя модифицированные пита¬
тельные среды Пирика и МС. Семена высевали также из недо¬
зрелых коробочек по методике В.А. Поддубной-Арнольди и В.А. Се¬
лезневой (Поддубная-Арнольди, 1957).
Через 14 сут культивирования семена набухали, образуя про¬
токормы. На 50-е сутки на протокормах начали появляться пер¬
вые листоподобные органы. На среде Пирика сеянцы развивались
медленнее, чем на среде МС. Кроме того, нами было отмечено по¬
явление витрифицированных растений (около 20 %). Через 140—
150 сут культивирования растения имели высоту 2 см, 2—3 листа
и 3—4 корня. У некоторых растений даже в этом возрасте обра¬
зовывались маленькие псевдоклубни. Первые растения были вы¬
сажены в субстрат через 305 сут с момента высева. К этому вре-
Мени каждый сформировавшийся псевдоклубень имел собствен¬
ную корневую систему. Сеянцам D. parishii соответствует симпо-
Диальный тип нарастания побеговой системы.
Необходимо подчеркнуть своеобразную биологическую особен¬
ность, свойственную этому виду. Установлено, что ювенильные
355
СПЕЦИАЛЬНАЯ ЧАСТЬ
растения D. parishii на протяжении 1 — 1,5 мес (ноябрь—декабрь)
находились в состоянии покоя. При этом все листья на псевдо¬
клубнях отмирали (рис. 4.69, а, см. вклейку). После окончания
периода покоя пробуждалась почка возобновления, расположен¬
ная у основания псевдоклубня. Таким образом, ювенильные рас¬
тения D. parishii в условиях in vitro сохраняют биологические ритмы,
присущие генеративным растениям (Иванников, 2002).
Кроме того, нами также зафиксировано цветение сеянцев
D. parishii в условиях in vitro на питательной среде Пирика на 152-е
сутки с момента высева семян. Цветение продолжалось 8 сут.
Цветок по морфологическому строению не соответствовал цветку
генеративного растения. В литературных источниках иногда встре¬
чаются сообщения о цветении орхидей в асептической культуре
(Arditti et al., 1996). Однако в отношении D. parishii факт цвете¬
ния был отмечен нами впервые.
Постасептическая адаптация ювенильных растений успешно
проходит при высадке их на блоки (рис. 4.69, б).
D. unicum Seid. (дендробиум единственный) — один из наибо¬
лее редких и оригинальных представителей рода Dendrobium. Эпи-
фитный вид, впервые введенный в культуру в Англии в 1970 г.
Произрастает в Таиланде, Лаосе и Вьетнаме. На начальных эта¬
пах интродукции этот вид значился в гербариях и живых коллек¬
циях как дендробиум пауковидный (D. arachnites Rchb.f.), пока
знаменитый исследователь флоры орхидей Юго-Восточной Азии
Г. Сейденфаден не выявил существенную разницу между двумя
видами (Kjellsson et al., 1987). На основании отличий в строении
губы цветка и несовпадения ареалов (D. arachnites встречается в
Мьянме и Индии) он описал это маленькое растение с ярко-
оранжевыми цветками как новый вид. В связи с уникальностью
данного вида и для пополнения коллекций ботанических садов
необходимо было разработать метод его семенного размножения
в культуре in vitro, провести морфологические исследования юве¬
нильных фаз развития сеянцев и определить приемы культивиро¬
вания D. unicum для наиболее критического периода — смены
асептической культуры на симбиотическую. Работа проводилась
в отделах тропических растений ГБС им. Н.В. Цицина РАН и
НБС им. Н.Н. Гришко НАН Украины.
Основные трудности при искусственном опылении и получе¬
нии семян у Dendrobium связаны с очень низким процентом завя¬
зывания и вызревания семян в пределах одного клона (Kjellsson
356
ГЛАВА 4. Методы размножения тропических и субтропических растений
et al., 1986). В естественных условиях также очень редко завязы¬
ваются плоды, что отмечают некоторые исследователи. Наличие
в коллекции орхидных ГБС РАН растений из двух разных клонов
позволило получить полноценные семена через 11 мес после ис¬
кусственного опыления.
Зрелые семена D. unicum проращивали на авизированных
питательных средах Кнудсона. Колбы с сеянцами выдерживали в
климатической камере со следующим режимом: температура
(дневная и ночная) — 25—27 °С, относительная влажность возду¬
ха — 70 %, освещенность — 7000 лк, фотопериод —16 ч. Субкуль¬
тивирование протокормов и сеянцев проводили через каждые
2 мес.
Прорастание семян D. unicum начинается с набухания заро¬
дыша, который на 12—15-е сутки после высева, увеличиваясь в
размерах, разрывает семенную оболочку и переходит в следую¬
щую стадию своего развития — протокорм (диаметр около 0,7 мм,
высота 0,3 мм), который имеет четко выраженную апикальную и
базальную части. Последняя содержит несколько рядов ризоидов,
апикальная часть — слегка выпуклую, окруженную 3—4 листовы¬
ми примордиями апикальную меристему.
Мы наблюдали также образование как нормально развитых
протокормов с единственным апексом, так и формирование про¬
токормов неправильной формы со множеством апексов или
групп протокормов, связанных между собой основаниями. Ана¬
логичные результаты были получены и при семенном размноже¬
нии Cymbidium hybr. (Батыгина и др., 1980, 1985; Шевцова и др.,
1986).
Через 1 мес после высева апекс протокорма приобретает
трубчатую форму и преобразуется в листоподобный орган. В его
основании через 45—50 сут после высева эндогенно закладывает¬
ся прокамбиальный тяж, дающий начало первому корню сеянца.
Еще через 150—170 сут полностью формируется ювенильный
побег.
Стадии развития сеянцев описывали по методике определе¬
ния морфологических структур, предложенной Е.С. Смирновой
(1990), согласно которой у каждого побега выделяли междоузлия
с чешуевидными и нормальными листьями.
Листовая серия побега состоит из 4 низовых влагалищных ли¬
стьев на удлиненном 4-метамерном участке и 1 нормально разви¬
того листа на вершине последнего слегка утолщенного междоуз¬
лия. Корневая система ювенильного побега состоит из 1—3 при¬
357
СПЕЦИАЛЬНАЯ ЧАСТЬ
даточных корней, последовательно появляющихся на корневищ¬
ном участке. Дальнейшее развитие сеянцев D. unicum может про¬
ходить тремя путями. Чаще всего побег второго порядка ветвле¬
ния образуется из почки, расположенной в пазухе четвертого
влагалищного листа ювенильного побега после окончательного
формирования его корневой системы, когда помимо 1—3 корней
на первом-третьем междоузлии формируются еще 4—6 корней на
четвертом, слегка укороченном междоузлии. Состав листовой се¬
рии побега второго порядка ветвления следующий: 2 низовых
чешуевидных листа на укороченных междоузлиях, 2 влагалищных
и 2 нормальных зеленых листа на вершине утолщенного псевдо¬
клубня. Третье и четвертое укороченные междоузлия в основании
побега второго порядка имеют корни, достигающие 1,5—2,0 см в
длину (обычно их 8—10).
Значительно реже вместо укороченных междоузлий в основа¬
нии побега второго порядка ветвления образуются удлиненные
корневищные междоузлия, а в остальном строение этих побегов
сходно с описанным морфогенезом сеянцев D. unicum. Образова¬
ние таких структур способствует освоению новых участков суб¬
страта. Иногда ювенильный побег дает начало 2—5 подобным
структурам, увеличивая тем самым коэффициент вегетативного
размножения сеянцев уже на ранних этапах развития.
Кроме описанных выше направлений развития сеянцев D. uni¬
cum, которым свойственно симподиальное ветвление в системе
побегов, иногда нами наблюдался аномальный тип развития. В
этом случае у ювенильного побега корневая система не разветв¬
ляется, а происходит последовательная закладка и развитие ли¬
стьев с утолщенными влагалищами, на каждом метамере после¬
довательно образуется по 1 придаточному корню. Иногда ано¬
мальный побег ветвится, давая боковые побеги второго порядка
и напоминая в целом растение с моноподиальным типом ветвле¬
ния. Однако мы согласны с Е.С. Смирновой (1990) в том, что
нецелесообразно использовать термины “моноподиальный или
симподиальный” при описании ювенильного возрастного состоя¬
ния растений, когда способ ветвления еще окончательно не вы¬
явлен.
В случае образования аномального побега, как правило, после
развития междоузлий с 7—10 листьями, начинается отмирание
протокорма и наблюдается некроз нижней части побега. Однако
в условиях асептической культуры аномальный побег может су¬
ществовать продолжительное время, постоянно нарастая своей
358
ГЛАВА 4. Методы размножения тропических и субтропических растений
верхушечной частью. Подобные нежизнеспособные особи D. uni¬
cum напоминают гиперморфы, описанные у Cymbidium hybr., в
отличие от которых не образуют симподиальную систему побе¬
гов, а просто погибают (Коломейцева и др., 2002).
Смена монополярной организации проростков на биполяр¬
ную, т. е. метаморфоз на начальных стадиях онтогенеза орхидных
происходит вследствие образования собственной корневой сис¬
темы. Согласно проведенным исследованиям, метаморфоз на¬
блюдается у сеянцев D. unicum, развивающихся по двум первым
направлениям морфогенеза.
При реализации третьего пути морфогенеза аномальная
структура не развивает характерную для вида корневую систему и
метаморфоз не происходит. Метаморфоз в онтогенезе D. unicum
заканчивается образованием корневой системы побега второго
порядка ветвления, а протокорм отмирает приблизительно через
год после высева семян. К этому времени сеянцы готовы к вы¬
садке в субстрат.
Адаптацию сеянцы D. unicum, состоящие из побегов первого
и второго порядков, проходили в оранжерее с теплым режимом
(зимняя ночная температура — 16—18 °С, относительная влаж¬
ность воздуха — более 70 %) на субстратах из сфагнового мха и
минеральной ваты. В оранжерейных условиях было отмечено из¬
менение длины междоузлий в связи с чередованием увлажнения
и подсыхания субстратов.
Развитие побега третьего порядка начинается в марте и за¬
вершается в октябре. Листовая серия побега состоит из 3 чешуе¬
видных, 2 влагалищных и 4—6 нормальных зеленых листьев. Суб¬
страт из сфагнового мха покрывает сеянцы почти на 2/3 их дли¬
ны, смягчая колебания влажности и освещенности. В таких усло¬
виях побег третьего порядка развивает ползучий корневищный
участок, состоящий из 4 удлиненных междоузлий. В пазухах вто¬
рого, третьего и четвертого чешуевидных, а также пятого и шес¬
того влагалищных листьев начинают развиваться пазушные поч¬
ки. Каждое из удлиненных междоузлий имеет по 2—8 коротких
корней длиной до 1,0—1,2 см.
Высадку сеянцев D. unicum в субстрат из минеральной ваты
проводили так, чтобы он не покрывал почку возобновления в
основании побега второго порядка, поскольку заглубленная по¬
садка может привести к загниванию почки при переувлажнении.
При этом сеянцы находятся в более жестких условиях, чем при
культивировании в сфагновом мху. В данном случае колебания
359
СПЕЦИАЛЬНАЯ ЧАСТЬ
освещенности и влажности в оранжерее ничем не смягчаются.
При таких условиях выращивания у побега третьего порядка
4 первых корневищных междоузлия укорочены. Его корневая
система состоит из коротких придаточных корней, развивающих¬
ся на укороченных междоузлиях корневища с середины июля.
Следует отметить, что при выращивании сеянцев на различ¬
ных субстратах строение побеговой системы принципиально не
меняется, однако длина междоузлий при повышении влажности
и затенении увеличивается. Проведенные исследования показали,
что развитие удлиненных или укороченных междоузлий корне¬
вищной части побегов в зависимости от внешних условий — ха¬
рактерная особенность развития D. unicum. Перевод сеянцев из
асимбиотической культуры в симбиотическую сопровождается
инфицированием их корней эндомикоризными грибами. Толи-
копофаговая эндомикориза обнаружена нами в корнях сеянцев
D. unicum спустя 2 мес после высадки их в субстрат из сфагно¬
вого мха. Микотрофность корней побегов третьего порядка со¬
ставила 6,45 % спустя 3,5 мес после высадки.
Наиболее благоприятным временем для высадки сеянцев
D. unicum в оранжереи, по нашим наблюдениям, является март.
Сформировавшийся в течение вегетационного сезона (март—сен¬
тябрь) побег третьего порядка ветвления в октябре—декабре сбра¬
сывает листья, и ритм побегообразования сеянца синхронизирует¬
ся с таковым генеративно зрелого растения. Побег четвертого по¬
рядка начинает развиваться в марте следующего года. У сеянцев,
оставшихся невысаженными (в колбах) и выдерживающихся в ус¬
ловиях климатической камеры с постоянным режимом, образова¬
ние побега третьего порядка происходит без периода покоя, лис¬
топад наблюдается только у ювенильного побега и побега второго
порядка. В то время как сеянцы, высаженные в оранжерейных ус¬
ловиях, находятся в состоянии относительного покоя, у сеянцев,
содержащихся в условиях климатической камеры, из 2—4 почек
возобновления без периода покоя развиваются побеги четвертого
порядка, имеющие, как правило, вид аномальных побегов.
Муссонный климат в районах произрастания D. unicum опре¬
деляет сезонность его развития — во время влажного летнего
муссона с июня по сентябрь наблюдается активный рост вегета¬
тивных побегов, а во время сухого зимнего муссона с октября по
февраль происходит цветение и закладка новых почек. Ритмы
побегообразования у сеянцев также сильно колеблются в зависи¬
мости от экологических условий. Первое цветение высаженных в
360
ГЛАВА 4. Методы размножения тропических и субтропических растений
оранжерею сеянцев D. unicum мы наблюдали на хорошо сформи¬
рованных и полностью сбросивших листья побегах пятого поряд¬
ка. Внепочечное развитие генеративных побегов у сеянцев так
же, как и у взрослых растений, длилось с февраля по май, цвете¬
ние продолжалось с мая по июнь. Цветки имеют ярко-оранжевые
лепестки и чашелистики, палевую губу с коричнево-оранжевыми
жилками. У них отсутствует скручивание завязи (ресупинация),
отчего цветки выглядят как бы перевернутыми губой вверх.
Как показали наши исследования, каждый побег D. unicum
развивается до тех пор, пока не реализуется потенциал всех его
вегетативных и генеративных почек. Симподиальное ветвление
новых побегов происходит вдоль всей оси, и нижние почки в ос¬
новании каждого из образующих ось ветвления побегов остаются
живыми на протяжении 4—6 лет. По-видимому, именно этот срок
следует считать максимальным сроком жизни побега D. unicum.
D. draconis Rchb.f. — облигатный эпифит, распространен в
Мьянме, Таиланде, Лаосе, Вьетнаме. Туберидии булавовидные,
30—45 см в длину. Молодые листья густо опушены черными жест¬
кими волосками, которые вскоре опадают. Цветки до 7 см в диа¬
метре, беловатые, с запахом. Размножают вегетативно и в культу¬
ре тканей (Черевченко и др., 2001).
В природе этот вид чрезвычайно декоративной орхидеи пре¬
бывает на грани исчезновения, поэтому одним из способов его
сохранения является изучение в условиях оранжерей, что требует
значительного количества посадочного материала. В связи с этим
разработка метода семенного размножения D. draconis в культуре
in vitro поможет сохранить данный вид ex situ.
Для получения семян D. draconis нами было проведено пере¬
крестное опыление цветков в условиях оранжерей. Плод — коро¬
бочка, до 3,5 см в длину, имеет обратнояйцевидную форму и со¬
зревает на протяжении 6—6,5 мес. Удлиненно-веретеновидные
ярко-желтые семена высевали на разные по составу питательные
среды Кнудсона, МС, Пирика. Установлено, что на среде Кнуд¬
сона они начинали прорастать уже на 14-е сутки, а на 20-е сутки
культивирования образовывали протокормы. На других средах
семена прорастали в течение 1—2 мес.
Добавление к среде 2 мг/л аденина значительно ускоряло этот
процесс. Полученные протокормы делили и субкультивировали
на среде МС с 4 мг/л аденина, 500 мг/л активированного угля и
без него. Также использовали среду Пирика-2 с активированным
углем и без него.
361
СПЕЦИАЛЬНАЯ ЧАСТЬ
Показано, что концентрации активированного угля и макро¬
элементов в среде значительно влияют на интенсивность раз¬
множения протокормов. Так, прирост массы протокормов на
среде МС составлял 3,4 г (через 2 мес культивирования), на среде
Пирика-2 — 2,2 г, количество регенерировавших побегов — соот¬
ветственно 40 и 25 шт. Ингибирующее действие активированного
угля в среде сказывалось на приросте массы протокормов (только
1,4 г) и количестве побегов (8 шт). Вычисленный нами ростовой
индекс на средах с активированным углем составлял 13,5, без
него — 21,6. Кроме того, на среде МС он достигал 34, на среде
Пирика-2 — 21,6. Таким образом, питательная среда МС без ак¬
тивированного угля с 4 мг/л аденина является оптимальной для
размножения протокормов D. draconis.
Для укоренения побегов D. draconis использовали среды МС с
НУК (0,1 мг/л), ИМК (0,1 мг/л) и Пирика-2. Установлено, что
по таким показателям, как высота сеянцев, количество и длина
листьев и корней лучшей средой была МС с 4 мг/л аденина и
0,1 мг/л НУК.
Количество укорененных сеянцев составляло 80 %. Показано,
что на среде с НУК количество побегов второго порядка было
значительно выше, чем на среде с ИМК. Эти побеги появлялись
либо при прорастании почек возобновления, расположенных у ос¬
нования базальной части сеянца, либо при прорастании спящих по¬
чек на образовавшихся маленьких туберидиях. Следует отметить,
что у 95 % сеянцев D. draconis через 1,5 года после высева сфор¬
мировались маленькие туберидии длиной от 0,5 до 1 см. По на¬
шему мнению, это объясняется тем, что повышенная концентра¬
ция цитокинина в среде устраняла апикальное доминирование и
способствовала пробуждению спящих почек (Лаврентьева и др.,
2005). На среде с 0,1 мг/л ИМК корни у сеянцев были более длин¬
ными и утолщенными, чем на среде с ИУК.
Для размножения в культуре in vitro D. antennatum Lindl.,
D. crumenatum (Rumph.) Sw., D. densiflorum Wall., D. kingianum
Bidwill ex Lindl., D. speciosum J.E. Smith, D. intricatum Gagnep.,
D. moniliforme Sw. использовали семена репродукции НБС. Их
высевали на модифицированную нами среду КПГУ (Черевченко
и др., 1986). Прорастание семян и развитие сеянцев проходило в
разные сроки (табл. 4.51).
Из 7 исследуемых видов раньше всех начинают прорастать се¬
мена D. kingianum — через 11 сут, остальные — через 23—30 сут.
Соответственно и формирование растений происходит в разные
362
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.51. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Dendrobium, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
D. antenna turn Lindl.
25
158
360
О. bellatulum Rolfe
41
135
290
D. clavatum var. auranticum
26
122
280
D. crumenatum (Rumph.) Sw.
27
90
284
D. densiflorum Wall.
30
247
347
D. discolor Lindl.
123
188
369
D. draconis Rchb.f.
31
105
270
D.formosum Roxb.
42
126
340
D. intricatum Gagnep.
29
174
386
D. kingianum Bidwill ex Lindl.
11
61
127
D. moniliforme Sw.
30
80
250
D. moschatum (Willd.) Sw.
53
123
188
D. nobile Lindl.
58
291
536
D. parischii Rchb.f.
16
138
320
D. phalaenopsis Fitzg.
25
126
141
D. speciosum J.E. Smith.
23
117
302
D. unicum Seid
15
50
180
Dendrobium Noel ’Richella4
21
144
247
Dendrobium Tangerine4
27
185
298
сроки: у D. kingianum, D. crumenatum, D. speciosum — за 60— 117 сут, у
D. moniliforme, D. intricatum — за 140—160 сут. Дольше всех этот
процесс проходил у D. densiflorum. Такая же тенденция сохраняет¬
ся и для сроков высадки сеянцев в субстрат: у D. kingianum это
происходит через 127 сут, а у остальных видов — почти в 2—
3 раза дольше. В субстрат высаживали сеянцы с 3—4 листьями и
2—3 корнями. У D. moniliforme и D. intricatum мы наблюдали в куль¬
туре in vitro период покоя: листья на сеянцах желтели и опадали, но
уже в январе в нижней части побега начинала прорастать почка
возобновления, формируя новый побег.
Прошлогодние побеги к этому времени уже образовывали не¬
большие туберидии с собственной корневой системой, поэтому
размножение in vitro может осуществляться как молодыми побе¬
гами, так и вновь сформированными туберидиями. Кроме того,
полученные in vitro растения могут быть использованы как вто¬
ричные экспланты.
Получить семена собственной репродукции у D. lomatochilum
Seidenf. нам не удалось, поэтому для его размножения применили
культуру тканей. Эксплантами были пазушные и апикальные почки
363
СПЕЦИАЛЬНАЯ ЧАСТЬ
побегов, которые отбирали весной. Следует отметить, что латераль¬
ные почки располагаются только в верхней и базальной части по¬
бега, а срединная часть их не имеет. Этот факт необходимо учиты¬
вать при отборе эксплантов. Культивировали экспланты (части по¬
бега длиной 1 см с почкой) на средах МС, Пирика и WPM. Регене¬
рация протокормов наблюдалась через 2 мес с момента введения в
культуру у почек верхней части побега и спящих почек цветоноса
на среде МС с 4 мг/л аденина. Полученные протокормы размножа¬
ли на среде Пирика-2. Регенерация побегов и их укоренение лучше
проходили на среде WPM.
х Doritaenopsis представляет собой гибрид, полученный при
скрещивании Doritis pulcherrima Lindl. х Phalaenopsis amabilis (L.)
Blume и садовых форм этих видов. Стебли мощные. Соцветия
длинные, прямостоящие, несут до 20 цветков всевозможной ок¬
раски и рисунка. Очень декоративен, размножается в культуре
тканей.
В качестве эксплантов используют различные части сеянцев,
полученных in vitro, и спящие почки цветоносов. В основном ме¬
тодика та же, что и при размножении Phalaenopsis Blume. Так,
протокормы Doritaenopsis формировались из сегментов листьев
сеянцев на среде Кнудсона с 2 г/л триптона. При этом сегменты
верхней части листьев регенерировали протокормы, сегменты ба¬
зальной — побеги.
Хорошие результаты были получены и при использовании ба¬
зальной части самого сеянца (1/2, 1/4 и 1/8). Регенерация прото¬
кормов проходила на той же среде, но с 4 г/л пептона, триптона
и 15—20 г/л сахарозы. Образовавшиеся протокормы размножали,
получая растения. Следует подчеркнуть, что наличие в среде ак¬
тивированного угля является обязательным условием успешного
размножения (Sagawa et al., 1982; Amaki et al., 1989).
Довольно часто при микроразмножении Doritaenopsis, так же,
как и Phalaenopsis, в питательную среду добавляют до 300 мг/л ас¬
корбиновой кислоты. Это снижает отрицательное воздействие фе¬
нолов, выделяемых в среду. Положительные результаты были полу¬
чены при микроразмножении Doritaenopsis на среде МС с 2 мг/л
НУК и 1—20 мг/л БАП. В последнее время в качестве дополни¬
тельного компонента к среде используют цитокинин ТДЗ. На пита¬
тельной среде МС с 0,2—5,0 мг/л ТДЗ получали сначала многочис¬
ленные протокормы, сформировавшиеся из почек цветоноса
Doritaenopsis, а потом и побеги, причем ТДЗ значительно усиливал
процесс пролиферации (Ernst, 1994).
364
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таким образом, используя описанные и разработанные нами
методы, можно с успехом размножать и получать растения Pha¬
laenopsis и х Doritaenopsis.
Doritis Lindl. Род включает 1 полиморфный вид эпифитов,
реже — наземных растений.
D. pulcherrima Lindl. — эпифитное растение, произрастающее
в Мьянме, Камбодже, Малайзии, Сингапуре. Стебли короткие,
образуют розетку. Цветки мелкие, разнообразной расцветки. От¬
носятся к растениям с моноподиапьным типом ветвления побе¬
гов. Размножают вегетативно, семенами и в культуре тканей.
В опытах по семенному размножению D. pulcherrima в культу¬
ре in vitro использовали семена репродукции НБС. При исследо¬
вании под микроскопом семян этого вида обнаруживается их
большая разнородность. Многие семена неправильной формы,
изогнутые, длина варьирует от 526,4 до 720,0 мкм, ширина — от
39,5 до 92,0 мкм. Высев семян проводили на среду Кнудсона.
Первые признаки прорастания наблюдали на 20-е сутки после
высева. За это время зародыш значительно увеличивался и дос¬
тигал уже 171,1 мкм. На 35-е сутки после высева признаки про¬
растания семян становились заметны невооруженным глазом, так
как длина и ширина семян увеличились почти в 10 раз, достиг¬
нув 342,2 и 197,4 мкм соответственно.
Зародыш за это время увеличивается почти в 3 раза и, разры¬
вая семенную оболочку, формирует протокорм. Через 3—3,5 мес
у сеянцев начинается дифференциация тканей проростка: обра¬
зуются конус нарастания и базальная часть с ризоидами. На этой
стадии у сеянцев впервые можно отметить положительный фото¬
периодизм. В последующем происходит активная закладка листо¬
вых примордиев вокруг апикальной меристемы, а еще через
2 недели появляется первый корень.
В этот период у большинства сеянцев образуются почки в па¬
зухах первого и второго листьев, а у 5 % сеянцев формируются по¬
беги второго порядка. Дальнейшее развитие сеянцев идет с боль¬
шей или меньшей скоростью и заключается в последовательном
нарастании листьев и закладке пазушных почек. В возрасте 1 года
растения в среднем достигают высоты 2,5—3,5 см, имеют 4—
5 листьев и 5 корней, три из которых развиваются у основания
побега, остальные — в пазухах первого, третьего и пятого листьев.
Именно в этот период рекомендуется пикировка сеянцев на
свежую среду или высадка растений в субстрат. В противном слу¬
чае развитие сеянцев затормаживается или совсем прекращается.
365
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис.'4.70. Сеянцы Doritispulcherrima Lindl.
Изложенное выше описание формирования сеянцев D. pul¬
cherrima относится к большинству высеянных семян. При этом
90 % всех сеянцев были морфологически однородны и не имели
отклонений (рис. 4.70), но различались окраской: одни были яр-
ко-зелеными, другие — с красновато-бурым оттенком.
Наряду с этим небольшое количество сеянцев (10 %) имели
некоторые морфологические отклонения. Их условно можно раз¬
делить на три группы. К первой относятся растения с удлинен¬
ными междоузлиями (до 1 см), что не свойственно этим растени¬
ям, из-за чего сеянцы достигали 3—5 см в длину. Сеянцы второй
группы, наоборот, выглядели несколько укороченными, так как
междоузлия у них очень малы, имели сравнительно короткие (до
1 см), но широкие (до 0,8 см) листья. Растения третьей группы
были очень длинными (до 3,5 см), с узкими (0,2 см) листьями.
Ничтожно малая длина междоузлий придавала им сплющенный
вид, расположение листьев напоминало розетку. Большое коли¬
чество воздушных корней (до 20 шт.), образующихся в пазухах
листьев, и растущие вертикально вниз корни приподнимали рас¬
тение над питательной средой.
Именно в этой группе сеянцев можно обнаружить наличие
сериальных почек, что подтверждает высокую систему надежно¬
сти воспроизводства у орхидных.
366
ГЛАВА 4. Методы размножения тропических и субтропических растений
Полученные нами результаты морфологических исследований
свидетельствуют о том, что сеянцам D. pulcherrima уже на ранних
этапах присущ тип развития моноподиальных орхидей: метамер¬
ность, наличие пазушных почек, развитие побега за счет функ¬
ционирования апикальных меристем. Кроме того, наши данные
свидетельствуют о сложной гетерозиготной природе гибридов ор¬
хидей, наиболее ярко проявляющейся при семенном размноже¬
нии. В результате этого происходит расщепление сортовых при¬
знаков и образование сеянцев с различными морфологическими
отклонениями. Такие растения подлежат либо выбраковке, либо
их используют для выведения новых сортов. Однако необходимо
отметить, что все же 90 % сеянцев D. pulcherrima не имеют мор¬
фологических отклонений.
Для клонального размножения D. pulcherrima эксплантами
служили различные части сеянцев и взрослых растений (высечки
из листьев, протокормы). С целью определения оптимальной пи¬
тательной среды для культивирования использовали более 20
сред с разными модификациями регуляторов роста, витаминов,
органических компонентов. Кроме того, все среды были испыта¬
ны в двух концентрациях: твердой (агар) и жидкой (мостики из
фильтровальной бумаги).
В экспериментах по определению оптимальной питательной
среды для культивирования использовали макро- и микроэле¬
менты по Мурашиге—Скугу, Кнудсону, Вацину—Венту. Все ос¬
тальные компоненты изучали в различных сочетаниях и концен¬
трациях (табл. 4.52).
Установлено, что оптимальными эксплантами являются пер¬
вичные протокормы, базальные части сеянцев и части стебля с
латеральными почками — именно на них получено наибольшее
количество протокормов. Нами отмечены также единичные слу¬
чаи образования протокормов на базальной части листьев с пазу¬
хами. Экспланты корней при культивировании увеличивались в
длину вследствие апикального роста. Подобные результаты полу¬
чены и у эксплантов Cymbidium hybr., подтверждая гипотезу о
том, что регенерационный потенциал клеток недозрелых листьев
и других органов, полученных in vitro, очень слабый (Lavrentyeva
et al., 1994). В опытах с эксплантами взрослых растений положи¬
тельные результаты не зафиксированы: они или погибали, или не
развивались.
Оптимальную питательную среду для культивирования изоли¬
рованных тканей D. pulcherrima определяли, выращивая на среде с
367
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.52. Морфогенетическая способность эксплантов
Doritis pulcherrima в культуре in vitro
Образовавшиеся структуры, шт.,
на средах
Эксплант
Мурашиге—Скуга
Кнудсона
Вацина—Вента
Прото¬
кормы
Побе¬
ги
Кор¬
ни
Прото¬
кормы
Побе¬
ги
Кор¬
ни
Прото¬
кормы
Побе¬
ги
Кор¬
ни
Верхняя и
средняя части
листа
Пазухи лис¬
тьев
Сегменты
корня
Сегменты
стебля с па¬
зушными ме¬
ристемами
Базальные
части сеянцев
3
1
2
2
1
—
1
3
11
8
4
4
2
1
1
9
5
3
макро- и микроэлементами по Мурашиге—Скугу, Кнудсону,
Вацину—Венту. Экспланты культивировали на свету и в темноте. В
опытах с минеральной основой по Мурашиге—Скугу хорошие
результаты получены при добавлении 3 мг/л аденина. В этом
варианте из 1 первичного протокорма регенерировало 3—5 новых,
которые в дальнейшем субкультивировали и получали побеги.
Иная картина наблюдалась на средах, основой которых были
минеральные соли по Кнудсону. Здесь хорошие результаты отме¬
чены в вариантах с добавлением 4 мг/л ИУК и 0,5 мг/л тиамина.
На эксплантах первичных протокормов сеянцев дифференцирова¬
лось до 10 новых протокормов, что значительно увеличивало ко¬
эффициент размножения. В дальнейшем при субкультивирова¬
нии они интенсивно регенерировали побеги.
В экспериментах с минеральными солями по Вацину—Венту
неплохие результаты получены при добавлении к среде 0,5 мг/л
ИУК, однако интенсивность образования протокормов была
низкая по сравнению с предыдущими опытами.
Положительные результаты отмечены также при добавлении
к среде 1 мг/л ИУК и 0,5 мг/л тиамина, что способствовало диф¬
ференциации большого количества протокормов (Лаврентьева та
368
ГЛАВА 4. Методы размножения тропических и субтропических растений
iH., 2004; Buyun et al., 2004; Lavrentyeva et al., 2004). Следует от¬
метить, что регенерацию протокормов наблюдали как в условиях
освещенности, так и в темноте. Однако в целом затемнение
стимулировало формирование всех новообразований (Черевченко
и др., 1982, 1987).
Таким образом, на основании изложенного выше мы счита¬
ем, что наилучшая среда для культивирования D. pulcherrima —
среда Кнудсона с добавлением 3 мг/л аденина, 4,0 — ИУК, 0,5 —
тиамина и 0,5 мг/л ИУК.
Epidendnm L. Один из самых многочисленных родов орхидей,
насчитывающий около 1000 эпифитных, наземных или литотроф-
ных видов, распространенных в тропической части Америки.
Миниатюрные или большие растения. Стебли прямые, вьющие¬
ся, тонкие. Цветки разнообразны по размеру и окраске (Черев¬
ченко и др., 2001). Размножают вегетативно делением клона, че¬
ренкованием побега и семенами в культуре in vitro.
Е. ciliare L. — эпифиты и литофиты, произрастающие от
Мексики и Перу до Бразилии. Туберидии цилиндрические, ли¬
стья мясистые. Цветки до 10 см в диаметре, мясистые, восковые,
светло-желтые, с запахом.
Е. difforme Jacq. — очень распространенный вид эпифитных
орхидей, от Флориды и Мексики до Бразилии. Стебли тонкие,
листья мясистые. Цветки до 3 см в диаметре, белые или желтые,
собраны в пучок по 20 шт. на верхнем цветоносе.
Е. nocturnum Jacq. — эпифиты или литофиты, произрастаю¬
щие в Мексике, Бразилии, Перу, Боливии. Стебли прямые, ли¬
стья овальные. Цветки до 9 см в диаметре, зеленовато-белые, с
сильным запахом ночью. Губа белая, с желтым гребнем.
Е. radicans Pav. ex Lindl. — эпифиты, литофиты или наземные
растения, произрастающие в тропиках Центральной Америки.
Генеративные растения могут образовывать на стеблях придаточ¬
ные побеги с корнями. Стебли тонкие, гладкие. Листья кожи¬
стые, с килем. В соцветии около 50 цветков различных оттен¬
ков — от белого и желтого до красного и фиолетового.
Е. elegans Rchb.f. — эпифиты, реже — наземные растения.
Распространены в центральной части Южной Америки. Побеги
Удлиненные, гладкие. Листья кожистые, овальной формы. Цвет¬
ки окрашены в светлые тона.
Для размножения in vitro использовали семена репродукции
НБС НАН Украины, которые высевали на модифицированную
нами среду Кнудсона. Результаты исследований показали, что се¬
369
СПЕЦИАЛЬНАЯ ЧАСТЬ
мена всех видов Epidendrum начинали прорастать и формировать
протокормы на 62-е сутки и только Е. radicans — на 60-е
(табл. 4.53).
Образование растений и высадка их в субстрат проходили
почти в одинаковые сроки (204—382 сут), и только у Е. radicans
данные процессы развивались в 2 раза быстрее. По нашему мне¬
нию, это связанно с тем, что семена данного вида были высеяны
на среду свежесобранными и не хранились в холодильнике.
Сведений о клональном размножении видов Epidendrum срав¬
нительно мало. Они не так популярны, как виды Cymbidium,
Cattleya, Aranda, и редко используются в промышленной индуст¬
рии орхидей. Для клонального размножения in vitro применяли
различные части взрослых растений (кончики воздушных кор¬
ней, почки цветоносов и сегменты стебля), сеянцев и растений-
регенерантов, полученных in vitro.
При микроразмножении Epidendrum пазушными почками ис¬
точником эксплантов служат отрастающие побеги. С них обры¬
вают листья, разрезают на сегменты так, чтобы каждый имел
1 почку (1 см), и стерилизуют. В условиях in vitro на питательной
среде Кнудсона почки прорастают, формируя, к сожалению, только
1 растение в течение 20 недель. Образование только 1 побега на¬
блюдается при использовании почек цветоносов (Zeng et al.,
1966; Steward, 1976).
В качестве эксплантов можно применять и кончики листьев
сеянцев и побегов, полученных in vitro. Этот метод размножения
используется многими исследователями (Churchill et al., 1973; Ku-
kulczanka, 1985). Для культивирования данного вида орхидных реко¬
мендуют различные модификации питательных сред (табл. 4.54).
Кончики листьев сеянцев и растений-регенерантов в возрасте
60 сут, но не старше 1 года использовали в качестве эксплантов.
Таблица 4.53. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Epidendrum, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
Е. radicans Pav. ex Lindl.
60
150
190
E. noctumum Jacq.
62
221
380
E. difforme Jacq.
62
220
382
E. ciliare L.
62
134
260
E. elegans Rchb.f.
62
204
380
370
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.54. Состав питательных сред, используемых для культивирования
эксплантов Epidendrum, мг/л
Компонент
Культивирование сегментов
листьев*1 сеянцев
Размножение
растений
Макроэлементы по Мурашиге—
Скугу
50,0
50,0
№,ЭДТА
74,6
37,3
FeS04 • 7Н20
27,8
27,8
Микроэлементы по Мурашиге—
Скугу"3
1,0
1,0
Тиамин
0,4
0,1
Глицин
2,0
2,0
Инозит
—
100,0
Пиридоксин
—
0,5
Никотиновая кислота
—
0,5
НУК
—
1,0
Кинетин
—
0,04
2,4-Д
1,0
—
БА
0,5
—
Кокосовое молоко *4
—
150,0
Сахароза
30 000,0
30 000,0
■' Среда Churchill и соавт. (1973). ’2 Среда Stewart—Button (1976). ° Приго¬
товление растворов (мл/л) описано в предыдущих главах. ‘4 В миллилитрах
на 1 л.
Их культивировали на твердых средах МС и JIC. Каллусную массу
образовывали только 7 % эксплантов. Растения формировались
после переноса каллуса на среду Кнудсона. Имеется сообщение о
том, что сегменты кончиков листьев длиной 2 мм культивировали
в жидкой среде МС в шейкере. После регенерации каллуса его
переносили на твердую среду МС или Кнудсона, на которой в те¬
чение 3 недель формировались растения (Rundolph et al., 1972).
Известен также метод размножения Epidendrum с использова¬
нием сегментов корней сеянцев, растений-регенерантов, воздуш¬
ных и подземных корней взрослых растений, выращиваемых в
оранжереях. Такие экспланты, как правило, сильно загрязнены
бактериями и грибами, и при культивировании in vitro дают вы¬
сокий процент контаминации. В связи с этим режим стерилиза¬
ции должен быть очень тщательным. На среде МС с 300 мг/л
желатина сегменты корней удлиняются до 6 см в длину, но про¬
токормы, каллус и побеги не образуются (Steward et al., 1978).
Через 1 год после введения в культуру эти корни отмирают.
371
СПЕЦИАЛЬНАЯ ЧАСТЬ
Несколько другую картину мы можем наблюдать при использо¬
вании в качестве эксплантов сегментов корней, сеянцев и побегов,
полученных in vitro. Известно, что не только кончики корней орхи¬
дей, но и других видов растений, содержащих меристематические
зоны, могут расти in vitro (Юсуфов, 1988). Особенно это относится
к изолированным тканям (Churchill, 1972; Лаврентьева и др., 1989).
Растения-регенеранты Epidendrum были получены из пазуш¬
ных почек молодого побега, а сеянцы — при проращивании се¬
мян на среде Кнудсона. Корни разрезали на сегменты длиной
4 см, затем вычленяли экспланты размером 4—8 мм и культиви¬
ровали на среде МС с 0,5 мг/л 2,4-Д. Через 3 недели выращива¬
ния наблюдали неорганизованный рост каллуса. Его субкульти-
вировали на среде Шенка—Хильдебранта с 1 мг/л 2,4-Д. Прото¬
кормы и побеги получали на безгормональной среде Кнудсона.
Следует подчеркнуть, что все структуры Epidendrum, полученные
in vitro, обладают замедленным ростом и развитием. Кроме того,
коэффициент размножения при использовании перечисленных
выше методов сравнительно невысок.
Laelia lindl. Согласно одной из наиболее приемлемых систем,
предложенной К. Withner (1988), род Laelia насчитывает около 59 ви¬
дов, 12 из которых представлены в коллекции НБС НАН Украины.
В качестве объектов исследований нами были использованы
некоторые эндемичные южно-американские виды тропических
орхидных из рода Laelia (L. anceps Lindl., L. lobata (Lindl.) Veitch,
L. lundii Rchb.f. et Warm., L. mantiqueirae Pabst., L. purpurata Lindl.,
L. rubescens Lindl., L. sincorana Schltr.), которые в природе зани¬
мают нишу факультативных эпифитов и в связи с их низкой чис¬
ленностью нуждаются в природоохранных мероприятиях.
Все виды рода являются многолетними травянистыми расте¬
ниями с симподиальным типом ветвления и ползучим корневи¬
щем, на котором компактно или на некотором расстоянии разме¬
щаются туберидии. Среди этих растений можно встретить группы с
различным типом развития побегов, что важно учитывать при мик¬
роразмножении. Так, у L. lundii генеративно опережающий тип
развития побегов, в то время как у большинства других видов —
вегетативно опережающий. По количеству ежегодно формируе¬
мых побегов виды рода также разделяют на несколько групп. Так,
в клоне L. lobata и L. purpurata в год образуется по 1 побегу, в то
время как у L. sincorana и L. lundii — по 2. На примере исследуе¬
мых видов нами было впервые показано, что внутрипочечная фаза
развития побега у представителей этого рода длится около 2 лет.
372
ГЛАВА 4. Методы размножения тропических и субтропических растений
Исключение составляют лишь L. sincorana и L. lundii, у которых в
год может формироваться 2 побега.
Высев и проращивание семян проводили согласно классиче¬
ским методикам (Поддубная-Арнольди и др., 1957; Черевченко и
др., 1982). Некоторые данные о сроках онтогенеза видов данного
рода приведены в табл. 4.55. Сеянцы культивировали на твердой
агаризированной среде, за основу была взята пропись среды МС.
Колбы с растениями размещали на стеклянных стеллажах в куль¬
туральном помещении (освещеность 2000—3000 лк, фотопериод
16 ч, температура 21—28 °С).
L. anceps Lindl. — эпифит или литофит. Туберидии удлинен¬
но-яйцевидные, длиной до 7 см, шириной 2,5 см, с заостренны¬
ми краями, утолщенные стороны ребристые, с 1 или 2 листками
на верхушке. Листья ланцетовидные, одиночные, килеватые, ко¬
жистые, заостренные, длиной до 15—20 см, шириной 3—4 см,
охватывают цветонос, формирующийся на верхушке туберидия.
Цветонос длиной до 70 см, несет 2—3 цветка. Растения этого ви¬
да распространены в Мексике.
В работе использовали семена репродукции НБС. Методики
высева и стерилизации исходного материала, приемов культиви¬
рования и размножения сеянцев традиционны. Семена высевали
на среду МС, на которой сеянцы могут находиться в течение
всего срока культивирования. Растения лучше развиваются на
средах, в состав которых включен активированный уголь. Адап¬
тация сеянцев не вызывает проблем. Ювенильные растения мож¬
но высаживать в мох или на блоки; во втором случае некоторое
время необходимо следить за уровнем влажности воздуха.
Таблица 4.55. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Laetta, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
L. anceps Lindl.
95
287
1458
L- gouldiana Rchb.f.
99
325
980
L- lobata (Lindl.) Veitch
11
240
1080
L- lundii Rchb.f. et Warm.
60
135
300
L. purpurata Lindl.
27
191
394
L. rubescens Lindl.
17
270
930
L. sincorana Schltr.
80-90
270
400
superbiens Lindl.
100
302
1002
L tenebrosa Rolfe
26
339
1080
373
СПЕЦИАЛЬНАЯ ЧАСТЬ
L. lobata (Lindl.) Veitch — один из наиболее интересных видов
секции Cattleyodes и в целом всего рода Laelia, который занесен в
первое приложение CITES эндемов Бразилии и Венесуэлы. Не¬
смотря на относительно небольшой ареал, у этого вида существу¬
ет достаточно большое количество цветковых форм. Представи¬
тели L. lobata in situ распространены в нескольких изолированных
локалитетах на склонах “органных” гор вулканического происхож¬
дения (200—800 м над ур. м.), которые окружают столицу Брази¬
лии и обращены к океану (Withner, 1988). Растения этого вида
встречаются и в окрестностях г. Нитерой, где произрастают на
открытых склонах среди кустарников Vellozia и небольшого ко¬
личества растений из рода Tillandsia.
В работе использовали семена репродукции НБС. Стерилиза¬
цию проводили по традиционной схеме. Сеянцы культивировали
в стандартных условиях.
Визуально семена L. lobata желтоватого цвета, поверхность не¬
ровная и непрозрачная. Зародыш семени этого вида четко диффе¬
ренцирован на апикальную и базальную часть и расположен
апексом в сторону халазального конца. На первых этапах прорас¬
тания в условиях асептической культуры семена существенно на¬
бухают — их ширина увеличивается в 2—3 раза, а длина остается
неизменной. Зародыши превращаются в шарики беловатого цве¬
та диаметром до 0,5 мм. В дальнейшем в их тканях начинают
синтезироваться фотосинтетические пигменты и молодые споро¬
фиты постепенно переходят к автотрофному способу питания.
Для семенного размножения L. lobata мы рекомендуем ис¬
пользовать несколько вариантов питательных сред (табл. 4.56).
Для проращивания семян использовали среду КПГУ. В про¬
цессе исследования установлено, что среди целого ряда пита¬
тельных сред, рекомендуемых в литературе для культивирования
видов этого рода, наиболее приемлемой является среда МС. На
этапе дифференциации второго листа сеянцы (рис. 4.71, а, см.
вклейку) пассивировали на среду МС с концентрацией солей,
меньшей в 1,5 раза. Последующие пассажи проводили регуляр¬
но через каждые 4—5 мес на эту же среду (рис. 4.71, б). Для
улучшения результатов мы рекомендуем последний пассаж про¬
водить на среде МСБ. Культивирование сеянцев на этой среде
на более ранних этапах не принесло желаемых результатов.
Первые сеянцы были высажены в субстрат через 2,5—3 года с
момента высева семян.
374
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.56. Состав питательных сред, используемых
для семенного размножения Laelia lobata, мг/л
Компонент
МС
КПГУ
МС-Б
Ca(N03)2
—
1000,0
—
КН2Р04
170,0
250,0
170,0
К2НР04
—
—
—
NaH2P04
—
—
—
MgS04 7Н20
370,0
250,0
370,0
СаС12 2Н20
440,0
—
440,0
KN03
1900,0
—
1900,0
(NH4)2S04
—
500,0
—
nh4no3
1650,0
—
1650,0
№2ЭДТА
74,5
37,5
74,5
FeS04 7H20
27,8
25,0
27,8
H3B03
6,2
—
6,2
MnS04 4H20
6,2
7,5
6,2
ZnS04
—
—
—
ZnCl2
3,93
—
3,93
KI
0,83
—
0,83
Na2Mo04 • 2H20
0,25
—
0,25
CuS04 5H20
0,025
—
0,025
CoC12 6H20
0,025
—
0,025
А/езо-инозит
100,0
—
100,0
Эдамин
1000,0
—
—
Глицин
2,0
—
—
Тиамин
0,1
—
—
Пиридоксин
Никотиновая
0,5
—
—
кислота
0,5
—
—
Гумат калия
50,0
—
Пептон
2000,0
—
ИУК
0,1
—
Сахароза
Активированный
30 000,0
20 000,0
30 000,0
уголь
—
1000,0
1000,0
Агар
8000,0
8000,0
8000,0
pH
5,6
5,5
5,7
К среде добавляли 200 г/л гомогената банана.
Полуненные результаты свидетельствуют, во-первых, о том,
что сеянцы этого вида нетребовательны к концентрации мине¬
ральных компонентов среды (на фоне наличия других необходи¬
мых составляющих) и вполне могут быть удовлетворены стан¬
дартными прописями среды МС. Во-вторых, гомогенат банана,
375
СПЕЦИАЛЬНАЯ ЧАСТЬ
вероятно, содержит такой баланс фитогормонов, который обес¬
печивает нормальное развитие сеянцев L. lobata на последних
этапах культивирования в условиях асептической культуры.
L. lundii Rchb.f. et Warm. — эпифит или литофит. Распростра¬
нена преимущественно в Бразилии. Имеет симподиальный тип
ветвления побегов. Осевую основу побега формирует удлиненно¬
веретеновидный туберидий зеленого цвета высотой 3—5 см и
шириной 1,5—2,5 см. Туберидии у этого вида, как правило, дву¬
листные. Листья линейные, полукруглые в поперечном разрезе,
на конце заостренные, кожистые, длиной до 9 см, шириной до
0,5 см. Цветонос может нести 1, реже — 2 цветка.
Приемы семенного размножения и постасептической адапта¬
ции этого вида аналогичны другим видам рода. Ювенильные рас¬
тения все этапы онтогенеза in vitro, вплоть до высадки в субстрат,
могут проходить на стандартной среде МС с активированным
углем (рис. 4.72, а, см. вклейку). Представители этого вида, в от¬
личие от других, практически не образуют вторичных протокор¬
мов, но активно формируют побеги второго и последующих по¬
рядков. Таким образом, разделяя сеянцы, можно клонировать
растения в необходимых количествах. Сеянцы L. lundii плохо пе¬
реносят добавление к питательной среде гомогената банана.
Адаптация стандартная — в субстрате из сфагнового мха.
L. mantiqueirae Pabst. — вид симподиально нарастающих ор¬
хидных. Как самостоятельная таксономическая единица стала из¬
вестна лишь с 1975 г., поэтому каких-либо конкретных литератур¬
ных данных о ее биологии, а тем более об особенностях размно¬
жения в искусственных условиях мы не встретили (Withner, 1990).
Для коллекции НБС НАН Украины первые растения L. man¬
tiqueirae в 1999 г. предоставили сотрудники аргентинской фирмы
“Winkler’s Orchids”. В наших условиях растения цветут в февра¬
ле-марте.
При высеве семян была использована методика “зеленых ко¬
робочек”, поэтому мы оставляли плод на растении на срок около
10 мес (Arditti, 1979). Семена высевали на модифицированную
среду КПГУ (Кушнир и др., 1981). Визуально набухание можно
было наблюдать уже на 5—7-е сутки, а к концу 3-й недели в за¬
родышах начинался синтез собственных фотосинтетических пиг¬
ментов — они приобретали зеленую окраску. К этому времени их
диаметр увеличивался до 2 мм.
Темпы индивидуального развития сеянцев существенно отли¬
чаются, что особенно заметно на последних этапах развития в
376
ГЛАВА 4. Методы размножения тропических и субтропических растений
условиях асептической культуры. Вероятно, это обусловлено вы¬
сокой гетерогенностью самих семян, а следовательно, и популя¬
ций L. mantiqueirae в целом, поэтому через 90 сут после высева
мы были вынуждены произвести первый пассаж с целью сорти¬
ровки сеянцев.
Согласно нашим наблюдениям, в условиях культуры in vitro
можно наблюдать несколько основных путей развития сеянцев.
Значительная их часть (до 80 %) на протяжении всего срока
культивирования развивается как самостоятельные растения, не
формируя побегов последующих порядков и имея моноподи-
альный тип нарастания. У 15 % растений на последних этапах
культивирования могут активизироваться почки в пазухах ниж¬
них листьев и образовываться побеги второго порядка. Еще
около 4 % растений погибает на ранних этапах развития (по
непонятным для нас причинам) и лишь некоторые экземпляры
в наших условиях проявляют тенденцию к формированию вто¬
ричных протокормов, а в дальнейшем — и целых конгломератов
растений.
Установлено, что сеянцы этого вида орхидных очень требова¬
тельны к освещению. Колбы с сеянцами располагались на рас¬
стоянии 25 см от источника света (3000 лк). При такой интен¬
сивности освещения и 16-часовом фотопериоде по периметру
листьев сеянцев появлялась характерная для данного вида пур¬
пурная полоса (шириной до 1,5 мм) с нечеткими границами.
При семенном размножении L. mantiqueirae мы рекомендуем
использовать три варианта питательных сред. Для проращивания
семян и на первых этапах развития сеянцев мы применяли среду
КПГУ (160—180 сут). Следующие 150—200 сут мы использовали
среду МС с 4 мг/л аденина, после чего растения доращивали на
1/2 концентрации среды МС с добавлением 200 мг/л гомогената
банана.
Первые сеянцы были высажены в субстрат в сентябре 2002 г.,
спустя 915 сут с момента высева семян (рис. 4.72, б): среднеста¬
тистическое растение имело 10 корней (длиной до 40 мм и 2 мм
в диаметре) и до 10 листьев (длиной до 45 мм и шириной
5,5 мм). Как показывает наша практика, ювенильные растения
можно крепить на блоки из коры сосны.
L. purpurata Lindl. — вид эпифитных симподиальных орхид¬
ных, распространен в Бразилии. Осевую основу побега формиру¬
ет веретеновидный туберидий зеленого цвета длиной до 15 см и
шириной 3 см. Туберидии генеративно зрелых растений, как пра¬
377
СПЕЦИАЛЬНАЯ ЧАСТЬ
вило, однолистные. Лист кожистый, прямостоящий, на конце
закругленный, длиной до 22 см и шириной 5 см. Цветонос несет
4—5 цветков.
Аналогично происходит образование протокормов у изолиро¬
ванных листьев L. purpurata. Инициация протокормов и индук¬
ция органогенеза у Laelia более интенсивны на среде Кнудсона с
добавлением 0,3 мг/л НУК и 2 мг/л БАП.
L. rubescens Lindl. впервые был описан в 1840 г. Эти декора¬
тивные эпифиты произрастают в местностях на высоте 1100м
над ур. м., широко распространены по Южноамериканскому
континенту (Мексика, Гватемала, Сальвадор, Никарагуа, Гонду¬
рас, Коста-Рика, Панама).
Семена L. rubescens были получены из оранжерей ГБС РАН
(Москва) в январе 2001 г. Высев проводили согласно классиче¬
ским методикам (Knudson, 1922) на модифицированную среду
КПГУ. В работе с этим видом мы использовали следующий ре¬
жим стерилизации: thimerosal (0,01 %) — 22 мин, chlorax —
15 мин, Н202 (15 %) — 9 мин. Сеянцы культивировали в стан¬
дартных условиях. Растения нормально развивались на средах,
рекомендуемых для видов этого рода.
В наших условиях проросло около 12 % семян. Первые при¬
знаки прорастания были заметны уже на 10—12-е сутки. В этот
период зародыши семян увеличивались в диаметре, постепенно
освобождаясь от семенной оболочки. На 22—27-е сутки они име¬
ли вид мелких беловатых шариков диаметром до 0,5—0,7 мм. На
30—35-е сутки после высева можно было наблюдать массовое по¬
зеленение зародышей, т. е. в этот период, вероятно, в проростках
запускаются механизмы синтеза собственных фотосинтетических
пигментов и постепенного перехода к автотрофному способу пи¬
тания. Описывая основные этапы онтоморфогенеза сеянцев L. ru¬
bescens в условиях асептической культуры, отметим, что в целом
он идентичен таковому у других видов этого рода (1ваннжов,
2001). Разница заключается лишь в некоторых деталях.
Протокормы L. rubescens в асептических условиях имеют ха¬
рактерную для всего рода сферическую сплюснутую в дорсовен-
тральном направлении форму. В терминальной части протокорма
формируется точка роста, которая в дальнейшем и дает начало
апикальной меристеме проростка (побега первого порядка). По¬
сле образования 2—3 первых листоподобных органов (на 90—125-е
сутки) у протокормов L. rubescens можно наблюдать формирова¬
ние и рост первых корней. Причем в отличие от сеянцев L. ап-
378
ГЛАВА 4. Методы размножения тропических и субтропических растений
ceps, L. lobata, L. lundii, L. mantiqueirae, L. purpurata, L. sincorana, у
сеянцев L. rubescens первый корень может образовываться непо¬
средственно из тела протокорма.
Характерной особенностью этого вида является активное
формирование в условиях in vitro большого количества (7—
12 шт.) вторичных протокормов непосредственно из тела первич¬
ного протокорма. В дальнейшем они активно наращивают веге¬
тативную массу и образуют первые листоподобные органы. При
этом развитие меристемы первичного протокорма приостанавли¬
вается, и его тело вследствие формирования массы вторичных
протокормов становится похожим на зеленую щетку (рис. 4.73,
см. вклейку). Чтобы избежать гибели отдельных индивидуумов,
подобные скопления необходимо регулярно разделять и переса¬
живать на свежую питательную среду.
Первый пассаж был проведен на среды МС и МСБ через
127 сут с момента высева. В обоих вариантах сеянцы развивались
нормально, имели здоровый вид (темно-зеленые, не вытянутые
листья и стебли) и активно формировали вторичные протокормы.
При следующих пересадках сеянцы, которые культивировались на
МСБ, практически в 2 раза опережали по темпам нарастания веге¬
тативной массы сеянцы, выращиваемые на МС. Кроме того, при
выращивании на среде МС мы иногда наблюдали формирование
витрифицированных растений, в связи с чем все последующие
пассажи проводили на среду МСБ. В дальнейшем сеянцы L. rubes¬
cens активно наращивали вегетативную массу, формируя полно¬
ценные листья и корни. Через 300—400 сут большинство растений
имело 3—4 листа и 1—2 корня. Необходимо отметить, что разви¬
тие индивидуумов в ювенильных популяциях L. rubescens в асеп¬
тических условиях происходит крайне неоднородно. Мы наблю¬
дали существенные различия в показателях массы, линейных раз¬
меров, наличии тех или иных органов у одновозрастных растений.
По нашему мнению, подобные факты могут свидетельствовать о
высокой экологической пластичности вида, которая характерна и
для других групп эпифитных орхидных.
Первые сеянцы были высажены из колб в возрасте 558 сут. К
этому моменту они имели 5—7 листьев и 3—5 корней. Некоторые
из них (около 15 %) начали формировать побеги второго порядка
и структуры, подобные туберидиям генеративно зрелых растений.
В этом возрасте туберидий у L. rubescens представляет собой
утолщение последнего или предпоследнего вытянутого междоуз¬
лия и имеет насыщенно-зеленый цвет. На его вершине располо¬
379
СПЕЦИАЛЬНАЯ ЧАСТЬ
жены 1—2 настоящих листа. Сеянцы высаживали на блоки из
коры сосны (Pinus sylvestris L.) и в измельченный сфагновый мох
(Sphagnum palustre L.). Ювенильные растения нормально развивают¬
ся в обоих вариантах, однако со временем (через 150—200 сут) их
лучше пересадить на блоки (рис. 4.74, а, см. вклейку).
Как показывает наша практика, сеянцы L. rubescens очень
чувствительны к мягкотелой щитовке, которая на ранних этапах
адаптации может массово поражать растения этого вида. Насеко¬
мые поселяются колониями на нижней стороне листовых пла¬
стинок у их оснований и в пазухах; сначала поврежденное место
желтеет, а со временем лист полностью отмирает.
L. sincorana Schltr. — эпифит. Ареал вида располагается на
территории Бразилии. Это симподиальные орхидеи, осевую ос¬
нову побега которых формирует однолистный туберидий удли¬
ненно-яйцевидной формы, длиной 3—6 см и шириной до 1,5 см.
Цветонос может нести 1, реже 2 цветка (Miranda, 1990).
Приемы семенного размножения стандартные, основные сре¬
ды для культивирования — МС и МСБ. Адаптировать растения ех
situ лучше на блоках (рис. 4.74, б).
При сравнительном изучении развития сеянцев исследуемых
видов в культуре in vitro на разных питательных средах установ¬
лены отличия их ростовых потенций. Так, сеянцы L. lundii нор¬
мально развиваются исключительно на модифицированных сре¬
дах МС. Для L. lobata и L. purpurata на последних этапах разви¬
тия желательно культивирование на средах,' в состав которых
входит гомогенат банана. L. sincorana выращивают в основном на
средах с гомогенатом банана.
Полученные нами результаты свидетельствуют, во-первых, о
невысокой требовательности растений к составу макро- и микро¬
элементов в среде (на фоне наличия других необходимых компо¬
нентов), во-вторых — о наличии в гомогенате банана микро- и
макроэлементов. Можно также предположить, что соотношение
фитогормонов в гомогенате банана обеспечивает нормальное раз¬
витие этой культуры.
Обобщая результаты наших наблюдений, полученные при
изучении онтогенеза сеянцев Laelia, мы условно выделяем 2 ос¬
новных варианта прохождения начальных этапов морфологиче¬
ского развития, которые можно наблюдать в культуре in vitro.
В первом случае из семян образуются протокормы, имеющие
одну точку роста. Далее из них формируются сеянцы, которым у
всех исследуемых видов на первых этапах развития присущи мо-
380
ГЛАВА 4. Методы размножения тропических и субтропических растений
ноподиальный тип роста и ортотропный характер нарастания
вегетативной сферы. Установлено, что эти сеянцы, как правило,
не образуют вторичных протокормов. В дальнейшем они форми¬
руют побеги второго и последующих порядков; по достижении
определенного возраста и размера их первыми переводят в сеп¬
тические условия.
Во втором случае деятельность апикальной меристемы пер¬
вичного протокорма тормозится. Вместо этого наблюдается ак¬
тивное образование новых меристематических центров на теле
протокорма, что приводит к формированию конгломератов вто¬
ричных протокормов. Последние либо приступают к процессам
органогенеза, либо продуцируют себе подобных.
В результате исследований установлено, что внутреннее стро¬
ение протокормов достаточно неоднородно. Верхняя их часть
плотная, насыщенно-зеленого цвета, тогда как нижняя — прак¬
тически прозрачна. Апикальная часть протокорма состоит из
мелких клеток, которые и формируют меристематический центр,
базальная — из клеток, линейные размеры которых больше в не¬
сколько раз. Процессы митотического деления в них практиче¬
ски отсутствуют, поэтому в результате роста они могут лишь не¬
значительно увеличиваться в размерах, в связи с чем протокормы
и приобретают сферическую форму. Подобные особенности раз¬
вития и строения протокормов были отмечены и другими авто¬
рами (Чудовская, 1994).
Выяснено, что протокормы видов этого рода освобождаются
от семенной оболочки двумя способами: или оболочка семени
растрескивается пополам, или проросток выходит через микро-
пилярное отверстие, постепенно сбрасывая с себя внешние по¬
кровы. Остатки семенной оболочки еще некоторое время могут
оставаться на базальной части протокорма (1ваншков, 1999). В
дальнейшем в этой части протокорма клетки со специфическими
выростами (ризоидами) формируют ризоидальный комплекс. По¬
следние собраны в группы по 3—15 шт. У некоторых сеянцев ри¬
зоидальный комплекс может формироваться не только на ба¬
зальной части протокорма, но и на боковых поверхностях.
Поглощающие волоски подобны корневым и образуют плот¬
ные структуры, с помощью которых протокорм удерживается на
поверхности. Под эпидермальными клетками расположены клет¬
ки с подковообразно утолщенной клеточной стенкой. Не утол¬
щенным остается только участок, непосредственно обращенный
к центру протокорма. Кроме того, эти клетки имеют более круп¬
381
СПЕЦИАЛЬНАЯ ЧАСТЬ
ные ядра. Таким образом, ризоидальный комплекс состоит из
двух слоев клеток, линейные размеры которых меньше таковых
клеток, формирующих окружающие ткани (Chudovskaya, 1999).
Сеянцы исследуемых видов в условиях асептической культу¬
ры развиваются асинхронно. На начальных этапах онтогенеза
протокормы всех видов имеют сферическую или яйцевидную
форму. Через 2—3 недели с момента прорастания форма прото¬
кормов становится более специфичной. Так, протокормы L. sin¬
corana приобретают шаровидную несколько приплюснутую форму,
причем апикальная часть более плоская. По форме протокормы
L. lobata и L. purpurata напоминают протокормы L. sincorana, од¬
нако в процессе развития могут иногда приобретать грибовидную
форму. Протокормы L. lundii растут преимущественно в длину,
поэтому имеют вытянутую, столбчатую форму.
Иногда на протокормах формируются несколько меристемати¬
ческих центров, из которых в дальнейшем развиваются минимум
два сросшихся между собой проростка. Формирование нескольких
проростков на теле одного протокорма В.А. Поддубная-Арнольди
(1957) считает примером монозиготической полиэмбрионии. Как
исключение мы наблюдали образование на кончике первого лис¬
топодобного органа L. lobata двухвершинного протокорма, из ко¬
торого впоследствии сформировались нормальные растения.
Когда на протокормах L. lobata и L. purpurata формируется
первый листоподобный орган, они могут приобретать грибовид¬
ную форму. Борозда на таких протокормах L. purpurata, на наш
взгляд, является местом схождения маргинальных выростов вла¬
галищной части первого листоподобного органа на теле прото¬
корма (Stancato et al., 1998).
В процессе дальнейшего роста и развития апикальной мери¬
стемы протокормов исследуемых видов также можно отметить
несколько вариантов (рис. 4.75):
• апикальная меристема может разделяться на две части и боль¬
ше, вследствие чего из 1 протокорма формируется 2 растения и
больше;
• из апикальной меристемы протокорма образуется 1 главный
побег, из которого в дальнейшем формируется 1 растение;
• после закладки 3—4 листьев почка, расположенная в пазухе
одного из них, развивается наравне с осью главного побега, вслед¬
ствие чего из 1 протокорма также образуется несколько растений;
• иногда в базальной части первичного протокорма могут
формироваться немногочисленные вторичные протокормы.
382
ГЛАВА 4. Методы размножения тропических и субтропических растений
У большинства исследуемых видов первый листоподобный
орган напоминает небольшую чешую, которая прикрывает апи¬
кальную меристему первичного протокорма. Листовая пластинка
как таковая отсутствует. Второй листоподобный орган развивает¬
ся непосредственно из пазухи первого, строго напротив. По раз¬
мерам он в 2—4 раза больше первого и имеет сформированную
листовую пластинку, у которой можно различить абаксиальную и
адаксиальную поверхности.
Закладка первого листоподобного органа на протокормах
L. lundii несколько отличается, в основном вследствие их вытяну¬
той формы. Соответственно, и первый листоподобный орган фор¬
мируется не на дне ямки, а на кончике конуса апикальной части
протокорма. Клетки протокорма начинают делиться асинхронно,
в результате чего образуется незамкнутый первый листоподобный
орган. Второй листоподобный орган формируется на верхушке
протокорма напротив первого. Последующие листки дифферен¬
цируются в строгой очередности. Дальнейшее развитие происхо¬
дит аналогично другим видам. В результате формируется бипо¬
лярный проросток, апекс которого вступает в регулярные пласто-
хронные циклы, последовательно закладывая зачатки листовых
примордиев.
Отметим, что первые листоподобные органы проростка могут
быть неправильной формы, остаются на нем и вместе с ним от¬
мирают. Срок функционирования первичного протокорма у раз¬
личных видов разный.
Первый корень у всех исследуемые видов закладывается эн¬
догенно возле основы первого листоподобного органа в верхней
части протокорма. К этому времени проросток получает все не¬
обходимые ему питательные вещества с помощью ризоидального
комплекса — своеобразный тип поликотилии. Процесс развития
первого корня длится всего 20—25 сут. За это время он может
вырасти в длину до 0,8 см.
Обычно у сеянцев L. lobata, L. purpurata, L. sincorana в куль¬
туре in vitro мы не наблюдали появление псевдоклубней на по¬
бегах первого порядка, но если растения “передержать” в куль¬
туре, то на некоторых экземплярах (на побегах п-го порядка)
могут формироваться характерные утолщения стебля (3x5 мм),
которые по форме и расположению на побеге напоминают
псевдоклубни генеративно зрелых растений. Они образуются на
побегах второго и следующих порядков и могут нести на себе
1—3 листа.
383
СПЕЦИАЛЬНАЯ ЧАСТЬ
Рис. 4.75. Варианты развития апикальной меристемы сеянцев Laelia Lindl.:
а — грибовидный протокорм L. purpurata с продольной бороздой на теле; б — про-
токорм L. lobafa; формирование апикальной меристемой двух точек роста (вид сверху):
в — проросток L. purpurata; образование нескольких меристематических центров (вид
сверху); г — формирование в нижней части первичного протокорма L. purpurata вто¬
ричных протокормов
Ювенильные растения L. lundii в отличие от других видов фор¬
мируют псевдоклубни не только на побегах п-х порядков, но
иногда и на побегах первого порядка. По форме, размерам
384
ГЛАВА 4. Методы размножения тропических и субтропических растений
(5x12 мм) и расположению на них листьев они похожи на псев¬
доклубни генеративно зрелых растений.
Псевдоклубни у всех четырех видов также могут появляться в
тех случаях, когда с целью размножения растительного материала
отделяли побеги п-х порядков и опять пассивировали их на пита¬
тельную среду. Дальше они развивались подобно побегу первого
порядка: у них формировалась полноценная корневая система на
побегах следующих порядков, которые тоже можно отделять и по¬
лучать самостоятельные растения.
Молодые растения L. lobata, L. purpurata, L. lundii на протяже¬
нии всего строка культивирования в стерильных условиях могут
нормально развиваться на 1,5 концентрации среды МС. В отли¬
чие от других L. sincorana относится к видам, “тяжелым” в куль¬
туре. Основная сложность, с которой мы встречаемся при его
культивировании in vitro, — формирование “монструозных” рас¬
тений, т.е. сеянцев с измененной морфологией. В основании та¬
кого растения находится отмерший протокорм. Возле него могут
располагаться живые одно- или многовершинные вторичные про¬
токормы. “Монструозное” растение представляет собой скопле¬
ние из 2—3 розеток, одна из которых материнская, а другие раз¬
виваются из ее низовых пазушных почек. Такие розетки распо¬
лагаются очень плотно, междоузлия на них сближены. Корни,
которые развиваются из междоузлия, в пространстве размешены
хаотично, имеют непропорциональную по отношению к разме¬
рам растения величину. По мере формирования листа его листо¬
вая пластинка смещается относительно оси по часовой стрелке
(иногда против). Все это приводит к хаотическому размещению
листьев и почек, а само растение похоже на конгломерат розеток.
Компактность подобной структуры препятствует нормальному
развитию, изменяется форма листовых пластинок. У “монструоз¬
ных” сеянцев отсутствует плагиотропная часть корневища, по¬
этому тяжело отследить соподчиненность побегов. Хотя процесс
их развития практически идентичен таковому нормальных сеян¬
цев данного вида, мы полагаем, что у этих особей происходит
гормональный сдвиг. Одним из аргументов в пользу такой точки
зрения может быть отмеченное нами в условиях культуры in vitro
Цветение представителей этого вида. Подобные случаи описаны и
в литературе (Вахромеева и др., 1991; Goh, 1996). Такие растения
очень тяжело адаптируются в культуре in vivo. Очевидно, это свя¬
зано со сложностью подбора оптимального соотношения фито¬
гормонов в питательной среде.
385
СПЕЦИАЛЬНАЯ ЧАСТЬ
Некоторые авторы в своих работах рекомендуют добавлять к
питательной среде жидкий эндосперм кокосового ореха, ино¬
гда — гомогенат банана, томатный сок или специально приго¬
товлений отвар картофеля и др. (Morel, 1964; Steward, 1971; Лав¬
рентьева, 1985; Черевченко и др., 1986). Добавление кокосового
молока — довольно популярный способ улучшения роста расте¬
ний, часто используемый зарубежными исследователями.
С целью получения морфологически однородных растений
L. sincorana, которые можно вывести из культуры in vitro, мы
культивировали сеянцы этого вида орхидей на ряде сред с гомо-
генатом банана или без него. Установлено, что лучшие результа¬
ты (в вариантах без гомогената банана) были получены на моди¬
фицированной среде МС (1,5 концентрации), наихудшие — на
модифицированной среде Кнудсона.
Наличие определенного количества сеянцев с морфологиче¬
скими отклонениями подтверждает сложную гетерозиготную при¬
роду генома орхидей, что особенно заметно при их семенном
размножении. В свою очередь, такие сеянцы могут стать ценной
первоосновой для селекционной работы.
Целью дальнейших наших исследований были сравнительный
анализ экологических условий природного произрастания 4 видов
рода Laelia и изучение их анатомических и биохимических особен¬
ностей для разработки рекомендаций по оптимизации методов пе¬
реведения растений из стерильных условий в условия оранжерей.
Объектами исследования служили представители следующих
видов: L. lobata (эпифит или литофит), L. lundii (эпифит или ли-
тофит), L. purpurata (эпифит) и L. sincorana (аэрофит). Изучались
3—4-летние растения, причем на протяжении 1 года нами осуще¬
ствлялись наблюдения за растениями в специальной климатиче¬
ской камере при температуре 19—25 °С, фотопериоде 8—10 ч,
влажности воздуха 70—90 % и освещенности 3000—4000 лк. В
табл. 4.57 приведены характеристики субстратов для культивиро¬
вания растений.
Все исследуемые виды произрастают на территории Брази¬
лии: L. lobata и L. sincorana — в достаточно засушливых местах
(со среднемесячным количеством осадков в пределах 50—
170 мм), L. purpurata и L. lundii — преимущественно во влажных
местах (среднемесячное количество осадков 100—2000 мм). Ми¬
нимальная и максимальная годовые температуры на этих террито¬
риях существенно не различаются, в то время как их суточный
перепад может составлять приблизительно 7 °С.
386
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.57. Состав и агрофизическая характеристика субстратов для культиви¬
рования представителей рода Laelia Lindl. в период постасептической адаптации
Ва¬
риант
Компонент
Соотноше¬
ние ком¬
понентов
Плотность,
кг/м:
Содержание
твердой
части, %
Общая
порис¬
тость, %
Влагоем-
кость, %
pH
1
Сфагновый
мох
87
6
94
94
4,0
2
Смесь поли-
акрилонит-
рильных и
базальтовых
волокон
105
7
93
78
7,0
3
Сфагновый
мох + сосно¬
вая кора
1 : 2
121
13
87
51
4,7
4
Сфагновый
мох + дубо¬
вая кора
1 : 2
127
15
85
45
5,0
5
Гранитная
крошка
_
189
29
71
23
7,1
6
Сосновая ко¬
ра + сфагно¬
вый мох +
+ песок
1:1:1
143
21
79
38
4,8
7
То же
1:2:1
130
18
82
42
4,7
8
» 1»
2:1:2
151
24
76
31
5,2
С увеличением высоты над уровнем моря значительно умень¬
шается количество осадков. Например, в местах произрастания
L. lundii оно может составлять до 2000 мм/мес, тогда как в местах
распространения L. sincorana — только 150 мм/мес. Безусловно,
этот факт отражается на анатомическом строении листьев орхид¬
ных (табл. 4.58).
Исходя из результатов проведенного нами количественно¬
анатомического анализа, исследуемые виды существенно разли¬
чаются. Так, нами отмечены различия в количестве и размерах
устьиц, толщине кутикулы (от 17,4—26,0 мкм на верхней стороне
листа до 10—26 мкм на нижней), количестве клеток мезофилла, а
также в количестве хлоропластов. Кроме того, хотелось бы под¬
черкнуть тот факт, что устьичный аппарат L. sincorana несколько
Углублен в кутикулярный слой, в то время как у других видов
°н расположен на одном уровне со слоем кутикулы (Ярослав¬
ская и др., 1999). Форма и размеры хлоропластов у всех видов (кро-
387
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.58. Параметры анатомического строения листовых пластинок
исследуемых видов Laelia Lindl.
Параметр
Вид
L. lobata
L. lundii
L. purpurata
L. sincorana
Толщина листа, мм
Площадь листовой
1,9
1,5
1,0
2,0
пластинки, см2
Количество устьиц
87,3 ± 0,5
4,5 ± 0,5
32,0 ± 0,5
24,6 ± 0,5
на 1 мм2
78,3 ±0,7
37,8 ± 0,6
54,0 ± 0,5
40,5 ± 0,7
Размер устьиц, мкм
Толщина кутикулы,
мкм
36,5 х 26,7
35,3 х 27,3
46,2 х 34,3
42,3 х 32,6
верхняя сторона
26,04 ± 0,5
17,4 ±0,5
20,1 ±0,5
22,0 ± 0,5
нижняя сторона
Количество клеток
мезофилла в 1 мм2*
21,7 ±0,5
10,4 ± 0,5
10,0 ±0,5
26,0 ± 0,5
верхняя часть
389,3 ± 3,7
206,3 ± 3,5
156,0 ± 3,5
303,0 ± 3,7
нижняя часть
Количество хлоро¬
519,0 ± 3,8
260,0 ± 3,6
237,0 ± 3,6
432,5 ± 3,5
пластов в клетке, шт.
35,6 ± 1,5
35,2 ± 1,5
27,0 ± 1,5
30,0 ± 1,5
Расположение хло¬
Пристеноч¬
Диффузное
Пристеноч¬
Пристеноч¬
ропластов в клетке
Размер хлороплас¬
ное
ное
ное
тов, мкм
Форма хлороплас¬
5,2 х 5,2
5,0 х 5,0
6,0 х 8,0
Сферическая
5,0 х 5,0
тов
Среднее количество
хлоропластов,
Сферическая
Сферическая
овальная
Сферическая
шт/мм2
16 167 ± 10
8208 ± 10
5305 ± 10
11 033 ± 10
’ Подсчет клеток мезофилла проводили на поперечном срезе листа.
ме L. purpurata, которая имеет более крупные хлоропласты) прак¬
тически одинаковые.
Исходя из данных табл. 4.59 можно констатировать, что пред¬
ставители L. purpurata характеризуются наибольшим содержанием
фотосинтетических пигментов (хлорофилла а + Ь — 35,3 мг/100 г
сырого вещества), a L. sincorana — наименьшим (14,4 мг/100 г).
Самое высокое содержание каротиноидов отмечено у L. lobata
(13,4 мг/100 г сырого вещества), а самое низкое — у L. lundii
(7,6 мг/100 г сырого вещества). На наш взгляд, подобный факт
может свидетельствовать о приспособительном характере строе¬
ния фотосистем исследуемых видов, так как известно, что каро-
тиноиды выполняют защитную функцию, предохраняя тем са¬
388
ГЛАВА 4. Методы размножения тропических и субтропических растений
мым центры фотосистем от преждевременного разрушения
(MycieHKO, 1995). По индексам а/b и а + b/K L. purpurata сущест¬
венно отличается от других видов: первый индекс наиболее низ¬
кий (в связи с высоким содержанием хлорофилла Ь), второй —
наиболее высокий (за счет низкого содержания каротиноидов).
В целом приведенные результаты показывают, что растения,
которые обитают на значительной высоте (800—1000 м над ур. м.),
характеризуются объемной и поверхностной плотностью фото¬
синтезирующих элементов листа. Эти виды имеют гелиоморфные
черты строения фотосинтетического аппарата. Часто им присуща
та или иная степень ксероморфизма, так как интенсивная сол¬
нечная инсоляция в местах их природного обитания, как прави¬
ло, сопровождается перегревом и недостатком влаги.
На начальных этапах адаптации сеянцев мы использовали
сконструированную по оригинальному проекту климатическую
камеру. В эксперименте растения “подкармливали” раствором
минеральных элементов по Кнудсону. Впервые был показан по¬
зитивный эффект применения смеси сахарозы и Ca(N03)2 на раз¬
витие корневой системы. На момент перевода в септические ус¬
ловия каждое растение имело хорошо сформированную корне¬
вую систему, листья и массу приблизительно 1 г. Морфологиче¬
ски каждый сеянец представлял собой систему упорядоченных
побегов.
Нами проведен ряд экспериментов по подбору и изучению
состава субстратов с целью оптимизации постасептического культи¬
вирования ювенильных растений видов Laelia (рис. 4.76). Уста¬
новлено, что первым необходимым условием успешного выведе¬
ния из культуры in vitro является легкая подсушка растений.
Корни тщательно отмывали от агаризированой среды, после чего
Таблица 4.59. Содержание фотосинтетических пигментов в листьях представи¬
телей рода Laelia Lindl., мг/100 г сырого вещества
Вид
Хлорофилл
a + b/K
Кароти-
НОИДЫ
(К)
a
b
a + b
a/b
L. lobata
24,3
1,2
25,5
20,6
1,9
13,39
L lundii
18,4
1,5
19,7
12,3
2,6
7,6
L- purpurata
28,7
6,6
35,3
4,3
4,2
8,3
L- sincorana
13,8
0,6
14,4
23,0
1,3
11,4
^^^0.95
1,39
0,09
0,87
389
СПЕЦИАЛЬНАЯ ЧАСТЬ
«
s
х
н
S
о.
о
со
т
х
§
*
20
15
10
5
0
20
15
10
5
0
ж
Месяцы
Рис. 4.76. Динамика выживаемости сеянцев исследуемых видов на различных
субстратах (а—з):
1 — L. lobata; 2 — L. lundii; 3 — L. purpurata; 4 — L. sincorana. Варианты субстратов
соответствуют вариантам 1—8, описанным в табл. 4.57
растения раскладывали на фильтровальной бумаге и оставляли в
таком состоянии на сутки. Высаживали в пластиковые емкости
(40 х 40 х 60 мм) согласно схеме эксперимента, на дно укладыва¬
ли дренаж из черепков (1/3 высоты горшка).
В качестве источника С02 нами использовались растения с
С3-путем фотосинтеза, которые находились непосредственно в
камере и вокруг нее, соответственно их физиологическим потреб-
390
ГЛАВА 4. Методы размножения тропических и субтропических растений
ностям в освещении. Блоки с L. sincorana фиксировались на
стенках камеры на расстоянии 5—10 см от ламп. Емкости с L. 1о-
bata также размещались в верхних ярусах, тогда как для сеянцев
L. purpurata и L. lundii было достаточно освещения на дне камеры
(расстояние до ламп 30—40 см).
Растения L. lundii и L. lobata одинаково хорошо развивались
как на сфагновом мху, так и на искусственном волокнистом суб¬
страте. Для L. purpurata наилучшей оказалась смесь из сосновой
коры и сфагнового мха (1:2). Как и ожидалось, очень интересные
результаты были получены при культивировании L. sincorana: ни
один из предложенных субстратов не был пригодным для их вы¬
ращивания, а введение в состав смеси дубовой коры спровоциро¬
вало быструю гибель растений. Укоренение происходило только
на блоках из сосновой коры. При таком способе культуры выжи¬
вало 70—75 % растений.
х Laeliocattleya — сложные гибриды, полученные при скрещи¬
вании в различных комбинациях видов из родов Laelia Lindl. и
Cattleya Lindl. Размножают вегетативно или клонально. Методики
микроразмножения и постасептической адаптации такие же, как
и для представителей исходных родов.
х Мокага — тройной гибрид (Arachis х Ascocentrum х Vanda),
полученный в Сингапуре. Клональное размножение in vitro с ис¬
пользованием пазушных почек и кончиков побегов более всего
применимо к симподиальным видам орхидей. Для моноподиаль-
ных видов в качестве эксплантов используют почки цветоносов.
Это позволяет свести до минимума вред, причиняемый растениям.
Для микроразмножения х Мокага также были использованы
почки цветоносов длиной 0,5—1,0 см. Вначале почки культиви¬
ровали в жидкой среде МС, затем их переносили на среду Кнуд¬
сона с 2 мг/л БА и 15 % кокосового молока, на которой проис¬
ходила дифференциация протокормов. Протокормы формирова¬
лись на базальных частях цветочных почек на протяжении 6 мес.
Регенерация растений отмечена на среде Вацина—Вента, моди¬
фицированной добавлением 150 мл/л кокосового молока и 75 г/л
гомогената банана. Растения х Мокага высотой 5 см были полу¬
чены после 14 мес культивирования, а укоренение образовав¬
шихся побегов происходило на протяжении еще 3 мес (Ghani et
al., 1992).
С помощью указанного выше метода размножены растения
Мокага при использовании в качестве эксплантов сегментов со¬
цветий длиной 2 мм. Полученные в предыдущих опытах растения
391
СПЕЦИАЛЬНАЯ ЧАСТЬ
могут служить вторичными эксплантами. Так, сегменты молодых
листьев длиной 1,5 см и шириной 0,5 см вычленяли из 3-летних
растений х Мокага. После 1 мес культивирования на среде Ваци¬
на—Вента с 200 мл/л кокосового молока они формировали про¬
токормы на проксимальной и дистальной частях эксплантов. При
добавлении в среду 0,5 мг/л кинетина они образовывали большую
массу протокормов, которые разрезали на части и субкультивиро-
вали. Регенерация побегов проходила еще в течение 2 мес.
Odontoglossum Н.В.К. Полиморфный род, насчитывающий
около 200 видов эпифитных орхидных, которые произрастают в
тропиках и субтропиках Центральной и Южной Америки. Назва¬
ние рода связано с наличием у основания губы отростков, напо¬
минающих зубы. Соцветия несут до 25 цветков различной яркой
окраски. Очень популярны в оранжерейной культуре (Черевчен¬
ко и др., 2001). Размножают вегетативно, семенным способом и в
культуре in vitro.
Виды, задействованные в работе, описаны ниже.
О. pulchellum Batem. — эпифитные орхидеи, произрастающие
в Гватемале. Туберидии овальной формы, собраны в группы, на
верхушке несут ассимилирующие листья. Листья 'линейные, до
20 см в длину. Цветки восковые, до 2 см в диаметре, с сильным
ароматом.
О. grande Lindl. — эпифит с коротким корневищем. Родина —
Гватемала, Мексика, может встречаться в горных лесах на высоте
до 2700 над ур. м. Туберидии яйцевидные, иногда почти округ¬
лые, длиной до 6 см. Листья плотные, кожистые, блестящие, эл¬
липтические или заостренные на конце, длиной до 30 см. Соцве¬
тие мощное, прямостоящее, длиной до 25 см, может нести до
8 цветков.
Для семенного размножения в культуре in vitro использовали
семена репродукции НБС НАН Украины. Высев проводили на
модифицированную нами среду Кнудсона с пептоном, гуматом
калия, активированным углем. Формирование протокормов у
О. pulchellum начиналось на 60-е, у О. grande — на 76-е сутки
(рис. 4.77, см. вклейку). Образование побегов и их укоренение у
обоих видов происходило в течение 480—492 сут, а высадка рас¬
тений в субстрат осуществлялась через 660—680 сут после высева.
Виды и гибриды Odontoglossum могут быть размножены с по¬
мощью апикальных и пазушных почек, культивируемых на сре¬
дах МС, Вацина—Вента, Кнудсона с 10—20 % кокосового молока
(Khaw et al., 1978). Кроме того, для их микроразмножения можно
392
ГЛАВА 4. Методы размножения тропических и субтропических растений
с успехом использовать методики, разработанные для Cymbidium
(Morel, 1964).
Oncidium Sw. Род насчитывает от 400 до 750 видов, распро¬
страненных в тропиках Америки — от южной Флориды и Мекси¬
ки до Аргентины на высоте до 4000 м над ур. м. Преимущественно
это эпифиты. Размер туберидиев варьирует в широких пределах.
Соцветия — прямая или изогнутая многоцветковая кисть. Цветки
от мелких до больших, яркие, в основном желтые с различными
оттенками. Размножают вегетативно делением клона, семенами и
в культуре тканей.
Для семенного размножения в культуре in vitro видов рода
Oncidium использовали семена приведенных ниже видов репро¬
дукции НБС НАН Украины.
О. cebolleta (Jacq.) Sw. — эпифитный вид, представители ко¬
торого произрастают в тропиках Мексики, Колумбии, Аргенти¬
ны, Бразилии. Туберидии маленькие, листья заостренные, мяси¬
стые, до 1 см в диаметре. В соцветии до 25 цветков диаметром
около 3 см ярко-желтого цвета.
О. lanceanum Lindl. — эпифиты, произрастающие в бассейне
р. Амазонка на территории Бразилии, Колумбии, в Суринаме, на о-
ве Тринидад. Туберидии мелкие, листья длинные. Соцветия высо¬
той до 40 см. Цветки яркие, ароматные. Лепестки волнистые, по
краям желто-зеленые, с пурпурными пятнами.
О. luridum Lindl. — большие (до 1 м в высоту) эпифиты, рас¬
пространенные на территориях от Мексики до Гондураса и Перу.
Туберидии мелкие, образуют плотные группы. Листья длиной до
80 см. Соцветие длиной до 1,5 м, может нести до 45 цветков. Цвет¬
ки до 4 см в диаметре, окрашены в характерные для рода красно¬
желтые тона.
О. pubes Lindl. распространены на территории Парагвая и
Бразилии. Эпифиты. В соцветии до 70 цветков. Цветки мелкие,
лепестки желтые, с поперечными коричневыми пятнами.
О. splendidum A.Rich, ex Duch. — эпифиты, ареал которых на¬
ходится в Бразилии, Парагвае, Гватемале, Гондурасе. Туберидии
округлые, листья острые. Цветонос длиной до 1 м. Цветки до
10 см в диаметре, желтые, с красно-коричневыми штрихами.
О. varicosum Lindl. ex Paxt. — эпифиты, произрастающие на
солнечных местах в тропических лесах Бразилии. Туберидии оваль¬
ные, с яркими пятнами. Соцветие до 1 м в длину, может нести до
100 цветков. Цветки до 2 см в диаметре, окрашены в коричнево¬
желтые тона.
393
СПЕЦИАЛЬНАЯ ЧАСТЬ
Следует отметить, что у О. splendidum всего 30 % семян имели
зародыши, а другие были скрученными и недоразвитыми. Семена
всех видов высевали на питательные среды Кнудсона с 2—4 мг/л
аденина, Кнудсона с 50 мг/л гумата калия, 2 г/л пептона и
0,750 мг/л активированного угля (КПГУ) и МС с 4 мг/л аденина
и 0,3 мг/л НУК.
Семена начинали прорастать через 30 сут после высева на
среде КПГУ с низкой концентрацией сахарозы. Установлено, что
на первых этапах развития протокормов они не требуют внесе¬
ния в среду фитогормонов и повышенного количества сахарозы.
Однако добавление активированного угля необходимо, поскольку
он поглощает вещества фенольной природы, которые активно
выделяются сеянцами в процессе метаболизма. Протокормы всех
исследуемых видов формировались на протяжении второго меся¬
ца культивирования. Полученные протокормы делили и субкуль-
тивировали на среде МС, на которой они образовывали конгло¬
мераты вторичных протокормов.
Наши исследования показали, что вторичные протокормы у
видов этого рода, как правило, формируются из эпидермальных
и субэпидермальных слоев первичных протокормов. Субкульти¬
вирование протокормов и полученных из них растений может
происходить достаточно долго (1—2 года), что увеличивает коэф¬
фициент размножения и позволяет выращивать необходимое ко¬
личество растений.
Полученные сеянцы могут быть вторичными эксплантами.
Так, с этой целью мы использовали сегменты листьев и корней
сеянцев (рис. 4.78, см. вклейку). На питательной среде МС с
4 мг/л аденина, 2 мг/л НУК и 2 г/л пептона в условиях темноты
они регенерировали сначала протокормы, а потом и растения.
Нами также проведено изучение морфогенеза исследуемых
видов в культуре in vitro. Следует сказать, что процессы, которые
происходили на разных этапах морфогенеза, у видов Oncidium
схожи между собой. Этапы прорастания семян и развитие сеян¬
цев некоторых видов Oncidium представлены в табл. 4.60, поэтому
мы описываем их на примере О. cebolleta и О. luridum.
Набухание семян происходит сравнительно быстро и прото¬
кормы на этапе закладки первого листа имеют 2—3 мм в диамет¬
ре. Верхняя часть протокорма сплющена и напоминает блюд¬
це. На его дне формируется апикальная меристема. Первый
лист закладывается валиком, образуя колпачок с вертикальной
щелью, остальные — последовательно вокруг меристемы. Проростки
394
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.60. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Oncidium, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
О. cebolleta (Jacq.) Sw.
34
156
490
О. lanceanum Lindl.
37
469
652
0. luridum Lindl.
30
142
360
0. pubes Lindl.
100
250
700
0. splendidum A.Rich, ex Duch.
70
300
550
0. varicosum Lindl.
62
360
720
долго сохраняют округлую форму. Первые пазушные почки за¬
кладываются в виде меристематических центров в пазухах четвер¬
того и пятого листьев. У сеянцев с 8—10 листьями пазушные
почки имеют уже 3—4 листовых примордия и меристему. Для
видов Oncidium характерно массовое образование многовершин¬
ных протокормов, которые образуют такое же количество расте¬
ний. Ризоиды на протокормах собраны в пучки и сохраняются
продолжительное время.
Еще одной особенностью сеянцев Oncidium является образо¬
вание побегов второго порядка из почек среднего яруса в культу¬
ре in vitro. Корни закладываются эндогенно как на протокорме,
так и в пазухах листьев, начиная с третьего. Сеянцы Oncidium
могут иметь не только по несколько пазушных почек, располо¬
женных в пазухе одного листа, но и 2—3 корня в одном междо¬
узлии.
Анализируя полученные результаты, необходимо отметить
различные сроки формирования сеянцев у Oncidium. Быстрее всех
формируются протокормы у О. luridum, медленнее — у О. pubes.
По скорости образования растений все виды можно разбить на
Две группы: в первой этот процесс занимает до 156 сут, во вто¬
рой — от 250 до 360 сут. В значительной мере скорость формиро¬
вания зависит от сроков сбора семян: если это свежесобранные
семена, то и развитие сеянцев происходит быстрее.
Сведений о клональном размножении видов Oncidium сравни¬
тельно мало. Некоторые авторы указывают на приемлемость при¬
менения таких же приемов, как и при размножении Cymbidium или
Cattleya (Morel, 1964; Scully, 1967; Aldrich, 1986).
Анализируя литературные данные, необходимо отметить, что
растения Oncidium могут быть размножены различными методами.
395
СПЕЦИАЛЬНАЯ ЧАСТЬ
Часто встречаются работы, в которых эксплантами служили раз¬
личные части сеянцев. Так, семена О. varicosum высевали на среду
Кнудсона с 60 г/л гомогената банана и 1 г/л активированного уг¬
ля, на которой они развивались в сеянцы. Затем у сеянцев отре¬
зали кончики корней (1,5 мм) и использовали их как экспланты.
На питательной среде Вацина—Вента с 15 % кокосового молока и
5 мг/л НУК они формировали сначала каллус, а потом протокор¬
мы. Регенерация протокормов лучше и быстрее проходила в жид¬
кой среде Вацина—Вента с 15 % кокосового молока и 1,25 мг/л
НУК. Полученные протокормы переносили на твердую среду
Кнудсона, где они образовывали растения (Kerbauy, 1984).
В Сингапурском ботаническом саду для микроразмножения
Oncidium использовали спящие почки цветоносов. На среде МС с
0,5 мг/л 2,4-Д, 2,0 — БА, 0,5 мг/л НУК почки формировали кал¬
лус, протокормы. Среду Вацина—Вента с 2 мг/л БА и 0,5 мг/л
НУК использовали для регенерации побегов (Lim-Ho et al., 1981,
1987).
Растения Oncidium можно размножать и с помощью апекса
побега. Из верхушки побега вычленяли апикальную меристему и
культивировали на питательной среде Вацина—Вента с 15 % ко¬
косового молока, получая протокормы. В дальнейшем микрораз¬
множение проходило, как у Cymbidium, Cattleya или Aranda (Khaw
et al., 1978).
Постасептическая адаптация видов данного рода, как прави¬
ло, не вызывает трудностей (рис. 4.79, 4.80, см. вклейку). Основ¬
ные приемы схожи с таковыми у Cattleyopsis lindenii.
Paphiopedilum Pfitz. Популярность представителей данного ро¬
да с каждым годом неуклонно растет не только из-за загадочно¬
сти этих редких растений, но главным образом потому, что куль¬
тиваторы находят все больше способов их легкой культуры.
Изначально интродуцирован в Европе в начале XIX ст. Paphio¬
pedilum venustum (Wall.) Pfitz. был первым видом, который цвел в
Англии в 1819 г., вскоре за ним последовал P. insigne (Wall, ex Lindl.)
Pfitz., а потом P. javanicum (Reinw. ex Lindl.) Pfitz. Десятилетием
позже были введены в культуру P. purpuratum (Lindl.). Stein.,
P. barbatum (Lindl.) Pfitz. и еще Шлет спустя — P. lowii (Lindl.)
Stein, и P. granduliferum (Blume) Stein. К 1860 г. интродуцировано
для культивирования в Англии около 16 видов.
В 1980-х годах, когда в Южной Америке нашли Phragmipedium
besseae Dodson & J.Kuhn, а в Китае и Вьетнаме были открыты
новые виды Paphiopedilum Pfitz., их стали нелегально собирать в
396
ГЛАВА 4. Методы размножения тропических и субтропических растений
огромных количествах и вывозить через Японию, Тайвань и Таи¬
ланд. После этого было решено занести в Первое приложение
CITES все виды данных родов, и с 1990 г. в него входят 70 видов
paphiopedilum и 22 вида Phragmipedium (Демидов и др., 2004).
Paphiopedilum Pfitz. — очень популярная оранжерейная куль¬
тура с разными формой, окраской и рисунком цветка. Все виды
условно разделяют на тепло- и холодолюбивые, что влияет на
условия их содержания. Вегетативно размножаются очень мед¬
ленно, поэтому для массового получения растений в основном
используют культуру in vitro.
Род Paphiopedilum впервые изучил и классифицировал Е. Pfitzer
(1899). Представители рода распространены в Северной и Юго-
Восточной Азии, имеют характерную форму губы, в связи с чем
их часто называют “башмачками”. Преимущественно это мезофиты
и гумусные эпифиты. Основной количественный состав рода еще
окончательно не определен и колеблется в пределах 70 видов.
Изученные нами виды и гибриды принадлежат к азиатской
флоре.
P. appletonianum (Gower.) Rolfe имеет средние размеры. Листья
сидячие, ремневидные, жесткие, на конце закругленные, с мра¬
морным рисунком. Цветонос высотой до 50 см, несет 1 лиловый
цветок (изредка — 2) до 10 см в диаметре с торчащими, немного
расширенными на концах, чашелистиками. Произрастает в ин¬
дийском штате Ассам и во Вьетнаме. В оранжереях НБС НАН
Украины содержится в умеренно теплых условиях.
Семена, высеянные традиционными способами, in vitro имели
очень плохую всхожесть — прорастали единичные экземпляры.
Если высев проводился из недозрелых коробочек, семена вообще
не прорастали. Сеянцы развивались очень медленно. Вероятно,
этот вид требует индивидуального подхода, что обусловлено его
биологией.
P. callosum (Rchb.f.) Stein отличают жесткие голубовато¬
зеленые листья длиной до 15 см и шириной 2,5 см. Ареал вида
расположен на территориях Таиланда и Камбоджи. На побеге, в
пазухах листьев, супротивно расположены 3—6 почек, размер кото¬
рых относительно друг друга уменьшается по направлению от ба¬
зальной части к верхушке. Количество листьев у генеративно зре¬
лого растения фиксировано. P. callosum также имеет одиночный
обоеполый, зигоморфный цветок в центре, до 8 см в диаметре.
Р. delenatii Guill. — травянистые растения, которые произра¬
стают как гумусовые эпифиты на гранитных выступах гор на юге
397
СПЕЦИАЛЬНАЯ ЧАСТЬ
Вьетнама на высоте от 800 до 1200 м над ур. м. Стебель прямой,
короткий, высотой до 3 см, несет от 3 до 7 двурядно расположен¬
ных листьев. Листья удлиненно-ланцетовидные, тупые, длиной до
10 см и шириной до 3 см, светло-зеленые, с множеством мелких
бурых пятен с нижней стороны. Цветонос прямой, опушенный,
цилиндрический, до 15 см высотой, обычно несет 1—2 цветка (до
8 см в диаметре). В условиях оранжерей НБС НАН Украины цветет
в период с марта по май. Описание семенного размножения и
постасептической адаптации представителей этого вида приведе¬
но ниже.
P. haynaldianum (Rchb.f.) Stein распространены на Филиппи¬
нских островах. Листья ремневидные, длиной до 30 см. Цветонос
опушенный, коричневый. Цветки до 15 см в диаметре. Верхний
чашелистик желто-зеленый, с коричневыми пятнами. Лепестки
узкие, до 9 см в длину, желто-зеленые, с коричневыми пятнами у
основания. Приемы клонального размножения и постасептической
адаптации, как и у других видов рода.
P. helene Aver. — недавно описанный (1996) миниатюрный
вид. Растения очень декоративны, имеют жесткие блестящие
темно-зеленые листья длиной до 8 см. Цветок крупный, выраста¬
ет на коротком (3—5 см) цветоносе. Верхний чашелистик зелено¬
вато-золотистый, лепестки окрашены в различные оттенки ко¬
ричневого и лилового цветов. Существует разновидность с цвет¬
ками почти однородного оранжево-желтого цвета. Растения в при¬
роде предпочитают известняковые скалы. Оранжерейная культура
сложна.
В работе использовали семена репродукции НБС НАН Ук¬
раины. Высев проводили по стандартной схеме на среду МС с
добавлением активированного угля. Всхожесть колебалась в пре¬
делах 1 %. Были получены единичные проростки, которые разви¬
вались очень медленно (рис. 4.81, а, см. вклейку). В ходе разви¬
тия половина сеянцев погибла. Для данного вида образование in
vitro вторичных протокормов наблюдалось крайне редко.
P. insigne (Wall, ex Lindl.) Pfitz. произрастает в Северной и
Восточной Индии, в горах на высоте 2000 м над ур. м. Предпо¬
читают затененные места с влажностью 75 % и температурой в лет¬
нее время 14—16 °С, в зимнее — 10—12 °С. Растения этого вида
имеют укороченный стебель. Листья продолговато-ланцетные,
блестящие, зеленые, с вогнутой средней жилкой, длиной до 20—
30 см, собраны в прикорневую розетку. В период покоя листья
не опадают.
398
ГЛАВА 4. Методы размножения тропических и субтропических растений
В природе виды P. insigne образуют группы по 8—12 растений.
Дочерние растения развиваются из нижней латеральной почки
материнского побега. В генеративную фазу развития побег всту¬
пает в середине мая, в это время в местах его географического
распространения наблюдается постепенное снижение температу¬
ры, обусловливающее индукцию цветения. Цветонос с единст¬
венным цветком развивается из апикальной меристемы до октяб¬
ря, цветение продолжается до середины февраля следующего го¬
да (150—160 сут).
P. lawrenceanum (Rchb.f.) Pfitz. был найден в северной части
о-ва Калимантан. Растения средних размеров. Листья со светлым
мраморным рисунком, в длину до 15 см. Цветонос до 30 см,
обычно формирует 1 цветок. Цветки имеют розово-белый верх¬
ний чашелистик, украшенный пурпурными полосками. В окраске
губы преобладают свекольные тона. В культуре достаточно легок.
Цветет с весны до начала лета.
Для получения стерильной культуры использовали семена ре¬
продукции НБС НАН Украины. Приемы стерилизации и высева
традиционны. Первоначально семена высевали на модифициро¬
ванную среду МС с активированным углем. После появления
бесцветных протокормов диаметром до 0,5 мм делали первый
пассаж на среду Пирика-2. В последующие 2 мес протокормы
позеленели, сформировали первые 2—3 листоподобных органа и
начали активно продуцировать вторичные протокормы и адвен¬
тивные побеги, после чего были вновь рассажены (рис. 4.81, б).
Эту процедуру можно повторять регулярно. Подросшие растения
перед высадкой культивировали на модифицированной среде МС
с активированным углем. Следует отметить, что среди сеянцев
встречались особи, которые активно развивались в крупные рас¬
тения, не формируя ни вторичных протокормов, ни дополни¬
тельных побегов. Они первыми были высажены для адаптации
уже через 502 сут с момента высева.
P. tonsum (Rchb.f.) Pfitz. — наземные растения, гумусовые
эпифиты высотой до 40 см. Родина — о-в Суматра (западные
склоны горного хребта Барисан) и северная часть о-ва Калиман¬
тан. Стебель укорочен и несет от 3 до 8 листьев. Листья удли¬
ненно-овальные, длиной до 20 см и шириной до 5 см. Верхняя
сторона листовой пластинки светло-зеленая с более темными зе¬
леными пятнами, нижняя — с пурпурным налетом. Цветонос зе¬
леновато-пурпурный, густоопушенный, длиной до 30 см. Цветок
блестящий, диаметром до 8 см. В наших условиях цветет в сен¬
399
СПЕЦИАЛЬНАЯ ЧАСТЬ
тябре—ноябре, продолжительность цветения 1 — 1,5 мес. При куль¬
тивировании не нуждается в известковом субстрате.
Этот вид мы размножали как семенным способом, так и кло-
нально. В первом случае с успехом применяли стандартные
приемы, во втором — в качестве превичных эксплантов исполь¬
зовали влагалищную часть листьев сеянцев, полученных в асеп¬
тических условиях. На средах МС и Вацина—Вента через 2—
3 мес проходила пролиферация протокормов, а затем и адвентив¬
ных побегов. Корни образовывались на этих же средах спон¬
танно, после чего растения-регенеранты высаживали из колб.
P. venustum (Wall.) Pfitz. — растения высотой до 40 см, обра¬
зующие плотные группы из листовых розеток. Как правило, это
гумусовые эпифиты или растения, ведущие наземный образ жиз¬
ни. Часто встречаются в густых лесах, зарослях бамбука или в
тени на открытых участках. Ареал данного вида достаточно ши¬
рок и охватывает юго-восточные склоны Гималаев на высоте от
1000 до 1600 м над ур. м. Стебель сильно укорочен. Листья тем¬
но-зеленые, с сизым мраморным рисунком, с обратной стороны
имеют темно-фиолетовую окраску. Цветонос несет 1 цветок и
может достигать до 15 см в высоту. В оранжереях цветет в октяб¬
ре-марте, продолжительность цветения — до 2 мес.
В работе мы использовали семена репродукции НБС НАН
Украины. Всхожесть достаточно низкая — около 1 %. Применяли
традиционные методики высева и стерилизации семенного мате¬
риала. Проростки в условиях асептической культуры активно об¬
разовывали вторичные протокормы и адвентивные побеги, веге¬
тативная масса нарастала медленно. Для культивирования ис¬
пользовали модифицированные среды МС и Пирика. По нашим
наблюдениям, ювенильные растения лучше развиваются на сре¬
дах без активированного угля.
P. villosum (Lindl.) Stein — эпифиты родом из Мьянмы и Таи¬
ланда. Листья линейные, до 40 см в длину, светло-зеленые.
Цветки до 10 см в диаметре, блестящие. Лепестки с волнистым
краем и широкой коричневой полосой вдоль жилки. Приемы
клонального размножения и постасептической адаптации, как у
других видов рода.
В литературе упоминается о семенном размножении различных
представителей рода. К примеру, используя семенное размножение
in vitro, были получены растения P. cilialare Pfitz. Для высева приме¬
няли семена через 1—8 ч после открытия плода и питательные сре¬
ды МС, Томале и Кнудсона. Колбы с семенами выдерживали в те¬
400
ГЛАВА 4. Методы размножения тропических и субтропических растений
чение 12 недель в условиях темноты. Положительные результаты
были получены на среде МС с 1/4 концентрации макроэлементов и
низким уровнем сахарозы. Добавление ауксинов незначительно
стимулировало прорастание семян. Проростки были получены через
1—1,5 года выращивания. Обязательным для их роста было внесе¬
ние триптона. Образовавшиеся проростки переносили на среду с
гомогенатом банана и 1 г/л активированного угля. Авторы подчер¬
кивают, что обязательным условием получения положительных ре¬
зультатов является высев свежесобранных семян (Pierik et al., 1988).
В плодах Paphiopedilum содержатся десятки тысяч семян. В
культуре in vitro на питательной среде можно прорастить боль¬
шинство из них, однако исходя из нашего опыта для успешного
культивирования необходимо учитывать следующее:
• плод у видов Paphiopedilum — коробочка продолговатой формы
длиной до 7 см и шириной до 1 см, созревает более 300 сут, од¬
нако на 150-е сутки после опыления в ней уже содержится до
40 % созревших семян (точнее, вполне развитых зародышей); в
случае высева семян из вскрывшегося плода количество созрев¬
ших семян составляет около 50—65 %; хранение семян в течение
1 — 1,5 года постепенно снижает процент всхожести до нуля в за¬
висимости от вида; соответственно возрастает и время прораста¬
ния, поэтому оптимальным является высев семян из недозрелых
коробочек;
• в плодах развиваются разнокачественные семена;
• наиболее жизнеспособные из них и хорошо сформировав¬
шиеся находятся в средней части плодов.
Для высева использовали семена репродукции НБС НАН Ук¬
раины, полученные с помощью искусственного опыления. Сте¬
рилизация исходного растительного материала — очень сложный
и ответственный этап. Необходимо было избавиться от бактерий
и спор симбиотических грибов, а также от группы грамотрица-
тельных бактерий, содержащихся в межклетниках растений. Борьба
с последними представляет особую сложность, так как, по наше¬
му мнению, они являются симбионтами (у растений отсутствует
отрицательная реакция на их наличие на протяжении всей
жизни).
В связи с изложенным выше растительный материал подго¬
тавливали особенно тщательно. Стерилизацию семян Paphiope¬
dilum проводили в следующем порядке: семена высыпали в ме¬
шочки и тщательно завязывали, затем мешочки с семенами по¬
следовательно помещали в 20%-й раствор хлорной извести (15 мин)
401
СПЕЦИАЛЬНАЯ ЧАСТЬ
и 15%-й раствор пероксида водорода (15 мин). После каждого
стерилизующего вещества семена тщательно промывали дистил¬
лированной водой. После стерилизации перед высевом часть се¬
мян замачивали в воде (8 ч), растворах ГК3 и гумата калия (экс¬
позиция различна).
В наших исследованиях были использованы свежесобранные
семена и семена с небольшим сроком хранения. Семена Paphio¬
pedilum имеют прозрачную сетчатую оболочку, под которой четко
просматривается темный зародыш овальной или веретеновидной
формы. Халазальный конец оболочки изогнут, трубкообразно рас¬
ширен, по сравнению с апикальным, и заканчивается округлым от¬
верстием. Базальная часть зародыша имеет вытянутую форму, апи¬
кальная — округлую.
Семена исследуемых видов перед высевом рассматривали под
микроскопом с целью определения наличия в них зародыша. По¬
сле стерилизации и замачивания их просушивали и высевали на
различные питательные среды:
• Кнудсона с добавлением сока алоэ и ампициллина;
• МС + микроэлементы по Митре;
• Кнудсона С.
Вторую и третью среды готовили в двух вариантах: в первом
сахарозу добавляли непосредственно в питательную среду по
прописи, во втором — отдельным раствором на готовую пита¬
тельную среду. Семена высевали редко, если 50 % из них имели
зародыш. Если же процент семян с зародышами был низок, то
увеличивали густоту высева.
Состав питательных сред, используемых для культивирования
семян и эксплантов исследуемых видов Paphiopedilum, представ¬
лен в табл. 4.61. Семена начинали прорастать на 7—20-е сутки,
что зависело от срока хранения и наличия предпосевной обра¬
ботки. Процесс прорастания семян происходил традиционно.
Вначале они набухали, зародыши изменяли свою окраску с ко¬
ричневой на светло-зеленую и увеличивались в размерах. Проис¬
ходил разрыв семенной кожуры вследствие преимущественного
увеличения диаметра зародыша. Из зародыша формировались ок¬
руглые протокормы: вначале одновершинные, затем многовершин¬
ные. Последние делили и рассаживали на свежую питательную
среду. После того как на апикальной части дифференцировались
листья, у проростка начиналось формирование корня. Одновре¬
менно с увеличением сеянцев в размерах продолжалось развитие
листьев (табл. 4.62).
402
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.61. Состав питательных сред, используемых
для культивирования семян и эксплантов Paphiopedilum, мг/л
Компонент
Проращивание
семян *'
Культивирование
эксплантов
Размножение
побегов *3
(NH4)2S04
60,0
—
—
nh4no3
370,0
—
—
Mg(N03)2 6Н20
110,0
—
—
KH2P04
300,0
—
—
KN03
400,0
—
FeS04 7Н20
20,0
—
—
СаС12 • Н20
75,0
75,0
—
MgS04 7Н20
250,0
250,0
—
NaH2P04
125,0
125,0
—
КС1
750,0
750,0
—
NaN03
600,0
600,0
—
Ыа2ЭДТА
Микроэлементы по
74,5
74,5
74,5
Мурашиге—Скугу *4
1,0
1,0
1,0
Пиридоксин
10,0
—
0,5
Глицин
—
—
2,0
Инозит
—
—
100,0
Никотиновая кислота
10,0
—
0,5
Тиамин
—
—
0,1
2,4-Д
—
1,0
—
НУК
—
—
0,1
2-iP
—
—
3,0
Аденин
—
—
30,0
Кокосовое молоко*4
—
—
150,0
Глюкоза
10,0
—
—
Фруктоза
10,0
—
—
Сахароза
—
20 000,0
30 000,0
*' Среда Stewart—Button (1975). -J Среда Stewart—Button (1976). ° Среда Huang
(1988). ’4 В миллилитрах на 1 л.
Анализируя полученные данные, следует отметить, что Пер¬
вые этапы развития, включая образование протокормов, у всех
видов проходят в течение сравнительно одинакового времени —
от 30 до 70 сут. Длительность же последующих этапов органоге¬
неза была различной, причем образование сеянцев P. delenatii
проходило значительно медленнее, чем остальных видов.
Отличительной особенностью семенного размножения видов
Paphiopedilum является формирование многовершинных прото¬
кормов, которые при делении образовывали новые протокормы.
Также установлено, что в развитии сеянцев исследуемых видов
403
СПЕЦИАЛЬНАЯ ЧАСТЬ
существуют некоторые особенности. Так, у P. insigne и P. callosum
90 % протокормов образуют проростки и лишь 10 % — много¬
вершинные протокормы (рис. 4.82, см. вклейку). Одна из причин
высокого коэффициента размножения протокормов (70 %) — по-
лиэмбриония. Протокормы P. callosum имели по несколько мери¬
стематических зон, что способствовало образованию 3—4 расте¬
ний и более из одного протокорма.
У P. delenatii все первичные протокормы регенерировали мно¬
говершинные протокормы, которые только после длительного
субкультивирования (около 6 мес) образовывали растения. Полу¬
ченные нами результаты соответствуют данным других исследо¬
вателей (Fay et al., 1988).
Многовершинные протокормы делили и рассаживали на све¬
жую питательную среду. После того как на апикальной части диф¬
ференцировались листья, у проростка начиналось формирование
корня. Одновременно сеянцы увеличивались в размерах и про¬
должалось развитие листьев. Через 250—350 сут проростки достига¬
ли оптимальных размеров для высадки в субстрат. Схема семенного
размножения видов рода Paphiopedilum в культуре in vitro пред¬
ставлена на рис. 4.83.
При проведении исследований по оптимизации семенного
размножения изучено влияние на скорость прорастания и каче¬
ство проростков следующих факторов:
• состав питательной среды;
• выдерживание всходов в темноте на первых этапах прорас¬
тания;
Таблица 4.62. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Paphiopedilum, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
P. appletonianum (Gower.) Rolfe
79
179
911
P. callosum (Rchb.f.) Stein
40
90
270
P. delenatii Guill.
40
200
350
P. haynaldianum (Rchb.f.) Stein
69
250
460
P. helenae Aver.
44
120
250
P. insigne (Wall, ex Lindl.) Pfitz.
69
272
664
P. lawrenceanum (Rchb.f.) Pfitz.
46
200
502
P. tonsum (Rchb.f.) Stein
52
25
583
P. venustum (Wall.) Pfitz.
80
322
678
P. villosum (Lindl.) Stein
53
315
491
404
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.83. Схема семенного размножения Paphiopedilum Pfitz.:
а — коробочка с семенами (al — семена под микроскопом); 6 — набухшее семя; в —
одновершинный протокорм; г — многовершинный протокорм; 2 — разделенные про¬
токормы; е — формирование первых листоподобных органов; ж — начало формирова¬
ния первого корня; з, и — проросток с первым корнем
• предпосевная обработка растворами ГК3 и гуматом калия;
• отдельно добавленный раствор сахарозы;
• сок алоэ и ампициллин как дополнительные стерилизаторы.
Установлено, что выдерживание прорастающих семян в темноте
уменьшает время прорастания семян Paphiopedilum с 52 до 10—
30 сут, т. е. в 2—5 раз увеличивает количество проросших семян и
образующихся протокормов. Так, количество протокормов, сфор¬
мировавшихся в темноте и на свету, составило соответственно 15 и
13 %. Некоторые семена, выдерживаемые с момента пересадки в
культуральном помещении на свету, не прорастали в течение года.
При перенесении их в темноту набухание семян началось на 15—
20-е сутки. В условиях темноты колбы с семенами выдерживали
16 недель, после чего переносили в культуральное помещение.
По нашему мнению, более энергичное прорастание семян в
темноте связано с устранением ингибирующего действия света.
Поскольку этот род относится к наземным орхидеям, в природ¬
ных условиях его семена, очевидно, начинают свое развитие в
слое лесной подстилки или почвы (Zakrejs, 1971).
405
СПЕЦИАЛЬНАЯ ЧАСТЬ
Согласно некоторым литературным данным, обработка семян
регуляторами роста значительно влияет на их всхожесть. Для
увеличения процента проросших семян Paphiopedilum мы обраба¬
тывали их растворами ГК3 и гумата калия. Семена замачивали в
растворах от 2 до 6 ч. Контрольное замачивание проводили в
дистиллированной воде. Колбы с семенами выдерживали на све¬
ту. Наилучшие результаты получены при замачивании семян в
течение 4ч в растворах гумата калия (200 мг/л) и ГК3 (1 мг/л).
Установлено, что такая обработка повышала всхожесть семян в
4—5 раз по сравнению с контролем. Прорастание семян в кон¬
троле длилось 56 сут и проросшие семена составляли 85 %, в то
время как при обработке их количество превышало 90 %. Таким
образом, предпосевная обработка семян Paphiopedilum повышает
всхожесть, энергию прорастания и сокращает сроки прохождения
фаз онтогенеза. Вероятно, подобная обработка будет особенно по¬
лезна семенам, которые долго хранились.
Важную роль в проведенном эксперименте играл и момент
обработки регуляторами роста. Так, семена, обработанные до сте¬
рилизации, имели низкую скорость прорастания. Это, по нашему
мнению, объясняется либо вымыванием регуляторов стерили¬
зующими веществами, либо ослаблением их действия. Поэтому
обрабатывать семена ГК3 и гуматом калия следует только после
стерилизации. Необходимо также отметить и негативные стороны
использования ГК3: образовавшиеся сеянцы были в 2 раза мельче,
чем в контроле. Однако этого можно избежать, если протокормы и
растения сразу же перенести на свежую питательную среду.
Добавление стерильного раствора сахарозы (30 г/л) на по¬
верхность среды в сочетании с условиями темноты или предпо¬
севной обработкой позволило выявить влияние данного компо¬
нента на накопление сеянцами вегетативной массы и их одно¬
родность: размеры и масса проростков увеличились в 2—3 раза;
также получены однородные по качеству сеянцы. Согласно на¬
шей точке зрения, этот эффект объясняется увеличением площа¬
ди контакта раствора сахарозы с семенами и более активным
влиянием на них. Имеет значение и концентрация сахарозы: в
растворе она намного превышает таковую в питательной среде
вследствие распределения не по всему ее объему, а только по по¬
верхности.
По нашему мнению, добавление сахарозы улучшает качество
проростков, приближая условия культивирования к природным.
Относительно влияния концентрации сахарозы на прорастание
406
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.63. Влияние добавленных к питательной среде Кнудсона
бактерицидных веществ на стерильность семян Paphiopedilum insigne
Компонент
Концентрация, мг/л
Количество
стерильных семян, %
Ампициллин
1,0
70
1,5
83
Ампициллин + сок алоэ
1,0 + 5,0
100
Сок алоэ
2,5
100
Контроль (среда Кнудсона)
50
семян орхидей мы присоединяемся к точке зрения Н. Бернара:
“Возрастание концентрации растворов для растений, развиваю¬
щихся без грибов, влечет за собой такой же результат, как и воз¬
растание активности грибов для проростков, вступивших в сим¬
биоз” (цит. по: Магру, 1949).
Семена и экспланты Paphiopedilum, как правило, сильно ин¬
фицированы спорами грибов и бактериями, поэтому для повыше¬
ния процента чистых семян мы использовали дополнительные сте¬
рилизующие вещества — сок алоэ и ампициллин. Предпосылкой к
применению сока алоэ послужили данные о его бактерицидных
свойствах, полученные С.Н. Приходько в 1990 г. (табл. 4.63).
Снижение процента инфицированных семян по сравнению с
контролем можно объяснить тем, что развитие инфекции сдер¬
живается наличием антибиотиков в питательной среде. Хорошие
результаты получены при добавлении ампициллина (1,5 мг/л),
сока алоэ (2,5 мг/л) и их комбинации. Кроме стерилизующего
воздействия было исследовано влияние перечисленных выше и
других компонентов на прорастание семян и развитие пророст¬
ков (табл. 4.64).
По данным этой таблицы, оптимальная среда для проращива¬
ния семян — среда Кнудсона с гуматом калия и пептоном. Анти¬
биотики не оказывали тормозящего действия на всхожесть семян,
а в случае добавления 1 мг/л ампициллина был получен довольно
высокий процент проросших семян по сравнению с контролем.
В то же время наибольшее количество протокормов образова¬
лось на среде с 1,5 мг/л ампициллина. Во всех остальных вариан¬
тах этот показатель был ниже контрольного, т.е. и антибиотики,
и Другие компоненты сдерживали скорость протокормообразова-
ния, поэтому их применение имеет смысл ограничить предпо¬
севной обработкой.
407
СПЕЦИАЛЬНАЯ ЧАСТЬ
Значительное внимание в наших исследованиях было уделено
оптимизации питательных сред на всех этапах развития сеянцев
Paphiopedilum. По имеющимся литературным данным (Pierik et
al., 1988), семена лучше всего высевать на среду МС с 1/4 кон¬
центрации всех макроэлементов (pH 6,0) и низкой концентраци¬
ей сахарозы. Таким образом, на первых этапах онтогенеза сеян¬
цы Paphiopedilum не нуждаются в обогащенном составе питатель¬
ной среды, а наоборот, лучше растут на среде с меньшим содер¬
жанием различных элементов. Необходимым является либо очень
невысокая концентрация сахарозы в среде, либо добавление ее
отдельно (как указывалось выше). Внесение активированного уг¬
ля также не имеет смысла, поскольку в начале своего развития
сеянцы еще не выделяют в среду фенольные соединения.
Кроме того, нами были проведены исследования по подбору
оптимальной питательной среды для роста сеянцев. В частности,
ориентируясь на потребность проростков Paphiopedilum в пони¬
женной концентрации минеральных солей, мы применяли пита¬
тельные среды Пирика. Учитывали специфическое действие ви¬
таминов на рост проростков. Так, биотин улучшает развитие про¬
токормов Paphiopedilum и увеличивает их способность образовы¬
вать хлорофилл (рис. 4.84).
Лучшие результаты получены на среде МС с активированным
углем (№ 1), регуляторами роста и аденином. Неожиданным был
хороший результат на среде МС с повышенной концентрацией са¬
харозы. Следует отметить, что на питательной среде № 1 разви¬
вающиеся протокормы имели большие размеры и делились актив-
Таблица 4.64. Влияние состава питательной среды Кнудсона на всхожесть семян
и образование протокормов Paphiopedilum insigne через 2 мес культивирования
Концентрация,
мг/л
Количество, %
Компонент
проросших
семян
образовавшихся
протокормов
Гумат калия + пептон*
50,0
30
30
100,0
64
10
Ампициллин
1,0
69
26
1,5
60
40
Ампициллин + сок алоэ
1,0 + 5,0
68
24
Сок алоэ
2,5
58
30
Контроль (среда Кнуд¬
сона)
—
58
32
' Концентрация пептона 2 г/л.
408
ГЛАВА 4. Методы размножения тропических и субтропических растений
60
40
20
о:
о
8 5
о 1
о М
У л
Ja
Ы а
ю
о
Я
/>ис. 4.84. Интенсивность образования протокормов Paphiopedilum callosum
(Rchb.f.) Stein на разных по составу питательных средах:
j - № 1 (среда МС + 1 г/л активированного угля); б — № 2 (МС + 60 г/л сахарозы);
в — № 3 (МС + 3 мг/л аденина); г — № 4 (МС + 15 % кокосового молока); д — № 5
(среда Митры); е — № 6 (среда Пирика-1)
Рис. 4.85. Формирование сеянцев Paphiopedilum callosum (Rchb.f) Stein в зави¬
симости от состава питательной среды. Условные обозначения см. на рис. 4.84
нее, чем на среде № 3. Высокий процент протокормообразования
был получен на среде № 2.
Данные рис. 4.85 свидетельствуют о том, что развитие расте¬
ний лучше всего проходило на среде № 6 (68 %) и № 5 (60 %). В
состав обеих сред входит БАП и 2,4-Д. Процент образовавшихся
сеянцев на среде № 1 оказался выше, так как в ней не содержит¬
ся ИУК, которая снижает количество побегов, зато активирует
образование корней. Качество проростков на двух указанных
выше средах было одинаково высоким и оставалось таковым до
момента получения укорененных проростков.
Добавление к среде 2,4-Д в концентрации более 0,08 мг/л уг¬
нетает рост проростков. Однако нужно отметить перспективу по¬
лучения каллуса из тканей сеянцев, что было выявлено на пита¬
тельной среде № 5.
Коэффициент размножения протокормов был значительным
на среде Пирика (60 %), а также на средах № 1 и № 5 (по 35 %)
(рис. 4.86, А). Отличительной особенностью всех трех сред явля¬
ется наличие в них регуляторов роста.
Коэффициент размножения сеянцев был высоким на средах
№ 1 и № 4 (рис. 4.86, Б). Таким образом, результаты исследо¬
ваний позволяют выделить оптимальные среды для различных
этапов онтогенеза сеянцев Paphiopedilum'.
• для проращивания семян и начальных этапов развития про¬
токормов рекомендуется использовать среды МС и Кнудсона с
отдельно добавленным раствором сахарозы; они увеличивают ско-
409
СПЕЦИАЛЬНАЯ ЧАСТЬ
а б в г д е а б в г д е
А Б
Рис. 4.86. Коэффициент размножения протокормов (А) и сеянцев (Б) Pa¬
phiopedilum callosum (Rchb.f.) Stein в зависимости от состава среды. Условные
обозначения см. на рис. 4.84
рость прорастания в 2—5 раз, количество проросших семян — на
20-30 %;
• для культивирования протокормов лучше применять пита¬
тельную среду МС с активированным углем;
• для роста и укоренения проростков оптимальной является
среда Пирика (Ernst, 1974; Лаврентьева и др., 2003);
• в качестве комплексной среды для культивирования
Paphiopedilum из семян можно использовать среду МС с макро¬
элементами по Митре (№ 5), уменьшив количество 2,4-Д с 0,1 до
0,08 мг/л. Процент прорастания семян на этой среде увеличива¬
ется в 4—5 раз, развитие проростков — в 2—3 раза, накопление
вегетативной массы — в 1,5—2 раза.
В заключение следует отметить, что успешное культивирова¬
ние семян P. insigne (рис. 4.87, см. вклейку) и P. callosum возмож¬
но при соблюдении следующих условий: высевать семена из не¬
дозрелых коробочек или свежесобранные семена; первые 12—
16 недель прорастающие семена выдерживать в темноте или ис¬
пользовать предпосевную обработку ГК3 и гуматом калия; при¬
менять среды с минимальным количеством сахарозы или добав¬
лять ее отдельно; регуляторы роста вносить в питательную среду
только тогда, когда сеянцы достигнут фазы протокорма.
При семенном размножении P. delenatii в культуре in vitro ис¬
пользовали семена репродукции НБС, полученные путем искус¬
ственного опыления. Коробочка находилась на растениях в сред¬
нем 300 сут. Масса коробочки с семенами составляла 800 мг, без
семян — 680 мг, ее длина 53 мм и ширина 7 мм. Из всего коли¬
чества семян лишь 35 % имели сформированные зародыши.
Визуально семя P. delenatii имеет желтый цвет. Поверхность
неровная, непрозрачная. На халазальном конце семени располо¬
410
ГЛАВА 4. Методы размножения тропических и субтропических растений
жено отверстие, благодаря которому внутреннее пространство со¬
общается с окружающей средой. Вероятно, в природе через него к
зародышу могут попадать влага и гифы симбиотических грибов.
Семена P. delenatii высевали из целых недозрелых коробочек,
которые стерилизовали, обжигая 3—4 раза над огнем спиртовки.
Потом коробочку раскрывали и высевали семена на поверхность пи¬
тательной среды. Подобная процедура стерилизации исключает
повреждение зародышей и угнетение их развития вследствие дей¬
ствия агрессивных реагентов во время поэтапной стерилизации.
В работе использовали наиболее подходящие для культивиро¬
вания орхидных агаризированные среды. Их основу составляли
прописи МС, Кнудсона, Пирика (табл. 4.65).
Таблица 4.65. Состав питательных сред, используемых
для культивирования Paphiopedilum delenatii, мг/л
Среда
Компонент
МС
мс;1
Пирика
КПГУ*2
Макроэлементы
По Мураши¬
ге—Скугу
По Мураши¬
ге—Скугу
По Пирику
По Кнудсону
Микроэлементы
То же
То же
То же
То же
Мезо- инозит
100,0
100,0
100,0
—
Эдам и н
1000,0
1000,0
—
—
Глицин
2,0
2,0
—
—
Тиамин
0,1
0,1
0,4
—
Пиридоксин
Никотиновая
0,5
0,5
0,5
—
кислота
0,5
0,5
0,5
—
Гумат калия
—
—
50,0
Пептон
—
—
—
2000,0
БАП
1,0
—
ИМК
—
НУК
—
—
ИУК
0,1
0,1
—
—
Гомогенат банана
200 000,0
—
—
Сахароза
Активированный
30 000,0
30 000,0
30 000,0
20 000,0
уголь
1000,0
—
—
1000,0
Агар
8000,0
8000,0
8000,0
8000,0
PH
5,5
5,5
5,3
5,5
1 Среда Мурашиге—Скуга с гомогенатом банана. *2 Модифицированная сре¬
да Кнудсона.
411
СПЕЦИАЛЬНАЯ ЧАСТЬ
I
к
s
<L>
О
А
Н
О
и
*
о
X
о
CQ
О
10 20 30 40 50 60 70 80 90 100
Время, сутки
Рис. 4.88. Динамика появления всходов Paphiopedilum
delenatii (Rchb.f.) Stein в разных условиях освещенности:
/ — на свету; 2— в темноте
Высев семян проводили на среду КПГУ. Колбы с посевами бы¬
ли разделены на две равные группы: первая находилась в темноте,
а вторая оставалась в культуральном помещении. Процесс прорас¬
тания начался одновременно (приблизительно через 50—52 сут), но
в темноте он протекал быстрее (рис. 4.88). Через 100 сут все колбы
были перенесены в одинаковые по освещенности условия.
Некоторые авторы указывают на положительное воздействие ак¬
тивированного угля на рост и развитие растения в условиях асепти¬
ческой культуры. В связи с этим мы исследовали влияние данного
компонента на интенсивность прорастания семян исследуемого ви¬
да. Оказалось, что добавление 1000 мг/л активированного угля в
среду МС положительно влияет на всхожесть семян (рис. 4.89).
С целью улучшения условий культивирования через 210 сут
после высева все сеянцы были разделены на равноценные груп¬
пы и высажены на разные среды (МС, МСБ, Пирика). После
60 сут культивирования получены следующие результаты:
• использование среды Пирика приводит к значительной за¬
держке роста сеянцев в сравнении с культурой на среде МС; ли¬
стья растений окрашены в темно-зеленый цвет, до конца срока
погибает около 35 %;
• оптимальной является среда МС; сеянцы активно наращи¬
вают вегетативную массу, формируют вторичные протокормы; до
конца срока некоторые растения уже образуют 4—5 листьев и 1 —
2 первых корня, однако зафиксирована и гибель одиночных се¬
янцев (вероятно, травмированных при пересадке);
412
ГЛАВА 4. Методы размножения тропических и субтропических растений
Время, сутки
Рис. 4.89. Динамика появления всходов Paphiopedilum
delenatii (Rchb.f.) Stein на разных питательных средах:
/ — без активированного угля; 2— с активированным углем
• культивирование сеянцев на МСБ провоцирует появление
бактерий, сеянцы практически не растут, до конца срока около
60 % сеянцев погибает.
В связи с этим все следующие пассажи проводились на среду
МС. На данной среде подавляющее большинство сеянцев развива¬
лись единично и лишь около 25 % растений формировали вторич¬
ные протокормы (рис. 4.90, а, см. вклейку). Активное образо¬
вание последних началось через 220—270 сут с момента появления
первых всходов.
Часть растений, которые развивались единично, погибла (7 %).
Оставшиеся представляли собой довольно разнородную по степени
развития группу. Первые сеянцы (25 шт.) были высажены в суб¬
страт в возрасте 370 сут (рис. 4.90, б). Темпы их развития представ¬
лены ниже. Однако в этой группе были и растения, находившиеся
на стадии формирования 3—4 листьев и 1—2 корней.
Первый корень появляется на уровне 1—3 междоузлий, раз¬
рывая при этом влагалище того листа, из пазухи которого он раз¬
вивается. При культивировании корни сеянцев могут распола¬
гаться как в толще среды, так и на ее поверхности. Их длина до
40 мм, они окрашены в светлые тона и густо покрыты корневы¬
ми волосками длиной до 1,5 мм. Корни, располагающиеся в
толще среды, также имеют корневые волоски, но они не такие
Длинные и расположены менее плотно. Кончик корня длиной
3—4 мм не имеет опушения и окрашен в бледно-зеленые тона.
413
СПЕЦИАЛЬНАЯ ЧАСТЬ
Динамика развития сеянцев P. delenatii в условиях культуры in
vitro представлена ниже:
Период, сут Появление новообразований в ходе онтогенеза
27—30 Набухание семян
50—52 Начало прорастания (освобождение от семенной оболоч¬
ки, формирование первичного протокорма)
65—70 Позеленение всходов (синтез собственных фотосинтетиче-
ских пигментов)
75—80 Формирование первого листоподобного органа
130—170 Формирование 2—4 листьев и первого корня
220—270 Активное наращивание вегетативной массы, формирова¬
ние вторичных протокормов (сеянцы имеют до 5 листьев и
2—4 корня)
350—370 Высадка в субстрат первых сеянцев (растения имеют до 7
листьев, 3—4 корня и массу 0,750—1,150 мг)
В условиях асептической культуры сеянцы, которые развива¬
ются единично, первыми достигают состояния, позволяющего
переводить их ex situ. В условиях in vitro остаются те сеянцы, ко¬
торые развиваются, проходя стадию вторичного протокорма. На
начальных этапах развития темпы их роста в 2—3 раза медлен¬
нее, чем у растений первой группы.
Заметим, что часть сеянцев (особенно те, в развитии которых
есть стадия вторичного протокорма) иногда имеет измененную
форму листовой пластинки. Причем чем лист онтогенетически бо¬
лее старый, тем больше вероятность того, что его листовая пластин¬
ка будет деформирована. Однако при увеличении порядка нараста¬
ния и линейных размеров форма листьев становится типичной у
большинства сеянцев, а изменения встречаются намного реже и
не так выражены (рис. 4.91).
Подводя итоги, заметим, что сеянцы P. delenatii в культуре in
vitro на среде МС могут развиваться двумя основными путями:
1. Развитие из зародыша семени протокорма, формирующего
один центр роста; в дальнейшем из него образуется один сеянец,
который не дает адвентивных побегов (за единичными исключе¬
ниями), имеет 4—5 листьев длиной 20—30 мм и шириной до
10 мм, 3—4 корня длиной до 30 мм и диаметром до 2 мм, приго¬
ден к высадке в субстрат. Как правило, такие особи развиваются
быстрее и их можно высаживать ex situ на 4—7 мес раньше тех,
которые развиваются, образуя вторичные протокормы.
414
ГЛАВА 4. Методы размножения тропических и субтропических растений
2. Формирование на теле протокорма зачатков 1—2 листопо¬
добных органов, после чего начинается активное наращивание
его вегетативной массы. Поверхность протокорма становится
неровной, бугристой, на ней постоянно хаотически формируют¬
ся новые центры роста, которые дают начало вторичным протокор¬
мам, образующим целые конгломераты на теле первичного прото¬
корма. Сформировав 2—3 листовых зачатка, вторичные протокормы
начинают активно расти. Такие конгломераты могут быть диамет¬
ром до 20 мм и полностью покрывать первичный протокорм,
тело которого в это время постепенно отмирает. Около 25 %
конгломератов витрифицированы, но, как показывает наша
практика, они могут формировать одиночные невитрифицирован-
ные особи. Органогенез у молодых растений происходит преимуще¬
ственно в верхней части конгломератов. Это хаотичный процесс.
Молодые растения отделяют и субкультивируют порознь. Переса¬
живая такие экземпляры несколько раз, можно добиться их даль¬
нейшего линейного роста. Таким образом, через 2—4 пассажа
мы получали растения, пригодные для высадки в субстрат.
Вероятно, подобные варианты развития (в том или другом
виде) можно встретить и в условиях in situ, поэтому мы считаем,
что поливариантность в развитии ювенильных растений в попу¬
ляциях P. delenatii не случайна и является приспособлением для
выживания в условиях in situ.
Таким образом, нами показано, что при семенном размноже¬
нии в условиях культуры in vitro сеянцам P. delenatii присущи два
а
а — сеянцы, которые проходят стадию вторичного про¬
токорма; б — ювенильные листья сеянцев в возрасте
300—350 сут
Рис. 4.91. Различные формы ювенильных листьев
Paphiopedilum delenatii (Rchb.f.) Stein:
б
415
СПЕЦИАЛЬНАЯ ЧАСТЬ
основных пути онтогенеза. Их активное вегетативное размноже¬
ние возможно уже на первых этапах развития, на стадии вторич¬
ного протокорма и на последующих за ними этапах органогенеза.
Установлено, что на процесс прорастания семян на начальных
этапах положительно влияет темнота и добавление к питательной
среде активированного угля. Наиболее пригодной для культиви¬
рования сеянцев P. delenatii оказалась среда МС. Первые сеянцы
можно переводить ex situ в возрасте 370 сут.
В отношении микроразмножения Paphiopedilum имеются не¬
многочисленные и противоречивые данные. Некоторые авторы
(Arditti, 1977) считают, что культура органов Paphiopedilum не¬
возможна, однако G. Stewart и соавт. (1975) смогли ввести апи¬
кальные меристемы в культуру in vitro и получить не только рас¬
тения-регенеранты по пути прямого органогенеза, но и немно¬
гочисленный каллус. Удалось также получить каллус на кончи¬
ках листьев сеянцев Paphiopedilum. Введение Paphiopedilum в
культуру in vitro затрудняется высоким уровнем инфицирован¬
ное™ тканей и отсутствием хорошо разработанной системы
стерилизации растительного материала. Перспективно исполь¬
зование сеянцев, полученных в культуре in vitro, так как их сте¬
рильность не вызывает сомнений. Единственным негативным
обстоятельством при этом является гетерогенность и отклоне¬
ние от родительских форм растений, выращенных из семян.
В результате наших исследований установлено, что в меж¬
клетниках апикальных и латеральных меристем Paphiopedilum на¬
ходится 5—6 видов симбиотических бактерий, два из них — грам-
отрицательные. Обычный режим стерилизации оказался непри¬
годным для получения асептической культуры, поэтому мы вели
поиски эффективного режима стерилизации для введения иссле¬
дуемых видов в культуру тканей.
Эксплантами для микроразмножения служили апикальные и
латеральные меристемы вегетирующих и отрастающих побегов. В
связи с тем что побеги Paphiopedilum имеют высоту всего 5—6 см,
выделить из них большое количество эксплантов не удается. Это
значительно ограничивает количество участвующих в экспери¬
ментах изолированных тканей.
Для стерилизации исходного материала проводили дополни¬
тельную обработку растворами антибиотиков. Было испытано два
режима стерилизации. Первый сводился к обработке ткани анти¬
биотиками перед применением обычных стерилизующих веществ.
Второй режим стерилизации отличался тем, что обработка тканей
416
ГЛАВА 4. Методы размножения тропических и субтропических растений
антибиотиками заканчивала весь процесс стерилизации. Контро¬
лем служил обычный режим стерилизации (табл. 4.66).
Как видно из данных этой таблицы, применение антибиоти¬
ков и их комбинаций после основной стерилизации дало поло¬
жительные результаты. Высокий выход асептической ткани обес¬
печивают клафоран (80 %) и карбенициллин (90 %). Особенно
эффективным оказался вариант канамицин + клафоран (95 %).
Асептические меристемы Paphiopedilum переносили на пита¬
тельную среду Кнудсона. Колбы с эксплантами помещали в тер¬
мостат (условия темноты, необходимые для регенерации) и про¬
водили тест на стерильность в течение 1,5 мес. Контроль осуще¬
ствляли каждые 7—10 сут. Экспланты, которые выдерживали
тест, переносили на питательную среду МС для регенерации. Эк¬
земпляры с проявившейся грибковой инфекцией выбраковывали,
с бактериальной — подвергали повторной стерилизации. В каче¬
стве стерилизующего вещества в данном случае нами впервые
был применен фермент из белка куриного яйца — лизоцим
(табл. 4.67).
Таблица 4.66. Эффективность стерилизующего действия антибиотиков
на экспланты Paphiopedilum
Антибиотик
Концентрация,
мг/100 мл
Время
обработки,
мин
Количество
стерильных
эксплантов, %
Ампициллин
1,0
34
10
Гентамицин
1,0
33
10
Оксациллин
1,5
32
10
Канамицин
3,0
32
0
Клафоран
1,0
32
80
Карбенициллин
1,0
32
90
Канамицин + клафоран
(3 : 1)
3,0 + 1,0
15 + 17
95
Ампициллин + кла¬
форан (1 : 1)
1,0 + 1,0
15 + 19
70
Ампициллин + оксацил¬
лин + клафоран
(1 : 1,5 : 1)
1,0 + 1,5 + 1,0
10 + 10 + 15
—
Гентамицин + клафоран
(1 : 1)
1,0 + 1,0
15 + 18
—
Контроль
—
—
—
Примечание. (—) — экспланты погибли.
417
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.67. Эффективность совместного действия стерилизующих веществ
на экспланты Paphiopedilum
Компонент
Время обработки,
мин
Количество стерильных
эксплантов, %
Пероксид водорода (20 %)
5-7
5-10
Пероксид водорода (15 %) +
+ лизоцим *
3+ 1,5
90
Лизоцим*
1,5-2
100
’ После обработки лизоцимом экспланты водой не промывали.
Как видно из табл. 4.67, лизоцим является очень сильным сте¬
рилизующим веществом, так как воздействует сразу на несколько
бактерий (в том числе и на грамотрицательные). Основой для его
применения послужили биохимические данные о высокой лизи-
рующей способности лизоцима по отношению к мембранам бак¬
терий. Однако этот фермент используют также для разрушения
клеточных стенок растений (при извлечении клеточных орга-
нелл), поэтому стерилизацию следует приводить осторожно, что¬
бы не повредить экспланты. Мы применяли лизоцим в очень ма¬
лых концентрациях и с коротким временем обработки (не более
2 мин).
В ходе эксперимента было выявлено, что самые жизнеспо¬
собные — латеральные меристемы P. insigne. Апикальные меристе¬
мы, ввиду их очень малых размеров, часто не выдерживали режима
стерилизации. На питательной среде эксплант, состоящий только
из апикального конуса, в скором времени погибал. Наилучшими
оказались латеральные меристемы, отобранные с молодых отрас¬
тающих побегов, а также апикальные меристемы с 2—3 листовы¬
ми примордиями.
По нашим наблюдениям, оптимальный срок отбора эксплан¬
тов — февраль—март. Экспланты, которые были введены в куль¬
туру осенью, находились в состоянии покоя до весны. Их разви¬
тие проходило по пути прямого органогенеза в темноте на пита¬
тельной среде МС с добавлением 2 мг/л аденина и 1 г/л активи¬
рованного угля. Апекс характеризовался недетерминированным
ростом. Это самоорганизующаяся зона.
По мере роста апекса на питательной среде закладывались лис¬
товые примордии, которые увеличивались в размерах, а над ними
образовывались новые листовые примордии. Латеральная почка за¬
кладывается из наружных слоев стеблевой части. Латеральные
418
ГЛАВА 4. Методы размножения тропических и субтропических растений
почки по своему развитию на питательной среде полностью иден¬
тичны росту апекса.
Следует отметить, что начало регенерации в культуре in vitro
совпало с началом весенней вегетации взрослых растений (конец
февраля — начало марта). Именно в этот период латеральные и
апикальные меристемы растений начинают развитие. Через 30—
40 сут от начала регенерации растения-регенеранты имели высоту
до 7 мм и на 1—2 нормальных срединных листа меньше, чем на
ювенильном проростке.
Таким образом, регенерация целого растения из апикальных
и латеральных меристем Paphiopedilum может быть использована для
его размножения, так как гарантирует генетическую идентичность
материнским формам. Отбор меристем необходимо проводить с
молодых отрастающих побегов и вводить в культуру in vitro в
конце февраля, поскольку такие экспланты более жизнеспособны
и обладают хорошей регенерирующей способностью. Высадку сле¬
дует осуществлять на модифицированную среду МС с активиро¬
ванным углем. Культивирование эксплантов Paphiopedilum воз¬
можно только в условиях темноты.
Необходимы дальнейшие исследования культуры тканей Pa¬
phiopedilum с целью выявления эксплантов, способных пролифе¬
рировать протокормы.
Также нами было проведено анатомо-морфологическое изу¬
чение этапов морфогенеза Paphiopedilum в асептической культуре.
Установлено, что на первых этапах прорастания семян зародыш
увеличивается в ширину почти в 2 раза. Апикальные клетки ак¬
тивно делятся адаксиально и абаксиально, образуя округлый про¬
токорм, который состоит из недифференцированных паренхим¬
ных клеток и однослойного эпидермиса. На протяжении 1 —
1.5 мес протокорм увеличивается в размерах, сохраняя сферическую
форму. На этом этапе можно наблюдать его дифференциацию на
базальную и апикальную части. Ризоиды появляются через
1.5 мес после высева семян. Клетки апикальной части меристе-
матические, базальной — крупные паренхимные. В апикальной
зоне закладывается апекс будущего побега в виде меристематиче-
ского центра, который состоит из мелких клеток с мелкозерни¬
стой цитоплазмой. Первый листоподобный орган закладывается
валиком вокруг апикальной меристемы и имеет форму конуса с
вертикальной щелью. Образование листьев осуществляется путем
последовательной их закладки в апексе побега в местах наиболее
активного деления клеток — субэпидермальных и эпидермальных
419
СПЕЦИАЛЬНАЯ ЧАСТЬ
слоях. Одновременно с появлением первого листа в теле прото¬
корма формируется прокамбиальный тяж. Дальнейший рост по¬
бега происходит в результате интенсивного деления клеток верх¬
ней части протокорма. Ткани молодых листьев состоят из очень
мелких клеток с плотной цитоплазмой. В дальнейшем клетки
эпидермиса листа приобретают характерную для них вытянутую
форму. Устьичный аппарат формируется с обеих сторон листа. Ла¬
теральная почка молодого побега Paphiopedilum состоит из апикаль¬
ной меристемы и 3—4 листовых примордиев.
Первый корень закладывается эндогенно в верхней части про-
камбиального тяжа протокорма между телом протокорма и первым
листом, имеет 2-слойный веламен и 6-слойную паренхиму (Залу-
каева, 1990). Последующие корни ювенильного побега развива¬
ются на удлиненном междоузлии второго листа, имеют 4-слой-
ный веламен и 8-слойную паренхиму.
Выше было описано развитие из протокорма Paphiopedilum
апикальной почки. Однако развитие протокорма может идти и
по пути вегетативного размножения, осуществляя функцию уве¬
личения численности вида (Батыгина и др., 1980). Именно по
этому пути происходило развитие протокормов P. callosum. После
помещения семян на питательную среду наблюдали образование
шаровидного проростка. Его рост осуществлялся главным обра¬
зом вследствие деления клеток. Клетки протокормов оставались
меристематическими очень долго (до 5—6 мес). По мере даль¬
нейшего развития проростка эндогенно обособлялись меристемати¬
ческие очаги, отчего протокорм приобретал бесформенный вид. На
этой стадии происходит закладка многочисленных корней. Они
морфологически обособляются раньше, чем заложатся примор¬
дии первых листьев (Андронова, 1988).
Возможность закладки большого количества меристематиче¬
ских очагов дочерних протокормов и корней у P. callosum опре¬
деляется долго сохраняющейся меристематичностью клеток про¬
токорма. В отличие от него у P. insigne меристематическим оста¬
ется лишь место между собственно телом протокорма и первым
листом, а также в узлах по мере развития побега. Таким образом,
дифференциация зародыша на органы начинается лишь после
образования специфической структуры — протокорма. В зависи¬
мости от условий произрастания (питательная среда) и вида рас¬
тения протокорм может выполнять разные функции: резервиро¬
вать питательные вещества для развития апикальной почки и
увеличивать численность вида.
420
ГЛАВА 4. Методы размножения тропических и субтропических растений
Апикальную часть протокорма можно сравнить с апикальной
меристемой побега, на котором у различных цветковых растений
образуются или семядоли, или примордии листьев.
В результате проведенных нами исследований установлено:
• плоды у Paphiopedilum созревают дольше, чем семена, по¬
этому высев семян из недозрелых коробочек значительно сокра¬
щает время образования сеянцев и дает наибольший процент
проросших семян;
• жизнеспособность семян низкая: высев семян из вскрыв¬
шихся коробочек дает лишь 65 % проросших; хранение семян
снижает всхожесть до 0—1 % через 1 — 1,5 года, в зависимости от
вида, а также увеличивает время развития сеянцев.
Установленные нами закономерности позволяют усовершен¬
ствовать методы семенного размножения Paphiopedilum. На пер¬
вых этапах развития семена должны культивироваться в темноте,
что, по нашему мнению, дает возможность приблизить условия
in vitro к нативным. Культивирование на свету позволяет прорас¬
тить лишь 30 % семян на 52—56-е сутки, остальные развиваются
постепенно в течение 1,5—2,0 лет. Культивирование в условиях
темноты сокращало время прорастания до 10—40 сут; это зависе¬
ло от вида и срока хранения семян, причем все жизнеспособные
семена начинали прорастать синхронно. Прорастание на свету,
на наш взгляд, сдерживается его ингибирующим действием на
семена, которые в природе начинают развиваться в подстилке
или субстрате. Энергия прорастания семян увеличивается также
при проведении предпосевной обработки.
Замачивание в ГК3 и гумате калия (эти соединения использо¬
ваны нами для орхидных впервые) позволило проращивать семе¬
на как свежесобранные, так и хранившиеся 7 мес, в условиях ос¬
вещенности. Скорость прорастания увеличилась в 2—4 раза, вре¬
мя развития сеянцев сократилось в 1,5—1,7 раза, что выше тех же
параметров у сеянцев, культивируемых в темноте. Особенно эф¬
фективной предпосевная обработка оказалась для хранившихся
семян, так как позволила увеличить количество проросших семян
на 20—30 % и ускорить развитие.
Известно, что большую роль в успехе культивирования играет
подбор углеводов и их концентрации (Arditti et al., 1978; Pierik et
al., 1988). Наши исследования позволили установить, что для
Paphiopedilum больше подходит глюкоза, а сахарозу нужно добав¬
лять в среду в небольшом количестве или на поверхность пита¬
тельной среды отдельным концентрированным раствором. При¬
421
СПЕЦИАЛЬНАЯ ЧАСТЬ
менение последнего дало возможность вырастить более сильные
и однородные сеянцы, которые быстрее и активнее накапливали
вегетативную массу (они были в 2 раза крупнее остальных).
В связи с высокой инфицированностью растений Paphiopedi¬
lum обычная стерилизация позволяла получить лишь 50 % асеп¬
тического материала. Добавление к питательной среде сока алоэ
и ампициллина увеличивало его количество до 70—100 %. В то
же время бактерицидные вещества не подавляли скорость разви¬
тия сеянцев и не уменьшали процент проросших семян.
При подборе оптимальной культуральной среды установлено,
что для проращивания семян Paphiopedilum можно рекомендовать
среды Кнудсона и МС с микроэлементами по Митре с отдельно
добавленным раствором сахарозы. Внесение ростостимулирующих
веществ на этом этапе не дало эффекта, а при большом их коли¬
честве даже угнетало развивающиеся зародыши. Для делящихся
протокормов наиболее подходящей является среда МС с фито¬
гормонами и витаминами (50 % образования протокормов отно¬
сительно контроля), для роста и укоренения проростков — среда
Пирика (68 % образования растений относительно контроля).
Нами исследована возможность введения Paphiopedilum в
культуру тканей. По имеющимся литературным данным (Steward
et al., 1975; Arditti, 1979), наибольшую трудность составляет по¬
лучение асептической ткани, так как обычная стерилизация ока¬
залась неэффективной. При использовании нами антибиотиков и
фермента лизоцима было получено 80—95 % стерильных экс¬
плантов, а в случае применения только лизоцима этот показатель
составил 100 %. Выявлено, что к регенерации способны апикаль¬
ные и латеральные меристемы молодых отрастающих побегов; их
развитие осуществлялось по пути прямого органогенеза. Извест¬
но, что 0,1 мг/л 2,4-Д вызывает регенерацию каллуса на эксплан-
тах орхидей. На корнях проростков Paphiopedilum, которые мы
выращивали на среде с 2,4-Д, также отмечено образование кал¬
луса.
Изучение онтогенеза Paphiopedilum показало, что развитие за¬
родыша и его дифференциация стимулируются после начала
прорастания и образования протокорма. Разные виды Paphiopedi¬
lum различаются критической массой протокорма и его функ¬
циями (резервирование питательных веществ для развития апи¬
кальной почки и увеличение численности вида). Проросток раз¬
вивается из протокорма, первый корень закладывается эндогенно
между первым листом и собственно телом протокорма. Постсе-
422
ГЛАВА 4. Методы размножения тропических и субтропических растений
менное развитие Paphiopedilum происходит по общей для всех ор¬
хидных схеме и отличается видоспецифичностью биологии раз¬
множения, что обеспечивает пластичность и надежность системы
воспроизведения в различных условиях их существования.
Первые сведения о клональном размножении Paphiopedilum in
vitro появились в 1973 г. (Bubeck, 1973). В качестве эксплантов
автор использовал апикальные и терминальные почки молодых
побегов, однако подчеркивал, что таких эксплантов можно вы¬
членить очень мало, что делает размножение рискованным. Кро¬
ме того, С. Bubeck выявил, что изолированные ткани сильно ин¬
фицированы и процент асептических эксплантов очень мал. Весь
процесс размножения он поделил на три этапа. На первом этапе
экспланты культивировали на среде МС с 50 мл/л кокосового
молока. Для формирования адвентивных почек их переносили на
среду с 4 мг/л аденина. На третьем этапе, после образования по¬
бегов, их укореняли на среде Кнудсона.
Более углубленные исследования провели G. Stewart и P. But¬
ton (1975, 1977). Эксплантами также служили латеральные почки
побегов, однако авторам удалось получить из почки только один
побег с ярко выраженным апикальным доминированием. Поэто¬
му в качестве эксплантов начали использовать и сегменты сеянцев.
На побегах и сеянцах удаляли листья, вычленяли апекс с 2 листо¬
выми примордиями и вырезали почки размером 5 х 5 х 5 мм. Куль¬
тивировали на средах Хеллера и МС с 1 мг/л 2,4-Д и 5 мг/л БА.
Экспланты развились только через 4 мес. Лучшие результаты по¬
лучены на среде МС. Регенерация протокормов зафиксирована
на среде МС с цитокининами. При культивировании эксплантов
отмечен высокий процент контаминации и слабый рост культур
(Stewart et al., 1976, 1977). Формирование протокормов, напри¬
мер, наблюдали только у 4 эксплантов из 18, и только один экс¬
плант P. callosum регенерировал 2 побега. Добавление к питательной
среде 10 мг/л БА устраняло апикальное доминирование и приво¬
дило к развитию пазушных почек.
Исследованию влияния различных дополнительных компо¬
нентов к питательной среде МС на развитие эксплантов Paphio¬
pedilum посвящена работа L. Huang (1988). Для размножения он
использовал апекс побега. Первые 4 недели культуры выдержива¬
ли в темноте, а затем переносили в жидкую среду МС с 0,1 мг/л
НУК, 3,0 — 2-iP, 100,0 — БА, 30,0 мг/л аденина, 15 % кокосового
молока. Массовое образование протокормов отмечено через 8 не¬
дель культивирования. На третьем этапе выращивания получен¬
423
СПЕЦИАЛЬНАЯ ЧАСТЬ
ные побеги высаживали на твердую среду МС с 0,3 мг/л НУК и
30 мг/л аденина, на которой они успешно укоренялись. Для уст¬
ранения контаминации применяли антибиотики (Anonymous,
1983; Waldenmaier et al., 1986).
Для микроразмножения Paphiopedilum эксплантами могут
быть также сегменты листьев и корней сеянцев. На питательной
среде МС с 1 мг/л НУК и кинетина через 7 недель культивирова¬
ния они регенерировали протокормы, а потом и побеги. Укоре¬
нение проходило на среде без фитогормонов (Northen, 1982).
Некоторые исследователи использовали аппликацию (нанесе¬
ние) пасты с цитокининами на латеральные почки Paphiopedilum.
Концентрация БА составляла 3750 мг/л. Для этого смешивали БА
с вазелином (5 г) и твином. Через некоторое время наблюдали об¬
разование цветоносов и пробуждение спящих почек (Nilman, 1980;
Sampolinski, 1983).
Таким образом, несмотря на имеющиеся положительные ре¬
зультаты, методы микроразмножения Paphiopedilum требуют даль¬
нейшего усовершенствования с целью получения массового по¬
садочного материала и возможной реинтродукции.
Phaius Lour. Род насчитывает около 50 крупных наземных
растений, распространенных в Азии, Индонезии, Австралии, Но¬
вой Гвинее, Африке, на о-ве Мадагаскар. Название связано с тем¬
ной окраской цветков у разных видов рода. Стебли цилиндриче¬
ские, несут до 8 листьев. Листья крупные, складчатые, с выступаю¬
щими жилками. Соцветия — прямые, верхушечные, плотные или
редкие, многоцветковые. Цветки различной окраски — белые, жел¬
тые, коричневые (Черевченко и др., 2001). Размножают вегетативно
и в культуре in vitro.
Ph. tankervilleae (Banks ex L’Her.) Blume — большие, до 20 см
в высоту, растения, произрастающие в Китае, Мьянме, Бангла¬
деш, Индонезии, Австралии, Панаме, на о-ве Куба. Это растение
часто называют “болотная орхидея”. Псевдоклубни яйцевидные,
высотой до 7 см, несут 3—4 листа. Листья заостренные, тонкие,
складчатые, до 100 см в длину. Соцветие — многоцветковая (до
25 цветков) кисть. Цветки до 12 см в диаметре, с запахом, белые,
зеленоватые, коричневые. Размножают вегетативно и семенами в
культуре in vitro.
Семена Ph. australis F.Muell, Ph. tankervilleae (Banks ex L’Her.)
Blume, Ph. mishmensis (Lindl. et Paxt.) Rchb.f. получали посредст¬
вом искусственного опыления растений. Семена высевали на пи¬
тательную среду МС с 2 мг/л аденина и 1 г/л активированного
424
ГЛАВА 4. Методы размножения тропических и субтропических растений
угля. Начало прорастания семян и формирование протокормов
отмечено на 57-е сутки у Ph. tankervilleae и Ph. mishmensis. Значи¬
тельно больше времени (203 сут) необходимо для прорастания
семян у Ph. australis. По срокам образования растений эта тен¬
денция несколько снижается. Формирование растений у Ph. aus¬
tralis происходит в 3 раза медленнее, чем у остальных двух видов.
Аналогичная тенденция сохраняется и по срокам высадки расте¬
ний в субстрат (см. прил. 1). Следует отметить, что такие же ре¬
зультаты получили X. Shan и соавт. (2000).
Phalaenopsis Blume. Род насчитывает около 50 эпифитных и
литофильных видов, распространенных в Индии, Юго-Восточ¬
ной Азии, Индонезии, Филиппинах. Моноподиальные растения.
Имеют хорошо развитые длинные мясистые воздушные корни.
Листья мясистые, яйцевидные. Цветки мелкие и большие, бело¬
го, розового, желтого и фиолетового цвета с точками и полосами.
Характерной особенностью является наличие в средней части
губы выростов, похожих на усики. Размножают семенами и в
культуре тканей.
Для семенного и клонального размножения в культуре in vitro
мы использовали виды Ph. amabilis (L.) Blume, Ph. schilleriana
Rchb.f., Ph. cornu-cervi (Breda) Blume et Rchb.f. Ph. lueddemanniana
Rchb.f. и культивары Phalaenopsis ’Callicome1, Phalaenopsis ’Cour¬
chevel*, Phalaenopsis ’Geogre Seurat', Phalaenopsis ’Valse Rose'.
Ph. amabilis (L.) Blume — эпифиты, ареал которых охватывает
Австралию, Новую Гвинею, Индонезию, Филиппины. Листья
мясистые, кожистые. Цветки восковые, до 10 см в диаметре, бе¬
лые, с мелким желтым пятном у основания губы.
Ph. cornu-cervi (Breda) Blume et Rchb.f. — эпифиты, распро¬
странены в Мьянме, Индонезии и Таиланде. Листья тупые, ко¬
жистые, до 20 см в длину, зеленого цвета. Цветки мясистые, вос¬
ковые, желто-зеленые, с коричневыми пятнами и штрихами.
Ph. lueddemanniana Rchb.f. — эпифит. Стебель прямой, покрыт
черепитчато расположенными основаниями листьев, высотой до
15 см. Листья (5—6) овальные или обратнояйцевидные, мяси¬
стые, притупленные, длиной до 25 см. Соцветие дугообразное,
свисающее, кистевидное, часто разветвленное. Представители ви¬
да распространены на Филиппинских островах.
Ph. schilleriana Rchb.f. — эпифиты, произрастающие на Фи¬
липпинских островах. Листья мясистые, до 45 см в длину. Цветок
изысканный, до 7 см в диаметре, окраска от белой до пурпурной.
Губа своеобразной формы, белая или розовая, со штрихами.
425
СПЕЦИАЛЬНАЯ ЧАСТЬ
Для получения семян Phalaenopsis мы проводили искусствен¬
ное опыление. Плод — эллипсоидно-удлиненная ребристая ко¬
робочка, блестящая, желтого цвета. Длина плода 6—7 см, диа¬
метр 1,0—1,5 см. Плодоножка опадает вместе с плодом, а сам
плод созревает в течение 120—150 сут.
Семена Phalaenopsis перед высевом просматривают под мик¬
роскопом для определения плотности высева и выявления щуп¬
лых и деформированных семян. Если у 80—90 % семян имеется
хорошо развитый зародыш, то семена высеивают редко. При бо¬
лее низком проценте семян с зародышем их рассеивают на по¬
верхности среды более плотно. Щуплые и деформированные се¬
мена не высеивают вообще.
Для стерилизации семян используют 10%-й раствор хлорной из¬
вести и 15—30%-й раствор пергидроля. Иногда применяют 0,1 %-й
раствор сулемы, однако при этом всхожесть семян снижается.
Удобнее всего использовать целые, но еще не пожелтевшие плоды.
В этом случае после поверхностной стерилизации плода в спирте
(1 мин) и хлорной извести (15 мин) семена непосредственно из
коробочки высевают на питательную среду, в данном случае — на
модифицированную нами среду Кнудсона. Этот прием значитель¬
но упрощает стерилизацию и дает хорошие результаты.
Прорастание семян Phalaenopsis начинается в среднем через
19—20 сут, в отдельных случаях — через 5—7 сут (табл 4.68). Снача¬
ла изменяется окраска семени от светлой до ярко-зеленой и
формируется протокорм, на поверхности которого в нижней части
появляются ризоиды, а затем образуются ракушкообразные проро¬
стки с 1 листом. После формирования 1—2 листьев появляется
короткий толстый корешок. Высаживают сеянцы Phalaenopsis по¬
сле образования 3—4 листьев и 2—3 корней. Формирование се¬
янцев происходит в среднем через 250 сут.
Характерной особенностью при семенном размножении Pha¬
laenopsis является почкование протокормов с образованием мно¬
гочисленных точек роста. Для получения большего количества
сеянцев необходимо после отделения растений от протокормов
разделить их и снова высадить на питательную среду, на которой
при повторном культивировании из них образуются проростки
(рис. 4.92, см. вклейку). Одно-двукратная пикировка способству¬
ет лучшему развитию сеянцев, которые значительно легче пере¬
носят период адаптации в септических условиях теплиц после
пересадки из колб, так как имеют более мощную корневую сис¬
тему и большую листовую поверхность (Ernst et al., 1990).
426
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.68. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Phalaenopsis, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
Ph. amabilis (L.) Blume
19
130
220
Ph. lueddemanniana Rchb.f.
26
147
534
Ph. schilleriana Rchb.f.
50
162
500
Phalaenopsis ’Antarctic4
20
150
264
Phalaenopsis ’Callicorne4
22
123
260
Phalaenopsis ’Courchevel4
19
229
529
Phalaenopsis ’Fifi‘
23
120
514
Phalaenopsis ’George Seurat4
55
220
560
Phalaenopsis ’Surprise de
Vales4
54
210
482
Подчеркнем, что Phalaenopsis растет медленно и для вегетатив¬
ного размножения требуются многие годы, в связи с чем разра¬
ботка методов клонального размножения имеет большое значение.
Сделано достаточно много попыток для разработки быстрых
и простых методов его массового размножения. Первых успехов
добился G. Kochba (1977) при культивировании апикальных ме¬
ристем побега с 2—4 примордиями, пазушных почек и почек цве¬
тоноса. Экспланты выращивали в жидкой среде Кнопа с 1—2 мг/л
БАП и 0,5—3,0 мг/л НУК в роллере при 160 об/мин в течение ме¬
сяца. Затем их переносили на агаризированную среду, на которой
через 1 мес образовывались протокормы. Для получения нужного
количества протокормов их необходимо делить и повторно куль¬
тивировать. Протокормы, оставленные без пересадки, регенери¬
руют растения, которые через 3—5 мес высаживают в субстрат.
Чрезвычайно редко эксплантами служат латеральные и апи¬
кальные меристемы. В последнем случае приходится использо¬
вать все растение, что совершенно неприемлемо, поэтому для
клонального размножения чаще всего берут спящие почки цве¬
тоносов. Эти почки расположены на цветоносе ниже бутонов и
обычно их потенциальные возможности не используются. Как
правило, они погибают вместе с отцветшим соцветием.
Разработанный нами метод микроразмножения заключался в
следующем: цветоносы срезали, часть цветоноса с бутонами ис¬
пользовали в аранжировке, остальную разрезали так, чтобы каж¬
дый отрезок содержал 1 спящую почку. Обычно на цветоносе (в
зависимости от его длины) расположено 2—4, реже — 6 спящих
427
СПЕЦИАЛЬНАЯ ЧАСТЬ
почек. Части цветоноса с почками тщательно мыли в проточной
воде, затем в воде с моющими средствами и ополаскивали дис¬
тиллированной водой.
Стерилизацию эксплантов проводили в том же режиме, что и
у Cymbidium. Если бактериальная инфекция в процессе культиви¬
рования проявлялась, то материал можно перестерилизовать в 10—
20%-м растворе пероксида водорода в течение 15 мин и промыть
дистиллированной водой. Колбы или пробирки с грибковой ин¬
фекцией подлежат удалению.
После стерилизации части цветоносов с почками обрезали
сверху и снизу так, чтобы их длина была не более 2 см, удаляли
брактеи с почек и помещали на питательную среду строго поляр¬
но, при этом почки должны были быть выше уровня среды.
Культивирование спящих почек Phalaenopsis проводили на пита¬
тельных средах МС, Кнопа, Кнудсона С, Вацина—Вента. Развитие
почек на среде зависит от температуры культивирования: при
температуре воздуха в культуральном помещении 28 °С из почки
образуется вегетативный побег; если же температура будет коле¬
баться в пределах 20—21 °С, то из почки формируется генератив¬
ный побег. Этот фактор необходимо особенно учитывать при мик¬
роразмножении. Через 2—3 недели после размещения на питатель¬
ной среде почки набухают, а еще через 2 недели формируется пер¬
вый лист. В течение последующих 2 недель у основания побега
образуется корень. Через 2 мес с момента культивирования фор¬
мируются нормальные растения, готовые к высадке в субстрат.
Следует отметить еще одну особенность при таком способе раз¬
множения. Экспериментально нами доказано, что при надрезе
почки стерильным скальпелем или препаровальной иглой ее тка¬
ни сначала пролиферируют многочисленные протокормы, а за¬
тем и побеги. Протокормы отделяют для дальнейшего субкульти¬
вирования, а потом — для получения побегов, их размножения и
укоренения. Для таких протокормов необходимым условием яв¬
ляется наличие цитокининов и активированного угля в питатель¬
ной среде (табл. 4.69).
Как показали наши исследования, полученные in vitro сеянцы
и растения-регенеранты можно использовать как экспланты для
последующего микроразмножения; эксплантами служат высечки
из листьев молодых побегов. При таком способе размножения не
только исчезает необходимость в дополнительной стерилизации,
но и увеличивается коэффициент размножения.
428
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.69. Состав питательных сред, используемых
для микроразмножения Phalaenopsis, мг/л
Компонент
Среда
Мурашиге—
Скуга
Вацина—
Вента
Кнудсона
Кнопа
NH4NO3
1650,0
KN03
1900,0
525,0
—
125,0
СаС12 • Н20
440,0
—
—
—
MgS04 • 7Н20
370,0
250,0
250,0
125,0
КН2Р04
170,0
250,0
250,0
125,0
1Ма2ЭДТА
37,3
—
37,5
—
FeS04 • 7Н20
27,8
—
25,0
—
Н3ВО3
6,2
—
—
—
Са3(Р04)2
—
200,0
1000,0
—
MnS04 • 4Н20
22,3
7,5
7,5
—
ZnS04 • 7Н20
8,6
—
—
0,033
KI
0,83
—
—
—
Na,Mo04 • 2Н20
0,25
—
—
—
CuS04 • 5Н20
0,025
—
—
0,04
СоС12 • 6Н20
0,025
—
—
—
(NH4)2so4
—
500,0
500,0
—
Ca(NO,)2 * 4Н20
—
—
—
500,0
М0О3
—
—
—
0,016
Fe-цитрат
—
—
—
0,016
Глицин
2,0
—
—
—
Эдам и н
1000,0
—
—
—
Мезо-инозит
100,0
—
100,0
100,0
Никотиновая кислота
0,5
—
—
—
Пиридоксин
0,5
—
—
—
Тиамин
0,1
—
0,4
0,4
Транс-коричная кислота
—
—
—
14,8
Изолейцин
—
—
—
13,2
БАП
—
—
—
0,2
Сахароза
30 000,0
20 000,0
20 000,0
20 000,0
pH
5,5
5,6
5,5
5,5
В ламинарном боксе из молодых листьев вырезают сегменты
размером 1 х 1 см и размещают их на одной из указанных в
табл. 4.69 сред. Через 2,5—3 недели на сегментах листьев форми¬
руются протокормы, которые отделяют и субкультивируют. На
среде Кнудсона или Кнопа из протокормов образуются нормаль¬
ные растения (Буюн и др., 1993).
Следует отметить, что изолированные ткани Phalaenopsis со¬
держат фенольные соединения, которые проникают в среду, вы¬
429
СПЕЦИАЛЬНАЯ ЧАСТЬ
зывая почернение и отмирание ткани. Поэтому многие авторы
советуют пассивировать культуру каждые 10 сут. Предотвратить
частые пересадки помогает добавление к среде активированного
угля (1—2 г/л), который адсорбирует токсичные выделения. Кроме
того, листья не следует разрезать на сегменты, а осторожно от¬
рывать их от стебля для уменьшения раневой поверхности и це¬
лыми размещать на среде.
Для индукции протокормообразования к среде МС добавляют
2 мг/л зеатина и 10 мг/л аденина. Формирование протокормов у
эксплантов листьев происходит довольно медленно — в течение
2—4 мес. В дальнейшем на протокормах образуются многочис¬
ленные адвентивные побеги, которые отделяют и укореняют на среде
с добавлением 0,1 мг/л кинетина и 1 мг/л ИУК.
Каждый протокорм, адвентивная почка и побег, благодаря спо¬
собности к регенерации, служит исходным материалом для даль¬
нейшего клонального размножения. Этим методом можно обеспе¬
чить получение большого количества растений (Чудовская и др.,
1993).
Сегменты листьев в качестве эксплантов использовали и мно¬
гие другие исследователи. При культивировании сегментов ли¬
стьев (8—10 мм) сеянцев и взрослых растений на твердой среде
МС установлено, что способность к прото кормообразован и ю бы¬
ла наиболее высокой у сегментов сеянцев. Кроме того, прокси¬
мальные ткани листьев образуют протокормы легче, чем дисталь¬
ные. Протокормы формировались из эпидермального слоя кле¬
ток на среде с 10 мг/л кинетина и 10 % кокосового молока или
яблочного сока (Intuwong et al., 1974; Tanaka et al., 1975, 1977).
Некоторые авторы также вычленяли покоящиеся почки и
культивировали их на среде Кнудсона с 10 % березового сока и
0,3 мг/л НУК в условиях темноты. Через 2 мес формировались
растения с корнями. Сегменты листьев, корней и стеблей выра¬
щивали на той же среде, но с 2 мг/л БАП и 0,3 мг/л НУК. Через
8 недель почти все экспланты образовали протокормы, а потом и
растения, которые опять размножали по предыдущей схеме (Pieper
et al., 1976). Аналогичные результаты описаны и другими автора¬
ми (Sagawa, 1961; Scully, 1966; Tin-Yan et al., 1971; Hackett et al.,
1972; Kukulczanka et al., 1984; Tanaka, 1987; Chen et al., 1990;
Smeltz, 1995).
Для получения побегов Phalaenopsis часто используют пита¬
тельные среды с различными дополнительными компонентами.
Так, отрезки цветоносов с верхней почкой культивировали на
430
Г JIА Б А 4. Методы размножения тропических и субтропических растений
твердой среде МС с 2 г/л дрожжевого экстракта, 13 мг/л изолей¬
цина и 100 мг/л /я/)а«с-коричной кислоты. Почки нижней части
помещали в жидкую среду МС с 2 г/л дрожжевого экстракта,
0,5 мг/л НУК и 2 мг/л БАП. В первом случае чаще образовыва¬
лись растения, во втором — протокормы, которые на твердой
среде МС с 2 г/л пептона и 0,5 мг/л НУК формировали растения
(Arditti et al., 1977; Griesbach, 1983).
Побеги и протокормы Phalaenopsis получены также на среде
Вацина—Вента с ферулловой кислотой и 20 % кокосового молока
при pH 5,3. Добавление активированного угля стимулировало
образование побегов. Следует отметить, что 50 % почек форми¬
ровали побеги в условиях длинного дня (Reisinger et al., 1976;
Flamee et al., 1977; Tanaka et al., 1988).
Довольно часто для размножения Phalaenopsis используют ко¬
косовое молоко (10—20 %) в сочетании с цитокининами. При
культивировании почек цветоноса на среде Вацина—Вента с
15 % кокосового молока и 5—10 мг/л ТДЗ и БАП были получены
придаточные побеги, причем ТДЗ оказался гораздо эффективнее
БАП. Укоренение побегов осуществляли на среде без гормонов
(Tram, 1974; Chen, 1995).
Необходимо подчеркнуть, что метод культивирования лате¬
ральных почек цветоноса Phalaenopsis известен давно и модифи¬
цирован во многих работах. Однако культивирование таких по¬
чек дает большой процент неразвивающихся эксплантов или из
каждой почки формируется только 1 побег. В наших эксперимен¬
тах мы добивались получения протокормов и растений при ране¬
нии почек.
Интересные исследования проведены коллективом авторов по
изучению влияния БА и температуры культивирования на обра¬
зование вегетативных побегов. Латеральные почки цветоноса
Ph. amabilis без брактей (секция 1 см в длину) размещали верти¬
кально в питательной среде Вацина—Вента с кокосовым молоком
(20 %) и БА (2,5 мг/л). Экспланты выращивали при температуре
20, 25 и 28 °С. Кроме того, все почки были условно разделены на
4 секции (табл. 4.70) Установлено, что наибольший процент не-
развившихся почек имели верхние секции. Почки, растущие при
20 °С (как правило, почки нижних секций), давали чаще всего
репродуктивные побеги. При 25—28 °С побеги были вегетатив¬
ными. При добавлении в среду 2,5—5,0 мг/л БА почки всех сек¬
ций формировали вегетативные побеги, однако концентрация
2,5 мг/л является оптимальной для развития растений. При 20 °С
431
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.70. Влияние температуры на морфогенез латеральных почек
соцветия Phalaenopsis amabilis в культуре in vitro
Номер
секции
Образовавшиеся структуры, % общего количества
Вегетативные
побеги
Репродуктивные
побеги
Неразвившиеся
экспланты
1
20
20 °С
80
2
—
50
50
3
60
30
10
4
80
—
20
1
25 °С
40
60
2
10
50
40
3
70
30
—
4
70
30
—
1
10
28 °С
90
2
60
—
40
3
90
—
10
4
100
—
—
и 2,5 мг/л БА положительные результаты получены для всех сек¬
ций, кроме первой. В то же время совместное действие таких фак¬
торов, как выращивание при 28 °С с 2,5 мг/л БА, дает наиболее оп¬
тимальный результат для развития вегетативных почек (Tanaka et
al., 1978).
Еще один из наиболее изученных и модифицированных ме¬
тодов микроразмножения Phalaenopsis — использование различ¬
ных частей сеянцев и растений-регенерантов, полученных in vitro.
Так, кончики корня сеянца Phalaenopsis 3 мм в длину культиви¬
ровали на среде МС. Через 260—270 сут сначала регенерировал
каллус, а уже потом из его паренхимных клеток формировались
протокормы. Они были отделены от экспланта и на среде с ИУК
образовывали растения. К недостаткам такого размножения сле¬
дует отнести очень медленный рост всех культур.
Участки самых молодых листьев 5—6-летних растений Ph. amabilis
культивировали на среде МС с 1 мг/л ИУК, 10 мг/л аденина и БАП.
Только у одного сегмента через 135 сут наблюдали формирование
протокормов, все остальные темнели и погибали. В дальнейшем про¬
токормы на среде Кнудсона с 2 г/л пептона образовывали растения.
432
ГЛАВА 4. Методы размножения тропических и субтропических растений
Растения-регенеранты Phalaenopsis также использовали как
источник вторичных эксплантов. У растений, образовавшихся из
почек соцветий, вычленяли сегменты листьев и выращивали на
средах Вацина—Вента и МС с 20 % кокосового молока и фито¬
гормонами. Регенерация протокормов была отмечена только на
твердой среде МС с 1 мг/л ИУК, 10 мг/л аденина и 10 мг/л БА.
Эксплантами для микроразмножения служили и листовые
сегменты сеянцев Phalaenopsis, которые вычленяли из апикаль¬
ной, средней и базальной частей. Также использовали листья
очень молодых сеянцев и достаточно взрослых растений. Пока¬
зано, что формирование протокормов чаще всего происходит на
базальной части листовой пластинки, т. е. проксимальные ткани
листа регенерируют протокормы более свободно, чем дистальные.
Кроме того, способность дифференцировать протокормы была зна¬
чительно выше у сегментов молодых листьев, чем у старых. Морфо¬
логическими исследованиями было установлено также, что форми¬
рование протокормов происходит в основном из эпидермальных
клеток эксплантов. Чаще всего процесс протокормообразования
осуществлялся на среде Кнудсона с витаминами, 5 мг/л НУК,
10 мг/л кинетина, 10 % кокосового молока и 3 % сахарозы (Tanaka
et al., 1975, 1976, 1985).
Резюмируя изложенное выше, приводим табл. 4.71 с пропи¬
сями сред, рекомендуемые авторами для разных этапов микро¬
размножения Phalaenopsis.
В литературе встречается описание оригинального метода по¬
лучения протокормов Phalaenopsis. Для этого апикальную почку и
почки цветоносов обрабатывали пастой, содержащей смесь эк¬
зогенных фитогормонов (чаще цитокининов). При обработке апек¬
са побега такой пастой происходило его ветвление. Время нахож¬
дения пасты на побеге и почках — 1 мес.
После обработки почек цветоноса пастой с БАП их вводили в
культуру in vitro, где они формировали не один, а несколько по¬
бегов и протокормы. При этом одна часть протокормов была пол¬
ностью белого цвета, другая — зеленого. Кроме того, такие почки
формировали in vitro не 1, а 2—4 побега. Однако у этого метода есть
один существенный недостаток: очень часто во время цветения
Phalaenopsis у растений, полученных с его помощью, наблюдаются
изменения окраски лепестков и губы, а также рисунка цветка
(Brasch, 1980; Zimmer, 1980).
Латеральные почки цветоносов Phalaenopsis могут быть ис¬
пользованы в качестве черенков для вегетативного размножения.
433
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.71. Состав питательных сред, используемых
для культивирования эксплантов Phalaenopsis, мг/л
Культивирование эксплантов
Компонент
Сегменты
листьев
сеянцев’1
Спящие
почки
цветоносов*2
Сегменты
корней
сеянцев*3
Формирова¬
ние прото¬
кормов*4
Регенера¬
ция расте¬
ний*5
NH4NO3
500,0
1650,0
СаС12 • Н20
—
—
440,0
—
—
MgS04 • 7Н20
250,0
250,0
370,0
250,0
300,0
KN03
525,0
—
1900,0
525,0
630,0
КН,Р04
250,0
250,0
170,0
250,0
300,0
№2ЭДТА
—
—
37,3
—
—
FeS04 • 7Н20
—
—
27,8
—
—
Н3ВО,
—
1,0
6,2
—
—
СоС12 • 6Н20
—
—
0,025
—
—
CuS04 • 5Н20
—
0,03
0,025
—
—
MnS04 • 4Н20
7,5
7,0
22,3
7,5
6,0
KI
—
1,0
0,83
—
—
Na,MoCV 2Н20
—
—
0,25
—
—
ZnS04 • 4Н20
—
1,0
8,6
—
—
(NH4)2S04
500,0
500,0
—
500,0
600,0
Са3(Р04)2
200,0
—
—
200,0
240,0
Fe3(C4H406)3 • 2Н20
28,0
30,0
—
28,0
33,6
Ca(NO)2 • 4Н20
—
500,0
—
—
—
А1С1,
—
0,03
—
—
—
NiCl,
—
0,03
—
—
—
Инозит
—
—
100,0
—
100,0
Глицин
—
—
3,0
—
—
Никотиновая
—
—
1,0
—
0,5
кислота
Пиридоксин
0,5
0,5
Тиамин
—
—
0,1
—
0,5
БАП
—
2,0
10,0
—
5,0
НУК
—
0,3
1,0
—
—
Кокосовое молоко*6
200,0
—
—
—
—
Березовый сок*6
(свежий)
100,0
200,0
Аденин
—
—
10,0
—
—
Активированный
—
—
—
—
1000,0
уголь
Сахароза
20 000,0
20 000,0
30 000,0
20 000,0
20 000,0
Среда Tanaka—Sakanishi (1980). *2 Среда Zimmer—Piper (1978). *3 Среда Ta¬
naka— Sakanishi (1977). *4 Среда Tanaka—Sakanishi (1985). *5 Среда Lin (1986).
*6 В миллилитрах на 1 л.
434
ГЛАВА 4. Методы размножения тропических и субтропических растений
Для этого сегменты цветоноса с одной почкой аккуратно среза¬
ют. Нижний срез (на расстоянии 3 см от почки) должен быть ко¬
сым, верхний — прямым. Срезы посыпают активированным уг¬
лем, с почки удаляют брактею и высаживают в стерильный суб¬
страт (сфагнум, насыщенный раствором удобрений и регуляторами
роста) под углом в 45—60°. Черенки накрывают пластмассовым
сосудом. После образования корней и достижения растениями
высоты 2,5—5,0 см их рассаживают в горшки (Grims, 1987).
Имеются сообщения о выделении протопластов из изолиро¬
ванных культур орхидей. Первые работы в этой области появи¬
лись в конце 1970-х годов (Тео et al., 1978). Они включали разра¬
ботку метода выделения протопластов, подбор веществ и усло¬
вий, необходимых для более полного их получения. Как правило,
для выделения протопластов используют мезофилл листьев сеян¬
цев и растений-регенерантов. Методы выделения протопластов у
Phalaenopsis изложены в работах М. Tanaka (1991) и W. Chen с
соавт. (1995).
Psychopsiella Lindl. Монотипный род.
P. limminghei Lindl. — один из интереснейших видов в кол¬
лекции тропических и субтропических орхидных НБС НАН Ук¬
раины. Ранее этот вид относили к роду Oncidium Sw. и только в
1982 г. его выделили в отдельный род. Это небольшой ползу¬
чий эпифит с ветвящимся корневищем, на котором на рас¬
стоянии 1—2 см друг от друга расположены туберидии. Листья и
туберидии у представителей этого вида плотно прилегают к опо¬
ре. Растения распространены в Бразилии и Венесуэле.
В работе использовали семена репродукции НБС. Их сте¬
рилизовали согласно общеизвестным методикам и высевали на
модифицированную среду КПГУ.
Первые визуальные признаки прорастания были замечены
нами на 32-е сутки с момента высева. Уже через неделю неко¬
торая часть образовавшихся протокормов (до 5 %) имела шаро¬
видную форму (до 0,5 мм в диаметре), их окраска на этот момент
варьировала от беловатой до светло-зеленой. Интересно отме¬
тить, что все сформировавшиеся протокормы, вне зависимости
от того, каким образом располагались семена на поверхности пи¬
тательной среды, были ориентированы базальной частью вниз.
Через 69 сут культивирования на апикальной части наиболее
развитых проростков можно было заметить зачаток первого
листоподобного органа в виде несомкнутого валика. На этой
стадии сеянцы пересаживали на модифицированную среду МС.
435
СПЕЦИАЛЬНАЯ ЧАСТЬ
Еще через месяц отдельные растения имели до 3 листьев. Тело
протокорма сохраняло шаровидную форму, сжатую в дорсовен-
тральном направлении. На базальной, а также на боковых частях
протокорма формировались группы всасывающих волосков, ко¬
торые были хорошо видны.
Спустя 180 сут после высева семян P. limminghei около 20 %
сеянцев имели 4—5 листьев (длиной до 5 мм, шириной до 2 мм).
В это же время мы наблюдали образование и рост первого корня
у протокормов: наибольший имел длину до 2,5 мм, наимень¬
ший — до 0,4 мм. При этом корень формировался не из пазухи
первого листоподобного органа (т. е. корневищной части по¬
бега), как это бывает обычно у сеянцев эпифитных орхидных
(1ваннжов, 2001), а из тела протокорма, диаметр которого в тот
момент составлял 2,2 мм. У сеянцев в возрасте 7,5 мес мы впер¬
вые наблюдали образование плоского округлого туберидия (до
2 мм), который, как правило, представляет собой разросшееся
междоузлие пятого листа с 1—2 настоящими листьями в апи¬
кальной части. После формирования первого туберидия у сеян¬
цев начинают отрастать побеги второго и последующих порядков
(Иванников и др., 2005).
Колбы с сеянцами P. limminghei располагались на верхних
полках стеллажей в культуральной, где было максимальное ос¬
вещение (3000—3500 лк), а температура днем могла достигать
30 °С. Такие условия, по нашему мнению, являлись наилучшими
для растений.
Начальные этапы морфогенеза у большинства сеянцев нор¬
мально протекали на среде МС (рис. 4.93, а, см. вклейку). При
добавлении к основной прописи этой среды гомогената банана
(200 г/л) сеянцы приобретали характерную для генеративно зре¬
лых растений пятнистую окраску листьев. Однако на среде МС
мы наблюдали отдельные экземпляры (5—7 %), развитие кото¬
рых резко отличалось от основной массы сеянцев. Среди них
можно условно выделить две разнонаправленные по характеру
новообразований группы:
• растения первой группы на стадии формирования первых
листоподобных органов прекращали процессы фолиогенеза и об¬
разовывали структуры, сходные по внешнему виду с вторичными
протокормами (до 1 мм), которые были окрашены в светло-жел¬
тые или салатовые тона; количество их постоянно увеличивалось
и в конечном итоге во много раз превысило объем самого первич¬
ного протокорма; к органогенезу эти структуры не приступали;
436
ГЛАВА 4. Методы размножения тропических и субтропических растений
• растения второй группы после образования первых двух
листоподобных органов начинали формировать листья с видоизме¬
ненной листовой пластинкой темно-зеленой окраски (рис. 4.93, б)
и зачатки корней; получить от них растения с нормальной мор¬
фологией нам не удалось, ex situ такие экземпляры нежизнеспо¬
собны.
Средняя масса сеянца, готового к высадке, составляла 311 мг,
масса наибольшего экземпляра — 650 мг. Первые сеянцы P. lim¬
minghei были перенесены в условия ex situ в возрасте 457 сут.
Ювенильные растения высаживались на блоки из коры пробкового
дуба (Quercus suber L.). На этот момент они имели по 2 сформиро¬
вавшихся туберидия (длиной до 7 мм и толщиной 2 мм) и 7—
10 корней. Из пазухи листа в основании туберидия второго порядка
уже начинал развиваться побег третьего порядка (рис. 4.93, в).
Psyhopsis Raf. Род насчитывает всего 5 видов. До 1982 г. их
относили к роду Oncidium Sw. Представители рода распростране¬
ны в Коста-Рике, Панаме, Колумбии, Эквадоре, Перу, Боливии
и Суринаме (Зденек, 2006).
P. kramerianum (Rchb.f.) H.G. Jones произрастает в Коста-
Рике, Панаме, Колумбии, Эквадоре. Растения имеют яйцевидные
псевдоклубни длиной до 4 см, которые несут одиночный жест¬
кий продолговатый, эллиптический лист, покрытый красными
точками. Цветонос многолетний. Одиночные цветки появляются
периодически в течение года.
P. papilio (Lindl.) H.G. Jones внешне очень схож с предыду¬
щим видом. Для размножения в качестве эксплантов использова¬
ли апикальные и спящие почки побегов. Для этого вначале по¬
беги разрезали на отрезки длиной 2 см, содержащие по 1 почке.
Затем из почек вычленяли сегменты размером 2 мм, которые пе¬
реносили на среды МС (жидкую и твердую) и Кнудсона. Регене¬
рация каллуса, а затем и протокормов была наилучшей в жидкой
среде МС с 0,5 мг/л НУК, 0,05 мг/л кинетина, 1 г/л пептона и
10 % томатного сока или гомогената банана. Через 6 мес культи¬
вирования было получено много протокормов. Образование по¬
бегов и их укоренение лучше проходило на твердой среде МС с
томатным соком и гомогенатом банана (Fast, 1973).
В нашем случае при семенном размножении всего 30 % се¬
мян P. kramerianum имели зародыши, а другие были скрученны¬
ми и недоразвитыми. Высев семян, культивирование сеянцев и
растений-регенерантов проводили традиционно. После 4 лет непре¬
рывного культивирования in vitro сеянцев P. kramerianum на среде
437
СПЕЦИАЛЬНАЯ ЧАСТЬ
МС с 4 мг/л аденина и 1 г/л активированного угля нами наблю¬
далось его цветение, причем в одних колбах сеянцы имели только
бутоны, в других — и бутоны, и цветки бледно-зеленого цвета, 2 см
в длину и 1—1,5 см в ширину. Растения с бутонами и цветками
культивировали отдельно, однако они через некоторое время
погибли.
Это очень интересное явление отмечено и в работах некото¬
рых авторов (Arditti, 1994). Они установили, что цветение расте¬
ний in vitro может зависеть от многих факторов, таких, как тем¬
пература, продолжительность светового периода, концентрация
сахарозы, фитогормонов и фосфора в питательной среде. Другие
исследователи (Wang et al., 1993) даже разработали методику
опыления in vitro, однако получить полноценные семена так и не
удалось. В нашем случае цветение сеянцев P. kramerianum в куль¬
туре in vitro, возможно, связано с длительным культивированием
на средах с повышенной концентрацией фитогормонов.
Необходимо все же отметить большую перспективность ис¬
следований, направленных на определение параметров, влияю¬
щих на этот процесс, что даст возможность ускорить и оптими¬
зировать селекцию орхидных.
У P. kramerianum на формирование растений из протокормов
уходит 620 сут. Высадку растений в субстрат осуществляют толь¬
ко через 1—3 года, поскольку образование растений и их укоре¬
нение происходят очень медленно (рис. 4.94). Приемы постасепти¬
ческой адаптации такие же, как и для других эпифитных орхидных.
На первых этапах наилучший субстрат — сфагновый мох, позже —
блок-культура.
Rhynchostylis Blume. Род насчитывает только 3 моноподиаль-
ных эпифитных вида, растущих в Тропической Азии, Индонезии,
на Филиппинских островах. Стебли короткие, мощные. Колонка
широкая, массивная. Их называют еще “орхидея — лисий хвост”.
Цветки яркие, белые или лиловые, с мелкими точками и пряным
ароматом. Размножают вегетативно и в культуре тканей.
Rh. gigantea (Lindl.) Ridl. — эпифит высотой до 20 см. Листья
линейные, очень плотные, длиной до 10 см. Соцветие длиной
35 см, прямое, плотное, многоцветковое. Цветки до 3 см в диа¬
метре, белые с розовыми пятнами. Губа широкая, темно-розово¬
го цвета.
Для микроразмножения представителей этого вида как ис¬
точник эксплантов использовали сеянцы, полученные в условиях
438
ГЛАВА 4. Методы размножения тропических и субтропических растений
Рис. 4.94. Сеянцы Psyhopsis krameria¬
num (Rchb.f.) H.G. Jones, пригодные
к высадке в субстрат
асептической культуры. Стери¬
лизацию семян, введение в
культуру, подбор сред для раз¬
множения и культивирования
эксплантов осуществляли со¬
гласно методу размножения
Cymbidium (Sagawa et al., 1966).
Семена высевали на среды, при¬
меняемые для проращивания
семян Dendrobium и Cattleya. В
качестве эксплантов использо¬
вали сегменты листьев, корней,
побегов сеянцев. К сожалению,
из одного сеянца можно полу¬
чить всего 5 или 6 эксплантов.
В течение первой недели экс¬
планты приобретали зеленую окраску, увеличивались в размерах.
Еще через 2 недели начали образовываться новые ткани. Регене¬
рация протокормов была отмечена только у 1 экспланта из 30. Кал¬
лус имел 10 мм в диаметре и его рост был очень слабым. В даль¬
нейшем из каллуса регенерировали растения (Vajrabhay et al.,
1970; Vij et al., 1984).
Rh. retusa (L.) Bl. — эпифит. Стебель имеет не менее 12 киле¬
видных листьев длиной до 50 м. Соцветие 10—45 см в длину. Цвет¬
ки до 2 см в диаметре, белые, с розовыми штрихами на кончиках
лепестков. Губа длинная, на конце окрашена в темно-розовые тона.
Для ее микроразмножения использовали сегменты (0,5—1,0 см)
молодых листьев 6-летних сеянцев, растущих in vitro. Культивирова¬
ли экспланты на среде Прасада—Митры с витаминами, 300 мг/л
пептона, 1 мг/л НУК и 1 мг/л кинетина. Через 4 недели выращи¬
вания наблюдали регенерацию протокормов из эпидермальных кле¬
ток эксплантов. Размножение протокормов проходило на среде без
фитогормонов в течение 4 недель. Полученные протокормы делили
и субкультивировали на среде с 20 % кокосового молока. Еще через
21 сут из протокормов формировались растения. Весь процесс раз¬
множения с момента введения в культуру и образования укоренен¬
ных растений занимает 10 недель (Vij et al., 1984).
439
СПЕЦИАЛЬНАЯ ЧАСТЬ
В качестве эксплантов можно также использовать сегменты
корней сеянцев Rh. retusa. У 38-недельных сеянцев отрезали сег¬
менты корней длиной до 1 см и помещали на питательную среду
МС с добавлением 2,0 мг/л глицина, 100,0— инозита, 1,0 —
НУК., 1,0 мг/л кинетина. Дифференциация протокормов прохо¬
дила очень медленно, на протяжении 5—6 недель. Полученные
протокормы делили и субкультивировали на среде МС с 1 мг/л
НУК. Органогенез (закладка почек, регенерация листьев и побе¬
гов) проходил в течение еще 12 недель, в результате чего форми¬
ровались нормальные растения (Sood et al., 1986; Vij et al., 1987).
Имеется сообщение о том, что представители Rh. retusa были
размножены с помощью сегментов листьев и корней, которые
выделяли из сеянцев, полученных в культуре in vitro. Формирова¬
ние протокормов проходило на среде Вацина—Вента, модифици¬
рованной добавлением 1,0 мг/л БА, 1,0 — НУК и 200 мг/л гид¬
ролизата казеина. Регенерация растений осуществлялась в тече¬
ние 2 мес на среде МС с 0,5 мг/л БА, 1,0 — НУК, 0,1 мг/л 2,4-Д.
Растения формировались также при добавлении в среду 0,1 мг/л
НУК и 200 мг/л гидролизата казеина (Vij et al., 1984).
Приемы постасептической адаптации такие же, как и для
других эпифитных орхидных. На первых этапах наилучший суб¬
страт — сфагновый мох.
х Renantanda — гибридная форма. Первый гибрид Renantanda
Sanderi (Reпа nthe га imshootiana x Vanda snavis) культивирован в
1935 г. В дальнейшем были получены и другие гибриды.
Для микроразмножения использовали сегменты молодых ли¬
стьев взрослых растений длиной 1—3 мм. Экспланты культиви¬
ровали на среде Вацина—Вента с 200 мл/л кокосового молока
молодых орехов, на которой они образовывали каллус и прото¬
кормы через 10 недель. Следует отметить высокую контамина¬
цию (54 %) в начале культивирования и несколько более низкую
(40 %) после формирования протокормов на этом типе среды.
Регенерация побегов и их укоренение занимает еще 3—4 недели
(Goh et al., 1982).
Эксплантами также были верхушки побегов длиной 2 мм. Их
отрезали, стерилизовали и помещали в жидкую среду Yamada с
200 мл/л кокосового молока, в которой они через 60 сут форми¬
ровали протокормы. Высокий процент протокормообразования
наблюдался на среде Вацина—Вента, модифицированной добав¬
лением 1,75 г/л пептона и 100 мл/л томатного сока. Полученные
протокормы делили и субкультивировали на твердой среде с 7 %
440
ГЛАВА 4. Методы размножения тропических и субтропических растений
агара в течение 8 недель. На этой среде происходило интенсив¬
ное образование побегов и их укоренение (Karim et al., 1992).
Spathoglottis Blume. Род насчитывает свыше 40 наземных ви¬
дов, распространенных в Индии, Юго-Восточной Азии, Китае,
Индонезии, на островах Тихого океана. Название связано с ши¬
рокой губой цветка, свойственной представителям этого рода.
Соцветие имеет 20—35 цветков, больших или маленьких, желтого
или пурпурного цвета.
S. plicata Blume — наземные растения до 1 м в высоту, кото¬
рые иногда называют “орхидеи Соломоновых островов”. Цвето¬
нос до 80 см, несет до 25 цветков белого, розового, сиреневого и
пурпурного оттенков.
Spathoglottis в культуре in vitro может быть размножен с помо¬
щью тех же методик, что и Phalaenopsis (Intuwong et al., 1974) или
x Мокага (Lim-Ho et al., 1984). В литературе имеется сообщение о
микроразмножении Spathoglottis с использованием сеянцев, полу¬
ченных in vitro. Для этого вычленяли сегменты листьев и корней
у 6-недельных сеянцев и размещали их на среде МС, модифици¬
рованной добавлением 6 мг/л НУК, 2,0 — 2,4-Д, 2,0 — кинетина
и 150 мл/л кокосового молока. На этой среде после 5 недель
культивирования происходила дифференциация ткани с образо¬
ванием каллусной массы.
Непрерывный рост каллуса продолжался при перенесении на
свежую среду с изменением концентрации гормональных компо¬
нентов, мг/л: НУК — 6,0, 2,4-Д — 2,0, кинетин — 2,0. После¬
дующее удаление или замена ауксинов, а также варьирование
концентрациями нитратов, гидролизата казеина, смеси амино¬
кислот или цитокининов, кокосового молока не приводили к
инициации побеговых меристем или протокормов, но всегда ин¬
дуцировали активный ризогенез (Bapat et al., 1977).
Stanhopea Frost ex Hook. Род насчитывает около 60 эпифит¬
ных видов, распространенных во влажных тропических лесах
Центральной й Южной Америки.
S. oculata (Lodd.) Lindl. — эпифиты или наземные растения,
ареал которых охватывает Мексику, Гватемалу, Коста-Рику, Бра¬
зилию. Псевдоклубни овальные, образуют группы. Цветонос сви¬
сающий. Цветки до 10 см в диаметре, окрашены в зеленовато¬
пастельные тона, имеют запах ванилина.
S. saccata Batem. распространена от Мексики до Коста-Рики.
Туберидии конусовидной формы, ребристые. Цветки желто-оран-
жевые, с запахом корицы.
441
СПЕЦИАЛЬНАЯ ЧАСТЬ
S. tigrina Batem. ex Lindl. Встречается только в восточной час¬
ти Мексики. Туберидии яйцевидные, с удлиненными бороздами,
образуют плотные группы. Цветки крупные, с сильным арома¬
том, быстро отцветают. Размножают вегетативно делением клона,
семенами и в культуре in vitro.
S. wardii Lodd. ex Lindl. — эпифиты, произрастающие от Ни¬
карагуа до Колумбии и Венесуэлы. Псевдоклубни овальные, яйце¬
видные, ребристые. Листья эллиптические. Цветки до 7 см в диа¬
метре. Веночек окрашен в желтые тона.
Для размножения в культуре in vitro использовали семена ре¬
продукции НБС НАН Украины следующих видов: S. tigrina Batem.
ex Lindl., S. oculata (Lodd.) Lindl., S. saccata Batem., S. wardii Lodd.
ex Lindl. Семена высевали на модифицированную среду Кнудсона
(табл. 4.72).
Таблица 4.72 Продолжительность периода прорастания семян
и развитие сеянцев некоторых видов Stanhopea в культуре in vitro, сут
Вид
Образование
протокормов
Образование
растений
Высадка
в субстрат
St. oculata (Lodd.) Lindl.
54
118
268
St. saccata Batem.
36
127
296
St. tigrina Batem. ex Lindl.
94
155
279
St. wardii Lodd. ex Lindl.
35
129
272
Таблица 4.73. Влияние состава питательной среды на всхожесть,
рост и развитие проростков Stanhopea tigrina в культуре in vitro
Всхо¬
жесть,
%
Интенсивность нарастания
вегетативной массы (за 6 мес)
Количество
Среда
Высота
растений, см
Длина кор¬
ней, СМ
Масса 100
растений, г
растений, при¬
годных к пе¬
ресадке, шт.
сырая
сухая
Кнудсона
Кнудсона + 10 %
кокосового мо¬
12,1
1,8
1,3
1,013
0,091
45
лока
Кнудсона + гумат
калия + пептон +
+ активирован¬
34,4
2,2
1,5
1,484
0,102
130
ный уголь *
100
4,4
4,7
3,619
0,202
430
’ Добавлено 50 мг/л гумата калия, 2 г/л пептона и 1 г/л активированного угля.
442
ГЛАВА 4. Методы размножения тропических и субтропических растений
Среди 4 видов Stanhopea быстрее всех прорастают семена S. sac¬
cata, S. wardii, медленнее — S. tigrina. Всхожесть семян зависит от
сроков их хранения и питательной среды. Позже всех, как прави¬
ло, прорастают семена, которые долго хранились или получены по
делектусному обмену. Наблюдается также зависимость от качества
семян. Сроки образования растений у большинства видов прибли¬
зительно одинаковы — 118—129 сут и только у S. tigrina — 155 сут.
Эта же тенденция выявлена в сроках высадки растений в субстрат:
их можно высаживать ex vitro в возрасте 268—280 сут.
Значительное влияние на всхожесть, энергию прорастания се¬
мян и интенсивность нарастания вегетативной массы у S. tigrina
оказывает состав питательной среды (Кушнир, 1981). На моди¬
фицированной нами среде цикл развития сеянцев ускоряется,
увеличивается количество растений, пригодных к высадке в суб¬
страт (табл. 4.73).
Приемы постасептической адаптации такие же, как и для дру¬
гих эпифитных орхидных. На первых этапах наилучший суб¬
страт — сфагновый мох.
Thunia Blume. Род насчитывает около 10 наземных листопад¬
ных видов, произрастающих в Индии, Мьянме, Азии, Китае. Псев¬
доклубни прямые, цилиндрические, облиственные. Листья заост¬
ренные, серо-зеленые. Соцветие — свисающая кисть. Цветки бе¬
лые, красочные, с приятным запахом. Губа очень красивая, вол¬
нистая по краям, желто-оранжевая в середине. Размножают веге¬
тативно, делением псевдоклубней и в культуре in vitro.
Т. marshalliana Rchb.f. распространена в Мьянме, Таиланде, на
юге Китая и является национальным цветком Мьянмы. Псевдоклуб¬
ни прямые, до 1 м в высоту, облиственные, листопадные. Листья
длиной до 30 см, заостренные. Цветки крупные, белые, с приятным
ароматом (Черевченко и др., 2001). Губа волнистая по краям, с
желтовато-оранжевой серединой.
Для получения семян Т. marshalliana растения искусственно
опыляли в условиях оранжерей. Затем семена стерилизовали и вы¬
севали на питательную среду КПГУ. Они начинали прорастать на
62-е сутки. Еще через 2 недели сформировались первичные прото¬
кормы. Растения образовывались в течение 113 сут. Высадку сеян¬
цев в субстрат проводили через 250 сут с момента высева семян (см.
прил. 1).
Для размножения Т. marshalliana in vitro использовали также
клональное размножение. Туния — листопадное растение с четким
периодом покоя, наступающим после цветения (конец июня —
443
СПЕЦИАЛЬНАЯ ЧАСТЬ
начало июля). В марте начинается отрастание новых побегов, а
старые псевдоклубни постепенно отмирают. Латеральные почки
(12—15 шт.) расположены вдоль всего стебля в пазухах каждого
листа. Однако прорастает, как правило, только базальная почка,
редко — 1—2 верхних, поэтому потенциальные возможности этого
растения для вегетативного размножения не полностью использу¬
ются. В связи с этим нами исследовались возможности увеличения
коэффициента размножения Т. marshalliana, изучался морфогене¬
тический потенциал растения in vitro и его связи с активностью
росторегулирующей системы. Известно, что регенерационная спо¬
собность растений зависит от соотношения эндогенных регулято¬
ров роста — ауксинов и ингибиторов, изменяющегося на протя¬
жении годичного цикла развития растений (Майко, 1980). Для оп¬
ределения оптимальных сроков отбора эксплантов, которыми слу¬
жили латеральные почки стебля, мы исследовали активность фи¬
тогормонального комплекса этих стеблей в разные периоды вегета¬
ции — покоя, начала отрастания новых побегов, активного роста,
бутонизации, цветения, перехода к покою.
Установлено, что в период покоя в растении отсутствовали
ауксины, но преобладали ингибиторы. Перед началом отрастания
молодых побегов активность ауксинов резко повышалась, актив¬
ность ингибиторов — снижалась, что свидетельствует о выходе
растений из периода покоя. В начале периода бутонизации в ста¬
рых побегах снова отмечалось увеличение активности стимулято¬
ров и уменьшение активности ингибиторов. В период цветения
растений наблюдалось вторичное снижение активности ауксинов,
но повышение активности ингибиторов; такое соотношение со¬
хранялось в течение всего периода покоя (Майко и др., 1981).
Параллельно с этими исследованиями изучали регенерацион¬
ную способность эксплантов тунии на разных питательных сре¬
дах. При регулярном отборе эксплантов в разные сроки вегета¬
ции выявлена корреляционная зависимость скорости регенера¬
ции растений и наличия эндогенных регуляторов роста в тканях
растения: чем больше ингибиторов в тканях, тем медленнее реге¬
нерировали растения из почек. Так, в декабре на среде Петру А
растения регенерировали через 105 сут, а экспланты выделяли
большое количество фенолов, вследствие чего среда быстро тем¬
нела, что вызывало необходимость частых пикировок. В период
отрастания новых побегов количество стимуляторов в тканях
увеличивалось, что приводило к усилению регенерационных про¬
цессов в эксплантах и растения образовывались уже через 55 сут.
444
Г Л А Б А 4. Методы размножения тропических и субтропических растений
Поэтому оптимальным для отбора эксплантов является период,
когда рост молодых побегов закончился, но период покоя еще не
наступил (Майко и др., 1981).
Нами также выявлено, что в период покоя регенерационные
процессы быстрее проходили на среде Петру А с 2,5 мг/л кине¬
тина и 4 мг/л ИУК. В последующие периоды роста лучше исполь¬
зовать среду МС. Очевидно, что увеличение эндогенных стимуля¬
торов в тканях эксплантов и их рост уже меньше зависят от эк¬
зогенных регуляторов роста в питательной среде.
В литературных источниках приводятся также результаты кло¬
нального размножения Thunia alba (Lindl.) Rchb.f. в культуре in
vitro. Эксплантами при этом были сегменты цветоноса с почками,
взятые после окончания цветения растения. Их культивировали в
жидкой среде Вацина—Вента с 10 мг/л БА и 15 % кокосового мо¬
лока, в которой они регенерировали протокормы. Растения же по¬
лучали на агаризированной среде того же состава. Для укоренения
растений-регенерантов к среде Вацина—Вента добавляли 5 мг/л
ИМК и 15 % кокосового молока (Singh, Prakash, 1984).
Vanda Jones. Родина — Тропическая Азия. Род насчитывает
около 45 эпифитных или литофильных видов. Высокие монопо-
диальные растения. Стебель цилиндрический, густо покрыт мяси¬
стыми кожистыми листьями. Имеет мощные воздушные корни.
Цветки крупные, ярко окрашенные, ароматные. Форма, окраска,
рисунок губы различны. Размножают семенами и в культуре in
vitro. Используют в экспозициях зимних садов и для среза.
V. teres Lindl. — эпифит, растущий от Гималаев до Мьянмы и
Таиланда. Стебель ветвистый, длиной до 3 м. Соцветие длиной до
30 см, несет 3—6 цветков до 10 см в диаметре, с приятным аро¬
матом. Лепестки белые, розовые, пурпурные. Губа опушена, ры-
же-коричневого цвета, колонка белая.
В асептических условиях можно размножать меристемами ла¬
теральных почек, которые находятся в пазухах листьев. На среде
Вацина—Вента с добавлением эндосперма кокосового ореха че¬
рез 45—60 сут у 63 % эксплантов сформировались протокормы.
Для увеличения количества протокормов их культивировали в
жидкой среде без сахарозы. Морфогенез происходил после суб¬
культивирования на агаризированную среду. В основном разви¬
тие протокормов у видов этого рода происходит по типу, кото¬
рый описан для цимбидиума.
Большими морфогенетическими потенциями обладают листья
сеянцев Vanda. На питательной среде МС в основаниях листьев
445
СПЕЦИАЛЬНАЯ ЧАСТЬ
через 1 мес культивирования образовались зеленые протокормы,
из которых регенерировали многочисленные адвентивные побе¬
ги. За год субкультивирования каждый лист регенерировал до
20—40 побегов с 2—3 листьями и 2 корнями. Их отделяли и вы¬
саживали в субстрат (Arditti, 1977).
V. tricolor Lindl. распространена в лесах Лаоса, Индокитая, на
Филиппинских островах. Стебель высотой до 1 м. Цветки до 9 см
в диаметре, с запахом. Размножают семенами и в культуре тка¬
ней. При семенном размножении V. tricolor в культуре in vitro ис¬
пользовали семена репродукции НБС НАН Украины.
Растения опыляли осенью, в период массового цветения. Се¬
мена созревали около 1 года. При просмотре под микроскопом
установлены их размеры: длина 289,5—316,0 мкм и ширина
79 мкм. Семена сравнительно однородны, около 60 % имеют за¬
родыш. Семена высевали в среду Кнудсона. Первые признаки
прорастания появились через 4 недели (табл. 4.74). Через 2 мес
после высева семена увеличились в длину почти в 4 раза, в ши¬
рину — в 7 раз, причем резкое увеличение в ширину произошло
из-за интенсивного роста зародыша.
На 20-е сутки культивирования сформировавшийся прото¬
корм имеет 200 мкм в длину. В дальнейшем, вследствие апикаль¬
ного роста и дифференциации тканей, протокорм начинает ин¬
тенсивно развиваться и на 5-й месяц выращивания формируется
типичный для орхидных протокорм со своеобразным гребнем.
Форма гребней бывает очень разной. Цитологические исследова¬
ния позволяют определить их как зачатки первого листа. Мери-
стематическая зона имеет вид остроконечного конуса. Интегу-
менты на начальных этапах развития сеянцев отсутствуют.
Первые листья закладываются в виде меристематического ку¬
пола, окутанного валиком, который и является зачатком листа; его
высота варьирует от 0,2 до 1,0 мм. В это время проросток имеет
4—5 мм в длину и на нем уже закладываются пазушные почки.
Таблица 4.74. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов Vanda, сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
V. tricolor Lindl.
79
160
251
V. sanderiana Rchb.f.
79
160
345
V teres Lindl.
89
350
690
446
ГЛАВА 4. Методы размножения тропических и субтропических растений
Наибольшее их количество находится в средней части побега. Три
пазушные почки вверху и 2 внизу имеют вид недифференциро¬
ванной меристемы. В дальнейшем идет интенсивная закладка
примордиев листьев, и проросток растет вверх. Первый корень
закладывается эндогенно. В этот период также формируются па¬
зушные почки в пазухах первого и второго листьев. Большинство
корней появляется в базальной части сеянцев.
На этом этапе развития рост сеянцев становится очень мед¬
ленным, а иногда и совсем останавливается. Это, на наш взгляд,
свидетельствует о том, что для дальнейшего развития сеянцев не¬
обходима среда иного состава. Развитие побегов второго порядка
на среде Кнудсона отмечается очень редко. В то же время на среде
МС почти у 50 % сеянцев появляются дополнительные точки роста,
из которых потом развиваются побеги второго порядка. На этом
этапе отмечено также почкование первичного протокорма, кото¬
рый можно делить и субкультивировать, получая новые прото¬
кормы и побеги. Это, в свою очередь, значительно увеличивает
коэффициент размножения (Лаврентьева та iH., 2004).
Литературных источников, содержащих данные о клональном
размножении V. tricolor, очень мало. Связано это, по нашему мне¬
нию, с тем, что лишь немногие ткани могут быть эксплантами, а
пригодные для этой цели ткани плохо защищены от загрязнения и
требуют очень тщательной стерилизации (Sagawa et al., 1967). На
стебле взрослого растения в пазухах листьев имеются недиффе¬
ренцированные меристематические участки, которые можно ис¬
пользовать как экспланты. Анатомическое строение таких лате¬
ральных меристем не изучено, а сама почка имеет малые разме¬
ры и слабо выражена. В связи с этим чаще всего для изолирова¬
ния эксплантов используют молодые побеги Vanda (Valmayor,
1977; Mathews, 1985).
Технология выделения эксплантов следующая: у молодого
стебля Vanda аккуратно обрывают листья, разрезают его на сег¬
менты с пазухами, потом острым скальпелем вырезают почку с
кусочком ткани и поэтапно тщательно стерилизуют (как Cymbi¬
dium). Затем почку размещают на среде Вацина—Вента с 15 % ко¬
косового молока. Через 2 мес она набухает и приобретает сфериче¬
скую форму. Такую почку аккуратно разбирают на чешуи и остав¬
ляют только апикальную меристему. Все части почки культиви¬
руют в жидкой среде того же состава, но без сахарозы. Регенера¬
ция протокормов протекает очень медленно. Сформировавшиеся
протокормы разрезают на части и субкультивируют на среде с
447
СПЕЦИАЛЬНАЯ ЧАСТЬ
20 % кокосового молока и 10—20 г/л сахарозы. На этой среде из
протокормов образовывались растения (Kunisaki et al., 1972; Тео
et al., 1973).
Для клонального размножения V. tricolor можно использовать
также апикальные и пазушные почки сеянцев. Эти экспланты
помещали в жидкую среду Вацина—Вента с 15 % кокосового мо¬
лока. Дифференциация растений из образовавшихся на данной
среде протокормов происходила на твердой среде того же состава
(Sanguthai et al., 1973; Mathews et al., 1980).
Для размножения в культуре in vitro популярного гибрида
Vanda ’Miss Joaquim' (V. teres x V. hookeriana) в качестве эксплан¬
тов использовали кончики побегов, пазушные почки и сегменты
корней 1,5-летних сеянцев. Для культивирования их размещали
на среде Уайта с 20 % кокосового молока и 2 мг/л 2,4-Д. Сегмен¬
ты корней переносили на среду Уайта с 10 % томатного сока или
100 мг/л ИУК. Пазушные почки формировали побеги на твердой
среде. Следует отметить, что сегменты корней ни протокормов,
ни побегов не формировали (Goh, 1970). Для микроразмножения
Vanda можно также использовать методику размножения Dend¬
robium.
Vanilla Sw. Род насчитывает более 70 видов, распространен¬
ных в тропических зонах всех материков. Наземные растения, эпи¬
фиты или литофиты с лианоподобным стеблем длиной до 30 м.
V. planifolia Andrews — первая американская орхидея, которая
стала известна европейцам. Произрастает в Центральной и Юж¬
ной Америке, Индии, Малайзии, Филиппинах, на о-ве Мадагаскар,
Сейшельских островах и островах Тихого океана. Изначально V. pla¬
nifolia культивировали как пряность. Это одна из немногих орхи¬
дей, продукты переработки которой нашли широкое применение
в кондитерской промышленности. После изобретения искусст¬
венного ванилина площади под этой культурой существенно со¬
кратились. Сегодня основные плантации V. planifolia находятся
на о-ве Мадагаскар. Ваниль выращивают также как экзотическое
комнатное растение. Кроме того, она занесена в фармакопеи мно¬
гих стран мира и является оригинальным украшением ботаниче¬
ских коллекций (Черевченко и др., 2001).
V. planifolia — эпифит с вьющимся моноподиальным побегом,
достигающим 10—15 м в высоту. Листья мясистые, вытянутые, до
20 см в длину. Каждое междоузлие несет воздушные корни.
Цветков в соцветии не более 10, зеленовато-желтого цвета. Цве¬
тет в течение 7—10 сут, в природе опыляется колибри или пче¬
448
ГЛАВА 4. Методы размножения тропических и субтропических растений
лами. Плоды ванили (или “бобы ванили”) сочные, цилиндриче¬
ской формы, длиной до 20 см и толщиной до 1,5 см.
Это интересное растение подвержено очень многим заболева¬
ниям, в первую очередь гнили корневой системы, вызываемой
различными возбудителями, которые находятся в почве и в тече¬
ние многих лет могут инфицировать растения. Кроме того, подоб¬
ного рода заболевания передаются при черенковании, что только
усугубляет положение. Существующую проблему можно решить дву¬
мя способами:
• с помощью современных биотехнологических методов полу¬
чить формы, устойчивые к данному патогену;
• методом культуры in vitro размножить культурные формы
ванили плосколистной.
Для исследований мы использовали как семена, так и лате¬
ральные почки, взятые от генеративных растений, культивируе¬
мых в условиях оранжерей НБС НАН Украины. Первичный ма¬
териал Vanilla был получен из ГБС РАН (Москва) в 1974 г.
Семена V planifolia культивировали на модифицированной
нами питательной среде КПГУ с агаром, пептоном, гуматом ка¬
лия и активированным углем, экспланты — на твердой среде МС
с различными сочетаниями ауксинов и цитокининов.
Для получения семян V. planifolia была применена методика
опыления цветков орхидных, разработанная в НБС НАН Украи¬
ны. Опыление проводили в утренние часы при солнечной погоде.
Опылять следует цветок, находящийся у основания соцветия. Это
дает возможность определить точный срок созревания плода.
Семена V. planifolia начали прорастать через 3 недели после
высева, причем всхожесть составила 100 %. Отличительная черта
орхидных — способность формировать на ранних этапах онтоге¬
неза специфические структуры, так называемые протокормы (как
in situ, так и in vitro). Однако в асептической культуре под влия¬
нием различных регуляторов роста и прочих компонентов пита¬
тельной среды могут образовываться вторичные протокормы.
Характерными особенностями семян V. planifolia являются боль¬
шие размеры, округлая форма и утрата семенем высокоспециали¬
зированной пленчатой оболочки, которая характерна для подав¬
ляющего большинства орхидных. В связи с этим прорастание и
образование протокормов полностью зависят от состава пита¬
тельной среды. В результате проведенных нами исследований по¬
добран состав питательной среды для проращивания семян ор¬
хидных, который способствовал сокращению сроков прорастания
449
СПЕЦИАЛЬНАЯ ЧАСТЬ
семян и более быстрому развитию сеянцев. На среде такого со¬
става образование первичных протокормов происходило в тече¬
ние 3-й недели культивирования. В последующие 2 недели фор¬
мировались первые листоподобные органы. Корни образовыва¬
лись на 7-й неделе культивирования. Через 8 недель выращива¬
ния были получены хорошо развитые сеянцы с 3—4 листьями и
2—3 корнями.
Для массового размножения V. planifolia использовали два
способа. Первый состоял в том, что полученные первичные про¬
токормы делили на 2—3 сегмента, каждый из которых субкульти¬
вировали на среде Кнудсона С с 2 мг/л аденина. При этом нами
была получена масса вторичных протокормов. Ювенильные рас¬
тения V. planifolia также можно успешно размножать с помощью
микрочеренкования (рис. 4.95, см. вклейку). Для этого побеги
разрезали на части, каждая из которых содержала 1 пазушную
почку. Через 50—60 сут культивирования формировались расте¬
ния, пригодные для высадки в субстрат. Кроме того, показано,
что для увеличения коэффициента размножения сеянцы, получен¬
ные in vitro, можно использовать как вторичные экспланты. В асеп¬
тических условиях сеянцы разделяли на части — листья, корни, по¬
беги. На питательной среде Кнудсона С с аденином базальные час¬
ти листьев формировали протокормы, а потом и растения. Части
стебля, помещенные на такую же питательную среду, регенери¬
ровали полноценные растения. Получить органогенез на экс-
плантах корней сеянцев не удалось.
Для клонального размножения V. planifolia эксплантами слу¬
жили части побегов взрослых растений с латеральными почками.
На среде МС с 4 мг/г аденина они, минуя стадию регенерации
протокормов, сразу формировали растения. Укоренение сеянцев
и растений-регенерантов происходило на среде МС с 1 мг/л
ИМК.
Для семенного размножения V. planifolia в культуре in vitro ис¬
пользовали традиционный способ высева семян. Во-первых, да¬
вали плоду полностью созреть. После созревания плод растрес¬
кивался (как это и происходит в природе), однако при этом часть
семян может быть потеряна. Стерилизацию и высев семян про¬
водили в асептических условиях.
Чаще всего для получения сеянцев многих видов орхидных
используют различные модификации сред Кнудсона, МС, ЛС (Аг-
ditti, 1977; Черевченко и др., 1986; Zhuping et al., 1987). Как пока¬
зали результаты исследований, разработанная нами модификация
450
ГЛАВА 4. Методы размножения тропических и субтропических растений
среды Кнудсона С является наиболее оптимальной для получе¬
ния не только сеянцев V. planifolia, но и других видов орхидных.
При наличии физиологически активных веществ гумусовой при¬
роды и пептона сеянцы более полно используют элементы мине¬
рального питания, в результате чего лучше развивается ассими¬
лирующая поверхность листьев и активизируются корнеобразова¬
тельные процессы. Добавление активированного угля обес¬
печивает затемнение среды для нормального развития корней, а
адсорбирующие свойства угля способствуют равномерному рас¬
пределению питательных элементов в среде и удалению продук¬
тов метаболизма развивающихся растений. При добавлении к
среде аденина более интенсивно формируются протокормы.
При клональном размножении V. planifolia интактные (лате¬
ральные) почки генеративных растений культивировали на пита¬
тельной среде МС с 2 мг/г аденина. Некоторые авторы культиви¬
ровали такие же экспланты на среде JIC (Philip et al., 1986), другие
получали побеги на среде Кнудсона С. В наших экспериментах
образование множества вторичных протокормов побегов наблю¬
далось на среде МС с 4 мг/л аденина. В то же время другие ис¬
следователи для получения побегов V. planifolia применяли среду,
используемую для культивирования кончиков листьев Cattleya.
Отдельные работы посвящены изучению возможности культиви¬
рования кончиков корней взрослых растений V. planifolia. Сег¬
менты корней культивировали на бумажных мостиках в жидкой
среде МС. После 3 мес роста их переносили на твердую среду
МС с 2 мг/л ИУК и 0,2 мг/л кинетина, на которой они образо¬
вывали много протокормов и побегов. Нам, к сожалению, не
удалось воспроизвести эти результаты опыта. Латеральные почки
V. planifolia, по нашим наблюдениям, очень толерантны к изме¬
нению концентрации и комбинации веществ в питательной сре¬
де. Так, для инициации первичных протокормов более приемле¬
мо наличие в питательной среде 30 г/л сахарозы, но для образо¬
вания адвентивных побегов и корней лучше применять среды с
15 г/л сахарозы. Среду Кнудсона С, по нашему мнению, можно
использовать для первичного этапа введения эксплантов V. plani¬
folia в культуру in vitro, однако в дальнейшем их следует перено¬
сить на среду МС.
Различные комбинации и концентрации цитокининов и аук¬
синов в питательной среде для культивирования эксплантов при¬
меняли многие авторы. Наши исследования показали, что ис¬
пользование ауксинов не вызывает индукцию протокормов или
451
СПЕЦИАЛЬНАЯ ЧАСТЬ
побегов у латеральных почек V. planifolia, но способствует обра¬
зованию побегов из протокормов и их укоренению. Кроме того,
добавление к питательной среде 2 мг/л аденина вызывало массо¬
вую индукцию вторичных протокормов, а затем и побегов. Реге¬
нерация корней и формирование побегов было оптимальным на
среде МС с 0,1 мг/л ИМК. Аналогичные результаты зафиксиро¬
ваны и при культивировании in vitro других видов ванили.
В результате проведенных нами исследований был получен
оздоровленный посадочный материал V. planifolia, который в даль¬
нейшем использовали как для формирования экспозиций НБС
НАН Украины, так и для делектусного обмена.
Для быстрого клонального размножения V. planifolia приме¬
няли кончики воздушных корней взрослых растений. Их культи¬
вировали в жидкой питательной среде МС с ИУК и кинетином.
Через некоторое время в культуре начинался лизис корневого
чехлика. Затем покоящиеся клетки корня делились и образовы¬
вали меристемоидные зоны, которые дифференцировались в за¬
чатки побеговых меристем. Через 3 мес культивирования экс¬
плантов на них образовывались многочисленные побеги с листья¬
ми. Корни закладывались эндогенно у основания побегов (Philip et
al., 1986, 1988).
Очень часто для микроразмножения V. planifolia используют
отрезки стеблей молодых побегов с пазушными почками. На сре¬
де МС с 1 мг/л ИУК и 3 мг/л БАП они образуют побеги, кото¬
рые служат вторичными эксплантами. Для укоренения побегов
использовали 1/2 концентрации среды МС с 0,5 мг/л ИУК и
15 г/л сахарозы (Cervera, 1981; Kononowicz et al., 1984; Перевалов
и др., 1997).
Многие работы посвящены изучению влияния регуляторов
роста и сахарозы на развитие изолированных эксплантов V. plani¬
folia в культуре in vitro. В экспериментах исследовались соотно¬
шения БА, 2,4-Д, ИУК, НУК, кинетина, кокосового молока и их
концентраций на регенерацию каллуса, протокормов и побегов.
Основой была среда JIC. Установлено, что при наличии в среде
0,2 мг/л 2,4-Д и 0,1 мг/л БА чаще всего наблюдалась регенерация
каллуса. При добавлении 0,5 мг/л БА, 0,5 мг/л кинетина и 15 %
кокосового молока, как правило, происходило образование сна¬
чала большого количества протокормов, а потом и побегов. На¬
личие в среде 0,2 мг/л НУК и ИУК способствовало образованию
корней. Необходимо отметить, что концентрация сахарозы 15 г/л
более благоприятна для регенерации каллуса и протокормов, а
452
ГЛАВА 4. Методы размножения тропических и субтропических растений
30 г/л — для регенерации побегов (Philip, 1986; Gu et al., 1987;
Zhuping et al., 1987).
V. walkeriae Wight, размножена in vitro стеблевыми отрезками с
пазушными почками. Побеги регенерировали на среде МС с
1 мг/л БА, 0,5 мг/л кинетина и 1 г/л гидролизата казеина. Для
укоренения полученных побегов использовали 1/2 концентрации
среды МС с 0,5 мг/л ИМК или ИУК и 30 г/л сахарозы. Расте-
ния-регенеранты в дальнейшем служили вторичными экспланта¬
ми (Agrawal et al., 1992).
Побеги V. barbellata Rchb.f. получены при культивировании
сегментов взрослых растений на среде Гамборга В5 с 0,1 мг/л ки¬
нетина и 0,5 мг/л 2,4-Д.
Каллус образовывался на среде с 0,5 мг/л 2,4-Д и 4 мг/л глу¬
тамина на эксплантах сформированных ранее побегов. Установ¬
лено, что глутамин стимулировал корнеобразование и увеличивал
количество корней (Singh, 1984).
Таким образом, используя перечисленные выше методы мик¬
роразмножения, можно с успехом культивировать многие виды
Vanilla.
х Vascostylis, х Neostylis, х Ascofinetia размножали с помощью
отрезков молодых соцветий, так как эти гибриды относятся к рас¬
тениям с моноподиальным типом ветвления побеговой системы,
поэтому использовать части растения, не повредив его, нельзя.
Молодые соцветия в различной стадии развития отделяли от
побегов и стерилизовали. Затем цветочные брактеи удаляли, опять
стерилизовали и промывали 3 раза в дистиллированной воде. От¬
резки соцветия делили на сегменты длиной 1,0—1,5, 3,0 и 3,5 см.
Все экспланты культивировали в жидкой среде Вацина—Вента с
кокосовым молоком (20 %) и сахарозой, используя роллер. Кроме
того, к средам добавляли 20 г/л сахарозы, 100 мл/л экстракта кар¬
тофеля, 100 г/л гомогената зеленых бананов.
После 2 мес культивирования на сегментах соцветий длиной
1 см начали формироваться протокормы. На сегментах длиной
3 см протокормов было очень мало. На эксплантах соцветий дли¬
ной 3,5 см образовывались нормальные цветки. Через 3 мес куль¬
тивирования количество регенерировавших протокормов было в
2 раза больше, чем через 1 мес. После 4 мес культивирования про¬
токормы занимали уже весь объем колб и на некоторых из них
формировались листовые структуры. Полученные протокормы раз¬
деляли на части и переносили на твердую среду Вацина—Вента с
кокосовым молоком, картофельным экстрактом и гомогенатом ба¬
453
СПЕЦИАЛЬНАЯ ЧАСТЬ
нана. Через 8 мес культивирования на этой среде были получены
растения высотой 5 см с 3 листьями и 4 корнями.
Использование в качестве эксплантов сегментов молодых со¬
цветий чрезвычайно важно для микроразмножения моноподи-
альных орхидей. Это дает возможность не только размножить
ценную форму, но и сохранить материнское растение.
х Vuylstekeara — сложный межродовой гибрид. В результате
скрещивания Odontoglossum и Miltonia была получена Odontonia, а
в результате скрещивания Odontonia и Miltonia — Vuylstekeara. От
Miltonia она унаследовала большую губу. Декоративность этому
растению придает яркая и своеобразная окраска цветков. Расте¬
ния чувствительны к условиям культивирования в оранжереях
(Os et al., 1990а—с).
Для размножения в культуре in vitro гибридов х Vuylstekeara
применяют методики культивирования Cymbidium (Morel, 1960,
1964, 1974). В литературе имеется сообщение о размножении
Vuylstekeara ’Cambria1 с помощью растений, полученных in vitro.
Из побегов высотой 10—12 см с 2—3 листьями вычленяли па¬
зушные почки и размещали их на среде МС, на которой сначала
дифференцировался каллус. Затем на нем образовывались много¬
численные мелкие протокормы. Регенерация побегов и их укоре¬
нение происходило на среде Кнудсона в течение 10 недель
(Kukulczanka et al., 1989).
Zygopetalum Hook. Род насчитывает около 40 эпифитных и на¬
земных видов, произрастающих в Бразилии, Парагвае, Перу, Бо¬
ливии. Псевдоклубни яйцевидные или овальные. Листья линей¬
ные, заостренные, тонкие. Соцветие — мало- или многоцветко¬
вая кисть. Цветки яркие, мелкие и крупные. Лепестки зеленые, с
коричневыми пятнами. Губа внизу волнистая, с синими или ма¬
линовыми большими пятнами или штрихами.
Z. mackaii Hook. — большие симподиальные растения, эпи¬
фиты и наземные. Распространены в Бразилии и Перу. Псевдо¬
клубни овальные, гладкие, до 10 см в длину, несут 10 листьев.
Соцветие — многоцветковая (до 15 шт.) кисть. Цветки до 6 см в
диаметре, приятно пахнут (Черевченко и др., 2001). Размножают
вегетативно и семенами в культуре in vitro.
Семена Z. mackaii репродукции НБС НАН Украины стерили¬
зовали по разработанной нами методике и высевали на питатель¬
ную среду Кнудсона с 2 г/л пептона, 50 мг/л гумата калия, 1 г/л
активированного угля. Семена начали прорастать и формировать
первичные протокормы через 52 сут после высева. Дальнейшее
454
ГЛАВА 4. Методы размножения тропических и субтропических растений
развитие сеянцев проходило очень медленно, в связи с чем пер¬
вые растения образовывались только через 400 сут. Эта тенден¬
ция сохранялась и в период роста и развития сеянцев, поэтому
высадку растений в субстрат проводили только через 1080 сут по¬
сле высева семян (см. прил. 1).
Piperaceae С.А. Agardh
Травянистые растения (реже кустарники или не¬
большие деревья), вьющиеся или лазящие, наземные и эпифиты,
преимущественно декоративно-лиственные. Листья очередные, ре¬
же супротивные, цельные, толстые, иногда кожистые. Цветки очень
мелкие, без околоцветника и с очень маленькими прицветниками,
обоеполые, реже однополые. В семействе 8 (12) родов и 2500 (1400)
видов (Сааков, 1983).
Peperomia Ruiz et Pav. В роде около 1000 видов, распространен¬
ных в тропической зоне Америки. Многолетние или однолетние рас¬
тения, скальные или эпифиты. Листья цельные, мясистые, зеленые
или пестрые. Цветки мелкие, собраны в цилиндрические соцветия.
P. obtusifolia (L.) A.Dietr. произрастает в тенистых лесах, на ска¬
лах, камнях. Листья мясистые, с округлой верхушкой зеленого или
другого цвета, с рисунком. Известно несколько форм. Размножают
семенами, черенками, делением клона и в культуре тканей.
Для микроразмножения Peperomia в культуре in vitro исполь¬
зуют сегменты листьев, отрезки черешков, цветоножек, сегменты
соцветия, верхушки побега, латеральные почки. Листья имеют
высокий уровень эндогенных регуляторов роста и являются хо¬
рошими эксплантами. Некоторые исследователи отмечают се¬
зонные изменения в регенерационной способности эксплантов
Peperomia. Так, она значительно снижается во время цветения
интактных растений (Appelgren, 1984).
Для культивирования изолированных эксплантов используют
среды Уайта и МС, модифицированные добавлением фитогор¬
монов, витаминов. Для индукции каллусообразования на сегмен¬
тах листьев, цветоножек, черешков у P. obtusifolia к среде МС до¬
бавляли 0,8 мг/л 2,4-Д, 2,0 — БА и 0,1 мг/л ИУК. Через 4 недели
культивирования формировался каллус, который переносили на
среду с 4 мг/л БАП для регенерации адвентивных побегов. Их
укореняли на среде с 2 мг/л ИМК, однако получить неравномер¬
ную окраску листьев (пестролистность) у растений-регенерантов
не удалось. Надо отметить, что с этой проблемой сталкивались
455
СПЕЦИАЛЬНАЯ ЧАСТЬ
многие исследователи (De Donato et al., 1989; Ramachandra et al.,
1989). Метод размножения in vitro пестролистных форм Peperomia
требует дальнейшего усовершенствования.
В других работах эксплантами были сегменты черешка дли¬
ной 5 мм. Их размещали на питательной среде МС с добавлени¬
ем НУК и кинетина. Через 4 недели происходила пролиферация
каллуса. Экспланты с каллусом переносили на среду МС с
80 мг/л аденина, 30 мг/л 2-iP. Через 8 недель образовавшиеся
адвентивные побеги размещали для укоренения на среде МС с
2 мг/л ИУК. Корнеобразование начиналось уже через 2—3 неде¬
ли. К концу 12-й недели культивирования растения высаживали
в вермикулит. Оптимальной средой для размножения являлась
среда МС с 1 мг/л НУК и 10 мг/л кинетина или среда МС с
2 мг/л НУК и 10 мг/л кинетина (Kukulczanka et al., 1977; Henny,
1978; Hui et al., 1981; Ramahcandra et al., 1989).
Proteaceae Juss.
Вечнозеленые растения, многолетние корневищ¬
ные травы, кустарники и полукустарники, реже деревья. Листья
очередные, простые или перисторассеченные, плотные, кожи¬
стые, без прилистников. Цветки обоеполые, реже однополые, со¬
браны в соцветие (кисть, колос, головку или зонтик). В семейст¬
ве 62 рода и 1050 (1400) видов (Сааков, 1983).
Grevillea R.Br. Родина — Австралия. Известно более 230 видов.
Вечнозеленые быстрорастущие деревья. Листья разной формы
и окраски. Цветки собраны в пучки или гроздья. Плод — ко¬
робочка.
G. robusta А.М. Cunn. ex R.Br., Hakea Schrad. — вечнозеленые
высокорослые (до 50 м) деревья, произрастающие в Австралии. Ли¬
стья ажурные, темно-зеленые, крупнозубчатые. Размножают семе¬
нами и черенками. Очень декоративные.
В литературе больше всего данных о размножении in vitro раз¬
личных видов из рода Grevillea. Способы размножения зависели
от используемого материала. Отрезки длиной 10—20 см с апи¬
кальной верхушкой, но без терминальных побегов укореняли при
29 °С с помощью мази, содержащей ИМК. У G. robusta и G. Ьап-
ksii было 100%-е укоренение, у других видов — только 44 %. Се¬
менное размножение in vitro ускоряется частичным удалением се¬
менной кожуры (Marsh, 1975; Steven et al., 1982).
456
ГЛАВА 4. Методы размножения тропических и субтропических растений
При размножении G. banksii и G. rasmarinifolia использовали
различные части сеянцев, полученных in vitro. Сегменты стебля
сеянцев на питательной среде регенерировали пазушные побеги
(Heslehurst, 1977; Ben-Iaacov, 1981).
Сегменты молодых побегов служили эксплантами при микро¬
размножении Leucospermum cordifolium, Telopea speciosissima. На пи¬
тательной среде МС с 10 мг/л БАП пазушные почки прорастали,
формируя один или несколько побегов, которые в дальнейшем ис¬
пользовали как вторичные экспланты (Ben-Iaacov, 1986; Brown et
al., 1986; Seelye et al., 1986).
Из семейства Proteaceae Juss. для изучения возможности раз¬
множения in vitro нами были отобраны растения 9 видов, обла¬
дающие наибольшей декоративностью. В качестве эксплантов ис¬
пользовали сегменты листьев, апексы молодых побегов и пазушные
почки. Экспланты культивировали на питательных средах Пири¬
ка, Кнудсона и МС. Дополнительными компонентами к средам
были 2,4-Д, аденин, НУК и БАП (табл. 4.75).
Данные табл. 4.75 свидетельствуют о том, что добиться про¬
лиферации каллуса из сегментов листьев нам не удалось ни у од¬
ного из видов. Однако при использовании в качестве эксплантов
почек или апекса побега были получены растения таких видов,
как Hakea sulcata, Н. leucoptera, Н. muelleriana, G. robusta.
Побеги регенерировали из пазушных почек на питательной
среде Кнудсона с 2 мг/л аденина. Несколько необычно проходи¬
ло образование побегов у G. robusta. На питательной среде Пирика
Таблица 4.75. Морфогенетическая способность эксплантов
некоторых видов семейства Proteaceae Juss.
Вид
Эксплант
Образовавшиеся
структуры
Banksia serratifolia Salisb.
Dryandra praemorsa L.
Grevillea robusta A.M. Cunn. ex
R.Br.
Hakea hilliona R.Br.
H. leucoptera R.Br.
H. muelleriana R.Br.
H. sulcata R.Br.
Lomatia raxinifolia L.
Stenocarpus sinuatus Endl.
Почки
Листья, почки, апекс
Листья, почки
Почки
»
Я
Я
Каллус, побеги
Побеги
>5
Примечание. (—) — структуры не образовались.
457
СПЕЦИАЛЬНАЯ ЧАСТЬ
с 2,4-Д (0,8 мг/л) из апекса побега вначале формировался белый
плотный каллус. Затем из нижней части каллуса регенерировали
побеги, которые отсаживали на среду с 1 мг/л НУК для укоренения.
Иной тип развития эксплантов наблюдается на среде Кнудсо¬
на с аденином (4 мг/л). Из апекса в течение 1 мес формировался
“пучок” адвентивных побегов. После подрастания их разделяли и
культивировали каждый отдельно на среде с НУК для образова¬
ния корней.
Кроме того, в культуре in vitro каждая пазушная почка G. ro¬
busta на среде МС с 4 мг/л аденина формировала сразу 2—4 но¬
вых побега. Их отсаживали и культивировали отдельно.
Нами были также предприняты попытки использовать для
размножения in vitro семена этого семейства (табл. 4.76), однако
мы убедились в том, что они имеют необычно твердую оболочку,
удалить которую практически не удается. Если семена пытались
разбить, то вместе с кожурой повреждался и зародыш, делая та¬
кие семена непригодными для размножения. Это подтверждает
сведения о том, что семена данного семейства растрескиваются
только во время пожаров, часто свирепствующих в Австралии.
Были проведены исследования, направленные на повышение
приживаемости растений, выращенных in vitro, в теплице. В лабо¬
ратории растения выдерживают при относительно низкой ос¬
вещенности. Перед высадкой их в течение 2 недель желательно
приучать к яркому свету, повышая освещенность до 3000—
10 000 лк. В теплице растения лучше затенять (как папоротники). В
результате 3-летних опытов установлено, что для нормального рос-
Таблица 4.76. Продолжительность периода прорастания семян
и развития сеянцев некоторых видов семейства Proteaceae Juss., сут
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
Banksia collina R.Br.
16
69
93
В. ericifolia Salisb.
16
69
93
В. latifolia R.Br.
17
69
93
В. marginata Cav.
28
58
93
B. notans var. cernoella
17
69
93
B. notans var. nutans
16
63
93
B. repens Labi 11.
16
69
93
B. serrata Salisb.
16
50
93
Hakea laurina R.Br.
16
54
93
Ysopagon dawsonii R. Baker
16
69
93
458
ГЛАВА 4. Методы размножения тропических и субтропических растений
та пересаженных растений Grevillea robusta A.M. Cunn. ex R.Br. в
течение первых 3—4 недель необходима относительная влажность
воздуха не ниже 85 % и температура 15—25 °С. Лучшим признан
песчаный субстрат с объемом пор 25 %. Профилактику грибко¬
вых заболеваний обеспечивают пропаривание субстрата, контей¬
неров и обработка фунгицидом растений сразу после высадки.
Используют побеги без корней, но сформировавшие каллус. При
высадке укорененных черенков большая часть корней поврежда¬
ется и темпы развития растений снижаются (Bowden, 1985).
Rubiaceae Juss.
Вечнозеленые или листопадные деревья, кустарни¬
ки и травянистые растения. В семействе около 500 родов и до
6500 видов. Широко распространены в Западном и Восточном
полушариях, преимущественно в тропических зонах. Среди пред¬
ставителей семейства много полезных, экономически важных пи¬
щевых, лекарственных, красильных и декоративных растений.
Coffea L. Вечнозеленые растения, низкорослые деревья и кус¬
тарники. Листья на побегах расположены супротивно, реже мутов-
чато. Цветки сидячие, пазушные. Распространены в Тропической
Азии и Тропической Африке. В роде около 40 видов.
С. arabica L. — низкорослые деревья с горизонтально попар¬
но расположенными ветвями. Листья супротивные, темно-зеле-
ные, гладкие. Цветки собраны группами, пазушные. В природе
произрастает в Эфиопии, в речных долинах Абиссинского наго¬
рья, поднимаясь на высоту до 2000 м над ур. м. Широко распро¬
странен в культуре, хорошо произрастает в помещении. Для не¬
которых стран имеет исключительное экономическое значение.
Методики клонального размножения этого вида приведены в
ряде работ. Согласно одной из них, стерильную культуру полу¬
чают при культивировании верхушечных или пазушных почек на
1/2 концентрации среды МС с 0,2 мг/л НУК, 3 мг/л БАП. Через
3 недели верхушки побегов образовывают 2—4 листа. Небольшие
побеги с целью сохранения скорости мультипликации субкульти-
вировали на той же среде каждые 4 недели. Для оптимизации
размножения in vitro проведена оценка влияния различных кон¬
центраций БАП, НУК, нитратов, РеЭДТА и активированного
угля. Изучены условия укоренения образующихся in vitro побегов
(Moses et al., 1985).
459
СПЕЦИАЛЬНАЯ ЧАСТЬ
По другой методике экспланты молодых листьев 6-летних де¬
ревьев на модифицированной среде МС, снабженной БА (5 мкМ),
пролиферировали белый рыхлый каллус, на котором образовыва¬
лись соматические зародыши. Эмбриогенная способность каллу¬
са сохранялась более 2 лет (Yasuda et al., 1985).
Rutaceae Lindl.
Распространены в тропиках и субтропиках Запад¬
ного и Восточного полушарий. В семействе 150 родов и 900 (160)
видов.
Citrus L. Распространен в Юго-Восточной Азии, Индонезии.
Род насчитывает около 30 видов сортов и гибридов. Вечнозе¬
леные деревья или кустарники. Плоды съедобные. Побеги часто
с колючками, листья яйцевидные. Цветки белые, с приятным
ароматом.
Процесс клонального размножения этой группы растений
имеет ряд отличительных черт, обусловленных своеобразием их
эмбриогенеза. Для большинства цитрусовых характерна полиэм-
бриония: из клеток нуцеллуса может возникать до 40 эмбриоидов
(Furusato et al., 1957). Можно индуцировать развитие эмбриоидов
и из каллуса, полученного, например, из незрелой семяпочки
(Kochba et al., 1972).
Другим методом размножения является индукция в каллусе
адвентивных почек (Grinblat, 1972). Культура меристемы цитру¬
совых до некоторых пор не имела большого успеха. Т. Murashige
(1972), а позже Л.Н. Шенгелия и соавт. (1988) предложили мето¬
дику асептической прививки стеблевых апексов на молодые под¬
вои для получения безвирусного потомства. В связи с тем что
цитрусовые растения, выращенные в культуре ткани, обычно
очень плохо растут в почве на собственных корнях, регенеранты
прививают на нормальные подвои, что улучшает и ускоряет рост
регенерантов.
С. aurantium L. растет в предгорьях Гималаев. Деревья очень
похожи на апельсин, побеги с колючками. Плоды шаровидные,
красноватые. Основной подвой для культурных форм цитрусо¬
вых.
С. aurantium (Christm.) ’Swingle* размножен in vitro с помощью
пыльников с тетрадами или одноядерными микроспорами. Экс¬
планты культивировали в жидкой среде МС с добавлением
0,5 мг/л БАП и 1 мг/л ИУК в течение 2—3 недель. Затем их пе¬
460
ГЛАВА 4. Методы размножения тропических и субтропических растений
реносили на полутвердые среды. Первичные эмбриоиды форми¬
ровались после растрескивания пыльников, а из гипокотилей и
семядолей пролиферировали многочисленные вторичные эмбри¬
оиды с диплоидным набором хромосом (Chaturvedi et al., 1985;
Sakai et al., 1990).
C. limott (L.) Burm.f. распространен в Северо-Восточной Ин¬
дии. Вечнозеленое дерево. Листья с запахом, побеги с колючка¬
ми. Цветки белые, с запахом. Известно много сортов.
С. reticulata Blanco — мандарин. Найден в культуре в Индоки¬
тае. Широко культивируется в Европе, Азии, Средиземноморье,
на юге США. Вечнозеленое дерево с густой кроной. Цветки бе¬
лые. Известно много сортов.
Для микроразмножения in vitro С. reticulata использовали ну-
целлярные зародыши, полученные в культуре тканей. Из таких
сеянцев вычленяли сегменты листьев эпикотиля, семядолей и
корней. У всех типов эксплантов дифференциация каллуса начи¬
налась через 10 сут. Наиболее оптимальными эксплантами оказа¬
лись сегменты эпикотиля, а наилучшей средой — среда МС, мо¬
дифицированная добавлением 10 мг/л НУК и 0,5 мг/л кинетина.
Для индукции соматического эмбриогенеза наиболее пригодной
была среда МС с 10 мг/л НУК, 1 мг/л кинетина и витаминами,
превышающими в 10 раз концентрации в среде МС. Каллус, ин¬
дуцированный из эпикотиля, превосходил таковой, полученный
из других эксплантов, по количеству культур, в которых был от¬
мечен соматический эмбриогенез (83 %). Большинство соматиче¬
ских зародышей прорастало как обычные зародыши, но только
некоторые из них регенерировали побеги. Через 10 сут после от¬
деления побегов начали образовываться корни. Длина корней на
побегах и их количество зависело от среды культивирования. Ус¬
тановлено, что приживаемость растений in vitro пропорциональна
количеству корней на одном побеге. Разработанный метод мик¬
роразмножения может быть использован для получения генети¬
чески трансформированных растений мандарина (Gill et al., 1995).
С. paradisi Macf. — грейпфрут. В диком виде не найден. Дере¬
вья с красивой кроной, ветви с редкими колючками. Плоды
крупные, желтые, шаровидные. Известны сорта и гибриды.
С. sinensis (L.) Osbeck — апельсин. Родина — Китай. Вечнозе¬
леное дерево высотой до 10 м. Листья зубчатые, зеленые. Цветки
белые, ароматные. Плоды шаровидные, приплюснутые. Не имеет
четкого периода покоя. Размножают черенками, семенами и в
культуре in vitro.
461
СПЕЦИАЛЬНАЯ ЧАСТЬ
Изолированные части нуцеллуса С. sinensis var. mosambii куль¬
тивировали в течение 2 лет на среде МС с добавлением 0,1 мг/л
НУК и 0,5 мг/л БАП, после чего наступало привыкание и для
дальнейшего роста не требовались ауксины и цитокинины. Для
сравнения эндогенного уровня цитокининов у привыкших тка¬
ней и продолжающих расти на среде с гормонами использовали
биотест с каллусом сои. Среди цитокининов преобладали веще¬
ства зеатиновой природы. В нормально растущих тканях их было
в 2 раза больше (Sakai et al., 1990; Tahati et al., 1995).
Сегменты (1,0—1,5 см) 2-недельных сеянцев С. sinensis var.
mosambii, полученных в культуре in vitro, размещали в горизон¬
тальном положении на среде МС. Регенерацию адвентивных по¬
чек на том конце, на котором сделан срез, наблюдали только у
эпикотилей. Добавление к среде 2 мг/л БАП способствовало уве¬
личению количества эксплантов, регенерировавших побеги, и
количества полученных побегов из одного экспланта. В то же
время высокие концентрации БАП приводили к снижению этих
показателей. Гиббереллин в концентрации 0,4 и 0,04 мг/л при
наличии 2 мг/л БАП или без него подавлял регенерацию адвен¬
тивных побегов у обоих типов эксплантов. АБК, добавленная к
среде, также угнетала регенерацию побегов, но в комбинации с
2 мг/л БАП оказывала сильное стимулирующее воздействие, осо¬
бенно в концентрации 0,2 мг/л. Отличительной чертой такого
влияния АБК является регенерация непосредственно из эпидер¬
миса, без формирования каллуса. Эти побеги не укоренялись да¬
же через 8—10 недель культивирования на основной среде, однако
на среде с 0,04 мг/л ГК3 они нормально развивались. R. Maggon и
соавт. (1995) считают, что такая система может быть полезна для
консервации зародышевой плазмы.
Некоторые авторы изучали микроразмножение в культуре соко¬
вых мешочков, выделенных из плодов лимона. Их культивировали
на среде МС, дополненной ИУК, кинетином и лимонной кислотой.
Установлено, что соковые мешочки сами по себе богаты эндоген¬
ными цитокининами и поэтому для цитодифференцировки необхо¬
димо добавление к среде только ауксина. Внесение лимонной кис¬
лоты значительно способствовало органогенезу (Tisserat et al., 1988).
Для микроразмножения часто используют части семядолей и
эпикотиля 1-месячных сеянцев лимона. Экспланты размещают на
среде МС, модифицированной добавлением витаминов, 7,5 мг/л БА,
1 мг/л НУК. Культуры выдерживают в темноте в течение 15 сут,
а затем 145 сут на свету. Побеги укореняют.
462
ГЛАВА 4. Методы размножения тропических и субтропических растений
Пестики с рыльцами С. aurantium, С. paradisi, С. sinensis куль¬
тивировали in vitro для индукции соматического эмбриогенеза.
Экспланты выделяли из цветочных почек и бутонов во время
цветения и культивировали на среде МС с добавлением 30 г/л
сахарозы, 500 мг/л солодового экстракта и 10 мг/л БАП. Через
4 недели от начала культивирования из оснований пестиков
дифференцировался каллус. Эмбриогенез наблюдался через 2—
3 мес. Его индукция проходила в каллусной ткани пестикового
происхождения у всех видов. Лучшие результаты по пролифера¬
ции и росту каллуса, а также регенерации зародышей получены у
С. sinensis, который культивировали на среде с БАП. Соматиче¬
ские зародыши отделяли от каллуса и размещали на среде МС с
500 мг/л солодового экстракта и 0,3 мг/л НУК. На этой же среде
наблюдали и регенерацию растений, которые после подрастания
(2 мес) высаживали в субстрат (Carimi et al., 1995).
У молодых проростков апельсина с семядолями и без них вы¬
членяли отрезки эпикотиля и корня на разном расстоянии от се¬
мядольного узла и размещали на питательной среде МС с 2 мг/л
БАП и НУК. Через 1 мес культивирования образовывались при¬
даточные почки. Наибольшее их количество было на среде с
0,02 мг/л НУК. Экспланты эпикотиля и корня, вычлененные из
участков проростка близ семядольного узла, имели больше почек,
чем экспланты дистальных участков. У эпикотильных эксплантов
почки формировались у среза, обращенного к кончику корня. Экс¬
планты, полученные из проростков с удаленными семядолями,
образовывали меньше почек. Удаление у проростков кончиков
побега и корня не влияло на количество сформировавшихся На
эксплантах почек. Было высказано предположение, что в семядо¬
лях, возможно, содержатся вещества, стимулирующие образова¬
ние почек (Burger et al., 1986).
При размножении апельсина in vitro отмечены морфологиче¬
ские изменения в период развития почек из эксплантов. В начале
развития боковые почки были закрыты несколькими профилла-
ми, покрытыми эпидермальными волосками. По мере роста про-
филлы раскрывались. Добавление к среде 5 мг/л БАП стимули¬
ровало индукцию почек. В дальнейшем в культуре in vitro они
делились и регенерировали каллус (Altman et al., 1978).
463
СПЕЦИАЛЬНАЯ ЧАСТЬ
Santalaceae R.Br.
В состав семейства входит два рода — Osyris L. и
Santalum L.
Santalum L. Родина — Индия. Вечнозеленое дерево 9—10 м
высотой, растущее в сухих листопадных (главным образом тико¬
вых) лесах на высоте до 1200 м над ур. м.
S. album L. культивировали in vitro: части зеленых плодов,
стеблей и эндосперма размещали на среде МС с добавлением
2,4-Д, кинетина и получали каллусную ткань. При переносе ее
на среду с 5 % сахарозы, 1 мг/л НУК и БАП регенерировало
большое количество зародышей. Эти зародыши на среде с 1 мг/л
ИУК, 0,5 мг/л ИМК и ГК3 формировали растения с корнями.
При выращивании сегментов гипокотилей на среде МС с
ауксинами наблюдали регенерацию стеблевых почек. На средах
с НУК, ИМК образование почек было слабым, тогда как на
среде с НУК — интенсивным. На средах с кинетином, зеатином
и аденином регенерировали 8—10 почек, а на среде с БАП —
15—20 почек. Укоренение полученных побегов происходило на
среде с 0,5 мг/л НУК и 5 мг/л ИМК. Растения, которые сфор¬
мировались из зародышей, образовавшихся в каллусе из эндоспер¬
ма, были триплоидными. Для размножения (получения каллуса и
побегов) также пригодны сегменты корней (Bhaskar et al., 1983).
В качестве эксплантов можно использовать и небольшие уча¬
стки стеблей (1,0—1,5 см), полученные из молодых побегов
взрослых растений. Их культивировали на среде МС с регулято¬
рами роста на свету. Установлено, что на эксплантах, содержа¬
щих узловые участки стеблей, на среде с БАП образуются много¬
численные побеги уже через 3 недели культивирования, однако
укоренить такие побеги не удается.
Экспланты стеблей с участками междоузлий на среде с 2,4-Д
и кинетином регенерировали быстрорастущий каллус. При пере¬
носе его на среду с НУК и БАП возникали многочисленные эм¬
бриоиды, которые на среде для регенерации формировали нор¬
мально развитые растения. Некоторые из растений-регенерантов
отличались от исходных растений по энергии роста, морфологи¬
ческим признакам и содержанию хлорофилла (Rao et al., 1984).
464
Рис. 3.4. Вегетативные побеги Phalaenopsis hybr., развившиеся из пазух ниж¬
них брактей цветоноса
Рис. 3.15. Формирование первого корня у проростков Paphiopedilum delenatii
Guill. (а) и Laelia lundii Rchb.f. et Warm. (6)
Рис. 4.1. Cordyline australis
Hook.f.
a — регенерация побегов
в темноте;
б — формирование адвен¬
тивных побегов в каллусе
на свету;
в — растения-
ре генеранты, пригодные
к высадке в субстрат
Рис. 4.2. Cordyline terminalis Kunth.:
a — индукция побегообразования из каллусной ткани в темноте; б —
мультипликация побегообразования на свету; в - адаптированные растения-
регенеранты
Рис. 4.3. Aglaonema commutation Schott:
a ~ растения-регенеранты; б — адаптированные растения-регенеранты
Рис. 4.6. Пролиферация каллуса и образование эмбриоидоподобных структур
(а, лист) и этиолированных побегов (б, стебель) в темноте на сегментах
сеянца Anthurium lucidum Kunth.
Рис. 4.9. Органогенез Anthurium leuconeurum Lem. на свету в культуре in vitro
Рис. 4.10. Постасептическая адаптация растений-регенерантов Anthurium
lucidum Kunth.
Рис. 4.11. Caladium
hortulanum cv. Candidum:
a — образование каллуса
на листовых эксплантах;
б — процессы органоге¬
неза на листовых
эксплантах;
в — растения-регенеран-
ты, пригодные к высадке
в субстрат
Рис. 4.12. Микрочеренкование побегов Dieffenbachia maculata (Lodd.) G.Don
cv. Camilla
Puc. 4.13. Органогенез Dieffenbachia maculata (Lodd.) G.Don cv. Camilla
в культуре in vitro
Рис. 4.15. Растения-регенеранты Dieffenbachia maculata (Lodd.) G.Don
cv. Camilla (а) и Dieffenbachia maculata (Lodd.) G.Don (6)
Рис. 4.17, Philodendron
bipinnatifidum Schott:
a — растения -
регенеранты,
пригодные к высадке
в субстрат;
б— постасептическая
адаптация растений-
регенерантов
на сфагновом мху;
в — хлорофиллде-
фектное растение-
регенерант
Рис. 4.19. Постасептическая адаптация растений-регенерантов Spathiphyllum
blandum cv. Mauna Loa на сфагновом мху
Рис. 4.18. Формирование этиолированных (а, в темноте) и адвентивных (б)
побегов Spathiphyllum blandum cv. Santa Maria
Рис. 4.20. Мультипликация побегов Begonia rex Putz.
Рис. 4.21. Растения-регенеранты Begonia rex Putz., пригодные к высадке
в субстрат
Рис. 4.24. Ювенильные растения Guzjnania monostachia Rusby ex Mez.
Рис. 4.26. Инициация развития пазушных почек на среде Пирика-1 у сеянцев
Tillandsia butzii Mez.
Рис. 4.25. Сеянец Tillandsia argentea Griseb., части которого пригодны для
клонального размножения
Рис. 4.27. Доращивание растений-регенерантов Tillandsia pseudobaileyi
S.Gard. (а), Tillandsia caput-medusae E.Morren (б) и Tillandsia baileyi Lose ex
Smoll. (в) на среде Мураш иге—Скуга перед высадкой в субстрат
Рис. 4.28. Растения-регенеранты Tillandsia baileyi Lose ex Smoll. на блоке из
коры пробкового дуба через 120 сут после высадки из колб
Рис. 4.29. Формиро¬
вание каллусных
масс тканями сеянца
Vriesea splendens
(Brongn.) Lem.
Рис. 4.30. Растения-регенеранты Vriesea saundersii (K.Koch) E.Moreen, при¬
годные к высадке в субстрат
Рис. 4.31. Astrophytum asterias Lem.:
а, б — формирование каллуса (a - первичного морфогенного, б — рыхлого
неморфогенного); в — органогенез в тканях экспланта; г — растения-
регенеранты, пригодные к высадке в субстрат
Рис. 4.32. Astrophytum capricome (D.Dietr.) Britton et Rose:
a — морфогенез в тканях экспланта; б — формирование витрифицированных
растений-регенерантов
Рис. 4.33. Ophiopogon jaburan (Kunth.) Lodd. var. variegates:
a — пролиферация каллуса и начальные процессы органогенеза в темноте;
б — органогенез на свету
Рис. 4.34. Dracaena draco L.:
a — морфогенез в каллусе в темноте; б — органогенез в тканях на свету;
в — формирование эмбриоидоподобных структур на влагалищной части
листьев в темноте; г — дифференциация эмбриоидоподобных структур
на свету; д — растения-регенеранты
Рис. 4.35. Nolina recurvata (Karw.) Hemsl.:
a — формирование этиолированных побегов в темноте; б — развитие расте-
ний-регенерантов на свету; в — растения-регенеранты, пригодные к высадке
в субстрат
Рис. 4.36. Sansevieria cylindrica Boj.:
a — пролиферация первичного каллуса из листовых эксплантов; б — кал-
лусная культура, начальные этапы морфогенеза; в — органогенез, форми¬
рование этиолированных побегов в темноте; г — органогенез на свету;
д — растения-регенеранты, пригодные к высадке в субстрат; е — постасеп-
тическая адаптация растений-регенерантов
Рис. 4.37. Azalea
indica ‘Prof. Walthers’:
a — рост пазушных
побегов; б — растение,
пригодное к микрочерен¬
кованию
Рис. 4.38.
Органогенез
в тканях
Ficus elastica Roxb.
ex Hormen.
Рис. 4.39.
Ррастения -регене-
ранты Ficus elastica
‘Brazil’
Рис. 4.40.
Укоренение расте-
ний-регенерантов
Ficus elastica
var. rubra
Рис. 4.41. Адаптиро¬
ванные растения-
регенеранты
Ficus elastica Roxb.
ex Hormen.
Рис. 4.42. Mws<2 папа Lour.:
а — пробуждение пазушных почек на первичном экспланте; б — адвентив¬
ное побегообразование; в — растения-регенеранты, пригодные к высадке
в субстрат; г — хлорофиллдефектное растение-регенерант
Рис. 4.43. Nepenthes madagascariensis Poir.:
a — формирование in vitro адвентивных побегов; б — растение-регенерант
Рис. 4.45. Сеянцы Nepenthes sp., пригодные к микрочеренкованию
in vitro
Рис. 4.47' Формирование вторичных протокормов и органогенез
сеянцев Angraecum eburneum Bory
Рис. 4.49. Первое цветение сеянцев Angraecum eburneum Bory
Рис. 4.55. Сеянец Cattleya aclandiae Lindl. на блоке из коры амурского
бархата
Рис. 4.57. Сеянцы Cattleya bowringiana Veitch, листовые пластинки которых
использовали для пролиферации протокормов
Рис. 4.59. Cattleyopsis lindenii
(Lindl.) Cgn.:
a — сеянцы, пригодные
к высадке в субстрат;
б — сеянец на коре
пробкового дуба
Рис. 4.67. Растения-
регенеранты Cymbidium hybr.,
пригодные к высадке ex vitro
Рис. 4.69. Сеянцы Dendrobium parishii Rchb.f.:
a — переходящие в стадию покоя in vitro; б — на блоке из коры пробкового
дуба
Рис. 4,71. Laelia lobata (Lindl.) Veitch:
a — протокормы и проростки на стадии формирования 1—2 листоподобных
органов; б — сеянцы
Рис. 4.72. Сеянцы пред¬
ставителей рода Laelia,
пригодные к высадке
в субстрат:
а — L. lundii Rchb.f.
et Warm.;
б — L. mantiqueirae Pabst.
Рис. 4.74. Адаптированные
сеянцы Laelia rubescens
Lindl. (а) и Laelia sincorana
Schltr. (б) на блоках
из сосновой коры
Рис. 4.77. Проростки
и протокормы Odontoglossum
grande Lindl.
Рис. 4.80.
Первое цветение сеянца
Oncidium splendidum
A. Rich, ex Duch.
Рис. 4.81. Сеянцы
представителей
рода Paphiopedilum:
а — P. helenae Aver.;
б — P. lawrenceanum
(Rchb.f.) Pfitz.
Рис. 4.82. Формирование вторичных протокормов проростками Paphiopedilum
callosum (Rchb.f.) Stein
Рис. 4.90. Paphiopedilum delenatii GuilL:
a — формирование вторичных протокормов на среде Мурашиге—Скуга;
б — сеянцы, пригодные к высадке в субстрат
Рис. 4.92. Формирование вторичных протокормов Phalaenopsis amabilis (L.)
Blume
Рис. 4.93. Psychopsiella limminghei Lindl.:
a — сеянцы, пригодные к высадке в субстрат; б — аномальные растения;
в — адаптированный сеянец
Рис. 4.98. Черенок сеянца
Camellia japonica
‘Magnoliae Flora’
на питательной среде
Рис. 4.97. Начало роста побега
Camellia japonica
‘Grandiflora Rosea’
Рис.4.99. Формирование
дополнительных побегов из
пазушной почки на черенках
сеянцев Camellia japonica
‘Magnoliae Flora’
Рис. 4.100. Образование
эмбриоидов Camellia japonica:
а — из тканей семядолей
сеянца ‘Eleanor Franchetti’;
Рис. 4.101. Дифференциация
соматических эмбриоидов
из тканей черенка
семядоли Camellia japonica
‘Anemonaiflora’
Рис. 4.103. Размножение
эмбриоидов
на питательной среде
I
Рис. 4.102. Образование
эмбриоидоподобных структур
(неоморф) из тканей семядо¬
лей Camellia japonica
‘Crandiflora Rosea’
Рис. 4.105. Регенерация каллуса на сегментах листьев взрослых растений
Camellia japonica ‘Grandiflora Rosea’ на питательной среде Мурашиге—Скуга
с 2,4-Д
I
Рис. 4.106. Регенерация
побегов из пазушных почек
Camellia japonica ‘Eleanor
Franchetti’
Рис. 4.107. Развитие спорофитов Adiantum diaphanum Blume
Рис. 4.109. Формирование спорофитов Platycerium elephantotis Schweinf.
Рис. 4.110. Адаптированные растения Platycerium alcicorne (Willemet) Desv.
спустя 2 года после высадки
Рис. 4.111. Формирование гаметофитов представителями рода Blechnum:
а — В. australe L. subsp. auriculatum (Cav.) de la Sota; б — B. gibbum (Labill.)
Mett.
Рис. 5.2. Сеянцы Paphiopedilum delenatii Guill. в субстрате из сфагнового мха
Рис. 5.1. Сеянцы на блоке из коры пробкового дуба:
а — Tillandsia butzii Mez. (Bromeliaceae Juss.); 6 — Cattleyopsis lindenii (Lindl.)
Cgn. (Orchidaceae Juss.)
б — Dendrobium parishii Rchb.f. на блоке из коры пробкового дуба с помощью
пластиковой сетки
Рис. 5.3. Крепление сеянцев:
а — Cattleyopsis lindenii (Lindl.) Cgn. на блоке из коры сосны обыкновенной
с помощью одноразовых резинок;
Рис. 5.4. Адаптация растений-регенерантов Musa папа Lour. (Musaceae Juss.)
в субстрате № 8
ГЛАВА 4. Методы размножения тропических и субтропических растений
Theaceae D.Don
I Вечнозеленые или листопадные деревья и кустар¬
ники. \ Листья простые, без прилистников. Цветки расположены
по одному, пазушные. Распространены в тропиках и субтропи¬
ках, преимущественно в Восточной Азии, некоторые — в уме¬
ренной зоне Северной Америки. Семейство насчитывает 16 (35)
родов и 500 (600) видов.
Camellia L. Вечнозеленые кустарники или небольшие деревья.
Произрастают в тропической и субтропической зонах Юго-
Восточной и Восточной Азии, на островах Японии, полуостровах
Индокитай и Корея, островах Ява, Сулавеси и Филиппинских
острова)(. По данным разных авторов, род насчитывает от 80 до
250 видов (Sealy, 1958; Chang Hung Та, 1984).
С. japonica L. отличается особой декоративностью среди мно¬
жества древесных тропических и субтропических растений защи¬
щенного грунта. Ее ареал охватывает влажные субтропики Юж¬
ного Китая, Северного Вьетнама, Южной Кореи.
История выращивания камелий в Азии насчитывает не одну
сотню лет. Ее культивировали сначала для получения листьев (из
них готовили чай) и цветов, которые высаживали возле культо¬
вых сооружений как декоративное растение. Особенно популяр¬
но это растение в Китае и Японии. В Европу камелия попала бо¬
лее 250 лет назад благодаря расширению торговых связей со
странами Восточной Азии (Chang Hung Та, 1984). Одними из
первых центров интродукции камелии были Италия, Англия и
Франция. В Россию камелию завезли во второй половине XIX в.
(Ратиани, 1956).
Современная коллекция камелий НБС НАН Украины зало¬
жена в 1972—1973 гг. Ее основой стали растения, привезенные из
различных ботанических садов Кавказа (Харченко, 1999).
Созревшие семена Camellia имеют твердую темно-коричневую
оболочку с гладкой, иногда шершавой поверхностью. Семена
С. japonica быстро теряют всхожесть и при семенном размноже¬
нии не сохраняют сортовых свойств (форму и окраску цветков).
Более эффективным способом вегетативного размножения явля¬
ется черенкование (Харченко, 2000, 2001). К недостаткам дан¬
ного способа следует отнести небольшой процент их укоренения.
На процесс укоренения черенков Camellia влияет также и тот
факт, что в данный период развития растения начинают заклады¬
ваться генеративные почки, что, в свою очередь, снижает качество
465
СПЕЦИАЛЬНАЯ ЧАСТЬ
черенков. В результате исследований, проведенных И.И. Харченко
(2003) с разными сортами камелии, разработана технология куль¬
тивирования этих растений в условиях умеренных широт.
Необходимость использования методов культуры in vitro для
размножения С. japonica обусловлена несколькими причинами.
Во-первых, некоторые сорта плохо размножаются вегетативно
вследствие очень низкого процента укоренения черенков. Во-вто¬
рых, некоторые сорта не завязывают семена. Кроме того, мак бы¬
ло сказано выше, семена очень быстро теряют всхожесть и не
передают особенностей конкретной декоративной формы, что
важно при ведении селекционной работы. В-третьих, высажен¬
ные в грунт семена и сформировавшиеся проростки довольно
часто погибают на ранних этапах развития. В связи с изложен¬
ным выше актуальность применения клонального размножения
С. japonica имеет не только научный, но и практический интерес.
Поскольку отечественная литература содержит ограниченные
данные о микроразмножении древесных растений, а сведения о
микроразмножении камелии японской единичные, считаем необ¬
ходимым привести короткий обзор доступной нам зарубежной
литературы по этому вопросу. Заслуживают внимания работы,
посвященные клонированию разных сортов чая — близкого род¬
ственника камелии японской. Так, при микроразмножении чая
сорта Колхида эксплантами служили молодые побеги взрослых
растений с пазушными почками и 4-месячные сеянцы. Эксплан-
ты сеянцев на питательной среде Гамборга В5 без регуляторов
роста образовывали 20 % побегов. Положительное влияние на их
развитие оказывало добавление БАП (2 мг/л), а вот кинетин и
зеатин показывали худшие результаты. Использовано несколько
вариантов питательных сред, однако оптимальной для развития
побегов была среда Гамборга В5 с БАП и ИУК. При добавлении
НУК у основания побегов образовывался каллус, а при культи¬
вировании с гиббереллином побеги имели измененную морфо¬
логию. Для устранения апикального доминирования к среде до¬
бавляли БАП (4 мг/л) и аденин (40 мг/л); образование адвентив¬
ных побегов происходило лишь после третьего пассажа. Укоре¬
нение осуществляли на 1/2 концентрации среды Гамборга В5 с
10 мг/л ИМ К. К недостаткам этого метода следует отнести его
долгосрочность и относительно небольшое количество укоре¬
нившихся черенков (50 %). Однако при культивировании в жид¬
кой среде процент укоренения возрастает до 95 (Кутубидзе и др.,
1988; Вечерина и др., 1990).
466
ГЛАВА 4. Методы размножения тропических и субтропических растений
Первым среди зарубежных исследователей камелии японской
в культуре in vitro был W. Lammert (1950). В дальнейшем разные
этапы метода микроразмножения этой культуры исследовали и
усовершенствовали W. Bennet (1977, 1978), J. Creze (1980), С. Frisch
и N. Camper (1985), A. Samartin и С. Gonsales (1986). Многие мето¬
ды, включающие культуру пыльников, меристем, семядолей, вер¬
хушек! побегов и почек, описаны для культивирования in vitro
разных видов и сортов камелии (Creze et al., 1980; Vieiter et al.,
1992; Redroso et al., 1993; San-Jose et al., 1993; Ballester et al., 1997).
Наиболее часто исследуются С. japonica L., реже С. reticulata Lindl.
и С. sinensis (L.) Kuntze, культивары и сорта.
Так! при микроразмножении Camellia ’Purple Down' эксплан-
тами бри пазушные почки молодых побегов. Для лучшего по¬
бегообразования к среде добавляли НУК, БАП и ГК3. Получен¬
ные побеги разрезали на сегменты. При использовании жидкой
среды количество побегов значительно возрастало (Carlisi et al.,
1986).
Для культивирования в условиях in vitro С. japonica L. cv. Alba
Plena использовали 50-летние деревья, черенки которых поме¬
щали в сосуд для культивирования. Экспланты молодых побегов
размещали на питательной среде WPM с БАП, аденином и ИМК.
Замачивание полученных побегов в растворе ИМК (1 г/л) на
20 мин обеспечивало 76%-е укоренение. При этом обязательным
было выдерживание побегов в темноте в течение 12 сут (Vieiter et
al., 1989).
Не менее интересные данные получены при культивировании
верхушек побегов и узлов асептических сеянцев С. granthamiana
Sealy, С. crapnelliana Tutch. и С. hongkongensis Seem. Из всех экс-
плантов образовались побеги, а некоторые даже регенерировали
каллус. Однако морфогенетические потенции разных по происхож¬
дению эксплантов зависели от генотипа растений. Несколько иные
результаты зафиксированы при культивировании эксплантов взрос¬
лых растений. L. Sin и соавт. (1995) отмечают, что высокая степень
загрязнения таких эксплантов не дает возможность достоверно объ¬
яснить полученные данные. Очевидны только зависимость диф¬
ференциации от возраста экспланта и действия НУК.
Многие исследователи выявили способность ювенильных тка¬
ней сеянцев камелии японской образовывать на питательных
средах эмбриоиды. В связи с этим значительное количество экс¬
периментов было посвящено изучению влияния генотипа расте¬
ний, состава питательных сред, условий культивирования и по¬
467
СПЕЦИАЛЬНАЯ ЧАСТЬ
лучению растений из эмбриоидов (Zhuang et al., 1985; Pedroso et
al., 1993).
Интересные исследования проводили с целью получения оздо¬
ровленного посадочного материала камелии. Для этого примени¬
ли метод микропрививки побегов in vitro. Он состоит в прививке
апикальной почки сортовой камелии на проростки С. janonica.
Почку с помощью парафина, который содержал антисептик и
ИМК, прикрепляли к подвою. Через 2 года культивирования
больше половины растений было освобождено от вирусов (iCreze,
1985). В последние годы с этой целью используют также методы
генетической инженерии (Haldeman, 1995).
Сохранение изолированных тканей, меристем, эмбриоидов и
каллуса в течение достаточно продолжительного срока без суб¬
культивирования всегда было трудной задачей. Поэтому значи¬
тельный интерес вызывают результаты, полученные L. Jaeiro и
соавт. (1996) в эксперименте с изолированными тканями каме¬
лии японской. Разработанный авторами метод даст возможность
создать банк изолированных культур разных видов, сортов и куль-
тиваров этого высокодекоративного растения с целью его интро¬
дукции в разные регионы мира.
Анализ приведенных данных показывает, что наиболее важ¬
ные условия микроразмножения С. japonica — обеспечение сте¬
рильности и оптимальных условий для деления и дифференциа¬
ции исходной ткани.
Согласно литературным сведениям, на данное время сущест¬
вует несколько разных методов микроразмножения С. japonica.
Различаются они лишь состоянием исходных тканей и клеток, ко¬
торые использовались для получения растений. Чаще всего пер¬
вичными эксплантами являются разные части сеянцев. Меристе-
матические клетки этих тканей регенерируют каллус, проходят пер¬
вичную дифференциацию, интенсивный органо- и гистогенез, фор¬
мируют эмбриоиды, почки, побеги и образуют растения.
В то же время необходимо отметить, что литературные сведе¬
ния иногда не полностью отображают сущность метода. Требуют
дальнейшего усовершенствования режим стерилизации первичных
эксплантов и условия их культивирования. Анализ литературных
источников обнаружил также зависимость морфогенеза от типа
экспланта, его возраста и физиологического состояния интактного
растения. Значительное внимание надо уделить подбору опти¬
мальной питательной среды для всех этапов микроразмножения
камелии. Кроме того, в литературе отсутствуют сообщения о куль¬
468
ГЛАВА 4. Методы размножения тропических и субтропических растений
туре in vitro листьев и черенков сеянцев и взрослых растений
С. japonica.
Исходя из этого возникает необходимость в разработке кон¬
кретной биотехнологии данного вида растений. Принимая во вни¬
мание высокую декоративность камелии, возможность примене¬
ния в|фитодизайне, эта задача не только актуальна, но имеет на¬
учными практический интерес.
Первые работы по семенному размножению С. japonica вы¬
полнил W. Lammert (1950, 1958). Потом в исследованиях был
значительный перерыв и только в 1980-х годах они опять активи¬
зировались (Samartin et al., 1984). Изучалось влияние стерилиза¬
ции, состава питательных сред и условий культивирования на
развитце семени.
Нами была исследована возможность семенного и клонального
размножения в асептической культуре некоторых сортов С. japo¬
nica, а именно ’Eleanor Franchetti1, ’Grandiflora Rosea‘, ’Magnoliae
Flora1, ’Anemonaiflora4. При семенном размножении в культуре in
vitro мы использовали семена, собранные в условиях открытого
грунта в г. Сухуми (Грузия) и в оранжереях НБС НАН Украины.
Один из важных этапов размножения — получение стериль¬
ного интактного материала. С этой целью нами был разработан
многоступенчатый режим стерилизации, который не повреждал
ткани, не угнетал рост семени и обеспечивал максимальную сте¬
рильность. Следует отметить, что для размножения использовали
семена без семенной кожуры, так как с ней оно не прорастало.
Семена имели хорошо развитые, большие семядоли и зачаточную
почку длиной 3—4 мм и 2—3 мм шириной.
Для стерилизации семян С. japonica применяли такой режим:
семена клали в мешочки из марли и выдерживали в 10%-м рас¬
творе хлорной извести (20 мин) и в 15%-м растворе пероксида
водорода (15 мин). Для стерилизации эксплантов (листьев, ку¬
сочков коры, отрезков побегов с пазушными почками) их после¬
довательно опускали в следующие растворы: 70%-й этанол (1 мин),
3%-й famosept (15 мин), 20%-ю хлорную известь (15 мин) и 15%-й
пероксид водорода (15 мин). После обработки всеми стерили¬
зующими веществами растительный материал промывали в сте¬
рильной воде.
Попытки культивирования зародышей отдельно от семядолей
не дали положительных результатов. Они или погибли сразу, или
некоторое время оставались в неизменном состоянии, без види¬
мых признаков развития, а потом также погибали.
469
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.77. Состав питательных сред, используемых для семенного
и клонального размножения Camellia japonica, мг/л
Среда
/
Компонент
Лирика
Кнудсона С
мс
Индукция
каллуса
Регенерация
побегов
Укор
по
?нение
5егов
nh4no3
_
1650
825
206
12
kno3
—
1900
950
950
1
■75
СаС12 • 2Н20
—
440
440
220
110
MgS04 • 7Н20
250
370
370
185
42
КН2Р04
250
170
85
85
'42
Ca(N03)2 • 4Н20
1000
—
—
—
FeS04 • 7Н20
25
27,8
27,8
27,8
27,8
(NH4)2S04
500
—
—
—
MnS04 • 4Н20
7,5
22,3
22,3
22,3
22,3
Na2 ЭДТА
37,3
37,3
37,3
37,3
37,3
Н3ВО3
—
6,2
6,2
6,2
6,2
ZnS04 • 4Н20
—
8,6
8,6
8,6
8,6
KI
—
0,83
0,83
0,83
0,83
Na2Mo04 • 2Н20
—
0,25
0,25
0,25
0,25
CuS04 • 5Н20
—
0,025
0,025
0,025
0,025
СоС12 • 6Н20
—
0,025
0,025
0,025
0,025
Никотиновая
—
0,5
0,5
0,5
0,5
кислота
Пиридоксин
0,5
0,5
0,5
0,5
Тиамин
—
0,4
0,4
0,4
0,4
Мезо-инозит
—
100,0
100,0
100,0
100,0
Глицин
—
2,0
2,0
2,0
2,0
2,4-Д
—
—
2,0
—
БАП
—
—
1,0
—
Аденин
4,0
4,0
—
10,0
2,0
НУК
—
2,0
—
—
ИУК
—
5,0
—
1,0
ИМК
—
—
—
—
10,0
Глюкоза
—
—
30 000,0
—
30 000,0
Сахароза
20 000,0
30 000,0
—
20 000,0
pH
4,8-5,2
5,5
5,8-6,0
5,8-6,0
5,8
-6,0
Стерильные семена размещали на питательной среде Кнудсо-
на, модифицированной добавлением 4 мг/л аденина, и выдержи¬
вали в темноте. Состав питательной среды приведен в табл. 4.77.
Надо отметить, что при размещении семян на питательной
среде необходимо придерживаться полярности, т. е. класть на по-
470
ГЛАВА 4. Методы размножения тропических и субтропических растений
Таблица 4.78. Продолжительность периода прорастания семян
и развития сеянцев сортов Camellia japonica в культуре in vitro, сут
\Сорт
Начало
прораста¬
ния
Образова¬
ние корня
Начало
роста
побега
Начало
развития
листьев
Образова¬
ние расте¬
ний *
Eleanot Franchetti
3
13
20
30
60
Grandihora Rosea
5
15
23
33
67
Magnonae Flora
4
14
28
40
70
Anemonaiflora
10
20
36
45
75
• Растения длиной 10 см с 1—2 корнями и 3—4 листьями.
верхность среды тем концом, на котором находится рубчик. Как
показали наши исследования, близ места локализации рубчика
расположены основные части зародыша — плюмула, гипокотиль
и зачаточный корешок. Если положить семя иначе, то нормаль¬
ный по морфологии сеянец получить не удается. После появле¬
ния корня пробирки с семенами переносили ближе к свету
(табл. 4.78).
Анализ полученных данных показал, что в культуре in vitro
сроки прорастания и развития сеянцев разных сортов С. japonica
почти не отличаются. Начало прорастания отмечено на 3-и сутки
у ’Eleanor Franchetti' и на 10-е — у ’Anemonaiflora*. Более позднее
прорастание семян этого сорта мы связываем с размером самого
семени — оно в 2 раза меньше семян растений других сортов.
Кроме того, качество последних значительно выше: в коробочке
все семена были созревшими и не имели дефектов.
В целом длительность процесса прорастания составляет 60—
70 сут в зависимости от сорта (табл. 4.78). Сначала (через 2—3 не¬
дели) формируется корень, затем начинается его интенсивный
рост. Над поверхностью появляются воздушные корешки белого,
а потом коричневого цвета. Наиболее часто образуется 1 корень
(рис. 4.96, а, см. вклейку), реже — 2—3 (рис. 4.96, б). Корни вто¬
рого и третьего порядка появляются после образования побега.
Иногда корень формируется и начинает расти вместе с побегом,
как будто окутывая его. Через 1 — 1,5 мес тонкая кожура семядо¬
лей сверху растрескивается и между ними появляется побег (рис.
4.97, см. вклейку). Далее, на протяжении еще 1 мес, происходит
интенсивный рост побега и на нем формируются листья. В это
время сеянцы имеют в длину 10 см и пригодны к высадке в суб¬
страт. По мере необходимости их вынимают из колб, высажива¬
471
СПЕЦИАЛЬНАЯ ЧАСТЬ
ют в сфагновый мох и помещают в теплицу при температуре 26—
28 °С, влажности воздуха 80 % и освещенности 4000—6000 лк.
Количество растительного материала увеличивают методом
черенкования сеянцев. При этом значительным преимуществом
является то, что сеянцы, полученные в условиях in vitro, можно
использовать без дополнительной стерилизации. Для этого! сеян¬
цы вынимают, разрезают в асептических условиях на сегменты
так, чтобы каждый из них имел пазушную почку. Затем сегменты
помещают в разные пробирки на питательную среду с повышен¬
ными концентрациями регуляторов роста (рис. 4.98, см. вклей¬
ку). Этим приемом устраняется апикальное доминирование, что
способствует активному развитию пазушных почек. От 1 почки мож¬
но получить 3—5 дополнительных побегов (рис. 4.99, см. вклей¬
ку). По нашему мнению, ювенильный материал более чувствите¬
лен к действию цитокининов и ауксинов, чем полученный от ге¬
неративно зрелых растений. Дополнительные сеянцы укореняют,
добавляя к питательной среде 5 мг/л ИУК, 2 мг/л НУК и 1 г/л
активированного угля.
При проведении экспериментов по семенному размножению
сортов С. japonica в культуре in vitro мы столкнулись с очень ин¬
тересным проявлением морфогенеза — соматическим эмбриоге¬
незом. Это же явление наблюдали и другие исследователи (Ly,
1982; Zhuang et al., 1985; Vieitez et al., 1990).
Соматический эмбриогенез относится к такому типу клональ¬
ного размножения, при котором зародышеподобные структуры раз¬
виваются асексуально, вне границ зачаточного мешка, из сома¬
тических клеток культивируемых тканей. В 1958 г. R. Stuart впер¬
вые получил эмбриоиды в суспензионной культуре клеток мор¬
кови. Установлено, что на данное время соматический эмбриоге¬
нез выявлен у 102 видов растений, однако только у 51 вида из
эмбриоидов получены растения (Williams et al., 1986). Показано
также, что способность к соматическому эмбриогенезу в культуре
тканей прежде всего зависит от генотипа исследуемого растения
(Kato, 1986).
Известно два типа соматического эмбриогенеза. Первый — пря¬
мой эмбриогенез, в результате которого зародыши появляются
непосредственно из тканей при отсутствии пролиферации каллу¬
са, второй — непрямой; сначала необходима дифференциация
каллуса, а уже потом эмбриоидов. Наряду с этим встречается и
вторичный эмбриогенез, когда на поверхности соматических за¬
родышей появляются дополнительные эмбриоиды (Rangaswami,
472
ГЛАВА 4. Методы размножения тропических и субтропических растений
1986). Сами эмбриоиды представляют собой биполярные струк¬
туры, которые одновременно развивают как корневой, так и
стеблёвой апексы. Образование соматических зародышей являет¬
ся типичным для многих видов тропических растений.
В наших исследованиях показано, что после 3—6 мес культи¬
вирования на питательной среде Кнудсона с 4 мг/л аденина на не¬
которых частях сеянцев С. japonica появились эмбриоиды. Установ¬
лены основные параметры, которые определяют соматический эм¬
бриогенез у сортов камелии — тип экспланта, стадия его разви¬
тия и взаимодействие между питательной средой и эксплантом.
Так] первые соматические эмбриоиды появлялись на черен¬
ках семядолей сеянцев. Причем они дифференцировались как из
тканей ^емядолей, так и из черенка, снизу и сверху (рис. 4.100, а,
см. вклбйку). Аналогичное явление зафиксировано и другими ис¬
следователями (Bennet, Sheibert, 1982). Эмбриоиды из других частей
зародыша при дальнейшем культивировании растений не регенери¬
ровали. Наибольшее количество соматических эмбриоидов полу¬
чено из тканей черенков семядолей исследуемых сортов камелии
(рис. 4.100, б\ 4.101, см. вклейку). Эти эмбриоиды имели доволь¬
но большие размеры (длину 3—5 мм и ширину 2—3 мм), как и у
некоторых других тропических растений.
Результаты наших исследований показали, что соматический
эмбриогенез, в результате которого получены эмбриоиды, имеет
три направления. Установлено, что дифференциация эмбриоидов
проходит асинхронно в эпидермальных и субэпидермальных сло¬
ях семядолей, причем в той их части, которая слегка приподнята
над поверхностью питательной среды.
Анализируя литературные данные и собственные результаты,
мы склоняемся к гипотезе, согласно которой прямой эмбриоге¬
нез in vitro происходит в клетках, которые были детерминирова¬
ны к эмбриогенному развитию еще при введении их в изолиро¬
ванную культуру. Этим эмбриогенно детерминированным клет¬
кам для перехода к делению клеток и экспрессии эмбриогенеза
необходимы только регуляторы роста или благоприятные усло¬
вия. В наших исследованиях это происходило тогда, когда кон¬
центрацию аденина в питательной среде увеличивали до 4 мг/л и
культуры выдерживали в условиях темноты. После перенесения
их на свет эмбриоиды приобретали зеленоватый цвет и в даль¬
нейшем из них регенерировали побеги.
В противоположность этому косвенный эмбриогенез требует
редетерминации дифференцированных клеток, пролиферации кал-
473
СПЕЦИАЛЬНАЯ ЧАСТЬ
луса и последовательного развивающегося эмбриогенно детерми¬
нированного состояния. Для многих видов растений стадия раз¬
вития экспланта является критической для экспрессии соматиче¬
ского эмбриогенеза и очень часто включает частичную дифферен¬
циацию (Pedroso, Pais, 1994). При прямом соматическом эмбриоге¬
незе специфичность стадии развития экспланта непосредственно
связана с его возрастом. Кроме того, этот процесс может быть
ограничен не только соответствующими стадиями развития, но и
определенным типом клеток (Plata et al., 1991). I
Некоторые исследователи отмечают сходство между Прямым
соматическим эмбриогенезом и инициацией к эмбриогенезу от¬
дельных клеток и многоклеточных образований. Многие отли¬
чия, наблюдаемые в наших опытах, могут быть связаны с необ¬
ходимостью редетерминации клеток для вхождения в эмбриген-
ное состояние, что совпадает с данными других исследований
(Barciela, Vieitez, 1993).
В целом, тип морфогенеза будет зависеть от того, сможет ли
данная группа клеток установить и поддерживать скоординиро¬
ванное поведение в качестве эмбриогенной единицы при дейст¬
вии разных факторов, которые, в свою очередь, влияют на меж¬
клеточные связи.
Кроме упомянутых выше проявлений эмбриогенеза мы ино¬
гда наблюдали образование эмбриоидоподобных структур (нео¬
морф) вместо соматических зародышей; в дальнейшем они силь¬
но разрастались, но растений не образовывали (рис. 4.102, см.
вклейку).
Полученные нами эмбриоиды культивировали на разных по
составу питательных средах (Кнудсона, МС, Пирика). Наиболее
оптимальной оказалась среда МС с 1/2 концентрации макро¬
элементов, модифицированная добавлением 2—5 мг/л аденина,
1 мг/л НУК (рис. 4.103, см. вклейку). Полученные растения уко¬
реняли на среде Кнудсона с 5—10 мг/л ИМК (рис. 4.104, см.
вклейку).
Растения, образовавшиеся из соматических зародышей, могут
проявлять сомаклональную вариабельность, которая, в свою оче¬
редь, может быть использована для получения новых исходных
форм в селекции растений. Кроме того, метод соматического эм¬
бриогенеза позволяет селекционерам выращивать большое коли¬
чество вегетативно размноженного материала с помощью культу¬
ры срезов семядолей, которые выделены из семян, полученных в
результате скрещивания.
474
ГЛАВА 4. Методы размножения тропических и субтропических растений
Для микроразмножения Camellia использовали молодые от¬
растающие побеги взрослых растений длиной 10—15 см и листья
этих Побегов. Все экспланты взрослых растений камелии очень
инфицированы как спорами грибов, так и бактериями. Данный
факт подчеркивается многими исследователями (Haldeman et al.,
1987, 1996).
В авязи с этим значительное внимание уделяли разработке
режима стерилизации, подбору стерилизующих веществ, их кон¬
центрации и времени экспозиции, поскольку необходимо было
получить не только стерильные, но и способные к регенерации
эксплангы. Всего испытано четыре варианта режима (табл. 4.79).
Полученные данные свидетельствуют о том, что раздельное
использование стерилизующих веществ менее эффективно, чем
совместное. Возможно, это связано с тем, что любое из них воз¬
действует только на определенный вид патогенной микрофлоры.
Наибольшее количество стерильных эксплантов было получено
при таком соотношении веществ: 2%-й famosept, 20%-й раствор
хлорной извести, 15%-й раствор пероксида водорода. Однако
10—25 % эксплантов остаются инфицированными. Чтобы умень¬
шить это количество, проводят вторичную стерилизацию эксплан-
Таблица 4.79. Эффективность стерилизации эксплантов различных
сортов Camellia japonica, %
Сорт
Вариант
опыта
Концен¬
трация, %
Eleanor
Franchetti
Grandiflora
Rosea
Magnoliae
Flora
Anemonai-
flora
1
2
1
2
1
2
1
2
Famosept
2
40
60
40
60
35
65
40
60
1
50
50
55
45
50
50
55
45
Famosept +
+ хлорная
известь
2 + 20
30
70
30
70
25
75
30
70
Famosept +
+ хлорная
известь +
+ пероксид
водорода
2 + 20+15
10
90
10
90
15
85
20
80
Примечание. В каждом варианте опыта исследовалось 20 эксплантов.
1 — инфицированные экспланты; 2 — неинфицированные экспланты.
475
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 4.80. Морфогенетический потенциал эксплантов различных сортов
Camellia japonica в культуре in vitro
Эксплант
Образовавшиеся структуры
Каллус
Побег
Корень
Цветочные
структуры
Структуры
листа
1
Верхушки побегов
+
+
!
Сегменты листа
+
—
+
—
—
Цветочные почки
+
—
—
+
—
Пазушные почки
+
+
+
—
+
Примечание. (+) — структуры образовались; (—) — структуры не обра¬
зовались.
тов в 15%-м растворе пероксида водорода или в растворе анти¬
биотиков (ампициллина или рифампицина). Несмотря на приня¬
тые меры, в 5 % случаев не удается устранить внутреннюю ин¬
фекцию; очень часто она сохраняется во всех пассажах и отрица¬
тельно влияет как на формирование каллуса, так и на другие про¬
цессы дифференциации.
Во многих случаях успех микроразмножения зависит от пра¬
вильного выбора экспланта. В наших исследованиях это сегмен¬
ты листьев взрослых растений и пазушные почки молодых отрас¬
тающих побегов. Изучен морфогенетический потенциал экс¬
плантов, которые культивировали на питательной среде МС
(табл. 4.80).
Анализируя данные табл. 4.80, видно, что каллус пролифе¬
рировали все экспланты, но он был немофогенным и получить
от него побеги не удалось. Побеги образовывали лишь верхушечные
и пазушные почки. Спонтанное формирование корня отмечено у
сегментов листьев и пазушных почек. Каллус пролиферировал
по всему периметру листа (рис. 4.105, см. вклейку), однако наи¬
более часто — на сегментах его базальной части и по жилкам.
Такое явление, на наш взгляд, связано с высоким морфогенети¬
ческим потенциалом этих зон, имеющих большое количество
клеток с достаточно высокой митотической активностью. В
культуре in vitro они функционируют как меристематические
клетки, образуя под влиянием регуляторов роста каллусную
массу.
Высокая интенсивность каллусогенеза на питательной среде
МС с 2 мг/л 2,4-Д зависела от возраста и генотипа растения. Не¬
которые исследователи также наблюдали формирование каллуса
476
ГЛАВА 4. Методы размножения тропических и субтропических растений
по периметру листа (Ogutaga et al., 1970; Frisch et al., 1987). Кал¬
лус, полученный из других эксплантов, был неморфогенным и
растения не регенерировал. Побеги образовывались только из
апикальных и пазушных почек (рис. 4.106, см. вклейку).
Полученные растения укореняли на питательной среде Пири-
ка с 10 мг/л ИМК и 1 г/л активированного угля. Следует отме¬
тить, что и сеянцы, и растения-регенеранты камелии можно ис¬
пользовать как вторичные экспланты, увеличивая тем самым ко¬
эффициент размножения.
^ POLYPODIOPHYTA
Отдел высших споровых растений Polypodiophyta
включает несколько классов. К классу Polypodiopsida относят¬
ся основные семейства, широко представленные в коллекциях
ботанических садов; некоторые виды являются лиственно-де-
коративными растениями, выращиваемыми в промышленных
садоводствах. Представители полиподиопсидиевых — травяни¬
стые или древовидные растения. Первые образуют корневище с ма¬
лоразвитым надземным стеблем, часто короткое, ползучее или под¬
земное, покрытое влагалищами отмерших листьев. Ствол древо¬
видных папоротников высотой от 5—10 см до 15—20 м.
У вьющихся папоротников (лиан) листья разного размера, пе-
ристо-рассеченные, дольчатые, реже — цельные; молодые листья
свернуты в улитковидные завитки, которые расправляются посте¬
пенно; крупные листья длиной 5 м. Заростки чаще обоеполые, в
основном зеленые. Сорусы локализуются преимущественно на
нижней стороне вай, редко — по краям, собраны в синангии или
расположены одиночно, реже — в виде колосков или метелок, от¬
дельно от стерильных вай (Сааков, 1983).
При размножении папоротников в асептической культуре
целесообразно использовать споры (Higuchi et al., 1989; Oliphant,
1989), а в отдельных случаях (декоративные формы, полученные
в результате соматических мутаций) — меристемы корневищ.
Однако при этом можно потерять маточный экземпляр; кроме
того, значительно увеличивается временной промежуток массо¬
вого получения пригодных к высадке ex vitro растений-регене-
рантов. При использовании в качестве исходного материала
спор также возникает две проблемы. Первая состоит в сложно¬
сти стерилизации спорового материала ввиду его очень малых
размеров. Вторая проблема связана с оплодотворением оогониев
477
СПЕЦИАЛЬНАЯ ЧАСТЬ
гаметофитов. В своей практике первую проблему мы решаем
тем же способом, что и для орхидных — используем шелковые ме¬
шочки. Вторая проблема может исчезнуть сама собой через неопре¬
деленный промежуток времени (у каждого вида он свой): в колбах
на гаметофитах появляются одиночные спорофиты, но их очень
мало. В связи с этим мы применяем метод “принудительного опло¬
дотворения”. Суть его состоит в том, что готовые к оплодотворению
гаметофиты помещают в стерильных условиях в емкости со сте¬
рильной водой и некоторое время интенсивно взбалтывают. После
этого их можно размещать на поверхности среды или на несте¬
рильном (но подготовленном) субстрате для дальнейшего куль¬
тивирования. Используя данный метод, мы получали спорофи¬
ты различных видов в больших количествах.
Adiantaceae (C.Presl.) Ghing
Многолетние наземные травянистые растения. Кор¬
невище короткое, покрыто чешуйками коричневого цвета. Листья
перистые и пятикратноперистые. Сорусы расположены вдоль
концов жилок.
Adiantum L. Распространены в тенистых, влажных лесах на по¬
верхности почвы и на скалах (особенно в расщелинах), вдоль рек, в
горах, на известняковых туфах, в тропической зоне, а также в суб¬
тропиках и частично — в умеренной зоне Восточного и Западно¬
го полушарий. В роде 200 видов.
A. diaphanum Blume — травянистое многолетнее растение вы¬
сотой до 40 см. Листья перистые или дваждыперистые у основания.
Спорангии почковидные, расположены по верхнему краю листа.
Черешки листьев длиной до 20 см. Произрастает во влажных местах
в Южном Китае, на п-ове Индокитай и в Новой Зеландии. Де¬
коративное растение. Используется как горшечная культура и на
срез.
Споры после предварительной стерилизации высевали на мо¬
дифицированную среду МС. Через 40—60 сут мы наблюдали фор¬
мирование первых гаметофитов. В дальнейшем, по мере развития,
на этой же среде гаметофиты спонтанно образовывали спорофиты
(рис. 4.107, см. вклейку). Последние субкультивировали отдельно
вплоть до высадки в субстрат.
478
ГЛАВА 4. Методы размножения тропических и субтропических растений
Blechnaceae (C.Presl.) Gopel.
Распространены в тропиках и субтропиках, реже в
умеренной зоне Южного полушария. В роде 200 видов. Некото¬
рые виды вполне пригодны для выращивания в комнатах, но
преимущественно содержатся в коллекциях ботанических садов.
Blechnum L. Вечнозеленые древовидные растения с крепким
корневищем, иногда возвышающимся над почвой в виде неболь¬
шого ствола высотой до 1 м; оно покрыто твердыми темными,
почти черными чешуями. Листья перистые и дваждыперистые,
кожистые, гладкие, цельнокрайные или пильчатые.
В. australe L. subsp. auriculatum (Cav.) de la Sota вводят в куль¬
туру, культивируют (рис. 4.111, а, см. вклейку) и проводят их пост-
асептическую адаптацию так же, как и В. brasiliense.
В. brasiliense Desv. — древовидные высокодекоративные рас¬
тения. Родина — Бразилия, Перу. Ствол высотой до 80 см, по¬
крыт темно-коричневыми волокнистыми чешуями. Листья пери¬
стые, в проекции овально-ланцетные, расширенные в верхней час¬
ти, длиной 1—2 м и шириной 30 см. Листочки сидячие, линейно¬
ланцетовидные, заостренные, сросшиеся у основания, 15—25 см в
длину, по краям — ровнопильчатые, в нижней части — мелкие; са¬
мые нижние — чешуйчатые, кожистые, голые, темно-зеленые.
Спорангии густо расположены вдоль средней жилки. Культивиру¬
ется в полутеплых и теплых оранжереях; хорошо растет в комна¬
тах и зимних садах.
В культуру in vitro этот вид вводили с помощью спор. Для
стерилизации исходного материала использовали трехкомпонент¬
ную (0,01 %-й thimerosal, 10%-й chlorax, 10%-й Н202) схему, как и
для семян орхидных. Первоначально применяли стандартную среду
МС, на которой и происходило формирование гаметофитов. В даль¬
нейшем на них спонтанно образовывались спорофиты, которые
после формирования 4—5 первых вай можно высаживать ex vitro.
В качестве первоначального субстрата лучше использовать сфаг¬
новый мох.
В. gibbum (Labill.) Mett. — древовидные растения, произра¬
стающие на островах Новая Каледония и Новые Гебриды. Ствол
высотой до 1 м, темно-коричневый, покрыт чешуями. Листья пери¬
стые, длиной 1 м; стерильные длиннее фертильных. Листочки густо
расположенные, линейные, расширенные в нижней части и плотно
находящие друг на друга, с ушковидными придатками, заостренные
в верхней части, цельнокрайные, кожистые, голые.
479
СПЕЦИАЛЬНАЯ ЧАСТЬ
Как декоративное растение в горшках и кадках (взрослые
растения) применяется для оформления зимних садов, интерье¬
ров. Культивируется в холодных и полутеплых оранжереях. При¬
емы введения, культивирования (рис. 4.111, 6) и постасептиче-
ской адаптации такие же, как и у В. brasiliense.
Cyatheaceae Reichenb.
Древовидные папоротники с прямым стволом или
без ствола. Листья дважды-, трижды-, реже — четыреждыпери-
стые, крупные. Спорангии расположены на нижней части листь¬
ев, покрыты оболочкой. Распространены в тропиках и субтропи¬
ках Западного и Восточного полушарий. В семействе 8 родов и
до 650 видов.
Cyathea Sm. Ствол прямой или отсутствует. Листья дваждыпе-
ристые, крупные, длиной до 4—6 м, опушенные или голые, плот¬
ные, расположены на вершине ствола. Распространены во влаж¬
ных лесах в нижнем ярусе и в мшистых лесах высокогорий тро¬
пической зоны Западного и Восточного полушарий, частично в
субтропиках Японии, Новой Зеландии, Капской провинции (ЮАР).
В роде 600 видов. Высокодекоративные растения. Содержатся в
коллекциях ботанических садов; некоторые виды, произрастаю¬
щие в умеренно теплых странах, пригодны для культивирования
в зимних садах (Сааков, 1983).
Для размножения С. dregii Kunze G. Finnie и соавт. (1987) ис¬
пользовали споры в качестве исходного материала. Высев прово¬
дили на среду МС, модифицированную 30 г/л сахарозы, 4 г/л
агар-агара, 1 мг/л цианкобаламина, 50 мг/л тиамина, 0,7 мг/л
биотина. На этой среде были получены гаметофиты. Далее на¬
веску из них массой 1 г помещали в колбу со средой МС без са¬
хара и агара и встряхивали в течение 10 с. Содержимое выливали
на стерильный субстрат в чашки Петри и помещали в термостат
при температуре 28 °С и интенсивном освещении. При таком
способе размножения из 1 г гаметофитов можно в дальнейшем
получить до 600 спорофитов.
В своих работах для размножения С. dregii мы также исполь¬
зовали споровый материал, который высевали на стандартную
среду МС, модифицированную 4 мг/л аденина. В таких условиях
активно формировались гаметофиты, а затем начинали спонтан¬
но образовываться спорофиты. Основные приемы дальнейшего
культивирования схожи с P. alcicorne.
480
ГЛАВА 4. Методы размножения тропических и субтропических растений
Oleandraceae Ching ex Pichi-Serm.
Многолетние травянистые листопадные растения
образуют толстое ползучее длинное или короткое корневище. Ли¬
стья перисто-рассеченные, опушенные, оголяющиеся. Черешок листа
сочленен с длинными выростами корневища. Спорангии располо¬
жены по краям нижней стороны листьев. Распространены во
всех тропических странах Западного и Восточного полушарий.
Nephrolepis Schott. Многолетние травянистые растения, про¬
израстающие во всех тропических странах. В роде 30 видов, сре¬
ди них имеются наземные растения и эпифиты. Многие виды вы¬
ращивают в ботанических садах и промышленных садоводствах;
они также хорошо растут в комнатах, зимних садах, широко при¬
меняются для аранжировок. Виды N. cordifolia и N. exaltata наи¬
более популярны и часто встречаются в интерьерах.
N. cordifolia (L.) C.Presl. — многолетние листопадные расте¬
ния, наземные и эпифиты; на корневище часто образуются оре¬
ховидные вздутия (без почек). Листья густо расположенные, ду¬
говидно повисшие. Произрастает на склонах холмов и полянах в
тропических лесах Западного и Восточного полушарий. Декора¬
тивный вид. Хорошо растет в комнатах.
Этот вид размножали клонально. Основой для культивиро¬
вания была среда В5 с добавлением 1 мг/л ИМК. Первичными
эксплантами служили сегменты столонов растений, выращен¬
ных в асептических условиях. Через неделю на них формирова¬
лись меристематические центры роста. После перенесения их
на среду с кинетином или БАП (0,5—1,0 мг/л) через 14 сут про¬
лиферировали многочисленные почки, из которых регенериро¬
вали растения (Tadhya et al., 1982; Rajarathhinam et al., 1989).
N. exaltata (L.) Schott — многолетние листопадные растения;
корневище не образует вздутий. Листья густо расположенные, дуго¬
видно повисшие, рахис красноватый. Спорангии собраны рядами
ближе к краям листьев. Обитает в тропической зоне Юго-Вос¬
точной Азии. Декоративный вид. Хорошо растет в комнатах.
В асептических условиях размножают подобно предыдущему
виду: как с помощью спор, так и клонально в условиях in vitro
(Camloh et al., 1989; Hvoslef-Eide, 1990).
481
СПЕЦИАЛЬНАЯ ЧАСТЬ
Polypodiaceae Bercht. et Presl.
Представители данного семейства — многолетние
травянистые растения с мясистыми, толстыми корневищами, по¬
крытыми чешуями и волосками. Многие виды эпифиты. Обита¬
ют во влажных тропических и высокогорных лесах тропической
зоны Восточного полушария и частично — Западного полуша¬
рия. Небольшое количество видов является ксерофитами и оби¬
тает в тропических лесах с ксерофитными условиями. Семейство
объединяет около 50 родов и до 1500 видов (Сааков, 1983).
Platycerium Desv. Род насчитывает до 17 видов эпифитных очень
декоративных папоротников, распространенных в тропиках Азии,
Австралии, Америки, Африки и на о-ве Мадагаскар. В коллекции
НБС НАН Украины данный род представлен 3 видами — P. alci¬
corne (Willemet) Desv., P. hillii Moore, P. willinckii Moore.
P. alcicorne (Willemet) Desv. — гнездовой эпифит, который в
природных условиях (Тропическая Австралия) поселяется в ос¬
новном на больших ветвях или стволах деревьев (Christensen, 1932;
Encke, 1958). Растения P. alcicorne, как и некоторые другие виды,
формируют два типа листьев: стерильные и фертильные (Федо¬
ров и др., 1956). Для растений данного вида характерно лами-
нальное расположение спорангиев на абаксиальной поверхности
листьев: они плотно примыкают друг к другу, образуя целостную
коричневую зону. Индузий отсутствует, вместо него защитную
функцию выполняют трихомы (Ковальская и др., 2004). Коэф¬
фициент размножения P. alcicorne в условиях оранжерейной куль¬
туры достаточно низок (ежегодно на взрослом экземпляре может
образовываться 3—5 дочерних растений), поэтому мы выращива¬
ли эти растения в условиях асептической культуры.
В работе использовали споры, собранные в оранжереях НБС
и полученные по делектусному обмену. Необходимо отметить,
что споры этого вида in vitro имели достаточно низкий процент
всхожести. Так, первые признаки этого процесса впервые были
замечены лишь спустя 4 мес с момента их высева. Низкий про¬
цент всхожести спор видов данного рода был также зафиксиро¬
ван и другими исследователями (Hennen et al., 1978; Thentz et al.,
1984). Еще через 1 мес мы наблюдали формирование проростков
как округлой, так и неправильной формы, на нижней стороне
которых развивались коричневые ризоиды (рис. 4.108, см. вклей¬
ку). В колбах, которые находились в темноте, диаметр гаметофи¬
тов был до 13 мм, на свету — до 5 мм. В дальнейшем проростки
482
ГЛАВА 4. Методы размножения тропических и субтропических растений
P. alcicorne субкультивировали на средах МС и Пирика, модифи¬
цированных 0,4 мг/л пиридоксина, 1 мг/л ИУК и 30 г/л сахаро¬
зы. В результате проведенных исследований установлено, что на
этом этапе лучше использовать среду МС.
Некоторые исследователи на данном этапе микроразмноже¬
ния P. alcicorne применяют гомогенизацию гаметофитов. Для это¬
го их помещают в емкости со стерильной водой и встряхивают до
получения однородной массы, которую выливают в герметичные
пластиковые боксы на субстрат, состоящий из сфагнового мха. Раз¬
витие спорофитов и их укоренение происходит непосредственно
в субстрате (Cooke, 1979; Janssens et al., 1989). Однако при таком
способе размножения процент контаминации достаточно высок.
Образование первых спорофитов было отмечено спустя 1 год
с момента высева спор на питательную среду (рис. 4.109, см.
вклейку). Их отделяли от гаметофитов и следующие 4 мес куль¬
тивировали на среде МС с 4 мг/л аденина. Укоренение растеньиц
происходило на среде МС с 2 мг/л ИМК.
В возрасте 14—16 мес спорофиты имели 3—4 сердцевидно
вытянутых листа длиной до 12 мм и шириной до 5 мм. На этом
этапе их высаживали в субстрат из мха и песка (2:1). Еще через
4—6 недель растения закрепляли на блоках из сосновой коры
(рис. 4.110, см. вклейку).
P. elephantotis Schweinf. — высокодекоративный вид, распро¬
страненный в Экваториальной Африке. Культивируют в теплых
оранжереях и комнатах. Приемы асептического размножения и по-
стасептической адаптации, как и у P. alcicorne.
P. grande (Fee) Kunze произрастают в Тропической Азии, Тро¬
пической Австралии и на Филиппинских островах. Растения
очень эффектно смотрятся в различных типах интерьеров. Куль¬
тивируют в теплых оранжереях и комнатах. Приемы асептиче¬
ского размножения и постасептической адаптации, как и у P. al-
cicome.
Глава 5
ПОСТАСЕПТИЧЕСКАЯ АДАПТАЦИЯ СЕЯНЦЕВ
И РАСТЕНИЙ-РЕГЕНЕРАНТОВ
5Л. УСЛОВИЯ КУЛЬТИВИРОВАНИЯ
В настоящее время размножение представителей
многих семейств высших растений в стерильных
условиях — наиболее быстрый и эффективный спо¬
соб получения большого количества однородного и
оздоровленного посадочного материала. В отечест¬
венной и мировой литературе накоплен достаточный
опыт по клональному и семенному размножению
тропических и субтропических растений в условиях
культуры in vitro, но практически полностью отсут¬
ствуют сведения о механизмах повышения адапта¬
ционных свойств сеянцев и растений-регенерантов
при перенесении их из стерильных условий в ус¬
ловия автотрофного питания (ex vitro).
Адаптивная ценность признаков у растений за¬
висит от функционального статуса, видовых осо¬
бенностей и экологических условий природных
мест произрастания, которые непосредственно
влияют на адаптацию и экспрессию характерных
черт пластичности. При этом виды одного и того
же рода, имея сходный цикл развития, могут суще¬
ственно различаться фенотипической реакцией на
свет, влагу, температуру и другие факторы среды.
Поэтому при разработке вопросов постасептиче-
ского культивирования прежде всего необходимо
определить теоретические основы и найти практи¬
ческие механизмы управления ростом и развитием
растений на основе комплексного анализа климати¬
ческих и эдафических условий на территории ареа-
484
ГЛАВА 5. Постасептическая адаптация сеянцев и растений-регенерантов
ла, четкого определения жизненной формы, изучения анатомиче¬
ских и физиолого-биохимических особенностей (Демидов, 1999).
К примеру, современные исследования, проведенные на мо-
лекулярно-биологическом уровне, доказали наличие среди ор¬
хидных определенной группы видов, которая занимает промежу¬
точное положение между наземными и эпифитными представи¬
телями этого семейства. Впервые было показано, что соотношение
величин РНК/ДНК листьев и корней может быть диагностиче¬
ским критерием при определении экотипа орхидных (Черевченко
и др., 2000). Полученные результаты дополняют и определенным
образом согласуются с работами A. Raunkiaer (цит. по: Galan de
Mera, 1999). В соответствии с его системой, все растения в зави¬
симости от их реакции на условия внешней среды можно услов¬
но разделить на ряд типов (Galan de Mera, 1999).
Следует отметить, что в пределах одного рода могут встре¬
чаться виды, которые относятся к различным экотипам, поэтому
при подобной классификации необходимо учитывать не только
климатические условия мест природного произрастания, но и
биологические особенности растений.
Момент перевода растений в условия автотрофного питания
является критическим вследствие изменения абиотических пока¬
зателей внешней среды. В качестве лимитирующих факторов в
этот период могут выступать колебания освещенности (количест¬
венный и качественный состав), влажности (по сравнению с ус¬
ловиями in vitro наблюдается выраженное различие влажности
воздуха и субстрата), температуры (изменяется в значительно бо¬
лее широком диапазоне, при этом не только по сезонам, но и на
протяжении суток). Также в данный период происходят выражен¬
ная качественная и функциональная перестройка основных метабо¬
лических процессов, перестройка работы устьичного аппарата,
адаптация антенных комплексов фотосистем ювенильных растений
к природным освещению, влажности и температуре. Вследствие
этого мы можем наблюдать анатомические и морфологические из¬
менения в тех вегетативных частях растений, которые сформиро¬
вались уже ex situ, и последовательную синхронизацию феноло¬
гических ритмов ювенильных растений ex vitro с ритмами генера¬
тивных растений в условиях оранжерей.
Многие из размножаемых в ботанических садах видов харак¬
теризуются исследователями как эпифиты (аэрофиты) или лито-
фиты (Withner, 1990; McQueen et al., 1993). Влагу и питательные
вещества, необходимые для развития, эпифиты получают из суб¬
485
СПЕЦИАЛЬНАЯ ЧАСТЬ
страта, содержащего гумус, который накапливается в трещинах
коры, дуплах или разветвлениях веток (Dressier, 1981).
Для высокоспециализированных эпифитов — аэрофитов, про¬
израстающих в районах с засушливым климатом, или в местах, вод¬
ный режим которых непригоден для существования большинства
цветковых растений (стволы деревьев и кустарников, отвесные
скалы), необходимо использовать блок-культуру. Сеянцы и рас-
тения-регенеранты таких видов при классических методах несте¬
рильной культуры гибнут, а если некоторые экземпляры и вы¬
живают, то довести их до цветения практически невозможно.
В нашей практике блок-культура применяется в основном
для выращивания представителей таких семейств, как орхидные,
бромелиевые, ароидные (рис. 5.1, 5.2, см. вклейку). Кроме того,
данный способ культивирования позволяет выдерживать расте¬
ния в оптимальных условиях и более эффективно использовать
площадь оранжерей (Coleman, 1986). В ходе исследований нами
были разработаны несколько приемов крепления ювенильных
растений эпифитных видов непосредственно к блокам (рис. 5.3,
см. вклейку).
После образования вегетативной и корневой сфер растения-
регенеранты и сеянцы переводят в септические условия. Дли¬
тельность культивирования in vitro представителей различных ви¬
дов — величина видоспецифическая и может варьировать в ши¬
роком диапазоне. Для достижения оптимального результата в этом
вопросе исследователь во многом должен полагаться на свою ин¬
туицию и знание биологии вида.
Высокая степень выживания клонированных in vitro растений
обеспечивается при соблюдении следующих условий: поддержа¬
ние высокой атмосферной влажности в первые 7—14 сут культи¬
вирования микроклонов путем диспергирования воды в виде ту¬
мана или использования полиэтиленовых покрытий (с отвер¬
стиями); правильное приготовление почвенной смеси. Сущест¬
венное значение имеет pH почвенной смеси: если pH превышает
5,6, то к смеси добавляют СаС03 или Na2CC>3. В странах с высо¬
ким уровнем развития биотехнологий культивирования микро¬
клонов коммерческие фирмы производят специальные почвен¬
ные смеси. На культивирование таких видов, как виноград, ма¬
лина, ежевика, и некоторых других положительный эффект ока¬
зывает выдерживание укорененных растений в условиях низких
температур в течение 1 мес.
486
ГЛАВА 5. Постасептическая адаптация сеянцев и растений-регенерантов
Подготовка растений к высадке в почву — очень важный этап,
которому часто не придают должного значения. На этом этапе про¬
водят закалку растений, повышая их устойчивость к патогенным
микроорганизмам и различным неблагоприятным факторам внеш¬
ней среды.
При подготовке растений к переносу в почву интенсивность ос¬
вещения, как правило, повышают до 10 ООО лк. Высокая освещен¬
ность может задерживать их рост и вызывать появление на листьях
незначительных хлорозов, тем не менее эти растения в почве чувст¬
вуют себя значительно лучше и растут более энергично, чем расте¬
ния, не прошедшие этап предварительной адаптации к повышен¬
ной освещенности.
Одним из приемов адаптации растений к септическим усло¬
виям может быть постепенное приучение растений-регенерантов
и сеянцев к естественному дневному свету. Для этого емкости с
растениями следует выставить из культурального помещения в
места с природным освещением. При этом необходимо избегать
попадания на растения прямых солнечных лучей и четко соблю¬
дать температурный режим. Через несколько дней можно приот¬
крыть крышки емкостей и оставить на некоторое время для зака¬
ливания растений. Время экспозиции нужно постепенно увели¬
чивать.
Другим способом подготовки растений к естественной веге¬
тации является наполнение на 1/3 в стерильных условиях стек¬
лянных емкостей специальным стерильным субстратом и высадка
в него растений. Емкости с растениями выдерживают в таких же
условиях, как и до этого. Когда растения дорастут до горлышка
емкости, на несколько дней снимают крышку, после чего расте-
ния-регенеранты вместе с комом можно высаживать в обычные
горшки. Растения извлекают очень осторожно, чтобы от крошеч¬
ных побегов не оторвать корни, которые располагаются в толще
питательной среды, и удаляют остатки агаризированной среды,
промывая корни в теплой воде (Grabowski et al., 1987).
5.2. СУБСТРАТЫ
Конечно, невозможно искусственно создать все
условия, которые встречаются в природе. В прошлом культивато¬
ры использовали очень сложные смеси для выращивания расте¬
ний в условиях закрытого фунта, стараясь при этом имитировать
природные условия (Уатсон, 1892). В настоящее время, наоборот,
487
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 5.1. Элементы минерального питания в субстратах, используемых для
видов тропических и субтропических растений
Субстрат
pH солевой
Солевая
концентра¬
ция, г/л
вытяжки
nh4
NO,
Р
Верховой торф
3,0
0,05
60,0
4,0
Сфагновый мох (лето)
4,1
0,20
100,0
28,0
10,0
Сфагновый мох (осень)
4,4
0,25
160,0
30,0
22,0
Древесный уголь
9,6
0,10
0
12,0
439,0
Корни осмунды, сфагно¬
вый мох, верховой торф,
древесный уголь, кора сос¬
ны, черепки (1:1:1:1:1:1)
5,4
0,20
90,0
35,0
34,0
Верховой торф, дерновая
земля, перегной, песок
(2:2:1:1)
5,6
0,15
80,0
68,0
40,0
Дерновая земля, перегной,
песок (2:1:1)
5,8
0,10
50,0
35,0
36,0
Верховой торф, песок (2:1)
4,2
0
25,0
0
0
Верховой торф, листовая
земля, сфагновый мох, дре¬
весный уголь, песок, кора
сосны (2:2:2:1:1:1)
5,5
0,15
90,0
83,0
135,0
Примечание. Здесь и в табл. 5.2, 5.3: (—) — элемент отсутствует.
существует тенденция к стандартизации субстратов (Черевченко
и др., 1986). Однако в большинстве случаев специалисты моди¬
фицируют общепринятые смеси с учетом местных условий. При
этом часто не обращают внимание на анатомо-физиологические
особенности растений разного экотипа, что приводит к плохой
приживаемости растений или даже к их гибели. Эпифитам, в срав¬
нении с наземными видами, нужен более крупнофракционный и
менее влагоемкий субстрат (кора, древесный уголь, отходы гон¬
чарной промышленности, полистирол и др.).
Субстрат для высадки ювенильных растений в каждом от¬
дельном случае должен включать компоненты, приемлемые и
доступные в конкретных условиях. К примеру, для ароидных это
может быть измельченный пенопласт, сфагновый мох, торф, лис¬
товая земля в различных соотношениях, для эпифитных бромелие-
вых и орхидных — полистирол, перлит, кора сосны и пробкового
дуба, пальмовое волокно, сфагновый мох. Для наземных растений
обычно используется смесь равных количеств листовой земли, вер-
488
ГЛАВА 5. Постасептическая адаптация сеянцев и растений-регенерантов
постасептической адаптации сеянцев и растений-регенерантов различных
Компонент, мг/л (1 н НС1)
К
Са
Mg
S
Fe
Си
Zn
Mn
В
Cl
12,0
466,0
41,0
0
100,0
1,2
0,5
10,0
1,0
_
25,0
497,0
86,0
53,0
15,0
0
0
10,0
0,5
—
72,0
533,0
132,0
125,0
50,0
0
0
10,0
1,0
—
2208,0
4065,0
610,0
0
0
0
0
20,0
2,5
119,0
1233,0
508,0
30,0
75,0
2,5
4,0
70,0
2,5
—
55,0
123,0
500,0
25,0
50,0
0,8
1,5
35,0
1,0
9,0
40,0
798,0
102,0
50,0
75,0
0
1,2
10,0
1,0
14,0
10,0
338,0
40,0
0
70,0
0
0
10,0
1,0
27,0
72,0
1666,0
291,0
100,0
125,0
2,5
3,0
40,0
1,5
14,0
хового торфа и перлита (рис. 5.4, см. вклейку). Общим условием
для всех видов субстрата должна быть 100%-я стерильность, ко¬
торая достигается путем термической обработки. Кроме того, он
должен быть легким и рыхлым.
В табл. 5.1, 5.2 приведены физико-химические свойства наи¬
более часто используемых нами субстратов и содержание элемен¬
тов минерального питания в различных почвосмесях. Результаты
исследования показали, что наилучшим субстратом для культи¬
вирования сеянцев и растений-регенерантов наземных орхидных
и многих других субтропических растений был субстрат № 5.
Большое значение имеет правильный подбор лесной подстилки.
Так, наилучшей оказалась лесная подстилка из-под дуба, березы
и лещины (табл. 5.3). Одним из оптимальных субстратов для пост¬
асептической адаптации и дальнейшего выращивания сеянцев и
растений-регенерантов эпифитных видов, по нашему мнению,
является сфагновый мох летнего сбора. Как и в опытах с эпи-
фитными видами орхидных, нас интересовали вопросы развития
489
СПЕЦИАЛЬНАЯ ЧАСТЬ
Таблица 5.2. Физико-химические свойства почвосмесей, используемых для вы
тропических и субтропических растений
Номер
субст¬
рата
Вариант опыта
Органическое
вещество, %
Гумус,
%
Зола,
%
pH солевой
вытяжки
1
Верховой торф
99,25
7,5
3,0
2
Верховой торф, песок (2:1)
94,72
—
—
4,2
3
Верховой торф, дерновая
—
2,94
—
5,6
4
земля, песок (2:2:1)
Дерновая земля, перегной,
песок (2:1:1)
4,96
5,8
5
Верховой торф, листовая
земля, сфагновый мох,
древесный уголь, песок,
кора сосны (2:2:2:1:1:1)
—
5,97
—
5,5
Таблица 5.3. Элементы минерального питания в лесной подстилке из-под различ
Вид
pH солевой
вытяжки
Солевая кон¬
центрация, г/л
nh4
N03
Р
К
Сосна
4,2
0,20
90,0
35,0
58,0
41,0
Дуб
4,9
0,10
60,0
45,0
40,0
120,0
Бук
5,0
0,30
20,0
13,0
22,0
202,0
Фундук
5,4
0,15
90,0
72,0
44,0
44,0
Акация
5,6
0,20
20,0
14,0
22,0
37,0
Береза
5,5
0,15
50,0
12,0
55,0
72,0
и роста наземных растений на простом, доступном в производст¬
венных условиях субстрате, в частности на верховом торфе. При
культивировании растений Cymbidium на верховом торфе они
развивались нормально, однако отставали в росте от растений,
выращиваемых на сфагновом мхе.
Таким образом, результаты проведенных опытов и многолет¬
них наблюдений дают возможность рекомендовать сфагновый
мох в качестве субстрата для выращивания сеянцев и растений-
регенерантов наземных орхидных. При отсутствии последнего
можно применять верховой торф как наиболее доступный в
производственных условиях материал. В последнее время в НБС
490
ГЛАВА 5. Постасептическая адаптация сеянцев и растений-регенерантов
ращивания и постасептической адаптации сеянцев и растений-регенерантов
Механический состав, % абсолютно сухой бескарбонатной навески
Объемная
масса, кг/л
Песок
Пыль
Ил
1,0-0,25
0,25-0,05
0,05-0,01
0,01-0,005
0,005-0,001
>0,001
0,17
—
—
—
—
—
—
0,22
—
—
—
—
—
—
0,32
38,71
24,83
11,12
6,39
9,20
9,75
0,94
39,35
20,15
12,53
5,48
13,54
8,95
0,77
10,12
17,29
11,47
6,74
14,60
9,78
ных видов лиственных деревьев
Компонент, мг/л (1 н НС1)
Са
Mg
S
Fe
Си
Zn
Mn
в
976,0
158,0
100,0
100,0
450,0
1,0
1530,0
508,0
25,0
75,0
—
—
400,0
2,0
366,0
98,0
175,0
50,0
—
—
100,0
—
1799,0
386,0
50,0
75,0
—
3,0
350,0
1,5
700,0
508,0
125,0
50,0
—
—
160,0
—
1698,0
354,0
100,0
75,0
—
—
40,0
0,1
НАН Украины при пересадке сеянцев и растений-регенерантов
используется субстрат, состоящий из сосновой коры, листьев ду¬
ба или березы, измельченных до фракции 0,3—0,5 см. Этот суб¬
страт является также дешевым и легкодоступным для промыш¬
ленного цветоводства.
Наряду с подбором субстратов для выращивания сеянцев и
растений-регенерантов очень важна разработка системы их ми¬
нерального питания. Молодые растения имеют низкую погло¬
щающую способность корневой системы, привыкшую к легко¬
доступным растворимым соединениям питательной среды в куль¬
туре in vitro. Как известно, питательные элементы в субстрате на¬
491
СПЕЦИАЛЬНАЯ ЧАСТЬ
ходятся в различном состоянии: часть элементов — в жидкой фа¬
зе, основное их количество — в составе нерастворимых комплек¬
сов. Последние недоступны для растений, поэтому необходимы
внекорневые подкормки. Учитывая состав питательной среды, на
которой произрастают растения, на первых этапах органогенеза
сеянцев мы использовали раствор веществ, входящих в питатель¬
ные среды Кнудсона и МС. Подкормку проводили 1 раз в неде¬
лю. Контролем служили сеянцы, опрыскиваемые водой. Уста¬
новлено, что наиболее интенсивный прирост листовой поверхно¬
сти сеянцев Phalaenopsis наблюдался при подкормке раствором
МС. Раствор Кнудсона, не содержащий микроэлементы, значи¬
тельно меньше влиял на рост и развитие сеянцев. Аналогичные
опыты проводили и с наземными видами орхидных — Cymbidium
и Calanthe: при применении внекорневых подкормок листья по¬
крываются налетом солей, вследствие чего снижается их фото-
синтетическая активность и уровень дыхания. В связи с этим ли¬
стья периодически необходимо очищать от этого налета.
Растения высаживают в маленькие цветочные горшки или
ящики, коробочки, миски, керамические и пластиковые цветоч¬
ные горшки или фосеты. Сразу после высадки в субстрат расте¬
ния очень чувствительны к влажности воздуха. Их следует регу¬
лярно сбрызгивать водой, распыляя ее. Однако увлажнение рас¬
тений является позитивным фактором лишь в случае сопутст¬
вующих оптимальных температур, которые для большинства
культур находятся в пределах 25—27 °С с небольшим снижением
на 2—3 °С ночью. Температурный режим культивирования дол¬
жен коррелировать с температурой мест их естественного произ¬
растания. Для тропических растений оптимальная температура
выращивания приближается к 27 °С, для большинства дру¬
гих составляет 25 °С.
Относительная влажность воздуха в помещениях для выращи¬
вания культур in vitro обычно поддерживается на уровне 65—
75 %. При пересадке в почву эти растения нуждаются в повы¬
шенной влажности, что достигается созданием в камерах атмо¬
сферы “тумана”.
ПРИЛОЖЕНИЯ
Приложение 1
Продолжительность периода прорастания семян и развития сеянцев
представителей некоторых видов семейства Orchidaceae Juss., сут
Вид
Начало
Образование
Высадка
прорастания
растений
в субстрат
Acacallis cyanea Lindl.
49
230
520
Лсатре multiflora Lindl.
70
146
326
Anguloa clowesii Lindl.
62
176
296
Anoectochilus dawsonianus Low.
57
251
534
A. roxburgii (Wall.) Lindl.
77
130
435
Arachnis lowii J.J. Smith
62
159
793
Arundina graminifolia (D.Don) Hochr.
33
140
350
Barkeria lindleyana Batem.
122
326
426
x Brassolaeliocattleya Malworth ’Orchid-
62
407
1018
glade'
x Brassolaeliocattleya Parador ’Diva'
59
300
595
x Brassolaeliocattleya Pastoral ’Innocense'
53
402
584
x Brassolaeliocattleya Golden Trails ’Rana'
59
350
621
Brassavola nodosa (L.) Lindl.
59
307
542
Bulbophyllum falcatum (Lindl.) Rchb.f.
25
204
284
B. grandiflorum Blume
91
198
342
Catasetum russelianum Hook.
51
125
254
Cattleyopsis lindenii (Lindl.) Cgn.
62
282
566
Coelogyne cristata Lindl.
21
82
184
C. lawrenceana Rolfe
25
95
202
C. viscose Rchb.f.
32
136
250
Cyrtochis arcuata (Lindl.) Schltr.
51
231
342
Doritis pulcherrima Lindl.
75
102
280
Eulophidium maculatum (Lindl.) Pfitz.
111
388
1040
E. decarianum (Rchb.f.) Pfitz.
91
254
438
Flickingeria fimbriata (Blume) Hawkes
65
450
580
Gongora galeata (Lindl.) Rchb.f.
30
58
372
x Laeliocattleya Amber Glow ’Magnificient'
235
571
762
Maxillaria nasuta Rchb.f.
164
504
572
493
ПРИЛОЖЕНИЯ
Окончание
Вид
Начало
прорастания
Образование
растений
Высадка
в субстрат
М. nigrescens Lindl.
160
385
470
Odontoglossum grande Lindl.
76
481
680
0. pulchellum Lindl.
60
243
500
Oeceoclades maculata Lindl.
91
249
593
Phaius australis F.Muell.
203
724
946
Ph. mishmensis Lindl. ex Paxt.
57
332
449
Ph. tankervilleae (Banks ex L’Her.) Blume
57
332
375
Polystachia affinis Lindl.
118
298
680
P. bracteosa Lindl.
162
350
720
P. grandiflora Lindl.
204
450
900
Psychopsiella limminghei Lindl.
32
250
457
Psychopsis kramerianum (Rchb.f.) H.G. Jones
25
225
1008
Pterostylis vittata Lindl.
33
313
575
Schomburgkia tibicinis Batem.
62
214
367
Thelymitra aristata Lindl.
33
192
304
Th. pauciflora R.Br.
34
181
257
Thunia marschalliana Rchb.f.
62
113
250
Vanilla planifolia Andrews
21
70
120
Zygopetalum mackaii Hook.
52
399
1080
Приложение 2
Продолжительность периода созревания плодов некоторых видов растений
семейства Orchidaceae Juss. в условиях оранжерей, сут
Вид
Созревание плодов, сут
Aerides fleldingii Jennings
150
Anguloa clowesii Lindl.
260
Anoectochilus sikkimensis King et Pantl
33
Bletilla striata (Thunb.) Rchb.f.
108
Brassavola nodosa Lindl.
122
Calanthe vestita Lindl.
90
Cattleya bowringiana Veitch
265
C. gaskelliana Rchb.f.
395
Cattleya hybr. hort.
290
C. intermedia Graham ex Hook.
286
Coelogyne mooreana Sander ex Rolfe
134
C. speciosa (Blume) Lindl.
361
Cymbidium hybr. hort.
245
Dendrobium formosum Lindl.
274
D. kingianum Bidwill ex Lindl.
138
494
ПРИЛОЖЕНИЯ
Окончание
Вид
Созревание плодов, сут
D. nobile Lindl.
290
D. phalaenopsis Fitzg.
165
Epidendrum radicans Pav. ex Lindl.
51
Gongora quinquenervis Ruiz et Pav.
137
Laelia anceps Lindl.
121
L. gouldiana Rchb.f.
120
L. lobata (Lindl.) Veitch
175
L. lundii Rchb.f. et Warm.
350
L. mantiquierae Pabst.
307
L. purpurata Lindl. et Paxt.
220
L. sincorana Schltr.
195
Ludisia discolor (Ker.—Gawl.) A.Rich.
62
Odontoglossum pulchellum Batem.
132
Paphiopedilum appletonianum (Gower) Rolfe
304
P. callosum (Rchb.f.) Stein
333
P. delenatii Guill.
327
P. helenae Aver.
310
P. insigne (Wall, ex Lindl.) Pfitz.
370
P. lawrenceanum (Rchb.f.) Pfitz.
255
P. malipoense S.C. Chen et Z.H. Tsi
294
P. purpuratum (Lindl.) Stein
355
P. villosum (Lindl.) Stein
304
Phaius flavus (Blume) Lindl.
215
Phalaenopsis amabilis (L.) Blume
124
Ph. lueddemanniana Rchb.f.
101
Pleione formosana Hayata
170
Stanhopea insignis Frost
212
S. tigrina Batem. ex Lindl.
270
Tainia penangiana Hook.f.
69
Vanda tricolor Lindl.
297
СЛОВАРЬ ТЕРМИНОВ
АБЕРРАЦИИ — отклонения от нормы в морфологии и фи¬
зиологии.
АБИОТИЧЕСКИЕ ФАКТОРЫ — совокупность физических
и химических факторов, формирующих среду обитания ор¬
ганизма.
АВТОЛИЗ — расщепление отдельных органов, тканей или
клеток организма под влиянием его же ферментов.
АВТОТРОФЫ — организмы, способные самостоятельно
синтезировать органические вещества из углекислоты, воды
и минеральных солей с использованием энергии солнечного
света (фотосинтез) или химических превращений (хемосин¬
тез). К автотрофам относятся все зеленые наземные расте¬
ния, которые содержат фотосинтетические пигменты, хемо-
трофные водные и грунтовые бактерии.
АДАПТАЦИЯ - совокупность возникших в процессе эво¬
люции приспособлений в строении и функциях организмов
к определенным условиям существования, обусловливаю¬
щих возможность существования отдельных индивидуумов
и сохранение вида.
АДВЕНТИВНЫЕ ОРГАНЫ — дополнительные органы рас¬
тений, которые развиваются в нехарактерных для них мес¬
тах (адвентивные почки на стеблях и листьях и т. п.).
АДВЕНТИВНЫЕ ПОЧКИ — почки, возникшие в нетипич¬
ных местах из тканей растений, обычно их не образующих.
АНДРОГЕНЕЗ — образование эмбриоидов из микроспор.
АНЕУПЛОИД - организм (ядро, клетка) с количеством
хромосом, отклоняющимся от ЛГ и от чисел, кратных X.
АПЕКС — активно функционирующий ростовой центр, со¬
стоящий из группы меристематических клеток (корня или
496
СЛОВАРЬ ТЕРМИНОВ
стебля), который обеспечивает формирование всех органов и первичных тка¬
ней побега — органо- и гистогенез. Источником постоянного самообновле¬
ния апекса являются инициальные клетки апикальной меристемы, сосредо¬
точенные в терминальной меристеме. В апексе происходят формообразо¬
вательные процессы, он обеспечивает рост органов в длину.
АПИКАЛЬНОЕ ДОМИНИРОВАНИЕ — явление, при котором верхушечная
почка подавляет развитие латеральных (пазушных) меристем побега.
АПИКАЛЬНЫЙ (ВЕРХУШЕЧНЫЙ) КОНЕЦ- морфологически верхний
конец органа или растения.
АТТРАГИРУЮЩИЙ ЭФФЕКТ — свойство растительных тканей, обогащен¬
ных ауксинами, притягивать воду и растворенные в ней питательные веще¬
ства.
АУКСИНЫ — фитогормоны, преимущественно индольной природы; индо-
лил-3-уксусная кислота и ее производные активируют рост отрезков колеоп-
тилей, стеблей и корней, вызывают их изгибы, а также стимулируют образо¬
вание корней у черенков растений и растяжение клеток, активируют дея¬
тельность камбия, влияют на рост боковых побегов и корней, на опадание
листьев и плодов.
БИОГЕННЫЕ ЭЛЕМЕНТЫ — химические элементы, постоянно входящие
в состав организмов, без которых их существование невозможно. К ним от¬
носятся кислород, азот, водород, углерод, кальций, фосфор, сера и др.
БИОТЕХНОЛОГИЯ - наука, изучающая биологические процессы с целью
их практического применения. Использует культуры клеток бактерий, дрож¬
жей, животных или растений, метаболизм и биосинтетические возможности
которых обеспечивают выработку специфических веществ.
БИОТЕХНОЛОГИЯ РАСТЕНИЙ — совокупность методов культуры клеток
и тканей растений с методами молекулярной биологии и техникой рекомби¬
нантных ДНК, основанных на тотипотентности растительных клеток, их
способности к генетической трансформации и модификации. Применяется
для создания и массового воспроизводства редких растений и растений с
уникальными хозяйственно полезными свойствами, а также для производст¬
ва в искусственных условиях растительной биомассы, продуцирующей веще¬
ства, искусственный химический синтез которых невозможен.
ВЕГЕТАТИВНОЕ (БЕСПОЛОЕ) РАЗВИТИЕ - воспроизведение потомства
из соматических клеток родительского растения, входящих в состав специа¬
лизированных органов — клубней, луковиц, корневищ, а также черенков,
фрагментов органов и изолированных тканей.
ВЕГЕТАТИВНОЕ РАЗМНОЖЕНИЕ — размножение растений неполовым
путем — частями таллома, отдельными органами, частями вегетативных ор¬
ганов или специальными вегетативными образованиями (выводковые почки,
497
СЛОВАРЬ ТЕРМИНОВ
клубни луковицы). В его основе лежит способность растений к регенерации.
Выделяют естественное (в природе) и искусственное (при участии человека)
вегетативное размножение.
ВИТРИФИКАЦИЯ — физиологические нарушения, которые происходят в
тканях растений, культивируемых in vitro, и обусловлены дисбалансом мине¬
рального питания и водного режима. При этом ткани приобретают стекло¬
видный внешний вид, изменяется их морфологическая структура.
ВРЕМЯ УДВОЕНИЯ ПОПУЛЯЦИИ — интервал времени, за который коли¬
чество клеток в популяциях увеличивается вдвое.
ГАПЛОИД — организм (ядро, клетка), характеризующийся половинным на¬
бором хромосом, свойственным виду.
ГЕНЕРАТИВНОЕ (ПОЛОВОЕ) РАЗМНОЖЕНИЕ - воспроизведение по¬
томства половым путем в результате слияния половых клеток (гамет) двух
родительских форм. У цветковых растений генеративное размножение осу¬
ществляется в процессе цветения и последующего образования семян.
ГИББЕРЕЛЛИНЫ — фитогормоны, преимущественно производные флуо-
ренового ряда. Гибберелловая кислота и другие соединения этой группы ин¬
дуцируют активный рост стеблей растений и образование партенокарпиче-
ских плодов, нарушают период покоя у многих растений, а также индуциру¬
ют цветение длиннодневных растений.
ГИБРИД — организм или клеточная линия, возникшие в результате скре¬
щивания генетически различных родительских форм.
ГИБРИДИЗАЦИЯ — процесс, приводящий к появлению гибридов.
ГОРМОНОНЕЗАВИСИМЫЕ КУЛЬТУРЫ — культуры, которые теряют по¬
требность в определенных группах экзогенных гормонов или перестают
реагировать на их наличие.
ДЕДИФФЕРЕНЦИАЦИЯ - переход дифференцированных, неделящихся
клеток к пролиферации новых поколений клеток без признаков специализа¬
ции, присущих родительским формам, в результате чего формируется каллусная
ткань. Индукторами могут выступать различные факторы окружающей среды
(как биотические, так и абиотические).
диплоид - организм (ядро, клетка), характеризующийся двойным гомоло¬
гичным набором хромосом, характерным для данного вида (символ 2л).
ДИФФЕРЕНЦИАЦИЯ - комплекс процессов, приводящих к структурным
и функциональным различиям между дочерними клетками, а также между
материнскими и дочерними клетками. В результате дифференциации образуют¬
ся клетки или ткани.
ДИФФЕРЕНЦИРОВКА — специализация клеток различных тканей в ходе
онтогенеза, вызванная экспрессией определенной генетической программы и
498
СЛОВАРЬ ТЕРМИНОВ
приводящая к возникновению структурных и функциональных особенностей
клеток.
ИЗОЛИРОВАННЫЙ ПРОТОПЛАСТ — растительная клетка, лишенная кле¬
точной стенки.
ИНГИБИТОРЫ РОСТА - соединения, подавляющие такие ростовые про¬
цессы, как прорастание семян и распускание почек. К природным ингиби¬
торам относятся соединения гормонального типа — абсцизовая кислота
(АБК) и ее аналоги, этилен, а также негормональные ингибиторы фенольной
(кумарин, салициловая кислота, нарингенин и др.) и терпеноидной (порту-
лал, кукурбитацин, подолактон) природы.
ИНГИБИТОРЫ ЦВЕТЕНИЯ — вещества, образующиеся в растении и спо¬
собные передвигаться к стеблевым почкам, в которых они замедляют или
полностью предотвращают образование цветочных зачатков, т. е. тормозят
цветение.
ИНИЦИАЛЬНЫЕ КЛЕТКИ - клетки меристем с неограниченной способ¬
ностью к делению.
ИНОКУЛЮМ - часть суспензионной культуры, которая используется для
субкультивирования.
ИНТЕРФАЗА (ВРЕМЯ ГЕНЕРАЦИИ КЛЕТКИ) — интервал между последо¬
вательными клеточными делениями.
КАЛЛУС — ткань, возникшая in vivo и in vitro путем активной неорганизо¬
ванной пролиферации клеток растений и эксплантов и состоящая из недиф¬
ференцированных и дифференцированных клеток; чаще всего образуется в
местах повреждения или в стерильной культуре in vitro. Может возникать из
любого органа семенных растений, у высших споровых растений образуется
редко.
КАРИОТИП — набор хромосом, характерных для данного вида.
КЛЕТОЧНАЯ СЕЛЕКЦИЯ — метод выделения мутантных клеток в селек¬
тивных условиях.
КЛОН — культура, возникшая от одной клетки.
КЛОНАЛЬНОЕ РАЗМНОЖЕНИЕ (МИКРОРАЗМНОЖЕНИЕ) - массовое
бесполое размножение растений из одной клетки с применением клеточной
культуры, при котором возникшие формы генетически идентичны исходно¬
му экземпляру.
КЛОНИРОВАНИЕ - получение клона или потомства одного растения при
его вегетативном размножении. Обеспечивает массовое размножение уни¬
кального генотипа и поэтому является важнейшим методом прикладного
растениеводства. При клонировании создается возможность выращивания
потомков одной особи с идентичной наследственностью.
499
СЛОВАРЬ ТЕРМИНОВ
КУЛЬТУРА АВТОТРОФНАЯ - культура, которая не зависит от внешних
источников органических веществ, так как создает собственные органиче¬
ские компоненты из неорганических составляющих.
КУЛЬТУРА ГЕТЕРОТРОФНАЯ — культура, которая зависит от одного или
нескольких источников органических веществ.
КУЛЬТУРА ЗАРОДЫШЕЙ — метод асептического выращивания на пита¬
тельной среде незрелых или зрелых изолированных зародышей.
КУЛЬТУРА ЗИГОТИЧЕСКИХ ЗАРОДЫШЕЙ - см. культура зародышей.
КУЛЬТУРА ИЗОЛИРОВАННЫХ ПРОТОПЛАСТОВ - метод выращивания
растительных клеток, лишенных клеточных стенок, в жидкой или на ави¬
зированной среде, содержащей в качестве дополнительного компонента ос¬
мотически активное вещество (стабилизатор) в оптимальной для данного
вида концентрации. При регенерации стенок изолированные протопласты
превращаются в культуру клеток.
КУЛЬТУРА КАЛЛУСНЫХ ТКАНЕЙ (КУЛЬТУРА ТКАНЕЙ) - метод вы-
ращивания в длительной пересадочной культуре тканей, возникших в ре¬
зультате пролиферации клеток изолированных сегментов разных органов
или самих органов (пыльники, семяпочки и т. д.). Термин “культура тка¬
ней растений” охватывает многие типы асептических культур, в том числе кал-
лусные культуры, получаемые из сегментов или частей различных органов рас¬
тения и выращиваемые на агаризированной среде, а также суспензионные куль¬
туры, представляющие собой единичные клетки или небольшие клеточные аг¬
регаты, остающиеся дисперсными во время роста в жидкой среде.
КУЛЬТУРА КЛЕТОК (СУСПЕНЗИОННАЯ КУЛЬТУРА) - метод выращи¬
вания отдельных клеток или небольших групп во взвешенном состоянии в
жидкой среде с использованием аппаратуры, обеспечивающей их аэрацию и
перемешивание питательного раствора.
КУЛЬТУРА КОРНЕЙ — метод асептического выращивания на искусствен¬
ной питательной среде в пересадочном режиме изолированных корней.
КУЛЬТУРА МЕРИСТЕМ — метод асептического выращивания на питатель¬
ной среде изолированного из апекса или пазушной почки участка конуса
нарастания с 1 или 2 листовыми примордиями.
КУЛЬТУРА ОДИНОЧНЫХ КЛЕТОК — метод выращивания одиночных кле¬
ток при низкой плотности высева на очень обогащенных питательных средах
с помощью культуры-“няньки” или питающего слоя.
КУЛЬТУРА ОПУХОЛЕВЫХ ТКАНЕЙ - метод выращивания в длительной
культуре тканей, изолированных из растительных опухолей разного проис¬
хождения и освобожденных от патогенов, индуцировавших развитие опу¬
холи.
500
СЛОВАРЬ ТЕРМИНОВ
КУЛЬТУРА ОРГАНОВ - метод асептического выращивания изолирован¬
ных корней, стеблевых апексов, листовых примордиев, зародышей частей
цветка и плодов. Культура пыльников при этом может рассматриваться
двояко. Случаи, при которых микроспоры дают начало эмбриоидным структу¬
рам (андрогенез) или каллусной ткани, не относятся к культуре органов,
но при создании условий для нормального прохождения пыльником свой¬
ственных ему стадий развития эта система может считаться культурой ор¬
гана.
КУЛЬТУРА ТКАНЕЙ- экспериментальный метод выращивания клеток,
тканей и органов, изолированных от растения, на искусственных питатель¬
ных средах in vitro.
КУЛЬТУРА ТРАНСГЕННЫХ (“БОРОДАТЫХ”) КОРНЕЙ — метод выращи¬
вания корней, полученных внесением Ri-плазмиды в геном клетки, которая
дает начало интенсивно ветвящимся трансформированным корням.
КУЛЬТУРА ЭКСПЛАНТОВ — метод выращивания в асептических услови¬
ях на питательных средах различных фрагментов тканей или органов рас¬
тений.
ЛЕЙКОЭМБРИОФИТЫ — растения, в зародыше которых хлоропласты не
формируются ни на одной из фаз эмбриогенеза.
ЛИНИЯ — культура с маркерными признаками, полученная из штамма в
результате селекции или клонирования.
МАКРОЭЛЕМЕНТЫ — химические элементы, которые усваиваются расте¬
ниями в значительных количествах. Их содержание выражается величинами
от десятков процентов до сотых долей процента.
МЕРИСТЕМА — группа активно делящихся клеток на кончике корня, стеб¬
ля, в интеркалярном камбии, почке, листе или цветке. Клетки меристемы
долго сохраняют способность к делению. Благодаря меристематическим тка¬
ням реализуются ростовые потенции растительного организма.
МИКРОЧЕРЕНОК — участок побега пробирочного растения, представлен¬
ный, как правило, одним междоузлием с пазушной почкой в верхней его
части. Используется как промежуточный эксплант в ходе клонального раз¬
множения in vitro многих культур.
МИКРОЧЕРЕНКОВАНИЕ — черенкование преимущественно участками
стебля растений-регенерантов в условиях культуры in vitro.
МОНОПЛОИД — организм (ядро, клетка), характеризующийся основным
количеством хромосом в полиплоидной серии (символ X).
МОРФОГЕНЕЗ — развитие форм и структур, присущих данному виду или
клону растений, размножаемых in vitro, в процессе их регенерации из экс¬
плантов или каллусной ткани.
501
СЛОВАРЬ ТЕРМИНОВ
МУТАЦИЯ — изменение генетической конституции клеток вследствие пере¬
стройки ДНК ядер и органелл, изменения структуры хромосом или путем
полиплоидии.
НЕКРОЗ — омертвение какого-либо органа или его части под воздействием
различных факторов.
ОРГАНОГЕНЕЗ IN VITRO — образование органов в культуре тканей и кле¬
ток de novo, а не из предшествующих инициалей, корней и почек.
ПАРАСЕКСУАЛЬНАЯ (СОМАТИЧЕСКАЯ) ГИБРИДИЗАЦИЯ- система,
вовлекающая в генетическую рекомбинацию ядра и органеллы вне поло¬
вого цикла, например, путем слияния изолированных протопластов. Приво¬
дит к появлению соматических гибридов — растений и гибридных клеточ¬
ных линий.
ПАРТИКУЛЯЦИЯ - один из видов вегетативного размножения растений,
который часто приводит к распаду их на части — партикулы. Партикулы
представляют собой структурные модули (или их системы), перешедшие к
автономному существованию. При партикуляции от растительного организ¬
ма отделяются структуры или части, морфологически четко обособленные и
способные к самостоятельному существованию и развитию.
ПОЛИПЛОИД — организм (ядро, клетка), характеризующийся умноженным
основным количеством хромосом (символ ЗХ, 4Х и т. д.).
ПОПУЛЯЦИЯ КЛЕТОК - совокупность культивируемых клеток, характе¬
ризуемая общим происхождением, строением и функцией.
ПРОЛИФЕРАЦИЯ — образование новых клеток и тканей путем размноже¬
ния уже существующих.
ПРОТОПЛАСТ - растительная клетка, полностью лишенная клеточной
стенки и имеющая только клеточную мембрану.
ПСЕВДОДИПЛОИД — организм (ядро, клетка), характеризующийся дипло¬
идным количеством хромосом и отличающийся от зиготы данного вида по
кариотйпу.
ПЦР- полимеразная цепная реакция. Эффективна для диагностики мико-
плазменной контаминации культур клеток.
РАФИДЫ - игольчатые, заостренные на обоих концах кристаллы оксалата
кальция. Чаще всего встречаются в клетках активно растущих частей
растений (меристемы, субэпидермальные и эпидермальные слои покровных
тканей растений). В клетках локализованы пачками (в виде стопок).
РЕГЕНЕРАЦИЯ — восстановление организмом утраченных или поврежден¬
ных органов и тканей либо возобновление целого организма из его частей
(соматический эмбриогенез, вегетативное размножение).
502
СЛОВАРЬ ТЕРМИНОВ
РЕГУЛЯТОРЫ РОСТА — органические соединения, вызывающие стимуля¬
цию или ингибирование процессов роста и развития растений. К ним отно¬
сятся как природные вещества, так и синтетические препараты, применяе¬
мые в практике растениеводства.
РЕДИФФЕРЕНЦИАЦИЯ - переход специализированных клеток из одного
состояния дифференцировки в другое методом деления или без.
РЕПАТРИАЦИЯ — один из приемов сохранения генофонда природной фло¬
ры и восстановления продуктивности естественного растительного покрова
путем возвращения аборигенных видов в места их произрастания. Различают
несколько типов: географическая, экологическая, фитоценотическая.
РЕЦЕССИВНЫЙ ПРИЗНАК - генетически обусловленный признак, про¬
являющийся в диплоидной клетке или организме при условии, что оба на¬
бора хромосом несут данные гены.
РИЗОИДЫ - одноклеточные образования на базальной части растений
(преимущественно низших), с помощью которых они прикрепляются к суб¬
страту и поглощают воду и питательные вещества из почвы.
РОСТОВОЙ ЦИКЛ — рост популяции клеток в цикле периодического вы¬
ращивания, характеризующийся сигмоидальной кривой. Различают следую¬
щие фазы: латентная, экспоненциальная, замедление роста, стационарная,
деградация.
РОСТОВЫЕ ВЕЩЕСТВА — органические вещества, стимулирующие рост
растений: фитогормоны (ауксины, гиббереллины, цитокинины) и природные
соединения негормональной природы (некоторые фенолы, производные мо¬
чевины, витамины и др.).
СОМАКЛОНАЛЬНЫЕ ВАРИАЦИИ И ВАРИАНТЫ - фенотипическое вы¬
ражение непостоянства ядерного и органелльных геномов и растительных
клеток. От истинных генных мутаций отличаются большей частотой возник¬
новения и комплексностью (изменение в структуре генов, хромосом, гено¬
мов).
СИНТЕТИЧЕСКИЕ ИНГИБИТОРЫ РОСТА- препараты, используемые
для угнетения роста растений: ретарданты, подавляющие рост стеблей (ССС,
AMO-1618, В-9); антиауксины (трийодбензойная кислота, дихлоранизол
нафтилметилпропиновая кислота и др.); морфактины, нарушающие процес¬
сы морфогенеза (флуоренол, хлорфлуоренол); парализаторы роста (гидразид
малеиновой кислоты и др.).
СЛИЯНИЕ ИЗОЛИРОВАННЫХ ПРОТОПЛАСТОВ - формирование одной
клетки из двух и более вследствие объединения их поверхностных мембран.
СОМАТИЧЕСКАЯ ГИБРИДИЗАЦИЯ - см ПАРАСЕКСУАЛЬНАЯ ГИБРИ¬
ДИЗАЦИЯ.
503
СЛОВАРЬ ТЕРМИНОВ
СОМАТИЧЕСКИЙ ГИБРИД — растение, полученное путем гибридизации
изолированных протопластов.
СОМАТИЧЕСКИЙ ЭМБРИОГЕНЕЗ — процесс образования зародышепо¬
добных структур (эмбриоидов) в культуре тканей и клеток путем, напоми¬
нающим нормальный зиготический эмбриогенез.
СУБКУЛЬТИВИРОВАНИЕ — перенос клеток, тканей, растений-регенеран¬
тов, сеянцев в другой культуральный сосуд на свежую питательную среду.
СУБПРОТОПЛАСТ — изолированный протопласт, утративший часть цито¬
плазмы и органоидов, но сохранивший ядро.
ТОКСИНЫ — группа веществ бактериального, растительного, животного или
синтетического происхождения, которые вызыйают патологические измене¬
ния в структуре и функциях клеток, тканей и организмов, вплоть до леталь¬
ного исхода.
ТОТИПОТЕНТНОСТЬ — потенциальное свойство любой клетки организма
регенерировать целостный организм на основе собственной генетической
информации в определенных условиях среды.
ТРАНСГЕНОЗ — перенос любым способом чужеродных генов в клетки рас¬
тений.
ТРАНСПЛАНТ — часть каллусной культуры, используемая для пересадки на
свежую среду.
ТУРГОР — напряженное состояние клеточной оболочки, обусловленное на¬
сыщенностью клетки влагой.
ФАСЦИАЦИЯ — утончение листьев и побегов, их рассечение.
ФИТОГОРМОНЫ — природные регуляторы роста. Известно 5 типов: аук¬
сины, гиббереллины и цитокинины (стимуляторы), а также абсцизовая ки¬
слота и этилен (ингибиторы).
ФИТОНЦИДЫ — биологически активные вещества высших растений, ока¬
зывающие бактерицидное или бактериостатическое действие. Большинство
имеют летучие фракции и действуют на расстоянии (чеснок, лук, хрен, грец¬
кий орех, сосна и т. п.). У растений выполняют защитную функцию.
ХАЛАЗА — основание семязачатка, от которого отрастают интегументы и
которым он крепится к семяножке.
ЦИБРИД — растение, полученное при слиянии изолированного протопласта
с цитопластом, протопластом с инактивированным ядром или с энуклеиро-
ванным протопластом.
ЦИКЛ ВЫРАЩИВАНИЯ — период от внесения инокулюма или трансплан-
та в свежую среду до последующего субкультивирования.
504
СЛОВАРЬ ТЕРМИНОВ
цитокинины - группа фитогормонов (природных или синтетических),
которые индуцируют деление клеток, формирование адвентивных почек и
побегов, а также, в большинстве случаев, ингибируют образование адвентив¬
ных корней. Цитокинины усиливают апикальное доминирование, способст¬
вуют закладке адвентивных почек у растений и в культуре изолированных
растительных тканей.
ЧЕРЕНКОВАНИЕ — способ вегетативного размножения с помощью стебле¬
вых, листовых и корневых черенков.
ШТАММ — культура, возникшая после первого субкультивирования. Со¬
стоит из многих клеточных линий, полученных из клеток первичной культу¬
ры. Этот термин широко применяется при культивировании микроорганиз¬
мов.
ЭКСПЛАНТ — фрагмент ткани или органа, культивируемый в асептических
условиях in vitro с целью индукции морфогенеза или для получения первич¬
ного каллуса.
ЭНДОМИТОЗ — форма митоза, при которой имеет место образование хро¬
мосом, однако их расхождение происходит внутри ядра с сохранением ядер-
ной оболочки и без формирования веретена деления клетки.
ЭПИГЕНЕТИЧЕСКИЕ ВАРИАЦИИ — фенотипическое выражение диффе¬
ренциальной активности генов. От мутаций и сомаклональных вариаций
отличаются тем, что не сохраняются в цикле клетка—растение—клетка.
ЭУПЛОИД — организм (ядро, клетка) с количеством хромосом, кратным X.
ЮВЕНИЛЬНОСТЬ — возрастное состояние в период до начала цветения,
при котором растения способны к усиленному формированию вегетативных
органов.
ЮВЕНИЛЬНЫЕ РАСТЕНИЯ — растения, которые пребывают на ранних
стадиях своего развития (до формирования органов размножения).
EX VITRO — перевод растений в асептические условия и дальнейшая их
адаптация.
IN VITRO — выращивание растительных объектов в стеклянной посуде (про¬
бирке, колбе, биореакторе) на искусственных питательных средах в асепти¬
ческих условиях.
СПИСОК ЛИТЕРАТУРЫ
Абраменко Н.И. Культура верхушечных меристем неко¬
торых растений для оздоровления их от вирусной инфек¬
ции // Вирусы и вирусные болезни растений. — Киев.: На¬
ук. думка, 1974. — С. 181 — 184.
Аветисов Л Л., Клюева Г. Э., Овчинников Ю. В. Каладиум
in vitro // Цветоводство. — 1990. — № 6. — С. 17.
Андреев JI.H., Горбунов Ю.Н. Роль ботанических садов
России в сохранении биологического разнообразия рас¬
тений // Материалы 3-й Междунар. науч. конф. “Био¬
логическое разнообразие. Интродукция растений”. — СПб,
2003. - С. 5-7.
Андронова Е.В. Эмбриогенез и постсеменное развитие
орхидных (на примере Dactylorhiza baltica, D. incarnata,
Thunia marschalliana, Bletilla striata)'. Дис. ... канд. биол. на¬
ук. -Л., 1988. - 225 с.
Андронова Е.В., Батыгина Т.Б., Васильева Е.В. Прото¬
корм // Эмбриология цветковых растений. Термино¬
логия и концепции / Под ред. Т.Б. Батыгиной. — СПб.:
Мир и семья, 2000. — С. 324—329.
Андронова Е.В., Куликов П.В., Филиппов Е.Г. и др. Про¬
блемы и перспективы семенного размножения орхидных
умеренной зоны // Эмбриология цветковых растений.
Терминология и концепции / Под ред. Т.Б. Батыги¬
ной. — СПб.: Мир и семья, 2000. — С. 513—524.
Барыкина Р.П. Партикуляция // Эмбриология цветко¬
вых растений. Терминология и концепции / Под ред.
Т.Б. Батыгиной. — СПб.: Мир и семья, 2000. — С. 306—310.
Батыгина Т.Б. Генетическая гетерогенность семян //
Эмбриология цветковых растений. Терминология и
концепции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и
семья, 2000а. — С. 397—406.
Батов С.Г. Культура кактусов. — М.: Слог-Прес-Спорт,
2001. - 432 с.
Батыгина Т.Б. Семя и семенное размножение // Эмб¬
риология цветковых растений. Терминология и концеп¬
ции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и семья,
20006. - С. 246 -252.
506
СПИСОК ЛИТЕРАТУРЫ
Батыгина Т.Б., Андронова Е.В. Есть ли семядоля у орхидных? // Докл.
АН СССР. - 1988. - 4, № 30. - С. 1017-1019.
Батыгина Т.Б., Бутенко Р. Г. Морфогенетические потенции зародыша
покрытосеменных растений (на примере представителей рода Paeonia сем.
Paeoniaceae) // Ботан. журн. — 1981. — 66, № 11. — С. 1531 — 1548.
Батыгина Т.Б., Васильева В.Е. Система воспроизведения у орхидных //
Охрана и культивирование орхидей: Тез. докл. — Таллин, 1980. — С. 107—110.
Батыгина Т.Б., Васильева В.Е. Развитие зародыша и проростка некото¬
рых орхидных // Охрана и культивирование орхидей. — Киев: Наук, думка,
1983. - С. 73-75.
Батыгина Т.Б., Шевцова Г.Г. Метаморфоз в онтогенезе орхидных // Бо¬
тан. журн. — 1985. — 70, № 12. — С. 1614—1621.
Бебин С.И., Синха Р., Талис В.К. Разнокачественность семян у зернобо¬
бовых культур в зависимости от метеорологических факторов и местополо¬
жения плодов //Докл. Темиряз. с.-х. академии. — 1969. — 152. — С. 65—69.
Белоус Ю.Н. Суккуленты. — М.: ЭКСМО; Донецк: СКИФ, 2003. — 303 с.
Белоусова Л.С., Денисова Л.В. Редкие растения мира. — М.: Лесн. пром-
сть, 1983. — 339 с.
Белоусова Л.С., Денисова Л.В., Никитина С.В. Редкие растения мира и их
охрана. — М.: ВНИИТЭИагропром, 1986. — 67 с.
Бернье Ж., Кине Ж.-М., Сакс Р. Физиология цветения. Переход к репро¬
дуктивному развитию. — М.: Агропромиздат, 1985. — Т. 2. — 317 с.
Бобров А.Е., Вислоух В.И., Молодкина О.А. и др. Тропические и субтро¬
пические растения в оранжереях Ботанического института АН СССР. — Л.:
Наука, 1973. — 275 с.
Болховских З.В., Гриф В.Г., Захарьева О.И. и др. Хромосомные числа
цветковых растений. — Л.: Наука, 1969. — 927 с.
Борисенко Т.И. Кактусы. — Киев: Наук, думка, 1986. — 287 с.
Бутенко Р.Г. Культура изолированных тканей и физиология морфогене¬
за растений. — М.: Наука, 1964. — 272 с.
Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнология
на их основе: Учеб. пособие. — М.: УБК-Пресс, 1999. — 160 с.
Бутенко Р.Г. Гибридизация соматических клеток растений// Молекуляр¬
ные механизмы генетических процессов. — М.: Наука. — 1979. — С. 43—89.
Бутенко Р.Г. Изолированные протопласты растений — объект и модель
для физиологических исследований // Культура клеток растений. — М.:
Наука, 1981. - С. 69-85.
Бутенко Р.Г. Экспериментальный морфогенез и дифференциация в
культуре клеток растений. — М.: Наука, 1975. — 50 с.
Бутенко Р.Г., Холодова В.П., Урманцева В.В. Закономерности роста и не¬
которые корелляции между ростом и содержанием сахаров в клетках культу¬
ры ткани сахарной свеклы // Физиология растений. — 1972. — 19, вып. 5. —
С. 926-936.
Буюн Л.И. Биология развития Calanthe vestita Lindl (Orchidaceae Juss.) в
условиях культуры: Автореф. дис. ... канд. биол. наук. — Киев, 1986. — 26 с.
Буюн Л.И., Будак В.Е. Ювенильное развитие Calanthe vestita Lindl. //
III Всесоюз. совещ. “Охрана и культивирование орхидей”: Тез докл. — М.:
Наука, 1986. - С. 68-70.
Буюн Л.И., Ковальская Л.А., Лаврентьева А.Н. Клональное микрораз¬
множение Phalaenopsis amabilis Bl. // Междунар. науч. конф. по культуре тка¬
ней: Тез. докл. — Алма-Ата, 1993. — С. 207.
507
СПИСОК ЛИТЕРАТУРЫ
Буюн JI.L, Ковалъсъка Л.А., Лаврентьева А.М. Перспективи охорони ех
situ рщкюних витв тротчних орхщей // Матер1али 1УПжнар. наук, конф.,
присвяч. 135-р1ччю ботан. саду Одес. нац. ун-ту iM. 1.1. Мечшкова. —
Одеса, 2002. - Ч. 1. - С. 62-65.
Вальтер Т. Растительность Земного шара. Эколого-физиологическая ха¬
рактеристика // Тропические и субтропические зоны. — М.: Прогресс,
1968. - 502 с.
Васильева О.Г., Александрова М.С. Биологические основы клонального
микроразмножения и регенерация интродуцированных видов рододендрона
in vitro // Бюл. Гл. ботан. сада. — 2005а. — Вып. 189. — С. 252—259.
Васильева О.Г., Александрова М.С. Опыт клонального микроразмножения
и регенерация рододендронов in vitro // Материалы Междунар. конф., посвя¬
щен. 60-летию Гл. ботан. сада им. Н.И. Цицина. — М., 20056. — С. 81—83.
Васильченко И.Т. Неотенические изменения у растений. — М; Л.: Наука,
1965. - 84 с.
Вахромеева М.Г., Денисова Л.В., Никитина С.В. и др. Орхидеи нашей
страны. — М.: Наука, 1991. — 221 с.
Вечерина Н.А., Таварткиладзе O.K., Кутубидзе В.В. Пролиферация и
морфогенетический потенциал стеблевого каллуса чайного растения сорта
'Колхида' // Субтроп, культуры. — 1990. — № 6. — С. 54—60.
Винклер Г.Н., Бутенко Р.Г., Лайнгер Б.Б. Применение метода культуры
изолированных тканей для освобождения картофеля от вирусной инфек¬
ции // Вирусы и вирусные инфекции растений. — Киев: Наук, думка,
1974. - С. 67-71.
Волошина Д.А., Головкина Г.И. Культура тканей юкк и агав и содержание
в них сомагенинов // Сб. науч. тр. ВНИИ лекарств, растений. — 1975. —
Вып. 7. - С. 158-160.
Высоцкий В.А. Регенерационная способность изолированных меристема-
тических верхушек черной смородины и вишни и методы получения из них
целых растений. — Л.: ВИР, 1978. — 12 с.
Глеба Ю.Ю., Бутенко Р.Г., Сытник КМ. Слияние протопластов и пара-
сексуальная гибридизация у Nicotiana tabacum L. // Докл. АН СССР. —
1975. - 221, №5. - С. 196-1198.
Глоба-Михайленко И.Д. Использование метода культуры ткани в цитру¬
соводстве // Субтроп, культуры. — 1983. — № 3. — С. 105—111.
Головкин Б.Н., Чеканова В.Н., Шахова Г.И. и др. Комнатные растения. —
М.: Лесн. пром-сть, 1989. — С. 340—343.
Гутман Т.С., Ширяева Г.А. Новый способ выращивания культуры изоли¬
рованных тканей высших растений // Растит, ресурсы. — 1980. — 16, № 4. —
С. 601-606.
Демидов А. С. К методике изучения орхидных на основе эколого-геогра-
фических сопоставлений // Охрана и культивирование орхидей. — Киев:
Наук, думка, 1999. — С. 15—17.
Демидов А.С., Коломейцева ГЛ. Пути и методы сохранения представителей
семейства Orchidaceae Juss // Интродукция растений. — 2004. —N° 1. — С. 13—19.
Денисьевская Н.А., Богатырь В.Б. Коллекция ароидных как источник
расширения ассортимента растений для фитодизайна // Коллекционные
фонды тропических и субтропических растений закрытого грунта и пробле¬
мы фитодизайна: Тез. докл. — Донецк, 1985. — С. 23—24.
508
СПИСОК ЛИТЕРАТУРЫ
Денисьевская Н.А., Лаврентьева А.Н. Особенности клонального микро¬
размножения растений семейства ароидных // Там же. — 1994. — Вып. 3. —
С. 42-45.
Денисьевская Н.Л., Майко Т.К., Кушнир Г.П. Значение эндогенных факто¬
ров при микроразмножении антуриума Андре // Интродукция и акклимати¬
зация растений. — 1988. — Вып. 9. — С. 66—70.
Джексон П.В. Анализ коллекций и научно-технической базы ботаниче¬
ских садов // Бюл. отд-ния Междунар. совета ботан. садов по охране расте¬
ний. - 2001. - Вып. 12. - С. 59-66.
Джексон П.В. Ботанические сады и историческое наследие // Там же. —
2005. - Вып. 14. - С. 107-111.
Дмитриева Н.Н. Проблема регуляции морфогенеза и дифференциации в
культуре клеток и тканей растений // Культура клеток растений. — М.: Нау¬
ка, 1981. - С. 113-124.
Дэгли С., Никольсон Д. Метаболические пути. — М.: Мир, 1973. — 310 с.
Жизнь растений / Под ред. АЛ. Тахтаджяна. — М.: Просвещение,
1982. -543 с.
Жмылев П.Ю., Алексеев Ю.Е., Карпухина Е.А. и др. Биоморфология рас¬
тений: иллюстрированный словарь: Учеб. пособие. — 2-е, изд. испр. и
доп. — М.: Наука, 2005. — 256 с.
Жукова Г.Я. Хлорофиллоносность зародыша как признак для классифи¬
кации цветковых растений // Эмбриология цветковых растений. Термино¬
логия и концепции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и семья,
1997. - С. 461-470.
Залукаева Г.Л. Особенности онтогенеза тропических и субтропических
орхидей в оранжерейной культуре: Автореф. ... канд. биол. наук. — М.: ГБС
АН СССР, 1990а. - 19 с.
Залукаева Г.Л. Особенности оранжерейной культуры башмачка замеча¬
тельного Paphiopedilum insigne (Wall, ex Ldl.) Pfitz. (Orchidaceae) // Сб. науч.
тр. Моск. лесотехн. ин-та. — 19906. — Вып. 224. — С. 103—106.
Запрометов М.Н. Вторичный метаболизм и его регуляция в культурах
клеток и тканей // Культура клеток растений. — М.: Наука, 1981. — С. 37—51.
Захленюк О.В., Алексеева И.В., Чарнецкий В.П. и др. Культура клеток рас¬
тений и биотехнология. — М.: Наука, 1986. — С. 37—41.
Зденек Е. Орхидеи. Иллюстрированная энциклопедия. — М.: Лабиринт-
пресс, 2006. — 304 с.
Злобин Ю.А. Репродуктивное развитие // Эмбриология цветковых расте¬
ний. Технология и концепции / Под ред. Т.Б. Батыгиной. — СПб: Мир и
семья, 2000. - С. 247-251.
1ваншков Р.В. Пор1вняльна характеристика початкових еташв морфоге-
нетичного розвитку Laelia sincorana Schltr. та Laelia lundii Rchb.f. & Warm
(Orchidaceae Juss.) // BicH. Ки!в. нац. ун-ту iMeHi Тараса Шевченка. 1нтроду-
кшя та збереження рослинного р1зноманггтя. — Вип. 2. — 1999. — С. 44—45.
1вантков Р. В. Бюл от розвитку вишв роду Laelia Lindl. в умовах оранже¬
рейной культури та культури in vitro: Дис. ... канд. бюл. наук. — К., 2001. — 152 с.
1ваншков Р.В. Насшневе розмноження Dendrobium parishii Rchb. f. в
умовах культури in vitro // Матер1али наук. конф. “Теоретичш та прикладш
аспекти штродукцп рослин та зеленого буд1вництва”. — Умань, 2002. —
С. 134-136.
509
СПИСОК ЛИТЕРАТУРЫ
leaHHifcoe Р.В., Лаврентьева Л.М. Використання гомогенату ‘банана при
культивуванш Laelia sincorana Schltr. (Orchidaceae Juss.) in vitro // Ытродукщя
рослин. — 1999. — № 2. — С. 85—87.
Иванников Р.В., Лаврентьева А.Н. Опыт размножения Monstera deliciosa
Liebm. var. borsigiana (С.Koch.) Engl, в культуре in vitro // VIII Интерн, конф.
“The Biology of Plant Cells in vitro and Biotechnology”: Тез. докл. — Саратов,
2003. - С. 126-127.
1ванников Р.В., Ковальська Л.А., Лаврентьева Л.М. Досвщ культивування
Cattleyopsis lindenii (Lindl.) Cgn. (Orchidaceae Juss.) // 1нтродукшя рослин. —
2004. - № 2. - С. 20-24.
Иванников P.В., Лаврентьева А.Н. Семенное размножение Psichopsiella lim-
minghei Lindl (Orchidaceae Juss.) в условиях асептической культуры //
Материалы Междунар. науч. конф. “Ботанические сады как центры со¬
хранения биоразнообразия и рационального использования раститель¬
ных ресурсов”. —М., 2005. — С. 190—192.
Иванников Р.В., Лаврентьева А.Н., Денисьевская Н.А., Иванникова Н.С.
Микроклональное размножение декоративно-лиственных видов рода Ап-
thurium Schott. (Araceae Juss.) // Там же. — С. 192—193.
Иванников Р.В., Иванникова Н.С. Клональное микроразмножение Ficus
elastica Roxb. // Материалы I(IX) Междунар. конф. молодых ботаников, 21 —
26 мая 2006. - СПб, 2006. - С. 245.
Иванов В.В. Клеточные основы роста растений. — М.: Наука, 1974. — 112 с.
Калинин Ф.Л., Кушнир Г.П., Сарнацкая В.В. Технология микроклональ-
ного размножения растений. — Киев: Наук, думка, 1992. — 227 с.
Калинин Ф.Л., Сарнацкая В.В., Полищук В.Е. Методы культуры тканей в
физиологии и биохимии растений. — Киев: Наук, думка, 1980. — 487 с.
Каляева М.А., Бурьянов Я.И. Регенерация однодольных растений рода
Sansevieria in vitro // Биотехнология. — 1997. — № 2. — С. 38—43.
Каляева М.А., Бурьянов Я.И. Особенности регенерации сансевьеры ци¬
линдрической (Sansevieria cylindrica Boj.) in vitro // Там же. — 1999. — № 5. —
С. 36-39.
Катаева Н.В. Параметрическое регулирование морфогенеза и клональ¬
ного микроразмножения растений на примере герберы и фрезии: Автореф.
дис. ... канд. биол. наук. — М., 1982. — 24 с.
Катаева Н.В., Бутенко РГ. Клональное микроразмножение растений. —
М.: Наука, 1983. - 96 с.
Кефели В.И. Рост растений. — М.: Наука, 1973. — 120 с.
Ковальська Л.А., Буюн Л.1., Лаврентьева А.М. Початков1 етапи розвитку
Acacallis cyanea Lindl. (Orchidaceae Juss.) в умовах культури // 1нтродукшя
рослин. — 1999. — № 2. — С. 64—67.
Ковальська Л.А., Лаврентьева А.М., 1ваншков Р.В. и др. Особливост1 спо¬
рового розмноження Platycerium alcicorne (Willemet) Desv. в культур! in vitro 11
Биол. вестн. Харьк. нац. ун-та. — 2004. — 8, № 1. — С. 81—83.
Коломейцева Г.Л. Признаки скульптуры семенной кожуры орхидных для
решения практических задач проращивания семян в культуре in vitro 11 Ма¬
териалы Междунар. науч. конф. “Ботанические сады как центры сохранения
биоразнообразия и рационального использования растительных ресурсов”. —
М., 2005. - С. 241-243.
510
СПИСОК ЛИТЕРАТУРЫ
Коломейцева Г.Л., Черевченко Т.М., Лаврентьева А.Н. Особенности онто¬
генеза Dendrobium unicum Seid. (Orchidaceae Juss.) в культуре in vitro и в оран¬
жерейной культуре // Ытродукшя рослин. — 2002. — № 2. — С. 62—68.
Кольчугина И.Б., Маркарова Е.Н., Гусев М.В. Содержание цитокининов в
каллусных тканях разных штаммов Ficus elastica, растущих на средах, разли¬
чающихся по количеству 6-БАП // Вести Моск. гос. ун-та. Сер. 16. —
1996. - № 2. - С. 35-39.
Кондратовиче Р.Я., Гертнере Д.Х., Мишке И. В., Тевелева М.К Микроб¬
ные цитокинины в клональном микроразмножении рододендронов // Био¬
логия культивируемых клеток и биотехнология: Тез. докл. — Новосибирск,
1988. - С. 37.
Корнеева И.Т. Получение безвирусного посадочного материала лилий
методом культуры ткани // Науч.-практ. конф. “Выращивание цветочных
культур меристемным способом”: Тез. докл. — Рига, 1977. — С. 15—17.
Красильникова Л.А., Авкеентьева О.А., Жмурко В.В. и др. Биохимия рас¬
тений. — Ростов-на-Дону: Феникс, 2004. — 224 с.
Куликов П.В. Экология и репродуктивные особенности редких орхидных
Урала: Автореф. дис. ... канд. биол наук. — Екатеринбург, 1995. — 22 с.
Куликов П.В., Филиппов Е.Г. О методах размножения орхидных умерен¬
ной зоны в культуре in vitro// Бюл. Гл. ботан. сада. — 1998. — Вып. 176. —
С. 125-131.
Куликов П.В., Филиппов Е.Г. Репродуктивная стратегия орхидных уме¬
ренной зоны // Эмбриология цветковых растений. Терминология и кон¬
цепции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и семья, 2000. —
С. 510-513.
Кунах В А. Цитогенетическое изучение клеточных популяций в культуре
изолированных тканей: Автореф. дис. ... канд. биол. наук. — Киев, 1974. — 22 с.
Кунах В.А. Цитогенетическая изменчивость клеточных популяций в
культуре изолированных тканей растений // Тканевые и клеточные культуры
в селекции растений. — М.: Колос, 1979. — С. 38—51.
Кунах В.А. Геномная изменчивость соматических клеток растений. 5.
Изменчивость роста и митотического режима в процессе адаптации к усло¬
виям выращивания in vitro // Биополимеры и клетка. — 1999. — 15, № 5. —
С. 343-359.
Кунах В.А. Геномная изменчивость соматических клеток растений. 6.
Изменчивость роста и отбор в процессе адаптации к условиям выращивания
in vitro // Там же. - 2000. - 16, N° 3. - С. 159-185.
Кунах В.А. Еволющя геному рослин в культур! юптин in vitro: особли-
BocTi, причини, мехашзми та наслщки // Генетика i селекшя в УкраУш на
мсж\ тисячолпъ. — К.: Логос, 2001. — Т. 1. — С. 53—67.
Кунах В.А. Бютехнолопя лкарських рослин. Генетичш та ф1зюлого-
6ioxiMi4Hi основи. — К.: Логос, 2005. — 730 с.
Куперман Ф.М. Морфофизиология растений. — М.: Высш. шк., 1977. —288 с.
Курсанов А.Л., Дубинина И.М., Кудрявцева Л. Ф. и др. Некоторые особен¬
ности углеводного обмена в культурах дедифференцированных тканей сахар¬
ной свеклы // Физиология растений. — 1976. — 23, N° 6. — С. 1119—1127.
Кутубидзе В.В., Таварткиладзе O.K., Вечерина Н.А. Некоторые особенно¬
сти введения в культуру in vitro пазушных почек чайного растения Thea
sinensis L. // Субтроп, культуры. — 1988. — N° 1. — С. 80—84.
511
СПИСОК ЛИТЕРАТУРЫ
Кушшр Г.П. Метод насшневого розмноження орхщей // 1нтродукшя та
аюпматизашя рослин на Украшь — 1979. — Вип. 14. — С. 67—70.
Кушнир Г.П., Будак В.Е. Опыт канального микроразмножения орхидей.
Охрана и культивирование орхидей. — Киев: Наук, думка, 1983. — С. 84—86.
Кушнир Г.П., Будак В.Е., Лаврентьева А.Н. Питательная среда для про¬
ращивания семян орхидей. Описания к авторскому свидетельству № 816438
(51) М. Кл. а 01G31/00/ Бюл. № 12 от 30.03.81. - 1981. - С. 1-6.
Кушнир Г.П., Будак В.Е. Метод клонального размножения бромелиевых //
Интродукция и акклиматизация растений. — 1984. — № 2. — С. 27—29.
Кушнир Г.П., Лаврентьева А.Н., Будак В.Е. Методы массового размноже¬
ния декоративных растений в культуре in vitro. // Тропические и субтропиче¬
ские растения закрытого грунта. — Киев: Наук, думка, 1988. — С. 30—37.
Кушшр Г.П., Черевченко Т.М. Орхще’1 — перспективш рослини для впро-
вадження в промислове квггництво // BicH. АН УРСР. — 1979. — N° 12. —
С. 51-53.
Лаврентьева А.Н. Зависимость регенерационной способности изолиро¬
ванных тканей цимбидиума от типа экспланта // Интродукция и акклимати¬
зация растений. — 1985а. — N° 4. — С. 49—52.
Лаврентьева А.Н. Оптимизация клонального размножения цимбидиума гиб¬
ридного в культуре тканей: Дис. ... канд. биол. наук. — Киев, 19856. — 195 с.
Лаврентьева А.Н., Ковальская А.А., Будак И.Е. Особенности размноже¬
ния дендробиум фаленопсис в культуре тканей // Биология культивируемых
клеток и биотехнология: Тез. докл. — Новосибирск, 1988. — С. 359.
Лаврентьева А.Н., Будак В.Е. Опыт клонального микроразмножения не¬
которых растений закрытого фунта в ЦРБС АН УССР. Метод, рекоменда¬
ции по массовому размножению декоративно-лиственных и красивоцвету-
щих растений в условиях защищенного грунта Украины и Молдавии. —
Киев, 1989. - 22 с.
Лаврентьева А.Н., Ковальская А.А. Разработка микроклонального раз¬
множения дендробиум фаленопсис // Вестн. Киев, ун-та, 1989. — С. 143.
Лаврентьева А.Н., Денисьевская НА. Клональное микроразмножение неко¬
торых растений семейства Агасеае // II Междунар. конф. по ароидным “Aroid
Conference”: Тез. докл., 25—30 авг. 1992. —М.: ГБС РАН, 1992. — С. 60—61.
Лаврентьева А.Н., Ковальская Л.А., Буюн Л.И. и др. Жизненные циклы
развития D. phalaenopsis // Международная школа молодых ученых. — Киев;
Львов, 1994. - С. 121-122.
Лаврентьева А.Н., Денисьевская Н.А. Микроклональное размножение ле¬
карственных видов ароидных // IV М1жнар. конф. з медично1 боташки: Тез.
доп. - К., 1997. - С. 334-335.
Лаврентьева А.М., Дешаевська Н.О. Клональне м1кророзмноження рослин з
роду Aglaonema Schott // 1нтродукц1я рослин. — N° 2. — 1999. — С. 73—76.
Лаврентьева А.М., Денисьевська Н.О. Д1фенбахп в колекци НБС НАН
УкраУни та i'x мкророзмноження // М1жнар. наук. конф. “Сучасш проблеми
штродукци рослин та збереження бюр1зноманггтя екосистем”. — Чершвш,
2002. - С. 60-61.
Лаврентьева А.Н., Вахрушкин B.C., Ковальская Л.А. Особенности семен¬
ного и клонального размножения видов рода Paphiopedilum Pfitz. (Orchidaceae
Juss.) в культуре in vitro // Биол. вестн. Харьк. ун-та. — 2003. — 7, N° 1/2. —
С. 39-42.
512
СПИСОК ЛИТЕРАТУРЫ
Лаврентьева А.Н., Мальцов И.Ю. Размножение Cordyline terminalis Comm ex
Juss. cv. Kiwi в культуре in vitro // VIII Интерн, конф. “The Biology of Plant
Cells in vitro and Biotechnology”: Тез. докл. — Саратов, 2003. — С. 176—177.
Лаврентьева A.M., 1вантков Р.В. Використання бютехнолопчних метод1в
розмноження декоративних штродуцешчв // BicH. JIbBiB. ун-ту. Сер. Бюло-
пя. — 2004а. — Вип. 36. — С. 137—145.
Лаврентьева А.М., 1ваншков Р.В. Використання метод1в асептично'1 куль¬
тури для розмноження рщюсних та високодекоративних представниюв
трошчноТ флори // 1нтродукщя рослин. — 20046. — № 1. — С. 41—47.
Лаврентьева А.М., Шишков Р.В. Вплив регулятор1в росту на морфогенез
in vitro трошчних штродуцешчв // Установч. з’Тзд Укр. тов-ва клггинноТ
бюлогп: Тези доп. — Льв1в, 2004в. — С. 88.
Лаврентьева А.М., Ковальськая А.А., Буюн Л.А. Насшневе розмноження
Dendrobium draconis Rchb. f. (Orchidaceae Juss.) у культур1 in vitro // BicH. Киш.
нац. ун-ту iMeHi Тараса Шевченка. — 2005. — N° 9. — С. 36—37.
Лодкина М.М. Эволюционные отношения однодольных и двудольных по
данным изучения зародыша и проростков // Ботан. журн. — 1988. — 73,
№ 5. - С. 617-630.
Лунева Л. С. Размножение ирисов методом культуры апикальных мери¬
стем // Там же. - 1977. - 62, № 3. - С. 416-421.
Лутова Л.А. Биотехнология высших растений. — СПб.: Изд-во Санкт-
Петербург. ун-та, 2003. — 228 с.
Магру Ж. Симбиоз у орхидей и картофеля. — М.: Изд-во иностр. лит.—
1949. - 138 с.
Майко Т.К. Динамика эндогенных регуляторов роста в годичном цикле
развития Тунии Маршалла // Охрана и культивирование орхидей. — Таллин:
Изд-во Эст. ССР, 1980. - С. 125-127.
Майко Т.К., Kyiunip Т.П., Черевченко Т.М., Лаврентьева А.М. Про зв’язок
м\ж активжстю ендогенних регулятор1в росту та здатшстю до регенераци
стебльових бруньок Туни Маршалла // 1нтродукц1я та aклiмaтизaцiя рослин
на УкраУш. —1981. — 18. —С. 96—98.
Максимов В.Н. Многофакторный эксперимент в биологии. — М.: Изд-во
Моск. ун-та, 1980. — 278 с.
Максимов В.Н., Федоров В.Д. Применение методов математического пла¬
нирования эксперимента. — М.: Изд-во Моск. ун-та, 1969. — 121 с.
Мананков М.К., Мусиенко Н.Н., Мананкова О.П. Регуляторы роста расте¬
ний и практика их применения. — Киев: Фитосоциоцентр, 2002. — 184 с.
Маркова Т.А., Ошарова Л.М., Павар С.С. и др. Метаболизм и механизм
действия фитогормонов. — Иркутск: Наука, 1979. — 204 с.
Медведев П.Ф. Новые культуры СССР (волокнистые). — М.: Сельхозгиз,
1940. _ 306 с.
Медведев С.С. Физиология растений. — СПб.: Изд-во Санкт-Петербург,
ун-та, 2004. — 334 с.
Мельничук М.Д., Новак Т.В., Кунах В.А. Бютехнолопя рослин: Пщруч-
ник. — К.: Пол^аф-консалтинг, 2003. — 520 с.
Месхи А.Б., Гогоберидзе М.К, Кацитадзе КП. Культура тканей юкки славной
(Jucca gloriosa) // Изв. АН ГССЗ, сер. биол. — 1978. — 4, № 1. —С. 79—82.
Мешкова Н.В., Макарова Р.В., Борисова ТА. и др. Роль экзогенных аук¬
синов и цитокининов на разных этапах микроклонирования кордилины вер¬
хушечной // Биотехнология. — 1999. — N° 1. — С. 71—79.
513
СПИСОК ЛИТЕРАТУРЫ
Мишарин С.И., Мозгова Е.А., Монастырева JI.E. и др. Сохранение специ¬
фических спектров белков в каллусных культурах кукурузы // Докл. АН
СССР. - 1977. - 236. - С. 1273-1276.
Морозова С.Е. Оптимизация питательных сред для культуры изолиро¬
ванных апексов картофеля разных сроков созревания // Регуляторы роста и
развития растений. — М.: Наука, 1981. — 167 с.
Мусатенко Л.1., Генералова В.М., Мартин ГУ. До ф1зюлогп спокою
насшня Aesculus hippocastanum L. // Укр. ботан. журн. — 1997. — 54, № 1. —
С. 86-91.
Мусатенко Л.И., Генералова В.М., Мартын ГУ. Гормональный комплекс
и ультраструктура созревающих семян Aesculus hippocastanum L. // Физиоло¬
гия растений. — 2003. — 50, N° 3. — С. 404—409.
Мусиенко Н.Н., Черновский А.И. Корневое питание растений. — Киев:
Вища шк., 1989. — 203 с.
MycieHKO М.М. Ф1зюлопя рослин. — К: Вища шк., 1995. — 502 с.
MycieHKO М.М. Ф1з1олопя рослин: Шдручник. — К.: Либщь, 2005. — 808 с.
MycieHKO М.М., Панюта О.О. Культура 1зольованих клпгин тканин i ор-
гашв рослин. — К.: Фпчэсоцюцентр, 2001. — 47 с.
MycieHKO М.М., Панюта О.О. Бютехнолопя рослин. — К.: Фггосоцю-
центр, 2005. — 115 с.
Назаров Е.Г. Дендробиум превосходный // Цветоводство. — 1973. — N° 8. —
С. 24.
Налимов В.В. Теория эксперимента. — М.: Наука, 1971. — 207с.
Немойкина А.Л. Влияние света и гормонов на морфогенез юкки слоновой
в культуре in vitro: Автореф. дис. ... канд. биол. наук. — Томск, 2003. — 19 с.
Немойкина А.А., Карнанук З.А. Морфогенез и гормональный баланс юкки
слоновой в культуре in vitro на свету разного спектрального состава // Мате¬
риалы Междунар. науч. конф. — Черновцы, 2002. — С. 79—80.
Новак Ф.И., Непустил Й. Клоновое размножение Anthurium andreanum
Lindl. посредством каллусной культуры in vitro // Культура клеток растений:
Тез. докл. — Ереван, 1979. — С. 140—141.
Отмашкина Н.В. Ризогенез Rhododendron ledebourii pojark в культуре in
vitro // Int. Conf. “The Biology of Plant Cells in vitro and Biotechnology”. — Са¬
ратов, 2003. — С. 239.
Перевалов P.Г., Лещану М.Г. Микроклональное размножение Vanilla
planifolia // IV Междунар. конф. з мед. боташки: Тез. доп. — К., 1997. —
С. 339-340.
Печеницын В.П., Ефимкова В.А., Весманова О.Я. и др. Получение экс¬
плантов монстеры привлекательной и изучение их морфогенетической ак¬
тивности in vitro // Интродукция и акклиматизация растений (Ташкент). —
1996. — № 27. - С. 123-126.
Писецкая Н.Ф. Некоторые особенности роста культуры изолированной тка¬
ни женьшеня: Автореф. дис. ... канд. биол. наук. — Владивосток, 1971. — 28*с.
Поддубная-Арнольди ВА. Исследование зародышей покрытосеменных расте¬
ний в живом состоянии // Бюл. Гл. ботан. сада. — 1952. — Вып. 14. —С. 3—Г2.
Поддубная-Арнольди ВЛ Цитоэмбриология покрытосеменных растений. —
М.: Наука, 1976. - 507 с.
Поддубная-Арнольди В.А., Селезнева В.А. Выращивание орхидей из се¬
мян // Тр. Гл. ботан. сада. — 1953. — 3. — С. 106—124.
514
СПИСОК ЛИТЕРАТУРЫ
Поддубная-Арнольди В.А., Селезнева В.А. Орхидеи и их культура. — М.:
Изд-во АН СССР, 1957. - 175 с.
Полевой В.В. Физиология растений. — М.: Высш. шк., 1989. — 464 с.
Попов Ю.Г. Оздоровление земляники, пораженной вирусными заболева¬
ниями, с помощью культуры изолированных меристематических верхушек //
С.-х. биология. - 1974. - 9, N° 5. - С. 23-27.
Попов М.Г. Культура in vitro меристематических верхушек стебля как ме¬
тод оздоровления и размножения растений // Биол. науки. — 1976. — 150,
№ 6. - С. 7-24.
Попов Ю.Г., Высоцкий В.А. Культура стеблевых верхушек in vitro как ме¬
тод ускоренного размножения плодовых и ягодных растений // Вести с.-х.
науки. - 1978. - № 4. - С. 124-127.
Попов Ю.Г., Черкасов О.А. Ускоренное размножение in vitro некоторых
луковичных растений семейства амариллисовых // С.-х. биология. — 1984. —
№ 4. - С. 76-79.
Попов Ю.Г., Черкасов О.А. Изучение факторов, влияющих на клональное
размножение растений семейства амариллисовых // Культура клеток расте¬
ний и биотехнология. — 1986. — С. 114—117.
Приходько С.Н., Яременко Л.М., Черевченко Т.М. и др. Декоративные рас¬
тения открытого и закрытого грунта. — Киев: Наук, думка, 1985. — 664 с.
Работное Т.А. Некоторые вопросы изучения диаспор растений в почвах
природных фитоценозов // Бюл. Моск. о-ва испытателей природы. Отд.
биол. - 1995. - 100, № 5. - С. 69-76.
Ратиани Ш.И. Камелия японская // Природа. — 1956. — № 5. —С. 113—114.
Ревин П. Речь на XVI Международном ботаническом конгрессе // Ин-
форм. бюл. Совета ботан. садов России и Моск. отд-ния Междунар. совета
ботан. садов по охране растений. — 2000. — Вып.11. — С. 38—47.
Робертис Э., Новинский В., Саэс Ф. Биология клетки. — М.:
Мир, 1973. - 487 с.
Сааков С.Г. Оранжерейные и комнатные растения. — Л.: Наука, 1983. —
621 с.
Саркисова М.А. Культура ткани диоскореи дельтовидной как продуцент
стероидных сапонинов: Автореф. дис. ... канд. биол. наук. — М.: Ин-т физи-
ол. растений АН СССР, 1973. — 22 с.
Смирнова Е.С. Морфология побеговых структур орхидных. — М.: Нау¬
ка, 1990. - 209 с.
Соловьян В.Т., Попович В.А., Кунах В.А. Переустройство генома культиви¬
руемых клеток Crepis capillaries L. (Warllr.)// Генетика. — 1989. — 25, № 10. —
С. 1768-1775.
Тараканова Г.А., Гудков Н.Л., Винникова Н.В. Некоторые особенности
первичного метаболизма и накопления диосгенина в культуре клеток
Dioscorea deltoidea // Физиология растений. — 1979. — 26. — С. 54—63.
Тарбаева В.М. Строение семян у араукариевых (Araucariaceae) // Бюл.
Гл. ботан. сада. — 1995. — Вып. 172. — С. 43—49.
Тахтаджян А.Л. Основы эволюционной морфологии растений. — М.;
Л.: Наука, 1964. — 205 с.
Терехин Э.С. Метаморфоз // Эмбриология цветковых растений. Тер¬
минология и концепции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и
семья, 2000. — С. 62—69.
515
СПИСОК ЛИТЕРАТУРЫ
Терехин Э.С., Камелина О.П. Эндосперм Orchideceae (К вопросу о редук¬
ции) // Ботан. журн. — 1969. — 54, N° 5. — С. 657—666.
Терехин Э.С., Никитичева З.И. О принципах создания экологической
классификации зародышей покрытосеменных растений // Актуальные во¬
просы эмбриологии покрытосеменных. — JI.: Наука, 1979. — С. 120—130.
Тихонова B.JI. Банк семян // Эмбриология цветковых растений. Тер¬
минология и концепции / Под ред. Т.Б. Батыгиной. — СПб.: Мир и
семья, 2000. — С. 286—289.
Тихонова B.JJ., Смирнов И.А., Морозова И.В. Банки семян и работы по
реинтродукции в ботанических садах // Бюл. отд-ния Междунар. совета бо¬
тан. садов по охране растений. — 2001. — Вып. 12. — С. 90—94.
Тихонова М.Н. О развитии побегов у Bletilla striata и Calanthe vestita //
Ботан. журн. — 1971. — 56, № 11. — С. 1697—1704.
Тимчишин Г.В. Рододендрони та Ух вирощування (практичш рекомен-
дацн). — К.: Фггосоцюцентр, 2003. — 16 с.
Трускинов Э.В., Оглуздин Н.С. Поддержание коллекционных образцов кар¬
тофеля в культуре in vitro // Тр. по прикл. ботанике, генетике и селекции
ВНИИ растениеводства. — 1992. — 73, № 2. — С. 73—79.
Уатсон У. Орхидеи. Уход за ними и их содержание с описанием всех ви¬
дов, встречающихся в садах. — М.: Сад и огород, 1892. — 434 с.
Урбан А. Колючее чудо. — Братислава: Веда, 1983. — 332 с.
Федоров А.А., Артюшенко З.Т., Кирпичников М.Э. Атлас по описательной
морфологии высших растений (Лист). — JI.: Наука, 1956. — 248 с.
Филлипов Е.Т. Внутривидовая изменчивость и экология видов рода
Dactylorhiza Neck, ex Nevski (сем. Orchidaceae) на Урале: Автореф. дис. ...
канд. биол. наук. — Екатеринбург, 1997. — 22 с.
Фролова Л.В. Особенности популяций культивируемых клеток // Куль¬
тура клеток растений. — М.: Наука, 1981. — С. 8—16.
Харченко И.И. Особенности семенного размножения камелии японской
(Camellia japonica L.) // Ытродукщя рослин. — 2000. — N° 1. — С. 133—134.
Харченко /./. Колекщя камелш Нацюнального боташчного саду iM.
М.М. Гришка НАН Украши // Там же. — 1999. — № 1. — С. 18—20.
Харченко /./. Особливост1 проростання насшня камели японськоТ в умо-
вах закритого грунту // Актуальш проблеми медицини, бюлоги, ветеринарп i
сшьського господарства. — Льв1в, 2001. — С. 105—106.
Харченко I.l. Camellia japonica L. (Theaceae D.Don): морфолопя, бюлопя
розвитку та технолопя культивування в умовах оранжерейноТ культури: Дис. ...
канд. бюл. наук. — К., 2003. — 178 с.
Холодова В. П. Рост и метаболизм углеводов в культуре ткани расте¬
ний. — М.: Наука, 1981. — 36 с.
Холодова В.П., Урманцева В.В., Накоренок Г.Б. и др. Использование угле¬
водов разными штаммами культуры ткани сахарной свеклы // И Всесоюз.
конф. по культуре клеток растений. — К.: Наук, думка, 1978. — С. 220—226.
Хотылева Л.В., Ермишин А.П. Использование методов математического
планирования эксперимента с целью оптимизации питательной среды для
культуры изолированных тканей пшеницы // Весш АН БССР. — 1979. —
№ 2. - С. 23-27.
Христева JI.A. Физиологическая функция гуминовой кислоты в процес¬
сах обмена веществ высших растений // Гуминовые удобрения: теория и
практика их применения. — Харьков, 1957. — С. 95—103.
516
СПИСОК ЛИТЕРАТУРЫ
Чайлахян М.Х., Бутенко Р.Г. Влияние аденина и кинетина на дифферен-
цировку цветочных почек у изолированных верхушек периллы // Докл. АН
СССР. - 1959. - 129, № 1. - С. 224-227.
Чеканова В.Н., Коровин С.Е. Бромелии — растения прошлого, настоя¬
щего и будущего. — М.: Наука, 2000. — 224 с.
Чеканова В.Н., Коровин С.Е. Бромелии. — М.: Фитон, 2001. — 176 с.
Черевченко Т.М. Тропические орхидные. Морфобиологическое изучение
и внедрение в культуру закрытого грунта: Автореф. ... д-ра биол. наук. —
Киев, 1984а. — 44 с.
Черевченко Т.М. Экспедиция НИС «Академик Вернадский» — источник
интродукции тропических и субтропических растений // Интродукция и
акклиматизация растений. — 19846. — Вып. 2. — С. 6—10.
Черевченко Т.М. Тропические и субтропические орхидеи. — Киев: Наук,
думка, 1993. — 254 с.
Черевченко Т.М. Роль ботанических садов умеренной зоны в сохранении
биоразнообразия тропических и субтропических растений в условиях защи¬
щенного грунта // Междунар. науч. конф. “Биологическое разнообразие.
Интродукция растений”. — СПб, 2003. — С. 17—18.
Черевченко Т.М., Ковальская Л.А. Культура орхидеи каланты одетой. —
К.: УкрНИИНТИ, 1980. - 10 с.
Черевченко Т.М., Кушнир Г.П. Биология и размножение антуриума Андре
в закрытом грунте // Доп. АН УРСР. — 1981. — № 10. — С. 83—86.
Черевченко Т.М., Кушшр Г.П. НаЫнне розмноження вид1в родини Orchi¬
daceae // Укр. ботан. журн. — 1982. — 38, № 6. — С. 51—55.
Черевченко Т.М., Кушнир Г.П., Лаврентьева А.Н. и др. Методические ре¬
комендации по массовому размножению орхидей. — К: Минжилкомхоз
УССР, 1982. -55 с.
Черевченко Т.М., Кушшр Г.П. Б1олопя i культура антур1ума Андре в за-
критому rpyHTi ЦРБС АН УРСР // 1нтродукщя та аюпматизашя рослин на
УкраМ. -1983. - Вип. 22. - С. 49-53.
Черевченко Т.М., Кушнир Г.П. Орхидеи в культуре. — Киев: Наук, думка,
1986. - 198 с.
Черевченко Т.М. Лаврентьева А.Н., Денисьевская НА. и др. Биотехнология
некоторых видов тропических растений закрытого фунта, перспективных для
внедрения в промышленное цветоводство. — Киев: Наук, думка, 1987. — 25 с.
Черевченко Т.М., Приходько С.Н., Майко Т.К. и др. Тропические и суб¬
тропические растения закрытого грунта. — Киев: Наук, думка, 1988. — 408 с.
Черевченко Т.М., Ковальская JI.A., Лаврентьева А.Н. и др. Методические
указания по биотехнологии Dendrobium phalaenopsis Fitzg. — Киев: Наук,
думка, 1989. - С. 21-31.
Черевченко Т.М., Лаврентьева А.Н., Будак В.Е. К вопросу о размножении
Nepenthes в культуре тканей // Всесоюз. совещ. “Интродукция тропических
и субтропических растений закрытого фунта”: Тез. докл. — Кишинев, 1989а. —
С. 158.
Черевченко Т.М., Лаврентьева А.Н., Заименко Н.В. Рациональная техно¬
логия размножения и культивирования цимбидиума гибридного // Сб. науч.
тр. Моск. с.-х. акад. — 19896. — Вып. 54. — С. 51—57.
Черевченко Т.М., Лаврентьева А.Н., Заименко Н.В. и др. Методические ре¬
комендации по биотехнологии Phalaenopsis amabilis Bl. — Киев: Наук, думка,
1989в. - С. 9-20.
517
СПИСОК ЛИТЕРАТУРЫ
Черевченко Т.М., Порубиновская Г.В., Богатырь В.Б. и др. Экспедиция в
тропики Бразилии // Интродукция и акклиматизация растений. — 1989г. —
Вып. 4. - С. 102 -110.
Черевченко Т.М., Лаврентьева А.Н., Будак В.Е. Биология, размножение и
культивирование Nepenthes madagascariensis Poir // Укр. ботан. журн. —
1992. - 49, № 2. - С. 87-90.
Черевченко Т.М., Лаврентьева А.М., Ковальская Л.А. и др. Начальные эта¬
пы развития Acacallis cyanea Lindl в культуре in vitro // Вивчення онтогенезу
рослин природних та культурних флор у боташчних закладах Свразп: Тези
доп. — Ки1в; JTbBie, 1994. — С. 270—272.
Черевченко Т.М, Антонюк Н.М., Шпилева Б.Е. и др. AHaTOMi4Hi особли-
BocTi онтогенезу непентеса мадагарскарского (Nepenthes madagascariensis
Poir) — ендем1ка острова Мадагаскар // Ботанические сады — центры сохра¬
нения биологического разнообразия мировой флоры: Тез. докл. — Ялта,
1995. - С. 214-215.
Черевченко Т.М., Лаврентьева А.Н., Буюн Л.И. и др. Особенности морфо¬
генеза растений рода Cattleya Lindl. в культуре in vitro // Культура тканей и
биотехнология: Тез. докл. — М., 1977а. — С. 477.
Черевченко Т.М., Лаврентьева А.Н., Чудовская Е.А. Развитие сеянцев Cat¬
tleya Lindl. (Orchidaceae Juss.) в условиях культуры in vitro // Там же. — М.,
19776. - С. 479.
Черевченко Т.М., Лаврентьева А.М., Буюн Л.1. та in. Особливост1 морфо¬
генезу вншв роду Cattleya Lindl. (Orchidaceae Juss.) в культур! in vitro I I
Онтогенез рослин в природ! та трансформованому середовищк Тез. доп. —
JIbBiB, 1998. - С. 80-82.
Черевченко Т.М., Заименко Н.В., Мартыненко Е.И. Биохимические осо¬
бенности видов орхидных различных экотипов // Физиология и биохимия
культ, растений. — 2000. — 32, N° 2. — С. 121 — 127.
Черевченко Т.М., Буюн Л.1., Ковальська Л.А. та in. ОрхщеУ. — К.: Про-
ceiTa, 2001. — 224 с.
Черевченко Т.М., Лаврентьева А.Н., Буюн Л.И. и др Семенное и клональ¬
ное размножение видов рода Cattleya Lindl. (Orchidaceae Juss.) в культуре in
vitro // VIII Интерн, конф. «The Biology of Plant Cells in vitro and Biotechno¬
logy»: Тез. докл. — Саратов, 2003. — С. 64—65.
Чудовская Е.А. Развитие сеянцев Doritis pulcherrima Ldl. в условиях куль¬
туры in vitro // Интродукция и акклиматизация растений. — 1994. — Вып. 21. —
С. 43-45.
Чудовская Е.А., Лаврентьева А.Н. Микроклональное размножение моно-
подиальных орхидей // Биология культивируемых клеток: Тез. докл. — Ал¬
ма-Ата, 1993. - С. 251.
Шевцова Г.Г., Батыгина Т.Б., Лаврентьева А.Н. Некоторые аспекты си¬
стемы воспроизведения орхидных на примере Cymbidium hybridum (Orchida¬
ceae) // Ботан. журн. — 1986. — 71, № 11. — С. 1457—1467.
Шенгелия Л.Н., Бутенко Р.Г. Микропрививки цитрусовых как способ
получения безвирусных растений // Физиология растений. — 1988. — 35,
N° 1. - С. 190-195.
Шорина Н.И. Вегетативное размножение // Эмбриология цветковых рас¬
тений. Терминология и концепции / Под. ред. Т.Б. Батыгиной. — СПб.:
Мир и семья, 2000. — С. 299—302.
518
СПИСОК ЛИТЕРАТУРЫ
Щелкунова С.Е. Изучение условий, способствующих регенерации мали¬
ны из меристематических верхушек: Автореф. дис. ... канд. биол. наук. — М.,
1973. - 14 с.
Щербакова Е.Н., Севрук О.Г., Маршавина З.В. Влияние компонентов
питательной среды на рост изомеров ткани Pelargonium roseum // Физиоло¬
гия растений. — 1977. — 24, № 3. — С. 648—652.
Юсуфов А.Г. Культура изолированных листьев. — М.: Наука, 1988. — 103 с.
Ярославская Ж.Н., Иванников Р.В. Особенности анатомического строения
листовой пластинки Laelia sincorana Schltr. и Laelia purpurata Lindl. в связи с
эколого-климатическими условиями обитания // 1нтродукщя рослин. —
1999. — N° 1. - С. 67-69.
Abdelouahhab Z., Tisserat В. Morphogenetic responses obtained from a variety
of somatic explant tissues of date palm // Bot. Mag. Tokyo. — 1983. — 96,
N 1042. - P. 67-73.
Abo El-Nil M.M., Zettler F.W. Callus initiation and organ differentiation from
shoot tip cultures of Colocasia esculenta // Plant Sci. Lett. — 1976. — 6, N 6. —
P. 401-408.
Abou-Mandour A.A., Czygan F.C. Kalluskulturen und Pflanzenregenerate vor
Sanseviera trifasciata cv. laurentii (Dracen.) // Gartenbauwissenschafl. — 1991. —
56, N 6. - S. 250-253.
Agrawal D.C., Morwal G.C., Mascarehas F. In vitro propagation and slow
growth storage of shoot cultures of Vanilla walkeriae Whight. — one endangered
orchid // Lindleyana. - 1992. - 7, N 2. - P. 95-99.
Alang Z.C. Importance of tissue culture in propagation of orchids. A review //
Nat. Plant Tissue Cult. Symp. — 1976. — P. 8—12.
Aldrich A. Egnitant Oncidium Culture—Tapping the Potential // Amer. Orchid
Soc. Bull. - 1986. - 55, N 7. - P. 676-683.
Altman A., Goren R. Development of citrus bud explants in culture // J. Amer.
Soc. Hort. Sci. - 1978. - 103, N 10. - P. 120-123.
Amaki W., Higuchi H. Effects of diving on the growth and organogenesis of
protocorm-like bodies in Doritaenopsis I I Sci. Hort. — 1989. — 39, N 1. — P. 63—72.
Anderson W.C. A revised tissue culture medium for shoot multiplication of
rhododendron // J. Amer. Soc. Hort. Sci. — 1984. — 109, N 3. — P. 343—347.
Andronova E.V. On the morphological and physiological polarity of embryo:
an opinion and facts // Bull. Polish Acad. Sci. (Biol. Sci.) — 1997. — 45, N 2. —
P. 217-223.
Anemas S., Drira N., Benbadis A. La culture in vitro du Palmier dottier (Pho¬
enix dactylifera L.) // Bull. Soc. bot. France (Actual. Bot.). — 1983. — 130,
N 2. - P. 120-123.
Anonymous S. Clonal propagation of the genus Paphiopedilum // Austral.
Orchid Rev. - 1983. - 48. - P. 182-185.
Appelgren M. Tissue culture of ornamental plants with special reference to
flowering potted plants // Micropropagation. — 1984. — 3. — P. 174—190.
Arditti J. Factors affecting germination of orchid seeds // Bot. Rev. — 1967. —
33, N 1. - P. 1-97.
Arditti J. Clonal propagation of orchids by means of tissue culture. Orchid
biology: Reviews and perspectives. — Ithaca, London: Cornell Univ. Press,
1977. - Vol. 1. - 310 p.
Arditti J. Aspects of the physiology of orchids // Adv. Bot. Res. — 1979. —
N 7. - P. 421-655.
519
СПИСОК ЛИТЕРАТУРЫ
Arditii J. Orchid Biology: Reviews and Perspectives. — Ithaca; London:
Cornell Univ. Press, 1982. — 310 p.
Arditti J. Orchid seed germination and seedling culture a manual: Introduc¬
tion, general outline, tropical orchids (epiphytic and terrestrial), and North Amer-
rican Terrestrial orchids // Orchid biology: Reviews and Perspectives. — Ithaca;
New-York: Cornell Univ. Press, 1982. — Vol. 2. — 293 p.
Arditti J. Orchid biology: Reviews and Perspectives. — Ithaca; London:
Cornell Univ. Press, 1997. — Vol. 3. — 340 p.
Arditti JBall E., Reisinger D.M. Culture of flower-stalk buds. A method for
vegetative propagation of Phalaenopsis // Amer. Orchid Soc. Bull. — 1974. — 46,
N 3. - P.236—240.
Arditti J., Michaud Y.D., Heaby P.Z. Morphometry of orchid // Amer. J.
Bot. - 1979. - 66, N 10. - P. 1128-1137.
Arditti J., Goh C.J. Production of flowering orchid seedlings and plantles //
Malayan Orchid Rev. — 1996. — 30. — P. 27—29.
Ault J.R., Blackmen W.J. In vitro propagation of Ferocactus acanthodes (Cac-
taceae) // HortScience. — 1987. — 22, N 1. — P. 126—127.
Baburaj S., Dhamontharan R, Santhaguree K. Regeneration of leaf callus of
Euphorbia Hitra Linn // Curr. Sci. (India). — 1987. — 56, N 4. — P. 194—196.
Bailey L.H. The standard cyclopedia of horticulture. — London: Macmillan,
1928. - 3639 p.
Ballester A., Janeiro L.V., Vieitez A.M. Cold storage of shoot cultures and
alginate encapsulation of shoot tips of Camellia japonica L. and Camellia reticulata
Lindley // Sci. Hort. - 1997. - 71. - P. 68-78.
Banerjee N., Langhe E. A tissue culture technique for rapid clonal propagation
and storage under minimal growth conditions of Musa // Plant Cell Reports. —
1985. - 4, N 6. - P. 351-354.
Banik М., Hadiuzzaman S., Rahman H. et al. Clonal propagation of Arundina
bambusifolia Lindl. — a terrestrial orchid // Malayan Orchid Rev. — 1986. —
N 20. - P. 340-347.
Bapat V.A., Narayanaswamy A. Rhizogenesis in a tissue culture of the orchid
Spathoglottis plicate // Bull. Torrey Bot. club. — 1977. — 104, N 1. — P. 2—4.
Barciela J., Vieitez A.M. Anatomical sequence and morphometric analysis
during somatic embryogenesis on cultured cotyledon explants of Camellia japonica
L. // Ann. Bot. - 1993. - 71. - P. 395-404.
Batygina T.B., Andronova E.V. Is There a Cotyledon in the Orchidaceae? An
Opinion // Recent Advances in Plant Biology / Ed. by C.P. Malik, Y.P. Abrol. —
Delhi: APN Publ. Corp, 1991. - P. 369-374.
Bechtel H., Cribb P., Launert E. The Manual of Cultivated Orchid Species. —
Cambridge, Massachusetts: MIT Press, 1986. — 444 p.
Becker-Zens R. Multiplication vegetative in vitro a partir de plantules d’hybri-
des F., de Pelargonium x Hortorum Baiby // Acta Horticulturae. — 1983a. — 131.
- P. 61-70.
Becker-Zens R. Anther and embryo culture in Pelargonium Zonale — hybrids
// Ibid. - 1983b. - 131. - P. 209-214.
Beiderbeck R, Knoop B. Ein Adsorbens als Speicher fur Phytohormone in
einer pflanzlichen Suspensionskultur // Z. Naturfosch. — 1984. — 39, N 1/2. —
S. 45-49.
Ben-Iaacov I., Dax E. In vitro propagation of Crevillea rasmarinifolia // Hort¬
Science. - 1981. - 16, N 3. - P. 309-310.
520
СПИСОК ЛИТЕРАТУРЫ
Ben-Iaacov I., Jacobs С. Establishing protea Leucospermum and Serruria in
vitro // Acta Horticulturae. — 1986. — N 185. — P. 39—52.
Benies Т., Devergh P. Nutritional and hormonal requirements for the growth
of Araucaria araucana callus in vitro // Meded. Fac. landbowwetersch. Rijksnii
Gent. - 1976. - 41, N 1. - P. 1599-1610.
Bennett W.Y. Tissue culture for camellias // Amer. Camellia Yearbook. —
1977. - N. 2. - P. 188-190.
Bennett W.Y. Tissue culture of camellias // Ibid. — 1978. — N 2. — P. 102—103.
Bennett W.Y., Sheibert A. In vitro generation of callus and plantlets from
cotyledons of Camellia japonica // Camellia J. — 1982. — N 37. — P. 5—12.
Berghoef Y.} Brinsma Y. Flower development of Begonia franconis Liebm //
Z. Pflanzenphyziol. - 1979. - 93, N 4. - S. 345-357.
Bernard N. L'evolution dans la symbiose: les orchidces et leurus champignons
commensaux // Ann. Sci. Nat. Bot. — 1909. — 9. — P. 1 — 196.
Bhaskar V, Rao N. In situ development of callus shoots in sandal // Indian
Forest. - 1983. - 109, N 1. - P. 45-46.
Bigot C. Multiplication vegetative de Gloxinia hybrida a partir d’organs cultives
in vitro // Amer. Ajnelior. Plantes. — 1975. — 25, N 3. — P. 337—351.
Bilkey P.C., Me Cown B.M., Nilderandt A.C. Micropropagation of African vio¬
let from petiole cross-sections // HortScience. — 1978. — 13, N 1. — P. 37—38.
Birngruber A., Beiderbeck R. In vitro-Vermherung von Fuchsia magellanica //
Gartenbauwissenschaft. — 1988. — 53, N 5. — S. 220—223.
Blazich F.A., Yiles C.G., Haemmerle CM. Micropropagation of Rhododendron
chapmahii // J. Environ. Hort. — 1986. — 4, N 1. — P. 26—29.
Boos W. Annual Review of Biochemistry / Ed. by E.E. Snell, P.O. Boyer,
A. Meister, C.C. Richardson. — Palo Alto (Cal.), 1974. — 43. — P. 123—146.
Bose Т.К., Jana B.K. Regeneration of plantlets in Hippeastrum in vitro 11 In¬
dian J. Hort. - 1977. - 34, N 4. - P. 446-447.
Bowden A. Transferring tissue-cultured plants — in particular grevilleas — to
the nursery environment // Comb. Proc. Int. Plant Propagators’ Soc. — 1985. —
N 34. - P. 76-78.
Brasch I.D., Kocsis G. You can “meristem” with hormones (Orchidaceae pro¬
pagation, tissue culture) // Amer. Orchid. Soc. Bull. — 1980. — 49, N 10. —
P. 1123-1132.
Brown N.E. Sansevieria. A monograph of all the known species // Kew Bull.
- 1915. - N 5. - P. 185-261.
Brown N.A.C., Van Staden I., Jacobs G. Germination of Achenes of Leucospe¬
rmum cordifolium // Acta Horticulturae. — 1986. — N 185. — P. 53.
Brummitt R.K., Powell C.E. Authors of plant names. — Kew: Royal Bot.
gardens, 1992. — P. 732.
Bubeck S.K. A study of Paphiopedilum meristems culture. — Ph. D. disser¬
tation ‘Rutgers University’. — New Brunswick, 1973. — P. 230.
Burgeff H. Samenkeimung der Orchideen und Entwicklung ihrer Keimp-
flanzen. — Jena: G. Fischer Verlag, 1936. — 132 p.
Burger D. W. In vitro micropropagation of Eucalyptus sideroxylon // Hort¬
Science. - 1987. - 22, N 3. - P. 496-497.
Burger D. W., Hackett W.P. Gradients of adventitious bud formation on excised
epicotyl and root sections of citrus // Plant Sci. — 1986. — 43, N 3. — P. 229—232.
Burrow Y.E. Leaf axel Anatomy in the Araucariaceae // Austral. J. Bot. —
1987. - N 1. - P. 631-640.
521
СПИСОК ЛИТЕРАТУРЫ
Burrow Y.E., Doley Т. In vitro propagation Araucaria via axillary meristems //
Ibid. - 1988. - N 2. - P. 631-640.
Buyun L., Lavrentyeva A., Kovalskaya L., Ivannikov R. In vitro germination of
seeds of some tropical orchids // Acta Univ. Latviensis, Biology. — 2004. —
676. - P. 159-162.
Batygina T.B., Vasilyeva V.E. System of reproduction of Orchidaceae (on
example of Dactylorhiza maculata (L.)Soo) // Proc. VII Int. Symp. “Fertilization
and Embryogenesis in Ovulated Plants”, High Tarta (Ra6kova dolina), 1982. —
Bratislava, 1983. — P. 27—33.
Cabr M.F., Tisserat B. Propagating palms in vitro with special emphasis on the
date palm (Phoenix dactylifera L.) // Sci. Hort. — 1985. — 25, N 3. — P. 255—262.
Camloh М., Gogala N., Ruzic R. The micropropagation of Nephrolepis
exaltata // Biol, vestn. Ljubljana. — 1989. — 37, N 3. — P. 23—32.
Cardemil Y, Jordan M. Light and electron microscopic studies in vitro of
cultured female gametophyte of Araucaria araucana (Mol.) Koch. // Z. Pflanzen-
physiol. - 1982. - 107. - S. 329-338.
Carimi F., De Pasquale F., Crescimanno F. Somatic embryogenesis in culture
pistils by representative genus of Citrus // Plant Sci. — 1995. — 105, N 1. —
P. 81-86.
Carlisi LA., Torres K.C. In vitro shoot proliferation of camellia “Purple
Down” // HortScience. — 1986. — 21, N 2. — P. 314.
Carneiro M.S., Candido R.F., Aranjo M.H. et al. Clonal propagation of Cryp-
tanthus sinuosus L.B. Smith, an endemic Stoloniferous Bromeliaceae Species from
Rio De Janeiro, Brazil // Plant. Tissue Cult, and Biotechn. — 1998. — 4,
N 3/4. - P. 152-158.
Carpenter W.I. Light and temperature govern germination and storage of
Caladium seeds // HortScience. — 1990. — 25, N 1. — P. 77—79.
Cassella A.C., Pluakett A. Production and growth analysis of plants from leaf
cuttings, and from tissue cultures of disks from mature leaves and young axenio
leaves of African Violet (Saintpaulia ionantha Wendl.) // Sci. Hort. — 1984. — 23,
N 4. - P. 361-369.
Cassella A.C., Pluakett A., Kelleher Д Screening of Saintpaulia ionantha
Wendl. cultivars for calusogenetic potential based on the in vitro responses of
young axenic leaves on auxin and cytokinin factorial media // Sci. Hort. —
1986. - N 1/2. - P. 151-157.
Cassells A.C., Morrish F.M. Growth measurements of Begonia rex Putz. Plants
regenerated from leaf cuttings and in vitro from leaf petioles, axenic leaves, recycled
axenic leaves and callus // Sci. Hort. — 1985. — 27, N 1/2. — P. 113—121.
Cassells A.C., Morrish F.M. Genetic, ontogenetic, and physiological factors
and the development of a broad-spectrum medium for Begonia rex Putz. cuttivars
// Ibid. - 1987. - 31, N 3/4. - P. 295-302.
Cayral J.C. Un exemple d’utilization judicieuse de multiplication in vitro
Philodendron // Pepinieristes Horticulteurs Maraichers. — 19Я1. — 217. — P. 47—49.
Cervera E., Mandrigal R. In vitro propagation of Vanilla (Vanilla planifolia) //
Environ. Exp. Bot. — 1980. — 21. — P. 441—443.
Champagnat M. Multiplication vegetative des Cattleya a partit de burgeous
cultives in vitro // Soc. Bot. France Mem. — 1969. — 116, N 36. — P. 111 — 132.
Champagnat М., Morel G., Marston B. La multiplication vegetative des Cattleya //
Ann. Sci. Nat. Bot. Biol. - 1970. - 11. - P. 97-114.
522
СПИСОК ЛИТЕРАТУРЫ
Champagnat М., Morel G. La culture in vitro des tissues de tubercules d'Op-
hrys // Comp. Rend. Acad. Sci. Paris. - 1972. - 274, N 10. - P. 3379-3380.
Chang Hung Т., Bruce B. Camellias. — Portland, Oregon: Timber Press,
1984. - 210 p.
Chase M.W., Pippen, T.S. Seed morphology and phylogeny in subtribe Ca-
tasetinae (Orchidaceae) // Lindleyana. — 1990. — 5, N 2. — P. 126—133.
Chaturvedi H.C., Sharma A.K. Androgenesis in Citrus aurantifolia (Christm.)
Swingle // Planta. - 1985. - 165, N 1. - P. 142-144.
Chaturvedi H.C., Sharma Л.К., Prasad R.N. Shoot apex culture of Bougainvil¬
lea glabra “Magnifica” // HortScience. — 1978. — 13, N 1. — P. 36—37.
Cheah K.T., Sagawa Y. In vitro propagation of Aranda Wendy Scott and
Aranthera James Storei // Ibid. — 1978. — 13, N 6. — P. 661—662.
Chen W.H., Hsien K.M., Tsai W.T. et al. Application of biotechnology in the
improvement of Phalaenopsis // Proc. Nagoya Int. Orchid Show. — 1990. — 90. —
P. 90-94.
Chen W.H., Hsieh K.M., Tsai W.T et al. Phalaenopsis at the TSC // Amer.
Orchid. Soc. Bull. - 1995. - 64, N 5. - P. 492-495.
Chen Y., Piluek C. The influence of TDZ and 6-BAP on the regenerations of
Phalaenopsis // Plant Growth Regul. — 1995. — 16, N 1. — P. 99—101.
Chen Y, Bihua J. Investigation of tissue culture and fast reproduction of
Spathiphyllum ‘Xiangshi’ // J. Fujian Coll. Forest. — 2000. — 20, N 3. —
P. 273-275.
Chia T.} Arditti J., Monique S. et al. Review: in vitro flowering of orchids //
Lindleyana. - 1999- - 14, N 2. — P. 60-76.
Chlyah A. Neoformation canlinaire et radiculaire chez les fragmens de fenille
de Begonia rex Putz // Biol. Plantarum. — 1972. — 14, N 3. — P. 204—212.
Christensen C. The Pteridophyta of Madagascar. — Kopenhavn: H. Hagemp's
Boghandel, 1932. — 253 p.
Chua A., Kunisaki K., Sagawa Y. In vitro propagation of Dracaena marginata
Tricolor’ // HortScience. — 1981. — 16, N 4. — P. 494—496.
Chudovskaya E.A. Some anatomo-gistological features of orchids morphogene¬
sis in vitro // Матер1али МЬкнар. наук. конф. “Охорона i культивування opxi-
дей”. — К.: Наук, думка, 1999. — С. 139.
Chug R.C.O., Goh С.I. High frequency direct shoot regeneration from corm
axillary buds and rapid clonal propagation of taro, Colocasia esculenta var.
esculenta (L.) Schott (Araceae) // Plant Sci. — 1994. — 104, N 1. — P. 93—100.
Churchill M.E., Ball A., Arditti J. Tissue culture of orchids. 2. Methods for
root tips //Amer. Orchid Soc. Bull. — 1972. — 41. — P. 726—730.
Churchill M.E., Ball A., Arditti J. Tissue culture of orchids. 1. Methods of leaf
tips// New Phytol. - 1973. - 72. - P. 161-166.
Ciliozeris S., Tamosiunas A. Micropropagation of Zantedeschia hybrids //
Biotechnology Approaches for Exploitation and preserwation of Plant Resourses. —
Jalta, 2002. - P. 21.
Ciliozeris S., Tamosiunas A. Zantedeschia x hybrids propagation by tissue
culture // Int. Conf. “Plant Tissue Culture: from Theory to Practice”. — Salaspils,
2004. - P. 53.
Clayton P.W., Hubstenberger J.F., Phillips G.C. et al. Micropropagation of
members of the Cactaceae subtribe Cactinae // J. Amer. Soc. Hort. Sci. —
1990. - 115, N 2. - P. 337-343.
523
СПИСОК ЛИТЕРАТУРЫ
Cocking Е. A method for the isolation of plant protoplasts and vacuoles //
Nature. - 1960. - 187. - P. 962-963.
Cohen D. The influence of explant source on the establishment of plant tissue
cultures // Curr. Sci. - 1986. - 2, N 2. - P. 95-97.
Cohl H.A., Moser B.C. Effect of protoperiodic manipulation on seasonal
variation in bud and shoot regeneration of Rieger begonia leaf cuttings //
HortScience. - 1976. - 11, N 4. - P. 376-377.
Coleman R.A. Growing orchids as epiphytes // Amer. Orchid Soc. Bull. —
1986. - 55, N 4. - P. 137-153.
Conover C.A. Effects lime source on pH of growing medium during production
of Dieffenbachia maculata family // Foliage Digest. — 1995. — 18, N 9. — P. 1—4.
Cooke R.C. Homogenization as an aid in tissue culture propagation of
Platycerium and Davallia // HortScience. — 1979. — 14, N 1. — P. 21—22.
Cooke R.C. Tissue culture propagation of African violets // Ibid. — 1977. —
12, N 6. - P. 545.
Cooper P.A., Cohen D. Caladium — a candidate for micropropagation //
Comb. Prek. - 1983. - 32. - P. 363-367.
Cresswell R., Nitsch C. Organ culture of Eucalyptus grandis L. // Planta. —
1975. - 125. - P. 87-90.
Creze J. Elimination des virus de Camellia par greffe d’apex in vitro // C. r.
Acad. agr. France. — 1985. — 71, N 6. — P. 572—576.
Creze J. The graft of Camellia meristem in vitro // Camellia Rev. — 1980. —
42. - P. 2-11.
Creze J., Beauchesn, M.G. Camellia cultivation “in vitro” // Int. Camellia
J. - 1980. - 12. - P. 31-34.
Dabin P., Bouharmonl J. Recherches sur la propagation de l’azaee en con¬
ditions artificielles // Rev. Agr. — 1983. — 36, N 2. — P. 291—299.
David H., Isemukali K., David A. Obtention de plants de Pin maritime (Pinus
pinaster Sol.) a partir de brachyblastes ou d’apex caulinaires de tres jeunes sujets
cultives in vitro // C. r. Acad. sci. — 1978. — N 4. — P. 245—248.
de Donato М., Perucco E., Mozzetti O. Micropropagation of Peperomia
obtusifolia variegata arigation and related problems in regenerated plants // Ann.
Fac. sci. agr. Univ. studi Torino. — 1989. — 15. — P. 153—164.
Deberg P.C., Maene L.J. A scheme for commercial propagation of ornamental
plants by tissue culture // Sci. Hort. — 1981. — 14. — P. 335—345.
Debergh P.C. An in vitro technique for the vegetative multiplication of chimaeral
plants in Dracaena and Cordyline // Acta Hort. — 1976. — 64. — P. 17—19.
Debergh P.C., de Wael J. Mass propagation of Ficus lyrata // Acta Hortic. —
1977. - 78. - P. 361-364.
Debergh P.C. Effects of agar brand and concentration on the tissue culture
medium // Physiol. Plant. - 1983. - 59, N 2. - P. 270-276.
Desilets H., Desjardins Y., Bolanger R.R. Clonal propagation of pelargonium x
hortorum through tissue culture: Effects of salt dilution and growth regulator
concentration // Can. J. Plant Sci. — 1993. — 73. — P. 871—878.
Dexiang N., Lei W., Wenxue F. et al. Ecological influence of quality light on
tissue culture Caladium bicolor // J. Ecol. — 1988. — 7, N 4. — P. 17—20.
Diallo N., Duhoux E. In vitro у Eucalyptus camalduleptus camaldulensis //
J. Plant Physiol. - 1984. - 115, N 3. - P. 177-182.
524
СПИСОК ЛИТЕРАТУРЫ
Dijk Е. Micorhizen der Orchideen. // Die Orchidee. — 1988. — 39, N 1. —
S. 38-41.
Dixon R.A. Plant Cell Culture: a Practical Approach. — Oxford: Univ. Press,
IRL Press, 1985. — 120 p.
Donnelly D.J., Vidaver W.E. Glossary of Plant Tissue Culture. — Portland,
Oregon: Timber Press, 1988. — 178 p.
Douglas Y.C. Propagation of eight cultivars of Rhododendron in vitro using
agar-solidified and liquid media and direct rooting of shoots in vitro // Sci.
Hort. - 1984. - 24, N 3/4. - P. 337-847.
Dressier R.L. The orchids. Natural history and classification. — London:
Harvard Univ. Press, 1981. — 332 p.
Duan J., Xie Y. The influence of phytohormones on differentiation by Begonia
tuberhybrida leafs explants // Acta bot. Yunnanica. — 1984. — 5, N 4. —
P. 471-472.
Duan J.X., Yazawa S. 6-Benzyladenine and low night temperature treatments
induce early flowering in young Phalaenopsis seedlings // Jap. J. Trop. Agr. —
1994a. - 38. - P. 258-260.
Duan J.X., Yazawa S. In vitro floral development in x Doriella Tiny (Dooritis
pulcherrima x Kingiella philippinensis) // Sci. Hort. — 1994b. — 59. — P. 253—264.
Duan J.X., Yazawa S. Floral induction and development in Phalaenopsis in
vitro // Plant Cell, Tissue and Organ Culture. — 1995. — 43. — P. 71—74.
Durmishidze S.V., Gogoberidze M.K., Mamaladzc M.N. Regeneration of plants
from callus tissue of Yucca gloriosa buds // Z. Pflanzenphysiol. — 1983. — 111,
N 2. - S. 179-182.
Eapen S., Rao P.S. Regeneration of plants from callus cultures of Anthurium
patulum // Curr. Sci. (India). — 1985. — 54, N 6. — P. 284—286.
Economon A.S., Read P.E., Spanoudaki M.J. Azalea regeneration from callus
culture // Acta Hort. — 1987. — 226. — P. 209—216.
Ellinger T.Z., Preece J.E. Aseptic micropropagation of Rhododendron
hybrids 11 J. Hort. Sci. - 1985. - 60. - P. 269-274.
Encke F. Pareys Blumengartnerei. — Berlin: Paul Parey in Berlin und Ham¬
burg, 1958. - Vol. 1. - 941 s.
Ernst R. Effect of carbohydrate selection on the growth rate of freshly germi¬
nated Phalaenopsis and Dendrobium Seed // Amer. Orchid Soc. Bull. — 1967. —
36, N 1. - P. 1168-1073.
Ernst R. The influence TDZ on propagation of Phalaenopsis and Doritaeno-
psis (Orchidaceae) in vitro // Plant Cell, Tissue and Organ Culture. — 1994. — 39,
N 3. - P. 273-275.
Ernst R. The use of activated charcoal in asymbiontic seedling culture of
Paphiopedilum // Ibid. — 1974. — 43, N 1. — P. 35—38.
Ernst R., Arditti J. Carbohydrate physiology of orchid seedlings. Ill Hydrolysis
of maltooligosaccharides by Phalaenopsis (Orchidaceae) seedlings // Amer. J.
Bot. - 1990. - 77, N 2. - P. 188-195.
Escalant I.V, Neisson C. Somatic embryogenesis and plants from immature
Zygotic embryos of the species Musa acuminata and Musa balbisiana // Plant Cell
Reports. - 1989. - 7. - P. 665-668.
Evaldsson I., Welander N. T. The effects of medium composition on in vitro
propagation and in vivo growth of Cordyline terminalis cv. Atoom // J. Hort.
Sci. - 1985. - 60, N 4. - P. 525-530.
525
СПИСОК ЛИТЕРАТУРЫ
Ewart A.J. On the longevity of seeds // Proc. Roy. Soc. Victoria. — 1908. —
21, N 1. - P. 1-210.
Fast G. Die Vermherung von Oncidium papilio durch Triebspitzen — Kultur
und Besperchung einiger Nahr median // Die Orchidee. — 1973. — N 30. —
P. 240-246.
Fast G. Orchid seed germination and seedling culture — a manual: European
terrestrial orchids (symbiotic and asymbiotic methods) Orchid biology — review
and perspectives. — Ithaca, New York: Cornell Univ. Press, 1982. — Vol. 2. —
P. 309-326.
Fay J.J., Fakeno K., Hori Y. Culture conditions suitable for in vitro seed ger¬
mination and development of seedlings in Paphiopedilum // J. Jap. Soc. Hort.
Sci. - 1988. - 57, N 2. - P. 243-249.
Fernando K.K.S. Clonal propagation of Dendrobium Caesar Red Lip by meristem
culture // Trop. Agr. (Columbo, Sri Lanka). — 1979. — 135. — P. 111 — 113.
Finnie G.F., Van Staden G. Multiplication of the Tree Fern Cyathea dregii I j
HortScience. — 1987. — 22, N 4. — P. 665.
Firoozabady E., Nicholas Y., Guttersou N. In vitro plant regulation and
advanced micropropagation methods for pineapple // In vitro Cell. Dev. Biol. —
1995. - 31, N 3. - P. 51.
Fitchet M. Clonal propagation of queen and smooth cayenne pineapples //
Acta Horticulture. — 1990a. — 275. — P. 261—267.
Fitchet M. Organogenesis in callus cultures of pineapple (Ananas comosus (L.)
Merr.) // Ibid. - 1990b. - 275. - P. 267-274.
Flamee М., Boesman G. Clonal multiplication of Phalaenopsis hybrids by
means of sections of the flower stalk // Meded. Fac. landbouwwetensch et
Rijksuniv. Gent. — 1977. — 42. — P. 1865.
Foja S., Prakash D. In vitro propagation of Thunia alba (Wall.) Rchb. f.
through flower stalk cutting // Sci. Hort. — 1984. — 24, N 3/4. — P. 385—390.
Fonnesbech М., Fonnesbech A. In vitro propagation of Spathiphyllum //
Ibid. - 1979. - 30, N 2. - P. 21—25.
Fonnesbech A., Fonnesbech M. Irr vitro propagation of Monstera deliciosa 11
HortScience. - 1980. - 15, N 6. - P. 740-741.
Fordham Y., Stimart D.P., Zimneerman R.H. Axillary and adventitious shoot
proliferation on Exbury Azalea in vitro // Ibid. — 1982. — 17. — P. 738—739.
Frank М., Kubalakova M. Explautatove kultury ndkterych druhu rodu
Aglaonema (Araceae Juss.) // Zahrad. listy. — 1987. — N 4. — S. 309—312.
Fridborg G., Pedersen М., Landstrom L. et al. T. The effect of activated char¬
coal on tissue cultures: adsorption of metabolites inhibiting morphogenesis 11
Physiol. Plant. - 1978. - 43, N 2. - P. 104-106.
Frisch C.H., Camper N.D. Callus from Camellia sinensis and C. japonica stem
tissue // The Camellia J. - 1987. - 42, N 3. - P. 26-27.
Fruutt J.J., D'trr M.A. Tissue, culture propagation of Liriope, Muscari and
Ophiopogon jaburan // HortScience. — 1983. — 18, N 4. — P. 431—432.
Fu Fan M.L. Studies on the tissue culture of orchids. 2. Clonal propagation of
Aranda, Ascocendra, Cattleya by leaf tissue culture // Orchid Rev. — 1979. —
87. - P. 343-346.
Fuchs R. Fascinating Catasetums // Amer. Orchid Soc. Bull. — 1987. — 56,
N 5. - P. 468-472.
526
СПИСОК ЛИТЕРАТУРЫ
Furusato К., Ohta У., Ishibashi К. Some aspects of citrus micropropagation //
Rept Kihara Inst. Biol. Res. — 1957. — 8, N 1. — P. 40—48.
Fowler M.W. // Frontiers of plant tissue cultures. — Int. Assoc. Plant Tissue
Cultures. — Calgary, 1978. — P. 443—452.
Galan de Mera A., Hage M.A., Vicente Orellana J.A. Aerophyte a new life form
in Raunkiaer's classification // J. Veget. Sci. — 1999. — 10, N 1. — P. 65—68.
Galli M.G., Levi M. Promoting effects of potassium ions in the interaction
between fusicoccin and abscisic acid during postgerminative growth of Haplo-
pappus gracilis // Plant Sci. Lett. — 1981. — 22. — P. 243—251.
Galli M.G., Sparvoli E., Caroi M. Comparative effects of fusicoccin and
gibberellic acid on promotion of germination and DNA synthesis initiation of
Haplopappus gracilis // Ibid. — 1975. — 5. — P. 351—357.
Gandawijaja D. Effects of nitrate and ammonium on growth of tissue culture
of Dendrobium phalaenopsis Fitz. // Ann. bogor. — 1980. — 7. — P. 63—69.
Garnett K. Cultivation and propagation of insectivorous plants // Comb. Proc.
Int. Plant Prop. Soc. — 1982. — 31. — P. 316—324.
Gas G., Lalta I.R., Fallot I. Intered des gels de polyacrylamide comme
supparts de culture in vitro. // C. r. 96 Congr. Soc. Savantes (Paris). — 1971. —
245, N 1. - P. 81-92.
Gautheret R.J. La Culture des Tissue Vegetaux, Techniques et Realisations. —
Paris: Masson et Cie, 1959. — 190 p.
Geier T. Morphogenesis and plant regeneration from spadix fragments of
Anthurium scherzerianum cultivated in vitro // Plant. Cell. Tissue and Organ Cul¬
ture. - 1982. - 65. - S. 137-138.
Geier T. Anthurium scherzerianum und Gewebekultur // Dt. Gartenbau. —
1986. - 40, N 43. - S. 2030-2033.
Ghani H.A., Haris B. Plantlet production from yong leaves of Mokara //
Lindleyana. - 1992. - 7, N 1. - P. 11-12.
Ghani, H.A.> Haris B., Ujang N.B. Micropropagation of Mokara // Ibid. —
P. 7-10.
Gilt R.S., Gill S.S., Cosal SS. Vegetative propagation of Eucalyptus
tereticornis Sm. through tissue culture // Plant, Cell. Tissue and Organ Culture. —
1994. - 27. - P. 17-20.
Gill M.S., Singh Z., Dhillon B.S. et al. Somatic embryogenesis and regenera¬
tion of Citrus reticulata plants // Sci. Hort. — 1995. — 63, N 3/4. — P. 167—174.
Goh C.J. Tissue culture of Vanda ‘Miss Joaquim // J. Singapore Nat. Acad.
Sci. - 1970. - 2. - P. 31-33.
Goh C.J. Production of flowering orchids seedlings and plantlets // Malayan
Orchid Rev. - 1996. - 30, N 49. - P. 27-29.
Goh C., Loh C. Further observations on meristem culture of Aranda Deborah
11 Ibid. - 1975. - N 12. - P. 10-13.
Goh C.J^ Tan H. Clonal propagation from bud explants in Renantanda orchid
hybrid // Ibid. - 1982. - 90. - P. 295-296.
Goodwin T.W. The biosynthesis of vitamins and related compounds. — New
York: Acad. Press, 1963. — 210 p.
Gordienko N.Y. Clonal micropropagation with preservation of decorative cha¬
racters of Saintpaulia cultivars // Biotechnology Approaches for Exploitation and
Preservation of Plant Resourses. — Jalta, 2002. — P. 30.
527
СПИСОК ЛИТЕРАТУРЫ
Grabowski К, Krause J., Lisiecka A., Oszkinis K., Szczepaniak S. Rosliny
ozdobne. — Warszawa: Panstwowe wydawnictwo naukowe, 1987. — 429 s.
Grace W.P. Propagation of Cordyline terminalis from Callus culture 11 Hort¬
Science. - 1978. - 13, N 6. - P. 600-604.
Gregorini C., Tognoni F., Alpi A., Salvatori L. Propagation per coltura in vitro
di apici vegetative di Cattleya sp. // Rev. Ortoflorofruttic. Ital. — 1975. — 59
N 3. - P. 162-170.
Griesbach R.Z. The use of indoleactylamino acids in the in vitro propagation
of Phalaenopsis orchids // Sci. Hort. — 1983. — 19, N 3/4. — P. 363—366.
Griesbach R.Z. Selection of a dwarf Hemerocallis through tissue culture //
HortScience. — 1989. — 24, N 6. — P. 1027—1028.
Grimes J. An easy method to induce Phalaenopsis ’’Stem Props” // Amer.
Orchid Soc. Bull. - 1987. - 56, N 4. - P. 369-371.
Grinblat. U. Differentiation of Citrus stem in vitro // J. Amer. Soc. Hort.
Sci. - 1992. - 12. - P. 599-603.
Grunewaldt G. Adventiv rospenbildung und Pflanzenregeneration bei Gesne-
riaceae in vitro // Gartenbauwissenschaft. — 1977. — 42, N 4. — S. 171—175.
Gu J., Arditti JLyman L.P. Vanilla planifolia: callus induction and plantlet
production in vitro // Lindleyana. — 1987. — 2, N 1. — P. 48—52.
Gu W. Tissue culture and fast reproduction of Anthurium scherzerianum 11
Plant Physiol. Commun. — 1995. — 31, N6. — P. 433.
Gupta P.K, Mascarenhas A.F., Yagannathan V. Tissue culture of forest trees
clonal propagation of mature trees of Eucalyptus citriodora Hook, by tissue
culture // Plant Sci. Lett. — 1981. — 20. — P. 195—201.
Hackett W.P., Tse A., Smith R.J. Adventitious bud formation on Phalaenopsis
buds as a propagation method // Plant Prop. — 1972. — 18, N 4. — P. 4—5.
Haines R.L, De Fassard RI. Propagation of Hooppine (Arauc. Cunninghammi
Aix) by organ culture // Acta Hort. — 1977. — 78. — P. 297—302.
Haldeman J.H., Thomas R.L., McKamy D.L. Use of benomyl and rifampicin
for in vitro shoot tip culture of Camellia sinensis and C. japonica 11
HortScience. — 1987. — 22, N 2. — P. 306—307.
Haldeman J.H. Prospects for using genetic engineering to obtain disease
resistance in Camellias 11 The Camellia J. — 1995. — 50, N 1. — P. 7—8.
Haldeman J.H., Kathleen J.L. Attempting the infection of Camellia japonica
leaf discs with Agrobacterium tumefaciens // The Camellia J. — 1996. — 51,
N 1. - P. 200-204.
Handro W. Araucaria (Ar. spp.) // Biotechnology in Agriculture and
Forestry / Ed. by I.H.S. Bajaj. — Berlin: Springer-Verlag, 1986. — P. 310—315.
Hangarther R.P., Peterson M.D., Good N.E. Biological activity of indoleace-
tylamine acids and their use as auxins in tissue culture // Plant Physiol. — 1980. —
65, N 5. - P. 761-767.
Hannapel D.J., Dirr M.A., Sommer H.E. Micropropagation of native Rhodo¬
dendron species // HortScience. — 1981. — N 16. — P. 391.
Hansech KT. Stand und Perspective der in vitro Kultur von Saintpaulia
ionantha // Gartenbau (Berlin). — 1988. — 35, N 6. — S. 186—187.
Haramaki C. Tissue culture of Gloxinia // Hort. Sci. — 1971. — 21. — P. 442—449.
Harbage J.F., Stimart D.P. Adventitious shoot regeneration from in vitro sub-
cultured callus of Rhododendron exbury hybrids // Ibid. — 1987. — 22, N 6. —
P. 1324-1325.
528
СПИСОК ЛИТЕРАТУРЫ
Harrison C.R. Ultrastructural and histochemical changes during the germination of
Cattleya aurantiaca (Orchidaceae) // Bot. Gaz. — 1977. — 138, N 1. — P. 41—45.
Harrison C.R., Arditti J. Physiological changes during the germination of
Cattleya aurantiaca (Orchidaceae) // Ibid. — 1978. — 139, N 2. — P. 180—189.
Hawkes A. Encyclopaedia of cultivated orchids. — London, Boston: Faber and
Faber Limited, 1987. — 602 p.
Hennen G.K., Sheehan T.I. In vitro propagation of Platycerium stemaria
(Beauvois) Desv // HortScience. — 1978. — 13. — P. 245.
Henny R.J. In vitro propagation of Peperomia 'Red Ripple' from leaf discs //
Ibid. - 13, N 2. - P. 150-151.
Henny R.J. Increasing basal shoot production in a nonbranching Dieffenbachia
hybrid with BA // Ibid. - 1987. - 21, N 6. - P. 1386-1388.
Heslehurst M.R. Germination of Grevillea leanksii // Aust. Plants. — 1977. —
9. - P. 206-208.
Hew C.S., Ting S.K., Chia T.F. Substrate utilization by Dendrobium tissues //
Bot. Gaz. - 1988. - 149, N 2. - P. 153-157.
Hew C.S. Lee F.Y. Control of flowering by floral bud removal in x Aranda
Christine under tropical field conditions // J. Jap. Soc. Hort. Sci. — 1989. — 58,
N 3. - P. 691-695.
Hicks G.S. Patterns of organ development in plant tissue culture and the
problem of organ determination // Bot. Rev. — 1980. — 48, N 1. — P. 1—25.
Higuchi H., Amaki W. Effects of 6-benzylaminopurine on the organogenesis of
Asplenium nidus L. through in vitro propagation // Sci. Hort. — 1989. — 37,
N 4. - P. 351-359.
Hijner J.A., Arditti J. Orchid mycorriza. Vitamin production and requirements
by the symbionts 11 Amer. J. Bot. — 1973. — 60. — P. 829—835.
Hilding A., Welander T. Effects of some factors on propagation of Begonia x
hiemalis in vitro // Swed. J. Agr. Res. — 1976. — 6, N 3. — P. 191 — 199.
Holder P.L., Kirkham M.B. Tissue-culture propagation of the cactus Echinopsis
turbinata L. // Ann. Arid. Zone. — 1984. — 23, N 2. — P. 95—97.
Hosoki Т., Asahira T. In vitro propagation of Bromelias in liquid culture //
Horticultura. - 1980. - 15, N 51. - P. 603-604.
Hsia C., Korban S. Influence of cytokinins and ions concentraton in Andre -
son's medium on implant shoots and proliferation of Azalea // Emphatic. — 1997.
- 93, N 1. - P. 11-17.
Huang L.C. Alternation methods for Cattleya propagation by tissue culture //
Amer. Orchid Soc. Bull. — 1984. — 53, N 2. — P. 60—67.
Huang L.C. A procedure for asexual multiplication of Paphiopedilums in
vitro // Ibid. - 1988. - 57. - P. 274-278.
Hughes K.W. In vitro ecology: exogenous factors affecting growth and mor¬
phogenesis in plant culture systems // Environ. Exp. Bot. — 1981. — 21, N 3/4. —
P. 281-288.
Hui L.H., Zee S.Y. In vitro propagation of Peperomia viridis using medium
supplemented with ginseng powder // HortScience. — 1981. — 16. — P. 86—87.
Hvoslef-Eide A.K. The effects of irradiance and temperature on in vitro
cultures of Nephrolepis exaltata (L.) Schott and Cordyline fruticosa (L.) A.
Chev. // Gartenbauwissenschaft. — 1990. — 55, N 6. — S. 259—264.
Ichihashi S., Kako S. Studies on clonal propagation of Cattleya through tissue
culture method // J. Jap. Soc. Hort. Sci. — 1977. — 46, N 3. — P. 325—330.
529
СПИСОК ЛИТЕРАТУРЫ
Intuwong О., Sagawa Y. Clonal propagation of Phalaenopsis by shoot tip
culture // Amer. Orchid Soc. Bull. — 1974. — 43, N 10. — P. 893—895.
Intuwong O., Sagawa Y. Clonal propagation of Dendrobium Golden Wave and
other Nobile Types // Ibid. - 1975. - 44, N 4. - P. 319-322.
Irawati A., Harjadi S., Suseno H. Tissue culture of Aranthera 'James
Snowier // Orchid Rev. - 1974. - 85, N 1007. - P. 138-142.
Ishii M. Studies on tissue culture of Cattleya species // J. Jap. Soc. Hort.
Sci. - 1980. - 49. - P. 127-131.
Ishii М., Uomoto S., Fujieda K. Studies on tissue culture of Cattleya species //
Ibid. - 1979. - 48, N 2. - P. 199-204.
Ivannikov R, Lavrentyeva A. Experience of propagation of Monstera deliciosa
Liebm. var borsigiana (C. Koch.) Engl, in culture in vitro // Int. Conf. “The Biology of
Plant Cells in vitro and Biotechnology”. — Saratov, 2003. — P. 126—127.
Ivannikov R., Lavrentyeva A. Microclonal propagation of Musa nana Lour. // Int.
Conf. “Plant Tissue culture: from Theory to Practice”. — Salaspils, 2004. — P. 73.
Ivanova N. Biotechnology methods of propagation in ornamental pot plants
Anthurium riger, Begonia elatior // Biotechnology Approaches for Exploitation and
Preservation of Plant Resourses. — Jalta, 2002. — P. 32.
Ivanova N. Clonal micropropagation of Dieffenbachia Schott in vitro // Int.
Conf. “Plant Tissue Culture: from Theory to Practice”. — Salaspils, 2004. — P. 72.
Iwashina Т., Konishi Т., Takayama A. et al. Isolation and identification of the
flavonoids in the leaves of Taro (Colocasia esculenta) Araceae // Ann. Tsukuba
Bot. Gard. - 1999. - N 18. - P. 71-74.
Jackson G.V.H., Ball E.A., Arditti J. Tissue culture of taro, Colocasia esculenta
(L.) Schott. // J. Hort. Sci. - 1977. - 52, N 3. - P. 373-382.
Jackson P.W. Development and adaption of the plant conservation by the
Convention on Biological Diversity: NGOs perspective // Bot. Gard. Conservation
News. - 2002. - 3, N 8. - P. 23-32.
Jacques М., Marie-Therese P. Capability for organogenesis of leafs of
Saintpaulia ionantha by cultivation in vitro // C. r. Acad. sci. — 1985. — 301,
N 5. - P. 265-268.
Jaiswal V.S., Narayan P. Regeneration of plantlets from the callus of stem
segments of adult plants of Ficus religiosa L. // Plant Cell Reports. — 1985. — 4,
N 5. - P. 256-258.
Janeiro L. V., Vieitez A.M., Ballester A. Cryopreservation of somatic embryos and
embryonic axes of Camellia japonica L. // Ibid. — 1996. — N 15. — P. 699—703.
Janssens G. Gomogenization in vitro of Begonia x hiemalis // Meded. Fac.
landbouwwetensch Rijksuniv. Gent. — 1987. — 52, N 4. — P. 1501 — 1503.
Janssens G., Sepalie M. In vitro multiplication of Blechnum sp. and Pelaea
rotundifolia (Forst.) Hook by homogenization // Sci. Hort. — 1989. — 38,
N 1/2. - P. 161-164.
Japichino G., Chen N.Y., Fuchigami Z.H. Plant regeneration from somatic
tissues of Rhododendron laetum x aurigeranum // Plant Cell, Tissue and Organ
Culture. - 1991. - 27. - P. 37-43.
Japichino G., Steve McC., Chen T.H.H. Adventitious shoot formation from leaf
explants of Rhododendron // Ibid. — 1992. — 30. — P. 237—241.
Jesch H.H. Anwendung der in vitro Vermehrung bei Ziergehoren // Gartenbau
(Berlin). - 1988. - 35, N 6. - S. 184-185.
530
СПИСОК ЛИТЕРАТУРЫ
Jha S., Sen S. Regeneration and rapid multiplication of Bowiea volubilis Harv.
in tissue culture // Plant Cell Reports. — 1985. — 4, N 1. — P. 12—14.
Johansson L.B. Effect of activated charcoal, cold treatment and elevated C02-
concentrations on embryogenesis in anther cultures // Proc. Int. Symp. “Gen
Manipulat. Plant Breed”. — Berlin (West), Sept. 8—13, 1985. — P. 257—264.
Johnson B.B. In vitro propagation of Gloxinia from leaf explants //
HortScience. - 1978a. - 13, N 2. - P. 149-150.
Johnson B.B. In vitro propagation of Episcia cupreata // Ibid. — 1978 b. —
13, N 5. - P. 596.
Jona R., Gribaudo I. Adventitious bud formation from leaf explants of Ficus
lyrata // Ibid. - 1987. - 22, N 4. - P. 651-653.
Jonard R., Baud P., Va Ideron G. Development in vitro de plantes a partir
d'apex preleves sur un cultivar de Figuier (Ficus carica L.) // Bull. Soc. bot.
France (Lett. bot). - 1983. - 130, N 4/5. - P. 301-306.
Jumin H.B, Nito N. Florification of Murraya paniculata in vitro //
Experientia. - 1996a. - 52, N 3. - P. 268-272.
Jumin H. B., Nito N. Florification in vitro of Fortunella hindsii // Plant Cell
Reports. - 1996b. - 15, N 7. - P. 484-488.
Kamada H., Harada H. Changes in the endogenous level and effects of abs-
cisic acid during somatic embryogenesis of Daucus carota L. // Plant Cell
Physiol. - 1981. - 22, N 8. - P. 1423-1429.
Kamemoto H. Evaluation of 16 seed-propagated amphidiploid Dendrobium
progenies // Hawaii Institute of Tropical Agriculture and Human Resources. —
1989. - N 105. - P. 8.
Kang L.C. Orchids, their cultivation and hybridization. — Singapore: Eastern
Univ. Press, 1977. — 94 p.
Kano K. Studies on the media for orchid seed germination // Mem. Fac. Agr.
Kagawa Univ. - 1965. - N 20. - P. 20-22.
Kano К Acceleration of the germination of so-called “hard-to-germinate”
orchid seeds // Amer. Orchid Soc. Bull. — 1968. — 37, N 8. — P. 690—698.
Karasawa K. On the media with banana and honey added for seed germina¬
tion and subsequent growth of orchids // Orchids Kew. — 1966. — 74. — P. 133.
Karim A.B., Ghani A., Haris H. et al. Production of Renantanda plantlets from
shoot tips in vitro // Lindleyana. — 1992. — 7, N 1. — P. 3—6.
Karpov P. Approaches in micropropagation in vitro of Yucca farreyi Shat.,
Y. aloifalia L. and Cordyline australis Hook. // Int. Conf., “Plant Tissue Culture:
from Theory to Practice”. — Salaspils, 2004. — P. 5.
Kato M. Micropropagation through cotyledon culture in Camellia japonica L.
and C. sinensis L. // Jap. J. Breed. — 1986. — 36, N 1. — P. 31—38.
Kavanagh J.M., Hunter S.A., Crossan P.S. Micropropagation of Catawba hyb¬
rid rhododendrons Nova Zambia, Cynthia and Pink Pearle. // Comb. Proc. Int.
Plant Prop. Soc. - 1987. - 36. - P. 264-272.
Kerbany G.B. In vitro flowering of Oncidium varicosum mericlones (Orchi-
daceae) // Plant Sci. Lett. — 1984a. — 35. — P. 73—75.
Kerbany G.B. Plant regeneration of Oncidium varicosum (Orchidaceae Juss.) by
means of root tip culture // Plant Cell Reports. — 1984b. — 3, N 1. — P. 27—29.
Kerbany G.B. Regeneration of protocorm-like bodies through in vitro culture
of root tips of Catasetum (Orchidaceae) // Z. Pflanzenphysiol. — 1984c. — 113. —
S. 287-291.
531
СПИСОК ЛИТЕРАТУРЫ
Kerbany G.B. In vitro conversion of Cattleya root tip cells into protocorm-like
bodies // J. Plant Physiol. - 1991. - 133. - P. 248-251.
Kerbany G.B. The effects of sucrose and agar on the formation of protocorm-
like bodies in recalcitrant root tip meristems of Oncidium varicosum (Orch.) //
Lindleyana. — 1993. — N 8. — P. 149—154.
Ketsa S., Boonrote A. Holding solutions for maximizing bud opening and
vaselife of Dendrobium “Gouppadeewan” flowers // J. Hort. Sci. — 1990. — 65,
N 1. - P. 41-47.
Kevers C. In vitro vegetative multiplication of Fuchsia hybrida // Sci. hort. —
1983. - 21, N 1. - P. 67-71.
Kevers C., Gaspar T. Vitrification of carnation in vitro: Changes in ethylene
production, ACC level and capacity to convert ACC to ethylene // Plant Cell,
Tissue and Organ Culture. — 1985. — 4. — P. 215—223.
Khaw C., Ong H., Nair H. Hormones in the nutrition of orchid tissues in
mericloning // Malaya Orchid Rev. — 1978. — 13. — P. 60—65.
Khosh-Khui М., Shekafandeh A., Azarakhsh H. Micropropagation of myrtle //
Sci. hort. - 1984. - 22, N 1/2. - P. 139-146.
Kim K, Kunisaki Y.T., Sagawa Y. Shoot tip culture of Dendrobium // Amer.
Orchid Soc. Bull. - 1970. - 39, N 12. - P. 1077-1080.
Kim K, Sagawa Y., Kunisaki Y Micropropagation of Dendrobium
(Orchidaceae) by root tip culture 11 Ibid. — 1982. — 47, N 11. — P. 813—815.
Kjellsson G., Rasmussen F.N. Does the pollination of Dendrobium unicum
Seid. Involve ‘pseudopollen’ // Die Orchidee. — 1987. — 38, N 4. — S. 183—187.
Kjellsson G.} Rasmussen F.N., Dupuis D. Pollination of Denrobium infundibu-
lum, Cymbidium insigne (Orchidaceae) and Rhododendron lyi (Ericaceae) by
Bombus eximis (Apidae) in Thailand: A possible case of floral mimicry // J. Trop.
Ecol. - 1986. - N 1. - P. 289-302.
Knauss /. A. Tissue culture method for producing Dieffenbachia picta cv.
‘Perfection’ free of fungi and bacteria // J. Hort. Soc. — 1976. — 2 - P. 293—296.
Knudson L. Nonsymbiotic germination of orchid seeds // Bot. Gaz. —
1922. - 73, N 1. - P. 1-25.
Knudson L. A new nutrient solution for germination of orchid seeds // Amer.
Orchid Soc. Bull. - 1946. - 15, N 4. - P. 214-217.
Kochba J., Spiegel-Roy P. Cell and tissue culture for breeding and develop¬
mental studies of Citrus // Hort. Sci. — 1977. — 12, N 2. — P. 110—114.
Kononowicz H., Janick J. In vitro propagation of Vanilla planifolia // Ibid. —
1984. - N 19. - P. 58-59.
Koshuchowa S. Cytologisch und histologische Veraderungen bex der Vitrifika-
tion von Pflancen unter Bedingungen der In vitro Kultur // Potsdam. Forsch.
C. - 1988. - 57. - S. 195-196.
Kostenyuk Y. The induction of flowering in orchid Cymbidium niveomargi-
natum in vitro // The 2-nd Int. Symp. “On Plant Biotechnology”. — Kiev,
1998. - P. 67.
Krikorian A.D. Cloning higher plants from aseptically cultured tissues and cells
(Colocasia) // Biol. Rev. Cambridge Philosoph. Soc. — 1982. — 57. — P. 151—218.
Kristiansen К Propagation of Ficus benjamina // Yarden Tid. — 1989. — 105,
N 50. - P. 1256-1257.
Kukulczanka К La production des orchids // Agricultura. — 1983. — 472. —
P. 83-84.
532
СПИСОК ЛИТЕРАТУРЫ
Kukulczanka К. Effects of biostimin on the growth of meristematic tissue and
protocorm formation of some orchids in vitro culture // Acta Hort. (Wagem-
ninder). - 1985. - N 167. - P. 273-278.
Kukutczanka K, Klimaszewska K, Pluta H. Regeneration of entire plants of
Peperomia scandens Ruiz from different parts of leaves in vitro // Acta Hort. —
1977. - 78. - P. 365—371.
Kukulczanka K, Wojciechowska К Propagation of two Dendrobium sp. by in
vitro culture // Acta Hort. (The Hague). — 1983. — 131. — P. 105—110.
Kukulczanka K, Kromer KD. Regeneracja restytucyina Phalaenopsis w culture
in vitro // Acta Univ. Bratisl.: Pr. bot. — 1984a. — N 30. — S. 3—14.
Kukulczanka K, Kromer KD. Regeneracja Yucca sp. z rozmnozek w Kulturze
in vitro // Ibid. - 1984b. - N 667. - S. 39-48.
Kukulczanka K., Iraly E. Modyfikacje wywolane morfaktyna u Caladium x
hortulanum birdsey w culture in vitro // Ibid. — 1984. — N 30. — S. 49—50.
Kukulczanka K, Czastka B. Propagation of some species of the Bromeliaceae
family cultured in vitro // Acta Horticulture. — 1989. — 251. — P. 167—181.
Kukulczanka K, Kromer K, Roginska B. Joint effects of growth regulators and
peptone on regeneration of Vuylstekeara Cambria orchid under tissue culture
conditions // Acta Hort. — 1989. — 261. — P. 161—166.
Kulkarni V.M., Choudhari A.N., Shah B.S. et al. Florification in vitro of Afri¬
can panic grass // Indian J. Exp. Biol. — 1995. — 33, N 2. — P. 142—143.
Kunisaki J.T. In vitro propagation of Cordyline terminalis (L. Kunth) // Hort.
Sci. - 1975. - 10, N 6. - P. 601-602.
Kunisaki J.T. Tissue culture of tropical ornamental plants, Araceae Juss //
Ibid. - 1977. - 12, N 2. - P. 17-18.
Kunisaki J.T. In vitro propagation of Anthurium andreanum Lindl. (tissue
culture) // HortScience. — 1980. — 15, N 4. — P. 508—509.
Kunisaki J.T., Kim KK, Sagawa Y. Shoot tip culture of Vanda // Amer. Or¬
chid Soc. Bull. - 1972. - 41, N 2. - P. 435-438.
Kusumoto M. Effects of combination of growth regulators and organic supple¬
ments on the growth of Cattleya plantlets cultured in vitro // J. Jap. Soc. Hort.
Sci. - 1979.- 47. - P. 492-501.
Kyte L., Kleyn J. Plants from test tubers. — Portland: Timber Press, 2003. — 240 p.
Lado P., Rasi-Caldogno F., Colombo R. Acidification of the medium associated
with normal and fusicoccin-induced seed germination // Physiol. Plant. — 1975. —
34. - P. 359-364.
Lammert W.E. The use of embryo culture in germination of Camellia seeds // Ca¬
mellia Research. Southern California Camellia Society. — California, 1950. — P. 7—8.
Lammert W.E. Embryo culture in camellia seeds germination: Camellia Cul¬
ture. — New York: Macmillan Comp., 1958. — 484 p.
Lang-Ying Z, Geng-guang L., Jun-Yary G. The somatic embryogenesis from
leaf Begonia flmbristipula development in vitro // Agr. Exp. Stat. J. — 1988. — 30,
N 2. - P. 134-139.
Lavrentyeva A.N. Factors influencing clonal micropropagation of plants of the
Araceae Juss. family // Int. Symp. “Plant Biotechnology and Jenetic engineering”,
Oct. 3-6, Kiev, 1994. - Kiev, 1994. - P. 98.
Lavrentyeva A.N. Some features of clonal propagation of Araceae Juss.
family // Thesi II Int. Symp. “Breeding, propagation in vitro and disease resistance
of horticultural plants”, Salaspils (Latvia), Apr. 12—16, 1996. — Salaspils, 1996. —
P. 56-58.
533
СПИСОК ЛИТЕРАТУРЫ
Lavrentyeva A.N., Cherevchenko Т.М. Elaboration of optimum biotechnologies
introducted into the production of greenhouse plants // Int. Symp. “Plant biotech¬
nology and genetic engineering”, Oct. 3—6, Kiev, 1994. — Kiev, 1994. — P. 99.
Lavrentyeva A., Buyun L.y Kovalskaya L. The vegetative progation of Den¬
drobium Sw // Int. Conf. of Baltic States “Plant tissue culture: from theory to
practice”, Salaspils (Latvia). — Salaspils, 1996. — P. 55.
Lavrentyeva A.N., Denisyevskaya N.A. Clonal micropropagation of some
Araceae Juss. plants // Int. Sci. Conf. “Plant genefund accumulation, evaluation
and protection in the botanical gardens”, Vilnius, July 1—2, 1999. — Vilnius,
1999. - P. 143-145.
Lavrentyeva A., Buyun L., Kovalskaya L. In vitro propagation as the mean of
ex situ conservation of rare tropical species of Orchidaceae family // Int. Conf. of
Baltic States “Plant tissue culture: from theory to practice”, Salaspils (Latvia). —
Salaspils, 2004. — P. 35.
Lavrentyeva A., Maltsov Y. Peculiarities of morphogenesis of Cordyline termi-
nalis Kunth. var. 'Kiwi' in vitro // Ibid. — P. 76.
Lazzeri P.A., Dunwell J.M. In vitro regeneration from seedling organs of
Brassica oleraceae var. italica Plenck cv. Green comet. 2. Effect of light conditions
and explant size // Ann. Bot. (USA). — 1986. — 58, N 5. — P. 699—710.
Levin R., Ran S., Alper L., Watad A. A technique for repeated non-axenic
subculture of plant tissues in a bioreactor on liquid medium containing sucrose //
Plant Tissues Cuture and Biotechnol. — 1997. — 3, N 1. — P. 41—45.
Lida Т., Yabe K, Wasida S., Sakurai Y. Mass propagation of Begonia tuber-
hybrida Voss plantlets using tissue culture // Res. Bull. Aichi-Ken Agr. Res:
Center.Nakagute, Aichi. — 1986. — N 18. — P. 186—190.
Lim-Ho C.Z. Experimental findings of the tissue culture of orchid hybrids at
the Singapore Botanic Gardens // Gard. Bull (Singapore). — 1981. — N 34. —
P. 148-160.
Lim-Ho C.Z., Lee G.C. Clonal propagationa of Oncidium from dormant buds
on flower stalk // Malay Orchid Rev. — 1987. — 21. — P. 48—52.
Lin D., Han J. Propagation in vitro of tips stem Cordyline terminalis // Plant
Physiol. Commun. - 1991. - 27, N 3. - P. 211-212.
Lindemann E.J.P., Yunckel Y.E., Davidson O.W Meristem culture of
Cattleya // Amer. Orchid Soc. Bull. — 1970. — 39. — P. 1002—1004.
Linden B. Aseptic germination of seeds of northern terrestrial orchids // Ann.
bot. fenn. - 1980. - 17, N 2. - P. 174-182.
Lipucci di Paola М., Siri A., Fossi D., Tognoni F. Propagazione in vitro di
Dieffenbachia amoena Hort. // Riv. Ortoflorofruttic. Ital. — 1986. — 70, N 4. -
P. 245-252.
Lis E. Propagation of orchids by means of the sheet meristem culture
method // Post, nauk rol. — 1971. — N 1. — P. 77—83.
Litz R. E. Somatic embryogenesis in tropical fruit trees // Tissue. Cult. Forest
and Agr. Proc. 3-rd Term. Symp. Plant Cell and Tissue Cult., Knoxville, Tenn.,
9-13 Sept., 1984. -v New York; London, 1985. - P. 179-193.
Loh C.S., Rao A.N., Goh C.I. Clonal propagation from leaves in the orchid
Aranda // J. Singapore Nat. Acad. Sci. — 1975. — 4, N 3. — P. 97—99.
Lubomski M. Rozmnazanie fiolka afrykanskiego metoda kultur in viuo //
Ogrodnictwo. — 1986. — 23, N 11. — P. 24—25.
534
СПИСОК ЛИТЕРАТУРЫ
Ly T.L. Regeneration of plantlets in cultures of immature cotyledons and
young embryos of Camellia oleifera Abel. // Acta Biol. Exp. Sinica. — 1982. — 15,
N 4. - P. 393-403.
Lyr H., Ricnter R., Hoffmann J. Die Bedentung des Wurzel-Systems bei der
Regulation des Pflanzenwachstums // Biol. Rdsch. — 1974. — 12, N 4. — S. 244—254.
Maene Y.I., Debergh P.C. Preliminary results on organ culture of Araucaria
excelsa (Zamb. R.Br.) // YUFRO Proc. Colloq., Int la Culture in vitro des
Essences Farestieres, AFOCEZ. — Nangia, France, 1988. — P. 155—158.
Maggon R, Deo S.B. Creationof of favourable conditions for regeneration by
adventive buds with helping ABA and 6-BAP of epicotyl and hypocotyl orange-
tree // Sci. Hort. - 1995. - 63, N 1/2. - P. 123-128.
Manorama P., Rao A., Goh C., Loh C. Leafs callus development in Aranda
and Dendrobium // Bull. Soc. Bot. France. — 1986. — N 3. — P. 102—109.
Mapes T. Tissue culture of bromeliada // Prog. Int. Plant Soc. — 1973. —
27. - P. 47-55.
Margara J. The influence of different factors on organogenesis in vitro by
Begonia elatior// C. r. Acad. sci. — 1982. — 294, N 3. — P. 181—184.
Margara J., Piollat M.T., Domin M. Organogenese normale ou atypique
en culture in vitro a partir dupetale de Begoria x elatior // Ibid. —
N 2. - P. 127-132.
Mariat F. Recherches sur la physiologie des embryons d'orchidees// Rev.
Gen. Bot. - 1952. - 59. - P. 324-337.
Marinova S., Iliev L. Effect of DROPP on adventitious bud formation in
Cordyline terminalis L. “Red Edge” // Докл. Бълг. АН. — 1992. — 45, N 6. —
С. 87-88.
Marsh J.E. Studies in the genus Crevillea // B. Sc. Agr. Thes. — Univ.
Sydney, 1975. — 10 p.
Mathews V.H., Rao P.S. In vitro multiplication of Vanda hybrid through tissue
culture technique // Plant Sci. Lett. — 1980. — 17, N 3. — P. 383.
Mathews V.H., Romgan T. Growth and regeneration of pineapple plantlets
callus cultures 11 Sci. Hort. — 1981. — 14. — P. 227—234.
Mathews V.H., Rao P.S. In vitro culture of Vanda (Vanda TMA x Vanda ‘Miss
Joaquim). 1. Studies of protocorm explants // Proc. Indian Natl. Sci. Acad. —
1985. - 51, N 1. - P. 96-103.
Matsumoto K., Yamaguchi H. Non-woven materials as a supporting agent for
in vitro culture of banana protocorm-like bodies // Trop. Agr. — 1989. — 66,
N 1. - P. 8-10.
Matsumoto K., Yamaguchi H., Tano S. et al. Induction of protocorm-like
bodies by Musa and delay of his growth with helping ocsiprolin 11 Environ. Contr.
Biol. - 1987. - 25, N 2. - P. 63-66.
Maia E., Paupet A., Marais A. et al. In vitro vegetative propagation of two
species Philodendron: P. houlletianum and P. scandens // Comtes Rendus Acad.
Sci. - 1983. - 296. - P. 673-676.
McQueen J.f McQueen B. Orchids of Brazil. — Portland, Oregon: Timber
Press, 1993. — 200 p.
McCown B.N., Lloyd G.B. Woody plant medium (WPM) a mineralnutrient
formulation for miroculture of woody plant species // HortScience. — 1990. —
25. - P. 797-800.
Mee G.W.P. Propagation of Cordyline terminalis from callus culture //
Ibid. - 1978. - 13, N 6. - P. 600.
535
СПИСОК ЛИТЕРАТУРЫ
Mehra-Palta A. Clonal propagation of Eucalyptus by tissue culture // Plant
Sci. Lett. - 1982. - 26, N 1. - P. 1-11.
Menard D., Coumans М., Caspar T. Micropropagation du Pelargonium a
Partir de Meristemes // Rijksuniv. Gent. — 1985. — 50, N 2. — P. 327—331.
Mercier H., Kerbany G.B. Micropropagation of Dyckia macedoi — an endan¬
gered endemic Brazilian bromeliad // Bot. Gardens: Micropropagation News. —
1993. - 1, N 6. - P. 70-72.
Meyer M.M. In vitro propagation of Rhododendron from flower buds //
HortScience. — 1981. — 16. — P. 390—391.
Meyer M.M. In vitro propagation of Rhododendron catawabiuse from flower
buds // Ibid. - 1982. - 17. - P. 891-892.
Michel H. In vitro Vermehrung von Syngonium podophyllum ‘White
Butterliy‘ // Gartenbau (Berlin). — 1988. — 35, N 6. — S. 187—188.
Migoshi K, Mii M. Ultrasonic treatment for enhancing seed germination of
terrestrial orchid. Calanthe discolor, in asymbiotic culture // Sci. Hort. — 1988. —
35, N 1/2. - P. 127-130.
Mii М., Mori N., Iwase N. Organ formation from the excised bulb scales of Hip-
peastrum hybridum in vitro // J. Hort. Sci. — 1974. — 49, N 3. — P. 241—244.
Mikkelsen E.P., Sink K.C. In vitro propagation of kieger Elatior Begonias //
HortScience. — 1978. — 13. — P. 242—244.
Miller L.R., Murashige T. Tissue culture propagation of tropical foliage
plants // In vitro. - 1976. - 12. - P. 797-813.
Minocha S. C., Halperin W. Hormones and metabolites which control tracheid
differentiation, with or without coucomitant effects on growth in cultured tuber
tissue of Helianthus tuberosus L. // Planta. — 1974. — 116, N 4. — P. 319—331.
Miranda F. E. Brazilian Laelias — Part I: Section Cattleyodes // Amer.
Orchid Soc. Bull. - 1990. - 59, N 3. - P. 234-245.
Mitra J.C. Studies on seeds shoot-tips and stem-discs of an orchid grown in
aseptic culture // Indian J. Exp. Biol. — 1971. — 9, N 1. —P. 79—85.
Mitra J.C., Prasad R.N. Inorganic salts and differentiation of protocorms in
seed — callus of an orchid and correlated changes in its free amino acid content //
Ibid. -1976. - 14, N 3. - P. 350-351.
Mohan R.H.Y., Steward F. The induction of growth in explonited tissue of
banana fruit // Can. J. Bot. — 1964. — 42. — P. 1559—1579.
Mokino R.K, Nakano R.T., Mokino P.Y. et al. Rapid cloning of Ficus cultivars
through application of in vitro methodology // In vitro. — 1977. — 13, N 3. -
P. 169-173.
Monconsin C. Pelargonium x Hartorum et cultures tissulaires // Rev. Hort.
Suisse. - 1977. - 50, N 11. - P. 367.
Morel G. Producing virus-free Cymbidium // Amer. Orchid Soc. Bull. —
1960. - 29, N 7. - P. 495-497.
Morel G. Tissue culture — a new means of clonal propagation of Orchids //
Bot. Gaz. - 1964. - N 6. - P. 473-478.
Morel G. Clonal multiplication of orchids // The Orchids. Scientific studies. —
New York: Wiley-Intersci. Publ., 1974. — P. 169—122.
Morziah М., Nag K.W., Roslan A. The influence of pH medium on growth of
young banana plants // Induced Mutat. and Mol. Techn. Crop Improv.: Proc Int.
Symp., Vienna, 19—23 June 1995. — Vienna, 1995. — P. 712—714.
536
СПИСОК ЛИТЕРАТУРЫ
Moses M.S., Sullivan J.E. Asexual propagation of coffee through shoot-tip cultu¬
re // Tissue Cult. Forest and Agr. Proc. 3-rd Tenn. Symp. Plant Cell and Tissue Cult.,
Knoxville, Tenn., Sept. 9—13, 1984. — New York; London, 1985. — P. 335.
Mosich S.K., Ball E.A., Arditti G. Clonal propagation of Dendrobium by means of
node cultures //Amer. Orchid Soc. Bull. — 1974. — 43, N 12. — P. 1055—1061.
Moucousin C. Contribution a la mise an point d’un millen de culture pour a
mueltiplication in vitro de Gesneriaceae // Rev. Hort. Suisse. — 1978. — 51,
N 10. - P. 295-301.
Muralidharan E.M., Mascarenhas A.F. In vitro plantlet formation by
organogenesis in Eucalyptus camaldulensis and by somatic embryogenesis in
Eucalyptus citriodora // Plant Cell Reports. — 1987. — 6, N 3. — P. 256—259.
Murashige T. Plant propagation through tissue cultures // Ann. Rev. Plant
Physiol. — 1974. — 25. — P. 135—166.
Murashige T. Parametrs in regenerating plants in vitro. // Plant tissues and cell
culture application to crop improvement. — Prague: S.N., 1984. — P. 23—31.
Murashige Т., Skoog F. A revised medium for rapid growth and bio-assays with
tobacco tissue cultures // Physiol. Plant. — 1962. — N 15. — P. 473—479.
Murashige Т., Billers W.R., Rangan T.S. et al. Citrus micropropagation //
J. Hort. Sci. - 1972. - 7, N 2. - P. 118-119.
Narayan P., Jaiswal V.S. Differentiation of plantlets from leaf callus of Ficus
religiosa L. I j Indian J. Exp. Biol. — 1986. — 24, N 3. — P. 193—194.
Narayan P., Jaiswal V.S. In vitro regeneration of plantles from leaf tissue of
Ficus religiosa L. 11 Proc. Indian Nat. Sci. Acad. — 1986. — N 4. — P. 505—507.
Negruti J., Jacobs M. Arabidopsis thaliana as a model system system in somatic
cell genetic. 2. Cell suspension culture // Z. Pflanzenphysiol. — 1978. — 90. — S.
423-430.
Nilman D. Plantlet formation in Paphiopedilum flower stems // Amer. Orchid
Soc. Bull. - 1980. - 49. - P. 372-373.
Nishimura G. Comparative morphology of Cattleya and Phalaenopsis (Orchi¬
daceae) seedlings // Bot. Gaz. — 1981. — 142, N 3. — P. 360—365.
Northen R.T. Keikis from Paphiopedilum roots // Amer. Orchid Soc. Bull. —
1982. - 51. - P. 21-22.
Norton M.E., Norton C.R. In vitro propagation of Ericaceae: A comparison of
the activity of the cytokine’s БА and 2iP in shoot proliferation // Sci. Hort. —
1985. - 27, N 3/4. - P. 335-340.
Noureddine D., Benbadis A. Multiplication vegetative du Palmier dattier (Phoe¬
nix dactylifera L.) par reversion, en culture in vitro, debauches florales de pieds fe-
melles // J. Plant Physiol. - 1985. - 119, N 3 - P. 227-235.
Nyman L.P., Arditti J.A. Effects of artificial seawater on morphology and
onatomy of taro Colocasia esculenta v. autiquorum (Araceae Juss.) tissues in vitro //
Environ. Exp. Bot. - 1988. - 28, N 3. - P. 215-224.
Nyman L.P., Gonzales C.J., Arditti Y Reversible structural changes associated with
callus formation and plantlet development from aseptically cultured shoots of taro
(Colocasia esculenta v. autiquorum) // Ann. Bot. — 1983. — 51. — P. 279—286.
Noguchi М., Matsutoto Т., Hirata Y. et al. // Plant tissue culture and its bio¬
technological application. — 1977. — P. 85—94.
Ogutaga D.B.A., Northcote D.H. Caffeine formation in tea callus culture //
J. Exp. Bot. - 1970. - 21. - P. 258-273.
537
СПИСОК ЛИТЕРАТУРЫ
Oliphant J.L. In vitro cultivation of Todea Barbara — from spore to sporo-
phyte // Int. Plant Prop. Soc. — 1989. — 38. — P. 324—326.
Oliphant J.L. The use of paclobutrazol in the rooting medium of micropro¬
pagated plants // Ibid. — 1990. — 40. — P. 358—360.
Oliveira S.A., Machdo M.F., Pridi A.J. et al. In vitro propagation of Cereus
peruvianus Mill. (Cactaceae) // In vitro Cell. Dev. Biol. — 1995. — 31, N 1. —
P. 47-50.
Orellana P.P., Echevama М., Clavclo L. The influence of different conditions
on propagation of banana ‘Gran Enano’ in vitro // Cent. Agr.: Rev. Min. Educ.
Super. Rep. Cuba. - 1993. - 20, N 3. - P. 69-80.
Os P.C., Mourik N.M. Extending the flowering period by means of tempera¬
ture is hardly possible. Raising yield of (Vuylstekeara) Cambria by growing at a
lower temperature // Vakblad voor de Bloemisterij. — 1990a. — 45, N 16. —
P. 32-33.
Os. P.C., Mourik N.M. Production of Paphiopedilum around Mothers Day is
possible. Extending the flowering period by cold treatment // Ibid. — 1990b. — 45,
N 12. - P. 54-55.
Os P.C., Mourik N.M. Vase life of (Vuylstekeara) Cambria can be improved
considerably // Ibid — 1990c. — 45, N 15. — P. 50—51.
Otmashkina N. V. Experience of introduction into in vitro cultivation of Rho¬
dodendron ledebourii pojark // Biotechnology Approaches for Exploitation and
Preserwation of Plant Resources. — Jalta, 2002. — P. 23.
Peck D.E., Cumming B.C. In vitro propagation of Begonia tuberhybrida from
leaf sections // HortScience. — 1984a. — 19, N 3. — P. 395—397.
Peck D.E., Cumming B.G. In vitro vegetative propagation of cape primrose
using the corolla of the flower // Ibid. — 1984b. — 19, N 3/1. — P. 399—400.
Pedroso M.C., Pais M.S. Regeneration from anthers of adult Camellia
japonica // In Vitro Cell Dev. Biol. — 1993. — 29. — P. 155—159.
Pedroso M.C., Pais M.S. Early detection of embryogenic competence and of
polarity in Camellia japonica L. by electron probe X-ray microanalysis // Plant
Sci. - 1994. - 96. - P. 189-201.
Pfttzer E. Orchideaceae // Die naturlichen pflanzenfamilien. — Leipzig:
Englemann, 1899. — Bd. 2, t. 6. — S. 52—218.
Phan C.T., Hagadus P. Possible metabolic basis for the developmental ano¬
maly observed in vitro culture, called “vitreous plants” // Plant Cell, Tissue and
Organ Culture. — 1986. — 6. — P. 83—94.
Philip V.T., Nainar S.A.Z. Clonal propagation of Vanilla planifolia Ames, using
tissue culture // J. Plant Physiol. — 1986. — 122. — P. 211—215.
Philip V.T., Nainar S.A.Z. In vitro transformation of root meristems to shoot and
plantlets in Vanilla planifolia // Ann. Bot. — 1988. — 61, N 2. — P. 193—199.
Philomena P.A., Gunaseeli B., David B.V. Clonal propagation of
Zephyrantes // Curr. Sci. (India). — 1987. — 56, N 13. — P. 672—673.
Pieper W., Zimmer K. Clonal propagation of Phalaenopsis in vitro // Acta
hort. - 1976. - 64. - P. 21-23.
Pierik R.L.M., Steegmans H.H.M. The effect of 6-BAP on growth and de¬
velopment of Cattleya seedlings grown from unripe seeds // Z. Pflanzenphysiol. —
1972. - 68, N 3. - S. 228-234.
Pierik R.L.M. Anthurium andreanum plantlets produced from callus tissues
cultivated in vitro // Physiol. Plant. — 1976. — 37, N 1. — P. 80—82.
538
СПИСОК ЛИТЕРАТУРЫ
Pierik R.L.M., Steegmans Н.Н.М., Meysl A.I. Plantlet formation in callus
tissues of Anthurium andreanum L. // Sci. Hort. — 1974. — 2. — P. 193—198.
Pierik R.L.M., Steegmans H.H.M. Vegetative propagation of Anthurium sche-
rzerianum Schott through callus cultures // Sci. hort. — 1976. — 4, N 3. —
P. 291-292.
Pierik R.L.M., Sprenkels PA., Harts B. et al. Seed germination of plantlets of
Paphiopedilum cilialare Pfitz. in vitro // Sci. Hort. — 1988. — N 1/2. — P. 139—153.
Pions Т., Mythili J. The development of tomato pollen in similar fruit structure,
produced in vitro // Curr. Sci. (India). — 1995. — 69, N 2. — P. 94—95.
Piven M.M., Barredo-Pool F.A. Borges-Argaez Y.C. et al. The key event and its
regulation during somatic embryogenesis in monocots Agaves. // Biotechnology
Approaches for Exploitation and Preservation of Plant Resourses. — Jalta, 2002. —
P. 24.
Plata E., Ballester A., Vieitez A.M. An anatomical study of secondary emb¬
ryogenesis in Camellia reticulata // In vitro Cell. Dev. Biol. — 1991. — 27. —
P. 183-189.
Podwyszynska М., Olszewski T. Influence of gelling agents on shoot multiplica¬
tion and the uptake of macroelements by in vitro culture of rose, cordyline and
homalomena // Sci. Hort. — 1995. — 64, N 1/2. — P. 77—84.
Poole R.T., Conover C.H. Establishment and growth of in vitro cultured
Dieffenbachia // HortSciense. — 1983. — 18, N 2. — P. 185—187.
Poole R.T., Conover C.A. Propagation of ornamental Ficus by cuttings //
Ibid. - 1984. - 19. - P. 120-121.
Popovs U. Effect of medium composition on micropropagation of Cactaceae //
Int. Conf. “Plant Tissue Culture: from Theory to Practice”, Latvia, Salaspils,
2004. - Salaspils, 2004. - P. 71.
Porter K.Y., Kuehnle A.R, Hu J.S. Lack of seed transmission of Cymbidium
mosaic virus in Dendrobium // Lindleyana. — 1996. — 11, N 4. — P. 211—213.
Prasad R, Mitra G. Nutrient requirement for germination of seeds and deve¬
lopment of protocorms and seedlings of Cymbidium in aseptic culture // Indian J.
Exp. Biol. - 1975. - 13, N 2. - P. 123-126.
Preil W., Engelhardt M. Meristem culture of azaleas (Rhododendron simsii) //
Acta Hort. - 1977. - 78. - P. 2003-208.
Pridgeon A. The illustrated encyclopedia of orchids. — Portland, Oregon: Tim¬
ber Press, 1992. — 304 p.
Pritchard H.W., Prendergast F.G. Araucaria hunsteinii K. Schum. 11 J. Exp.
Bot. - 1986. - 37, N 1. - P. 1388-1397.
Pontis H.G. Plant Biochemistry / Ed. by D.H. Northcote. — Baltimore: Univ.
Park Press, 1977. — 221 p.
Quynh H.T., Uyen N.V. Aroids Propagation by Tissue Culture: I. Shoot Tip
Culture and Propagation of Xanthosoma violaceum // HortScience. — 1987. — 22,
N 4. - P. 671-672.
Raghavan W., Torrey J.B. Effect of certain organic nitrogen compounds of
Cattleya // Bot. Gaz. — 1964a. — 125, N 4. — P. 260—267.
Raghavan W., Torrey J.B. Organic nitrogen nutrition of the seedlings of the
orchid Cattleya // Amer. J. Bot. — 1964b. — 51, N 3. — P. 264—274.
Rajarathhinam K., Padhya M.A. Nephrolepis cordifolia multiple bud formation
and plantlet regeneration in culture // Indian J. Exp. Biol. — 1988. — 26, N 3. —
P. 222-224.
539
СПИСОК ЛИТЕРАТУРЫ
Rajeeven M.S., Pandey R.M. Rooting and plantlet development in vitro from
papaya (Carica papaya L.) shoot cultures // Indian J. Plant Physiol. — 1986. —
29, N 3. - P. 187-195.
Ramachandra S., Khatamian H. Micropropagation of Peperomia and Begonia
species using Petiole segments // HortScience. — 1989. — 24, N 1. — P. 153—154.
Raman K. Rapid multiplication of Streptocarpus and Gloxinia from in vitro
cultured pedicel segments // Z. Pflanzenphysiol. — 1977. — 83, N 5. — S. 411—418.
Ramsay R.R., Dixon K.W., Sivasithamparam K. Patterns of infection and
endophytes associated with West Australian orchids // Lindleyana. — 1986. — 1,
N 4. - P. 203-214.
Rangaswami N.S. Somatic embryogenesis in angiosperm cell tissues and organ
cultures // Proc. Indian. Acad. Sci. Anim. Sci. — 1986. — 96, N 4. — P. 247—271.
Rao A. N. Histogenesis and organogenesis in orchid seedlings // Sem. on Plant
Cell, Tissue and Organ Cultures. — New Delhi, 1967. — P. 71—74.
Rao A.N. Tissue culture in the orchid industry // Plant Cell, Tissue and Organ
Culture / Ed. by J. Reinert, Y.P.S. Bajaj. — Berlin etc.: Springer-Verlag, 1977. —
P. 44-69.
Rao P.S., Bapat V.A., Mhatre M. Regulatory factors for in vitro multiplication
of sandalwood tree (Santalum album Linn) // Indian J. Exp. Biol. — 1984. — 50,
N 2. - P. 196-202.
Raven P.H., Evert P.F., Eichhorn S.E. Biology of Plants. — New York: Worth
Publ. Inc., 1987. - 775 p.
Rechcigl M.J. CRC Handbook, Series in Nutrition and Food. — Cleveland,
OH: CRC Press, 1978. - 130 p.
Redei G.P. Genetic blocks in the thiamine synthesis of the angiosperm Arabi-
dopsis // Amer. J. Bot. — 1965. — 52. — P. 834—841.
Reinert R., Mohr H. Propagation of Cattleya by tissue culture of lateral bud
meristems // Proc. Amer. Hort. Sci. — 1967. — 91. — P. 664—671.
Reisinger D.V., Ball E.A., Arditti J. Clonal propagation of Phalaenopsis by
means of flower stalk node cultures // Orchid Rev. — 1976. — 84. — P. 45—52.
Reynolds B.D., Blackmon W.J. Embryogenesis and plantlet regeneration from
callus of Hibiscus acetosella // J. Amer. Soc. Hort. Sci. — 1983. — 108, N 2. —
P. 307-310.
Richter W. Dendrobium nobile — Hybriden // Gartenbau (Berlin). —
1978. - 25, N 6. - S. 186-187.
Rival F.A., Berleuc F., Morcillo Y. Scaling-up in vitro clonal propagation
through somatic embryogenesis: the case of oil palm (Elaies guineensis Jacg.) //
Plant Tissue Culture and Biotechnology. — 1997. — 3, N 2. — P. 75—83.
Robert M.L., Herrera J.L., Contreras F. et al. In vitro propagation of Agave four-
croydes Lem // Plant Cell, Tissue and Organ Culture. — 1987. — 8, N 1. — P. 37—48.
Randolph М., Ball A., Arditti J. Tissue culture of orchids. Ill Does orthochlo-
rophenonyacetic acid select for or induce anthocianin production // Amer. Orchid
Soc. Bull. - 1972. - 41. - P. 1074-1078.
Sagawa Y. Vegetative propagation of Phalaenopsis by stem cutting // Ibid. —
1961. - 30. - P. 808-809.
Sagawa Y., Shoji Т., Shoji C. Clonal propagation of Cymbidium through shoot
meristem culture // Ibid. — 1966. — 35. — P. 118—122.
Sagawa Y, Sehgal O.P. Aseptic stem propagation of Vanda ‘Miss Joaquim’ //
Bull. Pacif. Orchid Soc. Haw. - 1967. - 25. - P. 17-18.
540
СПИСОК ЛИТЕРАТУРЫ
Sagawa Y, Kunisaki T. Clonal propagation of orchids by tissue culture (Do-
ritaenopsis) // Plant Tissue Culture. Jap. Assoc. — 1982. — 5. — P. 683—684.
Sagawa Y.t Shoji T. Clonal propagation of Dendrobium through shoot meris-
tem culture // Amer. Orchid Soc. Bull. — 1996. — 36, N 10. — P. 856—859.
Sakai A., Kobayashi S., Oijama Y Cryopreservation of Nuclear Cells of Navel
Orange (Citrus sinensis Osb. var. brasiliensis Tanaka) vitrification // Plant Cell
Reports. - 1990. - 19. - P. 30-33.
Samartin A., Gonzales M.L. In vitro cultivation as a method for the propaga¬
tion of camellias // Amer. Camellia Yearbook. — 1986. — N 6. — P. 39—45.
Samartin A., Vieitez A.M., Vieitez E. In vitro propagation of Camellia japonica
seedlings 11 HortScience. — 1984. — 19, N 2. — P. 225—226.
Samyn G. Influence of the sucrose concentration in the growth medium on
adventitious and axillary shoot production and on the stability of the chimeral Co-
ryline fruticosa (L.) A. Chev. cultivar ‘Rosa’ // Bull. Rech. Agron. Gembloux. —
1995. - 30, N 1/2. - P. 67-75.
Sanguthai 0., Sagawa Y. Induction of polyploidy in Vanda by colchicines
treatment // Haw. Orchid J. — 1973. — 2, N 2. — P. 17—19.
San-Jose M.C., Vieitez A.M. Regeneration of Camellia plantlets from leaf ex¬
plant cultures by embryogenesis and cauligenesis // Sci. Hort. — 1993. — 54. —
P. 303-315.
Scharma A.K., Chaturvedi H.C. Micropropagation of Bougainvillea x Buttiana
Scarlet Queen variegated by shoot tip culture // J. Exp. Biol. — 1988. — 26,
N 4. - P. 285-288.
Schenk R.U., Hildebrandt A.C. Medium and techniques for induction and
growth of monocotyledonous and dicotyledonous plant cell cultures // Can. J.
Bot. - 1972. - 50. - P. 199-204.
Scorza R. In vitro flowering // Hort. Rev. — 1982. — 4. — P. 106—127.
Scully RM. Aspects of meristem culture in the Cattleya alliance // Amer.
Orchid Soc. Bull. - 1967. - 36, N 7. - P. 103-108.
Scully RM. Stem propagation of Phalaenopsis // Amer. Orchid Soc. Bull. —
1966. - 35. - P. 40-52.
Sealy J.R. A Revision of the Genus Camellia. — London, 1958. — 235 p.
Seelye I.F., Butcher S.M., Dennis D.I. Micropropagation of Telopea
speciosissima // Acta Horticultural. — 1986. — N 185. — P. 281—285.
Sehgal C.B. In vitro differentiation of foliar embryos and adventitions buds
from the leaves of Begonia seur perflores Zinek and Otto // Can. J. Exp. Biol. —
1975. - 13, N 5. - P. 486-488.
Shan X.C., Weatherhead M.A., Song S.Q. et al. Malondialdehyde content and
superoxide dismutase activity in seed of Phaius tankervilliae (Orchidaceae) during
storage // Lindleyana. — 2000. — 15, N 3. — P. 176—183.
Sharma A.K, Chaturvedi H.C. Micropropagation of Bougainvillea x Buttiana
‘Scarlet Queen variegated’ by shoot tip culture // Indian J. Exp. Biol. — 1988. —
26, N 4. - P. 285-288.
Sharma A.K, Prasad R.N., Chaturvedi H.C. Clonal propagation of Bougain¬
villea glabra “Magnifica” through shoot apex culture // Plant Cell, Tissue and
Organ Cultural. — 1981. — N 1. — P. 33—38.
Sheehan T. Recent advances in botany, propagation and physiology of
orchids // Hort. Rev. - 1983. - 5. - P. 279-316.
541
СПИСОК ЛИТЕРАТУРЫ
Sheehan Т., Sheehan М. Cattleyopsis // Amer. Orchid Soc. Bull. — 1984. —
53, N 7. - P. 700-701.
Simmonds J'. In vitro photoinduction of leaf tissue of Streptocarpus nobilis //
Biol. Plant. - 1985. - 27, N 4/5. - P. 318-324.
Simmonds J., Werry T. Liquid-shake culture for improved micropropagation
of Begonia x Hiemalis // Hort. Sci. — 1987. — 22, N 1. — P. 122—124.
Sin L.P., Weatherhead M.A. Tissue culture of the Camellias of Hong Kong //
Bot. Gard. Micropropogation News. — 1995. — 2, N 1. — P. 6—9.
Singh F., Prakash D. In vitro propagation of Thunia alba (Wall.) Reichb. f.
through stalk cutting // Sci. Hort. — 1984. — 24, N 3/4. — P. 385—390.
Singh R.P., Singh B.D. Promoting effect of glutamine on root regeneration
from callus cultures of mung // Curr. Sci. — 1984. — 53, N 3. — P. 148—149.
Sita G., Lakshmi R., Shobha B. In vitro propagation of Eucalyptus grandis L.
by tissue culture // Plant Cell Reports. — 1985. — 4, N 2. — P. 63—65.
Skirvin K.M., Ganick G. Tissue culture — induced variation in scented Pelar¬
gonium sp. // J. Amer. Soc. Hort. Sci. — 1976. — 101, N 3. — P. 281—290.
Skoog F., Miller C.O. Chemical regulation of growth and organ formation in
plant tissue cultures in vitro (The biological action of growth substances) // Soc.
Exp. Biol. - 1957. - 11. - P. 118-131.
Smeltz K.C. An alternative method of Phalaenopsis stem propagation // Amer.
Orchid Soc. Bull. - 1995. - 64, N 5. - P. 496-500.
Smith E.F., Gribaudo /., Roberts A. V. et al. Paclobutrazol and reduced humidi¬
ty improve resistance to wilting of micropropagated grapevine // HortScience. —
1992. - 27. - P. 113-120.
Smith R.H. In vitro propagation of Nandina domestica // Ibid. — 1983. — 18,
N 3. - P. 304-305.
Smith R.H. Plant Tissue Culture: Techniques and Experiments. — San Diego:
Acad. Press, 1992. — 233 p.
Smith R.H., Norris R. In vitro propagation of African violet chimeras //
HortScience. - 1983. - 18, N 8. - P. 436-437.
Soediono N. Use of coconut water, NAA, 2,4-D and vitamins in shoot tip
cultures, of Dendrobium // Orchid Rev. — 1983. — 91. — P. 86—87.
Sood A., Vij S.P. In vitro root segment culture of Rhynchostylis retusa Bl. 11
J. Orchid Soc. India. — 1986. — N 1. — P. 463—468.
Stancato G., Chgas E., Mazzafera P. Development and germination of seeds of
Laelia purpurata (Orchidaceae Juss.) // Lindleyana. — 1998. — 13, N 2. — P. 97—100.
Stanley D. Tissue-culturing plants on cornstarch // Agr. Res. — 1995. —
11. - P. 9-21.
Starling R. Y, Hutson R. Sterile culture of succulent plants // Brit. Cactus and
Succulent J. — 1984. — 2, N 3. — P. 69—70.
Steffen K. Exoten fur den Endverkauf // Gartnerborse Gartenwelt. — 1990. —
90, N 12. - S. 594-597.
Steffen R., Jody D., Sachs R., Hackett W. Bougainvillea inflorevence meristem
development: comparative action of in vitro and ex vitro// Amer. J. Bot. — 1988. —
75, N 8. - P. 1225-1227.
Steven A. Dupee, G. Propagation of ornamental Crevillea // Int. Plant Prop.
Soc. - 1982. - 31. - P. 198-208.
Stewart F.C. Growth and organization in plants. — London: Addision Wesley:
Reading, 1968. — 50 p.
542
СПИСОК ЛИТЕРАТУРЫ
Stewart G., Button G. Tissue culture studies in Paphiopedilum // Amer. Orchid
Soc. Bull. - 1975. - 44. - P. 591-599.
Stewart J., Button G. Clonal propagation of Paphiopedilum and Epidendrum
with particular reference to tissue culture techniques // Thesis Dept. Botany. —
Pietermaritkburg, S. Africa: Univ. Natal. — 1976a. — P. 136.
Stewart J., Button G. Rapid vegetative multiplication of Epidendrum obrieia-
num in vitro and the greenhouse // Amer. Orchids Soc. Bull. — 1976b. — 45. —
P. 922-983.
Stewart G., Button G. The effect of benzyladenin on the development of lateral
buds of Paphiopedilum // Ibid. — 1977a. — 46. — P. 415—418.
Stewart J., Button G. A note on lateral bud development in Paphiopedilum //
Ibid. - 1977b. - 46. - P. 934.
Stewart J., Button G. Development of callus and plantlets from Epidendrum
root trips cultured in vitro // Ibid. — 1978. — 47. — P. 607—612.
Stewart F.C., Mapes M.O. Morphogenesis in aseptic cell cultures of Cym¬
bidium // Bot. Gaz. - 1971. - 132, N 1. - P. 65-70.
Stockey R., Ко. H. Cuticle micromorphology of Araucaria de Jussien //
Ibid. - 1986. - 147, N 4. - P. 508-548.
Stojka D., Kondakova V. Regeneratioan and in vitro propagation of Pelargo¬
nium peltatum // Biotechnology Approaches for Exploitation and Preservation of
Plant Resourses. — Jalta, 2002. — P. 29.
Stoutamire W.P. Terrestrical orchid seedlings (The orchids: Scientific
studies) — New York: Wiley-Intersci, 1974. — 128 p.
Strode RE., Oglesby R.P. Parameters in commercial propagation of Spathiphyllum
clevelandii through tissue culture // In vitro. — 1978. — 14. — P. 356.
Swamy B.G. Agamospermy in Spirantes cernua // Lloydia. — 1948. — 11,
N 3. - P. 149-162.
Swamy R.D., Sahijram L. Tissue culture propagation of Bougainvillea // Gar-
tenbauwissenschaft. — 1988. — 53, N 4. — S. 174—176.
Szubke E., Verzar-Petri G., Shavarda A.L. // Abst. of 4-th Int. Congr. of Plant
Tissue and Cell Culture. — Calgary, 1978. — P. 82.
Tabata M. Recent advances in the production of medical substances by plant
cell cultures // Plant tissue and its biotechnological application. — New York:
Springer-Verlag, 1977. — P. 3—16.
Tadhya M.A., Mehta A.R. Propagation of fern (Nephrolepis) through tissue
culture // Plant Cell Reports. — 1982. — 1. — P. 261—263.
Takebe J., Otsuki J., Aoki S. Infection of isolated tobacco mesophyll
protoplasts of tabacco mosaic virus // Des cultures de tissue de Plantes. — Paris:
C.N.R.S., 1971. - 503 p.
Tamosiunas S., Gliozeris L. Stuopyte. Prospects for micropropagation of Cala¬
dium as pot plants production // Int. Conf. “Plant Tissue Culture: from Theory to
Practice”, Latvia, Salaspils, 2004. — Salaspils, 2004. — P. 61.
Tanaka M. Studies on the clonal propagation of Phalaenopsis through in vitro
culture // Mem. Fac. Agr. (Kagawa Univ.) Miki. — 1987. — N 49. — 85 p.
Tanaka M. Electrofusion and cell division of Phalaenopsis protoplasts //
Taiwan Sugar. — 1991. — 38, N 2. — P. 14—18.
Tanaka М., Hasegava A. Studies on the clonal propagation of monopodia
orchids by tissue culture. Formation of protocorm-like bodies from leaf tissue in
Phalaenopsis and Vanda // J. Jap. Soc. Hort. Sci. — 1975. — 44, N 1. — P. 47—58.
543
СПИСОК ЛИТЕРАТУРЫ
Tanaka М., Senda Y, Hasegava A. Plantlet formation by root-tip culture in
Phalaenopsis // Amer. Orchid Soc. Bull. — 1976. — 45, N 1. — P. 1022—1024.
Tanaka М., Sakanishi Y. Clonal propagation of Phalaenopsis by leaf tissue
culture // Ibid. - 1977. - 46, N 8. - P. 733-737.
Tanaka М., Sakanishi Y Factors affecting the growth of in vitro cultured late¬
ral buds from Phalaenopsis flower stalks // Sci. Hort. —1978. — 8, N 2. —
P. 169-179.
Tanaka М., Sakanishi Y Regenerative capacity of in vitro cultured leaf seg¬
ments excised from mature Phalaenopsis plants // Bull. Univ. Osaka Prefect. —
1985. - 37. - P. 1-4.
Tanaka М., Kumura М., Goi M. Optimal conditions for shoot production from
Phalaenopsis flower-stalk cuttings cultured in vitro // Sci. Hort. — 1988. — 35,
N 1/2. - P. 124-126.
Tanaka 0., Yoshikawa S., Takeba G. et al. The photoperiodic reaction of Cus-
cuta japonica by cultivation in vitro // Man. Konah Univ. Sci. Ser. — 1995. — 42,
N 1. - P. 143-151.
Tapati D., Shyamali S. Endogenic cytokinins in habitual callus of Citrus sinen¬
sis var mosambii // Indian J. Exp. Biol. — 1995. — 33, N 1. — P. 17—21.
Taylor M.E., Knauss J.F. Tissue culture multiplication and subsequent hand¬
ling of known pathogen — free Dieffenbachia maculate cv. ‘Perfection’ // Proc.
Fla. State Hort. Soc. - 1978. - 91. - P. 233-235.
Teo C.K.H., Kunisaki J. Т., Sagawa Y. Clonal propagation of strap-leaved Van¬
da by shoot-tip culture // Amer. Orchid Soc. Bull. — 1973. — 2. — P. 402—405.
Teo C.K.H., Neuman KN. The culture of protoplasts isolated from Re-
nantanda “Rosalind Cheak”// Orchid Rev. — 1978a. — 86. — P. 156—158.
Teo C.K.H., Neumann KH. The isolation and hybridisation of protoplasts from
orchids // Die Orchidee. - 1978b. - 86. - P. 186-189.
Tewari Y.N., Pathak R.K Propagate India Ficus rubber ‘Decora’ through leaf-
shoot cutting // Indian Hort. — 1987. — 31, N 4. — P. 28.
Thakur S. Differentiation of shoot buds and roots in petiolar segments of Be¬
gonia picta smith 11 Indian J. Exp. Biol. — 1975. — 13, N 5. — P. 517—520.
Theiler R. Culture de tissues de geraniums // Hort. Marafchers romands. —
1978. - N 1. - P. 7-15.
Thentz М., Moncousin C. In vitro micropropagation of Platycerium bifurcatum
(Cav.). C. Chr. // Rev. Hort. Suisse. - 1984. - 57, N 10. - P. 293-297.
Thomas A., Feunell A. Evergreen Dendrobium culture — a practical guide for
the beginner //Amer. Orchid Soc. Bull. — 1986. — 55, N 11. — P. 1109—1116.
Thomas V., Rao P.S. In vitro propagation of oil palm (Elaeis guineensis Jacg
var. tenera) through somatic embryogenesis in leaf-derived callus // Indian
Hort. - 1985. - 54, N 4. - P. 184-185.
Thompson P. Growing orchids from seed // J. Roy. Hort. Soc. — 1974. — 99,
N 3. - P. 117-121.
Tiejian H., Gao K, Peng Z. Study of tissue cultures and (synthesis) bromeline
in tissue culture of Ananas sativus // J.S. China Univ. Technol. Natur. Sci. —
1994. - 22, N 1. - P. 75-78.
Tilton V.R., Russell S.H. Application of method in vitro pollination / fertili¬
zation // BioScience. — 1984. — 34, N 4. — P. 239—242.
Tin-Yan T.A., Smith R.J., Hackett W.P. Adventitious shoot formation on
Phalaenopsis nodues // Amer. Orchid Soc. Bull. — 1971. — 40. — P. 807—810.
544
СПИСОК ЛИТЕРАТУРЫ
Tisserat В. Factors involved in the production of plantlets from date palm
callus cultures // Euphytica. — 1982. — 31, N 1. — P. 201—214.
Tisserat B., Jones D., Salletta P. Adventitious juice vesicle initiation in lemon
(Citrus limon L.), mandarin (Citrus reticulata Blanco), sour orange (Citrus an-
romtium L.) and sweet orange (Citrus sinensis (Z.) Osb.) fruit explants //
Experientia. — 1988. — 44, N 8. — S. 722—724.
Tomsone S., Gertnere L., Novikova D. The influence of thidiazuron on rho¬
dodendrons shoots regeneration and proliferation in vitro // Int. Conf. “Plant Tissue
culture: from Theory to Practice”, Latvia, Salaspils, 2004. — Salaspils, 2004. — P. 69.
Tran TV. Induction of flowering in plants // Planta. — 1973. — N 87. —
P. 115-119.
Tran Т. V. Methods of acceleration of growth and flowering in a few species of
orchids // Amer. Orchid Soc. Bull. — 1974. — 43. — P. 699—707.
Veda H., Torikata H. Organogenesis in meristem cultures of Cymbidium. 1.
Studies on the effects of growth substances added to culture media under conti¬
nuous illumination // J. Jap. Soc. Hort. Sci. — 1968. — 37, N 3. — P. 240—248.
Uesato K. The effects of various carbon sources in the culture media on the
growth of young Cattleya seedlings // Sci. Bull. Coll. Agr. — 1975. — N 22. —
P. 79-84.
Vajrabhaja Т., Vajrabhaja M. Tissue culture of Rhynchostylis gigantean, a mo-
nopodial orchid j I Amer. Orchid Soc. Bull. — 1970. — 35. — P. 907—910.
Vajrabhaja Т., Vajrabhaja M. The study on growth of organs of orchids in
vitro (nutrition) // Chulalongkorn Res. J. — 1976. — N 3. — P. 109—127.
Valmayor H. Callus formation and plantlet morphogenesis in Vanda and Pha¬
laenopsis // NR.C.RRes. Bull. - 1977. - P. 156-178.
Van Dijck R., De Proft М., De Yreef Y. Role of ethylene and cytokinins in the
initiation of lateral shoot growth in Bromeliads // Plant Physiol. — 1988. — 86. —
P. 836-840.
Vanseveren N. Quelquest phenomenes d’organogenese dans des plantules de
Cattleya obtenues par propagation meristematique in vitro // Bull. Soc. Bot.
Belg. - 1969. - 102. - P. 211-220.
Vargas Т., de Jarcia E. Propagacion in vitro de cala blanca Spathiphyllum
sp. // Agron. trop. (Venez.). — 1997. — 47, N 2. — P. 171 — 183.
Veyret Y. Development of the embryo and the young seedling stages of
orchids. The orchids: scientific studies. — New York: Wiley, 1974. — 265 p.
Veyret Y. Embryogenie comparee et blastogenie chez les Orcidaceae. — Paris:
O.R.S.T.O.M., 1965. - 106 p.
Vieitez A.M., Barciela Y. Somatic embryogenesis and plant regeneration from
embryonic tissues of Camellia japonica L. 11 Plant Cell, Tissue and Organ
Culture. - 1990. - 21, N 3. - P. 267-274.
Vieitez A.M., Barciela Y, Ballester A. Propagation of Camellia japonica cv.
Alba Plena by tissue culture // J. Hort. Sci. — 1989. — 64, N 2. — P. 177—182.
Vieitez A.M., Vieitez M.L., Ballester A., Vieitez E. Micropropagation of Camellia
spp. // Biotechnol. Agr. and Forestry. — 1992. — 19, N 3. — P. 361—387.
Vij S.P., Pathak P. Micropropagation of Dendrobium chrysanthum Wall,
through pseudobulb segments // J. Orchid Soc. India. — 1989. — 3, N 1/2. —
P. 25-28.
Vij S., Sood A., Plaha K. Propagation of Rhynchostylis retusa Bl. (Orchida¬
ceae) by direct organogenesis from leaf segment cultures // Bot. Gaz. — 1984. —
145. - P. 210-214.
545
СПИСОК ЛИТЕРАТУРЫ
Vij S., Pathak P., Sharma M. On the regeneration of Rhynchostylis retusa root
segments: A study in vitro // J. Orchid Soc. India. — 1987. — N 1. — P. 71—74.
Vinterhalter B., Vinterhalter D. True — to the type in vitro propagation of
Aechmea fasciata Baker // Sci. Hort. — 1994. — 57. — P. 253—263.
Voyiatzi C.,Voyiatzis D.G. In vitro shoot proliferation rate of Dieffenbachia
exotica cultivar “Mariana” as affected by cytokinins, the number of recultures and
the temperature // Ibid. — 1989. — 40, N 2. — P. 163—169.
Vyskot B., Jara Z Clonal propagation of cacti through axillari buds in vitro //
J. Hort. Sci. - 1984. - 59, N 3. - P. 449-452.
Waldenmaier S., Preil W., Biinemann J. Vermendung vbn Antibiotika in der
Microvermenhrung // Gartenbauwissenschaft. — 1986. — 51, N 3. — S. 131 — 135.
Wang G., Lin P., Xu 2., Cai N. The influence of ABA on induction flowers
buds of Dendrobium candidum Wall, in vitro 11 Acta Dot. Sin. — 1995. — 37,
N 5. - P. 374-376.
Wang J. Tissue culture of Cymbidium: plant and flower induction in vitro //
Lindleyana. — 1988. — 3. — P. 184—189.
Wang J., Xu L., Chia Т., Chua N. In vitro flower formation of Cymbidium
ensifolium // Abstr. Orchid Conf. — Tokyo, 1992. — P. 290.
Wang J., Xu L.y Chia Т., Chua N. In vitrb flowering of an orchid (Dendro¬
bium candidum) // Thes. Conf. “Biotechnology in Agriculture”. — Peking,
1993. - P. 373-378.
Watts J. W., King J.M. A simple method for large-scale electrofusion and cul¬
ture of plant protoplasts // Biosci. Reports. — 1984. — 4. — P. 355—342.
Wencheng T. Regeneration of plants from callus cultures of Anthurium pa-
tulum // Acta bot. Yunnanica. — 1987. — 9, N 3. — P. 348—352.
Wencheng Т., Cegang D. Quick propagation of Caladium in stationary liquid
culture // Ibid. - 12, N 5. - P. 554-556.
Werbrouck S.P.O., Jeugt B.V., Dewitte W. et al. Metabolism of BA in Spa-
thiphyllum floribundum Schott.'Petite' in connection with problems of acclima¬
tization // Plant Cell Reports. — 1995. — 14, N 10. — P. 662—665.
Werksmeister R.P. Die Steuerung von Vermehrung (Proliferation) und Wach-
stum in der Meristemkultur von Cymbidium und Vermehrung eines Kohle-
Naehrmediums // Die Orchidee. — 1970a. — 21. — S. 126—131.
Werksmeister R.P. Steuerung der Meristemvermehrung bei Cymbidium durch
Licht // Erwerbsgarther. - 1970b. - 24, N 9. - S. 354-355.
Werksmeister R.P. Light induction of geotropism and the control of proli¬
feration and growth of Cymbidium in tissue culture // Bot. Gaz. — 1971. — 132,
N 4. - P. 346-350.
Westerhof J., Hakkaart F.A., Versluijs J.M A. Variation in two Begonia x hiemalis
clones after in vitro propagation // Sci. Hort. — 1984. — 24, N 1. — P. 67—74.
Williams E.G., Maheswaran G. Somatic embryogenesis: factors influencing co¬
ordinated behavior of cells as an embryogenic group // Ann. Bot. — 1986. — 57,
N 4. - P. 443-462.
Wilson M.R, Nell T.A. Foliar application of BA increase branching of ‘Wel-
keri’ Dieffenbachia // HortScience. — 1983. — 18. — P. 447—448.
Witham F.M. Effect of 2,4-D on the cytokinin requirements of soybean co¬
tyledon and tobacco stem pith callus tissues // Plant Physiol. — 1968. — 43, N 12. —
P. 1455-1457.
Withner C.L. Orchid Physiology. — New York.: Ronald Press, 1959. — 360 p.
546
СПИСОК ЛИТЕРАТУРЫ
Withner C.L. The Cattleyas and Their Relatives. Vol. 1. The Cattleyas. —
Portland, Oregon: Timber Press, 1988. — 147 p.
Withner C.L. The Cattleyas and Their Relatives. — Hong Kong: Timber Press
Inc., 1990. — 154 p.
Withner C. The Cattleyas and Their Relatives. Vol. 4. The Bahamian and Ca¬
ribbean Species. — Portland, Oregon: Timber Press, 1996. — 152 p.
Wolosiuk R.A., Pontis H.G. Early development in callus cultures // Mol. and
Celi Biochem. — 1974. — 4, N 2. — P. 115—123.
Yam T.M., Weatherhed M.A. Root-tip culture of several native orchids of
Hong Kong 11 Lindleyana. — 1991. — 6. — P. 151—153.
Yamaki M. Biphenanthrenes from Bletilla striata // Phytochemistry. —
1989. - 28, N 12. - P. 3503-3505.
Yanagawa Т., Sakanishi Y Regeneration of bullets on Hippeastrum bulb segments
exised from various parts of a parent beeb // J. Jap. Soc. Hort. Sci. — 1977. — 46,
N 2. - P. 250-260.
Yasuda Т., Fujii Y.t Yamaguchi T. Embryogenic callus induction from Coffea
arabica Leaf Explants by Benzyladenine 11 Plant and Cell Physiol. — 1985. — 26,
N 3. - P. 595-597.
Yasugi S., Kugimiga M. Isolation of mesophyll protoplasts in orchids // Bull.
Fac. Hort. Minamikgushu Univ. — 1986. — N 16. — P. 91—99.
Yeoman М. М., McLeod A. J. Plant tissue and cell culture / Ed. by
E. Street. — Oxford: Blackwell Sci. Publ., 1977. — 156 p.
Ymel M.Y., Preece J.E. Adventitious shoot formation from recultured leaves of
Rhod6dendron // HortScience. — 1988. — N 23. — P. 760.
Yoneda K., Sakamoto F., Sasaki H. Studies on mericlones of orchids. 1. Pro¬
pagation of Cattleya Protocorms by Means of Meristem Culture 11 Nihou Univ. —
1979. - N 36. - P. 64-73.
Yungnickel F. Sterilkultivierung vou Saintpaulia ionantha Wendl. and phyto-
hormon-freitm Medium // Arch. Gantenbau. — 1976. — 24, N 6. — S. 387—392.
Zacharova A.A., Batygina T.B. Embryoculture for reservation of northen
orchids // Abstrs. Int. Conf. on Reproductive Biology. — Kew: Roy. Bot. Gard.,
1996. - P. 61.
Zakrejs I. Mnozeni orchideji // Zahradnictvo. — 1976. — N 8. — P. 410—411.
Zakrejs Y. Orchideje rodu Paphiopedilum v Zahradnickem Zavode // Zahra-
duicke hasty. — 1971. — 64, N 9. — P. 281—282.
Zeng S., Cinan L.} Huang X. In vitro propagation of Epidendrum cochlea-
tum // Physiol. Comunen. — 1966. — 32, N 3. — P. 198—199.
Zens A., Zimer K. In vitro Vermherung von Anthurium scherzerianum //
Gartenbauwissenschafl. — 1986. — 51, N 8. — S. 26—31.
Zens A., Zimer K. Entwicklung von Klonsorten bei Anthurium scherzerianum
Schott, mit Hilfe von in-vitro-Kulturtechniken. Genotypische Variation der
Sprossproliferation in vitro gekeimter Samen // Gartenbauwissenschafl. — 1988a. — 53,
N 1. - S. 22-26.
Zens A., Zimer K. Entwicklung von Klonsorten bei Anthurium scherzerianum
Schott, mit Hilfe von in-vitro-Kulturtechniken. Histologische Analyse der Spros¬
sproliferation in vitro gekeimter Samen // Ibid. — 1988b. — 53, N 3. — S. 110—113.
Zettler F.W., Knauss J.F., Knauss M.E. et al. Evulation of Dieffenbachia
maculate ‘Perfection’ plants free of dasheen mosaic virus // Agr. Exp. Stations
J. - 1978. - N 2385. - S. 5-7.
547
СПИСОК ЛИТЕРАТУРЫ
Zhang В., Stoltz У P. Shoot proliferation of Euphorbia fulgens in vitro affected
by medium components // HortScience. — 1989. — 24, N 3. — P. 503—504.
Zhu Z, Sun J., Chen W., Lu S. Tissue culture and regeneration of Cala-
dium // Acta bot. Singapore. — 1984. — 26, N 6. — P. 574—579.
Zhuang C., Liang H. Camellia chrysantha. Yunnan zhiwu yanjiu // Acta bot.
Yunnanica. - 1985. — 7, N 4. — P. 446-450.
Zhuping G., Arditti J., Leslie P.N. Vanilla planifolia callus induction and plantlet
production in vitro // Lindleyafia. — 1987. — 2, N 1. — P. 48—52.
Z/ C., Dauh C. Pivotal roles of picloram and gelrite in banana callus culture j I
Environ. Exp. Bot. - 1988. - 28, N 3. - P. 249-258.
Zimmer K. Zur vegetativen vermenrung von orchideen // Dtsch. Gartenbau. —
1980. - N 23. - S. 330-334.
Zimmer K. Einfuhrung und Zuchtung von Anth. scherzerianum // Garten¬
bau. - 1989. - 43, N 23. - S. 1477-1479.
Zimmer K., Pieper W. Zur Vermehrung voa Aechmea fasciata aus Achaelk-
nospen // Gartenbauwissenchafl. — 1974. — 3, N 9. — S. 5—6.
Zimmer K., Pieper W. Methods and problems of clonal propagation of
bromelain in vitro I I Acta Hort. — 1976. — 64. — P. 25—29.
Zimmer K., Pieper W. In vitro Kultur Von Spadix Explantaten Von Spat-
hiphyllum Kurse Mitteilung // Gartenbauwissenchaft. — 1985. — 50, N 3. —
S. 142-144.
Zimmer K., Potthoff H. Gewebekultur bei Begonien. 1 // Dtsch. Gartenbau. —
1978a. - 32, N 21. - S. 867-869.
Zimmer K.t Potthoff H. Gewebekultur bei Begonien. 2 // Ibid. — 1978b. — 32,
N 23. - S. 962-965.
Zwar Y.A., Bruce M.I. Cytokinines from apple extract and coconut milk //
Austral. J. Biol. Sci. — 1970. — 23. — P. 289—297.
Алфавитный указатель
латинских названий растений
Adiantaceae 478
Adiantum 478
A. diaphanum 478
Agavaceae 17, 163
Agave 163
A. toureroydes 163
Cordyline 166
C. australis 166
C. terminalis (fruticosa) 165, 167
Yucca 168
Y gloriosa 168
Amaryllidaceae 34, 170
Hippeastrum 170
Zephyranthes 171
Araceae 17, 111, 171
Aglaonema 33, 34, 171, 172, 174,
175, 176
A. commutatum 172, 174, 175
A. commutatum ’Pseudobracteatunr
172, 174, 175
A. marantifolia 172, 174, 175
A. ’Silver Queen* 172, 174, 175
Alocasia 177
A. amazonica 177
A. cuprea 177
A. macrorhiza 177, 178
A. ’Black velvet* 177
Anthurium 30, 34, 171, 177
A. andreanum 30, 177, 178, 181
A. andreanum var. giganteum 183
A. andreanum var. roseum 183
A. andreanum var. rubrum 183
A. andreanum ’Ellerina4 183
A. andreanum ’Iga-Gold* 183, 184
A. andreanum ’Porzellan4 183, 184
A. bakeri 183
A. leuconeurum 178, 186, 187, 188
A. lindenianum 177
A. longifolium 183
A. lucidum 178, 186, 187, 188
A. magnificum 183
A. olfersianum 183
A. pedatum 185
A. scherzerianum 177, 183, 185
A. variable 183
A. warogueanum 183
Caladium 171, 189
C. bicolor 190, 191
C. bicolor cm. Crimson Way 192
C. bicolor cv. Triomphex de Expo¬
sition 191
C. bicolor cv. White Christmas 191
C. hortulanum cv. Birdsay 190
C. hortulanum cv. Candidum 190
Colocasia 192
C. esculenta 192
Dieffenbachia 34, 171, 193
D. amoena cv. Tropic Snow 194
D. maculata cv. Camilla 194
Monstera 33, 34, 113, 195
M. deliciosa var. borsigiana 196,
197
Philodendron 34, 113, 171, 196, 200
Ph. bipinnatifidum 198
Ph. erubescens ’Burgundy4 198
Ph. gloriosum 198
Ph. houlletianum 197
Ph. lace rum 198
Ph. laciniatum 198
Ph. pinnatifidum 198
549
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Ph. sanguineum 198
Ph. scandens 197, 198
Ph. speciosum 198
Ph. tuxta 198
Spathiphyllum 171, 200
S. blandum cv. Santa Maria 201
S. blandum cv. Mauna Loa 201
Scindapsus 202
Syngonium 34, 202
Xanthosoma 203
Zanthedeschia 202
Araucariaceae 203
Araucaria 204
A. angustifolia 204
A. araucana 204
A. cunninghammi 204
A. excelsa 204
Arecaceae 206
Elalis 207
E. guineensis 207
Phoenix 206
P. dactylifera 206
Begoniaceae 17, 208
Begonia 208
B. fimbristipula 211
B. franconis 211
B. picta 210
B. rex 208
B. tuberhybrida 209
B. x elatior 209
B. x hiemalis 211
Blechnaceae 479
Blechnum 479
B. australe L. subsp. auriculatum
(Cav.) de la Sota 479
B. brasiliensis 479
B. gibbum 479
Bromeliaceae 17, 212, 215
Aechmea 212
A. caudata 213
A. fasciata 213
A. nudicaulis 213
Ananas 90, 216
A. comosus 216
A. comosus war. sativus 217, 218
Billbergia 218
B. nutans 218
B. pyramidal is 219
B. saundersii 219
B. vittata 219
Cryptanthus 220
C. sinuosus 220
Dyckia 220
D. brevifolia 220
Gusmania 221
G. monostachia 221
Neoregelia 221
N. carolinae 222
N. carolinae cv. Ttricolor 222
Nidularium 222
N. burchellii 222
N. innocentii 222
Tillandsia 223
T. argentea 223
T. balbisiana 223
T. bulbosa 223
T. butzii 223
T. caput-medusae 223
T. pseudobaileyi 223
T. schiedeana 223
Vriesea 224
V. saundersii 224
V. splendens 224
Cactaceae 17, 225, 226
Ariocarpus 226
A. retusus 226
As trophy turn 221
A. asterias 221
A. capricorne (D.Dietr.) Britton et
Rose 227
Echinopsis 228
E. turbinata 229
Neochilenia 229
N. deherdbina 229
Roseocactus 229
R. kotschoubeyanus 229
Caricaceae 230
Carica 230
C. papaya 230
Convallariaceae 231
Ophiopogon 231
O.jaburan var. variegates 232
O.jaburan ’Ker-Gawe‘ 232
Cyatheaceae 480
Cyathea 480
C. dregii 480
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Dracaenaceae 232
Dracaena 34, 232
D. deremensis 233
D. draco 34, 233
D. marginata ’Tricolor' 233
Nolina 234
N. recurvata 234
Sansevieria 236
5. cylindrica 236, 239
S. grandis 240
S. trifasciata 240
Ericaceae 17, 240
Rhododendron 240
R. ledebourii 243
R. luteum 242
Azalea indica 240
A. indica ’Орхидная4 241
A. indica ’Подолянка4 241
A. indica ’Светлана4 241
A. indica ’Смуглянка* 241
A. indica ’Cy3ipV 241, 242
A. indica ’Европа4 241, 242
A. indica ’Imperatrice India4 241
A. indica ’Prof. Walthers4 241,242
A. indica ’Hermann4 242
Euphorbiaceae 245
Euphorbia 245
Geraniaceae 245
Pelargonium 245
P. peltatum 246
P. zonale 246
Gesneriaceae 17, 247
Episcia 247
E. cupreata 247
Gloxinia 247
G. perenis 247
Saintpaulia 248
S. ionantha 248
S. ionantha cv. Diana 249
Streptocarpus 249
S. nobilis 249
Liliaceae 34, 250
Bomea 250
B. valubilis 250
Malvaceae 251
Hibiscus 251
H. acetosella 251
Moraceae 252
Ficus 252
F. carica 252
F. elastica 253
F. elastica var. rubra 253
F, elastica ’Brasil4 253
F. elastica ’Schriveriana4 253
F. lyrata 255
F. religiosa 252
Musaceae 17, 255
Musa 255
M. acuminata 256
M. balbisiana 256
М. папа 256
Myrtaceae 258
Eucalyptus 258
E. camaldulensis 259
E. citriodora 258
E. grandis 259
E. sideroxylon 259
Myrtus 260
M. communis 260
M. communis ’Variegata4 260
Nyctaginaceae 266
Bougainvillea 266
B. glabra 266
Nandinaceae 260
Nandina 260
N. domestica 260
Nepenthaceae 17, 261
Nepenthes 261
N. madagascariensis 262
Oleandraceae 481
Nephrolepis 481
N. exaltata 481
N. cordifolia 481
Onagraceae 268
Fuchsia 268
Orchidaceae 268, 493
Acacallis 269, 493
A. cyanea 269, 271, 493
Angraecum 17, 34, 272
A. eburneum 212
A. modes turn 212
A. sanderianum 212
A. sesquipedale 212
Anoectochillus 137, 273, 275
A. dawsonianus 273, 275, 493
A. roxburgii 273, 275, 493
x Aranda 123, 274, 276
x Aranthera 211
551
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Arundina 278
A. bambusifolia 278
A. graminifolia 279, 493
Bletilla 279
B. striata 279, 494
х Brassolaeliocattleya 280, 290, 493
х Blc. Tchaikovski ’Mazeppa4
x Blc. Parador ’Diva‘
Calanthe 16, 280
C. vestita var. alba 280, 281, 494
C. vestita var. rosea 280, 281, 494
C. discolor 282
C. rubens 281
Catasetum 16, 282, 493
C. russellianum 283, 493
Cattleya 284, 289, 292
C. aclandiae 285, 288, 290
C. aurantiaca 290
C. 6/co/o/* 284, 290
C. bowringiana 284, 290, 494
C. forbesii 285, 290
C. granulosa 285, 290
C. guttata 290
C. intermedia 285, 494
C. labiata 290
C. luddemanniana 142, 290
C. maxima 290
C. percivaliana 17, 285, 290
C. The Frendly Third ’La Tuilerie4
293
C. Angel Bells ’Suzie‘ 293
Cattleyopsis 295, 493
C. lindenii 295, 296, 493
Coelogyne 299
C. cristata 299, 493
C. lawrenceana 299, 493
С. viscose 299, 493
Cymbidium 16, 48, 153, 157, 299,
301, 303, 310, 312, 314, 316, 320,
333, 337, 494
C. canaliculatum 300
C. giganteum 300
C. lancifolium 300
C. Iqwianum 300
C. Alexalban ’The Bride4 334, 335
C. Angelica ’Advent4 334
C. Arabian Nights ’Cooksbridge4
334, 335
C. Burgundian ’Chateau4 334, 335
552
C. California ’Pinkata4 334, 335
С. Caretta Fantaisie ’Sirius4 334
C. Cassandra ’Jennifer4 334, 335
C. Christmas Beauty ’St. Francis4
334
C. Clarisse Carlton ’Majestic4 334
C. Cooksbridge ’Pinkie4 334, 335
C. Durham Castle ’Irene4 334, 335
C. ’Fanfare4 334
C. Fusilier ’Thomas4 334, 335
C. Huber Cambourne ’Benita4 334,
335
C. Kurun ’Troubadour4 334
C. Lagoon ’Braemar4 334, 335
C. ’Leo Liles4 334
C. Lilian Stewart ’Gold4 334
C. Lilian Stewart ’St. Sherrie4 334,
335
C. Lilian Stewart ’Sundown4 334,
335
C. Lump of Gold ’Glitter4 334
C. Orient Legend ’Cinnamon4 334
C. Orient Legend ’Princess Rosek
334
C. Paciefic ’Pearl4 334
C. Sensation ’Melita4 334, 335
C. Showgirl Mem. ’Rose Greer4
334
C. ’Xanthos4 334, 335
C. ’Warrawa4 334, 335
Dendrobium 341, 349, 350
D. aduncum 355, 362
D. antennatum 341
D. bellatulum 341, 363
D. chrystalinum 355
D. clavatum var. aurantiacum 363
D. crumenatum 341, 355, 362, 363
D. densiflorum 362, 363
D. discolor 363
D. draconis 361, 363
D.formosum 363, 494
D. intricatum 341, 362, 363
D. kingianum 341, 362, 363, 495
D. loddigesii 363
D. lomatochilum 342
D. moniliforme 362, 363
D. moschatum 342, 363
D. nobile 100, 342, 363, 495
D. parishii 124, 137, 355, 356, 363
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
D. phalaenopsis 116, 144, 342, 345,
347, 348, 363, 495
D. speciosum 342, 362, 363
D. transparents 342
D. unicum 356, 363
D. ’Tangerine1 363
x Doritaenopsis 364
Doritis 34, 365
D. pulcherrima 365, 366, 493
Epidendrum 16, 135, 369, 370, 371,
495
E. ciliare 369, 370
E. difforme 369, 370
E. elegans 369, 370
E. noctumum 369, 370
E. radicans 16, 369, 370, 495
Laelia 16, 17, 39, 73, 134, 148, 151,
372
L. anceps 372, 373, 495
L. gouldiana 16, 373, 495
L. lobata 142, 372, 373, 374, 375,
384, 390, 495
L. lundii 141, 146, 372, 373, 376,
390, 495
L. mantiquierae 372, 376, 495
L. purpurata 144, 145, 372, 373,
377, 384, 390, 495
L. rubescens 372, 373, 378
L. sincorana 124, 141, 146, 372,
373, 380, 390, 495
L. superbiens 129, 373
L. tenebrosa 373
x Laeliocattleya 48, 123, 391, 493
x Mokara 391
Odontoglossum 91, 392
O. grande 142, 392, 494
0. pulchellum 392, 494, 495
Oncidium 72, 393
O. cebolleta 393, 395
0. lanceanum 393, 395
О. Л/гк/ши 393, 395
0. 393, 395
0. splendidum 393, 395
0. varicosum 123, 393, 395
Paphiopedilum 17, 48, 136, 396, 403,
405, 417
P. appletonianum 397, 404, 495
P. barbatum 396
P. callosum 139, 397, 404, 409, 410,
495
P. delenatii 17, 142, 397, 403, 404,
410,411,412,413,414,415, 495
P. granduliferum 396
P. haynaldianum 398, 404
P. helene 398, 404, 495
P. insigne 137, 396, 398, 404, 407,
408, 495
P. javanicum 396
P. lawrenceanum 399, 404, 495
P. lowii 396
P. purpura turn 396, 495
P. tonsum 399, 404
P. venustum 396, 400, 404
P. villosum 400, 404, 495
Phaius 424, 425
Ph. tankervilleae 424, 425, 494
Ph. australis 424, 425, 494
Ph. mishmensis 424, 425, 494
Phalaenopsis 142, 425, 429, 434
Ph. amabilis 100, 425, 427, 431,
432, 433, 495
Ph. cornu-cervi 425
Ph. lueddemanniana 425, 427, 495
Ph. schilleriana 425, 427
Ph. ’Antarctic* 427
Ph. ’Callicorne‘ 427
Ph. ’Conrchevel‘ 427
Ph. ’Fifi‘ 427
Ph. ’George Seurat‘ 427
Ph. ’Surprise de Vales‘ 427
Psichopsiella 137, 435, 494
P. limminghei 137, 435, 436, 494
Psichopsis 437, 494
P. kramerianum 124, 437, 439, 494
P. papilio 437
Rhynchostylis 438
Rh. gigantea 438
Rh. retusa 439
x Renantanda 123, 440
Spathoglottis 441
S. plicata 441
Stanhopea 16, 441, 495
S. oculata 441, 442
S. saccata 441, 442
tigrina 100, 442, 443, 495
S. wardii 137, 442
Thunia 16, 443
T. marshalliana 16, 144, 443, 494
553
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ
Т. alba 445
Vanda 48, 445
V sanderiana 446
V teres 445, 446
V tricolor 446, 495
Vanilla 92, 448
V. barbellata 448
V planifolia 92, 137, 448, 449,
450, 451, 452, 494
V walkeriae 453
x Vascostylis 113, 453
x Vuylstekeara ’Cambria4 454
Zygopetalum 454
Z mackaii 454, 494
Piperaceae 455
Peperomia 455
P. obtusifolia 455
Polypodiaceae 482
Platycerium 482
P. alcicorne 482
P. elephantotis 483
P. grande 483
Proteaceae 17, 456, 457, 458
Banksia 458
B. collina 458
B. serratifolia 457, 458
B. latifolia 458
B. marginata 458
B. notans var. cernoella 458
B. notans var. nutans 458
B. repens 458
B. serratifolia 457
Dryandra 457
D. praemorsa 457
Grevillea 456
G. robusta 456, 457
Hakea 456, 457
H. hilliona 457
H. laurina 458
H. leucoptera 457
H. muelleriana 457
H. sulcata 457
Lomatia 457
L. raxinifolia 457
Stenocarpus 457
S. sinuatus 457
Ysapagon 458
Y. dawsonii 458
Rubicaceae 459
Coffee 459
C. arabica 459
Rutaceae 460
Citrus 460
C. aurantium 460
C. aurantium ’Swingle4 460
C. limon 461
C. paradisi 461
C. reticulata 461
C. sinensis 461
C. sinensis var. mosambii 462
Santalaceae 464
Santalum 464
5. tf/Zwm 464
Theaceae 17, 465, 470
Camellia 34, 465, 470
C. japonica 34, 465, 467, 470, 471,
475, 476
C. japonica ’Alba Plena4 467
C. japonica ’Purple Down4 467
C. japonica ’Eleanor Franchetti1
469, 471, 475
C. japonica ’Grandiflora Rosea4
469, 471, 475
C. japonica ’Magnoliae Flora4 469,
471, 475
C. japonica ’Anemonaiflora4 469,
471, 475
Алфавитный указатель
родовых названий растений1
Acacallis 269, 493
Adiantaceae 478
Adiantum 478
Aechmea 212
Agavaceae 17, 163
Agave 163
Aglaonema 33, 34, 171, 172
Alocasia 177
Amaryllidaceae 34, 170
Ananas 90, 216
Angraecum 17, 34, 272
Anoectochillus 137, 275, 273
Anthurium 30, 34, 171, 177
Araceae 17, 111, 171
x Aranda 12, 123, 274, 276
x Aranthera 277
Araucaria 204
Araucariaceae 203
Arecaceae 206
Ariocarpus 226
Arundina 278
Astrophytum 227
Azalea 240
Banksia 458
Begonia 34, 208
Begoniaceae 17, 208
Billbergia 218
Blechnaceae 479
Blechnum 479
Bletilla 279
Bougainvillea 266
Bomea 250
x Brassolaeliocattleya 70, 280, 284,
290, 493
Bromeliaceae 17, 212, 215
Cactaceae 17, 225, 226
Caladium 171, 159
Calanthe 16, 135, 280, 493
Camellia 34, 465, 470
Carica 230, 231
Caricaceae 230
Catasetum 16, 282, 283, 493
Cattleya 16, 17, 39, 48, 284, 289,
290, 292, 494
Cattleyopsis 295, 493
Citrus 231, 460
Coelogv/;с 16, 17, 299, 493
Coffee 459
Colocasia 192
Convallariaceae 231
Cordyline 113, 164, 166
Cryptanthus 220
Cyathea 480
Cyatheaceae 480
Cymbidium 16, 48, 153, 157, 299,
301, 303, 310, 312, 314, 316, 320,
333, 337
Dendrobium 16, 50, 341, 349, 350,
495
Dieffenbachia 34, 171, 193
x Doritaenopsis 364
Doritis 34, 365
Dracaena 34, 232
Dracaenaceae 232
1 Для облегчения поиска названия гибридных родов в указателе даются без
знака гибридности х.
555
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАрТЕНИЙ
Dryandra 457
Dyckia 220
Echinopsis 228
Elalis 207
Epidendrum 16, 135, 369, 370, 371,
495
Episcia 247
Ericaceae 17, 240
Eucalyptus 258
Euphorbia 245
Euphorbiaceae 245
Ficus 33, 113, 252
Fuchsia 268
Geraniaceae 245
Gesneriaceae 17, 247
Gloxinia 247
Grevillea 456
Gusmania 221
Hakea 456, 457
Hibiscus 251
Hippeastrum 170
Laelia 16, 17, 39, 73, 134, 148, 151,
372, 388
x Laeliocattleya 48, 123, 284, 391, 493
Liliaceae 34, 250
Lomatia 457
Malvaceae 251
x Mokara 391
Monstera 33, 34, 113, 195
Moraceae 252
Musa 231, 255, 257
Musaceae 17, 255
Myrtaceae 258
Myrtus 260
Nyctaginaceae 266
Nandina 260
Nandinaceae 260
Neochilenia 229
Neoregelia 222
Nepenthaceae 17, 261
Nepenthes 34, 261
Nephrolepis 481
Nidularium 222
Nolina 234
Odontoglossum 91, 392
Oleandraceae 481
Onagraceae 268
Oncidium 72, 393
Ophiopogon 231
Orchidaceae 268, 493
Paphiopedilum 17, 48, 136, 396, 403,
405, 417
Pelargonium 245
Peperomia 455
Phaius 424, 425
Phalaenopsis 16, 34, 48, 135, 142,
425, 427, 429, 434
Philodendron 34, 113, 171, 196
Phoenix 206
Piperaceae 455
Platycerium 482
Polypodiaceae 482
Proteaceae 17, 456, 457, 458
Psichopsiella 137, 435, 436, 494
Psichopsis 437, 494
x Renantanda 123, 440
Rhododendron 240
Rhynchostylis 438
Roseocactus 229
Rubicaceae 459
Rutaceae 460
Saintpaulia 248
Sansevieria 236
Santalaceae 464
Santalum 464
Scindapsus 202
Spathiphyllum 171, 200
Spathoglottis 441
Stanhopea 16, 441, 495
Stenocarpus 457
Streptocarpus 249
Syngonium 34, 202
Theaceae 16, 465, 470
Thunia 16, 443
Tillandsia 223
Vanda 48, 445, 446
Vanilla 92, 448
x Vascostylis 113, 453
Vriesea 224
Vuylstekeara 454
Xanthosoma 203
Ysapagon 458
Yucca 113
Zanthedeschia 202
Zephyranthes 171
Zygopetalum 454
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ 5
ОБЩАЯ ЧАСТЬ
ГЛАВА 1
СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ СОХРАНЕНИЯ
МИРОВЫХ РАСТИТЕЛЬНЫХ РЕСУРСОВ EX SITU 11
1.1. Ботанические сады — центры сохранения флористического разно¬
образия 11
1.2. Лаборатория микроразмножения растений Национального бота¬
нического сада НАН Украины 15
ГЛАВА 2
ТЕХНОЛОГИЯ РАЗМНОЖЕНИЯ РАСТЕНИЙ В АСЕПТИЧЕСКИХ УСЛОВИЯХ 18
2.1. Лаборатория: требования к помещениям, их количеству и распо¬
ложению 18
2.2. Оснащение лаборатории 21
2.3. Стерилизация питательных сред, инструментов и вспомогательных
материалов 22
2.4. Технология микроразмножения 25
2.4.1. Выбор экспланта 28
2.4.2. Стерилизация растительного материала 35
2.4.3. Влияние внешних условий на процес введения в культуру in vitro 40
2.4.4. Приготовление питательных сред 42
2.4.5. Компоненты питательных сред 47
2.4.6. Оптимизация питательных сред. Математическое планирование
эксперимента 91
ГЛАВА 3
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РАЗМНОЖЕНИЯ РАСТЕНИЙ
В КУЛЬТУРЕ IN VITRO 93
3.1. История развития методов культивирования растений in vitro 94
3.2. Микроразмножение 103
3.2.1. Преимущества метода асептического размножения растений 104
557
ОГЛАВЛЕНИЕ
3.2.2. Основные направления культивирования частей растительных
организмов in vitro 106
3.2.3. Пути реализации репродуктивных свойств спорофита Цветковых
растений in vitro 116
3.2.4. Цветение in vitro 118
3.3. Семенное размножение 125
3.3.1. Эмбриогенез орхидных 128
3.3.2. Микотрофность спорофита орхидных 130
3.3.3. Особенности прорастания семян орхидных 133
3.3.4. Образование протокорма 139
3.3.5. Морфогенез 146
3.3.6. Влияние состава питательной среды на морфогенез 150
3.4. Культивирование в жидких питательных средах 154
3.5. Факторы, влияющие на культивирование растений 158
СПЕЦИАЛЬНАЯ ЧАСТЬ
ГЛАВА 4
МЕТОДЫ РАЗМНОЖЕНИЯ ТРОПИЧЕСКИХ И СУБТРОПИЧЕСКИХ
РАСТЕНИЙ В КУЛЬТУРЕ IN VITRO 163
Magnolyophyta 163
Agavaceae Endl 163
Amaryllidaceae Jaume St.-Hil 170
Araceae Juss 171
Araucariaceae Henkel et W. Hochstet 203
Arecaceae Sch.-Bip.(Palmae Juss.) 206
Begoniaceae C.A. Agardh 208
Bromeliaceae Juss 212
Cactaceae L 225
Caricaceae Dum 230
Convallariaceae Juss 231
Dracaenaceae Salisb 232
Ericaceae Juss 240
Euphorbiaceae St. Heel 245
Geraniaceae Juss 245
Gesneriaceae Dum 247
Liliaceae Juss 250
Malvaceae Juss 251
Moraceae Link 252
Musaceae Juss 255
Myrtaceae Juss 258
Nandinaceae Horan 260
Nepenthaceae Dum 261
Nyctaginaceae Juss 266
558
ОГЛАВЛЕНИЕ
Onagraceae Juss 268
Orchidaceae Juss 268
Piperaceae C.A. Agardh 455
Proteaceae Juss 456
Rubiaceae Juss 459
Rutaceae Lindl 460
Santalaceae R.Br 464
Theaeceae D.Don 465
Polypodiophyta 477
Adiantaceae (C.Presl.) Ching 478
Blechnaceae (C.Presl.) Copel 479
Cyatheaceae Reichenb 480
Oleandraceae Ching ex PiChi-Serm 481
Polypodiaceae Bercht. et Presl 482
ГЛАВА 5
ПОСТАСЕПТИЧЕСКАЯ АДАПТАЦИЯ СЕЯНЦЕВ
И РАСТЕНИЙ-РЕГЕНЕРАНТОВ 484
5.1. Условия культивирования 484
5.2. Субстраты 487
ПРИЛОЖЕНИЯ
Приложение 1. Продолжительность периода прорастания семян и раз¬
вития сеянцев представителей некоторых видов семейства Orchidaceae
Juss., сут 493
Приложение 2. Продолжительность периода созревания плодов неко¬
торых видов растений семейства Orchidaceae Juss. в условиях оранже¬
рей, сут 494
СЛОВАРЬ ТЕРМИНОВ 496
СПИСОК ЛИТЕРАТУРЫ 506
АЛФАВИТНЫЙ УКАЗАТЕЛЬ ЛАТИНСКИХ НАЗВАНИЙ РАСТЕНИЙ 549
АЛФАВИТНЫЙ УКАЗАТЕЛЬ РОДОВЫХ НАЗВАНИЙ РАСТЕНИЙ 555
Наукове видання
НАЦЮНАЛЬНА АКАДЕМ1Я НАУК УКРАШИ
НАЦЮНАЛЬНИЙ Б0ТАН1ЧНИЙ САД
iM. М.М. ГРИШКА НАН УКРА1НИ
ЧЕРЕВЧЕНКО Тетяна Михайипвна
ЛАВРЕНТЬбВА Алла МиколаТвна
1 ВАННiКОВ Роман Вкторович
БЮТЕХНОЛОПЯ ТРОГНЧНИХ
j СУБТРОГПЧНИХ РОСЛИН in vitro
КиУв, Науково-виробниче пщприемство
«Видавництво “Наукова думка” НАН Украши», 2008
Художне оформления М.А. Панасюк
Художнш редактор 1.П. Савицька
Техшчний редактор Т.М. Шендерович
Коректор Н.А. Дерев ’янко
Оператори О.О. 1щенко, М.А. Кравченко
Комп’ютерна верстка Л.М. Катковоi, Л.1. Прокопчук
Пщп. до друку 30.07.2007. Формат 60x90/16. Патр офс. № 1.
Гарн. Таймс. Друк офс. Ф1з. друк. арк. 35,0 + 4,5 вкл. на крейд. пап.
Ум. друк. арк. 39,5. Ум. фарбо-вщб. 53,5. Обл.-вид. арк. 40,33.
Наклад 300 прим. Зам. 8—49
НВП «Видавництво “Наукова думка” НАН Украши»
01601, Киш 1, вул. Терещенювська, 3
ТОВ “Друкарня Б1знеспол1граф”
02094 Киш 94, вул. В1скозна, 8