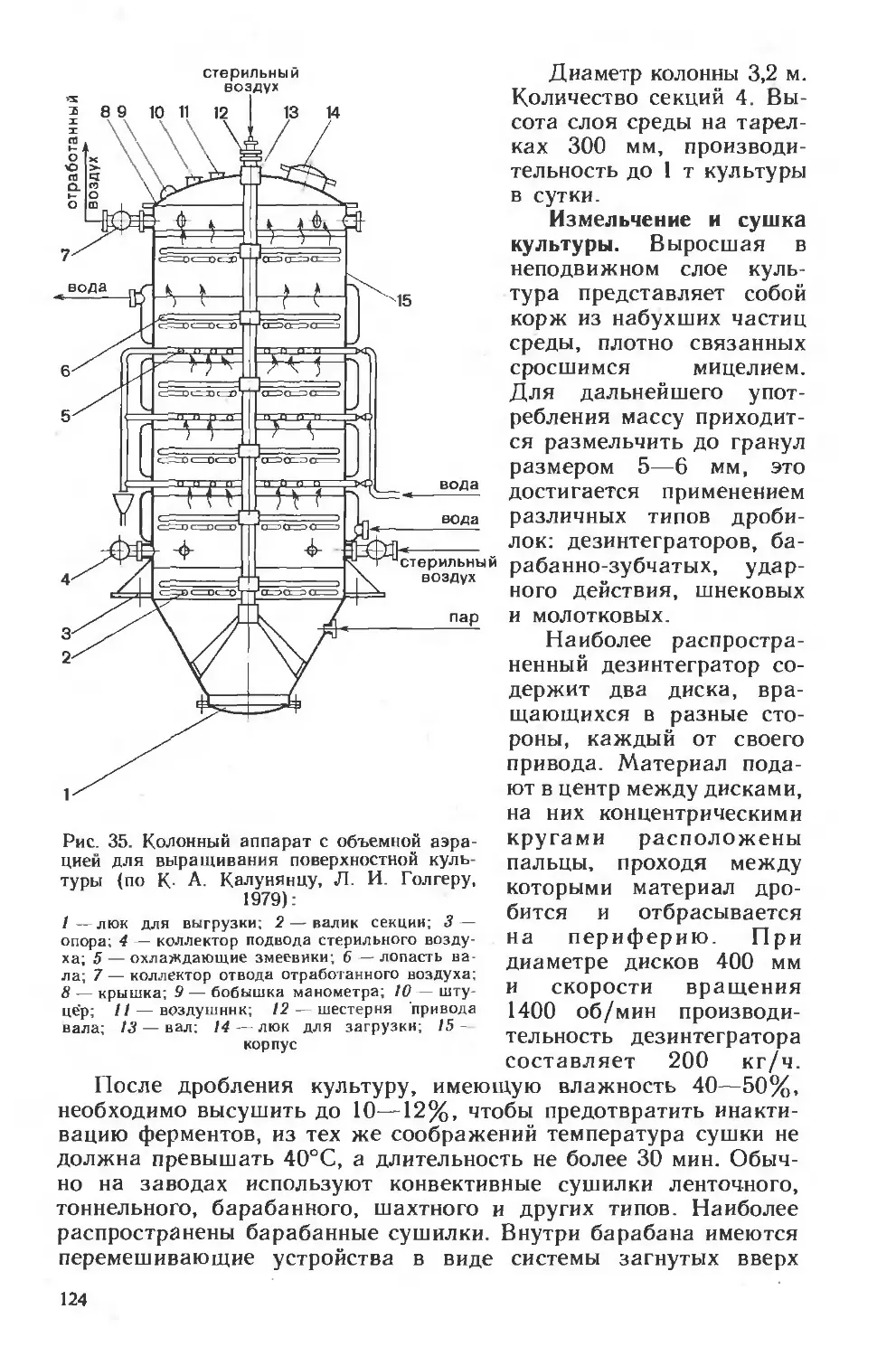
Похожие
Текст
ТЕННОЛОШН
В. А. Быков
МНМанаков
В.И. Панфилов
АА.Свитцов
Н.ВТарасова
ПРОИЗВОДСТВО
БЕЛКОВЫХ ВЕЩЕСТВ
ШОТЕННОЛОГиЯ
аютЕкнолошя
ушоиоичзюпд
в 8-ми книгах
БиОТЕННОЛОША
Под редакцией Н.С. Егорова
ЕЩСамуилова
ВАБыков
МНМанаков
В.И. Панфилов
ААСвитцов
Н.В.Тарасова
ПРОИЗВОДСТВО
БЕЛКОВЫХ ВЕЩЕСТВ
Москва «Высшая школа» 1987
ББК 30.6
Б 63
УДК 574.6
Рецензенты:
кафедра биотехнологии МИТХТ им. М. В. Ломоносова (зав. кафедрой
проф. Швец В. И.) и академик Скрябин Г. К- (Ин-т биохимии и физиоло-
гии микроорганизмов АН СССР)
Допущено Министерством высшего и среднего специального образо-
вания СССР в качестве учебного пособия для студентов биологических
специальностей высших учебных заведений.
2010000000 (4309000000)—354
001(01)—87
КБ—53—7—86
© Издательство <Высшая школа», 1987
ПРЕДИСЛОВИЕ
Серия учебных пособий, выпускаемых издательством «Выс-
шая школа» под общим названием «Биотехнология» (редакторы
проф. Н. С. Егоров и проф. В. Д. Самуилов), включает две кни-
ги, которые можно объединить наименованием «Промышленная
биотехнология». Этот термин отражает современное состряние
промышленности, которая основана на микробиологическом син-
тезе или трансформации органических соединений. Большое раз-
нообразие конкретных производств, входящих в промышленную
биотехнологию, заставляет при их описании выделить два основ-
ных направления, которым и посвящены, соответственно, пятая и
шестая книги этой серии.
Первым из этих важнейших направлений является промыш-
ленное производство микробного белка и ферментов; этим вопро-
сам посвящено настоящее пособие. Второе направление связано
с биосинтезом физиологически активных веществ, оно составляет
предмет следующей, шестой книги.
Поскольку процессы промышленного микробиологического
синтеза в своем технологическом и аппаратурном оформлении
имеют много общего, они могут обсуждаться как единая отрасль
промышленности со своими закономерностями и спецификой.
Это отразилось и на построении указанных учебных пособий:
первое из них, хотя и посвящено конкретно биосинтезу белковых
веществ, содержит главы 2 и 3, в которых дано общее представ-
ление о типичной структуре производства в биотехнологии и о
способах получения основных сырьевых источников, используе-
мых во всех разновидностях промышленного микробиологическо-
го синтеза. Во-втором излагаются лишь фактическое состояние
и перспективы развития производства биологически активных
препаратов микробного происхождения.
В настоящей книге В. А. Быковым кроме редактирования все-
го материала написаны введение; главы 1, 2 и заключение,
М. Н. Манаковым — введение, главы 1,2 и заключение, В. И. Пан-
филовым — главы 2 и 3, А. А. Свитцовым и Н. В. Тарасовой —
глава 4.
Авторы
ВВЕДЕНИЕ
Последние двадцать лет стали периодом бурного развития
биотехнологии как науки и отрасли промышленности. В научном
плане это связано с большими возможностями использования
методов генетической и клеточрой инженерии для получения био-
логических объектов с заданными свойствами, способность кото-
рых продуцировать то или иное вещество или противодейство-
вать определенным вредным воздействиям определена генети-
чески.
Развитие промышленной биотехнологии началось значительно
раньше; важным этапом в этом отношении было широкое про-
мышленное производство антибиотиков медицинского и ветери-
нарного назначения, начатое после второй мировой войны во
всех промышленно развитых странах мира. Однако в последние
годы число веществ, производимых методами микробиологиче-
ского синтеза и инженерной энзимологии, резко увеличилось и
продолжает быстро расти. Используя достижения биохимии, мо-
лекулярной биологии и микробиологии, технологи создают все
новые и новые производства для получения белка и аминокислот
кормового и пищевого назначения, медицинских препаратов, фер-
ментов, а также в целях охрайы окружающей среды.
Особенностью развития биотехнологии в СССР является вы-
сокий удельный вес промышленного производства белка однокле-
точных в общем объеме выпуска продуктов микробиологического
синтеза. Получение микробной биомассы как источника полно-
ценного белка, вводимого в корма для ведения интенсивного
животноводства, стало в нашей стране государственной задачей
в силу принятых партией и правительством решений о переводе
животноводства на промышленную основу. Известно, что интен-
сификация животноводства требует резкого увеличения произ-
водства кормового белка, поскольку высокопродуктивное мо-
лочное стадо, так же как и эффективные откормочные комплексы,
нуждаются в дополнительных источниках белка, компенсирую-
щих его недостаток в традиционных для нашей страны расти-
тельных кормах.
В большинстве развитых стран источником дополнительного
белка для кормопроизводства служат соевые бобы или шрот, со-
держащие большое количество полноценного белка, аминокис-
6
лотный состав которого принят за стандарт с точки зрения его
оптимальности для сельскохозяйственных животных. В - СССР,
как известно, основная часть пахотных земель находится вне так
называемой зоны уверенного (гарантированного) земледелия.
Именно это заставило нашу страну найти свой альтернативный
путь снабжения животноводства дополнительным белком. В на-
стоящее время в СССР осуществляется промышленное производ-
ство белка одноклеточных, основанное на крупномасштабном
культивировании дрожжей, бактерий и низших грибов.
Использование дрожжевых микроорганизмов в пищевых, ме-
дицинских и кормовых целях известно давно и широко распро-
странено во всех странах, оно основано на культивировании
дрожжей рода Sacharomyces на углеводных средах в условиях
брожения или аэробного дыхания. С появлением в нашей стране
гидролизного производства отходы после брожения и отделения
спирта стали использовать для выращивания кормовых дрож-
жей, которые утилизировали несбраживаемые моносахариды в
условиях аэробной ферментации. Такие «гидролизные дрожжи»
употребляли далее как дополнение к кормам в сельском хозяйст-
ве. Это позволило в настоящее время все углеводы, образующие-
ся при кислотном гидролизе растительных материалов, использо-
вать для получения кормовых дрожжей, выпуск которых резко
возрос.
Несмотря на то что гидролизные дрожжи давно являются
промышленными продуктами, действительным отправным пунк-
том в создании промышленности микробного белка надо считать
появление заводов, выпускающих дрожжевую биомассу с приме-
нением углеводородов в качестве источника углерода в питатель-
ных средах. Пуск в эксплуатацию в 60-х годах первых заводов,
производящих белково-витаминный концентрат (БВК) из углево-
дородов нефти, послужил причиной выделения микробиологиче-
ской промышленности в самостоятельную отрасль. Если перво-
начально заводы отрасли использовали лишь узкую фракцию
к-алканов, выделяемую из депарафинизата дизельного топлива, то
в настоящее время в СССР и ряде других стран разработаны и
внедряются процессы культивирования дрожжей и бактерий, пот-
ребляющих в качестве субстрата метанол, этанол, метан, отходы
органического синтеза или селективно извлекающих «-алканы не-
посредственно из дизельной фракции прямой перегонки нефти.
Биомасса дрожжей, выращенных на парафинах заданного
состава, содержит до 60% белка, безусловно полноценного по
своему аминокислотному составу, а также целый ряд биологически
активных веществ типа витаминов, кофакторов и т. п., что опреде-
ляет ее высокую кормовую ценность. То же можно сказать и о би-
омассе бактерий, растущих на метане и метаноле, — содержание
белка в этом продукте достигает 70%, а скорость роста выше, чем
у дрожжей. Хотя аминокислотный состав белка дрожжей и бак-
терий несколько отличается от принятого за стандарт состава ами-
нокислот белка сои (табл. 1), микробный белок включает все иеоб-
7
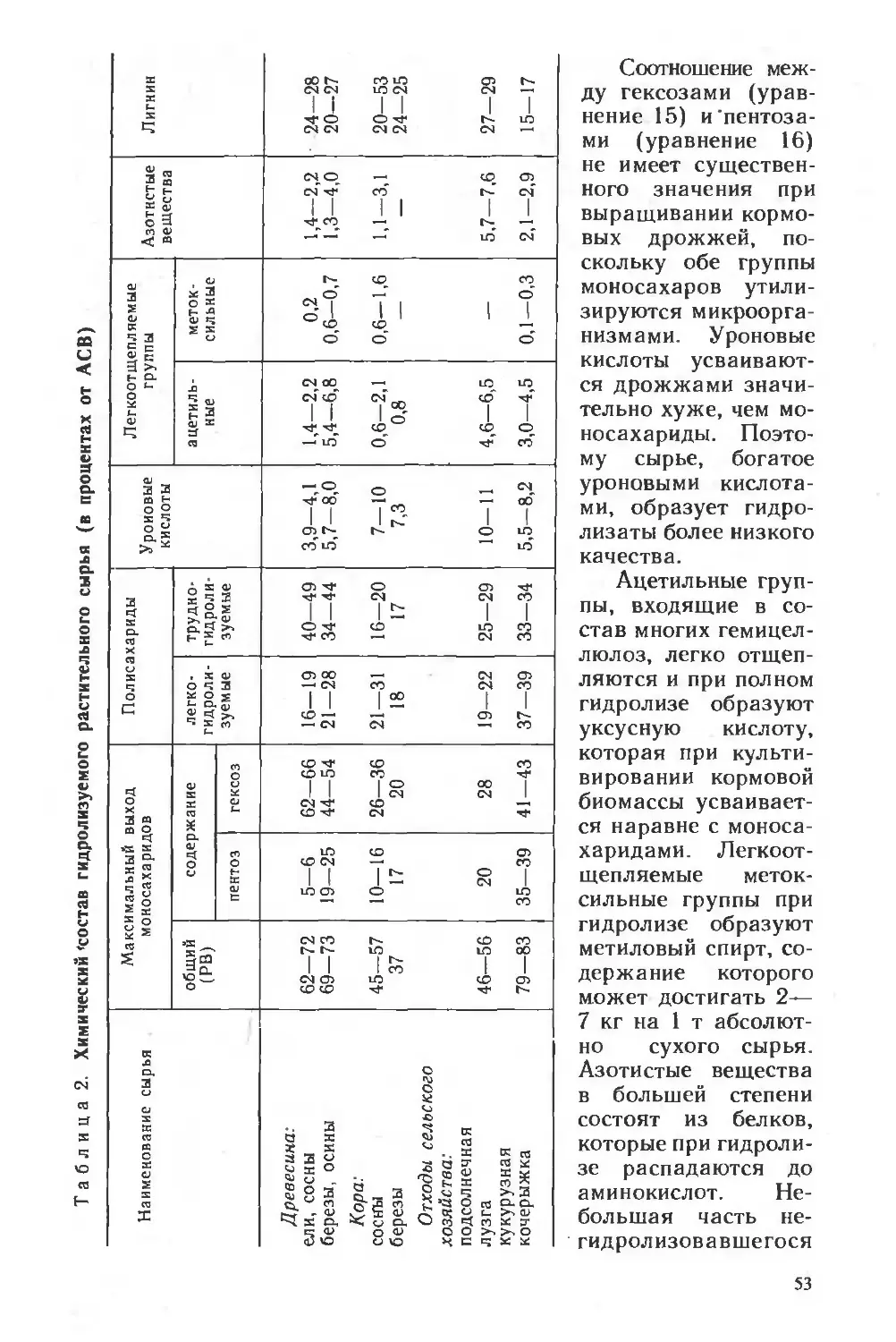
Таблица 1. Относительное содержание аминокислот в источниках
пищевого и кормового белка
Аминокислота Содержание в граммах на 100 г истинного белка
яичный аль- бумин бычнй сыво роточный альбумин соевая мука биомасса дрожжей
Триптофан 1,6 — 0,4 0,5
Лизин 6,4 15,0 5,1 5,1
Г истидин 2,4 3,9 1,8 1,7
Аргинин 6,1 6,0 4,4 2,3
Аспарагиновая кислота 9,0 10,2 6,7 4,6
Треонин 5,1 5,9 3,3 2,9
Серин 3,5 4,0 3,3 2,5
Глутаминовая кислота 16,0 16,8 8,6 6,5
Пролин 8,1 5,1 2,9 1,4
Глицин 3,6 2,0 2,5 2,2
Аланин 7,4 5,3 2,3 3,3
Цистин 2,4 — 0,9 0,3
Валин 7,3 7,0 3,4 3,0
Метионин 3,1 — 0,8 0,9
Изолейцин 6,6 2,4 2,8 3,1
Лейцин 8,8 10,8 4,4 3,7
Тирозин 4,2 4,5 2,1 2,3
Фенилаланин 5,8 5,8 3,1 2,5
Итого: сырой протеин (%) 47,1 60
истинный белок (%) 37,0 42.1
ходимые аминокислоты, а по содержанию большинства незамени-
мых аминокислот — лизина, треонина, триптофана и других —
практически не уступает или даже превосходит стандарт.
При всестороннем исследовании микробной биомассы была
выявлена ее чрезвычайно высокая технологическая и экономиче-
ская эффективность для мясного и молочного животноводства,
птицеводства и целого ряда других направлений народного
хозяйства. Кормовые дрожжи содержат в 5 раз больше белка
(в том числе лизина в 10, метиона в 5 и триптофана в 3 раза
больше), чем ячмень или овес. Кроме того, в сухих дрожжах
имеются практически все витамины группы В и целый ряд росто-
вых факторов. В результате этого 1 т кормовых дрожжей, добав-
ленных в корма сельскохозяйственных животных, обеспечивает
экономию до 7 т зерна и дополнительное производство 0,8 т
свинины, 5 т мяса птицы или до 15 тыс. шт. яиц. Включение 1 т
дрожжей в рацион телят и поросят высвобождает для питания
населения 6 т цельного или 1,5 т сухого обезжиренного молока.
Получение белковых веществ не является единственным на-
правлением развития промышленного микробиологического син-
теза, это лишь наиболее крупнотоннажная подотрасль современ-
ной биотехнологии, дающая миллионы тонн продукции ежегодно
и продолжающая быстро расти. Очень велика также роль про-
8
изводства аминокислот кормового, пищевого и медицинского
применения, различного рода ферментных препаратов, антибио-
тиков для медицины и ветеринарии, биологических удобрений
и средств защиты растений. Все большую роль играют процессы
микробной трансформации в производстве витаминов, пищевых
продуктов, полусинтетических антибиотиков и лекарственных
средств.
Промышленная биотехнология в Советском Союзе, как и
во всем мире, развивается исключительно динамично, из года
в год опережая по темпам роста производства и производитель-
ности труда многие другие отрасли народного хозяйства. Особенно
большое внимание уделяется биотехнологии в последние годы,
когда она была признана одним из приоритетных направлений
научно-технического прогресса стран СЭВ. Перспективы роста
медицинской и микробиологической промышленности в СССР
были определены решениями XXVII съезда КПСС, где особая
роль этой отрасли была отражена в Политическом докладе
ЦК КПСС съезду партии и в Основных направлениях экономиче-
ского и социального развития СССР на 1986—1990 годы и
на период до 2000 года. В частности, в последнем документе
указано, что микробиологическая промышленность должна
«увеличить выпуск продукции за пятилетку в 2 раза. Значительно
расширить производство кормового белка и других биологически
активных веществ. Развивать сырьевую базу биотехнологии, в
том числе за счет увеличения использования газа. Обеспечить
более полное удовлетворение потребности сельского хозяйства
в продуктах микробиологического синтеза».
При изложении соответствующих разделов в настоящей
книге авторы стремились дать представление не только о совре-
менном состоянии технологии, но и о перспективах ее развития
и расширения сырьевой базы отрасли.
Глава ОСНОВНЫЕ ПРИНЦИПЫ
1 ПРОМЫШЛЕННОГО
ОСУЩЕСТВЛЕНИЯ
БИОТЕХНОЛОГИЧЕСКИХ
ПРОЦЕССОВ
Большое разнообразие биотехнологических процессов, нашед-
ших промышленное применение, приводит к необходимости рас-
смотреть общие, наиболее важные проблемы, возникающие при
создании любого биотехнологического производства. Процессы
промышленной биотехнологии обычно разделяют на две большие
группы по признаку целевого продукта — производство биомассы
и получение продуктов метаболизма. При таком подходе удачно
освещается цель производства, которая в первом случае заклю-
чается в получении клеточной массы продуцента, вне зави-
симости от того, будет ли далее использоваться живая культура
(например, сахаромицеты для пищевых целей, споры с токси-
нами в целях защиты растений) или биомасса нежизнеспособных
клеток как источник белка, витаминов и других ценных веществ
для кормопроизводства. Ко второй группе относят все процессы,
где целевым продуктом становится один или несколько мета-
болитов, а клетки продуцента не нужны или даже вредны после
завершения фазы биосинтеза; это, например, получение продук-
тов брожения, ферментов, аминокислот, антибиотиков и всевоз-
можные виды микробных трансформаций.
У инженера-технолога такая классификация по целевому
продукту не вызывает возражений, однако она не отражает
наиболее существенных с технологической точки зрения аспектов
промышленных биотехнологических процессов, которые, с одной
стороны, роднят их с химической технологией, а с другой —
резко отличают от последней. В этом плане наиболее эффективно
рассмотреть, какие стадии включает в себя типичный процесс
промышленной биотехнологии, каковы общие черты и различия
этих стадий в зависимости от конечной цели производства.
Основными стадиями биотехнологического производства мож-
но считать пять операций, которые взаимосвязаны, но различа-
ются по целям и принципам их достижения. Две начальные
стадии включают подготовку сырья и биологически действую-
ю
щего начала. В процессах инженерной энзимологии они обычно
состоят1 из приготовления раствора субстрата *с заданными
свойствами (pH, температура, концентрация и т. д.) и подготов-
ки партии ферментного препарата данного типа, нативного или
иммобилизованного. При осуществлении микробиологического
синтеза необходимы стадии приготовления питательной среды
и поддержания чистой культуры, которая могла бы постоянно
или по мере необходимости использоваться в процессе. Поддер-
жание чистой культуры штамма-продуцента — по существу,
ключевая задача любого микробиологического производства,
поскольку только высокоактивный, не претерпевший нежелатель-
ных изменений штамм может служить гарантией получения
целевого продукта с заданной производительностью. В этой связи
роль микробиологической службы на современном биотехно-
логическом производстве трудно переоценить.
В рассматриваемой последовательности третьей оказывается
стадия ферментации, т. е. та основная стадия, на которой проис-
ходит образование целевого продукта. Подобно тому как в
химической технологии собственно химическое превращение в
реакторе определяет не только результаты производства, но и
стратегию осуществления последующих процессов выделения и
очистки продуктов, на стадии ферментации идет микробио-
логическое превращение компонентов питательной среды сначала
в биомассу, а затем, если это необходимо, в целевой метаболит.
Особое место в промышленной биотехнологии занимает
четвертая стадия общего производственного цикла, на которой
из культуральной жидкости выделяют и очищают целевые
продукты. Для промышленных микробиологических процессов
характерно,, как правило, образование очень разбавленных вод-
ных растворов или суспензий, содержащих, кроме целевого,
большое количество веществ, находящихся в смеси часто в до-
вольно больших количествах. Это делает весьма специфичной
и сложной задачу разделения и очистки основных, с точки
зрения целей производства, веществ. Как правило, микробио-
логический синтез требует на стадии выделения разделять смеси
веществ часто очень близкой природы, находящихся в растворе
в сравнимых концентрациях, да к тому же еще зачастую
весьма лабильных, легко подвергающихся термической деструк-
ции и т. д.
Заключительным этапом биотехнологического производства,
как и в химической технологии, является приготовление товарных
форм продуктов, однако и здесь, несмотря на схожесть задач,
имеются существенные особенности. Одна из них — необходи-
мость выпуска препаратов, в частности для медицинских целей,
в стерильной форме, что требует специальных решений на стадии
расфасовки и укупорки продукта. Общим свойством подавля-
ющего большинства продуктов микробиологического синтеза
является их недостаточная стойкость к хранению, поскольку
сами эти продукты склонны к разложению, например лизису,
и
и в таком виде представляют прекрасную среду для развития
посторонней, чаще всего гнилостной микрофлоры. Это заставляет
технологов принимать специальные меры для повышения сохран-
ности препаратов промышленной биотехнологии.
Ниже приводится обобщенная характеристика каждой из
стадий промышленного микробиологического синтеза, причем
особое внимание обращено не только на описание типичных
технологических решений, но и на внутреннюю взаимосвязь,
делающую каждое конкретное производство единым целым, в
котором изменение, внесенное на одной из стадий, как правило,
требует соответствующей коррекции технологии и на других
этапах промышленного производства.
§ 1. Технология приготовления питательных сред
для биосинтеза
Основу питательных сред для культивирования микроорга-
низмов составляют источники углерода. Исключительное много-
образие микроорганизмов делает число таких соединений почти
безграничным, так как, с одной стороны, существуют культуры,
способные при осуществлении биосинтеза потреблять углерод
только из высокоорганизованных молекул, например белков и
пептидов, а с другой — многие бактерии и отчасти дрожжи
утилизируют такие простейшие углеродсодержащие соединения,
как метан, метанол и даже углекислота.
Кроме углерода клетки микроорганизмов в процессе роста
испытывают необходимость в источниках азота, фосфора, макро-
и микроэлементов. Все вещества этого рода находятся в пита-
тельных средах в виде солей, исключением являются лишь среды,
где азот и фосфор могут усваиваться растущими культурами из
органических источников, например автолизатов или гидроли-
затов микробного или животного происхождения. В подавля-
ющем большинстве случаев в промышленных средах для культи-
вирования заранее содержатся все необходимые элементы питания,
кроме кислорода и, в некоторых производствах, углерода, если
последний вводится в виде газообразного соединения (СН4,
СО2 и т. п.).
Отделение приготовления питательной среды на современном
микробиологическом производстве представляет собой, как пра-
вило, цех, оборудованный емкостями для хранения твердых и
^кидких веществ, средствами их транспортировки и аппаратами
с перемешивающими устройствами для приготовления
растворов, суспензий или эмульсий. При этом питательные соли
хранятся обычно в твердом виде, а приготовление их смеси с
заданным соотношением компонентов производится в аппарате
с мешалкой, куда подаются непосредственно твердые компоненты
в необходимом количестве и далее проводится их растворение,
или ‘соединяются заранее приготовленные в специальных ап-
паратах растворы каждого или нескольких компонентов и про-
изводится лишь их окончательное смешение и гемогенизация.
12
Жидкие и твердые источники углерода предпочитают обычно
вводить в уже готовую питательную среду непосредственно перед
ферментацией, так как это устраняет опасность заражения
посторонней микрофлорой, вероятность которого, естественно,
резко' возрастает при хранении готовой питательной смеси.
В этой связи при непрерывном культивировании в производстве
микробного белка потоки углеводородов и питательных солей
вводят в ферментер раздельно по индивидуальным линиям
подачи, а смешение и эмульгирование нерастворимых в воде
w-алканов происходит уже в самом биореакторе. Аналогично
этому при культивировании бактерий на метане последний
постоянно барботирует в аппарат через специальные устройства.
Осуществление периодической ферментации связано с не-
сколько иными проблемами, поскольку в этом случае в начале
процесса инокулят (засевная доза микроорганизмов) вносится
в уже готовую питательную среду, содержащую все необходимые
компоненты. В таких случаях источники углерода вводят обычно
непосредственно перед засевом, а во многих производствах
используют так называемую подпитку, когда отдельные компо-
ненты среды, прежде всего источники углерода, дополнительно
вводят пр мере их потребления культурой, поддерживая в фер-
ментере некоторую оптимальную концентрацию, которая на
разных этапах ферментации может меняться по определенному
закону.
Важнейшим элементом приготовления питательных сред
является соблюдение требований асептики. В зависимости от
жесткости принятых в этом отношении решений возникает
необходимость либо только в создании заданного значения pH,
обеспечивающего подавление посторонних микроорганизмов,
либо в полной стерилизации всех подаваемых в биореактор
потоков и самого биореактора. В последнем случае для стерили-
зации газовых потоков, в первую очередь воздуха, используют
процесс фильтрации через специальные волокнистые фильтры с
последовательно расположенными фильтрующими элементами,
каждый из которых обеспечивает заданную степень снижения
концентрации клеток в газовом потоке. Общее количество фильт-
ров определяется необходимым уровнем (так называемым крите-
рием) стерилизации; нужная производительность по газовому
потоку достигается установкой ряда параллельно работающих
фильтрующих элементов. Основным требованием к фильтрующе-
му материалу является в этом случае допустимость его периоди-
ческой стерилизации, обычно осуществляемой подачей острого
пара в отключенный фильтр через заданные промежутки времени.
Жидкостные потоки стерилизуют различными методами, из
которых практический интерес представляют термический, радиа-
ционный, фильтрационный и отчасти химический. Самый распро-
страненный в промышленности термический метод стерилизации
жидких и твердых материалов основан на известном факте гу-
бительного действия на живые клетки высоких температур. Отми-
13
рание клеток под влиянием неблагоприятных факторов внешней
среды описывается зависимостью первого порядка
• -^L=kN, (1)
ат ' ’
где N — число жизнеспособных клеток к моменту времени т;
k — константа инактивации, зависящая от температуры по экспо-
ненциальному закону;
k = feoexp(~£//?r). (2)
Предэкспонента ko определяется типом культуры и составом
среды, а константа Е, аналогичная энергии активации в урав-
нении Аррениуса для химических реакций, зависит от природы
клеток и свойств культуральной жидкости, прежде всего от pH.
В интегральном виде зависимость (1) описывается экспонентой
No/N = (3)
т. е. отношение числа клеток, имевшихся в исходном материале No,
к числу выживших к моменту т меняется во времени по логариф-
мическому закону. Уравнение (3) позволяет рассчитать время
выдержки при заданной температуре Т, которое обеспечивает
достижение заданной степени (критерия) стерилизации, т. е. поз-
воляет снизить обсемененность в заданное число раз, при этом
константы k0 и Е находят из эксперимента.
Основным недостатком термической стерилизации, несмотря
на ее широкое практическое использование, следует считать
неизбежные потери питательных свойств среды, поскольку при
температурах, необходимых для стерилизации (порядка 120—
150°С), большинство субстратов, особенно углеводы, оказываются
термически нестабильными. Это заставляет очень жестко контро-
лировать время и температуру термического воздействия на
субстрат, который обычно поэтому стерилизуют отдельно от ос-
тальной питательной среды, где содержатся значительно более
устойчивые к нагреву компоненты. Типичным технологическим
решением процесса стерилизации является подогрев среды и суб-
страта (часто в растворе) острым паром в емкости или глухим
паром в теплообменнике, либо одновременное сочетание двух
этих приемов.
В заключение заметим, что целый ряд субстратов не требует
стерилизации, так как они сами обладают асептическим действием;
сюда относятся метанол, этанол, крепкая уксусная кислота и др.
В этих случаях в принципе можно ограничиться лишь стерилиза-
цией прочих элементов питательной среды.
Остальные методы стерилизации в силу различных причин
нашли значительно меньшее распространение. В частности, ра-
диационный метод, основанный на облучении материалов боль-
шими дозами ионизирующих излучений, главным образом у-излу-
чением, дает хорошие результаты при стерилизации небольших
объектов в основном медицинского назначения (перевязочный
14
материал и т. п.). Промышленное использование у-излучения для
стерилизации жидких и газообразных сред безусловно возможно,
но применяется редко из-за трудностей создания и Эксплуата-
ции необходимых в этом случае мощных источников у-квантов;
использование же маломощных излучателей делает процесс эконо-
мически неэффективным.
В отдельных случаях применяют химические стерилизующие
агенты, т. е. вещества с явно выраженным сильным асептиче-
ским действием. Основной проблемой в этом случае оказывается
необходимость устранения стерилизующего агента из питательной
среды после гибели посторонней микрофлоры и до внесения
инокулята продуцента. Химические антисептики должны быть не
только высокоэффективными, но и легко разлагаемыми при ив-
менении условий после завершения стерилизации. К сожалению,
выбор таких веществ невелик и их нельзя считать легко доступ-
ными; к числу лучших из них относится пропиолактон, обла-
дающий сильнейшим бактерицидным действием и легко гидроли-
зуемый далее в абсолютно нетоксичную молочную кислоту. Хи-
мическая стерилизация питательных сред не нашла промышленно-
го применения, однако в ряде случаев удачно используется в
Лабораторных и опытных условиях.
Нельзя отнести к распространенным и метод стерилизующей
фильтрации. Однако это объясняется не недостатками самого спо-
соба, а только аппаратурными трудностями. Метод основан на
способности полупроницаемых мембран с крупными порами (ти-
па микрофильтрационных мембран) пропускать жидкую фазу и за-
держивать (концентрировать) клетки микроорганизмов. Известно,
что микро- и ультрафильтрация принципиально отличаются от
обычной фильтрации тем, что разделяют гомогенные смеси (ра-
створы) и дают не осадок задерживаемого вещества, а его кон-
центрат, тогда как прошедший через мембрану раствор — пер-
меат — не содержит примесей, задерживаемых мембраной. В этом
смысле клетки микроорганизмов, как (условно называемая)
твердая фаза, затрудняют процессы мембранного разделения,
однако, учитывая их относительно крупные размеры по срав-
нению с диаметром пор мембраны (450 мкм и менее), они могут
быть отделены путем концентрирования на достаточно крупнопо-
ристых мембранах при интенсивном перемешивании концентра-
та, устраняющем осаждение клеток на мембране.
В принципе метод стерилизующей фильтрации является
идеальным средством стерилизации лабильных, в том числе тер-
мически неустойчивых жидких и газовых сред, поскольку он мо-
жет быть проведен при низкой температуре и требует лишь гра-
диента давления по разные стороны мембраны. Это позволяет
говорить о больших технологических перспективах мембранной
стерилизации, в первую очередь, жидких сред. Основная имевшая-
ся здесь трудность — наличие термостойких мембран, способных
выносить многократную термическую стерилизацию их самих в
ходе эксплуатации, сейчас успешно преодолевается путём широ-
15
кого применения термостойких полимеров в производстве мембран.
Можно утверждать, что по мере создания более совершенных
конструкций мембранных аппаратов с термостойкими мембрана-
ми, рассчитанными на длительную эксплуатацию, и защищенными
от налипания клеток, метод стерилизующей фильтрации будет
все шире применяться в промышленной биотехнологии, в том числе
в крупнотоннажных производствах.
§ 2. Поддержание чистой культуры
Характеристика микроорганизма-продуцента как основы лю-
бого процесса промышленной биотехнологии определяет струк-
туру промышленного производства. В технологическом процессе
используются полезные свойства штамма и вместе с тем должно
быть обеспечено сохранение и, если возможно, усиление его
производственных качеств — скорости роста и качества
в производстве белковых веществ и других продуктов этого
типа, скорости биосинтеза у штаммов — продуцентов амино-
кислот, ферментов, антибиотиков и т. п. Недостаточное под-
держание чистоты культуры может значительно снизить техноло-
гические и экономические показатели цеха, а в особо тяжелых
случаях полностью исключить возможность дальнейшей промыш-
ленной эксплуатации штамма.
Таким образом, отделение чистой культуры является тем
звеном в промышленном микробиологическом синтезе, которое
ответственно за постоянное и надежное воспроизведение полез-
ных свойств продуцента, найденных или достигнутых в свое
время в ходе лабораторных исследований. Поэтому такое отделе-
ние в любом цехе, где производится промышленный биосинтез,
включает в себя как лабораторные операции по контролю и
сохранению чистой культуры, так и маломасштабное культивиро-
вание для постоянной передачи штамма на стадию ферментации.
В лабораторной части отделения чистой культуры имеется
то же оборудование и используются те же приемы, что и в любой
микробиологической лаборатории: хранящиеся в музее цеха
несколько штаммов-продуцентов постоянно сохраняются извест-
ными способами, при этом в ходе контрольных высевов и мало-
масштабных ферментаций (в пробирках, колбах и т. п.) кон-
тролируется устойчивость всех имевшихся или приобретенных
признаков, которые послужили основанием для рекомендации
к промышленному применению именно этих культур и на основа-
нии которых был составлен действующий в цехе промышленный
регламент производства.
По мере необходимости из отделения чистой культуры по-
ступает заданная масса инокулята, идущая в производство, т.е.
в отделение промышленной ферментации. При периодическом
процессе культивирования, что характерно для цехов по выра-
ботке аминокислот, антибиотиков и ферментов, в отделении чистой
культуры готовят засевную дозу клеток для каждой из операций
16
основного производства. Непрерывная ферментация в хемостате
или каскаде хемостатов, к которому приближаются современные
аппараты для получения кормовых дрожжей и бактерий, не
нуждается, вообще говоря, в подаче биомассы с входящим по-
током среды. Однако на практике для повышения качества про-
дукта предпочитают время от времени или постоянно (по-
немногу) вводить в аппарат клетки основного штамма-про-
дуцента, получая их опять-таки из отделения чистой культуры.
Такое положение заставляет иметь в отделении фермента-
ционную часть, где проводится выращивание достаточно крупных
засевных партий микроорганизма-продуцента. Масштабы такого
выращивания зависят, прежде всего, от мощности основного
отделения — ферментационного — и сильно различаются на
разных заводах. Вне зависимости от того, какой характер под-
чиненности принят в данном конкретном цехе, функция отделения
чистой культуры состоит в поддержании культуры и выращива-
нии посевных доз последовательно в колбах и бутылях на 10—
20 л, находящихся на качалках или просто размещенных в
термостатируемом помещении, и далее в последовательности
ферментеров объемом (смотря по необходимости) 10, 100, 500
и 1000 л, в которых осуществляются перемешивание, аэрация
и термостатирование культуральной жидкости с клетками.
Очень велика и специфична роль всей службы микробиологи-
ческого контроля, в том числе и отделения чистой культуры,
в современном биотехнологическом производстве в связи с
характерной особенностью микробиологического синтеза, которая
заключается в наличии постоянной обоюдной связи и зависи-
мости между культурой-продуцентом и необходимой для нее
питательной средой. При первоначальном отборе штамма, от
которого зависит решение той или иной задачи биосинтеза,
главное внимание исследователи обращают, конечно, на его
продуктивность, т. е. способность быстро и эффективно вести
биосинтез заданного продукта. При отборе лучшего из ряда
найденных продуцентов учитываются их особенности, которые
могут отразиться на технологии и экономике производства:
устойчивость к фаголизису и изменениям условий внешней
среды — температуре, pH, аэрации и т. д. При прочих равных
условиях предпочтение, естественно, отдается тому продуценту,
который способен развиваться и давать продукт на недефицит-
ных питательных средах, не требующих использования редких,
дорогостоящих или технологически неудобных субстратов, в том
числе и пищевых продуктов.
После выбора штамма-продуцента проводится большая
исследовательская работа по оптимизации питательной среды
и условий его выращивания, результаты которой включаются
в технологический регламент, являющийся нормативным доку-
ментом для работников промышленности. Это правило подбора
среды для подуцента — одна из основ биотехнологии. Однако
в условиях производства может возникать и обратная задача,
17 •
которая, как правило, решается для каждого конкретного цеха
центральной заводской лабораторией и отделением чистой
культуры.
Одна из причин этого положения заключается в том, что
микробиологическая промышленность зачастую вынуждена ис-
пользовать в качестве компонентов питательных сред отходы и
побочные продукты сельского хозяйства и пищевой промышлен-
ности, такие, как, например, меласса, кукурузный экстракт и др.
Это ставит задачу дополнительной адаптации продуцента к
особенностям конкретной среды, имеющейся на данном заводе
и одновременно уточнения состава среды и ее дополнительной
оптимизации. В ряде случаев приходится учитывать и сезонные
изменения сырья, т. е. дополнительные операции с продуцентами
и питательными средами становятся, по существу, постоянной
задачей микробиологов, работающих в цехе и на заводе в целом.
Возможны, в принципе, и другие случаи, когда необходимо
сменить продуцент и использовать другой штамм из коллекции
завода. Это связано с тем, что в экстраординарных случаях,
например при серьезных неурожаях или невозможности получить
сырье по другим причинам, завод вынужден менять, по крайней
мере временно, основу питательных сред, ростовые факторы или
другие компоненты. В этом случае, естественно, необходимо
перейти к использованию штамма из числа имеющихся, наиболее
приспособленных к новой среде, и провести его дополнительную
адаптацию.
Причинами временного перехода на новый штамм могут
быть сезонные изменения температуры, которые частично компен-
сируются подбором достаточно продуктивных термотолерантных
штаммов, падение уровня аэрации вследствие незапланирован-
ных изменений в системе подачи и распределения воздуха и др.
Все это делает роль микробиологической службы завода и от-
делений чистой культуры в цехах очень большой и определяет
необходимость наличия в персонале заводских и цеховых
лабораторий и службы высококвалифицированных и опытных
микробиологов, хорошо знакомых с целями и особенностями
своего конкретного производства.
§ 3. Ферментация
В промышленной биотехнологии «производительной силой»
является штамм-продуцент, поэтому стадия ферментации оказы-
вается центральной среди этапов промышленного производства.
Под ферментацией понимают всю совокупность последовательных
операций от внесения в заранее приготовленную и термостатиро-
ванную среду инокулята и до завершения процессов роста,
биосинтеза или биотрансформации вследствие исчерпания пита-
тельных элементов среды, прекращения биосинтеза, потери ак-
тивности культурой или по иным причинам.
В промышленной биотехнологии можно выделить два прин-
ципиально отличающихся типа процессов, первый из которых
18
направлен на получение белка одноклеточных путем накопления
биомассы микроорганизмов — дрожжей, бактерий, микроскопи-
ческих грибов — и ее применение после высушивания в виде
сотового продукта. В этом типе производств, ориентированном
на максимальное накопление белковых веществ, прак-
тически не используются образующиеся в ходе роста метаболиты
и, более того, имеется четкая тенденция к их минимальному
выходу, что, естественно, повышает экономические характери-
стики за счет снижения расходных коэффициентов по сырью.
Второй тип производств, в противоположность первому, ха-
рактеризуется накоплением не только и даже не столько клеток
продуцента, сколько ценных веществ, возникающих в ходе роста
или на последующих стадиях развития культуры. Процессы этого
типа крайне разнообразны и включают общеизвестные производ-
ства аминокислот, ферментов, антибиотиков, а также и своеобраз-
ные варианты культивирования, когда целью является получение
жизнеспособных (в товарном виде) клеток, спор и токсинов,
выделяемых в культуральную жидкость на поздних стадиях раз-
вития клеток. К этому варианту относятся производства бакте-
риальных удобрений и препаратов для защиты сельскохозяй-
ственных растений. Несколько особняком стоят процессы микро-
биологической трансформации, широко распространенные в про-
изводстве лекарственных средств и витаминов. Наконец, в по-
следнее время все больший интерес проявляется к производ-
ствам, когда целевым продуктом оказывается продукт, находя-
щийся внутри клеток вследствие проведенных над ней генно-
инженерных операций, как, например, интерферон, гормон
роста и т. п.
С технологической и аппаратурной точек зрения очень важ-
ным различием двух вышеописанных типов микробиологического
процесса является характер построения производства во време-
ни: биомасса одноклеточных выращивается непрерывным спо-
собом в аппаратах хемостатного типа, а все процессы второй
группы осуществляются периодически, когда в одном и том же
аппарате в производственном цикле протекают все необходимые
фазы развития клеток и биосинтеза. Отметим, что интенсивные
исследования по непрерывному получению метаболитов ведутся
достаточно широко, но не нашли еще промышленной реализа-
ции. Процессы двух рассматриваемых видов существенно раз-
личаются и по требованиям к степени асептики. Это связано,
в первую очередь, с их объемами: белок одноклеточных произво-
дится в количествах, измеряемых миллионами тонн абсолютно
сухого вещества, тогда как выпуск продуктов наиболее крупно-
тоннажных процессов второго вида составляет, как максимум,
тысячи или десятки тысяч тонн. Понятно, что в первом случае
обеспечение полной асептики, т. е. выращивание абсолютно
чистой культуры в масштабах всего производства, — значительно
более трудная задача, чем во втором. Именно поэтому в произ-
водстве белковых веществ ограничиваются достаточно высокой,
19
но не 100%-ной степенью асептики, обеспечивая последнюю
главным образом подбором режима культивирования, подходя-
щего для продуцента, но неблагоприятного для возможных
примесных штаммов.
Проблемы асептики для производства аминокислот, фермен-
тов и т. п., напротив, могут быть решены лишь путем создания
такой технологии и аппаратуры, которые обеспечивали бы гаран-
тированную защиту культуральной среды от попадания по-
сторонней микрофлоры на всем протяжении процесса, т. е. в те-
чение десятков и сотен часов. Приемы, позволяющие реально
осуществить асептические процессы, удовлетворяющие этим тре-
бованиям, описаны, в специальной литературе и частично рас-
смотрены в последующих главах. Можно лишь подчеркнуть,
что они основаны на многолетнем опыте создания и эксплуа-
тации процессов асептического микробиологического синтеза, а
этот опыт неопровержимо показал отсутствие «мелочей» и необ-
ходимость на всем протяжении производственного цикла строго
соблюдать правила работы, обеспечивающие допустимо малую
вероятность контаминации. В этом отношении решения по про-
мышленной асептике в микробиологическом синтезе уместно
сравнить с правилами техники безопасности, имеющимися в лю-
бом промышленном производстве: построенные на отрицательном
опыте, они дают положительный результат только при их безус-
ловном соблюдении.
Технологическое оформление процессов промышленной био-
технологии в сильной степени определяется отношением микро-
организма — продуцента к кислороду и, следовательно, к возду-
ху. Большинство современных микробиологических производств
используют аэробные культуры, которые в своем развитии тре-
буют присутствия кислорода. Это ставит в качестве одной из
важнейших задачу обеспечения необходимой концентрации рас-
творенного кислорода в жидкой фазе в течение всего процесса
ферментации, причем необходимо учитывать, что потребность
культуры в кислороде может меняться в разных фазах развития.
В этой связи ферментационное оборудование аэробных процес-
сов и нормы технологического режима подбираются таким об-
разом, чтобы массообмен — перенос кислорода из газовой в
жидкую фазу — обеспечивал поступление кислорода к клеткам
в количествах, необходимых и оптимальных для данной культуры
в данной фазе роста. Обычно хорошее снабжение клеток кисло-
родом достигается за счет оптимизации массообменных харак-
теристик, определяющих скорость растворения кислорода в воде,
так как другой возможный путь — изменение парциального дав-
ления О2 в газе, например, за счет увеличения общего давле-
ния — менее удобен и связан с рядом технологических слож-
ностей.
Промышленное применение факультативных анаэробов не
требует аэрации ферментационной среды, но одновременно не
ставит и задачи абсолютного исключения кислорода из среды,
20
поэтому процессы этого типа, например брожение, технологи-
чески проще аэробных из-за отсутствия аэрации. В начальной
фазе таких процессов требуется лишь удалить кислород (воз-
дух) из газовой фазы над культуральной жидкостью, что может
быть достигнуто введением инертного газа или даже просто вы-
теснением воздуха углекислотой, выделяемой клетками при мета-
болизме.
Технологическое оформление строго анаэробных процессов,
напротив, сложнее, чем для процессов брожения, поскольку в
этом случае оказывается необходимым полностью исключить
возможность попадания кислорода в газовую, а оттуда и в
жидкую фазу. Хотя с точки зрения аппаратурной эта задача
безусловно разрешима — герметизация ферментеров вполне
возможна, она вызывает затруднения при самом проведе-
нии процесса прежде всего из-за трудно преодолимых проб-
лем перемешивания, теплообмена и вообще управления про-
цессом.
Вопросы термостатирования ферментационного процесса, т. е.
подвода или отвода тепла в ходе ферментации, являются очень
острыми в целом ряде производств биотехнологии. В аэроб-
ных условиях, особенно при производстве белка одноклеточных,
микробиологический синтез протекает со значительным тепло-
выделением, поэтому перед технологами возникает проблема от-
ведения значительных количеств тепла из аппаратов большого
объема (сотни и даже тысячи кубометров). Технологические
требования к скорости теплоотвода очень жесткие из-за узкого
температурного оптимума роста культуры, который укладыва-
ется обычно в интервал 2—3°. К сожалению, наиболее приемле-
мый на практике способ теплоотвода — охлаждение оборотной
водой через змеевики, рубашки и другие устройства — ослож-
няется в микробиологической промышленности очень малой раз-
ностью температур между содержимым биореактора (32—34°С
для дрожжей Candida) и охлаждающей водой, которая посту-
пает в теплообменные устройства с градирни с температурой
более 20°С, а в жаркое время года — и еще выше. Это застав-
ляет создавать в биореакторе развитую поверхность теплообме-
на, постоянно бороться со шламообразованием и обрастанием
поверхности теплообменных устройств, а также увеличивать ско-
рости движения жидкостей у обеих поверхностей теплообмен-
ника за счет большого объема прокачиваемой внутри труб или
рубашек охлаждающей воды и интенсивной циркуляции жид-
кости, находящейся в биореакторе.
Своеобразные проблемы возникают при необходимости термо-
статировать аппараты для аэробной твердофазной или анаэроб-
ной ферментации. Из-за отсутствия перемешивания, которое в
ряде случаев недопустимо или технически слишком сложно,
усреднение состава культурной среды в ходе процесса делается
невозможным, а теплообмен крайне неэффективным, поскольку
он в этих случаях лимитируется не теплопередачей через стенку,
21
а теплопроводностью среды, которая очень невелика и не под-
дается регулированию. Это заставляет при твердофазной фер-
ментации термостатировать воздушную среду во всем объеме
аппарата, а при анаэробных процессах либо ограничиваться
пассивным теплообменом, либо использовать специальные до-
вольно сложные аппаратурные решения.
Важнейшей целью технолога при проектировании и эксплуа-
тации ферментационного отделения любого биотехнологического
производства является обеспечение максимально благоприят-
ных условий для роста культуры и ее продуктивности. Это
касается не только рассмотренного поддержания заданной тем-
пературы процесса, но и, в неменьшей степени, состава и свойств
питательной среды. Ранее была подчеркнута необходимость под-
бора составов питательных сред, в наибольшей мере соответ-
ствующих потребностям штамма-продуцента. В непрерывнодей-
ствующих процессах биосинтеза задача технолога сводится, в
конечном итоге, к постоянному поддержанию необходимых кон-
центраций всех питательных веществ (и кислорода) в ходе про-
мышленной эксплуатации установки и дозированному введению
кислоты либо щелочи для рН-статирования системы на заданном
уровне.
Более сложные проблемы возникают при производстве мета-
болитов, когда в ходе периодического процесса культивирова-
ния состав среды, окружающей клетки штамма-продуцента,
должен изменяться в зависимости от фазы роста культуры, ее
состояния и уровня активности. Именно это обстоятельство
затрудняет перевод такого рода производств на непрерывный
режим эксплуатации, да и при периодическом режиме требует
от обслуживающего персонала постоянного контроля и управле-
ния процессом. Следует добавить, что колоссальное многооб-
разие имеющихся в природе, селекционируемых и получаемых
генно-инженерными методами продуцентов, естественно, увели-
чивает количество штаммов, находящихся в промышленной экс-
плуатации, а каждый из них требует учета его своеобразия и
соответствующих технологических решений при создании произ-
водства и в ходе его работы.
Простейшим вариантом управления стадией ферментации в
периодическом режиме является изменение концентрации компо-
нентов среды и ее pH, а также введение некоторых необходимых
добавок по заранее разработанной программе, реализуемой тех-
нологом в каждом цикле ферментации. Такой метод основы-
вается на результатах многочисленных и разносторонних иссле-
дований физиологии продуцента, положенных в основу техно-
логического регламента, обязательного для обслуживающего
персонала. Этот способ управления относительно прост и, что
особенно важно, легко поддается автоматизации. Необходимо
учитывать, однако, что в микробиологическом синтезе жесткая,
раз и навсегда заданная во времени последовательность опе-
раций управления может привести не к положительным, а к
22
отрицательным результатам из-за вариации во времени начала
и конца определенных фаз роста.
Современный подход к управлению микробиологическими про-
цессами основан иа учете состояния культуры как решающего
фактора всего процесса ферментации. Действительно, в силу
целого ряда причин повторные реализации одного и того же
процесса биосинтеза даже при условии полной стандартизации
посевной дозы могут значительно отличаться по конкретному
состоянию клеток продуцента во времени. В реальных условиях
довольно сильно меняется продолжительность лаг-фазы, скорость
достижения клетками экспоненциальной фазы роста и даже их
активность в этой фазе и в последующих фазах биосинтеза. Это
требует не только слежения за брутто-характеристиками био-
технологического процесса, но и постоянного и эффективного
контроля за поведением той реальной популяции клеток, кото-
рая складывается в данной конкретной ферментации в каждом
отдельном аппарате.
Современное состояние микробиологии, как области науки и
практики, не позволяет пока создать быстрый и эффективный
метод полной количественной характеристики состояния клеток
микроорганизмов в данный момент времени в данном объеме
(объекте исследования). Это связано с тем, что такая задача —
мгновенного количественного описания физиологического состоя-
ния клеток — до последнего времени не возникала. Поэтому
культуру характеризовали либо качественно, результатами мик-
роскопического-исследования, проводимого опытным микробиоло-
гом по ряду важнейших признаков, доступных прямому наблю-
дению, либо количественно или полуколичественно по анализу
клеточных структур или компонентов, а также по высевам на
те или иные стандартные среды.
Современный этап развития промышленной биотехнологии тре-
бует создания надежных экспресс-методов количественного изу-
чения свойств живых клеток как продуцента необходимых ве-
ществ. В области производства микробного белка появились
исследования и рекомендации по так называемому морфомет-
рическому контролю культуры, основанные на стандартизован-
ном анализе фотографий клеток, полученных в поле зрения ска-
нирующего микроскопа, с помощью ЭВМ по соответствующей
программе. Хотя этот подход и не нашел пока широкого практи-
ческого применения, его следует рассматривать как шаг вперед
в решении задачи управления. Тем ие менее контроль и управле-
ние периодическим биосинтезом метаболитов основан все еще на
медленных и малоэффективных методах исследования. Настоя-
тельная необходимость использования в первую очередь именно
здесь АСУ ТП заставляет использовать параметры, лишь косвен-
но характеризующие обстановку в биореакторе, а именно тем-
пературу, pH, концентрацию субстрата, кислорода, источников
азота, фосфора и т. п., а также титр клеток, содержание основ-
ного и побочных метаболитов, спор и токсинов и т. д. Наиболее
23
распространенным методом оптимизации периодических техноло-
гических процессов в биотехнологии остается поэтому адапта-
ционная оптимизация, когда с помощью достаточно мощной
ЭВМ контролируется набор необходимых сведений о текущих
параметрах культуральной среды, прогнозируется (на основании
имеющегося формализованного опыта) дальнейший ход процесса
и предпринимается корректировка условий и состава среды для
обеспечения наиболее эффективного хода процесса на последую-
щем этапе.
Во многих случаях условием биотехнологического производ-
ства оказывается необходимость возможно более полного исчер-
пания компонентов питательной среды на стадии ферментации,
с тем чтобы они не попадали на последующие стадии перера-
ботки. Это обстоятельство может быть связано с двумя основ-
ными причинами: дороговизной или дефицитностью субстрата
или его вредным воздействием на качество готового продукта.
Последний случай наиболее характерен для производства дрож-
жей на парафинах, когда выделение остаточных количеств
углеводородов из клеточной массы затруднено, а количество
примесей в конечном продукте жестко нормировано. Это приво-
дит к необходимости оснащать ферментационное оборудование
дополнительными секциями для так называемого дозревания,
когда происходит утилизация клетками тех углеводородов, ко-
торые были запасены в цитоплазме на предыдущих стадиях
роста.
В ряде случаев необходимость полной утилизации компо-
нентов питательной среды связана не только с их высокой
стоимостью и влиянием на качество продукта, но и с затрудне-
ниями, возникающими на стадии выделения и очистки метаболи-
тов как целевых продуктов при одновременном присутствии в
культуральной жидкости каких-либо неутилизированных пита-
тельных веществ. Таким образом, технология ферментации
тесно увязана и оказывает в ряде случаев решающее влияние
на технологическое и аппаратурное оформление последующих
стадий, прежде всего выделения целевого продукта, как это
показано в соответствующих главах (см. ниже).
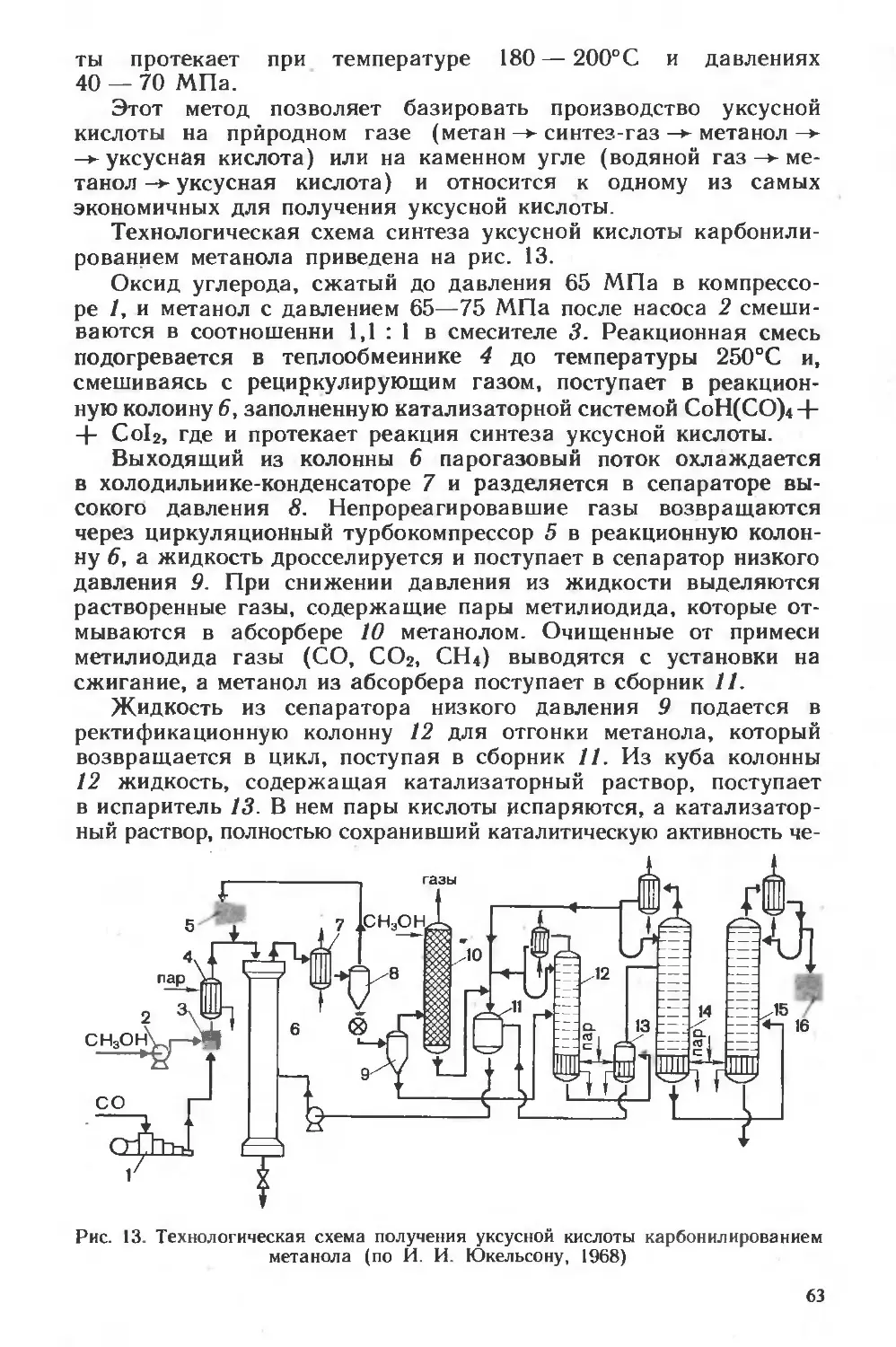
§ 4. Выделение и очистка продуктов
Продукты микробиологического синтеза, будь то клетки, спо-
ры или метаболиты, поступают из биореактора в виде водных су-
спензий или растворов; в обоих случаях характерно невысокое
содержание основного компонента и наличие многих примесных
веществ. В большинстве промышленных производств, использую-
щих клетки микроорганизмов без их предварительной иммоби-
лизации, в качестве первого этапа переработки культуральной
жидкости производят отделение биомассы продуцента от жидкой
фазы, которая далее также подвергается переработке, если она
содержит метаболиты, представляющие практическую ценность.
24
В тех производствах, где целевым продуктом являются клетки
как источник белка, культуральная жидкость (бесклеточная)
не перерабатывается, а подвергается лишь очистке, позволяющей
использовать водную фазу многократно и снизить образование
сточных вод (см. § 6 этой главы).
Технологические приемы, используемые для отделения клеток
от среды, в сильной степени зависят от природы продуцента
и определяются конечной целью производства. Так, при полу-
чении пищевой или кормовой биомассы интерес представляют
лишь сами клетки, все остальное можно, в первом приближении,
рассматривать как отход, поэтому на стадии выделения ста-
вится задача возможно более полного отделения клеток от жид-
кой фазы. Однако и в этом случае технология получения хлебо-
пекаренных дрожжей — сахаромицетов или кормовых дрожжей
на основе углеводов и углеводородов —- сильно различается.
Способность сахаромицетов флотироваться и относительно боль-
шие размеры их клеток позволяют после сгущения биомассы
флотацией отделить клетки фильтрованием на обычных бара-
банных вакуум-фильтрах. В дальнейшем биомассу, снятую с
фильтра, подвергают прессованию и получают продукт с высо-
ким содержанием живых клеток, имеющих хорошую хлебопека-
ренную активность («подъемную силу»).
Несмотря на близость по целому ряду признаков к сахароми-
цетам, дрожжи рода Candida, служащие источником кормового
белка, плохо флотируются и фильтруются; это заставляет резко
изменить методы выделения биомассы. Если для так называемых
гидролизных дрожжей, выращенных на гидролизатах древесины,
еще можно использовать флотацию в качестве первой стадии
выделения, то для дрожжей, растущих на углеводородах, а
также для бактерий-продуцентов белка на основе метана или
метанола первым этапом сгущения культуральной жидкости слу-
жит сепарация. Это объясняется тем, что очень небольшая раз-
ность плотностей биомассы и водного раствора питательных
веществ и метаболитов может быть эффективно использована
для разделения только в поле центробежных сил. Однако и после
нескольких, обычно двух-трех, ступеней сепарации удается до-
вести концентрацию клеток до 75 — 80 г АСВ */л, т. е. отделить
80 — 100% имеющейся воды.
Трудность дальнейшего сгущения биомассы дрожжей и бакте-
рий заставляет обычно отказаться от получения их в чистом виде
и удалять остальную воду путем выпаривания, оставляя все
компоненты жидкой фазы в конечном продукте. Эта цель дости-
гается последовательным применением операций выпарки, как
правило, вакуумной и многокорпусной для экономии энергии, а
далее сушки, чаще всего распылительной. Белковый продукт
называют белково-витаминным концентратом, однако его получе-
* АСВ — абсолютно сухое вещество (технический термин).
25
ние становится следствием не столько экономической или кор-
мовой целесообразности, сколько трудностей, возникающих при
разработке технологии отделения клеток от водной фазы и учета
того обстоятельства, что биомасса перед ее использованием в
качестве источника белка во всех случаях не должна содержать
живых клеток.
К аналогичному приему приходится прибегать и в производ-
стве бактериальных энтомопатогенных препаратов и удобрений.
Конечный продукт — споры и токсины или живые бактерии —
удается получить в активной форме, лишь в принципе отказав-
шись от выделения их из культуральной жидкости: содержимое
биореактора после соответствующей подготовки выпаривают и
далее сушат в условиях, обеспечивающих жизнеспособность
конечного продукта. Таким образом, кроме основных целевых
компонентов в сухом продукте оказываются и все нелетучие
ингредиенты культуральной жидкости, в том числе и неутилизи-
рованный субстрат, что может отразиться иа слеживаемости
и способности продукта к хранению.
Особенно сложные проблемы решаются технологами при
выделении и очистке какого-либо из целевых метаболитов,
например аминокислоты, фермента, антибиотика. Кроме отделе-
ния биомассы продуцента приходится использовать часто очень
сложный и, как правило, не типовой, а индивидуальный (для
данного конкретного продукта) набор стадий, позволяющих вы-
делить вещество достаточной степени чистоты из культураль-
ной жидкости. Обычно в этих случаях принимается решение
пожертвовать биомассой продуцента, накопившейся к концу
ферментации, если биомасса не содержит заметных количеств
целевого вещества. В большинстве конкретных процессов био-
массу отделяют осаждением, добавляя известь или другие твер-
дые компоненты, осадком которых увлекаются клетки или
мицеллий.
Полученная бесклеточная культуральная жидкость перерабаты-.
вается далее одним из подходящих способов. Например, в про-
изводстве ферментных препаратов — это чаще всего экстракция,
осаждение из растворов органическим растворителем (спиртом
и т. п.). или высаливание добавкой сульфата натрия и других
солей с высокой растворимостью в воде. Последующая очистка
ферментов может быть осуществлена повторными операциями
осаждения или даже перекристаллизацией, хотя последняя в
этих производствах применяется относительно редко.
При промышленном биосинтезе аминокислот, напротив, инди-
видуальный продукт можно получить только путем кристалли-
зации из растворов, однако сами растворы получаются, как пра-
вило, лишь с помощью ионного обмена. Комбинируя стадии
пропускания бесклеточной культуральной жидкости, иногда
после предварительного обесцвечивания, например, активными
углями, через колонны, заполненные катионитом и анионитом
с соответствующим подбором pH среды, добиваются осаждения
26
аминокислоты обычно на анионите и далее элюируют ее крепким
раствором аммиака. Из полученного элюата после подготовки
(упаривание, иногда дополнительное обесцвечивание) произво-
дят кристаллизацию целевой аминокислоты, возвращая маточник
в рецикл.
Получение антибиотиков не отличается принципиально от
двух опйсанных примеров, однако в этом случае часто прихо-
дится использовать еще более широкий набор приемов, вклю-
чающий и экстракцию, и ионный обмен, и кристаллизацию.
В последнее время существенный прогресс в выделении про-
дуктов метаболизма из культуральных жидкостей достигнут
благодаря применению мембранной технологии, прежде всего
процессов микрофильтрации и ультрафильтрации через полимер-
ные мембраны со специально подобранным размером пор' Таким
способом удается полностью удалить клетки из культуральных
жидкостей, концентрируя их микрофильтрацией и получая фильт-
рат, составляющий 90% и более (по объему) от исходной жид-
кости и абсолютно не загрязненный клетками. При использо-
вании ультрафильтрации бесклеточная жидкость может быть
отделена от крупных, например белковых, молекул, не проникаю-
щих через мембрану с диаметром пор 5—45 нм. Таким методом
в производстве аминокислот удается добиться значительного освет-
ления раствора, поскольку окрашенные примеси оказываются в
концентрате и не мешают выделению аминокислоты из пер-
меата.
Новые исключительно интересные возможности открываются
при совместном применении растворимых полимеров с функцио-
нальными группами и ультрафильтрационных мембран. Правиль-
ный выбор химической природы растворимого полимера позволя-
ет эффективно и обычно обратимо связывать низкомолекуляр-
ные компоненты раствора (аминокислоты, антибиотики) с поли-
мером. Полученный комплекс легко концентрируется и далее
отмывается от всех несвязанных примесей ультрафильтрацией,
если молекулярная масса полимера подобрана так, чтобы он
не проходил через мембрану. При необходимости комплекс
после концентрирования и промывки может быть разложен
соответствующим реагентом и полимер возвращен на комплек-
сообразование. В ряде случаев оказывается выгодным исполь-
зовать непосредственно комплекс, если входящий в него поли7
мер относительно недорог и неядовит, как это характерно,
например, для карбоксиметилцеллюлозы.
В последние годы своеобразная техническая задача возникла
в связи с необходимостью выделения и глубокой очистки про-
дуктов, находящихся внутри клеток продуцента, полученного
методами генетической инженерии. Примером могут служить
процессы получения интерферонов, гормона роста и т. д. В тако-
го рода производствах вводится стадия разрушения клеточных
оболочек (дезинтеграции биомассы), поскольку целевые веще-
ства не секретируются в культуральную жидкость; обычно для
27
дезинтеграции применяют механические, химические (раствори-
тели типа толуола и т. п.) или комбинированные методы.
Своеобразие рассматриваемых процессов состоит также в
том, что. конечный продукт, находящийся первоначально в очень
сложной смеси растворенных в воде веществ, должен быть полу-
чен со степенью чистоты, определяемой его последующим при-
менением, т. е. с чистотой фармакопейных препаратов. Такая
задача была бы крайне трудной, если бы не возможность исполь-
зования специфических антител. Действительно, промышленное
производство моноклональных антител из культур клеток, полу-
ченных методами клеточной инженерии (гибридомная техника),
оказалось тем биотехнологическим производством, которое дало
гигантский эффект в методах выделения особо чистых биопре-
паратов. Иммобилизация моноклональных антител, .специфиче-
ским антигеном которых является, например, аг-интерферон,
позволяет выделять последний в чистом виде из жидких смесей
любого состава, пропуская их через колонку, в которой целевой
продукт задерживается на твердом носителе, несущем антитело,
а все остальные компоненты раствора, не дающие реакции
«антиген—антитело», проходят неизменными. После промывки
комплекс интерферона с антителом легко разрушается и продукт
получается в чистом виде.
Можно надеяться, что дальнейшее совершенствование стадии
выделения и очистки биотехнологических продуктов, в особен-
ности с использованием современных методов биохимической
и мембранной технологии, приведут в ближайшие годы к рез-
кому упрощению и удешевлению этих стадий при одновременном
.повышении качества и чистоты продуктов.
§ 5. Получение товарных форм препаратов
Последней стадией технологического цикла в микробиологи-
ческом синтезе является получение товарной формы продукта.
В зависимости от принятых на предыдущей стадии — выделе-
ния — решений товарные формы представляют собой либо слож-
ную смесь, содержащую среди прочих некоторое количество
основного вещества, определяемое техническими условиями или
ГОСТом, либо достаточно высоко очищенный препарат, отве-
чающий ряду специальных требований, например асептики.
Как уже отмечалось, трудность разделения многокомпонент-
ных разбавленных растворов и суспензий, являющихся первич-
ным продуктом промышленной биотехнологии, в ряде случаев
заставляет отказаться от выделения основного компонента.
В производстве микробного белка это оправдано еще и потому,
что культуральная жидкость содержит целый ряд ценных пита-
тельных и стимулирующих физиологически активных веществ.
По существующей технологии лишь 60 — 75% жидкой фазы
отделяется при сепарации, остальная вода удаляется путем
выпарки и распылительной сушки. Это дает основайие называть
конечную сухую смесь клеток и метаболитов «белково-витамин-
28
ным концентратом> (БВК), ценность которого в кормопроиз-
водстве определяется, как показала практика животноводства,
не только теми белковыми веществами, которые содержатся в
биомассе микроорганизмов, но и многими примесями типа
витаминов, кофакторов и др.
В отличие от БВК использование такой же простейшей
технологии в других производствах хотя и имеет место, но яв-
ляется вынужденной мерой, не дающей практически никакого
дополнительного эффекта. Это полностью относится к произ-
водству бактериальных энтомопатогенных препаратов, где нали-
чие высушенных вместе с целевым продуктом — живыми клет-
ками и токсинами — побочных продуктов и остатков питатель-
ной смеси снижает содержание действующего начала и не спо-
собствует сохранению активности препарата при транспорти-
ровке и нахождении на складах.
В значительной степени важен этот вопрос.и для производ-
ства основной по тоннажу аминокислоты — лизина: из-за труд-
ности получения кристаллического лизина промышленность вы-
пускает также жидкий и так называемый кормовой концентраты
лизина (ЖКЛ и ККЛ соответственно). В первом случае про-
дуктом является просто упаренйая бесклеточная культуральная
жидкость, так как концентрация сухих веществ в жидкой фазе
повышается от 4—6 до 40%, а во втором — после выпарки к
жидкой фазе добавляют какой-либо кормовой наполнитель,
например отруби, и полученную пасту сушат на ленточных
сушилках. В отличие от быстро портящегося и нетранспорта-
бельного ЖКЛ сухой концентрат может храниться более про-
должительное время и удобен в применении, однако низкое содер-
жание лизина (15—20%) делает его невыгодным при перевозках
на большие расстояния. Понятно, что хотя оба вида концентра-
тов содержат дополнительное, кроме лизина, количество полез-
ных компонентов культуральной жидкости, перешедших в про-
дукт при упаривании и сушке, гораздо эффективнее получать
кристаллический лизин с высоким (>95%) содержанием основ-
ного вещества, а смесь других компонентов культуральной
жидкости, имеющих высокую физиологическую активность,
выпускать отдельно в качестве дополнительного продукта. К со-
жалению, технология получения кристаллической формы лизина
в удобном для хранения (негигроскопичном) виде требует даль-
нейшего совершенствования, что и оправдывает выпуск кон-
центратов с невысоким содержанием основной аминокислоты.
Стадия фасовки рассмотренных комплексных препаратов —
БВК, ККЛ, ферментов технического назначения — заключается
в помещении их в тару (мешки, барабаны и т. п.), размеры и тип
которой определяются потребностями заказчика и свойствами
продукта (его слеживаемостью, гигроскопичностью, стойкостью
к загниванию и т. д.). Для целого ряда биопрепаратов, однако,
этот вопрос решается значительно сложнее, поскольку биохими-
ческие реактивы и особенно медицинские препараты должны
29
иметь заданную степень чистоты и очень часто абсолютную
стерильность. Кроме обычных приемов, направленных на повы-
шение содержания основного вещества до значения, опреде-
ляемого требованием ГОСТ или Фармакопеи СССР, при фасовке
и укупорке продуктов медицинского и, отчасти, пищевого назна-
чения приходится использовать специальную технологию, позво-
ляющую стерилизовать, вещества и подготовленную для них
тару и произвести ее наполнение и укупорку в асептических
условиях. Последнее, как правило, достигается применением спе-
циальных автоматизированных линий фасовки и тщательным хи-
мическим и микробиологическим контролем производства.
В заключение следует отметить, что присутствие в составе
культуральных жидкостей и биомассы микроорганизмов огромно-
го количества ценных биологически активных веществ, зачастую
недоступных для других способов их синтеза, ставит перед
промышленной биотехнологией, проблему развития методов пере-
работки своих продуктов для обеспечения максимально широкой
номенклатуры и гаммы товарных форм. Поясним это на примере
уже упоминавшегося белково-витаминного концентрата, целью
производства которого являются кормовые концентраты, сбалан-
сированные по незаменимым аминокислотам при общем повы-
шении содержания усвояемого белка. Очевидно, что создание
методов выделения белка из биомассы (50—70% ее состава)
позволило бы получить концентрированный целевой продукт, а
другие компоненты клетки — нуклеиновые кислоты, липиды, по-
лисахариды и т. п. — использовать как самостоятельные про-
дукты, зачастую крайне дефицитные и необходимые, но малоцен-
ные для кормопроизводства и даже вредные для него, как, на-
пример, нуклеиновые кислоты. В перспективе можно было бы
поставить вопрос о деполимеризации (гидролизе) белковых мо-
лекул и выпуске необходимых в кормопроизводстве «дефицит-
ных» аминокислот — лизина, треонина, триптофана и других,
с тем чтобы остальные аминокислоты использовать в техниче-
ских целях.
Можно утверждать, что комплексная переработка биомассы
и других продуктов биотехнологии является одним из важней-
ших направлений совершенствования промышленного производ-
ства в этой важной и бурно развивающейся области народного
хозяйства.
$ 6. Экологические аспекты биотехнологии
Развитие промышленной биотехнологии создает ряд экологи-
ческих проблем, которые должны приниматься во внимание при
эксплуатации существующих предприятий и создании новых
производств. Особенностью микробиологического синтеза явля-
ется отсутствие или очень небольшое* образование твердых от-
ходов при одновременном использовании больших объемов воды
и воздуха (в аэробных процессах). На любом промышленном
предприятии в биотехнологии постоянно решаются две взаимо-
30
связанные задачи: устранение путей попадания посторонней
микрофлоры внутрь биореактора (так называемая промышлен-
ная асептика) и исключение возможности попадания живых
клеток микроорганизмов-продуцентов в воздушные н водные
выбросы, т. е. охрана окружающей среды.
Хотя все крупные микробиологические производства исполь-
зуют только непатогенные штаммы микроорганизмов, попадание
клеток в живом и даже убитом виде в воздушную среду неже-
лательно, так как может вызвать аллергические реакции у насе-
ления из-за наличия в клетках белка, чужеродного для человека.
Поэтому наряду с входными фильтрами грубой и тонкой очистки
воздуха, подаваемого в биореактор, иа производствах предусмот-
рена мокрая очистка технологического воздуха, выходящего из
всех аппаратов. В особо ответственных случаях для устранения
примесей клеток в отходящих газах (например, после сушилок)
их применяют повторно, направляя в топочные устройства, где
гарантируется сгорание всех микробиологических объектов, на-
ходящихся в газовом потоке.
Сложным и ответственным элементом современного биотехно-
логического предприятия является система водоиспользования,
которая . в этой отрасли оказывается гораздо сложнее, чем,
скажем, в химической промышленности. Дело в том, что кроме
оборотного водоснабжения, необходимого для поддержания теп-
лового режима в биореакторах, микробиологический синтез
требует огромных количеств технологической воды для приготов-
ления питательных сред (в случае глубинного культивирования)
и всякого рода операций промывки, элюирования и т. д.
Микробиологические процессы протекают, как правило, в ин-
тервале температур 30—40°С, поэтому темплосъем крайне за-
трудняется малой разностью температур между средой в биоре-
акторе и охлаждающей водой, которая в свою очередь охлажда-
ется затем на градирнях. В жаркие периоды года разность тем-
ператур воды внутри биореактора и в охлаждающей системе
составляет иногда . всего несколько градусов, что заставляет
резко увеличивать поверхности теплообмена в аппаратах и
прокачивать через рубашки, змеевики и т. п. огромное коли-
чество оборотной воды. Понятно, что сброс охлаждающей воды
без очистки в водоемы невозможен, так как через неплотности
в конструктивных элементах биореактора всегда возможно попа-
дание некоторого количества клеток и культуральной жидкости в
хладоагент. Поэтому поток оборотной воды замкнут в цикл, что
исключает ее попадание в окружающий водный бассейн.
Значительно труднее использовать водооборот для технологи-
ческой воды, составляющей среду в ферментерах глубинного
типа, а также для всякого рода промывных вод. Этот тип водо-
потоков содержит, как правило, большое количество растворен-
ных веществ и клеток, причем прямой возврат отделенной,
например, на стадии сепарации воды вновь в биореактор часто
оказывается невозможным, так как этот поток содержит при-
31
меси, ингибирующие рост или снижающие продуктивность куль-
туры. В наиболее крупнотоннажном производстве БВК вода со
стадии сепарации лишь частично может быть возвращена
непосредственно в ферментер, основная ее часть должна пройти
биологическую очистку активным илом. Как уже отмечалось,
большая масса технологической воды в этом процессе испа-
ряется на стадиях выпарки и сушки, что крайне неблагоприятно
отражается на энергетике производства, делая его очень энерго-
емким.
Аналогичные проблемы возникают и в целом ряде других
биотехнологических производств, которые вынуждены иметь
мощную систему биологической водоочистки для повторного
применения технологической воды или ее сброса в водоемы.
Значительный прогресс в этом направлении может быть достиг-
нут использованием мембранных методов разделения технологи-
ческих водных потоков, что позволило бы отделить ингибирую-
щие примеси и возвращать значительную часть водной среды
вновь на стадию культивирования. Большого эффекта можно
ожидать и от разработки так называемых метаболически зам-
кнутых производств, в которых технологическая вода, отделяе-
мая nocjie культивирования одного типа микроорганизмов,
служит основой питательной среды в каком-либо другом процес-
се, продуцент которого не ингибируется, а, возможно, даже
активируется метаболитами предыдущей стадии.
[лава
"1 СЫРЬЕВАЯ БАЗА
ПРОМЫШЛЕННОЙ
и БИОТЕХНОЛОГИИ
Питательные среды для культивирования микроорганизмов
содержат большое количество необходимых компонентов, основ-
ным из которых обычно считают тот, который служит микро-
организмам источником углерода н энергии. Это вещество или
смесь веществ называют субстратом, а все остальные — вспо-
могательными веществами. Поэтому при рассмотрении сырье-
вой базы промышленного микробиологического синтеза оцени-
вают доступность, методы получения, свойства и необходимые
качественные характеристики тех продуктов или отходов род-
ственных отраслей промышленности, которые в биотехнологии
употребляются как субстрат или многокомпонентная смесь,
содержащая необходимый клеткам субстрат и, возможно, другие
полезные или балластные компоненты.
Вопросы, связанные с промышленным производством всех
продуктов, дающих биотехнологии источники углерода и энергии
для роста микроорганизмов н биосинтеза, в этой главе подробно
рассматриваться не будут. Здесь будут кратко изложены основы
технологии наиболее важных веществ, в первую очередь субст-
ратов для биосинтеза микробного белка. К ним относятся/пара-
финовые углеводороды нормального строения^иетанолЗ этанол,
метан как компонент природного газа и ^углеводы различного
происхождения, прежде всего гидролизаты растительного сырья.
Белок одноклеточных можно получать н_ с утилизацией неко-
торых отходов целлюлозно-бумажного производства, химической
и нефтехимической промышленности, которые, однако, не приме-
няются в других процессах микробиологического синтеза.
Не ограничиваясь только производством белка, будут рас-
смотрены некоторые виды сырья, идущие для биосинтеза мета-
болитов. В "-‘тих производствах можно использовать широкую
гамму сыр’ ых источников синтетического происхождения и
особенно о.'оцоз сельского хозяйства и пищевой промышлен-
ности. Вкли-'цш в рассмотрение кроме широкоупотребляемых
в биотехнол ,’, и кганола и гидролизатов древесины также ук-
зз
сусная кислота и меласса — сырье для биосинтеза аминокислот
и целого ряда других биологически активных веществ. Обсуж-
дение технологии таких веществ, как пшеничная или соевая
мука, крахмал, отруби, кукурузный экстракт и т. п., выходит за
рамки настоящего пособия, так как этому вопросу уделено много
внимания в специальных руководствах пищевой промышлен-
ности.
§ 1. Получение углеводородного сырья
для промышленной биотехнологии
Источником—углеводородов в промышленном микробиологи-
ческом синтезе являются продукты переработки нефти, в первую
очередь дизельная фракция прямой перегонки, содержащая в
своем составе нормальные парафиновые углеводороды, структу-
ра и молекулярная масса которых оптимальна с точки зрения
их потребления дрожжами. В одном из вариантов получения
белка одноклёточныЗГсырьем служит непосредственно дизельная
фракция, из которой дрожжи утилизируют н-алканы, обеспечи-
вая получение низкозастывающего, так называемого «зимнего»
дизельного топлива. Более распространен, однако, вариант, по
которому депарафинизация ведется обычными методами, а жид-
кие парафины очищают далее с тем, чтобы они имели оптималь-
ные состав н свойства с точки зрения микробиологического
синтеза.
Получение нефтяных дистиллятов прямой перегонкой нефти.
Главным источником жидких парафинов и дизельной фракции,
используемых в микробиологической -промышленности, является
нефть, которая состоит главным образом из парафиновых, нафте-
новых и ароматических углеводородов с большей или меньшей
примесью кислородсодержащих и сернистых соединений. В зависи-
мости от месторождения соотношение в нефти различных клас-
сов углеводородов варьирует. В наиболее распространенных
нефтях содержится 50—60% нафтенов, 20—30% углеводородов
с открытой цепью и 15—30% ароматических. Каждый класс
углеводородов представлен в нефти многочисленными гомоло-
гами и изомерами. Поэтому при переработке нефти получают
фракции, представляющие собой сложные смеси углеводородов.
Перед перегонкой сырая нефть, содержащая до 1% (по
массе) воды и до 1800 мг/л хлоридов, обязательно подвергается
обессоливанию и обезвоживанию, это снижает содержание воды
в нефти до 0,1% (по массе) и хлоридов до 3—4 мг/л. После
этого нефть подается для перегонки на атмосферно-вакуумную
трубчатую (АВТ) установку, технологическая схема которой
приведена на рис. 1.
Поток нефти с давлением 0,3—0,4 МПа проходит предвари-
тельные теплообменники-рекуператоры /, где подогревается до
температуры 210—230°С и поступает в отбензинивающую колон-
ну 2. В этой колонне из нефти выделяется легкая бензиновая
34
Рис. 1. Технологическая схема получения нефтяных дистиллятов (по Н. Н Ле-
бедеву, 1975)
фракция, которая конденсируется и собирается в емкость 3.
Из нее часть легкой фракции возвращается на орошение ко-
лонны 2, а часть подается в стабилизационную колонну 7.
Из этой же емкости 3 выделившийся из нефти растворенный
газ поступает на компримирование и затем на газофракциони-
рующую установку (ГФУ).
Полуотбензиненная нефть с низа колонны 2 направляется
в трубчатую печь 11, где нагревается до 320—360°С. Выходя-
щий из трубчатой печи поток разделяется на две части: одна
(15—20%) часть возвращается в виде «горячей струи» в отбен-
зинивающую колонну 2, сообщая дополнительное количество
тепла, необходимое для ректификации; другая часть потока
поступает в атмосферную ректификационную колонну 5, где при
давлении 60—100 КПа происходит разделение нефти на несколь-
ко фракций:
— с верха колонны 5 в паровой фазе выходит тяжелый бен-
зин, который конденсируется в холодильнике-конденсаторе, по-
ступает в сборную емкость 4, из которой частично возвраща-
ется на орошение колонны 5, а частично направляется в стаби-
лизационную колонну 7;
— в качестве боковых продуктов выводятся керосиновая и
дизельная фракции, которые направляются в соответствующие
секции отпарной колонны 6.
В отпарной колонне 6 с помощью острого пара дополнительно
удаляются легкие фракции, которые возвращаются в атмосфер-
ную колонну 5. После секций отпарной колонны 6 керосиновая
и дизельная фракции через соответствующие теплообменники-
утилизаторы выводятся с установки.
С низа атмосферной колонны 5 выходит мазут с температу-
рой 300—350°С, который нагревается в трубчатой печи 10 до
35
400—420°С и поступает в колонну вакуумной перегонки 8,
работающую при давлении 4—10 КПа. В ней мазут разделяется
на вакуумные дистилляты и гудрон, которые в виде бокового
продукта и кубового остатка выходят из колонны 8 н через
теплообменники-утилизаторы / выводятся с установки. Сверху
вакуумной колонны 8 пароэжекторным насосом 9 отсасываются
пары воды, воздух, газы разложения и некоторое количество
легких нефтепродуктов, по температуре кипения близких к ди-
зельной фракции.
Для снижения температуры нижней части колонн 5 и 8 и бо-
лее полного извлечения дистиллятных фракций в низ колонн
подается острый водяной пар. Избыточная теплота в колон-
нах 5, 8 снимается циркулирующим орошением.
В стабилизационной колонне 7 при давлении 0,7—1,1 МПа
получают сверху сжиженный углеводородный газ, поступающий
на ГФУ, а снизу стабильный бензин, не содержащий углеводо-
родов Сз—С4, который затем подается на вторичную разгонку.
После разгонки нефти на АВТ получается ряд продуктов в
следующем количестве (в процентах от исходного количества
нефти) и выкипающих в следующем температурном диапа-
зоне (°C):
Продукты Количество Температура
Сжиженный газ . 1,0—1.2 до 50
Бензиновая фракция . 12—18 50—140
Керосиновая фракции 16—18 120—240
Дизельная фракция . 17—21 200—360
Вакуумный дистиллят 22—23 350—500
Гудрон . 20—30 свыше 500
Наиболее экономичным и доступным сырьем для производства
кормовой биомассы могут служить дизельные фракции парафи-
нистой и высокопарафинистой нефти, содержащие не менее
15% н-алканов. Более низкое содержание «-парафинов делает
процесс прямого получения биомассы неэффективным и требует
предварительного выделения н-алканов для их последующего
использования.
Микробиологическая депарафинизация дизельной фракции
(нефтяных дистиллятов) позволяет осуществить комплексную
переработку сырья, получая одновременно три целевых продук-
та: кормовую биомассу, технический биожир, компонент дизель-
ного топлива с пониженной температурой застывания.
Получение н-парафинов для культивирования микроорганиз-
мов переработкой нефтяных дистиллятов. Для получения кормо-
вой биомассы широко используются очищенные жидкие парафи-
ны с температурой кипения от 180 до 350°С следующего состава
(в %):
н-Алканы ... 87—98
Ароматические углеводороды . не более 0,5
Сера . .................. » » 0,05
Выделение парафинов с температурой плавления менее 30°С
(жидкие парафины) можно осуществлять несколькими спосо-
36
бами. При получении н-алканов с длиной цепи Сю—С20 как
сырья для микробиологической промышленности используют ме-
тоды карбамидной депарафинизации дизельной фракции или
адсорбционного извлечения жидких парафинов. Одновременно
с выделением парафинов в обоих случаях получают низко-
застывающее дизельное топливо (депарафинизат, нормализат)
с температурой застывания от —35 до —45°С.
Получение н-алканов карбамидной депарафинизацией ди-
зельной фракции. Выделение н-парафинов из дизельной фракции
основано на их способности образовывать с мочевиной (карба-
мидом) легко разлагаемые кристаллические соединения по
реакции
10—40°С
nCO(NH2)2 + RH RN-nCO(NH2)2 (1)
70—100°С
Технологическая схема этого процесса с применением раство-
рителя (метиленхлорида) для поддержания оптимальной темпе-
ратуры и лучшей грануляции комплекса приведена на рис. 2.
В кристаллизатор / подают равные объемы нефтяных дистил-
лятов, содержащих до 20—30% н-парафинов, метиленхлорида и
насыщенного при 70—80°С водного раствора карбамида. Кри-
сталлы образуются очень быстро, а тепло кристаллизации сни-
мается легкокипящим метиленхлоридом. Его пары конденсиру-
ются в конденсаторе 2 и растворитель возвращается в кристал-
лизатор /. Благодаря этому циклу в кристаллизаторе 1 поддер-
живается температура 35—40°С.
Образовавшаяся масса .направляется на барабанный
фильтр 12, осадок промывается-метиленхлоридом. Кристаллы с
фильтра 12 шнеком 11 направляются в подогреватель 10, где
они обрабатываются острым паром или горячей водой для раз-
ложения комплекса. Одновременно из подогревателя 10 отго-
няется метиленхлорид, унесенный с кристаллами, который затем
Рис. 2. Технологическая схема карбамидной депарафинизации
нефтяных дистиллятов (по Н. Н. Лебедеву, 1975)
37
конденсируется в холодильнике 4 и стекает в сборник метилен-
хлорида 9. Жидкость из подогревателя 10 отстаивается в от-
стойнике 8 (или разделяется на сепараторах), разделяясь на
два слоя: верхний — парафин и нижний — водный раствор карба-
мида. Горячий парафин из отстойника 8 и депарафинизат из
фильтра 12 поступают соответственно в ректификационные
колонны 7 и 6, где от них отгоняется растворитель. Пары раство-
рителя конденсируются в конденсаторе 5 и метиленхлорид сте-
кает в сборник 9. Жидкие парафины и депарафинизат выво-
дятся из кубов колонн 7 и 6. Водный раствор карбамида из от-
стойника 8 после «укрепления» в выпарном аппарате 3, где его
доводят до насыщенного состояния при 70—80°С, снова подают
в кристаллизатор.
Полученные карбамидным способом жидкие парафины содер-
жат до 85—92% н-алканов и до 5% алкилароматических соеди-
нений.
Снижение содержания ароматических углеводородов до тре-
бований микробиологической промышленности (не более 0,5%)
достигается с помощью дополнительной очистки серной кислотой
или олеумом. После такой очистки содержание ароматических
углеводородов составляет 0,2—0,4% и эти парафины можно
использовать при получении кормовой биомассы.
Адсорбционное извлечение жидких парафинов. Выделение
жидких парафинов фракции Сю—Сю из нефтяных дистиллятов
основано на способности цеолитов избирательно сорбировать
вещества с определенными размерами и конфигурацией молекул.
Процесс состоит из двух стадий: адсорбция н-алканов на цеоли-
тах (с размером пор до 0,5 нм) и их десорбции из пор цеолита.
Десорбцию можно проводить с помощью снижения давления,
повышения температуры или вытеснением другим веществом
(«-пентаном, н-гексаном, аммиаком и т. д).
Технологическая схема выделения н-алканов на неоли-
тах с использованием вытеснительной десорбции приведена
на рис. 3.
Подаваемая на очистку нефтяная фракция (температура ки-
пения 200—320°С) подвергается предварительной сушке в ад-
сорберах / или 2, работающих по сменно-циклическому гра-
фику для обеспечения регенерации адсорбента. После осушки
сырье смешивается с газом-носителем (азот или водородсодер-
жащий газ), подогревается в теплообменнике-утилизаторе 12
и после испарения н' нагрева в трубчатой печи 3 до температуры
150—200°С поступает в адсорбер 4, где и происходит адсорбция
н-алканов. Адсорберы 4, 5, 6 работают по сменно-циклическому
графику: адсорбция, продувка, десорбция. На этом рисунке по-
казан случай, когда адсорбер 4 работает по графику адсорбции,
5 — по графику продувки и 6 — десорбции н-парафинов.
Выходящую из адсорбера 4 смесь охлаждают в теплооб-
меннике-утилизаторе 12 и холодильнике 13, а в сепараторе 14
отделяют депарафинизированный конденсат от газа-носителя.
38
Рис. 3. Технологическаи схема адсорбционного извлечения жидких пара-
финов (по Н. Н. Лебедеву, 1975)
Депарафинизированная дизельная фракция с температурой
застывания (—35) — (—45) °C выводится с установки. Отделен-
ный в сепараторе 14 газ-носитель возвращается в цикл на сме-
шение с исходной фракцией.
После окончания адсорбции производится продувка адсорбе-
ра аммиаком с температурой 200°С (в адсорбере 5), при которой
из свободного объема адсорбера удаляются компоненты не всту-
пившего в реакцию сырья, а с внешней поверхности гранул
цеолита — нёселективно адсорбированные углеводороды. Проду-
вочный продукт проходит холодильник 10, в сепараторе-отдели-
теле 9 отделяется от аммиака и объединяется с депарафиниза-
том, уходящим с установки.
После продувки начинается стадия десорбции (в десорбере 6).
В адсорбер 6 подается аммиак с температурой 200°С; проходя
через цеолит, он десорбирует н-парафины из пор. Смесь «-алка-
нов с аммиаком выходит из адсорбера 6, охлаждается в холо-
дильнике 11, жидкие парафины при этом конденсируются и
затем отделяются от аммиака в сепараторе 8. «-Парафины вы-
водятся с установки, а аммиак из сепараторов 9 и 8 объединя-
ется в один поток, нагревается в трубчатой печи 7 и возвраща-
ется в процесс.
Полученные жидкие парафины имеют следующий состав
(в %):
н-Алканы............................... ие менее 98
^Ароматические углеводороды . . » более 0,2
Сера ............... » » 0.J3 5
Таким образом, полученные жидкие парафины пригодны для
дальнейшей микробиологической переработки без дополнитель-
ной очистки и могут быть поданы на стадию культивирования
микроорганизмов.
39
§ 2. Получение этилового спирта
Основным _ источником этанола является _ нефтехимический
синтез, использующий реакцию гидратации этилена в присут-
ствии различных катализаторов. Известны также промышлен-
ные способы получения так называемого гидролизного спирта
сбраживанием гексоз, содержащихся в гидролизатах расти-
тельного сырья, и высококачественного «пищевого» этанола,
образующегося в процессе брожения моносахаридов при фермен-
тативном гидролизе крахмала. Процессы брожения описаны в
специальных руководствах; здесь будет рассмотрена лишь тех-
нология получения синтетического этилового спирта.
Первый из способов производства синтетического этанола ос-
нован на сернокислотной гидратации этилена по реакции
СН2 = СН2 4- H2SO4 СНз - CH2OSO2OH
С2Н5ОН 4- H2SO4 (2)
Другим методом получения этанола является прямая гидра-
тация этилена водяным паром в присутствии катализатора —
фосфорной кислоты на носителе:
СН2 = СН2 4- Н2О ”зРС\сгН5ОН (3)
В промышленности существуют оба эти процесса получения
этанола, поэтому каждый из них будет рассмотрен отдельно.
Получение этанола сернокислотной гидратацией этилена.
Процесс осуществляется в две стадии:
— абсорбция этилена концентрированной серной кислотой с
образованием моно- и ди алкилсульфатов:
СН2 = СН2 4- H2SO4 СНз - CH2OSO2OH —+-- »
+ЯН‘ (СНз—CH2)2SO4 (4)
— гидролиз полученных алкилсульфатов водой:
(C2H5)2SO4 4- Н2О C2H5OSO2OH 4- С2Н5ОН
2СНз—СН2ОН 4- H2SO4 (5)
В качестве побочного продукта образуется диэтиловый эфир.
Технологическая схема процесса сернокислотной гидратации
этилена приведена на рис. 4.
Углеводородная фракция, содержащая 50—60% этилена,
40—48 этана и до 1 % примесей (газы пиролиза) под давлением
до 2,5 МПа подается в тарельчатый реактор-абсорбер 1. На верх-
ние тарелки этого реактора подается концентрированная серная
кислота в соотношении H2SO4:C2H4 = 1,0:1,2—1,4, что сокраща-
ет расход серной кислоты. В абсорбере 1 поддерживается тем-
40
в атмосферу
Рис. 4. Технологическая схема сернокислотной гидратации этилена (по Н. Н. Ле-
бедеву, 1975)
пература 65—75°С. Теплота абсорбции снимается охлаждаю-
щей водой, циркулирующей в трубчатых теплообменниках, уста-
новленных под каждой тарелкой в зоне жидкости (на схеме
показан только один). Газовый поток для отделения от брызг
проходит через слой насадки, расположенной вверху абсорбера /,
дросселируется до давления 0,2—0,3 МПа, поступает на очистку
и нейтрализацию в скуббер 13 и направляется на пиролиз. В от-
ходящем газе содержится более 90% этана и 2—4 этилена.
Раствор, содержащий моно- и диэтилсульфаты и немного
свободной серной кислоты, после абсорбера 1 охлаждается в
холодильнике 2 до 45—55°С, дросселируется до давления 0,6—
0,7 МПа, смешивается в смесителе 3 с оборотной водой и посту-
пает в гидролизер 4. Гидролиз этилсульфатов происходит при
давлении 0,2—0,3 МПа и температуре 95—100°С. В результате
снижения давления и увеличения температуры из раствора
выделяются растворенные газы, которые поступают в скруб-
бер 13.
Жидкость, выходящая снизу гидролизера 4, содержит эта-
нол, воду, частично непревращенные этилсульфаты и немного
примесей. Этот поток поступает на верхние тарелки отпарной
колонны 5, а вниз колонны подается острый пар. В этой колонне
завершается гидролиз этилсульфатов. Одновременно из жидкости
отгоняются этанол, эфир и часть водяных паров. Отходящую
из колонны 5 парогазовую смесь подают в нейтрализационно-
отпарную колонну 6, обогреваемую острым паром, где обраба-
тывают водным раствором щелочи NaOH. Нейтрализованная
парогазовая смесь проходит холодильник-конденсатор 7 и посту-
пает в сепаратор 8 для отделения растврренных газов, которые
после очистки в скруббере 9 направляются на сжигание. После
сепаратора 8 спирт-сырец, содержащий 30—40% этанола,
поступает в сборник 12.
Для получения товарного продукта спирт-сырец подвергают
двухступенчатой ректификации в колоннах 10 и 11. Сверху ко-
лонны 11 получают товарный продукт с содержанием этано-
41
ла 96%; выход этанола от этилена достигает 90%. Оставшаяся
после гидролиза серная кислота с концентрацией 45—50% от-
водится из отпарной колонны 5 и используется для получения
удобрений (сульфата аммония). Полученный этанол в виде
азеотропа с водой (96% этанола и 4% воды) с минимальным
содержанием ингибирующих примесей (не более 0,005%) явля-
ется готовым субстратом для культивирования микроорганиз-
мов.
Прямая гидратация этилена в этанол. Образование этанола
из этилена и воды с использованием в качестве катализатора
фосфорной кислоты, нанесенной на инертный носитель, про-
текает по обратимой реакции (3). Поскольку разбавление
этилена инертными примесями неблагоприятно сказывается на
равновесии и скорости этой реакции, исходный газ должен
содержать не менее 97—99% этилена. При рециркуляции газа
постепенно накапливаются инертные примеси: предельно допус-
тимой считается концентрация этилена в рециркулирующем
газе не менее 85%, для ее поддержания проводят отдувку части
рециркулирующего газа.
Фактическая степень конверсии этилена за один проход
составляет около 60% от равновесной, т. е. ~4—5%, что обеспе-
чивает после конденсации паров получение водного раствора,
содержащего до 15% этанола. Использование рециркуляции
газовой смеси позволяет повысить общий выход спирта до 95%
по этилену.
Процесс гидратации проводят при давлении 7—8 МПа,
температуре 280—300°С и мольном соотношении НгО:С2Н =
= (0,6—0,7): 1,0. Технологическая схема процесса приведена
на рис. 5.
Очищенный этилен (чистота 97—99%), сжатый компрес-
сором 1 до давления 7—8 МПа, проходит холодильник и масло-
отделитель, где очищается от масла. В смесителе 2 происходит
смешение свежего этилена с циркуляционным газом, доведенным
до рабочего давления в турбокомпрессоре 3. Газовый поток
смешивают с водным конденсатом в смесителе инжекторного
Рис. 5. Технологическая схема получения этанола прямой гидратацией этилена
(по Н. Н. Лебедеву, 1975)
42
типа 4 в соотношении CabUrHaO = (1,4—1,6):1,0 и смесь нагре-
вают до 200°С в теплообменнике-утилизаторе 5 отходящими
реакционными газами. Затем смесь дополнительно подогре-
вается до 290°С в змеевиках трубчатой печи 17 и поступает в
гидрататор 6, представляющий собой полую колонну, корпус и
днище которой выложены листами красной меди во избежание
коррозии. Катализатор представляет собой носитель (силикагель,
алюмосиликат), пропитанный фосфорной кислотой и содержа-
щий до 35% свободной Н3РО4; он насыпан высоким слоем на
опорный перфорированный конус. Ввиду малой степени кон-
версии, небольшого теплового эффекта реакции (3) и высокой
объемной скорости (~2000 ч-1) в аппарате 6 отсутствуют
устройства для дополнительного теплосъема.
Выходящие из реактора 6 реакционные газы, содержащие
этилен, пары воды, спирта, эфира, других примесей и небольшое
количество фосфорной кислоты, для предотвращения коррозии
аппаратуры нейтрализуют в нейтрализаторе 15, впрыскивая в
газопаровую смесь водный раствор щелочи NaOH. Образовав-
шиеся фосфаты отделяются в солеотделителе 16. После этого
реакционные газы проходят тgплooбмeнник-yтилизaтop 5, холо-
дильник 7 и поступают в сепаратор высокого давления 8, где
от газов отделяется конденсат, образовавшийся при охлаждении.
Парогазовая смесь из сепаратора 8 содержит значительное коли-
чество спирта и для его улавливания направляется в абсорб-
ционную колонну 10, орошаемую водой. Отходящие с верха ко-
лонны 10 циркуляционные газы направляются в циркуляцион-
ный турбокомпрессор 3 и снова подаются на гидратацию. Часть
рециркулирующего газа выводится из системы для поддержания
содержания этилена на уровне 85% и направляется на сжигание.
Водный конденсат из сепаратора высокого давления 8 и вод-
ный раствор из абсорбера 10 дросселируются до давления
0,5—0,6 МПа и поступают в сепаратор низкого давления 9, где
отделяются газы, выделившиеся из жидкости при снижении
давления. Полученный водный раствор, содержащий до 15%
этанола, из сепаратора 9 стекает в сборник этанола-сырца 13.
Для получения товарного продукта этанол-сырец подается
на ректификацию. Для получения чистого спирта-ректификата
используется двухколонная ректификация в аппаратах 11 и 12.
В ректификационной колонне 11 отгоняются легколетучие при-
меси (диэтиловый эфир, ацетальдегид), а сверху колонны 12
получают очищенный этиловый спирт в виде азеотропа с водой.
Выходящая из куба колонны 12 вода, содержащая высоко-
кипящие и нелетучие примеси, проходит очистку от солей в уста-
новке 14 и возвращается в цикл.
Полученный азеотроп этанола с водой является товарным
продуктом с содержанием ингибирующих примесей не более
0,007% и может с успехом использоваться в микробиологической
промышленности в качестве субстрата при культивировании
микроорганизмов как кормового, так и пищевого назначения.
43
§ 3. Сырье для культивирования
метилотрофов
Одним из перспективных процессов биотехнологии является
промышленное культивирование метилотрофов, которые уже се-
годня рассматриваются как важный источник белка однокле-
точных, а в дальнейшем, очевидно, могут найти еще более
широкое применение. Известно, что метилотрофы способны ути-
лизировать так называемые «одноуглеродные» соединения, т. е.
производные метана — метанол, формальдегид, метиламины
и т. д. Важнейшим из этих веществ является метанол, поскольку
это один из крупнотоннажных продуктов химической промышлен-
ности и, что особенно важно, может быть получен как из нефте-
химического (метан), так и из углехимического (кокс) сырья.
Ряд авторов высказывают точку зрения, что метанол является
своего рода «веществом будущего», так как позволяет в прин-
ципе перестроить многие нефтехимические процессы, основан-
ные сейчас на использовании все более дефицитного этилена.
В настоящем разделе кратко рассмотрена технология полу-
чения синтез-газа и его дальнейшего превращения в метанол
по реакции
СО 4- 2Н2 ^СНзОН (6)
которая протекает при катализе рядом оксидов (цинка, меди,
хрома и т. д.) и позволяет в силу своей высокой селективности
получать метанол с концентрацией выше 99,9% и содержанием
нежелательных для биотехнологии примесей не более 0,005%,
что вполне допустимо.
Получение синтез-газа. Раньше монооксид углерода (СО)
в виде смеси с другими газами (водяной газ) получали из камен-
ноугольного кокса по реакциям:
2С + О2 2СО (7)
С + Н2О 4- Н2 (8)
В этом случае твердое топливо подвергается газификации
при атмосферном или повышенном давлении. В качестве окисли-
теля используют водяной пар (паровое дутье) или смесь водя-
ного пара с кислородом (парокислородное дутьеС Получаемый
в результате водяной газ имел соотношение СО:Н2 <2 2, что
делало необходимым перед синтезом метанола регулировать
состав газа путем конверсии СО водяным паром по реакции
СО 4- Н2О СО2 4- Н2 (9)
с последующей очисткой конвертируемого газа от диоксида
углерода.
Ввиду дефицитности кокса и несовершенства технологии его
газификации эти методы были вытеснены другими, основан-
ными на переработке природного газа.
44
о
Рис. 6. Технологическая схема производства синтез-газа из твердого топлива
В настоящее время в связи с возникшими энергетическими
проблемами вновь возрос интерес к газификации каменного угля
с переработкой его через монооксид углерода в синтетические
продукты и моторное топливо. Процесс газификации может
быть как периодическим, так и непрерывным. Для получения
синтез-газа с соотношением СО:Нг=1,5—1,9 из крупнокуско-
вого топлива применяются печи с циркуляцией теплоносителя,
позволяющие проводить процесс газификации в непрерывном
режиме. Он нашел применение на заводах по получению искус-
ственного жидкого топлива.
Технологическая схема производства синтез-газа в печах с
обогревом высокотемпературной парогазовой смесью непрерыв-
ным методом приведена'на рис. 6.
Крупнокусковое топливо (60X40 мм) с влажностью около 15%
подается из бункера 1 в четыре вертикальные шахты печи 2
через специальное загрузочное устройство. Топливо опускается
вниз и подвергается последовательна процессам сушки (100—
200°С), полукоксования (200—700°С), газификации (700—
1000°С) и охлаждения.
В зону газификации подают высокотемпературную парога-
зовую смесь (~ на 1/3 высоты печи снизу) с температурой
1100—1200°С. При взаимодействии водяного пара с углеродом
образуется синтез-газ по реакции (8), который в конце реакцион-
ной зоны (~ 1 /2 высоты печи) с температурой 750—780°С
частично выводится из печи и направляется в конденсационно-
охладительную систему. Оставшаяся часть парогазовой смеси
(циркулирующий газ-теплоноситель) проходит в верхнюю часть
печи (выше отвода синтез-газа), где за счет тепла парогазовой
смеси происходят сухая перегонка и подсушка топлива. С верха
печи с температурой 100—120°С выходит смесь синтез-газа и
45
газов полукоксования, которую с помощью газодувки 12 направ-
ляют через пылеотделитель 10 и смолоотделитель 11 в регене-
ратор 13. Одновременно в регенератор 13 вводят первичный
водяной пар, который смешивается с парогазовой смесью, и вся
смесь нагревается в регенераторе до 1150—1200°С. При этой
температуре происходит термическое разложение углеводородов,
содержащихся в полукоксовом газе, что приближает состав
циркуляционного газа-носителя при выходе из регенератора к
составу синтез-газа. Из регенератора 13 парогазовая смесь вновь
поступает в печь 2.
Сырой синтез-газ выходит из печи 2, проходит пылеотдели-
тель 3, где очищается от крупной пыли, котел-утилизатор 4,
в котором охлаждается до 250°С, скруббер 5, где охлаждается
до 40°С, очищается от пыли и смолы в дезинтеграторе (центро-
бежном пылеотделителе) 6 и каплеуловителе 7. Из каплеулови-
теля 7 синтез-газ с температурой 30—35°С газодувкой 8 подается
на установку синтеза метанола, где его предварительно очи-
щают от сернистых соединений.
В котле-утилизаторе 4 получают пар, который используют на
этой же установке.
Поскольку в печи 2 для получения синтез-газа расходуется
только часть топлива, то оставшаяся часть его после охлаждения
в нижней части печи 2 выгружается в вагонетку 9 и направля-
ется на газификацию в газогенератор для получения отопитель-
ного газа (на схеме не показан). Отопительный газ сжигают
в топке одного из двух регенераторов 13, разогревая его, а в дру-
гом нагревают парогазовую смесь. Переключение регенерато-
ров 13 происходит автоматически через каждые 20 мин.
На установке получают синтез-газ в количестве до 30 000 нм3/ч
следующего состава (% по объему):
Моноокснд углерода 28—30 Водород . 54—56
Диоксид углерода 14—15 Азот 1,0
Метан 1,5
Полученный синтез-газ имеет соотношение СО:Н2 = 1,9—2,0
и может быть использован при синтезе метанола без дополни-
тельной конверсии монооксида углерода.
Получение синтез-газа из углеводородного сырья основано
на конверсии метана водяным паром, диоксидом углерода или
неполном его окислении кислородом:
СН4 + Н2О a=t СО + ЗН2 (10)
СН4 + СО2 2СО + 2Н2 (11)
СН4 + 0,5О2 СО 4-2Н2 (12)
Поскольку во всех реакциях образуется оксид углерода, а в
дутье имеется вода, то происходит вторичный процесс их взаи-
модействия:
СО -|- Н2О <=* СО2 -|- Н2
(.13)
46
Существуют три основных метода конверсии метана с полу-
чением синтез-газа различного состава:
— собственно конверсия водяным паром, диоксидом углерода
или их смесью на никелевом катализаторе при 750—800°С;
в этом случае процесс является сильно эндотермическим [реак-
ции (10) и (Н)] и требуется постоянный подвод тепла для под-
держания необходимой температуры;
— окислительная конверсия смесью водяного пара с кислоро-
дом на никелевом катализаторе при 900—950°С; здесь для
компенсации эндотермичности реакции (10) используют теплоту
сгорания части углеводородов в реакционном пространстве; при
соотношении СН4.'О2:Н2О = 1:0,55:1 суммарный процесс стано-
вится несколько экзотермическим и эта теплота расходуется на
подогрев исходной смеси и компенсацию потерь теплоты в окру-
жающую среду;
— неполное окисление метана кислородом без катализатора
при 1200—1500°С по реакции (12); к недостаткам этого метода
следует отнести выделение свободного углерода и получение
соотношения СО:Н2 < 2. •
Первоначально процесс конверсии углеводородов проводили
при атмосферном давлении, но затем процесс стали вести при
2—3 МПа и более, что интенсифицирует его и позволяет создать
установки большой мощности. Технологическая схема наиболее
распространенного процесса получения синтез-газа окислитель-
ной конверсией природного газа на катализаторе приведена
на рис. 7.
Природный газ при давлении 2—3 МПа, предварительно
очищенный от сернистых соединений, поступает в сатурацион-
ную башню /, орошаемую горячей водой. В ней он насыщается
парами воды, контактируя с конденсатом или очищенной водой,
предварительно нагретой и теплообменнике 6. Затем парогазовая
Рис. 7. Технологическая схема производства синтез-газа конверсией природного
газа (по Н. Н. Лебедеву, 1975)
47
смесь смешивается с СОа, поступающим со стадии очистки
синтез-газа из десорбера 11. Соотношение СН4:Н2О:СО2 зависит
от заданного соотношения СО:Нг в получаемом синтез-газе.
Затем смесь подогревается в теплообменнике-утилизаторе 2 до
температуры 500°С, смешивается с кислородом в смесителе 3
и поступает в конвертор 4. Конверсию проводят на никелевом
катализаторе при 800—900°С. Для исключения выброса пла-
мени в смеситель 3 скорость парогазовой смеси должна быть
выше скорости распространения пламени. Одновременно исполь-
зуют и огнепреградители.
Газ из конвертора 4 при температуре 800°С проходит после-
довательно котел-утилизатор 5, где его теплоту используют для
получения водяного пара высокого давления, теплообменник-
утилизатор 2, теплообменник 6 и водонагревательную башню 7,
в которых нагревают воду сатурационного цикла. В холодиль-
никё 8 прямого смешения газы окончательно охлаждаются во-
дой до 35—40°С. Полученный синтез-газ имеет соотношение
СО.Н2 ~ 1,5 и перед подачей на синтез метанола он проходит
очистку от СО2 с помощью моноэтаноламина (МЭА).
Синтез-газ из теплообменника 8 поступает в нижнюю часть
абсорбера 9, орошаемого 12—15%-ным водным раствором МЭА.
Раствор снизу абсорбера 9 подогревается в теплообменнике 12
и поступает в десорбер И, куб которого обогревается глухим
паром. Регенерация раствора МЭА проводится при 115—120°С.
После регенерации поток МЭА предварительно охлаждается в
теплообменнике 12, холодильнике 10 и поступает в абсорбер 9.
Выделившийся в десорбере 11 диоксид углерода подается на
дозирование в исходный поток природного газа.
Очищенный синтез-газ из абсорбера 9 после компримирова-
ния подается на стадию синтеза метанола.
Получение метанола из синтез-газа. Для получения метанола
необходим синтез-газ, имеющий состав, близкий к соотноше-
нию СО:Н2 = 1:2.
На промышленных установках синтеза метанола чаще всего
процесс проводят при давлении 20—35 МПа, температуре 370—
420°С и объемной скорости синтез-газа (10—35) • 103ч—1 (время
контакта 10—40 с). В этих условиях степень конверсии в реак-
торе составляет 10—20%.
В последнее время с целью сниженйя энергетических затрат
реализованы в промышленности способы синтеза метанола при
более низком давлении (5—10 МПа) и температуре (300—
350°С). Этого удалось достичь с помощью применения новых
более активных оксидных цинк-медь-хромовых катализаторов и
обеспечения лучшей очистки синтез-газа от сернистых соедине-
ний, дезактивирующих эти катализаторы.
Технологическая схема синтеза метанола при давлении 5—
10 МПа приведена на рис. 8.
Свежий синтез-газ сжимают 5—6-ступенчатым компрессором 1,
после каждой ступени которого он охлаждается и освобожда-
48
Рис. 8. Технологическая схема производства метанола из синтеза-газа (по И. Н. Ле-
бедеву, 1975)
ется от масла и воды (на схеме это приведено только для послед-
ней ступени). После второй или третьей ступени компрессора 1
газ при давлении 1—2 МПа направляют на очистку от диоксида
углерода, которая происходит в насадочном абсорбере 2, оро-
шаемом водой под давлением, создаваемым насосом 5. При сни-
жении давления дросселированием через дроссель 3 растворив-
шийся диоксид углерода выделяется из воды и отделяется в сепа-
раторе 4, а вода возвращается на абсорбцию.
Очищенный от СОг газ сжимается до рабочего давления
5—10 МПа в следующих ступенях компрессора /, охлаждается
в теплообменнике 6, отделяется от масла и воды в маслоотдели-
теле 7 и смешивается с циркулирующим газом в смесителе 9.
Циркуляционный газ, потерявший часть давления в процессе
синтеза, доводят до давления 5—10 МПа в циркуляционном
компрессоре или турбокомпрессоре 8 и затем подают на смеше-
ние со свежим газом в смеситель 9.
Перед подачей в реактор синтез-газ очищают от небольших
количеств образовавшегося летучего пентакарбонила железа в
адсорбере 10, заполненном активированным углем. После адсор-
бера 10 одна часть газового потока проходит через теплооб-
менник-утилизатор 11 и поступает в реактор 13. В период пуска
установки синтез-газ подогревают в электроподогревателе 12,
который затем отключают. Другая часть газового потока остает-
ся холодной и подается в реактор 13 между слоями катализатора
для съема выделяющегося при реакции синтеза тепла и охлаж-
дения газов.
Реакционные газы с температурой около 300°С, содержащие
5—10% (по объему) метанола, выходят из колонны синтеза 13
и разделяются на два потока. Один из них охлаждается в тепло-
обменнике-утилизаторе 11, а другой проходит через котел-утили-
затор 14 с образованием водяного пара средних давлений. Затем
оба потока объединяются и проходят холодильник-конденса-
тор 15, где из реакционных газов конденсируются метанол и
побочные продукты (вода, диметиловый эфир, высшие спирты).
Одновременно в конденсате растворяется большая часть обра-
зовавшихся газов (СОг и СН4). В сепараторе высокого давле-
49
ния 16 конденсат отделяется от непрореагировавших газов, кото-
рые после компримирования в компрессоре 8 возвращаются в
реактор 13. Поскольку в циркуляционном газе накапливаются
неконденсируемые примеси (главным образом азот), часть ре-
циркулирующих газов выводят с установки через дроссель 17
и направляют на сжигание.
Конденсат из сепаратора 16 (через дроссель 18) подают в се-
паратор низкого давления 19. В сепараторе 19 из конденсата
удаляются растворенные газы (СО2, СН4, СН3—О—СН3), на-
правляемые на сжигание. Метанол-сырец стекает из сепарато-
ра 19 в сборник 20.
Для получения товарного продукта метанол-сырец подвер-
гается ректификации, совмещенной с экстрактивной перегонкой
(в случае проведения процесса при высоком давлении) или
просто двухступенчатой ректификации в колоннах 21 и 22 (для
процесса при низком давлении).
Отходящий с верхних тарелок колонны 22 метанол-ректифи-
кат имеет следующий состав (в % по объему):
Метанол не менее 99,9
Вода » более 0,05
Органические кис-
лоты ... » » 0,002
Альдегиды, кетоны не более 0,006
Железо » » 0,00005
Такой метанол является товарным продуктом и может не-
посредственно использоваться для культивирования микроорга-
низмов.
Подготовка сырья для микроорганизмов, утилизирующих
метан. Альтернативой использования метанола для получения
микробного белка является культивирование продуцентов, спо-
собных утилизировать непосредственно метан-, так называемых
метанотрофбв. "Этот процесс, безусловно, перспективен, посколь-
ку метан — основной компонент природного газа и его концент-
рация может приближаться (для некоторых месторождений)
к 100%. Вместе с тем круг метанотрофов сравнительно огра-
ничен, а имеющийся в нашей стране природный газ требует
перед подачей в ферментер дополнительной очистки, в первую
очередь от сероводорода и других серусодержащих соединений,
сильно ингибирующих рост клеток. Ниже изложены основы
технологии очистки природного газа и его подготовки к подаче
в биореактор.
Очистка от меркаптанов, сероводорода и воды осуществляет-
ся с помощью моноэтаноламина (МЭА) по обратимой реакции:
9П_
NH2CH2—СН2ОН + H2S H2S-NH2CH2—СН2ОН (14)
70—80°C
Технологическая схема процесса моноэтаноламинной очистки
природного газа приведена на рис. 9.
50
очищенный
Рис. 9. Технологическая схема МЭА очистки природного
газа (по Н. Н. Лебедеву, 1975)
Природный газ с давлением около 0,3 МПа подается в ниж-
нюю часть абсорбера 1, где контактирует с движущимся про-
тивотоком 15%-ным водным раствором МЭА и освобождается
от примесей, которые переходят в раствор. Температура в аб-
сорбере 1 не превышает 35—40°С, что обеспечивает образование
комплексов по уравнению (14). Очищенный газ выводится с
установки. Насыщенный серусодержащими соединениями рас-
твор МЭА выводится из нижней части абсорбера 1 и поступает
в сепаратор 2, где за счет снижения давления до 0,15 МПа вы-
деляются растворившиеся газообразные углеводороды, которые
отделяются, компримируются до давления 0,3 МПа и соединя-
ются с газовым потоком из абсорбера 1.
Из сепаратора 2 раствор МЭА через теплообменник-рекупе-
ратор 3 и подогреватель 4 поступает в десорбер 5, в котором
под действием острого пара при температуре 115—130°С про-
исходит разложение комплекса и выделение поглощенных МЭА
серусодержащих соединений.
Регенерированный раствор МЭА выводится из десорбера 5,
охлаждается в теплообменнике-рекуператоре 3, холодильнике и
поступает в сборник 7. В этот же сборник для компенсации
потерь подается свежий раствор МЭА. Из сборника раствор
МЭА насосом подается в абсорбер 1.
Насыщенный сероводородом водяной пар из десорбера 5
проходит через холодильник-конденсатор 8 и поступает в сбор-
ник 6. Из сборника 6 паровой конденсат возвращается на оро-
шение десорбера 5,. а выделившийся сероводород выводится
с установки.
Полученный после очистки природный газ имеет следующий
состав (% по объему):
Метан ..............не менее 95
Гомологи: этан » более 2
пропан .... » » 1
сумма остальных » » 1
Диоксид углерода
Сероводород . . .
Серусодержащие со-
единения . . .
не более 1
» » 0,01
» » 0,001
51
Такой природный газ является товарным продуктом, пол-
ностью соответствует требованиям микробиологической промыш-
ленности и может быть использован для культивирования
микроорганизмов.
§ 4. Получение углеводов
гидролизом растительного сырья
Гидролиз растительного, главным образом древесного сырья,
предназначенный первоначально для получения гексоз, дающих
при сбраживании этанол, служит почти исключительно для из-
готовления гидролизатов как сырья для аэробного культиви-
рования дрожжей. Гидролизаты содержат смесь моносахаридов
состава Сб и Сб — пентоз и гексоз — и примеси, к сожалению, в
большинстве своем нежелательные для микробиологического
синтеза, но трудно отделяемые из получающегося разбавленного
раствора углеводов. Важнейшим побочным продуктом гидролиза
оказывается лишь фурфурол, химический синтез которого пока
слишком затруднителен и не реализован в промышленности.
Вследствие этого все схемы гидролиза предусматривают тща-
тельное отделение фурфурола, а для так называемого пенто-
зансодержащего сырья — подсолнечной и хлопковой шелухи,
кукурузных кочерыжек и т. п. — режим гидролиза подбирается
специально в расчете на наибольший выход фурфурола.
Химический состав растительного сырья, перерабатываемого
на гидролизных заводах, неодинаков и колеблется в широких
пределах. Главной частью этого сырья являются полисахариды,
количество которых составляет 40—75%, и лигнин, содержание
которого может варьировать от 15 до 60%. Обычно в гидролиз-
ной промышленности под лигнином понимают все нераствори-
мые при кислотном гидролизе полисахаридов компоненты расти-
тельного сырья.
Полисахариды растительного сырья делятся на легко- и
трудногидролизуемые. Легкогидролизуемая часть полисахаридов
состоит из гемицеллюлоз и пектиновых веществ, количество
которых составляет 15—40%. Трудногидролизуемая часть поли-
сахаридов состоит из целлюлозы с небольшой примесью геми-
целлюлоз, общее количество которых 25—50% в зависимости от
вида растительного сырья.
Химический состав некоторых видов растительного сырья,
максимально возможный выход редуцирующих веществ (РВ)
и соотношение между гексозами и пентозами после гидролиза
приведены в табл. 2.
Как видно из таблицы, наибольшее количество РВ может
быть получено при гидролизе кукурузной кочерыжки и древесины
хвойных и лиственных пород.
Полный гидролиз древесины (полисахаридов) можно пред-
ставить следующими уравнениями:
(СбН10О5)„= (п- 1)Н2О^пС6Н12О6 (15)
(С5Н8О4) т -|- (т—1) Н2О—►ШС5Н10О5 (16)
52
Таблица 2. Химический «состав гидролизуемого растительного сырья (в процентах от АСВ)
Соотношение меж-
ду гексозами (урав-
нение 15) и‘пентоза-
ми (уравнение 16)
не имеет существен-
ного значения при
выращивании кормо-
вых дрожжей, по-
скольку обе группы
моносахаров утили-
зируются микроорга-
низмами. Уроновые
кислоты усваивают-
ся дрожжами значи-
тельно хуже, чем мо-
носахариды. Поэто-
му сырье, богатое
уроновыми кислота-
ми, образует гидро-
лизаты более низкого
качества.
Ацетильные груп-
пы, входящие в со-
став многих гемицел-
люлоз, легко отщеп-
ляются и при полном
гидролизе образуют
уксусную кислоту,
которая при культи-
вировании кормовой
биомассы усваивает-
ся наравне с моноса-
харидами. Легкоот-
щепляемые меток-
сильные группы при
гидролизе образуют
метиловый спирт, со-
держание которого
может достигать 2—
7 кг на 1 т абсолют-
но сухого сырья.
Азотистые вещества
в большей степени
состоят из белков,
которые при гидроли-
зе распадаются до
аминокислот. Не-
большая часть не-
гидролизовавшегося
53
белка остается в лигнине. При производстве кормовой биомассы
аминокислоты легко усваиваются микроорганизмами и способ-
ствуют их росту.
Лигнин — нерастворенный при гидролизе остаток раститель-
ного сырья — находит ограниченное применение и в большинстве
случаев является балластом. При гидролизе хвойных пород,
содержащих от 2 до 10% смолистых веществ, часть смолы обра-
зует эмульсию и вместе с коллоидным лигнином и продуктами
распада сахаров оседает на стенках труб и приемников.
Основным способом гидролиза растительного сырья был и
остается перколяционный гидролиз разбавленной серной кисло-
той при повышенном давлении и температуре. По этому способу
горячая разбавленная кислота (жидкая фаза) непрерывно про-
текает через слой неподвижной твердой фазы (измельченное
растительное сырье), которая полностью погружена в жидкость.
Имеющиеся разновидности перколяционного гидролиза позво-
ляют изменять удельную производительность гидролизаппаратов,
варьировать температуру гидролиза и уменьшать расход кис-
лоты.
Технологическая схема гидролиза растительного сырья при-
ведена на рис. 10.
Измельченное растительное сырье транспортером 5 подается
в гидролизаппарат 2 через верхнюю горловину. Для проведения
процесса перколяции через верхний штуцер из смесителя 6 не-
прерывно подается горячая разбавленная серная кислота, полу-
чаемая смешением предварительно нагретой до 180—190°С воды
с концентрированной серной кислотой. Концентрированная сер-
ная кислота из емкости 25 проходит фильтр 24 для отделения
Рис. 10. Технологическая схема получения гидролизатов растительного
сырья (по В. И. Шаркову и др.. 19731
54
взвешенных частиц и затем плунжерным насосом 23 через обрат-
ный клапан подается в смеситель 6. Заданная концентрация
серной кислоты, поступающей в гидролизаппарат, определяется
соотношением потоков горячей воды и концентрированной кис-
лоты, поступающих в смеситель 6. Для контроля за количеством
жидкости в гидролизаппарате 2 под одну из его опор устанавли-
вается весомер 21, а под другую — подвижный шарнир 3.
Перед началом перколяции подогрев реакционной массы и
гидролизаппарата осуществляется острым паром, подаваемым
в нижний штуцер гидролизаппарата. В начальной стадии подо-
грева в верхней части гидролизатора 2 собирается воздух, вы-
тесняемый из растительного сырья. Находящийся в воздухе
кислород способствует образованию окисленных продуктов, что
снижает качество получаемого гидролизата и выход РВ. Удале-
ние воздуха из гидролизаппарата 2 (сдувка) проводится через
обратный клапан и штуцер 4 снижением давления внутри аппа-
рата с 0,3 до 0,1 МПа.
После сдувки давление пара в аппарате снова поднимается
до заданного значения и начинается стадия перколяции (одно-
временная подача варочной кислоты и отбор гидролизата). Перег-
ретый гидролизат с температурой 150 — 185°С отводится из гидро-
лизаппарата в систему последовательно соединенных испарителей
20, 19, 18, где происходит ступенчатое снижение давления и
охлаждение гидролизата до 100—105°С. Для более полной ре-
куперации теплоты отходящего гидролизата работа испарителей
регулируется так, чтобы давление в испарителе 20 было наиболь-
шим, а в испарителе 18 — наименьшим, близким к атмосферному.
(В случае проведения инверсии гидролизата при повышенном
давлении испаритель 18 не используется.) В процессе снижения
давления в испарителях образуются пары самоиспарения (около
10% объема гидролизата), вместе с которыми из гидролизата
удаляется большая часть фурфурола.
Пары самоиспарения из испарителя высокого давления 20
с температурой 140—150°С поступают на конденсацию в поверх-
ностный конденсатор высокого давления 10. Аналогично пары
самоиспарения из испарителей 19 и 18 с температурой 115—
125°С и 100—105°С соответственно конденсируются в конден-
саторах 11 и 12.
Жидкость из аппаратов 10—12 через конденсационные горш-
ки, пропускающие только жидкость, поступает в испаритель 15,
где охлаждается до 100°С, и затем поступает в сборник 16. На
ряде гидролизных заводов конденсат из сборника 16 направля-
ется на получение фурфурола.
Вода, используемая для разбавления серной кислоты, вначале
подогревается в теплообменнике низкого давления 12 до 50—
60°С и собирается в сборник теплой воды 13. Из него теплая
вода центробежным насосом 14 под давлением 0,4—0,5 МПа
подается последовательно в теплообменники 11 и 10, где нагре-
вается до 120—140°С. Подогретая вода центробежным насосом
55
высокого давления 9 под давлением до 1,0 МПа подается в по-
догреватель 8, где нагревается глухим паром до 160—170°С.
Окончательный нагрев воды осуществляется острым паром в
струйном подогревателе 7. Такой двухступенчатый подъем давле-
ния подогреваемой воды позволяет использовать часть тепло-
обменной аппаратуры, рассчитанной на меньшее давление.
По окончании процесса гидролиза оставшийся на дне гид-
ролизаппарата лигнин через быстрооткрывающийся клапан
22 выбрасывается (выстреливается) в циклон /, где отделяется
от паров самоиспарения, охлаждаясь до 105—110°С, и транспор-
тером удаляется из циклона.
Охлажденный до 103—108°С гидролизат из последнего испа-
рителя 18 поступает в инвертор 17, где происходит инверсия —
процесс превращения неполностью гидролизованных раствори-
мых в воде полисахаридов (в основном олигосахаридов и декст-
ринов) в моносахариды, усваиваемые микроорганизмами. Посту-
пающий в работающий при атмосферном давлении инвертор
17 гидролизат из-за снижения давления вскипает, охлаждаясь
до 98—99°С. Образующиеся пару самоиспарения поддерживают
эту температуру в инверторе в течение 2—3 ч — всего времени
инверсии. В процессе инверсии из гидролизата выделяется
взвешенный лигнин, унесенный через сетчатые фильтры из гидро-
лизаппарата 2, а также осадок смол, которые собираются в ко-
нусном днище инвертора и периодически удаляются из него.
Для уменьшения времени инверсии возможно проведение про-
цесса при повышенном давлении (температура), так при темпе-
ратуре 130°С время инверсии составляет 40 мин.
Кислый гидролизат с pH 1,3—1,4 после инверсии имеет
следующий состав (в % по объему):
Общее содержание РВ
Летучие органические
кислоты ......
Серная кислота
Уроновые кислоты
Фурфурол
2,5—3,5 Окснметил фурфурол 0,08—0,2
Формальдегид . . . 0,005—0,015
0,2—0,4 Коллоидные вещества
0,5—0,7 (лигнин, гуминовые
0,1—0,2 вещества) . . . . 0,2—0,4
0,03—0,09
При использовании гидролизата для культивирования микро-
организмов необходимо оценить его биологическую доброкачест-
венность, под которой понимают показатель, отражающий сте-
пень влияния вредных примесей среды на процесс выращивания
дрожжей или выход целевых продуктов их жизнедеятельности.
Таким образом, биологическая доброкачественность сред зависит
от содержания в них примесей, мешающих развитию микроор-
ганизмов, отрицательно действующих на их жизнедеятельность,
тормозящих процессы обмена. Доброкачественность сред опреде-
ляют биологическим методом по таким показателям, как выход
биомассы в единицу времени, физиологическая активность кле-
ток микроорганизмов и т. д.
В гидролизных средах основной примесью, подавляющей об-
мен веществ, рост и размножение дрожжей, является фурфурол,
56
тормозящее действие которого проявляется при концентрациях
выше 0,02%. Оксиметилфурфурол (ОМФ) —также ингибитор
процесса культивирования дрожжей, проявляет угнетающее дей-
ствие при концентрациях выше 0,1%. Однако при непрерывном
культивировании допускается содержание ОМФ в гидролизате
до 0,2%, незначительно снижающее скорость роста дрожжей.
Поскольку полного удаления всех ингибирующих примесей
достигнуть не удается, установлены минимально допустимые
концентрации (в %) основных ингибирующих примесей в
питательной среде:
Фурфурол
ОМФ . .
Лигногуминовые вещества .
не- более 0,03—0,04
0,05—0,1 (до 0,2)
до 0,1
Для получения биологически доброкачественных гидролиза-
тов необходимо провести их обработку, включающую в себя
следующие основные операции: нейтрализацию минеральных и
части органических кислот; отделение осадков и коллоидных
частиц; охлаждение субстрата до 30—35°С; удаление вредных
летучих примесей.
Технологическая схема обработки гидролизатов приведена на
рис. 11.
Периодическая или непрерывная нейтрализация гидролизата
происходит в вертикальных цилиндрических нейтрализаторах 1 и
2, снабженных перемешивающими устройствами. Горячий кислый
гидролизат после инверсии подается в нейтрализатор 1, где
происходит нейтрализация свободной серной и муравьиной кис-
Рис. 11. Технологическая схема обработки гидролизатов перед биохимической
переработкой (по В. И. Шаркову и др., 1973)
57
лот предварительно полученным раствором известкового молока
по реакции
H2SO4+Ca (OH)2=CaSo44-2H2O (17) ‘
2НСООН + Са (ОН)2 Са (НСОО)2-|-2Н2О (18)
pH гидролизата в нейтрализаторе 1 доводится до значений
3,0—3,2. Образующийся в результате реакции (17) гипс плохо
растворим в воде и часть его выпадает в виде кристаллов. Время
нейтрализации известковым молоком составляет 30—40 мин
при температуре 80—90°С, что обеспечивает формирование мел-
ких кристаллов гипса и предотвращает образование пересыщен-
ных растворов. Для предупреждения возникновения и оседания
крупных кристаллов гипса в нейтрализаторах происходит пере-
мешивание (п = 30 об/мин) реакционной смеси. При недостаточ-
ном перемешивании наблюдается локальное перещелачивание
гидролизата, что вызывает разрушение маносахаридов.
Из нейтрализатора 1 частично нейтрализованный гидролизат
поступает в нейтрализатор 2, где происходит донейтрализация
органических кислот и кислотность раствора доводится до
pH 4,2—4,4 при постоянном перемешивании жидкости. Такое
проведение процесса обеспечивает полную нейтрализацию серной
и муравьиной кислот и частичную нейтрализацию остальных
органических кислот. При pH 4,2 — 4,5 в гидролизате нахо-
дится еще до 0,15% свободных органических кислот (в пересче-
те на уксусную кислоту). Образующиеся при нейтрализации
соли органических кислот остаются в растворе.
Нейтрализованный гидролизат с температурой 80—85°С по-
дается в отстойник 3, где происходит осаждение взвешенных
частиц. Взвешенные частицы содержат 70—80% кристаллов
гипса и 20—30% органических веществ (лигнин, гуминовые
и смолистые вещества). Концентрация частичек примесей в гид-
ролизате зависит от вида сырья и изменяется от 5 — 7 г/л для
хвойной древесины до 12 г/л для сельскохозяйственных от-
ходов.
После отстойника 3 в осветленном гидролизате концентра-
ция взвешенных частиц составляет 0,5—0,8 г/л, из которых
около 80% приходится на органические коллоиды. Осадок из
отстойника 3 поступает на фильтр-пресс 9 и выделившийся гид-
ролизат возвращается в процесс, поступая в сборник 4.
Осветленный нейтрализат из отстойника 3 поступает в сбор-
ник 4, откуда насосом подается в непрерывно действующую
вакуум-охладительную установку 5, где охлаждается с 75—85°С
до 30—35°С. Конденсат, составляющий 5—7% от объема гид-
ролизата, с повышенной концентрацией фурфурола поступает в
цех выделения фурфурола.
Охлажденный до 30—35°С нейтрализат поступает в аэра-
тор 6, где обрабатывается мелко диспергированным воздуш-
ным потоком. При этом большая часть коллоидов коагулирует
и образует хлопья. Для отделения хлопьев коллоидов нейт|й-
58
лизат поступает в отстойник 7, где происходит оседание хлопьев,
что снижает концентрацию лигногуминовых веществ в нейтрали-
зате до 0,2—0,4 г/л. Из отстойника 7 нейтрализат (или гото-
вое сусло) сливается в сборник 8, откуда по мере необходимости
поступает на стадию ферментации.
Основными недостатками процесса перколяционного гидро-
лиза древесины являются образование крупнотоннажного отхо-
да — лигнина и низкое качество гидролизата с точки зрения
микробиологического синтеза: наличие в смеси и пентоз, и гек-
соз, а также заметных-количеств ингибирующих примесей огра-
ничивает применение гидролизата только производством белко-
во-витаминного концентрата (гидролизные дрожжи), во всех ос-
тальных биотехнологических производствах это сырье оказывает-
ся неприемлемым.
В настоящее время интенсивно разрабатываются более со-
вершенные процессы гидролиза растительного сырья, которые ре-
шают задачу повышения качества углеводного раствора и ути-
лизации лигнина. Перспективными можно считать методы кис-
лотного гидролиза- или так называемого автогидролиза (без
добавления кислот-катализаторов), предваряемые механическим
или механохимическим воздействием на древесину. Особенно
интересные возможности открываются при проведении не ис-
черпывающего, как это делается сейчас, а ступенчатого гид-
ролиза с постепенным извлечением пентоз и гексоз, которые в
этом случае могут быть получены раздельно.
В литературе по этим вопросам имеется обширная инфор-
мация, но рекламный характер большинства публикаций не поз-
воляет пока достоверно судить о технологической сущности
новых процессов гидролиза, поэтому они не отражены в на-
стоящем пособии. Необходимо подчеркнуть, что растительность
как единственный источник возобновляемого сырья, образую-
щегося ежегодно в крайне широких масштабах за счет утили-
зации энергии солнца, углекислоты и воды, должна в принципе
служить основой получения субстратов для микробиологического
синтеза, который характеризуется высокими расходными коэф-
фициентами по сырью. Можно полагать, что в недалеком бу-
дущем биотехнология будет базироваться на углеводном сырье
растительного происхождения, чему в немалой степени должно
способствовать и то обстоятельство, что подавляющее большин-
ство промышленных штаммов-продуцентов быстро и эффективно
растут на углеводных средах, предпочитая их многим другим
источникам углерода.
§ 5. Получение уксусной кислоты
Пищевая уксусная кислота издавна получается путем окис-
ления этанола культурами бактерии рода Acetobacter.
В последние годы было установлено, что уксусная кислота
представляет собой очень перспективный субстрат для биотех-
нологии; на ней хорошо развиваются дрожжи как источник
59
микробного__белка, однако наиболее интересно применение
“уксусной-кислоты в биосинтезе лизина. Очевидно, что в этих
случаях ввиду необходимости применять большое количество
уксусной кислоты она должна быть получена каким-либо круп-
нотоннажным методом, в частности химическим синтезом из
этилена через ацетальдегид или карбонилированием метанола.
Получение уксусной кислоты из этилена. Процесс полу-
чения уксусной кислоты из этилена проводится в два этапа по
следующей схеме:
X) ,О
СН2 = СН2 + 0,5О2 СНз—С< + о2 СНзСГ (19)
ХН 4)11
Процесс получения ацетальдегида прямым окислением этиле-
на проводят в одну стадию с использованием в качестве ка-
тализатора (/СТ1) водного раствора хлоридов палладия и меди
(PdCl2-CuCl2), что обеспечивает достаточно интенсивное проте-
кание процесса при температурах 110 — 130°С. Для поддержания
катализатора при этих температурах в растворе необходимо
избыточное давление 0,3—0,7 МПа, которое также способству-
ет ускорению процесса окисления этилена за счет повышения
его растворимости в реакционной массе.
На втором этапе получения уксусной кислоты проводят
жидкофазное окисление ацетальдегида, используя в качестве
катализатора (КТ2) раствор ацетата марганца в уксусной кисло-
те (0,05—0,1% по отношению к массе ацетальдегида), проводя
реакцию при температуре 50—80°С. Применение других катали-
заторов и снижение температуры ведет к накоплению надук-
сусной кислоты (как основного промежуточного продукта окис-
ления), что увеличивает взрывоопасность производства. Повы-
шение же температуры ограничено высокой летучестью ацеталь-
дегида и ускорением побочных реакций, снижающих выход ук-
сусной кислоты.
Таким образом, прямое каталитическое окисление этилена
обеспечивает получение ацетальдегида, а затем и уксусной
кислоты из дешевого сырья с суммарным выходом не менее 90%.
Общая технологическая схема получения уксусной кислоты
из этилена приведена на рис. 12.
Кислород и смесь рециркулирующего газа со свежим эти-
леном при рабочем давлении подают раздельно вниз реакцион-
ной колонны 1, заполненной раствором катализатора. Барботи-
руя через жидкость, газы растворяются в ней и вступают в
реакцию образования ацетальдегида. Непрореагировавшие газы
с парами ацетальдегида, воды и захваченным каталитическим
раствором охлаждаются в холодильнике 2. Сконденсировавшие-
ся пары воды и раствора возвращаются в реакционную колон-
ну 1, а газопаровая смесь, содержащая ацетальдегид, допол-
нительно охлаждается в холодильнике и подается на абсорбцию
ацетальдегида в абсорбер 4, орошаемый холодной водой. Газ
60
после абсорбера 4 дожимается циркуляционным компрессором /6
до рабочего давления и возвращается в реакционную колон-
ну 1. Небольшое количество рециркулирующего газа во избе-
жание чрезмерного накопления инертных примесей сбрасывается
в атмосферу.
Для поддержания активности катализатора часть жидкости
из колонны 1 непрерывно отводится на регенерацию в регене-
ратор 3, где ее обрабатывают кислородом и хлороводородом
при ультрафиолетовом облучении. Регенерированный катализа-
тор возвращают в колонну 1.
Стекающий из нижней части абсорбера 4 10%-ный водный
раствор ацетальдегида, содержащий растворенные газы и по-
бочные продукты (хлорацетальдегид, кротоновый альдегид),
поступает в абсорбционно-отпарную колонну 5, где острым па-
ром отгоняют растворенные газы, а захваченнцй ими ацеталь-
дегид абсорбируется водой. Затем раствор ацетальдегида за
счет избыточного давления поступает в ректификационную ко-
лонну 6, где он отгоняется от воды и высококипящих приме-
сей острым паром. Пары ацетальдегида конденсируются в холо-
дильнике-конденсаторе, из которого часть жидкости возвращает-
ся на орошение колонны 6 в качестве флегмы. Другая часть
ацетальдегида поступает либо в сборник, либо на синтез ук-
сусной кислоты в окислительную' колонну 7 после предваритель-
ного смешения с раствором ацетата марганца, приготовленного
в аппарате 15.
Для отвода теплоты реакции окисления ацетальдегида ре-
акционная колонна 7 снабжена пятью секциями змеевиков,
которые одновременно способствуют лучшему растворению
кислорода в жидкости за счет увеличения поверхности кон-
такта фаз. Ввиду высокой летучести ацетальдегида процесс
проводят в растворе рециркулирующей уксусной кислоты при
Рис. 12. Технологическая схема получения уксусной кислоты из этилена
(по И. И. Юкельсону, 1968)
61
давлении 0,3—0,4 МПа. Ввод кислорода осуществляют распре-
деление, для поддержания максимальной его концентрации в
жидкой фазе. В нижней части колонны поддерживают тем-
пературу 60°С и давление 0,4 МПа, а в верхней — температуру
75°С и давление 0,3 МПа с точным регулированием темпера-
туры. Для разбавления парогазовой смеси и снижения концент-
рации надуксусной кислоты в верхнюю часть колонны непре-
рывно подают газообразный азот. Парогазовая смесь сверху
окислительной колонны 7 поступает в холодильник-конденса-
тор, где происходит отделение несконденсировавшихся газов от
воды, уксусной кислоты и растворенного в них непрореагировав-
шего ацетальдегида. Газы после отмывки в скруббере 8 от ос-
татков альдегида и кислоты выводятся в атмосферу, а конден-
сат возвращается в нижнюю часть колонны 7.
Образующаяся в колонне 7 уксусная кислота (сырец) не-
прерывно отбирается из расширенной части колонны и посту-
пает в ректификационную колонну 9, в которой от сырца от-
гоняются легкокипящие примеси. Для очистки от высококипя-
щих примесей (катализатора, кротоновой кислоты, паральдегида
и продуктов осмоления) уксусная кислота снизу колонны 9
подается в ректификационную колонну 10. Пары уксусной кис-
лоты конденсируются в холодильнике-конденсаторе, откуда часть
кислоты возвращается в виде флегмы на орошение колонны 10,
небольшая часть поступает в аппарат 15 для приготовления
раствора катализатора, а большая часть направляется в реак-
тор 11 для очистки от примесей окислением их перманганатом
калия.
После окисления содержащихся примесей смесь из реакто-
ра 11 поступает в испаритель 14, где уксусную кислоту ис-
паряют при температуре 120—125°С и пары направляют в на-
садочную ректификационную колонну 12 для конечной очистки.
Очищенная уксусная кислота представляет готовый. продукт и
поступает в сборник 13.
Полученная таким способом ледяная уксусная кислота явля-
ется товарным продуктом, имеет 99,9% основного вещества и
удовлетворяет всем требованиям микробиологической промыш-
ленности.
Получение уксусной кислоты карбонилированием метанола.
Производство уксусной кислоты из метанола в промышленности
основано на взаимодействии спирта с оксидом углерода при
катализе комплексами Со и Rh или смесью СоН(СО)4 + Со12
по реакции
X)
СНзОН + СО Кг > СНз—С<
При использовании катализаторной системы из гидрокарбо-
нила кобальта и иодида кобальта процесс синтеза кисло-
62
ты протекает при температуре 180 — 200°С и давлениях
40 — 70 МПа.
Этот метод позволяет базировать производство уксусной
кислоты на природном газе (метан -► синтез-газ -► метанол -►
—уксусная кислота) или на каменном угле (водяной газ -► ме-
танол -► уксусная кислота) и относится к одному из самых
экономичных для получения уксусной кислоты.
Технологическая схема синтеза уксусной кислоты карбонили-
рованием метанола приведена на рис. 13.
Оксид углерода, сжатый до давления 65 МПа в компрессо-
ре 1, и метанол с давлением 65—75 МПа после насоса 2 смеши-
ваются в соотношении 1,1 : 1 в смесителе 3. Реакционная смесь
подогревается в теплообменнике 4 до температуры 250°С и,
смешиваясь с рециркулирующим газом, поступает в реакцион-
ную колонну 6, заполненную катализаторной системой СоН(СО)< +
+ Со12, где и протекает реакция синтеза уксусной кислоты.
Выходящий из колонны 6 парогазовый поток охлаждается
в холодильнике-конденсаторе 7 и разделяется в сепараторе вы-
сокого давления 8. Непрореагировавшие газы возвращаются
через циркуляционный турбокомпрессор 5 в реакционную колон-
ну 6, а жидкость дросселируется и поступает в сепаратор низкого
давления 9. При снижении давления из жидкости выделяются
растворенные газы, содержащие пары метилиодида, которые от-
мываются в абсорбере 10 метанолом. Очищенные от примеси
метилиодида газы (СО, СО2, СН<) выводятся с установки на
сжигание, а метанол из абсорбера поступает в сборник 11.
Жидкость из сепаратора низкого давления 9 подается в
ректификационную колонну 12 для отгонки метанола, который
возвращается в цикл, поступая в сборник 11. Из куба колонны
12 жидкость, содержащая катализаторный раствор, поступает
в испаритель 13. В нем пары кислоты испаряются, а катализатор-
ный раствор, полностью сохранивший каталитическую активность че-
Рис. 13. Технологическая схема получения уксусной кислоты карбонилированием
метанола (по И. И. Юкельсону, 1968)
63
рез сборник 11 вместе с метанолом возвращается в реакционную
колонну 6.
Пары кислоты из испарителя 13 подаются на двухступен-
чатую ректификационную очистку в колоннах 14 и 15, причем
сверху колонны 14 отделенный метанол возвращается в сбор-
ник 11, а из куба колонны 15 получаемый тяжелый остаток,
содержащий высшие карбоновые кислоты, выводится с установки.
Сверху колонны 15 товарная уксусная кислота поступает в сбор-
ник 16 и представляет собой готовый субстрат для нужд микробио-
логической промышленности.
§ 6. Меласса как субстрат для биотехнологии
.Меласса, содержащая до 50% сахарозы, является отходом са-
харного производства и очень широко используется в микробио-
логическом синтезе, так как многие продуценты белка и биологи-
чески активных веществ прекрасно утилизируют углеводы из ме-
лассы. В связи с реобходимостью увеличения производства са-
хара в СССР стоит задача возможно более полной утилизации
сахарозы, находящейся в клубнях сахарной свеклы; в этих целях
процесс сахароварения непрерывно совершенствуется прежде все-
го за счет снижения процента сахара, попадающего в мелассу.
Современная технология позволяет снизить содержание сахара в
мелассе, доводя его до 30 и даже 20%. Естественно, что такой
продукт будет представлять тем меньший интерес для биотехно-
логии, чем ниже содержание в нем сахарозы. Это делает весьма
актуальной упоминавшуюся задачу использования углеводов из
гидролизатов растительного сырья взамен мелассы.
Тем не менее меласса пока остается важнейшим, часто неза-
менимым сырьем, особенно для синтеза метаболитов типа амино-
кислот, средств защиты растений и т. п. Ниже описана классиче-
ская схема переработки сахарной свеклы с образованием мелас-
сы, приведенная на рис. 14.
Поступающая на свеклосахарный завод свекла смешивается с
водой для предварительной очистки, проходит систему ботвосоло-
мо- и песколовушек /; отделяется от промывной воды и поступает
в двухступенчатую свекломоечную машину 2, где окончательно
отмывается от примесей. Чистые клубни свеклы через водоотдели-
тель ленточным (или элеваторным) транспортером 3 с электро-
магнитным сепаратором подаются на свеклорезку центробежного
типа 4, где изрезываются в стружку для лучшей экстракции
сахарозы из свеклы. Полученная свекловичная стружка через
загрузочную шахту подается в ошпариватель 5 для набухания
и облегчения процесса экстракции, где нагревается сначала от-
ходящим диффузионным соком (1 мае. часть), а затем потоком
циркулирующего через теплообменник 6 диффузионного сока
(4 мае. части) до 75°С. Смесь стружки с циркулирующим соком
нагнетается в колонный диффузионный аппарат 7, где она пере-
мещается в вертикальном направлении противотоком к подавае-
64
Рис. 14. Технологическая схема переработки сахарной свеклы с образованием
мелассы (по А. Р. Сапронову, Л. Д. Бобровнику, 1981)
мой свежей сульфированной воде и диффузионному соку после
отделения жома (обессахаренной в диффузионном аппарате
свекловичной стружки) в шнековом водоотделителе с прессом 8.
Отходящая часть диффузионного сока после экстрактора 7
проходит ловушку 27 циклонного типа, где очищается от пульпы,
периодически возвращаемой в ошпариватель 5 на доэкстракцию,
н поступает в отделение очистки диффузионного сока от примеси
несахаров обработкой известью (дефекация) с последующим уда-
лением ее избытка диоксидом углерода (сатурация), осуществляе-
мые в две стадии: предварительные дефекация и сатурация, а
затем основные дефекация и сатурация, проводимые в аналогич-
ных аппаратах 9 и 10 соответственно. На стадии предварительной
дефекации, проводимой в дефекаторе 9, при pH 10,8—11,6 дости-
гается максимальная коагуляция и осаждение несахаров из
диффузионного сока; на первой стадии сатурации в сатураторе 10
образующийся осадок СаСОз служит фильтрующей основой для
фильтрации и очистки соков, являясь одновременно и активным
адсорбентом нескоагулированных несахаров. Целью основной де-
фекации является проведение реакций разложения амидов,
редуцирующих и пектиновых веществ, а также возможно более
полное осаждение анионов, способных давать с ионами Са2+
нерастворимые соединения. Процесс проводится при pH И —12
при температуре 80—85°С, после чего диффузионный сок посту-
пает на вторую стадию сатурации, где происходит перевод в оса-
док растворимых солей,и гидроксида кальция, которые дают
большое образование накипи в выпарной установке 11.
После каждой стадии дефекации и сатурации происходит от-
деление образующегося осадка в отстойниках 26 и барабанных
вакуум-фильтрах 25.
Однако после такой очистки в диффузионном соке все еще
много красящих веществ, снижающих качество получаемого са-
хара-песка. Для обесцвечивания красящих веществ и снижения
щелочности сока заменой соли К2СО3 на K2SO3 очищенный сок
подвергают сульфитации в жидкоструйном сульфитаторе 24, по-
давая туда диоксид серы и добиваясь значения pH 8,5—9,0. Очи-
3—154
65
щенный таким образом сок с содержанием 12—13% (по массе)
сухих веществ подается на 3—4-корпусную выпарную установ-
ку 11, где сгущается до содержания сухих веществ 60—65% (по
массе). Дальнейшее сгущение сиропа до содержания сухих ве-
ществ 92,5—93,5% (по массе) осуществляется в вакуум-аппара-
те 12. В последующем происходит выпадение кристаллов саха-
розы в смесителе 13 после введения в качестве затравки сахар-
ной пудры. Путем кристаллизации выделяется около половины
находящейся в сиропе сахарозы, а межкристальная жидкость
(утфель) подается на дополнительное выделение сахарозы.
Отделенный от утфеля на центрифуге 23 сахар-песок с влаж-
ностью 0,8% (по массе) направляется на сушку, после чего в ка-
честве готового продукта передается на склад.
При сгущении в сиропе уменьшается растворимость солей
кальция, разлагаются редуцирующие сахара, протекают другие
реакции, утособствующие образованию осадка и повышению
цветности.’Для предотвращения этих процессов в сироп добав-
ляют сул^фитированный сироп из сульфитатора 22.
Утфель с первого вакуум-аппарата 17 (утфель I) поступает в
выпарной' аппарат 14, концентрируется до содержания сухих
веществ ~93% (по массе) и направляется в кристаллизатор 15,
где образуются кристаллы желтого сахара, имеющие повышен-
ную цветность, и остаток — утфедь II, разделяемые на центри-
фуге 20.
Желтый сахар вместе с аффинированным желтым сахаром
последнего утфеля, отделенным на центрифуге 19, растворяют
в смесителе 21 соком, прошедшим вторую сатурацию, до содер-
жания сухих веществ 65—70% (по массе) и после сульфитации
в сульфитаторе 22 направляют на кристаллизацию саха-
ра-песка.
Утфель II, отделенный в центрифуге 20, направляется на из-
влечение сахарозы повторной кристаллизацией после упаривания
в аппарате 16 до содержания 94% (по массе) сухих веществ.
Кристаллизацию проводят в два этапа, начиная в шнековом кри-
сталлизаторе 17 и завершая в аппарате 18 при температуре
35—40 °C в течение 24—28 ч. Кристаллы, отделенные в центри-
фуге 19, направляют в смеситель 21, а вязкую жидкость — ме-
лассу — в качестве отхода производства направляют на
склад.
В зависимости от качества сахарной свеклы и технологиче-
ских режимов переработки состав мелассы колеблется в следую-
щих пределах (в % по массе); сухих веществ 76—84 (в том
числе сахарозы 46—51; общего азота 1,5—1,8; бетаина 4—7;
редуцирующих веществ 1,0—2,5; раффинозы 0,8—1,2; молочной
кислоты 0,2 — 0,5; красящих веществ 4 — 8; уксусной кис-
лоты 0,2 — 0,5; муравьиной кислоты 0,2 — 0,5; золы 6— 10).
Меласса используется как источник углеводов и некоторых
биологически активных веществ в средах, применяемых в раз-
личных отраслях микробиологической промышленности.
66
§ 7. Дополнительные источники сырья
для производства белка одноклеточных
Как уже отмечалось, многие смеси органических веществ,
особенно углеводов и некоторых других кислородсодержащих
соединений, могут служить субстратами для выращивания кормо-
вых дрожжей. Здесь будет рассмотрена только технология полу-
чения гидролизатов торфа и облагораживания сульфитных щело-
ков — отхода варки целлюлозы, поскольку эти продукты уже
нашли практическое применение в получении микробной био-
массы.
Получение гидролизатов торфа для биосинтеза белка. Од-
ним из перспективных источников углеводного сырья для получе-
ния кормовых дрожжей является верховой торф со степенью раз-
ложения не выше 20%, содержащий в своем составе до 50% поли-
сахаридов и до 15— 17% уроновых кислот.
Торф малой степени разложения имеет следующий состав
(в % от АСВ):
Полисахариды: общие................................ \Ц-51
легкогидролизуемые 28—32
трудногидролизуемые . 26—32
Негидролизуемый остаток . 14—25
Общий азот ... 0,7—1,2
Уроновые кислоты 10—17
Зольные вещества . 1,6—2,2
При мягком гидролизе до 80% уроновых кислбт торфа пере-
ходят в раствор и, легко декарбоксилируясь, превращаются в
пентозу по реакции о
СООН—(СНОН)4—-СН2ОН—(СНОН)з—+ СО, (21)
ХН
Таким образом, торф, содержащий значительные количества
азота и фосфора в легкоусвояемой форме, после предвари-
тельной подготовки может служить хорошим сырьем для микро-
биологической промышленности.
В связи с тем, что торф оказывает большое гидравлическое
сопротивление проходящей через него жидкости и не позволяет
обеспечить необходимую скорость отбора гидролизата, широко
распространенный перколяционный способ гидролиза не пригоден
для торфа. Кроме того, невысокое содержание целлюлозы в тор-
фе не дает заметного повышения РВ при увеличении времени
гидролиза, а замедленная скорость фильтрации приводит к раз-
ложению образующихся из легкогидролизуемой части моносаха-
ридов. Низкая скорость диффузии сахаров из частичек торфа
не дает возможности полностью удалять их из гидролизуемой
массы и гидролизат не насыщается сахарами.
Для гидролиза торфа предложен целый ряд способов, учи-
тывающих особенности его состава и свойств.
Рассмотрим наиболее перспективный непрерывный способ
гидролиза торфа разбавленной серной кислотой, технологическая
схема которого приведена на рис. 15.
3*
67
Рис. 15. Технологическая схема гидролиза торфа (по В. И. Шаркову
и др., 1973)
Верховой торф малой степени разложения смешивается с водой
до гидромодуля 8—10 и превращается в пульпу в смесителе /.
Из смесителя водная пульпа насосом 2 под давлением 0,6—
0,8 МПа подается в смеситель инжекторного типа 3, где происхо-
дит смешение с определенным количеством концентрированной
серной кислоты для обеспечения 0,5—0,7%-ной ее концентра-
ции. После этого пульпа нагревается острым паром до темпера-
туры 160—170°С в подогревателе 4 и поступает в реактор
5, работающий в режиме идеального вытеснения, где происходит
гидролиз торфа. Время пребывания в трубчатом реакторе
5, обеспечивающее получение максимального количества РВ,
регулируется дозатором выдачи 6, через который смесь гидроли-
зата и частичек торфа поступает в испаритель 7. В нем отделя-
ются пары самоиспарения, с которыми удаляется большая часть
летучих примесей, и температура гидролизата снижается до 100 —
105°С. Из испарителя 7 гидролизат поступает в сборник гидро-
лизата 8 и затем насосом подается в отстойник 9 для отделения
осадка. После отделения осадка осветленный гидролизат из от-
стойника 9 идет на дополнительную обработку, аналогичную
подготовке гидролизатов растительного сырья (см. рис. 11).
После этого нейтрализат поступает в отделение ферментации.
Подготовка отходов целлюлозно-бумажной промышленности
для культивирования микроорганизмов. Основными отходами
целлюлозно-бумажной промышленности являются предгидроли-
заты и сульфитный щелок.
Предгидролизаты образуются при первичной обработке дре-
весной щепы горячей водой для удаления гемицеллюлоз. При
этом отщепляется содержащаяся в древесине связанная уксусная
кислота и, переходя в водный раствор, создает в нем слабокис-
лую реакцию (pH ~ 4,5). Это способствует протеканию частич-
ного гидролиза гемицеллюлоз и накоплению в водном растворе
продуктов ее деполимеризации. При варке целлюлозы образуется
До В м3 предгидролизатов на 1 т перерабатываемой древесины.
Технология подготовки предгидролизатов для культивиро-
68
вания микроорганизмов аналогична процессу обработки гидро-
лизатов растительного сырья, приведенному на рис. 11.
Вторым отходом целлюлозно-бумажной промышленности яв-
ляется сульфитный щелок, объем которого составляет 6,5—8 м3
на 1 т полученной целлюлозы.
В промышленности для выделения целлюлозы из древесины
широкое распространение получил сульфитный метод, при кото-
ром древесину обрабатывают при повышенном давлении и тем-
пературе водным раствором солей сернистой кислоты. Нецеллю-
лозные компоненты древесного сырья, переходящие при такой
обработке в раствор (сульфитный щелок), можно после соответ-
ствующей обработки и подготовки использовать в микробиоло-
гической промышленности.
Состав образующегося сульфитного щелока зависит от вида
используемого сырья, режима варки и выхода целлюлозы. В за-
висимости от состава варочной кислоты различают следующие
виды сульфитных варок:
1. Моносульфитная варка — процесс варки при pH 6—7,
когда в гидролизаппарате вся сернистая кислота (диоксид
серы) находится в связанном состоянии в виде моносульфита
кальция (СаБОз).
2. Бисульфитная варка — процесс варки при pH 4,0—4,2,
когда весь диоксид серы связан в виде гидросульфита кальция
Ca(HSO3)2 без избытка SO2 в среде.
3. Кислая бисульфитная варка — процесс варки при pH 1,0—
1,5, когда в варочной кислоте вместе с гидросульфитом кальция
имеется значительный избыток свободного SO2.
Для микробиологической переработки пригодны сульфитные
щелока бисульфитной и кислой бисульфитной варок.
По окончании процесса сульфитной варки целлюлозы щелок
в варочном котле обладает различной доступностью. Около
40% щелока вообще не связано с волокнами целлюлозы и может
свободно стекать из массы; еще около 40% распределено между
волокнами и пучками волокон целлюлозы (наружный щелок),
для его отделения требуется избыточное давление до 0,3 МПа;
15—20% щелока находится в полостях волокон целлюлозы и мо-
жет быть извлечено только диффузией в окружающий раствор
с меньшей концентрацией щелока; около 5% щелока содержится
в клеточных стенках и удаляется только многократной промыв-
кой целлюлозной массы водой, что приводит к сильному раз-
бавлению щелока, исключающему его переработку. Таким образом
на переработку может быть направлено не более 95% объема
полученного в варочном котле сульфитного щелока.
Отбор всего сульфитного щелока из варочного котла значи-
тельно снижает его производительность из-за затрат времени, не-
обходимого для стекания щелока, вытеснения его оборотным щело-
ком и последующей ступенчатой промывки. Для увеличения произ-
водительности варочных котлов широкое распространение полу-
чил ступенчатый метод отбора сульфитного щелока с использованием
69
вода
Рис. 16. Технологическая схема отбора сульфитного щелока
(по В. И. Шаркову, 1973)
промежуточной емкости (сцежи), технологическая схема которо-
го приведена на рис. 16.
Из варочного котла 2 после окончания процесса варки и
проведения сдувки в сборник крепкого щелока 3 собирается
свободно стекающий щелок. После отбора этой части щелока
в котел 2 медленно подается из сборника 4 первый оборотный
щелок, вытесняющий находящийся между волокнами щелок,
который поступает в сборник 3. Это позволяет без разбавления
отобрать до 50% сульфитного щелока, находящегося в котле.
После окончания отбора крепкого щелока вся масса из
варочного котла 2 вымывается первым оборотным щелоком
(из сборника 4) в сцежу 1, представляющую собой емкость
из железобетона, облицованную кислотоупорными плитами и
имеющую специальное перфорированное ложное днище на высо-
те 0,5 м от днища сцежи, объем которой в 1,5—2 раза превышает
объем варочного котла 2. После выгрузки целлюлозы в сцежу
варочный котел вновь готов к следующему циклу варки целлю-
лозы.
Вымытая в сцежу 1 масса промывается вторым оборотным
щелоком из сборника 5, а стекающий под ложное дно раствор
направляется в сборник первого оборотного щелока 4. Затем в
сцежу подается из сборника 6 горячая вода для промывки цел-
люлозы, стекающий раствор направляется в сборник второго
оборотно^ щелока 5. После заполнения всех баков оборотными
щелокамй,яроводится дополнительная промывка целлюлозы во-
дой, последнего она выгружается из сцежи 1.
Такая схема позволяет отобрать не менее 90% щелока при
разбавлении его всего на 15—18%. Отобранный сульфитный
щелок в зависимости от сырья и условий варки (pH 1,5—2,0
или pH 3,5—4,2) имеет следующий состав (% по объему):
70
Общее сведение РВ .... 1,7—3,1
Летучие органические кислоты .... 0,2—0,5
Сернистая кислота (в пересчете на SOj) . 0,06—0,1
Метиловый спирт 0,03—0,06
Формальдегид 0,02—0,05
Фурфурол................. 0,02—0,06
Лигносульфоновые кислоты........... 3,5— 7,0
Гидросульфит кальция 0.03—0,8
Помимо концентраций ряда примесей, определяющих биоло-
гическую доброкачественность субстрата и приведенных ранее
(см. гл. 3, § 4), здесь необходимо отметить присутствие диоксида
серы, наиболее угнетающе действующего на рост и размножение
дрожжей. Концентрация свободного SO2 не должна превышать
0,005%, непосредственно титруемого SO2 — 0,03—0,06, альдегид-
носвязанного SO2 — 0,2—0,3%, содержание волокон целлюло-
зы — не более 0,05 г/л.
Для снижения концентраций вредных примесей до значений
ПДК сульфитные щелока перед культивированием должны прой-
ти обработку, включающую следующие стадии: отделение воло-
кон целлюлозы; десульфитацию, включающую как удаление сво-
бодного диоксида серы, так и выведение избытка сульфитов,
разрушение карбоксилсульфитных соединений, окисление ряда
сульфитов в сульфаты; нейтрализацию щелока с его после-
дующим охлаждением и отстаиванием (для щелоков кислой
бисульфитной варки).
Для повышения содержания усваиваемых моносахаров в
1,5—2 раза рекомендуется проведение инверсии сульфитных ще-
локов, аналогичное инверсии предгидролизатов и гидролизатов
растительного сырья. Технологическая схема процесса обработки
сульфитных щелоков приведена на рис. 17.
Сульфитный щелок с температурой 80—90°С поступает в
инвертор /, где в течение 2—3 ч происходит гидролиз олигосаха-
ридов. Из инвертора / сульфитный щелок направляется на отде-
ление волокон целлюлозы, осуществляемое на вакуум фильтре
Рис. 17. Технологическая схема подготовки сульфитных щелоков (по В. И. Шар-
кову и др., 1973)
71
2, так как волокна неблагоприятно влияют на процесс фермен-
тации дрожжей и забивают аппаратуру. Для предупреждения
потерь тепла в окружающую среду процесс проводят в закрытых
барабанных фильтрах. Отделенные на фильтре волокна целлю-
лозы направляют в сборник 3, а сульфитный щелок проходит
подогреватель 4, нагреваясь там до 90—95°С, и подается в бар-
ботажную колонну 5, где происходит отдувка сернистых соедине-
ний острым паром. Выходящая из колонны парогазовая смесь
конденсируется в конденсаторе 6 и направляется в систему реге-
нерации SO2.
Выходящий из колонны 5 щелок с температурой 105—108°С
отдает часть теплоты- в теплообменнике 4 и с температурой
80—85°С поступает в сборник-окислитель 7, в котором проду-
вается воздухом в течение 1-—3 ч для окисления растворимых
сульфитов в сульфаты. Степень окисления сульфитов в сульфаты
сильно зависит от температуры щелока, уменьшаясь при снижении
температуры. Для обеспечения не только полного окисления суль-
фитов, но и осаждения кристаллов гипса, присутствующего в лю-
бом щелоке, кислотность щелока не должна превышать 3,5. После
окисления в окислителе 7 сульфитный щелок бисульфитной варки
имеет pH 3,5—4,0 и может подаваться после осветления в отстой-
нике 8 на стадию культивирования дрожжей без дополнительной
обработки.
Сульфитный щелок после кислой бисульфитной варки имеет
pH 2—2,5 и должен подаваться на стадию нейтрализации, ана-
логичную приведенной на рис. 11. После стадии нейтрализации
сульфитный щелок с температурой 30—35°С и pH 3,7—4,2 по-
ступает на стадию ферментации для культивирования микроорга-
низмов.
Глава
3 ТЕХНОЛОГИЯ ПРОИЗВОДСТВА
БЕЛКОВЫХ ВЕЩЕСТВ И ЛИПИДОВ
МИКРОБНЫМ СИНТЕЗОМ
По данным ряда специалистов мировой дефицит белка к кон-
цу XX в. оценивается в 30—35 млн. т. Основным путем снижения
и ликвидации этого дефицита является производство биомассы
с помощью микробного синтеза, имеющее следующие преиму-
щества перед другими источниками белковых веществ: микроор-
ганизмы обладают высокой скоростью накопления биомассы,
которая в 5000—500 раз выше, чем у растений или животных;
микробные клетки способны накапливать очень большое коли-
чество белка (дрожжи — до 60%, бактерии — до 75% по массе);
в микробиологическом производстве за счет высокой специфич-
ности микроорганизмов отсутствует многостадийность; сам про-
цесс биосинтеза протекает в мягких условиях при температуре
30—45°С, pH 3—6 и давлении ~0,1 МПа, он менее трудоемок
по сравнению с получением сельскохозяйственной продукции
и органическим синтезом белков.
Все эти преимущества и предопределили быстрое развитие
технологии получения микробного белка, которое является самой
крупнотоннажной отраслью биотехнологии и открывает возмож-
ность промышленного производства с помощью микроорганизмов
важнейших кормовых добавок для животноводства и птице-
водства с высокой кормовой ценностью и в необходимом коли-
честве.
§ 1. Принципиальная технологическая схема
получения кормовой биомассы
Поскольку технология белковых веществ мало зависит от ти-
па используемого сырья, целесообразно рассмотреть вначале
общую технологическую блок-схему получения кормовой биомас-
сы, приведенную на схеме, по всем входящим в нее отделениям,
а затем перейти к особенностям проведения процесса в зависи-
мости от типа используемого источника углерода:
73
паР Термообработка
суспензии
I
I
Склад
готового продукта
Всякое производство требует наличия нормативного и аварий-
ного запаса исходных и вспомогательных веществ, обеспечиваю-
щего его нормальную эксплуатацию, в том числе и при времен-
ных перебоях в поставках. Вопросы поступления на завод и скла-
дирования веществ, служащих источниками углерода, азота,
фосфора, макро- и микроэлементов для культивирования произ-
водственных штаммов, выходят за рамки настоящего пособия
и не будут здесь рассматриваться.
Очень большое значение во всем процессе имеет отделение
получения засевной культуры (или отделение чистой культуры),
служащее для выделения чистой культуры посевного материала,
74
используемого для засева, подсева и пересева промышленных
ферментеров основной ферментации.
Обычно приготовление посевного материала проводится пе-
риодически, по мере необходимости, осуществляется р несколько
стадий (рис. 18) и начинается в микробиологической лаборато-
рии. Хранящиеся там штаммы-продуценты из пробирок 16 пере-
носят в конические качалочные колбы /5 со стерильной пита-
тельной средой, состав которой соответствует составу среды,
используемой в производстве. Колбы помещают на качалки и,
•проводя культивирование в оптимальных по температуре и pH
условиях, контролируют развитие микроорганизмов.
Чистую культуру, находящуюся в логарифмической стадии
роста, переносят в малый посевной аппарат 12 объемом 500 л
с подготовленной питательной средой. Питательную среду гото-
вят в специальном смесителе 7, снабженном рубашкой для обо-
грева и мешалкой. Все компоненты питательной среды поступают
из соответствующих сборников 1—5 через дозирующие устройст-
ва в биореактор 7, pH среды доводится до значения 5,5—5,8 ам-
миачной водой или известковым молоком. Одновременно в смеси-
тель подается жидкий источник углерода (субстрат), используе-
мый в данном производстве. Среду дополнительно обогащают
автолизатом дрожжей из автолизатора 6. После тщательного
перемешивания в течение 20 — 30 мин готовую питательную среду
перекачивают в отстойник 11, а если на заводе имеет место
инфициирование процесса посторонней микрофлорой, то среду
предварительно стерилизуют в греющей колонне 8 острым па-
ром и выдерживателе 9 в течение 10—15 мин. Стерильную пи-
тательную среду охлаждают в теплообменнике 10 и подают в
отстойник 11. На ряде производств питательная среда отдельно
не готовится, а отбирается из основного производства и в отде-
Рис. 18. Схема получения засевного материала (по И. М. Грачевой, и др., 1980)
75
лении чистой культуры только отстаивается в отстойнике 11, а при
необходимости предварительно стерилизуется.
Первоначально в посевной аппарат 12 подают около 40 л
питательной среды, разбавляют ее 4 — 4,5 раза стерильной
водой и при интенсивной аэрации добавляют остальное коли-
чество питательной среды (80—100 л), поддерживая при этом
значение pH на уровне 4,5—5,5 подачей аммиачной воды. Затем
из качалочных колб вносят микробную суспензию объемом 1,5—2 л
и проводят процесс культивирования до накопления в среде 3,5 —
4,0 Г кл^ток по абсолютно сухому веществу (АСВ). Обычно
продолжительность этого процесса не превышает 15—18 ч. Вся
полученная в аппарате 12 суспензия (около 300 л) подается
в большой посевной аппарат 13 объемом 4—5 м3, предварительно
заполненный питательной средой (около 200 л) и стерильной
водой (1,2—1,5 м3), включается аэрация и при постоянном
доливе 70—75 л/ч питательной среды и добавлении аммиачной
воды для поддержания заданного значения pH проводится куль-
тивирование в течение 10—12 ч.
На следующей стадии процесса проводится выращивание
засевной культуры в ферментере 14 объемом 15—20 м3.'Аппарат
на 10% (по объему) заполняется стерильной или прокипяченной
водой, туда же вводится около 0,5 м3 питательной среды и пол-
ностью перекачивается все содержимое посевного аппарата 13
(2,5—2,7 м3). Выращивание посевного материала без отбора
суспензии продолжается 8—9 ч при интенсивной аэрации и
постоянном доливе питательной среды (170—200 л/ч) до накоп-
ления в ферментере биомассы в количестве 4—5 г АСВ/л. После
этого засевную культуру начинают отбирать на основное произ-
водство в количестве 1,3—1,7 м3/ч при одновременном доливе
питательной среды.
Процесс ферментации длится от 5 до 10 сут, а затем цикл
приготовления посевного материала возобновляется по мере на-
добности.
При необходимости отбора засевной культуры на основную
ферментацию с большей скоростью используется дополнитель-
ный ферментер объемом 40—50 м3, в котором процесс идет, как
описано выше для аппарата 14, а малый ферментер 14 работает
в схеме аналогично большому посевному аппарату 13. В этом
случае удается получить поток засевной культуры в количестве
7—10 м3/ч.
К подготовительным стадиям производства относится приго-
товление растворов питательных солей и микроэлементов, необ-
ходимых для нормального развития .микроорганизмов; техноло-
гическая схема этого участка приведена на рис. 19.
Необходимые соли со склада транспортером через дозировоч-
ные устройства (весы) подаются в заданном количестве в сме-
сители 1 или 2 (объемом .10—15 м3), работающие поочередно
для обеспечения непрерывной подачи растворов солей на стадию
76
Рис. 19. Технологическая схема приготовления и стерилизации
растворов питательных солей и микроэлементов, (по М. С. Мо-
сичеву, 1982)
ферментации. Смеситель предварительно заполняется водой на
50—60% (по объему), затем включается перемешивающее уст-
ройство и поочередно подаются необходимые соли, которые под-
бираются таким образом, чтобы при их совместном растворении
не образовывался осадок. Для повышения скорости растворения
ряда солей в рубашку аппаратов 1 и 2 может подаваться грею-
щий пар. Процесс растворения продолжается 20—30 мин, затем
раствор поступает в отстойник 3, где удаляются нерастворимые
примеси и осадок, если он образовался при совместном растворе-
нии солей.
Осветленный раствор после отстойника 3 насосом 4 перека-
чивается на стадию ферментации. Если в качестве растворителя
использовалась отработанная культуральная жидкость (ОКЖ),
то для снижения инфицированности посторонней микрофлорой
раствор проходит тепловую стерилизацию на установке непре-
рывной стерилизации, включающей в себя: 1) теплообменник-
рекуператор 5 для подогрева исходного раствора до 60—70°С;
отходящим после стерилизации горячим потоком; 2) греющую
колонну 6, где прямой поток прогревается острым паром
(р-04 МПа) до температуры 120—130°С; 3) выдерживатель 7 —
основной аппарат, где раствор находится в течение 10—15 мин и
происходит гибель микроорганизмов; обычно выдерживатель вы-
полняют в виде реактора идеального вытеснения, так как время
стерилизации при этом минимально.
Для повышения технологичности процесса обычно весь необ-
ходимый набор минеральных компонентов группируют в два раст-
вора, которые параллельно подаются в основной ферментер;
1) раствор всех макроэлементов (N, Р, К), необходимое коли-
чество которых составляет 5—70 г/л; 2) раствор микроэлементов
(Mg, Мп, Fe, Zn и т. д.), концентрации которых не превышают
5—10 мг/л.
Отделение компримирования воздуха существует только на
тех заводах, где установлены ферментеры, требующие для рабо-
77
ты больших потоков воздуха под избыточным (около 0,3—
0,5 МПа) давлением, и использует, как правило, центробежные
компрессоры большой производительности. В случае применения
на основной ферментации трубоэжекционных самовсасывающих
мешалок необходимость в сжатом воздухе ограничивается его
подачей в отделение чистой культуры.
Технологические потоки из всех подготовительных отделений
поступают на главную стадию производства — стадию фермен-
тации.
Основным аппаратом в этом отделении является ферментер —‘
аппарат полного смешения по жидкой фазе, обеспечивающий:
1) рост и развитие популяций микроорганизмов в объеме жидкой
фазы; 2) транспорт питательных веществ к клеткам микроорга-
низмов; 3) отвод от микробных клеток продуктов их обмена
(метаболизма); 4) отвод из среды тепловыделений клеток как
результата их жизнедеятельности.
Исходя из вышеприведенных требований к ферментеру,
простейший аппарат должен иметь: 1) емкость /, обеспечиваю-
щую большой рабочий объем для роста микроорганизмов;
2) системы ввода и вывода жидкостных и газовых потоков 2;
3) систему перемешивания 3, обеспечивающую полное смешение
по жидкой фазе и интенсифицирующую массо- и теплопередачу
при определенной турбулентности потока; 4) систему дисперги-
рования газовой фазы в ферментере 4, необходимую для ускоре-
ния массопередачи из газовой фазы в жидкую; 5) теплообменные
устройства 5, позволяющие быстро отводить теплоту из зоны
реакции.
В промышленности получили широкое распространение не-
сколько типов ферментеров, отличающихся по своей конструк-
ции, сложности работы с учетом вида используемого сырья (жид-
кое, газообразное, водорастворимое или нет), количеству полу-
чаемой биомассы, и связанные в различные технологические
схемы:
— батарея параллельно работающих ферментеров позволяет
обеспечить большую производительность завода, использующего
в качестве исходного сырья моносубстрат;
— батарея последовательно работающих ферментеров приме-
няется в случае использования сложного субстрата, компоненты
которого ассимилируются штаммом-продуцентом с различной
скоростью, для обеспечения наиболее полной утилизации всех
углеродсодержащих компонентов;
— батарея последовательно работающих ферментеров с допол-
нительной промежуточной подачей питательной среды (с под-
питкой) обычно необходима в том случае, когда высокая кон-
центрация субстрата ингибирует или угнетает рост и развитие
микробной популяции, а малая концентрация не позволяет дос-
тигнуть экономически оправданной концентрации биомассы в
отходящей на стадию сгущения суспензии;
— батарея последовательно работающих ферментеров с рецир-
78
куляцией части суспензии микроорганизмов используется в
случае применения сложного трудноутилизируемого субстрата,
когда микроорганизмам требуется длительное время адаптации
к одному или нескольким компонентам сырья; в этом случае
введение некоторого количества уже адаптированных к данному
субстрату клеток позволяет значительно сократить время пребы-
вания микроорганизмов в ферментере, увеличить скорость про-
тока и повысить степень утилизации субстрата;
— батарея последовательно соединенных ферментеров с под-
питкой и рециркуляцией суспензии микроорганизмов позволяет
успешно решить задачу наиболее полной утилизации много-
компонентного трудноусваиваемого субстрата, ингибирующего в
высоких концентрациях микробные клетки.
Для решения проблемы повышения производительности заво-
да, работающего на сложном сырье, возможно параллельное
включение батареи ферментеров по одной из вышеприведенных
схем.
В обычных условиях стараются применять наиболее простое
сочетание промышленных ферментеров, обеспечивающее получе-
ние микробной суспензии после стадии ферментации с концентра-
цией 10—25 кг/м3(1—2,5% АСВ), которая и поступает в отделе-
ние сгущения суспензии микроорганизмов.
Основной задачей стадии сгущения или выделения является
повышение концентрации биомассы до 12—16% АСВ за счет
механического отделения большей части межклеточной влаги
за минимальное время.
На практике в процессе производства белковых веществ
наиболее широко используется разделение на центробежных
сепараторах, а в ряде случаев употребляется сочетание сепара-
ции с такими малоэнергоемкими методами, как флокуляция,
коагуляция, флотация или декантация:
.— двухступенчатая сепарация широко применяется при
получении БВК на парафинах нефти с использованием дрожже-
вой культуры; наличие предварительной емкости — обезгажива-
теля, обусловлено необходимостью получения светлой суспензии
для обеспечения нормальной работы сепараторов и осуществля-
ется механически вращающимся диском либо с добавлением
химического пеногасителя; такая схема позврляет увеличить
концентрацию дрожжей с 1,0—1,5 до 12—14% АСВ, содержание
клеток в осветленной культуральной жидкости (ОКЖ) при хоро-
шей работе сепараторов обычно составляет 0,1—0,3 г/л;
— двухступенчатая сепарация с доочисткой ОКЖ на сепара-
торах наиболее часто применяется при сгущении бактериальной
биомассы, поскольку в этом случае концентрация клеток в ОКЖ
после сепараторов I и особенно II ступени может достигать
1—3 г/л, что может вызвать заметные потери продукта; для
снижения потерь в схему включен сепаратор, снижающий кон-
центрацию клеток в ОКЖ до 0,1—0,3 г./л, а тяжелая фракция
возвращается на сепараторы I ступени;
79
— трехступенчатая сепарация с предварительной флотацией
широко применяется в случае хорошей флотируемости микробной
суспензии, что имеет место при культивировании дрожжей на
гидролизатах растительного сырья; использование флотатора
позволяет повысить концентрацию биомассы, поступающей на
сепараторы, в 2—3 раза (особенно при использовании двух-
ступенчатого флотатора); наличие трех ступеней сепарации в
данном случае вызвано необходимостью обязательной двукрат-
ной водной промывки суспензии от субстрата (в соотношении
1:1 после I ступени сепарации и 1:0,5 после II ступени), ко-
торая обеспечивает придание готовому продукту товарного
цвета;
— двухступенчатая сепарация с предварительной деканта-
цией используется только в случае культивирования микроор-
ганизмов на нефтяных дистиллятах (НД) и позволяет доста-
точно эффективно отделить большую часть водной фазы от сус-
пензии клеток в органической фазе в декантаторе; введение ПАВ
(сульфурид) в органическую фазу позволяет перевести дрож-
жевые клетки в водную фазу и на I ступени сепарации отделить
их от депарафинизированного дизельного топлива, а в сепара-
торах II ступени повысить концентрацию клеток до 20—22%
АСВ.
На ряде заводов производства БВК призвано целесообразным
проводить предварительный нагрев суспензии перед II ступенью
сепарации до 60—70°С, что позволяет снизить вязкость суспен-
зии и получить содержание клеток после II сепарации до 20—
22% АСВ, а это, в свою очередь, дает возможность отказаться
от очень энергоемкой стадии концентрирования методом выпа-
ривания.
Сконцентрированная до 15—17% АСВ микробная суспензия
должна пройти стадию термообработки, в процессе которой при
температуре 75—85°С в течение 10—40 мин погибает штамм-
продуцент и практически вся сопутствующая микрофлора. Нали-
чие этой стадии продиктовано необходимостью получения гото-
вого продукта из инактивированных клеток. Одновременно с этим
повышение температуры суспензии способствует снижению ее
вязкости и пенообразования в процессе последующего кон-
центрирования.
Дальнейшее концентрирование суспензии в отделении выпари-
вания до концентрации 23—25% АСВ проводят в 3-корпусной
вакуум-выпарной установке, в которой инактивированная био-
масса последовательно проходит три корпуса вакуум-выпарной
установки с выносными греющими камерами, где температура
кипения постепенно снижается (I корпус — 90°С, II — 75, III —
60°С). Обогрев кипятильных камер II и III корпусов осуществля-
ется вторичным паром, содержащим летучие продукты метабо-
лизма, что приводит к образованию кислого конденсата (pH ~
~4,5—5), который необходимо направлять на водоочистку.
Ввиду высокой вязкости суспензии клеток естественная циркуля-
80
влажная
биомасса
Рис. 20. Технологическая схема отделения сушки (по И. М. Грачевой
и др.. 1980)
ция в аппаратах сильно затруднена и для снижения локального
перегрева и предотвращения разрушения биологически активных
веществ в каждом аппарате осуществляется принудительная
циркуляция с использованием насосов, а температура выпарки
ограничена верхним пределом — 90°С.
Суспензия с концентрацией 22—25% АСВ поступает в отделе-
ние сушки, где и происходит образование готового продукта
с влажностью—10% (по массе). В процессе сушки из клеток
микроорганизмов удаляется большая часть внутриклеточной
влаги, что позволяет получить стабильную при хранении и удоб-
ную в потреблении кормовую биомассу.
В микробиологической помышлениости в основном использу-
ются конвективные сушилки (распылительные, кипящего слоя,
ленточные и барабанные). В крупнотоннажном производстве
белковых веществ практически повсеместно применяются лишь
распылительные сушилки, обеспечивающие малые потери био-
массы и большую (до 15 т/ч по испаряемой влаге) производи-
тельность.
Технологическая схема сушки представлена на рис. 20.
Суспензия микроорганизмов непрерывно подается на центробеж-
ный распыливающий механизм 5, которым разбрызгивается в
сушильную камеру 4, снабженную предохранительными клапа-
нами 6, в виде капель размером 60—80 мкм, что обеспечивает
большую поверхность теплоотдачи. Проходя воздухо-
дувку 1, нагретый до 350—450°С в топке 2 теплоноси-
тель подается по воздуховоду 3, соприкасается с каплями
суспензии: в доли секунды большая часть влаги переходит
в пар, что препятствует перегреву твердой частицы. Порошок
или гранулы сухой биомассы с температурой около 90°С (не вы-
ше!) опускаются в конусную часть сушилки и по пневмотран-
спортной линии 8 подаются в циклон-сепаратор 10, где отделяют-
ся от воздуха.
4—154 81
Рис. 21. Технологическая схема отделения грануляции (по М С Моси-
чеву и др., 1982; И. И. Бортникову, 1982)
Отходящий из сушильной камеры 4 воздух проходит по газо-
воду 7 через батарею циклонов 9, где освобождается от белковой
пыли и затем направляется на стадию окончательной очистки
газовоздушных выбросов (ГВВ).
Сухая биомасса, содержащая 8—10% (по массе) влаги, на
большинстве заводов представляет собой готовый продукт и
после упаковки направляется на склад и потребителю. Однако
в ряде случаев готовый продукт необходимо получать в виде
гранул и тогда в технологический процесс включают отделение
грануляции, технологическая схема которого представлена на
рис. 21.
Сухая и влажная (после выпарки) биомасса в соотноше-
нии 1:1 поступает во вращающийся барабанный гранулятор 3.
Влажная биомасса налипает на сухие частицы и вся масса
влажностью 45—50% (по массе) движется по образующей обе-
чайки аппарата, формируя гранулы, которые шнековым транс-
портером 5 подаются в сушилку кипящего слоя 6. Гранулы
подсушиваются до остаточной влажности 8—10% (по массе)
горячим воздухом (или топочными газами) с температу-
рой 260—300°С, подаваемым по воздуховоду 4 из топки 2,
воздуходувкой /.
Для получения более прочных гранул и уменьшения уиоса
биомассы с отходящим воздухом небольшое (около 3%) количе-
ство суспензии распыляется воздухом через диспергатор 8.
Отходящий через газовод 7 воздух направляется в циклон 9,
где очищается от мелких частичек и унесенной пыли и поступает
на дополнительную очистку ГВВ. Отделенная в циклоне 9 белко-
вая пыль вновь возвращается в гранулятор 3.
82
в атмосферу
очистку
Рис. 22. Технологическая схема очистки ГВВ (по И. И. Бортникову,
А. М. Босенко, 1982)
Подсушенные в верхней части сушилки гранулы опускаются вниз
и через шлюзовой затвор 10 поступают на классификатор //,
отделяющий мелкие гранулы в пыль, возвращаемые в грануля-
тор 3; товарные гранулы попадают в сборник готового продук-
та 12 и затем направляются на упаковку.
Заключительной стадией процесса получения кормовой био-
массы является стадия фасовки и упаковки готового продукта,
направляемого на склад. Сухая биомасса (порошок или гра-
нулы) поступает в приемный бункер и фасуется в бумажные
мешки с клапаном массой 25—30 кг, которые укладываются
на специальные поддоны. Готовые поддоны автопогрузчиком
отвозят на склад и отгружаются потребителю.
Обязательной стадией технологической схемы получения
белковых веществ является процесс очистки газовоздушных
выбросов (ГВВ), представляющих собой большие объемы воз-
духа, содержащего живые клетки микроорганизмов, белковую
пыль, другие продукты микробного синтеза.
Высокоэффективная очистка ГВВ из отделений ферментации,
флотации, сепарации, сушки, грануляции и вентиляционных
выбросов отделения упаковки осуществляется с помощью скруб-
беров Вентури (одинарного или двойного) (рис. 22), которые
обеспечивают снижение содержания загрязнений до предельно
допустимых концентраций (ПДК).
ГВВ подаются вентилятором 1 в трубу Вентури 3, где смеши-
ваются с вводимой под давлением через кольцевые отверстия
водой, которая, эффективно распыляясь, образует мельчайшие
83
4*
капли. На этих капельках происходит адсорбция примесей и
их частичная коагуляция. Вся газожидкостная смесь поступает
в инерционный аппарат 4, где газ частично отделяется от жид-
кости, проходит циклон-каплеотделитель 2 и очищенный воздух
направляется в дымовую трубу или выбрасывается в атмосферу.
Загрязненная вода из циклонов 2 и трубы Вентури 3 поступа-
ет в отстойник 5, где отделяется большая часть примесей. Более
чистая часть воды подается на повторное орошение трубы
Вентури 3, а загрязненная часть (15—25%) поступает на водо-
очистку.
Таким образом, очищая ГВВ, получают дополнительные коли-
чества загрязненной воды, в свою очередь требующей обработки,
которая осуществляется в общем для завода цехе очистки
сточных вод вместе со всеми остальными стоками завода.
§ 2. Технологические особенности
производства кормовой биомассы
на углеводородном сырье
Углеводородное сырье является одним из основных источни-
ков. углерода при получении кормовой биомассы. Поэтому в
первую очередь будут рассмотрены углеводородные субстраты,
используемые для культивирования микроорганизмов: очищен-
ные. н-парафины и нефтяные дистилляты.
Особенности культивирования микроорганизмов на очищен-
ных. н-парафинах. Очищенные жидкие н-парафины с температу-
рами кипения в пределах 200—340°С и длиной углеродной
цепи Сю—Сго, позволяют использовать в качестве продуцентов
как бактериальные, так и дрожжевые культуры, однако в насто-
ящее время получили распространение почти исключительно
дрожжи рода Candida: С. guilliermondii, С. maltosa, С. sake,
среди которых имеются и термотолерантные штаммы. Эти микро-
организмы при оптимальных условиях культивирования (pH, t°)
способны обеспечить высокий экономический коэффициент усво-
ения субстрата (н-алканов) —до 110%, накапливают большое
количество белка (свыше 60%) при достаточно высокой скорости
протока (до 0,22 ч-1) на оптимально составленной питательной
среде.
При использовании н-парафинов вопрос состава питательной
среды становится особенно актуальным ввиду практически пол-
ного отсутствия макро- и микроэлементов в самом сырье'. Кроме
того, очень заметное влияние на количество накапливаемого
клетками дрожжей белка оказывают количество и соотношение
вносимых в среду источников азота и фосфора, а также природа
соединений добавляемых элементов. По общепринятой схеме в
раствор макроэлементов вносят следующие соли: сульфат ам-
мония (—0,4 кг/м3); суперфосфат или аммофос ( — 1,5 кг/м3)
и хлорид калия ( — 0,9 кг/л). Раствор микроэлементов готовится
84
отдельно и состоит из ряда сульфатов, являющихся источниками
таких веществ, как магний, марганец, железо, цинк, медь,
натрий. Кроме того, для поддержания постоянным значения pH,
снижающегося в процессе культивирования, в ферментер по-
дается аммиачная вода, служащая одновременно дополнитель-
ным источником азота.
Условия культивирования дрожжей во многом определены
наличием в данном случае четырехфазной системы (газ —
вода — жидкие парафины — клетки дрожжей).
Изучение распределения клеток в жидких фазах показало,
что ~*/з клеток растет в водной фазе, потребляя капли пара-
фина диаметром менее 3 мкм, а ~2/з клеток адсорбируются
на поверхности парафиновых капель диаметром от 3 до 5 мкм.
Адсорбция на каплях большего диаметра незначительна, поэтому
диспергирование н-парафинов в водной фазе играет важную
роль в процессе культивирования. Кроме перемешивания на эф-
фективность диспергирования влияет поверхностное натяжение,
поэтому введение ПАВ снижает поверхностное натяжение и по-
вышает удельную скорость роста дрожжей.
Поскольку углеводородные субстраты могут усваиваться
дрожжами только в аэробных условиях, на эффективность про-
цесса большое влияние оказывает аэрация среды. На окисление
н-парафинов требуется в 2,6—2,8 раза больше кислорода, чем
на окисление углеводов, что вызывает и большее тепловыде-
ление в процессе культивирования. Таким образом, одновременно
с проблемой повышения интенсивности аэрации возникают воп-
росы обеспечения эффективного теплоотвода во время фермен-
тации.
Большое влияние на рост и развитие клеток дрожжей ока-
зывает pH среды, значение которого в процессе ферментации
поддерживается на уровне 4,0—4,5. Однако в качестве проме-
жуточного продукта окисления н-алканов выделяются жирные
кислоты, что снижает pH водной среды в процессе выращивания
и требует постоянной подачи щелочного агента (аммиачной
воды) в ферментер.
Одним из главных параметров процесса культивирования
клеток является температура среды, которая должна поддержи-
ваться на уровне 32—34°С. Выращивание при более высоких
(выше 36°С) температурах приводит к уменьшению скорости
роста клеток, снижению активности биосинтеза белковых ве-
ществ и, как следствие, понижению экономического коэффициен-
та усвоения субстрата. Ведение процесса при слишком низких
(ниже 28°С) температурах тоже снижает скорость роста кле-
ток, т. е. влечет за собой понижение продуктивности ферментера.
К технологическим особенностям процесса получения БВК на
н-парафинах следует отнести крупнотоннажность производства,
что сказывается на конструкции ферментеров и отделений пере-
работки.
На всех заводах нашей страны, работающих на жидких
85
парафинах, процесс культивирования проводится в ферментерах
марки Б-50 с эжекционной системой аэрации, представляющих
собой емкость в форме тора, общим объемом 800 м3 (рабочий
объем 320 м3), разделенную перегородками на 12 секций. Суспен-
зия клеток последовательно проходит все секции аппарата и из
последней выходит суспензия с минимальным содержанием н-
парафинов и максимальной концентрацией биомассы. Это до-
стигается наличием в ферментере Б-50 двухступенчатого куль-
тивирования: в секциях 1 — 9-й происходит активный рост и раз-
витие дрожжевых клеток, а в 10—12-й — процесс «дозревания»
биомассы. Он предусматривает выдерживание биомассы в сек-
циях, куда прекращена подача субстрата (н-алканов) и пита-
тельных веществ. Жизнедеятельность клеток осуществляется в
этом случае за счет эндогенных источников питания при одно-
временном использовании остаточных углеводородов. Стадия
«дозревания» (или голодания) дрожжей упрощает их выделение
и исключает необходимость экстрактивной очистки биомассы от
остаточных углеводородов. Все это обеспечивает более полное
использование н-парафинов и высокое качество получаемого
продукта.
Установленное в каждой секции эжекционное щелевое пере-
мешивающе-аэрирующее устройство обеспечивает хорошее пере-
мешивание и интенсивное смешение воздуха с жидкостью, насы-
щая ее кислородом воздуха.
Для отвода тепловыделений из ферментера, которое состав-
ляет 34—40 МДж/кг АСВ, в каждую секцию встроены змеевики
с теплообменной поверхностью 3000 м2.
Время выращивания дрожжей составляет 8—8,5 ч; произво-
дительность по АСВ >27 т/сут; исходная концентрация пара-
фина ~ 3?5% (по объему) ; содержание остаточных н-алканов
в ферментационной среде девятой секции 4 г/л; расход воздуха
на единицу рабочего объема 113 м3/м3- ч.
При установке в центральную часть ферментера дополни-
тельной 13-й секции общая производительность аппарата увели-
чивается на 10%. Предварительное сгущение дрожжевой суспензии,
выходящей из ферментера, осуществляется либо во флота-
торах с последующей сепарацией, либо сразу с помощью двух-
ступенчатой сепарации до концентрации 15—16% АСВ. Все ос-
тальные стадии выделения биомассы и получения готового про-
дукта аналогичны описанным ранее.
БВК, полученный на очищенных жидких парафинах, имеет
следующий состав (в %): сырой протеин — 50—60 и выше;
жиры — до 5; углеводы — 10 — 20; зола, влага — до 10; оста-
точные углеводороды — не более 0,1. Он является товарным
продуктом, пригодным для использования в качестве кормовой
добавки в корм сельскохозяйственным животным.
Особенности культивирования микроорганизмов на нефтяных
дистиллятах. При проведении такого варианта процесса возмож-
но получение сразу трех целевых продуктов: кормовой биомассы,
86
Рис. 23. Технологическая схема отделения экстракции биомассы (по И. М. Граче-
вой, 1980)
ннзкозастывающего дизельного топлива и биожира. Кроме того,
в этом процессе не требуется выделять и очищать н-парафины,
так как микроорганизмы сами селективно утилизируют фрак-
цию н-алканов из дистиллятов. Экономически целесообразно ис-
пользовать дистилляты нефти, выкипающие в интервале темпе-
ратур 240—360°С и содержащие не менее 15% н-парафинов.
По условиям культивирования, составу питательной среды и
используемому штамму-продуценту этот процесс практически
аналогичен рассмотренному получению БВК на н-парафинах.
Однако концентрация нефтяных дистиллятов в ферментере со-
ставляет 10—30% (в зависимости от концентрации в ней н-ал-
канов), что позволяет на стадии выделения использовать декан-
тацию с последующей сепарацией. Для наиболее полной депара-
финизации дизельного топлива возможно применение двухсту-
пенчатой ферментации, что позволяет понизить температуру за-
стывания топлива на 20—25°. В связи с присутствием в среде
широкой фракции углеводородов обязательной стадией при вы-
делении биомассы является экстракция из кормовых дрожжей
остаточных углеводородов, прежде всего непарафиновой струк-
туры; в ее ходе идет и извлечение биожира. Технологическая
схема экстракционной очистки, включающая подготовительное и
экстракционное отделения, представлена на рис. 23.
В подготовительном отделении сухой препарат после распыли-
тельной сушилки поступает в увлажнитель-гранулятор 1, где
увлажненная острым паром биомасса продавливается через
фильтры и влажные гранулы направляются на вальцы плю-
щильного станка 2. Размер зазора между вращающимися валь-
цами определяет толщину получаемого лепестка, которая обычно
составляет 0,1—0,2 мм.
Полученные лепестки элеватором подаются на распылитель
ленточной сушилки 3, в которой сушатся до остаточной влаж-
ности 8—10% (по массе) горячим воздухом. Сухие чешуйки
с температурой около 80°С проходят классификатор 4, где от-
87
деляются пыль и мелкая фракция. Отделенная пыль и мелкие
частички возвращаются иа грануляцию в аппарат I, а готовый
лепесток конвейером подается в противоточный экстрактор 5.
В экстрактор, снабженный самовыгружающимися сетчатыми
корзинами с горячим лепестком, противотоком подается раст-
воритель (обычно бензин), в котором растворяются остаточные
углеводороды и клеточные липиды. Обезжиренная таким образом
биомасса (биошрот) из последней корзины выгружается в при-
емную часть экстрактора и подается в десольвентор 6, снаб-
женный вращающимися перфорированными тарелками и скреб-
ковыми приспособлениями. Под действием пара и высокой тем-
пературы в десольвенторе 6 происходит удаление из биомассы
растворителя, который конденсируется в холодильнике-конденса-
торе 7 и стекает в отстойник 13. Освобожденная от растворителя
и частично подсушенная биомасса транспортером разгрузки де-
сольвентора 6 передается на стадии грануляции и фасовки.
Полученная на стадии экстрации мисцелла (раствор угле-
водородов и липидов в растворителе) из экстрактора 5 подается
на дистилляцию в аппарат 9, где происходит отгонка основ-
ного количества бензина (растворителя). Сконденсированный
бензин поступает в отстойник 13, а концентрированная мисцелла
подается в отпарную колонну 8 пленочного типа для оконча-
тельной отгонки остатков растворителя острым паром.
Выходящий из колонны 8 биожир с содержанием бензина
не более 0,4% (по массе) подается на стадию выделения и
фракционирования липидов, а конденсат поступает в отстойник
13. В нем происходит расслоение бензиновой и водной фаз
и отделение основного количества воды, которая поступает на
очистку, а бензин направляется в ректификационную колонну
10 на окончательную очистку. Очищенный бензин поступает в
сборник 11, откуда насосом 12 возвращается на экстракцию,
а отделенная вода — на очистку от остатков бензина.
Кормовая дрожжевая биомасса, полученная на нефтяных
дистиллятах, характеризуется следующим составом (%): сырой
протеин — 58—65; липиды — менее 3; остаточные углеводоро-
ды — не более 0,05; зола — до 10; влажность — до 10. Вы-
ход биомассы составляет от 100 до 300 кг на 1 т нефтяных
дистиллятов.
Особенности культивирования микроорганизмов на природ-
ном 'газе. Природный газ — один из перспективных источников
углерода в решении проблемы получения белковых продуктов
из непищевого сырья. Помимо широкой распространенности и
хорошей транспортабельности к его преимуществам следует от-
нести невысокую стоимость метана, практически полное отсутст-
вие в нем ингибирующих примесей, а также легкое и полное
удаление его из среды на всех стадиях переработки.
Однако при получении белковых веществ из метана возни-
кает и целый ряд технологических трудностей, например мед-
ленный рост микроорганизмов и их повышенная потребность
88
в кислороде (в 5 раз выше, чем на углеводах, и в 2—2,5 раза
выше, чем на н-парафинах); низкая растворимость метана в
культуральной жидкости (не более 0,02 г/л при атмосферном
давлении); взрывоопасность (в интервале концентраций 5—15%
по объему метан образует с воздухом взрывоопасные смеси).
Все эти трудности обусловливают необходимость более сложного
аппаратурного оформления стадии ферментации.
В качестве продуцентов на метане используются метан-
окисляющие бактерии, основными из которых являются Methylo-
coccus capsulatus, относящиеся к облигатным метилотрофяым
микроорганизмам. Заслуживает внимания применение в процессе
биосинтеза смешанных культур, одни из которых усваивают
метан, а другие — продукты окисления гомологов метана, что
позволяет смешанной популяции развиваться более активно, чем
чистые культуры.
В составе питательной среды для культивирования необходи-
мо наличие источников азота, фосфора, калия, микроэлементов
и других ростовых факторов. Потребность в азоте бактериаль-
ные штаммы могут удовлетворять за счет нитратов, солейам-
мония, аммиака и даже молекулярного азота, однако вид. ис-
точника азота в большей степени определяет экономический
коэффициент усвоения субстрата (У), который равен для NH^-
формы 0,85, для нитратной формы 0,70, а удовлетворение, по-
требности в азоте его молекулярной формой снижает У до 0,65.
В связи с культивированием олигонитрофильных бактерий
концентрация азота в питательной среде должна составлять
18—30 мг/л; более высокая угнетающе действует на рост клеток.
Источником фосфора для биосинтеза могут служить различные
соли фосфорной кислоты. Оптимальная концентрация фосфатов
в среде 1—5 г/л. Микроэлементы, как правило, в среду не; до-
бавляются, так как считается, что их вполне достаточно в
воде и солях, используемых для приготовления среды. Одно-
временно отмечено, что рост бактерий улучшается при добав-
лении небольшого количества дрожжевого автолизата или био-
тина.
Специфичность процесса культивирования метанокисляющих
бактерий на природном газе заключается в том, что основные
питательные вещества — это газы (метан и кислород), которые
необходимо подвести в достаточном количестве к стенкам кле-
ток. Кроме того, оптимальная концентрация метана зависит от
соотношения метангвоздух или метан.кислород. Термодинамиче-
скими расчетами установлено, что потребность бактерий в кис-
лороде в 2—3 раза превышает их потребность в метане.
Однако такое стехиометрическое соотношение метангвоздух-ле-
жит в интервале взрывоопасных концентраций и с учетом этого
фактора процесс культивирования ведут при составе газовой
фазы, отличающейся от оптимального в сторону избытка метана
при соответствующем лимите по кислороду.
Одновременно с этим отмечено, что присутствие в газообраз-
: 89
ной смеси диоксида углерода в концентрациях от 3 до 10%
(по объему) улучшает рост бактерий, а содержание кислорода
выше 18% (по объему) вызывает гибель клеток. Метанокисляю-
щие бактерии растут при pH 6,5—7,1 и температурах 34—38°С.
Для обеспечения эффективного роста клеток обычно используют-
ся ферментеры с интенсивным тепло- и массообменом, который
обеспечивается увеличением скорости газового потока, улучше-
нием перемешивания и повышением рабочего давления в аппара-
те для повышения растворимости газов.
К ферментерам, наиболее полно удовлетворяющим этим
требованиям, можно отнести струйные ферментеры.
Поскольку в прямоточной системе за один проход степень
утилизации метана не превышает 20%, то предложены системы
с рециркуляцией газовой смеси. В этом случае вместо воздуха
возможно применение кислорода и степень утилизации метана
и кислорода в зависимости от степени рециркуляции достигает
90 и 95% соответственно.
Для обеспечения рециркуляции в струйном ферментере вы-
делившийся из жидкости газ вновь подают на вход шахтных
переливов, чем обеспечивается хорошая циркуляция газовой
смеси. Для повышения растворимости газов, особенно метана,
в водной фазе и снижения лимитирования роста бактерий по
субстрату возможно включение струйных ферментеров в работу
под избыточным давлением. Концентрация суспензии, выходя-
щей из ферментера, достигает 4—6% АСВ.
К особенностям проведения процесса сгущения следует от-
нести предварительную коагуляцию бактерий, а при получении
готового продукта — необходимость грануляции бактериальной
биомассы.
Получаемая на метане кормовая бактериальная биомасса
имеет следующий состав (% по массе): сырой протеин — до 75;
липиды — до 5; зола — до 10; влага — до 10; нуклеиновые кис-
лоты — до 10.
Полученный таким образом кормовой белок по своей пита-
тельной ценности и сбалансированности по аминокислотному
составу сравнивают с рыбной мукой или соевым шротом.
§ 3. Получение микробного белка на низших спиртах
Особенности культивирования микроорганизмов на метаноле.
За последние годы как у нас в стране, так и за рубежом много
внимания уделяется разработке технологии получения кормо-
вой биомассы на метаноле.
Основными преимуществами этого субстрата являются высо-
кая чистота метанола, отсутствие канцерогенных примесей, хо-
рошая растворимость в воде, высокая летучесть, позволяющая
легко удалять его остатки из готового продукта. Наличие в
молекуле метанола атома кислорода снижает тепловыделение,
а следовательно, и затраты на охлаждение (по сравнению с
н-парафинами). Кроме того, биомасса, полученная на метаноле,
90
не содержит нежелательных примесей, что дает возможность
исключить из технологической схемы стадии очистки, а строи-
тельство установки производства кормовой биомассы в комплек-
се с цехом получения метанола — утилизировать теплоту син-
теза метанола на стадиях выделения биомассы.
Одновременно с этим, однако, необходимо учитывать при
проведении процесса и такие особенности метанола, как горю-
честь и возможность образования с воздухом взрывоопасных
смесей в диапазоне концентрации 6—35% (по объему), а также
высокую токсичность метанола, требующие при работе с ним
определенных мер предосторожности.
В качестве продуцентов, использующих метанол в конструк-
тивном обмене, были изучены как дрожжевые, так и бактери-
альные штаммы. Из дрожжей были рекомендованы в произ-
водство Candida boidinii, Hansenula polymorpha и Piehia pasioris,
оптимальные условия развития которых (температура 34—37°С;
pH 4,2—4,6) позволяют проводить процесс с экономическим
коэффициентом усвоения субстрата до 0,40 при скорости протока
в интервале 0,12—0,16 ч . Среди бактериальных культур при-
меняется Methylomonas clara. Pseudomonas rosea и другие,
способные развиваться при температуре 32—34°С, pH 6,0—6,4
с экономическим коэффициентом усвоения субстрата до 0,55
при скорости протока до 0,5 ч_|.
Очень перспективными при культивировании являются смеси
культур, одна из которых потребляет только метиловый спирт,
а другие — остальные субстраты и продукты собственного мета-
болизма. В этом случае наблюдаются значительное увеличение
скорости роста клеток, повышение оптимальной скорости про-
тока (с 0,2 до 0,64 ч~’), большая устойчивость к инфицирова-
нию, возможное повышение температуры культивирования и воз-
растание коэффициента выхода.
При подготовке питательной среды помимо традиционных не-
органических источников макро- и микроэлементов желательно
в качестве дополнительного источника азота, а также биологи-
ческих стимуляторов и витаминов внесение дрожжевого авто-
лизата, так как максимальная скорость роста дрожжей наблю-
дается при содержании биотина Л0 мкг/л; тиамина 100 мкг/л
или дрожжевого экстракта в количестве 50 мг/л.
Особенности процесса культивирования во многом обуслов-
лены применяемым штаммом-продуцентом (дрожжи или бакте-
рии) и условиями асептики (асептическая или частично
неасептическая ферментация). Так, ряд зарубежных фирм
предлагает использовать дрожжевые штаммы и проводить выра-
щивание в отсутствие строгой асептики. В этом случае технологи-
ческий процесс протекает в ферментере эжекционного типа про-
изводительностью до 75 т АСВ в сутки, а удельный расход
метанола составляет 2,5 т/т АСВ.
При культивировании дрожжей в асептических условиях ре-
комендованы аппараты колонного или эрлифтного типа произво-
91
Рис. 24. Схема струйного ферментера объемом
1000 м3 (по И. И. Бортникову, А. М. Босен-
ко, 1982)
ных вод и
дительностью 75—100 т
АСВ/сут при расходе
метанола до 2,63 т/т
АСВ. В том и другом
случае процесс культи-
вирования проводится
одностадийно, без ста-
дии «дозревания» с не-
высокой концентрацией
субстрата (8—10 г/л),
так как при концентра-
ции выше 15 г/л на-
блюдается угнетение
роста и гибель клеток.
Остаточное содержание
метанола в отходящей
на сгущение суспензии
не превышает 50 мг/л,
а концентрация био-
массы достигает 30 г/л.
Низкое исходное содер-
жание метанола в сре-
де, его малая остаточ-
ная концентрация в
суспензии наряду с уст-
ранением неточностей
ферментационного обо-
рудования позволяют
снизить потери спирта
из-за его летучести, об-
легчить очистку сточ-
повысить степень использования метанола.
В ряде стран в качестве продуцентов применяются бакте-
риальные штаммы, процесс проводится в асептических условиях
в ферментерах эрлифтного или струйного типов производитель-
ностью 100—300 т/сут и расходом метанола до 2,3 т/т АСВ.
Ферментация осуществляется одностадийно при невысоких кон-
центрациях спирта (до 12 г/л) с высокой степенью утилизации
метанола.
Наиболее перспективным по своей конструкции является
струйный ферментер конструкции Института технической химии
АН ГДР (рис. 24).
Ферментер 4 (объемом 1000 м3 состоит из секций, распо-
ложенных одна над другой и соединенных между собой шахт-
ными переливами 3. Ферментационная среда из нижней секции
ферментера по напорному трубопроводу 2 подается центробеж-
ными циркуляционными насосами 1 в верхние шахтные перели-
вы 7, через которые проходит в низлежащую секцию, подсасывая
при этом воздух из газовода 5. Таким образом, среда протекает
92
из секции в секцию, постоянно подсасывая новые порции воз-
духа. Шахтные переливы создают определенный уровень среды
в секциях аппарата. Падающие струи в шахтных переливах
обеспечивают интенсивное аэрирование среды (высокую степень
диспергирования газа). Одновременно с этим интенсивная при-
нудительная циркуляция ферментационной среды обеспечивает
высокую турбулентность потоков, что улучшает массообменные
характеристики ферментера.
Питательная среда непрерывно подается в зону верхних
шахтных переливов, а микробная суспензия отводится из вы-
носных циркуляционных контуров. Отвод тепла осуществляется
с помощью теплообменников, расположенных на линиях цирку-
ляционных контуров. Выделившийся из жидкости газ собирается
в воздушном трубопроводе 6 н через систему очистки ГВВ
выбрасывается в атмосферу.
На стадии выделения для всех видов продуцентов преду-
смотрено отделение грануляции с целью получения готового
продукта в гранулах.
Кормовые дрожжи, полученные на метаноле, имеют следую-
щий состав (%): сырой протеин 56—62; липиды 5—6; золр —
7—11; влага 8—10; нуклеиновые кислоты 5—6. Бактериальная
биомасса характеризуется следующим составом (%): сырой
протеин 70—74; липиды 7—9; зола 8—10; нуклеиновые кислоты
10—13; влажность 8—10.
Особенности культивирования микроорганизмов на этаноле.
К достоинствам этого высококачественного сырья можно отнести
его малую токсичность, хорошую растворимость в воде, доста-
точно высокую летучесть, небольшое количество примесей и лег-
кость его утилизации практически всеми микроорганизмами.
Кроме того, за счет наличия в молекуле спирта кислорода
потребность в кислороде или воздухе ниже, а значит, меньше
тепловыделение и интенсивность аэрации, чем при использовании
н-алканов, что снижает затраты на получение продукта. Одновре-
менно с этим необходимо учесть, что этанол — легковоспламе-
няющаяся жидкость, образующая с воздухом взрывоопасные
смеси в интервале концентраций 3—20% (по объему).
В качестве микроорганизмов — продуцентов белка на этило-
вом спирте как единственном источнике углерода могут исполь-
зоваться дрожжи (С. utitis, S. lambica,. Hansenula anomala
и бактерии Acinetobacter calcoaceticus), которые, однако, имеют
гораздо меньшее практическое значение.
В случае использования дрожжевых культур оптимальное
значение pH составляет 4,0—4,5, температура 31—34°C, а при
культивировании бактерий — температура 32—35°С, pH 6,5—
7,5.
При подготовке питательной среды для дрожжей здесь, как и
для любого синтетического субстрата, готовятся отдельно раст-
воры макро- и микроэлементов, имеющие следующие концент-
рации (в г/л): I — (NH4)2HPO4 — 4,0; K2SO4 — 0,7; (NH4)H2PO4 —
• 93
1,0; II — MgSO4-7H2O — 0,2; СаС12Н2О — 0,1; NaCl — 1, а так-
же соли Mn2+, Fe+2 и Zn+2 с концентрациями 10 мг/л. Добавка
биотина (0,4 мкг/л) для дрожжевого автолизата (0,1 г/л) улуч-
шает рост дрожжей.
Процесс культивирования проводят одностадийно в ферменте-
рах с высокими массообменными характеристиками при кон-
центрации этанола не более 15 г/л (более высокие концентра-
ции спирта вызывают ингибирование роста дрожжей). Обычно
процесс выращивания проводят в асептических условиях без
избытка кислорода в среде, который только усиливает холостое
окисление спирта и снижает экономический коэффициент усвое-
ния субстрата. Во время ферментации имеет место интенсивное
ценообразование, которое тем больше, чем выше концентрация
спирта в среде и инфицированность в аппарате.
На стадии выделения кормовой биомассы в отделении сгу-
щения с успехом может использоваться флотация, а также
другие описанные выше методы.
Дрожжи, выращенные на этаноле, содержат (%): сырого
протеина 60—62; липидов 2—4; золы 8—10; влаги до 10.
§ 4. Получение белковых веществ на углеводном сырье
Исторически одним из первых субстратов, используемых для
получения кормовой биомассы, были гидролизаты растительных
отходов, предгидролизаты и сульфитный щелок — отходы цел-
люлозно-бумажной промышленности. Интерес к углеводному
сырью как основному возобновляемому источнику углерода зна-
чительно возрос еще и с экологической точки зрения, так как
оно может служить основой для создания безотходной техно-
логии переработки растительных продуктов.
Особенности культивирования микроорганизмов на гидроли-
затах растительного сырья и сульфитных щелоках. В связи с
тем, что гидролизаты представляют собой сложный субстрат,
состоящий из смеси гексоз и пентоз, среди промышленных
штаммов-продуцентов получили распространение виды дрожжей
С. utilis, С. scottii и С. tropicalis, способные наряду с гексозами
усваивать пентозы, а также переносить наличие фурфурола
в среде.
Сейчас на большинстве гидролизных заводов внедрены наи-
более продуктивные штаммы кормовых дрожжей С. scottii,
удовлетворительно утилизирующие наиболее трудноусвояемую
арабинозу и развивающиеся при температуре 36—38°С и pH
4,2—4,6. На гидролизных заводах широко используется также
совместное культивирование С. scottii и С. tropicalis, так как
штаммы С. tropicalis более урожайные, но в отличие от С. scottii
они не являются прототрофами, так как не способны сами син-
тезировать все витамины. Совместное же выращивание этих
культур обеспечивает высокий выход биомассы при относи-
тельно невысоких требованиях к субстрату.
Состав питательной среды в случае культивирования на
94
углеводородном сырье
значительно отличается
от применяемого при
выращивании микроор-
ганизмов на углеводо-
родном субстрате.
В гидролизатах и суль-
фитных щелоках име-
ются в небольшом ко-
личестве практически
все необходимые для
роста дрожжей микро-
элементы, перешедшие
в раствор из раститель-
ных тканей, основных и
вспомогательных мате-
риалов и внесенные с
водой. Недостающие
количества азота, фос-
фора и калия вводятся
в виде общего раствора
солей аммофоса, хлори-
да калия и сульфата
аммония в количествах,
обеспечивающих кон-
центрацию каждого
элемента в среде
(мг/л): азота — до 900;
фосфора (в пересчете
на Р2О5) — 400 — 450;
калия — до 30.
Помимо неорганических добавок с сырьем в ферментацион-
ную среду поступает большое количество органических веществ,
причем кроме углеводов, там содержатся и органические кис-
лоты. В сульфитных щелоках это уксусная и муравьиная кис-
лоты. Дрожжи утилизируют уксусную кислоту совместно с са-
харами в такой последовательности: глюкоза >уксусная кисло-,
та > манноза > ксилоза >• галактоза > арабиноза.
При использовании смешанных культур наблюдается прак-
тически полное потребление субстрата в случае применения
двухступенчатой последовательной или параллельно-последова-
тельной схемы соединения ферментеров, что является одной из
основных особенностей процесса культивирования.
Ферментация осуществляется в эрлифтных аппаратах конст-
рукции Лефрансуа-Марийе объемом 320 и 600 м3 (рис. 25).
Резервуар ферментера J имеет цилиндрическую форму с усе-
ченным днищем, предотвращающую образование застойных
зон. Рабочйй объем ферментера составляет 200—250 м3. По
воздуховоду 3 диаметром 400 мм от воздуходувки производи-
95
тельностью 10 тыс. м3/ч в ферментационную среду подается
воздух под избыточным давлением 40—60 кПа. В нижней части
воздуховодная труба 3 выполнена в виде раструба с поднятыми
вверх краями для образования кольцевой полости (кюветы) 7.
В кювету по отдельному трубопроводу 5 подается питательная
среда в смеси с субстратом, которая в виде тонкой пленки
стекает с краев по внешним стенкам кюветы. Стекающая из
кюветы жидкость подхватывается встречным потоком воздуха,
проходящим со скоростью 20—25 м/с через кольцевой зазор
высотой 20—25 мм между основанием кюветы и днищем аппа-
рата. В процессе насыщения питательной среды образуется
газожидкостная эмульсия, плотность которой (300—500 кг/м3)
значительно меньше плотности среды между корпусом аппарата
и циркуляционным диффузором 2. Газожидкостная смесь по
диффузору 2 поднимается вверх, а в нижней части на ее место
поступает новая порция среды, которая, дойдя до кюветы, в
свою очередь, насыщается воздухом и поднимается вверх по
диффузору 2. Так осуществляются постоянная направленная
циркуляция среды и ее эффективное перемешивание с вновь
поступающим субстратом. Это способствует выравниванию кон-
центрации сред по объему аппарата, улучшению газонаполнения,
снижению энергозатрат на перемешивание и увеличению средне-
го времени контакта воздуха с жидкостью. Гашение образующей-
ся при аэрации пены происходит без использования химических
и механических пеногасителей за счет давления столба газо-
жидкостной эмульсии в ферментере.
Для отвода выделяющейся в процессе биосинтеза теплоты
внутрь диффузора 2 встроен теплообменник 6 и предусмотрено
орошение водой 4 внешней поверхности корпуса аппарата.
На биохимических заводах большой мощности по производ-
ству кормовых дрожжей на углеводном сырье успешно эксплуа-
тируются барботажно-эрлифтные ферментеры объемом 1300 м3 с
многозонным воздухораспределением. Рабочий объем аппарата
условно разделен на 4—5 зон, в каждой из которых расположен
один циркуляционный диффузор, работающий аналогично опи-
санному выше ферментеру.
Процесс культивирования дрожжей во всех рассмотренных
аппаратах осуществляется в непрерывном режиме при скорости
протока, равной 0,2—0,25 ч-1 и значении pH 4,2—4,6, что обеспе-
чивает преимущественное развитие основного штамма-продуцен-
та. Оптимальная температура ферментации при выращивании
С. utilis составляет 30—35°С, С. tropicalis — 36—37, С. scottii —
38—40°С.
При размножении дрожжей на гидролизатах растительного
сырья или сульфитном щелоке происходит повышение кислот-
ности среды за' счет накопления в среде сульфат-ионов. Поэтому
для поддержания pH среды проводят подтитровку аммиачной
водой.
При рассмотрении особенностей технологической схемы
96
получения дрожжевой биомассы остановимся на двух, наиболее
широко используемых вариантах. По первому из них применяет-
ся двухступенчатая схема культивирования микроорганизмов
на неразбавленном сусле с концентрацией редуцирующих ве-
ществ (РВ) 3,0—3,5% (по массе) при частичной их утилизации
[остаток РВ=1,0—1,2% (по массе)] на первой ступени. Здесь
дрожжами ассимилируются гексозы как наиболее легко усвояемые
сахара, затем клетки отделяются от культуральной жидкости
и направляются на стадии выделения и получения готового
продукта. Отделенная культуральная жидкость с концентрацией
РВ=1,0—1,2% (по массе), содержащая в основном пентозные
сахара, поступает на вторую ступень ферментации, где для более
полной утилизации пентоз используются другие штаммы дрож-
жей или микроскопических грибов.
В другом варианте процесс проводится в двух последователь-
но соединенных ферментерах. В первый (головной) аппарат
подается разбавленное до содержания РВ=1,4—1,8% (по массе)
сусло, сюда же поступают питательные соли и все остальные
компоненты и проводится ферментация, во время которой проис-
ходит утилизация гексозных сахаров и уксусной кислоты (при
работе на сульфитных щелоках). Полученная дрожжевая
суспензия непрерывно перетекает во второй ферментер, где при
интенсивной аэрации без добавки субстрата происходит доутили-
зация остаточных моносахаридов и увеличение концентрации
дрожжей до 12—14 г/л. В этом случае использование смешанных
культур позволяет довести усвоение до 80% РВ субстрата при
выходе биомассы (по отношению к РВ) до 70%.
Суспензия дрожжей из второго ферментера поступает в
одно- или двухступенчатый флотатор и с концентрацией 25—
35 г/л через газоотделитель подается в отделение сепарации.
Трехступенчатая сепарация с двукратной промывкой дрожжево-
го концентрата водой для удаления пигментных примесей и
снижения зольности готового продукта обеспечивает повышение
концентрации дрожжей до 15—20% АСВ. Дальнейший процесс
получения кормовой биомассы не отличается от ранее описанного.
На ряде промышленных предприятий кормовые дрожжи обо-
гащают витамином D2 с помощью облучения их ультрафиолето-
вым светом. В этом случае содержащийся в липидной фракции
дрожжей эргостерин в количестве 0,2—0,6% (по массе) превра-
щается в витамин Dz- Поскольку этот переход происходит через
ряд изомерных продуктов, то при неравномерном облучении могут
образовываться вредные соединения, а при слишком интенсивном
облучении возможно частичное разрушение белка. Поэтому
витаминизации чаще подвергают суспензию дрожжей, прокачи-
ваемую по кварцевым трубкам при облучении кварцевыми
лампами. Это позволяет получить содержание витамина D2 до
5000 м.е. в 1 г сухой биомассы (1 мг чистого витамина D2 соот-
ветствует 40 000 международных единиц — м.е.).
Кормовые дрожжи, полученные при культивировании на
97
гидролизатах растительного сырья и сульфитных щелоках, име-
ют следующий состав (%): белок 43—58; липиды 2,3—3,0;
углеводы 11—23; зола — до 11; влажность — не более 10.
В случае использования гидролизатов растительного сырья
возможно кроме рассмотренного пути непосредственного биосин-
теза кормовой биомассы осуществление процесса комплексной
переработки гексоз и пентоз. По этой технологии в качестве
готовых продуктов получают этанол, углекислоту и кормовые
дрожжи.
В соответствии с этим направлением гидролизаты раститель-
ного сырья с большими содержаниями гексоз на первой стадии
подвергаются культивированию в анаэробных условиях, при этом
гексозы сбраживаются дрожжами до этилового спирта и угле-
кислоты с последующей отгонкой этанола ректификацией. Остав-
шаяся послеспиртовая барда, содержащая в основном пеитозы
и органические кислоты, поступает в ферментер, где в аэробных
условиях дрожжи утилизируют остаточные углеводы и кислоты,
давая в качестве конечного продукта кормовую биомассу.
Так, при переработке 1 т абсолютно сухой хвойной древесины
по прямой схеме получается 200—240 кг кормовых дрожжей,
а в комплексном процессе— 175—180 л этанола, до 70 кг
углекислоты и до 35 кг кормовой биомассы.
Особенности культивирования микроорганизмов на гидроли-
затах торфа. Одним из перспективных субстратов в производстве
кормовой биомассы являются гидролизаты торфа, имеющие в
своем составе большое количество легкоусвояемых моносахаров
(в основном пентоз) и органических кислот.
В процессе культивирования наиболее урожайных дрожжей
С. tropicalis используется гидролизат торфа, разбавленный
отработанной культуральной жидкостью до содержания РВ
1,6—1,7% (по массе). Дополнительно в состав питательной среды
вводятся лишь наибольшие количества суперфосфата и хлорида
калия. Все остальные ингредиенты присутствуют в гидролизате
торфа в достаточных количествах. Источником азота служит
аммиачная вода, подаваемая в ферментер для поддержания pH
в интервале 4,2—4,6.
Для обеспечения максимальной степени утилизации источни-
ков углерода процесс культивирования проводят в двух последо-
вательно соединенных ферментерах по схеме, аналогичной ранее
рассмотренной для гидролизатов растительного сырья. Выход
дрожжей достигает 65—68% от РВ. По качеству (особенно по
аминокислотному составу и меньшему содержанию золы —
6—8% в готовом продукте) кормовая биомасса, полученная на
гидролизатах торфа, превосходит дрожжи, выращенные на отхо-
дах растительного сырья.
Особенности культивирования микроорганизмов на зерно-
картофельной и мелассной барде. Барда, являющаяся отходом
спиртового и ацетонобутилового производства, содержит в своем
составе до 12% сухих- веществ, среди которых в наибольшем
98
количестве из усваиваемых микроорганизмами форм углерода
(в %) присутствуют карбоновые кислоты (до 20 от сухих ве-
ществ); редуцирующие вещества (до 7 от АСВ), аминокислоты
(до 3 от АСВ), глицерин и другие спирты (до 6 от АСВ). Учитывая,
что наличие таких источников углерода позволяет получить из
1 м3 барды до 13—14 кг сухой кормовой биомассы, эти отходы
также могут являться субстратом для производства микробных
кормов. Для повышения выхода дрожжей в перерабатываемую
барду приходится добавлять дополнительные вещества: свекло-
сахарную мелассу, кукурузный экстракт и другие углеродсодержа-
щие вещества, что повышает себестоимость кормовых дрожжей.
Поэтому экономически выгодным является выращивание дрож-
жей С. guiltiermoridii на смеси барды и гидролизатов раститель-
ного сырья.
Присутствующие в значительных количествах соли калия,
натрия, кальция, магния и других микроэлементов делают не-
нужной специальную их добавку в ферментационную среду.
Недостаток в барде азота и фосфора восполняется добавлением
в питательную среду соответствующих солей и минеральных
кислот.
В связи с утилизацией дрожжами содержащихся в субстрате
карбоновых кислот кислотность среды прогрессивно снижается
(pH растет), поэтому для поддержания pH среды необходима
добавка минеральных кислот. Наибольший выход биомассы на-
блюдается при pH 5,5—6,0 (до 74 г/л), но в этом случае
культуральная жидкость сильно вспенивается, что ухудшает
условия ферментации и выделения дрожжей. Поэтому в процессе
культивирования поддерживают значение pH на уровне 4,5—4,8,
при этом выход биомассы достигает 69 г/л при температуре 30—
33°С.
Присутствие в барде микробных клеток, оставшихся после
отделения спирта или ацетона, позволяет проводить культивиро-
вание как с отделением мертвых клеток, так и без него. При
периодическом или полунепрерывном процессе отделять клетки
нет необходимости, а в случае непрерывной ферментации возни-
кает необходимость в отделении мертвых клеток с предыдущей
стадии.
Состав кормовых дрожжей, полученных культивированием на
зерно-картофельной и мелассной барде, следующий (в % отн.):
сырой протеин 47—56; липиды 2—5; углеводы 14—22; зола 7—
10; влажность до. 10.
$ 5. Технология получения микробных липидов
Под липидами в производстве микробного белка подразуме-
ваются все растворимые в неполярных растворителях клеточные
компоненты микроорганизмов. В настоящее время активно ведут-
ся поиски новых источников получения жиров, прежде всего на
технические иужды. Дополнительным источником таких жиров
99
являются микроорганизмы, липиды которых после соответствую-
щей обработки могут быть использованы в различных отрас-
лях промышленности: медицинской, химико-фармацевтической,
лакокрасочной, шинной, кожевенной, горнорудной, металлурги-
ческой и др., что позволит высвободить значительные количества
масел животного и растительного происхождения для пищевых
целей.
Технологический процесс получения микробных липидов в
отличие от получения белковых веществ обязательно включает
стадию выделения липидов из клеточной биомассы методом
экстракции в неполярном растворителе (обычно бензине или
эфире). При этом одновременно получаются два готовых продук-
та: микробный жир (биожир) и обезжиренный белковый препа-
рат (биошрот).
В процессе культивирования микроорганизмов на различных
субстратах, а сырьем для этого процесса являются те же среды,
что и для производства кормовой биомассы, получаются три
класса липидов: простые, сложные липиды и их производные.
К простым липидам относятся нейтральные жиры и воски.
Нейтральные жиры, являющиеся основными запасными компо-
нентами клетки, представляют собой эфиры глицерина и жирных
кислот (моно-, ди- и триацилглицериды), основная масса кото-
рых — триацилглицериды. Воски — эфиры высших жирных ки-
слот или монооксикислот и алифатических спиртов с длинной
углеродной цепью, по своей структуре и свойствам близки к
нейтральным липидам. Обычно к воскам относят также эфиры
холестерина и витаминов А и D2. Наибольшее количество ней-
тральных липидов синтезируется в дрожжах и мицелиальных
грибах, а у бактерий преобладают сложные липиды. Простые
липиды находят применение как технологические смазки в
процессах холодной и тепловой обработки металлов.
Сложные липиды включают два больших класса соединений:
фосфолипиды и гликолипиды. К фосфолипидам относятся фосфо-
глицериды (эфиры глицерофосфорной кислоты и спиртов) и
сфинголипиды (производные ненасыщенных аминоспиртов
с длинной цепью, например сфингозина (А18), и жирной кислоты,
содержащие дополнительно остаток фосфорной кислоты, атом
водорода в которой замещен спиртовой группой, и не содержа-
щие в своей молекуле глицерина). Фосфолипиды являются
структурными компонентами клетки, входят в состав различных
мембран и принимают активное участие в переносе электронов.
Их молекулы весьма поляриы и при pH 7,0 фосфатная группа
несет отрицательный заряд.
Концентрат фосфолипидов находит применение в качестве
антикоррозионной присадки к маслам как добавка при флотации
различных минералов.
Гликолипиды в отличие от фосфолипидов не содержат моле-
кулы фосфорной кислоты, однако они также являются сильно-
полярными соединениями за счет наличия в молекуле гидрофиль-
100
ных углеводных групп (остатков глюкозы, маннозы, галактозы
и др.).
К производным липидов относятся жирные кислоты, спирты,
углеводороды, витамины D, Е и К.
Жирные кислоты в основном представлены насыщенными и
ненасыщенными с одной двойной связью кислотами нормального
строения и четным числом углеродных атомов (пальмитиновая
С16, стеариновая Cie, олеиновая Cie,А9). Среди диеновых и
триеновых жирных кислот можно выделить линолевую (Сгв.А9,12)
и линолевую (Cie.A9,12,15). Двойные связи в ненасыщенных
жирных кислотах микробных липидов часто располагаются так,
что делят их на части, число углеродных атомов в которых крат-
но трем.
Очищенные монокарбоновые кислоты с числом углеродных
атомов Си—Cie находят широкое применение в мыловаренной,
шинной, химической, лакокрасочной и других отраслях промыш-
ленности. Спирты, присутствующие в липидах, включают три
группы соединений: спирты с прямой цепью, получаемые при
гидролизе восков; спирты с Р-ионовым кольцом, включающие
витамин А и каротиноиды; стерины, являющиеся одними из
компонентов неомыляемой части липидов. В дрожжах основным
компонентом является эргостерин, облучение которого ультрафи-
олетовым светом позволяет получать витамин Da- Углеводороды,
также входящие в состав иеомыляемой части липидов, представ-
лены алифатическими углеводородами, каротеноидами и сквале-
нами. Жирорастворимые витамины D, Е и К также входят в
состав микробных липидов.
Способность к усиленному накоплению липидов имеет про-
мышленное значение, ею обладают немногие микроорганизмы,
в первую очередь дрожжи. Процесс образования липидов у
большинства дрожжей состоит из двух четко разграниченных
стадий: первая характеризуется быстрым образованием белка
в условиях обильного снабжения культуры азотом и сопровожда-
ется медленным накоплением липидов (в основном фосфоглице-
ридов и нейтральных жиров); вторая — прекращением роста
дрожжей и усиленным накоплением липидов (в основном ней-
тральных липидов).
Типичными липидообразователями являются дрожжи
Cryptococcus terricolus, отличительная особенность которых —
способность синтезировать большое количество липидов (до 60%
от АСВ) в любых условиях, даже наиболее благоприятных для
синтеза белка. Из других липидообразующих дрожжей промыш-
ленный интерес представляют дрожжи С. guilUermondii, утили-
зирующие н-алканы, Lipomyces lipoferus и Rhodotorula gracilis,
накапливающие большие количества липидов и активно развива-
ющиеся на углеводных субстратах, в том числе и на мелассе,
гидролизатах торфа и древесины. У этих видов дрожжей липо-
генез очень сильно зависит от условий культивирования.
Использование дрожжей С. guilUermondii, обычно применяе-
101
мых для биосинтеза белковых веществ как продуцента липидов,
содержание которых у данного вида составляет 16—20% от АСВ,
является экономически оправданным, учитывая большие объемы
производства БВК и возможность получения биожира парал-
лельно с белком. Кроме того, все другие продуценты липидов
накапливают значительные (до 70%) количества триацилглице-
ридов, в то время как С. guilliermondii накапливают до 50%
фосфолипидов.
Микроскопические грибы пока не получили широкого распро-
странения как продуценты липидов, хотя жир грибов по своему
составу приближается к растительным жирам и выход жиров у
Asp terreus на углеводных средах достигает 51% от АСВ. Ли-
(шдныи~ состав грибов представлен в основном нейтральными
жирами и фосфолипидами.
Особенность бактерий как продуцентов липидов заключается в
своеобразии состава их липидов, включающих, в основном, слож-
ные липиды (фосфо- и гликолипиды), тогда как нейтральные жиры
составляют очень небольшую часть биомассы. Однако с учетом
более разнообразного состава жирных кислот (от Сю до С20),
входящих в жирорастворимую часть бактериальных клеток,
вопрос о промышленном использовании липидов бактерий может
возиикиуть при необходимости получения специфических жирных
кислот.
Водоросли представляются очень перспективными для культи-
вирования их в качестве липидообразователей, так как они не
нуждаются в органическом источнике углерода для биосинтеза
белка, углеводов и жира. Химический состав водорослей сильно
зависит от условий культивирования: меняя содержание азота
в среде, можно получить клетки, имеющие 58% от АСВ белка и
5% от АСВ жира или всего около 8% от АСВ белка и до 85% от
АСВ жира. Одиако наличие таких недостатков, как малая ско-
рость роста и накопление в клетках токсических соединений,
ограничивает их промышленное применение.
Таким образом из всех рассмотренных микроорганизмов пока
в процессе биосинтеза липидов используются дрожжевые штам-
мы, культивируемые иа том же сырье, которое применяется при
получении кормового белка, причем от ценности углеродного
питания во многом зависят выход биомассы, количество и состав
синтезируемых липидов. Особое влияние на биосинтез липидов
оказывают углеродсодержащие соединения, сами являющиеся
липидными компонентами. Применение в качестве источника
углерода углеводородов ведет к значительному изменению жир-
нокислотного состава липидов по сравнению с углеводными
и другими субстратами.
Для обеспечения направленного биосинтеза липидов в пита-
тельной среде употребляются легкоассимилируемые источники
азота. Очень большое влияние иа сдвиг биосинтеза в сторону
образования липидов или белка оказывает соотношение углерода
и азота в среде. Так, повышение концентрации азота вызывает
102
снижение липидообразоваиия, а недостаток азота при обеспечен-
ности углеродом ведет к понижению выхода белковых веществ
и высокому процентному содержанию жира. Установлено, что
оптимальное соотношение азот:углерод тем меньше, чем трудно-
доступнее для дрожжей источник углерода. Обычно для углево-
дородного сырья соотношение N:C=l:30, а для углеводного —
1:40.
Накопление липидов возможно только при наличии в среде
определенных доз фосфора. Его недостаток ведет к неполному
использованию источника углерода, а избыток — к накоплению
нелипидных продуктов. На фракционный состав липидов измене-
ние содержания фосфора практически влияния ие оказывает.
Воздействие остальных макро- и микроэлементов питательной
среды сказывается прежде всего на интенсивности роста дрож-
жей и скорости утилизации источника углерода, что косвенным
образом сказывается на количестве синтезируемых липидов,
практически не изменяя их состава.
Условия культивирования также оказывают существенное
влияние на количество и фракционный состав синтезируемых
липидов.
От интенсивности аэрации среды зависит синтез прежде всего
фосфоглицеридов, жирных кислот и триацилглицеридов: при
оптимальной аэрации липиды содержат в 4 раза больше триа-
цилглицеридов, в 2 раза меньше фосфо глицеридов и в 8 раз
меньше жирных кислот, чем в условиях недостаточной
аэрации.
С интенсификацией аэрации обычно возрастает степень нена-
сыщенности липидов и увеличивается относительное количество
всех групп ненасыщенных кислот.
Изменение pH среды в любую сторону от оптимальной приво-
дит к существенным изменениям фракционного состава и незна-
чительно сказывается на общем количестве синтезируемых
липидов. Так, повышение pH влечет за собой увеличение содер-
жания фосфоглицеридов и жирных кислот с одновременным
уменьшением количества триацилглицеридов.
Оптимальные температуры роста и липидообразоваиия для
клеток совпадают, причем общее содержание липидов мало
зависит от температуры культивирования. Однако степень
ненасыщенности жирных кислот прямо зависит от температуры
выращивания, изменяя которую можно регулировать жирноки-
слотный состав фосфоглицеридной фракции, создавая оптималь-
ные соотношения насыщенных и ненасыщенных кислот в составе
фосфолипидных мембран.
Технологическая схема получения микробного жира, включа-
ющая подготовительное и экстракционное отделения, полностью
аналогична рассмотренному ранее (см. рис. 23) отделению
экстракции кормовой биомассы, полученной на нефтяных дис-
тиллятах. Для углеводных субстратов наиболее отработана
103
технология получения липидов на гидролизатах торфа и древе-
сины.
Исследования показали, что при соотношении гидролизатов
торфа и древесины в смеси, равной 1:4, обеспечивается наиболь-
ший выход биомассы на стадии культивирования (до 10 г/л) при
максимальном содержании липидов (до 51% от АСВ) и вы-
соком экономическом коэффициенте усвоения субстрата
(до 0,54).
Из 1 т абсолютно сухого торфа после его гидролиза и фермен-
тации можно получить 50—70 кг микробного жира следующего
состава (в %): триацилглицериды 70,7—75,1; моно- и диацил-
глицериды 7,0 — 10,0; фосфоглицериды 5,0 — 6,6; стерины 4,8 —
6,0; жирные кислоты 2,3 — 9,6; стериновые эфиры и воски
1,7 — 2,1.
Состав белково-жировых дрожжей, полученных культивиро-
ванием на очищенных н-парафинах, следующий (в %): белок
30—49; зола 4,0—6,1; углеводы 3,7—4,5; влага 8—10; липиды
16,3—18,2, в том числе (%): моно- и диацилглицериды 2,5—6,0;
триацилглицериды 16—19; стерины 1,0-—1,5; жирные кислоты
3,5—22,0; эфиры стеринов и воски 0,5—4,0; фосфолипиды
18,0—50,0.
Глава
ТЕХНОЛОГИЯ
ЪЗ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
В этой главе будут рассмотрены только общие вопросы
технологии микробиологического производства ферментов в раз-
личных товарных формах. Основной трудностью, неизбежной при
описании технологии ферментных препаратов, является чрезвы-
чайное многообразие как конкретных продуктов, выпускаемых
для различных потребителей, так и большая разница в степени
очистки товарных форм, которая определяется требованиями
потребителя и главным образом сложностью и дороговизной
очистки ферментов от сопутствующих примесей.
Классификация ферментов основана на механизме их дейст-
вия и включает 6 классов:
1. Оксидоредуктазы — ферменты, катализирующие окисли-
тельно-восстановительные реакции.
2. Трансферазы — ферменты, катализирующие реакции пере-
носа групп.
3. Гидролазы — ферменты, катализирующие реакции гидро-
лиза.
4. Лиазы — ферменты, катализирующие присоединение групп
к двойным связям или, наоборот, отщепление группы с образо-
ванием двойной связи.
5. Изомеразы — ферменты, катализирующие реакции изоме-
ризации.
6. Лигазы (синтетазы) — ферменты, катализирующие реак-
ции конденсации двух молекул, сопряженные с расщеплением
пирофосфатной связи в молекуле АТФ.
Ферменты как биокатализаторы обладают рядом уникальных
свойств. Это прежде всего их необычайно высокая каталити^
ческая активность: добавка незначительного количества фермен-
та (10“7—1(ГВ 9 моль) может ускорить катализируемую реакцию
более чем в 1О10 раз. Другое важное свойство — избирательность
действия. В ряде случаев ферменты обладают абсолютной
105
специфичностью, катализируя превращение ~олько одного ве-
щества. Эта специфичность проявляется и в отношении условий
реакции.
Для каждого фермента существует свой оптимум pH, при
котором его каталитическое действие максимально. При резком
изменении pH среды ферменты могут инактивироваться в резуль-
тате необратимой денатурации (изменение конформации, раскру-
чивание). Температура на действие ферментов влияет так же,
как и на все химические процессы. Одиако ускорение реакции
с повышением температуры наблюдается в ограниченных преде-
лах, поскольку многие ферменты уже при температуре 40—50°С
денатурируют. Это свойство ферментов приходится учитывать
при разработке технологии нового препарата.
Поскольку ферменты — вещества белковой природы, то в
смеси с другими белками определить их количественно практи-
чески невозможно. Наличие фермента в препарате может быть
установлено лишь по протеканию той реакции, которую катали-
зирует фермент. Количественную характеристику, в частности,
можно дать, определив количество образовавшихся продуктов
реакции или количество израсходовавшегося субстрата. Естест-
венно, эта реакция должна протекать в некоторых выбранных
стандартных условиях: температура, концентрация субстрата,
значение pH, время от начала реакции. По решению Междуна-
родного биохимического союза принята так называемая стан-
дартная единица активности-, за единицу активности (Е или U)
любого фермента принимают то количество его, которое катали-
зирует превращение одного микромоля субстрата в 1 мин при
заданных стандартных условиях.
Решено активность определять при /=30°С по начальной
скорости реакции, когда концентрация субстрата достаточна
для насыщения фермента и временная зависимость близка к
кинетике реакции нулевого порядка. Остальные параметры
реакции индивидуальны для каждого фермента.
Активность ферментного препарата выражается в микромолях
субстрата, прореагировавшего под действием 1 мл ферментного
раствора или 1 г препарата в оптимальных условиях за 1 мин.
Если ферментный препарат не содержит балласта, то его актив-
ность выражается в тех же стандартных единицах на 1 мг
фермента. Если же балласт есть, то активность считается иа 1 мг
белка в ферментном препарате. Активность выпускаемого заво-
дом препарата является важнейшим нормируемым показателем
его качества.
В производственной практике пользуются понятием активность
условного ферментного препарата. Эта единица рассчитывается
по активности основного фермента в стандартном условном
препарате. За активность условного препарата принимают его
среднюю устойчивую активность, достигаемую в производствен-
ных условиях. Так, например, амилолитический стандартный
условный препарат из глубинной (Asp. oryzae 3-9-15) и поверх-
106
ностиой (Asp. oryzae -476) культур имеет активность 2300 ед.
на 1 г условного препарата.
За одну условную тонну ферментного препарата принимается
1 т препарата со стандартной активностью. Для пересчета
выработанной товарной продукции в условные тонны пользуются
соотношением
где Л4У — масса условного препарата; Мг — масса товарного
препарата; Ау — активность условного препарата;
Аф — фактическая активность товарного препарата.
Выпускаемые в СССР ферментные препараты принято обозна-
чать следующим образом: первая буква «П» или <Г» указывает
на способ культивирования продуцента — поверхностный или
глубинный; следующие за ней цифры показывают степень очи-
стки фермента в процессе его получения — чем выше очистка,
тем больше число; наличие фермента в препарате обозначается
буквой <Х». Например: препарат марки П10Х — обычно получа-
ют водной экстракцией из поверхностной культуры и последу-
ющим осаждением органическими растворителями.
$ 1. Промышленные ферментные препараты
Использование микробных ферментов в некоторых отраслях
промышленности началось более 70 лет назад. Большую часть
ферментов, поступающих на рынок, составляют гидролазы, так
как именно они являются основными в промышленной био-
технологии. От общего количества потребляемых ферментов 99%
выпуска приходится на 16 препаратов.
Рассмотрим подробнее некоторые группы ферментов.
К амилолитическим ферментам относятся а-амилаза, 0-ами-
лаза, глюкоамилаза. Их действие проявляется при гидролизе
крахмала и гликогена. Крахмал при гидролизе сначала расщеп-
ляется на более простые полисахариды — декстрины, а затем —
до глюкозы.
а-Амилаза гидролизует любые <а-1,4* глюкановые связи;
0-амилаза — фермент концевого действия, последовательно
отщепляет остатки мальтозы от концов цепей. Глюкоамилаза
последовательно отщепляет остатки глюкозы от концов цепей.
Эти ферменты применяются в спиртовой промышленности, хлебо-
печении.
Протеолитические ферменты относятся к гидролазам, образуя
класс пептидгидролаз. Их действие заключается в ускорении
гидролиза пептидных связей в белках и пептидах. Важная их
особенность — выборочный, селективный характер действия на
пептидные связи в белковой молекуле. Например, пепсин дей-
ствует только на связь с ароматическими аминокислотами,
трипсин — только на связь между аргинином и лизином.
107
Ферментов этого класса очень много. В промышленности их
классифицируют по способности проявлять активность в опреде-
ленной области pH: pH 1,5—3,7 — кислые протеазы; pH 6,5—
7,5 — протеазы; рН>8,0 — щелочные протеазы.
Применение протеаз широкое: мясная промышленность —
для умягчения мяса; кожевенная промышленность — при обезволо-
'шивании и мягчении шкур; кинопроизводство — для растворения
желатинового слоя на пленках при их регенерации; парфюме-
рия — при создании добавок в зубную пасту, кремы, лосьоны;
промышленность синтетических моющих средств — прй~примене-
нии моющих добавок для удаления загрязнений белковой при-
роды; медицина — при лечении воспалительных процессов, ожо-
гов, тромбозов.
Пектолитические ферменты объединены в одну группу по
внешнему проявлению своего действия — уменьшению молеку-
лярной массы и снижению вязкости пектиновых веществ (пектин,
пектиновые кислоты и протопектин) — представителей полисаха-
ридов. Они содержатся в фруктах, корнеплодах, стеблях (лен).
Пектиновые вещества имеют молекулярную массу от 20 000
до 200 000. Все пектиназы делятся на два вида — гидролазы
и трансэлиминазы. Первые отщепляют метильные остатки (пек-
тинэстеразы) или разрывают а-1,4- гликозидные связи (поли-
галактуроназы). Вторые ускоряют негидролитическое расщепле-
ние пектиновых веществ с образованием двойных связей.кПриме-
неиие: в текстильной промышленности — вымачивание льна пе-
ред его переработкой, в виноделии — осветление вин, уничтоже-
ние мутности; в консервировании — при приготовлении фруктовых
соков.
Целлюлолитические ферменты очень специфичны, их действие
проявляется лишь в деполимеризации _ молекул целлюлозы;
обычно они действуют в виде комплекса, который в целом до-
водит гидролиз целлюлозы до глюкозы. Использование их
очень перспективно: в гидролизной промышленности — это полу-
чение глюкозы из целлюлозы; в медицинской — выделение
лекарственных веществ (стероидов) из растений; в пищевой —
улучшение качества растительных масел; в сельском хозяйстве —
как добавки в комбикорма для жвачных животных.
§ 2. Факторы, влияющие на биосинтез ферментов
Существует мнение, что из клеток микроорганизмов можно
выделить любые из известных ферментов. Большинство микро-
организмов способно расти на относительно простых и дешевых
питательных средах. Имеется возможность усиливать способ-
ность микроорганизмов к биосинтезу ферментов с помощью
селекции, получая высокопродуктивные мутантные формы.
Биосинтез ферментов в растущих культурах можно регулиро-
вать технологическими приемами. Все это послужило толчком
108
к бурному развитию микробиологической технологии ферментов
в Японии, США, с начала 50-х годов в СССР.
Состав и количество синтезируемых клетками ферментов за-
висит главным образом от наследственных свойств данного
организма, так как структура каждого образующегося в клетке
белка определяется соответствующим геном. В то же время ген
как единица наследственности способен изменяться, делиться
и расщепляться под влиянием внешней среды, а также в ре-
зультате направленных мутаций искусственного характера.
Решение задачи получения промышленно ценных штаммов
мутантов с измененными генетическими свойствами успешно
осуществляется путем селекции с использованием мутагенных
факторов, таких, как ионизирующие и неионизирующие излучения,
изотопы, актинофаги, антибиотики, химические соединения, обла-
дающие высокой преобразующей способностью по отношению
к наследственным элементам клетки.
Несмотря на определяющую роль генетического фактора в
биосинтезе ферментов, производительность существующих тех-
нологических процессов по каждому ферменту не в последнюю
очередь зависит от состава питательной среды, имея в виду
наличие в ней не только источников углерода, азота, фосфора
и других элементов, но и веществ, играющих роль индукторов
или репрессоров биосинтеза данного конкретного фермента или
их групп. Хотя механизм этого явления не вполне изучен, сам
факт должен в максимальной степени учитываться технологами
в ходе биосинтеза.
Рядом примеров проиллюстрируем опыт, накопленный в этом
отношении. Фермент липаза почти не синтезируется грибом
Asp. awamori на среде без индуктора, внесение кашалотового
жира усиливает биосинтез фермента в сотни раз. Этот же вид
грнба при добавлении в среду крахмала и полном исключении
минерального фосфора интенсивно синтезирует другой фер-
мент — фосфатазу.
Однако не только наличие индуктора способно увеличить
выход фермента; не менее важно подыскание оптимального для
биосинтеза фермента состава питательной среды и оптимальных
условий культивирования. Значение этих факторов можно проил-
люстрировать на примере разработки процесса биосинтеза а-
амилазы культурой Asp. oryzae с индуктором — крахмалом.
Ниже показано влияние состава питательной среды иа био-
синтез а-амилазы:
Добавки в питательную среду
3% сахарозы и 0,05% NaNO3 . .
6% крахмала и 0,15% NaNO3.................
10 мл экстракта из солодовых ростков .
40 мл экстракта из солодовых ростков . .
Повышение в 1,5 раза концентрации основ-
ных компонентов среды.....................
Активность фер-
мента, Е/100 мл
20
60
250—300
500—560
1000—1100
109
Для интенсификации процесса роста и синтеза ферментов
часто добавляют всевозможные вытяжки или экстракты, содер-
жащие дополнительные факторы роста. К ним относятся прежде
всего аминокислоты. Они легко проникают внутрь клетки и спе-
цифически влияют на образование фермента. Механизм их дей-
ствия, вероятно, заключается в компенсации недостающих
свободных внутриклеточных аминокислот, необходимых для син-
теза фермента. Факторами роста являются также пуриновые
основания и их производные, РНК и продукты ее гидролиза.
Все рассмотренные факторы должны учитываться при состав-
лении питательных сред для культивирования продуцентов
ферментов. В промышленных средах в качестве источников орга-
нического углерода и азота чаще всего используют различные
сорта крахмала (картофельный, кукурузный, рисовый), кукуруз-
ный экстракт, соевую муку, гидролизаты биомассы дрож-
жей и т. д. Мирокоорганизмы для своего роста могут утилизиро-
вать и минеральные соединения азота, которые в конечном
счете превращаются в аммиак, необходимый для синтеза слож-
ных азотсодержащих органических соединений.
Существенное влияние оказывают минеральные соли Mg24",
Са2+, Mn2+, Zn2+, Fe2+, Cu2+ и некоторых других металлов.
Одиако о механизмах их действия известно немного. Некоторые
из них входят в состав ряда ферментов, ионы Са повышают
устойчивость а-амилазы, ионы Fe и Mg активизируют и стабили-
зируют протеолитические ферменты; Fe2+ и Си2+ участвуют
в реакциях, связанных с утилизацией и превращением энергии.
Оптимальный состав питательной среды для каждого про-
дуцента может быть определен двумя способами: методом эмпи-
рического подбора и с использованием математических методов
оптимизации, последний подход становится в последние годы
преимущественным благодаря применению ЭВМ.
С точки зрения характера процесса культивирования микро-
организма-продуцента все технологические процессы производ-
ства ферментных препаратов делятся на две принципиально
отличные группы: в первом случае ферментация ведется глубин-
ным методом в жидкой питательной среде, во втором использу-
ется поверхностная культура, растущая на специально подготов-
ленной рыхлой и увлажненной питательной среде.
§ 3. Глубинным метод культивирования продуцентов
ферментов
Глубинный метод культивирования заключается в выращи-
вании микроорганизмов в жидкой питательной среде. Он техни-
чески более совершенен, чем поверхностный, так как легко под-
дается механизации и автоматизации; переход к большим мас-
штабам производства осуществляется значительно легче и проще.
Весь процесс должен проводиться в строго асептических усло-
виях, что, с одной стороны, является преимуществом метода,
а с другой — составляет наибольшую техническую трудность,
110
поскольку малейшее нарушение асептики по причине несоблюде-
ния режима или несовершенства оборудования приводит иногда
к полному прекращению образования фермента.
Концентрация фермента в среде при глубинном культивиро-
вании обычно значительно ниже, чем в водных экстрактах
поверхностной культуры. Фильтраты культуральных жидкостей
содержат не более 3% сухих веществ. Это вызывает необходи-
мость предварительного концентрирования фильтратов перед
тем, как выделять ферменты любым методом.
Технологические схемы при глубинном способе культивирова-
ния почти не отличаются одна от другой, независимо от состава
среды и продуцента. Исключение представляют те редкие случаи
культивирования анаэробных микроорганизмов, в которых
опускается стадия подготовки воздуха. На рис. 26 представлена
типовая технологическая схема.
Получение посевного материала. Для засева питательной
среды посевной материал готовят также глубинным способом.
Вид посевного материала зависит от продуцента: для грибов и
актииомицетов — мицелиальная вегетативная масса, а для бак-
терий — молодая растущая культура на начальной стадии споро-
образования.
Получение посевного материала осуществляется постадийным
увеличением массы продуцента, например, для обслуживания
предприятий с большой суточной производительностью — в четы-
ре ступени: исходная культура продуцента-»-маточиая культура,
выращенная в колбах на качалке-*-посевная культура, выращен-
ная в инокуляторе->посевная культура, выращенная в посевном
аппарате.
Объем посевного материала зависит от физиологических
особенностей продуцента. Он резко возрастает, до 5—20%,
если продуцент размножается только вегетативно, и сокраща-
ется до 1%, если происходит обильное спороношение. Объем
посевного аппарата составляет до 10% от объема промышлен-
ного ферментера.
Существенное влияние на ход производственного культивиро-
вания оказывает возраст посевного материала. На рис. 27 по-
казано такое влияние на продуцирование ферментов культурой
Asp.oryzae 8F|. Обычно при использовании слишком молодой
посевной культуры процесс затягивается, а старая приводит
к нерациональному потреблению субстрата.
Приготовление питательных сред. Участок приготовления
среды обычно изолируют от других производственных помещений,
чтобы предотвратить попадание загрязненного микроорганизма-
ми сырья в основное производство. При большой производитель-
ности предприятия питательные среды готовят централизованно
для всего производства в отдельном здании.
Методы приготовления питательных сред различны и зависят
от состава компонентов. Для некоторых требуется предваритель-
ная обработка: измельчение, отваривание, экстрагирование,
III
Рис. 26. Принципиальная технологическая схема культивирования микроорганизмов глубинным методом
(по И. М. Грачевой, 1975):
/ — производственный ферментер; 2 — холодильник; 3 — выдерживатель; 4 — нагревательная колонка, 5, 6, 25 — насосы;
7 —емкость приготовления питательной среды для инокулятов; 8 — смеситель; 9 — шнек; 10—автоматические весы; 11, 13 —
трубоконвейер; 12 — бункер; 14 — циклон пневмотранспорта сухих компонентов среды; 15 — головной.фильтр; 16 — емкость для
стерилизации и хранения пеногасителя; 17, 20, 22, 23 — индивидуальные фильтры, 18 — подъемник-нория; /9 — посевной
аппарат; 2/— инокулятор; 24 — фильтр очистки отходящего воздуха; 26—теплообменник для захолаживания культуральной
жидкости
гидролитическое рас-
щепление и т. д. Затем
готовые к растворению
компоненты подают
при постоянном пере-
мешивании через дози-
рующие устройства в
емкость для приготов-
ления среды; необхо-
димо соблюдать после-
довательность введения
В смесь отдельных ком-
понентов.
Емкости и аппараты
для предварительной
обработки и смешива-
ния компонентов изго-
тавливают из нержаве-
ющей стали или с анти-
Возраст посевного материала,ч
Рис. 27. Влияние возраста посевного материала
на биосинтез ферментов при глубинном культи-
вировании Asp.oryzae 8F[ (5% посевного мате-
риала) (по И. М. Грачевой, 1975):
1 — амилаза; 2 — щелочная протеиназа; 3 — кислая
протеиназа
коррозионным покрытием. Передачу жидких потоков осуществля-
ют насосами, самотеком или передавливанием сжатым воздухом.
Отделение приготовления сред обычно занимает большое поме-
щение и насыщено оборудованием, так как там кроме смесите-
лей с мешалками и барботерами имеются теплообменники,
дозаторы, размельчители, экстракторы, варочные котлы, аппа-
раты для ферментативного гидролиза и др.
Стерилизация питательных сред. Это важнейшая подготови-
тельная операция, осуществляемая двумя способами — отделе-
нием микроорганизмов от среды или уничтожением их в среде.
Перспективнее первый способ, поскольку при любом методе
уничтожения микроорганизмов происходит воздействие «губи-
тельного» фактора и на компоненты питательной среды. Первый
способ проще всего провести с помощью полупроницаемых мем-
бран в процессе микрофильтрации. Отечественная промышлен-
ность уже осваивает производство стерилизующих микрофиль-
трационных патронов, однако их применение на практике еще
крайне ограничено.
Второй метод стерилизации на производстве осуществляют
почти исключительно с помощью высоких температур. Отмирание
микроорганизмов происходит в течение некоторого времени,
которое тем короче, чем интенсивнее «губительный» фактор, т. е.
чем выше температура. Кроме того, необходимая, экспозиция
зависит еще и от уровня обсемененности объекта, так как чем
больше микроорганизмов в обрабатываемом объеме, тем больше
особей выживет за данное время в выбранных условиях стерили-
зации. Методика расчета параметров тепловой стерилизации
приведена в книге В. Е.Матвеева (см. список литературы).
Стерилизацию питательных сред можно проводить периоди-
чески и непрерывно. В первом случае процесс ведут в самом
5—154
113
ферментере, куда заливают питательную среду, нагревают ее
до температуры стерилизации, выдерживают .при этой температуре
нужное время и охлаждают. Во втором случае предварительно
стерилизуют аппараты и коммуникации проточным паром, затем
подают в ферментер среду, которая прошла через нагреватель-
ную колонку (см. рис. 26), где нагрелась острым паром до 120—
140°С, выдерживатель, где находилась нужное время под темпе-
ратурой стерилизации, и холодильник, где охладилась до темпе-
ратуры культивирования.
Отдельно от среды периодическим способом стерилизуют
пеногаситель, все корректирующие растворы. Особую проблему
представляет стерилизация аммиачной воды, которую невозмож-
но нагревать.
Очистка воздуха до и после аэрирования. Атмосферный воз-
дух содержит частицы пыли органической и неорганической
природы, капли воды и микроорганизмы в количестве до 10е
частиц на 1 м3. Стерильность его достигается фильтрацией через
объемные волоконные фильтры. При производстве ферментных
препаратов необходима двойная очистка — на головном фильтре
(см. рис. 26), затем на индивидуальных фильтрах непосред-
ственно перед вводом воздуха в посевные и производственные
ферментеры. (Обзор фильтрующих материалов, конструкции
фильтров и методика их расчета представлены в упомянутой
книге В. Е. Матвеева.)
После аэрирования производственной культуры газовый по-
ток, отводимый из ферментера, несет с собой клетки продуцента.
Чтобы не загрязнять окружающий воздух микроорганизмами,
на отводящем воздуховоде устанавливают фильтр или систему
фильтров. При этом обычно ставится задача получить воздух
с установленным предельным значением обсемененности, опре-
деленной санитарными органами с учетом особенностей микро-
организмов.
Производственное культивирование. При культивировании
Продолжительность культивирования, ч
Рис. 28. Рост мицелия, образование а-амилазы и
потребление сухих веществ среды в глубинной куль-
туре Asp. oryzae (по И. М. Грачевой, 1975):
I — а-амилаза; 2 — мицелий; 3 — сухие вещества
114
продуцента в объеме жидкости
протекают два неразрывно свя-
занных, хотя зачастую и раз-
дельных во времени процес-
са — увеличение биомассы
микроорганизмов и накопле-
ние в среде или в микробной
клетке ферментов. Биосинтез
ферментов в глубинных куль-
турах протекает в течение 2—
4 сут при непрерывной подаче
воздуха и перемешивании. Из-
менения, происходящие в про-
цессе роста, показаны на рис.
28 на примере образования
а-амилазы продуцентом Asp.
oryzae 3-9-15.
Большинство ферментов
Продолжительность культивирования, ч
Рис. 29. Рост биомассы, активности £-
глюканазы и расходов РВ при культи-
вировании Вас. subtilis-402(no И. М.
Грачевой, 1975):
1 — РВ; 2 — биомасса; 3 — активность
фермента (в относительных единицах)
являются экстрацеллюларными
продуктами и выделяются в окружающую клетки жидкую среду,
при этом обычно в мицелии трехсуточной культуры остается
не более 10—15% ферментов. В этом случае препараты фермен-
тов выделяют из фильтратов после отделения биомассы. Иногда
ферменты не выделяются в окружающую среду и, будучи связан-
ными с клеточными органеллами, могут быть извлечены из клеток
лишь после их разрушения и соответствующей обработки.
Высокие концентрации питательных веществ на первых эта-
пах могут тормозить рост биомассы продуцента. Поэтому часто
свежая питательная среда или некоторые ее компоненты вво-
дятся в ферментер постепенно на стадии активного роста. Это
можно проиллюстрировать биосинтезом 0-глюканазы продуцен-
том Вас. subtilis-402 (рис. 29).
На первом этапе при /=40°С потребляются легко усваиваемые
компоненты, биомасса бурно нарастает (к 8-му часу ее содержа-
ние достигает 10 г/л). Редуцирующие сахара (по РВ) быстро
расходуются. Затем вводят дополнительное количество РВ в
виде гидролизата БВК (с 4 до 8 г/л), содержащего необходимые
для биосинтеза фермента вещества, особенно индуктор — 0-глю-
кан. Этот прием сокращает длительность культивирования с 28
до 20 ч и в 5 раз повышает конечную ферментную активность.
Одними из важнейших параметров глубинного культивирова-
ния являются концентрация ионов водорода и ее изменение в про-
цессе роста культуры. Кислотность среды в растущей культуре оп-
ределяется составом и свойствами минеральных солей и их потреб-
лением культурой, в первую очередь, это касается источников ми-
нерального азота. Потребление клетками иона аммония сопровож-
дается освобождением анионов, которые подкисляют среду. Если
же потребляются анионы NOi, то освобождающиеся ионы металла
подщелачивают среду.
Влияние pH на биосинтез ферментов можно проиллюстриро-
5*
115
Температура культивирования, °C
Рис. 30. Влияние температуры культивирова-
ния на накопление ферментов (по И. М. Гра-
чевой, 1975):
/ — протеиназа Asp. flavus 716; 2 и 3 — амилазы
Asp. awamori-22
вать на примере получе-
ния а-амилазы Asp.
oryzae 3-9-15. Даже при
незначительном подкисле-
нии, когда в течение всего
роста поддерживалось pH
6,0, наблюдалось заметное
понижение активности (на
23%). При выращивании
с постоянной кислот-
ностью исходной среды
(pH 5,5) через трое суток
обнаруживается лишь
40% от возможного выхо-
да фермента.
Интересно отметить, что
оптимальное значение pH
среды при биосинтезе
грибной а-амилазы (pH
7,5) резко отличается от pH оптимума каталитического дей-
ствия самого фермента (pH 4,7—4,9).
Уровень накопления и скорость образования ферментов силь-
но зависят от режима аэрации при культивировании. Отсутствие
надежных датчиков растворенного кислорода пока не позволяет
контролировать процесс впрямую. Однако известно, что интен-
сивное потребление кислорода свойственно молодой растущей
культуре в первые сутки культивйровация, поэтому максимальное
аэрирование и перемешивание среды обычно осуществляется
в начальный период. Следует отметить, что концентрация раство-
ренного кислорода определяется давлением воздуха, темпера-
турой, эффективностью перемешивания, которая, в свою очередь,
зависит от конструктивных особенностей ферментера; таким
образом, технологические и аппаратурные аспекты здесь тесно
взаимосвязаны.
Большинство продуцентов ферментов являются мезофиль-
ными микроорганизмами и оптимум их развития находится
при температуре 22—32°С. Почти все они термолабильны и
быстро инактивируются при повышении температуры сверх оп-
тимальной. На рис. 30 показана достигаемая активность различ-
ных ферментов при культивировании продуцентов в различных
температурных режимах.
В процессе культивирования приходится иметь дело со слож-
ной трехфазной системой: жидкость — условно твердая фаза
(клетки) — газ. В такой системе затруднены массообменные
процессы, что требует специальной аппаратуры. Обычно культи-
вирование проводится в герметичных цельносварных цилиндриче-
ских сосудах с эллиптическими крышкой и днищем объемом
до 100 м3, выполненных из нержавеющей стали. Основными
элементами любого ферментера являются перемешивающие и
116
аэрирующие устройства. Они должны обеспечить равномерное
распределение пузырьков воздуха по всему объему
жидкости, создать максимально большую поверхность фазового
контакта газ — жидкость и устойчивые циркуляционные потоки
жидкости с клетками в аппарате, особенно в зонах, где располо-
жены теплообменные устройства. Обычно воздух подают в ап-
парат через различного типа барботеры или форсунки. Для
перемешивания используют многоярусные сложные мешалки.
Важнейшим условием эффективной работы ферментеров
является контроль и автоматическое поддержание оптимального
уровня основных параметров процесса. В современных техноло-
гических процессах ведется, также непрерывное автоматическое
определение содержащихся в среде углеводов, количество
образовавшихся метаболитов и концентрации клеток. На основа-
нии этих данных с помощью ЭВМ разрабатывается и автомати-
чески осуществляется оптимальное управление процессом, обе-
спечивающее максимальную производительность каждой стадии
и наилучшее качество продуктов.
§ 4. Поверхностный метод
культивирования продуцентов ферментов
При поверхностном методе культура растет на поверхности
твердой увлажненной питательной среды. Мицелий полностью
обволакивает и довольно прочно скрепляет твердые частицы,
клетки получают питание за счет содержащихся в этих средах
веществ и используют для дыхания кислород воздуха, поэтому
для их нормального обеспечения кислородом приходится при-
менять рыхлые по своей структуре среды с очень небольшой
высотой слоя. Это приводит к необходимости иметь большую
поверхность контакта рыхлой среды с воздухом и при отсутствии
механизации придает всему процессу неинтенсивный характер,
требует больших затрат ручного труда.
Так, например, для завода, вырабатывающего 1 т поверхно-
стной культуры плесневых грибов на. пшеничных отрубях, при
двухсуточном росте требуется более 1000 отдельных кювет, на
которых тонким слоем раскладывается засеянная конидиями
гриба питательная среда. Мойка, стерилизация, перемещение
кювет внутри цеха, их заполнение и освобождение составляют
ту основную трудность, которая характерна для данного метода.
Выращивание производственной культуры происходит обычно
в неасептических условиях, однако как сама среда, так и кю-
веты первоначально должны быть надежно стерилизованы.
Это требование является безусловным, кроме того, перед каждой
новой загрузкой должны дезинфицироваться растильные
камеры, а также все мелкое оборудование и инвентарь.
Поверхностный метод имеет и преимущества, самое главное
из них — значительно более высокая конечная концентрация
117
фермента на единицу массы среды. Например, для осахарива-
ния 100 кг крахмала в спиртовом производстве требуется 5 кг
поверхностной культуры плесневых грибов или около 100 кг
культуральной жидкости. Поверхностные культуры можно бы-
стро и относительно легко высушить, их легко перевести в товар-
ную форму и транспортировать, если не требуется дополнитель-
ной очистки фермента. Положительной стороной поверхностного
метода является также меньшая потребность в электроэнергии
по сравнению с глубинным методом.
На рис. 31 приведена принципиальная технологическая
схема поверхностного метода выращивания.
Посевной материал. Для поверхностного метода производ-
ства он может быть подготовлен в виде культуры, выращенной
на твердой питательной среде, спорового материала или мице-
лиальной массы продуцента, выращенной глубинным методом.
Посевную культуру получают выращиванием микроорганизмов
во все возрастающем количестве в три или четыре этапа.
Исходную музейную культуру продуцента, находящуюся на
твердой агаризованной среде, пересевают сначала на 1 —1,5 г
увлажненных стерильных пшеничных отрубей в пробирку.
Выращивание проводят в термостате до обильного спорообразо-
вания. Второй этап осуществляют на той же среде и при тех же
условиях, но в колбах, содержащих до 100 г рыхлой среды.
Аналогичен и третий этап, но здесь выращивание проводится
в сосудах с 500 г среды.
На последнем, четвертом этапе выращивание ведут на посев-
ных кюветах, если материал нужен в виде культуры, или от-
деляют конидий от основной массы мицелия и субстрата на
специальном вибросепараторе, если необходимы споры, или,
наконец, в инокуляторе объемом 8—10 л на жидкой питательной-
среде, если инокулят нужен в виде мицелиальной массы.
Можно продлить срок хранения посевного материала, если
спороносящую культуру подсушить до влажности 10—12%, от-
деленные конидии поместить в герметичную тару, а мицелиаль-
ную массу охладить до 4—6°С.
Приготовление питательных сред. Основой почти каждой
твердой среды являются пшеничные отруби как источник
необходимых питательных и ростовых веществ. В увлажненном
состоянии отруби создают требуемую структуру среды. Для
повышения активности некоторых ферментов к отрубям добав-
ляют свекловичный жом как материал, богатый пектином и
целлюлозой, соевый шрот для повышения содержания белков и
индукции протеазы, соевую муку или другие включающие жиры
материалы для индукции липазы, пивную дробину, обогащенную
крахмалом, для стимулирования биосинтеза амилолитического
комплекса и др.
Дополнительное введение в отруби растительных отходов —
овсяной или рисовой шелухи, соломы, кукурузных кочерыжек
и древесных опилок — может улучшить структуру среды, особен-
118
Рис. 31. Принципиальная технологическая схема культивирования микроорганизмов поверхностным методом (по И. М. Грачевой,
1975):
/ — пневмотранспорт сыпучих компонентов; 2 — бункера; 3 — ворошители; 4 — шнек; 5 — пневмотранспорт отрубей; 6 — циклоны для
очистки отходящих газов; 7 — вентилятор; 8 — автоматический дозатор отрубей; 9— стерилизатор сыпучих компонентов; 10— стери-
лизатор воды; //—теплообменник; 12—мерник стерильной воды; 13—дозатор; 14—емкость для концентрированной соляной кислоты;
15 — мерник разбав-
ленного раствора со-
ляной кислоты; 16 —
емкость для посев-
ной суспензии; 17 —
стол; 18 — кювета
под загрузкой; 19 —
передвижная этажер-
ка для перемещения
кювет; 20 — расти-
тельная камера; 21—
кондиционер; 22 —
фильтр предвари-
тельной очистки;
23—фильтр очистки
от микробного за-
грязнения; 24 — эта-
жерка с готовой
культурой; 25 — мой-
ка этажерок; 26 —
стерилизация этаже-
рок; 27 — кювета на
разгрузке; 28 — гряз-
ная кювета; 29 —
мойка кювет; 30 —
чистая кювета; 31 —
камера для стерили-
зации кювет; 32 —
стерильная кювета;
33 — дробилка
но в случае мелких отрубей. Эти отходы вряд ли выполняют
роль индукторов, так как большая часть веществ в них на-
ходится в нерастворимом состоянии и лигнифицирована. Улуч-
шая структуру и облегчая доступ. воздуха, такие материалы
обедняют среду и понижают активность получающихся фер-
ментов. Устранить это влияние можно прибавлением источников
минерального азота и фосфора, а также материалов, богатых
ценными органическими веществами, например солодовыми рост-
ками, упаренным картофельным соком, кукурузным экстрак-
том и др.
Таким образом, как и при глубинном методе, изменяя состав
среды, учитывая физиологические особенности продуцента и
индуцибельность синтезируемых им ферментов, удается в из-
вестных пределах управлять процессом культивирования.
Стерилизация питательных сред и засев. Питательную среду го-
товят в специальных емкостях или непосредственно в стерили-
заторе. Сначала смешивают нужные компоненты, затем их
увлажняют, подкисляют соляной кислотой для лучшей стерили-
зации, добавляют минеральные источники азота и фосфора и
подают на стерилизацию.
Прогрев сыпучих смесей осуществляют острым паром в
цилиндрических аппаратах при постоянном перемешивании.
Время выдержки среды при температуре стерилизации (105—
140°С) больше, чем для жидкостей, так как труднее обеспечить
полный прогрев, обычно для этого требуется 60—90 мин. В стери-
лизаторах всех известных конструкций основным элёментом
является перемешивающее устройство — мешалки, шнеки, кон-
вейеры, лопатки, встряхиватели, которое должно перемещать
материал по длине стерилизатора и активно его перемешивать.
На рис. 32 показан часто применяемый на отечественных заводах
стерилизатор с мешалками.
После стерилизации среда охлаждается в этом же аппарате
продуванием стерильного холодного воздуха или водой, подава-
емой в рубашки. После снижения температуры до 38—40°С
в аппарат вводят посевную культуру продуцента, при этом также
производят тщательное перемешивание среды.
Большая доза посевного материала уменьшает длительность
лагфазы, но в этом случае, значительное количество субстрата
тратится на энергетический обмен, возрастает выход СОг и НгО,
медленно синтезируется фермент и соответственно снижается
его выход. Кроме того, такая культура начинает обильно споро-
носить, что осложняет дальнейшую переработку. Поэтому доза
посевного материала должна быть минимально возможной, обыч-
но 0,02—0,1% от массы среды. В заводских условиях из-за
неполной стерилизации вносят 0,5^-1,0%.
Засеянная среда поступает из стерилизатора на специальный
стол (см. рис. 31) и раскладывается ровным слоем на простери-
лизованные кюветы. Обычно эта операция производится вручную
и требует известной сноровки и быстроты, так как нельзя допус-
120
Рис. 32. Стерилизатор твердой сыпучей среды с мешалками (по И. М. Грачевой):
/ — корпус; 2 — крышка; 3 — задерживающая сетка; 4 — штуцер выаода отработанного
аоздуха; 5—штуцер загрузки посеаного материала; 6—люк для загрузки отрубей;
7 — штуцер ввода воздуха для охлаждения 8 — торцевая крышка; 9 — люк; 10 — опора;
// — штуцер выгрузки; 12 — вал мешалки, 13 — нагревательная рубашка; 14 —лопасти
кать переохлаждения среды ниже 28—30°С, чтобы не замедлить
начальный рост культуры. Затем заполненные кюветы устанавли-
вают на этажерки, которые сразу же задвигаются в растильные
камеры.
Производственное культивирование. Процесс выращивания
поверхностной культуры длится 36—48 ч. Весь цикл роста можно
разделить на три периода:
— в течение первых 10—12 ч происходит набухание конидий
и их прорастание; в этот момент температура не должна быть
ниже 28°С;
— в следующие 14—18 ч происходит быстрый рост мицелия,
его можно наблюдать в виде пушистого налета серовато-белого
цвета. Клетки потребляют основное количество питательных
веществ, очень энергично дышат и выделяют большое количество
тепла, которое необходимо отводить;
— третий период продолжается 12—18 ч. Процессы обмена
ослабевают, тепла выделяется меньше, но образование фермента
все еще происходит, а у большинства видов аспергиллов начина-
ется образование конидий.
В разные периоды роста параметры развития культуры различ-
ны, рассмотрим некоторые из них:
Энергетика процесса поверхностного культивирования. Соот-
ношение расходов субстрата, идущего на конструктивный и
121
Рис. 33. Динамика удельного тепловыде-
ления в процессе поверхностного культи-
вирования плесневых грибов (по И. М.
Грачевой, 1975):
/—Asp. niger, 2— Asp. or у гае, 3 — Asp
awamori
энергетический обмен, при-
мерно такое же, как и при
глубинном культивировании,
обычно экономический коэф-
фициент составляет 0,75—
0,80. Суммарное выделение
тепла в течение всего цикла
редко превышает 4000—
4200 кДж на 1 кг питатель-
ной среды, происходит нерав-
номерно, максимум прихо-
дится на середину второго
периода. На рис. 33 пред-
ставлена динамика тепловы-
деления для некоторых куль-
тур.
Динамика газового обме-
на. Потребление культурой
кислорода можно контроли-
ровать по выделению СОг. Установлено, что максимальная потреб-
ность поверхностной культуры в кислороде приходится на второй
период роста и хорошо согласуется по времени с тепловыделением.
Влажность питательной среды. При низкой влажности микро-
организмы попадают в неблагоприятные условия и проявляют
склонность к спороношению, что используют при получении по-
севного материала. Для продуцирования ферментов оптимальной
является влажность 55—70%. Чрезмерное увлажнение нарушает
рыхлую структуру среды, в результате чего снижается проникно-
вение воздуха, замедляется биосинтез.
Эти параметры поверхностных процессов определяют режим
аэрации растущей культуры. Аэробным продуцентам ферментов
кислород нужен для конструктивного и, особенно, энергетическо-
го обмена. Воздух, кроме того, необходим для съема выделяюще-
гося тепла, так как другие теплоносители подать в растильные
камеры технически сложно. Во втором периоде роста внутрь
приходится подавать до 60 объемов воздуха на объем камеры в
1 ч, при этом относительная влажность его должна приближать-
ся к 100% для предотвращения высыхания среды. Поскольку
расход воздуха велик, его стараются использовать многократно,
возвращая до 90% на рециркуляцию. Циркулирующий воздух
проходит через воздухоохладитель и используется вновь, а
отработанная часть очищается на фильтрах и выбрасывается
в атмосферу. По технологии, представленной иа рис. 31, выращи-
вание культуры происходит в кюветах. Они изготавливаются из
оцинкованной жести с перфорированным днищем. Размер их
обычно 600X800X30 мм, перфорация выполнена в виде щелей
2X20 мм. На некоторых заводах для равномерного заполнения
кювет установлены специальные барабанные дозаторы. Загру-
женные кюветы размещают на этажерках с небольшим наклоном
122
Рис. 34. Растильная камера с вертикальными кассетами (по
И. М. Грачевой, 1975)
через каждые 10—12 см по высоте. Многоярусные подвижные эта-
жерки устанавливают в растильные камеры, имеющие размеры
(в м) 2Х 10X2. Камеры располагают между двумя коридорами —
загрузочным и разгрузочным; с обеих сторон камеры снабжены
герметичными дверями. На кюветах каждой камеры можно раз-
местить до 700 кг среды, загрузка и выгрузка занимают 4 ч,
мойка и дезинфекция камер — еще 3 ч. Хотя получение культуры
продуцента на таких предприятиях технологически просто, себе-
стоимость ее высока за счет большой доли ручного труда.
Более современен способ выращивания культуры в вертикаль-
ных кассетах. Растительная камера разделена перфорированны-
ми перегородками иа 23 кассеты шириной 55—70 мм (рис. 34).
Просветы между кассетами выполняют роль воздушных каналов.
Толщина слоя среды за счет двусторонней аэрации увеличена
в 2—2,5 раза. Такая конструкция позволяет механизировать
загрузку среды засыпкой сверху при закрытых воздушных
каналах, а разгрузку проводить с помощью жалюзийного днища
и специально установленных вибраторов. В камеру размером
(в м) 1,6X1,6X1,3 загружается до 500 кг среды.
Резко улучшить производственные условия позволяет колон-
ный аппарат объемной аэрации, изображенный на рис. 35. Аппа-
рат разделен по высоте на секции перфорированными пластинами,
укрепленными на поворотных осях. На общем валу расположены
перемешивающие устройства, которые взрыхляют среду на
тарелках, улучшая условия аэрации. Через загрузочный люк
аппарат герметично соединен со. стерилизатором. Воздух-подает-
ся под каждую секцию, тепло дополнительно отводится охлажда-
ющей водой через рубашку. Перегрузка среды осуществляется
поворотом тарелок иа 90°, режим перегрузки сверху вниз можно
задать автоматически.
123
Рис. 35. Колонный аппарат с объемной аэра-
цией для выращивания поверхностной куль-
туры (по К- А- Калунянцу, Л. И. Голгеру,
1979):
/—люк для выгрузки; 2 — валик секции; 3 —
опора; 4 — коллектор подвода стерильного возду-
ха; 5 — охлаждающие змеевики; 6 — лопасть ва-
ла; 7—коллектор отвода отработанного воздуха;
8 — крышка; 9 — бобышка манометра; 10 — шту-
цер; // — воздушник; 12 — шестерня привода
вала; 13—вал; 14—люк для загрузки; 15-
корпус
Диаметр колонны 3,2 м.
Количество секций 4. Вы-
сота слоя среды на тарел-
ках 300 мм, производи-
тельность до 1 т культуры
в сутки.
Измельчение и сушка
культуры. Выросшая в
неподвижном слое куль-
тура представляет собой
корж из набухших частиц
среды, плотно связанных
сросшимся мицелием.
Для дальнейшего упот-
ребления массу приходит-
ся размельчить до гранул
размером 5—6 мм, это
достигается применением
различных типов дроби-
лок: дезинтеграторов, ба-
рабанно-зубчатых, удар-
ного действия, шнековых
и молотковых.
Наиболее распростра-
ненный дезинтегратор со-
держит два диска, вра-
щающихся в разные сто-
роны, каждый от своего
привода. Материал пода-
ют в центр между дисками,
на них концентрическими
кругами расположены
пальцы, проходя между
которыми материал дро-
бится и отбрасывается
на периферию. При
диаметре дисков 400 мм
и скорости вращения
1400 об/мин производи-
тельность дезинтегратора
составляет 200 кг/ч.
После дробления культуру, имеющую влажность 40—50%,
необходимо высушить до 10—12%, чтобы предотвратить инакти-
вацию ферментов, из тех же соображений температура сушки не
должна превышать 40°С, а длительность не более 30 мин. Обыч-
но на заводах используют конвективные сушилки ленточного,
тоннельного, барабанного, шахтного и других типов. Наиболее
распространены барабанные сушилки. Внутри барабана имеются
перемешивающие устройства в виде системы загнутых вверх
124
лопаток, которые расположены по винтовой линиии на внутренней
поверхности. Барабан медленно вращается (3—8 об/мин), высу-
шиваемый материал лопатками пересыпается и передвигается
вдоль оси аппарата. Мелкие частицы увлекаются током воздуха и
высушиваются быстрее, крупные падают почти вертикально и за-
держиваются в барабане на 7—8 мин. Суточная производитель-
ность достигает 1,5 т, потери активности 3—10%.
Дробление и сушка в простейшем случае завершают обработ-
ку препарата марки ПХ. Порошок упаковывают в крафт-мешки
с полиэтиленовой прокладкой по 15—30 кг, снабжают этикеткой
с указанием препарата и его активности и отправляют потребите-
лю. Однако в основном ферментные препараты выпускаются в
очищенном виде, после соответствующих операций, повышающих
удельную активность и потребительские свойства продукта.
Операции очистки мало связаны со способом культивирования
продуцента и поэтому рассматриваются вне связи с этой стадией.
§ 5. Получение товарных форм ферментных препаратов
Культура микроорганизмов, выращенная поверхностным
методом, и культуральная жидкость после глубинного культиви-
рования содержат большое количество балластных веществ:
биомассу продуцента, непотребленные компоненты среды, про-
дукты метаболизма. Доля собственно ферментов — активных
белков — составляет около 1% для поверхностных и не более
0,1% — для глубинных культур.
Выделение и очистка .ферментов — трудоемкий и дорогой
процесс, поэтому, как уже отмечалось, в некоторых случаях
ферментные препараты применяют в неочищенном виде: в коже-
венной и спиртовой промышленности степень очистки не влияет
на качество готовой продукции, введение биомассы продуцента
и примесей в корма для животных может даже повысить пита-
тельную ценность кормов. В то же время в пищевой промышлен-
ности, в бытовом обслуживании, в текстильных и микробиологи-
ческих производствах и особенно в медицине могут использовать-
ся только ферменты достаточно высокой, иногда предельной
степени очистки. В процессе очистки происходит повышение
удельной активности препарата, в табл. 3 на примере Asp.
oryzae показано это повышение по стадиям очистки.
Таблица 3. Последовательность очистки а-амилазы Asp oryzae
Стадия очистки Марка препарата Активность, Е/г АСВ
Поверхностная культура гриба ПХ 38
Упаренный водный экстракт из культуры П2Х 120—140
Осаждение этанолом из экстракта П10Х 600—800
Осаждение этанолом из диализованного П15Х 1300—1400
экстракта
Повторная кристаллизация П20Х 2000—2500
Кристаллическая а-амилаза — 6600
125
В лабораторной практике для указанных целей применяют
множество препаративных методов в нестандартной последова-
тельности и в самых неожиданных комбинациях. При создании
технологии получения высокоочищенных препаратов приходится
ориентироваться на разработанные в лаборатории приемы, по-
этому на заводах стараются обеспечить возможность мобильного
переключения с одной последовательности технологических опе-
раций на другую при смене продукта или повышении его ка-
чества.
Обсуждая проблемы получения очищенных ферментов, пра-
вильнее рассмотреть отдельные технологические стадии, не свя-
зывая их в единую технологическую линию. В любом случае,
однако, схема очистки сводится к: 1) освобождению от нераст-
воримых веществ; 2) освобождению от сопутствующих раствори-
мых веществ; 3) фракционированию, как правило, хроматогра-
фическими методами. В подавляющем большинстве случаев на
первом этапе используют экстракцию фермента.
Экстракция из поверхностной культуры. Наилучшим и наибо-
лее употребляемым экстрагентом для белков является вода, но,
к сожалению, вместе с ними в воду переходят часть сахаров, не
потребленных в процессе роста, полностью гидролизованные ге-
мицеллюлозы и пектиновые вещества, продукты гидролиза цел-
люлозы и белковых веществ, содержащихся в отрубях, раство-
римые пигменты, образуемые плесневыми грибами. Степень из-
влечения ферментов при различных способах экстракции можно
проследить на примере извлечения а-амилазы из культуры
Asp. oryzae:
Способ обработки культуры Активность, Е/мл
Настаивание с водой без растирания, 30 мин 8,3
То же, 60 мин...................................... 10,0
Растирание в ступке, экстракция 30 мин . 14,0
То же, 60 мин...................................... 14,0
Измельчение с водой в дезинтеграторе, 4 мии . 16,0
На практике механического разрушения мицелия не проводят
ввиду больших энергетических затрат. Установлено, что извле-
каемость ферментов значительно выше из сухих культур (10—12%
влажности), что связано с лучшей проницаемостью воды в под-
сушенные клеточные структуры. Ввиду большой молекулярной
массы ферменты медленно диффундируют в экстрагирующую
жидкость, а из-за их лабильности процесс надо проводить при
температурах не выше 30°С. Выход из этого положения — только
в увеличении времени контакта культуры с водой.
В производственных условиях очень важно избежать разбав-
ления экстрактов и не уменьшать концентрацию в них ферментов.
Это достигается тем, что в диффузионном процессе одна и та же
порция материала подвергается многократному выщелачиванию.
Однократная обработка водой дает растворы е концентрацией
АСВ 4—5%, поэтому используют многосекционные установки
126
подача готовой культуры на экстракцию
Рис. 36. Диффузионная батарея для экстрагирования ферментов (по
И. М. Грачевой, 1975)
противоточной экстракции, обычно 8-секционную батарею,
что позволяет поднять содержание АСВ в экстракте до
14-15%.
Батарея содержит 10 экстракционных аппаратов-диффузоров,
каждый из которых представляет собой емкость с коническим
днищем и заслонкой внизу. Сверху под переливным штуцером
расположена сетка для предотвращения уноса твердой среды по-
током воды. Объем аппарата 300 л, загрузка 60 кг. Аппараты
выполнены из нержавеющей стали и соединены в батарею из
10 шт., восемь из которых постоянно работают, один загружает-
ся, а один находится под разгрузкой (рис. 36). В каждый из
аппаратов можно подать как свежую воду, так и вытяжку из
предыдущего аппарата.
Время заполнения аппарата, а значит, и время нахождения в
нем жидкости 30 мин, поэтому общее время экстракции около
4 ч. Через каждые полчаса первый аппарат ставят под разгрузку,
второй делают первым, а с конца подключают восьмым аппарат
со свежей культурой. Производительность батареи до 3,5 т куль-
туры в сутки. Потери фермента на стадии экстракции обычно
составляют 10—12%.
Более современными являются экстракторы непрерывного
действия шнекового типа, с цепным транспортирующим органом,
а также колонные аппараты. Однако на отечественных производ-
ствах они пока используются редко.
Отделение твердой фазы. Фильтрация жидкостей, содержа-
щих мелкодисперсный клеточный материал, частично разрушен-
ные клетки и внутриклеточные биополимеры, осложнена тем, что
такая суспензия склонна к гелеобразованию, осадок сжимается и
127
производительность фильтров быстро падает. Это частично пред-
отвращают добавлением в исходную смесь или же предваритель-
ным нанесением на фильтровальную ткань вспомогательных
фильтрующих материалов — диатомитов, фильтроперлита (раз-
молотые вулканические породы SiOg, AI2O3), кизельгура, бенто-
нита и т. п. На ткани образуются несжимаемые осадки с хорошо
развитой пористой структурой, и производительность фильтра-
ции снижается значительно медленнее.
Большое значение имеет также коллоидное состояние фильт-
руемой суспензии. Улучшению процесса фильтрации способству-
ет регулирование pH, добавление флокулянтов или введение 0,1 %
хлорида кальция, который в присутствии ионов РО?- образует
гель фосфата кальция, улучшающий фильтруемость. Однако при
решении вопроса о любого рода добавках в фильтруемую суспен-
зию основным моментом является сохраняемость активности фер-
мента, так как известны случаи, когда добавки 4—5% фильтро-
перлита вызывали потерю ферментативной активности на 52—
58%.
Процесс проводят в вакуумных фильтрах ленточного, бара-
банного и фильтр-прессного типов. Потери фермента на. стадии
фильтрации 5—10% в основном с биомассой, которая сегодня
практически не используется и поступает в отвал.
Некоторые виды биомассы без добавок вспомогательных ве-
ществ можно отделять методом центрифугирования, используя
различие в плотностях жидкой фазы и условно твердой биомас-
сы микроорганизмов. Имеются специально разработанные сепа-
раторы с коническими тарелками для отделения мицелиальной и
бактериальной массы. Сепараторы снабжены устройством пуль-
сирующей выгрузки осадка, обычно отделяют 96—97% твердой
фазы. Для ферментных производств сепараторы должны иметь
систему охлаждения ротора желательно до 0—4°С. Для неболь-
ших производств иногда применяют суперцентрифуги, создающие
центробежное ускорение до 150 000 g, производительностью 40 —
80 л/ч. Потери фермента 10—15%.
Концентрирование ферментных растворов обычно проводит-
ся перед кристаллизацией продукта и чаще всего ограничивает-
ся упариванием. Основным условием успешного проведения про-
цесса является снижение температуры кипения и уменьшение
длительности процесса, поэтому выпаривание обычно проводят
не в циркуляционных, а в проточных выпарных аппаратах пле-
ночного типа, вслед за которыми сразу же установлены холо-
дильники для резкого снижения температуры и сокращения
времени пребывания раствора в нагретом состоянии. При темпе-
ратуре кипения среды 25—35°С температура греющего пара мо-
жет быть 60—85°С, для ускорения процесса параметры греюще-
го пара можно было бы поднять до 100—120°С, однако темпера-
туру кипения раствора фермента тогда надо снизить до 20°С,
т. е. обеспечить высокий вакуум. В производственных условиях
не всегда возможно достичь глубокого вакуума, поэтому по-
128
тери фермента из-за тепловой инактивации часто достигают
20 — 25%.
Известно, что чем чище выпариваемый раствор фермента,
тем больше его термическая инактивация. В то же время глубо-
кое концентрирование исходной культуральной жидкости’ или
водного экстракта неизбежно приводит к значительному измене-
нию их состава, так как выпадают в осадок гидроксиды, карбо-
наты и сульфаты магния, меди и других двухвалентных металлов,
улетучивается аммиак, продукты разложения некоторых органи-
ческих веществ, заметно изменяется в сторону подкисления и
pH. Все это необходимо учитывать и принимать специальные
меры для снижения потерь, поэтому иногда перед упариванием
в раствор добавляют специальные стабилизаторы: белки (аль-
бумин, казеин, БВК), хлорид кальция или натрия, другие соли
кальция, которые, впрочем, не должны мешать последующей
кристаллизации или другим приемам очистки товарной формы
препарата.
Ультрафильтрация. В отличие от других способов концентри-
рования ультрафильтрация позволяет одновременно удалить из
растворов все низкомолекулярные балластные примеси, т. е. она
одновременно выполняет функции и концентрирования, и очист-
ки. Поскольку процесс основан на разделении веществ по моле-
кулярной массе, он является идеальным именно в применении к
очистке ферментов: не требует изменения температуры и фазово-
го состояния, проводится без добавления химических реагентов,
позволяет получить теоретически любую необходимую концентра-
цию белка и достичь любой заданной степени очистки от при-
месей.
Основной элемент ультрафильтрационной установки — полу-
проницаемая мембрана. Правильный ее выбор для каждого кон-
кретного объекта целиком определяет возможность достижения
цели. Сегодня отечественная промышленность выпускает широ-
кий спектр мембран из ацетата целлюлозы, полиамидов, других
материалов с размерами пор от 3 до 100 нм.
На ферментных заводах ультрафильтрационную очистку про-
водят в. циркуляционных установках периодического действия
(рис. 37). В исходную емкость закачивают определенный объем
жидкости, уже прошедшей стадии отделения биомассы и стери-
лизующей фильтрации. Последняя необходима для предупрежде-
ния развития микрофлоры на мембранах и очистки раствора от
мелких взвесей, могущих загрязнять поверхность мембран. Раст-
вор постоянно охлаждается в емкости и в цикле; в зависимости
от свойств фермента температура составляет от 4 до 15°С. В ре-
зультате оттока через мембраны уровень жидкости в емкости по-
стоянно понижается, по нему иногда судят об окончании про-
цесса.
Циркуляционный насос создает над мембранами линейную
скорость жидкости 2—5 м/с для снижения концентрационной по-
ляризации, отрицательно влияющей на процесс. Это явление за-
129
обессоленная
вода
пермеат
Рис. 37. Схема ультрафильтрационной установки с циркуляцией концент-
рата и добавкой обессоленной воды (по Ю. И. Дытнерскому, 1978)
ключается в повышении концентрации белка в тончайшем слое
жидкости над мембраной за счет оттока через мембрану воды —
пермеата. Оно приводит к адсорбции крупных молекул — бел-
ков — на поверхности и в порах мембраны и постепенному
снижению ее удельной производительности. Время, от вре-
мени процесс концентрирования приходится останавливать
и проводить регенерацию мембраны специальными раст-
ворами.
Иногда во время концентрирования в емкость добавляют
обессоленную воду, т. е. осуществляют так называемый режим
диафильтрации. Такое разбавление способствует еще более высо-
кой очистке раствора от примесей, хотя и приводит к некоторому
увеличению длительности процесса. Совместное использование
диафильтрации и концентрирования позволяет на практике в
250—300 раз повысить удельную ферментативную активность
раствора.
Теоретически процесс ультрафильтрации можно проводить
без потерь фермента, на практике же потери достигают 20—30%
в основном из-за неправильного выбора мембран, несовершен-
ства конструкции мембранных аппаратов, допускающих протеч-
ки исходного раствора в пермеат, минуя мембрану, потерь фер-
мента с регенерирующими растворами и несоблюдения темпера-
турного режима в установке.
Осаждение органическими растворителями. Действие органи-
ческих растворителей основано на снижении диэлектрической
постоянной среды, значение которой определяет силы электро-
статического притяжения и отталкивания. Устойчивость белко-
вых растворов обусловлена наличием гидратного слоя у белковой
молекулы; если разрушить гидратную оболочку, начинается кон-
гломерация и осаждение белков. Для этого молекулы добавляе-
мого вещества должны быть более гидрофильными, чем молеку-
лы белка.
В качестве осадителей используют этанол, метанол, ацетон,
изопропанол. Исходя из механизма процесса, можно понять,
130
почему, используя различное количество растворителя и проводя
процесс при различных значениях pH, можно осаждать фермен-
ты фракциями с преобладанием какого-либо одного из них. На-
пример, из 50%-ного этанола осаждается до 80% протеазы и
лишь 3—5% амилазы. В то же время до 98% амилазы выпадает
при использовании 70% спирта.
Осаждение проводят в реакторах периодического действия.
Для уменьшения потерь фермента при смешивании растворителя
с водой обе жидкости первоначально охлаждают до 0—5°С.
Смесь тщательно перемешивают, спустя 20—30 мин начинают
выпадать мелкие частицы белка. В реакторе объемом 1,2 м3 по
высоте расположены несколько штуцеров для слива надосадоч-
ной жидкости. Оставшуюся суспензию направляют на фильтр
или сепаратор для отделения осадка.
Надосадочную жидкость, содержащую 50—70% растворите-
ля, направляют на- регенерацию в ректификационную колонну.
За каждый цикл теряется 5—7% растворителя, потери фермента
достигают 15% по причине инактивации при длительном контак-
те с растворителем..
Высаливание. Применение этого метода связано с очень боль-
шим расходом солей и трудностью их регенерации из маточного
раствора, тем не менее в ряде случаев метод находит применение
и в заводских условиях. Механизм этого процесса тот же, что и
при действии растворителей. Чаще всего как реагент используют
сульфат аммония, хорошо растворимый и наиболее дешевый.
Применяют также сульфат натрия, сульфат магния, фосфат
калия.
Осадок ферментов различной природы образуется за разное
время — от 0,5 до 12 ч. Длительность этого процесса, а также
расход соли сильно зависят от содержания АСВ в растворе, по-
скольку надо связать разное количество воды. Для выделения
1 кг препарата непосредственно из культуральной жидкости надо
затратить 45—50 кг соли, *а из раствора, упаренного до содержа-
ния 30% АСВ, — только около 1,5 кг.
Содержание соли в осажденном препарате зависит от кон-
центрации ее в растворе, но в любом случае оно велико — от 30
до 80%, тем не менее растворение и повторное осаждение
растворителями позволяет получать даже высокочистые препара-
ты медицинского назначения.
Сорбционная очистка. В молекуле фермента имеются функ-
циональные группы, сообщающие ей при соответствующих зна-
чениях pH среды кислотные или щелочные свойства. Поэтому
белки обычно способны сорбироваться по ионообменному меха-
низму. Для сорбции белков чаще всего применяют иониты на
основе целлюлозы: катионит — карбоксиметилцеллюлозу (КМЦ)
и анионит — диэтиламиноэтилцеллюлозу (ДЭАЭ). В последнее
время появилось множество высокоселективных ионитов, из ко-
торых можно выбрать наилучший для каждого конкретного
случая: термически обработанный крахмал, сефадексы на основе
. 131
декстрана, аниониты на основе поливинилового спирта, катиони-
ты на основе полиметакриловой кислоты и т. п.
После сорбции и промывки проводят десорбцию элюирую-
щими растворами, специально подбираемыми для каждого сор-
бента и фермента. Варьируя их расход, можно получить раз-
личную концентрацию фермента в элюате. Потери активности
обычно не превышают 15%.
Сорбционную очистку проводят либо непрерывно в колонках
насадочного типа, либо периодически в аппаратах с мешалкой с
последующим отделением твердой фазы.
Сушка ферментных препаратов. Этот процесс завершает ста-
дии выделения и очистки. Высушиванию подвергают культураль-
ные жидкости и диффузионные вытяжки, концентраты после
упаривания и ультрафильтрации, а также осадки после осажде-
ния растворителями или солями.
Жидкие полупродукты чаще сушат в распылительных сушил-
ках. Общие требования к процессу следующие: исходное содер-
жание АСВ не должно превышать 20—22%, температура тепло-
носителя не должна быть выше 130°С на входе и 50—70°С на
выходе, время контакта — несколько секунд, гидродинамика газо-
вых потоков в сушильной камере должна обеспечить отсутствие
контакта капель жидкости со стенками камеры. Перед сушкой в
раствор обязательно добавляют наполнители (обычно NaCl) для
предотвращения слипания частиц из-за большого количества
остаточных сахаров. Наполнителя вносится до 100% от массы
АСВ, потери ферментативной активности при сушке с наполни-
телями — 5—6, без них — 25—30%.
После сушки препарат должен содержать не более 6—8%
влаги, тогда срок его хранения в герметичной упаковке — до
года практически без потери активности.
Сушку осадков, имеющих влажность 70—80%, проводят под
вакуумом при обогреве водой с температурой 50—60°С; из-за
низкого потенциала сушки (движущей силы массопереноса)
длительность ее 14—16 ч. Препарат загружают на поддоны
слоем 10—15 мм и устанавливают их на обогреваемые водой
плиты внутри герметичной камеры, из которой вакуум-насосом
постоянно откачивается воздух.
Более современны и-эффективны сушилки, которые переме-
шивают продукт в процессе сушки (рис. 38). Барабанная ваку-
ум-сушилка состоит из барабана объемом 1,5 м3, в который за-
гружается до 1000 кг стальных шаров и 270 кг ферментного
осадка. Барабан снабжен рубашкой, через которую протекает
вода с температурой 35—60°С. Корпус барабана установлен под
углом 35°С к оси вращения, частота вращения 7 об/мин. Время
высушивания 10—12 ч. Потери активности определяются тща-
тельностью выдерживания режима сушки и обычно составляют
Ю-12%.
Стандартизация ферментных препаратов. Стандартизацией
называют операцию по доводке активности препарата до стан-
132
Рис 38. Барабанная вакуумная сушилка (по К. А. Калунянцу,
Л. И. Голгеру, 1979):
1 — шары; 2 — редуктор; 3 — электродвигатель; 4 — сушильная камера;
5 — кожух; 6 — встроенный фильтр
дартной, определяемой ГОСТ или техническими условиями. Для
этого используют различного рода нейтральные наполнители,
обычно это крахмал, лактоза, пищевая соль. Препарат и напол-
нитель тщательно перемешивают в барабанном смесителе в те-
чение 20—30 мин, количество наполнителя рассчитывают по
формуле
m = ^-7- — — М,
где т — масса наполнителя; М — масса исходного препарата;
Лисх — активность исходного препарата; Лст — стандартная ак-
тивность.
Проведенное выше общее рассмотрение технологии получе-
ния микробных ферментных препаратов позволяет сделать два
основных вывода о современном состоянии и перспективах раз-
вития этих производств. Во-первых, очевидно, что потенциальные
возможности микробиологического синтеза ферментов колоссаль-
ны, можно даже утверждать, что практически вся потребность
народного хозяйства в ферментах может быть покрыта их микро-
биологическим производством при условии правильного выбора
продуцента и оптимальной разработки технологии био-
синтеза.
Вместе с тем анализ проведенных в настоящей главе и имею-
щихся в литературе данных позволяет сделать и второй вывод о
явном несовершенстве современной биотехнологии ферментных
препаратов. Это определяется не только громоздкостью и малой
эффективностью технологических схем ферментации (особенно,
твердофазной), выделения и очистки, но и слишком высокой за-
висимостью результатов производства от ряда неучитываемых,
133
случайных и неопределенных факторов. Это вытекает из слабой
разработки научных основ технологии, прежде всего недостаточ-
ной глубины понимания и количественного описания физиологи-
ческих особенностей продуцентов.
Результатом неудовлетворительной проработки научных основ
биотехнологии многих ферментов является то абсолютно нетер-
пимое в промышленности обстоятельство, что при осуществлении
процесса строго по разработанному регламенту результаты на
всех стадиях сильно изменяются не только от завода к заводу, но
и на одном и том же предприятии в операциях, проведенных в
разное время. Так, потери ферментативной активности на стадии
фильтрации колеблются в пределах 14—40%, при осаждении —
от 19 до 51, экстракции — 8—20, ультрафильтрации — 7—25,
сушки — 7—40%. Конечно, такие колебания далеко выходят за
пределы случайного разброса и могут объясняться как ошибками
обслуживающего персонала, так и недостаточным знанием зако-
номерностей осуществляемого технологического процесса.
Учитывая огромные перспективы применения микробных фер-
ментных препаратов в самых различных отраслях промышленно-
сти и сельского хозяйства, медицине и т. п., можно сделать
заключение о необходимости расширения исследований, опытных
проверок и проектных разработок в этой области не только
вширь, увеличивая ассортимент продукции, но и вглубь, доби-
ваясь стабильности и оптимизации технологии и твердой гаран-
тии получения высокоактивных и стабильных препаратов микроб-
ных ферментов.
ЗАКЛЮЧЕНИЕ
Как уже отмечалось, решениями XXVII съезда КПСС преду-
смотрено приоритетное’ развитие биотехнологии как области
научной и практической деятельности, дающей огромный народ-
нохозяйственный эффект и во многом определяющей темпы науч-
но-технического процесса. На основании этих решений, а также с
учетом новейших достижений биотехнологической науки и прак-
тики можно определить ближайшие и перспективные задачи
промышленной биотехнологии белковых веществ, к которым от-
носятся :
— в области производства белка одноклеточных — резкое
увеличение числа субстратов, необходимых для ферментации,
за счет использования, прежде всего, природного газа, низших
спиртов, продуктов переработки растительного сырья; совершен-
ствование технологии в целях уменьшения расходных коэффици-
ентов, снижения энергоемкости, повышения и стабилизации ка-
чества товарных форм продуктов; расширение ассортимента про-
дукции за счет разработки и внедрения методов комплексной
переработки биомассы и культуральной жидкости, в том числе с
получением пищевых белковых изолятов, биологически активных
веществ и продуктов технического назначения;
— в области производства ферментных препаратов — совер-
шенствование и интенсификация стадии ферментации, упрощение
и повышение эффективности очистки, выпуск высококонцентриро-
ванных и активных товарных форм; расширение ассортимента
продукции за счет создания новых медицинских препаратов,
целлюлолитических ферментов высокой активности для деполи-
меризации растительных материалов; промышленное производ-
ство активных и стабильных форм иммобилизованных ферментов
в широкой номенклатуре.
В условиях ускорения научно-технического прогресса в нашей
стране приоритетное развитие биотехнологии означает необходи-
мость постоянного опережающего развития научных исследо-
ваний (в теоретическом и прикладном аспектах) и скорейшего
внедрения их результатов в промышленную практику. Решение
изложенных задач промышленной биотехнологии белковых ве-
ществ основывается на широком использовании специфических
методов, присущих именно этому роду знаний. Трудно переоце-
135
нить, в частности, роль методов генетической и клеточной инже-
нерии в создании высокоэффективных продуцентов, а в перспек-
тиве вообще биологических объектов с заданными свойствами.
Генно-инженерные методы применительно к производству
белковых веществ могут быть использованы в двух принципиально
различных целях: для улучшения качественных и количественных
характеристик продуцентов, способность которых образовывать
интересующий потребителя продукт уже обнаружена и может быть
использована, либо для придания микроорганизмам принципиаль-
но новых свойств превращения их, таким образом, в продуценты
необходимых веществ.
Оба эти подхода крайне важны для промышленного производ-
ства микробного белка, отметим лишь некоторые возможности,
очевидные уже сегодня. Прежде всего, генетические манипуляции
с дрожжами и бактериями, применяемые в промышленном био-
синтезе белка одноклеточных, могли бы улучшить аминокислот-
ный состав белка, так как они позволяют, в принципе, изменять
относительные скорости накопления разных белков клетки и поэ-
тому, в известных пределах, увеличивать внутриклеточный пул
особенно дефицитных аминокислот типа лизина, триптофана, трео-
нина и др. Возможно, что при этом можно было бы несколько
повысить и общее содержание протеина в биомассе, т. е. поднять
выход целевого вещества.
Не меньшее производственное значение имело бы придание
продуцентам белка генетически определенной способности к уско-
ренному метаболизму и размножению, что увеличило бы произво-
дительность предприятий без увеличения объема основной аппара-
туры. Можно говорить также о целесообразности придания про-
дуцентам белковых веществ свойства устойчивости к некоторым
химическим агентам, например, антибиотикам, что позволило бы
поднять уровень асептики в производство БВ К.
С другой стороны, большое практическое значение имеют
исследования, направленные на придание клеткам способности
утилизировать или какой-либо новый вид субстрата или устране-
ние вредного влияния примесей, имеющихся в питательной среде.
В этом отношении крайне важно добиться, например, устойчивости
дрожжей к фурфуролу и другим ингибиторам, неизбежно обра-
зующимся при гидролизе растительного сырья и снижающим
производительные показатели получения гидролизных дрожжей.
Здесь же стоит проблема «научить» клетки продуцировать цел-
люлазный комплекс и таким образом утилизировать не только
моносахариды, но и олигосахариды и даже целлюлозу, что
позволило бы исключить гидролиз как технологическую стадию.
Нетрудно себе представить в этом плане, какое значение имело
бы придание микроорганизмам — продуцентам белка, способность
утилизировать целлолигнин и, особенно, лигнин — один из самых
неприятных промышленных отходов. Возможности генетической
и клеточной инженерии, очевидно, не ограничиваются здесь пере-
численными примерами, достаточно упомянуть лишь возможность
136
расширить спектр поглощаемых дрожжами н-алканов, что изба-
вило бы от необходимости выделения узкой фракции сырья
для БВК-
В технологии ферментных препаратов генетическая инженерия
помогает усилить продуцирующую способность клеток или при-
дать им способность синтезировать новые ферментные системы
по типу уже разработанного синтеза белков — инсулина, интер-
ферона, гормонов и т. д. Учитывая сложность, дефицитность
и дороговизну сред, используемых в технологии ферментов, воз-
можность ввести в генетический аппарат клетки способности ути-
лизировать «простые» субстраты типа гидролизатов или низших
спиртов имела бы огромное экономическое значение.
Обсуждение роли генетической инженерии в совершенствова-
нии процессов промышленной биотехнологии можно было бы про-
должить, однако, не следует связывать прогресс этих производств
только с достижениями прикладной генетики. В практическом
плане прогресс биотехнологии белковых веществ сильно зависит
от совершенствования имеющихся производств. Уже были отме-
чены недостатки технологии ферментных препаратов, устранение
которых сделает эту подотрасль гораздо более современной, ста-
билизирует технологический процесс и поднимет качество товар-
ных препаратов,. Не меньшие возможности совершенствования
имеются и в производстве белка одноклеточных.
Культивирование микроорганизмов — продуцентов белка, се-
годня сталкивается с большими трудностями на стадиях выделе-
ния биомассы, которые, во многом, определяют общую энерго-
емкость производства и влияют на качество конечного продукта.
Немалое значение имеет и решение чисто технологических вопро-
сов усиления теплосъема при ферментации и снижения количеств
технологической и оборотной воды. Нельзя не отметить, однако,
и тот факт, что целью производства БВК является даже не сам
белок, а только часть находящихся в нем особо дифицитных
аминокислот. Поэтому разработка комплексной переработки мик-
робной биомассы как потенциального источника аминокислот,
белков, липидов, полисахаридов, кофакторов и других биологи-
чески активных веществ подняла бы весь технологический процесс
на качественно новый уровень.
Из всего вышесказанного ясно, как велики возможности про-
мышленного биосинтеза белковых веществ и как сложны и много-
образны задачи, которые предстоит решать ученым и производ-
ственникам, работающим в этой области.
Научно-технический прогресс в области биотехнологии белко-
вых веществ и ферментов должен в перспективе до 2000 года
привести к качественному и количественному росту производства
этих продуктов в нашей стране. Это позволит практически лик-
видировать дефицит белка в кормах для животноводства и до-
биться нового прогресса в органическом синтезе и пищевой
промышленности за счет использования новых эффективных
ферментных препаратов.
137
ЛИТЕРАТУРА
Биотехнология микробного синтеза/Под ред. М. Е. Бекера. — Рига: Зинатне,
1980. 287 с.
Грачева И. М., Гаврилова И. И.. Иванова Л. А. Технология микробных
белковых препаратов, аминокислот и жиров. — М.: Пищевая промышленность,
1980. 448 с.
Мосичев М. С., Складнее А. А., Котов В. Б. Общая технология микробиоло-
гических производств. — М.: Легкая и пищевая промышленность, 1982. 264 с.
Технология гидролизных производств/В. И. Шарков и др. — М.: Лесная и
пищевая промышленность, 1973. 316 с.
Калунянц К. А., Голгер Л. И. Микробные ферментные препараты. — М.:
Пищевая промышленность, 1979. 303 с.
Бортников И. И., Босенко А. М. Машины и аппараты микробиологических
производств. — Минск: Вышейшая школа, 1982. 288 с.
Брухман Э. Э. Прикладная биохимия. — М.: Легкая и пищевая промыш-
ленность, 1981. 294 с.
Матвеев В. Е. Основы асептики в технологии чистых микробиологических
препаратов. — М.: Легкая и пищевая промышленность, 1981. 311 с.
ПРЕДМЕТНЫЙ
УКАЗАТЕЛЬ
Барабанная вакуумная сушилка 133*
Белково-витаминный концентрат
/БВК/ 6, 28, 29
Биомасса 73
— кормовая 73 — 84, 90, 94
----получение на низших спиртах
90 — 94
---------углеводном сырье 94 — 99
----технологйческая схема отделения
экстракции 87*
----------получения 73 — 84
----технологические особенности про-
изводства на углеводородном сырье
84 — 90
— одноклеточных 19
----способы выращивания 19
---------непрерывный 19, 22
---------периодический 19, 22, 24
— получение 10, 18, 19
Биосинтез микробного белка 33
------- основы технологии субстра-
тов 33 — 67
Биотехническое производство 10, 22, 32
----стадии 10
-------выделение и очистка целевого
продукта 11
-------подготовка биологически дей-
ствующего начала 10, 11
-------подготовка сырья 10
-------приготовление товарных форм
продуктов 11
-------расфасовка и упаковка продук-
тов 11, 12
-------ферментации 11
----условия 24
Биотехнологические процессы 10
Взаимосвязь технологии ферментации
и технологического и аппаратурного
оформления последующих стадий 24
Диффузионная батарея для экстраги-
рования ферментов 127*
Кормовой концентрат лизина (ККЛ) 29
Меласса 64 — 66
----сырье для синтеза метаболитов 64
Метилотрофы 44
— подготовка сырья 50 — 52
— сырье для культивирования 44 — 52
--------- получение метанола нз син-
тез-газа 48 — 50
---------- сннтез-газа 44 — 48
Микробиологические процессы 23
---- управление 23
Микробные липиды 99, 100
---- источники 99 — 102
----технологическая схема получе-
ния 103
Отделение грануляции 82, 83
---- технологическая схема 82*
— сгущения суспензии микроорганиз-
мов 79, 80
— сушки 81, 82
----технологическая схема 81*
— чистой культуры 74
* Звездочкой отмечены страницы, иа которых помешены рисунки или таб-
лицы.
139
Питательные среды для биосинте-
за 12 — 16
--------- источники углерода 12, 13
— -------методы стерилизации
14— 16
--------------радиационный 14, 15
--------------химические 15
--------------стерилизующей фильт-
рации 15, 16
--------- отделение приготовления 12
--------- соблюдение требований
асептики 13
---------термическая стерилиза-
ция 14
-------------- недостатки 14
--------- технология приготовления
12— 16
------- культивирования микроорга-
низмов 33
Продукт 28
— метаболизма получение 10, 19, 20
— микробиологического синтеза 24
------- выделение и очистка 24
--------------новые возможности
27, 28
--------------применение мембран-
ной технологии 27
-------------- технологические прие-
мы 25, 27
— получение товарной формы 28 — 30
---------стадия фасовки 29, 30
Промышленная асептика в микробиоло-
гическом синтезе 20
— биотехнология 5, 6, 9, 10, 18, 28,
30, 107, 135
----два типа процессов 18, 19
----процессы 10
------- разделение по признаку целе-
вого продукта 10
----современный этап развития 23
----технологическое оформление про-
цессов 20, 21
Промышленные ферментные препара-
ты 107, 108
Промышленный микробиологический
синтез 33
-------сырьевая база 33
Растительная камера с вертикальными
кассетами 123*
Растительное сырье 52 — 54, 59
----- получение углеводородов гидро-
лизом 52 — 59
------------технологическая схе-
ма 54*
Стадия термообработки микробной су-
спензии 80
— фасовки и упаковки готового про-
дукта 83
— ферментации 78 — 80
Стерилизатор твердой сыпучей среды
с мешалками 121*
Схема получения посевного матери-
ала 75*
— ультрафильтрационной установ-
ки 130*
Термостатирование ферментационного
процесса 21
Технологическая схема карбамидной
депарафинизации нефтяных дистил-
лятов 37
—----очистки ГВВ 83*
----- приготовления и стерилизации
растворов питательных солей и мик-
роэлементов 77*
Углеводородное сырье 34 — 40, 67
-----дополнительные источники
67 — 72
-----получение 34 — 40
-------нефтяных дистиллятов прямой
перегонкой нефти 34.— 36
------------ технологическая схема
34, 35*
------- н-парафинов переработкой
нефтяных дистиллятов 36 — 39
Уксусная кислота 59 — 64
---- получение 59 — 64
-----7 — из этилена 60 — 62
------------технологическая схе-
ма 61*
-------карбонилированием метано-
ла 62 — 64
-------:----технологическая схе-
ма 63*
140
Ферментация стадия 18
Ферментеры 78, 79, 92, 95
— барботажно-эрлифтные 96
— струйный 92
----- схема 92*
— типы 78, 79
— требования 78
— эрлифтный 95, 96
-----схема 95*
Ферментные препараты 125, 132, 133
----- получение товарных форм
125— 133
-----стандартизация 132, 133
-----сушка 132, 133
Ферменты 105—133
— биосинтез 108
-----влияние возраста посевного мате-
риала 113*
— влияние .температуры культивирова-
ния на накопление 116*
— выделение и очистка 125, 126
— высаливание 131
— глубинный метод культивирования
продуцентов 110 — 117
------------ технологическая схема
111, 112*
— концентрирование растворов 128, 129
-------ультрафильтрацией 129, 130
— осаждение органическими раствори-
телями 130
— отделение твердой фазы методом
фильтрации 127, 128
------------центрифугированием 128
— поверхностный метод культивирова-
ния продуцентов 117— 125
------------влажность питательной
среды 122
------------динамика газового обме-
на 122*
------------ технологическая схема
118, 119*
------------ энергетика процесса
121, 122
— сорбционная очистка 131
— технология микробиологического
производства 105
— факторы, влияющие на биосинтез
108— ПО
— экстракция из поверхностной куль-
туры 109
Чистая культура 16, 17
----поддержание 16
Экологические аспекты биотехноло-
гии 30 — 32
-------метаболически замкнутые про-
изводства 32
Этиловый спирт 40 — 44
----получение прямой гидратацией из
этилена 42, 43
----технологическая
схема 42*
-------сернокислотной гидратацией
этилена 40 — 42
-------технологическая схе-
ма 41*
Этиловый спирт технология получе-
ния 40
ОГЛАВЛЕНИЕ
Предисловие......................................................... 5
Введение ............................................................. 6
Глава 1. Основные принципы промышленного осуществления биотех-
нологических процессов............................................... 10
§ 1. Технология приготовления питательных сред для биосинтеза . . . _ 12
§ 2. Поддержание чистой культуры 16
§ 3. Ферментация .................................................. 18
$ 4. Выделение и очистка продуктов ... 24
§ 5. Получение товарных форм препаратов ............................. 28
§ 6. Экологические аспекты биотехнологии........................ . 30
Глава 2. Сырьевая база промышленной биотехнологии.................... 33
$ 1. Получение углеродного сырья для промышленной биотехнологии . 34
$ 2. Получение этилового спирта.............. . ........ 40
§ 3. Сырье для культивирования .метилотрофов . ............... 44
§ 4. Получение углеводов гидролизом растительного сырья . . . 52
§ 5. Получение уксусной кислоты............ . 59
$ 6. Меласса как субстрат для биотехнологии.......................... 64
§ 7. Дополнительные источники сырья для производства белка одно-
клеточных ................. ................. . . .... 67
Глава 3. Технология производства белковых веществ и липидов мик-
робным синтезом . . ................. 73
$ 1. Принципиальная технологическая схема получения кормовой био-
массы ............................................................... 73
$ 2. Технологические особенности производства кормовой биомассы на
углеводородном сырье............................................. 84
§ 3. Получение микробного белка на низших спиртах . ... . 90
§ 4. Получение белковых веществ1 на углеводном сырье................. 94
§ 5. Технология получения микробных липидов.......................... 99
Глава 4. Технология ферментных препаратов . ..... 105
$ 1. Промышленные ферментные препараты . . .... 107
$ 2. Факторы, влияющие иа биосинтез ферментов ....... 108
§ 3. Глубинный метод культивирования продуцентов ферментов . ПО
§ 4. Поверхностный метод культивирования продуцентов ферментов . 117
§ 5. Получение товарных форм ферментных препаратов ................ 125
Заключение . . . . . . 135
Литература 138
Предметный указатель.................................................139
Учебное издание
БИОТЕХНОЛОГИЯ. В 8 ни.
Валерий Алексеевич Быков, Михаил Николаевич Манаков,
Виктор Иванович Панфилов,
Алексей Александрович Свитцов, Нина Васильевна Тарасова
Книга S
ПРОИЗВОДСТВО БЕЛКОВЫХ ВЕЩЕСТВ
Зав. редакцией А. Г. Гаврилов
Редактор М. М. Пенкина
Мл. редакторы Е. И. Попова, И. М. Павлова
Художественный редактор Т. А. Коленкова
Художник С. Ю. Вериченко
Технический редактор Н. А. Битюкова
Корректор С. К. Завьялова
ИБ № 6701
Изд. № Е — 555. Сдано в набор 24.02.87. Подп. в печать 03.06.87. Т-10183. Фор-
мат 60Х90*/1б. Бум. кн-журн. Гарнитура литературная. Печать офсетная.
Объем 9 усл. печ. л. 18,5 усл. кр.-отт. 8,95 уч.-изд. л. Тираж 30 000 экз. Зак.
№ 154. Цена 35 коп.
Издательство «Высшая школа», 101430, Москва, ГСП-4, Неглинная ул. д. 29/14.
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном коми-
тете СССР по делам издательств, полиграфии и книжной торговли. 150014, Ярос-
лавль, ул. Свободы, 97.
Биотехнология: Учеб, пособие для вузов. В 8 кн./Под
Б63 ред. Н. С. Егорова, В. Д. Самуилова. Кн. 5: Производство
белковых веществ/В. А. Быков, М. Н. Манаков, В. И. Пан-
филов и др. — М.: Высш, шк., 1987. —142 с.: ил.
Рассмотрены основные принципы промышленных биотехнологических про
цессов, сырьевые источники промышленной биотехнологии, основы технологии
белковых веществ и ферментов, современное аппаратурное оформление промыш
ленных производств, вопросы повышения качества продукции.
ББК 30.6+28.07
2010000000 (4309000000)—354
Б--------------------'---- КБ—53—7—86
001(01)—87
605
35 коп.
QQQQQQQQ
ПРОБЛЕМЫ
И ПЕРСПЕКТИВЫ
СОВРЕМЕННЫЕ МЕТСДЫ
СОЗДАНИЯ ПРОМЫШЛЕННЫХ
ШТАММОВ МИКРООРГАНИЗМОВ
КЛЕТОЧНАЯ ИНЖЕНЕРИЯ
АВТОМАТИЗАЦИЯ
БИОТЕХНОЛОГИЧЕСКИХ
ИССЛЕДОВАНИЙ
ПРОИЗВОДСТВО
БЕЛКОВЫХ ВЕЩЕСТВ
МИКРОБИОЛОГИЧЕСКОЕ
ПРОИЗВОДСТВО БИОЛОГИЧЕСКИ
АКТИВНЫХ ВЕЩЕСТВ И ПРЕПАРАТОВ
ИММОБИЛИЗОВАННЫЕ
ФЕРМЕНТЫ
ИНЖЕНЕРНАЯ
ЭНЗИМОЛОГИЯ